Author: Гаевская А.В.
Tags: биология клетки и субклеточных частиц цитология паразиты человека паразиты цестодозы пищевого происхождения
ISBN: 978-5-9500245-9-7
Year: 2017
Text
А.В. ГАЕВСКАЯ
МИР
ПАРАЗИТОВ ЧЕЛОВЕКА
III. ЦЕСТОДЫ И ЦЕСТОДОЗЫ ПИЩЕВОГО ПРОИСХОЖДЕНИЯ
Посвящается
моим сыновьям — Станиславу, Руслану и Алексею,
с пониманием отнёсшихся к моему увлечению паразитологией и паразитами и разделивших вместе со мной все радости и невзгоды, выпавшие на нашу долю.
Гаевская Альбина Витольдовна -
доктор биологических наук, профессор, заслуженный деятель науки и техники АР Крым, академик и член Президиума Крымской академии наук, лауреат премии им. И. И. Шмальгаузена за достижения в области зоологии, лауреат Государственной премии Украины в области науки и техники, лауреат Общегородского форума «Общественное признание» (Севастополь), Председатель Крымского отделения Паразитологического общества при РАН; награждена медалью «Ветеран труда», памятными медалями академика К. И. Скрябина и академика Е. Н. Павловского, почётными грамотами Государственной Думы РФ, Президиума НАН Украины, Верховной Рады, Совета министров РК, губернатора г. Севастополя. Научный редактор многих коллективных монографий. Автор и соавтор 380 работ, включая 5 патентов и более 30 монографий, в числе которых «Мир паразитов человека» в 3 томах (2017, 2016, 2015), «Паразиты и болезни рыб Чёрного и Азовского морей» в двух томах (2012, 2013), «Паразиты и болезни гигантской устрицы (Crassostrea gigas) в условиях культивирования» (2010), «Паразиты, болезни и вредители мидий (Mytilus, Mytilidae). I - X» (10 выпусков: 2006 - 2014), «Паразитология и патология рыб: Энциклопедический словарь-справочник» (2003, 2006), «Анизакидные нематоды и заболевания, вызываемые ими у животных и человека» (2005), «Паразиты и болезни морских и океанических рыб в природных и искусственных условиях» (2004), «Паразитолопя та патолопя риб: енциклопедичний словник-довщник» (2004) и др. Научный руководитель 13 кандидатских диссертаций
Российская академия наук Паразитологическое общество при РАН Крымское отделение
А. В. Гаевская
МИР
ПАРАЗИТОВ ЧЕЛОВЕКА
III. ЦЕСТОДЫ И ЦЕСТОДОЗЫ ПИЩЕВОГО ПРОИСХОЖДЕНИЯ
Севастополь
2017
УДК 576.895.121
Гаевская А. В. Мир паразитов человека. III. Цестоды и цестодозы пищевого происхождения. - Севастополь: ООО «Колорит», 2017. - 358 с., илл. - 184.
В монографии впервые в русскоязычной литературе обобщена вся доступная информация о 78 видах цестод, принадлежащих к 27 родам из 8 семейств 4 отрядов, чьё попадание к человеку прямо или опосредованно связано с его питанием. Приведены самые необходимые сведения о систематическом положении, морфологии, биологии, жизненном цикле, круге хозяев - промежуточных, дополнительных, окончательных, географическом распространении видов - возбудителей цестодозов человека, информация о случаях заражения людей, патогенезе, эпидемиологии и профилактике вызываемых ими заболеваний.
Для паразитологов, биологов, работников медицинских учреждений, санитарноветеринарных служб, рыбной, пищевой и туристической отрасли, аспирантов и студентов профильных институтов, а также всех любителей блюд из термически необработанных продуктов.
Печатается по рекомендации
Крымского отделения Паразитологического общества при Российской академии наук
Рецензенты:
О. Г. Миронов, доктор биол. наук, проф.
М. В. Юрахно, доктор биол. наук, проф.
ISBN 978-5-9500245-9-7
© Гаевская Альбина Витольдовна, 2017
СОДЕРЖАНИЕ
Введение, или ЧИТАТЬ ИЛИ НЕ ЧИТАТЬ.......................................... 7
Глава 1
ЛЕНТОЧНЫЕ ЧЕРВИ, ЛЕНТЕЦЫ, СОЛИТЁРЫ, ЦЕПНИ -ОДНИМ СЛОВОМ, - ЦЕСТОДЫ........................................И
Глава 2
ЛЕНТОЧНЫЕ ЧЕРВИ -НЕЖЕЛАТЕЛЬНЫЕ ПОСЕЛЕНЦЫ НАШЕГО ОРГАНИЗМА
Семейство Anoplocephalidae Cholodkovsky, 1902.............. 19
Род Bertiella Stiles et Hassall, 1902.....................20
Род Inermicapsifer Janicky, 1910 .........................28
Род Killigrewia Meggitt, 1927............................ 34
Род Mathevotaenia Akhumian, 1946......................... 35
Род Moniezia Blanchard, 1891 ............................ 37
Семейство Bothriocephalidae Blanchard, 1849................. 42
Род Schyzocotyle Akhmerov, 1960.......................... 43
Семейство Davaineidae Braun, 1900........................... 48
Род Buginetta Spassky, 1994...............................49
Род Raillietina Fuhrmann, 1920.......................... 53
Род Tenoretta Spassky, 1994.............................. 58
Семейство Diphyllobothriidae Liihe, 1910....................63
Род Diphyllobothrium Cobbold, 1858....................... 64
Род Adenocephalus Nybelin, 1931 .........................116
Род Diplogonoporus Lonnberg, 1892........................127
Род Ligula Bloch, 1782...................................137
Род Pyramicocephalus Monticelli, 1890....................144
Род Schistocephalus Creplin, 1829 .......................148
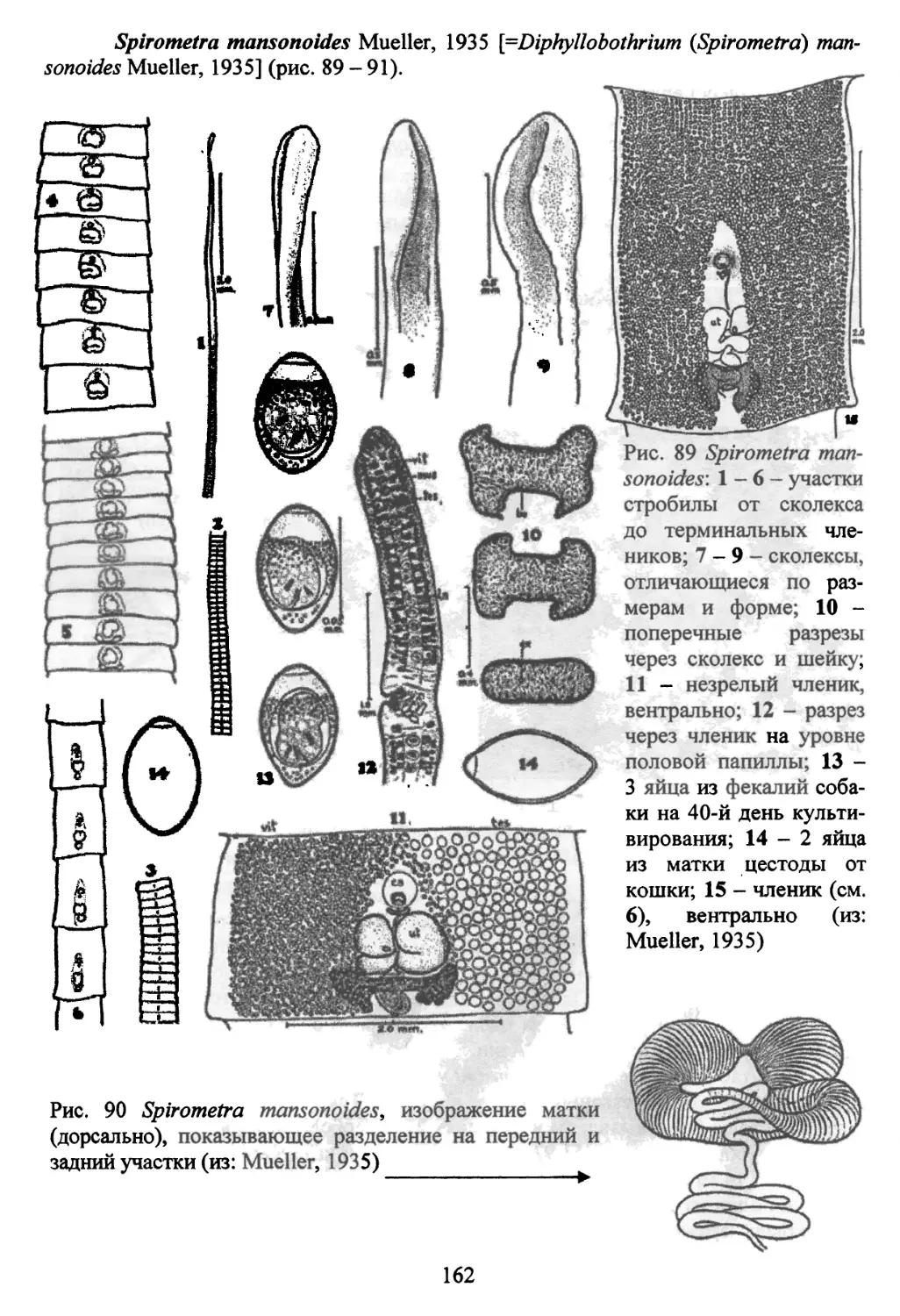
Род Spirometra Faust, Campbell et Kellogg, 1929..........153
Семейство Dipylidiidae Stiles, 1896......................181
Род Dipylidium Leuckart, 1863..........................181
Семейство Hymenolepididae Ariola, 1899...................189
Род Hymenolepis Weinland, 1858.........................191
PojxDrepanidotaenia Railliet, 1892.....................204
Род Pseudanoplocephala Baylis, 1927....................206
Род Rodentolepis Spassky, 1954.........................209
Семейство Mesocestoididae Fuhrmann, 1907.................226
Род Mesocestoides Vaillant, 1863.......................227
Семейство Taeniidae Ludwig, 1886.........................236
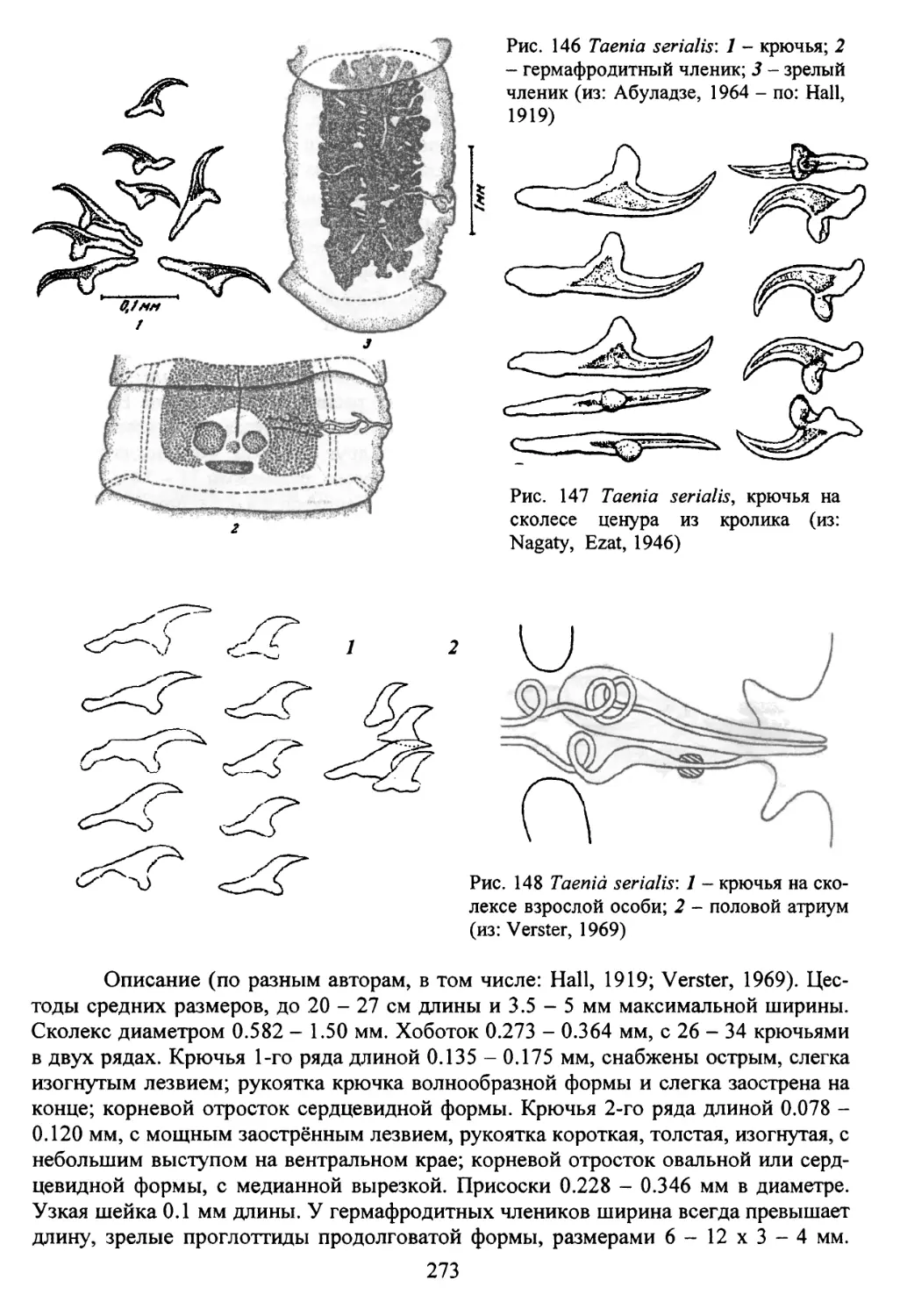
Род Taenia Linnaeus, 1758..............................237
Род Echinococcus Rudolphi, 1801........................284
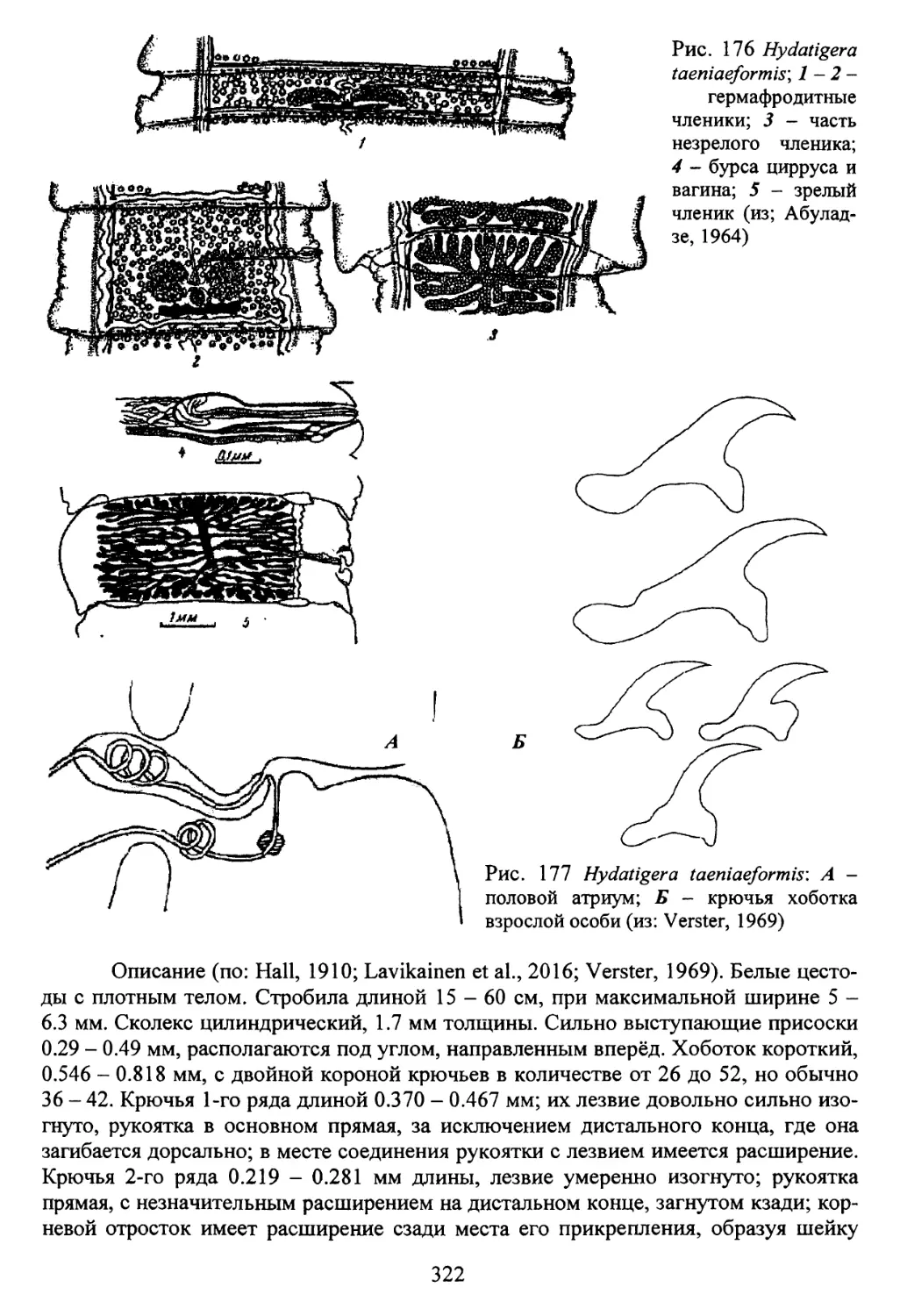
Род Hydatigera Lamarck, 1816...........................321
Семейство Tentaculariidae Poche, 1926....................328
Род Nybelinia Poche, 1926..............................329
Глава 3, или
ПУСТЬ ПИЩА БУДЕТ ЛЕКАРСТВОМ...............................335
Приложение 1
СЛОВАРЬ НЕОБХОДИМЫХ ТЕРМИНОВ И ПОНЯТИЙ............................341
Приложение 2
ПЕРЕЧЕНЬ ПАРАЗИТОВ И ВЫЗЫВАЕМЫХ ИМИ ЗАБОЛЕВАНИЙ................................351
Научные (латинские) названия...........................351
Русские названия.......................................356
Если не знаешь названий, теряется и познание вещей.
Карл Линней
Carolus Linnaeus (1707 -1778) Шведский естествоиспытатель и врач, создатель единой системы классификации растительного и животного мира.
Он был приспособлен для выживания в современном мире как солитёр в кишечнике -Не was as fitted to survive in this modern world as a tapeworm in an intestine.
Сэр Уильям Голдинг Sir William Golding (1911 - 1993) Английский писатель, лауреат Нобелевской премии по литературе
Введение, или
ЧИТАТЬ ИЛИ НЕ ЧИТАТЬ?
В 2015 г. вышел в свет первый том монографии «Мир паразитов человека», посвящённый одной из групп паразитических плоских червей - трематодам, заражение которыми у человека связано с пищей (Гаевская, 2015) \ На тот момент в мире таковых насчитывалось 129 видов из 57 родов, относящихся к 25 семействам. В следующем, 2016-м, году была опубликована вторая книга упомянутой монографии; на этот раз речь шла о паразитических круглых червях - нематодах, чьё попадание к человеку также прямо или косвенно связано с его питанием (Гаевская, 2016)* 2. Перечень таких нематод включал 137 видов из 66 родов 34 семейств.
Однако список гельминтов, попадающих к человеку с пищей и могущих представлять реальную угрозу его здоровью, не исчерпывается только трематодами и нематодами. Не менее, а в ряде случаев и более опасными являются представители ещё одной группы паразитических плоских червей - цестоды. Именно этим гельминтам и посвящён третий том названной монографии.
Мир цестод разнообразен, но всё же не столь многочислен, как, например, у нематод или трематод. Мнения разных авторов относительно численности видового состава данного класса значительно расходятся: в литературе можно встретить самые разные цифры - от более 1000 до 5100 - 5400 видов.
’ Гаевская А. В. Мир паразитов человека. I. Трематоды и трематодозы пищевого происхождения. - Севастополь, ЭКОСИ-Гидрофизика, 2015. - 410 с.
2 Гаевская А. В. Мир паразитов человека. II. Нематоды и нематодозы пищевого происхождения. -Севастополь, ЭКОСИ-Гидрофизика, 2016.-442 с.
7
В половозрелом состоянии цестоды паразитируют у самых разных водных и наземных позвоночных животных, - от акул, скатов и костистых рыб до человека. В жизненном цикле этих гельминтов в качестве промежуточных и дополнительных /или паратонических хозяев участвуют многочисленные виды беспозвоночных и позвоночных животных, включая рыб, амфибий, рептилий, птиц и млекопитающих, а передача инвазионного начала от одного хозяину к другому осуществляется только трофическим путём. Именно потому, что заражение человека цестодами происходит непосредственно через пищевые продукты, вызываемые ими заболевания получили название цестодозов пищевого происхождения. Для одних цестод человек выступает в роли окончательного хозяина, как правило, случайного, и только для немногих видов этих гельминтов - облигатного дефинитивного. Для большинства же регистрируемых у человека цестод тот является для них дополнительным и зачастую случайным «тупиковым», хозяином, а его заражение яйцами и/или личинками цестоды происходит с питьевой водой, немытой зеленью, овощами, почвой или же через грязные руки. Строго говоря, в таких случаях нет пищевого пути заражения в нашем обычном понимании: человек может не есть немытую зелень, не пить воду из подозрительного источника, но всё равно рискует заразиться опасными цестодами, поскольку «забывает» о необходимости соблюдения элементарных правил санитарии и личной гигиены. В целом же разделить всех цестод, регистрируемых у человека, на тех, которые попадают к нему только с едой, и тех, заражение которыми происходит с водой, немытой зеленью (ведь это - тоже еда!) или грязными руками, довольно трудно. К тому же, в одном и том же семействе могут быть виды, одни из которых попадают в организм человека только с заражёнными пищевыми продуктами, а другие - с контаминированной зеленью, овощами, ягодами, с почвой и грязными руками.
В процессе работы над данной монографией удалось собрать сведения о 76 (78) вилах цестод из 27 родов, принадлежащих к 9 семействам, чьё попадание к человеку прямо или косвенно связано с особенностями его питания. Все эти виды подробно описаны в главе 2. И всё же установить точное количество видов цестод, потенциально опасных для здоровья человека и полезных животных, довольно трудно. В мире регулярно описываются новые таксоны этих гельминтов, причем зачастую среди тех родов и/или семейств, отдельные представители которых уже известны у человека, и нет никакой гарантии того, что среди них не окажутся потенциально патогенные для него виды.
Многие виды цестод встречаются у человека чрезвычайно редко или же очень локально, некоторые относительно безвредны для его здоровья и не имеют серьёзной социально-экономической значимости. Тем не менее, среди выявленных у человека 76 видов цестод есть такие, что характеризуются обширным распространением по планете и вызывают серьёзные заболевания, сопровождающиеся патологическими изменениями в организме человека, могущими привести даже к летальному исходу. В тексте подробно описаны все виды - и редко встречающиеся, и обычные для людей, с характеристикой тех изменений, к которым приводит их поселение в организме человека.
Вместе с тем, отсутствие информации об обнаружении у людей того или иного вида цестод из числа потенциально патогенных для него вовсе не означает отсутствие инвазии им как таковой в природе. Именно по этой причине многие специалисты
8
считают, что в ряде случаев потенциально опасными для здоровья человека могут быть все представители того или иного рода, несмотря на факт регистрации у человека только одного или нескольких представителей из них. Многочисленные примеры сказанного приведены ниже при описании цестод соответствующих родов / семейств.
Многие из цестод, встречающиеся у человека, являются паразитами важных в хозяйственном и промысловом отношениях млекопитающих и птиц, а также домашних животных. По этой причине вызываемые у них этими гельминтами болезни имеют и ветеринарное и экономическое значение, а заболевания домашних питомцев (кошек, собак) придают им ещё и социальную значимость. Известно, что от животных к человеку может быть передано множество контактных болезней.
Во всём мире изучению патогенных для человека цестод, вопросам диагностики, патогенности, профилактики, терапии и распространения вызываемых ими заболеваний уделяется огромное внимание. Им посвящены сотни монографий, общие, региональные и таксономические обзоры, многочисленные диссертационные исследования, десятки учебно-методических пособий, не говоря уже о многих тысячах статей.
Тем не менее, в русскоязычной литературе мне не встретилось ни одной работы, в которой в полной мере были бы сведены воедино накопленные к настоящему времени данные обо всех цестодах, а также упомянутых выше трематодах и нематодах, чьё попадание к человеку прямо или опосредованно связано с его питанием. Именно данное обстоятельство и послужило фактически основным стимулом для написания мною трёхтомной монографии «Мир паразитов человека». Каждый из нас просто обязан знать, где и какой опасный паразит может встретиться, к каким последствиям может привести инвазия им и как избежать риска заражения. Иными словами, что нужно делать для того, чтобы пища, как говорят китайские мудрецы, была лекарством, а не источником заболевания.
Итак. Данная монография посвящена цестодам, чьё попадание к человеку прямо или косвенно связано с его питанием, а изложение материала построено по той же схеме, что и в предыдущих томах монографии.
Первая глава содержит краткую характеристику класса цестод: описаны морфология, анатомия, особенности жизненных циклов этих гельминтов, их распространение в природе, сделаны ссылки на соответствующие таксономические сводки, которые послужили основой при изложении материала во второй главе.
Вторая глава посвящена описанию всех цестод, зарегистрированных у человека, чьё попадание к нему прямо или косвенно связано с пищей, а последствия заражения ими зачастую носят весьма пагубный характер. Первоначально приведена характеристика семейства, к которому принадлежат роды цестод, чьи представители зарегистрированы у человека, а затем дана характеристика рода и входящих в него видов. Для каждого вида приведены сведения об истории его открытия, морфологии, биологии, жизненном цикле, круге промежуточных, дополнительных и окончательных хозяев, географическом распространении, о случаях заражения людей, патогенезе, эпидемиологии и профилактике вызываемых им заболеваний. Текст сопровождается иллюстрациями, заимствованными из опубликованных источников, на которые сделаны обязательные ссылки в подписи к соответствующему рисунку. Характеристику каждого семейства, а в случае если тот представлен
9
несколькими родами, то характеристику каждого рода завершает список использованной литературы. В отличие от первого тома, где невероятно объёмный список источников (более 1500) приведён в конце монографии, в данном томе, как и во втором, посвящённом нематодам, выбран более рациональный способ его размещения, значительно облегчающий читателю работу с цитируемой литературой.
Для удобства изложения и восприятия материала семейства, роды внутри семейств, а также виды внутри родов расположены в тексте в алфавитном порядке. Исключение составляют типовые род или вид - если таковые имеются среди описываемых, - их описание предваряет остальные.
Третья глава, небольшая по объёму, - своего рода заключение, в котором приведены обобщённые данные о современных масштабах и особенностях распространения на планете отдельных цестодозов человека.
В конце книги помещены Словарь необходимых терминов и понятий (приложение 1) и Перечень названий паразитов и вызываемых ими заболеваний на латинском (425) и русском (110) языках (приложение 2).
При изложении материала использованы все доступные литературные источники по интересующей нас проблеме. При описании цестод учтены последние изменения в систематике того или иного таксона, о чём сделаны соответствующие ссылки. Если же точки зрения разных авторов на систематическое положение того или иного таксона не совпадают, то в тексте цитируются соответствующие публикации, отражающие мнение разных авторов по данному вопросу.
Видовая принадлежность беспозвоночных и позвоночных животных, упоминаемых в тексте, приведена в соответствии с соответствующими современными справочными материалами, прежде всего, WoRMS (www.marine-species.org /aphia/php), FishBase.
В заключение приношу сердечную признательность моим неизменным рецензентам д.б.н., проф. О. Г. Миронову и д.б.н., проф. М. В. Юрахно за благожелательное отношение к предложенной их вниманию рукописи данной монографии. Искренне благодарна зав. библиотекой ФГБУН ИМЕЙ РАН (Севастополь) О. А. Андреевой и директору Международной ассоциации хранителей реки «Есо-TIRAS» И. Д. Тром-бицкому (Кишинёв, Молдова) за содействие в поисках некоторых труднодоступных публикаций. Весьма признательна к.б.н. А. А. Макарикову (ИСиЭЖ СО РАН, г. Новосибирск) за заочные консультации по вопросам систематики цестод семейства гименолепидид. Особенную благодарность выражаю Лаборатории паразитологии Гарольда Мантера (the Parasitology, Harold W. Manter Laboratory of University of Nebraska - Lincoln), усилиями сотрудников которой стал возможным доступ ко многим работам по паразитологии, опубликованным в США, в частности в «Journal of Parasitology». И, наконец, низкий поклон авторам публикаций, использованных при написании настоящего текста, в том числе и за содержащийся в них иллюстративный материал, что сделало приводимые мною описания обнаруженных у человека цестод более наглядными и полноценными.
10
Глава 1
ЛЕНТОЧНЫЕ ЧЕРВИ, ЛЕНТЕЦЫ, СОЛИТЁРЫ, ЦЕПНИ -ОДНИМ СЛОВОМ, - ЦЕСТОДЫ
Цестоды (Cestoda), или, как их ещё называют, ленточные черви, лентецы, солитеры, цепни - класс плоских червей (Platyhehninthes), наиболее примечательной особенностью представителей которого является полное отсутствие у них пищеварительной системы и необычайно высокая плодовитость.
Тело обычно беловатого цвета, уплощённое дорсовентрально, узкое, лентовидное (отсюда одно из названий этой группы гельминтов - ленточные черви, tapeworms), а его длина варьирует от 0.6 мм (у Mathevolepis petrotschenkoi Spassky, 1948 - паразита землероек) до 30 м (у Hexagonoporus physeteris Gubanov in Dela-mure, 1955 - паразита китов). В большинстве случаев в теле цестод различают головку (сколекс), которая несёт различного типа органы прикрепления, шейку (зона роста) и стробилу, состоящую из члеников, - проглоттид. У ряда видов наружного расчленения стробилы нет, а у некоторых цестод тело вообще не расчленено.
Головка цестод образована передним концом тела и снабжена разнообразными органами прикрепления: ботридиями, ботриями, желобками, присасывательными ямками, присосками, крючьями, шипиками, хоботками, которые, несмотря на их большое морфологическое разнообразие, можно свести к 2 типам: присасывательные образования и якореподобные крючья и шипы (рис. 1). Сложный и мощный фиксаторный аппарат сколекса обеспечивает прочное прикрепление паразита к стенке кишечника хозяина.
11
Форма и строение сколекса, особенности его вооружения, форма и размеры крючьев являются диагностическими признаками в систематике цестод.
За головкой расположена короткая нерасчленённая шейка. От её заднего участка, являющегося зоной роста, отшнуровываются располагающиеся линейно новые членики. Передние членики - самые маленькие, но по направлению к заднему концу их размеры постепенно увеличиваются, но до определённых границ, характерных для каждого конкретного вида. У многих видов зрелые проглоттиды с яйцами отрываются от заднего конца тела и выносятся с фекалиями хозяина во внешнюю среду, а тело паразита восстанавливается за счёт образования новых члеников в области шейки. У некоторых видов формирование новых члеников происходит только в самом начале развития червя, а сами проглоттиды сохраняются в составе стробилы продолжительное время.
Проглоттиды обычно имеют четырёхугольную форму, а их количество в зависимости от размеров паразита варьирует от единиц до нескольких тысяч. Эту часть тела червя, представляющую собой цепочку члеников, называют стробилой.
Покровы ленточных червей отличаются глубокой специализацией поверхностных структур и выполняют самые разные функции: барьерно-защитную, пищеварительную, абсорбционную, опорную, секреторную, экскреторную, осморегу-ляционную (Куперман, 1988). Тело покрыто тегументом, состоящим из наружного цитоплазматического слоя клеток, имеющих вытянутую форму, благодаря чему ядра находятся в погружённом слое. Поверхность тегумента с многочисленными выростами - микротрихиями (пальцевидными выростами, внешне похожими на микроворсинки), форма и размеры которых варьируют на разных участках поверхности даже в пределах одного членика. В зависимости от выполняемой функции различают микротрихии трофические, принимающие непосредственное участие в сорбции пищевых веществ, и прикрепительные, позволяющие червю заякориваться в эпителии кишечника хозяина. Наружный слой тегумента подстилает мембрана, под которой располагаются кольцевые и продольные мышцы. Непосредственно под ними находятся цитоны тегумента и миоцитоны, связанные соответственно с цитоплазматической пластинкой и с мышечными отростками (рис. 2). У цестод, как и у других плоских червей, имеются пучки дорсовентральных мышц.
Рис. 2 Схема строения кожномускульного мешка цестод (из: Тихомиров и др., 2005)
цитоны тегумента
микротрихии
цитоплазматическая пластинка тегумента базальная пластинка
кольцевые мышцы
продольные мышцы
паренхима
12
Нервная система цестод ортогонального типа и напоминает решётку. В сколексе имеется парный мозговой ганглий, от которого отходят нервные тяжи, соединённые кольцевыми перетяжками. Наиболее развиты два латеральных ствола. В покровах червей располагаются чувствительные клетки, более всего их на сколексе.
Органы дыхания и пищеварительная система у ленточных червей отсутствуют. Редукция пищеварительной системы связана с особенностями обитания этих червей в организме дефинитивного хозяина: цестоды поселяются в тонком кишечнике, где находится уже переваренная и готовая к всасыванию пища.
Выделительная система ленточных червей протонефридиального типа и состоит из крупных клеток с мерцательным «пламенем», отходящих от них капилляров и системы собирательных каналов, представленных у большинства цестод двумя парами продольных каналов - дорсальной и вентральной, которые проходят по бокам стробилы. Вентральные каналы у заднего края каждого членика соединены поперечными комиссурами. Реже система собирательных каналов представлена бблыпим числом продольных каналов, соединённых между собой анастомозами.
Половая система гермафродитная и повторяется в каждом членике, в котором закладывается своя самостоятельная система половых органов, причём в одном членике может насчитываться от 2 до 14 половых комплексов (Юрахно, 1992). У видов с нерасчленённым телом может быть одиночный половой аппарат или мета-мерный ряд половых аппаратов. Развитие половой системы обычно идёт одновременно с ростом стробилы, и у большинства видов первоначально формируются органы мужской половой системы. Несколько дальше от сколекса начинает формироваться женская половая система, и таким образом комплекс половых органов становится гермафродитным. Близ заднего конца стробилы половая деятельность желез постепенно ослабевает, и сначала мужские, а затем и женские половые железы резорбируются; на их месте в членике остаётся интенсивно развивающаяся матка с яйцами.
Мужская половая система (рис. 3) состоит из округлых семенников, количество которых в каждом членике в зависимости от вида паразита колеблется от одного до нескольких сотен. От каждого семенника отходит тонкий семявыносящий каналец; канальцы сливаются в более крупные протоки, а те затем в общий семяпровод. Последний, многократно извиваясь, входит в мышечную бурсу цирруса. Общий семявыносящий проток образует расширение - семенной пузырёк, расположенный внутри или вне бурсы цирруса. Бурса открывается в половую клоаку, обычно располагающуюся на боковом крае членика. Здесь же открывается вагина. Половая клоака выступает за край членика, образуя половой сосочек. Половые поры бурсы цирруса и вагины открываются или на одной из латеральных сторон членика, или же правильно / неправильно чередуясь, в разных члениках то с одной, то с другой стороны. Сторона членика, на которой открывается половая пора, называется поральной, противоположная ей - апоральной.
Женская половая система (см. рис. 3) представлена яичником, имеющим двулопастную, двукрылую, вееровидную или иную неправильную форму и располагающимся в медуллярной паренхиме ближе к заднему краю членика и к вентральной стороне. Желточники находятся в медуллярной или кортикальной паренхиме, могут окружать половой комплекс со всех сторон или только в боковых зонах, у некоторых видов имеют вид латеральных боковых тяжей или сетчатый. Отходящий от яичника яйцевод и общий желточный проток, соединяясь вместе, впа
13
дают в оотип. От наружного полового отверстия начинается вагина, имеющая вид трубки, которая близ яичника расширяется в семяприемник, открывающийся, в свою очередь, в яйцевод перед его впадением в оотип. От оотипа отходит матка, имеющая самое различное строение. В зрелых члениках матка переполнена яйцами, которые у разных групп цестод имеют различное строение и находятся на разных стадиях эмбрионального развития.
Рис. 3 Схема строения половой системы цестод (на примере Diphyllobothrium): в - вагина; ж - желточни-ки; жп - желточные протоки; м - матка; с - семенники; сж - скорлуповая железа; сп - семяпровод; спр - семяприемник; спу -семенной пузырёк; сц -сумка (бурса) цирруса; я -яичник (из: Определитель, 1987)
м
У цестод небольших размеров оплодотворение перекрёстное. Очень крупные формы обычно встречаются в кишечнике хозяина поодиночке, что практически делает невозможным перекрёстное оплодотворение. При половом размножении у них происходит копуляция разных члеников одной особи. Самооплодотворение в пределах одного членика наблюдается очень редко.
Плодовитость цестод чрезвычайно высока; например, солитёр в год продуцирует около 600 млн. яиц, а за всю жизнь паразита (18-20 лет) их количество может достичь почти 11 млрд. (Акимушкин, 1995).
Развитие цестод сопровождается сложным метаморфозом и сменой хозяев. У одних ленточных червей развитие происходит в двух хозяевах (промежуточном и окончательном), у других - в трёх - четырёх (промежуточном, дополнительном, транспортном и окончательном).
У большинства видов цестод эмбриональное развитие яиц происходит в матке; попадающие во внешнюю среду яйца имеют относительно тонкую наружную оболочку и содержат развивающийся или вполне развитий, вооружённый шестью острыми хитиновыми крючьями эмбрион - онкосферу. Когда яйцо оказывается в кишечнике промежуточного хозяина - полихет, пиявок, ракообразных, насекомых, моллюсков, или же позвоночных животных онкосфера покидает его скорлупу, с помощью крючьев и секрета железистых клеток проходит через стенку кишечника животного и проникает в кровеносные сосуды. Током крови или лимфы онкосферы разносятся по различным органам и тканям, где оседают и в зависимости от вида цестоды развиваются в соответствующего типа личиночную стадию -
14
лярвоцисту (ларвоцисту). У некоторых червей онкосфера оседает в стенках кишечника промежуточного хозяина, где продолжает своё развитие.
У ряда ленточных червей выходящие во внешнюю среду яйца обладают твёрдой оболочкой, снабжены крышечкой на одном из полюсов, а их эмбриональное развитие происходит во внешней среде - воде. Покинувший яйцо ресничный эмбрион - корацидий (онкосфера, защищённая ресничным эмбриофором) некоторое время ведёт свободноплавающий образ жизни. Для дальнейшего развития корацидий должен попасть в промежуточного хозяина, каковым, как правило, являются веслоногие рачки, в теле которых из корацидиев выходят онкосферы,'проникающие в полость тела рачка и развивающиеся в следующую личиночную стадию -процеркоид. Процеркоид, проглоченный вторым промежуточным, или дополнительным, хозяином, проникает из его кишечника в полость тела или в некоторые органы и ткани, где развивается в плероцеркоид.
Цестоды характеризуются исключительным разнообразием личиночных форм, которые отличаются не только морфологическими особенностями, но и онтогенезом, а также экологией. Точки зрения авторов относительного номенклатурного обозначения различных типов личинок цестод значительно расходятся, что служит предметом дискуссий уже многие десятилетия (см., напр., Гуляев, 1997; Скрябин, Матевосян, 1942, 1945; Спасский, 1963; Chervy, 2002; Villot, 1883) (рис. 4, 5). В середине 20-го столетия всех паразитических личинок цестод вне зависимости от хозяина - промежуточного или дополнительного - было предложено именовать метацестодами (Wardle, McLeod, 1952). В настоящее время известно более 70 морфологических типов метацестод, что, по мнению В. Д. Гуляева, «далеко не исчерпывает их разнообразия» (Гуляев, 1997: с. 26).
И всё же, как бы ни называли личинок цестоды, в любом случае к окончательному хозяину они попадают с его пищей (рис. 6). Подобным образом происходит и заражение человека теми видами ленточных червей, которые к настоящему времени зарегистрированы у него.
Рис. 4 Типы лярвоцист представителей семейства Hymenolepididae: 1 - стафи-лоциста; 2 - уроциста; 3 -церкоциста; 4 - рамицерк; 5 - микроцерк; 6 - моноцерк; 7 - диплоциста (из: Спасский, 1963 - по: Скрябин, Матевосян, 1945)
15
J^Oncospheres develop into cysticerci in muscle
Рис. 5 Схема строения некоторых типов личинок ленточных червей: а -плероцеркоид, б - цистицеркоид, в - цис-тицерк (финна), г - ценур, д - эхинококк (из: dic.academic.ru)
Cattle (T salinate} and pigs (T solium) become infected by Ingesting vegetation contaminated by eggs or gravid proglottids
Oncospheres hatch, penetrate intestinal wall, and circulate Io musculature
A Humans infected by Ingesting w raw or undercooked infected meal
T sagmata T. sofium
0 Adults in small intestine
GDC
A* Infective Stage Л* Diagnostic Stage
Рис. 6 Схема жизненного цикла цестод на примере представителей рода Taenia: 1 - яйца или зрелые проглоттиды с фекалиями попадают во внешнюю среду; 2 - крупный рогатый скот, свиньи заражаются при поедании растительности, на которой оказались яй-ца/проглоттиды; 3 - вышедшая из яйца онкосфера проникает через стенку кишечника в мышечную ткань, где развивается в цистицерк; 4 - человек заражается через сырое или плохо обработанное мясо; 5 - сколекс прикрепляется к стенке тонкого кишечника; 6 -взрослые особи паразита в тонком кишечнике (i - инвазионная стадия; d - диагностическая стадия) (из: CDC - Taeniasis - Biology, www.cdc.gov)
16
Suolex attaches to intestine
Eggs or gravid proglottids in feces and passed into environment
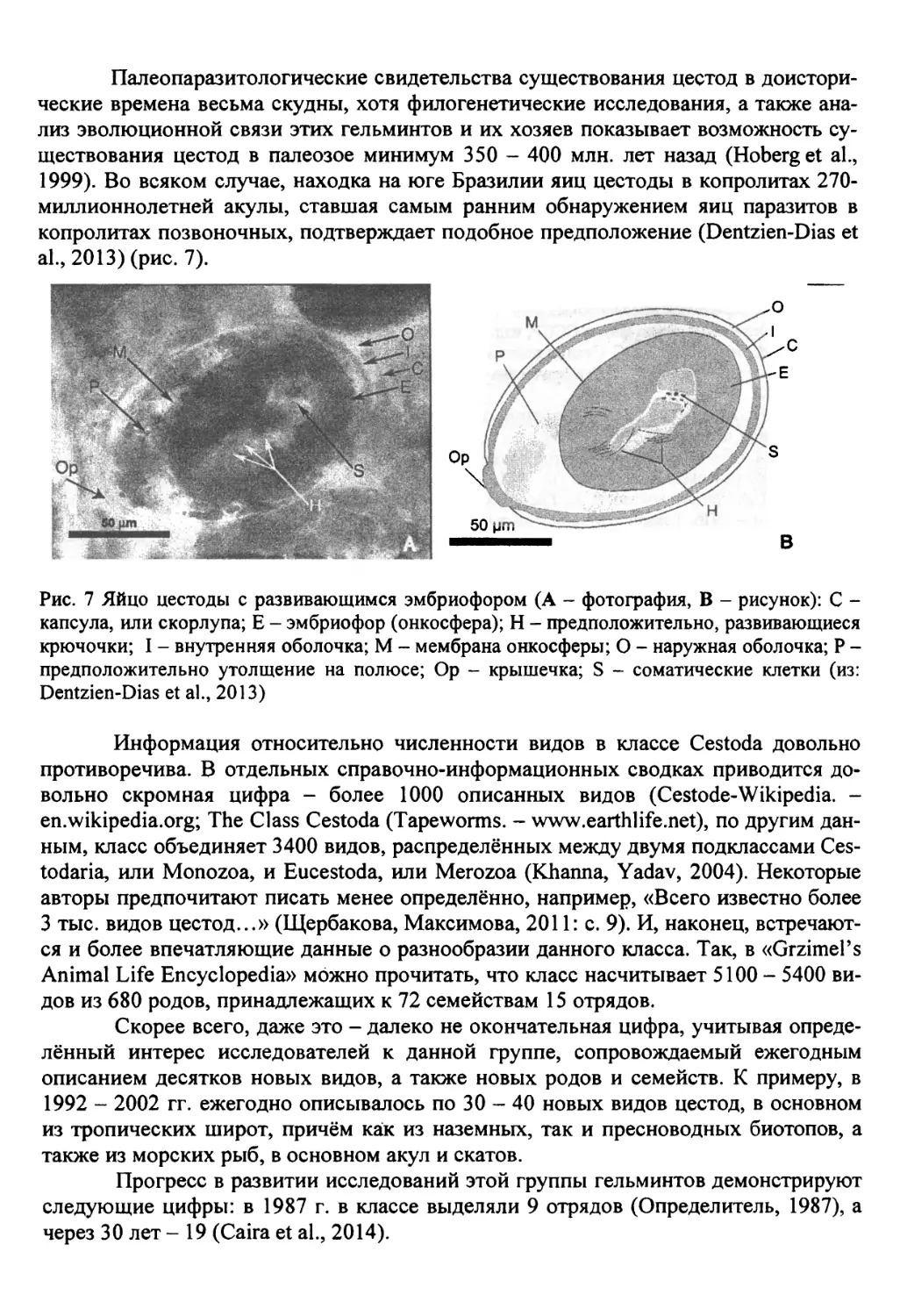
Палеопаразитологические свидетельства существования цестод в доисторические времена весьма скудны, хотя филогенетические исследования, а также анализ эволюционной связи этих гельминтов и их хозяев показывает возможность существования цестод в палеозое минимум 350 - 400 млн. лет назад (Hoberg et al., 1999). Во всяком случае, находка на юге Бразилии яиц цестоды в копролитах 270-миллионнолетней акулы, ставшая самым ранним обнаружением яиц паразитов в копролитах позвоночных, подтверждает подобное предположение (Dentzien-Dias et al., 2013) (рис. 7).
Рис. 7 Яйцо цестоды с развивающимся эмбриофором (А - фотография, В - рисунок): С -капсула, или скорлупа; Е - эмбриофор (онкосфера); Н - предположительно, развивающиеся крючочки; I - внутренняя оболочка; М - мембрана онкосферы; О - наружная оболочка; Р -предположительно утолщение на полюсе; Ор - крышечка; S - соматические клетки (из: Dentzien-Dias et al., 2013)
Информация относительно численности видов в классе Cestoda довольно противоречива. В отдельных справочно-информационных сводках приводится довольно скромная цифра - более 1000 описанных видов (Cestode-Wikipedia. -en.wikipedia.org; The Class Cestoda (Tapeworms. - www.earthlife.net), по другим данным, класс объединяет 3400 видов, распределённых между двумя подклассами Ces-todaria, или Monozoa, и Eucestoda, или Merozoa (Khanna, Yadav, 2004). Некоторые авторы предпочитают писать менее определённо, например, «Всего известно более 3 тыс. видов цестод...» (Щербакова, Максимова, 2011: с. 9). И, наконец, встречаются и более впечатляющие данные о разнообразии данного класса. Так, в «Grzimel’s Animal Life Encyclopedia» можно прочитать, что класс насчитывает 5100 - 5400 видов из 680 родов, принадлежащих к 72 семействам 15 отрядов.
Скорее всего, даже это - далеко не окончательная цифра, учитывая определённый интерес исследователей к данной группе, сопровождаемый ежегодным описанием десятков новых видов, а также новых родов и семейств. К примеру, в 1992 - 2002 гг. ежегодно описывалось по 30 - 40 новых видов цестод, в основном из тропических широт, причём как из наземных, так и пресноводных биотопов, а также из морских рыб, в основном акул и скатов.
Прогресс в развитии исследований этой группы гельминтов демонстрируют следующие цифры: в 1987 г. в классе выделяли 9 отрядов (Определитель, 1987), а через 30 лет - 19 (Caira et al., 2014).
Наибольшее число патогенных для человека видов цестод относится к отрядам Pseudophyllidea и Cyclophyllidea из подкласса Eucestoda (Year et al., 2013).
Цитируемая литература
Акимушкин И. И. Жизнь солитера // Мир животных. Беспозвоночные. Ископаемые животные. - 3-е изд. - М.: Мысль, 1995. - 4. - С. 78.
Гуляев В. Д. Классификация метацестод как система жизненных форм паразитических личинок цестод И Бюл. Моск. О-ва испытателей природы. Отд. Биол.,- 1997. -102, 2. - С. 26 - 33.
Куперман Б, И. Функциональная морфология низших цестод: онтогенетический и эволюционный аспекты. - Л.: Наука, 1988. - 167 с.
Определитель паразитов пресноводных рыб. Т. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - С. 7. - (Определители по фауне СССР, изд. Зоол. ин-том АН СССР; Вып. 149).
Скрябин К. И., Матевосян М. С. Стадии постэмбрионального развития цестод семейства Hymenolepi-didae и опыт установления морфологических типов их ларвоцист // Докл. АН СССР. - 1942. - 35, 3. -С. 89-92.
Скрябин К. И., Матевосян М. С. Ленточные гельминты - гименолепидиды домашних и охотничье-промысловых птиц. - М., 1945. - 486 с.
Спасский А. А. Гименолепидиды - ленточные гельминты диких и домашних птиц // Основы цестодо-логии. - Под ред. акад. К. Й. Скрябина. - М.: Изд-во АН СССР, 1963. - 2, часть первая. - 417 с.
Тихомиров И. А., Добровольский А. А., Гранович А. И. Малый практикум по зоологии беспозвоночных.
Часть 1. - М. - СПб: Товарищество научных изданий, 2005. - 304 с.
Щербакова М. В., Максимова Ю. В. Малый практикум по зоологии беспозвоночных. Часть 2. Черви, моллюски, членистоногие, иглокожие. Практикум. - Томск: Томский гос. унив-т, 2011. - 74 с.
Юрахно М. В. О систематике и филогении некоторых групп цестод отряда Pseudophyllidea // Паразитология. -1992. - 26, 2. - С. 449 - 461.
Caira J. N„ Jensen К., Waeschenbach А„ Olson Р. D., Littlewood D. I. J. Orders out of chaos - molecular phylogenetic reveals the complexity of shark and stingray tapeworm relationships // Int. J. Parasitol. - 2014. -44, l.-P. 55-73.
Chervy L. The terminology of larval cestodes or metacestodes П Syst. Parasitol. - 2002. - 52, l.-P. 1 - 33.
Dentzien-Dias P. C, Poinar G. Jr, de Figueiredo A. E. Q., Pacheco A. C. L., Horn B. L. D., Schultz C. L.
Tapeworm eggs in a 270 million-year-old shark coprolite // PLoS ONE. - 2013. - 8, 1: e55007. doi:10.1371/joumal.pone.0055007.
GrzimeTs Animal Life Encyclopedia. Encyclopedia.com.5 Dec.2016 (on-line: http.7/www.encyclopedia, com).
Hoberg E. P., Gardner S L., Campbell R. A. Systematics of the Eucestoda: advances toward a new phylogenetic paradigm, and observations on the early diversification of tapeworms and vertebrates // Syst. Parasitol. -1999.-42, l.-P. 1-12.
Khanna D. R., Yadav P. R. Biology of Helminthes. - Discovery Publ. House, New Dehli, 2004. - 449 pp. VillotA. M&noire sur les cystiques des T6nias // Ann. Sci. natur. Zool. - 6 S6r. - 1883. -15, 4. - P. 1-61. Wardle R. A., McLeod J. A. The Zoology of Tapeworms. - Univ. Minnesota Press, Minneapolis, 1952. - 780
PP-
Yera H, Kuchta R, Brabec J., Lapierre A. R., Dupouy-Camet J. First identification of eggs of the Asian fish tapeworm Bothriocephalus acheilognathi (Cestoda: Bothriocephalidea) in human stool 11 Parasitol. Intern. -2013.-62,3.-P. 268-271. DOI: 10.1016/j.parint.2013.02.001.
18
Глава 2
ЛЕНТОЧНЫЕ ЧЕРВИ -
НЕЖЕЛАТЕЛЬНЫЕ ПОСЕЛЕНЦЫ НАШЕГО ОРГАНИЗМА
Для удобства восприятия материала все семейства цестод, чьи представители обнаружены у человека и чьё попадание к нему так или иначе связано с пищей, расположены в алфавитном порядке вне зависимости от принадлежности к тому или иному отряду.
Начнём с семейства Anoplocephalidae.
Семейство Anoplocephalidae Cholodkovsky, 1902
Семейство Anoplocephalidae относится к отряду циклофиллидей (Cyclophyllidea), чьи представители характеризуются наличием на сколексе 4 присосок и хоботка, часто вооружённого одинарной или двойной короной крючьев; зрелая матка без наружного отверстия, а наполненные яйцами членики отделяются от стробилы и выносятся во внешнюю среду.
Описание (по: Спасский, 1951; Olsen, 1974). Цестоды от мелких и средних до относительно крупных размеров, со сколексом, лишённым крючьев и хоботка, но с 4 присосками. Проглоттиды краспедотного типа, обычно вытянуты в поперечном направлении, с 1 или 2 наборами половых органов и латерально расположенными половыми порами. Семенники обычно многочисленные. Имеются обособленные желточник и тельце Мелиса. Матка в виде поперечной трубки, образующей отростки или карманы, или же в виде общей сети из трубочек. Вагина и семяпроток проходят дорсально к осморегуляторным каналам и нервным тяжам. Вагина атрофируется и исчезает до созревания членика. Развитие зародыша происходит в полости матки. Яйца в типичных случаях снабжены грушевидным аппаратом, - специфическим парным рожковидным придатком оболочки, окружающей зародыш. Лярвоци-ста типа цистицеркоида. Типовой род - Anoplocephala Blanchard, 1848.
В жизненном цикле аноплоцефалид участвуют два хозяина: дефинитивные - рептилии, птицы и млекопитающие (в основном) и промежуточные - обычно панцирные клещи орибатиды (Acarina). Орибатиды - исключительно многочисленная, распространённая по всей планете группа членистоногих, чьи размеры колеблются от 0.2 до 1.4 мм; питаются разнообразной пищей - живыми и мёртвыми растениями и грибами, лишайниками, падалью, некоторые виды являются неспециализированными хищниками. У орибатид 127 видов из 27 семейств выявлены личиночные стадии 27 видов аноплоцефалид из 14 родов (Denegri, 1993). У отдельных родов этих червей в качестве промежуточных хозяев известны и другие членистоногие - сеноеды и коллемболы, или ногохвостки (Denegri et al., 1998).
Яйца цестоды попадают во внешнюю среду с фекальными массами дефинитивного хозяина, находясь в оторвавшихся звеньях стробилы. Во внешней среде они выживают не более суток, а зимние температуры вообще действуют на них губительно. Панцирные клещи активно поедают зрелые яйца аноплоцефалид, содержащие онкосферу. Попав вместе с пищей в организм промежуточного хозяина, онкосфера выходит из оболочек яйца и через стенку кишечника проникает в полость его тела, где и происходит её развитие. Основным фактором, регулирующим сроки
19
развития личинок и достижения процеркоидами инвазионного состояния, является температура.
Показано, что на пастбищах, например, в местах выпаса овец, заражённость клещей достигает 3 - 4 %, при этом в одном клеще может находиться от 4 до 13 личинок. В итоге на одном акре пастбища насчитывается до 400 тыс. цистицеркои-дов, а каждая овца с каждым фунтом травы заглатывает до 1200 микроскопически мелких клещей (Olsen, 1974).
Практически во всех публикациях, в которых идёт речь о возможности паразитирования или же находках аноплоцефалид у людей, утверждается, что заражение человека носит случайный характер и связано с заглатыванием промежуточных хозяев этих гельминтов. Ещё в середине прошлого столетия А. А. Спасский подчёркивал: «Медицинское значение цестод изучаемой группы сравнительно невелико» (Спасский, 1951; стр. 37). И всё же подобные случаи время от времени регистрируют в самых разных странах мира, а посему ниже приведено описание всех представителей аноплоцефалид, когда-либо обнаруженных у человека.
В справочно-информационной сводке «Медицинская гельминтология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru/Ces-toda) перечислены следующие виды семейства Anoplocephalidae: Bertiella mucrona-ta (Meyner, 1895), В. studeri (Blanchard, 1891), Inermicapsifer cubensis (Koura 1938), I. madagascariensis (Davaine, 1870), Mathevotaenia symmetrica (Baylis, 1927) viMoniezia expansa (Rudolphi, 1810). (Небольшое замечание: в цитируемом перечне в названии рода Moniezia «исчезла» буква -е-). В сводке (Ashford, Crewe, 2003) упомянуто о регистрации у человека Killigrewia sp. (Chowdhury, Tada, 2001). И, наконец, предполагается, что к человеку от обезьян могут передаваться цестоды рода Anoplocephala (Dolezalova et al., 2015). Всего в семействе известно 16 родов.
Цитируемая литература
Спасский А. А. Аноплоцефаляты - ленточные гельминты домашних и диких животных // Основы цес-тодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1951. -1. - 735 с.
Ashford R. W., Crewe W. The parasites of Homo sapiens: An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - P. 85.
Denegri G. Review of oribatid mites as intermediate hosts of tapeworms of the Anoplocephalidae // Exp. Appl. Acarol. - 1993. -17, 8. - P. 567 - 580.
Denegri G., Bernadina W., Perez-Serrano J., Rodriguez-Caabeiro F. Anoplocephalid cestodes of veterinary and medical significance: a review // Folia Parasitol (Praha). - 1998. - 45,1. - P. 1-8.
Dolezalova J., Vallo P„ Petrzelkova K. J., Foitova I. et al. Molecular phylogeny of anoplocephalid tapeworms (Cestoda: Anoplocephalidae) infecting humans and non-human primates // Parasitology. - 2015. -142, 10.-P. 1278-1289. doi: 10.1017/S003118201500058X.
Olsen O. W. Animal parasites: their life cycles and ecology. - Dover Publ. Inc., New York, 1974. - 564 pp.
Род Bertiella Stiles et Hassall, 1902
Синонимы (no: Denegri et al., 1998):
Bertia Blanchard, 1891
Parabertiella Nybelin, 1917
Prototaenia Baer, 1927
Indotaenia Singh, 1962 Beveridgia Spasski, 1988
В 1891 г. P. Бланшар (Blanchard, 1891) обосновал новый род цестод, который назвал Bertia. Однако это название оказалось преоккупированным: несколькими годами ранее так назвали 20
уникальный род наземных моллюсков Bertia Апсеу, 1888. Учитывая данное обстоятельство, в 1902 г. Bertia применительно к цестодам было заменено на другое, но, тем не менее, близкое название - Bertiella (Stiles, Hassall, 1902).
Описание (по: Спасский, 1951). Цестоды средних или крупных размеров с характерными чертами семейства. Мускулистые присоски располагаются на сколексе на своеобразных разращениях, принимающих иногда стебельчатый характер. Стробила плотная, широкая, с хорошо развитой мускулатурой. Экскреторная система в виде двух пар продольных стволов; вентральные стволы соединяются в задней части каждого членика поперечным анастомозом. Половой аппарат одинарный. Половые поры чередуются. Многочисленные семенники находятся в передней части среднего поля каждого членика. Яичник дольчатый, располагается в поральной половине членика. Вагина открывается позади сумки цирруса, образуя объёмистый семяприемник. Первоначально матка закладывается в виде поперечной трубки, затем по мере развития принимает форму лопастного мешка. Яйца с грушевидным аппаратом. Типовой вид - Bertiella studeri (Blanchard, 1891) Stiles et Hassall 1902.
В 1950-е годы в роде Bertiella насчитывалось 17 видов (Спасский, 1951), а через 50 лет - уже 29 (Bhagwant, 2004). Согласно последней сводке (http://eol. org/pages...overview), род объединяет 15 видов. Многие исследователи подчёркивают трудности в идентификации видов данного рода.
Виды Bertiella - обычные паразиты тонкого кишечника сумчатых, грызунов, шерстокрылов и антропоморфных приматов родов Anthropithecus, Cercopithe-cus, Cynomolgus, Hylobates, Macaca, Pan, Papio, Simya, Troglodytes и других, но при некоторых обстоятельствах могущие заражать и человека. На Филиппинах цестод данного рода обнаружили у собаки (Africa, Garcia, 1935).
Жизненный цикл Bertiella, как и у всех аноплоцефалид, включает смену
двух хозяев - промежуточного и дефинитивного (рис. 8).
Рис. 8 Схема жизненного цикла Bertiella'. 1 - яйцо с фекалиями попадает во внешнюю среду; 2 -клещи заглатывают яйца; 3 - развитие цистицер-коида в клеще; 4 - дефинитивные хозяева заражаются, поедая промежуточных хозяев; 5 -взрослые черви в тонком кишечнике; 6 - сколекс; 7 - человек заражается, случайно заглатывая промежуточного хозяина (рисунок размещён online: www.dpd.cdc.gov) (i - инвазионная и d - диагностическая стадии)
Практически
все случаи регистрации бертиелл у человека связаны с Bertiella studeri и В. тисго-
nata, и чаще всего наблюдаются у детей.
21
Bertiella studeri (Blanchard, 1891) Stiles et Hassall 1902 [=Bertia studeri Blanchard, 1891; =Bertia satyri Blanchard, 1891; =Bertiella satyri (Blanchard, 1891) Stiles et Hassall, 1902] (рис. 9, 10). Синонимы приведены по работе: Faust, 1949. А. А. Спасский (1951) перечисляет в синонимах В. studeri 9 видов.
Впервые паразит описан на материале от шимпанзе (Studer, 1880; цит. по: Спасский, 1951), однако автор находки никак не назвал найденных им цестод. В 1891 г. Р. Бланшар (Blanchard, 1891), обнаружив подобных же червей, обосновал для них новый род Bertia с типовым видом В. studeri (название виду - studeri - было дано в честь его первооткрывателя). Одновременно по экземплярам, полученным из орангутанга, Р. Бланшар описал новый вид Bertia - В. satyri, который многие исследователи рассматривают синонимом В. studeri. Неадекватное описание представителей Bertiella, и в частности В. studeri, по мнению ряда авторов (Galan-Puchades et al., 2000), вынуждает рассматривать данный вид как сборный - «В. studeri species complex». И, наконец, несколько лет назад появилась публикация (Foi-tova et al., 2011), авторы которой восстанавливают самостоятельность В. satyri.
Рис. 9 Bertiella studeri, сколекс (А), зрелый проглоттид (В), яйцо (С) (из: Faust, 1949 по: А, В - Chandler, 1925;
С-Blanchard, 1913)
Рис. 10 Bertiella studeri: членик с недоразвитым вторым яичником (Л) и сколекс (j5) (из: Спасский, 1951 - по: Stunkard, 1940)
Общая длина тела червей 15 - 45 см при максимальной ширине до 15 мм. Опубликованы сведения о находках и более крупных особей: 70 см - от человека (Adams, Webb, 1933), 80 см - от шимпанзе (Baer, 1927) (цит. по: Спасский, 1951). Сколекс поперечным диаметром 0.475 - 0.620 мм, отделён от шейки. Э. Фауст пишет о наличии на сколексе рудиментарного невооружённого хоботка (Faust, 1949). Заметные овальные присоски размерами 0.220 х 0.150 мм (Faust, 1949) или 0.18 -0.19 (Stunkard, 1940). Стробила состоит из 400 сегментов. В каждом членике от 225 22
до 265 семенников (Bhagwant, 2004; Stunkard, 1940). Семенники располагаются в шести слоях непрерывной полосой близ дорсальной стенки членика в передней части срединного поля. Половые поры нерегулярно чередуются. Бурса цирруса короткая, 0.25 - 0.32 мм, не достигает экскреторных протоков. Яичник, а также скор-луповая железа и семяприемник расположены на поральной стороне сегмента. Дистальная (копулятивная) часть вагины расширена и окружена толстым слоем железистых клеток. Размеры округло-овальных яиц (по разным авторам): 40 - 60 (Stunkard, 1940), 45 - 46 х 49 - 50 (Faust, 1949), 40 - 50 (Richard-Lenoble et al., 1986), 51.1 x 48.7 (Galan-Puchades et al., 1997b), 50 - 65 x 30 - 45 (в среднем 58.05 x 39.2) (Bhagwant, 2004), 37.93 - 50.0 (в среднем 45.31) (Sun et al., 2006) или же 49 - 60 x 36 - 40 pm (Lozano et al., 2010). Наружная оболочка яйца прозрачная. Грушевидный аппарат 25 -33 x 18-28 рш, его рожки продолжаются в филаменты, достигающие наружной оболочки яйца.
Первое сообщение о заражении человека В. studeri появилось более 100 лет назад - в 1913 г. (Blanchard, 1913). Тогда описывался случай выявления в фекалиях 8-летней девочки с о. Маврикий головки и сегментов цестоды, ранее описанной от приматов как В. satyri (Blanchard, 1891). В монографии 1949 г. Э. Фауст перечислил всего несколько находок В. studeri (=В. satyri) у человека: на Маврикии, в Индии, Индонезии, на Филиппинах и в Вест-Индии. Однако к 1997 г. география подобных случаев значительно расширилась: В. studeri зарегистрировали у человека в Йемене, Габоне, Конго, Восточной Африке, Индии, Индонезии (чаще всего на Суматре, а также на Яве, Калимантане и Борнео), Таиланде, Сингапуре, на Филиппинах, о. Маврикий, в США, Великобритании, Испании, России, Вест-Индии (см. сводку: Denegri, Perez-Serrano, 1997), в Шри-Ланке (Edirisinghe, Cumararajan, 1976 - в цитируемой выше сводке отсутствует), Кении (Galan-Puchades et al., 1997а), Экваториальной Гвинее (Galan-Puchades et al., 1997b), Японии (Ando et al., 1996). Замечу, что в ряде случаев авторы определяли цестод как В. satyri.
В последующие годы заражение человека В. studeri зафиксировали в Бразилии (Lopes et al., 2015), Вьетнаме (Xuan et al., 2003), Китае (Sun et al., 2006), Африке (Galan-Puchades et al., 2000), была подтверждена встречаемость гельминта у людей на Маврикии (Bhagwant, 2004; Taleb-Hossenkhan, Bhagwant, 2012), в Экваториальной Гвинее (Lozano et al., 2010), Индии (Malik et al., 2013).
Чаще всего инвазию В. studeri выявляют у детей от полутора лет и старше и вне зависимости от пола ребёнка (Adams, Webb, 1933; Africa, Garcia, 1935; Bhagwant, 2004; Blanchard, 1913; Buckley, Fairley, 1950; Desowitz et al., 1961; Edirisinghe, Cumararajan, 1976; Jones et al., 1971; Kagei et al., 1992; Kwo, Koh, 1968; Lopes et al., 2015; Lozano et al., 2010; Margono, 1989; Panda D., Panda M., 1994; Richard-Lenoble et al., 1986; Stunkard et al., 1964; Xuan et al., 2003 и др.).
Заражение человека не имеет явно выраженных специфических симптомов, хотя иногда наблюдаются эпизодические боли в животе, периодические поносы, неспецифический гастроэнтерит, запор, отсутствие аппетита, потеря веса, общая усталость. К слову, подобные симптомы проявляются и при паразитировании у человека других гельминтов, в частности отдельных видов нематод или же трематод. В очень редких случаях пациенты могут жаловаться на сильные, периодические абдоминальные боли с перемежающейся рвотой. У детей часто выражены боли в животе, потеря аппетита и кратковременная диарея. Тем не менее, в Великобритании описан случай, когда у 6-летнего мальчика, после его двухлетнего проживания
23
в Адене, в течение 6 месяцев периодически выходили проглоттиды бертиеллы, при этом ребёнок не жаловался на кишечное расстройство (Thompson et al., 1967; вид цестоды - Bertiella sp. - авторы не определяли).
Первым признаком заражения В. studeri является появление в фекальных массах очень широких фрагментов цестоды, число члеников в которых может достигать 20. Судя по публикациям, от предполагаемого момента заражения бертиел-лой, что, впрочем, установить невероятно трудно, до появления в кале фрагментов червя обычно проходит до нескольких месяцев (Bhagwant, 2004; Jones et al., 1971). По этой причине вызывает определённые вопросы случай, имевший место в Экваториальной Гвинее (Galan-Puchades et al., 1997b). В 1996 г. 50-летняя женщина родом из племени банту обратилась в медицинское учреждение за помощью, поскольку обнаружила в кале непонятные белые образования, которые и принесла для «опознания». Одновременно она пожаловалась на абдоминальные боли, беспокоившие её с 1990 г., т.е. в течение 6 лет Выявленные в фекалиях пациентки образования оказались проглоттидами В. studeri. Однако поскольку время заражения было неизвестно, то вполне возможно, что столь продолжительный период неприятного дискомфорта был связан с заражённостью больной другими паразитами, в частности филяриями, власоглавом, кишечной амёбой, тогда же найденными у неё.
Для лечения, т.е. изгнания бертиелл из организма, обычно применяют ник-лозамид (niclosamide) (Bolbol, 1985; Galan-Puchades et al., 1997b; Lozano et al., 2010; Thompson et al., 1967; Xuan et al., 2003) или празиквантел (Galan-Puchades et al., 1997b; Werner, 2014). Мебендазол, как оказалось, не давал желаемого результата. Дозы и курс приёма препаратов - в компетенции медицинских работников.
Bertiella mucronata (Meyner, 1895) Stiles et Hassall, 1902 [-Taenia (Bertia) mucronata Meyner, 1895; =Bertia mucronata (Meyner, 1895) Stiles, 1896]. Впервые описан на материале от обезьян под названием Taenia (Bertia) mucronata Meyner, 1895. Видовое название цестоды: mucronata - остроконечный.
В «Энциклопедии природы» (ZipcodeZoo - the free nature encyclopedia; zipcodezoo.com) неожиданно для себя обнаружила (дословно): «.Bertiella mucronata is a species within the kingdom Fungi, family Teichosporaceae». Эта информация основана на сводке: Lumbsch Н. Т., HuhndorfS. М. (ed.) 2007. Outline of Ascomycota - 2007. Myconet 13: 1 - 58. Действительно, в царстве грибов в составе семейства Teichosporaceae М. Е. Barr 2002 значится род Bertiella (Sacc.) Sacc. & Р. Syd.
В. mucronata — близкий к В. studeri вид. Отличается от него размерами железистого участка вокруг вагины, количеством семенников в члениках, размерами яиц и грушевидного аппарата (Acha, Szyfres, 2003). Кроме того, предполагают, что исторически В. mucronata приурочен к приматам Западного полушария, а В. studeri - к таковым Восточного. Длина червей достигает 15 см (из: Спасский, 1951), по другим данным, до 40 (www.cdc.gov/CDC-DPDx-Bertiella infection) и даже 45 см (El-Dib et al., 2004). В каждом членике около 140 семенников, расположенных вдоль его переднего края узкой лентой в 2 - 3 слоя. Бурса цирруса удлинённая, до 0.5 мм. Яйца диаметром 40 - 46 х 36 - 40 pm (Lozano et al., 2010).
Описание первой находки В. mucronata у человека появилось в 1928 г. (Cram, 1928). Именно так цитируемый автор определил цестод, которых передал ему Д-р Alberto Recio, в свою очередь, получивший материал от человека и трёх особей шимпанзе в Гаване. Обезьяны, кстати, были завезены на Кубу с африканского континента, а пациент ранее жил на Канарских о-вах.
24
В следующем сообщении описывался случай заражения цестодой 29-летнего местного жителя в Бразилии (Pessoa, 1930).
В последующие годы появлялась информация о спорадических находках В. mucronata у человека в Аргентине (Bacigalupo, 1949; Feldman et al., 1983; Garaguso, Mendez, 1983), Бразилии (Costa et al., 1967), Парагвае (D’Alessandro et al., 1963).
Симптомы заражения сходны с таковыми, наблюдаемыми при инвазии В. studeri. И только однажды описан случай проявления у больного нервозности, гипертонии, тахикардии, желудочно-кишечного недомогания и анального зуда (Feldman et al., 1983).
Итак. Как видно из анализа имеющихся данных, к настоящему времени у человека достоверно паразитирование двух видов Bertiella - В. studeri и В. mucronata. Однако если признать факт существования самостоятельного вида В. satyri, то речь будет идти уже о 3 видах рода, встречающихся у человека. Отдельные авторы, обнаруживая бертиелл у человека, предпочитали определять цестод только до рода (Achir et al., 2008; Bolbol, 1985; El-Dib et al., 2004; Jones et al., 1971; Pafd et al., 2003; Silva et al., 2011; Thompson et al., 1967), иные же отмечали их сходство с В. studeri/B. mucronata, но всё же оставляли обнаруженный вид как Bertiella sp. (Furtado et al., 2012).
Многие исследователи обращают внимание на рост числа случаев регистрации Bertiella не только у человека, но, прежде всего, у приматов как в тропических и субтропических регионах, так и на других широтах, и подчёркивают зоонозное значение этих цестод (Denegri, Perez-Serrano, 1997; Pafd et al., 2003; Santa Cruz et al., 1995). Небезынтересен и тот факт, что зачастую заражение людей бертиеллой происходит во время их проживания в субтропиках или тропиках, в частности в африканских странах (Buckley, Fairley, 1950; Galan-Puchades et al., 1997a; Jones et al., 1971; Thompson et al., 1967 и др.). В целом вопрос «транспортировки» паразита из одного региона в другой заслуживает самого пристального внимания. К примеру, во всех случаях регистрации бертиеллы у человека в Саудовской Аравии (Bolbol, 1985; El-Dib et al., 2004), Кувейте (Shoura, Morsy, 1974) и Алжире (Achir et al., 2008) носителями инвазии оказывались выходцы из Йемена. Кстати, 6-летний британец, у которого обнаружили бертиеллу, в течение двух лет жил с родителями в Йемене в Адене (Thompson et al., 1967).
Однако основную роль в распространении бертиелл' по странам и континентам всё же играют приматы - естественный источник инвазии человека. Кстати, у приматов специфические симптомы заражения цестодами не выражены, в связи с чем практически невозможно определить, заражено животное или нет. Известно, что обезьян активно перемещают в разные регионы для пополнения экспозиций в зоопарках и зоосадах, для лабораторных исследований и даже в качестве домашних животных. Полагают, например, что на Маврикий В. studeri попала в 17-м столетии вместе с обезьянами, завезёнными из Юго-Восточной Азии (Bhagwant, 2004).
Заражение обезьян происходит при заглатывании ими инвазированных клещей вместе с пищей. В равной степени и человек может заразиться, случайно заглотнув клещей с пищей, контаминированной частицами почвы, в которой могли оказаться эти микроскопические мелкие членистоногие. Подобное обычно происходит в тех случаях, когда люди находятся в близком контакте с обезьянами, которых содержат дома или в зоопарках, или же когда на территории, прилегающей к домашним строениям, обитает большое количество обезьян. Показателен в этом 25
отношении случай заражения детей на Маврикии, когда кишечное расстройство проявилось у них через месяц после употребления в пищу гуавы земляничной, которую, как полагают родители, дети могли подобрать с земли и съесть во время прогулки в близлежащий лес, населённый обезьянами (Bhagwant, 2004).
Цитируемая литература
Спасский А. А. Аноплоцефаляты - ленточные гельминты домашних и диких животных И Основы цес-тодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1951. - 1. - С. 226 - 254.
Acha Р. Н., Szyfres В. 2. Cestodiases / Zoonoses and communicable diseases common to man and animals. 3rd Ed. Vol. III. Parasitoses. - Wash., D.C.: РАНО, 2003. - Sci. & Tech. Publ. No. 580. - P. 160 - 161.
Achir L, Zait H., Hamrioui B. [Human infection due to Bertiella sp. (Cestoda: Anoplocephalidae) in a man originating from Yemen in Algeria] // Bull. Soc. Pathol. Exot. - 2008. - 101, 2. - P. 107 - 108.
Adams A. R. D., Webb L. Two further cases of human infection with Bertiella studeri (Blanchard, 1891) Stiles and Hassall, 1902, with some observations on the probable synonymy of the specimens previously recorded from man // Ann. Trop. Med. Parasit. - 1933. - 27, 3. - P. 471 - 475.
Africa C, Garcia E. The occurrence of Bertiella in man, monkey and dog in the Philippines 11 Philip. J. Sci. -1935.-56, l.-P. 1-11.
Ando K„ Ito T., Miura K., Matsuoka H. Infection of an adult in Mie Prefecture, Japan by Bertiella studeri // Southeast Asian J. Trop. Med. Public Health. - 1996. - 27, l.-P. 200 - 201.
Bacigalupo J. Primer caso humano de Bertiella sp. en Sud Am6rica // Rev. Soc. mex. Hist. nat. - 1949. - 10. -P. 177- 183.
Baer J. G. Monographie des Cestodes de la familie des Anoplocephalidae И Bull. biol. Fr. Belg., Paris. -1927.-Suppl. 10.-P. 1-241.
Bhagwant S. Human Bertiella studeri (family Anoplocephalidae) infection of probable Southeast Asian origin in Mauritian children and an adult H Am. J. Trop. Med. Hyg. - 2004. - 70, 2. - P. 225 - 228.
Blanchard R. Sur les helminthes des primates antropoides // Мёт. Soc. Zool. Fr. - 1891. - 4, 1-2. - P. 186 — 196.
Blanchard R. Bertiella satyri de TOrang-outang, est aussi parasite de 1’homme H Bull. Acad. M£d., Paris. 3 sdr. - 1913.-69.-P. 285-296.
Bolbol A. Bertiella sp. infection in man in Saudi Arabia П Ann. trop. Med. Parasit. - 1985. - 79, 6. - P. 643 -644.
Buckley J., Fairley N. Demonstration of a cestode, Bertiella'. a rare parasite in man and recorded for the first time as a human infection in Africa // Trans, roy. Soc. trop. Med. Hyg. - 1950. - 44, l.-P. 2.
Chandler A. C. New records of Bertiella satyri (Cestoda) in man and apes H Parasitology. - 1925. - 17, 4. -P. 421-425.
Costa H. M. de, Correa L., Brener Z. [A new human case of a parasitic infection caused by Bertiella mucro-nata (Meyner, 1895) Stiles & Hassal, 1902 (Cestoda - Anoplocephalidae)] // Rev. Inst. Med. Trop. S2k> Paulo. - 1967. - 9, 2. - P. 95 - 97.
Cram E. B. A species of the cestode genus Bertiella in man and the chimpanzee in Cuba // Amer. J. Trop. Med. - 1928. - 8. - P. 339 - 344.
D'Alessandro A., Beaver P. C, Masi Pallares R. Bertiella infection in man in Paraguay // Amer. J. Trop. Med. - 1963. - 12. - P. 193 - 198.
Denegri G. M., Bernardina W., Perez-Serrano J., Rodriguez-Caabeiro F. Anoplocephalid cestodes of veterinary and medical significance П Folia Parasitol. (Praha). - 1998. - 45, 1. - P. 1 - 8.
Denegri G. M., Perez-Serrano J. Bertiellosis in man: a review of cases И Rev. Inst. Med. Trop. SSo Paulo. -1997.-39, 2.-P. 123- 127.
Desowitz R., Wong H„ Fernando M. The first record of human infection with Bertiella studeri in Malaya // J. Helminthol. - 1961. - 35, 1. - P. 207 - 208.
Editisinghe J. C, Cumararajan S. M. The first record of Bertiella studeri infection in a child from Sri Lanka И Ceylon Med. J. - 1976. - 21, 2. - P. 137 - 140.
El-Dib N. A., Al-Rufaii A., El-Badry A. A., Al-Zoheiry A. A., Abd El-aal A. A. Human infection with Bertiella studeri in Saudi Arabia // Saudi Pharmaceutical J. - 2004. - 12, 4. - P. 168 - 169.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 279 - 281.
Feldman R.,Denegri G., Avolio J., Cantu N. Nuevo caso humano de teniasis por Bertiella mucronata Meyner, 1895 (Cestoda - Anoplocephalidae) en la Argentina. I. Diagndstico у tratamiento // Acta Bioqui'm. clin. La-tinoam. - 1983. - 17, 4. - P. 571 - 578.
26
Furtado A. P., Batista E. de J. O., Gongalves E. C., Silva A. M. H. O. et al. Human bertielliasis in Amazonia: Case report and challenging diagnosis // PLoS Negl. Trop. Dis. - 2012. - 6, 6. - el580. doi: 10.1371/ jour-nal.pntd.0001580.
Galan-Puchades M. T, Fuentes M. V., Mas-Coma S. Human Bertiella studeri in Spain, probably of African origin H Am. J. Trop. Med. Hyg. - 1997a. - 56, 6. - P. 610 - 612.
Galan-Puchades M. T, Fuentes M. V., Mas-Coma S, Morphology of Bertiella studeri (Blanchard, 1891) sen-su Stunkard (1940) (Cestoda: Anoplocephalidae) of human origin and a proposal of criteria for the specific diagnosis of bertiellosis // Folia Parasitol. (Praha). - 2000. - 47, 1. - P. 23 - 28.
Galan-Puchades M. T, Fuentes M. V., Simarro P. P., Mas-Coma S. Human Bertiella studeri in Equatorial Guinea // Trans. R. Soc. Trop. Med. Hyg. - 1997b. - 91, 6. - P. 680.
Garaguso P., Mendez O. Primer caso argentine de parasitismo humano por Bertiella mucronata (Meyner, 1895) // Congreso Latinoamericano de Parasitologia. - SSo Paulo, 1983. - Resumes. - P. 232.
Jones R,, Hunter H, van Rooyen С. E. Bertiella infestation in a Nova Scotia child formerly resident in Africa I I Canad. Med. Ass. J. - 1971. -104, 7. - P. 612.
Kagei N. L., Purba K, Sakamoto O. Two cases of human infection with Bertiella studeri in North Sumatra, Indonesia // Jap. J. trop. Med. Hyg. - 1992. - 20. - P. 166 - 168.
Kwo E. H, Koh I. T. Six more cases of human infection with Bertiella studeri in Sumatra, Indonesia I I Proc. Seminar on filariasis and immunology of parasitic infections and laboratory meeting. - 1968. - P. 230 -233.
Lopes V. V., Santos H A. dos, Silva A. V. M. da, Fontes G. et al. First case of human infection by Bertiella studeri (Blanchard, 1891) Stunkard, 1940 (Cestoda: Anoplocephalidae) in Brazil // Rev. Inst. Med. Trop. S&o Paulo.-2015.-57, 5.-P. 447-450. doi: 10.1590/S0036-46652015000500015.
Lozano M. del C, Garcia-Martos P., Garcia-Tapia A., Fernandez C. Bertiella studeri infection in a girl from Equatorial Guinea // Enferm. Infecc. Microbiol. Clin. - 2010. - 28, 9. - P. 652 - 653.
Malik S, Srivastava К. K, Samantaray J. C. Human bertiellosis from North India П Indian J. Pediatr. - 2013. -80.-P. 258-260.
Margono S. S. Cestodes in man in Indonesia П Bui. Penelit. Kesebat. - 1989. - 17, 2. - P. 60 - 66.
Радд J. M., Campos D. M. В., Araujo J. L. B. Parasitismo humano por Bertiella sp. (Cestoda -Anoplocephalidae) no Estado de Goi£s, Brasil // Rev. Inst. Med. trop. S&o Paulo. - 2003. - 45, 3. http://dx.doi.org/10.1590/S0036-46652003000300008.
Panda D. N., Panda M. R, Record of Bertiella studeri (Blanchard, 1891), an anoplocephalid tapeworm, from a child // Ann. Trop. Med. Parasitol. - 1994. - 88, 4. - P. 451 - 452.
Pessoa S. B. Sobre um caso de parasitismo humano por cestoide anoplocephalideo do genero Bertiella // Bol. Soc. Med. Cirurg. - 1930. - 14. - P. 158 - 162.
Richard-Lenoble D., Kombila M., Maganga M.-L, Affre G, Bertiella infection in a Gabon-born girl // Am. J. Trop. Med. Hyg. - 1986.-35, 1. -P. 134.
Santa Cruz A., Gomez L., Rott M. de, Lombardero O. J, Ruiz JC. El parasitismo en Alouatta caraya у Saimi-ri boliviensis ingresados al ’’Centro Argentino de Primates” // Rev. Medic. Vet., Buenos Aires. - 1995. -76, 3.-P. 150-152.
Shoura M., Morsy T, A, A case of Bertiella infection in an immigrant from Yemen H J. Kuwait Med. Ass. -1974. - 8.-P. 55-56.
Silva A. V. M„ Arruda F. C. S., Costa G. A., Santos H. A. Bertielose humana: segundo relato em Minas Gerais, Brasil // Rev. Patol. Trop. - 2011. - 40. - P. 185-189.
Stiles C, Hassall A. Bertiella, new name for the cestode genus Bertia Blanchard, 1891 // Science. - 1902. -16, no. 402. -P. 434.
Stunkard H. W. The morphology and life history of the cestode, Bertiella studeri 11 Am. J. Trop. Med. - 1940. -20, 2.-P. 305-335.
Stunkard H, Koivastik T, Healy G. Infection of child in Minnesota by Bertiella studeri (Cestoda -Anoplocephalidae) // Am. J. Trop. Med. Hyg. - 1964. - 13, 3. - P. 402 - 409.
Sun X, Fang Q., Chen X.-Z., Hu S.-F, Xia H, Wang X-M. Bertiella studeri infection, China // Emerg. Infect. Dis.-2006.-12, l.-P. 176-177. doi: 10.3201/eidl201.050579.
Thompson C. D., Jellard С. H, Buckley J. J. Human infection with a tapeworm, Bertiella sp., probably of African origin // Brit. med. J. - 1967. - 3 (5566). - P. 659 - 660.
Werner B. A. Infecciones por par&sitos m£s frecuentes у su manejo // Revista M6dica Clinica Las Condes. -2014.-25, 3.-P. 485-528.
Xuan le T, Anantaphruti M. T, Tuan P. A., Tu le X, Hien T. V. The first human infection with Bertiella studeri in Vietnam // Southeast Asian J. Trop. Med. Public Health. - 2003. - 34, 2. - P. 298 - 300.
27
Род Inermicapsifer Janicky, 1910
Синоним (no: Mettrick, Weir, 1963):
Megacapsula Wahid, 1961
А. А. Спасский (1951) рассматривал Inermicapsifer в составе семейства Linstowiidae.
Описание (по: Спасский, 1951; Mettrick, Weir, 1963). Сколекс с 4 присосками, способными втягиваться вглубь сколекса. Половой аппарат одинарный. Половые поры односторонние или неправильно чередующиеся (Mettrick, Weir, 1963), половые протоки проходят между экскреторными сосудами дорсально от нерва. Семенники многочисленные, расположены по бокам или позади женских половых желез, могут распределяться в две латеральные группы. Семяприемник может отсутствовать. Женские половые железы расположены медианно или порально от средней линии. Матка в виде поперечной трубки или мешка изменчивой формы. После распадения матки яйца - от одного до нескольких - сосредотачиваются небольшими группами в паренхиматозных капсулах, развивающихся в результате местных разращений паренхимы (рис. 14). Во взрослом состоянии - паразиты даманов и грызунов, а также человека. Типовой вид - Inermicapsifer hyracis (Rudolphi, 1819) Janicky, 1910.
В упомянутой на стр. 20 справочно-информационной сводке «Медицинская гельминтология» (www.worms-info.ru/Cestoda) среди паразитирующих у человека цестод перечислены два представителя рода Inermicapsifer - I. cubensis (Kouri, 1938) и I. madagascariensis (Davaine, 1870). Первый из них в настоящее время относят к синонимам I. madagascariensis.
Inermicapsifer madagascariensis (Davaine, 1870) Baer, 1956 (рис. 11 - 15). Небольшая ремарка: в некоторых источниках (Faust, 1949; Tenora et al., 2004) годом первоописания вида указан 1869-й. Впервые паразит описан как Taenia madagascariensis Davaine, 1870 на материале от двух детей 2-х и 1.5 лет, - один из них с острова Реюньон, а второй с Кубы, проживавших в течение соответственно 2 и 5 месяцев на о. Майотта (входит в группу Коморских о-вов, к которым географически относится и Мадагаскар). В последующие годы Т. madagascariensis побывал первоначально в роде Davainea, затем - Raillietina и, наконец, - Inermicapsifer (Baer, 1956). Замечу, что не все исследователи согласны с переводом Raillietina madagascariensis в Inermicapsifer (Мовсесян, 2003).
Если суммировать все известные комментарии относительно таксономии I. madagascariensis, то количество его синонимов впечатляет - 11 видов (см., напр., Miiller, 1989). Среди них нас интересуют два: уже упомянутый выше Inermicapsifer cubensis (Kouri, 1938) Kouri, 1940 и Inermicapsifer arvicanthidis (Kofend, 1917) Baer, 1925.
В 1950 r. I. cubensis, впервые описанного на материале от человека на Кубе, перевели в синоним I. arvicanthidis, паразита африканских грызунов (Fair, 1950), а затем оба вида -к I. madagascariensis (Baer, 1956). Большинство исследователей согласились с подобным действом, причём перевод I. cubensis в синоним I. madagascariensis был воспринят безоговорочно (см., напр., Gdlvez, Martrinez, 2014; Mayor, Herrera, 2004). Что касается I. arvicanthidis, то недавно группа исследователей (Tenora et al., 2004, 2013), детально изучив данный вид, пришла к выводу о его валидности; при этом авторы рассматривают I. arvicanthidis генерализованным паразитом африканских грызунов, a I. madagascariensis - паразитом человека, завезённым на Кубу из Африки. К слову, видовое название arvicanthidis цестода получила от латинского названия рода грызунов - травяных мышей Arvicanthus, у которых она впервые была найдена.
28
Таким образом, представляется довольно проблематичным установить, о каком конкретно виде сообщал тот или иной автор, если он признавал существование только I. madagascariensis, а в действительности мог иметь в своём распоряжении и/или I. arvi-canthidis. К тому же, многие публикации содержат данные только о размерах выявленных члеников, содержащих капсулы с яйцами, и количестве последних.
Ниже приведено описание I. madagascariensis, но с соответствующими оговорками, если приводимые данные/рисунки, по мнению авторов, принадлежали I. arvicanthidis.
Рис. 11 Inermicapsifer madagascariensis: 1 - общий вид червя; 2 - 3 - сколекс с выступающими присосками; 4 - 6 - проглоттиды разной степени развития; 7 - яйцевая капсула: 8 -яйцо с маленькой онкосферой (с - циррус; ср - яйцевая капсула; d - семяпроток; о - яичник; t - семенники; и - матка; vg - вагина; vt - желточники) (из: Faust, 1949 - по: Kourf, Rappaport, 1940, как Inermicapsifer cubensis)
Длина тела I. madagascariensis 24 - 42 см, максимальная ширина 2.6 мм (Faust, 1949), у I. arvicanthidis - соответственно 70 см и 2 мм (цит. по: Гефтер, 1968). Диаметр сколекса 0.61, присосок 0.185 мм. В стробиле насчитывается 310 -368 члеников. В созревающих члениках I. madagascariensis их ширина превышает длину (1.5 х 2.3 мм), тогда как в зрелых - обратное соотношение: у I. madagascariensis - 3 - 3.5 х 1 - 2 (Faust, 1949) или 2.9 - 3.2 х 2.3 - 2.7 мм (Hira, 1975), у I. arvicanthidis - 1.6 х 1.2 мм (Baer, 1955). Половые поры латеральные, открываются на середине расстояния между верхней и нижней границами членика. Семеников от 33 до 49. В каждом зрелом сегменте у I. madagascariensis 48- 175 капсул, в каждой из которых от 6 до 11 яиц диаметром 55 х 49 или 50 - 64 х 19-23 цт (Faust, 1949; Hira, 1975; Acha, Szyfres, 2003), у «/. cubensis» - по 126 - 180 капсул с 4 - 7 яйцами диаметром 36 цт (Baer et al., 1949), у I. arvicanthidis -10-50 капсул с 11 - 13 яйцами (Joueux, Baer, 1936). По мнению ряда исследователей, количество капсул в чле-
29
нике не может рассматриваться как диагностический признак по причине его
Рис. 12 Inermicapsifer madagascariensis: 1 - 3 - сколекс при разных условиях фиксации; 4 -фрагмент капсул с яйцами (из: Baer et al., 1949, как Inermicapsifer cubensis)
Рис. 13 Inermicapsifer madagascariensis: A - передний конец тела; В - зрелый проглоттид: С -зрелое яйцо (из: Faust, 1949 - по разным авторам; как Raillietina madagascariensis)
Рис. 14 Членик Inermicapsifer arvicanthidis с капсулами, содержащими яйца (из: Baer, 1955)
Жизненный цикл I. madagascariensis, несмотря на его широкое распространение, до сих пор детально не изучен. Предполагают, что промежуточным хозяином, как и у многих аноплоцефалид, являются членисто-
ногие. Однако возможность участия в нём клещей, известных как промежуточные хозяева почти у 30 видов аноплоцефалид, у некоторых исследователей вызывает сомнения из-за крупных размеров капсул с яйцами, попадающих во внешнюю среду.
Годом первого официально зарегистрированного случая заражения человека цестодами данного рода следует считать 1870-й, когда на материале, собранном д-ром Grenet от двух детишек на о. Майотта (Коморские о-ва), появилось описание Taenia madagascariensis Davaine, 1870.
В 1938 г. стало известно о новом виде цестод - Raillietina cubensis Kouri, 1938, обнаруженном в 1930 г. у 16-месячного ребёнка на Кубе. Через год тот же
30
автор перевёл описанный им вид в род Inermicapsifer (Kouri, Rappaport, 1940). Тогда же цестоду обнаружили у человека в Венесуэле (см.: Kouri, 1944).
В 1949 г. было опубликовано сообщение о находке Inermicapsifer arvicanthidis у 2-летнего ребёнка, чья семья вернулась в Англию из Найроби (Кения) (Baylis, 1949). Через несколько недель после возвращения в фекалиях малыша обнаружились сегменты цестоды необычной формы. Д-р Е. R. Jones, патолог из Департамента здравоохранения Мэйдстоуна (Public Health Department Madestone) сообщил, что эти образования похожи на зрелые проглоттиды I. cubensis. Однако названный вид в те годы рассматривали эндемичным для о. Куба, ребёнок же прибыл из Африки, где у грызунов широко распространён I. arvicanthidis, поэтому обнаруженных цестод отнесли к африканскому виду. Напомню, что до 1956 г. I. madagascariensis входил в состав рода Raillietina.
С тех пор заражение людей I. madagascariensis (=1. cubensis', = I. arvicanthidis) было зафиксировано во многих странах мира, и к настоящему времени география подобных находок выглядит следующим образом: Конго, Кения, Замбия, Танзания, Зимбабве, Руанда, Южная Африка, Мадагаскар, Маврикий, Реюньон, Коморские о-ва, Куба, Пуэрто-Рико, Венесуэла (Muller, 2002, а также Del Risco et al., 2006; Frean, Dini, 2004; Galvez, Martrinez, 2014; Herrera et al., 2007; Martinez et al., 2009; Mayor, Herrera, 2004; Prosl, 2005; Sanchez, Valdes, 2003; Acha, Szyfres, 2003).
Помимо того, в ряде обзорных работ среди подобных регионов указывают также Филиппины, Таиланд и Индонезию (см., напр., Margono, 1989). Подобное обстоятельство может быть связано с тем, что в синонимы данного вида, но ещё как Raillietina madagascariensis, некоторые исследователи (напр., Мовсесян, 2003) перевели Raillietina garrisoni Tubangui, 1931, паразита человека на Филиппинах (Stransky, Lorenzo, 1960), и Raillietina siriraji Chandler et Pradatsundarasar, 1957, выявленную у детей в Таиланде (Chandler, Pradatsundarasar, 1957; Pradatsundarasar, 1960). Между тем, в индо-тихоокеанском регионе широкое распространение получил другой вид Raillietina - R. celebensis (Janicki, 1902), среди синонимов которого называют, в частности, R, garrisoni (см. далее семейство Davaineidae). Более того, ещё в 1959 г. китайские исследователи писали о несостоятельности идеи о принадлежности всех райллиетин, выявленных у человека в различных регионах мира, к одному единственному виду - R. madagascariensis (Tang, Lin, 1959).
Предполагается, что в Восточной Африке I. madagascariensis распространён шире, чем это описано в литературе (Muller, 2002). Кстати, регистрация подобных случаев в таких странах, как, например, Англия (Baylis, 1949) или Австрия (Prosl, 2005), касается лиц, побывавших в регионах, эндемичных по данному гельминтозу: в первом случае ребёнок заразился в Кении, во втором - на о. Маврикий. К слову, выявленные у ребёнка в Австрии проглоттиды определили как принадлежащие Raillietina madagascariensis (Prosl, 2005).
До 1948 г. наибольшее количество случаев - более 100 - было зафиксировано на Кубе (Calvo, 1951; Kouri, 1972). Затем на острове наступил период относительного затишья, но с 1996 г. количество заражённых людей в различных регионах Кубы постоянно увеличивается. Так, в 1996 г. было описано 2 случая (Nufiez et al., 1996), с 1993 по 1997 гг. - 17 (Alvarez et al., 2001), в 2003-м - 23 (Sanchez, Valdes, 2003), в 2006-м - 17 (Del Risco et al., 2006), в 2007-м - 24 (Herrera et al., 2007), c 2000 no 2009 гг. только в провинции Камагуэй (Camaguey) зафиксировали 37 случаев заражения детей и 4 - взрослых (Del Risco et al., 2012), а в 2009 г. в двух горо-
31
дах провинции Пинар-дель-Рио было выявлено 47 детишек - от грудных до пятилетнего возраста, поражённых I. madagascariensis (Galvez, Martrinez, 2014).
Будучи впервые описанным от детей, I. madagascariensis по-прежнему в основном у них и обнаруживается. В Танзании, к примеру, цестоду нашли у ребёнка 3.5 лет (Baer, 1955), в Зимбабве - у семерых ребятишек (Goldsmid, Muir, 1972), в Замбии - у троих детей от года до 3 лет (Hira, 1975), в Кении - у 10-месячной малышки (Chunge et al., 1987). На Кубе также основной контингент заболевших -дети, причём самого разного возраста, например, 3-летний ребёнок (Garmendia et al., 1956), годовалая девочка (Mayor, Herrera, 2004), две малышки 11 месяцев и одного года от роду (Gonzalez et al., 1996), 17 детей средним возрастом 1.8 года (Alvarez et al., 2001) и т.д., и т.д. Иногда заражёнными оказываются все члены семьи. Известен случай, когда цестод выявили у 18-месячного ребёнка, его матери и дедушки (Martinez et al., 2009).
Характерные симптомы заражения Inermicapsifer фактически отсутствуют. У детей инвазия обычно проявляется отсутствием аппетита, потерей веса, апатией, бессонницей, наблюдаются водянистый, полуслизистый стул, боли в животе, общая слабость. Маленькие дети постоянно плачут. Именно наличие подобных симптомов заставляет родителей обращаться в медицинские учреждения за помощью.
Диагноз ставится на основании выявления в стуле пациентов подвижных белых образований, похожих на зёрна риса, а иногда и фрагментов стробилы, и определения их систематической принадлежности (Acha, Szyfres, 2003). Яйца в фекалиях не встречаются. Учитывая сходство члеников Inermicapsifer и Raillietina, для подтверждения диагноза весьма желательно изучить сколекс цестоды (Baer et al., 1949), что обычно достигается изгнанием паразита из организма человека.
Для изгнания гельминтов с успехом применяется празиквантел (Gonzalez et al., 1996; Martinez et al., 2009; Prosl, 2005), дозу и курс приёма которого определяют медицинские работники в соответствии с индивидуальными показателями пациента. Обычно у ребёнка паразитирует одна особь цестоды, в редких случаях их может быть больше. После курса лечения все негативные симптомы у пациентов исчезали.
Пути попадания I. madagascariensis в организм человека детально не изучены. Существует мнение, что в Африке обычный путь циркуляции гельминта в природе - «грызун - членистоногое - грызун» или «грызун - членистоногое - человек», а вне Африки этот вид паразитирует только у человека: «человек - членистоногое - человек» (Acha, Szyfres, 2003). Однако известно, что на Кубе эта цестода была найдены у крысы (Kouri Р., Kouri J., 1952).
В любом случае совершенно очевидно, что люди заражаются per os, при случайном заглатывании промежуточного хозяина, что в определённой степени объясняет и выявление единственной особи паразита у пациентов при их лечении.
Цитируемая литература
Гефтер В. А. Глава XXII. Прочие цестодозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 527 -537. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Мовсесян С. О. Давэнеаты — ленточные гельминты животных и человека И Основы цестодологии. -М.: Наука, 2003. -13,1. - 295 с.
Спасский А. А. Аноплоцефаляты - ленточные гельминты домашних и диких животных // Основы цестодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1951. -1. - С. 596 - 617.
32
Acha P. H, Szyfres B. 2. Cestodiases I Zoonoses and communicable diseases common to man and animals. 3rd Ed. Vol. III. Parasitoses. - Wash., D.C.: РАНО, 2003. - Sci. & Tech. Publ. No. 580. - P. 205 - 206.
Alvarez I., Ponce J., Gonzalez I., Nunez F. Parasitismo intestinal por Inermicapsifer madagascariensis. Estu-dio clfnico-epidemioldgico de cinco aflos // Rev. Enf. Inf. Ped. - 2001. - 15, 59. - P. 67 - 71.
Baer J. G. Un nouveau cas de parasitisme d’un enfant en Afrique orientale par le cestode Inermicapsifer arvicanthidis (Kofend, 1917) // Acta Trop. - 1955. - 12, 2. - P. 174 - 176.
Baer J. G. The taxonomic position of Taenia madagascariensis Davaine, 1870, a tapeworm parasite of man and rodents 11 Ann. Trop. Med. Parasitol. - 1956. - 50. - P. 152 - 156.
Baer J. G., Kouri P., Sotolongo F. [Anatomy, systematic position and epidemiology of Inermicapsifer cubensis (Kouri 1938) Kouri, 1940, a cestode parasitic in man in Cuba] // Acta Trop. - 1949. - 6, 2. - P. 120 -130. http://doi.org/10.5169/seals-310228 (Text in French, English summary).
Под этим же названием статья названных авторов была опубликована в 1950 г. в журнале: Rev. Kuba Med. Trop. Parasitol. - 1950. - 6, 1-2. - P. 9 - 13.
Baylis H. A. A new human cestode infection in Kenya; Inermicapsifer arvicanthidis, a parasite of rats // Trans. R. Soc. Trop. Med. Hyg. - 1949. - 42, 6. - P. 131 - 142.
Calvo F. R. Una nueva endemia: la inermicapsiferiasis I I Cuba. - 1951. - 7, 9-10. - P. 109 - 110.
Chandler A. C., Pradatsundarasar A. Two cases of Raillietina infection in infants in Thailand, with a discussion of the taxonomy of the species of Raillietina (Cestoda) in man, rodents, and monkeys I I J. Parasitol. -1957.-43, l.-P. 81-89.
Chunge R. N, Kabiru E. W„ Mugo В. M. A human case of infection with a rodent cestode (Inermicapsifer) in Kenya // East Afr. Med. J. - 1987. - 64, 6. - P. 424 - 427.
Del Risco B. U., Dieguez L., Balaguer B. A., Sanchen C. A., Del Risco B. Y. Inermicapsifer madagascariensis. A propdsito de 17 casos // Rev. Panam. Infectol. - 2006. - 8, 4. - P. 46 - 49.
Del Risco B. U., Zayas Martinez I. G.. Dieguez L., Del Risco B. Y. Aspectos clinicos у epidemioldgicos de Inermicapsifer madagascariensis (Davaine, 1870). Camarguey 2000 - 2009 I I RED VET. Rev. electron. Vet. - 2012. - 13, N 05B. - 7 pp.
Fain A. Inermicapsifer cubensis (Kouri, 1938): presence du cestode I. cubensis, synonyme de Inermicapsifer arvicanthidis (Kofend, 1917), chez un enfant indigene et chez un rat (Rattus r. rattus L.) an Ruanda-Urundi (Congo beige) П Bull. Soc. Path. Exot. - 1950. - 43. - P. 438 - 443.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 281- 282.
Frean J., Dini L. Unusual anoplocephalid tapeworm infection in South Africa // Ann. Austral. Coll. Trop. Med.-2004.-5.-P. 8-11.
Galvez C. Z. A., Martinez I. C. Inermicapsifer madagascariensis en Pinar del Rio, Cuba // Rev. Panam. Infectol. - 2014. - 16, 4. - P. 246 - 249. http://www.revistaapi.com.
Garmendia L., Castillo J. M. del, Munoz Bolivar O. Inermicapsifer cubensis'. Primer caso hallado en la pro-vincia de Oriente 11 Laboratorio. - 1956. - 1, 3. - P. 126.
Goldsmid J. M., Muir M. Inermicapsifer madagascariensis (Davaine, 1870) Baer, 1956 (Platyhelminthes: Cestoda) as a parasite of man in Rhodesia I I Cent. Afr. J. Med. - 1972. - 18, 10. - P. 205 - 207.
Gonzalez N. I, Diaz J. M., Nunez F. F. [Infection by Inermicapsifer madagascariensis (Davaine, 1870); Baer, 1956. A report of 2 cases] // Rev. Cubana Med. Trop. - 1996. - 48, 3. - P. 224 - 226.
Herrera V. N, Diaz G. M. E., Sandoval A. M„ Garcia B. N. Inermicapsifer madagascariensis 11 Rev. Cub. Med. Mil. - 2007. - 36, 1. - P. 28 - 29.
Hira P. R. Human and rodent infection with the cestode Inermicapsifer madagascariensis (Davaine, 1870) Baer, 1956 in Zambia //Ann. Soc. Belg. Med Trop. - 1975. - 55, 4. - P. 321 - 326.
Joyeux Ch., Baer J. G. Faune de France. 30. Cestodes. - Fed. Fr. Soc. Sci. Nat. Office Control de Faunisti-que. - Paris, 1936. - 613 pp.
Kouri P. Tercer informe en relacidn al Inermicapsifer cubensis (Kouri, 1938) Kouri, 1939 // Rev. Med. Trop. Parasitol. - 1944. - 10. - P. 107 - 112.
Kouri P. Inermicapsifer cubensis: Helmintologia humana. - La Habana: Institute Cubano del Libro, 1972. -P. 409-428.
Kouri P., Kouri J. Finding of Inermicapsifer cubensis in the white rat; preliminary note // Rev. Kuba Med. Trop. Parasitol. - 1952. - 8, 4-6. - P. 27.
Kouri P., Rappaport I A new human helminthic infection in Cuba I I J. Parasitol. - 1940. - 26, 3. - P. 179 - 181.
Margono S. S. Cestodes in man in Indonesia I I Bui. Penelit. Kesebat. - 1989. - 17, 2. - P. 60 - 66.
Martinez I. G. Z., Lopez D. B., Gonzalez G. G„ Canete I. D. Primer reporte familiar de Inermicapsifer maga-dascariensis (cubensis) // Rev. Arch. Medico de CamagUey. - 2009. -13, 2. - www.revistaamc.sld.cu.
Mayor V. M., Herrera J. C. S. Primer caso de Inermicapsifer madagascariensis (Davaine, 1870; Baer, 1956) informado en la Provincia de Santiago de Cuba // MEDISAN. - 2004. - 8, 2. - P. 26 - 29.
33
Mettrick D. F., Weir J. S. Studies on the genus Inermicapsifer Janicky, 1910 with notes on some genera in the subfamilies Inermicapsiferinae, Linstowiinae and Davaineinae // Proc. Helm. Soc. Wash. - 1963. - 30, 2. -P. 199-205.
Miiller H. E. Die Infektions erreger des Menschen: Klinik, Epidemiologic, Okologie und Nomenklatur. -Springer-Verlag, 1989.-403 pp.
Muller R Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 102 - 105.
Pradatsundarasar A. Nine cases of Raillietina infection in Bangkok // J. Med. Assoc. Thailand. - 1960. - 43, l.-P. 56-58.
Prosl H. Traumurlaub mit Folgen - ein ungewOhnlicher Bandwurmbefall bei einem zweieinhalbjShrigen Kind // Wien. Klin. Wochenschr. - 2005. - 117, Suppl. 4. - P. 56 - 59.
Sdnchez P. M, Valdes L. R. Inermicapsiferosis: una parasitosis frecuente у poco diagnosticada en nuestro medio // Medicentro. - 2003. - 7, 3. - www.capirovcl.sld.cu/medicentro/v7 n3O3/pdf71nermicapsi. pdf.
Stransky E., Lorenzo A. S. On raillietiniasis in the Philippines // Acta Trop. - 1960. - 17, 1. - P. 80 - 83.
Tang С. C., Lin R S. [Human infection and taxonomic problem of Raillietina celebensis (Janicki. 1902) Fuhrmann: 1920 // Bull. Fukien Normal College (1). - 1959. - P. 57 - 67.
Tenora F, BaruS V, ProkeS M. Discussion to several tapeworm species from the families Hymenolepididae, Anoplocephalidae and Davaineidae parasitizing rodents and man // Acta Univ. Agric. et Silvic., Mendel. Brun. - 2004. - 52, 1. - P. 23 - 28.
Tenora F.t BaruS V.t ProkeS M., Sumbera R., Koubkova B. Helminths parasitizing the silvery mole-rat, Helio-phobius argenteocinereus (Rodentia: Bathyergidae) from Malawi П Helminthologia. - 2013. - 40, 3. - P. 153-160.
Род Killigrewia Meggitt, 1927
В монографической сводке по паразитам человека (Ashford, Crewe, 2003) приведена очень краткая информация об обнаружении у человека в Индии цестод неопределённого вида из рода Killigrewia. К величайшему сожалению, найти публикацию (Chowdhury, Tada, 2001), послужившую основанием для включения данного рода в реестр регистрируемых у человека цестод, не удалось.
Род Killigrewia был установлен для двух новых видов цестод из коллекции Д-ра А. Ло-осса (A. Looss), собранной им в основном в Египте, с типовым видом К frtvola и вторым видом К pamelae (Meggitt, 1927). О. Фурман (Fuhrmann, 1932) исследовал новые экземпляры цестод из той же коллекции и от того же хозяина и пришёл к выводу, что К. pamelae практически ничем не отличается от Aporina delafondi (Railliet, 1892), а сам род Killigrewia является синонимом Aporina Fuhrmann, 1902. Самостоятельность К. frivola он никак не комментировал. Зато этот второй вид стал предметом обстоятельного изучения другого автора (Hudson, 1934), который в результате пришёл к выводу об идентичности К frivola и Aporina delafondi. А. А. Спасский (1951) также рассматривал Killigrewia синонимом Aporina.
В настоящее время мнения исследователей по данному вопросу разделились. В информационной сводке (bug.tamu.edu/research/collection /hallan/.../Anoplocephalidae.txt) в состав семейства включены и Aporina (с 3 видами), и Killigrewia с типовым видом К. frivola. Здесь же в синонимах Killigrewia перечислены 3 рода: Nepalesia Sharma, 1943; Columbia Srivastava et Capoor, 1966; Pseudoaporina Saxena et Baugh, 1973. В директивном документе OFEFP (2003), посвящённом классификации паразитических организмов, Aporina отмечена как синоним Killigrewia, а к числу возможных паразитов человека отнесена Killigrewia (j=Aporina) delafondi. Этой же точки зрения на статус сравниваемых родов (и видов) придерживаются составители «Ветеринарно-медицинской паразитологии» (Btlrger et al., 2006) и некоторые другие авторы (см., напр., Gonzdlez et al., 2004; Smith, Fedynich, 2012). Однако параллельно можно встретить и публикации, в которых Aporina delafondi фигурирует как самостоятельный вид (см., напр., Al-Bayati, 2011).
34
Killigrewia delafondi (Railliet, 1892) Meggitt, 1927 (рис. 15). Цестоды средних размеров, до 14 - 15 см длины при максимальной ширине до 5 - 5.5 мм. Апикальная часть сколекса уплощена. Шейка очень короткая. Ширина члеников значительно больше их длины. В каждом сегменте одинарный набор половых органов. Половые поры открываются в передней трети бокового края членика. Половые протоки проходят дорсально от экскреторных сосудов. Семенников до 120, располагаются в два слоя во всю ширину среднего поля сегмента, справа и слева от женских половых желез. Бурса цирруса грушевидная, содержит внутренний семенной пузырёк и циррус, покрытый мелкими кутикулярными щетинками. Женские половые железы преимущественно в поральной половине членика. Яичник в виде нескольких пальцевидных долек, направленных главным образом дорсально. Позади середины яичника находится желточник. В процессе развития матка образует характерные выпячивания. Яйца 30 - 42 х 22 - 24 цш.
Паразит голубиных птиц (Columbiformes) на всех континентах.
Рис. 15 Killigrewia delafondi, членик (по: Спасский, 1951 - из: Ваег, 1927, как Aporina delafondi)
Цитируемая литература
Спасский А. А. Аноплоцефаляты - ленточные гельминты домашних и диких животных И Основы цес-тодологии. - Под ред. акад. К. И. Скрябина. -М.: Изд-во АН СССР, 1951. - 1. - С. 218-226.
Al-Bayati N. Y. A study on pigeons (Columbia livia) cestode infection 11 Diyala Agricult. Sci. J. - 2011. - 3, 2.-P. 1-12.
Ashford R. W., Crewe ИС The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - P. 85.
Baer J. G. Monographic des Cestodes de la famille des Anoplocephalidae // Bull. Biol. Fr. Belg., Paris. -1927.-Suppl. 10.-241 pp.
Burger H.-J, Eckert J., Kutzer E., Korting W., Rommel M. Veterinarmedizinische Parasitologie. - Georg Thieme Verlag, 2006. - 808 pp.
Fuhrmann O. Les t£ntas des oiseaux // Мёт. Univ. Neuchatel. - 1932. - 8. - P. 1-181.
Gonzalez D., Daugschies A., Rubilar L., Pohlmeyer K. et al. Fauna parasitaria de la tdrtola comun (Zenaida auriculata, De Murs, 1847) (Columbiformes, Columbidae) en Nuble, Chile//Parasitol. Latinoam. - 2004. -59, 1-2.-P. 37-41.
Hudson J. R. XXVIII. Notes on some avian cestodes H Ann. Mag. Nat. Hist. - 1934. - Ser. 10. - 14, 80. - P. 314 - 318. http://dx.doi.org/10/1080/00222933408654898.
Meggitt F. J. Report on a collection of Cestoda, mainly from Egypt. Part I. Families Anoplocephalidae, Da-vaineidae П Parasitology. - 1927. - 19, 3. - P. 314 - 227.
OFEFP. Directives. Classification des organisms. Parasites. - OFEFP, Berne, 2003. - 38 pp.
Smith A. J., Fedynich A. M. Helminth community composition, structure, and pattern in six dove species (Columbiformes: Columbidae) of South Texas // J. Parasitol. - 2012. - 98, 1. - P. 11 - 21. DOI: http://dx.doi. org/10.1645/GE-2561.1.
Род Mathevotaenia Akhumian, 1946
А. А. Спасский (1951) рассматривал данный род в составе семейства Linstowiidae.
Описание (по: Спасский, 1951). Цестоды мелких или средних размеров. Присоски способны втягиваться в сколекс. Экскреторная система в типичных случаях пред
35
ставлена двумя парами латеральных стволов, причём вентральные соединены одним поперечным каналом или сетью вторичных ветвей. Половой аппарат одинарный. Половые поры неправильно чередуются. Половые протоки проходят между экскреторными каналами или дорсально от них. Семенники находятся позади и по сторонам от женских половых желез, лежащих по срединной линии. Половая клоака без присоскообразного мышечного органа. Матка существует кратковременно. Зрелые яйца залегают по одному в толще паренхимы. Лярвоцисты типа амфицисты (с ввёрнутым сколексом). Типовой вид - Mathevotaenia symmetrica (Baylis, 1927) Akhumian, 1946 (рис. 16).
Паразиты в основном млекопитающих (грызунов, сумчатых, броненосцев, антропоморфных приматов), а также рептилий и птиц (Mathevotaenia ornithis Saxena et Baugh, 1978). Промежуточные хозяева - членистоногие, прежде всего, жуки, моли. Цистицеркоиды не теряют жизнеспособности в процессе метаморфоза промежуточного хозяина, поэтому «инвазионных лярвоцист могут содержать и имаги-нальные стадии даже таких насекомых (например, мучная моль), особенности питания и строения ротового аппарата которых не позволяют приобрести инвазию» (Спасский, 1951; стр. 510).
Род включает около 50 видов. Установить их точное количество довольно трудно, что связано не только со слабым описанием отдельных видов и трудностями в их синонимизации, но и тем, что часть видов Mathevotaenia была переведена в этот род из Oochoristica Ltihe, 1898, Oschmarenia Spasskii, 1951, Schizorchodes Bienek et Grundman, 1973 (Beveridge, 2008; Bursey et al., 2010).
5
Рис. 16 Mathevotaenia symmetrica': 1 - молодые членики; 2 - молодые членики с незрелыми половыми железами; 3 - развитый гермафродитный членик; 4 - средняя часть членика с остатками женских половых желез; 5 - сколекс (из: Спасский, 1951)
Единственный вид Mathevotaenia, когда-либо зарегистрированный у человека, это - Mathevotaenia symmetrica (рис. 16). Причём авторы находки (Lamon, Greer, 1986), описывая паразита, только подчёркивают, что обнаруженные цестоды более всего похожи на М. symmetrica.
Названный случай имел место в Таиланде. 10-месячная девочка, жительница Бангкока, в течение двух недель страдала от диареи. После лечения празиквантелом у неё выделилось И экз. цестод. Длина червей составляла около 13 см при
36
ширине 1-2 мм (Lamon, Greer, 1986). Сколекс шириной 0.27 - 0.29 мм, с четырьмя сферическими присосками диаметром 0.103 - 0.122 мм. Шейка шириной 0.22 - 0.27 мм. Передние проглоттиды широкие, но у зрелых длина заметно превышает ширину, 2 - 3 х 1.5 мм. Половые поры в передней трети члеников. Половой атриум хорошо развит. Удлинённая грушевидная бурса цирруса размерами 0.072 - 0.097 х 0.039 - 0.051 мм. Семенников в каждом сегменте от 38 до 51. Яичник двудольчатый, шириной от 0.27 до 0.5 мм. Замечу, что приведённые размеры червей и их органов меньше тех, что указаны для этого вида А. А. Спасским (1951).
М. symmetrica широко распространена у грызунов в Таиланде, а её цисти-церкоиды выявлены в моли и мучных жуках (Muller, 2002).
Цитируемая литература
Спасский А. А. Аноплоцефаляты - ленточные гельминты домашних и диких животных // Основы цес-тодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1951. -1. - С. 507 - 533.
Beveridge I. Mathevotaenia niuguiniensis n. sp. (Cestoda: Anoplocephalidae: Linstowiinae) from the water-rat Parahydromys asper (Thomas) in Papua New Guinea, with a list of species of Mathevotaenia Akumyan, 1946 // Syst. Parasitol. - 2008. - 71, 3. - P. 189 - 198. doi: 10.1007/sl 1230-008-9155-5.
Bursey C. R., Goldberg S. R., Telford S. R., Jr. A new species of Mathevotaenia (Cestoda, Anoplocephalidae, Linstowiinae) from the lizard Sceloporus malachiticus (Squamata, Phrynosomatidae) from Panama // Acta Parasitol. - 2010. - 55, 1. - P. 53 - 57.
Lamon C., Greer G. J. Human infection with an anoplocephalid tapeworm of the genus Mathevotaenia I I Am. J. Trop. Med. Hyg. - 1986. - 35,4. - P. 824 - 826. http://doi.org/10.4269/ajtmh.1986.35.824.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 102 - 105.
Род Moniezia Blanchard, 1891
Описание (по разным авторам, в том числе: Спасский, 1951). Одни из самых крупных цестод среди аноплоцефалид. Сколекс округлый, невооруженный, без хоботка, с 4 мускулистыми присосками без придатков. Стробила плоская, широкая, проглоттиды многочисленные. Гермафродитные членики вытянуты в поперечном направлении. Экскреторная система представлена двумя парами продольных сосудов с поперечным анастомозом в задней половине каждого сегмента. Половой аппарат парный; мужские и женские половые органы располагаются двумя группами возле каждого бокового края членика, где соответственно имеется половая клоака, куда открываются мужские и женские половые протоки, проходящие дорсально от экскреторных каналов и нерва. Вагина на правой стороне стробилы открывается вентрально от бурсы цирруса, а на левой - дорсально. Семенники многочисленные, расположены между экскреторными сосудами. Семяпровод внутри и за пределами бурсы цирруса образует извивы. Оформленные семенные пузырьки отсутствуют. Женские половые железы лопастного строения, лежат в боковых отделах среднего поля. Матка сначала в виде сети тяжей, затем - трубок, и наконец, в виде лопастного мешка, может выходить за пределы среднего поля. Яйца характерной квадратной или треугольной формы, с толстой оболочкой и грушевидным аппаратом, рожки которого обычно прикрыты колпачком или пластинкой. Взрослые формы - паразиты тонкого кишечника копытных, цистицеркоиды - в клещах. Типовой вид - Moniezia expansa (Rudolphi, 1810) Blanchard, 1891.
Среди многочисленных - несколько сотен - источников, посвящённых цес-тодам данного рода, встретилось два сообщения о регистрации у человека одного из них - Moniezia expansa. Кроме того, А. А. Спасский (1951) цитирует работу (Ер-37
шов, Малыгин, 1937), в которой описан случай заражения человека Moniezia, близкой, по мнению авторов цитируемой статьи, к Moniezia benedeni (Moniez, 1879).
Moniezia expansa (Rudolphi, 1810) Blanchard, 1891 (рис. 17, 19). Впервые описана как Taenia expansa Rudolphi, 1810 (expansa - растянутая).
С характерными чертами рода. Очень крупные цестоды; их длина может достигать 600 см при ширине 16 мм. Сколекс шириной 0.7 - 1.0 мм (Спасский, 1951) или 0.36 - 0.8 мм (Monnig, 1934). На переднем конце члеников на дорсальной и вентральной сторонах имеются розетковидные межпроглоттидные железы, с каждой стороны по 1 - 18 розеток размерами 0.03 - 0.05 мм. В каждом сегменте двойной набор половых органов. В каждом членике 150 - 327 семенников. Яйца серовато-тёмного цвета, треугольной или пирамидальной формы, диаметром 53 -78 (Спасский, 1951), 56 - 67 (M6nnig, 1934), грушевидный аппарат длиной 48 цт.
Рис. 17 Moniezia expansa: слева - сколекс, справа - зрелый членик (из: Спасский, 1951)
М. expansa поселяется в тонком кишечнике овец (наиболее обычный хозяин этого паразита), коз, крупного рогатого скота, буйволов, верблюдов, северных оленей и других копытных по всему миру. В Перу цестоду эпизодически обнаруживают у домашних свиней (Gomez-Puerta et al., 2008). Заражению более всего подвержен молодняк, однако и взрослые животные также могут заражаться этими гельминтами.
Промежуточный хозяин М. expansa - панцирные клещи родов Ceratozetes, Epilohmannia, Galumna, Oppiella, Oribatella, Peloribates, Scheloribates, Xylobates, Zygoribatula (Cheng, 2011; Denegri, 1989; Olsen, 1974). В. А. Гефтер (1968) цитирует работы В. А. Потёмкиной (1941 - 1949), согласно данным которой развитие цисти-церкоида в организме клеща в зависимости от температуры завершается в течение 3.5-7 месяцев.
Заболевания, вызываемые мониезиями, наносят огромный ущерб животноводству. Иногда гибель молодняка скота в отдельных хозяйствах может достигать 80 %. Тяжесть заболевания зависит от интенсивности инвазии животного. Известны случаи, когда у молодняка овец или телят просвет тонкого кишечника на большом протяжении был почти полностью заполнен цестодами.
К 2003 г. был зафиксирован первый случай регистрации М. expansa у человека, имевший место в США (Ashford, Crewe, 2003), а в 2004-м появилось второе сообщение о подобном случае, но на этот раз в Египте (el-Shazly et al., 2004). В последней из цитируемых публикаций речь шла об обнаружении яиц цестоды в стуле 15-летнего пастуха, для лечения которого с успехом был использован никлозамид.
38
Moniezia benedeni (Moniez, 1879) Blanchard, 1891 (рис. 18 - 20). Вид впервые описан под названием Taenia benedeni Moniez, 1879. Назван в честь видного бельгийского учёного Пьера-Жозефа Ван Бенедена (P.-J. Van Beneden, 1809 - 1894), известного своими работами, в том числе и в области морской паразитологии.
Вид очень похож на М. expansa, но отличается от него большей шириной стробилы, которая может достигать 2.6 см. Длина червей до 2.5 -4 м. Проглоттиды поперечно-удлинённые. Межпроглоттидные железы располагаются в коротком ряду близко к срединной линии сегмента. Яйца квадратной или кубической формы диаметром 70 - 94, грушевидный аппарат длиной до 63 - 70 pm.
Рис. 18 Moniezia benedeni: сколекс (из: Спасский, 1951) и общий вид цестоды (из: Ali-cata, 1964)
Рис. 19 Зрелые членики Moniezia benedeni (А) и Moniezia expansa (В) в сравнительном аспекте (из: M6nnig, 1934)
Рис. 20 Moniezia benedeni, яйца (из: www.flickr.com)
Промежуточные хозяева М. benedeni - также почвенные клещики, причём фактически тех же родов, что и у М. expansa, а развитие цистицеркоида в промежуточном хозяине занимает, по разным данным, до 2.5 (Monnig, 1934) или 4 месяцев (Cheng, 2011). Заражение дефинитивных хозяев обычно происходит уже в 6-недельном возрасте, хотя и
39
не исключается возможность инвазии животных старшего возраста. В организме дефинитивного хозяина взрослые цестоды живут не более 3 месяцев (Monnig, 1934).
Известно, что из-за своих крупных размеров паразиты даже при невысокой численности представляют серьёзную угрозу здоровью животных, вызывая у тех закупорку кишечника и даже прободение его стенок.
Что касается истории с обнаружением М. benedeni (?) у человека, то позволю себе привести описание этого случая из монографии А. А. Спасского (1951), который, в свою очередь, цитирует работу В. С. Ершова и С. А. Малыгина (1937). Речь идёт о заражении 30-летней жительницы Кировской области бывшего Советского Союза. Заболевание протекало с резко выраженными клиническими признаками. «Больная ощущала болезненность в области пупка и несколько выше... Иногда наблюдались позывы к рвоте. Часто наблюдались отсутствие аппетита, головокружение и общая слабость. Больная была сильно анемична, истощена...» (Ершов, Малыгин, 1937; стр. 627). Приём экстракта корневища мужского папоротника избавил пациентку от мониезий, а через 2 недели у неё наступило полное выздоровление.
Цитируемая литература
Гефтер В. А. Глава XXII. Прочие цестодозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 527 -537. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Ершов В. С., Малыгин С. А. Случай обнаружения монезиоза (Moniezia) у человека// Медиц. паразит, и паразит, болезни. - 1937. - 6, 5. - С. 627 - 629.
Спасский А. А. Аноплоцефаляты - ленточные гельминты домашних и диких животных И Основы цес-тодологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1951. - 1. - С. 371 - 392.
Alicata J. Е. Parasitic infections of man and animals in Hawaii I I Tropical Bull. - Honolulu, Hawaii, 1964. -No 61.-138 pp.
Ashford R W., Crewe W. The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - P. 85.
Cheng G. Cestode development research in China // J. Veterinar. Sci. Technol. - 2011. - S3: 002. http://dx.doi.org/10.4172/2157-7579.S3-002.
Denegri G. M. New potential intermediate host of Moniezia expansa Rudolphi, 1810, in Argentina // Vet. Parasitol. - 1989.-33, 2. -P. 191 - 194.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - P. 96 - 98.
Olsen O. W. Animal parasites: their life cycles and ecology. - Dover PubL, Inc., New York, 1974. - 564 pp. Gomez-Puerta L. A., Lopez-Urbina M. T., Gonzalez A. E. Occurrence of Moniezia expansa (Rud, 1810) Blanchard, 1891 (Cestoda: Anoplocephalidae) in domestic pig (Sus scrofa domesticaLmnaws, 1758) in Peru H Vet. Parasitol. - 2008. - 158, 4. - P. 380 - 381.
el-Shazly A. M., Morsy T. A., Dawoud H. A. Human Monieziasis expansa'. The first Egyptian parasitic zoonosis I I J. Egypt. Soc. Parasitol. - 2004. - 34, 2. - P. 515 - 518.
Итак. В результате анализа доступной литературы список регистрируемых у человека аноплоцефалид, приведённый в цитируемом на стр. 20 источнике (www.worms-info.ru/Cestoda) и включающий Bertiella mucronata, В. studeri, Inermicapsifer cubensis, I. madagascariensis, Mathevotaenia symmetrica и Moniezia expansa, претерпел определённые изменения.
Прежде всего, есть все основания предполагать, что род Bertiella представлен не двумя, а тремя видами (этим третьим видом может быть В. satyri, имеющий,
40
как показали недавние исследования, право на самостоятельное существование). Далее. Достоверно установлено, что Inermicapsifer cubensis и I. madagascariensis -это один и тот же вид, т. е. I. madagascariensis. Тем не менее, количество видов Inermicapsifer, регистрируемых у человека, не уменьшилось, поскольку исследователи (Tenora et al., 2013), восстанавливая самостоятельность Inermicapsifer arvicanthi-dis, тем самым возвращают данный вид в число, пусть и случайно, но встречающихся у человека. И, наконец, к этому же списку следует добавить род Killigrewia (конкретный вид не известен), а также вид Moniezia benedeni.
Таким образом, всего у человека к настоящему времени зарегистрированы аноплоцефалиды 8 (9) видов из 5 родов.
Предполагается также, что к человеку от обезьян могут передаваться представители рода Anoplocephala (Dolezalova et al., 2015). Скорее всего, с таким же успехом можно говорить о возможности случайного попадания к человеку и других представителей аноплоцефалид, чьими окончательными хозяевами являются млекопитающие. Фактически и Killigrewia sp., и Mathevotaenia symmetrica, и Moniezia expansa, и Moniezia benedeni были выявлены у человека только один, в лучшем случае, два раза, что доказывает их явно случайное попадания к нему.
Среди пяти перечисленных родов чаще других встречающимися и наиболее значимыми являются представители двух - Bertiella и Inermicapsifer. При этом следует также обратить внимание на факт роста числа случаев регистрации аноплоцефалид, особенно видов Bertiella, как у человека, так и у приматов не только в тропических и субтропических регионах, но и на других широтах, что вызывает определённую тревогу у медицинских работников.
И, наконец, не может не насторожить то обстоятельство, что заразиться этими гельминтами могут не только местные жители, но и лица, по тем или иным причинам посещающие эндемичные по данным цестодозам регионы. Сказанное наглядно продемонстрировал, описанный выше случай, имевший место в Австрии (Prosl, 2005).
Что касается путей заражения человека, то учитывая особенности жизненного цикла аноплоцефалид, в который включены промежуточные хозяева, можно с уверенностью говорить о том, что происходит оно per os с загрязнённой пищей, а также с грязными руками, на которых случайно могли оказаться частицы почвы с инвазированными клещиками или же сами членистоногие.. Во всяком случае, известно, что дефинитивные хозяева многих аноплоцефалид, в частности овцы, козы, крупный рогатый скот, верблюды и многие-многие другие, заражаются при случайном заглатывании клещиков или других насекомых с растительной пищей.
Если говорить о медицинских препаратах для лечении, т.е. изгнания гельминтов из организма человека, то в подавляющем большинстве публикаций сообщается об успешном применении для этих целей празиквантела (Gonzalez et al., 1996; Lamon, Greer, 1986; Martinez et al., 2009; Prosl, 2005 и т.д.) или же никлозами-да (el-Shazly et al., 2004).
Однако, как известно, любое заболевание легче предупредить, чем лечить, и потому соблюдение соответствующих санитарно-гигиенических правил, как в личной жизни, так и в общественных местах, является самым надёжным заслоном на пути проникновения паразита в организм человека.
41
Семейство Bothriocephalidae Blanchard, 1849
Синонимы (no: Kuchta et al., 2008b):
Ptychobothriidae Ltlhe, 1902
Acompsocephalidae Rees, 1969
Семейство Bothriocephalidae включают в состав отряда Bothriocepbalidea, объединяющего в целом 4 семейства с 48 родами и 134 видами (Brabec et al., 2015; Kuchta et al., 2008a, b). Представители отряда - цестоды от мелких до крупных размеров, характеризуются положением половой поры на дорсальной, дорсолатеральной или латеральной сторонах и позади вентральной маточной поры, отсутствием мускулистого наружного семенного пузырька, наличием мешкообразной матки, иногда известной как маточный мешок, и паразитированием в основном в костистых рыбах. Гомойотермные позвоночные среди окончательных хозяев ботриоцефалидей не известны (Kuchta et al., 2008b).
Несмотря на то, что взрослые формы Bothriocephalidae являются паразитами рыб и амфибий (отмечены у саламандр семейства Plethodontidae), материалы по данному семейству включены в монографию, поскольку недавние публикации (Yera et al., 2013) показали, что яйца этих гельминтов могут быть обнаружены у человека.
Описание (по: Протасова, 1977; Kuchta et al., 2008b). Цестоды от мелких и средних до крупных размеров, с характерными чертами отряда. Стробила уплощённая или, реже, спирально закрученная. Сегментация имеется или отсутствует. Проглотти-дыы краспедотные или нет, их ширина обычно больше длины. Сколекс варьирует по форме; как правило, с двумя ботриями и вооружённым крючочками или невооружённым апикальным диском, последний иногда может отсутствовать. В половом сегменте одинарный или двойной набор половых органов. Семенники медуллярные, в основном в двух латеральных полях, могут сливаться медианно. Сумка цирруса маленькая, тонкостенная, циррус невооружённый. Половой атриум дорсальный, расположен в срединном поле проглоттиды. Половая пора медианная или слегка субмедианная (основной отличительный признак ботриоцефалид от представителей других семейств отряда Bothriocephalidea). Яичник расположен позади, обычно поперечно-удлинённый. Вагина позади сумки цирруса. Желточные фолликулы обычно кортикальные. Маточный проток синусоидный, проходит вокруг сумки цирруса. Матка ботриоцефалидного типа, сферическая или овальная, реже дольчатая, с медианным или субмедианным маточным отверстием. Яйца с крышечкой или без неё. Паразиты морских, солоноватоводных и пресноводных костистых рыб, редко - амфибий. Типовой род - Bothriocephalus Rudolphi, 1808.
Семейство Bothriocephalidae объединяет 14 родов (Kuchta et al., 2008а, b).
В упомянутом выше случае регистрации у человека яиц ботриоцефалид (Yera et al., 2013) речь шла об одном из представителей типового рода - Bothriocephalus acheilognathi Yamaguti, 1934. Однако в результате выполненной недавно ревизии ботриоцефалидей, когда была восстановлена самостоятельность рода Schyzo-cotyle Akhmerov, 1960, обоснованного более полувека назад для цестод, паразитирующих у амурского плоскоголового жереха Pseudaspius leptocephalus, названный вид был переведён в этот род как Schyzocotyle acheilognathi (Yamaguti, 1934) (Brabec et al., 2015; Bray, 2015).
42
Род Schyzocotyle Akhmerov, 1960
Синонимы (no: Brabec et al., 2015):
Bothriocephalus Rudolphi, 1808 (частично)
Ptychobothrium LOnnberg, 1889 (частично) Coelobothrium Dollfus, 1970 Capooria Malhotra, 1985
A. X. Ахмеров (1960) обосновал новый род Schyzocotyle с типовым видом Schyzocotyle flu-viatilis Akhmerov, 1960 для цестод, обнаруженных им в кишечнике амурского плоскоголового жереха на Дальнем Востоке. Неверно оценив расположение ботрий, которые, по мнению А. X. Ахмерова, открывались на апикальном диске, автор поместил новый род в семейство Cyathocephalidae. Видимо, по этой причине он отсутствует в монографии Е. Н. Протасовой (1977), посвящённой Bothriocephalidae. М. Н. Дубинина (1982, стр. 43) отнесла Schyzocotyle fluviatilis к числу синонимов Bothriocephalus acheilognathi Yamaguti, 1934 («по характеру сколекса»), а сам род Schyzocotyle - к синонимам Bothriocephalus («по строению стробилы»). Результаты выполненных недавно молекулярно-генетических исследований ботриоцефалидей показали самостоятельность названных родов, которые, к тому же, чётко отличаются морфологией сколекса: у Schyzocotyle он имеет сердцевидную форму с узкими глубокими ботриями и слабо развитым апикальным диском, тогда как у всех Bothriocephalus сколекс удлинённый, с мелкими длинными ботриями (Brabec et al., 2015).
Описание (по: Ахмеров, 1960; Brabec et al., 2015). Черви средних размеров. Стробила обычно с акраспедотными проглоттидами, чья ширина больше их длины. Членики отделены один от другого. Сколекс сердцевидный; апикальный диск слабо развитый, не вооружённый крючьями; ботрии узкие, глубокие, с простыми краями. Шейка отсутствует. Семенники в двух латеральных полях, между проглоттидами не прерываются. Сумка цирруса сферическая, циррус невооружённый. Половая пора медианная. Яичник медианный, поперечно-двудольчатый, компактный. Вагина позади сумки цирруса. Желточники многочисленные, циркумкортикальные. Маточный проток S-образный, в зрелых проглоттидах обычно расширенный. Матка от сферической до поперечно-овальной, в терминальных члениках занимает постмедианное пространство. Маточная пора медианная. Яйца с крышечкой. Типовой вид -Schyzocotyle acheilognathi (Yamaguti, 1934).
Учитывая перевод Schyzocotyle fluviatilis (типового вида Schyzocotyle) в синонимы «Bothriocephalus acheilognathi», типовым видом данного рода становится Schyzocotyle acheilognathi (Yamaguti, 1934), как описанный по времени раньше, чем Schyzocotyle fluviatilis (Brabec et al., 2015). Помимо типового вида, род содержит ещё один вид - Schyzocotyle nayarensis (Malhotra, 1985) Brabec et al., 2015.
Schyzocotyle acheilognathi (Yamaguti, 1934) Brabec, Waeschenbach, Scholz, Littlewood et Kuchta, 2015 (=Bothriocephalus acheilognathi Yamaguti, 1934; =Bothriocephalus aegyptiacus Rysavy et Moravec, 1975; =Bothriocephalus fluviatilis Yamaguti, 1952; =Bothriocephalus gowkongensis Yeh, 1955; =Bothriocephalus kivuensis Baer et Fain, 1958; =Bothriocephalus opsariichthydis Yamaguti, 1934; =Bothriocephalus phoxini Molnar, 1968; ^Schyzocotyle fluviatilis Akhmerov, 1960) (рис. 21 - 23). Синонимы приведены по работам: Дубинина, 1982; Brabec et al., 2015; Korting, 1975; Kuchta, Scholz, 2007; Pool, 1987; Pool, Chubb, 1985.
Впервые паразит описан на материале от горчака Acheilognathus rhombeus из озера Огура (Ogura) на реке Йода (Yoda) в Японии (Yamaguti, 1934). Видовое название цестоде было дано по латинскому названию рода её хозяина: Acheilogna-
43
thus - ханкинские, или амурские, горчаки из семейства карповых. В последующие годы паразит был выявлен по всему миру в многочисленных представителях карповых рыб, причём описан он не менее чем под 20 различными названиями (Kuchta, Scholz, 2007). Чаще всего среди них упоминались Bothriocephalus gowkon-gensis и В. opsariichthydis (синонимы Schyzocotyle acheilognathi).
Рис. 21 Schyzocotyle acheilognathi, сколекс (из: http://nas.er.usgs.gov/queries/greatlakes/FactSheet.aspx)
Schyzocotyle acheilognathi'. сколекс
овЬоо Л о® о о Л® ~
ООоОО^О
оо?°оо
Рис. 22
(A), - участок половозрелой стробилы (Б) (из: Yamaguti, 1934; как Bothriocephalus acheilognathi)
Рис. 23 Schyzocotyle acheilognathi, сегмент (cs - сумка цирруса; ut - матка; ov - яичник; vit -желточники; t - семенники; vd - семяпроток) (из: Bertasso, Avenant-Oldewage, 2005; как Bothriocephalus acheilognathi)
44
Взрослые особи S. acheilognathi длиной от 10 до 80 при ширине 1.2 - 3.2 мм. Анализ многочисленных литературных данных показал, что длина тела паразита зависит от вида хозяина и его возраста, от численности цестод в рыбе и возраста заражения, а также региона обитания хозяина и обычно не превышает 8 см, хотя описаны и более крупные особи. Сегментация полная на всём протяжении стробилы, но в её передней части не совсем отчётливая из-за наблюдаемого здесь вторичного деления сегментов. Ширина члеников намного меньше таковой сколекса. Сколекс сердцевидный, с характерными узкими и глубокими ботриями. Форма сколекса и ботрий зависит от того, в каком положении червь зафиксирован на предметном стекле, а также от способа фиксации (Pool, Chubb, 1985). Семенников 60 - 100 в каждом сегменте. Половая пора располагается на членике медианно. Поперечно-овальный мускулистый маточный мешок находится в медианном поле и при заполнении яйцами может заходить на предшествующий сегмент. Яйца 50-54 х 33 - 40 pm (Yamaguti, 1934). При выходе из матки червя яйца содержат почти сформированный эмбрион. Вылупление личинок из яиц при температуре 28 - 30°С происходит в течение 1-5 дней, а при 10 - 15°С - от 10 до 28 (Marcogliese, 2008).
В отличие от многих представителей ботриоцефалид, 5. acheilognathi имеет более упрощённый жизненный цикл, в котором участвуют всего два хозяина -промежуточный и дефинитивный. В роли промежуточного хозяина выступают многочисленные и широко распространённые рачки из родов Acanthocyclops, Cyclops, Diacyclops, Eucyclops, Macrocyclops, Megacyclops, Mesocyclops, Paracyclops, Thermocyclops, Tropocyclops, которые активно заглатывают плавающих в воде сво-бодноживущих корацидиев. В организме циклопов личинки проникают в гемоцель (полость тела), где развиваются в следующую личиночную стадию - процеркоид, который достигает инвазионного состояния при температуре 29 - 31°С в течение 11 -18 дней, а при 20°С - 49 дней. Попав в организм окончательного хозяина - питающихся копеподами рыб, личинки достигают взрослого состояния за 21 - 23 дня при температуре 28 - 29°С. Хищные рыбы заражаются при поедании мирных рыб, поражённых S. acheilognathi, но, тем не менее, их участие в жизненным цикле данного паразита не является обязательным.
S. acheilognathi, получивший название азиатского рыбьего червя (Asian fish tapeworm), имеет исключительно широкий круг дефинитивных хозяев: 234 вида рыб, 1 вид амфибий, 3 вида рептилий и 3 вида птиц (Jichoya, 2011). Обнаружение этих гельминтов у нетипичных хозяев, в частности птиц, вполне объяснимо, учитывая, что те могут питаться рыбой, в том числе заражённой. Более того, подобные «хозяева» способствуют пассивному распространению паразита, поскольку во внешнюю среду вместе с экскрементами хозяина попадают и яйца гельминта. И всё же наиболее обычные хозяева этого вида - карп Cyprinus carpio, как разводимый, так и дикий, а также белый амур Ctenopharyngodon idelkr, массовое расселение этих рыб по странам и континентам, наблюдаемое в последние десятилетия, обеспечило и широкое распространение цестоды.
В настоящее время S. acheilognathi известен на всех шести континентах, включая изолированные океанические острова (на Гавайях, например, им заражено 5 видов местных рыб; Font, Tate, 1994), и даже водоёмы подземных пещер (Choud-hury et al., 2013; Scholz et al., 2012)..
Известно, что S. acheilognathi наносит значительный экономический ущерб в рыбных хозяйствах индустриального типа из-за снижения общего объёма выра
45
щиваемой продукции, а иногда и гибели рыб. В случае массовой инвазии, в частности карпа, белого амура, пёстрого толстолобика, серебряного и золотого карасей и ряда других рыб, цестоды вызывают у тех заболевания, сопровождающиеся серьёзными изменениями в различных органах и тканях, глубокими нарушениями многих жизненно важных функций. Прикрепляясь к слизистой кишечника, черви повреждают её, вызывают разрушение клеток, кровоизлияния, воспаление, при этом повреждённые участки становятся местом поселения болезнетворных бактерий, что усложняет течение болезни. Большое количество червей, к тому же, приводит к закупорке кишечника, нарушает процесс пищеварения. И наконец, продукты обмена гельминтов, выделяемые ими в процессе жизнедеятельности, отравляют организм рыбы. Больные рыбы становятся вялыми, плавают у поверхности воды, отказываются от корма, истощены, брюшко вздуто.
После общего ознакомления с азиатским червем, обратимся к источнику, послужившему основанием для его включения в данную монографию.
В 2013 г. увидела свет статья, авторы которой (Yera et al., 2013) сообщили об обнаружении яиц «Bothriocephalus acheilognathi» в стуле человека. Пострадавшим оказался 32-летний житель Французской Гвианы, проводивший во Франции в апреле 2009 г. свой отпуск. Через две недели после прибытия в Лион он посетил Отдел тропических болезней Центра вакцинации (International Travel Vaccination Centre) для прививки от жёлтой лихорадки. При этом пациент пожаловался на беспокоившие его в течение нескольких недель абдоминальные боли. Копроовоскопи-ческий анализ показал наличие в его стуле яиц цестоды, похожих на таковые ди-филлоботриидей или ботриоцефалидей (рис. 24).
Рис. 24 Schyzocotyle acheilognathi, яйца цестоды, выявленные в стуле человека (из: Yera et al., 2013; как Bothriocephalus acheilognathi)
Яйца имели овальную форму, крышечку на одном из полюсов и достигали в размерах 47 - 52 х 33 -36 pm. На основании морфологических особенностей яйца первоначально отнесли к роду Diphyllo-
bothrium, но для подтверждения диагноза всё же отправили в Париж в Департамент паразитологии Университетской больницы (Cochin Hospital). Здесь в результате молекулярно-генетического анализа была показана идентичность выявленных у человека яиц с таковыми Bothriocephalus acheilognathi (=Schyzocotyle acheilognathi). В ходе собеседования с пациентом выяснилось, что дома он регулярно ест сырую рыбу, в частности рыбу-волка Hoplias aimara, псевдоплатистому Pseudoplatystoma и горбыля Plagioscion squamosissimus. Надо полагать, что яйца «ботриоцефала» попали в организм пострадавшего с плохо обработанной рыбой, заражённой этим
гельминтом.
Авторы публикации рассматривают данный случай в качестве примера так называемого ложного паразитизма, когда случайно попавшие в организм человека яйца паразита транзитом проходят через его пищеварительный тракт. Тем не менее, стоит обратить внимание на тот факт, что человек, у которого были обнаружены яйца этой цестоды, жаловался на абдоминальные боли. Никаких других симптомов, указывающих на паразитарную инвазию, у пациента не было выражено. После
46
приёма никлозамида (niclosamide) брюшные боли исчезли, а контрольный анализ стула дал отрицательный результат.
Цитируемая литература
Ахмеров А. X. Ленточные черви рыб реки Амур // Труды Гельминтологической лаборатории АН СССР.-1960.-10.-С. 15-31.
Дубинина М. Н. О синонимизации видов рода Bothriocephalus (Cestoda, Bothriocephalidae), паразитирующих в карповых СССР // Паразитология. - 1982. - 16, 1. - С. 41 - 45.
Протасова Е. Н. Ботриоцефаляты - ленточные гельминты рыб И Основы цестодологии. - М.: Наука, 1977.-298 с.
Bertasso A., Avenant-Oldewage A. Aspects of the ecology of the Asian tapeworm, Bothriocephalus acheilognathi Yamaguti, 1934 in yellowfish in the Vaal Dam in South Africa П Onderstepoort Journal of Veterinary Research. - 2005. - 72, 3. - P. 207 - 217.
Brabec J., Waeschenbach A., Scholz T., Littlewood D.T., Kuchta R. Molecular phylogeny of the Bothrioce-phalidea (Cestoda): Molecular data challenge morphological classification I I Int. J. Parasitol. - 2015. - 45, 12. -P. 761 -771. doi: 10.1016/j.ijpara.2015.05.006.
Bray R. (2015). Schyzocotyle acheilognathi (Yamaguti, 1934) Brabec, Waeschenbach, Scholz, Littlewood & Kuchta. 2015. Accessed through: World Register of Marine Species at http://www.marine species. org/aphia.php?p=yaxdetails&id=851606 on 2017.01-06.
Choudhury A., Zheng S.t Perez-Ponce de Leon G., Martinez-Aquino A„ Brosseau C, Gale E, The invasive Asian fish tapeworm, Bothriocephalus acheilognathi Yamaguti, 1934, in the Chagres River / Panama Canal drainage, Panama I I BioInvasions Records. -2013.-2, 2. - P. 99 - 104. doi: dx.doi.org/10.3391/ bir. 2013.2.2.02.
Font W. F.t Tate D. C. Helminth parasites of native Hawaiian freshwater fishes: an example of extreme ecological isolation 11 J. Parasitol. - 1994. - 80, 5. - P. 682 - 688.
Jichova M. [The hosts and geographical distribution of the tapeworm Bothriocephalus acheilognathi (Cestoda: Bothriocephalidea). - BSc. Thesis, in Czech.]. - Faculty of Science, Univ. South Bohemia, Ceskd Bud$jovice, Czech Republic, 2011. - 65 pp.
Korting W. Larval development of Bothriocephalus sp. (Cestoda: Pseudophyllidea) from carp (Cyprinus car-pio L.) in Germany 11 J. Fish Biol. - 1975. - 7, 6. - P. 727 - 733.
Kuchta R, Scholz T. Diversity and distribution of fish tapeworms of the ’Bothriocephalidea’ (Eucestoda) // Parassitologia. - 2007. - 49, 1. - P. 21 - 38.
Kuchta R, Scholz T, Brabec J., Bray R. A. Suppression of the tapeworm order Pseudophyllidea (Platyhel-minthes: Eucestoda) and the proposal of two new orders, Bothriocephalidea and Diphyllobothriidea // Int. J. Parasitol. - 2008a. - 38, 1. - P. 49 - 55.
Kuchta R, Scholz T„ Bray R. A, Revision of the order Bothriocephalidea Kuchta, Scholz, Brabec & Bray, 2008 (Eucestoda) with amended generic diagnoses and keys to families and genera П Syst. Parasitol. -2008b.-71, 2.-P. 81 - 136. doi: 10.1007/sl 1230-008-9153-7.
Marcogliese D. J. First report of the Asian fish tapeworm in the Great Lakes 11 J. Great Lakes Res. - 2008. -34, 3.-P. 566-569.
Pool D. W. A note on the synonymy of Bothriocephalus acheilognathi Yamaguti 1934, B. aegyptiacus RySavy and Moravec, 1975 and B. kivuensis Baer and Fain, 1958 H Parasitol. Res. - 1987. - 73, 2. - P. 146 -150.
Pool D. W., Chubb J. C. A critical scanning electron microscope study of the scolex of Bothriocephalus acheilognathi Yamaguti 1934, with a review of the taxonomic history of the genus Bothriocephalus parasitizing cyprinid fish I I Syst. Parasitol. - 1985. - 7, 3. - P. 199-211.
Scholz T., Kuchta R., Williams C. Bothriocephalus acheilognathi Yamaguti, 1934. Chapter 17 / Woo P. T. K., Buchmann K., eds. Fish parasites: pathobiology and protection. - Oxfordshire, UK: CAB International, 2012.-P. 282-297.
Yamaguti S. Studies on the helminth fauna of Japan. Part 4. Cestodes of fishes П Japan. J. Zool. - 1934. - 6, l.-P. 1-112.
Yera H., Kuchta R., Brabec J., Lapierre A. R, Dupouy-Camet J. First identification of eggs of the Asian fish tapeworm Bothriocephalus acheilognathi (Cestoda: Bothriocephalidea) in human stool 11 Parasitol. Intern. -2013.-62, 3.-P. 268-271. DOI: 10.1016/j.parint.2013.02.001.
47
Семейство Davaineidae Braun, 1900
Семейство входит в состав отряда Cyclophyllidea (см. характеристику в Anoplocephalidae).
Описание (по разным авторам, в том числе: Мовсесян, 2003).. Цестоды от средних до очень крупных размеров. На верхушке сколекса имеется хоботок, вооружённый многочисленными мотыго- или молоткообразными крючьями, расположенными в один, два или несколько рядов. Присоски на сколексе с шипиками или без них. Половой аппарат в члениках одинарный или двойной. Семенные пузырьки отсутствуют. Половые поры односторонние. Матка устойчивая или распадающаяся на капсулы. Яйца, по одному или несколько, заключены в паренхиматозные капсулы. Паразиты птиц, реже млекопитающих, в том числе человека. Типовой род - Davainea Blanchard, 1891.
В научной и научно-справочной литературе в качестве автора рода, как правило, называют только Р. Бланшара (Blanchard, 1891), что фактически соответствует действительности. Однако в некоторых источниках у данного рода указаны два автора: Davainea Blanchard et Railliet, 1891 (Мовсесян, 2003; www.gbif.org).
Жизненный цикл Davaineidae включает смену двух хозяев - промежуточного (членистоногие, моллюски) и дефинитивного (птицы, млекопитающие). Случаи нахождения этих цестод у представителей других классов позвоночных пока не известны.
Семейство Davaineidae - одно из самых богатых видами в отряде цикло-филлидей. Оно объединяет около 450 видов из 14 родов, паразитирующих главным образом в птицах (около 425 видов, 127 из которых зарегистрированы у отряда куринообразных), а также в млекопитающих (включая 6 видов - паразитов человека; см. далее) (Jones et al., 1994; Littlewood et al., 2008). А. А. Спасский (1996) рассматривал в составе семейства 50 родов (в настоящее время подавляющее большинство из них сведены в синонимы), а С. О. Мовсесян (2003) - 18.
У человека зарегистрированы представители трёх родов давенеид - Buginet-ta Spassky, 1994, Raillietina Blanchard, 1891 и Tenoretta Spassky, 1994. Несмотря на то, что и Buginetta, и Tenoretta признаны валидными родами (www.gbif.org; bug.ta-mu.edu), по непонятной причине они не включены в последнюю монографию С. О. Мовсесяна (2003), посвящённую Davaineidae, и даже не обсуждаются в ней, а входящие в них виды рассматриваются в составе рода Raillietina.
Не вступая в дискуссию по данному вопросу, рискну привести описание обнаруженных у человека Davaineidae в соответствии с предложенной А. А. Спасским (1994,1996) классификацией.
Цитируемая литература
Мовсесян С. О. Давэнеаты - ленточные гельминты животных и человека И Основы цестодологии. -М.: Наука, 2003. -13,1. - 295 с.
Спасский А. А. Три новых рода давенеид (Cestoda: Cyclophyllidea)- паразитов млекопитающих // Bule-tinul Academiei de Stiinte a Rep. Moldova, Stiinte Biologice si Chimice. - 1994. - nr. 6. - P. 66.
Спасский А. А. Три новых рода цестод подсемейства Raillietininae (Cestoda, Cyclophyllidea, Davaineidae) - паразитов млекопитающих // Вестник зоологии. - 1996. - № 3. - С. 54 - 55.
Ashford R. W., Crewe W. The parasites of Homo sapiens: An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
48
Blanchard R Notices helminthologiques. Sur les Teniades a ventouses armies generes Echinocotyle, Davai-nea, Ophriocotyle // Mem. Soc. zool. France. - 1891. - 4. - P. 420 - 489.
Jones A., Bray R. A, Family Davaineidae Braun, 1900 / Khalil L. F., Jones A., Bray R. A. eds. Keys to the cestode parasites of vertebrates. - CABI, Wallingford, U. K., 1994. - P. 407 - 441.
Littlewood D. T. J., Waeschenbach A., Nikolov P. N. In search of mitochondrial markers for resolving the phylogeny of cyclophyllidean tapeworms (Platyhelminthes, Cestoda) - a test study with Davaineidae 11 Acta Parasitol. - 2008. - 53, 2. - P. 133 - 144.
Род Buginetta Spassky, 1994
В 1994 г. А. А. Спасский установил новый род Buginetta для одного из представителей рода Raillietina — R. alouattae (Baylis, 1947), который и стал типовым в нём. В 1996 г. этот же автор (Спасский, 1996) включил в обоснованный им род ещё один вид Raillietina - R. demera-riensis (Daniels, 1895).
Описание (по: Спасский, 1996). Цестоды средних и крупных размеров, с характерными чертами семейства. На хоботке двойная корона из многочисленных крючьев. Вооружение присосок многорядное. Проглоттиды многочисленные, краспедотного типа, ширина половозрелых члеников превышает их длину. Продольная мускулатура не образует крупных пучков. Вентральные экскреторные сосуды широкие, с анастомозами, расположены кнаружи от узких дорсальных каналов. Половой аппарат одинарный. Половые поры односторонние. Половые протоки проходят между поральными сосудами. Женские половые железы расположены субмедианно. Яичник многолопастный, желточник позади яичника. Семенники многочисленные, находятся в среднем поле, латерально от женских половых органов. Семяпровод спирально извит, окружён массой железистых клеток. Бурса цирруса грушевидная, не достигает вентральных сосудов. Циррус с мелкими шипиками. Вагина позади мужского протока, её копулятивная часть изнутри со щетинками, снаружи покрыта слоем железистых клеток. В капсулах до 12 яиц. Взрослые формы - паразиты обезьян. Типовой вид - Buginetta alouattae (Baylis, 1947) Spassky, 1994.
Buginetta alouattae (Baylis, 1947) Spassky, 1994 (рис. 25). Вид описан на материале от обезьяны ревуна из Гайаны. Видовое название паразита - производное от родового названия его хозяина: Alouatta - род обезьян ревунов, обитающих в Южной и Центральной Америке.
В монографии С. О. Мовсесяна (2003) приведено краткое описание вида по работе описавшего его автора (Baylis, 1947). Стробила длиной 13 - 34 см и максимальной шириной 2.5 - 7 мм; однажды встретился червь длиной 58 см. Сколекс шириной 0.45 - 0.62 мм. Хоботок диаметром 0.19-0.15 мм, вооружён 176 - 224 крючьями длиной 15-17 pm, расположенными в два ряда. Присоски диаметром 0.12-0.17 мм, с 10 - 12 рядами шипиков, имеющих длину до 8 - 9 pm. Половые отверстия открываются с левой стороны у переднего края членика. Половые протоки проходят между дорсальными и вентральными экскреторными сосудами. Бурса цирруса 0.2 - 0.25 х 0.10 - 0.11 мм. Кутикулярные стенки семяизвергательного канала покрыты шипиками. Семенников 110 - 140. Матка распадается на 38 - 55 яйцевых капсул диаметром 0.15 х 0.45 мм, в каждой из капсул по 6 - 11 яиц диаметром 44 - 60 pm, онкосфера 14 - 20 pm. X. Сато с соавт. (Sato et al., 1988) приводят литературные данные, согласно которым количество семенников в членике достигает 150, количество яйцевых капсул варьирует от 40 до 80, а в каждой капсуле содержится по 3 - 8 яиц.
49
Рис. 25 Buginetta alouttae: J, 6 - сколекс; 2, 4, 8 - гермафродитные членики; 3 -зрелый членик; 5 - продольный срез половой бурсы и вагины; 7 - крючки хоботка; 9 -11 - зрелые членики (из: Мовсесян, 2003 - по разным авторам, в том числе 10 и 11 - оригинальные рисунки автора; как Raillietina alouatta)
Взрослые формы В. alouattae - облигатные паразиты обезьян ревунов - гайанского, рыжего и других в Южной Америке.
Названный вид - или как Raillietina alouattae (Мовсесян, 2003), или как Buginetta alouattae (Спасский, 1994, 1996; Muller, 2002) - упоминают практически всегда, когда заходит речь о паразитировании давенеид у человека. Однако мне не удалось найти первоисточник, послуживший основой для данного утверждения; да и в цитируемых работах какие-либо ссылки по этому поводу отсутствуют.
Buginetta demerariensis (Daniels, 1895) Spassky, 1996 [-Taenia demerariensis Daniels, 1895; ^Raillietina demerariensis (Daniels, 1895) Joyeux et Baer, 1929] (рис. 26). Вид описан по двум экземплярам цестоды, без сколекса, полученным от жителя Британской Гвианы (с 1966 г. - Гайана) (Daniels, 1895). Видовое название паразита связано с названием местности Демерара (Demerara), где он был обнаружен.
Через четверть века R. demerariensis выделили от 10-летнего ребёнка в Эквадоре (Davila, 1922), определив как Davainea madagascarensis. Л. Леон (Le6n, 1938), работавший в Эквадоре и собравший обширный материал по этим цестодам, описал их как новый вид Raillietina quitensis, а Р.-П. Дольфю на материале Л. Леона не только переопи-сал R. quitensis (Dollfus, 1939), но и обосновал новые виды - Raillietina brumpti, R. equator iensis, R, leoni и R. luisaleoni (Dollfus, 1939-1940). Все перечисленные виды в последующем сведены в синонимы Raillietina demerariensis. В 1996 г. А. А. Спасский (1996) включил Raillietina demerariensis (Daniels, 1895) в род Buginetta.
50
Рис. 26 Buginetta demerariensis'. 1 - сколекс и крючья; 2 - 5 - членики разной степени развития (из: Мовсесян, 2003; как Raillietina demerariensis)
Длина цестод до 90 - 120 см (Геф-тер, 1968; Sawada, 1965), черви от агути достигали в длину 32 - 66 см (Sato et al., 1988). При описании данного вида Э. Фауст (Faust, 1949) указывает для него длину в 10 - 12 м, ссылаясь на материалы из коллекции Л. Леона (Leon) («Leon’s specimens measured up to
10 to 12 meters in length..»; стр. 291). Однако, если судить по одной из публикаций исследователя, на которого ссылается Э. Фауст, то Л. Леон для цестоды, описанной им как Raillietina quitensis (в настоящее время - синоним у Buginetta demerariensis), указал длину 1.2 м (Leon, Leon, 1978).
Сколекс с двойной короной из 162 - 184 крючьев на хоботке. Овальные присоски с шипиками. В стробиле до 5000 члеников. Половые поры односторонние, у передней трети бокового края члеников. Бурса цирруса размерами 0.120 -0.180 х 0.050 - 0.066 мм, достигает вентрального экскреторного сосуда. Вагина позади бурсы цирруса. Многочисленные семенники (48 - 70) окружают яичник по бокам и сзади, а в некоторых члениках и спереди. Желточник компактный. Зрелые проглоттиды содержат по 75 - 250 яйцевых капсул, в каждой из которых по 7 - 9 яиц размерами 25 - 40 pm, реже яиц меньше, иногда больше, до 12 (Faust, 1949). X. Сато с соавт. (Sato et al., 1988) в члениках цестод из лесного кролика насчитали по 125 - 187 капсул, в каждой из них по 16-25 яиц размерами 28 - 34 х 18-20 pm, а в особях из агути - соответственно 234 - 331 капсул, 20 яиц, 32 - 36 х 22 - 24 pm.
Дефинитивные хозяева паразита - грызуны, в частности хутия кубинская, дикобраз короткохвостый волосатый карликовый, агути, лесной кролик, а также приматы, в том числе рыжий, или красный, ревун. В одной из публикаций (Gillani et al., 2012) её авторы пишут об участии в жизненном цикле В. demerariensis муравьёв рода Cardiocondyle (ссылки на источник информации отсутствуют). В действительности эти муравьи - промежуточные хозяева другого вида даванеид -Raillietina celebensis (см. Tenoretta celebensis) (Tang, Tang, 1964).
Первое обнаружение В. demerariensis у человека датируется 1895-м годом, тогда этого паразита выявили у жителя Гайаны (Daniels, 1895). В 1922 г. зафиксировали второй случай, на этот раз в Эквадоре в Кито у 10-летнего мальчика, стра
51
давшего диареей и жаловавшегося на боли в животе (Davila, 1922). В последующие годы подобные случаи наблюдались в разных регионах Эквадора, и к 1958 г. их количество превысило сотню (Le6n, 1964). В частности в районе Тумбако (Tumbaco) с 1933 по 1961 гг. было отмечено 104 случая (Leon, Le6n, 1978). Эквадор, скорее всего, является регионом, эндемичным по данному гельминтозу. В этой стране в сельской местности вокруг Кито цестоду выявили у 5 % пациентов. Чаще всего от инвазии страдают дети (Garcia, 2007).
Единичные случаи заражения людей В, demerariensis зафиксированы также на Кубе, в Гайане, Гондурасе, Аргентине и Венесуэле (Leon, Leon, 1978).
Заражение В. demerariensis не имеет специфических симптомов. Тем не менее, могут наблюдаться тошнота, рвота, колики, диарея, боли в животе, слабость, головная боль и другие неприятные симптомы, часто сопровождающие различные гельминтозные инвазии у человека (DAvila, 1922; Leon, Leon, 1978).
Предполагается, что люди заражаются при случайном попадании на пищу частиц почвы, в которой могли оказаться инвазированные насекомые.
Цитируемая литература
Гефтер В. А. Глава XXII. Прочие цестодозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 527 -537. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Мовсесян С. О. Давэнеаты - ленточные гельминты животных и человека // Основы цестодологии. -М.: Наука, 2003. - 13,1. - 295 с.
Спасский А. А. Три новых рода давенеид (Cestoda: Cyclophyllidea) - паразитов млекопитающих // Bule-tinul Academiei de Stiinte a Rep. Moldova, Stiinte Biologice si Chimice. - 1994. - nr. 6. - P. 66.
Спасский А, А. Три новых рода цестод подсемейства Raillietininae (Cestoda, Cyclophyllidea, Davaineidae) - паразитов млекопитающих И Вестник зоологии. - 1996. - № 3. - С. 54 - 55.
Baylis Н. A. Some roundworms and flatworms from the West Indies and Surinam. 2. Cestodes // J. Linn. Soc. (Zool.), London. - 1947. - 41. - P. 406 - 416.
Daniels C. W. Taenia demerariensis II Br. Guiana Med. Ann. - 1895. - 7. - P. 96 - 98.
Davila L. G. Contribucidn al estudio de la parasitologia en el Ecuador. Dos casos de Tenia // Ann. Univ. Central. Quito. - 1922. - 31, no. 244. - P. 11-15.
Dollfus R.-P. Cestodes du genre Raillietina rdcemment observes chez I’homme en Equateur // Bull. Soc. Path. Exot. - 1939. - 32, 6. - P. 660 - 665.
Dollfus R.-P. Cestodes du genre Raillietina trouves chez I’homme en Amdrique Intertropical // Ann. Parasitol. Hum. Comp. - 1939 - 1940. - 17, 5-5. - P. 416 - 442, 542 - 556.
Faust E. C. Human Helminthology. - Lea & Febiger, Philadelphia, 1949. - P. 290 - 291.
Gillani S. W., Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - 2012. - 111 pp. (https:// books.google.com/books?isbn=1105494594).
Leon L. A. Contribucidn al studio de la parasitologia Sudamericana. El gdnero Raillietina у su fracuencia en el Ecuador // Rev. Med. Trop., Parasitol., Bacteriol., Clin, у Laborat. - 1938. - 4,4. - P. 214 - 230.
Leon L. A. Un foco endemic de raillietiniasis observado a travds de treinta aflos // Rev. Medicina (Mexico). -1964.-44, 944.-P. 342-348.
Leon L. A. Leon В. C. de. Raillietiniasis en America у especialmente en el Ecuador // Rev. Ecuator Med. Cienc. Biol. - 1978. -14, 5. - P. 313 - 320.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 103.
Sato H., Okamoto M., Ohbayashi M., Basanez M. G. A new cestode, Raillietina {Raillietina) oligocapsulata n. sp., and R. (R.) demerariensis (Daniels, 1895) from Venezuelan mammals // Japan. J. Vet. Res. - 1988. -36, l.-P. 31-45.
Sawada I. On the genus Raillietina Fuhrmann 1920 (П) // J. Nara Gakuge Univ. (Nat.). -1965. -13. - P. 5 - 38. Tang С. C., Tang С. T. Raillietina (Raillietina) celebensis (Janicki, 1902), its development in intermediate host, epidemiology and taxonomy // Acta Parasitol. Sinica. - 1964. - l.-P. 1-13.
52
Род Raillietina Fuhrmann, 1920
Синонимы (по: bug.tamu.edu):
Ransomia Fuhrmann, 1921, подрод
Kotlania L6pez-Neyra, 1929
Nonarmina Movsesyan, 1966, подрод
Nonarmiella Movsesyan, 1966, подрод
Kotlanotaurus Spassky, 1973
Oschmarinetta Spassky, 1984
Roytmania Spassky, 1973 ,
Skrjabinotaurus Spassky et Yurpalova, 1973
Описание (по разным авторам, в том числе: Мовсесян, 1977, 2003; Спасский, 1994). Цестоды от средних до очень крупных размеров. Хоботок вооружён крючками, расположенными в один ряд. Присоски с шипиками иди без них. Стробила состоит из многочисленных члеников. Семенники обычно многочисленные. Бурса цирруса грушевидная. Половые отверстия латеральные, односторонние. Яичник расположен в центре или немного порально. Компактный желточник находится позади яичника. В яйцевых капсулах по несколько яиц. Паразиты птиц, промежуточные хозяева -муравьи, жуки. Типовой вид - Raillietina tetragona (Molin, 1858) Fuhrmann, 1920.
Род Raillietina весьма разнообразен. Однако информация о видовом составе регистрируемых у человека райллиетин, а также количестве самих видов очень противоречива. В справочно-информационной сводке «Медицинская гельминтология...» (www.worms-info.ru/Cestoda) перечислены 3 вида Raillietina-. R. asiatica, R celebensis и R madagascariensis, тогда как В. А. Гефтер (1968) относит к этой группе 5 видов — R asiatica, R celebensis, R demerariensis, R madagascariensis и R. siri-rayi.
В монографии, посвящённой болезням человека (Muller, 2002), её автор отмечает в качестве паразитов человека R. asiatica, R celebensis, R garrisoni и R. siri-rayi, а на страницах Wikipedia (en.wikipedia.org.Raillietina) можно прочитать, что у человека встречаются Raillietina asiatica, R demerariensis и R formosana.
Авторы «Чек-листа по паразитам человека» (Ashford, Crewe, 2003) по поводу отмеченных у человека видов Raillietina пишут следующее, ссылаясь при этом на работу (Beaver et al., 1984): Raillietina asiatica - вид сомнительного определения, а для установления таксономического положения R garrisoni и R. siriraji необходимы более детальные исследования («More detailed study required to determine taxonomic status»).
В монографии «Diagnostic Medical Parasitology» (Garcia, 2007) среди паразитов человека перечислены Raillietina asiatica, R garrisoni u R siriraji, в сводке «Паразитические болезни человека» (http://www/ginomedical.com/index...cyclo-phyllidea) - R asiatica, R. celebensis, R demerariensis, R. garrisoni и R siriraji, а в «Helminthiais; Clinical insights» (Gillani et al., 2012) — R celebensis, R demerariensis и R siriraji.
В настоящее время Raillietina demerariensis переведена в род Buginetta, а Raillietina madagascariensis - в род Inermicapsifer (не все согласны с подобной трактовкой), для вида Raillietina celebensis создан новый род Tenoretta Spassky, 1994. К синонимам Raillietina celebensis относят R formosana и R garrisoni, а к синонимам R madagascariensis - R siriraji и упомянутую выше R garrisoni.
53
Raillietina asiatica (von Linstow, 1901) Stiles et Hussel, 1926 [=Taenia asiatica von Linstow, 1901; Davainea asiatica (von Linstow, 1901) Braun, 1903] (рис. 27). Экземпляр, по которому О. фон Линетов описал вид, был получен от человека в Ашгабаде (Туркменистан) и представлен фрагментом червя примерно с 750 проглоттидами, но без сколекса (von Linstow, 1901). Видовое название отражает регион обнаружения паразита: asiatica - азиатская. В некоторых зарубежных источниках местом обнаружения паразита иногда указывают северный Иран (Faust, 1949; http://www/ginomedical.com/index...cyclophyllidea) или Иран (Muller, 2002).
Небольшое отступление. В 1901 г., когда была описана «Taenia asiatica», Ашгабад, именуемый в те годы Асхабад (Ashabad), был административным центром Закаспийской области Российской империи. Этот город официально отошёл к Российской империи по Ахапскому договору с Персией 21 сентября 1881 г.
Рис. 27 Raillietina asiatica'. 1 - гермафродитный членик; 2 - маточный членик; 3 - поперечный срез в области гермафродитного членика; 4 - 5 -срезы члеников с яйцевыми капсулами (из: Мовсесян, 2003 - по: 1 -3 - Динник, Зверева, 1940; 4 - 5 -von Linstow, 1901)
Описание (по: von Linstow, 1901). Экземпляр, по которому описан вид, не имел сколекса и зрелых яиц; его длина составила 298 мм. Стробила очень узкая, самые передние проглоттиды шириной около 0.16 мм, а в конце стробилы они достигают 1.78 в ширину и 0.99 мм в длину. Семенники 0.035 - 0.044 мм, расположены в два ряда в мозговом слое и не соприкасаются друг с другом. Бурса цирруса грушевидная, 0.079 х 0.048 мм. Крупный яичник достигает внутренних стенок обоих экскреторных сосудов, с вентральной стороны он сужен и не охватывает желточ-ник. Желточник почти круглый, лежит по средней оси и занимает 1/8 поперечного сечения. Вагина внутри бурсы цирруса расширяется в большой семяприемник. Проглоттиды содержат крупные, неправильной формы яйцевые капсулы, по 60 - 70 в одном членике. Яйца 38.6 х 36.4 pm.
В дикой природе данный паразит не известен. Помимо описанного выше случая, ещё однажды упоминается находка R. asiatica у человека, на этот раз на Северном Кавказе. У 8-летнего мальчика из Армавира выделилась стробила длиной 10.2 см, состоящая из 174 члеников, в каждом из которых насчитывалось по 40 - 50 капсул с 8 - 14 яйцами (Динник, Зверева, 1940). И вновь был выявлен только фраг
54
мент цестоды, без сколекса. Авторы описали червя как Raillietina sp., указав на его большое сходство с R. asiatica.
Примечательно, но Ф. Тенора с соавт. (Tenora et al., 2004), несмотря на явные недостатки в описании R. asiatica, рассматривают возможность включения райллиетин, описанных от человека под названием Raillietina celebensis (в настоящее время - Tenoretta celebensis), в этот вид.
Raillietina garrisoni Tubangui, 1931 (рис. 28). Впервые вид описан в 1931 г. на материале от серой крысы на Филиппинах (Tubangui, 1931). В действительности же на Филиппинах его нашёл П. Гаррисон (Garrison, 1911) ещё в 1911 г., но описал
тогда под названием Davainea madagascariensis. Отметив это обстоятельство при описании нового вида, М. Тубангуи назвал цестоду в честь её первооткрывателя -
Рис. 28 Raillietina garrisoni, гермафродитные и зрелый членики (из: Tubangui, 1931)
райллиетина Гаррисона.
Паразит достигает в длину 30 см; половые поры односторонние; проглоттиды размером 3 х 1.5 мм, бурса цирруса 0.120 - 0.160 х 0.064 - 0.100 мм; в капсулах по 1 - 3 яйца, в среднем 2. По форме, размерам и цвету проглоттиды напоминают зёрна риса.
R. garrisoni очень похожа на Raillietina madagascariensis, и всё же М. Тубангуи (Tubangui, 1931) и К. Африка и Э. Гарсиа (Africa, Garcia, 1934) дифференцировали её от сравниваемого вида. Е. Странски и А. Лоренцо (Stransky, Lorenzo, 1960), обнаружившие данного гельминта у двоих детишек на Филиппинах, также рассматривают R. garrisoni самостоятельным видом, приуроченным на Филиппинах к грызунам, а к человеку попадающим случайно.
R. garrisoni фигурирует в качестве самостоятельного вида и в ряде сводок по паразитам человека (напр., Garcia, 2007; Muller, 2002, http://www/ginomedical. com/index.. .cyclophyllidea).
В то же время авторы отдельных публикаций рассматривают данный вид как синоним Raillietina madagascariensis (Мовсесян, 2003) или Raillietina celebensis (Baer, Sandars, 1956; Fain et al., 1977; Sawada, 1965).
R. garrisoni - довольно распространённый паразит грызунов на Филиппинах. Сообщения же о регистрации этой цестоды у людей очень редки. Первый подобный случай имел место в 1911 г., когда П. Гаррисон обнаружил паразита у взрослого человека в Маниле (Garrison, 1911). Затем уже в 1934 г. К. Африка и Э. Гарсиа (Africa, Garcia, 1934) приводят информацию об обнаружении гельминта на Филиппинах у двух детишек двухлетнего возраста. В 1960 г. опубликована упомянутая выше статья (Stransky, Lorenzo, 1960), авторы которой изучали инвазию этой цестодой двухлетнего ребёнка и 8-месячного малыша; оба случая также имели ме
55
сто на Филиппинах. Для определения цестоды фиксированный материал был отправлен проф. Э. Гарсиа (Е. Garcia), ранее работавшему с данной группой гельминтов.
В своём письме, отправленном авторам находки, проф. Э. Гарсия подчёркивал, что на Филиппинах промежуточными хозяевами R garrisoni являются различные беспозвоночные - навозные жуки, моллюски, саранча, причём именно саранча, скорее всего, является источником инвазии человека, поскольку относится к числу его пищевых объектов.
Raillietina siriraji Chandler et Pradatsundarasar, 1957. Впервые описана на материале от человека из Бангкока (Таиланд). Видовое название паразита - райллие-тина Сирирайи происходит от Siriraj: так называется клиника в Бангкоке - Siriraj Hospital, получившая, в свою очередь, это название в честь принца Siriraj Kakutta-phen, скончавшегося от дизентерии в 18-летнем возрасте.
Длина цестод достигает 25 - 26 см при максимальной ширине у заднего конца стробилы 2.3 - 2.5 мм. Сколекс шириной 0.33 - 0.44 мм, с двойной короной из 80 - 82 крючьев. Присоски овальные, 0.120 мм. Половые поры односторонние. В члениках от 38 до 54 семенников. Вагина открывается в половую клоаку сразу же позади бурсы цирруса. Желточник находится позади яичника по средней линии сегмента. В матке 100 - 400 капсул, в каждой из которых по 1 - 4 яйца размером 99 - 125 х 38-46 цт.
В Таиланде R siriraji - обычный паразит грызунов, в частности крыс полинезийской и серой (Chaiyapom, Patharangkura, 1975; Chenchittikul et al., 1983; Muller, 2002). Предполагается, что промежуточным хозяином данного гельминта в этой стране могут быть тараканы (Pradatsundarasar, 1960). Попытки заразить хрущака малого мучного Tribolium confusum и долгоносика рисового Sitophilus oryzae, скармливая им яйца цестоды, потерпели неудачу (Chaiyapom, Patharangkura, 1975).
В 1957 г. стало известно о двух случаях инвазии R siriraji детей 2 и 5-ти лет в Бангкоке (Таиланд) (Chandler, Pradatsundarasar, 1957). Описывая новый вид, авторы предположили, что цестода, найденная ранее у ребёнка в Бангкоке (Leuckart, 1891), принадлежит к этому же виду. Через несколько лет один из выше цитируемых авторов (Pradatsundarasar, 1960) добавил к этим трём случаям ещё 6 новых, причём двое пациентов из этих шести, как выяснилось при анамнезе, брали (?ели) в рот тараканов. В целом из 9 пострадавших семеро были детьми не старше 3 лет, коим и свойственно брать в рот «всякую гадость».
В 1975-м году была опубликована статья, авторы которой обратили внимание на рост числа случаев заражения людей Я siriraji и отметили, что им стало известно о 10 подобных случаях за последнее пятилетие (Chaiyapom, Patharangkura, 1975).
Напомню, что часть исследователей в своих публикациях цитируют Я siriraji как самостоятельный вид (Гефтер, 1968; Garcia, 2007; Gillani et al., 2012; Muller, 2002), другие рассматривают видом, для подтверждения валидности которого необходимы дополнительные, более детальные исследования (Ashford, Crewe, 2003), а третьи относят Я siriraji к синонимам Raillietina madagascariensis (Мовсесян, 2003).
Raillietina sp. - под таким названием описана цестода, обнаруженная в Коста-Рике у маленькой девочки (2 года и 7 месяцев), в течение 4 месяцев страдавшей
56
абдоминальными болями, периодической диареей и изредка подъёмом температуры (Brenes et al., 1983). Кстати, то было первое обнаружение данного паразита в этом регионе. Авторы не определяли видовую принадлежность найденной цестоды, но отметили трудности в видовой идентификации райллиетин и большое морфологическое сходство представителей Raillietina и Inermicapsifer. Статья проиллюстрирована несколькими фотоснимками члеников и яиц цестоды, неудовлетворительное качество которых не позволило скопировать их.
Цитируемая литература
Динник И. А., Зверева Н. С. Случай паразитизма цестод из рода Raillietina Fuhrmann у ребёнка на Кавказе // Мед. паразит, и паразитарн. заболевания. - 1940. - 9, 5. - С. 458.
Мовсесян С. О. Цестоды фауны СССР и сопредельных территорий (Давэнеаты). - М.: Наука, 1977. -272 с.
Мовсесян С. О. Давэнеаты - ленточные гельминты животных и человека И Основы цестодологии. -М.: Наука, 2003. -13, 1.-295 с.
Africa С. М., Garcia Е. Y. A rat tapeworm {Raillietina garrisoni Tubangui, 1931) transmissible to man, with notes on Davainea madagascariensis Garrison, 1911 // Philip. J. publ. Health. - 1934. - 1, 1. - P. 44 - 51.
Ashford R. W., Crewe ИС The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Beaver P. C., Jung R. C, Cupp E. W. Clinical Parasitology. - 9th edition. - Lea & Febiger, Philadelphia, 1984.-825 pp.
Brenes R., Hamgen G., Monge E., Munoz G., Rodriguez G., Loria C. R. Primer caso humano de parasitosis por Raillietina sp. en Costa Rica // Rev. Cost. Cienc. Mdd. - 1093. - 4, 2. - P. 81 - 88.
Chaiyaporn V., Patharangkura A. Experimental feeding of Raillietina siriraji ova to two species of weevils // Siriraj Hospital Gazette. - 1975. - 27, 12. - P. 1959 - 1963.
Chandler A. C., Pradatsundarasar A. Two cases of Raillietina infection in infants in Thailand, with a discussion of the taxonomy of the species of Raillietina (Cestoda) in man, rodents, and monkeys П J. Parasitol. -1957.-43, l.-P. 81-89.
Chenchittikul M., Daengpium S., Hasegawa M„ Iton T, Phanthumachinda B. A study of commensal rodents and shrews with reference to the parasites of medical significance in Chanthaburi Province, Thailand // Southeast Asian J. Trop. Med. Publ. Health. - 1983. - 14. - P. 255 - 259.
Fain A., Limbos P., Van Ros G., De Mulder P., Herin A. [Presence of the cestode Raillietina (R.) celebensis (Janicki, 1902) in a child from Tahiti] // Ann. Soc. Belg. Med. Trop. - 1977. - 57, 3. - P. 137 - 142.
Faust E. C Human Helminthology. - Lea & Febiger, Philadelphia, 1949. - P. 288 - 291.
Garcia L. S. Diagnostic Medical Parasitology. 5th ed. - ASM Press, Washington. D. C., 2007. - 1202 pp.
Garrison P. Davainea madagascariensis (Davaine) in the Philippine Islands // Philip. J. Sci., B. - 1911. - 6. -P. 165- 176.
Gillani S. W„ Sari Y. O., Baig A. A.t Baig M. Helminthiais; Clinical insights. - 2012. - 111 pp. (https:// books, google. com/books?isbn=l 105494594).
Leuckart R. Uber Taenia madagascariensis Davaine 11 Abhandl. Deutschl. Zoolog. Gesellschaft. - 1891. - P. 68-71.
von Linstow O. Taenia asiatica, eine neue Tania des Menschen // Centralbl. Bakteriol. Parasitenk. - 1901. - 1 (Grig.), 29.-P. 982-985.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ, 2002. - P. 103.
Pradatsundarasar A. Nine cases of Raillietina infection in Bangkok // J. Med. Assoc. Thailand. - 1960. - 43, l.-P. 56-58.
Sawada I. On the genus Raillietina Fuhrmann 1920. (II) П J. Nara Gakuge Univ. (Nat.). - 1965. - 13. - P. 5 -38.
Stransky E., Lorenzo A. S. On raillietiniasis in the Philippines 11 Acta Trop. - 1960. - 17, 1. - P. 80 - 83.
Tenora F., Barus V, ProkeS M. Discussion to several tapeworm species from the families Hymenolepididae, Anoplocephalidae, and Davaineidae parasitizing rodents and man // Acta Univ. Agric. et Silvic, Mendel. Brun. - 2004. - 52, 1. - P. 23 - 28.
Tubangui M. Worm parasites of the brown rat {Mus norvegicus) in the Philippine Islands // Philip. J. Sci. -1931.-46.-P. 537-583.
57
Род Tenoretta Spassky, 1994
В 1994 г. А. А. Спасский (1994) обосновал новый род Tenoretta для одного из представителей рода Raillietina - R. celebensis (Janicki, 1902), который и стал типовым в нём. В 1996 г. этот же автор включил в новый род ещё один вид - Raillietina formosana (Akashi, 1916).
Описание (по: Спасский, 1996). С характерными чертами семейства. Цестоды средних размеров. На хоботке двойная корона из многочисленных крючьев длиной до 10 цт; имеется воротник из мелких шипиков. Проглоттиды многочисленные, краспедотного типа, ширина половозрелых члеников превышает их длину. Экскреторных сосудов две пары; широкие вентральные - с поперечными анастомозами, узкие дорсальные расположены медиально от вентральных. Половой аппарат одинарный. Половые поры односторонние, находятся в передней части края членика. Половые протоки проходят между поральными сосудами. Женские половые железы расположены субмедианно. Яичник двудольный, желточник позади яичника. Семенники многочисленные, находятся в среднем поле, по сторонам от женских гонад. Семяпровод сильно извитой. Бурса цирруса грушевидная, короткая, не достигает поральных сосудов. Копулятивная часть вагины изнутри покрыта шипика-ми. Матка распадается на толстостенные капсулы (более 100 до 500), в каждой из которых содержится по 2 - 4 яйца. Взрослые формы - паразиты грызунов. Типовой вид - Tenoretta celebensis (Janicki, 1902) Spassky, 1994.
От типичных райллиетин новый род отличается наличием двойной короны крючьев, а также шипиков на хоботке и на стенке копулятивной части влагалища; дорсальные экскреторные каналы у нового рода смещены медианно, яичник двукрылый. К. Яницкий (Janicki, 1902) при описании этого вида наблюдал мелкие ши-пики и на сферических бокаловидных присосках. Как и у Buginetta, дефинитивными хозяевами Tenoretta являются млекопитающие.
Tenoretta celebensis (Janicki, 1902) Spassky, 1994 [=Davainea celebensis Ja-
nicki, 1902; =Raillietina (Ransomia) celebensis (Janicki, 1902) Fuhrmann, 1920; =Kotlania celebensis (Janicki, 1902) Lopez-Negra, 1931] (рис. 29).
Рис. 29 Tenoretta celebensis'. 1 - сколекс и крючья хоботка; 2 - гермафродитный членик; 3 - маточный членик; 4 - сколекс (из: Мовсесян, 2003 - по: Joyeux, Baer, 1927)
58
Впервые паразит описан на материале от крысы тройчатозубой, Lenomys myeri, с о-ва Целебес (Сулавеси) под названием Davainea celebensis (Janicki, 1902). Его видовое название связано с регионом обнаружения: celebensis - целебесский.
Длина теноретты Целебесской варьирует от 1.6 до 60 см, максимальная ширина составляет 2.5 мм. В. А. Гефтер (1968) приводит длину червя в 1.6 м. Сколекс с хоботком, покрытым маленькими шипиками, вооружён 90 - 160 крючьями длиной 18-23 щп. Присоски с маленькими шипиками. В стробиле более 700 члеников. Половые отверстия односторонние, расположены в пределах передней трети латерального края членика. В каждом сегменте от 31 от 37 семенников. Сумка цирруса грушевидная, 0.114 - 0.151 х 0.050 - 0.073 мм. Вагина с семяприемником. Яичник двудольный, желточник овальный. Яйцевых капсул до 400, в каждой капсуле по 1 -4 яйца размерами 90 - 99 х 46 pm. Овальная онкосфера длиной 13 pm.
Взрослые формы Т. celebensis - обычные паразиты грызунов, в том числе крыс серой, чёрной, колючей, рисовой полевой, тройчатозубой, австралийской кустарниковой и тёмной, мышей филиппинской лесной, домовой, бандикоты бенгальской. На Тайване, например, в 1970-е годы заражённость крыс чёрной, серой, колючей и рисовой полевой варьировала от 17:6 до 37.8 % (Olsen, Kuntz, 1977), в 1990-х паразита обнаружили у 35.8 % особей серой крысы (Hasegawa et al., 1994), а в 2000-е в фермерских хозяйствах центрального Тайваня - у 48.8 % особей серой крысы и 42.9 % - чёрной (Tung et al., 2009).
Промежуточный хозяин цестоды - муравьи, в частности из рода Cardiocondyle, которые затаскивают в муравейник встретившиеся на земле проглоттиды для кормления личинок (Tang, Tang, 1964).
Т. celebensis эпизодически регистрируют у людей в самых разных регионах Азии и Океании. Если принять утверждение, что Raillietina formosana (Akashi, 1916) является синонимом Raillietina celebensis (сиречь Tenoretta celebensis), то первая информация о находке у человека этого паразита датируется 1916-м годом (Akashi, 1916). Тогда цестоду обнаружили у ребёнка на Тайване и в Японии.
Однако А. А. Спасский (1996) рассматривает «Raillietina formosana» самостоятельным в составе рода Tenoretta. В таком случае, вполне вероятно, что у человека Т. celebensis впервые обнаружили в Австралии в 1956 г. (Baer, Sandars, 1956). В фекалиях 21-месячного ребёнка из Брисбена выявились зрелые проглоттиды, аналогичные таковым, найденным авторами в крысе австралийской кустарниковой Rattus fuscipes assimilis (в материале от грызуна были представлены полные особи цестод).
В 1959 г. появилось первое сообщение о регистрации Т. celebensis в Китае (Tang, Lin, 1959). Исследователи отметили, что с 1952 г. в провинции Фуджиян (Fujian) насчитали 5 подобных случаев у детей в возрасте от 2 до 5 лет. С того времени инвазия детей тенореттой целебесской обнаруживалась в разных регионах страны, чаще всего у ребятишек до 5 лет, которые заражались со случайно съеденными насекомыми (Мао, 1991).
В 1977 г. был описан случай заражения девочки, чей возраст не достигал и двух лет (21 месяц), имевший место на Таити (Fain et al., 1977). Общая длина выделенных после лечения ребёнка фрагментов цестоды, каждый по 1 - 1.5 см длиной, составила около 60 см при максимальной ширине 3 мм (рис. 30). Диаметр сколекса 0.420, присосок 0.140 мм. Хоботок вооружён молоткообразными крючьями, длина которых колебалась от 18 до 25 щп. В каждом членике насчитывалось от 45 до 60
59
семенников, из числа которых 15-20 располагались порально. Бурса цирруса грушевидная, размером 0.160 -0.165 х 0.072 - 0.078 мм. Зрелые проглоттиды достигали размера 3 х 1.5 - 2 мм. Количество капсул в члениках достигало 280 - 320, в каждой капсуле насчитывалось по 1 - 3 яйца.
Рис. 30 Tenoretta celebensis, фрагменты цестоды, выделенные от ребёнка (из: Fain et al., 1977; как Raillietina celebensis)
Случай заражения человека на Таити был первым, выявленным в Океании, а в 1981 г. появилось сообщение ещё о четырёх случаях инвазии людей Т. celebensis, но уже на острове Муреа во Французской Полинезии (Rougier et al., 1981).
В целом инвазия человека Т. celebensis зафиксирована в Австралии, Китае, Японии, Таиланде, на Таити, Филиппинах, Тайване, о. Муреа (остров во Французской Полинезии) (Gillani et al., 2012). Поскольку география паразита шире - он известен у грызунов на Филиппинах, Тайване, в Индонезии, Китае, Японии, Малайзии, Вьетнаме, Мьянме, Лаосе, Индии, Австралии, островах Океании (Fain et al., 1977; Tenora et al., 2004) -, то вполне можно ожидать его случайного обнаружения
у человека во всех перечисленных странах.
Инвазия Т. celebensis обычно проявляется обнаружением в фекалиях человека подвижных сегментов цестоды, похожих на зёрна риса. Как уже отмечено, чаще всего поражаются дети (www.theparasitologist.com).
Заражение обычно асимптоматичное. Тем не менее, паразит может влиять на циркуляционную, нервную или пищеварительную систему человека (Acha, Szy-fres, 2006).
Для изгнания паразита обычно назначают курс приёма никлозамида (Garcia, 2007). Для лечения ребёнка на Таити был использован мебендазол (100 мг х 3) (Fain et al., 1977).
Tenoretta formosana (Akashi, 1916) Spassky, 1996 [^Davainea formosana Akashi, 1916; =Raillietina formosana (Akashi, 1916) Joyeux et Baer, 1929; Kotlania formosana (Akashi, 1916) Lopez-Neyra, 1931]. Впервые паразит описан из Тайваня и Японии под названием Davainea formosana Akashi, 1916. Вид не отличим от Raillietina celebensis (Joyeux, Baer, 1929) и практически во всех последующих публикациях его относят к синонимам последнего (см., напр., Baer, Sandars, 1956; Fain et al., 1977; Faust, 1949; Sawada, 1965).
Тем не менее, в 1996 г. А. А. Спасский (1996) включил Raillietina formosana (Akashi, 1916) в состав рода Tenoretta на правах самостоятельного вида, второго в данном роде.
60
Цитируемая литература
Гефтер В. А, Глава XXII. Прочие цестодозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 527 -537. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Мовсесян С. О. Давэнеаты - ленточные гельминты животных и человека // Основы цестодологии. -М.: Наука, 2003. -13, 1. - 295 с.
Спасский А. А. Три новых рода давенеид (Cestoda: Cyclophyllidea) - паразитов млекопитающих // Bule-tinul Academiei de Stiinte a Rep. Moldova, Stiinte Biologice si Chimice. - 1994. - nr. 6. - P. 66.
Спасский А. А. Три новых рода цестод подсемейства Raillietininae (Cestoda, Cyclophyllidea, Davaineidae) - паразитов млекопитающих // Вестник зоологии. - 1996. - № 3. - С. 54 - 55.
Acha Р. N., Szyfres В. Zoonoses and communicable diseases common to man and animals. 3rd ed. - Vol. III. Parasitoses. - Publ. by WHO, Geneva, 2006.
Akashi S. Davainea formosana n. sp., a new tapeworm reported from Formosa and Tokyo // Taiwan Igakkai Zasshi. - 1916. -N. 167 (in Japanese). Abstract in: China Med. J. - 1917. - 31. - P. 166 - 167.
Baer J. G., Sandars D. F. The first record of Raillielina (Raillietina) celebensis (Janicki, 1902) (Cestoda) in man from Australia, with a critical survey of previous cases // J. Helminthol. - 1956. - 30, 2/3. - P. 173 — 182. https://doi.org/10.1017/S0022149X00033137.
Fain A., Limbos P., Van Ros G., De Mulder P., Herin A. [Presence of the cestode Raillietina (R.) celebensis (Janicki, 1902) in a child from Tahiti] // Ann. Soc. Belg. Med. Trop. - 1977. - 57, 3. - P. 137 - 142.
Faust E. C. Human Helminthology. - Lea & Febiger, Philadelphia, 1929. - P. 290.
Garcia L. S. Diagnostic Medical Parasitology. 5th ed. - ASM Press, Washington. D. C., 2007. - 1202 pp.
Gillani S. W.t Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - 2012. - 111 pp. (https://books.google.com/books?isbn=l 105494594).
Hasegawa H, Kobayashi J„ Otsuru M. Helminth parasites collected from Rattus rattus on Lanyu, Taiwan // J. Helminth. Soc. Wash. - 1994. - 61, 1. - P. 95 - 102.
Janicky C. Uber zwei neue Arten der genus Davainea aus celebensischen Saigem 11 Arch. Parsitol. - 1902. -6.-P. 257-292.
Joyeux Ch, Baer J. G. Les cestodes rares de 1’homme // Bull. Soc. Path exot., Paris. - 1929. - 22, 2. - P. 114 -136.
Mao S. P. Protozoan and helminth parasites of humans in mainland China // Intern. J. Parasitol. - 1991. - 21, 3.-P. 347-351.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 103.
Olsen O. W„ Kuntz R. E. Cestodes from Rattus Fischer in Taiwan // J. Helminthol. Soc. Wash. - 1977. - 44, l.-P. 101-102.
Rougier Y., Legros F., Durand J. P., Cordoliani Y. Four cases of parasitic infection by Raillietina (R.) celebensis (Janicki, 1902) in French Polynesia // Trans. R. Soc. Trop. Med. Hyg. - 1981. - 75, 1. - P. 121.
Tang С. C., Lin R S. [Human infection and taxonomic problem of Raillietina celebensis (Janicki. 1902) Fuhrmann: 1920 // Bull. Fukien Normal College (1). - 1959. - P. 57 - 67. ’
Tang С. C, Tang С. T. Raillietina (Raillietina) celebensis (Janicki, 1902), its development in intermediate host, epidemiology and taxonomy // Acta Parasitol. Sinica. - 1964. - l.-P. 1-13.
Tenora F., BaruS V., ProkeS M. Discussion to several tapeworm species from the families Hymenolepididae, Anoplocephalidae and Davaineidae parasitizing rodents and man // Acta Univ. Agric. et Silvic., Mendel. Brun. - 2004. - 52, 1. - P. 23 - 28.
Tung K.-C, Hsiao F-С., Yang С.-H., Chou C.-C. et al. Surveillance of endoparasitic infections and the first report of Physaloptera sp. and Sarcocystis sp. in farm rodents and shrews in Central Taiwan // J. Vet. Med. Sci.-2009.-71, l.-P. 43-47.
Небольшое заключение по данному разделу.
Напомню, что в справочно-информационной сводке «Медицинская гельминтология...» (www.worms-info.ni/Cestoda), к которой мы ещё не раз будем возвращаться, среди регистрируемых у человека перечислены 3 вида Raillietina'. R. asiatica, R. celebensis и R. madagascariensis.
61
Взяв за основу классификацию, предложенную для этой группы цестод А. А. Спасским (1994, 1996), мною приведена информация о трёх родах даванеид, чьи представители встречены у человека: Buginetta, Raillietina и Tenoretta.
Род Buginetta представлен двумя видами - В. alouattae и В. demerariensis. Оба распространены у приматов в центрально- и южноамериканских странах. Но если первый из них явно чрезвычайно редко регистрируется у человека (настолько редко, что я даже не смогла найти источник, в котором шла бы речь о подобном случае), то заражение людей вторым из них довольно обычно для Центральной Америки, прежде всего, Эквадора.
Род Raillietina, по мнению А. А. Спасского (1994, 1996), объединяет виды, чьи взрослые формы являются паразитами птиц. Это обстоятельство, кстати, послужило дополнительным доводом для выделения из него в отдельные роды (Buginetta и Tenoretta) видов, во взрослом состоянии паразитирующих у млекопитающих. Информация о роде Raillietina, который по данным составителей выше названной справочно-информационной сводки является единственным представителем даванеид у человека, включающим 3 вида - R. asiatica, R. celebensis и R. madagascariensis, в действительности претерпела серьёзные изменения. И если R. asiatica по-прежнему входит в состав данного рода, то R. celebensis стала типовым видом рода Tenoretta, a R. madagascariensis вообще переведена в другое семейство -Anoplocephalidae, а в нём включена в род Inermicapsifer. Справедливости ради следует сказать, что не все исследователи согласились с подобной трансформацией R. madagascariensis. В целом, среди Raillietina, регистрируемых у человека, остались уже упомянутая R. asiatica, которую многие рассматривают сомнительным видом, R garrisoni, а также R. siriraji, которую большинство авторов считают синонимом R. celebensis (=Tenoretta celebensis).
Род Tenoretta включает всего два вида - Т. celebensis и Т. formosana, причём оба зарегистрированы у человека. Однако второй вид практически все специали-сты-цестодологи, а вслед за ними и медицинские работники относят к синонимам первого.
Таким образом, семейство даванеид у Homo sapiens представлено 7 (или 5) видами из 3 родов.
Инвазию людей давенеидами официально регистрируют со второй половины 19-го столетия, тем не менее, за исключением В. demerariensis и, возможно, Т. celebensis, находки всех остальных видов носят в полном смысле этого слова единичный характер.
География регионов обнаружения даванеид у человека весьма обширна, но всё же прослеживается явная приуроченность всех выявленных случаев к странам, расположенным в тропических и субтропических широтах.
Чаще всего инвазия выявляется у детей, причём, как и в случае с аноплоце-фалидами, обычно заражаются дети младшего возраста. Тому может быть два взаимосвязанных объяснения: несоблюдение правил личной гигиены и элементарных санитарных правил, предусматривающих чистоту принимаемой пищи, а также рук, и особенности жизненного цикла цестод, чьи промежуточные хозяева могут оказаться на загрязнённых руках и в принимаемой пище.
И, наконец, любители насекомых, той же саранчи, рискуют вместе с пищей проглотить и личинок даванеид, о чём ещё в середине прошлого столетия писал проф. Э. Гарсиа.
62
Семейство Diphyllobothriidae Luhe, 1910
Синонимы (по: Делямуре и др., 1985):
Dibothriocephalidae Lllhe, 1902 Ltlheellidae Baer, 1924
До недавнего времени семейство включали в состав отряда Pseudophyllidea. Однако Р. Кухта с соавт. (Kuchta et al., 2008) создали для него отдельный отряд Diphyllobothriidea, основными отличительными чертами представителей которого являются вентральное положение половой поры кпереди от маточной, наличие мускулистого наружного семенного пузырька, отсутствие маточного мешка. В состав Diphyllobothriidea цитируемые авторы включили 4 семейства с 17 родами. Однако, судя по публикациям последних лет (Dhaliwal, Juyal, 2013; Jeon et al., 2015, 2016), не все исследователи согласились с подобными нововведениями и продолжают числить семейство в составе отряда Pseudophyllidea.
Описание (по: Делямуре и др., 1985; Kuchta et al., 2008). Длина тела от 5 - 10 см до 27 м (у Diplogonoporus balaenopterae). Сколекс сравнительно небольшой, невооружённый, с двумя щелевидными ботриями, расположенными дорсально и вентрально и являющимися наиболее примитивными органами прикрепления, поскольку не имеют специальной, дифференцированной мускулатуры. Иногда края ботрий извилистые, складчатые. Крупные дифиллоботрииды, по-видимому, только на ранних стадиях развития удерживаются в организме хозяина с помощью сколекса, на более поздних основное значение имеет собственное движение лентецов навстречу перистальтике кишечника хозяина. Внешняя сегментация, за редким исключением, хорошо выражена. Выделительная система состоит из продольных каналов и анастомозов, иногда образует сложную сеть. Половые поры открываются вентрально близ медианной линии, маточная пора ниже мужского и женского половых отверстий. Половые аппараты обычно одинарные, реже удвоены; встречаются виды, имеющие в члениках от четырех до восьми и более половых комплектов. Семенники расположены в двух латеральных полях в мозговой паренхиме. Семяпровод открывается в семенной пузырёк, впадающий в бурсу цирруса. Яичник и тельце Мелиса расположены медианно. Желточные фолликулы лежат в кортикальной паренхиме. Семяприемник хорошо развит. Матка образует петли влево и вправо от медианной линии членика. Яйца толстостенные, с крышечкой, их размеры могут сильно варьировать. Половозрелые формы - паразиты морских и наземных млекопитающих, птиц островов и побережий. Типовой род - Diphyllobothrium Cobbold, 1858.
Жизненный цикл дифиллоботриид включает последовательную смену дефинитивного, первого и второго промежуточных, а иногда и паратонических хозяев. Яйца гельминта попадают в воду, где из них выходит подвижная реснитчатая личинка, так называемый корацидий, который некоторое время плавает с помощью ресничек. Корацидии заглатываются чаще всего низшими ракообразными, в полости тела которых развивается следующая личиночная стадия паразита - процеркоид. Во второго промежуточного хозяина процеркоид попадает с пищей и проникает в полость его тела, мускулатуру, печень и другие внутренние органы, где постепенно развивается в плероцеркоид. При этом личинка заметно увеличивается в размерах, на переднем конце её тела формируются ботрии. При попадании в паратонического хозяина плероцеркоид остаётся на той же стадии развития, не увеличиваясь в размерах. На всех этапах жизненного цикла передача паразита от одного хозяина к другому осуществляется только трофическим путём.
63
За полтора столетия, прошедшего после открытия дифиллоботриид - к слову, одной из сложнейших групп гельминтов - мировая наука накопила огромный материал по этим цестодам, что в значительной степени обусловлено важным медицинским, ветеринарным и социально-экономическим значением многих представителей данного семейства.
По состоянию на 2008-й год семейство объединяло 13 родов (Kuchta et al., 2008). Недавно была восстановлена самостоятельность 14-го рода - Adenocephalus Nybelin, 1931 (Hemandez-Orts et al., 2015). В качестве паразитов человека называют цестод из 7 родов - Diphyllobothrium, Adenocephalus^ Diplogonoporus Lonnberg, 1892, Ligula Bloch, 1782, Pyramicocephalus Monticelli, 1890, Schistocephalus Creplin, 1829 и Spirometra Faust et al., 1929.
Цитируемая литература
Делямуре С. Л., Скрябин А. С., Сердюков А. М. Дифиллоботрииды - ленточные гельминты человека, млекопитающих и птиц. - Отв. ред. В. Е. Судариков. // Основы цестодологии. - М.: Наука, 1985. -11.-200 с.
Dhaliwal В. В., Juyal Р. D. Parasitic Zoonoses. - Springer, India, 2013. - P. 67 - 68, 74 - 75.
Jeon H.-K, Park H, Lee D„ Choe S., Kim K-H. et al. Human infections with Spirometra decipiens plerocercoids identified by morphologic and genetic analyses in Korea // Korean J. Parasitol. - 2015. - 53, 3. -P. 299-305. doi: 10.3347/kjp.2015.53.3.299.
Jeon H.-K, Park H., Lee D., Choe S, Kim K-H. et al. Genetic identification QiSpirometra decipiens plerocercoids in terrestrial snakes from Korea and China И Korean J. Parasitol. - 2016. - 54, 2. - P. 181-185. doi: 10,3347/kjp.2016.54.2.181.
Kuchta R., Scholz T., Brabec J, Bray R. A. Suppression of the tapeworm order Pseudophyllidea (Platyhel-minthes: Eucestoda) and the proposal of two new orders, Bothriocephalidea and Diphyllobothriidea // Int. J. Parasitol. - 2008. - 38, 1. - P. 49 - 55.
Род Diphyllobothrium Cobbold, 1858
Синонимы (по: Делямуре и др., 1985):
Dibothriocephalus Ltlhe, 1899
Glandicephalus Fuhrmann, 1921
Liiheella Baer, 1924
Diancyrobothrium Bacigalupo, 1945
Cordicephalus Wardle et Stewart, 1947 (частично)
Из синонимов Diphyllobothrium, приводимых в цитируемой монографии, исключён Adenocephalus Nybelin, 1931, чей родовой статус, как отмечено выше, недавно был восстановлен.
Описание (Делямуре и др., 1985). Мелкие, средней величины и крупные цестоды. Сколекс вытянутый, широкоовальный, сердцевидный, листовидный или ланцетовидный, часто впереди тупоконический, с двумя щелевидными, иногда извилистыми нежными ботриями. В каждом членике один половой комплекс, лежащий меди-анно. Типовой вид - Diphyllobothrium stemmacephalum Cobbold, 1858.
Половозрелые особи - паразиты птиц, млекопитающих и человека. В русскоязычной литературе цестод данного рода называют лентецами.
Род немногочислен - всего 18 видов (Kim Н. et al., 2014).
Основные морфологические признаки при определении взрослых цестод: особенности строения сколекса, стробилы и отдельных деталей половой системы, а также расположение паренхимной мускулатуры. В последние годы при идентификации этих гельминтов широко используют молекулярно-генетические методы (Wicht et al., 2008, 2010; Yamasaki et al., 2016 и др.).
64
Схема жизненного цикла Diphyllobothrium характерна для большинства ди-филлоботриид. Первый промежуточный хозяин - ракообразные, в организме кото
рых проглоченный из воды кораци-дий развивается в процеркоид, в свою очередь, развивающийся в организме рыб-планктофагов в следующую личиночную стадию -плероцеркоид (рис. 31).
Рис. 31 Стадии развития видов Diphyllobothriunr. А - сложное яйцо; Б - корацидий; В - процеркоид в полости тела циклопа; Г - процеркоид (стрелкой обозначен церкомер); Д - плероцеркоид
Плероцеркоиды удлинённой формы, тело молочно-белого или кремового цвета, с характерными щелевидными ботриями на переднем конце (рис. 32). Личинки локализуются в мышечной ткани, полости тела и внутренних органах рыб (рис. 33) и благодаря крупным размерам хорошо заметны невооружённым глазом.
Рис. 33 Плероцеркоид Diphyllobothrium sp. в полости тела антарктической серебрянки (из: Гаевская, Ковалёва, 1991)
Рис. 32 Передний конец тела плероцеркоидов Diphyllobothrium spp.
В монографии 1985-го года С. Л. Делямуре с соавторами описали 30 видов Diphyllobothrium, За прошедшие 30 лет в систематике цестод данного рода произошли существенные изменения. В частности, была восстановлена самостоятельность рода Adenoce-phalus вместе с его типовым видом A. pacificum Nybelin, 1931 (=Diphyllobothrium pacificum). Часть видов Diphyllobothrium была сведена в синонимы, например, Diphyllobothrium yonagoense Yamane et al., 1981 - к D. stemmacephalum, D. wilsoni Shipley, 1907 - к D. mobile (Rennie et Reid, 1912). Одновременно в этот же период были описаны новые виды Diphyllobothrium - D. nihonkaiense Yamane et al., 1986, D. orcini Katsushika et Shirouzu, 1990, D.fayi Rausch, 2005 и ряд других.
T. Дик (Dick, 2007) приводит список из 10 видов Diphyllobothrium, зарегистрированных у человека, в работе (Scholz, Kuchta, 2016) таковых перечислено 14 видов, а в справочно-информационной сводке «Медицинская гельминтология...» (www.worms-info.ru/Cestoda)- 19.
65
Diphyllobothrium stemmacephalum Cobbold, 1858 (^Diphyllobothrium ponti-cum Delamure, 1971; ^Diphyllobothrium yonagoense Yamane, Kamo, Yazaki, Fukumoto et Maejima, 1981) (рис. 34 - 36).
Впервые этих гельминтов обнаружили при вскрытии морской свиньи из североморских вод Шотландии. Изучив материал, Т. Кобболд пришёл к выводу о необходимости обоснования для этих цестод нового рода Diphyllobothrium с типовым видом D. stemmacephalum (Cobbold, 1858). Отмеченный среди синонимов этого ви-
да D. ponticum Delamure, 1971 был описан от черноморской афалины (Делямуре,
1971), a D. yonagoenseYamane et al., 1981 - на материале от человека в Японии
(Yamane et al., 1981).
Рис. 34 Diphyllobothrium stemmacephalum'. 1 -сколекс, латеровен-трально; 2 - то же, лате-рально; 3 - неполовозрелый членик; 4 - членик на стадии формирования первых яиц; 5 -половозрелый членик из задней трети стробилы (из: Делямуре, 1968)
Описание (Делямуре, 1968; Stunkard, 1949). Длина стробилы до 4 - 5 м при максимальной ширине 11-12 мм. Сколекс маленький, 0.3 - 0.43 х 0.44 - 0.65 мм, сплющен дорсовентрально, его латеральные стороны не нависают на шейку. С вентральной (или дорсальной) стороны сколекс овальный, на его вершине в месте межботриальной перегородки имеется небольшое углубление, поэтому свободные, изогнутые края ботрий несколько возвышаются над центром сколекса. Шейка тонкая. Стробила состоит из нескольких сотен члеников. У зрелых члеников ширина превышают длину в 2 - 2.5 раза. Вдоль вентральной и дорсальной поверхностей стробилы справа и слева от медианной области заметны борозды, местами довольно глубокие. Т. Кобболд (Cobbold, 1858) пишет о 10 - 12 таких бороздках, Э. Кон (Kohn, 1912) - о 10. Известковых телец нет Внутренняя продольная мускулатура хорошо развита, толщина её слоя 6 - 8, в области маточного поля 5-6 цт. Кольцевая и дорсо-вентральная мускулатура развита слабо. Экскреторная система состоит из четырёх крупных каналов в мозговой паренхиме и многочисленных мелких канальцев - в корковой. Щелевидная маточная пора находится на уровне последних
66
петель матки. Семенники овальные, 0.05 - 0.098 х 0.094 - 0.16 мм. В каждом половозрелом членике, по разным данным, около 1000 (Stunkard, 1949), 1620 - 2478 (Делямуре, 1968) или 2000 семенников (Hatsushika, Okino, 1999). Бурса цирруса яйцевидная или грушевидная, мускулистая, 0.3 - 0.5 х 0.2 - 0.5 мм. Семенной пузырёк шаровидный или овальный, толстостенный, мускулистый, лежит под бурсой и впадает в неё на одном уровне с отверстием вагины (рис. 36). Яичник состоит из нескольких гроздевидных пластин, вплотную прилегает к задней границе членика, местами внедряясь между петлями матки. Желточные фолликулы несколько вытянуты в спинно-брюшном направлении. Впереди от поля матки желточники, как и семенники, не соприкасаются. Вагина без значительных изгибов, местами расширяется. Матка в средней трети ширины членика, с каждой стороны образует 14-16 (иногда 18-19) петель. Яйца овальные, 60 - 70 х 43 - 50, оболочка толщиной 4 pm, диаметр крышечки 21 pm. По (Hatsushika, Okino, 1999), матка образует по 6 - 8 петель, а средний размер яиц составляет 72.4 х 54.1 pm.
Рис. 35 Diphyllobothriwn stemmacephalunr. 1 - сколекс и передние проглоттиды; 2 - для сравнения приведён рисунок сколекса Diphyllobothrium latum при том же увеличении, что и на рис. Г, 3 - сколекс, тот же, что на рис. 1, увеличен; 4 - поперечный разрез срединного поля членика через маточную пору; 5 - два членика (семенники изображены слева, желточники - справа) (из: Stunkard, 1949)
67
Рис. 36 Diphyllobothrium stemmacephalum, сагиттальный разрез в области бурсы, отверстия вагины и маточной поры (из: Делямуре, 1968)
Ареал D. stemmacephalum охватывает воды Мирового океана и его морей в северном полушарии.
Окончательные хозяева паразита - представители семейства дельфиновых, в том числе морская свинья, афалина, или дельфин бутылконосый, дельфин тихоокеанский белобокий, дельфин серый, белобочка длиннорылая, дельфин-
белобочка, или обыкновенный дельфин, афалина индийская, гридна обыкновенная.
В Чёрном море, к примеру, D. stemmacephalum обнаружили у морской сви-
ньи, сначала в водах Румынии (Вогсеа, 1935), а затем у дельфина, случайно попавшего в рыбацкие сети у западных берегов Крыма (Делямуре, 1968). К. А. Джинга-радзе и Я. И. Близнюк (1982) сообщили о цестоде длиной 530 см, выделившейся у афалины в Батумском дельфинарии после лечения фенасалом. В последующем паразита неоднократно отмечали у черноморских афалин (Birkun, 2002).
Второй промежуточный хозяин D. stemmacephalum не известен, хотя совершенно очевидно, что им могут быть только рыбы. По этой причине информация о регистрации в Чёрном море в водах Турции личинок Diphyllobothrium sp. у бриля (семейство ромбовых) (Merdivenci, 1983) представляет несомненный интерес. По
скольку у черноморских млекопитающих достоверно известен только D. stemmacephalum (Делямуре и др., 1985), то не исключено, что в данном сообщении речь мо-
жет идти о находке у рыбы плероцеркоидов именно этого вида.
Первый случай регистрации D. stemmacephalum у человека зафиксирован в 1965 г. в Японии. Инвазию выявили у 29-летнего жителя Окинавы (Sunagawa, 1965), но паразита тогда определили как Diphyllobothrium latum (L., 1758). Практически все последующие находки D. stemmacephalum у людей в Японии и единственный подобный случай в Корее описаны под названием D. yonagoense. Однако ещё в 1987 г. D. yonagoense на основании морфологического сходства с D. stemmacephalum перевели в синоним последнего (Andersen, 1987). Правомочность этого действия исследователи недавно подтвердили результатами молекулярногенетического анализа (Yamasaki et al., 2016).
Всего насчитывается 25 официальных находок D. stemmacephalum у человека, из них 24 - в Японии (на островах Кюсю, Хонсю и Окинава) (Fukumoto et al., 1992; Hasegawa et al., 1989; Hatsushika, Okino, 1999; Kumazawa, Matsuoka, 1998; Yamane et al., 1981; Yamasaki et al., 2016) и 1 - в Корее (Lee S. et al., 1988).
Заражение обычно асимптоматично.
Diphyllobothrium alascence Rausch et Williamson, 1958 (рис. 37). Вид описан на материале из 126 экз. цестод, полученных в декабре 1955 г. от 10 ездовых собак из посёлка Чевак, расположенного в дельте рек Юкон и Кускокуим на Аляске (Rausch, Williamson, 1958). Отсюда и видовое название паразита: alascence - лентец аляскинский. Впоследствии паразита несколько раз находили у собак из упомяну
68
того посёлка Чевак и посёлка Хупер-Бэй, также расположенного на юго-западе Аляски (Rausch, Adams, 2000).
Цитируемые авторы, детально изучившие D. alascense, отмечают, что морфологически он очень похож на Diphyllobothrium cordatum (Leuckart, 1863), но, тем не менее, дифференцируют его от сравниваемого вида. Примечательно, что D. alascense встречался в собаках совместно с D. dendriticum (Nitzsch, 1824) и D. dalliae Rausch, 1956 (Rausch, Adams, 2000).
Рис. 37 Diphyllobothrium alascense; 1 - сколекс, латерально; 2 - половозрелый членик, вентрально; 3 - сагиттальный разрез половозрелого членика (из: Делямуре и др., 1985 - по: Rausch, Williamson, 1958)
Описание (по: Hilliard, 1960; Rausch, Adams, 2000; Rausch, Hilliard, 1970; Rausch, Williamson, 1958). Относительно крупные цестоды, длина тела до 73 см или более, максимальная ширина до 9 мм. Сколекс сердцевидный, 2x2 мм, резко отграничен от шейки. Ботрии глубокие, с гибкими краями. Шейка хорошо развита. Стробила мускулистая,
слегка краспедотная, резко расширяющаяся позади шейки. В задней трети стробилы соотношение длины членика к его ширине выглядит как 1:3. Закладка половых органов заметна на расстоянии 10 мм от сколекса. Грушевидная бурса цирруса диаметром 0.5 мм, расположена антеро-дорсально, передней частью простирается к предлежащему членику. Семенной пузырек яйцевидный или сферический, хорошо развит. Семенники диаметром 0.1 мм, расположены в 2 - 3 слоя в латеральных полях, не перекрывая концы маточных петель. Количество семенников в членике варьирует от 600 до 715 (в среднем 656). Вагина простирается почти до уровня маточной поры, затем резко поворачивает дорсально к бурсе цирруса, изгибается в вентральную сторону и впадает в дно полового атриума (см. рис. 37, 3). Яичник состоит из двух треугольных долей, соединённых узким перехватом, и находится в задней части членика. Многочисленные желточники простираются дорсально и вентрально в двух латеральных полях, слегка перекрывающих концы маточных петель. Начальная часть матки очень изогнута. Участок матки, содержащий зрелые яйца, образует 3-5 петель по обе стороны от средней линии; последние петли впереди не выходят за середину бурсы цирруса. Яйца от светло-янтарного до желтоватого цвета, размером 55.9 - 79.7 х 38.1 - 67 pm (в среднем 73 х 48), отношение ширины яйца к его длине 1 : 1.4. Оболочка яйца толщиной 2.15 - 2.4 pm, поверхность мелкоячеистая, диаметр углубления 0.46 pm; штифтик имеется. Корацидий находится в центре яйца, его средний размер 45 х 28 pm. Длина эмбриональных крючьев 10.5 - 12.8 pm. Морфологические особенности яиц D. alascense характерны для
69
морских видов Diphyllobothrium, а корацидии приспособлены к обитанию в морской воде (при 20°С сохраняют жизнеспособность в течение 12 ч, а при 2°С - двое суток) (Hilliard, 1960).
На Аляске плероцеркоиды D. alascense были обнаружены у речного налима, типично пресноводной рыбы, и анадромной корюшки из нижнего течения реки Кускокуим (Rausch, Adams, 2000). У налима личинки локализовались в слизи, покрывающей слизистую оболочку желудка. Заражённость налима достигала 50 %, а интенсивность инвазии исследователи не устанавливали по причине многочисленности личинок и их исключительно мелких размеров (0.73 - 1.5 мм). Сколекс нечётко отделён от тела, а его длина достигает одной трети или половины длины тела личинки при ширине 0.25 - 0.36 мм. Авторы полагают, что поскольку личинки располагались в слизи желудка в свободном состоянии и в столь огромном количестве, то они попадали к налиму с пищей, т.е. с какими-то рыбами, возможно, корюшкой, и потому налим является паратеническим хозяином для данного паразита.
При экспериментальном заражении собак плероцеркоидами из налима первые яйца цестоды в фекалиях подопытных животных появились на 19-й день. При вскрытии двух собак на 21-й день после заражения в их тонком кишечнике обнаружилось соответственно 9 и 77 особей D. alascense различной степени развития. Дальнейшее изучение развития стробилы исследователи проводили с двухдневным интервалом, закончив эксперимент на 32-е сутки.
Единственное сообщение об обнаружении D. alascense у человека было опубликовано 50 лет назад (Rausch et al., 1967). Речь шла о предварительном определении под этим названием яиц цестоды, выделившихся у местного жителя Ньютока на Аляске после антигельминтозного лечения. Взрослые цестоды тогда не были получены. Иной информации о регистрации D. alascense у человека нет.
Diphyllobothrium cameroni Rausch, 1969 (рис. 38). Паразит описан на материале от гавайского тюленя-монаха, обследованного на атолле Мидуэй, Гавайские о-ва (Rausch, 1969). Вид назван в честь известного канадского паразитолога и ветеринара проф. Томаса Кэмерона (Т. W. М. Cameron, 1894 - 1980), уроженца Шотландии (J. Parasitol., 1981, 67,1. Р. 113-115).
Рис. 38 Diphyllobothrium cameroni: 1 -
сколекс, лате-рально; 2 - то же, вентрально; 3 - половозрелый членик, вентрально; 4 - сагиттальный разрез членика (из: Делямуре и др., 1985 - по: Rausch, 1969)
70
Черви длиной 50 - 62 мм при максимальной ширине 3.5 - 5.6 и толщине 1.5 - 2 мм. Сколекс ланцетовидный, заострённый, в расслабленном состоянии 1.6 - 2 х 0.79 - 1 мм. Ботрии глубокие, обычно с мелкозубчатыми краями, простираются по всей длине сколекса, несколько раздвинуты у его вершины. Шейка отсутствует. Стробила мускулистая, со слегка зазубренными краями. На вентральной и дорсальной поверхностях имеются одна медианная и 2 - 4 латеральные продольные борозды. У незрелых члеников отношение длины к ширине 1 : 10, у терминальных - 1 : 3. Толщина слоя продольной мускулатуры 0.25 мм. Известковые тельца многочисленны. Зачатки половых органов видны в передней пятой части стробилы. Половая пора у переднего края членика, прикрыта складкой предыдущего членика. Половой атриум овальный, с округлыми сосочками, скрыт краями медианной борозды. Бурса цирруса продолговатая, размером 0.42 - 0.52 х 0.15 мм, расположена дорсально от полового атриума, достигает дорсального слоя продольной мускулатуры. Бурса содержит спирально скрученный семяизвергательный канал и слабо развитый сосочкообразный циррус. Семенной пузырёк продолговатый, размером 0.15 - 0.24 х 0.11 - 0.13 мм, расположен позади бурсы цирруса, окружён петлями матки. Субсферические семенники очень многочисленны, расположены латерально на глубине 2 - 3 мм, перед половым атриумом сливаются. Вагина располагается вентрально. Двудольный яичник шириной 1.3 - 1.6 мм, расположен у заднего края членика, дорсально от матки. Желточники сливаются перед половым отверстием, их медианные края слегка покрывают маточные петли и доли яичника. Маточные петли достигают уровня переднего края полового атриума. Маточная пора открывается в заднюю стенку полового атриума, её терминальная часть толстостенная, с клапанообразной структурой у выхода. Яйца эллипсоидальные, 41 - 52 х 33 - 37 щп (в среднем 47 х 35), с апикальным утолщением.
Как уже отмечено, D. cameroni описан от гавайского тюленя-монаха, эндемика Гавайских о-вов. В других регионах данный паразит не отмечен и возможно, что за пределами атоллов этих островов не встречается.
Всего две публикации содержат информацию о регистрации D. cameroni у человека, во всех трёх сообщается о находках этих цестод у японских моряков (Kamo et al., 1978, 1981). В первой работе описан случай, имевший место в декабре 1969 г. в г. Фукуока: тогда у 57-летнего моряка выделилась желтовато-коричневая стробила длиной около 600 мм (Kamo et al., 1978). Паразита определили как «Another marine species of the genus Diphyllobothrium from a man in Japan - Другой морской вид рода Diphyllobothrium из человека в Японии». Позже после тщательного морфологического изучения цестоду отнесли к D. cameroni (Kamo et al., 1981). При описании паразита авторы подчеркнули, что гельминт по своим морфологическим особенностям соответствует первоописанию вида, а отличия в размерах семенного пузырька и яиц могут быть связаны с более крупными размерами цестоды из человека (600 мм против 60 мм). По их мнению, более крупные размеры червя в данном случае могут быть связаны с более благоприятными для него условиями роста в большем пространстве кишечника человека.
Ещё в одной статье (Kamo et al., 1986) D. cameroni упоминается как возможный паразит человека. Описывая цестоду, спонтанно вышедшую у 27-летнего мужчины, авторы подчеркнули, что паразит внешне похож на D. cameroni, но отличается от него относительным положением маточной поры, а ближе всего цестода стоит к D. hians, отличаясь от него формой и размером сколекса.
71
Вследствие отсутствия подтверждённых доказательств того, что D. cameroni может заражать людей, его нельзя рассматривать как паразита человека (Scholz, Kuchta, 2016).
Diphyllobothrium cordatum (Leuckart, 1863) Gedoelst, 1911 (^Bothriocephalus cordatus Leuckart, 1863) (рис. 39). Вид впервые описан по одному экземпляру зрелой цестоды, которая вышла с рвотой у находящейся на пятом месяце беременности женщины из посёлка Годхавн (Godhavn) на западе Северной Гренландии, и примерно по 20, более мелким и не полностью зрелым экземплярам с различной морфологией, полученным от нескольких собак из того же посёлка (Leuckart, 1863). Видовое название cordatum, возможно, от cordate - сердцевидный, имеет отношение к форме сколекса цестоды. Вид, первоначально описанный как Bothriocephalus cordatus, впоследствии включали в состав рода Dibothrium, затем Dibothriocephalus и, наконец, в Diphyllobothrium.
История открытия и последующего описания D. cordatum необычайно запутана, о чём пишет известный цестодолог, профессор Роберт Рауш (Rausch, 2005), посвятивший изучению дифиллоббтриид не один десяток лет. По его мнению, единственные черви в сборах из Гренландии, которые определённо могут быть отнесены к D. cordatum, следуя их первоописанию и рисункам (Leuckart, 1863), это - цестоды из собак. При этом собранные в Годхавне цестоды - один из них от женщины - представляют типовой материал D. cordatum, изученный Leuckart’oM. Детальное переописание D. cordatum от морского зайца и моржа из Гренландии, выполненное С. Марковским (Markowski, 1952), следует рассматривать как первое надёжное сообщение об этом гельминте из млекопитающих. Видовую идентификацию цестод, исследованных С. Марковским, подтвердила К. Андерсен (Andersen, 1987), работавшая с этим же материалом, находящимся в Британском Музее (Естественной Истории). Р. Рауш (Rausch, 2005) полагает, что в определении D. cordatum от тихоокеанского моржа С. Л. Делямуре (1955) допущена ошибка, которая затем была повторена в монографии С. Л. Делямуре с коллегами (1985). В действительности у тихоокеанского моржа паразитирует другой вид - Diphyllobothrium fayi, который, по мнению Р. Рауша, с 1955 г. в течение 50 лет определяли как D. cordatum (см., напр., Протасова, 2006; Юрахно, 1971).
D. cordatum - обычный и очень характерный паразит морского зайца в Беринговом и Чукотском морях и в Арктике (Bishop, 1979; Markowski, 1952; Rausch, 2005); внешне легко определяется на основании необычной формы стробилы.
Описание (по: Markowski, 1952; Rausch, 2005). Форма тела исключительно изменчивая: маленькие экземпляры плоские и ланцетовидные, чем похожи на Diphyllobothrium lanceolatum, более крупные особи червеобразные. Длина тела 2 - 20, максимально до 35 см, максимальная ширина у расслабленного червя до 6 мм. Стробила тонкая и у расслабленных особей более или менее полупрозрачная; максимальная толщина по средней линии 0.65 - 0.85 мм. Сколекс округлосердцевидный, 0.7 - 1 х 0.9 - 1.5 мм. У хорошо вытянутых цестод стробиляция заметна уже в 0.3 мм от сколекса. Проглоттиды трапециевидные, их длина намного меньше ширины. У червя длиной 34 см насчитали 597 члеников. В передних двух третях стробилы ширина члеников, включая зрелые, заметно больше их длины, в примерно последней трети проглоттиды истончаются, так что их относительная длина увеличивается. Половой зачаток обычно появляется в 50-м членике от сколекса, а зрелые яйца впервые появляются в матке на середине стробилы или слегка вблизи неё. Отверстие полового атриума расположено в 0.02 - 0.025 мм от переднего края членика, маточная пора - в 0.04 - 0.08 мм от атриума.
72
Вентральная поверхность вокруг полового атриума и маточной поры с многочисленными сосочками, располагающимися в круговой зоне диаметром 0.4 мм, которая протягивается от маточной поры почти до переднего края членика.
Рис. 39 Diphyllobothrium cordatum из морского зайца: 1 - сколекс; 2 - сагиттальный разрез членика; 3 - сагиттальный разрез членика, иллюстрирующий расположение семенников; 4 -горизонтальный разрез членика; 5 - поперечный разрез членика (с - циррус; cb - известковые тельца; cs - бурса цирруса; ех - экскреторная система; 1ш - продольная мускулатура; п - нервы; о - яичник; t - семенники; и - матка; ио - маточная пора; v - вагина; vd - семяизвергательный канал; vg - желточники; vo - вагинальная пора; vs - семенной пузырёк) (из: Markowski, 1952)
73
Продольная мускулатура в трёх слоях. Первый - субтегументальный, тонковолокнистый, второй проходит над желточниками и состоит из групп мускульных волокон, третий ограничивает медуллярную паренхиму и состоит их многочисленных волокон, не собранных в пучки. Общая толщина третьего слоя 0.15 -0.24 мм и варьирует в зависимости от размеров тела червя. Поперечная мускулатура сильно развита. Имеются также чёткие дорсо-вентральные волокна. Экскреторная система состоит из двух главных экскреторных каналов в медуллярной паренхиме и многочисленных канальцев в кортикальной.
Бурса цирруса от грушевидной до овальной формы, 0.450 - 0.752 х 0.225 -0.349 мм, её размеры варьируют в зависимости от размеров тела. Длинная ось сумки цирруса направлена антеро-дорсально. Циррус с толстыми мускулистыми стенками, свёрнут кольцами. Семенной пузырёк от сферической до удлинённой формы, длиной 0.100 - 0.23 мм, толщина его стенок 0.010 - 0.045 мм, наибольшая толщина в дистальной части пузырька. Семяизвергательный канал расположен дорсально и свёрнут в толстые кольца. Семенники неправильно-сферической формы, лежат в медуллярной паренхиме в 2 или 3 слоя, слегка перекрывая края яичника, но не концы маточных петель. Яичник из двух компактных долей, шириной 1.04 - 1.5 мм, находится у заднего края членика, содержит крупные яйцеклетки. Вагина толстостенная, проходит к внутреннему краю дорсального слоя продольной мускулатуры, поворачивает вентрально и тянется к вентральной поверхности членика, а затем поворачивает назад. Желточные фолликулы располагаются в один ряд между центральным и самым внутренним пучком продольной мускулатуры, отсутствуют в узкой зоне вокруг половых органов в центральной части членика. Матка формирует несколько, обычно 5-6, петель, окружающих обе стороны бурсы цирруса на её верхнем уровне. Яйца эллипсоидальные, 75 - 80 х 50 (Leuckart, 1863), 66 - 79 х 40 -43 (Markowski, 1952), 51 - 70.6 х 36.5 - 58.0 pm (в среднем 64.6 х 40.0) (Rausch, 2005). Диаметр крышечки 19-22 щп.
По данным (Hilliard, 1960), средний размер яиц D. cordatum (материал от спонтанно заражённого лахтака) 64 х 42 (максимальный диаметр приходится на уровень середины яйца), толщина оболочки 3, диаметр крышечки 21 щп. Поверхность яйца ячеистая (диаметр ямок 0.54 щп), цвет тёмно-янтарный; шов, отделяющий крышечку, глубокий, штифтик отсутствует.
Корацидий размером 34 х 41 щп, находится в центре яйца. Длина эмбриональных крючьев 10.23 - 13.10 pm. В морской воде при 2°С корацидии прожили 104 дня, но при 20°С - всего два дня (Hilliard, 1960).
Среди хозяев D. cordatum - тюлени гренландский, полосатый и обыкновенный, ларга, заяц морской, или лахтак, морж, сивуч, или северный морской лев Стеллера, нерпа кольчатая, а также домашние собаки и человек (явно случайные хозяева). В Беринговом море, к примеру, паразит был обнаружен у 20 % из 55 обследованных особей ларги (Shults, 1982).
Ареал вида охватывает воды Аляски, Берингово, Чукотское, Баренцево, Белое и Северное моря, проливы Скагеррак и Каттегат, воды Гренландии, Шпицбергена, Исландии.
В 1932 г. была опубликована краткая заметка о находке половозрелых особей D. cordatum у медведей в Йеллоустоунском парке в США (Scott, 1932). Описание цестоды в работе отсутствует, лишь указано максимальное число члеников у одной из 6 цестод, бывших в распоряжении исследователя, - 410. По мнению авто
74
ра заметки, к этому виду могут принадлежать плероцеркоиды, обнаруженные в этом же парке у форели; длина этих личинок достигала 18 см. Эти сведения о паразитировании D. cordatum у медведей включены в информационную сводку: wildpro. twycrosszoo.org. Cestode infections in bears (Parasitic disease summary). Тем не менее, довольно трудно представить паразитирование одного и того же вида цестод у медведей из Йеллоустоуна, региона, расположенного на высоте в среднем 2400 м над уровнем моря и со всех сторон окружённого хребтами Скалистых гор, и у морских млекопитающих субарктической и циркумбореальной зон.
Первое достоверное обнаружение D. cordatum у человека - это случай, имевший место в Гренландии ещё в 1860 г., когда из-за рвоты у женщины выделилась зрелая цестода, которую первоначально отнесли к роду Bothriocephalus, описав в качестве нового для науки вида В. cordatum (Leuckart, 1863). В 1930-е годы появилось сообщение Т. А. Колпаковой (1933) о 41 - 64 % заражённости этой цес-тодой местного населения на севере Якутии (см.: Талызин, 1936). Последний из цитируемых авторов, переисследовав материал Т. А. Колпаковой, пришёл к выводу, что она ошибочно отнесла к D. cordatum атипичные экземпляры D. latum.
В работе 1967-го года Р. Рауш с соавт. (Rausch et al., 1967) упомянули, что обнаружили у жителя района устья реки Кускокуим на Аляске сколексы цестод, возможно, принадлежащие D. cordatum. Однако более к этой информации Р. Рауш никогда не возвращался, даже в статье, в которой детально описал историю обнаружения данного гельминта (Rausch, 2005).
И ещё одна публикация, в которой упоминается о регистрации D. cordatum у человека, на этот раз - в Японии (Okamura et al., 1972). Судить о её содержании могу только по названию статьи; сама же работа опубликована на японском языке и, к сожалению, осталась недоступной мне.
Diphyllobothrium dalliae Rausch, 1956 (рис. 40). Исследуя фауну цестод анадромных рыб Аляски, Р. Рауш (Rausch, 1956) обнаружил в полости тела чёрной даллии неизвестные неинцистированные плероцеркоиды. Скормив этих личинок серокрылой чайке и собакам, он получил половозрелых червей, которых назвал D. dalliae. Видовое название паразита происходит от латинского названия рода хозяев: Dallia - род рыб семейства умбровых. Позднее данный вид был зарегистрирован у человека и песца на Аляске (Rausch, Hilliard, 1970). На территории России плероцеркоиды D. dalliae были найдены на Чукотке у даллии (у 90 % рыб) и арктического гольца (у 6 %) (Жуков, 1963).
Описание (по: Rausch, 1956; Rausch, Hilliard, 1970). Длина стробил варьирует и может достигать 522 мм при максимальной ширине 9 мм; такая стробила состоит из 234 члеников. Края стробилы отчётливо зазубренные. Передняя часть тела резко обособлена от сколекса. У зрелых члеников отношение их длины к ширине 1 : 2.5. Сколекс ланцетовидный, 2 х 0.75 мм. Шейка очень короткая. Половая пора медианная, находится в передней трети членика, окружена сосочками. Семенники расположены в 2 - 3 слоя; в каждом членике около 500 семенников. Бурса цирруса грушевидная, 0.25 х 0.21 мм. Семенной пузырёк сферический, 0.13 х 0.1 мм. Многочисленные петли семяизвергательного канала расположены дорсально. Вагина от яичника идёт вентрально, поворачивает дорсально, затем вновь вентрально и впадает в половую клоаку параллельно бурсе цирруса. Маточная пора открывается в 0.14 мм от половой клоаки. Яичник состоит из двух лопастей, соединённых коротким перешейком, расположен близ задней границы членика. Желточные фоллику-
75
лы многочисленные, их латеральные поля соединяются впереди бурсы и позади яичника, иногда они покрывают концы маточных петель, закрывают пространство вокруг бурсы. Матка становится заметной в первых 10-20 проглоттидах. Передняя часть матки образует с каждой стороны 5-7 компактных петель, не достигающих передней части бурсы. Зона вокруг зрелой матки и других структур в срединной части членика свободна от семенников и желточников. Яйца овальные, 51 - 64 х 40 - 44 щп (в среднем 59 х 42), штифтик отсутствует.
2 1 мм
Рис. 40 Diphyllobothrium dalliae: I — сколекс, латерально; 2 - половозрелый членик, вентрально; 3 - сагиттальный разрез половозрелого членика (из: Делямуре и др., 1985 -по: Rausch, 1956)
Д. Хиллиард (Hilliard, 1960) указывает средний размер яиц у D. dalliae от человека 66 х 50 (наибольший диа-
метр возле полюса с крышечкой), толщина оболочки 1.2, диаметр крышечки 21 pm; поверхность яйца гладкая, бледно-янтарного цвета, шов не углублён. Корацидий диаметром 41, после вылупления - 48 щп, длина эмбриональных крючьев 11.3 -13.3 pm. Инкубационный период развития паразита в человеке, чайке серокрылой и песце составляет 7-8 дней, в собаке - 19.
Плероцеркоиды D. dalliae из даллии характеризуются ланцетовидным, сильно уплощённым телом, конически заострённым с обоих концов (Rausch, 1956). Максимальная длина личинок до 32 мм. Сколекс вытянутый, в дорсо-вентральной проекции резко отграничен от тела, размером 1 х 0.57 мм. В латеральном положении сколекс ланцетовидный, в дорсо-вентральном - заострённый; ботрии тянутся вдоль всей его длины. Поверхность тела с густо расположенными микротрихиями длиной 8 щп. Известковые тела сферические или овальные, диаметром 6-13 цт. Мускульный слой хорошо развит. Фронтальные железы многочисленные, диффузные, расположены только в сколексе, в тело личинки не распространяются.
Плероцеркоиды D. dalliae устойчивы к низким температурам и могут выживать в рыбке массой 17 г при -6°С в течение 24 ч (Hilliard, 1959).
D. dalliae - довольно обычный паразит человека, собак и песцов на западе Аляски. Как-то у одного местного жителя из Чевака после антигельминтозного лечения квинакрином выделилось 16 взрослых хорошо развитых цестод, а также 124 плероцеркоида и стробил ранней стадии развития (Rausch, Hilliard, 1970). Заражённость даллии в этом регионе достигает 84 % при средней интенсивности инвазии 3.7 экз. в одной рыбе (Hilliard, 1960; Rausch, Hilliard, 1970; Rausch et al., 1967). Ha западе Аляски местное население заготавливает даллию в огромном количестве и обычно употребляет её в пищу в сыром виде. Этой же рыбой кормят и ездовых со
76
бак, особенно в зимний период, с чем и связана высокая заражённость этих животных цестодами. Однажды в марте при аутопсии собаки в её тонком кишечнике насчитали 1087 экз. D. dalliae, большинство из которых всё ещё находились на стадии созревания (Rausch, Hilliard, 1970).
Diphyllobothrium dendriticum (Nitzsch, 1824) Liihe, 1910 (=Bothriocephalus dendriticus Nitzsch., \Z2^',=Diphyllobothrium fissiceps (Creplin, 1829); =Z>. cordiceps (Leidy, 1872); =D. exile (Linton, 1892); =Sparganum sebago Ward, 1910; =Dibothrio-cephalus minor Cholodkovsky, 1916; =D. canadense Cooper, 1921; = Diphyllobothrium strictum (Talysin, 1932); =D. strictum Neveu-Lemaire 1936; =£>. obdoriense Plotnikoff, 1933; =D. nenzi Petrov, 1938; =D. laruei Vergcer, 1942; =D. oblongatum Thomas, 1946; =D. medium Fahmy, 1954; =D. microcordiceps Szidat et Soria, 1957; =D. norvegi-cumN\k, 1957) (рис. 41). Синонимы приведены по работе: Scholz, Kuchta, 2016. Столь широкий круг синонимов у данного вида фактически свидетельствует о его морфологической вариабельности, поскольку каждый из перечисленных видов, по мнению их авторов, так или иначе отличался от типичного D. dendriticum.
Вид описан на материале от обыкновенной моевки из Северной Германии под названием Bothriocephalus dendriticus (Nitzsch, 1824). Видовое название dendri-ticus - ветвящийся, древовидный.
Описание (по: Сердюков, 1972, 1979; Kuchta et al., 2013). Тело светло-жёлтое, длиной до 100 см и максимальной шириной до 1 см. В зависимости от хозяина и физиологического состояния червя форма и размеры его тела значительно варьируют. Сколекс плоский, ланцетовидный, чётко отграничен от тела; форма сколекса изменяется в зависимости от степени его сокращения. Ботрии не нависают на шейку. Стробила состоит из нескольких сотен члеников, в каждом из которых имеется один набор половых органов. Зрелые проглоттиды, т. е. содержащие полностью сформированные яйца, размером 0.13 - 2.1 х 0.82 - 10.0 мм, с характерными вогнутыми латеральными краями и более или менее заострёнными выступами в месте соединения члеников. Под тегументом разбросаны редкие пучки хорошо развитой продольной мускулатуры. Кольцевая мускулатура развита очень слабо, дор-со-вентральная, напротив, представлена хорошо развитыми пучками, проходящими между внутренними органами в мозговой паренхиме. Слой корковой паренхимы почти вытеснен желточниками. Экскреторная система представлена двумя крупными продольными каналами в медуллярной паренхиме и мелкими - в кортикальной. Семенники сферические, многочисленные, располагаются в медуллярной паренхиме и, как и жедточники, сливаются между сегментами и вдоль переднего края членика. Бурса цирруса овальная. Семенной пузырёк небольшой, не достигает и половины длины бурсы цирруса, лежит дорсально к ней. Общая половая пора медианная, располагается в передней трети сегмента на возвышении, плотно покрытом папиллами. Яичник двудольчатый, овально-вытянутый, находится у заднего края сегмента. Желточные фолликулы многочисленные, маленькие, сферические или субсферические, располагаются в кортикальной паренхиме.
Вагина вентральнее матки слабо извивается, под бурсой резко сворачивает на вентральную сторону и впадает в общий половой атриум. Матка трубчатая, с каждой стороны образует 6-8 петель, последние из них окружают бурсу снизу и с боков. Яйца толстостенные, янтарного цвета, размером (по разным данным) 58 х 40 (Hilliard, 1960), 57 - 61 х 39 - 41 (Сердюков, 1979), 62.5 - 70 х 48.5 - 52.5 (64 х 49) (de Marval et al., 2013), 50 - 70 x 30 - 52 pm (Kuchta et al., 2013), с крышечкой дна-
77
метром 18 pm и штифтиком. Поверхность яйца почти гладкая, с редкими мелкими ямками.
Корацидий размером 32 х 35, после вылупления - 38 х 41, крючья длиной 11.0 - 12.5 цт. В пресной воде при 20°С инкубационный период составлял 6-8 суток; при 20°С корацидии сохраняли активность в течение 18 ч (Hilliard, 1960).
Рис. 41 Diphyllobothrium dendriticum (с первичной стробилой) из человека, Тюменская область: 1 - сколекс, вид сбоку; 2 - гермафродитный членик; 3 - половозрелый членик из первой трети длины тела; 4-7 - срезы через половозрелые членики из первой трети (4 - медианный срез в области бурсы; 5 - сагиттальный срез через латеральное поле; 6 - поперечный срез через бурсу; 7 - то же на уровне первых петель матки); 8 - половозрелый членик из последней трети; 9 и 10- срезы через членик (8) (9 - медианный срез через бурсу; 10 - сагиттальный срез через латеральное поле); 11 - яйцо (из: Сердюков, 1972)
78
Среди дефинитивных хозяев D. dendriticum - рыбоядные птицы 9 семейств (Accipitridae, Alcidae, Corvidae, Gaviidae, Laridae, Pandionidae, Pelecanidae, Podicipe-didae, Stemidae), однако основными хозяевами для этого паразита всё же являются лайковые (Kuchta et al., 2013). Из-за своей приуроченности к чайкам, как основным хозяевам, цестода даже получила название лентеца чайкового. Цестода встречается также у млекопитающих, таких, например, как арктический песец, волк, домашние собаки и кошки. В тихоокеанском регионе Канады D. dendriticum обнаружили у гризли (Catalano et al. 2015). В экспериментальных условиях половозрелые особи D. dendriticum были выращены в хомячках золотистом и сирийском, чайках серебристой, серокрылой, озёрной и доминиканской, домашних собаках, кошках, серой крысе и человеке (Кутырев, 2017; Andersen et al., 1987; Fraser, 1960; Hilliard, 1960; Kuhlow, 1953; Rausch, Hilliard, 1970; Sharp et al., 1990; Torres et al., 1981 и др.). Например, в Чили личинок из микижи скормили доминиканской чайке и домашней собаке, вырастив половозрелые особи D. dendriticum, что позволило впервые выявить данного паразита на юге страны (Torres et al., 1981). Предполагают, что паразит мог попасть в Южную Америку из Северной Америки или Европы с путешест-венниками-паразитоносителями, или был занесён зимующими в Южной Америке птицами, такими как крачки полярная и речная, Франклинова чайка.
В организме дефинитивного хозяина взрослые формы D. dendriticum обычно живут 4-6 месяцев. По информации А. М. Сердюкова (1979), который заразил себя, добровольно проглотив плероцеркоиды из пеляди, срок паразитирования чайкового лентеца составил 58 дней. Однако известен случай двухлетней заражённости человека этим паразитом, которое сопровождалось хронической повторяющейся диареей (Wicht et al., 2008а).
Плероцеркоиды чайкового лентеца зарегистрированы более чем у 50 видов пресноводных рыб из 12 семейств (Kuchta et al., 2013), но основными дополнительными хозяевами являются лососёвые, а среди них виды рода сигов - пелядь, пыжьян, омуль, чир, муксун и т.д. В отдельных регионах заражённость рыб личинками этого гельминта может достигать 100 %. Так, в различных водоёмах Западной Сибири широко распространённая здесь пелядь поражена плероцеркоидами данного вида на 27 - 100 % при интенсивностей инвазии 1 — 15 экз. (Сердюков, 1979). В Швеции паразит был обнаружен у 83.2 % обследованных особей арктического гольца при средней интенсивности инвазии 11.3 экз. (Henricson, 1977). В регионах, где сиги не обитают, роль основного дополнительного хозяина переходит к другим видам рыб, и опять-таки, лососёвым. Например, на юге Чили в оз. Пангвипульи ми-кижа из семейства лососёвых оказалась заражена D. dendriticum на 57 %, при этом у 11 % рыб личинки локализовались и в мышцах (Torres et al., 2012). Обследованные вместе с микижей местные рыбы - два вида из семейства атеринопсид, были заражены на 2 и 5 %.
Плероцеркоиды заключены в капсулы диаметром от 3 до 11 мм и локализуются в пищеводе, желудке, пилорических придатках, печени, гонадах, сердце, селезёнке, плавательном пузыре, полости тела рыб и очень редко в их мускулатуре.
Извлечённые из капсул личинки от светло-жёлтого до кремового цвета и могут достигать в длину 5 см. Тело сильно складчатое. Сколекс округлой формы, слегка сжат с боков, отделён от тела глубокой перетяжкой (Делямуре и др., 1985; Кутырев, 2017). Ботрии глубокие, их наружные края складчатые, с дорсальной и вентральной стороны сколекса обычно сомкнуты в виде щели, плотно сомкнутой 79
на всём своём протяжении. Поверхность тела покрыта плотным слоем микротрихий двух типов - трубчатыми, длиной до 5 pm, и конусовидными, длиной до 1 pm. Железы проникновения расположены только в сколексе и вместе с элементами нервной системы образуют нейро-железистый комплекс. Центральную часть тела личинки занимает мозговая паренхима, в которой проходят попарно расположенные два основных экскреторных канала и два нервных ствола.
В пресной воде плероцеркоиды чайкового лентеца выживают 2.5 - 3 ч.
В организме человека личинка D. dendriticum достигает половозрелого состояния менее чем за 2 недели. То, как быстро растут цестоды в дефинитивном хозяине, продемонстрировали опыты с заражением озёрной чайки, в которой была выращена 18-дневная стробила (Kuhlow, 1953). Оказалось, что черви ежедневно увеличивались в размерах на 70- 100 мм, что соответствовало 58 - 76 членикам.
В первых сообщениях о регистрации D. dendriticum у человека паразит фигурировал под другими назаниями. Так, дифиллоботрииду, выявленную у человека, живущего на берегах озера Байкал, описали как Dibothriocephalus minor (Холод-ковский, 1916), цестоду, найденную у аборигена на о. Ольхон на Байкале, - как D. strictum (Talysin, 1932), а у жителя Архангельской области из района нижнего течении Печоры - как D. nenzi (Петров, 1938). Кстати, последний был описан по единственному экземпляру без переднего конца и со времени его открытия более никем не был обнаружен. Все три вида, как известно, в настоящее время рассматривают синонимами D. dendriticum.
В целом случаи заражения людей чайковым лентецом были зафиксированы в Сибири на территории Омской, Томской, Новосибирской и Тюменской областей, на Таймыре, Ямале и Гыданском полуострове, в Бурятии, Иркутской области, Якутии, причём в последние годы в Прибайкалье наблюдается положительный тренд снижения их количества. За пределами РФ подобные случаи зарегистрированы на севере-западе Канады и на Аляске (Rausch, Hilliard, 1970). По данным (Scholz, Kuchta, 2016), в мире насчитывается около 1000 случаев инвазии людей D. dendriticum. На мой взгляд, эта цифра весьма условная. Кроме того, известно несколько успешных попыток самозаражения волонтёров в Финляндии, бывшем Советском Союзе, Норвегии, США и Канаде, предпринятых исследователями с целью изучения особенностей развития цестоды и её возможного влияния на организм человека (Сердюков, 1979; Чижова, Гофман-Кадошников, 1960; Andersen et al., 1987; Bylund, Wikgren, 1968; Rausch, Hilliard, 1970; Vik, 1957). К примеру, норвежский исследователь Р. Вик не только 11 раз проводил на себе подобные эксперименты, но и, работая в США, заразил себя плероцеркоидами из лосося Кларка, чтобы затем сравнить живые особи «американских» и «норвежских» представителей D. dendriticum (Andersen et al., 1987; Vik, 1957). Работавшие на Аляске американские исследователи Р. Рауш и Д. Хиллярд (Rausch, Hilliard, 1970) в опытах по заражению человека плероцеркоидами из микижи вырастили 65-дневную стробилу D. dendriticum, что, кстати, позволило им детально сравнить морфологические особенности этого вида с таковыми D. latum.
В Европе инвазия людей чайковым лентецом ранее официально не была известна. Однако в 21-м столетии появились сообщения о подобных случаях, имевших место в Нидерландах, Швейцарии и Чехии, причём если удавалось выяснить источник заражения, оказывалось, что оно произошло вне страны проживания пациента.
80
В Швейцарии первым пациентом, у которого обнаружилось заражение D. dendriticum, стала в 2006-м году 59-летняя женщина, побывавшая в Норвегии, Канаде и на Аляске, где в её меню наиболее обычным блюдом была рыба (Wicht et al., 2008а). Второй случай имел место в 2010 г. (de Marval et al., 2013); на этот раз инва-
зию выявили у 4-летнего мальчика после 15-дневного семейного путешествия на Бали и в Сингапур. До возвращения домой у ребёнка уже наблюдались абдоминальные боли и жидкий стул, а через 12 дней после возвращения в стуле были обнаружены фрагменты цестоды. Во время пребывания в Юго-Восточной Азии все члены семьи ели копчёную или почти сырую рыбу, а дома в их меню всегда присутствовали атлантический лосось, импортируемый из Норвегии, и местный окунь. Кстати, родители и сестра мальчика не пострадали.
Рис. 42 Яйца Diphyllobothrium dendriticum из стула пациента, Швейцария, 2010 г. (белая стрелка указывает на крышечку, серая - на штифтик) (из: de Marval et al., 2013)
В Нидерландах инвазию выявили у 31-летнего мужчины и первоначально цестоду определили как D. latum (van Doom et al., 2005), но после молекулярногенетического анализа отнесли к D. dendriticum (Kuchta et al., 2013). За 5 месяцев до этого неприятного инцидента пациент посетил Бразилию.
И, наконец, последний случай, имевший место в Чехии (Kuchta et al., 2013). Здесь пострадавшей оказалась 28-летняя женщина, которая летом 2010 г. работала на разделке рыбы на рыбокомбинате в Клавоке на Аляске. В начале января 2011 г. она обнаружила в стуле большой фрагмент цестоды длиной в 30 см. По словам пациентки, в период пребывания на Аляске она регулярно ела барбекю из нерки и горбуши, а также омуля. Скорее всего, последний и стал источником её заражения.
Заражение людей D. dendriticum в таких странах Европы, где раньше этого паразита не находили, свидетельствует о том, что возбудители зоонозов могут распространяться по всему миру, а для таких широко специфичных паразитов, как чайковый лентец, окончательные хозяева которого могут разносить и разносят яйца паразита на огромные расстояния, границ фактически не существует.
Паразитирование D. dendriticum у человека обычно проходит мягко и в большинстве случаев асимптоматично (Scholz et al., 2009). Многие авторы пишут об отсутствии каких-либо проблем со здоровьем при заражении плероцеркоидами чайкового лентеца, хотя и известны случаи проявления диареи (Wicht et al., 2008а) или же абдоминальных болей (de Marval et al., 2013).
Замечу, что D. dendriticum никогда не рассматривали как серьёзного или опасного возбудителя зоонозов человека, угрожающего его жизни (Andersen et al., 1987). В своё время А. М. Сердюков писал: «Паразитирование D. dendriticum у человека не оказывает серьёзного действия на организм, в связи с чем указанный возбудитель играет значительно меньшую роль в этиологии дифиллоботриозов» (Сердюков, 1979; стр. 100). При этом автор подчёркивал важное эпизоотологическое значение данного гельминта в рыбоводных хозяйствах, о чём в последующие годы писали и другие исследователи (см., напр., Rahkonen et al., 1996).
81
Diphyllobothrium elegans (Krabbe, 1865) Meggitt, 1924 (рис. 43, 44). Вид описан под названием Bothriocephalus elegans на материале, полученном в Гренландии в мае 1В60 г. от тюленя хохлача (Krabbe, 1865). В последующем вид был переведён в род Dibothriocephalus Luhe, 1899, а затем - в Diphyllobothrium (Meggitt, 1924). Видовое название паразита происходит от латинского elegans - стройный, изящный.
Рис. 43 Diphyllobothrium elegans от гавайского тюленя-монаха: 1 -сколекс, вентрально; 2 - половозрелый членик; 3 - сагиттальный разрез членика в области бурсы и вагины (из: Rausch, 1969)
Рис. 44 Diphyllobothrium elegans от тюленя-монаха, Сенегал: 1 - сколекс, вентрально; 2 -горизонтальный разрез членика; 3 - сагиттальный разрез членика; 4 - поперечный разрез членика (cs - бурса цирруса; 1m - продольная мускулатура; о - яичник; t - семенники; и - матка; ио - маточная пора; v - вагина; vd -семяизвергательный канал; vg - желточники; vo - вагинальная пора; vs - семенной пузырёк) (из: Markowski, 1952)
Описание (по: Markowski, 1952; Rausch, 1969). Стробила тонкая, слегка сужающаяся кпереди, с зазубренными краями, длиной 4 - 18 см и максимальной шириной 1.5 мм. Дорсальная и вентральная поверхности стробилы несколько вогнуты. Сколекс овальный в очертании, размерами 1.8 х 0.78 (Markowski, 1952) или 0.58 -0.90 х 0.29 - 0.41 мм (Rausch, 1969). Шейка хорошо развита, её длина варьирует от 0.18 до 1.6, ширина - от 0.2 до 0.8 мм. Проглоттиды квадратные или слегка удлинённые. Мускулатура развита слабо. Паренхима нежная. Экскреторных сосудов много. Известковые тельца имеются, но немногочисленны. Зачатки половых органов видны в первых члениках. Половые поры расположены в передней трети членика. Вагина открывается рядом с мужской гонопорой в общий половой атриум, окружённый сравнительно крупными сосочками. Бурса цирруса грушевидная, 0.09 - 0.14 х 0.02 (Rausch, 1969) или 0.168 - 0.182 х 0.116 - 0.132 мм (Markowski, 1952). Семенной пузырек крупный, сферический или почти сферический, расположен позади бурсы цирруса; толщина его стенки 17-23 цш. Семенники субсферические,
82
немногочисленные, расположены в один слой, впереди и у заднего края членика сливаются. Яичник хорошо развит, несколько U-образной формы. Желточные фолликулы более или менее сферические, многочисленные; как и семенники, сливаются впереди и у заднего края сегмента. Матка расположена в задней половине членика, с каждой стороны от медианной линии образует несколько (4-5) петель. Зрелые проглоттиды содержат от 6 до 40 яиц. Яйца эллипсоидальные, размером 43 - 46 х 33 - 36 (Markowski, 1952) или 37 - 41 х 26 - 30 pm (в среднем 39 х 29) (Rausch, 1969), штифтик имеется.
Окончательные хозяева паразита - хохлач, тюлень обыкновенный, сивуч, тюлень-монах, гавайский тюлень-монах. Вид известен в Северной и Центрально-Восточной Атлантике, Северной и Центральной Пацифике, в Средиземном море. Однако Т. Шольц и Р. Кухта (Scholz, Kuchta, 2016) придерживаются того мнения, что информация о находках D. elegans у иных хозяев, чем хохлач, и в других районах Мирового океана требует подтверждения.
Единственная информация о регистрации у человека цестоды, похожей на D. elegans, была опубликована 30 лет назад в Японии (Kamo et al., 1986). Авторы описали цестоду, обнаруженную ещё в ноябре 1969 г. после лечения камалой у 50-летнего моряка из префектуры Нагасаки. Отметив её сходство с D. hians по ряду признаков при одновременном отличии по форме и положению бурсы цирруса и положению бурсы цирруса по отношению к семенному пузырьку, они пришли к выводу, что по этим признакам обнаруженная цестода похожа на D. elegans. Авторы закончили статью утверждением, что окончательная идентификация паразита должна быть установлена в будущем на основании более детальных материалов и методов (The definite identification should be established in the future on the basis of more detailed materials and methods - Kamo et al., 1986; стр. 84).
Описание цестоды из человека (Kamo et al., 1986). Тонкий, молочно-белый червь достигал в длину 102 см при ширине 7 мм. Стробила со слегка зазубренными краями. Проглоттиды несколько выпуклые латерально, в созревающих члениках отношение длины к ширине составляло 1 : 5, в терминальных - 1: 1.5. Известковые тельца имелись. Бурса цирруса грушевидная, 0.484 - 0.567 х 0.288 - 0.391 мм. Субсферический семенной пузырёк располагался позади бурсы, его размеры составляли 0.309 - 0.433 х 0.175 мм. Желточные фолликулы диаметром 0.052 - 0.072 мм. Яйца 43 - 48 х 33 - 39 pm (в среднем 44 х 35) (рис. 45).
Рис. 45 Яйцо Diphyllobothrium (?) elegans из человека, Япония: общий вид (слева) и поверхность яйца (справа, SEM) (из: Kamo et al., 1986)
В доступной литературе какие-либо иные сведения о регистрации D. elegans у человека отсутствовали.
83
Diphyllobothrium hians (Diesing, 1850) Meggitt, 1924 (рис. 46, 47). Впервые
паразит описан на материале от срезиземноморского тюленя-монаха под названием Dibothrium hians (Diesing, 1850). Далее вид поочерёдно оказывался в родах Bothriocephalus, Dibothriocephalus, а в 1924 г. был переведён в род Diphyllobothrium (Meggitt, 1924).
Рис. 45 Diphyllobothrium hians от тюленя, Лондонский зоопарк: 1 - сколекс; 2 - сагиттальный разрез членика, иллюстрирующий сфинктер вагины и строение стенки матки; 3 - горизонтальный разрез членика; 4 -поперечный разрез членика (cs - бурса цирруса; ех - экскреторная система; 1m - продольная мускулатура; п - нервы; о -яичник; t - семенники; и - матка; ио - маточная пора; v - вагина; vd -семяизвергательный канал; vg - желточники; vo - вагинальная пора; vs -семенной пузырёк; vsp -сфинктер вагины) (из: Markowski, 1952)
Рис. 46 Diphyllobothrium hians от гавайского тюленя-монаха: 1 - сколекс, вентрально; 2 - то же, ла-терально; 3 - половозрелый членик; 4 - сагиттальный разрез членика в области бурсы и вагины (из: Делямуре и др., 1985 - по: Rausch, 1969)
84
Описание (по: Markowski, 1952; Matz, 1892; Rausch, 1969). Стробила мускулистая, вытянута кпереди, с параллельными, слегка зазубренными краями. Длина тела может достигать 36 см, ширина 5-6 мм. Сердцевидный сколекс размером 1.5 х 2 мм. Ботрии глубокие, простираются по всей длине сколекса. Шейка отсутствует, или, как пишет С. Марковский, её видимое отсутствие может быть вызвано сокращением тела червя. Дорсальная и вентральная поверхности тела с продольной бороздой по средней линии. У незрелых членика отношение длины к ширине 1 : 8, у терминальных зрелых 1:4. Первый слой продольной мускулатуры находится под тегументом и состоит из тонких волокон, второй развит слабо и состоит из одиночно разбросанных волокон, расположенных вдоль тела над желточными фолликулами. Третий слой хорошо развит, образует непрерывное кольцо, состоящее из многочисленных волокон. Имеются многочисленные известковые тельца. Экскреторная система состоит из двух медуллярных и многочисленных кортикальных каналов. Половая пора медианная, в передней трети членика. Мужское и женское половые отверстия расположены близко и открываются в общий полвой атриум. Бурса цирруса удлинённая, трубчатая, размерами 0.487 х 0.312 (Matz, 1892), 0.525 х 0.105 (Markowski, 1952) или 0.34 х 0.06 - 0.09 мм (Rausch, 1969). Семенной пузырек удлинённо-овальный, размером 0.26 - 0.30 х 0.105 - 0.17, толщина стенок 0.026 мм, расположен вентрально к бурсе цирруса. Субсферические семенники расположены в латеральных полях членика в один слой, сливаясь впереди половой клоаки. Вагина тянется вперёд, затем поворачивает вентрально к половому атриуму, где и открывается позади отверстия бурсы цирруса. В терминальной части вагины близ отверстия её стенки образуют характерное, похожее на сфинктер образование, размером 30 х 3 щп в сагиттальном разрезе. Яичник отчётливо двулопастный, лежит у заднего края членика. Многочисленные желточные фолликулы образуют две области, сливающиеся перед половым отверстием, но оставляющие свободными зоны вокруг половых органов. Медианные края желточных полей перекрывают концы маточных петель вентрально и дорсально. Матка толстостенная. Яйца от эллипсоидальных до субсферических, 59.2 х 38.2 (Matz, 1892), 45 х 33 (Markowski, 1952), 41 -48x30-37 pm (в среднем 42 х 34) (Rausch, 1969), штифтика нет.
D. hians зарегистрирован у котика северного морского, тюленя обыкновенного, нерпы кольчатой, зайца морского, тюленя-монаха, гавайского тюленя-монаха, у которых поселяется в тонком кишечнике. Ареал вида включает акваторию Северной Атлантики, Средиземное море, северную и центральную части Тихого океана. Т. Шольц и Р. Кухта (Scholz, Kuchta, 2016) в обзорной работе по цестодам рода Diphyllobothrium подчёркивают, что информация о находках D. hians у иных хозяев, чем средиземноморский монах-тюлень, сомнительна, поскольку по своей морфологии эти экземпляры отличаются от типового материала вида.
В 1986 г. в упомянутой выше (стр. 71 - 72) статье японских исследователей (Kamo et al., 1986) речь также шла о цестоде, обнаруженной ещё в октябре 1969 г. у 27-летнего моряка из префектуры Нагасаки. При описании цестоды авторы статьи подчеркнули, что паразит внешне похож на D. cameroni, но, тем не менее, ближе всего к D. hians, от которого отличается только формой и размером сколекса. Однако приводимые ими размеры сколекса фактически мало отличаются от указываемых для D. hians, например, С. Марковским (Markowski, 1952), но размеры бурсы цирруса и семенного пузырька у «японского» экземпляра действительно намного больше, чем известно для D. hians.
85
Сокращённый экземпляр достигал в длину 40 см при максимальной ширине 12.5 и толщине 2.0 мм и состоял из 500 члеников. Терминальные членики отсутствовали. Соотношение длины членика к его ширине изменялось от 1 : 15 до 1 : 10 в терминальной части стробилы. Сколекс размером 1.08 х 1.13 мм. Внутренний слой продольной мускулатуры толщиной 0.288 мм. Сумка цирруса удлинённая, 1.123 -1.164 х 0.098 - 0.133 мм. Семенной пузырёк удлинённый, 0.412 - 0.525 х 0.124 -0.139 мм, расположен позади параллельно бурсе цирруса, соединяется с ней коротким протоком. Яйца эллипсоидальные или субсферические, 48 - 56 х 33 - 44 цт (в среднем 49 х 36), поверхность с плотно расположенными ямками (рис. 48).
Рис. 48 Яйцо, общий вид (слева) и поверхность яйца (справа, SEM) Diphyllobothrium (?) hians из человека, Япония (из: Като et al., 1986)
В 1988 г. была опубликована статья (Kamo et al., 1988) с описанием, как пи
шут авторы, «первого» (?) случая обнаружения D. hians у человека в Японии, на этот раз у 29-летнего моряка. Ознакомиться с названной статьёй я не имела воз
можности.
Diphyllobothrium lanceolatum (Krabbe, 1865) Meggitt, 1924 (рис. 49, 50). Вид впервые описан по экземплярам от зайца морского из Гренландии под названием Bothriocephalus lanceolatus (Krabbe, 1865). В разное время его включали в род Di-bothriocephalus, Cordicephalus и, наконец, в Diphyllobothrium (Meggitt, 1924). Видовое название паразита происходит от латинского lanceola - маленькое копьё, копьецо, на которое, по мнению автора первоописания, похожа цестода.
Описание (по: Делямуре, 1955; Markowski, 1952). Тело сильно уплощённое, суженное спереди и сзади, длиной 2 - 7 см при максимальной ширине 3-7 мм. Сколекс размерами 1.2 - 1.6 х 1.0 - 1.45 мм, латерально сжат, его ботриальные поверхности нависают на стробилу. Ботрии щелевидные, глубокие, на вершине сколекса разделены узкой перегородкой. Шейка отсутствует. Продольная мускулатура состоит из трёх слоёв. Имеются многочисленные известковые тельца (С. Марковский пишет об отсутствии известковых телец у изученных им экземпляров). Половые поры медианные, открываются в передней половины членика близко друг к другу и окружены хорошо развитыми половыми сосочками. Бурса цирруса толстостенная, почти грушевидная, 0.47 х 0.36 (Делямуре, 1955) или 0.27 х 0.165 мм (Markowski, 1952). Циррус свёрнут кольцами. Почти шаровидный мускулистый семенной пузырек размером 0.134 х 0.153 или 0.099 х 0.063 мм (по данным выше упомянутых авторов), лежит дорсо-латерально к бурсе цирруса; толщина его стенок 20 -23 pm. Семенники немногочисленные, расположены в один слой, но ближе к медианной линии - в два слоя, впереди сливаются. Яичник двулопастный. Вагина извитая, проходит вентральнее матки. Матка образует с каждой стороны 4-6 (чаще 4 -5) петель. В зрелых члениках матка мешковидная; её последние разросшиеся петли окружают бурсу снизу и с боков, но не со всех сторон.
86
Рис. 49 Diphyllobothrium lanceolatum: 1 - сколекс, латерально; 2 - то же, вентрально; 3 - половозрелый терминальный членик; 4 - поперечный разрез членика на уровне яичника и первых петель матки; 5 - сагиттальный разрез членика (из: Делямуре и др., 1985)
Рис. 50 Diphyllobothrium lanceolatum'. 1 - сколекс; 2 - сагиттальный разрез членика (cs - бурса цирруса; и - матка; ио - маточная пора; v - вагина; vg -желточники) (из: Markowski, 1952)
Яйца размером 66 х 40 (Markowski, 1952), 69 - 72 х 40 - 42 (Делямуре, 1955), 54.7 - 70.2 х 40.5 - 47.6 цт (в среднем 58.5 - 70.7 х 42 - 45.1) (Hilliard, 1960), с крышечкой диаметром 19-20 цт, шов глубокий; штифтика нет. Оболочка янтарного или тёмно-янтарного цвета, с ячеистой поверхностью (диаметр ямок 0.5 jim). Корацидий расположен в центре яйца, его размер 41 х 30, после вылупления 42 цт в диаметре, эмбриональные крючья длиной 11.26 - 14.31 цт (Hilliard, 1960). В физиологическом растворе при 20°С инкубация длилась 12-18 дней.
Окончательные хозяева D lanceolatum -заяц морской, котик северный морской, тюлени обыкновенный, полосатый (крылатка), гренландский, тюлень-монах, нерпа кольчатая, фоцена, белуха, домашняя собака (случайный хозяин). Ареал вида охватывает Средиземное, Балтийское, Белое, Баренцево, Карское, Восточно-Сибирское, Чукотское, Берингово и Охотское моря, Северную Атлантику, Северный Ледовитый океан, север Тихого океана, Аляску.
С. Л. Делямуре с соавт. (1985) полагают, что определённые несоответствия, имеющиеся в описаниях D. lanceolatum у разных авторов, вызваны широким спектром хозяев этого паразита из различных географических регионов, результатом которых стала его политипичность.
Второй промежуточный хозяин паразита - ряпушка сибирская, пресноводная рыба из рода сигов, у которой плероцеркоиды располагаются в мускулатуре и полости тела.
Уже упоминавшиеся выше (стр. 80) американские паразитологи (Rausch, Hilliard, 1970) в период своей работы на Аляске обнаружили у местного жителя из Чевака после его лечения квинакрином три хорошо развитые стробилы D. dalliae и 52 плероцеркоида и стробил на ранней стадии развития, среди которых оказался
87
единственный экземпляр D. lanceolatum. Такие же плероцеркоиды Р. Рауш, по его словам, находил на Аляске в полости тела ряпушки сибирской (рис. 51).
Учитывая отсутствие у D. lanceolatum приуроченности к определенному хозяину, о чём свидетельствовали находки этого паразита у ^амых разных хозяев, включая собак, цитируемые авторы (Rausch, Hilliard, 1970) пришли к выводу, что этот вид является потенциальным паразитом человека.
Рис. 51 Diphyllobothrium lanceolatum, плероцеркоиды: слева - из человека, справа - из ряпушки (из: Rausch, Hilliard, 1970)
Diphyllobothrium latum (Linnaeus, 1758) Liihe, 1910 (рис. 35, 52 - 57, 82). He будет преувеличением сказать, что лентец широкий, или как его ещё называют солитёр, является одним из наиболее распространённых и наиболее узнаваемых паразитов человека, заражению которым на планете подвержены миллионы людей.
В 1592 г. швейцарский исследователь Т. Дунус (Dunus), проживавший в Люцерне, весьма своеобразно описал червя, известного в настоящее время как Diphyllobothrium latum\ «De lumbrico lato (mirae longitudinis): squamosus instar serpentis, nisi rectius genicu-latus dicatuus, fotus sui simillimus», что можно перевести как «Широкий червь (удивительно длинный): имеет облик чешуйчатой змеи, за исключением того, что ведущие суставы (узлы) закреплены и поддерживают друг друга». К сожалению, это описание практически не позволяло отличить паразита от других подобных видов, паразитирующих у человека. В последующие годы вплоть до выхода в свет знаменитой Линнеев-ской «Systema Naturae» (Linnaeus, 1758) цестоду описывали под самыми разными названиями, которые, как было принято в те времена, обычно носили описательный характер. К. Линней назвал паразита коротко: Taenia lata - лентец широкий. И всё же своё окончательное место в системе дифиллоботриид данный вид получил только в 1910 г., когда М. Люэ (Ltlhe, 1910) поместил его в род Diphyllobothrium. В итоге в настоящее время к числу синонимов Diphyllobothrium latum относят 54 вида (Делямуре и др., 1985). Повторять их здесь не имеет смысла.
Литература, посвящённая Diphyllobothrium latum, необычайно обширна, что вполне объяснимо, учитывая медицинское, ветеринарное и социально-экономическое значение данного гельминта. Упомянуть здесь даже малую толику того, что опубликовано, - а это многие сотни статей, десятки монографий, - практически невозможно, да в этом и нет особой необходимости. Подробная история открытия и многочисленных описаний D. latum, начиная с 1592 г., изложена в монографии Д. Гроува (Grove, 1990). Детальное описание морфологии и анатомии паразита можно найти в статье Р. Рауша и Д. Хил-лярда (Rausch, Hilliard, 1970) (доступно: http://digitalcommons.unl.edu/ parasitologyfac-pubs/551). Материалы этой статьи в своё время вошли в монографию С. Л. Делямуре с соавт. (1985), с содержанием которой можно ознакомиться на сайте «lekmed.ru». Монография А. М. Сердюкова (1979), посвящённая дифиллоботриидам Западной Сибири, содержит, в частности, данные о вариабельности морфо-анатомических характеристик D. latum на личиночной и половозрелой стадиях. Уже в нынешнем столетии опубликованы обзорные работы с результатами тщательнейшего анализа современного состояния изученности D. latum и проблемы заражённости им людей (Dick, 2007; Kuchta et al., 2007,2014; Scholz, Kuchta, 2016; Scholz et al., 2009).
88
еа
Рис. 53 Diphyllobothrium latum\ 1 - маточный членик (на рисунке семенники изображены справа, желточники - слева; gp - половой атриум и пора; оо - оотип; ov - яичник; t - семенники; ut - матка; va - вагина; vit - желточники); 2 -стробила (из: Faust, 1949) --------------------------
vii
Рис. 52 Diphyllobothrium latum, общий вид цестоды (из: Хо-дакова, Плотников, 1968)
-GG — OP
uterus
Ж
vrtellana vitelline dud ootype
Рис. 55 Diphyllobothrium latum, маточный членик (желточники изображены справа, семенники - слева) (из: Muller, 2002)
Рис. 54 Diphyllobothrium latum'. 1 - сколекс; 2 - половая система; 3 - сагиттальный разрез членика (из: Rausch, Hilliard, 1970)
cirrus
genital роге vagina / vas deferens
89
Описание (по разным авторам, в том числе: Сердюков, 1979; Rausch, Hilliard, 1970). Стробила тонкая, прозрачная или полупрозрачная, после фиксации приобретает белый или желтоватый цвет. Молодые черви достигают в длину 2-3, более старые - 10 м и больше при максимальной ширине 14-16 мм. В литературе упоминается обнаружение у человека лентецов длиной до 20 м (Ward, 1895) и даже 28 м (Torres et al., 1993). Известен случай выделения у 42-летнего финна 16 червей, общая длина которых составила 333 м, т.е. средняя длина одного лентеца составила 20.8 м (von Bonsdorff, 1964). Сколекс обычно булавовидный, 2.5 х 1 мм, ботрии глубокие, простираются по всей длине сколекса. Шейка хорошо выражена. Стробила состоит из 3 - 4 тысяч члеников, её края зубчатые. На дорсальной и вентральной поверхностях стробилы имеются продольные бороздки. У разных стробил полностью развитые проглоттиды, т.е. имеющие максимальную ширину, изменчивы по форме, но обычно прямоугольные, у некоторых стробил - трапециевидные. Латеральные края члеников слегка выпуклые, редко прямые или немного вогнутые. У передних члеников ширина значительно превышает их длину, а максимально широкие проглоттиды расположены в последней трети тела (см. рис. 53); к концу тела длина члеников увеличивается, ширина уменьшается и соотношение их величин выглядит как 1:1. Известковые тельца не найдены. Дорсовентральная мускулатура представлена мощными пучками волокон, которые проходят между внутренними органами. Экскреторная система представлена двумя продольными каналами в мозговой паренхиме и 7 - 11 мелкими - в корковой. Пламенные клетки состоят из 50 - 80 близко расположенных жгутиков, отходящих от общей базальной пластины.
Половой атриум расположен медианно в передней пятой или четвёртой части членика и окаймлён сосочками высотой 15-19 цт. Половое отверстие открывается на приподнятой, покрытой сосочками зоне, простирающейся от передней границы членика назад за маточное отверстие, расположенное позади половой поры. Бурса цирруса толстостенная, в зависимости от степени сжатия от субсферической до вытянуто-яйцевидной или грушевидной формы. Величина бурсы зависит от размеров членика, но в одной и той же стробиле изменчивость этой величины небольшая. Размеры бурсы, приводимые разными авторами, укладываются в пределы 0.375 - 0.840 х 0.245 - 0.460 мм. Семенной пузырёк размером 0.172 - 0.357 х 0.130 -0.233 мм с толщиной стенок 20-57 щл, находится позади проксимального конца бурсы цирруса, его длинная ось направлена постеро-вентрально. Размеры и форма семенного пузырька зависят от объёма его содержимого. Семенники многочисленные, расположены в один слой в латеральных полях, слегка покрывают дорсальные доли яичника, изредка сливаются у передней и задней границ членика. Количество семенников изменчиво, по этой причине данный признак нельзя считать пригодным для таксономического различия на уровне вида.
Слабо извитая вагина тянется вентральнее матки, доходит до бурсы цирруса, резко поворачивает, проходит под ней и впадает в половой атриум. На всём протяжении (кроме дистального конца) вагина тонкостенная, но в расширенном проксимальном участке (семяприемник) имеется слой мышечных волокон. Яичник сетчатый, состоит из двух одинаковых крылообразных долей, соединённых узкой перемычкой, и занимает среднюю треть ширины членика у его задней границы. Задние участки долей яичника расходятся, окружая железу Мелиса, и часто немного заходят в следующий членик. Желточные фолликулы расположены в раздельных
90
латеральных полях вентрально и дорсально, часто перекрывают концы маточных петель и боковые края яичника, изредка сливаются у переднего края членика. Зрелая матка обычно заходит за уровень заднего отдела бурсы цирруса, образует 6-11 петель. Метратерм толстостенный, с многочисленными железистыми клетками. Яйца овальные, желтовато-коричневатого цвета, оболочка двухконтурная; на одном полюсе яйца имеется крышечка, на противоположном - маленький бугорок. Как и у всех Diphyllobothrium, размеры яиц у D. latum сильно варьируют (табл. 1). При откладке яйца недоразвиты.
Таблица 1 Размеры яиц Diphyllobothrium latum (в pm), по данным разных авторов
| Длина | Ширина | Автор публикации |
50-70 35-45 Ward, 1895
62 - 76 (в среднем 67) 42-51 (46) Rausch, Hilliard, 1970
49 - 82 (64) 37 - 50 (43) Делямуре и др., 1985
70 50 Bouchet et al., 1995 (в копролитах)
67-71 40-51 Bowman et al., 2002
58-76 40-51 Santos, Faro, 2005
64.2-74.1 (67.9 ±4.3) 44.5-49.4(46.9 ±2.1) Lou et al., 2007
Жизненный цикл D. latum типичен для дифиллоботриид (рис. 31, 56).
Рис. 56 Схема жизненного цикла Diphyllobothrium latum'. 1 - дефинитивные хозяева (человек, плотоядные млекопитающие); 2 - первый промежуточный хозяин (ракообразные - циклопи-ды, каляниды); 3 - второй промежуточный хозяин (планктоноядные рыбы); 4 - паратонический хозяин (крупные хищные рыбы) (из: Делямуре и др., 1985)
Яйца D. latum выводятся из организма хозяина с его испражнениями и для дальнейшего развития должны попасть в воду. Ежесуточная продуктивность цестоды достигает 1 млн. яиц. Яйца лентецов при
температуре не выше 10°С сохраняют жизнеспособность в воде не менее 2-х лет, в
почве на поверхности погибают на 3-и сутки, а в выгребных ямах сохраняются до 14 суток (www.eurolab.ua). В воде в яйце в течение 10 - 14 дней развивается шарообразная, покрытая ресничками личинка - корацидий, обладающий 3 парами крючьев (Dick, 2007). Покинув яйцо, корацидий в течение некоторого времени плавает в воде при помощи ресничек. Эта свободноплавающая личинка в течение 12 ч должна быть проглочена первым промежуточным хозяином, в качестве какового называют около 40 видов мелких пресноводных рачков. Корацидии заглатываются, прежде всего, циклопами Cyclops, Diaptomus, в организме которых онкосфера по
91
кидает оболочку и с помощью крючьев проникает в полость их тела, где спустя полторы - три недели формируется процеркоид размером около 0.5 мм. В теле одного рачка иногда локализуется до 20 процеркоидов. Питающиеся планктоном рыбы, как правило, это - мелкоразмерные рыбы-планктофаги или же молодь хищных рыб, вместе с пищей получают и личинок цестоды, которые пробуравливают стенку их кишечника и проникают в мышцы и/или внутренние органы, где за 3 - 5 недель формируется следующая стадия паразита - плероцеркоид. Более крупные хищные рыбы, такие как налим, форель, судак, щука, вместе с пищей - рыбами-планктофагами заглатывают и плероцеркоиды лентеца, которые постепенно накапливаются в их организме. Экстенсивность и интенсивность заражения таких хозяев может быть очень высокой.
Тело плероцеркоида D. latum складчатое, длиной 4.5 - 7 см, шириной 3 мм; головной конец не отделён от тела, обычно втянут (рис. 57). Железы проникновения в виде крупных овальных клеток, расположены не только в сколексе, но и в паренхиме тела. У плероцеркоидов хорошо выражена осморегулятор-2 mrn \£-' ’ ная способность: в пресной воде
Х~Т\ у- ' * Л при температуре +16... 18°С паразит
Д 4 А Э живёт более 24 ч.
к 'Ад ; Рис. 57 Плероцеркоид Diphyllobothrium
: i ; latum из рыбы (из: Muller, 2002)
Попадая в желудочно-кишечный тракт дефинитивного хозяина, личинка прикрепляется к слизистой оболочке начальной части тонкой кишки и превращается сначала в незрелую взрослую особь, а затем - в зрелую, никогда не покидающую тонкий кишечник. От момента попадания плероцеркоида в организм человека и до появления первых яиц обычно проходит 4-6 недель, но этот период может варьировать от 2 недель до 2 лет. В золотистых хомячках этот процесс завершался за 13 -17 суток (Сердюков, 1979). При экспериментальном заражении собак самый быстрый рост червей наблюдался с 6 по 15-й день после заражения, а первые яйца цестоды обнаружились в фекалиях животных между 18 и 20-м днями (Wardle, Green, 1941). В некоторых собаках через 30 дней после заражения черви достигли полутораметровой длины.
Весь цикл развития цестоды - от яйца и до яйца - занимает 15-25 недель, а продолжительность её жизни может достигать 20-ти и даже 25 лет (Leiper, 1936).
Окончательные хозяева D. latum - человек и домашние, а также дикие млекопитающие, в чей пищевой рацион входит рыба. В разных регионах паразит отмечен у собак, кошек, свиней, волков, лисиц, медведей, песца, енотовидной собаки, енота и других. К примеру, в европейской части Российской Федерации лентеца отмечают как у бродячих собак городской популяции, так и у собак, постоянно проживающих в городских квартирах (Крючкова и др., 2011). Так, в посёлке Са-меть на побережье Костромского разлива Горьковского водохранилища яйца лентеца были выявлены у 50 % собак (Новак, 2011). В Белорусском Полесье паразита зарегистрировали у 10 % обследованных особей волка (Анисимова, 2003).
D. latum - один из наиболее распространённых паразитов человека, который является для него облигатным окончательным хозяином. Заражение им людей было известно ещё в доисторические времена, о чём свидетельствуют находки яиц этого
92
гельминта при палеопаразитологических исследованиях. Впервые подобную информацию опубликовал Л. Шидат (Szidat, 1944), описавший яйца D. latum в материале из Австрии, датируемом 1500 годом до н.э. В последующем подобные находки были сделаны и в других странах, например, в Бельгии, Германии, Израиле, Норвегии, Франции (см. обзорную работу: Scianto et al., 2009). Учитывая особенности жизненного цикла D. latum, вполне резонно предположить, что история заражения человека лентецом широким берёт своё начало с того самого времени, когда сырая или полусырая рыба впервые появилась в его рационе. В настоящее время в мире количество людей, заражённых лентецом широким, оценивается в 10-20 млн. человек (Scholz, Kuchta, 2016).
Вполне естественно, что первые сообщения о заражении человека D. latum опубликованы в Европе. Вплоть до 1758 г., как подчёркивалось выше, паразита описывали под самыми разными названиями, с 1758 по 1910 гг. - как Taenia lata, и только с 1910 г. практически все исследователи, за редким исключением, стали упоминать паразита под его нынешним названием - Diphyllobothrium latum. Проанализировать все работы, в которых так или иначе комментируются случаи заражения европейцев лентецом широким, практически невозможно (их многие сотни), а если перечислять страны, в которых они когда-либо регистрировались, то перед нами будет практически вся карта Европы (см.: Делямуре и др., 1985). Ещё в прошлом столетии крупные очаги дифиллоботриоза существовали в Финляндии, Швеции, на севере Франции, в Швейцарии, Дании, Румынии, Италии, Германии, на севере европейской части России. За последние 20 лет в Европе, особенно в её северных и восточных регионах (Латвии, Литве, Эстонии), наблюдается снижение уровня заражённости людей лентецом широким. В Финляндии, к примеру, где количество официально фиксируемых случаев инвазии людей было очень высоким (von Bonsdorff, 1964), к настоящему времени регистрируется не более 20 случаев в год (Scholz et al., 2009). Однако в субальпийских регионах Швейцарии, Франции и Италии, напротив, отмечается даже их рост. С 1987 по 2008 гг. вокруг озёр Женевское, Муртенское, Бильское, Лаго-Маджоре, Комо, Изео, Гарда было зафиксировано 530 случаев заражения человека D. latum, что связано с возросшим среди туристов спросом в местных ресторанчиках на блюда из сырой рыбы, в частности окуня (Scholz et al., 2009). В некоторых странах, таких как Австрия, Испания, Нидерланды, Чехия, которых ранее рассматривали свободными от дйфиллоботриозиса, с начала 2000-х годов регистрируются отдельные случаи, связанные с употреблением в пищу сырой импортируемой рыбы (Scholz et al., 2009).
В Украине очаги дифиллоботриоза всё ещё отмечаются в нижнем течении рек Днепр, Дунай, в зоне днепровских водохранилищ, т.е. в местах, где рыба постоянно присутствует в меню местного населения (Садовниченко, 2015). В Молдове единичные случаи заражения людей приурочены к низовьям Прута и Днестра.
Если в странах Европы заражение человека £>. latum официально фиксируют с 16 века, то в Северной Америке - только с начала 20-го. Предполагается, что в восточные регионы США паразит попал с иммигрантами из Северной Европы (Magath, 1929), а первый автохтонный случай заражения человека - ребёнка, родившегося в Миннесоте, - описан в 1906 г. (Nickerson, 1906). В настоящее время инвазия людей встречается в ряде штатов на востоке США, особенно в районе Великих озёр, в Канаде (Манитоба, Саскачеван) и на Аляске. На Аляске D. latum - один из наиболее распространённых паразитов эскимосов, особенно на западе полуострова,
93
где рыба занимает основное место в пищевом рационе местного населения (Rausch, Hilliard, 1970). Широкому распространению цестоды в этом регионе способствует также обычная практика местных жителей сбрасывать фекалии в ручьи и небольшие водоёмы. Аляску относят к числу эндемичных по дифиллоботриозису регионов, хотя и не исключено, что паразит мог попасть сюда в конце 18 столетия (Rausch, Hilliard, 1970).
В странах Центральной и Южной Америки случаи инвазии человека D. latum известны на Кубе, в Венесуэле, Чили, Аргентине, Бразилии (помимо названного вида в этих странах у людей регистрируют и других представителей дифилло-ботриид). Полагают, что в Южную Америку паразит был завезён в 20-м столетии иммигрантами и туристами из Европы (Neghme et al., 1950; Semenas, Ubeda, 1997; Torres et al., 1993, 2012).
Единственная работа, в которой упоминается находка D. latum у человека на Кубе, датируется 1990-м годом (Bouza Suarez et al., 1990), а в Венесуэле - 1953-м (Vogelsang, Potenza, 1953).
В Чили первый случай заражения человека описан в 1950 г. (Neghme et al., 1950), а в 1980-е годы заражённость местного населения варьировала в пределах 3.5 - 4 % (Donoso-Scroppo et al., 1986; Torres, 1982). Исследователи как-то проанализировали историю 15 случаев, задокументированных в стране в 1981 - 1992 гг. (Torres et al., 1993). Так, у одного пациента после лечения никлозамидом выделилось 5 сколексов и 28-метровая (!) стробила, у 5 - по одному червю длиной от 2.9 до 11 м, а у 9 - только яйца. Из 15 пациентов 13 человек - жители юга Чили, где отмечается высокая заражённость лососёвых плероцеркоидами D. latum, а местное население традиционно употребляет в пищу копчёную или сырую рыбу.
В Бразилии заражение человека D. latum впервые зафиксировали уже в нынешнем столетии. В 2004 г. инвазию обнаружили у 29-летней женщины, жительницы г. Салвадор, единственным возможным источником заражения которой было sushi, купленное в одном из супермаркетов (Santos, Faro, 2005). Т. Дик (Dick, 2007) в своей обзорной монографии ссылается на работы бразильских исследователей (напр., Emmel et al., 2006), согласно которым в 2005 г. в Бразилии было отмечено 48 случаев заражения людей в результате употребления в пищу сырой рыбы, используемой для приготовления sushi и sashimi.
В Аргентине, по мнению медицинских паразитологов, заражение людей D. latum носит случайный характер (Semenas et al., 2001). Первая публикация на эту тему датируется 1913-м годом (Cortelezzi, 1913), в которой сообщается о находке в 1911 г. паразита у молодой русской иммигрантки, прибывшей в Аргентину. В следующей публикации (Malamud et al., 1940) также описывается инвазия иммигрантов из Европы. Первое же сообщение о заражении местного жителя - им оказался 20-летний молодой человек - появилось только в 1983 г. (Garaguso, 1983). С 1986 по 1995 гг. в стране зафиксировали 13 аналогичных случаев, из числа которых 10 -в Андо-Патагонском регионе (Semenas, Ubeda, 1997). Любопытные сведения содержит последняя из цитируемых статей. Из 10 пациентов 8 были местными жителями (в том числе 2 чилийца, 1 югослав и 5 аргентинцев) и 2 приезжих (оба - аргентинцы). У 6 пацентов наблюдался спонтанный выход цестод, а у 4-х инвазию выявили по результатам копрологического анализа.
В странах Азии заражение людей D. latum носит спорадический характер, а картина распространения выявленных случаев выглядит довольно пёстрой. К при
94
меру, единственная информация о находке D. latum у человека в Пакистане содержится в статье, опубликованной ещё в 1980-е годы (Bilqees et al., 1984). В Индии первое заражение человека D. latum было зафиксировано только в конце 20-го столетия (Panchratnam et al., 1998), а в последующие годы описано несколько случаев инвазии детей (Kumar et al., 2003; Ramana et al., 2011; Sheela Devi et al., 2007). В одном из них обнаруженные в стуле 9-летней девочки яйца (размером 75 х 40 pm) и фрагменты цестоды определили как Diphyllobothrium spp. (Ramana et al., 2011). Поскольку инвазированные дети не выезжали за пределы страны, то их заражение явно носит местный характер.
В Саудовской Аравии заражение человека лентецом широким впервые обнаружили в 2006 г. (Alkhalife et al., 2006). Как выяснилось, пострадавший, 38-летний мужчина, вернулся из длительной поездки по странам Европы и Юго-Восточной Азии, где, скорее всего, и мог заразиться.
В Корее инвазию человека лентецом широким впервые выявили ещё в начале 20-го столетия на основании обнаружения яиц паразита в фекалиях двух жителей на юге страны (Kojima, Ко, 1919), а взрослого червя впервые выделили в 1971 г. (Cho et al., 1971). С 1971 по 2007 гг. количество подобных случаев возросло до 41 (Lee Е. et al., 2007), а к 2012 г. — до 48 (Kim Н. et al., 2014). Недавно к ним добавился ещё один аналогичный случай (Lee S. et al., 2015). На этот раз у 10-летнего мальчика самопроизвольно выделился кусок стробилы длиной 85 см, без сколекса и шейки, который родители принесли для «опознания» в детскую клинику. Выяснилось, в течение 6 месяцев ребёнок страдал от периодической тупой боли в нижней части живота, которая после дефекации исчезала на 2 - 3 дня; при этом стул был водянистым. Эти неприятные симптомы проявились у ребёнка спустя 2 месяца после употребления в пищу сырого окуня, а ещё через 3 месяца в его фекалиях обнаружилось несколько беловатых, похожих на лапшу образований, но родители тогда не стали обращаться к врачу. Доставленный в клинику фрагмент стробилы определили как принадлежащий D. latum, а мальчику в качестве лечебно-профилактического препарата прописали празиквантел в дозе 15 мг • кг'1. Небольшая ремарка: молекулярно-генетический анализ цестод от человека, собранных в последние годы в Корее, показал ошибочность их определения как D. latum, в действительности эти цестоды относились к D. nihonkaiense (см. стр. 100).
В Китае с 1927 по 2012 гг. официально было известно всего 12 случаев заражения людей лентецом широким, причём принадлежность к D. latum цестод, обнаруженных в последние годы, была подтверждена результатами их молекулярногенетического анализа (Guo et al., 2012).
На Тайване инвазию человека D. latum впервые зарегистрировали в 1964 г. у 2 местных жителей из 141 (цит. по: Lou et al., 2007). Второй случай имел место спустя 40 лет (Chou et al., 2006). На этот раз пациентом оказался 8-летний мальчик, жаловавшийся на выход из ануса при дефекации каких-то образований; при этом в течение года у него наблюдались умеренные абдоминальные спазмы. После двух доз празиквантела у ребёнка вышли фрагменты цестоды общей длиной 183 см. И, наконец, последний случай был описан 10 лет назад (Lou et al., 2007): у 30-летнего мужчины после 3-дневного курса приёма празиквантела вышли проглоттиды общей длиной 196 см.
В Малайзии первая подобная находка описана в 2002 г.: инвазию выявили у 62-летнего китайца - любителя sushi (Rohela et al., 2002). Второй случай имел место
95
в 2006-м году, на этот раз инвазия обнаружилась у 37-летнего китайца, такого же любителя сырой рыбы (Rohela et al., 2006). В обоих случаях пациенты были вылечены разовой дозой празиквантела. Обнаружение в субтропической Малайзии D. latum, которого считали приуроченным исключительно к странам с умеренным и холодным климатом, наводит на определённые размышления о возможности обнаружения этого гельминта и в других странах данного региона (Wiwanitkit S., Wiwa-nitkit S., 2016).
В Японии до недавнего времени D. latum рассматривали как одного из наиболее распространённых возбудителей дифиллоботриозиса, что вызывало некоторое недоумение, учитывая, что этот вид является типично пресноводным паразитом, а японцы употребляют в пищу в основном морскую и солоноватоводную рыбу. В настоящее время принято считать, что возбудителями дифиллоботриозиса в стране являются D. cameroni, D. hians, D. nihonkaiense, D. orcini, D. pacificum, D. scoticum, D. stemmacephalum (-yonagoense) и, под вопросом, D. latum (Yamane, Shiwaki, 2003).
Сообщения о возможной встречаемости D. latum в Африке и Австралии сомнительны и требуют проверки (Scholz, Kuchta, 2016).
На территории России «очаги дифиллоботриоза известны в районах Финского залива, Ладожского, Онежского, Псковско-Чудского озер, в бассейне рек Печоры, Северной Двины, Волги, Немана, Оби, Енисея, Лены. Высока заболеваемость дифиллоботриозом в Карелии, Архангельской и Пермской областях, Поволжье, на севере Сибири, Якутии, в Прибайкалье, на Дальнем Востоке, Сахалине» (Поляков и др., 2007; стр. 108). Цитируемые авторы приводят цифры, иллюстрирующие заражённость в 1998 г. местного населения в наиболее неблагополучных регионах: Эвенкийский АО (548.8 на 100 000 населения), республика Якутия-Саха (379.8), Таймырский АО (343.7), Ямало-Ненецкий АО (315.8), республика Хакасия (307.4).
В. К. Ястребов (2013), проанализировав распространение и структуру очагов дифиллоботриозиса, вызываемого в Сибири и на Дальнем Востоке D. latum, пришёл к выводу, что они являются антропическими. В частности, он пишет: «Степень эпидемиологической напряженности очагов дифиллоботриоза возрастает по направлению к северу и достигает максимальных показателей в Ханты-Мансийском АО. С продвижением к северу, вниз по течению рек Обь, Надым, Пур, Таз, к побережью Обской и Тазовской губ дифиллоботриоз у населения встречается реже. Аналогичное явление отмечено и на Таймыре. Объясняется оно тем, что в уловах рыбы и в питании населения в районах низовьев рек, побережий губ и морских заливов преобладают сиговые рыбы, не зараженные плероцеркоидами лентеца широкого» (Ястребов, 2013; стр. 29).
На юге Западной Сибири, в частности в Алтайском крае и на территориях, прилегающих к Казахстану, этот биогельминтоз достоверно не установлен (Сердюков, 1979; Ястребов, 2013).
В течение длительного времени полагали, что основным возбудителем дифиллоботриозиса местных жителей тихоокеанского бассейна Дальнего Востока России, в том числе северо-востока страны, является лентец широкий. В дальнейшем было установлено, что в данном регионе эту роль играет другой представитель Diphyllobothrium - D. klebanobskii Muratov et Posokhov, 1988, впоследствии сведённый в синоним D. nihonkaiense (Arizono et al., 2009).
96
В кишечнике человека обычно обитает одна, иногда несколько особей лентеца широкого, однако известны случаи паразитирования и большего кличества гельминтов. А. М. Сердюков (1979), к примеру, приводит информацию о заражённости местных жителей одного из районов Ханты-Мансийского АО. Средний показатель интенсивности инвазии дегельминтизированной группы составил 74 цестоды на одного человека, при этом 1 экз. лентеца был выявлен у 1 человека, 2-10 экз. - у 9-ти, 11-30 экз. - у 13-ти, 31-100 экз. - у 13-ти и 101 - 1003 экз. - у 6 человек. Иными словами, речь идёт о возможности обнаружения у сильно заражённого человека нескольких сотен особей D. latum.
Лентец широкий оказывает на организм своего хозяина механическое, токсико-аллергическое и нервно-рефлекторное воздействие, приводит к возникновению гипо- и авитаминозов (Поляков и др., 2007; Ходакова, Плотников, 1967). Механическое воздействие связано с тем, что многометровая стробила препятствует нормальному передвижению перевариваемой пищи по кишечнику, вплоть до его непроходимости, а щелевидные ботрии при фиксации цестоды ущемляют слизистую оболочку тонкой кишки. Токсико-аллергическое воздействие проявляется в сенсибилизации организма человека продуктами обмена паразита, что ведёт к развитию аллергии, одним из проявлений которой является эозинофилия крови, а также приводит к угнетению нормальной флоры кишечника и в конечном итоге к развитию дефицита витамина В12. Нервно-рефлекторные влияния возникают из-за раздражения лентецом нервных элементов стенки кишечника, что способствует изменению функций желудка и других органов, в которых эти цестоды не поселяются.
У многих инвазированных людей заболевание протекает без выраженных симптомов, у некоторых отмечается стёртая форма заболевания, клиника которого сводится в основном к повышению или понижению аппетита (Поляков и др., 2007). Однако у отдельных пациентов могут наблюдаться обильное слюноотделение, тошнота, рвота, урчание, вздутие живота, диарея, абдоминальные спазматические боли, парестезия, при пальпации живота возможна болезненность. Иногда на коже появляется крапивница, в отдельныех случаях наблюдаются эпилептиформные судороги, обтурационный илеус. Больные жалуются на слабость и головокружение, сонливость и снижение работоспособности. Параллельно начинают проявляться признаки В ^-дефицитной, или пернициозной, анемии (megaloblastic anemia) (устаревшее название - злокачественное малокровие) (Поляков и др., 2007; Ходакова, Плотников, 1967; Donoso-Scroppo et al., 1986; Nyberg et al., 1961; Osorio et al., 1974). Особенно чувствительны к этому заболеванию костный мозг и ткани нервной системы. У пациентов появляются боль и парестезия в языке, в тяжёлых случаях -глоссит Хантера с формированием ярко-красных, болезненных пятен и трещин на языке с последующей атрофией сосочков языка (язык становится блестящим и гладким, так называемый «лакированный» язык), иногда эти изменения распространяются на дёсны, слизистые оболочки щёк, нёба, глотки, пищевода. Наблюдаются тахикардия, систолический шум, гипотензия.
Лабораторные признаки В12-дефицитной анемии: снижение количества эритроцитов и гемоглобина при высоком цветовом показателе, относительный лимфоцитоз и нейтропения при ускоренной СОЭ, Наличие в мазках крови мегалобластов, телец Жоли, колец Кэбота, полихроматофильных эритроцитов и эритроцитов с базофильной зернистостью (Баранова, Лесина, 2008). Чаще встречаются лёг-
97
кие формы анемии: уровни гемоглобина и эритроцитов находятся в норме, но эритрометрия показывает наличие макро- и мегалоцитоза.
Диагноз ставится на основании обнаружения в стуле больного яиц и/или фрагментов стробилы лентеца широкого. При постановке диагноза особое внимание следует обращать на эпидемиологические, анамнестические и клинические данные.
Для лечения рекомендуют празиквантел, никлозамид, дозы и курс лечения которыми находятся в компетенции медицинских работников. В народной медицине для изгнания паразита широко используются тыквенные семечки.
Diphyllobothrium nikonkaiense Yamane, Kamo, Bylund et Wikgren, 1986 (=Diphyllobothrium klebanovskii Muratov et Posokhov, 1988) (рис. 58, 59).
Рис. 59 Diphyllobothrium nihonkaiense'. 1 - сколекс, латерально и вентрально; 2 -яйцо; 3 - половозрелый членик (из: Муратов, Посохов, 1988, как Diphyllobothrium klebanovskii)
Рис. 58 Diphyllobothrium nihonkaiense, сагиттальный разрез зрелого членика (С - циррус; CS -бурса цирруса; SV - семенной пузырёк; U - матка) (из: Yamane et al., 1986)
0,5 мм
Долгие десятилетия, с того самого дня, когда некий исследователь, добровольно проглотил несколько плероцеркоидов из симы, выловленной в реке Тонегава на о. Хонсю, и получил взрослую форму, которую определил как Botriocephalus latus (lijima, 1889), всех лентецов, обнаруживаемых у людей в Японии, описывали как D. latum (=Botriocephalus latus) (Yamane et al., 1986). Однако к началу 1980-х годов на фоне проводимых в Норвегии, Финляндии и на Аляске работ по изучению морфологических, биологических и экологических особенностей «европейского» D. latum назрела необходимость пересмотра таксономического статуса и «японского» D. latum. В результате совместных исследований японских и финских паразитологов на материале из Японии 98
был описан новый для науки вид - D. nihonkaiense. Для получения взрослой формы паразита исследователи ввели в желудок золотистых хомячков плероцеркоидов из симы и горбуши, отловленных в Японии на Хоккайдо, и личинок из щуки, выловленной в озере Пюхяселькя в Финляндии (Yamane et al., 1986). Описывая новый вид, авторы привели результаты детального сравнения его взрослых форм и плероцеркоидов с таковыми европейского D. latum. Последующие биохимические и генетические исследования подтвердили правомочность выделения нового вида, отличного от D. latum (Arizono et al., 2009a; Choi et al., 2015; Wicht et al., 2007,2008a, 2010).
Из-за внешнего морфологического сходства D. nihonkaiense и D. latum для видовой идентификации паразита в последнее десятилетие исследователи широко используют методы молекулярно-генетического анализа (Fang et al., 2015; Go et al., 2015; Jeon et al., 2009; Suzuki et al., 2006; Wicht et al., 2008b; Yamasaki, Kuramochi, 2009; Y6ra et al., 2006).
И. В. Муратов и П. С. Посохов (1988) описали новый вид дифиллоботриид Diphyllobothrium klebanovskii по материалам, полученным при дегельминтизации населения Приамурья и о. Сахалин, а также при экспериментальном заражении золотистых хомяков плероцеркоидами из дальневосточной кеты и горбуши. Н. Аризоно с соавт. (Arizono et al., 2009а) на основании результатов молекулярно-генетического анализа и по совокупности морфологических признаков свели данный вид в синоним D. nihonkaiense, что, судя по публикациям, впоследствии было поддержано большинством исследователей (Серёдкин и др., 2013; Фролова, Фролов, 2013; Scholz, Kuchta, 2016). Некоторые авторы всё же продолжают упоминать D. klebanovskii как самостоятельный вид (напр., Ястребов, 2013).
Описание (по: Yamane et al., 1986). Цестоды из экспериментально заражённого хомячка. Длина тела до 64.5 - 74.1 см, максимальная ширина 2.9 мм. Сколекс шпателевидный, 2.4 - 2.8 х 1.2 — 1.5 мм, на верхушке имеются многочисленные ямки. Ботрии глубокие, простираются на всю длину сколекса. Шейка хорошо развита, 14.4 - 16.8 х 1.16 - 1.28 мм. Стробила мускулистая, состоит из 631 - 665 заострённых члеников. Ширина члеников больше их длины, но ближе к заднему концу их длина увеличивается. У незрелых члеников соотношение длины членика к его ширине выглядит как 1 : 7, у зрелых 1 : 3.5. Закладка половых органов заметна в 117 -120-м члениках, у червей из человека - от 124 до 800-го (Arizono et al., 2009). Половая пора открывается вентрально по срединной линии вблизи переднего края сегмента. Половые папиллы плоские, эллипсоидальные, менее развиты и расположены не столь плотно, как у D. latum. Бурса цирруса овальная, крупная, 0.42 - 0.48 х 0.39 - 0.40 мм, открывается наклонно в половой атриум. Семенной пузырек эллиптический, крупный, 0.25 х 0.19 мм, толстостенный (толщина стенок 0.05 мм), располагается постеро-дорсально по отношению к бурсе цирруса и соединяется с ней под острым углом. Семенники сферические, расположены в один слой в медуллярной паренхиме и покрыты слоем продольной мускулатуры толщиной 5-10 цт. Яичник почкообразный, находится у заднего края членика. Участок матки, содержащий зрелые яйца, образует 6-7 петель по обе стороны от средней линии; последние петли впереди не выходят за передний край полового атриума. Яйца широкоовальные, отношение ширины яйца к его длине 1 : 1.45 ± 0.06 (табл. 2). Оболочка яйца гладкая, с разбросанными мелкими углублениями. Длина I - III эмбриональных крючьев соответственно 11.06, 12.2 и 12.35 цт.
Описание (по: Муратов, Посохов, 1988; цестоды из человека, как Diphyllobothrium klebanovskii). Стробила тонкая, белого цвета, иногда с кремовым или желтоватым оттенком, в передней части узкая, к заднему концу постепенно расши
99
ряющаяся. Длина тела 1.22 - 7.7 м (в среднем 4.338). Общее количество члеников от 1054 до 3426 (2039). Длина шейки 5-37 мм (в среднем 15.1). Сколекс овальный или миндалевидный, 1.2 - 3.5 х 0.65 - 1.35 мм (2.3 х 1.07). Зачатки половых органов появляются в 234 - 1197 членике. Краспедотность выражена слабо. Отношение длины членика к его ширине 1 : 1.6 - 1 : 6. Половые поры открываются в половой атриум, расположенный вентрально в передней трети сегмента. Бурса цирруса продолговатая, 0.49 - 0.63 х 0.38 - 0.45 мм. Семенной пузырёк округлый, диаметром 0.13 - 0.20 мм, располагается дорсально и каудально от бурсы цирруса под острым углом к ней. Яичник состоит из двух долей, соединённых перешейком. Проксимальный отдел матки занимает всю толщу членика между дорсальным и вентральным слоями мускулатуры. С каждой стороны матка формирует 3-6 петель.
Таблица 2 Размеры яиц Diphyllobothrium nihonkaiense (в pm), по данным разных авторов
| Длина | Ширина | Автор публикации |
55.2 ± 1.3 38.2 ± 1.6 Yamane et al., 1986
58 34 Муратов, Посохов, 1988
60 41 Yera et al., 2006
56.68 - 57.82 (57.3±0.6) 43.58-45.42 (44.5±0.9) Wicht et al., 2007
53.2-58.5 35.4-40.2 Wicht et al., 2008b
57.5-65 40-42.5 Shimizu et al., 2008
67.2 ± 3.3 44.9 ±2.4 Fang et al., 2015
Исследователи приводят любопытную информацию об обнаружении в Японии у 6-летнего мальчика аномальной стробилы D. nihonkaiense (Yanagida и др. 2010). Червь состоял из члеников с наклонными передним и задним краями и 4 - 6 комплектами половых органов, расположенных между краями. Морфология цестоды, таким образом, не соответствовала ни одному из описанных видов данного рода, однако молекулярная идентификация на основе ядерных и митохондриальных генов чётко показала их принадлежность к D. nihonkaiense.
Окончательные хозяева D. nihonkaiense - человек, а также медведи чёрный, или барибал, гризли, гималайский, бурый, или обыкновенный, волк, домашняя собака, лисица, иногда свиньи, американская норка (Catalano et al. 2015; Scholz, Kuchta, 2016). Главная роль в диссеминации возбудителя инвазии принадлежит медведям. Например, в Камчатском крае и в Сахалинской области, где D. nihonkaiense является обычным паразитом бурого медведя, в августе - сентябре во время интенсивного питания этих животных идущими на нерест лососями доля экскрементов с яйцами данного вида цестоды у них доходит до 39 % (Серёдкин и др., 2013). В этот период наблюдались максимальные показатели экстенсивности инвазии медведей -55.4 ± 6.7 % при средней интенсивности инвазии 170.2 экз., тогда как в осенне-зимний сезон эти показатели составляли в среднем 8.3 ± 5.63 % и менее 10 цестод соответственно (Ястребов, 2013).
Дополнительные хозяева D. nihonkaiense - лососёвые рыбы, в частности сима, кета, нерка, горбуша, кунджа, таймени обыкновенный и сахалинский, у которых плероцеркоиды локализуются в мускулатуре.
Плероцеркоиды желтовато-белые, с характерным цилиндрическим телом. Длина личинок 6.2 - 10.7, ширина 0.9 - 1.3, толщина 0.6 - 0.8 мм. Максимальная ширина на уровне середины тела, которое постепенно сужается к заднему концу.
100
Головной конец втянут и имеет лабиальный вид, хвост вогнутый. Тегумент с поперечными складками и микротрихиями длиной 2.5-10 цт.
В 1990-е годы группа японских исследователей обнаружила яйца D. nihonkaiense в отложениях 7-го столетия в руинах древних туалетов в префектурах Нара и Ивате (Isobe et al., 1994; Yamane et al., 1994). В настоящее время D. nihonkaiense -второй по частоте встречаемости у человека представитель рода Diphyllobothrium. Многие десятилетия его регистрировали только у жителей Японии (Yamane, Shiwa-ki, 2013; Yamane et al., 1998; Yoshida et al., 1999), да и в настоящее время в этой стране ежегодно выявлется 4-8 подобных случаев (Simizu et al., 2008). Вместе с тем, в свете отмеченной выше синонимизации D. klebanovskii и D. nihonkaiense, ареал вида намного шире, чем это было принято считать. На Дальнем Востоке существуют природные очаги заболевания, вызываемого этим паразитом и приуроченные к опреснённым участкам прибрежных биотопов дальневосточных морей (Ястребов, 2013). Локализация природных очагов в Хабаровском крае согласуется с показателями поражённости местного населения, достигающими максимального уровня у жителей побережья Татарского пролива. Аналогичная ситуация отмечается и в других частях Хабаровского края (Ястребов, 2013).
В последние годы появились сообщения об обнаружении D. nihonkaiense у людей в Корее (Choi et al., 2015; Jeon et al., 2009; Park et al., 2015), Китае (Chenet al., 2014; Zhang et al., 2015), в странах Европы - Франции (Yera et al., 2006), Швейцарии (Simizu et al., 2008; Wicht et al., 2007), а также в Канаде (Wicht et al., 2008b), США (Fang et al., 2015), на Гавайях (Hutchinson et al., 1997), в Новой Зеландии (Yamasaki, Kuramochi, 2009).
Весьма показательна история регистрации этого паразита в Корее. К 2012 г. в стране было зафиксировано 48 случаев заражения людей D. latum (при определении цестод исследователи опирались на их морфологические признаки). Однако анализ нуклеотидных последовательностей митохондриального гена сох! отдельных экземпляров «корейского» D. latum показал, что в действительности эти цестоды относятся к D. nihonkaiense (Jeon et al., 2009). К слову, цитируемые авторы проанализировали весьма солидный материал: 62 экз. цестод, собранных с 1982 по 2007 гг. и определённых как D. latum. X. Ким с соавт. (Kim et al., 2014) описывают ещё 3 случая заражения человека в 2011 - 2013 гг., возбудители которых также относились к названному виду. Учитывая широкое распространение в регионе плероцеркоидов D. nihonkaiense у лососёвых рыб, авторы высказали предположение, что все случая заражения людей в Корее были вызваны данном видом, a D. latum в Корее вообще не встречается. Такого же мнения придерживаются С. Парк с соавт. (Park et al., 2015), проанализировавшие материал по четырём случаям за 1995 -2014 гг. и установившие, что все цестоды относились к D. nihonkaiense.
В Китае с 1927 по 2012 гг. было отмечено 15 случаев дифиллоботриазиса людей, возбудитель которого был определён как D. latum (Chenet al., 2014). Цитируемые авторы перепроверили видовую идентицикацию цестод в 5 случаях, имевших место в 2008 — 2011 г. в Шанхае и Харбине, и выяснили, что в действительности цестоды относятся к D. nihonkaiense.
В 2008 г. появилось сообщение о первом заражении D. nihonkaiense человека в Северной Америке (Wicht et al., 2008b). Пострадавшим оказался турист из Чехии, который во время двухнедельной поездки в Канаду в конце лета - начале осени 2005 г. постоянно ел блюда из сырой или полусырой нерки и других местных
101
лососёвых рыб. По возвращении домой он почувствовал определённые проблемы с пищеварением, на коже ног появилась крапивница, а через 10 дней в стуле обнаружились фрагменты цестоды. В 2015 г. описали находку паразита в штате Вашингтон (тихоокеанское побережье США) у 20-летней местной жительницы, источником инвазии которой стало sushi из тихоокеанского лосося (Fang et al., 2015). Авторы цитируемой публикации полагают, что D. nihonkaiense и раньше был источником заражения людей в США, но его, скорее всего, определяли как D. latum. В обоих выше отмеченных случаях видовую принадлежность цестоды подтверждали результатами молекулярного анализа.
Все факты регистрации D. nihonkaiense у людей в Европе, т. е. далеко за пределами естественного ареала паразита, связаны с употреблением в пищу импортируемых тихоокеанских лососёвых - кеты, симы, горбуши. В частности, исследователи, выполнившие молекулярно-генетический анализ цестод от 23 случаев заражения, имевших место в Швейцарии в 2004 - 2006 гг., установили, что в 2 из них возбудителем был D. nihonkaiense, причём в одном случае заражение было связано с кетой, купленной в супермаркете во Франции (Wicht et al., 2007). Из официальных источников известно, что в последние годы в странах Евросоюза тихоокеанские лососёвые поступают в торговую сеть в больших, чем раньше, объёмах (Che-trick, 2007). Напомню, что рыба поступает в продажу в охлаждённом виде на льду.
В основе же всех официально выявленных случаев заражения людей D. nihonkaiense, не только в Европе, но и во всех остальных странах, лежит употребление в пищу блюд из сырой рыбы, экзотических - для европейцев и традиционных -для жителей тихоокеанского региона (Fang et al., 2015; Go et al., 2015; Hutchinson et al., 1997; Paugam et al., 2009; Simizu et al., 2008; Wicht et al., 2007, 2008b; Yamasaki, Kuramochi, 2009; Yamasaki, et al., 2007; Yera et al., 2006 и др.).
При заражении D. nihonkaiense медицинские работники настоятельно рекомендуют празиквантел per os в разовой дозе 5-10 (Ohnishi, Kato, 2003) или 12 мг • кг'1 (Simizu et al., 2008). Установлено, что D. nihonkaiense более чувствителен к данному препарату, чем D. latum или же Adenocephalus pacificus.
Diphyllobothrium orcini Hatsushika et Shirouzu, 1990. Вид впервые описан по экземплярам от косатки из вод о. Хонсю в Японии (Hatsushika, Shirouzu, 1990). Видовое название цестоды происходит от латинского названия рода хозяев: Orcinus -название рода морских млекопитающих из семейства дельфиновых.
Рис. 60 Diphyllobothrium orcini из человека, Япония: 1 — общий вид стробилы; 2 - зрелые проглоттиды; 3 - сагиттальный разрез на уровне полового отверстия (С - циррус; Со -мужская пора; Cs - бурса цирруса; О - яичник; U - матка; Uc - маточная пора) (из: Kifiine et al., 2000)
102
Описание (по: Hatsushika, Shirouzu, 1990; Kifune et al., 2000; Nakazawa et al., 1992). Довольно крупные цестоды Длина тела 80 - 147 см, максимальная ширина 12 - 22 мм. Длина зрелых члеников меньше их ширины и составляет 1.0 - 2.7 при толщине 1.23 - 2.4 мм. Вокруг полового отверстия имеются заметные папиллы. Половые органы размещаются на срединной линии членика. Семенники располагаются в один слой, средний диаметр семенников 0.14 - 0.16 х 0.09 - 0.11 мм. Бурса цирруса удлинённо-овальная, размерами 0.71 - 0.85 х 0.2 - 0.28 мм, толщина стенки бурсы 10.4 - 37 цт; бурса располагается в членике горизонтально. Семенной пузырёк эллиптический, лежит позади бурсы цирруса, размером 0.46 - 0.58 х 0.15 -0.36 мм, толщина его стенки 27.5 - 86.8 pm. Зрелая матка формирует по 4 - 6 петель с каждой стороны. Яйца эллиптические, размером 66.7 - 70.1 х 46.8 - 57.5 (в среднем 66.9 х 50.2) (Hatsushika, Shirouzu, 1990), 61.2 - 79.1 х 46.4 - 56.6 (68.6 х 50.5) (Nakazawa et al., 1992) или 58.3 - 64.7 х 40.0 - 46.3 (61.3 х 42.0) pm (Kifune et al., 2000). Толщина оболочки яйца, соответственно данным цитируемых авторов, 2.4 - 2.5 (3.2), 1.5- 2.5, 1.0 - 1.8 (1.5) щп. Поверхность яйца с небольшими ямками.
Известно всего два случая регистрации этого гельминта у человека, и оба -в Японии. Первый из них имел место в Иокогаме, где у 39-летнего мужчины самопроизвольно выделилась 80-сантиметровая стробила, но без сколекса (Nakazawa et al., 1992). Второй случай зафиксирован в Касуге, здесь у 25-летнего мужчины спонтанно вышла стробила длиной 147 см, и также без сколекса (Kifune et al., 2000). В обоих случаях источником инвазии людей стала сырая рыба.
Diphyllobothrium scoticum (Rennie et Reid, 1912) Meggitt, 1924 [=Dibothrio-cephalus scoticus Rennie et Reid, 1912; = Dibothriocephalus pygoscelis Rennie et Reid, 1912; = Diphyllobothrium quadratum (Linstow, 1892) sensu Delamure, 1955 (nec Railiet et Henry, 1912)] (рис. 61). Синонимы приведены по работе: Делямуре и др., 1985.
Рис. 61 Diphyllobothrium scoticum от морского леопарда, Антарктика: 1 - сколекс, лате-рально; 2 - половозрелый членик; 3 - поперечный разрез части членика; 4 - сагиттальный разрез членика в области бурсы и вагины (из: Делямуре и др., 1985 - по: Markowski, 1952а)
Описание (по: Markowski, 1952а). Длина стробилы 52 - 130 см, ширина 5 - 18 мм. Размеры эллиптического сколекса 3.5 х 1 мм. Шейка очень короткая.
Проглоттиды широкие и короткие, с выпуклыми латеральными краями. В задней части стробилы членики сужаются, терминальный членик у небольших экземпляров имеет яйцевидную форму. Продольная, поперечная и дорсо-вентральная мускулатура развита хорошо. Толщина слоя продольной мускулатуры, состоящей из
103
многочисленных волокон, собранных в не очень чёткие пучки, 0.15 мм. Экскреторная система представлена 2 каналами в медуллярной паренхиме и 20 - в кортикальной. Половые зачатки имеются уже в первом членике. Мужская пора окружена многочисленными радиально расположенными сосочками. Размеры бурсы цирруса на сагиттальном разрезе 0.23 х 0.14 мм. Семенной пузырёк размером 0.28 х 0.18 мм, толщина стенок 20 pm; расположен на той же оси, что и бурса. На каждой стороне членика по 300 семенников, расположенных в один слой и не сливающихся в передней части членика. Яичник сетчатый. Желточные фолликулы крупные, 0.06 -0.105 мм; сливаются в передней части членика, оставляя свободным пространство вокруг полового отверстия. Маточные отверстия неправильно чередующиеся, находятся в поперечной складке. Терминальная часть матки формирует толстостенный карман, выстланный ворсинчатой тканью. Эта особенность характерна для данного вида. Матка образует более или менее отчётливые петли по 5 - 12 с каждой стороны. Яйца размером 76 - 79 х 56 щи, штифтик имеется.
Взрослые формы паразитируют у леопарда морского и льва южного морского, обитателей антарктических вод. Жизненный цикл паразита не известен.
Единственное сообщение об обнаружении D. scoticum у человека опубликовано 30 лет назад (Fukumoto et al., 1988). Речь идёт о фрагменте стробилы без сколекса, выделившемся у 30-летнего японского моряка после лечения битионолом. По словам пациента, будучи в антарктическом рейсе, он ел сырого криля. Однако даже если тот и был заражён процеркоидами, то те не могли развиться в организме человека в половозрелую форму, поскольку в жизненном цикле паразита обязательно участвует дополнительный хозяин - рыба. Скорее всего, в трапезе моряка присутствовала сырая рыба, заражённая метацестодами. Иными словами, заражение человека D. scoticum носит явно случайный характер, но, тем не менее, данный случай свидетельствует о возможности инвазии людей этим гельминтом.
Diphyllobothrium ursi Rausch, 1954 (=Diphyllobothrium gonodo Yamaguti, 1942) (рис. 62). Описан на материале, собранном в 1952 г. от кадьяка (подвид бурого медведя) (взрослые цестоды) и нерки (плероцеркоиды) на о. Кадьяк, расположенном у южного побережья Аляски (Rausch, 1954). Видовое название происходит от латинского названия рода хозяина: Ursus - медведи. Самостоятельность вида подтверждена молекулярно-генетическим анализом (Yamasaki et al., 2012).
Описание (по: Rausch, 1954). Максимальная длина стробилы 11м, максимальная ширина 23 мм, максимальное количество члеников 1800. У передних сегментов, содержащих яйца, отношение длины к ширине 1 : 8, у более старых - 1 : 1.5. Края стробилы только слегка зазубрены. Сколекс относительно небольшой, мускулистый, изменчивой формы, 1.0 - 1.5 х 1.5 (ширина) х 0.75 мм (толщина). Ботрии простираются по всей длине сколекса. Шейки нет. Участок стробилы, примыкающий к сколексу, шире него. Половая пора в передней половине членика, часто около переднего края, окружена приподнятым участком с сосочковидными выступами. В каждом членике до 1650 семенников изменчивого диаметра, но обычно около 0.150 мм. Семенники обычно расположены в разобщённых латеральных полях или простираются через среднюю линию вперёд к половой поре, но никогда не проходят через среднюю линию позади к яичнику. Бурса цирруса грушевидная, крупная, 1.3 х 0.57 мм, её дистальный конец направлен вперёд; семяизвергательный канал спирально скручен. Семенной пузырёк хорошо развит, сферический, диаметром 0.65 мм, расположен позади дистального конца бурсы цирруса.
104
''"ШЯ
№&£&
/b° 4/*f
•LL
8
ss
ЧР <ЪЙО ОС<А
?tfQ о 9 ° ° о о
' 1
7
да.
10
tfflo a i <3ou0 5^ л л Л л O-
Рис. 62 Diphyllobothrium ursi (1 - 5 - из естественно инвазированного бурого медведя): 1, 2, 4 - зрелый членик; 3 - сколекс; 5 -сагиттальный размер зрелого членика в области половых протоков; 6 -плероцеркоид из нерки; 7 - 10-дневный членик из экспериментально заражённого медведя; 8-61-дневный членик из экспериментально заражённого медведя; 9 - 10 - зрелые членики из человека (из: Rausch, 1954)
Мужская гонопора открывается в передней части дна полового атриума. Яичник сетчатый, расположен у задней границы членика, состоит из двух долей, соединённых посередине узким перешейком. Передние и задние участки долей изменчивы по расположению и степени развития. Вагина проходит от яичника прямо вперёд поверхностно и вентрально почти до половой поры, потом резко поворачивает дорсально и тянется близко к дорсальной стенке членика, затем также резко поворачивает вентрально, проходя параллельно бурсе цирруса к половому синусу, и открывается на его дне непосредственно позади мужской поры. Желточники многочисленные, изменчивые по величине, расположены в латеральных разобщённых полях, которые у переднего края членика иногда сливаются дорсально и вентрально или же только дорсально. Желточники могут покрывать маточные петли, что зависит от степени сжатия членика. Желточные фолликулы своими длинными осями направлены дорсо-вентрально. Зачатки матки заметны в члениках, расположенных на расстоянии 5 мм от сколекса. В зрелых члениках задний участок матки скручен спирально, а передний, содержащий зрелые яйца, формирует по 4 - 8 петель с каждой стороны. Передние петли часто простираются далеко за половое отверстие. Конфигурация матки зависит от степени сокращения членика. Маточная пора открывается на средней линии. Яйца 56 - 69 х 39 - 49 р.т (в среднем 65 х 43).
105
По данным Д. Хиллиярда (Hilliard, 1960), исследовавшего материал от спонтанно инвазированного бурого медведя и экспериментально заражённой большой полярной чайки, яйца D. ursi от янтарного до коричневого цвета, овоидальные, с наибольшим диаметром у полюса с крышечкой, имеющей диаметр 20 щп. Оболочка яйца гладкая, толщиной 1.2 щп. Шов не углублён. Размеры яиц цестод из медведя 51.2 - 74.9 х 36.9 - 47.6, из чайки - 50.0 - 59.5 х 35.7 - 42.8 щп. Корацидий расположен у полюса с крышечкой, его диаметр 36, после вылупления - 46 цш. Эмбриональные крючья длиной 11.8 - 12.9 щп. В пресной воде при 20°С инкубация длится 14 - 19 дней. При этой температуре продолжительность жизни корацидиев составила 8 дней, при 2°С - 27.
D. ursi отличается от лентеца широкого более крупным и массивным сколексом, мускулистой стробилой с относительно прямыми боковыми краями, вследствие чего стробила имеет лентовидный вид, а также наличием вокруг половой поры приподнятой зоны с папиллами.
Окончательные хозяева D. ursi - медведи, в том числе бурый, кадьяк, гризли. Дополнительный хозяин — лососёвые рыбы, прежде всего, нерка. Заражённость рыб может достигать очень высоких показателей. К примеру, 200 смолтов нерки, отловленных на выходе из озера Карлук на Аляске, были заражены плероцеркоидами D. ursi на 100 % и содержали от 1 и более личинок (Rausch, Hilliard, 1970).
Плероцеркоиды располагаются на серозе пилорических придатков, желудка, на печени или селезёнке рыб в мелких цистах (2 - 3.5 х 1 - 2.5 мм). Длина тела извлечённых из цист личинок 5 - 20 мм (по: Rausch, 1954). Сколекс вытянутый, шириной около 1 мм, сбоку овальный до сердцевидного и около 0.5 мм толщины. К переднему и заднему концам тело сужается, иногда уплощено дорсо-вентрально; задний конец тупой. Максимальная ширина на 1 мм выше середины тела. Имеются дорсальные и вентральные срединные бороздки, тегумент со складками или без них. Поверхность тела, включая сколекс, с микротрихиями длиной 8-9 щп. Передние железы хорошо развиты, расположены дорсально или вентрально и соединены тонким перехватом, но не распространяются на шейку. Толщина тегумента 4 - 5, подтегументального слоя 8 щп. Следующая за ней более глубокая зона толщиной 24-30 щи содержит известковые тельца. Мускулатура в паренхиме расположена большими пучками толщиной 30 - 50 щп.
D. ursi — пресноводный паразит, но выживает в морской период жизни лососёвых и, когда рыбы идут на нерест в реки, возвращается вместе с ними, чтобы завершить свой жизненный цикл.
Известно всего несколько случаев заражения людей D. ursi, имевших место на тихоокеанском побережье США и Канады ещё в 1950 - 1970-е годы (Margolis et al., 1973; Rausch, Hilliard, 1970). К примеру, в Британской Колумбии (Канада) у 15-летнего мальчика спонтанно вышел фрагмент стробилы длиной 758 и шириной И мм, в котором насчитывалось 543 членика, и ещё один фрагмент большей длины (авторы не приводят цифр, характеризующих его длину) (Margolis et al., 1973).
Кратко резюмируем изложенное выше. Прежде всего, о видовом составе представителей рода Diphyllobothrium, регистрируемых у человека. Как уже отмечено (см. стр. 65), мнения исследователей и составителей различного рода сводок по данному вопросу расходятся. Во многом это связано с тем, что некоторые виды из числа цитируемых в той или иной работе уже не числятся самостоятельными (как, например, D. giljacicum, D. tungussicum, D. skrjabini - синонимы D. latum или же D. luxi -106
синоним A. pacificus) или рассматриваются как сомнительные (D. glaciate). В итоге пока можно говорить о 14 видах Diphyllobothrium, когда-либо зарегистрированных или отмечаемых и в настоящее время у человека. Из них наиболее распространены три - это, прежде всего, D. latum, а также D. dendriticum и D. nihonkaiense. Среди остальных видов чаще других у человека регуистрируют D. dalliae, D. stemmacephalum и D. ursi. Остальные 8 видов за всю историю наблюдений были отмечены 1 - 3 раза.
Примечательно, что даже изменение видовой принадлежности цестод, ранее регистрируемых в Японии и Корее как D. latum, не отразилось на всеобщем признании того факта, что лентец широкий - наиболее распространённый представитель дифиллоботриид у человека. По разным оценкам, в мире этими гельминтами поражено от 10 до 20 млн. человек (Chai et al., 2005). В частности, на территории России выделено пять крупных районов, очаговых по дифиллоботриозам: Северо-Запад Европейской части России с водными системами бассейнов Балтийского, Белого и Баренцева морей, Волжско-Камский, Обь-Иртышский, Енисейско-Ленский и Дальневосточный районы (Сергиев и др., 2006). В 2006 г., к примеру, в стране было отмечено 13 тыс. случаев инвазии людей D. latum, прежде всего, в Республиках Хакасия и Саха, Вологодской, Калужской, Ярославской, Пермской и Иркутской областях (Баранова, Лесина, 2008).
Виды Diphyllobothrium, регистрируемые у плотоядных животных и человека, вызывают у тех природно-очаговое заболевание, называемое дифиллоботриази-сом, дифиллоботриозисом (diphyllobothriasis, diphyllobothriosis) или дифиллобот-риозом. Самым серьёзным патогеном человека считается D. latum, лентец широкий, инвазия которым может привести к дефициту в организме человека витамина В12 со всеми вытекающими отсюда негативными последствиями.
Заражение человека происходит при употреблении в пищу сырой или недостаточно термически обработанной рыбы, содержащей личинок паразита, на что обращают внимание практически все исследователи, сталкивающиеся с подобными случаями (см., напр., Сердюков, 1979; Arizono et al., 2009b; Chai et al., 2005; Hutchinson et al., 1997; Lee K. et al., 2001; Paugam et al., 2009; Rausch, Hilliard, 1970; Torres et al., 2004; Wicht et al., 2008b; Yamasaki, et al., 2007). К примеру, изучая связь встречаемости двух видов Diphyllobothrium - D. latum и D. dendriticum у местного населения на юге Чили с питанием людей рыбой, исследователи установили, что из пяти видов рыб более всего заражена этими цестодами интродуцированная микижа. В городе Чосуэнко, где 12.5 % населения употребляет в пищу копчёную рыбу, D. latum был обнаружен у 2.8% обследованных жителей, тогда как в Панги-пульи, где только 5.2 % жителей едят копчёную или сырую рыбу, заражение отсутствовало. Одновременное обследование фекалий собак в этих городах выявило их инвазированность лентецами и в Чосуэнко (4.5 %), и в Пангипульи (1.8 %) (Torres et al., 2004).
В разных странах мира сырая рыба, которую, помимо всего прочего, едят и в вовсе необработанном виде, входит в состав самых различных блюд, но суть их одна: рыба в них не подвергается горячей термической обработке. В России, например, в некоторых регионах местное население употребляет в пищу сырую или свежемороженую рыбу в виде так называемой строганины, свежую слегка подсоленную икру щуки или же печень налима. Во всех случаях при наличии плероцеркоидов лентецов в мышечной ткани рыб, в их икре или печени, те представляют
107
реальную угрозу для здоровья человека. В северных регионах страны мелкую, не очищенную от внутренностей рыбу иногда запекают в тесте: в таком пироге гельминты остаются живыми, поскольку за время приготовления подобного блюда температура внутри рыбы не достигает величин, критических для этих личинок. В Финляндии местное население обычно употребляет в пищу присоленное филе рыбы, выдержанное в маринаде в течение 2-3 суток, что также не гарантирует гибели всех паразитов.
В Юго-Восточной Азии среди местного населения с давних времён весьма популярны традиционные для этого региона sushi и sashimi, в латиноамериканских странах - cebiche, tiradito и т.д., основу которых составляет сырая пресноводная или морская рыба, к которой добавляются различные специи. В последние десятилетия во всём мире, и, прежде всего, в европейских и североамериканских странах наблюдается невероятный бум спроса на подобные блюда, что неизбежно влечёт за собой и увеличение числа регистрируемых случаев заражения человека (Schantz, McAuley, 1991). При этом, как мы видели, риск заражения людей возрастает также вследствие поступления в торговую сеть рыбы из эндемичных по ди-филлоботриазису стран тихоокеанского региона Северной и Южной Америки. Следует заметить, что такая рыба доставляется в торговую сеть не в замороженном состоянии, а охлаждённая на льду.
В целях предупреждения возможного заражения при употреблении в пищу рыбы, выловленной в неблагополучном по дифиллоботриозису водоёме, или купленной в торговой точке без соответствующего сертификата, рекомендуется подвергнуть её термической обработке при низких или высоких температурах.
Данные о температурном режиме заморозки рыбы в разных источниках значительно разнятся, что наглядно демонстрируют цифры, приведённые авторами обзорной статьи по трём, патогенным для человека родам дифиллоботриид (Kuchta et al., 2015; стр. 320). Скорее всего, это связано с размерами и массой замораживаемой рыбы, текстурой её мышечной ткани, а также локализацией паразита в теле рыбы и наличием или отсутствием у того цисты. Тем не менее, анализ имеющейся информации показывает, что наиболее оптимальным для обеззараживания рыбы является её заморозка с последующим хранением при температуре -20°С в течение не менее суток. П. П. Софронова (1999) установила, что в морозильной камере бытового холодильника при температуре -12°С плероцеркоиды лентеца широкого в рыбе погибают через 60 ч, т.е. через 2.5 суток.
Обеззараживание рыбы с применением высоких температур также зависит от её массы. К примеру, при жарке распластанных кусочков рыбы толщиной не более 3 - 3.5 см для гибели личинок лентеца широкого достаточно 10 мин, а при толщине порции 4 - 4.5 см требуется уже 20 мин. При варке рыбы её обеззараживание достигается через 15 мин. При названных режимах температура в толще мышц достигает 78 - 86°С, что достаточно для гибели плероцеркоидов (Софронова, 1999).
Растворы соли по-разному действуют на те или иные виды лентецов, особенно если учесть, что среди них есть пресноводные и морские виды. Тем не менее, свежую малосолёную икру щуки, как и других рыб, употреблять в пищу не рекомендуется, т.к. при 5 % посоле плероцеркоиды в ней погибают только через 6 ч (Ходакова, Плотников, 1968). Для посола рыбу рекомедуется выдерживать в 10 -14 % растворе соли в течение 14 - 16 суток.
108
Холодное копчение оставляет паразиту все шансы на выживание: рыба предварительно только присаливается, а температура копчения, по одним данным, составляет 30 - 40°С, по другим, не должна превышать 25 - 26°С. Горячее копчение рыбы осуществляется при более высокой температуре: при непосредственном копчении она составляет около 100°С, причём рыба пропекается насквозь (пареге-kate.narod.ri Технология копчения рыбы).
П. П. Софронова (1999) установила, что при обработке рыбы в микроволновой печи время гибели плероцеркоидов лентеца широкого находится в прямой зависимости от величины порции рыбы. При массе рыбы 400 г находящиеся в ней цестоды погибают уже через 3 мин, 500 г - через 5 мин, 650 - 700 г - через 7 мин, 850 - 900 г - через 10, а 1000 - 1100 г - через 12 мин. В указанном временном интервале температура в глубине мышц достигает 88°С, что является губительным для паразита.
Цитируемая литература
Анисимова Е. И. Формирование гельминтофауны волка (Canis lupus) и лисицы (Vulpes vulpes) в ландшафтных подзонах Беларуси И Изв. НАН Беларуси. Сер. биол. наук. - 2003. - 4. - С. 100 - 107.
Баранова И. П., Лесина О. Н. Гельминтозы и другие паразитарные заболевания. Учебное пособие для врачей (послевузовское профессиональное образование). - Пенза, 2008. - 80 с.
Гаевская А. В., Ковалёва А.А. Справочник основных болезней и паразитов промысловых рыб Атлантического океана. - Калининград: Кн изд-во, 1991. - С. 141.
Делямуре С. Л. Гельминтофауна морских млекопитающих в свете их экологии и филогении. - М.: Изд-во АН СССР, 1955. - 517 с.
Делямуре С. Л. Находка Diphyllobothrium stemmacephalum (Cobbold) в водах Советского Союза И Паразитология. - 1968.-2, 4. - С. 317-321.
Делямуре С. Л. Diphyllobothrium ponticum nov. sp. - новая дифиллоботриида от афалины (Tursiops trin-catus Montagu) / Сборник работ по гельминтологии. - М., 1971. - С. 123- 125.
Делямуре С. Л., Скрябин А. С,, Сердюков А. М. Дифиллоботрииды - ленточные гельминты человека, млекопитающих и птиц. - Отв. ред. В. Е. Судариков. // Основы цестодологии. - М.: Наука, 1985. -11.-200 с.
Джингарадзе К. А., Близнюк Я. И. Применение фенасала при дифиллоботриозе у афалин / Изучение, охрана и рациональное использование морских млекопитающих: Тез. докл. 8-го Всесоюз. совещания (Астрахань, 1982). - 1982. - С. 111 - 112.
Жуков Е. В. Паразитофауна рыб Чукотки. Сообщение II. Эндопаразитические черви морских и пресноводных рыб И Паразитол. сб. ЗИН АН СССР. - 1963. - 21. - С. 96 - 139.
Крючкова Е. Н., Петров Ю. Ф. Шахбиев X. X. Гельминтофауна у домашних и диких плотоядных животных в европейской части Российской федерации // Ветеринария Кубани. - 2011. - № 4. -С. 18-21.
Кутырев И. А. Морфофункциональные и иммунологические аспекты взаимоотношений в системе паразит - хозяин: цестоды - рыбы: Дисс.. .докт. биол. наук. - 03.02.11 - паразитология. - М., 2017. -Том 1. - 196 с.
Муратов И, В., Посохов П. С. Возбудитель дифиллоботриоза человека - Diphyllobothrium klebanovskii sp. n. // Паразитология. - 1988. - 22, 2. - С. 165 - 170.
Новак А. И. Особенности распространения Diphyllobothrium latum в популяциях промежуточных и дефинитивных хозяев в северной части Верхневолжского региона И Рос. паразитол. журн. - 2011. -№3.-С. 54-58.
Петров М. И. Новые дифиллоботрииды человека И Мед. паразитол. и паразит, болезни. - 1938. - 7. -С. 407-409.
Поляков В. Е, Иванова И А., Полякова Н Р. Дифиллоботриоз /// Педиатрия. - 2007. - 86, 5. - С. 104 - 108.
Протасова Е. Н, Соколов С. Г., Цейтлин Д. Г., Казаков Б. Е. Diphyllobothrium cordatum (Pseudophyllidea, Diphyllobothriidae) от моржа Чукотского моря // Vestnik zoologii. - 2006. - 40, 2. - Р. 185 - 187.
Садовниченко Ю, А. Класс Ленточные черви (Cestoda). Метод, указ, для самост. внеауд. работы студ. -Харьков: ХНМУ, 2015. - 24 с.
Сергиев В. П, Лобзин Ю. В., Козлов С. С., ред. Паразитарные болезни человека (протозоозы и гельминтозы): Руководство для врачей. - СПб: Фолиант, 2006. - 592 с.
109
Сердюков A. М. Diphyllobothrium dendriticum (Nitzsch, 1824) - паразит человека в Тюменской области И Паразитология. - 1972. - 6, 5. - С. 419 - 425.
Сердюков А. М. Дифиллоботрииды Западной Сибири. - Отв. ред. д. б. н. проф. С. Л. Делямуре. - Новосибирск: Наука, 1979. - 120 с.
Серёдкин И. В., Есаулова Н. В., Коняев С. В. Дифиллоботриоз бурого медведя на Дальнем Востоке России / Паразитология в изменяющемся мире: Мат. V Съезда Паразитол. общества при РАН (23-26.09.2013, Новосибирск). Ред. К. В. Галактионов. - Новосибирск: Гарамонд, 2013. - С. 176.
Софронова П. П. Ветеринарно-санитарная характеристика и оценка рыб, зараженных плероцеркоидами лентеца широкого: Автореф. дисс... канд. вег. наук: 16.00.08 - гигиена животных, продуктов животноводства и ветеринарно-санитарная экспертиза. - С.-Петербург, 1999. - 24 ч.
Талызин Ф. Ф. К вопросу о нахождении Diphyllobothrium cordatum (Leuck.) у населения Вилюйского округа Якутской АССР / Патогенные животные: Тр. Отдела паразитологии ВИЭМ: М., 1936. - 2. -С. 251 -256.
Фролова С. Е„ Фролов Е. В. Межгодовая динамика численности плероцеркоидов Diphyllobothrium nihonkaense у локальных стад горбуши южного Сахалина / Паразитология в изменяющемся мире: Мат. V Съезда Паразитол. общества при РАН (23-26.09.2013, Новосибирск). Ред. К.В. Галактионов. - Новосибирск: Гарамонд, 2013. - С. 205.
Ходакова В. И., Плотников Н Н Глава XX. Дифиллоботриозы И Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: «Медицина», 1968. -С. 493 - 508. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Холодковский Н A. (Cholodkovsky N.A.) Cestodes nouveaus ou peu connus. Troisieme serie // Ежегодн. Зоол. муз. Императ. АН. - 1916. -19. - С. 164-166.
Чижова Т И, Гофман-Кадошников П. Б. Природный очаг дифиллоботриоза на Байкале и его структура И Мед. паразитол. и паразитар. болезни. - 1960. - 29, 2. - С. 687 - 692.
Ястребов В, К Эпидемиология дифиллоботриозов в Сибири и на Дальнем Востоке // Эпидемиология и вакцинопрофилактика. - 2013. - № 5 (72). - С. 25 - 30.
Alkhalife L S., Hassan R К, Abdel-Hameed A, A., Al-Khayal L. A. Diphyllobothriasis in Saudi Arabia П Saudi Med. J. - 2006. - 27, 12. - P. 1901 - 1904.
Andersen К. 1. A redescription of Diphyllobothrium stemmacephalum Cobbold, 1858 with comment on other marine species of Diphyllobothrium Cobbold, 185811 J. Nat. Hist. - 1987. - 21. - P. 411 - 427.
Andersen K, Ching R.t Vik R. A review of freshwater species of Diphyllobothrium with redescriptions and distribution of D. dendriticum (Nitzsch, 1824) and D. ditremum (Creplin, 1825) from North America 11 Ca-nad. J. Zool. - 1987. - 65, 9. - P. 2216 - 2228. 10.1139/z87-336.
Arizono N.t Shedko M.t Yamada M., Uchikawa R. et al. Mitochondrial DNA divergence in populations of the tapeworm Diphyllobothrium nihonkaiense and its phylogenetic relationship with Diphyllobothrium kleba-novskii 11 Parasitol. Int. - 2009a. - 58, 1. - P. 22 - 28.
Arizono N„ Yamada Nakamura-Uchiyama F, Ohnishi K. Diphyllobothriasis associated with eating raw pacific salmon // Emerg. Infect. Dis. - 2009b. - 15, 6. - P. 866 - 870. doi: 10.3201/eidl506.090132.
Bilqees F. M., Khan A., AH N. Diphyllobothrium latum infestation in Karachi - a case report // Pakistan. J. Med. Res. - 1984. - 23, 1. - P. 55 - 57.
Birkun A., Jr. Natural mortality factors affecting cetaceans in the Black Sea I G. Notarbartolo di Sciara (Ed.), Cetaceans of the Mediterranean and Black Seas: state of knowledge and conservation strategies. A report to the ACCOBAMS Secretariat, Monaco, February 2002. - Section 16. - 13 pp.
Bishop L. Parasite-related lesions in a bearded seal, Erignathus barbatus 11 J. Wildl. Dis. - 1979. - 15. - P. 285-293.
Borcea L. L. Sur la presence du cestode: Diphyllobothrium stemmacephalum Cobbold comme parasite chez le marsouin Phocaenaphocaena de la Mer Noire 11 Ann. Sci. Univ. Jassy. - 1935. - 21. - P. 524 - 525.
Bouchet F, Petrequin P., Paicheler J. C., Dommelier S. Premidre approuche pal6oparasitologique du site n£olitique de Chalain(Jura, France) I I Bull. Soc. Path. Exot. - 1995. - 88. - P. 265 - 268.
Bouza Suarez M, Hormilla Manso G, Dumenigo Ripoil B. et al. [The first certain case of Diphyllobothrium latum in Cuba]. Rev Cubana Med Trop. - 1990. - 42, 1. - P. 9 - 12. (in Spanish).
Bowman D. D.t Hendrix С. M, Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-P. 185- 180.
Bylund G. Delimitation and characterization of European Diphyllobothrium species. - Abo Department of Biology. Abo Akademi, 1975. - 116 pp.
Bylund G, Wikgren B. J. P. Linnunmatoja ihmisissa Fagelmaskar i manniskor // Tiedoksianto Information. -1968. - 8.-P. 19-20.
110
Catalano S, Lejeune M.t Tizzani P., Verocai G. G. et al. Helminths of grizzly bears (Ursus arctos) and American black bears (Ursus americanus) in Alberta and British Columbia, Canada 11 Canad. J. Zool. -2015.-93, 10. -P. 765-772. 10.1139/cjz-2015-0063.
Chai J.-Y., Murrell J. D., Lymbery A. J. Fish-borne parasitic zoonoses: status and issues // Int. J. Parasitol. -2005.-35, 11-12.-P. 1233-1254.
ChenS., Ai L., Zhang Y., Chen J. et al. Molecular detection Qi Diphyllobothrium nihonkaiense in humans, China//Emerg. Infect. Dis.-2014.-20, 2.-P. 315-318. 10.3201/eid2002.121889.
ChetrickJ. Sales of premium products to EU drive record U.S. seafood exports. - FAS Worldwide. U.S. Department of Agriculture. http://www.fas.usda.gov/info/fasworldwide/2007/03-2007/EUSeafood.htm.
Cho S. Y., Seo B. S., Ahn J. H. One case report of Diphyllobothrium latum infection in Korea 11 Seoul. J. Med.-1971.-12.-P. 157- 163.
Choi S, Cho J,, Jung B.-K, Kim D.-G. et al. Diphyllobothrium nihonkaiense’, wide egg size variation in 32 molecularly confirmed adult specimens from Korea // Parasitol. Res. - 2015. - 114. - P. 2129 - 2134.
Chou H. F„ Yen С. M., Liang ИС C, Jong Y. J, Diphyllobothriasis latum’, the first child case report in Taiwan I I Kaohsiung. J. Med. Sci. - 2006. - 22, 7. - P. 346 - 351.
Cobbold T. S. Observations on entozoa with notices of several new species // Trans. Linn. Soc. London. -1858.-22, 3.-P. 155- 172.
Cortelezzi E. Loprotozoos у vermes parasites: apuntes de parasitologia. - Talleres Grificos Sese, La Plata, Argentina, 1913. (цит. no: Scholz et al., 2009).
De Marval F., Gottstein B., Weber M., Wicht B. Imported diphyllobothriasis in Switzerland: molecular methods to define a clinical case of Diphyllobothrium infection as Diphyllobothrium dendriticum, August 2010 H Euro Surveill. - 2013. - 18, 3. -P. 31-36: pii=20355.
Dick T. A. 4. Diphyllobothriasis: The Diphyllobothrium latum human infection conundrum and reconciliation with a worldwide zoonoses I Food-borne parasitic zoonoses. Fish- and plant-borne parasites. Eds. D. Murrell, B. Fried. - Springer Sci. + Bussines Media, LLC, 2007. - P. 151 - 184.
Donoso-Scroppo M., Raposo L., Reyes H, Godorecci S, Castillo G. Anemia megalobl&stica secundaria a infeccidn por Diphyllobothrium latum // Rev. M6d. Chile. - 1986. - 114, 12. - P. 1171 - 1174 (in Spanish)
Emmel V. E.t Inamine E., Secchi C, Brodt T. C. et al. [Diphyllobothrium latum’, case report in Brazil] 11 Rev. Soc. Bras. Med. Trop. - 2006. - 39, 1. - P. 82 - 84. (In Portuguese).
Fang F. C„ Billman Z. P., Wallis С. K, Abbott A. N. et al. Human Diphyllobothrium nihonkaiense infection in Washington State H J. Clin. Microbiol. - 2015. - 53, 4. - P. 1355 - 1357.
Faust E. C. Human Helminthology. Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 258 - 268.
Fraser P. G. The occurrence of Diphyllobothrium in trout, with species reference to an outbreak in West of England H J. Helminthol. - 1960. - 34, 1/2. - P. 59 - 72.
Fukumoto S, Maejima J, Yazaki S. et al. The two cases of Diphyllobothrium yonagoense in Kyishu district-revision and identification of previously reported cases // Japan. J. Parasitol. - 1992. - 41, l.-P. 16-32.
Fukumoto S, Yazaki S, Maejima J., Kamo H, et al. The first report of human infection with Diphyllobothrium scoticum (Rennie et Reid, 1912) // Japan. J. Parasitol. - 1988. - 37, 1. - P. 84 - 90.
Garaguso P. Primer caso argentine humano de parasitismo “autdctono” por Diphyllobothrium latum I Congr. Latinoam. Parasitol., 6°. - S&o Paulo, 1983. - Resumenes. - P. 229.
Go Y. B., Lee E. H., Cho J, Choi S, Chai J.-Y. Diphyllobothrium nihonkaiense infections in a family I I Korean J. Parasit. -2015. -53, l.-P. 109-112. DOI: https://doi.org/10.3347/kjp.2015.53.L109.
Grove D. I. A History of Human Helminthology. - CAB Intern., Wallingford, UK, 1990. - P. 397 - 420.
Guo A.-J, Liu K, Gong W., Luo X.-N. et al. Molecular identification of Diphyllobothrium latum and a brief review of diphyllobothriosis in China//Acta Parasitol. - 2012. - 57, 3. -P. 293 - 296.
Hasegawa H., Arakaki T„ Teruya K.t Yamauchi H. Diphyllobothrium yonagoense from a man of Okinawa with special reference to morphological differences due to fixation methods // Japan. J. Parasitol. - 1989. -38. - P. 333 - 338. (In Japanese with English abstract).
Hatsushika R., Okino T. Case study of human infection with a marine species diphyllobothriid tapeworms: morphological variations of strobila due to fixation procedures // Kawasaki Med. J. - 1999. - 25,1. - P. 29 - 38.
Hatsushika R., Shirouzu H. A new species of marine tapeworm, Diphyllobothrium orcini (Cestoda: Pseudophyllidea) found from killer whale, Orcinus orca (Linnaeus, 1758) in Japan // Japan. J. Parasitol. - 1990. -39.-P. 566-573.
Henricson J. The dynamics of infection of Diphyllobothrium dendriticum (Nitzsch) and D. ditremum (Crep-lin) in the char Salvelinus alpinus (L.) in Sweden H J. Fish Biol. - 1977. -11, 3. - P. 231 - 248.
Hernandez-Orts J. S, Scholz T., Brabec J, Kuzmina T., Kuchta R. High morphological plasticity and global geographical distribution of the Pacific broad tapeworm Adenocephalus pacificus (syn. Diphyllobothrium
111
pacificum)'. molecular and morphological survey // Acta Trop. - 2015. - 149. - P. 168 - 178. doi: 10.1016/j. actatropica.2015.05.017.
Hilliard D. K. The effects of low temperatures on larval cestodes and other helminths in fish // J. Parasitol. -1959.-45, 3.-P. 291-294.
Hilliard D. K. Studies on the helminth fauna of Alaska. XXXVIII. The taxonomic significance of eggs and coracidia of some diphyllobothriid cestodes // J. Parasitol. - 1960. - 46, 6. - P. 703 - 716.
Hjima I. The source of Botriocephalus latus in Japan I I Coll. Sci. Tokyo Imp. Univ. - 1889. - 2. - P. 49 - 56.
Isobe A., Hojo Y„ Fukushima T., Shiwaku K. et al. Paleoparasitology of archeological soils in Japan (2) I I Clim. Parasitol. - 1994. - 5. - P. 207 - 209 (in Japanese).
Jeon H K, Kim К. H, Huh S., Chai J. Y, et al. Morphologic and genetic identification of Diphyllobothrium nihonkaiense in Korea // Korean J. Parasitol. - 2009. - 47, 4. - P. 369 - 375. 10.3347/kjp.2009.47.4.369.
Kamo H, Yamane Y., Kawashima К The first record of human infection with Diphyllobothrium earneroni Rausch, 1969 //Japan. J. Trop. Med. Hyg. - 1981. -9. -P. 199-205. DOI: 10.2149/tmhl973.9.199.
Kamo H, Yazaki S, Fukumoto S, Maejima J, Sakaguchi Y. Two unknown marine species of the genus Diphyllobothrium from human cases // Jpn. J. Trop. Med. Hyg. - 1986. -14, 1. - P. 79 - 86.
Kamo H, Yazaki S., Fukumoto S., Fujino T. et al. The first human case infected with Diphyllobothrium hians (Diesing, 1850) // Japan. J. Parasitol. - 1988. - 37, 1. - P. 29 - 35.
Kifune T, Hatsushika R, Ushirogawa H, Takeda S et al. A case study of human infection with diphyllobothriid tapeworm (Cestoda: Pseqdophyllidea) found from a man in Fukuoka prefecture, Japan // Med. Bull. Fukuoka Univ. - 2000. - 27,2. - P. 93 - 100. (in Japanese).
Kim H.-J., Eom К S., Seo M. Three cases of Diphyllobothrium nihonkaiense infection in Korea // Korean J. Parasitol. - 2014. - 52, 6. - P. 673 - 676. doi.org/10.3347/kjp.2014.52.6.673.
Kohn E. Ueber Diphyllobothrium stemmacephalum Cobbold. - Inaug. Diss. Konigsberg, 1912.-30 pp.
Kojima R, Ko T. Researches on intestinal parasites of Koreans in South Keisho-Do: especially on the distribution of liver flukes I I J. Chosun. Med. Assoc. - 1919. - 26. - P. 42 - 86. (in Japanese)
Krabbe H. Helminthologiske UntersOgelser I Danmark og paa Island, med saerligt Hensyn til Blaereormlidel-seme pas Island IIK. Danske Vidensk. Selsk. Sk. Naturv. Og Math. Afd. - 1865. - 7. - P. 347 - 408.
Kuchta R, Brabec J., Kubdtkova P.f Scholz T. Tapeworm Diphyllobothrium dendriticum (Cestoda) - neglected or emerging human parasite? // PLoS Negl. Trop. Dis. - 2013. - 7, 12. - doi: 10.1371/journal. pntd.0002535.
Kuchta R., Esteban J.-G., Brabec J, Scholz T. Misidentification of Diphyllobothrium species related to global fish trade П Eur. Emerg. Inf. Dis. - 2014. - 20. - P. 1955 - 1957.
Kuchta R., Scholz T.9 Brabec J, Narduzzi-Wicht B. 17. Diphyllobothrium, Diplogonoporus, and Spirometra I Biology of food-borne parasites. - Xiau L., Ryan U., Feng Y. eds. - CRC Press, 2015. - P. 299 - 326.
Kuhlow F. Uber die Entwicklung und Anatomie von Diphyllobothrium dendriticum Nitzsch, 1824. - Ztschr. Parasitol. und Tropenmed. - 1953. - 16, 1. - P. 1 - 35.
Kumar C. S, Anand Kumar H, Sunita V., Kapur I. Prevalence of anaemia and worm infestation in school going girls at Gulbarga, Karnataka 11 Indian Pediatr. - 2003. - 40, 1. - P. 70 - 72.
Kumazawa H., Matsuoka R. Diphyllobothrium yonagoense: another case found in Kochi Prefecture, Japan // Parasitol. Int.- 1998.-47, l.-P. 41-45. doi: 10.1016/S. 1383-5768 (97)00051-2.
Lee E. B., Song J. H, Park N. S, Kang В. K. et al. A case of Diphyllobothrium latum infection with a brief review of diphyllobothriasis in the Republic of Korea H Korean J. Parasitol. - 2007. - 45, 3. - P. 219 - 223.
Lee К W., Suhk H. C.t Pai К S, Shin H. J. et al. Diphyllobothrium latum infection after eating domestic salmon flesh // Korean J. Parasitol. - 2001. - 39, 4. - P. 319 - 321.
Lee S. H, Chai J.-Y., Hong S.-T, Sohn W.-M., Choi D.-L A case of Diphyllobothrium yonagoense infection П Seoul J. Med. - 1988. - 29. - P. 391 - 395.
Lee S. H, Park H, Yu S. T. Diphyllobothrium latum infection in a child with recurrent abdominal pain 11 Korean J. Pediatr.-2015.-58, 11.-P. 451 -453. doi: 10.3345/kjp.2015.58.11.451
Leiper R T. Some experiments and observations on the longevity of Diphyllobothrium infections // J. Helminthol. - 1936. - 14, 3. - P. 127 - 130.
Leuckart R. Die menschlichen Parasiten und die von ihnen herrUhrenden Krankheiten. Ein Hand- und Lehr-buch fllr Naturforscher und Aerzte. - Leipzig und Heidelberg: C. F. Winter’s Verlag, 1863. - 1. - 766 pp.
Lou H-Ч., Tsai P.-C, Chang C.-C, Lin Y.-H. et al. A case of human diphyllobothriasis in northern Taiwan after eating raw fish fillets // J. Microbiol., Immunol. & Infect. - 2007. - 40, 5. - P. 452 - 456.
Lithe M. Die Siiswasserfauna Dutschlands. Parasitische Platwurmer. 2. Cestodes. - Jena, 1910. -18. - 153 pp
Maejima J, Yazaki S, Fukumoto S. Comparative studies on egg-sizes and -forms of various Diphyllobothrium species from man in Japan // Jpn. J. Parasitol. - 1991. - 40. - P. 170-176.
112
Maejima J., Yazaki S, Fukumoto S, Kamo H. Scanning electron microscopic observations of flame cell and associated excretory systems in Diphyllobothrium 11 Japan. J. Parasitol. - 1989. - 38, 1. - P. 7 - 16.
Magath T. B. Experimental studies on Diphyllobothrium latum 11 Amer. J. Trop. Med. - 1929. - 9, l.-P. 17 -48.
Malamud T., lussem B.f Barg I. Dos casos de Botriocephalus latus // Prensa Med. Arg. - 1940. - 2. - P. 305 -306.
Margolis L., Rausch R. L., Robertson E. Diphyllobothrium ursi from man in British Columbia - First report of this tapeworm in Canada // Canad. J. Publ. Health. - 1973. - 64, 6. - P. 588 - 589.
Markowski S. The cestodes of pinnipeds in the Arctic and other regions I I J. Helminthol. - 1952. - 26, 4. - P. 171-214.
Markowski S, The cestodes of seals from the Antarctic H Bull. Brit. Mus. (Natur. Hist.). Zool. - 1952a. - 1, 7. -P. 123- 150.
Matz F. Beitrage zur Kenntnis der Bothriocephalen H Arch. Naturgesch. - 1892. -1. - P. 97 - 122.
Meggitt F. J, The cestodes of mammals. - London, 1924. - 282 pp.
Merdvinci A. We inform that the parasites in thirty years (1952 - 1982) 11 J. Turk. Mikrobiol. Soc. - 1983. -13.-P. 1-2.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 65 - 70.
Nakazawa M., Amano T., Oshima T. The first human case of Diphyllobothrium orcini Hatsushika and Shirouzu, 1990 II Japan. J. Parasitol. - 1992. - 39. - P. 679 - 573.
Neghme A., Donckaster R., Silva R. Diphyllobothrium latum en Chile // Rev. M6d. Chile. - 1950. - 78. - P. 410-411.
Nickerson W. S. The broad tapeworm in Minnesota, with the report of a case of infection acquired in the state H J. Amer. Med. Ass. - 1906. - 46. - P. 711 - 713.
Nyberg W., Grasbeck R., Saarni M., Von BonsdorffB. Serum vitamin B12 levels and incidence of tapeworm anemia in a population heavily infected with Diphyllobothrium latum 11 Am. J. Clin. Nutr. - 1961. - 9. - P. 606-612.
Ohnishi K.9 Kato Y. Single low-dose treatment with praziquantel for Diphyllobothrium nihonkaiense infections // Intern. Med. - 2003. - 42. - P. 41 - 43.
Okamura L, Tomita S, Sumida K, Hamada K. [A case of human infection with Diphyllobothrium cordatum (R. Leuckart, 1863) Faust, 1929] H Kumamoto Igakkai Zasshi. - 1972. - 46, 2. - P. 119 - 128 (in Japanese)
Osorio G, Daiber A., Donckaster R, Ubilla M. et al. Severe megaloblastic anemia due to Diphyllobothrium latum. First case identified in Chile // Rev. Med. Chil. - 1974. - 102. - P. 700 - 703. (in Spanish).
Panchratnam S., Jacob E, Kang G. Human diphyllobothriasis: First report from India // Trans. R. Soc. Trop. Med. Hyg. - 1998. - 92, 2. - P. 179 - 180.
Park S. H, Jeon H. K, Kim J. B. Four additional cases of Diphyllobothrium nihonkaiense infection confirmed by analysis of COXI gene in Korea 11 Korean J Parasitol. - 2015.- 53, l.-P. 105 - 108. doi: 10.3347/kjp.2015.53.1.105
Paugam A., Yera H, Poirier P., Lebuisson A., Dupouy-Camet J. Diphyllobothrium nihonkaiense infection: a new risk in relation with the consumption of salmon // Presse M6d. - 2009, - 38. - P. 675 - 677.
Rahkonen R.t Aalto J, Koski P. et al. Cestode larvae Diphyllobothrium dendriticum as a case of heart disease leading to mortality in hatchery-reared sea trout and brown mrout // Dis. Aquat. Org. - 1996, - 25, l.-P. 15-22.
Ramana К V, Rao S, Vinaykumar M., Krishnappa M. et al. Diphyllobothriasis in a nine-year-old child in India: a case report//J. Med. Case Rep. - 2011.-5, l.-P. 332. DOI: 10.1186/1752-1947-5-332.
Rausch R Studies on the helminth fauna of Alaska. XXL Taxonomy, morphological variation, and ecology of Diphyllobothrium ursi n. sp. provis. On Kofiak Island 11 J. Parasitol. - 1954. - 40, 5. - P. 540 - 563.
Rausch R. Studies on the helminth fauna of Alaska. XXVIII. The description and occurrence of Diphyllobothrium dalliae n. sp. (Cestoda) H Trans. Amer. Microsc. Soc. - 1956. - 75. - P. 180-187.
Rausch R. L. Diphyllobothriid cestodes from the Hawaiian monk seal, Monachus schauinslandi Matschie, from Midway Atoll 11 J. Fish. Res. Bd. Canada. - 1969. - 26, 4. - P. 946 - 956.
Rausch R. L. Diphyllobothrium fayi n. sp. (Cestoda: Diphyllobothriidae) from the Pacific Walrus, Odobenus rosmarus divergens // Comp. Parasitol. - 2005. - 72, 2. - P. 129 - 135.
Rausch R L., Adams A. M. Natural transfer of helminths of marine origin to freshwater fishes with observations on the development of Diphyllobothrium alascense 11 J. Parasitol. - 2000. - 86, 2. - P. 319 - 327.
Rausch R. L., Hilliard D. K. Studies on the helminth fauna of Alaska. XLIX. The occurrence of Diphyllobothrium latum (Linnaeus, 1758) (Cestoda: Diphyllobothriidae) in Alaska, with notes on other species П Can. J. Zool. - 1970. - 48, 6. - P. 1201 - 1212.
113
Rausch R. L., Scott E. M., Rausch V. R. Helminths in Eskimos in Western Alaska with particular reference to Diphyllobothrium infection and anaemia // Trans. R. Soc. Trop. Med. Hyg. - 1967. - 61, 3. — P. 351 — 357.
Rausch R. L., Williamson F. S. Studies on the helminth fauna of Alaska. XXXIII. The description and occurrence of Diphyllobothrium alascense n. sp. (Cestoda) // Ztschr. Tropenmed. & Parasitol. - 1958. - 8, 1. - P. 64-72.
Rohela M., Jamaiah I., Chan K. W,t Yusoff W. S. Diphyllobothriasis: the first case report from Malaysia // Southeast Asian J. Trop. Med. Public Health. - 2002. - 33, 2. - P. 229 - 230.
Rohela M., Jamaiah L, Goh К L., Nissapatorn V. A second case of diphyllobothriasis in Malaysia // Southeast Asian J. Trop. Med. Public Health. - 2006. - 37, 5. - P. 896 - 898.
Santos F. L. N., Faro L. B. The first confimed case of Diphyllobothrium latum in Brazil // Mem Inst. Oswal-do Cruz. - 2005. - 100, 6. - P. 685 - 686.
Schantz P. M., McAuley J, Current status of food-borne parasitic zoonoses in the United States // Southeast Asian J. Trop. Med. Public Health. - 1991. - 22, Suppl. - P. 65 - 71.
Scholz T, Garcia H. H., Kuchta R., Wicht B. Update on the human broad tapeworm (genus Diphyllobothrium), including clinical relevance // Clin. Microbiol. Rev. - 2009. - 22,1. - P. 146 - 160.
Scholz T, Kuchta R. Fish-bome, zoonotic cestodes (Diphyllobothrium and relatives) in cold climates. A never-ending story of neglected and (re)-emergeny parasites // Food & Waterborne Parasitol. - 2016. - 4. - P. 23-38. doi: 10.1016/j.fawpar.2016.07.002.
Scianto L., Chame M., Silva C.S.P., Goncalves M.L.C. et al. Animal helminthes in human archeological remains: a review of zoonoses in the past // Rev. Inst. Med. Trop. SSo Paulo. - 2009. - 51, 3. - P. 119— 130.
Scott J. W. Diphyllobothrium cordatum (Leuckart, 1863) in bears of Yellowstone Park, Wyoming // J. Parasitol. - 1932. -19, 2. - P. 162 - 163.
Semenas L., Kreiter A., Urbanski J. New cases of human diphyllobotrhriasis in Patagonia, Argentina // Rev. Saude Publ. - 2001. - 35. - P. 214 - 216.
Semenas L., Ubeda C. Difilobotriais humana en la Patagonia, Argentina // Rev. Saude Publ. - 1997.-31, 3. -P. 302-307. (In Spanish).
Sharp G. J. E, Secombes C. J, Pike A. W. The laboratory maintenance of Diphyllobothrium dendriticum (Nitzsch, 1824) H Parasitology. - 1990. -101.1. - P. 153 - 161.
Sheela Devi C, Shashikala, Srinivasan S, Murmu U. C. et al. A rare case of diphyllobothriasis from Pondicherry, South India I I Indian J. Med. Microbiol. - 2007. - 25, 2. - P. 152- 154.
Shimizu H., Kawakatsu H.t Shimizu T.t Yamada M. et al. Diphyllobothriasis nihonkaiense: possibly acquired in Switzerland from imported Pacific salmon // Intern. Med. - 2008. - 47, 14. - P. 1359 - 1362.
Shults L. M. Helminths of the spotted seal, Phoca largha, from the Bering Sea // J. Wildl. Dis. - 1982. - 18, 1. -P. 59-62.
StunkardH. W. Diphyllobothrium stemmacephalum Cobbold, 1858 and D. latum (Linn., 1758) // J. Parasitol. -1949.-35, 6.-P. 613-624.
Sunagawa К Treatment of diphyllobothriasis latum with filmaron oil administered intraduodenally П Okinawa Med. J. - 1965. -1. - P. 42 - 44.
Suzuki J, Murata R, Yanagawa Y, Araki J. Identification of Diphyllobothrium nihonkaiense by PCR-based approach // Clin. Parasitol. (Japan). - 2006. - 17. - P. 22 - 24.
Szidat L. Uber die Erhaltungsfthigkeit von Helmintheneiren in Vor- und Frilhgeschichtlichen Moorleichen H Z. Parasitenk. - 1944. - 13. - P. 265 - 274.
Talysin T Dibothriocephalus strictus n. sp. Menschenparasit des Baikalgestades 11Z. Parasitenk. - 1932. - 4. -P. 722-729.
Torres P. Estado actual de la investigacidn sobre cestodos del g£nero Diphyllobothrium Cobbold en Chile I I Rev. M6d. Chile. - 1982. -110. - P. 463 - 470.
Torres P., Cuevas C, Tang M., Barra M. et al. Introduced and native fishes as infection foci of Diphyllobothrium spp. in humans and dogs from two localities at Lake Panguipulli in Southern Chile H Comp. Parasitol. - 2004. - 71,2. - P. 111 - 117. doi: http://dx.doi.org/10.1654/4119.
Torres P., Franjola R, Figueroa L., Schlatter R. et al. Researches on Pseudophyllidea (Carus, 1813) in the south of Chile. IV Occurrence of Diphyllobothrium dendriticum (Nitzsch, 1824) H J. Helminthol. - 1981. — 55, 3.-P. 173- 187.
Torres P., Franjola R, Weitz J._C, Perla G., Morales E. [New records of human diphyllobothriasis in Chile (1981 - 1992), with a case of multiple Diphyllobothrium latum infection] // Bol. Chil. Parasitol. - 1993. -48, 3-4. - P. 39 - 43. (In Spanish).
Torres P., Leydn И, Puga S. Prevalence, intensity, and abundance of infection and pathogenesis caused by diphyllobothriosis in vulnerable, native and introduced trout in Lake Panguipulli, Chile H J. Wildl. Dis. -2012.-48, 4.-P. 937-950.
114
Van Doorn H. R., van Vugt M., Wetsteyn J. C, van Gool T. Infestation with the tapeworm Diphyllobothrium latum after eating raw fish // Ned. Tijdschr. Genees. - 2005. -149. - P. 2470 - 2472.
Vik R. Studies on the helminth fauna of Norway I. Taxonomy and ecology of Diphyllobothrium norvegicum n. sp. and the plerocercoid of Diphyllobothrium latum (L) 11 Nytt. Mag. Zool. - 1957. - 5, 1. - P. 25 - 93.
Vogelsang E. G., Potenza L. Presencia de Diphyllobothrium latum (L. 1758) en Venezuela // Rev. Med. Vet. Parasitol.- 1953.-12.-P. 189- 193.
von Bonsdorff B. The fish tapeworm, Diphyllobothrium latum\ a major health problem in Finland // World Med. J. - 1964. - 11. - P. 170 - 172.
Ward H. B. The parasiric worms of man and the domestic animals // Report of the Zoologist. - Stud. Zool. Lab.: Univ. Nebrasca. - 1895. - Paper 9. - P. 294 - 296.
Wardle R. A., Green N. K. The rate of growth of the tapeworm Diphyllobothrium latum (L) // Can. J. Res. Sect. D. Zool. Sci. - 1941. - 19, 8. - P. 245 - 251.
Wicht B., de Marval F., Gottstein B., Peduzzi R, Imported diphyllobothriasis in Switzerland: molecular evidence of Diphyllobothrium dendriticum (Nitzsch, 1824) // Parasitol. Res. - 2008a. - 102, 2. - P. 201 - 204
Wicht B., de Marval E, Peduzzi R. Diphyllobothrium nihonkaiense (Yamane et al., 1986) in Switzerland: first molecular evidence and case reports // Parasitol. Int. - 2007. - 56, 3. - P. 195 - 199.
Wicht B., Scholz T.t Peduzzi R., Kuchta R. First record of human infection with the tapeworm Diphyllobothrium nihonkaiense in North America // Am. J. Trop. Med. Hyg. - 2008b. - 78, 2. - P. 235 - 238.
Wicht B., Yanagida T., Scholz T., Ito A. et al. Multiplex PCR for differential identification of broad tapeworms (Cestoda: Diphyllobothrium) infecting humans 11 J. Clin. Microbiol. - 2010. - 48. - P. 3111 - 3116.
Wiwanitkit S., Wiwanitkit V. Diphyllobothriasis caused by Diphyllobothrium latum in southeasr Asia: A new emerging fish-bom disease 11 J. Coastal Life Med. - 2016. - 4, 1. - P. 78 - 79.
Yamane Y, Isobe A., Hojo Y., Fukushima T. et al. Paleoparasitology of archeological soils in Japan (1) // Clim. Parasitol. - 1994. - 5. - P. 204 - 206 (in Japanese).
Yamane Y.t Kamo H., Bylund G., Wikgren B.-J. R. Diphyllobothrium nihonkaiense sp. nov. (Cestoda: Diphyl-lobothriidae) - Revised identification of Japanese broad tapeworm H Shimane J. Med. Sci. - 1986. - 10. -P. 29-48.
Yamane Y., Kamo H., Yazaki S. et al. On a new marine species of the genus Diphyllobothrium (Cestoda: Pseu-dopyllidea) found from a man in Japan // Japan. J. Parasitol. - 1981. - 30. - P. 101-111.
Yamane Y., Shiwaki K. 2. Diphyllobothrium nihonkaiense and other marine-origin cestodes 11 Progress of Medical Parasitology in Japan. Vol. 8. Eds. Otsuru M., Kamegai S., Hayashi S. Chapter III. - Meguro Parasitol. Mus., Tokyo, 2003. - P. 245 - 259.
Yamane Y., Shiwaki K, Fukushima T., Isobe A. et al. The taxonomic study of diphyllobothriid cestodes with special reference to Diphyllobothrium nikonkaiense in Japan I Host response to International Parasitic Zoonoses. - H. Ishikura et al., eds. - Springer-Verlag, Tokyo, 1998. - P. 25 - 38.
Yamasaki H., Kumazawa H, Sekikawa Y., Oda R. et al. First confirmed human case of Diphyllobothrium stemmacephalum infection and molecular verification of the synonymy of Diphyllobothrium yonagoense with D. stemmacephalum (Cestoda: Diphyllobothriidea) // Parasitol. Int. - 2016. - 65, 5, Pt. A. - P. 412 -421. doi: 10.1016/j.parint.2016.06.003.
Yamasaki H., Kuramochi T. A case of Diphyllobothrium nihonkaiense infection possibly linked to salmon consumption in New Zealand // Parasitol. Res. - 2009. - 105, 2. - P. 583 - 586. 10.1007/s00436-009-1468.
Yamasaki H.t Muto M., Yamada M., Arizono N, Rausch R. L. Validity of the bear tapeworm Diphyllobothrium ursi (Cestoda: Diphyllobothriidae) based on morphological and molecular markers // J. Parasitol. -2012.-98, 6.-P. 1243- 1247. doi: 10.1645/GE-3063.1.
Yamasaki H., Nakaya K, Nakao M,, Sako Y, Ito A. Significance of molecular diagnosis using histopathological specimens in cestode zoonoses П Trop. Med. Health. - 2007. - 35, 4. - P. 307 - 321.
Yanagida T, Matsuoka H., Kanai T, Nakao M, Ito A. Anomalous segmentation of Diphyllobothrium nihonkaiense 11 Parasitol. Int. - 2010. - 59, 2. - P. 268 - 270. doi: 10.1016/j.parint.2009.12.006.
Y£ra H., Estran C.t Delaunay P., Gari-Toussaint M. et al. Putative Diphyllobothrium nihonkaiense acquired from a Pacific salmon (Oncorhynchus keta) eaten in France; genomic identification and case report H Parasitol. Int. - 2006. - 55,1. - P. 45 - 49.
Yoshida M.9 Hasegawa H.f Takaoka H, Miyata A. A case of Diphyllobothrium nikonkaiense infection successfully treated by oral administration of Gastrografin // Parasitol. Int. - 1999. - 48, 2. - P. 151 -155. Doi: 10.1016/S1383-5769(99)00011 -2.
Zhang W„ Che F, Tian S., Shu J., Zhang X. Molecular identification of Diphyllobothrium nihonkaiense from 3 human cases in Heilongjiang province with a brief literature review in China // Korean J. Parasitol. -2015. - 53, 6. - P. 683 - 688. doi: 10.3347/kjp.2015.53.6.683.
115
Род Adenocephalus Nybelin, 1931
Описание (no: Hemandez-Orts et al., 2015; Nybelin, 1931). Крупные цестоды. Стробила состоит из многочисленных члеников, ширина которых превышает их длину. Сколекс с двумя глубокими ботриями; шейка имеется. Семенники медуллярные, в один слой; сумка цирруса и наружный семенной пузырёк крупные, толстостенные. Мужская половая пора медио-вентральная, в передней трети членика. На вентральной поверхности члеников между их передним краем и передним краем мужского полового отверстия имеются поперечные папиллообразные тегументальные выросты, разделённые узкими полукруглыми желобками и уменьшающиеся в размерах по направлению к краю членика. Яичник двулопастный. Вагина трубчатая, открывается позади мужской гонопоры. Желточные фолликулы мелкие, многочисленные, кортикальные, занимают большую часть членика, за исключением срединной области. Матка трубчатая, образует несколько петель в виде розетки; маточная пора медио-вентральная, позади женского полового отверстия. Яйца почти шаровидные, относительно небольшие, с крышечкой, при откладке не содержат эмбриона. Типовой и единственный вид -Adenocephaluspacificus Nybelin, 1931.
Adenocephalus pacificum Nybelin, 1931 [=Bothriocephalus sp. Stiles et Hassall, 1899; =Bothriocephalus macrophallus von Linstow, 1905, pro parte; =Diphyllobothrium glaciale (Cholodkovsky, 1915); ^Adenocephalus septentrionalis 1931; =Di-
phyllobothrium arctocephali Drummond, 1937; =Diphyllobothrium arctocephalinum Johnston, \931,=Diphyllobothrium krotovi Delyamure, 1955; =Diphyllobothriumpacificum (Nybelin, 1931) Margolis, 1956; =Diphyllobothrium atlanticum Delyamure et Pa-rukhin, 1968] (рис. 63, 64). Синонимы вида приведены по работе: Scholz, Kuchta, 2016.
Рис. 63 Adenocephalus pacificus: I - сколекс, вентрально; 2 - половозрелый членик, вентрально; 3 - поперечный разрез членика в области начальных петель матки (из: Делямуре и др., 1985 - по: Делямуре, 1955)
Вид впервые описан на материале от морского котика фернандес-ского с островов Хуан-Фернандеса, расположенных в юго-восточной части Тихого океана близ побережья Чили (Nybelin, 1931). Видовое название паразита происходит от названия региона его обнаружения: pacificus -
тихоокеанский.
116
В 1956 г. Л. Марголис (Margolis) перевёл Adenocephalus pacificus в род Diphyllobothrium. В 2006 г. группа исследователей (Skerikova et al., 2006) отметила, что на морфогенетическом уровне D. pacificum отличается от родственных видов Diphyllobothrium, паразитирующих у человека, и вид должен быть сохранён в своем первоначальном роде - Adenocephalus. Наконец, в 2015 г. после детального изучения большого фактического материала, полученного от котика северного морского, на основании молекулярных данных и уникальных морфологических особенностей, присущих этому паразиту, самостоятельность рода Adenocephalus была восстановлена, a Diphyllobothrium pacificum вернули его искомое название (Hemandez-Orts et al., 2015).
Рис. 64 Adenocephalus pacificus, сагиттальный разрез членика: LP - продольный вырост; CS - бурса цирруса; SV - семенной пузырёк; UP - маточная пора; U - матка с яйцами (из: Mercado et al., 2010)
Описание (по разным авторам, в том числе: Делямуре и др., 1985; Cattan et al., 1977; Hemandez-Orts et al., 2015; Kuzmina et al., 2015; Rausch et al., 2010). Средних размеров цестоды: обычная длина до 1 м (у 90 % исследованных червей), но иногда могут встретиться экземпляры длиной до 4 м (Jimenez et al., 2012). Сколекс маленький, ланцетовидный, в боковом аспекте овальный или удлинённый; размеры сколекса, приводимые разными авторами, укладываются в пределы 1.8 - 4.0 х 1.0 - 3.7 мм. Ботрии начинаются в передней части сколекса и тянутся до половины его длины. Шейка короткая, но чётко
выраженная. Передние проглоттиды короткие, чётко краспедотные. На вентральной поверхности члеников имеется от 1 до 7 (обычно 5-6) поперечных папиллообразных тегументальных выростов. Экскреторная система из кортикальных и медуллярных продольных каналов, протянувшихся через всю стробилу. Семенники довольно крупные, несколько вытянуты дорсо-вентрально; по (Hemandez-Orts et al., 2015), семенники более или менее сферические. Семенники расположены в двух латеральных полях в один ряд; вокруг бурсы цирруса, а также на значительном расстоянии впереди неё отсутствуют; у переднего и заднего краёв членика не сливаются и слегка перекрывают концы петель зрелой матки, но не концы яичника и маточных петель. Бурса цирруса грушеобразная или яйцевидная, 0.2 - 0.34 х 0.08 -0.21 мм; её задняя, более притупленная, стенка не упирается в слой поперечной мускулатуры. В полости бурсы заключены множество железистых клеток и тонкостенный, сильно извитой семенной проток. Семенной пузырёк яйцевидный или округлый, толстостенный, размером 0.072 -0.16х 0.10-0.15 мм; его стенки образованы продолжением мускульных волокон, составляющих стенку бурсы (см. рис. 64). У задней границы членика медианно расположен двулопастный яичник, латеральные лопасти которого направлены вперёд и достигают начальных петель матки. Между лопастями яичника находится тельце Мелиса. Желточные фолликулы лежат в кортикальной паренхиме, желточники правого и левого поля соединяются
117
у передней границы членика. Вагина проходит вентральнее матки, её терминальный отрезок расширен. Матка расположена в центре задней половины членика, в зрелых проглоттидах образует 4-6-8 вздутых петель, расположенных билатерально. Последняя петля сильно расширена и в некоторых члениках покрывает нижележащие петли, создавая впечатление мешковидной матки. Яйца овальные, с толстой оболочкой. Размеры яиц 41 - 62 х 34 - 48.7 щп (табл. 3).
Таблица 3 Размеры яиц Adenocephalus pacificus (в щп), по данным разных авторов
| Длина 1 Ширина [ Автор публикации |
55-51 40-42 Nybelin, 1931
49-53 34-38 Делямуре, 1955
50-60 36-40 Baer et al., 1967
50-56 38-43 Cattan et al., 1977
48.8 - 60.4 38.6-45 Kamo et al., 1982
53.63 ± 2.82 39.42 ± 5.64 Ferreira et al., 1984 (в копролитах)
52-59 42-50 Makiya et al., 1987
54 37 Cabrera et al., 2001 (из собаки)
48.7-56 (53.1) 38.9-48.7(41.3) Rausch et al., 2010
41-62 (53 ±3.3) 35-48 (42 ±0.1) Hemdndez-Orts et al., 2015
К настоящему времени A. pacificus известен от 9 видов ушастых тюленей (Otariidae) из 16, входящих в это семейство. Среди его хозяев морские котики -фернандесский, новозеландский, южноамериканский, южноафриканский (капский), субтропический (амстердамский) и северный, морские львы - австралийский, южный и северный, у которых паразит выявлен в водах Канады, США, Перу, Чили, Аргентины, Уругвая, Южной Африки, Новой Зеландии, Австралии, юга Дальнего Востока (см.: Hemandez-Orts et al., 2015; Kuchta et al., 2015).
Небольшая ремарка. У льва южного морского имеется два научных названия: Otaria by-ronica и О. flavescens. Относительно правомочности использования того или иного из них существуют серьёзные разногласия: у каждого из названий есть и сторонники, и противники. В сообщениях о регистрации A. pacificus у льва южного морского, их авторы чаще используют О. flavescens (см., напр., George-Nascimento, Carvajal, 1981; Markowski, 1952; Rausch et al., 2010; Tantale&n, 1993), чем О. byronica (Baer, 1969).
Гельминт обнаружен также у домашней собаки на южном побережье Перу в г. Чинча (Cabrera et al., 2001). Длина выявленного червя составила 920 мм, сколекс размером 2.2 х 1.5, зрелые маточные членики 3.8 х 5.34 мм. Находили эту цестоду у собаки и на юге Чили (Torres et al., 1983). Недавно паразит был отмечен у шакала чепрачного на юго-востоке Африки (Hemandez-Orts et al., 2015). Известно, что эксперименты по заражению аденоцефалом собак, а также человека потерпели неудачу (Baer, 1969). В то же время в других сообщениях их авторы пишут об удачных опытах с собаками (Escalante, Miranda, 1986).
Заражённость морских животных A. pacificus, видимо, может достигать очень высоких показателей. Во всяком случае, на о. Святого Павла (Сент-Пол) (один из островов Прибылова в Беринговом море) паразит был зарегистрирован в среднем у 97.4 % (95.9 - 98.3) обследованных особей котика северного морского при средней интенсивности инвазии 17.6 экз. (16.5 - 18.8) (Kuzmina et al., 2015).
Жизненный цикл паразита до сих пор полностью не изучен; тем не менее, его схема типична для дифиллоботриид (рис. 65).
118
Рис. 66 Схема жизненного цикла Adenocephalus pacificus (фотографии из: ru.wikipedia.org; absfreepic.com)
Известно, что в качестве дополнительного хозяина в жизненный цикл A. pacificus включены многочисленные морские рыбы. В юго-восточной Пацифике, например, таковых известно более 20 видов из 12 семейств: кохиноба, галеихт, пара-лихт перуанский, корифена, ставрида перуанская, горбыль-лорна, горбыль судачий, или лорна, райда, или паралонхус перуанский, мерлуза перуанская, пеламида и другие (Baer, 1969; Escalante, Miranda, 1986; Kuchta et al., 2015; собств. данные). В других регионах Мирового океана, где у ушастых тюленей обнаруживают этого паразита, в его жизненный цикл будут вовлечены иные, местные виды рыб. Плероцеркоиды локализуются в полости тела рыб, на внутренних органах, в стенке желудка, гонадах и очень редко - в мышечной ткани и заключены в тонкостенные, овальные, перламутрово-белые цисты диаметром 2-4 мм. Извлечённые из цист личинки довольно крупные, их длина достигает 2.2 см, ботрии 0.5 - 1.4 мм; поверхность тела морщинистая, с мелкими микротрихиями длиной до 4 щп (Kuchta et al., 2015).
Учитывая, что первый промежуточный хозяин дифиллоботриид - планктонные ракообразные, а рыбы, у которых обнаруживаются метацестоды A. pacificus и которые являются излюбленной пищей котиков и львов, относятся к хищникам, то роль обязательного второго промежуточного хозяина должны играть какие-то рыбы-плантофаги. В тихоокеанских водах Южной Америки самый массовый вид пелагических планктофагов - анчоус перуанский, или анчовета, питающийся не только фитопланктоном, как считалось ранее, но и мелким и крупным зоопланктоном (Espinosa, Bertrand, 2008). Эта некрупная рыбка, чья максимальная длина не превышает 20 см, является основной пищей многих из перечисленных выше рыб. Скорее всего, в данном регионе именно анчоус перуанский и служит вторым промежуточным хозяином в жизненном цикле A. pacificus, а все остальные рыбы играют роль паратенического хозяина.
Впервые о заражении человека A. pacificus стало известно в августе 1957 г., когда на Панамериканском педиатрическом конгрессе двое его участников из Перу 119
выступили с докладом о регистрации в этой стране данного паразита у детей (Ayulo, Filomena, 1957). Ещё один подобный случай был описан в 1961 г.: тогда инвазию выявили у студента из Трухильо, но паразита определили как Diphyllobothrium latum (Miranda et al., 1961). В следующей публикации на эту тему речь шла уже о 7 новых случаях поражения людей в Перу (Baer et al., 1967). В том же году в Аргентине появилась информация (Rego, 1967) о находке у студента-перуанца цестоды, которую определили как Luheella sp. (синоним у Spirometra). Недавнее переисследование этого материала, хранящегося в Гельминтологической коллекции в Институте Освальдо Круза в Рио-де-Жанейро, показало, что в действительности у студента был найден A. pacificus (Kuchta et al., 2015). Напомню, что до 2015 г. практически во всех публикациях, связанных с обнаружением этой цестоды у тюленей и людей, паразит фигурировал под названием Diphyllobothrium ра-cificum, или же данный вид описывали под теми названиями, которые в настоящее время отнесены к синонимам A. pacificus.
К 1969 г. в Перу в городах вдоль побережья и даже внутри страны было зафиксировано, по меньшей мере, 60 случаев дифиллоботриазиса (Baer, 1969). Объясняя столь резкий рост числа инвазий человека, автор отмечает, что сведения о многих из них получили документальное подтверждение после недельного семинара в Трухильо, когда ведущих паразитологов страны попросили привезти с собой на семинар не определённый материал.
Примечательно, что после первых же находок этого паразита у человека специалисты предположили, что подобные инвазии были известны в Южной Америке ещё в доколумбовую эпоху, «the Christian era» (Baer, 1969; стр. 722), что и подтвердили последующие палеопаразитологические исследования (Araujo et al., 1983; Ferreira et al., 1984; Reinhard, Urban, 2003 и др.). Описано, к примеру, обнаружение яиц «Diphyllobothrium pacificum» в мумиях 4000 - 5000-летнего возраста культуры Чинчорро в Перу, удалённого от тихоокеанского побережья на 40 км (Reinhard, Urban, 2003). К слову, сообщение об обнаружении яиц A. pacificus в захоронении ребёнка на о-ве Адак в группе Алеутских о-вов (Bouchet et al., 2001), по мнению авторов обзорной работы по данному виду (Kuchta et al., 2015), не соответствует действительности, поскольку выявленные яйца по форме отличались от типичных яиц, характерных для этого вида.
К настоящему времени в мире насчитывается примерно 1000 официально зарегистрированных случаев заражения людей A. pacificus. Их подавляющее большинство приходится на страны Южной Америки, а в ней - на Перу. По данным Министерства зравоохранения Перу, в 1981 - 2001 гг. заражённость местного населения по регионам страны колебалась от 0.13 до 7.48 % (Peru/Minsa/oge-03/039 & Ser. Inf. Тёс. Invest. Epid.). Регистрация подобных случаев продолжается и в наши дни (Garcia et al., 2006; Jimenez et al., 2012).
Вторым регионом по частоте обнаружения A. pacificus у людей, но, безусловно, не столь значимым, как Перу, является Чили. Впервые об обнаружении данного гельминта у человека в этой стране стало известно в 1967-м году (Atias, Cattan, 1967) и с тех пор в печати эпизодически появляются публикации на эту тему. Большинство выявленных случаев фиксировалось на севере страны, иногда - на юге. Сообщается, например, о двух инвазированных чилийцах в северном регионе (Sagua et al., 1976), или сразу об одиннадцати подобных случаях (Sagua et al., 1979), или же об инвазии трёх мальчиков (Mercado et al., 1988, 2010; Sagua et al., 2000) и
120
26-летней жительницы Антофагасты (Gonzalez et al., 1999). На одном из упомянутых случаев остановлюсь несколько подробнее. Речь идёт о публикации, в которой описана инвазия 3-летнего малыша из Антофагасты (Mercado et al., 2010). В 2000 г. у ребёнка вышли хорошо сохранившиеся проглоттиды цестоды, которых зафиксировали в формалине. Через 9 лет группа исследователей, разрабатывавших методику молекулярной идентификации видов Diphyllobothrium, вызывающих заболевания у населения Чили, установила их принадлежность к Diphyllobothrium pacificum. Мать мальчика поделилась воспоминаниями, что они обычно ели местное рыбное блюдо ceviche, основу которого составляла морская рыба - горбыль-лорна и кохи-ноба. К слову, в своё время плероцеркоиды A. pacificus были выявлены у обоих видов рыб, например, у 16 из 112 вскрытых горбылей (Escalante, Miranda, 1986).
К 2000 г. в Чили насчитывалось 16 официально зарегистрированных случаев заражения людей A. pacificus (Sagua et al., 2000, 2001). Цитируемые авторы выполнили ретроспективный анализ доступных материалов по заражённости людей данным паразитом в стране за 1975 - 2000 гг. и пришли к выводу об их связи с цикличностью Эль-Ниньо (Sagua et al., 2001). Напомню, что Эль-Ниньо, с которым связывают глобальные изменения климата на планете, оказывает существенное влияние на трофодинамику, биопродуктивность, миграционные перемещения и распределение рыб, в том числе промысловых, в прибрежных водах Чили и Перу.
Ещё одна южноамериканская страна, где была выявлена инвазии людей А. pacificus, это - Эквадор, причём случай имел место не на побережье страны и не в её континентальной части, а на архипелаге Jambeli, расположенном, как пишут в рекламных проспектах, в 20 минутах поездки на катере из ближайшего порта. Каждому из 463 жителей этого острова было предложено сдать пробы для копроово-скопического анализа. В итоге в распоряжении исследователей оказалось 373 пробы, в 13 (3.5 %) из которых обнаружились яйца A. pacificus (Gallegos, Brousselle, 1991). В те годы, как подчёркивают авторы публикации, на острове не было питьевой воды, электричества и санитарных удобств, что, впрочем, никак не могло повлиять на заражение людей дифиллоботриидами, поскольку оно происходит только через пищу. К слову, в настоящее время Jambeli - процветающий туристский край, где отдыхающим предлагают комфортное жильё со всеми удобствами.
За пределами южноамериканского континента единичные случая инвазии людей A. pacificus известны в Японии, Испании и Австралии.
Паразитирование этого гельминта у людей в Японии кратко рассмотрено в обзорной работе, посвящённой A. pacificus (Kuchta et al., 2015). По данным названных авторов, в этой стране выявлено всего 6 подобных случаев, однако ни одна из находок, как они пишут, не подтверждена молекулярными данными. Эта ремарка связана с тем, что в Японии у людей зарегистрировано 11 видов дифиллоботриид, а учитывая трудности в идентификации яиц этих цестод, нельзя исключать возможность ошибочного определения паразита. Впервые A. pacificus обнаружили у 35-летнего жителя Окинавы в 1965 г. (Sunagawa, 1965), а спустя полтора десятилетия этот материал был переисследован (Kamo et al., 1982). О втором факте регистрации паразита стало известно в 1987 г. (Makiya et al, 1987). На этот раз инвазию выявили у 54-летнего члена экипажа торгового судна; источник и место заражения пострадавшего фактически остались не известными. Самый последний случай описан от 59-летнего мужчины из Мацуямы, виновником заражения которого стало традиционное sashimi (Tsuboi et al., 1993).
121
Ещё один регион, где в последние годы фиксируют инвазию человека A. pacificus, это - Испания (Kuchta et al., 2014; Pastor-Valle et al., 2014). В одной из цитируемых публикаций (Kuchta et al., 2014) речь идёт об уточнении видовой принадлежности цестод, ранее обнаруженных у человека в этой стране и определённых как Diphyllobothrium latum (Colomina et al., 2002; Esteban et al., 2014). Скрининг этого материала (partial IsrDNA и последовательности гена coxl) в результате показал неверную идентификацию червей, которые в действительности оказались A. pacificus. Авторы другой статьи (Pastor-Valle et al., 2014) также использовали метод молекулярного анализа для идентификации дифиллоботриидных цестод, выявленных в 2008 - 2010 гг. у четырёх жителей страны и предварительно определённых как Diphyllobothrium sp. В результате выяснилось, что в одном случае человек был инвазирован Diplogonoporus balaenopterae (см. ниже), а в трёх - A. pacificus. Необычность находок A. pacificus в любой европейской стране заключается в том, что у рыб данного региона этот паразит вообще не встречается и источником инвазии человека может быть только рыба, импортированная из эндемичных по данному зоонозному виду регионов. Это обстоятельство не может не привлечь внимания санитарно-ветеринарных служб любого европейского государства, куда поступает рыба из таких стран, как Перу, Чили или Эквадор.
Иногда в публикациях можно обнаружить в одной связке два слова - Россия и A. pacificus (Kuchta et al., 2015). Дело в том, что ещё в 1937 г. на востоке России от 10 местных жителей о-ва Сахалин был описан новый вид дифиллоботриид - Diphyllobothrium luxi (Руткевич, 1937), самый крупный экземпляр которого достигал в длину 3.63 м, а размеры яиц не превышали 57 щп. В последующем вид был переведён в синоним D. latum (Делямуре и др., 1985), что, по мнению ряда исследователей (Kuchta et al., 2015), некорректно, т.к. D. luxiочень близко связан с A. pacificus. Следует заметить, что D. luxi у человека в дальневосточном регионе более никто не находил, хотя плероцеркоиды данного вида довольно регулярно отмечают у рыб (напр., Поспехов и др., 2013). В равной степени отсутствуют сведения о регистрации в этом регионе и A. pacificus.
В 2016 г. база данных, содержащая информацию о заражённости населения разных стран A. pacificus, пополнилась новыми сведениями. На этот раз инвазию выявили у ребёнка в Австралии (Moore et al., 2016). Трёхлетний мальчик из прибрежного городка на п-ове Эйр в Южной Австралии, никогда не выезжавший за пределы страны, был доставлен в медицинскую клинику, поскольку его родители в течение 2 дней находили в фекалиях ребёнка фрагменты солитёра, а сам малыш в течение месяца страдал отсутствием аппетита и непонятной перистальтикой кишечника. По словам родителей, ребенок регулярно ел сырую морскую рыбу - бара-булю австралийскую, тунца австралийского, силагиноида пятнистого, которых отец, как рыболов-любитель, вылавливал в заливе Спенсер. Данные, полученные в результате анализа гена coxl фрагмента стробилы длиной 6 см и яиц цестоды, показали, что изолят от ребёнка не отличим от A. pacificus из котика австралийского морского. Ребёнок был вылечен празиквантелом; через 3 недели после начала процедуры лечения яйца паразита в кале не обнаруживались.
Анализ литературных данных показывает, что паразит может встретиться у лиц любого возраста, поскольку решающее значение имеет питание человека. Самым маленьким пациентом, у которого была выявлена инвазия A. pacificus, оказался 16-месячный ребёнок из Перу (Tantalean, Atencia, 1993).
122
Что касается клинических признаков, по которым можно было бы определить инвазию аденоцефалом, то специфические симптомы практически отсутствуют, а те, что наблюдаются, присущи многим кишечным гельминтозам. Одни авторы указывают на метеоризм, сильные абдоминальные боли и диарею, сопровождающие заражение данным паразитом (Lumbreras et al., 1982), другие пишут о жалобах пациентов на головную боль, тошноту и брюшные боли (Baer et al., 1967). Некоторые авторы акцентируют внимание на отсутствии у пациентов отклонений от нормы (Gonzalez et al., 1999) или же сообщают о полном отсутствии каких-либо симптомов (Sagua et al., 2000).
В этом отношении очень характерен следующий пример. Из разных районов Лимы в детскую клинику по подозрению на кишечную инфекцию поступил 21 ребёнок (Medina et al., 2002). У 13 из них в фекалиях были выявлены яйца A. pacificus, у 6 — проглоттиды, а у двоих выделились цельные черви. При этом у одного ребёнка симптомы инвазии вообще не были выражены, у двоих наблюдалась диарея, ещё у двоих - диарея с рвотой и брюшными болями, у шестерых отмечена брюшная боль с диареей, а у 10 (42.6 %) - только абдоминальные боли. У 19 из 21 ребёнка была выражена эозинофилия и менее чем у 10 % - признаки анемии. Примечательно, что у трети детишек вместе с цестодой обнаружились и другие кишечные паразиты, в том числе Giardiat lamblia, Rodentolepis (=Hymenolepis) папа, Blastocystis hominis, Ascaris lumbricoides. Естественно, определить конкретного возбудителя недомогания у подобных детей весьма проблематично.
Известно, что паразитирование некоторых видов дифиллоботриид высоко патогенно для человека, в частности лентец широкий зачастую приводит к мегалобластической анемии или недостатку витамина В12. В отличие от него заражение аденоцефалом тихоокеанским редко вызывает подобное состояние. Авторы одной из публикаций, касающейся данной проблемы (Jimenez et al., 2012), приводят следующую картину симптоматики инвазии 18 пациентов в возрасте от 3 до 66 лет. В целом, на усталость и умеренные абдоминальные боли пожаловались 66.6 % из 18 пациентов, запор или диарею испытывали 44 % опрошенных, исхудание - 16 % и отсутствие аппетита - 11 %. При этом у всех пациентов, за исключением одного, уровень витамина В12 соответствовал базовому. И только у одного пациента, страдавшего, к тому же, хроническим диабетом и атрофией желудка, наблюдались низкий уровень витамина В12 и мегалобластическая анемия. Анамнез показал, что все пациенты - любители рыбы: у 94 % из них в меню обычна жареная рыба, у 83 % -тушёная рыба и у 72 % - ceviche, национальное блюдо из сырой рыбы с лимоном и приправами. При этом предпочитаемой рыбой у всех опрошенных были ставрида перуанская, корифена, пеламида чилийская, кефаль-лобан, райда, или паралонхур перуанский.
Таким образом, основными симптомами инвазии аденоцефалом, скорее всего, являются абдоминальные боли, тошнота, рвота и диарея, перемежающаяся с запорами. Могут также наблюдаться головная боль, отсутствие аппетита, похудание, лёгкая эозинофилия, анемия.
Как правило, у человека обнаруживается одна особь цестоды, а посему избавление от неё приводит к полному выздоровлению пациента.
В последние десятилетия наиболее эффективным лечебным препаратом при инвазии аденоцефалом считается празиквантел, применение которого приводит к полному оздоровлению организма (Espejo, 1977; Gonzalez et al., 1999; Lumbreras et
123
al., 1982; Moore et al., 2016; Pawlowski, 2015 и др.). Только один пример. Тридцати одному пациенту был назначен празиквантел в разовой дозе из расчёта 10 мг • кг’1 массы тела. В первые три дня у 11 больных вышли частично разрушенные цестоды, а через 30, 60 и 90 дней после лечения ни у одного пациента яйца цестоды не обнаруживались (Lumbreras et al., 1982). Авторы публикации рекомендуют также включать в схему лечения приём слабительного, чтобы исключить необходимость проведения повторного контроля, - полностью ли вышел червь или нет. 3. Павловски (Pawlowski, 2015), однако, полагает, что для оценки эффективности применения празиквантела спустя несколько месяцев желательно проводить копроовоскопиче-ский анализ.
Единственным источником инвазии людей является рыба, причём, только морская, а заражение происходит лишь в случае употребления в пищу инвазиро-ванной рыбы в сыром или слабо обработанном виде. Традиционные для стран тихоокеанского побережья Южной Америки блюда, основу которых составляет сырая рыба, это - cebiche (сырая рыба с лимоном и перцем чили), tiradito (сырая рыба с лимоном, чесноком и перечным соусом), chinguirito (сырая рыба с лимоном и красным перцем) (Bowman N. et al., 2006), а также peroles (морепродукты с лимоном) (Sagua et al., 2000). В принципе, суть всех блюд одна — сырая морская рыба, отличаются лишь специи и время выдержки продукта в них.
Что касается возможности заражения людей аденоцефалом в тех странах, где, казалось бы, подобное невозможно, как, например, в Испании, то основополагающую роль здесь играет импорт рыбы из стран, эндемичных по данному зоонозному виду. При транспортировке рыбы на льду, без заморозки инвазионность личинок сохраняется, и подобная рыба без глубокой заморозки представляет реальную опасность для здоровья человека.
Цитируемая литература
Делямуре С. Л. Гельминтофауна морских млекопитающих в свете их экологии и филогении. - М.: Изд-во АН СССР, 1955. - 517 с.
Делямуре С. Л., Скрябин А. С., Сердюков А. М. Дифиллоботрииды - ленточные гельминты человека, млекопитающих и птиц / Отв. ред. В. Е. Судариков. И Основы цестодологии. - М.: Наука, 1985. -11. - 200 с.
Поспехов В. В., Атрашкевич Г. И., Орловская О. М. Гельминты и паразитические ракообразные проходных гольцов (Salmonidae: Salvelinus) Северного Охотоморья // Известия ТИНРО. - 2013. - 174. -С. 208-233.
Руткевич Н. Л. Diphyllobothrium giljacicum nov. sp. и Diphyllobothrium luxi nov. sp. - два новых паразита человека с острова Сахалин / Работы по гельминтологии. Сборник, посвящ. 30-летию научн., пе-даг. и обществ, деят-ти засл. деят. науки акад. К. И. Скрябина. - М.: Изд-во ВАСХНИЛ, 1937. - С. 575 - 580.
Araujo A., Ferreira L. Е, Confalonieri U. Е., Nunez L., Cruz F. O. Eggs of Diphyllobothrium pacificum in precolumbian human coprolites // Paleopathol. Newsletter. - 1983. - 41. - P. 11 - 13.
Atias A., Cattan P. E. First case of human infection with Diphyllobothrium pacificum in Chile // Rev. Med. Chile. - 1976. -104, 4. -P. 216-217.
Ayulo V., Filomena C. Incidencia del parasitismo en los niflos de la costa, sierra у selva del Pert // V Congre-so Panamericano de Pediatrla. Ago 5-11 1957. - Lima, 1957. - P. 463 - 479.
Baer J. G. Diphyllobothrium pacificum, a tapeworm from sea lions endemic in man along the coastal area of Peru // J. Fish. Res. Board Can. - 1969.-26,4. -P. 717 - 723. 10.1139/f69-071.
Baer J. G., Miranda С. H., Fernandez R. W., Medina T. J. Human diphyllobothriasis in Peru // Z. Parasi-tenkd. - 1967. - 28, 3. - P. 277 - 289.
124
Bouchet F, West D, Lefevre Ct Corbett D. Identification of parasitoses in a child burial from Adak Island (Central Aleutian Islands, Alaska) 11C. R. Acad. Sci. Paris (S£r. III). - 2001. - 324. - P. 123 - 127.
Bowman N. et al. 8.3.2. Diphyllobothrium pacificum I Food-borne parasitoses. - Ed. Y. R. Ortega. - Springer Science + Business Media, 2006. -P. 214-215.
Cabrera Ch. R., Tantalean V. M., Rojas M. R. Diphyllobothrium pacificum (Nybelin, 1931) Margolis, 1956 en Cams familiaris de la ciudad de Chincha, Peru // Bol. chil. parasitol. - 2001. - 56, 1-2. Santiago ene. http://dx.doi.org/10.4067/S0365-94022001000100007.
Cattan P. E, Atias A., Babero В. B., Torres D. Helmintofauna de Chile. V. Primer hallasgo de Diphyllobothrium pacificum (Nybelin, 1931) Margolis, 1956, en lobos marinos de la costa Chilena H Rev. iber. parasitol. - 1977. - 37, 3/4. - P. 285 - 290.
Colomina J., Villar J., Esteban G. Asymptomatic infection by Diphyllobothrium latum in a Spanish 3-year-old child // Med. Clin. (Bare). - 2002. - 118. - P. 279. 10.1016/80025-7753(02)72359-2 (in Spanish).
Escalante H., Miranda H. Diphyllobothrium pacificum'. Recovery of plerocercoids from Peruvian marine fishes and development of adult worms in Canis familiaris 11 Bol. Chil. Parasitol. - 1986. - 41, ‘Л. - P. 7 -13. (in Spanish)
Espejo H. Tratamiento de infecciones por Hymenolepis папа, Taenia saginata, Taenia solium у Diphyllobothrium pacificum con praziquantel (EMBAY 8440) 11 Bol. Chil. Parasitol. - 1977. - 32, 1. - P. 39 - 40.
Espinosa P., Bertrand A. Revisiting Peruvian anchovy (Engraulis ringens) trophodynamics provides a new vision of the Humboldt Current system // Progress in Oceanography. - 2008. - 29. - P. 215 - 227. Doi: 10.1016/j .pocean.2008.10.022.
Esteban J. G., Munoz-Antoli C, Borras M.t Colomina J.t Toledo R. Human infection by a “fish tapeworm”, Diphyllobothrium latum, in a non-endemic country //Infection. - 2014. - 42. - P. 191 - 194. 10.1007/S15010-013-0491-2.
Ferreira L. F., de Araujo A. J. G., Confalonieri U. E. C., Nunez L. The finding of eggs of Diphyllobothrium in human coprolites (4100-1950 B.C.) from northern Chile 11 Mem. Inst. Oswaldo Cruz, Rio de Janeiro. - 1984. - 79, 2. - P. 175 - 180. 10.1590/S0074-02761984000200004.
Gallegos R., Brousselle C. Intestinal parasitosis of inhabitants living in an Ecuatorian archipelago I I Bull. Soc. Fr. Parasitol. - 1991. - 9, 2. - P. 219 - 223. (in French).
Garcia C., Rodriguez E, Do N., Lopez de Castilla D., Terashima A., Gotuzzo E. Parasitosis intestinal en el paciente con infeccidn VIH-SIDAI I Rev. Gastroenterol. Peru. - 2006. - 26, 1. - P. 21- 24.
George-Nascimento M., Carvajal J. Helminth parasites of the South American sea lion Otaria flavescens from the Gulf of Arauco, Chile //Bol. Chil. Parasitol. - 1981.-36, 3-4. -P. 72-73. (in Spanish).
Gonzalez A., Sagua H, Cortes L., Lobo J., Neira I., Araya J. [Human diphyllobothriasis by Diphyllobothrium pacificum. A new case in Antofagasta, Chile] 11 Rev. Med. Chil. - 1999. - 127, 1. - P. 75 - 77. (in Spanish).
Hemandez-Orts J. S, Scholz T, Brabec J., Kuzmina T.t Kuchta R. High morphological plasticity and global geographical distribution of the Pacific broad tapeworm Adenocephalus pacificus (syn. Diphyllobothrium pacificum)'. molecular and morphological survey // Acta Trop. - 2015. - 149. - P. 168 - 178. doi: 10.1016/j.actatropica.2015.05.017.
Jimenez J. A., Rodriguez S, Gamboa R., Rodriguez L., Garcia H. H. Diphyllobothrium pacificum infection is seldom associated with megaloblastic anemia // Am. J. Trop. Med. Hyg. - 2012. - 87, 5. - P. 897 - 901. doi: 10.4269/ajtmh.2012.12-0067.
Kamo H, Maejima J, Yazaki S, Otsuru M., Hasegawa H. et al. Occurrence of human infection with Diphyllobothrium pacificum (Nybelin, 1931) Margolis, 1956 in Japan 11 Japan. J. Parasitol. - 1982.-31, 3. -P. 31 - 36. (In Japanese).
Kuchta R, Esteban J.-G.t Brabec J., Scholz T. Misidentification of Diphyllobothrium species related to global fish trade, Europe 11 Emerg. Infect. Dis. -2014.-20, 11. -P. 1955 - 1957. 10.320 l/eid2011.140996.
Kuchta R, Serrano-Martinez M. E, Scholz T. Pacific broad tapeworm Adenocephaluspacificus as a causative agent of globally reemerging diphyllobothriosis П Emerg Infect Dis. -2015.-21, 10. - P. 1697 - 1703. doi: 10.3201/eid2110.150516.
Kuzmina T. A., Hemandez-Orts J. S, Lyons E. T, Spraker T R, Kornyushyn V. V., Kuchta R. The cestode community in northern fur seals (Callorhinus ursinus) on St. Paul Island, Alaska // Int. J. Parasitol. Parasites Wildl. -2015. -4, 2. -P. 256-263. doi:10.1016/j.ijppaw.2015.04.007.
Lumbreras H, Terashima A., Alvarez H, Tello R., Guerra H. Single dose treatment with praziquantel (Cesol R, EmBay 8440) of human cestodiasis caused by Diphyllobothrium pacificum 11 Tropenmed. Parasitol. -1982.-33, l.-P. 5-7.
Makiya K., Tsukamoto M., Horio M., Goto M. Diphyllobothrium pacificum, a cestode of marine mammals, expelled from a Japanese seaman П Japan. J. Parasitol. - 1987. - 36. - P. 145- 153. (In Japanese).
125
Margolis L. Parasitic helminths and arthropods from Pinnipedia of the Canadian Pacific coast // J. Fish. Res. Board Canada. - 1956. - 13, 4. - P. 489 - 505.
Markowski S. The cestodes of pinnipeds in the Arctic and other regions // J. Helminthol. - 1952. - 26, 4. - P. 171-214.
Medina J. F., Tantaledn M. V., Leon M. R, Cano M. R. Diphyllobothrium pacificum en niftos del Peru П Diagnostico (Peru). - 2002. - 41, 4. - P. 161 - 164.
Mercado R, Torres P., Lobos A., Schenone H. [Infection by Diphyllobothrium pacificum, probably acquired in the South of Chile, in a З-уеаг-old child] // Bol. Chil. Parasitol. - 1988. - 43, 3-4. - P. 54 - 56. (in Spanish).
Mercado R, Yamasaki H„ Kato M., Munoz V., Sagua H. et al. Molecular identification of the Diphyllobothrium species causing diphyllobothriasis in Chilean patients // Parasitol. Res. - 2010. - 106, 4. - P. 995 -1000. doi: 10.1007/s00436-010-1765-6.
Miranda H, Fernandez W., Castillo A., Soriano M. Presencia en Trujillo Peru, del Diphyllobothrium latum (Linneo, 1758) Ltihe, 1910 // Arch. Per. Pat. Clin. - 1961. - 15. - P. 67 - 76.
Moore C. V.t Thompson R. C. A., Jabbar A., Williams J., Rasiah K. et al. Rare human infection with Pacific broad tapeworm Adenocephalus pacificus, Australia 11 Emerg. Infect. Dis. - 2016. - 22, 8. - P. 1510 -1512. doi: 10.320l/eid2208.160156.
Nybelin O. Sflugetier- und Vogelcestoden von Juan Fernandez / Skottsberg C., ed. Natur. Hist. Juan Fernandez Easter Island, Uppsala. - 1931. -N. 3-4. - P. 493 - 523.
Pastor-Valle J., Gonzalez L. M., Martin-Clemente J. D., Merino F. J. et al. Molecular diagnosis of diphyllobothriasis in Spain, most presumably acquired via imported fish, or sojourn abroad // New Microbe New Infect. - 2014. - 2. - P. 1 - 6. doi. 10.1002/2052-2975.28.
Pawlowsli Z. S. 198. Tapeworms (cestodes) / Clinical Infectious Disease. Secod Edition. - Ed. D. Schlossberg. - Cambridge Univ. Press, 2015. - P. 1273 - 1279.
Rausch R. L., Adams A. M., Margolis L. Identity of Diphyllobothrium spp. (Cestoda: Diphyllobothriidae) from sea lions and people along the Pacific coast of South America // J. Parasitol. - 2010. - 96, 2. - P. 359 -365. doi: 10.1645/GE-2257.1.
Rego A. A. Uma nova ocorrencia de „Lilheella“ (Diphyllobothriidae, Pseudophyllidea) em homem // Atas. Soc. Biol., Rio de Janeiro. - 1967. - 10. - P. 161 - 162.
Reinhard К J., Urban O. Diagnosis ancient Diphyllobothriasis from Chinchorro mummies I I Mem. Inst. Oswaldo Cruz, Rio de Janeiro. - 2003. - 98, Suppl. 1. - P. 191 - 193. http://dx.doi.org/10.1590/S0074-02762003000900028.
Sagua H. F., Aliaga P. R., Neira I.C., Araya J. R, Gonzalez J. C. Diphyllobothriosis humana por infeccidn por Diphyllobotrhium pacificum en un nifto de 3 aftos en Antofagasta, Chile 11 Rev. chil. pediatr. - 2000. -71, 5. - Santiago set. http://dx.doi.org/10.4067/S0370-41062000000500009.
Sagua H, Fuentes A., Soto J, Delano B. [Human diphyllobotriasis due to Diphyllobothrium pacificum in Chile. An experience with 11 cases] // Rev. Med. Chil. - 1979. - 107, l.-P. 16 - 19. (in Spanish).
Sagua H, Miranda E., Fuentes A., Vladillo V. Diphyllobothrium pacificum (Nybelin, 1931) Margolis, 1956. First two human cases of infection in Northern Chile // Bol. Chile. Parasit. - 1976. - 31, 1-2. - P. 33.
Sagua H„ Neira L, Araya J., Gonzalez J. Nuevos casos de infeccidn humana por Diphyllobothrium pacificum (Nybelin, 1931) Margolis, 1956 en Chile у su probable relacidn con el fendmeno de El Nifto, 1975-2000 11 Bol. chil. parasitol. - 2001. - 56, 1-2. - P. 22 - 25. Santiago ene. http://dx.doi.org/10.4067/S0365-94022001000100006. (in Spanish).
Scholz T, Kuchta R. Fish-borne, zoonotic cestodes (Diphylloboyhrium and relatives) in cold climates. A never-ending story of neglected and (re)-emergeny parasites 11 Food & Waterborne Parasitol. - 2016. - 4. - P. 23-38.
Skerikova A., Braber J, Kuchta R, Jimenez J. A, et al. Is the human-infecting Diphyllobothrium pacificum a valid species or just a South American population of the Holarctic fish broad tapeworm D. latum? // Am. J. Trop. Med. Hyg. - 2006. - 75, 2. - P. 302 - 310.
Tantaledn И M. Algunos helminthos de mamiferos marines del Peru у su importancia mddica // Rev. Per. Med. Trop. - 1993. - 7, 1. - P. 67-71. (in Spanish).
Tantaledn M., Atencia G. Nota sobre parasitismo intestinal diagnosticado en el Institute de Medicina Tropical Daniel Alcides Carridn I I Rev. Per. Med. Trop. - 1993. - 7, 2. - P. 99 - 103. (in Spanish).
Torres P., Figueroa L., Franjola R. Pseudophyllidea in the South of Chile. IX. Types of plerocercoids in trouts from five lakes and new cases of Diphyllobothrium latum in man and D. pacificum in a dog // Int. J. Zoonoses. - 1983.-10, l.-P. 15-21.
Tsuboi T, Torii M., Hirai K. Light and scanning electron microscopy of Diphyllobothrium pacificum expelled from a man // Jap. J. Parasitol. - 1993. - 42. - P. 422 - 428.
126
Род Diplogonoporus Lonnberg, 1892
Синонимы (по: Делямуре и др., 1985):
Krabbea Blanchard, 1894
Cordicephalus Wardle, McLeod et Stewart, 1947 (in part)
Описание (по: Делямуре и др., 1985; Kuchta et al., 2015). Цестоды средних и крупных размеров. Сколекс со щелевидными, расширенными вверху ботриями. В каждом членике обычно два половых комплекта, расположенных в двух правильных рядах на одном поперечном уровне справа и слева от медианной линии. Между ними в части члеников могут быть дополнительные комплекты. Увеличение количества члеников в стробиле у части видов происходит путём их поперечного деления. Половые поры располагаются в продольном ряду в маточном поле. Семенники и желточники находятся в одном медианном и в двух латеральных полях. Яичник двудольчатый, в задней трети сегмента. Матка образует 4-5 петель с каждой стороны от медианной линии, в зрелых члениках имеет розетковидную форму. Яйца толстостенные, с крышечкой. Паразиты млекопитающих. Типовой вид - Diplogonoporus balaenopterae (Lonnberg, 1891) L6nnberg, 1892.
Род немногочислен; по разным данным, включает не более 3-4 видов. Взрослые формы Diplogonoporus - паразиты кишечника морских млекопитающих, встречаются также у наземных животных, включая норок, собак. D. balaenopterae известен как паразит человека.
Diplogonoporus balaenopterae (L6nnberg, 1891) Lonnberg, 1892 [-Bothrioce-phalus balaenopterae L6nnberg, 1891; -Bothriocephalus sp. Ijima et Kurimoto, 1894; -Krabbea grandis Blanchard, 1894; =Bothriocephalus grandis (Blanchard, 1894) Braun, 1895; ^Diplogonoporus grandis (Blanchard, 1894) Liihe, 1899] (рис. 67 - 70).
Синонимы приведены по работе: Делямуре и др., 1985. Р. Брэй (Bray, 2010) указывает для D. balaenopterae 2 синонима.* Diplogonoporus brauni Leon, 1907 и D. fukuokaensis Kamo et Miyazaki, 1970. Перевод D. brauni в синоним D. balaenopterae достаточно сомнителен, если учесть, что первый из них описан по плероцеркоидам, обнаруженным у человека в Румынии (Leon, 1907), а второй является паразитом китов, не обитающих в Чёрном море. Как в таком случае мог заразиться житель Румынии китовым паразитом, - не понятно. В справочно-информационной сводке «Fauna Europeae».* Diplogonoporus brauni Leon, 1907 фигурирует как валидный вид (www.faunaeur.org/full_ result. php?id=412107).
D. balaenopterae впервые описан по экземплярам от сейвала из Норвегии под названием Bothriocephalus balaenopterae LSnnberg, 1891 (Lonnberg, 1891). Видовое название цестоды происходит от латинского названия рода хозяина: Balae-noptera - киты-полосатики. В 1892 г. тот же автор (Lonnberg) обосновал для этого вида новый род Diplogonoporus с типовым видом D. balaenopterae.
В 1894 г. в Японии в префектуре Нагасаки у местного жителя были обнаружены цестоды, очень похожие на Diplogonoporus balaenopterae, но авторы находки определили их как Bothriocephalus sp. (Ijima, Kurimoto, 1894). P. Бланшар (Blanchard, 1894) перевёл этого паразита в созданный им новый род Krabbea под названием К. grandis. Буквально через 5 лет в Германии (Liihe, 1899) и Японии (Kurimoto, 1900) данного гельминта перевели в род Diploponoporus, и многие десятилетия во всех монографических и других работах, посвящённых дифиллоботриидам, и особенно диплогонопорам, паразит упоминался под названием D. grandis.
127
В 1960-е годы Р. Рауш (Rausch, 1964), изучив материал по D. balaenopterae от горбатого кита, или, как его ещё называют, горбача (воды Калифорнии), кита неопределённого вида (воды штата Вашингтон) и домашней собаки (Аляска), заключил, что D. grandis является синонимом D. balaenopterae. «D. grandis есть ни что иное как D. balaenopterae в необычном хозяине (человеке) и поэтому должен считаться его синонимом» (стр. 1055). Однако D. grandis описывался только от человека, причём в те годы за пределами Японии не был известен, а такого материала в распоряжении Р. Рауша не было.
В отличие от выше цитйруемого автора, С. Л. Делямуре и А. С. Скрябин (1986) детально изучили не только имеющиеся в их распоряжении экземпляры D. balaenopterae, но и материал по D. grandis от человека, присланный им из Японии проф. X. Камо. Результаты этого исследования, а также анализ литературных данных позволили им придти к выводу об идентичности названных видов. Этот вывод в последующем был подтверждён результатами молекулярно-филогенетического анализа сравниваемых видов и других представителей дифиллоботриид (Pastor-Valle et al., 2014; Yamasaki et al., 2012). Более того, выяснилось, что D. balaenopterae наиболее близко связан с Diphyllobothrium stemmacephalum (Yamasaki et al., 2012).
Рис. 67 Diplogo-noporus balaenopterae'. 1 - сколекс, латерально; 2 - то же вентрально; 3 - передний участок стробилы со сколексом и псевдосколексом; 4 - половозрелый членик; 5 - часть поперечного разреза членика в области яичника; 6 - сагиттальный разрез членика (из: Делямуре и др., 1985 - разные авторы)
128
Рис. 68 Diplogonoporus balaenopterae из собаки: 1 - сколекс цестоды, видно поперечное членение сегментов; 2 - членик, вентрально (из: Rausch, 1964)
В литературе можно найти более или менее подробные описания морфоанатомических особенностей D. balaenopterae от самых разных хозяев - китов, домашней собаки, человека (Делямуре, Скрябин, 1986; Делямуре и др., 1985; Faust, 1949; Hatsushika et al., 1994; Kuchta et al., 2015; Rausch, 1964).
Черви очень крупные, длиной до 27 м (Kuchta et al., 2015). Сколекс очень маленький, округлый, овально-яйцевидный, несколько уплощённый в латеральном направлении, размерами (по разным данным) 0.8 - 1.5 х 0.65 - 1.6, 1.5 х 1.32, 2.5 х 1.3 мм. Ботриальные щели очень глубокие, расширенные спереди, простираются по всей длине сколекса, их нежные края могут заворачиваться как внутрь, так и наружу. Шейка короткая, тонкая, иногда почти не заметна. Членики краспедотные, обычно диплогонадные, с зазубренными латеральными краями, глубокими поперечными бороздами. Близ сколекса несколько расширенный передний участок стробилы собран в глубокие поперечные складки, образуя так называемый псевдосколекс, являющийся отличительной чертой данного вида. Вдоль стробилы на её вентральной и дорсальной поверхностях тянутся восемь продольных борозд приблизительно на равных расстояниях друг от друга. В углублениях третьей и шестой борозды (считая от любого латерального края тела) вентрально и субмедианно открываются половые поры: впереди - мужская, за ней - отверстие вагины и далее назад - маточная пора, иногда окружённая щелевидной складкой тегумента. Лате-рально от каждой из этих борозд расположены две, а медианно - одна борозда. Слой кортикальной паренхимы почти полностью вытеснен лежащими в нём желточными фолликулами. Внутренняя продольная мускулатура развита хорошо, поперечная и дорсовентральная - хуже. Основные продольные каналы экскреторной системы расположены по одному в каждой латеральной зоне медуллярной паренхимы, примерно на середине расстояния между бурсой цирруса и нервным стволом. Семенники овально вытянутые, несколько сплющенные в переднезаднем направлении, лежат в один слой в мозговой паренхиме латеральных и медианного полей, не прерываясь в медианном. Позади женских гонад и дорсально от бурсы семенники отсутствуют. В одном членике примерно от 1700 до 2000 семенников. Бурса цирруса грушевидная, тонкостенная, размером (по разным авторам) 0.430 х 0.215, 0.53 х 0.28, 0.35 х 0.21, 0.33 - 0.6 х 0.18 - 0.3 мм. Дно бурсы шаровидное, с утолщённой стенкой, наружная поверхность которой не упирается в слой продольной мускулатуры, хотя и связана с последней пучком мускульных волокон. Семяпровод впадает в расположенный у задней границы бурсы шаровидный или оваль-129
ный толстостенный семенной пузырёк размером (по разным данным) 0.15 - 0.16, 0.18 х 0.11, 0.1 - 0.16 х 0.14 - 0.33, 0.054 - 0.15 х 0.078 х 0.16, 0.2 х 0.15 или же 0.11 -0.15 х 0.06 - 0.12 мм. Яичник сетчатый, состоит из двух долей, соединённых узким перехватом; расположен у заднего края членика. Лопасти яичника простираются в мозговой паренхиме вентрально от семенников. Желточные фолликулы мелкие, многочисленные, лежат в кортикальной паренхиме медианного и латеральных полей, несколько перекрывают края маточных петель. Тонкостенная вагина начинается позади яичника, проходит вентральнее матки и, загибаясь на вентральную поверхность, открывается непосредственно позади бурсы. Начальный участок матки спирально закручен, а конечный, содержащий созревшие яйца, образует по обе стороны от медианной линии 3-5-8 петель, из которых последняя обычно
расположена позади полового отверстия, иногда почти достигает переднего края членика. Количество петель зависит от возраста и репродуктивного состояния стробилы. Яйца сравнительно тонкостенные, широкоовальные, тёмно-коричневого
цвета (рис. 69).
Рис. 69 Diplogonoporus balaenopterae, яйцо (из: Faust, 1949, как Diplogonoporus grandis)
Размеры яиц, приводимые разными авторами, укладываются в пределы 56.3 - 81 х 34 - 53 цт (табл. 4). Толщина скорлупы 1.7 - 2.8 (2.3) pm (Katsushika et al., 1994). Крышечка плохо заметна. Корацидий расположен в центре яйца.
Табл. 4 Размеры яиц Diplogonoporus balaenopterae (в цт), по данным разных авторов
Длина яиц Ширина яиц Автор публикации
62-72 53 Baer, 1932
63-68 50 Faust, 1949
65.5-92.1 44-51.2 Hilliard, 1960 (хозяин - собака)
63 - 74 (в среднем 68) 39 - 52 (в среднем 43) Rausch, 1964 (хозяин - собака)
66.4 45.4 Rausch, 1964 (хозяин - горбач)
56.3-65 40-45 Ichihara et al., 1968
59.4-81.0 35.1-51.3 Majeima et al., 1969
57-61 38-42 Делямуре и др., 1985
59.2-72.9(65.3) 45.1-51.4(48.2) Hatsushika et al., 1994
57-80 34-46 Chung et al., 1995
57-71.2 38.4-42.7 Clavel et al., 1997
Детали жизненного цикла D. balaenopterae всё ещё не ясны, но предполагается, что он протекает по обычной для дифиллоботриид схеме. Первые промежуточные хозяева в природе не известны, однако экспериментальным путём было установлено, что ими вполне могут быть морские веслоногие ракообразные (Kamo et al., 1972, 1973). Исследователи инкубировали яйца цестоды в морской воде при 25 - 27°С и через 4-5 суток в них развивались корацидии, выживавшие при этой температуре в течение 25 - 35 ч. При температуре ниже 15 и выше 30°С наблюдалась высокая смертность личинок. В физиологическом растворе корацидии погибали через несколько минут, в водопроводной воде - сразу же. Полученных в эксперименте корацидиев скормили морским копеподам Oithonia папа и Labidocera ja-130
ponica, широко распространённым в морях, омывающих Японские о-ва. Выяснилось, что в организме копепод онкосферы через 3 ч проникали через стенку кишечника в полость их тела, где в течение 9-10 дней развивались в процеркоид.
Дополнительный хозяин D. balaenopterae - морские рыбы, а окончательный -полосатик малый, финвал, сейвал, или кит ивасёвый, кит синий, или блювал, кит горбатый, или горбач, у которых паразита регистрируют в Северном и Южном полушариях (Делямуре, Скрябин, 1986; Делямуре и др., 1985). Помимо того, цестоду находили у спонтанно заражённых собак (Hilliard, 1960; Rausch, 1964) и кошки (Scholz, Kuchta, 2016). Известен этот вид и у человека.
Самое первое сообщение о находке диплогонопора у человека датируется 1894-м годом. Его авторы (Ijima, Kurimoto, 1894) описали цестоду, обнаруженную Накамурой (Nakamura) в 1892 г. у 28-летнего жителя префектуры Нагасаки на о. Кюсю в Японии, под названием Bothriocephalus sp. Как отмечено выше, данный вид от человека впоследствии описывался под названиями Krabbea grandis, Bothriocephalus grandis и, наконец, Diplogonoporus grandis. Последний в настоящее время рассматривают синонимом D. balaenopterae (Делямуре, Скрябин, 1986) (рис. 70).
Рис. 70 Diplogonoporus balaenopterae', 1 - 2 - сколекс цестоды (/ - из человека, 2 - из сейвала), 3 -4 - парасагиттальный разрез членика цестоды (3 - из человека, 4 - из сейвала) (из: Делямуре, Скрябин, 1986; 3 - рисунок по фотографии от проф. X. Камо)
После первого сообщения о находке дип-
логонопора у человека (1894-й год), к 1993 г., т.е. практически за 100 лет, в Японии было выявлено 183 подобных случая (Suzuki et al., 1993). Однако вполне возможно, что реальное количество людей, заразившихся диплогонопорами, было выше официально приводимых цифр. Так, в одной из статей её авторы (Kamegai et al., 1968) писали, что из 8 известных им случаев заражения людей в Нагасаки и Сизуоке три не были опубликованы. Тем не менее, исходя из выше указанной цифры (183), в год в Японии в среднем фиксировалось 1.8 случая. На этом фоне весьма неожиданно выглядят данные о 27 случаях инвазии людей диплогонопором, зарегистрированных в этой стране за последующие 1993 - 1994-й годы, т. е. всего за два года (Ando et al., 1993; Harada et al., 1993; Nakamura et al., 1993; Terada et al., 1993, а также Akao et al., 1994; Hatsushika et al., 1994; Kawada et al., 1994; Maejima et al., 1994).
И совсем уж невероятное, даже для Японии, число пострадавших было зафиксировано в 1996 г. на тихоокеанском побережье страны в префектуре Сизуока:
131
46 человек, причём в основном лица старше 50 лет (Kino et al., 2002). Все выявленные случаи пришлись на период с мая по сентябрь, но большинство из них наблюдалось в июне - июле. В этот период в регионе идёт сезонный лов анчоуса японского, употребляемого местными жителями в пищу предпочтительно в сыром виде. Вероятнее всего, пресловутый анчоус и стал источником заражения людей.
Случаи заражения людей D. balaenopterae в Японии продолжают фиксировать и в нынешнем столетии (см., напр., Arizono et al., 2008; Kamimura, Matsuse, 2001; Kawai et al., 2013; Nishimura et al., 2007; Sato, 2005; Yamasaki et al., 2007).
Вплоть до конца 20-го столетия Япония оставалась единственной в мире страной, где одного из представителей рода Diplogonoporus - D. grandis регулярно регистрировали у человека. Единственный случай находки диплогонопора у человека вне Японии, известный к тому времени, это - обнаружение паразита у чилийского моряка (Wilhelm, 1968). Учитывая специфику работы пострадавшего, «привязывать» данный случай к какому-либо региону не имеет смысла.
Однако в 1995 г. появилось первое сообщение об обнаружении этого гельминта у жителя Кореи (Chung et al., 1995). Пациентом оказался 41-летний мужчина, у которого самопроизвольно выделился фрагмент стробилы длиной около 100 см. После изучения морфологических особенностей члеников стробилы и анализа литературных данных исследователи определили паразита как D. balaenopterae. Примечательно, что при лабораторном обследовании пациента все показатели у того были в норме, за исключением лёгкой эозинофилии (6 %) и экстраординарно высокого содержания иммуноглобулина Е (IgE) (10.182 кЕ/мл), обычно обнаруживаемого в крови в незначительных количествах. По словам пострадавшего, при застолье в качестве закуски к выпивке была сырая морская рыба.
В 1997 г. стало известно о заражении D. balaenopterae местного жителя в Испании (Clavel et al., 1997). Это был первый случай регистрации данного гельминта у человека далеко за пределами Дальнего Востока. 58-летний мужчина, любитель сырой рыбы, не покидавший в течение последних 20 лет пределов своей родной Сарагосы, вдруг обнаружил у себя в стуле короткое звено из зрелых члеников цестоды. В качестве лечебного препарата ему назначили парамомицина сульфат из расчёта 50 мг • кг'1, разделённый на 3 дозы, которые он принял в течение одного дня, а также слабительное на ночь. На первый и второй день у пациента вышло несколько фрагментов разрушающейся стробилы, на 3 и 4-й день обнаруживались только яйца цестоды. На 25-й день после предпринятого лечения выделилась длинная цестода со сколексом, незрелыми, зрелыми и маточными проглоттидами, которую определили как D. balaenopterae. Скорее всего, как предполагают авторы публикации, заражение человека произошло с импортируемой из Юго-Восточной Азии рыбой, выживаемость в которой инвазионных личинок цестоды свидетельствует об устойчивости паразита к тем условиям, при которых транспортируется такая рыба.
И ещё один аналогичный случай имел место также в Испании (Pastor-Valle et al., 2014). На этот раз 54-летний житель Касереса (запад центральной Испании) обратился к врачу по поводу выделившихся члеников цестоды. По словам пациента, он регулярно ест копчёного лосося и выращиваемого на морских фермах спара золотистого, или дорадо. К слову, в Испании запечённый с головой спар золотистый с лимоном и травами - излюбленное обеденное блюдо. В результате макро- и микроскопического исследования обнаруженные проглоттиды были определены как принадлежащие Diphyllobothrium sp. Фрагменты стробилы зафиксировали в
132
формалине, а затем вместе с материалом по другим дифиллоботриидам, также обнаруженным у людей в Испании, исследовали с применением митохондриальных и ядерных маркёров. В результате выяснилось, что в действительности пациент в Касересе был заражён, как написали авторы: Diplogonoporus - balaenopterae или grandis. И далее они пришли к выводу, что на данном уровне наших знаний эти виды следует рассматривать как синонимы.
Изложенная выше информация невольно наводит на мысль, что в перспек
тиве можно ожидать новых случаев заражения человека диплогонопорами в самых разных регионах мира, вне зависимости от их географического положения.
Обычно у людей выделяются половозрелые черви, в члениках которых содержатся многочисленные яйца, но иногда обнаруживают цестод, ещё не достигших половозрелости (см., напр., Kamegai et al., 1968). Длина выявленных стробил впечатляет: в отдельных случаях она достигает 150 - 300 см (рис. 71). Известен случай выделения у пациента после лечения 6-метровой стробилы (Nishimura et al.,
2007).
Рис. 71 Diplogonoporus balaenopterae, фрагмент стробилы длиной 170 см из человека (из: Katsushika et al., 1994, как D. grandis)
Примечание: второй фрагмент стробилы, полуразрушенной вследствие приема пациентом лекарства, достигал в длину 130 см.
В большинстве случаев инвазия людей диплогонопорами асимптоматична и практически не имеет присущих только ей особенностей. Например, 65-летний житель префектуры Окаяма, у которого спонтанно вышел фрагмент стробилы D. balaenopterae (,~D. grandis), чьё изображение можно лицезреть на рис. 71 (Hatsushika et al., 1994), не испытывал никаких неприятных симптомов, за исключением зуда в анальной области, появившегося за 3 дня до выхода паразита. О незначительных клинических проявлениях инвазии у 42-летнего мужчины, у которого вышло два фрагмента стробилы общей длиной 100 см, пишут и С. Камегаи с соавт. (Kamegai et al., 1968). Однако иногда пациенты могут жаловаться на диарею, потерю веса, усталость (Ichihara et al., 1968), что, впрочем, довольно часто встречается у людей при различных кишечных гельминтозах. Э. Фауст (Faust, 1949) среди симптомов заражения называет абдоминальные колики, диарею, чередующуюся с запорами, учащённый пульс (120), прогрессирующую вторичную анемию.
Единственный путь попадания плероцеркоидов D. balaenopterae в организм человека - трофический. Практически все пациенты сообщали о предпочтительном употреблении ими в пищу морской рыбы или головоногих моллюсков в сыром виде. К примеру, 56-летний пациент из префектуры Сизуока, у которого выделилось два червя длиной 100 и 195 см, по еголсловам, предпочитал употреблять в пищу сырую рыбу, прежде всего, псенопса японского и луну-рыбу (Ichihara et al., 1968).
133
Другой пациент любил сырое мясо акулы и таких рыб, как ставрида японская и желтохвост, а также мясо каракатицы (Hatsushika et al., 1994). Третий, 64-летний японец, обнаруживший у себя выходящие из ануса куски цестоды, обычно ел морскую рыбу, так называемую whitebait, в сыром виде (Kawai et al. 2013). К слову, whitebait - собирательное название для молоди рыбы, размером 2.5 - 5 см, которую едят целиком с различными приправами.
Подобных примеров можно привести множество, но суть их одна - источником инвазии людей диплогонопорами является сырая морская рыба, в том числе лосось, сельдь-круглобрюшка, сардина дальневосточная, анчоус японский, ставрида японская, скумбрия восточная, тунец полосатый, желтохвост, а также головоногие моллюски - кальмар тихоокеанский и каракатица, составляющие основу традиционного японского блюда sashimi.
Учитывая изложенное выше, полагаю, что следует согласиться с мнениями тех исследователей, которые рассматривают D. balaenopterae случайным для человека паразитом (Hoffman, 1970; Meyer, 1970). Действительно, в заражении людей этим гельминтом, облигатными хозяевами которого являются киты, решающую роль играет случай: оказалась в меню заражённая рыба, съел её человек в необработанном виде и попал к нему плероцеркоид. При этом даже если цестода в организме человека достигает половозрелого состояния и продуцирует яйца, попадающие с его фекалиями во внешнюю среду, для паразита это - тупик, поскольку первого промежуточного хозяина, морских копепод, рядом нет, да и быть не может.
Diplogonoporus brauni Leon, 1907 (рис. 72). В 1907 г. известный румынский паразитолог Н. Леон сообщил о находке у мужчины в Румынии плероцеркоида длиной 29 см, имевшего вид толстой сероватой ленты. Червь характеризовался отсутствием шейки, двойным набором половых органов, относительно короткими и широкими проглоттидами, атрофированными, по словам автора, в терминальной части настолько, что невооружённым глазом его можно было принять за головку и шейку цестоды (Leon, 1907). И хотя взрослая форма паразита не была известна, тот был описан как новый вид - Diplogonoporus brauni Ьёоп, 1907. К слову, червь встретился у человека совместно с лентецом широким. В 1910 г. тот же автор описал ещё одну находку D. brauni в Румынии (Leon, 1910). И в том, и в другом случа-
ях пациенты жаловались на анемию.
Рис. 72 Diplogonoporus brauni: А - общий вид червя; В - передний конец тела (из: Faust, 1949 - по: Ьёоп, 1907)
Как сказано выше, Diplogonoporus brauni в 1929 г. перевели в род Digramma, который некоторые исследователи рассматривают синонимом рода Ligula.
В справочно-информационных сводках «Global Biodiversity Information Facility» (www.gbif.org/
134
species/441385) и «World Register of Marine Species» (Bray, 2010) D. brauni отнесён к синонимам Diplogonoporus balaenopterae. Однако в «Fauna Europeae» D, brauni L6on, 1907 указан как валидный вид.
Именно по причине разночтений относительно родового и видового статуса Diplogonoporus brauni я привожу краткую информацию по данному виду, которую удалось собрать. Кстати, более данного паразита никто не находил, хотя упоминают его в публикациях довольно часто, особенно в тех, где речь идёт о паразитах человека (см., напр., Lamothe-Argumedo, Garcia Prieto, 1985; Muller, 2002).
Цитируемая литература
Делямуре С. К., Скрябин А. С, Об идентичности видов Diplogonoporus balaenopterae и Diplogonoporus grandis (Cestoda: Diphyllobothriidae) // Паразитология. - 1986. - 20, 1. - С. 69 - 72.
Делямуре С. К., Скрябин А. С., Сердюков А. М, Дифиллоботрииды - ленточные гельминты человека, млекопитающих и птиц / Отв. ред. В. Е. Судариков. // Основы цестодологии. - М.: Наука, 1985. - 11. -200 с.
Akao S, TakahashiA., Mikami S.t Mikami F. et al. Four human cases of diplogonoporiasis И Japan. J. Parasitol. - 1994. - 43, (Suppl.). - P. 122. (In Japanese).
Ando K, Sato Y., Miura K, Chinzei Y., Sakai T., Noda M. Second case of human infection with Diplogonoporus grandis in Mie Prefecture // Mie Med. J. - 1993. - 43,2. - P. 215 - 217.
Arizono N., Fukumoto S„ Tademoto S, Yamada M,t Uchikawa R, et al. Diplogonoporiasis in Japan: genetic analyses of five clinical isolates // Parasitol. Int. - 2008. - 57, 2. - P. 212 - 216.
Baer J. C. Contribution i 1’etude des cestodes de cdtacds // Rev. Suisse Zool. - 1932. - 39. - P. 195 - 228. Blanchard R. Notice sur les parasites de I’homme IV. Sur le Krabbea grandis, et remarques sur la classification des Bothrioc^phalinds // Compt. Rend. Soc. Biol. Paris. - 1894. - 46. - P. 699 - 702.
Bray R. (2010). Diplogonoporus balaenopterae (LOnnberg, 1892). Accessed through: World Register of Marine Species at http://www.marinespecies.org/aphia.php?p=taxdetails&id=l 05209.
Chung D. I., Kong H H, Moon C. H, Choi D. W. et al. The first human case of Diplogonoporus balaenopterae (Cestoda: Diphyllobothriidae) infection in Korea I I Korean J. Parasitol. - 1995. - 33, 3. - P. 225 - 230. http://dx.doi.Org/10.3347/kjp.1995.33.3.225.
Clavel A., Bargues M. D.t Castillo F. J., Rubio M. D„ Mas-Coma S. Diplogonoporiasis presumably introduced into Spain: first confirmed case of human infection acquired outside the Far East // Am. J. Trop. Med. Hyg. - 1997. - 57, 3. - P. 317 - 320.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 273 - 274.
Harada K, Mitsuyama K.t Nishiyama T., Ban S. et al. A case of two individuals infection of Diplogonoporus grandis in Kurume City, Kyushu // Clinical Parasitol. - 1993. - 4. - P. 119 - 123 (In Japanese).
Hatsushika R., Okino T., Matsuda S, Case study of human infection with Diplogonoporus grandis (Cestoda: Diphyllobothriidae) found in Okayama Prefecture, Japan // Kawasaki Med. J. - 1994. - 20. - P. 125-131.
Hilliard D. K. Studies on the helminth fauna of Alaska. XXXVIII. The taxonomic significance of eggs and coracidia of some diphyllobothriid cestodes // J. Parasitol. - 1960. - 46, 6. - P. 703 - 716.
Hoffman G. L. Incidental aquatic zoonoses H J. Wildl. Dis. - 1970. - 6. Proc. Ann. conf. - P. 272.
Ichihara A., Kamegai S, Suguro T., Suzuki N. One more case of human infection with Diplogonoporus grandis // Res. Bull. Meguro Parasitol. Mus. - 1968. - No. 2. - P. 44.
Ijima J„ Kurimoto T. On a new human tape-worm (Bothriocephalus sp.) // J. Coll. Sci. Imp.Univ. Tokyo. -1894. - 6.-P. 372-385.
Joyeux C E, Baer J. G. Les cestodes raresde I’homme//Bull. Soc. Pathol. Exot.- 1929. -22. -P. 114-136. Kamegai S, Ichihara A.t Nonobe H, Hara T. A case of human infection with the immature worm of Diplogonoporus grandis II Res. Bull. Meguro Parasitol. Mus. - 1968. - No. 2. - P. 18.
Kamimura K, Matsuse. Two cases of human infection with Diplogonoporus balaenopterae in Toyama Prefecture // Med. Entomol. Zool. - 2001. - 52 (Suppl., P3). - P. 78. http://doi.org/10.7601/mez.52.78__3.
Kamo H, Iwata S, Hatsushika R.t Maejima J. Experimental studies on the life-cycle of Diplogonoporus grandis, I. Embryonation and hatching of the egg I I Japan. J. Parasitol. - 1972. - 21, 2. - P. 59 - 69.
Kamo H, Iwata S, Hatsushika R., Maejima J. Experimental studies on the life-cycle of Diplogonoporus grandis, II. Experimental infection of marine copepods with coracidia // Japan. J. Parasitol. - 1973. - 22, 1. - P. 79 - 89. (In Japanese, English summary).
135
Kawada К., Kawamura N, Shiba Y., Shigematsu T. et al. Additional 4 cases of diplogonoporiasis in Shizuoka Prefecture I I Japan. J. Parasitol. - 1994. - 43. - P. 72 (In Japanese).
Kawai S„ Ishihara Y., Sasai T, Takahashi F, et al. A case of cestode infection caused by Diplogonoporus balaenopterae most likely due to the consumption of raw whitebait 11 Dokkyo J. Med. Sci. - 2013. - 40, 3. -P.189- 192. (In Japanese), https://www.researchgate.net/publication/289340238.
Kino H., Hori W., Kobayashi H., Nakamura N., Nagasawa K. A mass occurrence of human infection with Diplogonoporus grandis (Cestoda: Diphyllobothriidae) in Shizuoka Prefecture, central Japan // Parasitol. Int.-2002.-51, l.-P. 73-79.
Kuchta R, Scholz T, Brabec J., Bray R. A. Suppression of the tapeworm order Pseudophyllidea (Platyhel-minthes: Eucestoda) and the proposal of two new orders, Bothriocephalidea and Diphyllobothriidea I I Int. J. Parasitol. - 2008. - 38, 1. - P. 49 - 55.
Kuchta R, Scholz T, Brabec J., Narduzzi-Wicht B. 17. Diphyllobothrium, Diplogonoporus, and Spirometra I Biology of Foodbome Parasites. Section III. Important Foodbome Helminths. - Xiao L., Ryan U., Feng Y. Eds. - CRC Press, 2015. - P. 299 - 326.
Kurimoto T. Diplogonoporus grandis (R. Blanchard). Beschreibung einer zum ersten Male im menschlichen Darm gefunden. Art Bothriocephalus // Zeitschr. Klin. Med. - 1900. - 40, 1. - P. 1 - 16.
Lamothe-Argumedo R., Garcia Prieto L. Cestodes, parasites del hombre // Salud. Publ. Mexico. - 1985. -27, 5.-P. 420-435.
Leon N. Diplogonoporus brauni II Zool. Anz. - 1907. - 37. - P. 376 - 379.
Ьёоп N. Un nouveau cas de Diplogonoporus brauni I I Centrlbl. Bakteriol. Abt. Orig. - 1910. - 55. - P. 23 - 27.
Lonnberg E. Mittelungen Uber einige Helminthen aus dem zoologischen Museum der Universitat zu Kristia-nia I I Biol, fbren. fbrhandl. Stockholm. - 1891. - 3,4/6. - P. 64 - 78.
Lonnberg E. Anatomische Studien Uber skandinavische Cestoden. II. Zwei Parasiten aus Walfischen und zwei aus Lamna cornulica II Kgl. sven. vetenskapsakad. hand!. - 1892. - 24, 2. - P. 4 - 28.
Liihe M. Zur Anatomie und Systematik der Bothriocephaliden I I Verhandl. Deut. Zool. Ges. - 1899. - 9, 1. -P. 30-55.
Maejima J., Yazaki S, Fukumoto S, Tanihata T. et al. Three cases of diplogonoporiasis in Tottori Prefecture I I Japan. J. Parasitol. - 1994. - 43, (Suppl.). - P. 134. (In Japanese).
Meyer M. C. Cestode zoonoses of aquatic animals I I J. Wildl. Dis. - 1970. - 6, Proc. Ann. Conf. - P. 249 -254.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 69.
Nakamura N, Nakayama J., Shimazu T, Kojima K, Uchikawa R, First two cases of diplogonoporiasis grandis from Nagano Prefecture, Japan I I Japan. J. Parasitol. - 1993. - 42. - P. 434 - 437.
Nishimura Y., Yamaguchi S, Sahara T, Nagazaki Y. et al. Two cases of intestinal cestode infections diagnosed by genetic analysis // Clin. Parasitol. - 2008. - 18. (in Japanese) (цит.по: Yamasaki et al. 2007).
Pastor-Valle J., Gonzalez L. M., Martin-Clemente J. D., Merino F. J. et al. Molecular diagnosis of diphyllobothriasis in Spain, most presumably acquired via imported fish, or sojourn abroad // New Microbe New Infect. - 2014. - 2. - P. 1 - 6. doi. 10.1002/2052-2975.28.
Rausch R L. Studies on the helminth fauna of Alaska. XL1. Observations on cestodes of the genus Diplogonoporus LUnnberg, 1892 (Diphyllobothriidae) 11 Canad. J. Zool. - 1964. - 42, 6. - P. 1049 - 1069. http: 11 digitalcommons.unl.edu/parasitologyfacpubs/527 или 10.1139/z64-103.
Sato Y. Recent state of parasitoses in Japan. Epidemiology and clinicians // JMAJ. - 2005. - 48, 3. - P. 148 — 154.
Scholz T, Kuchta R. Fish-borne, zoonotic cestodes (Diphylloboyhrium and relatives) in cold climates. A never-ending story of neglected and (re)-emergeny parasites // Food & Waterborne Parasitol. - 2016. - 4. - P. 23 - 38. http://dx.doi.Org/10.1016/j.fawpar.2016.07.002.
Suzuki N, Imamura K, Kumazawa H. Diplogonoporiasis in Kochi Prefecture between 1991-92 // Japan. J. Parasitol. - 1993. - 42. - P. 123 - 127. (In Japanese, English summary).
Wilhelm O. Pseudophyllides (Diphyllobothrium у Diplogonoporus) en Chile // Bol. Soc. Biol. Concepcidn. -1958. - 33. - P. 125 - 130 (цит. no: Scholz, Kuchta, 2016).
Terada M., Kino H., Ishii A., Sano M. Twelve cases of Diplogonoporus grandis infection in Shizuoka Prefecture, Japan // Clinical Parasitol. - 1993. - 4. - P. 124-126 (In Japanese).
Yamasaki H„ Nakaya K, Nakao M., Sako Y., Ito Л. Significance of molecular diagnosis using histopathological specimens in cestode zoonoses 11 Trop. Med. Health. - 2007. - 35, 4. - P. 307 - 321.
Yamasaki H., Ohmae H., Kuramochi T. Complete mitochondrial genomes of Diplogonoporus balaenopterae and Diplogonoporus grandis (Cestoda: Diphyllobothriidae) and clarification of their taxonomic relationships//Parasitol. Int. -2012. -61, 2. -P. 260-266. doi: 10.1016/j.parint,2011.10.007.
136
Род Ligula Bloch, 1782
Род Ligula ранее включали в состав семейства Ligulidae (Гаевская, 2006; Дубинина, 1962, 1966; Определитель, 1987). В настоящее время его рассматривают в семействе Diphylloboth-riidae (см.: Bray, 2010), правомочность вхождения в состав которого подтверждают и молекулярно-генетические данные (Logan et al., 2004). Тем не менее, отдельные авторы по-прежнему относят Ligula к Ligulidae (Жохов, Пугачева, 2012; Пронина, Пронин, 2013).
В половозрелом состоянии лигулы паразитируют у рыбоядных птиц, и их практически никогда не относили к числу опасных для здоровья человека. Однако в последние годы этих цестод все чаще упоминают как возможных возбудителей зоонозов пищевого происхождения (Barson, Marshall, 2003; Lamothe-Argumedo, Garcia Prieto, 1985; Urdej, Hangan, 2013).
Описание (по: Определитель, 1987). Тело цестод мускулистое, ремневидное (отсюда ещё одно их название - ремнецы), нерасчленённое. Типичная головка отсутствует, её функции выполняет передний конец стробилы, на котором находятся дорсальные и вентральные щелевидные ботрии. На небольшом участке переднего конца тела видна ложная членистость (от 24 до 40 ложных члеников), не соответствующая внутренней организации. Вдоль всей поверхности тела с вентральной и дорсальной сторон проходит по одной медианной продольной борозде, более чётко выраженной у плероцеркоидов, чем у взрослых особей. Половые комплексы в стробиле расположены в один неправильный продольный ряд. Семенники, находящиеся в центральной паренхиме, формируют один равномерный слой вдоль стробилы, прерываясь по средней линии в местах расположения половых комплексов. Яичники сетчатого строения, при созревании становятся гроздевидными, располагаются, неправильно чередуясь, по одному в каждом половом комплексе, подковообразно окружая половые протоки с апоральной стороны. Желточные фолликулы лежат в кортикальной паренхиме одним равномерным слоем со всех сторон стробилы, с дорсальной и вентральной сторон прерываются вдоль линии расположения половых комплексов. Половые поры каждого комплекса располагаются в один продольный ряд. Отверстия бурсы цирруса открываются приблизительно на средней продольной линии стробилы; рядом с ними в одну из боковых сторон каждого из них, неправильно чередуясь, выходят отверстия вагины и затем матки. Типовой вид - Ligula intestinalis (Linnaeus, 1758)Gmelin, 1790.
Жизненный цикл лигул включает смену трёх хозяев - первого и второго промежуточного (соответственно ракообразные и рыбы) и окончательного (птицы).
Ligula intestinalis (Linnaeus, 1758) Gmelin, 1790 (рис. 73, 74). Впервые паразит описан под названием Taenia intestinalis Linnaeus, 1758. В справочно-информационной сводке «http://bug.tamu.edu/research/.../hallan/Platyhelminthes/Family/Di-phyllobothriidae.txt» у данного вида перечислено 15 синонимов. Видовое название паразита происходит от латинского intestini - кишечник: intestinalis - кишечная. В русскоязычной литературе цестоды рода Ligula и входящие в его состав виды получили название ремнецов, a Ligula intestinalis - ремнеца обыкновенного.
Небольшая ремарка. В работах мексиканских исследователей (Lamothe, Cruz, 1972; Lamothe-Argumedo, Garcia Prieto, 1985) первооткрывателем вида по неизвестной причине назван не К. Линней: Ligula intestinalis (Goeze, 1782).
Взрослые цестоды иногда достигают 140 см в длину, при ширине не более 12 мм. Передние половые комплексы у взрослых особей располагаются несколько позади зоны ложных члеников, число которых варьирует от 24 до 40, но чаще их 30
137
- 32. Внутри тела метамерно расположено от 700 до 2000 комплектов половых органов. Матка в виде сильно извитой трубки. Яйца овальной формы, с крышечкой на одном полюсе, размеры яиц 60 - 70 х 40 - 50 цт, на выходе из матки яйца не содержат эмбрионов.
УЖ®
Рис. 73 Ligula intestinalis. 1 - поперечный срез через стробилу: а - тегумент; б - слой субтегументальных клеток; в -пучки продольной паренхимной мускулатуры; г - поперечная паренхимная мускулатура; д - зачатки половых протоков; е - зачатки яичника; ж - желточники; з - семенники (из: Дубинина, 1962); 2 - передний конец тела (из: ru.wikipedia.org - Обыкновенный ремнец)
Жизненный цикл Ligula intestinalis включает поэтапную смену трёх хозяев -первого промежуточного, дополнительного, или второго промежуточного, и окончательного. Взрослые черви поселяются в кишечнике рыбоядных и околоводных птиц, в том числе чаек, уток, крачек, поганок, крохалей, бакланов, пеликанов, цапель, чирков и многих-многих других (рис. 74).
Рис. 74 Схема жизненного цикла Ligula intestinalis (из: Дубинина, 1966)
Вместе с экскрементами птиц яйца цестоды попадают в воду. Скорость развития заключённого в них зародыша (кора-цидия) зависит от температуры воды. При температуре 21 -25°С корацидии развиваются в течение 5
- 7 дней, при 16 - 19°С - за 8 - 10, а при 10 - 12°С этот процесс длится 12 - 15 дней. Корацидий - покрытая ресничками личинка, имеющая 3 пары зародышевых
138
крючьев, - выходит из яйца через отверстие, прикрытое крышечкой, и в течение 2 -3 суток свободно плавает в воде, но затем, если не попадёт в соответствующего хозяина, погибает. Первые промежуточные хозяева L. intestinalis - мелкие планктонные ракообразные отрядов Cyclopoida и Calanoida, которые заглатывают свободно плавающих в воде корацидиев. В полости их тела корацидий через 10-29 дней превращается в инвазионного процеркоида (Stefka et al., 2009). Таких заражённых рачков заглатывают рыбы - лещ, густера, вобла, плотва, краснопёрка и другие карповые. В числе дополнительных хозяев L. intestinalis многие десятки видов пресноводных и даже солоноватоводных рыб, питающихся зоопланктоном (Гаевская, 2013; Определитель, 1987). Дальнейшее развитие личинок происходит в брюшной полости рыб. К слову, описан случай аномальной локализации плероцеркоидов лигулы в перикардиальной полости и спинных мышцах молоди краснопёрки одномесячного возраста (Огг, 1968). Весь процесс развития личинки до стадии инвазионного плероцеркоида занимает 10 - 14 и даже до 24 месяцев (Stefka et al., 2009).
Плероцеркоиды белого или слегка желтоватого цвета, с тупым передним концом, ремневидные, очень крупные, их длина фактически равна таковой взрослых особей (рис. 75). На этой фазе у лигул осуществляются основной рост и развитие половой системы, в результате чего инвазионные плероцеркоиды отличаются от взрослых червей только тем, что не продуцируют яйца.
Рис. 75 Ligula intestinalis, плероцеркоид в полости тела рыбы (из: Гаевская 2013)
Установлено, что в организме рыбы паразиты могут со-
хранять жизнеспособность в течение трёх лет и даже более. Заражённая рыба ослабевает и чаще поднимается к поверхности воды, где становится лёгкой добычей голодных птиц - их окончательных хозяев. К тому времени, когда заканчивается формирование плероцеркоида, инвазированная рыба зачастую погибает. Особенно губительна инвазия для молоди рыб (см., напр., Конькова, 2013). '
Поселившиеся в кишечнике птиц плероцеркоиды уже через 2-6 суток развиваются в половозрелых особей, которые начинают продуцировать яйца. Процесс выделения яиц недолог - не более недели, после чего цестоды погибают и с экскрементами птиц выделяются наружу.
Ухудшение товарной кондиции рыбы, снижение её питательной ценности и, наконец, гибель, вызываемая лигулами, несомненно, приводят к серьёзным экономическим потерям в рыбохозяйственной отрасли (Апсолихова, Свешников, 2013; Конькова, 2013; Barson, Marshall, 2003; Sohnet al., 2016 и др.).
139
L. intestinalis обнаружена на всех континентах, включая Австралию, куда была завезена человеком (Жохов, Пугачёва, 2012).
По мнению ряда авторов, кстати, подтверждаемому результатами их исследований с использованием молекулярных маркёров, L. intestinalis представляет собой комплекс из нескольких/многих сильно изолированных линий или даже крип-тических видов (Stefka et al., 2009; стр. 1197: «£. intestinalis complex is likely to be composed of several/many highly isolated lineages or even cryptic species»).
Что касается регистрации этих цестод у человека, то первая документально подтверждённая информация по этому поводу датируется началом 20-го столетия (см. Faust, 1949), когда известный румынский исследователь Н. Леон (Leon, 1907, 1908, 1910) опубликовал описание двух новых видов цестод, обнаруженных у че
ловека.
В 1907 г. он сообщил о находке у мужчины в Румынии плероцеркоида неизвестной дифиллоботриидной цестоды, которая была описана им как новый вид -Diplogonoporus brauni Leon, 1907. В 1910 г. этот же автор сообщил ещё об одной находке данного паразита в Румынии (Leon, 1910).
Французские исследователи (Joyeux, Baer, 1929) не согласились с тем, что данный паразит является представителем рода Diplogonoporus, и предположили, что это, скорее всего, личиночная форма птичьей цестоды, случайно попавшая к человеку с сырой рыбой. На этом основании они перевели D. brauni в род Digram-та Cholodkovsky, 1914 как Digramma brauni. Именно под этим названием - D. brauni описывает паразита в своей монографии Э. Фауст (Faust, 1949; стр. 274 -275), приводя рисунок плероцеркоида, выполненный в своё время Н. Леоном.
Вместе с тем, согласно недавно выполненной ревизии цестод семейства Di-phyllobothrriidae (Kuchta et al., 2008), род Digramma является синонимом рода Ligula. Однако по своим морфоанатомическим характеристикам, о которых, пусть и очень кратко, сообщил первооткрыватель вида (Leon, 1907), Diplogonoporus brauni
никак не может относиться к данному роду.
В 1908 г. появилось ещё одно сообщение всё того же румынского исследователи (Leon, 1908), обнаружившего в 1907 г. у железнодорожного рабочего в Яссах цестоду, которую он описал под названием Braunia jassyensis (сейчас это - синоним Ligula intestinalis) (рис. 76). Червь достигал в длину 18 см и ширину 12 мм и не содержал яиц. Повторно подобный паразит встретился в тех же Яссах в 1916 г. у продавца рыбой.
И, наконец, ещё об одной похожей находке сообщают французские исследователи (Joyeux, Du Noyer, 1931), обнаружившие личинку лигулы в рвотных массах женщины.
Рис. 76 Ligula intestinalis, передний конец тела (из: Faust, 1949 - по: Ьёоп, 1908)
В 1970-м году была опубликована небольшая статья, автор которой обсуждал проблему зоонозного значения цестод из водных животных (Meyer, 1970). При этом речь шла, в основном, о Diphyllobothrium и Spirometra и лишь очень кратко упоминалось о «нескольких случайных сообщениях» (a few incidental host records) трёх видов цестод - Ligula intestinalis, Schistocephalus solidus и Diplogononoporus
140
balaenopterae (ссылки на соответствующие источники в цитируемой статье отсутствовали).
В начале 1970-х годов в США выполнялся проект «Здоровье водных животных» (Aquatic Animal Health), исполнители которого (Poppensiek et al., 1973) по поводу Ligula intestinalis написали буквально следующее (стр. 21): «Ligula intestinalis <...> often infects carnivorous mammals but is rare in humans». Переведём: «Ligula intestinalis часто заражает плотоядных млекопитающих, но редко - человека». Своё утверждение авторы подкрепляли ссылкой на монографическую работу (van der Hoeden, 1964).
С того времени в отдельных справочниках, пособиях, обзорных работах и на некоторых информационных веб-сайтах лигулу упоминают в числе редких, случайных паразитов человека (Barson, Marshall, 2003; Beaver et al., 1984; Eslami, 2006; Hooman et al., 2011; Lamothe-Argumedo, Garcia Prieto, 1985; Ozbek, Oztiirk, 2010). В частности, в обзорной монографии «Worms and Human Diseases» («Черви и болезни человека») её автор (Muller, 2002) отмечает, что L. intestinalis была найдена у человека в Польше (?) и Румынии. Ссылки на источники в данном случае отсутствуют, но, возможно, что говоря о Румынии, автор имел в виду процитированные выше работы румынского исследователя.
М. Барсон и Б. Маршалл (Barson, Marshall, 2003; стр. 1) так комментируют возможность заражения людей L. intestinalis'. «There is concern over human health risks associated with the eating of infected fish, especially when raw or not properly cooked» (Существует обеспокоенность относительно рисков для здоровья человека, связанных с употреблением в пищу заражённой рыбы, особенно сырой или неправильно приготовленной).
В свою очередь, В. Дагне и А. Нуру (Dagne, Nuru, 2016) подчёркивают: «Therefore the fishermen should aware of the risks for the occurrence and transmission of Ligula plerocercoids and the potential danger of the parasite in fishery sector» (... рыбаки должны знать о рисках встречаемости и передачи плероцеркоидов лигул и потенциальной опасности паразита для рыбной отрасли).
И всё же подавляющее большинство авторов сходятся во мнении, что лигулы не представляют опасности для здоровья человека:
«Рыба, поражённая Л. <лигулой>, не представляет опасности для человека и пригодна в пищу» (БСЭ, 1973; стр. 413);
«Рыба, поражённая лигулой, не принесёт вреда человеку. Её можно спокойно употреблять в пищу» (treefrog.ru. - 28.06.2012).;
«Anglers have no reason to be concerned about Ligula or Schistocephalus. These tapeworms cannot infect humans». (У рыболовов нет основания для беспокойства по поводу Ligula или Schistocephalus. Эти ленточные черви не могут заражать человека) (esrd.alberta.ca/fishwildlife/ wildlife-diseases, November 2014);
«Для человека такая рыба особой опасности не представляет» (netglista.ru).
О. Н. Юнчис (1999) в статье «Опасные, и не очень, рыбные паразиты», комментируя паразитирующих у рыб лигул, пишет (дословно): «Для человека и животных лигулы не опасны. В ряде районов Поволжья эти крупные черви считаются у рыбаков деликатесом и употребляются в пищу.<...>. Если рыболов поймал рыбу, зараженную лигулой, то выбрасывать ее в озеро ни в коем случае нельзя. Нужно разрезать ей брюшко, вынуть внутренности, лигула вынется вместе с ними. Внут
141
ренности нужно закопать или выбросить в места, недоступные для птиц. Рыбу, освобожденную от лигулы, можно употреблять в пищу без ограничений».
В неоднократно упоминаемой мною Международной классификации болезней 10 пересмотра (МКБ-10) (ICD-10, Version: 2016) Ligula intestinalis отнесена к «Группе гельминтозов животных и видов цестод, их вызывающих», упоминаемых в документе только в качестве примера: «Ligula intestinalis (обыкновенный ремнец или обыкновенная лигула) - возбудитель лигулеза карповых и других рыб (промежуточные хозяева), паразит чаек, уток и других рыбоядных птиц (окончательные хозяева)».
И последнее. Не могу не привести выдержку из «Большой Медицинской Энциклопедии» (bigmedem.ru), - поскольку её могут прочитать все желающие и сделать соответствующие выводы, - где по поводу лигул читаем следующее (цитата): «Сан. и вет. <санитарным и ветеринарным> врачам приходится производить экспертизу и оценивать, поскольку зараженная ремнецом рыба опасна для употребления в пищу. Человек не является окончательным хозяином этого паразита, поэтому ремнец для него безвреден». Так всё-таки - опасна или нет заражённая лигулами рыба?
Итак. Поскольку практически все известные случаи обнаружения лигулы у человека имели место почти или более 100 лет назад, носили явно случайный характер и, к тому же, черви были представлены личинками, но не половозрелыми особями, Ligula intestinalis не может рассматриваться как паразит человека (Scholz, Kuchta, 2016). Я присоединяюсь к мнению названных авторов. Более того, обнаружив в рыбе подобного паразита, следует поступить так, как советует О. Н. Юнчис (1999): рыбу выпотрошить, а внутренности с лигулой закопать, и ни в коем случае не скармливать рыбные отходы птицам и домашним животным.
Цитируемая литература
Апсолихова О. Д., Свешников Ю. А. О зараженности карповых рыб водоемов Республики Саха (Якутия) ремнецами / Паразитология в изменяющемся мире: Материалы V Съезда Паразитол. общества при РАН (23-26.09.2013, Новосибирск). Ред. К. В. Галактионов. - Новосибирск: Гарамонд, 2013. -С. 13.
БСЭ. Лигулёз // Большая Советская Энциклопедия. Третье издание. / Гл. ред. А. М. Прохоров. - М.: Изд-во «Советская энциклопедия», 1973. - 14. - С. 431.
Гаевская А. В. Паразитология и патология рыб: энциклопедический словарь-справочник (издание второе, дополненное и переработанное). - Севастополь: ЭКОСИ-Гидрофизика, 2006. - 396 с.
Гаевская А. В. Паразиты и болезни рыб Чёрного и Азовского морей: II - полу проходные и пресноводные рыбы. - Севастополь: ЭКОСИ-Гидрофизика, 2013. - 354 с.
Дубинина М. Н. Ленточные черви / Определитель паразитов пресноводных рыб СССР. - Л., 1962. - С. 384-438.
Дубинина М. Н. Ремнецы (Cestoda, Ligulidae) фауны СССР. - Гл. ред. Б. Е. Быховский. - М.-Л., Наука, 1966.-262 с.
Жохов А. Е., Пугачёва М. Н. Распространение и встречаемость плероцеркоидов Ligula intestinalis L. (Cestoda, Ligulidae) у рыб оз. Тана, Эфиопия // Биология внутр, вод. - 2012. - № 3. - С. 71 - 76.
Конькова А. В. Лигулидозы молоди воблы Rutilus rutilus caspicus (J.) и леща Abramis brama (L.) в Каспийском море / Паразитология в изменяющемся мире: Мат. V Съезда Паразитол. общества при РАН (23-26.09.2013, Новосибирск). Ред. К. В. Галактионов. - Новосибирск: Гарамонд, 2013. - С. 88.
Определитель паразитов пресноводных рыб. Т. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - С. 42 - 49. - (Определители по фауне СССР, изд. Зоол. ин-том АН СССР; Вып. 149).
Пронина С. В., Пронин Н. М. Возрастные и многолетние изменения зараженности плотвы сибирской плероцеркоидами ремнеца Ligula intestinalis (Cestoda: Pseudophyllidea) в Чивыркуйском заливе озера Байкал / Паразитология в изменяющемся мире: Мат. V Съезда Паразитол. общества при РАН (23-26.09.2013, Новосибирск). Ред. К. В. Галактионов. - Новосибирск: Гарамонд, 2013. - С. 152.
142
Юнчис О, Н. Опасные, и не очень, рыбные паразиты // Спортивное рыболовство. - 1999. -№ 1.
Barson М., Marshall В. Е. The occurrence of tapeworm, Ligula intestinalis L., in Barbus paludinosus, from a small dam in Zimbabwe // Afr. J. Aquat. Scvi. - 2003. - 28, 2. - P. 1-4. www.ajol.info/view.article. php?jid=114&id=8739.
Beaver P. C., Jung R C, Cupp E. W. Clinical Parasitology. 9th ed. - Philadelphia, USA: Lea & Febiger, 1984.-P. 499.
Bray R. (2010). Ligula intestinalis (Linnaeus, 1758). Accessed through: World Register of Marine Species at http://www.marinespecies.org/aphia.php?p=taxdetails&id= 105210 on 2017-03-24.
Dagne W., Nuru A. Ligula intestinalis plerocercoid infection in large Barbus fish (Barbus intermedius complex) from tributaries of Lake Tana, Ethiopia // Livestock Res. for Rural Development. - 2014. - 26, 5. Online version: www.lrrd.org.
Eslami A. Cestoda / Veterinary helminthology. - Univ. Tehran Press, 2006. -P. 240 - 241.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 235 - 276.
Hooman R. H, Bahador H, Emad A., Hossein A. E. M. et al. A study of infestation of Alburnoides bipuncta-tus with Ligula intestinalis in Latian reservoir Dam Lake, Tehran province, Iran: A histological study // Human & Vet. Med. Intern. J. Biolux Sci. - 2011. - 3, l.-P. 18-24.
Joyeux С. E, Baer J. G. Les cestodes rares de I’homme // Bull. Soc. Pathol. Exot. - 1929. - 22. - P. 114 -136.
Joyeux С. E, Du Noyer R. Presence d’une larva de ligule dans des vomissements П Marseille Med. - 1931. -68. -P. 235-236.
Kuchta R., Scholz T., Brabec J., Bray R Л. Suppression of the tapeworm order Pseudophyllidea (Platyhel-minthes: Eucestoda) and the proposal of two new orders, Bothriocephalidea and Diphyllobothriidea // Int. J. Parasitol. - 2008. - 38, 1. - P. 49 - 55.
Lamothe R, Cruz A. Hallazgo de Ligula intestinalis (Goeze, 1782) Gmelin, 1790 en Lermichthys multiradiatus (Meek) (Pisces: Gooderidae) I I Rev. Soc. Mex. Hist. Nat. - 1972. - 33. - P. 99 - 106.
Lamothe-Argumedo R., Garcia Prieto L. Cestodes, parasites del hombre // Salud. Publ. M£xico. - 1985. -27, 5.-P. 420-435.
Leon N. Diplogonoporus brauni I I Zool. Anz. - 1907. - 37. - P. 376 - 379.
Leon N. Ein neuer menschlicher cestode // Zool. Anz. - 1908. - 33. - P. 359 - 361.
Leon N. Un nouveau cas de Diplogonoporus brauni // Centralbl. Bakteriol. Abt. Orig. - 1910. - 55. - P. 23 -27.
Logan F. J, HorakA., Stefka J, Aydogdu A., Scholz T. The phylogeny of diphyllobothriid tapeworms (Cestoda: Pseudophyllidea) based on ITS-2 rDNA sequences П Parasitol. Res. - 2004. - 94, 1. - P. 10 - 15.
Meyer M. C. Cestode zoonoses of aquatic animals // J. Wildl. Dis. - 1970. - 6 (Proc. Ann. Conf.). - P. 249 -254.
Muller R Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 69.
Orr T. S. C Anomalous positions of the plerocercoid of Ligula intestinalis (Linnaeus 1758) // J. Helminthol. - 1968.-42, .3-4. -P. 363-366 DOI: https://doi.org/10.1017/S0022149X00017958.
Ozbek M., Ozturk M. O. Investigations on Ligula intestinalis plerocercoid L.,. 1758 infection of some fishes from Dam Lake Kunduzlar (Kirka, Eski§ehir) // Turkiye Parazitol. Derg. - 2010. - 34, 2. - P. 112 - 117 (in Turkish).
Poppensiek G. C, Hutton R. E, Klontz G. W., Pearce J. B. et al. Aquatic Animal Health. - Nat. Acad. Sci., Washington, D. C., 1973. - 46 pp.
Scholz T., Kuchta R. Fish-borne, zoonotic cestodes (Diphyllobothrium and relatives) in cold climates: A never-ending story of neglected and (re)-emergent parasites // Food and Waterborne Parasitology. - 2016. - 4. -P. 23 -38. http://dx.doi.Org/10.1016/j.fawpar.2016.07.002.
Sohn W.-M., Na B.-K, Jung S. G., Kim К H Mass death of predatory carp, Chanodichthys erythropterus, induced by plerocercoid larvae of Ligula intestinalis (Cestoda: Diphyllobothriidae) // Korean J. Parasitol. -2016.-54, 3. -P. 363-368. doi: https://doi.Org/10.3347/kjp.2016.54.3.363.
Stefka J. HypSa V., Scholz T. Interplay of host specificity and biogeography in the population structure of a cosmopolitan endoparasite: Microsatellite study of Ligula intestinalis (Cestoda) // Molecular Ecology. -2009. - 18, 6. - P.l 187 - 1206. DOI: 10.111 l/j.l365-294X.2008.04074.
Urde§ L., Hangan M. The epidemiology of Ligula intestinalis (Phylum Platyhelminthes) within the cyprinid populations inhabiting the Danubian Delta area // Animal Sci. & Biotechnol. - 2013. - 46, l.-P. 273 -276.
Van Der Hoeden J. (Ed.). Zoonoses. - Elsevier Publishing Co., Amsterdam, London, and New York, 1964. -774 pp.
143
Род Pyramicocephalus Monticelli, 1890
Синоним (по: Делямуре и др., 1985):
Cordicephalus Wardle, McLeod et Stewart, 1947, part.
P. Брэй с соавт. (Bray et al., 1994) поместили Pyramicocephalus в синонимы Diphyllobothrium, с чем не согласились многие специалисты (см.: Rausch, Adams, 2000).
Описание (по: Делямуре и др., 1985). Сколекс очень характерной формы: массивный, тупоконический, с двумя глубокими, очень извилистыми ботриями, края которых дорсально и вентрально выступают над его поверхностью. У вершины сколекса складки намного меньше, чем у его основания. Остальные характеристики как у Diphyllobothrium. Паразиты ластоногих, редко хищных млекопитающих, плероцеркоиды - в рыбах. Типовой вид - Pyramicocephalus phocarum (Fabricius, 1780) Monticelli, 1890.
Жизненный цикл пирамикоцефалов - типичный для дифиллоботриид, т.е. в нём участвуют три хозяина: два промежуточных и окончательный. Однако вполне реально включение в него ещё одного хозяина - паратонического, в роли которого выступают хищные рыбы, к которым плероцеркоиды попадают вместе с пищей, инвазированными рыбами-планктофагами.
Pyramicocephalus phocarum (Fabricius, 1780) Monticelli, 1890 (рис. 77). Паразит впервые описан О. Фабрициусом (Fabricius, 1780) на материале от тюленей Гренландии как Taenia phocarum. Видовое название паразита связано с латинским названием рода его хозяина: Phoca - тюлени, phocarum - тюлений.
Рис. 77 Pyramicocephalus phocarum'. 1 -сколекс, латерально; 2 — сколекс, вентрально; 3 - половозрелый членик; 4 -поперечный срез половозрелого членика в области бурсы; 5 - яйцо (из: Делямуре, 1955)
В 1890 г. Ф. Монтичелли (Monticelli, 1890) обосновал новый род Pyramicocephalus для вида Taenia anthocephala Rud., 1810, который, таким образом, стал типовым в нём. Впоследствии выяснилось, что Р. anthocephala является синонимом
вида, описанного ранее О. Фабрициусом, вследствие чего типовым видом рода стал Pyramicocephalus phocarum (Fabricius, 1780). В монографии, посвящённой семейст-
144
ву дифиллоботриид, С. Л. Делямуре с соавт. (1985) перечисляют у Р. phocarum 14 синонимов.
Подробно об истории открытия и детальное описание Р. phocarum см. в монографии С. Л. Делямуре с соавт. (1985), on-line версия которой размещена на lekmed.ru.
Длина тела цестод 7.8-15.7 см, максимальная ширина до 3.3 мм (Делямуре, 1955) или соответственно 38 - 82 см и 5 мм (Markowski, 1952). Встречаются экземпляры длиной более 1 м. Сколекс (в расслабленном состоянии) пирамидальный, мускулистый, 3x2 мм, с двумя хорошо развитыми, извилистыми ботриями, имеющими многочисленные глубокие складки, которые уменьшаются в размерах по направлению к вершине. Нижняя расширенная часть сколекса нависает на первые членики. Шейка анатомически отсутствует, членики начинаются непосредственно за нависающими ботриями. Корковая паренхима в значительной мере вытеснена желточными фолликулами. Половые поры медианные, окружены гороховидными сосочками. Шаровидная половая клоака диаметром 0.19 мм. Снизу в неё впадает вагина, а впереди от её отверстия открывается мужской половой проток. Маточная пора находится позади отверстия половой клоаки. Многочисленные семенники разбросаны в латеральных полях членика, на медианной линии не соединяются. Бурса цирруса овально вытянутая, размером 0.26 - 0.28 х 0.165 мм. Дорсально в бурсу вдаётся грушевидный, толстостенный (толщина стенки 46 щи) семенной пузырёк размером 0.165 х 0.149 мм. Яичник двулопастный, находится у нижней границы членика. Желточные фолликулы плотно прилегают друг к другу, образуя в корковой паренхиме правильный ряд, их латеральные поля медианно не соприкасаются. Слабо извивающаяся вагина расположена дорсально от матки. Матка образует 6-9 петель с каждой стороны. Последняя петля матки не расширена. Яйца продолговато-овальные, с крышечкой, размером 56 х 48 (Markowski, 1952), 65 - 69 х 38 - 42 (Делямуре, 1955), 58.3 - 67.8 х 36.9 - 42.8 |im (Hilliard, 1960); толщина скорлупы 2 - 2.5, диаметр крышечки 19.5 цт. Размер корацидия в яйце 35 х 38 цт.
Р. phocarum - амфибореальный вид морского происхождения; его ареал охватывает моря Северной Атлантики и Северного Ледовитого океана - Гренландское, Норвежское, Белое, Баренцево, Карское, Чукотское, Охотское и Берингово, побережье Канады, Аляски, Гренландии. Дефинитивные хозяева паразита - ластоногие: заяц морской, лахтак, котик северный морской, сивуч, нерпы кольчатая и охотская кольчатая, тюлень обыкновенный (ларга), крылатка, хохлач, калан. У многих из перечисленных животных Р. phocarum встречается достаточно редко, а облигатными хозяевами этого паразита являются заяц морской и лахтак (Делямуре и др., 1985). Степень заражённости зайца морского может превышать 90 %, а интенсивность инвазии достигать 150 экз. В водах Аляски плероцеркоиды пирамико-цефала были обнаружены у свиньи морской (Rausch, Hilliard, 1970). Обсуждая эту находку, авторы публикации подчеркнули, что Р. phocarum, тем не менее, является характерным паразитом ластоногих, к коим дельфины не относятся. В литературе можно встретить упоминания о регистрации этого гельминта даже у домашней собаки (Yamaguti, 1959). Вместе с тем, авторы одной из публикаций, работавшие на Аляске (Rausch, Adams, 2000), описывают неудавшуюся попытку заразить плероцеркоидами пирамикоцефала 16 подопытных собак, домашнюю кошку и двух волонтёров, каковыми согласились быть взрослые мужчины. Такой же неудачей закончился эксперимент по заражению хомяков плероцеркоидами Р. phocarum, выделенными из печени трески беломорской (Мустафина, Хуторянская, 2016).
145
Ластоногие заражаются пирамикоцефалом с пищей - рыбами, среди которых как мирные планктофаги, так и крупные хищники: треска балтийская, гренландская и беломорская, пикша, минтай, навага европейская и дальневосточная, сайка, керчак европейский, пинагор, рогатка ледовитоморская и дальневосточная, бычок плоскоголовый, палтус стрелозубый, обыкновенный и белокорый, камбала охотоморская и обыкновенная, микижа и другие (Вялова, 2006; Гаевская, 2004; Соколов и др., 2005; Цимбалюк, Семешко, 1971; Grabda, 1977; Rausch, Adams, 2000 и многие другие). На юго-западе Аляски в нижнем течении реки Кускокуим плероцеркоиды Р. phocarum были обнаружены у исключительно пресноводной рыбы -налима обыкновенного (Rausch, Adams, 2000). По мнению авторов статьи, плероцеркоиды могли попасть к нему или через морских рыб, которые заходят в солоноватые воды устьев рек и их низовья, или же при охоте налима на анадромных рыб во время миграции последних вверх по рекам. Возможным доводом в пользу, во всяком случае, одного из предположений может служить обнаружение плероцеркоидов Р. phocarum у анадромной проходной микижи, отловленной в реке Утхолок на западе Камчатки (Соколов и др., 2005). Встречаемость Р. phocarum у налима заслуживает безусловного внимания, поскольку дифиллоботрииды относятся к числу зоонозных видов, а налим является объектом промысла во многих регионах.
Плероцеркоиды пирамикоцефала находятся в рыбах в свободном состоянии, располагаясь между пилорическими придатками, на кишечной серозной мембране, гонадах, печени, в пилорических придатках, желудке, кишечнике, реже в мышцах. При поражении печени наблюдается её разрушение.
Плероцеркоиды довольно крупные, обладают треугольным, пирамидообразным сколексом (рис. 78) размером до 4-5x1.2-3 мм, имеющим крупные, с сильно фестончатыми краями ботрии, и длинным, до 5 - 6 (собств. данные), 5-8 (Rausch, Adams, 2000) и даже 8 - 9 см (Вялова, 2006), хвостом. Поверхность тегумента сколекса поперечно-складчатая, несёт многочисленные удлинённо-цилиндри-JL ческие микротрихии (Мустафина, Хуторянская, 2016). К ' •--’*‘^4. слову, А. Р. Мустафина иН. М. Бисерова (2016) с помо-
tgi щью световой и трансмиссионной микроскопии детально
изучили структурные элементы тегумента сколекса, строение мышечной, экскреторной и нервной систем •Ж ? О У плероцеркоидов Р. phocarum из беломорской трески.
11^
(1Я 1 а) Рис. ^8 Pyramicocephalus phocarum, сколекс плероцеркоида (из:
Grabda, 1977)
Заражённость отдельных видов рыб может достигать очень высоких показателей. К примеру, в водах Са-
халина цестода была обнаружена у 39.3 - 90.9 % наваги при интенсивности инвазии 1-44 экз., причём личинки встречались даже в мышцах рыб (Вялова, 2006).
Р. phocarum достаточно регулярно указывают среди паразитов человека (Ashford, Crewe, 2003; Coombs, Crompton, 1991), также как и человека называют среди хозяев этого гельминта (Делямуре и др., 1985; Schmidt, 1986). Учитывая эту информацию, Р. phocarum был отмечен и мною в энциклопедическом справочнике «Паразиты и болезни рыб», как встречающийся у человека (Гаевская, 2006). Вместе с тем, в процессе работы над данной монографией, я попыталась найти первоис
146
точник, в котором шла бы речь о находке Р. phocarum у человека, но - безрезультатно. Об этом же пишут зарубежные коллеги (Scholz, Kuchta, 2016): «However, the present authors were unable to find any reliable report of this seal tapeworm from humans» (Однако авторы не смогли найти ни одного достоверного сообщения об этом тюленьем солитёре из человека).
Цитируемая литература
Вялова Г. П. Взаимоотношения гидробионтов различных таксонов при ихтиопатологическом мониторинге водоемов Сахалина (бактерии, паразитические беспозвоночные, рыбы): автореф. дисс.... докт. биол. наук; 03.09.18 - гидробиология. - Южно-Сахалинск, 2006. - 39 с.
Гаевская А. В. Паразиты и болезни морских и океанических рыб в природных и искусственных условиях. - Севастополь: ЭКОСИ-Гидрофизика, 2004. - 237 с.
Гаевская А. В. Паразитология и патология рыб: Энциклопедический словарь-справочник (издание второе, дополненное и переработанное). - Севастополь: ЭКОСИ-Гидрофизика, 2006. - С. 255 - 256.
Делямуре С. Л. Гельминтофауна морских млекопитающих в свете их экологии и филогении. - М.: Изд-во АН СССР, 1955. - 517 с.
Делямуре С. К., Скрябин А. С, Сердюков А. М. Дифиллоботрииды - ленточные гельминты человека, млекопитающих и птиц / Отв. ред. В. Е. Судариков. // Основы цестодологии. - М.: Наука, 1985. -11. -200 с.
Мустафина А. Р., Бисерова Н. М. Строение плероцеркоида Pyramicocephalus phocarum (Cestoda: Di-phyllobothriidea) - паразита беломорской трески // Фауна и экология паразитов. Труды Центра паразитологии (отв. ред.: С.О. Мовсесян). - 49. - М.: Тов-во научных изданий КМК, 2016. — С. 73-75.
Мустафина А. Р., Хуторянская М. Ю. Особенности биологии и строения Pyramicocephalus phocarum (Diphyllobothriidea) из печени беломорской трески / Современные проблемы теоретической и морской паразитологии: Сборник научных статей / ред. К. В. Галактионов, А. В. Гаевская. - Севастополь: Изд-во Бондаренко Н. Ю., 2016. - С. 188 - 190.
Соколов С. Г„ Кузищин К. В., Груздева М. А. Предварительное исследование разнообразия паразитов проходной камчатской микижи Parasalmo mykiss mykiss (Osteichthyes: Salmoniformes: Salmonidae) H Паразитология. - 2005. - 39, 1. - C. 38 - 49.
Цимбалюк E. M, Семешко H H. Цестоды рыб литорали западной Камчатки И Паразитология. - 1971. -5, 5.-С. 424-428.
Ashford R. JV., Crewe JV. The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - P. 58.
Bray R. A., Jones A., Andersen KJ. Order Pseudophyllidea Carus, 1863 / Khalil A., Jones A., Bray R. A. (Eds). Keys to the Cestode parasites of vertebrates. - CAB Intern., Wallingford, U. K., 1994. - P. 205 -247.
Coombs I., Crompton D. W. T. A Guide to Human Helminths. - Taylor & Francis Ltd, Lnd., 1991. - 196 pp. Fabricius O. F. Fauna Groenlandica, systematice sistens animalia Groenlandiae occidentalis hactenus indaga-ta, etc. - Hafhiae; Lipsiae, 1780. - 452 pp.
Grabda J. Studies on parasitisation and consumability of Alaskan pollack, Theragra chalcogramma (Pall.) // Acta Ichthyol. Pescat. - 1977. - 7, 2. - P.15 - 33.
Hilliard D. K. Studies on the helminth fauna of Alaska. 38. The taxonomic significance of eggs and coracidia of some diphyllobothriid cestodes // J. Parasitol. - 1960. - 46. - P. 703 - 716.
Monticelli F. S. Note elmintologiche // Boll. Soc. natur. Napoli. - 1890. - 4. - P. 189 - 208.
Rausch R. L, Adams A. M. Natural transfer of helminths of marine origin to freshwater fishes with observations on the development of Diphyllobothrium alascense 11 J. Parasitol. — 2000. - 86, 2. - P. 319 - 327.
Rausch R. L., Hilliard D. K. Studies on the helminth fauna of Alaska. 49. The occurrence of Diphyllobothrium latum (Linnaeus, 1758) (Cestoda: Diphyllobothriidae) in Alaska, with notes on other species // Canad. J. Zool. - 1970. - 48, 6. - P. 1201 - 1219.
Schmidt G. D. CRC Handbook of Tapeworm Identification. - CRC Press, Boca Raton, USA, 1986.
Scholz T., Kuchta R. Fish-bome, zoonotic cestodes {Diphyllobothrium and relatives) in cold climates: A never-ending story of neglected and (re)-emergent parasites // Food and Waterborne Parasitology. -2016.-4. -P. 23-38. http://dx.doi.Org/10.1016/j.fawpar.2016.07.002.
Yamaguti S. The cestodes of vertebrates / Systema Helminthum. - New York; L.: Interscience, 1959. - 2. -860 pp.
147
Род Schistocephalus Creplin, 1829
Ранее род Schistocephalus включали в состав семейства Ligulidae (Дубинина, 1966; Определитель, 1987). М. В. Юрахно (1992) создал для данного рода отдельное семейство Schistoce-phalidae, однако это нововведение не получило поддержки среди цестодологов. В настоящее время род рассматривают в составе семейства Diphyllobothriidae (Bray et al., 1994). Результаты сравнения Schistocephalus с Ligula, Digramma или Diphyllobothrium no ITS-2 rDNA показали, что данный род в Diphyllobothriidae является самым базальным таксоном (Logan et al., 2004).
Описание (по: Определитель, 1987). Средних размеров цестоды со стробилой, полностью расчленённой уже на стадии плероцеркоида. Стробила удлинённо-овальная, к заднему концу несколько суженная; наружное расчленение строго соответствует внутреннему расположению половых комплексов. В каждом членике находится по одному половому комплексу, формирование которого практически завершается на стадии плероцеркоида. Желточные фолликулы располагаются одним равномерным слоем со всех сторон между внутренним продольным и средним поперечным слоями мышц. Семенники многочисленные, лежат в один слой вдоль стробилы, прерываются у каждого полового комплекса по средней линии. Яичник двухлопастный, сетчатого строения, находится в центральной паренхиме ближе к вентральной стороне и заднему краю членика. Половые поры открываются на вентральной стороне членика: отверстие бурсы цирруса и лежащее позади него отверстие вагины - на средней продольной линии членика, а отверстие матки, неправильно чередуясь, - с одной или другой стороны от отверстия вагины. Во взрослом состоянии - паразиты птиц. Типовой код, — Schistocephalus solidus (О. F. Muller, 1776) Steenstrup, 1857.
В русскоязычной литературе этих цестод называют щелеголовами из-за наличия щелевидных желобков на переднем конце тела.
Названный типовой вид упоминается в нескольких источниках как выявленный у человека.
Schistocephalus solidus (О. F. Muller, 1776) Steenstrup, 1857 (рис. 79-81). Видовое название от латинского solidus - твёрдый, плотный.
С характерными чертами рода. Передний конец тупо закруглённый, с узкими щелевидными желобками. Длина взрослых особей и инвазионных плероцеркоидов от 20 до 76, ширина 5-11 мм. Число члеников в стробиле - от 50 до 150 (Дубинина, 1966; Smyth, 1946). Длина стробилы и у взрослых особей, и у плероцеркоидов зависит от количества сегментов. Например, у цестоды от колюшки из Уэльса (Великобритания) длина стробилы составляла 14 - 34, в среднем 25.48 мм (±5.63), количество члеников - 51 - 86, в среднем 66.33 (±8.68), а из колюшки, выловленной в Ботническом заливе Балтийского моря - соответственно 23 - 48, 33.23 (±4.64) и 99 - 138, 117.27 (±10.30) (Chubb et al., 1995). В стробиле взрослых червей из нерпы балтийской кольчатой насчитывалось 77 - 136 члеников, в среднем 106.16 (±10.60), а у цестод из баклана, исследованного в Великобритании, соответственно 54-97, 73.13 (±8.78).
Яйца размером 60 - 70 х 40 - 50 pm. Подсчитано, что в течение своей жизни одна особь продуцирует более 20 тыс. яиц (Clarke, 1954).
Взрослые черви поселяются в кишечнике рыбоядных птиц. Круг окончательных хозяев S. solidus очень широк и включает более 40 видов рыбоядных и околоводных птиц (Nishimura et al., 2011; Vik, 1954). Известна находка этого гель
148
минта у выдры речной в Канаде (Hoberg et al., 1997), у нерпы кольчатой на Балтике (Chubb et al., 1995). И, наконец, в лабораторных условиях паразит был выращен в хомяках и мышах (McCaig Hopkins, 1962).
Рис. 79 Schistocephalus solidus, плероцеркоиды на разных стадиях развития из полости тела колюшки трёхиглой (из: Дубинина, 1966)
Рис. 81 Схема цикла развития Schistocephalus solidus_ а - яйцо; б - свободноплавающий корацидий; в - процеркоид в полости тела циклопа; г - плероцеркоид в полости тела колюшки трёхиглой; д - взрослые черви в окончательном хозяине (из: Дубинина, 1966)
Рис. 80 Schistocephalus solidus, два плероцеркоида из колюшки трёхиглой из озера Nedre Vollvatn, Бодё, Норвегия (из: https:// com-mons.wikimedia.org/... File: Stickleback_with_ Schosto-cephalus.jpg) (замечание к названию файла: в название паразита вкралась досадная опечатка)
149
В яйцах паразита, попавших в воду с экскрементами дефинитивного хозяина, в течение 3-4 недель происходит развитие корацидия. Продолжительность периода свободного плавания у покинувшего яйцо корацидия не превышает 2 суток, и для дальнейшего развития он должен попасть в промежуточного хозяина, в роли которого выступают планктонные циклопоидные копеподы. В полости тела копепод, проглотивших корацидия, в течение 3-4 недель формируется удлинённый непрозрачный процеркоид, с церкомером с крючьями на заднем конце (Clarke, 1954). К следующему хозяину, дополнительному, каковым для S. solidus является колюшка трёхиглая, паразит попадает также трофическим путём. В эксперименте удалось выяснить, что попавшие в желудочно-кишечный тракт колюшки личинки проникают через стенку кишечника в полость её тела в течение 12 - 24 ч. При этом большую часть времени они проводят в желудке и только очень короткий период, до 2 ч, - в кишечнике (Clarke, 1954). До того, как проникнуть в полость тела, личинка теряет наружный слой вместе с церкомером (Hammerschmidt, Kurtz, 2007).
В дополнительном хозяине личинка интенсивно растёт и менее чем за 6 недель увеличивается в 4000 раз, заполняя собою большую часть полости тела рыбы (Sharsack et al., 2004, 2007а, b). В отличие от остальных цестод, у S. solidus половая система практически полностью формируется в промежуточном хозяине.
В одной рыбке может одновременно паразитировать 2 - 3 и даже до 4 - 6 плероцеркоидов, что, учитывая её небольшие размеры и, напротив, крупные размеры личинок, резко негативно влияет на организм приютившего паразита хозяина. Напомню, что максимальная длина колюшки трёхиглой не превышает 12 см, но это длина всей рыбки, а паразит живёт в полости её тела (см. рис. 80).
В кишечнике окончательного хозяина, в основном это - птицы, цестода уже не растёт, а претерпевает определённые физиолого-биохимические изменения, формируясь в половозрелую особь, продуцирующую яйца уже через 3-4 дня. Для S. solidus присуще как перекрёстное, так и самооплодотворение. Замечено, что половозрелые черви могут задерживать формирование яиц в ожидании спаривания, что, скорее всего, является проявлением естественного отбора, так как самооплодо-творяющиеся особи имеют более низкую продуктивность, что, отнюдь, не способствует выживанию вида как такового (Schjorring, 2004).
Поскольку время развития той или иной стадии S. solidus сильно варьирует, то и общая продолжительность жизни отдельной особи паразита также может варьировать. Что касается продолжительности жизни собственно взрослой стадии, то она в разных хозяевах отличается: например, в лабораторных крысах она составляет 6 дней, голубях - 10, утках - 14, хомяках - 18 (Clarke, 1954; Dietrich; McCaig Hopkins, 1962; Sharsack et al., 2007b; Smyth, 1946).
S. solidus распространён в Северной Америке, включая Аляску и Канаду, в Европе и Евразии, т.е. там, где обитает его облигатный дополнительный хозяин -колюшка трёхиглая (Braten, 1966; Poulin et al., 2011). Широкому распространению паразита в немалой степени способствует то, что он, как колюшка трёхиглая, проявляет определённую толерантность к солёности, встречаясь и в пресных, и в солоноватых водах. Корацидии нормально развиваются при солёности до 12.5 %о, но выше этого показателя выживаемость яиц быстро уменьшается и при 20 %о вылупления яиц вообще не наблюдается (Simmons, Barber, 2016).
По поводу возможности паразитирования S. solidus у человека я попыталась собрать всю доступную информацию. Что в итоге удалось выяснить.
150
В 1970-м году была опубликована небольшая статья, в которой её автор обсуждал проблему зоонозного значения цестод из водных животных (Meyer, 1970). При этом речь шла, в основном, о Diphyllobothrium и Spirometra и лишь очень кратко упоминалось о «нескольких случайных сообщениях» (a few incidental host records) трёх видов цестод - Ligula intestinalis, Schistocephalus solidus и Diplogono-noporus balaenopterae. Вполне возможно, что автор опирался на данные статьи (Rausch et al., 1967), в которой описывалось два случая обнаружения плероцеркоидов S. solidus у местных жителей в посёлке Чевак на Аляске.
Случайной же называют находку S. solidus у человека и авторы монографии, посвящённой гельминтам человека (Coombs, Crompton, 1991).
В монографии «Worms and Human Diseases» («Черви и болезни человека») её автор (Muller, 2002) также пишет, что S. solidus найден у человека на Аляске. Ссылка на источник в данном случае отсутствует, но это явно не данные самого автора монографии.
Ещё одна группа авторов называет S. solidus среди паразитов человека на Аляске, и опять-таки без первоисточника (Gillani et al., 2012). При этом они подчёркивают, что в норме окончательными хозяевами этого паразита являются собаки (?!) и рыбоядные птицы. К слову, в монографии, посвящённой зоонозным паразитам собак и их опасности для здоровья общества, ни слова не сказано о паразитировании S. solidus у этих животных (Macpherson, Torgerson, 2013). Читаем далее (Gillani et al., 2012; стр. 93): «The adult worm is found in the lumen of the small intestine. Infection is usually accompanied by few symptoms», т.е. взрослый червь найден в просвете тонкого кишечника; заражение обычно сопровождается несколькими симптомами. И, наконец, в цитируемой работе для лечения от инвазии S. solidus рекомендуется празиквантел (на каком основании? - АГ).
В поисках первоисточника, послужившего основанием для всех последующих упоминаний о регистрации S. solidus у человека, я обратилась, прежде всего, к работам, выполняемым на Аляске в Департаменте рыб и дичи (Alaska Department of Fish and Game). В Департаменте функционирует Лаборатория патологии рыб, сотрудники которой уже многие годы активно используют S. solidus в качестве объекта для изучения различных аспектов паразито-хозяинных отношений. В 2008 г. ими была опубликована небольшая, с прекрасными иллюстрациями монография, посвящённая наиболее обычным болезням диких и разводимых рыб на Аляске (Meyers et al., 2008). В названной публикации по повод)' опасности Schistocephalus для человека написано следующее: «There are no known human health concerns associated with Schistocephalus» (стр. 72), т.е. проблемы co здоровьем человека, связанные с Schistocephalus, не известны.
Ещё в одном официальном источнике, на этот раз в Канаде, заявлено: «Anglers have no reason to be concerned about Ligula or Schistocephalus. These tapeworms cannot infect humans» (esrd.alberta.ca/fishwildlife/wildlife-diseases, November 2014). У рыболовов нет основания для беспокойства по поводу Ligula или Schistocephalus. Эти ленточные черви не могут заражать человека.
И, наконец, в МКБ-10 S. solidus отнесён к «Группе гельминтозов животных и видов цестод, их вызывающих», упоминаемых только в качестве примера (дословно): «Schistocephalus solidus - возбудитель шистоцефалеза колюшек и других рыб (2-й промежуточный хозяин), паразит рыбоядных птиц (окончательный хозяин), а также грызунов».
151
Цитируемая литература
Дубинина М. Н. Ремнецы (Cestoda, Ligulidae) фауны СССР. - Гл. ред. Б. Е. Быховский. - М.-Л.: Наука, 1966.-262 с.
Определитель паразитов пресноводных рыб. Т. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - С. 42 - 49. (Определители по фауне СССР, издаваемые Зоологическим институтом АН СССР; Вып. 149).
Юрахно М. В. О систематике и филогении некоторых групп цестод отряда Pseudophyllidea // Паразитология. - 1992. - 26, 6. - С. 449 - 461.
Braten Т. Host specificity in Schistocephalus solidus H Parasitology. - 1966. - 56, 4. - P. 657 - 664.
Bray R. A., Jones A., Andersen KI. Order Pseudophyllidea Carus, 1863 / Khalil A., Jones A., Bray R. A. (Eds). Keys to the Cestode parasites of vertebrates. - CABI, Wallingford, U. K., 1994. - P. 205 - 247.
Chubb J. C., Valtonen E. T., McGeorge J., Helle E. Characterisation of the external features of Schistocephalus solidus (MUller, 1776) (Cestoda) from different geographical regions and an assessment of the status of the Baltic ringed seal Phoca hispida botnica (Gmelin) as a definitive host // Syst. Parasitol. - 1995. - 32, 2. -P. 113-123.
Clarke A. Studies on the life cycle of the pseudophyllidean cestode Schistocephalus solidus // J. Zool. - 1954. - 124, 2.-P. 257-302. DOI: 10.1111/j. 1469-7998.1954.tb07782.
Coombs I., Crompton D. W. T. A Guide to Human Helminths. - Taylor & Francis Ltd, Lnd., 1991. - 196 pp Dietrich D. ADW: Information. - animaldiversity.org.
Gillani S. W., Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - 2012. - P. 93. (https://books.google.com/books?isbn= 1105494594).
Hoberg E. P., Henny C. J, Hedstrom O. R., Grove R. A. Intestinal helminths of river otters (Lutra canadensis) from the Pacific Northwest // J. Parasitol. - 1997. - 83, 1. - P. 105-110.
Macpherson C. N. L., Torgerson P. R. 8. Dogs and cestode zoonoses / Dogs, Zoonoses and Public Health. -Eds. Macpherson C. N. L., Meslin F.-X., Wandeler A. I. - 2nd Edition. - CABI, 2013. - P. 127 - 152.
McCaig L., Hopkins C. Studies on Schistocephalus solidus II. Establishment and longevity in the definite host // Exp. Parasitol. - 1962. -13, 3. -P. 273 - 283.
Meyers T, Burton T, Bentz C., Starkey N. Common diseases of wild and cultured fishes in Alaska. - Alaska Department of Fish and Game, Fish Pathology Lab., 2008. - P. 72 - 73. On-line: www.adfg.alaska. gov/static/.. ./Schistocephalus/pdf.
Nishimura N, Heins D., Anderson R., Barber L, Czesko W. Distinct lineages of Schistocephalus solidus parasites in threespine and ninespine stickleback hosts revealing by DNA sequence analysis // Pios ONE. -2011.-5, 7: e22505. doi:10.1371/joumal.pone.0022505.
Poulin R, Blanar C., Thieltages D., Marcogliese D. The biogeography of parasitism in sticklebacks: distance, habitat differences and the similarity in parasite occurrence and abundance // Ecography. - 2011. - 34. - P. 540-551. doi: 10.1111/j. 1600-0587.2010.06826.
Rausch R. L., Scott E. M., Rausch V. R. Helminths in Eskimos in Western Alaska with particular reference to Diphyllobothrium infection and anaemia // Trans. R. Soc. Trop. Med. Hyg. - 1967. - 61, 3. - P. 351-357.
Schjorring S. Delayed selfing in relation to the availability of a mating partner in the cestode Schistocephalus solidus // Evolution. - 2004. - 58, 11. - P. 2591 - 2596.
Sharsack J, Kalbe M., Derner R., Kurtz J, Milinski M. Modulation of granulocyte responses in three-spined sticklebacks Gasterosteus aculeatus infected with the tapeworm Schistocephalus solidus // Dis. Aquat. Organ. - 2004. - 59. 2. - P. 141 - 150.
Sharsack J, Kalbe M„ Harrod C., Rauch G. Habitat-specific adaptation of immune responses of stickleback (Gasterosteus aculeatus) lake and river ecotypes // Proc. R. Soc. Lond. B. Biol. Sci. - 2007a. - 274. - P. 1523 - 1532. doi:10.1038/rspb.2007.0210.
Sharsack J, Koch K, Hammerschmidt K. Who is in control of the stickleback immune system: interactions between Schistocephalus solidus and its specific vertebrate host // Proceeding: Biol. Sci. - 2007b. - 115, 1629.-P. 3151-3158.
Simmons N. E, Barber I. The effect of salinity on egg development and viability of Schistocephalus solidus (Cestoda: Diphyllobothriidae) // J. Parasitol. - 2016. -102, 1. - P. 42 - 46. doi: 10.1645/14-701.
Smyth J. Studies on tapeworm physiology // J. Exp. Biol. - 1946. - 23, 1. - P. 47 - 69.
Vik R. Investigations on the pseudophyllidean cestodes of the fish, birds and mammals in the Anoya water system in Trondelag. Part I. Cyathocephalus truncatus and Schistocephalus solidus // Nytt Mag. Zool. -1954.-2,1.-P.5-51.
152
Род Spirometra Faust, Campbell et Kellogg, 1929
В 1929 г. Э. Фауст с коллегами (Faust et al., 1929), работавшие в те годы в Китае, разделили род Diphyllobothrium на два подрода - Diphyllobothrium и Spirometra. Основное отличие между ними заключалось, по их мнению, в строении яиц и наружных маточных петель. В 1936 г. Юстас Мюллер (Mueller, 1936) дополнил перечень различий между подродами и предположил, что при более полном исследовании данного рода может возникнуть необходимость поднятия ранга этих подразделений до родового уровня, что он и сделал на следующий год, выделив род под названием Spirometra (Mueller, 1937; стр. 309) (рис. 82). К слову, свою работу Ю. Мюллер назвал очень кратко и символично: «А repartition of the genus Diphyllobothrium» - Передел рода Diphyllobothrium. И хотя некоторые разногласия относительно родового статуса данных цестод всё же существуют, тем не менее, Spirometra принимают как самостоятельный род (Kuchta et al., 2015; Okamoto et al., 2015).
Рис. 82 Сагиттальные срезы стробилы (схематично), иллюстрирующие расположение пор и цирруса у цестод групп: 1 - Diphyllobothrium latum} 2 - Spirometra} 3 - Genus 3; 4 и 5 - латеральный (4) и дорсальный (5) вид сколекса, шейки и переднего участка стробилы у цестод групп D. latum и Spirometra} 6 - 7 - то же у группы Genus 3 (gs - половой синус; ov - яичник; sv - семенной пузырёк; up - половая пора; ut - матка; v'a - вагина; vu - вульва) (из: Mueller, 1937)
Описание (по разным авторам, в том числе: Mueller, 1937). Средних и крупных размеров цестоды: взрослые особи достигают в длину 75 - 150 см, плероцеркоиды - 4 - 15 см. Сколекс маленький, шпателеобразный. Шейка длинная и узкая. Половые поры расположены вентрально по средней линии в передней 1/5 сегмента. Циррус и вагина открываются раздельно, женская половая пора находится близ мужской. Маточная пора отдельная, позади половых пор. Семенники многочисленные, в двух латеральных полях, вдоль заднего края членика не сливаются. Бурса цирруса содержит циррус и семенной пузырёк. Гантелеобразный яичник лежит недалеко от заднего края сегмента. Передняя матка в виде спирали из 2 - 7 плотно расположенных колец. Яйца овальные, заострённые, с отчётливой крышечкой на одном полюсе. Типовой вид - Spirometra erinaceieuropaei (Rudolphi, 1819) Mueller, 1937.
153
Окончательные хозяева спирометр - многочисленные представители семейств псовых и кошачьих, в организме которых черви живут в тонком кишечнике.
Жизненный цикл спирометр (рис. 83) напоминает таковой представителей рода Diphyllobothrium, за исключением того, что процеркоиды развиваются в циклопах, обитающих на мелководье в небольших водоёмах типа прудов, запруд, тогда как у дафиллоботриумов процеркоиды развиваются в копеподах, населяющих крупные водоёмы. Видимо, это обусловлено тем, что у спирометр в качестве второго промежуточного хозяина выступают амфибии, обитатели прибрежной полосы небольших водоёмов, а у дифиллоботриумов - рыбы. Продолжительность периода свободного плавания корацидиев достигает 48 ч.
Рис. 83 Схема жизненного цикла цестод рода Spirometrcr. 1 - яйца попадают во внешнюю среду с фекалиями хозяина; 2 - развитие яиц в воде; 3 - покинувшие яйцо корацидии заглатываются ракообразными; 4 - развитие процеркоидов в полости тела копепод; 5 - вторые промежуточные хозяева заглатывают инвазированных копепод; 6 - цикл завершается, когда дефинитивные хозяева (7) поедают заражённого промежуточного/паратенического хозяина;
8 - пути заражения человека (из: www.cdc.gov/parasites/)
Попавшие в организм амфибии процеркоиды мигрируют из пищеварительного тракта в подкожные ткани, целомическую полость, брюшину, мускулатуру, где формируется плероцеркоид (Бакиев, Кириллов, 2007; Елизаров, 2009; Arakelyan, 2014; Cho S. et al., 1975; Kavana et al., 2014; Kim C., 1983; Min, 1990; Moon, 1976; Rego, Schaffer, 1992; Wei et al., 2015; Weinstein et al., 1954; Zhang et al., 2014 и другие).
Своеобразие жизненного цикла спирометр заключается в том, что в него может вклиниваться несколько паратонических хозяев, прежде чем паразит попадёт в подходящего дефинитивного хозяина, в котором он достигает половозрелого состояния. Среди подобных хозяев - различные животные, например, рептилии
154
(Пенькевич, 2015; Шарпило, 1983; Jeon et al., 2016a; Zhang et al., 2014), колонок (Lee et al., 2013), бородавочник африканский (Opuni, 1974), ёж, крот, норка американская и хорь чёрный (Дубина и др., 2006), домашние свиньи (Jang, 1964), дикий кабан (Дубина и др., 2006; Елизаров, 2009; Пенькевич, 2015; Lee et al., 2013) и многие другие. В Польше, к примеру, у евразийского барсука, найденного погибшим на дороге, в подкожной ткани в основном задних ног и вдоль позвоночника насчитали 128 цельных и 40 фрагментов плероцеркоидов, средняя длина которых составила 87 ± 38 мм (Kolodziej-Sobocinska et al., 2014). В кишечнике животного взрослые черви не были найдены, что свидетельствует о том, что барсук является паратоническим хозяином для данных цестод. Анализ нуклеотидных последовательностей гена 18S rRNA и морфологических особенностей обнаруженных плероцеркоидов показал их принадлежность к роду Spirometra. Продолжительность жизни личинок в организме паратонического хозяина, скорее всего, соответствует таковой самого хозяина, о чём свидетельсвует информация авторов, сообщивших о 15-летнем спаргануме у ботропса Bothrops pubescens (Oda et al., 2016).
Отмечают этих личинок и у антропоморфных приматов, например, у бабуинов, гривета, мартышки голубой (Chai et al., 1997; Myers, Kuntz, 1967; Nobrega-Lee et al., 2007 и другие).
Попавшие в организм паратонических хозяев личинки мигрируют из кишечника в самые разные ткани и органы, зачастую вызывая в них определённые патологические отклонения.
Среди дефинитивных хозяев спирометр - собаки, как домашние, так и одичавшие, лисицы обыкновенная и парагвайская, рыси, песец, енотовидная собака, волк, шакал, львы, леопард, лесной кот, домашние и дикие кошки, другие представители псовых и кошачьих (Дубина и др., 2006; Корнюшш та in., 2013; Пенькевич, 2015; Gregory, Munday, 1976; Petrigh et al., 2015; Ugarte et al., 2005 и многие другие).
В 1929 г. Э. Фауст с коллегами (Faust et al., 1929) различали в составе подрода Spirometra 6 видов, а к середине 20-го столетия в роде Spirometra насчитывалось уже 14 видов (Ward, McLeod, 1952). В обзорной монографии по цестодам позвоночных животных С. Ямагути (Yamaguti, 1959) свёл все виды Spirometra к одному - S. erinaceieuropaei. Однако затем была восстановлена видовая самостоятельность трёх из «синонимов» -S.mansonoides Mueller, 1935, S. pretoriensis (Baer, 1925) и S. theileri (Baer, 1925) (Kamo, 1999) и, таким образом, к началу 21-го столетия род Spirometra насчитывал 4 вида. Недавно восстановили самостоятельность вида Spirometra decipiens (Diesing, 1850), которого также рассматривали синонимом S. erinaceieuropaei (Eom et al., 2015; Jeon et al., 2015, 2016 a, 2016 b). Надо полагать, что углублённые исследования этой группы цестод с применением молекулярно-генетических методов заставят по-новому взглянуть на видовой состав данного рода. Замечу, что весьма полезным молекулярным маркёром в таксономических исследованиях плоских червей, в том числе цестод, считается последовательность митохондриальной ДНК (Jeon, Eom, 2013; Le et al., 2002).
Учитывая сказанное, не приходится удивляться тому, что мнения исследователей относительно количества видов Spirometra, регистрируемых у человека, и их состава значительно разнятся. Например, В. И. Ходакова и Н. Н. Плотников (1968) среди подобных дифиллоботриид называли один вид Spirometra - S. erinacei (как Diphyllobothrium е.). В обзорной работе по цестодам, паразитирующим у человека (Lamothoe-Argumedo, Garcia Puerto, 1985), её авторы перечисляют Spirometra erinacei Faust, Campbell et Kellogg, 1929, S. houghtoni Faust et al., 1929, S. decipiens, Spirometra ranarum Meggitt, 1925 и S. mansonoides Mueller, 1935. Из числа назван
155
ных видов, как мы видели, первые четыре были сведены в синонимы S. erinaceieu-ropaei (Kamo, 1999). Однако недавно появилась публикация, авторы которой (Jeon et al., 2015) утверждают, что в Корее у людей наряду с S. erinaceieuropaei встречается S. decipiens, но при этом две трети всех известных случаев в стране всё же приходится на долю первого из них. Более того, та же группа исследователей (Jeon et al., 2016b) доказала распространение S. decipiens и в США, где у человека обычно регистрировали только 5. mansonoides.
В монографической сводке по паразитическим зоонозам (Acha, Szyfres, 2003) перечислены Spirometra mansoni, S. mansonoides, S. erinaceieuropaei и S. proliferum, а в другой аналогичной сводке (Dhaliwal, Juyal, 2013) - Spirometra erinacei, S. erinaceieuropaei и S. mansonoides.
В справочно-информационной сводке «Медицинская гельминтология. Полный перечень из 384 гельминтов...» (www.worms-info.ru/Cestoda) все спирометры включены в состав рода Diphyllobothrium - D. erinaceieuropaei, D. mansoni и D. mansonoides.
По мнению многих исследователей, идентификация плероцеркоидов спирометр из человека только по морфологическим признакам чрезвычайно затруднена (Rego, Schaffer, 1992), поэтому зачастую неясно, какие из перечисленных в публикациях названий соответствуют в действительности существующим видам Spirometra (Kuchta et al., 2015). Видимо, по этой причине во многих случаях определение плероцеркоидов, выявленных у паратенических хозяев, к числу которых теоретически можно отнести и человека, заканчивается на уровне рода. И всё же невольно просматривалась определённая тенденция определять виды спирометр, выявленные у человека в странах Дальнего Востока, как S. mansoni, обнаруженные в Америке - как S. mansonoides, а в Австралии - как 5. erinaceieuropaei (Acha, Szyfres, 2003). Однако, как показывают последние исследования, это далеко не соответствует действительности, и в мире наблюдается более сложная картина распространения видов Spirometra, да и сам видовой состав рода по-прежнему нуждается в серьёзном изучении с применением новых методологических подходов.
У человека паразитируют только плероцеркоиды паразита, хотя в Японии и Корее известно 13 случаев регистрации у пациентов взрослых особей Spirometra (Faust, Wassel, 1921; Kamo, 2003; Lee et al., 1984; Suzuki et al., 1982).
Обнаруженные у млекопитающих плероцеркоиды Spirometra называют спарганами или спарганумами (под таким родовым названием - Sparganum - были когда-то описаны эти личинки). По этой причине вызываемое ими заболевание получило название спарганозиса, спарганоза, спарганимоза (sparganosis).
В этой связи считаю необходимым обратить внимание на следующую публикацию, увы! на китайском языке, но с английским резюме. По мнению её авторов (Qiu М. Н., Qiu М. D., 2009), плероцеркоид Spirometra не следует путать со Спартаком. Первый из них имеет сколекс с ботриями или ботриальными щелями, а у второго нет истинного сколекса. Плероцеркоид является развивающейся стадией солитёра, имеющего родовое название Spirometra, тогда как Sparganum - это другое родовое название псевдофил-лидных цестод. Плероцеркоид вызывает доброкачественный плевроцеркоидозис, а Sparganum провоцирует «злокачественный спарганозис». Плевроцеркоидозис является паразитарным зоонозом, который может иметь пищевое происхождение, водное, контактное или материнское. Для плероцеркоидов человек выступает в качестве тупикового хозяина, копеподы и лягушки служат промежуточными хозяевами, змеи и хищные звери - паратеническими хозяевами. Жизненный цикл Sparganum неизвестен.
156
Spirometra erinaceieuropaei (Rudolphi, 1819) Mueller, 1937 (=Spirometra erinacei Faust, Campbell et Kellogg, 1929) (рис. 84 - 86). Паразит впервые описан К. Рудольфи (Rudolphi, 1819) как Dubium erinaceieuropaei по личинкам, обнаруженным в межрёберных мышцах ежа. Видовое название цестоды непривычно длинное, и происходит от названия вида хозяина, у которого были найдены плероцеркоиды: Erinaceus europaeus - ёж европейский, или обыкновенный. К слову, иногда в публикациях можно встретить раздельное или через дефис написание двух слов, составляющих видовой эпитет паразита: erinacei europaei или erinacei-europaei.
При обосновании рода Spirometra Ю. Мюллер (Mueller, 1937) сделал описанный К. Рудольфи вид типовым. Э. Фауст с коллегами (Faust et al., 1929) обнаружили подобные плероцеркоиды в Китае в еже амурском и, скормив их собакам, получили половозрелых червей. При описании паразита они подчеркнули сходство найденных ими плероцеркоидов с таковыми из ежа европейского.
Г. Шмидт (Schmidt, 1986), рассматривавший род Spirometra синонимом Diphyllobothrium, насчитал у D. erinaceieuropaei 28 синонимов. Кстати, некоторым из них уже вернули самостоятельный статус.
Рис. 84 Spirometra erinaceieuropaei, передний конец и членики (из: Рыженко)
Длина стробилы 68 см (Jeon et al., 2015; см. рис. 87). Сколекс шпателеобразный, маленький, длиной 1.0 и диаметром 0.2 мм. Шейка следует непосредственно за сколексом и достигает в длину 0.5 см. Зрелые проглоттиды с яйцами впервые появляются на расстоянии 14 см от сколекса, их размеры 1.1 - 2.0 х 6.8 - 10.8 мм (Примечание'. эти цифры заимствованы мною из текста статьи; в табл. 2, сопровождающей текст, указанные размеры приводятся для 5. decipiens).
Половая пора расположена вентрально по средней линии в передней 1/5 сегмента. Маточные поры на средней линии позади переднего края зародышевого шара, 0.08 -0.1 мм. Максимальный диаметр семенников 0.07 - 0.08 мм. Бурса цирруса овальная, 0.20 - 0.25 х 0.12 - 0.15 мм. Циррус меньше, чем у остальных родственных видов. Семенной пузырёк эллиптический, 0.20 - 0.22 х 0.15 - 0.17 мм. Гантелеобразный яичник у заднего края сегмента. Матка формирует с обеих сторон по 5 - 7 петель. Яйца 57-61 х 33 - 36 pm. По данным Г. Ф. Рыженко (1969), паразиту свойственна значительная вариабельность в размерах, а также в строении и расположении внутренних органов.
157
Жизненный цикл S. erinaceieuropaei хорошо изучен, что во многом связано с тем, что плероцеркоиды этой цестоды имеют серьёзное медицинское значение как возбудители заболеваний человека (Denegri, Reisin, 1993). Более того, жизненный цикл данного паразита полностью изучен и в экспериментальных условиях (Ры-женко, 1969; Lee et al., 1990; Okino et al., 2017).
Из попавших в воду яиц (рис. 85) в зависимости от температуры воды на 10 - 12 - 16-й день выходят корацидии, чья продолжительность жизни при благоприятных условиях не превышает двух суток. Циклопы захватывают корацидиев с помощью околоротовых конечностей, а затем всасывают в пищевод, из которого те проникают в полость их тела. Здесь происходит формирование процеркоидов, количество которых в одном циклопе может колебаться от 1 до 7 - 8 экз. (Елизаров, Малышева, 2010; Рыженко, 1969). Например, в водоёмах Курской области заражённость обследованных копепод колебалась от 3.98 до 13.66 %, а интенсивность инвазии - в среднем от 4.5 до 4.8 экз. (Елизаров, Малышева, 2010). На 12 - 15-й
день процеркоиды достигают инвазионного состояния, при этом их размеры составляют 0.15 -0.18 х 0.05 - 0.06, а диаметр церкомера (хвостового придатка) не превышает 0.03 - 0.04 мм. При попадании в кишечник дополнительного хозяина церкомер выворачивается и участвует в процессе пробуравливания стенки кишечника (Рыженко, 1969), после чего процеркоид мигрирует в различные ткани и органы, где происходит формирование следующей личиночной стадии паразита - плероцеркоида.
Рис. 85 Spirometra erinaceieuropaei, эмбриональное развитие яиц (из: Рыженко)
Одной из примечательных особенностей плероцеркоидов S. erinaceieuropaei является их способность секретировать ростовой гормоноподобный продукт, который стимулирует ускоренный рост млекопитающих (Hirai, 2003).
Информация о регистрации 5. erinaceieuropaei в промежуточных, паратонических и дефинитивных хозяевах весьма обширна и охватывает самые разные регионы. К примеру, на юге Китая в Гуанси-Чжуанском автономном районе плероцеркоиды S', erinaceieuropaei встретились у лягушек китайской съедобной и травяной (у 30.37 % обследованных особей) и у змеи китайской водяной (50 %) (Zhang et al., 2014), а в центральном Китае в провинции Хэнань - у лягушек чёрнопятнистой (14.85 %), рисовой (20.82 %) и травяной (10.91 %) (Wei et al., 2015). Обследованная тогда же жаба дальневосточная оказалась свободна от личинок. Принадлежность изолятов от всех перечисленных хозяев к названному виду была подтверждена результатами молекулярно-генетического анализа (Wei et al., 2015; Zhang et al., 2014).
В Волжском бассейне плероцеркоиды отмечены у ужей водяного и обыкновенного, полоза узорчатого и гадюки обыкновенной (Бакиев, Кириллов, 2007), в Курской области - у лягушек остромордой и озёрной (у 10.4 % особей), ужа обыкновенного (15.3 %) и дикого кабана (17.6 %) (Елизаров 2009), в Армении - у ужа водяного (6.25 %) и гюрзы (16.6 %) (Arakelyan, 2014). На территории Беларуси плероцеркоиды этого вида зарегистрированы у енотовидной собаки (19.04 %), рыси 158
(3.7), кабанов (9.16), ежей (22.2), хорька (33.3), норки американской (1.7) и кротов (3.7 %) (Дубина и др., 2006), а в Полесском радиационно-экологическом заповеднике - у 64.2 % ужей и 16.6 % гадюк, 50.6 % особей кабана и 88.4 % енотовидных собак (Пенькевич, 2015). По данным Е. И. Анисимовой (2007), американская норка в Беларуси заражена 5. erinaceieuropaei на 50.6 %.
Взрослые формы цестоды - обычные паразиты собак, волков, лисиц, кошек. На территории Беларуси, например, они выявлены у 1.22 % особей собак, 15 % волков, 18.5 % рысей (Дубина и др., 2006), а в упомянутом Полесском заповеднике - у 41.4 % волков (Пенькевич, 2015). На Тасмании дикие кошки, обитающие в центральной части острова, оказались заражены S. erinaceieuropaei на 66.3 %, а населяющие о. Кинг - на 19 % (Gregory, Munday, 1976). В Украине паразита находили у волка, енотовидной собаки и лесного кота (Корнюшш та ш., 2013), в Эстонии - у бездомной кошки (Коняев и др., 2011), в Новой Зеландии - у диких кошек (Ugarte et al., 2005), в Аргентине - у лисицы парагвайской (Scioscia et al., 2014) и т.д. Взрослые формы были получены в экспериментально заражённых песцах, собаках, лисице серебристо-чёрной, кошках (Рыженко, 1969; Lee et al., 1990). В кошках, в частности, выделение яиц паразита наблюдалось на 15 - 18 день после заражения.
Вид широко распространён в природе и может быть обнаружен практически везде, где возможно прохождение его жизненного цикла. Электрофоретические исследования S. erinaceieuropaei из Японии и Австралии, например, показали их тесную связь, если не тождественность (Fukumoto et al., 1992).
Геном S. erinaceieuropaei, полученный от червя из поражённого мозга пациента (Bennet et al., 2014), оказался примерно в 10 раз больше, чем у других червей, и составил треть от генома человека. Возможно, увеличение числа генов помогает паразиту разрушать белки и вторгаться в организм хозяина. К тому же, у него выявлены различные молекулярные механизмы для перемещения белков вокруг его клеток, что может лежать в основе изменения формы тела и адаптации к окружающей среде, которые претерпевает червь, имеющий сложный жизненный цикл. Геном доступен через веб-сайт WormBaseParaSite.
Spirometra decipiens (Diesing, 1850) (рис. 86). Впервые паразит описан на материале из Бразилии от животного, похожего на кошку (Diesing, 1850). Затем цестоду обнаружили у домашней кошки и леопарда дымчатого в зоопарке Калькутты (Индия) (Chandler, 1925), а в Уругвае взрослых червей вырастили в собаках, которым скормили плероцеркоидов из лягушек (Wolffhiigel, Vogelsang, 1926). Под этим же названием - decipiens (видовое название можно перевести как обманчивый, вводящий в заблуждение) - паразита описали на материале из кошки, леопарда и собаки в Китае, а также из собаки, которую заразили личинками из лягушек (Faust et al., 1929). Затем вид свели в синонимы S. erinaceieuropaei и долгие десятилетия о нём не было никакой информации. Тем более неожиданным оказалось появление в печати трёх публикаций, в которых приводятся доказательства существования в природе самостоятельного вида S. decipiens. В одной из статей её авторы утверждают, что в Корее у людей( наряду с S. erinaceieuropaei, встречается S. decipiens (Jeon et al., 2015), а в другой приводят ошеломляющие сведения о находках у змей Китая и Кореи плероцеркоидов только одного вида - S. decipiens (Jeon et al., 2016 а). В третьей статье показано, что в США под именем S. mansonoides может в действительности скрываться S. decipiens (Jeon et al., 2016 b). В качестве доказательной базы приводятся результаты молекулярно-генетического анализа изученных видов.
159
Описание S. decipiens из Кореи (Jeon et al., 2015). Длина стробилы 47 см. Сколекс шпателеобразный, маленький, 1.5 х 0.5 мм. Шейка до 1.0 см длиной. Зрелые проглоттиды с яйцами впервые появляются на расстоянии 14 см от сколекса, их размеры 2.1 - 3.2 х 3.1 - 4.2 мм (Примечание: цифры из текста цитируемой статьи; в табл. 2, сопровождающей текст, эти размеры приводятся для S. erinaceieuropaei). Половая пора расположена вентрально по средней линии в передней 1/5 сегмента. Маточные поры на средней линии. Матка образует по 4 - 4.5 петель с обеих сторон. Яичник у заднего края сегмента. Бурса цирруса овальная, 0.20 - 0.22 х 0.15 -0.17 мм. Циррус удлинённый, сильно мускулистый. Семенной пузырёк эллиптический, 0.24 - 0.28 х 0.10 - 0.15 мм. Диаметр семенников 0.07 - 0.08 мм. Яйца 56 -
60 х 34 - 36 цш.
Рис. 86 Зрелые проглоттиды: Spirometra erinaceieuropaei (А) и Spirometra decipiens (В) (GP - половая пора; VP - вагинальная пора; UP - маточная пора) (из: Jeon et al., 2015)
В процитированной выше работе (Jeon et al., 2016 b), в которой доказывается возможность встречаемости S. decipiens на территории США, речь идёт об экспериментальном выращивании взрослой формы паразита из яиц, материал по которым получен из Университета в Небраске (США), где их определили как принадлежащие S. mansonoides. Исследователи инкубировали яйца, а вылупившихся кора-цидиев скормили циклопам, затем инвазированных процеркоидами рачков скормили головастикам и лягушкам, в которых были получены плероцеркоиды, использованные для заражения кошки. Через 3 недели в кишечнике кошки обнаружили взрослого червя длиной 41 см. Длина сколекса цестоды 1.5, диаметр 0.2, длина шейки 1.0 мм. Первые яйца наблюдались в члениках на расстоянии 10 см от шейки.
В Китае и Корее заражённость местных пресмыкающихся плероцеркоидами S. decipiens очень высока: динодон краснопоясный поражён на 100 % (индекс обилия 1.8 экз.), щитомордник каменистый - на 85 % (8.4 экз.), в Корее уж тигровый заражён на 80 % (3 экз.) (Jeon et al., 2016 а). Самое поразительное то, что ни в одной из 283 обследованных змей ни разу не встретился S. erinaceieuropaei. хотя этот вид встречается в Корее у людей в два раза чаще, чем S. decipiens.
По мнению, цитируемых авторов (Jeon et al., 2016 b), естественный ареал S. decipiens включает Бразилию, Китай, Корею. Видимо, к ним следует добавить Уругвай и Индию, о которых шла речь выше. В Северную Америку паразит вполне мог попасть с завезёнными кошками или собаками.
160
Spirometra mansoni (Cobbold, 1882) (=Ligula mansoni Cobbold, 1882) (рис. 87, 88). Вид назван в честь д-ра Патрика Мансона (Р. Manson), впервые обнаружившего 12 плероцеркоидов этого паразита при аутопсии местного жителя в Сямыне на юго-востоке Китая в 1882 г. В англоязычной научно-популярной литературе паразита часто называют Мансоновским солитёром - Manson’s tapeworm или спарганом Мансона - Sparganum mansoni.
Описание (по: Joyeux, Houdemer, 1928; Mueller, 1936; m-leaming.zju.edu.cn). Длина червей до 60-100 см. В стробиле насчитывается до 1000 члеников. Сколекс ложкообразный, размером 1 - 1.5 х 0.4 - 0.8 мм, с двумя присасывательными желобками. На поперечном срезе сколекс квадратный. Свободные края ботрий хорошо развиты. Обычны известковые частицы. Дистальные проглоттиды почти квадратные. Вагина латерально расширена. Матка формирует 3-5 больших передних петли. Э. Фауст с соавт. (Faust et al., 1929) переисследовали типовой материал и обнаружили в наружной части матки 4.5 петли. Яйца 52 - 78 х 31 - 44 pm, светло-жёлтого цвета; созревают в течение 3 недель.
Рис. 88 Spirometra mansoni, сагиттальный разрез червя из Панамы: семяприемник (sr), вагина (у), задние (ре) и передние (иГ) кольца матки, семенной пузырёк (sv) (из: Mueller, 1936)
Рис. 87 Spirometra mansoni: слева - взрослый червь, справа - яйцо (из: ш-leaming.zju.edu.cn)
Взрослые формы - паразиты кошек и собак; на Филиппинах найдены у циветты пальмовой (Hinz, 1985). На Филиппинах первый промежуточный хозяин паразита - циклопы родов Eucyclops и Cryptocyclops, второй - лягушки, заражённость которых достигает 2.1 %, змеи, в которых может насчитываться до 120 - 160 личинок, и гекконы (Hinz, 1985). Плероцеркоиды данного вида встретились даже в птице - волчке охристом из семейства цаплевых, широко распространённом в тропических и субтропических регионах Азии.
В Китае звстречаемость S. mansoni у собак и кошек колеблется от 0 до 77.9 и от 0.9 до 69 % соответственно (Hong et al., 2016). Так, в провинции Гуанчжоу яйца этой цестоды были выявлены в фекалиях 27.5 % обследованных собак и 40.5 % кошек, а плероцеркоиды - у 51.92 % особей лягушки китайской съедобной (по 1 -47 экз.) и 35.14 % лягушки рисовой (по 1-17 экз.) (Hong et al., 2016). При этом на фермах ни одна из 1382 обследованных лягушек (китайская съедобная и лягушка-бык) не была заражена.
161
Spirometra mansonoides Mueller, 1935 [=Diphyllobothrium (Spirometra) man-
sonoides Mueller, 1935] (рис. 89 - 91).
Рис. 90 Spirometra mansonoides, изображение матки (дорсально), показывающее разделение на передний и задний участки (из: Mueller, 1935)
Рис. 89 Spirometra mansonoides: 1 - 6 - участки стробилы от сколекса до терминальных члеников; 7 - 9 - сколексы, отличающиеся по размерам и форме; 10 -поперечные разрезы через сколекс и шейку; 11 - незрелый членик, вентрально; 12 - разрез через членик на уровне половой папиллы; 13 -3 яйца из фекалий собаки на 40-й день культивирования; 14-2 яйца из матки цестоды от кошки; 15 - членик (см. 6), вентрально (из: Mueller, 1935)
162
Впервые цестоду обнаружили в 1933 г. у кошек из Сиракуз (Нью-Йорк, США) (Mueller, 1935, 1974). Название вида можно перевести как «спирометра, похожая на mansoni»; так автор подчеркнул общее сходство нового вида с ранее описанным Diphyllobothrium mansoni (Mueller, 1935).
После упрёка в недостаточности материала для обоснования нового вида, которого по этой причине свели в синоним Diphyllobothrium mansoni (Skinker, 1935), Ю. Мюллер получил дополнительный материал от кошек из той же местности, и дополнил описание цестоды, ещё раз подчеркнув обоснованность описания нового вида и его положение в составе подрода Spirometra (Mueller, 1936). Одновременно он изучил единственный экземпляр D. mansoni, найденный в тонком кишечнике кошки, погибшей при наводнении в Луизиане в 1927 г. (Dickmans, 1931), и переопределил его как D. mansonoides.
В 1937 г. Spirometra, имевшая до того ранг подрода, стала родом, a Diphyllobothrium mansonoides - его полноправным членом. По данным Ю. Мюллера (1936), заражённость кошек этим гельминтом в Сиракузах составляла 4.6 %. В собаках он этого паразита не встретил, но предположил возможность его обнаружения и в этих хозяевах.
Электрофоретические исследования S', mansonoides подтвердили его отличия от типового вида рода - S', erinaceieuropaei на генетическом уровне (Fukumoto et al., 1992).
Взрослые черви розоватого цвета (Mueller, 1974), что связано с абсорбцией ими витамина Bi2 (Marchiondo et al., 1989). Длина до 100 - 140 см, максимальная ширина до 7 - 10 мм. Сколекс диаметром 0.2 - 0.5 мм, слабо отграничен от шейки, на поперечном срезе имеет продолговатую форму. Ботрии мелкие, длиной до 1 мм, со слабо развитыми свободными краями, широкие, уплощённые в нижней части, где они сливаются с поверхностью шейки. Ширина шейки непосредственно у сколекса 0.25 мм, до начала сегментации 0.5 - 1 мм. Зрелые проглоттиды появляются на расстоянии 16 - 20 см от сколекса. Соотношение длины членика к его ширине меняется от 1 : 2 - в молодых проглоттидах до 4 : 1 - в терминальных. Циррус открывается маленькой порой, вагина - сразу же позади в виде поперечной щели. Маточные поры посередине между вагинальной порой и задним краем членика, слегка сдвинуты от средней линии. Семенники многочисленные, сферические. Яичник в виде уплощённой вентральной ленты с сетчатыми краями. Матка из двух частей (рис. 90), соединённых узким протоком, достаточным для того, чтобы там разместилось 3-4 яйца. Задний участок из 7 - 8 узких тонкостенных колец. Дорсально к наружной маточной массе узкий тонкостенный маточный проток образует 4 или 5 петель. Яйца размером 57 - 66 х 33 - 37 цш, заострённые, с конической
крышечкой (рис. 91). Яйца созревают в течение 50 дней. Могут сохранять жизнеспособность при 4°С, по меньшей мере, в течение года.
Рис. 91 Spirometra mansonoides, яйца (из: ге-search.vet.upenn.edu - Spirometra mansonoides)
Окончательные хозяева паразита - дикие и домашние кошки и собаки, а также еноты и рыси, допол-
нительные и паратенические - амфибии, рептилии, в частности водные змеи Natrix, птицы, млекопитающие. В Луизиане, например, плероцеркоиды данного вида выявлены у 2 видов амфибий, 8 видов рептилий и 3 видов млекопитающих (в опоссуме, еноте и лисице серой) (Mueller, 1974), а на юго-востоке США - у барибала (Crum et al., 1978).
163
Развитие червей в кошках завершается в течение 10-30 дней, а продолжительность их жизни достигает 3.5 лет (Mueller, 1974). Некоторые плероцеркоиды могут развиваться в стенке кишечника животного.
Возможность заражения человека плероцеркоидами S. mansonoides была доказана экспериментальным путём (Mueller, Coulston, 1941). Двум волонтёрам, а в этой роли выступали сами исследователи, в кожу левой руки над бицепсом ввели двухмиллиметровых личинок цестоды из экспериментально заражённой лягушки: Ю. Мюллеру ввели 2 личинок, а его коллеге - одну. Через 68 дней после того, как личинка в руке Ф. Коулстона проникла в подмышечную область, преодолев расстояние в 12 см, её извлекли из руки волонтёра. Длина спаргана была равна 50 мм, т.е. за два месяца червь увеличился в размерах в 25 раз. Через 69 дней под местной анестезией удалили личинку из бицепса Ю. Мюллера. Её длина составила 60 мм. Тогда же был обнаружен фрагмент хвоста длиной 10 мм второй личинки. Через 97 дней у Ю. Мюллера удалили вторую личинку, чья длина достигала 60 мм. Эта последняя была скормлена кошке, в кишечнике которой цестода выросла до взрослого червя длиной 127 см. Выращенными из яиц этого червя процеркоидами успешно заразили макаку-резус. Описанные опыты имели большое теоретическое и практическое значение, поскольку демонстрировали способность паразита выживать и сохранять инвазионность после многочисленных пассажей через разных хозяев, в том числе человека.
Ареал вида охватывает территорию США, Мексики, Панамы, Колумбии, Эквадора, Бразилии.
Sparganum proliferum (Ijima, 1905) (=Plerocercoides proliferus Ijima, 1905) (рис. 92). Эти личинки впервые описаны ещё в начале 20-го столетия на материале из подкожных тканей женщины, живущей близ Токио (Ijima, 1905). Видовое название паразита от латинского proliferatio’, proles - потомство и ferres - носить. Оно связано со способностью клеток этих личинок непрерывно и интенсивно делиться, что вкупе с их способностью к бесполому размножению приводит к росту числа паразитов, которое может исчисляться тысячами особей в одном хозяине.
Sparganum proliferum - полиморфная личинка удлинённой формы. Апикальный конец способен выворачиваться или втягиваться. Обычно имеются боко-л вые выросты, которые время от времени отрывают-I J ся и развиваются в новую личинку. В личинках раз-
\ \ личаются волнистый тегумент, несколько слоёв
\ 4 V j эпидермальных клеток, неразвитые мышечные
J клетки, экскреторные каналы и известковые части-
f Д цы (Nakamura et al., 1990). S. proliferum обладает л многими паренхиматозными и тегументальными образованиями, характерными для личинок других цестод, но у них имеются одиночные или множественные паренхиматозные полости, окружённые те-гументом, в некоторых случаях, видимо, играющие роль примитивного пищеварительного тракта (Noya et al., 1992).
T* < Л? / Рис. Sparganum proliferum, общий вид (из: seesaawi-
Jx Л ’jc ki-jp)
164
Взрослые формы этих личинок в природе никогда не были встречены (Acha, Szyfres, 2003). Потерпели неудачу и попытки получить половозрелых червей при экспериментальном заражении животных, которые могли бы сыграть роль дефинитивного хозяина: плероцеркоиды в них просто переваривались. Однако при трансплантации личинок в подкожную ткань или брюшную полость различных животных те приживались в них и начинали размножаться бесполым путём.
Предполагают, что S. proliferum может быть аберрантной формой S. mansonoides или S. erinaceieuropaei (Kuchta et al., 2015). Тем не менее, согласно морфологическому (Ijima, 1905), серологическому (Nakamura et al., 1990) и молекулярному (Bennet, Mok, 2014; Miyadera et al., 2001; Okamoto et al., 2007) анализам S. proliferum отличается от S. erinaceieuropeai, хотя и близко связан с ним. Попытки доказать, что Sparganum proliferum является ветвящимся вариететом S. mansoni, оказались безуспешными (Faust, 1949).
Примечательно, что заражение людей пролиферирующими спарганами регистрируют в самых разных, географически удалённых друг от друга регионах - в Таиланде и Парагвае, в США и Китае, Японии и Венесуэле, на Тайване и Филиппинах.
Первый случай заражения человека спарганами официально датируется 1596-м годом (цит. по: Kuchta et al., 2015). К настоящему времени инвазия людей плероцеркоидами спирометр фиксируется практически на всех континентах (за исключением Антарктиды). В обзорной статье по дифиллоботриидам, регистрируемым у человека, Р. Кухта с коллегами (Kuchta et al., 2015) представили краткую информацию о находках спирометр у людей в разных странах. Мне остаётся только сослаться на их данные, добавив некоторые, отсутствующие в их работе детали, в частности о заражении спарганами человека на территории РФ и ряда других стран. Совершенно очевидно, что привести всю литературу, а это - сотни источников, посвящённую паразитированию спирометр у человека, практически невозможно, поэтому ограничусь ссылками на наиболее интересные из них.
В Европе заражение людей плероцеркоидами спирометр зарегистрировано в Чехии (Faust, 1949 - у мигранта из Польши; Rehak et al., 2006), Франции (Botterel, Bouree, 2003; Garin et al., 1997), Италии (Pampiglione et al., 2003), Нидерландах (см.: Faust, 1949), Германии (Тарре et al., 2013 - у женщины японского происхождения), Испании (Lo Presti et al., 2015 - у 29-летнего боливийца), Беларуси (Минская и Гомельская области) (Турицин и др., 2008) и РФ (Ивановская и Псковская области, Удмуртия) (Турицин и др., 2008; www.jurbase.ru). Пять последних стран цитируемыми выше авторами (Kuchta et al., 2015) не упоминаются. Примечательно, что в Чехии, Германии и Испании инвазия была выявлена у иммигрантов.
В Северной Америке спарганозис человека выявлен в США (Cummings et al., 2000; Faust, 1949; Griffin et al., 1996 - по состоянию на 1996 г. в стране было зафиксировано 62 случая; Holodniy et al., 1991), Мексике (Landero et al., 1991). Последняя в работе (Kuchta et al., 2015) не упоминается.
В Центральной и Южной Америке заражение людей спирометрами, включая несколько случаев пролифелирующего спарганозиса, отмечено в Белизе, Пуэрто-Рико и Гайане (см.: Faust, 1949), Эквадоре (Guderian et al., 1990; Kron et al., 1991), Венесуэле (Moulinier et al., 1982), Аргентине (Rolon, 1976; de Roodt et al., 1993 - у выходца из Перу), Бразилии (Maciel, Haddad, 1968; Mentz et al., 2011), Колумбии (Botero, G6mez, 1958), Уругвае (Sakamoto et al., 2003), Парагвае (Beaver,
165
Rolon, 1981; Boero et al., 1991), Перу (Beltran Fabian et al., 2015), Боливии (Jones M. et al., 2013). Последние две страны в работе (Kuchta et al., 2015) не упоминаются.
Азия - регион, где более всего распространено заболевание людей спарга-нозисом и только здесь известны находки у пациентов взрослых спирометр (Faust, Wassel, 1921; Kamo, 2003; Lee et al., 1984; Suzuki et al., 1982; Tu et al., 1973). К слову, в двух случаях цестод первоначально определили как Diphyllobothrium latum. Среди эндемичных регионов, прежде всего, следует отметить Китай: в 25 провинциях страны описано более 1000 случаев спарганозиса (Chen, Ye, 2014; Li et al., 2011). Далее по количеству выявленных случаев, тем не менее, значительно уступая по этому показателю Китаю, следуют Корея (Cho J. et al., 2000; Cho К. et al., 1987; Jeon et al., 2015; Min, 1990; Oh et al., 2014; Seo et al., 1964; Yoon et al., 2004), Вьетнам (Chen, Ye, 2014), Таиланд (Anantaphruti et al., 2011; Laovachirasuwan et al., 2015; Wiwanitkit, 2004), Япония (Ijima, 1905; Ishii et al., 2001; Iwatani et al., 2006; Kamiya et al., 2004; Nakamura et al., 1990; Tanaka et al., 1997). В остальных странах -Индии (Khurana et al., 2012; Nath, Gogoi, 2015; Rengarajan et al., 2008; Subudhi et al., 2006), Индонезии (Bonne, 1942), Лаосе (Fontan et al., 1975), Гонконге (Tang et al., 2017), на Филиппинах (Eduardo, 1991) и Тайване (Lo et al., 1987; Su, 2013) - подобные случаи отмечают спорадически. На Тайване, например, к 2013-му году зафиксировали всего 28 случаев заражения людей, в том числе три - пролиферирующим спарганозисом (Su, 2013). В РФ единичные случаи заражения людей спарганами известны на Дальнем Востоке (Турицин и др., 2008).
На африканском континенте спарганозис человека выявлен в Демократической Республике Конго, Габоне, Кении и Танзании (Kavana et al., 2016; Schmid, Watschinger, 1991 - среди масаи на севере страны), Либерии, Уганде (Jones D., 1962), Зимбабве, на Мадагаскаре, в Мозамбике (Alves et al., 1954), Эфиопии и Южном Судане (Eberhard et al., 2015). Три последние страны у цитируемых авторов (Kuchta et al., 2015) не упоминаются. Возбудителями заболевания на этом континенте могут быть иные, «местные» виды спирометр - S', pretoriensis или S. theileri.
В Австралии зафиксировано несколько случаев подкожного спарганозиса у местных жителей, к слову, никогда не выезжавших за пределы страны (Cleland, 1918; Hughes, Biggs, 2002).
В итоге к настоящему времени почти в 50 странах мира, главным образом, в Южной и Юго-Восточной Азии, выявлено более 1600 случаев заражения людей спарганами (Liu et al., 2015).
Не исключено, что в действительности заболевание человека спарганозисом более широко распространено, чем это принято считать, т.к. вполне вероятно, что в ряду случаев оно просто не зафиксировано соответствующими медицинскими учреждениями. Более того, нельзя исключать и возможность неверной идентификации паразитов, как это имело место, например, в Китае, где черви, обнаруженные у двух молодых людей из долины Янцзы и определённые как Diphyllobothrium latum, были переопределены как Spirometra erinacei (Lee et al., 1984).
Плероцеркоиды могут локализоваться в самых разных органах и тканях человека:
• в подкожной и мышечной ткани - Chan et al., 2004; Cho J. et al., 2000; Cho S. et al, 1975; de Roodt et al., 1993; Garin et al., 1997; Griffin et al., 1996; Guderian et al., 1990; Ijima, 1905; Johnson et al., 2015; Koo et al., 2011; Nakamura et al., 1990; Tang et al., 2017; Тарре et al., 2013; Tsou, Huang, 1993; www.jurbase.ru; и многие другие;
166
• в глазах - Botterel, Bouree, 2003; Jones, 1962; Kittiponghansa et al., 1989; Mentz et al., 2011; Rehak et al., 2006; Sen et al., 1989; Subudhi et al., 2006; Yoon et al., 2004;
• в ротовой (lamaroon et al., 2002), брюшной (Beaver, Rolon, 1981; Lee et al, 2005) и грудной полостях (Beaver, Rolon, 1981; Kudesia et al., 1998);
• в плевре и лёгких - Huang et al., 2012; Ishii et al., 2001; Iwatani et al., 2006; Kamiya et al., 2004; Oh et al., 2014; Tanaka et al., 1997;
• в мочеполовой системе - Jeong, 2004; Oh et al., 1993; Seo et al., 1964; Zhao et al., 2014;
• в спинном и головном мозге - Chang et al., 1992; Cummings et al., 2000; Faust, 1949; Holodniy et al., 1991; Hughes, Biggs, 2002; Kim D. et al., 1996; Kudesia et al., 1998; Landero et al., 1991; Lo et al., 1987; Lo Presti et al., 2015; Ou et al., 2010; Renga-rajan et al., 2008; Song et al., 2007; Wang et al., 2009;
• в костной ткани - Laovachirasuwan et al., 2015; Nakamura et al., 1990; Settakom etal., 2002.
Фактически каждый случай заражения человека тем или иным видом спирометр становится объектом детального исследования и предметом обсуждения в соответствующей статье.
В зависимости от локализации паразита можно выделить подкожный, глазной, ротовой, висцеральный, лёгочный, мочеполовой, церебральный, костный спар-ганозис. Пролиферирующий спарганозис в ряде случаев трудно отнести к какой-либо определенной категории, поскольку одновременно могут быть поражены многие органы человека. Клинические симптомы заболевания варьируют в зависимости от локализации паразита в организме человека.
Подкожный спарганозис - самый распространённый тип поражения людей. Локализация цестод под кожей приводит к образованию узелков, абсцессов (Cho J. et al., 2000; Guderian et al., 1990; de Roodt et al., 1993; Тарре et al., 2013). Симптомы, связанные с подкожной инвазией, проявляются уплотнениями в месте локализации червя, отёком, угрёвой сыпью, периодически возникающими болью, крапивницей и зудом, которые обычно связаны с передвижениями паразита. Эти периодические местные реакции могут сопровождаться ознобом и чувством глубокой депрессии и недомогания (Mueller, Coulston, 1941). Подкожные повреждения зачастую напоминают липому, фиброму, сальные цисты, при этом могут наблюдаться некроз тканей, гранулёматозные образования, инфильтрат лимфофлегмонных клеток со скоплениями эозинофилов (Griffin et al., 1996; Коо et al., 2011; Moulinier et al., 1982; Tsou, Huang, 1993). Проникновение личинок в более глубокие мышечные слои проследить и, тем более, диагностировать труднее (Kim J., Lee, 2001).
В ноябре 2001 г. в Псковской области РФ в поликлинику онкодиспансера обратилась 33-летняя женщина с жалобами на опухоль в области молочной железы, чувство жжения и шевеления в этой опухоли (Письмо...). Предварительный диагноз гласил: липома грудной стенки. При контрольном осмотре в апреле 2002 г. пациентка пожаловалась на изменение локализации опухоли. На этот раз ей диагностировали фиброаденому молочной железы и порекомендовали удалить опухоль. Во время операции после рассечения инфильтрата было обнаружено лентовидное образование белесоватого цвета до 30 см длиной. Заболевание пациентки связали с её пребыванием в 2000 г. на сельскохозяйственных работах в Калмыкии, где воду для питья брали из открытых водоёмов и доставляли в цистернах.
167
«Приведенный пример заболеваемости спарганимозом, зарегистрированный в Псковской области (г. Великие Луки), не является единичным на территории Российской Федерации, т.к. ряд подобных заболеваний проходит под диагнозами ди-рофиляриетоза и других филярий» (Письмо..
У местных жителей в Эфиопии и Южном Судане зарегистрировали необычную локализацию личинок спирометр - в открытых кожных повреждениях (Eberhard et al., 2015). О том, что это, скорее всего, не было случайным попаданием личинок в повреждения на коже, свидетельствует количество пострадавших - 37.
Полагают, что в ряде случаев асимптоматичные подкожные поражения из-за трудностей в диагностике могут оказаться вне поля зрения медиков, а потому действительное количество пострадавших фактически неизвестно (Tang et al., 2017). Инкубационный период длится от одного дня до нескольких месяцев.
Локализация паразитов в глазах сопровождается ощущением инородного тела в глазу, покраснением, болезненным отёком, обильным слезотечением, болью, которая может распространяться на оба глаза, в лобную область. При локализации личинки в субконъюнктиве в ней образуются опухоли (Kittiponghansa et al., 1989; Nath, Gogoi, 2015). Заболевание приводит к птозу (опущению верхнего века), экзофтальму, острому иридоциклиту, конъюнктивиту и эндофтальмиту, и, при отсутствии лечения, к слепоте (Botterel, Bouree, 2003; Rehak et al., 2006; Sen et al., 1989; Yang et al., 2007). При поселении паразита в мышечной ткани век формируются толстостенные поражения размером до 1.5 х 1.5 см, вызванные гранулёматозной реакцией организма (Yoon et al., 2004). Длина тела обнаруживаемых в глазах личинок варьируют от 1 - 3 до 20 см, чаще 5 - 7 см (Botterel, Bouree, 2003; Mentz et al., 2011; Subudhi et al., 2006; Yoon et al., 2004). Однако известны находки и более крупных червей. Так, в Таиланде у одного пациента из субконъюнктивальной опухоли извлекли личинку длиной 44 см и шириной 1 мм (Kittiponghansa et al., 1989), а у другого, 37-летнего мужчины, из вздутия на верхнем веке - червя длиной 70 см (Jenchitr et al., 1989). Как правило, в глазу поселяется одна личинка, но иногда их может быть две и даже три (Mentz et al., 2011).
Спарганозис ротовой полости - исключительно редкий тип заражения человека. Во всяком случае, известен единственный случай, имевший место в Таиланде (lamaroon et al., 2002). В слизистой верхней губы 21-летней пациентки был обнаружен асимтоматичный узелок размером 1x1 см. Патологическое исследование выявило личинку спирометры, окружённую фиброзной капсулой с сильным эозинофильным инфильтратом.
При висцеральном спарганозисе плероцеркоиды локализуются в стенке кишечника, брюшном жире, мезентерии, иногда во внутренних органах и брюшной стенке (Не, Huang, 1983; Khurana et al., 2012). Инвазия приводит к образованию узелков, абсцессов, содержащих эхогенный материал, и сопровождается болью в животе, лихорадкой (Lee J. et al., 2005), иногда могут наблюдаться кишечная непроходимость (Cho К. et al., 1987), перитонит (Не, Huang, 1983). В подобных случаях спарганозис обычно диагностируется при оперативном вмешательстве, показаниями для которого стали перитонит, аппендицит, непроходимость кишечника, грыжа. Именно в ходе операции по поводу грыжи брюшной полости у пациента был обнаружен червь, активно передвигающийся к месту, прилегающему к грыже (Kron et al., 1991). Возбудителями висцерального спарганозиса могут быть как плероцеркоиды отдельных видов Spirometra, так и пролиферирующие личинки Spar-
168
ganum proliferum. К примеру, в Китае 11 -летний мальчик скончался от диффузного перитонита, вызванного многочисленными спарганами, локализующимися в брюшной полости, различных внутренних органах и брюшной стенке (Не, Huang, 1983). У 24-летнего индейца в Парагвае крупная опухоль в нижней части живота и плевральной полости образовалась вследствие поселения множества мелких, ветвящихся личинок, которые в результате оказались погружёнными в фиброзную ткань (Beaver, Rolon, 1981).
Лёгочный спарганозис вызывают личинки, поселившиеся в лёгких или плевре и вызывающие образование узелков и абсцессов. При гистологическом исследовании вокруг узелка выявляются гранулёматозное воспаление с инфильтрацией нейтрофилов и эозинофилов вокруг червя и интерстициальная пневмония, окружающая узелок (Iwatani et al., 2006). Заболевание сопровождается болью, эозинофильным плевральным выпотом (Ishii et al., 2001; Lin et al., 2015; Oh et al., 2014; Tanaka et al., 1997). Симптоматика поражения лёгких неспецифична, а потому поставить соответствующий диагноз довольно трудно. Описан, например, случай, когда 43-летнему крестьянину ошибочно диагностировали лёгочный туберкулёз, лечение которого не давало положительного результата (Huang et al., 2012). Авторы публикации подчёркивают, что неверный диагноз создаёт серьёзную угрозу для здоровья пациента.
Проникновение паразитов в мочеполовую систему и его последствия весьма наглядно иллюстрируют описанные в литературе случаи поражения мошонки или же мочевого пузыря. Локализация спарганов в мошонке может привести к развитию гангрены Фурье, - прогрессирующему некрозу тканей кожи, подкожной клетчатки и мышечной стенки, который может распространиться до ключицы, ягодиц и нижних конечностей и представляет опасность для жизни человека (Jeong, 2004). В описанном случае червь был удалён, а пострадавшему назначен курс антибиотиков. В другом случае у 43-летнего жителя Кореи капсула размером 3 х 4 см локализовалась в левой нижней мошоночной зоне (Seo et al., 1964). После удаления в капсуле обнаружились 3 личинки длиной 19 - 29 см и шириной 2 - 6 мм. И совершенно уникален случай заражения 5-месячного младенца, которому поставили диагноз тератомы мошонки, а после удаления воспалённой массы выяснилось, что виновником патологии был спарган, явно попавший к малышу через лягушачье мясо, которое прикладывали к его пупку в качестве лечебного средства (Zhao et al., 2014).
Поражение мочевого пузыря спарганом привело к развитию у пострадавшего эозинофильного цистита; при этом в стенке пузыря был хорошо заметен извилистый некротизированный путь передвижения червя (Oh et al., 1993).
Церебральный спарганозис объединяет случаи поражения головного и спинного мозга человека и является наиболее тяжёлым проявлением спарганозиса (Chang et al., 1992; Cummings et al., 2000; Faust, 1949; Gao, Wang, 2006; Hughes, Biggs, 2002; Lo Presti et al., 2015; Rengarajan et al., 2008; Tsai et al., 1993; Wang et al., 2009). Заболевание сопровождается головокружением, головной болью, судорогами, эпилептиморфными припадками, гемипарезом, временной слепотой, потерей памяти, вялой реакцией (Bennet et al., 2014; Boero et al., 1991; Holodniy et al., 1991; Ou et al., 2010; Song et al., 2007). В определённой степени это может быть связано с высоким внутричерепным давлением с быстрым сбросом цереброспинальной жидкости (Ou et al., 2010). Повторяющиеся судороги наблюдаются примерно в 84 % случаев, гемипарез - в 59 %, головные боли с конвульсиями - в 56 % (Muller, 2002).
169
Интенсивное острое воспаление головного мозга может привести к очаговому энцефалиту (Landero et al., 1991). Установлено, что в Китае 15.4 % случаев энцефалопатии связано с заражением ЦИС спарганами (Wang et al., 2009).
Группа исследователей как-то провела ретроспективный анализ 25 случаев церебрального спарганозиса, в результате которого выяснилось, что у всех пациентов наблюдались отёк и дегенерация белого вещества мозга (Song et al., 2007). При этом у всех больных, за исключением одного, была поражена половина мозга.
Столь же неприятные последствия наблюдаются при поражении спарганами спинного мозга. На Тайване у 43-летней жительницы, жаловавшейся на боли в пояснице, слабость в ногах, которые подкашивались при ходьбе, были выявлены многочисленные спарганы, прикрепившиеся к спинному мозгу и нервным корешкам (Lo et al., 1987). Парапарез, диагностированный у 10-летней девочки, был вызван срединно-грудным поражением ЦНС, которое привело к формированию в области позвоночника зоны поражения, напоминающего абсцесс, в котором находилась личинка Spirometra mansoni (Kudesia et al., 1998).
Поражение головного мозга клинически и рентгенологически часто похоже на туберкулему или новообразование, что зачастую приводит к диагнозу, ошибочность которого выявляется только в ходе хирургической операции. Так, височнозатылочное поражение у 28-летней женщины из Южной Индии на снимках было похоже на туберкулёму, вследствие чего в течение 7 месяцев она проходила противотуберкулёзное лечение. При операции был выявлен паразитарный абсцесс, содержащий S. mansoni (Rengarajan et al., 2008). Авторы цитируемой публикации подчёркивают, что в районах, эндемичных по туберкулёзу, таких как, например, Индия, следует иметь в виду возможность имитации названного заболевания спарганами, особенно в тех случаях, когда соответствующее лечение не даёт результата.
Внутрикостный спарганозис регистрируется очень редко. Описан, к примеру, спарганозис у 63-летнего мужчины с патологическим переломом дистального участка левой плечевой кости. До этого инцидента пациенту поставили диагноз опухоли кости. Рентгенография показала наличие слабовыраженных остеолитических поражений кости, а в костной и мягкой тканях обнаружили сложенную личинку цестоды с известковыми тельцами (Laovachirasuwan et al., 2015). Тесты антител IgG на спарганозис дали положительный результат.
У 51-летнего мужчины, пожаловавшегося на постепенно растущую болезненную массу на правой ноге, при рентгенографии выявилось повреждение кости, с крапчатым обызвествлением в проксимальной части большеберцовой кости, характерное для хондросаркомы. При биопсии же обнаружили огромное количество маленьких шарообразных белых паразитов - пролиферирующих спарганов (Settakom et al., 2002).
Поражение Sparganum proliferum рассматривают наиболее опасным для человека, прежде всего, из-за способности этих личинок многократно размножаться в организме хозяина, захватывая всё новые ткани и органы. Иногда личинки локализуются только в одном или в смежных органах, например, в головном мозге (Cummings et al., 2000; Faust, 1949), в трубчатой кости (Settakom et al., 2002), в ягодичных мышцах и тазовой кости (Nakamura et al., 1990). Однако чаще регистрируют тысячи личинок, локализующихся в подкожной и мышечных тканях, в стенках пищеварительного тракта, мезентерии, почках, лёгких, сердце и мозге (Connor et al., 1976). Попытки организма хозяина отгородиться частью ткани от паразита приво
170
дят к образованию многочисленных узелков, а ткани хозяина становятся пористыми от повреждения (рис. 93). В каждом таком узелке содержится от одной до нескольких личинок вместе с водянистой или лимфатической жидкостью.
Рис. 93 Мышечная ткань человека, поражённая Sparganum proliferum (из: Faust, 1949; фотография материала, присланного автору профессором Т. Сузуки из Японии)
Диагностика спарганозиса человека, за исключением случаев подкожной локализации паразитов, трудна и практически не разработана. Более того, до недавнего времени личинки обнаруживались обычно при хирургической операции по поводу опухолей неясной этиологии или же патологии брюшной полости. Однако с развитием современных серологических и радиологических методов обследования диагноз на спарганозис удаётся поставить до операции. Наиболее перспективными и удобными для применения на практике являются методы сте
реотаксической биопсии, магнитно-резонансной (MRI) и компьютерной (СТ) томографии, а также иммуноферментный анализ (ELISA) (Chang et al., 1992; Gao, Wang, 2006; Kamiya et al., 2004; Kim D. et al., 1996; Kim H. et al., 1982; Song et al., 2007).
Что касается лечения спарганозиса, то наиболее радикальное средство - это хирургическое удаление личинок, поскольку хорошо зарекомендовавшие себя антигельминтные препараты, такие как альбендазол, празиквантел, мебендазол, в данном случае не всегда дают желаемый результат и имеют ограниченное воздействие. Вместе с тем, при пролиферирующем спарганозисе операция зачастую невозможна из-за огромного количества личинок, локализующихся в самых разных органах.
Заражение человека личинками спирометр (пути попадания в организм человека спаргана пролиферирующего не известны) происходит несколькими путями: через питьевую воду со случайно проглоченными циклопами, через сырое или недожаренное/недоваренное мясо рептилий, амфибий, домашней птицы, млекопитающих и, наконец, в результате применения мяса рептилий и/или амфибий в медицинских целях.
Циклопы могут встречаться в питьевой воде только в тех случаях, когда та не прошла соответствующей обработки, что очень часто наблюдается в сельской местности, в местах, удалённых от благ цивилизации, в походных и полевых условиях. К примеру, в сельской местности на севере Танзании 94.9 % людей пьют воду из природных источников, и заражённость жителей этого региона плероцеркоидами спирометр составила 62.5 % (Kavana et al., 2016). Предполагается, что именно так могла заразиться особа в Таиланде, у которой личинку обнаружили в ротовой полости и которая, по её словам, никогда не ела сырого мяса, но пила сырую воду во время походов в горы (lamaroon et al., 2002). Таким же образом заразился 20-летний мужчина, у которого в брюшной полости был выявлен абсцесс, содержащий паразита (Lee J. et al., 2005).
171
Ещё один путь попадания личинок к человеку - употребление в пищу инва-зированного плероцеркоидами мяса лягушек, змей, птиц, млекопитающих (кабанов, медведей, свиньи) (Liu et al., 2015; Mentz et al., 2011; Ou et al., 2010; Ruitenberg et al., 1979; Seo et al., 1964; Song et al., 2007; Тарре et al., 2013). В подобных случаях при поедании одного хозяина другим, животным или человеком, к нему переходят и плероцеркоиды его жертвы. В Корее, например, 59.8 % случаев заражения людей спарганами связано с употреблением лягушек (Lee et al., 2013). Примечателен случай обнаружения спарганозиса у 58-летней женщины японского происхождения, живущей в Германии уже 42 года. В Германии она покупала завозимую из Японии еду, а во время посещения исторической родины ела местные блюда, в том числе сырое мясо змей, которое и стало источником её инвазии (Тарре et al., 2013).
К слову, исследователи отмечают наблюдающийся в последние годы рост числа случаев спарганозиса из-за увеличивающегося употребления в пищу сырого мяса пресноводных лягушек и змей (Liu et al., 2015).
Источником заражения человека спирометрами может быть и еда, приготовленная из мяса диких животных, добытых на охоте, например, кабана (Mentz et al., 2011). Известно, что в природе одним из основных резервуарных хозяев спирометры является дикий кабан, во многом обязанный этим своей всеядности. К примеру, в Беларуси на территории Национального парка Припятский заражённость кабана плероцеркоидами спирометры равна 100%, а в каждом из животных исследователи насчитывали от 80 до 227 экз. личинок (Турицин и др., 2008). Цитируемые авторы подчёркивают, что обнаружить личинок в теле кабана можно с первых минут разделки туши, поскольку множество паразитов локализуется непосредственно под кожей и в мышцах. Охотники при разделке туши такого животного в качестве охотничьего трофея забирают лишь шкуру и череп, а поражённую тушу оставляют на месте разделки. Останки животного становятся пищей, а, следовательно, и источником заражения новых особей дефинитивных хозяев - волков и бродячих собак, численность которых на территории парка достаточно высока. Мясо заражённых кабанов нередко используют в качестве корма для охотничьих и дворовых собак, которые таким образом участвуют в поддержании численности паразита в природе и расширению его ареала.
И, наконец, ещё один источник заражения человека: используемые в лечебных целях мясо или экзотические мази из лягушек, змей и других пресмыкающихся и земноводных, в которых могли оказаться плероцеркоиды спирометр (Acha, Szy-fres, 1987; Lloyd, 2011; Mueller, 1974). В народной, и, прежде всего, восточной медицине мясо амфибий или рептилий прикладывают к ранкам, к коже или глазам, и тогда живые личинки, чьи активные передвижения инициирует тепло тела человека, проникают через раневые поверхности или через слизистую оболочку глаза в прилегающую ткань органа человека. В Эквадоре описан случай заражения спарга-ном пациента, страдавшего грыжей брюшной полости и применявшего в качестве обезболивающего средства мясо змеи, которое он прикладывал к болевому месту на животе (Kron et al., 1991). В Таиланде заражение людей спарганами чаще всего является результатом лечения примочками из лягушек (Anantaphruti и др., 2011).
Любопытные результаты были получены при анализе возможного источника заражения 25 пациентов в возрасте от 9 до 83 лет, наглядно проиллюстрировавшие все три пути попадания паразитов в организм человека (Song et al., 2007). Из 25 человек 12, т.е. практически 50 %, жили в сельской местности и регулярно упот
172
ребляли в пищу сырое или полусырое мясо лягушек и змей, поскольку в тех местах оно, равно как и сырое мясо цыплят, считается тонизирующим средством. Пятеро пациентов применяли сырое мясо животных в качестве примочек на язву, как то принято в народной медицине. Ещё четверо заразились через воду, видимо, содержащую контаминированных рачков. И только четверо пострадавших не знали, как к ним попали эти паразиты.
Исходя из сказанного, довольно легко определить и основные меры, направленные на предупреждение инвазии людей личинками спирометр. Среди них, прежде всего, кипячение и/или фильтрование питьевой воды в случае её забора из открытых водоёмов, а также полноценная термическая обработка пищи, приготавливаемой из мяса кабанов и других животных, лягушек, змей, других земноводных и пресмыкающихся. Мясо лягушек, змей, птиц и млекопитающих, сильно поражённое плероцеркоидами спирометр, подлежит уничтожению, скармливать его собакам, кошкам, свиньям и другим животным категорически запрещается. При слабом поражении мяса допускается его зачистка и последующая промышленная переработка. При использовании мяса амфибий и/или рептилий в лечебных целях его следует внимательно обследовать на наличие паразитов. Последние имеют довольно крупные размеры и легко различимы невооружённым глазом.
И, наконец, немаловажное значение придаётся санитарно-просветительской работе, направленной на реализацию обозначенных выше превентивных мер.
Учитывая медицинское и ветеринарное значение цестод рода Spirometra, те включены в Международную классификацию болезней 10-го пересмотра МКБ-10 (ICD-10, Version: 2016). Напомню, что МКБ-10 - общепринятая классификация для кодирования медицинских диагнозов, разработанная Всемирной организацией здравоохранения; состоит из 22 классов, каждый из которых содержит рубрики с кодами заболеваний и состояний. Спарганозису присвоен код В70.1.
Цитируемая литература
Анисимова Е. И. Мониторинг заражённости американской норки гельминтами . Экологические проблемы западного региона Беларуси: сб. науч, статей. Под общей ред. д.в.н., проф. Е. П. Кремлёва. -Гродно: ГрГУ, 2007. - С. 267 - 269.
Бакиев А. Г., Кириллов А. А. Основные итоги изучения паразитов змей Волжского бассейна. Сообщение 1. Простейшие и гельминты И Вести. Мордовск. ун-та. - 2007. - № 4. - С. 60 - 68.
Дубина И. И, Пенькевич В. А., Карасёв Н. Ф. Циклы развития Spirometra erinacei-europaei Rudolphi и Sparganum erinacei Rudolphi в Беларуси И Becui Нац. акад, навук Беларусь Сер. б!ял. навук. - 2006. -№>1.-С. 96- 102.
Елизаров А. С. Обнаружение Spirometra erinacei europaei (Rudolphi, 1819) у диких животных на территории Курской области И Теория и практика паразитарных болезней животных. - 2009. - № 10. - С. 159-161.
Елизаров А. С., Малышева Н. С. Заражённость копепод процеркоидами Spirometra erinacei europaei на территории Курской области // Рос. паразитол. журн. - 2009. -№ 4. - С. 43 - 46.
Коняев С. В., Сятковская О. С., Филимонова А. Ю. Случай обнаружения имагинальной формы Spirometra erinacei у кошки в Эстонии // Рос. ветер, журн. - 2011. - № 3. - С. 40 - 41.
Корнюшш В. В., Малишко Е. L, Малега О. М. СвШски собаки i коти як резервен™ природновогнище-вих i зоонозних гельминтаив у сучасних умовах УкраТни И Ветеринарка медицина. - 2013. - Вип. 97.-С. 383-387.
Пенькевич В. А. Распространение спарганоза в Полесском государственном радиационно-экологическом заповеднике / Сахаровские чтения 2015 года: экологические проблемы XXI века: мат. 15-й меж-дунар. науч. конф. 21-22 мая 2015 г., г. Минск, Республика Беларусь / под ред. С. С. Позняка, Н. А. Лысухо. - Минск: 2015. - С. 223 - 224.
173
Письмо Федерального центра госсанэпиднадзора Минздрава РФ от 18 февраля 2003 г. N 22 ФЦ/751 «О мерах профилактики спарганимоза на территории РФ» (www.jurbase.ru).
Рыженко Г. Ф. Биология и морфология Spirometra erinacei-europaei (Rudolphi, 1819) - возбудителя спирометроза и спарганумоза животных и человека: Автореф. дис... канд. биол. наук. - М., 1969. -23 с.
Турицин В. С., Жаворонок С. В., Козлов С. С. Спарганоз в Беларуси и России / Актуальные вопросы инфекционной патологии. Под ред. проф. В. М. Семенова. - Мат. междунар. Евро-Азиатского конгресса по инфекц. болезням (Витебск, 5-6 июня 2008 г.). - Витебск, 2008. - С. 68 - 69.
Ходакова В. И„ Плотников Н. Н. Глава XX. Дифиллоботриозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: «Медицина», 1968. -С. 493 - 508.
Шарпило В. П. Рептилии фауны СССР как промежуточные и резервуарные хозяева гельминтов И Паразитология. - 1983. - 17, 3. - С. 177 - 184.
Acha Р. Н, Szyfres В. 2. Cestodiases / Zoonoses and communicable diseases common to man and animals. 3rd Ed. Vol. III. Parasitoses. - Wash., D.C.: РАНО, 2003. - Sci. & Tech. Publ. No. 580. - P. 210 - 213.
Alves W. D„ Gelfand KT., Weinberg R. A case of sparganosis in an African from Portuguese East Africa П Trans. R. S. Trop. Med. Hyg. - 1954.-48, l.-P. 84. https://doi.org/10.1017/CB09781107415324.004.
Anantaphruti M. T, Nawa Y., Vanvanitchai Y. Human sparganosis in Thailand: an overview // Acta Trop. -2011.-118,3.-P. 171-176. doi: 10.1016/j.actatropica,2011.03.011.
Arakelyan M. Helminthes of some reptiles from Republic of Armenia // NAS of Armenia Elect. J. Nat. Sci. -2014.-1 (22). - P. 50 - 54. www.researchgate.net/publication/268632618.
Beaver P. C, Rolon F. A. Proliferating larval cestodes in a man in Paraguay: a case report and review I I Am. J. Trop. Med. Hyg. - 1981. - 30, 3. - P. 625 - 637.
Beltran Fabian NT., Peralta J. S, Alvarez N. C, Alfaro Lossio D. et al. Ocular infestation by pleurocercoid of Spirometra mansonoides'. first case report in Peru // Rev. Peru. Med. Exp. Salud Publica. - 2015. - 32. - P. 391 -394.
Bennet H. NT., Mok H. A., Gkrania-Klotsas E., Tsai I. J. et al. The genome of the sparganosis tapeworm Spirometra erinaceieuropaei isolated from the biopsy of a migrating brain lesion // Genome Biol. - 2014. - 15, 11: 510. doi: 10.1186/s 13059-014.
Boero A. M. E„ Garaguso P., Navarre J. A case of cerebral sparganosis in South America // Arq. Neuro Psi-quiatr. - 1991. - 49. - P. 111 - 113.
Bonne C. Researches on sparganosis in the Netherlande East Indies // Am. J. Trop. Med. - 1942. - 22, 6. - P. <643-645.
Botero D., Gomez 1.1. The first case of sparganosis // Am. J. Trop. Med. Hyg. - 1958. - 7, 6. - P. 597 - 599.
Botterel F, Bouree P. Ocular sparganosis: A case report // J. Travel Med. - 2003. - 10, 4. - P. 245 - 246.
Chai D., Farah I., Muchmi G. Sparganosis in non-human primates // Onderstepoort J. Vet. Res. - 1997. - 64.
-P. 243-244.
Chan A. B., Wan S. K, Leung S. L., Law В. K. et al. Sparganosis of the breast H Histopathology. - 2004. - 44, 5.-P. 510-521. DOI: 10.1111/j. 1365-2559.2004.01831.x.
Chandler A. C. The helminthic parasites of cats in Calcutta and the relation of cat to human helminthic infections // Ind. J. Med. Res. - 1925. - 13. - P. 213 - 220.
Chang К. H, Chi J. G., Cho S. Y„ Han M. H. et al. Cerebral sparganosis: analysis of 34 cases with emphasis on CT features // Neurobiology. - 1992. - 34, l.-P. 1-8.
Chen Y., Ye B. Chapter 11. Sparganosis in China / H. Mehlhom et al. (eds.). Treatment of human parasitosis in traditional Chinese medicine. Parasitology Research Monographs 6. - Springer-Verlag Berlin Heidelberg, 2014.-P. 169-183. Doi.10.1007/978-3-642-39824-7_l 1.
Cho J. H, Lee К. B., Yong T S, Kim B. S. et al. Subcutaneous and musculoskeletal sparganosis: imaging characteristics and pathological correlation // Skeletal Radiol. - 2000. - 29. - P. 402 - 408. Doi: 10.1007/S002560000206.
Cho K. J., Lee H. S, Chi J. G. Intramural sparganosis manifested as intestinal obstruction: a case report П J. Korean Med. Sci. - 1987. - 2, 2. - P. 137 - 139.
Cho S. У, Bae J. H, Seo B. S. Some aspects of human sparganosis in Korea // Korean J. Parasitol. -1975. -13, l.-P. 60-77.
Cleland J. B. The occurrence of Sparganum (larval cestode) in the subcutaneous tissues of man in Australia// Med. J. Australia. - 1918. - 5, 2. - P. 239 - 240.
Connor D. H, Sparks A. K, Strano A. J., Neafie R. C„ Juvelier B. Disseminated parasitosis in an immunosuppressed patient. Possibly a mutated sparganum П Arch. Pathol. Lab. Med. - 1976. - 100, 2. - P. 65 - 68.
Crum J. M., Nettles V. F., Davidson W. R. Studies on endoparasites of the black bear (Ursus americanus) in the southeastern United States // J. Wildl. Dis. - 1978. -14, 2. -P. 178 - 186.
174
Cummings T. J., Madden J. F., Gray L., Friedman A. H, McLendon R. E. .Parasitic lesion of the insula suggesting cerebral sparganosis: case report // Neuroradiology. - 2000. - 42, 3. - P. 206 - 208.
Denegri G., Reisin I. The complete biological cycle of Diphyllobothrium erinaceieuropaei (Cestoidea, Pseudophyllidea) under experimental conditions // Helminthologia. - 1993. - 30, 2. - P. 177 - 179.
Dhaliwal В. B., Juyal P. D. Parasitic Zoonoses. - Springer, India, 2013. -P. 74 - 75.
Dickmans G. An interesting tapeworm from the cat in Louisiana // J. Parasitol. - 1931. - 18, 1. - P. 47.
Eberhard M. L., Thiele E. A., Yembo G. E., Yibi M. S. et al. Case report: Thirty seven human cases of sparganosis from Ethiopia and South Sudan caused by Spirometra spp. П Am. J. Trop. Med. Hyg. - 2015. - 93, 2. -P. 350-355.
Eduardo S. L. Food-borne parasitic zoonoses in the Philippines // Southeast Asian J. Trop. Med. Public Health.- 1991.-22, Suppl.-P. 16-22 (www.tm.mahidol.ac.th/seameo/.../06-16-22/).
Eom K, Park H, Lee D., Choe S. et al. Mitochondrial genome sequences Qi Spirometra erinaceieuropaei and S. decipiens (Cestoidea: Diphyllobothriidae) // Korean J. Parasitol. - 2015. - 53, 4. - P. 455 - 463. doi: 10.3347/kjp.2015.53.4.455.
Faust E. C Human Helminthology. - 3rd Ed. - Lea & Febiger, Philadelphia, 1949. -P. 268 - 273, 276 - 278.
Faust E. C„ Campbell H. E, Kellogg C. R, Morphological and biological studies on the species of Diphyllobothrium in China H Am. J. Epidemiol. - 1929. - 9, 3. - P. 560 - 583. doi. 10.1093/oxfordjoumals.aje. al21670.
Faust E. C., Wassel M, Preliminary survey of the intestinal parasites of man in the central Yangtze valley // Chin. Med. J. - 1921. - 35, 6. - P. 532 - 561.
Fontan R.t Beauchamp F., Beaver P. C. New helminthiases in Laos. II. Plathelminths П Bull. Soc. Pathol. Exot. Filiales. - 1975. - 68, 6. -P. 566 - 573.
Fukumoto S, Tsuboi T, Hirai K, Phares С. K. Comparison of isozyme patterns between Spirometra erinacei and Spirometra mansonoides by isoelectric focusing // J. Parasitol. - 1992. - 78, 4. - P. 735 - 738.
Gao B.t Wang X. Neuroimaging and pathological findings in a child with cerebral sparganosis // J. Neurosurgery: Pediatrics. - 2006. - 105, 6. - P. 470 - 472.
Garin Y. J. F., Frottier J, Lavergne-Slove A., Houdart R„ Poirot J. L. Cutaneous sparganosis in France: the second case described from Europe. Case report 11 Acta Pathol., Microbiol., Immunol. Scand. - 1997. -105, l.-P. 70-73.
Gregory G. G., Munday B. L, Internal parasites of feral cats from the Tasmanian Midlands and King Island I I Aust. Vet. J. - 1976. - 52, 7. - P. 317 - 320.
Griffin M. P., Tompkins К J., Ryan M. T. Cutaneous sparganosis // Am. J. Dermatopathol. - 1996. - 18, 1. -P. 70 - 72.
Guderian R, Roldan J., Guevara A., Chico M. [Human sparganosis in Ecuador: report of a case in the province of Esmeraldas] // Rev. Soc. Bras. Med. Trop. - 1990. - 23, 2. - P. 115-116. (in Portuguese).
He Y. M., Huang G. M. A case report of proliferating sparganosis // Ann. Bull. Soc. Parasitol., Guangdong Province. - 1983. - 4/5. - P. 102 - 104.
Hinz E. Human helminthiases in the Philippines. The epidemiological and geomedical situation. - Springer-Verlag, 1985.-P. 165- 166.
Hirai К Spirometra erinaceieuropaei. (2) Growth hormone-like factor prodqced by plerocercoides of Spirometra erinaceieuropaei I Otsuru M., Kamegai S., Hayashi S. (Eds.). Progress of medical Parasitology in Japan. - Vol. 8. - Meguro Parasitol. Museum, 2003. - P. 273 - 280.
Holodniy M., Ahmenoff J., Loutit J. Cerebral sparganosis. Case report and review И Rev. Infect. Dis. - 1991. -13, l.-P. 155- 159.
Hong Q., Feng J., Liu H, Li X, Gong L. et al. Prevalence of Spirometra mansoni in dogs, cats, and frogs and its medical relevance in Guangzhou, China // Int. J. Infect. Dis. - 2016. - 53. - P. 41 - 45. doi.org/10/ 1016/ijid.2O16.10.013.
Huang F., Gong H Y, Lu M. H Pulmonary sparganosis mansoni: a case report // Trop. Biomed. - 2012. -29, 2.-P. 220-223.
Hughes A. J., Biggs B. A. Parasitic worms of the central nervous system: an Australian perspective // Intern. Med. J. - 2002. - 32, 11. - P. 541 - 553.
lamaroon A., Sukontason K, Sukontason K. Sparganosis: a rare case of the oral cavity // J. Oral. Pathol. Med. - 2002. - 31, 9. - P. 558 - 560.doi: 10.1111/j. 1440-1827.2006.02028x.
Ijima I. On a new cestode larva parasitic in man (Plerocercoides prolifer) II J. Coll. Sci. Imp. Univ. Tokyo. -1905.-20.-P. 1-21.
Ishii H., Mukae H, Inoue Y., Kadota J.-i. et al. A rare case of eosinophilic pleuritis due to sparganosis // Int. Med. - 2001. - 40, 8. - P. 783 - 785.
175
Iwatani K.t Kubota L, Hirotsu Y., Wakimoto J„ Yoshioka M. et al. Sparganum mansoni parasitic infection in the lung showing a nodule // Pathol. Int. - 2006. - 56, 11. - P. 674 - 677.
Jang D. H. Sparganosis of swine in Korea // J. Korean Vet. Med. Assoc. - 1964. - 8. - P. 3 - 11. (in Korean).
Jenchitz W., Chaijukool S, Ying-Yuad P. Ocular sparganosis in Lampang П Thai J. Ophthalmol. - 1989. - 3, 1. - P. 21 - 25. (in Thai with English Abstract).
Jeon H.-K, Eom К Molecular approaches to Taenia asiatica 11 Korean J. Parasitol. - 2013. - 51, 1. - P. 1 -8. doi: 10.3347/kjp.2013.51.1.1.
Jeon H.-К., Park H., Lee D., Choe S, Kim K.-H. et al. Human infections with Spirometra decipiens plerocercoids identified by morphologic and genetic analyses in Korea // Korean J. Parasitol. - 2015. - 53, 3. -P. 299-305. doi: 10.3347/kjp.2015.53.3.299.
Jeon H.-К., Park H., Lee D., Choe S., Kim K.-H. et al. Genetic identification of Spirometra decipiens plerocercoids in terrestrial snakes from Korea and China // Korean J. Parasitol. - 2016a. - 54, 2. - P. 181 - 185. doi: 10.3347/kjp.2016.54.2.181.
Jeon H.-K, Park H., Lee D., Choe S, Sohn W.-M., Eom К S. Molecular detection of Spirometra decipiens in the United States 11 Korean J. Parasitol. - 2016b. - 54, 4. - P. 503 - 507. doi: 10.3347/kjp.2016. 54.4.503.
Jeong H. J, Fournier's gangrene associated with sparganosis in the scrotum // Urology. - 2004. - 63, l.-P. 176-177.
Johnson G., Gardner J, Fukai T, Goto К Cutaneous sparganosis: a rare parasitic infection // J. Cutan. Pathol. - 2015. - 42, 3. - P. 159 - 163.
Jones D. W. E. Ocular sparganosis in an African woman // Br. J. Ophthalmol. - 1962. - 46, 2. - P. 123 - 125.
Jones M. C, Agosti M. R., D Agustini M., Uriarte V, Drut К Esparganosis cerebral: Presentacidn de un caso pedtatrico// Arch. Argent. Pediatr. -2013. - 111, l.-P. 1-4.
Joyeux C, Houdemer E. Recherches sur la faune helminthologique de Г Indochine (Cestodes er Trematodes). Pt. 2 П Ann. Parasitol. - 1928. - 6, 1. - P. 27 - 58.
Kamiya H, Shimizu H, Kobayashi N„ Kudo K. [A case of sparganosis with eosinophilic pleural effusion] H Nihon Kokyuki Gakkai Zasshi. - 2004. - 42, 12. - P. 1019 - 1023. (in Japanese).
Kamo H. Guide to identification of diphyllobothriid cestodes. - Gendai Kikaku, Tokyo, Japan, 1999. - 146 pp. (in Japanese) (цит. no: Petrigh et al., 2015).
Kamo H. Chapter III: Cestodes. I. General view // Progr. Med. Parasitol. Japan. - 2003. - 8. - P. 236.
Kavana N. J, Lim L, H S, Ambu S. The life-cycle of Spirometra species from Peninsular Malaysia // Tropical biomedicine. - 2014. - 31, 3. - P. 487 - 495.
Kavana N., Sonaimuthu P., Kasanga C, Kassuku A., Al-Mekhlafi H. M. Seroprevalence of Sparganosis in Rural Communities of Northern Tanzania // Am. J. Trop. Med. Hyg. - 2016. - 95, 4. - P. 874 - 876. doi: 10.4269/ajtmh.l 6-0211.
Khurana S, Appannanavar S, Bhatti H. S, Verma S. Sparganosis of liver: a rare entity and review of literature // BMJ Case Rep. - 2012; 2012: bcr2012006790. doi: 10.1136/bcr-2012-006790.
Kim С H. The infection status of sparganum and Gnathostoma in frogs of southern part of Korea // Korean J. Parasitol. - 1983. - 21, 1. - P. 83 - 86. (In Korean).
Kim D. G., Park S. H., Chang К. M. et al. Cerebral sparganosis: Clinical, manifestations, treatment, and outcome // J. Neurosurg. - 1996. - 85, 6. - P. 1066 - 1071.
Kim H, Kim S. L, Cho S. Y. Serological diagnosis of human sparganosis by means of micro-ELISA // Korean J. Parasitol. - 1984. - 22. - P. 222 - 228.
Kim J, R., Lee J. M. A case of intramuscular sparganosis in the sartorius muscle // J. Korean Med. Sci. -2001. - 16, 3.-P. 378-380.
Kittiponghansa S, Tesana S, Ritch R. Ocular sparganosis: a cause of subconjunctival tumor and deafness H Trop. Med Parasitol. - 1988. - 39, 3. - P. 247 - 248.
Kolodziej-Sobocinska M., Tokarska M., Kowalczyk R. The first report of sparganosis (Spirometra sp.) in Eurasian badger (Meles meles) // Parasitol. Int. - 2014. - 63, 2. - P. 397 - 399. doi: 10.1016/j.parint.2013.12.
Koo M., Kim J. H., Kim J. S, Lee J. E, Nam S J, Yang J. H. Cases and literature review of breast sparganosis // World J. Surg. - 2011. - 35, 3. - P. 573 - 579. doi: 10.1007/s00268-010-0942-1.
Kron M. A., Guderian R., Guevara A., Hidalgo A. Abdominal sparganosis in Ecuador: a case report // Am. J. Trop. Med. Hyg. - 1991. - 44, 2. - P. 146 - 150.
Kuchta R., Scholz T, Brabec J., Narduzzi-Wicht B. 17. Diphyllobothrium, Diplogonoporus, and Spirometra I Biology of Foodbome Parasites. Section III. Important Foodbome Helminths. - Xiao L., Ryan U., Feng Y. Eds. - CRC Press, 2015. - P. 300 - 326.
Kudesia S, Indira D. B., Sarala D., Vani S. et al. Sparganosis of brain and spinal cord: unusual tapeworm infestation (report of two cases) // Clin. Neurol. Neurosurg. - 1998. - 100, 2. - P. 148 - 152.
176
Lamothe-Argumedo R., Garcia Prieto L. Cestodes, parasites del hombre 11 Salud. Publ. Mdxico. - 1985.-27, 5.-P. 420.
Landero A., Hernandez F., Abasolo M. A., Rechy D. A., Nunez P. Cerebral sparganosis caused by Spirometra mansonoides. Case report П J. Neurosurg. - 1991. - 75, 3. - P. 472 - 474.
Laovachirasuwan P., Mootsikapun P., Maleev? ong W., Intapan P. M. Intraosseous proliferative sparganosis presenting as a pathological fracture: a case report and review of the literature // Southeast Asian J. Trop. Med. Publ. Health. - 2015. - 46, 4. - P. 558 - 563.
Le T. H, Blair D., McManus D. P. Mitochondrial genomes of parasitic flateworms // Trends Parasitol. -2002.-18, 5.-P. 206-213.
Lee J. H, Yu J. S, Park M. S„ Lee S. I., Yang S. W. Abdominal sparganosis presenting as an abscess with fistulous communication to the bowel // Am. J. Roentgenol. - 2005. - 185, 4. - P. 1084 - 1085.
Lee S.-H., Chai J.-Y., Seo В.-S., Cho S.-Y. Two cases of human infection by adult of Spirometra erinacei H Korean J. Parasitol. - 1984. - 22, 1. - P. 66 - 173
Lee S.-H., Choe E.-Y., Shin H.-D., Seo M. Spargana in a weasel, Mustela sibirica manchurica, and a wild boar, Sus scrofa, from Gangwon-do, Korea // Korean J. Parasitol. - 2013. - 51, 3. - P. 379 - 381. doi: 10.3347/kjp.2013.51.3.379.
Lee S.-H, We J.-S., Sohn W.-M., Hong S.-Т., Chai J.-Y. Experimental life history of Spirometra erinacei If Korean J. Parasitol. - 1990. - 28, I. - P. 161 - 171.
Li M. W., Song H. Q., Li C., Lin H. Y. et al. Sparganosis in mainland China // Int. J. Infect. Dis. - 2011. - 15, 3.-P. 154- 156. doi: 10.1016/j.ijid.2010.10.001.
Lin Q„ Ouyang J. S, Li J. M., Yang L. et al. Eosinophilic pleural effusion due to Spirometra mansoni spargana: a case report and review of the literature П Int. J. Infect. Dis. - 2015.- 34, 1. - P. 96 - 98. doi: 10.1016/j.ijid.2015.03.014.
Liu Q., Li M.-W., Wang Z.-D., Zhao G.-H, Zhu X.-Q. Human sparganosis, a neglected food bom zoonosis П Lancet Infect. Dis. - 2015. - 15,10.-P. 1226-1235. Doi: 10.1016/S 1473-3099(15)00133-4.
Lloyd S. Other adult and larval cestodes I Palmer S. et al. (Eds.). The Oxford textbook of zoonoses, 2nd ed. -Oxford Univ. Press. Oxford, UK, 2011. - P. 643 - 649.
Lo Y.-K., Chao D., Yan S.-H, Liu H. C. et al. Spinal cord proliferative sparganosis in Taiwan: A case report // Neurosurgery. - 1987. - 21, 2. - P. 235 - 238.
Lo Presti A., Aguirre D. T„ De Andres P., Daoud L. et al. Cerebral sparganosis: case report and review of the European cases // Acta Neurochir. (Wien). - 2015. - 157, 8. - P. 1339 - 1343. doi: 10.1007/s00701-015-2466-9.
Maciel P., Haddad С. M. Esparganose: primeiro caso no Brasil (nota previa) // Rev. Paul Med. - 1968. - 72. -P. 270.
Marchiondo A. A, Weinstein P. P., Mueller J. F. Significance of the distribution of 57Co-Vitamin B12 in Spirometra mansonoides (Cestoidea) during growth and differentiation in mammalian intermediate and definitive hosts // Int. J. Parasitol. - 1989. - 19. - P. 119 - 124.
Mentz M. B., Procianoy F„ Maestri M. K., Rott M. B. Human ocular sparganosis in southern Brazil // Rev. Inst. Med. trop. S. Paulo. - 2011. -53, 1. -P. 51 - 53. Doi: 10.1590/S0036-46652011000100009.
Min D. Y. Cestode infections in Korea // Korean J. Parasitol. - 1990. - 28, Suppl. - P. 123 - 144.
Miyadera H, Kokaze A., Kuramochi T., Kita K. et al. Phylogenetic identification of Sparganum proliferum as a pseudophyllidean cestode by the sequence analysis on mitochondrial CO1 and nuclear sdhB genes // Parasitol. Int. -2001. -50, 2. -P. 93 - 104. Doi: 10.1016/S1283-5769(1 )00071-X.
Moon J. R. Public health significance of zoonotic tapeworms in Korea 11 Int. J. Zoonoses. - 1976. - 3, l.-P. 1-18.
Moulinier R., Martinez E., Torres J., Noya O. et al. Human proliferative sparganosis in Venezuela: report of a case // Am. J. Trop. Med. Hyg. - 1982. - 31, 2. - P. 358 - 363.
Mueller J. F. A Diphyllobothrium from cats and dogs in the Syracuse region П J. Parasitol. - 1935. - 21, 2. -P. 114-122.
Mueller J. F. Comparative studies on certain species of Diphyllobothrium I I J. Parasitol. - 1936. - 22, 5. - P. 471 -478.
Mueller J. F. A repartition of the genus Diphyllobothrium I I J. Parasitol. - 1937. - 23, 3. - P. 308 - 310.
Mueller J. F. The biology of Spirometra // J. Parasitol. - 1974. - 60, 1. - P. 3 - 14.
Mueller J. F., Coulston F. Experimental human infection with the sparganum larva of Spirometra mansonoides (Mueller, 1935) // Am. J. Trop. Med. - 1941. - 21, 3. - P. 399 - 425.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 70 - 71.
177
Myers В. J., Kuntz R. E. Parasites of baboons taken by the Cambridge Mwanza expedition (Tanzania 1965) I I East Afr. Med. J. - 1967. - 44. - P. 322 - 324.
Nakamura E, Hara M., Matsuoka M., Kawabata M., Tsuji M. Human proliferative sparganosis: A new Japanese case // Am. J. Clin. Pathol. - 1990. - 94, 2. - P. 224 - 228.
Nath R, Gogoi R. N. Ocular sparganosis from Assam // Trop. Parasitol. - 2015. - 5, 1. - P. 64 - 67.
Nobrega-Lee M., Hubbard G., LoVerde P., Carvahlho-Queiroz C. et al. Sparganosis in wild-caught baboons (Papio cynocephalus Anubis) // J. Med. Primatol. - 2007. - 36, 1. - P. 47 - 54.
Noya O, Alarcon de Noya B., Arrechedera H, Torres J., ArgUello C. Sparganum proliferum', an overview of its structure and ultrastructure // Int. J. Parasitol. - 1992. - 22, 5. - P. 631 - 640.
Oda F. H, Borteiro C., Graqa R J. de, Tavares L. E. R et al. Parasitism by larval tapeworms genus Spirometra in South American amphibians and reptiles: new records from Brazil and Uruguay, and areview of current knowledge in the region П Acta Tropica. - 2016. - 164. - P. 150 - 164. http://dx.doi.org/10.1016/ j.actatropica.2016.09.005.
Oh S. J., Chi J. G., Lee S. E. Eosinophilic cystitis caused by vesical sparganosis: a case report // J. Urol. -1993.-149, 3.-P. 581 -583.
Oh S. J., Kim J-Т, Kim M.-K, Chang Y.-J et al. Eosinophilic pleuritis due to sparganosis: a case report //Korean J. Parasitol.-2014.-52, 5.-P. 541 -543. doi.org/10.3347/kjp.2014.52.5.541.
Okamoto M., Iseto C, Shibahara T, Sato M. O. et al. Intraspecific variation of Spirometra erinaceieuropaei and phylogenetic relationship between Spirometra and Diphyllobothrium inferred from mitochondrial CO1 gene sequences // Parasitol. Intern. 2015. - 56, 3. - P. 235 - 238. doi:10.1016/j.parint. 2007.03.003.
Okino T, Ushirogawa H, Matoba K, Nishimatsu S. L, Saito M. Establishment of the complete life cycle of Spirometra (Cestoda: Diphyllobothriidae) in the laboratory using a newly isolated triploid clone // Parasitol. Int.-2017.-66, 2.-P. 116-118. doi: 10.1016/j.parint.2016.12.011.
Opuni E. K. Studies on Spirometra theileri (Baer, 1925) n. comb. I. Identification and biology in the laboratory // J. Helminthol. - 1974. - 48, 1. - P. 15 - 23.
Ou Q., Li S.-J., ChengX.-J. Cerebral sparganosis: A case report // Biosci. Trends. - 2010. - 4, 3. - P. 145 -147.
Pampiglione S. Human sparganosis in Italy - Case report and review of the European cases // Apmis. - 2003. - Ill, 2. - P. 349 - 354. doi: 10.1034/j. 1600-0463.2003.1110208.x.
Petrigh R. S, Scioscia N. P., Denegri G. M., Fugassa M. H Coxl gene sequence of Spirometra in Pampas foxes from Argentina // Helminthologia. - 2015. - 52, 4. - P. 355 - 359.
Qiu M. H, Qiu M. D. [Human plerocercoidosis and sparganosis: I. A historical review on aetiology] // Chinese J. Parasitol. & Parasit. Dis. - 2009. - 27, 1. - P. 54 - 60. (In Chinese).
Rehdk M. Ocular sparganosis in the Czech Republic - a case report 11 Klin. Mikrobiol. Infect. Lek. - 2006. -12, 4.-P. 161-164. (in Czech).
Rego A. A., Schaffer G. W. Esparganosis em alguns vertebrados do Brasil. Dificuldades na identificasao das espScies de Luheela (Spirometra) // Mem. Inst. Oswaldo Cruz, Rio de Janeiro. - 1992. - 87, Suppl. l.-P. 213 - 216. (In Portuguese).
Rengarajan S, Nanjegowda N, В hat D„ Mahadevan A. et al. Cerebral sparganosis: a diagnostic challenge // Br. J. Neurosurg. - 2008. - 22, 6. - P. 784 - 786. doi: 10.1080/02688690802088073.
Rolon P. A. Human sparganosis: report of a probable 7th case in South America and review of the subject H Bull. Soc. Pathol. Exot. Filiales. - 1976. - 69. - P. 351 - 359.
de Roodt A. R., Suarez G., Ruzic A., Bellegarde E, Braun M., Blanco С. M. [A case of human sparganosis in Argentina] П Medicina (B Aires). - 1993. - 53, 3. - P. 235 - 238. (In Spanish).
Rudolphi C. A. Entozoorum synopsis cui accedeuntmantiss duplex et indices locupletissimi. Berolini, 1819. -811pp.
Ruitenberg E. J., Knapen F. van, Weiss W. Food-borne parasitic infections - old stories and new fact // Veterinary Quarterly. - 1979. - 1, 1. -P. 5 - 13. DOI: 10.1080/01652176.1979.9693715
Sakamoto T, Gutierrez C, Rodriguez A., Sauto S. Testicular sparganosis in a child from Uruguay // Acta Tropica. - 2003. - 88, 1. - P. 83 - 86.
Schmid H, Watschinger H. Sparganosis in the Masailand // Acta Trop. - 1972. - 29, 3. - P. 218 - 230.
Schmidt G. D. Handbook of Tapeworm Identification. 2nd Printing. - Boca Raton, Flo, USA: CRC Press, 1986.-P. 93-95.
Scioscia N. P., Petrigh R. S., Beldomenico P. M., Denegri G. M. The Pampas fox (Lycalopex gymnocercus) as new definitive host for Spirometra erinacei (Cestoda: Diphyllobothriidae) // Acta Tropica. - 2014. - 133, l.-P. 78-82. Doi: 10.1016/j.actatropica.2014.02.006.
Seo S.-S, Rim H-J„ Yoon J.-J., Lee D.-J. A case report of sparganosis // Korean J. Parasitol. - 1964. - 2, 3. -P. 179-182.
178
Settakorn J., Arpornchayanon O., Chaiwun B., Vanittanakom P. et al. Intraosseous proliferative sparganosis: a case report and review of the literature // J. Med. Assoc. Thai. - 2002. - 85, 1. - P. 107 - 113.
Skinker M. S. Miscellaneous notes on cestodes // Proc. Helm. Soc. Wash. - 1935. - 2, l.-P. 68.
Song T., Wang W-S, Zhou B.-R, Mai W.-W. et al. CT and MR characteristics of cerebral sparganosis I I Am. J. Neuroradiol. -2007. -28, 9. -P. 1700- 1705. DOI: https://doi.org/10.3174/ajnr.A0659.
Su K.-E. Present situation of parasitic zoonoses in Taiwan / Parasitic Zoonoses in Asian-Pacific Regions 2012. Eds. M. Tokoro, S. Uga. - Yapan: SANKEISHA Co., Ltd, 2013. -P. 75.
Subudhi B. N., Dash S., Chakrabarty D., Mishra D. P., Senapati U. Ocular sparganosis // J. Indian Med. Assoc. - 2006. - 104, 9. - P. 529 - 530.
Suzuki N., Kumazawa H., Hosogi H, Nakagawa O. A case of human infection with the adult of Spirometra erinacei (Rudolphi, 1819) Faust, Campbell and Kellogg, 1929 // Jap. J. Parasitol. - 1982. -31, 1. -P. 23 -26. (In Japanese).
Tanaka S, Maruyama H, Ishiwata K, Nawa K. A case report of pleural sparganosis // Parasitol. Int. - 1997. -46, l.-P. 73-75.
Tang T. H. C, Wong S. S. Y, Lai С. К C, Poon R. W. S. et al. Molecular identification of Spirometra erinaceieuropaei tapeworm in cases of human sparganosis, Hong Kong // Emerg. Inf. Dis. - 2017. - 23, 4. - P. 665-668. http://dx.doi.org/10.3201/eid2304.160791.
Тарре D., Berger L., Haeupler A., Muntau B. et al. Case report: molecular diagnosis of subcutaneous Spirometra erinaceieuropaei sparganosis in a Japanese immigrant // Am. J. Trop. Med. Hyg. -2013.-88, 1. -P.198 - 202. http://dx.doi.org/10.4269/ ajtmh.2012.12-0406.
Tsai M.-D., Chang С.-H., Ho Y.-S., Wang A. D.-J. Cerebral sparganosis diagnosed and treated with sterotactic techniques. Report of two cases 11 J. Neurosurg. - 1993. - 78, l.-P. 129- 132.
Tsou M. H, Huang T. W. Pathology of subcutaneous sparganosis: Report of two cases // J. Formosan Med. Ass. - 1993. - 92, 7. - P. 649 - 653.
Tu J. T., Qiu M. H, Zhou Y. C. [A case report of human infection of adult Spirometra mansoni] // Nat. Med. J. China. - 1973. - 53. - P. 691 - 692.
Ugarte С. E., Thomas D. G., Gasser R. В., Hu M., Scott J. Spirometra erinacei / S. europaei in feral cat in Manawutu with chronic intermittent diarrhea // N. Z. Vet. J. - 2005. - 53, 5. - P. 347 - 351.
Wang S. M., Yang F. F., Huang Y. X., Shi G. F., Weng X. H. Clinical analysis of 78 cases of parasitic encephalopathy // Chinese J. Parasitol. & Parasit. Dis. - 2009. - 27. - P. 245 - 248. (In Chinese).
Wardle R. A., McLeod J. A. The Zoology of Tapeworms. - Minneapolis, USA: Univ. Minnesota Press, 1952. -P. 559-615.
Wei T, Zhang X., Cui J., Liu L. N., Jiang P., Wang Z. Q. Levels of sparganum infections and phylogenetic analysis of the tapeworm Spirometra erinaceieuropaei sparganum in wild frogs from Henan Province in central China // J. Helminthol. - 2015. - 89, 4. - P. 433 - 438. doi: 10.1017/S0022149X14000248.
Weinstein P. P., Krawczyk H J, Peers J. H. Sparganosis in Korea // Am. J. Trop. Med. Hyg. - 1954. - 3, 1. -P. 112-129.
Wiwanitkit V. A review of human sparganosis in Thailand // Int. J. Infect. Dis. - 2005. - 9, 6. - P. 312 - 316.
Wolffhugel K, Vogelsang E. G. Dibothriocephalus decipiens (Diesing) у su larva Sparganum reptans en el Uruguay // Rev. Med. Vet., Montevodeo Jg. - 1926. - 2. - P. 433 - 434. .
Yamaguti S. Systema Helminthum. Vol. II. The cestodes of vertebrates. - N. Y., USA: Intersci. Publ., 1959. -P. 358-361.
Yang J. W.t Lee J. H, Kang M. S. A case of ocular sparganosis // Korean J. Ophthalmol. - 2007. - 21, 1. -P.48 - 50. doi:10.3341/kjo.2007.21.1.4.
Yoon К. C, Seo M. S., Park S. W, Park Y. G. Eyelid sparganosis // Am. J. Ophthalmol. - 2004. - 138, 5. -873-875. doi: 10.1016/j.ajo.2004.05.055.
Zhang X, Cui J, Wei T, Li L. Y. et al. Survey and genetic variation of Spirometra erinaceieuropaei sparganum in frogs and snakes from Guangxi of southern China // Trop. Biomed. - 2014. - 31, 4. - P. 862 - 870.
Zhao Y.-M., Zhang H-C, Li Z.-R, Zhang H-Y. Scrotal sparganosis mimicking scrotal teratoma in an infant: A case report and literature review // Korean J. Parasitol. - 2014. - 52, 5. - P. 545 - 549. doi.org/10.3347/kjp.2014.52.5.545.
Несколько слов в качестве заключения по данной группе цестод.
Дифиллоботрииды - не очень многочисленное по видовому и родовому разнообразию семейство. Тем не менее, его представители встречаются практически повсеместно от Арктики до Антарктики, на всех континентах в западном и восточном
179
полушариях. Назвать такой уголок земного шара, где не был бы обнаружен тот или иной представитель данного семейства, довольно затруднительно.
В качестве паразитов человека известны цестоды из 7 родов - Diphyllobothrium, Adenocephalus, Diplogonoporus, Ligula, Pyramicocephalus, Schistocephalus и Spirometra, представленные 29 (или 30, если валидность Diplogonoporus brauni будет доказана) видами. Наиболее многочисленны роды Diphyllobothrium (14 видов) и Spirometra (5), остальные роды представлены одним видом каждый (род Diplogonoporus может включать 2 вида). Однако я бы не рискнула рассматривать приводимую цифру в 29 (30) видов как окончательную, учитывая те широкомасштабные исследования дифиллоботриид, которые проводятся в последние десятилетия на основе новых методологических подходов и которые заставляют нас по-новому взглянуть на статус многих видов и даже родов. Яркий пример тому - восстановление самостоятельности рола Adenocephalus и его типового вида A. pacificus (см. стр. 116-124).
Всех дифиллоботриид по приуровенности к водоёмам, где возможно прохождение их жизненного’цикла, условно можно разделить на два комплекса - морской и пресноводный, при этом большая доля видов приходится на первый из них (Делямуре и др., 1985). С этим обстоятельством связан и тот факт, что большинство видов дифиллоботриид, зарегистрированных у людей, принадлежат к морскому комплексу. Пресноводные формы представлены всего 6 видами - Diphyllobothrium dalliae, D. latum, D. nihonkaiense, D. ursi, Ligula intestinalis и Schistocephalus solidus, причём один из них - D. latum - является самым распространённым среди всех дифиллоботриид паразитом людей. Ещё со времён глубокой древности известно, что D. latum, так называемый лентец широкий, принадлежит к числу цестод, наиболее обычных паразитов человека, являющегося для него облигатным окончательным хозяином. Как отмечалось выше, по разным оценкам, в мире этим гельминтом поражено от 10 до 20 млн. человек (Chai et al., 2005; Scholz, Kuchta, 2016).
Поскольку в жизненном цикле дифиллоботриид обязательно участие дополнительных хозяев, а в некоторых случаях в него включаются и паратенические хозяева, причём и те, и другие из числа объектов, съедобных для человека (рыбы, амфибии, рептилии, различные птицы и млекопитающие), то совершенно очевидно, что заражение человека происходит только через пищу, содержащую живых инвазионных личинок цестод. Выше по тексту приводились примеры различных блюд -«виновников» заражения людей дифиллоботриидами в тех или иных странах (см. стр. 76, 81, 101, 102, 108, 121, 122, 124, 132, 134, 172).
Среди дифиллоботриид, чьими личинками человек заражается только через пищу, выделяются спирометры, попадающие к человеку как через питьевую воду со случайно проглоченными циклопами, так и через сырое или недожарен-ное/недоваренное мясо рептилий, амфибий, домашней птицы, млекопитающих, а также в результате применения мяса рептилий и/или амфибий в медицинских целях (см. стр. 172).
В состав семейства дифиллоботриид входят гельминты, способные паразитировать как у человека, так и у полезных животных - ценных пушных зверей, ездовых собак и других домашнх животных, поэтому во всё мире изучению дифиллоботриид уделяется самое пристальное внимание, а результатам подобных исследований посвящена обширная медицинская литература, лишь малая толика которой процитирована в настоящем разделе.
180
Семейство Dipylidiidae Stiles, 1896
Семейство включено в состав отряда Cyclophyllidea, одного из самых многочисленных среди ленточных червей (по некоторым данным, отряд насчитывает 3100 видов из 380 родов -Grzimel’s Animal Life Encyclopedia. - http://www.encyclopedia.com).
Группа цестод, объединённых в семейство Dipylidiidae, до 1994 г. входила в состав семейства Dilepididae в ранге подсемейства Dipylidiinae. Семейство включает 4 рода - Dipylidium Leuckart, 1863, Diplopylidium Beddard, 1913, Jouexiella Fuhrmann, 1935 (cm.: Jones, 1994) и Diskrjabiniella Matevosyan, 1954 (http://bug.tamu.edu/.../Family/Dipylidiidae.txt).
Описание (по: Матевосян, 1963; Jones, 1994 и др.). Цестоды от небольших до средних размеров. Стробила с многочисленными проглоттидами, длина зрелых сегментов больше их ширины. Сколекс с четырьмя невооружёнными присосками и с выступающим хоботком, вооружённым несколькими рядами шиповидных крючьев. В каждом членике двойной набор половых органов и двойные половые поры. Семенники многочисленные, располагаются в интерваскулярном пространстве и могут простираться к переднему краю членика. Семявыносящий проток спирально закручен. Семенной пузырёк отсутствует. Бурса цирруса обычно достигает или пересекает экскреторные каналы. Вагина, как правило, открывается кзади бурсы цирруса, но может пересекать её и открываться впереди. Небольшой семяприемник на уровне яичника. Яичник разнообразной формы - от веерообразного до двукрылого. Матка первоначально сетчатая, в зрелых проглоттидах замещается тонкостенными капсулами, содержащими от 1 и более яиц. Все дипилидииды являются паразитами хищных млекопитающих. Типовой род - Dipylidium Leuckart, 1863.
Жизненный цикл дипилидиид сложный. Первый промежуточный хозяин у Dipylidium - блохи, у Diplopylidium и Jouexiella - навозные жуки, у представителей двух последних родов в жизненном цикле участвует также дополнительный хозяин - мелкие млекопитающие и рептилии (Bowman, 2009).
Единственный вид из данного семейства, регистрируемый у человека, это представитель типового рода Dipylidium - D. caninum (Linnaeus, 1758).
Род Dipylidium Leuckart, 1863
Синоним (по: bug.tamu.edu/research/collection/hallan/.../Family/Dipylidiidae.txt): Microtaenia Sedgwick in Claus-Sedgwick, 1884
С характерными чертами семейства. Сколекс очень маленький, хоботок вооружён мелкими шиповидными крючьями. Длина зрелых члеников больше их ширины. Половые поры билатеральные, находятся в середине, но чаще кзади от середины членика. Половые протоки проходят между экскреторными каналами. Семенники расположены по всему среднему полю. Вагина открывается в клоаку позади половой бурсы. Типовой вид-Dipylidium caninum (Linnaeus, 1758) Leuckart, 1863.
Dipylidium caninum (Linnaeus, 1758) Leuckart, 1863 (рис. 93 - 97). Данный паразит давно известен человеку, ещё со времён Древнего Мира, но первое научное название он получил только в 1748 г., когда Карл Линней в соответствии с принятой в те годы полиноминальной системой классификации организмов назвал цестоду Taenia osculus marginalibus oppositus. В 1758 г. К. Линней опубликовал свою знаменитую «Systema Naturae», введя бинарную номенклатуру, и цестода получила
181
новое название - Taenia canina (Linnaei, 1758). Видовое название гельминта происходит от латинского названия рода хозяина: Canis - собака, caninum - собачий. В 1863 г. вид был выбран типовым при обосновании нового рода Dipylidium (Leuck-art, 1863).
Широкое распространение паразита по планете привело к тому, что в разных странах его многократно описывали под самыми разными родовыми и видовыми названиями. В итоге список синонимов D. caninum включает 38 видов (Мате-восян, 1963). В монографической работе по паразитологии кошек (Bowman et al., 2002) у D. caninum перечислены 14 основных синонимов, в том числе Dipylidium cati Neumann, 1896, Dipylidium crassumMiXznQr, 1926, Dipylidium halli Tubangui, 1925, Dipylidium porimamillanum Lopez-Neyra, 1927 и другие.
Рис. 94 Dipylidium caninum'. 1 - сколекс; 2 -гермафродитный членик (из: Матевосян, 1963 - по: Lopez-Neyra, 1928)
Рис. 93 Dipylidium caninum, общий вид червя (из: Public Domain Shapiro, Leo; источник EOL)
as
Рис. 97 Dipylidium caninum'. 1 - сколекс; 2 - гермафродитный членик; 3 - зрелый членик (из: Матевосян, 1963 - по: Lopez-Neyra, 1929)
Рис. 95 Dipylidium caninum, проглоттиды (из: Pictorial key to families of cestodes of veterinary importance - instruction.cvhs.okstate.edu)
Рис. 96 Dipylidium caninum, капсула с яйцами (из: Endoparasites Fleshcards by ProProfs www.proprofs.com)
182
Цестоды слегка красновато-желтоватого цвета, длиной 10 - 70 см при максимальной ширине 2-3 мм. Сколекс очень маленький, до 0.5 мм в диаметре. Хоботок округлый или овальный, вооружён крючьями, расположенными в 4 - 7 рядах и по форме похожими на шипы роз. Количество крючьев в рядах, по разным данным, варьирует от 10 - 20 до 20 - 30 (см.: Матевосян, 1963). Длина крючьев уменьшается по направлению от первого ряда к последующим. Шейка эластичная. В стробиле от 60 до 175 или более члеников. Половые поры слегка позади середины сегмента. Зрелые проглоттиды эллиптические, кремового цвета, длиной до 10 - 14 мм и по своей форме похожи на огуречные семена, с чем связано одно из названий паразита - огуречный цепень. Проглоттиды заполнены капсулами, числом до 20 (Macpherson, Torgerson, 2013), в каждой из которых может находиться от 3 до 30 яиц, склеенных вместе прозрачным веществом. Диаметр яиц, по разным данным, варьирует от 25 до 50 |лп.
Небольшая ремарка. В монографии Е. М. Матевосян (1963) на стр. 608 её автор приводит следующие размеры капсул и яиц у D. caninum: соответственно 0.025 х 0.017 и 0.026 - 0.050 мм. Если учесть, что в одной капсуле у описываемого вида обычно содержится от 3 до 30 яиц, то абсолютно непонятно, каким образом даже одно яйцо может поместиться в меньшую, чем оно, капсулу. Авторы одной из публикаций (Samkari et al., 2008) указывают для капсул размеры 0.150 х 0.120 мм и для яиц около 0.042 мм, при этом в одной капсуле, по их данным, насчитывалось от 6 до 10 яиц.
Яйца накапливаются в каждом членике до тех пор, пока тот не будет заполнена ими наподобие спелого стручка (Georgi, 1987). Поскольку проглоттиды обладают круговой и продольной гладкой мускулатурой (Chitwood, Lichtenfels, 1972), то они способны передвигаться в перианальной области животного, на фекалиях, полу, земле, белье или на любой поверхности, куда они могли попасть (Griffiths, 1978). Во внешней среде проглоттиды пересыхают, часто напоминая сырые рисовые зёрна (Boreham, Boreham, 1990). Замечено, что яйца D. caninum выдерживают высушивание в течение 1 - 2 дней, но в воде теряют жизнеспособность за 1 - 2 мин (Muller, 2002).
Жизненный цикл D. caninum включает смену двух хозяев (рис. 98). У заражённых животных отторжение зрелых члеников от стробилы происходит самопроизвольно, иногда по несколько экземпляров в день (Матевосян, 1963). Выделенные с фекалиями дефинитивного хозяина членики цестоды во внешней среде распадаются на коконы с яйцами, которые рассеиваются по земле, попадая на шерсть и лапы животного. Живущие на животных личинки блох, обладающие сильно развитыми челюстями, питаются различными органическими веществами, фекалиями и рассеянными коконами. Из попавших в их кишечник яиц вылупляются онкосферы, которые параллельно с развитием личинок блохи и их превращением во взрослую особь развиваются до инвазионной стадии. Одно взрослое насекомое может содержать до нескольких десятков цистицеркоидов. Обычными промежуточными хозяевами D. caninum служат столь же широко распространённые паразиты животных, прежде всего, блохи - кошачья Ctenocephalides felis, собачья С. canis, человеческая Pulex irritans, и менее обычно - собачья вошь, или власоед, Trichodectes canis (Boreham, Boreham, 1990; Georgi 1987; Marshall, 1967; Zimmermann, 1937).
К слову, весьма любопытные результаты были получены при изучении встречаемости личинок D. caninum среди насекомых у кошек и собак в Австрии (Hinaidy, 1991). От 198 кошек и 182 собак было собрано 9134 экз. блох, из числа которых каждое 44-е насекомое от кошек и каждое 61-е от собак оказались носите-183
лями инвазионного начала. При этом заражённость Ctenocephalides felis от кошек составила 2.3 %, а от собак - 1.2%, тогда как С. canis от собак был инвазирован на 3.1 %. Количество цистицеркоидов в одном насекомом варьировало от 1 до 162.
Egg packets containing embryonaled eggs are ingested by larval stage cl flea.
▲ Infective Stage
A» Diagnostic Stage
Each proglottid contains egg packets that are held together by an outer embryonic membrane (see©).
The proglottids disintegrate and release the egg packets
Рис. 98 Схема жизненного цикла Dipylidium caninum: 1 - зрелые проглоттиды выходят с фекалиями или из перианальной области хозяина; 2 - во внешней среде проглоттиды распадаются на капсулы с яйцами, которые поедаются личинками блох; 3 - в полости тела блох развивается цистицеркоид; 4 - взрослые блохи содержат инвазионную личинку цестоды; 5 -окончательные хозяева заражаются, заглатывая инвазированных блох; 6 -животные передают инвазированных блох человеку; 7 - заражение человека, прежде всего, детей происходит при заглатывании блох; 8 - взрослый червь в тонком кишечнике человека (i - инвазионная стадия; d-диагностическая стадия) (из: CDC-DPDx - Dipylidium caninum).
Инвазионная лярвоциста представляет инвагинированный бесхвостый сколекс в задней части личинки и достигает в размерах 0.3 - 0.5 мм, на хоботке различимы 4-5 рядов крючьев. После попадания в дефинитивного хозяина через 2-4 недели паразит достигает зрелого состояния (Bowman, 2009). Рост паразита во многом зависит от питания, возраста и состояния здоровья окончательного хозяина.
Дефинитивные хозяева D. caninum - псовые и кошачьи, причём для домашних собак и кошек эта цестода является одним из наиболее широко распространённых паразитов. «Нет такой страны, где при гельминтологических исследованиях собак не выявили бы этого гельминта» (Матевосян, 1963; стр. 617). В статье, содержащей результаты анализа заражённости гельминтами домашних собак на территории РФ, Т. В. Москвина и А. В. Ермоленко приводят цифры, согласно которым встречаемость D. caninum у собак варьировала от 10.4 % в Курске и 26.6 % в Дагестане до 72.2% в Воронеже и 100 % в Москве (Moskvina, Ermolenko, 2016).
184
Судя по многочисленным публикациям, D. caninum известен и в природе, где его находят у многих представителей плотоядных животных: кошек камышовой и степной, циветты малайской пальмовой, или мусанга, песца, волка, динго, лисиц обыкновенной, парагвайской, саванновой, или майконга, гиены, шакала, енотовидной собаки, енота уссурийского и других.
При высокой численности паразитов инвазия животных сопровождается судорогами, иногда эпилептиформными припадками (Boreham, Boreham, 1990). У молодых животных могут наблюдаться неспецифические симптомы в брюшной полости, в том числе запор или понос, вздутое брюшко. В очень редких случаях возможна кишечная непроходимость.
В русскоязычной справочной и научно-справочной литературе D. caninum именуют цепнем собачьим, тыквенным или огуречным, собачьим солитёром, в англоязычной литературе обычно встречается the flea tapeworm (блошиный солитёр), double-pored dog tapeworm (из-за наличия у проглоттид двух половых пор), cucumber seed tapeworm (огуречный ленточный червь).
В качестве паразита человека D. caninum известен ещё со времён Древнего Вавилона (Venard, 1938), а первое научное описание цестоды из человека появилось в 1748 г. в диссертационной работе G. Dubois - ученика К. Линнея (цит. по: Grove, 1990). В организме человека цестода развивается так же, как и у её обычных хозяев - кошек и собак, и достигает половой зрелости. И хотя заражение людей не является столь уж обычным явлением, подобные случаи всё же спорадически фиксируют в самых разных уголках земного шара. В Чили, например, при обследовании 51020 человек инвазия была выявлена у 18 из них (Reyes et al., 1972). Данные об общем количестве известных случаев регистрации этого паразита у людей довольно противоречивы. В зарубежной литературе последних лет обычно подчёркивается их единичный характер: 120 случаев за всю историю наблюдений (Parija, 2006), менее 200 (Macpherson, Torgerson, 2013). В то же время М. М. Сарбашева с колл. (2012) отмечают, что на территории Кабардино-Балкарской Республики за 2006 - 2012 гг. было зафиксировано 152 случая заражения детей и 305 - взрослых лиц. Эти цифры на общем фоне обсуждаемых в литературе выглядят впечатляюще.
Скорее всего, цепень огуречный в действительности встречается у людей намного чаще, чем выявляется и описывается в литературе. Во многом это можно объяснить несколькими причинами. Известно, например, что инвазию D. caninum довольно часто ошибочно принимают за заражение нематодой Enterobius vermicu-laris, на что уже давно обращают внимание многие медицинские паразитологи (Chappell et al., 1990; Georgi, Georgi, 1992; Reid et al., 1992; Samkari et al., 2008; Taylor, Zitzmann, 2011 и др.). Подобный ошибочный диагноз связан с тем, что выползающие в перианальную область подвижные членики цестоды внешне похожи на остриц, довольно обычных и широко распространённых паразитов человека, в том числе детей (см.: Гаевская, 2016). Замечено также, что попавшие вместе с экскрементами во внешнюю среду подвижные проглоттиды внешне напоминают личинок мух или опарышей (CDC-DPDx - Dipylidium caninum), что также может ввести в заблуждение.
Если же подытожить всю известную информацию относительно регионов регистрации D. caninum у человека, то перед нами возникнет практически чуть ли не вся карта мира: Австрия, Армения, Болгария, Германия, Грузия, Дания, Испания, Италия, Польша, Россия, Румыния, Украина, Франция, Швейцария, Шотландия,
185
Канада, США, Мексика, Гватемала, Венесуэла, Куба, Пуэрто-Рико, Аргентина, Уругвай, Бразилия, Чили, Индия, Индонезия, Китай, Узбекистан, Филиппины, Япония, Шри-Ланка.
От заражения цепнем огуречным обычно страдают дети, чаще всего младшего возраста (Blanchard, 1907; Cabello et al., 2011; Hamrick et al., 1983; Lloyd, 2011; Margolis, 1983; Nitzulescu et al., 1966; Raitiere, 1992; Reid et al., 1992; Stiles, 1903; Tan et al., 1986; Wijesundera, Ranaweera, 1989 и многие другие). В США, например, цестоду выявили у 6-месячного младенца (Molina et al., 2003), в Японии - у 17-месячной девочки (Tsumura et al., 2007), в Мексике - у 18-месячной девочки (Cabello et al., 2011), в Верхней Австрии - у 22-месячного малыша (Brandstetter, Auer, 1994), на юго-востоке Польши - у 2-летнего ребёнка (Szwaja et al., 2011), в Чили - у мальчика 2 лет и 8 месяцев (Neira et al., 2008), в Индии - у 4-летнего мальчика (Narasimham et al., 2013) и т.д. Известны случаи инвазии малышей в возрасте 5, 4, 3 и 2-х месяцев (соответственно Reddy, 1982; Taylor, Zitzmann, 2011; Vacca, 1909; Belmar, 1963) и даже 40-дневного младенца (см.: Матевосян, 1963; стр. 616).
Клинически инвазия может проявляться рвотой, диареей, отсутствием аппетита, похудением, усиленным слюнотечением, периодическими абдоминальными боями, вздутием живота, иногда зудом в перианальной области, т.е. симптомами, характерными и для заражения острицами. Могут наблюдаться повышенная нервная возбудимость, беспокойный сон (Гефтер, 1968). В некоторых случаях инвазия у детей внешне никак не проявляется, и выявляется только тогда, когда родители, обнаружив в кале ребёнка непонятные белые образования, приносят их в медицинские учреждения для выяснения их происхождения.
Диагноз на инвазию цестодами ставится на основании обнаружения члеников с последующим определением их систематической принадлежности. Своевременность постановки правильного диагноза продиктована необходимостью выбора соответствующего препарата для лечения пациента (Taylor, Zitzmann, 2011). Подтверждают сказанное следующие примеры. Двухлетнюю девочку, у которой диагностировали заражение «острицами», в течение 3 месяцев безуспешно лечили мебендазолом, не эффективным в случае заражения цепнем собачьим (Samkari et al., 2008). До постановки правильного диагноза столь же безуспешным было лечение двухлетнего ребёнка, у которого через несколько дней после приёма пирантела и альбендазола вновь выделились проглоттиды (Szwaja et al., 2011).
Препаратом выбора при инвазии цепнем огуречным является празиквантел, антигельминтик широкого спектра действия, разовая доза которого, по разным данным, варьирует от 10 до 25 мг . кг’1 (Muller, 2002; Narasimham et al., 2013; Neira et al., 2008; Schenone et al., 1987; Wijesundera, Ranaweera 1989).
Несмотря на то, что человек не является обязательным окончательным хозяином D. caninum и вероятность его заражения данным гельминтом невысока, тем не менее, она вполне реальна, поскольку для этого достаточно проглотить всего одну заражённую блоху, случайно оказавшуюся на еде. Подобное может произойти, если, например, обедать вместе с животными или же подбирать еду с пола, земли, что особенно часто делают маленькие дети. Замечено, что в окружении больных, как правило, имелись кошки и/или собаки, а также их паразиты - насекомые. Большее число случаев регистрации инвазии среди детей, в сравнении с взрослыми, связано с их более тесными контактами с домашними питомцами. Следовательно, при содержании в доме кошек, собак или каких-либо других животных - потенци
186
альных окончательных хозяев D. caninum необходимо следить за их чистотой и здоровьем, предупреждая возможность их заражения данным паразитом, для чего самым радикальным способом является их избавление от паразитических насекомых. Нет блох - нет и источника инвазии человека. При обнаружении у домашних питомцев признаков заражения цепнем следует немедленно обратиться в ветеринарные службы для проведения курса дегельминтизации животных.
В природных условиях заражение цепнем собачьим и взрослых лиц, и детей предупреждается соблюдением элементарных санитарных правил, исключающих возможный контакт животного с едой человека.
Учитывая определённое патогенное влияние D. caninum на организм человека, особенно детей, данный паразит включён в Международную классификацию болезней 10-го пересмотра МКБ-10 (ICD-10, Version: 2016). Напомню, что МКБ-10 - общепринятая классификация для кодирования медицинских диагнозов, разработанная Всемирной организацией здравоохранения; состоит из 22 классов, каждый из которых содержит рубрики с кодами заболеваний и состояний. Заболеванию, вызываемому D. caninum, присвоен код В71.1.
Цитируемая литература
Гаевская А. В. Мир паразитов человека. II. Нематоды и нематодозы пищевого происхождения. - Севастополь: ЭКОСИ-Гидрофизика, 2016. - С. 365 - 369.
Гефтер В. А. Глава XXII. Прочие цестодозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: Изд-во «Медицина», 1968. - С. 527 -537.
Матевосян Е. М. Дилепидоидеа - ленточные гельминты диких и домашних животных // Основы цес-тодологии. Под ред. акад. К. И. Скрябина. - М.: Изд-во АНСССР, 1963. - 3. - С. 600 - 684.
Сарбашева М. М., Биттирова А. А., АтабиеваЖ. А., Биттиров А. М., Биттиров Ан. М. Краевая эпидемиология цестодозов человека в Кабардино-Балкарской Республике // Эпидемиология и инфекционные болезни. - 2012. - № 6. - С. 35 - 37.
Belmar R. Dipylidium caninum en nifios. Comunicacidn de 13 casos у tratamiento con un derivado de la sali-cilamida // Bol. Chil. Parasit. - 1963. -18. - P. 63 - 67.
Borcham R. E., Borcham P. F. L. Dipylidium caninum’. life cycle, epizootiology, and control // Comp. Cont. Educ. Pract. Vet. - 1990. - 12, 5. - P. 667 - 676.
Blanchard R. Dipylidium caninum chez 1’enfant й Paris // Bull. Acad. M6d. Paris (3). - 1907. - 57, - P. 562 -567.
Bowman D. D. Georgis’ Parasitology for veterinarias. Ninth Edition. - Elsevier Inc,. 2009. - 452 pp.
Bowman D. D., Hendrix С. M., Lindsay D. Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002. -P. 205-211.
Brandstetter W., Auer H. [Dipylidium caninum, a rare parasite in man] // Wien. Klin. Wochenschr. - 1994. -106, 4. - P. 115-116. (Article in German).
Cabello R. R, Ruiz A. C., Feregrino R. R, Romero L. C., Feregrino R. R, Zavala J. T. Dipylidium caninum infection // BMJ Case Rep. - 2011. - 2011 :ber0720114510.
Chappell C. L., Enos J. P., Penn H. M. Dipylidium caninum, an underrecognized infection in infants and children // Pediatr. Infect. Dis. J. - 1990. - 9, 10. - P. 745 - 747
Chitwood M., Lichtenfels J. R. Identification of parasitic metazoa in tissue sections // Exp. Parasitol. - 1972. -32, 3.-P. 407-519.
Georgi J. R Tapeworms // Vet. Clin. North Am. Small Anim. Pract. - 1987. - 17, 6. - P. 1285 - 1305. Georgi J. R, Georgi J. R Canine clinical Parasitology. - Philadelphia, Pa: Lea & Febiger, 1992. - P. 138 - 141. Grove D. I. A histoiy of human helminthology. - CAB Intern., 1990. - P. 422.
Hamrick H J., Drake W. R, Jones H M„ Askew A. P., Weatherly N. F. Two cases of dipylidiasis (dog tapeworm infection) in children: update on an old problem // Pediatrics. - 1983. - 72. - P. 114-117.
Hinaidy H K. Beitrag sur Biologie des Dipylidium caninum. 2. Mitteilung // J. Vet. Med. Ser. B. - 1991. -38, 4. - P. 329 - 336. 10.1111/j. 1439-0450.1991.tb00879.x.
Jones A. Family Dipylidiidae Stiles, 1896. In: Keys to the Cestode Parasites of Vertebrates, Khalil L. F., Jones A., Bray R. A., eds. CAB International, Wallingford, UK, 1994.
187
Leuckart R. Die Parasiten des Menschen und die von ihnen herrtihrenden Krankheiten И Leipzig u. Heidelberg. - 1863.-P. 1879- 1886.
Linnaei C. Systema Naturae per regna tria naturae, secundum classes, ordines, genera, species cum characteri-bus, differentiis, synonimis, locis. Editio decimal, reformata. - Holmiae, 1758. - 834 pp.
Lloyd S. Other adult and larval cestodes / Palmer S., Soulsby L., Torgerson P, Brown D. (eds) The Oxford Textbook of Zoonoses. 2nd ed. - Oxford Univ. Press, Oxford, UK, 2011. - P. 643 - 649..
Lopez-Neyra C. R. Recherches sur le genere Dipylidium, avec description de quatre espfcces nouvelles 11 Bull. Soc. pathol. exot., Paris. - 1928. - 21. - P. 239 - 253.
Lopez-Neyra C. R. Revision del gdnero Dipylidium Leuckart // Mem. Real. Acad, cienc. exact, fis. у nat., Madrid.-1929.-32, l.-P. 1-112.
Macpherson C. N. L., Torgerson P. R. 8. Dogs and cestode zoonoses / Dogs, Zoonoses and Public Health. -Eds. Macpherson C. N. L., Meslin F.-X., Wandeler A. I. - 2nd Edition. - CABI, 2013. - P. 127 - 152.
Margolis B. Dog tapeworm infestation in an infant // Am. J. Dis. Child. - 1983. - 137, 7. - P. 702.
Marshall A. G. The cat flea, Ctenocephalides felis felis (Bouchd, 1835) as an intermediate host for cestodes I I Parasitology. - 1967. - 57, 3. - P. 419 - 430.
Molina С. P., Ogburn J., Adegboyega P. Infection by Dipylidium caninum in an infant // Arch. Pathol. Lab. Med. - 2003. - 127, 3. - P. 157 - 159.
Moskvina T. K, Ermolenko A. К Helminth infections in domestic dogs in Russia // Vet. World. -2016.-9, 11.-P. 1248- 1258. doi: 10.14202/vetworld.2016.1248-1258.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 102 - 105.
Narasimham M. V., Panda P., Mohanty I., Sahu S, Padhi S., Dash M. Dipylidium caninum infection in a child: A rare case report // Indian J. Med. Microbiol. - 2013. - 31, 1. - P. 82 - 84.
Neira О. P., Jofre M. L„ Munoz S. N. [Dipylidium caninum infection in a 2 year old infant: case report and literature review] // Rev. Chilena Infectol. - 2008. - 25, 6. - P. 465 - 471. (In Spanish).
Nitzulescu V, Feldioreanu T, Purcherea A. [A further case of human dipylidiasis with Dipylidium caninum] И Pediatria (Bucur). - 1966. - 15, 4. - P. 357 - 358. (Article in Romanian).
Parija S. C. Textbook of Medical Parasitology. 3 rd ed. - New Delhi: All India Publishers and Distributors; 2006.-P. 233-235.
Raitiere C. R. Dog tapeworm [Dipylidium caninum) infestation in a 6-month-old infant // J. Fam. Pract. -1992.-34, l.-P. 101-102.
Reddy S. B. Infestation of a five-month-old infant with Dipylidium caninum // Del. Med. J. - 1982. - 54, 8. -P. 455-456.
Reid C. J., Perry F. M., Evans N. Dipylidium caninum in an infant // Eur. J. Pediatr. - 1992. - 151, 7. - P. 502 -503.
Reyes H., Doren G., Inzunza E. Teniasis humana. Frecuencia actual de la infection por diferentes especies en Santiago de Chile // Bol. Chil. Parasitol. - 1972. - 27, 1. - P. 23 - 29 (цит. no: Neira et al., 2008).
Samkari A., Kiska D. L., Riddell S. W., Wilson K.9 Weiner L. B., Domachowski J. B. Dipylidium caninum mimicking recurrent Enterobius vermicularis (pinworm) infection // Clin. Pediathries. - 2008. - 37, 4. - P. 397 - 399. 10.1177/000992207310247.
Schenone H., Thompson L., Quero M. S. [Infection by Dipylidium caninum in a young girl treated with praziquantel] // Bol. Chil. Parasitol. - 1987. - 42, 3-4. - P. 74 - 75. (Article in Spanish).
Stiles C. W. A case of infection with the double-pored dog tapeworm (Dipylidium caninum) in an American child // Am. Med., Phila. - 1903. - 5, 1. - P. 65 - 66.
Szwaja B., Romahski L., ZabczykM. A case of Dipylidium caninum infection in a child from the southeastern Poland 11 Wiad. Parazytol. - 2011. - 57, 3. - P. 175 - 178.
Tan У. У, Kwee H. G., Sautter R. L. Dipylidium caninum infection // Clin. Microbiol. - 1986. - 8, 15. - P. 113-114.
Tsumura N., Koga H., Hidaka H,, Mukai F, Ikenaga M. et al. [Dipylidium caninum infection in an infant] // Kansenshogaku Zasshi. - 2007. - 81, 4. - P. 456 - 458. (Article in Japanese).
Vacca A, Elmintiasi Dipylidium caninum (L.) in un bambino de 3 mesi d’eta//Riv. Clin. Pediatr. - 1909. -7.-P. 739 - 745.
Venard С. E. Morphology, bionomics, and taxonomy of the cestode Dipylidium caninum // Ann. N. Y. Acad. Sci.-1938.-37.-P. 273-328.
Wijesundera M. D., Ranaweera R. L. Case reports of Dipylidium caninum; a pet associated infection 11 Ceylon. Med. J. - 1989. - 34, 1. - P. 27 - 30.
Zimmermann H. R. Life-history studies on cestodes of the genus Dipylidium from the dog П Z Parasitenk. -1937. - 9, 6. - P.717 - 729. doi: 10.1007/BF02122160.
188
Семейство Hymenolepididae Ariola, 1899
Синонимы (по: Спасский, 1963):
Fimbriariidae Wolfhilghel, 1898
Hymenolepidae Ariola, 1899
Echinocotylidae Ariola, 1899
Hymenolepinidae Fuhrmann, 1907 Diploposthidae Poche, 1926
В отдельных публикациях, посвящённых данной группе цестод, среди авторов семейства Hymenolepididae можно встретить разные имена: Ariola, 1899; Fuhrmann, 1907; Perrier, 1897; Railliet & Henry, 1909. В данной работе я придерживаюсь точки зрения авторов самого последнего по времени разработки определителя цестод семейства Hymenolepididae (Czaplinsky, Vaucher, 1994), принятого «Европейским регистром морских видов» («European register of marine species») и «Мировым регистром морских видов» («World Register of Marine Species») (Bray, 2001, 2010).
Описание (по: Спасский, 1963; Czaplinski, Vaucher, 1994; Tkach, 2010). Цестоды от мелких до относительно крупных размеров. Сколекс с 4 присосками, которые иногда могут быть усажены крючочками или шипиками. Втяжной мешковидного типа хоботок с мышечным влагалищем, вооружён от 8 до нескольких сотен крючьями, иногда хоботок редуцирован или вообще отсутствует. Проглоттиды обычно многочисленные, краспедотного типа, половозрелые членики вытянуты в поперечном направлении. Продольная паренхимная мускулатура обычно двухслойная. Имеется две пары продольных экскреторных сосудов, иногда их больше. В проглоттидах по одному комплекту половых органов, располагающихся в его срединном поле. Половые поры односторонние, латеральные. Половые протоки проходят дорсально от поральных экскреторных каналов. Семенников немного - от 1 до 4, что является характерной чертой цестод данного семейства. Имеются наружный и внутренний семенные пузырьки. Желточник компактный, располагается позади, редко сбоку яичника. Матка в зрелых проглоттидах мешковидная, редко сетчатая, иногда формируются такие образования как синкапсулы или коконы. Взрослые черви - паразиты птиц и млекопитающих. Типовой род - Hymenolepis Weinland, 1858.
Гименолепидиды - наиболее широко распространённая и многочисленная группа отряда Cyclophyllidea, история разработки зоологической системы которой охватывает более чем 200-летний период. В 1963 г. А. А. Спасский насчитал в составе семейства около 100 родов и более 400 видов. К настоящему времени семейство объединяет около 90 валидных родов с 900 видами, из числа которых около 700 видов описано от птиц и около 250 - от млекопитающих (Tkach, 2010), в том числе более 150 видов выявлено у насекомоядных животных (Tkach, 1994).
Однако публикации последних лет показывают, что самостоятельность отдельных видов и родов гименолепидид, равно как и состав некоторых родов этого семейства требуют ревизии с привлечением данных по морфологии, анатомии, специфичности и биогеографии (Mas-Coma, Galan-Puchades, 1991), а также геномам сомнительных (спорных) таксонов (Okamoto et al., 1997; Olson, Tkach, 2005). Сказанное подтверждают регулярно появляющиеся в печати статьи с пересмотром статуса и состава существующих родов (напр., Макарикова и др., 2010; Kornienko, Binkiene, 2014; Tkach et al., 2013), описанием новых родов гименолепидид (напр.,
189
Макариков, Гуляев, 2009), а также критическим анализом структуры не только данного семейства, но и отдельных отрядов цестод (Cheng et al., 2016).
Как уже отмечено, в половозрелом состоянии гименолепидиды паразитируют только у теплокровных животных, при этом у птиц и млекопитающих нет общих видов и родов этих цестод. Однако на личиночной стадии эти гельминты используют в качестве промежуточных хозяев беспозвоночных из самых разных классов и даже типов. Всё вместе взятое, включая присущее гименолепидидам обилие видов, находит отражение в значительном разнообразии их жизненных циклов и необычайно широком круге промежуточных и дефинитивных хозяев.
Роль промежуточного хозяина гименолепидид играют ракообразные - наземные, пресноводные, а у некоторых видов и морские (жаброногие раки, гаммари-ды, остракоды, копеподы), многочисленные насекомые (жуки, блохи, бабочки, мухи, термиты, уховёртки), реже олигохеты, пиявки, многоножки. Метацестоды могут встречаться также в пресноводных брюхоногих моллюсках, служащих в данном случае паратоническими хозяевами паразита (Спасская, 1966).
Из яиц, попавших в организм промежуточного хозяина, выходят онкосферы, которые через стенку его кишечника проникают в соответствующие участки тела, где и происходит их дальнейшее развитие до инвазионной стадии, способной заражать дефинитивного хозяина. К примеру, в организме жаброногих раков Arte-mia salina и Branchinella spinosa, участвующих в жизненных циклах птичьих гименолепидид, цистицеркоиды локализуются в грудных и брюшных сегментах, плавательных ножках и даже в яйцевых мешках, а в одном рачке может насчитываться до 3 - 4 личинок (Максимова, 1973). Зрелая личинка обычно имеет вид толстостенной цисты, в которой содержится вполне сформированный, но не вывернутый наизнанку сколекс, прикрепляющийся при помощи шейки к задней стенке цисты в том месте, где от неё отходит хвостовой придаток - церкомер (см. рис. 4). Показано, что у гименолепидид - автохтонных паразитов млекопитающих в процессе развития цистицеркоида инвагинация сколекса происходит на ранней стадии (Гуляев и др., 2010; Hurt, Bums, 1994; Rothman, 1957).
В справочно-информационной сводке «Медицинская гельминтология. Полный перечень из 384 гельминтов...» (www.worms-info.ru/Cestoda), а также в работе (Mirdha, Rehman, 2013) перечислены следующие виды семейства Hymenolepididae, выявленные у человека: Drepanidotaenia lanceolata (Bloch, 1782), Hymenolepis dimi-nuta (Rudolphi, 1819), Hymenolepis microstoma (Dujardin, 1845) и Hymenolepis папа (von Siebold, 1852). В 1986 г. виды Hymenolepis microstoma и H. папа были переведены в род Vampirolepis Spassky, 1954 (Schmidt, 1986), а затем - в Rodentolepis Spassky, 1954 (Czaplinski, Vaucher, 1994).
В монографии (Gillani et al., 2012) среди паразитов человека упоминаются только два вида гименолепидид: D. lanceolata и Н diminuta, на страницах «Википедии» (en.wikipedia.org. Hymenolepididae-Wikipedia) - также два: Н. diminuta и Н. папа, в монографии Э. Фауста (Faust, 1949) - три вида: D. lanceolata, Н. diminuta и Н папа, в обзорной работе (Ashford, Crewe, 2003) - также три: D. lanceolata, Н diminuta и Rodentolepis папа (=Hymenolepis папа).
Итак, отсутствие среди исследователей единого мнения не только о количестве и составе видов гименолепидид, регистрируемых у человека, но и о родовом статусе отдельных видов совершенно очевидно. Тем не менее, начнём описание этих цестод с типового рода Hymenolepis.
190
Цитируемая литература
Гуляев В. Д., Ишиногенова А. А., Корниенко С. А. Морфогенез церкоцисты Staphylocystis furcata (Cyclophyllidea, Hymenolepididae) // Паразитология. -2010.-44, 1. - С. 12-21.
Макариков А. А., Гуляев В. Д. Pararodentolepis gen. n. - новый род цестод грызунов и описание Р. sinistra sp. n. (Cyclophyllidea: Hymenolepididae) 11 Паразитология. - 2009. - 43, 6. - C. 454 - 459.
Макарикова T. А., Гуляев В. Д.» Тиунов М. IL, Feng J. Paramilina nishidai (Sawada, 1982) gen. n., comb. n. и Hymenolepis magna sp. n. (Cyclophyllidea, Hymenolepididae) // Зоол. журн. - 2010. - 89, 2. - С. 131 - 139.
Максимова А. П. Жаброногие рачки - промежуточные хозяева цестод сем. Hymenolepididae И Паразитология. - 1973. - 7, 4. - С. 349 - 352.
Спасская Л. П, Цестоды птиц СССР. Гименолепидиды / Отв. ред. акад. К. И. Скрябин, акад. АН Молд. ССР А. А. Спасский. - М.: Наука, 1966. - С. 17.
Спасский А. А. Гименолепидиды - ленточные гельминты диких и домашних птиц // Основы цестодо-логии. Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1963. - 2, часть 1. - С. 55 - 80.
Ashford К W., Crewe W. The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - P. 61.
Bray R. A. Cestoda I Costello M. J. et al. (Ed.) European register of marine species: a check-list of the marine species in Europe and a bibliography of guides to their identification. Collection Patrimoines Naturels, 2001.-50: P. 146-149.
Bray R. (2010). Hymenolepididae Ariola, 1899. Accessed through: World Register of Marine Species at http://www.marinespecies.org/aphia.php?p=taxdetails&id=104930 on 2017-02-26.
Cheng T, Liu G. H, Song H Q. et al. The complete mitochondrial genome of the dwarf tapeworm Hymenolepis папа - a neglected zoonotic helminth // Parasitol. Res. - 2016. - 115, 3. - P. 1253 - 1262. doi: 10:1007/s00436-015-4862-8.
Czaplinski B.9 Voucher C. Family Hymenolepididae Ariola, 1899 // Keys to the cestode parasites of vertebrates / eds. L. F. Khalil, A. Jones, R. A. Bray. - Wallingford, U.K.: CAB Intern., 1994. - P. 595 - 663.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 291 - 298.
Gillani S. W., Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - 2012. - P. 89. (https://books.google.com/books?isbn=l 105494594).
Kornienko S. A., Binkiene R. Redescription and systematic position ofSoricinia tripartita Zamowski, 1955 (Cestoda: Cyclophyllidea), a cestode species parasitic in shrews of the genus Sorex, including erection of Gulyaevilepis gen. n. // Folia Parasitol. - 2014. - 61, 2. - P. 141 - 147. 10.1441 l/fp.2014.015.
Mas-Coma S, Galan-Puchades M. T. A methodology for the morphoanatomic and systematic study of the species of the family Hymenolepididae Railliet et Henry, 1909 (Cestoda: Cyclophyllidea) 11 Research and Review in Parasitology. - 1991.-51, 1-4.-P. 139- 173.
Mirdha B.R., Rehman S. Chapter 23. Hymenolepis / Molecular detection of human parasitic pathogens. - D. Liu ed. - Taylor & Francis Group, LLC, 2013. - P. 265 - 276.
Okamoto M., Agatsuma T, Kurosawa T, Ito A. Phylogenetic relationships of three hymenolepidid species inferred from nuclear ribosomal and mitochondrial DNA sequences // Parasitology. - 1997. - 115. - P. 661 - 666. http://joumals.cambridge.org.
Olson P. D., Tkach V V. Advances and trends in the molecular systematics of the parasitic Platyhelminthes // Adv. Parasitol. - 2005. - 60. - P. 165 - 243.
Schmidt G. D. Handbook of tapeworm identification. - CRC Press, Boca Raton, Florida, 1986. - 675 pp.
Tkach V V. Description of cysticercoids of Coronacanthus vassilevi Genov, 1980 (Cestoda: Hymenolepididae) H Parasite. - 1994. - 1. - P. 161 - 165.
Tkach V. (2010). Hymenolepididae / A survey of tapeworms from vertebrate bowels of the Earth. -sites.google.com - Hymenolepididae - tapeworm PBI.
Tkach V V., Makarikov A. A., Kinsella J. M. Morphological and molecular differentiation of Staphylocystis clydesengeri n. sp. (Cestoda, Hymenolepididae) from the vagrant shrew, Sorex vagrans (Soricomorpha, So-ricidae), in North America // Zootaxa. - 2013. - 3691 (3). - P. 389 - 400.
Род Hymenolepis Weinland, 1858
Описание (по: Макарикова и др., 2010; Czaplinski, Vaucher, 1994; Makarikov, Tkach, 2013; Mas-Coma, Tenora, 1997). Цестоды средних размеров. Проглоттиды многочисленные, поперечно-удлинённые, краспедотного типа. Сколекс с рудиментарным хоботковым аппаратом; невооружённый ринхус втянут в хоботковое влагалище, 191
куда проникают осморегуляторные каналы. Присоски невооружённые, иногда со слабой мускулатурой. Дорсальные и вентральные экскреторные каналы располагаются в одном и том же сагиттальном плане; вентральные каналы с поперечными анастомозами. Продольные мышцы в 2 слоях. Половые поры односторонние, с правой стороны. Половые протоки проходят дорсально к экскреторным каналам. Семенников три, расположены в один ряд или треугольником; поральный семенник отделён от двух апоральных женскими гонадами. Сумка цирруса мускулистая, не достигает срединной линии членика. Циррус с очень мелкими шипиками. Наружный и внутренний семенные пузырьки имеются. Яичник многолопастный или двудольчатый, медианный, желточник за яичником, слегка дольчатый. Вагина с мускулистыми стенками, снаружи покрыта толстым слоем интенсивно окрашивающихся клеток. Полностью развитая матка обычно мешкоподобная, с дорсальным и вентральным выростами, билатерально проходит дальше осморегуляторных каналов, дорсально к остальным органам. Яйца многочисленные, крупные, субсферические или сферические, с толстой наружной оболочкой. Эмбриофор субсферический. Типовой вид- Hymenolepis diminuta (Rudolphi, 1819) Blanchard, 1891.
Hymenolepis - самый старый род в семействе, основанный ещё в середине 19-го столетия Д. Уэйнландом (Weinland, 1858) после изучения им большого количества фрагментов цестод из коллекции Бостонского медицинского общества, полученных в 1842 г. от 19-месячного ребёнка.
Небольшая ремарка. Род с аналогичным названием - Hymenolepis известен и в растительном мире, где он входит в состав семейства пупавковых, Anthemideae, насчитывающего более 100 родов.
К 1925 г. род Hymenolepis объединял уже 200 видов из млекопитающих и птиц (Mayhew, 1925), а к 1940-м годам - более 300 (см.: Makarikov, Tkach, 2013). После многочисленных ревизий к концу 1980-х годов в Hymenolepis (sensu stricto) остался всего 21 вид (Gardner, Schmidt, 1988), а к настоящему времени - около 18 (12-13 видов в грызунах, около 4 видов - в летучих мышах и 1 вид - в ежах) (Makarikov, Tkach, 2013). В итоге Hymenolepis включает только виды с невооружённым сколексом - паразитов грызунов и насекомоядных млекопитающих.
Единственный вид Hymenolepis, встречаемый у человека, это - Н. diminuta.
Hymenolepis diminuta (Rudolphi, 1819) Blanchard, 1891 (=Taenia diminuta Rudophi, 1819; =Taenia leptocephala Creplin, 1825; ^Hymenolepis flavopunctata Weinland, 1858; =Taenia varesina Parona, 1884; =Taenia minima Grassi, 1886). Синонимы по работам: Faust, 1949; Grassi, 1888. По (Burt, 1980), у H diminuta 28 синонимов. Видовое название от латинского diminut-, в свою очередь, от deminut- - мелкий, маленький или же расплющенный. В англоязычной научной и научносправочной литературе паразит получил название «rat tapeworm», в русскоязычной его обычно именуют цепнем крысиным (рис. 99-101).
Небольшая справка (по: Mayhew, 1925). Обосновывая род Hymenolepis, Д. Уэйнланд описал по изученному им материалу ылл, flavopunctata. В 1888 г. Б. Грасси (Grassi, 1888) отметил, что «.Taenia diminuta Rud., Taenia leptocephala Creplin и H. flavopunctata Weinland» синонимичны. Ив 1891 г. P. Бланшар (Blanchard, 1891), основываясь на упомянутой работе Б. Грасси, детально описал Hymenolepis diminuta, включив при этом в род Hymenolepis 14 видов, каждому их которых дал краткий диагноз.
Сам же паразит, впоследствии ставший Hymenolepis diminuta, впервые был обнаружен у крыс в Рио-де-Жанейро ещб в 1766 г. Ulfers’oM (Belding, 1965), а в 1819 г. его адекват-192
ное описание под названием Taenia diminuta выполнил К. Рудольфи (Rudolphi, 1819) на материале от крыс и мышей.
Длина стробилы от 10 до 60 см, но чаще 30 - 45 см, ширина у шейки 0.5, у дистального конца 3.5-4 мм. Количество члеников до 1000 и более. С. Гарднер (Gardner, 1985) насчитал в стробилах червей из орегонского гофера, Thomomys bul-bivorus, от 1025 до 1188 члеников. Яйца желтоватые, скорее, сферические, чем округлые, с двумя оболочками: наружной - прозрачной эластичной, толщиной 7 pm и внутренней - более тонкой, неправильно исчерченной (морщинистой); маленький эмбрион заключён в третью оболочку толщиной 1 pm (Weinland, 1858). Пространством между мембранами гладкое или тонкозернистое. Полярные филаменты в пространстве между онкосферой и наружной мембраной отсутствуют. Размеры яиц: 59 - 77 х 49 - 69 (Семёнова, 1968), 56 - 60 х 63 - 66 (Genov, 1984), 67 - 83 х 61 - 77 (Gardner, 1985), 70 - 85 х 60 - 80 (www.microbeworld.org), 62 - 87 (Mowlavi et al., 2008), 70 - 80 (Alvarez-Femander et al., 2012), 70 (Patamia et al., 2010; Tena et al., 1998), от 65 x 69 до 70 x 67 pm (Kolodziej et al., 2014). Онкосфера c 6 крючками, 36 - 42 x 31 - 36 (Gardner, 1985), 23 - 25 x 28 - 31 pm (Genov, 1984).
Рис. 99 Hymenolepis diminuta: 1 - сколекс; 2 -половозрелые мужские членики с развитым семяприемником и недоразвитыми женскими гонадами; 3 -такой же членик с треугольным расположением семенников; 4 - 5 - маточные членики разной степени зрелости (4 - молодой, 5 -зрелый); 6 - яйцо (из: Спасский, 1963 - по разным авторам)
Рис. 100 Hymenolepis diminuta, яйцо (из: А - Ftlllebom, 1922; Б-Тепа etal., 1998)
193
Подсчитано, что за сутки одна взрослая особь продуцирует 250 тыс. яиц, следовательно, за год её продуктивность достигает ста миллионов яиц. Если бы все заключённые в этих яйцах онкосферы могли развиться до взрослого червя, то масса их тканей составила бы 20 т (eol.org Rat Tapeworm - ... - Details - Encyclopedia of Life). К счастью, природа не предоставила паразитам таких шансов.
Яйца цепня крысиного, попавшие с экскрементами хозяина во внешнюю среду, заглатываются личинками или имаго различных насекомых, прежде всего, хрущаками мучнистыми из родов Tribolium и Tenebrio, некоторыми видами тараканов, блохами кошачьей, мышиной и крысиной, уховёртками, огнёвкой мельничной и другими, - всего около 20 видов (Семёнова, 1968; Karuna, Khadanga, 2013; Kolodziej et al., 2014; Lethbridge, 1971; Marshall, 1967; Rau, 1979 и др.). В кишечнике насекомого онкосферы мигрируют в его гемоцель (полость тела), где формируется цистицеркоид, способный инвазировать дефинитивного хозяина (рис. 102). В условиях эксперимента инвагинация сколекса наблюдалась на 13-й день, а через 29 дней цисти-церкоиды достигали инвазионного состояния (Hurd, Bums, 1994).
Рис. 101 Hymenolepis diminuta, 14-дневный цистицеркоид (из: Спасский, 1963 - по: Rothman, 1957)
Заражение окончательных хозяев - грызунов происходит при поедании ими насекомых, содержащих инвазионных цистицеркоидов (рис. 102).
Рис. 102 Схема жизненного цикла Hymenolepis diminuta'. 1 - яйца попадают во внешнюю среду с фекалиями хозяина; 2 - зрелые яйца заглатываются промежуточным хозяином; 3 - онкосфера покидает яйцо и проникает через стенку кишечника в полость тела хозяина; 4 - насекомое с цистицер-коидом заглатывается дефинитивным хозяином или, случайно, человеком; 5 - личинка прикреп-
ляется к стенке тонкого кишечника при помощи присосок сколекса; 6 - развитие взрослых червей в кишечнике; 7 - зрелые проглоттиды отрываются от стробилы, разрушаются и находящиеся в них яйца попадают в фекальные массы, i - инвазионная стадия, d - диагностическая стадия (из: www/cdc/gov CDC - DPDx - Hymenolepisis)
194
В организме дефинитивного хозяина процесс развития паразита до момента откладки им яиц завершается за 20 дней. В условиях эксперимента первые яйца в экскрементах крыс появились примерно через месяц (Makki et al., 2011).
В результате тринадцати последовательных операций по пересадке взрослых особей Н. diminuta от одного хозяина к другому удалось установить, что потенциальная продолжительность жизни этого вида может достигать 14 лет (Read, 1967), далеко превосходя жизненный потенциал его обычных хозяев - крыс, средняя продолжительность жизни которых составляет 2-2.4 года. Кстати, цитируемый автор провёл самозаражение и избавлялся от паразита в первый раз через 5 недель, а во второй - через 7 недель после заражения.
Круг окончательных хозяев Н. diminuta насчитывает 100 видов, в основном грызунов (Burt, 1980), а их заражённость довольно высока. К примеру, на северо-западе Ирана в Germi (Иранский Азербайджан) паразита выявили у 38.8 % особей песчанки персидской, Meriones persicus (Kia et al., 2010), а на Лейте, одном из островов Филиппинского архипелага, - у 18.75 % крысы рисовой (Fedorko, 1999). Примечательно, что у крыс эту цестоду находят не только в природных условиях, но и у зверьков, содержащихся в лабораториях. Так, при обследовании 50 особей крысы белой, полученных из Ветеринарного исследовательского института в Изат-нагаре (Индия), и 28 экз. крысы серой, отловленных при помощи ловушек на экспериментальном полигоне того же института, цепень был выявлен соответственно у 24 и 10.71 % из них (Goswami et al., 2011). Ещё в одной работе приводится информация о заражённости этим гельминтом 39.6 % лабораторных крыс и 27 % диких особей, при интенсивности инвазии 1 - 3 экз., максимально 5-7 (Somvanshi, 1997). Удивляться обнаружению цепня крысиного у лабораторных животных не приходится, поскольку такое заражение вполне возможно через сухой корм, в котором могут находиться инвазированные насекомые или их личинки.
Литература по Hymenolepis diminuta обширна и насчитывает многие сотни источников. В 1980 г. была опубликована солидная монография объёмом в 733 страницы, посвящённая самым разнообразным аспектам - таксономическим, биологическим, физиологическим, биохимическим этого гельминта. Авторы монографии обсуждают историю открытия и систематику данного вида, морфологию, гистологию, тонкое строение и физиологию взрослых червей, строение и ультраструктуру личинок и метацестод, развитие цестод в организме дефинитивного хозяина и их адаптацию к обитанию в тонком кишечнике животного и многие другие вопросы (Burt, 1980; Lumsden, Specian, 1980; Mettrick, 1980; Roberts, 1980; Ubelaker, 1980 и др.). Впечатляет и список цитируемых источников: так, глава, содержащая информацию об истории открытия и систематике вида, сопровождается ссылками на 348 публикаций (Burt, 1980). Подобное внимание к Н. diminuta обусловлено не только его встречаемостью у человека, но и тем, что данный паразит, успешно культивируемый в лабораторных условиях, представляет собой удобный модельный объект для проведения молекулярно-генетических исследований цестод как таковых, а также для изучения самых различных аспектов паразито-хозяинных отношений ленточных червей с их хозяевами (Rozario, Newmark, 2015).
Столь же обширна и литература, посвящённая паразитированию Н. diminuta у человека. Фактически каждый официально зарегистрированный случай освещается в литературе. Во многом это связано с тем, что чаще всего им заражены дети (Alvarez-Femander et al., 2012; Clark, 1930; Cohen, 1989; Hamrick et al., 1990; Kalai-
195
vani et al., 2014; Kilin^el et al., 2015; Kolodziej et al., 2014; Kwo, Jo, 1965; Marangi et al., 2003; McMillan et al., 1971; Mowlavi et al., 2003; Patamia et al., 2010; Rohela et al., 2012; Sane et al., 1984; Verhese et al., 1998; Watwe, Dardi, 2008; Weinland, 1858; Zang et al., 2006 и многие-многие другие).
Напомню, что Н. diminuta впервые обнаружили в 1842 г. у 19-месячного ребёнка в США (Weinland, 1858), а к 1924 г. в мире был известен 61 подобный случай, в том числе 16 - в США (Butka, 1924). Цитируемый автор перечислил страны, в которых к 1924 г. встретилось заражение человека этим паразитом (в порядке убывания числа случаев): Бразилия, США, Индия, Италия, Никарагуа, Аргентина, Бельгия, Куба, восток Африки, Гренада, Япония, Мартиника, Филиппины.
К началу 21-го столетия, по данным ряда авторов (Goswami et al., 2011; Wiwanitkit, 2004), в мире официально насчитывалось 500 случаев обнаружения цепня крысиного у человека. Иными словами, с 1924 г. ежегодно фиксировалось в среднем 5.5 подобных случаев. К слову, иногда в одной публикации сообщается сразу о нескольких инвазированных персонах. Например, в Индонезии на юге о-ва Сулавеси из 659 обследованных местных жителей Н. diminuta обнаружился у троих (0.4 %) (Cross et al., 1972). На о-ве Бали подобную инвазию выявили также у троих человек, которые, кстати, проходили лечение от тэниазиса (Widarso et al., 1983).
В целом география находок Н. diminuta у человека охватывает страны Азии, прежде всего, Юго-Восточной и Южной, а также Африки, Америки и Европы. К названным выше регионам (Butka, 1924) добавились Индонезия, Малайзия, Новая Гвинея, Таиланд, Корея, Сингапур, Китай, Иран, Шри-Ланка, Турция, Эфиопия, Испания, Польша, Франция, Россия, Ямайка, Эквадор, Мексика, Перу, Чили.
В Индонезии, например, помимо перечисленных выше случаев, известно о заражённости 3-летнего ребёнка (Kwo, Jo, 1965) и об обнаружении яиц Н. diminuta в одной из 270 проб, полученных от жителей трёх деревень на о-ве Бали в 1974 г. (Stafford et al„ 1980).
В гористых районах Новой Гвинеи среди местного населения, обследованного на наличие кишечных паразитов, цепень крысиный встретился у 0.7 % из них, причём наиболее инвазированными оказались представители возрастной группы 6 - 15 лет- 1.9 % (McMillan et al., 1971).
В Малайзии о заражении человека Н. diminuta впервые сообщили в 1978 г.: цестоду выявили у одного из рабочих завода по производству пальмового масла (Sinniah, 1978). В последующем в этой стране было описано ещё три случая инвазии людей (Ahmad et al., 2016; Kan et al., 1981; Rohela et al. 2012).
В Корее зафиксированы единичные находки цестоды у людей (Min, 1990).
В Таиланде первое сообщение о регистрации Н. diminuta у людей датируется 1935-м годом (Pisash, 1935), а к 2003-му году здесь зафиксировали 10 подобных случаев (Wiwanitkit, 2004). Практически все они выявлялись случайно при стандартном обследовании пациентов. Хотя ни в одном из описанных случаев источник инвазии не был установлен, автор цитируемой публикации считает, что заражение людей происходит через насекомых, традиционно употребляемых в пищу в стране.
50 лет назад цестоду нашли у китайского ребёнка в Сингапуре (Paul, Zaman, 1969), а в 2006 г. появилась первая информация об обнаружении Н. diminuta у малыша в Китае (Zang et al., 2006).
Недавно стало известно о заражении крысиным цепнем ребёнка в Шри-Ланке (Sinhabahu et al., 2014).
196
В Индии Н. diminuta регистрируют у детей и взрослых с 1927-го года. В первом сообщении приводились результаты обследования почти 10000 проб стула местных жителей на наличие гельминтозной инвазии: в 23 из них обнаружились яйца Н diminuta (Chandler, 1927). Одновременно тот же автор отметил несколько случаев выявления цестоды у пациентов в больницах Калькутты. В 2000-е годы инвазию цепнем крысиным отметили у 10 - 12-летних детей из сельской местности (Gupta et al., 2016; Kalaivani et al., 2014; Mane, Sangwan, 2016; Tiwari et al., 2014; Watwe, Dardi, 2008), а также у 18-летнего фермера (Калта, Khadanga, 2013).
В Иране первый случай заражения человека Н. diminuta описан только в 1968 г.: паразита обнаружили у 10-летнего ребёнка на северо-востоке страны (Мо-takef, 1968). Затем цестоду зарегистрировали у 4 детей и одного мужчины, проживающих в сельской местности вдоль Персидского залива (Ghadirian, Arfaa 1972). В последней по времени публикации работе (Mowlavi et al., 2008) изложена история выявления инвазии у 16-месячной девочки, чья семья переехала в Тегеран буквально за несколько дней до обращения к врачам, поводом для которого стали длительная диарея, рвота и вышедшие из ануса ребёнка фрагменты червя.
В Турции о возможности паразитирования Н. diminuta у человека узнали совсем недавно (Kilin?el et al., 2015). Пациентом оказался 21-месячный мальчик, который, как выяснилось, жил в доме над сараем и, к тому же, видимо, имел привычку глотать насекомых (there was a history of insect swallowing).
На африканском континенте инвазию человека Н diminuta описывают очень редко. Мне известны всего 4 публикации, затрагивающие данную проблему, - в Сан-Томе и Принсипи (Pampiglione et al., 1987), Эфиопии (Lo et al., 1989; Ta-desse, 2005) и Марокко (El Fatni et al., 2014). Однако, судя по географии зарегистрированных случаев, с большой долей вероятности можно предсказать, что паразит встречается у населения и в других африканских странах.
Среди европейских стран, прежде всего, следует упомянуть Испанию, где первый, подтверждённый факт заражения человека крысиным цепнем был описан ещё в 1914 г. (Buen, 1914), а самое последнее сообщение опубликовано в 1998 г., согласно которому в стране известно 7 случаев инвазии людей (Тепа et al., 1998).
Что касается Италии, то последняя по времени публикация на эту тему увидела свет в 2010 г. (Patamia et al., 2010). Авторы цитируемой статьи описали случай заражения 2-летнего ребёнка на востоке Сицилии. В данной истории примечательно то, что первоначально малышу в частной лаборатории поставили ошибочный диагноз: выявленные яйца цестоды приняли за таковые Dipylidium caninum, и по этой причине предпринятое лечение мебендазолом не дало желаемого результата.
Ещё одна европейская страна, в которой в последние годы отмечают инвазию детей Н. diminuta, - Польша. В статье 2014-го года, в которой изложена история болезни 3-летнего мальчика (Kolodziej et al., 2014), её авторы, ссылаясь на соответствующие источники, перечисляют подобные случаи, зарегистрированные в Польше в 1994, 1997, 2001, 2002 и 2009 гг.
Последняя информация об обнаружении цепня крысиного у человека в России датируется 2002 г. (Баранова, Лесина, 2008).
В западном полушарии чаще всего эту цестоду находили у людей в США. Выше упоминалось, что к 1924 г. в стране было известно 16 случаев (Butka, 1924), а с 1965 по 1998 гг. таковых выявили 48 (Тепа et al., 1998). Как правило, среди пациентов доминировали дети самого разного возраста.
197
В Центральной и Южной Америке случаи инвазии людей Н. diminuta имели место на Ямайке (Cohen, 1989), в Перу (Ayulo-Robles, 1963; Naquira et al., 1973), Чили (Mercado, Arias 1995), Мексике (Alvarez-Femander et al., 2012). В Мексике, к примеру, заражение обнаружили у 38-летней матери и её 12-летнего сына, у которых в течение года наблюдались неприятные симптомы анорексии, диареи, кишечных болей, а у мальчика ещё и запоры, перемежающиеся с поносом. При копроово-скопии у обоих пациентов были выявлены яйца цепней крысиного и карликового.
Итак, совершенно очевидно, что восприимчивость людей к заражению цепнем крысиным носит повсеместный характер, а подавляющее большинство выявленных случаев приходится на долю детей. Минимальный возраст ребёнка, у которого отмечено заражение (из числа тех, что встретились мне в публикациях), - 9 месяцев; при лечении этого малыша выделилось 12 червей (Riley, Shannon, 1922).
Поселяющийся в тонком кишечнике человека паразит повреждает слизистую оболочку и провоцирует нарушение моторных функций желудочно-кишечного тракта, тем самым ухудшая процесс пищеварения и всасывания пищевых веществ. К тому же, продукты жизнедеятельности гельминта вызывают у больного токсико-аллергические реакции, обычно проявляющиеся при сенсибилизации организма.
Заражение цепнем крысиным часто асимптоматично или же симптомы выражены очень слабо, а в случае их проявления они практически не отличаются от таковых при паразитировании других гименолепидид. Суммируя всю информацию с описаниями тех или иных признаков инвазии данным гельминтом, можно составить общую картину проявления симптомов, характеризующих заражение.
Итак, при инвазии Н. diminuta у больного могут быть выражены: абдоминальные боли приступообразного характера, чаще всего тупые или тянущие, тошнота, повышенное слюнотечение, рвота, снижение и даже отсутствие аппетита, диарея, запоры, недержание мочи, общая слабость, повышенная утомляемость, головные боли и головокружение, неспокойный сон и даже бессонница, повышенная раздражительность, анальный зуд, крапивница, эозинофилия. Среди перечисленных симптомов чаще всего встречаются абдоминальные боли, диарея, анорексия.
В качестве лечебного препарата первого ряда назначают празиквантел (Alvarez-Femander et al., 2012; Dwinell et al., 1995; Kalaivani et al., 2014; Marangi et al., 2003; Rohela et al. 2012; Tena et al., 1998; Vokfal et al., 2012 и др.), дозы и курс приёма которого регламентируются медицинскими работниками. Хорошую эффективность показывает также никлозамид (Cohen, 1989; Hamrick et al., 1990; Jones, 1979; Kwo, Jo, 1965; Tanowitz et al., 1993; Tena et al., 1998), тогда как альбендазол, как выяснилось, не даёт желаемого результата (Kotodziej et al., 2014).
При своевременно оказанном лечении прогноз благоприятный.
Как же происходит заражение человека цепнем крысиным? Учитывая особенности жизненного цикла цестоды, человек может заразиться, лишь проглотив промежуточного хозяина, содержащего инвазионных цистицеркоидов паразита. Подобное, естественно, может произойти только случайно вместе с непропечёнными мучными изделиями, а также при опробовании муки или же сырых мучных изделий. Известно, что промежуточные хозяева этого паразита - хрущаки мучные, зерновые, личинки огнёвки мучнистой и других мелких насекомых являются обычными вредителями зерна, муки и приготовленных на их основе сухих продуктов
198
питания. И ни для кого не секрет, что в складских помещениях, где они хранятся, грызуны, и, прежде всего, крысы и мыши достаточно многочисленны.
Вместе с тем, тот факт, что Н. diminuta регистрируется преимущественно у детей, причём часто младшего возраста, свидетельствует о возможности их заражения при непосредственном заглатывании насекомых. В этом плане весьма нагляден следующий пример. В Калифорнии 4-летний мальчик из очень чистоплотной благополучной семьи отличался тем, что ел всё подряд - землю, мусор, песок, листья, веточки, мелкие игрушки. Однажды, после того, как он съел маленький мячик из губчатой резины, у него выделился червь, что и послужило поводом для его лечения. В результате очистки кишечника у ребёнка единым клубком вышло 14 цестод, которых определили как Н. diminuta (Clark, 1930).
Анализируя информацию о случаях регистрации у человека цепня крысиного, невольно обращаешь внимание на тот факт, что их подавляющее большинство приурочено к регионам с низким социальным статусом населения, плохими санитарно-гигиеническими условиями. Отсюда напрашивается вывод: чем больше в зоне обитания человека крыс и насекомых - источников инвазии, чем ниже культура быта, тем больше шансов у человека заразиться крысиным цепнем. Так, сообщая об инвазии девочки из небольшой индийской деревни в Девгаре, авторы публикации подчёркивают, что там, где жила её семья, в изобилии водились грызуны и тараканы (Watwe, Dardi, 2008). Похожую картину наблюдали и многие другие исследователи, в том числе, к примеру, и П. Мэйн с коллегой (Mane, Sangwan, 2016), описавшие заражение цепнем крысиным 10-летнего мальчика из сельской местности на севере Индии: по словам ребёнка, в их доме жили крысы.
Следует учитывать также, что, помимо грызунов, распространению инвазии могут способствовать многие домашние насекомые, например, мухи.
Более 100 лет назад У. Николл (Nicoll, 1911) в экспериментальных условиях доказал возможность распространения яиц цепня крысиного домашними мухами. В эксперименте мух кормили экскрементами грызунов, содержащими яйца цестоды, однако ни в кишечнике, ни в экскрементах мух яйца не были найдены, поскольку слишком крупны для этих насекомых, чтобы они могли их съесть. Зато яйца цепня были обнаружены на поверхности тела и лапках мух, а через 24 ч - в сахарном сиропе, ёмкость с которым была поставлена на другом конце клетки.
И, наконец, подобную же роль распространителя яиц паразита играют сами инвазированные насекомые, точнее, их фекалии, что наглядно продемонстрировали эксперименты с хрущаком большим мучным (Pappas, Barley, 1999). После того, как жукам скормили яйца цепня, полученные от заражённых грызунов, многие из яиц через 48 ч оказались в их фекалиях. В ходе эксперимента новые особи жуков заразились как собранными с фекалиями хрущаков яйцами, так и при их подсадке к ранее инвазированным жукам. Иными словами, фекалии насекомых, содержащие яйца цестоды, являются не только источником инвазии других особей насекомых, но и способствуют распространению паразита во времени и пространстве.
Таким образом, чтобы уберечь себя от возможного заражения цепнем крысиным, прежде всего, следует озаботиться чистотой помещения, уничтожением вредных грызунов и не менее вредных насекомых.
Резюмируя изложенную выше информацию по цестодам рода Hymenolepis, в том числе Н. diminuta, подчеркну, что интенсивные исследования гименолепидид, развернувшиеся в последние годы, могут внести серьёзные коррективы в таксономи-199
ческий статус многих видов, что, в свою очередь, неизбежно повлечёт за собой изменение наших представлений об их биологии, экологии и географическом распространении. В частности, известный цестодолог Ф. Тенора (Тепога, 2007) предполагает, что Н. diminuta, обычно регистрируемый у человека по всему земному шару, в действительности является паразитом грызунов, у человека же он выявлен всего дважды и только на основании обнаружения яиц паразита (Burt, 1980). По его мнению, паразитом человека является Hymenolepis flavopunctata Weinland, 1858, впервые описанный на материале от ребёнка, но долгие годы практически всеми исследователями рассматриваемый в качестве синонима Hymenolepis diminuta.
Ещё одна информация подтверждает возможность паразитирования у человека других представителей рода, отличных от Hymenolepis diminuta (Nkouawa et al., 2016). У 52-летней женщины из Тибета была обнаружена цестода, молекулярногенетический анализ которой показал, что она значительно отличается от Hymenolepis diminuta, хотя по строению яиц и похожа на сравниваемый вид. Зарегистрированный у жительницы Тибета Hymenolepis sp., по мнению авторов, является сестринским видом Hymenolepis hibernia Montgomery, Montgomery et Dunn, 1987, паразита евроазиатских мышей родаДро<7етииу.
И, наконец, не исключено, что в род Hymenolepis может быть переведён Pseudanoplocephala crawfordi Baylis, 1927, найденный у человека в Китае (Xue, 1980). По результатам филогенетического анализа данный вид группируется в кластер Hymenolepis и, как полагают авторы исследования, должен быть одним из членов этого рода (Jia et al., 2016).
Однако поскольку пока никто «не ликвидировал» род Pseudanoplocephala Baylis, 1927, описание Р. crawfordi не включено мною в род Hymenolepis.
Цитируемая литература
(в разделе процитирована лишь небольшая часть опубликованных источников по Н. diminuta)
Баранова И. П., Лесина О. Н Гельминтозы и другие паразитарные заболевания: учебное пособие для врачей. - Пенза, 2008. - 80 с.
Макарикова Т. А., Гуляев В. Д., Тиунов М. П., FengJ. Paramilina nishidai (Sawada, 1982) gen. n., comb. n. и Hymenolepis magna sp. n. (Cyclophyllidea, Hymenolepididae) // Зоол, журн. - 2010. - 89, 2. - С. 131 - 139.
Семёнова Н. Е. Глава XIX. Гименолепидозы И Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: «Медицина», 1968. - С. 484 - 492.
Спасский А. А. Гименолепидиды - ленточные гельминты диких и домашних птиц И Основы цестодо-логии. Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1963. - 2, часть 1. - 417 с.
Ahmad A. F., Ngui R., Ong J., Sarip F. et al. Case report: A symptomatic case of Hymenolepis diminuta infection in an urban-dwelling adult in Malaysia H Am. J. Trop. Med. Hyg. - 2016.
Alvarez-Ferndnder В. E., Rodrlguez-Bataz E., Diaz-Chiguer D. L., Mdrquiz-Navarro A. et al. Mixed Hymenolepis species infection in two family members: a case report from an urban area of Chilpancingo, Guerrero, Mexico H Trop. Gastroenterol. - 2012. - 33, 1. - P. 83 - 84.
Ayulo-Robles И M. La infeccion humana con Hymenolepis diminuta on el Peru I Proc. 7th Intern. Congr. Trop. Med. Malaria (Rio de Janeiro, Sept. 1963). - 1963. - 2. - P. 192.
Belding D. L. Textbook of clinical Parasitology. 3rd ed. - New York, N. Y., DAppleton-Century Co., 1965. -P. 387-440.
Blanchard R Histoire zoologique et m£dicale des teniad£s du genre Hymenolepis Weinland. - Paris, 1891. -112 pp.
Buen S. Sobre una tenia nueva en Espafla П Bol. EspafL Biol. - 1914. - 1. - P. 83.
Burt M. D. B. Life history and systematics of Hymenolepis diminuta I Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. -N. Y.: Acad. Press Inc., 1980. - P. 1 - 57.
Butka H. E. Infestation with Hymenolepis diminuta (rat tapeworm) H J. Amer. Med. Ass. - 1924. - 82, 11.-P. 875 - 876.
200
Chandler A. C The distribution of H. diminuta infections in India and discussion of its epidemiological significance // Indian J. Med. Res. - 1927. -14. - P. 973 - 994.
Clark E. B. Human infestation with the rat tapeworm (Hymenolepis diminuta) // J. Amer. Med. Ass. - 1930. -95, 18.-P. 1342.
Cohen L P. A case report of Hymenolepis diminuta infection in a child in St James Parish, Jamaica // J. Louisiana State Med. Soc. - 1989. - 141, 3. - P. 23 - 24.
Cross J, H, Clarke M. A., Irving G. S, Duncan G. F. et al. Intestinal parasites and malaria in Margolembo, Luwu Regency, South Sulawesi, Indonesia // Southeast Asian J. Trop. Med. Publ. Health. - 1972. - 3. - P. 587-593.
Czaplinski B., Voucher C. Family Hymenolepididae Ariola, 1899 // Keys to the cestode parasites of vertebrates / eds. L. F. Khalil, A. Jones, R. A. Bray. - Wallingford, U.K.: CAB Intern., 1994. - P. 595 - 663.
Dwinell M. B., Bass P., Oaks J. A. Praziquantel treatment normalizes intestinal myoelectric alterations associated with Hymenolepis diminuta-\nfecte& rats // J. Parasitol. - 1995. - 81, 6. - P. 979 - 984.
El Fatni C, El Fatni EL, Romero D., Olmo F, Rosales M. J. Intestinal parasitism in Moroccan children: comparative quantative study of the Faust’s and Ritchie’ coprologic methods // Intern. J. Innovation & Sci. Res. - 2014. - 11, 1. - P. 53 - 64. Accessed through: www.ijisr.issr-joumals.org/.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 291 - 298.
Fedorko J. M. Schistosoma japonicum in the black rat, Rattus mindanensis, from Leyte, Philippines, in relation to Oncomelania snail colonies with reference to other endoparasites // Southeast Asian J. Trop. Med. Publ. Health. - 1999. - 30. - P. 343 - 349.
FUlleborn F. Ueber Hymenolepis diminuta (Rud.) 1819 // Arch. Schiffs- u. Tropen. Hyg. - 1922. - 26. - P. 193-202.
Gardner S. L. Helminth parasites of Thomomys bulbivorus (Richardson) (Rodentia: Geomyidae), with a description of a new species of Hymenolepis (Cestoda) // Can. J. Zool. - 1985. - 63, 5. - P. 1463 - 1469.
Gardner S. L., Schmidt G. D. Cestodes of the genus Hymenolepis Weinland, 1858 sensu stricto from pocket gophers Geomys and Thomomys spp. (Rodentia: Geomyidae) in Colorado and Oregon, with a discriminant analysis of four species of Hymenolepis // Can. J. Zool. - 1988. - 66, 4. - P. 896 - 903.
Genov T, [Helminths of insectivores and rodents in Bulgaria]. - Izdatelstvo na Bulgarskata Akademiya na Naukite, Sofia, 1984. - 348 pp. (In Bulgarian).
Ghadirian E, Arfaa F. Human infection with Hymenolepis diminuta in villages of Minab, southern Iran 11 Int. J. Parasitol. - 1972. - 2, 4. - P. 481 - 482.
Goswami R., Singh S. M., Kataria M., Somvanshi R. Clinicopathological studies on spontaneous Hymenolepis diminuta infection in wild and laboratory rats // Braz. J. Vet. Pathol. - 2011. - 4, 2. - P. 103-111.
Grassi B. Taenia flavopunctata Weinl., Taenia leptocephala Creplin, Taenia diminuta Rud. //Atti R. Accad. Sci. Torino. - 1888. - 23. - P. 492 - 501.
Gupta P., Gupta P., Bhakri В. K., Kaistha N., Omar B. J. Hymenolepis diminuta infection in a school going child: First case report from Uttarakhand // J. Clin. Diagn. Res. - 2016. - 10, 9: doi: 10.7860/JCDR/2016/ 21718.8522.
Hamrick H J., Bowdre J. H, Church S. M. Rat tapeworm (Hymenolepis diminuta) infection in a child II Pediatr. Infect. Dis. J. - 1990.-9, 3. - P. 216 - 219.
Hurd H, Burns L Observations on the axenic culture of metacestodes of Hymenolepis diminuta 11 Canad. J. Zool. - 1994. - 72, 4. - P. 618 - 623. doi. 10.1139/z94-084.
Jia Y. Q., Yan W. C, Du S. Z., Song J. K., Zhao W. et al. Pseudanoplocephala crawfordi is a member of genus Hymenolepis based on phylogenetic analysis using ribosomal and mitochondrial DNA sequences 11 Mitochondrial DNA. A DNA Mapp. Seq. Anal. -2016. - 27, 3. - P. 1688 - 1692. doi: 10.3109/19401736. 2014.958729.
Jones IV E. Niclosamide as a treatment for Hymenolepis diminuta and Dipylidium caninum infection in man H Am. J. Trop. Med. Hyg. - 1979. - 28, 2. - P. 300 - 302.
Kalaivani R., Nandhini L., Seetha K. S. Hymenolepis diminuta infection in a school-going child: A rare case report // Australas. Med. J. - 2014. - 30, 7(9). - P. 379 - 381. doi: 10.4066/AMJ.2014.2136.
Kan S. K, Kok R.. T, Marto S., Thomas I., Teo IV. W. The first report in Hymenolepis diminuta infection in Sabah, Malaysia H Trans. R. Soc. Trop. Med. Hyg. - 1981. - 75, 4. - P. 609.
Karuna T, Khadanga S. A case of in a young male from Odisha // Trop. Parasitol. - 2013. - 3, 2. - P. 145 -147. Accessed through: www.tropicalparasitology.org/text.asp72013/3/2/145/122145.
Kia E. B, Shahryary-Rad E., Mohebali M., Mahmoudi M. et al. Endoparasites of rodents and their zoonotic importance in Germi, Dashte-Mogan, Ardabil Province, Iran 11 Iran. J. Parasitol. - 2010. - 5,4.- P. 15 - 20.
Kilingel O., Oztiirk С. E., Gun E„ Oksuz $. et al. [A rare case of Hymenolepis diminuta infection in a small child] // Mikrobiyol. Bui. - 2015. - 49, 1. - P. 135 - 138. (Article in Turkish; English summary).
201
Koiodziej P., Rzymowska J., St?pien-Rukasz H, Lorencowiez R. et al. Analysis of a child infection with Hymenolepis diminuta in Poland П Ann. Agricult. Environment. Med. - 2014. - 21, 3. - P. 510 - 511. Accessed through: www.aaem.pl.
Kwo E. H, Jo К. T. A case report of Hymenolepis diminuta in Medan // Pediatr. Indonesia. - 1965. - 5. - P. 24-27.
Lethbridge R. C. The hatching of Hymenolepis diminuta eggs and penetration of the hexacanth in Tenebrio molitor beetles П Parasitology. - 1971. - 62, 3. - P. 445 - 456.
Levi M H., Raucher B. G., Teicher E., Sheehan D. J, McKitrick J. C. Hymenolepis diminuta'. one of three pathogens isolated from a child И Diagn. Microbiol. Infect. Dis. - 1987. - 7. - P. 255 - 259.
Lo С. T, Ayele Y., Birrie H. Helminth and snail survey in Harerge region of Ethiopia with special reference to Schistosomiasis // Ethiop. Med. J. - 1989. - 27. - P. 73 - 83.
Lumsden R D„ Specian R. The morphology, histology, and fine structure of the adult stage of the cyclophyl-lidean tapeworm Hymenolepis diminuta / Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. - N. Y.: Acad. Press Inc., 1980. - P. 157 -280.
Makarikov A. A., Tkach V. V. Two new species of Hymenolepis (Cestoda: Hymenolepididae) from Spalacidae and Muridae (Rodentia) from eastern Palearctic 11 Acta Parasitol. - 2013. - 58, 1. - P. 37 - 49
Makki M S, Shahbazi F., Teimoori S., Rokni M. B., Abaci M. R. et al. Establishment of Hymenolepis diminuta life cycle to provide parasite mass production // Iran. J. Parasitol. - 2011. - 6, 2. - P. 60 - 63.
Mane P„ Sangwan J. Hymenolepis diminuta infection in a young boy from rural part of Northern India П J. Family Med. Prim. Care. - 2016. - 5, l.-P. 166- 167. doi: 10.4103/2249-4863.184655.
Marangi M., Zechini B., Fileti A., Quaranta G., Aceti A. Hymenolepis diminuta infection in a child living in the urban area of Rome, Italy // J. Clin. Microbiol.- 2003. - 41, 8. - P. 3994 - 3995. DOI: 10.1128/JCM.41.8.3994-3 995.2003.
Margono S. S. Cestodes in man in Indonesia И Bui. Penelit. Kesehat. - 1989. -17, 2. - P. 60 - 66.
Marshall A. G. The cat flea, Ctenocephalides felis felis (Bouch£, 1835) as an intermediate host for cestodes // Parasitology. - 1967. - 57, 3. - P. 419 - 430.
Mas-Coma S, Tenora F. Proposal of Arostrilepis n. gen. (Cestoda: Hymenolepididae) 11 Research and Review in Parasitology. - 1997. - 57, 1-4. - P. 93 - 101.
Mayhew R. L. Studies on the avian species of the cestode family Hymenolepididae // Illinois Biol. Monogr. -1925. -10.-P. 1-126.
McMillan B., Kelly A., Walker J. C. Prevalence of Hymenolepis diminuta infection in man in the New Guinea highlands // Trop. Geogr. Med. - 1971. - 23. - p. 390 - 392.
Mercado R., Arias B. Infections by Taenia sp. and other intestinal cestodos in patients of consultorios hospitals and the public sector north of Santiago de Chile (1985-1995) И Bol. Chil. Parasitol. - 1995. - 50, l.-P. 80-83.
Mettrick D. F. The intestine as an environment for Hymenolepis diminuta I Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. -N. Y.: Acad. Press Inc., 1980. - P. 281 - 356.
Min D. Y. Cestode infections in Korea 11 Kisaengchunghak Chapchi. - 1990. - 28, Suppl. - P. 123 - 144. doi.org/10.3347/kjp. 1990.28.Suppl. 123.
Motakef M. Report of a case infected with Hymenolepis diminuta in Mashad // J. Mashad School Med. -1968. -10.-P. 472-474.
Mowlavi Gh., Mobedi L, Mamishi S, Rezaeian M. et al. Hymenolepis diminuta (Rudolphi, 1819) infection in a child from Iran // Iranian J. Publ. Health. - 2008. - 37, 2. - P. 120 - 122.
Ndquira C., Delgado E., Tantaledn M., Ndquira F., Elliot A. Prevalencia de enteroparasitos en escolares de los distritos de San Juan у Magdalena // Rev. Peruv. Med. Trop. - 1973. - 2. - P. 37 - 40.
Nicoll W. Further reports (n° 4) on flies as carriers of infection. 3. On the part played by flies in the dispersal of eggs of parasitic worms // Rep. Local Goverm. Bd. Publ. Health & Med. Subjects. (New Ser. № 53). -1911.
Nkouawa A., Haukisalmi V. , Li T, Nakao M.> Lavikainen A. et al. Cryptic diversity in hymenolepidid tapeworms infecting humans 11 Parasitol. Intern. - 2016. - 65, 2. - P. 83 - 86.
Pampiglione S, Visconti S, Pezzino G. Human intestinal parasites in Subsaharan Africa. II. Sao Тотё and PrincipeПParassitologia. - 1987.-29, l.-P. 15-25.
Pappas P. W., Barley A. J. Beetle-to-beetle transmission and dispersal of Hymenolepis diminuta (Cestoda) eggs via the feces of Tenebrio molitor 11 J. Parasitol. - 1999. - 85, 2. - P. 384 - 385.
Patamia L, Capello E., Castellano-Chiodo D., Greco F. et al. A human case of Hymenolepis diminuta in a child from Eastern Sicily // Korean J. Parasitol. - 2010. - 48, 2. - P. 167 - 169. doi. 10.3347/kjp.2010.48.2.
Paul F. M., Zaman V. Hymenolepis diminuta infestation in a Chinese baby 11 J. Syngapore Paediatr. Soc. -1969.-11, l.-P. 67-72.
202
Pisash К. S. Cestodes П J. Med. Assoc. Thai. - 1935. - 18. - P. 293 - 309.
Rau M E. The frequency distribution of Hymenolepis diminuta cysticercoids in natural, sympatric populations of Tenebrio molitor and T. obscurus // Intern. J. Parasitol. - 1979. - 9, 2. - P. 85 - 87.
Read С. P. Longevity of the tapeworm, Hymenolepis diminuta 11 J. Parasitol. - 1967. - 53, 5. - P. 1055 -1056.
Riley W. A., Shannon W. R. The rat tapeworm, Hymenolepis diminuta, in man 11 J. Parasitol. - 1922. - 8. - P. 109-117.
Roberts L. S. Development of Hymenolepis diminuta in its definitive host / Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. - N. Y.: Acad. Press Inc., 1980. - P. 357 - 423.
Rohela M., Ngui R., Li Y. A. L., Kalaichelvan B. et al. A case report of Hymenolepis diminuta infection in a Malaysian child // Trop. Biomed. - 2012. - 29, 2. - P. 224 - 230.
Rozario T., Newmark P. A. A confocal microscopy-based atlas of tissue architecture in the tapeworm Hymenolepis diminuta // Exp. Parasitol. - 2015. - 158. - P. 31 = 41.
Rothman A. H. The larval development Qi Hymenolepis diminuta and H citalli 11 J. Parasitol. - 1957. - 43, 6. -P. 643-648.
Sane S. Y., Irani S., Jain N, Shah K. N. Hymenolepis diminuta a rare zoonotic infection report of a case // Indian J. Pediatr. - 1984. - 51 (413). - P. 743 - 745.
Scaglione L., Troielli F., Ansaldi E., Orsi P. G., Garavelli P. L. Hymenolepis diminuta*. a rare helminthiasis in humans. Description of a clinical case П Minerva Med. - 1990. - 81. - P. 65 - 67.
Sinhabahu V. P., Perera T. M. R., Samarasinghe S. A case of Hymenolepis diminuta (tapeworm) infestation in a child I I Ceylon Med. J. - 2014. - 59, 2. - P. 70 - 71.
Sinniah B. Hymenolepis diminuta infection in a Malaysian oil palm estate worker - first case from Malaysia // Southeast Asian J. Trop. Med. Public Health. - 1978. - 9, 3. - P. 453 - 454.
Somvanshi R. Pathology of Hymenolepis diminuta in laboratory and wild rats П Indian J. Vet. Pathology. -1997.-21, l.-P. 55.
Stafford E. E, Sudomo M., Masri S.t Brown R. J. Human parasitoses in Bali, Indonesia // Southeast Asian J. Trop. Med. Public Health. - 1980. - 11, 3. - P. 319 - 323.
Tadesse G. The prevalence of intestinal helminthic infections and associated risk factors among school children in Babile town, east Ethiopia // Ethiop. J. Health Dev. - 2005. - 19, 2. - P. 140 - 147.
Tanowitz H. B., Weiss L. M., Wittner M. Diagnosis and treatment of intestinal helminthes. I. Common intestinal cestodes 11 Gastroenterologist. - 1993. - l.-P. 265 - 273.
Tena D., Perez Simon M., Gimeno C., Perez Pormata M. T., Illescees S. et al. Human infection with Hymenolepis diminuta*. case report from Spain // J. Clin. Microbiol. - 1998. - 36, 8. - P. 2375 - 2376.
Tenora F. Taxonomic status of several sibling species - parasites in man and in other vertebrates // Acta Univ. Agricult. Silvicult. Mendelianae Brunensis. - 2007. - 55, 5. - P. 235 - 240.
Tiwari S, Karuna T., Rautaraya B. Hymenolepis diminuta infection in a child from a rural area: a rare case report H J. Lab. Physicians. - 2014. - 6, 1. - P. 58 - 59. doi. 10.4103/0974-2727.129096.
Unelaker J. E. Structure and ultrastructure of the larvae and metacestodes of Hymenolepis diminuta I Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. -N. Y.: Acad. Press Inc., 1980. - P. 59 - 156.
Verghese S. L., Sudha P., Padmaja P., Jaswal P. W., Kuruvilla T. Hymenolepis diminuta infestation in a child H J. Commun. Dis. - 1998.-30, 3. -P. 201 - 203.
Vokral J.t Jirasko R., Jedlidkovd V.t Bdrtikova H. et al. The inability of tapeworm Hymenolepis diminuta and fluke Dicrocoelium dendriticum to metabolize praziquantel H Vet. Parasitol. - 2012. - 185. - P. 168 - 174. doi. 10 1016/j.vetpar.2011.09.026.
Watwe S, Dardi С. K. Hymenolepis diminuta in a child from rural area // Indian J. Pathol. Microbiol. - 2008. -51, l.-P. 149- 150.
Weinland D. F. Human cestoides. An essay on the tapeworms of man, giving a full account of their nature, organization, and embryonic development; the pathological symptoms they produce, and the remedies which have proved successful in modem practice. To which is added an appendix, containing a catalogue of all species of helminthes hitherto found in man. - Metcalf & Co., Cambridge, Massachusetts, U.S., 1858. -93 pp.
Widarso H. S, Koesharjono C., Sachlan R. et al. Pengobatan taeniasis dengan Bithionol di Propinsi Bali И Seminar Parasitol. Nacional III. - 1983. (цит. no: Magrono, 1989).
Wiwanitkit V. Overview of Hymenolepis diminuta infection among Thai patients // Med. Gem. Med. - 2004. -6,2:7.
Xue J. D. [First record of human infection of Hsuolepis cheni] I I Shaanxi Xin Yiyue. - 1980. - 9. - P. 29- 33.
Zang P., Yao R. C., Zhou B. J. [Heavy infection of Hymenolepis diminuta in an infant] // Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. - 2006. - 24, 4. - P. 318. (In Chinese).
203
Koiodziej P.t Rzymowska J, Stepien-Rukasz H, Lorencowiez R. et al. Analysis of a child infection with Hymenolepis diminuta in Poland // Ann. Agricult. Environment. Med. - 2014. - 21, 3. - P. 510 - 511. Accessed through: www.aaem.pl.
Kwo E. H, Jo К. T. A case report of Hymenolepis diminuta in Medan П Pediatr. Indonesia. - 1965. - 5. - P. 24-27.
Lethbridge R. C. The hatching of Hymenolepis diminuta eggs and penetration of the hexacanth in Tenebrio molitor beetles П Parasitology. - 1971. - 62, 3. - P. 445 - 456.
Levi M. H, Raucher B. G., Teicher E., Sheehan D. J, McKitrick J. C. Hymenolepis diminuta: one of three pathogens isolated from a child H Diagn. Microbiol. Infect. Dis. - 1987. - 7. - P. 255 - 259.
Lo С T, Ayele Y., Birrie H. Helminth and snail survey in Harerge region of Ethiopia with special reference to Schistosomiasis // Ethiop. Med. J. - 1989. - 27. - P. 73 - 83.
Lumsden R. D., Specian R. The morphology, histology, and fine structure of the adult stage of the cyclophyl-lidean tapeworm Hymenolepis diminuta / Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. - N. Y.: Acad. Press Inc., 1980. - P. 157 -280.
Makarikov A. A., Tkach V. V. Two new species of Hymenolepis (Cestoda: Hymenolepididae) from Spalacidae and Muridae (Rodentia) from eastern Palearctic // Acta Parasitol. -2013.-58, 1. - P. 37 - 49
Makki M. S, Shahbazi F.t Teimoori S, Rokni M. B., Abaci M. R. et al. Establishment of Hymenolepis diminuta life cycle to provide parasite mass production // Iran. J. Parasitol. - 2011. - 6, 2. - P. 60 - 63.
Mane P., Sangwan J. Hymenolepis diminuta infection in a young boy from rural part of Northern India // J. Family Med. Prim. Care. - 2016. - 5, l.-P. 166- 167. doi: 10.4103/2249-4863.184655.
Marangi M., Zechini B., Filed A., Quaranta G., Aceti A. Hymenolepis diminuta infection in a child living in the urban area of Rome, Italy // J. Clin. Microbiol.- 2003. - 41, 8. - P. 3994 - 3995. DOI: 10.1128/JCM.41.8.3994—3995.2003.
Margono S. S. Cestodes in man in Indonesia H Bui. Penelit. Kesehat. - 1989. - 17, 2. - P. 60 - 66.
Marshall A. G. The cat flea, Ctenocephalides felis felis (Bouchd, 1835) as an intermediate host for cestodes // Parasitology. - 1967. - 57, 3. - P. 419 - 430.
Mas-Coma S, Tenora F. Proposal of Arostrilepis n. gen. (Cestoda: Hymenolepididae) 11 Research and Review in Parasitology. - 1997.-57, 1-4. -P. 93 - 101.
Mayhew R. L. Studies on the avian species of the cestode family Hymenolepididae И Illinois Biol. Monogr. -1925. - 10.-P. 1-126.
McMillan B., Kelly A., Walker J. C. Prevalence of Hymenolepis diminuta infection in man in the New Guinea highlands 11 Trop. Geogr. Med. - 1971. - 23. - p. 390 - 392.
Mercado R., Arias B. Infections by Taenia sp. and other intestinal cestodos in patients of consultorios hospitals and the public sector north of Santiago de Chile (1985-1995) // Bol. Chil. Parasitol. - 1995. - 50, l.-P. 80-83.
Mettrick D. F The intestine as an environment for Hymenolepis diminuta I Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. -N. Y.: Acad. Press Inc., 1980. - P. 281 - 356.
Min D. Y. Cestode infections in Korea // Kisaengchunghak Chapchi. - 1990. - 28, Suppl. - P. 123 - 144. doi.org/10.3347/kjp.1990.28.Suppl.123.
Motakef M. Report of a case infected with Hymenolepis diminuta in Mashad П J. Mashad School Med. -1968. -10.-P. 472-474.
Mowlavi Gh., Mobedi L, Mamishi S, Rezaeian M. et al. Hymenolepis diminuta (Rudolphi, 1819) infection in a child from Iran H Iranian J. Publ. Health. - 2008. - 37, 2. - P. 120 - 122.
Ndquira C, Delgado E., Tantaledn M., Ndquira F., Elliot A. Prevalencia de enteroparasitos en escolares de los distritos de San Juan у Magdalena 11 Rev. Peruv. Med. Trop. - 1973. - 2. - P. 37 - 40.
Nicoll W. Further reports (n°4) on flies as carriers of infection. 3. On the part played by flies in the dispersal of eggs of parasitic worms // Rep. Local Goverm. Bd. Publ. Health & Med. Subjects. (New Ser. № 53). -1911.
Nkouawa A., Haukisalmi V., Li T, Nakao M., Lavikainen A. et al. Cryptic diversity’ in hymenolepidid tapeworms infecting humans П Parasitol. Intern. - 2016. - 65, 2. - P. 83 - 86.
Pampiglione S, Visconti S, Pezzino G. Human intestinal parasites in Subsaharan Africa. II. S&o Тотё and Principe // Parassitologia. - 1987. - 29, 1. - P. 15 - 25.
Pappas P. W., Barley A. J. Beetle-to-beetle transmission and dispersal of Hymenolepis diminuta (Cestoda) eggs via the feces of Tenebrio molitor П J. Parasitol. - 1999. - 85, 2. - P. 384 - 385.
Patamia L, Capello E., Castellano-Chiodo D., Greco F. et al. A human case QiHymenolepis diminuta in a child from Eastern Sicily 11 Korean J. Parasitol. - 2010.-48, 2. - P. 167 - 169. doi. 10.33 47/kjp.2010.48.2.
Paul F M., Zaman V. Hymenolepis diminuta infestation in a Chinese baby H J. Syngapore Paediatr. Soc. -1969.-11, l.-P. 67-72.
202
Pisash К. S. Cestodes 11 J. Med. Assoc. Thai. - 1935. - 18. - P. 293 - 309.
Rau M E. The frequency distribution of Hymenolepis diminuta cysticercoids in natural, sympatric populations eiTenebrio molitor and T. obscurus II Intern. J. Parasitol. - 1979. - 9, 2. - P. 85 - 87.
Read С. P. Longevity of the tapeworm, Hymenolepis diminuta 11 J. Parasitol. - 1967. - 53, 5. - P. 1055 -1056.
Riley W. A., Shannon W. R. The rat tapeworm, Hymenolepis diminuta, in man 11 J. Parasitol. - 1922. - 8. - P. 109-117.
Roberts L. S. Development of Hymenolepis diminuta in its definitive host / Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. - N. Y.: Acad. Press Inc., 1980. - P. 357 - 423.
Rohela M., Ngui R., Li Y. A. L., Kalaichelvan B. et al. A case report of Hymenolepis diminuta infection in a Malaysian child П Trop. Biomed. - 2012. - 29, 2. - P. 224 - 230.
Rozario T., Newmark P. A. A confocal microscopy-based atlas of tissue architecture in the tapeworm Hymenolepis diminuta 11 Exp. Parasitol. - 2015. - 158. - P. 31 = 41.
Rothman A. H. The larval development of Hymenolepis diminuta and H citalli 11 J. Parasitol. - 1957. - 43, 6. -P. 643-648.
Sane S. Y., Irani S., Jain N., Shah K. N. Hymenolepis diminuta a rare zoonotic infection report of a case 11 Indian J. Pediatr. - 1984. - 51 (413). - P. 743 - 745.
Scaglione L., Troielli F., Ansaldi E., Orsi P. G., Garavelli P. L. Hymenolepis diminuta'. a rare helminthiasis in humans. Description of a clinical case 11 Minerva Med. - 1990. - 81. - P. 65 - 67.
Sinhabahu V. P., Perera T. M. R., Samarasing he S. A case of Hymenolepis diminuta (tapeworm) infestation in a child И Ceylon Med. J. - 2014. - 59, 2. - P. 70 - 71.
Sinniah B. Hymenolepis diminuta infection in a Malaysian oil palm estate worker - first case from Malaysia // Southeast Asian J. Trop. Med. Public Health. - 1978. - 9, 3. - P. 453 - 454.
Somvanshi R. Pathology of Hymenolepis diminuta in laboratory and wild rats П Indian J. Vet. Pathology. -1997.-21, l.-P. 55.
Stafford E. E, Sudomo M., Masri S.f Brown R. J. Human parasitoses in Bali, Indonesia П Southeast Asian J. Trop. Med. Public Health. - 1980. - 11, 3. - P. 319 - 323.
Tadesse G. The prevalence of intestinal helminthic infections and associated risk factors among school children in Babile town, east Ethiopia // Ethiop. J. Health Dev. - 2005. - 19, 2. - P. 140 - 147.
Tanowitz H B„ Weiss L. M., Wittner M, Diagnosis and treatment of intestinal helminthes. I. Common intestinal cestodes 11 Gastroenterologist. - 1993. - l.-P. 265 - 273.
Tena D., Perez Simon M., Gimeno C., Perez Pormata M. T., Illescees S. et al. Human infection with Hymenolepis diminuta'. case report from Spain // J. Clin. Microbiol. - 1998. - 36, 8. - P. 2375 - 2376.
Tenora F. Taxonomic status of several sibling species - parasites in man and in other vertebrates H Acta Univ. Agricult. Silvicult. Mendelianae Brunensis. - 2007. - 55, 5. - P. 235 - 240.
Tiwari S, Karuna T., Rautaraya B. Hymenolepis diminuta infection in a child from a rural area: a rare case report//J. Lab. Physicians. - 2014. -6, l.-P. 58-59. doi. 10.4103/0974-2727.129096.
Unelaker J. E. Structure and ultrastructure of the larvae and metacestodes of Hymenolepis diminuta I Biology of tapeworm Hymenolepis diminuta. Ed. H. P. Arai. - N. Y.: Acad. Press Inc., 1980. - P. 59 - 156.
Verghese S. L., Sudha P., Padmaja P., Jaswal P. W.t Kuruvilla T. Hymenolepis diminuta infestation in a child H J. Commun. Dis. - 1998. - 30, 3. -P. 201 - 203.
Vokrdl J, Jirasko R., Jedlidkovd V., Bdrtikova H. et al. The inability of tapeworm Hymenolepis diminuta and fluke Dicrocoelium dendriticum to metabolize praziquantel 11 Vet. Parasitol. - 2012. - 185. - P. 168 - 174. doi. 10 1016/j.vetpar.2011.09.026.
Watwe S., Dardi С. K. Hymenolepis diminuta in a child from rural area П Indian J. Pathol. Microbiol. - 2008. -51, l.-P. 149- 150.
Weinland D. F. Human cestoides. An essay on the tapeworms of man, giving a full account of their nature, organization, and embryonic development; the pathological symptoms they produce, and the remedies which have proved successful in modem practice. To which is added an appendix, containing a catalogue of all species of helminthes hitherto found in man. - Metcalf & Co., Cambridge, Massachusetts, U.S., 1858. -93 pp.
Widarso H. S, Koesharjono C., Sachlan R. et al. Pengobatan taeniasis dengan Bithionol di Propinsi Bali I I Seminar Parasitol. Nacional III. - 1983. (цит. no: Magrono, 1989).
Wiwanitkit V. Overview of Hymenolepis diminuta infection among Thai patients П Med. Gem. Med. - 2004. -6,2:7.
Xue J. D. [First record of human infection of Hsuolepis cheni] I I Shaanxi Xin Yiyue. - 1980. - 9. - P. 29- 33.
Zang P., Yao R. C., Zhou B. J. [Heavy infection of Hymenolepis diminuta in an infant] П Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. - 2006. - 24, 4. - P. 318. (In Chinese).
203
Род Drepanidotaenia Railliet, 1892
Описание (по: Спасская, 1966; Спасский, 1963; Komyushin et al., 1996). Сколекс с четырьмя невооружёнными присосками. Хоботок с короной из 8 диорхоидных крючьев, у которых длина рукоятки превосходит длину лезвия, а отросток корня короткий. Псевдосколекс отсутствует. Проглоттиды короткие и очень широкие. Пучки внутреннего слоя продольных мышц многочисленные. Экскреторных сосудов две пары. Половой аппарат одинарный. Половые поры односторонние. Половые протоки проходят дорсально от осморегуляторных каналов. Семенников три, расположены в одну линию в срединном поле членика. Циррус с шипиками. Бурса цирруса без добавочного мешочка (sacculus accessoris). Яичник многодольчатый, возле апоральных экскреторных каналов. Желточник слабо дольчатый, располагается позади и вентрально от яичника. Семяприемник длинный и волнообразный. Вагина проходит впереди двух поральных семенников и позади апорального. Матка первоначально трубчатая, позднее приобретает вид поперечного мешка с многочисленными слепыми карманами. Онкосфера овальная. Взрослые формы - паразиты птиц отряда Anseriformes. Типовой вид - Drepanidotaenia lanceolata (Bloch, 1782) Railliet, 1892.
По состоянию на 1986 г. род объединял 14 видов (Schmidt, 1986), однако в результате критического пересмотра статуса многих из них к настоящему времени в нём осталось всего 2 валидных вида - уже упомянутый D. lanceolata и D. czaplins-kii Komyushin et Tkach, 1995 (Komyushin et al., 1996).
Единственный вид Drepanidotaenia, которого во многих публикациях упоминают как зарегистрированного у человека, это - D. lanceolata. Последние молекулярно-генетические исследования показали очень близкую связь данного вида с родом Hymenolepis (Gao et al., 2015).
Drepanidotaenia lanceolata (Bloch, 1782) Railliet, 1892 [ =Taenia lanceolata Bloch, Y1XI',z Hymenolepis lanceolata (Bloch, 1782) Weinland, \Z5Z-,-Taenia anseris Bloch, -Taenia anserum Rudolphi, 1810] (рис. 103). Синонимы приведены по работе: Faust, 1949. Впервые паразит описан под названием Taenia lanceolata. Видовое название lanceolata происходит от латинского lanceo - маленькое копьё, копьецо, и связано, видимо, с копьевидной формой крючьев хоботка.
Длина цестод от 5 до 23 см при максимальной ширине 5 - 18 мм. Сколекс почти шарообразный, присоски с глубокими полостями, диаметром 0.95 мм. На цилиндрическом хоботке корона из 8 крючьев, чья длина достигает 30-35 при ширине 6, длина рукоятки крючка 18-22, лезвия 12-13 цт. Бурса цирруса длиной 1.5 мм. Желточник розетковидный. Ширина зрелых маточных члеников превышает их длину в 20 раз. Яйца округло-овальные, светло-серого цвета, с 4 оболочками, размер яиц по внешнему контуру 46 - 106 х 37 - 103 щп; на полюсах имеются филаменты в виде длинных парных нитей. Онкосфера размерами 20-32x16-21 цт.
D. lanceolata - паразит водоплавающих и болотных птиц. Развитие гельминта происходит с участием промежуточных хозяев - многочисленных циклопов из родов Cyclops, Diaptomus, Arctodiaptomus и других, в изобилии населяющих пресноводные водоёмы (Faust, 1949; Ratajac et al., 1997). В роли транспортного хозяина могут выступать пресноводные моллюски, прежде всего, лимнэиды. В теле циклопа онкосфера выходит из яйца и развивается в полости его тела в грушеобразный цистицеркоид размерами 0.13 - 0.14 х 0.1 - 0.11 мм, с очень длинным
204
изогнутым хвостовым отростком на заднем полюсе. Попав в организм дефинитивного хозяина, личинка при помощи присосок и крючьев хоботка прикрепляется к слизистой оболочке тонкого кишечника и за 2-3 недели превращается во взрослую особь.
O.OInn
Рис. 103 Drepanidotaenia lanceolata: 1 - сколекс; 2 -крючок хоботка; 3 - мужские и 4 - женские членики;
5 - маточные членики; 6 -яйцо (из: Спасская, 1966 -по разным авторам)
D. lanceolata -широко распространённый паразит гусиных, являющихся для него облигатными хозяевами; «у других систематических групп, как и у человека, этот гельминт встречается только случайно» (Спасская, 1966; стр. 219).
Что касается регистрации D. lanceolata
у человека, то подобная информация встретилась мне в нескольких обзорных работах. Одни авторы (Lamothe-Argumedo, Garcia Prieto, 1985; Muller, 2002) отмечают, что паразит однажды был обнаружен у мальчика (a boy) в Германии, другие (Ashford, Crewe, 2003) пишут, что цестоду нашли у человека в США (ссылки на источники в перечисленных работах отсутствуют). Надо полагать, что основным источником информации для этих и других публикаций, где D. lanceolata упоминается как паразит человека, является монография Э. Фауста (Faust, 1949). Цитируемый автор, в свою очередь, ссылается на сообщение Ф. Чокке (Zschokke, 1902), который описал имевший место в Германии случай спонтанного выхода двух червей у 12-
летнего мальчика.
Более никто этих цестод у человека не находил (во всяком случае, обнаружить какую-либо иную информацию по данному вопросу, кроме упомянутой выше монографии Э. Фауста, не удалось).
Тем не менее, D. lanceolata относят к группе паразитов, чьё попадание к человеку всё же может произойти при случайном заглатывании им инвазированных циклопов с неочищенной питьевой водой (Gillani et al., 2012; Jordan, 1974).
205
Цитируемая литература
Спасская Л. П. Цестоды птиц СССР. Гименолепидиды / Отв. ред. акад. К. И. Скрябин, акад. АН Молд. ССР А. А. Спасский. - М.: Наука, 1966. - С. 219 - 238.
Спасский А. А. Гименолепидиды - ленточные гельминты диких и домашних птиц И Основы цестодо-логии. Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1963. - 2, часть 1. - С. 11-74.
Ashford R W.t Crewe РГ. The parasites of Homo sapines'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - P. 61.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 298.
Gao J.-F., Hou M.-R., Cui Y-С., Wang L.-K., Wang C.-R. The complete mitochondrial genome sequence of Drepanidotaenia lanceolata (Cyclophyllidea: Hymenolepididae) // Mitochondrial DNA. - 2015. Dx.dpi.org/10.3109/19401736.2015.1122762.
Gillani S. W„ Sari Y. O., Baig A. A., Baig M. Helminthiais; Clinical insights. - 2012. - P. 89. Accessed through: https:// books, google. com/books?isbn=l 105494594.
Jordan H E. Consideration of potential parasites food hazards И РАНО Bull. - 1974. - 8, 2. - P. 143 - 149.
Kornyushin V. V., Czaplinski B., Tkach И V. Composition of the genus Drepanidotaenia Railliet, 1892 and its place in the system of hymenolepidid cestodes 11 Helminthologia. - 1996. - 33, № 3. - P. 153 - 155.
Lamothe-Argumedo R., Garcia Prieto L Cestodes, parasites del hombre // Salud Publica Мёх. - 1985. - 27, 5.-P. 419-435.
Muller R, Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 101.
Ratajac R., Petrovid Z., Cakic P. The first record of Drepanidotaenia lanceolata (Bloch, 1782) larva in Arc-todiaptomus spinosus (Daday, 1891) Diaptomidae in Yugoslavia 11 Helminthologia (Bratislava). - 1997. -34, l.-P. 53-54.
Schmidt G. D. Handbook of tapeworm identification. - CRC Press, Boca Raton, Florida, 1986. - 675 pp.
Zschokke E Hymenolepis {Drepanidotaenia) lanceolata Bloch als Schmarotzer im Menschen // Ctrbl. Bakte-riol. - 1902.-31.-P. 331 -335.
Род Pseudanoplocephala Baylis, 1927
Синоним (по: Спасский, 1980):
Hsuolepis Yang, Zhai et Chen, 1957
В 1927 г. Бэйлис (Baylis, 1927) описал от дикой свиньи на Цейлоне новый род цестод Pseudanoplocephala с типовым видом Pseudanoplocephala crawfordi. В последующем было показано широкое распространение данного паразита у диких и домашних свиней в Юго-Восточной Азии, а в 1980 г. появилось сообщение о его обнаружении у группы людей в провинции Шэньси в Китае (Xue, 1980).
В настоящее время Р. crawfordi относят к группе паразитов зоонозного значения, представляющих потенциальную опасность для здоровья человека, а изучению его геномики, экологии и биологии уделяется серьёзное внимание. Благодаря этим исследованиям была показана принадлежность данного вида не к семейству аноплоцефалид, куда его отнесли изначально, а к гименолепидидам (Спасский, 1980), что недавно было подтверждено геномным анализом вида (Zhao et al., 2016). Более того, филогенетический анализ, основанный на трёх фрагментах гена, показывает, что Р, crawfordi группируется в кластер Hymenolepis и должен быть одним из членов этого рода, но никак не Pseudanoplocephala (Jia et al., 2016).
Описание (по: Спасский, 1980). Черви довольно крупных размеров. Сколекс невооружённый, имеется рудимент хоботкового влагалища. Стробила краспедотного типа, с многочисленными проглоттидами, вытянутыми в поперечном направлении. Продольные экскреторные сосуды без поперечных анастомозов. Половые органы непарные, половые поры односторонние. Половой атриус невооружённый, дополнительные копулятивные приспособления отсутствуют. Семенники многочисленные (до 50), располагаются в двух группах по сторонам от женских половых желез,
206
залегающих субмедианно. Латеральные семенники могут выходить за линии продольных сосудов. Наружный и внутренний семенные пузырьки имеются. Бурса цирруса небольшая, за среднее поле не заходит. Яичник многолопастный, вееровидный. Желточник компактный, позади яичника. Вагина короткая, поральные сосуды не пересекает. Семяприемник длинный, может волнообразно изгибаться. Матка первоначально в виде трубки, зрелая матка мешковидная, лопастная, пересекает экскреторные сосуды, не распадается. Яйца многочисленные, крупные, округлые, с толстостенной двухконтурной наружной оболочкой. Эмбриофор крупный, сферический. Эмбриональные крючья длинные. Типовой вид - Pseudanoplocephala crawfordi Baylis, 1927.
Pseudanoplocephala crawfordi Baylis, 1927 (=Hsuolepis shengi Yang, Zhai et Chen, 1957; =Hsuolepis shensiensis Liang et Zheng, 1963) (рис. 104, 105).
Рис. 104 Pseudanoplocephala crawfordi'. слева -сколекс (Sc) с присосками (S) и продольными экскреторными каналами (ес); справа - участок стробилы с продольными экскреторными каналами и половыми железами (t -семенники; о - яичник; gp - половая пора; ес - экскреторный канал) (из: Mudaliar, Iyer, 1938)
Как уже отмечено, данный вид впервые был описан на материале от дикой свиньи на Цейлоне (Baylis, 1927), а через 11 лет появилось его описание, основанное на музейной коллекции сборов от домашних свиней из Индии (Mudaliar, Iyer, 1938). В монографии 1951 г. А. А. Спасский рассматривал вид ещё в составе Anoplocephalidae, но уже в 1980 г. обосновал невозможность его вхождения в это семейство. Тем не менее, некоторые авторы традиционно относят Р. crawfordi к анопло-цефалидам (например, Д. А. Криволуцкий с соавт. (1991), отметившие этого паразита у дикой свиньи во Вьетнаме). Кстати, перевод выше упомянутых видов Hsuo-lepis shengi и Н. shensiensis в синонимы Р. crawfordi несколько расширил границы меристических признаков данного паразита.
Длина червей достигает 210 - 310 при ширине 3-4 мм (Mudaliar, Iyer, 1938). Если же учесть длину стробилы Hsuolepis shensiensis, переведённого в синонимы Р. crawfordi, то длина этих цестод может составить 1475 при ширине до 11.1 мм (Liang, Zheng, 1963). Ширина сегментов в передней части стробилы больше их длины, но по мере удаления к заднему концу стробилы их длина постепенно увеличивается. Сколекс маленький, не более 0.45 мм в ширину. Присоски диаметром 0.1 - 0.14 мм. Шейка сжата, 0.35 мм в ширину. Экскреторная система представлена одной парой широких, волнистых продольных каналов, расположенных вентрально; поперечная комиссура у заднего конца членика отсутствует. Ширина каналов 0.075 - 0.1 мм. В каждом членике одинарный набор половых органов. Семенников от 25 до 26 (Mudaliar, Iyer, 1938), 26 - 32 (Yang et al. 1957) или 24 - 44 (Liang,
207
Zheng, 1963), располагаются поперёк членика, более на апораль-ной, чем на поральной стороне. Семяпровод проходит от средней линии почти прямолинейно, по-рально от яичника образует грушевидный или веретеновидный наружный семенной пузырёк. Бурса цирруса удлинённая, 0.66 -0.60 х 0.07 мм. Парный яичник с пальцевидными выростами по периметру, желточник также дольчатый, занимает среднюю зону членика. Вагина лежит вентрально к циррусу, заключённому в бурсу. Семяприемник тянется от бурсы цирруса до тельца Мелиса волнообразно изгибающейся трубкой. Матка в виде удлинённого мешка, с многочисленными карманами. Яйца размером 97 - 110, эмбриофор 55 -60 х 45 - 55 цт.
Рис. 105 Pseudanoplocephala crawfordi: 1 - горизонтальный разрез гермафродитного участка стробилы; 2 - поральная часть членика на поперечном срезе; 3 - зрелый членик; 4 - яйцо (из: Спасский, 1951-по: Baylis, 1927)
Р. crawfordi - характерный паразит свиней, как диких, так и домашних, у которых при сильной инвазии может вызывать потерю веса, задержку роста, абдоминальные боли, диарею и даже гибель (Wang et al., 2015). Заболевание встречается в странах Южной и Юго-Восточной Азии - Индии, Шри-Ланке, Китае, Японии.
Подавляющее большинство работ, посвящённых различным аспектам морфологии, биологии и распространения данного паразита, выполнено в Китае и опубликовано в местных журналах на китайском языке, что делает их практически недоступными для нас.
Жизненный цикл Р. crawfordi проходит с участием промежуточного хозяина - хрущаков малого булавоусого, мучного большого, мучного тёмного, блестянок (Jiang et al. 1990). Развитие паразита в насекомых занимает от одного до полутора месяцев, а полный жизненный цикл завершается за 2 - 2.5 месяца. Цитируемые авторы сообщают также о выявленной ими 22 % заражённости этим паразитом крысы серой.
208
В 1980 г. появилось первое сообщение об обнаружении этого паразита у группы людей в провинции Шэньси (центр Китая) (Xue, 1980). В англоязычном резюме своей статьи, размещённом на «www.cnki.com.cn», её авторы (Wang et al., 2015) пишут о 21 известном случае заражения людей этим гельминтом в трёх провинциях Китая - уже упомянутой Шэньси, а также Ляонин (на северо-востоке страны) и Хэнань (на востоке Китая).
Предполагается, что заражение людей могло произойти с пищей через хрущака малого булавоусого Tribolium castaneum, чьё участие в жизненном цикле этой цестоды доказано экспериментально (Jiang et al. 1990; Мао, 1991). К великому сожалению, эти жуки в изобилии водятся в местах хранения муки, круп, отрубей, мучных изделий, а также сушёных фруктов, бобов, какао, фасоли, гороха, семян льна, подсолнечника в складских помещениях, магазинах и домашних кладовках, что создаёт реальную угрозу здоровью человека в случае их случайного попадания в его организм.
Цитируемая литература
Криволуцкий Д. А„ Нгуен Тхи Ки, Фан Тхе Вьет. Фауна аноплоцефалят - ленточных гельминтов домашних и диких животных Вьетнама // Паразитология. - 1991. - 25, 5. - С. 468 - 469.
Спасский А. А. Аноплоцефаляты - ленточные гельминты домашних и диких животных И Основы цестод ологии. - Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1951. - 1. - С. 357 - 359.
Спасский А. А. Гименолепидиды как облигатные паразиты свиней // Ветеринария. - 1980. - № 1. - С. 34-37.
Baylis Н A. Ann. Mag. Nat. Hist. Ser. 9. - 1927. - 19. - P. 417 - 425.
Jia Y.-Q.t Yan W.-C, Du S.-Z., Song J.-K.t Zhao W. et al. Pseudanoplocephala crawfordi is a member of genus Hymenolepis based on phylogenetic analysis using ribosomal and mitochondrial DNA sequences П Mitochondrial DNA. Part A: DNA Mapp. Seq. Anal. -2016. - 27, 3. - P. 1688 - 1692. doi: 10.3109/19401736. 2014.958729.
Jiang T. J., Jin Z. H, Wu H, Cui C. Q. A study on the life-cycle and epidemiology of Pseudanoplocephala crawfordi Baylis, 1927//J. Helminthol. -1990.-64, l.-P. 54-61.
Liang L. Q., Zheng Z. M. Note on a new tapeworm Hsuolepis shensiensis sp. nov. (Cestoda: Hymenolepididae) from swine in Shensi province, China, and a revision of genus Hsuolepis Yang, Zhan and Chen, 1957 11 Acta Zool. Sinica. - 1963. - 15. - P. 211 - 216. (in Chinese).
Mao S. P. Protozoan and helminth parasites of humans in mainland China П Intern. J. Parasitol. - 1991. - 21, 3.-P. 347-351.
Mudaliar S. V., Iyer K. S. G. Pseudanoplocephala crawfordi Baylis, 1927 // Ind. J. Vety. Sci. & Anim. Husb. - 1938. - 8, 3. - P. 235 - 237. http://digital.nls.uk/75244384.
Wang H.t SongJ, Lin Q.t Yu S, Zhao G. The complete mitochondrial genome of Pseudanoplocephala crawfordi'. comparison with other selected cestodes 11 www.cnki.com.cn. 2015. (in Chinese, English summary).
Xue J. D. [First record of human infection of Hsuolepis cheni] П Shaanxi Xin Yiyue. - 1980. - 9. - P. 29- 33. (in Chinese).
YangP., ZhaiX. G., Chen G. S. A new adult cestode, Hsuolepis shengi nov. gen. sp. collected from domestic pig, Kansu province, China // Acta Microbiologica Sinica. - 1957. - 5. - P. 361 - 367. (in Chinese).
Zhao G. H, Wang H B., Jia Y. Q., Zhao W. et al. The complete mitochondrial genome of Pseudanoplocephala crawfordi and a comparison with closely related cestode species 11 J. Helminthol. - 2016. - 90, 5. - P. 588 -595. doi: 10.1017/S0022149X15000802
Род Rodentolepis Spassky, 1954
До последнего времени к данному роду относили всех гименолепидид, обладающих многочисленными (более 10) хоботковыми крючьями и паразитирующих у мышевидных грызунов (Czaplinski, Vaucher, 1994). Недавние исследования показали, что Rodentolepis (sensu lato) является сборной группой, включающей виды с разнообразной морфологией (Макари-ков, Гуляев, 2009). По мнению специалистов, точное число видов Rodentolepis пока не мо
209
жет быть определено, поскольку род остро нуждается в тщательной таксономической ревизии (Макариков, Ткач, 2014).
В 2009 г. вышла в свет публикация, авторы которой (Макариков, Гуляев, 2009) на материале от серой крысы из Западной Сибири обосновали новый род гименолепидидных цестод -Pararodentolepis. Обнаруженные цестоды обладали «своеобразным комплексом признаков, отличающих их не только от типового вида Rodentolepis, но и от других представителей рода» (Макариков, Гуляев, 2009; стр. 454). В своей диссертационной работе А. А. Макариков (2008) высказал предположение, что к новому роду может относиться и Rodentolepis папа (von Siebold, 1852) (^Hymenolepis папа), и даже перевёл его в этот род. Однако поскольку диссертация является рукописью, то любые таксономические нововведения в подобных случаях не могут считаться официально узаконенным. При личной переписке А. А. Макариков написал (15.03.2017): «..."папа" пока остался в роде Rodentolepis (sensu lato)». Тем не менее, в одной из публикаций (Vlasov et al., 2015) Rodentolepis (^Hymenolepis) папа цитируется уже как представитель рода Pararodentolepis.
В настоящее время к роду Rodentolepis (sensu stricto) относят гименолепидид, отвечающих следующим характеристикам (Макариков и др., 2010). Хоботок с многочисленными хоботковыми крючьями крицетоидного типа. Половые поры односторонние, расположены на правой стороне. Семенников три, располагаются в виде треугольника. Лабиринтная матка выходит в латеральное поле членика. Эмбриофор гексакантов с 3 - 5 полярными филаментами. Остальные характеристика, как у семейства. Взрослые формы - паразиты мышевидных грызунов; промежуточные хозяева - различные насекомые.Типовой вид - Rodentolepis straminea (Goeze, 1752).
У человека зарегистрированы два вида Rodentolepis - R. microstoma (Dujardin, 1845) и уже упомянутый R. папа (оставим его пока в этом роде).
Rodentolepis microstoma (Dujardin, 1845) Spassky, 1954 [=Taenia microstoma Dujardin, 1845; = Taenia brachydera Diesing, 1854; = Taenia murisdecumani Diesing, 1863; = Hymenolepis microstoma (Dujardin, 1845) Blanchard, 1891] (рис. 106). Вид впервые описан на материале от мышей М. Дюжардином (Dujardin, 1845), который отнёс его к роду Taenia L., 1758, объединявшему в то время всех известных ленточных червей. В 1891 г. П. Бланшар (Blanchard, 1891) перевёл Taenia microstoma в род Hymenolepis, одновременно приведя расширенное описание вида.
В англоязычной литературе R microstoma обычно называют «rodent tapeworm» - солитёр грызунов или «mouse bile duct tapeworm» - солитёр жёлчного протока мыши.
Помимо R. microstoma, в грызунах паразитирует близкий вид - R. straminea. Оба вида внешне очень похожи, вследствие чего их даже рассматривали как синонимы (Bear, Tenora, 1970). Однако при внешнем сходстве названные виды отличаются по ряду морфометрических и физиологических показателей (Casanova et al., 2001), а также на молекулярно-генетическом уровне (Haukisalmi et al., 2010).
Описание R. microstoma (по разным авторам, в том числе: Casanova et al., 2001; Cunningham, Olson, 2010). Длина цестод от 4 до 35 см, максимальная ширина тела не более 2 мм. Сколекс маленький, длиной до 0.2 мм. Хоботок 0.1 мм, вооружён короной из 27 (Joyeux, Kobozieff, 1928), 23 - 28 (Dvorak et al., 1961), 23 - 29 (Casanova et al., 2001) или же 22 - 26 (Cunningham, Olson, 2010) крючьев длиной 10.2 - 23 pm (Casanova et al., 2001). Проглоттиды слабо краспедотные, терминальные членики размером 0.13 - 0.26 х 0.45 - 1.43 мм.
210
Рис. 106 Rodentolepis microstoma (Nottingham strain): A - общий вид червя; В - крючок, иллюстрирующий параметры промеров; С - яйцо; D - сколекс; Е - маточный членик; F - поперечный срез через маточный членик. Сокращения: b - лезвие; с - циррус; cs - бурса цирруса; doc - дорсальный экскреторный канал; eb - эмбриофор; eh - эмбриональные крючья; es - оболочка яйца; esv - наружный семенной пузырёк; h - рукоятка; isv - внутренний семенной пузырёк; пс - нервный ствол; о - яичник; ос - онкосфера; pf -полярные филаменты; г - хоботок; гр - хоботковое влагалище; sr - семяприемник; t - семенники; и - матка; va -вагина; voc - вентральный экскреторный канал. Масштаб: А = 1 мм; В = 10 pm; С = 50 цт; D - F = 100 цт (из: Cunningham, Olson, 2010, как Hymenolepis microstoma}.
Парные экскреторные каналы и продольные нервные стволы располагаются в латеральных полях. Половые поры односторонние, открываются примерно посередине бокового края членика. Сферические или овальные семенники, один поральный и два апоральных (в некоторых члениках - обратная пропорция), размерами 0.05 -
211
0.17 х 0.06 - 0.115, овальная бурса цирруса размером 0.097 - 0.302 х 0.03 - 0.1 мм, содержит свёрнутый циррус и внутренний семенной пузырёк. Семяприемник медианный. Вагина находится вентрально от мужской половой системы. Яичник дольчатый, частично перекрывает компактный желточник. Яйца тонкостенные, размерами 80 - 90 (Joyeux, Kobozieff, 1928), 62.6 - 98 х 51.5 - 75.7 (Casanova et al., 2001), 85 pm (Pritchett, 2007), содержат эмбриофор с тремя полярными филаментами и онкосферу с эмбриональными крючьями, расположенными параллельно. Размеры онкосферы 27.3 - 47.5 х 29.3 - 54.5 pm (Casanova et al., 2001).
Замечено, что длина тела цестод зависит от их возраста и численности: при большем количестве черви имеют меньшие размеры и, наоборот, при меньшем количестве цестоды обладают большими размерами. В данном случае наблюдается проявление так называемого эффекта скученности (crowding effect): в итоге биомасса червей в хозяине более или менее постоянна вне зависимости от интенсивности его заражения. В лабораторных условиях количество взрослых червей в мышах ограничивалось примерно 12 экз. (Hymenolepis microstoma - Wikipedia. en.wikipedia.org).
Личиночное развитие R. microstoma происходит в мучных жуках - хрущаках малом мучном, малом булавовидном, большом мучном, мукоеде суринамском и других (Goodchild, Stullken, 1970; Marshall, 1967; Voge, 1964). Среди подобных хозяев известна даже блоха кошачья (Marshall, 1967). Инвазионный цистицеркоид формируется в гемоцели насекомых в течение примерно 7-10 дней (Goodchild, Stullken, 1970; Voge, 1964), и может оставаться в таком состоянии в организме насекомого столько, сколько живёт его хозяин, т.е. до 3 лет. При экспериментальном заражении хрущака малого мучного выяснилось, что в одном жуке может находиться от 15 до 30 цистицеркоидов (Litchford, 1963).
Взрослые особи R. microstoma поселяются в жёлчном протоке животных, что, кстати, является уникальным среди гименолепидид. Среди его хозяев - мыши домовая, полевая, жёлтогорлая, европейская, многососковая, травяная четырёхполосная, полёвки серые, песчанки малые, хомячки африканские лазающие (Жигилё-ва, 2013; Casanova et al., 2001; Foronda et al., 2011 и многие другие). В экспериментальных условиях заражался и золотистый хомячок, но черви в этих грызунах оставались недоразвитыми, вызывая при этом у животных серьёзную патологию (Dvorak et al., 1961; Litchford, 1963). Что касается возможности паразитирования R. microstoma в крысах, то одни авторы (Dvorak et al., 1961) считают их невосприимчивыми к заражению, по мнению других (Litchford, 1963), это свойство они приобретают с возрастом, а третьи (Joyeux, Kobozieff, 1928) сообщают об успешном заражении крыс данным паразитом. П. Форонда с соавт. (Foronda et al., 2011) пишут о находке R. microstoma на Канарских о-вах не только у домашней мыши, но и на одном из островов, Тенерифе, у крысы чёрной (у одной из 96).
Грызуны заражаются, поедая инвазированных насекомых. У цистицеркоидов, попавших в желудок животного, под действием соляной кислоты и пепсина разрываются мембраны, и личинка покидает их. После примерно 3 дней миграции в верхней части желудочно-кишечного тракта ювенильные черви достигают жёлчного протока и примерно через неделю начинают продуцировать яйца (de Rucke, van Grembergen, 1966). Через 14 дней ни одного червя вне жёлчного протока не обнаруживается. В лабораторных условиях продолжительность жизни червей в мышах достигала 6-12 месяцев.
212
Несмотря на наличие в жизненном цикле R. microstoma облигатного промежуточного хозяина, у дефинитивных хозяев, видимо, может наблюдаться аутоинвазия. Во всяком случае, подобное явление было прослежено на иммунодефицитных мышах (Andreassen et al., 2004). Уже заражённым зверькам скормили их же фекалии, содержание яйца цестоды. В кишечнике мышей вышедшие из яйца онкосферы проникали в его ткани, где происходило формирование цистицеркоида, чьё дальнейшее развитие до взрослой особи наблюдалось в тонком кишечнике и жёлчном протоке мыши.
Единственное сообщение об обнаружении R. microstoma у человека опубликовано уже в нынешнем столетии. В ходе 3-летнего мониторинга встречаемости желудочно-кишечных паразитов у жителей отдалённых районов на северо-западе Западной Австралии, где было выявлено широкое распространение Rodentolepis папа, у четырех из числа обследованных лиц неожиданно обнаружилась смешанная инвазия названным видом и Rodentolepis microstoma (Macnish et al., 2003). Это первый, и пока единственный случай обнаружения R. microstoma у человека. Говорить о каких-либо конкретных проявлениях инвазии этим гельминтом не приходится, поскольку то была смешанная инвазия двумя видами гименолепидид.
Тем не менее, данное сообщение свидетельствует о возможном поражении человека Л microstoma в местах распространения данного паразита.
Rodentolepis папа (von Siebold, 1852) Spassky, 1954 (рис. 107 - 109). Впервые описанный как Taenia папа von Siebold, 1852, впоследствии этот вид побывал в родах Hymenolepis, Diplacanthus Weinland, 1858, Vampirolepis Spassky, 1954, Vari-olepis Spassky et Spasskaya, 1954, и, наконец, как отмечено выше, предполагается его возможный перевод в Pararodentolepis. Кстати, Hymenolepis fraterna Stiles, 1906, который долгие годы рассматривали вариететом, подвидом и даже синонимом Hymenolepis папа, уже переведён в род Pararodentolepis (Tkach et al., 2013).
В англоязычной литературе Р. папа называют «dwarf tapeworm» (английское dwarf - перевод латинского nanos, карлик) - цепень карликовый. Под таким названием этот паразит вошёл и в русскоязычную литературу. А. Брем (2004) называл цестоду малым солитёром.
Некрупные черви длиной от 2.5 до 30 или 40 мм при максимальной ширине 0.5 - 0.75, не более 1 мм. Сколекс очень маленький, диаметром 0.25 - 0.32, присоски до 0.08 мм. Хоботок короткий, с 27 (Grassi, 1887а), 24 - 28 (Ward, 1894), 22 - 30 (Deaderick, 1906), 20 - 30 (Faust, 1949), 24 - 30 (Поляков и др., 2006) мелкими крючьями. Шейка длинная и узкая. В стробиле 150 - 200 члеников, из которых терминальные имеют размеры 0.15 - 0.3 х 0.8 - 0.9 мм. В. Е. Поляков с соавт. (2006) при описании «Hymenolepis папа» указывают максимальное количество члеников - 1000, что не соответствует действительности. Семенников три. Яичник двухлопастный. Зрелая матка в виде мешка. Яйца прозрачные, эллипсоидной, реже шаровидной формы, с тонкой двухконтурной оболочкой. В терминальных члениках по 80 - 180 яиц в каждом (Deaderick, 1906). Размеры яиц (по разным авторам) 40 (Ward, 1894), от 36 х 32 до 56 х 42 (Ransom, 1904), 26 - 58 (Deaderick, 1906), 30 - 47 (Faust, 1949), 40 х 50 (Pritchett, 2007), 40 - 70 pm (Поляков и др., 2006). Онкосфера диаметром 23 (Ward, 1894), 16- 19 (Faust, 1949), до 30 pm (Поляков и др., 2006), с 6 крючьями и тонкой оболочкой, от утолщённых полюсов которой отходят тонкие полярные филаменты длиной 4-8 pm.
213
Рис. 107 Rodentolepis папа, общий вид червя (из: Ward, 1894 — по: Railliet, 1893, как Hymenolepis папа)
Рис. 108 Rodentolepis папа'. А — общий вид червя; В - сколекс, сильно увеличен; С - яйцо (из: Faust, 1949 - по разным авторам, как Hymenolepis папа)
Рис. 109 Rodentolepis папа, схематичное изображение сколекса (из: Muller, 2002, как Hymenolepis папа)
◄----------------
Цепень карликовый уникален, прежде всего, тем, что его жизненный цикл может проходить в одном хозяине, который является одновременно и окончательным, и промежуточным.
Возможность полного развития карликового цепня в одном и том же хозяине, без участия промежуточного хозяина, была доказана экспериментальными работами ещё в 19-м столетии. Так, Д. Грасси (Grassi, 1887b) и он же с коллегой (Grassi, Rovelli, 1892) скормили зрелые проглоттиды цестоды незаражённым крысам и проследили развитие червей в их организме. На 13-й день в экскрементах грызунов появились первые яйца паразита. С другой стороны, Д. Бачигалупо (Baci-galupo, 1931) представил экспериментальные доказательства того, что хрущаки мучные, различные блохи, могут служить промежуточными хозяевами «Hymenolepis fratema», способствуя его распространению среди мышевидных грызунов. Но -
214
в данном случае речь идёт о виде, которого уже не рассматривают синонимом Hymenolepis папа и который стал самостоятельным видом в роде Pararodentolepis.
К слову, экспериментальные попытки заразить лабораторных животных -крыс, хомяков и мышей, даже иммунодефицитных, изолятами Rodentolepis (=Hymenolepis) папа от человека потерпели неудачу (Macnish et al., 2002). Попытка заражения 24 изолятами R. папа хрущака малого мучного была более удачной: из одной пробы в пяти жуках сформировалось 73 цистицеркоида, однако заразить затем ими мышей также не удалось.
В этой связи заслуживает внимания работа, авторы которой показали, что «Hymenolepis папа» в природе представлен тремя различными штаммами, каждый из которых приурочен к определённым хозяевам - мышам, крысам или человеку (Ito, Smyth, 1987). Надо полагать, что одним из таких выделенных штаммов был Pararodentolepis (^Hymenolepis) fraterna.
Обсуждая жизненный цикл цепня карликового, А. А. Спасский (1963) предположил, что в давние времена его промежуточными хозяевами, как у остальных гименолепидид, чей жизненный цикл известен, служили различные наземные членистоногие, но по каким-то причинам паразит постепенно приспособился к развитию цистицеркоидов в организме дефинитивного хозяина. Попав в организм человека, онкосфера покидает яйцевые оболочки и внедряется в ворсинку тонкого кишечника, где в течение 5-7 дней происходит развитие цистицеркоида. Зрелые цистицеркоиды после разрушения тканей ворсинки выпадают в просвет кишечника, где и происходит их дальнейшее развитие. Каждый червь прикрепляется к слизистой оболочке кишечника и формируется в половозрелую особь, от стробилы которой начинают отделяться зрелые членики, содержащие яйца (рис. ПО, 111). Обычно этот процесс занимает 14-16 дней.
Рис. 111 Схема жизненного цикла «.Hymenolepis папа'. 1 -стробила; 2 - отделяющиеся зрелые членики; 3 - яйца выходят с фекалиями или остаются в кишечнике; 4 - покинувший яйцо эмбрион внедряется в ворсинку слизистой и развивается в 5 - личинку со сколексом, снабжённым присосками и хоботком с крючьями, как у взрослой формы; 6 - личинка выходит в просвет кишечника и 7- 8 - прикрепляется к эпителию слизистой кишечника, развиваясь во взрослую форму (1) (из: Faust, 1949)
Рис. 111 Схематичный рисунок расположения цистицеркоида и взрослой особи Rodentolepis папа в подвздошной кишке хозяина (из: Muller, 2002)
215
Впервые заражение человека карликовым цепнем открыл Т. Билхарц в Каире в 1851 г. При аутопсии мальчика, скончавшегося от менингита, он обнаружил у того в тонком кишечнике бесчисленное множество («countless number») мелких цестод.
В 1902 г. А. Брем писал, что случаи заражения человека «малым солитёром» известны только в Сербии и Каире и предположил, что промежуточные хозяева этого гельминта, по-видимому, насекомые или слизняки. «Так как в Сербии дети часто едят одного белого слизняка, то у них часто наблюдается присутствие этих паразитов» (см.: Брем, 2004; стр. 1047). Однако к концу 19 столетия инвазия людей была выявлена не только в Египте и Сербии, но уже и в Италии, Англии, Аргентине, США (Ward, 1894). В 1904 г. Б. Рэнсом (Ransom, 1904) опубликовал сведения о 118 случаях заражения людей в мире: в Египте (3 случая), Англии (1), Италии (75), Сербии (1), России (3), Германии (4), Сиаме (Лаосе) (1), Японии (2), США (24), Южной Америке (4). При этом он не учёл ещё 24 аналогичных случая, выявленных к тому времени в США (Deaderick, 1906). Кстати, к 1913 г. их количество в этой стране выросло до 76 (Gerber, 1913).
С того времени R. папа регистрируют по всем странам и континентам, причём чаще всего инвазия обнаруживается у детей. Общее число людей, заражённых этим гельминтом в мире, оценивается от 20 млн. (Andreassen, 1998) до 50 - 75 млн. (Crompton, 1999; Muehlenbachs et al., 2015). В отдельных регионах поражённость населения колеблется от 0.1 до 50 % и выше. Проиллюстрирую сказанное несколькими примерами из публикаций последних лет.
Так, в центральной Сербии, где в течение 10 лет был обследован 5981 учащийся в возрасте 7-11 лет, инвазия обнаружилась у 0.06 % из них (Nikolic et al., 1998). В секторе Газа в результате анализа проб стула 1370 детей в возрасте от 6 до 11 лет заражение цепнем карликовым было выявлено у 1 % из них (Astal, 2004), а на юго-западе Саудовской Аравии - у 3 % из 1281 обследованного школьника 5 -13 лет (Omar et al., 1991). К слову, в Саудовской Аравии R. папа обычно регистрируют у детей и редко - у эмигрантов из Судана, Йемена и Египта (Alruzug et al., 2016).
В Кыргызстане в Ошском районе в результате копроовоскопии яйца R. папа были обнаружены в пробах 4.4 % школьников (Steinmann et al., 2010), а в Пакистане в центральном районе Карачи - у 0.9 % малышей в возрасте от года до 5 лет (Mehraj et al., 2008).
В Мали в пригородной зоне Бамако паразита зарегистрировали менее чем у 1 % из 1017 школьников в возрасте 6-14 лет (Dabo et al., 2003), а в провинции Те-туан на севере Марокко заражёнными оказались 1.45 % учащихся городских учебных заведений и 1.11 % - сельских (El Fatni et al., 2014). Похожая картина, правда, с более высокими показателями, наблюдалась в Зимбабве: здесь при обследовании 351 ребёнка из пригорода небольшого городка и 315 детей из 3 сельских посёлков инвазия была выявлена у 21 % из них, при этом заражённость городских детей составила 24 %, а сельских - 18 % (Mason, Patterson, 1994). В Буркина-Фасо яйца карликового цепня были зарегистрированы в 28.6 % проб (Fortunato et al., 2014), на востоке Эфиопии в Бабиле - у 10.1 % из 442 обследованных школьников (Tadesse, 2005), а на северо-западе этой страны - у 13.8 % учащихся общинной школы (Ge-law et al., 2013).
216
В Боливии в департаменте Санта-Крус среди почти 400 внешне здоровых пациентов яйца R. папа обнаружились у 8.7 % из них (Cancrini et al., 1988), в Боливийском Чако - у 5.8 % (Maccioni et al., 2016), а в Чили в провинции Вальдивия - у 0.4 % школьников (Navarrete, Torres, 1994). По данным Министерства зравоохране-ния Перу, в 1981 - 2001 гг. заражённость местного населения R. папа по регионам страны колебалась от 0.62 до 46.6 % (Peni/Minsa/oge-03/039 & Ser. Inf. Тёс. Invest. Epid.). Анализ архивных материалов по посетителям детской поликлиники в Трухильо за 2008 - 2012 гг. выявил рост числа случаев регистрации этого паразита у пациентов с 0.3 % в 2008 г. до 5.4 % - в 2012-м (Sotero, Jara, 2014). В Эквадоре на архипелаге Jambeli, расположенном близ побережья, яйца R. папа обнаружились в 4.8 % 373 проб, полученных от местных жителей (Gallegos, Brousselle, 1991).
В Канаде при копроовоскопии маленьких пациентов, находящихся в детской больнице Альберта, заражение карликовым цепнем выявилось у 2 % из них (Kabani et al., 1995).
В Корее с 1971 по 1997 гг. заражённость населения цепнем карликовым колебалась от 0.02 до 0.7 % (Min, 1990). Последнее широкомасштабное исследование в рамках всей страны, выполненное в 2004 г., дало отрицательный результат (Kim Т. et al., 2009), хотя спорадические случаи в этой стране всё же имеют место (Kim В. et al., 2014).
В разных регионах Австралии заражёнными оказались от 20.5 % (Meloni et al., 1993) до 54.6 % обследованных местных жителей (Reynoldson et al., 1997).
Подобных примеров можно привести великое множество, но все они лишь подтвердят факт повсеместного распространения R. папа, которого справедливо относят к видам-космополитам.
В обзорной монографии «Черви и болезни человека» её автор (Muller, 2002) приводит общие цифры случаев регистрации R. папа у населения в разных странах мира (скорее всего, по состоянию на конец 20-го столетия): Албания - 1.5 %, Боливия - 9, Куба - 0.008, Доминиканская Республика - 2, Эквадор - 3 - 4, Мексика - 5, Ирак - 7, Египет - 0.2, Кения - 5, Мадагаскар - 9, Намибия - 1, Сенегал - 1.5, Австралия (аборигены) - 55 % и т.д.
По данным того же автора, в РФ этой цестодой поражено 0.1 % населения. Практически во всех отечественных источниках отмечается, что районами обнаружения R. папа у населения РФ являются Томская и Амурская области и Северный Кавказ (см., напр., www.medicalj.ru).
Справедливости ради следует заметить, что заражение людей R. папа было известно во многих республиках бывшего Советского Союза - Молдавии, Грузии, Украине, Казахстане, Узбекистане и т.д. Скорее всего, подобная ситуация сохранилась и в настоящее время. В Украине, например, этого паразита по-прежнему выявляют у человека, а самый высокий уровень заражения наблюдается в Херсонской, Одесской и Ивано-Франковской областях (Садовниченко, 2015; с. 13).
Количество цестод у человека варьирует от единичных экземпляров до нескольких сотен и более. Единичная инвазия у пациентов встречается редко, гораздо чаще регистрируют сотни и даже тысячи червей, что вполне объяснимо, учитывая возможность эндогенной инвазии человека, особенно с ослабленным иммунитетом, когда весь цикл развития паразита - от яйца и до яйца - полностью проходит в одном и том же хозяине. В Индонезии, например, описан случай гиперинвазии 24-
217
летнего мужчины, жителя Медана, у которого после лечения разовой дозой 800 мг квинакрина (quinacrine) выделилось 1115 экз. цестод (Tjiong, Sri Oemijali, 1968).
При заражении карликовым цепнем большую роль в патогенезе играет механическое и химическое воздействие паразитов на ткани кишечника. «Пораженные цистицеркоидами ворсинки тонкой кишки утолщаются. Созревающие личинки вызывают явления некробиоза и некроза. Строма пропитывается экссудатом, инфильтруется сегментоядерными лейкоцитами, частично десквамируются эпителиальные клетки. Длительная фиксация головок цепней приводит к разрушению ворсинок, образованию множественных язвочек, достигающих подслизистого слоя. Развиваются гиперемия всех слоёв тонкой кишки, лимфоидных фолликулов, дистрофия нервных клеток кишечного сплетения. <...> Определяются очаговая дистрофия и пролиферация соединительной ткани печени, поджелудочной железы, легких, миокарда» (Поляков и др., 2006; стр. 83).
Иногда заражение людей асимптоматично, что в значительной степени зависит от количества паразитов и состояния иммунной системы человека. Обычно же пациенты жалуются на тошноту, обильное слюнотечение, тупые боли в животе, учащённый жидкий стул с примесью слизи, метеоризм, отсутствие аппетита, пониженную работоспособность, могут также наблюдаться рвота, отрыжка, изжога, головные боли, нервная возбудимость, раздражительность (Семёнова, 1968). Вследствие длительного поноса и отсутствия аппетита больные худеют. Так, в Египте из 200 заражённых детей у 84 % из них были выражены различные симптомы инвазии, при этом у 62 % из этого числа наблюдалась потеря веса (Khalil et al., 1991). Аллергические проявления инвазии могут выражаться в виде кожного зуда, высыпаний на коже (Di Lemia et al., 2004), хронической крапивницы (Marseglia et al., 2007). Иногда у больных наблюдаются нервные подёргивания, эпилептиформные припадки. Описан случай заражения Л папа 18-летнего юноши, у которого заболевание сопровождалось тошнотой, головной болью, судорогами, болями в животе (Gerber, 1913). Известно, что у детей заболевание выражено в более тяжёлой форме, чем у взрослых.
К слову, практически все перечисленные симптомы проявляются и при заражении другим представителем гименолепидид - цепнем крысиным.
В этой связи следует напомнить, что заражение R. папа довольно часто сопровождается наличием у пациентов и других паразитов, вызывающих подобные же симптомы. Например, при копроовоскопии проб от 321 ребёнка в возрасте от одного года до 12 лет, находящихся с симптомами гастроэнтерита в больнице Ка-лара (мухафаза Сулеймания на востоке Ирака), у 4.04 % из них были выявлены яйца цепня карликового. При этом в 38.46 % случаев наблюдалась смешанная инвазия, в том числе с Entamoeba hystolitica (23.1 %), Е. coli и Giardia lamblia (по 7.7 %) (Bajalan, 2010). Выше приводился случай смешанной инвазии цепнями крысиным и карликовым двух членов мексиканской семьи (Alvarez-Femander et al., 2012). И подобных примеров в опубликованных источниках более чем достаточно (вообще, описанию различных аспектов биологии, экологии, распространения, патогенеза R. папа можно, при желании, посвятить солидную монографию).
Таким образом, точная идентификация паразита приобретает решающее значение в постановке правильного диагноза, а, следовательно, и назначении соответствующего лечения. В Саудовской Аравии, к примеру, имел место случай, когда 34-летнего мужчину безуспешно лечили от синдрома возбудимого (раздражённого)
218
кишечника (Alruzug et al., 2016). И только после колоноскопии, когда было выявлено заражение пациента цепнем карликовым, тот был успешно вылечен празиквантелом.
Обычно диагноз ставят на основании обнаружения в пробах стула яиц R. папа, причём из-за особенностей цикла развития паразита копроовоскопию рекомендуется проводить трёхкратно с интервалами в 2 - 3 недели. При слабой инвазии, когда яиц в испражнениях мало, используют метод обогащения (по Фюлле-борну, Като, Калантарян). Некоторые исследователи полагают, что большую помощь в определении заражённости человека при асимптоматичном течении заболевания может оказать колоноскопия (Alruzug et al., 2016; Kim В. et al., 2014).
В качестве лечебного препарата первой линии рекомендуют празиквантел, а также альбендазол, мебендазол, никлозамид, фенасал (Ben-Ismail, 1977; Kim В. et al., 2014; Muller, 2002), курс лечения которыми детально разработан медицинскими работниками (см.: Баранова, Лесина, 2008; Марушко, Грачёва, 2012; Поляков и др., 2006).
При отсутствии лечения инвазия может продолжаться в течение нескольких лет, что, в первую очередь, связано со способностью паразита многократно поражать одну и ту же особь дефинитивного хозяина, что чаще всего наблюдается у людей с синдромом приобретённого иммуннодефицита.
Источником распространения R. папа в природе является инвазированный человек, который опасен, прежде всего, для непосредственно окружающих его лиц. Тот факт, что яйца цестоды инвазионны уже при выходе из кишечника, создаёт предпосылки для их широкого распространения. Основным фактором передачи инвазии является занесение яиц через руки в рот, что более всего характерно для детей, «забывающих» мыть руки после посещения туалета, возвращения домой после прогулок, игр на земле и в песочницах. Оказавшиеся на грязных руках микроскопически мелкие яйца гельминта попадают на пищевые продукты, фрукты, овощи, которые, в свою очередь, также становятся источником иназии человека, как детей, так и взрослых. И, наконец, яйца R. папа могут заноситься на пищевые продукты домашними насекомыми - мухами, тараканами, что особенно вероятно в условиях низкой санитарной культуры населения.
При комнатной температуре во внешней среде яйца R. папа сохраняют жизнеспособность в течение 3-4 суток, при 18 - 20°С в воде - до 25 - 35 суток, а в фекальной жидкости и сточных водах - до 19 суток (цит. по: Семёнова, 1968). По данным зарубежных коллег (Baskerville et al., 1988), яйца R. папа вне организма хозяина остаются инвазионными в течение 11 дней. Способность яиц паразита в течение довольно длительного времени сохранять жизнеспособность в сточных водах играет не последнюю роль в заражении человека. Наглядным примером сказанного могут служить результаты обследования детей в районе Бени-Меллаль в Марокко (Habbari et al., 2000). Из 740 детей, проживающих в районе, где в сельском хозяйстве для полива и удобрения полей используют неочищенные сточные воды, инвазия обнаружилась у 7.2 % из них, тогда как из 603 детей, живущих в местности, где подобный способ ирригации не практикуют, только у 0.6 %.
Многие исследователи подчёркивают тот факт, что заражение R папа обычно регистрируется в регионах с низким социально-экономическим статусом населения, отсутствием элементарных навыков личной гигиены. Об этом, например, пишут турецкие исследователи, выявившие паразита у 10 % обследованных
219
пациентов на юге страны в районе Измира (Akisu et al., 2001) и у 4.8 % детей на западе страны в провинции Маниса (Giinduz et al., 2005). На это же обстоятельство обращают внимание авторы публикации (Dhanabal et al., 2014), обнаружившие у жителей региона Южного Ченнаи в Индии яйца R. папа в 2.7 % проб. Надо сказать, что в Индии этого паразита вообще считают частой причиной диареи у детей -обитателей городских трущоб (Mirdha, Samantray, 2002).
Специфика жизненного цикла цепня карликового определяет и характер превентивных мер, призванных предупредить любую возможность заражения им человека. Среди них: санитарно-просветительная работа, особенно среди детей; копроовоскопическое обследование персонала дошкольных учреждений, а также детей и школьников младших классов не реже одного раза в год; своевременное выявление и лечение больных с обязательным обследованием всех членов семьи пациента; отстранение работников пищевых предприятий от работы на период лечения; охрана водоёмов от загрязнения фекалиями; дегельминтизация (при необходимости) сточных вод, используемых для удобрения полей, садов и огородов; уничтожение домашних насекомых; гигиеническое содержание продуктов питания; строгое соблюдение правил личной гигиены.
Проблему заражения населения планеты гименолепидидами, в том числе цепнем карликовым, Всемирная организация здравоохранения рассматривает на межгосударственном уровне. Учитывая определённую патогенность Rodentolepis (^Hymenolepis) папа для человека, и особенно для детей, данный паразит включён в Международную классификацию болезней 10-го пересмотра МКБ-10 (ICD-10, Version: 2016), в котором вызываемому им заболеванию присвоен код В71.0.
В РФ в Методических Указаниях «МУ 3.2 1756-03. Эпидемиологический надзор за паразитарными болезнями. 3.2 Профилактика паразитарных болезней» гименолепидозы отнесены к группе 3.2.5 «Гельминтозы, заражение которыми происходит непосредственно при контакте с инвазированными людьми (контагиозные гельминтозы)», а в соответствии с Постановлением Главного государственного санитарного врача РФ от 03.02.99 № 4 «Об утверждении Санитарных Правил» Rodentolepis (^Hymenolepis) папа отнесён к гельминтам IV группы патогенности.
Цитируемая литература
Баранова И. П., Лесина О. Н. Гельминтозы и другие паразитарные заболевания: учебное пособие для врачей. - Пенза, 2008. - 80 с.
Брем А. Жизнь животных / Предисловие и комментарии М. С. Галиной и М. Б. Корниловой. - М.: ОЛМА-ПРЕСС, ОАО «Красный пролетарий», 2004. - 1192 с.
Жигилёва О. Н. Гельминтофауна мышей (Apodemus agrarius, Mus musculus) селитебных и межселенных территорий Западной Сибири// Поволжск. экол. журн. - 2013. -№ 2. - С. 156-163.
Макариков А. А. Цестоды семейства Hymenolepididae Perrier, 1897 (Cyclophyllidea) грызунов азиатской части России: автореф. дисс...канд. биол. наук: 03 00 08 - зоология. - Новосибирск, 2008. - 21 с.
Макариков А. А., Гуляев В. Д. Pararodentolepis gen. n. - новый род цестод грызунов и описание Р. sinistra sp. n. (Cyclophyllidea: Hymenolepididae) // Паразитология. - 2009. - 43, 6. - С. 454 - 459.
Макариков А. А., Гуляев В. Д„ Кривопалов А. В. Nomadolepis (Cyclophyllidea, Hymenolepididae) — новый род цестод грызунов И Зоол. журн. - 2010. - 89,8. - С. 948 -955.
Макариков А. А., Ткач В. В. Морфологические и молекулярные подходы к ревизии рода Rodentolepis Spassky, 1954 (Cestoda, Hymenolepididae) // Систематика и экология паразитов: Труды Центра паразитологии ИПЭЭ им. А. Н. Северцова РАН. -М.: Тов-ство научных изданий, 2014. -48. - С. 170- 172.
Марушко Ю. В., Грачёва М. Г. Современное состояние проблемы гельминтозов у детей. Вопросы диагностики и лечения. - Современная педиатрия. - 2012. - № 3 (43). - С. 1-5.
220
Поляков В. Е, Иванова И. А., Полякова Н. Р. Гименолепидозы // Педиатрия. - 2006. - № 3. - С. 81 -86.
Садовниченко Ю. А. Класс Ленточные черви (Cestoda): Метод, указ, для самост. внеауд. работы студентов. - Харьков: ХНМУ, 2015.-24 с.
Семёнова Н. Е. Глава XIX. Гименолепидозы // Протозойные болезни, гельмииггозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: «Медицина», 1968. - С. 484 - 492. -(Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Спасский А. А. Гименолепидиды - ленточные гельминты диких и домашних птиц // Основы цестодо-логии. Под ред. акад. К. И. Скрябина. - М.: Изд-во АН СССР, 1963. - 2, часть 1. - С. 9.
Akisu Q., Aksoy CZ, inci A„ A$ikgoz Orhan V Investigation of intestinal parasites in school children living under low-social-economic conditions in Izmir // T. Parazitol. Derg. - 2001. - 24, 1. - P. 52 - 54.
Alruzug I. M., Khormi M. M, Alhanoot I. K. Hymenolepis папа human diagnosed through colonoscopy: A case report // J. Bacteriol. Parasitol. - 2016. - 7: 265. doi: 10.4172/2155-9597.1000265.
Alvarez-Fernander В. E., Rodriguez-Bataz E, Dlaz-Chiguer D. L, Mdrquiz-Navarro A. et al. Mixed Hymenolepis species infection in two family members: a case report from an urban area of Chilpancingo, Guerrero, Mexico I I Trop. Gastroenterol. - 2012. - 33, 1. - P. 83 - 84.
Andreassen J. Chapter 27 Intestinal tapeworms / Cox F. E. G., Kreier J. P., Wakelin D. (Eds). Topley and Wilson’s microbiology and microbial infections. - Oxford Univ. Press, 1998. - P. 521 - 537.
Andreassen J., Ito A., Ito M., Nakao M., Nakaya K. Hymenolepis microstoma', direct life cycle in immunodeficient mice 11 J. Helminthol. - 2004. - 78, l.-P. 1-5.
Astal Z. Epidemiological survey of the prevalence of parasites among children in Khan Younis governorate, Palestine // Parasitol. Res. - 2004. - 94, 6. - P. 449 -451.
Bacigalupo J. Evolution de ГHymenolepis fraterna Stiles, chez Pulex irritans L., Xenopsylla cheopis Rothschild et Ctenocephalus canis Curtis // Ann. Parasitol. - 1931. - 9. - P. 339 - 343.
Bajalan M. M. M. Epidemiological study of Hymenolepis папа in children in Kalar city / Sulaimani province 11 Diyala J. Pure Sci. - 2010. - 6, 4. - P. 272 - 286.
Baskerville M, Wood M., Newton С. M. Mebendazole for worming mice: effectiveness and site effects H Lab. Anim. - 1988. - 22. - P. 263 - 268.
Bear J. G., Tenora F. Some species of Hymenolepis (Cestoidea) from rodents and from primates // Acta Sci. Nat. Acad. Sci. Bohemoslovacae, Brno. - 1970. - 4. - P. 1 - 32.
Ben-Ismail R. [Evaluation of the activity of mebendazole in taeniasis caused by Hymenolepis папа in Tunisia] // Bull. Soc. Pathol. Exot. Filiales. - 1984. - 77, 3. - P. 363 - 368. (Article in French).
Blanchard R. Histoire zoologique et mddicale des t£niad£s du genre Hymenolepis Weinland. - Paris, 1891. -112 pp.
Cancrini G., Bartoloni A„ Nunez L, Paradisi F. Intestinal parasites in the Carniri, Gutierrez and Boyuibe areas, Santa Cruz Department, Bolivia // Parassitologia. - 1988. - 30, 2-3. - P. 263 - 269.
Casanova J. C., Santalla F., Durand P., Vaucher C., Feliu C., Renaud F. Morphological and genetic differentiation of Rodentolepis straminea (Goeze, 1752) and Rodentolepis microstoma (Dujardin, 1845) (Hymenolepididae) П Parasitol. Res. - 2001. - 87, 6. - P. 439 - 444.
Crompton D. W.T. How much human helminthiasis is there in the world? // J. Parasitol. - 1999. - 85, 3. - P. 397-403.
Cunningham L. J., Olson P. D. Description of Hymenolepis microstoma (Nottingham strain): a classical tapeworm model for research in the genomic era // Parasites & Vectors. - 2010. - 3. - P. 123. DOI: 10.1186/ 1756-3305-3-123.
Czaplinki B., Vaucher C, Family Hymenolepididae Ariola, 1899 // Keys to the cestode parasites of vertebrates / eds. L. F. Khalil, A. Jones, R. A. Bray. - Wallingford, U.K.: CAB Intern, 1994. - P. 595 - 663.
Dabo A., Sow А/. Y., Sangare L, Maiga I, Keita A. et al. Transmission de la schistosomose urbaine et pr£va-lence des helminthoses intestinales й Bamako, Mali // Bull. Soc. Pathol. Exot - 2003. - 96, 3. - P. 187-190.
Deaderick W. H. Hymenolepis папа and Hymenolepis diminuta, with report of cases // J. Am. Med. Ass. -1906.-47, 25.-P. 2087-2090. doi: 10.1001/jama. 1906.25210250041002.
Dhanabal J., Selvadoss P. P„ Muthuswamy K, Comparative study of the prevalence of intestinal parasites in low socioeconomic areas from South Chennai, India П J. Parasitol. Res. - 2014. doi: 10.1155/2014/630968.
Di Lernia V., Ricci C,, Albertini G, Skin eruption associated with Hymenolepis папа infection // Int. J. Dermatol. - 2004. - 43, 5. - P. 357 - 359.
Dujardin M, F. Histoire Naturelie des Helminthes ou vers intestinaux. - 1845. - 680 pp.
Dvorak J. A., Jones A. W., Kuhlman H H. Studies on the biology of Hymenolepis microstoma (Dujardin, 1845) // J. Parasitol. - 1961.-47, 5. -P. 833 - 838. doi. 10.2307/3275481.
221
El Fatni C, El Fatni EL, Romero D., Olmo F., Rosales M. J. Intestinal parasitism in Moroccan children: comparative quantative study of the Faust’s and Ritchie’ coprologic methods // Intern. J. Innovation a. Sci. Res. - 2014. - 11, 1. - P. 53 - 64. Accessed through: www.ijisr.issr-joumals.org.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 291 - 296.
Foronda P., Lopez-Gonzalez M., Hernandez M., Haukisalmi V., Feliu C. Distribution and genetic variation of hymenolepidid cestodes in murid rodents on the Canary Islands (Spain) // Parasites & Vectors. - 2011. - 4, 1:185. Accessed through: http://www.parasitesandvectors.eom/content/4/l/185.
Fortunato S., Castagna B., Monteleone M. R, Pierro R. et al. Parasite prevalence in a village in Burkina Faso: the contribution of new techniques // J. Infect. Dev. Ctries. - 2014. - 8, 5. - P. 670 - 675.
Gallegos R., Brousselle C. Intestinal parasitosis of inhabitants living in an Ecuatorian archipelago // Bull. Soc. Fr. Parasitol. - 1991. - 9, 2. - P. 219 - 223. (in French).
Gelaw A., Anagaw B., Nigussie B,, Silesh B. et al. Prevalence of intestinal parasitic infection and risk factors among schoolchildren at the University of Gondar Community School, Northwest Ethiopia: a cross-sectional study // BMC Public Health. - 2013. - 13: 304. Doi: 10.1186/1471-2458-13-304.
Gerber I. A case infection with Hymenolepis (Taenia) папа, the dwarf tapeworm // Boston Med. Surg. J. -1913.-168.-P. 346-348.
Goodchild C. G., Stullken R. E. Hymenolepis microstoma', cysticercoid morphologenesis // Trans. Am. Mi-crosc. Soc. - 1970. - 89, 2. - P. 224 - 229. doi: 10.2307/3224378.
Grassi G. B. Die Taenia папа und ihre medicinische Bedeutung // Centrbl. f. Bakteriol. u. Parasitenk. (Orig.) - 1887a. - 1,№ 4.-P. 97- 100. ’
Grassi G. B. Entwicklungscyclus der Taenia папа 11 Centrbl. f. Bakteriol. u. Parasitenk. (Orig.) - 1887b. - 2, № 11.-P. 305-312.
Grassi G. B., Rovelli G. R Ricerche embriologiche sui cestodi // Ann. Acad. Gionea, Catana. Sect. Nat. -1892. - 4.-P. 1-108.
Gilnduz T, Demirel M. M., Ingeboz T, Tosun S, Yereli K. Prevalence of intestinal parasitosis in children with gastrointestinal symptoms associated with socio-economic conditions in Manisa region И T. Parazitol. Derg. - 2005. - 29, 4. - P. 264 - 267.
Habbari K, TifnoutiA., Bitton G„ Mandil A. Intestinal parasitosis and environmental pollution: 143 pediatric in Beni-Mellal, Morocco // Tunis. Med. - 2000. - 78, 2. - P. 109-114.
Haukisalmi V., Hardman L. M., Foronda P., Feliu C, Laakkonen J. et al. Systematic relationships of hymenolepidid cestodes of rodents and shrews inferred from sequences of 28S ribosomal RNA // Zool. Scripta. -2010.-39.-P. 631 -641.
Ito A., Smyth J. D. Adult cestodes - Immunologt of the lumen-dwelling cestode infection / Immune responses in parasitic infections: Immunology, Immunopathology and Immunoprophylaxis. - Vol. 2. (Ed. Soulaby E. J. L.) - CRC Press, Boca Raton, Florida, 1987. - P. 115 - 163.
Joyeux C, Kobozieff N. I. Recherches sur ГHymenolepis microstoma (Dujardin, 1845) // Ann. Parasitol. -1928. - 6.-P. 59-79.
Kabana A., Cadrain G., Trevenen C., Jadavji T, Church D. L:Practice guidelines for ordering stool ova and parasite testing in a pediatric population. The Alberta Children’s Hospital // Am. J. Clin. Pathol. - 1995. -104.-P. 272-278.
Khalil H. M., El-Shimi S, Sarwat M. A., Fawzy A. F., El Sorougy A. O. Recent study of Hymenolepis папа infection in Egyptian children 11 J. Egypt. Soc. Parasitol. -1991.-21 l.-P. 293 - 300.
Kim B. J, Song К S, Kong H- H, Cha H.-J„ Ock M. Heavy Hymenolepis папа infection possibly through organic foods: Report of a case П Korean J. Parasitol. - 2014. - 52, l.-P. 85 - 87. doi: 10.3347/kjp. 2014.52.1.85.
Kim Т.-S., Cho S-H, Huh S, Kong Y., Sohn W.-M. et al. A nationwide survey on the prevalence of intestinal parasitic infections in the Republic of Korea, 2004 // Korean J. Parasitol. - 2009. - 47, 1. - P. 37 - 47. doi: 10.3347/kjp.2009.47.1.37.
Litchford R. G. Observations on Hymenolepis microstoma in three laboratoiy hosts: Mesocricetus auratus, Mus musculus, and Rattus novegicus // J. Parasitol. - 1963. - 49, 3. - P. 403 - 410. doi. 10.2307/3275808.
Maccioni F, Segundo H, Totino V., Gabrielli S, Rojas P. et al. Intestinal parasitic imfecions and associated epidemiological drivers in two rural communities of the Bo;ivian Chako // J. Infect. Dev. Ctries. - 2016. -10, 9. - doi: 10.3855/jidc/7657.
Macnish M. G., Morgan U. M., Behnke J. M., Thompson R C. Failure to infect laboratoiy rodent hosts with human isolates of Rodentolepis (^Hymenolepis) папа 11 J. Helminthol. - 2002. - 76, 1. - P. 37 - 43.
Macnish M. G., Ryan U.M., Behnke J. M., Thompson R. C. Detection of the rodent tapeworm Rodentolepis (^Hymenolepis) microstoma in humans. A new zoonosis? // Int. J. Parasitol. - 2003. - 33, 10. - P. 1079 -1085.
222
Margono S. S. Cestodes in man in Indonesia // Bui. Penelit. Kesehat. - 1989. - 17, 2. - P. 60 - 66.
Marseglia G. L., Marseglia A., Licari A., Castellazzi A. M., Ciprandi G. Chronic urticaria caused by Hymenolepis папа in an adopted girl //Allergy, - 2007. - 62, 7. - P. 821 - 822.
Marshall A. G. The cat flea, Ctenocephalides felis felis (Bouchd, 1835) as an intermediate host for cestodes //Parasitology. - 1967. -57, 3. -P. 419 - 430.
Mason P. R, Patterson B. A. Epidemiology of Hymenolepis папа infections in primary school children in urban and rural communities in Zimbabwe // J. Parasitol. - 1994. - 80, 2. - P. 245 - 250.
Mehraj И, Hatcher J., Akhtar S., Rafique G., Beg M. A, Prevalence and factors associated with intestinal parasitic infection among children in an urban slum of Karachi // PLoS ONE. - 2008. - 3, 11: e3680. doi: 10.1371/joumal.pone.0003680
Meloni В. P., Thompson R C. A., Hopkins R M., Reynolds on J. A., Gracey M. The prevalence of Giardia and other intestinal parasites in children, dogs and cats from Aboriginal communities in the Kimberley // Med. J. Australia. - 1993. - 158, 3. -P. 157 - 159.
Min D. Y. Cestode infections in Korea // Kisaengchunghak Chapchi. - 1990. - 28, Suppl. - P. 123 - 144.
Mirdha B. R, Samantray J. C. Hymenolepis папа: a common cause of paediatric diarrhoea in urban slum dwellers in India // J. Trop. Pediatr. - 2002. - 48, 6. - P. 331 - 334.
Muehlenbachs A., Bhatnagar J., Agudelo C. A., Hidron A., Eberhard M. L. et 13 others. Malignant transformation of Hymenolepis папа in a human host // N. Engl. J. Med. - 2015. - 373. - P. 1845 - 1852. DOI: 10.1056/NEJMoal505892.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 98 - 101.
Navarrete N., Torres P. Prevalence of infection by intestinal helminths and protozoa in school children from a coastal locality in the province of Valdivia, Chile 11 Bol. Chil. Parasitol. - 1994. - 49, 3-4. - P. 79 - 80 (Article in Spanish).
Nikolic A., Djurkovic-DJakovic O., Bobic B. [Intestinal parasitic infections in Serbia] // Srp. Arh. Celok. Lek. - 1998. - 126, 1-2. - P. 1 - 5. (Article in Serbian).
Omar M. S., Abu-Zeid H A., Mahfouz A. A. Intestinal parasitic infections in schoolchildren of Abha (Asir), Saudi Arabia // Acta Trop. - 1991. - 48, 3. - P. 195 - 202.
Pritchett K. R. Helminth parasites of laboratory mice / The mouse in biomedical research. 2nd ed. Vol. II. Diseases. - Eds. Fox J. G., Barthold S. W., Davisson M. T. et al. - Elsevier, Inc., 2007. - P. 551 - 564.
Railliet A. Treatise on medical and agricultural zoology. 2nd ed. Part 1. - Paris, 1893.
Ransom В. H An account of the tapeworms of the genus Hymenolepis parasitic in man, including several new cases of the dwarf tapeworm (Я. папа} in the United States H Hyg. Lab., U. S. Publ. Health & Mar.-Hosp. Serv., Wash., 1904. - Bull. 18. -P. 1 - 138.
Reynoldson J. A., Behnke J. M., Pallant L. J., Macnish M. G. et al. Failure of pyrantel in treatment of human hookworm infections (Ancylostoma duodenale} in the Kimberley region of North West Australia // Acta Tropica. - 1997. - 68, 3. - P. 301 - 312.
Rycke P. H De, van Grembergen G. Z. F. Development of the cestode of Hymenolepis microstoma (Dujardin, 1845) // Zeitschr. Parasitenk. - 1966. - 27, 4. - P. 350 - 354. doi. 10.1007/BF00260033.
Sotero P. P. P., Jara C. A. Prevalencia del enteroparasitismo en pacientes atendidos en el Laboratorio Quintanilla SRL., Trujillo (Peru): 2008 - 2012 // REBIOLEST. - 2014. - 2, 1: e29.
Steinmann P., Usubalieva J, Imanalieva C., Minbaeva G., StefiukK. et al. Rapid appraisal of human intestinal helminth infections among schoolchildren in Osh oblast, Kyrgyzstan H Acta Trop. - 2010. - 116, 3. - P. 178- 184. doi: 10.1016/j.actatropica.2010.06.008.
Tadesse G. The prevalence of intestinal helminthic infections and associated risk factors among school children in Babile town, east Ethiopia // Ethiop. J. Health Dev. - 2005. -19, 2. - P. 140 - 147.
Tjiong G. P., Sri Oemijali. Pengobatan hiperinfersi Hymenolepis папа dengan Quinacrine H J. Indones. Med. Ass. - 1968. - 18. - P. 20 - 22. (цит. no: Margono, 1989).
Tkach V. K, Makarikov A. A., Kinsella J. M. Morphological and molecular differentiation of Staphylocystis clydesengeri n. sp. (Cestoda, Hymenolepididae) from the vagrant shrew, Sorex vagrans (Soricomorpha, So-ricidae), in North America // Zootaxa. - 2013. - 3691 (3). - P. 389 - 400.
Vlasov E. A., Malisheva N. S, Krivopalov A. V. Helminth fauna of myomorph rodents (Rodentia, Myomor-pha) in the Central Chernozem State nature Reserve // Росс, паразитол. журн. - 2015. - № 4. - С. 24 - 33.
Voge М. Development of Hymenolepis microstoma (Cestoda: Cyclophyllidea) in the intermediate host Tribo-lium confusum // J. Parasitol. - 1964. - 50, 1. - P. 77 - 80. doi: 10.2307/3276032.
Ward H B. The parasitic worms of man and the domestic animals // Report of the Zoologist: Nebr. State Board of Agr., 1894. - Paper 9. - P. 225 - 348.
223
Небольшое резюме по данному разделу.
Напомню, что в справочно-информационной сводке «Медицинская гельминтология...» (www.worms-info.ru/ Cestoda) среди найденных у человека гименолепидид-ных цестод перечислено четыре вида из двух родов: Drepanidotaenia lanceolata, Hymenolepis diminuta, H. microstoma и H. папа. Однако, как показал анализ опубликованной к настоящему времени информации, в действительности у человека выявлены гименолепидиды шести видов из четырёх родов. К обозначенным выше родам Drepanidotaenia и Hymenolepis добавились род Pseudanoplocephala с видом Р. crawfordi, а также род Rodentolepis, в который перевели Hymenolepis microstoma и Н папа. И, наконец, указанный список дополнился пока не определённым до вида представителем рода Hymenolepis, выявленным у жительницы Тибета (Nkouawa et al., 2016).
Следует также подчеркнуть, что, судя по результатам молекулярногенетических, филогенетических и физиолого-биохимических исследований, которыми в последние годы охватывается всё большее число видов и родов гименоле-пидид, вполне возможен перевод Pseudanoplocephala crawfordi в род Hymenolepis, а Rodentolepis папа - в род Pararodentolepis, в который уже перевели Hymenolepis fraterna (напомню, что Н. fraterna долгие годы рассматривали вариететом и даже синонимом Hymenolepis папа).
Не исключено также, что учёный мир признает истинным паразитом человека не Hymenolepis diminuta, как это было принято считать все годы, а близкий ему вид Hymenolepis flavopunctata, ранее практически всеми исследователями относимый к синонимам Н. diminuta. Ссылки на соответствующие источники сделаны в разделе по ходу теста. Иными словами, приведённый выше список гименолепидид, которых когда-либо регистрировали у человека, никак нельзя рассматривать как окончательный, а в исследованиях этих гельминтов ещё рано ставить точку.
Среди перечисленных видов наиболее обычным паразитом человека является Rodentolepis (=Hymenolepis) папа, так называемый цепень карликовый, в распределении которого по разным странам и континентам трудно уловить какую-либо закономерность, кроме двух особенностей. Во-первых, чаще всего заражению подвержены дети, а во-вторых, паразит обычно встречается у жителей трущоб, густонаселённых городских кварталов, в условиях антисанитарии и низкого социально-экономического статуса населения. К группе риска относят также бездомных людей, чернорабочих мигрантов, беженцев (Juckett, 1995), что не может не насторожить в условиях нынешней социально-политической ситуации в мире.
Помимо фекально-орального пути заражения непосредственно яйцами упомянутого гельминта, существует реальная опасность заражения ими и через контаминированную пищу и воду, о чём неоднократно говорилось выше.
Что касается остальных представителей гименолепидид - это 5 видов -, зарегистрированных у человека, то заражение ими всё же следует признать случайным, несмотря даже на 500 зафиксированных случаев инвазии людей так называемым цепнем крысиным, Hymenolepis diminuta (500 случаев - за 175 лет наблюдений!).
Заражение этими гименолепидидами происходит с пищевыми продуктами, а также с водой, в которых случайно оказались чрезвычайно мелкие инвазирован-ные цистицеркоидами насекомые (у видов Hymenolepis, Pseudanoplocephala crawfordi, Rodentolepis microstoma) или ракообразные (у Drepanidotaenia lanceolata), или
224
же со случайным образом заглоченными насекомыми, что чаще всего характерно для детей.
Если оглянуться назад, вглубь веков, то мы увидим, что гименолепидидные цестоды сопровождают человека ещё с доисторических времён. В Бразилии, к примеру, яйца Rodentolepis {-Hymenolepis) папа обнаружились в копролитах, чей возраст составлял 4000 - 2000 лет (Gon?alves et al., 2003). В копролитах 1400-летнего возраста из пещеры Куэва-де-Чинито-Лос-Муэртос (Cueva de los Muertos Chiquitos) в Дуранго в Мексике встретились яйца Hymenolepis sp. (Jimenez et al., 2012). Ha Плато Колорадо (США) в пяти доисторических индейских памятниках были обнаружены яйца и личинки нескольких видов нематод и цестод, в том числе яйца ги-менолепидид (Reinhard et aL, 1987). Результаты исследований, о которых идёт речь в последнем из цитируемых источников, позволили его авторам сделать вывод о том, что охотники-собиратели были меньше заражены гельминтами, чем земледельцы.
Иными словами, проблема заражения людей гименолепидидами не нова, что, однако, не означает, что с этим следует смириться.
Учитывая особенности жизненного цикла гименолепидидных цестод, профилактика вызываемых ими у человека заболеваний в значительной степени базируется на решении вопросов санитарии и гигиены, в том числе на соблюдении соответствующих санитарных правил на предприятиях общественного питания, в местах торговли, складских помещениях, в детских учреждениях, о чём неоднократно говорилось выше. Нет крыс, мышей, блох, мух, тараканов - нет и источников инвазии и распространения паразитов. И, безусловно, ещё никто не отменял необходимость соблюдения правил личной гигиены. Немаловажную роль при этом играет санитарно-просветительская работа среди населения, прежде всего, в детских дошкольных и школьных учреждениях.
Цитируемая литература
Gongalves М. L. С., Araujo A., Ferreira L. F. Human intestinal parasites in the past: New findings and a review // Mem. Inst. Oswaldo Cruz, Rio de Janeiro. - 2003. - 98, Suppl. l.-P. 103-118.
Juckett G. Common intestinal helminthes И Am. Fam. Physician. - 1995. - 52, 7. - P. 2039 - 2048, 2051 -2052.
Jimenez F. A., Gardner S. L.t Araujo A„ Fugassa M., Brooks R. H. et al. Zoonotic and human parasites of inhabitants of Cueva de los Muertos Chiquitos, Rio Zape Valley, Durango, Mdxico // J. Parasitol. - 2012. -98, 2.-P. 304-309. doi: 10.1645/GE-2915.1.
Nkouawa A., Haukisalmi V., Li T., Nakao M., Lavikainen A. et al. Cryptic diversity in hymenolepidid tapeworms infecting humans // Parasitol. Intern. - 2016. - 65, 2. - P. 83 - 86.
Reinhard K. J., Hevly R. H, Anderson G. A. Helminth remains from prehistoric Indian coprolites on the Colorado Plateau // J. Parasitol. - 1987. - 73, 3. - P. 630 - 639.
225
Семейство Mesocestoididae Fuhrmann, 1907
Входит в состав отряда Cyclophyllidea. В монографической работе, посвящённой гельминтам человека, её автор (Faust, 1949; стр. 283) пишет: Family Mesocestoididae (Benham, 1901) Fuhrmann, 1907 emend. Byrd and Ward, 1943. В монографии A. H. Чертковой и Г. А. Косупко (1978) автор семейства Mesocestoididae - Perrier, 1897.
Описание (по: Черткова, Косупко, 1978; Rausch, 1994). Сколекс с 4 мускулистыми присосками, хоботок и крючья отсутствуют. Членики акраспедотного типа. Половые поры открываются медианно на вентральной стороне тела. Половая бурса медианная. Семенники многочисленные. Семяпровод сильно извитой, возле половой бурсы образует клубок петель, входит в бурсу, где переходит в циррус. Вагина от половой клоаки направляется вперёд в виде широкой прямой трубки, затем поворачивает и, образовав ряд петель с одной из латеральных сторон бурсы, проходит к центру членика, где спускается до уровня яичников и соединяется с яйцеводом. Яичники и желточники двойные, находятся в задней половине членика. Матка сначала в виде узкой замкнутой трубки; ещё в зрелых гермафродитных члениках около её задней части начинает формироваться парутеринный (околоматочный) орган, в который постепенно переходят яйца из матки. В конечном итоге мешковидная часть матки редуцируется, а парутеринный орган принимает округлую форму, образуя толстостенную капсулу с пальцевидным придатком. Паразиты тонкого кишечника млекопитающих, реже птиц. Типовой род - Mesocestoides Vaillant, 1863.
Семейство немногочисленное, в его составе всего 2 рода. В жизненном цикле мезоцестоидид участвуют два промежуточных хозяина. Первый из них - членистоногие, возможно, жуки-копрофаги, второй - рептилии, амфибии или птицы и мелкие млекопитающие, содержащие личинку, так называемый тетратиридий (te-trathyridium; в русскоязычной литературе часто встречается неверное латинское написание этого термина - tetratyridium). Тетратиридий представляет собой личинку, у которой невооружённый, с 4 присосками и относительно длинным хвостовым придатком сколекс ввёрнут наподобие пальца перчатки; хвостовой пузырёк отсутствует (рис. 112, А). Тетратиридии примечательны своей способностью к бесполому размножению путём почкования и продольного деления (рис. 112, Б).
Рис. Тетратиридии Mesocestoides'. Л - от разных хозяев и Б - бесполое размножение (из: Черткова, Косупко, 1978 - по разным авторам)
226
К слову. Впервые название Tetrathyridium ввёл в научную литературу Карл Рудольфи (Rudolphi, 1819), и на протяжении столетия многих личинок цестод, находимых в разных позвоночных - млекопитающих, птицах, рептилиях, амфибиях, описывали под этим названием как самостоятельные виды. В 1920-е годы была доказана идентичность тетратиридиев с видами рода Mesocestoides. Недавно для тетратиридиев было предложено новое название - мероцеркоид, merocercoid (Chervy, 2002).
Тетратиридии у разных хозяев часто встречаются при значительной интенсивности инвазии и могут оказывать патогенное влияние на их организм.
У человека зарегистрированы представители рода Mesocestoides.
Род Mesocestoides Vaillant, 1863
Диагноз рода соответствует таковому семейства. Типовой вид - Mesocestoides lineatus (Goezs, 1782) Railliet, 1893.
Анализируя многочисленные литературные и собственные данные по Mesocestoides, А. Н. Черткова и Г. А. Косупко (1978) пришли к выводу об исключительной запутанности систематики цестод данного рода и отсутствии достоверной информации об особенностях их жизненного цикла. Учитывая большую вариабельность морфометрических признаков видов Mesocestoides, цитируемые авторы предложили при их определении использовать такие параметры, как длина цирруса и форма половой бурсы, расположение семенников, форма и положение женских половых желез в совокупности с второстепенными признаками и данными по экологии и географии этих цестод.
Через 33 года в статье, опубликованной коллективом авторов (Коняев и др., 2011), читаем: «Систематика рода Mesocestoides Villant, 1863 (опечатка в тексте, в действительности Vaillant - АГ) до сих пор остаётся слабо разработанной» и далее «Жизненный цикл мезоцестоидесов остаётся не полностью расшифрованным и, по-видимому, включает окончательного, промежуточного, дополнительного и факультативных резервуарных хозяев, причём промежуточный хозяин неизвестен» (стр. 38).
О том, что род требует тщательной ревизии, основанной на исследовании типового материала, пишут и многие зарубежные коллеги, например, Д. Боумэн с соавт. (Bowman et al., 2002; стр. 200): «However, this genus is in need of a careful revision based on the examination of type material».
Род Mesocestoides - немногочислен, но практически космополит (не известен только в Австралии). Среди его дефинитивных хозяев - в основном представители семейств Canidae, Felidae, Mustelidae, Procyonidae, Sciuridae, Ursidae и другие плотоядные животные.
Во всех публикациях, посвящённых вопросам паразитирования цестод у человека, упоминаются два представителя Mesocestoides - М. lineatus и М. variabilis Muller, 1928. А. Н. Черткова и Г. А. Косупко (1978) отнесли М. variabilis к синонимам М. lineatus, а для М. variabilis Muller, 1928 sensu Byrd et Ward, 1943 из опоссума обосновали новый вид Mesocestoides didelphus (Черткова, Косупко, 1977). Тем не менее, во всех источниках, опубликованных после 1978 г., среди регистрируемых у человека Mesocestoides по-прежнему фигурирует М. variabilis (см. далее).
Mesocestoides lineatus (Goeze, 1782) Railliet, 1893 (рис. ИЗ, 114). Вид впервые описан в 1782 г. в Германии на материале от дикой кошки (Felis sylvestris) под названием Taenia lineata (Goeze, 1782), и только через 100 лет его перевели в род Mesocestoides (Railliet, 1893). Латинское lineatus можно перевести как выпрямленный, испещрённый полосками, полосатый. Давняя история открытия М. lineatus
227
lineatus, отсутствие достаточно чётких видовых критериев, широкое распространение, обширный круг хозяев - всё это нашло отражение в том количестве видов-синонимов, которые в настоящее время имеет данный вид. Одни авторы (Черткова, Косупко, 1978; Gubanui, Eszterbauer, 1998) отмечают у М. lineatus 14 синонимов, другие (Bowman et al., 2002) - 21.
Рис. 113 Mesocestoides lineatus из собаки. Слева: 1 - сколекс; 2 - срез через половую бурсу и вагину; 3 - молодые гермафродитные членики; 4 - зрелый гермафродитный членик; 5, 6 -половая бурса; справа: 1 - 4 - развитие матки и формирование яйцевой капсулы (из: Черткова, Косупко, 1978; оригинальный материал авторов)
Рис. 114 Mesocestoides lineatus (слева - зрелый членик, справа - маточный членик): c.s. - бурса цирруса; е. s. - паруте-ринный мешок; ov. - яичник; t. - семенники; ut. -матка; v.d. - семяизвергательный канал; vit. - желточники (из: MOnnig, 1934 - по: Baylis, 1929)
Описание (по разным авторам). Цестоды от молочно-белого до красноватожёлтого цвета, длиной до 1.5 м, но обычно 35 - 65 см; максимальная ширина не превышает 3 мм. Молодые проглоттиды почти квадратные, у маточных члеников длина больше ширины. Семенники круглые или овальные, их число варьирует от
228
28 до 83. Половая бурса 0.081 - 0.253 х 0.066 - 0.209 мм, лежит косо по отношению к брюшной поверхности. Циррус длиной 0.170 - 0.246 мм. Мужское половое отверстие и вагина открываются в воронкообразное углубление половой бурсы; половая пора в центре вентральной поверхности членика. Овальные желточники лежат у заднего края членика, ближе к его вентральной стороне. Яичники неправильноовальной формы, расположены ближе к дорсальной стороне. Вагина поднимается выше уровня апорального края бурсы, затем поворачивает и спускается в область желточных протоков. Яйца овальные, с тонкой прозрачной оболочкой, размером 39 х 29 (Hamann, 1885), 31 - 34 х 24 - 29 (Kamegai et al., 1967), 26 - 32 (Черткова, Косупко, 1978), 28.2 - 31.7 х 20.1 - 24.1 (Eom et al., 1992), 35 x 27 pm (Cho et al., 2013), содержат эмбрион с 6 зародышевыми крючками. Г. Мённиг (Monnig, 1934) приводит для этого вида более крупные размеры яиц: 40 - 60 х 35 - 43 pm.
Цикл развития М. lineatus полностью не расшифрован. Более всего неясностей в отношении той личиночной стадии, которая развивается в первом промежуточном хозяине - членистоногих, каковые практически не известны. Имеющиеся в литературе фрагментарные данные по биологии Mesocestoides довольно проблематично отнести к какому-либо конкретному виду данного рода (Черткова, Косупко, 1978) из-за отсутствия чётких определительных признаков для идентификации личинок на стадии тетратиридиев. Неоценимую помощь в этом вопросе должно оказать применение молекулярно-генетических методов (Коняев и др., 2011; Padgett, Crosby, 2013).
Среди дефинитивных хозяев М. lineatus - псовые (собаки, енотовидная собака, лисица обыкновенная, корсак, песец, волк, шакал), кошачьи (кошки домашняя, европейская дикая, степная или пятнистая, барханная, камышовая, дальневосточный лесной кот, рыси, каракал, тигр), куньи (барсуки, горностай, ласка, колонок, куницы лесная и каменная, росомаха, хорьки) и многие - многие другие, в том числе и грызуны. А. Н. Черткова и Г. А. Косупко (1978), сопоставив цестод из грызунов с экземплярами из собак и кошек, высказали мнение, что грызуны не являются естественными хозяевами для М. lineatus, поскольку выявляемые у них черви заметно угнетены и в большинстве случаев не достигают зрелости.
В организме дефинитивных хозяев половозрелые цестоды локализуются в тонком отделе кишечника. Тетратиридии обнаруживаются практически в любом участке тела животных, но чаще всего в брюшной полости, а также в грудной полости, стенках кишечника, пищевода, кровеносных сосудов, в диафрагме, лёгком, зобной железе, печени, средостении, иногда их можно обнаружить в мышцах.
Заражённость животных и половозрелыми червями, и тетратиридиями в естественных условиях довольно высока. При гельминтологическом обследовании некоторых представителей семейства псовых на западе Ирана уличные собаки оказались заражены на 26.5, лисица обыкновенная - на 81.82, а шакал - на 70 % (Dalimi et al., 2006). В провинции Карс (Турция) цестоду выявили у 60 % обследованных особей лисицы обыкновенной (Gicik et al., 2009), а в биосферном заповеднике «Аскания-Нова» (Украина) - у 72 % лисиц при интенсивности инвазии 1-315 экз. (Звегинцева и др., 2007). В Армении личинок М. lineatus обнаружили у 26.6 % особей ящерицы прыткой, или обыкновенной, 20 % ящерицы средней, или трёхлинейчатой, 42.8 % змееголовки стройной при интенсивности инвазии 80 - ПО экз. (Arakelyan, 2014). И. Н. Дубина (2013), сотрудник Витебской государственной академии ветеринарной медицины (Беларусь), сообщил о регистрации тетратиридиев
229
M. lineatus у кроликов (0.64 %), зайцев (4.16), серых крыс (17.7), мышей лесной (5.5), домовой (5.26) и белой (16.21), а также морской свинки (3.34 %). Автор не приводит информации, где и при каких обстоятельствах были выявлены цестоды у перечисленных животных, - в природных или экспериментальных условиях. В любом случае приведённые данные свидетельствуют о возможности участия в жизненном цикле М. lineatus многочисленных представителей грызунов, в том числе из числа обитающих в окружении человека, что не может не насторожить, учитывая зоонозное значение данного вида.
Впервые о заражении человека М. lineatus стало известно в 1942 г.: цестода была выявлена в Японии у 36-летнего жителя Тойохаси (Kosaka, 1942). Сообщение о втором подобном случае появилось только через 20 лет (Ito et al., 1962). На этот раз инвазию обнаружили у 51-летней женщины, у которой после приёма камалы вышел полностью развитый червь. К слову, в Японии 1960-е годы вообще были «богаты» на сообщения об обнаружении мезоцестоидесов у человека в самых разных уголках страны: в Нагойе - у 42-летнего мужчины (Morisita et al., 1964), в Токио - у 31-летнего мужчины (Hagihara et al., 1964), в префектуре Сайтами (Miyagi et al., 1965), вновь в Токио - у 30-летнего ресторатора и его 57-летней матери (Kamegai et al., 1967). В 1972 - 1975 гг. опять появились публикации о заражении человека мезоцестоидесами (все статьи на японском языке), в 1983 г. было описано ещё два случая (Nagase et al., 1983; Ohtomo et al., 1983a, 1983b), а к 1992 г. их количество достигло 14 (см.: Eom et al., 1992).
В 1954 г. стало известно о заражении человека мезоцестоидесом в Астриде (с 1962 г. Бутаре или Бютар - разные переводы Butare) на территории бывшей Ру-анда-Урунди в Африке (Fain, Herin, 1954). Источником инвазии были куропатки.
В 1967 г. описан первый случай обнаружения М. lineatus у человека в Корее (Choi et al., 1967), через 25 лет - второй (Eom et al., 1992). Однако именно этот второй случай заслуживает того, чтобы остановиться на нём подробнее. 45-летний работник птичьей фермы в течение нескольких месяцев испытывал периодические абдоминальные боли, голодные боли, головокружение; в его стуле почти ежедневно обнаруживалось множество маленьких, похожих на семена сезама «червей». После приёма 2 г никлозамида у него выделилось 32 червя, но без сколекса, чья длина достигала 71 см, а ширина 2 мм, размеры свободных проглоттидов составляли 2.1 -2.25 х 1.25 - 1.43 мм. Такого количества мезоцестоидесов у человека ни ранее, ни впоследствии ни разу не находили. По словам пострадавшего, он обычно ест сырые внутренности цыплят, которые, скорее всего, и стали источником его заражения.
В 1988 г. появилось сообщение о первой находке М. lineatus у человека в Китае (Fan, Sun, 1988), через 3 года - ещё об одной (Jin et al., 1991).
И, наконец, в литературе упоминается о заражении человека этим гельминтом в Шри-Ланке (Muller, 2002).
Если принять точку зрения ряда специалистов о том, что М. variabilis является синонимом М. lineatus (Черткова, Косупко, 1978; www.aavp.org; GBIF -www.gbif.org;Iberfauna.mncn.csis.es), то здесь следовало бы привести информацию и о встречаемости «М. lineatus» у людей в США. Однако практически во всех зарубежных источниках, даже датируемых 2000-ми годами (Ashford, Crewe, 2003; Fuentes et al., 2003; Ubelaker et al., 2014), M. variabilis фигурирует как самостоятельный вид, по этой причине приведу его краткое описание.
230
Mesocestoides variabilis Muller, 1927 (рис. 115). Вид впервые описан на материале от скунсов пятнистого и малого, а также от лисицы серой из Калифорнии (MUller, 1927). Видовое название variabilis — изменчивый, переменный подчёркивает присущую виду вариабельность его признаков.
Рис. 115 Mesocestoides variabilis: А - сколекс с четырьмя присосками; В - участок зрелого членика; С - маточный членик с парутеринным органом; D - Е- тетратиридии (из: Faust, 1949 - по: А - MUller, 1927; В, С- Byrd, Ward, 1943; D,E- Witenberg, 1934) (с - бурса цирруса; gp - половая пора; ov - яичник; ро - парутеринный орган; sg - тельце Мелиса; sv -семенной пузырёк; t - семенник; ut - матка; va - вагина; vd - семяпровод; vit - желточник; vit d - желточный проток).
Примечание к рисунку: Э. Фауст приводит фрагменты рисунка М. variabilis (В, С) из работы (Byrd, Ward, 1943); однако именно на этом материале А. Н. Черткова и Г. А. Косупко (1978) описали новый вид Mesocestoides didelphus.
Типовые экземпляры этого вида варьировали в длину от 5 до 8 см при максимальной ширине до 1 мм и состояли из 400 члеников. Экземпляры, описанные А. Чандлер (Chandler, 1942), достигали в длину 40 см при ширине 1.5 - 1.8 мм. Маточные проглоттиды 1.7 - 2.5 х 1.25 - 1.6 мм. Далее приведу описание вида из работы Э. Фауста (Faust, 1949). Маленький сколекс, 0.35 - 0.40 х 0.47 - 0.6 мм, отделён от шейки чёткой перетяжкой и снабжён относительно крупными глубокими присосками. Шейка длиной 7-10 мм. Половые железы лежат медианно к паре внутренних продольных экскреторных сосудов. Половая пора медианная дорсальная, примерно в одной трети длины членика от его проксимального конца. В проглоттидах
231
насчитывается от 45 до 55 семенников, расположенных на каждой стороне сегмента вентрально к главному экскреторному каналу. Циррус мускулистый, окружён простатическими железами и является продолжением наружного семенного пузырька. Яичник в задней части членика. Пара желточников лежит слегка латераль-но к наружному участку каждой доли яичника. Парутеринный орган размером 0.4 -0.53 х 0.32 - 0.36 мм. Яйца размерами 24 - 26 х 20 - 22 цт.
Паразит широко распространён у плотоядных на территории Северной Америки. В частности, его находили здесь не только у отмеченных выше животных (Muller, 1928), но и у лисицы американской, койота, рыси рыжей (Voge, 1953), у енота (Cole, Shoop, 1987), кошек (15 %) (Shoop et al., 1991), корсака американского (29 %) (Ubelaker et al., 2014) и ряда других животных. Тетратиридии данного вида были выявлены у ящерицы северной аллигаторовой, игуаны западной заборной, сцинка полосатого, змеи стройной подвязочной, гремучника зелёного (Voge, 1953).
Примечательно, что первое сообщение об обнаружении М. variabilis у человека появилось, как и в случае с М. lineatus, в 1942 г., правда, в другом, западном, полушарии (Chandler, 1942). В США в восточном Техасе у 13-месячной девочки, в течение нескольких недель страдавшей от болей в животе и плохого аппетита, после лечения выделились, по меньшей мере, 4 червя длиной до 40 см.
Всё последующие находки М. variabilis у человека также отмечались в США и только у детей: в Миссури (Gleason, Healy, 1967), Нью-Джерси (Gleason et al., 1973), Огайо (Gutierrez et al., 1978), Миссисипи (у 17-месячного малыша) (Hutchison, Martin, 1980), Калифорнии (Schultz et al., 1992), Луизиане (Fuentes et al., 2003).
Остановлюсь на последнем, седьмом по счёту, случае, имевшем место летом 1998 г. (Fuentes et al., 2003). После приёма разовой дозы празиквантела (10 мг кг’1) у 19-месячного ребёнка выделилась стробила, которая состояла из 35 члеников, имевших размеры 2.35 - 2.45 х 1 - 1.23 мм. В проглоттидах насчитывалось по 18 - 80 семенников диаметром 19.9 - 42.7, размер яичника составлял 48.4 - 91.2 х 34.2 - 76.9, желточников 34.2 - 48.4 х 28.5 - 34.2, бурсы цирруса 114 - 228 х 105.4 -206.4, парутеринного органа 298.7 х 275.7 - 287.2 цт. Поскольку мезоцестоидесов, найденных у людей в США во всех шести предыдущих случаях, определяли как М. variabilis, то и обнаруженного у малыша из Луизианы гельминта авторы (Fuentes et al., 2003), как они сами пишут об этом, также отнесли к данному виду.
В разговоре с матерью ребёнка выяснилось, что незадолго до инцидента она приготовила кейджинские колбаски с внутренностями диких животных (семья жила в пригороде и промышляла охотой). Кейджинские колбаски готовят по местному рецепту (мясо с овощами и рисом) и часто едят на ходу с крекерами. В данном случае колбаски первоначально держали в холодильной камере, а затем уже заморозили при -20°С. Заражение ребёнка могло произойти только до заморозки продукта. У остальных членов семьи заражение отсутствовало.
Итак. Судя по официальным сообщениям, к настоящему времени в мире зарегистрировано около 40 случаев заражения человека мезоцестоидесами (Mehlhom, 2016). Однако, вполне возможно, что многие случаи остаются неопубликованными, и поэтому данная цифра не отражает полной картины.
Что касается видового состава отмеченных у человека Mesocestoides, то встречающиеся в литературе разночтения лишний раз убеждают в необходимости
232
тщательной ревизии данного рода. К настоящем}' времени подтверждена валидность только четырёх видов Mesocestoides - М. lineatus, М. litteratus (Batsch, 1786), М corti Hoppli, 1925 (=Л/ vogae Etges, 1991) и M. canislagopodis (Rudolphi, 1810) на основании сравнительного анализа их морфологических признаков и молекулярных данных (см. Skimisson et al., 2016). Возможно, что ревизия видового состава Mesocestoides внесёт и определённые коррективы в географию регистрируемых у человека мезоцестоидесов. К примеру, в ряде работ (напр., Ashford, Crewe, 2003; Fuentes et al., 2003; Muller, 2002) среди районов обнаружения у человека М. variabilis указана Гренландия, тогда как в этом регионе одним из широко распространённых паразитов песцов является М. lineatus (Kapel, Nansen, 1996). Кстати, единственный источник, содержащий информацию о находке М. variabilis у человека в Гренландии, это - монография А. Чандлер 1949-го года (Chandler, 1949).
Судя по опубликованным данным, М. lineatus зарегистрирован у людей в Японии, Китае, Корее, Шри-Ланке и Руанде, а М. variabilis - в США и Гренландии. При этом в восточном регионе практически все пациенты были взрослыми людьми, а в западном - дети, начиная с полуторагодовалого возраста.
Тем не менее, признаки инвазии и у взрослых, и у детей проявляются практически одинаково - болями в животе, тошнотой, рвотой, диареей, головокружением и ощущением тяжести в голове, слабостью, к которым у детишек прибавлялись анемия, общее истощение и капризность. При изгнании мезоцестоидесов из кишечника человека отмеченные выше неприятные симптомы прекращались.
Диагноз на заражение мезоцестоидесами ставили по обнаружению в фекалиях пациентов зрелых члеников цестоды.
В качестве антигельминтных средств в описанных выше случаях применялись самые разные препараты - атебрин, паромомицина сульфат, магния сульфат, никлозамид, камалу, битинол, празиквантел.
Что касается источника инвазии людей мезоцестоидесами, то во многих случаях ими становились кровь, печень, жёлчный пузырь, сердце змей, лягушек или черепах, употребляемые в странах Востока в сыром виде с лечебной целью или в качестве тонизирующего средства. Например, в упомянутом выше случае обнаружения М. lineatus у ресторатора и его матери в Токио (Kamegai et al., 1967) оба в течение нескольких лет употребляли в пищу в сыром виде кровь, сердце и жёлчный пузырь полоза малочешуйчатого лазающего (соответственно 20 и 30 экз.) и щитомордника обыкновенного (10 и 20 экз.).
В других случаях, как мы видели, заражение происходило вследствие употребления недоброкачественно приготовленной домашней пищи из мяса диких млекопитающих или птиц (Fain, Herin, 1954; Fuentes et al., 2003) или же внутренностей птиц в сыром виде (Eom et al., 1992).
И последнее. В Международной классификации болезней 10-го пересмотра МКБ-10 (ICD-10, Version: 2016) заболеванию, вызываемому цестодами рода Mesocestoides, присвоен код В71.9.
Цитируемая литература
Дубина И. Н. Стресс как механизм неспецифической адаптации при развитии личиночных цестодозов животных // Наук, npaui Швден. ф!л. Нац. ун-ту 6iopec. i природокористування Украши КАУ. Сер.: Вег. науки. - 2013. - Вип. 151. - С. 182 - 190. http://nbuv.gov.ua/UJRN/Npkau_2013_151_32.
233
Звегинцева Н. С., Думенко В. П., Вароди Э. И. Гельминты лисицы обыкновенной (Vulpes vulpes) из биосферного заповедника «Аскания-Нова» (Украина) // Вести, зоол. - 2007. - 41, 2. - С. 153 - 157.
Коняев С. В., Есаулова Н. В., Найденко С. В., Давыдова О. Е,, Лукаревский В. С. и др. Обнаружение Mesocestoides paucitesticulus Sawada et Kugi, 1973 у азиатского барсука {Meles leucurus) на территории России // Рос. паразитол. журн. - 2011. - № 4. - С. 35 - 40.
Черткова А. И., Косупко Г. А. Ревизия цестод подотряда Mesocestoidata Skrjabin, 1940 II Труды Все-союзн. института гельминтологии. - 1977. - 23. - С. 139-151.
Черткова А. Н, Косупко Г. А. Подотряд Mesocestoida Skrjabin, 1940 / Тетработрииды и мезоцестоида-ты - ленточные гельминты птиц и млекопитающих // Основы цестодологии. - Отв. ред. К. М. Рыжиков. - М.: Наука, 1978. - 9. - С. 118 - 229.
Arakelyan М. Helminthes of some reptiles from Republic of Armenia // NAS of Armenia Elect. J. Nat. Sci. -2014. -1 (22). - P. 50 - 54. www.researchgate.net/publication/268632618.
Ashford R W., Crewe W. The parasites of Homo sapiens'. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - P. 61.
Baylis H A manual of helminthology, medical and veterinary. - Baillidre, Tindall and Cox, London, 1929.
Bowman D. D., Hendrix C. M.t Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-P. 199-204.
Byrd E. E., Ward J. W. Observations on the segmental anatomy of the tapeworm Mesocestoides variabilis Mueller, 1928, from the opossum // J. Parasitol. - 1943. - 29, 3. - P. 217 - 226.
Chandler A. C. First case of human infection with Mesocestoides // Science. - 1942. - 96, no. 2483. - P. 112.
Chandler A. C. Introduction to Parasitology. 8th ed. - N. Y.: John Wiley & Son, 1949. - Цит. no: Fuentes et al., 2003.
Chervy L. The terminology of larval cestodes or metacestodes // Syst. Parasitol. - 2002. - 52, l.-P. 1 - 33.
Cho S.-H, Kim T.-S, Kong Y., Na B.-K, Sohn W.-M. Tetrathyridia of Mesocestoides lineatus in Chinese snakes and their adults recovered from experimental animals // Korean J. Parasitol. - 2013. - 51. 5. - P. 531 -536. DOI: https://doi.org/10.3347/kjp.2013.5L5.531.
Choi W.Y., Kim В. C, Choi H. S. The first case of human infection with tapeworms of the genus Mesocestoides in Korea H Korean J. Parasitol. - 1967. - 5, 2. - P. 21 - 23.
Cole R. A., Shoop W. I. Helminths of the raccoon (Procyon lotor) in western Kentucky // J. Parasitol. - 1987. -73, 4.-P. 762-768.
Dalimi A., Sattari A., Motamedi G. A study on intestinal helminthes of dogs, foxes and jackals in the western part of Iran H Vet. Parasitol. - 2006. - 142, 1-2. - P. 129 - 133.
Eom К S, Kim S. H, Rim H J. Second case of human infection with Mesocestoides lineatus in Korea // Korean J. Parasitol. - 1992. - 30, 2. - P. 147 - 150.
Fain A., Herin V. Notes й propos d’un cas d’infestation humaine par un Mesocestoides й Astrida (Ruanda-Urundi) // Ann. Soc. Belg. Med. Trop. - 1954. - 34. - P. 893 - 900.
Fan S. Q., Sun M. F. First case of Mesocestoides lineatus in China // Chinese J. Parasitol. & Parasit. Dis. -1988. - 64, 4. - P. 310. (in Chinese).
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 283 - 285.
Fuentes M. V., Galan-Puchades M T., Malone J. B. N new case report of human Mesocestoides infection in the United States П Am. J. Trop. Med. Hyg. - 2003. - 68, 5. - P. 566 - 567.
Gicik K, Kara M„ Sari B„ Kili$ K., Arslan M. 0. Intestinal parasites of red foxes (Vulpes vulpes) and their zoonotic importance for human in Kars Province П Kafkas Univ. Vet. Fak. Dery. - 2009. - 15, l.-P. 135 -140. Doi: 10.9775/kvjd.2008.109-A.
Gleason N. N, Healy G. R. Report of a case of Mesocestoides (Cestoda) in a child in Missouri // J. Parasitol. - 1967.-53, l.-P. 83-94.
Gleason N. N., Kornblum R., Walzer P. Mesocestoides (Cestoda) in a child in New Jersey treated with Nick-losamide (Yomesan*) П Am. J. Trop. Med. Hyg. - 1973. - 22, 6. - P. 757 - 750.
Goeze J. A. E. Versuch einer Naturgeschichte der Eingeweide - wilrmer tierscher Korper. - Blankenburg, 1782.-471 pp.
Gubanyi A., Eszterbauer E. Morphological investigation of Mesocestoides (Cestoda, Mesocestoididae) species parasitizing Vulpes vulpes in Hungary H Misc. Zool. Hung. - 1998. - 12, l.-P. 11-19.
Gutierrez Y., Buchino J. J., Schubert W. K. Mesocestoides (Cestoda) infection in children in the Unites States H J. Pediatr. - 1978. - 93, 2. - P. 245 - 247.
Hagihata T., Amaki K, Okayasu D., Nakashima S. et al. Two cases of curious helminthiasis (Mesocestoidia-sis and Mansoniasis) // Japan. Med. J. - 1964. - 2088. - P. 24 - 27. (in Japanese).
Hamann 0. Taenia lineata Goeze, eine Taenie mit flachenstandigen Geshlechtsoffungen // Z. wiss. Zool., Leipzig. - 1885. - 42. - P. 718 - 744.
234
Hutchison W. F., Martin J. B. Mesocestoides (Cestoda) in a child in Mississippi treated with paromomycin sulfate (humatin) // Am. J. Trop. Med. Hyg. - 1980. - 29, 3. - P. 478 - 479.
Ito J., Honda J., Ishigoro M. The second record of a case of human infection with Mesocestoides lineatus (Cestoda) in Japan // Japan. J. Parasitol. - 1962. - 11, 2. - P. 5 - 9. (in Japanese).
Jin L. G.t Yi S. H, Liu Z. The first case of human infections with Mesocestoides lineatus (Goeze, 1782) in Jilin Province // J. Norman Bethune Univ. Med. Sci. - 1991. - 4. - P. 360 - 361.
Kamegai S.t Ichihara A., Nonobe H, Machida M. The 6th and 7th records of human infection with Mesocestoides lineatus (Cestoda) in Japan // Res. Bull. Meguro Parasit. Mus. - 1967. - l.-P. 1-17.
Kapel C. M.t Nansen P. Gastrointestinal helminths of Arctic foxes (Alopex lagopus') from different bioclima-tological regions in Greenland /! J. Parasitol. - 1996. - 82, 1. - P. 17 - 24.
Kosaka S. The first record of human infection with Mesocestoides lineatus in Japan // likken Shokakibyogaku Zasshi. - 1942. - 17. - P. 405 - 408. (in Japanese).
Mehlhorn H. Human parasites. Diagnosis, treatment, preventation. - Springer, 2016. - P. 201.
Miyagi T., Hurusawa K, Oshima T.t Wakeshima T., Ozu S. et al. A case of human infection with Mesocestoides (?) // Japan. J. Parasitol. - 1965. - 14, 7, - P. 613 - 614. (in Japanese).
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - P. 94 - 95.
Morisita T., Kobayashi M., Goto M., Eguchi T. et al. The third record of a case of human infection with Mesocestoides lineatus (Cestoda) in Japan // Japan. J. Parasitol. - 1964. - 13, 2. - P. 1-4. (in Japanese with English summary).
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 103.
Miiller J. F. Two new species of the genus Mesocestoides // Trans. Amer. Microsc. Soc. - 1927. - 46. - P. 294.
Muller J. F. The genus Mesocestoides in mammals П Zool. Jahrb., Jena Syst. Abt. - 1928. - 55, 5-6. - P. 403 -418.
Nagaso K., Nani A., Totani T., Hamamoto T., Torikai K. Report of a human case of Mesocestoides lineatus and preliminary investigation into infective sources // Japan. J. Parasitol. - 1983. - 32 (Suppl.). - P. 18.
Ohtomo H, Hioki A.t Ito A., Kagei N, Hayashi S. The 13th human case of the infection with Mesocestoides lineatus in Japan treated with paromomycin sulfate // Jap. J. Antibiotics. - 1983a. - 36. - P. 1490 - 1493. (in Japanese).
Ohtomo H, Hioki A., Ito A., Kajita K, Ishizuka T. et al. [Therapeutic effect of paromomycin sulfate on the 13th case of Mesocestoides lineatus infection found in Japan] // Jap. J. Antibiotics. - 1983b. - 36, 3. - P. 632 - 637. (in Japanese with English summary).
Padgett K. A,, Crosby P. R. 25. Mesocestoides / Molecular detection of human parasitic pathogens. - Ed. Liu D. - CRC Press, 2013. - P. 277 - 285.
Railliet A. Traite de zoologie medicale et agricole. - Paris, 1893. - P. 310 - 315.
Rausch R, L, Family Mesocestoididae Fuhrmann, 1907 I Keys to the Cestode parasites of vertebrates. Ed. L. F. Khalil, A. Jones, R. A. Bray. - Wallingford, UK: CAB Intern., 1994. - P. 309 - 314.
Rudolphi C. A. Entozoorum synopsis cui accedunt mantissa duplex et indices locupletissimi. - Berolini, 1819. -P.514.
Schultz L. J., Roberto R. R.t Rutherford G. W,t Hummert B., Lubell I. Mesocestoides (Cestoda) infection in a California child // Ped. Infect. Dis. J. - 1992. - 11. - P. 332 - 334.
Shoop W. L„ Haines H W., Michael B. F, Eary С. H, Endris R. G. Molineus barbatus (Trichostrongylidae) and other helminthic infections of the cat in Arkansas // J. Helminthol. Soc. Wash. - 1991. - 58, 2. -P. 227 - 230.
Skirnisson K, Jouet D., Ferte H, Nielsen O. F. Occurrence of Mesocestoides canislagopodis (Rudolphi, 1810) (Krabbe, 1865) in mammals and birds in Iceland and its molecular discrimination within the Mesocestoides species complex // Parasitol. Res. - 2016. March 2016 DOI: 10.1007/s00436-016-5006-5.
Ubelaker J. E., Griffin B. S., Mendoza К. M., Duszynski D. W., Harrison R. L, Distributional records of helminths of the swift fox (Vulpes velox) from New Mexico // Southwest. Naturalist. - 2014. - 59, l.-P. 129 -132. doi: http://dx.doi.Org/10.1894/N07-JC-73.l.
Vaillant L. Sur deux helminthes cestoides de la genette // Inst. Paris. - 1863. - 31. - P. 87 - 88.
Voge M. New host records for Mesocestoides (Cestoda: Cyclophyllidae) in California // The American Midland Naturalist. - 1953. - 49, 1. - P. 249 -251.
Witenberg G, Studies on the cestode genus Mesocestoides 11 Arch. zool. itaL, Torino. - 1934. - 20. - P. 467 -508.
235
Семейство Taeniidae Ludwig, 1886
Семейство входит в состав отряда Cyclophyllidea (Jones et al., 1994).
Описание (по: Абуладзе, 1964; Rausch, 1994). Стробила крупная, лентовидная, с многочисленными проглоттидами, или же тонкая, с несколькими члениками. Сколекс, как правило, небольших размеров, с 4 мускулистыми присосками. Хоботок хорошо развит, обычно с короной из двух рядов крючьев и с эпифизом. Крючья имеют типично тениидную («taeniid») форму, которая очень похожа на головку молотка-гвоздодёра. Крючья одного ряда меньше, чем другого. Крючья служат для прикрепления паразита к слизистой оболочке кишечника хозяина, чему способствует также секрет находящихся в сколексе желез. Шейка, как правило, хорошо выражена. Длина зрелых члеников значительно превышает их ширину. В каждом сегменте один набор половых органов. Половые поры латеральные, неправильно чередующиеся. Семенники многочисленные, занимают поле преимущественно впереди женских половых желез. Яичник медианный, двудольчатый. Желточная железа компактная, медианная, находится позади яичника. Матка обычно с многочисленными ответвлениями. Яйца с тёмно-коричневой оболочкой, сформированной из многочисленных маленьких усечённых блоков; при выходе во внешнюю среду содержат личинку с 6 крючьями. Типовой род - Taenia Linnaeus, 1758.
Жизненный цикл тениид уникален, поскольку для его прохождения необходимы только млекопитающие животные. Дефинитивный хозяин - хищные млекопитающие, в основном, псовые и кошачьи, в тонком кишечнике которых развивается взрослая особь паразита, чьи яйца или зрелые проглоттиды с яйцами вместе с фекалиями хозяина попадают во внешнюю среду. Проглоттиды могут выделяться из кишечника пассивно, вместе с экскрементами, или же активно выползать из анального отверстия и даже передвигаться на определённые расстояния. Промежуточный хозяин - животное, поедающее онкосферы или зрелые проглоттиды, содержащие яйца. Это, прежде всего, грызуны, зайцеобразные, парнокопытные, в организме которых формируется личиночная стадия паразита. У многих видов тениид лярвоцисты способны размножаться в промежуточном хозяине бесполым путём, тем самым увеличивая интенсивность его инвазии. Иногда один и тот же организм может быть и окончательным, и промежуточным хозяином, например, Taenia solium L., 1758 - у человека или же Echinococcus granulosus (Batsch, 1786) - у собак. Подобное наблюдается в том случае, если у животного или человека - носителя взрослых цестод - содержимое кишечника вместе с находящимися в нём онкосферами по тем или иным причинам попадает в желудок.
В разное время в состав семейства включали разное количество родов, поскольку одни исследователи признавали существование только нескольких родов, а другие, напротив, множили их количество. К. И. Абуладзе (1964), например, рассматривал в семействе 13 родов. После многочисленных ревизий в настоящее время в нём числится 4 рода с 54 валидными видами (Lavikainen, 2014). В справочноинформационной сводке «bug.tamu.edu/research/collection/.../Family/ Taeniidae.txt» в семействе оставлены всего 2 рода - Taenia и Echinococcus Rudolphi, 1801.
Несмотря на свою немногочисленность, тенииды, тем не менее, одна из наиболее важных в практическом отношении групп цестод. Среди них имеется ряд весьма опасных паразитов человека, а также домашних и промысловых животных,
236
причём большинство тениид оказались общими для диких жвачных и сельскохозяйственных животных. Некоторые из этих гельминтов, как на взрослой стадии, так и на личиночной, вызывают у человека очень тяжёлые заболевания, даже могущие привести к летальному исходу.
Непосредственную опасность для здоровья человека представляют виды из трёх родов тениид - Taenia, Echinococcus Rudolphi, 1801 и Hydatigera Lamarck, 1816. Род Multiceps Goeze, 1782, упоминаемый во многих публикациях в числе тениид, патогенных для человека и полезных животных, в настоящее время отнесён к синонимам рода Taenia (Rausch, 1994; Lavikainen, 2014).
Цитируемая литература
Абуладзе К. И. Тениаты - ленточные гельминты животных и человека и вызываемые ими заболевания И Основы цестодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1964. - 4. - 530 с.
Jones A., Bray R.A., Khalil L.F. Order Cyclophyllidea van Beneden in Braun, 1900 / Khalil L.F., Jones A., Bray R.A. (eds.). Key to the cestode parasites of vertebrates. - CAB Int., Wallingford, 1994. - P. 305- 307.
Lavikainen A. A taxonomic revision of the Taeniidae Ludwig, 1886 based on molecular phylogenies: Academic dissertation. - University of Helsinki, 2014. - 64 pp.
Rausch R. L, Family Taeniidae Ludwig, 1886 / Khalil L. F., Jones A., Bray R. A. (eds.). Keys to the cestode parasites of vertebrates. - CAB Int., Wallingford,.1994. - P. 665 - 672.
Род Taenia Linnaeus, 1758
Ещё в Древней Греции известные философы и естествоиспытатели Гиппократ, Аристотель, Теофраст для обозначения неких плоских червей, предположительно Taenia solium, встречающихся у человека, употребляли названия (в переводе с греческого): Helmins Plateia -плоский червь или Tainia, Taenia - ленточный червь. Тем не менее, официально род Taenia, как таксономическая единица, был обоснован только в 1758 г. знаменитым шведским естествоиспытателем Карлом Линнеем. Более подробно с историей открытия рода Taenia и его типового вида Taenia solium можно ознакомиться в монографии по истории гельминтологии человека «А History of Human Helminthology» (Grove, 1990). В последующие десятилетия с постоянным открытием новых видов цестод в роде Taenia оказались многие формы, далеко отстоящие друг от друга в систематическом отношении. В результате род фактически стал сборным, что наглядно иллюстрирует, например, тот факт, что в настоящее время род Taenia насчитывает 25 синонимов (Абуладзе, 1964), а 32 вида Taenia были переведены в другие роды, принадлежащие к иным семействам и даже отрядам (Bray, 2015). В упомянутой выше справочно-информационной сводке «bug.tamu.edu/research/collection/.../Family/Taeniidae» у рода Taenia перечислено почти 50 синонимов.
Описание (по: Абуладзе, 1964; Rausch, 1994; Verster, 1969). Средне- или крупноразмерные, иногда мелкие цестоды с характерными чертами семейства. Хоботок вооружён двумя рядами хитиновых крючьев, в редких случаях ряд один или крючья отсутствуют. Шейка имеется. Половые поры неправильно чередующиеся. Семенники многочисленные, сливаются впереди женских половых органов, расположенных в задней части членика. Терминальный участок половых протоков проходит между продольными экскреторными каналами, у некоторых видов - вентрально к ним. Матка в виде продольного ствола с многочисленными боковыми ответвлениями. Лярвоциста в виде вооружённого цистицерка, ценура, фимбриоцерка или стробилоцерка. Типовой вид - Taenia solium Linnaeus, 1758.
Жизненный цикл тений протекает по общей схеме, характерной для тениид, и к настоящему изучен более чем у 80 % представителей рода (Hoberg, 2006).
237
Taenia - космополитный род, распространённый повсеместно. Тем не менее, в Южной Америке он представлен только одним эндемичным видом (Rossin et al., 2010), а в Австралии и некоторых регионах Океании отсутствует (Grove, 1990; Loos-Frank, 2000).
В соответствии с недавно опубликованными таксономическими сводками, род объединяет 40 валидных видов (см.: Lavikainen, 2014). Однако, судя по последним публикациям (Haukisalmi et al., 2016), нас по-прежнему ждут открытия новых видов Taenia, и названную цифру никак нельзя считать окончательной. Род выглядит монофилетическим, но генетически разнообразен; к тому же, в нём имеется несколько субкладов с неясным таксономическим положением (Lavikainen, 2014).
Взрослые формы тений вызывают у животных и человека заболевание те-ниоз, тениазис (taeniasis), тениозис (taeniosis), а их личиночные формы, метацесто-ды, - ценурозы (coenurosis) и цистицеркозы (cysticercosis).
Существующие разночтения относительно состава семейства Taeniidae и собственно рода Taenia затрудняют определение истинного количества видов данного рода, зарегистрированных у человека. В монографии Э. Фауста (Faust, 1949), например, перечислены 5 видов Taenia, паразитирующих у человека: Т. solium, Т. africana v. Linstow, 1900, Т. confusa Ward, 1896, T. saginata Goeze, 1782 и T. taeniae-formis (Batsch, 1786), в сводной работе «Worms and Human Diseases» (Muller, 2002) - 8 видов: T. solium, T. brauni (Setti, 1897), T. crassiceps (Zeder, 1800), T. glomeratus (Railliet et Henry, 1915), T. longihamatus (Morishita et Sawada, 1966), T. multiceps Leske, 1780, T. saginata и T. serialis (Gervais, 1847), в справочно-информационной сводке «Медицинская гельминтология. Полный перечень из 384 гельминтов...» (www.worms-info.ru/Cestoda) - 4: Т. solium, Т. saginata, Т. saginata asiatica, Т. tae-niaeformis, а отдельные авторы (Craig, Ito, 2007; Hoberg, 2006) вообще называют только 3 вида тений у человека: Т. solium, Т. asiatica Eom et Rim, 1993 и T. saginata.
Определённо можно сказать только одно: до тех пор, пока не будет окончательно установлен статус многих видов и родов тениид, говорить о точном количестве и составе видов Taenia - паразитов человека не приходится. Достаточно сказать, к примеру, что род Multiceps, цитируемый во многих публикациях и электронных базах данных, в настоящее время почти все авторы рассматривают синонимом Taenia, а род Hydatigera, ранее сведённый в синонимы Taenia, равно как и его вид Н. taeniaeformis (^Taenia taeniaeformis), считаются валидными. Упоминаемые Э. Фаустом (1949) Т. africana и Т. confusa являются синонимами Т. saginata, Т. brauni одни исследователи считают самостоятельным видом, другие - подвидом Т. serialis, а Т. longihamatus отнесён к синонимам Н. taeniaeformis.
Опираясь на классическую работу К. И. Абуладзе (1964), посвящённую те-ниатам, мы будем всё же придерживаться взглядов на систематический состав семейства Taeniidae и рода Taenia в соответствии с последними разработками ведущих специалистов по данной группе цестод (Hoberg, 2006; Lavikainen, 2014; Loos-Frank, 2000; Rausch, 1994).
Taenia solium Linnaeus, 1758 (рис. 116-119). Э. Фауст (Faust, 1949), ссылаясь на P. Лейкарта (R. Leuckart), пишет, что видовое название solium происходит от сирийского термина schuschl — цепочка, которое, в свою очередь, уходит корнями к арабскому слову susl или sosl, затем трансформированному в латинское solium. По его мнению, в данном случае это название не имеет никакого отношения к латинскому solus - единственный, отдельный. Паразит человека.
238
Рис. 117 Taenia solium'. 1 - крючья; 2 - гермафродитный членик; 3 - зрелый членик (из: Абуладзе, 1964)
Рис. 116 Taenia solium\ 1 - сколекс; 2 - зрелый членик; 3 яйцо (из: Faust, 1949; 7 - 2 - по разным авторам)
Рис. 119 Taenia solium, сколекс (из: ru.wikipeida.org. Свиной солитёр. Википедия)
Рис. 118 Taenia solium, сколекс (из: Muller, 2002)
239
Рис. 120 Taenia solium: 1 - общий вид червя; 2 -мышечная ткань свиньи с цистицерками; 3 - цис-тицерк; 4 - сколекс (из: Verrill, 1870)
Описание (по: Абуладзе, 1964; Шульман, Лейкина, 1968; Faust, 1949; Monnig, 1934; Verster, 1969). Стробила достигает 1.5 - 3 м в длину и 1 - 2 мм в ширину. По данным Г. Мённига (Monnig, 1934), длина цепня свиного составляет 3-5, в редких случаях - до 8 м. Сколекс диаметром 0.6 - 2 мм, с 4 крестообразно расположенными, слегка выступающими чашеобразными присосками диаметром 0.4 -0.5 мм. Верхушка сколекса с хоботком, вооружённым двойной короной из чередующихся крупных и мелких крючьев, число которых равно 22 - 32. Длина крупных крючьев 0.16-0.18, мелких - 0.093 - 0.14 мм. Имеется небольшая нерасчле-нённая шейка. В стробиле насчитывается до 1000 члеников. В передней части стробилы ширина члеников превышает их длину, в средней части стробилы они становятся почти квадратными, а маточные членики имеют удлинённо-прямоугольную форму. Маточные проглоттиды размером 10-12x5-6 мм (M6nnig, 1934). Половые поры с мощным сфинктером, неправильно чередующиеся. Семенники многочисленные, расположены в дорсальном участке членика, в каждом членике их до 150 - 200. По другим данным, в каждом членике насчитывается 375 - 575 семенников (Verster, 1969) или 350 - 600 (Flisser, 2013). Яичник состоит из трёх долей -двух симметричных крупных и одной дополнительной на стороне половой поры. Желточники в виде мелких фолликулов, располагающихся узкой эллиптической полосой у заднего края членика позади оотипа. Матка, как и у всех цепней, закрытого типа, т.е. не имеет выводного отверстия, состоит из центрального ствола с 7 -16 (обычно 9) боковыми ответвлениями и содержит 30 000 - 50 000 яиц. Яйца сферические или субсферические, диаметром 31-43 цт; по другим данным, размеры яиц составляют 29 - 34 (Verster, 1969) или 26 - 34 pm (Flisser, 2013). Яйца с толстой, радиально исчерченной оболочкой (рис. 116).
Жизненный цикл свиного цепня, как у всех тениид, включает смену двух хозяев (рис. 121).
240
Рис. 121 Схема жизненного цикла Taenia solium (из: Абуладзе, 1964)
Окончательным хозяином цепня свиного является человек, а промежуточным - свиньи, значительно реже - человек и другие приматы, ещё реже - овцы, собаки, грызуны.
Взрослые особи паразита поселяются в тонкой кишке человека, преимущественно в его передних двух пятых. По мере созревания от стробилы отделяются фрагменты, состоящие из 5 - 6 члеников, которые выделяются наружу с фекалиями заражённого человека. Следует подчеркнуть, что проглоттиды цепня свиного не обладают самостоятельной активностью. При отрыве членика через
его разрушенный передний край часть яиц из матки может выдавливаться, попадая в кишечник хозяина. Яйца в члениках содержат уже сформированную личинку, у которой нет необходимости в дозревании во внешней среде.
Онкосферы цепня свиного отличает устойчивость к воздействию неблагоприятных факторов внешней среды (Чебышев и др., 2012). В частности, они способны переносить высыхание до 10 месяцев или перезимовать под снегом при колебаниях температуры от 4 до -38°С, оставаясь жизнеспособными. Более чувствительны онкосферы к высоким температурам: в воде при 65°С они погибают через 3 мин. Летом на поверхности почвы под действием солнечных лучей их гибель наступает в пределах 2 дней, но под защитой растительности они сохраняют жизнеспособность до 40 дней. Под действием 5 % раствора карболовой кислоты онкосферы погибают за 10 ч, в 10 - 20 % растворе лизола - за 6 - 8 ч, а в 10-20% растворе хлорной извести - в течение 5 - 6 ч (см. обзорную работу: Поляков и др., 2004).
Промежуточные хозяева заражаются с пищей или же водой при заглатывании члеников и/или онкосфер. В кишечнике промежуточного хозяина онкосферы освобождаются от оболочки, с помощью крючьев внедряются в слизистую и проникают в кровеносные сосуды. Далее по кровотоку они разносятся по всему организму, чаще всего оседая в мышцах шеи, языка, конечностей, в головном мозге, передней камере и стекловидном теле глаз, реже - в лёгких, сердце, печени, брюшной полости, где в течение 2.5-4 месяцев из них сформировываются инвазионные лярвоцисты, так называемые цистицерки - Cysticercus cellulosae (Gmelin, 1790).
Инвазия свиней, особенно в неблагоустроенных хозяйствах, часто бывает очень высокой, поскольку этим животным свойственна копрофагия, в результате чего они заглатывают целые проглоттиды с десятками тысяч яиц.
241
Цистицерк (рис. 122, 123) представляет собой широкий, овальный, заполненный жидкостью пузырь беловатого цвета с втянутым сколексом, вооружение которого уже соответствует таковому взрослой особи. Размеры пузыря составляют 6-20 х 5 - 10 мм.
Рис. 122 Цистицерк Taenia solium с втянутым в пузырь сколексом (из: Faust, 1949)
Рис. 123 Цистицерки Taenia solium (из:
MOnnig, 1934)
Продолжительность жизни цистицерков в организме свиньи достигает 3-6 лет, после чего они сморщиваются и погибают. Личинки цепня свиного могут паразитировать и у человека, вызывая у того тяжёлое заболевание - цистицеркоз.
Окончательный хозяин заражается при проглатывании цистицерков. В двенадцатиперстной кишке человека под действием жёлчи и пищеварительных ферментов сколексы выворачиваются из пузырьков и при помощи крючьев прикрепляются к слизистой оболочке кишечника. Через 2-3 месяца формирование стробилы завершается, и от неё начинают отделяться проглоттиды, заполненные зрелыми яйцами. Общая продолжительность жизни цепня свиного в кишечнике человека точно не установлена; тем не менее, все исследователи пишут о нескольких годах. Впрочем, данная ситуация вполне объяснима, т.к. при выявлении заражения обычно предпринимаются все меры для изгнания паразита из организма больного.
Т. solium уже давно известен как паразит человека. О нём упоминали, в частности, древнегреческие философы Аристофан и Аристотель, которые, говоря о личинках цепня, образно сравнивали их с градинами. В 16 веке учёные подтвердили заражение людей личиночными стадиями червя, а в 19 веке было показано, что оно связано с поеданием мяса свиньи, поражённого личинками этого гельминта. Поскольку свинья, точнее, мясо свиньи является основным источником инвазии человека, то в англоязычной научно-справочной и справочной литературе Т. solium получил название pig tapeworm, а в русскоязычной - свиного цепня (солитёра) или вооружённого цепня (из-за наличия крючьев на сколексе).
Заражение людей цепнем свиным регистрируют во всех странах и регионах, где развито свиноводство: в Индии, Пакистане, Казахстане, Северном Китае, странах Юго-Восточной Азии, в том числе в Индонезии, Лаосе, Вьетнаме, Корее, Таиланде, Камбодже, Японии, в странах Латинской Америки и Африки, в Европе - Беларуси, в западных областях Украины, в Молдове, Литве, Латвии, Эстонии, Польше, Чехии, Болгарии, Испании, Португалии и др. (Бессонов, 1996; Поляков и др., 2004; Чебышев и др., 2012; Шульман, Лейкина, 1968; Anantaphruti et al., 2007; Assana et al., 2013; Domey et al., 2004; Flisser, 2002; Ito et al., 2003, 2005, 2006; Joshi et al., 2012; Margono et al., 2006; McManus, 1995; Michelet et al., 2010; Min, 1990; Verster, 1969; Willingham et al., 2010; Yamagida et al., 2012; Ziaei et al., 2011 и мно-гие-многие другие).
242
Например, в Кении, Эфиопии, ДР Конго от цистицеркоза страдает примерно 10 % населения, а на Мадагаскаре - 16 % (http:www.who.int/Zoonoses/diseases /taeniasis). К слову, на Мадагаскаре в регионах с высоким уровнем развития животноводства распространённость цистицеркоза достигает 21 %, при этом на острове присутствуют афроамериканский и азиатский генотипы Taenia solium (Michelet et al., 2010).
Первый случай заражения человека цистицерком Т. solium в Латинской Америке был выявлен в 1901 г., в Мексике, а в настоящее время это заболевание регистрируют во многих латиноамериканских странах примерно у 1 - 9 % населения (Flisser, 2002).
В большинстве стран Юго-Восточной Азии встречаются 3 вида Taenia - Т. solium, Т. saginata и Т. asiatica, при этом в некоторых регионах среди них доминирует цепень свиной. Так, на западе Таиланда доля Т. solium составила 45.8 % от общего числа выявленных случаев заражения местного населения тениями (Апап-taphruti et al., 2007). В одном пациенте может паразитировать от 1 до 6 экз. Т. solium, при этом более 2 экз. цестод отмечается более чем у трети больных. Иногда в одном и том же хозяине одновременно паразитируют Т. solium и Т. saginata.
Как тениоз, так и цистицеркоз, вызываемые Т. solium, широко распространены в Индонезии, особенно в Папуа, на Бали и Северной Суматре (Margono et al., 2006; McManus, 1995). Наиболее высокие показатели заражённости местного населения фиксируют в Папуа, где, например, в 1991 - 1995 гг. инвазия была выявлена у 1120 из 15939 жителей, при этом у 293 из них заболевание сопровождалось эпилептическими припадками (Margono et al., 2006).
В Японии наибольшее количество случаев было зафиксировано в годы Второй Мировой войны, в 1936 - 1945 гг. (225 случаев). Затем их количество резко уменьшилось и за 1986 - 1993 гг. было выявлено всего 15 случаев (Araki, 1994). Тем не менее, специалисты высказывают опасения относительно возможного роста в стране заболеваемости людей цистицеркозом, что, по их мнению, обусловлено несколькими социальными и демографическими причинами. Прежде всего, с начала 21 столетия количество иностранных резидентов в Японии увеличилось с 1.4 до 2.2 млн. Одновременно увеличилась численность японцев, продолжительность пребывания которых за рубежом превышает 3 месяца, - с 430 тыс. до 760 тыс. И, наконец, вырос поток зарубежных туристов в эту страну (Yamagida et al., 2012).
На территории России ежегодно наблюдается до 500 случаев заражения людей цистицерками цепня свиного, при этом примерно 5 - 7 % из числа инвази-рованных приходится на долю детей. Более всего заболевших наблюдается среди работников свиноводческих хозяйств и мясокомбинатов, а также домохозяек (см.: Поляков и др., 2004).
Медицинские работники с тревогой отмечают регистрацию тениоза и нейроцистицеркоза у людей в регионах, неэндемичных по тениозу (Abu Salem, Hassan, 2003; Hira et aL, 2004; Ito et al., 2006; Schantz et al., 1992). При этом заболевание фиксируют даже тех в странах и общинах, где употребление свинины - основного источника инвазии людей цистицерками цепня свиного - запрещено по религиозным канонам. Подобная инвазия, к примеру, была выявлена в исламском Кувейте: здесь у 16 пациентов обнаружилось поражение мозга, а у 6 - центральной нервной системы (Hira et al., 2004), описан также случай перитонита, спровоцированного цепнем, поселившимся в тонком кишечнике человека (Abu Salem, Hassan, 2003).
243
Роль человека в жизненном цикле Т. solium двояка. С одной стороны, при попадании в его организм цистицерков он является дефинитивным хозяином паразита, а с другой, при заглатывании яиц цестоды, - промежуточным. В первом случае у человека развивается заболевание, получившее название тениоза (тениазис, тениозис), а во втором - цистицеркоза (цистицеркозис).
Взрослые формы Т. solium вызывают у человека заболевание, одним из основных клинических проявлений которого является нарушение функций желудочно-кишечного тракта, протекающее с токсико-аллергической реакцией и диспепти-ческими расстройствами. При этом у больных в основном наблюдаются нарушение аппетита, тошнота, рвота, ощущение препятствия в горле, схваткообразные боли в животе, неустойчивый стул, зуд в области анального отверстия, периодические головные боли, головокружение, обморочные состояния, нарушение сна (Поляков и др., 2004; Чебышев и др., 2012). Подобные явления могут сопровождаться механической кишечной непроходимостью, аппендицитом, холангитом, панкреатитом. Иногда наблюдается перфорация кишечной стенки (Abu Salem, Hassan, 2003; Khan, 2007; Narayan Shrihari et al., 2011). Клинические проявления тениоза могут начаться уже через 2-3 недели после заражения, хотя встречается и бессимптомное течение заболевания (Поляков и др., 2004).
Диагноз на заражение взрослыми формами цепня ставится на основании обнаружения в испражнениях яиц и/или зрелых члеников цестоды, которые отделяются группами по 5 - 6 экз., реже поодиночке. В последние годы для выявления заражения цепнем свиным, а также его цистицерками широко применяют серологические методы (Levine et al., 2004; Margono et al., 2006; McManus, 1995).
Дифференциальная диагностика тениоза проводится с обтурационной формой кишечной непроходимости, острой инвагинацией тонкого кишечника, острым аппендицитом (Поляков и др., 2004).
Человек, выделяющий с фекалиями членики и яйца гельминта, представляет реальную опасность как источник заражения и для окружающих лиц, и для возможных промежуточных хозяев паразита, главным образом, свиней. К тому же, человек - носитель взрослых форм цестоды рискует заразиться и её цистицерками, поскольку яйца гельминта, попавшие в его желудок, например, при рвоте, наблюдающейся в подобных случаях, далее развиваются по тому же сценарию, что и в промежуточном хозяине. Показано, к примеру, что 15 - 25 % пациентов с диагнозом нейроцистицеркоза, или раньше или в момент заболевания были поражены те-ниозом (Garcia et al., 2005).
Заражение человека цистицерками цепня свиного проявляется разнообразными симптомами в зависимости от локализации личинок и их количества. Например, при небольшой интенсивности инвазии цистицеркоз мягких тканей может протекать бессимптомно. При подкожном паразитировании цистицерков, обычно натруди и спине человека, наблюдаются мягкие одиночные или множественные узлы, которые после гибели личинок уплотняются и становятся болезненными.
Глазной цистицеркоз отмечают у 13 - 46 % инвазированных пациентов (Vashist, Ahuja, 2000). Поражение глаз сопровождается воспалением, болью и может закончиться частичной или полной потерей зрения (Ziaei et al., 2011). Говоря о глазном цистицеркозе, нельзя не упомянуть о находках в глазах людей ювенильных форм Т. solium (Joshi et al., 2012). В цитируемой статье её авторы описывают обнаружение молодых особей названного вида у 48-летнего индуса и 38-летнего не
244
пальца. Первый из них, живущий в предгорьях Гималаев, поступил в клинику с жалобами на покраснение, боль и постепенную потерю зрения левым глазом. При обследовании в переднем сегменте глаза были обнаружены абсцесс и крупный подвижный лентоподобный червь, прикрепившийся присосками к радужной оболочке. Червя вместе с кусочком оболочки удалили хирургическим путём. У второго пациента, поступившего в клинику с жалобами на прогрессирующую в течение 2 месяцев потерю зрения и покраснение левого глаза, при обследовании обнаружились значительный зрачковый дефект, умеренное воспаление передней камеры, а в задней камере - крупное субретинальное кистоподобное образование с ввёрнутым сколексом, вызвавшее отслоение сетчатки. Кисту удалили, но у больного продолжался воспалительный процесс, несмотря на высокие дозы пероральных кортикостероидов. На 12-й день после операции в передней камере глаза обнаружился живой, резко извивающийся червь, которого также удалили хирургическим путём.
Наиболее опасно поражение головного мозга, при котором в мозговой ткани формируются цистицерки, или как их называют, финны, диаметром до 5 - 15, а в мозговых желудочках- до 30 - 50 мм, сдавливающие мозговую ткань. И хотя неврологические симптомы иногда отсутствуют (Fleury et al., 2006) или слабо выражены, у ряда пациентов нейровоспаления приводят к тяжёлой форме болезни (Adalid-Peralta et al., 2012; Domenici et al., 1995). В зависимости от локализации цистицерков в головном мозге инвазия сопровождается головными болями, повышенным краниальным давлением, на фоне которого может развиться гипертензи-онный синдром, эпилептиформными припадками, психическими расстройствами, протекающими с нарушением сознания, галлюцинациями, аментивным синдромом, при котором у больного наблюдается бессвязность мышления и речи, хаотичность движений. Полагают, что именно заражение цистицерками цепня свиного является наиболее важной причиной приобретённой эпилепсии в развивающихся странах, а, возможно, и в мире (Garcia et al., 2007; Margono et al., 2006). Летальность от нейроцистицеркоза может достигать 16.4 - 25.9 % (Takaynagui, Leite, 2001).
Диагностика поражения цистицерками Т. solium осуществляется с помощью компьютерной и магнитно-резонансной томографии, а также с использованием серологических и молекулярно-генетических методов (Ito et al.. 2005; McManus, 1995; Oka et al., 1996; Sako et al., 2000). При внутриглазной локализации цистицерк хорошо виден при биомикроскопии или офтальмоскопии как прозрачное кистозное образование с лёгкой жемчужной окраской.
Лечение больных тениозом проводят в стационарных условиях с соблюдением гигиенического режима и специальной обработкой фекалий. Препарат первой линии - празиквантел (18 мг • кг'1), тогда как никлозамид отличается низкой эффективностью - 70 - 90 % (De et al., 1998). Поскольку при однократном курсе ни один препарат всё же не гарантирует 100 % положительного эффекта, а стробила может регенерировать через 1-4 месяца, то диспансерное наблюдение пациента продолжают в течение 4 месяцев. После этого периода при наличии отрицательного результата анализа на яйца цепня пациента снимают с учёта (Поляков и др., 2004).
Что касается лечения церебрального цистицеркоза, то, как выяснилось, и альбендазол (15 мг • кг'1 в течение 20 дней), и празиквантел (30 мг • кг'1 в течение 10 дней) в данном случае обладают относительно низкой эффективностью, и большинству пациентов приходится проходить повторный курс лечения (De et al.,
245
1998). Фактически же удаление цистицерков из мозга или глаза возможно только хирургическим путём (Dic.academic.ru).
Как известно, заражение человека цистицерками Т. solium происходит при употреблении в пищу слабо просоленного, недоваренного или недожаренного мяса, в основном домашних свиней, а также диких кабанов. Так, в Таиланде основным источником заражения людей являются блюда пет chua и пет chao (Domey et al., 2004). Основу, к примеру, пет chua составляет очень мелко порубленное мясо говядины и свинины, к которому добавляют сахар, соль, чеснок и чили, а затем в течение суток выдерживают в холодильнике для ферментации. Мясо подают в виде сформированных брикетиков, которые едят с рисом. В приготовленном таким образом мясе цистицерки не погибают. Более того, показано, что при 0°С они сохраняют жизнеспособность в течение 6 недель, но погибают, как только при заморозке мяса промораживается жидкость в пузыре цистицерка (Monnig, 1934).
Учитывая высокую устойчивость цистицерков цепня свиного к низким температурам, обеззараживание свиных туш методом замораживания производят при более жёстком температурном режиме. Температуру в толще туши необходимо довести до -10°С и выдержать тушу при температуре воздуха в камере -12°С в течение 10 суток.
Как уже отмечено, человек может заразиться не только цистицерками паразита, но и его яйцами, что возможно как при самозаражении, так и при приёме загрязнённой пищи, зелени или при питье воды, в которой могли оказаться яйца цестоды. Например, яйца тениид были обнаружены на зелени, продаваемой на пригородном рынке в Ханое, Вьетнам (Uga et al., 2009). Из числа опрошенных взрослых жителей этой деревни более 80 % удобряли огороды не только экскрементами животных, но и нечистотами, тем самым фактически создавая благоприятные условия для циркуляции инвазионного начала в природе (Uga et al., 2009).
Загрязнение почвы фекалиями, свободное перемещение домашних свиней, низкий уровень социально-экономического развития и отсутствие осведомлённости местного населения относительно путей заражения человека и опасности этих заболеваний играют важную роль в сохранении очагов тениоза и цистицеркоза, вызываемых Т. solium, в африканских странах (Assana et al., 2012).
В равной степени образ жизни и социально-экономические аспекты являются основополагающими в сохранении и даже расширении границ распространения тениоза и цистицеркоза в той части Папуа, которая в настоящее время относится к Индонезии (Margono et al., 2006).
Комплекс мероприятий, направленных на предупреждение заражения людей Т. solium, разрабатывается с учётом того обстоятельства, что человек может заражаться как личиночными стадиями цестоды, так и её яйцами. В целом профилактические мероприятия включают: выявление и лечение всех больных тениозом, санитарное просвещение населения, благоустройство населённых пунктов, обеззараживание фекальных масс, обеспечение должного санитарного надзора за содержанием и забоем свиней, а также ветеринарный контроль мяса. Следует помнить, что употребление в пищу мяса, не прошедшего санитарно-ветеринарной экспертизы, опасно для здоровья. Установлено, что в процессе помола мяса на мясорубке погибает только 2 - 9 % цистицерков (Поляков и др., 2004).
В 2003 г. Всемирная Ассамблея Здравоохранения (World Health Assembly) объявила Т. solium видом, имеющим всемирное значение для здоровья населения
246
планеты. В Международной классификации болезней 10-го пересмотра МКБ-10 (ICD-10, Version: 2016) заболеванию, вызываемому Т. solium, присвоен код В68.0 (Инвазия, вызванная Taenia solium). В этом же кодификаторе заболевания, вызываемые цистицерками, включены в В69 (Цистицеркоз, вызванный личиночной формой свиного цепня Taenia solium): В69.0 (Цистицеркоз центральной нервной системы), В69.1 (Цистицеркоз глаза) и В69.8 (Цистицеркоз других локализаций).
Taenia asiatica Eom et Rim, 1993 (рис. 124). Видовое название паразиту дали по региону его распространения: asiatica - азиатская.
В 1992 г. увидела свет статья, в которой были представлены результаты проведённого в Корее экспериментального заражения человека цистицерками тений, извлечёнными из печени естественно заражённой домашней свиньи (Eom, Rim, 1992). Через 76 дней после заражения спонтанно появились первые зрелые проглоттиды, которых определили как принадлежащие азиатской форме Т saginata. В 1993 г. эти же авторы описали новый вид Taenia из Азии, взрослые особи которых отличались от Т saginata наличием невооружённого хоботка на сколексе, большим количеством маточных петель (16 — 21) и наличием на члениках заднего выроста, а цистицерки (Cysticercus viscerotropica) - наличием бородавкоподобных образований на наружной поверхности пузыря (Eom, Rim, 1993). Отличались и особенности жизненного цикла этих видов: промежуточный хозяин у Г. saginata - крупный рогатый скот, а у Г. asiatica - свинья (Eom, 2006).
Через два года другие исследователи (Fan et al., 1995), сравнив тайваньский штамм Taenia со штаммами Т saginata из Америки, Швейцарии и Польши, пришли к выводу, что хотя морфологически они похожи, но у протосколекса тайваньского штамма имеется погружённый хоботок, обычно окружённый двумя рядами рудиментарных крючочков, а у типичной Т saginata - только апикальное углубление, с очень редко встречающимися крючочками. Основываясь на результатах молекулярного анализа и морфологических характеристиках, цестоду из Восточной Азии, похожую на Т. saginata, исследователи описали как подвид Т. saginata, который назвали Т saginata asiatica.
Рис. 124 Taenia asiatica: 1 - сколекс с хоботком; 2 -маточные проглоттиды, не прессованные (РР - задний вырост); 3 - гер-членик; 4 - маточный членик, сдавленный (ut - матка); 5 - яйцо; 6 - метаце-стода (цистицерк) с бородавкоподобными образованиями на поверхности пузыря (из: Eom, Rim, 1993)
247
В настоящее время Taenia asiatica рассматривают валидным, сестринским Т. saginata видом. Оба вида имеют независимое пространственное и временное расхождение от общего предка, имевшее место 0.78 - 1.71 млн. лет назад в Африке или Евразии. И хотя исследователи доказали наличие случайной гибридизации между названными видами, они не исключают при этом возможности сохранения у них полиморфизма предка (Okamoto et al., 2010).
На основании морфологических особенностей отличить Т. asiatica от Т. saginata очень трудно и для этой цели используют молекулярный анализ (Hoberg, 2006). В этом отношении примечательны результаты исследований, выполненных группой авторов на западе Таиланда (Anantaphruti et al., 2007). Цитируемые авторы проанализировали ДНК тений, обнаруженных здесь у людей, и установили, что во многих случаях цестоды, отнесённые по морфологическим особенностям к Т. saginata, в действительности принадлежат Taenia asiatica. В итоге 53.3 % цестод, определённых как Т. saginata, были отнесены к Т. asiatica. Иногда оба вида одновременно встречались в одном и том же хозяине.
Несмотря на внешнее морфологическое сходство Т. asiatica и Т. saginata, цистицерки этих видов различаются. У Т. asiatica цистицерки молочно-белого цвета, овальные, некрупные, максимальной длиной 1.9-3 мм. Оболочка тонкая, прозрачная. Наружная поверхность пузыря с бородавкоподобными образованиями, состоящими из многочисленных микротрихий. Хоботок с рудиментарными крючочками, от 0 до 37, которые, однако, были выявлены только у 17 % изученных цистицерков (Eom, 2006; Eom, Rim, 1993).
Окончательный хозяин Т. asiatica - человек, промежуточный - свинья, однако могут быть заражены и другие животные - крупный рогатый скот, козы, некоторые виды обезьян (Fall et al., 1995; Fan, 1988; Fan et al., 1989, 1992b). После попадания яиц в организм промежуточного хозяина через 4 недели в нём обнаруживаются уже зрелые цистицерки (Eom et al., 1992; Fan, 1988), локализующиеся в основном в паренхиме печени, реже на её поверхности. Помимо печени их можно встретить также в лёгких, сальнике, серозе и мезентерии (Eom et al., 1992; Fall et al., 1995; Zhang et al., 1999), что, возможно, связано с миграцией личинок с поверхности печени (Fall et al., 1995). После попадания цистицерков в организм дефинитивного хозяина через 2-4 месяца в его стуле появляются подвижные зрелые проглоттиды цестоды (Chang et al., 2006; Chao et al., 1988; Eom, Rim, 1992), причём ежедневно может выделяться до 35 члеников (Chang et al., 2006; Chao et al., 1988).
Продолжительность жизни T. asiatica в организме дефинитивного хозяина точно неизвестна, однако описаны случаи, когда проглоттиды выделялись у людей в течение 30 лет (Chung et al., 1990; Fan et al., 1992a). Эта информация заслуживает того, чтобы остановиться на ней более подробно. Речь идёт об обследовании в 1974 - 1989 гг. аборигенов из 10 гористых районов Тайваня. Тогда инвазию тенией азиатской выявили в среднем у 76 % местных жителей (Fan et al., 1992а). Наиболее высокой заражённостью (81%) отличались атаялы - одна из коренных народностей Тайваня. Исследователи выяснили, что из проанализированных 1153 случаев у 10% пациентов проглоттиды выделялись в течение менее года, у 24 % - в течение 1 - 3 лет, у 17 % - 4 - 5 лет, у 23 % - 11 - 20 лет, у 7 % - 21 - 30 лет и у 3 % аборигенов инвазия длилась более 30 лет. Цифры, безусловно, впечатляющие, однако неизвестно, характеризуют ли они реальную продолжительность жизни одной особи
248
паразита или же происходило неоднократное новое заражение человека (что более правдоподобно, учитывая образ жизни местного населения).
Т. asiatica пока найдена только в странах Юго-Восточной Азии: на Тайване, в Корее, Малайзии, Китае, Непале, Индонезии, Таиланде, Вьетнаме, Японии, на Филиппинах (Anantaphruti et al., 2007; Chung et al., 1990; Devleesschauwer et al., 2012; Eom, 2006; Fan et al., 1992a; Ito et al., 2003, 2005, 2006; Willingham et al., 2003; Yamasaki et al., 2011 и многие другие). На фоне сказанного относительно систематического положения вида и переопределения форм, описанных как «Г. saginata», невольно напрашивается вывод, что и границы распространения данного вида, и частота его встречаемости у людей требуют уточнения. Во всяком случае, в последние годы регулярно появляются сообщения о находках Т. asiatica во всё новых регионах. К примеру, в 2010 г. её обнаружили в Токио и его окрестностях у 10 человек (Yamasaki et al., 2011), а в 2012 г. сообщили о находке этих цестод у местных жителей на юго-востоке Непала (Devleesschauwer et al., 2012).
Таким образом, информация о встречаемости обоих сравниваемых видов в Азии и Тихоокеанском регионе нуждается в переосмыслении, что, естественно, потребует определённого времени (Ito et al., 2005).
Инвазия людей сопровождается анальным зудом, тошнотой, абдоминальными болями, головокружением, повышенным аппетитом, головной болью и другими симптомами, характерными для тениоза (см. выше).
Taenia brauni Setti, 1897 \=Multiceps brauni (Setti, 1897); =Taenia serialis brauni', -Taenia brachysoma Setti, 1899) (рис. 125, 126). Вид впервые описан на материале от собаки из Эритреи (Северо-Восточная Африка) (Setti, 1897).
Рис. 125 Taenia brauni: 1 - крючья; 2 -гермафродитный членик; 3 - зрелый членик (из: Абуладзе, 1964 - по: Fain, 1952)
/
' Рис. 126 Taenia brauni, сколекс (из: Hall, 1919 — по: Setti, 1897)
Описание (по: Fain, 1956; Hall, 1919). Стробила от 15 - 18 до 30 - 42 см длины при максимальной ширине 4-6 мм. Сколекс слегка приплюснут сверху, диаметром 1-1.5 мм. Шейка довольно слабо выражена. Округлые присос
249
ки диаметром 0.25 - 0.30 мм. Хоботок шириной 0.25 мм, с 26 - 30 крючьями. Крючья 1-го ряда длиной 0.130 - 0.153, 2-го - 0.085 - 0.110 мм. У первых члеников ширина больше длины; по мере удаления от сколекса они постепенно удлиняются, и последние имеют размеры 12 х 3 мм. Общее число члеников у развитых особей в пределах 120 - 150. Половые поры неправильно чередуются. Половые сосочки рельефно выступают. Толщина тегумента около 10 - 12 цт. Под тегументом расположен слой железистых клеток толщиной 50 pm. Известковые тельца рассеяны по всей паренхиме. Мускулатура развита довольно слабо. Экскреторная система представлена крупным вентральным и более узким дорсальным сосудами, проходящими латерально. В гермафродитных члениках от 250 до 350 семенников, располагающихся в основном латерально между экскреторными каналами. Половая бурса 0.375 - 0.480 х 0.1 - 0.14 мм. Семенной пузырёк отсутствует. Яичник двулопастный, поральная лопасть меньше апоральной. Желточник хорошо развит, позади яичника; между лопастями яичника находятся тельце Мелиса и веретеновидный семяприемник. Терминальный участок вагины окружён хорошо развитым кольцевидным сфинктером. Мужской и женский половые каналы открываются почти в одной точке на дне широкого полового отверстия. Матка в виде продольного ствола, в самых зрелых члениках формирует по 10 - 14 боковых ветвей, не выходящих за пределы экскреторных каналов. Яйца овальной формы, 32 - 36 х 26 - 30 цт (в среднем 35 х 28); по (Hall, 1919), диаметр яиц 35 - 38 цт.
Личиночная стадия (Coenurus brauni) в виде мелких, продолговатой формы ценуров, с тонкой оболочкой, размерами 1 - 2 х 0.5 см. Ценур заполнен прозрачной или слегка опалесцирующей жидкостью. Чаще встречаются типичные ценуры, с эндогенным развитием сколексов, иногда наблюдаются ценуры смешанного типа, имеющие одновременно наружные и внутренние сколексы. С возрастом ценура число сколексов, очевидно, увеличивается. Количество крючьев, их размер и форма соответствует таковым взрослых особей.
Дефинитивные хозяева Т. brauni - собака, шакал африканский чепрачный, собака гиеновая; черви живут у них в тонком кишечнике. Промежуточные хозяева - песчанка египетская, мышь полосатая, слепыши, крысы и другие грызуны; ценуры локализуются у них под кожей, в брюшной и грудной полости, мозге.
Впервые ценур Т. brauni обнаружили в Конго в подкожной клетчатке предплечья женщины (Taramelli, Dubois, 1931). В 1950-е годы появились сообщения о ценурозе детей на территории Руанда-Урунди (Fain, 1956; Fain et al., 1956). Здесь в 1948 - 1956 гг. выявили 7 случаев подкожного ценура у детей в возрасте от 11 месяцев до 5 лет и один - у мальчика 14 лет. У 4 детишек ценуры находились в области рёбер. У всех пациентов было по одному ценуру, а их размеры варьировали от величины миндаля до сливы. В 1964 г. описано ещё два случая ценуроза у детей в Руанде, вызванного Т. brauni'. у 6-летней девочки ценур размером с крупную вишню располагался в орбите глаза, а у 2-летнего ребёнка - на боковой поверхности черепа (Vanderick et al., 1964). В двух статьях 1971-го года описывался ценуроз у местных жителей в Уганде: в одной из них речь шла о 10 пациентах с подкожным и четырёх - с глазным ценурозом (Templeton, 1971), а во второй - о 5 случаях глазного ценуроза у пациентов в возрасте от 6 месяцев до 35 лет (Williams, Templeton, 1971). В следующем сообщении речь шла о выявлении ценура уже в США, но у нигерийки, у которой предварительно диагностировали внутрипротоковую карци
250
ному, а в ходе операции в подмышечной области обнаружили округлую массу диаметром 1.2 см, оказавшуюся ценуром Т. brauni (Kurtycz et al., 1983).
И, наконец, в начале 1990-х годов появилась информация о регистрации глазного ценуроза у 25-летнего жителя Северной Нигерии, приведшего к потере зрения правым глазом вследствие токсичного эндофтальмита и отслоения сетчатки (Ibechukwu, Onwukeme, 1991). В процессе беседы с пациентом выяснилось, что он, как мусульманин, вообще не ест свинины, т. е. заражение через мясо исключается, но в его доме живут три местные собаки.
Taenia crassiceps (Zeder, 1800) Rudolphi, 1810 [=Alyselminthus crassiceps Zeder, 1800; —Cysticercus longicollis Rudolphi, 1819; ^Cysticercus talpae Bendz, 1842; =Cysticercus taenia-crassicipitis (Zeder, 1800) Joyeux et Baer, 1936; ^Taenia crassiceps Rudolphi, 1810; =Cysticercus multiformis Holldobler, 1937; -Taenia multiformis (Holl-dobler, 1937) Wardle et McLeod, 1952] (рис. 127, 128). Видовое название, скорее всего, происходит от латинского crassus - толстый, плотный. Поскольку первоописа-
ние вида осталось недоступным мне, трудно сказать, что имел в виду автор, назы-
вая таким образом от-
крытого им паразита.
Рис. 127 Taenia crassiceps: 1 - сколекс; 2 - крючья; 3 - гермафродитный членик; 4 - зрелый членик (из: Абуладзе, 1968 - по: Фуникова, 1940)
Рис. 128 Taenia crassiceps, половой атриум (из: Verster, 1969)
Описание (из: Абуладзе, 1964; с дополнениями других авторов, в том числе: Hoberg et al., 1999; Verster, 1969). Некрупные цестоды длиной 14 - 16 см и максимальной шириной 2.0 -2.2 мм. Сколекс шарообразный, размером 0.62 - 0.96 мм.
251
Хоботок диаметром 0.261 - 0.400 мм, вооружён 30 - 34 (редко 28) крючьями в двух рядах. Крючья характерной формы: лезвие длиннее рукоятки. Крючья 1-го ряда длиной 0.155 - 0.200, 2-го - 0.107 - 0.155 мм. Шейка выраженная. Стробила краспедотного типа, состоит из 78 - 86 члеников. Начальные проглоттиды короткие, их ширина в 5 раз превышает длину. Гермафродитные членики начинаются со второй половины стробилы, их длина 1.82 - 3.64, ширина 1.09 - 1.82 мм, зрелые членики размером 6.18 х 2.18 мм. Половые поры неправильно чередующиеся, половые сосочки выступают за край членика. Семенников около 200 в каждом членике, они располагаются вдоль экскреторных сосудов и в заднем крае членика под желточником. Срединное поле членика и пространство между яичником и желточ-ником свободно от семенников. Овальная бурса цирруса размером 0.182 - 0.272 х 0.126 - 0.162 мм, располагается близ продольных экскреторных сосудов. Яичник двулопастный, доли имеют почковидную форму. Желточник крупный, в виде высокого треугольника, расположен близ заднего края членика и своими латеральными краями никогда не достигает уровня боковых краев яичника. Вершина желточ-ника с кратерообразным углублением. В зрелых члениках от медианного ствола матки отходят 18-20 боковых ветвей, которые, в свою очередь, могут давать добавочные ветви. Матка в последних 6 члениках набита зрелыми яйцами. Яйца овальной формы, 27 - 29 х 21 - 22 или 21 - 26 х 19 - 22 pm (Verster, 1969).
Жизненный цикл Т. crassiceps происходит с участием промежуточных хозяев, среди которых установлены мыши домовая и полевая, мышь-малютка, полёвки обыкновенная, водяная и общественная, полёвка-экономка, лемминги, крысы чёрная и водяная, суслики европейский и крапчатый, хомяк закавказский, крот, ондатра, сурки и многие другие (Абуладзе, 1964; Freeman, 1954, 1962; Hoberg et al., 1999; Miyaji et al., 1990). Известны находки цистицерков у гамадрила, а также у собаки и лисицы. В организме промежуточных хозяев цистицерки локализуются в мышечной ткани, подкожной клетчатке, реже в грудной и брюшной полостях. Окончательные хозяева заражаются при поедании грызунов или насекомоядных животных, инвазированных цистицерками. Среди окончательных хозяев - домашние собаки, волк, лисица обыкновенная и её многочисленные подвиды, корсак, песец,
Цистицерки (Cysticercus longicollis Rudolphi, 1819) в виде тонкостенного пузыря яйцевидной или почти овальной формы, размерами 2-9x1.1-4 мм (рис. 129). Сколекс снабжен хоботком с 30 - 36 крючьями, форма и размеры которых соответствуют таковым взрослых особей.
Рис. 129 Taenia crassiceps, цистицерки (из: Freeman, 1962)
При развитии цистицерков первоначально на одном из полюсов пузырька образуется утолщение, на месте которого формируется сколекс. По мере роста сколекса передний (сколексный) полюс личинки от-шнуровывается от остального пузыря и через некоторое время на заднем полюсе отпочковывается 1-6 дочерних пузырьков. Последние растут и на конце, противоположном месту своего прикрепления к мате-252
рысь обыкновенная.
ринскому пузырьку, образуют утолщение, где развивается ввёрнутый сколекс. Иногда формирование дочерних пузырьков происходит на боковой поверхности материнского пузырька. Поверхность более старых цистицерков с поперечной складчатостью, перпендикулярной главной оси цистицерка. Наряду с экзогенным почкованием может происходить и эндогенное почкование, однако оно начинается, как правило, с полюса, противоположного расположению сколекса (Freeman, 1954, 1962).
При экспериментальном заражении щенков цистицерками японского изоля-та Т. crassiceps черви достигали в них половозрелого состояния через 17-31 день. Ежедневно от стробилы отделялся один членик, в каждом из которых насчитывалось 13 тыс. яиц (Miyaji et al., 1990).
Т. crassiceps - бореальный вид, встречается в странах Европы, Азии и Северной Америки. На протяжении последних 50 лет выполнен большой объём экспериментальных исследований взрослых и личиночных форм Т. crassiceps. В результате получены уникальные данные по морфологии и инвазионности этого паразита, динамике развития цистицерков, иммунной реакции хозяев на вторжение паразита и многим другим аспектам паразито-хозяинных отношений, что, в свою очередь, вносит существенный вклад в познание биологии столь важной в практическом отношении группы гельминтов, каковыми являются цестоды (Willms, Zurabian, 2010).
Несмотря на то, что находки цистицерков Т. crassiceps у человека чрезвычайно редки (Willms, Zurabian, 2010), тем не менее, данный вид относят к числу опасных для него паразитов, прежде всего из-за способности цистицерков размножаться в организме промежуточного хозяина бесполым путём (Hoberg et al., 1999). Сообщения о регистрации пролиферирующих личинок Т. crassiceps в подкожной и мышечной ткани (Heldwein et al., 2006), в том числе у иммунодепрессивных пациентов (Chermette et al., 1995; Francois et al., 1998; Goesseringer et al., 2011; Maillard et al., 1998), подчеркивают потенциальную важность тениид как зоонозных паразитов. Сказанное тем более актуально, если учесть случаи поражения этими личинками таких жизненно важных органов человека, как, например, глаза (Arocker-Mettinger et al., 1992; Freeman et al., 1973).
Taenia glomeratus (Railliet et Henry, 1915) Brumpt, 1922 (=Multiceps glomeratus Railliet et Henry, 1915; =Coenurus glomeratus (Railliet et Henry, 1915) Turner et Leiper, 1919) (рис. 130).
В начале 20-го столетия в Тунисе при вскрытии песчанки карликовой в её брюшной полости обнаружилось опухолевидное образование эллипсоидной формы и размером 12 х 10 мм. Материал был передан французским паразитологам (Railliet, Henry, 1915), которые пришли к выводу, что это - ценур, у которого размеры и форма крючьев сколекса отличались от таковых известных на то время личинок тениид. На сколексе ценура располагалось от 18 до 34 крючьев, часть которых была ещё не совсем сформирована. Наиболее развитые крючья первого ряда достигали 0.132 - 0.138, второго - 0.078 -0.090 мм. Крючья обладали сильно изогнутым лезвием, относительно короткой рукояткой и довольно редко выступающим корневым отростоком. Форма из песчанки была описана как новый вид Multiceps glomeratus.
Однако и в настоящее время ряд исследователей сомневается относительно видовой самостоятельности данного ценура, рассматривая его как недоразвитую лярвоцисту или же как случай уродства.
253
Рис. 130 Taenia glomeratus: I - крючья; 2 и 3 — ценуры (из: Абуладзе, 1984 - по: Railliet, Henry, 1915 - как Multiceps glomeratus)
В одной из статей 1940-го года её автор (Clapham, 1940а) сообщает об обнаружении у собаки 25 экз. цестод длиной до 70 см, которые были определены как принадлежащие Multiceps glomeratus. Зрелыми члениками этой цестоды автор заразил белых мышей, кроликов и песчанок, а затем полученными от них ценурами -собак. Тем не менее, описания взрослых форм цестод автор не приводит.
Описание ценура (из: Абуладзе, 1964 - по: Clapham, 1940а, 1940b). Ценуры из мышей имели овальную форму и 5.5 - 27.2 мм в диаметре, были покрыты нежной соединительнотканной оболочкой и локализовались под кожей в межмышечной соединительной ткани. Сколексы располагались на внутренней оболочке ценура двойными рядами и занимали до 2/3 её площади.
Ценуры от кроликов были различной формы и до 121 х 76 мм в диаметре. Ценур заполняла прозрачная жидкость, имеющая щелочную реакцию. Через прозрачную наружную оболочку просвечивали сколексы, располагавшиеся так же, как и в ценурах от мышей. На многих ценурах наблюдались внутренние и наружные дочерние пузыри. Наружные пузыри в виде почек от 0.001 до 0.4 мм длины, с типичным тениидным сколексом с множеством известковых телец. Количество ответвлений достигало нескольких десятков и даже сотен.
При скармливании зрелых члеников 23 мышам и 4 кроликам удалось заразить 7 мышей и одного кролика, но ценуры достигли в них инвазионной стадии через длительный срок - до года (Clapham, 1940а, 1940b). Так, у одной из мышей лишь через 10 месяцев в области паха появилось новообразование диаметром 2 мм, через 26 дней увеличившееся почти в 10 раз и достигшее 19 мм. При вскрытии в ценуре обнаружилось 53 сколекса, характерных для Coenurus glomeratus. При последующем заражении этими сколексами собаки у той через 7 недель с фекалиями начали выделяться зрелые членики. Песчанки заражались ценурами легко, и в их организме те достигали инвазионного состояния значительно быстрее. Автор считает песчанок облигатными, а мышей и кроликов - факультативными промежуточными хозяевами в жизненном цикле данного паразита.
В 1919 г. появилось описание первого случая обнаружения Coenurus glomeratus у человека (Turner, Leiper, 1919). Доктор W. В. Johnson отправил цитируемым авторам для определения цисту, которую извлёк из подкожной ткани, покрывающей межрёберные мышцы, у аборигена из Северной Нигерии. Ценур имел размер 2 х 1 см и содержал 35 втянутых сколексов, вооружённых 32 крючьями, расположенными в два ряда. Длина крючьев составляла соответственно 0.090 -0.100 и 0.065 - 0.070 мм.
254
Второй аналогичный случай был зарегистрирован у 30-летнего мужчины, также из Северной Нигерии (Cannon, 1942). Поступивший в госпиталь больной жаловался на скованность и дискомфорт в правой руке, испытываемые им в последние 2 недели, особенно в тех случаях, когда он брал в руки винтовку. На участке нижней трети трицепса правой руки больного обнаружилось гладкое округлое эластичное вздутие диаметром около 2.5 см. При резекции под местным наркозом из межмышечных волокон 6tuia извлечена некрупная бесцветная желеподобная масса без капсулы, но сохранявшая свою форму при различных манипуляциях с ней. Разрез кисты выявил узкую цисту с многочисленными сколексами на внутренней поверхности, выступающими в её полость. Выявленного ценура (Coenurus sp.) впоследствии отнесли к Multiceps glomeratus (Faust, 1949).
Taenia hydatigena Pallas, 1766 (рис. 131 - 133). Один из самых «старых» представителей рода, которого уже 250 лет отмечают по всему земному шару в качестве паразита домашних и диких псовых, медведя, очень редко - кошачьих. Среди его синонимов - несколько десятков видов (Абуладзе, 1964), перечислять которые здесь не имеет смысла, поскольку практически все эти виды описывались в 18 - первой половине 19 веков и в настоящее время упоминаются только в специальной литературе. Отмечу только два синонима: Taenia ursina von Linstow, 1893 и Taenia jakhalsi Ortlepp, 1938; эти виды были описаны уже после упомянутого выше временного периода (Verster, 1969).
Рис. 131 Taenia hydatigena: 1 - общий вид; 2 - онкосфера (из: Абуладзе, 1964 - по: Раевская, 1931)
Рис. 132 Taenia hydatigena: 1 - крючья, вверху -второго ряда, внизу - первого ряда; 2 - гермафродитный членик; 3 - зрелый членик (из: Hall, 1919, в том числе: 1 - оригинал; 2 - по: Deffske, 1891; 3 -по: Ransom, 1913)
255
Рис. 133 Taenia hydatigena: 1 - крючья на хоботке сколекса взрослой особи; 2 - половой атриум (из: Verster, 1969)
S'"-'—'\J Видовое название паразита, скорее все-
го, происходит от ново-латинского hydatid-, в / L свою очередь, от греческого hydatis - водяни-
----------Cz-~xJ стый пузырёк, от hydat-, hydor - вода (slovar-vocab.com). Словом, Taenia hydatigena - тения, образующая водянистые пузырьки, или тения пузыреобразующая.
Описание (по разным авторам, в том числе: Hall, 1919; Verster, 1969). Черви средних и крупных размеров. Стробила длиной от 75 см до 5 м, состоит из 550 -700 очень широких члеников. Сколекс грушевидной, сферической, цилиндрической или почковидной формы, диаметром 0.6 - 1.0 мм. Присоски 0.228 - 0.31 мм в диаметре. Хоботок с 26 - 44 крючьями, расположенными в два ряда. Крючья 1 -го ряда длиной 0.170 - 0.220 мм, с умеренно изогнутым лезвием, 2-го - 0.110 - 0.160 мм, с сильно изогнутым лезвием. Шейка короткая. Латеральные края стробилы гладкие, задние края члеников несколько прикрывают передние края соседних члеников. Молодые проглоттиды широкие и короткие, у гермафродитных члеников ширина почти в два раза превышает длину, типичные зрелые членики продолговатой формы, размерами 10-15x4-5 мм. Половые сосочки маленькие, неправильно чередующиеся, не выступающие. В каждом членике 600 - 700 семенников, расположенных в один дорсальный слой и занимающих почти всю его срединную часть между продольными экскреторными каналами. Позади желточников семенники не сливаются. Цилиндрическая бурса цирруса размером 0.32 - 0.45 х 0.13 - 0.16 мм. Циррус диаметром 0.041 - 0.046 мм, покрыт волосоподобными щетинками. Яичник состоит из двух долей неравных размеров. Узкий и вытянутый в поперечном направлении желточник своими латеральными краями не достигает боковых краёв яичника. Между яичником и желточником находится почти круглое тельце Мелиса. Вагина с хорошо развитой мышечной стенкой. Её начальная расширенная часть, не доходя до продольных экскреторных сосудов, загибается под прямым углом, постепенно сужается, идёт по направлению к медианной линии членика и близ медианного ствола матки направляется кзади, огибая близлежащую долю яичника и образуя расширенную часть семяприемника. В зрелых члениках с каждой стороны от медианного ствола матки отходит по 5 - 10 латеральных ветвей, в свою очередь, образующих на свободном конце дополнительные ответвления. Яйца овальной
256
формы, размерами 36-39x31 - 35 jim, оболочка толщиной 4 щи, эмбриофор размером 4.5 - 5.6 pm.
К. Канчев (Kanchev, 2015) экспериментально заразил двух собак полученными со скотобоен цистицерками Т. hydatigena от овец, и в течение 15 недель наблюдал процесс выделения члеников из подопытных животных. Суммарно ежесуточно ими выделялось от 2 до 45 члеников. Как впоследствии выяснилось, в двух собаках прижилось 9 цестод. Исследователь подсчитал, что одна цестода в среднем выделяла от 0.67 до 1.78 экз. члеников. Учитывая, что каждый проглоттид Т. hydatigena содержит 31-38 тыс. яиц (Deplazes, Eckert, 1988), нетрудно подсчитать, что только один червь ежесуточно может поставлять во внешнюю среду от 21 - 25 до 55 - 67 тыс. яиц.
Во внешнюю среду членики попадают или пассивно вместе с фекалиями хозяина, или же выползают через анальное отверстие, активно передвигаясь от места откладки фекалий, при этом через их передний край могут выделяться яйца. В конечном итоге проглоттиды или яйца оказываются на травинках или попадают в воду, а затем с пищей - травой или водой оказываются в желудке промежуточного хозяина - травоядных животных. Яйца Т hydatigena отличаются устойчивостью к воздействию неблагоприятных факторов внешней среды. Показано, к примеру, что в предгорной зоне Кабардино-Балкарии после зимнего периода среди находившихся в воде яиц свою жизнеспособность сохранили 29.2 %, в почве - 34.4 %, в фекалиях собак - 39.6 %, в силосе - 79.2 %, сене - 85 % и в комбикормах - 96 % (Биттиров и др., 2015). По мнению цитируемых авторов, столь высокая выживаемость яиц в зимний период обеспечивает раннее весеннее заражение сельскохозяйственных и
диких животных.
Яйцо содержит онкосферу, обладающую 3 парами крючьев, с помощью которых та пронизывает стенку кишечника животного. Далее личинка или оседает на печени или продолжает свой путь в мезентерий, серозу, сальник. Прикрепившись к соответствующему органу, личинка трансформируется в следующую стадию - цистицерк. Когда цистицерк попадает в кишечник дефинитивного хозяина, то его обо
лочка переваривается, сколекс выворачивается и при помощи крючьев и присосок
прикрепляется к стенке кишечника, где и происходит рост и созревание паразита. От момента попадания личинки в организм дефинитивного хозяина и до достижения цестодой половой зрелости проходит 10-12 недель.
Личиночная стадия Taenia hydatigena (рис. 133) известна под названием Cysticercus tenuicollis Rudolphi, 1810. Цистицерк представляет собой очень крупный пузырь, размером до 8 х 10 см, полузаполненный прозрачной жидкостью, заклю-
чённой в собственную оболочку. В стенке оболочки находится ввёрнутый сколекс, вооружённый крючьями и присосками. Внутренняя оболочка цистицерка покрыта наружной оболочкой (капсулой), образованной тканями хозяина.
Рис. 133 Taenia hydatigena, цистицерк с вывернутой головкой (слева - из: Monnig, 1934; справа -из: Абуладзе, 1964)
257
Размеры цистицерков в значительной мере зависят от возраста животного-хозяина, а также от локализации личинок в его организме. Цистицерки из молодых животных-хозяев обычно имеют меньшие размеры, чем экземпляры из особей старших возрастов. Цистицерки, расположенные под капсулой печени или глубоко в её паренхиме, имеют меньшие размеры, чем личинки из других органов. Форма цистицерков, локализующихся под капсулой печени, приближается к шару с упругой консистенцией, заключённому в плотную капсулу, образованную тканями хозяина. Личинки, поселяющиеся на сальнике, брыжейке и других органах, имеют форму висячего мешка, полунаполненного прозрачной жидкостью. Наличие тонкой длинной шейки у пузыря послужило основанием для названия цистицерка: thin-necked bladderworm - тонкошеий пузырчатый червь.
Окончательные хозяева Т. hydatigena, как отмечено выше, псовые - домашние собаки, койоты, волки, лисицы, а также медведи и очень редко - кошачьи, в том числе рысь. Среди промежуточных хозяев цестоды - домашние и дикие жвачные, свиньи, лошади и другие млекопитающие, всего более 50 видов. В Танзании, к примеру, при обследовании животных, поступивших на скотобойни, цистицерки Т. hydatigena были выявлены у 51.9 % овец, 45.7 % коз и 6.6 % свиней (Braae et al., 2015). Личинки данного вида вызывают у животных серьёзное заболевание, которое при высокой заражённости может быть даже смертельным для молодых особей - козлят, ягнят, поросят (Kanchev, 2015).
Как уже сказано, Т. hydatigena широко распространена в различных странах и на разных континентах, особенно в сельской местности. Что касается её паразитирования у человека, то хотя в отдельных сводках и встречается упоминание о редкой встречаемости у людей цистицерков Т. hydatigena, найти какой-либо первоисточник, послуживший основанием для подобного утверждения, мне не удалось. Например, в «Taenia Infections. Taeniasis, Cysticercosis, Neurocysticercosis, Coenurosis, Neurocoenurosis» (http://www.cfsph.iastate.edu/.../pdfs/taenia.pdf) на стр. 5 читаем: «Taenia hydatigena <...> Rabbits, rodents and humans are rarely infected» (Кролики, грызуны и люди заражаются редко). Тем не менее, утверждать, что подобное случайное заражение в действительности не может иметь места, не берусь. По этой причине выше и было приведено краткое описание данного вида тений.
Taenia martis (Zeder, 1803) Freeman, 1956 (=Halysis martis Zeder, 1803). Вид впервые описан от куницы из Германии под названием Halysis martis (Zeder, 1803). Видовое название дано по родовому названию его хозяина: Martes - род куниц в семействе куньих: Taenia martis - тения кунья.
В 1810 г. К. Рудольфи (Rudolphi, 1810) перевёл Halysis martis, наряду с ещё двумя видами тений, описанными от куниц, в созданный им новый вид Т. intermedia Rudolphi, 1810. К. И. Абуладзе (1964; стр. 89) придерживается этой же точки зрения. Однако практически во всех публикациях последующих лет Т. martis фигурирует как самостоятельный вид (Шималов, 2010; Юшков, 1995; Brunet et al., 2014; De Liberate et al., 2014; Loss-Frank, 2000; Ribas et al., 2004; Verster, 1969).
Описание (no: Verster, 1969) (рис. 134). Цестоды от каменной куницы из Швейцарии. Сколекс размером 0.96 - 1.1, хоботок 0.352 - 0.357, присоски 0.229 -0.242 мм. На хоботке 28 - 30 крючьев одинаковой формы, расположенных в два ряда. Крючья 1-го ряда длиной 0.193 - 0.218 (в среднем 0.206.3 ± 8.0), 2-го - 0.151 -0.169 (в среднем 0.167.7 ± 5.1) мм. В каждом членике насчитывается 106 - 158 семенников, расположенных в двух дорсальных слоях. Латерально семенники прохо-258
дят к заднему краю членика, но позади желточников не сливаются; проникают в пространство между яичником и желточниками. Бурса цирруса размером 0.148 -0.182 х 0.030 - 0.050 мм, проходит к медианной стенке продольного экскреторного канала. Циррус без щетинок. Яичник двудольчатый, с неравными долями. Вагина прямая, толстостенная, в кортикальной паренхиме образует расширение диаметром 27 - 50 pm. Зрелая матка формирует по 6 - 9 боковых петель. Яйца сферические, диаметром 28 - 33, толщина эмбриофора 2.2 - 3.4 pm.
Рис. 134 Taenia martis из каменной куницы: слева - крючья хоботка, справа - половой атриум (из: Verster, 1969)
Ларвоцисты Т. martis в виде удлинённой ложночленистой стробилы с инва-гинированным сколексом и более узким «хвостовым» отростком (рис. 135). Форма и размер ларвоцист у разных хозяев могут несколько отличаться. Сколекс с 3 присосками и двойной короной из 26 - 32 крючьев (Шималов, 2010).
Рис. 135 Taenia martis, цистицерки из полёвок и мышей (слева) и белки (справа) (из: Шималов, 2010)
Т. martis поселяется в тонком кишечнике куньих, прежде всего, куниц каменной и лесной. Однако и другие куньи, например, барсук, выдра, хорёк, росомаха, а также псовые могут быть её окончательными хозяевами (Юшков, 1995; Eberwein et
al., 2013; Loss-Frank, 2000; Verster, 1969 и др.). Заражённость куниц, по некоторым данным, может доходить до 10.8, соболей - до 16.6, росомах - до 17.6 % (Юшков, 1995). В юго-западной Беларуси В. В. Шималов (2010) обнаружил Т. martis в кишечнике (в одном случае - в желудке) 3 обследованных особей куницы лесной.
Промежуточные хозяева этой цестоды - грызуны и насекомоядные млекопитающие, в том числе полевка рыжая, мыши желтогорлая и полевая, белка обык
259
новенная, ондатра, у которых личинки (лярвоцисты) локализуются преимущественно в грудной и брюшной полости. Заражённость животных чрезвычайно варьирует по регионам и в зависимости от вида хозяина. К примеру, в Бельгии личинки Т. martis были обнаружены у 22.2 % ондатры (Mathy et al., 2009), а на юго-западе Беларуси - у 2.6 - 2.8 % полёвки рыжей, 1.5 % мыши желтогорлой и 0.4 % мыши полевой (Шималов, 2010).
Обращает на себя внимание факт обнаружения цистицерков у таких совершенно нетипичных хозяев, как, например, лемур (De Liberate et al., 2014) или же макак тонкский (Brunet et al., 2014). В первой из цитируемых статей её авторы описывают заражение личинками Т. martis лемура кольцехвостого, или кошачьего, в Римском зоопарке, приведшее к гибели животного. Обычная еда погибшего лемура и его 15 соплеменников в зоопарке состояла из свежих фруктов и овощей, йогурта и яиц. За 10 дней до гибели у животного наблюдалось отсутствие аппетита, вздутие живота и диарея. При вскрытии был выявлен тяжелый экссудативный фиброзногнойный перитонит с многочисленными спайками между брюшной стенкой и петлями кишечника. После удаления кишечника были обнаружены два живых, беловатых, листоподобных паразита в неприкреплённом состоянии. Их длина составляла 4 см. По результатам молекулярного анализа личинок отнесли к Т. martis.
Во второй из процитированных выше статей (Brunet et al., 2014) описана инвазия трёхлетнего самца макака тонкского, к слову, эндемика о. Сулавеси (Индонезия), родившегося и выросшего во Франции, у которого при лапаротомии было выявлено множество пузырьков, определённых как цистицерки Т. martis. При идентификации личинок исследователи опирались на результаты изучения морфологических особенностей сколекса и крючьев, подтверждённых молекулярногенетическими анализами, включая амплификацию ДНК.
На фоне сказанного не может не насторожить появляющаяся в последние годы информация о заражении цистицерками Т. martis человека. Первое сообщение датируется 2013-м годом (Eberwein et al., 2013). В июне 2010 г. 43-летняя жительница небольшой деревни на юго-западе Германии обратилась за медицинской помощью из-за мешавшего ей в течение 4 дней мерцания в поле зрения и парацентральной скотомы в левом глазу. При обследовании глазного дна в верхнем ретинальном сосуде обнаружилась подвижная субретинальная опухоль со смежным кровотечением. Опухоль оказалась личинкой цестоды, которую на основании результатов молекулярного анализа определили как Т. martis. Авторы публикации подчёркивают, что подобную инвазию можно ошибочно принять за цистицеркоз, вызываемый Т. solium, поэтому точную видовую идентификацию можно выполнить только с применением молекулярно-генетических методов.
Второе сообщение на аналогичную тему появилось через год, в 2015-м году, хотя сам случай имел место в январе 2012 г. (Brunet et al., 2015). 44-летняя жительница востока Франции поступила в больницу Страсбургского университета по поводу правостороннего гемипареза и афазии с подозрением на менингоэнцефалит. Не буду пересказывать все перипетии её лечения, но в итоге на основании результатов магнитно-резонансной томографии, показавшей наличие небольшого узелка в левой височной доле коры, в мае того же года это постороннее включение было удалено хирургическим путём. Патологическое исследование показало отсутствие каких-либо признаков опухолевого процесса, а выявленное образование оказалось толстостенной паразитарной кистой с плотным фиброзом и интенсивным мононук-
260
леарным воспалением. Киста содержала густую жидкость, состоящую из плотной светлой эозинофильной ленты мембранной ткани и известковых телец. Последующее исследование с использованием серологических и молекулярно-генетических методов показало принадлежность выявленной цисты к Т. martis.
Описанный случай церебрального цистицеркоза показал, что возбудителями подобного заболевания могут быть не только уже известные в этом отношении Taenia solium и Т. asiatica, но также и Т. martis, на что уже обратили внимание медицинские работники (Joob, Wiwanitkit, 2016).
И, наконец, третий случай, и вновь глазного цистицеркоза, вызванного цис-тицерком Т. martis, был описан в 2016 г. на этот раз у 70-летней пациентки из Северной Германии (Koch et al., 2016). Как и в первом случае глазного цистицеркоза (Eberwein et al., 2013), паразит локализовался в субретине и был удалён хирургическим путём.
Совершенно очевидно, что попадание цистицерков Т. martis к человеку носит абсолютно случайный характер. Однако тот факт, что видовая идентификация этого паразита из нетипичных хозяев - лемура, обезьяны и людей оказалась возможна только с помощью молекулярно-генетических методов, может свидетельствовать о возможной ошибочности некоторых диагнозов, выполнявшихся ранее, когда подобные методы были ещё не разработаны или недоступны исследователям. Как-то с трудом верится, что заражение человека Т. martis вдруг началось только во втором десятилетии 21-го столетия, хотя сам паразит известен уже более 200 лет.
И ещё один важный момент, на который следует обратить внимание. Обнаружение цистицерков Т. martis у обезьян и человека, пусть даже эпизодическое, случайное, показывает восприимчивость приматов к заражению данным видом, который таким образом приобретает зоонозное значение.
Taenia multiceps Leske, 1780 (рис. 136 - 137). Несмотря на то, что этот паразит, точнее, его личиночная стадия, был известен ещё со времён Древней Греции, где вызывал у овец тяжёлые эпилептические припадки, впервые официально он был описан только в 1780 г. (Leske, 1780). Обнаружив на оболочке извлечённого из мозга овцы пузыря сколексы, очень похожие на головки цестод, цитируемый автор сделал вывод, что эти пузыри являются личиночной стадией цестоды, которую он назвал Taenia multiceps - тения многоголовая. В последующие годы эту цестоду описывали под разными видовыми названиями, переводили в другие роды, в результате чего во многих источниках данный вид можно было обнаружить в каком-либо из ниже названных родов: Hydatigena Goeze, 1782, Multiceps Goeze, 1782, Hy-datula Abildgaard, 1790, Vesicaria Mueller, 1787, Hydatis Blumenbuch, 1797, Coenu-rus Rudolphi, 1808, Polycephalus Zeder, 1803. C 1910 no 1969 гг. вид входил состав рода Multiceps (Hall, 1910), а в 1969-м возвращён в Taenia (Verster, 1969), где и числится в настоящее время.
Литература, посвящённая Т. multiceps, чрезвычайно обширна, что связано с санитарно-ветеринарным, медицинским и социально-экономическим значением этого гельминта, чьи личинки (ценуры) вызывают серьёзные заболевания у сельскохозяйственных животных, прежде всего, овец и коз, и представляют реальную угрозу для здоровья человека. В русскоязычной справочной и научно-справочной литературе тения многоголовая из-за приуроченности ценуров к овцам даже получила название овечьего мозговика.
261
Рис. 136 Taenia multiceps: 1 - корона крючьев; 2 - сколекс, вид сверху; 3 - крючья; 4 - гермафродитный членик; 5 - зрелый членик (из: Абуладзе, 1964 - по: Hall, 1910)
Рис. 137 Taenia multiceps: 1 - крючья хоботка взрослой особи (слева - крючья 1-го ряда, справа - крючья 2-го ряда); 2 - половой атриум (из: Verster, 1969)
Попытаемся выделить из огромного массива
данных - многие сотни статей, десятки монографий - наиболее информативные и интересные, с тем, чтобы составить общее представление об этом паразите и той
опасности, которую он представляет и для полезных животных, и для человека.
Описание (по разным авторам). Стробила достигает в длину 40 - 100 см и максимальной ширины до 5 мм, состоит из 200 - 250 члеников. Сколекс грушевидной формы, диаметром 0.75 - 0.96 мм. Слаборазвитый хоботок 0.273 - 0.364 мм в диаметре, вооружён 22 - 32 крючьями в двух рядах. Крючья 1-го ряда длиной 0.150 - 0.170 (Faust, 1949) или 0.157 - 0.177 (в среднем 0.168) мм (Verster, 1969), облада
262
ют острым изогнутым лезвием, извилистой рукояткой, снабжённой на дорсальном крае на границе перехода рукоятки в лезвие довольно глубокой выемкой; корневой отросток слегка расширен в средней части и конически закруглён на свободном конце. Крючья 2-го ряда длиной 0.090 - 0.130 (Faust, 1949) или 0.098 - 0.136 (в среднем 0.125.7) мм (Verster, 1969). Эти крючья обладают слегка изогнутым острым лезвием, небольшой выпуклостью на дорсальном крае рукоятки на границе с лезвием; дистальный конец рукоятки слегка заострён и направлен дорсально; корневой отросток слегка расширен в средней части, конически закруглён на конце и образует неглубокую медианную выемку. Присоски диаметром 0.200 - 0.300 мм. Шейка длиной 2-3 мм. Гермафродитные членики почти квадратной формы, хотя их длина всё же превышает ширину. Зрелые членики, отрывающиеся от стробилы, размерами 8 - 10x3-4 мм. Половые поры неправильно чередующиеся, латеральные. Половые сосочки небольшие. В члениках 200 семенников (А. Верстер пишет о 284 - 388 семенниках), располагающихся в двух дорсальных слоях, главным образом в боковых полях. Медианное поле проглоттиды почти лишено семенников; они отсутствуют по бокам и между семяпроводом и вагиной, а также в задней части членика. Бурса цирруса грушевидной формы, размерами 0.315 - 0.350 х 0.110 -0.145 или 0.238 - 0.306 х 0.078 - 0.101.мм (Verster, 1969). Циррус с волосовидными щетинками. Яичник бабочковидной формы, лежит в задней половине членика; обе доли овальные, почти равных размеров. Небольшой треугольный желточник располагается близ заднего края членика, его латеральные края никогда не достигают боковых краёв яичника. Небольшое круглое тельце Мелиса находится между яичником и желточником. Вагина в виде полой трубки; огибая одну из долей яичника, образует расширение - семяприемник. В зрелых члениках от медианного ствола матки отходит с каждой стороны по 9 - 26 ветвей, обычно образующих близ своего свободного края добавочные веточки. Яйца овальные, 31-36 (Faust, 1949), 29 - 37 (Абуладзе, 1964), 28 - 36 х 24 - 33 pm (Verster, 1969), оболочка 4 pm, эмбриофор 3.4 х 5.6 pm.
Цикл развития Т. multiceps впервые расшифровал фон К. Зибольд (von C.Siebold), который добился превращения ценура Coenurus cerebralis из мозга овцы в половозрелую стадию в кишечнике собаки (рис. 138).
Рис. 138 Схема жизненного цикла Taenia multiceps (из: Абуладзе, 1964)
Тения многоголовая во взрослом состоянии является паразитом, прежде всего, псовых, у которых живёт в тонком кишечнике. На личиночной стадии этот паразит поселяется в головном и спинном мозге в основном у овец, реже у коз и крупного рогатого скота и, как исключение, может быть обнаружен у некоторых домашних и диких копыт
263
ных животных, в том числе у лошади. Полное формирование личинки в организме промежуточного хозяина завершается за 7 - 8 месяцев, а первые симптомы инвазии проявляются через 2-7 месяцев. Личинки Т. multiceps могут быть обнаружены и у человека.
Личиночная стадия тении многоголовой, так называемый ценур, описана под названием Coenurus cerebralis (Batsch, 1786). Ценуры обычно округлой или овальной формы, с очень тонкой гладкой полупрозрачной стенкой (рис. 139).
Рис. 139 Ценур Taenia multiceps из мозга овцы (слева - из: Faust, 1949 -по: Hall, 1910; справа - из: Monnig, 1934)
Пузырь заполнен бесцветной жидкостью, количество которой варьирует в зависимости от его размера, в свою очередь, зависящего от степени развития, места локализации в мозге и вида животного. Так, ценуры из овец могут достигать 10 см в диаметре, а количество жидкости в них - 150 - 200 мл. Внутренняя герминативная оболочка с множеством сколексов, по своему строению идентичных таковым взрослых особей (рис. 140). По (Becklund, 1970), сколексы обладают 26 - 32 крючьями (у большинства их 28), длина больших крючьев 142 -168 (в среднем 155.8), маленьких 85-118 (106.7) pm.
Рис. 140 Ценур Taenia multiceps из мозга овцы: 1 - последовательные стадии - Л, В, С - развития сколекса в ценуре (из: Faust, 1949); 2 - сколекс, извлечённый из стенки ценура (из: Faust, 1949-по: Hall, 1910)
В зрелом ценуре наряду со сколексами с развитыми крючьями и присосками встречаются сколексы на стадии почкования. Сколексы располагаются близко друг к другу, обычно на одной стороне пузыря, их количество по мере развития
264
ценура увеличивается до нескольких десятков и даже сотен. Образование сколексов происходит на протяжении всей жизни ценура.
Как уже сказано, основными промежуточными хозяевами Т. multiceps являются овцы и козы, поражаемые ценурозом по всему миру, но чаще всего - в Азии и Африке. Заболеванию подвержены в основном молодые животные - овцы и козы в возрасте одного - полутора лет, крупный рогатый скот - до 2 - 3 лет. Ценуры поселяются только в центральной нервной системе животных, в основном в полушари-*, ях головного мозга (Achenef et al., 1999), а также в спинном мозге, вблизи поверхности теменной коры головного мозга или выступают в желудочки мозга. Локализация ценуров в субарахноидальном пространстве полушарий головного мозга обеспечивает питание паразита спинномозговой жидкостью (Epstein et al., 1959). Патогенез при церебральном ценурозе вызывается механическим воздействием паразита и интоксикацией токсинами, содержащимися в жидкости ценуров и проникающими в кровь животного. У больных животных наблюдаются анорексия, вялость, частые мышечные фасцикуляции, скрежет зубов, нарушение координации и хаотичные движения, а в тяжёлых случаях - слепота (Sharma et al., 1998). При гистопатологическом обследовании обнаруживаются дегенерация нейронов, обширные участки некроза, микроглия клеток, демиелинизации в поражённом мозге, внутренняя гидроцефалия и множественные сколексы на внутренней поверхности ценура (Hassanein, Elghaffar, 2016; Nourani, Kheirabadi, 2009). При этом патоморфо-логические изменения в мозге поражённого животного распространяются также на участки, удалённые от места локализации ценура.
Поражение мозга ценурами Т. multiceps опасно ещё и тем, что мигрирующие личинки могут переносить бактерий, вызывающих у поражённых животных бактериальный менингоэнцефалит (Christodoulopoulos, 2007).
Что касается возможности паразитирования ценуров у людей, то хотя в данном случае для тении многоголовой человек является случайным, фактически тупиковым хозяином, тем не менее, подобные случаи вот уже более 100 лет эпизодически отмечают по всему земному шару.
Первый аутентичный случай заражения человека зафиксирован в 1911 г. во Франции (Brumpt, 1913). При аутопсии 40-летнего парижского слесаря, страдавшего при жизни полной или частичной утратой речи и эпилептическими припадками, в боковом желудочке мозга обнаружились два ценура Т. multiceps - один дегенери-рованный, погружённый в мозговое вещество, а другой с 75 сколексами.
Второй случай описан в Южной Африке: при аутопсии женщины племени банту в левом боковом желудочке мозга выявили неприкреплённую плавающую цисту Т. multiceps (Culver, 1940). На следующий год появилось сообщение о церебральном ценурозе у 39-летнего британского моряка, в течение 5 лет страдавшего от головной боли, у которого ценур локализовался в заднем роге левого бокового желудочка мозга, полностью заняв его полость (Clapham, 1941). В 1942 г. было опубликовано описание поражения ценуром ромбовидной ямки (дно IV желудочка мозга) у 42-летней француженки, ставшего причиной её смерти (Roger et al., 1942).
Следующий случай имел место в Уэльсе (Великобритания): здесь у 14-летней девочки, в течение почти 3 месяцев страдавшей от паралича обеих конечностей, в спинном мозге обнаружился маленький ценур (Buckley, 1947; Crusz, 1948).
К 1962 г. случаи церебрального ценуроза были зафиксированы в Великобритании (3), Франции (4), Мексике (1), США (1), на востоке и юге Африки (12)
265
(см. обзоры: Абуладзе, 1964; Correa et al., 1962). Практически все они имели летальный исход. Тогда же появилось сообщение о первой регистрации церебрального ценуроза в Южной Америке: 42-летняя домохозяйка из Бататайса (Бразилия) скончалась от поражения ценуром паутинной оболочки мозга (Correa et al., 1962).
К концу 20-го столетия случаи заражения людей личинками Т. multiceps были зафиксированы не только на уже известной по данному заболеванию территории, например, в США (Hermos et al., 1970; Schellhas, Norris, 1985), но и в новых регионах, в частности в Швейцарии (Michal et al., 1977), в Италии (Pau et al., 1987, 1990), в том числе на Сардинии (Turtas et al., 1989).
Сообщения об обнаружении церебрального ценуроза у люлей эпизодически появляются и в 21 -м столетии. Последние публикации касаются регистрации ценуроза у людей в Израиле (Benifla et al., 2007; El-On et al., 2008), Индии (Mahadevan et al., 2011), Италии (Sabbatani et al., 2004).
Церебральный ценуроз чаще всего проявляется головной болью, обычно приступообразной, которая сопровождается головокружением, нарушением дыхания, брадикардией, тошнотой, рвотой, болями в области шеи, позвоночника, наблюдаются слабость, потливость, апатия. У пациентов могут наблюдаться непроизвольно возникающие движения различных групп мышц, нарушения координации движения, дезориентация во времени и пространстве, возможны потеря сознания, парезы, эпилептиформные припадки. Давление цереброспинальной жидкости повышается, в ней нередко увеличиваются содержание белка и количество лимфоцитов. При локализации ценуров в спинном мозге возможны потеря чувствительности в некоторых нервах, параплегия, расстройство функций тазовых органов, воспаление, боль.
Для диагностики церебрального ценуроза первостепенное значение имеют методы компьютерной и магнитно-резонансной томографии (Benifla et al., 2007; Pau et al., 1987; Schellhas, Norris, 1985), а единственным радикальным средством избавления от паразитов является их хирургическое удаление.
Учитывая особенности локализации личинок Т. multiceps в промежуточном хозяине - головной и спинной мозг, - следует признать маловероятным заражение человека непосредственно через инвазированную пищу. В какой-то степени это объясняет и довольно редкую встречаемость ценуроза у человека при столь распространённом поражении им овец и коз. Известно, что фермеры, хорошо знакомые с этим заболеванием, обнаружив у овец характерные признаки заражения ценурами, обычно забивают этих животных, не прибегая к помощи ветеринаров и уничтожая поражённые органы. По этой причине наиболее вероятным способом заражения человека является случайное заглатывание им яиц цестоды. Подобное вполне возможно при контакте с инвазированными собаками, особенно у детей, а также при употреблении в пищу продуктов, загрязнённых яйцами цестоды, что никак нельзя исключать в условиях антисанитарии и низкой культуры быта.
Безусловно, о массовом поражении людей ценурами Т. multiceps никак нельзя говорить. С. Ллойд (Lloyd, 2011), к примеру, пишет о нескольких сотнях случаев по всему миру. Однако, учитывая высокую патогенность этого гельминта для человека, заражение которым нередко заканчивается летальным исходом, мы обязаны знать особенности его биологии, экологии, географического распространения, патогенности и мерах профилактики, направленных на предупреждение заражения им.
266
Taenia saginata Goeze, 1782 (=Taenia confusa Ward, 1896; = Taenia africana von Linstow, 1900 in part; Taenia hominis von Linstow, 1904; Taenia tonkinensis Railliet et Henry, 1905; Taenia phillipina Stephens, 1908; Taenia cylindrica Leon, 1922) (рис. 141 - 144). Синонимы приведены по работе: Verster, 1969. В целом же список синонимов Т saginata включает более 50 видов (Абуладзе, 1964). В некоторых публикациях и в настоящее время вид всё ещё описывают под его устаревшим названием Taeniarhynchus saginatus (Goeze, 1782) Weinland, 1858. Паразит человека.
Рис. 141 Taenia saginata: 1 - сколекс; 2 - гермафро- Рис. 142 Taenia saginata, сколекс и дитный членик; 3 - зрелый членик (из: Абуладзе, общий вид червя (из: Faust, 1949)
1964)
Рис. 143 Taenia saginata: а - общий вид цестоды; б -сколекс; в - зрелый членик (из: Чебышев, 2012)
Рис. 144 Taenia saginata, половой атриум (из: Verster, 1969)
267
Видовое название цестоды saginata от латинского sagina - полнота, тучность, saginatio - откармливать, откорм. Возможно, при выборе названия для нового вида И. Гёзе (Goeze, 1782) хотел подчеркнуть его отличия от уже известной к тому времени Taenia solium. В отличие от сравниваемого вида у Т. saginata членики более крупные, толстые, их оболочка более грубая и менее прозрачная.
Описание (по разным авторам, в том числе: Абуладзе, 1964; Faust, 1949; Verster, 1969). Очень крупные цестоды серого или беловатого цвета. Длина стробилы достигает 4 - 12 и даже 25 м при ширине 12-14 мм; стробила состоит из 1000 -2000 члеников. При множественной инвазии и размеры червей, и количество члеников в стробиле намного меньше. Сколекс квадратно-овальной формы, шириной 1.4 - 2.0 мм, с 4 полусферическими присосками диаметром 0.53 - 0.8 мм. Вооружение отсутствует; по этой причине паразита называют цепнем невооружённым (в отличие от свиного, вооружённого, цепня). Хоботок в виде рудиментарного образования, больше похож на апикальную присоску. И присоски, и хоботок иногда резко пигментированы. Половые поры неправильно чередующиеся. Закладка полового аппарата начинается примерно с 200-го членика. Зрелые членики размерами 16 - 20 х 4 - 7 мм. В каждом членике 300 - 400 (Faust, 1949), 880 - 1200 (Verster, 1969) семенников, плотно лежащих в одном дорсальном слое; из-за высокой плотности иногда создаётся впечатление наличия второго слоя семенников, расположенного латерально к женским половым органам. Бурса цирруса размером 0.356 -0.571 - 0.101 - 0.142 мм, за продольные экскреторные каналы не проходит. Циррус невооружённый, диаметром 25 - 32 pm. Яичник состоит из двух округлых неравных долей, соединённых перемычкой. Имеется вагинальный сфинктер. Позади яичника параллельно заднему краю членика находится трубчатый желточник. По мере созревания членика начинает формироваться матка, которая закладывается в виде продольного стволика, отходящего от места слияния яйцевода и общего протока желточников. Если в кишечнике обитает один червь, что наблюдается чаще всего, то у данной особи происходит оплодотворение между разными члениками, при этом тело червя петлеобразно изгибается. Если же червей больше одного, тогда осуществляется перекрестное оплодотворение между разными особями. Зрелая матка имеет вид медианного ствола с боковыми ответвлениями в количестве, по разным авторам, 18 - 32, 14 - 32, 15 - 35, 17 - 35. Каждое из них может, в свою очередь, разветвляться на маленькие веточки. Яйца овальные, диаметром 45 (Monnig, 1934), 31 -43 (Faust, 1949), размерами 46 - 50 х 39 - 41 (Verster, 1969), 41 х 31 pm (Muller, 2002), диаметр эмбриофора 6.7 - 8.4 pm. В одном членике насчитывается 0.8 - 1 х 105яиц (Muller, 2002).
Когда терминальные проглоттиды полностью заполняются зрелыми яйцами, они начинают отрываться от стробилы, обычно поодиночке, и выходят наружу или с фекалиями, или же самостоятельно, по 6 - 8 ежесуточно. Проглоттиды способны активно двигаться и некоторое время ползают по почве, рассеивая яйца, выдавливаемые из матки через передний край членика. Яйца содержат зрелые онкосферы и способны сохранять жизнеспособность во внешней среде в течение нескольких недель и даже месяцев (Ilsoe et al., 1990). В частности, в условиях пастбища они выживают в течение 60 - 180 дней, в речной воде - несколько недель, в сточных водах при 18°С - 16 дней, при 50°С - в течение 1 ч (Muller, 2002). Для дальнейшего развития они должны попасть в промежуточного хозяина, каковым для Т. saginata является крупный рогатый скот. Кстати, от этой приуроченности к
268
крупному рогатому скоту цестода получила ещё одно название - цепень бычий (beef tapeworm). Заражение животных происходит при заглатывании ими члеников или онкосфер с травой, сеном, водой.
В кишечнике промежуточного хозяина онкосферы пробуравливают стенку кишки и с током крови и лимфы разносятся по всему организму, оседая в мышцах, сердце, печени, а также в подкожной клетчатке, глазах, головном мозге и других органах, где превращаются в финны типа цистицерков. При экспериментальном заражении телят (23 особи) исследователи выяснили, что в среднем 15.7 % всех цистицерков осело в сердце, а 6.5 % - в жевательных мышцах (Kyvsgaard et al., 1990). Цистицерки (описаны под названием Cysticercus bovis Cobbold, 1866) имеют форму овальных пузырьков величиной от горошины до зерна фасоли, примерно 7.5 - 9 х 5.5 мм (Monnig, 1934). Через плотную, но тонкую стенку просвечивает внутренняя полость, заполненная прозрачной жидкостью, в которой видны сколекс и зачаток шейки цестоды. Продолжительность жизни цистицерков - 8 - 9 месяцев, после чего они погибают и кальцифицируются.
Для завершения жизненного цикла необходимо, чтобы цистицерки попали к человеку (рис. 145).
Рис. 145 Схема жизненного цикла Taenia saginata: А - окончательный и Б - промежуточный хозяева (7 - сколекс; 2 - гермафродитный членик; 3 - зрелый членик; 4 - яйцо; 5 - цистицерк (финна) в мышцах крупного рогатого скота (из: http://licey.net/free/6-biologiya/22-zoologiya ...cepni cyclophyllidea. html)
В кишечнике человека финны высвобождаются от окружающей их ткани и их головки выворачиваются. Оставшийся на конце тела пузырь через некоторое время отваливается, а сколекс с шейкой начинают усиленно расти; от шейки отходят всё новые и новые проглоттиды, формируя стробилу. Ежесуточно червь вырастает на 7 -8 см, и уже через неделю его длина
достигает полуметра (Калинина, 2005). Новые членики формируются только от шейки, а зрелые набитые яйцами проглоттиды постоянно отрываются и выводятся во внешнюю среду вместе с фекалиями или же выползают самостоятельно. Весь процесс созревания червя занимает 18 недель. Срок жизни цепня бычьего в кишечнике человека, при благопритяных для этого условиях, может достигать 18-20 лет.
Не секрет, что в наши дни наиболее популярным средством общения и источником информации для большинства людей является интернет. По этой причине сведения, содержащиеся на справочно-информационных сайтах, не должны вводить читателей в заблуждение, особенно в тех случаях, когда речь заходит о здоровье человека. К сожалению, довольно часто содержащаяся в подобных источниках информация, мягко говоря, не соответствует действительности. Один характерный пример сказанного. На
269
«http://parazitytut.ru/tsepen/bychij.html - Что нужно знать о бычьем цепне» читаем: «Бычий цепень у человека в организме развивается примерно 3 месяца до момента формирования финн, которые затем выходят наружу вместе с фекалиями» (выделено мною -АГ). Стиль изложения не комментирую, но согласитесь, что между яйцом, которое выводится из организма дефинитивного хозяина - человека, и финной (цистицерком), которая формируется в организме промежуточного хозяина - крупного рогатого скота, как в таких случаях говорят, дистанция огромного размера.
Т. saginata - широко распространённый паразит крупного рогатого скота, а также буйволов, зебу, яков, северных оленей. Ареал паразита включает страны Европы, Азии, Африки, Северной, Центральной и Южной Америки, Австралию. При этом показатели заражённости животных варьируют не только между разными странами, но и в пределах одной страны. Приведу несколько примеров, наглядно иллюстрирующих картину распространения цистицеркоза среди крупного рогатого скота на разных континентах. Так, в верхнем Египте в провинции Асьют цистицер-ки были выявлены у 1.6 % особей крупного рогатого скота и 0.8 % буйволов. При этом животные старше 2 лет оказались заражены сильнее, чем особи до 2-летнего возраста: соответственно 2.7 и 0.9 % против 1.1 и 0.6 %. Кстати, одновременно в этой же провинции тениоз зарегистрировали у 0.6 % пациентов с диагнозом гастроэнтерита (Basem et al., 2009). На севере Кении в округе Туркана при серодиагностике скота цистицеркоз обнаружился у 13 - 20.9 % (в среднем 16.7 %) животных и у 0.8 - 5.6 % (2.5 %) обследованного местного населения (Asaava et al., 2009).
В Иране на скотобойне в Керманшахе в 2010 г. цистицеркоз был выявлен в 29 из 48171 обследованной туши (0.06 %), а в 2011 г. - в 20 из 51869 (0.03 %) (Faraji et al., 2015).
Недавно были проанализированы результаты стандартного обследования мяса крупного рогатого скота на наличие цистицерков Т. saginata, проводившегося в 1990 - 2014 гг. в 23 странах Европы, в основном Западной и Центральной. Выяснилось, что в 95 % случаев заражённость мяса была ниже 6.2 %. Вместе с тем, серологические исследования и детальный осмотр мяса дают более высокий показатель его поражённости - от 0.41 до 14 % (Laranjo-Gonzalez et al., 2016).
Следует напомнить, что мясная промышленность многих стран несёт значительные экономические потери из-за заражённости животных цистицерками цепня бычьего. В Кении, к примеру, ежегодные потери, связанные с выбраковкой заражённых туш, снижением сортности мяса и его заморозкой, оценивают в 850 тыс. долларов (см.: Asaava et al., 2009).
Сведения об этой цестоде как о паразите человека встречаются в литературе с давних времён. К настоящему времени подобные случаи известны в экваториальной Африке, Египте, Турции, странах Латинской и Южной Америки, в среднеазиатских странах, в Монголии, Китае, Японии, Камбодже, Корее, на Филиппинах, в некоторых частях Европы, спорадические случаи зарегистрированы в Новой Зеландии и Австралии. В высокогорных районах эндемичных территорий заболевание встречается чаще, чем в равнинной местности. Здесь следует сделать небольшую оговорку. Поскольку в странах Юго-Восточной Азии распространён очень близкий к Т. saginata вид - Т. asiatica, которого до недавнего времени рассматривали подвидом Т. saginata, то, по мнению многих исследователей, видовую идентификацию азиатских тений следует проводить только с использованием молекулярногенетических методов (Cho et al., 2014).
270
На территории России заражение цепнем бычьим отмечают в Ямало-Ненецком АО, Чеченской Республике, на Алтае, в Республике Коми, Дагестане и ряде других, где этот показатель колеблется от 1.1 до 10 и выше случаев на 100 тыс. населения (Быкова, 2017). С определённой частотой встречаемости этого гельминта регистрируют у местного населения в Удмуртии, Пермском, Красноярском и Краснодарском краях, в Новосибирской и Омской областях, Республике Мари-Эл (0.5 -1 на 100 тыс. населения). На остальной территории России заболевание редко. Так, в Москве в 2012 г. было зафиксировано 7 случаев заражения человека Т. saginata, при этом инвазия пациентов произошла вне столицы - в Московской области, Чечне, Дагестане, Армении, Таджикистане; за 9 месяцев 2013 г. выявлен только 1 случай, и также завозной (Худякова, 2014).
Патогенное воздействие цепня бычьего на организм человека, как и при поражении цепнем свиным, разнонаправленно. Здесь и механическое воздействие, вызываемое присосками червя, которыми тот фиксируется к слизистой кишечника, или активно двигающимися члениками, и нарушение моторной и секреторной функций кишечного тракта, вызываемое поселением в тонком кишечнике многометрового червя. Здесь и сенсибилизация организма с развитием аллергических реакций, и провокация болевого синдрома при прохождении проглоттидами баугиниевой заслонки. Описаны случаи проникновения паразита в жёлчевыносящие пути и панкреатический проток с последующей их обструкцией (Kim et al., 1981).
Заболевание обычно проявляется общей слабостью, недомоганием, утомляемостью, головокружением, головной болью, повышенной раздражимостью. Могут быть выражены тошнота, рвота, изжога, неустойчивый стул, повышенное слюноотделение, боли в животе без чёткой локализации, кишечная непроходимость. Очень часто у пациентов наблюдаются изменения аппетита в сторону его понижения или повышения, а также значительное похудение. В отдельных случаях заражение человека никак не проявляется до тех пор, пока в стуле не обнаруживаются проглоттиды. Однако возможны и осложнения, в частности развитие перитонита, панкреатита, аппендицита, холангита, бескаменного холецистита (Daou et al., 1998).. В любом случае, характер проявления инвазии в значительной степени зависят от возраста человека и состояния его иммунной системы. Чаще всего у человека встречается одна особь паразита.
При клиническом обследовании в 70 % случаев у больных наблюдается снижение кислотности желудочного сока, в общем анализе крови могут быть выражены небольшая эозинофилия, анемия или пониженное содержание лейкоцитов.
Диагностика базируется, прежде всего, на основании обнаружения в стуле больного члеников цестоды и определения их систематической принадлежности. Немаловажную роль играет эпидемиологический анамнез. Дифференциальный диагноз проводится с тениозом и дифиллоботриозом.
Заражение человека происходит только через пищу - сырое или слабо обработанное мясо, содержащее личинок цестоды. Подсчитано, что одна тушка теоретически может стать источником инвазии для 8-20 человек (Dupuy et al., 2014).
Для профилактики тениоза первостепенное значение приобретает обязательная экспертиза мяса и мясопродуктов на бойнях, рынках, с тем, чтобы цистицеркозные продукты не попали на стол человека. Так, 6 июля 2017 г. на официальном сайте города Мантурово Костромской области (www.manturovo.org) появилось сообщение о выделении цистицерков цепня бычьего при исследовании биомате
271
риала от крупного рогатого скота, поступившего на убойную площадку мясоперерабатывающего предприятия Костромской области. Если бы реализация этого мяса была проведена без паразитологического анализа, то данный продукт мог бы послужить причиной заражения потребителей.
Для обеззараживания мяса и мясопродуктов, содержащих цистицерки цепня бычьего, обычно прибегают к их замораживанию. При температуре -6...-9°С тушу выдерживают в холодильной камере не менее 24 ч, однако при снижении температуры в толще мяса до -12 °C все цистицерки погибают немедленно. Требования к обеззараживанию «условно годной» мясной продукции на территории РФ диктуются СанПиН 3.2.1333-03.
В домашних условиях, на предприятиях общественного питания следует строго соблюдать регламент кулинарной обработки говядины: мясо следует полностью проваривать или прожаривать (температура внутри куска должна составлять не менее 80°С). Сырой фарш пробовать нельзя. Подобные меры предосторожности вполне оправданы, поскольку, как полагают некоторые авторы (Kyvsgaard et al., 1990), при очень низкой заражённости мяса (цитируемые авторы находили от 2 до 2569 цистицерков в тушке) цистицерки могут быть случайно пропущены.
Индивидуальная профилактика ориентирована, прежде всего, на исключение из рациона питания сырого и недостаточно термически обработанного мяса крупного рогатого скота, а также мяса, не прошедшего ветеринарного контроля, подтверждаемого наличием специального клейма на мясной туше. Следовательно, приобретать мясо крупного рогатого скота в местах, не отведённых для торговли им, т. е. мясо неизвестного происхождения, не рекомендуется.
Общественные превентивные меры заключаются в недопущении попадания сточных вод и нечистот в открытые водоёмы и на места выпаса крупного рогатого скота, соблюдении санитарно-ветеринарных правил на животноводческих фермах, бойнях, предприятиях пищевой промышленности, общественного питания и торговли, обследовании на наличие гельминтов работников животноводства, торговли и общепита, своевременном выявлении больных, их изоляции и лечении. Большое значение в профилактике тениоза принадлежит санитарно-просветительной работе. Население должно знать, насколько опасно использование в пищу мяса, не прошедшего ветеринарной экспертизы, и как можно его надежно обезвредить.
. В Международной классификации болезней 10-го пересмотра МКБ-10 (ICD-10, Version: 2016) в «Классе I. Некоторые инфекционные и паразитарные болезни (А00-В99)», а в нём в блоке «В65-В83 Гельминтозы» заболеванию, вызываемому данным паразитом, присвоен код В68.1 (Инвазия, вызванная Taenia saginata).
Taenia serialis (Gervais, 1847) Brumpt, 1936 [^Coenurus serialis Gervais, 1847; =Multiceps serialis (Gervais, 1847) Stiles et Stevenson, 1905] (рис. 146 - 148). Впервые данный вид описан по ценурам. Ещё в самом начале 19-го века известный французский врач и патологоанатом Р. Лэнне (Laennec, 1804), опираясь на устные сообщения охотников о находках в мышцах зайцев каких-то личинок, предположил, что это был Coenurus cerebralis. Леблон (Leblond, 1837) также определил присланного ему ценура из зайца как С. cerebralis. П. Жервэ, исследовав упомянутый материал, описал его как новый вид Coenurus serialis Gervais, 1847. Называя новую форму ценура serialis, автор тем самым хотел подчеркнуть присущее этим пузырям удивительное свойство последовательно образовывать всё новые пузыри со сколексами, количество которых может исчисляться несколькими десятками.
272
Рис. 146 Taenia serialis'. 1 - крючья; 2 - гермафродитный членик; 3 - зрелый членик (из: Абуладзе, 1964 - по: Hall, 1919)
Рис. 147 Taenia serialis, крючья на сколесе ценура из кролика (из: Nagaty, Ezat, 1946)
лексе взрослой особи; 2 - половой атриум (из: Verster, 1969)
Описание (по разным авторам, в том числе: Hall, 1919; Verster, 1969). Цестоды средних размеров, до 20 - 27 см длины и 3.5 - 5 мм максимальной ширины. Сколекс диаметром 0.582 - 1.50 мм. Хоботок 0.273 - 0.364 мм, с 26 - 34 крючьями в двух рядах. Крючья 1-го ряда длиной 0.135 -0.175 мм, снабжены острым, слегка изогнутым лезвием; рукоятка крючка волнообразной формы и слегка заострена на конце; корневой отросток сердцевидной формы. Крючья 2-го ряда длиной 0.078 -0.120 мм, с мощным заострённым лезвием, рукоятка короткая, толстая, изогнутая, с небольшим выступом на вентральном крае; корневой отросток овальной или сердцевидной формы, с медианной вырезкой. Присоски 0.228 - 0.346 мм в диаметре. Узкая шейка 0.1 мм длины. У гермафродитных члеников ширина всегда превышает длину, зрелые проглоттиды продолговатой формы, размерами 6 - 12 х 3 - 4 мм.
273
Задние края и углы молодых члеников вытянуты и прикрывают передние края соседних члеников, придавая всей стробиле зубчатый вид. В зрелых члениках задние края образуют воронкообразное вдавливание, прикрывающее передние края соседних члеников. Половые сосочки сильно выступающие. Зачатки половых органов можно различить почти непосредственно позади шейки. В каждом членике 350 -500 семенников, расположенных в 1 - 3 слоях, обычно в двух. В передней части членика семенники сливаются, позади достигают уровня желточников, но не сливаются. Семяпровод начинается близ медианной линии с поральной стороны и, слабо извиваясь, направляется к латеральному краю членика. Узкая вытянутая бурса цирруса размером 0.200 - 0.300 х 0.055 - 0.099 мм. Яичник двудольчатый, по-ральная доля меньше апоральной. Желточник поперечно-овальной формы лежит кзади от яичника и своими латеральными краями никогда не достигает уровня его боковых краёв. Между яичником и желточником располагается слабо выраженное тельце Мелиса. Трубчатая вагина со сфинктером диаметром 36 - 59 цт; близ экскреторных каналов образует один или несколько расширенных изгибов. В зрелых члениках от медианного ствола матки отходит по 20 - 25 латеральных ветвей, свободные концы которых настолько переплетаются друг с другом, что иногда трудно сосчитать их количество. Яйца слегка овальной формы, размерами 31 - 34 х 29 - 30 (Hall, 1919), 34 - 41 х 30 - 34 pm (Verster, 1969), эмбриофор 3.4 - 5.6 pm.
Схема жизненного цикла Т. serialis в принципе не отличается от таковой других тениид (рис. 149).
Рис. 149 Схеме жизненного цикла Taenia serialis: 1 - зрелые проглоттиды и яйца с фекалиями хозяина попадают во внешнюю среду; 2 -яйца попадают во второго промежуточного хозяина, в организме которого онкосферы разносятся током крови в самые разные органы (3), где формируются ценуры (4); 5 - заражение окончательных хозяев (6); 7 - человек заражается при случайном заглатывании яиц гельминта с пищей или водой; 8 -покинувшие яйца онкосферы оседают в разных оргайах, где через 3 месяца формируется ценур (9) (i -инвазионная стадия; d - диагностическая стадия) (из:
cdc.gov/dpdx/coenurosis /index.tml)
274
Ценуры Т. serialis имеют весьма разнообразную форму и достигают размеров голубиного яйца или меньше (рис. 150, 151).
Рис. 150 Ценур Taenia serialis (из: Абуладзе, 1964)
Рис. 151 Ценур Taenia serialis из бабуина гелада, Эфиопия (из: Nguyen et al., 2010)
Приведённое ниже описание ценура заимствовано из монографии К. И. Абуладзе (1964; стр. 211): «Материнский пузырь у облигатных хозяев в местах нормальной локализации обычно овальной формы, размер его достигает 3 - 4 см в диаметре. Наружная оболочка ценура сравнительно нежная и не спаяна с окружающей ее соединительнотканной капсулой хозяина. На внутренней оболочке располагаются сколексы, сидящие, как правило, несколькими параллельными или расходящимися рядами, причем в каждом ряду насчитывается 30 - 50 сколексов. Сколексы большей частью занимают верхнюю треть площади пузыря. В отдельных случаях сколексы не имеют определенного расположения, а концентрируются группами (Clapham, 1942; Hamilton, 1950). Иногда ценуры образуют дочерние пузыри, которые могут отпочковываться как эндогенно, так и экзогенно от материнского пузыря. Экзогенные дочерние пузыри часто прикрепляются к материнскому при помощи коротких ножек в виде пальцевидных отростков, что придает им разнообразную ветвистую структуру. От дочерних пузырей могут в свою очередь отпочковываться новые пузыри. Большинство сколексов достигает в длину 8 мм, т. е. они значительно длиннее сколексов, обнаруживаемых в экзогенных дочерних пузырях. Дистальные концы, где располагаются крючья и присоски, загнуты и слегка расширены, образуя головку, ножка или шейная область значительно удлиняется, причем размер ее связан с возрастом. Сколексы в материнском пузыре неровные, часть из них более крупная, и у них шейная область близ точки прикрепления к герминативной оболочке сильно расширяется, образуя пузырек».
Сколексы обладают вполне развитыми крючьями, чьи размеры вписываются в таковые, приводимые для взрослых форм. По одним данным (Becklund, 1970), сколексы имеют 22 - 36 крючьев (у большинства их 30), длина больших крючьев 0.125 -0.157 (в среднем 0.143.6), маленьких 0.083 - 0.115 (0.086.7), по другим (Nagaty, Ezat, 1946), на сколексах насчитывается 30-32 крючка, размером соответственно 0.148 - 0.153 и 0.094 - 0.104 мм.
Взрослые особи Т. serialis паразитируют у собак, волков, лисиц, шакалов, енотовидных собак и, очень редко, у кошек. В Испании, например, паразит был вы-
275
явлен у 8 % волков при интенсивности инвазии 3-60 экз. (Segovia et al., 2003). Промежуточные хозяева паразита - зайцы и кролики, у которых личинки локализуются в межмышечной соединительной ткани и подкожной клетчатке на передних и задних конечностях, шее, в области лопаток, а также в брюшной и грудной полостях, сердце в виде единичных пузырей или группами. Помимо поражения кроликов и зайцев, известны единичные случаи ценуроза сериального у белок, нутрий, обезьян, в том числе бабуинов, а также человека.
Первый случай харажения человека Т. serialis описан в 1933 г.: 59-летняя француженка, любительница собак, обнаружила у себя в правой ягодице довольно крупную овальную опухоль размером 9 х 3.5 см (Bonnal et al., 1933). Опухоль удалили хирургическим путём. Внутри опухоли оказался ценур Coenurus serialis с многочисленными сколексами. Некоторые из этих дочерних ценуров скормили собаке, а через 12 дней в её кишечнике было выявлено 7 незрелых стробил. Сколекс характеризовался наличием 32 крючьев, чьи размеры соответствовали таковым С. serialis.
Второй случай был описан на следующий год и вновь во Франции (Brumpt et al., 1934). На этот раз у пострадавшей под кожей обнаружились 3 опухоли.
Следующие сообщения касались заражения человека и животных в Египте (Nagaty, 1940), обнаружения ценура в мозге скончавшегося мальчика, жившего в сельской местности в Калифонии (Craig, Faust, 1943).
В последующие годы сообщения на подобную тему эпизодически появлялись в разных странах мира. К примеру, в 1981 г. был зафиксирован первый случай заражения человека ценуром Т. serialis в Канаде (Benger et al., 1981). Пациентка, 38-летняя женщина, страдала от периодической сыпи, лихорадки, ночного потоотделения и лимфаденопатии, что было похоже на симптомы, характерные для лимфомы, а, возможно, и болезни Ходжкина (лимфогранулёматоза). В течение трёх лет больная прошла несколько курсов химиотерапии, что помогало ей только в период лечения. Когда же в левой груди у неё появилась геморрагическая масса, то её удалили хирургическим путём и тогда-то и выяснилось, что все перечисленные симптомы были результатом паразитирования пузыреподобного ценура Т. serialis.
К 1998 г. в США было известно о 6 случаях церебрального или кожного ценуроза у людей, в том числе детей (Ing et al., 1998).
Упомяну ещё одну публикацию на эту тему (Collomb et al., 2007). Авторы описывают заражение 24-летней француженки, вернувшейся из Кот-д'Ивуара.
В целом, сообщения о заражении человека личинками Т. serialis очень немногочисленны, хотя практически во всех источниках данный вид перечисляют в числе обычных видов тений, регистрируемых у людей.
Симптомы заражения человека ценурами Т. serialis практически не отличаются от таковых, наблюдаемых при инвазии другими видами тений.
Кратко резюмируем изложенную информацию по цестодам рода Taenia, зарегистрированным к настоящему времени у людей. Таковых известно 10 видов - Taenia solium, Т. asiatica, Т. brauni, Т. crassiceps, Т, glomerata, Т. hydatigena, Т. martis, Т. multiceps, Т. saginata, Т. serialis. Тем не менее, вполне возможно, что этими видами перечень опасных для человека тений далеко не исчерпывается. Скорее всего, следует признать, что человек может быть восприимчив к заражению любым видом Taenia. Сказанное наглядно подтверждают публикации последних лет, например, о регистрации у человека нового для него вида тений - Т. martis или же о выделении 276
в качестве самостоятельного вида Г. asiatica, ранее рассматриваемой подвидом Г. saginata, что потребовало пересмотра информации о регистрации Т. saginata (s. 1.) у населения Юго-Восточной Азии. Справедливости ради сдедует заметить, что не все исследователи согласились с выведением Г. saginata asiatica на уровень вида и считают, что более целесообразно рассматривать азиатскую форму как подвид или штамм Т. saginata, чем самостоячтельный вид Т asiatica (McManus, 2006).
И, наконец, в ряде источников их авторы по ряду причин не идентифицируют выявленных у человека тений. Так, описывая обнаружение в мозге 48-летнего уроженца Луизианы (США) кистевидного цистицерка, у которого отсутствовали сколекс и крючья, авторы (Jung et al., 1981) отметили, что эта личинка может быть стерильным ценуром Т. multiceps или Г. serialis или же аберрантной формой Т solium, или же вообще другим видом Taenia. Кстати, пациенту перед операцией был поставлен диагноз опухоли мозга.
Практически для всех зарегистрированных у человека видов тений, за исключением Т solium и Т. saginata, попадание к нему является для паразита тупиком. Трудно предположить, каким образом развившиеся в организме человека личинки (цистицерки или ценуры) могут попасть к окончательному хозяину, разве что при случайной гибели того где-либо на природе. Для двух упомянутых видов человек - окончательный хозяин. Более того, как мы видим, Т solium вообще способен завершить жизненный цикл, не попадая во внешнюю среду и без участия до-полнтельного хозяина.
В настоящее время в мире около 80 млн. человек заражено Т. solium и Т. saginata (Akarsu et al., 2013). К примеру, в Перу встречаемость Taenia sp. у местного населения в 1981 - 2001 гг. колебалась по регионам от 0.1 до 40 %, составив в среднем 3.9 % (Peru/Minsa/oge-03/039 & Ser. Inf. Тёс. Invest. Epid.). В Северном и Центральном Вьетнаме заражённость населения тениазом достигает 7.2 % (De et al., 2001), причём на севере этой страны в специализированные клиники в связи с данным заболеванием ежегодно обращаются 100 - 150 человек (Nguyen, 2013).
И последнее. Подсчитано, что ежегодно от поражения центральной нервной системы или сердечной недостаточности, вызванного заражением тениями, умирает 50 тыс. человек.
Цитируемая литература
Абуладзе К. И. Тениаты - ленточные гельминты животных и человека и вызываемые ими заболевания И Основы цестодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1964. - 4. - С. 43 - 163 с.
Бессонов А. С. Тениоз - Taenia solium - цистицеркоз. - М.: Колос, 1996. - 334 с.
Биттиров А. М., Кабардиев С. ILL, Пежева А/. X, Карпущенко К. А. Устойчивость инвазионных элементов цестоды Taenia hydatigena Pallas, 1766 внешней среде в условиях предгорной зоны Кабардино-Балкарской Республики И Ветеринария и кормление. - 2015. - № 6. - С. 8 - 10.
Быкова Н. И. Тениаринхоз (бычий цепень). - www.medicalj.ru. - Accessed 03.07.2017.
Калинина О. И. Биология гельминтов и профилактика гельминтозов (учебное пособие). - Владивосток: Изд-во ТГЭУ, 2005. - 80 с.
Поляков В. Е., Лысенко А. Я., Константинова Т. Н., Авдюхина Т. И. Тениоз у детей и подростков И Педиатрия. - 2004. - № 4. - С. 60 - 64.
СанПин 3.2.1333-03. Профилактика паразитарных болезней на территории Российской Федерации (30.05.2003. № 105).
Фуникова С. В. К вопросу изучения глистных инвазий пушных зверей Татарии: канд. дисс. - М., 1940. Библиотека ВИГИС (цит. по: Абуладзе, 1964).
Худякова С. А. Биогельминтозы: эпидемиологическая ситуация в Москве И Санэпиднадзор. Охрана труда. - 2913. - № 1. - С. 108-113. Доступно он-лайн: www.profiz.ru.
277
Чебышев Н. В. и#др. Медицинская паразитология: Учебное пособие / Под ред. Н. В. Чебышева. - М.: Медицина, 2012. - 304 с. (доступно он-лайн: vmede.org/index.php?board=452.0).
Шималов В. В. Taenia martis (Cestoda, Taeniidae) у позвоночных животных в Республике Беларусь // Паразитология. - 2010. - 44, 5. - С. 435 - 440.
Шульман Е. С., Лейкина Е. С. Глава XVIII. Тениидозы / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: «Медицина», 1968. - С. 460 - 483. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Юшков В. П. Фауна европейского Северо-Востока России. Т. 3. Гельминты млекопитающих. - СПб.: Наука, 1995.-202 с.
Abu Salem О. Т, Hassan М. A. Acute abdomen and Taenia solium peritonii // Kuwait Med. J. - 2003. - P. 299-300.
AchenefM., Markos T, Feseha G., Hibert A., Tembely S. Coenurus cerebralis infection in Ethiopian highland sheep: incidence and observations on pathogenesis and clinical signs // Trop. Anim. Health Prod. - 1999. -31, 2.-P. 15-24.
Adalid-Peralta L., Fleury A., Garcia-Ibarrat T M., Hernandez M. et al. Human neurocysticercosis: in vivo of peripheral regulatory I cells and their recruitment in the central nervous system // J. Parasitol. - 2012. - 98, l.-P. 142-148.
Akarsu M., Kantar F. U., Akpinar H. Taenia saginata in the small intestine // Video Journal and Encyclopedia GI Endoscopy. -2013. 1, l.-P. 281-282. Doi. Org/10/1016/S2212-0971(13)70122-5.
Anantaphruti M. T, Yamasaki H, Nakao M. et al. Sympatric occurrence of Taenia solium, T. saginata and T asiatica, Thailand // Emerg. Inf. Dis. - 2007. -13, 9. - P. 1413 - 1415. doi: 10.3201 /eid 1309.061148/
Araki T.President lecture: current trend of cerebral cysticercosis in Japan // Clin. Parasitol. - 1994. - 5, l.-P. 12 - 24 (In Japanese; цит. no: Yamagida et al., 2012).
Arocker-Mettinger E., Huber-Spitzy V., Auer H. et al. [Taenia crassiceps in the anterior chamber of the human eye. A case report] 11 Klin. Monbl. Augenheilkd. - 1992. - 201, 1. - P. 34 - 37.
Asaava L. L, Kitala P. M., Gathura P. B., Nanyingi M. O. et al. A survey of bovine cysticercosis/human tae-niosis in Northern Turkana District, Kenya // Prevent. Vet. Med. - 2009. - 89. - P. 197 - 204. Doi: 10.1016/j .preventmed.2009.02.010.
Assana E, Lightowlers M. W., Zoli A. P., Geerts S. Taenia solium taeniosis/cysticercosis in Africa: risk factors, epidemiology and prospects for control using vaccination 11 Vet. Parasitol. - 2013. - 195, 1-2. - P. 14 -23. doi: 10.1016/j.vetpar.2012.12.022.
Basem R. N. A., Amal SM. S, Asmaa A.A. H, Mohsen I. A. Occurence of Cysticercosis in cattle and buffaloes and Taenia saginata in man in Assiut Governance of Egypt // Vet. World. - 2009. - 2, 5. - P. 173 - 176.
Becklund IV. IV. Current knowledgw of the gid bladder worm, Coenurus cerebralis (-Taenia multiceps) in North American domestic sheep, Ovis aries // J. Helminthol. Soc. Wash. - 1970. - 37, 2. - P. 200 - 203.
Benger A., Rennie R. P., Roberts J. T, Thornley J. H, Scholten T. A human coenurus infection in Canada // Am. J. Trop. Med. Hyg. - 1981. - 30, 3. - P. 638 - 644.
Benifla M., Barrelly R., ShelefL et al. Huge hemispheric intraparenchymal cyst caused by Taenia multiceps in a child. Case report // J. Neurosurg. - 2007. -107, 6. - P. 511 - 514.
Bonnal O., Joyeux V., Bosch P. Un cas de cenurose humaine du & Multiceps serialis (Gervais) // Bull. Soc. pathol. exot. - 1933. - 26, 8. - P. 1060 - 1071.
Braae U. C, Kabululu M., Normark M. E, Nejsum P. et al. Taenia hydatigena cysticercosis in slaughtered pigs, goals, and sheep in Tanzania 11 Trop. Amer. Health Prod. - 2015. - 47. - P. 1523 - 1530. Doi: 10.1007/sl 1250-015-0892-6.
Bray R. (2015). Taenia Linnaeus, 1758. Accessed through: World Register of Marine Species at http: // www.marinespecies.org/aphia.php?p=taxdetails&id=l05005 (2017-06-08).
Brumpt E. Precis de parasitologic. 2nd edn. - Paris: Masson et Cie, 1913. - P. 281.
Brumpt E, Duvoir N., Sainton J. Un cas de cdnurose humaine du Coenurus serialis, parasite habituel des lapins et des lievres // Ann. Parasitol. Hum. Comp. - 1934. - 12, 5. - P. 371.
Brunet J, Benoilid A., Kremer S., Dalvit C. et al. First case of human cerebral Taenia martis cysticercosis // J. Clin. Microbiol. -2015. -53, 8. -P. 2756-2759. doi: 10.1128/JCM.01033-15.
Brunet J., Pesson B., Chermette R., Regnard P. et al. First case of peritoneal cysticercosis in a non-human primate host (Macaca tonkeana) due to Taenia martis 11 Parasites & Vectors. - 2014. - 7. - P. 422. DOI: 10.1186/1756-3305-7-422.
Buckley J. J. C. Coenurus from human cord 11 Trans. Roy. Soc. Trop. Med. Hyg. - 1947. - 41, 1. -
Cannon D. A. A case of human infection with a species of Coenurus 11 Ann. Trop. Med. Parasitol. - 1942. -36, 1/2.-P. 32-34.
278
Chang S. L., Ooi H. K, Nопака N„ Kamiya M., Oku Y. Development of Taenia asiatica cysticerci to infective stage and adult stage in Mongolian gerbils // J. Helminthol. - 2006. - 80, 3. - P. 219 - 223.
Chao D., Wong M. M., Fan P.-C. Experimental infection in a human subject by a possibly undescribed species of Taenia in Taiwan П J. Helminthol. - 1988. - 62, 3. - P. 235 - 242. 10.1017/S0022149X00011585.
Chermette R., Bussieras J.t Marionneau J., Boyer E. et al. [Invasive cysticercosis due to Taenia crassiceps in an AIDS patient] П Bull. Acad. Natl. Med. - 1995. -179,4. - P. 777 - 780. (In French).
Cho J., Jung В. K.t Lim H., Kim M. J. et al. Four cases of Taenia saginata infection with an analysis of COXI gene // Korean J. Parasitol. - 2014. - 52, 1. - P. 79 - 83. doi: 10.3347/kjp.2014.52.1.79.
Christodoulopoulos G. Two rare clinical manifestations of coenurosis in sheep 11 Vet. Parasitol. - 2007. -143, 3-4.-P. 368-370.
Chung W. C.t Fan P.-С., Lin C. Y., Wu С. C. Studies of taeniasis in Taiwan. XII. Prevalence of taeniasis among Atayal aborigines in Wufeng District, Hsinchu County, northwest Taiwan // Gaoxiong Yi Xue Ke Xue Za Zhi. - 1990. - 6, 1. - P. 66 - 72.
Clapham Ph. A. Studies on Coenurus glomeratus 11 J. Helminthol. - 1940a. - 18, 1. - P. 45 - 52.
Clapham Ph. A. Further studies on Coenurus glomeratus 11 J. Helminthol. - 1940b. - 18, 2/3. -P. 95 - 102.
Clapham Ph. A. An English case of Coenurus cerebralis in the human brain 11 J. Helminthol. - 1941. - 19, 3/4.-P. 84-86.
Cluver E. H. Annual Report of the South African Institute for Medical Research, 1940. - P. 49.
Collomb J., Machouart M, Biava M. F., Brizion M. et al. Contribution of NADH dehydrogenase subunit I and cytochrome C oxidase subunit I sequences toward identifying a case of human coenuriasis in France // J. Parasitol. - 2007. - 93, 4. - P. 934 - 937.
Correa F. M. A., Filho F. F.t Forjaz S, Martelli N. Cenurose cerebral. A propdsito de um caso humano П Rev. Inst. Med. Trop. SSo Paulo. - 1962. - 4, 1. - P. 38 - 45.
Craig P., Ito A. Intestinal cestodes // Curr.Opin. Infect. Dis. - 2007. - 20, 5. - P. 524 - 532.
Crusz H. On an English case of an intramedullary spinal Coenurus inman, with some remarks on the indetity of Coenurus spp. Infesting man // J. Helminthol. - 1948. - 22, 2. - P. 73 - 76.
Daou R.t Achram M., Abousalbi M., Dannaoui M. Acute acalculous cholecystitis due to Taenia saginata // Chirurgie. - 1998. - 123, 2. - P. 195 - 197.
De N. И, Kim H. T, Toan N. D. et al. Intestinal and foodbome parasitic infection in Hoa Binh province. Summary record of scientific research works 1996-2000. - Hanoi: National Institute of Malariology, Parasitology and Entomology, 2001.-P. 615 -621.
De N. K, Lam К. T, Chau L. К et al. Study on trematodosis and cestodosis // Malaria Parasit. Dis. Prevent. Bull.- 1998.-2, l.-P. 29-33.
De Liberate C., Berrilli F., Meoli R., Friedrich K. G. et al. Fatal infection with Taenia martis metacestodes in a ring-tailed lemur (Lemur catta) living in an Italian zoological garden // Parasitol. Int. - 2014. - 63, 5. - P. 695-697. doi: 10.1016/j.parint.2014.05.008.
Deplazes P., Eckert J. Investigation of Taenia hydatigena infections in dogs // Schweizer Archiv fllr Tierheil-kunde. - 1988. -130, 6. - P. 289 - 306.
Devicesschauwer B., Aryal A., Joshi D. D., Rijal S. et al. Epidemiology of Taenia solium in Nepal: is it influenced by the social characteristics of the population and the presence of Taenia asiatica? // Trop. Med. Int. Health.-2012.-17, 8.-P. 1019- 1022. 10.1 lll/j.1365-3156.2012.03017.x.
Dejjke O. Die Entozoen des Hundes // Arch. Wissensch.prakt. Thierh., Berl. - 1891. - 17, 1-2. - P. 1 - 60; 4 -5.-P. 253-289.
Domenici R., Matteucci L., Meossi C.t Stefani G., Frugoli G. [Neurocysticercosis: a rare cause of convulsive crises] 11 Pediatr. Med. Chir. - 1995. - 17, 6. - P. 577 - 581.
Dorny P., Somers R., Dang C. T. T., Nguen V. K., Vercruysse J. Cysticercosis in Cambodia, Lao PDR and Vietnam // Southeast Asian J. Trop. Med. Public Health. - 2004. - 35, Suppl. l.-P. 223 - 226.
Dupuy C., Mor lot C., Gilot-Fromont E, Mas M. et al. Prevalence of Taenia saginata cysticercosis in French cattle in 2010 // Vet. Parasitol. -2014. -203, 1-2. -P. 65 - 72. doi: 10.1016/j.vetpar.2014.02.054.
Eberwein P.t Haeupler A.t Kuepper F.t Wagner D. et al. Human infection with marten tapeworm // Emerg. Infect. - 2013. - 19, 7. - P. 1152 - 1154.
El-On J., Shelef I., Cagnano E. et al. Taenia multiceps'. a rare human cestode infection in Israel // Vet. Ital. -2008.-44, 4.-P. 621 -631.
Eom K. S. What is Asian Taenia // Parasitol. Int. - 2006. - 55, Suppl. - P. 137-141.
Eom K. S, Rim H.-J. Experimental human infection with Asian Taenia saginata metacestodes obtained from naturally infected Korean domestic pigs // Korean J. Parasitol. -1992. - 30, 1. - P. 21 - 24. doi/org/ 10.3347/kjp.1993.31.1.1.
279
Еот К. S., Rim H.-J. Morphological descriptions of Taenia asiatica sp. n. // Korean J. Parasitol. - 1993. - 31, l.-P. 1 -6. doi.org/10.3347/kjp. 1992.30.1.21.
Еот K. S., Rim H.-J., Geerts S. Experimental infection of pigs and cattle with eggs of Asian Taenia saginata with special reference to its extrahepatic viscerotropism // Kisaengchunghak Chapchi. - 1992. - 30, 4. -P. 269-275.
Epstein E., Proctor N. S. F., Heinz H. J. Intra-ocular Coenurus infestation // South African Med. J. - 1959. -33.-P. 602 - 604.
Fain A. Morphologie et cycle 6volutif de Taenia brauni Setti, 1897, Cestode trds commun chez le chien et le chacal en Ituri (Congo Beige) // Rev. Suisse zool. - 1952. - 59, 25. - P. 487 - 501. 10.5962/bhl.part.75378.
Fain A. Coenurus of Taenia brauni Setti parasitic in man and animals from the Belgian Congo and Ruanda-Urundi // Nature. - 1956. - 178 (4546). - P. 1353.
Fain A.t DenisoffN., Homans L, Questiaux G. et al. Cenurose chez I’homme et les animaux due & Taenia brauni Setti au Congo Beige et au Ruanda-Urundi. II. Relation de huit cas humains // Ann. Soc. belg. Med. trop. - 1956. - 36, 5bis. - P. 679 - 696.
Fall E. H, Geerts S., Kumar K, Vervoort T. et al. Failure of experimental infection of baboons (Papio hama-dryas) with the eggs of Asian Taenia // J. HelminthoL- 1995. - 69, 4. - P. 367 - 368. doi: 10.1017/S0022149X00014978.
Fan P.-C. Taiwan Taenia and taeniasis // Parasitol Today. - 1988. - 4, 3. - P. 86 - 88. doi: 10.1016/0169-4758(88)90204-9.
Fan P.-С., Chung JK C, Lin C. Y., Chan С. H. Clinical manifestations of taeniasis in Taiwan aborigines // J. HelminthoL - 1992a. - 66, 2. - P. 118 - 123.
Fan P.-С., Lin C. Y., Chen С. C., Chung JK C. Morphological description of Taenia saginata asiatica (Cyclophyllidea: Taeniidae) from man in Asia // J. HelminthoL - 1995. - 69, 4. - P. 299 - 303.
Fan P.-С., Lin C.Y., Chung W. C. Experimental infection of Philippine Taenia in domestic animals // Int. J. Parasitol. - 1992. - 22, 2. - P. 235 - 238. doi: 10.1016/0020-7519(92)90107-V.
Fan P.-С., Lin C.Y., Wu С. C., Chung W. C, Soh С. T. Experimental studies of Korea Taenia (Cheju strain) infection in domestic animals // Ann. Trop. Med. Parasitol. - 1989. - 83, 4. - P. 395 - 403.
Faraji R., Nazari N., Negahdary M. Prevalence of cysticercus of Taenia saginata in cattle slaughtered // Int. J. Res. Med. Sci. - 2015. - 3, 7. - P. 1662 - 1665.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949.-P. 299-314.
Fleury A., Morales J., Bobes К J, et al. An epidemiological study of familial neurocysticercosis in an endemic Mexican community // Trans. R. Soc. Trop. Med. Hyg - 2006. - 100. - P. 551 - 558.
Flisser A. Epidemiological studies of taeniosis and cysticercosis in Latin America / Cestode zoonoses: Echinococcosis and cysticercosis. - Eds. Craig P. & Pawlowski Z. - IOS Press, Amsterdam, 2002. - P. 3 - 12.
Flisser A. State of the art of Taenia solium as compared to Taenia asiatica 11 Korean J. Parasitol. - 2013. -51,1.- P. 43 - 49. doi: 10.3347/kjp.2013.51.1.43.
Francois A., Favennec L., Cambon-Michot C. et al. Taenia crassiceps invasive cysticercosis: a new human pathogen in acquired immunodeficiency syndrome? // Am. J. Surg. Pathol. - 1998. - 22, 4. - P. 488 - 492.
Freeman R. S. Studies on the biology of Taenia crassiceps (Zeder, 1800) Rudolphi, 1810 // J. Parasitol. -1954. - 40, 5, Sec. 2 (SuppL). - P. 41.
Freeman R. S. Studies on the biology of Taenia crassiceps (Zeder, 1800) Rudolphi, 1810 (Cestoda) // Canad. J. Zool. - 1962. - 40. - P. 969 - 990.
Freeman R. S., Fallis A. M., Shea M., Maberley A. L., Walters J. Intraocular Taenia crassiceps (Cestoda) Part II. The parasite // Am. J. Trop. Med. Hyg. - 1973. - 22, 4. - P. 493 - 495.
Garcia H, Gonzalez A. E., Carlton A. W. et al. Taenia solium cysticercosis // Lancet. - 2005. - 35, l.-P. 547-556.
Garcia H. H, Moro P. L., Schantz P. M. Zoonotic helminth infections of humans: echinococcosis, cysticercosis and fascioliasis // Curr.Opin. Infect. Dis. - 2007. - 20, 5. - P. 489 - 494.
Gervais P. Sur quelques entozoaires taenioides et hydatides // M6m. Acad, sci. et lettr. de Montpellier. Sect, sci.- 1847.-P. 85-104.
Goesseringer N., Lindenblatt N., Mihic-Probst D. et al. Taenia crassiceps upper limb fasciitis in a patient with untreated acquired immunodeficiency syndrome and chronic hepatitis C infection—the role of surgical debridement // J. Plast. Reconstr. Aesthet. Surg. - 2011. - 64, 7. - P. 174 - 176. 10.1016/j.bjps.2011.02. 011
Goeze J. A. E. Versuch einer Naturgeschichte der Eingeweidewtirmer thierischer Кбгрег. - Blankenburg, 1782.-P. 1-471.
Grove D. I. A History of Human Helminthology. - CAB Int., 1990. - P. 355 - 362.
Hall M. C. The gid parasite and allied species of the genus Multiceps. I. Historical review. - Bureau of Animal Industry. U. S. Dept. Agric. - 1910. - Bull. 125. - 68 pp.
280
Hall M. C. The adult taenioid cestodes of dogs and cats, and of related carnivores in North America // Proc. U. S. Nat Museum. - 1919.-55, 2258. - P. 1 - 94.
Hassanein К. M. A., Elghaffar S. K. A. Internal hydrocephalus caused by Coenurus cerebralis in a ewe // J. Ad. Vet. Animal Res. - 2016. -3, 2. - P. 184 - 187.
Haukisalmi K, Konyaev S., Lavikainen A. et al. Description and life-cycle of Taenia lynciscapreoli sp. n. (Cestoda, Cyclophyllidea) // ZooKeys. - 2016. - 584. - P. 1 - 23. Doi: 10.3897/zookeys.584.8171.
Heldwein K., Biedermann H G., Hamperl W, D., Bretzel G. et al. Subcutaneous Taenia crassiceps infection in a patient with non-Hodgkin’s lymphoma //Am. J. Trop. Med. Hyg. - 2006. - 75, l.-P. 108-111.
Hermos J. A., Healy G. R., Schultz M G.t Barlow J., Church W. G. Fatal human cerebral coenurosis // J. Amer. Med. Ass. - 1970.-213, 9. -P. 1461 - 1464. doi:10.1001/jama.l970.03170350029006.
Hira P. R., Francis I., Abdella N. A., Gupta R. et al. Cysticercosis: imported and autochthonous infections in Kuwait П Trans. R. Soc. Trop. Med. Hyg. - 2004. - 98, 4. - P. 233 - 239. 10.1016/S0035-9203(03)00061.
Hoberg E. P. Phylogeny of Taenia: Species definitions and origin of human parasites // Parasitol. Int. - 2006. -55, Suppl.-P. 23-30. doi: 10.1016/j.parint.2005.11.049.
Hoberg E. P., Ebinger W., Render J. A. Fatal cysticercosis by Taenia crassiceps (Cyclophyllidea: Taniidae) in a presumed immunocompromised canine host // J. Parasitol. - 1999. - 85, 6. - P. 1174-1178.
Ibechukwu B. L, Onwukeme К. E. Intraocular coenurosis: A case report // Brit. J. Ophthalmol. - 1991. - 75, 7. -P. 430-431. http://dx.doi.Org/10.1136/bjo.75.7.430.
Ilsoe B.t Kyvsgaard N. C.t Nansen P., Henriksen S. A. A study on the survival of Taenia saginata eggs on soil in Denmark // Acta Vet. Scand. - 1990. - 31. - P. 153 - 158.
Ing M. B.t Schantz P. M., Turner J. A. Human coenurosis in North America: Case reports and review // Clin. Inf. Dis. - 1998. - 27, 3. - P. 519 - 523.
Ito A., Craig P. S, Schantz P. M. Taeniasis/cysticercosis and echinococcosis with focus on Asia and the Pacific // Parasitol. Int. - 2006. - 55. - P. 1 - 308. 10.1016/j.parint.2005.11.001
Ito A., Nakao M.t Wandra T Human taeniasis and cysticercosis in Asia //Lancet. -2003. - 362 (9399). -P.1918-1920. 10.1016/S0140-6736(03) 14965-3
Ito A., Nakao M.; Wandra T., Suroso T. et al. Taeniasis and cysticercosis in Asia and the Pacific: present state of knowledge and perspectives // Southeast Asian J. Trop. Med. Public Health. - 2005. - 36, Suppl. 4. - P. 123- 130.
Joshi G., Parchand S., Dogra M. R., Gupta P. K. et al. Live juvenile strobilate tapeworm in the anterior chamber of the human eye /7 Arch. Ophthalmol.- 2012. - 130, 11. - P. 1464 - 1466. doi: 10.1001 /archophthalmol.2012.553.
Jung R C> Rodriguez M. A.t Beaver P. C, Schenthal J. E.t Levy R. W. Racemose cysticercus in human. A case report // Am. J. Trop. Med. Hyg. - 1981. - 30, 3. - P. 620 - 624.
Kanchev K. On Taenia hydatigena (Pallas, 1766) biological characteristics, important for the tenuicol cysticercosis epizootology // Bulgar. J. Agric. Sci. - 2015. - 21, 5. - P. 1080 - 1085.
Khan Z. Small intestinal perforation which is caused by tape worm // Pakistan J. Surgery. - 2007. - 23, l.-P. 73 - 75.
Kim Y. Ht Chi G. J., Cho S.-Y. A case of Taenia saginata infection involving gallbladder and common bile duct // Korean J. Parasitol. - 1981. - 19, 2. - P. 167 - 172.
Koch T, Schoen C, Muntau B., Addo M. et al. Molecular diagnosis of human Taenia martis eye infection // Am. J. Trop. Med. Hyg. -2016. -94, 5. -P. 1055 - 1057. doi: 10.4269/ajtmh. 15-0881.
Kurtycz D. F. L, Alt B., Mack E. Incidental coenurosis: larval cestode presenting as an axillary mass // Am. J. Clin. Pathol. - 1983. - 80, 5. - P. 735 - 738.
Kyvsgaard N. C, Ilsoe B., Henriksen S. A., Nansen P. Distribution of Taenia saginata cysts in carcases of experimentally infected calves and its significance for routine meat inspection // Res. Vet. Sci. - 1990. - 49, l.-P. 29-33.
Laennec R. Th. H. Memoire sur les vers vesiculaires et principalement sur ceux qui se trouvent dans le genre humain. - Paris: Soc. Fac. Mdd., 1804. (цит. по: Абуладзе, 1964, с уточнениями).
Laranjo-Gonzalez M., Devleesschauwer B., Gabriel S.t Dorny P.t Allepuz A. Epidemiology, impact and control of bovine cysticercosis in Europe: a systematic review // Parasit. Vectors. - 2016. - 9: 81. doi: 10.1186/S13071-016-1362-3.
Lavikainen A. A taxonomic revision of the Taeniidae Ludwig, 1886 based on molecular phylogenies: Academic dissertation. - University of Helsinki, 2014.-64 pp.
Leske M. G. Von dem Drehen der Schafe und dem Blasenbandwilrme im Gehime derselben, als der Ursache Krankheit. - Leipzig, 1780. - 52 pp.
Levine M. Z.t Calderon J. C, Wilkins P. P. et al. Characterization, cloning, and expression of two diagnostic antigens for Taenia solium tapeworm infection // J. Parasitol. - 2004. - 90, 3. - P. 631 - 638
281
Lloyd S. Other adult and larval cestodes / Palmer S., Soulsby L., Torgerson B., Brown D. (eds). The Oxford Textbook of Cestodes. 2nd ed. - Oxford univ. Press, Oxford, UK, 2011. - P. 643 - 649.
Loos-Frank В. An up-date of Verster’s (1969) “Taxonomic revision of the genus Taenia Linnaeus” (Cestoda) in table format // Syst. Parasitol. - 2000. - 45, 3. - P. 155 - 183.
Mahadevan A., Dwarakanath S., Pai S. et al. Cerebral coenurosis mimicking hydatid disease - report of two cases from South India // Clin. Neuropathol. - 2011. - 30, 1. - P. 28 - 32.
Maillard H.t Marionneau J., Prophette B., Boyer E, Celerier P. Taenia crassiceps cysticercosis and AIDS // AIDS.-1998.-12, 12.-P. 1551 - 1552.
Margono S. S., Wandra T, Swasono M. F., Murni S. et al. Taeniasis/cysticercosis in Papua (Irian Jaya), Indonesia // Parasitol. Int. - 2006. - 55, Suppl. - P. 143 - 148.
Mathy A Hanosset R Adant S Losson B. The carriage of larval Echinococcus multilocularis and other cestodes by the musk rat (Ondatra zibethicus) along the Ourthe River and its tributaries (Belgium) // J. Wildl, Dis. -2009. - 45, 2. - P. 279 - 287. 10.7589/0090-3558-45.2.279.
McManus D. P. Improved diagnosis as an aid to better surveillance of Taenia solium cysticercosis, a potential public health threat to Papua New Guinea // P. N. G. Med. J. - 1995. - 38, 4. - P. 287 - 294.
McManus D. P. Molecular discrimination of taeniid cestodes // Parasitol. Int. - 2006. - 55, Suppl. - P. 31 - 37. Min D. Y. Cestode infections in Korea // Kisaengchunghak Chapchi. - 1990. - 28, Suppl. - P. 123 - 144.
Michelet L., Carod J. F,t Rakontondrazaka M., Ma L. et al. The pig tapeworm Taenia solium, the cause of cysticercosis: Biogeographic (temporal and spacial) origins in Madagascar // Mol. Phylogenet. Evol.-2010.-55, 2. -P. 744-750. doi: 10.1016/j.ympev.2010.01.008.
Miyaji S„ Oku Y., Kamiya M., Okamoto M. et al. Growth of a Japanese isolate of Taenia crassiceps in intermediate and definitive hosts // Parasitol. Res. - 1990. - 76, 4. - P. 351 - 354.
Monnig HO. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - P. 114-125.
Muller R Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 71 - 85.
Nagaty H. F. On some larval cestodes from domesticated and laboratory animals // J. Egypt. Med. Assoc. -1940.-23, 5.-P. 318-322.
Nagaty H. F, Ezat M. A. On the Multiceps multiceps (Leske, 1780), M. gaigery Hall, 1916, M. serialis (Gervais, 1780), with a review of these and similar forms in man and animals // Proc. Helm. Soc. Wash. - 1946. -13, 2.-P. 33-44.
Narayan Shrihari, Mariraj J., Kumudini T S., Krishna S. Intestinal perforation due to tapeworm: Taenia solium HL Clin. Diagnostic Res.-2011.-5, 5.-P. 1101 - 1103.
Nguyen N. taeniasis and cysticercosis in a selected group of inhabitants from a mountainous province in Northern Vietnam. - ITMA - MSTAH thesis, Belgium. No. 56. - 2006.
Nguyen N., Fashing P. J., Boyd D. A., Barry T. S, et al. Fitness impacts of tapeworm parasitism on wild gela-da monkeys at Guassa, Ethiopia // Amer. J. Primatology. - 2015. - 77, 5. - P. 579 - 594.
Nourani H„ Kheirabadi К. P. Cerebral coenurosis in a goat: pathological findings and literature review // Comp. Clin. Pathol.-2009.-18, l.-P. 85-87. doi:10.1007/s00580-008-0742-2.
Oka Y.t Fukui K, Shoda D., Abe T. et al. Cerebral cysticercosis manifectinh as Hydrocephalus // Neutol. Med. Chit. - 1996. - 36. - P. 654 - 658.
Okamoto M., Nakao M„ Blair D., Anantaphruti M. T. et al. Evidence of hybridization between Taenia saginata and Taenia asiatica 11 Parasitol. Int. -2010.-59, 1. - P. 70 - 74. doi: 10.1016/j.parint.2009.10.007.
Pau A., Perria C.t Turtas S. et al. Long-term follow-up of the surgical treatment of intracranial coenurosis // Br. J. Neurosurg. - 1990. - 4, 1. - P. 39 - 43.
Pau A.t Turtas S.t Brambilla M. et al. Computed tomography and magnetic resonance imaging of cerebral coenurosis // Surg. Neurol. - 1987. - 27, 6. - P. 548 - 552.
Railliet A., Henry A. Sur un c^nurose de la gerbille & pieds velu // Bull. Soc. pathol. exot. - 1915. - 8, 4. - P. 173-177.
Ransom В. H. Cysticercus ovis, the cause of tapeworm cysts in mutton // J. Agric. Res., Dept. Agric., Wash. -1913.-1, l.-P. 15-58.
Rausch R. L. Family Taeniidae Ludwig, 1886 / Khalil L. F., Jones A., Bray R. A. (eds.). Keys to the cestode parasites of vertebrates. - CAB Int., Wallingford, 1994. - P. 665 - 672.
Ribas A., Milazzo C., Foronda P,, Casanova J. C. New data on helminths of stone marten, Martes foi-na (Carnivora, Mustelidae), in Italy // Helminthologia. - 2004. - 41, 1. - P. 59 - 61.
Roger H., Sautet J., Paillas J. E. Un cas cdnurose de la fosse cdrdbrale postdrieure // Rev. Neurologie. - 1942. -74.-P. 319-321.
282
Rossin M., Timi J. T, Hoberg E. P. An endemic Taenia from South America: validation of T. talicei Dollfus, 1950 (Cestoda: Taeniidae) with characterization of metacestodes and adults // Zootaxa. - 2010. - 2636. - P. 49-58.
Rudolphi C. A, Entozoorum sive vermium intestinalium historia naturalis, v. 2. - Amstelaedami, 1810.
Sabbatani S„ Zucchelli M., Calducci F., Roncaroli F., Chiodo F. A case of cerebral cenurosis // Infez. Med. -2004. - 12.-P. 205-210.
Sako Y., Nakao M., Ikejima T, Piao X. Z., Nakaya K., Ito A. Molecular characterization and diagnostic value of Taenia solium low-molecular-weight antigen genes // J. Clin. Microbiol. - 2000. - 38. - P. 4439 - 4444.
Schantz P. M., Moore A. C, Munoz J. L., Hartman B. J, et al. Neurocysticercosis in an orthodox Jewish community in New York City // N. Engl. J. Med. - 1992. - 327. - P. 692 - 695.
Schellhas К, P., Norris G. A, Disseminates human subarachnois coenurosis: computed tomographic appearance // Am.J. Neuroradiol. - 1985. - 6, 4. - P. 638 - 640.
Segovia J.-M., Guerrero R., Torres J., Miquel J., Feliu C. Ecological analyses of the intestinal helminth communities of the wolf, Canis lupus, in Spain // Folia Parasitol. - 2003. - 50. - P. 231 - 236.
Setti E. Nuovi elminti dell’Eritrea// Atti Soc. Ligust. sci .natur. Geogr., Genova. - 1897. - 8.
Sharma D. K., Singh H, Tiwari H A. Prevalence and pathology of coenurosis in organized goat farms // J. Vet. Parasitol. - 1998. - 12, 1. - P. 30 - 32.
Takaynagui О. M., Leite J. P. Neurocysticercosis // Rev. Soc. Bras. Med. Trop. - 2001. - 34, 3. - P. 283 -290.
Taramelli N., Dubois A. Un cas de c^nurose chez I’homme // Ann. Soc. Beige Med. Trop. - 1931. - 11, 2.
Templeton A. C. Anatomical and geographical location of human Coenurus infection // Trop. Geogr. Med. -1971.-23, l.-P. 105- 108.
Turner M., Leiper R. T. On the occurrence of Coenurus glomeratus in man in West Africa // Trans. R. Soc. Trop. Med. Hyg. - 1919. - 13, 1. -P. 23 -24.
Turtas S, Perria C, Brambilla M., Pau A. Follow up of 5 cases of cerebral coenurosis // XXXVIII Congr. Soc. It. Neurochirurgia. - 1989. - P. 735 - 740.
Uga S, Hoa N, T„ Noda S., Moji K., Cong L. et al. Parasite egg contamination of vegetable from a suburban market in Hanoi, Vietnam // Nepal Med. Coll. J. - 2009. - 11, 2. - P. 75 - 78.
Vanderick F., Fain A., Langi S, Vanbalen H. Deux nouveaux cas de cdnurose humaine & Taenia brauni au Rwanda, avec une localisation orbitaire du cdnure. // Ann. Soc. Beiges Med. Trop. Parasitol. Mycol. -1964. - 44, 6. - P. 1077 - 1079. (In French).
Vashist S, Ahuja S'. An unusual presentation of orbitalcysticercosis // Indian J. Ophthalmol. - 2000. - 48, 4. -P. 331 -332.
Verrill A. E. The external and internal parasites of man and domestic animals. - Report of the Connecticut Board of Agriculture, 1870. - P. 1-140.
Verster A. A taxonomic revision of the genus Taenia Linnaeus, 1758, s. str. // Onderstepoort J. Vet. Res. -1969.-36, l.-P. 3-58.
Williams P. H, Templeton A. C. Infection of the eye by tapeworm Coenurus 11 Brit. J. Ophthalmol. - 1971. -55, 11. -P. 766-769. http://dx.doi.org/10.H36/bjo.55.ll.766.
Willingham A. L. 3rd, De N. V., Doanh N. Q. et al. Current status of cysticercosis in Vietnam // Southeast Asian J. Trop. Med. Public Health. - 2003. - 34, Suppl. 1. - P. 35 - 50.
Willingham A. L. 3rd, Wu H~W, Conlan J., Satrija F. Combating Taenia solium cysticercosis in Southeast Asia: an opportunity for improving human health and livestock production // Adv. Parasitol. - 2010. - 72. -P. 235-266. doi: 10.1016/S0065-308X(l 0)72009-1.
Willms K., Zurabian R. Taenia crassiceps'. in vivo and in vitro models // Parasitology. - 2010. - 137, 3. - P. 335-346. doi: 10.1017/S0031182009991442.
Yamasaki H, Muto M., Morishima Y., Sugiyama H. et al. Taenia asiatica infection occurring in Kanto District, 2010 // Clin. Parasitol. - 2011. - 22, 1. - P. 75 - 78. (in Japanese).
Yanagida T, Sako Y., Nakao M., Nakaya K., Ito A. Taeniasis and cysticercosis due to Taenia solium in Japan //Parasites & Vectors. -2012. -5:18. DOI: 10.1186/1756-3305-5-18.
Joob B., Wiwanitkit V. Cerebral neurocysticercosis due to Taenia martis, the third species that needs attention //Arch. Neurosci.-2016.-3, 1: e31856. doi: 10.5812/archneurosci.31856.
Zeder J. G. H Anleitung zur Naturgeschichte der Eingeweidewiirmer. - Bamberg, 1803 (цит. по: Абуладзе, 1964).
Zhang L., Tao H, Zhang B., Wang H. et al. First discovery of Taenia saginata asiatica infection in Yunnan province // Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. - 1999. - 17, 2. - P. 95 - 96.
Ziaei M., Elgohary M., Bremner F. D. Orbital cysticercosis, case report and review // Orbit. - 2011. - 30, 5. -P. 230-235. doi: 10.3109/01676830.2011.587938.
283
Род Echinococcus Rudolphi, 1801
Синоним: Alveococcus Abuladze, 1960
Описание (по: Абуладзе, 1964; Rausch, 1994). Мелкие тонкие цестоды. Стробила длиной до 12 мм, состоит не более чем из 7 члеников. Сколекс небольшой, хоботок с очень маленькими крючьями, расположенными в два ряда. Семенники относительно немногочисленные. Яичник состоит из двух компактных масс, соединённых узким перешейком. Половое отверстие в середине или в задней половине бокового края членика. Зрелая матка мешковидной формы, её латеральные края формируют выпячивания (последние могут отсутствовать). Полностью зрелая матка - в терминальном членике. Взрослые черви - паразиты кишечника хищных млекопитающих - псовых и кошачьих. Метацестоды - однокамерный, альвеолярный, многоцистный гидатиды, локализующиеся в различных органах и тканях млекопитающих. Типовой вид - Echinococcus granulosus (Batsch, 1786) Rudolphi. 1801.
Представители данного рода легко отличаются от остальных тениид миниатюрными размерами взрослых особей и гидатидными метацестодами. К слову, для всех видов Echinococcus опубликованы данные по ДНК (Lavikainen, 2014).
Как и у всех тениид, в жизненный цикл цестод рода Echinococcus на всех стадиях их развития вовлечены исключительно млекопитающие животные.
Род объединяет 11 видов (Lumbery et al., 2015а; Nakao et al., 2013), большинство из которых представляют потенциальную опасность для здоровья домашних и диких животных, а также человека. За исключением трёх видов - Е. feli-dis Ortlepp, 1937, Е. equinus Williams et Sweatman, 1963 и E. lycaontis Ortlepp, 1934 -остальные 8 видов зарегистрированы также и у человека. Охарактеризуем их.
Echinococcus granulosus (Batsch, 1786) Rudolphi. 1801 {-Hydatigena granulosa Batsch, 1786) (рис. 152 - 154). В своей личиночной стадии паразит известен человеку ещё со времён глубокой древности, но взрослые особи цестоды были описаны только в 1752 г. по экземплярам из кишечника собаки, причём ошибочно отнесены к роду Taenia под названием Т. serrata (=Taenia pisiformis) (Roedel, 1752). В 1786 г. было высказано предположение, что пузырьчатые формы из сельскохозяйственных животных и человека, и ленточные формы из кишечника собаки представляют собой разные стадии одного и того же вида - Hydatigena granulosa Batsch, 1786. В 1801 г. К. Рудольфи (Rudolphi. 1801), обосновывая новый род Echinococcus, сделал его типовым в нём. Видовое название granulosus от латинского granulum, granum - зёрнышко (эхинококк зернистый). В русскоязычной научной и справочнонаучной литературе паразит получил название эхинококка однокамерного (гидати-дозного), в англоязычной - hydatid tapeworm.
Из-за своего медицинского и ветеринарного значения Е. granulosus уже многие столетия привлекает внимание исследователей, а потому и неудивителен обширный список его синонимов - 80 (!) видов и подвидов (Абуладзе, 1964). Однако развернувшиеся в последние годы исследования видов Echinococcus с применением новых методологических подходов, в частности методов молекулярно-генетического анализа, заставили по-новому взглянуть на статус многих из них (Cucher et al., 2015; McManus, 2013; Zait et al., 2016; Zheng et al., 2013 и др.). В частности Е. granulosus, ранее рассматриваемый как единый вид с высоким генетическим и фенотипическим разнообразием (Абуладзе, 1964; Constantine et al., 1993), теперь признаётся комплексом критических видов, существенно различающихся по морфологии, развитию, хозяинной специфичности (в том
284
числе инвазионности / патогенности для человека) и другим аспектам (Alvarez Rojas et al., 2014, 2016, 2017; McManus, 2013; Romig et al., 2015 и др.). На основе фенотипических особенностей и последовательностей генов £. granulosus (s. 1.) разделён на: £ granulosus (s. s.) («овечий штамм» - sheep strain, генотипы G 1 - 3; штамм домашней овцы - G1, тасманийской овцы - G2, буффало - G3), £. felidis Ortlepp, 1937 («львиный штамм» - lion strain), £. equinus Williams et Sweatman, 1963 («лошадиный штамм» -horse strain, G4), £. ortleppi L6pez-Neyra et Soler, 1943 («штамм крупного рогатого скота» - cattle strain, G5) и £. canadensis. Последний вид демонстрирует наибольшее разнообразие и включает «верблюжий штамм» (camel strain - генотип G6), «свиной штамм» (pig strain - G7) и два «оленьих штамма» (cervid strains - G8 и G10). Поскольку при выделении названных видов авторы обязаны были руководствоваться Правилами зоологической номенклатуры, то в результате часть названий старых видов, ранее синоними-зированных с £. granulosus, была восстановлена (Romig et al., 2015).
В результате подобных исследований изменились наши представления об особенностях морфологической изменчивости £. granulosus, его биологии, распространении среди окончательных и промежуточных хозяев и степени патогенности для каждого из них. И хотя овечий штамм £. granulosus G 1 наиболее распространён и чаще всего связан с заражением человека (88.44 % всех известных случаев) (Alvarez Rojas et al., 2014), тем не менее, в большинстве случаев интерпретировать ретроспективные данные о £ granulosus без исследования контрольных образцов довольно трудно.
Рис. 152 Echinococcus granulosus'. 1 - половозрелая стадия в возрасте 3 месяцев; 2 -крючья (из: Абуладзе, 1964 - по: 7 - Носик, 1953; 2 - Петров, Черткова, 1959)
о
,О
о
о
Рис. 153 Echinococcus granulosus'. 1 - яйцо; 2 - зрелый членик (из: Faust, 1949)
285
Рис. 154 Echinococcus granulosus, детали строения женской половой системы (V - вагина; ОС - оотип; OVD - яйцепроток; J - соединение семяпротока с яй-цепротоком; VD - желточный проток; VIT - желточ-ник; UD - маточный проток; М - тельце Мелиса; UT -матка; SR - семяприемник; OV - яичник (из: Rausch, Bernstein, 1972)
Описание (по разным авторам). С характерными чертами рода. Стробила всегда меньше 1 см, обычно 2.7 - 8.5 мм длины и состоит из 3 -4 члеников. Диаметр сколекса до 0.37, присосок 0.13, хоботка 0.14 мм. Хоботок с 28 - 40 крючьями. чаще всего их 30 - 36. Крючья сильно варьируют как по форме, так и по величине. Крючья 1-го ряда длиной 30 - 43, 2-го - 20 - 36 цт; по (Monnig, 1934), соответственно 40 - 49 и 30 - 42. Шейка короткая. Длина терминального, единственно членика, содержащего зрелые яйца, достигает более половины длины всей стробилы. По-
юры всегда открываются в задней половине членика. Семенники фолликулярные. их количество варьирует от 32 до 60. Половая бурса длиной до 0.27 мм, гги до середины членика. Вагина примерно на расстоянии 0.100 мм от полового отверстия имеет кольцеобразный мышечный сфинктер. Женские половые органы расположены в задней трети гермафродитного членика. Вблизи заднего края членика позади яичника медианно находится желточник, а между яичником и желточником - тельце Мелиса. Матка простирается по всей длине зрелого членика, снабжена боковыми ветвями и выпячиваниями и содержит до 5000 яиц (Muller, 2002). Яйца круглые или овальные, 28 - 37 х 24.5 - 33 рш.
Для жизненного цикла эхинококка характерна смена двух хозяев (рис. 155). Дефинитивные хозяева цестоды - домашняя собака, динго, койот, лисицы обыкновенная, патагонская серая, аргентинская серая, или южноамериканская, волк, шакал, гиена - выделяют во внешнюю среду яйца цестоды. При 7°С яйца сохраняют жизнеспособность в течение 200 дней, оставаясь инвазионными для промежуточного хозяина, при 21 °C это состояние сохраняется в течение 50 дней, но при 40°С - только несколько часов (Muller, 2002). .
Промежуточные хозяева - овцы, крупный рогатый скот, козы, буйволы, буффало, сумчатые заглатывают яйца вместе с травой, сеном или водой. Особенно легко и часто это происходит на пастбище, где вместе со скотом находятся и сопровождающие пастухов собаки. Кстати, пассивными разносчиками яиц паразита являются также и мухи, довольно обычные на пастбищах. Оказавшись в кишечнике животного, онкосферы проникают через его стенку и попадают либо в венозные, либо в лимфатические сосуды. Обычно они заносятся в воротную вену и оседают в печени, поэтому та поражается эхинококком чаще других органов. Часть онкосфер проходит печёночный барьер и через нижнюю полую вену, правое предсердие, правый желудочек и малый круг кровообращения попадает в лёгкие, где они могут задержаться в лёгочных капиллярах и развиться в эхинококковые пузыри.
286
Рис. 155 Схема жизненного цикла Echinococcus granulosus: 1 - взрослая особь живёт в тонком кишечнике псовых; 2 - зрелый проглоттид реализует яйца, которые выходят во внешнюю среду с испражнениями; 3 - в промежуточном хозяине в тонком кишечнике из яйца выходит онкосфера, которая через стенку кишечника проникает в кровеносную систему и мигрирует, оседая в различных органах, чаще всего печени и лёгких; 4 - онкосфера развивается в цисту, которая постепенно увеличивается в размерах, образуя протосколексы и дочерние цисты, заполняющие полость цисты; 5 - в организме дефинитивного хозяина, который заражается, поедая инвазированные цистами органы животного-промежуточного хозяина, протосколекс выворачивается и 6 - прикрепляется к слизистой кишечника. Схема заимствована из: https://www.cdc.gov/parasites/ echinococcosis/biology.html.
Часть онкосфер может проскочить через капиллярную сеть печени и лёгких и, пройдя левое предсердие и аорту, попадает в большой круг кровообращения. И, наконец, единичные онкосферы могут быть занесены в любой орган и в любую ткань, где постепенно превращаются в эхинококковые пузыри.
Личиночная стадия Е. granulosus, известная под названием Echinococcus unilocularis Huber, 1896 или однокамерный эхинококк, внешне представляет собой пузырь, наполненный жидкостью (рис. 156, 157). Эхинококковые пузыри обычно размером от горошины до арбуза, но в отдельных случаях могут быть значительно крупнее. Ветеринарные врачи находили в печени крупного рогатого скота пузыри массой свыше 60 кг, в которых содержалось около 43 л жидкости. Личинка эхинококка растёт медленно: через месяц её диаметр достигает всего 1 мм, через пять вырастает до 10-55 мм, а инвазионной становится только через 1 - 2 года (Muller, 2002). Предельных размеров пузырь может достичь только через 20 - 30 лет.
Наполняющая пузырь жидкость содержит немного белка и жира, около 3 % солей и небольшое количество янтарной кислоты. Пузыри, локализующиеся в печени, могут содержать жёлчные пигменты, а в почках - следы мочи.
287
Рис. 156 Echinococcus granulosus, сколекс из выводковой капсулы (из: Абуладзе, 1964)
Рис. 157 Е. granulosus, процесс пузыря, дочерних пузырей, выводковых капсул и сколексов. I - эндогенное почкование (однокамерный тип): А - выводковая капсула, формируемая из зародышевого слоя; В - свободные вторичные (дочерние) пузыри, продуцирующие сколексы; С - стерильный зародышевый
развития гидатидного
слой; D - стерильные дочерние цисты. II - экзогенное почкование (альвеолярный тип) (из: Faust, 1949)
Стенка пузыря состоит из наружной тегументальной оболочки и внутренней герминативной, или зародышевой. Наружная оболочка толщиной около 1 мм, молочно-белого цвета, иногда со слегка желтоватым оттенком, у более старых пузырей она мутнеет, принимая желтушный цвет. Наружная оболочка является производной герминативной оболочки, состоит из концентрически расположенных пластинок, по своему химическому составу близких к хитину, и непроницаема для микрофлоры, белков хозяина, а также резистентна к нагноению. Будучи своеобразной полупроницаемой мембраной, оболочка обеспечивает доступ низкомолекулярных питательных веществ к паразиту и предохраняет клетки герминативной оболочки от воздействия неблагоприятных факторов хозяина. Тонкая (10-25 pm), но плотная герминативная оболочка выстилает полость пузыря изнутри и представляет собой своеобразную эмбриональную ткань, могущую продуцировать выводковые капсулы с одновременным формированием в них зародышевых сколексов, морфологически идентичных сколексам ленточной стадии, и вторичных (дочерних) пузырей. Количество выводковых капсул в одном пузыре, а также число развившихся в них сколексов варьируют в широких пределах. Иногда элементы герминативной оболочки проникают между слоями тегумента на её наружную поверхность, создавая условия для экзогенного развития вторичных пузырей. В периферической части капсулы на границе с нормальной тканью хозяина обычно наблюдается лимфоидная инфильтрация. Зрелые сколексы, как правило, свободно плавают в полости пузыря, образуя так называемый гидатидозный песок (hydatid sand).
Зародышевые сколексы Е. granulosus, выделенные из выводковой капсулы, яйцевидно-овальной формы, размерами 014 - 0.16 х 0.09 - 0.12 мм (рис. 158, 159).
Длина инвагинированной части сколекса до 0.06 - 0.08 мм. В средней части сколекса находится хоботок с 4 присосками и 34 - 38 крючьями. Крючья непостоянны по своей форме, длина лезвия обычно превышает длину рукоятки. Тело зародышевого сколекса заполнено многочисленными прозрачными, различными по форме и величине образованиями, которые или концентрируются вдоль краёв тела зародыша, или полностью заполняют его.
288
Рис. 158 Echinococcus granulosus: A - сколекс втянут в мембрану гидатидной кисты; В - сколекс с вывернутым хоботком с крючьями (из: Faust, 1949)
hooks
Рис. 159 Echinococcus granulosus: а - сколекс втянут в мембрану гидатидной кисты; Ь - сколекс с вывернутым хоботком с крючьями из кишечника собаки (hooks - крючья; sucker - присоска; calcareous bodies - известковые тельца) (из: Muller, 2002)
Из каждого сколекса, попавшего в организм дефинитивного хозяина, может развиться отдельный паразит, а весь процесс развития взрослой особи, несмотря на её небольшие размеры, занимает довольно длительное время - от 32 до 80 дней. Продолжительность жизни паразита в кишечнике собаки 5-6 месяцев, а иногда и более года.
У домашних собак обычно насчитываются десятки - сотни эхинококков (Cohen et al., 1998), но у диких хищников в тропической Африке и Австралии их количество может достигать многих тысяч особей (Macpherson, Craig, 2000).
Е. granulosus вид-космополит, его отмечают в Европе, Азии, Африке, Северной и Южной Америке, Австралии. Заражённость псовых, и, прежде всего, домашних собак, а также крупного рогатого скота, овец, коз чрезвычайно варьирует и зависит не только от наличия благоприятных условий для циркуляции паразита в природе, но и от проведения противогельминтных мероприятий и степени их эффективности. Известно, что в некоторых регионах, например, в Исландии, Новой Зеландии, Австралии, на Кипре и Тасмании проведение подобных кампаний на государственном уровне привело к полному или заметному снижению численности популяции Е. granulosus (Moro, Schantz, 2009). Приведу один характерный пример, иллюстрирующий сказанное. В уезде Хайянь провинции Цинхай Тибетского автономного округа (запад центральной части Китая) в 1991 - 1994 гг., наряду с санитарно-просветительской работой среди местного населения, проводили противоглистную обработку животных, которым скармливали празиквантел с месячным интервалом (Li Y., Li D., 2010). В результате заражённость собак упала с 63.6 % до 0, а у овец снизилась с 87 до 10 %. Однако после прекращения антигельминтной обработки животных встречаемость эхинококка у овец к 2004 г. вновь поднялась, достигнув 46.1 %. Исследования заражённости собак в уезде тогда не проводились, однако известно, что в целом в провинции Цинхай Е. granulosus поражает более чем 50 % собак (Wang et al., 2006), а также более 50 % овец и яков (Zhang J., Wang,
289
2007; Zhang X., Wanma, 2007). К слову, заражённость местных скотоводов Е. granulosus в названной провинции достигает 6.1 % (Han et al., 2006).
О том, насколько взаимосвязана встречаемость паразита у дефинитивных и промежуточных хозяев, говорят следующие цифры. Так, в Чили заражённость эхинококком собак достигает 8 %, овец и крупного рогатого скота - 5 - 22 %, а местного населения - 0.009 %, в Иране - соответственно 3-63,2-7и3%, Болгарии -7, 32 и 0.003 - 0.006 %, Кении - 10 - 72, 5 - 30 и 10 - 16 % и т.д. (Muller, 2002). В Западно-Казахстанской области Е. granulosus был обнаружен у 35 % волков, 3.9 -15.2 % собак (более всего оказались поражены приотарные собаки), 15.2 - 42.7 % овец и 14 - 23.4 % особей крупного рогатого скота (Абирова и др., 2010). В окрестностях Улан-Батора (Монголия) эхинококком заражено 59 % домашних собак, в связи с чем многие авторы цитируемой публикации высказывают опасения относительно возможной заражённости этим паразитом и членов тех семей, которым принадлежали обследованные животные (Narankhajid et al., 2006).
Во многих странах мира эхинококкоз сельскохозяйственных и полезных домашних животных по-прежнему представляет серьёзную проблему, поскольку наносит значительный экономический ущерб животноводству, исчисляемый сотнями миллионов долларов (Craig et al., 2007; Dakkak, 2010).
Столь же серьёзное значение имеет Е. granulosus и для здоровья человека, который может заражаться личиночной формой паразита в результате попадания яиц цестоды к нему непосредственно от собаки. Ухаживая за собакой, человек загрязняет руки прилипшими к шерсти животного яйцами эхинококка, которые затем попадают в пищу, а с ней в кишечник человека. Особенно легко заражаются дети, которые любят играть с животными и «забывают» мыть руки после подобных контактов. Именно поэтому чаще всего эхинококком заражаются дети, но из-за медленного роста кисты - от 1 до 5 см в год - заболевания чаще обнаруживается уже у взрослых лиц: у детей моложе 16 лет диагностируется только 10 - 20 % всех случаев (Moro, Schantz, 2009).
И хотя для Е. granulosus человек фактически является тупиковым хозяином, случаи заражения людей эхинококком однокамерным известны по всему миру. Их регистрируют в самых разных странах, чаще всего в регионах развитого животноводства. Сообщений на эту тему великое множество, но, как уже отмечено выше, во многих случаях ранее имело место ошибочное определение выявленного у человека паразита (см., напр., Dybicz et al., 2015). Перечисляя страны, в которых у человека действительно был выявлен Е. granulosus, так называемый овечий штамм, я ориентировалась в основном на публикации последних лет, авторы которых при идентификации паразита применяли молекулярно-генетические и/или иммунологические методы.
Достоверно установлено, что овечий штамм G1 поражает людей в Алжире (Zait Н. et al., 2016), Болгарии (Marinova et al., 2017), Иране (Zhang L. et al., 1998), Испании (Daniel-Mwambete et al., 2004), Италии (Dakkak, 2010), Китае (Han et al., 2006), Польше (Dybicz et al., 2015), России (Konyaev et al., 2012), США (Castrodale et al., 2002), Таджикистане (Муминов и др., 2010), Тунисе (Chaabane-Banaoues et al., 2016), странах Южной Америки (Аргентине, Боливии, Бразилии, Перу, Уругвае, Чили) (Alvarez Rojas et al., 2014, 2016, 2017; Cohen et al., 1998; Cucher et al., 2016; Guamera et al., 2004; Kamenetzky et al., 2002; Manterola, Otzen, 2016; Moro et al., 2009), Узбекистане (Назыров и др., 1999), Украине (Велиева, 2015), Южной Афри
290
ке (Mogoye et al., 2013). Определение эхинококков, обнаруженных у людей в Таджикистане (Муминов и др., 2010), Узбекистане (Назыров и др., 1999) и Украине (Велиева, 2015), как Е. granulosus, судя по публикациям, основано только на морфологических особенностях выявленных пузырей и протосколексов. Однако известно, что, например, в Словакии, Украине, Польше, России и других странах, распространён ещё один вид эхинококка - Е. canadensis (см. далее).
И всё же, поскольку, например, в различных регионах Таджикистана эхинококк зарегистрирован у 7 - 53.2 % овец, 2.5 - 7.9 % крупного рогатого скота, а на юге страны ещё и у 31.8 % особей мелкого рогатого скота, то речь явно идёт о распространённом здесь овечьем штамме Е. granulosus (Муминов и др., 2010). На этом основании с уверенностью можно утверждать о встречаемости в этой стране данного гельминта, в том числе и у местных жителей. С 2000 г. здесь ежегодно регистрируют 450 - 500 случаев эхинококкоза (Муминов и др., 2010). Только в одной клинической больнице скорой медицинской помощи г. Душанбе в 1997 - 2001 гг. было прооперировано 234 больных эхинококкозом, а в 2004 - 2009-м - 235. Среди различных патологий, ставших причиной смерти людей, 1.4% пришлось на долю эхинококкоза. Кстати, в Таджикистане Е. granulosus был также обнаружен у 2.1 % свиней на 4 из 8 обследованных свиноферм, т.е. в данном случае это, скорее всего, был свиной штамм, который в настоящее время рассматривается самостоятельным видом Е. canadensis (или Е. intermedius - см. далее).
Аналогичная ситуация складывается и в Узбекистане, где уровень поражённости эхинококкозом людей к концу 20-го столетия составлял в среднем от 6 до 9 человек на 1000 населения, причём тенденции к снижению не наблюдалось (Назыров и др., 1999). Количество операций, проводимых по поводу эхинококкоза, варьировало от 1000 до 1500 в год, число осложнённых форм заболевания достигало 25 - 45 %, а летальность при оперативном лечении удерживалась на уровне 2.5 - 7 % и более.
В Российской Федерации наиболее высокая заболеваемость населения эхинококкозом регистрируется в Башкортостане, Татарстане, в Республике Саха (Якутия), на территории республик Северного Кавказа, в Ставропольском, Краснодарском, Алтайском, Красноярском и Хабаровском краях, Волгоградской, Самарской, Ростовской, Оренбургской, Челябинской, Томской, Омской, Магаданской, Амурской областях и Чукотском АО (http://lookmedbook.ru/disease/ehinokokkoz).
Чаще всего у людей поражаются печень (65 %) и лёгкие (25 %), однако личинки могут осесть также в почках, селезёнке, сердце, костном и головном мозге, суставах, костях. В частности, к концу первого десятилетия нынешнего столетия в мире было описано около 350 случаев обнаружения эхинококковых пузырей в сердце человека (Сухарева, 2014). У большинства больных встречается одна киста, но в 20 - 40 % случаев наблюдается множественная инвазия (Pawlowski et al., 2001). Развитие множественного эхинококкоза возможно не только из-за разрыва пузыря, в результате которого вылившиеся вместе с жидкостью сколексы и обрывки зародышевой оболочки ведут к образованию многочисленных новых пузырей, но и вследствие первичного попадания в кишечник большого количества онкосфер, а также повторного заглатывания новых порций яиц паразита. В подобных случаях эхинококком одновременно могут быть поражены разные органы.
Эхинококкоз однокамерный, или гидатидозный, - тяжёлое, хронически протекающее паразитарное заболевание, нередко приводящее к инвалидности, а в
291
запущенных случаях заканчивающееся летально (Лукашенко, Брегадзе, 1968; Сергиев и др., 2008; Шалимов и др., 2002; Castrodale et al., 2002 и др.). Заболевание ха-рактеризируется длительным скрытым течением, что из-за поздней обращаемости в медицинские учреждения исключает возможность своевременного радикального
лечения.
Основное патологическое воздействие Е. granulosus на организм человека связано с сенсибилизирующим и механическим факторами (Лукашенко, Брегадзе, 1968; Поляков и др., 2006). В результате сенсибилизации организма продуктами жизнедеятельности паразита в окружающих его тканях развивается хронический воспалительный процесс. При этом вокруг пузыря формируется соединительнотканная фиброзная капсула, наружный слой которой имеет рыхловолокнистое строение и богат кровеносными сосудами, окружёнными большим количеством эпителиоидных, плазматических, гигантских клеток и эозинофилов. Внутренний слой, примыкающий к эхинококку, состоит из однородной и плотной, часто гиали-низированной ткани. В глубоких слоях капсулы нередко можно наблюдать очаги некроза. Толщина капсулы зависит от особенностей тканей органа, в котором происходит развитие одного или нескольких эхинококковых пузырей.
Активизация клеточных механизмов защиты в начальной стадии развития процесса, направленная на уничтожение паразита, иногда заканчивается его гибелью с последующим обызвествлением пузыря. Это - наиболее благоприятный исход болезни. В менее благоприятных случаях погибший паразит подвергается нагноению, в результате чего окружающая ткань постепенно разлагается, а гной может прорваться в соседние органы, полости или, в лучшем случае, наружу. При недостаточности иммунного ответа, к тому же в процессе развития пузыря постепенно нарастающей, рост и развитие паразитарной кисты прогрессируют.
Всасывание тканями, окружающими пузырь, эхинококковой жидкости вызывает у больного анафилактическую реакцию (Das et al., 2003), которая в лёгких случаях проявляется крапивницей, кожным зудом, а в редких тяжёлых случаях развивается очень стремительно, что приводит к коллапсу. Иногда после разрыва или прокола пузыря уже через несколько минут (иногда даже секунд) развивается коматозное состояние, заканчивающееся летальным исходом (Лукашенко, Брегадзе, 1968).
Механическое воздействие эхинококка на ближайшие ткани в некоторых случаях достигает очень высокой степени и приводит к нарушению функции поражённых органов, вследствие чего наступает их атрофия и отмирание. Эхинококк, достигший больших размеров, объём которого может достигать нескольких литров (Moro, Schantz, 2009), сдавливает или смещает ближайшие органы (рис. 160), а в детском и юношеском возрасте может привести к деформации грудной клетки, чаще всего в области правой рёберной дуги.
Рис. 160 Мальчик с растянутой брюшной стенкой, вызванной поражением печени эхинококком однокамерным (из: Moro, Schantz, 2009)
292
На начальных этапах заболевание обычно протекает бессимптомно, что связано как с очень медленным ростом самих пузырей, так и с высокими защитными и компенсаторными свойствами организма. Причём подобное состояние может продолжаться месяцами и даже годами, а признаки интоксикации могут отсутствовать, поскольку толстая фиброзная капсула защищает организм от содержимого эхинококковой кисты. В этот период зародышевые элементы паразита могут погибнуть, а его оболочки подвергнуться обызвествлению. С такой петрифицированной кистой больной может дожить до глубокой старости, а саму кисту обнаруживают случайно при аутопсии. Однако в случае локализации в глазах или мозге даже маленькие цисты могут вызывать клинические симптомы, поэтому большинство случаев церебрального эхинококкоза диагностируется у детей (Moro, Schantz, 2009).
Локализация и размеры пузыря определяют основную симптоматологию и обусловливают тяжесть данного заболевания (Садовниченко, 2015). Так, симптомы поражения печени зависят от места расположения в ней эхинококкового пузыря. При поражении правой доли у больного выражены боли в правом подреберье или в области желудка, напоминающие печёночную колику или боли при холецистите. Поражение левой доли печени обычно проявляется изжогой, отрыжкой, рвотой. Сдавливание растущим пузырём жёлчных протоков приводит к истощению, желтушности кожных покровов и склер, иногда крапивнице и лихорадке. При локализации кист в задних отделах печени крупные сосуды часто сдавливаются, развивается застой в системе воротной вены, что приводит к асциту и расширению вен живота, появлению отёков нижних конечностей.
Локализующийся в печени пузырь может прорваться в брюшную полость, а иногда через диафрагму и плевру - в лёгкие. Подобный прорыв сопровождается резко выраженной аллергической реакцией вплоть до анафилактического шока, развитием перитонита, обсеменением брюшной и/или грудной полости, которое приводит к образованию новых пузырей.
Начальному периоду поражения лёгких свойственен полиморфизм клинических проявлений (Поляков и др., 2006). Наиболее важным симптомом является кровохарканье, вызванное деструктивными изменениями в мелких сосудах, окружающих кисты. Иногда заболевание начинается с упорного сухого ночного кашля, который постепенно нарастает и не поддаётся медикаментозному воздействию. Постепенно кашель становится влажным. Боли в раннем периоде бывают колющие, щемящие, ноющие. Могут быть выражены аллергические проявления.
Поражение кости встречается необычайно редко, но если имеет место, то в результате заселения паразитом полости костного мозга и развивающегося спон-гиоза происходит интенсивное разрушение кости.
В целом клинические проявления эхинококкоза однокамерного обычно разделяют на 4 группы (Сухарева, 2014). Цитируемый автор ссылается на работы: Геллер, 1989; Дейнека, 1968.
• Синдром опухоли живота (печени, брыжейки, почек и т.д. с желтухой, гематурией и др.), нередко с обсеменением брюшины, или синдром внутригрудной опухоли;
• Синдром лихорадки при нагноении кисты, которое одновременно приводит к гибели паразита;
• Аллергический синдром в виде зуда, крапивницы, эозинофилии вследствие сенсибилизации организма чужеродным белком паразита, периодически посту
293
пающим в кровь; в редких случаях при прорыве кисты он может быть даже в виде тяжёлого, даже смертельного анафилактического шока;
• Эмболический синдром - множественная эмболия органов сколексами паразитов, например, при разрыве внутрисердечной кисты.
Диагностика заболевания эхинококкозом однокамерным зависит от локализации паразита в организме человека. Поражение лёгких диагностируют по рентгенограмме, а если киста инкрустирована солями извести, то этим методом её можно обнаружить и в органах брюшной полости - в печени, селезёнке и др. Поражение печени выявляют при компьютерной томографии, а также с использованием изотопных методов (сканирование) и ядерного магнитного резонанса. Нередко заболевание выявляется совершенно случайно при прощупывании опухоли или самим больным, или врачом, к которому пациент обратился по поводу какого-либо другого заболевания. Для подтверждения диагноза рекомендуется применять комплексные иммунологические исследования (РИГА, РСК, РАЛ, РИФ, ИФА) (Садовничен-ко, 2015). Максимальная эффективность серологических методов (до 98 %) наблюдается при локализации эхинококковых пузырей в брюшной полости и забрюшинном пространстве, при множественном и сочетанном поражении. При поражении лёгких, а также при наличии 1-3 кист небольшого размера (до 2 см) эффективность серологической диагностики ниже, в таких случаях возможно определение низких титров антител. Наименее информативны серологические методы при поражении нервной системы, глаз, а также при погибшем обызвествлённом паразите (не более 40 %). Резкое снижение титров возможно при далеко зашедшем процессе в поздней неоперабельной стадии эхинококкоза (Баранова, Лесина, 2008).
Поскольку оболочка эхинококковых пузырей непроницаема для лекарств, то избавиться от них, как правило, можно только хирургическим путём. Метаанализ показал, что хирургическое вмешательство даёт самые лучшие результаты по летальности (2 %), заболеваемости (23 %) и частоте рецидивов (10.4 %) (Butten-schoen К., Buttenschoen С., 2003). Лишь в тех случаях, когда пузыри мелкие, возможно их уничтожение терапевтическими средствами, но для этого необходима ранняя диагностика заболевания с помощью серологических методов. При операции медицинский персонал должен быть предельно аккуратным в обращении с удаляемой кистой, поскольку повреждение оболочки может привести к её разрыву с последующим попаданием содержимого пузыря в брюшную или лёгочную полости, что чревато как анафилактическим шоком, так и последующим вторичным заражением больного.
Что касается путей заражения человека Е. granulosus, то все исследователи в данном случае единодушны: заражение происходит только при контакте людей с инвазированными собаками, когда оказавшиеся на шерсти животного яйца гельминта случайно попадают на руки человека, а затем и в пищу. Однако яйца Е. granulosus могут также переноситься насекомыми - мухами, в изобилии обитающими в местах выпаса скота, или же тараканами, нежелательными кухонными поселенцами. Роль мясных продуктов как таковых в заражении человека эхинококками, скорее всего, минимальна, поскольку горячая термическая обработка мяса, равно как и его заморозка, приводят к гибели паразита. Тем не менее, такую возможность нельзя отрицать для лиц, занятых на убое скота, разделке мяса и шкур.
294
Меры профилактики эхинококкоза подробно расписаны практически во всех справочниках, пособиях и буклетах, посвящённых проблеме эхинококкоза человека. Мне остаётся только кратко обобщить их. Итак.
Профилактика эхинококкоза - это комплексная медико-ветеринарная проблема, включающая комплекс самых разнообразных превентивных мероприятий. Прежде всего, должен быть налажен чёткий взаимный обмен информацией между органами здравоохранения и ветеринарной службой о каждом выявленном случае эхинококкоза среди людей и животных. Лица, связанные с разведением, содержанием, забоем и разделкой животных, а также ранее прооперированные или состоящие на диспансерном учёте по поводу эхинококкоза должны проходить обследование на возможную заражённость эхиноккоком в сроки, утверждённые соответствующими нормативными документами. Борьба с распространением эхинококка основана на разрыве его жизненного цикла, поэтому поражённые внутренности овец, крупного и мелкого рогатого скота необходимо уничтожать, ни в коем случае не скармливая их собакам и другим животным - окончательным хозяевам паразита. Правила личной гигиены включают мытьё рук после ухода за собаками, перед едой, после сбора зелени и фруктов, работы с землёй, разделки шкур диких плотоядных животных и охоты на них, тщательное мытьё овощей, фруктов, зелени, ягод, употребляемых в пищу в сыром виде. Воду из открытых водоёмов следует пить только после кипячения или тщательной фильтрации. Не рекомендуется приводить в жилые помещения приотарных, сторожевых и служебных собак. И не последнее место в профилактических мероприятиях принадлежит просветительской работе среди населения по вопросам профилактики эхинококкоза.
В Международной классификации болезней 10-го пересмотра МКБ-10 (ICD-10, Version: 2016) Е. granulosus присвоен код В67.0-4.
Echinococcus canadensis Cameron, 1960. В 1960 г. Т. Кэмерон описал цестоду Echinococcus granulosus var. canadensis, причём в его распоряжении были только личинки этого гельминта от канадских оленей (Cameron, 1960). По его мнению, описываемый паразит морфологически практически идентичен Е. granulosus, но серологическое тестирование выявило отличие оленьей формы от типичного эхинококка однокамерного; к тому же, отличались эти формы и особенностями жизненного цикла. На этом основании Т. Кэмерон предложил рассматривать оленью форму как вариетет Е. granulosus. Диагноз половозрелой стадии паразитам был дан спустя 3 года уже другими авторами (Sweatman, Williams, 1963), которые выделили описанную Т. Кэмероном форму в подвид Е. granulosus canadensis, отметив, что паразит был завезён в Канаду из Скандинавии вместе с полуодомашненным северным оленем.
А. Верстер (Verster, 1965) изучила материал по Е. granulosus canadensis, переданный ей проф. Т. Кэмероном (Т. W. М. Cameron) из Канады, в свою очередь, получившего цестод от естественно заражённого волка канадского, а также от собаки, которой были скормлены личинки из северного оленя.
Черви от собаки оказались непригодны для изучения, поскольку содержали всего 2 членика, при этом первый был полностью незрелый, а второй содержал незрелые яйца. Экземпляры из волка явно были неполными и также состояли из 2 члеников, но терминальный сегмент был полностью зрелым.
В маточных проглоттидах (изучено 8 экз.) половая пора располагается посередине или слегка позади середины длины членика от переднего края. Семенни-295
ков (в 6 экз.) от 28 до 36 (в среднем 31.6 ± 3.2). Семенники находятся в двух половинах членика; впереди половой поры насчитывается 13-18 (16.8±2.0), позади -14 - 18 (15.8 ± 1.5) семенников. Размеры бурсы цирруса 0.114.8 - 0.168 х 0.056 -0.092.4 мм (0153.1 ± 0.017.9 х 0.080.3 ± 0.012.1).
А. Верстер подчеркнула, что изученные ею цестоды от канадского волка несколько отличались от ранее описанных (Sweatman, Williams, 1963): у экземпляров из волка стробила явно состоит из 3 члеников, а семенники равномерно распределены впереди и позади половой поры. По данным цитируемых ею авторов, стробила состоит из 2 и очень редко 3 члеников, а большинство семенников лежит ниже половой поры. Тем не менее, А. Верстер считает, что эти отличия укладываются в присущую цестодам данного рода вариабельность указанных признаков.
Как уже отмечено (стр. 284), молекулярно-генетические и серологические исследования Е. granulosus показали, что данный вид является генотипически неоднородным, фактически сборным, будучи представленным в разных регионах отдельными штаммами - otGI до G10 (рис. 161). При этом генотипы G6, G7, G8 и G10, по мнению многих исследователей, принадлежат Е. canadensis (Cucher et al., 2016; Dybicz et al., 2015; Guamera et al., 2004; Konyaev et al., 2012; Mogoye et al., 2013; Nakao et al., 2013; Romig et al., 2015; Schneider et al., 2010; Snabel et al., 2009; Zait H. et al., 2016). Приняв эту точку зрения, авторы сообщений об обнаружении у людей эхинококков, как правило, подчёркивали принадлежность выявленного паразита к конкретному генотипу Е. canadensis.
К настоящему времени мы располагаем информацией о регистрации этого вида у людей, помимо Канады, в Австрии (Е. canadensis G7) (Schneider et al., 2010), Алжире (G6) (Zait H. et al., 2016), Аргентине (G6) (Guamera et al., 2004), Египте (G6) (Aaty et al., 2012), Кении (G6) (Casulli et al., 2010), Китае (G7 - Zhang T. et al., 2014 и G10 - Yang et al., 2015), Мавритании (G6) (Bardonnet et al., 2002), на западе Монголии (G6, G10) (Jabbar et al., 2011), в Нигере (G6) (Angheben et al., 2017), Перу (G6) (Moro et al., 2009), Польше (G7) (Dybicz et al., 2015), России (G6, G10) (Konyaev et al., 2012), в CILLA на Аляске (G8) (McManus et al., 2001), в Турции (G7) (Snabel et al., 2009), Южной Африке (G6/7) (Mogoye et al., 2013), странах Южной Америки - Бразилии, Чили (G6 и G7) (Cucher et al., 2016).
(ишеП
<H0
£ framriMut 68 gmtv** IcmvW)
Рис. 161 Схема расположения половых органов в терминальном членике Echinococcus granulosus G6, G7, G10, G8 (из: Lumbery et al., 2015a)
296
Сделаем небольшую оговорку. Несмотря на то, что в Е. canadensis различают 4 генотипа, в Канаде, где впервые был описан этот паразит, встречаются только два из них - G8 и G10, так называемые лесные (sylvatic) генотипы, которые, как полагают, и представляют самостоятельный вид Е. canadensis (Moks et al., 2008; Nakao et al., 2006; Thompson et al., 2006). В высоких арктических широтах и на атлантическом побережье Канады Е. canadensis отсутствует. На северо-западе страны у оленей вапити и карибу, а также у лося встречается G10, а на северо-востоке у овцебыка - G8 (Schurer et al., 2013). К примеру, в Манитобе в Национальном парке Райдинг-Маунтинг паразит был выявлен у 10.5 % вапити (Schurer et al., 2013).
По частоте встречаемости у человека Е. canadensis рассматривают вторым после Е. granulosus: на долю Е. canadensis G6 приходится 7.3 % всех случаев заражения эхиноккоком, а Е. canadensis G7 - 3.7 % (Higuita et al., 2016), по другим данным, 12.2 и 9.6 % соответственно (Cucher et al., 2016).
В отличие от эхинококка однокамерного, у которого предпочтительным местом локализации в промежуточном хозяине является печень, у эхинококка канадского 83 % кист обнаруживаются в лёгких, 3 % - в печени и 6 % в других органах (Schurer et al., 2013).
Известно также, что инвазия эхинококком канадским не приводит к столь серьёзным последствиям, как у эхинококка однокамерного, разрыв пузыря не сопровождается анафилактическим шоком и обсеменением, и в большинстве случаев заражение асимптоматичное. Следовательно, правильная видовая идентификация паразита имеет первостепенное значение при проведении различных мероприятий, направленных на предупреждение заражения эхинококками человека и домашних животных, а также при лечении эхинококкозов.
К тому времени, как выстроилась достаточно чёткая картина распределения Е. canadensis по странам и континентам, в печати появилась статья, авторы которой (Lumbery et al., 2015а) приводят, по их мнению, убедительные доказательства того, что генотипы Е. canadensis G6 и G7 представляют единый вид, отличающийся от G8 и G10. Иными словами, генотипы G6 - G10 отнюдь не принадлежат одному виду - Е. canadensis. По их мнению, G6 (верблюжий штамм) и G7 (свиной штамм) являются одним видом - Е. intermedius Lopez-Neyra et Soler, 1943, a G8 и G10 (оленьи штаммы) принадлежат Е. borealis Sweatman et Williams, 1963 и E. canadensis соответственно. Цитируемые авторы полагают, что использование названия Е. canadensis для форм из оленей и верблюда/свиньи неверно, т.к. у них имеются различия в географическом распространении, круге хозяев, эпидемиологии. Таким образом, если принять эту точку зрения, то регионы, где у людей был отмечен Е. canadensis G6 и G7, войдут в ареал Е. intermedius, но это - большинство перечисленных на стр. 295 стран. К слову, названная статья вызвала дискуссию между её авторами и группой исследователей, также занимающейся проблемой таксономии рода Echinococcus вообще и Е. canadensis в частности (Lumbery et al., 2015b; Nakao et al., 2015). Нам остаётся только следить за ней.
Параллельно с анализируемой статьёй вышла в свет ещё одна работа, авторы которой описали Е. canadensis G10 от пациента на северо-востоке Китая (Yang et al., 2015). Последовательность гена coxl китайской формы показала 100 % гомологию с таковыми от волков из Монголии и лося из России.
Итак, какой информацией относительно Е. intermedius мы располагаем.
297
Echinococcus intermedius Lopez-Neyra et Soler, 1943 (рис. 161). Паразит впервые описан по двум экземплярам, обнаруженным у домашней собаки в Испании (Lopez-Neyra, Soler, 1943). Видовое название intermedius в переводе с латинского - промежуточный.
В течение многих десятилетий, на протяжении которых видовая идентификация Echinococcus базировалась только на морфологии, анатомии и особенностях жизненного цикла выявляемых цестод, практически все исследователи рассматривали Е. intermedius синонимом Е. granulosus, поскольку по своим морфометрическим признакам эти виды практически не отличались (Rausch, Nelson, 1963). В монографии К. И. Абуладзе (1964) Е. intermedius лишь упоминается на стр. 312 в числе известных представителей данного рода без каких-либо комментариев; отсутствует Е. intermedius и в обширном перечне синонимов Е. granulosus, который приводит К. И. Абуладзе. Возможно, это связано с отсутствием у автора первоисточника работы, т.к. ссылки на неё нет и в библиографическом списке. Мне не удалось найти оригинал описания вида, а потому пришлось буквально по крупицам собирать известную информацию о нём.
В процитированной выше статье (Rausch, Nelson, 1963) приведено несколько цифр из работы авторов (Lopez-Neyra, Soler, 1943), описавших Е. intermedius. Длина стробилы 3.3 мм, в стробиле 4 членика. Сколекс с 38 крючьями на хоботке, длина больших крючьев 35-38, маленьких -24-30 pm. Половая пора открывается позади середины членика. В зрелом членике 52 - 60 семенников, которые тянутся от заднего края членика в переднюю часть к яичнику и желточникам. Бурса цирруса размером 0.080 - 0.100 х 0.036 мм.
В опубликованной в 2014 г. «Encyclopedia of Food Safety» в главе, посвящённой двум видам эхинококков - Е. granulosus и Е. multilocularis, её автор П. Тургерсон (Torgerson, 2014) перечисляет страны и континенты, где встречается Е. intermedius'. Ближний Восток, Африка, Аргентина, Индия, Китай, Центральная Азия, восточная Европа. Известны также публикации, в которых сообщается об обнаружении Е. intermedius (=Е. canadensis G7) в Португалии - у домашних свиней (Castro et al., 2005) и иберийского волка (Guerra et al., 2013), в Испании - у диких кабанов и коз (Mwambete et al., 2004), в Мексике - у собак и свиней (Rodriguez-Prado et al., 2014). Одновременно можно найти работы, в которых этого паразита описывают от человека: в Австрии (Schneider et al., 2010), Польше (Dybicz et al., 2015), Турции (Snabel et al., 2009), Южной Африке (Mogoye et al., 2013).
Если же мы примем точку зрения упомянутых выше авторов (Lumbery et al., 2015а) о принадлежности к Е. intermedius также и Е. canadensis G6, то перечень регионов, где у человека находили или находят Е. intermedius, дополнят Бразилия, Чили, Россия. В результате Е. intermedius становится вторым после Е. granulosus по частоте регистрации у людей видом Echinococcus. И тогда Е. canadensis, естественный ареал которого включает северную Евразию и Северную Америку (Torgerson, 2014), окажется в группе видов, редко встречаемых у человека. Подтверждённые молекулярно-генетическим анализом находки этого вида у людей приурочены к Китаю, Монголии и России.
И наконец, ещё один, третий, вид, к которому предложено отнести на этот раз Е. canadensis G8, -Е. borealis Sweatman et Williams, 1963 (Lumbery et al., 2015a).
Echinococcus borealis Sweatman et Williams, 1963 (рис. 161). Этот вид первоначально имел ранг подвида Е. granulosus и был описан на материале из Север-298
ного Онтарио (Канада) от домашних собак, как окончательного хозяина, и лося, как промежуточного хозяина (Sweatman, Williams, 1963). При этом авторы подчеркнули, что в отличие от завезённого в Канаду Е. granulosus canadensis, подвид Е. granulosus borealis является местной формой, чей жизненный цикл связан с лосями, а не оленями. Видовое название borealis от латинского boreus - северный.
В 2008 г. Е. granulosus G8 был впервые описан от лося из Эстонии - это было первое обнаружение данного генотипа в Евразии (Moks et al., 2008). Как отмечено выше, для оленьего штамма Е. canadensis G8 было предложено видовое название Е. borealis (Lumbery et al., 2015a).
А. Верстер (Verster, 1965) изучила материал по E. granulosus borealis, переданный в её распоряжение коллегами из Канады, в свою очередь, получивших цестод от естественно заражённых домашних собак, а также от трёх экспериментально заражённых собак.
Стробила цестод из экспериментально заражённых животных состояла из 3 члеников и достигала в длину 2.952 - 5.72 мм (в среднем 4.081± 0.8). Длина зрелого членика составляла больше половины от общей длины тела: 51.2 - 69.8 % (в среднем 56.5). В зрелых проглоттидах половая пора находится почти посередине или позади середины длины членика от переднего края. Семенников от 32 до 51 (в среднем 39.1 ± 5.0). Семенники располагаются в двух половинах членика, впереди половой поры насчитывается 16 - 30 (21.6 ± 2.9), позади - 11 - 26 (17.5 ± 3.0) семенников. Бурса цирруса круглая, размером 0.106.4 - 0.196 х 0.056 - 0.103.6 мм (0.162.3 ± 0.017.7 х 0.083.8 ± 0.009.1).
У червей из естественно заражённых собак насчитывалось от 28 до 35 семенников (в среднем 31.7 ± 3.2). Впереди половой поры располагалось 16 - 20 (18.0 ± 1.9), позади - 12 - 15 (13.7 ± 2.0) семенников. Бурса цирруса 0.092 - 0.119.6 х 0.055.2 - 0.078.2 мм (0.106.3 ± 0.009.3 х 0.064.4 ± 0.007.6).
Единственное сообщение о регистрации «£. canadensis G8» у человека опубликовано в начале 21-го столетия (McManus et al., 2001). Описываемый случай имел место в США на Аляске.
Echinococcus multilocularis (Leuckart, 1863) Vogel, 1957 \=Taenia echinococcus multilocularis Leuckart, 1863; =Taenia alveolaris Klemm, 1883; =Echinococcus si-bericensis Rausch et Schiller, 1954; =Alveococcus multilocularis (Leuckart, 1863) Abdu-ladze, 1960] (рис. 162, 163).
Как и у многих других видов эхинококков, Е. multilocularis первоначально был известен по его личиночной стадии, обнаруживаемой у человека в печени. Однако из-за своеобразного внешнего вида лярвоцисты сущность этой цестоды довольно длительное время оставалась невыясненной, и потому вызываемые ею заболевания диагностировали под самыми разными названиями: альвеолярный коллоид, студенистый (коллоидный) рак, карцинома с обратным развитием (см. историческую справку: Абуладзе, 1964; стр. 346).
И только в 1855 г. Р. Вирхов (Virchow, 1855), обнаружив в удалённой из печени мужчины опухоли многочисленные эхинококковые пузыри с отдельными сколексами, у ряда из которых имелись крючья, установил её паразитарное происхождение, охарактеризовав как «мультилокулярная эхинококковая опухоль печени». В 1863 г. Р. Лейкарт (Leuckart, 1863) дал лярвоцисте научное название - Taenia echinococcus multilocularis.
299
Многие авторы, в том числе Э. Фауст (Faust, 1949), рассматривали данный вид в качестве синонима Echinococcus granulosus. В 1960 г. К. И. Абуладзе создал для эхинококка многокамерного новый род - Alveococcus Abuladze, 1960, впоследствии сведённый в синоним Echinococcus (Rausch, Nelson, 1963). Видовое название multilocularis переводится как многолокулярный, многокамерный. В русскоязычной литературе название альвеококк довольно часто употребляют применительно и к самому паразиту, и к вызываемому им заболеванию.
Рис. 162 Echinococcus multilocilaris'. 1 - общий вид стробилы; 2 - сколекс; 3 - гермафродитный членик; 4 - 6 - крючья (из: Абуладзе, 1964 - по разным авторам)
20мм
Рис. 163 Echinococcus multilocilaris'. А - общий вид, Б - яйца (из: research, et. upenn. du. Echinococcus multilocilaris)
300
Описание (по разным авторам, в том числе: Абуладзе, 1964; Faust, 1949; Muller, 2002; Thompson, McManus, 2001). Цестоды очень маленькие, суженные к переднему концу; размеры червей, приводимые разными авторами, укладываются в пределы 1.2 - 4.5 мм, но обычно отмечают длину от 1.6 до 3 мм. Фактически длина их тела составляет примерно одну треть или половину длины тела Е. granulosus. Стробила состоит из 2 - 6 члеников, но чаще всего 4-5. Отношение длины передней части стробилы к длине зрелого членика 1 : 0.31 - 0.80. Задний отдел последнего членика оканчивается тупо, часто с углублением в середине. Сколекс конусообразной формы, до 0.3 мм в диаметре. На хоботке в два ряда располагаются 20 - 36 крючьев в виде венчика диаметром 0.12 - 0.15 мм. Крючья 1-го ряда длиной 24.9 -34 pm. Массивная рукоятка на конце обычно с небольшим изгибом в вентральную сторону. В месте перехода рукоятки в корневой отросток и лезвие имеется характерное утончение, обусловленное наличием вырезки на вентральной поверхности крючочка. Основание корневого отростка расположено почти на середине крючка, с некоторым сдвигом в сторону лезвия, имеет бульбообразно расширенную верхушку, несколько наклонённую к острому, умеренно изогнутому лезвию. Крючья 2-го ряда длиной 20.4 - 31 pm. Рукоятка длинная, изогнута в вентральную сторону. У основания вытянутого и наклонённого к лезвию корневого отростка иногда видна небольшая выемка. Шейка стробилы тонкая, удлинённая. Экскреторная система представлена двумя каналами, идущими спереди назад и открывающимися у зрелых цестод на конце последнего членика. Половая пора расположена на или впереди середины членика. Семенников от 16 до 35, в среднем 18-26; впереди половой поры располагается от 0 до 5 семенников (в среднем 2.3). Сильно извитой семяпровод впадает в мощно развитую грушевидную половую бурсу размерами 0.034 -0.60 х 0.086 - 0.129 мм, расположенную в передней половине членика и занимающую почти половину его ширины. Яичник состоит из двух больших лопастей, соединённых узким перешейком, и находится кзади от половой бурсы. Почти круглый желточник располагается в заднем конце членика. Вагина, снабжённая расширенным семяприемником, поднимается снизу от середины членика вверх к половой бурсе и открывается рядом с семяпроводом в передней половине членика. Зрелая матка обычно круглой формы, не образует боковых ветвей, не имеет выходного отверстия и, как правило, расположена в передней половине членика. В неокрашенном зрелом членике матка с яйцами имеет вид белого пятна, которое хорошо видно невооружённым глазом, что является отличительным признаком вида. Матка содержит 250 - 400 яиц размерами 27-38 pm. Яйца внешне очень похожи на таковые Е. granulosus.
Р. Рауш (Rausch, 1995) описал жизненный цикл Е. multilocularis, в который в качестве окончательного хозяина был вовлечён песец, а промежуточного - грызуны родов Microtus, Lemmus и Clethriomys. В других частях земного шара в роли дефинитивного хозяина выступают лисицы обыкновенная, сахалинская, тибетская, корсак, койоты, волки, енотовидная собака и другие дикие животные, у которых черви поселяются в заднем отделе тонкого кишечника. Иногда эту цестоду встречают также у кошек; подобные случаи известны в Канаде, Германии, Франции, Иордании, Японии (Bowman et al., 2002). В Арктике вокруг посёлков в жизненный цикл цестоды включаются домашние собаки, через которых заражается и человек. В экспериментальных условиях половозрелые черви были выращены в домашних собаках, кошках, енотовидной собаке, лисице обыкновенной (Kapel et al., 2006).
301
В целом, схема жизненного цикла Е. multilocularis выглядит следующим
образом (рис. 164).
Рис. 164 Схема жизненного цикла Echinococcus multilocilaris'. А - взрослый червь в организме окончательного хозяина (В); С -проглоттид с яйцами во внешней среде; D - яйцо с онкосферой попадает в организм человека (Е) или грызуна (F); F -грызун с метацестодами; G -печень грызуна с метацестодами; Н - одиночная циста с протосколексами (из: www.researchgate.net)
Экстенсивность и интенсивность инвазии естественных хозяев в природе очень высока. Так, на о. Св. Лаврентия количество цестод в одном песце колебалось от 1 до 84000 экз., при этом средняя интенсивность инвазии составляла 7400 -54000 экз. (Rausch et al., 1990). В Швейцарии в окрестностях Цюриха заражённость лисиц варьировала от 47 % в парковой зоне до 57 % на прилегающей территории, причём из 133 заражённых животных у 3 % особей в кишечнике насчитывалось более 10 тыс. червей у каждой. В Цюрихском парке полёвка водяная - промежуточный хозяин этого гельминта - оказалась заражена личинками Е. multilocularis на 20 % в 1997 г. и на 9 % в 1998-м (Hofer et al., 2000). На территории Польши паразит был обнаружен у лисиц практически повсеместно - в 14 из 15 воеводств, - при этом в восточной части страны те были заражены на 0.0 - 11.8 %, а в западной - на 17.5 - 50 % (Karamon et al., 2014). В кишечнике одного животного насчитывалось в среднем 2807 экз. цестод. В центральных регионах Северной Америки заражённость койотов колеблется от 6 до 35 % (Ecker et al., 2011). В Японии на о. Хоккайдо в г. Отару из 67 обследованных особей лисицы сахалинской обыкновенной заражёнными оказались 38; всего у них насчитали 2817000 экз. цестод, т.е. на одно животное приходилось в среднем 74134 цестоды (Yimam et al., 2002).
Столь высокая заражённость животных обусловливает и то огромное количество яиц, которое выделяет один хозяин во внешнюю среду, несмотря на, казалось бы, небольшое количество яиц в одном черве - 200 - 400. В 1 г фекалий дефинитивного хозяина может насчитываться до 100 тыс. яиц. В организме дефинитивного хозяина паразит созревает за 28 - 35 дней, а продолжительность его жизни составляет 5-7 месяцев.
Промежуточные хозяева Е. multilocularis - многочисленные грызуны из семейств беличьих, хомяковых, мышиных, пищух; иногда в этой роли могут высту
302
пать землеройковые, кротовые (Torgerson, Budke, 2003). Все они заражаются яйцами цестоды, заглатывая их с пищей или водой. Известно, что яйца цестоды очень устойчивы к внешним воздействиям (Абуладзе, 1964). Так, в воде при температуре +2°С они сохраняют жизнеспособность в течение двух лет. Низкие температуры действуют на онкосфер очень слабо. До двух лет и более остаются жизнеспособными яйца альвеококка в замерзших трупах животных. Так, например, были обнаружены инвазионные яйца Е. multilocularis в трупе песца, в течение нескольких лет пролежавшего в тундре под снегом. Попавшие в организм промежуточных хозяев яйца развиваются быстро, будучи приспособлены к непродолжительной жизни этих животных, и через 2-3 месяца становятся инвазионными (Muller, 2002).
Личиночная форма представляет собой тонкостенную многокамерную кисту, локализующуюся в печени, лёгких, головном мозге (т.е. в паренхиматозных органах), с множеством микроскопических, заполненных жидкостью пузырьков, которые почкуются, прорастая в ткань по типу злокачественной опухоли, плотно прилегая или срастаясь друг с другом (рис. 165).
Рис. 165 Срез через альвеолярную кисту Echinococcus multilocilaris из печени песчанки (из: Muller, 2002)
В большинстве пузырьков имеются зародышевые сколексы яйцевидно-овальной формы с глубоко инвагинированной частью сколекса. Размеры больших крючьев у протосколекса 25 - 29.7, маленьких 21.8 -
27 цгп. Тело зародышевого сколекса заполнено многочисленными прозрачными образованиями, различными по форме и величине, количество и расположение которых непостоянно: они могут заполнять всё тело протосколекса или концентрироваться только по его краям, и тогда середина его тела остаётся свободной.
Пузырьки полностью покрыты пластинчатым слоем - бесклеточным, богатым углеводами поверхностным образованием, которое защищает паразита от иммунологических и физиологических реакций со стороны хозяина (Gottstein, Hemphill, 2008). Метацестоды Е. multilocularis обладают способностью использовать иммунологические реакции хозяина в свою пользу, прежде всего, за счёт выдавливания иммунорегуляторных молекул, которые вмешиваются и манипулируют функциональной активностью макрофагов и Т-клеток.
Ареал Е. multilocularis охватывает Северное полушарие от Северной Америки через Европу к центрально- и восточноазиатским странам, включая северные регионы Японии (Deplazes et al., 2017; Moro, Schantz, 2009; Muller, 2002). При этом у изолятов из Аляски, Северной Америки, Евразии и о. Хоккайдо наблюдаются некоторые морфологические и биологические отличия (Thompson, McManus, 2001).
Случаи заражения человека Е. multilocularis зарегистрированы практически везде, где известен этот паразит в природе (Deplazes et al., 2017). Я попыталась было составить перечень стран, где когда-либо отмечали или отмечают в настоящее время заражение людей данным паразитом. Но, во-первых, этот список фактически
303
охватывает все страны, в которых находят эту цестоду у тех или иных псовых, а во-вторых, подробную информацию о распространении альвеолярного эхинококкоза среди людей по странам и континентам можно найти в цитируемой выше работе (Deplazes et al., 2017). Отмечу только, что с начала 21-го столетия в Европе наблюдается рост числа случаев заражения эхинококком многокамерным (Torgerson, Budke, 2003). Так, в Швейцарии в 1956 - 1992 гг. регистрировалось 0.12 - 0.15 случаев на 100000 населения, в 1993 - 2000-м - 0.10, а в 2001 - 2005 гг. - 0.26 (Schweiger, 2007). Это явление во многом связано со значительным увеличением во многих странах Европы, прежде всего, в городских и пригородных условиях, численности лисиц - основного дефинитивного хозяина данного гельминта (Barabasi et al., 2010; Sreter et al., 2004; Schweiger, 2007). К слову, приуроченность этого паразита к лисицам как основным хозяевам подчёркивает его название - fox tapeworm (цепень лисий), - используемое в англоязычной литературе. О постоянном росте заражённости людей Е. multilocularis пишут, к примеру, и польские исследователи (Nahorski et al., 2013), по чьим данным с 1990 по 2011 гг. в стране был выявлен 121 человек с альвеолярным эхинококкозом. В Литве встречаемость паразита у людей увеличилась с 0.03 случаев на 100000 населения в 2004 г. до 0.57 в 2009-м и 0.74 - в 2012 г. (Marcinkute et al., 2015). В Германии, по данным Института им. Роберта Коха, в 2001 г. был зафиксирован 21 аналогичный случай, а в 2015-м - 47 (https://survstat.rki.de). В Чехии первые два случая обнаружения Е. multilocularis у людей датируются 2007-м годом, а к 2014 г. таковых было известно уже 20 (Kolarova et al., 2015). В 2015 г. появились первые сообщения о заражении людей этой цестодой в Швеции (Wahlstrom et al., 2015). И подобных примеров можно привести множество.
Аналогичная картина наблюдается и в странах азиатского региона. К примеру, в Киргизии первые случаи заражения людей были зафиксированы в 1996 г. и до 2003 г. таковых ежегодно регистрировали 0-3 (Usubalieva et al., 2013). Однако с 2004 г. в стране наблюдается постоянный рост заболеваемости людей альвеолярным эхинококкозом и в 2011 г. здесь был выявлен уже 61 случай (Usubalieva et al., 2013), а в 2013-м - 148 (Raimkylov et al., 2015). Наиболее высокая заболеваемость людей наблюдается в Ошской области: в одном из кишлаков в 2013 г. инвазия обнаружилась у 42 человек, что соответствует 58 случаям на 100000 населения. Авторы связывают подобное изменение эпидемиологической ситуации в стране с изменениями социально-экономических условий, последовавшими за распадом Советского Союза.
На общем фоне относительно равномерного распределения встречаемости альвеолярного эхинококкоза у людей особое место занимает Китай. Подсчитано, что из 11900 - 28200 (в среднем 18235) случаев заражения людей Е. multilocularis, ежегодно выявляемых в мире, более 90 % приходится на долю Китая, а в нём - на Тибет (Torgerson et al., 2010). В провинции Цинхай (Тибетский АО), например, заражённость местных скотоводов достигает 5.1 % (Han et al., 2006).
В целом расчёты показывают, что в Китае Е. multilocularis могут быть заражены 230 тыс. человек, а в группе риска находятся 22.6 млн. человек из 7 провинций (Torgerson et al., 2010).
В Российской Федерации альвеолярный эхиноккокоз распространён преимущественно на территории Республики Саха (Якутия), Красноярского, Алтайского и Хабаровского краёв, в Томской, Омской и других областях. Спорадически
304
заболевание также регистрируют в Татарстане и Башкортостане, на Кольском п-ове.
При альвеолярном эхиноккокозе, помимо механического действия на поражённый орган, паразит оказывает также иммунопатологическое, иммуносупрессивное и токсико-аллергическое воздействие на организм человека.
Онкосферы цестоды, попавшие через рот в кишечник человека, оседают преимущественно в правой доле печени, в которой формируются беловатого цвета узлы продуктивно-некротического воспаления, нередко хрящевой плотности, на разрезе напоминающие ноздреватый сыр (Лукашенко, Брегадзе, 1968). Размеры узла варьируют от 0.5 до 30 см и более в диаметре. При длительном течении болезни пациенты жалуются на тяжесть в правом подреберье, отсутствие аппетита, слабость, снижение веса. Температура тела может незначительно повышаться. При присоединении вторичной инфекции возникают гнойный холангит, абсцессы печени, нагноение и распад узла. Иногда развивается цирроз печени. При прорастании пузырей в жёлчные протоки развивается механическая желтуха, сопровождаемая желтушностью слизистых оболочек, склер, кожи, кожным зудом, светлым калом, потемнением мочи.
Поражение других органов является следствием прорастания многократно почкующегося пузыря через поверхность печени в соседние ткани и органы - лёгкие, почки, селезёнку, мышцы, брюшину, брыжейку. При этом нарушается целостность кровеносных сосудов, и оторвавшиеся отдельные пузырьки заносятся током крови чаще всего в мозг, образуя метастазы и делая их похожими на злокачественную опухоль. «Паразитарный рак печени» - так вполне обоснованно называют поражение печени Е. multilocularis.
При поражении лёгкого узлы прорастают в основном из печени через диафрагму, однако возможно развитие в лёгких и самостоятельных метастатических узлов. Поражение сопровождается болью в груди, кашлем со слизисто-кровянистой или гнойной мокротой, иногда окрашенной жёлчью. В ряде случаев возникает эмпиема плевры.
Поражение почек наблюдается редко и характеризуется образованием в почке очагов продуктивно-некротического воспаления с пролиферацией соединительной ткани в форме узла, который макроскопически выглядит как злокачественная опухоль. В ткани узла выявляются многочисленные мелкие спавшиеся пузырьки паразита, образовавшиеся за счёт инфильтративного роста по межтканевым щелям. У больных могут развиться протеинурия, гематурия, лейкоцитурия, цилиндру-рия, возможно прогрессирование почечной недостаточности с развитием анурии.
Поражение головного мозга характеризуется появлением множества пузырьков, вокруг которых наблюдаются воспаление, участки размягчённого мозгового вещества, кровоизлияния. Воспалительная реакция затрагивает и оболочки мозга. Заболевание проявляется внезапной сильной головной болью, выпадением полей зрения, тошнотой, рвотой, эпилептическими припадками, нарушением речи.
Поражение эхиноккоком многокамерным коварно тем, что это медленно растущее инфильтрационное повреждение печени может длиться годами - от 5 до 15 лет, прежде чем проявятся клинические симптомы заражения. В таких случаях его обнаруживают при профилактическом осмотре пациента или же при обследовании по поводу какого-либо иного заболевания при ультразвуковом обследовании
305
печени. Часто заболевание обнаруживается именно при УЗИ печени. Иногда первым признаком может быть желтуха, вызванная сдавливанием жёлчных протоков.
Прогноз заболевания серьёзный: при отсутствии лечения больные умирают от печёночной недостаточности или кахексии, реже от метастазов в головной мозг.
Диагноз подтверждают с помощью латекс-агглютинации с антигеном из жидкости эхинококковых пузырей, реакции энзим-меченых антител. Применяют также кожно-аллергическую пробу (реакцию Каццони); она наиболее информативна при эхинококкозе печени. При рентгенологическом обследовании кисты в печени и лёгких видны как округлые тени с чёткими контурами, вокруг кист в печени часто выявляются кольца обызвествления (http://diagnos.ru/diseases/parasit/alveo-kokkoz). Изредка в мокроте обнаруживают сколексы цестоды. При общем анализе крови у больных могут наблюдаться выраженная эозинофилия, повышенное СОЭ.
При выявлении кист паразита рекомендуется их хирургическое удаление вместе с прилегающими участками поражённых органов - лёгких, диафрагмы, печени. Медикаментозное лечение антигельминтными препаратами, например, мебендазолом, эффективно в ограниченной степени.
Заражение человека происходит при проглатывании яиц паразита при нарушении правил личной гигиены (немытые руки) после контакта с шерстью и шкурами окончательных хозяев, при употреблении в пищу загрязнённых фекалиями животных дикорастущих ягод и трав, а также овощей и ягод с огородов. Попадание яиц цестоды к человеку возможно также с любой пищей, на которой они могли оказаться, будучи занесены на неё домашними насекомыми.
В Международной классификации болезней 10-го пересмотра МКБ-10 (ICD-10, Version: 2016) Е. multilocularis присвоены коды В67.5 (Инвазия печени, вызванная Echinococcus multilocularis), В67.6 (Инвазии другой локализации и множественный эхинококкоз, вызванный Echinococcus multilocularis), В67.7 (Инвазия, вызванная Echinococcus multilocularis, неуточнена).
Echinococcus oligarthra (Diesing, 1863) Liihe, 1910 (=Taenia oligarthra Diesing, 1863; ^Echinococcus oligarthrus (Diesing 1863) Cameron, 1926; =Echinococcus cruzi Brumpt et Joyeux, 1924; =Echinococcus pampeanus Szidat, 1967) (рис. 166 — 169). Синонимы приведены по работе: Nakao et al., 2013.
История описания этого вида очень примечательна. 200 лет назад, 9 апреля 1817 г., австрийский император Франц I отправил в Бразилию группу учёных, среди которых был и 36-летний орнитолог J. Natterer. Последний настолько увлёкся этой страной, что вернулся в Вену только через 18 лет - с супругой, 3 детьми и 37 коробками собранного материала, среди которого была и цестода из верхней части тонкого кишечника пумы. В 1850 г. К. Дизинг (С. Diesing), разбиравший коллекционные материалы Музея, поместил этого паразита в своей знаменитой сводке «Systema Helminthinn» как ювенильную форму Taenia crassicollis «Taeniolae in fele concolore lectae probabiliter pullae». Позднее К. Дизинг (Diesing, 1863) переопределил цестоду как Taenia oligarthra. Видовое название oligarthra происходит от латинских oligo - малый, незначительный и arthron - сустав; Taenia oligarthra - тения малосуставная, малочленистая. Присваивая такое название новому виду Taenia, автор тем самым подчёркивал его отличие от остальных тений, обладающих, как известно, большим числом члеников. Известный немецкий врач и гельминтолог М. Люэ (LUhe, 1910) из Кёнигсберга, изучив коллекционный материал из Венского музея, перевёл Taenia oligarthra в род Echinococcus, для которого вообще характерны очень мелкие размеры и не более 7 члеников. Таким образом, эпитет oligarthra, как видовой признак, потерял смысл, но остался как историческое название вида.
306
Рис. 166 Echinococcus oligarthra'. 1 - стробила (по: Yamaguti, 1959); 2 - гермафродитный членик (по: Ltlhe, 1910) (из: Абуладзе, 1964)
Рис. 167 Echinococcus oligarthra, крючья (из: Ltlhe, 1910)
Рис. 168 Крючок Echinococcus oligarthra (из: D'Alessandro,
Rausch, 2004) -----------------►
Рис. 169 Крючья Echinococcus oligarthra из экспериментально заражённой кошки (из: Sousa, 1970) 4-----------,--------.---
А. Верстер (Verster, 1965) изучила 4 экз. Е. oligarthrus из материала, по которым в своё время Т. Кэмерон (Cameron, 1926) переописал данный вид и чьё описание приводит в своей монографии К. И. Абуладзе (1964).
Описание (по разным авторам, в том числе: Абуладзе, 1964 - по: Cameron, 1926; Thompson, McManus, 2001; Verster, 1965). Стробила очень маленькая, 1.7 -2.9 мм длины и состоит из 3 - 4 члеников. Отношение длины передней части стробилы к длине терминального членика 1 : 0.96 - 1 ; 1.10 (Thompson, McManus, 2001), или же длина последнего членика составляет 50 - 54.7 % (в среднем 51.8) от общей длины стробилы (Verster, 1965). Сколекс конусообразной формы. Присоски около 1.0 мм в диаметре. Хоботок длинный, с 36 - 40 крючьями. Крючья 1-го ряда длиной 43 - 60 pm. Лезвие крючка резко изогнуто и в месте соединения с рукояткой образует ясную выемку; рукоятка длинная и извилистая; корневой отросток яйцевидной формы, несколько продолговат, расположен под прямым углом к лезвию и рукоятке. Крючья 2-го ряда длиной 28 - 45 pm; лезвие более узкое и менее изогнуто, чем у больших крючьев; рукоятка тоньше и длиннее; корневой отросток сравнительно широкий и образует тупой угол с рукояткой. Половые поры неправильно череду
307
ются и располагаются в середине или выше середины бокового края стробилы. Семенники мелкие, округлой формы, их количество варьирует от 15 до 46 (в среднем 29), располагаются в середине членика, между экскреторными сосудами. У изученных А. Верстер (Verster, 1965) 4 экз. цестод насчитывалось 21-33 семенника (в среднем 26.5), при этом кпереди от половой поры располагалось 7-16 (9.5) семенников, а позади 12-23 (17). Семяпровод длинный, сильно извитой. Бурса цирруса грушевидной формы, размером 0.056 - 0.072.8 х 0.046 - 0.047.6 мм (0.062.6 х 0.047.1) (Verster, 1965). Яичник состоит из двух долей, соединённых узкой перемычкой. Желточник располагается кзади от яичника, между ними находится тельце Мелиса. Матка в зрелых члениках имеет вид медианной трубки с латеральными вздутиями, придающими ей мешковидную форму.
Ареал Е. oligarthra охватывает территорию Центральной и Южной Америки - от севера Мексики через Коста-Рику до юга Аргентины. Окончательные хозяева -дикие кошачьи, прежде всего, пума, рысь рыжая, ягуар, кугуар, ягуарунди, оцелот, кошка пампасская (Leopardus pajeros). В экспериментах с заражением домашних кошек была доказана возможность их участия в жизненном цикле паразита в качестве дефинитивного хозяина (Sousa, 1970; Sousa, Thatcher, 1969). Яйца цестоды появились в фекалиях кошек на 86 - 87 день после заражения.
Промежуточные хозяева паразита - грызуны, в том числе агути центральноамериканский, чёрный и бразильский, опоссум южный, крыса мягкоиглая щетинистая, тихоокеанская щетинистая, пака (D'Alessandro, Rausch, 2008). В Венесуэле паразита обнаружили у кролика флоридского (известно, что эти животные уже проникли через Панамский перешеек в Южную Америку) (Melendez et al., 1984). Метацестоды локализуются в мышцах, селезёнке, печени животных.
Лярвоциста Е. oligarthra была впервые описана под названием Echinococcus cruzi по одной крупной кисте из селезёнки и трёх более мелких из печени одного агути из 4 обследованных (Brumpt, Joyeux, 1924). Киста представляет собой сферический, заполненный жидкостью пузырь, у которого отсутствуют какие-либо признаки экзогенной пролиферации. Содержимое жидкости напоминает «гидатидный песок». Протосколексы размером 0.160 - 0.180 х 0.100 - 0.110 мм, обладали 32 - 36 крючьями; большие крючья длиной 37 - 40, мелкие 30 - 34 pm. Поскольку крючья отличались от описанных М. Люэ (Liihe, 1910) для Т. oligarthra, то авторы предположили, что найденные ими метацестоды могут принадлежать ещё не описанному виду взрослых цестод, который они предварительно назвали Echinococcus cruzi. Т. Кэмерон (Cameron, 1926) высказал мнение, что Е. cruzi является личиночной формой Е. oligarthra. Для доказательства этой гипотезы один из исследователей попытался вырастить взрослую форму из гидатид, обнаруженных в правой лопаточной мышце и левом боку взрослой самки агути в Панаме (Sousa, 1970). К слову, в других органах животного эхинококки не встретились. Внешне кисты - всего было найдено две гидатиды - выглядели как пузырь, но на срезе внутри хорошо были видны многокамерные образования с перегородками. Кисты были стерильными, 10 - 18 мм длиной, с более чем 100 выводковыми капсулами и скоплениями протосколексов. Протосколексы размером 0.112 - 0.126 х 0.081 - 0.084 мм, большие крючья длиной 32-40, мелкие 27 - 35 pm. Одну кисту автор скормил домашней кошке, и через 121 день при вскрытии животного в его тонком кишечнике насчитали более 1000 червей, в основном 1-2-сегментных, которых определили как Е. oligarthra. Размеры крючьев 1-го и 2-го рядов у этих червей составляли 54 - 56 и 43 - 45 pm.
308
Тот факт, что Е. oligarthra может развиваться в домашних кошках, свидетельствует о зоонозном значении данного вида. Сказанное находит подтверждение в сообщениях, к счастью, очень немногочисленных, о находках гидатидных кист у людей в Венесуэле, Суринаме и Бразилии.
Впервые заражение человека метацестодой Е. oligarthra было зарегистрировано у местной жительницы в Венесуэле, у которой внутриглазная гидатида левого глаза была выявлена с помощью компьютерной томографии (Lopera et al., 1989). Кисту удалили хирургическим путём.
Второй случай имел место в Бразилии. На этот раз кисту обнаружили в сердце человека, скончавшегося от столбняка (D’ Alessandro et al., 1995).
Третий случай был зафиксирован в Суринаме, где пациентом оказался 6-летний мальчик, у которого в левом глазу проявилась опухоль размером 15 х 25 мм, вызвавшая пучеглазие, отёк века и конъюнктивы, птоз века и слепоту (Basset et al., 1998). В данном случае кисту также удалили хирургическим путём.
В 1997 и 2000-м годах появились сообщения о двух случаях подчелюстного эхинококкоза у взрослых людей в Индии (Kini et al., 1997; Sahni et al., 2000). В обоих случаях авторы публикаций определили возбудителя заболевания как «Е. oli-garthrum», представляющего, по их мнению, редкий вариетет Е. granulosus (а гаге variety of Echinococcus granulosus). Одновременно эти авторы отметили, что ранее в Индии были зарегистрированы 3 случая подчелюстного эхинококкоза, вызванного заражением Е. granulosus. Обе публикации были тщательно проанализированы двумя ведущими специалистами по данной группе цестод (D'Alessandro, Rausch, 2004), которые в результате пришли к выводу, что в действительности возбудителем подчелюстного эхинококкоза в Индии у людей был один и тот же вид - Е. granulosus. В своём утверждении авторы опирались не только на отличия в форме и размерах крючьев протосколексов из Индии от таковых Е. oligarthra, но и на отсутствие в Индии специфичных хозяев данного паразита - тех видов диких кошек и дикообразных грызунов, прежде всего, агути и щетинистых крыс, к которым приурочен данный неотропический вид, встречающийся только в Центральной и Южной Америке.
Echinococcus ortleppi Lopez-Neyra et Soler, 1943 («штамм крупного рогатого скота» - cattle strain, G5) (рис. 170). В 1934 г. Р. Ортлепп (Ortlepp, 1934), работавший в Претории в Южной Африке, обнаружил у домашней собаки эхинококков, которых определил как Е. granulosus. Испанские исследователи (Lopez-Neyra, Soler, 1943) посчитали, что эти цестоды представляют собой новый вид, который они назвали в честь его первооткрывателя - Е. ortleppi. Р. Рауш и Д. Нельсон (Rausch, Nelson, 1963) рассматривали выделение Е. ortleppi неправомочным, полагая, что Р. Ортлепп был прав в своём определении.
Длина стробилы обнаруженных Р. Ортлеппом (Ortlepp, 1934) цестод варьировала от 5 до 8.5 мм, количество члеников было равно 3. Крючьев 30 - 38, длина крючьев 1-го ряда 42 - 49, 2-го - 32 - 42 щп. Семенники в количестве 30 - 53 располагались в средней части членика, оставляя свободными его проксимальную и дистальную зоны.
А. Верстер (Verster, 1965), исследовав оригинальный материал из коллекции Р. Ортлеппа, который состоял из 7 экз. цестод, а также собранный ею также в Претории материал от собак, шакала и быков, пришла к выводу, что Е. ortleppi является подвидом Е. granulosus - Е. granulosus ortleppi.
309
Длина 7 экз. цестод из коллекции Р. Ортлеппа составляла 2.99 - 4.11 мм (в среднем 3.42 ± 0.48). В стробиле насчитывалось 3-4 членика, обычно 3. Зрелый членик имел в длину 1.62 - 3.6 мм, что составляло 51.8 - 87.5 % (в среднем 61.1) от всей длины тела. Половая пора во второй половине боковой линии членика. Количество семенников 31 - 39 (в среднем 33.2 ± 3.5), впереди половой поры располагалось 18 - 25 (20.6 ± 3.0), позади 11-14 (12.6 ± 1.1) семенников, позади желточников они отсутствовали. Бурса цирруса 0.115 х 0.069 мм.
ВРис. 170 Echinococcus ortleppi, половозрелый членик (из: Verster, 1965, как Е. granulosus ortleppi, синтип)
Цестоды из естественно заражённых собак, добытые А. Верстер, достигали в длину (измерено 45 цестод) 2.03 - 4.25 (в среднем 2.92 ± 0.2) мм. Стробила состоит из 3 члеников, второй из них уже половозрелый. Длина маточного членика 0.864 - 2.08 (1.703) мм и составляет 42.6 -66.1 (57) % от общей длины стробилы. Половая пора близ середины боковой линии членика. Количество семенников 28 - 42 (в среднем 34.9 ± 3.2), впереди половой поры располагалось 19 - 28 (22.0 ± 2.0), позади 9-18 (12.9 ±1.1) семенников. Бурса цирруса 0.086 - 0.138 х 0.041 - 0.069 (в среднем 0.105 х 0.055) мм.
Стробила цестод из экспериментально заражённых собаки и шакала состояла из 2, 3 или 4, но чаще 3 члеников и достигала в длину 2.59 - 7.01 (4.9 ± 0.7) мм. Количество семенников 25 - 47 (в среднем 32.2 ± 4.0), впереди половой поры насчитывалось 13 - 28 (20.2 ± 2.7), позади 8-19 (12.02 ± 2.3) семенников.
В настоящее время на основе молекулярно-генетических и фенотипических отличий Е. ortleppi выделен из Е. granulosus как самостоятельный вид (см. стр. 284 - 285). М. Накао с коллегами (Nakao et al., 2006) рассматривают Е. ortleppi и Е. canadensis сестринскими видами «sister species».
Окончательные хозяева Е. ortleppi - собаки и шакал, промежуточный -крупный рогатый скот.
Ареал вида до недавнего времени был ограничен территорией Южной и Восточной Африки. Однако в 2008 г. появилось сообщение об обнаружении этого паразита у быков в Италии (Casulli et al., 2008), в 2009-м - в Индии (Pednekar et al., 2009), в 2011 г. - у собак, крупного рогатого скота и человека в Бразилии (de la Rue et al., 2011), в 2014-м - у крупного рогатого скота и человека во Франции (Grenouil-let et al., 2014). Ещё раньше, в 2003 г., Н. А. Никулина с соавт. писали о встречаемости Е. granulosus G5 на территории РФ, Молдовы и Казахстана, а М. Накао с коллегами (Nakao et al., 2006) получали для исследования материал по Е. ortleppi из Аргентины.
Что касается регистрации Е. ortleppi у людей, то хотя в Южной Африке им поражено 3 % местного населения (Mogoye et al., 2013), в остальных регионах подобные находки - в полном смысле этого слова - единичны. К примеру, в Европе первый случай регистрации цистного гидатидоза, вызванного заражением Е. ortleppi, зафиксирован в Нидерландах (Bowles et al., 1992). В 2011 и 2012 гг. во Франции
310
выявили два случая инвазии печени лярвоцистами Е. ortleppi; одним их пострадавших был 63-летний мужчина с востока страны, а вторым - 29-летняя женщина, жительница западного региона Франции (Grenouillet et al., 2014). Оба пациента проходили курс лечения по поводу абдоминальной боли, и у обоих при ультразвуковом обследовании в печени были выявлены узлы, оказавшиеся, при тщательном изучении, лярвоцистами Е. ortleppi диаметром 6 и 3 см - в первом случае и 7 см - во втором. В Южной Америке инвазия была выявлена у одного человека в Бразилии (de la Rue et al., 2011).
Во всех цитируемых публикациях определение цестод базировалось, помимо морфометрических данных, на результатах молекулярно-генетического анализа. Надо полагать, что активное внедрение подобных методов при идентификации эхинококков изменит наши представления о географическом распространении многих из них, в том числе и Е. ortleppi.
Echinococcus vogeli Rausch et Bernstein, 1972 (рис. 171, 172). Паразит описан на материале от собаки кустарниковой, которую отловили в Эквадоре в конце 1969 - начале 1970 гг. и доставили в Лос-Анджелесский зоопарк. При стандартном обследовании фекалий у животного были выявлены яйца, по меньшей мере, 4 видов нематод и членик маленькой цестоды. После антигельминтозной обработки дро-карбилом (drocarbil) выделились многочисленные цестоды, которые отличались от известных представителей рода Echinococcus и были описаны как новый вид - Е. vogeli (эхиноккок Фогеля). Название виду было дано в честь проф. Ганса Фогеля (Hans Vogel)’ из Гамбурга в знак признательности за его заслуги в деле изучения таксономии цестод рода Echinococcus.
Рис. 171 Echinococcus vogeli: А - общий вид стробилы; Б - второй членик, дорсально; В - крючья (из: Rausch, Bernstein, 1972)
Описание (по: Rausch, Bernstein, 1972). Стробила узкая, 3.94 - 5.58 мм длиной, состоит из 3 сегментов, у которых длина больше их ширины. Сколекс относительно крупный, 0.345 - 0.577 х 0.262 - 0.322 мм. Хоботок массивный, 0.103 - 0.134 х 0.154 - 0.188 мм, с 28 - 36 крючьями. Длина крючьев 1-го ряда 49 - 57 (в среднем
311
53), 2-го - 30 - 47 (43) pm. Присоски овальные, с длинной осью, направленной ан-теро-медианно, диаметром 0.115 - 0.134 мм. Длина шейки 0.157 - 0.300 мм. Маточный членик длинный, узкий, с почти параллельными краями. Отношение длины передней части стробилы к длине маточного членика 1 : 2.2 - 1 : 3.1. Половые поры односторонние или чередующиеся, ниже середины боковой линии членика. Волокна внутреннего слоя продольной мускулатуры толстые, но редкие и широко разделённые. Бурса цирруса от полусферической до грушеобразной формы, размерами 0.107 - 0.135 х 0.058 - 0.069 мм, располагается в центре членика. Циррус с мелкими шипиками, в вывернутом состоянии достигает в длину 0.066 - 0.085 при диаметре 0.010 - 0.014 мм. Семенники в количестве 50 - 67, субсферические или сферические, диаметром 0.031 - 0.047 мм, располагаются от заднего края желточников до уровня дистального конца матки, большая часть семенников находится выше половой поры. Толстостенная вагина проходит от полового атриума медианно, поворачивает назад возле серединной линии и расширяется возле уровня переднего края яичника, образуя тонкостенный семяприемник. Яичник слабо дольчатый, 0.057 - 0.144 х 0.107 - 0.160 мм, находится вентрально в задней трети членика. Тельце Мелиса располагается медианно между яичником и желточни-ком. Зрелая матка мешкоподобная, трубчатая, содержит 400 - 500 яиц. Эмбриофоры размером 32 -42 х 29 - 40 (в среднем 37 х 33) pm.
Рис. 172 Echinococcus vogeli, детали строения женской половой системы (V - вагина; ОС - оотип; OVD - яйце-проток; J - соединение семяпротока с яйцепротоком; VD - желточный проток; VIT - желточник; UD - маточный проток; М - тельце Мелиса; UT - матка; SR - семяприемник; OV - яичник (из: Rausch, Bernstein, 1972)
Окончательные хозяева эхинококка Фогеля -
собака кустарниковая (в природе) и домашняя собака. В Южной Америке собака кустарниковая - широко распространённый обитатель влажных лесов, а её основной пищей являются крупные грызуны семейства Dasyproctidae - пака, агути, акуши. Перечисленные животные, а также крыса щетинистая участвуют в жизненном цикле Е. vogeli в качестве промежуточного хозяина.
Личинка цестоды развивается в печени хозяина, где она обычно расположена поверхностно, частично под глиссоновой капсулой (Rausch et al., 1981). Инвазионная личинка состоит из почти шаровидного до асимметричного, заполненного жидкостью пузыря, от 2 до 80 мм в диаметре, окружённого плотной пластинчатой мембраной. Пузырь, как правило, содержит множество камер, часто взаимосвязанных, образуемых эндогенный пролиферацией зародышевой и пластинчатой ткани, в которой возникают выводковые капсулы из зародышевого слоя. Экзогенной пролиферации, типичной при поражении человека, в естественных промежуточных хозяевах не наблюдается. Пузыри встречаются одиночно, группами или в виде плотной массы. Размеры крючьев 1-го и 2-го рядов у протосколекса, по данным разных авторов, несколько разнятся: соответственно 37 - 44 (39.83) и 27 - 35 (32.59) (Gardner et al., 1988), 38.2 - 45.6 и 30.4 - 36.9 (Thompson, McManus, 2001),
312
40 - 45.5 (42.8) и 30 - 35 (33.5) цш (Vizcaychipi et al., 2013). Вполне вероятно, что эти небольшие различия могут быть связаны с возрастом сколекса. Показано также, что морфометрические признаки крючьев варьируют в зависимости от локализации паразита (Almeida et al., 2015).
Ареал вида охватывает обширную территорию Центральной и Южной Америки от юга Мексики через Боливию и Парагвай до севера Аргентины.
К концу 1998 г. в Центральной и Южной Америке, было известно 40 случаев заражения людей Е. vogeli, в том числе в Панаме (1 случай), Колумбии (13), Эквадоре (6), Венесуэле (2) и Бразилии (18) (D’Alessandro, 1999). В последующие годы к этому списку добавились Суринам (Basset et al. 1998), Перу (Somocurcio et al., 2004) и Французская Гвиана (Debourgogne et al., 2017; Knapp et al., 2009), были отмечены новые случаи в Бразилии (Rodrigues-Silva et al., 2002). В Суринаме, к примеру, пациентом оказался 41-летний мужчина, у которого хирургическим путём была удалена кистная масса в печени и животе, во Французской Гвиане инвазия обнаружилась у 6-летнего ребёнка (Debourgogne et al., 2017) и охотника из тропических лесов (Knapp et al., 2009).
В Перу - к слову, это был первый случай в стране - у пациентки, 44-летней женщины, из печени была удалена опухоль, состоящая из множества отдельных или сросшихся кист размерами 1 - 4 см (рис. 173, А).
Рис. 173 Echinococcus vogeli-. А - кисты, удалённые из печени пациентки; Б - крючья протосколекса (из: Somocurcio et al., 2004)
Большинство пузырей содержали бесцветную жидкость, некоторые - некротический желтоватый материал, несколько пузырей были кальцифицированы. При гистологическом исследовании в пузыре обнаружены зародышевый слой и протосколексы с крючьями длиной 40 - 45 и 28 - 35 pm (рис. 173, Б) (Somocurcio et al., 2004).
К 2009-му году случаи заражения людей полицистным гидатидозом были официально зарегистрированы уже в 12 латиноамериканских странах, а их количество достигло 168 (Knapp et al., 2009). И, наконец, в 2013 г. описан случай заражения человека в Нидерландах, однако пациентом оказался выходец из Суринама (Stijnis et al., 2013).
Обычным местом локализации метацестод Е. vogeli является печень и прилегающие ткани (в 80 - 85 % случаев), но личинки могут встретиться также в лёгких (15 %), селезёнке, брюшной полости, подреберье, груди.
Патогенез метацестод Е. vogeli для человека, как и личинок Е. multilocularis, является следствием атипичного разрастания пузырьков, вызванного несовместимостью данной пары паразит-хозяин (Rausch et al., 1981).
313
Итак, коротко подытожим изложенную выше информацию о представителях рода Echinococcus, которых находят у людей.
Прежде всего, отметим, что таковых в настоящее время насчитывается 8 видов - Е. granulosus, Е. canadensis, Е. borealis. I. intermedius, Е. multilocularis, Е. oligarthra, Е. ortleppi и Е. vogeli, но эта цифра правомочна в том случае, если видовая самостоятельность двух видов - Е. borealis и I. intermedius будет признана научным сообществом. В противном случае список эхинококков, регистрируемых у человека, будет включать 6 видов. Подмечено, что во многих случаях определение обнаруженных у человека эхинококков не доводилось ло логичного конца. К примеру, по состоянию на 1999 г. в Южной Америке было зафиксировано 37 случаев заражения Е. vogeli, 3 - Е. oligarthrus, а в 56 случаях видовую принадлежность паразита не установили, чаще всего по причине отсутствия крючьев у протосколексов (D’Alessandro, 1999). Проблемы видовой идентификации Echinococcus во многом объясняются эволюционной молодостью этой группы, у которой очень быстро идут процессы видообразования и глобальной радиации (Knapp et al., 2011). К слову, использование для идентификации метацестод эхинококков серологических и молекулярно-генетических методов, широко практикуемое в настоящее время, значительно облегчает эту задачу.
Подчеркну, что вопросы правильной видовой иденетификации этих цестод, определения среди них внутривидового полиморфизма не являются праздными, а имеют огромное практическое значение для совершенствования превентивных мер по снижению уровня заболеваемости эхинококкозом, а также проведения лечебных мероприятий (см., напр., Kamenetzky et al., 2005; Moro, Schantz, 2009; Rozenzvit et al., 1999; Zhang L. et al., 1999).
Среди всех видов Echinococcus два - E. granulosus и E. multilocularis имеют наиболее серьёзное медицинское значение (Higuita et al., 2016). Первый из них, к примеру, поражает свыше 1 млн. человек, а ежегодные убытки, связанные с лечением, потерей трудоспособности и гибелью людей, превышают 3 млрд, долларов США. Сюда же надо присовокупить потери в сельсохозяйственном производстве, также исчисляемые миллионами долларов. В Чили, например, ежегодные потери, связанные с поражением людей и домашнего скота эхинококками, оцениваются в 14.35 млн. долларов (Manterola, Otzen, 2016).
В целом эхинококкозы человека и сельскохозяйственных животных представляют серьезную медицинскую, ветеринарную и социально-экономическую проблему. Однако, несмотря на определённые успехи в лечении, появление современных инструментальных и серологических методов диагностирования количество больных эхинококкозом во многих странах мира не только не снижается, но и растёт (Moro, Schantz, 2009). По данным медицинской статистики, за 20 лет постперестроечного периода заболеваемость населения эхинококкозом в РФ возросла в 7.5 раза (Романенко, 2004). К тому же, в современном мире проблема заболевания эхинококкозом в той или иной стране перестаёт быть узколокальной, а приобретает межгосударственное значение. В Италии, например, полицистный гидатидоз был зарегистрирован у иммигранта, прибывшего в страну из Нигера через Ливию (Ang-heben et al., 2017). В Нидерландах большинство пациентов, поступающих в клиники по поводу эхинококкоза, это - выходцы из стран Восточной Европы, Северной Африки, Ближнего Востока и из Турции (Stijnis et al., 2013). Ежегодно в этой стране фиксируют около 20 новых случаев заболевания людей.
314
Цитируемая литература
Абирова И. М., Шалменов М. Ш., Поскребышева А. Н., Майконов Н. G Эхинококкоз сельскохозяйственных животных и диких плотоядных семейства Canidae / Ветеринарная медицина. Современные проблемы и перспективы развития: Мат. Между нар. научно-практ. конф. / Под ред. А. А. Волкова. -ФГОУ ВПО «Саратовский ГАУ», 2010. - С. 3 - 6.
Абуладзе К. И, Тениаты - ленточные гельминты животных и человека и вызываемые ими заболевания И Основы цестодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1964. - 4. - С. 312 - 367.
Баранова И, П., Лесина О. Н Гельминтозы и другие паразитарные заболевания: Учебное пособие для врачей (послевуз. проф. образование). - Пенза, 2008 - 80 с.
Велиева Т. А. Проблемы диагностики и лечения эхинококкоза // ScienceRise. - 2015. - 5, 4(10). - С. 8 -11. Doi.org/10.15587/2313-8416.2015.42974.
Геллер И. Ю. Эхинококкоз. - М.: Медицина, 1989. - 208 с.
Дейнека И. Я. Эхинококкоз человека. - М.: Медицина, 1968. - 376 с.
Лукашенко Н. П., Брегадзе Н. П. Глава XXI. Эхинококкоз и альвеококкоз / Протозойные болезни, гельминтозы, членистоногие, имеющие медицинское значение, и ядовитые животные. - М.: «Медицина», 1968. - С. 509 - 526. - (Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. Том IX. - Ред. действ, член АМН СССР, проф. П. Г. Сергиев).
Муминов А. М., Махмадов И. Ф., Куватов М. К. Эхинококкоз в Таджикистане / Ветеринарная медицина. Современные проблемы и перспективы развития: Мат. Междунар. научно-практ. конф. / Под ред. А. А. Волкова. - ФГОУ ВПО «Саратовский ГАУ», 2010. - С. 300 - 304.
Назыров Ф. Г., Исмаилов Д. А., Леонов Ф. В., Байбеков И. М. Эхинококкоз. - Ташкент, 1999. - 208 с.
Никулина Н. А., Бенедиктов И. И., Гараев М. М. Применение метода оценки полиморфизма длин рестрикционных фрагментов ПЦР для типирования Е. granulosus // Мед. паразитол. - 2003. - № 2. - С. С. 29-32.
Онищенко Г Г О заболеваемости эхинококкозом в Российской Федерации в 2006 году, http: И www. rospotrebnadzor.ru.
Петров А. М., Черткова А. Н, Отличительные признаки однокамерного и альвеолярного эхинококков по личиночным и половозрелым формам И Труды ВИГИС. - 1959. - 7. (цит. по: Абуладзе, 1964).
Поляков В. Е., Иванова И. А., Полякова Н. Р. Эхинококкоз однокамерный // Педиатрия. - 2006. - № 5. - С. 88 - 96.
Романенко И. А. Практическое использование санитарно-гельминтологических исследований // Медицинская паразитология. - 2004. -№ 5, - С. 34 - 36.
Садовниченко Ю. А. Класс Ленточные черви (Cestoda): Метод, указ, для самост. внеауд. работы студ. -Харьков: ХНМУ, 2015. - 24 с.
Сергиев В. П, Легонькое Ю. А., Полетаева О. Г. и др. Эхинококкоз цистный (однокамерный). Клиника, диагностика, лечение, профилактика: Информационно-методическое пособие. - М.: Ин-т мед. паразит, и троп. мед. им. Е. И. Марциновского, 2008. - 36 с.
Сухарева Г. Э. Эхинококкоз сердца у ребёнка // Здоровье ребёнка. -2014.-4 (55). - С. 143 - 149.
Шалимов А. А., Грубник В. В., Ткаченко А. И. Особенности инфекционного контроля при лечении больных эхинококкозом // Инфекционный контроль. - 2002. - № 2. - С. 20-23.
Aaty Н. Е, Abdel-Hameed D. М., Alam-Eldin Y. Н. et al. Molecular genotyping of Echinococcus granulosus in animal and human isolates from Egypt H Acta Trop. - 2012. - 121, l.-P. 125 - 128.
Almeida F., Oliveira F, Neves R., Siqueira N. et al. Morphometric characteristics of the metacestode Echinococcus vogeli Rausch & Bernstein, 1972 in human infections from the northern region of Brazil II J. Helminthol. - 2015. - 89, 4. - P. 480 - 486. doi: 10.1017/S0022149X14000376.
Alvarez Rojas C. A., Ebi D.t Gauci C. G., Scheer linck J. P. et al. Microdiversity of Echinococcus granulosus sensu stricto in Australia // Parasitology. - 2016. - 143, 8. - P. 1026 - 1033.
Alvarez Rojas C. A., Ebi D.t Paredes R. et al. High intraspecific variability of Echinococcus granulosus sensu stricto in Chile//Parasitol. Int. -2017. -66, 2. -P. 112 - 115. doi: 10.1016/j.parint. 2016.12.001.
Alvarez Rojas C. A., Romig T., Lightowlers M. W. Echinococcus granulosus sensu lato genotypes infecting humans - review of current knowledge // Int. J. Parasitol.- 2014. - 44, 1. - P. 9 - 18. doi: 10.1016/j.ijpara.2013.08.008.
Angheben A., Mariconti M., Degani M., Gobbo M. et al. Is there echinococcosis in West Africa? A refugee from Niger with a liver cyst//Parasit. Vectors.-2017. - 10, l.-P. 232. doi: 10.1186/s 13 071-017-2169-6.
Barabdsi S. S, Deplazes P., Cozma V,t Pop S. et al. Echinococcus multilocularis confirmed in Romania 11 Sci. Parasitol. - 2010. - 11, 2. - P. 89 - 96.
315
Bardonnet К., Piarroux R., Dia L. et al. Combined eco-epidemiological and molecular biology approaches to assess Echinococcus granulosus transmission to humans in Mauritania: Occurrence of the 'camel' strain and human cystic echinococcosis // Trans. R. Soc. Trop. Med. Hyg. - 2002. - 96, 4. - P. 383 - 386.
Basset D.t Girou C.t Nozais I. P. et al. Neotropical echinococcosis in Suriname: Echinococcus oligarthrus in the orbit and Echinococcus vogeli in the abdomen // Am. J. Trop. Med. Hyg. -1998. - 59, 5. - P. 787 - 790.
Bowles J., van Knapen F., McManus D. Cattle strain of Echinococcus granulosus and human infection // Lancet. - 1992. - 339 (8805). - P. 1358.
Bowman D. D., Hendrix С. M., Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-P. 227-231.
Brumpt E., Joyeux Ch. Description d'un nouvel dchinocoque: Echinococcus cruzi n. sp. // Ann. Parasitol. Hum. Comp. - 1924. - 2. - P. 226 -231.
Buttenschoen K., Buttenschoen C. D. Echinococcus granulosus infection: the challenge of surgical treatment // Langenbecks Arch. Surg. - 2003, - 388, 4. - P. 218 - 230.
Cameron T. W. M. Observations on the genus Echinococcus Rudolphi 1801 // J. HelminthoL - 1926. -4, 1. -P. 13-22.
Cameron T. W. M. The incidence and diagnosis of hydatid cyst in Canada. Echinococcus granulosus var. canadensis I I Parassitologia. - 1960. - 2. - P. 381 - 390.
Castro A., Silva M.t Veloso G., Freire L. et al. 2005. Determination of Echinococcus granulosus genotypes with NADH dehydrogenase 1 and cytochrome c oxidase 1 sequences // Acta Parasitol. Port. - 2005. - 12. -P. 395 - 396.
Castrodale L. J, Beller M.t Wilson J. F, Schantz P. M. et al. Two atypical cases of cystic echinococcosis (Echinococcus granulosus) in Alaska, 1999 // Am. J. Trop. Med. Hyg. - 2002. - 66, 3. - P. 325 - 327.
Casukki A., Zeyhle E., Brunetti E.t Pozio E. et al. Molecular evidence of the camel strain (G6 genotype) of Echinococcus granulosus in humans from Tutkana, Kenya // Trans. R. Trop. Med. Hyg. - 2010. - 104, 1. -P. 29-32.
Casulli A., Manfredi M. T.t La Rosa G., Cerbo A. R. et al. Echinococcus ortleppi and E. granulosus Gl, G2 and G3 genotypes in Italian bovines И Vet Parasitol. - 2008. - 155, 1-2. - P. 168 - 172. doi: 10.1016/j. vet-par. 2008.04.004.
Chaabane-Banaoues R., Oudni-M'rad M., M'rad S, Mezhoud H., Babba H. Environmental contamination by Echinococcus granulosus sensu lato eggs in relation to slaughterhouses in urban and rural areas in Tunisia// Korean J. Parasitol. - 2016. - 54, 1. -P. 113 - 118. DOI: https://doi.org/10.3347/kjp.2016.54.Ll 13.
Cohen H, Paolillo E, Bonifacino R., Botta B. et al. Human cystic echinococcosis in a Uruguayan community: a sonographic, serologic, and epidemiologic study // Am. J. Trop. Med. Hyg. - 1998. - 59, 4. - P. 620 - 627.
Constantine С. C., Thompson R. C, Jenkins D. J. et al. Morphological characterization of adult Echinococcus granulosus as a means of determining transmission patterns // J. Parasitol. - 1993. - 79, 1. - P. 57 - 61.
Craig P. S.t Budke С. M., Schantz P. M., Li T. et al. Human echinococcosis: A neglected disease? // Trop. Med. Health. - 2007. - 35, 4. - P. 283 - 292.
Cucher M. A., Macchiaroli N., Baldi G., Camicia F. et al. Cystic echinococcosis in South America: Systematic review of species and genotypes of Echinococcus granulosus sensu lato in humans and natural domestic hosts П Trop. Med. Int. Health. - 2016. - 21, 2. - P. 166 - 175. doi: 10.1111/tmi. 12647
Dakkak A. Echinococcosis/hydatidosis: a severe threat in Mediterranean countries // Vet. Parasitol. - 2010. -174, 1-2.-P. 2- 11. doi: 10.1016/j.vetpar.2010.08.009.
D'Alessandro A. Neotropical echinococcosis: Echinococcus vogeli and E. oligarthrus // Arch. int. Hidatid. -1999.-33, l.-P. 50-51.
D'Alessandro A., Ramirez L. E., Chapadeiro E., Lopes E. R.t de Mesquita P. M. Second recorded case of human infection by Echinococcus oligarthrus 11 Am. J. Trop. Med. Hyg. - 1995. - 52, 1. - P. 29 - 33.
D'Alessandro A., Rausch R~ L. Erroneous reports of the neotropical Echinococcus oligarthrus as a cause of echinococcosis in India // J. Parasitol. - 2004. - 90, l.-P. 202 - 203.
D'Alessandro A., Rausch R. L. New aspects of neotropical polycystic (Echinococcus vogeli) and unicystic (Echinococcus oligarthrus) echinococcosis // Clin. Microbiol. Rev. - 2008. - 21, 2. - P. 380 - 401. doi: 10.1128/CMR.00050-07.
Daniel-Mwambete K., Ponce-Gordo F., Cuesta-Bandera O. Genetic identification and host range of the Spanish strains of Echinococcus granulosus // Acta Trop. - 2004. - 91, 2. - P. 87 - 93.
Das S. S., Kumar D., Sreekrishnan R. Chapter 26. Hydatidosis in animals and man / Helminthology in India. - Ed. Sood M. L. - Inti. Book Dist. Dehradun., 2003. - P. 467 - 509.
Debourgogne A., Blanchet D., Fior A., Umhang G. et al. Neotropical echinococcosis caused by Echinococcus vogeli in a 6-year-old child: the second report in humans in French Guiana // Paediatr. Intern. Child Health. -2017.-37, l.-P. 63-65.
316
de la Rue M. J., Takano K., Brochado J. F., Costa С. V. et al. Infection of humans and animals with Echinococcus granulosus (G1 and G3 strains) and E. ortleppi in Southern Brazil // Vet. Parasitol. - 2011. - 177, 1 -2.-P. 97- 103. doi: 10.1016/j.vetpar.2010.11.018.
Deplazes P., Rinaldi L., Alvarez Rojas C. A., Torgerson P. R. et al. Global distribution of alveolar and cystic echinococcosis / Thompson R. C. A., Deplazes P., Lymbery A. J. (Eds.). Echinococcus and Echinococcosis, Part A.-2017.—P. 315-493.
Diesing К. M. Revision der Cephalocotyleen. Abtheilung: Cyclocotyleen // Sitzungsberichte der Akademie der Wissenschaften Wien, mathematisch-naturwissenschaftliche Klasse. - 1863. - 49. - P. 357 - 430.
Dybicz M., Borkowski P. K, Dqbrowska J., Chomicz L. Cases of Echinococcus granulosus sensu stricto isolated from Polish patients: Imported or indigenous? И BioMed Res. Intern. - 2015. - Vol. 2015, Article ID 728321. - 5 pp. http://dx.doi.org/10.1155/2015/728321.
Ecker J., Deplazes P.t Kern P. Alveolar echinococcosis (Echinococcus multilocularis) and neotropical forms of echinococcosis (Echinococcus vogeli and Echinococcus oligathus) II Palmer S. R., Torgerson P. R., Brown D. W. G. (eds). The Oxford Text Book of Zoonoses: Biology, Clinical Practice and Public Health Control. - Oxford Univ. Press, Oxford, UK, 201 l.-P. 669 - 699.
Faust E. C. Human Helminthology. - Third Edition. - Lea & Febiger, Philadelphia, 1949. - P. 317 - 332.
Gardner S. L., Rausch R. L.t Camacho О. C. J. Echinococcus vogeli Rausch and Bernstein, 1972, from the paca, Cuniculus paca L. (Rodentia: Dayproctidae), in the Departamento de Santa Cruz, Bolivia // J. Parasitol. - 1988. - 74, 3. - P. 399 - 402. http://digitalcommons.unl.edu/parasitologyfacpubs/16.
Gottstein B., Hemphill A. Echinococcus multilocularis'. The parasite-host interplay 11 Exp. Parasitol. - 2008. -119, 4.-P. 447-452.
Grenouillet F, Umhang G., Arbez-Gindre F, Mantion G. et aL Echinococcus ortleppi infections in humans and cattle, France//Emerg. Infect. Dis. -2014.-20, 12. -P. 2100-2102. doi.org/10.3201/eid2012.140641.
Guamera E. A., Parra A., Kamenetzky L., Garcia G., Gutierrez A. Cystic echinococcosis in Argentina: evolution of metacestode and clinical expression in various Echinococcus granulosus strains H Acta Trop. -2004.-92, 2.-P. 153 - 159.
Guerra D., Armua-Fernandez M. T, Silva M., Bravo I. et al. Taeniid species of the Iberian wolf (Canis lupus signatus) in Portugal with special focus on Echinococcus spp. 11 Intern. J. Parasitol.: Parasites and Wildlife. -2013.-2.-P. 50-53.
HanX., Wang H, Qiu J., Ma X. et al. Epidemiological study on Echinococcus multilocularis and E. granulosus in Banma County of Qinghai Province // Chin. J. Zoon. - 2006. - 22. - P. 189 - 190. (in Chinese).
Higuita N. I. A., Brunetti E., McClaskey C. Cystic echinococcosis // J. Clin. Microbiol. - 2016. - 54, 3. - P. 518-523.
Hofer S, Gloor S, Muller U., Mathis A, et al. High prevalence of Echinococcus multilocularis in urban red foxes (Vulpes vulpes) and voles (Arivicola terrestris) in the city of Zurich, Switzerland H Parasitology. -2000.-120, 2.-P. 135- 142.
Jabbar A,, Narankhajid M.t Nolan M. J., Jex A. R. et al. A first insight into the genotypes of Echinococcus granulosus from humans in Mongolia // Molecular and Cellular Probes. -2011.-25, 1. - P. 49 - 54.
Kamenetzky L., Gutierrez A. M.t Canova S. G., Haag К L. et al. Several strains of Echinococcus granulosus infect livestock and humans in Argentina // Infect. Genet. Evol. - 2002. - 2, 2. - P. 129- 136.
Kamenetzky L., Muzulin P. M., Gutierrez A. M., Angel S. O, et al. High polymorphism in genes encoding antigen В from human infecting strains of Echinococcus granulosus 11 Parasitology. - 2005. - 131, 8. - P. 805-815.
Kapel С, M., Torgerson P. R., Thompson R. C,, Deplazes P. Reproductive potential of Echinococcus multilocularis in experimentally infected foxes, dogs, raccoon dogs and cats П Int. J. Parasitol. - 2006. - 36, l.-P. 79-86.
Karamon J., Kochanowski M., Sr oka J, Cencek T. et al. The prevalence of Echinococcus multilocularis in red foxes in Poland - current results (2009-2013) И Parasitol Res. - 2014. - 113, 1. - P. 317 - 322. doi: 10.1007/S00436-013-3657-Z
Kini U., ShariffS., Nirmala V. Aspiration cytology of Echinococcus oligarthrus. A case report 11 Acta Cyto-logica. - 1997. - 41. - P. 544 - 548.
Knapp J„ Chirica M., Simonnet C., Grenouillet F. et al. Echinococcus vogeli infection in a hunter, French Guiana//Emerg. Infect. Dis. -2009. - 15, 12.-P. 2029-2931. http://dx.doi.org/10.3201/eidl512.090940.
Knapp J.,Nakao M., Yanagida T, Okamoto M. Phylogenetic relationships with within Echinococcus and Taenia tapeworms (Cestoda: Taeniidae): An inference from nuclear protein-coding genes H Mol. Phyloge-net. Evol. - 2011. - 61. - P. 628 - 638.
Kolar ova L., Mateju J, Hrdy J, Kolarova H. et al. Human alveolar echinococcosis, Czech Republic, 2007 -2014 // Emerg. Infect. Dis. - 2015. - 21, 12. - P. 2263 - 2265.
317
Konyaev S. V., Yanagida T, Ingovatova G. M. et al. Molecular identification of human echinococcosis in the Altai region of Russia// Parasitol. Int. -2012. -61,4. -P. 711 - 714. doi: 10.1016/j.parint.2012.05.009.
Lavikainen A, A taxonomic revision of the Taeniidae Ludwig, 1886 based on molecular phylogenies: Academic dissertation. - University of Helsinki, 2014. - 64 pp.
Leuckart R. Die menschlichen Parasiten und die von ihnen herruhrenden Krankheiten. - Lepzig u. Heidelberg, 1863.-Vol 1.
Li Y. F., Li D. S. An epidemiological study on echinococcosis in Haiyan County // China Academ. J. Electronic. - 2010. - 27. - P. 38 - 39. (In Chinese).
Loper a R. D., Melendez R. D., Fernandez L, Sirit J., Perera M. P. Orbital hydatid cyst of Echinococcus oli-garthrus in a human in Venezuela // J. Parasitol. - 1989. - 75, 3. - P. 467 - 470.
Lopez-Neyra C. R, Soler P. M. A. Revision del genero Echinococcus Rud. Y description de una especie nu£va parasite intestinal del porro en Almeria 11 Rev/ Ibdr. Parasitol. - 1943. - 3. - P. 169 - 194.
Liihe M. Cystotaenien siidamerikanischer Feliden H Zool. Jahrb. - 1910. - Suppl. 12, 3. - P. 687 - 710.
Lymbery A., Jenkins E. J., Schurer J. M., Thompson R. S. A. Echinococcus canadensis, E, borealis, and E. intermedius. What’s in a name? 11 Trends in Parasitology. - 2015a. - 31, 1. - P. 23 - 29. Doi.org./10.1016/ j.pt.2014.11.033.
Lymbery A., Jenkins E. J, Schurer J. M., Thompson R. S. A. Response to Nakao et al. - is Echinococcus intermedius a valid species ? H Trends in Parasitology. - 2015b. - 31, 8. - P. 343 - 344.
Macpherson C. N. L., Craig P. S. Dogs and cestode zoonoses / Macpherson C. N. L., Meslin F. X., Wandeler A. I. (eds). Dogs, Zoonoses and Public Health. - CAB Intern., Wallingford, UK, 2000. - P. 177-212.
Manterola C., Otzen T Molecular epidemiology of cystic echinococcosis: Genotypic characterization in humans and different livestock // Int. J. Morphol. - 2916. - 34, 4. - P. 1472 - 1481.
Marcinkute A., Sarkunas M., Moks E., Saarma U. et al. Echinococcus infections in the Baltic region // Vet. Parasitol. - 2015. - 213, 3-4. - P. 121 - 131.
Marinova L, Spiliotis M., Wang J., Murtarov M. et al. Molecular characterization of Echinococcus granulosus isolates from Bulgarian human cystic echinococcosis patients // Parasitol. Res. - 2017. - 116, 3. - P. 1043- 1054. Doi. 10.1007/s00436-017-5386-1.
McManus D. P. Current status of the genetics and molecular taxonomy of Echinococcus species 11 Parasitology. - 2013. - 140, 13.-P. 1617- 1623. doi: 10.1017/S0031182013000802.
McManus D. P.r Zhang L., Castrodal L. J, Le T H. et al. Short report: molecular genetic characterization of an unusually severe case of hydatid disease in Alaska caused by the cervid strain of Echinococcus granulosus // Am. J. Trop. Med. Hyg. - 2002. - 67, 3. - P. 296 - 298.
Melendez, R. D., Yepez M. S, Coronado A. Echinococcus oligarthrus cysts of rabbits in Venezuela // J. Parasitol. - 1984. - 70, 6. - P. 1004 - 1005.
Mogoye В. K., Menezes C. N, Wong M. L, et al. First insights into species and genotypes of Echinococcus in South Africa // Vet. Parasitol. - 2013. - 196, 3-4. - P. 427 - 432.
Moks E., Jogisalu L, Valdmann H., Saarma U. First report of Echinococcus granulosus G8 in Eurasia and a reappraisal of the phylogenetic relationships of “genotypes” G5-G10 11 Parasitology. -2008. - 135, 5. -P. 647 - 654.
Monnig H. O. Veterinary helminthology and entomology. The diseases of domesticated animals caused by helminth and arthropod parasites. - London, 1934. - P. 125 - 130.
Moro P. L, Nakao M., Ito A., Shantz P. M. et al. Molecular identification of Echinococcus isolates from Peru //Parasitol. Int. -2009. -58, 2. -P. 184-186. doi: 10.1016/j.parint.2009.01.005.
Moro P., Schantz P. M. Echinococcosis: a review // Int. J. Infect. Dis. - 2009. - 13, 2. - P. 125 - 133. DOI: http://dx.doi.Org/10.1016/j.ijid.2008.03.037.
Muller R. Worms and Human Diseases - with contributions and chapter on immunology from D. Wakelin. -2nd Ed. - CABI Publ., 2002. - P. 85 - 97.
Mwambete K. D., Ponce-Gordo F, Cuesta-Bandera C. 2004. Genetic identification and host range of the Spanish strains of Echinococcus granulosus 11 Acta Trop. - 2004. - 91, 1. - P. 87 - 93.
Nahorski W. L., Knap J. P., Pawlowski Z. S., Krawczyk M. et al. Human alveolar echinococcosis in Poland: 1990-2011 //PLoS Negl. Trop. Dis. -2013. - 7, 1: el986. doi: 10.137l/joumal.pntd.0001986.
Nakao M., Lavikainen A., Hoberg E. Is Echinococcus intermedius a valid species? // Trends in Parasitology. -2015.-31, 8.-P. 342-343.
Nakao M„ Lavikainen A., Yanagida T, Ito A. Phylogenetic systematics of the genus Echinococcus (Cestoda: Taeniidae)//Int. J. Parasitol.-2013.-43, 12- 13.-P. 1017-1029. doi: 10.1016/j.ijpara.2013.06.002.
Nakao M., McManus D. P., Schantz P. M. et al. A molecular phylogeny of the genus Echinococcus inferred from complete mitochondrial genomes И Parasitology. - 2006. - 134, 5. - P. 713 - 722.
318
Narankhajid M., Bolormaa V., Sayamaa S., Ito A. et al. The study of distribution of Echinococcus granulosus in Ulaanbaatar // Inter. Fed. Med. Biol. Eng. - IFMBE Proceeding. Sun I. Kim, Tae Suk Suh (Eds.). -2006. - 14/1, Track 03. - P. 229 - 233.
Ortlepp R . J. Echinococcus in dogs from Pretoria and vicinity I I Onderstepoort J. Vet. Sci. - 1934. - 3, 1. -P. 97- 108.
Pawlowski Z., Eckert J., Vuitton D. A., Ammann R. IV. et al. Echinococcosis in humans: clinical aspects, diagnosis and treatment I J. Eckert, M. A. Gemmell, F. X. Meslin, Z. Pawlowski (Eds.). WHO/OIE Manual on Echinococcosis in humans and animals. - Office International des Epizooties, Paris, 2001. - P. 20-71.
Pednekar R. P., Gatne M. L., Thompsom R. C. A., Traub R. J. Molecular and morphological characterisation of Echinococcus from food producing animals in India // Vet. Parasitol. - 2009. - 165, 1 - 2. - P. 58 - 65.
Raimkylov К. M., Kuttubaev О. T, Toigombaeva V S. Epidemiological analysis of the distribution of cystic and alveolar echinococcosis in Osh Oblast in the Kyrgyz Republic, 2000 - 2013 // J. HelminthoL - 2015. -89, 6. -P. 651 -654. doi: 10.1017/S0022149X15000565...
Rausch R. L. Family Taeniidae Ludwig, 1886 I Khalil L. F., Jones A., Bray R. A. (eds.). Keys to the cestode parasites of vertebrates. - Wallingford, UK: CAB Int., 1994. - P. 665 - 672.
Rausch R. L. Life cycle patterns and geographic distribution of Echinococcus species I Echinococcus and Hydatid Disease. - Eds. R. C.A. Thompson, A. J. Lymbery. - Wallingford, UK: CABI, 1995. - P. 89 - 134.
Rausch R. L., Bernstein J. J. Echinococcus vogeli sp. n. (Cestoda: Taeniidae) from the bush dog, Speothos venaticus (Lund) // Zeitschr. Tropenmed. Parasitol. - 1972. - 23, 1. - P. 25 - 34.
Rausch R. L., D'Alessandro A., Rausch V. R. Characteristics of the larval Echinococcus vogeli Rausch and Bernstein, 1972 in the natural intermediate host, the paca, Cuniculus paca L. (Rodentia: Dasyproctidae) П Ann. Trop. Med. Parasitol. - 1981. -30, 5. -P. 1043 - 1052.
Rausch R. L., Fay F.H., Williamson F. S. The ecology of Echinococcus multilocularis (Cestoda: Taeniidae) on St. Lawrence Island, Alaska. II. 11 Ann. Parasitol. Hum. Comp. - 1990. - 65, 3. - P. 131-140.
Rausch R. L., Nelson G. S. A review of the genus Echinococcus Rudolphi, 1801 11 Ann. Trop. Med. Parasitol. -1963.-57, 2.-P. 127- 135.
Roeder er J. G. Zwc\ Gattungen von Fasciolids (Secretary’s abstract.) // Gottingen Anz. gelehrt. Sachen (1761 -62).-1762.-2, 19.
Rodrigues-Silva R., Peixoto J. R., de Oliveira R. M., Magalhdes Pinto R.t Gomes D. C. An autochthonous case of Echinococcus vogeli Rausch & Bernstein, 1972 polycystic echinococcosis in the state of Rondonia, Brazil II Mem. Inst. Oswaldo Cruz. - 2002. - 97, 1. - P. 123 - 126.
Rodriguez-Prado U., Jimenez-Gonzalez D. E., Avila G. et al. Genetic variation of Echinococcus canadensis (G7) in Mexico // Am. J. Trop. Med. Hyg. - 2014. - 91, 6. - P. 1149 - 1153. doi: 10.4269/ajtmh. 14-0317.
Romig T, Ebi D., Wassermann M. Taxonomy and molecular epidemiology of Echinococcus granulosus sensu lato //Vet. Parasitol. -2015. -213, 3^1. -P. 76-84. doi.org/10.1016/j.vetpar.2015.07.035.
Rozenzvit M. C., Zhang L. H., Kamenetzky L.t Canova S. G. et al. Genetic variation and epidemiology of Echinococcus granulosus in Argentina // Parasitology. - 1999. - 118. - P. 523 - 530.
Sahni J. K, Jain M., Bajaj Y., Kumar V., Jain A. Submandibular hydatid cyst caused by Echinococcus oligarthrus // J. Laryngol. Otol. - 2000. - 114, 6. - P. 473 - 476.
Schneider R.t Gollackner B., Schindl M. et al. Echinococcus canadensis G7 (pig strain): an underestimated cause of cystic echinococcosis in Austria // Am. J. Trop. Med. Hyg. - 2010; - 82, 5. - P. 871 - 874.
Schurer J., Shury T, Leighton F., Jenkins E. Surveillance for Echinococcus canadensis genotypes in Canadian ungulates 11 Int. J. Parasitol.: Parasites and Wildlife. - 2013. - 2. - P. 97 - 101. doi.org/10.1016 /j.ijppaw.2013.02.004.
Schweiger A. Human alveolar echinococcosis after fox population increase, Switzerland П Emerg. Infect. Dis. - 2007. - 13, 6. - P. 878 - 882. doi: 10.3201 /eidl306.061074.
Snabel V, Altintas N., DAmelia S. et al. Cystic echinococcosis in Turkey: genetic variability and first record of the pig strain (G7) in the country // Parasitol. Res. - 2009. - 105, l.-P. 145- 154.
Somocurcio J. R, Sanchez E. L., Ndquira C, Schilder J. et al. First report of a human case of polycystic echinococcosis due to Echinococcus vogeli from neotropical area of Peru, South America // Rev. Inst. Med. Trop. Sao Paulo. - 2004. - 46, 1. - P. 41 - 42.
Sousa О. E. Development of adult Echinococcus oligarthrus from hydatids of naturally infected agoutis // J. Parasitol. - 1970. - 56, 1. - P. 197 - 198.
Sousa О. E, Thatcher V. E. Observations on the life-cycle of Echinococcus oligarthrus (Diesing, 1863) in the Republic of Panama// Ann. Trop. Med. Parasitol. - 1969. -63, 2. -P. 165 - 175.
Sreter T, Szell Z., Sreter-Lancz Z., Varga I. Echinococcus multilocularis in Northern Hungary // Emerg. Infect. Dis. - 2004. - 10, 7. - P. 1344- 1346. doi: 10.3201/eidl007.031027
319
Stijnis C, Bart A., Brosens L., Van Gool T. et al. First case of Echinococcus vogeli infection imported to the Netherlands, January 2013 11 Euro Surveill. - 2013. - 18, 15: pii=20448. http://www.eurosurveillance. org/ViewArticle.aspx?ArticleId=20448.
Sweatman G. K.t Williams J. F. Comparative studies on the biology and morphology of Echinococcus granulosus from domestic livestock, moose and reindeer 11 Parasitology. - 1963. - 53. - P. 493 - 514.
Thompson R. C. A., Boxell A. C., Ralston B. J., Constantine С. C. et al. Molecular and morphological characterization of Echinococcus in cervids from North America // Parasitology. - 2006. - 132, 5. - P. 439 - 447.
Thompson Л C. A., McManus D. P. Chapter 1. Aetiology: Parasites and life-cycles I WHO/OIE Manual on echinococcosis in human and animals. - Office International des Epizooties, Paris, 2001. - P. 1 — 19.
Torgerson P. R. Helminth-Cestode: Echinococcus granulosus and Echinococcus mutilocularis I Motaijemi Y. Encyclopedia of Food Safety. - Waltham, MA: Elsevier, 2014. - P. 63 - 69. doi.org/10.1016/B978-0-12-378612-8.00147-5.
Torgerson P. R., Budke С. M. Echinococcosis - an international public health challenge // Res. Vet. Sci. -2003.-74, 3.-P. 191 -202.
Torgerson P. R.t Keller K.t Magnotta M., Ragland N, The global burden of alveolar echinococcosis // PLoS Negl. Trop. Dis. - 2010. - 4, 6: e722. 10.1371/joumal.pntd.0000722.
Usubalieva J., Minbaeva G.t Ziadinov I., Deplazes P., Torgerson P. R. Human alveolar echinococcosis in Kyrgyzstan // Emerg. Infect. Dis. - 2013. - 19, 7. - P. 1095 - 1097. doi: 10.3201 /eid 1907.121405.
Verster A. J. M. Review of Echinococcus species in South Africa 11 Onderstepoort J. Vet. Med. - 1965. - 32, 1.-P.7-118.
Virchow R. Die multiloculSre, ulcerirende Echinokokkengeschwulst der Leber П Verhandlungen der Physica-lisch-Medicinischen Gesellschaft Wurzburg. - 1855. - P. 84 - 95.
Vizcaychipi K. A., Helou M., DeMatteo K, Macchiaroli N. et al. Primera identificacidn de Echinococcus vogeli en una paca en la provincial de Misiones, Argentina // Rev. Argent. Microbiol. - 2013. - 45, 3. - P. 169- 173.
Wahlstrom H, Enemark H. L., Davidson R. K., Oksanen A. Present status, actions taken and future considerations due to the findings of E. multilocularis in two Scandinavian countries // Vet. Parasitol. - 2015. - 213, 3-4.-P. 172-181. doi: 10.1016/j.vetpar.2015.07.037.
Wang H, Zhang J. X., Schantz P. M., Ito A. et al. Epidemiologic survey and analysis on echinococcosis in humans and animals from 1995 to 2005 in Qinghai Province I I Chin. J. Zoon. - 2006. - 22. - P. 1129 -1134. (In Chinese, with English summaiy).
Yang D., Zhang T, Zeng Z., Zhao W. et al. The first report of human-derived G10 genotype of Echinococcus canadensis in China and possible sources and routes of transmission // Parasitol. Int. -2015. - 64, 5. - P. 330-333. doi: 10.1016/j.parint.2015.05.001.
Yimam A. E., Nonaka N,, Oku Y.t Kamiya M. Prevalence and intensity of Echinococcus multilocularis in red foxes {Vulpes vulpes schrencki) and raccoon dogs {Nyctereutesprocyonoides albus) in Otaru City, Hokkaido, Japan I I Jpn. J. Vet. Res. - 2002. - 49, 4. - P. 287 - 296.
Zait H., Kouidri M., Grenouillet F. E, Umhang G. et al. Molecular characterization of Echinococcus granulosus sensu stricto and Echinococcus canadensis in humans and livestock from Algeria // Parasitol. Res. -2016.-115, 6.-P. 2423-2431. doi: 10.1007/s00436-016-4994-5.
Zhang J. X, Wang H, Epidemiological survey on Echinococcus infection in animals in Qinghai Province H Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. - 2007. - 25, 4. - P. 350 - 352. (In Chinese, with English summary).
Zhang L„ Eslami A., Hosseini S. H., McManus D. P. Indication of the presence of two distinct strains of Echinococcus granulosus in Iran by mitochondrial DNA markers // Am. J. Trop. Med. Hyg. - 1998. - 59, l.-P. 171-174.
Zhang T, Yang D., Zeng Z. et al. Genetic characterization of human-derived hydatid cysts of Echinococcus granulosus sensu lato in Heilongjiang Province and the first report of G7 genotype of E. canadensis in humans in China // PLoS ONE. - 2014. - 9, 10, Article ID el09059.
Zhang X. Q., Wanma D. Z. Study on the prevalence of echinococcosis in yaks at Tianjun County, China П Chin. J. Anim. Health Inspection. - 2007. - 24. - P. 36 (in Chinese).
Zheng H., Zhang W., Zhang L., Zhang Z. et al. The genome of the hydatid tapeworm Echinococcus granulosus//^. Genet.-2013.-45, 10.-P. 1168- 1175. doi: 10.1038/ng.2757.
Zhang L. H., Gasser R. B., Zhu X, McManus D. P. Screening for different genotypes of Echinococcus granulosus within China and Argentina by single-strand conformation polymorphism (SSCP) analysis // Trans, roy. Soc.trop. Med. Hyg. - 1999. - 93, 3. - P. 329 - 334.
320
Род Hydatigera Lamarck, 1816
Синоним: Reditaenia Sambon, 1924
Долгие десятилетия род Hydatigera многие исследователи рассматривали синонимом рода Taenia, куда первоначально и был отнесён вид Taenia taeniaeformis Batsch, 1786, ставший впоследствии типовым в роде Hydatigera. Несмотря на то, что в монографии К. И. Абуладзе (1964) данный род вместе со своим типовым видом фигурирует как самостоятельный, многими специалистами второй половины 20 - начала 21-го столетий валидность данного рода не признавалась (Bowman et aL, 2002; Verster, 1969; Wilcox et al., 2009). И лишь несколько лет назад в результате тщательного молекулярно-филогенетического анализа всех ныне существующих тениид самостоятельность Hydatigera была восстановлена (Nakao et al., 2013).
Описание (по: Абуладзе, 1964; Lavikainen, 2014; Rausch, 1994). Стробила от маленьких до средних размеров, с многочисленными проглоттидами. У незрелых и гермафродитных члеников ширина больше длины, маточные проглоттиды удлинённой формы. Хоботок сколекса с двумя рядами крупных крючьев. Выраженная шейка отсутствует. Половые поры неправильно чередующиеся, открываются посередине бокового края членика. Терминальные половые протоки проходят вдоль продольных экскреторных каналов вентрально. Семенники многочисленные, располагаются в основном впереди и сбоку женских половых органов, могут сливаться позади желточника. Яичник двудольчатый. Желточник поперечно-удлинённый, находится позади яичника. Матка в виде медианного продольного ствола; зрелая матка с несколькими боковыми ветвями, часто вторично ветвящимися. Взрослые формы - паразиты хищных млекопитающих, преимущественно кошачьих. Метацестоды построены по типу стробилоцерка. Типовой вид - Hydatigera taeniaeformis (Batsch, 1786) Lamarck, 1816.
Род очень немногочисленный и объединяет всего 4 вида (Lavikainen, 2014; Lavikainen et al., 2016). У людей иногда находят один вид - Н taeniaeformis.
Hydatigera taeniaeformis (Batsch, 1786) Lamarck, 1816 (=Taenia taeniaeformis Batsch, 1786; =Cysticercus fasciolaris Rudolphi, 1808; =Taenia infantis Bacigalupo, 1922; =Multiceps longihamatus Morishita et Sawada, 1966; =Hydatigera himalayotaenia Malhotra et Capoor, 1982) (рис. 174 - 177). Видовое название - taeniaeformis от латинских taenia - лента и formis - форма; Hydatigera taeniaeformis можно перевести
как гидатигера лентовидная.
Рис. 174 Hydatigera taeniaeformis, общий вид стробилы (из: www.biolib.cz)
Рис. 175 Hydatigera taeniaeformis, яйцо (из: Bowman et al., 2002)
321
Рис. 176 Hydatigera taeniaeformis', 1-2-гермафродитные членики; 3 - часть незрелого членика;
4 - бурса цирруса и вагина; 5 - зрелый членик (из; Абуладзе, 1964)
Рис. 177 Hydatigera taeniaeformis'. А -половой атриум; Б - крючья хоботка взрослой особи (из: Verster, 1969)
Описание (по: Hall, 1910; Lavikainen et al., 2016; Verster, 1969). Белые цестоды с плотным телом. Стробила длиной 15-60 см, при максимальной ширине 5 -6.3 мм. Сколекс цилиндрический, 1.7 мм толщины. Сильно выступающие присоски 0.29 - 0.49 мм, располагаются под углом, направленным вперёд. Хоботок короткий, 0.546 - 0.818 мм, с двойной короной крючьев в количестве от 26 до 52, но обычно 36 - 42. Крючья 1-го ряда длиной 0.370 - 0.467 мм; их лезвие довольно сильно изогнуто, рукоятка в основном прямая, за исключением дистального конца, где она загибается дорсально; в месте соединения рукоятки с лезвием имеется расширение. Крючья 2-го ряда 0.219 - 0.281 мм длины, лезвие умеренно изогнуто; рукоятка прямая, с незначительным расширением на дистальном конце, загнутом кзади; корневой отросток имеет расширение сзади места его прикрепления, образуя шейку
322
между расширением и прикреплением, и оканчивается коническим дистальным образованием. Члеников более 200. Первый членик имеет ту же ширину, что и сколекс, или даже шире его, терминальные проглоттиды достигают в длину 8 - 10 и ширину 5-6 мм. Известковые тельца многочисленные, овальной формы. Половые сосочки слабо выражены, располагаются непосредственно или слегка впереди середины бокового края членика. Многочисленные семенники (450 - 500) круглой или овальной формы, тесно прилегают друг к другу, расположены в два слоя в боковых краях среднего поля членика, ближе к экскреторным каналам. Семенники оставляют свободное пространство по бокам от медианного ствола матки, доходят до яичника, соприкасаясь с ним, позади желточника не сливаются. Семяпровод образует многочисленные петли в виде густых тесно сближенных колец. Половая бурса тонкая и часто изогнутая. Яичник компактный, двухлопастный. Желточник лежит между лопастями яичника и соприкасается с его задними краями. Тельце Мелиса слабо выражено, обычно прикрыто или яичником, или желточником. Вагина у соединения с половым синусом обычно загибается или даже образует заметную петлю, направленную к задней части членика, и окружена хорошо развитым сфинктером диаметром 55 - 69 |im. От сфинктера вагина идет параллельно бурсе цирруса и семяпроводу, а затем загибается вокруг ближайшей доли яичника. Средний ствол матки начинает образовывать две боковых ветви уже в гермафродитных члениках, по одной с каждой стороны у переднего конца членика; сзади них образуются другие ветви, затем добавляются новые, всего по 5 - 12 с каждой стороны. Яйца округлые, диаметром 26 - 33 х 23 - 33 (в среднем 28 х 27) pm (Lavikainen et al., 2016).
Дефинитивные хозяева Н. taeniaeformis - кошки, у которых черви поселяются в первой половине тонкого кишечника и которые заражены этой цестодой практически повсеместно. Эта приуроченность к кошкам отразилась и в названии паразита, которого нарекли цепнем кошачьим (cat tapeworm). В 2010 г. появилась информации об обнаружении этой цестоды у леопарда переднеазиатского в Иране (Esfandiari, Youssefi, 2010), а в 2015-м - у волка на севере Италии в Лигурии (Gori et al., 2015). Что касается паразитирования данного вида у волка, то некоторые исследователи полагают, что Н. taeniaeformis из стран средиземноморского региона следует тщательно изучить на предмет его возможной принадлежности к иному, хотя и близкому виду (Lavikainen et al., 2016).
Цикл развития Н. taeniaeformis протекает следующим образом (Абуладзе, 1964; Чеснокова, 1983; Bowman et al., 2002; Williams, Shearer, 1981). Отдельные зрелые проглоттиды, а также яйца цестоды попадают во внешнюю среду с фекалиями животного; кроме того, зрелые членики способны самостоятельно выползать из анального отверстия кошки и передвигаться рядом с животным или близ его ануса. Ежедневно может выделяться 3-4 членика, в каждом из которых насчитывается в среднем 1606 (± 492) яиц (Williams, Shearer, 1981). Максимальное количество яиц, которое насчитали исследователи в одном членике, составило 12800, но более 60 % члеников содержали 500 яиц или меньше. Проглоттиды и/или яйца заглатываются промежуточными хозяевами - мышами и крысами с кормом или водой. В их кишечнике под действием пищеварительных соков онкосфера выходит из яйца, проникает в кровеносные сосуды и гематогенным путем заносится в печень. Здесь личинка оседает в капиллярах между периферией и центром печёночной дольки, приобретая форму многоклеточного шаровидного образования. В течение
323
первых дней рост личинок происходит очень быстро, так что уже к шестому дню их можно заметить невооружённым глазом в виде светлых прозрачных точек, выступающих на тёмном фоне поверхности печени. Типичная пролиферация клеток хозяина начинается на 8 - 10-й день и достигает максимальной активности на 15 -20-й день, после чего активные процессы постепенно затухают. Вокруг паразита формируется капсула из одного - двух рядов фибробластов. Образованная таким образом киста продолжает расти и выступает подобно пузырьку над поверхностью печени. С 30-го дня инвазии у цистицерка обнаруживается ввёрнутый внутрь сколекс с присосками и крючьями, начинающий выворачиваться наружу. С этого времени в капсуле обосабливаются два слоя, которые на 50-й день чётко разделяются на наружный, состоящий из рыхлой соединительной ткани, и внутренний - из более зрелой соединительной ткани. Сколекс полностью выворачивается и оказывается связанным с пузырём короткой тонкой шейкой. В последующие сроки пузырь постепенно уменьшается и редуцируется, тело паразита растёт, в нём появляется ложная стробиляция. По мере роста паразита структура капсулы не изменяется, а её толщина остаётся неизменной - 0.139 - 0190 мм (Чеснокова, 1983). Формирование инвазионного стробилоцерка завершается в среднем через два месяца (Singh, Rao, 1965). В организме окончательного хозяина - кошки от момента заражения и до появления первых яиц цепня проходит от 32 до 80 дней, а продолжительность жизни паразита колеблется от 7 месяцев до трёх лет (Williams, Sheareer, 1981).
Личинки, которые по каким-либо причинам не могут развиваться дальше, не вызывают описанной выше клеточной пролиферации, вскоре погибают и замещаются рубцовой тканью.
Личиночная стадия Н. taeniaeformis, так называемый стробилоцерк, известна под названием Strobilocercus fasciolaris (рис. 178). Стробилоцерк характеризует-ся хорошо выраженным сколексом с отходящей от него длинной ложночленистой стробилой, заканчивающейся на заднем конце небольшим пузырьком, наполненным жидко-Д стью. В паренхиме стробилы имеется множество известковых телец. Стробилоцерки достигают 20 см длины, при ши-| рине 0.3 - 0.5 мм. Хоботок с четырьмя хорошо выраженными крупными присосками и крючьями, чьи размеры и фор-Ч ма практически соответствуют таковым ленточной стадии.
Рис. 178 Hydatigera taeniaeformis, стробилоцерк (на срезе хорошо видны две присоски на переднем конце) (из: Bowman et al., 2002)
Есть мнение, что Н. taeniaeformis возник в Азии, но параллельно с расселением домашней кошки постепенно распространился по всему земному шару (Lavikainen et al., 2016). Его встречаемость у кошек в разных регионах заметно отличается, что зависит от множества абиотических и биотических факторов, и, прежде всего, от наличия и численности промежуточного хозяина -различных грызунов. К примеру, У. Хатчисон (Hutchison, 1957), обследовавший кошек в одном из городов в Шотландии, выявил эту цестоду у 7.7 % животных из 132; при этом у 47.7 % особей из числа инвазированных обнаружился только один червь, у 25.7 % - по 2 - 3, а у остальных — от 4 до 23 экз. В Ширазе (Иран) уличные кошки были заражены на 12.3 % (Zibaei et al., 2007), а в нижнем Египте в дельте
324
Нила - на 22 % (Khalafalla, 2011). Тем не менее, известны случаи 40 - 50 и даже 100 % заражённости кошек, чаще всего, диких (см.: Dvofakova, Prokopid, 1984).
Высокая численность взрослых особей цестоды в кишечнике кошки может иметь негативные последствия для здоровья животного. Не так давно в Австралии зафиксирован случай острой кишечной непроходимости у короткошерстной домашней кошки, вызванной инвазией гидатигерой, сопровождающейся рвотой, вялостью, отсутствием аппетита, одышкой (Wilcox et al., 2009).
Заражённость грызунов стробилоцерками паразита также не проходит бесследно для них. В экспериментах с мышами было показано, что соматические белковые продукты Н taeniaformis обладают кариопатическим действием, вызывая угнетение деления клеток красного костного мозга и снижая активность мейоза в семенниках животных, с максимумом повреждений через 48 - 72 ч после их внутрибрюшинного введения (Сивкова, 2010).
В 1980-е годы в Южной Богемии имела место массовая гибель ондатры, причиной которой стала её инвазии гидатигерой (Dvofakova, Prokopid, 1984). У погибших животных печень была сплошь покрыта кистами числом от 10 до 20, имевших размеры от боба до грецкого ореха, в каждой из которых находился стро-билоцерк длиной от 4 до 12 см.
Что касается случаев регистрации Н. taeniaeformis^ как взрослых, так и личиночных форм, у человека, то они чрезвычайно редки и носят явно случайный характер.
Первое сообщение об обнаружении взрослого червя в кишечнике человека опубликовано ещё в 1922 г.: тогда инвазию выявили у 5-летнего мальчика из Буэнос-Айреса (Аргентина); паразит был описан под названием Taenia infantis (Baci-galupo, 1922).
В 1960-е годы появились сообщения о регистрации взрослых цестод Н, taeniaeformis у двух девочек 3-х и 4 лет и у 5 5-летней женщины в Японии, причём у трёхлетней девочки обнаружилось 3 цестоды (цит. по: Bowman et al., 2002). Найти первоисточники мне не удалось, а потому и пришлось ограничиться ссылкой на авторов, откуда почерпнута эта информация.
И, наконец, единственный случай обнаружения стробилоцерка у человека имел место в Пльзени (StSrba, Barus, 1976). Сферическая киста, содержащая свёрнутую личинку цестоды, была выявлена при аутопсии 77:летнего мужчины, скончавшегося, однако, не в результате инвазии этим паразитом.
Каким образом произошло заражение людей, в том числе детей, во всех перечисленных выше случаях, можно только догадываться.
Цитируемая литература
Абуладзе К. И. Тениаты - ленточные гельминты животных и человека и вызываемые ими заболевания // Основы цестодологии. - Под ред. акад. К. И. Скрябина. - М.: Наука, 1964. - 4. - С. 43 - С. 239 -257.
Сивкова Т. Н. Кариопатические и патоморфологические изменения под действием продуктов метаболизма паразитов и влияние на репродуктивную функцию домашних плотоядных: автореф. дисс... докт. биол. наук . - 03.00.11 - паразитология. - М., 2010. - 47 с.
Чеснокова М. В. Морфологические и функциональные особенности фибробластов и эндотелия капилляров капсулы цистицерка (стробилоцерка) Hydatigera taeniaeformis (Batsch, 1786) Lamarck, 1816 в печени белых крыс: дисс...канд. биол. наук. - 03.00.19. - Л., 1983. - 164 с.
Bacigalupo J. Sobre una nueva especie de Taenia, Taenia infantis // Semana Med. - 1922. - 26. - P. 726.
325
Bowman D. D., Hendrix C. M.t Lindsay D. S., Barr S. C. Feline Clinical Parasitology. - Iowa State Press, 2002.-P. 219-225.
Dvordkova L., Prokopic J. Hydatigera taeniaeformis (Batsch, 1786) as the case of mass deaths of muskrats // Folia Parasitol. - 1984. - 31. - P. 127 - 131.
Esfandiari B., Youssef M. R. First report of Taenia taeniaeformis in Persian leopard (Panthera pardus sax-icolor) in Iran 11 Pak. Vet. J. - 2010. - 30, 4. - P. 253 - 254.
Gori F., Armua-Fernandez M. T, Milanesi P„ Seraflni M. et al. The occurrence of taeniids of wolves in Liguria (northern Italy) // Int. J. Parasitol.: Parasites and Wildlife. - 2015. - 4. - P. 252 - 255.
Hall M. C. The gid parasite and allied species of the genus Multiceps. I. Historical review. - Bureau of Animal Industry. U. S. Dept. Agric. - 1910. - Bull. 125. - 68 pp.
Hutchison W. M. The incidence and distribution of Hydatigera taeniaeformis and other intestinal helminths in Scottish cats // J. Parasitol. - 1957. - 43, 3. - P. 318 - 321.
Khalafalla R. E. A survey study on gastrointestinal parasites of stray cats in northern region of Nile Delta, Egypt //PLoS One.-2011. -6, 7: e20283. doi: 10.1371/journal.pone.0020283.
Lavikainen A. A taxonomic revision of the Taeniidae Ludwig, 1886 based on molecular phylogenies: Academic dissertation. - University of Helsinki, 2014. - 64 pp.
Lavikainen A., Iwaki T, Haukisalmi V., Konyaev S. V. et al. Reappraisal of Hydatigera taeniaeformis (Batsch, 1786) (Cestoda: Taeniidae) sensu lato with description of Hydatigera kamiyai n. sp. // Int. J. Parasitol. -2016.-46, 5-6.-P. 361 -37.4. doi.org/10/1016/j.ijpara.2016.01.009.
Nakao M, Lavikainen A., Iwaki T, Haukisalmi V. et al. Molecular phylogeny of the genus Taenia (Cestoda: Taeniidae): Proposals for the resurrection of Hydatigera Lamarck, 1816 and the creation of a new genus Versteria // Int. J. Parasitol. - 2013. - 43. - P. 427 - 437. doi.org/10/1016/j.ijpara.2012.11.014.
Rausch R. L. Family Taeniidae Ludwig, 1886 / Khalil L. F., Jones A., Bray R. A. (eds.). Keys to the cestode parasites of vertebrates. - CAB Int., Wallingford, 1994. - P. 665 - 672.
Singh В. B., Rao В. V. Some biological studies on Taenia taeniaeformis // Ind. J. Helminthol. - 1965. - 18. -P. 151-160.
Sterba J., Barus V. First record of Strobilocercus fasciolaris (Taeniidae - larvae) in man П Folia Parasitol. (Praha). - 1976. - 23, 3. - P. 221 - 226.
Verster A. A taxonomic revision of the genus Taenia Linnaeus, 1758, s. str. // Onderstepoort J. Vet. Res. -1969.-36, l.-P. 3-58.
Wilcox R. S, Bowman D. D., Barr S. C., Euclid J. M. Intestinal obstruction caused by Taenia taeniaeformis infection in a cat H J. Am. Anim. Hosp. Assoc. - 2009. - 45, 2. - P. 93 - 96.
Williams J. F.t Shearer A. M. Longevity and productivity of Taenia taeniaeformis in cats 11 Am. J. Vet. Res. -1981.-42, 12.-P. 2182-2183.
Zibaei M, Sadjjadi S. M.t Sarkari B. Prevalence of Toxocara cati and other intestinal helminths in stray cats in Shiraz, Iran // Trop. Biomed. - 2007. - 24, 2. - P. 39 - 43.
Итак. Семейство Taeniidae - немногочисленное по числу входящих в него родов и видов, тем не менее, относится к группе цестод, имеющих серьёзное медицинское, ветеринарное и социально-экономическое значение. К настоящему времени у людей зарегистрированы 10 видов рода Taenia, 8 видов рода Echinococcus и 1 вид Hydatigera - итого 19 видов тениид. Однако не исключено, что перечень опасных для человека тениид перечисленными видами может не исчерпываться. Переисследо-вания многих представителей данного семейства с применением новых методологических подходов, предпринимаемые в последние годы, наглядно иллюстрируют, сколь далека от совершенства существующая систематика этой группы (Lavikainen et al., 2016; McManus, 2006; Xiao et al., 2009). Примеры сказанного многократно приводились при описании того или иного рода / вида тениид.
Более того, аналитический обзор тениид, результаты которого приведены выше, даже на современном уровне наших знаний, позволил внести уточнения в список регистрируемых у человека цестод, приводимый в справочноинформационной сводке «Медицинская гельминтология. Полный перечень из 384 гельминтов...» (www.worms-info.ru/Cestoda). В названном источнике в качестве паразитов человека перечислено 13 видов и 1 подвид тениид, при этом среди них
326
указывается род Multiceps, в настоящее время отнесённый к синонимам рода Taenia, но отсутствует род Hydatigera, чья самостоятельность восстановлена всего год назад.
Тенииды - одна из немногих групп цестод, чьих представителей можно обнаружить практически по всему земному шару (Lavikainen, 2014). Во многом это обусловено их тесной связью с человеком, как с биологическим объектом, а также с его хозяйственной деятельностью в области животноводства и разведения домашних животных, прежде всео, кошек и собак. Например, высокая заражённость местного населения провинции Цинхай в Тибетском О А Китая эхиноккоками (£. granulosus выявлен у 6.1% и Е. multilocularis - у 5.1% обследованных пациентов) связана с их кочевым образом жизни. В этом регионе разводят яков и овец, хорошо адаптированных к жизни на высокогорье, а для их охраны на пастбищах держат собак. Известно, что и домашние собаки, и крупный рогатый скот, и овцы участвуют в жизненном цикле Е. granulosus, одни - как дефинитивные, другие - как промежуточные хозяева паразита. К тому же, собаки, поедающие на пастбищах различных гразунов, заражаются через них Е. multilocularis. Всё вместе взятое и объясняет встречаемость обоих видов эхиноккоков у кочевников Тибета (Han et al., 2006).
О приуроченности того или иного вида тениид к сельскохозяйственным и домашним животным, в одних случаях как к промежуточным, в других как окончательным хозяевам, свидетельствуют даже их названия, например, цепень свиной (Taenia solium), цепень, бычий (Taenia saginata), цепень кошачий (Hydatigera taeniaeformis) и т.д. В частности именно с расселением кошек по странам и континентам связывают массовое распространение их специфичного паразита - Hydatigera taeniaeformis (Lavikainen et al., 2016).
Несмотря на то, что для подавляющего большинства тениид попадание их личинок к человеку является, по сути, тупиком для паразита, для двух видов тений - Т. solium и Т. saginata - человек служит окончательным хозяином. Более того, как мы видим, Т. solium вообще способен завершить жизненный цикл, не попадая во внешнюю среду и без участия дополнительного хозяина
Литература, посвящённая различным аспектам жизнедятельности тениид, их эпидемиологическому значению и распространению на планете, необычайно обширна и насчитывает сотни монографий, тысячи статей, и десятки диссертационных разработок, в том числе и в России. В данном случае я была вынуждена ограничиться лишь небольшой их частью.
Цитируемая литература
Lavikainen A. A taxonomic revision of the Taeniidae Ludwig, 1886 based on molecular phylogenies: Academic dissertation. - University of Helsinki, 2014. - 64 pp.
Lavikainen A., Iwaki T., Haukisalmi V., Konyaev S. V. et al. Reappraisal of Hydatigera taeniaeformis (Batsch, 1786) (Cestoda: Taeniidae) sensu lato with description of Hydatigera kamiyai n. sp. // Int. J. Parasitol. -2016.-46, 5 -6. -P. 361 -374. doi.org/10/1016/j.ijpara.2016.01.009.
McManus D. P. Molecular discrimination of taeniid cestodes // Parasitol. Int. - 2006. - 55, Suppl. - P. 31 - 37. Han X., Wang H, Qiu J., Ma X. et al. Epidemiological study on Echinococcus multilocularis and E. granulosus in Banma County of Qinghai Province // Chin. J. Zoon. - 2006. - 22. - P. 189 - 190. (in Chinese).
Xiao N., Qiu J., Nakao M., Li T., Yang W. et al. Echinococcus shiquicus, a new species from the Qinghai-Tibet plateau region of China: Discovery and epidemiological implications // Parasitol. Int - 2006. - 55 (Suppl.).-P. 233-236.
327
Семейство Tentaculariidae Poche, 1926
Синонимы (по: bug.tamu.edu/research/collection/hallan):
Nybelinidae Poche, 1926
Rufferidae Guiart, 1927
Kotorellidae Euzet et Radujkovic, 1989
Рассматриваемое семейство включают в отряд Trypanorhyncha в составе надсемейства Тгу-panorhynchoidea (Palm et al., 2009). Эти цестоды относятся к числу наиболее обычных многоклеточных паразитов морских рыб и объединяют 277 видов, относящихся к 52 родам из 15 семейств. Причём эта цифра явно не отражает истинного разнообразия трипаноринх, поскольку в печати с завидной регулярностью появляются сообщения об открытии не только новых видов, но и новых родов цестод данной группы.
Цестоды отряда Trypanorhyncha характеризуются наличием 2 или 4 ботрий и располагающегося на апикальном конце сколекса хоботкового аппарата, состоящего из хоботков с многочисленными крючьями. Данная группа цестод уникальна тем, что специалисты могут определять относящиеся к ней виды даже по личинкам из беспозвоночных и рыб, используя для этой цели особенности морфологии сколекса и его хоботкового аппарата (Palm, 2010).
Окончательные хозяева трипаноринх - хрящевые рыбы, первый промежуточный хозяин - копеподы и другие морские беспозвоночные, второй - морские рыбы и головоногие моллюски (они же могут играть роль транспортного хозяина). К слову, личиночные формы трипаноринх характеризуются низкой хозяинной специфичностью и широким географическим распространением.
Во второй половине 20-го столетия были описаны два случая обнаружения в Южной Африке в фекалиях человека живых метацестод Hepatoxylon trichiuri (Holten, 1802) из сем. Sphyriocephalidae, входящего в состав отряда трипаноринх (Fripp, Mason, 1983; Heintz, 1954). О каких-либо отклонениях в состоянии здоровья обоих паразитоносителей в цитируемых статьях ничего не сообщается. В данных публикациях привлекает внимание тот факт, что личинки, пройдя через пищеварительный тракт человека, остались живыми, но неизвестно, жизнеспособными ли. Иной информации о подобных случаях в доступной литературе не обнаружено.
<Н. trichiuri - вид-космополит. Его личинки не образуют цист, обычно встречаются в брюшной полости, на серозе, реже в мышцах рыб и на мантии кальмаров. Тело очень плотное, молочно-белого цвета, длиной до 8.5 и даже 10 см (обычно 2 - 3), шириной 3 - 5 мм (рис. 179). Сколекс длиной 7-9 мм, нечётко отделён от стробилы, с 2 листовидными ботридиями и 4 короткими, почти сферическими хоботками, вооружёнными крупными крючьями.
У рыб обычно паразитируют единичные личинки, но из-за крупных размеров они очень заметны.
Рис. 179 Hepatoxylon trichiuri, метацестода из полости тела мавролика, Юго-Западная Атлантика (из: Гаевская, 2006)
328
В целом, трипаноринх, чьи взрослые формы живут в желудке и кишечнике акул и скатов, можно было бы и не упоминать среди регистрируемых у человека цестод: уж совсем далеки от нас окончательные хозяева этих гельминтов. Тем не менее, основанием для их включения в данную монографию послужили случаи -пусть и единичные, но, всё же, имевшие место, в том числе и в последние годы, -регистрации у человека личинок одного из рода трипаноринх, а именно рода Nybelinia, принадлежащего к семейству Tentaculariidae.
Более того, в последние десятилетия всё большее число исследователей обращают внимание на возможную способность личинок трипаноринх провоцировать аллергические реакции у человека (Gomez-Morales et al., 2008; Rodero, Cuellar, 1999; Vazquez-Lopez et al., 2002).
Описание цестод семейства Tentaculariidae. Тело состоит из сколекса, зоны роста (pars proliferans) и стробилы. В сколексе различают следующие участки: область ботрий (pars bothrialis), область влагалищ хоботков (pars vaginalis), область мышечных бульбусов (pars bulbosa), постбульбусная область (pars postbulbosa). Хоботковый аппарат состоит из 4 хоботков, хоботковых влагалищ и мускульных бульбусов, в большинстве случаев располагающихся параллельно продольной оси сколекса. Поверхность хоботков покрыта крючьями, форма, размеры и расположение которых используются в качестве важных отличительных признаков в систематике цестод данной группы. Выворачивание хоботков осуществляется сокращением мышечных бульбусов, а их вворачивание - при помощи сократительных мышц, отходящих от основания бульбусов. Стробила состоит из многих члеников, каждый из которых содержит один набор половых органов. Типовой род - Tentacidaria Bose, 1797.
Как отмечено выше, известно несколько случаев регистрации у человека тентакуляриидных личинок из рода Nybelinia.
Род Nybelinia Poche, 1926
Синонимы (по: bug.tamu.edu/research/collection/hallan):
Acoleorhynchus Poche, 1926
Rufferia Guiart, 1927
Pleronybelinia Sezen et Price, 1969, а также (no: http://www.gbif.org/species/3268570):
Congeria Guiart, 1935 Syngenes Dollfus, 1930
Описание (по разным авторам). Цестоды с характерными чертами семейства. Базальный участок хоботков с крючьями различной формы и длины или без них. Стробила анаполитичная. Маточные членики акраспедотные. Половые поры неправильно чередующиеся, открываются латерально или сублатерально. Семенники многочисленные, располагаются по всему членику. Бурса цирруса трубчатая. Наружный семенной пузырёк между яичником и передним краем членика. Яичник в задней части или посередине членика. Желточники протягиваются в двух латеральных полях по всей длине членика, перекрывая осморегуляторные каналы. Матка трубчатая, достигает переднего края членика. Яйца округлые. Типовой вид - Nybelinia lingualis (Cwier, 1817) Poche 1926.
329
По мнению специалистов, среди всех Trypanorhyncha род Nybelinia является наиболее трудной для изучения группой (Palm et al., 1997). До недавнего времени он насчитывал около 60 видов. В результате ряда таксономических преобразований в настоящее время в нём осталось 30 валидных видов, 21 вид переведены в другие роды или сведены в синонимы, а часть видов рассматриваются как сомнительные (Bray, 2004).
Заражение человека личинками Nybelinia было выявлено в Японии (N. sur-menicola) и Перу (Nybelinia sp.).
Nybelinia surmenicola Okada in Dollfus, 1929 (рис. 180 - 182).
Рис. 180 Nybelinia surmenicola'. 1 - сколекс; 2 -срединный участок хоботка; 3 -женская половая система, латерально (схематично); 4 - правая половина маточного членика, вентрально; 5 - правая половина фронтального среза через оотип зрелого членика (из: Shimazu, 1975)
Учитывая, что в данном случае речь может идти о возможности зараже
нии человека через пищу лишь метацестодами данного вида, ниже приведено опи-
сание только личинок Nybelinia surmenicola.
Рис. 180 Nybelinia surmenicola, мета-цестода (из: http://dailyparasite.blog spot, com72010_08_01_archive.html)
◄----------,----------
Рис. 182 Nybelinia surmenicola, крючья хобота и общий вид метацестоды (из: Определитель, 1986)
330
Описание личинок Nybelinia surmenicola (по разным авторам, в том числе: Гордеев, 2016; Kim et al., 2015; Lee et al., 2016; собств. данные). Тело личинок плоское, удлинённое, молочно-белого цвета, длиной 8 - 13 и шириной 1.5 - 3.0 мм. Ботрии подвижные, бобовидные, ограничены валиками, внутренние края которых соприкасаются по всей длине, без лакун и поперечной исчерченности; края ботрий с нитевидными микротрихиями. Мускулатура ботрий состоит из нескольких слоёв
кольцевых, продольных и косых мышечных волокон, которые прикрепляются к многослойной базальной пластине тегумента, но лишены собственной опорной пластинки. Хоботки относительно тонкие, полые, длиной 2.3 - 2.5 мм, располага-
ются ближе к середине дорсальной и вентральной сторон сколекса и вооружены спирально расположенными крючьями, имеющими одинаковую форму и длину 30 - 32 щп. Бульбы хоботков банановидные, 0.96 - 1.2 мм, их длина составляет примерно 1/3 длины ботрий. Личинки характеризуются наличием своеобразной складки - велюма (velum), окружающей задний участок тела наподобие мантии; её длина равна или больше длины ботрий. Покровы представлены тегументом и субтегумен-тальной (покровной) мускулатурой. Тегумент состоит из наружного цитоплазматического слоя, апикальная поверхность которого несёт три типа микротрихий: трубчатые, чешуйчатые и щетинковидные (Гордеев, 2016). Кожно-мускульный мешок имеет несколько дополнительных слоёв кольцевых и продольных мышц в суб-тегументе, хоботковые влагалища окружены общим многослойным мышечным слоем, протянувшимся от апикального до базального конца хоботковых влагалищ, что, в частности, отличает род Nybelinia от большинства других трипаноринх.
N. surmenicola - широко распространённый тихоокеанский бореальный вид. Известно, что взрослые особи цестоды паразитируют у лососёвой акулы Lamna di-tropis, а её первый промежуточный хозяин - криль Euphausia pacifica (Shimazu,1975, 1999).
Среди дополнительных и паратонических хозяев N. surmenicola - рыбы 74 видов (Palm, Caira, 2008). К примеру, у берегов Сахалина нибелинии найдены у корюшек зубатой (0.2 - 6.2 %; по 1 - 2 экз.) и малоротой (0.3 - 1.5 %; 0 - 1 экз.) (Вялова, Фролов, 2005). К слову, оба вида корюшек - излюбленный объект любительского лова на Сахалине. Американские исследователи (Bryan et al., 2012) отмечают рост заражённости личинками нибелинии мерлузы тихоокеанской в водах США, наблюдаемый в последние годы: в 1999 г. эти личинки были выявлены у 35.1 % рыб, а в 2008 - 2009-м - у 82 %.
В качестве паратенических хозяев известны также головоногие моллюски, прежде всего, кальмары (Lee et al., 2016). В частности, в корейских водах нибелинии были обнаружены у 27 % особей тихоокеанского кальмара (Kim et al., 2015).
У одних хозяев нибелинии в тканях гибнут сравнительно быстро, у других живут довольно долго, но, в конце концов, также погибают, однако у тресковых, и особенно у минтая (рис. 183), всегда остаются живыми.
Рис. 183 Nybelinia surmenicola, метацестоды в стенке желудка минтая (из: Grabda, 1991)
331
В феврале 1997 г. мы обследовали партию потрошённого и обезглавленного минтая, выловленного в Охотском море и доставленного в Севастополь (Гаевская, 2004). Размеры тушек колебались от 24 до 40 см. На серозе, брыжейке, остатках гонад и печени 95 % тушек было выявлено от 1 до 22 личинок нибелинии, чьи размеры достигали 5-6 мм. Скелетная мускулатура также была поражена нибели-ниями, находящихся в мелких (до 2 - 3 мм в диаметре), белого цвета, сферических или овальных цистах.
После попадания в рыбу некоторое количество личинок проникает в её мускулатуру. В мышечной ткани нибелинии не инцистируются — по С. В. Михайлову (2002), они инкапсулируются - и, по-видимому, постоянно перемещаются на небольшие расстояния. В результате механического и токсического воздействия со стороны паразита мышечные волокна приобретают бесформенную структуру, в них обнаруживаются распавшиеся на отдельные пучки миофибриллы, поперечные разрывы и некроз. Максимальное количество нибелиний в мускулатуре может достигать нескольких сотен экземпляров. Высокая заражённость минтая нибелиниями вызывает определённые трудности при его реализации в торговой сети.
Заражённость минтая и темпы её роста с возрастом рыбы наименьшие в Беринговом море, по направлению к югу они постепенно увеличиваются и достигают максимума в Японском море. В водах Британской Колумбии нибелинии встречаются в мускулатуре у 8 - 70 % рыб с интенсивностью инвазии 1 - 678 экз. (Arthur et al., 1982). Половина обследованных нами (см. выше) тушек потрошённого, обезглавленного минтая также содержали в мясе по 1 - 4 личинки нибелиний.
На основе анализа полученных показателей инвазии и существующей практики оценки пищевой пригодности морских рыб, и в частности минтая, был сделан вывод о том, что япономорский минтай полностью относится к категории «нестандарт» и без дополнительной обработки не пригоден для использования в пищевых целях (Михайлов, 2002). В Охотском море к этой категории относится минтай размером более 45 см. В Беринговом море показатели зараженности нибелиниями ниже допустимой критической нормы, что позволяет использовать эту рыбу в пищевых целях.
В 1949 г. Э. Фауст, говоря о нибелиниях, как возможных паразитах человека, подчёркивал: «No human representatives» (Faust, 1949; стр. 256). П. Г. Ошмарин с коллегами также утверждали абсолютную безопасность этого гельминта для человека, поскольку его взрослые формы поселяются только в акулах (Ошмарин и др., 1961). Авторы аннотированного списка паразитов человека (Ashford, Crewe, 2003) отнесли эту цестоду к числу его псевдопаразитов, написав: «Apparently mere attachment of a specimen to a tonsil». О безопасности для человека пищи, содержащей нибелиний, пишут и корейские исследователи (Lee et al., 2016), тем не менее, оговаривая возможность активизации этих личинок в горле людей в случае употребления ими в пищу сырых морепродуктов, в данном случае кальмаров.
Действительно, если говорить о возможности развития личинок нибелиний в организме человека, то это не представляется возможным. Тем не менее, личинки, попавшие с пищей в ротовую полость или гортань человека - абсолютно неспецифичную для них среду, - ведут себя очень агрессивно, раздражая слизистую и вызывая неприятные ощущения у пострадавшего. Об этом свидетельствуют те немно
332
гочисленные случаи попадания нибелиний к человеку, о которых сообщается в литературе (Kikuchi et al., 1981; Miyahara, 2003).
В первом из цитируемых источников (Kikuchi et al., 1981) речь идёт о нибелинии, обнаруженной в миндалине жителя о. Хоккайдо через несколько часов после употребления им в пищу сырого кальмара. Второй источник (Miyahara, 2003) найти не удалось, но ссылки на него имеются в ряде публикаций, в которых обсуждается возможность паразитирования трипаноринх у человека.
8 августа 2010 г. Сюзан Перкинс (Susan Perkins) разместила на сайте «Паразит дня» («Parasite of Day»; dailyparasite.blogspot.com/2010/08/august-8-nybelinia-surmenicola.html) небольшой пост: August 8 - Nybelinia surmenicola. Согласно этому сообщению, у жительницы Японии, пожаловавшейся на сильную боль во рту, наступившую сразу после еды, - а ела она сырых кальмаров, - доктора извлекли из миндалин и глотки 4 личинок цестод Nybelinia surmenicola. Источник информации С. Перкинс не указывает.
Пост С. Перкинс получил интересное продолжение. 25 января 2015 г. некто Calton, комментируя её информацию, написал(а) о том, что в Паразитологическом музее Мегуро, расположенном в Токио, среди прочих сувениров продаётся брелок в виде мобильного телефона с заключённой в прозрачный акрил Nybelinia surmenicola.
Можно привести ещё одну информацию регистрации нибелиний у млекопитающих, на этот раз у домашней кошки в Японии (Saito et al., 1997). Случай имел место в г. Фукуяма, а цестода была обнаружена в рвотных массах животного.
Что касается упомянутой на стр. 330 информации о регистрации Nybelinia sp. у человека в Перу, то эти сведения я почерпнула из статьи, авторы которой представили результаты изучения встречаемости трипаноринх у Paralichthys isosceles в водах Бразилии (Felizardo et al., 2010). Обсуждая актуальность изучения заражённости трипаноринхами морских рыб, цитируемые авторы сообщили, что в сентябре 2009 г. на Первом Латиноамериканском совещании по гельминтам, проходившем в Терезополисе в Бразилии, J. М. Cardenas-Callirgos рассказал об обнаружении личинки Nybelinia sp. в мягком нёбе у местного жителя в Лиме, Перу.
Цитируемая литература
Вялова Г. П., Фролов Е. В. Паразиты и динамика их численности у корюшек Osmerus mordax dentex и Hypomesus nipponensis Сахалина И Известия ТИНРО. - 2005. - 142. - С. 270 - 281.
Гаевская А. В. Паразиты и болезни морских и океанических рыб в природных и искусственных условиях. - Севастополь: ЭКОСИ-Гидрофизика, 2004. - 237 с.
Гаевская А. В. Паразитология и патология рыб: энциклопедический словарь-справочник. - Севастополь: ЭКОСИ-Гидрофизика, 2006. - 396 с. (издание второе, дополненное и переработанное).
Гордеев И. И. Микроскопическая анатомия плероцеркоидов цестод отрядов Trypanorhyncha и Diphy 1-lobothriidea: автореф. дисс...канд. биол. наук. - 03.02.04: зоология. - М., 2016. - 23 с.
Мамаев Ю. Л., Баева О. М.9 Лактионова В. Д. О зараженности нибелиниями минтая Берингова моря и северной части Тихого океана // Рыбное хоз-во. - 1965. - № 6. - С. 66 - 68.
Михайлов С. В. Фауна паразитов минтая дальневосточных морей (состав, динамика численности, пространственное распределение и практическое значение): Автореф. дисс. ... канд. биол. наук. -03.00.08, 03.00.19: паразитология - Владивосток, 2002. - 24 с.
Определитель паразитов пресноводных рыб. Т. 3. Паразитические многоклеточные. - Л.: Наука, 1987. - С. 583. - (Определители по фауне СССР, изд. Зоол. ин-том АН СССР; Вып. 149). - С. 72 - 73.
333
Ошмарин П. Г, Парухин А. М., Мамаев Ю. Л., Баева О. М. О зараженности минтая личинками нибелиний и использовании этой рыбы в пищу И Сообщ. ДВФ СО АН СССР. - 1961. - Вып. 14. - С. 77 -80.
Arthur J. R., Margolis L., Whitaker D. J., McDonald T. E. A quantitative study of economically important parasites of walley pollock (Theragra chalcogramma) from British Columbia waters and effects of postmortem handling on their abundance in the musculature H Can. J. Fish. Aquat. Sci. - 1982. - 39, 5. - P. 710 -726.
Ashford R W., Crewe W. The parasites of Homo sapiens’. An annotated checklist of the Protozoa, Helminths and Arthropods for which we are home. - Taylor & Francis Inc., 2003. - Second edition. - 184 pp.
Bray R. 2004. Nybelinia Poche, 1926. Accessed through: World Register of Marine Species at http://marinespecies.org/ aphia.php?p=taxdetails&id=105080 on 2016-12-05.
Bryan D. R., Jacobson К. C, Buchanan J. C. Recent increase in Nybelinia surmenicola prevalence and intensity in Pacific hake (Merluccius productus) off the United States west coast H J. Parasitol. - 2012. - 98, 1. -P. 85 - 92. doi: 10.1645/GE-2906.1.
Felizardo N. N, Torres E. J. L., Fonseca G. M. C, Pinto R. M. et al. Cestodes of the flounder Paralichthys isosceles Jordan, 1890 (Osteichthyes - Paralichthyidae) from the State of Rio de Janeiro. Brasil // Neotropical Helminthol. - 2010. - 4, 2. - P. 113 - 125.
Fripp P. J., Mason P. R. Spurious human infection with a trypanorhynchiid tapeworm П South Afr. J. Sci. -1983. - 79.-P. 473.
Gomez-Morales M. A., LudovisiA., Giuffra E., Manfredi M. T. et al. Allergenic activity of Molicola horridus (Cestoda, Trypanorhyncha), a cosmopolitan fish parasite, in a mouse model H Vet. Parasitol. - 2008. - 157, 3-4.-P. 314-320. doi: 10.1016/j.vetpar.2008.07.010.
Grabda J. Marine fish parasitology. An outline. - Warszawa: PWN - Polish Sci. Publ., 1991. - 306 pp.
Heinz H J. A case of tetrarhynchid (cestode) infection in man H Rev. Ecuat. Entomol. Parasitol. - 1954. - 2. - P. 227 - 230.
Kikuchi Y., Takenouchi T., Kamiya M., Ozaki H Trypanorhynchiid cestode larva found on the human palatine tonsil H Jap. J. Parasitol. - 1981. - 30. - P. 497 - 499. (In Japanese with English summary).
Kim H-С., Park J., Yu D.-H, Chae J.-S. et al. A survey and morphological study of plerocercoidal Nybelinia surmenicola (Cestoda: Tentaculariidae) in the common squid from the Korean coastal waters // J. Vet. Clin.-2015.-32, 3.-P. 239 • DOI: 10.17555/jvc.2015.06.32.3.239.
Lee J. Y., Kim J. W., Park G. M, Plerocercoids of Nybelinia surmenicola (Cestoda: Tentacularidae) in squids, Todarodes pacificus, from East Sea, the Republic of Korea // Korean J. Parasitol. - 2016. - 5, 2. - P. 221 -224. doi: 10.3347/kjp.2016.54.2.221
Miyahara M. A case of Nybelinia surmenicola larva found in the oral cavity // Mem. Kyushu Univ. School Health Sci. - 2003. - 2. - P. 91 - 94.
Palm H W. Nataliella marcelli n. g., n. sp. (Cestoda: Trypanorhyncha: Rhinopteridae) from Hawaiian fishes H Syst. Parasitol. - 2010. - 75, 1. - P. 105 - 115.
Palm H. W., Caira J. N. Host specificity of adult versus larval cestodes of the elasmobranch tapeworm order Trypanorhyncha// Intern. J. Parasitol. - 2008. - 3. - P. 381 - 388.
Palm H. W., Waeschenbach A., Olson P. D., Littlewood D. T. J. Molecular phylogeny and evolution of the Trypanorhyncha Diesing, 1863 (Platyhelminthes: Cestoda) H Molec. Phyl. Evol. - 2009. - 52. - P. 351 -367.
Palm H. W„ Walter T.t Schwerdtfeger G., Reimer L. W. Nybelinia Poche, 1926 (Cestoda: Trypanorhyncha) from the Mozambique coast, with description of N. beveridgei sp. nov. and systematic consideration of the genus//S. Afr. J. Mar. Sc. - 1997.-18, l.-P. 273 -285. DOI: 10.2989/025776197784161018.
Rodero M., Cuellar C. Humoral responses induced by Gymnorhynchus gigas extracts in BALB/c mice П J. Helminthol. - 1999. - 73, 3. - P. 239 - 273.
Saito T, Habara T, Yamacuchi H, Yoshida .K, Tongu Y. Plerocercoids of Nybelinia surmenicola vomited from a domestic cat in Fukuyama city, Japan H Bull. School Health Sci. Okayama Univ. - 1997. - 8. - P. 165- 168.
Shimazu T. A description of the adult of Nybelinia surmenicola with discussions on its life-history (Cestoda: Trypanorhyncha: Tentaculariidae) 11 Bull. Japan. Soc. Sci. Fish. - 1975. - 41, 8. - P. 823 - 830.
Shimazu T. Plerocercoids with blastocysts of the trypanorhych cestode Nybelinia surmenicola found in the euphausiid crustacean Euphausia pacifica П Otsuchi Marine Science. - 1999. - 24. - P. 1 - 4.
Vazquez-Lopez C, Armas-Serra C, Bernadina W., Rodriguez-Caabeiro F. A 24-kDacollagenase from Gymnorhynchus gigas elicits rat ileum hyperreactivity and is a target of humoral responses in mice previously given a single oral dose of parasite extract H Digest. Dis. Sci. - 2002. - 47. - P. 935 - 942.
334
Глава 3 или
ПУСТЬ ПИЩА
БУДЕТ ЛЕКАРСТВОМ
Пусть пища будет лекарством. Так говорят мудрые китайцы. И с этим постулатом трудно не согласиться. Что же или кто мешает претворить в жизнь столь простой на первый взгляд тезис? Безусловно, это - паразиты. Никак не может быть лекарством пища, заражённая опасными для здоровья гельминтами, а таковых, как нам удалось установить, в настоящее время насчитывается более 350 видов нематод, трематод, цестод, или ленточных червей, и скребней, или, как их ещё называют, колючеголовых червей (Acanthocephala). О нематодах и трематодах можно почитать в предыдущих двух томах монографии «Мир паразитов человека» (Гаевская. 2015, 2016 - см. ссылки на стр. 7). Скребни (см. Приложение 1, стр. 348) у человека очень немногочисленны и представлены всего 7 видами: Macranthorhynchus hirudinaceus (Pallas, 1781), М ingens (von Linstow, 1879), Acanthocephalus rauschi (Schmidt, 1969), Pseudoacanthocephalus bufonis (Shipley, 1903), Moniliformis moniliformis (Bremser, 1811), Corynosoma strumosum (Rudolphi, 1802) и Bolbosoma sp. (www.cdc.gov; Muller, 2002). Что же удалось узнать о ленточных червях, заражение человека которыми прямо или косвенно связано с пищей.
Первоначально немного статистики.
В опубликованной в 2002 г. монографии «Worms and Human Diseases» («Черви и болезни человека») её автор (Muller, 2002 - см. ссылку на стр. 34) называет 56 видов взрослых и/или личиночных форм цестод, опасных для здоровья человека. В справочно-информационной сводке «Медицинская гельминтология. Полный перечень из 384 гельминтов, поражающих человека» (www.worms-info.ru/Cestoda) таковых перечислено 59 видов и 1 подвид из 18 родов 8 семейств. Однако 8 видов из приведённых во втором из цитируемых источников не являются валидными, так как сведены в синонимы, или же отнесены к категории сомнительных. К слову, и монография, и сводка - одни из немногих источников, дающих общее впечатление о современном видовом составе гельминтов всех таксономических групп, встреченных у человека.
В «Международной классификации болезней 10-го пересмотра (МБК-10)» в классе 1. «Некоторые инфекционные и паразитарные болезни А00-В99» в разделе В67 -В71 перечислено около 15 видов цестод, вызывающих заболевания у человека. Напомню, что Международная классификация болезней (МКБ) является нормативным документом, обеспечивающим единство методологических подходов и международную сопоставимость материалов. В принципе названная цифра - явно заниженная, но следует учесть, что это, как подчёркивается в МКБ, только «некоторые болезни».
В процессе работы над данной монографией удалось собрать сведения о 76 (78) видах цестод, когда-либо зарегистрированных и/или же отмечаемых в настоящее время у человека, которые принадлежат к 27 родам из 9 семейств 4 отрядов. В скобках замечу, что ранее практически все цестоды, встречаемые у людей, входили
335
в состав двух отрядов - Cyclophyllidea и Diphyllobothriidea, в настоящее время к ним добавились представители ещё двух - Bothriocephalidea и Trypanorhyncha.
Наибольшим числом родов цестод, выявленных у человека, представлено семейство Diphyllobothriidae (7), далее следуют Anoplocephalidae (5) и Hymenolepididae (4), в двух семействах (Davaineidae и Taeniidae) - по 3 рода, в одном (Tentaculariidae) -2, а в остальных (Bothriocephalidae, Dipylidiidae, Mesocestoididae) - по одному роду. По числу видов также доминирует семейство Diphyllobothriidae - 29 (30), а далее следует семейство Taeniidae с 19 видами. В Anoplocephalidae - 8 (9) видов, в Davaineidae - 7, в Hymenolepididae - 6, а в остальных 1-3. Если же рассматривать количество видов, принадлежащих к тому или иному роду, то среди них доминируют Diphyllobothrium (14 видов) и Taenia (10), далее следуют Echinococcus (8 видов) и Spirometra (5). Остальные 23 рода представлены 1 - 2 видами.
Сделаем небольшое отступление. Дело в том, что приведённые выше цифры количества видов и родов ленточных червей, опасных для здоровья человека, фактически никак нельзя считать окончательными. По ходу текста приводились многочисленные примеры изменения таксономического статуса многих видов и даже родов цестод, что было связано с применением новых методологических подходов при их изучении. В качестве примеров напомню о восстановлении статуса видов Bertiella satyri (см. стр. 22), Inermicapsifer arvicanthidis (стр. 28) и Spirometra decipiens - qj\-ного из представителей весьма опасного для человека рода дифиллоботриид (стр. 159), родов Schyzocotyle (стр. 42, 43) и Adenocephalus с его типовым видом A. pacificum (стр. 116 - 126). К настоящему времени восстановлена также самостоятельность вида Taenia multiceps (стр. 261), считаются валидными род Hydatigera. ранее сведённый в синонимы Taenia, равно как и его вид Н taeniaeformis (=Taenia taeniaeformis) (стр. 321) и т.д. Специалисты предполагают возможный перевод Pseudanoplocephala crawfordi в род Hymenolepis. a Rodentolepis папа - в род Pararodentolepis. в который уже перевели Hymenolepis fraterna (к слову, Н fraterna долгие годы рассматривали вариететом и даже синонимом Hymenolepis папа) (стр. 224). Одновременно многие виды и даже роды цестод переводятся в синонимы уже известных: примеры подобных таксономических изменений можно найти на страницах 36, 50,58, 65,98, 149, 189, 192,210, 237, 261.
Не стоит забывать и о том, что среди цестодологов иногда отсутствует единая точка зрения по поводу статуса отдельных видов или родов среди упоминаемых на страницах данной книги семейств - аноплоцефалид, гименолепидид, давэнеид, дифиллоботриид, тениид (см. стр. 28, 34, 48, 53, 55, 56, 134, 137, 153, 156, 190, 200, 238, 277). Иными словами, мы вправе ожидать изменений в сведениях не только о видовом и родовом составе регистрируемых у человека цестод, но и о распространении, особенностях биологии, физиологии, патогенности тех или иных таксонов, подвергшихся ревизии. Наглядным примером сказанного служат те таксономические изменения, которым в последние годы подвергся широко распространённый представитель рода Echinococcus - Е. granulosus (s. 1.), разделённый на основе фенотипических особенностей и последовательностей генов на 10 генотипов, многие из которых даже были выделены в самостоятельные виды (стр. 284). В результате изменились наши представления об особенностях морфологической вариабельности Е. granulosus, его биологии, распространении среди окончательных и промежуточных хозяев и степени патогенности для каждого из них.
336
Всё сказанное выше относительно преобразований в системе классификации цестод никак нельзя рассматривать только как неуёмное желание учёных определить точное место каждого живого существа, в том числе многих тысяч видов цестод, в иерархии животного мира. Напомню один из эпиграфов, отнюдь не случайно выбранных мною к этой работе: «Если не знаешь названий, теряется и познание вещей» (К. Линней). Шведский естествоиспытатель Карл Линней был великим учёным, он прекрасно понимал, что, не зная «в лицо» с каким существом имеешь дело, ты не сможешь понять его сути. В данном же случае речь идёт об опасных для здоровья человека гельминтах, для избавления от которых, для предупреждения заражения которыми особую важность приобретает информация о точном систематическом положении паразита, а, следовательно, о его биологии, приуроченности к тому или иному хозяину, распространении, патогенности. Известно, к примеру, что дифиллоботриидная цестода Diphyllobothrium nihonkaiense более чувствительна к празиквантелу, чем родственный Diphyllobothrium latum или же относящийся к тому же семейству A. pacificum (стр. 102). Заражение дипилидиидной цестодой Dipylidium caninum часто ошибочно диагностируют как инвазию острицами (нематодой Enterobius vermicularis - одним из наиболее обычных паразитов человека) и назначают соответствующее лечение, неэффективное в данном случае (стр. 200). Таких примеров много, часть из них осталась за рамками монографии, но их легко найти в соответствующих публикациях.
Многие из зарегистрированных у человека цестод встречаются у него крайне редко, действительно случайно попадая к нему, некоторые были зарегистрированы всего однажды многие десятилетия назад и более никем не встречены. Вспомним единичные находки Killigrewia (стр. 34), Mathevotaenia symmetrica (стр. 36), обоих видов Moniezia (стр. 38, 40), Schyzocotyle acheilognathi (стр. 46), Buginetta alouattae (стр. 50), практически всех видов из рода Raillietina (стр. 54), Nybelinia surmenicola (стр. 333) и т.д. К настоящему времени у человека выявлено 14 видов Diphyllobothrium, однако 9 из них встречены у того буквально один - три раза (см. стр. 70, 71, 75, 83, 86, 88, 103, 104, 105). К числу исключительно редко встречающихся видов можно отнести также Drepanidotaenia lanceolata (стр. 205), Pseudanoplocephala crawfordi (стр. 209), Taenia glomeratus (стр. 254). Более того, в некоторых случаях не удалось даже найти первоисточник, послуживший основанием для отнесения цестоды к числу найденных у человека, как это имело место у Pyramicocephalus phocarum (стр. 146), Schistocephalus solidus (стр. 151) или же Taenia hydatigena (стр. 258).
В то же время отдельные опасные цестодозы распространены по многим странам и континентам, поражая десятки миллионов людей. К примеру, в 1999 г., по подсчётам специалистов, цепнем бычьим (Taenia saginata) во всём мире было поражено 77 млн. человек, цепнем карликовым [Rodentolepis папа (=Hymenolepis папа)] - 75 млн., цепнем свиным (Taenia solium) - 10 млн., лентецом широким (Diphyllobothrium latum) - 9 млн., эхинококками однокамерным и многокамерным (Echinococcus granulosus и Е. multilocularis) - 2.7 млн. (Grzimek’s Animal Life Encyclopedia. Second Edition. 2004. Vol.l.). К числу широко распространённых цестод, регистрируемых у человека, относятся также цепень собачий, или огуречный (Dipylidium caninum), цепень крысиный (Hymenolepis diminuta) и ряд других. Фактически именно эти виды и перечислены в упомянутой выше «Международной классификации болезней 10-го пересмотра».
337
Однако не исключено, что некоторые виды цестод из разряда исключительно редко встречающихся у людей могут перейти в категорию его довольно обычных паразитов. Об этом свидетельствуют, например, наблюдающийся в последние годы рост числа случаев регистрации у людей (и приматов) аноплоцефалидных цестод (стр. 41) или же выявленные уже в нынешнем столетии случаи поражения людей цистицерками Taenia martis, ранее у человека не отмечавшейся (стр. 260).
Известно, что расширение ареала паразитов, в том числе и зоонозных видов, во многом происходит благодаря человеку, в результате его хозяйственной деятельности, о чём пишут многие авторы. Немалую роль в этом процессе играют также активные перемещения населения. Иммигранты, беженцы, иностранные наёмные рабочие привносят в новую среду обитания не только свои нравы и обычаи, но и паразитов, особенно из числа долгоживущих, коими они заразились у себя на родине. Туристы и деловые люди, посещающие регионы, где имеются те или иные эндемичные очаги, нередко считают для себя просто обязательным попробовать экзотичные блюда в местах пребывания, что в итоге приводит к заражению гельминтами, нехарактерными для мест постоянного проживания этих людей (подобные примеры неоднократно приводились в тексте). И, наконец, серьёзное значение в распространении зоонозных видов имеют современные способы транспортировки продуктов питания. Быстрая доставка свежих продуктов гарантирует их высокое качество, но никак не гибели паразита, который не теряет своей инвазионности и остаётся опасным для человека, особенно в случае последующего приготовления блюд без соответствующей термической обработки. Так, растущий импорт в Европу охлаждённой морской рыбы из Эквадора, Чили и Перу - основного региона распространения Adenocephalus pacificum - привёл к появлению случаев заражения этим гельминтом людей в Старом Свете, в частности в Испании (Kuchta et al., 2015: см. ссылку на стр. 125). Подтверждают сказанное также многочисленные примеры, приводимые на стр. 25, 31, 71, 80, 81, 132, 165, 271, 313, 314.
И, наконец, большую роль в распространении и поддержании очагов заражения человека многими цестодами играют животные, не только дикие и сельскохозяйственные, но и домашние, в частности кошки и собаки, на что уже давно обращают внимание исследователи. В немалой степени этому способствует наблюдающийся в последние десятилетия рост их численности, а также расширение круга животных, входящих в список домашних питомцев. О тесной связи человека и его окружения в животном мире свидетельствуют даже названия цестод: свиной солитёр (стр. 239), овечий мозговик (стр. 281), цепень кошачий (стр. 323), цепень собачий (стр. 185), цепень бычий (стр. 269) и т.д.
Для большинства из регистрируемых у него цестод человек является окончательным хозяином: попавшие в его организм личинки затем проходят в нём обычный путь развития, как и в своих естественных хозяевах в природе. Цепни карликовый и свиной могут использовать человека и как промежуточного, и как окончательного хозяина, а первый из них, к тому же, вообще способен развиваться в организме одного и того же хозяина, даже не попадая во внешнюю среду. Представители рода Spirometra паразитируют у человека в основном на личиночной стадии, но иногда у него встречаются и взрослые формы (см. стр. 156). Во многих случаях взрослые ленточные черви не вызывают у человека очень серьёзной патологии, хотя их присутствие бывает крайне неприятным и может сопровождаться определёнными отклонениями в состоянии здоровья. Однако заражение личинками цестод, как мы 338
видели, обычно приводит к развитию патологического процесса, который при тяжёлой инвазии может даже привести к летальному исходу, особенно в случае поражения головного мозга.
По ходу текста приводились многочисленные примеры того, как переносчиками цестод, потенциально опасных для здоровья человека, могут оказаться контаминированные инвазионными личинками рыбы, насекомые и ракообразные, лягушки и змеи, а также заражённое мясо или печень крупного и мелкого рогатого скота, свиней и некоторых диких животных. Источником заражения могут стать также питьевая вода и водные растения, в которой или на которых по разным причинам оказались яйца/личинки цестод или же промежуточные хозяева этих гельминтов, содержащие инвазионных личинок. Столь же реально заражение человека через свежую зелень, овощи, ягоды, выращенные на участках, где для удобрения используют не-обеззараженные фекалии сельскохозяйственных животных и/или нечистоты, а также через землю и грязные руки. В общем, фактором передачи возбудителей тех или иных цестодозов может послужить любая загрязнённая пища в зависимости от характера загрязнения. Так, блоха, инвазированная цистицеркоидами Dipylidium caninum, случайно проглоченная с молоком или кашей человеком, а чаще всего ребёнком, может стать источником заражения дипилидиозом. Заражение этой цесто-дой также возможно, если ребёнок ест, сидя на полу, а в доме есть инвазированные собаки или кошки (стр. 183, 184).
Несколько особняком в этом плане стоят спирометры, заражение личинками которых возможно также при непосредственном контакте со слизистыми и кожными покровами человека находящихся в мясе лягушек или же змей личинок. Обычно такие случаи регистрируют в странах Юго-Восточной Азии, где в народной медицине широко практикуются методы лечения кожных и глазных заболеваний примочками из сырого мяса амфибий и рептилий. В этом отношении весьма примечателен следующий случай, имевший место в 2012 г. в Великобритании (см.: Richard Gray. The Guardian newspaper. Friday 21 November 2014 - theguardian.com/science/ 2014/21/ tapeworm-parasite-mans-brain-four-years-china).
Живущий в Восточной Англии 50-летний мужчина китайского происхождения обратился к врачам по поводу головных болей, припадков, вспышек внезапной потери памяти и ощущения странных запахов, мучавших его в течение 4 лет. Многочисленные тесты на различные заболевания, включая туберкулёз, сифилис, ВИЧ-инфекцию, дали отрицательный результат, но после двух биопсий в правой медианной височной доле больного были обнаружены кольцеобразные извилистые ходы длиной 5 см, а затем и проделавший их червь длиной 1 см, который был удалён хирургическим путём. Червя определили как Spirometra erinaceieuropaei. К слову, после операции, несмотря на приём лекарственных препаратов, мужчина продолжал испытывать боли вследствие тех повреждений мозговой ткани, которые были нанесены цестодой. Медики предположили, что пациент заразился во время одной из своих поездок в Китай, которые он регулярно совершал все годы, где для лечения больных глаз обычно применяют примочки из сырого лягушачьего мяса
Итак. Резюмируем выше изложенное. Совершенно очевидно, что проблема заражения человека цестодами многопланова и в ней можно выделить как медицинские, так и ветеринарные и социально-экономические аспекты, что неоднократно подчёркивалось мною по ходу текста. Совершенно очевидно также и то, что в подавляющем большинстве случаев человек сам является вольным или невольным ви
339
новником регистрируемых у него цестодозов. Ведь не стоит большого труда запомнить, что: после прогулок и туалета, общения с животными руки необходимости мыть; мясо, рыбу и другие продукты животного происхождения, приобретённые в ненадлежащих местах и без соответствующего сертификата, следует обработать при высокой температуре или использовать в пищевых целях после заморозки; растительную пищу перед употреблением обязательно надо промыть в проточной воде; воду из непроверенных источников можно пить только после фильтрации или кипячения. В неблагополучных по тем или иным цестодозам регионах особое внимание необходимо уделить профилактическим мероприятиям, в частности санитарному обустройству поселений в сельской местности, животноводческих ферм, усилению санитарно-ветеринарного контроля скотобоен, предприятий общественного питания и торговли, периодической дегельминтизации домашних и приотар-ных собак, регуляции численности бродячих животных. Перечисленные тезисы есть суть санитарно-просветительской работы, которую соответствующие медицинские учреждения обязаны проводить среди населения, в том числе в детских дошкольных учреждениях, школах, а также среди всех лиц, которые по роду своей деятельности связаны с таким деликатным объектом как продукты питания человека. Отсутствие должной информации относительно возможного распространения в регионе тех или иных цестодозов и вероятности заражения людей вызывающими их гельминтами способствует сохранению и распространению очагов заболевания.
И, наконец, последнее, на что я не могу не обратить внимания уважаемых читателей, это факт наблюдаемой в последние годы чрезвычайной популярности темы «паразитов человека», о чём свидетельствуют, в том числе, многочисленные сайты, посвящённые данной теме. К великому сожалению, судя по тем неточностям и даже заведомо неверной информации, которые содержат отдельные сайты, пишут их не всегда, скажем мягко, специалисты-паразитологи. И уж совсем негоже, когда подобное можно встретить в официальных документах.
В нормативном документе «Методические указания МУК 4.2.2747-10 (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека 11 октября 2010 г.)» в разделе 8.2 читаем: «Цистицерк целлюлозный (свиной) - полупрозрачный пузырек шарообразной или овальной формы <...>. Внутрь пузырька вогнут сколекс, просвечивающийся в виде белой точки. Исследуя сколекс финны при малом увеличении микроскопа обнаруживают ротовую щель (бот-рикс), четыре присоски и хитиновые крючья...». Ну откуда у сколекса ротовая щель, если цестоды вообще не имеют пищеварительной системы, в том числе и ротового отверстия (щели)?!
В заключение пожелаю всем пищи, свободной от паразитов, и отменного здоровья.
340
Приложение 1
СЛОВАРЬ
НЕОБХОДИМЫХ ТЕРМИНОВ И ПОНЯТИЙ
Аберрантный - необычный, отклонившийся от нормы.
Абиотические факторы - совокупность условий неорганической среды, влияющих на организмы.
Агент - название возбудителя заболевания, так называемого патогенного агента.
Аллергены - антигены, вызывающие у чувствительных к ним людей аллергические реакции.
Аллергия - форма иммунологического ответа организма, проявляющаяся в его повышенной чувствительности к разнообразным антигенам. Аллергию рассматривают как патологическое нарушение иммунитета.
Амплитуда интенсивности инвазии - величины минимальной и максимальной интенсивности инвазии конкретным видом паразита, встреченным в обследованной выборке (например, от 1 до 114 экз.; обычно записывается: 1 - 114).
Анамнез (от греческого avapvrpic; - воспоминание) - совокупность сведений, получаемых при медицинском обследовании путём расспроса самого обследуемого и/или знающих его лиц; играет основополагающую роль в постановке диагноза на гельминтозное заражение.
Анемия (синоним: малокровие, олигемия) - патологическое состояние, характеризующееся уменьшением количества эритроцитов и снижением содержания гемоглобина в единице объёма крови.
Антигельминтики — вещества, применяемые для борьбы с гельминтами.
Антигены - чужеродные для организма органические вещества, вызывающие образование антител и изменяющие его иммунологическую активность.
Антитела - глобулярные белки, обладающие способностью специфически связываться с антигенами.
Антропозоонозы - болезни человека, вызываемые специфическими патогенами животных и переносимые животными.
Антропонозы - болезни, свойственные только человеку, возбудители которых приспособились в процессе эволюции к паразитированию только в организме человека и передаются от человека к человеку, другие животные в распространении не участвуют. К антропонозам в частности относятся гельминтозы без промежуточного хозяина.
Антропургический очаг заболевания - природный очаг, возникший в результате хозяйственной деятельности человека при освоении им ранее не обжитых территорий; источником возбудителя заболеваний являются синантропные дикие и домашние животные.
Ареал - часть территории или акватории, в пределах которой распространён и проходит полный цикл развития данный таксон (вид, род, семейство и т. д.).
341
Базальный (основной) - относящийся к основанию, расположенный у основания, обращенный к нему и т. п.
Биомониторинг - постоянное наблюдение за состоянием экосистемы с использованием биологических методов.
Биотические факторы - совокупность факторов, относящихся к органическому миру и определяющих условия существования организмов в том или ином месте. Действие этих факторов может быть не только непосредственным, но и выражаться в изменении условий среды. Взаимодействие биотических и абиотических факторов обусловливает возникновение и характер течения различных болезней животных и в конечном итоге предопределяет исход болезни.
Болезнь - ненормальное состояние организма или его части, которое нарушает их нормальное физиологическое функционирование.
Вентральный - брюшной, относящийся к брюшной стороне тела животного организма.
Ветеринария (от латинского veterinarius). ветеринарная медицина - отрасль науки, занимающаяся профилактикой, диагностикой и лечением болезней животных, а также их расстройствами и травмами.
Вид - в биологии: основная структурная и классификационная (таксономическая) единица в системе живых организмов. Количеством видов измеряется разнообразие любого таксона, экосистемы и биосферы.
Витаминная недостаточность - дефицитом витаминов в организме. При частичной витаминной недостаточности наступают преимущественно нарушения функционального характера (гиповитаминозы). Патологическое состояние, наступающее при полной витаминной недостаточности в организме, называется авитаминозом.
Витамины - низкомолекулярные биологически активные органические соединения различной химической природы, жизненно необходимые организму для осуществления важнейших биохимических и физиологических процессов.
Встречаемость паразита - характеристика естественного распределения какого-либо паразита в популяциях того или иного хозяина; встречаемость выражается цифровыми показателями экстенсивности и интенсивности инвазии, а также пространственным (или географическим) распределением.
Второй промежуточный хозяин - животное, в организме которого находится второе (бесполое) поколение паразита.
Выборка объекта для паразитологического обследования - часть от всего количества данного объекта, взятая для исследования с целью получения общей характеристики его заражённости.
Габитус (от латинского habitus) - в биологии, внешний облик организма, совокупность признаков, характеризующая общий тип строения.
Гельминтозные заболевания, гельминтозы - болезни человека, животных и растений, вызываемые паразитическими червями - гельминтами.
Гельминтология - раздел паразитологии, изучающий паразитических червей -гельминтов и заболевания, вызываемые ими у человека, животных и растений.
Гельминты, или паразитические черви - паразитические турбеллярии, моно-генеи, цестоды (ленточные черви), гирокотилиды, трематоды, нематоды (круглые черви), скребни (колючеголовые черви) и пиявки.
342
Гематокритное число - объёмное соотношение форменных элементов крови и плазмы. Является одним из показателей степени выраженности патологического процесса.
Геогелъминты - группа паразитических червей (гельминтов) животных и человека, развивающихся без участия промежуточного и дополнительного хозяев. Яйца и личинки геогельминтов развиваются до инвазионного состояния во внешней среде (в грунте, перегное и в других субстратах).
Гистолиз - разрушение тканей животного организма путём растворения их элементов (клеток и межклеточного вещества) при участии особых клеток (фагоцитов) и ферментов.
Гистопатология - раздел патологической анатомии, изучающий микроскопические процессы, протекающие в тканях при различных заболеваниях.
Девастация - комплекс мероприятий, направленных на уничтожение возбудителя болезни на всех фазах его жизненного цикла всеми доступными средствами -механическими, физическими, химическими, биологическими.
Дегельминтизация - комплекс лечебно-профилактических мероприятий, направленных на оздоровление окружающей среды от инвазионного материала и оздоровление животных и населения от гельминтов; является частью более широкого комплекса мероприятий - девастации. Термин впервые предложил К. И. Скрябин в 1925 г.
Дезинсекция (фр. des - уничтожение, удаление и лат. insectum - насекомое) -уничтожение специальными средствами паразитических насекомых, а также насекомых-вредителей хозяйства.
Декстралъный (dextral) - расположенный справа.
Дератизация (фр. deratisation - «уничтожение крыс») - комплексные меры, направленные на уничтожение вредных грызунов (крыс, мышей, полёвок и др.).
Дефинитивный хозяин - то же, что и окончательный хозяин.
Диморфизм - различия в размерах, форме или цвете между экземплярами одного вида («половой диморфизм» - между особями противоположного пола).
Дистальный (от лат. disto - отстою) - участок органа, расположенный дальше от места его отхождения, прикрепления. Противоположный термин - проксимальный.
Дополнительный хозяин - то же, что и второй промежуточный хозяин.
Дорсальный - спинной, относящийся к спинной стороне тела, находящийся на спине животного организма.
Жизненный цикл паразита - совокупность всех фаз развития, пройдя которые организм достигает зрелости и способен дать начало следующему поколению. Длительность отдельных фаз у разных паразитов различная, общая длительность всего жизненного цикла (от яйца до яйца следующего поколения) значительно варьирует.
Жизнестойкость - устойчивость организма к воздействию неблагоприятных факторов среды.
Заражённость - наличие в организме животного каких-либо патогенных микроорганизмов или паразитов; характеризуется экстенсивностью и интенсивностью инвазии.
Зоонозы (от греческого zoon - животные) - болезни беспозвоночных и позвоночных (кроме человека), которые могут быть переданы человеку. Болезни, пере
343
даваемые от человека к животным, иногда называют реверсными (обратными) зоонозами или антропонозами (от греческого anthropos - человек и nosos - болезнь).
Иммунитет (лат. immunitas - освобождение, избавление от чего-либо) - способность иммунной системы организма избавляться от генетически чужеродных объектов; обеспечивает гомеостаз организма на клеточном и молекулярном уровнях организации. Реализуется иммунной системой.
Иммунодефициты (иммунологическая недостаточность) - нарушения иммунологической реактивности, обусловленные выпадением одного или нескольких компонентов иммунного аппарата или тесно взаимодействующих с ним неспецифических факторов, что ведёт к снижению функции иммунной системы и сопротивляемости организма по отношению к различным инфекциям. По происхождению иммунодефициты делят на первичные и вторичные.
Инвазионные болезни - болезни, вызываемые паразитическими простейшими, гельминтами, паразитическими ракообразными и другими паразитами животного происхождения. Болезни, вызываемые паразитическими простейшими, нередко относят к инфекционным.
Инвазия (от латинского invasio - нашествие, нападение) - многозначный медицинский и биологический термин. В эпидемиологии и паразитологии инвазией называют проникновение паразитов в организм хозяина или - в более узком смысле - проникновение паразитов через эпителиальные барьеры хозяина.
Индекс обилия (в англоязычной литературе - Abundance) - среднее число паразитов конкретного вида, приходящееся на одну особь исследуемого вида; определяется путем деления общего числа выявленных паразитов данного вида на количество всех обследованных особей определённого вида.
Инкапсуляция - возникновение соединительно-тканной капсулы вокруг паразита или другого инородного включения в тканях животного-хозяина.
Интенсивность инвазии (заражённости) (в англоязычной литературе -Intensity) - количество паразитов данного вида в одной особи исследуемого вида хозяина; по результатам исследования нескольких особей интенсивность инвазии обычно указывается двумя цифрами - минимальной и максимальной.
Инфекция - внедрение и размножение в организме болезнетворных микроорганизмов, сопровождающееся комплексом реактивных процессов; завершается инфекционным заболеванием, бактерионосительством или гибелью микроорганизмов.
Инцистирование - процесс формирования цисты.
Капсула - обычно толстостенное соединительно-тканное уплотнение, образуемое тканями хозяина вокруг паразита или другого инородного включения.
Класс - один из основных рангов иерархической классификации в биологической систематике ниже по своему положению, чем Тип, но выше, чем Отряд.
Клиническая картина (синоним: клиника) - условное обозначение совокупности проявлений болезни и особенностей её течения как основы диагноза, прогноза и лечения.
Копрологическое исследование - обследование кала на наличие кишечных паразитов - яиц, личинок и/или взрослых особей червей, а также их фрагментов.
Копроовоскопия - исследование кала на наличие яиц гельминтов.
Ларвальный (лярвалъный) паразитизм — характерен для личинок цестод, скребней и нематод, метацеркарий трематод, которые живут в организме промежу
344
точного или паратонического хозяина и освобождаются из него только тогда, когда данного хозяина проглотит подходящий окончательный хозяин.
Латентное течение болезни - скрытое течение болезни, протекающее без видимых симптомов.
Латеральный - боковой; термин, указывающий на расположение какой-либо части тела организма или органа в стороне от его срединной плоскости.
Лизис - разрушение клеток под влиянием различных агентов, например, ферментов.
Ликвидация паразитов - полное искоренение в пределах определённой территории возбудителя болезни, что исключает возможность нового возникновения ликвидированного паразитоза без внесения возбудителя извне.
Личиночная стадия паразита - постэмбриональная стадия индивидуального развития паразитов, у которых запасы питательных веществ в яйце недостаточны для завершения морфогенеза. Превращение личинки во взрослую особь заключается в перестройке организации, тем более глубокой, чем больше личинка отличается от закончившего своё развитие организма.
Локализация - отнесение чего-либо к определённому месту, ограничение распространения какого-либо явления, процесса возможно более тесными границами, территориальными пределами.
Локализация паразитов - местонахождение паразита в теле хозяина. Каждый паразит имеет более или менее определённое место поселения в организме хозяина, к которому он приспособлен наилучшим образом. В некоторых случаях паразит попадает в несвойственное ему место, что обычно заканчивается его гибелью.
Локальный - местный, не выходящий за обозначенные границы, присущий данному месту.
Максимальная интенсивность инвазии - наибольшее число паразитов данного вида, зарегистрированное в одной особи обследуемого вида хозяина из общего числа исследованных особей.
Максимальная экстенсивность инвазии - наибольший процент обследуемого вида хозяина, заражённых конкретным видом паразита в какой-либо из обследуемых выборок; определяется при обследовании нескольких выборок.
Микроскопия - применение микроскопа и способы приготовления микроскопических препаратов.
Минимальная интенсивность инвазии - наименьшее число паразитов данного вида, найденное в одной особи обследуемого вида хозяина из общего числа исследованных особей.
Минимальная экстенсивность инвазии - наименьший процент обследуемого вида хозяина, заражённых конкретным видом паразита в какой-либо из обследуемых выборок; определяется при обследовании нескольких выборок.
Мониторинг - непрерывный процесс наблюдения и регистрации параметров какого-либо конкретного объекта в сравнении с заданными критериями.
Облигатный - обязательный, постоянно встречающийся.
Облигатный паразит - определённый вид паразита, который абсолютно не способен жить и размножаться без своего хозяина.
Облигатный хозяин - животное, обязательное в жизненном цикле определённого вида паразита, без которого тот абсолютно не способен жить и размножаться.
345
Объекты водного промысла - отдельные виды рыб, моллюсков, ракообразных, морских млекопитающих, водная растительность и др., образующие скопления, обеспечивающие их рентабельную добычу и переработку.
Окончательный хозяин - животное, в организме которого развивается и живёт половозрелая стадия паразита.
Онтогенез - индивидуальное развитие любого организма с момента зарождения до смерти; совокупность последовательных морфологических, физиологических и биохимических преобразований, которые проходит организм от зарождения до смерти.
Опасные для здоровья человека паразиты - паразиты, чьё попадание в организм человека представляет угрозу его здоровью.
Отряд - в биологии: таксономическая категория (ранг) в систематике животных. В отряды (иногда сначала в подотряд) объединяют родственные семейства.
Паразит - организм, постоянно или временно живущий на поверхности или внутри тела другого, более крупного животного и питающийся за его счёт.
Паразитарные болезни - болезни, вызываемые паразитами.
Паразитизм - исторически сформированная ассоциация генетически разнородных организмов, основанная на трофических связях и взаимоотношениях, когда один (паразит) использует другого (хозяина) как среду жизни и источник пищи, причём оба партнера находятся в антагонистических отношениях разной степени остроты. Паразитизм - преимущественно экологическое понятие, аналогичное понятиям планктонного, бентосного образа жизни организмов. Характерная особенность паразитизма определяется своеобразием среды жизни, каковой для паразита является живой организм (хозяин), активно реагирующий на присутствие паразита. Среда существования паразита, как показали Е. Н. Павловский и В. А. Догель, имеет двойственный характер: среда 1-го порядка - органы и ткани хозяина, окружающие паразита; среда 2-го порядка - среда, окружающая хозяина. Большая часть паразитов практически полностью утратила связь с внешним миром, и все стадии их развития происходят в организме хозяев. В зависимости от продолжительности паразитирования различают временный и стационарный паразитизм, последний включает паразитизм периодический и постоянный.
Паразитология - комплексная биологическая наука, изучающая явление паразитизма, т.е. взаимоотношения между паразитом и хозяином, их зависимость от факторов внешней среды, а также вызываемые паразитами заболевания и методы борьбы с ними.
Паразитоноситель - животное, в теле которого паразит присутствует, но не приводит к заболеванию хозяина; сам хозяин при этом становится источником распространения паразита.
Паразитостойкость — мера стойкости организма к заражению определённым видом паразита.
Паразитофауна - совокупность видов паразитов, обитающих на определённой территории (акватории), в определённом хозяине (группе хозяев).
Паратенический хозяин — потенциальный промежуточный хозяин, не являющимся необходимым для онтогенетического развития гельминта, т.к. в нём не происходит его развития.
Патогенез - совокупность последовательных процессов, определяющих механизмы возникновения и течения болезни; включает в себя взаимосвязанные про
346
цессы, происходящие в больном организме (физиологические, биохимические, морфологические, иммунологические и т. д.), развивающиеся в нём после воздействия этиологического фактора.
Патогенный - болезнетворный, способный вызвать нарушения в организме хозяина.
Патология - 1) комплексная наука, изучающая закономерности возникновения, течения и исхода заболеваний, а также отдельных патологических процессов в организме животных; 2) патологические отклонения от нормы.
Первичный очаг заболевания - издревле существующий природный очаг.
Первый промежуточный хозяин — животное, в организме которого обитает поколение паразита, развивающееся из яйца.
Перкутанный (через кожу) - активное проникновение личинок паразита через неповреждённую кожу.
Персистенция - длительное существование патогена в конкретных условиях или на конкретной территории.
Проксимальный (новолат. proximalis, от лат. proximus — ближний)- участок органа, расположенный ближе к месту его отхождения, прикрепления. Противоположный термин - дистальный.
Резервуарный хозяин - животное, в организме которого личинки паразита (гельминта) могут переживать длительное время, но не развиваются и соответственно не достигают половой зрелости. Резервуарному хозяину принадлежит значительная роль в сохранении, аккумуляции и распространению данного вида гельминта.
Резистентность (дословно - сопротивление, противодействие) - устойчивость организма к воздействию различных физических, химических или биологических повреждающих факторов. В отношении человека и животных чаще используется термин иммунитет.
Род — в биологии: основная надвидовая таксономическая категория (ранг) в биологической систематике; объединяет близкие по происхождению виды..
Семейство - в биологии: таксономическая категория (ранг) внутри отряда, подотряда или надсемейства, состоящее из группы близких подсемейств, триб и родов.
Сенсибилизация биологическая - приобретение организмом специфической повышенной чувствительности к чужеродным веществам - аллергенам, повышение его чувствительности к воздействию раздражителей.
Синдром - совокупность симптомов, объединённых единым патогенезом (механизмом возникновения) и характеризующих определённое патологическое состояние организма. В некоторых случаях синдром характеризует всю картину заболевания, а остальные симптомы только детализируют её.
Синистралъный (sinistral) - расположенный слева.
Синоним в биологической таксономии - два или более названия, относящиеся к одному и тому же биологическому таксону. Только один из всех синонимов может быть названием, под которым данный таксон должен быть известен. Обычно это тот синоним, который был обнародован раньше других.
Систематика (от греч. сгооттщатгкб? - упорядоченный, относящийся к системе) - раздел науки (в частности, зоологии), относящийся к классификации изучаемых объектов.
347
Скребни (Acanthocephala) - тип паразитических червей, с единственным классом. Дефинитивные хозяева - рыбы, водные млекопитающие, водоплавающие птицы. Скребни, окончательными хозяевами которых являются теплокровные животные, опасны для здоровья человека. Тело взрослых особей удлинённое, овальное или цилиндрическое, иногда коническое, длиной от 1.5 до 8 см (самцы мельче самок), белого, жёлтого, красно-оранжевого, коричневого цветов. У многих скребней тело с шипами. На перед-нем конце тела вооружённый крючьями хоботок, втягивающийся в полость хоботкового влагалища. Основание хоботка, т. н. шейка, без шипиков. По бокам хоботкового влагалища у самцов расположены парные органы - лемниски. Пищеварительная система отсутствует, питание осуществляется осмотическим путём. Раздельнополые. Жизненный цикл сложный, со сменой хозяев. Другое название - акантоцефалы, колючеголовые черви.
Рис. 184 Личинка скребня Corynosoma semerme из рыбы
Смертность - интенсивность процесса гибели особей в популяции; выражается количеством особей, умерших или погибших за определённый период на некоторой территории относительно условного их числа (до 100 или 1000). Иногда используют удельную смертность - в расчёте на одну особь в единицу времени. Период времени, для которого определяют смертность, варьирует от часов и суток для мелких организмов (бактерий, простейших) до года.
Специфичный хозяин - хозяин, к которому данный паразит адаптирован наилучшим образом. В результате взаимной и всесторонней приспособленности паразита и специфичного хозяина отношения между ними принимают закономерный, и даже облигатный, характер.
Средняя интенсивность инвазии - общее количество особей паразитов данного вида, выявленное при исследовании выборки определенного вида животных, деленное на число заражённых особей хозяев (т. е. среднее число паразитов данного вида, приходящееся на одну заражённую особь хозяина в исследованной выборке).
Средняя экстенсивность инвазии - средний процент заражённости нескольких исследованных выборок данного вида хозяина конкретным видом паразита.
Таксон - классификационная единица в систематике организмов; группа организмов, связанных той или иной степенью родства и достаточно обособленная, чтобы ей можно было присвоить определённую таксономическую категорию того или иного ранга - вид, род, семейство, отряд, класс и т.п.
Таксономия - теория и практика классификации организмов. Иногда термин «таксономия» используют как синоним систематики.
Терминальный - концевой, конечный (например, терминальная артерия).
Тип - один из высших рангов таксономической иерархии в зоологии.
Токсичность - способность ряда веществ биологической природы и/или химических соединений оказывать вредное действие на организм человека и животных.
Фиксатор, фиксирующая жидкость - специальная жидкость для фиксации паразитов (или других животных), частей их тела или кусочков поражённых ими
348
тканей, чтобы сохранить их морфологическое строение и химический состав для последующих морфологических, анатомических, гистологических или цитологических исследований. Для каждой систематической группы паразитов существуют свои фиксаторы.
Фронтальный - лобный, относящийся ко лбу, параллельный его поверхности.
Хозяин - животное, на котором или в котором обитает паразит.
Цестодозы - заболевания человека, домашних и диких животных, возбудителями которых являются цестоды.
Циста - плотная оболочка, выделяемая паразитом и окружающая его.
Штамм (от нем. Stamm, буквально — «ствол», «род») - чистая культура вирусов, бактерий, других микроорганизмов или культура клеток, изолированная в определённое время и в определённом месте.
Эксплантация - культивирование клеток, зачатков тканей и органов вне организма; то же, что культура тканей.
Экстенсивность инвазии, или встречаемость паразитов (в англоязычной литературе - Prevalence) - выраженное в процентах отношение количества особей определённого вида хозяев, заражённых конкретным видом паразита, к числу исследованных особей данного вида (т. е. процент заражённости).
Эндемики — виды, роды, семейства или другие таксоны животных и растений, распространённые исключительно только в определённой, чаще сравнительно ограниченной местности.
Эндемия - постоянное наличие и периодическое распространение некоторых болезней в определённой местности, обусловленное её природными особенностями и своеобразием условий жизни населения. Эндемия некоторых инфекционных и инвазионных заболеваний связана с наличием их природных очагов. Понятие эндемии относят и к болезням, которые распространены повсеместно, но степень их распространённости определяется условиями жизни населения на данной территории: например, распространение описторхозиса связано, прежде всего, с неудовлетворительным санитарным состоянием территории и водоёма, а также низким уровнем санитарно-просветительской работы.
Эндопаразиты - живут во внутренних полостях, тканях и клетках хозяина. Некоторые авторы разделяют эндопаразитов по месту их расположения на полостных, тканевых, внутриклеточных и т.д.
Эозинофилия - увеличение количества эозинофилов в крови в лейкоцитарной формуле выше 5 % и в абсолютных числах выше 320 в 1 мм3 крови; в большинстве случаев является проявлением аллергической реакции сенсибилизированного организма, в том числе при инвазии гельминтами.
Эозинофилы - одна из форм зернистых лейкоцитов (гранулоцитов) крови позвоночных. Цитоплазма эозинофилов содержит гранулы, окрашивающиеся кислыми красителями, в том числе эозином, в красный цвет. Количество эозинофилов возрастает при аллергических реакциях, инвазии гельминтами, болезнях кожи.
Эпидемиология (от древнегреческого ётпЗтрдла - имеющая всенародное распространение и Абуод - учение) - общемедицинская наука, изучающая закономерности возникновения и распространения заболеваний различной этиологии с целью разработки профилактических мероприятий. Предметом изучения эпидемиологии является заболеваемость - совокупность случаев болезни на определённой территории в определённое время среди определённой группы населения.
349
Эпизоотии - характеризуются тем, что болезнь охватывает массовые количества животных на определённой площади. При этом патоген заносится из других регионов или происходит одновременное заражение животных от общего источника инфекции, не характерного ранее для данного района.
Эпизоотический очаг - понятие, характеризующее место пребывания источника (или источников) возбудителя инфекции или инвазии (больное животное, микробоноситель), где при данной ситуации возможна передача возбудителя восприимчивым животным.
Эпизоотология — ветеринарная наука о закономерностях возникновения, развития и угасания массовых болезней животных. Для профилактики и лечения болезней необходимо знать условия, которые приводят к проникновению возбудителя в организм животного.
Этиология - изучает причины и условия возникновения болезней; неразрывно связана с патологией.
In part - частично.
In situ - в месте нахождения.
In vitro - в пробирке.
In vivo - на живом организме; в естественных условиях; в действительности. Sensu lato - в широком значении, в широком понимании (какого-либо слова). Sensu stricto - в узком значении, в узком понимании (какого-либо слова).
Species inquirenda - вид, систематическое положение которого неясно и нуждается в дальнейшем изучении.
350
Приложение2
ПЕРЕЧЕНЬ
ПАРАЗИТОВ И ВЫЗЫВАЕМЫХ ИМИ ЗАБОЛЕВАНИЙ
Научные (латинские) названия
Acanthocephala 335
Acanthocephalus rauschi 335
Acoleorhynchus 329
Acompsocephalidae 42
Adenocephalus 64, 65, 116 - 126, 180, 336
A. pacificum 65, 102, 107,1161,117, 118,
119, 120- 126,180,336-338
A. septentrional is 116
Alveococcus 284, 300
A. multilocularis 299
Alyselminthus crassiceps 251
Anoplocephala 19, 41
Anoplocephalidae 19 - 41,48, 62, 207, 336
Aporina 34
Aporina delafondi 34, 35 As car is lumbricoides 123
bertia 20 - 22
Bertia mucronata 24
B. satyri 22
B. studeri 22
Bertiella 20 - 27, 40, 41
Bertiella mucronata 20, 21, 24, 25, 40
B. satyri 22, 23,25,40,336
B. studeri 20, 21, 22, 23 - 25,40
Bertiella sp. 24, 25
Beveridgia 20
Blastocvstis hominis 123
Bolbosoma sp. 335
Bothriocephalidae 42 - 47, 336
Bothriocephalidea 42, 336
Bothriocephalus 42, 43, 75, 84
B. acheilognathi 42, 43, 44, 46
B. aegyptiacus 43
B. balaenopterae 127
B, cordatus 72
B. dendriticus 77
1 Здесь и далее жирным шрифтом указан номер страницы с рисунком данного вида
В. elegans 82
В, fluviatilis 43
В. gowkongensis 43, 44
В. grandis 127, 131
В. kivuensis 43
В. lanceolatus 86
В. latus 98
В, macrophallus 116
В. opsariichthydis 43,44
В. phoxini 43
Bothriocephalus sp. 116, 127, 131
Braunia j assyensis 140
Buginetta 48 - 52, 53, 62
B. alouattae 49, 50, 62
B, demerariensis 50, 51, 52, 62
Capooria 43
Coelobothrium 43
Coenurus 261
C. brauni 250
C. cerebralis 263, 264, 272
C. glomeratus 253, 254
C. serialis 272, 276
Coenurus sp. 255
Columbia 34
Congeria 329
Cordicephalus 64, 86, 127, 144
Corynosoma strumosum 335
Cyathocephalidae 43
Cyclophyllidea 19, 48, 181, 226, 236, 336
Cysticercus bovis 269
C. cellulosae 241
C. fasciolaris 321
C. longicollis 251, 252
C. multiformis 251
C. taenia-crassicipitis 251
C. talpae 251
C. tenuicollis 257
C. viscerotropica 247
351
Davainea 28, 48
D. asiatica 54
D. celebensis 58, 59
D. formosana 60
D. madagascariensis 50
Davaineidae 48 - 62, 336
Diancyrobothrium 64
Dibothriocephalidae 63
Dibothriocephalus 64, 72, 82, 84, 86
D. minor 11, 80
Z). pygoscelis 103
D. scoticus 103
Dibothrium 72
D. hians 84
Digramma 140, 148
Digramma brauni 140
Dilepididae 181
Diphyllobothriasis, diphyllobdthriosis 107
Diphyllobothriidae 63 - 180, 336
Diphyllobothriidea 63, 336
Diphyllobothrium 14, 46, 63 - 64, 65, 66 -115, 117, 144, 148, 151, 153, 154, 156, 157, 180,336, 337
D. alascense 68, 69, 70
D. arctocephali 116
D. arctocephalinum 116
D. atlanticum 116
D. cameroni 70, 71, 72, 85, 96
D. cordatum 69, 72, 73, 74, 75
D. cordiceps 11
D. dalliae 69, 75, 76, 77, 87, 107, 180
D. dendriticum 69, 77, 78, 79 - 80, 81, 107
D. elegans 82, 83
D, erinacei 155
D. erinaceieuropaei 156, 157
Z). exile 11
D. fayi 65, 72
D. fissiceps 11
D. giljacicum 106
D. glaciate 107, 116
Z). gonodo 104
D. hians 11,84, 85, 86, 96
D, klebanobskii 96, 99, 101
D. krotovi 116
D. lanceolatum 72, 86, 87, 88
D. laruei 11
D. latum 67, 75, 80, 81, 88, 89, 90, 91, 92, 93-98, 99, 101, 102, 106, 107, 120, 122, 153, 166, 180, 337
D. luxi 106, 122
D. mansoni 156, 163
D. mansonoides 156, 163
D. medium 11
D. microcordiceps 11
D. mobile 65
D. nenzi 11, 80
D. nihonkaiense 65, 95, 96, 98, 99 - 102,
107, 180, 337
D. norvegicum 11
D. obdoriense 11
D. oblongatum 11
D. orcini 65,96,102, 103
D. pacificum 65, 96, 116, 117, 120, 121
D. ponticum 66
D. quadratum 103
D, scoticum 96, 103, 104
D. skrjabini 106
D. stemmacephalum 64, 65, 66 - 68, 96,
107, 128
D. strictum 11, 80
D, tungussicum 106
D. ursi 104, 105, 106, 107, 180
D. wilsoni 65
D. yonagoense 65, 66, 68
Diphyllobothrium sp. 68, 122, 132
Diphyllobothrium spp. 95
Diphyllobothrium (Spirometra) mansonoides 162
Diplacanthus 213
Diplogonoporus 64, 127 - 136, 180
D. balaenopterae 63, 122, 127, 128- 131,
132,133, 134, 135, 141, 151
D, brauni 127,134, 135, 140, 180
Z). fukuokaensis 127
D. grandis 127, 128,130, 131, 132,133
Diploposthidae 189
Diplopylidium 181
Dipylidiidae 181 - 188,336
Dipylidiinae 181
Dipylidium 181-188
D. caninum 181,182, 183,184, 185 - 187,
197, 337,339
D. cati 182
D. crassum 182
D. halli 182
D. porimamillanum 182
Diskrjabiniella 181
Drepanidotaenia 204 - 206, 224
D. czaplinskii 204
D. lanceolata 190, 204, 205, 206, 224, 337
Dubium erinaceieuropaei 157
352
Echinococcus 236, 284 - 320, 326, 336
E, borealis 297, 298, 299, 314
E canadensis 285, 291, 295, 296, 297, 298, 310,314
E. canadensis G1 - GIO 296 - 299
E. cruzi 306, 308
E. equinus 284
E./eZWw 284, 285
E. granulosus 236, 284, 285 - 289, 290 -295, 296, 297, 298, 300, 301, 309, 310, 314, 327,336, 336,337
E. granulosus borealis 299
E. granulosus canadensis 295, 299
E. granulosus ortleppi 309, 310
E granulosus var. canadensis 295
E granulosus G5 310
E intermedius 291, 297, 298, 314
E lycaontis 284
E mutilocularis 298, 300, 301, 302,303, 304-306,313,314, 327, 337
E oligarthra 306, 307, 308, 314
E oligarthrum 309
E oligarthrus 306
E ortleppi 285, 309,310,311,314
E pampeanus 306
E sibericensis 299
E unilocularis 287
E vogeZZ 311-313, 314
Echinocotylidae 189
Entamoeba hystolitica 218
E c<?Z/218
Enterobius vermicularis 185, 337
Fimbriariidae 189
Giardia lamblia 123, 218
Glandicephalus 64
\Jalysis martis 258
Hepatoxylon trichiuri 328
Hexagonoporus physeteris 11
Hsuolepis 206
H shengi 207
H. shensiensis 207
Hydatigena granulosa 284
Hydatigera 237, 261, 321 - 327, 336
H. himalayotaenia 321
H taeniaeformis 321, 322, 323, 324, 327, 336
Hydatis 261
Hydatula 261
Hymenolepidae 189
Hymenolepididae 15, 189-225, 336
Hymenolepinidae 189
Hymenolepis 189 - 203, 206, 213, 224, 336
H diminuta 190, 192,193, 194, 195-203, 224, 337
H flavopunctata 192,200, 224
Hfraterna 213, 214, 224, 336
H hibernia 200
H lanceolata 204
H microstoma 190, 210, 211, 224
H папа 190, 210, 213, 214, 215, 224, 336, 337
? Hymenolepis flavopunctata 192
Hymenolepis sp. 200, 225
\ndotaenia 20
Inermicapsifer 28 - 34, 41, 53, 57, 62
I. arvicanthidis 28, 29, 30, 31,41, 336
I. cubensis 20, 28, 29, 30, 31,40, 41
I. hyracis 28
L madagascariensis 20, 28, 29, 30, 31, 32, 40,41
Jouexiella 181
Edlligrewia 34, 41, 337
Killigrewia. delafondi 35
K. frivola 34
K. pamelae 34
Killigrewia sp. 20, 41
Killigrewia (=Aporina) delafondi 34
Kotlania 53
Kotlania celebensis 58
K. formosana 60
Kotlanotaurus 53
Kotorellidae 328
Krabbea W
K. grandis 127, 131
EigulaM, 134, 137- 143, 148, 151, 180
L. intestinalis 137, 138, 139,140, 141 - 143, 151,180
L. mansoni 161
Ligulidae 137, 148
Linstowiidae 28, 35
Liiheella 64
Luheellasp. 120
LQheellidae 63
353
Macranthorhynchus hirudinaceus 335
M. ingens 335
Mathevotaenia 35-37
M. ornithis 36
M.. symmetrica 20, 36, 37, 40, 41, 337
Mathevolepis petrots chenkoi 11
Megacapsula 28
Mesocestoides 226, 227 - 235
M. canislagopodis 233
M. corti 233
M. didelphus22f231
M. lineatus 227, 228, 229, 230, 232, 233
M. litteratus 233
M. variabilis 227, 230, 231, 232, 233
M. vogae 233
Mesocestoididae 226 - 235, 336
Microtaenia 181
Moniezia 20, 37 - 40, 337
M. benedeni 38, 39,40,41
M. expansa 20, 37, 38, 39, 40, 41
Moniliformis moniliformis 335
Multiceps 237, 238, 261,327
M. glomeratus 253, 254, 255
M. longihamatus 321
M. serialis 272
N ep ales ia 34
Nonarmiella 53
Nonarmina 53
Nybelinia 329 - 333
N. lingualis 329
N surmenicola 330, 331, 332, 333, 337
Nybelinia sp. 330, 333
Nybelinidae 328
Oochoristica 36
Oschmarenia 36
Oschmarinetta 53
Parabertiella 20
Pararodentolepis 210, 213, 215, 224, 336
Pararodentolepis (=Hymenolepis) fraterna
218
Plerocercoides proliferus 164
Pleronybelinia 329
Polycephalus 261
Prototaenia 20
Pseudanoplocephala 200, 206 - 209, 224
P. crawfordi 200, 206, 207, 208, 224, 336,
337
Pseudoacanthocephalus bufonis 335
Pseudoaporina 34
Pseudophyllidea 63
Ptychobothriidae 42
Ptychobothrium 43
Pyramicocephalus 64, 144 - 147, 180
P. anthocephala 144
P. phocarum 144, 145, 146, 147, 337
Raillietina 28, 31, 32, 48, 49, 53 - 57, 61, 62, 337
R. alouattae 49, 50
R. asiatica 53, 54, 55, 61, 62
R. brumpti 50
R. celebensis 31, 51, 53, 55, 58, 59, 60, 61, 62
R. cubensis 30
R. demerariensis 49, 50, 53
R. equatoriensis 53
R. formosana 53, 58 - 60
R. garrisoni 31, 53, 55, 56, 62
R. leoni 50
R, luisaleoni 50
R. madagascariensis 28, 30, 31, 53, 55, 56, 61,62
R. quitensis 50, 51
R. siriraji 31, 53, 56, 62
R. tetragona 53
Raillietina sp. 55, 56
Raillietina (Ransomia) celebensis 58
Ransomia 53
Reditaenia 321
Rodentolepis 190, 209 - 223, 224
R. microstoma 210, 211, 212, 213
R. папа 190, 210, 213, 214, 215, 216 - 220, 224, 336, 337
R, straminea 210
Rodentolepis {-Hymenolepis) папа 123, 215,220, 224, 225
Roytmania 53
Ruff er ia 329
Rufferidae 328
Schistocephalidae 148
Schistocephalus 64, 141, 148- 152, 180
S. solidus 140, 148, 149, 150- 152, 180, 337
Schyzocotyle 42 - 47, 336
S. acheilognathi 42, 43, 44, 45, 46, 47, 337
S. fluviatilis 43
S. nayarensis 43
354
Schizorchodes 36
Skrjabinotaurus 53
Sparganum 156
S. mansoni 161
S. sebago 77
Sphyriocephalidae 328
Spirometra 64, 120, 140, 151,153,154, 155 - 180,336, 339
£ decipiens 155, 156, 156, 159,160, 336
S. erinacei 155 - 157, 166
S. erinaceieuropaei 153, 155, 156,157, 158, 159, 160, 163, 165,339
S. houghtoni 155
£ mansoni 156, 161, 165, 170
£ mansonoides 155, 156, 159, 160,162, 163, 164, 165
S. pretoriensis 155, 166
S. proliferum 156, 164, 170,171
£ ranarum 155
£ theileri 155, 166
Syngenes 329
Taenia 16, 236 - 283, 284, 306, 321, 326, 327,336 .
T africana 238, 267
T alveolaris 299
T anseris 204
T anserum 204
T anthocephala 144
T asiatica 54, 243, 247, 248, 249, 261, 270, 276, 277
T. benedeni 39
T brachydera 210
T.brachysoma 249
T brauni 238, 249, 250, 251, 276
T canina 181
T confusa 238, 267
T. crassiceps 238, 251, 252, 276
T crassicollis 306
T cylindrica 267
T demerariensis 50
T diminuta 192, 193
T. echinococcus multilocularis 299
T expansa 38
T glomeratus 238, 253, 254, 276, 337
T. hominis 267
T hydatigena 255 - 257, 258, 276, 337
T infantis 321, 325
T intermedia 258
T intestinalis 143
T jakhalsi 255
T lanceolata 204
T lata 88
T lineata 227
T leptocephala 192
T longihamatus 238
T madagascariensis 28, 30
T martis 258, 259, 260, 261, 276, 338
T microstoma 210
T minima 192
T multiceps 238, 261, 262 - 264, 265, 266, 276, 277, 336
T. multiformis 251
T murisdecumani 210
T папа 213
T oligarthra 306
T osculus marginalibus oppositus 181
T phillipina 267
T phocarum 144
T pisiformis 284
T saginata 238, 243, 247, 248, 267, 268, 269, 270 - 272, 276, 277, 327, 337
T saginata asiatica 238, 247, 277
T serialis 238, 272, 273 - 275, 276, 277
T serialis brauni 249
T s err ata 284
T solium 236 - 238, 239 - 242, 243 - 247, 261,268, 276, 277, 327,337
T taeniaeformis 238, 321, 336
T tonkinensis 267
T ursina 255
T varesina 192
Taenia {Bertia) mucronata 24
Taenia sp. 277
Taeniarhynchus saginatus 267
Taeniidae 236 - 327, 336
Tenoretta 48, 53, 58 - 61, 62
T celebensis 51,55, 58, 59, 60, 62
T formosana 60, 62
Tentacularia 329
Tentaculariidae 328 - 334, 336
Tetrathyridium 226
Trypanorhyncha 328, 330, 336
Trypanorhynchoidea 328
Variolepis 213
Vampirolepis 190, 213
Vesicaria 261
355
Русские названия
Аденоцефал(ы) 123, 124
Альвеолярный коллоид 299
Альвеолярный эхинококкоз 304, 305
Альвеококк 300, 303,
Аноплоцефалиды 20, 21, 41,206, 207, 336,338
Бактериальный менингоэнцефалит 265
Бертиеллы 24, 25
Блошиный солитёр 185
Ботриоцефалидеи 42,46
Ботриоцефалиды 42, 45
Висцеральный спарганозис 168
Внутрикостный спарганозис 170
Вооружённый цепень 242
Гангрена Фурье 169
Гидатигера 325
Гидатигера лентовидная 321
Гименолепидиды 189, 190, 199, 206,210, 212, 215, 218, 220, 224, 225, 336
Глазной ценуроз 250, 251, 261
Глазной цистицеркоз 244, 261
Даванеиды 48, 50, 51, 62, 336
Дипилидииды 337
Дипилидиоз 339
Диплогонопоры 127, 131, 132, 134
Дифиллоботриидеи 46
Дифиллоботрииды 63 - 65, 80, 91, 99, 119, 121, 123, 127, 130, 133, 140, 144, 146, 179, 180, 336,337
Дифиллоботриоз, дифиллоботриазис, дифиллоботриозис 93 - 96, 107, 108, 120
Дифиллоботриум 154
Карцинома с обратным развитием 299
Кожный ценуроз 276
Колючеголовые черви 335
Лентец(ы) 11, 63, 64, 108
Лентец аляскинский 68
Лентец чайковый 79-81
Лентец широкий 88, 93,95, 97, 98, 106 -108, 123, 134, 180, 337
Ленточные черви 11, 19, 195, 237, 335, 338
Лёгочный спарганозис 169
Лигула 137, 139, 141, 142
Малый солитёр 213
Мезоцестоидес(ы) 227,232,233
Мезоцестоидиды 226
Мультилокулярная эхинококковая опухоль печени 299
Нейроцистицеркоз 243 - 245
Нибелиния 331 - 333
Овечий мозговик 261, 338
Огуречный цепень 183
Острицы 186, 337
Паразитарный рак печени 305
Пирамикоцефал(ы) 144-146
Плоские черви 11
Подкожный спарганозис 166, 167
Подчелюстной эхинококкоз 309
Полицистный гидатидоз 313, 314
Пролифелирующий спарганозис 165 -167
Райллиетина Гаррисона 55
Райллиетины 55, 57, 58
Ремнец(ы) 137, 142
Ремнец обыкновенный 137
Свиной солитёр 239, 338
Свиной цепень 240, 242, 243
Скребни 335
Собачий солитёр 185
Солитёр(ы) 11, 14, 88, 122, 242
Солитёр грызунов 210
Солитёр жёлчного протока мыши 210
Спарган(ы) 156, 165, 166, 169, 170
Спарган Мансона 161
Спарганозис 156, 166- 168, 171 - 173
Спарганозис подкожный, глазной, ротовой, висцеральный, лёгочный, мочеполовой, церебральный, костный 167
356
Спарганозис пролифелирующий 165 -167
Спарганозис ротовой полости 168
Спарганум(ы) 155, 156
Спирометры 154- 156, 165, 167, 168, 171 - 173, 180, 339
Студенистый (коллоидный) рак 299
Тениоз, тениазис, тениозис 238,243 -246, 271,272
Тенииды 236, 237, 239, 240, 246, 253, 284, 326, 327, 336
Тения 237, 243, 248, 270, 276, 277
Тения азиатская 248
Тения кунья 258
Тения многоголовая 261, 263, 264
Тения, образующая водянистые пузырьки 256
Тения пузыреобразующая 256
Теноретта Целебесская 59
Тонкошеий пузырчатый червь (thinnecked bladderworm) 258
Трипаноринхи 328, 329, 331,333
Ценур 264, 265, 266, 275, 276
Ценуроз(ы) (coenurosis) 238, 250, 265, 266
Ценуроз сериальный 276
Цепень(цепни)11,187
Цепень бычий (beef tapeworm) 269 - 272, 327, 337, 338
Цепень карликовый 198, 213 - 220, 224, 337,338
Цепень кошачий (cat tapeworm) 323, 327, 338
Цепень крысиный (rat tapeworm) 192, 194 -200,218, 224,337
Цепень лисий (fox tapeworm) 304
Цепень огуречный 185, 186, 337
Цепень свиной (pig tapeworm) 241 - 246, 271,327, 337
Цепень собачий 185, 186, 187, 337, 338
Цепень тыквенный 185
Церебральный спарганозис 169
Церебральный ценуроз 265, 266, 276
Церебральный цистицеркоз 245, 261
Церебральный эхинококкоз 293
Цистицеркоз(ы), цистицеркозис (cysticercosis) 238, 242 - 244, 246, 260, 270
Циклофиллидеи 19, 48
Щелеголовы 148
Эхинококк(и) 286, 289 - 291, 297, 308, 309,314, 327
Эхинококк канадский 297
Эхинококк многокамерный 300, 304, 305, 337
Эхинококк однокамерный, или гидатидозный (hydatid tapeworm) 287, 290, 291, 292, 293-295, 297, 337
Эхинококк Фогеля 311,312
Эхинококкоз 290, 291, 293 - 295, 314
357
Научное издание
УДК 576.895.121
Гаевская А. В. Мир паразитов человека. III. Цестоды и цестодозы пищевого происхождения. - Севастополь: ООО «Колорит», 2017. - 358 с., илл. - 184.
Отпечатано с готового оригинал-макета
Издание настоящего тома, как и обоих предыдущих томов монографии «Мир паразитов человека» (Гаевская, 2015, 2016), осуществлено за счёт личных средств автора.
Подписано в печать 27.09.2017 г. Заказ № 66. Тираж 100 экз.
ООО «Колорит»
ОГРН 1169204061454 от 18.11.2016 299011, г. Севастополь, ул. Ленина, 28 Тел (8692) 54-31-46 e-mail: colorit.ooo2016@yandex.ru