Author: Волькенштейн М.В.
Tags: материальные основы жизни биохимия молекулярная биология биофизика молекулярная физика
Year: 1965
Text
<чХ
^
М. В. ВОЛЬКЕН ШТЕЙН
МОЛЕКУ Ы
Ж ЗНЬ
М. В. ВОЛЬКЕНШТЕЙН
МОЛЕКУЛЫ
И ЖИЗНЬ
ВВЕДЕНИЕ
В МОЛЕКУЛЯРНУЮ
БИОФИЗИКУ
ИЗДАТЕЛЬСТВО «НАУКА»
' ГЛАВНАЯ РЕДАКЦИЯ
ФИЗИКО-МАТЕМАТИЧЕСКОЙ ЛИТЕРАТУРЫ
МОСКВА 1965
В 71 АННОТАЦИЯ
57.04
УДК 577.3 Молекулярная биофизика — актуальная
область современного естествознания, в
которой за последние годы сделаны
крупнейшие открытия, описанные в этой книге:
установлена молекулярная природа
наследственности, изменчивости, иммунитета и т. д.
В книге изложены основные понятия
биологии (генетики и науки о клетке) с
точки зрения физики. Изложены современные
представления о синтезе белков, подробно
описаны работы по установлению так
называемого генетического кода.
Проанализированы общие вопросы связи биологии с
физикой и биофизики с квантовой механикой.
Основные разделы книги написаны доступно
для неспециалиста, но наряду с этим дано
и подробное математическое изложение
ряда вопросов, напечатанное мелким
шрифтом.
Книга рассчитана на широкий круг
читателей, интересующихся молекулярной
биологией и биофизикой: на физиков,
биологов, химиков, математикоз — студентов,
аспирантов, педагогов, научных работников.
Михаил Владимирович Волькенштейн
Молекулы и жизиь
М., 1965 г., 504 стр. с илл.
Редактор В, А. Лешковцев.
Техн. редактор К, Ф. Брудно, Корректор 3. В, Мтояеева
Сдаио в иабор 13/V 1965 г. Подписано к печати 22/IX 1965 г. Бумага 60 X 907ie-
Физ. печ. л. 31,5. Условн. печ. л 31,5. Уч.-нзд. л. 31,03. Тираж 14000 экз.
Т-13233. Цена книги 1 р. 75 к. Заказ 1515.
Издательство «Наука»
Главная редакция физико-математической литературы
Москва, В-71, Ленинский проспект, 15.
Ленинградская типография № 2 имени Евгении Соколовой Главполиграфпрома
Государственного комитета Совета Министров СССР по печати.
Измайловский проспект, 29.
ОГЛАВЛЕНИЕ
Предисловие 9
Глав а 1
Физика и биология И
Физика и жизнь 11
Молекулярная физика • • . 20
Молекулярная биофизика , ...... 26
Термодинамика и биология 30
Теория информации -36
Глава 2
Клетки, вирусы, наследственность .45
Живая клетка . ' ' Ш
Деление клеток • . . . . 55
Вирусы и бактериофаги 63
Основные законы генетики 69
Мутации и изменчивость 78
Генетика бактерий и фагов ... 85
Глава 3
Биологические молекулы 99
Аминокислоты и белки • 99
Асимметрия биологических молекул 106
Первичная структура белка Н4
Нуклеиновые кислоты . 120
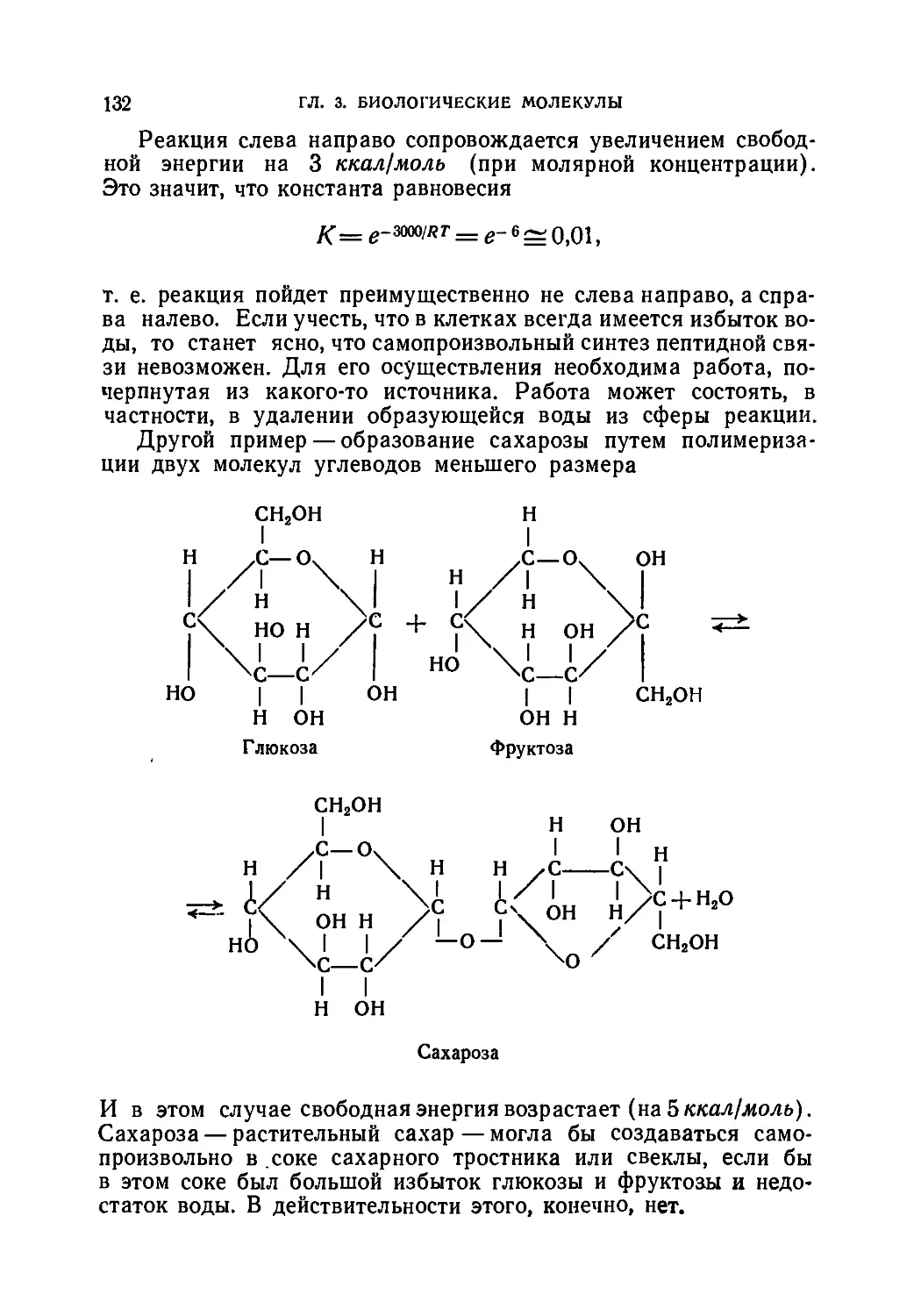
Некоторые биохимические процессы в клетке • • • 130
Глава 4
Физика макромолекул .145
Физические свойства макромолекул 145
Поворотно-изомерная теория макромолекул ........ 153
Макромолекула — кооперативная система . 160
Кристаллические полимеры . 167
Методы исследования макромолекул в растворе . . ..... 174
Полиэлектролиты 182
6 ОГЛАВЛЕНИЕ
Глава 5
Физика белка 188
Вторичная структура белка ....... 188
Третичная и надмолекулярная структура белка . . • . . . 200
Конформационные превращения белка 207
Теория переходов спираль — клубок ...... , . . ■ . 217
Оптические свойства белков и полипептидов 225
Оптическая активность ос-спиралей 235
Глава 6
Физика нуклеиновых кислот . 244
Биологическая роль нуклеиновых кислот . ......... 244
Вторичная структура ДНК, РНК и полинуклеотидов .... 250
Денатурация ДНК • . . 266
Ренатурация ДНК и силы, стабилизующие двойную спираль 275
Редупликация ДНК 283
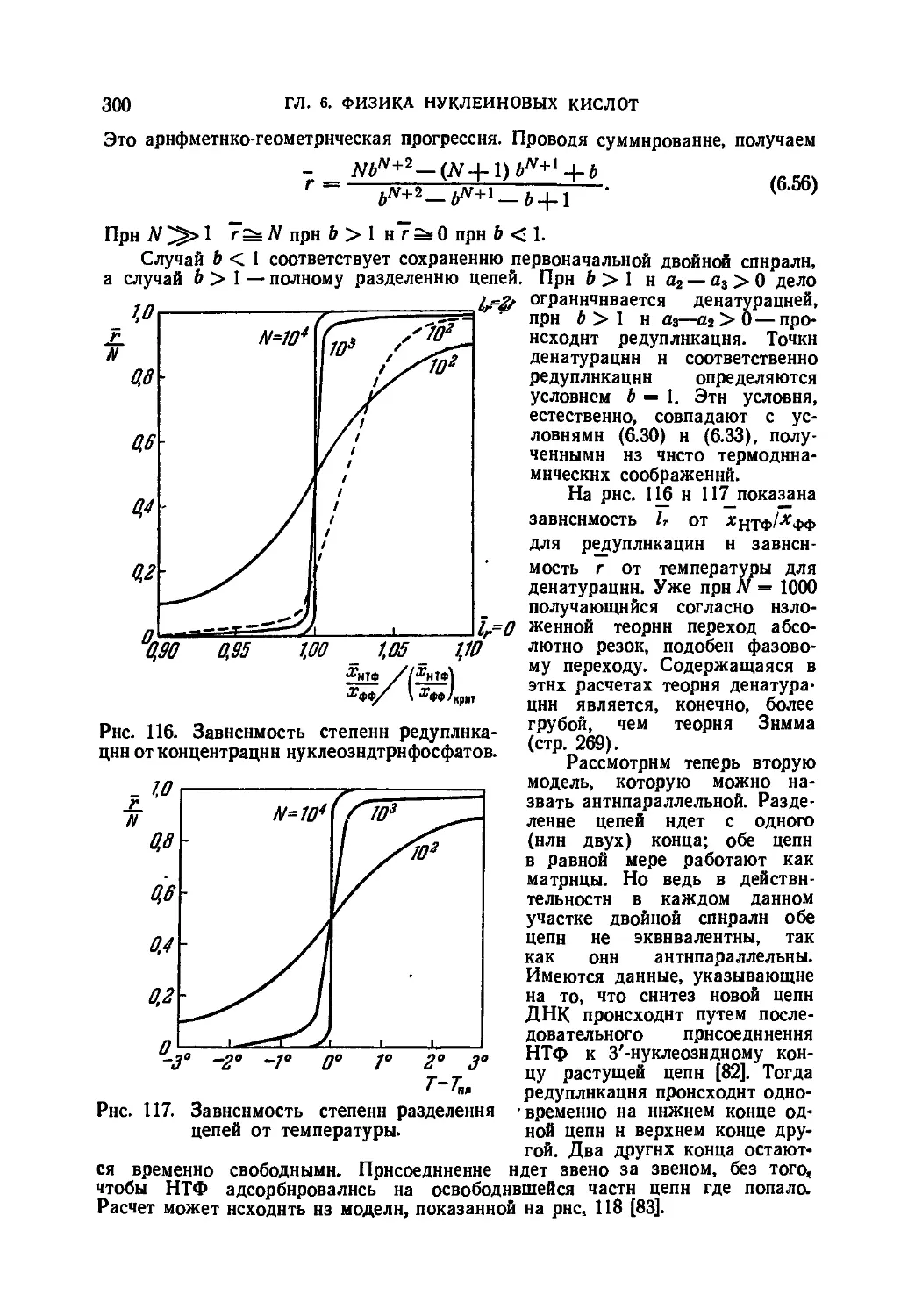
Статистическая физика и кинетика редупликации ДНК . . • 296
Глава 7
Синтез белка , . 310
Проблема генетического кода 310
Матричный синтез белка . 319
Генетический код 333
Химический мутагенез 345
Проблемы регуляции . ...... 354
Глава 8
Биологическая специфичность и строение молекул 365
Иммунитет 365
Антитела и антигены 374
Ферментативные реакции . 384
Природа действия ферментов 393
Аллостеризм и оксигенация гемоглобина 404
Нуклеопротеиды и синапсис хромосом 412
Стереохимическая теория запаха ■ . . 420
Глава 9
Меха нохи ми чес кие процессы 424
Природа механохимических процессов 424
Мышечная деятельность 431
Молекулярные теории мышечной деятельности ....... 441
Движения клеток и митоз 458
Глава 10
Проблемы молекулярной биофизики ... 466
Макромолекулы и биология ........... 466
Молекулярная биофизика и квантовая механика 471
Заключение 479
Литература . 482
Предметный указатель 501
Посвящаю
Стелле Иосифовне
Алениновой
«Не то, что мните вы, природа —
Не слепок, не бездушный лик.
В ней есть душа, в ней есть свобода,
В ней есть любовь, в ней есть язык».
Ф. #. Тютчев.
«Природа не храм, а мастерская,
и человек в ней работник».
Я. С. Тургенев.
ПРЕДИСЛОВИЕ
Противоречат ли эти эпиграфы друг другу? Должны ли мы
только восхищаться красотой и прелестью живой природы —
благоуханием розы, полетом бабочки, мыслью человека, или
эти чудесные явления подлежат точному научному
исследованию?
Природа — грандиозная мастерская, в которой развитие
материи, подчиненное строгим объективным законам, привело к
созданию живых организмов — сложнейших систем,
характеризуемых замечательной согласованностью структуры и функций.
Вершина этого развития на Земле — человеческий разум,
который сегодня имеет уже реальные возможности не только
познать законы жизни, но и активно вмешаться в окружающую
природу ради блага общества. Задачи материалистического
естествознания в этом и состоят. Но подлинная наука не может
существовать без эстетического восприятия изучаемой
действительности. Душа и свобода природы, о которых говорит
гениальный русский поэт, представляют, с точки зрения ученого,
выражение законов биологии, физики и химии, но не
становятся от этого менее привлекательными и интересными.
Эта книга должна служить введением в молекулярную
биофизику. Молекулярная биофизика есть, с одной стороны,
раздел молекулярной физики, с другой — молекулярной
биологии— новой области естествознания, созданной в последние
десятилетия.. Объединенные усилия биологов, физиков, химиков
позволили раскрыть сущность ряда основных явлений жизни,
исходя из строения и свойств молекул, входящих в состав
организмов — прежде всего белков и нуклеиновых кислот.
Достижения молекулярной биологии знаменуют подлинное
торжество материализма в той области, которая до недавнего
времени казалась наиболее таинственной и загадочной.
Дальнейшее развитие науки обещает человечеству необозримые
перспективы как в расширении теоретических знаний, так и в
практике — в сельском хозяйстве, медицине, химической технологии,
10
ПРЕДИСЛОВИЕ
Задача книги — рассказать читателям —биологам, физикам,
химикам и всем, кто хочет познакомиться с молекулярной
биофизикой, об этой области науки. Наряду с разделами,
написанными популярно, в книгу включены и разделы, посвященные
более строгому, математическому рассмотрению ряда вопросов,
в том числе и исследованных автором и его сотрудниками. Эти
разделы могут быть опущены при* первом чтении. Каждая глава
: снабжена библиографией, имеющей выборочный характер.
Содержание молекулярной биофизики этой книгой далеко
не исчерпывается. В ней рассмотрены главным образом
вопросы, непосредственно связанные со структурой и свойствами
белков и нуклеиновых кислот.
Я благодарю всех ученых, прочитавших рукопись книги, за
ценные советы и замечания.
Ленинград, М. Волькенштейн
сентябрь 1964 г.
ГЛАВА I
ФИЗИКА И БИОЛОГИЯ
ФИЗИКА И ЖИЗНЬ
Живые организмы, существующие на Земле, представляют
собой открытые, саморегулирующиеся и
самовоспроизводящиеся системы, важнейшими функциональными веществами
которых являются биополимеры — белки и нуклеиновые
кислоты. Весьма общие научные соображения доказывают
существование жизни за пределами Земли — в Космосе, если не на
других планетах солнечной системы. Сегодня мы знаем лишь
земные организмы — сообщения о нахождении следов
микроорганизмов в метеоритах пока не подтверждены.
Термин «открытая система» в применении к организму имеет
то же значение, что и в термодинамике. Открытой называется
система, обменивающаяся с окружающей средой веществом и
энергией. Такой обмен — необходимая черта жизни; его
необратимое прекращение означает смерть. Одна из основных задач
биохимии — изучение химических процессов метаболизма, т. е.
обмена веществ.
Термин «саморегулирующаяся» указывает на высокую
степень согласованности, регуляции всех физико-химических и
биологических процессов внутри организма. Эта регуляция
обеспечивается специфической структурой организма и его составных
частей вплоть до молекул.
Термин «самовоспроизводящаяся» говорит о характерных
для живого свойствах роста .и размножения. Эти процессы,
которые также удается проследить вплоть до
самовоспроизведения молекул, происходят путем конвариантной редупликации
[1]. Речь идет о следующем: организмы и их составные части,
размножаясь, редуплицируются, т. е. создают свои копии.
Копии эти не являются вполне точными, так как в них отражают-»
ся изменения, вариации объекта, возникающие перед копиров
ванием. Ясно, что, будучи открытой системой, редуплицируемый
объект подвергается действию внешней среды, вызывающему те
или иные изменения.
Приведенное определение живого организма представляет
развитие классической формулы Энгельса: «Жизнь — это способ
12
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
существования белковых тел, существенным моментом
которого является постоянный обмен веществ с окружающей' hn
внешней природой...» [2, стр. 244]. Формула Энгельса полностью
сохранила свое значение. О нуклеиновых кислотах Энгельс еще
не мог знать — сейчас нам известно, что они также необходимы
для жизни, как белок. В связи с этим следует подчеркнуть, что
живые организмы обязательно содержат взаимодействующие
вещества различного характера, что для жизни необходима
химическая гетерогенность. Отдельно взятое химически
индивидуальное вещество любой сложности — будь то белок или
нуклеиновая кислота — не может быть живым. Бессмысленно
говорить о живых молекулах. Жизнь возникает при специальном
взаимодействии ряда молекул различного сорта.
Совершенно очевидно, что организмы значительно сложнее
любых известных объектов неживой природы. В какой же мере
физика может исследовать строение и свойства живых
организмов?
Глубокая связь физики и биологии сохранялась на
протяжении длительного времени. Затем она была в какой-то мере
утрачена. В наши дни развитие биологии вновь привело ее к
тесному контакту с физикой.
Укажем прежде всего что основной закон физики — закон
сохранения и превращения энергии — был открыт при изучении
живых организмов. Майер обратил внимание на то, что у
людей, живущих в тропиках, венозная кровь по яркости окраски
приближается к артериальной. Отсюда он заключил, что при
повышенной температуре окружающей среды нужна меньшая
затрата энергии для поддержания постоянной температуры
тела. Дальнейший ход рассуждений привел Майера к
формулировке общего закона и к оценке механического эквивалента
теплоты. Менее известно, что и другой первооткрыватель
закона сохранения энергии — Гельмгольц, также исходил из
биологических данных. Гельмгольц писал: «По Шталю, силы,
действующие в живом теле, суть физические и химические силы
органов и веществ, но какая-то присущая телу жизненная
душа или жизненная сила может связывать или освобождать их
деятельность... Я нашел, что теория Шталя приписывает всякому
живому телу свойства так называемого perpetuum mobile
(вечного двигателя)... Таким образом я натолкнулся на вопрос:
какие отношения должны существовать между различными
силами природы, если принять, что perpetuum mobile вообще
невозможно...» [3, стр. 13].
Материалистическое естествознание исходит из того, что
наиболее общие законы движения материи универсальны и в этом
смысле живые организмы подчиняются тем же законам при-
ФИЗИКА И ЖИЗНЬ
13
роды, что и неживые тела. Задача науки состоит в выяснении
специфической сущности живого, в выяснении природы явлений
жизни. Здесь возможны только два пути. Первый основывается
на материальности биологических явлений и возможности
познать их сущность средствами научного естествознания. Второй
путь характеризуется приписыванием живому организму
особенностей, принципиально непознаваемых точной наукой —
физикой и химией. Идя по этому пути, приходится поставить
непреодолимый рубеж между биологией, с одной стороны, и
физикой и химией — с другой — и считать, что организмам
присуща некоторая «жизненная сила», определяющая
направленность биологических процессов, их так называемую
целесообразность. Эта концепция называется витализмом. Именно
против этого направления в науке выступал Гельмгольц (а также
Майер). В измененной форме витализм существует и теперь.
Он апеллирует к несводимости биологии к физике и химии,
подчеркивая качественную специфичность биологических
закономерностей, которые принципиально нельзя понять на основе
физического и химического исследования. Современные виталисты
не отвергают, конечно, применения физики и химии к биологии
и, напротив, охотно говорят о пользе, приносимой физическими
и химическими методами и приборами при биологических
исследованиях. Такие утверждения, однако, тривиальны и
лишены содержания. Биология пользуется физическими методами
очень давно — по крайней мере с того времени, как Левенгук
применил к биологическим объектам микроскоп — физический
прибор. Каждый раз, когда мы измеряем температуру тела с
помощью градусника, а не на ощупь, мы пользуемся физическим
методом, физическим прибором при решении проблемы
несомненно биологического характера. Решение вопроса о
соотношении физики и биологии, конечно, не сводится к применению
физических методов и приборов.
Проблемой соотношения физики и биологии занимались
крупнейшие ученые. НильсБор[4] исходил из принципа
дополнительности. Он считал, что, собственно, биологические законы
дополнительны к тем, которым подчиняются неживые тела. Иными
словами, нельзя одновременно изучать физико-химические
свойства организма и явления жизни — познание одного исключает
познание другого. Принцип дополнительности в трудах Бора
возник как обобщение принципа неопределенности квантовой
механики. Атомная физика показала принципиальную
невозможность ^исключить взаимодействие микрообъекта (например,
электрона) с прибором, вследствие чего оказывается
невозможным одновременное определение координаты и скорости
микрообъекта и других его «некоммутирующих» характеристик. Бор
14
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
рассматривал жизнь «как основной постулат биологии, не
поддающийся дальнейшему анализу, подобно тому, как
существование кванта действия ... образует элементарную основу
атомной физики» [4, стр. 37]. Тем самым Бор считал биологические
и физико-химические исследования дополнительными, т. е.
несовместимыми, хотя и не противоречащими друг другу.
Существенно, что, по мысли Бора, это отнюдь не означает наличия
какой-либо границы применения физики и химии к решению
биологических проблем. «...Ни один результат биологического
исследования не может быть однозначно описан иначе, как на
основе понятий физики и химии, совершенно так же, как
всякое описание опыта даже в атомной физике должно в
конечном счете опираться на понятия, необходимые для
сознательной регистрации чувственных восприятий» [4, стр. 37].
Исходя из того же принципа дополнительности, говорят о
несовместимости познания морфологии и функциональности,
гомологии и аналогии, среды и внутреннего состояния,
наследственности и адаптируемости. Утверждают, что, изучая одну
сторону биологического явления, мы так сильно влияем на
другую, что она оказывается принципиально непознаваемой [5].
Так как в жизни одновременно проявляются все некоммути-
рующие факторы, жизнь непознаваема. Мы можем изучить
атомно-молекулярную структуру организма, но для этого он
должен быть убит.
Изложенная точка зрения, в сущности, не нова. Еще Гете
устами Мефистофеля говорил:
«Кто хочет живое описать и познать,
Пытается дух из него изгнать.
И вот он держит все части в руках,
Но связи духовной в них нет —
лишь прах.
«Encheiresin naturae»—вот химии слово,
Самой над собой посмеяться
готовой»*).
Взгляды Бора не остались неизменными. Позднее он
говорил уже не о дополнительности биологии и физики, но о
дополнительности «между практически применяемыми в
биологии соображениями физико-химического характера и понятиями,
прямо связанными с целостностью организма и выходящими
*) Я попытался дать точный перевод этого интересного отрывка. Еп
cheiresin naturae — повадка природы, способ ее дейстия.
ФИЗИКА И ЖИЗНЬ
15
за рамки физики и химии» [4, стр. 107]. Применение принципа
дополнительности в биологии Бор аргументирует уже не по-
стулативным характером понятия жизни, но чрезвычайной
сложностью живого организма как целостной системы. В своем
последнем выступлении, посвященном обсуждаемым вопросам
[6], Бор говорит уже только о практической, но не
принципиальной дополнительности, связанной с неисчерпаемой сложностью
жизни.
С ранними статьями Бора трудно согласиться. Принцип
дополнительности, которому Бор придает такое большое
значение, нельзя считать законным обобщением принципа
неопределенности. Последний формулирует в негативной форме строгие
квантовомеханические закономерности, действующие в
микромире. Эти законы неприменимы к организмам, так как
организмы принципиально макроскопичны. Жизнь в целом нельзя
считать квантовомеханическим эффектом, хотя квантовые
процессы и играют важную роль в некоторых биологических
явлениях. Сложность организмов нельзя считать принципиальным
препятствием для их физико-химического изучения.
Неисчерпаемость живого в философском смысле не отличается от
неисчерпаемости любого материального объекта, скажем,
электрона.
Ленин писал: «Мы не можем представить, выразить,
смерить, изобразить движение, не прервав непрерывного, не
упростив, угрубпв, не разделив, не омертвив живого.
Изображение движения мыслью есть всегда огрубление, омертвление, —
и не только мыслью, но и ощущением, и не только движения, но
и всякого понятия» [7, стр. 243].
Здесь речь идет о самой сути диалектики. Ленин
формулирует ее общие законы, равно справедливые для познания
материальных объектов живой и неживой природы.
«Омертвление живого» здесь имеет совершенно не тот смысл, что в
словах Гете. Ясно, что возможность познания относительной,
а не абсолютной истины не ставит никаких границ
конкретному изучению любого явления природы — живой или
неживой.
В ответе на мое письмо, в котором выражались сомнения по
поводу его взглядов, Нильс Бор писал: «.„Я хорошо знаю, что
некоторые из моих ранних высказываний вызвали неправильное
понимание моей общей установки. Более современное
изложение моих взглядов, которые, насколько я могу судить,
находятся в тесном согласии с Вашими, дано в короткой речи [6]...
В настоящее время я работаю над более полным изложением
эпистемологических проблем в физике и биологии...». Эта
работа оборвалась смертью великого ученого.
16
ГЛ. I. ФИЗИКА И БИОЛОГИЯ
В 1945 г. другой замечательный физик — Шредингер
написал содержательную книгу о связи физики с биологией [8]*).
Шредингер формулирует различие между объектами живой и
и неживой природы. Оно сводится к исключительно высокой
упорядоченности организма, который в этом смысле подобен
«апериодическому кристаллу», к способности этой
упорядоченности поддерживать себя и производить упорядоченные
явления. Здесь речь идет о саморегуляции и самовоспроизведении.
Шредингер писал, что организмы непрерывно создают
«порядок из порядка» в том смысле, что «извлекают упорядоченность
из окружающей среды» в виде «хорошо упорядоченного
состояния материи в пищевых продуктах». Это последнее
утверждение подвергнуто убедительной критике Пасынским [9],
указавшим, что при пищеварении происходит полная деградация
упорядоченных молекул белка, что можно питаться и простой
смесью аминокислот. Организмы извлекают из окружающей
среды не упорядоченность (мерой которой является
информация или негэнтропия, см. стр. 39), а свободную энергию. Но
эта критика только подтверждает основную мысль Шредингера
о возможности физического (точнее, физико-химического)
истолкования явлений жизни. Жизнь творит «порядок из
беспорядка», а такого рода процессы давно известны в физике —
например, кристаллизация жидкости.
Шредингер отвечает на вопросы о причине макроскопич-
ности, многоатомности организма. В системе, состоящей из
малого числа атомов, статистические флуктуации должны
уничтожить всякую упорядоченность. Шредингер обосновывает
материалистическое представление о том, что генетические факторы,
обусловливающие появление наследственных признаков,
заложены в определенных молекулярных структурах клетки, и
ставит вопрос о природе такого наследственного вещества и
причинах его исключительной устойчивости. Последующее
развитие науки полностью подтвердило взгляды Шредингера и дало
ответы на ряд поставленных им вопросов. В своей книге
Шредингер, не погружаясь в глубь философии, рассмотрел
конкретные перспективы применения физических идей в биологии. При
этом он исходил из оптимистической концепции о
познаваемости природы жизни средствами физики.
Напротив, в книге Эльзассера [10], также являющегося
физиком, биология и физика противопоставляются друг другу.
Эльзассер утверждает, что запас информации, содержащейся
*) В эпилоге к этой книге, не связанном с ее основным текстом,
Шредингер изложил некий вариант идеалистической философии, не
заслуживающий внимания*
ФИЗИКА И ЖИЗНЬ
17
в исходной зародышевой клетке (см. стр. 60), значительно
меньше, чем во взрослом многоклеточном организме. «Никакой
возможный набор измерений, выполненных над зародышевой
клеткой, не может вскрыть полный объем информации вида».
Эльзассер развивает так называемую эпигенетическую
концепцию, основанную на наличии причинных закономерностей,
определяющих возрастание запаса информации при росте эмбриона.
Эти закономерности не имеют себе подобных в физике и
обладают специфическим «биотонным» характером. Биотонное
поведение физически непредсказуемо. Эльзассер полемизирует с
Шредингером и сознательно отстаивает свою точку зрения, как
виталистическую.
Развитие биологии опровергает эти представления. Они
оказываются несостоятельными и в свете анализа, проведенного на
основе молекулярной физики и теории информации (см. стр. 40).
Современная биология неотделима от физики и химии и не
оставляет никаких возможностей витализму. В то же время
отпали и упрощенные механистические представления.
Исследование природы кровообращения, проведенное Гарвеем, и другие
открытия XVII и XVIII веков привели ряд мыслителей этой
эпохи к концепции организма-машины. Декарт считал, что все
функции живого сводятся к химии и механике. Синтез
мочевины, осуществленный Вел ером в 1828 г., уничтожил, казалось,
грань между химией живого и неживого. Все это оказалось
неверным и сегодня так уже никто не думает.
Правильное понимание соотношения между физикой, химией
и биологией основывается на диалектико-материалистическом
анализе проблемы. Энгельс писал: «Называя... биологию —
химией белков, я желаю этим выразить переход одной из этих
наук в другую, — следовательно, как существующую между
ними связь, непрерывность, так и различие, дискретность обеих»
[2, стр. 200].
И, далее: «Физиология есть, разумеется, физика и в
особенности химия живого тела, но вместе с тем она перестает быть
специально химией...» [2, стр. 204].
Таким образом, Энгельс считал, что в основе биологических
явлений лежат явления физические и химические и,
следовательно, природа жизни может быть познана при дальнейшем
развитии физики и химии. Энгельс утверждал это с полной
определенностью: «...Химия подводит к органической жизни, и она
продвинулась достаточно далеко вперед, чтобы гарантировать
нам, что она одна*) объяснит нам диалектический переход
к организму» {2, стр. 198]. «...Остается добиться еще только
*) Курсив Энгельса.
2 М. В. Волькенштейн
18
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
одного: объяснить возникновение жизни из неорганической
природы. На современной ступени развития это означает не что
иное, как следующее: изготовить белковые тела из
неорганических веществ» [2, стр. 156].
В свете современной науки последняя фраза неверна. Мы
знаем сейчас, что живой организм состоит не только из белков,
что белковая молекула не живет. Более того, в конце 1963 г.
был впервые синтезирован белок (инсулин, см. стр. 116), но это
крупное достижение биохимии не означает, конечно, решения
проблемы жизни. Тем не менее суть дела от этого не меняется.
Диалектико-материалистическая концепция Энгельса в целом
не только сохранила свое значение, но и приобрела новое
богатое содержание. Она противостоит как витализму, так и
механицизму. Не только нет никаких границ для физики и химии
в биологин, но, напротив, без физики и химии познание жизни
невозможно. В то же время живое отлично от неживого.
Биология несводима к физике и химии в том смысле, что
биологические законы действуют только в живой природе и имеют
интегральный характер по отношению к более простым физическим
и химическим закономерностям [11]. (См. также статьи Энгель-
гардта, Маркова, Тумермана в [12].)
«Организм есть, несомненно, высшее единство, связывающее
в себе в одно целое механику, физику и химию» [2, стр. 199].
В биологии мы имеем дело с последовательностью уровнен
строения и свойств: молекулярный уровень, клеточный,
индивидуальный или организменный, популяционный и далее вплоть
до биосферы в целом. Каждый из уровней включает в себя
предыдущие, он интегрален по отношению к ним, и
характеризуется специфическими закономерностями. Эти закономерности не
противоречат более простым законам поведения на
предшествующих уровнях, но включают их. Тем самым нет ни границ,
ни противоречий между биологией, с одной стороны, и физикой
и химией, с другой. Молекулярная биология в значительной
мере сводится к физике и химии, но на последующих уровнях
такой сводимости нет.
Диалектико-материалистическое понимание проблемы
перспективно и оптимистично. Объединение биологии с физикой и
химией обещает объяснение всех основных явлений жизни. При
дальнейшем научном исследовании мы можем, конечно,
встретиться с границами применимости существующей физической
теории. Тогда придется расширить теорию, включив в нее
какие-то новые принципы. Однако до сих пор такие границы не
обнаруживаются. Поэтому нет оснований принимать
умозрительные концепции, основанные на «биотонных» законах или
принципе дополнительности,
ФИЗИКА И ЖИЗНЬ
19
Задача науки применительно к обсуждаемой проблеме
состоит в раскрытии существа специфических процессов,
отличающих живое от неживого. Исследование строения и свойств
белков и нуклеиновых кислот действительно показало, что в
организмах происходят явления, отличные от встречающихся в
других телах. Эти явления связаны со специфическими
свойствами биополимеров, в частности, с ферментативным
катализом, с обратной связью (стр. 406), обеспечиваемой стереохими-
ческими соотношениями и т. д. Существенно, однако, что эти
новые для науки явления с успехом исследуются на основе
ранее установленных принципов физики и химии. Эти
исследования вскрывают сущность того высшего единства, связывающего
в себе в одно целое механику, физику и химию, о котором
говорил Энгельс.
Практически независимо от анализа общей проблемы
соотношения физики и биологии развивалась биофизика. Вплоть
до недавнего времени ее предметом были, с одной стороны,
проявления общих законов физики в живой природе, с другой —
физиологические явления, более или менее непосредственно
связанные с очевидными физическими воздействиями на организм.
Особенно подробно изучались органы чувств, задача которых и
состоит в восприятии организмом физических и химических
воздействий. Уже Гельмгольц подверг ряд относящихся сюда
проблем строгому физико-математическому анализу. Сеченов
говорил, что физиология есть физико-химия живого организма.
Структура традиционного курса биофизики, как правило,
подобна структуре курса физики (см., например, [13, 14]):
механика организмов, тепловые явления в них, биоакустика,
действие света на организмы, электрические явления и т. д. При
этом речь идет либо о свойствах организмов, рассматриваемых
как физические тела, либо о воздействии физических полей на
организмы.
Традиционная биофизика не изучала, таким образом,
основные явления жизни, исходила из существования организмов как
факта, не подлежащего анализу. Эта книга посвящена новой —
молекулярной биофизике.
В середине XX века, наряду с атомной физикой, ведущими
областями естествознания стали кибернетика и молекулярная
биология. Стремительное развитие биологии привело ее к
гораздо более глубокому взаимодействию с физикой и химией,
чем это было раньше. Биология перешла от макроскопических
наблюдений и опытов к детальному исследованию клеточных
структур в связи с их функциональностью и раскрыла
молекулярную природу ряда основных явлений жизни. Молекулярная
биология изучает строение и поведение молекул, ответственных
*
20
ГЛ. I. ФИЗИКА И БИОЛОГИЯ
за важнейшие функции организмов, за наследственность,
изменчивость, обмен веществ и подвижность организмов и их
частей. Такими молекулами являются прежде всего белки и
нуклеиновые кислоты. Молекулярная биология — новая область
науки, пограничная между молекулярной физикой,
органической химией и биологией.
МОЛЕКУЛЯРНАЯ ФИЗИКА
Рассмотрим прежде всего основные принципы молекулярной
физики, которые понадобятся для дальнейшего.
Молекулярная физика изучает физические явления,
существенным образом зависящие от атомно-молекулярной природы
вещества, в которых эта природа находит свое прямое или
косвенное выражение. Так, к молекулярно-оптическим явлениям
относится преломление и рассеяние света — процессы
взаимодействия света с веществом, определяемые строением
последнего. Напротив, дифракция и интерференция света могут
изучаться как оптические явления сами по себе.
Таким образом, молекулярная физика дает информацию, во-
первых, о строении вещества, т. е. о строении молекул,
жидкостей, кристаллов на основании изучения их физических свойств.
Во-вторых, она дает информацию о природе физических (и
физико-химических— провести рубеж между молекулярной
физикой и физической химией зачастую невозможно) процессов в
веществе, исходя из его строения. Можно соответственно
указать три группы задач молекулярной физики.
Первая группа — определение строения, понимаемого в
широком смысле слова. Методы физики (и химии) позволяют
установить геометрическое расположение атомов в молекулах,
кристаллах и жидкостях. Главную роль здесь играет
рентгенография и электронография. Интерференция рентгеновских
лучей и электронных волн, рассеянных атомами, зависит от
межатомных расстояний и позполяет их определять. В
большинстве случаев такие исследования используют сведения о
строении молекул, полученные химией, однако во многих
(и весьма сложных) случаях исчерпывающая информация о
геометрическом строении молекул была получена методом рент<
геноструктурного анализа. Это относится, например, к
структуре пенициллина, к структуре важных белков — миоглобина и
гемоглобина. Геометрия простых молекул изучается также
методами радиоспектроскопии. Расстояния между уровнями
вращательной энергии молекул зависят от их моментов инерции,
т. е. от межатомных расстояний. Поэтому частоты во враща-
МОЛЕКУЛЯРНАЯ ФИЗИКА
21
тельных спектрах дают возможность определить эти расстояния
с большой точностью.
Атомы водорода слабо рассеивают рентгеновы лучи и
электроны. Расположение атомов водорода может быть лучше
установлено по рассеянию нейтронов.
Механические характеристики молекул, т. е. силы
взаимодействия между атомами, определяют частоты и формы
колебаний атомов в молекуле относительно друг друга.
Соответственно они устанавливаются путем изучения колебательных
спектров молекул — инфракрасных спектров и спектров
комбинационного рассеяния. Пространственное распределение
электронов в молекуле, набор уровней энергии электронов и
вероятности переходов между уровнями определяют оптические,
электрические и магнитные свойства молекул. За электрические и
оптические молекулярные явления ответственны в первую
очередь две основные молекулярные константы — поляризуемость
и дипольный момент. Поляризуемость характеризует
способность электронов смещаться под действием постоянного или
переменного электрического поля, она находит свое выражение
в диэлектрической проницаемости, в преломлении и рассеянии
света и т. д. Дипольный момент молекулы или ее составной
части (отдельной химической связи, группы атомов) выражает
полярность системы, равновесное распределение зарядов.
Свойства электронной оболочки молекулы непосредственно
проявляются в электронных — ультрафиолетовых и видимых
спектрах. Теория строения электронной оболочки молекулы и
явлений, им определяемых, — квантовая механика. Само явление
химической связи и тем самым существование молекулы
определяется квантовомеханическими закономерностями.
Однако во многих случаях проблемы, связанные с
электромагнитными свойствами молекул, с успехом решаются на основе
полуэмпирической классической теории, позволяющей обойти
чрезвычайные трудности квантовомеханических расчетов в
случае сколько-нибудь сложных многоэлектронных систем.
Вопросы строения молекул рассмотрены мною в .другой
книге [15].
Вторая группа задач молекулярной физики связана с
равновесными свойствами молекулярных систем — газов, кристаллов,
жидкостей. Общее, феноменологическое описание этих свойств
дается термодинамикой.
Рассмотрим, например, кристаллизацию жидкости —
фазовый переход первого рода, т. е. такое термодинамическое
превращение, при котором происходит скачкообразное изменение
основных термодинамических величин — объема V, энтальпии //,
энтропии 5 и т. д. Термодинамическое условие перехода состоит
22
ГЛ. I. ФИЗИКА И БИОЛОГИЯ
в равенстве термодинамических потенциалов жидкости и
кристалла
F = H -TS = E + pV—TS. (1.2)
Из (1.1) следует
ДЯ-ГПЛА5 = 0, (1.3)
где Д# и AS— разности энтальпий и энтропии жидкости и
кристалла. Отсюда температура кристаллизации или плавления Тил
равна
' пл === д5 * (1*4)
Конкретное вычисление АЯ и А5 требует уже знания
зависимости этих величин от структуры молекул, образующих
жидкость, знания молекулярной природы процесса кристаллизации.
Связь между термодинамическими величинами и строением
молекул дается статистической механикой (см., например, [15]).
Термодинамические функции вещества, характеризующие его
равновесные свойства, выражаются через так называемую
статистическую сумму
Q = 2^"ftr. (1-5)
i
где Ei — энергия i-то энергетического уровня системы, g{ —
соответствующий статистический вес, т. е. число состояний
системы, обладающих энергией Eiy й= 1,37 • Ю-16 эрг/град —
постоянная Больцмана. Суммирование осуществляется по всем уровням
системы. Для достаточно разреженных газов энергии Е{
являются энергиями изолированных молекул. Они могут быть
найдены, если известны массы атомов и геометрическая
структура молекулы, а также уровни вращательной, колебательной и
электронной энергий. Эти уровни определяются
спектроскопическими методами.
Если известно Q, то без труда находятся основные
термодинамические функции. Приходящаяся на молекулу свободная
энергия равна
F = E — TS = — kT]nQ; (1.6)
внутренняя энергия
E = kT*£jj£-; (1.7)
энтропия
S = £^ = kT^- + k\nQ. (1.8)
МОЛЕКУЛЯРНАЯ ФИЗИКА
23
Так устанавливается прямая связь между термодинамикой и
молекулярной теорией.
Свойства конденсированной системы, однако, не могут быть
выражены через свойства изолированных молекул. Необходимо'
учесть взаимодействие между молекулами, в свою очередь
определяемое строением их электронных оболочек и их
относительным расположением. При этом вычисление статистической
суммы крайне усложняется и практически оказывается не всегда
возможным. Важнейшие процессы, происходящие в
конденсированной среде, кооперативны, т. е. они существенным образом
зависят от взаимодействия молекул. Именно таким процессом
является кристаллизация. Если бы молекулы не
взаимодействовали— они не могли бы образовать кристалл.
Совсем не очевидно, как выражения (1.5) — (1.8) могут
объяснить скачкообразные изменения термодинамических величин
при фазовом переходе. Если совокупность (ансамбль) содержит
конечное число молекул, Q можно дифференцировать по Т
любое число раз без особенностей и разрывов при каком-нибудь
значении 7, так как функция е~Е'1' плавно изменяется с
температурой. Однако для очень большого, практически бесконечного
ансамбля ряд для Q или некоторых его производных по Т
может уже не сходиться при некотором значении Т. Фазовый
переход возможен лишь в очень большом ансамбле. Он
определяется соотношением между Е (или Н) и S (см. (1.2)).
Молекулярная теория, учитывающая взаимодействие,
приводит при упрощенном рассмотрении реального газа к
уравнению Ван-дер-Ваальса
[р + Тг){У-Ь) = ЯТ (1.9)
и вытекающему из него условию перехода газ — жидкость,
выраженному через молекулярные параметры а и Ь. Переход
связан с членом a/V2, который сам зависит от V. При
уменьшении объема роль этого члена возрастает, и при некоторой
температуре оказывается выгодным резкое сокращение объема,
так как соответствующая потеря энтропии перекрывается
выигрышем энергии сил притяжения между молекулами. Такое
взаимодействие кооперативно — оно само себе помогает.
(Термин «кооперативный» применительно к молекулярным явлениям
был введен Фаулером.)
Доля молекул, находящихся в состоянии с энергией Ей в
условиях равновесия равна
_ gte Ч _ gfi
l~^gle-EtlkT~ Q ' (1Л0)
24
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
Из (1.6) следует, что
Член gie~E'llkT также может быть записан в виде e~Fdk .
так как статистический вес gi представляет собой энтропийный
фактор
gt = esilk. (1.12)
Следовательно,
SjT Et
gie-EilkT = ekT-kT =e-Fi/kTt (1.13)
Константа равновесия для перехода молекул из одного
состояния в другое \<^2 равна
К= Ш = **'*?* = е-1р*-рм*т = е~д™г, (1.14)
хх ft«-«*r
откуда
AF = — kTlnK. (1.15)
Это соотношение справедливо при постоянном объеме. При
постоянном давлении
Кр = е-ьРЧ*г (1.16)
и
'№ = — kTlnKp. (1.17)
Задачи молекулярной физики при исследовании
равновесных систем состоят в нахождении термодинамических условий
равновесия и их статистическом истолковании на основе
молекулярных представлений. Грубо говоря, для решения этих
задач необходимо и достаточно нахождение такой молекулярной
модели, которая позволила бы вычислить статистическую
сумму Q.
Третья группа задач молекулярной физики относится к
рассмотрению кинетических свойств исследуемых систем.
Классическая термодинамика является в сущности термостатикой —
она игнорирует временной ход процессов, считая их
практически бесконечно медленными. Тем самым ни
термодинамические, ни статистические расчеты не дают ответов на вопросы,
относящиеся к скоростям изучаемых превращений вещества.
Соответствующие задачи решаются методами физической
кинетики и термодинамики необратимых процессов.
Любые кинетические явления, как физические, так и
химические, состоят в переходах молекул из одного равновесного
состояния в другое. При вязком течении жидкости переход
означает изменение пространственного положения молекул; при
МОЛЕКУЛЯРНАЯ ФИЗИКА
25
химической реакции, например, при таутомерном превращении
кетаминной группы в эниминную
О Н О—Н
и I *=* I
_С—N— _C=N—
молекула переходит из одного равновесного состояния в
другое. Равновесным состояниям отвечают минимумы свободной
энергии, между этими состояниями имеется энергетический
барьер (гора), через который нужно перевалить для того, чтобы
переход осуществился (рис. 1).
Очевидно, что переходы происходят тем реже
(скорость процесса тем меньше), чем
выше этот барьер.
Вероятность того, что молекула
приобрела энергию, равную высоте барьера,
выражается через тот же фактор Больц-
мана. Для молекулы в состоянии /
(рис. 1) она равна
w
1-»2
А1в-Е*1кТ,
(1.18)
где Еа — энергия активации процесса,
<44 — фактор пропорциональности, имею-
-1
Рис. 1. Энергетическая
схема химической
реакции.
щии размерность сект1 и содержащий
энтропийный множитель £ fl/ (Sa — энтропия активации).
Скорость перехода, т. е. число переходов слева направо, за 1 сек
равна
v
1-»2
*lWl+2
пгАге-в*/№9
(1.19)
где nt — число молекул в состоянии /. Это — закон Аррениуса,
выражающий зависимость скорости процесса от температуры.
Чем выше температура, тем больше скорость процесса.
Для перехода справа налево
И
2-Я
^1=м2*-(Е°+ДЯ)/ЙГ.
При тепловом равновесии
v
1-»2
V.
2->Ь
(1.20)
(1.21)
(1.22)
и константа равновесия равна
щ А
к
п2
At
2_ e-AEfkT _ e- AF/kTt
26
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
Мы получили прежнее выражение (1.14). Таким образом, от
высоты барьера Еа зависит скорость перехода, но не
равновесные количества молекул. Величина Еа ответственна за кинетику
процесса; напротив, разность энергий конечного и начального
состояний Д£ определяет условия термодинамического
равновесия.
В кооперативных процессах картина существенно
усложняется. Например, вязкое течение жидкости кооперативно, так
как перемещающиеся частицы жидкости взаимодействуют со
своийи соседями. Поэтому для своего перемещения частицы
должны растолкать своих соседей и тем самым преодолеть
некоторый энергетический барьер, т. е. обладать энергией
активации. Ситуация подобна той, с которой встречается человек,
пробивающийся вперед в переполненном автобусе. Для того чтобы
он мог пройти, должны подвинуться остальные пассажиры. Коо-
перативность выражается в зависимости энергии активации от
числа частиц, уже преодолевших барьер. Действительно, чем
больше людей вышло из автобуса, тем легче пробраться к
выходу. В отсутствие кооперативное™ зависимость логарифма
скорости процесса от обратной температуры линейна — из
закона Аррениуса (1.19) следует
lnv = lnnlAl — ^. (1.23)
При наличии кооперативности закон Аррениуса и условие
(1.25) уже несправедливы, так как Еа не является
константой.
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
Мы уже говорили о возникновении молекулярной биологии.
Нахождение молекулярных процессов, лежащих в основе
жизненных явлений, привело биологию в непосредственный контакт
с молекулярной физикой. Молекулярная биофизика изучает
физическую природу явлений, исследуемых в биологическом
аспекте молекулярной биологией. Мы встречаемся здесь с теми
же тремя группами задач: изучением структуры,
термодинамических равновесий и кинетики.
В современной молекулярной биофизике главное внимание
уделяется строению и физическим свойствам белков и
нуклеиновых кислот, определяющим их биологическую
функциональность. Молекулярная биофизика исследует условия равновесия
молекулярных биологических процессов, в которых участвуют
названные биополимеры и другие молекулы и ионы, а также
кинетику этих процессов. Речь идет о структурных и химиче-
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
27
ских превращениях белков и нуклеиновых кислот, ответственных
за ряд важнейших жизненных явлений, о синтезе белка, о
ферментативном катализе и т. д. Как мы увидим, молекулярная
биофизика основывается на теоретических представлениях и
экспериментальных методах современной молекулярной
физики. Таким образом, молекулярная биофизика есть часть
молекулярной биологии, представляющей более широкую область
знания. Это — ее физическая часть.
Невозможно, конечно, отделить молекулярную биофизику
от биофизической химии (см. [9]), так же как нельзя отделить
молекулярную физику от физической химии. Ясно, что на
молекулярном уровне процессы, протекающие как в живой, так и в
неживой природе, могут быть одновременно и физическими и
химическими.
В связи с этим можно поставить вопрос о целесообразности
термина «молекулярная биофизика». Но если признать
существование биофизики как науки (а это уже не вызывает
сомнений), то законно говорить и о ее молекулярном разделе — о
молекулярной биофизике. Сегодня это самый важный, самый
интересный раздел биофизики.
Молекулярная биология и тем самым молекулярная
биофизика далеко не исчерпывают содержания биологии. Если
генетические проблемы сейчас уже решаются на молекулярном
уровне, то это никак не относится к ряду других биологических
явлений, к проблемам целостного поведения организмов. Самая
простая функциональная часть организма — клетка —
неизмеримо сложнее молекул, из которых она построена. Это — высо-
коупорядоченная система, состоящая из надмолекулярных
структур, свойства которой не могут быть получены простым
суммированием свойств составляющих молекул — необходимо
учитывать их взаимодействие. Биология все глубже проникает
в детали строения и физиологии клеток, а физика и химия
изучают молекулы биологически функциональных веществ. Эти ива
пути еще не встретились — для такой встречи необходима
разработка физико-химии сложнейших надмолекулярных структур,
а это — задача будущего.
Как мы увидим, жизнь есть действительно «форма
существования белковых тел» в том смысле, что все важнейшие
функции организмов осуществляются белками. Биохимические
реакции, процессы обмена веществ (метаболизма) протекают
с обязательным участием катализаторов-ферментов, не
изменяющихся в результате реакций, но существенно ее
ускоряющих. Ферменты являются белками. Белки ответственны за
перенос веществ внутрь клетки, они выполняют и специальные
функции переноса кислорода в организме (гемоглобин крови) и
28
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
защищают организмы от чужеродных, патогенных веществ в
процессах иммунитета. Жизнь невозможна без
механического движения, без перемещения организмов и их частей в
пространстве. Такие механические движения, начиная с
молекулярных и кончая мышечными, выполняются специальными
белками.
Белки не могут сделать только одного — сами себя
синтезировать. Для этого, как оказалось, необходимы молекулы
другого типа — нуклеиновые кислоты. Их функция состоит именно
в синтезе белков строго определенного строения. Нарушение
такого синтеза влечет за собой очень тяжелые последствия для
организма. Наследственное воспроизведение организмов
означает прежде всего воспроизведение всего набора необходимых
белков. Тем самым вещества, обеспечивающие синтез белков,—
нуклеиновые кислоты и являются ответственными за
наследственность и изменчивость организмов.
Начало атомно-молекулярной биологии и биофизики было
положено работами Тимофеева-Ресовского, Дельбрюка и
других ученых, установивших некоторые основные закономерности
радиобиологии и получивших важные сведения о молекулярной
природе гена [1]. Тимофеев-Ресовский указывает, что первым
ученым, пытавшимся ввести молекулярные представления в
генетику еще в 1893 г., был московский химик Колли. Позднее
Кольцов вполне отчетливо формулировал основные положения
молекулярной гипотезы генетических явлений [1]. Сейчас мы
располагаем уже не гипотезой, но последовательной физико-
химической теорией наследственности. Эта теория имеет не
только всесторонние экспериментальные подтверждения, но
позволяет сознательно вмешиваться в генетические явления.
Белки и нуклеиновые кислоты являются цепочечными
большими молекулами, содержащими сотни и тысячи атомов. Это —
полимерные вещества. Следовательно, молекулярная биофизика
представляет собой физику биополимеров — новую область
физики полимеров, до недавнего времени занимавшейся
преимущественно синтетическими полимерными веществами (каучука-
ми, пластмассами, волокнами). Теоретической основой физики
полимеров и тем самым молекулярной биофизики является
термодинамика и статистическая физика. Ввиду того, что
биологические процессы — это прежде всего процессы
упорядочения, в их физическом истолковании основную роль играет
теория фазовых переходов, теория кооперативных процессов.
Поэтому молекулярная биофизика и.опирается на теорию
кооперативных явлений.
Каково соотношение между молекулярной биофизикой и
физикой микромира — квантовой механикой?
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
29
Сам факт существования молекул, явление химической
связи между атомами в молекуле, может быть объяснен только
квантовой механикой. В этом смысле квантовая механика
лежит в основе молекулярной физики. Любые изменения
структуры молекул и их энергетических состояний имеют квантовую,
дискретную природу.
Однако, исходя из факта существования молекул, можно
развивать исследования молекулярных явлений на
классической основе, так как организмы состоят из очень большого
числа атомов; то же относится и к молекулам биополимеров.
Применения квантовомеханических представлений требует
истолкование ряда специальных процессов, в частности, связанных с
воздействием коротковолновой радиации на организм. Ряд
ученых придерживается иной точки зрения, считая, что квантово-
механические процессы миграции энергии и резонанса имеют
определяющее значение в молекулярной биологии. Вопрос о
соотношении молекулярной биофизики и квантовой механики
подробно рассматривается в последней главе книги.
Молекулярная биология и биофизика обещают в будущем
открытия громадного практического значения.
Физико-химическая генетика должна привести к сознательному управлению
наследственностью, к созданию новых видов
сельскохозяйственных растений и животных. Понимание молекулярной природы
наследственности и изменчивости, процессов метаболизма и
ферментативного катализа должно привести к решению
важнейших проблем медицины, в частности общебиологической
проблемы рака. С другой стороны, молекулярная биология
открывает необозримые перспективы для химии и химической
технологии. Изучив физико-химию молекулярных биологических
процессов, химия приобретет замечательные возможности
высокоспецифичного синтеза новых веществ, энергетика поставит
на службу человечеству механохимические устройства с
высоким коэффициентом полезного действия, подобные мышце.
Сегодня молекулярная биология является еще главным
образом областью теоретических исследований. О значении таких
исследований трудно сказать лучше, чем сказал К- А.
Тимирязев:
«Да, вопрос не в том, должны ли ученые и наука служить
своему обществу и человечеству, — такого вопроса и быть не
может. Вопрос в том, какой путь короче и вернее ведет к этой
цели. Идти ли ученому по указке практических житейских
мудрецов и близоруких моралистов или идти, не смущаясь их
указаниями и возгласами, по единственному возможному пути,
определяемому внутренней логикой фактов, управляющей
развитием науки...
30 ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
...Критериумом истинной науки является не та внешность
узкой ближайшей пользы, которой именно успешнее всего
прикрываются адепты псевдонауки, без труда добывающие для
своих пародий признания их практической важности и даже
государственной полезности» [16].
К созданию молекулярной биологии привела
неопровержимая логика развития науки. Молекулярная биология
открывает прямой путь, ведущий к таким открытиям в области
сельского хозяйства и медицины, которые сейчас трудно себе
представить. Это утверждение покажется читателю менее
декларативным, когда он подойдет к концу книги.
ТЕРМОДИНАМИКА И БИОЛОГИЯ
Естественно, что физическое исследование жизни,
исследование организма должно начинаться с рассмотрения наиболее
общих его свойств, как молекулярной системы. Такое
рассмотрение, предшествующее конкретному молекулярно-физическо-
му анализу, основывается на законах термодинамики.
На первый взгляд, живой организм существует вопреки
термодинамике. Согласно второму началу термодинамики,
упорядоченность изолированной системы должна убывать, при
соответственном возрастании меры неупорядоченности—энтропии.
Выражением этого фундаментального закона является
выравнивание температур в результате теплопроводности,
выравнивание концентраций газов и жидкостей в результате диффузии и
множество других явлений, при которых энтропия системы
стремится к максимуму.
Напротив, организм непрерывно создает порядок из порядка
в смысле самовоспроизведения и порядок из беспорядка в силу
обмена веществ. Из неупорядоченной системы малых молекул,
получаемых организмом в процессах питания и дыхания,
создаются сложные, высокоупорядоченные макромолекулы
биополимеров, строятся совершенные надмолекулярные
структуры— организм растет и развивается или сохраняется в
стационарном (но не статическом) состоянии высокой
упорядоченности. Именно это имел в виду Шредингер, когда говорил, что
организм — апериодический кристалл.
Здание, предоставленное самому себе, постепенно
разрушается и рано или поздно превращается в груду щебня.
Разумная деятельность живого организма — человека — направлена
на преодоление второго начала. Человек строит здания и
поддерживает их в порядке, он не увеличивает, а уменьшает
энтропию.
ТЕРМОДИНАМИКА И БИОЛОГИЯ 31
•
Значит ли это, что живые организмы не подчиняются
законам физики, что справедлива точка зрения витализма?
Законы классической термодинамики относятся к
изолированным от внешнего мира системам. Организм является
открытой системой, обменивающейся с окружающей средой и
веществом, и энергией. В такой системе не соблюдаются уже
и законы сохранения массы и энергии. Термодинамическое
описание организма требует применения термодинамики открытых
систем, разработанной в XX веке главным образом
бельгийскими физиками Де-Донде [17] и Пригожиным [18] (см.
также [9, 19]), Независимо те же идеи были блестяще применены
к некоторым вопросам молекулярной физики Мандельштамом
и Леонтовичем [20].
Как и следовало ожидать, при учете того, что организм
есть открытая система, все противоречия с термодинамикой
оказываются мнимыми.
Рассмотрим некоторые положения термодинамики открытых систем.
Энтропия открытой системы изменяется за счет необратимых процессов,
протекающих внутри нее, и за счет притока энтропии (или оттока) из
внешней среды
dS—diS + dgS, (1.24)
где dS — общее изменение энтропии, djS — ее изменение внутри системы,
dcS — приток или отток энтропии. Согласно второму началу,
45>а (1.25)
Знак deS может быть как положительным, так и отрицательным. В
организмах продукция энтропии создается прежде всего химическими реакциями.
При реакции изменяются массы химических компонент. Изменение массы mY
компоненты у за время dt может быть записано в виде
dmy = vyMydl (1.26)
где vY—стехиометрический коэффициент, Af„— масса компоненты у в молях,
I — степень прохождения реакции. Например, при окислении глюкозы
С6Н12Об + 602 —>• 6С02 + 6Н20,
v™ Ь v0= — 6, vc02 = 6, vH5o = 6.
и
dmTJl dm02 dmCOi dmHiQ
- Мг1 — 6М0г 6AfC02 6AfHa0
В закрытой системе справедлив закон сохранения массы
db
т = 2 ту dm = 0 (1.27)
Y
и, следовательно,
dm = d\ 2 vYMY = 0. (1.28)
Y
32 ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
Уравнение
2 vYAf Y = 0, (1.29)
Y
следующее из (1.28), есть уравнение химической реакции. Заменив массы ту
числами молей nyt напишем вместо (1.26)
dny = \yd\. (1.30)
Скорость реакции может быть представлена в виде
dnv d\
"ЗГ = V3T e vv* <L31>
Энтропия системы меняется как в результате изменения количества
тепла
,*<?'_ dQ__dE + pdV
где dE — изменение внутренней энергии, pdV — механическая работа, так
и в результате химической реакции — энтропия продуктов реакции отлична
от энтропии реагентов. Последнее изменение выражается формулой
^■■"Ит^1 (1,32)
Y
Величины \iy, называемые химическими потенциалами, соответственно
выражаются как
■v—ТШ г
V ylE,V,ny
Индекс пу указывает на то, что производная по изменению числа молей пу
данной компоненты взята при постоянных количествах всех остальных
химических компонент.
Следуя Де-Донде, напишем
dtS =^jX>0. (1.33)
Величина А именуется сродством химической реакции. Сопоставляя (1.33),
(1.32) и (1.30), находим
Y
В состоянии равновесия А = 0.
Продукция энтропии в единицу времени
diS A d\ Av
dt T dt T
> 0. (1.35)
Если в системе одновременно протекает несколько химических реакций
(а в организме их очень много), то
^=т2^^ (1,36)
р
ТЕРМОДИНАМИКА И БИОЛОГИЯ 33
где Л0 — сродство р-й реакции. Соответственно
djS
dt ''
Р
-rSVp>a (Ш>
Этот результат очень важен. Допустим, что отдельно взятая реакция не
может протекать, так как для нее
Аы <0. (1.38)
При наличии одновременно протекающей реакции 2, для которой A2v2 > О,
первая реакция становится возможной, если соблюдено условие
Alvl + A2v2>0, (1.39)
так как соотношение (1.37) относится к сумме обоих процессов. Именно
такой характер имеют химические реакции в организмах. Изолированная
реакция синтеза белка из составляющих его аминокислот (см. стр 99)
невозможна, так как она сопровождается увеличением свободной энергии. Но
сопряжение этого процесса в организме с другими термодинамически
выгодными реакциями, описываемое соотношением (1.37), делает его
осуществимым. То же относится и к другим явлениям. В живые клетки происходит
активный транспорт ряда веществ, идущий в направлении, противоположном
убыванию концентрации Иными словами, при малой концентрации
необходимого вещества во внешней среде его концентрация в клетке может и
повышаться, клетка «высасывает» растворенное вещество из раствора, вопреки
закону обычной диффузии, являющемуся частным случаем второго начала.
Это оказывается возможным вследствие сопряжения процесса переноса с
другими процессами, обеспечивающими суммарное выполнение второго начала.
В состоянии, отличном от термодинамического равновесия, но близком
к нему, скорость химической реакции пропорциональна сродству
/ А
v = -ty-. (1.40)
Если в системе протекает несколько химических реакций, то скорость
данной реакции может, вообще говоря, зависеть от сродства каждой из реакций
»р=т2ар^ (1-41)
t
и, следовательно, соотношение (1*37) перепишется в виде
р т
Коэффициенты пропорциональности /,рт, именуемые феноменологическими
коэффициентами, симметричны, т. е. удовлетворяют соотношениям Онзагера
V = V (143>
Все это справедливо, как уже сказано, вблизи состояния равновесия.
Количественное условие такой близости имеет вид
^<1- (1-44)
3 М- В, ВолькенштеЙн
34 ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
Оно, конечно, далеко не всегда выполняется. Однако можно пользоваться
линейными соотношениями (1.41), (1.42), если условие (1.44) соблюдено для
отдельных реакций, т. е.
Р|<1. (1-45)
RT
Даже если в целом
2\
Р
RT RT
> 1. (1.46)
Биохимические процессы в организмах отвечают этим условиям и
допускают поэтому применение линейных соотношений. Разработка
термодинамики для нелинейной области является актуальной задачей науки.
Продукция энтропии в единицу времени diS/dt есть центральная
величина термодинамики необратимых процессов. Она выражает отклонение от
Термодинамического равновесия, в котором А — О, v = О и ^ =0. В
изолированной системе энтропия непрерывно возрастает, стремясь к максимуму,
отвечающему равновесию, но если система открытая, то она может в течение
длительного времени оставаться в состоянии с низкой энтропией, благодаря
ее потоку из системы в окружающую среду. Величина dS в (1.24) может
быть и отрицательной, если deS < 0 и \deS\ > \diS\,
Рассмотрим изолированную систему, состоящую из организма и
некоторой внешней среды. Организм получает из этой среды продукты питания,
кислород, которым он дышит. В то же время в эту среду поступают
вещества, выделяемые организмом. В таких условиях находится, например,
космонавт. Он является открытой системой по отношению к своему кораблю, но
Корабль в целом хорошо изолирован. Общее изменение энтропии системы
dS = dSi + dS2, (1.47)
где dS\ — изменение энтропии космонавта, dS2 — окружающей его в корабле
среды. Согласно второму началу dS>Ot так как в системе протекают
необратимые процессы жизнедеятельности космонавта. Но dS{ < 0. Это значит,
что dS2 > 0 и \dS2\ > \dS{\. Иными словами, возрастание упорядоченности
в организме космонавта перекрывается ее уменьшением в окружающей среде.
Энтропия выделяемых веществ значительно больше, чем энтропия продуктов
питания.
То же относится к биосфере нашей планеты в целом. Если
рассматривать солнечную систему, как изолированную (что, конечно, весьма далеко от
истины), то энтропия ее непрерывно увеличивается за счет излучения
Солнца. На фоне этого грандиозного процесса уменьшение энтропии во всех
живых организмах ничтожно мало.
Открытая система достигает стационарного состояния, если продукция
энтропии внутри нее в точности компенсируется потоком энтропии во
внешнюю среду.
В стационарном состоянии все функции состояния независимы от вре*
мени — это справедливо и для энтропии. Таким образом,
ь е.
ТЕРМОДИНАМИКА И БИОЛОГИЯ
35
так что
deS
dt
dtS
dt
Очевидно, что стационарное состояние не есть состояние равновесия,
в котором
dt "'
т. е. энтропия достигла максимума. Для поддержания неравновесного
состояния открытой системы необходим поток энтропии через нее. Энтропия
вещества, входящего в систему, меньше, чем энтропия, отдаваемая системой
окружающей среде. В этом смысле открытая система деградирует
вещество—космонавт деградирует продукты питания, превращая их в вещества,
выделяемые его организмом. Такие явления можно хорошо моделировать
течением жидкости из одного
сосуда в другой. Течение жидкости
изображает течение химической
реакции. Если система замкнутая,
т. е. жидкость не поступает в
сосуды извне и не вытекает наружу,
то со скоростью, определяемой
Рис. 2. Равновеснее
состояние жидкости в
замкнутой системе сосудов.
Рис. 3. Стационарное
состояние жидкости в открытой
системе сосудов.
величиной отверстия крана, вся жидкость перельется из верхнего
сосуда в нижний и установится равновесное состояние (рис. 2), Уровень
жидкости в нижнем сосуде изобразит степень прохождения реакции в таком
состоянии.
Если система открытая, то и в верхнем и в нижнем сосуде установится
определенный уровень жидкости, не соответствующий равновесию (рис. 3).
Этот уровень будет зависеть от степени поворота крана. Кран моделирует
катализатор — вещество, не участвующее в реакции, но влияющее на ее
скорость. В закрытой системе конечная степень прохождения реакции не
зависит от ее скорости — от поворота крана; в конечном счете устанавливается
постоянный уровень жидкости в нижнем сосуде. В открытой системе не
3*
36 ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
только скорость, но и степень прохождения реакции оказывается зависящей
от катализатора. При изменении концентрации катализатора (при повороте
крана) устанавливаются новые уровни жидкости, новое стационарное
состояние.
Способность организмов поддерживать постоянные концентрации веществ
(гомеостазис) определяются тем, что организмы являются открытыми
системами, приходящими в стационарные состояния. Термодинамический анализ
показывает, что открытая система, выведенная из стационарного состояния,
стремится вернуться в это состояние, так же как закрытая система,
выведенная из состояния равновесия, возвращается в это состояние.
Существенным свойством стационарного состояния является то, что это состояние
отвечает минимальной продукции энтропии. Допустим, что в системе протекают
химические процессы и имеется поток тепла. Тогда
i£_ _Z*iZl + -dL>0 (149)
dt ~ Г* дх + Т > °' ила'
Первый член выражает изменение внутренней энтропии вследствие
теплопроводности, Wx — поток тепла. В линейной области
w Lth дТ А
_ L2ldT А
Т'дх +icAT*
причем L[2—L2[ (см. (1.43)). Следовательно,
diS Lth I дТ\* . Ll2 дТ А , , /Ay
(1.50)
1дТ\* Lu дТ A (Ay
и
dt T*
д (diS\ 0Z,I2 дТ . .. A
д
(4-)
{*$■)—**%+**+-*■ <"»
Но в стационарном состоянии общий поток вещества, характеризуемый v,
равен нулю. Нет накопления или утраты вещества. Следовательно,
производная от ' (1.52) равна нулю и * в этом случае минимально (вторая
производная, как легко видеть, положительна и равна 2/,сЛ).
Термодинамический анализ оказывается весьма поучительным
применительно не только к отдельному организму, но и к процессу эволюции
в целом [21].
ТЕОРИЯ ИНФОРМАЦИИ
Теория информации является одной из основ кибернетики —
науки, изучающей процессы управления и контроля в
управляющих системах. Живые организмы и их функциональные части
представляют собой наиболее совершенные образцы
управляющих, саморегулирующихся систем. Тем самым они подлежат
кибернетическому исследованию. Процессы управления и
регуляции возможны лишь в результате передачи и переработки
соответствующей информации. Математическое изучение этих
ТЕОРИЯ ИНФОРМАЦИИ
37
процессов «состоит в алгоритмическом описании переработки
информации, изучении строения перерабатывающего алгоритма
и принципов его материальной реализации» [22]. Здесь нас
интересует не математическая сторона вопроса, а физические
основы изучаемых биологических процессов.
Общежитейский смысл термина «информация» не требует
пояснений. В науке это понятие обрело строгий
количественный характер. Оно оказалось тесно связанным с понятием
энтропии—меры неупорядоченности.
Информация, заключающаяся в каком-либо сообщении, есть
количественная мера сведений, которые такое сообщение со->
держит. Допустим, что мы имеем дело с игральной костью.
Пока она не брошена, нет события и нет сообщения о событии.
Все шесть исходов равновероятны, информация отсутствует —
она равна нулю. После того, как брошена кость и выпало,
допустим, три очка — опыт сделан, реализовано определенное
событие, и информация отлична от нуля. Как оценить ее
количественно? Очевидно, что при опыте, в котором брошены
одновременно две кости, мы получаем вдвое большую информацию.
В сообщении — на первой кости три очка, на второй — пять —
содержится вдвое больше сведений, чем в сообщении о том, что
на одной кости — три очка. Вероятность осуществления двух
независимых событий равна произведению их вероятностей,
информация о двух таких событиях равна сумме информации об
этих событиях, взятых порознь. Следовательно, рационально
связать информацию с логарифмом вероятности. В
рассматриваемом примере вероятность выпадения определенного числа
очков на кости P0i= -g- Вероятность выпадения определенного
числа очков на первой и второй кости
Информация
/ =-/Clog Р0 = -/Oog Ро1 -/Oog Р02;
где К — фактор пропорциональности. Очевидно, что / пропори
циональна логарифму отношения числа возможных событий в
начальной ситуации (до бросания костей, 1/Р0=36 возможных
исходов) к числу реализованных событий в конечной ситуации
(в приведенном примере одно событие: 3 на первой кости, 5 —
на второй). Рационально пользоваться логарифмом при
основании 2 и можно приравнять К единице. Тогда
/ = _log3P, (1.53)
38
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
Такое определение соответствует задачам, в которых возможны
только два события, т. е. на вопрос о результате отдельного
опыта возможны только два ответа — да или нет. Допустим, что
в родильном доме за какое-то определенное время появилось
на свет п младенцев. Вероятность того, что рождается мальчик
или девочка равна Уг. Начальная ситуация не содержит
никакой информации, возможно 2П различных событий (первый
ребенок — мальчик, остальные п—1 девочки, первый —
девочка, остальные мальчики и т. д.). Сообщение о результате всех
рождений содержит информацию, равную
/ = -log2^r = log22" = /*, (1.54)
т. е. при таком определении информация просто равна числу
выборов с двоичной альтернативой. Единица информации при
п—\ называется бит.
Поясним сказанное еще одним примером. Допустим, что
задумано некоторое трехзначное число. Какую информацию
даст нам узнавание этого числа? Всего может быть 900 трех-
значных чисел. Каждая из трех цифр может иметь 10
значений—от 0 до 9. Следовательно,
/ = 31og210 = 3 - 3,32 = 9,96 бит.
Указанное определение информации соответствует двоичной
системе исчисления, в которой любое число записывается в виде
степеней числа 2 — посредством цифр 0 и 1 (например, 7=111,
как как 4=100, т. е. 22, 2=10, т. е. 21, и 1 = 1, т. е. 2°). Одна
десятичная единица дает 3,32 бит информации, т. е. двоичная
запись числа требует в 3,32 раза больше цифр, чем десятичная
(см. также [23, 24]).
Следует подчеркнуть, что количественное определение
информации никак не связано с ее ценностью для человека. Так,
жизнь на Марсе может существовать или не существовать.
Имеются всего две возможности. Ясно, что положительный
ответ на вопрос о наличии жизни на Марсе содержит 1 бит
информации, т. е. ровно столько же, сколько констатация того
факта, что при бросании монеты выпал герб. Между тем
ценность полученной информации в этих двух случаях
несоизмерима. В свою очередь, если от бросания монеты — жребия —
зависит решение какого-либо важного вопроса, то ценность
полученной информации существенно больше, чем в том случае,
когда речь идет о простой игре. В то же время, очевидно, что
количественное определение ценности информации не может
быть ни простым, ни постоянным, завися от множества
обстоятельств. Игнорирование вопроса о ценности информации еле-
tEOHlfl ИНФОРМАЦИИ 39
дует считать не недостатком, а достоинством теории, позволяю-
щей установить количественные критерии информации.
Мы видим, что научное понятие информации тесно связано
с вероятностью. Как известно, статистическое, т. е. в конечном
счете, молекулярное истолкование энтропии, данно'е Больцма-
ном, также связывает ее с вероятностью состояния системы.
Это дает возможность установить количественное соответствие
между информацией и энтропией, что и было впервые сделано
Сцилардом [25] — выдающимся физиком, который в последние
годы занимался вопросами биологии.
Энтропия выражается формулой Еольцмана
S = klnW> (1.55)
где W — термодинамическая вероятность данного состояния
рассматриваемой системы, т. е. число различных способов
реализации данного состояния, k — постоянная Больцмана, равная
1,37* 10-16 эрг/град. Очевидно, что W обратно пропорциональна
вероятности Р, которой мы только что пользовались.
Рассмотрим кристаллизацию жидкости. Жидкость обладает
большей энтропией, чем кристалл, так как ее состояние может
быть реализовано большим числом способов распределения
молекул, чем состояние кристалла. Кристалл упорядочен, его
молекулы могут располагаться только в узлах кристаллической
решетки. Энтропия при кристаллизации уменьшается на
величину
А5 = 5Ж — 5К = k (In Wm — In WK). (1.56)
Но перейдя от жидкости к кристаллу, мы отобрали из всех
возможных состояний молекул только те, которые соответствуют
упорядоченной решетке. Тем самым, в отличие от жидкости,
кристалл содержит некоторую информацию о расположениях
молекул. Введя в определение информации коэффициент
пропорциональности, равный
/C=A:log2£, (1.57)
мы можем отождествить информацию, содержащуюся в кри*
сталле, с убыванием энтропии 5 или с увеличением негэнтропии
(отрицательной энтропии) N:
I = — klog2elogP = kln^ = AS^~AN. (1.58)
Таким образом, увеличение информации, содержащейся в
системе, означает понижение ее энтропии. Это не формальная
аналогия, но описание конкретных физических процессов.
40
ГЛ. I. ФИЗИКА И БИОЛОГИЯ
Анализируя второе начало термодинамики, Максвелл
предложил следующий фантастический опыт. Сосуд с газом
разделен на две части перегородкой с заслонкой, которой управляет
демон — сознательное существо молекулярных размеров. Когда
к перегородке приближается быстро летящая молекула, демон
открывает заслонку. Медленные молекулы он в свою половину
сосуда не пропускает. В результате в одной половине сосуда
скапливаются быстрые, в другой — медленные молекулы.
Устанавливается разность температур, и второе начало
термодинамики оказывается нарушенным.
Этот парадокс уже давно был разрешен в науке. Бриллюэн
рассмотрел его с точки зрения теории информации [26]. Для
того чтобы увидеть молекулу, демон должен ее осветить, т. е.
располагать источником излучения, не находящимся в
равновесии с окружающей средой. Такой источник имеет пониженную
энтропию, т. е. обладает негэнтропией, из которой демон
получает информацию. Раз информация получена, ее можно
использовать для понижения энтропии газа, т. е. для увеличения не-
гэнтропии. Полный расчет изменения энтропии с учетом
баланса.
негэнтропия -> информация -> негэнтропия
показывает, что энтропия системы в целом (источник света
плюс газ плюс демон) не уменьшится, а вырастет и второе
начало полностью соблюдается.
Любой опыт, дающий информацию о физической системе,
приводит к увеличению энтропии системы или ее окружения.
Это увеличение энтропии больше или равно полученной
информации.
Теперь мы можем вернуться к обсуждению
«эпигенетической» концепции Эльзассера (см. стр. 16). Возрастание
информации (или понижение энтропии) при переходе от зародышевой
Клетки к многоклеточному организму, как указывалось,
возможно только в открытой системе и аналогично возрастанию
информации при кристаллизации жидкости. Кристаллизация
также невозможна в изолированной системе — для
превращения жидкости в кристалл нужно ее охладить, т. е. увеличить
энтропию холодильника. Понижение энтропии и при росте
организма и при кристаллизации жидкости оплачивается
увеличением энтропии окружающей среды в полном согласии со
вторым началом термодинамики. Следовательно, никакой
«биотонной», нефизической закономерности здесь нет.
Информация о будущем кристалле уже закодирована в
строении каждой его молекулы, в структуре ее электронной
оболочки. Знание строения молекул позволяет заранее сказать,
ТЕОРИЯ ИНФОРМАЦИИ 41
каков будет кристалл — кубическая решетка NaCl или
гексагональная НгО. Все данные современной биологии
свидетельствуют о том, что в молекулах зародышевой клетки
закодирована информация о свойствах будущего организма —
апериодического кристалла, так что и в этом отношении аналогия
остается полной.
При развитии организма увеличивается суммарная
информация, но не информация, приходящаяся на отдельную клетку.
Но ведь то же самое происходит и при кристаллизации
жидкости. Жидкость содержит меньшую информацию, обладает
большей энтропией, чем составляющие ее молекулы, вследствие их
теплового движения. При кристаллизации избыточная энтропия
жидкости отдается холодильнику и энтропия кристалла пони-
жается, грубо говоря, до энтропии неподвижных составляющих
молекул. Тем самым возрастает информация. Так как
энтропия и информация — аддитивные величины, чем большее
количество жидкости закристаллизуется, тем большим будет
выигрыш информации. Но увеличение информации, приходящееся
на одну молекулу, останется при этом неизменным.
При возникновении многоклеточного организма из одной
клетки информация, приходящаяся на клетку, не
увеличивается. Более того, часть этой информации блокируется. Ясно, что
в зародышевой клетке используется больший объем
информации, чем в любой специализированной тканевой клетке
организма, предназначенной для выполнения только определенных
функций — клетке мышцы или нервной клетке. Ведь из
зародышевой клетки развивается весь организм.
Информация всегда каким-то образом запасается,
кодируется в автоматическом устройстве или в организме. Так, любое
число в двоичной системе может быть закодировано при
помощи двух знаков — 0 и 1. Азбука Морзе является
четвертичным кодом — ее знаки: точка, тире, промежуток между
знаками, двойной промежуток между словами.
О какой информации можно говорить в случае живого
организма? Прежде всего генотипическая, наследственная
информация, определяющая существование вида и индивидуума с
его наследственными признаками. Способность запасания гено-
типической информации обеспечивает устойчивость
наследственных признаков. Фенотипическая память означает запасание
информации об условиях существования данной особи —
например, приобретение условных рефлексов и т. д. Наконец, память
в обычном смысле слова — запасание информации в
центральной нервной системе.
Теория информации и кибернетика в целом дают
блестящие возможности феноменологического описания организмов,
42
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
четкого истолкования не только их детализированных свойств,
но и целостного поведения. Уже простой перевод биологических
закономерностей на язык теории информации позволяет с
большой ясностью поставить задачи научного исследования и
отбросить ряд ложных представлений. Прекрасные примеры такого
перевода содержатся в статье Ляпунова [22].
Информация передается от одной части системы к другой
всегда посредством некоторого кода [27]. Этот код или шифр
переводится в ряде случаев в другой код (пример — письменная
расшифровка телеграфного сообщения, переданного с помощью
азбуки Морзе); попутно возможны различные перекодировки.
Всякая передача информации, как уже указывалось,
сопровождается увеличением энтропии, т. е. частичным разрушением
информации. В теории связи это называется шумами. Так, в
известной детской игре в испорченный телефон вся ее прелесть
заключается в искажении информации, вызванном шумами.
Хорошо построенный автомат или организм сводит эти шумы к
минимуму. Но абсолютное их уничтожение невозможно. Как мы
увидим, именно с этим фактом связана изменчивость
организмов, т. е. невозможность существования наследственного
вещества и генотипической информации в совершенно неизменяемом
виде. Различные внешние воздействия увеличивают уровень
шумов в системе.
В регулирующих устройствах, в живых организмах и их
сообществах важнейшую роль играет обратная связь. Система
выполняет некоторые действия и получает информацию об их
результатах. В зависимости от этой информации система
меняет свое поведение. Очевидно, что любая регуляция основана
на обратной связи. Обратная связь непосредственно
реализуется в реакциях организмов, в физиологических процессах, в
рефлекторном, инстинктивном или сознательном поведении.
Присущий организмам гомеостазис — например, поддержание
постоянной температуры, осмотического давления, концентрации
ионов в протоплазме — с одной стороны означает
стационарность термодинамического состояния (стр. 34), с другой — нали?
чие обратной связи. Иными словами, любое изменение
соответствующих физико-химических величин так изменяет
функционирование регулирующего устройства, что восстанавливаются
те значения этих величин, которые необходимы для нормальной
жизнедеятельности. Обратная связь реализуется не только в
отдельных элементах организма или в организме в целом, но и в
популяциях, и в эволюционном процессе.
Яркий пример управляющей системы с обратной связью,
основанной на инстинктивном поведении, дает регуляция
температуры в пчелином улье [28]. Если температура повышается вы-
ТЕОРИЯ ИНФОРМАЦИИ 43
ше нормы, пчелы-работницы перестают доставлять в улей мед,
но приносят вместо него воду. Другие пчелы, находящиеся в
улье, берут эту воду у прилетающих пчел и распыляют ее,
усиливая испарение непрерывными взамахами крыльев. Обратная
связь проявляется в том, что, как только температура в улье
снижается, пчелы перестают забирать воду у прилетающих
работниц и те вновь переходят на сбор меда.
Кибернетика и теория информации имеют фундаментальное
значение для теоретической биологии, так как дают
возможность строгого физико-математического анализа явлений жизни.
Поразительные успехи в этой области и возможности ее
дальнейшего развития описаны в ряде работ (см., например, [29,
30]). Однако такой анализ является феноменологическим и в
значительной мере сводится к моделированию биологических
процессов. Это разъясняет многое, но далеко не исчерпывает
проблему. Для изучения сущности жизненных явлений наряду
с кибернетикой необходима молекулярная биология,
молекулярная биофизика.
Задача молекулярной биофизики состоит в нахождении
конкретных молекулярных механизмов запасания, кодирования,
передачи, перекодирования биологической информации,
природы шумов, разрушающих эту информацию, регуляторных
механизмов, обратной связи. Современная физика молекул
расшифровала код, связывающий строение молекул со строением
кристаллов (см. стр. 40). Развитие молекулярной биологии
дает серьезные основания верить в то, что со временем, зная
молекулярное строение зародышевой клетки, мы сможем
предсказывать все наследственные свойства организма, т. е.
научимся полностью расшифровывать заложенную в этой клетке
информацию. Более того, мы уже сегодня уверенно говорим о
молекулярных основах эволюции в целом [31], Полная
реализация этой программы потребует длительных усилий, но
программа эта осуществима.
Молекулярная биология добилась пока что наибольших
успехов в расшифровке генетического кода, так как генотипи-
ческая информация закодирована на молекулярном уровне, в
структуре молекул нуклеиновых кислот. Здесь еще многое
предстоит сделать, но прочные основы молекулярной генетики уже
заложены. Эти вопросы подробно освещаются в гл, 6 и 7.
Напротив, природа регуляторных процессов лишь начинает
изучаться в аспекте молекулярной физики и физической химии.
Роль кибернетики здесь остается ведущей. Тем более это
справедливо для явлений высшей нервной деятельности, для
мышления, физико-химическая природа которого еще совершенно
неясна.
44
ГЛ. 1. ФИЗИКА И БИОЛОГИЯ
Как уже указывалось, в молекулярной биофизике важную
роль играют кооперативные процессы (стр. 23). Существенно,
что ими может быть обеспечена обратная связь. Это
показывает уравнение Ван-дер-Ваальса (1.9). Уменьшение объема
реального газа V влечет за собой увеличение давления, которое
в свою очередь уменьшает объем. Дальнейшее протекание
процесса зависит от его результатов на предыдущей стадии. Такая
ситуация возможна лишь при наличии эффективного
взаимодействия между частицами, участвующими в процессе, т. е. при
кооперативности. Как мы увидим, процессы регуляции в
клетках, молекулярная природа которых становится сейчас
известной, основываются на обратной связи, осуществляемой
посредством кооперативного процесса (стр. 406).
Молекулярная биофизика не противостоит биокибернетике и
термодинамике, но объединяется с ними при решении великих
задач современного естествознания. Сама постановка этих
задач оказалась возможной прежде всего в результате развития
биологии. Дальнейшее движение вперед происходит в
результате совместных усилий биологов, физиков, химиков,
математиков, кибернетистов, усилий, основанных на оптимистическом
убеждении в неограниченных возможностях науки.
ГЛАВА 2
КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
ЖИВАЯ КЛЕТКА
Прежде чем обратиться непосредственно к молекулярной
биологии и биофизике, необходимо изложить некоторые
основные положения цитологии — науки о клетке, и генетики — науки
о наследственности и изменчивости организмов. В этой главе
дается краткий обзор важнейших фактов, относящихся к этим
областям биологии, предназначенный для читателей — физиков
и химиков.
Основной и относительно простейшей единицей каждого
живого организма является клетка. Клетка живет, она выполняет
все функции живого. Существует множество одноклеточных
организмов, животных, растительных и бактериальных, играющих
громадную роль в природе. В этих случаях клетка живет
совершенно самостоятельно, и поведение ее может быть очень
сложным. В свою очередь любой многоклеточный организм не
только возникает из единственной зародышевой клетки —
зиготы, образовавшейся в результате соединения мужской и женской
половых клеток — гамет, но и состоит из клеток. Некоторые виды
клеток многоклеточного организма существуют как независимые
образования, не будучи объединены в общую структуру. Такие
клетки находятся обычно в жидкой среде. Сюда относятся,
например, красные кровяные шарики — эритроциты, спермин —
мужские половые клетки и т. д. Большинство клеток
многоклеточных организмов входит в состав сложных систем, в которых
клетки действуют согласованно, — тканей, в свою очередь
образующих органы и системы органов.
Неклеточные формы жизни в настоящее время на Земле не
существуют. Появлявшиеся еще недавно утверждения о
существовании таких форм оказались основанными на грубых
экспериментальных ошибках. Если бы примитивная неклеточная
форма жизни возникла в настоящее время, она была бы
немедленно поглощена и уничтожена более совершенными
клеточными организмами. Сказанное не относится, конечно, к вирусам
(см. стр. 63).
Элементарное представление о клетке сводится к
следующему. Клетка состоит из ядра и цитоплазмы и окружена
46
ГЛ. 2. КЛЕТКИ. ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
мембранной оболочкой. Уже в оптическом микроскопе видно,
что цитоплазма имеет сложное строение, в ней находятся
различные органоиды — центросомы, митохондрии, а также
пузырьки— вакуоли. В ядре—хроматтювые глыбки и ядрышки (рис.4).
Жидкое вещество клетки, носящее наименование протоплазмы,
состоит в основном из воды, но содержит также сложные
органические соединения и соли.
Центросома
Цитоплазма
Вакуоль
Ядрышно
Ядро
Хроматин
Рис. 4. Схематическое изображение клетки, основанное на
наблюдениях в оптическом микроскопе.
Несмотря на громадные достижения оптической микроскопии,
принципиальные ограничения разрешающей способности
микроскопа не позволяли определить детали строения клеточных
органоидов. В результате открытия волновой природы вещества
был создан электронный микроскоп, позволяющий увидеть не
только надмолекулярную структуру клеточных органоидов, но
даже и отдельные большие молекулы.
Сейчас мы знаем, что строение клетки очень сложно. Не
только организм состоит из клетки, но в сущности каждая
клетка представляет собой организм, составные части которого
действуют согласованно, выполняя различные жизненные функции.
ЖИБАЯ КЛЕТКА
47
В этом смысле можно говорить о физиологии клетки.
Многоклеточный организм построен из клеток, а клетка из органоидов,
представляющих собой надмолекулярные структуры.
Необходимо понять функции клетки и роль, которую играют в
выполнении этих функций ее структурные элементы.
Живые клетки являются живыми потому, что они способны:
1) запасать и преобразовывать энергию;
2) синтезировать молекулы биологически функциональных
вещестз — прежде всего белков;
3) делиться (размножаться);
4) дифференцироваться (при делении зародышевой и
последующих клеток многоклеточных организмов); ■
5) осуществлять различные механические движения —
перемещение составных частей клетки и всей клетки, как целого, в
пространстве;
6) выполнять приспособительные реакции, обеспечивающие
сохранение основных внутриклеточных процессов при изменении
состояния внешней среды.
Первая функция — энергетическая — необходима для
осуществления всех остальных. Химические и механические процессы
требуют энергии — в противном случае клетка была бы вечным
двигателем первого рода. Откуда же заимствуется эта энергия?
Клетка представляет собой термодинамически открытую
систему, способную обмениваться энергией и веществом с
окружающей средой. Энергия поступает в клетку извне. На Земле
существуют организмы двух типов — автотрофные и
гетеротрофные. К первым относятся пурпурные бактерии и все зеленые
растения. Они получают энергию из солнечного света. В клетках
автотрофных организмов находятся хлоропласты, органоиды,
содержащие зеленое вещество — хлорофилл. Энергия квантов
света, поглощаемых хлорофиллом, запасается в химических
связях определенных органических соединений. Этот процесс
называется фотосинтезом. При этом сложные органические
соединения создаются из простых неорганических. Так, из воды и
углекислоты получается глюкоза
H20 + C02 + Av _> С6Н1206 + 02
(Av —энергия кванта света).
Второй тип автотрофных организмов — хемисинтезирующие
бактерии, получающие энергию при окислении некоторых
минеральных соединений.
Гетеротрофы — организмы, неспособные синтезировать
питательные вещества из неорганических соединений. Они получают
энергию из химических веществ других организмов, питаясь ими
48 ГЛ. 2. КЛЕТКИ, ВИРУСЫ. НАСЛЕДСТВЕННОСТЬ
или продуктами их разложения. Гетеротрофами являются все
животные, грибы и большинство бактерий.
Для выполнения полезной работы необходимо освобождение
энергии, заключенной в химических связях. Этот процесс
происходит в результате дыхания, т. е. окисления. Он осущест*
вляется в других специализированных органоидах — в
митохондриях, присутствующих во всех растительных и животных
клетках.
Процесс окисления, т. е. освобождения энергии,
противоположен процессу ее запасания, например фотосинтезу
С6Н1206 + 602 —> 6C02+6H20 + 686 ккал/моль.
Окисление может происходить и без участия кислорода, в
анаэробных условиях. Так, сбраживание сахара в спирт дрожжами
представляет собой неполное окисление
С6Н1206 —> 2С2Н5ОН + 2С02.
Количество свободной энергии, выделяющееся в этом процессе,
составляет 55 ккал/моль.
NH2
[ li \ 0 0 0
/4N/4N/ CH о-р-о-р-о-Р
н \ ^оч / III
_>„/ ЧУ ., о" о- о
н-чг с-н
\ /
н—с — с—н
I I
он он
Рис. 5. Строение АТФ.
Замечательной особенностью живой клетки является ее
способность запасать и преобразовывать энергию в условиях
постоянной и достаточно низкой температуры, причем химические
соединения, участвующие в этих процессах, частично
существуют в виде разбавленного водного раствора, в узком интервал?
кислотности (или щелочности).
Во всех клетках основным веществом, в котором запасается
энергия, является так называемая аденозинтрифосфорная
кислота, сокращенно обозначаемая АТФ. Структурная формула
этого соединения показана на рис. 5. При разрыве связи, со^дин^т
ЖИВАЯ КЛЕТКА
49
ющей крайнюю фосфатную группу с остальной частью молекулы,
выделяется энергия, составляющая, примерно 12 ккал/моль. При
этом АТФ превращается в аденозиндифосфорную кислоту —
АДФ. Разрыв следующей фосфатной связи дает энергию того
же порядка, разрыв третьей связи — всего лишь 2,5 ккал/моль.
Первые две фосфатные связи, богатые энергией, называются
макроэргическими. Запасание энергии в любых других
соединениях, в частности в глюкозе, происходит с участием АТФ, де-
фосфорилирующейся до АДФ. Выше мы написали только
суммарную реакцию получения глюкозы, в действительности
протекающую через ряд промежуточных стадий (см. гл. 3) .
Свободная энергия, производимая в клетке, расходуется на
синтез белков и других биологически функциональных веществ,
т. е. на химическую работу. При делении клеток, при
внутриклеточном движении протоплазмы, при движении жгутиков и
ресничек, которыми снабжены многие клетки, при мышечной
деятельности совершается механическая работа. Через мембранные
оболочки клеток происходит перенос питательных и других
веществ извне в клетку и из клетки во внешнюю среду. При этом
зачастую такой перенос происходит из области, в которой
концентрация переносимого вещества меньше, в область более
высокой концентрации, т. е. в направлении, противоположном
диффузии. Значит, клетка выполняет осмотическую работу. Если
такой перенос сопровождается разделением противоположно
заряженных ионов, то совершается и электрическая работа.
В клетках специализированных тканей, например у
электрического угря, электрическая работа может быть весьма
значительной. Наконец, у светящихся организмов запасенная в АТФ
энергия превращается в световую.
Таким образом, клетка представляет собой сложную
физико-химическую систему, выполняющую весьма разнообразные
функции.
Несмотря на принципиальную общность всех клеток, не
существует такой вещи, как типичная клетка. Бактериальная
клетка, специализированные клетки растений и животных
отличаются друг от друга.
Типичная бактериальная клетка имеет длину порядка 3\i и
диаметр порядка 1 \i. Ее объем около 2,5 р,8. На 70% такая
клетка состоит из воды; сухой вес клетки порядка 6,7-10~13 г.
Большая часть этого веса — 70%—приходится на белки, около
15%—на нуклеиновые кислоты, около 10%—на жировые ве-.
щества — липиды и фосфолипиды и около 5% на полисахариды
(углеводы). Общее число молекул этих соединений (не считая
малых молекул неорганических солей и т. д.) составляет вели-,
чину порядка 40 миллионов.
^ м. в. Волькенщтейн
50 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
Существуют и очень малые одноклеточные организмы, так
называемые ОППП (организмы, подобные вызывающим плейро-
пнеймонию). Наименьшая клетка такого типа Mycoplasma laid-
lawii имеет диаметр всего лишь в 1000 раз больше диаметра
атома — порядка 0,1ц,. В такой клетке содержится около 20 000
больших молекул биополимеров, в ней синтезируется несколько
десятков различных ферментов. Эти организмы, подобно
бактериям, способны размножаться на неживой питательной среде.
Очевидно, что здесь мы находимся у нижней границы
возможных размеров клеток; если учесть, что клеточная мембрана
должна иметь определенную толщину, то получится, что
наименьший размер клетки порядка 0,05 \i [1].
Клетки простейших могут быть иногда видимы даже
невооруженным глазом, клетки многоклеточных организмов также
значительно крупнее бактериальных.
Ознакомимся со строением клетки. Оно представлено
схематически на рис. 6 [2].
Клетка окружена мембраной, имеющей толщину порядка
80 А (т. е. 8-10~7 см). Мембрана состоит из белков и липидов-
жиров, молекулы которых расположены в виде упорядоченных
слоев — между двумя слоями липидов лежит слой белка. По-
видимому, в мембране имеются поры, через которые (а также
через слои липидов и белков) различные вещества проникают в
клетку. По отношению к этим веществам клеточная мембрана
ведет себя особым образом. В клетках существуют специальные
устройства, обеспечивающие неодинаковую проницаемость
мембран к ионам Na+ и К+, несмотря на то, что эти ионы очень
схожи друг с другом по заряду и размерам. С проникновением
этих ионов в нервную клетку и выходом из нее связано
распространение нервного возбуждения.
Цитоплазма клетки имеет сложную структуру, содержит
внутренние мембраны и различные органоиды.
Мы уже говорили о митохондриях, фигурирующих во всех
клетках, и о хлоропластах растительных клеток. Митохондрии
являются силовыми станциями той фабрики белков и других
веществ, которую представляет собой клетка. Число
митохондрий в клетках варьирует в широких пределах — от 50 до 5000.
Это сравнительно крупные органоиды, имеющие длину 3—4 \i
(в клетках печени млекопитающих) и, следовательно, видимые в
обычном микроскопе. Электронный микроскоп раскрыл
внутреннее строение митохондрий, оказавшееся весьма сложным
(рис. 7). Митохондрия представляет собой сосуд с внутренними
перегородками. Внешние и внутренние мембраны имеют
толщину порядка 185 А, они состоят из двух слоев белка,
разделенного двойным липидным слоем. Молекулы, обеспечивающие
Рис. 6. Современная схема строения клетки, основанная на наблюдениях
в электронном микроскопе.
4*
52 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
окислительные процессы, связанные с переносом электронов
(см. стр. 136), и биологические катализаторы — ферменты, без
которых эти процессы не идут, по-видимому, регулярно
расположены в белковых слоях.
Хлоропласты растений — своего рода солнечные
энергетические станции. Поглощающие свет молекулы хлорофилла
расположены в регулярной структуре хлоропласта строго
упорядочение, образуя подобие
электрической батареи (рис. 8) [3].
В цитоплазме находятся
лизосомы — органоиды,
содержащие ферменты, с помощью
которых большие молекулы
жиров, белков и нуклеиновых
кислот расщепляются на
малые фрагменты, в дальнейшем
окисляемые в митохондриях.
Действие этих расщепляющих
ферментов столь сильно, что
при разрыве оболочки лизосомы
они уничтожают клетку, рас-
Рис. 7. Строение митохондрии. щепляя белок и липиды ее
внешней и внутренней мембран.
В цитоплазме расположен эндоплазматический ретикулум,
являющийся сложной мембранной системой, образующей ряд
каналов, по которым различные вещества перемещаются от
внешней мембраны клетки к ядру. С этой системой тесно
связан аппарат Гольджи, роль которого, возможно, состоит в
синтезировании новых мембран. Другая возможная функция
аппарата Гольджи — защитная — отделение посторонних вредных
частиц.
Вдоль стенок эндоплазматического ретикулума, а также
непосредственно в цитоплазме расположено множество малых
частиц молекулярного размера (диаметром порядка 100—150А),
называемых рибосомами. Эти, наблюдаемые только в
электронном микроскопе, гранулы содержат одну из нуклеиновых
кислот — рибонуклеиновую, сокращенно обозначаемую РНК. Роль
рибосом исключительно важна, так как в них синтезируются
белки. Если продолжить сравнение клетки с фабрикой, то
рибосомы являются цехами, выдающими основную продукцию.
Наконец, в клетке находятся центросомы или центриоли,
У ряда организмов — это две пары цилиндрических частиц,
перпендикулярных друг к другу. Высота цилиндрика 3000—5000 А,
диаметр порядка 1500А. Он состоит из девяти групп
параллельно уложенных трубочек, в каждую группу входят две или
Рис. 8. Хлоропласт клетки кукурузы (электронный микроскоп,
увеличение 40000).
Рис. 9. Строение центриоли (поперечное сечение, электронный
микроскоп, увеличение 175 000).
54 ГЛ. 2. КЛЕТКИ, ВИРУСЫ. НАСЛЕДСТВЕННОСТЬ
три трубочки (рис. 9). Центриоли играют существенную роль в
делении клеток (см. следующий параграф). Интересно, что у
клеток, обладающих приспособлениями для самостоятельного
движения—"жгутиками и ресничками, имеются структуры — ки-
нетосомы, лежащие в основаниях жгутиков и ресничек и
построенные подобно центриолям. Центриоли и кинетосомы
являются устройствами, участвующими в механическом движении.
Дальнейшие подробности о строении клетки читатель найдет
ё работах [2] и [4].
Мы описали важнейшие Цеха фабрики-клетки. Как же эта
фабрика управляется?
Управляющим центром клетки является ее ядро. Оно
отделено от цитоплазмы мембраной, обладающей порами,
посредством которых ядро сообщается с цитоплазмой. В ядре
находятся хроматиновые нити длинные образования, с трудом
наблюдаемые в неделящейся клетке, т. е. в клетке, существующей
в период между двумя делениями. Хроматин в ядре такой
клетки распределен достаточно диффузно. Однако, когда клетка
готовится к делению, из хроматина создаются хорошо видимые,
даже под обычным микроскопом, образования — хромосомы.
Число и форма хромосом строго постоянны для данного вида
организмов. Обычно хромосомы фигурируют попарно, т. е.
имеется по две хромосомы каждого сорта. Соответствующие
клетки называются диплоидными. В каждой соматической
клетке человеческого тела (но не в половых клетках) содержатся
23 пары хромосом, т. е. всего 46, в соматических клетках
плодовой мушки-дрозофилы 4 пары хромосом, в соматических клетках
мягкой пшеницы 21 пара хромосом. В половых клетках —
гаметах — число хромосом уменьшено вдвое, т. е. имеется лишь по
одной хромосоме каждой пары. Такие клетки называются
гаплоидными. При обычном делении диплоидных
клеток—митозе— число хромосом удваивается и каждая новая клетка
содержит полный диплоидный набор хромосом, аналогичный
исходному. При делении клеток, приводящем к образованию гамет,
число хромосом уменьшается вдвое.
В хромосомах содержится другая нуклеиновая кислота — де-
зоксирибонуклеиновая, ДНК и специальные белки.
Изображение хромосомы см. на рис. 24.
Забегая вперед, укажем, что именно хромосомы являются в
первую очередь ответственными за жизнь клетки, за развитие
организма, за передачу наследственных признаков. В них
сосредоточена наследственная генетическая информация. Они
управляют синтезом белков, управляют всей работой фабрики.
Клетка, лишенная ядра, может еще просуществовать некоторое
время. Однако ее синтетическая способность постепенно зату-
ДЕЛЕНИЕ КЛЕТОК
55
хает, и она не может делиться. Хромосомы — это как бы
конструкторское бюро и плановый отдел фабрики. Каким-то
способом они передают необходимую информацию рабочим цехам.
Бактериальные клетки не имеют видимого ядра, но
содержат хромосомы, т. е. ядерные структуры. Особенно детально
изученные в генетическом отношении бактерии кишечной
палочки (Escherichia coli) имеют одну хромосому. Бактерии —
гаплоидные клетки.
Помимо хроматина в ядре содержится еще так называемое
ядрышко — сферическое тело, богатое РНК. В ядрышке имеются
гранулы, подобные рибосомам, и соответственно в нем также
происходит синтез белка и РНК. Хроматин и ядрышки
погружены в жидкую среду — ядерный сок.
Очевидно, что познание структуры и работы клетки ставит
целый ряд физических и химических вопросов. Каковы общие
принципы деятельности этой сложной согласованной
организации? Что заставляет клетку делиться и как это происходит?
В каком виде генетическая информация заключена-в
хромосомах и как она передается рибосомам, синтезирующим белки?
Почему клетки дифференцируются? Ответы на эти вопросы
должны дать биохимия и молекулярная биофизика. Анализируя
клетку, мы непосредственно подошли к молекулярному уровню
организации и имеем дело уже с молекулами.
ДЕЛЕНИЕ КЛЕТОК
Деление клеток в настоящее время хорошо изучено. Оно
заснято на пленку с помощью цейт-рафферной кинокамеры.
Обычное, митотическое деление клеток происходит следующим
образом (рис. 10) [5].
Как уже говорилось, в период между двумя делениями, в
интерфазе хроматиновые нити, из которых состоят хромосомы,
расположены в ядре диффузно. Каждая из двух пар центриолей
состоит из одной большей материнской центриоли и меньшей —
дочерней, расположенной под прямым углом к материнской
(рис. 10, а). В какой-то момент перед началом деления
хромосомы удваиваются — реплицируются. Иными словами, около
каждой хромосомы появляется ее «сестра» — копия исходной.
Одновременно между парами центриолей образуется
митотическое веретено — волокна, протянутые между центриолями
(рис. 10,6). В профазе митоза (рис. 10, б и г) хромосомы
свертываются в спирали, уплотняются, ядерная оболочка и ядрышко
исчезают и центриоли расходятся к противоположным концам
клетки, образуя полюса, к которым будут двигаться хромосомы.
В этой же фазе посредством волокон митотического аппарата
д) е) ж)
Рис. 10. Схема митоза.
а) Период между двумя делениями— ннтерфаза; б) —начинает образовываться
ж), з) телофаза.
ДЕЛЕНИЕ КЛЕТОК 57
устанавливается связь между специфическими центральными
участками хромосом — центромерами — и полюсами. В мета-
фазе (рис. 10, (?) хромосомы перемещаются к «экватору» клетки.
Во время анафазы (рис. 10, е) сестринские хромосомы
разделяются и движутся к противоположным полюсам. Наконец, на
заключительной стадии митоза — в телофазе (рис. 10, ж и з)
хромосомы вновь деспирализуются, вновь создаются ядерные
мембраны и ядрышки. Каждая центриоль «родила» дочернюю.
Деление заканчивается образованием новой межклеточной
мембраны, и две вновь созданные клетки оказываются в состоянии
интерфазы. Таким образом, в результате митоза из исходной
клетки получились две новые, во всем подобные исходной.
Наиболее существенной чертой этого подобия является точное
воспроизведение начального набора хромосом.
Продолжительность стадий митоза различна для различных
тканей и видов организмов. У живых человеческих клеток
профаза длится 30—60 минут, метафаза 2—6 минут, анафаза
3—15 минут, телофаза 30—60 минут. Весь процесс занимает
1—2 часа.
Таковы факты. Наблюдатель митоза видит совершенно
закономерный процесс, биологическая целесообразность которого
не вызывает сомнений. Должны ли мы ограничиться признанием
этой целесообразности и усматривать в ней подтверждение
витализма, как это делает Хаас [6]? Такое отношение к проблеме
весьма далеко от научного познания.
Очевидно, что в основе митоза должны лежать глубокие
физико-химические закономерности. Как указывает Александров^],
в изучении клетки имеются три основные проблемы: эволюции,
авторегуляции и авторепродукции. При исследовании митоза
прежде всего возникает третья проблема. Каковы
физико-химические механизмы репликации хромосом и центриолей и их
расхождения в дочерние клетки? Хромосома — надмолекулярное
образование, но совершенно очевидно, что репликация такой
структуры непосредственно связана с репликацией образующих
ее молекул — прежде всего ДНК. Следовательно, .эта проблема
в значительной степени сводится к молекулярной физике.
Многое в этой области стало ясным за последнее время (см.
стр. 283).
Проблема перемещения хромосом и центриолей связана с
более общим вопросом о природе механических процессов в
клетках и организмах. Это — механохимические процессы. Они
реализуются в условиях постоянной температуры и давления,
источником механической работы является химическая энергия,
запасенная в клетках. Мэзия, особенно детально изучавший
митоз в последние годы, раскрыл ряд факторов, объясняющих
58 гл. 2. клетки, вирусы, наследственность
строение и функцию митотпческого аппарата на молекулярном
уровне [8]. Эти вопросы обсуждаются в гл. 9 нашей книги.
Проблема авторегуляции митоза, т. е. объяснение
согласованного поведения ядра и цитоплазмы делящейся клетки, изучена
много хуже. Эта проблема отчетливо сформулирована
Александровым [7]. Мы пока не понимаем, какие физико-химические
факторы побуждают клетку к делению и какие молекулярные
взаимодействия определяют согласованное поведение всей клет*
ки во время митоза.
Проблема эволюции связана с митозом следующим образом.
Материалистическое естествознание исходит из основного
положения о происхождении жизни из неживой материн. Клетка и
все ее свойства, в том числе способность к митотическому
делению, возникли в результате длительной эволюции, в ходе
которой неклеточные формы жизни оказались стертыми с лица
Земли. Биологическая целесообразность митоза означает в этом
смысле наличие определенных преимуществ в естественном
отборе. Познание хода эволюции, приведшего к митотическому
процессу, представляет чрезвычайные ^трудности, так как на
Земле не осталось следов доклеточной жизни. Однако мы бы
вступили в противоречие с наукой, если бы признали эти
трудности непреодолимыми. Если жизнь когда-то возникла на Земле
из неорганической материи, то нет принципиальных причин,
которые могли бы воспрепятствовать ученым воспроизвести этот
процесс в своих лабораториях.
Рассмотрим теперь редукционное деление клеток,
приводящее к образованию гамет — мейоз.
Мейоз в сущности состоит из двух делений клетки. Поэтому
названия фаз те же, что и в случае митоза. В ранней профазе
первого мейотического деления (рис. 11,а) возникает веретено
и появляются хромосомы в ядре. За этим следует специфический
процесс — синапсис или конъюгация гомологичных хромосом.
Две хромосомы каждой пары соединяются друг с другом
(рис. 11,6). Хромосома представляет собой неоднородное
образование, отдельные ее части отличаются друг от друга и
морфологически, и функционально. При синапсисе парные
хромосомы соединяются своими сходными местами. Далее происходит
удвоение синаптировавших хромосом, в результате которого
образуются группы из четырех одинаковых хромосом — тетрады
(рис. 11, в). В метафазе первого мейотического деления тетрады
располагаются по «экватору» клетки (рис. 11, г). В анафазе
хромосомы отходят к полюсам, в отличие от митоза, парами
(рис. 11,5). В телофазе первого мейотического деления
образуются две клетки с парными синаптировавшими хромосомами
(рис. 11,е). Затем начинается второе мейотическое деление. На
a) 6) в)
г) д) в)
Рис. 11. Схема мейоза.
Число хромосом предполагается равным четырем, исходные клетки диплоидны, а) раиияя
профаза первого мейотического деления; б) сииапсис хромосом; в) образование тетрад;
г) метафаза первого деления; д) анафаза первого деления; е) — телофаза первого деления;
Ж) профаза второго мейотического деления; з) метафаза второго деления; и) анафаза
второго деления; к) зрелые гаметы.
60 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
рис. 11, ж изображена его профаза, на рис. 11,з и 11, и —
соответственно метафаза и анафаза. В результате получаются
зрелые гаметы (рис. 11,/с), содержащие число хромосом вдвое
меньшее, чем в исходной клетке. Из одной диплоидной клетки
создаются четыре гаплоидных.
Описанная схема мейоза справедлива для сперматогенеза—
образования мужских гамет, спермиев. При овогенезе —
образовании яйцеклеток — четыре гаметы неодинаковы, три из них, так
называемые полярные тельца, дегенерируют и только одна
превращается в зрелую яйцеклетку [4, 9].
Мейоз выдвигает те же общие научные проблемы, что и
митоз, а также ряд специальных проблем. Из них для физики
особенно интересен процесс синапсиса. Какие силы заставляют
сходные хромосомы притягиваться гомологичными местами?
Этот вопрос давно волнует физиков, и для его решения
привлекалась квантовая механика. Очевидно, что мейотическое
деление, являющееся важнейшей стадией полового
размножения, обеспечивает сохранение основных признаков вида у
потомства. При соединении яйцеклетки и спермия
восстанавливается диплоидный набор хромосом, присущий данному
организму. Половина хромосом поступает от отца, половина — от
матери. В результате обеспечивается определенная
возможность— далеко не единственная — вариации признаков
вследствие сочетания наследственности отца и матери.
Существенно, что хромосомы одной пары при мейозе
расходятся независимо от хромосом других пар. Это создает
возможность большого числа сочетаний отцовских и материнских
хромосом— у человека число сочетаний составляет 223. Половое
размножение определяет важнейшие преимущества в естествен- ■
ном отборе, в эволюции видов.
Оплодотворение состоит в проникновении ядра спермия в
яйцеклетку. Само приближение спермиев — свободно
движущихся клеток — к яйцеклетке и взаимодействие их с яйцеклеткой
несомненно вызывается физико-химическими факторами. Те
же факторы, но более загадочной природы позволяют только
одному спермию проникнуть в яйцеклетку — после
внедрения спермия в яйцо на поверхности последнего образуется
тонкая оболочка, преграждающая доступ в него другим
сперматозоидам. Гаплоидные наборы хромосом спермия и яйцеклетки
сливаются, возникает зигота, которая дальше делится и
дифференцируется.
Следует подчеркнуть, что сперматозоид вносит в яйцо
практически только хромосомы. В остальном его роль
второстепенная. Вся цитоплазматическая организация зиготы получена от
матери, но отсюда не следует, чтд дальнейшее развитие орга-
ДЕЛЕНИЕ КЛЕТОК
61
низма идет по материнской линии. Оплодотворение наполовину
обновляет конструкторское и плановое бюро фабрики-клетки, и
продукция, которую она будет выпускать в дальнейшем, в
равной мере зависит от обоих родителей.
Тем не менее возможно развитие и неоплодотворенного яйца
вплоть до взрослого организма. Такое размножение называется
девственным или партеногенетическим. Например, у
перепончатокрылых насекомых (пчелы, муравьи, осы, орехотворки) самцы
развиваются из неоплодотворенных яиц. Соответственно эти
особи являются гаплоидными. Партеногенез может быть вызван
Рис. 12. Яйцеклетка в конце роста.
искусственно, посредством добавления некоторых химических
веществ к воде, в которую погружены яйца, или посредством
укола яйца тонкой иглой. Удалось получить партеногенетических
кроликов и лягушек.
Еще до оплодотворения яйцо сильно увеличивается — у
лягушки его объем возрастает в 1600 000 раз. В яйце происходит
ряд структурных изменений, усиленный синтез липидов,
гликогена (животный крахмал — углевод), белков и нуклеиновых
кислот. Радиальная симметрия яйца заменяется билатеральной
(рис. 12 и 13), что соответствует общей симметрии будущего
головастика. Таким образом, еще до оплодотворения начинается
дифференциация материала яйца. После оплодотворения
деление зиготы приводит к дифференцированным,
специализированным клеткам, и в конечном счете создается весь
многоклеточный организм.
Проблемы дифференциации клеток изучаются в области
биологии, именуемой динамикой развития. Описание этих интерес*
62 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
нейших и важнейших явлений выходит за рамки этой книги. Мы
еще очень далеки от понимания молекулярных процессов,
определяющих дифференциацию, от понимания причин, делающих
определенную клетку зародышем будущего глаза или
конечности. Укажем лишь, что прямые опыты показывают, что
дифференциация клеток предопределена строением ядра и
цитоплазмы исходной зиготы [10] (см. также [11, 12]).
Рис. 13. Билатеральная симметрия яйца и сим
метрия головастика.
Не подлежит сомнению, что в конечном счете вся механика
развития многоклеточного организма определяется физическими
и химическими взаимодействиями синтезируемых в клетке
веществ. Этот синтез контролируется генетически: ведь вся
совокупность основных признаков организма передается, как
наследственная. Вопросы механики развития оказываются
несравненно более сложными, чем вопросы генетики, как таковой, —
речь идет не только о синтезе определенных соединений, но об
их сложнейшем взаимодействии, выражающемся в построении
определенных надмолекулярных структур и происходящем в та*
ких структурах. Эти взаимодействия, надо думать, кооператив*-
ны и подчиняются сложной системе прямых и обратных связей.
Предопределена не только структура, но и строгая регуляция и,
в частности, синхронизация роста и деления клеток, нарушение
которой неизбежно привело бы к невозможности возникновения
нормального организма. Генотипическая информация реализует-
ВИРУСЫ И БАКТЕРИОФАГИ
63
ся в механике развития. В настоящее время молекулярная
биология и молекулярная биофизика только подошли к рубежу, за
которым начинаются проблемы дифференциации (см. стр. 354).
До сих пор соответствующие исследования имели чисто
биологический характер (см., например, [13]).
Основные достижения молекулярной биологии связаны с
исследованием одноклеточных организмов — бактерий. Ясно, что
проблемы дифференциации здесь не возникают.
ВИРУСЫ И БАКТЕРИОФАГИ
В 1892 г. русский ботаник Ивановский обнаружил, что сок
растения табака, больного мозаичной болезнью, выражающейся
в пятнистости листьев, способен заражать здоровые растения
даже после пропускания этого сока через самые тонкие фильтры.
Так был открыт первый фильтрующийся вирус, вирус табачной
мозаики — ВТМ. В дальнейшем, с помощью электронного
микроскопа удалось изучить частицы ВТМ и других вирусов.
Частицы ВТМ имеют форму длинного цилиндра диаметром в 17тр,
и длиною в 300 т^х. Внутри полого цилиндра находится РНК, а
оболочка цилиндра состоит из ряда слоев белка. Сейчас
известно множество вирусов растений и животных, вызывающих
целый ряд заболеваний. Низкие урожаи картофеля,
наблюдавшиеся в южных районах СССР, определяются вирусным
заболеванием растения, непрерывной инфекцией, сохраняемой при
вегетативном, клубневом размножении. Изучение вирусов и
карантинные антивирусные меры приводят к резкому
повышению урожая.
Вирусными болезнями человека являются грипп, корь, оспа,
бешенство, полиомиелит и т. д. Ряд опухолевых заболеваний
вызывается вирусами. Вирусные частицы разнообразны по форме
и размерам. Частицы вируса пситтакоза — болезни, переносимой
попугаями и весьма опасной для человека — имеют диаметр
около 275 mj.i, частицы вируса ящура крупного рогатого скота —
10 тр,.
Вирусы не являются клетками. Их строение несравненно
более примитивно, они лишены ядра и цитоплазмы и в сущности
могут рассматриваться как молекулярные комплексы белка и
РНК (а также в ряде случаев ДНК). Соответственно, в отличие
от бактерий и простейших, вирусы не могут размножаться на
неживой питательной среде. Они размножаются только в живых
клетках. Вирусы — паразиты клеток. Таким образом, вирусы
неспособны к самовоспроизведению, они воспроизводятся только
живыми клетками, В 1935 г, Стэнли установил, что можно
получить ВТМ в кристаллическом виде. Кристаллизуются и другие
вирусы.
64 ГЛ. 2. КЛЕТКИ, ВИРУСЫ. НАСЛЕДСТВЕННОСТЬ
Являются ли вирусы живыми или неживыми? Этот вопрос
был предметом оживленной дискуссии на Московском
симпозиуме 1957 г. о происхождении жизни [13]. В сущности это
вопрос определения жизни. Если включить в такое определение
способность самовоспроизведения в неживой среде, то вирус не
живет. Если не включать в определение такое жесткое условие,
можно считать вирус живым. Ситуация подобна описанной в
известном научно-фантастическом романе Веркора «Люди или
животные», в котором фигурируют человекоподобные обезьяны,
открытые на Новой Гвинее, Судьба этих существ зависит от
определения — люди они или животные. В случае вирусов их
значение для науки в общем не зависит от определения, и мы
не будем им заниматься.
Существование вирусов неразрывно связано с
существованием клеток и организмов, и, независимо от определения,
проблема эвол*оции, приводящей к вирусам, стоит весьма отчетливо.
Здесь высказывались различные, взаимно исключающие
гипотезы, которые мы не можем рассматривать детально, Опарин[14]
считал вирусы прямыми потомками каких-то очень примитивных
доклеточных форм жизни. Напротив, гипотеза «дегенерации»
считает вирусы развившимися из клеточных форм жизни, путем
утраты всей цитоплазмы, ненужной вирусу для его
существования. Подобно хромосоме частица вируса является нуклеопротеи-
дом — комплексом белка и нуклеиновой кислоты. Дальнейшие
подробности см. в книге [15], В работах Гирера и Шрамма [16]
и Френкель-Конрата [17] было показано, что РНК, выделенная из
ВТМ, сама по себе обладает инфицирующим действием, т. е. при
заражении ею растения в нем возникают целые вирусные
частицы. Иными словами, достаточно нуклеиновой кислоты, чтобы
заставить зараженную клетку синтезировать нуклеиновую
кислоту и белковую оболочку вируса. Еще ранее Стэнли получил
гибридные вирусы, сочетая РНК одного вида вируса с белком
другого. Такие гибриды размножались и обладали новыми
свойствами.
Рассмотрим более подробно свойства вирусных частиц на
примере бактериальных вирусов — бактериофагов, открытых
Туортом (1915 г.) и Д'Эррелем (1917 г.), В прекрасном романе
Синклера Льюиса «Эроусмит» ярко и убедительно описана
история открытия бактериофага. Герой романа — молодой
бактериолог— делает это открытие почти одновременно с Д'Эрре-
лем, но работа последнего выходит из печати раньше и
Мартину Эроусмиту остается только напечатать статью, содержащую
дополнительные детали.
Бактериофаги или бактериальные вирусы представляют собой
паразиты бактерий. Они неспособны размножаться на неживой
ВИРУСЫ И БАКТЕРИОФАГИ 65
питательной среде подобно вирусам, но размножаются в
бактериальных клетках. В настоящее время с помощью электронной
микроскопии и ряда биохимических и бактериологических
методов хорошо исследованы многие виды бактериофагов —их
морфология, функциональность и генетика. Частица одного из
наиболее изученных фагов —
фага Т2, размножающегося в
кишечной палочке Escherichia со-
li, — имеет вид, показанный на
Рис. 14. Схема строения Рис, 15. Частицы Т-четиого фага
фага Т2. под электронным микроскопом.
рис. 14, на котором приведены также и размеры в А. На рис. 15
показана электронно-микроскопическая фотография таких
фаговых частиц. Фаг Т2 состоит из ДНК, находящейся внутри частицы,
и белковой оболочки. Кроме того, в нем содержится некоторое
количество растворимого белка, входящего, очевидно, в комплекс
с ДНК, и углевода, также связанного с ДНК. Таким образом,
в основном фаг состоит из ДНК и белковой оболочки. Этим он
отличается от тех вирусов, в которых вместо ДНК фигурирует
РНК. Процесс заражения бактерий фагом происходит
следующим образом (рис. 16). Частицы фага, испытывающие
броуновское движение, встречаются с бактериальными клетками.
Фаговая частица адсорбируется на клетке-хозяине, прикрепляясь к ее
стенке концом своего хвоста. Этот процесс исключительно
специфичен — с определенным штаммом бактерий взаимодействует
определенный фаг. Для адсорбции существенна концентрация
5 М. В. Волькеиштсйн
66 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
ионов в окружающей среде. У ряда фагов существует
потребность в некоторых веществах, без которых адсорбция не
происходит* Так, для одного из фагов £. coli необходима
аминокислота триптофан, вступающая с фагом в обратимую реакцию
Тень фага
Нлетт } -*■
-С0
ФЛ
Рис. 16. Схематическое изображение развития фага, начиная от
заражения клетки до ее лизиса.
и превращающая его из неадсорбирующегося в
адсорбирующийся.
Процесс адсорбции является физико-химическим процессом, и при избытке
бактерий скорость адсорбции выражается простым уравнением (Крюгер)
~4г=*вя- <2Л>
т. е. скорость уменьшения концентрации фага Р пропорциональна его
концентрации и концентрации бактерий В, к— константа скорости. Концентрация
свободных фаговых частиц убывает с течением времени по закону
/>=/>-**'. (2-2)
Константа скорости к может быть выражена через константу диффузии
фаговых частиц Ь и радиус бактерии R (Шлезингер):
к = 4nDR. (2.3)
Принимая радиус сферы R, обладающей той же поверхностью, Что и
клетка кишечной палочки, равным 8-10-5 см и взяв опытное значение
константы диффузии фага Т4 Z)=2,4 • Ю-6 см2/мин, находим из (2.3) к—
=0,24 • 10~8 смъ/мин. Прямое измерение скорости сорбции дает для фага
Т4 6=0,25'10"8 смг/мин. Совпадение теории с опытом идеальное.
Адсорбция, по-видимому, состоит из двух стадий —
обратимой и необратимой. Вторая стадия существенно зависит от
температуры. Первая стадия сводится к образованию ионных свя-
ВИРУСЫ И БАКТЕРИОФАГИ
67
зей между заряженными группами на поверхности фага и
бактерии — прежде всего NH<t и СОО". Дальше развивается более
специфическое химическое взаимодействие, позволяющее фагу
или, точнее, его части внедриться в клетку.
Второй этап состоит во внедрении фага. Изучение этого
процесса с помощью меченых атомов вскрыло его сущность (Херши
и Чейз). Белок содержит серу,
ионе содержит фосфора. ДНК
содержит фосфор, но не
содержит серы. Фаг был помечен
рзг и $35f ПрИ внедрении
практически весь радиоактивный
фосфор попадает в клетку,
напротив, радиоактивная сера
остается во внешней среде.
Следовательно, в клетку
проникает лишь ДНК фага, и его
белковая оболочка остается
снаружи. Это подтверждается
прямыми наблюдениями,
сделанными с помощью
электронного микроскопа. Удается
увидеть «тени» фага — пустые
белковые оболочки,
оставшиеся после внедрения ДНК фага
в бактерию (рис. 17).
Мы видим, что фаговая
частица действует подобно
медицинскому шприцу — она
инъецирует в бактерию свое
содержимое. Этот процесс
может рассматриваться как химическая реакция, если считать
фаговую частицу молекулой нуклеопротеида, т. е. комплекса
белка и ДНК:
Белок-ДНК+Бактерия->Белок +Бактерия-ДНК
После инъекции ДНК фага в клетку в ней через некоторое
время (скрытый, или латентный, период) возникают целостные
фаговые частицы (рис. 16), причем «посев» ДНК одной исходной
частицы приводит почти к стократному «урожаю». При
размножении фага в клетке в ее цитоплазме происходят существенные
изменения, она перестает делиться и в конце концов погибает в
результате наступающего лизиса — разрушения оболочки клетки
новыми фаговыми частицами (рис. 16). Эти частицы выходят
в среду и могут заражать новые клетки.
Рис. 17.
Электронно-микроскопический снимок бактерии Escherichia
coli, на стенках которой
адсорбированы частицы фага Т5.
5*
68
ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
Способность ДНК фага организовать в цитоплазме клетки-
хозяина синтез белковой оболочки фага представляет
исключительный интерес. Этот процесс моделирует важнейшие моле-
кулярно-биологические явления, которым посвящена гл. 7 этой
книги.
Лизис бактерий фагом наблюдается непосредственно. Если
вырастить культуру бактерий на плотной питательной среде —
на агаре, они образуют мутную пленку. При заражении
бактерий фагом и его размножении на пленке возникают прозрачные
Утрата прорага
Шяизогеямая Ч I Лизигенная \Профаг
л/ттяв QD
Лизогенкая
реакция
Лизис
Лишсная
реакция
СрЭ Индукция
• Вегетатиб-
\ ная (раза
V Ж
i
i
Рис. 18. Схема соотношений клетки и фага при лизогении.
круглые стерильные пятна, или бляшки, форма и размеры
которых характерны для данного вида фага. Изучение этих пятен
цает очень ценную информацию о генетике фагов (см. стр. 95).
Описанный процесс взаимодействия фага с бактерией не
единственный. Существует замечательное явление лизогении, в
котором фаг не убивает бактерию, но влияет как на ее
поведение и свойства, так и на поведение и свойства отдаленных
потомков этой бактерии. Определенные, так называемые
умеренные фаги могут в одних случаях убивать клетки, а в других
образовывать устойчивые комплексы с выжившими бактериями,
сохраняясь в них в виде безвредного профага. Генетический
материал фага при этом объединяется с генетическим материалом
ОСНОВНЫЕ ЗАКОНЫ ГЕНЕТИКИ
69
хозяина, физиологические свойства клетки изменяются и эти
изменения сохраняются в последующих поколениях. Если
воздействовать на лизогенную клетку каким-нибудь сильным агентом,
например ультрафиолетовыми лучами, она начинает
продуцировать фаг и гибнет. Лизогения представляет собой
наследственное свойство бактерии, приобретенное при заражении фагом.
На рис. 18 показана общая схема взаимоотношений
бактериальных клеток с лизогенным фагом.
Другое, очень важное для молекулярной биологии явление —
трансдукция. Этим термином обозначается перенос генетической
информации из одной бактериальной клетки в другую
посредством фаговых частиц. Для понимания этого явления нужло
обратиться к генетике бактерий (стр. 85). Дальнейшие
подробности см. в работах [18—20].
Для молекулярной биологии особенно существенны
генетические свойства фагов. Мы неоднократно будем их касаться в
последующем изложении. Сейчас ограничимся указанием на то,
что в генетике фагов ясно выражаются закономерности, общие
для всех организмов, что в этом смысле природа действует по
единому принципу и в паразите кишечной палочки, и в клетках
человека.
ОСНОВНЫЕ ЗАКОНЫ ГЕНЕТИКИ
Законы передачи наследственной информации от родителей
к потомкам, лежащие в основе жизни вида и индивидуума, а
также в основе эволюции видов, были впервые открыты на
уровне многоклеточных организмов путем наблюдения результатов,
получающихся при скрещивании растений. Памятник Менделю,
сделавшему это открытие сто лет назад, стоит на площади
его имени в городе Брно в Чехословацкой Социалистической
Республике. В этом городе он и работал.
Скрещивая два сорта садового гороха — с белыми и
пурпурными цветками, — Мендель установил, что в первом
поколении потомства все цветки пурпурные. Следовательно, признак
пурпурного цвета, внесенный в зиготу одним из родителей,
доминирует над признаком белого цвета. Пурпурный цвет —
доминантный, а белый — рецессивный признак. Существование
такого доминирования уже само по себе чрезвычайно важно и
интересно.
Спрашивается, что получится во втором поколении — при
скрещивании пурпурных растений первого поколения? В
клетках таких растений в каком-то виде заложены признаки обоих
исходных родителей, но пурпурный цвет доминирует. Какова
дальнейшая судьба этих признаков?
70 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
При изучении большого числа растений второго поколения
(существенно, чтобы это число было большим — далее мы
увидим почему) Мендель установил свой первый закон — закон
расщепления. 75% растений оказалось с пурпурными цветками
и 25% — с белыми, т. е. отношение цветов с доминантным и
рецессивным признаками равно 3: 1. Эти опыты показали, что за
Рис 19. Схема наследования доминантного
и рецессивного признаков. $ — «Щит Марса» —
обозначение мужской особи, $ —«Зеркало
Венеры» — обозначение женской особи.
появление наследственного признака ответственны некоторые
материальные структуры, которые могут существовать в двух
формах, дающих пурпурную и белую окраску. Такие формы
называются аллельными. В первом поколении они существуют,
не смешиваясь, а во втором — расходятся. Обозначив
доминантный аллель /?, а рецессивный г, получаем следующую
схему (рис. 19). Эта схема находится в полном согласии с тем,
что говорилось ранее о хромосомах. В гаплоидных клетках —
гаметах содержится по одной хромосоме, несущей признак R
ОСНОВНЫЕ ЗАКОНЫ ГЕНЕТИКИ
71
или г. При оплодотворении образуются пары RR, Rr, rR и гг.
Очевидно, что вероятности этих четырех зигот во втором
поколении одинаковы. Но так как аллель R доминирует, растения,
возникшие из зигот RR, Rr и rR, имеют пурпурные цветки, а
возникшие из зигот rr — белые. Отсюда отношение 3 : L„
Разница между растениями RR и Rr или rR заключается
в том, что при любых скрещиваниях между первыми
получатся только пурпурные цветки, а при скрещиваниях Rr или
rR будет вновь происходить расщепление по закону 3:1.
Растения RR, Rr и rR тождественны макроскопически, но их
гаметы различаются. Они принадлежат к одному фенотипу, но
генотипы RR и Rr, rR различны. Растения RR (а также rr)
называются гомозиготными, так как их зиготы содержат один
тип аллелей. При их скрещиваниях генотип не меняется. Rr и
rR гетерозиготны, так так аллели их зигот неодинаковы; при
их скрещивании происходит расщепление.
Аналогичное рассмотрение скрещивания RR с Rr
показывает, что в первом поколении все растения будут с пурпурными
цветками (RR, RR, Rr, rR), отношение гомозиготных и
гетерозиготных особей, равное у родителей 1:1, сохранится.
Теперь ясно, почему для установления этих законов
необходимо большое число особей. При оплодотворении могут
встретиться любые гаметы, и если мы получим малое число растений,
то, хотя и с небольшой вероятностью, все цветки второго
поколения могут оказаться белыми (rr). Законы, основанные на
статистике, соблюдаются с тем большей точностью, чем больше
поставлено опытов. Так, при бросании монеты выпадение герба
или решки в 50% случаев будет происходить с тем
большей точностью, чем больше будет бросаний. Впрочем, теория
вероятностей позволяет оценить и отклонения от закона 3:1
при сравнительно небольшом числе особей [21].
Второй закон Менделя установлен при скрещивании
генотипов, отличающихся несколькими независимыми признаками.
Это — закон независимого расщепления. Иллюстрируем его
примером, взятым уже не из растительного, а из животного
царства [9]. Скрещиваются черная, короткошерстная морская
свинка и коричневая, длинношерстная. Оба признака первой
являются доминантными. Обозначим их В и S, а
соответствующие рецессивные аллели Ь и s. Гаметы родителей BS и bs.
В первом поколении получаем зиготы BbSs — гетерозиготные
особи с доминантным по обоим признакам фенотипом. Гаметы
второго поколения BS, Bs, bS, bs. Для нахождения
распределения признаков во втором поколении удобно воспользоваться
схемой рис. 20. Получается на 9 черных короткошерстных —
3 черных длинношерстных, 3 коричневых короткошерстных и 1
72
ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
коричневая длинношерстная. Отношения 9:3:3: 1. Эти
результаты означают, очевидно, что за независимо расщепляющиеся
признаки ответственны разные хромосомы. Соблюдение
законов Менделя в такой простой форме присуще далеко не всем
признакам и далеко не всем видам. В большинстве случаев
картина оказывается гораздо более сложной, так как признаки
не подчиняются простому
доминированию. Например,
у некоторых видов растений
гетерозиготные особи имеют
цветки с окраской,
промежуточной между
гомозиготными (скажем, цветки Rr
розовые), т. е. признаки
могут быть не независимыми,
а специальным образом
сцепленными друг с другом
и т. д. Тем не менее
законы Менделя и их
интерпретация на основе знаний
о хромосомах всегда
остаются ключом к пониманию
наследственности.
Иногда говорят, что
Менделю повезло — он
наткнулся на растения, у которых
генетические
закономерности проявляются в особенно
простой форме. Это,
конечно, не так. Необходимо
было провести большую
работу, чтобы найти такие растения и исходить из чистых
линий— из гомозиготных генотипов. Если бы исходные растения
с пурпурными цветками были не гомозиготными, а
гетерозиготными, указанные закономерности не могли бы быть
установлены. Не менее существенно, что Мендель дал правильное
толкование своих опытов, заключив путем строго логического
рассуждения, что они свидетельствуют о наличии материальных
факторов наследственности, заложенных в гаметах. Ведь это было
сделано задолго до открытия генетической роли хромосом!
В 1911 г. Иогансен назвал факторы, содержащиеся в
хромосомах и ответственные за наследственные признаки, генами.
Мендель, в сущности, уже говорил о них в своих работах.
Далее излагается современное представление о гене — цистроне
(стр. 93).
Рис. 20. Схема наследования двух
независимых признаков.
•
ОСНОВНЫЕ ЗАКОНЫ ГЕНЕТИКИ
73
Генетические эксперименты установили с громадной
точностью ряд свойств генов задолго до того, как их природа была
раскрыта молекулярной биологией.
Дальнейшее исследование генетических закономерностей
связано с весьма невзрачным и не имеющим никакого
практического значения существом — плодовой мушкой Drosophila mela-
nogaster. Дрозофила чрезвычайно удобна для экспериментов по
ряду причин. Она быстро размножается и дает многочисленное
потомство. Она характеризуется большим разнообразием
хорошо наблюдаемых наследственных признаков (окраска тела,
глаз, форма крыльев и т. д.). Ее соматические клетки
содержат лишь четыре пары хромосом. В клетках слюнных желез
дрозофилы находятся хромосомы очень крупных размеров, их
строение легко изучать под микроскопом. Короче говоря,
дрозофила представляет собой великолепный объект для
генетических опытов. Ее изучение, впервые проведенное Морганом
[22], позволило установить основные закономерности генетики,
справедливые для самых различных видов организмов — для
человека [23], для растений, имеющих большое практическое
значение, например кукурузы и т. д. Ситуация очень
характерная для методологии научного исследования — важнейшие
практические выводы удается получить при изучении на
первый взгляд объекта совершенно бесполезного, но хорошо
моделирующего основные закономерности.
Различные признаки оказываются в ряде случаев
сцепленными друг с другом — определяемыми факторами,
локализованными в одной и той же хромосоме. Рассмотрим, в
частности, наследование признаков, сцепленных с полом. Известно,
например, что тяжелое наследственное заболевание —
гемофилия (несвертываемость крови) встречается преимущественно у
лиц мужского пола [23]. Пол — генетически определяемый
признак. У диплоидных организмов имеется одно исключение из
правила парности хромосом. Имеется одна пара хромосом,
ответственных за пол. У самки обе хромосомы в паре
тождественны и обозначаются как ЛЧхромосомы (пара XX). У самца одна
хромосома пары X, а другая, меньшего размера, обозначается
У (пара XY). Соответственно женские гаметы будут всегда X,
а мужские — X или У в равной пропорции. Пол ребенка тем
самым задается не яйцеклеткой, а сперматозоидом. У
дрозофилы ген, ответственный за цвет глаз, локализован в Х-хромо-
соме. Красный цвет (R) доминирует над белым (г). При
скрещивании QRXRXXrXVc?
в первом поколении получаются красноглазые самцы и самки
cfRXY и QRXrX. Во втором поколении расщепление 9RXRX,
R0r л
96,9%
11%
Рис. 21, Схема наследования при перекресте.
ОСНОВНЫЕ ЗАКОНЫ ГЕНЕТИКИ
75
QrXRX, cfRXY и </* rXY. Отношение полов 1 :1, отношение при-»
знаков 3:1. При обратном скрещивании
QrXrXXRXVc?
в первом поколении 9 RXrX и с/1 rXY — самки красноглазые,
самцы белоглазые. Во втором поколении
$RXrX, QrXrX, J RXY, cfrXY.
Отношение полов и признаков 1:1 (ср. [24]).
Очевидно, что, изучая расщепление признаков, можно
установить, какие из них независимы, а какие сцеплены между
собой, т. е. принадлежат одной и той же хромосоме. Ничего не
зная о хромосомах, на основании опытов по скрещиванию
можно установить число групп сцепления, т. е. число хромосом.
Более того, генетика позволяет определить последовательность
расположения генов в хромосоме.
У дрозофилы имеется и другой признак, сцепленный с
полом,— окраска тела серая (W) или желтая (ш). Желтый цвет
тела определяется Х-хромо-
сомой. При скрещивании
белоглазой желтой самки
с красноглазым серым
самцом
9 rwXrwX X RWXY J
аналогично только что опи- Рис. 22. Схема перекреста,
санному случаю следует
ожидать в первом поколении QRWXrwX и ^Г rwXY —
красноглазых серых самок и белоглазых желтых самцов. Во втором
поколении должно быть 25% QRWXrwX* 25% $ rw V/даДГ,
25% 0я RWXY и 25% <frwXY. Опыт дает следующие
результаты и для самцов, и для самок (рис. 21):
Серые красноглазые .
Желтые белоглазые . .
Серые белоглазые . .
Желтые красноглазые.
.24,725%
• 24,725 %
. 0,275%
. 0,275%
т. е., несмотря на сцепление обоих генов в одной и той же хро-*
мосоме, признаки в небольшой степени расщепляются. Это
объясняется явлением кроссинговера, или перекреста. Сходные
гомологичные хромосомы обмениваются своими участками, со-*
держащими соответствующие гены (рис. 22). Это заключение,
76
ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
У
SG
Нш
fa-
ее
rb
си
cf
5П
КХ)
0.0+
1.50+
3,0
5,5
7,5
--13.7
1г +
v
m
a
Ч
f
6
fu
car
ai
e
T0
dp
cl
20.0
21.0
27,7
lozenge ,
33.0
36,1
- - 31,0
43,0
44.4
56.7
57,0
59.5
62,5
b
rd
BL^54;
ft'
СП
bb -L 66,0 vg _ _ щ
I
С
13,0
16,5
J --41,0
48,5
51.0
54.5
^54,8
'55,0
57,5
72.0
75,5
hy - - 93,3
Ьш
sp
7u = 0
ue
ju - -19,2
se
h
th-
St'
cu
en - - 62.0 sr -:
Sb4
ss-
bX
sr
m
н
e
0.2
Z6.0
26,5
cd - - 74,7
--Щ5 ca +100,7
41.5
43,2
44.0
475
48.0
50.0
,58.2
58! 7
62.0
63,0
66,2
69,5
70,7
ro-- 91.1
Рис. 23. Генная карта хромосом
дрозофилы.
сделанное на основании
опытов по скрещиванию,
подтверждается
микроскопическими наблюдениями. Обмен
участками (перекрест)
происходит во время синап-
сиса хромосом при мейозе
(стр. 58).
Эти замечательные
факты свидетельствуют о том,
что гены расположены в
хромосоме в некоторой
линейной последовательности.
Естественно предположить,
что частота
рекомбинации двух сцепленных
генов зависит от расстояния
между ними — чем больше
это расстояние, тем более
вероятен перекрест. Таким
образом были получены
так называемые генные
карты — изображение
последовательности генов в
хромосоме с расстояниями,
выраженными в процентах
рекомбинаций (рис. 23).
Допустим, что три гена Л,
В, С находятся в одной
хромосоме. Вероятность
перекреста А и В 5%, В и С
3%. Тогда вероятность
перекреста А и С должна быть
равна или 5%— 3%=2%,
или 5%+3%=8%, чт0 и
наблюдается. В первом
случае последовательность
генов АСВ, во втором ABC.
Эти выводы полностью
подтверждены прямым
наблюдением гигантских
хромосом слюнных желез
двукрылых насекомых (и
прежде всего дрозофилы).
Структурные неоднородно-
ОСНОВНЫЕ ЗАКОНЫ ГЕНЕТИКИ
77
сти этих хромосом находятся в соответствии с генной картой
(рис. 24).
Мы рассмотрели лишь простейшие случаи наследования.
Ситуация очень осложняется в тех весьма распространенных
случаях, когда появление признака зависит от нескольких
различных генов. Эти случаи рассмотрены в современных курсах
генетики (см. [25, 26]),
ЩЩ0ЩЩ0Д51,72,63,0465,56,9 7,5
yjwjcsvrbrDnwrslcpftLdmepbi rb
а)
6)
по
i
Щ7 Wfl
cv ruz
I I
W WWW ЦП ЦЗ
shf cm ci sn oc dd
TT+
I I
I I 'I
J—J.
I
т
I I
№
\
шйштшяяят1шщ^^ятгтлшщшштяшш
20
T
a)
6)
32$ 33,0 36,1 36,2 38,3
ras v m dy fm
\/ \/ I
41.9 43Р44Щ545j 47,9
Щ s ff ty na pi
I \// I
' и I li
i
T^l
T
T
t
40
щщшжшттШмтмтш
fff/e
a)
47,9 515 54,154,454,556,757,058,259,459,5 62,5 62,7 64,0 66,0 ?№
pi sd me un n f В ad Bxfu car Mn sw bb sp-a
I I \l/ \/ \l/ \/ / ' \
| ' i 'i » | i'i i '"'l i){ » iM'| ■ ■»■ I | I -\
50 И JO \ 70
6) 1Ш1111Ш)11И^^
Рнс. 24. Генная карта (а) и строение (б) ^-хромосомы дрозофилы.
Гены и организмы в целом находятся под непосредствен-
гым мощным воздействием окружающей среды. Это
воздействие приводит, с одной стороны, к изменению самих генов —
наследственных факторов — к так называемым мутациям (см.
следующий раздел). Наряду с такими изменениями генотипа
влияние среды определяет фенотип, т. е. то или иное проявление
действия генов. Изменяя внешние условия, можно управлять
индивидуальным развитием организмов. Важнейшие
результаты на этом пути были получены Мичуриным, писавшим:
«В законе Менделя я нисколько не отвергаю его достоинств,
напротив, я лишь настаиваю на необходимости внесения в него
78 ГЛ. 2. КЛЕТКИ, ВИРУСЫ. НАСЛЕДСТВЕННОСТЬ
поправок и дополнений» [27, стр. 339]. Мичурин показал, в
частности, что возможно управлять доминированием при развитии
гибридов плодовых и ягодных растений. Исследования
Мичурина привели к ценнейшим практическим результатам. Следует
подчеркнуть, что, в отличие от Менделя и Моргана, Мичурин
работал с объектами очень сложными — культурные растения
имеют сложное гибридное происхождение, и генетический
анализ здесь существенно затруднен. Замечательные работы
Мичурина основываются, по-видимому, на специфике
индивидуального фенотипического развития и на длительных модификациях
(стр. 68), вызываемых действием среды или так называемой
вегетативной гибридизации.
МУТАЦИИ И ИЗМЕНЧИВОСТЬ
Как мы уже говорили, гены подвергаются действию
окружающей среды. Совершенно неправильно представлять себе
дело таким образом, что гены, содержащиеся в хромосомах,
неизменны, что все разнообразие особей данного вида и
разнообразие видов связано только с различными комбинациями
однажды заданного генофонда. Такие взгляды, высказывавшиеся
на первых этапах развития генетики, давно отвергнуты наукой.
Изменчивость генов может быть объяснена на основе физико-
химических представлений.
Уже чисто генетические исследования показывают, что
наследственность определяется реальными материальными
структурами, входящими в состав хромосом. В конечном счете это
несомненно молекулярные структуры. Но неизменных и
неподвижных молекул не бывает. Любые молекулы, и тем более это
относится к молекулам органических соединений, построенных
из легких атомов С, Н, О, N, P, S (нуклеиновые кислоты и
белки), «живые» в том смысле, что они подвержены тепловому
движению, не прекращающемуся и при абсолютном нуле. В
результате теплового движения (прежде всего колебательного
движения атомов в молекулах) химические связи могут
случайно, статистически накапливать энергию, достаточную для их
разрыва. Следовательно, даже тепловое движение может
вызвать изменения в химическом строении молекул
наследственного вещества. Еще более значительные изменения должны
возникать при различных воздействиях на это вещество —
химических или радиационных. Таким образом, молекулярные
представления невозможно согласовать с абсолютной
неизменностью генов.
С другой стороны, молекулярная структура гена должна
быть сравнительно устойчивой, так как, если бы она легко на-
МУТАЦИИ И ИЗМЕНЧИВОСТЬ
79
рушалась тепловым движением или, скажем, космической
радиацией, попадающей на поверхность Земли, вообще нельзя
было бы говорить о закономерной наследственности, и жизнь на
Земле выглядела бы совершенно иначе.
Де Фриз установил, что новые формы у растений возникают
в результате внезапных изменений, наследуемых потомством.
Такие изменения были названы им мутациями. В настоящее
время ясно, что наследственные вариации определенного
признака представляют собой результаты мутаций. Так, гены,
определяющие окраску тела или глаз у дрозофилы, в мутантных
формах дают разную окраску. Принято называть более
распространенный, доминантный тип диким типом, а
измененные— мутантными. Серая красноглазая дрозофила
принадлежит к дикому типу. Рыжие волосы у человека — результат
мутации. Количество таких примеров бесчисленно — у одной
дрозофилы известно более 400 различных мутантов.
Термин «дикий тип» не является чисто условным, хотя,
очевидно, можно было бы назвать дикой более редкую форму, а
мутантной — форму особенно распространенную. Дикая форма
в указанном смысле слова сложилась в результате длительной
эволюции, отбора таких мутантных признаков, которые
обеспечивают виду наиболее благоприятные условия существования
в данной среде. Следовательно, мутантные формы обычно
менее приспособлены. Во многих случаях доминантность означает
наличие какого-то благоприятного признака, рецессивность —
отсутствие этого признака. Тогда естественно, что фенотип гете-
розиготы Rr аналогичен фенотипу гомозиготы RR, а не
гомозиготы rr. R характеризует наличие некоторого признака, г — его
отсутствие.
Из сказанного следует, что появление новых мутантов у
сложившегося вида с несравненно большей вероятностью приведет
к появлению признаков, вредных для его существования, чем
к появлению полезных признаков. Соответственно в дальнейшей
борьбе за существование возникшие мутанты погибнут, и
по-прежнему будет преимущественно существовать дикая,
не мутировавшая форма. Таким образом, дикий генотип
стабилизуется естественным отбором, конечно, только до тех
пор, пока не произошло существенных изменений условий
среды.
В ряде случаев мутация является вообще летальной, т. е.
приводит к появлению нежизнеспособного организма,
погибающего на той или иной стадии развития. Возможно, например,
возникновение мутантных гамет, неспособных к
оплодотворению. При этом, очевидно, изменяются менделевские отношения.
Так, если г — летальный аллель, то гомозигота гг не появится
80 ГЛ. 2. КЛЕТКИ. ВИРУСЫ. НАСЛЕДСТВЕННОСТЬ
вовсе. Вместо RR, Rr, rR и rr в поколении, получившемся при
скрещивании Rr с rR, будут только особи RR, Rr и rR. Все
они фенотипически тождественны. При летальности R
получится, наоборот^ Rr, rR и rr с отношением 1:2, Такой
результат получается 'при скрещивании желтых (R) и черных (г)
мышей.
Известны мутации двух сортов — генные, или точечные, и
хромосомные. В первом случае речь идет об изменениях
генетического вещества на молекулярном уровне организации (см.
гл. 7), Такие изменения не могут быть наблюдаемы под
микроскопом. Напротив, хромосомные мутации состоят в видимых
под микроскопом разрывах и перестройках хромосом,
большей частью гибельных для огранизма.
Обсудим прежде всего природу точечных мутаций. Они
должны приводить к появлению дискретных новых, по сравнению
с немутировавшим организмом, признаков. Не постепенное, а
скачкообразное изменение гена должно быть результатом такой
мутации. Причиной этого является дискретность состояний
молекул и химических связей.
Основные результаты квантовой механики в применении к
атомам и молекулам состоят в том, что такие, состоящие из
атомных ядер и электронов системы могут находиться лишь в
дискретных энергетических состояниях. Химическая связь
между атомами или существует, или не существует—
промежуточное состояние невозможно. Для возникновения мутаций
существенны, в частности, так называемые таутомерные
превращения молекул (см. стр. 25), связанные с переходом атома
водорода из одного положения в другое. При этом вместо одних
химических связей получаются другие.
Таким образом, молекулярная, точечная мутация должна
происходить по принципу «все или ничего». Иными словами,
мутация происходит или не происходит, промежуточных
изменений не бывает. Скачкообразность, а не постепенность
изменения наследственных признаков имеет весьма глубокое кван-
товомеханическое обоснование. Здесь вновь проявляется
единство законов природы.
Конечно, и хромосомные мутации являются дискретными,
хотя бы уже потому, что перестройка надмолекулярной
структуры— хромосомы — может происходить только в результате
изменений химических связей.
Мутации возникают спонтанно, самопроизвольно или под
влиянием внешних воздействий. Спонтанные мутации
вызываются тепловым движением. Ясно, что повышение температуры
(т. е. изменение условий среды) должно привести к увеличению
вероятности тепловых мутаций, По какому закону?
МУТАЦИИ И ИЗМЕНЧИВОСТЬ
81
Следует, очевидно, считать мутацию результатом некоторой
химической реакций —1 изменения молекулярной структуры.
Скорость такого процесса в простейшем случае подчиняется
закону Аррениуса (стр. 25)
v = Ae-E*l*T, (2.4)
где v характеризует число переходов через активационный
барьер высотою Еа за 1 сек. Очевидно, что значительная
устойчивость вещества генов связана с высокими энергетическими
барьерами, защищающими организмы от мутирования.
Предположение о неизменности генов означает, очевидно,
бесконечно большие барьеры, т. е. Еа-^оо и соответственно 0-Я). С
другой стороны, очевидно, что при Еа-*0 переходы должны были
бы происходить непрерывно и вместо дискретного
распределения состояний молекул и тем самым мутантных форм
существовала бы некая размазанная непрерывность этих форм.
Однако для молекул органических соединений Еа велики, но не
бесконечны. Значения Еа, определяемые для молекул физико-
химически, как раз такого порядка, что объясняют как
устойчивость наследственного вещества, так и его способность время
от времени мутировать (см. [7]). Точечные мутации в первом
приближении действительно подчиняются закону Аррениуса
(2.1) —мутабильность дрозофилы возрастает с температурой
в соответствии с этим законом.
Точная проверка этого закона затруднена тем
обстоятельством, что данный организм вообще может существовать лишь
в узком интервале температур. В то же время изменение
температуры влияет не только на генную молекулу, но и на ее
окружение, изменяя состояние среды, что не может не сказываться
на гене. Схема, приведенная на рис. 1, и соотношение (2.4)
являются упрощенными, они не учитывают кооперативного
характера рассматриваемых процессов (стр. 26)* Эти вопросы,
чрезвычайно интересные и важные, подлежат дальнейшему
исследованию.
Частота мутаций на ген на поколение у дрозофилы
варьирует в обычных условиях от 10~5 до Ю-6. Внешние воздействия
могут значительно увеличить это значение. В 1925 г. Надсон и
Филиппов впервые открыли мутагенез под действием
рентгеновых лучей на низших грибах [28]. Двумя годами позже Меллер
установил сходные явления на дрозофиле (см. [29]). Кванты
высокой энергии вызывают большое число мутаций. Количественное
изучение этих процессов было впервые проведено Тимофеевым-
Ресовским и его сотрудниками (обзорные работы [30, 31], см.
также [32, стр. 65]). Оно показало, что число мутаций
пропорционально общей дозе облучения, измеряемой вызываемой
6 М. В. Волькенштейн
82 ГЛ. 2. КЛЕТКИ. ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
ею степенью ионизации, независимо от частоты кванта.
Радиационный мутагенез, по-видимому, вызывается ионизацией либо
самих генетических молекул, либо соседних молекул,
приводящей к перестройке генов. По мере накопления
экспериментального материала картина значительно осложнилась, и в
настоящее время радиационная генетика представляет важную и
обширную область биологии, целиком основанную на физико-
химических исследованиях. Здесь мы не имеем возможности
излагать богатейшие научные данные и их обобщения,
полученные радиобиологией за короткое время ее существования
(популярное изложение см. [33], монографическое [34, 35]).
Необходимо подчеркнуть, что действие ионизирующих
излучений связано прежде всего с изменениями хромосом,
а не цитоплазмы. Это особенно ярко демонстрируется опытами
Астаурова [36], изучавшего влияние излучения на
наследственные свойства тутового шелкопряда — бабочки, гусеницы
которой называются шелковичными червями. Они-то и делают шелк.
Как показал Астауров, у этого насекомого можно получить ан-
дрогенез — развитие зародыша из яйцеклетки, лишенной
собственного ядра и содержащей только отцовские хромосомы,
внесенные одним или несколькими спермиями. Развившиеся из
таких зигот особи — всегда мужские. Яйца подвергались
рентгеновскому облучению и оплодотворялись иеоблученной
спермой. Вскоре после проникания спермиев (у шелкопряда
существует полиспермия — в яйцо проникает несколько спермиев),
когда, женское ядро еще не слилось ни с одним из мужских,
яйца нагревались до 40° в течение 135 минут. При этом женские
ядра теряют способность участвовать в оплодотворении.
Происходит «мужское оплодотворение» — слияние двух мужских
ядер и получаются вполне жизнеспособные андрогенетические
зародыши. Значит, облучение цитоплазмы не влияет на их
судьбу. Напротив, обычные особи мужского и женского пола,
получившие хромосомы и от облученного яйца и от необлученного
спермия, обладают тем меньшей жизнеспособностью, чем
больше доза облучения яйца. Астауров впервые получил взрослые
организмы при взаимодействии ядра и цитоплазмы разных
видов. Удалось реализовать межвидовой андрогенез —
оплодотворить несколькими спермиями шелкопряда одного вида яйцо
шелкопряда другого вида, ядро которого также подвергалось
тепловому шоку. Как и следовало ожидать, получившиеся
организмы оказались подобными отцу, а не матери.
Опыты Астаурова однозначно доказывают, что генетическое
действие радиации производится на ядро, т. е. на хромосомы, а
не на цитоплазму. Астауров дает яркое сравнение кванта
радиации с пулей. Пуля в равной мере разрушает мышцы и серд-
МУТАЦИИ И ИЗМЕНЧИВОСТЬ
83
ца, и ноги. Но попадание ее в сердце убивает организм, а
попадание в ногу сравнительно неопасно. Ядро с его хромосомами
играет в клетке ту же роль, что и сердце — оно контролирует
все биосинтетические и формообразующие процессы, в то время
как цитоплазма осуществляет обмен веществ, выполняет
приспособительные реакции и т. д.
Мы встречаемся здесь с одним из основных для биологии
вопросов. Ясно, что «лишь клетка как целостная система, тесно
спаянная интимным ядерно-плазменным взаимодействием и
притом лишь в определенном диапазоне необходимых для
жизнедеятельности условий среды, обеспечивает преемственность
организации, которую мы называем наследственностью» (Ас-
тауров, предисловие к [37]). Ведущей, информационной,
управляющей системой является, однако, именно ядро клетки с его
хромосомами.
План дифференцированной цитоплазмы генотипичен,
следовательно, он заложен в ядре.
Существует, однако, не только ядерная, но и цитоплазмати-
ческая наследственность [37, 25]. В редких случаях редуплици-
руются не только хромосомы, но и некоторые структуры
цитоплазмы. Эти явления, естественно неподчиняющиеся законам
Менделя, должны рассматриваться как исключения из общего
правила. Конечно, они представляют большой интерес. В то же
время установлено, что ряд фактов, рассматривавшихся как ци-
топлазматическая наследственность, в действительности имеет
совершенно иной характер.
Существуют штаммы (сорта) инфузорий-туфелек
(Paramecium aurelia), именуемые «убийцами». Они выделяют в
окружающую среду вещество парамеции, убивающее клетки других
штаммов, но сами «убийцы» к этому веществу
нечувствительны. Такие штаммы гомозиготны по доминантному фактору /С, и
в их плазме находятся так называемые частицы каппа. При
конъюгации инфузории типа /С с чувствительной к парамецину
инфузорией типа /С+ возникают особи /С/С+, имеющие частицы
каппа. Если бы этих частиц не было, то особи /С/С* остались бы
чувствительными к парамецину. Частицы каппа переходят из
одной клетки в другую по плазматическому мостику при
конъюгации и, казалось бы, представляют собой наследуемые
плазматические структуры, способные размножаться в плазме
только в присутствии аллеля /С- Однако выяснилось, что эти
частицы, содержащие ДНК — палочкообразные тельца длиной от
0,6 до 1,0 \i, являются инородными телами, возможно,
измененными вирусными или бактериальными частицами. Дело
здесь состоит не в плазматической наследственности, а в
контролируемом генотипом симбиозе.
6*
84 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
Большая мутагенность коротковолнового излучения
является одной из важнейших опасностей испытаний ядерного
оружия. До сих пор японским врачам и биологам приходится
сталкиваться с тяжелыми генетическими последствиями
взрывов атомных бомб в Хиросиме и Нагасаки — этих ужасных
преступлений против человечества. Изучение радиобиологических
явлений, с одной стороны, научно обосновывает необходимость
запрещения испытаний ядерного оружия, с другой — намечает
пути борьбы с радиационным мутагенезом.
Те же вопросы возникают в связи с космическими полетами.
Уровень космической радиации резко возрастает в
определенных зонах за пределами земной атмосферы. Для безопасных
полетов на другие планеты и возвращения на Землю
необходимы эффективные меры защиты от действий радиации.
Радиационно индуцированные мутации, как правило,
вредны. Однако и они могут быть использованы на благо
человечества. Ввиду того, что радиация вызывает очень большое число
всевозможных мутаций, из них могут быть отобраны такие
мутации сельскохозяйственных растений и животных, которые
представляют большой интерес для селекции. Таким путем
были получены новые высокоурожайные, устойчивые к ряду
грибковых заболеваний культуры ячменя, пшеницы, бобовых [48].
Методом радиационного мутагенеза были получены мутанты
плесневых грибков, дающие большую продукцию пенициллина
и других антибиотиков.
Химический мутагенез был впервые изучен советскими
генетиками Сахаровым [39], Лобашевым [40] и, главным образом,
Рапопортом [41]. Целый ряд веществ вызывает химические
реакции, приводящие как к генным, так и хромосомным мутациям.
Среди этих веществ можно назвать колхицин, иприт и т. д.
С этими явлениями нам придется не раз встречаться в
дальнейшем изложении (см. 25, 42).
Одним из генетических изменений, вызываемых, в частности,
колхицином, является возникновение полиплоидии.
Полиплоидными называются клетки (и организмы), содержащие более чем
две гомологичные хромосомы, т. е. не пары, а тройки, четверки
и т. д. гомологичных хромосом. Такое умножение хромосом
очень интересно для генетики, так как в этом случае каждый
ген присутствует в виде ряда копий. Полиплоидные организмы
обычно имеют размеры, значительно большие диплоидных.
Полиплоидия присуща ряду культурных растений и
микроорганизмов (дрожжи) и весьма важна для сельского хозяйства.
До сих пор мы говорили о мутациях в гаметах — половых
клетках. Ясно, что только такие мутации имеют генетическое
значение, могут проявиться у потомства.
ГЕНЕТИКА БАКТЕРИЙ И ФАГОВ
85
Мутациям подвержены конечно хромосомы и гены в любых
клетках—и в половых, и в соматических. Соматические
мутации могут быть весьма существенны для организма. Интересны
так называемые мозаики. При мутировании делящейся клетки
на стадии образования двух первых клеток, если мутация
происходит только в одной из них, возникает организм, правая и
левая половины которого могут отличаться по каким-нибудь
признакам. Таковы люди, у которых один глаз карий, а
другой— голубой, или волнистые попугайчики с голубоватым one-'
рением одной половины тела и зеленым — другой.
Несравненно более важно то, что злокачественные опухоли,
возникающие в результате патологического роста и
размножения клеток, также связаны с соматическими мутациями. Это
понятно, ведь именно хромосомы управляют биосинтезом, т. е.
развитием клеток. Соматические мутации клеток, которые
быстро делятся по свойственной им природе (клетки кроветвор-*
ных органов, кишечного эпителия и т. д.), должны, очевидно,
иметь особенно серьезные последствия для организма. В этом,
по-видимому, состоит одна из важнейших причин лучевой
болезни.
Изучение явлений наследственности и изменчивости на мо«
лекулярном уровне методами молекулярной биологии и моле-*
кулярной биофизики необходимо для сознательного
управления мутациями, т. е. для управления наследственностью и
изменчивостью. Эти возможности уже реализованы в случаях
бактерий и вирусов. Именно с такими возможностями связаны
грандиозные перспективы молекулярной биологии.
ГЕНЕТИКА БАКТЕРИЙ И ФАГОВ
Сегодня уже не дрозофила, а гораздо более простые
объекты— грибки, бактерии и даже вирусы являются главным
материалом генетических исследований.
Для жизни человека не так уж важно, будут ли его глаза
голубыми или карими (это — наследственный признак).
Важно, чтобы вся система биохимических реакций в его клетках
была правильно отрегулирована, чтобы в них синтезировались
надлежащие ферменты. Именно синтез биологически
функциональных веществ, прежде всего белков, предопределен
генетически.
Как же изучить прямые химические действия генов? Это
весьма затруднительно в случае многоклеточных организмов.
За красную окраску глаз у дрозофилы ответственны
многочисленные химические процессы, и проследить их чрезвычайно
трудно.
86 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
Бактерии представляют исключительно удобный материал
для такого рода исследований. Они быстро размножаются,
образуя на плотной среде (желеобразное вещество агар) колонии
по 107—109 клеток, являющиеся потомством одной клетки.
И, что самое важное, их генетические признаки непосредственно
связаны с обменом веществ, метаболизмом. Бидл и Тэтум
открыли новые возможности в биологии, начав генетическое
изучение бактерий. Бактерии растут на неживой питательной среде,
содержащей неорганические соли и какой-либо сахар,
являющийся источником углерода и химической энергии.
Состав питательной среды для Escherichia coli: на 1000 мл
воды 1,0 г NH4C1, 0,13 г MgS04, 3,0 г КН2Р04, 6,0 г Na2HP04,
4,0 г глюкозы. Фосфорные соли являются источниками фосфора,
необходимого для синтеза нуклеиновых кислот; в то же время
они поддерживают нужную концентрацию ионов водорода.
Хлористый аммоний — источник азота. Магний, калий и натрий
необходимы для жизни. Для размножения клеток Escherichia
coli в такой среде желательно продувание воздуха — без
кислорода размножение идет медленно. Генетические вариации —
мутации устанавливаются непосредственно по биохимическим
свойствам бактерий. Мутанты могут отличаться по своей
способности усваивать различные сахара, способности
синтезировать из неорганических азотистых соединений и сахара
аминокислоты и другие необходимые для жизни вещества, по
степени устойчивости к таким ядам, как антибиотики и
сульфамиды, по степени устойчивости к бактериофагам. Все это —
химические характеристики.
Для данного вида бактерий может быть установлена так
называемая минимальная среда, содержащая минимум
веществ, необходимых для размножения дикого типа. Некоторые
мутанты таких бактерий оказываются неспособными
размножаться на минимальной среде — они, скажем, не могут
синтезировать на ней одну из аминокислот, необходимых для
образования белковых молекул. При добавлении в среду этой
аминокислоты бактерии вновь размножаются.
Прежде чем рассмотреть генетику бактерий —
биохимическую генетику, необходимо установить характер их
наследственных изменений.
Бактерии, к нашему несчастью, очень легко изменяются.
Так, наблюдается «привыкание» бактерий к антибиотикам. При
лечении пневмонии пенициллином в затянувшихся случаях он
перестает помогать, и приходится прибегать к другому
антибиотику— стрептомицину. Получается раса, штамм
пневмококков, устойчивых к пенициллину и тем самым более опасный
для человека.
ГЕНЕТИКА БАКТЕРИЙ И ФАГОВ
87
Появление устойчивых штаммов бактерий иногда объясняют
их адаптацией, т. е. приспособлением к изменившимся условиям
среды. При этом, естественно, предполагается, что адаптация
передается по наследству.
Другая возможность определяется мутациями. Если данная
популяция бактерий содержит мутанты, устойчивые по
отношению к определенным ядам, то в среде, содержащей такие яды,
выживут и будут размножаться только устойчивые мутанты.
Среда в этом случае действует на бактерии как фактор отбора,
т. е, так же, как при естественном отборе многоклеточных
организмов. Происходит селекция, искусственный отбор микробов, и
создается новый устойчивый, резистентный штамм, столь
опасный для больного.
Таким образом, имеются две возможности изменения
бактерий— адаптация и мутации. Какая из них реализуется?
Вопрос подлежит экспериментальной проверке.
Соответствующие опыты были проведены Дельбрюком и Лурия [43].
Ввиду того, что наследуемая адаптация происходит
постепенно и направленно, усиливаясь из поколения в поколение, а
мутация имеет случайный характер, статистический анализ
популяций должен в этих двух случаях приводить к разным
результатам. Опыты делались следующим образом.
Большое число N порций питательной среды заражалось
малыми количествами клеток одного и того же штамма
микробов. Через какое-то время после роста культур определялось
среднее число п устойчивых, резистентных клеток в каждой из
них путем посева на среду, содержащую яд (скажем,
пенициллин, если речь идет о пневмококках). Если происходит
адаптация, то вероятность стать резистентной для клетки одинакова
как в пределах одной культуры, так и во всех культурах.
Более того, в этом случае можно указать и распределение
отступлений от среднего числа п устойчивых клеток. Это обычное
распределение по закону Пуассона. Средний квадрат
отклонения от среднего равен самому среднему:
(п — п)2 = п. (2.5)
Оказалось, что в пределах одной культуры соблюдается
распределение Пуассона. Но средние значения п для разных
культур отличаются иногда в десятки раз. Этот результат
опровергает предположение об адаптации. Остается предположить, что
за привыкание к яду ответственны мутации.
Ввиду того, что мутации возникают случайно, в течение
роста каждой культуры с малой вероятностью, происходят
статистические флуктуации их числа, особенно значительные в начале
роста. Эти флуктуации резко умножаются при размножении
88 ГЛ. 2, КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
клеток, что естественно приводит к большим различиям в
значениях п в разных культурах. Строгий математический анализ
результатов описанных опытов, проведенный Дельбрюком и
Лурия, показал, что эти результаты находятся в полном
согласии с предположением о мутационной, а не адаптационной
изменчивости микробов [43, 44].
Таким образом, резистентные клетки оказываются
возникающими случайно в любой порции бактериальной культуры;
среда, содержащая яд, действует как «проявитель» этих клеток.
Аналогичные результаты получаются во всех тех случаях,
когда изменчивость микробов изучается строгими
количественными методами. И одноклеточные организмы не наследуют
приобретенные признаки. Их отличие от многоклеточных, в
обсуждаемом смысле, сводится к большей вариабильности и
возможности очень быстро получать новые мутантные штаммы.
Сказанное не означает, конечно, что адаптации, т. е.
ненаследственного приспособления к условиям среды, не
существует в природе. Напротив, каждый огранизм, обладая
определенным генотипом, обладает тем самым определенной
способностью к адаптации и обязательно адаптируется. Вариации
стенотипических признаков определяются и наследственными
мутациями и модификациями, возникшими под влиянием внешней
среды. Наследуются, однако, только первые. К модификациям
относятся признаки, переходящие из поколения в поколение при
непрерывном существовании в постоянных условиях, но
исчезающие сразу же при изменении этих условий. Существуют,
однако, и длительные модификации, сохраняющиеся в течение
ряда поколений, живущих в изменившихся условиях, но в конце
концов исчезающие. Длительные модификации обычно
наблюдаются при неполовом размножении; конъюгация, т. е.
обновление ядерного вещества, их немедленно устраняет. Так
обстоит дело, например, с инфузориями-туфельками, которые
способны адаптироваться к существованию в 5%-ном растворе
мышьяковой кислоты. Эта адаптация сохраняется, постепенно
ослабевая, на протяжении нескольких сот поколений,
полученных делением, и исчезает сразу при конъюгации (см.
также [45]).
Вернемся к бактериям. Как же изучить их генетику,
получить их генные карты? Ведь для этого нужно произвести
скрещивание, а бактерии обычно размножаются простым делением.
Наряду с делением наблюдается, однако, и конъюгация
бактерий — их временное соединение с последующим
расхождением. Оказывается, что в некоторых случаях такая
конъюгация подобна оплодотворению, т. е. одна из клеток ведет себя
как мужская, а другая — как женская половая клетка. Иными
ГЕНЕТИКА БАКТЕРИЙ И ФАГОВ
89
словами, бактерии могут иметь пол. Это обстоятельство было
выяснено сравнительно недавно как раз путем генетических
исследований [44, 46, 47].
Излюбленным объектом в генетике бактерий и в
молекулярной биологии является кишечная палочка Escherichia colt
(сокращенно Е. сой). Эти бактерии обычно не патогенны, их легко
размножать и изучать. Е. coli имеет ряд мутантных форм. Так,
например, тип или штамм, называемый диким, способен расти
на среде, содержащей лактозу— один из Сахаров. Этот тип
Lac+ сбраживает лактозу. Мутант Lac~ такой способностью не
обладает и не растет на минимальной среде, содержащей в
качестве источника углерода
только лактозу. Тип Р+ спосо- S* LT
бен синтезировать фермент фос- F ' х
фатазу, тип Р" этого делать не $s i+
может. Штаммы Е. coli раз- Hfr—i i
нятся по устойчивости к фагам
и антибиотикам и т. Д. Рис. 25. Схема образования зиготы
Ледерберг впервые устано- У бактерий,
вил, что при смешении
некоторых отличающихся друг от друга штаммов Е. colic вероятностью
порядка Ю-7 происходят генетические рекомбинации, подобные
тем, которые реализуются при кроссинговере у
многоклеточных. Далее было показано, что дикие штаммы типа Hfr (high
frequency recombinants — с большой частотой рекомбинаций)
вызывают генетические рекомбинации у клеток типа,
обозначаемого F~. Первые клетки обладают характером мужских, до-
норных клеток, вторые — являются женскими, акцепторными.
При конъюгации происходит передача наследственного
вещества от первых ко вторым, но не наоборот. Генетическое
рекомбинации реализуются реже, чем конъюгации. Но при любой
конъюгации могут происходить асимметричные изменения
наследственных свойств конъюгирующих клеток. Следовательно,
и у бактерий возможно явление перекреста, или аналогичное
ему. Бактерии — гаплоидные клетки, имеющие одну хромосому.
При конъюгации из мужской клетки в женскую переходит
хромосома и образуется диплоидная зигота со структурой
хромосом, показанной на рис. 25. Hfr—мужская хромосома, F~ —
женская. S, L — обозначения некоторых генетических маркеров.
Рекомбинации могут происходить путем перекреста (рис. 26,а),
но возможны и другие механизмы [48].
Ледерберг рассмотрел так называемое выборочное
копирование— copy choice (рис. 26,6). Вновь синтезируемая
хромосома, попадающая в дочернюю клетку, частично копирует
«отцовскую», частично «материнскую» хромосому. Процесс этот
90 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
случаен, и поэтому вероятность того, что изображенный на
рис. 26,6 перескок копии произойдет на участке S—L,
пропорциональна длине участка. Таким образом, выборочное
копирование по своим результатам аналогично перекресту.
Наконец, рекомбинации осуществимы в результате
фрагментации хромосом — разрыва хромосомы и включения в это
место фрагмента другой хромосомы с последующим удвоением
генетического материала. По-видимому, так происходит рекомби-
^ нация у фагов Т2, Т4. Как она
i . 1+ происходит у бактерий, сейчас
1 еще не ясно, но при любом
механизме рекомбинации дают
gf S \ч^ i~ возможность построения ген-
Hfr \ ^ ' ной карты хромосомы, в кото-
а\ рой расстояния между генами
выражаются в частотах ре-
S* 1т комбинаций. Однако эти рас-
Г* ' | стояния могут быть выражены
/ Г и в единицах времени — в ми-
Ss / нутах.
ff/y [" х , Хромосома в клетке Е. coli
Ss L* имеет форму замкнутого коль-
Ф ца. Это обстоятельство уста-
Рис. 26. Рекомбинация. новлено генетически и под-
а) перекрест; б) выборочное копирование. ТВерЖДеНО ЭЛвКТрОННОЙ МИКрО-
скопией. Буквой F мы
обозначили некоторый материальный фактор, находящийся в
цитоплазме и при некоторых условиях сообщающий клеткам
способность быть донорными — мужскими. Этот фактор существует у
типа, обоаначаемого соответственно F+. Рентгеновыми лучами
фактор F можно инактивировать. При этом получаются
мутанты У7-, способные играть роль только акцепторов — женских
клеток. Наличие фактора F у типа F+ не означает в то же время,
что все клетки F+ будут мужскими и будут способны к передаче
хромосомы акцепторам — женским клеткам. Вольман и Жакоб
установили, что в клетках F+ возможен разрыв замкнутой
хромосомы, в результате которого происходит процесс F+-^Hfr.
Кольцо, разорванное в каком-либо месте, присоединяет
фактор F и превращается в линейную хромосому, способную
перейти из мужской клетки в женскую (F') при их конъюгации
(рис. 27). Фактор F называется фактором пола.
Разрыв хромосомы можно считать спонтанной мутацией
F+->Hfry ее вероятность 10*4—10*5. Вольман и Жакоб
проводили опыты с прерванной конъюгацией клеток. Хромосоме
нужно некоторое время для того, чтобы перейти из клетки Hfr в
ГЕНЕТИКА БАКТЕРИЙ И ФАГОВ
91
Рис. 27. Присоединение /''-фактора и
разрыв хромосомы у бактерий Е. coll.
клетку F~. Если прервать конъюгацию до истечения этого
времени, что может быть сделано просто сильным перемешиванием
культуры в микроизмельчителе, в клетку F~ успеет перейти
лишь часть хромосомы от Hfr. Образуется так называемая
мерозигота— клетка, содержащая всю материнскую хромосому и
лишь часть отцовской. Мерозигота имеет «плоидность»,
большую единицы и меньшую двух. Изучая свойства потомства ме-
розиготы, можно определить, сколько времени нужно для
перехода того или иного
маркера (гена) от Hfr к F~. Вы- g
яснилось, что вся хромо-
сома передается за 2 ча-
са — очень длительное вре- ^
мя. Сам фактор F
передается за это же время,
следовательно, он
прикреплен к дальнему концу
хромосомы, входящему в
клетку последним. Другие
маркеры передаются,
естественно, за более короткое
время. В результате можно построить генную карту хромосомы
с расстояниями, выраженными во временах перехода.
Ситуация осложняется тем, что разрыв кольца в принципе
может произойти в любом месте, и поэтому маркеры,
расположенные между начальной точкой О и конечной точкой F
образовавшейся линейной хромосомы, могут следовать в разном
порядке. Это было исследовано и учтено при построении генной
карты. Генная карта хромосомы Е. coli показана на рис. 28.
Для генетики бактерий (и, конечно, фагов) громадное
значение имеют явления лизогении и трасдукции (см. стр. 68).
Как уже говорилось, лизогения — это наследственная
способность клетки продуцировать фаг при некоторых индуцирующих
воздействиях. Эта способность приобретается клеткой при
заражении ее умеренным фагом. Генетические исследования,
основанные на изучении рекомбинантов, показали, что геном
(совокупность генов) фага в этом случае непосредственно
связывается с хромосомой бактерии. В частности, деление профа-
гов точно сбалансировано с делением бактериальной клетки.
Каждый тип профага располагается определенным образом в
хромосоме бактерии. Следовательно, существует сродство
(взаимодействие) между геномом фага и геномом бактерии.
Наличие такого взаимодействия показано прямыми опытами. В то же
время профаг нельзя считать частью хромосомы. Он прикреплен
к ней, но в своей большей части остается вне хромосомы.
Val2
Rjso
Pyr2J
" Ad4. Arg
Met3 [vatj; Ura
Pttiu] r. I
[Ara2]
Val,bAzRTRl, .
Gal
[Blot]
Рис. 28. Генная карта хромосомы Е. coli (штамм #12).
Генетические маркеры выражают способность синтезировать: Г—треонин, L — лейцип,
Pant —пантотеновую кислоту. Pro —пролин. Риг—пурины. Blot —биотин. Руг —пиримидины,
Try—триптофан, Shlk — шикимовую кислоту. His—гистидин, Arg —аргинин, Lys—лизин,
Nlc —никотинамид, Gua—гуанин. Ad —аденин, РАВ — парааминобензойную кислоту, Туг
—тирозин, Phen — фенила ланин, Gly — глицин, Ser — серии, Cys — цистеин, М—метионин,
В12—витамин В12, J so—изо лейцин, В, — тиамин, Val—валин. Способность сбраживать;
Ага — арабинозу, Lac —лактозу, Gal —галактозу, Mai —мальтозу, Xyl —ксилозу, Mtl —маннит.
Succ —потребность в янтарной кислоте, Asp —аспарагиновой кислоте, GIu — глютаминовой
кислоте, Az^—резистентность к азиду Na, Sm° —к стрептомицину, Т? — к фагу Ти
т£— к фагу Г. R. -репрессия изолейцина,Я_ —триптофана; 85, Я,, 434, 381, 424, 466—
локусы индуцируемых ультрафиолетовым светом профагов; 186, 370, 299, 18, w — ue-
индуцируемых профагов.
ГЕНЕТИКА БАКТЕРИЙ И ФАГОВ
93
Характерно, что профаг приобретается или утрачивается как
единое целое (см. [19]). *
Выше говорилось о раке, о злокачественных опухолях, как
результатах некоторых соматических мутаций. Давно уже
предложена другая теория рака — ряд ученых считает, что он
вызывается вирусной инфекцией. Явление лизогении показывает, что
различие между этими точками зрения не столь значительно.
Существование профагов как бы перебрасывает мостик между
наследственностью и инфекцией, между ядерной и цитоплаз-
мэтической наследственностью [46]. Вирусы действительно
приводят к изменениям генетических свойств клеток и не только
в случае лизогенных бактерий. Известны злокачественные
новообразования, вызываемые вирусами — саркома Рауса у кур,
полиома у ряда грызунов. Это — умеренные вирусы, способные
размножаться внутри клеток в ряде поколений, подобно
умеренному бактериофагу. Ясно, что интеграция фагового или
вирусного генома по своим последствиям аналогична мутации в
хромосоме бактерии,
Профаг подобен половому фактору бактерий в том
отношении, что он может существовать в двух различных состояниях —
в автономном в цитоплазме клетки и в интегрированном —
присоединенным к хромосоме. Генетические элементы, обладающие
такими свойствами, называются эписомами. Очевидно, что
эписомы не обязательно присутствуют в клетке. Если эписомы
отсутствуют, то они могут попасть в клетку только извне. В
интегрированном состоянии эписомы локализованы на бактериальной
хромосоме, но не являются частью ее линейной структуры. В то
же время между эписомами и соседними элементами хромосомы
возможны генетические рекомбинации, в результате которых
типичные гены бактерий могут приобретать свойства эписом.
Подробное изложение замечательных результатов,
полученных в генетике бактерий и вирусов, читатель найдет в
монографиях Жакоба и Вольмана [46] и Бреслера [44] (см, также [47]),
Рассмотрим теперь подробнее понятие гена. До сих пор мы
вводили это понятие, имея в виду некоторую материальную часть
хромосомы, ответственную за появление определенного
наследственного признака, С другой стороны, в явлениях перекреста и
выборочного копирования осуществляется способность
хромосомы рекомбинировать, и ген фигурирует как некоторая
единица рекомбинации, т. е, такая отдельность в структуре
хромосомы, которая не разделяется на составные части при
рекомбинации. Далее, в явлениях мутирования ген выступает как
участок хромосомы, изменяющий свое строение и свойства в
результате спонтанной или индуцированной мутации — как
единица мутации, В настоящее время в литературе приняты
94
ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
• + + • • +
+ 1 • I ~ | + + |~+
+ 1 • I +~~] I + 1 • ГТ
+ + "Т~| | + | + +
• 1 + 1 +~~| I • I + ГТ
+ + • + + +
Транс-
мутантншй
тип
Цис-
диний
тип
Рис, 29. Цис-транс тест.
введенные Бензером [49] термины «рекон» и «мутон». Рекон —
наименьший элемент в линейном расположении, который
может обмениваться, но не разделяться при генетической
рекомбинации. Мутон — наименьший элемент, изменение которого
приводит к появлению мутантной формы организма.
Несомненно, что за биосинтетическую способность, за
рекомбинации и мутации ответственны реальные молекулярные
структуры. Молекулярная
биология ставит вопрос о
характере этих структур и отвечает
на него.
Как уже подчеркивалось,
основная функция гена —
биосинтетическая. Бидлу
принадлежит выражение: «Один
ген — один фермент». Здесь
имеется в виду
функциональная единица наследственного
вещества, ответственная за
синтез определенного белка.
Современная наука исходит
прежде всего из
функционального определения гена. При
этом прежний, как мы видели, неопределенный термин — ген
сейчас уже почти не применяется. Функциональная единица
называется теперь не геном, а «цистроном» (Бензер [49]). Прежде
всего возникает вопрос о числе цистронов в хромосоме. Ответ
на него сразу дает возможность установить, совпадает ли ци-
строн с мутоном и реконом, или же это разные единицы.
Число цистронов и их размеры, выраженные в единицах
рекомбинации или в минутах (в случае бактерий), могут быть
найдены методами генетики независимо от биохимии. Известно
явление псевдоаллелизма. Определенные участки хромосом
контролируют очень близкие друг к другу процессы. Это относится,
в частности, к генам, именуемым Lozenge у дрозофилы (см.
рис. 23), Мутация в таком участке вызывает изменения окраски
глаз и других признаков насекомого. Мутанты рецессивны, и
следовательно, гетерозигота имеет нормальный, доминантный
фенотип. В результате изучения перекрестов было выяснено, что
в участке Lozenge имеются три мутантных локуса — мутация
в любом из этих трех мест вызывает появление рецессивного
аллеля. Расстояние между тремя локусами очень мало—менее
0,1 единицы рекомбинации. Можно получить, очевидно, зиготы
различных типов, показанные на рис. 29. На рисунке
изображены отрезки двух гомологичных хромосом зиготы, разбитые на
ГЕНЕТИКА БАКТЕРИЙ И ФАГОВ
95
три участка, отвечающие мутирующим локусам, т. е. мутонам.
Точками обозначены мутации Lozenge, плюсами — немутировав-
шие мутоны. Во всех шести приведенных случаях в зиготе
имеются по две мутации. Если эти две мутации происходят в
разных гомологичных хромосомах (так называемая
транс-конфигурация), то насекомое принадлежит к мутантному фенотипу,
если в одной хромосоме (цис-конфигурация), то сохраняется
нормальный, дикий фенотип. Чем это объясняется? Очевидно,
что мутация в любом из трех мутонов означает нарушение
нормальной функции гена. Если мутации произошли в обеих
хромосомах (транс), то эта функция отсутствует. Если же одна из
хромосом осталась неповрежденной, то функция сохраняется.
Таким путем можно выделить функциональный участок
хромосомы; соответствующий генетический эксперимент называется
цис-транс тестом. Отсюда термин «цистрон».
Понятие цистрона связано с известной трудностью. После
знакомства с явлением рекомбинации может показаться, что в
транс-конфигурации фигурируют рекомбинировавшие
хромосомы. Но дело в том, что речь идет просто о двух родительских
хромосомах, без всякой их рекомбинации.
Мы видим, что цистрон, т. е. ген, имеет тонкую структуру —
он содержит ряд мутонов. Рекон еще меньше мутона. Особенно
детальное исследование тонкой структуры цистрона было
проведено Бензером, работавшим с бактериофагом Т4. Независимо
от того, считать ли фаги живыми или неживыми, существенно,
что они моделируют все генетические закономерности.
Фаг Т4 паразитирует на клетках Е. coll Дикий тип фага
образует на колонии штамма Е. coli В мелкие разбросанные
бляшки (стр. 68). Девять различных мутантов,
обозначаемых г, дают бляшки другого типа — более крупные. На колонии
другого штамма Е. coli К те же мутанты ведут себя по-иному —
два дают бляшки типа г, один — дикого типа, а шесть вообще
не дают бляшек, так как не размножаются в этих клетках. Со
штаммом Е. coli S получается картина, отличная от первых
двух.
Генетическая карта для фага может быть построена в
результате опытов по заражению одной и той же клетки двумя
фаговыми частицами разных типов. При этом происходит их
скрещивание и возникают рекомбинации. Оказывается, что
указанные три группы мутаций попадщот в разные участки карты,
В табл. 1 приведена морфологическая характеристика трех
типов мутантов; гейная карта (в зависимости от выбора хозяина)
показана на рис. 30.
Среди мутантов группы г II обнаружены такие, которые
нельзя изобразить точками на генной карте. Они представляют
96
ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
Таблица 1 [27]
Морфология бляшек, образуемых разными штаммами
фага Т4 при заражении ими различных хозяев
Штаммы фага
Дикий ТИП (w)
г I
г II
г III
Морфология бляшек при заражении штамма
В
Дикий тип
г
г
г
S
Дикий тип
г
Дикий тип
Дикий тип
к
Дикий тип
г
Не размножается
Дикий тип
/77
И
Рис. 30. Генная карта фага Т4 в
зависимости от штамма Е. coll.
изменение целого участка карты и никогда не дают обратных
мутаций типа r-+w (дикий тип), в то время как обычные
мутанты могут ревертировать. Эти мутации представляют собой
делеции, т. е. утрату части
гП rl гШ генетического материала,
В Ш%Ш Щ Ц его выпадение из карты.
Наличие делеций позволи-
г ло Бензеру значительно
упростить задачу, так как
этим исключается
необходимость скрещивать
соответствующий мутант с
другими, у которого мутация
располагается на карте
внутри района делеции.
Мутации сначала разделяются на группы, расположенные в разных
участках карты на основе скрещивания с использованием деле-
тировавших мутантов. Дальнейшее скрещивание производится
уже внутри каждой группы.
Ввиду того, что клетка Е. coli, в которую введен
генетический материал от двух частиц фага, подобна диплоидной
зиготе, можно произвести цис-транс тест. Мутанты оказались
принадлежащими к двум различным цистронам, Бензер изучил
тонкую структуру этих цистронов, исследовав 923 мутанта г\
В результате этой замечательной работы было установлено, что
в частотах рекомбинаций реконы имеют величину 0,02%, му-
тоны — примерно 0,05%. а цистроны содержат сотни мутонов.
Забегая вперед, укажем, что на основании такого рода
исследований были установлены молекулярные размеры гена-
цистрона и его структурных деталей — мутона и рекона.
Дело в том, что генетический материал фага представлен одной
длинной молекулой ДНК, размеры которой можно определить
ГЕНЕТИКА БАКТЕРИЙ И ФАГОВ 97
физическими методами. Это позволяет перевести единицы
рекомбинации в числа определенных атомных групп. Работы по
генетике фагов, начатые Бензером, имели далеко идущие
следствия. Они привели к раскрытию основных закономерностей
генетического кода.
Рис. 31. Электронно-микроскопический снимок циклической «хромосомы»
А-фага. Увеличение 44000. Стрелкой указано место разрыва.
Исследование генетических свойств ряда фагов привело к
открытию циркулярности их «хромосом» [19, 47]. Это получило
прямое подтверждение. На рис, 31 показана
электронно-микроскопическая картина «хромосомы» (т. е. цепи ДНК, см. далее)
Х-фага, недавно полученная Рисом и Чендлером [50],
«Хромосомы» фагов цикличны подобно хромосомам бактерий.
Таким образом, в настоящее время ген (цистрон) есть не
гипотетическая, а совершенно конкретная молекулярная
структура, строение и свойства которой раскрыты наукой.
История гена подобна истории атома. Понятие атома
необходимым образом возникло в химии задолго до его
исследования физиками. Понятие гена необходимым образом возникло в
7 М. В, Вольксиштейн
98 ГЛ. 2. КЛЕТКИ, ВИРУСЫ, НАСЛЕДСТВЕННОСТЬ
генетике, задолго до его исследования специалистами в области
молекулярной биологии. Ряд физиков и физико-химиков, и
прежде всего Оствальд, отрицал существование атомов до тех пор,
пока не были получены прямые, физические доказательства их
реальности. Есть люди, которые еще и сегодня отрицают
существование генов и отстаивают наследственность, лишенную
конкретных материальных носителей.
Экспериментальное и теоретическое изучение строения
атомов было начато работой Бора (1913 г); в настоящее время
строение атомов хорошо известно. Изучение структуры гена
началось с открытия генетической роли ДНК и исследования ее
строения, в настоящее время установлены основные
молекулярные характеристики гена. К чести Оствальда надо сказать, что
после получения прямых доказательств существования атомов
он отказался от своей концепции.
ГЛАВА 3
БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
АМИНОКИСЛОТЫ И БЕЛКИ
Перейдем теперь к рассмотрению химического строения и
свойств основных веществ, ответственных за жизнедеятельность
организмов. Мы уже много говорили об этих молекулах, пора
познакомиться с н'ими поближе.
Несмотря на чрезвычайную сложность физико-химического
строения организма, оказывается возможным подойти к
пониманию этого строения на молекулярном уровне организации,
изучив свойства сравнительно 'немногих классов органических
соединений. Как мы увидим, соответствующие исследования
находятся еще на достаточно ранней стадии развития,
молекулярная биология — молодая наука. Но очень важно, что в
организмах нет бесконечного разнообразия соединений.
Неисчерпаемое разнообразие видовых и индивидуальных свойств живого
оказывается связанным с разнообразием сочетаний
ограниченного числа атомных групп в биологических молекулах. Природа
действует в этом смысле экономно. Экономия является,
конечно, результатом закономерного процесса естественного отбора,
а не влияния каких-то жизненных сил, недоступных научному
познанию.
Все белковые молекулы в природе представляют собой
цепочки различной длины, построенные из звеньев, число типов
которых невелико. Эти звенья—аминокислотные остатки. В
подавляющем большинстве случаев приходится иметь дело с
аминокислотами 20 сортов, известно еще несколько природных
аминокислот, встречающихся очень редко.
Аминокислотами называются соединения, содержащие
наряду с кислотной, карбоксильной группой СООН и
аминогруппу NH2. Строение молекулы а-аминокислоты
Rtv .СООН
С
R2/ \NH2
где Ri и R2 — какие-либо радикалы. Таким образом,
аминокислоты обязательно содержат С, О, N, Н; в состав радикалов
могут входить и другие атомы, в частности S.
7*
100
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Соединение аминокислот в белке происходит путем
поликонденсации. Выделяется вода и образуется пептидная связь
—СО—NH—. Реакция соединения двух аминокислот с
образованием дипептида идет по схеме
Rtv ХООН R3v _ уСООН
С 4- С —►
+
R2/ \NH2 R4/ \NH4
Rl4 У^З
—► С—CO—NH—С—R4 + Н20
2 NH2 COOH
В белках или синтетических поликонденсатах аминокислот —
полипептидах цепочка продолжается
Ri\ /Ra R34 yR4
—NH—С— CO—NH—С—СО—
В табл. 2 приведены формулы всех 20 аминокислотных
остатков, входящих в состав белков [1].
Остаток Цис—S—S—Цис, изображенный после № 13
Глу—NH2, представляет собой результат соединения двух
Цис—SH с удалением водорода и образованием дисульфидной
связи —S—S—. Поэтому он не рассматривается как
независимый.
Кроме указанных остатков в белках имеются концевые
группы— кислотный концевой карбоксил — СОТ (обозначение —С)
+
и основная аминная группа —NH3 (обозначение —N).
В табл. 2 аминокислотные остатки разбиты на три класса.
В первой из них входят остатки, не несущие электрических
зарядов, во второй и третий — остатки, приобретающие такие
заряды в соответствующей среде. В связи с этим нужно указать,
что аминокислоты в нейтральной среде фигурируют не в форме,
показанной на стр. 99, а в форме
R,v XOO"
r/ \nh3
Такая молекула, в целом нейтральная, но имеющая
локализованные положительный и отрицательный заряды, называется
диполярным ионом или цвиттерионом.
Среди 20 аминокислот две — метионин и цистеин —
содержат серу, четыре — фенилаланин, триптофан, тирозин и гисти-
дин — ароматические или гетероциклические группы. Пролин
АМИНОКИСЛОТЫ И БЕЛКИ 101
Таб лица 2
Амииокислотиые остатки, обычно встречающиеся в белках
н
Название аминокислоты
и остатка
Сокращенное
обозначение
Формула
Глицин
Глицил
Алании
Алания
Валин
Валил
Лейцин
Лейцил
Изолейцин
Изолейцил
Фенилаланин
Фенилаланил
Пролин
Пролил
8
10
И
Триптофан
Триптофанил
Серии
Серил
Треонин
Треонил
Метионин
Метионил
I. Нейтральные остатки
Гли
Ала
Вал
Лей
Илей
Фен
Про
Три
Сер
Тре
Мет
-со-сн2
NH
I
-СО-СН-СН8
^н
I
-со-сн-сн/
I
^сн,
/СНа
-со-сн-сн2-сн(
NH
I
<СН2—СНэ
кн '
I
-сн9
-СО-СН-СНз-
NH
I
-СО-СН—СН2
N—СН2
н н
С-С^
н н
>
■сн,
н
с
-СО-СН-СН2-С-
кн н4 I <*н
н н
-со-сн-сн2-он
NH
I
-СО-СН-СН<
кн ХсНа
I
-CO-CH-CH2-CHa-S-CH3
lm
I
102
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Продолжение табл. 2
№
12
13
Название аминокислоты
и остатка
Аспарагин .
Аспарагинил
Глутамин
Глутаминил
Цистин
Цистинил
Сокращенное
обозначение
AcnNH2
HiyNH2
Цис
Формула
-CO-CH-CH2-CO-NH2
1
-CO-CH-CH2-CO-NH2
1
-CO-CH-CH2-S-S-CHr-CH—СО-
NH NH
1 1
II. Кислотные остатки (анионы)
14
15
16
17
Аспарагиновая
кислота
Аспартил
Глутаминовая
кислота
Глутамил
Цистеин
Цистеинил
4
Тирозин
Тирозил
III. Осн
18
19
20
Гистидин
Гистидил
Лизин
Лизил
Аргинин
Аргинил
Асп
Глу
Цис
Тир
овн ые ос'
Гис
Лиз
Apr
-СО-СН-СНз—С 00"
1
-СО-СН-СН2-СНг-СОО~
Ан
i
-CO-CH-CHa-S~
Ан
i
н н
/~Ч
-СО-СН~СН2-С С-0~
Ан ХХс-с^
1 н н
гатки (катионы)
-со-сн-сн2-с=сн
NH H3N+ N
1 Чн*
-CO-CH-CH2-CH2-CH2-NH,
Ан '
1
i
-CO-CH-CH2-CH2-NH-C=NH2
1 1
NH NHa
1
АМИНОКИСЛОТЫ И БЕЛКИ 103
является, собственно говоря, не амино-, аиминокислотой — в его
остатке находится не —NH—, а —N-группа. Серии и треонин
содержат гидроксилы. Мы видим, что эти 20 аминокислот, по
причине их универсальности иногда именуемые «магическими»,
очень разнообразны как по своему химическому строению, так
и по способности приобретать электрические заряды.
Редкие аминокислотные остатки — сверх 20 повсеместно
распространенных — представляют собой производные
некоторых из перечисленных аминокислот. Это — нейтральный
остаток оксипролил
—со—сн—сн2ч
| >СН—ОН
^N—СН/
Кислотные остатки дийодтирозил и дкбромтирозил,
встречающиеся только в морских организмах,
.СН—CJv
—СО—СН—СН2—C<f %С-0"
I \сн=ск
и
ХН-СВгч
—СО-^-СН— СН2—C<f %С-0~
| \СН =СВг/
/NH
и тироксил
ХН—CJv4 ХМ—Ok
—со—сн—сна_ c<f \с—о—c<f Чс-о-
I \нс=ск \hc=cj/
/NH
В коллагене фигурирует основной остаток оксилизил
ОН
I +
—со—сн—сн2—си2—сн—сн2—nh3
NH
I
Есть веские основания думать, что эти остатки являются
вторичными, т. е. они возникают в результате соответствующих
химических реакций в уже образовавшихся белковых цепях.
Число аминокислотных остатков в молекулах белков
варьирует в очень широких пределах. В необходимом для жизни
человека и других млекопитающих белке — гормоне инсулине
104
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
содержится 51 аминокислотное звено, в белке мышцы —
миозине это число доходит до 4000. Соответственно молекулярные
веса белков лежат в очень широком интервале от нескольких
тысяч до сотен тысяч (средний вес аминокислотного звена в
белках 100—ПО) и даже десятков миллионов.
Для исследования строения белка нужно прежде всего
установить его аминокислотный состав. Белок расщепляют на
аминокислоты путем гидролиза — нагревания в растворе соляной
кислоты (6N) в течёниёЮ—15 часов. Аналогичный процесс
происходит и в желудке человека или любого животного. В
желудочном соке содержится соляная кислота, а также ферменты,
катализирующие расщепление, и белки, полученные в пище,
гидролизуются желудочным соком л& аминокислот. Затем эти
аминокислоты всасываются клетками и из н'лх вновь
синтезируются белки, но уже такого состава и строения, которые
необходимы для существования организма.
Гидролизат, т. е. раствор, содержащий смесь всех
аминокислот белка, анализируется методом хроматографии. Этот
метод был найден русским ботаником Цветом в 1906 г.
Замечательное открытие Цвета сыграло выдающуюся роль в биохимии
и молекулярной биологии — без хроматографического анализа
«воз был бы и ныне там», — развитие многих областей науки
было бы сильнейшим образом заторможено.
Метод хроматографии состоит в следующем. Исследуемая
смесь — раствор — фильтруется через колонку адсорбирующего
вещества. Так как различные компоненты смеси сорбируются
по-разному, они располагаются в разных зонах колонки.
Далее, они могут быть вымыты из этих зон различными
растворителями и таким образом разделены. Современная
хроматография— обширная область физической химии, имеющая
важнейшие научные и технические применения (см. [2, 3]). Сам термин
«хроматография» (от греческого chromos — цвет) связан с тем,
что Цвет занимался разделением на компоненты хлорофилла и
зоны в его опытах имели различную окраску.
Хроматография может проводиться и не на колонке, а
просто на фильтровальной бумаге. Если опустить уголок
промокательной бумаги в чернильную кляксу, то произойдет
разделение— сорбция, и капиллярные силы подымут воду выше, чем
красящее вещество чернил. Вблизи одного из углов
прямоугольного листа плотной фильтровальной бумаги помещается капля
анализируемого гидролизата белка. Затем'лист подвешивается
к лотку со специальным растворителем и промывается им. Через
некоторое время бумага высушивается, лист поворачивается на
90° и вновь промывается уже другим растворителем. Лист снова
высушивается, обрызгивается раствором вещества, дающего
АМИНОКИСЛОТЫ И БЕЛКИ
105
цветную реакцию с аминокислотами и нагревается. На листе в
разных местах появляются цветные пятна, отвечающие разным
аминокислотам (рис. 32). Зная условия опыта, можно по
расположению этих «отпечатков пальцев» определить
аминокислотный состав белка. Вырезая участки бумаги с пятнами и элюй-
руя, извлекая из них
аминокислоты
растворителями, можно
определить весовое содержание
аминокислот.
В настоящее время
лаборатории, изучающие
белки, пользуются
автоматическими
анализаторами, выдающими
сведения о составе белка в
виде кривой, записанной
на бумажной ленте
самописца. Определение
аминокислотного состава не
представляет теперь
никаких затруднений.
В последние годы,
после того как было
изучено строение
простейших веществ белковой
природы — гормонов ад-
ренокортикотропина и
инсулина, удалось
синтезировать их из веществ
неживого происхождения.
В то же время химия
располагает рядом
способов получения синтетических полипептидов —
поликонденсатов аминокислот. Так, полиглутаминовая кислота, имеющая
строение
НООС—СН—NH—СО—СН—NH—СО NH—СО— СН—NH2
I I 1
СН2 СН2 СНг
i i i
СНг СНг СНг
I I I
СООН СООН СООН
получается в результате химических реакций in vitro (в колбе)
3 обычных лабораторных условиях. Синтетические пелипептиды
н-£утамш-У*щусшя
тештй-ВоШ (4:1-5) ~~"~
Рис. 32. Хроматограмма («отпечатки
пальцев») гидролизата белка — окисленной рибо-
нуклеазы.
106
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
похожи на белки, но лишены биологической функциональности,
зависящей не только от состава, но и от последовательности
аминокислотных остатков (см. далее). Тем не менее изучение
полиаминокислот очень важно для молекулярной биофизики,
так как они хорошо моделируют многие физико-химические
свойства белков. И белки, и полиаминокислоты содержат
пептидную связь. Пространственное расположение атомов,
соседствующих с этой
связью, изображено на
рис. 33, на котором
указаны и межатомные
расстояния в А. Существенно, что
все четыре атома пептидной
группировки —NH—СО—
лежат в одной плоскости,
что установлено методом
рентгеноструктурного
анализа. Это, а также
уменьшенное по сравнению с
обычным межатомное
расстояние N—С, указывает на
сопряжение связей N—С и
С = 0, на перекрывание их
электронных оболочек.
Построение белков из аминокислот с образованием
пептидных связей точно установлено. Высказывавшиеся
некоторыми- учеными другие предположения о химическом строении
белка (например, «дикетопиперазиновая» теория [4]) оказались
ошибочными.
Рис. 33. Геометрия пептидной связи.
АСИММЕТРИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ
Важные в функциональном отношении биологические
молекулы обладают одной замечательной особенностью: они
асимметричны.
В 1848 г. великий французский ученый Пастер, изучая
винную кислоту — вещество, выделяемое из продукта
биологического происхождения, из вина, установил, что кристаллы винной
кислоты существуют в двух формах — правой и левой (рис. 34).
Эти формы представляют зеркальные отражения друг друга,
т. е. соотносятся, как правая и левая рука. Открытие Пастера
легло в основу стереохимии — области химии, изучающей
пространственное строение молекул и кристаллов. Было выяснено,
что существуют асимметричные вещества двух типов.
Во-первых, кристаллические вещества, теряющие свою асимметрию
АСИММЕТРИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ
107
Рис. 34. Кристаллы правой
винной кислоты.
и левой
при плавлении или растворении и, следовательно,
характеризующиеся асимметричным строением кристаллов в целом, но не
молекул, из которых эти кристаллы построены. Таковы,
например, кристаллы кварца. Плавленный кварц лишен асимметрии.
Во-вторых, вещества, состоящие из асимметричных молекул.
Расплав или раствор, полученный из кристаллов винной
кислоты одного сорта — правого
или левого — сохраняет
свойства асимметрии. То же
относится к раствору сахара и к
бесчисленному множеству
других веществ биологического
происхождения.
Как же проявляется
асимметрия? Правая и левая
винная кислота имеют
одинаковые химические свойства, их
кристаллы имеют одинаковую плотность, температуру
плавления и т. д. Основное специфическое свойство асимметричных
веществ состоит в их способности вращать плоскость
поляризации света — они обладают оптической активностью. Раствор
правых кристаллов винной кислоты вращает плоскость
поляризации света в одну сторону,
левых— в другую. О теории
оптической активности мы будем
говорить далее (см. стр. 231).
Для того чтобы вращать
плоскость поляризации, среда
должна быть асимметричной,
т. е. не иметь плоскости и
центра симметрии. На рис. 35
показаны такие элементы
симметрии в молекуле пара-
дихлорбензола. Плоскость
симметрии — плоскость, при
отражении в которой все
атомы переходят в себе подоб-
имеет три такие плоскости —
плоскость самой молекулы и две ей перпендикулярных. Центр
симметрии — точка в центре молекулы, при отражении в кото*
рой все атомы также переходят в себе подобные — первый атом
С1 во второй и т. д.
Большая часть асимметричных молекул органических
соединений содержит так называемый асимметрический атом
углерода, т. е. такой атом, который валентно связан с четырьмя
Рис. 35. Плоскости и центр
симметрии молекулы парадихлорбензола.
ные. Молекула дихлорбензола
108 ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
различными группами. Так как валентные связи углерода
расположены под примерно тетраэдрическими углами друг к
другу, т.е. под углами, близкими к 109°28', при наличии
асимметрического атома углерода действительно отсутствуют и центр, и
плоскость симметрии. Тем самым соответствующие молекулы
могут существовать и в правой и в левой форме, которые не
переходят друг в друга ни
при каком повороте. На
рис. 36 показаны две такие
формы — оптические
антиподы— молекулы
аминокислоты аланина.
Асимметрический атом С отмечен
звездочкой. Антиподы
являются взаимными зеркальными
L D отражениями, как правая
Рис. 36. Оптические антиподы амино- и левая руки.
кислоты — аланина. Очевидно, что
асимметрический атом С
присутствует во многих самых разнообразных органических
соединениях сколько-нибудь сложного строения. В молекуле винной
кислоты таких атомов два
соон
Нч I .ОН
с*
но/1 \юон
н
Атом С, соединенный с NH2 и СООН группами, асимметричен
во всех аминокислотах, кроме глицина (см. табл. 2).
Значит ли это, что вещество, состоящее из молекул,
содержащих асимметрический атом углерода, будет в целом
асимметрично, будет вращать плоскость поляризации света?
Допустим, что мы синтезируем такое вещество обычными методами
химии в колбе. В этом случае должна получиться смесь,
содержащая 50% правых молекул и 50% левых, называемая
рацемической. В самом деле, такой состав соответствует
максимуму беспорядка, максимуму энтропии, т. е. согласуется со
вторым началом термодинамики.
Энтропия возрастает при смешении молекул. Допустим, что у нас
имеется Nd правых и Ni левых молекул в газе или в растворе. Пока эти
газы не смешаны, часть энтропии, зависящая от объема, равна
S0 ^ Nak In Vd + Ntk In Vl9 (3.1)
АСИММЕТРИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ
109
(3.3)
где Vd и Vi — объемы, занимаемые правыми и левыми молекулами. Уберем
перегородку, разделяющую газы. Тогда и те и другие молекулы займут общий
объем V ~Vd-\-Vi, Энтропия изменится и станет равной
S=Nk\i\V9 (3.2)
где N — Nd-\-Nit Разность энтропии
/bS = S-S0 = k (Nd\n—- + Ni\n—^.
Если оба газа находились при одном и том же давлении, то
V—JL JL-JL (34)
и энтропия смешения равна
AS-A^ln-^- + ^ln-^)>0. (3.5)
Спрашивается, при каких значениях Nd и Ni> если N постоянно, AS и тем
самым S будет иметь наибольшее значение? Для нахождения максимума
подставим Ni=*N — Nd> продифференцируем AS no Nd и приравняем
производную нулю
д AS . N — Nd n /qcv
——- s In гт—— =а 0. (3.6)
dNd Nd
Отсюда видно, что энтропия максимальна, когда N— Nd = Af; = Ndt
смесь содержит по 50% правых и левых молекул.
Действительно, в обычных условиях химического синтеза
всегда получается рацемическая смесь, не вращающая
плоскость поляризации света, так как она содержит равные
количества правых и левых молекул. Напротив, важнейшие
вещества биологического происхождения содержат только один
оптический антипод. В этом также проявляется общий закон
упорядоченности живой материи, неравенство энтропии
организма максимальной, что, как мы видели, возможно только в
открытой системе.
Все аминокислоты, выделяемые из белков, относятся к
одному стереохимическому ряду; это так называемые
/.-аминокислоты (L — левый). Это не значит, что они вращают
плоскость поляризации влево. Левый ряд органических соединений
ведется от левовращающего глицеринового альдегида
0=СН-С*Н(ОН) -СН2ОН. Все L-соединения могут быть в
принципе получены из этого соединения путем замещения
соответствующих атомов и групп, присоединенных к С* без
изменения общей конфигурации молекулы. При этом могут
получаться как право-, так и левовращающие соединения, и
символ L означает не знак вращения, а принадлежность к
определенному стереохимическому ряду.
110
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Абсолютная конфигурация природной аминокислоты
показана на рис. 37.
Оптической активностью, т. е. строением чистого антипода,
обладают все важнейшие биологические
молекулы—аминокислоты, белки, нуклеиновые кислоты, углеводы. Это
замечательное явление очень специфично для жизни. Недаром Вернадский
говорил об асимметрической организации пространства живыми
организмами.
Получение чистых антиподов в химических лабораториях
осуществляется с помощью асимметричных веществ
биологического происхождения (обычно ал-
С00" калоидов). Действуя на
рацемическую смесь асимметричным
веществом, можно выделить отдельные
Н N ^V l\\ У& И антиподы. Обозначим рацемиче-
3 ^^^ *=* j^^^ скую смесь (D, L). Действуем на
^*^ с >^^ нее веществом U. Получаем
(D, L) + L'-+DL' + LL'.
Вещества DU и LU уже не
являются зеркальными антиподами
(такими антиподами были бы вещества
DU и LD'), следовательно, у них
Рис. 37. Абсолютная конфигу- Должны различаться и другие
рация L-аминокислоты (I-ала- свойства, а не только оптическая
нина). активность. Они могут быть
разделены, например, кристаллизацией.
Для отделения правого антипода от левого необходимо
вещество (или существо), «чувствующее» разницу между правым
и левым, т. е. по-разному взаимодействующее с правым и
левым. Такое вещество (или существо) само должно иметь
асимметричное строение. Эту роль играл Пастер, когда он
отбирал правые и левые кристаллы винной кислоты под лупой.
Человек, как и всякий организм, имеет асимметричное
строение и ощущает разницу между правым и левым. В любом
месторождении кристаллического кварца (S1O2) — сугубо
неорганического вещества, в соответствии со вторым началом
термодинамики, встречается в среднем равное число правых
и левых кристаллов. Человек отделяет правые кристаллы
от левых, что существенно для оптического
приборостроения.
Асимметрия присуща не только биологическим молекулам,
но и организмам в целом. На рис. 38 показан внешний вид
колоний бактерии Bacillus mycoides, образующих структуры,
закрученные влево — против часовой стрелки. Правые штаммы
СН3
АСИММЕТРИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ
111
весьма редки. На том же рисунке показаны лево- и правозави-
тые раковины моллюска Fructicicola lantzi из Средней Азии [5].
Опять-таки, одна форма распространена гораздо больше, чем
Другая.
Мы убеждены в абиогенном происхождении жизни — в ее
возникновении из неживого вещества. Теория Опарина, впервые
подробно аргументировавшего эту материалистическую
концепцию (см. [6]), завоевала
всеобщее признание.
В связи с асимметрией
живого на всех уровнях его
структуры — от организменно-
го до молекулярного —
возникает ряд вопросов. Прежде
всего — как могла возникнуть
асимметрия, если второму
началу термодинамики
соответствует рацемическая смесь, а
не чистые антиподы? Далее,
почему и каким образом
однажды возникшая асимметрия
закрепляется при развитии
жизни, какую роль она играет
в эволюции? Рис. 38. Колонии Bacillus mycoides
Первый вопрос в общем и раковины Fructicicola lantzi
плане сводится к вопросу о
возникновении жизни в целом. Высокая упорядоченность и
организация живой материи, как мы видели, только на первый
взгляд противоречит второму началу (стр. 30). В этом смысле
асимметрия есть только частное проявление общей
закономерности; связанное с асимметрией увеличение информации (не-
гэнтропии) относительно невелико. Что касается конкретных
возможностей выделения чистых антиподов на заре жизни, то
они могут быть достаточно разнообразными.
Оптическая активность неразрывно связана с эффектом Кот-
тона— круговым дихроизмом. Это явление заключается в том,
что асимметричное вещество, чистый антипод, по-разному
поглощает свет, поляризованный по кругу вправо и влево [7].
Напомним, что в свете, поляризованном по кругу, вектор
электрической напряженности световой волны, всегда
перпендикулярный к направлению ее распространения, непрерывно вращается
вокруг этого направления. Если правый антипод сильнее
поглощает левополяризованный свет, то левый антипод будет сильнее
поглощать правополяризованный, и наоборот. В интересных
работах Брауна, Куна и Кнопфа [8, 9] эффект Коттона был
112
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
применен для частичного разделения антиподов. Исследовались
вещества, подвергающиеся фотохимическому разложению под
действием света, — этиловый эфир а-бромпропионовой кислоты
и диметиламид а-азидпропионовой кислоты. Выход
фотохимической реакции пропорционален интенсивности поглощенного
света. Рацемическая смесь подвергалась действию света,
поляризованного по кругу. Разлагался преимущественно один
антипод— тот, в котором этот свет вследствие эффекта Коттона
поглощался сильнее. В результате смесь частично обогащалась
одним из антиподов, становилась асимметричной и оптически
деятельной.
Наряду с асимметричным фотохимическим разложением
удалось осуществить и асимметрический фотосинтез. Так, при
гидроксилировании перекисью водорода диэтилового эфира
фумаровой кислоты, протекающем под действием правого цир-
кулярно-поляризованного света, получается некоторый избыток
правовращающего диэтилового эфира винной кислоты [10]
нбс2оосч л\ "
С НО—С*—СООС2Н5
+ 20Н—*
с н—с*—соос2н5
I
он
н/ \соос2нБ
В отраженном солнечном свете на поверхности Земли
имеется некоторый избыток компоненты света, поляризованной по
кругу вправо. Тем самым оказывается возможным высказать
гипотезу об абиогенном происхождении первичных антиподов
у биологических молекул.
Вторая возможность связана с существованием
асимметричных кристаллов, в частности, кварца. В соответствии с общим
соотношением, написанным на стр. ПО, взаимодействие
асимметричной кристаллической поверхности с рацемической смесью
может приводить к разделению смеси. Кристаллическая
поверхность может катализировать реакцию, в ходе которой
преимущественно превращается один из антиподов. Она может
осуществлять асимметрическую адсорбцию и т. д. Множество
опытов такого характера было проведено с полным успехом
(см. [11]).
Однако, как уже указывалось, в любом месторождении
кварца количества правых и левых кристаллов одинаковы.
В среднем должны получаться рацематы.
Наконец, хотя и с малой вероятностью, появление чистого
антипода возможно в результате местной флуктуации, местного
нарушения справедливого в среднем статистического второго
АСИММЕТРИЯ БИОЛОГИЧЕСКИХ МОЛЕКУЛ
113
начала термодинамики. Известны опыты по спонтанной
кристаллизации рацемических смесей. Первичный, случайно
возникающий зародыш растущего из рацемической смеси кристалла
может с равной вероятностью содержать правые и левые
молекулы. Но если зародыш правый, то при дальнейшем росте
к нему присоединяются преимущественно правые молекулы. При
многократной перекристаллизации вещества с участием таких
асимметричных зародышей, игравших роль затравки, удалось
добиться полного выделения антипода [12].
Аналогия между упорядочением вещества в живых
организмах и кристаллизацией позволяет думать, что случайно
возникшая асимметрия закрепляется в организмах и неограниченно
реплицируется. Очевидно, что асимметрия биологических
молекул обеспечивает более специфические реакции —
асимметричная молекула по-разному взаимодействует с правыми и левыми
веществами. В интересной книге Гаузе «Асимметрия
протоплазмы» [13] приведено множество примеров такого характера.
Известны вещества, ядовитые в форме одного антипода и
безвредные в форме другого. Правая аспарагиновая кислота —
сладкая, левая — безвкусная. Как установил еще Пастер,
бактерии питаются преимущественно одним антиподом данного
вещества и т. д.
Молекулярные и надмолекулярные структуры биологически
функциональных веществ всегда асимметричны. Мы будем
постоянно встречаться с асимметрией в последующем изложении.
Рацемизация, симметризация означала бы уничтожение высоко-
упорядоченной биологической структуры. Асимметрия, очевидно,
закреплялась в эволюционном процессе, в ходе которого
организмы избавлялись от антиподов противоположного знака.
Характерно, что в то время как белки, нуклеиновые кислоты, ли-
пиды, углеводы в организмах всегда асимметричны, менее
важные для жизни молекулы — продукты переработки, экскреты,
запасные вещества (органические кислоты, алкалоиды, глюко-
зиды, терпены и т. д.) могут встречаться в виде обоих
антиподов и в частично рацемизованной форме.
Трудно думать, что жизнь зародилась однажды и в одном
месте. Гораздо более вероятно, что возникновение жизни
происходило во многих местах поверхности Земли — точнее,
покрывавшего Землю Океана. Но это зарождение не было
одновременным. В результате возникала конкуренция между более и
менее развившимися формами жизни. Случайно вырвавшиеся
вперед системы, содержавшие избыток одного антипода,
вытесняли менее развитые системы, построенные из
противоположных антиподов — процесс, сходный со спонтанной
асимметричной кристаллизацией.
8 М, в. Волькенштейн
114
ГЛ. 3, БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Таким образом, проблема асимметрии живого неразрывно
связана с общей проблемой происхождения и развития жизни.
Не столь существенно, как возник в данном месте избыток
данного антипода. Это мог быть фотохимический процесс,
каталитическая реакция на поверхности кварца или просто
флуктуация. Существенно, что асимметрия закрепляется в
биогенезе, в эволюции (см. также [6, 14]).
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
Вернемся к белкам. Очевидно, что сведения об
аминокислотном составе белка еще не характеризуют его структуру.
Ситуация в этом смысле такая же, как при исследовании обычных
соединений. Элементарный анализ говорит нам, например, что
данное вещество содержит 52,2% С, 34,8% О и 13,0% Н. Брут-
то-формула, отвечающая такому составу С2Н60. Но формула
ничего не говорит о строении молекулы; оно может быть уже
в этом простейшем случае двояким: С2Н5ОН (этиловый спирт)
или (СНзЬО (диметиловый эфир). Речь идет об изомерии. При
одном и том же аминокислотном составе аминокислотные звенья
могут располагаться в разной последовательности в белковой
цепи. Белки отличаются друг от друга, как правило, и
составом и последовательностью аминокислот. Принято называть
последовательность аминокислотных остатков первичной
структурой белка (термин Линдерштрем-Ланга). Как мы увидим,
первичной структурой в конечном счете определяются все
свойства, вся биологическая функциональность белковых молекул.
При описании первичной структуры белка и ее роли обычно
пользуются наглядной аналогией, имеющей реальное научное
значение. Трудно придумать лучшее объяснение, да в этом и
нет надобности. Можно уподобить белковую молекулу тексту,
напечатанному 20-буквенным алфавитом. Каждый
аминокислотный остаток играет роль буквы. Двадцати букв более чем
достаточно, чтобы записать любую информацию — в азбуке
Морзе всего четыре знака. Очевидно, что смысл и содержание
текста зависят от последовательности букв, точно так же
свойства и функциональность белка зависят от последовательности
аминокислот. Короткие белковые цепи можно сравнивать с
текстом в несколько строк — с каким-нибудь афоризмом,
длинные— если не с толстой книгой, то с брошюрой. При этом
возникает ряд «текстологических» и «типографских» вопросов.
Является ли текст вполне определенным и одинаковым во всех
экземплярах книги, т. е. одинаковы ли все молекулы данного
белка или белок представляет собой гетерогенную смесь
разнородных объектов? Как прочитать текст, т, е. как найти последо-
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
115
вательность аминокислот? Какой смысл имеет прочитанное, т.е.
каким образом данная первичная структура определяет
биологические функции белка? Какую роль играют опечатки? Как
пишется этот текст, т. е. что заставляет аминокислоты
соединяться в строго заданную последовательность при
биологическом синтезе белка?
Точно установлено, что белки представляют собой
индивидуальные химические соединения, а не смеси разнородных
молекул. Данный текст один и тот же во всех экземплярах книги.
Это обстоятельство далеко не случайное. Если бы тексты
разнились от молекулы к молекуле, то не приходилось бы говорить
о биологической роли первичной структуры белка. Способность
клетки печатать большое число идентичных копий, выпускать
соответствующие тексты большими тиражами имеет
фундаментальное значение.
Как прочитать текст? При определении аминокислотного
состава белка весь набор рассыпается — остаются только
отдельные буквы. Что можно сказать о тексте на основании подсчета
числа букв всех 20 сортов? Только указать язык, на котором
этот текст написан, а кем была написана книга — Кочетовым
или Паустовским — остается совершенно неизвестным. И
действительно аминокислотный состав целого ряда гомологичных
белков, выполняющих одинаковые функции в разных
организмах, оказывается сходным. Эти белки могут различаться
только последовательностью аминокислот.
Первый крупный успех в установлении первичной структуры
белка был достигнут Сэнгером, определившем строение
инсулина, (Инсулин — белковый гормон, выделяемый островками
Лангерганса в поджелудочной железе, при отсутствии инсулина
возникает тяжелое нарушение обмена веществ — диабет.) Идея
метода Сэнгера исходит из того, что хроматографический анализ
позволяет идентифицировать короткие пептиды, содержащие по
3—4 аминокислоты — слога или слова текста. Прежде всего
определяется число строк—полипептидных цепей, входящих в
состав белка. В инсулине таких цепей две (рис. 39)'. Это можно
установить определением числа N-концов цепей. Дальше строки
отделяются друг от друга и изучаются порознь. Это делается
путем окисления —S—S—связей, соединяющих пептидные
цепи. Каждую строчку разделяют на слоги (или короткие
слова) посредством ферментативного гидролиза. Один из протеоли-
тических (пищеварительных) ферментов — трипсин —
расщепляет пептидные связи только вблизи аргинина и лизина.
Фрагменты разделяются хроматографией. Имеется ряд химических
реакций, позволяющих определить конечные аминокислоты
образовавшихся фрагментов. Пользуясь другими ферментами,
8*
116
ГЛ, 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
расщепляют белок на другие слоги и т. д. Сопоставление всех
образовавшихся в нескольких расщеплениях фрагментов
позволяет установить текст — первичную структуру белка. Допустим,
что в результате первого расщепления мы получили смесь
фрагментов, идентифицированных, как
БЕЛ, ЗНИ, СНОВ, ОКО, АЖИ,
а при втором расщеплении
БЕ, ИЗ, ОСН, ЛОК, ОВАЖ, НИ.
Простая комбинаторика, подобная применяемой при решении
кроссвордов, позволяет прочесть строку
БЕЛОКОСНОВАЖИЗНИ
Конечно, эти химические исследования в действительности
чрезвычайно сложны и трудоемки (подробное описание метода
A NH2 | S S 1 NH2 NH2 NH2
Глу-Илей-Вал-Глу-Глу-Цис-Цис-Ала-Сер-Вал-Цис-Сер-Лей-Тир-Глу-Лей-Глу-Асп-Tup-Uuc-Acn
S S -
I 1
NH2 NH2 S S
III I
Фен-Вал-Асп-Глу-Гис-Лей-Цис-Гли-СЕр-Гис-Лвй-Вал-Гпу-Ала-Лвй-Тир-Лей-Вал-Цис-Гли
I
В Ала-Лиз-Про-Тре-Тир-фен-Гли- Apr -Глу
Рис. 39. Структура инсулина.
см. в монографии [15]). В последние годы к ним на помощь
пришел прямой физический метод — рентгеноструктурныи анализ
(см. гл. 5). В результате химических (точнее, биохимических,
поскольку применяются ферментативные реакции) и
физических исследований в настоящее время полностью установлена
первичная структура ряда белков — инсулина, рибонуклеазы
(фермент, расщепляющий РНК, стр. 394), белка вируса
табачной мозаики ВТМ, адренокортикотропина (гормон,
выделяемый гипофизом — железой внутренней секреции). Методом
рентгенографии изучены миоглобин и гемоглобин. В последнее
время расшифрована структура важных ферментов — лизоцима
и химотрипсиногена и цитохрома с (см. стр. 140). Установлено
строение отдельных фрагментов для большого числа других
белков. Белковая «текстология» быстро развивается.
Перейдем к следующему вопросу — о смысле белкового
текста, Последовательность аминокислот в белке определяет все
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
117
его свойства, его биологическую функциональность.
Классический, особенно хорошо исследованный пример — связь
первичной структуры и биологической функции гемоглобина.
В ряде районов Африки и Средиземноморья, а также в
странах Юго-Восточной Азии существуют тяжелые наследственные
заболевания крови — анемии. При так называемой серповидно-
клеточной анемии красные кровяные шарики имеют форму
серпов. В этом случае гемоглобин (S-гемоглобин, в отличие от
нормального Л-гемоглобина) легко образует кристаллоподобные
структуры, эритроциты легко создают тромбы и подвергаются
гемолизу — распаду. Тяжелые нарушения кровообращения,
вызванные этим заболеванием, приводят к смерти в раннем
возрасте. Средиземноморская анемия (Г-гемоглобин),
выражающаяся в быстром распаде эритроцитов, малокровии,
компенсаторном усиленном размножении кроветворной ткани костного
мозга, вызывающем скелетные деформации, в увеличении
печени и селезенки — также гибельна. Эти заболевания насле*
дуются рецессивно, в соответствии с первым законом Менделя.
Иными словами, за S- и Г-гемоглобин ответственны аллельные
гены, в норме вырабатывающие Л-гемоглобин. Нормальный ген
доминантен. Соответственно болезнь проявляется лишь у
гомозиготных особей 55 и tt, но не у гетерозиготных Л5 или At При
скрещивании Л5ХЛ5 в потомстве с вероятностью 0,25 будут
здоровые люди АА, с вероятностью 0,5 здоровые Л5 и с
вероятностью 0,25 больные 55, обреченные на раннюю гибель. В крови
Л5 обнаруживаются как серповидные, так н нормальные
клетки. Полинг, Итано, Сэнгер и Уэллс [16] обнаружили, что
подвижность S- и Л-гемоглобина при электрофорезе различна, что
объясняется различием в последовательности аминокислот,
приводящим к различию в чиеле электрически заряженных групп.
Полинг определил болезни гемоглобина, как молекулярные.
«Уродства», болезни молекул приводят к болезни организма.
Действительно, как показал Ингрэм, отличие аномальных гемо-
глобинов от нормального связано с заменой всего лишь одной
аминокислоты в одной из пептидных цепей белка [-17]. Смысл
текста радикально изменяется при замене одной буквы в одной
строке*).
В табл. 3 приведено строение четвертого пептида
нормального Л-гемоглобина и некоторых измененных гемоглобинов.
*) Такое случается и в настоящих текстах, В одной книге, изданной в
1947 г,, было написано: «Не считая вопросы приоритета существенными для
истории науки, я все же должен отметить роль великого ученого Имярек».
Автора подвергли жестокой критике за недостаточное внимание к вопросам
приоритета. Оправдываясь, автор сослался на опечатку, В рукописи, по его
словам, значилось: «Но считая и тг д.».
US
ГЛ, 3, БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Таблица 3
Строение четвертого пептида гемоглобина
НвЛ
HbS
НвС
НвО
Вал Гис
Вал Гис
Вал Гис
Вал Гис
Лей
Лей
Лей
Лей
Тре
Тре
Тре
Тре
Про
Про
Про
Про
Глу
Вал
Лиз
Глу
Глу
Глу
Глу
Гли
Лиз
Лиз
Лиз
Лиз
Попутно возникает вопрос о причинах сохранения этих
наследственных болезней в указанных районах на протяжении
столетий. Ведь выщепленные гомозиготы 55 и т. д. должны
вымирать до наступления половой зрелости. В Африке есть зоны,
где носителями гена 5 в гетерозиготной форме являются 40%
населения. Вероятность браков между ними равна 0,4-0,4=16%,
а вероятность гомозигот 55 — 0,25* 16% =4%. Оценка
показывает, что для достижения столь высокого содержания гена 5
необходимо, чтобы гетерозиготы As были на 20—25% более
жизнеспособны, чем здоровые люди АА [18]. В чем же дело?
Эти наследственные анемии распространены в тех районах
земного шара, где одной из важнейших причин смертности
является малярия. Оказывается, что больные гемоглобины
обеспечивают иммунитет против малярии — плазмодий
малярийного комара не размножается в эритроцитах As. По-видимому,
это связано с изменением условий взаимодействия фермента
плазмодия с гемоглобином [18]. После того, как в Северной
Африке, в Италии, в Греции, в Юго-Восточной Азии будут
проведены такие же противомалярийные меры, как в СССР,
процент гетерозигот As заметно уменьшится.
Мы видим, что опечатки в белковом тексте недопустимы —
они очень опасны для организма. Наряду с анемиями известен
ряд других наследственных мо-
Таблица 4
Аминокислоты № 8, 9, 10
в цепи Л инсулина
лекулярных болезней [19].
Первичная структура
белков, обладающих одинаковой
биологической функцией, во
многом сходна у различных
видов. В табл. 4 приведены
фрагменты цепи А инсулина
пяти млекопитающих.
Фрагменты совпадают у
таких далеких животных, как
свинья и кит. Можно проследить и в этом ив других случаях, как
изменяется первичная структура белков в связи с эволюцией.
Как показывает выдающийся чехословацкий биохимик Шорм
[20], здесь могут быть установлены определенные закономерности
Бык
Свинья
Лошадь
Баран
Кит
. Ала
Тре
Тре
Ала
Тре
Сер
Сер
Гли
Гли
Сер
Вал
Илей
Илей
Вал
Илей
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
119
замещения аминокислот. Общий вывод состоит в том, что
первичные структуры белков далеко не случайны. Они определяются
единым путем развития жизни на Земле, единой биохимической
эволюцией. Исследования изменений первичной структуры
однотипных белков при эволюции действительно подобны
текстологическим. Для истории культуры и общества очень интересно
проследить, как менялся текст какого-нибудь древнего
литературного произведения, например биографий Плутарха, — на
протяжении веков.
Следующий вопрос состоит в способе создания текста.
Приведенные примеры показывают, что этот способ имеет
генетическую природу, он задается генами (цистронами),содержащимися
в хромосомах. Это согласуется и с фактами, описанными во
второй главе.
Физико-химические соображения показывают, что первичная
структура белка не может образоваться «сама по себе».
Представим себе совокупность аминокислот в растворе — в
однородной среде. Если даже созданы все условия для их соединения,
все равно осмысленного текста не получится — возникнет цепь,
представляющая собой беспорядочную последовательность
звеньев. Данная аминокислота «не понимает», почему она должна
присоединиться именно в данном месте цепи. Ведь между
молекулами действуют реальные химические и межмолекулярные силы,
быстро убывающие с расстоянием. Данная аминокислота может
«чувствовать» одиу-две соседние аминокислоты, но не имеет
никакой информации о дальнейшей цепи. Выход из положения
мог бы состоять в привлечении большого числа специфических
ферментов. Известно, что они необходимы для биосинтетических
процессов. Однако если за соединение любых двух аминокислот
ответствен особый фермент, то для синтеза одного белка с
определенной первичной структурой необходимо множество
ферментов. Но ферменты — это белки. Значит, для синтеза данного
белка нужно много других. А как они получились? Мы
попадаем в порочный круг.
Следовательно, прямой синтез белка в однородной среде
невозможен. Необходимо устройство для печатания текста,
подобное типографской матрице. Это устройство должно содержаться
в хромосомах. Логический анализ биологических фактов,
основанный на идеях физики и химии, привел нас к весьма важному
выводу. В гл. 7 процесс синтеза белка описан подробно. Здесь
мы ограничимся указанием на то, что роль исходной матрицы
играют молекулы ДНК, из которых состоят гены.
С другой стороны, если первичная структура белка известна,
нет никаких принципиальных препятствий для искусственного ее
воспроизведения химиком в лаборатории, Имеется ряд способов
120
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
получения синтетических полипептидов путем поликонденсации
аминокислот. В последнее время найдены способы соединения
аминокислот в заданной последовательности в результате
постепенного наращивания цепи. Так, например, был получен
синтетический кортикотропин, имеющий биологическую гормональную
активность [21]. Это — тетракосапептидамид, содержащий 23
аминокислоты (в том числе и отличающиеся от природных).
Рис. 40. Структура синтетического адренокортикотропинг.
Формула соединения приведена на рис. 40. В ряде случаев
синтетические полипептиды, специальным образом синтезированные,
прекрасно моделируют биологические функции белков —
каталитическую [22], иммунологическую [23].
В конце 1963 г. Катсоянис, Тометско и Фукуда сообщили об
успешном завершении синтеза инсулина, аналогичного инсулину
овцы [24]. Существенно, что в этой работе удалось получить
белковый гормон, состоящий из двух полипептидных цепей,
соединенных строго определенным способом (рис. 39).
Синтетический инсулин обладает тем же строением и теми же свойствами,
что и природный.
НУКЛЕИНОВЫЕ КИСЛОТЫ
Нуклеиновые кислоты стали известны значительно позже,
чем белки. Их открыл Мишер в 1872 г., изучая химический
состав спермы лосося. Нуклеиновые кислоты, так же как и белки,
представляют собой высокополимерные, макромолекулярные
соединения. Но их цепи построены из звеньев совершенно иного
типа. Основная цепь нуклеиновой кислоты по сравнению с
белковой однообразна — она состоит из чередующихся звеньев
фосфорной кислоты и сахаристого вещества — рибозы в
рибонуклеиновой кислоте РНК и дезоксирибозы в дезоксирибонуклеиновой
кислоте ДНК- К сахарам присоединены так называемые
азотистые основания — и в ДНК и в РНК их по четыре сорта.
Общая схема строения цепи имеет вид:
Азотистое основание Азотистое основание
— Сахар — Фосфат— Сахар — Фосфат
НУКЛЕИНОВЫЕ КИСЛОТЫ 121
Формулы D-рибозы и D-2-дезоксирибозы:
носн2. о. ,н
с* н н с*
но/М 1/\он
с*—с*
I I
он он
НОСН2 Ov Н
\ / х /
С* Н НС*
но/ Vc7 Чон
он н
Пурины и пиримидины представляют собой
азотсодержащие гетероциклические плоские молекулы, обладающие
основными свойствами, так как атомы азота могут присоединять
протоны, приобретая положительный заряд:
\n+hci —* \n—н+сг.
Пиримидиновые основания — производные пиримидина
СН
N СН
НС СН
V-
Пиримидин
В ДНК фигурируют
NH2 ОН
N СН N С—СН3
НО-С СН НО—С СН
Цитозин, Ц Тимпн, Т
122 гл. з. биологические молекулы
и в некоторых случаях в малом количестве
NH2 NH2
N С—СНЯ N С—СН2ОН
НО—С СН НО-С СН
5-метилцитозин и 5-оксиметилцитозин
(в фагах Т2, Т4, Т6)
В РНК фигурирует Ц и
ОН
А
N СН
НО—С СН
W
Урацил, У
Пуриновые основания содержат два цикла — шести- и пяти
членный
Р N
N C \н
НС С /
Пурин
И в ДНК, и в РНК фигурируют
NH5 ОН
г N г N
^С\ / ч ^с\ / ч
N С V N С \
СН I II СН
НС С / H2N—С С
Аденин, А Гуанин, Г
НУКЛЕИНОВЫЕ КИСЛОТЫ 123
Приведем еще формулы трех пуриновых оснований, не
входящих в состав природных нуклеиновых кислот, но
существенных в молекулярной биологии:
он он он
г N г N r N
У\ / ч ^\ / Ч >с\ / Ч
N С \ NC4 NC4
| I СП | || СН | || С-ОН
нс с / но-с с / ее/
Гипоксантин Ксантин Уридиловая кислота
У пуринов и пиримидинов возможны таутомерные формы
(стр. 25). Выше изображены энольные формы, содержащие
группу ОН. Наряду с ними существуют кето-формы
NH,
N СН
Ц I II
С СН
/\N/
о н
он о
II
ус\ /с\
N СН(СНз) HN СН(СНз)
Т и У | || +± | II
С СН С СН
Он Он
о
с N
HN C \*
Щ^Л/
124
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
и т. д. В нуклеиновых кислотах кето-формы азотистых
оснований преимущественны.
Соединения азотистых оснований с рибозой и дезоксири-
бозой называются нуклеозидами — соответственно рибонуклео-
зидами и дезоксирибонуклеозидами. Азотистое основание
присоединяется всегда к определенному углероду сахара,
например,
NH2
ч.
N
НС С /
%/ \N/
носн2
/°\
: н н с
/\1 1/\
н с—с н
он он
Аденин + рибоза = Аденозин
И
NH
2
носн,
N СН
1 И
0=С СН
\N/
С Н Н С
/\| 1/
н с—с
i—н
он он
Цитозин + рибоза = Цитидин
нуклеиновые кислоты 125
Аналогичные соединения Г и Т называются гуанозином и
тимидином.
Фосфорные эфиры нуклеозидов называются нуклеотидами —
рибонуклеотидами или дезоксирибонуклеотидами. Например,
NH
2
носн
2V
у\/
\
N С V
1 II СН
НС С /
^N/\NX
С Н Н С—Н
/\| 1/
н с—с
Н203РО ОН
Аденозин-З'-фосфат, аденозинмонофосфат, АМФ
Нуклеотид может быть фосфорилирован дальше, присоединяя
еще один или два остатка фосфорной кислоты:
о о
II И
НО—Р—О—Р—ОСН2, . О А
ОН ОН \н НС
/\| |/\
н с—с н
он он
Аденозиндифосфат, АДФ
0 0 0
НО-Р-О-Р—О—Р—ОСН2
I I I
он он он
он он
Аденозинтрифосфат, АТФ
126 ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Эти соединения чрезвычайно важны во многих биохимических
процессах (стр. 134),
Нуклеиновые кислоты представляют собой полимеры нук-
леотидов. На рис. 41 и 42 показано строение РНК и ДНК. Во
всех без исключения организмах, начиная с бактериофагов и
NH2
0 = Р—О—СН2 п '
| I ^0
'2 n "N^N
о
Н| | Н
о он
NH2
н [I н
о он
I
Рис. 41. Строение РНК.
кончая человеком, цепи нуклеиновых кислот построены из одних
и тех же звеньев. Если отвлечься от редких метилцитозина и
оксиметилцитозина, то ДНК содержит А, Ц, Г и Т, а РНК А, Ц,
Г и У. Нуклеиновые кислоты оптически активны (вращают
плоскость поляризации вправо) хотя бы уже потому, что рибоза
и дезоксирибоза содержат асимметрические атомы углерода и
представлены чистыми антиподами.
Нуклеотидный состав нуклеиновых кислот устанавливается
методом гидролиза, расщепляющего цепи на нуклеотидные
звенья, и последующим хроматографированием [15, 25]. Ввиду
НУКЛЕИНОВЫЕ КИСЛОТЫ 127
того, что азотистые основания поглощают свет в сравнительно
близкой ультрафиолетовой области (максимум поглощения
около 260 тр,), для обнаружения нуклеиновых кислот и
идентификации продуктов их расщепления применяются спектры
поглощения.
Оптические свойства ДНК и РНК обсуждаются в гл. 6. Схема
гидролиза ДНК следующая:
ДНК -> нуклеотиды -► нуклеозиды + фосфорная кислота -> А,
Т, Г, Ц +дезоксирибоза.
NH2
0 = р_о_СН2 < X ^ А
J- IrfV в
0 = Р — 0 — СН2
0- СН н
0 н
ц
0=»р — 0 —СН2
I
0'
н о
| нэсчАин
0 = Р— 0— СН2 п %f\
о
Рис. 42. Строение ДНК.
ДНК содержится в ядрах клеток, в хромосомах, а также
входит в состав ряда вирусов и фагов. Наличие ДНК в
хромосомах наблюдается непосредственно, путем микроскопии в
ультрафиолетовых лучах, которые ДНК поглощает. Характерно,
что содержание ДНК в гаплоидных половых клетках вдвое
меньше, чем в диплоидных соматических клетках того же
128
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
организма. ДНК — очень большие молекулы с молекулярными
весами порядка 107 и больше (гл. 6).
РНК на 90% содержится в цитоплазме и на 10% в ядре
клетки, а также в вирусах. Установлено существование
четырех типов РНК. Высокомолекулярная РНК, содержащаяся в
рибосомах (молекулярный вес порядка 2*106), транспортная или
Т-РНК в клеточном соке с малым молекулярным весом порядка
25000—30 000, матричная или информационная М-РНК (смысл
обоих терминов выясняется в гл. 7) с широким распределением
молекулярных весов от 30000—50000 до 2-Ю6 и выше. М-РНК
переходит из ядра в цитоплазму и содержится в клетке в
наименьшем относительном количестве. Наконец,
высокомолекулярная вирусная РНК, имеющая молекулярный вес порядка
2'106 (вирус табачной мозаики, ВТМ).
Нуклеотидный состав ДНК оказывается подчиняющимся
определенным закономерностям — правилам Чаргаффа. Молярное
содержание А в ДНК всегда равно содержанию Т, а содержание
Г равно содержанию Ц. Следовательно,
А + Г
Т + Ц — *'
т. е. сумма пуриновых оснований в любой ДНК равна сумме
пиримидиновых оснований. В то же время
£+1—1
т. е.. количество 6-NH2 — групп в основаниях цепи ДНК равно
количеству 6-С = 0 — групп. Правила Чаргаффа
иллюстрируются табл. 5.
Таблица 5 [25]
Молярные пропорции в °/0 иуклеотидов в ДНК
разного происхождения
Источник ДНК
А
28,2
27,9
28,7
28,6
27,9
32,8
273
31,3
26,0
15,1
35,7
г
21,5
22,7
22,2
21,4
19,5
17,7
22,7
18,7
24,9
34,9
17,1
Ц
21,2
20,8
20,7
20,4
21,5
17,3
16,8
17,1
25,2
35,4
15,4
т
27,8
27,3
27,2
28,4
28,2
32,1
27,1
32,9
23,9
14,6
31,8
Метил-
цитозин
1,3
1,3
1,3
1,1
2,8
1,1
6,0
^—
Бык, вилочковая железа
Бык, селезенка ....
Бык, сперма
Крыса, костный мозг .
Сельдь, семенники . . .
Paraceutrotus lividus .
Пшеница, зерно ....
Дрожжи
Escherichia coli • . . .
Mb. tuberculosis ....
Rickettsia prowaczeki .
НУКЛЕИНОВЫЕ КИСЛОТЫ
129
Белозерский и Спирин [26] изучили нуклеотидный состав ДНК
разных видов растительных и животных организмов и
установили, что фактор специфичности
Г + Ц _ Г _ Ц
А + Т — А- Т
у микроорганизмов варьирует в широких пределах от 0,45 до
2,8. У бактериофагов это отношение близко к 0,5. У высших
растений и животных состав ДНК более или менее постоянен,
фактор специфичности равен 0,43—0,45, т. е. содержание А + Т
несколько больше, чем содержание Г+Ц [27, 28]. Исключениями,
не подчиняющимися правилам Чаргаффа, являются ДНК
фага фХ 174 и немногих других. Далее рассказано как о
молекулярном объяснении правил, так и об особых свойствах этих
фагов.
Тотальная, т. е. преимущественно рибосомная, РНК не
подчиняется правилам Чаргаффа. Фактор специфичности для
общей РНК
Г + Ц
А + У
меняется для микробов параллельно изменению фактора спе
цифичности ДНК, но в более узких пределах — от 1,05 до 1,35.
Развитие биохимии нуклеиновых кислот привело к открытию
метода, позволяющего синтезировать их аналоги — полинуклео-
тиды. Об этом рассказано в гл. 6 и 7.
Как уже не раз указывалось, биологическая роль
нуклеиновых кислот существенно отлична от роли белков. ДНК,
содержащаяся в хромосомах, является исходной матрицей для
синтеза белков, это вещество генов. Многочисленные и
разнообразные доказательства этого важнейшего положения суммированы
в гл. 6 и 7. Такую же роль играет РНК вирусов. Все остальные
виды РНК так или иначе связаны с процессом синтеза белковых
молекул (гл. 7).
Первичная структура ДНК и РНК определяется
последовательностью азотистых оснований. Это — тексты, написанные
четырехбуквенными алфавитами. Генетическая информация
записана в ДНК — при синтезе белка происходит ее перекодирование,
перевод четырехбуквенного текста в двадцатибуквенный.
Несмотря на то, что нуклеотидный текст пока не удалось прочитать
ни в одном случае, проблема кодирования в основном решена
в последние годы (см. гл. 7). Установление первичной
структуры нуклеиновых кислот связано с гораздо большими
трудностями, чем решение аналогичной задачи для белков — тоже
весьма нелегкой. Дело в том, что основная цепь ДНК и РНК
совершенно однородна и монотонна, различные буквы привешены
9 М. В. Волькенштейн
130
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
в цепи сбоку. Поэтому здесь труднее воспользоваться
специфическим расщеплением цепи в определенных местах на
определенные фрагменты. Тем не менее нельзя считать эти трудности
принципиально непреодолимыми — нуклеотидные тексты
несомненно будут прочитаны. В последнее время крупные успехи
в этой области были достигнуты Кочетковым и его сотрудниками
(см., например, [29]). Химические методы, развитые
Кочетковым, являются, по-видимому, многообещающими.
Естественно, что более доступными исследованию являются
сравнительно короткие цепи транспортной РНК. В некоторых
случаях удалось расшифровать структуру ее фрагментов*).
НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В КЛЕТКЕ
Мы говорили о структуре важнейших биологических
молекул— белков и нуклеиновых кислот, не касаясь вопроса об их
возникновении в клетке. Как образуются аминокислоты и нук-
леотиды, что необходимо для их объединения в цепи?
Нет возможности рассмотреть здесь сколько-нибудь
подробно биохимические реакции, посредством которых
осуществляются указанные процессы. Ограничимся краткой
характеристикой основных процессов создания биологических молекул.
Как уже говорилось (стр. 24), константа равновесия
реакции К связана с разностью свободных энергий AF конечных
и исходных веществ соотношением
К=е-Щкт9 (3.7)
или
&F = — kT In К, (3.8)
при условии, что изменение объема в ходе реакции
пренебрежимо мало:
Д/? = Д£—TAS, (3.9)
где Д£ — разность внутренних энергий, a AS— разность
энтропии.
Очевидно, что реакция будет идти в данном направлении
1->2 и равновесие будет смещено в соответствующую сторону,
т. е. К будет много больше единицы, если AF отрицательно и по
абсолютному значению много больше kT. Иными словами,
реакция протекает в заданном направлении лишь при уменьшении
свободной энергии. Простая аналогия может быть заимствована
*) Недавно полностью расшифрована структура одного из видов Т-РНК,
см. R. НоПеу и др., Science, март, 1965; В. Азерников, Наука и
жизнь, № 5, 35, 1965. (Примечание при корректуре.)
НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В КЛЕТКЕ
131
из механики. В чисто механических процессах (в пренебрежении
трением) AS=О и AF=Д£. Механическое движение
самопроизвольно происходит в том направлении, в котором энергия
уменьшается — вода течет сверху вниз, а не снизу вверх.
Необходимо подчеркнуть, что формулы на странице 25
справедливы для мономолекулярной реакции, в ходе которой
молекулы одного сорта превращаются в молекулы другого сорта
таким образом, что в первичном акте реакции участвует одна
молекула
А +±В.
В случае бимолекулярной реакции (о некоторых из них мы
будем говорить дальше)
скорости прямой и обратной реакции выражаются, как
vi = ПАПвАге' E*tkT, v2 = псПоА&-Р*+ Д£>/Аг, (ЗЛО)
и константа равновесия определяется из условия Vi = Vz:
п„п
К=,^Ж = 21.е-ЬЕ1ПТ.
ПАПВ
(3.11)
Соотношение (3.8) и выводы из него сохраняются и в этом
случае.
Большинство реакций, с которыми имеет дело химия,
действительно идет с уменьшением свободной энергии. Такие реакции
называются экзергонными. Напротив, основные биохимические
процессы сопровождаются увеличением свободной энергии — это
эндергонные процессы. В экзергонных реакциях свободная
энергия выделяется, в эндергонных — поглощается. Приведем
простые примеры.
Образование пептидной связи при соединении аминокислот —
эндергонный процесс
НЯС
\
&
сн.
н
Н3Сч ^СН3
СН2 + H2N—С—Н
СН,
+ н2о
H,N—С—Н
соон
H9N—С—Н
СООН
о=с н
Лейцин
Глицин
HN—С—СООН
i
И
Лейцилглицин
9*
132
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Реакция слева направо сопровождается увеличением
свободной энергии на 3 ккал/моль (при молярной концентрации)
Это значит, что константа равновесия
К=е-ш)щт = е-б^о,01,
т. е. реакция пойдет преимущественно не слева направо, а
справа налево. Если учесть, что в клетках всегда имеется избыток
воды, то станет ясно, что самопроизвольный синтез пептидной
связи невозможен. Для его осуществления необходима работа,
почерпнутая из какого-то источника. Работа может состоять, в
частности, в удалении образующейся воды из сферы реакции.
Другой пример — образование сахарозы путем
полимеризации двух молекул углеводов меньшего размера
СН2ОН Н
I I
Н X— Оч Н X—Оч
I /l \ I н /| \
\/ н \1 I/ н
с\ но н /с + ^\ н он
но
с—с
он
н он
Глюкоза
НО
\г.—с/
с—с
I I
он н
Фруктоза
СН,ОН
СН2ОН
I
С—О
\ н
I
с
н
I
Н уС
н он
Сахароза
ОН
iн
ОН Н /| | \'
ri/c + H,o
СН2ОН
И в этом случае свободная энергия возрастает (на 5 ккал/моль).
Сахароза — растительный сахар—могла бы создаваться
самопроизвольно в .соке сахарного тростника или свеклы, если бы
в этом соке был большой избыток глюкозы и фруктозы и
недостаток воды. В действительности этого, конечно, нет.
НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В КЛЕТКЕ
133
Сахароза представляет собой дисахарид. Углеводы в
организмах представлены как моно- и дисахаридами, так и
полисахаридами. К последним относятся растительный крахмал и
животный крахмал — гликоген. Эти полисахариды обеспечивают
накопление химической энергии. На рис. 43 показана структура
О
о
о
<£*РЧ>Р*Р*£К>-
о
О
о
9
Рис. 43. Строение гликогена.
части макромолекулы гликогена [1]. В клетках углеводы часто
фигурируют в виде соединений с белками и жирами.
Высокомолекулярным углеводом является опорное вещество растений —
целлюлоза, фрагмент цепи которой имеет строение
СН,ОН
н он
—О —
/
/ОН Н
\
\
н
СН-ОН
н
о/ -
Хитин — вещество, из которого построен внешний -скелет
насекомых и ракообразных, также углерод, родственный
целлюлозе.
Итак, важнейшие биохимические реакции эндергонны. Чтобы
их осуществить, нужно заставить воду течь вверх. Но это воз-
134
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
можно, если включить в систему некий насос, который в свою
очередь приводится в движение падением воды в другом
потоке. Короче говоря, нужен источник свободной энергии,
источник химической работы.
Клетка и организм — открытые системы. В открытой системе
возможно поддержание' неравновесных концентраций
химических веществ за счет сопряженных реакций. Так, реакция
образования сахарозы происходит путем сопряжения с
гидролизом АТФ [30]:
АТФ + Н20 —> АДФ+Н3Р04 (А/7^—12 шал!ноль).
Сопряжение происходит путем фосфорилирования глюкозы и
последующей реакции глюкозофосфата с фруктозой
АТФ +Глюкоза —> Глюкоза- 1-Н2Р03 + АДФ
(А/7 = — 7 ккал/моль),
Глюкоза-ЬН2Р03+ Фруктоза —> Сахароза+ Н3Р04
(Д/7^0 ккал/моль).
Общий баланс свободной энергии — 7 ккал/моль, т. е. процесс
в целом выгоден. Реакции протекают с участием
катализаторов— ферментов. В результате на образование одной эфирной
связи в молекуле дисахарида затрачена одна молекула АТФ,
деградировавшая до АДФ. Для поддержания реакции в клетке
необходима непрерывная регенерация АТФ — она должна вновь
образовываться из АДФ и фосфорной кислоты, что в свою
очередь требует 12 ккал/моль свободной энергии. В обычном
автомобиле аккумулятор заряжается за счет работы двигателя
внутреннего сгорания, т. е. в конце концов за счет химической
энергии топлива. В живых организмах «зарядка» АДФ
происходит в конечном счете путем поглощения солнечной энергии
(у аутотрофов) или химической энергии, получаемой с пищей
(у гетеротрофов) и при дыхании (у растений и у животных).
Выше приведен пример синтеза дисахарида при участии АТФ.
Это — частный случай. Роль аденозинтрифосфЪрнои кислоты
универсальна, она занимает «ключевую позицию» [31]. За счет
АТФ производится химическая, механическая, осмотическая,
электрическая, оптическая работа клетки. Роль АТФ в
фотосинтезе была открыта сравнительно недавно [32]. «Зарядка»,
т. е. образование АТФ из АДФ, происходит в хлорпластах
растительных клеток. У гетеротрофных организмов «зарядка» осу-
НЕКОТОРЫЕ БИОХИЛ1ИЧЁСКИЕ ПРОЦЕССЫ В КЛЕТКЕ 135
ществляется в митохондриях в результате окислительных
процессов, происходящих при дыхании клетки. Во многих случаях
«горючим» служит глюкоза, окисляемая в конце концов до
углекислого газа и воды.
Многоклеточные гетеротрофные организмы нуждаются в
«горючем» и в материалах для роста и развития — в белках,
углеводах и жирах. Необходимы также витамины, значение которых
иное. Витамины служат для синтеза так называемых просте-
тических групп и коферментов — веществ, активирующих
ферменты. Многие ферментативные реакции требуют в качестве
катализаторов комплексы фермент + кофермент (гл. 8). Таким
образом, витамины каталитические, а не питательные вещества,
соответственно их нужно немного.
Энергия освобождается из питательных веществ в три
фазы [31]. В первой из них происходит расщепление макромоле-
кулярных цепей на отдельные звенья, во второй образование
из этих звеньев новых веществ — ацетилкофермента А, а-кето-
глутаровой и щавелевоуксусной кислоты. В третьей фазе
происходит окисление и «зарядка» АТФ (табл. 6). Все эти процессы
осуществляются в ряде последовательных стадий, подробное их
изучение — очень важное достижение биохимии. Ведь
необходимо накопить значительную энергию. Если пользоваться
аналогией, приведенной выше, то это означает подъем против течения
на большую высоту. Но когда теплоход поднимается на 80 м
у Днепровской гидроэлектростанции, это делается посредством
системы шлюзов. Точно так же биохимические реакции проходят
ступенями, причем изменение свободной энергии на каждой
ступеньке не так уже велико [33].
Рассмотрим теперь более подробно вторую и третью фазы, начав с
глюкозы (для многих бактерий глюкоза или другие гексозы могут служить
единственным источником энергии и органического сырья).
Реакции второй фазы:
Глюкоза + АТФ «г> Глюкоза-6-Р04 + АДФ
Глюкоза-6-Р04 iz^ Фруктоза-6-Р04
Фруктоза-6-Р04 + АТФ —► Фруктоза-1,6-(Р04)2 + АДФ
Дифосфат фруктозы —► 3-глицеральдегидфосфат
\ t I
Дигидроацетонфосфат
3-глицеральдегидфосфат + 2Н3Р04 + 2ДПН —>
—> 2 1,3-дифосфоглицерин-|-2 ДПНН2
2 1,3-дифосфоглицерат-|-2 АДФ —> 2 3-фосфоглицерат-{-2 АТФ
2 3-фосфоглицерат ■—► 2 Энолфосфопируват
2 Энолфосфопируват+ 2 АДФ —> 2 Пируват + 2 АТФ
2 Пируват + 2 ДПНН2 —> 2 Лактат + 2 ДПН
Три главные фазы освобождения энергии из питательных веществ
Таблица 6 [31]
Фаза
Процесс
Углеводы
Гексозы
Белки
20 аминокислот
Жиры
Глицерин, жирные кислоты
3
■ё
оз
СП
S
о
О
-1
S
X
гч
п
S
гч
о
Ьа
гч
S
Е
II
Гексозы
Молочная
кислота
Глицерин
Аминокислоты
(Ала, Сер,
Цис-SH)
Жирные
кислоты
Пиров ино-
градная
кислота
Аминокислоты
(Лей, Тир,
Фен)
Аминокислоты
(Глу Гис,
Про, Apr)
Аминокислоты
(Асп, Тир,
Фен)
Ацетилкофермент А
а-кетоглутаровая кислота
Щавелево-
уксусная
кислота
III
Ацетилкофермент А
а-кетоглутаровая кислота
i
Щавелевоуксусная кислота
I
Цикл Кребса
НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В КЛЕТКЕ 137
Итогом процесса на каждый моль глюкозы является превращение двух
молей АДФ в АТФ, глюкоза при этом превращается в молочную кислоту
Н3С • СНОН • СООН (лактат — ион этой кислоты);
Глюкоза+ 2 АДФ + 2Н3Р04 —► 2 Лактат+ 2 АТФ.
Пнруват —ион пировиноградной кислоты Н3С-СО*СООН, ДПН — дифосфо-
пиридиннуклеотид, играющий роль кофермента. В ходе приведенных реакций
он восстанавливается, а здесь снова окисляется (рис, 44), Процесс
превращения глюкозы, содержащей 6 атомов углерода, в две молекулы молочной
кислоты, содержащих по 3 атома углерода С, называется гликолизом, В
процессе гликолиза освобождается 49,7 ккал/моль свободной энергии. Из н^х
24 ккал/моль расходуется на «зарядку» АТФ. Очевидно, что гликолиз
происходит без участия кислорода, анаэробно. Фосфорилирование АДФ здесь не
является окислительным.
Дальнейшее окисление продуктов гликолиза до СОг и Н20, при котором
освобождается основное количество свободной энергии и соответственно
«заряжается» большая часть АТФ, происходит в так называемом цикле трикарбоно-
вых кислот Кребса [30, 31]. Этот цикл схематически представлен на рис. 45.
Таким образом, в цикле Кребса происходит выделение двух молей СОг
и окисление — отдача восьми атомов Н и тем самым восьми электронов.
Окисление происходит за счет молекулярного кислорода, поступающего
в клетку в процессе дыхания. Как показали исследования советского
биохимика Белицера и других, перенос каждой пары электронов к кислороду
сопровождается фосфорилированием трех молей АДФ. Суммарная реакция
окисления пирувата
СН3 • СО. СООН + 15Н3Р04 + 15АДФ +50 —> ЗС02 + 15АТФ + 2Н20
или
СН3 • СО • СООН + 50 —> ЗС02 + 2Н20 (Д/7 = — 273 ккал/моль),
15АДФ + 15Н3Р04 —> 15АТФ (Д/7 = 12-15 = 180 ккал/моль).
Следовательно, при окислении выигрывается 273 ккал/моль свободной
энергии, из которых 180 ккал/моль расходуется на «зарядку» АТФ,
Эффективность процесса (КПД) составляет 180/273= 67%.
Как же происходит окислительное фосфорилирование? Белицер
предположил, что роль переносчика электронов от восстановленного ДПН к 02
играют ферменты дыхательной цепи — флавопротеин ФП и цитохромы Ь, с,
а и а3. Суммарная реакция
ДПНН2 + О + ЗН3Р04 + ЗАДФ —> ДПН + Н20 + ЗАТФ
или
ДПНН2 + О —> ДПН + Н20 (AF = — 55 ккал/моль),
ЗН3Р04 + ЗАДФ —> ЗАТФ (Д/7 = 12.3 = 36 ккал/моль).
Флавопротеины — белки, содержащие рибофлавин, вещество желтого цвета
с интенсивной зеленой флуоресценцией:
н н н
сн2—с—с—с—сн2он
он он он
NH
4/\N/\c/
II
о
о
II
С— NH.
+2Н
Н
-2Н н
а
он
I
С—NH2
N
НС
НС
н
с.
о
II
•Счч
NH,
^
СН
\
и
/
сн,—о—
о
I
р
он
I
Р—О
II
о
НС
S
N\
— О—Р—О —СН,—О
\
/
N
с-
I
н
с*
I
н
н
н
/Ч?н Ч7Ч
с
I
н
с
I
н
н
Рис. 44. Дифосфопиридиннуклеотид.
Вверху изображена схема восстановления и окисления пиридиновой группировки.
НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В КЛЕТКЕ
,
!
1
i
+
<
в
+
в
t
t-
t
В
<
-О
t
7 ♦ t
t |U I I t
о
re
X
Jiijjx-
~ 1
t
tTli
IT
s з § <§ s ф$ * <s
У
ы
T
« I
11
I
I
1
1
|
I
: <§ I
J-J
та
О
<D
CU
4
s
140 ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
Цитохромы — белки, содержащие группу гема, подобную входящей в
состав гемоглобина. На рис. 46 показано строение цитохрома с быка.
Для передачи электрона существенно наличие в группе гема атома
железа, который способен окисляться и восстанавливаться, превращаясь из
двухвалентного в трехвалентный и обратно:
Fe++ "<"* Fe+++ + электрон.
Таким образом, при дыхательном окислении происходит фосфорилирование.
NH2 NH2 -.
Н-Гис-.-.-Вал-Глу-Лиэ-ЦисЗ-Ала-Глу-ЦисБ-Гис-Тре-Вал-Глу-Лиэ-.-
СН-СН3
I
Рис. 46. Цитохром с быка.
Роль цитохромов может быть иллюстрирована следующей схемой
реакций при одной из стадий цикла Кребса — окислении янтарной кислоты до
фумаровой:
Сукцинат + 2Fe+++ (Цитохром Ь) -> Фумарат + 2Fe++ (Цитохром 6)+2Н+
2Fe++ (Цитохром Ь) + 2Fe+++ (Цитохром с) -> 2Fe+++ (Цитохром Ь) +
+ 2Fe++ (Цитохром с)
2Fe++ (Цитохром с) + 2F6+++ (Цитохром а) -> 2Fe+++ (Цитохром с) + 2Fe++
(Цитохром а\
2Fe++ (Цитохром а) + 2Fe+++ (Цитохр ом оксид аза а3) -> 2Fe+++ (Цитохром а) -Ь
2Fe++ (Цитохромоксидаза <h).
2Fe++(Цитохромоксидаза аг) + -д-02 -> 2Fe+++ (Цитохромоксидаза az) + О**
2Н+ + О" -> НаО,
НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В КЛЕТКЕ Щ
Последняя реакция является итоговой. Через ряд цитохромов — окислн-
гельно-восстановнтельных ферментов — два электрона от атома кислорода
передаются на два атома водорода и образуется вода. Все этапы процесса
протекают с участием специфических ферментов.
Сопряжение окислительного процесса с фосфорилированием
специфично для биологических систем. Детальная его природа
все же не ясна. Блюменфельд и Темкин предложили
гипотетическую схему такой реакции [34]. Известно, что А, АДФ, АТФ
могут быть восстановлены электрохимически. При таком
восстановлении присоединяется электрон и образуется свободно-
радикальная форма типа семихинона (рис. 47). При этом
должна резко повышаться основность аминогруппы — она выше у
алифатических аминов, чем у ароматических (константа
диссоциации анилина 3,5-10~10, метиламина — 5-10~4).
Предполагается, что АДФ в полувосстановленной форме должна
присоединять фосфорную кислоту к аминогруппе с образованием
прочной ионной связи
V-NH30- P<
/ || Ч)Н
О
После присоединения фосфорной кислоты к аденину
образование третьей, макроэргической фосфатной связи происходит
путем замыкания цикла (рис. 48). При окислении пуриновая
группа возвращается в исходное состояние, ионная связь рвется
и образуется АТФ. Такой механизм «зарядки аккумуляторов»
непосредственно связывает фосфорилирование АДФ с
окислительно-восстановительным процессом в адениновом остатке. Эта
наглядная и правдоподобная гипотеза будет подтверждена, если
удастся доказать периодичность окисления и восстановления.
Дальнейшие подробности, относящиеся к окислительному
фосфорилированию, содержатся в специальной литературе (см.
[30, 31]). Мы рассказали здесь о чисто биохимической картине
процесса, являющейся теперь классической. Однако в
последнее время выяснилось, что молекулы ферментов, участвующие
в дыхательном цикле и расположенные в мембранах
митохондрий, выполняют не только химическую, но и осмотическую и
механическую работу. Митохондрии «дышат» — под действием
АТФ они сокращаются и набухают, обеспечивая регулярную
подачу и удаление воды и малых ионов. Имеются данные,
указывающие на сходство механохимических процессов в
митохондриях с процессами, определяющими мышечную
деятельность (см. [35]), описанную в гл. 9.
н
НС
^
NH2
С
N'
II JJH
а)
+е"
-е"
мн2
7Г
I
II
"Ч^/
сн
NH2
Ч /Ч
+нф \г ^с
-н+
I
не.
N
■V"
N
II СН
\
+е-+и*
-е--н* НС.
| II СН
'N
N
/
\
V
Рис. 47. а) «окисленная» форма аденина — слабое основание; б) «полувосстановленная» форма
сильное основание; в) «восстановленная» форма — сильное основание.
ЙН3
I 3
I II
НС С
он о
| , л ||
О —Р-гОН НО-г-Р
II *- —/\
о но
N
N
Ч
сн он он
/ |_|
о
НО—Р
I
/°
сн,
=0
НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В КЛЕТКЕ 143
Как мы увидим (гл. 6), полинуклеотиды и нуклеиновые
кислоты образуются из нуклеозидтрифосфатов, соединений,
подобных АТФ и, следовательно, содержащих запас энергии. Эта
значит, что нуклеозиды должны фосфорилироваться,
активизироваться для создания важнейших биологических молекул —
РНК и ДНК. АТФ и другие нуклеозидтрифосфаты и здесь
занимают ключевые позиции.
Мы не рассматриваем здесь процесса фотосинтеза (см. [36]).
Приведем все же формулу хлорофилла (рис. 49). Как и в
сн,
IIг
сн снч
н3с с. н с
С\\ / \ /С"Сн^снз
НзС-нс \ с \-щ
СНг НС С=0
Г |
сн2 с -о-сн3
о = с-о о
Рис. 49. Строение хлорофилла.
цитохроме, здесь имеется специфическая группа атомов, в
центре которой расположен один атом металла — на этот раз
магния. Эта группа называется порфириновым кольцом. Порфи-
риновые соединения играют важнейшую роль в биологии.
В состав гемоглобина крови входит гем — железосодержащее
порфириновое кольцо, сходное с фигурирующим в цитохроме.
Перенос кислорода гемоглобином осуществляется путем
присоединения молекулы кислорода к атому железа. При
отравлении угарным газом, окисью углерода СО, она связывается с
железом гема и нарушает его функцию. В крови ряда
беспозвоночных присутствуют порфириновые группы с другими
атомами металлов. У каракатиц роль железа играет медь. У
оболочников (асцидий) вместо четырехпиррольного порфиринового
144
ГЛ. 3. БИОЛОГИЧЕСКИЕ МОЛЕКУЛЫ
кольца содержится дипиррольная группировка, к которой
присоединен уже ванадий. Пиррол — простое
гетероциклическое соединение
Н
НС СН
II II
НС СН
Общий вывод, который можно сделать из этого краткого
рассмотрения биохимических процессов и биологических
молекул,— поразительное единство химических основ жизни во всех
организмах — растительных и животных.
ГЛАВА 4
ФИЗИКА МАКРОМОЛЕКУЛ
ФИЗИЧЕСКИЕ СВОЙСТВА МАКРОМОЛЕКУЛ
Итак, белки, нуклеиновые кислоты и полисахариды
(углеводы) представляют собой макромолекулы —
высокомолекулярные соединения. Для того чтобы понять природу их
биологической функциональности и познакомиться с методами их
исследования, необходимо установить, каковы общие особенности
макромолекул.
Естественно, что первыми полимерами, с которыми
встретились химия и физика, были полимеры биологического
происхождения. Кроме основных биологических макромолекул здесь
следует назвать вещества, содержащиеся в соке некоторых
растений— каучук и гуттаперчу. В дальнейшем синтетическая
химия разработала методы получения множества полимеров,
играющих сегодня очень большую роль в технике и в быту. К
полимерам относятся синтетические каучуки, пластмассы,
волокна. Физика полимеров, физика макромолекул была развита в
последние десятилетия прежде всего применительно к
синтетическим полимерам. Общие закономерности, установленные в
этой области, оказываются применимыми и к биополимерам.
Иными словами, синтетические макромолекулы, строение
которых гораздо проще, чем строение белков, ДНК и РНК, могут
моделировать ряд свойств этих биологических веществ. В этом
смысле физика биополимеров является частью физики
полимеров. Физика полимеров имеет два основных пути развития: один
из них ведет в технику, другой — в биологию. Здесь нас
интересует второй путь, ему мы и будем следовать.
Простейшими синтетическими полимерами являются
углеводороды, например,
v ,CH2v yCU2K /CHjv у
СИ 2 CH2 CHj СН2
Полиэтилен
н/ \qh5h5c/ \н
Полистирол (атактический)
20 М. В. Волькенштейн
146
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
И
ч /СН2Х /Н Н3СЧ /СН2—
\сн2/ >с=с< >с=сс
н3сх х:н2—сн2/ \н
Транс-полиизопрен (гуттаперча)
\ /СН2Ч /СН2—СН2Ч СН2—
м:н/ >с=с< >с=с<
НЛ(У ХН Н3(Х \Н
Цис-полиизопрен (натуральный каучук)
Эти и другие полимеры растворяются в органических
растворителях, причем дают истинные, а не коллоидные растворы.
Физические свойства изолированных макромолекул изучаются
именно в растворах полимеров, так как нет другого способа
получения отдельных макромолекул — полимеры разлагаются до
их испарения.
Прежде всего необходимо отметить, что, в отличие от
белков, синтетические полимеры состоят из неоднородных
макромолекул. Приведенные формулы цепей идеализированы в том
смысле, что реальные цепи зачастую содержат и другие
группы, например, некоторые из атомов Н в полиэтилене могут
быть замещены на метил СН3 и т. п. Линейные цепи могут быть
в некоторых местах разветвлены. Любой образец
синтетического полимера содержит смесь макромолекул с различными
длинами цепей. Следовательно, молекулярный вес синтетического
полимера является средним значением по всей группе полимер-
гомологов. Полимерные цепи типа (—CHR—СНг—)п, например
полистирол, где R = C6H5, могут обладать различными
конфигурациями. Каждая из групп R может смотреть вправо или влево
по отношению к основной цепи, т. е. иметь два различных
положения. Если число мономерных звеньев в цепи равно 1000,
что еще не очень много, то число цепей с различными
конфигурациями составит 21000 и будет, следовательно, значительно
большим числа макромолекул в данном образце. Иными
словами, все макромолекулы в образце будут разными. Таким
образом, синтетические макромолекулярные вещества не
подчиняются одному из основных законов химии — закону
постоянства состава и строения. Природа в этом отношении работает
гораздо аккуратнее, чем химик в лаборатории. Все молекулы
данного белка имеют вполне определенное строение и состав.
В последние годы химия пошла на сближение с природой.
Итальянский ученый Натта открыл способы получения стерео-
регулярных полимеров, в которых конфигурации мономерных
звеньев являются вполне определенными. На рис. 50 показано
строение цепей изотактического и синдиотактического полисти-
ФИЗИЧЕСКИЕ СВОЙСТВА МАКРОМОЛЕКУЛ
147
рола. В первом случае все фенильиые группы C6Hs
расположены по одну сторону основной цепи, во втором — поочередно
справа и слева.
Специфика физических свойств макромолекул определяется
большим числом одинаковых звеньев в цепи. Это, очевидно,
относится к любым макромолекулам — как синтетическим, так и
биологическим. Аминокислоты в цепи белка отличаются друг
/СН2\ / СНг \ / CHz \ / СИг\ / СИ2\
[Г С С С
d\d\d\d\
а)
/СН2ч /СН2ч /СНг\ /СИ\ /СН2\
и и и и
Рис. 50. Строение изотактического (а) и синдиотакти-
ческого (б) полистирола.
от друга, но эти различия относятся к привескам, а основные
звенья —С—NH—СО— однотипны. Благодаря тому, что за
физическое поведение макромолекул ответственно прежде всего их
цепное строение, оказывается возможным построить общую
физическую теорию поведения макромолекул, позволяющую в то
же время учесть природу составляющих цепь атомов и групп.
Такая теория применима к полиэтилену и к белкам, к каучуку
и к нуклеиновым кислотам. Поэтому изучение простых
макромолекул не только полезно, но и необходимо для понимания
физических свойств биологических полимеров.
Ярким выражением специфики макромолекул является вы-
сокоэластичность — свойство, присущее только полимерам —
натуральному и синтетическому каучукам. Сейчас мы говорим
уже не об отдельных макромолекулах, но о полимере в блоке.
Как мы увидим, однако, высокоэластичность блочного каучука
в конечном счете определяется строением и свойствами его
макромолекул. Высокоэластичность — способность к очень
10*
148
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
большим упругим деформациям, достигающим сотен процентов,
при малом модуле упругости. При небольших деформациях
каучук, подобно другим упругим телам, подчиняется закону Гука —
деформация пропорциональна приложенному напряжению
0 = tLzh.. (4.1)
Здесь а — напряжение, т. е. сила, отнесенная к единице
сечения недеформированного образца, L — длина
растянутого, L0—нерастянутого образца, е — модуль упругости. В то
время как для стали е=20000—22 000 кг/мм, для каучуков
е=0,02—0,8 кг/мм — в миллион раз меньше. В этом смысле
каучук подобен идеальному газу. При сжатии газа возникает
упругая сила, газ стремится расшириться. Вычислим
соответствующий модуль упругости. Идеальный газ подчиняется
уравнению состояния
pV = RT. (4.2)
Сожмем газ при постоянной температуре, увеличив давление
на dp. Объем при этом уменьшится на dV. Дифференцируя
(4.2), получаем
pdV + Vdp = 0 (4.3)
или
dp = -P^ = P^T^^ (4.4)
где LQ— начальный уровень поршня, L — уровень поршня при
сжатии газа. Уравнение (4.4) аналогично (4.1), роль модуля
упругости е играет давление /?. Атмосферному давлению
соответствует е=1 /сг/ои = 0,01 кг/мм, т. е. величина того же
порядка, что и у каучука. Аналогия между свойствами каучука
и идеального газа этим не исчерпывается. При адиабатическом
растяжении (адиабатическим называется процесс, идущий без
теплообмена с окружающей средой) каучук нагревается
подобно тому, как нагревается при адиабатическом сжатии
идеальный газ. Внутренняя энергия каучука практически не зависит
от его растяжения, так же как внутренняя энергия идеального
газа не зависит от его расширения или сжатия.
Упругие свойства обычных твердых тел имеют другой
характер. Упругая сила возникает при деформации стальной
пружины, так как эта деформация вызывает изменение межатомных
расстояний и соответствующее увеличение внутренней энергии.
Следовательно, упругость стали и любого другого
неполимерного материала является энергетической. Очевидно, что
происхождение высокоэластичности существенно иное. Для того что
ФИЗИЧЕСКИЕ СВОЙСТВА МАКРОМОЛЕКУЛ
149
бы понять в чем дело, рассмотрим основные термодинамические
соотношения, характеризующие процесс растяжения каучука.
Работа, необходимая для изотермической деформации
каучука, равна изменению его свободной энергии при постоянной
температуре
dA = dF = dE—T dS. (4.5)
С другой стороны, работа растяжения равна произведению
растягивающей силы на удлинение образца
dA = fdL. (4.6)
Пренебрегая очень малым изменением объема каучука при его
деформации, можем написать
t=m=№)r-T№r- <«>
Опыт показывает, как уже было сказано, что для каучука
т. е.
/—т(ж)т- <4-9)
Действительно, упругая сила в каучуке пропорциональна
абсолютной температуре Г, т. е. соотношение (4.9) правильно.
Значит, возникновение упругой силы определяется изменением
не внутренней энергии, а энтропии.
Это — феноменологическая термодинамика. Каков же
конкретный смысл изложенного?
Для идеального газа справедлив тот же вывод — его
упругость имеет энтропийную природу. Это означает, что при
уменьшении объема идеального газа возрастает число ударов
молекул о стенки, т. е. упругая сила связана с тепловым движением
молекул. Сжатие газа уменьшает его энтропию, так как газ
переходит из более вероятного разреженного состояния в менее
вероятное — сжатое. Очевидно, что сходный процесс должен
происходить и в каучуке, т. е. каучук состоит из большого числа
элементов, обладающих какими-то независимыми тепловыми
движениями, и растяжение каучука означает переход от более
вероятного расположения этих частиц к менее вероятному, т. е.
уменьшение энтропии. Только в этом может состоять смысл
аналогии между каучуком и идеальным газом.
О каких же независимых элементах можно говорить в
случае макромолекулярного вещества — каучука? Ведь атомы
связаны здесь в цепи, а в упругом, вулканизированном каучуке
цени сшиты друг с другом отдельными перемычками.
150
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
Макромолекулы натурального и синтетических каучуков
содержат единичные связи С—С (а также С—О, С—N и др.),
вокруг которых возможно внутреннее вращение. Это явление
хорошо изучено у малых молекул [1]. Рассмотрим молекулу
этана Н3С—СНз (рис. 51). Как это явствует из термодинамических
и других свойств этана, в его молекулах группы СН3 способны
выполнять повороты вокруг оси С—С.
Внутреннее вращение в этане несвободно, для
поворота на 120° необходимо перевалить через
энергетический барьер высотою примерно в
3 ккал/моль. Зависимость энергии молекулы U
от угла поворота <р может быть для этана
представлена приближенным выражением
о*
и=
Щ-(\ — cos3(p),
(4.10)
Рис. 51. Строение
молекулы этана.
где Uq — высота барьера. На рис. 52 показан
вид соответствующей кривой £/(<р). Причина
заторможенности внутреннего вращения —
отличия UQ от нуля — состоит во взаимодействии электронных
оболочек валентно несвязанных атомов (в данном случае
атомов Н).
В макромолекулярной цепи, состоящей из единичных связей
С—С, внутренние повороты происходят в каждом звене цепи.
0° 60° Ш° №° 240*300е 360° у
Рис. 52. Потенциал внутреннего
вращения в этане.
Рис. 53. Внутреннее
вращение в макромолекулярной
цепи.
Фиксируем положение двух первых звеньев (рис. 53). Третье
звено может иметь различные положения на поверхности
конуса с раствором 29, где я — 9 — фиксированный валентный угол
между связями С—С. Положение четвертой связи по
отношению к первым двум является еще менее определенным, так как
она располагается на конусе, описанном вокруг каждого из по-
ФИЗИЧЕСКИЕ СВОЙСТВА МАКРОМОЛЕКУЛ
151
ложеиий третьей связи и т. д. В результате достаточно
удаленная связь располагается по отношению к исходной — первой
связи — совершенно произвольным образом. Поэтому
макромолекула в целом приобретает беспорядочно спутанную кон-
формацию*). Так как повороты звеньев происходят случайно,
в результате теплового движения, конформации свободной
макромолекулы непрерывно изменяются, флуктуируют.
Макромолекула ведет себя как гибкая нить, случайным образом
спутавшаяся в клубок. Размеры
такого клубка могут быть
охарактеризованы расстоянием h
от его начала до конца.
Чему должно быть равно это
расстояние?
Разобьем мысленно
макромолекулу на сегменты —
участки, положения которых уже
не коррелированы друг с
другом (рис. 54). Пусть число
таких свободно сочлененных
сегментов равно Z, длина ка- Рис. 54. Разбиение макромолекулы
ждого сегмента — Ь. Очевид- на сегменты,
но, что среднее по всем кон-
формациям значение вектора h равно нулю, так как любые
направления вектора равновероятны.
Это можно пояснить следующей аналогией. Вдребезги
пьяный человек блуждает по площади, выйдя из некоторой
исходной точки. Длина его шага 6, он сделал Z шагов.
Спрашивается, где он остановился, как направлен в среднем его путь?
Очевидно, что средняя длина пути равна нулю, так как он с
одинаковой вероятностью шагает в любом направлении, и вперед и
назад. Отличным от нуля будет среднее значение квадрата
длины пути от исходной до конечной точки А2. Решение такой
задачи случайного блуждания (задачи очень важной в теории
броуновского движения, в теории диффузии) дает при Z^§>\\
I2 = Zb2. (4.11)
Если бы человек был трезв и шел все время в одном
направлении, т. е. если бы макромолекулярная цепь была вытянута,
*) Конформациями молекулы называются различные ее формы, которые
могут быть получены одна из другой без разрыва химических связей,
например в результате внутренних поворотов. Напротив, для перехода от одной
конфигурации к другой такой разрыв связей необходим (например, правый
и левый стереоизомеры).
А
152
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
длина пути h равнялась бы Zb и, следовательно,
ALx = ZV, (4.12)
т. е. клубок закручен в ]/Z раз. Если, например, число
сегментов равно 100, то клубок короче вытянутой цепи
в 10 раз.
Теперь спрашивается, как распределены вероятности
осуществления тех или иных значений Л, которые могут меняться от
нуля до максимальной длины вытянутой цепи Zb? Ответ на этот
вопрос снова дает теория диффузии. Вероятность того, что
конец цепи отстоит от ее начала на расстояние, лежащее в
интервале от h до h+dhy равна
W{h) dh = {-^zw)k bnWe-wv™ dh. (4.13)
Соотношение (4.11) прямо следует из (4.13). В самом деле,
оо
h? = fh2W(h)dh = Zb2. (4.14)
о
Таким образом, свободные макромолекулы свернуты в
клубок. Такое состояние наиболее вероятно, ибо вытянутая кон-
формация цепи может осуществиться одним способом, а
свернутая — множеством способов. Исследование формы и
размеров макромолекул в растворах подтверждает эти результаты
теоретического исследования, впервые проведенного Куном.
Теперь мы можем понять и энтропийную природу высоко-
эластичности каучука. В нерастянутом состоянии каучука цепи
свернуты в статистические клубки. При растяжении клубка его
энтропия уменьшается, так как уменьшается вероятность —
вытянутая конформация макромолекулы менее вероятна, чем
свернутая. Роль независимых элементов, подверженных тепловому
движению, играют сегменты свободно-сочлененных цепей.
Гибкость макромолекул является их специфическим
физическим свойством.
Это — общая теория. Однако от физической теории
требуется не только общее объяснение явления, но и количественное
истолкование и предсказание экспериментальных данных.
Статистическая теория конформаций макромолекул должна
учитывать особенности их реального строения. Поэтому
моделирование макромолекул свободно-сочлененными цепями
недостаточно.
Для среднего квадрата длины цепи с фиксированными
валентными углами и несвободным внутренним вращением
ПОВОРОТНО-ИЗОМЕРНАЯ ТЕОРИЯ МАКРОМОЛЕКУЛ
153
получается следующая формула [2] — формула Ока*):
h* = NP j + C0SQ9 j+Л, (4.15)
1 — cos 9 1 — т] v '
где / — длина уже не условного сегмента, а мономерного
звена, N — число мономерных звеньев в макромолекуле, 0 — угол,
дополнительный к валентному, ц — средний косинус угла
внутреннего вращения. При совершенно свободном внутреннем
вращении т]=0 и цепь является особенно гибкой: напротив, у
жесткой цепи т] близко к 1. Если вращение несвободно, то
2я I 2я
t] = cosmp = f e-"(<P)/wCos<pd<p f e-uW<lfcTd<p. (4.16)
о /о
Очевидно, что для вычисления_ т] и, следовательно, для
сравнения теоретического значения А2 (4.15) с экспериментальным,
необходимо знать вид функции £/(<р). Для всех реальных
полимеров нахождение £/(<р) в полном виде представляет большие и
пока еще непреодоленные трудности. £/(<р) для макромолекул
никогда не совпадает с (4.10). Однако, как мы увидим ниже,
имеется возможность упрощенного теоретического
рассмотрения этой проблемы.
Необходимо подчеркнуть, что все изложенное относилось
только к термодинамически равновесному поведению
макромолекул. Иными словами, нас не интересовало время растяжения
макромолекулы, скорость деформации. Кинетическая гибкость
полимерной цепи, т. е. ее способность изменять свою конформа-
цию во времени, зависит от скорости внутренних поворотов
вокруг единичных связей. Следовательно, кинетические свойства
макромолекул определяются энергетическими барьерами,
которые должны преодолеть звенья при поворотах.
ПОВОРОТНО-ИЗОМЕРНАЯ ТЕОРИЯ МАКРОМОЛЕКУЛ
При внутренних поворотах в молекуле этана-на 120° и 240°
получаются конформации, тождественные исходной. Оно и
понятно— ведь метильные группы СН3, из которых состоит этан —
симметричны. Иначе обстоит дело у менее симметричных
молекул, например для нормального бутана Н3С • Н2С—СН2-СН3.
-Здесь вокруг центральной С—С-связи вращаются группы С2Н5.
Соответственно потенциальная кривая внутреннего вращения
*) Эта формула обычно именуется формулой, Тейлора. Однако, как мне
лишь недавно стало известно, она была впервые получена не Тейлором
.(1947 г.), а японским физиком Ока [Ргос. Phys.-Math. Soc. Japan. 24, 657
(1942)].
154
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
уже не описывается простой формулой (4.10). Кривая £/(<р)
для «-бутана имеет вид, показанный на рис. 55. На этой кривой
имеются минимумы энергии, отвечающие <р = 0° и примерно 120°
и 240°, неодинаковой глубины. Конечно, молекулы «-бутана
существуют в состояниях с
U наименьшей энергией, т. е.
они проводят большую
часть времени в конформа-
циях, соответствующих
углам поворота <р = 0°, 120°,
240°. На рис. 56 показаны
эти конформации
«-бутана — поворотные изомеры.
В отличие от конформации
этана, поворотные изомеры
«-бутана различны. Первый
из них—транс-изомер имеет
центр симметрии. Два других отличны от транс-изомера и
относятся друг к другу как правая и левая руки. Поворотные
изомеры могут быть обнаружены с помощью ряда физических
методов, но их нельзя разделить химически.
360* ?
Рис. 55. Потенциал внутреннего
вращения в н-бутане.
Рис. 56. Поворотные изомеры н-бутана.
Проекция на плоскость, перпендикулярную к центральной связи С—С.
Высоты барьеров внутреннего вращения порядка
нескольких килокалорий на моль. Скорость перехода через барьер
(скорость поворотной изомеризации) выражается уравнением
Аррениуса (см. стр. 25). Расчет показывает, что при
указанных высотах барьеров повороты в малых молекулах
происходят 1010 раз в секунду! Ясно, что невозможно разделить
поворотные изомеры и разложить их по баночкам — они все время
превращаются друг в друга.
Как же можно тогда обнаружить существование
поворотных изомеров? В каждый данный момент в совокупности из N
ПОВОРОТНО-ИЗОМЕРНАЯ ТЕОРИЯ МАКРОМОЛЕКУЛ
155
молекул «-бутана часть молекул будет в транс-форме, часть —
в свернутых формах. Доли этих форм (доли поворотных
изомеров) зависят от температуры в соответствии с уравнением
(1.14):
1 - в-ЩкТ
Nt = N i+fr-w N* = Ni=N 1Ч!а.-да <4Л7>
И
■Ж = 'Я7=е~*Е1"г' (4Л8)
т. е. при данной температуре Т доля свернутых конформации
будет тем меньше, чем больше их относительная энергия АЕ.
При Г->оо Nt = Nd = Ni; напротив, при Т-+0 остаются только
транс-изомеры.
Наличие поворотных изомеров в такой динамической смеси
обнаруживается, в частности, методом инфракрасных спектров,
в которых наблюдаются частоты колебаний атомов в
молекулах. Эти частоты имеют порядок 1012—1018 колебаний в
секунду; следовательно, за время существования поворотного
изомера (1010 сек) молекула успевает «проколебаться» 100—
1000 раз, успевает «выдать» свой инфракрасный спектр.
Колебательные спектры поворотных изомеров отличны друг от
друга. Значит, спектр «-бутана должен представлять собой
наложение спектров его поворотных изомеров. Отношение интеисив-
ностей спектральных полос описывается выражением (4.18) и
из изменения этого отношения при повышении или понижении
температуры можно определить разность энергий поворотных
изомеров Д£ [1, 2]. Для «-бутана Д£ составляет 800 кал/моль.
Обратимся теперь к макромолекулам. Цепочка полиэтилена
построена так же, как молекула «-бутана. Повороты здесь
возможны вокруг каждой из единичных связей С—С, в каждом
звене цепи. Естественно предположить, что в результате таких
поворотов возникают дискретные конформации — поворотные
изомеры, подобные поворотным изомерам «-бутана. В самом
деле, по отношению к каждой связи в полиэтилене поворотные
изомеры вполне сходны с поворотными изомерами бутана, с тем
отличием, что вместо СН3-групп бутана в полиэтилене
фигурируют СНг~ -группы (~ — продолжение цепи) (рис. 57).
Таким образом, макромолекулу в ее термодинамически
равновесном состоянии можно рассматривать как смесь поворотных
изомеров [3, 2]. Доли поворотных изомеров в такой смеси, т. е.
доли звеньев, находящихся в соответствующих дискретных кон-
формациях, выражаются формулами (4A7)yrjieN=Nt + Nd+Ni—
полное число звеньев (степень полимеризации). Звенья в
макромолекуле находятся не в состоянии беспорядочного вращения,
156
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
но располагаются в дискретных положениях. Мы как бы
«квантуем» макромолекулу, заменяя непрерывную кривую
внутреннего вращения несколькими дискретными положениями,
СН2~
Н
~Н,С
СНг~
сн2~ сн2~ снг~
Рис. 57. Поворотные изомеры полиэтилена.
~ означает продолжение цепи.
которым отвечают разные значения энергии (рис. 58).
Соответственно при вычислении rj = cos<p интегрирование (4.16)
заменяется суммированием по
поворотным изомерам:
т
2 $1 COS ф.
Т| =
/=1
т
1=\
(4.19)
F/
Гж
<Рз
9
Рис. 58. Замена непрерывной кривой
внутреннего вращения дискретными
минимумами.
Здесь gi — статистические
веса поворотных изомеров,
gi = e'Eilk\ (4.20)
Ei — энергия иго
поворотного изомера, отвечающая
углу фг*. Всего у нас т поворотных изомеров для каждого
звена. Для поворотных изомеров полиэтиленов (рис. 57) т = 3, и
мы получаем:
транс-изомер Ег = 0, <рг = 0°, cos <р2 = 1;
правый свернутый Е2 = АЕ, <р2 = 120°, cos<p2 = — 0,5;
левый свернутый Е3 = Л£, ф3 = 240°, cos <р3 = — 0,5.
Подставляя эти значения в (4.19), находим
При Д£=800 кал/моль и 7=0° С находим т] = 0,53. Средний
ПОВОРОТНО-ИЗОМЕРНАЯ ТЕОРИЯ МАКРОМОЛЕКУЛ 157
квадрат длины цепи по формуле Ока (4.15) равен (я—0 =
= 109°28'— тетраэдрический валентный угол, cos0=—7з):
h* = NP. 1,63.
Этот результат, однако, согласуется с опытом только по
порядку величины. Причины расхождения рассматриваются далее
(стр. 171).
Термодинамическая гибкость макромолекул, т. е. степень
скрученности статистического клубка, тем больше, чем меньше
т], т. е. чем меньше Д£. При Д£=0 т] = 0, т. е. макромолекула
ведет себя как цепь со свободным внутренним вращением.
Поворотно-изомерная теория позволяет избежать
затруднительного интегрирования (4.13) и представить конформации
макромолекул в ясном и наглядном виде. При этом возникает
следующий принципиальный вопрос: не является ли поворотно-
изомерная теория просто неким упрощающим математическим
приемом? Существуют ли реально поворотные изомеры в
макромолекулах— ведь может быть, что кривая £/(<р) и не имеет
резко выраженных минимумов, что означало бы наличие
непрерывных вращений, а не дискретных конформации звеньев
макромолекулы? Ответ на эти вопросы может дать только опыт.
Соответствующие экспериментальные исследования были
проведены методом инфракрасной спектроскопии. И действительно
оказалось, что у полиэтилена имеется поворотная изомерия,
причем Д£ составляет 500—800 кал/моль, как и у «-бутана [4].
Аналогичные результаты были получены и для других
полимеров. Наиболее прямые доказательства поворотной изомерии
макромолекул дает изучение их растяжения (стр. 159).
Таким образом, существование поворотной изомерии в
макромолекулах доказано. Спрашивается, однако, является ли
именно поворотная изомерия ответственной за гибкость
полимерных цепей, за то, что макромолекула сворачивается в
клубок в растворе? Есть ведь и другая возможность, связанная с
крутильными колебаниями звеньев.
Представим себе, что каждому звену отвечает
один-единственный, скажем, транс-изомер. Это еще не означает, что цепь
будет жесткой и не свернется в клубок. Тепловое движение
звеньев, выражающееся в их крутильных колебаниях вокруг
единичных связей, хотя бы и с малой амплитудой, приведет к
тому, что достаточно длинная цепь окажется свернутой в
клубок и в отсутствие поворотной изомерии. Однако теоретические
расчеты размеров клубков и других свойств макромолекул
показывают, что предположение об определяющей роли
крутильных колебаний не дает согласия с опытом. Напротив,
поворотно-изомерная модель полностью подтверждается.
J 58
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
Другая важнейшая проблема состоит в нахождении
истинных значений углов <р*, которым отвечают минимумы
потенциальной энергии £/(<р), т. е. нахождении истинных конформаций
цепей. Мы рассмотрели полиэтилен по аналогии с «-бутаном,
приписав <рг- значения 0°, 120°, 240°. Очень важно найти эти
значения из независимого опыта, руководствоваться
экспериментальными, а не умозрительными данными о конформациях
макромолекул. Как мы увидим далее, эти данные можно получить,
изучая кристаллические
Н\ / Н\ / Н\ s полимеры (стр. 167).
\/ \/ \/ Рассмотрим теперь,
С .С у С. > как поворотно-изомерная
^^ / ^^ / ^\ / теория объясняет специ-
С С С фическое свойство поли-
/\ [ \ /\ меров — высокоэластич-
Н Н Н Н Н Н ность каУчУк<>в-
При растяжении мак-
Рис. 59. Транс-цепочка полиэтилена. ромолекулы цепь
переходит из более свернутого
в менее свернутое состояние. Это значит, что происходит
вынужденное внешней силой изменение набора конформаций цепи.
Такое изменение осуществляется путем внутренних поворотов,
путем поворотной изомеризации. Наиболее вытянутому
состоянию цепи полиэтилена соответствуют сплошные
трансизомеры (рис. 59), скрученному — смесь /-, d- и /-поворотных
изомеров. Это можно пояснить наглядно с помощью
одномерной модели макромолекулы. Допустим, что каждое звено
цепи моделируется стрелкой длины /, которая может смотреть
вправо или влево. Одному поворотному изомеру отвечают две
соседние стрелки, смотрящие в одну сторону — пусть это будет
транс-изомер. Второму поворотному изомеру соответствуют две
соседние стрелки, смотрящие в разные стороны. Общая длина
цепи выражается векторной суммой всех стрелок. На рис. 60, а
изображена цепь, состоящая из 10 звеньев. Из них 5 смотрят
вправо, 5 влево, следовательно, общая длина цепи Л=0. Числа
повторных изомеров: 5 первого типа, обозначенного буквой t,
и 5 второго типа, обозначенного буквой s (чтобы общее число
поворотных изомеров равнялось числу звеньев, т. е. 10, мы
добавляем мысленно еще одно «минус первое» звено,
изображенное пунктиром). Будем растягивать такую цепь, т. е.
подействуем на наши звенья силой, направленной слева направо.
На рис. 60,6 показано одно из вытянутых (но не предельно
вытянутое) состояний цепи. Здесь число стрелок, смотрящих
вправо, равно 7, влево — 3, следовательно, общая длина цепи
Л=(7—3)/=4/. Что касается поворотных изомеров, то их доли
ПОВОРОТНО ИЗОМЕРНАЯ ТЕОРИЯ МАКРОМОЛЕКУЛ [59
остались прежними — 5 сорта / и 5 сорта s. Цепь удлинилась в
результате простого перераспределения поворотных изомеров
без изменения их относительного содержания. В начале
последовательность поворотных изомеров была ttsststsst, потом tttsstssts.
Такое изменение не сопровождается, очевидно, изменением
энергии— она остается постоянной и равной 5Et + 5Es. Но энтропия
при этом, конечно, меняется, убывая по мере увеличения
упорядоченности в расположении /- и s-звеньев.
Очевидно, что путем простого перераспределения /- и s-изо-
меров по цепи нельзя добиться ее полной вытяжки. В нашей
модели полностью вытянутому состоянию цепи отвечает
сплошной набор /-изомеров (рис. 60, б; ср. рис. 59). При растяжении
а) —*•—»» » *~ *-—»» « * ■ —»-*———
б) ———-—~-——~-—.——
в) —з~ —— —. - , , . -
Рис. 60. Одномерная модель растяжения макромолекулы.
а) нерастянутая цепь; 6) растянутая цепь; в) полностью растянутая цепь.
макромолекулы наряду с перераспределением поворотных
изомеров происходит превращение свернутых изомеров в более
вытянутые транс-изомеры, т. е. переходы
5-изомер -> ^-изомер.
Такое превращение сопровождается не только изменением
энтропии, но и изменением внутренней энергии, так как
ШьФЬЕг + ЬЕ&.
На основе очень упрощенного, модельного рассмотрения мы
приходим к весьма интересным и далеко не тривиальным
выводам. Процесс растяжения полимера состоит в его поворотной
изомеризации. К ней и сводится механизм высокоэластичности,
получающей тем самым ясное молекулярное истолкование.
Возвращающая упругая сила в каучуках должна при этом быть не
чисто энтропийной, но частично и энергетической — в случае,
если поворотные изомеры обладают разной энергией [2, 5]. Ясно,
что эти выводы теории подлежат экспериментальной проверке.
Изучение растяжения полимеров методом инфракрасных
спектров действительно показало, что при растяжении
изменяется относительное содержание поворотных изомеров [2, 6, 7].
160
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
Иными словами, растяжение действительно означает
принудительное изменение конформации макромолекулы.
В то же время тщательное исследование термомеханических
свойств каучукоподобных полимеров, проведенное Флори и его
сотрудниками на основе изложенной теории [9] (см. также [10]),
показало, что чисто энтропийный характер высокоэластичности,
о котором говорилось выше, присущ далеко не всем полимерам
и что имеется также и энергетическая упругая сила.
Экспериментальные данные оказались не только в качественном, но и
в количественном согласии с теорией. При исследовании
термомеханических свойств высокоэластичного полиэтилена была
определена энергетическая упругая сила
f—i£
'— dL •
из значений которой была вычислена разность энергий
поворотных изомеров Д£, совпавшая с найденной спектроскопическим
путем.
* Таким образом, поворотно-изомерная теория макромолекул
получила полное экспериментальное подтверждение. На основе
этой теории удается в хорошем согласии с опытом вычислять
физические характеристики макромолекул—их размеры и
форму, дипольные моменты и оптические поляризуемости.
Мы говорили все время о простых синтетических полимерах,
в частности о полиэтилене. Но все изложенное имеет общее
значение. Для понимания строения и физических свойств
биополимеров— белков, нуклеиновых кислот, углеводов необходимы те
же конформационные представления, та же
поворотно-изомерная теория.
МАКРОМОЛЕКУЛА — КООПЕРАТИВНАЯ СИСТЕМА
Выше дано упрощенное качественное изложение поворотно-
изомерной теории. Для того чтобы теория была количественной,
давала бы количественное согласие с опытом, необходимо
учесть важные особенности макромолекул, ранее не отмеченные.
В «-бутане связь между отдельными молекулами
осуществляется только межмолекулярными силами, вообще говоря
гораздо более слабыми, чем внутримолекулярные. Молекулы
бутана и в газе и в жидкости практически независимы друг от
друга, и превращения их поворотных изомеров происходят
также независимо. Напротив, в макромолекулярной цепи все звенья
связаны друг с другом. Поэтому повороты в данном звене не
независимы от конформации соседних связей. Например, кои-
формация трех последовательных звеньев полиэтилена, показан-
МАКРОМОЛЕКУЛА — КООПЕРАТИВНАЯ СИСТЕМА
161
Рис. 61. Одна из невозможных
конформаций трех
последовательных звеньев в цепи полиэтилена.
ная на рис. 61, вообще невозможна, так как в ней атомы
водорода, отмеченные белыми и зачерненными кружками,
слишком близко подходят друг к другу и между ними
возникают большие силы отталкивания. Следовательно, вероятность
найти данное звено макромолекулы в данной конформаций
зависит от конформаций соседних звеньев. В этом смысле макро-
молекулярная цепь
представляет собой цепь Маркова.
Великий русский математик
Марков создал теорию цепных
вероятностных процессов. Если
в совокупности
последовательных случайных событий
вероятность каждого последующего
события зависит от того, какие
события осуществлялись перед
ним, то такая совокупность
образует цепь Маркова. Приведем
пример такой цепи.
Вынимаем из колоды одну
карту наудачу. Вероятность
появления карты данной масти составляет 25%. Если карта
кладется в колоду обратно, то при последующем извлечении карты
вероятность появления данной масти не меняется. Но если
карта не возвращается в колоду, то вероятность вторичного
появления карты данной масти оказывается зависящей от
результата предыдущего извлечения. Так, если вынута трефовая
карта, то в колоде осталось по 13 карт червонных, бубновых и
пиковых и 12 трефовых. Следовательно, вероятность вторично
извлечь трефовую карту составляет -gj-, что меньше 25%.
Напротив, если вынута карта другой масти, то вероятность при
втором извлечении получить трефовую карту составляет
-gj->25%. Это пример сложной Цепи Маркова — вероятность
извлечь карту данной масти зависит от результатов всех
предыдущих испытаний, а не только соседнего.
Другой пример относится к генетике. Допустим, что
скрещиваются гетерозиготные особи с генотипами Rr. Результат
скрещивания в первом поколении может быть записан в виде
т. е. вероятности появления особей Rr, RR и rr равны
соответственно -j»-т и т- Какова вероятность появления гетерозиготы
И М. В. Волькенштейн
162
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
Rr в любом последующем поколении, получаемом в результате
случайных скрещиваний в популяции, содержащей Rr, RR
и rr с заданными вероятностями? Она, очевидно, зависит от
того, какие родители были в предыдущем поколении, т. е. от
осуществления предыдущего события. Это снова цепь Маркова.
Математическая теория цепей Маркова сложна, и мы не
будем ее здесь излагать. Из сказанного, однако, очевидно, что
такого рода цепные процессы очень существенны. Цепи Маркова
находят важнейшие применения в современной статистической
физике, в метеорологии (вероятность определенной погоды
сегодня зависит от того, какая была погода в предыдущие дни)
и т. д.
Интересно отметить, что сам Марков применил свою теорию
к исследованию чередования гласных и согласных в русском
литературном языке, исследовав тексты «Евгения Онегина»
Пушкина и «Детских годов Багрова-внука» Аксакова. Ясно, что
вероятность появления согласной или гласной зависит от того,
какая буква ей предшествует.
При рассмотрении свойств макромолекул — а их
специфичность связана именно с конформационными изменениями —
необходимо учитывать взаимодействие звеньев, согласованность
их движения. В молекулярной физике системы, поведение
которых существенно зависит от взаимодействия составляющих
элементов, называются кооперативными; процессы, зависящие от
таких взаимодействий, называются кооперативными процессами.
Таким образом, макромолекула является поворотно-изомерной
кооперативной системой.
Как же подойти к рассмотрению свойств кооперативной
системы? Задолго до создания современной физики макромолекул
экспериментально и теоретически изучались кооперативные
процессы— фазовые переходы. К ним относятся: кристаллизация
жидкостей и плавление кристаллов, переходы двойных сплавов
(например, меди с цинком) из неупорядоченного в
упорядоченное состояние, переходы ферромагнитных материалов
(например, железа) из ферромагнитного в парамагнитное состояние
и т. д. Надо сказать, что, располагая общей термодинамической
теорией фазовых переходов, физика пока что не решила задачи
их полного молекулярного истолкования на основе
статистической механики [11, 12]. До сих пор нет, например,
количественной молекулярной теории плавления кристаллов. Как же быть
с полимерами? Ведь их строение гораздо более сложно, чем
строение простого кристалла — скажем, каменной соли NaCl.
Упрощающим обстоятельством является линейное строение
полимерной цепи. В макромолекуле наиболее сильные
валентные связи расположены в виде линейной последовательности.
МАКРОМОЛЕКУЛА —КООПЕРАТИВНАЯ СИСТЕМА 163
В этом смысле цепь одномерна. В то же время в кристалле
NaCl от каждого иона исходит 6 одинаково прочных связей
по всем трем направлениям в пространстве. Кристалл —
трехмерен.
Важнейшие успехи теоретической физики достигнуты
нахождением связей между явлениями на первый взгляд весьма
далекими друг от друга. Например, установление связи между
теорией теплоемкости твердых тел и рассеяния света этими
телами (Мандельштам) сыграло большую роль в развитии
молекулярной физики. Излагая здесь физику макромолекул, мы
руководствуемся тем же методом. Оказывается, что понимание
природы высокоэластичности каучука позволяет понять, почему
из сваренного яйца уже никогда не выведется цыпленок.
Понять, что и как происходит с белком при его денатурации. Эти
совершенно различные явления имеют в некотором смысле
слова общую причину — они определяются изменениями конфор-
маций макромолекул.
В построении современной статистической теории
макромолекул использована идея, первоначально предложенная для
теории ферромагнетизма.
Способность железа намагничиваться объясняется поведением
его электронов. Каждый электрон представляет собой
магнитик, он обладает магнитным моментом — спином. Можно,
следовательно, изобразить электрон стрелкой. Под действием
магнитного поля электронные магнитики поворачиваются — спины
ориентируются в определенную сторону. Но в ферромагнитном
материале, в железе, электронные спины, кроме того,
взаимодействуют друг с другом таким образом, что параллельное
расположение соседних спинов оказывается более выгодным, т. е.
характеризующимся меньшей энергией, чем антипараллельное
расположение. Поэтому железо может быть намагниченным и в
отсутствие магнитного поля, в результате параллельной
установки спиновых магнитиков.
В 1925 г. Изинг предложил одномерную модель
ферромагнетика, состоящую из последовательности стрелок, смотрящих
вправо или влево, причем две соседние параллельные стрелки
имеют энергию, отличную от энергии двух соседних
антипараллельных стрелок [13]. Такая модель совершенно аналогична
приведенной на рис. 60 модели одномерной полимерной цепи.
Очевидно, что модель Изинга кооперативна — энергия каждого
звена зависит от ориентации соседних звеньев. Тем самым мы
имеем дело со своеобразной цепью Маркова. Оказывается, что
статистический метод решения соответствующих задач,
развитый в дальнейшем Крамерсом и Ваннье [2, 10, 14, 15], с
особенным успехом применим именно в физике макромолекул.
И*
164
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
Выше проблема высокоэластичности была рассмотрена качественно.
Проведем теперь количественный расчет растяжения одномерной цепи внешней
силой.
Пусть энергия двух соседних параллельных звеньев, т. е. энергия /-кон-
формации звена, равна — 8, энергия двух соседних антипараллельных звеньев,
т. е. энергия s-конформации звена, равна 8. Следовательно, разность энергий
двух поворотных изомеров равна
А£ = е — (— е) = 2е. т. е. е = —н~.
Это условие можно записать в виде
( — гор?, если / = / 4- 1,
£И о/ если i + jXl. (422)
Здесь Oi — о$ — 1, если звено смотрит вправо, а* = о$ — —1, если звено
смотрит влево, /, / — номера звеньев. Энергия равна нулю, когда звенья не
соседние, при i=f=\ + 1. Если на систему действует внешняя сила /,
направленная слева направо, то каждая стрелка приобретает дополнительную
энергию
Ef= — ifop (4.23)
где / — длина стрелки, т. е. длина звена, поворачиваемого силой. В самом
деле, потенциальная энергия стрелки в поле внешней силы равна
Ef=—lf cos (U /),
где cos (l*f)—косинус угла между направлением стрелки и направлением
силы. В нашем случае стрелка может иметь только два направления,
отвечающие углам 0° (<Jj = 1) и 180° (o"j = —1). Поворот каждой стрелки в
модели рис. 60 влечет за собой изменение состояния ее соседей, кооперативное
изменение их конформаций. Повернем, например, пятую стрелку справа на
рис. 60, а. При этом изменится конформация и четвертого звена — произойдет
переход от ttsststsst к ttsssttsst, в результате которого цепь удлинится.
Вычислим теперь статистическую сумму рассматриваемой системы
Q = ^e-Erlk\ (4.24)
Т
Статистическая физика показывает, что любые равновесные свойства системы
могут быть вычислены, если известна ее статистическая сумма (см.,
например, [16]). Так, энергия системы в целом выражается в общем случае
формулой
Ш=кТ>*Ш, (4.25)
а длина цепи, т. е. алгебраическая сумма длин всех стрелок,
h=kT^-. (4.26)
В нашем случае число состояний системы равно 2N, так как каждая
из N стрелок может иметь две ориентации — вправо и влево.
Статистическая сумма имеет вид
(N-\ N \
ТтЪ°М+1+ТгЪ°Н- (427)
j 2 _ _ — ;=i ;=i /
МАКРОМОЛЕКУЛА - КООПЕРАТИВНАЯ СИСТЕМА
165
В каждой сумме по два члена, соответствующих правой и левой ориентации
стрелки — Oj= ± 1. Как же вычислить это выражение при больших
значениях N7
Для расчета удобно ввести дополнительное взаимодействие между
первой и последней стрелкой wNo. (т. е. а.. = аЛ что физически
эквивалентно замыканию линейной модели в кольцо. При N ^> 1 это не вносит
практической ошибки. Тогда Q можно переписать в виде
j=jy
<?= 2 2-2 Upl°J-°J+i)>
Oj=± 1 02=± 1
oN=±l У-l
где
Р (oj, oj+l) = ехр {-j—ojaJ+ г + -ф- ojj.
(4.28)
(4.29)
Величина Я(а/, Qj+i) может принимать четыре значения соответственно
четырем случаям:
oj = aj+i = 1; oj = 1, Oj+l = — 1; oj = — 1, oJ+l= 1; Oj = oJ+l = — 1.
Следовательно, можно рассматривать (4.29) как элементы матрицы второго
ранга
/Г>/1 1\ D/1 1\ \
(4.30)
/Я(1, 1) />(1. -1)
\Р(-Ь
1.-D \
-1.-1)/'
1) Р(
Можно без труда показать, что сумма (4.28) равна следу матрицы Р,
возведенной в N-ю степень. Следом матрицы называется сумма ее диагональных
членов; она обозначается символом Sp:
Q = Sp(PNl (4.31)
След матрицы не меняется при ее преобразовании к диагональной форме
(см., например, [17]). Имеем в такой форме
р*=
%г о
N
X? 0
(4.32)
и
0 V V0 ^
SpP^-lf+jg, (4.33)
где Я,,, %2 — корни матрицы, которые находятся путем решения уравнения
Р(\. \)-% Р(\, -1)
Р(—1, 1) Р(—1, — 1) — Я
= 0,
(4.34)
или. в явном виде,
е"+Ь — % е-а+ь
,-а-Ь
(р-Ь — %
= 0,
(4.35)
где
_ е //
Уравнение (4.35) есть квадратное уравнение
1? - X (еа+ь + еа~ ь) + е2а - е~2а = 0.
(4.36)
166 ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
Его корни
Xl=eachb + (e2a sh2 b + e~2af\
X2=eachb- (<?a sh2 b + е-2а)4'. (4.37)
Напомним читателю, что гиперболические косинус и синус равны
ch Ь = ^ , sh b «= л *
е ^
Корень А,, больше %2- При больших N можно поэтому пренебречь ц[ по
сравнению с Я^, и мы получаем
Q ~ ^ = [*" ch* + G?2fl sh2a + *-2fl)V*r. (4.38)
Длина нашей модели
А = kT AlZLO. _ NkT H£b. = jv /sh* . (4.39)
Таким образом, путем весьма изящных расчетов удается полностью
решить статистическую задачу для кооперативной одномерной системы
звеньев. Мерой кооперативности, мерой взаимодействия является величина е,
т. е. разность энергий поворотных изомеров Д£. При £->0, Д£->0 и,
следовательно, а->0
h -> N1 th b = N1 th -^r. (4.40)
Иными словами, при свободном внутреннем вращении, в отсутствие
поворотной изомерии длина цепи тем больше, чем больше сила и чем ниже
температура. Напротив, при очень большой разности энергий поворотных
изомеров А£. т. е. при большой жесткости цепи, отвечающей условию А£ ^> kT
и. следовательно, а ^> 1, можно пренебречь в (4.39) величиной е~Аа, и мы
получаем _
h = Nl (4.41)
независимо от действующей силы. Цепь жесткая и поэтому вытянута. Тот же
результат получается, очевидно, при больших силах, т. е. при // ^> kT,
Здесь также sh2 Ь ^> е~Аа\ большая сила полностью растягивает цепь.
При малых силах, т. е. при // <^ kTt можно разложить sh b в ряд:
sh b = я ^ —■ ■ я «*<li
и из (4.39) следует, что при свободном вращении; когда а = 0:
h^Nlb=Nl2^rf (4.42)
или _
f-kT-^
' N1**
т. е. длина цепи пропорциональна растягивающей силе (закон Гука); модуль
упругости пропорционален абсолютной температуре, в согласии с
термодинамическими свойствами каучука (стр. 149). Кооперативность, отличие а, т. е.
Д£, от нуля, вносит определенную поправку.
КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ 167
а
Одномерная модель Изинга оказалась неадекватной
ферромагнетику, специфические свойства которого удается объяснить
лишь на основе трехмерной модели. Расчеты для последней
связаны с чрезвычайными математическими трудностями; не
удается получить Q в строгой аналитической форме (см. [2, 14, 15]).
Напротив, при исследовании кооперативных свойств
макромолекул метод расчета, основанный на применении одномерной
модели, оказался необычайно плодотворным. Впервые этот
метод был применен к макромолекулам синтетических полимеров
в работе [5] (см. также [2] и [10]) и к молекулам белков и
нуклеиновых кислот в работах, изложенных в гл. 5 и 6. Дело в том,
что макромолекула действительно линейна в смысле
выделенных преимущественных взаимодействий атомов вдоль
линейной цепи.
Реальные макромолекулы, конечно, закручиваются в
трехмерном пространстве. Трехмерным является и любой образец
каучука, подвергающийся растяжению. Тем не менее теория
растяжения, основанная на одномерной модели Изинга и
учитывающая одновременно конформации звеньев в трех измерениях,
дает хорошее согласие с опытом. Те же теоретические
соображения позволяют обосновать методы расчета физических
характеристик макромолекул в растворе — их размеров, формы, ди-
иольных моментов, анизотропных оптических поляризуемостей.
Поворотно-изомерная теория макромолекул, учитывающая
кооперативное™ конформации и пользующаяся полуэмпирическим
методом нахождения конформации, дает прекрасное согласие
с опытом и физическое объяснение ряда явлений [2, 10].
КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ
Синтетические полимеры обычно существуют в аморфном
состоянии — стеклообразном (пластмассы), пластическом и
высокоэластичном (каучуки). Имеются, однако, и
кристаллические полимеры, и это очень важно. Дело в том, что ткани, в
которые одеваются и одевались люди, состоят из кристаллических
полимеров — природных, а теперь и синтетических волокон.
Развивается техника, меняются моды, но кристаллические, волокно-
образующие полимеры по-прежнему незаменимы. Шерсть и
шелк — природные белковые волокна, современные капрон и
нейлон — волокна синтетические. Кристалличность таких
материалов доказывается всеми их свойствами. Они имеют
сравнительно узкий интервал температур плавления, они анизотропны.
Кристалличность этих материалов подтверждена
рентгенографически.
&
168
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
В отличие от обычных низкомолекулярных веществ,
синтетические полимеры, как правило, кристаллизуются не нацело.
В веществе имеется и аморфный и кристаллический материал.
Это объясняется двумя причинами. Во-первых, как уже
указывалось, синтетические полимеры неоднородны—содержат
макромолекулы разной длины, разного стереохимического строения
и т. д. Естественно, что система, состоящая из таких
разнородных объектов, не может вся целиком образовать регулярную
кристаллическую решетку. В такую решетку уложатся только
сходные макромолекулы или их сходные части. Во-вторых, для
того, чтобы образовать кристалл, макромолекулы должны
переориентироваться, изменить свое расположение. Для этого
необходимо множество поворотов в звеньях цепей, т. е. эти звенья
должны преодолеть соответствующие энергетические барьеры
внутреннего вращения. Это требует времени, тем большего, чем
ниже температура. Значит, вторая причина неполной
кристаллизации имеет кинетическую природу — при температуре
кристаллизации цепи просто не успевают уложиться в кристаллическую
решетку за обозримое время. Действительно, прогрев полимера
или его набухание в низкомолекулярном растворителе
облегчают кристаллизацию, увеличивают степень кристалличности.
Чем более регулярно строение макромолекул, тем легче они
кристаллизуются. Так изотактический полистирол кристалличен,
образует волокна, в то время как обычный атактический
полистирол аморфен и представляет собой стекловидную пластмассу.
Кристаллическое строение характерно для
волокон.Макромолекулы в волокне уложены регулярно, ориентированы
определенным образом, обычно так, что цепи лежат параллельно
оси волокна. Именно этим объясняется большая анизотропия
волокон. Волокно является ориентированным полимерным
поликристаллом. В то же время ряд полимеров образует и
монокристаллы— при кристаллизации из раствора. Изучены
монокристаллы полиэтилена, «-каучука, целлюлозы и т. д.
Белки гомогенны — образец данного белка состоит из
одинаковых молекул. Поэтому очень многие белки кристаллизуются.
Множество ферментов получено в кристаллическом виде [18],
Но значение кристаллических полимеров для молекулярной
биофизики определяется не этим. Кристаллизация полимеров —
есть образование некоторой регулярной надмолекулярной
структуры, состоящей из макромолекул. Надмолекулярные
структуры в клетках — их мембраны и органоиды также имеют
регулярное строение. Разница между обычными полимерными
кристаллами и биологическими надмолекулярными структурами
состоит в том, что последние содержат комплексы различных
биополимеров — нуклеопротеиды в хромосомах, липопротеиды
КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ
169
в клеточных мембранах и т. д. Теория надмолекулярных
структур пока не создана, наши знания о них далеко недостаточны.
Можно думать, однако, что путь к изучению этих структур
проходит через теоретическое и экспериментальное
исследование кристаллических полимеров.
Строение ряда полимерных кристаллов хорошо изучено ме-*
тодами реитгено- и электронографии. На рис. 62 показано
строение кристаллической решетки полиэтилена. Ясно, что в
кристалле макромолекулы фигурируют уже не в форме
беспорядочно закрученного клубка, но в определенной, регулярной
конформации. Так, макромолекулы полиэтилена в кристалле
Рис. 62. Строение кристаллической решетки полиэтилена.
являются транс-цепочками (см. рис. 59). Иными словами, при
кристаллизации фиксируется один определенный поворотный
изомер, а остальные конформации оказываются исключенными.
В кристаллическом полиэтилене это транс-изомер, но чаще
приходится иметь дело со свернутыми поворотными
изомерами — в этом случае цепь кристаллизуется в виде спирали. На
рис. 63 показана кристаллическая конформация цепи изотак-
тического полистирола. Это — тройная спираль с поворотными
изомерами, характеризуемыми углами <pi = 0° и ф2=120° пово*
ротов соответственно вокруг связей CHR — СНг и СНг— CHR.
Далее мы увидим, как важна спиральная структура
биополимеров— белков и нуклеиновых кислот (гл. 5 и 6).
Фиксация определенного поворотного изомера у всех звеньев
цепи, находящейся в кристаллическом состоянии, обеспечивает
дальний порядок в кристалле. Зная положение атомов данного
170
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
мономерного звена, можно указать такие положения для сколь
угодно удаленных звеньев, так как расположение атомов строго
периодично. В то же время, конечно, имеется определенный
порядок в расположении соседних звеньев — ближний
порядок. При переходе к расплаву или раствору полимера
дальний порядок исчезает в результате поворотной изомеризации.
Напротив, элементы ближнего порядка должны сохраняться.
В этом смысле плавление полимерного кристалла или его
растворение аналогичны плавлению обычного низкомолекулярного
кристалла. В образовавшейся жидкости
исчезает дальний порядок, но атомы или
молекулы, соседние с данным атомом
или молекулой, расположены почти так
же, как в кристалле — в жидкости
имеется ближний порядок.
Современная теория жидкостей
основывается на этих представлениях о
квазикристаллическом их строении,
впервые введенных Френкелем [19]. Исходя
из указанной идеи о ближнем порядке
в макромолекулах, Птицын и Шаронов
предложили метод определения
поворотных изомеров, их
характеристических углов <рг- для отдельных
макромолекул [20] (см. также [2, 10]). Метод
рентгеноструктурного анализа позво-
Рис. 63. Конформация ляет определить конформацию макромо-
изотактического полисти- лекулы в кристалле, найти углы <р* для
рола в кристалле. избранных кристаллизации поворотных
изомеров.
К некристаллическим системам этот метод неприменим, и
поэтому приходится находить конформации другим способом.
Птицын и Шаронов предположили, что наиболее
устойчивому поворотному изомеру мономерного звена в растворе
полимера соответствует тот же набор углов, что и в кристалле.
Точно установлено, что именно так обстоит дело для малых
молекул, например, «-бутан кристаллизуется в форме
транс-изомера и этому же изомеру отвечает наименьшая энергия в газе
и жидкости. Это в особенности справедливо для неполярных
веществ, у которых сравнительно слабы силы
межмолекулярного взаимодействия. Если потенциал внутреннего вращения
симметричен, то существует несколько поворотных изомеров с
одинаковой энергией. Так, в полимере типа
—CHg—CR^—CHg—CR^—
КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ 171
Потенциал не зависит от того, происходят ли повороты вокруг
единичных связей по или против часовой стрелки, т. е.
^(«Pi. Фг) = ^(— <Pi> —Фа)»
где ф1 — угол поворота вокруг связи СН2 — CR2, фг — вокруг
CR2—СН2. Одновременно справедливы равенства
^(<Pi, Ф2) = ^(ф2> <Pi) = ^(—Ф* — Ф1>.
гак как две связи, о которых идет речь, одинаковы. Если в
кристалле реализуется единственный изомер (фь фг), то в растворе
наряду с ним должны фигурировать изомеры (ф2, фО, (—фь
—Ф2), (—фг, —фО с той же энергией. Значения фь фг найдены
рентгенографически. Следовательно, известен весь набор
поворотных изомеров и можно рассчитать характеристики
макромолекулы в растворе. Таким способом получено прекрасное
согласие с опытом, например для полиизобутилена, в котором
R = CH3. Здесь ф1=ф2=82°. Расчет и опыт дают
(?)*=1.8®*.
•где А0—величина, отвечающая свободному внутреннему
вращению.
На этой основе успешно определяются и предсказываются
характеристики ряда макромолекул, в том числе стереорегуляр-
ных — изо- и синдиотактических (см. [2, 10]). Однако, как уже
указывалось, во многих случаях необходимо непосредственно
учитывать кооперативность внутренних вращений, корреляцию
внутренних поворотов в соседних звеньях. Детальные расчеты,
проведенные для малых молекул, в частности для «-бутана,
показывают, что необходимо иметь представление не о кривой
£/(ф), а поверхности £/(<рь фг, ...) [21]. В «-бутане имеются
три угла внутреннего вращения: ф — угол поворота вокруг
связи —СНг — СНг— и ф1 = фг — углы поворотов вокруг связей
Н3С—СН2—. Функция £/(ф, ф!=фг) имеет минимумы при ф=0°,
Ф1 = ф2=±120° и при ф=ф1 = ф2=±120°.
Корреляция поворотов в соседних звеньях изменяет длину
цепи. Расчет дает
Ь2 = е-*и'кт(Щм=0, (4.43)
где (в простейшем случае двух эквивалентных изомеров)
Д£/=£/[(ф, ф), (ф, <р)]_£/[(<р, <р), (_<р, _<р)].
Первая и вторая круглые скобки относятся к двум соседним
мономерам.
172
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
Для цепей, кристаллизующихся в спиральной
конформации, последовательность одинаковых поворотных изомеров
более выгодна, чем последовательность разных поворотных
изомеров. В этом случае
^[(ф> ф)> (ф> ф)] < ^[(ф> Ф)> (—Ф. — Ф)]
и Д£/<0. Значит, корреляция удлиняет цепь, т. е. делает ее
более жесткой.
Величины AU могут быть найдены путем теоретического
расчета. В простейшем полимере — полиэтилене мы имеем дело
с двумя углами поворота <pi и <рг в соседних мономерах. Расчет
показывает, что устойчивы следующие конформации: ф! = ф2=0°
(//); ф1=0°, ф2=±120° (ts); ф2=0°, ф1 = ±120° (5/); ф1=±120°,
ф2=±120 (ss). Конформация ф1 = 120°, щ=—120° (s+s~)
энергетически невыгодна [22]. В этом случае в конформациях ts и st
фигурируют неэквивалентные поворотные изомеры и учет
корреляции несколько более сложен, чем по формуле (4.43).
Значения AU для // и st равны нулю, для ts и ss 0,5 ккал/моль, для
s+s~—2,3—2,7 ккал/моль. Расчет дает
/Г2=3,2А?
в прекрасном согласии с опытом [23, 10]. Хорошие результаты
получаются и в других случаях вычислений размеров, диполь-
ных моментов, оптических анизотропии макромолекул [10].
Таким образом, представление о сохранении ближнего
кристаллического порядка в свободной полимерной цепи доказано.
Кооперативность внутренних вращений как раз и находит свое
выражение в ближнем порядке.
Вернемся к полимерным кристаллам. Кристаллизация
полимера есть, стало быть, конформационное превращение
макромолекул— отбор определенного поворотного изомера. Напротив,
плавление полимерного кристалла есть поворотная
изомеризация — переход от единственного поворотного изомера к их
статистической смеси, переход от регулярной конформации
макромолекулы в целом к клубку.
Общий характер условий, определяющих плавление
полимерных кристаллов, может быть найден опять-таки на основе
поворотно-изомерной теории. Термодинамика дает следующее
условие плавления (стр. 22):
Тпя = ^-, (4-44)
т. е. температура плавления тем выше, чем больше выигрыш
энергии (энтальпии) при кристаллизации и чем меньше про-
КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ
173
игрыш в энтропии. АН есть, очевидно, теплота плавления
кристалла. Это вполне универсальное выражение для любых
веществ.
Ясно, что температура плавления кристаллического полимера
должна зависеть от гибкости макромолекул, т. е. от числа
поворотных изомеров и разностей их энергий. Так как в
кристаллическом состоянии все цепи находятся в одной определенной
конформации, отвечающей, скажем, транс-изомеру, то изменение
энтальпии при плавлении равно ее изменению в результате
перехода от транс-изомера к смеси поворотных изомеров и тем
самым АН связана с АЕ — разностью энергий поворотных
изомеров.
Энтропия AS при плавлении увеличивается, так как
возникает смесь поворотных изомеров, появляется энтропия смешения
и дополнительная энтропия, определяемая увеличением энергии
поворотных изомеров.
Чем больше конформации имеет звено, т. е. чем более гибка
макромолекула [2], тем ниже температура плавления полимера.
Строгая теория, развитая Флори, учитывает, кроме того,
межмолекулярную энтропию, т. е. различные расположения
макромолекул в кристаллическом и расплавленном полимере [24].
Основной физический результат от этого не меняется. Чем более
гибки макромолекулы, чем выгоднее их поворотная
изомеризация, тем ниже температура плавления полимера. Для того
чтобы гибкие макромолекулы закристаллизовались, необходимо
межмолекулярное притяжение. Напротив, жесткие
макромолекулы должны кристаллизоваться, образовывать упорядоченные
структуры, даже если энергия их межмолекулярного
взаимодействия равна нулю. В самом деле, попробуем заполнить
некоторый объем жесткими палочками. Ясно, что их наиболее
выгодное расположение, отвечающее наибольшей плотности, будет
параллельным — они уложатся, как спички в спичечной коробке,
несмотря на отсутствие каких-либо сил притяжения между ними.
Но тогда очевидно, что и не вполне жесткие макромолекулы,
т. е. цепи, обладающие ограниченной гибкостью, также должны
укладываться не беспорядочно, а согласованно друг с другом.
Макромолекулы с ограниченной гибкостью при Т<Тпл
образуют кристаллы, а при Т>Тпл структуру, частично
упорядоченную, но в целом аморфную. Каргин, Китайгородский и
Слонимский [25] провели качественное рассмотрение таких структур,
названных ими пачками. Недавно Ди Марцио исследовал эту
проблему возникновения упорядоченности в совокупности
макромолекул количественно, на основе статистической теории [26].
Он показал, что наличие межмолекулярной упорядоченности
и ее изменений при растяжении полимера должно влиять на
174
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
зависимость напряжения от деформации, что, по-видимому,
наблюдается на опыте (см. также [27]).
Затронутые здесь проблемы очень важны для молекулярной
биофизики. Мы видим, что макромолекулы по самому
характеру своего строения — вследствие высокомолекулярное™ цепей
и ограниченной их гибкости, должны образовывать
упорядоченные надмолекулярные структуры типа кристаллических или
пачечных. Каргин наблюдал такие структуры у многих полимеров
методом электронной микроскопии [28]. В синтетических
полимерах упорядоченности мешает неоднородность их размеров и
строения. Но клетка «печатает» свои белковые «тексты» во
многих тождественных экземплярах.
Как мы увидим, макромолекулы белков (а также ДНК)
достаточно жестки — по специальным причинам, о которых будет
сказано в гл. 5 и 6. Поэтому возникновение высокоупорядочен-
ных надмолекулярных структур в органоидах и мембранах
клетки в значительной мере определяется макромолекулярным
строением биологических молекул. Мы пока что не располагаем
строгой количественной теорией, позволяющей предсказывать
строение и свойства надмолекулярных структур на основе
сведений о строении отдельных макромолекул. Создание такой
теории, объясняющей термодинамику и кинетику возникновения
подобных структур, — актуальная задача физики полимеров и
молекулярной биофизики. Бернал рассматривает
автоматическое сложение надмолекулярной структуры из идентичных
макромолекул как одно из необходимых условий жизни [29, 30].
Наличие упорядоченных структур необходимо для регулированного
выполнения любых функций белков, нуклеиновых кислот,
углеводов, липидов и их комплексов. В этом одна из причин
правильной работы клетки — ее способности синтезировать
множество идентичных молекул.
Очевидно, что исследование упорядоченности в
синтетических полимерах — объектах, во многих отношениях более
простых, чем биополимеры, позволяет разумно подойти и к
исследованию биологических надмолекулярных структур. В частности,
выяснение роли конформаций, влияния гибкости макромолекул
на упорядоченность является важным шагом вперед в решении
этих очень трудных проблем молекулярной биофизики.
МЕТОДЫ ИССЛЕДОВАНИЯ МАКРОМОЛЕКУЛ В РАСТВОРЕ
Сведения о строении отдельных макромолекул получаются
путем исследования их свойств в растворах физическими
методами. Эти методы применяются для любых макромолекул— как
синтетических, так и биологических. Что же они дают? Приве-
МЕТОДЫ ИССЛЕДОВАНИЯ МАКРОМОЛЕКУЛ В РАСТВОРЕ 175
дем перечень устанавливаемых этими методами основных
физических характеристик:
1) молекулярный вес и тем самым степень полимеризации;
2) размеры макромолекулы и тем самым ее
термодинамическая гибкость;
3) форма макромолекулы;
4) оптическая анизотропия макромолекулы;
5) электрический дипольный момент;
6) степень ионизации — для тех макромолекул, которые
способны нести электрические заряды (см. следующий параграф).
Этим дело не исчерпывается, но перечисленные
характеристики наиболее важны. Здесь приводится краткое описание
физических методов и информации, получаемой с их помощью.
Более подробные сведения читатель найдет в книгах [31—37].
Наилучший метод определения молекулярных весов
полимеров— седиментация в ультрацентрифуге. Идея метода, впервые
созданного шведским ученым Сведбергом, проста.
Кювета с раствором полимера подвергается очень быстрому
вращению — в современных ультрацентрифугах скорости вра-*
щения достигают 60 000 оборотов в минуту и более. Молекулы
растворенного полимера, гораздо более тяжелые, чем молекулы
растворителя, смещаются в направлении от оси вращения к
периферии— к дну кюветы. Это смещение регистрируется
оптическими методами — по изменению показателя преломления или
поглощения раствора. Скорость смещения (скорость
седиментации) пропорциональна скорости вращения и молекулярному
весу М и обратно пропорциональна коэффициенту трения q
макромолекул о среду:
где со — угловая скорость вращения, т. е. 2rcv, v — число
оборотов в секунду, х радиус вращения, т. е. расстояние от оси
вращения ротора ультрацентрифуги до движущейся границы
оседающего полимера. Множитель а — архимедов фактор,
выражающий то обстоятельство, что макромолекула, погруженная
в жидкий раствор, теряет в своем весе столько, сколько весит
вытесненная ею жидкость:
а=\— Vp, (4.46)
где р — плотность растворителя, V— 1/р' — удельный объем
полимера, т. е. величина, обратная его плотности. Очевидно, что
соотношение (4.45), переписанное в виде
176
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
выражает равенство центробежной силы и силы трения, т. е.
условие некоторого стационарного режима. Обычно
определяется константа седиментации
Размерность S — время; S принято выражать в специальных
единицах — сведбергах; 1 сведберг—10~13 сек.
Зная vy со, х, определяем S, зная S, р, р' и qt находим
молекулярный вес полимера М. Плотности р и р' измеряются
независимо, обычными способами. Константа трения q зависит от
размеров и формы макромолекулы.
Чтобы найти <7» необходимо измерить коэффициент диффузии
полимера D в том же растворителе. Диффузия подчиняется
закону Эйнштейна
D = -f. (4.48)
Следовательно,
В случае синтетических полимеров М — некоторый средний
молекулярный вес, в случае белков — истинный вес макромолекул.
Другие абсолютные методы измерения молекулярного веса — осмометрия
и рассеяние света. В идеальных разбавленных растворах осмотическое
давление выражается законом Вант-Гоффа
я = ^ с, (450)
где с — весовая концентрация растворенного вещества. Растворы полимеров
(в том числе и биополимеров) всегда неидеальны. В этом случае
я=4гс+*с2+Ссз+ •■• (4-51)
или
JL = /V. + Bc + C<*+ ... (4.52)
Коэффициенты В, С,... (второй, третий и т. д. — вириальные коэффициенты);
зависят от взаимодействия макромолекул с молекулами растворителя. Обычно
для разбавленных растворов Сс2<^Вс. Это значит, что, строя график
зависимости л/с от с, мы получим линию, отсекающую по оси ординат отрезок,
равный RT/M, Наклон кривой определяет В (рис. 64). Из RT/M находим М.
Седиментационный метод применим для полимеров с большими
молекулярными весами, начиная с десятков тысяч. Напротив, точность осмометриче-
ского метода падает с ростом молекулярного веса. Тем не менее примерно
до 300 000 он еще применим.
МЕТОДЫ ИССЛЕДОВАНИЯ МАКРОМОЛЕКУЛ В РАСТВОРЕ
177
Рассеяние света — важнейшее явление молекулярной оптики,
исследование которого дает очень ценную и разнообразную информацию о строении и
свойствах молекул рассеивающего вещества [35]. Свет рассеивается данным
объемом газа или жидкости по всем направлениям, так как любая среда
неоднородна, в ней имеются случайные уплотнения и разрежения —
статистические флуктуации плотности, а также флуктуации ориентации молекул.
В растворах имеются флуктуации
концентрации. Вследствие того, что свет,
проходящий через вещественную среду,
рассеивается, его интенсивность
уменьшается по закону.
/-V**
(453)
где /о — интенсивность падающего света,
х—путь, проделанный светом в
рассеивающей среде, h — коэффициент экстинк-
ции, характеризующий мутность среды.
Для молекул, размеры которых
значительно меньше длины волны света А,
теория дает
128л:5
А-ТХГ*1*,. (454)
20 , JO
с, г/л
Рис. 64 Зависимость я/с от с для
полиметилметакрилата.
/) в хлороформе; 2) в тетрагидрофуране;
3) в диэтилкетоне.
где N] — число молекул в единице
объема, а—поляризуемость молекулы. Свет
рассеивается нязкомолекулярной средой
тем сильнее, чем меньше длина волны,
по закону Аг4, Именно поэтому небо
голубое — атмосфера преимущественно
рассеивает короткие волны. Красный цвет Солнца на закате и восходе
объясняется тем же—при прохождении косых лучей через большую
толщу атмосферы сильнее всего ослабляются коротковолновые синие и
зеленые лучи.
В газе поляризуемость а просто связана с показателем преломления я:
а =
л-1
2яАГ,
(455)
Следовательно, (454) можно переписать в виде
. 32я3 (п— 1)2
Если известны показатель преломления п и плотность р газа, то, измерив h
мы находим Ni и, следовательно, М молекул, так как ' '
Na—число Авогадро.
В растворах рассеяние происходит на флуктуациях концентрации.
Выражение для коэффициента экстинкции имеет в этом случае вид
h =
32я3 nt(n-noy
3V 7Г} ' С457)
где п — показатель преломления раствора, я0 — растворителя, N} — число,
}2 М. В. Волькенштейц
178 ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
растворенных частиц в 1 см*. Вводя весовую концентрацию с раствора
в г*см~\ получаем, вследствие того, что N\M=cNA\
нт=-м> <4-58>
где
32я2 nl /п — пЛ2
Это справедливо для идеальных разбавленных растворов. Для неидеального
раствора (ср. сказанное об осмотическом давлении)
где В — тот же второй вириальный коэффициент.
Вычислив Я с помощью измеренных значений ntnQtc и определив h
непосредственно из опыта, строим график зависимости H~~jr от с и находим
-7J- и В так же, как в осмометрическом методе. Точность результатов,
полученных по методу светорассеяния, растет с молекулярным весом.
Наконец, простейшим, но не абсолютным методом
определения М полимера является измерение вязкости раствора. При
малых концентрациях удельная вязкость раствора равна
Л8Р = Л^. (4.61)
где ?i — вязкость раствора, цо—растворителя, ц тем больше,
чем больше с. Характеристическая вязкость
[г,] = Нш (-1), (4.62)
как показывают теория и опыт, непосредственно зависит от
молекулярного веса
[ц] = КМа. (4.63)
Величина а, лежащая в пределах от 0,5 до 2,0, зависит от
формы макромолекул: а = 0 отвечало бы твердой сфере, а=2 —
жесткой палочке. Ясно, что для нахождения М по значению [rj]
нужно знать а и /С. Эти величины определяются путем
независимых измерений молекулярных весов полимеров данного сорта
вышеописанными абсолютными методами. Если а и К известны,
го можно просто определить М для других образцов полимера
того же сорта и в том же растворителе. Естественно, что
вязкость существенно зависит от растворителя. В плохих
растворителях взаимодействия между звеньями полимерной цепи,
свернутой в клубок, больше, чем между этими звеньями и молеку-
МЕТОДЫ ИССЛЕДОВАНИЯ МАКРОМОЛЕКУЛ Ь РАСТВОРЕ 1?§
лами растворителя. Поэтому увеличивается число контактов
полимер — полимер, и клубок оказывается компактным. В этом
случае а=0,5. Напротив, в хороших растворителях
взаимодействие полимер — растворитель более выгодно, поэтому клубок
набухает в растворителе и раздувается. Для сильно набухших
клубков а=1,0. Ясно, что во втором случае вязкость больше,
чем в первом. По тем же причинам очевидно, что вязкость
должна возрастать при увеличении длины цепи, т. е. при
увеличении М полимера.
Вообще говоря, [ц] тем больше, чем длиннее и чем более
жестки макромолекулы. Ясно, что совокупность жестких
палочек в растворе течет с гораздо большим трением, чем
совокупность сферических частиц.
Размеры макромолекул — статистических клубков или
жестких стержней — также определяются методом светорассеяния.
Но на этот раз измеряется не абсолютная интенсивность
рассеянного света, т. е. А, а зависимость интенсивности рассеяния от
угла наблюдения.
Для малых молекул интенсивность света /о, рассеянного под углом 0
к направлению падающего света, пропорциональна 1 + cos20 и обратно
пропорциональна квадрату расстояния от
рассеивающего объема до точки
наблюдения г2. Угловая зависимость
учитывается отношением Релея
/?g-r2A = _|-(i + cos2 0)A. (4.64)
Для больших молекул, размеры которых
соизмеримы с А, т. е. для
макромолекул, зависимость интенсивности от 0
более сложна. Каждая точка
макромолекулы рассеивает свет с определенной
фазой; сложение (интерференция)
световых волн, рассеянных разными звеньями
макромолекулы, приводит к тому, что
рассеяние света вперед в этом случае
сильнее, чем назад (рис. 65).
Конкретное значение Rq для макромолекул
зависит от их формы. Как показал Дебай,
для статистического клубка интерференция волн, рассеянных его сегментами,
дает отношение Rq к соответствующему значению для малых молекул
§ = />(в)=4г^"2И-1+г")' (4-65)
J\Q Z U
где г—число статистических сегментов длины Ъ (ср. стр. 151), а и равно
/4я 0\2 Ь2
и = l-jr sin -И -g-, (4.66)
А'— длина волны света в растворе.
Рис. 65. Эффект Ми.
В точке Р разность хода
интерферирующих лучей SOP и S'O'P меньше, чем
в точке Р' разность хода SOP' и S'O'P''.
12*
180 ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
Для малых молекул в силу (4,58)
h = HcM,
Не 1
*e _^-(l + cos20)Af
Для макромолекул аналогичное соотношение имеет вид
с
(4.67)
Н
1 +2-А.С+....
RQ MP (0) ' RT
(468)
Фактор рассеяния Р(0) определяется экспериментально по зависимости
интенсивности рассеяния от 0. В свою очередь Я(0) зависит от размеров
макромолекулы
4я sin тг
Рф)=1-
9'
V
"Т" •• • »
(469)
V — длина световой волны в растворе, р — вращательный радиус
макромолекулы. Для палочкообразной молекулы длины L р= —у=-\ для статисти-
ческого клубка р=—*—» где г2 — средний квадратичный радиус клубка.
О Q4 Ц8 12 IS 2,0 2,4 2,8
ъ\л\г^Ф 2000'С
Рис. 66. График Зимма для раствора тринитро-
целлюлозы в ацетоне при 25° С.
Для достаточно больших макромолекул нужно учитывать и следующие
члены разложения (4.68); в этом случае оказывается возможным
определение и размера и формы макромолекулы Зимм предложил графический метод
одновременного определения М и р. По оси ординат откладываем Hc/R$,
по оси абсцисс sin2 o-+c°nst-с. При этом получаем два семейства
параллельных прямых (кривых, если нельзя пренебречь в (469) следующими членами
разложения). Прямые одного семейства изображают зависимости Hc/Rq от с
МЕТОДЫ ИССЛЕДОВАНИЯ МАКРОМОЛЕКУЛ В РАСТВОРЕ 181
при заданных значениях sin2 -^ , прямые другого семейства — зависимости
Hc/Rq от sin2 y при заданных значениях с. На рис. 66 показан график
Зимма для тринитроиеллюлозы в ацетоне [36]. Он дает М = 400 000 и
Y7* = 1500 А. Макромолекула оказывается скрученной более чем в четыре
раза. В самом деле, мономерное звено имеет в этом случае молекулярный
вес 294 и длину 5,15 А. Степень полимеризации, т. е. число звеньев в цепи,
равно 400000:294= 1350. Длина вытянутой цепи равнялась бы 5,15-1350 =
= 6950 А. Степень скрученности 6950 : 150 = 4,6. Это сравнительно жесткая
цепь.
Из сказанного выше о вязкости — величине,
характеризующей гидродинамические свойства молекул, очевидно, что она
также зависит от размеров и формы макромолекул и тем
самым измерение [rj], как функции М, дает сведения о структуре
макромолекул в изучаемом растворе.
Очень тонким и точным способом исследования формы и
оптической анизотропии макромолекул является измерение
двойного лучепреломления раствора полимера в потоке.
Соответствующие методы теории и эксперимента развиты в работах Цвет-
кова и его сотрудников [37]. Это явление (эффект Максвелла,
см. [35]) состоит в следующем: в быстротекущем растворе
полимера макромолекулы определенным образом ориентируются
относительно направления потока. В результате жидкость
становится анизотропной и следовательно двоякопреломляю-
щей. Из величины двойного лучепреломления находится
собственная анизотропия макромолекулы, связанная, в частности,
с ее неодинаковой протяженностью в различных
направлениях— статистический клубок всегда имеет форму боба, а не
горошины.
Ценную информацию о структуре ориентированных
полимеров, а также о размерах и формах макромолекул в растворах
дает изучение рассеяния рентгеновых лучей под малыми
углами (обычно меньше 2°). Применение этого метода особенно
перспективно для биополимеров, макромолекулы которых
сохраняют и в растворах специфические конформации, отличные
от беспорядочных клубков.
Наконец, большие макромолекулы удается наблюдать и
непосредственно в электронном микроскопе.
Все эти методы, а также ряд других дают ценные сведения
о макромолекулах, в частности, макромолекулах белков,
нуклеиновых кислот и других биополимеров. Молекулярная биофи-*
зика унаследовала многое от физики полимеров, и
соответствующие гены еще не подверглись мутированию.
182 гл. 4. физика макромолекул
ПОЛИЭЛЕКТРОЛИТЫ
Специфическими свойствами обладают макромолекулы,
атомы которых способны ионизоваться. Это— полиэлектролиты.
Для молекулярной биофизики они особенно важны, так как и
белки и нуклеиновые кислоты содержат атомные группы,
способные нести положительные и отрицательные заряды.
Биополимеры— полиамфолиты, так как в них имеются и катионные
и анионные группы. Мы видели, что существуют кислотные и
основные аминокислотные остатки в белках. В нуклеиновых
кислотах фосфатные группы — анионные, а атомы азота в
азотистых основаниях могут при соответствующих условиях
заряжаться положительно и играть роль катионов. Биологическая
функциональность биополимеров тесно связана с их
электрохимическими свойствами.
Рассмотрим какой-нибудь простой полиэлектролит, например
полиакриловую кислоту. Ионизованная форма этой
поликислоты имеет вид
сн2 Сн2^ СН2 -^ СН2
У Ч' \./ '^\./ \
с ^с с
н соо- н соо- -оос н
Между одноименно заряженными звеньями цепи действуют
значительные силы электростатического отталкивания. Поэтому
конформации макромолекулы полиэлектролита должны сильно
зависеть от ее зарядки, т. е. от кислотных или основных свойств
среды, характеризуемых концентрацией водородных ионов Н+,
и от ионной силы среды — концентрации любых
низкомолекулярных ионов.
Полиэлектролиты, в том числе белки и нуклеиновые кислоты,
растворяются в воде и в заряженном состоянии проводят
электрический ток. Посмотрим прежде всего, как выражается
концентрация водородных ионов. Воду можно считать и кислотой
и основанием. Строгие физико-химические определения этих
понятий заключаются в том, что кислотой является молекула,
способная отщепить протон, а основанием — молекула,
способная присоединить протон, являющаяся его акцептором (Брен-
стед). Вода выступает как кислота в реакции
Н20 ^ Н+ + ОН"
и как основание в реакции
H20 + H+ ^± Н30+ (ион оксония).
полиэлектролиты
183
Однако вода очень слабый электролит; ее электропроводность
очень мала. Константа диссоциации воды на ионы Н+ и ОН-,
т. е. константа равновесия первой реакции, равна
К= [П+$°щ~] = Ю-14 моля/л.
(4.70)
Так как [Н+]=[ОН~], концентрация водородных ионов в воде
[Н+]=10~7 моля/л. С такими числами работать неудобно,
поэтому обычно пользуются отрицательными десятичными
логарифмами концентраций протонов, обозначаемыми рН. Для воды
pH = -log[H+] = 7.
Приняв воду за эталон электрохимически нейтрального
вещества, мы приходим к выводу, что в кислой среде, содержащей
избыток протонов по сравнению с водой, рН<7, а в щелочной,
в которой протонов меньше, чем в воде, 7<рН<14. Такой
полиэлектролит, как полиакриловая кислота, является в водном
растворе слабым, т. е. малодиссоциированным электролитом —
константа диссоциации группы СООН на СОО" и Н+ равна 10~5.
Можно увеличить степень диссоциации поликислоты, добавляя
в раствор щелочь, скажем, NaOH. Молекулы NaOH в воде
практически полностью диссоциированы на Na+ и ОН", ионы
ОН- соединяются с ионами Н+, образуя воду. Поэтому [Н+]
уменьшается и рН увеличивается. Это вызывает смещение
равновесия в реакции диссоциации кислоты, и в результате в
раствор переходят добавочные ионы Н+, частично компенсируя
тем самым увеличение рН и увеличивая степень диссоциации
кислоты.
Иначе говоря, при добавлении к слабой кислоте сильного
основания получается соль сильного основания и слабой
кислоты, практически целиком диссоциированная. Описанный
процесс представляет собой нейтрализацию кислоты щелочью.
Определяя изменение рН раствора при титровании, можно
найти константу диссоциации кислоты, равную
у_[Н+][А-]
К~ [НА] ' (4-71)
где НА — кислота, А"—анион. Считая соль щелочного металла
и слабой кислоты полностью диссоциированной, можем
написать
"[НАТ = Т^Г' (4-72)
где а — молярная доля добавленной щелочи, т. е. степень
184
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
нейтрализации. Следовательно,
и, логарифмируя, получаем
pH = pK + log147r, (4.73)
где рК = — log /О При титровании рН определяется рядом
методов, на которых мы не будем останавливаться (см. [38]).
Зная а (по количеству добавленной щелочи) и рН, находим рК-
Для слабого основания в уравнении (4.73) в правой части
вместо знака + стоит —.
Простое уравнение (4.73) справедливо для одноосновной
кислоты, содержащей одну ионизуемую группу. Но мы ведь
имеем дело с поликислотой. Очевидно, что заряженная
макромолекула создает вокруг себя значительный электростатический
потенциал, притягивающий ионы Н+ в случае поликислоты и
отталкивающий их в случае полиоснования. Этот потенциал,
естественно, растет с ростом а. Поэтому рост рН с ростом а для
поликислот и уменьшение рН с ростом а для полиоснований
идут более круто, чем для одноосновных электролитов. Кривая
титрования, т. е. зависимость рН от а, определяется
взаимодействием соседних групп в цепи и может быть найдена
теоретически, исходя из рассмотрения макромолекулы полиэлектролита
как кооперативной системы.
Изменение рН и ионной силы раствора могут изменить
размеры макромолекул полиэлектролитов в пять раз и более.
Теория размеров таких макромолекул должна учитывать наряду
с факторами, определяющими размеры обычных макромолекул,
кулоновское взаимодействие заряженных групп, а также ионную
атмосферу, образуемую малыми противоионами около каждого
заряженного атома цепи. Теорией размеров полиэлектролитных
макромолекул занимались многие ученые, среди которых
прежде всего надо назвать Качальского [39, 40]. Птицын предложил
строгую теорию размеров макромолекул полиэлектролитов при
малых степенях ионизации [41] и приближенную теорию,
справедливую при любых степенях ионизации [42]. Теория Птицына
впервые дала хорошее количественное совпадение с опытом и
его полное объяснение. Излагать эту теорию здесь
невозможно— это завело бы читателя слишком далеко.
Одна из трудностей расчетов, относящихся к
полиэлектролитам, связана с необходимостью учета диэлектрических свойств
среды, окружающей макромолекулу. Ведь в выражение для ку-
лоновской силы отталкивания одноименных зарядов в\ и е2у на-
полиэлектролиты
185
ходящихся в вещественной среде, входит ее диэлектрическая
постоянная е:
/— ег2 "
Для воды при комнатной температуре е=80. Значит ли это, что
сила взаимодействия двух заряженных групп макромолекулы
в водном растворе в 80 раз меньше, чем в вакууме? Зная,
какова должна быть теоретическая зависимость кривой
титрования и размеров макромолекулы от е, можно найти эффективные
значения е из экспериментальных данных. Оказывается, что
локальное значение диэлектрической постоянной,
характеризующей взаимодействие между близкими группами, значительно
меньше 80. При расстояниях между группами порядка 4 А
локальная е=20; она становится равной 80 лишь при г=8—10 А.
В области 4—8 А е пропорциональна г-2, а на очень малых
расстояниях, меньших 4 А, быстро убывает как г*3. Уменьшение
локальной е объясняется тем, что между близкими группами
находится очень мало молекул воды.
Из изложенного следует замечательная особенность молекул
полиэлектролитов. Можно изменять размеры этих молекул,
изменяя рН среды. Если эти молекулы образуют, например,
волокно, то изменение зарядки будет сопровождаться удлинением
или укорочением волокна и, следовательно, может произвести
работу. Эта работа выполняется при постоянной температуре и
давлении. Таким образом, химическая энергия (точнее,
электрохимическая) может быть непосредственно превращена в
механическую работу, минуя тепло. О таких механических процессах
рассказано в гл. 9. Забегая вперед, укажем на интересную идею,
которая, естественно, здесь возникает—не сводится ли
мышечная деятельность к механохимии полиэлектролитов? Как бы это
было хорошо — ведь тогда одна из биологических загадок
получила бы сравнительно простое решение!
Обратимся к белкам. Они построены из аминокислот —
слабых кислот или слабых оснований. Мы уже говорили, что
аминокислота должна изображаться не обычной формулой
H2N • CRiRa • СООН,
а формулой диполярного иона
H3N+.CR1R2.COO"-
Чем же это доказывается? Известно, что теплоты реакций
ионизации органических кислот
RCOOH «=£ RCOO" + Н+
186
ГЛ. 4. ФИЗИКА МАКРОМОЛЕКУЛ
составляют величины порядка 1000 кал/моль, а замещенных
ионов аммония
RNH3^-RNH2 + H+
— порядка 12000 кал/моль. Аминокислоты в кислом растворе
характеризуются теплотами ионизации от 1300 до 2100 кал/моль,
в щелочном 10 000—13 000 кал/моль, т. е. идут реакции
H3N • CRjRa • COO" + Н+ +± H3N - CRjRj. СООН
и
H3N • CRjRa • COO" + ОН" «=± H2N • CRjRj ■ COO" + H2(X
Другие доказательства диполярного строения аминокислот
состоят в том, что при их растворении в воде сильно
повышается диэлектрическая постоянная, и в том, что твердые
аминокислоты обладают большой плотностью и высокими 7ПЛ, так
как молекулы в кристалле связаны большими электростатиче-.
скими силами между ( + ) одной и (—) другой молекулы [43].
Вследствие амфотерности аминокислот они характеризуются
двумя константами диссоциации — отвечающими титрованию
кислотой (нейтрализация СОО"-группы) и щелочью
(нейтрализация Н3№"-группы). Приводим таблицу соответствующих
величин.
Таблица 7 [43]
Электрохимические коистаиты алифатических
моиоамииокислот
Аминокислота
рк,
2,35
2,34
2,36
2,21
рк2
9,78
9,87
9,60
9,15
рн*
6,1
6,1
6,0
5,7
В табл. 7 рН| означает рН в изоэлектрической точке. Если
аминокислота заряжена положительно — она движется к катоду,
если отрицательно — к аноду. Изоэлектрическая точка отвечает
нейтральному состоянию амфотерного электролита —
аминокислота остается неподвижной между электродами и не участвует
в электропроводности. Имеем
pHf = -J-(pKi + pKa).
ПОЛИЭЛЕКТРОЛИТЫ
187
То же, естественно, относится и к белкам. Будучи полиамфоли-
тами, они характеризуются изоэлектрическои точкой — важной
константой белковой макромолекулы. Небольшое изменение
аминокислотного состава белка сразу сказывается на его
изоэлектрическои точке — на способности белковых молекул
перемещаться между электродами, опущенными в раствор
(электрофорез). Выше уже говорилось о различии электрофоретических
свойств нормального и мутантных гемоглобинов (стр. 117).
Кривые титрования белков и нуклеиновых кислот дают
ценную информацию об их свойствах. Особенно интересны явления
конформационных превращений в белках, нуклеиновых
кислотах и их синтетических аналогах, вызываемых изменениями рН
(см. стр. 215, 270). Очевидно, что роль ионного окружения
биополимеров очень важна и не может не сказываться на их
биологической функциональности. Ряд примеров таких явлений
встретится в последующих главах.
В заключение укажем на важное практическое значение
синтетических полиэлектролитов. Сшитые поперечными связями
нерастворимые полиэлектролиты, набухающие в воде и других
жидкостях, применяются в качестве ионообменных смол,
называемых ионитами (см. [44]). Иониты оказываются способными
сорбировать определенные ионы из растворов, что находит
применение при очистке и фракционировании различных
электролитов и для очистки неионных веществ от присутствующих
электролитов. Блестящий пример применения ионитов — очистка
антибиотиков, разработанная Самсоновым и Бреслером [45].
С помощью этого метода, широко применяемого в
фармацевтической промышленности, получаются пенициллин, стрептомицин
и другие антибиотики, освобожденные от вредных примесей.
Очевидно, что вопросы ионного обмена важны для
биологии, так как клеточные мембраны в ряде случаев
характеризуются специальной способностью сорбции ионов. То же,
по-видимому, относится и к другим надмолекулярным биологическим
структурам.
Теперь, ознакомившись с некоторыми сведениями о строении
и свойствах макромолекул, а также методами их теоретического
и экспериментального исследования, мы можем вернуться к
биологическим молекулам — прежде всего к белкам.
ГЛАВА 5
ФИЗИКА БЕЛКА
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
Выше говорилось о первичной структуре белка. Но сам этот
термин заставляет думать о наличии вторичной, третичной и т.д.
структур. Действительно, такая иерархия структур присуща
белкам.
В синтетическом полимере последовательность мономерных
звеньев (макромолекулярный «текст») является либо
монотонным, простым повторением одинаковых букв, либо — в
сополимерах— беспорядочным чередованием небольшого числа
(обычно двух) разных букв. И в том и в другом случае нет
специфической первичной структуры, макромолекула не содержит в
этом смысле никакой информации. В то же время
макромолекула имеет некоторую структуру, как целое, правда,
флуктуирующую, но в среднем определенную. Цепь закручена в более
или менее вытянутый клубок, благодаря конформационному
многообразию звеньев, благодаря поворотной изомерии.
В белке первичная структура несет большой запас
информации [1] и является строго определенной. В то же время белок
отличается от простого полимера наличием специфических
групп в аминокислотных остатках, способных образовывать
химические, электростатические, водородные, ван-дер-ваальсовы
связи. Остатки цистеина соединяются друг с другом химически
дисульфидными мостиками S—S. Такими мостиками соединены,
например, две пептидные цепи А и В в молекуле инсулина
(рис. 39). Положительно и отрицательно заряженные группы
вступают друг с другом в электростатическое взаимодействие.
Ван-дер-ваальсовы силы, т. е. обычные межмолекулярные силы,
действуют между любыми, достаточно сблизившимися атомами
и группами атомов — в этом смысле белок не имеет
принципиального отличия от других полимеров. Особую роль играет
водородная связь.
Атомы водорода, входящие в состав гидроксильной группы
ОН, иминной и аминной групп NH, NH2 и некоторых других
групп (но не СН, СН2, СН3), образуют специфические
невалентные связи с другими атомами О и N. Это — водородные связи,
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА 189
обозначенные ниже пунктиром:
-0-Н...О<^, -О-H...N^, ^>N-H...O^
^>N-H ... N^
Наличие водородной связи проявляется в уменьшении
расстояния между атомами О и О, О и N или N и N в указанных
группах. Так, наименьшее расстояние между двумя валентно
несвязанными атомами кислорода равно сумме их ван-дер-ва-
альсовых радиусов, т. е. 1,40-2=2,80А. В группе —О—Н., .О—
это расстояние должно быть больше, а именно должно
равняться сумме длины О—Н связи (около 1 А), ван-дер-ваальсова
радиуса водорода (от 1 до 1,4 А) и такого же радиуса
кислорода (1,4А). В итоге получаем от 3,4 до 3,8А. Между тем при
образовании водородной связи это расстояние уменьшается до
2,7 А, т. е. водород стягивает два атома кислорода. Энергия
водородной связи составляет несколько ккал/моль. Это
значительно меньше, чем энергии обычных химических связей
(порядка 100 ккал/моль), но заметно больше, чем энергия
межмолекулярного взаимодействия.
Наличие водородных связей между молекулами должно
существенно сказываться на свойствах вещества. Сравним два
изомерных вещества — этиловый спирт С2Н5ОН и диметиловый
эфир (СНз)гО. Молекулы первого образуют водородные связи
Н
О—Н ... 0-С2Н5
I
с2н5
Молекулы второго водородных связей не дают. Соответственно
температура кипения спирта, равная 78°С, много выше, чем
эфира (—24°С). Теплота испарения спирта 10,19 ккал/моль,
эфира 4,45 ккал/моль. Высокая температура кипения воды (по
сравнению, скажем, с метаном СН4, молекулы которого
содержат столько же электронов, сколько и НгО), большая теплота
ее испарения, известные аномалии воды объясняются наличием
водородных мостиков, связывающих все молекулы Н20 в
единую сетку. Энергия водородной связи для льда 4,5 ккал/моль.
Лэнгмюр говорил, что благодаря водородным связям весь океан
представляет собой как бы одну молекулу, а ловля рыбы в
нем — процесс диссоциации.
Природа водородной связи сложна, в ней наличествует как
электростатическое взаимодействие, так и квантовомеханическая
190 ГЛ. 5. ФИЗИКА БЕЛКА
донорно-акцепторная связь, определяемая переходом электрона
от атома водорода к атому, валентно с ним несвязанному. Теория
водородной связи была развита Соколовым [2] и Коулсоном [3].
Водородные связи играют большую роль в таутомерных
превращениях (см. стр. 123). Например, переход водорода при
кето-энольной таутомерии происходит через временно
образуемую водородную связь.
Водородные связи без труда обнаруживаются рядом
методов, в частности, методом инфракрасной спектроскопии. Полосы
поглощения групп ОН, NH, NH2, участвующих в водородной
связи, смещены в сторону более длинных волн и значительно
расширены. Спектроскопия позволяет определить долю групп,
вступивших в водородные связи, определить характер этих
связей, например, отличить связь в О—Н.. .О от связи в О—Н.. .N.
С другой стороны, водородные связи обнаруживаются
методами рентгенографии и электронографии путем измерения
межатомных расстояний. Наличие водородных связей сказывается
на изотопном обмене водорода на дейтерий и тритий,
существенно его замедляя. Более подробные сведения читатель найдет
в работах [4, б].
Какую же роль играют водородные связи в строении
белков? Каждая пептидная группа —СО—NH — содержит атом
водорода, способный давать водородную связь, и атом кислорода,
способный вступать в связь с таким водородом:
\с=о ... н—n/
Структура и свойства белков существенным образом
определяются водородными связями. То же относится к другим
важнейшим биологическим молекулам — нуклеиновым кислотам,
углеводам и липидам. Наконец, жизнь на Земле требует прежде
всего воды, молекулы которой взаимодействуют с
биологическими молекулами посредством водородных связей.
Значение водородных связей в природе весьма велико. К
первому элементу менделеевской системы — водороду — относятся
два важнейших понятия — водородная бомба и водородная
связь. И если водородная бомба грозит человечеству смертью и
разрушением, то водородная связь может быть названа одним
из источников жизни.
Полинг и Кори [6, 7], руководствуясь общими молекулярно-
физическими представлениями, пришли к выводу о
специфической макромолекулярной структуре белка, определяемой
наличием внутримолекулярных водородных связей. Они исходили из
того, что пептидная группа —СО—NH — плоская (стр. 106) и
все пептидные группы в макромолекуле должны быть располо-
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
191
жены одинаково, образуя по две водородные связи. При этом
в каждой группе С = 0... Н—N все четыре атома должны
располагаться примерно вдоль одной прямой. По оценке Полинга
отклонение от линейного расположения С=0 и Н—N не должно
превышать 20°, Основываясь на этих
соображениях, Полинг и Кори
предложили структуру белковой цепи в
виде так называемой а-спирали
(рис. 67). На один виток такой
спирали приходится 3,6 аминокислотных
остатков, т.е. период спирали
составляет 5 витков или 18 остатков
(наименьшее целое число, делящееся на
3,6). Высота одного витка равна 5,6 А,
диаметр спирали 10,1 А. Спираль
удерживается водородными связями,
направленными параллельно ее оси.
Эти связи соединяют первую
пептидную группу с пятой, пятую с первой
и с девятой и т. д.
Модель Полинга и Кори получила
блестящее подтверждение при прямом
рентгенографическом исследовании
ряда белков, а также их аналогов —
синтетических полипептидов. Это —
замечательный успех молекулярной
биофизики. Другое доказательство
состоит в изучении кинетики
изотопного обмена иминных водородов белка
с дейтерием и тритием. Замедление
обмена по сравнению с
низкомолекулярными пептидами, найденное Линдер-
штрем-Лангом, а также Бреслером [8],
позволяет грубо оценить число
пептидных групп, участвующих во
внутримолекулярных водородных связях. Рис. 67. а-спираль ио По-
Таким образом, макромолекулы лингу и Кори,
белка находятся в состоянии
выделенной конформации, ее звеньям соответствуют однозначно
определенные поворотные изомеры — по отношению к вращениям
вокруг связи ОС—NH реализуется транс-изомер, а по
отношению к связям HN—CHR и RHC—СО—поворотные изомеры,
повернутые в одну и ту же сторону на 120°.
Структура а-спирали подобна структуре полимера в
кристаллическом состоянии. Но если фиксация поворотных
192
ГЛ. 5. ФИЗИКА БЕЛКА
изомеров в кристаллических полимерах происходит благодаря
межмолекулярной упаковке цепей, то в спиральной белковой
цепи поворотные изомеры фиксируются внутримолекулярными
водородными связями, играющими роль «скрепок». Поэтому
структура а-спирали данной макромолекулы задана
независимо от соседних макромолекул и может сохраняться в
растворе. Макромолекула в виде регулярной, периодической
а-спирали подобна кристаллу, но весь «кристалл» в этом случае
состоит из одной молекулы.
Спрашивается, каково направление вращения в спирали,
какую имеет нарезку этот винт — правую или левую? Правая и
левая спирали относятся друг к другу как зеркальные
отражения— оптические антиподы. Это — асимметричные образования.
Если бы аминокислотные остатки сами по себе были
симметричны, то правая и левая спирали возникали бы, очевидно, с
равной вероятностью. Но все аминокислоты, кроме глицина,
асимметричны и относятся к одному стереохимическому ряду —
это /-аминокислоты. Можно построить d-спираль из
/-аминокислот и /-спираль из /-аминокислот. Эти две спирали уже не будут
зеркальными отражениями друг друга, но будут реально
отличаться расположением и упаковкой боковых групп. В
подавляющем большинстве случаев а-спираль является правой (d-спи-
ралью) —такой, какая показана на рис. 67. Белковая а-спираль
обладает, следовательно, двойной асимметрией — она содержит
асимметричные аминокислотные звенья и асимметрична, как
целое, как винтовая структура. Это находит свое выражение
в оптических свойствах белков и полиаминокислот (см. далее,
стр. 225),
Строение а-спирали приспособлено к выполнению белком
его различных функций. Внутри а-сиирали содержатся
однотипные группы белка — пептидные связи. Напротив, различные
боковые группы разных аминокислот белка обращены наружу и
могут поэтому взаимодействовать с молекулами, находящимися
в окружающей среде.
а-спираль — не единственная возможная структура белка.
Полинг и Кори предложили другой вариант упорядоченной
структуры^— р-форму. В этом случае белковые цепи находятся
в состоянии гораздо большей вытянутости, чем в случае
а-спирали— они образуют зигзаг. Такая структура стабилизована
(фиксирована) уже не внутримолекулярными, а
межмолекулярными водородными связями между параллельно вытянутыми,
но антипараллельными цепями. Возникает складчато-слоистая
структура, изображенная на рис. 68. Так как эта структура
может быть регулярно связанной водородными мостиками только
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
193
в совокупности белковых макромолекул, она имеет меньше
шансов на сохранение в растворе.
Стоит отметить, что строение, подобное р-форме белка, имеют
некоторые синтетические кристаллические полимеры —
полиамиды, например,
-CO-NH-(CH2)6-NH-CO-(CH2)4—CO-NH—
Полиамиды хорошо знакомы читателям — из них делаются
искусственные волокна найлон и капрон. В то же время такое
Рис. 68. р-форма полипептидных цепей.
строение имеют и природные белковые волокна — фиброин
шелка. Гусеница тутового шелкопряда ВотЬух mori великолепно
вырабатывает высокоупорядоченное волокно, и только в XX веке
химия научилась создавать материалы, конкурирующие с
шелком, р-форма определяет ценные качества шелка, его прочность
и эластичность.
Фиброин шелка — пример фибриллярного, волокнообразую-
щего белка. Другие фибриллярные белки — коллаген, входящий
в состав кожи, кератин — в перьях птиц и волосах
млекопитающих. Структура их специфична (см. стр 205) и далеко не всегда
сводится к р-форме.
13 М. В. Волькенштейи
194
ГЛ. 5. ФИЗИКА БЕЛКА
У поли-0-ацетил-£-£ерина обнаружена так называемая
скрещенная р-форма макромолекулы. В этом случае поперечные
водородные связи, подобные существующим в обычной р-форме,
соединяют регулярно расположенные участки одной цепи
(рис. 69). Та же форма свойственна некоторым белкам.
Подавляющее большинство биологически активных белков,
действующих в качестве ферментов, антител в явлениях
иммунитета и т. д., фигурируют в виде
глобул — компактных структур.
Полипептидные цепи во многих исследованных
глобулярных белках представлены а-спира-
лями.
Таким образом, макромолекулы
белков могут обладать высокоупорядоченной
структурой в целом — вторичной
структурой. Далее рассматриваются условия
Рис. 69. Схема скрещен- возникновения и разрушения вторичной
ной р-формы. структуры (стр. 207). Забегая вперед,
укажем, что в реальных белках нет
полной вторичной упорядоченности — наряду с регулярными,
например, спиральными участками цепей, имеются и неупорядоченные
участки, звеньям которых присущ целый набор конформаций —
поворотных изомеров.
Вторичная структура белка или синтетического полипептида
устанавливается с помощью ряда физических методов. Это, во-'
первых, рентгенография. Во-вторых, инфракрасная
спектроскопия. Расскажем об инфракрасных спектрах белков подробнее.
Амидная (пептидная) группа — СО—NH — имеет ряд
характеристических колебаний атомов, которым отвечают
определенные полосы поглощения в инфракрасном спектре. В табл. 8
приведены типичные частоты таких полос (выраженные в
числе волн на 1 см, т. е. в см~1) для жидкого метилацетамида
Н3С—СО—NH—СН3.
Полосы амида I и II оказываются характерными для
определенных конформаций пептидных цепей. Характерна при этом
не только частота соответствующего колебания, но и его
поляризация, т. е. направление колебания. Если изучать поглощение
плоскополяризованного инфракрасного света в растянутой
пленке белка или полипептида, то наблюдается явление дихроизма
и полосы поглощения разделяются на параллельные и
перпендикулярные. В первых сильнее поглощается свет с
направлением колебаний, параллельным оси растяжения, во вторых —
с перпендикулярным этой оси. Если макромолекулы (в а- или
р-форме) сами вытянуты вдоль этой оси, то знак дихроизма
указывает на ориентацию колеблющейся связи в макромолекуле.
ЙЙ
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
Характерные амидные полосы
195
Таблица 8 [9]
Обозначение
А
В
I
II
III
IV
V
VI
VII
Частота,
САГ1
3280
3090
1653
1567
1299
627
725
600
206
Характер колебания
Расщепленная вследствие взаимодействия с обертоном
полосы 11
Полоса валентного N—Н колебания
Валентное С=0 колебание
Деформация угла С—N—Н в плоскости и растяжение
связи С—N
Второе колебание того же типа, что и предыдущее
Деформация угла 0=С—N в плоскости
Деформация угла C=N—Н с выходом из плоскости
Деформация угла 0=С—N с выходом из плоскости
Крутильное колебание вокруг связи С—N
В а-спиралях связи С = 0 ... Н—N расположены вдоль оси
молекулы, в р-формах — перпендикулярно к ней. Это находит
четкое выражение в инфракрасном дихроизме.
Для а-формы характерны значения частот амид-I около
1650—1660 сиг1, амид-П — около 1550 сиг1. Первая полоса
поляризована параллельно (11), а вторая — перпендикулярно (JL).
У р-формы полоса I около 1630 см~х, полоса II около 1520 см~г.
В табл. 9 приведены данные, относящиеся к синтетическим
полипептидам.
Таблица 9 [10]
Полосы амид-I и амид-И у различных синтетических полипептидов
Полипептид
* i
<и <и
*• Я
gSS
л да т
5 >»«
5 * «
сьо я
Амид-1
Частота,
см~1
Дихроизм
Амид-П
Частота,
см~1
Дихроизм
Форма
Поли-£-валин . . . .
Поли-/.-лейцин . . .
Поли-Я-метил- /,-ци-
стеин
Поли-5-бензил-£-ци-
стеин
Поли-£-метионин . .
Поли-0-ацетил-/.-се-
рин
Поли-£-серин ....
Поли-Р-бензил-£-ас-
партат
Поли-у-бензил-£-глу-
тамат
190
35
140
365
135
130
130
190
100
19000
3 900
16000
77000
18 000
16800
11300
39000
22000
1638
1650
1632
1632
1648
1637
1653
1668
1645
I!
J.
±
II
1545
1543
1540,1525
1542
1540
1520
1525—35
1563
1542
II
±
II
II
±
II
J.
J.
р
а
р
р
а
Р
Клубок
а
а
13*
196
ГЛ. 5. ФИЗИКА БЕЛКА
Использование полос поглощения амид-I и амид-П для
определения конформаций белковых молекул встречается, однако,
с трудностями. Эти полосы у белков сложны, их не легко
интерпретировать. Получение глобулярных белков в ориентированном
состоянии также затруднительно. В работе Волчка и Пуркиной
[11] показано, что для изучения вторичной структуры белков
можно воспользоваться полосой амид-V, отвечающей внеплоско-
стным деформационным колебаниям NH. а-форме отвечает
полоса 620 сиг1, р-форме — 700 сиг1, клубку — 650 см~г.
Полученные данные свидетельствуют о возможности применения такого
чисто частотного критерия (без дихроизма) для определения
структуры белка как в растворе, так и в лиофильно
высушенном состоянии в виде порошка, спрессованного с КВг.
Дальнейшие подробности об инфракрасных спектрах белков и
полипептидов читатель найдет в работах [9, 12].
Вторичные структуры определяются и другими методами —
с помощью исследования оптической активности (об этом см.
далее), изотопного обмена и путем измерения вязкости,
светорассеяния, дипольных моментов в растворах исследуемых
веществ. Конечно, конформация макромолекулы зависит от
природы раствора — от состава растворителя, его рН, от
растворенных ионов. Если раствор содержит полипептиды в а-форме,
то его характеристическая вязкость, представляемая
зависимостью [ц]=КМа (стр. 178), выражается показателем степени 1,8—
величиной, близкой к той, которая должна быть для жестких
палочек. Напротив, если жесткая конформация утрачена и
полипептид приобрел форму статистического клубка, показатель
степени а уменьшается до 0,9. Из закона вязкости удается
установить отношение малой и большой оси а-спирали, в согласии
с расчетами Полинга. Такое же согласие дает определение
формы макромолекулы по угловому распределению
светорассеяния (стр. 179) и по измерениям дипольных моментов [13].
Наконец, недавно удалось получить непосредственные фотографии
а-форм и клубкообразных макромолекул полипептидов в
электронном микроскопе.
Очень важен и интересен вопрос о зависимости вторичной
структуры полипептида и белка от аминокислотного состава и
в конечном счете в случае белка — от его первичной структуры.
Проблема эта в целом пока не решена, но уже сегодня мы
располагаем таким количеством сведений о белках и полипептидах,
что это решение можно считать близким.
Блоут сформулировал соответствующую конформационную
гипотезу [10]. Образованию а-спирали могут препятствовать, во-
первых, геометрические (стерические) факторы и, во-вторых,
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
197
возникновение других водородных связей, мешающих
регулярной конформации. У полипептидов, содержащих
аминокислотные остатки с громоздкими заместителями у р-углеродного
атома, образование а-формы затруднено. С другой стороны,
а-форма не возникает, если остаток содержит гетеро-атом О
или S, способный вступать в водородные связи, отличные от
основных, стабилизирующих а-спираль. Далее, а-спираль
образуется лишь при достаточно высоких степенях полимеризации —
короткие цепи «предпочитают» р-форму (в твердом состоянии).
Если боковые группы способны заряжаться, то
электростатическое взаимодействие может помешать образованию а-спирали.
Этот фактор должен, очевидно, особенно сильно зависеть от
среды. В табл. 10 приведена конформационная классификация
аминокислот.
Мы встречаемся с очень серьезной конформационной
проблемой, состоящей в анализе поворотной изомерии
кооперирующих мономерных звеньев белковых и полипептидных цепей.
Основой такого анализа может и должна быть поворотно-
изомерная теория макромолекулы, о которой рассказано в гл.4.
Из изложенного следует, что синтетические полипептиды
образуют те же вторичные структуры, что и белки. Полипептиды
состоят из одинаковых повторяющихся аминокислот. Но,
поскольку аминокислоты соединяются пептидными связями, все
соображения Полинга и Кори сохраняют свое значение и
для синтетических полипептидов. Это — очень важное для
молекулярной биофизики обстоятельство. Оно означает
возможность моделирования существенных свойств сложных
макромолекул белка поведением гораздо более простых
макромолекул синтетических полипептидов, имеющих известное
строение.
Таким образом, белки и синтетические полипептиды могут
фигурировать или в растворе, или в виде твердых тел — пленок,
волокон, кристаллов. В клетках белки находятся либо в
растворе— и в этом случае, как правило, имеют глобулярную
форму, в которой и выполняют свою ферментативную и другие
функции, либо — в органоидах и мембранах. Во втором случае
белки образуют сложные надмолекулярные структуры, в
частности— фибриллярные. Изучение природы белковых глобул и
белковых надмолекулярных структур — одна из важных задач
молекулярной биофизики.
В заключение этого раздела приведем таблицу 11, в которой
суммированы некоторые данные о высших уровнях структуры
белков и других биополимеров и синтетических полимеров.
Указаны молекулярные веса -М, число цепей в глобуле п и число
дисульфидных связей S—S.
198 ГЛ. 5. ФИЗИКА БЕЛКА
Таблица 10 [10]
Конформационная классификация «-аминокислот
—NH—СН—С—
I II
R О
Образуют а-спираль
Алании
-CHj
Эфиры аспарагиновои кислоты
о
—СН2—С—О—Алкил
Глутаминовая кислота
о
-СН2-СН2-С-ОН
Эфиры глутаминовой кислоты
о
II
—CHj-CHa—С—О—Алкил
Лейцин
/СН8
-сн2-сн<
Лизин
- СН2-СН2- СН2- CH2-NH2
Метионин
—СН2— СН2—S—СН,
Фенилаланин
—CHj—С6Нб
Тирозин
-СН2-С6Н4-ОН
Норлейцин
— СН2—СН2—СН2—СН3
Норвалин
—СН2—СН2—СН?
О-ацетил-гомосерин
о
~СН2-СН2-0-С-СНз
Не образуют а-спираль
По стерическим причинам:
Валин
/СНз
-сн<
NCHS
Изолейцин
/СН,
-сн<
\сн2-сн3
По другим причинам:
О-ацетил-серин
о
-сн2-о-с-сн3
Серии
-сн2-он
S-метилцистеин
—СН2—S— СН8
Треонин
.он
-сн<
\сня
О-ацетил-треонин
о
-СН-0-C-CHj
СН,
•
Компактные глобулярные частицы
Полимер
М
п
S-S
Статистические клубки
Полимер
М
Вытянутые частицы
Полимер
М
Полистирол латекс
Инсулин. . .
Рибоиуклеаза
Лнзоцим . .
Многлобнн .
Папани
Трипсин
Хнмотрнпснн
Карбокснпептндаза . .
Р-лактоглобулнн ....
Гексокнназа
Овальбумнн
Альбумин плазмы (бык)
Энолаза дрожжей . . .
Гемоглобин
Дегидрогеназа печени .
Гемэретрнн
Альдолаза
у-глобулнн
Рибосомы (из дрожжей)
Bushy Stunt
Virus
J.
109
5 800
13 700
14400
17 000
20900
23800
24500
34300
35000
45000
44000
66500
67000
68000
83000
107000
142000
160000
3,5.10е
8,9 • 10е
2
1
1
1
1
1
3
1
1
1
4
2
8
3
4
0
3
4
5
0
3
6
5
0
0
17
0
0
0
О
О
25
Полистирол в толуоле
Восстановленная
рибоиуклеаза
Окисленная
рибоиуклеаза
Овальбумнн в мочевине
Альбумин плазмы в
мочевине
Мнознн в гуанндингнд-
рохлориде
РНК
Денатурированная
ДНК
13 700
14100
Фибриноген
Коллаген
Мнознн
ДНК
Вирус табачной
мозанки
44000
66500
200000
1,5.10е
5.10е
330000
345000
620000
5.10е
4-107
3
о
чз
S
Л
X
£
О
н
43
43
>
га
>
200
ГЛ. 5. ФИЗИКА БЕЛКА
ТРЕТИЧНАЯ И НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА БЕЛКА
Как же построены глобулы? Является ли их строение
случайным, т. е. подобным статистическим клубкам, или оно так
же имеет регулярный характер?
Глобулярные белки можно выделить в кристаллической
форме. Уже этот факт сам по себе заставляет думать, что
глобулы данного белка вполне однородны и регулярны. Изучение
строения некоторых белков методом рентгенографии позволило
раскрыть природу глобул. Впервые рентгенографическое
изучение белков было начато в 1930 г. Берналом, Фанкухеном, Пе-
рутцем и Дороти Кроуфут-Ходжкин. Это важное направление
молекулярной биофизики привело к крупным успехам,
достигнутым, однако, лишь в последние годы. Отсюда можно
заключить, как трудна эта работа. Мы не имеем возможности
описывать здесь метод рентгенографии. Читатель может познакомиться
с ним по специальной литературе [15, 16]. Ограничимся
простейшими сведениями. Рентгеновы лучи отличаются от видимого
света очень малыми, в тысячи раз меньшими длинами волн. Как
известно, при прохождении света через малые отверстия,
размеры которых соизмеримы с длиной волны, наблюдаются
дифракционные явления — лучи света «загибаются» за отверстия.
Это происходит потому, что каждая точка отверстия является
источником вторичных волн, усиливающих друг друга в одних
направлениях и ослабляющих — в других. Дифракция света
применяется для его спектрального разложения — лучи разной
длины волны отклоняются по-разному и проходящий через
малое круглое отверстие белый свет дает дифракционную картину
в виде совокупности концентрических окружностей, окрашенных
в спектральные цвета. Для разложения света в спектр
пользуются дифракционными решетками — регулярной
последовательностью узких щелей. По отклонению дифрагировавшего
луча, зная ширину щели, можно определить длину волны света,
а зная длину волны света — ширину щели. Для рентгеновых
лучей роль дифракционных решеток играют кристаллы, так как
они представляют собой регулярные решетки, состоящие из
атомов и молекул, отстоящих друг от друга на расстояния порядка
одного или нескольких ангстрем, т. е. того же порядка, что и
длина волны рентгенова луча. Рентгенов луч, проходящий через
монокристалл, дает совокупность регулярно расположенных
пятен на фотопленке—рассеянные кристаллом лучи расходятся
по строго определенным направлениям. На рис. 70 показана
рентгенограмма кристалла миоглобина кашалота. Если известна
длина волны рентгеновых лучей, то по положению
дифракционных пятен можно определить расположение атомов в кристалле.
ТРЕТИЧНАЯ И НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА БЕЛКА 201
Если молекулы, из которых построен кристалл, сложны,
содержат много атомов, то задача такого определения
оказывается очень трудной. Для этой цели разработаны специальные
тонкие методы. Крупным достижением была полная
расшифровка структуры витамина В12, полученная Кроуфут-Ходжкин.
Молекула витамина В12 содержит около 90 атомов, не считая
атомов водорода. Но молекулы белков содержат гораздо больше
атомов!
Рис. 70. Рентгенограмма кристаллического
миоглобина кашалота.
Существенная трудность рентгеноструктурного анализа
заключается в том, что легкие атомы, из которых и состоят белки,
очень слабо рассеивают рентгеновы лучи. Атомы водорода
оказываются, таким образом, вообще незаметными, и их наличие
и расположение определяются только специальными косвенными
методами.
В 1935 г. Перутц разработал метод исследования
гемоглобина, основанный на получении производных этого белка,
содержащих тяжелые атомы — серебро и ртуть. Удалось создать
производные, кристаллизующиеся изоморфно с гемоглобином.
Наличие атомов Ag и Hg (замещающих Н у сульфгидрильных
групп —SH) позволяет получить гораздо более резкую дифрак-
циенную картину. Пользуясь этим методом, Перутц изучил
202
ГЛ. 5. ФИЗИКА БЕЛКА
строение гемоглобина, а Кендрью — более простого, но
сходного белка — миоглобина. Гемоглобин содержится в
эритроцитах крови, а миоглобин — в мышцах. В состав обоих белков
входят порфириновые группы гема, в центре которых находятся
атомы Fe. Миоглобин содержит одну группу гема, а
гемоглобин— четыре группы.
На рис. 71 показана модель миоглобина, построенная на
основании строгого рентгенографического анализа |l6—18]. Диск,
видимый с ребра слева
внизу — группа гема,
малые сферы—тяжелые
атомы, присоединенные к мио-
глобину. «Червеобразные»
структуры представляют
собой а-спирали. Рентге-
ноструктурный анализ в
согласии, с данными по
изотопному обмену и с
результатами оптических
исследований (см. далее
стр. 240), показывает, что
в спиральном состоянии
находится около 75 %
аминокислотных остатков.
Рис. 71. Строение миоглобила. Остальные 25%
соответствуют неупорядоченным
участкам. Сложная глобулярная структура — третичная
структура — миоглобина поддерживается химическими связями —
серными мостиками, гидрофобными и водородными связями
и электрическими взаимодействиями. Рентгенографическое
исследование позволило почти полностью расшифровать и
первичную структуру этой макромолекулы, содержащей 153
аминокислотных остатка и имеющей молекулярный вес 18 000.
Таким образом, а-сяираль в глобуле в свою очередь
скручена в специфическую третичную структуру. Биологическая
роль третичной структуры, как мы увидим (гл. 8), весьма
значительна.
Гемоглобин, исследованный Перутцем, оказался построенным
из четырех субъединиц, имеющих каждая строение, сходное со
строением миоглобина. Эти четыре субъединицы расположены
примерно по вершинам правильного тетраэдра. Здесь мы
встречаемся уже с четвертичной структурой — 4 глобулы образуют
регулярную систему. Можно привести и другие примеры
четвертичной структуры. Так, белок частицы вируса табачной мозаики
состоит из 2000 одинаковых субъединиц, каждая из которых
ТРЕТИЧНАЯ И НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА БЕЛКА 203
имеет размеры того же порядка, что и миоглобин. Эти
субъединицы расположены в форме полой спирали, внутри которой
находится РНК вируса. В частицах сферических вирусов
субъединицы расположены симметрично на поверхности правильных
или почти правильных многогранников.
Бернал рассмотрел общую «архитектурную» проблему
организации надмолекулярных структур в биологии, как с точки
зрения геометрических условий такой организации, так и с точки
зрения сил, действующих между молекулами [19]. Исходными
являются два принципа. Во-первых, клетка создает множество
тождественных макромолекул. Во-вторых, вероятность
образования структуры высшей сложности из ее элементов возрастает,
а число возможных путей ее формирования уменьшается, если
изучаемые структуры могут быть разложены на конечный ряд
субструктур, последовательно включенных одни в другие.
Бернал показывает, что существует такого рода иерархия
биологических структур, подобная космической: звезды образуют
галактические скопления, галактики входят в метагалактики и т. д.
На рис. 72 показаны шесть последовательных порядков
увеличения клетки мышцы. Идя справа налево, мы переходим от
фрагмента белковой цепи к а-спиралям, от а-спиралей к
надмолекулярной структуре, состоящей из параллельных цепей
белковых молекул (миозин) в миофибриллах, от таких цепей к
миофибрилле, от миофибриллы к параллельной агрегации мио-
фибрилл в фибрилле, и, наконец, к части клетки
поперечно-полосатой мышцы, видимой в микроскопе.
Характер структур на каждом уровне организации
определяется геометрическими свойствами структур предшествующего
уровня и силами, действующими между ними. Эта
«сверхкристаллография», построение которой начато Берналом, имеет
общенаучное значение. Здесь чрезвычайно важен автоматизм
образования вполне определенных структур из
предшествующих. Задача, четко сформулированная Берналом, еще не
решена— она состоит в нахождении строгих условий организации
всех уровней строения, В идеале, решив ее, мы сможем
предсказать макроскопическое строение мышцы, зная химическое
строение ее белков.
Обратимся теперь к конформациям белков и полипептидов
в твердом состоянии [20, 21]. Мы уже говорили о р-форме
шелка. Та же форма присуща кератину волос, р-форму дает
полиглицин. Интересно отметить, что глицин составляет 44% всех
присутствующих в фиброине аминокислотных остатков, р-форма
означает наличие плоских слоев макромолекул, соединенных
водородными связями. Эти слои в свою очередь соединяются
межмолекулярными силами.
204 ГЛ. 5. ФИЗИКА БЕЛКА
Наряду с р-формой существует скрещенная р-форма,
обнаруженная в волокнообразном инсулине и в эпидермине (белок
эпидермиса). В этом случае оси цепей расположены
перпендикулярно к оси волокна. Такую же форму имеют цепи в шелке,
20ju - ■ Вр —- — 2000А —-
а) б) в)
i
200А—~ -—20А — 2 А
г) д} е)
Рис. 72. Шесть последовательных порядков увеличения клетки
мышцы.
производимом мухой Chrysopa flava. При растяжении этого
шелка скрещенная р-форма превращается в обычную р-форму.
Вытянутые а-спирали создают специфические структуры,
а-спирали скручиваются друг с другом, образуя подобие
многожильного кабеля. При этом характерна гексагональная
упаковка спиралей.
Поли-р-бензил-£-аспартат, полученный в виде пленки из
хлороформа и затем прогретый в вакууме, обладает новой, так
называемой w-формой, в которой а-спираль несколько иска-
ТРЕТИЧНАЯ И НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА БЕЛКА 205
жена: она имеет уже четверную, а не тройную симметрию. На
рис. 73 показана проекция о-формы этого полипептида на
плоскость, перпендикулярную к оси спирали.
Интересна конформация поли-^-пролина. Дело в том, что
пролин есть имино-, а не аминокислота, он не содержит NH2-
групп. Соответственно невозможно образование водородных
связей N—Н...О. По стерическим причинам полипролин не может
быть полностью вытянутым — этому
мешает циклическая группировка в
мономере. В кристалле полипроли-
на установлена тройная спираль с
повторяющимся расстоянием 9,38 А.
Полная расшифровка
надмолекулярной и вторичной структуры по-
липролина пока отсутствует. В
связи с этим надо сказать, что эта
область исследований только
начата и в сущности мы знаем о
надмолекулярных структурах белков
сравнительно мало.
Одним из относительно хорошо
изученных белков является колла- Рис 73 ^opbia поли-р-бен-
ген — основной структурный эле- зил-£-аспартата.
МеНТ КОЖИ И СОеДИНИТеЛЬНЫХ ТКанеЙ проекция на плоскость, перпеидику-
ЖИВОТНЫХ ЛЮбЫХ ВИДОВ. ЕГО фуНК- лярную спирали.
ция опорная. Коллаген содержит
более 30% глицина, много пирролидиновых колец и около
24% пролина и оксипролина. Структура коллагена сходна
со структурой полиглицина в одной из его
кристаллических модификаций. Полиглицин II, исследованный Криком и
Ричем [20], имеет гексагональную структуру, все полипептидные
цепи параллельны друг другу и каждая из них представляет
собой тройную спираль. Каждая цепь соединена с шестью
другими посредством водородных связей, имеющих различные
направления и не лежащих в одной плоскости. Такая структура
показана на рис. 74. Молекула коллагена получается из тройки
полиглициновых цепей, закрученных в единый жгут — это
структура со скрученной спиралью (рис. 75). Совместное скручивание
трех полипептидных цепей объясняется стерическим
взаимодействием неглициновых остатков — групп пролина и оксипролина.
Так как коллаген — белок сравнительно простой первичной
структуры, оказывается возможным проследить, как она
определяет вторичную и третичную (эти понятия здесь трудно
разделить) структуры коллагена. При неполном гидролизе
коллагена получаются трипептиды гли-про-оксипро.
206 ГЛ. 5. ФИЗИКА БЕЛКА
Андреева и ее сотрудники поставили задачу искусственного
создания полипептида, аналогичного природному коллагену. Был
синтезирован полимер (гли-про-опро)п с молекулярным весом
в несколько тысяч. Он оказался действительно подобным
коллагену, как это показали исследования методами рентгенографии,
Рис. 74. Структура полиглицина И.
инфракрасной спектроскопии и поляриметрии [22]. Эта
интересная работа не является, конечно, искусственным синтезом
природного белка. Но результат ее важен, так как на этом
относительно простом примере удалось прямым экспериментом
доказать связь между первичным и высшими уровнями
структуры белка.
Есть все основания думать, что первичная структура всегда
задает вторичную, третичную, четвертичную структуры белка.
Иными словами, реализуется тот самый автоматизм в создании
иерархии структур, о котором говорит Бернал. Первичная
КОНФОРМАЦИОННЫЕ ПРЕВРАЩЕНИЯ БЕЛКА 207
структура белка закодирована генетически. Но поскольку
высшие уровни структуры однозначно определены первичной —
они также закодированы, Значит, строение генного материала,
природа матрицы, штампующей белковый текст, задает и
Рис. 75. Структура коллагена.
молекулярное и надмолекулярное строение биологического
вещества. Дальнейшие исследования в этой области ведут к
решению проблем, связанных со строением клеток и организма,
как целостных надмолекулярных систем с дифференциацией
клеток и тканей.
КОНФОРМАЦИОННЫЕ ПРЕВРАЩЕНИЯ БЕЛКА
Таким образом, нативный, т. е. фигурирующий в организме и
выполняющий свою биологическую функцию белок — структурно
организованная система. Этому не противоречит неполная спи-
рализация в ряде белков, например в гемоглобине и миогло-
бине. Наличие неупорядоченных областей может
рассматриваться как элемент определенного порядка, так как число
звеньев, входящих в эти области, в среднем фиксировано. В
целом макромолекула белка имеет заданную структуру, которую,
однако, нельзя считать статической, неподвижной. Конформа-
ции белка могут изменяться под действием различных
факторов, в том числе и простого теплового движения. Как показано
далее (гл. 8), ферментативная активность, по-видимому,
связана с флуктуациями — конформационной лабильностью натив-
ного белка. Более резкие изменения, приводящие к полному или
208
ГЛ. 5. ФИЗИКА БЕЛКА
частичному разрушению вторичной и высших уровней структуры
(но без разрыва пептидных связей, следовательно, с
сохранением первичной структуры), называются денатурацией белка.
Денатурированный белок уже не в состоянии выполнять свои
биологические функции, но, конечно, по-прежнему может
служить источником необходимых для организма аминокислот,
поступая в него в качестве пищи. Денатурация вызывается
нагреванием, действием определенных растворителей, изменением рН
среды. Вареная или жареная пища содержит денатурированные
белки.
Здесь мы, к сожалению, подошли к границе применимости
аналогии белка с напечатанным текстом. Аналогия
ограничивалась ведь только первичной структурой. За биологическую
функциональность первичная структура ответственна лишь в
конечном счете — непосредственную роль играют высшие уровни
строения.
Денатурация может происходить как в массе белка, т. е.
в твердом теле, так и в его растворе. Рассмотрим, каково
поведение макромолекул во втором случае.
Ввиду того, что вторичная и высшие структуры белка
поддерживаются достаточно сильными гидрофобными (см. стр. 210),
водородными, электростатическими и дисульфидными связями,
макромолекулы могут сохранять упорядоченную структуру и
в водном растворе. Если бы это было не так, то растворенные
в цитоплазме клетки белки-ферменты не могли бы играть свою
роль. В организме растворенные белки находятся в нативной
форме. Вызывая их денатурацию in vitro — в колбе или в
пробирке, — мы дезорганизуем, разупорядочиваем эту структуру.
При этом макромолекулы, как положено полимерам, переходят
в состояние статистических, беспорядочных клубков. Этот
процесс особенно четок у синтетических полипептидов (см.
следующий раздел).
Макромолекула ведет себя в разбавленном растворе, как
независимое тело. Напротив, в растворах высокой концентрации
могут и должны возникать упорядоченные системы, подобные
жидким кристаллам. Мы видели, что кристаллизация полимеров
связана с гибкостью или, скорее, с жесткостью макромолекул,
которые нельзя уложить иначе, как упорядоченным образом,
если их гибкость и предоставленный им объем ограничены.
Очевидно, что такая же ситуация может реализоваться и в
растворе. Она была рассмотрена Флори [23].
В концентрированном растворе полимерные цепи не могут
уже принимать различные конформации независимо друг от
друга, возможны лишь такие конформации, в которых каждое
из звеньев данной цепи занимает положения в пространстве, не
КОНФОРМАЦИОННЫЕ ПРЕВРАЩЕНИЯ БЕЛКА
209
занятые другими ее звеньями или звеньями соседних
макромолекул. Если о — число возможных конформаций каждого звена
с соответствующими вероятностями, то общее число
конформаций отдельно взятой цепи, содержащей N звеньев, равно u>N.
Общее число конформаций п независимых друг от друга цепей
Q = (fi^ = o^. (5.1)
Увеличим концентрацию раствора так, чтобы объемная доля
полимера равнялась v. Флори показал, что при этом число
конформаций каждой макромолекулы уменьшается в e~vN раз и,
следовательно, Q становится равным
(? = (©*-*)"". (5.2)
Если полимер не разбавлен, v=\ и
« = (5f • (5.3,
со является, очевидно, мерой гибкости цепи. Если гибкость
настолько мала, что о приближается к е, то Q стремится к
единице. Так как неупорядоченному состоянию отвечает Q>1, т. е.
оно может быть реализовано многими способами, то это
означает, что макромолекулы должны упорядочиваться. При у=1
возникает кристаллизация, а в растворе (v<l) возникает
анизотропная жидкокристаллическая фаза. Эти теоретические
соображения согласуются с опытом. Таким образом, поведение
макромолекул — и, в частности, макромолекул биополимеров —
в растворе зависит от их жесткости, от концентрации раствора
и, конечно, от температуры, рН среды и природы растворителя.
На рис. 76, заимствованном из работы Флори, показаны кон-
формационные переходы, происходящие при растворении
полимера и при его конформационных превращениях в растворе.
Отметим попутно, что изучение конформаций полимеров в
растворе очень важно для понимания технологического процесса
формования волокна. Синтетические волокна получаются
путем продавливания концентрированных растворов
соответствующих полимеров через фильеры — очень малые отверстия.
Растворитель испаряется, остается волокно. Упорядоченная,
кристаллическая структура волокна существует в какой-то степени
уже в растворе, до испарения растворителя. Физические
исследования процесса формования, в результате которых технология
получения волокон может быть существенно улучшена, должны,
очевидно, основываться на конформационной теории. Надо
сказать, что живые организмы делают свои волокна таким же
способом. И паук, выпускающий паутину, и гусеница шелкопряда,
14 М. В. Волькеищтейц
210
ГЛ. 5. ФИЗИКА БЕЛКА
делающая тончайшую шелковую нить, гонят концентрированные
растворы белков через очень малые отверстия. Мы видим, что
здесь проблемы молекулярной биофизики сходятся с
проблемами техники, и несомненно, что изучение биологического
процесса структурирования волокнистого белка окажет важную
помощь производству.
Теперь рассмотрим физико-химические факторы,
ответственные за денатурацию, за разрушение высших уровней структуры
Плотная кристаллическая фаза
Тантоидальная анизотропная
фаза в растеоре
%
Изотропный
разбавленный
растеор
спиралей
Рис. 76. Коиформациоииые превращения белка при растворении.
белка. Денатурация — явление такого же типа, как обычно
изучаемые молекулярной физикой. Это — переход от порядка к
беспорядку, подобный плавлению кристалла.
Переход от нативной к денатурированной форме белка
сопровождается изменением свободной энергии
(термодинамического потенциала) AF, суммирующим ряд эффектов,
рассмотренных особенно детально в работах Шераги (см. [24]):
AF = AFb + AFH+AFNp + AFe + AFm + AFx +
(5.4)
&Fb — изменение свободной энергии, связанное с
раскручиванием а-спирали, т. е. с разрывом внутримолекулярных
водородных связей и с увеличением числа конформаций при переходе
от спирали к клубку (см. следующий параграф); А^я —
изменение свободной энергии в результате разрыва водородных связей
между боковыми группами соседних макромолекул: &FNp
отвечает разрыву неполярных, гидрофобных связей.
Существование гидрофобных (т. е. водоотталкивающих), связей можно
КОНФОРМАЦИОННЫЕ ПРЕВРАЩЕНИЯ БЕЛКА 211
пояснить следующим образом. Свободная энергия системы
^б"5 • • • "5^6—
Н20 ... Н20
ниже, чем системы
—С6Н5... Н20
Н20 ... Н5С6—
Главную роль здесь играет понижение энтропии воды во
второй системе. Окружающие неполярную группу молекулы воды
упорядочиваются — вода приобретает льдоподобную структуру.
AFe возникает вследствие различия в электростатических силах,
действующих в спиральной и неупорядоченной формах; AFm —
изменение свободной энергии (энтропии), определяемое
смешением денатурированных молекул с растворителем; AFX
определяется уничтожением поперечных связей между
спиралями, существовавшими в кристаллической фазе.
Величины AFb и AFX не зависят от рН, так как оии относятся к
процессам, в которых ионизируемые группы не участвуют. Все остальные члены
Л/7 зависят от рН. Количественное выражение перечисленных изменений
следующее:
tHFb = (N — 4) Д//0 — (N — 1) Т AS0, (5.5)
где N— число звеньев цепи, ЛЯ0 и Л50 — изменения энтальпии и энтропии,
приходящиеся иа одно звеио бесконечно длинной цепи при переходе
спираль— клубок. Цепь из N аминокислот имеет N— 4 водородные связи,
причем закреплен, лишен конформациониой подвижности N — 1 аминокислотный
остаток. Из выражения (5.5) сразу следует, что спираль стабильна, т. е.
&Fb > 0 лишь в том случае, если N достаточно велико. В самом деле, можно
переписать (5.5) в виде
!HFb = (N — 4) (А//0 — Т AS0) — ЗТ ASp.
Считая Л//0 н А50 положительными, мы видим, что при малых N (порядка
четырех) AFb < 0.
bFH=—kT 2 ln(l — Jfy). (5.6)
где xtj—доля молекул, имеющих побочную водородную связь между
данными группами / и /'.
bFm = - 2pkT\n (1 + Кс), (5.7)
где /С — константа равновесия для взаимодействия NH или СО — группы
белка с малой молекулой в растворе. Так, мочевина (NHs)sCO образует
водородные связи с белком и способствует денатурации. В этом случае с —
молярная концентрация мочевины, ар — число остатков «кристаллической»
цепи, которые после уничтожения спирали могут взаимодействовать с
мочевиной. Конечно, молекулы воды также взаимодействуют с белком, ио это
взаимодействие уже учтено в AF6, AFh и Д/7/^ При малых с
!HFm == — 2pkTKc. (5.8)
14*
212 ГЛ. 5. ФИЗИКА БЕЛКА
Член AFX чисто энтропийный:
М?х = — Т bSx = kT ^-(In л + 3), (5.9)
v — число спиралей, соедииеииых поперечными связями, п — число звеньев
между поперечными связями.
Количественное выражение AFNp и AFe представляет большие трудности.
Отвлекаясь от этих членов (есть основание думать, что оии относительно
невелики), можно написать
bF=(N-4)bH0-(N-l)TbS0 + bFH — TbSx. (5.10)
В присутствии мочевины нужно добавить еще и &Fm.
По оценке Шеллмаиа [25] Д#о= 1500 кал/моль, AS0=4,2 кал • моль~1. град~\
Величина Д#о значительно меньше обычных энергий водородной связи,
имеющих порядок 4—6 ккал/моль. Это объясняется тем, что Д#0 не есть разность
энергии пептидных групп, соединенных и ие соединенных водородными
связями, а является разностью энергий групп, соедииеииых
внутримолекулярными связями, и групп, соединенных межмолекулярными водородными
связями с молекулами воды.
Ввиду малости величины АИ0 прямое измерение ее затруднительно.
Привалов развил точную калориметрическую методику, с помощью которой
получены значения, близкие к оценке Шеллмаиа [26] (см. также работу Бреслера
и сотрудников [27]).
Необходимо подчеркнуть одно весьма важное обстоятельство. Д#о и AS0
ие малы, но AFb—малая величина, так как &F0 и Д50 компенсируют друг
друга. В самом деле, внутримолекулярные водородные связи прочнее связен
с водой, и их разрыв означает проигрыш в энтальпии. Напротив, при
денатурации энтропия возрастает, так как свободная цепь, т. е. клубок, имеет
гораздо больше коиформацнй, чем спираль. При больших N
AFb » N (Д//0 — Т AS0) (5.11)
и при Г=300° К AFb^N (1500-1260) =240 N кал/моль звеньев. Величина
240 кал/моль звеньев меньше kT= 600 кал/моль. При длине цепи N= 14
Д/^ь = —1380 кал/моль. &FH сильно зависит от рН. При больших и малых
рН AFH стремится к нулю. Оценка Д5Ж дает для п = 14 и v = 1 Д5Ж =
= —8,5 кал • моль-* • град~\ т. е. — T^Sh=2550 кал/моль. В присутствии
мочевины AFm отрицательно, т. е. этот член уменьшает стабильность иативиого
белка. Напротив, AFNp увеличивает его стабильность. Температура перехода
находится из условия
Д/?=0 (5.12)
(ср. стр. 22). Если белок ие содержит побочных водородных или
гидрофобных связей, то (5.12) означает
и
(N-4)AH0-(N-l)TnJlbS0-TnJlbSx = 0
(АГ-4)А//0
(5.13)
Величина ASX также пропорциональна числу звеньев цепи N. В самом деле,
чем длиннее цепь, тем больше поперечных связей она может образовать.
Значит, v = р#. Если N^$>\, то Гпл ие зависит от Nf так как N входит
множителем и в числитель и в знаменатель (5.13) и сокращается. Очевидно,
что если Д//0 и Д5о известны, по значению Тпл можно определить ASX. Такое
определение согласуется с вышеприведенной оценкой.
КОНФОРМАЦИОННЫЕ ПРЕВРАЩЕНИЯ БЕЛКА 213
Если известно Д/\ как функция температуры, рН и т. д., доля
денатурированного материала х может быть йайдеиа с помощью выражения
g-APikT i
*" l+.-AW™ 1+,W (5Л4)
В точке перехода AF=0 и, конечно, х=1/2. В работе Немети, Штейнберга и
Шерага [28] проведен детальный анализ водородных и гидрофобных связей
в системе белок—вода. Даиы количественные оценки значений Д/7, ЛЯ и AS.
Эти оценки согласуются с изложенным — суммарная свободная энергия
образования простой структуры, включающая как энергию водородных, так и
гидрофобных связей, лежит в пределах —0,5 до —2,4 ккал/моль,
соответственно, ЛЯ от —1,5 до —0,5 ккал/моль, AS от —3 до +7 кал • моль~1 • град'1.
Показано, что, вообще говоря, гидрофобные связи укрепляют водородные
связи. Рассмотрено поведение групп, способных давать водородные связи, ио
«погруженных» в неполяриые области молекулы. Такие группы способны
давать добавочные водородные связи с водой при коиформацноином
превращении белка.
Шахман [14] дает следующие оценки изменения свободной
энергии белка при его денатурации: конформационная энтропия
изменяет F на — 1,5 ккал/моль пептидных связей,
межпептидные водородные связи (считая, что 50% белка находится в
форме а-спирали) — на 0,5 ккал/моль, гидрофобные связи — на
1,0 ккал/моль. Водородные связи боковых групп и ионные связи
дают малый вклад, так что суммарная свободная энергия
денатурации близка к нулю.
В последнее время установлен ряд фактов, показывающих,
что главную роль в стабилизации структуры глобулярного
белка играют не столько водородные связи, сколько именно
гидрофобные взаимодействия, т. е. большая выгодность контактов
углеводородных радикалов аминокислот друг с другом по
сравнению с контактами между ними и молекулами воды. Впервые
на это указали Бреслер и Талмуд [14а], но лишь недавно
Шерага изучил гидрофобные связи количественно [146]. Модельные
опыты показывают, что свободная энергия растворения
углеводородных молекул в воде намного больше, чем свободная
энергия их растворения в любом органическом растворителе. Вместе
с тем свободная энергия образования водородных связей типа
NH...OC в водной среде близка к нулю. Рентгенографические
исследования структуры гемоглобина показывают, что
большинство неполярных групп находится внутри белковой глобулы,
а полярные — снаружи. Все это указывает на значительную
роль гидрофобных взаимодействий между углеводородными
радикалами в стабилизации компактной структуры глобулярных
белков, молекулы которых могут быть грубо уподоблены
каплям жира, плавающим в водной среде.
214
ГЛ. 5. ФИЗИКА БЕЛКА
Отсюда следует, что денатурация глобулярных белков
определяется прежде всего распадом компактной глобулярной
структуры макромолекулы. Действительно, процесс денатурации
происходит слишком кооперативно, т. е. в слишком узком
интервале изменения температуры или состава растворителя, чтобы
это можно было объяснить кооперативным плавлением
сравнительно коротких а-спиральных участков.
Резкая кооперативность денатурации белков была недавно
объяснена Птицыным и Эйзнером [29] на основе аналогии между
процессом денатурации и процессом испарения жидкой капли.
Рассматривая внутримолекулярные взаимодействия в любой
макромолекуле, они показали, что при достаточно низкой
температуре зависимость объема макромолекулы от температуры
образует петлю типа петли на кривой Ван-дер-Ваальса
зависимости давления реального газа от объема. Наличие такой петли
означает наличие фазового перехода первого рода типа
перехода газ — жидкость. Молекула при некоторой температуре
должна совершать внутримолекулярный фазовый переход из
неконденсированного клубкообразного состояния в
конденсированное глобулярное состояние. Обычно такой переход
маскируется происходящей одновременно межмолекулярной
конденсацией с выпадением полимера в осадок. Однако если
макромолекулы могут удерживаться в растворе с помощью других групп,
не участвующих в конденсации, например, в случае белков,
глобулярное состояние макромолекул в растворе оказывается
возможным.
Согласно работе [29], денатурация глобулярных белков
представляет собой переход глобула — клубок, аналогичный
переходу жидкость — газ в простых веществах*).
Денатурация белка зависит, таким образом, от многих
факторов, изучение которых представляет немалые трудности. Они
связаны с различием аминокислотных остатков, со сложностью
первичной структуры белка. Исследование макромолекул,
способных переходить из упорядоченной формы в неупорядоченную,
способных «плавиться» путем разрыва водородных связей, но
имеющих простое строение, может значительно упростить дело.
Доти поставил задачу, заключающуюся в проверке способности
синтетических полипептидов в растворе находиться в регулярной
форме, в частности, в виде а-спирали. Он и его сотрудники син-
*) Недавно Фишер (Proc. Nat. Acad. Sri. US 51, 1285 (1964)), исходя из
концепции гидрофобных связей, убедительно показал, что, зиая число
полярных и иеполярных остатков в белке, можно сделать далеко идущие выводы
о его третичной и даже четвертичной структуре. (Прим. при корректуре.)
КОНФОРМАЦИОННЫС ПРЕВРАЩЕНИЯ БЕЛКА 215
тезировали несколько полипептидов и рядом методов доказали,
что эти макромолекулы могут находиться в растворе в двух
формах — в упорядоченном, вероятно, а-спиральном состоянии
и в виде статистического клубка. При определенных условиях
происходит резкий переход спираль — клубок,
внутримолекулярное плавление полипептида [30, 31].
Был подробно изучен поли-у-бензил-А-глутамат (ПБГ)
RNH—[СО—СН—NH]rt^
СН2
сн2
со
о
сн2
с6н5
и полиглутаминовая кислота ПГК, получаемая из ПБГ путем
гидролиза. ПБГ удобна для исследования потому, что
растворяется в ряде органических растворителей. ПГК растворяется
в воде. ПБГ не имеет ионизируемых групп. Ее конформации
в разных растворителях различны. В растворителях, не
способных к образованию водородных связей (например, в бензоле),
макромолекулы сильно ассоциированы. В дихлорэтане,
хлороформе, формамиде ПБГ существует в виде жестких палочек.
Изучение этих растворов методом светорассеяния и
вискозиметрии, а также прямое фотографирование частиц в
электронном микроскопе дало результаты, полностью согласующиеся со
спиральным строением. То же относится к ПГК в водных
растворах при рН<5. Напротив, в растворителях, дающих
водородные связи с ПБГ — в трихлоруксусной и трифторуксусной
кислотах макромолекулы ПБГ существуют в форме статистических
клубков. Такие растворы, в частности, имеют очень малое
двойное лучепреломление в потоке. ПГК превращается в клубки при
рН>5.
На рис. 77 показана зависимость ионизации,
характеристической вязкости [ц] и удельной вращающей способности [а] ПГК
от рН среды. В области около рН=6 происходит переход
спираль— клубок, сопровождающийся увеличением ионизации,
резким падением вязкости и удельного вращения. О причинах
последнего явления подробно рассказано далее (стр. 235). Здесь
мы ограничимся указанием на основные факты. Уменьшение
216
ГЛ. 5. ФИЗИКА БЕЛКА
оптической активности белка при его денатурации известно
давно. Оно связано с исчезновением упорядоченной
асимметричной спиральной структуры. Оптическая активность а-спирали
слагается из оптической активности асимметричных
аминокислотных остатков и оптической активности спирали, как целого.
При плавлении получается беспорядочный клубок, в оптической
МЫ
о л°
-Я-0,5
-40-
-50-
3 4 5 6 7 д 9 10 11 12 13
Рис. 77. Переход спираль — клубок в ПГК.
активности которого остается только первое слагаемое. При
переходе спираль — клубок происходит также изменение
интенсивности поглощения ультрафиолетового света — в области 190,
197 и 205 m\i. Интенсивность поглощения в клубке больше, чем
в спирали (стр. 229).
Аналогичные результаты были получены Доти для
полилизина, сополимеров лизина и глутаминовой кислоты и т. д. Ясно,
что работа с синтетическими полипептидами позволяет изучить
конформационные превращения белка. По значениям [а] и
интенсивности поглощения ультрафиолетовых лучей, а также по
измерениям изотопного обмена Н на D (Линдерштрем-Ланг)
Таблица 12
Степень спиральности белка в процентах
Белок
(3-лактоглобулин . . .
По данным
ультрафиолетовой
спектроскопии
100
82
66
40
30(рН=6,4)
16 (рН = 8,7)
По данным
изотопного
обмена
>70
~60
35
25
По данным
рентгенографии
77
75
По
оптической
активности
100
75
78
38
16
30
ТЕОРИЯ ПЕРЕХОДОВ СПИРАЛЬ - КЛУБОК
217
М
оказывается возможным определить степень спиральности
белка, т. е. степень совершенства его вторичной структуры.
Примечательно, что различные методы
дают согласующиеся результаты
(табл. 12).
Переходы спираль — клубок в
полипептидах и белках
представляют собой исключительно
интересное физическое явление. Здесь
особенно замечательна большая
резкость перехода. Приводим еще один
рисунок, показывающий
зависимость [а] ПБГ от состава
растворителя, являющегося бинарной смесью
хлороформа и дихлоруксусной
кислоты. При 80% последней
происходит удивительно резкое падение
оптической активности (рис. 78).
Своеобразие рассматриваемого перехода заключается в том,
что, будучи подобен плавлению, он осуществляется в отдельной
молекуле, а не в кристалле. Это — внутримолекулярное
плавление, разрушение упорядоченной вторичной структуры.
75
9%0
10
5
О
-5
-10
-15
'/
1 U.
л
\
V
, N.
О 20 40 60 80 100
СНС13 СНС12С00Н
Рис. 78. Оптическая
активность ПБГ (Л! =350 000) как
функция состава растворителя.
ТЕОРИЯ ПЕРЕХОДОВ СПИРАЛЬ — КЛУБОК
Резкость, острота перехода при нагревании может быть вычислена из
выражения (5.14) для доли денатурированного материала.
Продифференцируем х по Т. Получаем
dx
1т
AFikT
1+0
bFlkT
(-
AF 1 dAF
Hf* ~kT dT
и, так как ЛЯ и AS практически не зависят от температуры,
dAF
dT
= _Д5 = —
Ш—AF
При Т=ТПл А/7 = 0 и
(
dx\
dT]T
Ш
AkT
(5.15)
пл
пл
Значит, наклон кривой х(Т), т. е. резкость перехода, тем больше, чем больше
А//. Мы видели, что температура перехода Гпл не зависит от числа
элементов, в нем участвующих. Напротив, КН должно зависеть от числа элементов.
Если при переходе одновременно изменяется состояние г звеньев цепи, то
Ш ^ г Д//0
и резкость перехода пропорциональна г.
218 ГЛ. 5. ФИЗИКА БЕЛКА
Наблюдавшиеся Доти и другими очень резкие переходы сви»
детельствуют о том, что в них одновременно участвует большое
число звеньев —кооперативное явление, в котором
взаимодействуют много элементов. Оно и понятно. В а-спирали каждое
звено соединено водородными связями с двумя другими, отстоящими
от него на четыре звена вдоль цепи. Это поясняется схемой,
показанной на рис. 79. Для освобождения данного звена и
предоставления ему возможности принимать произвольные конфор-
мации недостаточно, очевидно, разорвать две водородные связи,
Рис 79. Одномерная модель а-спирали.
а нужен разрыв нескольких таких связей кряду. Поэтому
переход возможен только при участии в нем целой серии звеньев.
Теория явления строится на основе тех же общих положений
теории кооперативных процессов, которые с таким успехом были -
применены к исследованию свойств синтетических
макромолекул, растяжения каучука и т. д. Эта теория основывается на
одномерной модели Изинга. Облегчающим условием является
линейность последовательности аминокислотных звеньев в белке.
Интересно посмотреть, как развивалась теория конформаций
макромолекул, статистика полимерных цепей. Советскими
учеными была создана поворотно-изомерная теория макромолекул,
основанная на рассмотрении их как кооперативных систем с
помощью одномерной модели Изинга [32, 33]. Позднее, независимо,
та же идея была положена рядом американских ученых в
основу теории переходов спираль —клубок [34—38]. Здесь мы
изложим вариант теории, предложенный Зиммом и Брэггом [34],
имеющий преимущество наибольшей простоты и ясности.
Значительно более подробное изложение этой теории содержится
в книге [33]. Наконец, та же идея об одномерной
кооперативной системе была применена для создания теории матричного
редупликационного синтеза ДНК (гл. 6).
Итак, рассмотрим полипептидную цепь, в которой возможны водородные
связи в соответствии со схемой рис. 79. Как уже говорилось, образование
водородной связи между *-м и / — 4-м мономерным звеньями накладывает
ограничение на конформаций звеньев it i—\t 1 — 2 и i — З. Для нахождения
ТЕОРИЯ ПЕРЕХОДОВ СПИРАЛЬ - КЛУБОК 219
условий перехода спираль — клубок и характеристики состояния цепи
необходимо вычислить статистическую сумму цепи, учитывая всевозможные
распределения водородных связей между звеньями. Будем различать два состояния
каждого звена |it = 0 и р* = 1. Первое состояние отвечает отсутствию
водородной связи у звена, второе — ее наличию, т. е. при \it = 0 мономерное
звено находится в свободном, а при ц = 1 — в связанном состоянии.
Очевидно, что свободная энергия цепи представится суммой
/>,. I»,.... и„)= 2 Foxi-^ i*/-* ■*/-!• ъ> (5Л6)
N— число звеньев в цепи. Если #^>1, можно пренебречь состояниями
крайних звеньев. Члены, стоящие под знаком суммы, можно представить в виде
^(Иг-з. W-s. |*i-i. \4)=F(\4) + P(Pl-z* Ш-2. |**-1. |*i> (5.17)
Здесь F(\ii) — собственная свободная энергия йю звена, включающая и
энергию его водородных связей, a F учитывает зависимость свободной энергии
/-го звена от состояний трех предшествующих звеньев. Если \ii = 0, то
^0**-8. 1*1-2. W-L 0)=FQ=Fcso6, (5-18)
так как состояние свободного звеиа не зависит от состояний
предшествующих звеньев. Если 1-е звено связано, то его состояние зависит от этих
состояний. Если одновременно связано и /—1-е звено, то жестко ограничены
конформации и /—1-го, и /— 2-го, и /— 3-го звеньев, независимо от того,
находятся ли они в связанном или свободном состояниях. Следовательно,
если за связанным звеном I—1—следует связанное звено /, то свободная
энергия последнего
/*<W-s. W-i. 1. 1) = /?(1) + /?связ. (5.19)
Изменение свободной энергии при освобождении /-го звена
HF=AH—TAS = Рсвяз — FCBo6. (&20)
ДЯ < 0 — разность энергий (энтальпий) внутримолекулярной водородной
связи и водородной связи свободного звена с молекулами растворителя,
Д5 < 0—уменьшение энтропии вследствие связывания звена, идущего вслед
за уже связанным звеном.
При образовании водородной связи звеном, следующим за тремя
свободными звеньями, нужно затратить некоторую свободную энергию. В этом
случае закрепляются сразу четыре звеиа кряду, они вынуждены принять
жесткую спиральную конформацию. Следовательно, организуется сразу целый
спиральный участок, причем происходит понижение энтропии
/?(0, 0, 0, 1)=/?„Ниц 2ГД5, (5.21)
где Лтиц — свободная энергия инициирования спирального участка. Если
принять, что при вращении свободного звена около каждой связи возможны
три поворотных изомера, то
Рият ^ — 2 • 300 • 4 • In (у) ^ 2,5 ккал/моль,
т. е. Янннц -=- заметная энергия.
Появление одного или двух свободных звеньев между связанными
сопряжено с большим увеличением свободной энергии и поэтому практически
невозможно. Ведь можно разорвать водородные связи, сохранив звенья в
220
ГЛ. 5. ФИЗИКА БЕЛКА
жесткой спиральной конформации, т. е. без компенсации затраченной энергии
выигрышем энтропии. Таким образом,
/^-з,1. 0, !)->«,,
F(h 0, 0, 1)->оо.
Статистическая сумма цепи равна
Q=^e-P^}lkT. (5.23)
Суммирование производится по всем состояниям цепи, т. е. по значениям
ц*=*0,1 для каждого звена. Если принять свободную энергию свободного
звена за нуль, то вклад данного состояния цепн в Q определяется
произведением множителей:
1) множителя 1 для каждого звена в свободном состоянии (jij = 0);
2) множителя s для каждого звена в связанном состоянии (ji* = 1),
равного
s _ e-bFlkT = ^(ДЯ-ГД5)АГ {^щ
s — константа равновесия для реакции образования водородной связи в звене,
следующем за связанным звеном, т. е. константа равновееня для увеличения
серии связанных звеньев на одно звено, за счет соседнего участка свободных
звеньев;
3)' множителя а для каждого звена в связанном состоянии (ц* = 1),
следующего за тремя и более свободными звеньями (\ii~i = щ_2 = Jif-з = 0).
Очевидно, что
а = e~F*mnlkT = £ AS/A _ 10-2. (5 25)
4) множителя 0 для каждого связанного звена (цг- =1), следующего за
свободными звеньями, если их число меньше трех (\ii-i = 0, Ц1-2 = 1 или
Hi-i = |ii-2 = 0, Ht-з = 1). Этот нуль соответствует (5.22). Следовательно,
<? = 2 Д ™ ° "»р -Ч Л,_1р „О - Ч_, 0 Vs, о)]- <*26>
Здесь
1, если а—Ь%
0, если афЬ.
-{
Как мы видели (стр. 165), Q, выраженное в виде суммы произведений, может
быть представлено как след некоторой матрицы, взятой в степени N:
Q = Sp(P"). (5,27)
В рассматриваемом случае матрица имеет порядок 23 = 8, так как нужно
учесть состояния трех последовательных звеньев, каждое из которых может
быть связанным или свободным. Зимм и Брэгг провели полный анализ этой
задачи и одновременно показали, что практически те же результаты могут
быть получены и при упрощенном рассмотрении, учитывающем лишь
состояния двух, а не четырех последовательных звеньев. В самом деле, связь между
состоянием /-го звена и состоянием i — 2-го и i—3-го звеньев дается лишь
ТЕОРИЯ ПЕРЕХОДОВ СПИРАЛЬ - КЛУБОК 221
условием (5.22). Если отвлечься от этого условия, то вместо (5.16) можно
написать
>>,. И2 !»„)= 2 />,_,. ц,) (&28)
и вместо (6.17)
/*<W-i. ^)=/?(И/) + ^(^-1. W* (5.29)
При этом в соответствии с (5.18), (5.19), (5.21) получаем
/?(0)=/?своб.
F(\)= ^связ»
?(0, 1)=/?иаиц.
?(0, 0)=?(1, 0)=?(1, 1) = 0.
(5.30)
В статистическую сумму каждое связанное звено вносит множитель s,
каждое свободное — единицу, а первое из связанных звеньев, следующее за
одним или большим числом свободных звеньев, — множитель а. Таким
образом,
<?= 2 nsV'(1_,l'_l)=sp(/>;V)- (s-31)
Матрица Р в этом случае второго порядка, так как ситуация вполне
аналогична рассмотренной для простейшей модели одномерной
поворотно-изомерной цепи (стр. 164):
Р=\ 0
0 1
1 as | (&32)
1 5
Характеристическое уравнение матрицы
(А — 1) (А — s) = as. (5.33)
Рассмотрим два крайних случая а = 1 ио = 0. Если а = 1, то
кооперативное^ отсутствует, так как это значит, что /^ннц = 0 (ср. (5 25)). При
этом корни уравнения (5.33) равны 1 + s и 0, и
т. е.
Q = 4N> (5.34)
где д= 1 +s — статистическая сумма отдельного звена. Следовательно,
статистическая сумма цепи равна произведению статистических сумм звеньев,
являющихся независимыми друг от друга.
Найдем долю звеньев, связанных водородными связями. Она равна
N dins 1+* l+*-W - (5>35)
222
ГЛ. 5. ФИЗИКА БЕЛКА
т. е. отвечает обычному некооперативному равновесию, х плавно зависит от
температуры и, следовательно, случай а = 1 соответствует постепенному
переходу от спирали к клубку при нагревании (рис. 80, кривая а). Этот случай
не согласуется с опытом — экспериментально наблюдаемые переходы
являются очень резкими.
При а = 0 корни уравнения равны 1 и s, и следовательно,
Q = 1 + *". (5.36)
т. е. цепь может находиться только в двух состояниях — полностью
спиральном ((^спираль = sN) и полностью свободном —в виде статистического
клубка ((Глубок = 1). При S>\ SN ~^§> 1
и Q = sN, т. е. цепь является
полностью спиральной. Напротив, при 5 < 1
sN<^\ и Q= 1, т. е. цепь является
клубком. При s = 1 происходит резкий
кооперативный переход спираль—
клубок. Доля связанных единиц
м
д: =
1 d\nQ =
N dins ~l+s
N
(5.37)
2 3 4 5s
Рис 80. Переход спираль —
клубок: а) некооперативный, б)
кооперативный.
откуда при N^>\
(1, s>l,
10, s< 1.
(5.38)
Этот резкий переход, происходящий
по принципу «все или ничего»,
показан на кривой б рис. 80. При переходе энергия, так же как х, меняется
скачком
d\ns
Е=кГ
d\nQ
дТ
= №Т
,лг
d\ns
\+s" d\nT
NkT
0,
d\nT*
s> 1,
s < 1.
(5.39)
Случай а = 0 соответствует /7нннц->оо, т. е. абсолютной кооперативности.
Как мы видели, а хотя и мало, но отлично от нуля. В общем случае
0 < a < 1 корни уравнения (5.33) равны
Ku! = l+l±/H^L+as.
(5.40)
Переход оказывается тем менее резким, чем больше а, и осуществляется при
изменении s от 1 +"КсГдо 1 — УТ. Расчет показывает, что при а<^1
интервал плавления a-спирали AT равен
kT2
ат=У7
А^пл
(5.41)
Учет конечности числа звеньев цепи также приводит к расширению
перехода и его сдвигу в сторону больших Т. Сопоставление теории с
экспериментальными данными Доти, относящимися к ПБГ в растворе в смеси дихлор-
уксусной кислоты и дихлорэтилена, дает хорошее согласие теории с опытом
при |Д//| =* 900— 1100 кал/моль и а а* 2 «Ю-4, а оказывается очень малым.
ТЕОРИЯ ПЕРЕХОДОВ СПИРАЛЬ - КЛУБОК 223
т. е. степень кооперативности весьма велика — она отвечает одновременному
переходу 102 звеньев. Значение ЛЯ близко к вышеприведенным оценкам
(стр. 212).
В связи с изложенной теорией возникает принципиальный физический
вопрос, который до открытия переходов спираль — клубок в биополимерах
рассматривался только в абстрактном плане. Является ли переход спираль —
клубок истинным плавлением, т. е. фазовым переходом первого рода? Иными
словами, может ли сосуществование спиральных и неупорядоченных участков
цепи в области перехода рассматриваться как равновесие двух фаз, т. е.
равновесие между двумя сколь угодно большими участками цепи,
соприкасающимися в одной точке?
Ландау и Лифшиц [39] доказали невозможность такого равновесия в
одномерной системе. Свободная энергия системы равна свободной энергии
суммарных количеств обеих фаз плюс свободная энергия точек соприкосновения
между фазами. Если число таких точек соприкосновения равно т, то
F = NxFCBil3 + N(\ — x) FCB06 + mkT\n~^ + шф. (5.42)
Логарифмический член выражает энтропию смешения точек соприкосновения
со звеньями цепи, ф — энергия поверхностного натяжения в граничных
точках. Из (5.42) следует
6F
F будет стремиться к минимуму, отвечающему условию -ч—, т. е.
■J- = е-*". (5.44)
Следовательно, обе фазы будут стремиться перемешиваться до тех пор, пока
не разделятся на малые конечные отрезки, удовлетворяющие условию (5.44).
Значит, фазового равновесия в одномерной системе нет, невозможны и
фазовые переходы.
Статистическая теория позволяет вычислить среднюю долю пар звеньев,
находящихся на стыке связанных и свободных участков. Эта доля равна [33]
^ = Vo=e~Fmml2kT. (5.45)
Сравнение (5.44) и (5.45). показывает, что роль энергии поверхностного
натяжения играет /7пппц/2. При конечном значении Лпшц и, следовательно, при
а < I переход, как мы видели, резок, но не абсолютно резок и тем самым
не является истинным фазовым переходом, истинным плавлением. Фазовый
переход получается только при а = 0,т. е. при /7нннц->оо и ф->оо, что
невозможно. Практически, однако, поскольку а <^ 1, переход очень резок и
может рассматриваться как квазиплавление одномерной цепи.
Теория перехода спираль—клубок, вызванного ие повышением
температуры, а изменением растворителя или изменением рН среды, строится на тех
же основах (см. [33]). В первом случае необходимо учесть, что каждое звеио
может находиться уже ие в двух, а в трех состояниях: без водородной связи,
с внутримолекулярными водородными связями и с межмолекулярными
водородными связями с молекулами растворителя. Межмолекулярное связывание
можно считать некооперативным, тогда каждое несвязанное
внутримолекулярное звеио вносит в Q уже не 1, а 1 + е^ . где Дц— разность
химических потенциалов звеиа в состоянии с межмолекуляриой водородной связью
и в свободном состоянии, т. е. изменение свободной энергии моиомерного
звена при образовании водородной связи [35, 38]. Соответственно условие
перехода оказывается зависящим от Дц. Резкость перехода по-прежнему
224
ГЛ. 5. ФИЗИКА БЕЛКА
зависит от а. При увеличении концентрации специфически связываемых
молекул растворителя Тлл понижается. Если в отсутствие
межмолекулярного взаимодействия температура плавления равна 7^л, то в присутствии
активного растворителя [38]
Т —
1 пл —
1 пл
l + ™ln(l + eAwW)
(5.46)
\ЬН\
4
Спираль Кяубак
/
/
О 0,2 Q4 Ц6 Ц4 W се
Рис. 81. Кривая потенциоме-
трического титрования
полипептида.
При Дц-> — со, т. е. когда состояние с межмолекулярной водородной связью
практически не осуществляется, Гпл = г£л. Чем больше Дщ тем меньше Тпа.
Эта теория хорошо объясняет описанные
выше результаты, полученные для ряда
синтетических полипептидов.
Полипептиды, построенные из
ионизуемых аминокислотных остатков (например,
полиасп, полиглу, полилиз и т. д.),
совершают переходы спираль —клубок при
изменении рН. Переход может быть в этом
случае обнаружен ие только путем
измерения х методом вискозиметрии или
поляриметр и и, но и методом потенциометрического
титрования, дающего степень ионизации
макромолекул а. Теория перехода в
полипептидах с ионизуемыми группами
дана в работах Пеллера [38] и Зимма и
Раиса [40]. Последняя работа по-прежнему
основана на методе Изинга.
В цепи с ионизуемыми звеньями
каждое звено должно характеризоваться.
ие только параметром щ = 0,1 соответственно для свободного и связанного
звена,'но и вторым параметром r\i = 0,1 соответственно для незаряженной и
заряженной ионизуемой группы. Статистическая сумма цепи имеет вид
0=2 е~р \HVkT 2 П «"'«"'ft'J ({М)/*Г (5-47)
Здесь F {\i(} — свободная энергия незаряженной цепи при данном наборе
значений \it — та же свободная энергия, с которой мы уже встречались,
а—отношение активностей заряженного и незаряженного звена, связанное
с рН среды уравнением
log а = ± (рН — рК) (5.48)
(ср. стр. 184). Знак (+) относится к кислотной, (—■) — к основной группе.
ре x(y\i\)—свободная энергия электростатического взаимодействия
заряженных групп при заданных наборах уа и г|(. Выражение Q учитывает тем
самым взаимное отталкивание заряженных групп; величина этого
отталкивания, естественно, зависит от конформаций звеньев, т. е. от набора ц*.
Расчет показывает, что отталкивание в спиральной конформаций цепи больше,
чем в клубкообразиой, и, следовательно, зарядка цепи должна способствовать
переход спираль — клубок. Нахождение статистической суммы по методу
Изинга позволяет количествеиио определить понижение Т при увеличении
степени ионизации цепи а, а также кривую титрования полипептида (рис. 81).
На последней отчетливо обнаруживается излом, соответствующий переходу
спираль—клубок. Теория хорошо согласуется с опытом (см. [33, 40]).
ОПТИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И ПОЛИПЕПТИДОВ 225
Таким образом, природа перехода спираль — клубок в
полипептидах ясна. Это—кооперативное конформационное
превращение, не являющееся фазовым переходом первого рода, но
практически мало от него отличимое и поэтому могущее быть
рассматриваемо как квазиплавление макромолекулы. Явление,
конечно, замечательное.
Переходы спираль — клубок в белках имеют такой же
характер. Принципиальное отличие белка от синтетического
полипептида состоит в наличии у белка специфической первичной
структуры и поэтому структуры третичной. Это находит свое
выражение в неполной спиральности белка — благодаря разнообразию
аминокислотных остатков и их специальному расположению,
благодаря, в частности, наличию серных цистиновых мостиков
часть материала макромолекулы не спирализована даже при
низкой температуре и нейтральном рН. Соответственно переход
оказывается менее резким, чем у полиаминокислоты. Выше
описаны оценки, данные Шерагой. Построение строгой теории
для белка — задача нерешенная и встречающаяся с трудностями
принципиального характера. Мы не располагаем пока
статистической теорией, эффективно учитывающей индивидуальные
свойства различных компонент ансамбля, а в белке таких
компонент 20, соответственно 20 сортам аминокислот. Более того,
свойства белка зависят от последовательности аминокислот,
белок— «апериодический кристалл». Сегодня трудно даже указать
путь построения такой теории*). Приходится поэтому
довольствоваться синтетическими моделями, дающими, к счастью, все-
таки очень ценную информацию.
ОПТИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И ПОЛИПЕПТИДОВ
Уже говорилось, что оптическая вращающая способность
резко изменяется при переходе спираль — клубок. По этому
изменению можно судить о переходе, оно чрезвычайно характерно.
В то же время изменяется и интенсивность ультрафиолетового
поглощения.
Оптические методы имеют особое значение в физике
молекул. В чем прежде всего выражается строение системы,
состоящей из атомных ядер и электронов — атома или молекулы?
В спектре такой системы можно вычислить все основные
константы, характеризующие свойства атомов и молекул, если
известны уровни энергии и вероятности переходов между ними.
Расстояния между уровнями выражаются в частотах или
длинах волн в спектре, вероятности перехода — в интенсивностях
*) См., однако, примечание на стр. 214,
15 М, В Волыи'шшейн
226
ГЛ. 5. ФИЗИКА БЕЛКА
соответствующих линий и полос. Строение атома было
определено на основании его спектра — в том и состояла задача
теории Бора. Спектроскопия молекул — один из важнейших
источников информации об их строении. Естественно поэтому, что
и физика белков обращается к спектрам при решении задач,
относящихся к строению
макромолекулы, в
частности, к их вторичной
структуре. Мы уже видели, что
инфракрасные спектры
позволяют различать а- и р-фор-
мы белков и полипептидов.
За инфракрасное
поглощение ответственны переходы
между уровнями
колебательной энергии молекулы
или, проще сказать,
колебания ее атомов. Напротив,
ультрафиолетовые спектры
I
N-V, (79MА) /г=3,053
\
С* N "в? (Г
B'->n*(W50A) /i=f,4JJ
я
п+б*(?5О0& {л=1,83
X
Рис. 82. Уровни энергии
электронов амидной
группы.
Рис. 83. Направления и величины
переходных моментов в амидной
группе.
определяются переходами между разными состояниями
электронов в молекуле. В не содержащих ароматические циклы
полипептидах ближайшие ультрафиолетовые полосы расположены в
достаточно далекой области спектра — вблизи 200 т^. Эти полосы
определяются изменениями состояния электронов в плоской
i
амидной группе 0=С—N—Н. Выше указывалось, что я-элек-
троны в такой системе частично обобщены и обладают
повышенной подвижностью. На рис. 82 показана схема электронных
уровней амидной группы, а на рис. 83 направления поляризации
соответствующих переходов, вычисленные теоретически [41].
ОПТИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И ПОЛИПЕПТИДОВ
227
CD
<г>
hv,
hv*
В этих направлениях лежат так называемые дипольные
моменты перехода \i или, если использовать классическую,
наглядную модель, происходят колебания электронных осцилля*
торов.
Прежде всего нужно учесть, что эти осцилляторы находятся
под влиянием окружающей среды. Рассматриваемая амидная
группа — хромофорная группа, ответственная за поглощение
света, находится под действием соседних молекул и других
звеньев цепи. Эти частицы, окружающие группу, в свою очередь
обладают зарядами,
постоянными дипольными момен- /-аз
тами и поляризуемостями.
Электростатические
взаимодействия хромофорной
группы со средой приводят
прежде всего к изменению
частот поглощения группы по
сравнению с ее частотами в
вакууме. Детальное
теоретическое и экспериментальное
исследование влияния
межмолекулярных сил на
электронные спектры
поглощения сложных молекул было
проведено Непорентом и Бах-
шиевым [42]. На рис- 84
показана схема,
иллюстрирующая сказанное [41]. Чем
больше поляризуемость и дипольный момент молекул
растворителя, тем больше сдвиг частоты поглощения в «красную
сторону» — в сторону меньших частот или больших длин волн. По
этой причине денатурация может вызывать сдвиг частот в
обратную сторону, увеличивать их и уменьшать длины волн. При
денатурации амидные группы могут переходить из окружения с
большей поляризуемостью в нативном белке в окружение q
меньшей поляризуемостью — в денатурированной форме в
растворе. Это действительно наблюдается [43].
Наличие регулярной совокупности большого числа
идентичных групп приводит к другому, не менее существенному
эффекту. Идентичные группы обладают одинаковыми энергетическими
уровнями. Вследствие этого квант света, поглощенный одной
группой, может мигрировать в соседнюю и т. д., если только
эти группы имеют регулярное и фиксированное расположение.
Каждая группа, взятая порознь, имеет свои собственные
уровни энергии, соответствующие основному и возбужденным
Рис. 84. Схема сдвига энергии молекулы
при ее помещении в растворитель.
13*
228
ГЛ. 5. ФИЗИКА БЕЛКА
состояниям. Допустим, что имеется основное и одно
возбужденное состояние. Переход электрона из первого во второе происходит
в результате поглощения света определенной частоты, с
определенной длиной волны. Если имеется большое число одинаковых
и регулярно расположенных групп, то поглощенная энергия
может перейти от первой группы ко второй и т. д. В системе
распространяется волна возбуждения, называемая экситоном.
Одновременно вследствие осуществляемого таким образом
взаимодействия групп — их резонанса — каждый энергетический
уровень расщепляется в целую почти непрерывную зону.
Полоса в спектре поглощения расщепляется на две или более
компонент. Это было установлено в важных работах Давыдова [44],
развившего теорию поглощения света молекулярными
кристаллами (см. также [45], гл. 12).. Термин «давыдовское
расщепление» является теперь общепринятым в мировой научной
литературе.
Но в а-спирали также имеется регулярная совокупность
большого числа идентичных амидных групп. Мы вновь
приходим к глубокой аналогии между свойствами регулярной
жесткой макромолекулы и кристалла. Расчет показывает, что
пептидная полоса 190 гп|л в результате Давыдовского расщепления
в а-спирали превращается в две полосы 198 m^i и 189 m\i.
Направление осциллятора в первой из них параллельно оси
спирали, во второй — перпендикулярно к ней [41, 46]. Это
согласуется с опытом.
Влияние конформационных изменений на интенсивность
поглощения также может быть объяснено теорией. Интенсивность
поглощения в данной полосе, отвечающей переходу О-w,
выражается так называемой силой осциллятора
^ = Щ~\^ (5-49)
где е и т — заряд и масса электрона, ft— квантовая постоянная,
Vot — частота перехода, равная разности энергий двух уровней,
деленной на ft:
vol = 4-(£,-*o)- (5.50)
(i0i«—дипольный момент перехода — так называемый
матричный элемент дипольного момента
где i|?o и ty]—соответственно волновые функции состояний
молекулы, между которыми осуществляется переход.
ОПТИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И ПОЛИПЕПТИДОВ 229
Сила осциллятора связана с наблюдаемым коэффициентом
поглощения полосы го* простым соотношением
fo* = 4,32-l(T9J4^v'. (5.52)
Интеграл берется по всей полосе поглощения; v'— частота,
выраженная в см"1 (v'=v/c, где с — скорость света).
Квантовая механика показывает, что сумма сил
осцилляторов для всех электронных
стеме есть величина
постоянная, равная числу
электронов. Поэтому
изменения интенсивностей в
отдельных полосах могут
происходить только в
результате
перераспределения интенсивностей. Оно
происходит благодаря
взаимодействию
переходных моментов- Одна
полоса «крадет»
интенсивность у другой.
Нас интересует
поведение наиболее
длинноволновых полос при кон-
формационном
превращении— при переходе
спираль— клубок. Если
взаимодействующие
переходные моменты двух полос
перпендикулярны друг к
другу, интенсивность вообще не меняется. Если моменты кол-
линеарны, направлены вдоль одной оси, интенсивность более
длинноволновой полосы увеличивается (за счет
коротковолновой), осуществляется гиперхромный эффект. Напротив, если
моменты параллельны друг другу, интенсивность более
длинноволновой полосы уменьшается — гипохромный эффект. В а-спи-
рали амидные группы параллельны друг другу, параллельны и
соответствующие переходные моменты. Поэтому наиболее
длинноволновая амидная полоса имеет меньшую интенсивность в
а-спирали, чем в статистическом клубке, — наблюдается гипо-
хромизм.
На рис. 85 показаны экспериментальные результаты для по-
лиглутаминовой кислоты [41]. При рН=4,9 полипептид
находится в состоянии а-спирали, при рН=8 —в состсянии клубку.
переходов в данной электронной си-
Л,/я/г
/80 790 200 210 220 230240Ш
5,6 5,4 5,2 5,0 4,8 4,6 4,4 4t2
v (слг1)-Ю~4
Рис. 85. Кривые поглощения для полиглу-
, таминовой кислоты.
Вертикальные линии показывают вычисленные
положения полос поглощения спирали.
230
ГЛ. 5. ФИЗИКА БЕЛКА
Видны две .полосы, возникшие в результате Давыдовского
расщепления, и большой гипохромизм — интенсивность поглощения
для клубка значительно больше, чем для спирали. Отношение
сил осциллятора / спираль// клубок составляет 0,7, что
находится в хорошем согласии с результатами теоретического
расчета. При денатурации происходит небольшой сдвиг максимума
поглощения в-красную сторону. Наблюдается также небольшой
гиперхромизм в области 215 тщ причина которого неясна.
Подробное изложение теории см. в работе Де Во [47].
Из изложенного следует, что ультрафиолетовые спектры
белков могут дать очень ценные сведения об их строении. Здесь
много нерешенных экспериментальных и теоретических проблем.
Сколько-нибудь полные расчеты проведены только для
простейших полипептидов. Велики затруднения, связанные с
необходимостью работы в далекой ультрафиолетовой области спектра.
Но игра стоит свеч — дальнейшие исследования обещают
многое. В связи с этим надо указать на большую актуальность
построения общей теории электронных спектров полимеров,
учитывающей кооперативность конформаций соседних звеньев даже
в статистических клубках.
Перейдем теперь к оптической активности. Как и все
оптические явления, она тесно связана с электронными спектрами
([45], гл. 11, [48]). Обычная поляризуемость молекул,
ответственная за показатель преломления среды, выражается следующим
образом:
е2 у! foi _ eb мл fi»*t» ,_ _0,
ё, m — заряд и масса электрона, с — скорость света. В
числителе этой формулы стоят силы осциллятора, резонансный
знаменатель содержит разность квадратов частоты соответствующего
электронного перехода vo* и частоты падающего света v.
Подставляя (5.49) в (5.53), получаем
Показатель преломления газа, состоящего из молекул с
поляризуемостью а, равен
я=1 + 4лЛГ,а=Н —>,Т2—7Г • (5-55)
ОПС •" А — Aqj
Таким образом, отличие показателя преломления от единицы
и его. зависимость qt частоту или, что „то же самое, от длины
ОПТИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И ПОЛИПЕПТИДОВ 231
волны падающего света определяется наличием полос
поглощения в спектре молекулы. Вода имеет п =1,35 для желтого света
потому, что она поглощает свет в далекой ультрафиолетовой
области спектра. По мере приближения к полосам поглощения п
возрастает — наблюдается дисперсия света. В самой области
поглощения п—1 меняет знак — наблюдается аномальная
дисперсия. Формулы (5.53) — (5.55) справедливы для нормальной
дисперсии — в области спектра, удаленной от полос поглощения
вещества.
Важнейшее для молекулярной биофизики оптическое
явление— оптическая активность, естественное вращение плоскости
поляризации света средой, состоящей из асимметричных
молекул. Как показал еще Френель, оптическая активность есть
круговое двулучепреломление света. Иными словами, поворот
плоскости поляризации в активной среде определяется различием
в скоростях распространения света, поляризованного по кругу
вправо и влево. В самом деле, электрический вектор в линейно
поляризованной световой волне может быть представлен как
наложение двух волн — одной, поляризованной по кругу вправо,
и другой, поляризованной влево. При различных скоростях
распространения этих волн между ними возникнет разность фаз и
результирующий вектор линейно поляризованной волны
повернется на угол ф', равный
¥ = j(nL-nR)L (5.56)
где nL и nR — показатели преломления для левой и правой
волны, К—длина волны, / — длина пути, проходимого светом в
активной среде. На единицу длины пути (обычно выражаемого
в дм) угол вращения равен
Ф = у (nL — nR) град/дм. (5.57)
Оптически активные вещества характеризуют удельным
вращением [а]:
[а] = Д-—— град • см3/дм ■ г, (5.58)
с' — концентрация растворенного вещества в г/см3.
Молекулярное вращение
M = I«lw = *lf#' (5-59)
где М — молекулярный вес.
Почему же среда, состоящая из асимметричных молекул,
обладает круговым двулучейреломлением? Ответ на этот вопрос
232 ГЛ. 5, ФИЗИКА БЕЛКА
в качественной форме дала электронная теория — работы Дру-
де, Борна, Озеена — ив строгой количественной форме
квантовая механика—работа Розенфельда. В молекулярной теории
распространения света в вещественной среде (в теории
поляризуемости) размеры молекулы принимаются исчезающе малыми по
сравнению с длиной волны света. В самом деле, порядок
размеров молекул (не макромолекул) Ю-8—10~7 см, а длины волн
видимого света порядка 10~5 см, Это значит, что теория
пренебрегает различием фаз световой волны в разных точках
молекулы. Такая теория прекрасно объясняет преломление и
дисперсию света, но принципиально недостаточна для истолкования
оптической активности. Оптическая активность есть эффект
порядка отношения d/X (d — размер молекулы), определяемый
г именно различием фаз световой волны в
разных точках молекулы, так сказать,
внутримолекулярной интерференцией (Обреимов).
Расчет показывает, что при наличии в молекуле
плоскости или центра симметрии оптической
активности не будет. Простейшая модель
оптически активной молекулы, предложенная
Куном (ему же принадлежит кинетическая
Рис. 86. Двухос- теория упругости каучука, стр. 152), состоит
цилляторная мо- из двух осцилляторов (двух электронов), на-
дель Куна. ходящихся на некотором расстоянии друг от
друга и колеблющихся в различных
плоскостях .(рис- 86). Здесь соблюдены оба условия — имеется
расстояние d, которым нельзя пренебречь, и модель лишена плоскости
и центра симметрии. Однако для оптической активности
необходимо и третье условие, всегда реализуемое в молекулах,—
колебания электронов должны быть связаны друг с другом.
Строгая квантовая теория выражает оптическую активность
через переходные моменты — электрический до* и магнитный mi0:
mi0 = j %m% dx, (5.60)
т — вектор магнитного момента. Имеем
ф = —ёг— Р> (5.61)
где р — молекулярный параметр оптической активности, равный
Символ Im означает, что нужно брать-лишь мнимую часть
комплексного выражения йо/^/о*
ОПТИЧЕСКИЕ СВОЙСТВА БЕЛКОВ И ПОЛИПЕПТИДОВ 233
Сравним формулы (5.62) и (5.54), Они похожи, Это —
дисперсионные формулы, В числителе каждого члена суммы для
поляризуемости стоит так называемая дипольная сила
а в числителе каждого члена в (5.62) —сила вращения
Дипольная сила (т, е, сила осциллятора) находится из
интенсивности поглощения, Как же найти из независимого опыта
силу вращения, отвечающую данному электронному переходу
(W?
Так же как поляризуемость связана с обычным поглощением
света, оптическая активность связана с эффектом Коттона,
с круговым дихроизмом (стр, 111). Круговой дихроизм, т, е. раз*
личное поглощение правого и левого циркулярно-поляризован*
ного света, находит свое выражение в том, что свет с А,, отве*
чающей поглощению, пройдя через оптически активную среду,
не только испытает поворот плоскости поляризации, но станет
еще и эллиптически поляризованным, Мера эллиптичности
0. =-?<**-**)• (5.65)
где хл, Xl — показатели поглощения для правой и левой волн.
Если свет с интенсивностью /о прошел в среде с показателем
поглощения х путь /, то его интенсивность уменьшается до
Показатель х связан с молекулярным коэффициентом поглоще*
ния 8 выражением
где с — концентрация поглощающего вещества, выраженная в
молях на литр.
Сила вращения данной полосы выражается через
эллиптичность, подобно тому, как дипольная сила или сила осциллятора
выражается через показатель поглощения
Интеграл берется по всей полосе поглощения, Таким образом,
прямое измерение эффекта Коттона дает значения основных
констант—сил вращения.
234
ГЛ. 5. ФИЗИКА БЕЛКА
Теория показывает, что в то время как сумма всех диполь-
ных сил есть константа, равная общему числу электронов в
молекуле, сумма сил вращения равна нулю:
2 Я* = 2 Im (Ро/Л1/о) = 0- (5.69)
Действительно, по правилам матричного исчисления,
а такое выражение вещественно, и его мнимая часть
тождественно равна нулю. Из этого важного соотношения следует, что
оптически активное вещество должно характеризоваться по
крайней мере двумя полосами поглощения, обладающими
разными знаками Ri или 0г. Модель Куна удовлетворяет этому
условию: в простейшем случае, когда оба осциллятора
одинаковы, но колеблются, будучи связаны друг с другом, модель
имеет два нормальных колебания — в фазе и противофазе, с
противоположными знаками 0. Дальнейшие подробности о
теории оптической активности см. в [45, 48].
Таким образом, оптическая активность обладает
специфической дисперсионной зависимостью от v (или К). Вдали от
собственной полосы поглощения дисперсия оптической активности
простых молекул может быть приближенно выражена формулой
Друде
Здесь Ко — некоторая эффективная длина волны, отвечающая
поглощению света. Формула Друде соответствует одному члену
формулы (5.62). В самом деле,
г ч го 1800 28 800 jiW, 9o
М=-г—= -?—«r-*» =
_2880(W, я 2 yi Ri _ 28 800 я//, V Rfai /с 7П
И если ограничиться одним членом этой формулы, отождествив
Koi с Ао, то получаем (5.70) с
А = ^^*Л (5-72)
ОПТИЧЕСКАЯ АКТИВНОСТЬ а-СПИРАЛЕЙ 235
В расчетах необходимо еще учесть показатель преломления
среды (поправка Лорентца). Соответственно в выражение tp
нужно ввести множитель (/г2+2)/3.
Обратимся теперь к экспериментальным данным,
относящимся к белкам и синтетическим полипептидам.
ОПТИЧЕСКАЯ АКТИВНОСТЬ а-СПИРАЛЕЙ
При переходе спираль — клубок происходит значительное
изменение оптической активности. Во многих исследованных
случаях это изменение оказалось одного и того же порядка. Поли-
бензилглутамат в диоксане (спираль) имеет [а]о =+9°, в
трифторуксусной кислоте (клубок)—46°. Изменение составляет
55°. Как уже говорилось, оно объясняется исчезновением
вращающей способности спирали как целого.
Для проверки этого естественного предположения Доти и
сотрудники изучили оптическую активность сополимеров L и D
у-бензилглутамата [49]. При увеличении числа D-остатков,
включаемых в полипептидную цепь, удельное вращение спирали
возрастало до больших положительных значений, а у клубка
пропорционально убывало до нуля. Доти и Лундберг [50]
получили ряд сополимеров, инициируя смеси D и L W-карбокси-
ангидридов бензилглутамата (из которых синтетически
получаются полипептиды) чистыми /,-полипептидами, уже имевшими
спиральную конформацию. Если бы эти инициирующие
полипептиды имели спирали с одним определенным направлением
вращения, то оно должно было бы сохраняться и при росте цепи
за счет добавления новых D- и L-групп. После того, как
добавлялось около 25 таких остатков к каждой цепи, измерялась
оптическая активность и из полученного значения вычиталась
оптическая активность инициирующей цепи. Полученная таким
образом зависимость [а] от процентного содержания D-rpynn
показывает, что удельное вращение линейно растет с
увеличением этого содержания вплоть до 30% D-групп. При
содержании D-групп, превышающем 30%, кривая загибается вниз, что
объясняется перестройкой левой спирали в правую при наличии
последовательностей из четырех D-rpynn [51]. При
концентрации, меньшей 30%, наличие таких последовательностей
маловероятно. Экстраполируя полученную прямую к 50% D-групп
(рацемическая смесь аминокислот в полипептиде), Доти и Лундберг
получают [а]=54°. Эта величина характеризует оптическую
активность самой спирали и находится в прекрасном согласии
С найденной на опыте разностью 55°. Изложенное можно
236
ГЛ. 5. ФИЗИКА БЕЛКА
выразить следующими соотдошениями:
1а1спираль == 1а1спираль ~Т" Достатки == ~Т" ° »
как целое
1а1клубок = [Достатки = 4и .
Следовательно,
Нспираль = 9° - (- 46°) = 55°,
как целое
С другой стороны, для сополимера
1а1спираль == [^спираль I V^L ^Df Достатки»
как целое
где xL, xD — доли I- и D-остатков. При 50% L и D
гЧспираль ^= гЧспираль =г=г "4 .
как целое
Следовательно, при переходе спираль — клубок действительно
происходит плавление спирали и ее оптическая активность
исчезает так же, как оптическая активность кристаллического
кварца при его плавлении. Вновь та же аналогия с кристаллом!
Наблюдается и другая особенность оптической активности
спирали. Дисперсия оптической активности малых молекул или
отдельных групп выражается, как уже сказано, формулой Друде
(5.70), которую мы перепишем в виде
3 М „ А*
IQ] = 3TT^H = «-^TT- (5-73)
-0.
/1*4-2 loo *"J a*—aj
Оказалось, что дисперсия спирали описывается более сложной
закономерностью (52] (Моффит)
[QI = (а + аспираль) -^^ + b (-^т)2> <574)
я, ^спираль, Ь — константы. Для а-спиральных синтетических
полипептидов ^спираль = 650, Ь =—630, Ао=212 m\i. Константы
^спираль и Ъ определяются независимо по ходу дисперсии. Надо
отметить, что дисперсия оптической активности кристаллических
кварца и киновари также описывается не простой формулой
Друде, а квадратичной формулой типа (5.74) [53]. Как же
объяснить специфическую дисперсию оптической активности
спиралей?
Общая формула строгой теории оптической активности
(5.71) не дает еще возможностей практических расчетов
применительно к конкретным задачам. Для этого нужно было бы
ОПТИЧЕСКАЯ АКТИВНОСТЬ а-СПИРАЛЕП
237
знать полный набор волновых функций молекулы г|э*. Как всегда,
в квантовой химии приходится искать упрощенные,
приближенные методы, позволяющие обойти эту трудность. До недавнего
времени такие методы в теории оптической активности были
весьма несовершенны, позволяя вычислять силы вращения в
лучшем случае с точностью до порядка величины. Только этим
объясняется недостаточное применение оптической активности
при исследовании строения молекул. Ведь оптическая
активность— явление, может быть, наиболее чувствительное к любым
изменениям структуры молекул и их окружения. Однако, во-
первых, в работах Джерасси [54] было доказано, что
существующие теоретические представления позволяют извлечь
важные сведения о строении малых молекул и, в частности, об их
конформациях из дисперсии оптической активности (ранее
стремились к расчету оптической активности для одной длины
волны— обычно D-линии Na — и это приводило к плохим
результатам). Во-вторых, специфика строения линейных полимеров и
здесь вносит определенные упрощения, позволяя
интерпретировать дисперсию оптической активности спиралей и клубков.
Были предложены две теории оптической активности,
опирающиеся на общую формулу (5.71). Первая теория может
быть названа теорией поляризуемости. Каждая группа атомов
в молекуле обладает анизотропной поляризуемостью. Так, связь
С—Н имеет поляризуемость ai = 7,9«10~25 см3 вдоль связи и
а2=5,8'10~25 см3 в перпендикулярном направлении. Учет
анизотропных поляризуемостеи связей позволяет исследовать ряд
оптических свойств молекул на основе так называемой валентно-
оптической схемы (см. [45]). В теории оптической активности
необходимо рассмотреть взаимодействие диполей,
индуцированных электрическим полем световой волны в каждой из связей
или групп молекулы. При этом получается приближенное
выражение оптической активности через поляризуемости групп и
связей а и их относительное расположение в молекуле
Р = Т S "3" (a*i — a«) («и — *й) X
6Й Пи
Х(г,ЛА/]){а/-3^^1, (5.75)
rkl —вектор, соединяющий группы k и /, А, / — единичные
векторы, направленные вдоль осей симметрии этих групп, аьи ссй2—
продольные и поперечные поляризуемости. Легко показать, что
при наличии центра или плоскости симметрии р обращается
в нуль. Формула (5.75) была получена квантовомеханическим
путем Кирквудом [55]. Позднее удалось получить то же
238
ГЛ. 5. ФИЗИКА БЕЛКА
выражение на чисто классической основе н учесть дальнейшие
приближения [56].
Формулы типа (5.75) и идеи теории поляризуемости были
применены Фиттсом и Кирквудом к расчету оптической
активности а-спирали, к объяснению специфической дисперсии (5.74)
[57]. Моффит провел квантовомеханическое рассмотрение
регулярной спирали на основе теории Давыдова, также исходящее
из учета диполь-дипольного взаимодействия [58,59]. Объединение
теорий Моффита, Фиттса и Кирквуда дано в [60]. Квадратичная
зависимость (5.74) действительно получается.
Новый вариант теории, отличающийся особой простотой и
ясностью, дан Мак Лахланом и Боллом [60а]. Как и у Моффита,
рассматривается влияние упорядоченности на электронный
спектр, возникающее в результате диполь-дипольного
взаимодействия. В простейшей модели — в димере — происходит
расщепление частот. Вместо частоты свободного мономера vo
появляются две частоты vi и V2:
Vi = v0+K v2 = v0-l/. (5.76)
где V характеризует энергию взаимодействия двух переходных
диполей, зависящую от их величины и геометрического
расположения диполей в димере. Двум частотам отвечают силы
вращения, отличающиеся только знаком. Следовательно,
[а] = const • /?
что при малом значении V, малом экситонном расщеплении,
дает отрицательный квадратичный вклад в оптическую
активность:
[а = const • НУ2-т-о—94-7^5 5Г = — const - #7-5—ж». фЛЪ)
1 ' (vl-V^(V2-*V) (V0-*VT
Моффит ограничивался рассмотрением только лл
переходов в пептидной связи. Необходимо учитывать, однако, и
гораздо более слабые ял переходы, что сделали Шеллман и Ориел
(см. далее). Необходимость учета и тех и других переходов
подробно аргументирована Хольцвартом и Доти [606]. Из их
работы следует, что экситонная теория дает количественное
истолкование электронного спектра а-спирали, но недостаточно
точна для определения ее оптической активности.
Таким образом, ситуация сложная, Теория
поляризуемости имеет существенные недостатки. Она заведомо
неприменима к рассмотрению молекул с сопряженными связями.
Такие связи нельзя охарактеризовать автономными эллипсоидами
/ у2 у2 \
U„v2 V*-V2j
(5.77)
ОПТИЧЕСКАЯ АКТИВНОСТЬ а-СПИРАЛЕЙ
239
поляризуемости; приходится рассматривать всю систему
сопряженных связей, например бензольное кольцо, как одну группу.
Это ограничение валентно-оптической схемы не столь важно в
нашем случае — белки или полипептиды не являются
сопряженными системами. Это и позволяет строить теорию оптических
свойств а-спиралей по аналогии с теорией молекулярных
кристаллов, считая амидные группы в первом приближении
независимыми. Более существенно то, что при малых расстояниях
между атомами, свойственных молекулам, предположение о ди-
поль-дипольном взаимодействии нестрого. Поэтому теория
поляризуемости гораздо лучше применима к исследованию
влияния межмолекулярного взаимодействия на оптическую
активность [61].
Принципиальный недостаток теории поляризуемости состоит
в том, что она связывает оптическую активность с наиболее
интенсивными полосами поглощения, определяющими
поляризуемость, в то время как общая теория указывает на важнейшую
роль не дипольных сил, а сил вращения. Эти последние могут
быть велики как раз для слабых, а не сильных полос — для
полос с малыми цоь но большими т^. Можно сказать, что теория
поляризуемости учитывает лишь часть оптической активности,
определяемую сильными полосами. Не удивительно, что она
дает совпадение с опытом лишь по порядку величины.
Вторая приближенная теория оптической активности,
позволяющая проводить конкретные расчеты, основана на так
называемой одноэлектронной модели [45—48]. Рассматривается
поведение наиболее подвижного электрона хромофорной группы
(в нашем случае — амидной группы) в возмущающем
асимметрическом поле окружающих атомов. Это — квантовомеханиче-
ская теория, непосредственно учитывающая и электрические и
магнитные моменты перехода, фигурирующие в выражениях для
сил вращения (5.64). Расчеты проводятся с помощью
приближенных волновых функций. Вклады остальных электронов не
учитываются. Теория свободна от недостатков более наглядной
теории поляризуемости и может служить основой для
интерпретации данных по дисперсии оптической активности как вне, так
и внутри полосы поглощения.
Шеллман и Ориел [62] провели экспериментальное
исследование аномальной дисперсии оптической активности некоторых
белков и полипептидов в области 225 m^i и объяснили
полученные кривые на основе одноэлектронной модели. Они рассчитали
асимметричное электростатическое поле спирали и его влияние
на слабый пл переход в амидной группе, показав, что
благодаря спиральному полю возникает магнитный переходной
диполь. Несмотря на ряд допущений и приближений, эта работа
240
ГЛ. 5. ФИЗИКА БЕЛКА
дает истолкование соответствующего вклада в оптическую
активность. Исследование общей формулы (5.62) показывает, что
она содержит члены, отвечающие одноэлектронной теории,
теории поляризуемости и другие.
Тиноко провел более строгие расчеты оптической активности,
исходя не из частных приближений, а из общей теории [63—65];
он показал, что вдали от собственных полос поглощения
дисперсия должна быть близка к моффитовой. Однако возможность
учитывать лишь одну эффективную длину волны представляется
в свете этих более строгих расчетов сомнительной. Тиноко
рассмотрел также круговой дихроизм спиралей.
Несмотря на эти работы, до сих пор не построена полная
количественная теория, учитывающая конкретную атомную
структуру а-спирали. Таким образом, формулу Моффита (5.74)
следует оценивать пока что как полуэмпирическую. Это не
мешает пользоваться ею для оценки степени спиральности белков.
При проценте спиральности, равном Д вместо (5.74) следует
написать
Щ=а Л2^Л2 +/ (^спираль jfj^ + & (tf — tff Г ^5'79)
/ может быть определено из наклона прямой на графике, по оси
ординат которого отложена величина а по оси
абсцисс (А-До—l)" . Это — определение по величине Ь.
Независимо / определяется по отрезку, отсекаемому этой прямой на
оси ординат; при известном из данных для денатурированного
белка значении а это — определение по величине Дспираль-
Танфорд [66] показал, однако, что при небольших
экспериментальных значениях Ь интерпретация их как bf и определение
из них процента спиральности * недостаточно надежны. Метод,
несомненно, нуждается в подробном теоретическом
истолковании и дальнейшем исследовании. Тем не менее можно
утверждать, что степень спиральности белка должна в первую
очередь изучаться методом дисперсии оптической активности (и
кругового дихроизма в полосе поглощения) и что полученные
таким способом данные несравненно более точны, чем
определяемые по дейтерообмену.
Недавно Шехтер и Блоут показали, что дисперсия
оптической активности полипептида вдали от полосы поглощения
может быть представлена не формулой Моффита, а двучленной
формулой Друде [67]. Не пользуясь эффективной длиной волны
io = 212 тц, а учитывая экспериментально наблюдаемые
максимумы поглощения Ai=193 m^i и А,2=225 пцх, имеем следующее
ОПТИЧЕСКАЯ АКТИВНОСТЬ а-СПИРАЛЕЙ
241
значение наблюдаемого вращения, приходящегося на одну
пептидную группу:
Ы =
А "~~ Ai
+
А2-А
(5.80)
Константы А\ и А2 связаны линейным соотношением. В водных
растворах
А2 = — 0,55Д — 430.
Аг — положительна, А2 — отрицательна. В органических
растворителях (синтетические полипептиды)
А2 = — 0,55 Аг — 280.
На А\ и А2 влияет только диэлектрическая постоянная
растворителя. В состояниях клубка Лг = 0, А\ = —600 (1,1 кополи-
/,-метионин-/,-метил-5-цистеин в 1 : 1 смеси дихлоруксусной и
трифторуксусной кислот), в а-спирали А \ = 3020, А2= — 1900
(поли-А-метионин в хлороформе). Отсюда процент спиральности
. _Л]+600
'193_ 36,2
/225 —
19,0'
Более удобно пользоваться общим эмпирическим уравнением
(5.81)
. _ Ах — Л2 + 650
' ~ 55,8
В табл. 13 приведены данные, вычисленные с помощью
последнего метода. Эти данные отличаются от полученных с помощью
формулы Моффита. Для контроля необходим независимый
метод определения.
Таблица 13
Процент спиральности нативиых белков
в водных растворах
Белок
Альбумин плазмы . .
Яичный альбумин . . .
из Ь
0,88
0,75—0,80
0,70—0,80
0,46
0,38
0,31
0.29
0,16
из аспираль
0,87
0,58
0,57
0,50
0,39
0,17
по (5.81)
0,97
0,53
0,40
0,72
0,48
0,64
16 М. В. Волькеиштейн
242
ГЛ. 5. ФИЗИКА БЕЛКА
сс-спираль
R
/фаситель
\J
so
Наиболее ценная информация о структуре белков и
полипептидов может быть получена при измерении оптической
активности и кругового дихроизма непосредственно в полосах
поглощения. Таких работ пока мало — необходима специальная
аппаратура для далекой ультрафиолетовой области спектра.
Круговой дихроизм измерялся в работах [60а] и [62]. Степень
спиральности также может быть определена в таких
исследованиях.
В связи с этим необходимо указать на ошибочное
применение термина «эффект Коттона» в тех случаях, когда измеряется
аномальная дисперсия оптической активности. Эффект
Коттона— это круговой дихроизм, и именовать таким образом
аномальную дисперсию
оптической активности не
более осмысленно, чем
называть поглощением
света аномальную дисперсию
преломления света.
Блоут и сотрудники
[68] открыли важную
возможность изучения
аномальной дисперсии
оптической активности
биополимеров не в
ультрафиолетовой, а в видимой
области спектра. Изучалась
оптическая активность
полипептидов, сорбировавших молекулы красителей. Эти
молекулы симметричны, они плоские и поэтому собственной
оптической активностью не обладают. Однако комплексы спиральных
макромолекул с акридиновыми красителями обнаруживают
аномальную дисперсию оптической активности в полосах
поглощения красителя. Аналогичные результаты получены для белков —
ферментов, содержащих простетические группы с
длинноволновыми полосами поглощения, для миоглобина и гемоглобина [69].
При денатурации биополимера эффект исчезает — никакой
аномальной дисперсии оптической активности в видимой области
спектра не остается (см. стр. 409). Чем же можно это объяснить?
Возможны три альтернативы: асимметрия в каждой молекуле
красителя индуцируется асимметричным окружением, молекулы
красителя образуют спираль, навитую на а-спираль
полипептида; молекулы красителя полимеризуются под влиянием а-спи-
рали в свою собственную спираль (рис. 87). Оказалось, что
справедливо только первое предположение: эффект наблюдается
и при очень малом относительном содержании молекул краси-
Рис. S7. Возможные модели
взаимодействия молекул красителя с а-спиралыо.
ОПТИЧЕСКАЯ АКТИВНОСТЬ а-СПИРАЛЕЙ 243
теля, что исключает вторичные спирали с достаточно близкими
друг с другом молекулами красителя [70]. Индуцированная
аномальная дисперсия оптической активности особенно важна для
изучения ферментов. Это явление наблюдается и у комплексов
нуклеиновых кислот с красителями.
Таким образом, изучение оптической активности дает
возможность ответить на существенные вопросы молекулярной
биофизики— исследовать конформации биополимеров и их
изменения. Мы должны быть благодарны природе за этот дар —
асимметрию биологических молекул.
Ряд задач здесь еще не решен. Необходимо дальнейшее
развитие теории и эксперимента. Весьма перспективны прямые
измерения эффекта Коттона — количественная интерпретация
аномальной дисперсии оптической активности требует знания
эллиптичности. Необходимы измерения аномальной дисперсии
оптической активности в собственных полосах поглощения
биополимеров— в далекой ультрафиолетовой области спектра.
Подобно поляризуемости величина р и сила вращения являются
тензорами — оптическая активность различна по разным
направлениям в молекуле. Расчеты показывают, что оптическая
активность вдоль и поперек спирали может иметь даже разные знаки.
Нет сомнения в том, что определение анизотропной оптической
активности обещает новую ценную информацию о структуре
биополимеров. Для такого определения необходимо
ориентировать макромолекулы. Здесь, к сожалению, трудно
воспользоваться ориентирующим действием электрического поля, так как
биополимеры — полиэлектролиты и в поле будут подвергаться
электрофорезу. Пока что удалось провести измерения только
в одном случае — для полибензилглутамата — неполиэлектро-
литной полиаминокислоты [71]. Однако, можно думать, что эти
трудности удастся преодолеть.
Есть веские основания считать, что очень ценную
информацию о структуре биополимеров может дать исследование
эффекта Фарадея — оптической активности вещества,
помещенного в магнитное поле. Здесь особенно интересны измерения в
области полос поглощения.
Теоретическая и экспериментальная поляриметрия — важная
область молекулярной биофизики.
ГЛАВА 6
ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
БИОЛОГИЧЕСКАЯ РОЛЬ НУКЛЕИНОВЫХ КИСЛОТ
Прежде чем говорить о строении и физических свойствах
нуклеиновых кислот, необходимо рассмотреть их биологическую
роль. На страницах этой книги неоднократно указывалось, что
ДНК — основное генетическое вещество, что нуклеиновые
кислоты ответственны за синтез белков. Пора наконец привести
доказательства этих утверждений.
Как уже говорилось, ДНК локализована в хромосомах —
органоидах, ответственных за передачу наследственной
информации. Содержание ДНК в хромосомах весьма показательно. Во-
первых, содержание ДНК в диплоидных (соматических) клетках
разных тканей у особей одного и того же вида весьма
постоянно. Во-вторых, в гаплоидных половых клетках
(сперматозоидах) количество ДНК вдвое меньше, чем в соматических
клетках. Это иллюстрируется следующей таблицей.
Таблица 14 [1]
Среднее содержание ДНК. в клеточных ядрах в пикограммах
(10~12 г) иа ядро
Орган
Крыса
6,4
6,7
6,5
6,7
6,6
—
6,5
7,3
—
,^_
Курица
2,6
2,3
2,6
2,6
2,5
2,7
2,3*)
2,5*)
1,3
Бык
6,4
6,3
—
—
—
—
—
,^_
2,8
Лягушка
15,7
—
—
15,0
—
—
—
—
Тритон
_
—
—
7,3
—
—
3,7
Карп
3,3
—
—
3,5
—
—
—
—
i,6
Печень
Почка
Селезенка
Легкое
Лейкоциты
Эритроциты
Сердце
Поджелудочная железа
Мозг
Мышца
Сперма
*) Зародыш цыпленка
биологическая роль нуклеиновых кислот 245
Эти факты сами по себе с достаточной ясностью
свидетельствуют о генетической роли ДНК* Характерно, что содержание
других биологических функциональных веществ, входящих в
состав хромосом и клеточных ядер — рибонуклеопротеидов,
белков,— не постоянно, а варьирует от одних тканей к другим.
Содержание ДНК в клетках удваивается при митозе, т. е.
при удвоении числа хромосом.
Если ДНК — генетическое вещество, то она должна быть,
с одной стороны, особенно устойчивой к внешним воздействиям,
с другой — способной к изменениям под действием мутагенных
агентов. И действительно, ДНК — вещество, обладающее особой
метаболической стабильностью, что доказывается прямыми
опытами с мечеными атомами. Меченый (содержащий Р32) аденин
не включается в ДНК неделящихся клеток. Если клетки делятся
(опыты с Escherichia coli) в среде, содержащей меченые
атомы— они включаются во вновь образуемую ДНК, но в
дальнейшем в ней сохраняются, практически не участвуя более в
метаболизме. Синтез ДНК является необратимым процессом.
Интересно, что в клетках злокачественных опухолей (опыты на
мышах) метаболическая стабильность ДНК нарушается и
происходит заметное включение Р32 и С14. В целом многочисленные
опыты показывают, что ДНК, не являясь полностью инертной
в обмене веществ, гораздо более стабильна, чем другие
компоненты клетки. Причины повышенной стабильности нативной ДНК
лежат в ее специфической вторичной структуре (см. следующий
раздел). Вопрос о замечательной устойчивости наследственного
вещества, поставленный Шредингером [2], решен современной
наукой.
В то же время доказано участие ДНК в мутагенезе. Спектр
действия ультрафиолетовых лучей, вызывающих мутации,
совпадает со спектром поглощения нуклеиновых кислот (максимум
поглощения у 260 m^i). Этот факт сам по себе не вполне
доказателен, так как мутагенное действие коротковолновой
радиации сложно — кванты света могут поглощаться ДНК, но влиять
через посредство химических реакций на какое-либо иное
вещество. Имеются, однако, доказательства изменений ДНК,
вызываемых радиацией. Совсем не случайно образцы ДНК был^
отправлены на одном из советских кораблей в Космос — это
было сделано с целью изучить влияние космических лучей на
ДНК, для того чтобы понять их мутагенное действие.
Еще более определенные сведения дает изучение химического
мутагенеза. Заменгоф и сотрудники [3] показали, что при
включении в ДНК 5-бромурацила, вещества, аналогичного тимину,
возрастает частота мутаций. Мутагенное действие азотистой
кислоты можно проследить химически. Оно состоит в замене
246 ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
■аминогруппы на гидроксил — в дезаминировании
— NH2-f HN02 —> — ОН + N2-f H20.
*
Тем самым азотистая кислота превращает цитозин в урацил,
гуанин в ксантин и аденин в гипоксантин. Речь идет о вполне
определенных изменениях именно ДНК, которые и проявляются
в мутациях (см. стр. 350).
Замечательным доказательством генетической роли ДНК
является трансформация бактерий. В 1928 г. Гриффит открыл
трансформацию пневмококков (Diplococcus pneumoniae). My-
тантные штаммы пневмококков разнятся характером своих по-
лисахаридных клеточных оболочек. Эти различия
обнаруживаются иммунологически (гл. 8) и непосредственно по виду
колоний. Штамм S образует «гладкие» блестящие колонии —
клетки имеют прочные капсульные оболочки. Штамм R состоит
из клеток, утративших способность вырабатывать необходимый
для таких капсул полисахарид — колонии являются
«шероховатыми». Если живая культура типа R вспрыскивалась в мышь —
обычную жертву биологических экспериментов—вместе с
убитыми пневмококками типа S, мышь заболевала пневмонией и
посев размножившихся в ней бактерий давал живую культуру
вирулентных пневмококков типа S. Отсюда следует, что
мертвые бактерии S содержат некий трансформирующий фактор,
способный превращать штаммы R в штамм S. Далее было
показано, что бактериальная трансформация может быть
осуществлена не только in vivo —в организме мыши или другого
животного, но и in vitro. Трансформации установлены в ряде
бактерий в Bacillus subtilis, в Е. colt и т. д. Оказывается
возможным, в частности, трансформировать устойчивость к тем или
иным антибиотикам или сульфамидам. Природа
трансформирующего фактора вначале была не ясна. Но* в конце концов,
в результате весьма сложной и трудоемкой работы удалось не
только выделить этот фактор в чистом виде, но и полностью
его охарактеризовать.
Оказалось, что трансформирующий фактор — ДНК. Это было
впервые показано Эвери, Мак Леодом и Мак Карти [4]. ДНК,
выделенная из клеток типа S, при добавлении в среду, на
которой растет культура R, вызывает трансформацию #->S, причем
тип S дальше размножается неограниченно. В этих и
последующих опытах было доказано, что трансформирует именно чистая
ДНК — примеси белков и других веществ были исключены.
Более того, дезоксирибонуклеаза (ДНК-аза) — фермент,
расщепляющий ДНК, прекращает трансформацию.
Особенно подробно явление трансформации было изучено
Готчкисом [5, 6, 7]. В частности, им была исследована способ-
биологическая роль нуклеиновых кислот 247
ность пневмококков к так называемому индуцированному
синтезу фермента — дегидрогеназы маннита. Имеется штамм,
способный использовать маннит (шестиатомный спирт
СН2ОН(СНОН)4 СН2ОН) в качестве источника углерода, т. е.
вырабатывающий соответствующий фермент, причем
присутствие маннита стимулирует выработку фермента — в его
отсутствие клетки лишены нужной ферментативной активности (см.
стр. 335). Мутантный штамм лишен такой способности. ДНК.
извлеченная из первого штамма, превращает мутантные клетки
в клетки, способные вырабатывать фермент при индуцирующем
действии маннита.
ДНК может переносить несколько генетических признаков
сразу. Так, например, один вид ДНК может передать
пневмококкам устойчивость к пенициллину и стрептомицину, а также
способность образовывать капсулы. Среди трансформированных
клеток 98% приобретают одну из трех характеристик, 2% —две
из трех и только 0,01% — все три. Оно и понятно, вероятности
таких трансформаций следует считать независимыми, и поэтому
вероятность двойной трансформации равна произведению
вероятности двух одиночных. Это указывает на включение в
трансформируемые клетки только части материала, содержащегося
в ДНК. Сказанное иллюстрируется табл. 15.
Таблица 15 [8]
Трансформация устойчивости к стрептомицину и пенициллину
и способности использовать маииит у пневмококков
Свойства
Донорной ДНК
MS
Ms + mS
Ms
mS
MsP
Акцепторных
клеток
ms
ms
tnS
Ms
msp
Свойства траисформантов
Единичных
Ms mS
Ms mS
MS (ms)
MS (ms)
Msp msP
Двойных
Много MS
Меньше, чем в среднем MS
Много MS
Много mS
Меньше, чем в среднем MsP
Здесь М — использование, т — неиспользование маннита, S —
устойчивость, s — неустойчивость к стрептомицину, Р —
устойчивость, р — неустойчивость к пенициллину.
Что же в сущности происходит при трансформации? Это
поясняется схемой рис. 88. В исходной культуре пневмококков при
размножении возникают мутанты, скажем, устойчивые к
пенициллину (на наше несчастье). При воздействии пенициллином на
такую культуру гибнут все клетки, кроме мутантных; последние
248
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
после размножения образуют культуру Р. Из нее
извлекается ДНК. При добавлении этой ДНК к исходной культуре
в ней возникает значительно больше Р-мутантов, чем в
отсутствие ДНК —трансформирующего фактора. Увеличение числа
мутантов очень велико. Если число спонтанных мутантов
составляло 1 на 107 клеток, то в результате трансформации оно
увеличивается до 1 на 102—103 клеток, т. е. в 104—105 раз!
Эти результаты однозначно доказывают передачу
генетической информации молекулами ДНК.
Культура
С трансформированными
нлетналш
°оО°°°о
о о о
Рис 88. Схема, поясняющая трансформацию бактерий
посредством ДНК.
Другой ряд доказательств генетической роли нуклеиновых
кислот был получен при изучении вирусов и фагов. В гл. 2
говорилось о явлении лизогении. Оказывается, что некоторые
штаммы фагов способны переносить генетический материал от
бактерии-донора, в которой фаг размножался, к
бактерии-реципиенту, инфицируемой этим фагом. Это — явление трансдук-
ции. Трансдукцией передаются различные генетические признаки
бактерии, частица фага переносит как свой собственный
генетический материал, так и некоторое количество генетического
материала бактерии-донора. Этот генетический материал—вновь
ДНК [9, 10].
Опыты с бактериофагами, в частности с Т2, меченными S35 и
Р32, показывают, что при заражении бактериальной клетки
фагом в нее почти не входит белок (метка по сере), но входит
большая часть ДНК (метка по фосфору). Частица фага Т2
состоит из ДНК, окруженной белковой оболочкой. Она ведет себя
Исходная
культура
о
° °°°S О °
о о о о о
о о о "
о о
'
0 о о о°0 о
о о о % • __
оо0 о 0
рооо°0
Нул&тура
С м/г
тнтом
| ДНК | .
t
• • •
^ ••• •••
••••:•••
Мутантнал
нульл
iypa
Биологическая роль нуклеиновых кислот 249
как медицинский шприц — вспрыскивает свою ДНК в бактерию.
Это схематически показано на рис. 16 (стр. 66). Поскольку в
клетке в дальнейшем происходит размножение частиц фага,
очевидно, что ДНК организует как синтез своих копий, так и синтез
белковых оболочек. Иными словами, ДНК является
генетическим веществом фага. Прямые опыты с мечеными атомами
показывают, что при размножении фаговых частиц в клетке ее
собственная ДНК разрушается, а из полученного таким образом
строительного материала — нуклеотидов — синтезируется ДНК,
подобная фаговой [11, 12].
В частицах растительных вирусов роль ДНК играет РНК-
Френкель-Конрат [13] и Гирер и Шрамм [14] показали, что РНК,
выделенная из вируса табачной мозаики (ВТМ), обладает
инфицирующим действием. Это значит, что молекулы вирусной РНК,
попадая в растительные клетки, оказываются способными
организовать синтез новых вирусных частиц. Результаты — того же
характера, что и относящиеся к бактериофагам, они доказывают
генетическую роль вирусной РНК.
Френкель-Конрат сумел построить целые частицы ВТМ,
смешивая РНК ВТМ с его белком. Эти восстановленные частицы
оказались обладающими биологическими свойствами исходного
вируса. Были получены также гибридные вирусы путем
комбинирования РНК одного штамма ВТМ с белком другого штамма-
В белке потомства гибридного вируса содержатся метионин и
гистидин, характерные для белка вируса — донора РНК, но
отсутствующие в белке второго штамма. Эти результаты вновь
свидетельствуют о генетической роли вирусной РНК [15].
Вся совокупность приведенных фактов неопровержимо
доказывает, что ДНК клеток и фагов и РНК вирусов являются
наследственными веществами, т. е. что эти нуклеиновые кислоты
содержат информацию о синтезе белка. Как эти вещества
работают, мы увидим дальше (гл. 7).
Сразу же возникает естественный вопрос: а что служит
матрицей для ДНК? У нас нет пока что прямых данных о
первичной структуре ДНК. Но вся совокупность результатов,
полученных в молекулярной биологии и в химической генетике,
доказывает, что первичная структура ДНК (и вирусной РНК)
фиксирована. Да и что бы это была за матрица без
фиксированного текста? Так вот, чем же задается первичная структура
наследственного вещества? Может быть, нужно еще какое-нибудь
вещество, служащее матрицей для синтеза ДНК и так далее, до
бесконечности? Ответ на этот вопрос найден в результате
изучения вторичной структуры ДНК- Оказывается, что, в отличие от
белка, ДНК сама по себе способна редуплицироваться, т. е.
служить матрицей для автокопирования.
250
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Мы рассмотрели биологическую роль ДНК и вирусной РНК.
Какова же функция трех других типов РНК — рибосомной,
транспортной и матричной? Ограничимся здесь краткой
характеристикой— дальнейшие подробности излагаются в следующей
главе. Матричная или информационная РНК синтезируется в ядре
и переходит к рибосомам. Она копирует код, которым записана
наследственная информация в ДНК хромосом, и представляет
собой тем самым переносимую матрицу. В этом смысле
информационная РНК подобна тем матрицам центральных газет,
которые каждое утро развозятся на самолетах во все крупные
центры Советского Союза. Рибосомная РНК служит,
по-видимому, подкладкой для матричной РНК. Роль транспортной,
низкомолекулярной РНК состоит в присоединении к
активированным аминокислотам. Число сортов транспортной РНК равно
числу различных аминокислот, т. е. 20, или превышает его. На
матрице собираются не аминокислоты, а молекулы
транспортных РНК, к которым аминокислоты присоединены. В результате
такой сборки аминокислоты соединяются друг с другом —
происходит синтез белка.
Таким образом, РНК трех типов участвуют в синтезе белка
по программе, заданной ДНК.
ВТОРИЧНАЯ СТРУКТУРА ДНК, РНК И ПОЛИНУКЛЕОТИДОВ
Ключ к биологическим свойствам ДНК, к ее генетической
функциональности лежит в строении молекулы. Первичная
структура ДНК пока неизвестна, но вторичная структура
установлена надежно.
Громадное значение для молекулярной биофизики имело
рентгенографическое исследование структуры ДНК. Уилкинз
изучил ориентированные волокна Li-соли нативной ДНК, полу-
'чив прекрасные рентгенограммы, содержащие до 100
дифракционных пятен [16] (см. также [17]). Элементарная ячейка
кристаллической ДНК моноклинная, ее параметры а=22,2А, 6=40 А,
с=28,1 А. В ячейку входят две макромолекулы. Уотсон и Крик
расшифровали структуру ДНК на основании полученных
рентгенографических данных [18, 19].
Наблюдаемую дифракционную картину удалось объяснить
полностью, приписав нативной ДНК строение двойной спирали.
Приводим слова Крика [20]: «Молекула ДНК состоит из двух
полинуклеотидных цепей, антипараллельных и закрученных
одна вокруг другой. Эти две цепи удерживаются вместе
посредством водородных связей между азотистыми основаниями,
причем каждое основание одной цепи присоединено к своему «парт-
ВТОРИЧНАЯ СТРУКТУРА ДНК, РНК II ПОЛПНУКЛИОТИДОВ
251
неру». Спаривание оснований специфично; аденин (А)
соединяется только с тимином (Т), а гуанин (Г) с цитозином (Ц)».
Строение двойной спирали ДНК показано на рис. 89.
Диаметр спирали около 20 А, виток ее содержит 10 мономерных
Рис. 89. Двойная спираль ДНК.
звеньев и на каждые 3,46 А длины спирали приходится по два
азотистых основания, по два нуклеотида* Такая структура
присуща ДНК, извлеченной из самых различных источников — or
вилочковой железы теленка до бактериофага. Более того, при
рентгенографическом исследовании головок сперматозоидов
252
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
И цепи
Нцепи
Рис- 90. Пары азотистых оснований, соединенных
водородными связями.
ВТОРИЧНАЯ СТРУКТУРА ДНК, РНК И ПОЛИНУКЛЕОТИДОВ 253
получается та же картина, т. е. спираль Уотсона — Крика
наблюдается непосредственно в живых клетках.
Как уже сказано, имеется однозначное соответствие между
азотистыми основаниями двух цепей. На рис. 90 показаны
водородные связи спаренных оснований — пуринового и пиримиди-
нового. Плоскости оснований параллельны друг другу, эти
плоскости и водородные связи расположены перпендикулярно
а) 6)
Рис. 91. Двойная спираль ДНК.
а) из аитипараллельных цепей; 6 — из параллельных цепей.
к оси спирали. Существенно, что А и Т соединены двумя водо
родными связями, а Г и Ц — тремя. Таким образом, если
известна первичная структура одной из цепей, то однозначно
определена структура второй, являющейся как бы дополнением
первой. Указанное однозначное спаривание оснований объясняет,
очевидно, правила Чаргаффа (стр. 128) —содержание А в ДНК
всегда равно содержанию Т, а содержание Г — содержанию Ц.
Две цепи являются антипараллельными, а не
параллельными. Что это означает? На рис. 91 показаны оба варианта.
Первый лучше согласуется с данными по рентгеновской
дифракции. В то же время имеется однозначное доказательство
антипараллельности цепей, полученное биохимическим путем
[21]. Как мы увидим, возможен синтез ДНК in vitro. Такой
синтез реализуется, если внести в смесь, содержащую нуклеозид-
трифосфаты всех четырех сортов, необходимый фермент и
некоторые ионы, а также нативную ДНК в качестве затравки,
254
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Затравка действует как матрица для редупликации ДНК,
причем синтезируемая ДНК совершенно аналогична затравочной.
Были проведены опыты, в которых один из четырех трифос-
фатов содержал меченый Р32 в связанном с сахаром (дезокси-
рибозой) фосфате (рис. 92). С помощью ферментов (ДНК-аза
микрококков и фосфодиэстераза из селезенки теленка)
полученная ДНК расщеплялась до З'-дизоксинуклеотидов, так чтобы
Рис. 92. Синтез цепи ДНК, меченной Р32, и
ее последующее ферментативное расщепление
до З'-дезоксирибоиуклеотидов.
меченый атом Р оказывался в положении 3' ближайшего ну-
клеотида (рис. 92). Получались четыре разных З'-дезоксинукле-
отида и разделялись при помощи электрофореза на бумаге.
Существенно, что исходный нуклеотид метился не в 3'-, а в
5'-положении. Поэтому, определяя радиоактивность
полученных мономеров, можно было установить, насколько часто Р32
связывается с другими нуклеотидами. Если помечен только один
из четырех исходных трифосфатов, то возможны 4 комбинации
(помечен, скажем А, тогда возможны комбинации АФА, АФТ,
АФГ, АФЦ, Ф — обозначает фосфат с Р32). Но эти опыты были
повторены со всеми четырьмя нуклеотидами и поэтому были
исследованы все 16 возможных комбинаций. В табл. 16
показаны полученные результаты.
Правило Чаргаффа, конечно, соблюдается. Одинаковыми
римскими цифрами обозначены сочетания, содержание которых
должно быть соответственно равным, если цепи антипарал-
лельны; одинаковыми латинскими буквами — если цепи
параллельны. В самом деле, в первом случае (см. рис. 91) должны
ВТОРИЧНАЯ СТРУКТУРА ДНК. РНК И ПОЛИНУКЛЕОТИДОВ 255
Таблица 16 [21]
Относительное содержание различных сочетаний соседних
нуклеотндов в препарате ДНК, полученном с затравкой — натнвной
ДНК нз тнмуса теленка
Меченый трифосфат
ДАТФ-Р32
ДТТФ-Р32
ДГТФ-Р32
ДЦТФ-Р32
Итого
Выделенный З'-дезоксирибонуклеотид
ТФ
а
ТФА
0.053
Ь
ТФТ
0.087
I
е
ТФГ
0.076
II
ТФЦ^
0.067
III
0.283
АФ
ь
АФА
0.089
I
а
АФТ
0.073
АФГ
0.072
IV
е
АФЦ
0.052
V
0.286
ЦФ
с
ЦФА
0.080
II
d
ЦФТ
0.067
IV
g
ЦФГ
0.016
h
ЦФЦ
0.054
VI
0.217
ГФ
d
ГФА
0.064
III
с
ГФТ
0.056
V
h
ГФГ
0.050
VI
g
ГФЦ
0.044
0.214
быть, например, равны содержания комбинаций АФЦ и ГФТ, во
втором случае — комбинации АФЦ и ТФГ, так как разрезаемые
ферментом связи с Р32 по-разному расположены- в двух
рассматриваемых случаях. Табл. 16 служит решающим
доказательством антипараллельности двух цепей ДНК, входящих в
спираль Уотсона— Крика.
Каковы же свойства нативной ДНК в растворе?
Молекулярный вес ДНК, определяемый методами седиментации и
светорассеяния, очень велик. Для обычных препаратов — это
величины порядка 106. Однако, по-видимому, ДНК, получаемая
из клеток и фагов, частично деструктируется в процессе
извлечения. Более тщательное и осторожное выделение ДНК приводит
к увеличению молекулярных весов. Гены £. colt и бактериофага
4
256
ГЛ. G. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Т2 образуют по одной группе сцепления, т. е. имеют по одной
хромосоме. Можно думать, что вся хромосома в этих случаях
является одной молекулой ДНК- Действительно, из фага Т2 были
выделены молекулы длиной до 49 ц, а из £. coli— до 400 ц. Это
соответствует молекулярному весу порядка 109. Такие большие
молекулы, как ДНК, хорошо наблюдаются в электронном
микроскопе в виде длинных нитей (рис. 93, см. также рис. 31).
Рис. 93. Нативная ДНК под электронным микроскопом.
Необходимо рассказать об очень интересных опытах Левин-
таля и Томаса [22]. Изучался фаг Т2. Этим фагом заражались
клетки Е. coli, выращенные на среде с большим процентом
радиоактивного фосфора — на «горячей» среде. Этот фосфор
включался в ДНК размножавшихся фаговых частиц. Популяция
фага выделялась, капля суспензии фазовых частиц наносилась
на слой фотоэмульсии, содержавшей большое количество AgBr
и поэтому чувствительной к электронам, и заливалась сверху
такой же фотоэмульсией. Через неделю производилось
проявление. За это время распадалась lU атомов Р32 и электроны,
выделившиеся при распаде, оставляли свои следы в пластинке.
Под микроскопом видны эти следы — треки; каждая частица
фага дает свою «звезду», имеющую 10—15 «лучей». Число
лучей определяет число атомов Р32 в каждой фаговой частице. Так
как известна удельная активность фосфора, т. е. доля атомов
Р32, по «звездам» определяется молекулярный вес ДНК фага.
ВТОРИЧНАЯ СТРУКТУРА ДНК. РНК И ПОЛИНУКЛЕОТИДОВ 257
Он оказался равным 1,4* 108 — значительно больше, чем у ДНК,
изучаемой в растворе. Несомненно, что это объясняется
«нежностью» молекул ДНК — при выделении они рвутся на части;
более того, молекулы ДНК испытывают деструкцию даже при
течении раствора (см. [23]). Вся ДНК фаговой частицы
является одной молекулой.
Так метод толстослойных фотоэмульсий, развитый в ядерной
физике, был с успехом применен для изучения ДНК.
Структура нативной ДНК в растворе исследовалась всеми
возможными методами, ранее разработанными для
синтетических полимеров (гл. 4). Модель Уотсона и Крика была
предназначена для объяснения рентгенографических данных,
полученных при изучении кристаллической ДНК. Лузатти, Николаев и
Массой [24], пользуясь методом рассеяния рентгеновых лучей
под малыми углами, доказали, что масса, приходящаяся на
единицу длины ДНК в растворе, согласуется со структурой
Уотсона— Крика. Эти и другие факты доказывают, что двойная
спираль ДНК сохраняется в растворе. Растворы нативной ДНК
очень вязки. Это не означает, однако, что макромолекулы ДНК
фигурируют в растворе в виде жестких стержней.
Данные, полученные методами светорассеяния,
седиментации, вискозиметрии, динамического двулучепреломления,
показывают, что двойная спираль нативной ДНК свернута в
растворе в большой рыхлый клубок. Линейные размеры
макромолекулы ДНК с молекулярным весом порядка 106 достигают
0,5 |i. Если бы макромолекула была вытянута, то ее длина
составила бы 5 \i [25]. Таким образом, рыхлый клубок свернут в
10 раз.
Характеристическая вязкость [т|] раствора ДНК
пропорциональна примерно первой степени М, в то время как для
жесткого стержня [r)]~Af2 (ср. стр. 178). Это отвечает рыхлому
клубку. Его строение может быть охарактеризовано значением
так называемой персистентной длины L макромолекулы, т. е.
длины прямолинейного спирального участка. В результате
исследования зависимости константы седиментации ДНК от
молекулярного веса [26, 27] было найдено значение L=360 A.
Как указал Садрон, давший подробный критический анализ
методов исследования растворов ДНК и РНК f28], метод Зимма
(светорассеяние, стр. 180) неприменим к таким большим
молекулам— оказывается невозможным определить начальные
наклоны соответствующих кривых. Птицын и Федоров предложили
метод определения персистентной длины из рассеяния под
большими углами и нашли значения L порядка 300 А, в согласии
с вышеприведенным [29]. Вопреки мнению Садрона,
имеющаяся экспериментальная информация не дает, однако,
17 М. В. ВолькенштеЙн
258
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
возможности однозначно охарактеризовать рыхлый клубок, о
котором идет речь. Нельзя сказать, является ли макромолекула
зигзагообразной, состоящей из строго прямолинейных участков
с изломами, или она имеет «червеобразное» строение с
непрерывно меняющейся кривизной (в этом случае значение L
условно). Ситуация осложняется еще и гетерогенностью молекул
ДНК.
Насколько же гетерогенны молекулы ДНК? Ответить на
этот вопрос труднее, чем на аналогичный вопрос в случае
%ГЦ
Рис. 94. «Спектр* плотностей смеси
различных образцов ДНК.
белка, так как при выделении ДНК происходит ее частичная
деструкция. Тем не менее применение нового замечательного
метода седиментации макромолекул позволило прийти к
достаточно определенным заключениям. Речь идет о методе
седиментации в градиенте плотности, предложенном Месельсоном, Ста-
лем и Виноградом [30] (см. также [31]). Седиментация ДНК
производится в достаточно крепком водном растворе CsCl. Под
действием центробежной силы устанавливается градиент
плотности раствора, увеличивающейся от оси вращения к
периферии. Так как плотности раствора лежат в той же области, что
и плотность ДНК (порядка 1,7), молекулы ДНК данной
плотности сосредоточиваются в определенном слое. При
фотографировании получаемого распределения в ультрафиолетовом
свете (максимум поглощения ДНК 260 m\i) получается спектр
плотностей, содержащий полоски, отвечающие ДНК различной
плотности. На рис. 94 показан такой спектр смеси из семи об-
ВТОРИЧНАЯ СТРУКТУРА ДНК. РНК И ПОЛИНУКЛЕОТИДОВ 259
разцов ДНК различного происхождения. Характерно, что
полосы весьма узки — это указывает на значительную
однородность ДНК. Наиболее однородна ДНК, выделенная из
бактериофага, наименее — выделенная из клеток высших организмов.
Грубая оценка показывает, что число различных сортов
молекул ДНК при одном и том же молекулярном весе порядка 107,
в клетке млекопитающего составляет 106, в бактериальной
клетке— 100 и в частице бактериофага— 10.
Исследования Доти показали, что плотность ДНК линейно
возрастает с увеличением содержания Г+Ц. Оно и понятно —
молекулярный вес А+Т = 247, Г+Ц = 273. В то же время эти
пары занимают примерно одинаковые объемы в двойной
спирали. На каждый процент увеличения содержания Г+Ц
приходится увеличение плотности на 0,00103 г/смг. Метод
седиментации в градиенте плотности настолько чувствителен, что
позволяет определять молекулы, меченные по азоту — содержащие
N15 вместо N14 (см. стр. 285).
Вторая конформация, которую ДНК имеет в растворе —
конформация денатурированной ДНК — статистический клубок.
При нагревании, изменении рН и т. д. нативная ДНК
разрушается, двойная спираль разделяется на две цепи, каждая из
которых приобретает форму клубка. О денатурации ДНК
рассказано в следующем разделе.
На VI Международном биохимическом конгрессе в Нью-
Йорке летом 1964 г. Лузатти и его сотрудники сообщили об
открытии третьей формы ДНК—промежуточной между натив-
ной и денатурированной. Методом рассеяния рентгеновых
лучей под малыми углами показано, что при нагревании
сначала сохраняется общая нативная форма, но убывает
масса, приходящаяся на единицу длины и аксиальный
радиус вращения. Макромолекула становится более рыхлой.
Потом уже происходит переход спираль — клубок. Эти
результаты очень интересны, но вопрос требует дальнейшего
исследования-
Мы видели, что для понимания вторичной структуры белка
большую роль сыграли исследования синтетических
полипептидов. Аналогичная ситуация имеется и в случае нуклеиновых
кислот. Изучение синтетических полинуклеотидов (полирибо-
нуклеотидов) не только позволило лучше понять структуру ДНК
и РНК, но и дало исключительно ценные результаты при
решении проблемы генетического кода (гл. 7).
Грюрберг-Манаго и Очоа выделили из бактериальных
клеток фермент — полинуклеотидфосфорилазу, обладающий
способностью соединять различные нуклеозиддифосфаты с
образованием синтетических полирибонуклеотидов [323. Реакция идет
17»
260
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
по схеме:
20_—
О О
II II
Р — О—Р—О-
I I
О" О"
О-—
о о
II II
P—О—P—О—СН
о
о
V
°\
он он
о он
Ч- нро4-
онон
Таким образом, синтезируются высокомолекулярные полину-
клеотиды— полиуридиловая кислота (ПолиУ), полиадениловая
кислота (ПолиА) и т. д., полиинозиновая кислота (ПолиИ),
содержащая гипоксантин (стр. 123) и даже необычный полири-
бонуклеотид—ПолиТ (тимин в РНК не содержится).
Синтезируются также сополимеры этих нуклеотидов с известным их
относительным содержанием, но, конечно, с неизвестной,
случайной последовательностью.
Оказалось, что, подобно тому как синтетические
полипептиды в ряде случаев образуют характерные для белков
«-спирали, синтетические полинуклеотиды образуют двойные спирали
типа Уотсона — Крика и даже тройные спирали. Методами
двойного лучепреломления и рентгенографии доказано,
например, что две раздельные цепи ПолиА и ПолиУ соединяются,
образуя двойную спираль. Независимое доказательство состоит
в изменении ультрафиолетового поглощения при К 260 т\\.
В двойной спирали имеется гипохромный эффект в этой
области спектра (ср. стр. 229) — понижение интенсивности
поглощения по сравнению с денатурированной формой. Если
смешивать раствор ПолиА и ПолиУ в присутствии 0,1 М NaCl,
наибольший гипохромизм наблюдается при составе смеси 1:1,
при этом образуется двойная спираль [33]. Если ввести в
раствор двухвалентные ионы металлов—1,2*10~2Л1 MgCk, то
максимальный гипохромизм наблюдается при соотношении ПолиУ:
ПолиА, равном 2: 1 (рис. 95). Образуется тройная спираль, что
подтверждается измеренным значением константы седиментации.
ВТОРИЧНАЯ СТРУКТУРА ДНК, РНК И ПОЛИНУКЛЕОТИДОВ
261
Тройную спираль образует и полиинозиновая кислота — сама
по себе, в отсутствие какого-либо иного полинуклеотида.
Роль ионов металлов при образовании двойных и тройных
спиралей, вероятно, заключается в нейтрализации заряженных
фосфорных групп и уменьшении взаимного отталкивания цепей.
Для создания тройной спирали, по мнению Рича, нужно
преодолеть больший электростатический барьер, что достигается в
25 50 75
Концентрация Поли У
_i 1_л L.
700
j
ЮО
75 50 25
Концентрация Поли А
О
Рис. 95. Гипохромизм в смесях ПолиУ с ПолиА.
а) образование комплекса 1:1; б) образование комплекса 2:1.
результате специфического связывания ионов Mg++ (или Мп44")
фосфатными группами (ср. [31]). Другая возможность состоит
в связывании этими ионами атомов азота в гетероцикле,
подобно тому, как это происходит в хлорофилле. Ионы
внедряются внутрь двойной спирали и скрепляют ее. Этот вопрос
нельзя считать окончательно выясненным, но важность его
несомненна, так как ионы Mg"14" играют большую роль в процессе
синтеза белка в живой клетке.
Характерно, что ни ПолиУ, ни ПолиА сами по себе не
образуют двойных и тройных спиралей. А дополняет У, так же как
в ДНК А дополняет Т. В двойной и тройной спирали А
соединяется с У водородными связями.
1
262
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Фреско и Альберте изучали гипохромизм смесей растворов
ПолиУ и сополимеров ПолиАУ различного состава. При этом
были получены очень интересные результаты [33]. Гипохромный
эффект показывает, что можно получить двойные и тройные
I
А — У
I
У
I
А—У
I
А—У
I
Г У
А—У
I
А — У
I
У
I
— У
I
а)
Рис. 96. Две
возможности образования
двойной спирали
ПолиУ: ПолиАУ.
Г
I I
У-А—
I
У-А—У
1 I
у<А-Г
SA—У
I I
у<А-"Г
ЧА—У
V
спирали из ПолиУ и ПолиАУ
(соответственно ПолиАУ+ПолиУ и ПолиАУ+ПолиУ+
+ ПолиУ). Но, поскольку связываются
ДРУГ с другом А и У, спирали должны быть
дефектными. Здесь имеются две
возможности, показанные на рис. 96. Либо в тех
местах, где против У стоит У, нет
водородных связей, но спираль остается спиралью
(случай а), либо в этих местах группы У
вытесняются за пределы спирали, образуя
петли (случай б). Эти два случая
различаются процентным соотношением ПолиУ
и ПолиАУ одинакового молекулярного веса
в двойной спирали — системе с наибольшим
гипохромизмом. Для фрагментов спиралей,
изображенных на рис. 96, молярные
соотношения ПолиАУ: ПолиУ, следующие: в
случае а 10: 10, т. е. 1 : 1, в случае б 6: 10, т. е.
3:5. Можно, следовательно,
экспериментально установить, какой случай
реализуется в действительности. Полученные результаты приведены
в табл. 17.
Таблица 17 [33]
Молярный процент ПолиУ в смеси с максимальным гипохромизмом
Смесь
У
* *
ПолиА + ПолиУ
ПолиАУ 90+ПолиУ(90%А)
ПолиАУ 66-
ПолиАУ 53 Н
ПолиАУ 62 Н
ПолиАУ 82 Н
ПолиАУ 37 Н
-ПолиУ . . •.
-ПолиУ . .• .
-ЛолиУ . . *,
-ПолиУ . . .
-ПолиУ . . .
Двойная спираль
Найдено
50
—
38±1
34±1
—
—
38±3
Вычислено
в случае
а
50
—
50
50
—
—
50
Вычислено
в случае
-
—
40
34,5
—
—
39
Тройная спираль
Найдено
67
65±1
54±1
—
57
64
^^^^
Вычислено
в случае
а
67
67
67
—
67
67
^^^^
Вычислено
в случае
64,5
57
—
55
62
^^—
—»'
Эти результаты доказывают, что петли действительно
образуются. Рассмотрение такой дефектной структуры с помощью
ВТОРИЧНАЯ СТРУКТУРА ДНК, РНК И ПОЛИНУКЛЕОТИДОВ 263
молекулярной модели показывает, что наличие петель не
мешает организации спирали Уотсона — Крика, если не считать
небольшого сближения фосфатных групп, наименьшее
расстояние между которыми уменьшается с 7 до 6 А, что не столь уже
существенно. Это дает основания думать, что и в ДНК
случайное включение неподходящего основания — А, Г или Ц
вместо Т напротив А — вызывает образование петли.
Приведенные данные, относящиеся к синтетическим поли-
рибонуклеотидам, позволяют высказать предположения о вто-*
ричной структуре РНК. В отличие от ДНК, не удается получить
вирусную или рибосомную РНК в кристаллической форме.
Поэтому не имеется и достаточно четких картин рентгеновской
дифракции на таких молекулах РНК. В растворе образцы на-
тивной РНК обнаруживают значительно меньшую вязкость, чем
ДНК, и большие скорости седиментации, что указывает на
более компактную, клубкообразную форму макромолекул.
Характеристическая вязкость нативной РНК пропорциональна
квадратному корню из молекулярного веса, а это означает, что
форма молекулы клубкообразна. При денатурации вязкость РНК,
в отличие от ДНК, не уменьшается, а увеличивается — клубок
становится более рыхлым.
Двойное лучепреломление РНК в потоке значительно
меньше, чем для ДНК- Персистентная длина цепи вряд ли
превышает 100 А. При малой ионной силе раствора клубки РНК
набухают, раздуваются; при повышении ионной силы — становятся
более компактными. Как уже указывалось, рибосомная РНК
не подчиняется правилам Чаргаффа.
Способность РНК к денатурации (см. следующий раздел),
выражающаяся, в частности, в увеличении интенсивности
поглощения света с %260tn\i, и большая компактность клубков
заставили Доти прийти к заключению о частично спиральной
структуре нативной РНК- Возможны частично спирализованные
участки молекулы, замкнутой самой на себя, подобно шпильке
для волос. У соединяется водородными связями с А, а Г с Ц.
Существенно, что стабильность РНК по отношению к тепловой
денатурации действительно возрастает с увеличением
содержания Г+Ц (напоминаем, что в отличие от Т+А в ДНК илиУ+А
в РНК, Г+Ц образуют не две, а три водородные связи).
Температура плавления спиральных участков оказывается линейно
зависящей от содержания Г+Ц. По оценке Доти и его
сотрудников наименьший спиральный участок РНК без петель
состоит из четырех пар нуклеотидов. Дефектная спираль в РНК
может содержать петли. Спиральный участок с петлями,
конечно, менее устойчив, чем вполне аккуратно построенный, но
264
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
петли увеличивают число оснований, соединенных водородными
связями. В целом вторичная структура РНК, по идее Дот
V х
Ч/ х>
Л
4-^а
А-Г
„Г-й А И г
^r-u^y-r-t-Y-t-fVr-r; У
.и^ ?:A-Uj.Kr-r'y
А' г-У Ц А У
Рис. 97. Вторичная структура РНК по Доти.
подобна «морской звезде» (рис. 97). Такая структура не
противоречит имеющимся экспериментальным данным и объясняет
наблюдаемый высокий
процент спирализованных
участков — до 77% (рибосом-
ная РНК) и даже до 88%
(РНК из ВТМ [34]).
Спирин, руководствуясь
той же идеей о частичной
двуспиральной структуре
РНК, предложил другую
модель ее строения (рис.98).
На основании электронно-
микроскопических и других
данных сделаны следующие
заключения: макромолекула
РНК является единой
цепью; при высокой ионной
силе раствора РНК —
компактный клубок, при низкой
ионной силе — компактная
палочка [35]. При
нагревании, подкислении или
полном обессоливании раствора РНК денатурируется, превращаясь
в деспирализованный рыхлый клубок.
а)
Ф
Рис. 98. Вторичная структура РНК по
Спирину.
а) при высокой ионной силе раствора; б) при
низкой ионной силе; в) при нагревании,
подкислении или полном обессоливании раствора.
ВТОРИЧНАЯ СТРУКТУРА ДНК, РНК И ПОЛИНУКЛЕОТИДОВ 265
Между моделями Доти и Спирина нет больших
принципиальных различий. Обе модели не противоречат
экспериментальным данным. Тем самым эти данные не позволяют
однозначно определить вторичную структуру РНК в растворе.
Нельзя считать исключенной возможность необычного
спаривания нуклеотидов РНК в результате таутомерных превращений.
Так, например, урацил обычно, по-видимому, фигурирует в
кето-форме:
О
II
/С\/Н
НС N
II I
НС Сч
\N/V>
В этой форме он дает уотсон-криковскую пару с А. Но
возможна и энольная форма:
НС N
II I
НС С=0
в которой У может соединяться тремя водородными связями
с Г (стр. 123). Таутомерия пиримидиновых и пуриновых
оснований пока еще недостаточно изучена. Не исключено, что такого
рода превращения возможны и образующиеся водородные связи
стабилизируют таутомер. Несомненна во всяком случае
большая роль таутомерии в мутагенезе (стр. 346). Задачи,
относящиеся к полимерным цепям, в которых наряду с поворотной
изомерией реализуется таутомерия, до сих пор никем не
рассматривались. Если указанная возможность действительно
осуществляется в РНК, то таутомерия может быть причиной
большого содержания спиральных участков в макромолекулах
РНК, не имеющих регулярной первичной структуры.
Наконец, не уотсон-криковские пары могут образовываться
с уменьшенным числом водородных связей — одной вместо двух
и двух вместо трех. Такие пары соединены менее прочно, но
266 ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
все-таки могут обеспечивать спирализацию. Необходимо
подчеркнуть, что взаимодействие азотистых оснований, входящих в
состав двух дополняющих друг друга цепей, не сводится только
к водородным связям. Имеются и обычные ван-дер-ваальсовы
силы, в частности, должно быть значительным взаимодействие
параллельно расположенных оснований одной цепи, входящей в
двойную спираль (см. далее, стр. 280).
Вопрос, как видим, открытый. Для его решения, наряду с
дальнейшим исследованием РНК, необходимо
экспериментальное и теоретическое изучение таутомерии в
нуклеотидах и подробный анализ возможных
конформаций цепей, содержащих таутомеры
и образующих водородные связи. Это —
задача молекулярной биофизики, тем более
актуальная, что РНК играет важнейшую роль в
синтезе белка.
Строение Т-РНК изучалось Уилкинзом и
сотрудниками. Первое сообщение о двуспи-
ральном строении этой короткой цепи [36] по
последним данным, полученным теми же
авторами, оказалось ошибочным. По-видимому,
Рис. 99. Структура молекулы Т-РНК подобны рибосомной РНК.
транспортной РНК. Они не кристаллизуются. Есть основания
думать, что они образуют две двойные
спирали— как бы двойную шпильку для волос, причем один конец
первой шпильки соединен с концом другой (рис. 99). Такая
модель согласуется с последними данными по рентгеновской
дифракции [37] и с результатами тщательного исследования
динамического двулучепреломления растворов Т-РНК,
проведенного Цветковым и его сотрудниками [38].
ДЕНАТУРАЦИЯ ДНК
Вышеописанные сведения о вторичной структуре
нуклеиновых кислот получены как в результате прямого исследования
нативных ДНК и РНК в растворе, так и в результате
изучения их денатурации.
Наиболее ясные данные по денатурации ДНК были
получены Доти и его сотрудниками [39]. При нагревании раствора
нативной ДНК или обработке его кислотой или щелочью в
мягких условиях наблюдаются резкие изменения ряда свойств — в
частности гидродинамических и оптических. Происходит
значительное уменьшение вязкости, увеличение интенсивности
поглощения света с К 260тц, т. е. исчезновение гипохромного
эффекта, уменьшение оптической активности. Точными опытами
ДЕНАТУРАЦИЯ ДНК 267
доказано, что все эти явления определяются разделением
двойной спирали ДНК на две независимые цепи, которые
сворачиваются в компактные статистические клубки. При денатурации
зависимость характеристической вязкости от молекулярного
веса оказывается при большой ионной силе (порядка 0,15),
типичной для статистического клубка
[Л] = 7,5.10-4Л10'52
(ср. стр. 178). Разделение двойной спирали на две цепи
доказывается центрифугированием ДНК, содержащей меченый азот
N15 в градиенте плотности CsCl по Месельсону (стр. 258).
Клетки Е. coll, выросшие в среде с N15, переводились в среду
с обычным азотом N14. При делении клеток образовывались ре-
дуплицированные двойные спирали, в которых одна цепь
содержала N15, а другая N14. Такая нативная ДНК нагревалась и
изучалась методом Месельсона. До денатурации наблюдался
один пик плотности, отвечающий 1,717 г/ом3 — плотности натив-
ной ДНК N15—N14. После денатурации появляются два пика:
1,740, соответствующий однонитевым клубкам с N15, и 1,724,
соответствующий клубкам с N14. Плотность денатурированной
ДНК больше, чем нативной, именно, из-за комплектности клубков
[40, 31]. Прямые определения молекулярного веса ДНК
показывают, что при денатурации он уменьшается вдвое [39, 41, 42].
Образование клубков при денатурации может
непосредственно наблюдаться в электронном микроскопе. На рис. 100
показан такой снимок. Его следует сравнить с рис. 93 — со
снимком нативной ДНК. Различие весьма отчетливое! При
малой ионной силе макромолекулы денатурированной и,
следовательно, одноцепочечной ДНК обнаруживают полиэлектролитное
поведение. Цепочки заряжены, заряды не экранированы про-
тивоионами, и поэтому между звеньями цепи действуют
значительные силы отталкивания. В этих условиях (ионная сила
0,01) макромолекула уже не клубкообразное, а заметно
вытянутое образование. Соответственно
[П] = 2,7.10-5ЖЭ'93.
Денатурация ДНК — типичный переход спираль — клубок,
подобный открытым Доти у полипептидов (гл. 5). В отличие
от белков здесь при переходе разрываются водородные связи,
соединяющие две цепи в спирали. Процесс может трактоваться
как внутримолекулярное плавление, резкость перехода с
несомненностью указывает на его кооперативный характер.
Следовательно, так же как в случае полипептидов, этот переход может
рассматриваться как плавление спирали. Аналогичные
переходы, естественно, наблюдаются и у двойных спиралей из
268 ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
синтетических полинуклеотидов, в частности, ПолиА-ПолиУ
(стр. 260). Эта модельная двойная спираль плавится при 65° С
(в растворе 0,15Л1 NaCI при нейтральном рН). Интенсивность
поглощения света в области А,260тц увеличивается при
плавлении на 34%, а удельное вращение [а]о убывает на 275°-
Тпл ДНК, как и следовало ожидать, зависит от
относительного содержания Г+Ц— эти основания связаны более прочно,
Рис. 100. Денатурированная ДНК под электронным микроскопом.
чем А+Т. Зависимость от содержания Г+Ц оказывается
линейной [43]. Экстраполяция этой прямой дает предельные значения
7,пл = 69° для Поли-д(А — Т) и Гпл = 110° для Поли-д(Г — Ц).
Экспериментальные значения, полученные Корнбергом для
аналогичных синтетических сополимеров, равны соответственно 65°
и 104°. Совпадение достаточно хорошее.
Тпл ДНК существенно зависит от ионной силы раствора,
возрастая примерно пропорционально логарифму концентрации
катионов. Гдл для ДНК из Diplococcus pneumoniae в 0,01 М КС1
равна 68°, в 0,6М KCI — 90°.
Температура кипящей воды достаточна для денатурации
любых образцов ДНК, так как содержание Г+Ц никогда не
превосходит 75—80%. Полная денатурация при кипячении
происходит примерно за 10 минут.
ДЕНАТУРАЦИЯ ДНК
269
Как и в случае поли пептидов, теорией переходов у ДНК
занимались многие авторы [44—49]. Наиболее совершенный и
простой вариант теории предложен Зиммом [48], и для этого
случая применяющим одномерную модель Изинга.
Рассматривается несколько идеализированная двойная
спираль ДНК—не учитывается то обстоятельство, что прочность
сцепления А с Т и Г с Ц различна. Нужно вычислить
статистическую сумму. Каждая пара оснований может быть в двух
состояниях — соединенном (ц*=1) и несоединенном (|i{=0)
водородными связями. Состояние данной пары оснований
зависит от состояний предыдущих пар. Если / предшествующих пар
оснований не связаны, то образование водородной связи в
(/+1)-й паре означает образование кольца из / пар
несвязанных оснований. Это накладывает ограничения на конформации
звеньев цепей, входящих в кольцо, и определяет кооператив-
ность плавления двойной спирали. Очевидно, что если все
молекулярные звенья, предшествующие рассматриваемой паре ос
нований, не связаны, то изменение свободной энергии при обра
зовании водородной связи включает уменьшение энтропии
вследствие уменьшения числа конформации соединенных цепей
Таким образом, сущность кооперативности свойств ДНК
состоит в том, что уничтожение сцепления между отдельными
нуклеотидами в двойной спирали невыгодно, так как при этом
звенья не освобождаются и не увеличивают свою энтропию
В результате такой разрыв немедленно залечивается. Разор
ваться необратимо может лишь достаточно длинная
последовательность водородных и ван-дер-ваальсовых связей между
основаниями — в этом случае проигрыш в энтальпии
компенсируется выигрышем в энтропии.
Вклад каждого состояния двух цепей в статистическую сумму состоит из
произведения следующих множителей.
1) I для состояния 0 пары звеньев; это означает, что свободная энергия
такой пары принята за нуль, ЯСвоб = 0;
2) множитель
s = e-M,t*T (6.1)
для связанного состояния пары; s — константа равновесия процесса
увеличения спирального участка на одну пару мономеров за счет соседнего участка
несвязанных единиц;
3) множитель
JL = ^„ниц/*2" (6.2J
для первой пары мономерных единиц в состоянии I. Здесь V — объем
системы, и—объем, доступный для центра тяжести одной нз связанных цепей
при фиксированном центре тяжести другой цепи;
2?0
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
4) множитель
tj=e-(pj)
иниц
jkT
(6.3)
для кольца из / несвязанных мономеров каждой цепи.
_Константа s естественно зависит от ионной силы раствора. Энергии FKmn
и (^)иниц определяют степень кооператнвностн. Если эти энергии равны
и
нулю, то -у- = I, Qj = I и кооператнвность отсутствует (ср. стр. 222).
Напротив, при значениях /"иниц и (Fj)vimn^>kT -y-=0,aj^O и
кооператнвность полная. В этом случае при 5=1, т. е. AF = АН — TAS = 0, должен
происходить резкий скачкообраз-
/г-: ■? —i ный переход из состояния
двойной спирали, в котором все пары
оснований связаны (5 > I, доля
связанных оснований х = I) в
состояние двух свободных клубков
(5<0, х=0). Это —
кооперативный переход, происходящий по
принципу «все или ничего».
Реальные переходы
отличаются от описанных крайних случаев.
Для рассмотрения реальных
переходов нужно учесть все
возможные состояния в статистической
сумме. Решение этой задачи для
двойных спиралей оказывается
гораздо более сложным, чем для
полнпептндов, в основном из-за специфического фактора aj — состояний с
кольцами. Не удается получить аналитическое выражение статистической суммы
и приходится пользоваться графическим методом решения [46, 48]. На
рнс. 101 показана зависимость доли связанных оснований х от s, вычисленная
Знммом при двух значениях параметра кооператнвностн <т0 (0,1 и 0,01),
связанного с Qj соотношением
(6.4)
0.8 0.9 W 1J 12 13 ft4 15
16 s
Рнс. 101. Зависимость доли связанных
оснований от параметра s»
O0=Oj(j+l)\
Переход спираль — клубки происходит в узком температурном интервале
вблизи значения
Дд 1 + 1.61206 а1' (&5)
Теория позволяет также определить, как функцию s и температуры,
среднюю долю пар оснований, находящихся на стыке спираль — клубки. При
о"о ^ 0,1 вблизи температуры перехода эта доля составляет около 1%. Опыт
согласуется с теорией, если принять а0^10~ —10" . Значение теплоты
плавления ДНК АЯ ^ 5 ккал/моль было определено экспериментально [50].
Переходы спираль — клубок в ДНК вызываются не только нагреванием,
но и изменением рН раствора. Натнвная форма устойчива при комнатной
температуре при рН от 3,5 до 4,5 и от 9 до 11,5 (в зависимости от ионной силы).
Дело в том, что константы днссоцнацнн групп NH2 и NH—СО азотистых
оснований, способных ионизоваться, если разорваны водородные связи,
отличаются. pKNHa равно для Г 2,35—2,9, для А 3,7—3,85, для Ц 4,5—4,85,
P^nh-co5^9»5- ^ (Г. Т, У) [50]. Группа NH2 заряжается при
ДЕНАТУРАЦИЯ ДНК
271
pH<pKNH2, превращаясь в NH^I", а группа NH—СО при рН > pKNH_C0>
превращаясь в N" — СО. Спиральная конфигурация устойчива в области
PKnh2<P^ < P^NH-co» когда группы не заряжены и между ними не
действуют силы отталкивания.
Бнрштейн теоретически исследовала влияние ионизации оснований на
переходы спираль — клубок и влияние переходов на кривые титрования [51]
(см. также [48]). Условие перехода имеет вид (ср. стр. 220)
5=,-(Д"-ГплЛ*)/*Гпл=1 + апл1 (66)
где а — отношение активностей заряженных и незаряженных групп,
зависящее от рН и рК. Поэтому, измеряя зависимость температуры плавления
двойных спиралей Гпд от рНПл (т. е. от аПл), можно определить ЛЯ и AS.
Такое определение дает для двойной спирали ПолнУ—ПолнА
АН = 8 ± I ккал/моль и AS = 25 кал * моль-1 • град-1. Теория хорошо
согласуется с опытом: In (I + апл) действительно линейно зависит от 1/Гпл.
Сухорукое, Мошковскнй, Бнрштейн и Лысцов [52] провели аналогичное
определение для ДНК; оказалось, что Д# = 10—II ккал/моль, а
AS *= 30 кал - моль~1 • град-1. Теория также прекрасно объясняет ход кривых
титрования натнвной и денатурированной ДНК.
Более элементарный вариант теории денатурации ДНК приведен далее
(стр. 293).
Основываясь на развитой им общей теории макромолекул
полиэлектролитов [53], Птицын показал, что заряженные клубки
должны быть сильно раздуты из-за электростатических взаи.
модействий между удаленными друг от друга звеньями. Именно
так ведут себя макромолекулы денатурированной ДНК.
Указанные взаимодействия дальнего порядка должны
препятствовать переходу спираль — клубок, и соответственно плавление
более высокомолекулярных спиралей должно происходить при
более высоких температурах, чем плавление коротких спиралей.
Это подтверждается экспериментальными данными,
относящимися к ПолиА — ПолиУ. Но отсюда в свою очередь следует, что
для высокомолекулярной ДНК должен существовать интервал
температур, в котором плавление коротких участков выгодно,
а длинных невыгодно. Поэтому денатурациониый переход
происходит в две стадии — сначала должны плавиться короткие
участки и возникать частично денатурированное, состояние с
многочисленными крупными петлями и лишь затем —
происходить полное плавление двойной спирали. Первая стадия должна
быть, очевидно, обратимой, вторая — необратимой. Эти
теоретические выводы подтверждаются данными Доти, который
показал, что денатурация ДНК тимуса теленка в некотором
температурном интервале обратима, а затем становится
необратимой [54]. Частичную денатурацию ДНК удалось наблюдать
непосредственно с помощью электронного микроскопа [55].
Возможно, что промежуточная структура, найденная Лузат-
ти (стр. 259), соответствует предсказанной Птицыным,
272 ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Как уже не раз отмечалось, о денатурации ДНК (а также
РНК) легче всего судить по исчезновению гипохромного
эффекта— денатурированная, одноцепочечная ДНК гораздо
сильнее поглощает ультрафиолетовый свет с длиной волны 260 тц,
чем нативная. Теория гипохромного эффекта в двуспиральных
полинуклеотидах была развита Тиноко [56, 57]. Она исходит
из тех же представлений, что и аналогичная теория для
полипептидов (стр. 229). Поглощение при А,260тц определяется
электронным переходом в плоскости азотистого основания ну-
клеотида. Или, говоря классическим языком, электронный
осциллятор колеблется в этой плоскости. Как мы видели, при
регулярном расположении таких осцилляторов может
происходить давыдовское расщепление электронных уровней, а значит,
и спектральных полос. Если осцилляторы, т. е. переходные
моменты, расположены коллинеарно друг другу, интенсивность
более длинноволновой полосы увеличивается (гиперхромный
эффект), если моменты параллельны — уменьшается (гипохром-
ный эффект). В полинуклеотидах и нуклеиновых кислотах
азотистые основания параллельны друг другу, лежат как столбик
монет, и следовательно, должен наблюдаться именно гипохро-
мизм (как и у полипептидов). Расчет дает и количественное
согласие с опытом. Силы осциллятора для полосы ~260 m\i
свободных нуклеотидов равны /а=0,30; fr =0,40; /ц =0,17;
/т = 0,21. В зависимости от угла поворота в спирали следующей
пары оснований по отношению к предыдущей получается
уменьшение средней силы осцилляторов на 10—40%. Теория дает
зависимость гипохромизма от длины спирали (он растет с длиной
спирали, стремясь к насыщению), подтверждаемую опытом[39].
Более детализированные и строгие расчеты проведены
недавно [58].
Итак, мы познакомились с убедительной статистико-термо-
динамической теорией денатурации ДНК- Но как же все-таки
происходит денатурация? Статистика и термодинамика не дают
ответа на этот вопрос, так как полностью игнорируют фактор
времени. Между тем нас не может не интересовать скорость
процесса раскручивания двойной спирали. Здесь мы сразу же
встречаемся с трудностями.
Допустим, что произошло такое изменение среды или
температуры, при котором разрыв водородных связей,
соединяющих две цепи ДНК, стал термодинамически выгоден. Связи
порвались. Но ведь для разделения цепей нужно раскрутить
множество витков. Впервые этот вопрос был рассмотрен
Куном [59]. Он исходил из макромолекулы ДНК с молекулярным
весом 3-106 (в действительности М, как мы видели, значительно
больше). Длина двойной спирали в этом случае Z, = 3-10~4 см;
ДЕНАТУРАЦИЯ ДНК
273
она содержит примерно v=900 витков. Какое время нужно для
разделения двойной спирали путем последовательного
раскручивания витка за витком, происходящего в результате
броуновского теплового движения? Для этого нужно раскрутить 450
витков, так как разделение
может происходить
одновременно с двух сторон. При
развертывании одного витка нить
проходит путь
s = У?2+(2яг)2, (6.7)
где 9 = 3,4- Ю-7 см—длина
витка вдоль оси спирали,
г= Ю-7 см — радиус спирали.
Если уже раскручено /—1
витков, то при /-м витке конец
нити проходит путь / = 2я/5/]/г2 (рис. 102). Время
диффузионного броуновского движения при /-м витке
т _ /2 _ (2njs/V2)2
v — 2D — 2D
Рнс. 102. К расчету времени
раскручивания двойной спнралн ДНК.
(6.8)
Кун принимает константу диффузии D равной таковой для ]Д
части освободившейся цепи длиной /s/4:
2kT 4 (6.9)
D =
Зять Js •
г)о — вязкость окружающей среды. Следовательно,
_ Зя3 з J3
(6.10)
Полное время раскручивания
(6.11)
так как все витки развертываются независимо, один за другим.
Расчет дает при 7,=300°К и ло=Ю"2 т=1,3-107= 150 дней!
Значит, диффузионное раскручивание должно происходить
очень медленно. Для денатурации ДНК в действительности
нужно гораздо меньшее время, порядка минут. Кун находит
остроумный выход из положения. Он показывает, что уже
частичное развертывание двойной спирали может привести к ее
разделению на две нити. Если заставить конец спирали
выполнить некоторое число оборотов dv(d<l) в направлении,
противоположном направлению вращения в спирали, так чтобы
18 М. В. Волькенштейн
274 ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
расстояние между центром спирали и концом (и,
следовательно, q) осталось неизменным, то перемещение на отрезок q вдоль
оси спирали уже не требует полного оборота, но лишь его доли,
равной 1—$. В самом деле, после #v таких поворотов радиус
цилиндра стал больше, так как
2я(1— 0)г' = 2яг
и
Если, например, 0=0,3, то уже после 150, а не 450 поворотов
с каждой стороны двойную спираль можно разделить, просто
вынув одну однонитевую спираль из другой, т. е. произведя
простое поступательное перемещение. В этом случае время
разделения спирали равно
г = (Уъ+Уъ)\ (6.12)
где ti — время вращательного, а %%—поступательного
диффузионного движения. Расчет, основанный на тех же разумных
значениях молекулярных постоянных, дает при 0=0,3 ti=3 сек,
тг=35 сек и т=58 сек — величина, вполне сопоставимая с
опытной. Таким образом, Кун приходит к выводу, что разделение
двойной спирали является результатом сочетания
вращательного и поступательного движения.
Лонгет-Хиггинс и Зимм [60] дают иное объяснение
раскручиванию. Разделившиеся концы цепей имеют больше степеней
свободы,чем эквивалентные им отрезки цепей,связанных сдвой-
ной спиралью. Следовательно, развертывание сопровождается
выигрышем энтропии или понижением свободной энергии
— AF=TAS. Поэтому, помимо чисто диффузионного,
броуновского движения, должно существовать вращение, вызванное
вращающим моментом энтропийного происхождения. Мы ведь
уже встречались с энтропийной силой на стр. 149; на тех же
основаниях существует и энтропийный момент силы Я, равный
Здесь ф=36°/57,3° — выраженный в радианах угол, на который
нужно повернуть «хвост» цепи для освобождения одной пары
азотистых оснований. Скорость раскручивания равна
© = ^-, (6.14)
где К — коэффициент трения. Расчет дает для спиралей с
Л1~106 величины т порядка секунд. На это затрачивается
свободная энергия AF порядка 10- килокалорий на моль звеньев.
i
РЕНАТУРАЦИЯ ДНК И СИЛЫ, СТАБИЛИЗУЮЩИЕ ДВОЙНУЮ СПИРАЛЬ 275
Фиксман провел вычисления времени раскручивания
двойной спирали, считая, что этот процесс идет с одного конца под
влиянием как диффузии, так и вращающего момента,
связанного с выигрышем свободной энергии (энтропии) [61J. Основной
результат расчетов сводится к следующему: если понижение
свободной энергии при развертывании одного витка равно
AF = akT (6.15)
и если
аЛГ;>1, (6.16)
где N—полное число витков в молекуле, то время
развертывания составляет
т^3,6- \0'9a'lN\ (6.17)
Это время значительно меньше, чем у Лонгет-Хиггинса и Зим-
ма, чьи расчеты менее точны. Если а = 0, т. е. механизм чисто
диффузионный, то
tsl,2« KTV, (6.18)
что дает при N=104(M~ 106)т=20 мин. Если принять в
соответствии с [60] а=17,5, то из (6.17) находим т~0,02 сек. Если
соблюдается условие (6.16), то диффузия не играет
практической роли в раскручивании.
РЕНАТУРАЦИЯ ДНК И СИЛЫ,
СТАБИЛИЗУЮЩИЕ ДВОЙНУЮ СПИРАЛЬ
Можно ли из полностью разделившихся цепей
денатурированной ДНК вновь получить нативную двойную спираль? Мы
всегда говорили об обратимой и необратимой денатурации и
выяснили, что полное разделение цепей означает необратимость.
Казалось бы поэтому, что ответ на поставленный вопрос
должен быть отрицательным.
Но, с другой стороны, почему бы двум разделившимся при
высокой температуре цепям не соединиться вновь при
охлаждении? Ведь при низкой температуре двойная спираль более
устойчива, чем разделившиеся клубки — ей отвечает меньшая
свободная энергия. Очевидно, что для такой рекомбинации или рена-
турации цепей требуется лишь, чтобы дополняющие друг друга
цепи встретились в растворе и сцепились бы в одном из
надлежащих мест водородными связями. Образовавшаяся пара могла
бы послужить зародышем последующей «кристаллизации»,
выигрыш свободной энергии при образовании водородных связей
привел бы к появлению силы, распутывающей клубки и
укладывающей цепи в регулярную двойную спираль.
Действительно, опыты с денатурацией синтетических полинуклеотидов
18*
276
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
указывают на ее обратимость—при охлаждении расплавленных
двойных комплексов они вновь восстанавливаются.
Значит, утверждение о необратимой денатурации имеет
относительный характер. Можно найти условия, при которых
необратимая денатурация, т. е. полное разделение цепей,
оказывается обратимым процессом.
Ренатурация ДНК была открыта и изучена Доти, Марму-
ром и сотрудниками [62, 63]. После нагревания ДНК из Diplo-
coccus pneumoniae в течение
10 минут до 100° и столь же
быстрого охлаждения
ренатурация не возникает — клубки
остаются устойчивыми и при
комнатной температуре. Они,
очевидно, находятся в
термодинамически неравновесном,
«закаленном» состоянии. Об
этом свидетельствует как
отсутствие гипохромного
эффекта, так и утрата ДНК ее
биологической активности. Дело в
том, что биологически функ-
циональна, обладает трансфор-
/00 90 60 70 60 50 40 30 мирующей способностью толь-
MuHy!HnL Температура ко нативная двуспиральиая
щшНИГС охлаждения днк> но не денатурированная.
Рнс. 103. Ренатурация ДНК. Чем это объясняется -- иной
способностью проникновения в
бактериальную клетку или изменением матричной генетической
функциональности, — неясно, но факт остается фактом.
Вероятно, имеет значение и то и другое.
При медленном охлаждении денатурированной нагреванием
ДНК ее биологическая активность восстанавливается, правда,
не на 100, а на 30%. В других случаях удалось получить и 60%.
Восстанавливается и гипохромный эффект. Это показано на
рис. 103. Неполному восстановлению трансформирующей
активности не приходится удивляться — молекулы ДНК очень нежны
и несомненно испытывают частичную деструкцию при
нагревании, т. е., попросту говоря, рвутся на части. Существенно, что
ренатурация все-таки происходит. Ренатурация происходит и
после быстрого охлаждения денатурированной ДНК, если
замороженный образец вновь подвергнуть нагреванию до
температуры 67° — более низкой, чем температура плавления.
За ренатурацией удобно следить по изменению плотности
методом Месельсона, На рис. 104 показаны пики плотности для
%
РЕНАТУРАЦИЯ ДНК И СИЛЫ, СТАБИЛИЗУЮЩИЕ ДВОЙНУЮ СПИРАЛЬ 277
нативной, «закаленной» и «отожженной» ДНК- Левый пик,
отвечающий 1,725 г/см*, — марка для отсчета. Нативная ДНКимеет
плотность 1,704, денатурированная и закаленная в этом
состоянии— 1,716, а ренатурированная— 1,700. Плотность при рена-
турации восстановилась на 75%. О
факте ренатурации непосредственно
свидетельствует и электронная
микроскопия.
Ренатурация требует, с одной
стороны, температуры, достаточно
высокой для того, чтобы клубки могли
развернуться, с другой — достаточно
низкой для того, чтобы двойная спираль
была существенно устойчивее
разделенных цепей. Можно, следовательно,
ожидать максимума на кривой
зависимости скорости ренатурации от
температуры— ренатурация должна идти
быстрее всего при некоторой
оптимальной промежуточной температуре.
Так и оказалось — ДНК из Diplococ-
cus pneumoniae ренатурируется при
67°С в 2,5 раза быстрее, чем при 80°
и 50° С.
Ренатурацию удается получить
далеко не у всех образцов ДНК. Она
получается в опытах с ДНК,
извлеченной из бактерий, и особенно легко
с фаговой ДНК, но не получается с
ДНК, извлеченной из многоклеточных
организмов, в частности из клеток
млекопитающих. Это легко понять.
Если бы образцы ДНК, полученные из
вилочковой железы (тимуса) теленка,
типичной бактерии и бактериофага, все имели молекулярные
веса порядка 107, то число различных молекул ДНК,
приходящееся на одну клетку (или частицу фага), составило бы
соответственно 106, 100, 10. Следовательно, при той же весовой
концентрации эти три образца имели бы весьма различные
концентрации дополняющих друг друга цепей. По сравнению с
бактериальной ДНК концентрация дополнительных цепей в ДНК
из тимуса теленка равняется 10~4, а в фаговой—10. Ясно, что
вероятность встречи двух дополнительных цепей, возникших при
денатурации одной молекулы, в образце из клеток
млекопитающих очень мала.
Рнс. 104.
Пнкн
ДНК.
плотности
278
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Ренатурирован'ная ДНК все-таки несколько «хуже» исходной
нативной ДНК. Ее термическая устойчивость немного меньше,
меньше (процентов на 15) и гипохромный эффект. Двойная
спираль ренатурированной ДНК немного
испорчена.
Описанные опыты интересны сами по
себе, так как они позволяют лучше
понять физическую природу ДНК и ее кон-
формационных превращений.
После открытия ренатурации ДНК
естественно возникла идея получения
гибридной ДНК — ренатурированной
двойной спирали из двух цепей, которые
предварительно не были спарены. Таким
образом удалось, прежде всего,
получить гибридную спираль из цепи ДНК,
содержащей меченые атомы N15, и
дейтерий из немеченой цепи ДНК,
полученных из Bacillus subtilis. По методу Ме-
сельсона после ренатурации были
получены три пика, отвечающих плотности
1,744; 1,725 и 1,704 г/см* (рис. 105).
Первый пик — двойные спирали, где обе
цепи меченые, второй — спирали, где одна
цепь меченая, тяжелая, а вторая —
легкая, т. е. гибридная цепь, и третий —
обе цепи немеченые. Так как площадь
под каждым пиком пропорциональна
относительному содержанию ДНК, легко
видеть, что количество гибридных
молекул примерно вдвое больше, чем
количество каждой из негибридных
компонент.
В этих опытах очень легко принять
за образование гибрида образование
неспецифического аморфного агрегата —
цепи ДНК просто перепутываются друг
с другом и дают соответствующие пики плотности при
седиментации в градиенте CsCl. Такие агрегаты, однако, разрушаются
ферментом фосфодиэстеразой, в то время как истинные двойные
спирали им не затрагиваются. Это позволяет отличить
гибридизацию от агрегации [63].
Мармур и Доти, естественно, попытались получить
гибридные ДНК из ДНК различных видов бактерий. Очевидно, что
для успешного спаривания двух цепей ДНК необходимо, чтобы
Рис. 105. Пики плотности
нет ридных и
гибридных двойных спиралей
ДНК из Bacillus subtilis.
а) до обработки ферментом;
б) после обработки.
РЕНАТУРАЦИЯ ДНК И СИЛЫ, СТАБИЛИЗУЮЩИЕ ДВОЙНУЮ СПИРАЛЬ 279
они дополняли друг друга. Различия видов бактерий сводятся,
в конечном счете, к различиям в нуклеотидном тексте их ДНК-
Ясно, что лишь очень близкие виды могут дать истинные
гибриды ДНК. Гибридизация хорошо удается с молекулами ДНК,
выделенными из различных мутантных штаммов Е. coll. Надо
думать, что в соответствующих двойных спиралях образуются
петли в тех местах, в которых произошли мутации (стр. 262).
Такие гибридные ДНК при
трансформации бактерий с их
помощью могут привести к
возникновению совершенно
новых, ранее неизвестных
мутантов. Это открывает
замечательную возможность
искусственного получения, если не новых
видов, то новых мутантов
бактерий.
Удалось получить и
истинные межвидовые гибриды в
тех случаях, когда два вида
имеют тот же нуклеотидный
состав ДНК и связаны
способностью одного вида
трансформировать другой. На рис. 106
показана кривая плотности
при ренатурации смеси ДНК—
легкой из Bacillus natto и
меченой, тяжелой из Bacillus
sub tills [63].
Получены также гибриды
из ДНК Е. coli — Schigella dy-
senteriae, E. coli и разных
видов и штаммов Salmonella.
Гибридизация ДНК вскрывает внутренние генетические
связи между организмами. На эти связи впервые обратили
внимание Белозерский и Спирин, изучившие состав ДНК ряда
видов [64]. Мы видим, что генетически связаны организмы,
имеющие сходные молекулы ДНК, и генетические соотношения
разнятся от таксономических, т. е. от определяемых внешними
признаками. Наряду с трансформацией (стр. 247) и трансдук-
цией (стр. 248) образование молекулярных гибридов дает
прекрасную возможность изучения генетических и эволюционных
взаимоотношений организмов — пока одноклеточных. Здесь
молекулярная биология непосредственно вторгается в область
фундаментальных биологических проблем.
Рис. 106. Пики плотности ДНК при
образовании межвидовых гибридов.
1,691— стандартная метка (ДНК из CI. per-
fringens); 1,707 и L716 —реиатурироваииая
гнатурироваинай'ДНК Bacillus natto;
1,732 —гибрид Bacillus natto —Bacillus
и денатурированная
иор]
sub tills; 1,746 и 1,759—реиатурироваииая и
денатурированная N16 — дейтерированная
ДНК Bacillus subtilis. После обработки
фосфодиэстеразой пики 1,716 и 1,759 исчезают.
280
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Вернемся к физике. Опыты по ренатурации с особенной
яркостью демонстрируют силы, соединяющие азотистые
основания двух цепей ДНК в спираль Уотсона — Крика. Мы все время
исходили из того, что эти силы — водородные связи, причем
Г + Ц соединены тремя водородными связями, а А+Т — двумя.
Эти положения можно считать установленными. В то же время
водородные связи — не единственные взаимодействия между
азотистыми основаниями в двойной спирали.
Де Во и Тиноко [65], пользуясь методами квантовой химии,
рассчитали энергии обычных межмолекулярных взаимодействий
соседних азотистых оснований, как вдоль цепи, так и в парах,
соединенных водородными связями. Под обычными
взаимодействиями мы понимаем взаимодействия, определяющие отличие
реального газа от идеального, сжижение газов и т. д. Это —
физические взаимодействия Молекул, в которых насыщены
химические связи. Существуют три типа таких взаимодействий.
Во-первых, диполь-дипольные силы. Два электрических диполя
притягиваются друг к другу, если ( + ) одного близок к (—)
другого, и отталкиваются друг от друга, если близки одноименные
заряды. Энергия взаимодействия двух диполей равна
^ = -^(cos6-3cosq>iCOSifc), (6Л9>
где \i\ и \i2 — взаимодействующие дипольные моменты, R —
расстояние между ними, е — диэлектрическая постоянная среды,
в—угол между диполями, q>i и фг —углы, образуемые первым
и вторым диполем с вектором /?. Во-вторых, диполь одной
молекулы индуцирует во второй молекуле коллинеарный ему
диполь и, следовательно, создает индукционное взаимодействие,
тем большее, чем больше поляризуемость а молекулы. Энергия
индукционного взаимодействия в случае изотропно
поляризующихся молекул равна
Ера = ^ё ^Г • (6-20)
Так как в действительности поляризуемости молекул
анизотропны, т. е. имеют разные значения по разным направлениям,
строгое выражение £ца более сложно — в него входят анизотропные
поляризуемости и геометрические факторы, зависящие от
относительного расположения молекул.
Но взаимодействуют и бездипольные молекулы. Ведь
сжижаются и газы, состоящие из сферически симметричных
атомов, например благородные газы. Это значит, что существует
третий тип межмолекулярных взаимодействий, который удается
истолковать только на основе квантовой механики. Так
называемые дисперсионные или лондоновские силы объясняются
РЕНАТУРАЦИЯ ДНК И СИЛЫ, СТАБИЛИЗУЮЩИЕ ДВОЙНУЮ СПИРАЛЬ 281
взаимодействием мгновенных диполей, возникающих вследствие
движения электронов в атомах и молекулах. Энергия этих сил
зависит уже только от поляризуемостей молекул. Она может
быть представлена формулой
Р v «Mrf2 а*а2
сл— 2 /,+/2 е/?6 '
(6.21)
где J и /2 — энергии, необходимые для ионизации первой и
второй молекулы. При анизотропии поляризуемостей выражение £л
опять-таки более
сложно. Дальнейшие подроб- ' г
ности см. в [66].
Де Во и Тиноко
вычислили дипольные
моменты и анизотропные
поляризуемости азотистых
оснований ДНК. На рис.
107 показаны
вычисленные дипольные моменты
в парах А+Т и Г + Ц.
Примечательно, что в
паре А+Т они малы и
отталкиваются, а в Г + Ц—
велики и притягиваются.
Расчет дает значения
энергий, приведенные в
табл. 18.
Г притягивается к Ц,
а А отталкивается от Т.
К этим значениям
должны быть добавлены
энергии водородных
связей. Энергии в табл. 18 вычислены при е—1; значит,
действительные энергии меньше. Нужно, конечно, подставлять не е=81
(вода при 25°С), а е=2—5 — локальное значение е при
взаимодействиях на малых расстояниях.
Таблица 18 [65]
Энергия взаимодействия оснований
(в ккал/моль)
Рис. 107. Дипольные моменты в азотистых
основаниях пар А+Т и Г + Ц.
Пара
оснований
г+ц
А + Т
Е№
-3,1
0,8
Ера
—0,3
-0,1
Ел
-0,5
—0,5
Сумма
—3,9
0,2
282
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Но в двойной спирали диполь-дипольные, индукционные и
лондоновские силы действуют не только между спаренными
основаниями, но и между другими соседями, в том числе и
вдоль одной цепи. Лондоновское взаимодействие плоских
оснований, лежащих одно над другим, особенно значительно.
Расчет (опять-таки при 8=1) приводит к интересным результатам
(табл. 19).
Таблица 19 [65]
Полусумма четырех взаимодействий между иеспареииыми
основаниями (ккал/2 моля оснований)
Примыкающие
пары *)
<Щ1
*ца
л
Сумма
tan
turj
turj
\rn\
[ml
tffil
|atJ
ttfj
—5,8
2,1
—0,5
—0,9
3,3
3,1
4,2
1,3
2,2
2,2
—4,1
—3,3
—2,0
-1,4
—2,0
-2,4
-2,4
-0,7
—0,6
-0,4
—6,0
—6,8
—6,8
—3,6
—6,8
—6,0
—3,6
—6,0
—6,8
—3,6
—19,8
—11,9
—11,2
-7,8
-7,4
-7,2
—5,7
—5,2
—5,0
—1,6
*) Стрелки указывают на антипараллельность цепей, например ТА
означает Т-сахар-3'-фосфат-5'-сахар-А.
Для получения полной энергии взаимодействия двух пар
нужно сложить суммарные энергии табл. 18 и 19. Например, для
t
AT I
ГЦ |
получаем —7,4+0,2—3,9=—11,1.
редупликация Днк 283
Де Во и Тиноко считают, что эти энергии значительно
больше энергий водородных связей и тем самым образование
двойной спирали определяется главным образом обычными
межмолекулярными взаимодействиями. С этим трудно согласиться —
если бы это было так, то нельзя было бы понять, почему Г
спаривается с Ц, а А с Т.
Не приходится доверять и числам, найденным Де Во и
Тиноко. Квантовомеханические расчеты таких сложных молекул
пока не очень надежны. Локальные значения е неизвестны. Тем
не менее эти результаты важны в качественном отношении. Они
с несомненностью свидетельствуют, во-первых, о том, что пары
ГЦ связаны прочнее, чем AT, и, во-вторых, о существенном
различии энергий взаимодействия при разных
последовательностях оснований вдоль данной цепи. Тем самым
термодинамическая устойчивость разных нуклеотидных текстов различна и,
возможно, что это накладывает некоторые ограничения на
генетическую информацию, заключенную в ДНК. Для проверки
последнего предположения нужно знать
текст—последовательность нуклеотидов. Как уже говорилось, в отличие от белковых
текстов, нуклеиновые тексты еще никто никогда не читал.
При рассмотрении ван-дер-ваальсовых сил Де Во и Тиноко
не учитывают роли воды, которая не сводится к
диэлектрической постоянной. Надо учитывать энергию взаимодействия с
водой при ее вытеснении из двойной спирали. Остается пока еще
совершенно невыясненным значение гидрофобных
взаимодействий. Водородные связи в нуклеотидных парах во всяком
случае означают структурное соответствие двух дополняющих друг
друга цепей. Очевидно, что энергии денатурации, о которых
говорилось ранее, суммируют все эти эффекты. Мы будем по-
прежнему говорить о водородных связях, имея в виду сказанное.
РЕДУПЛИКАЦИЯ ДНК
Мы познакомились со своеобразным строением молекул ДНК
и некоторыми свойствами этих молекул. Биологическая
функция ДНК неразрывно связана с ее строением и не менее
поразительными химическими свойствами.
Основной способ передачи наследственной информации от
клетки к клетке состоит в редупликации хромосом при митозе
и мейозе, при делении клеток. Детальное изучение этих
процессов свидетельствует о том, что дочерняя хромосома
представляет собой копию материнской, построенную вновь из
присутствующего в делящейся клетке материала. Так как основным
веществом хромосомы является ДНК, совершенно естественно
возникло предположение о том, что удвоение надмолекулярных
284
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
структур — хромосом — определено на молекулярном уровне
организации удвоением (редупликацией) макромолекул ДНК-
Как уже рассказано, ДНК служит матрицей для синтеза белка.
Если она действительно редуплицируется, то снимается вопрос
о какой-то иной матрице, необходимой для синтеза ДНК — она
служит сама для себя такой матрицей.
Модель Уотсона — Крика дает качественное объяснение
редупликации ДНК. Представим себе, что исходная двойная
спираль ДНК, состоящая из комплементарных, дополняющих друг
друга цепей, разделилась в результате разрыва водородных и
-А---Т-
-Т:г:А-
-А:ггТ-
-г-~ц-
-Т~:А-
-ц~г-
а)
*"
-А Т-
-Т А-
-А Т-
-Г Ц-
-Т А-
-ц г-
6)
*"
-Аг"Т-
-Т:г:а-
-А":Т-
-Г~:Ц-
-Т~:А-
-Ц~=Г-
в)
-А"ГТ-
-Т":А-
-А==:Т-
-Г=~Ц-
-Т":А-
-Ц5=гГ-
Рис. 108. Модель редупликации ДНК.
а) «материнская» двойная спираль; б) две разделившиеся цепи; в) две «дочерние»
двойные спирали, тождественные первоначальной.
ван-дер-ваальсовых связей и раскручивания двойной спирали
(рис. 108,а и б). Каждая из возникших цепей может служить
матрицей для сборки из мономеров (нуклеозидтрифосфатов)
новой цепи. Нуклеотиды соединяются с матрицей, причем таким
образом, что образуются уотсон-криковские пары — А
присоединяется кТ, ТкА, ГкЦиЦкГ (рис. 108, б). Одновременно
происходит поликонденсация нуклеотидов, и в результате вместо
одной исходной спирали образуются две, тождественные
первоначальной. Такая редупликация конвариантна — иными словами,
если в каком-то месте оказался неподходящий нуклеотид,
образующий в исходной спирали петлю или какой-либо иной дефект,
то при дальнейшем удвоении этот нуклеотид оказывается уже
законно занимающим свое место и дефект исчезает. Такая
фиксация дефекта структуры является, очевидно, хорошей моделью
мутации.
В принципе возможны три различных механизма
редупликации [67]. При консервативном механизме материнская двойная
спираль сохраняется, но с ее помощью создается новая,
дочерняя спираль (рис. 109,а). Полуконсервативный механизм
изображен на рис. 108 и на рис. 109,б— в новых двойных спиралях
РЕДУПЛИКАЦИЯ ДНК
285
одна цепь старая, другая—новая. Наконец, при дисперсивном
механизме происходит равномерное распределение
родительского материала между четырьмя цепями двух дочерних двойных
спиралей (рис. 109,б). Вопрос о природе механизма подлежит
экспериментальному решению. Полуконсервативный
представляется наиболее
механизм
I
I
i
\
а)
I
I
n It
6)
I I
Mil
it It
редупли-
Рис. 109. Возможные механизмы
кации ДНК.
а) консервативный; б) полуконсервативный; в) дис-
персивный.
Родительские молекулы
привлекательным, так как
он обеспечивает конвари-
антность без каких-либо
затруднений—дефект при
удвоении перестает быть
дефектом. Действительно,
опыт свидетельствует в
пользу
полуконсервативного механизма.
Месельсон и Сталь
изучили редупликацию
ДНК при делении клеток Е. coli с помощью меченых атомов и
седиментации в градиенте плотности [68]. Кишечные палочки
выращивались на питательной среде, содержащей только меченый,
радиоактивный азот N15. Так была получена популяция клеток,
сплошь меченных N15.
Клетки в периоде интерфазы
переносились в новую среду,
содержавшую уже только
обычный азот N14. В этой
среде клетки делились.
Изучалась исходная популяция,
ее «дети» и «внуки». Из
исходной клетки и клеток
потомства первого и второго
поколения извлекалась
ДНК, которая изучалась в
ультрацентрифуге —
определялась ее плотность и
радиоактивность. Оказалось,
что исходная ДНК имеет
наибольшую плотность, она
нацело мечена N15. ДНК «детей» мечена наполовину — ее
плотность равна среднему арифметическому из плотности
ДНК- N15 и ДНК- N14, выделенной из клеток, выросших на
немеченой среде. Наконец, ДНК «внуков» разделились в градиенте
плотности на две зоны —одна соответствует ДНК-N14, а другая
ДНК, меченной наполовину. Полученные результаты
иллюстрируются рис. ПО. Но ведь это как раз та картина, которая
he поколение
2-е поколение
N*NM
Рис. НО. Результаты опыта Месельсона
и Сталя.
286
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
должна получаться при полуконсервативной редупликации по
схеме рис- 108 или 109,6.
Вопрос о строении хромосомы в целом и о том, как
расположены в ней двойные спирали ДНК, пока что выходит за
рамки молекулярной биофизики. Хромосома — сложная
надмолекулярная структура, в которой еще не удалось полностью
разобраться. Сложность связана, в частности, с тем, что хромосома
состоит не из ДНК, а из комплексов ДНК с белками (гистоны,
протамины)—нуклеопротеидов, о которых мы также мало что
знаем. Хромосомы содержат также РНК. К настоящему
времени молекулярная биофизика достигла больших успехов в
исследовании строения и свойств отдельных биологических
молекул, но не сложных надмолекулярных структур.
Тем не менее и о строении хромосом многое уже известно.
Хромосомы, по-видимому, состоят из многих нитей, каждая из
которых имеет толщину порядка 200 А. Эти нити в основном
идут параллельно, но скручиваются друг с другом в областях
дисков, наблюдаемых в хромосомах. Обнаруживается целая
иерархия надмолекулярных спиральных структур (69—71]. Если
Рис. 111. Схема распределения ДНК при удвоении хромосом.
Пунктирные линии —меченая ДНК. Точки'Изображают зерна на радиоавтографе, а) удвоение
в присутствии Н3-тимидина; б) первая мета фаз а после включения метки; в) удвоение в
отсутствие метки; г) вторая мета фа за. (По Тейлору.)
в первом порядке единицей структурной организации является
нить с диаметром около 200 А, то единицей следующего порядка
служит более толстая, двойная нить с диаметром 500 А. По
мнению Риса, хромосома сходна с вирусной частицей в том смысле,
aj
в)
Рнс. 112. Схема редуплнкацнн хромосомы.
а) исходное состояние; б) З'-звепья открываются надлежащими ферментами*
в) началу редупликации. (По Тейлору.) '
288 гл. 6. физика нуклеиновых кислот
что ее сердцевина состоит из нуклеиновых кислот, а оболочка —
из белка [71].
Тейлор показал, что и редупликация хромосом в целом
происходит полуконсервативно так же, как и редупликация
макромолекул ДНК, из которых построены хромосомы [72]. Для этого
был применен метод радиоавтографии. В хромосомах клеток
некоторых растений (Vicia faba, Bellevalia, Crepis, Allium)
содержался тимидин, меченный тритием. Окружающая хромосомы
среда трития не содержала, поэтому при удвоении по
полуконсервативному механизму дочерние хромосомы должны быть
нерадиоактивными. Соответствующая схема показана на рис. 111.
Рнс. 113. Редупликация циклической хромосомы Е. coli (по Кэнрнсу).
— меченая ДНК; # —«шарнир».
Так как тритий р-радиоактивен, он сам себя фотографирует —
дает отпечатки в фотоэмульсии. Действительно, полученные
результаты соответствовали приведенной схеме.
Тейлор предложил модель редупликации хромосом,
происходящей в результате редупликации ДНК (рис. 112). Эта модель
РЕДУПЛИКАЦИЯ ДНК
289
согласуется с рядом опытных фактов [72]. При изучении генетики
бактерий и фагов не приходится встречаться с трудностями
исследования сложной надмолекулярной структуры. В этих случаях
хромосома представляет собой, по-видимому, просто
макромолекулу ДНК — двойную спираль, свитую в замкнутое кольцо.
Немногими известными исключениями являются однонитевые
ДНК фага <рХ174 [73], а также фагов S13 и q>R[74].
Тем же методом радиоавтографии была изучена
редупликация кольцеобразной хромосомы Е. coli. Метки давал тритий.
На рис. 113 схематически показаны полученные результаты [75].
Из них следует, что включение метки идет последовательно от
нуклеотида к нуклеотиду. Хромосома испытывает редупликацию,
начиная с некоторого локуса. Химические доказательства
редупликации ДНК получены в результате уже упоминавшихся выше
(стр. 253) работ Корнберга по синтезу ДНК in vitro [76, 77].
ДНК удается синтезировать, если инкубационная смесь
содержит трифосфаты тимидина, дезоксицитозина, дезоксигуано-
зина и дезоксиаденозина (ТТФ, ЦТФ, ГТФ, АТФ), ионы
Mg** (6*10~3Л1), рН 7,5, фермент—полимеразу, выделенный из
Е. coli и нативную ДНК в качестве затравки. В качестве нее
бралась ДНК из вилочковой железы теленка. Если система
является полной, то в ней происходит синтез ДНК, нуклеотидный
состав которой совершенно аналогичен составу затравочной
ДНК. Реакция не идет при отсутствии хотя бы одного из
компонентов смеси или при предварительной обработке затравочной
ДНК дезоксирибонуклеазой — ферментом, разрушающим ДНК-
Это иллюстрируется следующей табл. 20.
Таблица 20 [76]
Потребности в различных компонентах
при включении дезоксннуклеотндов в ДНК
Система
Полная система (5 тцмолей
каждого нз 4 трнфосфатов, 1 цмоль
MgCI2, 10 \хг ДНК, 3 \iz фер-
То же без ЦТФ, ГТФ, АТФ ....
ДНК была предварительно обрабо-
Количество
ДНК
т\кмоли
•
0,50
<0,01
<0,01
<0,01
< 0,01
<0,01
<0,01
<0,01
19 М. В. Волькенштейн
290 гл. 6. физика нуклеиновых кислот
Включение нуклеотидов в новую ДНК исследуется с
помощью нуклеотидов, меченных Р32. При включении каждого из
нуклеотидов в цепь происходит выделение неорганического ди-
фосфата, пирофосфата ФФ (т. е. Н4Р2О7). Реакция идет по
схеме
пТФФФ
пГФФФ
пАФФФ
пЦФФФ
"ТФ"
ГФ
АФ
_ЦФ_я
-|- 4пФФ,
т. е. это реакция поликонденсации, а не полимеризации.
Согласно закону действия масс реакция может быть заторможена
и обращена при увеличении концентрации пирофосфата.
Действительно, если пирофосфат присутствует в количестве, в 100
раз большем, чем общее количество дезоксинуклеозидтрифос-
фатов, то реакция тормозится примерно на 50%.
К сожалению, до сих пор не существует более детальных
экспериментальных исследований термодинамики и кинетики
синтеза ДНК in vitro, не говоря уже о синтезе in vivo. Тем не
менее работы Корнберга являются очень крупным достижением,
позволяя подойти к важнейшему явлению — редупликации ДНК,
как к обычному физико-химическому процессу.
Тем же методом получались молекулы ДНК с замещением
некоторых азотистых оснований. Т можно заменить на У (при
этом скорость синтеза заметно падает) и на 5-Вг-У (при этом
скорость синтеза не меняется). Ц заменяется на 5-Вг-Ц и на
5-СНз-Ц, а Г—на гипоксантин. Фермент Корнберга при
действии на неполную смесь мономеров также работает, но лишь
после длительного инкубационного периода (см. далее стр. 308).
Из смеси АФФФ и ТФФФ получается сополимер регулярного
периодического строения с двойными спиралями типа
—А—Т—А—Т—А—Т—А—Т—
—Т-А-Т-А-Т-А-Т-А-
Из смеси ГФФФ и ЦФФФ получаются уже гомо-, а не
сополимеры с двойными спиралями
_г— г— г — г — г — г — г — г —
-ц-ц-ц-ц-ц-ц-ц-ц-
В этих случаях сначала медленно полимеризуется матрица,
затем происходит матричный синтез.
Очевидно, что редупликационный синтез ДНК может и
должен быть предметом термодинамического рассмотрения. Как
РЕДУПЛИКАЦИЯ ДНК
291
всегда, в задачах молекулярной физики и физической химии
термодинамический анализ предшествует детальному
теоретическому исследованию, процесса. Термодинамика дает общие
условия протекания такого процесса, ничего не говоря, конечно,
о его скорости — если речь идет о равновесных условиях. Ста-
тистико-термодинамическое рассмотрение редупликации ДНК
было предложено в работах [78, 79].
Рассмотрим начальное состояние системы, образованной двойной
спиралью ДНК н окружающим ее водным раствором нуклеозндтрнфосфатов
(НТФ), н конечное состояние, в котором вместо одной исходной двойной
спирали возникли две двойные
спирали, тождественные
первоначальной, а в раствор поступило
соответствующее количество пнро-
фосфата ФФ (рис. 114). Вычислим
разность термодинамических
потенциалов конечного н начального
состояний
AF + pAV^AF. (6.22)
Изменение свободной энергии
можно представить в виде
AF = — N (2£, 4- Ё2) — TAS, (6.23)
где N — число нуклеотидов в
каждой нз цепей спирали, Е\ —
энергия, выделяемая при включении
одного нуклеотнда в цепь, Е2 —
средний выигрыш энергии при
образовании водородных связей
между азотистыми основаниями в
уотсон-крнковской паре, AS —
изменение энтропии. Очевидно, что
Е2 должно зависеть от относительного содержания Г + Ц, так как сцепление
в А — Т менее прочно, чем в Т — Ц. Поэтому напншем
Рис. 114. Начальное, промежуточное н
конечное термодинамические состояния
редуплнцнрующейся ДНК.
£2 = а£гц + (1— а)£АТ,
(6.24)
где а —доля Г—Ц в ДНК,
а =
|Г + Щ
[А + Т]+[Г + Ц]
(6.25)
Как же представить энтропийный член? Изменение энтропии при
включении нуклеотнда в цепь определяется тремя факторами. Во-первых, замена
нуклеозндтрнфосфата на пнрофосфат в растворе выражается через разность
нх собственных энтропии в свободном состоянии — это молекулы разного
строения, массы н размера. Во-вторых, нуклеотид, включенный в двойную
спираль, лишен свободы поступательного н вращательного движения.
В-третьих, прн включении нуклеотида изменяется энтропия смешения
раствора. Объединяя два первых фактора в одни фактор k \nqt выражающий
19*
292 гл. 6. физика нуклеиновых кислот
изменение собственной энтропии, приходящееся на одни нуклеотнд, напишем
AS = 2№\п (q^^V (6.26)
х
фф
Г
где *фф — концентрация ФФ в растворе, а *нтф — средняя
концентрация НТФ, равная
-*НТФ ~(*р*Ц"*А~ -^т" ) » (6.27)
где х^у ХцУ Хд, хт — концентрации соответствующих НТФ. Если онн равны
ДРУГ Другу* то
-*НТФ
Хг—Хц=ХА=Хт= £
и
-*нтф =—4—' (&Щ
Термодинамическое условие редупликации состоит в равенстве друг другу
свободных энергий конечного н начального состояний. Условие редупликации
Л/7<0, (6.29)
т. е.
2El + E2+ 2kT\n (q **НТФ ) > 0. (6.30)
\ -*ФФ /
Иными словами, чем больше выигрыш энергии 2Е\ + E2t тем выгоднее
процесс Роль энтропийного члена зависит от его знака. Если при редупликации
энтропия повышается, то она работает в ту же сторону. Если энтропия
понижается, то происходит конкуренция между энергетическим и энтропийным
факторами.
На' первый взгляд может показаться, что увеличение упорядоченности
вещества при образовании второй спирали должно сопровождаться
уменьшением энтропии, и такая конкуренция имеет место. Это действительно было бы
так, если бы синтез ДНК происходил путем полимеризации, а не полнконден-
сацнн. Выделение ФФ в раствор приводит к тому, что знак AS зависит от
-*НТФ
отношения — и, конечно, от величины д.
Оценка величин, фигурирующих в (6.30), не является вполне строгой,
но ею можно пользоваться для орнентнровочных_ расчетов. Разумное
значение Ei порядка 4 ккал/моль. Примем величину Е2 порядка 5 ккал/моль (как
указано на стр. 271, Е2 может быть н больше). Величина q имеет значение
*~^, (6.31)
где ^1 н ql — собственные статистические суммы НТФ в растворе и в
состоянии нрнсоедннення к цепн-матрнце водородными связями, q2 н q2 —
собственные статистические суммы свободного ФФ в растворе н ФФ,
входящего в НТФ, присоединенный к матрице водородными связями. Считая, что
молекулы в растворе имеют независимые степени свободы поступательного
н вращательного движений, утрачиваемые прн закреплении молекул на
РЕДУПЛИКАЦИЯ ДНК 293
матрице, находим, пользуясь обычными формулами статистической механики,
учитывающими массы и размеры молекул, q ~ 10*2. Итак, при 300° К условие
редупликации имеет вид
13+ 1,21п /КГ2 4т15-) > 0- (6.32)
\ -*фф /
Это условие выполняется до тех пор, пока отношение хфф ; -*НТФ не
станет равным 1 :400. В клетках (а также в опытах Корнберга) это
отношение значительно больше. Значит, и энергетический и энтропийный факторы
работают в одном направлении — термодннамнческое условие редупликации
соблюдается. Реальные причины, препятствующие редупликации на
определенной стадии развития клетки, являются, вероятно, не термодинамическими,
а кинетическими (см. [81]. Они могут заключаться в отсутствии в клетке
необходимого фермента, который вырабатывается на более поздней стадии
митоза. Возможно также, что не относительная, а абсолютная концентрация
НТФ в ннтерфазе недостаточна для синтеза ДНК. Несомненно, что
редупликация подчиняется сложным регуляционным закономерностям (см. стр. 361),
на объяснение которых излагаемая модельная теория не претендует.
Приведенные расчеты следует сравнивать не с процессом, идущим in vivo, а с
опытами Корнберга. Теория этим опытам не противоречит, но говорить о полном
согласии можно будет лишь после исследования концентрационной и
температурной зависимости синтеза ДНК.
В рамках той же теории получается описание денатурации ДНК,
рассматриваемой как разрыв водородных и ван-дер-ваальсовых связей между
азотистыми основаниями комплементарных цепей. Разность свободных
энергий разделенных цепей и двойной спирали может быть представлена в виде
Л/7' » NE2 — 2NkT I n q't (6.33)
где (f — изменение собственной энтропии цепи, приходящееся на один нуклео*
тнд. Условие денатурации имеет вид
AF' < 0.
В первом приближении можно считать, что все изменения энтропии цепей
при денатурации определяются их гибкостью. Тогда Q/^zt где z — число
конформаций звена одиночной полинуклеиднои цепи. В звене содержится
5 единичных связей (ср. рис. 42), а каждой связи отвечают 2—3 поворотных
изомера. Так как из-за стернческнх ограничений, вероятно, не все
возможные конформаций реализуются, z должно составлять величину порядка
10—100.
Из (6.31) следует, что температура денатурации
т £2 __ а£гц +П —«) £дт _ £дт , м £гц — £ат „^
4nJl~~2k\nq' ~~ 2k\nq' " 2k\nq' ^ 2k\nq'
т. е. Тпл действительно линейно зависит от а. Численное согласие с
найденной Мармуром и Доти зависимостью Тпд от содержания Г+Ц [62]:
Л1л=342°К + 41а°К
получается при ЕАТ » 4,7 ккал/моль, £Гц = 5,3 ккал/моль и z = 32.
Согласно термодинамической теории судьба двойной спирали ДНК
зависит от соотношения величин А/7 и AF' соответствующих разностей
свободных энергий. Если
AF<AF' и Л/7<0
294
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
то происходит редупликация. Если
то происходит денатурация. Если
то оба процесса термодинамически равновероятны.
Если *
AF > О, Л/7' > О,
то двойная спираль остается без изменений.
Следует подчеркнуть, что изложенная термодинамическая теория
исходит из обратимости процессов редупликации и денатурации. В опытах
Корнберга включение меченого ФФ в свободные НТФ свидетельствовало об
обратимости промежуточных стадий
процесса. Денатурация может быть
на определенной стадии обратимой
(стр. 275). Однако в целом, в
процессах, протекающих in vivo,
редупликация ДНК необратима.
Необратима и полная денатурация ДНК.
Для строгого рассмотрения этих
явлений необходимо пользоваться
кинетикой или термодинамикой
необратимых процессов. Излагаемая
«равновесная» теория является модельной
и приближенной. Ее результаты
полезны, хотя теория и не претендует
на полное описание процесса.
Эта теория позволяет
оценить термодинамические
вероятности мутаций,
рассматриваемых как петли (стр. 262).
Для этого можно
воспользоваться условием редупликации
(6.30) [79, 80]. При
образовании петли проигрывается
энергия водородных связей,
приходящаяся на одну пару
оснований. Вероятность
мутации в данном звене, содержащем основание К (К—А, Т, Г, Ц),
может быть представлена формулой
(6.35)
Рис. 115. Различные типы петель,
моделирующие точечные мутации.
W=e-*FblkT,
где A'Fft — разность свободных энергий мутированного и
немутированного состояний звена с основанием К в цепи ДНК. Расчет
дает различные вероятности для разного типа петель,
изображенных на рис. 115. При принятых зыше значениях энергий и
РЕДУПЛИКАЦИЯ ДНК 295
энтропийных факторов получаются следующие результаты
(табл. 21).
Таблица 21
Вероятности образования петель
Тип петли
I — петлн в обеих це-
11/1Л *******
II — петлн в
«материнской» цепн . . .
III —петлн в «дочерней»
IV — двойная петля
в «дочерней» цепн
Звено содержит
в нормальном состоянии
Г или Ц
1.4 • 10~4
10"'
1.5 • 10"'
2,0-10"4
А или Т
4-10"4
2,5-10"'
1,5-10"'
2,0-10"4
Эти вероятности значительно больше наблюдаемых на
опыте. У бактерий число мутаций на ген на поколение не
превышает 10~Б—10~7%. Ясно, что с увеличением числа нуклеотидов
в петле вероятность ее образования быстро убывает—примерно
в 100 раз на каждый нуклеотид. Исправить положение таким
способом, однако, невозможно. Расшифровка кода ДНК — белок
(гл. 7) показывает, что точечная мутация связана с заменой
всего лишь одного нуклеотида. Учет таутомерии нуклеотидов
(стр. 265) может лишь ухудшить ситуацию, так как
способность неподходящего нуклеотида в таутомерной форме
создавать нужные водородные связи приведет к увеличению, а не
к понижению вероятности мутирования. Можно думать, что если
петли правильно моделируют точечные мутации, то их
образование лимитируется не термодинамическими, а кинетическими
факторами—наличие высокого активационного барьера
приводит к резкому понижению вероятностей образования петель (ср.
[81])._С другой стороны, если принять большее значение
энергии Ег, например, следующее из экспериментальных
результатов работы [52], теоретические вероятности существенно
уменьшатся, и, возможно, получится согласие с опытными данными.
При дальнейшем развитии теории спонтанных мутаций
необходимо также учесть результаты расчетов Де Во и Тиноко [58].
Очевидно, что число различных типов петель и соответственно
различных типов мутаций с разными вероятностями при этом
сильно возрастет.
Однако уже и на этой стадии термодинамические расчеты
приводят к интересным следствиям.
296 гл. 6. физика нуклеиновых кислот
Во-первых, получается естественный результат — замена
А—Т на Г—Ц термодинамически более вероятна, чем обратная,
так как Г—Ц соединены прочнее. Отсюда, конечно, не следует,
что в процессе эволюции должно возрастать содержание Г—Ц
в ДНК. Термодинамика ничего не говорит и не может сказать
о естественном отборе мутаций. Действительно, у высших
организмов содержание Г + Ц в ДНК стабилизовано на уровне
40—45%, в то время как у бактерий оно может достигать и
80%. Молекулярная биология объясняет эти факты (стр. 339).
Во-вторых, из расчета следует, что вероятность мутаций
зависит от относительных концентраций различных НТФ в
растворе.
Приведенные в табл. 21 цифры получены для
эквимолекулярной смеси всех четырех НТФ. Для того чтобы уровень
спонтанных мутаций был постоянен, соотношение концентраций НТФ
в растворе должно сохраняться неизменным. Любое нарушение
баланса приведет к изменению в числе и типах мутаций. Это
положение в принципе может быть проверено экспериментально.
Оно, по-видимому, справедливо и при кинетическом, а не
термодинамическом происхождении мутирования. Одно из
косвенных воздействий радиации на мутирование может состоять в
нарушении баланса нуклеотидов в цитоплазме. Известно, что
коротковолновая радиация по-разному действует на различные
нуклеотиды. Здесь существенно локальное воздействие квантов
на нуклеотиды, находящиеся в непосредственной близости от
редуплицируемой ДНК.
СТАТИСТИЧЕСКАЯ ФИЗИКА И КИНЕТИКА РЕДУПЛИКАЦИИ ДНК
Термодинамический анализ процесса редупликации не дает,
естественно, сведений о механизме этого процесса.
Определяются условия перехода, но какой характер имеет этот переход,
насколько он резок — на эти вопросы термодинамика не дает
ответа. Ситуация вполне аналогичная той, которая имеется в
теории кристаллизации жидкости или плавления кристаллов.
Выше показано, что рассмотрение макромолекулярной цепи,
как кооперативной системы на основе одномерной модели Изин-
га, позволяет объяснить все основные физические свойства
макромолекул, явления перехода спираль — клубок, т. е.
денатурацию белков и нуклеиновых кислот. Предположим, что и процесс
редупликации, т. е. синтез новой цепи на одномерной матрице,
протекает кооперативно. К его рассмотрению также можно
применить одномерную модель Изинга [78, 79].
Предположим, что присоединение новых нуклеотидов
происходит на освободившихся звеньях цепей, т. е. на тех звеньях,
СТАТИСТИЧЕСКАЯ ФИЗИКА И КИНЕТИКА РЕДУПЛИКАЦИИ ДНК 297
водородные связи между которыми разорваны. Будем считать,
что разделение двойной спирали происходит с одного конца, а
не в середине (расчет практически не меняется, если
рассматривать разделение двух концов). Таким образом, наряду с
начальным и конечным состояниями системы рассматриваются и
любые промежуточные, в которых некоторое число звеньев, по г на
каждую цепь, разделилось и способно присоединять НТФ из
раствора (рис. 114).
Полная статистическая сумма системы запишется в виде
N _
Q=%e-rE>!kTQ2r. (6.36)
Первый сомножитель под знаком суммы выражает разрыв межцепочечных
связей в г уотсон-крнковскнх парах, на что расходуется энергия гЕ2. Второй
сомножитель — статистическая сумма 2г освободившихся звеньев ДНК. Для
вычисления Огг воспользуемся методом Изннга.
Считаем, что' каждое из 2г звеньев может находиться в трех
состояниях: 1) к звену присоединен водородными связями «подходящий» НТФ из
раствора (А к Т, Т к А, Г к Ц, Ц к Г); 2) к звену присоединился
«неподходящий» НТФ из раствора (Г, Ц, Т к А и т. д.); 3) звено осталось
свободным, т. е. оно может присоединить молекулы воды. Это, очевидно, грубая
модель, так как в ней не учитывается различие в энергии взаимодействия
в уотсон-крнковскнх и в не уотсон-крнковскнх парах нуклеотндов.
Состояния 1, 2, 3 характеризуются следующими свободными энергиями:
Fl = — E2 — kT\n I хНТФ
(*н»-5г)'
р\ Е2-кТ\п[х'тФ ^
Fo = — kTlnz.
■Г-). (6.37)
-*НТФ отличается от -*нтф» так как к каждому звену цепи может
присоединиться один «подходящий» и три «неподходящих» НТФ. Имеем
-*нтф = [(-* - *т? (-* - -*ц)а (•* - хА)1 - а {х - хт)1 - «]* (6.38)
где
х — хНТФ.
ПрН ХА = Хт •= ХГ = Хц
■*нтф — "4"x " ^*нтф • (6.39)
Основная гипотеза заключается в том, что поликонденсацня, т. е.
образование фосфорно-эфнрной связи между двумя нуклеотндамн с
одновременным выделением в раствор одной молекулы ФФ, происходит лишь тогда,
когда к соседним звеньям цепи присоединены подходящие нуклеотнды. Если
298
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
два соседних звена находятся в состоянии 1, то происходит дополнительное
изменение свободной энергии на величину
/>3 = -£,-*Лп(.*фф|1).
(6.40)
В этом и состоит кооперативное™ процесса.
В соответствии с теорией одномерной модели Изннга статистическая
сумма Q2r может быть представлена как след матрицы вероятностей, взятой
в степени 2г (стр. 165). Здесь эта матрица имеет вид
Я(1, 1) Я (1,2) Я (1,3)
Р«| Я(2, 1) Я(2, 2) Я(2, 3)
Р (3,1) Р (3,2) Р (3,3)
(6.41)
где Р (/, у) есть термодинамическая вероятность того, что данное звено
находится в состоянии /, если следующее за ним звено находится в
состоянии у. i, у» 1, 2, 3, так как каждое звено может находиться в трех
состояниях.
Обозначив
-F.lkT
1/J
-F'JkT , -F^/kT -F*-FofkT
ah e ll =a„ e 2/ »a2, e l 3/ =я3, (6.42)
получаем в нашем случае
аъ а\ а\
lit
<Z] #j С\
а2 й2 й2
(6.43)
Для нахождения следа матрицы Р, решаем ее характеристическое
уравнение
ИЛИ
а^ d\ — A aj =0
а2 д2 а2— Л
^3 — (а1 + ^2 + аз) *2 + (а1аз — вЛ — а\а\ + a2^) Л = 0.
Наибольший корень
*
(а[ + а2—а^2
(6.44)
(6.45)
bmax
^ + д2+д3 , Г
2 +L"
+ а1<*1
1%
1 + « AJ •
(6.46)
Статистическая сумма (?2г равна
2г
и при 2г ^> 1
<?2,^
max*
(6.47)
(6.48)
*
При принятых выше значениях Е\, Е2 и т. д. во всей интересующей
нас области концентраций и температур ах и а[ много меньше, чем а2 и аг.
Иными словами, вероятность при соединения НТФ водородными связями
СТАТИСТИЧЕСКАЯ ФИЗИКА И КИНЕТИКА РЕДУПЛИКАЦИИ ДИК 299
без поликонденсацнн очень мала. Действительно, при ■*НТф~' 10~QM
(концентрация в опытах Корнберга) а, и а[ имеют значения порядка 10"б, в то
время как а2 при комнатной температуре ~30, а а3 в точке
редупликации ^ 102. Следовательно, с большой степенью точности получаем
, _ а2 + оз. + Г(аг-аз)г1'/^ {6Щ
,vmax
Если а2 — аз > 0» то
Если а2— az < 0, то
Если а2 — az» 0
2
^max = &2'
^max = аз«
'max
При фиксированном г среднее число заполнмернзовавшнхся звеньев
равно
h д\паг —* d\naz ' {Ь,Щ
При Лщах^аг /Г«0, т. е. редупликация не идет. При Атах^а3 7Г « 2г,
т. е. на освободившихся цепях синтезируются новые цепи — редупликация
идет. Наконец, при Amax= 2*Г 3 1Т^ 2г р— = г, так как здесь а2—вз-
л fl2*T~^3
Это соответствует редупликации, прошедшей наполовину.
Теперь мы знаем Q2r и можем написать полную статистическую сумму
Суммирование распространяется на все состояния —ют иеразделившейся
двойной спнралн (г = 0) до двойной спнралн, разделившейся полностью
(г « Л''). Замена Q2r на Л^ах справедлива при больших г. Можно показать,
однако, что более строгое решение, учитывающее в Q2r и второй корень
(третий корень А3» 0), не меняет результата.
Выражение (6.51) есть геометрическая прогрессия. Проведя
суммирование, получаем
bN+l — 1
где
^О'^ (6-54)
Мы получили простое аналитическое выражение полной статистической
суммы. С помощью Q можно вычислить все термодинамические функции
системы. Найдем среднее число разделившихся звеньев
is
г=0
N
rbr. (6.55)
300
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Это арнфметнко-геометрнческая прогрессия. Проводя суммирование, получаем
- NbN+2-(N+l)bN+l+b
Г" bN+2-bN+l-b + l '
(6.56)
W
При N^>1 r^N при b > I и r^sgO при b < 1.
Случай b < I соответствует сохранению первоначальной двойной спирали,
а случай b > I — полному разделению цепей. При b > I и а2 — вз > 0 дело
l^ty ограничивается денатурацией,
при b > 1 и аз—а2 > 0 — про-
Л N=10* (j03 /r /и~^Л исходит редупликация. Точки
N I / у^ш^ Денатурации и соответственно
Ц8\ | ix редупликации определяются
условием b = I. Эти условия,
естественно, совпадают с ус-
nffy н / / ловнямн (6.30) и (6.33), полу-
ченнымн из чисто
термодинамических соображений.
-. , На рис. 116 и П7_показана
^ ' • зависимость U от хНТФ/хфф
для редупликации и
зависимость г от температуры для
денатурации. Уже при N — 1000
получающийся согласно нзло-
N , i i I \1г=0 женной теории переход абсо-
%Ю № 1,00
0,2-
1,05 _ pff
'ФФ/крмт
Рис. 116. Зависимость степени
редупликации от концентрации нуклеозндтрнфосфатов.
Т-Тя
ПА
Рис. 117. Зависимость степени разделения
цепей от температуры.
лютно резок, подобен
фазовому переходу. Содержащаяся в
этих расчетах теория
денатурации является, конечно, более
грубой, чем теория Знмма
(стр. 269).
Рассмотрим теперь вторую
модель, которую можно
назвать антнпараллельной.
Разделение цепей идет с одного
(или двух) конца; обе цепи
в равной мере работают как
матрицы. Но ведь в
действительности в каждом данном
участке двойной спирали обе
цепи не эквивалентны, так
как они антнпараллельны.
Имеются данные, указывающие
на то, что синтез новой цепи
ДНК происходит путем
последовательного присоединения
НТф к З'-нуклеозндному
концу растущей цепи [82]. Тогда
редупликация происходит
одновременно на нижнем конце
одной цепи и верхнем конце
другой. Два других конца
остаются временно свободными. Прнсоеднненне идет звено за звеном, без того,
чтобы НТФ адсорбировались на освободившейся части цепи где попала
Расчет может исходить из модели, показанной на рис, 118 [83].
СТАТИСТИЧЕСКАЯ ФИЗИКА И КИНЕТИКА РЕДУПЛИКАЦИИ ДНК 301
Статистическая сумма в этом случае имеет вид
^SS S 2*i+'*2+4^2 2*2,+'". (6-57)
г=0 *«=0 р-0 1=0 г'=0г"=0
где
"2
Первое слагаемое относится к состояниям, в которых цепи ДНК еще не
разделились и удерживаются вместе хотя бы одной водородной связью. В
качестве произвольного промежуточного состояния взято состояние, в котором
с одного конца разорвалось г связей между основаниями и выросла новая
цепь из i нуклеотидов, а с другого конца разорвалось р связей и выросла
цепь из / нуклеотидов. Второе слагаемое
относится к состояниям, в которых все водородные
связи разорваны и синтез идет на одиночных цепях
ДНК. В качестве промежуточного взято
состояние, в котором на одной цепи выросла новая
цепь из г', а на другой — из г" нуклеотидов.
После довольно громоздких суммирований
получаем
/1—*2)2 L(i —A42/1 A ач2^
+
(l-*2)2 L(l-*l)2(l-*l*2)2
*"(*2-1)
(l-*l)2(l-*l*2)
«+'(*2-1) Mf
(1-*,)(1-*,*2)2 1-*,
b»b2(b»-l)(l-2bib2+b2) Nb»b»+2
(1-*2)(1-*,)(1-*,*2) \ — bxbt
+ *r-2W+4W+"]. (6'58) Рнс.118.А„тнпараллель-
Это сложное выражение упрощается. При невысо- ная м°ДельРеДУплнкацнн
кнх температурах, когда денатурация термодинамн- Д"л.
чески невыгодна, Ь\ < 1. Редупликация идет только
при й,*2> 1. Значит, нас интересует Q лишь при значениях Ьг < 1 и bxb2 < 1.
При этом можно пренебречь членами порядка Ь^ и Ь^ьйЦ. Тогда
1 , (bfflbj
Q ~ (l-*i)2(l-*,M2 + (1-М2* (6'59)
Среднее число присоединившихся нуклеотидов равно
ЩЬ2 2N(bxbfyN b\ 2 {b$f b
2?= dlnQ^TT=6i)2(l-M2)3+ (I-62)2 " ib%-\?
2
(6.60)
302
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Если Ьфг>< 1, то 2г^-=—ЦЛ—, и если Ь* мало, то и г очень мало. Если
1 * 1 — b\b2 l
— 9 —
^1*| > !• т0 2г ^ 2N — т т, т. е. г близко к М Следовательно, точка ^9=1
является точкой редупликации. Это условие в раскрытом виде совпадает
с термодинамическим условием (6.30). В точке перехода г равно не N/2>
как в расчете на основе кооперативной модели, а 0,2//. Это объясняется
ролью промежуточных состояний при неполном разделении цепей, когда
синтез новых цепей менее выгоден, так как разрыв данной водородной связи
может привести к росту лишь одной цепи. Переход по-прежнему очень
резок при больших N (пунктир на рис. 116).
Статистико-термодинамическая теория не противоречит
экспериментальным результатам, но пока что нельзя считать ее
подтвержденной. Дело в том, что еще нет данных о зависимости
синтеза ДНК от концентрации нуклеотидов, от температуры
и т. д. В теории не учтена роль ионов металлов и рН среды.
Неясна пока что и роль ферментов.
Апошьян и Корнберг получили очень интересные результаты
при исследовании синтеза ДНК [84]. Они изучали явления,
возникающие при заражении клеток Е. coti бактериофагом Т2.
В клетках синтезируется путем редупликации фаговая ДНК,
причем оказывается, что возникают новые ферменты,
отсутствующие в неинфицированных клетках. В экстрактах из
зараженных клеток полимеразная активность в 10 раз больше, чем
в экстрактах из здоровых клеток. Эксперименты, проведенные
Апошьяиом и Корнбергом, показывают, что заражение клеток
фагом вызывает ряд событий. При попадании в клетку фаговой
ДНК происходит немедленная инактивация хромосомы, т. е.
инактивация ДНК бактерии. В результате бактериальные белки
уже не синтезируются и бактериальная ДНК не редуплици-
руется. Какова физико-химия этой инактивации, пока
неизвестно. Фаговая ДНК сразу берет на себя генотипическую и фе-
нотипическую функции. Через 4 минуты после инфекции
наблюдаются новые ферментативные реакции, обеспечивающие
редупликацию фаговой ДНК. Скорость синтеза ДНК, как уже
говорилось, увеличивается десятикратно. В то же время
остальные ферментативные механизмы исходной клетки,
ответственные за продукцию энергии и различные биохимические
процессы, остаются без изменений и поддерживают размножение фага.
По-видимому, в этих случаях действуют два фермента —
один катализирует процесс раскручивания двойной спирали, а
второй — полимераза — синтез новых цепей. Полимеразу Т2
удалось выделить. Самое замечательное состоит в том, что при
применении ее для синтеза ДНК In vitro с затравкой из какой-либо
ДНК она работает в 10—20 раз активнее, если затравка
вводится в денатурированной нагреванием форме — в виде отдель-
СТАТИСТИЧЕСКАЯ ФИЗИКА И КИНЕТИКА РЕДУПЛИКАЦИИ ДНК 303
ных цепей. Эффективной затравкой при работе с этим
ферментом служит и однонитевая ДНК фага фХ174. Эти результаты
доказывают, что при синтезе фаговой ДНК редупликации
предшествует разделение цепей. Еще ранее Боллум [85] показал, что
препараты отнюдь не фаговой полимеразы, а фермента,
выделенного из тимуса теленка, оказываются более активными при
редупликации гретой, а не нативной ДНК. Однако тепловая
денатурация ДНК затравки не ускоряет матричного синтеза ДНК,
если пользоваться полимеразои, выделенной из незараженных
клеток Е. colu
Вопрос о том, происходит ли редупликация ДНК после
разделения двойной спирали или одновременно с ним, решается
этими опытами в пользу первой возможности в случае фаговой
ДНК. Весьма вероятно, что в зависимости от фермента может
быть реализована и первая и вторая возможность.
Спрашивается, как в первом случае происходит синтез, если матричная
однонитевая ДНК закручена в клубок? Во-первых, может быть
не так уж она и закручена в этих условиях, если только на ней
имеются заряды, отталкивающиеся друг от друга. Во-вторых
(и это более правдоподобно), поскольку по всем данным синтез
новой цепи идет на старой, звено за звеном, этот процесс может
вызывать последовательное развертывание клубка, начиная с
одного конца, и образование двойной спирали.
С другой стороны, Синсхеймер прямыми опытами (меченые
атомы, седиментация в градиенте плотности) показал, что и
размножение одионитевого фага фХ174 идет через стадию
двойной спирали ДНК [86]. Когда частица фага попадает в клетку,
одиночная нить ДНК работает как матрица для построения
дополнительной цепи. Дальше происходит репликация путем
раскручивания образовавшейся двойной спирали и наращивания
новых цепей. Непосредственно перед созреванием частицы фага
две цепи разделяются и лишь одна из них включается в
готовую частицу. Интересно, что и репликация РНК вирусов идет
через промежуточную двухцепочечную структуру [87].
Изложенная выше статистико-термодинамическ'ая теория на
первый взгляд отвечает второй возможности — одновременному
синтезу и раскручиванию двойной спирали. Однако в
действительности теория не противоречит и однонитевому механизму —
ведь последовательность процессов во времени ею не
затрагивается. В этом смысле несущественно, являются ли состояния
системы, входящие в статистическую сумму, одновременными
или разделенными во времени. Следует подчеркнуть, что модель,
рассмотренная во втором варианте расчета (рис. 118), означает
наличие значительной части ДНК (до 33%) в
денатурированной форме. В недавней работе Рольфе [88] было прямыми
304
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
опытами показано, что при редупликации ДНК ряда бактерий
(во время экспоненциального роста культур) ДНК фигурирует
в неполностью денатурированном состоянии, что согласуется с
обеими рассмотренными моделями.
В последнее время получены надежные данные,
свидетельствующие об одновременном раскручивании и репликации, в
полном соответствии со схемой, положенной в основу теории.
Репликация хромосомы Вас. subtilis идет по механизму
раскручивания с одного конца [89]. Радиоавтографическое исследование
репликации циклической ДНК в £. coli (стр. 287)
непосредственно показывает одновременность разделения исходной
двойной спирали и возникновения новых. Концы бактериальной ДНК
соединены, и ДНК остается циклом во время репликации. То
же относится, видимо, и к фагам, ДНК которых также
образует циклы [90].
Обратимся теперь к кинетике редупликации ДНК —
рассмотрим, чем определяется скорость синтеза. Изложенная
термодинамическая и статистическая теория не дает и не может дать
ответа на этот вопрос, так как исследует лишь изменение
равновесного состояния независимо от времени. Резкость редупли-
кационного перехода, в смысле зависимости его условий от
концентрации мономеров и температуры, то обстоятельство, что
переход происходит по принципу «все или ничего», не имеет
никакого отношения к вопросу о скорости перехода. Это можно
пояснить следующим примером: кристаллизация жидкости
также идет по принципу «все или ничего», при точно определенной
температуре, но может происходить весьма медленно, так как
скорость процесса зависит от скорости образования
кристаллических зародышей и их дальнейшего роста.
Кинетика синтеза ДНК в клетке представляет
непосредственный биологический интерес. Термодинамические условия
синтеза, вероятно, всегда реализованы в клетке, но синтез
осуществляется лишь на той стадии ее развития, в которой
выполнены определенные регуляторные кинетические условия.
Поэтому кинетика синтеза более интересна, чем термодинамика.
Речь идет об общей кинетической теории синтеза полимера на
матрице, теории, которая, в конечном счете, должна быть
применима как к редупликационному синтезу ДНК, так и к синтезу
матричной РНК на матрице ДНК и к синтезу белка на РНК-
В качестве матрицы для редупликационного синтеза
работают одиночные цепи ДНК. Следовательно, — и это согласуется
с опытом — образованию дочерних двойных спиралей должно
предшествовать разделение материнской. Разделение двойной
спирали при ее одновременной редупликации происходит в
более благоприятных условиях, чем в случае простой термической
СТАТИСТИЧЕСКАЯ ФИЗИКА И КИНЕТИКА РЕДУПЛИКАЦИИ ДНК 305
денатурации. Освободившиеся цепи, на которых нарастились
новые, уже не могут вернуться в исходное состояние — процесс
отчетливо необратим. Выделяющаяся при редупликации
свободная энергия более чем достаточна, чтобы обеспечить быстрое
раскручивание спирали.
Левинталь и Крейн [91] провели соответствующие расчеты,
исходя из модели, показанной на рис. 119. Здесь двойные
спирали вращаются подобно кабелю
спидометра автомобиля. При одновременном
вращении в направлениях, показанных
стрелками, торможение, создаваемое вязкой
средой, очень мало. Выделение энергии и
соответствующее крутящее усилие
локализованы в развилке Y. Скорость
разделения оказывается очень большой — больше
чем при денатурационном разделении.
Однако, поскольку до сих пор неясно,
предшествует ли разделение редупликации, или
оба процесса идут одновременно, трудно
говорить о правильности модели Левин- Рнс- 11а Модель Ле-
таля и Крейна. Их модель не может объяс- вннталя н Крейна.
нить редупликацию по механизму рис. 118.
Рассмотрение редупликации циклической двойной спирали
(рис. 113) требует, очевидно, решения специальных задач
топологии и механики такой системы. Это еще не сделано.
Раскручивание двойной спирали при одновременной
редупликации на двух (четырех) или на одном (двух) освободившихся
концах цепи может происходить и чисто диффузионно (стр. 273).
В самом деле, при этом раскручивание необратимо, и вместо
формулы Куна (6.11) нужно написать
Т ^= Т| —f- T2 —f- ... 4~Tv/2» (6.61)
где т выражается по-прежнему (6.10). Даже приняв куновское
значение D (6.9), мы получаем
v/2
т = 2 Ь = "Г1 if f № = -Шт W3*4 с*к. (6-62)
6
т. е. при v~1000 т~200 мин, что намного меньше, чем у Куна.
В действительности нельзя пользоваться значением D (6.9) для
совершенно жесткого стержня, так как длинные двойные
спирали ДНК образуют рыхлые клубки. Нужно соответственно
уменьшить показатель степени при v в (6.62) с 4 примерно до
2,5, вследствие чего при тех же условиях время раскручивания
уменьшается до долей минуты [92].
2Q М. В, Волькенштейи
306
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Проблему раскручивания нельзя считать решенной. Для
строгого учета необратимости при разделении цепей необходимо
принять во внимание, что раскручивающаяся спираль является
открытой системой по отношению к окружающей среде. При
редупликации должно выполняться условие AF=0 (стр. 292)
для системы в целом — спираль плюс раствор. Необратимость
процесса может обеспечиваться тем, что разделение двойной
спирали и ферментативный синтез новых цепей происходят
быстрее, чем обратный процесс, связанный с возвращением
выделившихся молекул пирофосфата из раствора. В целом проблема
весьма сложна и интересна.
Так или иначе, есть основания считать, что даже весьма
длинная спираль успевает раскрутиться за время порядка
десятков секунд. Между тем порядок величины времени
редупликации заметно больше — он составляет 103 сек. Это значение
следует как из опытов Корнберга по синтезу ДНК In vitro, так
и из скорости митоза. Отсюда следует, что скорость синтеза
лимитируется не скоростью раскручивания двойной спирали, а
скоростью ферментативной поликонденсации.
Рассмотрим осаждение нуклеотндов на матрицу (одиночную цепь ДНК)
с образованием водородных связей, считая, что необратимая полнконденсация
происходит с одного конца [93]. Процессы осаждения нуклеотнда на матрицу
и его отделения состоят по крайней мере из двух актов — днффузнн, т. е.
подхода из раствора нлн ухода нуклеотнда в раствор н собственно
присоединения нлн отрыва нуклеотнда, требующего преодоления актнвационного
барьера (нужно разорвать водородные связи нуклеотнд—вода при
присоединении, нуклеотнда и нуклеотид — нуклеотнд прн отрыве нуклеотнда). Ячейки
матрицы могут быть в следующих состояниях: 1) занятые заполнмернзован-
нымн нуклеотндамн (их доля Х\)\ 2) занятые осажденными, т. е. связанными
с матрицей водородными связями, но не заполнмернзованными нуклеотндамн;
доля таких ячеек дг2; 3) свободные ячейки (xz) н 4) ячейки в комплексах
с непрнсоеднненнымн к ним, но находящимися в непосредственной близости
нуклеотндамн (#4). Если число ячеек матрицы равно JV, то кинетические
уравнения имеют вид
dxx и х%
Лъ-Ыъ-Къ-Ъ^. (6.63)
~~7[f = — ^дифЯ-^з Ч~ Кдиф*4»
Х\ -{- Х% -{- Х$ -{- Х^ = 1.
Здесь и, k и К — соответственно константы скоростей полнконденсацнн,
отрыва и присоединения нуклеотндов, £ДИф и /Сдиф —константы скоростей
днффузнн нуклеотнда в «реакционную область» и нз нее, п — число
нуклеотндов в 1 см* раствора. В уравнениях учтено то обстоятельство, что осаждение
н уход нуклеотндов происходят в любой точке матрицы, не занятой новой
цепью, а необратимая полнконденсация идет с одного конца. Оценка коэффн-
СТАТИСТИЧЕСКАЯ ФИЗИКА И КИНЕТИКА РЕДУПЛИКАЦИИ ДНК 307
цнентов дает Лдиф в б2и = Ю~12 се/с-1 • см* (б « 10~7 см — размеры нуклео-
тнда, и *s 102 см • сек'1 — средняя скорость его днффузнн);
#Сдаф --J = 10е «ж-1;
AT = v0 ехр ( ^pi1 = 102 «к-1 (v0 « 1013 сек-1).
£ння 15 /е/еал/моль — средняя энергия активации при разрыве водородных
связей в одной паре нуклеотидов; k/K = exp(AE/RT) ^ 102 (АЕ ~
*** 3 ккал/моль — средняя разность свободных энергий водородных связей
нуклеотнд—нуклеотнд и нуклеотид—вода), т. е. k = 104 сект1; п= 1017 см~г
(концентрация в опытах Корнберга).
Если ферментативная полнконденсацня протекает значительно быстрее,
чем уход нуклеотндов с матрицы, т. е. к/#^Э>/(, то нз первых двух
уравнений (6.33) следует
"(*«+*»> =kXi. (6.64)
Учитывая, что диффузионные процессы протекают быстрее процессов на
матрице (kn « 105 сек~х% /СДИф « Ю9 сек~К в то время как k = 104 сек~1),
получаем
-=^-, (6.65)
откуда
*!+.*2=1 —*-'/т, (6.66)
где время осаждения с последующей конденсацией
t ■ ^диф
т = ^2!*!L ^ 1 аж, (6.67)
Это — слишком малое время.
Рассмотрим другой случай — скорость лимитируется ферментативной
поликонденсацней, т. е. x/N <^ /С. Тогда в стационарных условиях
Х2 k Хг /Сдиф
= -7Т- И = -г , (О.ОО)
хА К хА «диф«
и
dxi * * (6.69)
где
Следовательно,
dt ~ N 1+v'
Y_*^+*«№. (6.70)
dXl~ * ^Ю-2—• (6.71)
dt "* Ny - v N
20'
308
ГЛ. 6. ФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
Из экспериментальной оценки
~~dF
/***
103
.-l
сек следует, что к/N ^ Ю
-1
т. е. х~/ 10~1N,
Таким образом, рассматриваемая модель позволяет оценить по общей
скорости синтеза ДНК константу скорости ферментативной полнконденсации.
Сравнение с опытом показывает, что время валового синтеза 103 сек не
может определяться только скоростью заполнения матрицы нуклеотидами,
но зависит от ферментативного процесса. Ms (6.69) следует также, что в этом
случае число заполимеризовавшихся нуклеотидов растет пропорционально
времени
t
хх —
N
(6.72)
где т —полное время роста цепи
'N
-(1 + Y)~—
(6.73)
Орлов и Фишман рассмотрели тот же процесс, не учитывая активации,
необходимой для разрыва связей и, естественно, получили гораздо большую
скорость синтеза [94]. В сущности, эта
работа игнорирует участие фермента в реакции.
В работе [93] рассмотрена также и
другая, кооперативная модель. Предполагается,
что поликонденсация происходит в любом
месте матрицы, где две или больше
соседние ячейки заняты осажденными
нуклеотидами. Пользуясь общим методом кинетики
кооперативных процессов [95], получаем
dt -'* (1+Y)2 ' К }
т. е.
*1 =
21 3
Часы
Рис. 120. Изменение вязкости
инкубационной смеси в ходе
синтеза сополимера А—Т.
где
!-#-"*
1+Y*-"*'
1+Y.
2х
Y
5ё'
(6.75)
(6.76)
В этом случае число заполимеризовавшихся
нуклеотидов зависит от времени нелинейно,
о заметным индукционным периодом. Время
т в 2N раз меньше, чем т^ (6.73). Опыт показывает, что синтез ДНК
идет со скоростью, отвечающей Tjv, а не т, и без индукционного периода.
Следовательно, справедлив механизм полнконденсацнн с одного конца, а не
повсеместной.
Как уже говорилось (стр. 290), синтез ДНК н полннуклеотндов (ПолнАТ)
без «затравки» идет лишь после длительного латентного периода — 3—5
часов. Это показано на рнс. 120 [21]. Во время латентного периода происходит,
очевидно, постепенная полнконденсацня мономеров, образующих матрицу,
на которой затем идет быстрый синтез. Расчет скорости безматрнчного
синтеза при тех же константах дает время синтеза самой матрицы
t
N
(&77)
СТАТИСТИЧЕСКАЯ ФИЗИКА И КИНЕТИКА РЕДУПЛИКАЦИИ ДНК 309
что на два порядка больше, чем время синтеза на матрице (6.73)\ Это
согласуется с опытом. Прн увеличении концентрации фермента растет константа
скорости ферментативной полнконденсацнн и и время латентного периода tN
должно падать. Это действительно наблюдается на опыте [96].
Статистические и кинетические расчеты, приведенные в этом
разделе, имеют главным образом иллюстративный характер.
Еще слишком мало известно об условиях синтеза ДНК, чтобы
можно было строить настоящую физико-химическую теорию.
Можно надеяться, однако, что описанные результаты
теоретического анализа окажутся полезными для дальнейшего
развития физики ДНК.
ГЛАВА 7
СИНТЕЗ БЕЛКА
ПРОБЛЕМА ГЕНЕТИЧЕСКОГО КОДА
Факты, приведенные в предыдущей главе, свидетельствуют
о том, что генетическая информация записана, закодирована в
макромолекулах ДНК (и вирусной РНК). Это — информация о
синтезе белковых молекул, т. е. об их первичной структуре.
Непосредственно очевидно, что генетический текст ДНК написан
линейно, четырехбуквенным алфавитом. Иными словами,
сведения о последовательности 20 аминокислот в белке
закодированы последовательностью 4 нуклеотидов ДНК. Как только
состав и генетическая роль ДНК были установлены, оказалось
возможным сформулировать очень ясные
физико-математические проблемы, от решения которых в значительной мере
зависит раскрытие природы биосинтеза белка. Заслуга в постановке
этих задач принадлежит физикам, прежде всего Гамову [1].
Шредингер [2], четко определив роль молекулярного
генетического кода, не имел возможности пойти дальше, так как
структура ДНК и ее роль были еще не установлены, когда он
писал свою книгу.
Каков генетический код, т. е. каково соответствие
четырехбуквенного текста двадцатибуквенному? В этом состоит
основная проблема. С момента ее постановки до почти полного
решения прошло короткое время — семь лет. Этот успех науки в
одном из кардинальных ее вопросов объясняется объединением
усилий ряда исследователей, с энтузиазмом занявшихся
разработкой новой области — биологов, физиков и химиков.
Допустим, что код установлен, т. е. известно, какие нуклео-
тиды и сколько нуклеотидов ответственно за включение данной
аминокислоты в белковую цепь. Тогда возникают вопросы,
относящиеся к механизму передачи генетической информации,
вопросы физико-химического характера. Известно, что матрицей
для синтеза белка является не непосредственно ДНК, а
матричная РНК, синтезируемая на ДНК. Это не изменяет
проблемы кода, так как РНК содержит информацию, также
записанную четырехбуквенным алфавитом, и в этом смысле
несущественно, что одна буква заменена другой —РНК содержит У,
ПРОБЛЕМА ГЕНЕТИЧЕСКОГО КОДА
311
а ДНК — Т. Необходимо, однако, установить, как происходит
синтез М-РНК на ДНК, каким образом М-РНК переходит к
рибосомам и создает в них матрицу и, наконец, как белковая цепь
собирается на этой матрице из аминокислот. Это — задачи,
которые не могут быть решены теоретически. Для их решения
нужно заглянуть в клетку и узнать, как она работает, нужно
экспериментальное исследование.
Сама проблема кода имеет на первый взгляд несколько иной
характер. Нельзя считать исключенной a priori возможность
чисто умозрительного нахождения шифра, посредством которого
информация, заключенная в ДНК» передается белку. Не
исключено, что здесь могут оказаться ключевыми простые
соображения комбинаторики. Именно так и подошел к этой задаче Га-
мов [3, 4].
Число нуклеотидов — 4, число аминокислот — 20. Сразу ясно,
что каждой аминокислоте соответствует комбинация из
нескольких нуклеотидов. Из скольких? Двух недостаточно, так как
число сочетаний из четырех по два равно 42== 16- Значит, кодовое
отношение, т. е. количество нуклеотидов, кодирующее одну
аминокислоту, должно быть не меньше трех. Но если каждая
комбинация из трех нуклеотидов отвечает одной аминокислоте, то
получается слишком большое число 43=64.
Несмотря на то, что проблема кода относится к теории
информации, информационный анализ может лишь определить
условия, которым должен удовлетворять код. Такой анализ не
дает самого кода. Он позволяет ответить на вопрос о
минимальном числе нуклеотидов, необходимом для кодирования
одной аминокислоты. Выраженная в двоичной системе (см. стр. 38)
информация, приходящаяся на одну аминокислоту, равна
/aK = log2 20 = 4,322 бит,
и на один нуклеотид
/н = ]og2 4 = 2,000 бит.
Следовательно (ввиду аддитивности информации), наименьшее
число нуклеотидов, приходящихся на одну аминокислоту, равно
я = -^=2,161,
т. е. /г = 3, так как число нуклеотидов должно быть целым. Мы
вновь получили уже приведенный и достаточно тривиальный
результат.
Гамов нашел необходимое «сакраментальное» число 20
двумя способами комбинирования нуклеотидов. Считая, что
генетическая информация заложен^ не в единичной цепи,
312
ГЛ. 7. СИНТЕЗ БЕЛКА
а в двойной спирали Уотсона — Крика, Гамов предложил
ромбический код. Три следующие друг за другом в двойной спирали
пары оснований образуют комбинации, в которые входит одно
основание первой пары, вторая пара целиком и одно основание
третьей пары, например,
Общее число таких ромбов значительно меньше числа
произвольных сочетаний из 4 по 4, равного 44=256. Ведь структура
ц
Афт
г
лфг
ц
г
г
ц
гф.
т
ц
4'
Г
Г
ц
Т
4'
т
гфц
А
гфи
Г
ц
А
.фг
ц
Г^Ц
Рнс. 121. 20 ромбических комбинаций нуклеотидов.
ДНК накладывает ограничивающие условия —малая диагональ
ромба соединяет всегда А с Т или Г с Ц. Число 20 получается,
если считать тождественными, в смысле кодирования, правые
и левые формы несимметричных ромбов, например,
д Ат = тА д
А ц 1 _ 1 ц А.
На рис. 121 показаны 20 ромбов. Из них 8 обладают
двусторонней симметрией, а 12 ее лишены. Можно найти стереохимц-
ПРОБЛЕМА ГЕНЕТИЧЕСКОГО КОДА 313
ческие аргументы в пользу такого тождества (см.
[4]).Поскольку в каждый ромб входят основания из трех последовательных
пар, код является перекрывающимся — два основания,
лежащие на одной стороне ромба, являются общими для двух
соседних ромбов. Этим накладываются достаточно жесткие
ограничения на возможные последовательности 20 букв, т. е.
аминокислот в белке. В табл. 22 приведены возможные сочетания
ближайших соседей в ромбическом коде (см. рис. 121).
Таблица 22
Сочетания ближайших соседей
в ромбическом коде
а, е, U о
d, g, k, n
U rrty p
k, s, t
by с, г
/, и, v
соединяются с
соединяются с
соединяются с
соединяются с
соединяются с
соединяются с
a, d> е, /, gy ft, U U
т> ги о» р> и, v
а, by Су dy ву gy k> iy
ky Пу Оу Г, Sy t
а, ву и U niy Оу р
gy ky ky Пу Sy t
dy fy gy hy Пу Uy v
a, by Су ву iy Оу г
Гамов попытался проверить правильность перекрывающегося
ромбического кода, сопоставив возможные соотношения
ромбов с известной первичной структурой инсулина и адренокорти-
котропного гормона [4]. Это привело к неразрешимым
противоречиям— последовательности аминокислот ромбическим кодом
не расшифровываются. Не согласуется с опытом также и
представление о двухнитевой матрице. Дело в том, что матрицей
является не ДНК, а М-РНК, которая вовсе не имеет
регулярной двуспиральной структуры (см. следующий раздел).
В качестве однонитевого кода были предложены различные
варианты треугольного кода. Предполагается, что аминокислота
кодируется тройкой оснований, расположенных в вершинах
треугольника. Число 20 получается, если принять, что в кодовом
смысле тождественны все треугольники, получаемые изданного
путем поворотов и отражений, например,
АГТ, ТАГ, ГТА, ТГА, гЧ, АТГ
и
АГА, ААГ, I^A.
Треугольный код, являясь однонитевым, может быть плотно
перекрывающимся, неплотно перекрывающимся и неперекрыва-
314
ГЛ. 7. СИНТЕЗ БЕЛКА
ющимся. В первом случае боковые стороны треугольника
являются общими для дзух соседних треугольников, во втором —
общими для двух соседей являются две из трех вершин, в
третьем — каждой аминокислоте отвечает свой собственный
треугольник. Эти три возможности схематически показаны на
рис. 122. В двух первых случаях (а и б) на возможную
последовательность аминокислот наложены ограничения, в третьем
случае (в—д) таких ограничений нет, но возникает вопрос о
том, что играет роль
«запятой» — какой фактор
указывает, что нуклеотид-
ный текст должен
читаться в соответствии,
скажем, с рис. 122, в, а не
с рис. 122, г.
Ряд фактов (см. далее)
показывает, что
перекрывающийся код
вообще невозможен. Что
касается вопроса о
«запятой», то ему посвящена
интересная работа Крика,
Гриффита и Оргела [5].
В случае
неперекрывающегося кода треугольник
уже теряет смысл, существенно лишь наличие тройки
последовательных оснований, например АТТ. Предполагая, что «запятых»
не существует, можно получить число 20 из 64 возможных
триплетов, руководствуясь следующими соображениями. Некоторые
из 64 триплетов имеют смысл, другие его лишены. Если код
однозначен, т. е. может читаться только одним способом, а
запятых нет, то последовательности типа AAA, ТТТ, ГГГ и ЦЦЦ
бессмысленны, потому что мы получаем один и тот же
результат, читая, например, последовательность АААААА, начиная с
первой или со второй буквы. Значит, 4 триплета отбрасываются.
60 остающихся триплетов можно сгруппировать в 20 наборов
по 3, в каждом наборе из 3 фигурируют только циклические
перестановки, например АТЦ, ТЦА и ЦАТ. Из этих
перестановок должна быть выбрана только одна, так как если
аминокислоте h отвечает ТЦА, то последовательности hh отвечают
ТЦАТЦА. Так как нет запятых, то ЦАТ и АТЦ должны быть
отброшены. Ввиду того, что из каждого циклического набора
можно выбрать только один триплет, получается 20 триплетов.
Наличие пар аминокислот gh и hg не уменьшает этого
числа, так как можно написать конструкцию, подчиняющуюся всем
а) Т!Г^Г,ТГ№иГгТт^А
+-|-ч- |-4-j u-f
4> А,Т, А Г Ц.А.Ц Ц Г.Т.А А
в) ,А Т А,'Г Ц AJU Ц Г'Т А А'
г) А, Т А Г,Ц А Ц, U, Г Т,А А
д) А Т,А Г Ц,А Ц Ц,Г Т А,А
Рнс. 122. Трнплетные коды: а) полностью
перекрывающийся, б) неполностью
перекрывающийся, в), г), д)
неперекрывающийся.
ПРОБЛЕМА ГЕНЕТИЧЕСКОГО КОДА 315
сформулированным правилам и кодирующую 20 различных
аминокислот. Одно из возможных решений имеет вид
А А А А £
AT ЦТ ТГ„
Т Т Ц Ц р
А
где АТу означает АТА и АТТ и т. д. Любые два триплета
этого ряда можно поместить друг за другом, не создавая
принадлежащие ряду «бессмысленные» триплеты. Приведенное
решение— одно из 288 возможных.
Код без запятых может быть правилен, если, например,
аминокислота присоединяется к осмысленному триплету прочнее,
чем к бессмысленному, или если присоединение аминокислот
идет триплет за триплетом, от одного конца матрицы к другому.
Очевидно, что отсутствие перекрытий в коде означает
отсутствие возможности его расшифровки на основании известных
аминокислотных последовательностей. Было сделано еще
несколько попыток обойти эти трудности. Можно, например,
считать код не вполне однозначным, предполагая, что лишь один
средний нуклеотид триплета жестко фиксирован в кодовом
смысле, а первый и третий нуклеотиды являются «младшими»
и могут заменяться без того, чтобы изменилась кодируемая
аминокислота. Этот код «старший — младший», разработанный
Гамовым и др. [4] и Фейнманом (известным физиком),
оказался противоречащим опыту. Другой физик — Теллер —
предложил код, основанный на том, что аминокислота кодируется
двумя нуклеотидами и предыдущей аминокислотой. В коде Тел-
лера на последовательность аминокислот накладываются
определенные ограничения, и в этом смысле он подобен
перекрывающемуся коду. Не говоря уже об отсутствии физико-химического
обоснования такой идеи, код Теллера опять-таки не
соответствует опыту.
Описанные здесь умозрительные попытки расшифровки
генетического кода, равно как и некоторые другие, не' увенчались
успехом. И это неудивительно; ведь ни в одном случае мы пока
не располагаем сведениями о первичной структуре ДНК или
РНК, и эти остроумные гипотезы означают попытки прочитать
нуклеотидный текст на основании немногих известных белковых
текстов. Гамов и его последователи подошли к своей задаче
примерно так же, как ученые, занимающиеся расшифровкой
древних текстов, написанных на неизвестном языке. В
археологии немало блестящих достижений такого рода, начиная с
расшифровки египетской иероглифической письменности,
сделанной Шампольоном, и кончая расшифровкой письменности майя,
316
ГЛ. 7. СИНТЕЗ ВЕЛКА
проводимой в Сибирском отделении Академии наук СССР с
помощью электронных машин. Важнейшим событием, сделавшим
возможным чтение египетских иероглифов, оказалась находка
так называемого Розеттского камня, на котором одна и та же
надпись была сделана иероглифами, упрощенными египетскими
демотическими письменами и по-гречески. Шампольон,
владевший древнегреческим и коптским (родственным
древнеегипетскому) языками, прочел эти надписи и тем положил начало
научной египтологии. В нашем случае Розеттского камня нет,
никакими сведениями о нуклеотидном языке мы не располагаем,
и следовательно, для решения проблемы кода необходимы иные
методы.
Следует ли из изложенного, что комбинаторные попытки
расшифровки генетического кода были совершенно бесплодны?
Такое заключение ошибочно. Проведенная аналитическая
работа не только позволила четко сформулировать проблему, но
и установила некоторые факты. В этом смысле работы Гамова
и других ученых сыграли такую же роль, как работы
предшественников Шампольона в области египтологии. Во-первых, в
этих работах установлено, что код должен быть по крайней
мере триплетным. Во-вторых, поставлена проблема «запятой»
в неперекрывающемся коде и указаны возможные пути ее
решения. В-третьих, можно считать установленным, что
генетический текст записан в нити нуклеиновой кислоты, а не в
двойной спирали — сравнение перекрывающихся кодов с опытом
заставляет от них отказаться. Этим, собственно говоря, и
уничтожается возможность чисто теоретического нахождения кода.
В чем же состоит экспериментальное опровержение перекрытий?
Как мы видели, мутации могут заключаться в замене всего
лишь одной аминокислоты на другую (см. сказанное о
гемоглобине, стр. 117).
Виттман [6] и Тсугита и Френкель-Конрат [7] показали, что
«химические» мутанты ВТМ, созданные обработкой HNCb,
возникают в результате замены только одной аминокислоты в
белке вируса. В то же время известно, что HNO2 действует на
отдельные нуклеотиды РНК. Но если коды перекрывающиеся,
то замена одного нуклеотидного триплета на другой должна
приводить к замене нескольких аминокислот в белке — трех в
случае, показанном на рис. 122, а, двух — при замене крайних
нуклеотидов в триплете в случае рис. 122,6. Правда, если в
последнем случае заменить только центральный нуклеотид
триплета, изменится одна аминокислота.
Код «старший — младший» допускает возможность замены
одной аминокислоты в результате замены одного нуклеотида.
Но при любых перекрывающихся кодах на последовательность
ПРОБЛЕМА ГЕНЕТИЧЕСКОГО КОДА
317
аминокислот в белках накладываются некоторые ограничения.
Данные о первичной структуре изученных белков и ряда
полипептидных фрагментов не свидетельствуют о наличии таких
ограничений, т. е. о наличии корреляции между соседними
аминокислотами. Этот вопрос был рассмотрен Гамовым, Ричем и
Ичасом [4], а также Ичасом [8].
Рис. 123. Пары соседних аминокислотных остатков в белках.
Построим решетку, в которой по вертикали расположены
первые, а по горизонтали вторые, следующие за первыми
аминокислоты. Решетка строится так, что в ней N-концевые
остатки представлены строками, а С-концевые — столбцами. Всего в
решетке, очевидно, 20 «20=400 клеток. В каждой клетке
приведено число, показывающее, сколько раз встречается
соответствующая пара среди изученных дипептидных
последовательностей (рис. 123). В работе [4] было определено, отвечает ли
это распределение чисел распределению Пуассона, т. е.
совершенно случайному распределению. Искомое соответствие было
найдено. Однако, как указано в работе [8], этим методом
318
ГЛ. 7. СИНТЕЗ ВЕЛКА
пользоваться нельзя, так как он не учитывает того
обстоятельства, что различные аминокислоты встречаются с сильно
различающимися частотами.
Более строгий анализ показывает, однако, то же самое —
отсутствие какой-либо корреляции между аминокислотами [8].
В этом смысле белковый текст радикально отличается от
текста на любом из языков. Так, в русском языке вероятность
появления гласной буквы вслед за согласной значительно больше,
чем вероятность появления подряд двух гласных или двух
согласных букв. Вероятность появления двух соседних
одинаковых гласных очень мала, а трех — равна практически нулю
(вспомним слово «длинношеее»). Напротив, в эстонском языке
одинаковые гласные часто следуют друг за другом. Именно
благодаря такой корреляции обычный текст может
рассматриваться как пример цепи Маркова (стр. 161). Белковая цепь в
этом смысле, т. е. в смысле первичной структуры, цепью
Маркова не является — корреляция между аминокислотами в белке
относится к их конформациям и определяет вторичную, а не
первичную структуру.
Нужно подчеркнуть, что число исследованных дипептидиых
последовательностей пока ограничено. Этим, вероятно,
объясняется наличие пустых клеток в решетке на рис. 123. Если
такие клетки останутся и после изучения значительно большего
материала, это будет означать некоторую корреляцию между
соседними аминокислотами.
Оженстин [9] провел информационный анализ
аминокислотных последовательностей и пришел к выводу, отличному от
выводов работ [4, 8]. Согласно его оценкам, между
аминокислотами имеется все-таки некоторая корреляция, уменьшающая
информацию, содержащуюся в первичной структуре белка до
0,85—0,95 максимально возможного значения. Но и такая
степень корреляции не может быть согласована с
перекрывающимися нуклеотидными кодами. Бреннер доказал в общем виде
невозможность перекрывающихся кодов [10].
Можно сформулировать, таким образом, два общих вывода.
Во-первых, код должен быть неперекрывающимся. Во-вторых,
информационный анализ последовательности аминокислот в
белках должен быть продолжен, исходя из нуклеотидного кода,
установленного экспериментально.
В заключение остановимся еще на одной работе Гамова и
Ичаса [11]. Они предположили, что аминокислота определена
тремя нуклеотидами, взятыми без учета их расположения.
Таких троек 20, они неперекрывающиеся. Число триплетов типа
АГЦ, определяющих одну и ту же аминокислоту, равно 6—
числу перестановок, число триплетов ААГ равно 3, триплет AAA
МАТРИЧНЫЙ СИНТЕЗ ВЕЛКА
319
один. Определив нуклеотидный состав ДНК или РНК (в
вирусе), можно найти частоты появления соответствующих
триплетов и представить их в виде графика, по оси абсцисс которого
расположены все 20 триплетов. Оказывается, что график,
изображающий частоты появления аминокислот в
соответствующем белке, имеет аналогичную форму [4, 8, 11].
Эти и другие данные заставляют думать, что нуклеотидный
код является триплетным и неперекрывающимся. При этом,
конечно, возможно и вырождение кода, т. е. соответствие
нескольких триплетов (например, трех триплетов ААГ, АГА и
ГАА) одной и той же аминокислоте и одновременно
нескольких аминокислот одному и тому же триплету.
Ранее мы говорили об интересной работе Де Во и Тиноко
(стр. 280), из которой следует, что энергетические факторы
могут создать определенную корреляцию в последовательности
нуклеотидов в ДНК. Если такая корреляция действительно
существует, то она может вводить корреляцию белка и при
неперекрывающемся коде. Отсутствие корреляции аминокислот
может означать преобладание эволюционных, биологических
факторов над термодинамическими (что, конечно, требует
детального истолкования). С другой стороны, возможное
вырождение кода может практически исключить эту корреляцию-
Здесь необходимы дальнейшие исследования. Мы видим, что в
проблеме кода имеется множество нерешенных принципиальных
вопросов. Многие из них, несомненно, будут решены к моменту
выхода в свет этой книги.
МАТРИЧНЫЙ СИНТЕЗ БЕЛКА
Для того чтобы продвинуться дальше в решении проблемы
генетического кода, необходимо, таким образом, изучить
конкретную физико-химическую природу синтеза белка. В
сущности в этом и состоит основная задача молекулярной биологии,
а проблема кода является лишь частью этой общей задачи.
Итак, в ДНК закодирован синтез белка. Но в каком
смысле? Мы ведь уже говорили, что ДНК сосредоточена в ядре
клетки, в хромосомах, а белок синтезируется в рибосомах, в
цитоплазме. Значит, ДНК не является прямой матрицей,
подложкой для белкового синтеза — генетическая информация должна
каким-то образом передаваться от ДНК к рибосомам.
Рибосомные частицы Е. coli можно классифицировать по их
константам седиментации в ультрацентрифуге. Размеры частиц
зависят от концентрации двухвалентных ионов. При
концентрации Mg++10~4 M преобладают частицы с константами
седиментации 50 S и 30 S (молекулярные веса соответственно
320
ГЛ. 7. СИНТЕЗ ВЕЛКА
1,85- Ю6 и 0,95* 106). При [Mg++]>10"s M эти частицы слипают»
ся и образуют более крупные, с константой 70 S. При [Mg++] >
> 10"2 М частицы 70 S димеризуются, образуя частицы 100 S.
Состав РНК, выделенной из рибосом, почти не коррелирует с
составом ДНК [12]; поэтому нет оснований думать, что рибо-
сомная РНК играет роль матрицы для белкового синтеза. В то
же время было естественно искать матричное вещество именно
среди молекул РНК, так как между РНК и ДНК имеется
большое сходство, ДНК не содержится в цитоплазме и является
генетическим веществом.
Фолькин и Астрахан [13] изучали события, происходящие
в клетке Е. colt после заражения фагом Т2. Этот фаг содержит
ДНК, а не РНК, но при его размножении, т. е. редупликации
ДНК и синтезе белка фага, синтезируется и некоторое
количество РНК- Эта РНК оказывается обладающей повышенной (по
сравнению с рибосомной) метаболической активностью —
быстро включает меченый фосфор Р32. Состав вновь
синтезируемой РНК сходен с составом фаговой ДНК, что определяется
по соотношению удельных радиоактивностей, а именно ДНК
18Ц: 32Ц: 32Т: 18Г; РНК 18Ц: ЗОА: ЗОУ: 22Г [14]. Получается,
что в процессе синтеза фаговых частиц на основе фаговой ДНК
участвует промежуточное между ДНК и белком вещество —
некий сорт РНК.
Гро и сотрудники установили наличие такой особой РНК
в незараженных клетках £. coli и подробно изучили ее
свойства [15]. Выяснилось, что эта РНК (будем обозначать ее
М-РНК — из дальнейшего станет ясным почему) обладает
константой седиментации 12 S. Она характеризуется большой
метаболической активностью, что доказывается следующими
интересными опытами.
Бактерии подвергались кратковременной метке —
размножались в среде, содержащей С14-урацил. Экстракт из таких
бактерий ультрацентрифугировался в градиенте плотности и
измерялось распределение оптической плотности при 260 m\i
(полоса поглощения нуклеиновых кислот) и радиоактивности
по фракциям. Результаты показаны на рис. 124.
Радиоактивность оказывается сосредоточенной во фракции 12 S,
остальные фракции не становятся радиоактивными. М-РНК при
высоких концентрациях Mg++ (Ю-2 М) связывается с рибосомами
70 S. По данным Уотсона ионы Mg**1" образуют мостики между
рибосомами М-РНК и Т-РНК, нейтрализуя фосфатные группы.
Кинетика включения радиоактивных аминокислот показывает,
что именно устойчивая разновидность рибосом 70 S
ответственна за синтез белка. Такие рибосомы именуются
активными. Исследования с помощью того же метода меченых ато-
МАТРИЧНЫЙ СИНТЕЗ ВЁЛКА
321
50S
имп
О
20 30
Фракции
мов показывают, что некоторое количество М-РНК обратимо
соединяется с рибосомами 70 S. Содержание М-РНК в
бактериях, размножающихся за 1 час, составляет около 3% от
общей РНК; молекулярный вес М-РНК до 2- 106.
Эти и подобные им результаты, а также косвенные данные,
полученные при изучении индуцированного синтеза ферментов
(см. далее, стр. 355), доказывают существование особой М-РНК,
переносящей
генетическую информацию от
ДНК к рибосомам, из £260
конструкторского и
планового бЮрО фабрИКИ- nggg
клетки к цехам,
выпускающим готовую
продукцию— белки. Для но- Ц400
вого сорта РНК
предложено много разных на- П9пп\
званий — это информаци- %*""'
онная РНК или РНК-
посредник (Messenger
RNA, M-RNA). Мы будем
называть ее матричной,
М-РНК.
М-РНК синтезируется
в ядрах, и состав ее
подобен составу ДНК. В
связи с этим немедленно
возникает вопрос о
структурных взаимоотношениях ДНК и РНК. Эта проблема
рассматривалась рядом авторов, в частности Ричем [16]. Рич писал об
этом еще до открытия М-РНК, сделанного в 1960 г. Теперь
мы знаем, что при совместной ренатурации М-РНК н
соответствующих одноцепочечных ДНК, полученных нагреванием на-
тивной ДНК, получаются гибридные комплексы М-РНК-ДНК,
двойные спирали, состоящие из одной нити М-РНК и одной
нити ДНК [17]. Это доказывает, что не только состав М-РНК
аналогичен составу ДНК, но и последовательности оснований
двух цепей дополнительны. У в РНК соединяется с А в ДНК,
что следует и из прямых опытов с синтетическими полирибо-
нуклеотидами (стр. 260).
Комплексы ДНК-РНК удалось выделить и непосредственно
из клеток [18, 19]. Наконец, найдены ферменты, с помощью
которых РНК синтезируется на ДНК, как на
матрице-затравке. Получаемая таким образом РНК дополнительна к ДНК
[20—22].
Рис. 124. Распределение радиоактивности
и оптической плотности в экстракте из
бактерий, меченных С14, после
седиментации в градиенте плотности.
Радиоактивность указана пунктиром.
21 М. В. Волькенштейи
322
ГЛ. 7. СИНТЕЗ БЕЛКА
О какой же дополнительности идет речь? Этот вопрос
непосредственно связан с важной проблемой синтеза М-РНК на
ДНК. Очевидно, что такой синтез может осуществляться тремя
способами: М-РНК синтезируется на обеих дополняющих друг
друга цепях ДНК и полностью копирует их «текст»; М-РНК
копирует «тексты» обеих цепей, но всегда в разных областях —
осуществляется своего рода выборочное копирование;
матрицей для синтеза М-РНК является только одна цепь.
Если реализуется первый способ, то в дальнейшем синтезе
белка могут быть различные возможности. Если обе цепи
М-РНК «печатают» белки на основе единого кода, то каждому
белку должен соответствовать белок, дополнительный по
аминокислотному составу. Но этого не наблюдается. Можно тогда
предположить, что дополнительные кодирующие группы —
например, АГУ и УЦА — ответственны за одну и ту же
аминокислоту. Это также противоречит опыту (см. стр. 333).
Наконец, возможно, что из двух дополнительных цепей М-РНК
генетически функциональна только одна цепь. Вторая цепь
либо не работает вовсе — тогда неясно, зачем она нужна
клетке,— либо служит матрицей для синтеза функциональной
цепи. Последнее предположение вносит вторичный механизм
матричного синтеза помимо синтеза на ДНК. Не излишество
ли это?
Такие умозрительные соображения не могут, однако, дать
убедительный ответ на поставленный вопрос. Здесь необходимы
экспериментальные данные.
Шпигельман и сотрудники недавно провели
соответствующие исследования [23]. Как уже указывалось, при
редупликации фага фХ174 его однонитевая ДНК строит вторую
дополнительную цепь из материала инфицированной клетки. Пользуясь
мечеными атомами и седиментацией в градиенте плотности,
Хаяши и Шпигельман установили, что синтезируемая фагом
М-РНК гибридизуется только с одной из двух цепей ДНК-
Это не исходная нить фага, а вновь синтезированная,
дополняющая ее. Этим доказано, что в случае фага срХ174 М-РНК
«печатается» только одной цепью ДНК, вторая же цеиь
необходима для репликации. Так протекает процесс in vivo.
Напротив, опыты in vitro с препаратами ДНК и
необходимым ферментом показали, что в этом случае в синтезе М-РНК
функциональны обе цепи ДНК- Различие определяется тем, что
в строящемся фаге двойная спираль ДНК имеет циклическую
структуру, которая разрушается при выделении ДНК — in vitro
действуют отдельные фрагменты ДНК. Было показано, что
синтез М-РНК происходит in vivo на одной из двух цепей ДНК
не только в случае фага срХ174, но и в других системах [24, 25].
МАТРИЧНЫЙ СИНТЕЗ БЕЛКА
323
Пока неизвестно, какие факторы определяют
функциональность одной цепи ДНК и отсутствие функциональности другой
цепи. Маалое установил, что синтез М-РНК влияет на
редупликацию ДНК [26]. Дальнейшее изучение проблемы
редупликации требует рассмотрения всего процесса синтеза белка и
исследования обратных связей в этом процессе (см. далее,
стр. 406).
Недавно Уорнер, Рич и Холл методом электронной
микроскопии показали, что несколько рибосом соединяются друг
с другом во время синтеза белка посредством молекул М-РНК
Рис. 125. Схема полисомы.
[27, 28]. Схема такого объединения показана на рис. 125
(см. обзор Уотсона [29]). Образуется система, содержащая от
4 до 8 и более рибосом, называемая полисомой. Электронно-
микроскопический снимок полисомы приведен на рис. 126.
Имеются теоретические и экспериментальные
доказательства движения рибосом вдоль цепи М-РНК- В данный момент
рибосома имеет одну синтезированную белковую цепь.' N-конец
этой цепи удаляется от места образования пептидной связи, и
цепь отделяется от рибосомы. Следующая аминокислота
должна присоединиться к С-концу цепи, что обеспечивается
специфическим положением кодирующей группы М-РНК на
рибосоме. Но для этого М-РНК должна переместиться вдоль
рибосомы — иначе ее работающая кодирующая группа нуклео-
тидов отвечала бы не новой аминокислоте, а
предшествующей, уже образовавшей пептидную связь [29]. Действительно,
недавно методом меченых атомов было непосредственно
доказано движение рибосом вдоль М-РНК- Следовательно, синтез
21*
324
ГЛ. 7. СИНТЕЗ БЕЛКА
белка связан со специфическим механохимическим процессом
(см. гл. 9), природа которого совершенно не изучена. Эта
проблема очень важна и интересна. Высказывались качественные
соображения, основанные на элементарной механической
аналогии—рибосома 70 5, состоящая из двух частей (30 S и 50 5),
Рис. 126. Электронная микрофотография полисомы.
Молскгда М-РНК —нить внизу слева, соединяющая шарообразные рибосомы.
Увеличение 135 000.
рассматривается как вращающийся блок, тянущий нить М-РНК.
Эти соображения пока ничем не подтверждены.
Кинетика синтеза белка на полисомах была исследована в работе [30],
в которой определялась зависимость количества Fn включенного меченого С14
лейцина, приходившегося на единицу массы РНК, от времени для полисом,
содержащих разные количества рибосом. Исследование это не является
достаточно полным, тем не менее в нем получены данные, позволяющие
провести теоретические расчеты. Это и было сделано в работе [31].
Очевидно, что в соответствии с описанной моделью средняя скорость v
движения рибосом вдоль нити М-РНК должна быть пропорциональна
средней скорости w включения аминокислот в белок на одной рибосоме
v=Xw. (7.1)
Если v измеряется числом нуклеотидов, на которое рибосома перемещается,
a w измеряется числом аминокислот, включенных за то же время, то X равно
числу нуклеотидов в кодирующей группе — в кодоне. Если в момент
времени t имеется Ki(t) полисом, содержащих по i рибосом, то за единицу
МАТРИЧНЫЙ СИНТЕЗ БЕЛКА 325
времени включается Y аминокислот
Y=j^iKi(t)w. (7.2)
Суммирование ведется по всем типам полисом.
Рибосомы имеют различное расположение в полисоме Пусть / —
максимальное расстояние первой рибосомы до конца нити М-РНК полисомы.
Число «-сом, первая рибосома которых находится на расстоянии / — \ до
конца нити, равно КпО, I). Тогда
Кп (0 = J Кп С Е) <*$ (7.3)
о
Скорость изменения Кп (t) пропорциональна числу л-сом, в которых
первая рибосома дошла до конца нити и готова оторваться
/U0 = -***('■'). (7-4)
*
и— вероятность отрыва крайней рибосомы от нити М-РНК. Скорость
изменения Кп U, О-
* * <*■ 0 = - к*, С 0 + / * (Б) Кп {U I) dt (7.5)
о
k (£)— вероятность того, что к моменту t до конца нити дойдет рибосома,
в начальный момент находившаяся на расстоянии / — % от конца. Из (7.4) и
(7.5) следует
Яп (0 - &* ('■ О - / k (I) Кп <*, I) dt (7.6)
о
Если скопления рибосом на конце нити не происходит, то kn(t* 0=0—
реализуются стационарные условия. Предполагая такую стационарность
и равномерность распределения рибосом в интервале (0, /), т. е.
K„(t,l) = ^P-, (7.7)
получаем
Rn(t) = -kKn(th (7.8)
где ^
k = jfk(t)dt (7.9)
о
— среднее значение k (£) в интервале (0, /). Для полисом с i < n получаются
уравнения
*i=*'(*i+i-*i>. (7-10)
где kr = kt если / равно среднему расстоянию между рибосомами в
полисоме. Уравнение (7Л0) описывает возникновение i-сомы из i+1-сомы
в результате отрыва одной рибосомы и разрушение i-сомы —ее
превращение в i — 1-сому путем такого же отрыва.
326 ГЛ. 7. СИНТЕЗ БЕЛКА
Решаем систему уравнений (7.8), (7.10) при начальных условиях
*я(0) = ** *,<0)-О (1</<й_1).
Решение имеет вид
Скорость в^уу^чения Си-лейцина на единицу массы РНК равна
(7.11)
л
nKJJAf ^
(7.12)
где Af — масса РНК одной рибосомы, х— доля меченого лейцина во всем
лейцине, у — отношение включавшегося лейцина к общему числу
включившихся аминокислот. Из (7.11) и (7.12) следует
/.»-■?•-"
где
W^
wxy
~ЯГ'
(7.13)
Гроведи расчеты для конкретных значений я=2, 4, 6, 8, получаем теорети-
ч.ские кривые, хорошо согласующиеся с опытными данными (рис. 127). Угол
О 70 20 30 40 %мин
Рис. 127. Зависимость включения меченого лейцина в белок
от времени.
л—число рибосом в полисоме; сплошные линии—теоретические
кривые; О —экспериментальные точки.
наклона кривых при /=0 один и тот же, его тангенс дает W, а предельные
значения при /->оо пропорциональны W/L Из опыта находим №=284 имп/мш£
и А=0,3 минг\
МАТРИЧНЫЙ СИНТЕЗ БЕЛКА
327
Если ввести L = vk~l — расстояние, которое проходит рибосома за
время кг\ то получаем
ь-Тр- <714>
При равномерном движении рибосом L=0,5/. Среднее расстояние
между рибосомами / из данных седиментационного анализа и электронной
микроскопии равно 90 нуклеотидам. М — порядка 2 • 106. К сожалению,
значения х и у неизвестны. Я оказывается равной трем нуклеотидам при
х — 1/2, у = 1/20. Во всяком случае X. совпадает с размером кодона по
порядку величины, и теория в целом непротиворечива и согласуется
с опытом.
Для осуществления рассмотренного механохимического процесса
движения рибосомы по нити М-РНК необходима энергия. Можно думать, что
источником энергии является макроэргическая связь ГТФ. Ее энергия
оценивается в 8—13 ккал/моль. Часть энергии, равная 3,5 ккал/моль, расходуется
на синтез пептидной связи. На механохимию остается 4,5—9,5 ккал/моль,
если нет других, еще не изученных процессов диссипации.
Движение рибосомы происходит в одном направлении,
подчиняясь еще неизвестному регуляторному действию,
осуществляемому, вероятно, ферментом или ферментами.
Рибосомная РНК не играет непосредственной матричной
роли. Она включена в сложную регулярную структуру, недавно
раскрытую Спириным и Киселевым (см. стр. 415).
Матрица для синтеза белка одномерна, это линейная
макромолекула М-РНК. Очевидна биологическая целесообразность
одномерности в этом случае. Представим себе трехмерную
матрицу. Это — нечто вроде трехмерных шахмат—игры, которую
предложил некий изобретательный ум. Играть в них, конечно,
невозможно. Невозможно было бы и извлечь из трехмерной
матричной сетки синтезированные в ней биологические
молекулы. Двухмерная матрица, о которой в свое время говорил Га-
уровитц, также крайне неудобна, так как она должна встречать
большое сопротивление при перемещении в клетке и ее кон-
формационная подвижность не может быть достаточной для
образования функциональных структур типа комплексов М-РНК
с рибосомами. Одномерная матрица М-РНК находится, конечно,
в соответствии с линейным строением синтезируемого
биополимера — белка.
Проблема синтеза белка, с большой четкостью
сформулированная Криком [32], не исчерпывается, однако, проблемой
матричного синтеза линейного полимера.
Белок синтезируется из аминокислот. Поликонденсация
аминокислот— эндергонный процесс (стр. 134), термодинамически
невыгодный. Он должен быть, следовательно, сопряжен с
процессом экзергонным, снабжающим реакцию свободной энергией.
Как и в других биологических процессах — это дефосфорилиро-
328
ГЛ. 7. СИНТЕЗ БЕЛКА
вание АТФ, являющейся аккумулятором химической энергии.
Иными словами, аминокислоты вступают в реакцию синтеза
NH3
I II сн
H4N/CV
сн2-о—
I
Э
I
О"
о
II
о—с
1 I
он он
Рис. 128. Структура аминоациладенилата.
R
I +
С—NH,
I
Н
белка в активированной форме. Как показали исследования
Хогланда, Замечника и других [33, 34], активация аминокислоты
заключается в образовании
но-
0"
1
-р-
II
0
■о-
0"
1
-р-
II
0
А
1
0
1
-0-Р
//\
0 0
R
HC-NH?
I 3
0-С
II
0
так называемого аминоацил-
аденилата:
Аминокислота + Фермент+
+ АТФ
Фермент-
It
А
I
0
I
HC-NH?
I
-Аминоациладенилат + ФФ.
Структура аминоацил-
аденилата показана на рис.
128. Реакция идет с
участием специфического
фермента. Две фосфатные
группы АТФ выделяются в виде
пирофосфата. Схема
реакции показана на рис. 129,
где заштрихована
поверхность молекулы фермента
(см. следующую главу).
Есть предположение, что в
роли кофактора этого
фермента выступает витамин
BJ2. Доказано, что для каждой аминокислоты нужен свой
собственный фермент. Следовательно, для синтеза одной белковой
молекулы нужно 20 ферментов. Вопрос о том, откуда взялись эти 20
0
I
0'
I
но-р-о-р-о-
II II
о о
р-о-с
#\ II
0 0" 0
Рис. 129. Схема образования аминоацил-
аденилата.
МАТРИЧНЫЙ СИНТЕЗ БЕЛКА
329
ферментов — также белковых молекул,—непосредственно связан
с проблемой происхождения жизни. Несомненно, что они
синтезируются также с участием ДНК и РНК.
Следующий этап синтеза белка состоит в переносе
активированных аминокислот на матрицу. Доказано, что активированная
аминокислота присоединяется к концевому участку молекулы
транспортной РНК. Соединение происходит путем образования
эфирной связи в результате взаимодействия с одним из двух
рядом расположенных гидроксилов рибозы аденозина, которым
всегда оканчивается
молекула Т-РНК (рис. 130) [35,
Ц
36]. Взаимодействие обеспе- А.
чивается тем же ферментом. \ 0" / \~0Н 0 NH
Число различных типов
Т-РНК также не менее 20,
т. е. числа аминокислот.
N
0
УН I *
о-с-с-н
А
Иными словами, для каж- ° С
дой аминокислоты сущест- "2
вует свой фермент и своя рис. 130. Схема присоединения амиио-
Т-РНК. Все 20 или более кислоты к Т-РНК.
типов Т-РНК имеют
одинаковые конечные группы. На одном конце расположены
остатки АФЦФЦ, и именно к этому концу присоединяется
аминокислота, другой конец — ФГ. Концы молекулы Т-РНК,
следовательно, неспецифичны. Специфика Т-РНК, проявляющаяся
дважды — в присоединении определенной аминокислоты и в
посадке на определенное место матрицы М-РНК, должна быть
локализована не на концах Т-РНК, а в ее внутренних нуклео-
тидных звеньях.
В работе Лагерквиста и Берга [37] была установлена
последовательность нуклеотидов, примыкающих к АФЦФЦ в Т-РНК.
Эти нормально существующие группы удалялись путем
ферментативного расщепления и замещались присоединенными
мечеными группами — ф32ЦФ32Ц по схемам
— Ф НТФ^ФКФ^ФЦФЦФА + ФФ ->
_> _ ф Щ'ФХФУФг + 2ЦТФ + АТФ,
— Ф УГФХФУФг + 2ЦТФ (Ф*) -> — Ф 1ГФ^ФГФ2Ф*ЦФ*Ц+2ФФ.
Здесь X, Y, Z, W—неизвестные нуклеотиды. Полученная таким
образом видоизмененная меченая РНК подвергалась различным
видам ферментативного расщепления и определялись меченые
фрагменты: ЦФ*Ц, ЯФУФ2Ф*, 2Ф*, 2Ф*ЦФ* и т. д. Было
установлено, что на четвертом от конца месте находятся
преимущественно пуриновые основания А и Г, но не Ц. Далее тем же
330
ГЛ. 7. СИНТЕЗ БЕЛКА
методом удалось установить, что специфическая для изолейцина
Т-РНК заканчивается последовательностью
— ФГФЦФГФЦФАФЦФЦФА,
а для лейцина
— ФГФЦФАФЦФЦФА
и
— ФГФГФАФЦФЦФА.
В настоящее время ведутся многочисленные работы,
посвященные расшифровке первичной структуры Т-РНК. Определены
последовательности фрагментов Т-РНК, действующих как
переносчики аланина, тирозина, валина в дрожжах [38]. Реализован
ступенчатый синтез некоторых специфических олигонуклеотидов
с известной последовательностью оснований, что дает ценный
материал для выяснения природы действия ферментов на
нуклеиновые кислоты [39]*).
Все три вида РНК, а не только М-РНК синтезируются, по-
видимому, на ДНК. Показано, что ДНК содержит
последовательность нуклеотидов, дополнительную к рибосомальной РНК
23 S и 16 S. Однако эти цистроны занимают лишь небольшую
долю хромосомы Е. coli. Цистрон 23 S отвечает 0,2% всей ДНК,
цистрон 16 S—0,1%. Транспортная РНК на основании опытов
по гибридизации соответствует 0,02% ДНК [40].
Необходимо подчеркнуть, что двойная специфичность Т-РНК,
вероятно, имеет сходные основания — и во взаимодействии с
ферментом и во взаимодействии с М-РНК. И то и другое
определяется, по-видимому, структурным соответствием звеньев
Т-РНК и поверхности фермента и структурным соответствием
Т-РНК и М-РНК. Недавно прямыми опытами было показано,
что за эти две функции (узнавание аминокислоты и ее
присоединение, а также кодирование и включение аминокислоты в
белок) ответственны разные участки молекулы Т-РНК. Функции
этих двух участков в разной степени нарушаются бромирова-
нием **).
Следующий этап синтеза белка состоит в образовании пеп-
• тидной цепи. Аминоацил-Т-РНК присоединяются к матрице
рибонуклеиновыми концами, одна за другой. По-видимому,
происходит реакция роста белковой цепи
H2N-CHR-CO~T-PHK+H2N.CHR'-CO~T-PHK'->
-> H2N • CHR • CONH • CHR'. CO ~ T-PHK' + T-PHK
*) См. примечание на стр. 130.
*) См. Chiian-Tao Yu, P. C. Zamecnik, Science 144, 56 (1964).
МАТРИЧНЫЙ СИНТЕЗ БЕЛКА
331
и т. д. Концевая группа, содержащая Т-РНК, играющую роль
катализатора, все время остается реакционноспособной, т. е.
готовой для дальнейшего роста цепи. В этом смысле реакция
подобна ряду хорошо изученных процессов каталитической
полимеризации в химии синтетических полимеров.
Написать такую реакцию нетрудно, но до сих пор очень
многое здесь остается совершенно неясным. Как и почему
начинается рост цепи на , . j
матрице, что определяет : р I/
его окончание? Каковы
пространственные
характеристики этого процесса?
Перечислим еще раз
основные этапы синтеза
белка.
На ДНК хромосом
синтезируются молекулы
М-РНК, переходящие на
рибосомы, где они
образуют матрицы.
Аминокислоты ферментативно
активируются АТФ, образуя
аминоациладенилаты,
которые теми же
специфическими ферментами
присоединяются к молекулам
Т-РНК. Комплексы
аминокислоты — Т-РНК
собираются на матрице,
причем образуется белковая
цепь, покидающая
матрицу и уходящая в
цитоплазму и далее
следующая по своему
назначению. Дальнейшая судьба
Т-РНК
Алп/нонислоты
Рис. 131. Упрощенная схема синтеза белка.
участвовавших в синтезе
молекул М-РНК и Т-РНК не вполне ясна. Первые,
по-видимому, распадаются.
На рис. 131 показана общая упрощенная схема процесса. Он
достаточно сложен, но в то же время экономен в том смысле,
что синтез белка обеспечивается однотипными соединениями:
ДНК, М-РНК, АТФ, Т-РНК и рибосомной РНК, играющей роль
подложки для М-РНК.
Поскольку исходными веществами для синтеза белка
являются нуклеиновые кислоты, можно сказать, что оптическая
332
ГЛ. 7. СИНТЕЗ БЕЛКА
асимметрия белков и аминокислот определяется асимметрией
ДНК. Последняя фигурирует всегда в виде правой спирали, что
. в свою очередь диктуется асимметрией углеводной группы —
дезоксирибозы. На асимметричной матрице собираются
асимметричные же комплексы Т-РНК с аминокислотами; последние
принадлежат всегда к одному и тому же стереохимическому
ряду. В этом смысле асимметрия аминокислот есть функция
асимметрии углеводов.
Биологическая роль различных сортов РНК теперь
становится ясной. Это — вспомогательные вещества, обеспечивающие
синтез белка, руководимый ДНК. Генетическая информация
поступает в белок от ДНК через посредство РНК; однажды
поступив в белок, она уже не может из него «выйти» (Крик [32]),
т. е. передача информации с белка на белок или с белка на
нуклеиновую кислоту не происходит.
Можно рассуждать на тему об эволюционном происхождении
описанного механизма. Не исключено, что на заре жизни он
был более простым, скажем, сходным с синтезом белка
растительных вирусов, происходящим без участия ДНК. Как уже
указывалось, некоторые ученые считают вирусы примитивными
живыми организмами, деградировавшими до паразитического
способа существования после возникновения более совершенных
форм жизни.
Ясно также, что этот механизм синтеза не оставляет места
каким-либо предшественникам белка — пептидам, содержащим
несколько аминокислот, и понятно, почему такие пептиды не
обнаруживаются в клетках. Это, кстати, было бы и менее
экономно— понадобилось бы не 20 ферментов и 20 сортов Т-РНК,
а гораздо больше. Так, если бы белок синтезировался из дипеп-
тидов, то их общее число могло бы достигать 202=400, а в
случае трипептидов 203=8000.
Успехи в изучении синтеза белка очень значительны, но мы
еще далеки от его полного понимания. До сих пор нет настоящей
физико-химической теории процесса, не изучена его
термодинамика и кинетика. Скорость синтеза белка не очень велика —
пептидная цепь гемоглобина синтезируется за 1,5 мин, т. е. за одну
секунду полимеризуются две аминокислоты [41]. Что определяет
эту скорость? Полные ответы на возникающие здесь вопросы
будут получены тогда, когда наука научится моделировать
синтез белка в неживой системе, в системе небиологического
происхождения. Об этой задаче писал еще Энгельс. С ее решением
откроются грандиозные возможности для химии.
Как мы увидим далее (стр. 354), синтез белка управляется
сложной системой регуляции — описанный здесь механизм
является лишь упрощенной схемой. Еще мало что известно об од-
Генетический код 353
ном из важнейших факторов в синтезе белка — о действии
участвующих в этом процессе ферментов. И тем не менее данные,
полученные за последние годы, позволили выяснить природу
другого основного фактора, обеспечивающего синтез — главные
черты генетического кода. Мы можем теперь вернуться к этой
проблеме и подойти к ней уже не комбинаторно, не
умозрительно, но опираясь на конкретные физико-химические особенности
синтеза белка.
ГЕНЕТИЧЕСКИЙ КОД
Решение проблемы генетического кода (к осени 1964 г. еще
неполное) было получено в результате прямых генетических и
биохимических исследований. Сама постановка этих работ,
безусловно, связана с предшествующими теоретическими
изысканиями (см. первый раздел этой главы).
Крик и его сотрудники [42] предприняли генетическое
исследование цистрона В области Гц бактериофага Т4,
паразитирующего на Е. coli. Генная карта этой области была ранее изучена
Бензером (стр. 95), что и позволило установить основные
черты кода. Среди точечных мутаций Гц имеются мутации,
определяемые выпадением нуклеотидов (делениями) и определяемые
добавлением нуклеотидов. Такие мутации вызываются, в
частности, акридиновыми красителями [43]. Мутанты неспособны
давать бляшки данного типа на соответствующих культурах
Е. coli. Однако мутанты FCO, изученные Криком и
сотрудниками, способны возвращаться, ревертировать к дикому типу в
результате появления второй мутации в том же цистроне. Такие
«ревертанты дикого типа» оказались в действительности
двойными мутантами с «диким» фенотипом. Каждая из двух
мутаций порознь приводит к утрате способности синтезировать
соответствующий белок, но сочетание двух мутаций в одном цистроне
восстанавливает эту способность. Было изучено около 80
независимых r-мутантов цистрона 5, двойные и тройные их
комбинации. Многие из двойных и тройных комбинаций оказались
относящимися к дикому типу. Полученные факты
непринужденно объясняются на основании гипотезы о триплетном
неперекрывающемся коде, читаемом, начиная с определенного нукле-
отида цистрона или молекулы ДНК. Если код читается триплет
за триплетом, то выпадение или добавление одного нуклеотида
сбивает весь последующий текст.
На рис. 132 цепь ДНК условно представлена
последовательностью букв АВСАВС... Чтение кода, начиная с определенного
нуклеотида, означает наложение на эту последовательность
рамки с прорезями, показанной на рис. 132,6—ж. Если одна из
334
ГЛ. 7. СИНТЕЗ БЕЛКА
букв выпала (—) или, напротив, добавилась ( + ), то в
прорезях рамки появится уже другая последовательность (рис. 132,6
и в). Если имеется двойной мутант, в когором в одном месте
буква выпала, а в другом добавилась (~ + ), то
последовательность искажена лишь в области между двумя мутациями, а в
остальной части текст правильный (рис. 132, г и д). Если
неправильная область не слишком длинная, то синтезируемый белок
может сохранить свою функцию.
а)
б)
в)
V
Ф
е)
ж)
ABC
ABC
ABC
ABC
ABC
ABC
ABC
ABC
ABC
+ABC
ABC
ABC
ABC
А В С
^штт,
ABC
ABC
Рис. 132. «Текст» ДНК.
а) дикий тип; б) мутант с делецией; в) мутант с добавлением; г), д) двойные
мутанты типа + —; е) тройной мутант ; ж) тройной мутант + + +.
Заштрихован искаженный участок текста.
Это согласуется с данными Левинталя и сотрудников [44],
изучавшими мутанты Е. colu Были получены ревертанты,
образующие фермент (щелочную фосфатазу), обладающий
нормальной активностью, но имеющий измененный состав
полипептидной цепи. Белок может содержать участки, в которых
произошли замены аминокислот, не сопровождающиеся изменением
ферментативной активности (см. стр. 393). Все комбинации типа
( + + ) или ( ) должны относиться к мутантному r-типу,
напротив, ряд комбинаций (Н—) может относиться к дикому
типу. При этом следует иметь в виду, что любая длинная
последовательность нуклеотидов может читаться правильно одним
способом, а неправильно — двумя в зависимости от того,
смещена ли рамка на одно место вправо или влево (—(- или Н—).
Очевидно, что последовательность неправильных триплетов
между — и + и соответственно между + и — различна. Анализ
двойных мутантов показывает, что сдвиг (—(-) приемлем везде
внутри рассматриваемой области (приемлем в смысле
появления дикого фенотипа), а сдвиг (Н—) приемлем только в более
ограниченном участке.
ГЕНЕТИЧЕСКИЙ КОД
335
На .основании такой гипотезы Крик сделал предсказания
свойств 28 мутантов, полностью оправдавшиеся на опыте.
6 тройных мутантов типов ( + + + ) и ( ), выбранных
таким образом, чтобы не было сдвигов через неприемлемые
области типа ( + —), вновь оказываются обладающими диким
фенотипом (рис. 132, е, ж).
Таким образом, принятая гипотеза согласуется с фактами.
Отсюда следует, что код неперекрывающийся и нуклеотидный
текст читается с определенного места. Что касается кодового
отношения, т. е. числа нуклеотидов, ответственных за включение
одной аминокислоты в белок, то оно может равняться трем или
быть кратным трем. Очевидно, что ничего не изменится, если
накладывать рамку с прорезями, в которых поместится не 3,
а 6 или даже 9 нуклеотидов. Наиболее правдоподобным
представляется, однако, число 3, т. е. триплетный нуклеотидный код.
Эта выдающаяся работа устанавливает общий характер
кода, но не дает его расшифровки. Расшифровка (пока еще
неполная) получена в результате биохимических исследований.
Установление общего характера кода позволяет
окончательно определить молекулярные размеры гена — цистрона, которые
выражались ранее в вероятностях рекомбинации или в минутах
(стр. 96). При степени полимеризации синтезируемого белка,
равной 500, что отвечает молекулярному весу порядка 50000,
длина цистрона, т. е. участка цепи ДНК, ответственного за
синтез этого белка, отвечает 1500 звеньев-нуклеотидов.
Следовательно, молекулярный вес цистрона равен 1500 • 330 • 2= 106
(330 — молекулярный вес нуклеотида, 2 — число цепей в
двойной спирали). Мутоном, очевидно, является триплет, тройка
нуклеотидов. Рекон — один-два нуклеотида цепи.
В августе 1961 г. на V Международном биохимическом
конгрессе в Москве Ниренберг и Маттеи [45] сообщили о
замечательных опытах по включению аминокислот в белки в
бесклеточной биологической системе. Была взята рибосомная фракция,
выделенная центрифугированием из разрушенных клеток Е. colu
К ней добавлялась иадосадочная жидкость, содержащая
растворимую РНК, а также АТФ, и система, генерирующая АТФ.
Эта безъядерная смесь представляет собой как бы не
укомплектованную фабрику, способную синтезировать белки. Такая
фабрика лишена управляющего планового и конструкторского бюро,
но в принципе может выпускать свою продукцию, если снабдить
ее чертежами со стороны. Роль таких чертежей в нормальной
фабрике играют молекулы М-РНК. Ниренберг и Маттеи
вводили в систему рибосомную РНК и синтетические полирибону-
клеотиды и изучали включение меченых по С14 аминокислот
в белок- Оказалось, что в присутствии РНК радиоактивная
336
ГЛ. 7. СИНТЕЗ БЕЛКА
метка включается значительно сильнее, чем в отсутствие РНК.
Процесс включения подавляется ферментом, разрушающим
РНК — РНК-азой, а также пуромицином и хлорамфениколом.
Было установлено, что РНК стимулирует включение С,4-валина,
а синтетическая полиуридиловая кислота — С,4-фенилаланина.
В отсутствие ПолиУ на 1 мг белка приходилось 44
радиоактивных импульса в минуту, в присутствии ПолиУ — 39 800
импульсов!
Таким образом, в этих работах впервые биологическая
система была «обманута» — вместо природной матричной РНК
в нее вводилась синтетическая матрица ПолиУ, кодировавшая
по всем данным фенилаланин. Если код действительно трип-
летен, то фенилаланину отвечает триплет УУУ в матрице
РНК.
Вслед за Ниренбергом и Маттеи аналогичные работы были
проведены Ленгиелом, Очоа и их сотрудниками, испытавшими
наряду с ПолиУ ряд других синтетических полирибонуклеоти-
дов [46—59].
Было установлено, что ПолиУ вызывает синтез кислотноне-
растворимого полифенилаланина, причем на включение одного
моля фенилаланина требуется 3,25 молей остатков У в ПолиУ.
При добавлении ПолиА к системе, в которую введен ПолиУ,
включения фенилаланина не происходит, что объясняется
образованием двойных спиралей ПолиА+ПолиУ (стр. 260), в
которых ПолиУ уже не работает как матрица. Был испытан ряд
сополимеров — У с Г, сАиЦ, сЦиГ, сАиГ, а также А с Г
и с Ц, взятых в различных пропорциях. Это позволило найти
кодовые триплеты для всех аминокислот. Метод определения
триплета можно иллюстрировать примером серина или лейцина.
Сополимер УЦ в пропорции 3: 1 вызывает включение Фен, Сер
и Лей в белок. В отсутствие полирибонуклеотида Фен
включается в количестве 0,06 тц, молей на 1 мг рибосомного белка,
Сер — в количестве 0,04, Лей — 0,06. В присутствии ПолиУЦ
(3:1) Фен — 2,2, Сер — 0,9, Лей — 0,6. В предположении о три-
плетном коде отношение числа триплетов в ПолиУЦ (3:1)
равно
УУУ/УУЦ (или УЦУ или ЦУУ) = 3.
Близкая величина получается, если сравнить полученные доли
включения
Фен/Сер (или Лей) = 2,2/0,75 = 2,9.
Следовательно, Сер и Лей кодируются триплетами,
содержащими 2У и Щ. Напротив, Про кодируется 2Ц1У. ПолиЦ не
Стимулирует включению Про, но ПолиУЦ стимулирует.
ГЕНЕТИЧЕСКИЙ КОД
Испытывался ПолиУЦ (5: 1). При этом
Фен/Про = 7/0,4 =18
УУУ/2У1Ц = 5, УУУ/1У2У
337
И
= 25,
По-видимому Про отвечает 2Ц1У [38].
В табл. 23 приведены кодовые триплеты или так называемые
кодоны для всех 20 аминокислот согласно данным,
опубликованным к середине 1964 г.
Таблица 23
Кодоны М-РНК *)
Аминокислота
Состав кодоиов (58]
Состав кодоиов (59]
Ала
Apr
Асп
Acn-NH2
Вал
Гис
Гли
Глу
Глу-ЫН2
Илей
Лей
Лиз
Мет
Про
Сер
Тир
Тре
Три
Фен
Цис
АГЦ, УГЦ, ГЦЦ
ААГ, УГЦ. ГЦЦ
АУГ, АГЦ
ААУ, ААЦ, АУЦ
УУГ
АУЦ, АЦЦ
АГГ, УГГ, ГГЦ
ААГ, АУГ, АУЦ
ААЦ, АГГ
ААУ, АУУ, АУЦ
АУУ, УУГ, УУЦ, УЦЦ
AAA, ААУ
АУГ
АЦЦ, УЦЦ, ЦЦЦ
АГЦ, УУ11, УЦЦ
АУУ, АУЦ
ААЦ, АУЦ, АЦЦ
УГГ
УУУ, УУЦ
УУГ
УГЦ, ГЦЦ, АГЦ
ГЦЦ, ААГ, УГЦ, АГЦ
A A LT, АУГ, АГЦ
ААУ, АУЦ, ААЦ
УУГ, АУГ
АЦЦ, АУЦ
УГГ, АГГ, ГГЦ
ААГ, АУГ, АГЦ
ААЦ, ААГ, АУГ
АУУ, ААУ
АУУ, УУГ, УУЦ, (УУУ)
AAA, ААУ
АУГ
АЦЦ, УЦЦ, ГЦЦ, ЦЦЦ
ууц, уги, уцц, агц
АУУ
AUU, АЦЦ
УГГ
УУУ, УУЦ
УУГ
») Во втором столбце —данные Очоа, Леигиела и др., исследовавших'48 кодоиов
лз 64 возможных; в третьем — большей частью с ними согласующиеся даииые Ниреи-
берга. Последовательность иуклеотидов в кодоие неизвестна, поэтому буквы размещены
в порядке А, У, Г, Ц. Полужирным шрифтом выделены триплеты, согласующиеся
с химическими мутантами ВТМ, полученными посредством дезамииироваиия (стр. 351).
В работе [60] синтетические полирибонуклеотиды были
подвергнуты обработке HN02, вызывающей дезаминирование
азотистых оснований, в результате которого Г превращается в
ксантин и гипоксантин, а Ц в У. Дезаминированные полимеры
обладают'пониженной активностью (причина этого неясна).
Выяснилось, что гипоксантин может замещать Г в кодирующем
22 М- Э- Золькеищтейц
338
ГЛ. 7. СИНТЕЗ БЕЛКА
триплете. Кодовые триплеты оказались согласующимися с
производимой заменой оснований. Так, ПолиУА (5:1) не
стимулирует включения Вал (триплет 2У1Г). После обработки HN02
А превращается в гипоксантин, аналогичный Г, и дезаминиро-
ванный полимер стимулирует включение валина. Анализ ряда
мутантов ВТМ, полученных с помощью HNO2 (см. стр. 350),
также подтверждает код.
«Обман» биологической системы в описанных опытах весьма
значителен. Оказывается возможным комбинировать рибосом-
ную фракцию одного происхождения с надосадочной жидкостью
другого происхождения [40]. Система, содержащая рибосомы из
печени крысы и надосадочную жидкость из клеток Е. coli,
работает почти так же хорошо, как система, полученная только из
Е. coli. К системе обратного состава и к системе, полученной
только из клеток печени, это не относится — в них ПолиУ
оказывается менее активным. Причина этого пока неясна.
В работе [61] получены предварительные данные,
указывающие на возможность заставить систему из Е. coli синтезировать
белок, структура которого задана введением надлежащей
матричной РНК. В систему вводилась РНК из ВТМ, при этом
происходило стимулирование включения ряда меченых аминокислот
и синтез белка, подобного белку ВТМ. Эти данные, однако,
нуждаются в проверке.
Описанные работы, начатые Ниренбергом и Маттеи и
продолженные рядом других исследователей, имеют
фундаментальное значение для молекулярной биологии. Окончательно сорван
покров биологической тайны с клетки, как биосинтетической
системы. Открыта возможность вмешиваться прямым образом
в синтез белка, прямыми опытами доказан ранее предложенный
«технологический процесс» клеточной фабрики. Но еще большее
значение имеет открытие генетического кода — решение задачи,
поставленной в начале пятидесятых годов. Нахождение
кодовых триплетов означает раскрытие структуры гена — мутона.
Код пока неполон. Первые данные о последовательностях
нуклеотидов в кодонах появились лишь недавно (см. стр. 342).
В этом смысле можно сравнить современное состояние науки
о строении гена с состоянием атомной физики непосредственно
перед появлением теории Бора. Из опытов Резерфорда
следовало, что атом состоит из очень малого положительно
заряженного ядра и окружающих это ядро электронов. Было, однако,
неизвестно, каковы состояния этих электронов. Мы знаем сейчас
состав кодонов (неоднозначно), но не имеем еще сведений о
последовательности нуклеотидов. Можно не сомневаться, что
в ближайшие годы все основные кодовые проблемы будут
решены.
ГЕНЕТИЧЕСКИЙ КОД 339
Еще до открытия кода Суеока исследовал корреляцию
состава тотального белка ряда бактерий с составом их ДНК [62].
Как уже говорилось, содержание ГЦ в ДНК бактерий
варьирует в широких пределах — от 25 до 75%. Суеока построил для
16 аминокислот графики, показывающие зависимость их
содержания в общем белке от сбдержания ГЦ в ДНК. Зависимости
оказались линейными. При этом аминокислоты разбились на
три группы. В первой из них коэффициент корреляции,
выражающий наклон прямой, положителен, т. е. содержание
аминокислоты в белке растет с содержанием ГЦ в ДНК, во второй
группе коэффициент близок к нулю и в третьей — отрицателен.
Сам Суеока пытался вывести код (не обязательно триплетный)
из этих данных, но безуспешно [62, 63]. Однако сопоставление
данных Суеока с кодовыми триплетами, найденными методом
Ниренберга и Маттеи, весьма поучительно [64]. Такое
сопоставление дано в табл. 24. В ней фигурируют кодоны второго
столбца табл. 23.
Мы видим, что трем группам аминокислот отвечают три
типа триплетов в смысле содержания ГЦ. Этим, в общем,
подтверждается правильность найденных кодонов. С табл. 24
совместимы, правда, триплеты, содержащие А вместо У и Г
вместо Ц и наоборот, но не Г и Ц вместо А и У. Большинство
кодонов содержит избыток А и У по сравнению с Г и Ц. Только
в первой группе аминокислот содержание ГЦ в триплете
больше, чем АУ. Для этой группы среднее число Г+Ц в кодоне
составляет 2,25, для двух остальных групп оно меньше 2. У ДНК
высших организмов с содержанием ГЦ, равным 40—45%,
среднее число Г+Ц в любой, случайно занятой тройке нуклеотидов
равно 1,30. Если вычислить среднее число Г+Ц для всех
кодонов табл. 24, то мы получим то же число— 1,33 (44%).
Следовательно, найденные до настоящего времени кодоны согласуются
с составом ДНК у высших организмов.
Если бы все кодоны были функциональны, то мы получили
бы мало отличающееся число—1,50 (50% ГЦ), Этим
объясняется противоречие с термодинамической теорией мутаций
(стр. 296). Поскольку в кодовых РНК имеется, в общем,
избыток АУ и соответственно в кодонах ДНК — избыток AT,
накопление Г+Ц в ходе эволюции выше некоторого предела
означает прекращение синтеза белков, появление летальных мутаций.
Таким пределом и является 40—45% Г+Ц. Эволюция
состава ДНК определяется не термодинамикой, но всем химизмом
белкового синтеза и естественным отбором. Бактерии с
повышенным содержанием ГЦ не противоречат сказанному, так как
их белки далеко не столь разнообразны, как белки высших
организмов.
22*
340 Гл- 7. СИНТЕЗ БЕЛКА
Таблица 24
Сопоставление кодонов с данными по корреляции аминокислотного
состава белка с содержанием ГЦ в ДНК
Аминокислоты
Ала
Apr
Гли
Про
Вал
Тре
Лей
Гис
Сер-
Мет
Фен
Тир
Глу \
Глу-ЫН2 J
Асп \
Acn-NH2 /
Лиз
Илей
Коэффициент
корреляции
Ь
0.164
0.089
0.051
0.024
0,008
0.000
—0,006
—0.010
-0,017
-0.024
-0.040
-0.047
-0,052
-0,053
-0.084
-0.098
Кодоиы в М-РНК
Число ГЦ
в кодойе
Группа 1 Ь > 0
АГЦ. ГЦЦ, УГЦ
ААГ, УГЦ. ГЦЦ
АГГ, УГГ, ГГЦ
АЦЦ, УЦЦ, ЦЦЦ
2, 3, 2
1,2,3
2, 2, 3
2. 2, 3
Среднее по группе 2,25
Группа 2 Ь^О
УУГ
ААЦ, АУЦ, АЦЦ
АУУ. УГГ, УУЦ, УЦЦ
АУЦ. АЦЦ
АГЦ, УУЦ. УЦЦ
1
1. 1. 2
а 1.1.2
1. 2
2. 1. 2
Среднее по группе 1,31
Группа 3 b < 0
АУГ
УУУ. УУЦ
АУУ, АУЦ
ААГ, АУГ, АУЦ
ААЦ. АГГ
АУГ. АГЦ
ААУ, ААЦ, АУЦ
AAA, ААУ
ААУ, АУУ, АУЦ
1
0, 1
0, 1
1. 1. 1
1. 2
1.2
0. 1. 2
0, 0
0. 0. 1 (
Среднее по группе 0,80
Средняя
доля ГЦ
в кодойах
0.77
0,67
0.77
0,77
0.72
0,33
0.44
0.33
0.50
0,56
0.44
0,33
0,17
0,17
0,33
0.50
0.50
0.33
0.00
0,11
0,27
ГЕНЕТИЧЕСКИЙ КОД
341
Стоит отметить, что указанное соответствие между
данными Суеока и составом кодонов было установлено еще до
открытия ряда кодонов (см. [64]). При этом были сделаны
предсказания, полностью подтвердившиеся в работах [54] и [55].
Например, возможность нахождения в кодонах первой группы
большего числа Г и Ц и возможность замены У на А в кодонах
второй и третьей группы.
Ланни опубликовал работу [65], в которой он приходит к тем
же результатам, что и сформулированные в работе [64]. Ланни
считает, что не-ГЦ код свидетельствует о копировании
молекулой М-РНК только одной из двух цепей ДНК. Доля А в ДНК
бактерий меняется от Ve до %• Даже богатые А и Т ДНК
бактерий могут кодировать РНК, богатую У, только если имеется
некоторая поляризация — А содержится преимущественно в
одной цепи, а Т в другой. Если это так, то должно быть больше
соседств АФА+ТФТ, чем АФТ+ТФА. Это действительно
следует из данных Джоссе.
Все имеющиеся данные свидетельствуют об универсальности
кода. С найденными кодонами согласуются и данные по
мутантам ВТМ и данные по мутантам гемоглобина человека.
Недавно показано, что ПолиУ стимулирует включение Фен
в белок в системах, получаемых из клеток крысы, кролика,
человека и зеленых водорослей Chlamydomonas [66].
Код обеспечивает передачу информации, необходимой для
синтеза любого белка, и нет никаких оснований думать, чтобы
он мог меняться в ходе эволюционного процесса *).
Из табл. 23 следует, что код является вырожденным.
Большинство аминокислот кодируется несколькими кодонами
разного нуклеотидного состава. Вырождение возможно и более
значительно, так как последовательность нуклеотидов в
триплете неизвестна. Возможно, что на совместно вырожденные
триплеты накладывается добавочное термодинамическое
условие устойчивости — согласно данным Де Во и Тиноко (стр. 282)
различные триплеты не равновероятны. Более того, разные
последовательности триплетов имеют разную энергию. '
Вырождение, очевидно, генетически выгодно в том смысле,
что оно уменьшает число нефункциональных, некодирующих
триплетов.
Следует упомянуть и о попытках иного истолкования
полученных генетических и биохимических данных. Так, Уолл
показал, что код с частичным перекрыванием (например,
*) Недавно показано (М. В. Волькенштейн, Генетика, т. 1, 1965),
что полярные и неполярные аминокислоты (ср. стр. 214) кодируются
триплетами, заметно различающимися по составу. (Примечание при корректуре.)
342
ГЛ. 7. СИНТЕЗ БЕЛКА
квадруплетный код, в котором перекрываются только два
крайних нуклеотида) не противоречит никаким из имеющихся
результатов [67]. Такое предположение оказывается, однако,
недостаточно оправданным.
Очень важна и актуальна задача определения
последовательности нуклеотидов в кодовых триплетах (см. [68]). Ленгиел,
Очоа и сотрудники приступили к экспериментальному решению
задачи, синтезировав полирибонуклеотиды типа АУУУ... и
ААУУУ... Для такого синтеза в качестве затравки
использовались короткие цепочки, содержавшие АУ и АУУ— олигорибону-
клеотиды. Оказалось, что в бесклеточной системе Е. coli эти
полимеры стимулировали включение Фен и малых количеств
Тир, но не Илей, Асп и Лиз. Неупорядоченный сополимер УА
стимулирует включение Илей и Тир в равной степени. Так как
состав триплетов для Илей и Тир одинаков (2У1А), полученные
результаты показывают, что включение Тир вызывается
триплетом АУУ. Синтез полипептида начинается с N-терминальной
аминокислоты, и код РНК читается с конца, на котором
расположена неэтерифицированная З'-ОН-группа, т. е. читается
справа налево в'последовательности типа АУУУ... УУ [69]. (См.
также работу [70].)
В самое последнее время опубликованы работы Ниренберга
и Ледера*). Они установили, что к рибосомам в бесклеточной
системе можно присоединить не только полирибонуклеотид,
имитирующий М-РНК, но и короткие олигорибонуклеотиды. Затем
в систему вводится меченая по С14 амино-ацил-Т-РНК.
Оказалось, что триплетные нуклеотиды присоединяют аминокислоты, -
а дублеты не функциональны. Тем самым окончательно
опровергнуты дублетные коды. Установлено, например, что валин
присоединяется триплетом ГУУ, но не УГУ или УУГ.
Установление последовательности нуклеотидов в кодоне для валина
позволило определить такие последовательности и для некоторых
других аминокислот, исходя из данных по мутантам: Илей — АУУ,
Ала —ГЦЦ, Глу—ГАА, Apr —АГА, ГГЦ. Таким образом, эта
работа открыла путь для полной расшифровки кода.
Было обращено внимание на то обстоятельство, что
совместно вырожденные кодоны, кодирующие одну и ту же
аминокислоту, как правило, имеют два общих нуклеотида. Это
иллюстрируется табл. 25. Эти данные заставляют думать, что два
из трех нуклеотидов для данной аминокислоты фиксированы и
вырождение не имеет случайного характера.
*) P. Leder, M. Nirenberg, Proc. Nat. Acad. Sci. US 52, 420, 1521
(1964); Science 145, 1399 (1964); M. В е г п f i e 1 d, M. Nirenberg, Science
M7, 179 (1965); они же и др., Proc. Nat. Acad. Sci. US 53, 807 (1965).
ГЕНЕТИЧЕСКИЙ КОД 343
Таблица 25
Общие иуклеотиды в кодоиах *)
Аминокислоты
Ала
Apr
Асп
Acn-NH2
Вал
Гис
Гли
Глу
Глу-ЫН2
Илей
Лей
Лиз
Мет
Про
Сер
Тир
Тре
Три
Фен
Цис
Кодоны
ГЦА, ГЦУ, ГЦЦ
ГЦУ, ГЦЦ, (ААГ)
АГУ, АГЦ
ААУ, ААЦ, (АУЦ) или АУА, АУЦ, (ААЦ)
УУГ
АЦУ, АЦЦ
ГГА, ГГУ, ГГЦ
АГА, АГУ, (АУЦ) или АУГ, АУЦ, (ААГ)
(ААЦ, АГГ)
АУА, АУУ, АУЦ
УУА, УУГ, УУЦ (УЦЦ)
AAA, ААУ
АУГ
ЦЦА, ЦЦУ, ЦЦЦ
УЦУ, УЦЦ, (АГЦ)
АУУ, АУЦ
АЦА, АЦУ, АЦЦ, (ГЦЦ)
УГГ
УУУ, УУЦ
УУГ
») В скобках — кодоны, для которых это правило не выполняется.
Совпадающие иуклеотиды иаписаиы иа первом и втором месте.
Другая интересная закономерность рассмотрена в [55]. Число
кодируемых данной тройкой аминокислот согласуется с
возможным числом перестановок нуклеотидов — с числом кодонов
(табл. 26). Расхождения с указанным законом относительно
невелики и всегда отрицательны. Эти данные служат
дополнительным подтверждением кода и указывают на то, что перемена
последовательности нуклеотидов в кодоне изменяет кодируемую
аминокислоту.
Основы решения проблемы кода можно считать прочно
установленными. Несомненно, однако, что состав кодонов подлежит
еще дальнейшим уточнениям. Необходимо установить
последовательности нуклеотидов в кодонах. Критический анализ
полученных до 1963 г. результатов содержится в статьях Крика
[71,72], Баева[73]и др.
Решение проблемы кода далеко не означает решения всех
вопросов, относящихся к синтезу белка. При включении
аминокислот в белковую цепь возможны ошибки на всех этапах
344 ГЛ. 7. СИНТЕЗ БЕЛКА
Таблица 26
«Вырождение» кодонов
Состав
триплета
AAA
ААУ
ААГ
ААЦ
АУУ
АУГ
АУЦ
АГГ
АГЦ
АЦЦ
УУУ
УУГ
УУЦ
УГЦ
УГГ
УЦЦ
ггг
ГГЦ
гцц
ццц
Число
кодоиов
1
3
3
3
3
6
6
3
6
3
1
3
3
6
3
3
1
3
3
1
Аминокислоты
Лиз
Acn-NH2, Илей, Лиз
Apr, Глу
Acn-NH2, Глу-ЫН2, Тре
Илей, Лей, Тир
Асп, Глу, Мет
Асп, NH2, Гис, Глу, Илей, Тир, Тре
Гли, Глу-ЫН2
Ала, Асп, Сер
Гис, Про, Тре
Фен
Вал, Илей, Цис
Лей, Сер, Фен
Ала, Apr
Гли, Три
Лей, Про, Сер
__
Гли
Ала, Apr
Про
Число
аминокислот
1
3
2
3
3
3
6
2
3
3
1
3
3
2
2
3
0
1
2
1
Расхождение
—
—1
—
—
—3
—1
—3
__
—4
-1
—
-1
—2
—1
^^-
синтеза. Во-первых, ошибка — включение ненадлежащего
нуклеотида— возможна при редупликации ДНК. Это—мутация,
наследуемое изменение генотипа. О химическом мутагенезе
рассказано в следующем разделе. Во-вторых — включение
ненадлежащего нуклеотида в М-РНК. И в-третьих — ошибка при
синтезе белка, неправильное «чтение» кодона. Возможно, что
ошибки второго и третьего типа ответственны за некоторые
явления фенотипической изменчивости.
Недавно было показано, что можно исказить код, внести
ошибки его «прочтения», вводя в бесклеточную систему,
синтезирующую белок, стрептомицин [74—76]. Антибиотики, и в том
числе стрептомицин, убивают бактерии, влияя каким-то
образом на синтез белка. Как уже говорилось, устойчивость или
чувствительность к антибиотику может возникнуть в результате
мутации. Оказалось, что стрептомицин влияет на рибосомы,
включая в них 30 S единицы.
В присутствии стрептомицина ПолиУ гораздо слабее
стимулирует включение фенилаланина — синтез полимера
блокируется на 50—85%. Напротив, включение других аминокислот,
в норме не стимулируемое ПолиУ, происходит и в присутствии
стрептомицина.
ХИМИЧЕСКИЙ МУТАГЕНЕЗ
345
Включается изолейцин, слабее — серии и лейцин. Сходные
эффекты наблюдаются при введении других синтетических по-
линуклеотидов и под воздействием других антибиотиков — коли-
мицина и неомицинов В и С. Таким образом, блокировка
синтеза белка антибиотиками связана с ошибочным «чтением»
кода, с модификацией участка рибосомы, связывающего Т-РНК.
Как пишут авторы работы [75], изменение в этом участке,
вызванное связыванием стрептомицина, позволяет «ошибочной»
Т-РНК так хорошо соответствовать матрице, что «ошибочная»
аминокислота входит в пептидную цепь. Дальнейшая
модификация, вызванная мутацией, изменяет структуру участка так,
что спаривается правильная Т-РНК независимо от присутствия
стрептомицина. Речь идет о возникновении мутантов,
устойчивых к стрептомицину. Наконец, возможна и такая
модификация, в которой участок рибосомы нуждается в молекуле
стрептомицина для правильного функционирования. Этим
объясняется существование мутантов, зависящих от
антибиотика.
В работе [77] было показано также, что кодирование
посредством ПолиУ зависит от концентрации ионов Mg++. При
концентрациях, существенно отличных от физиологических, код
читается неправильно.
Эти первые результаты работ, в которых исследуется
влияние среды на кодирование, очень важны и интересны. В живых
клетках состав цитоплазмы стабилизован, и код работает в
постоянных условиях. Нарушение этих условий может иметь
далеко идущие последствия.
Несмотря на успехи исследований, проводимых в бесклеюч-
иых системах, возникают некоторые сомнения по поводу
установленного кода в связи с тем, что синтез происходит ие в
клетке, а в измененных условиях. Не исключено поэтому, что
при переходе к исследованиям in vivo некоторые кодоны
придется изменить.
ХИМИЧЕСКИЙ МУТАГЕНЕЗ
Точечные мутации сводятся к замене одного азотистого
основания другим, к выпадению основания (делеции) или к
добавлению лишнего основания к матричной нуклеиновой кислоте.
Очевидно, что такие мутации являются попросту химическими
превращениями ДНК и РНК. Рассмотрим в связи с этим
действие некоторых химических мутагенов — веществ, вызывающих
мутации.
Высокой мутагенной активностью обладают некоторые
аналоги азотистых оснований нуклеиновых кислот. Таковы,
346
ГЛ. 7. СИНТЕЗ БЕЛКА
например, 5-бромурацил (БУ)
О О—Н
vv /V*
I || <=± | II
С С СС
o^\n/\h o^\n/\h
н н
Кето-форма Энольная форма
и 2-аминопурин (АП)
Н
•
vv„
I II /
С С /
h2n/ ^n/\n4
Эти соединения включаются в ДНК, как таковые, заменяя
обычные азотистые основания. Так, при синтезе ДНК in vitro,
по Корнбергу, БУ включается в цепи вместо Т, 5-бромцитозин
(БЦ) вместо Ц и Гк вместо Г. Мутагенность объясняется, надо
думать, ошибками редупликации ДНК, в которой вместо
нормальных оснований фигурируют аномальные [78].
По-видимому, БУ может имитировать Т и образовывать пару
с А, если он фигурирует в обычной кето-форме (рис. 133,а).
Напротив, в более редкой энольной форме БУ имитирует Ц и
образует пару с Г (рис. 133,6). Эти два случая отличаются
друг от друга. Первый из них может рассматриваться как
ошибка включения, происходящая во время редупликации
исходной ДНК — к А присоединяется не Т, а БУ. Во втором
случае мы имеем дело с ошибкой редупликации — цепь ДНК, уже
содержавшая БУ, образует в этом месте не пару БУ—А (что
исправило бы ошибку включения:
А—БУ —■> А, БУ —■> А—Т, БУ—А —■*
—> А — Т, БУ, А —■> А — Т, БУ — А, А— Т и т. д.,
а пару БУ— Г в результате таутомерного превращения БУ [79].
Вероятность таутомерного перехода в энольную форму
возрастает благодаря наличию атома Вг, который оттягивает на себя
ХИМИЧЕСКИЙ МУТАГЕНЕЗ
а)
б)
н н
*;
Рис. 133. Не уотсон-криковские пары:
а) Кето-БУ-А; б) Энол-БУ-Г; в) АП-Т; г) АП-Ц.
348
ГЛ. 7. СИНТЕЗ БЕЛКА
электроны из пиримидинового кольца, вследствие чего Н легче
переходит к О, чем в У," не содержащем Вг.
В связи со сказанным необходимо подчеркнуть важность
исследований — экспериментальных и теоретических — тауто-
мерных переходов в пуринах и пиримидинах. Здесь необходимы
хотя бы ориентировочные квантовохимические расчеты (на
точные вычисления при современном состоянии квантовой химии
рассчитывать не приходится) относительных содержаний кето-
и энольных форм. Такие расчеты могут пролить свет на
проблемы мутагенеза — в том числе и спонтанного. Дело в том, что
и обычные для ДНК основания могут фигурировать в тауто-
мерных формах и образовывать не уотсон-криковские пары.
Мы пока что не располагаем какими-либо другими принципами
для рассмотрения возможных пар, кроме оценки возникающих
водородных связей. Очевидно, что учет таутомерии необходим
для построения молекулярной теории мутагенеза.
АП в нормальной форме может образовать пары: с Т —
двумя водородными связями и с Ц — одной водородной связью
(рис. 133,в и г), следовательно, он способен имитировать и А
и Г [80].
Другая группа мутагенных веществ — красители
акридинового ряда, например профлавин;
Н
Ввиду того, что эти вещества взаимодействуют с ДНК в ка-
тионной форме, предполагается,, что они соединяются с
фосфатными группами ДНК [81]. Но, может быть, это происходит и
иначе, как показывают результаты, описанные далее.
Интересные сведения о взаимодействии молекул ДНК с
мутагенами и канцерогенами дает изучение поляризованной
люминесценции комплексов ДНК-краситель.
Явление люминесценции состоит в том, что люминесцирую-
щая молекула, поглотив свет определенной частоты, испускает
через короткое, но конечное время т свет другой частоты.
Пользуясь языком классической физики, можно сказать, что
электромагнитные волны определенной частоты поглощаются
некоторым электронным осциллятором в молекуле, колеблющимся в
фиксированном направлении. Поглощенная энергия переходит
к другому осциллятору, колеблющемуся с другой частотой и в
другом направлении. Он и излучает свет. Так как оба
осциллятора имеют фиксированное направление в молекуле, излучае-
ХИМИЧЕСКИЙ МУТАГЕНЕЗ
349
мый свет оказывается поляризованным, если молекулы
движутся сравнительно медленно. Однако, если за время т люми-
несцирующая молекула успевает повернуться, поляризация
исчезает. Следовательно, степень поляризации
подвижности молекул. Это иллюстрируется рис.
подробное описание явления
зависит от
134, более
читатель найдет в [82] и [83].
В работе [84] изучалось
взаимодействие ДНК с
акридиновым оранжевым
красителем
Н
N+ /N (СН3)2
Свет
(СН3).
Рис. 134. Схема, поясняющая явление
поляризованной люминесценции.
принадлежащим к группе мутагенных. Эти молекулы ярко лю-
минесцируют. Изучалась зависимость поляризации Р
люминесцентного свечения комплекса ДНК-
краситель в растворе от
температуры и вязкости среды.
Оказывается, что поляризация нативного
комплекса медленно падает с ростом Т
(соответственно обратная величина
1/Р медленно возрастает) вплоть до
температуры плавления спирали
75° С. При этой температуре 1/Р
резко возрастает до значения,
соответствующего свободным
молекулам красителя. Для комплексов
с денатурированной ДНК кривая
зависимости 1/Р от Т/ц не имеет
резкого излома (рис. 135).
Эти и другие опыты показывают,
что краситель стабильно
связывается нативной, двуспиральной
ДНК- Эта связь не имеет
химического характера, так как она
исчезает при денатурации и молекулы
красителя в свободном состоянии
поступают в раствор. Можно
думать, что молекулы красителя
проникают в полость внутри двойной спирали, образуя так
называемое клатратное соединение (соединение включения [85]).
К аналогичному выводу пришел Лузатти, изучивший такие
100 300 500 700 900 1100
Т/71
Рис. 135. Зависимость
поляризации свечения комплекса ДНК-
акридин оранжевый от
температуры.
1) нативная ДНК; 2)
денатурированная ДНК.
350
ГЛ. 7. СИНТЕЗ БЕЛКА
комплексы методом рассеяния рентгеновых лучей под малыми
углами [86]. Следовательно, мутагенное действие красителей
может заключаться в изменении условий редупликации двойной
спирали.
В упомянутой работе [84] установлено существование двух
стадий денатурации — обратимой и необратимой — в
соответствии с другими экспериментальными и теоретическими
результатами.
Надо отметить, что некоторые конденсированные
ароматические соединения (акридиновые красители также являются
конденсированными ароматическими соединениями) обладают
канцерогенной активностью — вызывают рак. Так, в папиросном
дыме содержится бензпирен — очень сильный канцероген
лгут
Полинг подсчитал, что при выкуривании одной сигареты (на
что идет примерно 5 минут) ожидаемая средняя
продолжительность жизни сокращается на 15 минут — из-за
соответствующего увеличения вероятности заболеть раком легких.
Начав с рассмотрения химического мутагенеза, мы дошли
до лекции о вреде табака. Но дело в том, что рак, по-видимому,
связан с мутациями — с соматическими мутациями. Поэтому
изучение мутагенного действия химических соединений может
и должно раскрыть некоторые вопросы, связанные с сущностью
рака.
Не раз уже упоминавшееся мутагенное действие азотистой
кислоты HNO2 сводится к дезаминированию азотистых
оснований (см. стр. 246). В ДНК чаще всего дезаминируется Г, реже
всего А, в РНК не дезаминируется У [86]. Было подробно
изучено действие HN02 на ВТМ. РНК из ВТМ подвергалась деза-
минированию in vitro, затем химически измененной РНК
заражали растения. В ряде случаев получались новые мутантные
формы вирусов [81, 87—89]. В других случаях инфекционная
активность РНК утрачивалась. Для создания' мутантного ВТМ
оказывалось достаточным дезаминировать только 1 нуклеотад
из 6500. Варьируя условия экспериментов, удалось получать
любое нужное число дезаминированных оснований в одной
молекуле вирусной РНК.
В работах с нитритными мутантами ВТМ впервые
реализована давняя мечта биологов — осуществлено прямое,
сознательное и направленное воздействие на наследственные признаки.
ХИМИЧЕСКИЙ МУТАГЕНЕЗ
Точечные химические мутации
351
Таблица 27
Замещение аминокислоты
Число
случаев
Изменение кодона
Изменение
нуклеотида
Мутанты ВТМ, создаваемые HNOa
Тре
Илей
Про —>• Сер
Сер
Лей
Фен
Фен
Сер
Лей
Илей
А сп
Глу
Илей
Вал
Гли
Гли
Мет
Acn-NH2—>-Cep
Apr
Гли
Тре —>- Сер
8
ААЦ-
АУЦ-
АЦЦ-
ГЦЦ
УЦЦ-
ГЦЦ-
ЦЦЦ-
АЦЦ
УУЦ-
УЦЦ-
УГЦ
АГЦ
УУЦ-
УЦЦ-
АУУ
УУГ
(УУУ)
УЦЦ-
УУЦ-
УГЦ
АГЦ
АУУ-
ААУ
АУЦ
АГЦ-
АУГ —
ААЦ
ААГ —
АУГ —
ААЦ
ААУ-
АУУ
АУЦ
ААЦ-
АУЦ-
ААУ
ААГ —
УГЦ
гцц
ААЦ-
АУЦ-
АЦЦ
ААУ
АУУ
АУЦ
УУЦ
УГЦ
УЦЦ
АГЦ
УУУ
УУЦ
УУУ
УУЦ
УУЦ
(УУУ)
УЦЦ
АУУ
УУГ
УУГ
ГГЦ
УГГ
АГГ
АГГ
УГГ
ГГЦ
АУГ
-АГЦ
-УГЦ
УУЦ
УЦЦ
АГГ
УГГ
ГГЦ
■УГЦ
УГЦ
УЦЦ
ц
ц
ц
ц
ц
ц
ц
ц
ц
ц
ц
ц
А
А
А
А
А
А
А
А
У
У
У
У
У
У
У
У
У
У
У
У
Г
г
г
г
г
г
г
г
352
ГЛ. 7. СИНТЕЗ БЕЛКА
Продолжение табл. 27
Замещение аминокислоты
Число
случаев
Изменение к од он а
Изменение
нуклеотида
Асп
Ала
ААЦ
АГЦ
АУГ
Мутанты гемоглобина
-АГЦ
УГЦ
ГЦЦ
Лиз
Асп
Acn-NH2 —>• Лиз
Глу-ЫН2
Лиз
Вал
Гли
Вал
АГГ
АГГ
УГГ
ГГЦ
У
1
ХИМИЧЕСКИЙ МУТАГЕНЕЗ
Зс-3
Продолжение табл. 27
Замещение аминокислоты
Число
случаев
Изменение кодона
Изменение
нуклеотида
Гли
Асп
Гис
Гис
Тир
Apr
АГГ-
АГГ-
УГГ-
ГГЦ-
АУЦ
АЦЦ
АУЦ.
АЦЦ
АГЦ
АУГ
АУГ
АГЦ
ААЦ
АУУ
-АУЦ
-УГЦ
-ГЦЦ
АГГ
Г-
Г-
Г-
Г-
Ц
Ц
А
А
Ц
У
А
А
У
У
Г
г
ЦЦЦ
Несущественно, что речь идет о генетике столь примитивных
организмов (если это вообще организмы), как вирусы.
Принципиальная задача решена, и авторам фантастических романов,
желающим исходить, подобно Жюлю Верну, из реальных
достижений науки, открыты новые
возможности. Сейчас уже не подлежит сомнению,
что химическая генетика в недалеком
будущем приведет к полному перевороту
в сельском хозяйстве и медицине.
В самом деле, при нитритном
мутагенезе нам точно известны превращения
нуклеотидов. Как уже указывалось
(стр. 246), дезаминирование приводит к
переходам
А -
Ц-
Г —
ЦЦУ f УЦЦ
IXKI
ЦУУ I УУЦ
УУУ
Рис. 136. Превращения
кодонов в результате
дезаминирования.
Гк спаривается уже не с Т, а с Ц, У с А, а не с Г, К; как и Г
спаривается с Ц, но образует на одну водородную связь
меньше.
Виттман изучил 100 нитритных мутантов ВТМ и установил
соответствие полученных изменений с триплетным кодом [6, 90].
На рис. 136 показана схема превращений кодонов в
результате дезаминирования [87, 68]. В табл. 27 приведены результаты
воздействия HNO2 на РНК, выражающиеся в изменении
строения соответствующего белка. Эти результаты сопоставлены с
возможными изменениями кодонов. В той же таблице
приведены аналогичные данные для природных мутантов человеческого
Гк (гипоксантин)
У
К (ксантин)
23 М. В. Волькенштейн
354
ГЛ. 7. СИНТЕЗ БЕЛКА
гемоглобина. С кодом не согласуются только мутации ВТМ,
вызванные HN02, Тре->Мет. Мутанты гемоглобина получаются
путем замены одного нуклеотида. Характерно, что, в отличие
от этих природных мутаций, мутации, вызванные HN02, идут
только в одном направлении. Так, например, есть переход
Про-*Сер, но нет перехода Сер->Про.
Сильным мутагеном является диэтилсульфат (C2H5)2S04. Он
вызывает этилирование Г с его последующим удалением из
ДНК. Гидроксиламин NH2OH взаимодействует с Ц, создавая
соединение, имитирующее Т. И в этих случаях речь идет о
воздействии на отдельные основания. Фриз подробно изучил
влияние химических мутагенов на генетику фага Т4. Ряд
новейших данных о химическом мутагенезе см. в обзоре Фриза [91].
ПРОБЛЕМЫ РЕГУЛЯЦИИ
Итак, белки синтезируются по плану, закодированному в
ДНК, и при участии различных сортов РНК. Схема в общем
достаточно простая, несмотря на ряд нерешенных еще
вопросов. Но можно ли действительно утверждать, что вся проблема
синтеза белка и, следовательно, проблема поведения организма
на молекулярном уровне сводится к передаче информации
ДНК->РНК->белок? Нет, действительность гораздо сложнее.
Белок синтезируется не непрерывно, а тогда, когда это нужно
клетке—на определенных стадиях ее развития. Редупликация
ДНК происходит также не непрерывно, а лишь в интерфазе
митоза. При дифференциации клеток многоклеточного
организма специализируются их белки, специализируется вся
биохимия. Следовательно, синтез белков каким-то способом
регулируется в клетках. Тоже, очевидно, относится и к редупликации
ДНК.
Простейший способ регуляции действия любой машины —
обратная связь. Работа регулируемой системы зависит от
результатов этой работы. Живые системы прекрасно
отрегулированы. Одной из наиболее актуальных задач молекулярной
биологии и молекулярной биофизики является изучение
природы этой регуляции, нахождение молекулярных «контуров»
обратной связи. Решение этой задачи началось с исследования
индуцированного синтеза ферментов.
Известны три явления воздействия немутагенных веществ на
синтез белка. Это, во-первых, синтез антител под действием
чужеродных биополимеров — антигенов, лежащий в основе
иммунитета, во-вторых — индукция синтеза ферментов, в-третьих —
подавление, репрессия такого синтеза некоторыми веществами.
Об иммунитете, антителах и антигенах говорится в следующей
ПРОБЛЕМЫ РЕГУЛЯЦИИ 355
главе. Здесь мы остановимся на тесно связанных друг с другом
явлениях индукции и репрессии синтеза ферментов.
О природе ферментативной активности также рассказано в
следующей главе. Забегая вперед, укажем, что данный фермент
катализирует некоторую химическую реакцию. Вступающее в
реакцию вещество (или вещества) называется субстратом,
получающиеся в результате реакции вещества — продуктами
ферментативной реакции. Явление индукции заключается в том,
что клетки, не синтезирующие некий фермент, начинают
производить его под влиянием специфического химического
соединения, которое' почти всегда оказывается субстратом данного
фермента или сходным с таким субстратом веществом. Явление
репрессии состоит в подавлении синтеза фермента
специфическим химическим соединением, представляющим собой продукт
реакции, катализируемой этим ферментом, или аналог продукта.
Индуцированный си^ез ферментов хорошо изучен у ряда
бактерий, в частности у Е. coli. Эти клетки способны
вырабатывать фермент р-галактозидазу (р-Гал), катализирующий
гидролиз р-Д-галактозидов, т. е. реакцию
СН2ОН СН2ОН
ОН А °\ O-R ОН /С °
I/ H \l +no£ri/ н
i\ °н V /\ i\ он
н \i \/ н н \
н он
Бактерии Е. coli дикого типа, растущие в среде из
неорганических солей с негалактозидным источником углерода — с
янтарной кислотой, — почти не синтезируют р-Гал. Добавление
подходящего галактозида к растущей культуре увеличивает
скорость синтеза этого фермента в 1000 раз. Большая скорость
синтеза р-Гал сохраняется до тех пор, пока в питательной среде
имеется индуктор — галактозид или сходное соединение. При
удалении индуктора, т. е. при переносе растущих клеток в новую
среду, не содержащую индуктора, скорость синтеза падает до
исходного значения. Эта ситуация иллюстрируется рис. 137, на
котором представлена зависимость дифференциальной
интенсивности синтеза Р, определяемой как отношение прироста
количества фермента Аг к общему приросту клеточной массы AM:
п_ А*
23*
356
ГЛ. 7. СИНТЕЗ БЕЛКА
от общего количества белка бактерий [92, 93]. Стимуляция
синтеза р-Гал происходит очень быстро, Р увеличивается в
1000 раз менее чем за 2 минуты после введения индуктора.
Ферменты, получаемые при индуцированном синтезе,
называют индуцированными. Термин этот неточен — речь идет не
о каком-то особом ферменте, но об особом синтезе.
Наряду с дикими, индуцируемыми клетками существуют му-
тантные штаммы £. coli, синтезирующие р-Гал в отсутствие
индуктора. В этом случае говорят о конститутивном ферменте
или (что точнее) о конститутивном
мутанте.
Первый вопрос, возникающий при
изучении индуцированного синтеза,
состоит в следующем: действует ли
индуктор на некоторые белковые
предшественники р-Гал, активируя их
каким-то образом, или белок синтези-'
руется заново — de novo, если
пользоваться традиционной биологической
латынью?
Ответ на этот вопрос был получен
с помощью меченых атомов. Мы уже
не первый раз встречаемся с
исключительными возможностями, которые
открылись для биологии благодаря
искусственной радиоактивности, мир-
Рис. 137. Индуцированный ным применениям атомной энергии,
синтез фермента. в опытах Ходжнесса бактерии
£". coli выращивались на среде,
содержащей S35 в виде сульфата. В клетках синтезировались меченые,
радиоактивные белки. Затем такие клетки переносились в среду,
содержавшую немеченый сульфат и индуктор — метил-р-/)-тио-
галактозид (тио — сера, в этом соединении она замещает
кислород в пиранозном кольце галактозида). Клетки росли и
синтезировали р-Гал. Оказывается, что меченая сера в р-Гал не
содержится. Следовательно, индуцированная р-Гал не имеет
белковых предшественников. Одновременно этот результат
показывает, что другие белки, синтезированные на первом этапе опыта
в отсутствие индуктора и содержащие S35, не распадаются вновь
на аминокислоты, которые могли бы быть включены в р-Гал на
втором этапе. Синтез белка, в том числе и р-Гал, является
существенно необратимым процессом. Аналогичные результаты
были получены и с помощью С14.
Таким образом, индуцированный синтез происходит de novo
из аминокислот. Считая, что синтез белка всегда определен ге-
ПРОБЛЕМЫ РЕГУЛЯЦИИ
357
нетически и происходит с непременным участием ДНК и РНК,
мы должны прийти к заключению о влиянии индуктора именно
на генетическую систему клетки, нг нуклеиновые кислоты, Жа-
коб и Моно провели генетический анализ индуцированного
синтеза, исходя из весьма стройной и изящной гипотезы, которая
подтвердилась фактами и тем самым превратилась в научную
теорию [94, 95].
Гипотеза состоит в том, что индуцированный синтез
угнетается специфическим соединением, находящимся в цитоплазме.
Это соединение можно назвать репрессором, т. е. подавителем
синтеза. Репрессор синтезируется под контролем особого «гена-
регулятора», отличного от обычных «структурных» генов,
ответственных за первичную структуру соответствующих ферментов.
Кроме того, в клетке имеется «ген-оператор», управляющий
переносом информации сразу от нескольких структурных генов
к нескольким белкам. Оператор способен взаимодействовать с
репрессором. Это взаимодействие подавляет работу оператора,
и синтез белков прекращается. Действие индуктора
(метаболита) состоит в химическом влиянии на репрессор, в результате
которого репрессор уже не блокирует оператор.
Эта гипотеза объясняет наряду с явлением индукции и
явление репрессии синтеза фермента. Репрессирующий метаболит
(продукт или аналог продукта ферментативной реакции)
должен в этом случае активировать взаимодействие репрессора и
оператора- Описанная модель представлена схематически на
рис. 138. Модель является на первый взгляд сугубо
умозрительной и абстрактной. Однако она позволяет сформулировать ряд
выводов, допускающих экспериментальную проверку.
Если гены регулятор и оператор действительно существуют,
то они должны быть способны к мутированию.
Рассмотрим сначала такие мутанты Е. colt, которые
доказывают наличие гена-регулятора. У дикого типа Е. coli можно
вызвать индукцию, обозначим его R+* Соответственно
обнаружен мутант #~, вырабатывающий р-Гал конститутивно —
очевидно, что в нем регулирующее устройство утрачено, т. е.
репрессор отсутствует. Если это верно, то диплоидные гетерозиготы
R+/R~ должны быть индуцируемыми, а не конститутивными —
репрессор, как вещество, поступающее в цитоплазму, должен
влиять и на ген-оператор хромосомы R~. В этом смысле аллель
R+ доминантен. Так оно и есть.
Дополнительным подтверждением является существование
мутантов Rf, свойства которых зависят от температуры. При
низкой температуре репрессия активна и система работает
подобно R+ — является индуцируемой. При высокой температуре
репрессор инактивируется, и система подобна конститутивному
358
ГЛ. 7. СИНТЕЗ БЕЛКА
мутанту R-. То обстоятельство, что введенный метаболит —
индуктор реагирует с репрессором в цитоплазме, доказывается
существованием «суперрепрессирован-ного» аллеля Rs. Мутанты
Rs неспособны синтезировать (J-Гал даже в присутствии
индуктора. Гетерозигота Rs/R+ подобна Rs, т. е. в этом случае
доминантой является не наличие некоторой функции, а ее утрата.
Свойства Rs, очевидно, могут быть объяснены тем, что в этом
Оперон
^
Ген-регулятор О СП Щ
Опруктурные гены
L- Rep +Jnd 5=: Rep Ind —*J \ ' \
/ WWW WWW
Рибосомы y^ * |
"WOW OOTOW
Белок-1 Белок-2
Аминокислоты
Рис. 138. Схема действия оперона — системы гена-регулятора»
гена-оператора и структурных генов.
случае ген-регулятор контролирует -выработку репрессора с
пониженным химическим сродством к индуктору.
Взаимодействие репрессора с индуктором может быть
записано в форме
Rep + Ind <=± Rep • Ind,
т. е. отвечает обратимой ассоциации в комплексе Rep • Ind.
В индуцируемой системе Rep активен и препятствует синтезу
фермента, а комплекс Rep • Ind в этом смысле неактивен.
Напротив, в репрессируемой системе репрессор и индуктор как бы
меняются местами — вещество, вырабатываемое под контролем
гена-регулятора, неактивно, но комплекс Rep • Ind. активен и
блокирует синтез фермента.
Действительно, недавно был открыт «обращенный» мутант
Я. coli Rr. Этот мутант частично конститутивен, но добавление
галактозидов, являющихся индукторами для дикого типа R+.
ПРОБЛЕМЫ РЕГУЛЯЦИИ
359
вызывает у Rr понижение продукции р-Гал, т. е. вызывает
репрессию. Таким образом, мутация гена-регулятора может
превратить индуцируемую систему в репрессируемую.
Таблица 28 [95]
Мутации гена-регулятора синтеза Р-галактозидазы у Е. colt
и гена-регулятора фага Л
Аллель
Продукт
Свойства мутанта
Умеренный фаг К
R
R
&
R1
R*
Репрессор дикого
типа
Неактивный реп-
рессор
Индуцируем
специфическими
индукторами (р-галак-
тозиды)
Суперрепрессор,
не подавляемый
индуктором
Система
репрессии
чувствительна к
температуре
Обращенная
система
Конститутивный.
Гетерозигота
R+/R~
индуцируема
Неспособен
производить фермент
даже в
присутствии индуктора.
Rs/R+ и Rs/R-
также не
производят фермент
Индуцируем при
низкой температуре,
конститутивен при
высокой
Частично
конститутивен.
Репрессируем р-га лактоз и-
дами
Способен к лизогении. Ли-
зогенная система
индуцируема для продукции
фага освещением
ультрафиолетовым светом и
химическими
воздействиями
Неспособен к лизогении.
При смешанной
инфекции с /?+ получается
лизогенная система
R+/R-
Способен к лизогении.
Лизогенная система
неиндуцируем а. Системы
RS/R+>RS/R~
аналогичны Rs
Способен к лизогении при
низкой температуре, но
не при высокой. Лизо-
генные системы,
выросшие при низкой
температуре, производят фаг
при нагревании
. Изложенные факты суммированы в табл. 28.
В последнем столбце таблицы приведены свойства лизоген-
ных систем (см. стр. 68), образованных при заражении клеток
Е. coli фагом X. ДНК фага включается в генетическую систему
клетки-хозяина; которая при лизогении спокойно размножается,
пока не подвергнется действию индуктора. При этом в клетке
начинает синтезироваться фаг и клетка гибнет. Таблица
360
ГЛ. 7. СИНТЕЗ БЕЛКА
показывает, что превращение профага в фаг подчиняется тем же
закономерностям, что и синтез р-Гал, т. е. управляется геном-
регулятором. Удивляться этому >не приходится — ведь
размножение фага также связано с синтезом белка.
Ген-оператор мутирует в свою очередь. Мутант 0°
неспособен синтезировать ни р-Гал, ии второй фермент,
обеспечивающий проникновение галактозида в клетку — р-галактозид пер-
меазу. Мутант О— конститутивен, мутант 0+ — нормальный
индуцируемый. Гетерозиготы 0+/Ос конститутивно синтезируют оба
белка, то же относится к 0°/Ос. Следовательно, действие гена-
оператора производится не через продукт, поступающий в
цитоплазму, а непосредственно в хромосоме. Ген-оператор
контролирует работу примыкающих к нему структурных генов. Вся
эта система называется опероном (рис. 138). Опытами по
скрещиванию бактерий доказано, что ген-регулятор
пространственно и структурно независим от оперона; они расположены
достаточно далеко друг от друга.
Аналогичные явления обнаружены не только у Е. coli, но и
у других видов бактерий, например у Salmonella. Здесь для
синтеза гистидина нужно 8 ферментов. Структурные гены,
контролирующие их производство, входят в состав одного оперона.
Опыт подтвердил ряд предсказаний теории Жакоба и Моно.
Оказалось, в частности, что отделение структурных генов от
гена-оператора в результате хромосомных перестроек может
вывести эти гены из-под контроля исходного оператора и
связать их с другим опероном — либо с примыкающим к исходному
(в случае делеции), либо с отделенным от него (в случае
транслокации). Из изложенного следует, что ген-оператор определяет
место, с которого начинается чтение генетического текста ДНК,
т. е. то место, в котором может начаться действие фермента —
полимеразы РНК, катализирующей образование М-РНК
на ДНК.
Что же представляет собой репрессор, синтезируемый под
контролем гена-регулятора? Вещество это пока не удалось
выделить, но ряд свойств индуцируемых систем заставляет
Жакоба и Моно считать репрессор белком. Репрессор, подобно
ферменту, взаимодействует с низкомолекулярным метаболитом —
индуктором.
Таким образом, действие генетической системы хромосомы
регулируется через посредство цитоплазмы — через репрессор.
Известны и более сложные системы регуляции. Для синтеза
некоторого метаболита необходим ряд химических реакций,
каждая из которых катализируется определенным ферментом.
Конечный продукт всей цепи реакций блокирует действие
фермента, катализирующего первую реакцию цепи, «есмотря на то,
ПРОБЛЕМЫ РЕГУЛЯЦИИ
361
что этот продукт не имеет ничего общего с субстратом или
продуктом первой реакции. О природе этого замечательного
явления, именуемого аллостеризмом, рассказано в следующей
главе (стр. 404). Ясно, что здесь реализуется обратная связь в
истинном смысле этого слова.
Синтез белка регулируется при помощи цитоплазмы. В
отличие от кибернетических машин, в которых регуляция
осуществляется посредством электромагнитных взаимодействий, в
клетке регуляция производится
химически. Здесь, по-видимому, важнейшую
роль играют структурные соответствия
взаимодействующих молекул (см. гл. 8).
До сих пор мы говорили о регуляции
синтеза белка. На молекулярном уровне
регулируется, по-видимому, синтез М-
РНК. Но регуляции подлежит и
редупликация ДНК, редупликация хромосом.
Ведь эти процессы также протекают
согласованно с развитием клетки. рис. 13д. Схема репли-
Жакоб и Моно [95] (см. также [96]) кона.
выдвинули гипотезу, согласно которой
редупликация ДНК должна быть инициирована неким
веществом белковой природы. Генетический элемент — хромосома
или эписома — редуплицируется как целое после такого
инициирования. Они называют такой элемент репликоном-
Существенно то, что, в отличие от оперона, репликон начинает работать
под действием активатора-инициатора, а не под действием
индуктора, влияющего на репрессор. На рис. 139 показана схема
репликона. Циклическая хромосома — ДНК бактерии или
фаг£ — содержит структурный ген, ответственный за синтез
белка — активатора, действующего на ген-репликатор. Вероятно,
при этом происходит разрыв кольца, и хромосома
реплицируется далее как целое.
Гипотеза репликона приводит к ряду генетических выводов
о природе мутантов структурного гена и гена-репликатора. Эти
выводы подтвердились экспериментом [97]. Ряд данных, в том
числе результаты прямых исследований методом электронной
микроскопии, показывают, что при делении бактериальных
клеток инициатор связан с клеточной мембраной. Деление клеток
происходит по схеме: сигнал для редупликации хромосом —
рост поверхности клеток — сигнал для редупликации хромосом.
На рис. 140 такая схема показана наглядно.
Конъюгация бактерий (стр. 88) также происходит в
результате направленной редупликации генетического материала
(рис. 141),
362
ГЛ. 7. СИНТЕЗ БЕЛКА
Система управления синтезом белка в клетке ответственна
за развитие клетки и дифференциацию клеток в
многоклеточных организмах. Различные гены срабатывают не
одновременно. Хесин [98] исследовал закономерности синтеза и регуляции
специфических М-РНК в клетках Е. coli В, инфицированных
Хромосома
Рис. 140. Схема редупликации репликонов и деления клетки.
фагом Т2. Выяснилось, что сначала синтезируются молекулы
М-РНК, определяющие синтез ферментов, образующихся в
начале инфекции, а затем — молекулы М-РНК, от которых зависит
синтез так называемых вирусных антигенов. «Ранние» и
«поздние» М-РНК синтезируются на разных участках ДНК фага.
V//////////
Система репликации,
прикрепленная к стенке
Hfr
Рис. 141. Схема редупликации ДНК при конъюгации бактерий.
Регуляция синтеза М-РНК, подавление одних генов и
активация других согласованы с редупликацией фаговой ДНК и
зависят от образования белков. Вначале «заблокированы» гены
ДНК, ответственные за синтез «поздних» М-РНК.
Недавно получены данные, указывающие на то, что гисто-
ны — белки хромосом высших организмов (см. стр. 413) —
влияют на скорость синтеза РНК, Это означает, что регуляция
синтеза может осуществляться через посредство гистонов —
включение и выключение синтеза происходят в разное время в
разных локусах хромосом [99, 100].
По оценке Алфрея и Мирского [99] в лимфоцитах тимуса
теленка генетически активно, т. е. синтезирует М-РНК, 15—20%
ПРОБЛЕМЫ РЕГУЛЯЦИИ ' , 363
ДНК. Добавление гистонов тимуса к суспензии изолированных
ядер тимуса ингибирует синтез РНК; напротив, селективное
удаление гистонов ускоряет этот синтез. Добавление гистонов
к изолированным хромосомам типа «ламповых щеток»
вызывает сокращение петель и уменьшение синтеза РНК.
Таким образом, регуляционные процессы, видимо,
ответственные за дифференциацию клеток, состоят в блокировании
или деблокировании части генетической информации.
Важную роль здесь играют гистоны — белковые компоненты
хромосом.
Решение проблемы регуляции позволит перейти к клеточному
и организменному уровням структуры — к вопросам
дифференциации клеток [101]. В человеческом теле содержится
примерно 1015 клеток, принадлежащих к 102 разным типам. Каждая
соматическая клетка содержит весь набор генов, аналогичный
существовавшему в исходной зиготе. Однако в любой
специализированной клетке действует только малая часть всей запасен*
ной генетической информации — остальные гены, очевидно,
заблокированы. Недавно получены прямые доказательства этого
принципиально важного положения.
В клетках слюнных желез двукрылых насекомых (в
частности, дрозофилы) содержатся гигантские хромосомы —
многократно увеличенные копии хромосом других клеток.
Неоднородное распределение генетического материала отчетливо видно в
таких хромосомах под обычным микроскопом (рис. 24, стр. 77).
Здесь гены непосредственно наблюдаемы. На хромосомах
видны вздутия, или пуффы. Оказалось, что именно в этих местах на
определенной стадии развития происходит усиленный синтез
РНК — пуффы представляют собой активные гены [102], в
отличие от остальных участков хромосом. Удалось также
установить, что структурно различные участки так называемых
хромосом типа «ламповых щеток», возникающих в созревающих
яйцеклетках амфибий [103], петли и гранулы соответствуют
генам различной активности [99, 101, 104].
В связи с изложенным следует рассказать об интересных
опытах, проделанных с морковью [105, 106]. Из тонких срезов
нерастущей области корнеплода моркови вырезались маленькие
цилиндрические образцы в 1—2 мг. Они помещались в
питательную среду, например, в кокосовое молоко, в которое
добавлялись стимуляторы роста, в частности аденин, и подавался
воздух. Ткань моркови начинала быстро расти — за 20 дней ее вес
возрастал в 80 раз! Однако рост происходил
недифференцированно— размножались круглые бесцветные клетки. Они
разделялись. Затем отдельная клетка помещалась вновь в
питательную среду и развивалась самостоятельно. В этих условиях,
364
ГЛ. 7. СИНТЕЗ БЕЛКА
в ряде случаев клетка вела себя подобно зиготе: из нее
развивалось целое растение с корнями и листьями!
Таким образом, было показано, что в определенных
условиях в специализированной клетке ткани растения срабатывает
большой объем генетической информации. Очевидно, произошла
разблокировка генов. Вероятно, мы имеем дело со сходными
явлениями при разведении картофеля глазками, бегонии —
листьями и т. д.- Ясно, что эти опыты обещают важные для
практики результаты.
Проблема дифференциации клеток — одна из основных в
современной биологии. Ее подробное рассмотрение выходит за
рамки этой книги. Отметим только, что для дифференциации
несомненно существенна неэквивалентность пространственного
и, следовательно, химического состояния клеток растущего
зародыша. К проблеме дифференциации примыкает проблема
рака — злокачественных новообразований. Для раковых клеток
характерно именно отсутствие дифференциации. Если бы
удалось каким-то способом блокировать часть генетических систем
этих клеток, они должны были бы утратить свою
злокачественность (см. некоторые подробности в неоднократно цитированной
книге Бреслера [107], а также монографию Медведева [108]).
Исследования регуляции и дифференциации, очевидно,
более «биологичны», чем исследования выделенных
биополимеров и даже матричного синтеза белка. Регуляция
осуществляется в целостной живой клетке, и пока не найдены возможности
ее моделировать в упрощенной системе. Это, однако, никоим
образом не означает существования какой-либо границы для
молекулярной биофизики. Напротив, успехи в понимании регу-
ляторных процессов убедительно доказывают, что и целостные
биологические системы доступны физико-химическому
исследованию. Тем самым идеи, связанные с применением принципа
дополнительности в биологии (стр. 13) опровергаются
фактами.
ГЛАВА 8
БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ
И СТРОЕНИЕ МОЛЕКУЛ
ИММУНИТЕТ
В этой и следующей главе рассматривается работа белков—
способ выполнения ими весьма специальных задач,
возложенных на них природой. Задачи эти очень разнообразны, они уже
перечислялись в начале книги (стр. 27). Мы остановимся на
некоторых важнейших функциях белков, отнюдь не
рассчитывая исчерпать этим всю проблему. Начнем с иммунологической,
защитной функции.
С незапамятных времен известно, что однажды переболев
заразной болезнью, люди и животные в ряде случаев
становятся невосприимчивыми к повторной инфекции. Замечательные
успехи бактериологии, с такой яркостью описанные в книгах
Поля Де-Крюи, связаны, с одной стороны, с нахождением
химических средств борьбы с патогенными микроорганизмами
(сальварсан, сульфамиды, антибиотики), с другой — с
нахождением сывороток и вакцин, введение которых в организм
создает иммунитет к тем или иным заболеваниям. Миллионы
человеческих жизней были спасены в результате трудов Пастера,
Коха, Мечникова, Хавкина и других ученых, чья работа была
поистине героической. Здесь наука подошла к грани между
жизнью и смертью — нельзя поэтому без волнения читать не
только художественные произведения, посвященные врачам-
бактериологам, но и их специальные научные исследования. Мы,
однако, не будем здесь рассказывать бесконечно увлекательную
историю борьбы науки за здоровье человека.
При попадании в организм чужеродных белков или
некоторых других полимерных соединений, вызывающих заболевание,
в качестве ответной реакции организма в нем начинают
вырабатываться специфические белки, препятствующие действию
патогенных соединений. Чужеродные вещества, о которых идет
речь, именуются антигенами (к понятию гена этот термин
отношения не имеет), а «ответные» белки — антителами.
Антигены вносятся в организм вирусами, бактериями и другими
одноклеточными существами. Антитела производятся
кроветворными органами: лимфатическими узлами, селезенкой,
костным мозгом и поступают в кровь и лимфу. Они относятся
366 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
к глобулярным белкам, к группе так называемых
гамма-глобулинов (многие знают, что гамма-глобулин вводится ребенку,
бывшему в контакте с другим, заболевшим корью, чтобы
предупредить или облегчить болезнь). Молекулярные веса
антител велики. Так у человека, у кролика и ряда других видов
антитела имеют М порядка 160000, у лошади, свиньи и т. д.
антипневмококковые антитела имеют М порядка 900000.
Взаимодействие антител с антигеном может выразиться в
целом ряде явлений [1]: а) антитела к токсинам могут
нейтрализовать токсичность антигена, антитела к вирусам —
нейтрализовать инфективность антигена; б) антитела к растворимым
белкам и другим растворимым антигенам могут образовывать
с ними нерастворимые осадки (реакция преципитации); в)
антитела к микроорганизмам или чужеродным эритроцитам могут
вызывать их склеивание друг с другом и выпадение в осадок —
аглютинацию; г) антитела к чужеродным клеткам могут
вызывать их распад — лизис. Для его осуществления требуется
участие и других компонент плазмы крови, называемых в целом
комплементом; д) антитела вызывают набухание оболочек,
капсул ряда микроорганизмов; е) взаимодействие антител с
чужеродными клетками делает эти последние более поддающимися
фагоцитозу — атаке на них лейкоцитов; ж) фиксация
комплемента, т. е. его адсорбция на комплексе антиген — антитело при
их реакции может служить критерием наличия такой реакции —
на этом, например, основана реакция Вассермана, применяемая
для обнаружения сифилиса; з) реакция антиген — антитело
может повлечь за собой освобождение гистаминов и других
токсических веществ из тканей хозяина, что приводит к болезненным
последствиям — анафилаксии и аллергии. Примеры
аллергических заболеваний, вызываемых чужеродными биополимерами,
общеизвестны — сенная лихорадка, детский диатез, астма и т. д.
От аллергии страдают люди, вынужденные отказываться от
земляники, крабов, яиц и других продуктов, вызывающих уэтих
людей острые болезненные явления.
Если ввести антиген в организм кролика, то выработка
антител, специфичных для данного антигена, происходит через
несколько дней. То, что именуется кризисом при заболевании,
зачастую означает появление большого количества антител в
крови. Антитела быстро удаляют антигены, но их содержание
также через (некоторое время уменьшается. Если, однако,
ввести новую порцию антигена тому же кролику, то дня через
три вновь образуются антитела, концентрация которых
достигает высокого уровня, медленно убывает, но надолго остается
заметной. Это — вторичная реакция на антиген, образование
прочного иммунитета. Оспу приходится прививать в течение
ИММУНИТЕТ
367
жизни неоднократно, но желтая лихорадка, например, дает
иммунитет практически на всю жизнь. Вторичное заболевание
инфекционной болезнью, будь то корь, скарлатина или
полиомиелит— событие, к счастью, весьма редкое. Таким образом,
иммунность организма означает наличие у него определенной
памяти об антигенах, выражаемой в способности непрерывно
синтезировать антитела.
Организм новорожденного кролика неспособен
вырабатывать антитела, более того, если ввести в него большое
количество антигена и он, паче чаяния, выживет, то и во взрослом
состоянии этот кролик не будет производить в своих
кроветворных органах антитела к исходному антигену. Это
интересное явление называется иммунной толерантностью.
Образованию антител препятствует рентгеновское облучение. Если ввести
большое количество антигена после облучения, то
неспособность производить антитела сохраняется и после уничтожения
других эффектов облучения. Напротив, если антиген введен до
облучения, то оно не мешает образованию антител. Если
кролик получил первую порцию антигена за несколько дней до
облучения, то оно не блокирует вторичную реакцию.
Очень важный для человека пример взаимодействия
антиген— антитело связан с группами крови, открытыми Ландштей-
нером в 1900 г. При переливании крови у людей без учета групп
крови могут возникать тяжелые патологические последствия.
Это объясняется агглютинацией эритроцитов антителами,
присутствующими в плазме крови. Существуют четыре основные
группы крови, обозначаемые О, А, В и АВ и различающиеся
между собой присутствием антигенов (агглютиногенов) А и В
в эритроцитах и антител (агглютининов) а и b в плазме: а
агглютинирует A, b агглютинирует В. Поэтому нельзя смешивать
кровь группы А с кровью группы В. В табл. 29 показаны
основные соотношения [2] для групп крови.
Таблица 29
Группы крови человека
Группа
крови
О
А
В
АВ
Примерный
процент людей
(США)
45
42
10
3
Агглютиногены
в эритроцитах
А
В
А и В
Агглютинины
в плазме
а и b
b
а
Группы,
которым можно
перелить
кровь
О, А, В, АВ
A, АВ
B, АВ
АВ
Группы, от
которых может
быть перелита
кровь
О
О, А
О, В
О, А, В, АВ
На рис. 142 [1] показаны возможности переливания крови.
Люди с кровью О являются универсальными донорами, с
368 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
кровью АВ — универсальными реципиентами. Реакции типа
А + а->Аа применяются в судебной медицине для определения
групп крови. Эти реакции настолько чувствительны, что с их
помощью удалось определить группы крови давно умерших,
мумифицированных людей из Древнего Египта, Мексики и Перу.
Кровь этих наших предков оказалась такой же, как
современная. Расы людей разнятся
частотой разных групп крови, но не
характеризуются какой-либо одной
группой.
Группы крови являются
наследственными, генетически
определенными признаками, подчиняющимися
Q законам Менделя [3]. Оно и
понятно, ведь речь идет о специфических
белках эритроцитов и плазмы,
строение которых определено
генетически. В дальнейшем было
установлено, что существуют два типа
антигена А — Ai и А2, имеющих
значение для судебной медицины и
Рис. 142. Соотношения групп антропологии, но не для перелива-
крови* ния крови. То же относится к
антигенам М, N и S.
В 1940 г. Ландштейнер и Винер открыли еще один важный
агглютиноген крови — резус-фактор (Rh), впервые
обнаруженный у обезьяны резуса (Macacus rhesus), Его наличие может
привести к гибели ребенка во чреве матери, вследствие
взаимодействия антиген-антитело. У 85% людей белой расы кровь
содержит Rh-антиген, является Rh-положительной. Если у
женщины кровь Rh-отрицательна, а отец ребенка Rh-положителен,
то ребенок может унаследовать от отца Rh-антиген. Если кровь
плода проникла в русло крови матери, то в последней
возникают антитела к Rh-антигену. При вторичной беременности
взаимодействие антитела с антигеном приведет к агглютинации
эритроцитов плода, и он погибнет от так называемого феталь-
ного эритробластоза до рождения или вскоре после рождения.
Во втором случае ребенка удается иногда спасти массивным
переливанием крови. Наилучший способ избежать этого
несчастья состоит, однако, в учете состава крови при вступлении
в брак. Вероятность опасного сочетания c/'Rh ( + ) X $Rh (—), к
счастью, невелика, она составляет 3%, всех браков, а
вероятность трагических последствий не превышает 0,25%.
Дальнейшие подробности, относящиеся к биологии и медицине
иммунитета, см. в книге Зильбера [4].
ИММУНИТЕТ
369
Две группы вопросов возникают в связи с описанными
явлениями. Во-первых — как происходит выработка антител и чем
объясняются явления памяти? Во-вторых — какова природа
взаимодействия антиген — антитело? Первая группа вопросов —
биологическая в истинном смысле этого слова, но и здесь ряд
важных положений установлен молекулярной биологией.
Вторая группа — физико-химические проблемы. С нее мы и начнем.
Антитела производятся только in vivo, но их
взаимодействие с антигенами может изучаться и in vitro. Благодаря
этому иммунохимия стала областью точного
физико-химического исследования. Если >налить в пробирку сыворотку крови
иммунизированного организма и добавить в нее
соответствующий антиген, то реакции преципитации или агглютинации
наблюдаются непосредственно. Удобно следить за появлением
осадка — мутной зоны — в агаровом геле при диффузии
растворов антигена и антител навстречу друг другу. Короче
говоря, антитела можно просто титровать. Это открывает
прекрасные возможности для количественного изучения
иммунологических реакций.
Важнейшее свойство антител — их высокая специфичность.
Иммунитет к данному заболеванию не снижает
восприимчивости к любой другой инфекции. Поэтому, если едешь в
тропические страны, то приходится делать много разных прививок.
Специфичность антител высока, но не абсолютна: человек,
болевший переносимым блохами сравнительно легким тифом,
вызываемым Rickettsia mooseri, оказывается иммунным к
сыпному тифу, переносимому вшами и вызываемому другим
микроорганизмом— Rickettsia prowaceki [1].
С чем же связана специфичность антител? Как она
определяется их молекулярной структурой? Ответы на эти вопросы
удалось получить в результате работ Ландштейнера ,{5]. В 1919г.
он нашел замечательный способ создания искусственных,
синтетических антигенов. Его метод основан на способности диазо-
тированных ароматических аминосоединений соединяться с
белками в слабощелочных растворах.
Схема реакции Ландштейнера следующая;
НО—^ ^>—СН2—СН щелочь "*■
NH
НО—/ >—GH,—СН
r_/ \-N=N CO
24 М. В. Волькеиштейн
370 ГЛ- 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
R-фенилазосоединение, взаимодействуя с аминокислотными
остатками белка, прежде всего с тирозилом, вводит в белок в
принципе любой радикал R. Получается R-фенилазобелок,
который может быть применен в качестве искусственного
антигена. Измененные таким способом (а также другими путями)
белки действительно вызывают образование антител и
специфические иммунологические реакции (эти реакции называют
еще серологическими от латинского serum — сыворотка).
Таким образом, задолго до создания современной
молекулярной биологии были уже сделаны работы, в которых
изменение жизнедеятельности организмов — в данном случае
образования антител — вызывались искусственным химическим
воздействием.
Сопоставление иммунологических свойств прицепленных к
белкам радикалов R и самих белков показало, что
определяющее влияние на антигенную специфичность оказывает радикал,
а роль белка — второстепенная. Это было доказано
перекрестными реакциями: антисыворотка, полученная под воздействием
антигена типа R—^ у—N=N— Белок 1, реагирует с любыми
другими антигенами, содержащими R, но другие белки-носители,
серологически весьма отличные друг от друга, но не реагирует
с антигеном R'—<^ у—N=N—Белок 1, содержащим другой
радикал R'. Следовательно, R — является детермичантной
группой. R-фенилазобелок дает с соответствующим антителом
труднорастворимый осадок. Если добавлять к системе R-антиген —
R-антитело малые молекулы, содержащие ту же детерминант-
ную группу, тот же радикал, например,
R
~<3>~N=N~0/~R#
то реакция преципитации тормозится, а при дальнейшем
повышении концентрации низкомолекулярного соединения
прекращается вовсе. Малые молекулы указанного типа не создают у
подопытного животного антител и, следовательно, не являются
антигенами. Однако они взаимодействуют с ранее созданными
антителами, образуя растворимые соединения. Это — так
называемое гаптеновое действие, а указанные малые молекулы
называются гаптенами. Гаптены, очевидно, конкурируют с
антигенами и, следовательно, взаимодействуют с теми же
реактивными областями антител. Эти реакции имеют характер
обычных химических реакций и подчиняются закону действия масс.
Таким образом, антиген содержит детерминантную группу и
высокомолекулярный носитель, гаптен — только детерминант-
ИММУНИТЕТ
371
ную группу. При постепенном разрушении белковой
компоненты антигена его действие сначала сохраняется, затем
заменяется гаптеновым.
Исследование иммунохимических реакций показывает, что
природные антигены содержат ряд детерминантных групп и
являются в этом смысле поливалентными. Группы могут быть различны,
поэтому при иммунизации они могут вызвать образование ряда
различных антител. Пользуясь искусственными частичными
антигенами, можно селективно отделить разные антитела друг от друга.
В иммунохимических реакциях определяющую роль играют
пространственное строение и протяженность детерминантной
группы. Искусственный антиген типа
Rr-CO^
\\~ N=N — Белок (I)
r2_Co/
где R, есть — NH—CH2—COOH, т. е. Гли, a R2 —
—NH—СН —СООН
СН2—СН (СНзЬ
т. е. Лей, вызывает образование двух типов антител: к антигену
Rx—СО,
\_N=N — Белок (II)
N=N — Белок (III)
и к антигену
r2_Co/
но не к I как целому. Это показывает, что размеры
детерминантных групп и адекватных им реактивных участков антител
сравнительно невелики [6].
Наличие специальных реактивных групп в антителах
непосредственно доказывается красивыми опытами Прессмана и
Штернберга [7]. Кролик иммунизировался искусственными
антигенами, содержащими остатки я-азобензойной и я-азофенил-
арсиновой кислоты в качестве детерминантных групп
НООС—<" V-N=N — Белок
H203As—<f~4—N=N —Белок
Полученные антитела подвергались йодированию, этим
полиостью подавлялась их иммунологическая активность. Однако
если йодирование производилось в присутствии гаптенов, то
24*
372 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Гаптен
Иммунологически
неактивно
оно не нарушало серологической активности. Это означает, что
введение йода в реактивную область антитела уничтожает ее
действие, а гаптен защищает реактивную область от йода.
Сказанное иллюстрируется схемой рис. 143. Очевидно, что между
реактивной областью антитела, с одной стороны, и гаптеном
или детерминантной
группой — с другой, имеется
структурное соответствие —
они подходят друг к другу
как ключ к замку.
Становится понятным и гаптено-
вое действие — гаптен,
замещая детерминантную
группу антигена, играет
роль «собаки на сене», и
«ключ» антигена уже не мо-
& AT-J Зр >-« АТ-Г »-< жет войти в «замок» анти-
^^ jg^ ^———^ тела.
Ситуация в этом смысле
такая же, как если бы
баловавшиеся дети засунули в
отверстие замка
пластилин — для того чтобы
открыть замок, нужно
удалить гаптеновую группу.
Степень иммуноспецифич-
ности весьма высока. Ее
можно иллюстрировать табл. 30.
Здесь 0 — отсутствие осадка;
+, +++, ++++ — возрастающие
его количества.
Если детерминантная
группа (будем ее называть
гаптеном) куриной сыворотки лишена кислотной группы —
взаимодействия нет. Оно наблюдается лишь, если кислотная группа
находится в мета-положении. Хлор и метильная группа на
взаимодействие почти не влияют. Замена СОО~ группы на БОз
резко уменьшает взаимодействие.
Взаимодействие антиген — антитело «чувствует» и стереохи-
мическое строение гаптена и его конформации [5,- 6, 8, 9]. Сте-
реоизомерные винные кислоты, присоединенные к белку по
методу Ландштейнера
НООС—СН (ОН)—СН (ОН)—СО—NH -/~~V-N=N — Белок,
Иммунологически
активно
Рис. 143. Схема, объясняющая гаптено-
вое действие.
дают разные специфические антитела (табл. 31),
Таблица 30 [8]
Влияние структурных изменений детерминантной группы на взаимодействие антитела с антигеном
Детерминанты а я
группа, присоединенная
к антигену лошадиной
сыворотки,
использованной для получения
антитела
Л
\/\соо-
ч,
Л
Интенсивность реакции преципитации при введении в антигены куриной сыворотки разных детерминантных
групп
Ч
6
0
0
*
ч
1
/\
Чч/\:оо-
+ + +
0
ч
\/\соо-
++++
ч
н-ЧА
^^соо-
+++
0
ч
1
/\
и
1
соо-
0
0
1
N\\
N
1
о
+
++++
5
3:
3:
а:
s
н
СО
374 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Таблица 31 [4]
Серологическая специфичность трех изомерных винных кислот
Иммунные сыворотки
против
D-винной кислоты
I-винной кислоты
Мезовинной кислоты
Антиген
с D (-)-винной
кислотой
с L (+)-винной
кислотой
с мезовинной
кислотой
Разбавление антигена
1 : 2000 1 :10 000 1 :2000 1 :10 000 1 ; 2000 1 :10 000
+ + +
0
(±)
++
0
(±)
(±)
+++
0
0
++
0
+
+
+++
(±)
(±)
+++
Структура трех винных кислот показана на рис. 144.
ноос
но
ноос
с*
а)
н
он
ноос
с*
н
он
ноос
н
ноос
но
с*
н
но
н
б)
Рис. 144. Стереоизомерные винные кислоты.
а) правая; б) левая; в) мезовинная кислота.;
В)
И
он
соон
Молекулярная теория взаимодействия антиген — антитело,
объясняющая иммунологическую специфичность и дающая ей
количественное истолкование, развита Полингом и его
сотрудниками.
АНТИТЕЛА И АНТИГЕНЫ
Согласно идее Полинга, дополнительность, структурное
соответствие антитела к антигену, выражаемое словами «ключ
и замок», означает, что при таком соответствии различные,
слабые по сравнению с химическими, силы эффективно
связывают антиген с антителом [8, 15]. Эти слабые, быстро
убывающие с расстоянием силы — ван-дер-ваальсовы силы,
водородные связи, электростатические взаимодействия и т. д.
АНТИТЕЛА И АНТИГЕНЫ
375
Структурное соответствие определяется, таким образом, ван-
дер-ваальсовой поверхностью гаптеновой группы. Сечения
таких поверхностей для орто-, мета- и параазобензарсенатов
показаны на рис. 145 [15]. Поверхность проводится в соответствии
с ван-дер-ваальсовыми радиусами атомов и групп, т. е. с теми
расстояниями, на которые они могут сближаться. Поверхность
полости антитела отвечает поверхности гаптена.
Мерой структурного соответствия может служить константа
гаптенового торможения /Со» также введенная Полингом. Это
Белок Белок Белак
Рис. 145. Ван-дер-ваальсовы поверхности орто-, мета- и
параазобензарсенатов.
относительная константа взаимодействия гаптен — антитело,
определяемая по торможению реакции преципитации антигена
низкомолекулярным гаптеном.
На рис. 146 показаны значения Ко для взаимодействия
антител анти-о-азобензарсената, анти-ж-азобензарсената и анти-я-
азобензарсената с различными гаптенами.
Ко меняется на несколько порядков, причем антитело типа
орто- сильно взаимодействует с орто-гаптенами и слабо с мета-
и пара- и т. д. [14, 15].
Реакция антиген — антитело подобна обычной химической
реакции, подчиняется закону действия масс, и поэтому можно,
измерив истинную, а не относительную константу равновесия
/(о, определить свободную энергию взаимодействия. Это можно
сделать путем прямого измерения теплоты реакции и другими
способами. Если во взаимодействии участвуют противоположно
заряженные группы, то константа взаимодействия должна
зависеть от рН среды, что действительно в ряде случаев
наблюдается на опыте. Зависимость константы равновесия от рН
следующая:
/ 1 М *н
376 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
где К — измеренная константа .равновесия, Ко — ее значение
при нейтральном рН, Ки — константа диссоциации кислотной
Анти-о -
азобензарсенат
Анти-м-
азобензарсенат
ЩО
$0
го
005-
001
J
т
м
Анти-п-
азобензарсенат
т
/7
о NN О ОН
х С1
• N02
© СН3
+ NH2
Рис. 146. Значения констант гапгенового торможения /f0.
Рис. 147. Схема, поясняющая реакцию преципитации антигена
антителом.
*
группы белка [16]. Зависимость l°gn?- — тг) 0Т ^ в ЭТ0М
случае линейная. Для взаимодействия овальбумин — анти-
АНТИТЕЛА И АНТИГЕНЫ 377
овальбумин Кк оказалась равной 105> что согласуется с
участием в реакции ионизуемой карбоксильной группы СООН ->
-* СОСГ + Н+.
Большинство антител двухвалентно, а белковые антигены
поливалентны. Именно этим объясняется преципитация и
агглютинация (см. рис. 147) —взаимодействующие молекулы
образуют большой нерастворимый агрегат, выпадающий
в осадок.
Константа равновесия в присутствии свободного антигена может быть
представлена уравнением [17]
[АТ-(АГ)2] „
[АГ][АТ-АГ] ~Л> K*U)
отвечающим реакции
AT - АГ + АГ —>■ AT • (АГ)2.
Здесь AT — антитело, АГ — антиген.
Нас интересует, однако, энергия единичной связи AT — АГ. Соединение
AT • (АГ)2 содержит две такие связи и один моль АГ содержит v молей гап-
теновых групп, где v — валентность АГ. Константа /(', отвечающая
равновесию
Связи AT — АГ
— Свободные группы АГ • Свободные группы AT '
равна
2[АТ-(АГ)2]
К ~ *[АГ][АТ.АГ]> (W)
т. е.
К' = £ К. (8.4)
и понижение свободной энергии при образовании одной связи составляет
AF RT\nK'= — RT\nK + RT\n^. (8.5)
В табл. 32 приведены значения А/7, АЯ и AS [1].
Обозначения во втором столбце относятся к реакциям
А: п AT + АГ +±. (АТ)Я АГ
В: АТ + (АТ)„_, АГ ^=± (АТ)„ АГ
С: AT + 2АГ ^=t AT (АГ)2
D: АТ-АГ + АГ ^=> АТ(АГ)2
Е: АТ + 2Г +=> АТ(Г)2
F: Г-группа + активная группа AT +zt. Связь Г — AT.
Здесь Г — гаптен.
378 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Таблица 32
Термодинамические характеристики серологических реакций
Антигены или гаптен
Гемоцианин
-
Альбумин из плазмы
крови человека
Альбумин из плазмы
крови быка
Овальбумин
Карбоксипептидаза
/^-глобулин быка
/^-альбумин быка
5-альбумин быка
Гаптен-jT
е-динитро-фенил-ли-
зин
D-J
«Лак»
Краситель В
Реакция
А
С
D
D
В
В
D
В
F
Е
Е
Метод
Прямое
измерение
Прямое
измерение
+ III + IV
III
III
II
II
I
II
IV
I
I
I
I
А/7.
ккал/моль
—10
—7,5; —8,0
—5,5 ±0,2
—5,6 ±0,2
—9
л*—8.5
—5,2 ±0,2
—8,5
—7,4 ±0,2
—6,8
—7,24
—7,25
—6,54
А//,
ккал/моль
—40
—3,66
0±2
0±2
—7
—2
0±2
—2,8
—0,8 ±2,6
-1,6
-7,1
-9,7
—3,93
AS,
кал/моль- град
—100
13,1; 14,8
20±8
20±8
7
21
18±8
21
22±9
17
0,3
-8,8
8,75
Обозначения в первом столбце относятся к соединениям
As03H2 S03H C0NHC6H4As03H2
R
Y Y
N=N— N=N— CONHC6H4As03H2
Hv
N=N—c\
N (CH3)2
В HOOC
D-/ <(~)—CHNHCO
—N=N
«JIdK»
H OH
H
coo*
CH2OH
/
o>
H
\OH H /
о -<(3-N-=N-^Z/~N <СНЛ
CH,OH
li OH
H
АНТИТЕЛА И АНТИГЕНЫ 379
Методы определения (третий столбец): I — равновесный
диализ, II — прямой анализ осадков и надсадочиой жидкости,
III — электрофорез и седиментация в ультрацентрифуге, IV —
рассеяние света.
Табл. 32 показывает, что изменения свободной энергии и
энтальпии при взаимодействии AT—АГ невелики. Их порядок
величины соответствует образованию одной-двух водородных
связей или сумме слабых ван-дер-ваальсовых взаимодействий.
Удивительно на первый взгляд увеличение энтропии при
взаимодействии (за двумя исключениями). Казалось бы, что
связывание AT с АГ должно понизить, а не повысить энтропию.
Это может быть объяснено освобождением молекул воды,
ранее связанных с поверхностями антитела и антигена [1, 17].
Дальнейшие подробности, относящиеся к термодинамике
серологических реакций, см. в [1], гл. 9 и 10, и [8].
Таким образом, эти реакции определяются структурным
соответствием, геометрией поверхностей молекул антигена и
антитела. Поверхность задается вторичной и третичной
структурой белка (или другого биополимера). Характерно, что при
денатурации белок теряет свои антигенные свойства. По мысли
Полинга структурное соответствие между антигеном и
антителом является не статическим, но динамическим. Глобулин
присоединяется какими-то связями к молекуле антигена, и
третичная структура антитела формируется антигеном так, что
ее поверхность образует полость, отвечающую гаптеновым
группам антигена. Модель очень наглядная и, как мы увидим
дальше, согласующаяся с современными представлениями
о ферментативной активности белков. Однако при этом
число образовавшихся молекул антител должно находиться
в определенном соответствии с числом молекул антигена, и
остается непонятным, каким образом в иммунной плазме
сохраняется постоянный титр антител даже в отсутствие
антигенов.
Мы подошли ко второй основной проблеме, связанной с
иммунитетом (стр. 369) — к вопросу о природе синтеза антител
в организме.
Здесь был предложен ряд гипотез. Дилемма состоит в
следующем: является ли синтез антител генетически
предопределенным и только усиливаемым в присутствии антигенов или
антигены заново формируют антитела? Со сходной дилеммой
мы уже встречались при обсуждении индуцированного синтеза
ферментов (стр. 356). Вторая возможность опять-таки
расщепляется на две: происходит ли заново самый синтез антитела
или антиген только перестраивает третичную структуру
готового глобулина — так как считал Полинг? .
380 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Гауровитц, исходивший из того, что матрицей для синтеза
белка является сам белок [18], полагал, что антиген
включается в матрицу и, закрепляясь в ней, обеспечивает
дальнейшее производство антител. Эта точка зрения
аргументировалась опытами с мечеными белками, содержавшими S35, С14,
а также J131 в присоединенном к белку соединении йода.
Обнаруживалось, что меченые атомы надолго сохраняются в
клетке [19]. Существенно, что приобретенный иммунитет не
передается потомству по наследству. Отсюда Гауровитц заключал,
что матричное действие антигена ограничивается цитоплазмой
специализированных соматических клеток. Гауровитц считал,
что антитела отличаются от нормальных глобулинов плазмы
только своей вторичной структурой (доказано, что несколько
концевых аминокислот в этих двух случаях одинаковы).
Поэтому он принимал гипотезу Полинга об антигене, как
факторе, обеспечивающем определенное свертывание глобулы, но
помещал этот фактор на матрицу. Этим, очевидно, снимается
вышеприведенное возражение против гипотезы Полинга.
Таким образом, в теории Гауровитца, антиген является
мутагеном третичной структуры белка, ответственным за
соматические мутации клеток, в которых синтезируются
глобулины [19, 20].
Возражения против теории Гауровитца связаны прежде
всего с тем, что матрицей для белка служит не белок,
а М-РНК, и белок не может синтезироваться путем
автокопирования. Если антигенное действие и является матричным, то
нельзя его рассматривать столь упрощенно. Кстати, антиген и
антитело дополняют, а не копируют друг друга. В то же время
никак нельзя считать доказанным, что первичная структура
нормальных глобулинов и антител одинакова. Более того,
сейчас можно считать установленным, что третичная структура
однозначно связана с первичной.
Бернет [21] исходил из того, что антитела продолжают
вырабатываться в течение весьма длительного времени после
иммунизации— до 50 лет в случае желтой лихорадки. Трудно
представить себе, чтобы антиген «застрял» так надолго в
матричной системе, синтезирующей белок. Роль антигенов, с точки
зрения Бернета, сводится к усилению синтеза ферментов,
необходимых для синтеза антител. Это — ферменты
индуцируемого типа, и после того, как антиген однажды индуцировал их
синтез, они производятся неограниченно не только в исходных
клетках, но и в их потомках. Как показывает опыт, введение
антигена вызывает сильную активацию митозов в
лимфатическом узле, бурное размножение клеток, причем преимуще-
АНТИТЕЛА И АНТИГЕНЫ
381
ственно клеток, вырабатывающих антитела к данному
антигену.
Таким образом, Бернет впервые обратил внимание на
сходство между синтезом антител и индуцированным синтезом
ферментов.
Возражая Бериету, Гауровитц недоумевал, каким образом
клетки сами по себе могут оказаться способными синтезировать
антитела к экзотическим, искусственным антигенам, например,
к содержащим фениларсиновую группу. Гауровитц считал
совершенно несовместимой теорию Бернета и теорию матричного
действия антигена [19].
Ранее Ерне [22] рассматривал антиген как своего рода
фактор естественного отбора. Лимфатические клетки в норме
производят множество различных глобулинов, антитела к любым
мыслимым антигенам. Введение антигена стимулирует
производство нужных антител, производит своеобразное каталитическое
действие. Реализуется эффект усилителя — вторично
введенный антиген встречает большую концентрацию специфических
молекул и вызывает более быструю их продукцию. Какая-либо
физико-химическая аргументация в работе Ерне отсутствует.
Физик Лео Сцилард, занявшись биологией, заинтересовался
прежде всего именно проблемой синтеза антител. Он развил
математическую теорию, основанную на ряде допущений.
Основная идея работ Сциларда состоит, как и у Бернета, в
общности синтеза антител и индуцированного синтеза ферментов [23].
Антиген, по идее Сциларда, является индуктором, т. е. он
снимает репрессию синтеза специфического у*гл°булина клеткой
и одновременно индуцирует синтез других белков, важных для
роста клеток. В результате растут именно те клетки, в которых
синтезируются нужные антитела. В этом состоит первичная
реакция на антиген. Память о первоначальном введении антигена
сохраняется, так как увеличено количество лимфатических
клеток, способных синтезировать данные антитела. Этим
объясняется, следовательно, и вторичная реакция.
В последние годы получены данные, свидетельствующие о
различиях в первичной структуре антител, вырабатываемых
одним и тем же организмом к различным антигенам. Это — пря»
мое подтверждение концепции Бернета.
Эфраимсон рассмотрел явления наследственного иммунитета
у растений и человека [24]. Громадное значение для сельского
хозяйства имеет иммунитет растений к их паразитам, в
частности, к ржавчинным грибкам. Создание нового сорта пшеницы,
устойчивого к ржавчине, происходит путем отбора надлежащих
генетических признаков, отбора мутантов пшеницы. В свою
очередь разведение такого сорта служит средством для отбора
382 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
новых агрессивных мутантов ржавчины и дальнейшая
селекционная работа протекает на основе «борьбы» мутантов хозяина и
паразита. Существенно, что иммунитет определяется геномом
растения-хозяина, агрессия — геномом грибка-паразита и при
гибридизации соблюдаются законы генетического расщепления. Очевидно,
что в этих важных явлениях речь идет о синтезе в клетках
пшеницы белков, работающих как антитела к белкам ржавчины; в
агрессивных мутантах последней вырабатываются другие белки.
Мы уже видели (стр. 118), что ген серповидноклеточной
анемии обеспечивает иммунитет человека к плазмодию
малярийного комара. В этом случае точно показано, что появление
иммунитета связано с заменой одной аминокислоты в
гемоглобине, т. е. с точечной мутацией в одном кодоне.
К наследственному иммунитету относятся и взаимодействия
эритроцитов различных групп крови.
Можно думать, что между явлениями наследственного и
приобретенного иммунитета имеется много общего. Если принять
предположение о том, что антитела разнятся своей первичной
структурой, то они должны рассматриваться как мутантные
глобулины. Число таких мутантов должно быть очень большим
уже в норме. Организм животного содержит 10п—1012 лимфоид-
ных клеток, характеризуемых большой частотой соматических
мутаций. Активная группа антитела состоит из 3—4
аминокислот, общее же их число в молекуле антитела имеет порядок
величины 1500. Следовательно, возможен набор мутантов,
содержащий единичные молекулы антител по отношению ко всем
практически мыслимым антигенам, в том числе и к самым
экзотическим. Введение антигена в организм вызывает
усиленное размножение тех лимфатических клеток, которые
производят надлежащие антитела. Изложенная точка зрения Эфраим-
сона [24] близка к гипотезе Ерне [22], но содержит более
глубокое генетическое обоснование.
Можно сформулировать общие позиции для теории
образования антител. Во-первых, эта теория не может строиться
независимо от общей теории синтеза белка. Во-вторых, она должна
быть связана с теорией дифференциации клеток и регуляции
клеточного деления. Получены убедительные
экспериментальные данные, свидетельствующие о том, что синтез антител
происходит de novo, а не путем какого-то превращения предсуще-
ствовавшего -угл°булина [25, 26]. Швит и Оуэн [27], развивая
идеи Бернета, предложили нагчядную модель образования
антител. Образование антител действительно имеет много общего
с индуцированным синтезом ферментов (см. стр. 355). Последний
происходит только в клетках, обладающих принципиальной
генетической способностью к образованию такого фермента и акти-
АНТИТЕЛА И АНТИГЕНЫ
383
вируемых индуктором, не играющим роли в процессе
формирования третичной структуры фермента. Индуктор этот подобен
субстрату фермента, т. е., как мы увидим далее (стр. 396),
находится в структурном соответствии с молекулой фермента. То же
справедливо для синтеза антител. Однако имеются и
существенные отличия. В одних и тех же клетках синтезируются антитела
с различной структурой, зависящей от антигена. Синтез антител
характеризуется изменениями деления клеток, их дифференци-
ровки и роста. Предполагаемая Швитом и Оуэном
биохимическая модель основана на том, что, с одной стороны, антиген
изменяет матрицу ДНК, соединяясь с ней. Под влиянием
антигена образуется модифицированная ДНК, конвариантно реду-
плицированная в митозах. Во-вторых, антиген действует как
индуктор.
Действительно, установлено, что антиген в ряде случаев
проникает в ядро лимфоидиой клетки и, как уже говорилось,
стимулирует появление волны митозов. В размножающихся
клетках значительно увеличивается количество цитоплазматической
РНК- Антиген перестраивает работу фабрики-клетки, создает
новую цепь реакций. Он тем самым приводит систему в состояние, в
котором возможна индукция. При вторичном введении антигена,
наряду с прямым влиянием на ДНК, происходит и индукторное
действие. Подавление иммунитета при введении антигена
эмбрионам или молодым животным (стр. 367) может быть
объяснено тем, что у них еще нет клеток, которые в дальнейшем
дифференцируются в клетки, производящие антитела, и антиген
направляет развитие клеток в иную сторону.
Таким образом, современная теория синтеза антител —
мутационная теория. Прямыми опытами доказано, что антитела
синтезируются подобно другим белкам на рибосомах [28]. Синтез
этот, конечно, происходит под генетическим контролем ДНК-
Синтезируются любые антитела, к любым мыслимым
антигенам, но введение данного антигена, оказывая индуктивное
действие, стимулирует выработку определенного антитела, рост
клеток, производящих эти антитела.
Возражение Гауровитца опровергается расчетами Ледербер-
га [29]. При наличии 10п лимфатических клеток в человеческом
организме возможно возникновение громадного числа
спонтанных мутаций, таких, в результате которых начинается
выработка антител к потенциальному антигену, с которым клетка
никогда еще не встречалась. Это не более удивительно, чем
«адаптация» микроорганизмов — отбор мутантов, устойчивых к ядам,
отсутствующим в природных условиях (стр. 87). Таким
образом, идеи Бернета, Ерне, Сциларда, Эфраимсона несравненно
убедительнее представлений Гауровитца (см. также 130]).
384 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Вопрос, конечно, далек еще от полного решения. Мы
видели, что глубокие исследования индуцированного синтеза
ферментов привели к существенному усложнению представлений о
синтезе белка, к открытию гена-регулятора и оперона (стр.357).
Индуцированный синтез ферментов удалось объяснить в» общих
чертах в рамках молекулярной биологии, но мы еще далеки от
расшифровки роли тех или иных участков ДНК, ответственных
за эти процессы. Синтез антител — более сложное и
специальное явление, чем индуцированный синтез ферментов. Для его
полного понимания необходимо молекулярное истолкование
процессов дифференциации. Тем не менее есть основания
считать сложившуюся концепцию вполне правдоподобной.
Изучение иммунохимических процессов весьма
существенно для дальнейшего развития молекулярной биологии и
биофизики. С одной стороны, синтез антител представляет удобный
и яркий пример синтеза белка, изучаемый количественными
методами. С другой стороны, во взаимодействии антиген —
антитело четко проявляется значение структурных соответствий,
играющих, как мы увидим, важнейшую роль в биологии.
ФЕРМЕНТАТИВНЫЕ РЕАКЦИИ
Самая существенная биологическая функция белков —
действие ферментов. В ферментативных реакциях также
проявляются структурные соответствия молекул, до некоторой степени
подобные соответствию антиген — антитело, о которых мы
говорили, как о «замке и ключе».
Ферменты — катализаторы. Для того чтобы понять их
действие, нужно прежде всего рассмотреть работу обычных
катализаторов. Всевозможные твердые тела, начиная с чистых
металлов и кончая весьма сложными соединениями, могут
действовать как катализаторы, ускоряя химические реакции,
протекающие в газах или жидкостях. Мы говорим сейчас о
гетерогенном катализе—катализатор в этом случае образует отдельную
фазу и реакция происходит на его поверхности. Гомогенный
катализ реализуется в тех случаях, когда катализатор и реагенты
находятся в одной фазе, например, в общем растворе.
Гомогенный катализ происходит поэтому не на поверхности раздела
фаз, а в результате взаимодействия между молекулами в
растворе — обычно через посредство промежуточных соединений.
Процесс гетерогенного катализа заключается в адсорбции
реагирующих молекул поверхностью катализатора, реакции
между ними и десорбции, т. е. отделения от поверхности
получившихся продуктов. Адсорбция приводит реагирующие
молекулы в состояние тесного соприкосновения, изменяет структуру
ФЕРМЕНТАТИВНЫЕ РЕАКЦИИ
385
их электронных оболочек и тем самым снижает высоту актива-
ционного барьера, отделяющего реагенты от продуктов
(стр. 25). На рис. 148 сопоставлены профили кривых
энергии для данной реакции S-*P (S — реагенты,
ты) в отсутствие катализатора и в
каталитическом процессе. Во втором случае актива-
ционный барьер понижен, и поэтому
скорость реакции значительно увеличена.
Вспомним, что скорость реакции зависит
от высоты барьера экспоненциально
(стр. 25)
k = Ae-E*lBT. (8.6)
поэтому понижение высоты барьера,
скажем, на 6000 кал/моль, означает увеличение
скорости в е10, т. е. примерно в 30000 раз.
Очевидно, что для действия
катализатора существенно изменение состояния
молекулы при адсорбции. Баландин впервые
показал, что здесь важнейшую роль играет
структурное соответствие между
поверхностью катализатора и адсорбируемой
молекулой. Металлический катализатор кри-
сталличен. Атомы на его поверхности
расположены строго определенным способом,
на фиксированных расстояниях друг от
друга. Если симметрия этого
расположения и межатомные расстояния
соответствуют геометрии адсорбируемых молекул,
последние могут эффективно сорбироваться
поверхностью металла и приходить в
необходимое для реакции состояние в результате электронного
взаимодействия с атомами металла. Так, реакция гидрирования
бензола
QH6 + ЗН2 -> СбН12.
катализируется платиной, никелем и некоторыми другими
металлами, но не катализируется железом, серебром и т. д.
Это объясняется тем, что молекула бензола представляет собой
правильный шестиугольник с расстояниями между
соседними атомами углерода, равными 1,4 А. Атомы на поверхности
никеля также располагаются в виде шестиугольников, и
расстояния между ними согласуются с бензольными (рис. 149 '[31]).
То же относится к другим металлам, катализирующим
гидрирование бензола. Напротив, некаталитические для этой реакции
Рис. 148. Профиль
энергии для реакции:
а) в отсутствие
катализатора; б) в
присутствии катализатора.
25 М. В. ВолькенштеЙн
386 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
металлы либо не имеют шестиугольного расположения атомов
на поверхности, либо имеют такое расположение, но их атомы
обладают неподходящими размерами.
В состоянии структурного соответствия с металлом
химические связи в бензоле испытывают превращение
^НС^СН^ ~НС-СН—
Ni NI
Ni Ni
изображающее разрыв я-электронной связи в бензоле и
образование за счетл-электронов связей с атомами металла. В этом
состоянии бензол легко реагирует
с водородом
Н—Н
~НС—СН
Ni Ni
—Н2С—СН2—
Ni Ni
Рис. 149. Модель адсорбции
бензола на никеле.
Теория структурных
соответствий низкомолекулярных реагентов
и твердых катализаторов была
подробно развита Баландиным. Это—
так называемая мультиплетная
теория [32]. Она раскрывает механизм
гетерогенных каталитических
реакций и указывает научно обоснованные пути подбора
катализаторов.
После прохождения реакции на поверхности продукты
реакции уходят, десорбируются и катализатор вновь способен к
действию. Таким образом, шесть атомов никеля способны
переработать множество молекул бензола.
Ферменты — глобулярные белки. Они выполняют свою
каталитическую функцию, либо находясь в растворе, либо входя в
состав организованных твердых систем. Так, например,
ферменты окислительного фосфорилирования (стр. 134) работают в
митохондриях. Но и в том и в другом случаях действие
фермента скорее подобно дейртвию гетерогенного катализатора, так
как реакция разыгрывается на поверхности глобулы,
определяемой третичной структурой белка. В то же время имеются и
некоторые черты сходства с гомогенным катализом, так как
удается установить образование промежуточных соединений
фермента с реагирующими молекулами.
В настоящее время изучено множество ферментов и
ферментативных реакций. Большой материал приведен в книге
Диксона и Уэбба [33], хорошее популярное описание дано Азимовым
ФЕРМЕНТАТИВНЫЕ РЕАКЦИИ 387
[34]. Здесь мы приводим лишь основные результаты общего
характера, сосредоточив внимание на структурных соответствиях,
как существенных факторах, определяющих ферментативную
активность.
Прежде всего — основные понятия. Вещество, вступающее
в реакцию под действием фермента, именуется, как мы уже
знаем, субстратом. Во многих случаях для осуществления реакции
кроме фермента и субстрата необходимо еще дополнительное
вещество — кофактор. Кофакторами являются кбферменты,
сложные органические вещества, обычно участвующие в
катализируемой реакции как переносчики некоторых химических групп.
Весьма важными источниками ряда коферментов служат
витамины. Хорошо известно, что отсутствие витаминов в пище
приводит к тяжелейшим последствиям — к цинге, пеллагре и
другим болезням. Дело в том, что организм животного или
человека не может синтезировать витамины—он должен получать
их в готовом виде. К счастью, витаминов нужно очень мало и
нормальная пища содержит их достаточно. Витамины группы
В необходимы как источники коферментов, участвующих в
фундаментальном процессе окислительного фосфорилирования, в
котором производится зарядка аккумулятора — синтез АТФ
(стр. 135). В состав коферментов I и III входят гетероциклы
с азотом, их-то и вносят витамины Вг (тиамин) и Вг
(рибофлавин).
Другие кофакторы — активаторы ферментов. Это обычно
простые соединения, например неорганические ионы.
В ряде случаев в состав фермента входит так называемая
простетическая группа небелковой природы. Такова группа
тема, участвующая в окислительно-восстановительных процессах
в цитохромах (стр. 140). Простетические группы содержат
зачастую атомы металлов — железо в геме и т. д.
Таким образом, при изучении ферментов мы имеем дело с
весьма сложной химией. И все-таки это именно химия, а не
биология. Ферментативные реакции исследуются химическими и
физико-химическими методами, они проходят не только in vivo,
но и in vitro. Это и понятно, ведь ферменты — индивидуальные
белки, которые удается получать в чистом виде и даже
кристаллизовать. Действие ферментов заключается во влиянии на
скорость реакции. Поэтому прямой путь изучения
функциональности ферментов состоит в исследовании кинетики
ферментативных процессов.
Приведем основные соотношения, справедливые в простейших
случаях [33, 35, 36].
При взаимодействии фермента Е с его субстратом или субстратами S
образуется комплекс ESt в котором реакционная способность субстрата
?5
388 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
повышена — субстрат превращается в продукт реакции, а фермент
возвращается в исходное состояние
Ь + S «
ES
£ + />.
„Пусть ки Л-ь k2— константы скоростей соответственно прямой реакции
образования комплекса, обратной реакции его распада и реакции превра де-
ния субстрата в продукт. Обычно приходится иметь дело с большим избыт*
ком субстрата—его количество значительно больше количества фермента
(S^>£). В стационарных условиях процесса концентрации свободных
молекул фермента, которую мы обозначим Fu и молекул фермента, связанных
в комплекс с субстратом F2, постоянны.
Руководствуясь схемой рис. 150, можем написать кинетические уравнения
fil^-klSFl + (k_l + k2)F2 = 0>
F2 = fuSFi — (k_t -f k2) F2 = 0
E = Fl + F2.
Выражение для стационарной скорости процесса
имеет вид
v = — 5' =* Р = k2F2.
Находим F2 из (8.7) и (8.8). Получаем
kxk2ES k2ES
и
(8.7)
(8.8)
(8.9)
Рис. 150. Схема
стационарной
ферментативной реакции.
v =
где
k_x + k2 + kxS KM + S
км Я '
(8.10)
(8.11)
Уравнение (8.10) — уравнение Михаэлиса — Ментен.
С' увеличением концентрации субстрата 5 скорость реакции v растет,
асимптотически приближаясь к максимальной
(8.12)
fmax = Hm v = k2E.
5-» оо
Исследуя зависимость v от Е и S, можно найти константы скоростей.
Имеем
v - y**Sn = ?™£. ^ (
где
К-М + ^ ж, , ^max i о
*S+ kxE +Ъ
К *-1 1
Л*" А, ~Kf
(8.14)
К — константа равновесия реакции £ + 5 •<~>- £5.
На рис. 151 показана кривая зависимости v от S, соответствующая (8.13).
Из этой формулы следует
v К v
max 1 _ _. S i max
v S "I" ktES'
При постоянной концентрации субстрата £ зависимость
(8.15)
v
max
v
— 1 ОТ I/,
max
изображается прямой линией, отсекающей на оси ординат отрезок Ks/S,
ФЕРМЕНТАТИВНЫЕ РЕАКЦИИ
389
а на оси абсцисс — k^E/K^ Тангенс угла наклона прямой равен \jkxES
(рис. \Ъ2). Так как vmix = k2Et то из прямых, полученных при разных
значениях S, можно найти ktEt £_,£ и k2E
и, если известна концентрация фермента
Е, определить все три константы ско-
рости kb £_; и k2.
V
tt
max
Рис. 151. Зависимость стационарной
скорости ферментативной реакции от
концентрации субстрата по Миха-
элису — Ментен.
jcd^L
О 200 400 600 800 ц,
Рис. 152. Определение
кинетических констант
ферментативной реакции.
Так, при дегидрировании янтарной кислоты до фумаровой с помощью
дегидразы
СН2СООН НООС-СН
I -2Н —> ||
СН2СООН НС-СООН
,-2
.-1
-7
kx— 1,15-10~£ сек~\ £_| = 3,6-10"' моль сек
-1
,-6
-1
k2= 5Д5-10"° моль • сек'1 [35].
Основная идея Михаэлиса (1913 г.) об образовании
комплекса фермент—субстрат подтверждается косвенно согласием
между наблюдаемым ходом реакции и кинетическими
уравнениями, и в ряде случаев непосредственно. Так, комплексы ката-
лаз и перексидаз (ферментов, содержащих простетическую
группу типа гема) с субстратами удалось наблюдать
спектроскопически. Свободная каталаза поглощает свет в области 410 тр,
значительно сильнее, чем ее комплексы с перекисью водорода
Н202 и с гидроперекисью метила СН3ООН [37].
Укажем, кстати, что с действием каталазы знаком каждый,
кто когда-либо дезинфицировал порез или царапину перекисью
водорода. При ее соприкосновении с кровью интенсивно
выделяется кислород — Н2О2 разлагается. Это происходит потому,
что в крови содержится каталаза, Константы для реакции
390 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
следую!дие: k\ = 5 • 106 моль'1 - ce/r1, k-\=0,02 селг1,
= 1,8 • Ю7 моль'1 < сект1. Реакция в этом случае имеет вид
ko=
Каталаза + Н202 *
Каталаза • Н202 + Н202 —
Каталаза • Н202
Каталаза + 2Н20 + Оа.
Вторая реакция здесь является наиболее быстрой.
Во многих случаях приходится иметь дело со значительно
более сложными соотношениями. Но так или иначе
кинетический анализ дает возможность определить константы скоростей
ряда этагюв ферментативной реакции. В свою очередь изучение
зависимости констант ско-
М
(Малеат)
Q
б)
Рис. 153. Профиль ферментативной
реакции фумаровой кислоты.
о) свободная энергия; б) энтальпия.
ростей от температуры, рН
и других факторов дает
значения свободных энергий,
энтальпий и энтропии,
определяющих энергетический
профиль ферментативной
реакции, сходный, конечно,
с профилем, показанным на
рис. 148. На рис. 153, а
показан профиль свободной
энергии реакции
превращения фумаровой кислоты в
L-гидроксиянтарную,
катализируемой фумаразой
НООС.СН
II + Н20 —>
НС • СООН
Н2С • СООН
*НО - НС • СООН
На рис 153, б приведен профиль энтальпии [38]. Реакция
является более сложной, чем рассмотренные ранее — необходимо
учесть и комплекс ферменттпродукт ЕР, т. е.
E+S <=± ES* +±ES+±. EX* +± ЕР <=£ ЕР* —> Е + Р.
Звездочки относятся к активированным состояниям на
вершинах активационных барьеров. Самый высокий барьер ртречае?
переходу
ES <=£ ЕХ* ^± ЕР.
Эта стадия превращения закрепленного на ферменте субстрата
в закрепленный на ферменте продукт лимитирует весь процесс,
Т9к как ее скорость — наименьшая.
ферментативные Реакции 391
Большое различие между кривыми рис. 153, а и б указывает
на значительную роль энтропийного фактора. Ведь
TAS = AH— AF.
В ряде ферментативных реакций профиль свободной энергий
в основном задается энтропией. Этим ферментативные реакции
существенно отличаются от обычных каталитических
реакций (39].
Какими же силами определяется взаимодействие фермента
с субстратом? В общем теми же, что и взаимодействие антигена
с антителом. Это, во-первых, образование химических связей,
Рис. 154. Схема действия фумаразы.
в частности солевого характера (такие связи достаточно
слабы, так как с ними конкурируют связи с молекулами воды);
во-вторых, водородные связи, в-третьих, ион-дипольные
взаимодействия, в-четвертых, гидрофобные и ван-дер-ваальсовы
связи.
Наконец, в ряде случаев взаимодействие осуществляется
путем обмена электронов.
Поверхность молекулы фермента, в отличие от поверхности
металла, весьма сложна и неоднородна. За адсорбцию
субстрата могут быть ответственны одни белковые группы, а за
катализ— другие. На рис. 154 показана схема действия фумаразы
'[40]. Адсорбция происходит вследствие электростатического
взаимодействия групп СОО~ иона фумарата с положительными за*
рядами на поверхности белка — фумаразы. Каталитическими
группами являются R' и R (последняя, вероятно, Гис),
расположенные в другом месте поверхности. Очевидно, что структурное,
геометрическое соответствие между субстратом и ферментом
чрезвычайно существенно. Оно требует одновременной
близости адсорбирующих и каталитических групп в молекуле суб*
страта.
392 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Ферментативное действие может быть подавлено рядом веществ —
ингибиторов. Нужно различать конкурентное и неконкурентное ингибирование.
В первом случае ингибитор взаимодействует с поверхностью фермента
подобно субстрату, занимая место последнего. Опять-таки «собака на сене»,
как гаптен в иммунохимии. Такой ингибитор сходен по строению с
субстратом, но не способен к реакции. Во втором случае ингибитор взаимодействует
с уже образовавшимся комплексом ES, препятствуя его превращению в
продукт и фермент. Известны случаи смешанного действия.
f: -*
а)
б)
Рис. 155. Схема стационарной
ферментативной реакции в присутствии ингибитора.
а) конкурентный нигнбнтор; б) неконкурентный
ингибитор.
Соотношения стационарной кинетики и здесь легко получаются.
Приходится решать системы двух линейных уравнений с двумя неизвестными. При
конкурентном торможении имеем (рис. 155, а)
Д = kJFx — k'Fb = 0,
E=F\ + F2 + Ft.
(8.16)
(8.17)
Здесь / — концентрация ингибитора, /з — концентрация комплекса £/. Ре
шая (8.16) и (8.17), находим
k2SE
v = koFo =
где
«ж+W+s'
(8.18)
При неконкурентном тОрмокенйй (рис. 155, d")
гз —
k^SFj - (k_ j + k2 + kf) F2 + k'F'3
kJF2 — k F$
Рх + Ъ+Р»
0,
0,
0,
(8.19)
(8.20)
ПРИРОДА ДЕЙСТВИЯ ФЕРМЕНТОВ
F$ — концентрация комплекса £5/. Находим
. k2SE
»-**Ъ- Km + KjSj+S-
В первом случае vmax не зависит от /, во втором — зависит.
ПРИРОДА ДЕЙСТВИЯ ФЕРМЕНТОВ
Мы видим, что есть определенная аналогия между
взаимодействием антиген—антитело (или гаптен — антитело) и
взаимодействием субстрат—фермент. Антигенная активность
сохраняется у биополимеров, от которых отрезана значительная часть
цепи. Имеются данные, показывающие, что для ферментативной
активности также не всегда необходима вся белковая молекула.
Фермент папаин состоит из 180 аминокислотных остатков.
Можно удалить 80 остатков без изменения активности папаина.
Активность адренокортикотропина также не меняется после
удаления более трети всех остатков [41]. Сходные результаты
были получены Бреслером для трипсина [42]*).
С другой стороны, в ряде случаев для ферментативной
активности нужна вся белковая молекула. При этом в активный
центр входят аминокислотные остатки, сильно удаленные друг
от друга по цепи. Особенно детально в этом отношении изучена
рибонуклеаза. Этот фермент, расщепляющий РНК, содержит
124 аминокислотных остатка, последовательность которых
полностью расшифрована (стр. 394). Часть молекулы, скрепленная
дисульфидными мостиками, образует «сердцевину», к которой
прикреплены два «хвоста» — N-концевой, состоящий из 25
звеньев, и С-концевой, состоящий из 14 звеньев. На рис. 156
показана схема пространственного строения рибонуклеазы [43]. При
отщеплении 20 звеньев N-«xBoera» белка его активность
сохраняется, если отщепленный «хвост» присоединяется к оставшейся
цепи пехимическими связями. Можно проделать то же самое и
с С-«хвостом».
Активность белка полностью исчезает при полном
разрушении третичной структуры — разрыв всех четырех S—S-связей
путем их восстановления до- SH-групп. Однако активность
белка сохраняется (хотя и уменьшается) при разрыве одной или
даже двух S—S-связей. Если провести денатурацию обратимой
вновь воссоздать S—S-связи (это было сделано Анфинсеном),
активность восстанавливается. В этом случае для активного
центра нужны и «хвосты» и «сердцевина», но. вероятно, в нем
*) Новые данные противоречат работам [41, 42]; Е. Smith а. о., J.
Biol. Chem. 240, 253 (1965); J. Chevallier a. o., Biochem. Biophys, Acta
92, 5?1 (1964). (Прим. при корректуре.)
393
(8.21)
394 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
принимают участие далеко не все аминокислотные остатки [41,
43, 44].
Денатурация фермента, в частности переход спираль —
клубок, как правило, уничтожает его каталитическую активность. Эта
важнейшая биологическая функция белка неразрывно связана
с высшими уровнями его структуры.
Еще один интересный пример. Пищеварительные, протеоли-
тические ферменты — пепсин, трипсин и химотрипсин
синтезируются в виде неактивных предшественников — пепсиногена,
f Ала • Ала «Лиз'Фен- глу • Apr • Сер • Тре • Сер • Сер • Асп • Гис • Мет - Глу • Ала * Ала ■ Сер * Сер\
L ' / ~z=r ■ ч iuS
Ала/
Тре
Глу
Лиз
NH
. ЙНг ту, Вал)(Ала,Вал,Сер
{лу 2>сер'Тир.Сер'Тре-Мет-Сер
Ала
ЧмГ
Лей,
Гис,
(Ала
1иэ
Глу г«Асп г.тре-Тре-Лиз-Тир.Цис-Ала-Асп 2*ПрО'Тир'Лиз«Гли'Сер«Тре'Се
(
Гис. «-NH? -
С1Вал,Илейг)(Асп , Глу, Про, Гли
*Ч^Вал, Гпу г)*Феи.(Вал,Про,Лиз, Цис
—■—■—■ и--
,Цис,Ала)Тир'(Вал2»Про,ГисУФеи'Асп^ла>СеР'ВаЛ'С00н| J • I
1ис,Тре, Асп^-Арг'АсП'ЛиЗ'Тре-Лей-Асп^АрГ'З^
Рис. 156. Строение рибонуклеазы.
Черные участки —S —S-связи.
трипсиногена и химотрипсиногена. Было показано, что
активация трипсиногена, его превращение в трипсин происходит в
результате разрыва одной пептидной связи Лиз-Илей. При этом
отщепляется гексапептид Вал-(Асп)4-Лиз. Отрыв такой
цепочки приводит к изменению третичной структуры, показанному на
рис. 157. Отделение гексапептида ликвидирует нехимические
взаимодействия (водородные связи или электростатические
силы), удерживавшие в трипсиногене длинный конец деци, вото^
рый, освободившись, свертывается как пружина и срздае?
активный центр трипсина. Изучены также структурные
превращения при переходе химотрипсиноген — химотрипсин [45, 46].'
В молекуле фермента следует, вообще говоря, различать
две части. Одна из них ответственна за образование активногр
центра фермента; она содержит адсорбирующий и каталити:
ческий участки. Вторая часть непосредственно не влияет на
ферментативную активность. Спрашивается, зачем она нужна? Нд
этот вопрос сейчас трудно ответить. Возможно, что нефункцио:
ПРИРОДА ДЕЙСТВИЯ ФЕРМЕНТОВ 395
нальная часть цепи имеет рудиментарный характер — когда-то,
на давно миновавших стадиях эволюции она играла
существенную роль, а затем, в связи с эволюционным изменением
метаболизма, эту роль утратила. В этом смысле
нефункциональная часть белковой цепи подобна аппендиксу. Другой
ответ гласит, что эта часть цепи играет свою роль и сейчас, но
нам пока неизвестно, в чем эта роль заключается. Если
справедливо первое предположение, то нефункциональная часть
I Активный
j центр
Рис. 157. Переход трипсиноген — трипсин.
цепи подлежит гораздо большим мутационным изменениям,
чем активный центр белка. Действительно, в ней наблюдаются
гораздо большие видовые различия, чем в активном центре.
Так, лизин, занимающий 37-е положение в рибонуклеазе быка,
у овцы заменен на глутаминовую кислоту, и связанное с этим
резкое изменение заряда не сказывается на ферментативной
активности. Но пока это лишь изолированные работы.
Наличие в белке нефункциональных участков в свое время
приводило к мысли об отсутствии фиксированной первичной
структуры белка и, следовательно, о возможности его синтеза
(или хотя бы ресинтеза из продуктов гидролиза) без матрицы.
Сейчас мы знаем, что белковый текст фиксирован и общий
характер синтеза белка — обязательно матричный.
396 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Для образования активного центра белковая цепь должна
сложиться в строго определенную третичную структуру. Это
иллюстрируется рис. 158. Возможность образования такой
конструкции задана первичной структурой. Какой же должна быть
эта конструкция?
Специфичность фермента по отношению к субстрату весьма
значительна, но не абсолютна. Ряд ферментов катализирует
реакции переноса связи типа
В—X + Y—>B—Y + X.
Если В — метильная группа, то такая реакция может
рассматриваться как проходящая через этапы
н\
у _|_ Н—С—X
и/
н н
• • • \j • • •
I
н
у—с—Н + X
Если В не метил, а асимметричная группа и ВХ — оптически
активное соединение, то перенос сопровождается инверсией,
превращением правого антипода в левый, что
действительно и наблюдается.
При объяснении специфичности ферментов,
катализирующих реакции переноса,
возникают трудности. Фосфорилазы и киназы ката-
S лизируют перенос гидроксильной группы ОН
у ряда соединений. Однако вода Н—ОН не
реактивна в этих случаях. Казалось бы, что
молекула Н20 с успехом должна
адсорбироваться и перерабатываться активным центром, раз
она меньше обычных субстратов. Фосфотранс-
ацетилаза действует на ацетат, пропионат и
бутират (СНзСОО-, С2Н5СОО-, С3Н7СОО-),
но не действует на формиат (НСОО").
Некоторые соединения заведомо адсорбируются активным участком,
но не реагируют.
Эти и другие факты были объяснены Кошландом,
предложившим наглядную качественную теорию специфичности
ферментов [47, 48, 49]. Теория исходит из следующего: субстрат,
взаимодействуя с активной группой фермента, изменяет
геометрическую структуру белка; для ферментативного действия
необходима специальная ориентация каталитических групп,
вызываемая теми изменениями геометрии белка, которые создаются
субстратом. Наглядная модель Кошланда изображена на
рис. 159. На рис. 159, а показано соответствие нормального
субстрата и фермента, каталитическая группа С которого распола-
Рис. 158. Схема
образования
активного центра.
ПРИРОДА ДЕЙСТВИЯ ФЕРМЕНТОВ
397
гается рядом с перемещаемой связью именно благодаря тому,
что S вошел в тесный контакт с гибкой молекулой £ На
рис. 159,6 показано нарушение этого соответствия при замене
нормального субстрата на вещество с более протяженной, а на
рис. 159,6 — при замене на вещество с менее протяженной
группой. И в том и в другом случае положение функциональных
Ф 6) г)
Рис. 159. Модель Кошланда.
труггп С изменено, и они уже не находятся в
пространственном соответствии с перемещаемой связью. Наконец, на
рис. 159, г показано влияние ингибитора.
Таким образом, не только фермент изменяет состояние
субстрата, но и субстрат изменяет состояние фермента. В первом
процессе реализуется изменение электронной оболочки
субстрата, в одновременно протекающем втором процессе —
изменение конформационного состояния макромолекулы фермента.
Кооперация нескольких групп катализатора моделируется
!И некоторыми явлениями гомогенного кислотно-основного
катализа. 2-гидроксипиридин катализирует мутаротацию глюкозы,
308 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
разрывая ее шестичленное кольцо и испытывая таутомерное
превращение
но\/ч
Глюкоза 2-Гидрокси-
пиридин
О- Н».-0=/Ч
. >—0-»H^N
+
V
=0
HN
V
Такая же реакция с участием смеси пиридина и фенола
Q+ho-A
N
II I
протекает в 7000 раз медленнее [50]. Для образования
промежуточного „соединения необходима пространственная близость
функциональных групп, реализуемая в гидроксипиридине. .
Мы видим, что теория Кошланда рассматривает
соответствие фермент — субстрат не как статическое соотношение
неподвижных замка и ключа, но как динамическую «подгонку»
одного к другому.
Еще ранее Каруш, изучая взаимодействие сывороточного
альбумина с различными органическими соединениями, пришел
к аналогичным общим выводам — белок обладает
«конфигурационной адаптабильностью», т. е. его структура может
приспособиться к структуре субстрата [51]. Именно этим объясняется
способность альбуминов соединяться с самыми разнообразными
веществами. Идея Полинга о динамическом структурном
соответствии антиген — антитело (стр. 379) оказалась
справедливой для совсем иной группы явлений — в теории действия
ферментов.
Очевидно, что исходная предпосылка этих работ состоит в
рассмотрении макромолекул белка как гибкой системы. Но мы
действительно знаем, что, в отличие от синтетических
полипептидов, глобулярные белки «заспирализованы» лишь частично.
Какие-то части цепи находятся в состоянии жесткой спирали,
скрепленной водородными связями, тогда как другие части,
напротив, «расплавлены», им отвечает статистический набор кон-
формаций (стр. 207). Если изложенная точка зрения верна, то
за важнейшую биологическую функцию белков ответственна,
в конечном счете, их макромолекулярная гибкость, т. е.
способность к поворотной изомеризации (ср. стр. 153). Речь идет
о весьма общих свойствах макромолекул. Можно полагать, что
ферментативная активность и упругость каучука имеют
сходную физическую природу.
ПРИРОДА ДЕЙСТВИЯ ФЕРМЕНТОВ
399
Действительно, имеется ряд прямых аке*щряменхальных
доказательств конформационных изменений фермента при его
взаимодействии с субстратом. Эти доказательства относятся, в
частности, к двум реакциям, катализируемым химотрипсином
(XT): реакции с диизопропилфосфофлуоридатом, дающим ди-
изопропилфосфорил-а-химотрипсин и HF, и реакции
гидролиза п-нитрофенилацетата {52]. Промежуточный комплекс второй
реакции также удается изолировать. Доказательства
конформационных превращений химотрипсина в этих комплексах
состоят в следующем [53].
1. Кинетические исследования показывают, что моноацетил-
ХТ существует в двух формах, из которых лишь одна является
промежуточным комплексом fS-реакции гидролиза.
2. Вторая форма способна к агрегации, что доказывается
методом светорассеяния.
3. Спектроскопическое исследование комплексов ES в обеих
реакциях показывает изменение в расположении триптофана.
4. Доказано изменение реакционной способности
определенных аминокислотных остатков фермента при его вступлении в
комплекс.
5. Изменяется кривая титрования фермента.
6. Изменяются параметры оптической активности.
7. Изменяются термодинамические параметры,
характеризующие конформационные превращения белка.
Косвенные, но не менее убедительные доказательства кон-
формационной лабильности фермента как фактора,
определяющего его каталитические свойства, дает упоминавшееся выше
явление аллостеризма (стр. 404).
Аналогичные факты установлены Кошландом при
исследовании фосфоглюкомутазы [48]. В работе {54] методом поляриме-
трии показано, что изменение активности химотрипсина при
изменении рН параллельно изменению степени спирализации
белка.
Браунштейн, Торчинский, Коренева [55] исследовали
аномальную дисперсию оптической активности в полосе
поглощения аспартат-глютамат трансаминазы и смогли
интерпретировать изменения аномальной дисперсии оптической активности
при взаимодействиях фермента с субстратами и
ингибиторами, как вызванные конформационными превращениями
фермента.
Кошланд провел и некоторые количественные расчеты,
оценив увеличение скоростей реакций при сближении и
надлежащей ориентации реактивных групп субстратов. Такое
сближение и ориентация достигаются в результате индуцированного
структурного со<?тветствия фермент — субстрат [56].
400 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
В какой же мере динамическая модель фермента поддается
теоретико-физическому анализу? Первые шаги в этом
направлении были сделаны Линдерштрем-Лангом и Шеллманом [45].
Изменение свободной энергии при конформационном «плавлении»
вторичной структуры белка мало, так как увеличение
энтальпии компенсируется увеличением энтропии. Но отсюда следует,
что структура белка должна все время флуктуировать — одни
участки цепи будут плавиться, а другие спирализоваться
практически без общего изменения свободной энергии. При
взаимодействии с субстратом происходит отбор таких конформаций,
которые наиболее выгодны в смысле соответствия фермент —
субстрат. Тем самым изменяется конформационная свободная
энергия белка, изменяется уровень флуктуации. Эти изменения
кооперативны — звенья белковой цепи связаны друг с другом, и
конформационное превращение в данном месте передается по
цепи.
В тех случаях, когда субстрат макромолекулярен, в нем
происходят аналогичные изменения под действием фермента. Про-
теолитические ферменты расщепляют белок. Можно думать,
что атака фермента направлена в основном на беспорядочные,
а не спирализованные и тем самым защищенные водородными
связями участки макромолекул. Но как только разрывается
какая-либо из пептидных связей гидролизуемого белка,
кооперативное взаимодействие ослабляет всю структуру,
скрепленную водородными связями, и повышает в ней уровень
флуктуации. Это облегчает вторичную атаку и т. д. Расщепление
белка протеолитическим ферментом — кооперативный процесс
(см. [57]). Из динамической концепции ферментативного
катализа следует, что термодинамика соответствующих реакций
должна быть своеобразна. Наблюдаемые изменения свободной
энергии, энтальпии и энтропии должны включать изменения
термодинамических параметров белковой цепи фермента,
связанных с изменением ее конформаций.
Можно представить себе такую картину. Приближение
субстрата к какому-то месту цепи сопровождается уменьшением
свободной энергии. Выделившаяся энергия кооперативно
передается по цепи, вызывая ее частичное плавление, т. е. увеличивая
ее энтропию. Флуктуации возрастают, возрастает число
конформаций цепи и среди них возникают такие, которые приспо^
соблены к максимальному взаимодействию с субстратом, к
наилучшему структурному соответствию с ним. Образуется
комплекс фермент-субстрат. В этом комплексе состояние
фермента необычно — из возможных конформаций отобраны
некоторые вполне определенные и поэтому энтропия белковой цепи
понижена. Возникает энтропийная упругость (стр. 149), белок
ПРИРОДА ДЕЙСТВИЯ ФЕРМЕНТОВ
401
стремится вернуться в состояние с наибольшей энтропией.
Образовавшаяся конформация фермента благоприятствует
взаимодействию субстрата с активными группами на поверхности
белковой молекулы и изменению строения электронной оболочки
субстрата. С точки зрения мультиплетной теории такое
взаимодействие было рассмотрено Баландиным [58, 59]. В результате
молекула субстрата оказывается как бы растянутой на «дыбе»,
активационный барьер реакции понижен.
Конечно, помимо понижения барьера вследствие
взаимодействия с активными группами фермента имеется понижение,
вызванное появлением упругой энтропийной силы. Однако этот
вклад незначителен — модуль энтропийной упругости всегда
очень мал (стр. 148). Энтропийная упругая сила не может
разорвать или существенно деформировать химическую связь. В то
же время изменение энтропии белка вследствие его конформа-
ционного изменения существенно влияет на энтропийный
профиль реакции.
Как только прошла реакция, происходит десорбция —
фермент как бы «выстреливает» продуктами реакции, действуя
подобно рогатке- Избыточная, по сравнению с присущей
исходному состоянию фермента, тепловая энергия уходит в
окружающую среду, и весь процесс может начаться заново.
Это — качественная модель, исходящая из общих принципов
современной физики макромолекул. Особенности белкового
катализатора, отличающие его от обычных гетерогенных
катализаторов, связываются здесь с кооперативными конформацион-
ными свойствами полимерной цепи.
Количественная теория, основанная на такой модели, еще
не разработана. Мы встречаемся здесь со значительными
трудностями. Прежде всего не разрешен основной вопрос: в какой
мере универсален механизм действия ферментов? Существует
ли единая физика для всех ферментативных реакций или
различные ферментативные процессы имеют и разную физическую
природу? Несмотря на обилие экспериментального материала
в этой области, он пока что недостаточен для ответа на этот
вопрос. Поэтому динамическая концепция действия ферментов
сегодня должна рассматриваться как гипотеза. Ценность ее
заключается в том, что она позволяет сделать ряд выводов,
подлежащих экспериментальной проверке. Одно из интересных
следствий гипотезы относится к поведению фермента в поле
внешней силы. Если растянуть молекулу фермента, набор ее
конформаций должен измениться. А это означает, что должна
измениться и ферментативная активность. Пока неясно, в
каком эксперименте можно осуществить растяжение, но
принципиальной невозможности здесь нет. С другой стороны, эта идея
26 М. В. Волькенштейн
402 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
может быть исдользована в теории мышечной деятельности
(см. стр. 449).
Трудности создания модельной теории действия ферментов
определяются сложностью сочетания термодинамических,
кинетических и структурных факторов. Должно быть исследовано
взаимодействие гетерогенной, апериодической макромолекулы с
субстратом. Оно осуществляется в открытой системе. Задача
теории состоит в количественном объяснении понижения акти-
вационного барьера для реакции субстраты — продукты, т. е.
задача в основном кинетическая. Следовательно, методы
статистической физики, применимые к системам, находящимся в
термодинамическом равновесии, здесь недостаточны (ср. [39]).
В несколько ином плане идея о флуктуациях в
макромолекуле была применена для объяснения ферментативной,
активности в работах Кирквуда [60, 61]. В них рассматриваются
флуктуации электрических зарядов в макромолекуле. При
данном рН среды распределение зарядов по цепи
полиэлектролита может происходить различными способами. Если эти
распределения мало разнятся по свободной энергии, то заряды
флуктуируют. Введение субстрата отбирает подходящее
распределение зарядов, приводя к специфическому
электростатическому взаимодействию фермент — субстрат. На этой основе
удалось провести расчеты влияния рН на константы,
определяющие активность ферментов в удовлетворительном согласии
с опытом. Теория Кирквуда не может, однако, считаться
доказанной. Она применена лишь к частным случаям, в ней не
учитываются флуктуации конформаций самой структуры.
Количественные расчеты сомнительны, так как в них используются
величины, непосредственно неизмеряемые на опыте — в частности,
локальная диэлектрическая постоянная.
В целом специфическая каталитическая способность
ферментов определяется рядом факторов, с особенной четкостью
указанных Браунштейном [62].
1. Высокая степень сродства фермента и субстрата, т. е.
большая вероятность образования комплекса £S, эквивалентна
в обычных условиях резкому увеличению концентрации
реагентов (эффект сближения).
2. Строгая взаимная ориентация реагентов, кофакторов и
активного центра фермента (эффект ориентации). В обычных
гомогенных реакциях вероятность строгой ориентации трех или
более взаимодействующих молекул очень мала.
3. Воздействие в контактном участке комплекса ES нуклео-
фильных и электрофильных групп активного центра (эффект
синхронного внутримолекулярного яислотно-рсновного ката-*
диза),
ПРИРОДА ДЕЙСТВИЯ ФЕРМЕНТОВ 403
4. В итоге этих трех эффектов резкое увеличение
абсолютной скорости реакции в результате замены маловероятных
реакций высшего порядка, требующих соударений трех и более
молекул, высокоэффективными реакциями первого порядка —
реакциями внутримолекулярного полифункционального
катализа.
5. Активация субстрата путем перераспределения
электронной плотности под действием электроактивных групп фермента
(эффект поляризации).
И, наконец, то, о чем больше всего говорилось:
6. Изменение конформации белка при взаимодействии с
субстратом (эффект индуцированного контакта).
Можно думать, что последний эффект и определяет
возможность всех предыдущих.
Весьма важной для науки и техники задачей явилось бы
искусственное моделирование фермента синтетическим
полимерным катализатором. Если бы это удалось, то открылся бы путь
для получения катализаторов, обладающих исключительно
высокой активностью и специфичностью, работающих в обычных
условиях — без применения высоких температур и давлений.
Это означало бы подлинную революцию в химической техно-*
логии.
На какой же основе может развиваться работа по созданию
моделей ферментов? Для этого необходимо исследование
химических свойств полимеров, прежде всего реакций в цепях, пока
еще почти совсем не изученных в смысле количественной
кинетики и термодинамики. Дело в том, что функциональная группа
макромолекулы имеет фиксированные соседние группы и
поэтому ее химическая реакционная способность должна
отличаться от реакционной способности аналогичной группы в
малой молекуле. Должна отличаться также и каталитическая ак*
тивность (см. сказанное о действии гидроксипиридина на
стр.398).
Химия полимеров позволяет подойти к пониманию
ферментативной активности и с другой стороны. Так называемая
стерео-специфическая полимеризация, приводящая к образованию
изотактических полимеров (стр. 146), осуществляется на по*
верхности твердых катализаторов. Поверхность эта
асимметрична, что и позволяет создать определенную пространственную
конфигурацию полимерной цепи [63]. Асимметрия активного
центра фермента приводит к стереоспецифическому течению
катализируемой реакции. С помощью меченых атомов доказано,
что реакции молекул типа СААВВ происходят на поверхности
фермента асимметрично. Это относится, в частности, к
превращению амино-малоновой кислоты (содержавшей меченый
26*
404 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
углерод в одной из двух карбоксильных групп) в глицик
С*ООН
I
H2N-C—H -
I
соон
с*оон
I
H2N—С—Н
I
н
Рис. 160. Асимметричный
комплекс фермент — субстрат.
Реакция проходит только в одной группе, химически и
геометрически неотличимой от другой. Это объясняется
асимметрией поверхности фермента
(рис. 160). Так как группы Y и Z
фермента различны, реакционная
способность двух карбоксилов
неодинакова [49]. Таким образом,
изучение стереоспецифического
катализа при полимеризации дает
ценную информацию о
возможном механизме стереоспецифич-
йости ферментов.
Из сказанного следует, что
ферменты прекрасно различают
стереоизомеры и оптический
антипод данного субстрата
субстратом уже не является. Так как
ферментативные реакции
представляют собой основу жизни, естественно, что в ходе
биохимической эволюции произошел отбор стереоизомеров всех
веществ— необходимых участников метаболизма.
АЛЛОСТЕРИЗМ И ОКСИГЕНАЦИЯ ГЕМОГЛОБИНА
Мы уже не раз упоминали об аллосгеризме. Это,
по-видимому, одно из важнейших явлений в биохимии. В нем ярко
выражаются кооперативные свойства макромолекулы фермента.
Простые соотношения стационарной кинетики Михаэлиса —
Ментен (8.10), (8.18), (8.21) далеко не всегда соблюдаются.
Вместо кривой рис. 151, подобной изотерме Лэнгмюра для
адсорбции газа твердой поверхностью, в ряде случаев
наблюдаются кривые с перегибами (рис. 161) и даже с максимумами.
Была сделана попытка объяснить такой ход кривых тем, что
одна молекула субстрата взаимодействует с двумя или
большим числом молекул фермента. Это объяснение оказалось
несостоятельным— реакция идет при большом избытке субстрата
(только в этих условиях можно пользоваться теорией
Михаэлиса и отмечать отклонения от нее), вероятность тройных соуда-
АЛЛОСТЕРНЗМ И ОКСИГЕНАЦИЯ ГЕМОГЛОБИНА 405
рений указанного типа при этом ничтожно мала. Не спасает
эту идею и попытка рассматривать реакцию взаимодействия
субстрата с двумя участками (или большим числом участков)
активного центра фермента, как бимолекулярную [64]. В
действительности реакция S с Е мономолекулярна, и строгий
расчет приводит вновь к уравнению типа (8.10) [65].
Истинные причины «аномальной» кинетики заключаются
в кооперативном взаимодействии нескольких активных центров
фермента. Если молекула
фермента присоединяет две или и
большее число молекул
субстрата двумя или большим числом ""
активных центров и если
присоединение S и реактивность
комплекса ES в данном активном
центре зависят от
присоединения S другими активными
центрами, то получаются кривые v(S)
с изгибами и максимумами. Речь
идет, таким образом, о взаимо- рис. 161. Кривая v(S) при неми-
действии активных центров, ко- хаэлисовой кинетике,
торое может осуществляться
посредством конформационных изменений макромолекулы.
Строгий математический анализ подтверждает эти соображения [65].
По ходу кинетических кривых можно тем самым судить об
интимных процессах, протекающих в белке при адсорбции
субстрата.
Явление аллостеризма имеет непосредственное отношение
к сказанному. Синтез метаболита, например аминокислоты,
в клетке происходит ступенчато, с участием ряда ферментов.
Как было впервые показано Новиком и Сцилардом [66],
зачастую конечный продукт всей этой цепи реакций — метаболит —
ингибирует активность первого фермента, катализирующего
первую реакцию цепи (см. [67, 68]). В этом и состоит аллосте-
рический эффект. На рис. 162 приведена (неполная) схема
синтеза ЦТФ в клетке Е. cotL Конечный продукт, ЦТФ,
ингибирует действие первого фермента — аспартата транскарбами-
лазы (АТК). Существенно и удивительно то обстоятельство,
что ЦТФ структурно не сходен с субстратами АТК и,
следовательно, не является обычным конкурентным ингибитором.
Между тем ингибирование имеет конкурентный характер.
Схема кинетических процессов аллостерического ингибирова-
ния показана на рис. 163. Обычно аллостерическое торможение
связано с влиянием ингибитора на взаимодействие единиц
белка [69], см. также [65].
406 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Общее объяснение аллостеризма предложено Жакобом и
Моно [70], {69]. Согласно этой простой и наглядной картине,
•аллостерический ингибитор индуцирует общее изменение
формы белковой молекулы таким образом, что становится
невозможным создание динамического соответствия Е и S по Кош-
ланду (рис. 164). Такое изменение свидетельствует о
кооперативном конформационном превращении макромолекулы.
,0
-0-С* А %
т f Annnnt
У
о-
/тг + / г л "г Щ СК2
t« Р^ j. u м /и Лспартат л / / 6 ш
Ю—С + H3N—СН f\ > 0=С /и + Н
N) 0 р Транснарбсшшюза 4n^V . u
к- -л >«» а-
Нарбамилфосфат Acnapmam /1 J Карбамид
' ' / аспартат
ЦТФ
Рис. 162. Обратная связь в реакции синтеза ЦТФ,
Важное значение аллостеризма состоит в том, что им
обеспечивается обратная связь в биосинтетических процессах.
..-Метаболит регулирует свой собственный уровень в клетке,
воздействуя на исходный фермент. Есть основания думать, что
.аллаедеризм лежит в основе ряда регуляторных процессов,
рассмотренных выше (стр. 354).
Вернемся к свойствам АТК. Кинетика реакции, приводящей
:к образованию карбамиласпартата (рис. 161), немихаэлисова,
на кривой зависимости v(S) есть перегиб. Это означает, что
• фермент имеет несколько взаимодействующих друг с другом
.активных центров или (что в смысле кинетики то же самое)
-.состоит из нескольких субъединиц. ЦТФ ингибирует АТК, из-
. *
АЛЛОСТЕРИЗМ И ОКСИГЕНАЦИЯ ГЕМОГЛОБИНА
407.
меняя взаимодействие субъединйц фермента таким образом,
что активность его понижается и кинетика становится михаэ-
лисовой [68]. Аллостерический ингибитор влияет на
кооперативные конформационные (1>
взаимодействия в макро- {*
молекуле белка. '* п
Интересным аналогом
фермента, состоящего из
взаимодействующих
субъединиц, является
гемоглобин. Гемоглобин,
конечно, не фермент, его
роль не каталитическая,
он служит переносчиком
кислорода. Но
присоединение к нему молекул
кислорода подобно
образованию комплекса
фермент-субстрат. Группы
групп.
Молекула гемоглобина состоит из четырех субъединиц,
каждая из которых содержит гем, Таким образом, молекула
Рис. 163. Схема стационарного процесса
с аллостерическим торможением.
F1 ,..., г* — ферменты соответствующих стадий
реакции, 5,
Sn — метаболиты, 5 — аллостери^
ческий ингибитор.
гема играют роль простетических.
0 J
IXIj
СЮ
Рис. 164. Схема, поясняющая явление аллостеризма.
гемоглобина способна присоединить четыре молекулы
кислорода. Отдельно взятая субъединица подобна молекуле миог-
глобина, как это доказано методом рентгеноструктурного ана-.
лиза, с помощью которого установлено строение этих двух важ-.
ных белков (стр. 200). Взаимодействие гемоглобина с кислоро-.
дом происходит кооперативно — изотерма реакции
НЬ + 402 <=± НЬ08
не сходна £ раедермой Лэнгмюра, но имеет резкий церегиб при
рпределенном рарциадоном давлении кислорода; р-кривая
S-образна, подобна изображенной на рис! 161, с тем ртличием,
Нто по оси ординат отлоэ^ер процент оксигенации, а по
оси
408 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
абсцисс — р. Эмпирическое уравнение, описывающее эту
изотерму, имеет вид (Хилл):
v — АрП (8.22)
где /г^2,8. В то же время изотерма для миоглобина
одной субъединицы гемоглобина — лэнгмюрова:
Г'
Вр
1 + Вр-
аналога
(8.23)
При оксигенации (не окислении, так как присоединяются
целые молекулы СЬ координационными связями) гемоглобина
наблюдается эффект Бора — отщепление протонов в цепи
белка. В случае миоглобина эффект Бора отсутствует. Полинг
показал, что кривая (8.22) действительно объясняется
кооперативным взаимодействием субъединиц гемоглобина при его
оксигенации [71].
Приведем расчеты в модифицированной форме. Четыре субъединицы
гемоглобина имеют примерно тетраэдрическое расположение. На
промежуточных стадиях оксигенации имеется набор молекул, приведенный в табл. 33.
Таблица 33
К расчету равновесия НЬ + 402
Тип молекул
нь
ньо2
ньо4
ньо6
ньо8
Статистический
вес
1
4
6
4
1
Относительная
свободная
энергия
0
-зл
—ЗЛ—3^2
—6F2
Здесь во втором столбце указано число способов присоединения кислорода:
F\ — свободная энергия взаимодействия субъединицы, содержащей кислород
со свободной субъединицей; F% — свободная энергия взаимодействия двух
субъединиц, содержащих кислород. F\ и F2 включают изменение свободной
энергии кислорода. Обозначив
получаем выражение для статистической суммы системы
Q = 1 -J- 4а3 + 6а4* + 4а3*3 + Ь*.
Предположим, что F2 = 2FV Тогда
9 = (1 + а»г.
(8.24)
(8,25)
АЛЛОСТЕРИЗМ И ОКСИГЕНАЦИЯ ГЕМОГЛОБИНА 409
На присоединенные молекулы кислорода приходится статистическая сумма
Q' « 4а3 + 2 • №Ь + 3 • 4аЧэ + 46е, (8.26)
и при F2 =• 2^i
Q'=:4a3(l + a3)3. (8.27)
Средняя степень оксигенации, согласно (8.25) и (8.27), равна
*~ 4 Q ~~ 1 + а3'
и так как
F2 = F'2 + 2kT\np,
а пропорционально р.
Мы получили уравнение Хилла (8.22) с п = 3 вместо 2,8. Тем самым
показано, что в гемоглобине имеются парные взаимодействия субъединиц.
Величина
р'/кТ
А = е ll (8.30)
характеризует свободную энергию этого взаимодействия.
В 1935 г., когда Полинг провел сходные расчеты, еще
ничего не было известно о конформациях макромолекул. Поэтому
представлялось неясным, каким образом могут
взаимодействовать гемы, далеко отстоящие друг от друга. Сейчас есть все
основания предполагать, что эти взаимодействия
осуществляются посредством конформационных перестроек белковых
цепей, вызванных изменениями электронного состояния гемов
при их оксигенации. Об этом же свидетельствует эффект Бора.
Электронные состояния гема рассмотрены, в частности, в книге
Блюменфельда [72]. Дальнейшие подробности, относящиеся
к оксигенации гемоглобина, см. в статьях [73—75].
Мурхэд и Перутц [76] доказали изменение четвертичной
структуры гемоглобина при оксигенации непосредственно, с
помощью метода рентгеноструктурного анализа. Различают а- и
р-субъединицы гемоглобина. При оксигенации расстояния
между атомами железа некоторых гемов уменьшаются на 7 А
(Pi — Э2 с 40,3 до 33,4 A, Pi —а2 с 37,4 до 30,4 А). По меткому
выражению Энгельгардта, сама молекула гемоглобина
«дышит», изменяя свои размеры. Метод рентгенографии пока не
позволил, однако, установить, изменяется ли третичная и
вторичная структуры белка при оксигенации гемоглобина. Такие
изменения представляются весьма вероятными. И миоглобин и
гемоглобин обнаруживают аномальную дисперсию оптической
активности в полосе поглощения гема. На рис. 165, а и 165,6
показаны изменения аномальной дисперсии оптической
активности при оксигенации миоглобина и гемоглобина [77]. В то
(8.28)
(8.29)
410 ГЛ. S. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
| |" 111 $ * I I 8 I
*ч »ч ^ | , t t
I
I
X «
со
АЛЛОСТЕРИЗМ И ОКСИГЕНАЦИИ ГЕМОГЛОБИНА 411
время как у миоглобина форма кривой и вращательная сила
практически не меняются (/?мь=0,74-10"38, /?мьо2-0,85«10"38),
у гемоглобина при оксигенации происходит появление второй
аномалии на кривой аномальной дисперсии оптической
активности; вместо /?нь —1.10-10"38 следует принять два значения
Яньо8, равные 2,10-10~38 и —0,68-10-38. Эти интересные факты,
возможно, свидетельствуют о конформационном изменении
белка, но для окончательного решения проблемы необходимы
детальные расчеты оптической активности, требующие
преодоления серьезных трудностей (стр. 235).
Таким образом, свойства гемоглобина заслуживают
пристального внимания. Многие задачи здесь еще не решены.
Гемоглобин— важный аналог аллостерических ферментов, его
изучение несомненно прольет свет на их природу.
Мы рассмотрели пока что три явления структурных
соответствий, играющих важнейшую роль в биологии. Это, во-
первых, соответствие дополнительных антипараллельных цепей
в ДНК, соответствие ДНК с матричной РНК и соответствие
матричной РНК с транспортной РНК, несущей аминокислоту.
Это, во-вторых, соответствие антиген — антитело. И, наконец,
соответствие фермент — субстрат. Во всех случаях
взаимодействие осуществляется с определенными конформациями
макромолекул, для возникновения которых существенна первичная
структура и определяемые ею высшие уровни структуры. Для
взаимодействия оказывается необходимой пространственная
близость атомных групп; при этом условии относительно
слабые силы нехимического характера — ван-дер-ваальсовы силы,
электростатические силы, водородные и гидрофобные связи —
обеспечивают значительный выигрыш свободной энергии.
Можно сказать, что принцип структурного соответствия универсален
в молекулярной биофизике.
Именно кооперативные конформационные превращения
белков определяют посредством изменения структурных
соответствий регуляторные процессы в клетках. Лабильность
белковой молекулы позволяет ей «узнавать» различные метаболиты
и соответственно изменять свое поведение. Это особенно ярко
демонстрируется явлением аллостеризма. В то время как в
кибернетических машинах передача информации осуществляется
посредством электризации или намагничения, в организмах
она происходит путем структурного соответствия. Речь идет
именно об «информационных», а не об энергетических
процессах— при изменении конформации макромолекулы ее энергия
меняется незначительно, а энтропия — существенно. Так, ин-
гибирование фермента при аллостеризме означает переход
негэнтропии в информацию (см. стр. 40). В сущности сходный
412 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
характер имеет копирование ДНК молекулами М-РНК, да
и сама редупликация ДНК. Передача «структурной
информации» результирует в соответствующих энергетических
процессах, «структурная информация» является своего рода
сигналом. В дальнейшем будет развиваться общая теория
биологических регуляторных процессов, основанная, с одной
стороны, на представлениях молекулярной физики и физической
химии и, с другой стороны, на идеях теории информации.
В последних параграфах этой главы мы рассмотрим
некоторые другие предполагаемые или установленные случаи
структурных соответствий в молекулярной биофизике.
НУКЛЕОПРОТЕИДЫ И СИНАПСИС ХРОМОСОМ
Высокомолекулярные нуклеиновые кислоты ДНК, рибосом-
ная РНК фигурируют в клетке не в виде чистых веществ,
а в комплексах с белками — в нуклеопротеидах. Комплекс
ДНК с белком — дезоксинуклеопротеид (ДНП), комплекс РНК
с белком — рибонуклеопротеид (РНП).
Основным веществом хромосом является ДНП. ДНК
соединена с белками щелочного характера — с протаминами
(в сперме рыб) или с гистонами (в других случаях). Имеется
также некоторое количество негистонного кислого белка.
Щелочные свойства гистонам и протеинам придают содержащиеся
в них основные аминокислотные остатки — Apr и Лиз:
I I
СО + СО
I лт2 1 +
СН (СН2)3 СГ СН (СН2)4 NH3
I XNH2 |
NH NH
I I
Apr Лиз
Протамины — сравнительно простые белки с 9
молекулярными весами порядка 4000—10 000. Две трети всех
аминокислот протамина — аргинин. Остальные аминокислоты не имеют
основного характера и фигурируют в цепи протамина парами.
Связь протамина с ДНК электростатическая. Положительно
заряженные амино-группы протаминов взаимодействуют с
отрицательно заряженными фосфатными группами ДНК. Это
доказывается тем, что комплекс ДНП полностью диссоциирует
при концентрации NaCl больше 1 М — место амино-группы
занимает Na+, место фосфатной группы — СГ [78].
Рентгенографическое исследование дезоксинуклеопротамина
показало, что относительно короткие цепи протамина обвц*
НУКЛЕОПРОТЕИДЫ И СИНАПСИС ХРОМОСОМ 413
ваются вокруг двойной спирали ДНК, располагаясь в
неглубокой борозде на ее поверхности (рис. 166). При этом остатки
Apr располагаются у фосфатных групп, а остальные
аминокислоты лежат парами в складках полипептидной цепи,
образуя петли, если к этому вынуждает геометрия. Расстояние
между нуклеотидами в ДНК 3,4 А такое же, как и период
полипептидной цепи в р-форме.
Следовательно, протамин фигурирует в ДНП
в р-форме. Аминокислоты в петлях,
вероятно, взаимодействуют с азотистыми
основаниями ДНК [79]. Таким
образом, и здесь речь идет о структурном
соответствии — в данном случае ДНК
и протамина.
Сходное взаимодействие
реализуется и в нуклеогистонах. Гистоны—
белки с молекулярным весом более
10000, содержащие около 30%
основных аминокислот. По-видимому,
гистоны связывают друг с другом
различные молекулы ДНК, различные
двойные спирали. Нуклеогистон,
выделенный из тимуса теленка, имеет
молекулярный вес 18,5-106, он
содержит ДНК с молекулярным весом
18-Ю6. Зубей и Доти считают такой
нуклеогистон фундаментальной внут-
рихромосомной структурой [80]. рис. 166. Строение дезокси-
Роль протаминов и гистонов пока нуклеопротамина.
не выяснена. Функция хромосомы
заключается в хранении генетической информации, ее передачи
путем синтеза М-РНК и ее воспроизведения путем
редупликации. Казалось бы, что все это может быть обеспечено
молекулами ДНК, как таковыми. Действительно, ДНК хранит
генетическую информацию и редуплицируется даже in vitro. Гистоны
и протамины несомненно участвуют в редупликации хромосомы.
Как уже говорилось, гистоны влияют на синтез М-РНК,
регулируют активность генов (стр. 363).
Комплексы ДНП хромосом представлены спирализованными
нитями диаметром в 20 А. Из этих нитей строятся
микрофибриллы— волокна диаметром 200 А. В свою очередь
наблюдаемые уже под микроскопом элементарные составные части
хромосом— хромонемы — имеют толщину 0,5—1 \i и состоят из
множества микрофибрилл. Таким образом, хромосома
содержит целую иерархию структур. Как уже говорилось, измерение
414 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
Белой
РНК
Рис. 167.
Схема
строения
вируса
табачной мозаики.
дихроизма красителей, поглощенных хромосомами, показывает,
что оси двойных спиралей ДНК параллельны оси ДНП и оси
хромосомы.
В построении хромосомы существенную роль играют
двухвалентные ионы Са++ и Mg++. Вещества, образующие с этими
ионами комплексные (так называемые хелатные)
соединения, расщепляют хромосомы морского ежа
на частицы длиною 4000 А и толщиной в 200 А —
микрофибриллы или их отрезки.
Хромосома сходна с частицей бактериофага в
том отношении, что содержит ДНК (видимо, в
сердцевине) и белок (видимо, в качестве внешней
«обмотки»). Напротив, рибосомы, состоящие из
РНП, похожи на частицы растительных вирусов.
Последние могут рассматриваться как молекулы
РНП. Частица вируса табачной мозаики
представляет собой цилиндр длиною 3000 А и диаметром
170А, ее молекулярный вес 4-Ю7. Она содержит
6% РНК с молекулярным весом 2,5* 106 в виде
одной спиральной молекулы диаметром 80 А. РНК
«обмотана» белком, состоящим из 2300 субъединиц
с молекулярным весом 17000. На рис. 167
показана схема белковой «обмотки» вируса табачной мозаики, на
рис. 168 приведена ее молекулярная модель.
Известные науке вирусы растений и животных представляют
собой симметричные геометрические структуры — цилиндры или
сферы. Их общие геометри- _
ческие свойства были про- елои
анализированы Криком и
Уотсоном [81]. Регулярное
строение получается в
результате упаковки
идентичных единиц — молекул
белка — вокруг нуклеиновой
кислоты. Характерно, что
сферические вирусы
образуют кубические кристаллы.
Основное структурное
требование состоит в создании
белковой оболочки,
предназначенной, по-видимому, для
защиты наследственного
вещества— вирусной РНК — от внешних воздействий. Можно
думать, что ту же роль играют гистоны и протамины в
хромосомах. Оболочка цо необходимости должна быть достаточно
РНК
Рис. 168. Белок в вирусе табачной
мозаики.
НУКЛЕОПРОТПИДЫ И СИНАПСИС ХРОМОСОМ 415
большой, й оказывается «удобнее» построить ее из большого
числа одинаковых малых белковых молекул, чем из немногих
больших цепей. Можно показать теоретически, что малые
молекулы должны организоваться именно в шары или цилиндры.
Число малых молекул белка в цилиндрической оболочке
неограниченно, в сферической оболочке кратно 12. Дело в том, что
г) д) е) ж)
i —a QP Ф @
3) U} Н) Л)
L* ^
Один микрон
Рис 169. Схематическое изображение различных вирусов и фагов.
а) вирус Vaccinia; б) вирус пустулезного дерматита; в) свинка; г) Т-четны» фаг; д) герпес;
е) Tipula iridescent; ж) инфлуэнца; з) вирус табачной мозаики; и) аденовирус; к) полнома;
д) полиомиелит.
в сущности речь идет не о сфере, а о высокосимметричном
многограннике— октаэдре, додекаэдре, икосаэдре. Характерно, что
и головки бактериофагов, имеющих, вообще говоря,' более
сложное строение, чем вирусы, представляют собой в ряде случаев
такие многогранники. На рис. 169 показаны в едином масштабе
структуры различных вирусов и фагов [82].
Имеются данные, указывающие на то, что структурные
соответствия существенны для сорбции фага поверхностью
бактериальной клетки.
Спирин и Киселев выяснили ряд факторов, относящихся
к строению рибосом [83]. Удалось развернуть рибосомы в
длинные гибкие ленты РНП. Для этого рибосомы 70 S
обрабатывались 0,5 М NH4C1 и затем помещались в раствор малой ионной
413 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
силы — без ионов Mg++. Развертывание обратимо; ионы Mg++
воссоздают рибосому.
Электронно-микроскопическое исследование свернутых и
развернутых рибосом показало, что структурной основой каждой
рибосомной субъединицы (50 S и 30 S) является
макромолекула РНК с непрерывной полинуклеотидной цепью, образующей
многочисленные короткие двуспиральные участки за счет
взаимодействия смежных секций цепи. РНК соединена с гистоно-
подобным структурным белком, локализованным в желобках
спиральных участков РНК и между этими участками. Такой
тяж РНП содержит 75% РНК и 25% белка. Он имеет диаметр
около 30 А и длину в несколько сотен А и свернут в компактную
структуру. Эти «прорибосомы» в свою очередь окружены
белком, удерживаемым с помощью ионов Mg++. Из «прорибосом»
формируются окончательные рибосомные частицы.
Надмолекулярная структура рибосомы определяется
взаимодействиями РНК и белка, в которых, вероятно, важную роль
играют структурные соответствия.
Таким образом, важнейшие элементарные надмолекулярные
структуры жизни — хромосомы, рибосомы, бактериофаги,
вирусы— состоят из нуклеопротеидов. Совершенно очевидно, что
изучение этих комплексов — одна из наиболее актуальных
задач молекулярной биофизики. Сделано в этой области пока что
немного, несравненно меньше, чем в области исследования
молекул нуклеиновых кислот и белков.
Имея общее представление о природе редупликации ДНК»
мы не имеем ясной картины удвоения хромосом. Главная
трудность состоит здесь в переходе от молекулярного к
надмолекулярному уровню организации. Можно думать, что принцип
структурных соответствий сыграет важную роль в расшифровке
механизма удвоения хромосом. Но все это пока лишь
предположения.
Рассмотрим теперь одну специальную проблему,
относящуюся к свойствам хромосом и уже давно привлекшую
внимание физиков. Речь идет о синапсисе или конъюгации хромосом.
При мейозе (клеточном делении, приводящем к образованию
гаплоидных половых клеток, стр. 58) в профазе происходит
попарное слияние тождественных хромосом. Процесс этот
замечательно точен и специфичен. Хромосомы соединяются «ген
к гену», гомологическими участками. В синапсисе хромосома
ведет себя как единое целое.
Здесь возникает физическая проблема (или, точнее, две
проблемы). Какие силы заставляют хромосомы, находящиеся на
больших (по сравнению с их размерами) расстояниях,
сближаться, а затем соединяться именно тождественными участ-
НУКЛЕОПРОТЕИДЫ И СИНАПСИС ХРОМОСОМ 417
ками? Представлялось заманчивым рассмотреть такой процесс
на основе простой физической модели Первую попытку в этом
направлении предпринял Иордан — физик-теоретик,
работавший в области квантовой механики [84, 85]. Его идея
заключалась в том, что между тождественными участками двух
гомологических хромосом действуют квантовомеханические
резонансные силы. О таком резонансе мы уже говорили (стр. 228).
Если одна из двух тождественных молекулярных структур
находится в возбужденном состоянии, то энергия возбуждения
может быть передана второй структуре, что приводит к общему
понижению энергии. Сила резонансного взаимодействия обратно
пропорциональна четвертой степени расстояния между
хромосомами. Тождество взаимодействующих структур является
необходимым условием резонанса. Таким образом, задолго до
создания молекулярной биологии Иордан предложил теорию, которая
несомненно относится к молекулярной биофизике.
Теория эта, однако, неверна. Основное возражение состоит
в том, что резонансные силы могут иметь существенное
значение для взаимодействия только в том случае, если заметное число
молекул возбуждено. Энергии возбуждения электронных
состояний молекулярных структур, образующих хромосомы, весьма
велики, они намного больше энергии теплового движения kT.
Поэтому доля электронно-возбужденных молекул в
действительности очень мала. Возбуждение колебательных состояний
тех же структур требует гораздо меньшей энергии, сравнимой
с kT9 но резонансное взаимодействие колебательных уровней
также очень мало — уже по другой причине. Дело в том, что
колебательные движения атомов связаны лишь с небольшими
изменениями распределения электрических зарядов, а в
конечном счете именно эти изменения и проявляются в резонансном
взаимодействии [86] (см. также [87]).
Джеле отказался от резонансного взаимодействия и
попытался объяснить притяжение гомологичных участков хромосом
межмолекулярным взаимодействием — дисперсионными силами,
определяемыми поляризуемостями (стр. 281). Действительно,
можно показать, что дисперсионное взаимодействие одинаковых
частиц больше, чем различных. Взаимодействие зависит от
близости поляризуемостей частиц, т. е. от частот в их электронных
спектрах (также и в колебательных, но их роль несущественна).
Силы дисперсионного взаимодействия обратно
пропорциональны седьмой степени расстояния между хромосомами [88,89].
К работам Джеле примыкают работы Зырянова [90]. При
помощи так называемого метода коллективных взаимодействий
Зырянов рассматривает в конечном счете те же
дисперсионные силы. Физическая картина взаимодействия состоит в
27 М. В. ВолькенштеЛи
418 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
следующем: хромосомы рассматриваются как электрически
нейтральные системы, но поскольку электроны и атомные ядра в
них не неподвижны, то ими создаются электромагнитные поля.
Движения электронов и ядер можно представить как
колебательные, с теми частотами, которые определяют поляризуемость.
Детальный математический анализ показывает, что между
электромагнитными полями двух систем возникает взаимодействие,
приводящее к их притяжению друг к другу. Величина сил
притяжения тем больше, чем ближе друг к другу наборы их частот,
эти силы максимальны при совпадении частот. Взаимодействие
и здесь имеет резонансный характер, но оно существует
независимо от наличия возбужденных состояний, так как и электроны
и ядра даже в невозбужденном состоянии не находятся в
покое и обладают отличной от нуля энергией. Теория Зырянова
является частным случаем общей теории взаимодействия
твердых тел, развитой Лифшицем [91].
В работах Зырянова рассмотрено также влияние
окружающей среды на взаимодействие между хромосомами. Среда
представляет собой водный раствор электролитов. Предполагается,
что между хромосомой и электролитом возникает контактная
разность потенциалов, поляризованное облако ионов. Эти
ионные облака, окружающие хромосомы, естественно создают
взаимное их отталкивание, конкурирующее с электромагнитным
притяжением. Если притяжение все-таки превалирует, то оно
может быть нарушено при изменении концентрации ионов.
Работы Джеле и Зырянова неубедительны. В них не
содержится попытки связать теоретические расчеты с конкретным
строением хромосом — с электрическими свойствами нуклеопро-
теидов. ДНП состоят из ДНК, содержащей в общем
однотипные пиримидиновыс и пуриновые основания, и белка,
содержащего не слишком разнообразные аминокислоты (67% аргинина
в протаминах). Никакой особой специфичности в спектрах
отдельных участков хромосомы ожидать поэтому не приходится.
Достаточно напомнить, что все уотсон-криковские пары
азотистых оснований характеризуются весьма близкими полосами
поглощения с максимумами у 260 m\i. Если говорить о цистро-
нах в целом, то их поляризуемости не могут сильно разниться.
Следовательно, дисперсионный, резонансный механизм не
объясняет преимущественного притяжения гомологических
участков. Наверняка разность энергий притяжения различных
участков хромосом меньше тепловой энергии kT и, следовательно, не
может обеспечить специфического взаимодействия — оно
нарушится тепловым движением. Тем более он не объясняет и
взаимодействия хромосом на больших расстояниях; найденные силы
быстро убывают с расстоянием.
НУКЛЕОПРОТКИДЫ И СИНЛПСИС ХРОМОСОМ 419
Мы встречаемся здесь с достаточно частой в теоретической
физике ситуацией. Теория предсказывает некое явление, и все
теоретические выкладки правильны. Но при количественном
расчете, при подстановке в соответствующие уравнения
величин, найденных на опыте, выясняется, что явление не
существует, так как величины энергии, силы и т. д. пренебрежимо
малы. Задача физической теории состоит не в качественном
объяснении, которое может быть обманчивым, но в
количественном истолковании наблюдаемых явлений.
Таким образом, удовлетворительной теории синапсиса
хромосом сейчас не имеется. Ясно, что для ее создания
необходима гораздо более подробная информация о строении
хромосом и состоянии клетки при мейозе, чем та, которой мы сегодня
располагаем. Можно высказать, однако, некоторые общие
соображения.
Прежде всего следует разделить проблему. Взаимное
притяжение хромосом на больших расстояниях вовсе не должно
быть специфическим. Важно, чтобы между хромосомами
действовали силы, медленно убывающие с расстоянием. Такими
силами могут быть либо электростатические силы
взаимодействия зарядов и диполей, либо гидродинамические силы,
возникающие вследствие течения жидкости между двумя
плавающими в ней массами. Рассмотрим второй эффект. Если
жидкость течет по трубе, то скорость течения жидкости
увеличивается в месте сужения трубы. При этом уменьшается давление
жидкости. В самом деле, всякий элемент жидкости, двигаясь по
токовой трубке с уменьшающимся сечением, должен
увеличивать свою скорость. Для этого на элемент должна действовать
сила в направлении его движения и, следовательно, давление на
передней границе элемента должно быть меньше, чем на задней
(см. [92]). Если между двумя хромосомами течет жидкость, то
давление между ними меньше, чем снаружи, и их толкает друг
к другу. Хорошо известно, что такие явления приводят к
столкновению кораблей.
Но существует ли движение жидкости, протоплазмы в
клетке? Оно было открыто еще в 1774 г. Корти. Движение
протоплазмы происходит, оно отличается большим разнообразием, и
его изучение представляет весьма интересную проблему [93]
(см. также стр. 458). В связи с синапсисом хромосом оно не
исследовалось. Поэтому можно лишь предполагать, что на
определенной стадии мейоза между хромосомами возникает ток
жидкости.
Электростатическое притяжение между хромосомами — в
целом нейтральными или одноименно заряженными — могло бы
осуществляться за счет изменения концентрации ионов между
27*
420 ГЛ. 8. БИОЛОГИЧЕСКАЯ СПЕЦИФИЧНОСТЬ И СТРОЕНИЕ МОЛЕКУЛ
ними — эффект, на который обратил внимание Зырянов. Если
на стадии синапсиса концентрация ионов в отталкивающихся
друг от друга ионных атмосферах хромосом убывает, то
хромосомы могут притягиваться друг к
другу.
Эти взаимодействия неспецифичны.
Но вот хромосомы достаточно
сблизились. Тогда нет причин искать здесь
исключения из принципа структурного
соответствия. Трудность состоит в том, что
хромосомы тождественны друг другу, а
не дополняют друг друга- Но если учесть
действие ионов, в особенности
поливалентных и гидратированных, то можно
наглядно представить себе
специфическое притяжение участков со сходным
профилем поверхности (рис. 170).
Известным подтверждением такого пред-
Рис. 170. Гипотетическая ставления является упоминавшееся ра-
модель синапсиса хромо- нее влияние удаления двухвалентных
сом. ионов на целостность хромосом —
удаление ионов Ga++ и Mg++ приводит к
расщеплению хромосом на микрофибриллы. Для образования
двойных полинуклеотидных спиралей также необходимо
присутствие ионов (стр. 260).
Все это только качественные соображения, однако они
могут послужить рабочей гипотезой для создания будущей
теории синапсиса хромосом.
СТЕРЕОХИМИЧЕСКАЯ ТЕОРИЯ ЗАПАХА
В заключение этой главы обратимся к явлению совершенно
иного характера — к восприятию запаха. Как мы увидим, оно
также, вероятно, сводится к структурным соответствиям молекул.
До недавнего времени обоняние представлялось наиболее
загадочным из всех чувств. Сетчатка глаза воспринимает
световые кванты, орган слуха — звуковые колебания. Осязание
означает восприятие механических воздействий, вкус —
химических (так, кислый вкус означает присутствие ионов Н+). Но что
воспринимает обоняние?
Были попытки связать запах с колебаниями молекул,
частоты которых попадают в инфракрасную область спектра.
Идея естественная — глаз реагирует на электромагнитные волны
в видимой области спектра, ухо—на звуковые колебания.
Почему бы носу не реагировать на инфракрасные? Однако эта
СТЕРЕОХИМИЧЕСКАЯ ТЕОРИЯ ЗАПАХА
421
гипотеза оказалась ложной — вещества со сходными
инфракрасными полосами поглощения имеют различные запахи и
наоборот. Более того. Носовая полость замкнута, это своего
рода абсолютно черное тело, и если в него попадают молекулы,
то их излучение должно находиться в термодинамическом
равновесии со стенками полости — колебания не будут
восприниматься. Возражение, состоящее в том, что равновесие
нарушается, когда мы втягиваем в нос струю более холодного
воздуха, несостоятельно. При температуре 37° С розы пахнут очень
сильно.
Для того чтобы обладать запахом, вещество должно быть
достаточно летучим. Далее, оно должно хотя бы в
минимальной степени растворяться в воде и в жирах — окончания
обонятельных нервов покрыты водяной пленкой и для проникновения
в нервные клетки нужно пройти сквозь клеточные мембраны.
Эти положения достаточно очевидны. Неясно другое. Чем
определяется тот или иной запах данного вещества,
удовлетворяющего указанным требованиям? Запахи весьма разнообразны
и несомненно зависят от строения молекул пахучего вещества.
Так, правый и левый оптические антиподы одного и того же
соединения имеют зачастую разный запах.
Монкрифф предположил, что и в этом случае справедлива
идея «замка и ключа», идея структурного соответствия. Оно
должно осуществляться между структурой молекулы пахучего
вещества и структурой некой полости в рецепторной клетке.
Руководствуясь этой идеей, Эмур провел исследования
запахов многих сотен органических соединений. Восприятие
запаха субъективно в отношении его оценки, как приятного или
неприятного. Тем не менее систематическая работа позволила
привести запахи в систему. Подобно тому, как имеются четыре
первичных вкуса — сладкий, соленый, кислый, горький, —
имеется семь первичных запахов. Это следующие запахи (в скобках
указаны примеры соединений):
1. Камфарный (камфара),
2. Мускусный (пентадеканолактон),
3. Цветочный (фенилметилэтилкарбинол),
4. Мятный (ментон),
5. Эфирный (дихлорэтилен),
6. Едкий, острый (муравьиная кислота),
7. Гнилостный (бутилмеркаптан).
Сопоставление структур веществ, обладающих этими
запахами, показало, что запах определяется не химическим
составом, а формой и размерами молекулы. Так, вещества,
характеризуемые камфарным запахом, имеют форму, близкую
Камфарный
W—^*
Мятный
Е-У. -.'Им» и J
Мускусный
Цветочный
-«-■ »-.:.!
(?;
Эфирный
*»«Л*.1#ЙЙЙЯ
«й-
Едкий
Гнилостный
Рис. 171. Структуры молекул и ячеек б рецепторных клетках для семи
основных запахов.
СТЕРЕОХИММЧЕСКАЯ ТЕОРИЯ ЗАПАХА
423
к сферической, с диаметром порядка 7 А, Примечательно, что в
эту группу попадают молекулы самого разнообразного
химического строения, например камфара СюН^О, гексахлорэтанС2С16,
дихлоридэтиламид тиофосфорной кислоты C2H6NG2SP и цикло-
октан CsHi6. Вещества с мускусным запахом имеют форму диска
с диаметром около 10 А. Для веществ с мятным запахом
помимо специфической формы (своего рода клин) необходимо
наличие группы атомов, способной образовывать водородную
связь в определенном положении.
На рис. 171 показаны структуры молекул и формы полостей
в рецепторных клетках, которые этим структурам соответствуют.
Едкий и гнилостный запахи определяются, по-видимому, не
столько структурой, сколько способностью соответствующих
молекул приобретать заряд — электрофильные вещества с малыми
размерами молекул имеют едкий запах (НСООН, SO2, CI2
и т. д.), нуклеофильные (H2S) —гнилостный. Сложные запахи
возникают в тех случаях, когда разные группы одной и той же
молекулы попадают в несколько различных полостей. Одно и
то же вещество может иметь различные первичные запахи, если
его молекулы могут разместиться в полостях различных типов.
Эти положения установлены на основе ряда косвенных и
прямых экспериментальных фактов. Проведены опыты над людьми,
лягушками, пчелами. Наличие различных рецепторных клеток
доказано непосредственно с помощью микроэлектродов.
Решающим доказательством теории, своего рода experiment
turn cruets, явился направленный синтез пахучего вещества
путем смешения нескольких веществ, обладавших первичными
запахами, соответствующими структуре их молекул.
Убедительны также опыты по изменению запаха в результате
изменения формы молекулы — замены водорода на метильную
группу.
Оригинальная работа Эмура, Рубина и Джонстона
опубликована в малодоступном журнале парфюмерной
промышленности [94]. Наше изложение основывается на популярной статье
этих же авторов [95],
Мы описали эту интересную гипотезу, включившую обоняние
в область молекулярной биофизики, с целью рассказать об еще
одном ярком примере, свидетельствующем об
общебиологическом значении структурных соответствий.
ГЛАВА 9
МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
ПРИРОДА МЕХАНОХИМИЧЕСКИХ ПРОЦЕССОВ
Мы рассмотрели две функции белка — каталитическую
(ферментативную) и защитную (иммунологическую). И то и другое
оказывается связанным с достижением структурного
соответствия белка с другой молекулой. Возможность структурного
соответствия в свою очередь определяется многообразием кон-
формаций, присущих макромолекулам белка. Эта глава
посвящена еще одной важнейшей функции белка — его механической
работе.
Поразительная особенность живых организмов и их
функциональных частей состоит в способности к движению, к
выполнению механической работы в условиях постоянных
температур и давлений. В каждой клетке, в каждом организме
заключен некий двигатель, чья работа выражается в делении и
движении клеток, в движении органов и организма как целого.
Какие-то силы растаскивают материнскую и дочернюю
хромосомы в разные стороны, создают самостоятельное движение
сперматозоида или инфузории, вызывают сокращение мышц,
когда писатель ведет перо по бумаге или боксер нокаутирует
своего противника. Является ли природа такого двигателя,
таких сил во всех случаях единой? Полного ответа на этот вопрос
еще нет, но скорее всего он будет положительным. Так или
иначе, все эти движения происходят без изменения температуры
и давления и рабочими веществами в них служат белки. Ясно,
что источником механической работы организмов и клеток
является химическая энергия, получаемая ими из внешней среды
в процессах питания и дыхания. В этом смысле живые системы
являются системами механохимическими.
В паровой машине или двигателе внутреннего сгорания
также происходит превращение химической энергии в
механическую работу. Однако превращение не непосредственное.
Сгорание топлива есть химическая реакция окисления, подобная
дыханию. Но для работы здесь используется не химическая
реакция, как таковая, а выделяемая теплота. Несущественно,
какие молекулы вступают в реакцию и какие получаются — лишь
ПРИРОДА МЕХАНОХИМИЧЕСК11Х ПРОЦЕССОВ 425
бы топливо обладало достаточно высокой теплотворной
способностью. Во второй стадии процесса теплота превращается в
работу, что возможно лишь при наличии перепада температур —
для действия двигателя наряду с нагревателем необходим
холодильник. Рабочее вещество теплового двигателя, скажем,
водяной пар, не испытывает химических изменений. Коэффициент
полезного действия тепловой машины всегда невысок — он
определяется разностью температур нагревателя и холодильника.
Напротив, в механохимической системе химическая энергия
превращается в механическую работу непосредственно, минуя
тепловую стадию. Соответственно нет надобности в перепаде
температур или давлений. Как же может происходить подобный
процесс?
Можно указать несколько способов превращения химической
энергии в механическую работу в системах, рабочими
веществами которых являются полимеры. Рассмотрим эти способы.
1. Полимерный гель может изменять свой объем в
результате набухания — взаимодействия с некоторым
низкомолекулярным растворителем. Изменение объема может быть
использовано для производства работы. Такого рода процессы, возможно,
имеют значение для движения протоплазмы.
2. Как уже упоминалось (стр. 185), при изменении заряда
полиэлектролита должна изменяться длина его цепи. Можно
проделать такой лекционный опыт: взять полиэлектролитное
волокно, приготовленное из полианиона, например из
полиакриловой кислоты, и натянуть его в сосуде таким образом, чтобы
верхний конец волокна был перекинут через блок и
удерживался грузом. Волокно погружено в жидкость. Будем добавлять
в нее раствор кислоты, понижая рН. Заряды полимерных цепей
волокна будут нейтрализоваться, и вследствие уменьшения
электростатического отталкивания уменьшатся расстояния
между звеньями цепи, а значит, и сократится волокно. Оно будет
поднимать груз, производить механическую работу. Очевидно,
что здесь химическое (электрохимическое) взаимодействие
приводит к прямому превращению химической энергии в
механическую работу.
Был предпринят ряд попыток объяснить мышечную
деятельность, исходя из представлений о полиэлектролитной природе
мышечного белка. Подробнее об этом см. далее.
3. Если полимерная цепь удлиняется путем полимеризации
или поликонденсации, т. е. включения в нее новых звеньев, а
к концам цепи прикреплены некоторые массы, то рост цепи
приведет к раздвижению этих масс, т. е. к механической работе.
Имеются данные, показывающие, что такого рода процесс и
обратный ему возможен при митозе,
426 ГЛ. 9. МЕХАИОХИМИЧЕСКИЕ ПРОЦЕССЫ
4. Набор конформаций полимерной цепи может изменяться
и без перезарядки, в результате иного химического или физико-
химического взаимодействия с другими молекулами. Это также
может вызывать изменение длины цепи и, следовательно,
производить работу.
Исходя из принципов термодинамики, мы приходим с
абсолютной необходимостью к выводу о возможности обратных
процессов— изменения химического состояния полимера под
действием внешней силы, превращения механической работы в
химическую энергию. Точно так же механическая работа может
быть превращена в теплоту — пустив тепловой двигатель в
«обратном направлении», мы превращаем его в холодильник.
Растягивая полиэлектролитное волокно грузом, мы изменим степень
его ионизации. Среди таких «обратных» процессов особый
интерес представляет ферментативная механохимия, пока не
реализованная экспериментально, но, возможно, играющая важную
роль в мышечной деятельности.
5. Растяжение полимерного катализатора внешней силой
должно приводить к изменению каталитической активности и,
следовательно, к изменению химического состояния системы.
Возможны ли аналогичные процессы в низкомолекулярных
веществах? Конечно, да, но в биологических системах они вряд
ли имеют значение. Если химическая реакция
низкомолекулярного вещества сопровождается изменением объема системы, то
химическая энергия может быть преобразована в механическую
работу. В двигателе внутреннего сгорания происходит реакция
окисления углеводородов. Однако изменение объема газа
определяется не непосредственным увеличением удельного объема,
а тепловым расширением — реакция идет с большим
выделением тепла.
Низкомолекулярное вещество может менять свой объем и
при изменении зарядов или поляризации молекул — явление
электрострикции. Соответствующие эффекты, однако,
невелики.
Существенно, что механохимия малых молекул может
определяться в основном изотропным изменением объема, в то время
как механохимия полимерных цепей связана с направленными,
анизотропными движениями.
Физический анализ механохимических процессов должен
начинаться, как и в других вопросах молекулярной физики, с
установления общих, феноменологических закономерностей,
независящих от конкретной природы рабочего вещества и
химических реакций. Термодинамика механохимических процессов
была развита Качальским и его сотрудниками {1].
ПРИРОДА МЁХАНОХИМИЧЕСКИХ ПРОЦЕССОВ
42?
В общем случае химических и тепловых превращений изменение
внутренней энергии системы выражается уравнением
dE = TdS — dA + %\itdnr
(9.1)
где dS—возрастание энтропии системы при температуре Г, dA —
механическая работа, производимая системой, йщ — количество молей /-ой
компоненты, вводимой в систему при химическом потенциале ц*.
Если система состоит из однородных волокон длины L и объема V,
растягиваемых силой /, то
dA=pdV — fdL (9.2)
и
dE^TdS-pdV + fdL + ^[xidnr (9.3)
Это общее выражение. В обычном механическом процессе, скажем, при
растяжении пружины, dS=0 (чисто механический процесс всегда
адиабатический), dV = 0, drii в 0. Следовательно,
dE = / dL. (9.4)
В обычной тепловой машине
dE=TdS — pdV%
и в изотермическом процессе dE =• 0, следовательно,
dA=pdV=TdS,
т. е. все тепло превращается в работу.
При изотермическом растяжении резины (ср. стр. 149)
dE^O, rfV=0, dnt = 0
dA=fdL = — TdS.
(9.7)
f
Наконец, в изотермическом меха-
нохимяческом процессе
dA^f dL^^^^tdnv
(9.8)
(9.5)
(9.6)
Построим рабочий цикл механо- Рис. 172. Механохимический цикл,
химической машины. Для простоты построенный из изофор и изопотен-
лредлоложим, что реакция происхо- циалов.
дит только с одной химической
компонентой и, следовательно, система имеет две степени свободы, описывается
двумя независимыми переменными ц и f, от которых зависит п и L.
Построим цикл в переменных f и L (рис. 172). Он будет образован изопотен-
циалами — линиями, отвечающими постоянному значению ц, и изофорами —
линиями, отвечающими постоянному значению п. Все точки изопотенциаль-
кой кривой могут быть получены из одного опыта, в котором зависимость
деформации L от напряжения / определяется в большом резервуаре с
постоянным химическим потенциалом ц. Очевидно, что изопотеициалы сходны с
изотермами, находимыми путем измерения механических изменений тепловой
428 ГЛ. 9, МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
машины, происходящих при ее контакте с большим резервуаром,
имеющим постоянную температуру, т. е, постоянный тепловой потенциал.
Напротив, изофоры, выражающие поведение изолированного волокна при
постоянном количестве реагирующего вещества, подобны адиабатам — кривым,
изображающим изменение состояния тепловой машины при постоянной
энтропии, т. е. в отсутствие теплообмена, Механохимический цикл, таким
образом, сходен с циклом Карно—ц играет роль Г, п играет роль 5,
Простейший механохимический цикл — машина, работающая между двумя
резервуарами с одной и той же реактивной компонентой при химических
потенциалах ц1 Ф цП. Работа выражается следующим образом (см. рис. 172):
Л = — mfdL= I \kdn-\- \ ц tf л =
= ц! С dn + ц» Г dn = (ц1 — цП) Дл, (9.9)
I И
Дя— количество реактивного вещества, отнятое от резервуара II и
перенесенное в резервуар I. Напомним, что в тепловой машине, в цикле Карно
Л = (Г! — Г2)Д5. (9.10)
Коэффициент полезного действия тепловой машины равен
Tl==zrr2- (9Л1)
Казалось бы, что можно написать по аналогии для механомехаиической
машины
П = ^- (9.12)
Однако это выражение лишено смысла, так как химический потенциал не
имеет абсолютного нуля. Поэтому отношение работы, полученной в цикле,
к «работе», введенной при более высоком потенциале ц! Д/г, зависит от
выбранного стандартного значения ц. Тем не менее можно ввести КПД меха-
нохимической машины в виде отношения работы, полученной в реальном
цикле, к работе, которая производится в обратимом круговом процессе:
&fdL
t,'-~"Ti~E • (9ЛЗ)
2и J ■*« dnt
Приведем, наконец, некоторые характерные термодинамические
соотношения, имеющие свои аналоги в тепловых процессах:
№.--№,•
и т. д.
Это —термодинамика. Какова же, однако, молекулярная природа мехаио-
механических процессов?
ПРИРОДЛ ЛШХАНОХИМИЧЕСКИХ ПРОЦЕССОВ
429
L,MM
Впервые механохиыические явления наблюдались Энгель-
гардтом и Любимовой на гелях миозина — белка, выделенного
из мышечного волокна [2]. При добавлении АТФ происходит
сокращение миозиновых волокон, имеющее обратимый характер-
Источником механической работы здесь является химическая
энергия, запасенная в макроэргической связи АТФ, так как при
взаимодействии с миозином АТФ дефосфорилируется (см.
далее стр. 434). В дальнейшем механохимические процессы
удалось наблюдать в уже
упомянутых системах —
волокнах и пленках из
синтетических
полиэлектролитов [3—5].
Пасынский и Блохина
впервые наблюдали
обратный процесс —
превращение механической
работы в
химическую—смещение изоэлектрической
точки белка (кератина)
при его деформации [6].
Воробьев исследовал
изменение рН среды при
механическом
растяжении находящегося в ней
нуклеогистонового
волокна [7].
Для механической
работы полимерной системы
необходимо наличие у нее способностей к обратимым
деформациям и к изменению формы отдельных молекул или
молекулярной системы в целом под действием внешней силы и
химического окружения. Изученные модельные системы и прежде всего
простейшие из них—полиэлектролитные — обладают этими
способностями. На рис. 173 показана циклическая деформация нити
нуклеогистона при периодическом изменении рН среды. На
рис. 174 — схема, поясняющая течение прямого и обратного
процесса превращения химической энергии в механическую работу
для полианионного волокна [7]. То обстоятельство, что
изменение длины полиэлектролитного волокна при изменении рН
связано с изменением конформаций цепей, представляется вполне
очевидным. Но детальный механизм соответствующих процес
сов далеко не тривиален.
Диссоциация и рекомбинация в полиэлектролитной цепи-
кооперативное явление. Константы диссоциации ионизуемы:
25 30 35 мин
Рис. 173. Циклическая деформация нити
нуклеогистона при периодическом
изменении рН среды.
430
ГЛ, 9, МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
групп в полимере отличаются от соответствующих констант в
мономере вследствие взаимодействия соседних заряженных
групп — их электростатического отталкивания. В свою очередь
отталкивание зависит от конформаций- цепи [8, 9]. Эти явления
находят свое выражение в кривых потенциометрического
титрования полиэлектролитов.
Существуют два рода влияний свободных зарядов на
свойства макромолекул в растворах [10]. Во-первых
—дальнодействие, т. е. взаимодействие зарядов, сильно удаленных друг от
друга вдоль цепи. Во-вторых —
близкодействие, т. е.
взаимодействие близкорасположенных
зарядов. Теория показывает, что
при не очень малых силах /,
достаточных для ориентации цепи
как целого, первый эффект не
играет роли и длина цепи
выражается уравнением (ср. стр. 166)
f ~2 (9Л6)
Н"
- Н'
X
Рис. 174. Схема механохимиче-
ского цикла для полианионной
системы.
3kT
hi
Здесь h0—средний квадрат
расстояния между концами цепи
с учетом одних только ближних взаимодействий. Эта величина
зависит, конечно, от степени ионизации а, т. е. от рН среды.
"2 dhl n
Если при увеличении а величина h0 растет, т. е. *^- > 0, то
полиэлектролитные цепи в поле постоянной силы растягиваются
при ионизации и сокращаются при уменьшении степени иониза-
dh
о
ции, если-з— <0, то все происходит наоборот. Второй случай
реализуется у синтетических полипептидов; h0 в области
перехода спираль — клубок убывает с ростом а, так как увеличение
степени ионизации разрушает вытянутую спиральную структуру.
Напротив, у синтетических атактических полианионов h0 растет
с ростом а. Конкретная зависимость h0 от а в общем случае
может быть представлена в виде [10]
feSW-™7". (9-17)
где Д£ — разность энергий взаимодействия свободных зарядов
в свернутой и вытянутой конформациях цепи. Очевидно, что ДЕ
МЫШЕЧНАЯ ДЕЯТЕЛЬНОСТЬ 431
есть мера кооперативности системы; если A£ = 0, цепь некоопе-
ративна, изменение состояния ионизации не влияет на
вероятность различных конформаций и, следовательно, длина цепи
при f=const не зависит от а. Знак производной —г-
определяется знаком Д£. Та же теория, основанная на учете
кооперативного взаимодействия зарядов, позволяет определить, как
должно изменяться рН среды при растяжении цепи.
Надо отметить, что описанный кооперативный механизм не
может считаться единственным — возможны также
полиэлектролитные механохимические процессы, определяемые изменениями
степени связывания ионов.
Таким образом, изменения конформаций цепи, вызванные
изменением химического окружения при воздействии постоянной
силы, производят механическую работу. Напротив, действующая
сила должна менять конформаций цепи. В работах Флори [12]
и Бирштейн [13] было рассмотрено влияние внешней силы на
переходы спираль—клубок в полипептидных цепях. Теоретическое
исследование одномерной модели, основанное на применении
метода, описанного ранее (стр. 164, 218) [13], показало, что
если приложенная внешняя сила не очень велика, то она
стабилизует спиральную конформацию цепи. Наоборот, большая
сила стабилизует конформацию сильно вытянутого клубка.
Смещение температуры перехода может достигать 20—30°;
острота перехода от силы практически не зависит. В заряженных
цепях не очень большая внешняя сила приводит к увеличению
степени диссоциации, вызывающей переход при фиксированной
температуре. При большой внешней силе степень диссоциации,
вызывающая переход, может быть меньше, чем в отсутствие
силы. В зависимости от величины приложенной силы при
переходе спираль — вытянутый клубок может наблюдаться как
увеличение, так и уменьшение размеров цепи в направлении силы.
Ряд выводов, следующих из статистического рассмотрения
механохимических процессов, подлежит дальнейшей
экспериментальной проверке.
МЫШЕЧНАЯ ДЕЯТЕЛЬНОСТЬ
С какими же механохимическими процессами мы встреча-
емся в клетках и организмах? Они достаточно разнообразны.
На клеточном уровне — это движение протоплазмы, движение
жгутиков и ресничек и, конечно, митоз и мейоз- На уровне
организмов— это мышечная деятельность животных и движения
растений (например, подсолнух поворачивает свой цветок
ц Солнцу),
432
ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
и////"-
'< t/i"'
e/ss/t
tfff*
Ядро
Начнем рассмотрение биологических механомеханических
процессов с мышечной деятельности. Естественно, что она
издавна интересовала ученых. Познакомимся с основными
фактами.
Существуют мышцы различного типа и поведения. Скелетные
мышцы позвоночных прикреплены к костям и контролируются
нервной системой.
Мышцы стенок желудка
работают непроизвольно, то
же относится и к
сердечной мышце. Мы будем
говорить дальше главным
образом о скелетной
мышце. Классическим
объектом
экспериментального исследования является
поперечно-полосатая
мышца лягушки — так
называемый сарториус.
Мышца состоит из пучков
волокон, каждое из
которых является очень
длинной клеткой, содержащей
много ядер и
обладающей клеточной стенкой,
именуемой сарколеммой.
Между мышечными
волокнами располагаются
капиллярные кровеносные сосуды. Схема единичного мышечного
волокна показана на рис. 175 {14]. Волокно расщепляется на так
называемые миофибриллы,
имеющие весьма
характерную структуру, хорошо
изученную с помощью
электронного микроскопа. Они
разделяются так называемыми
Z-мембранами на
отдельные цилиндрические
участки длиною примерно в
2,5 \i- Эти участки называются саркомерами. Среда внутри
миофибриллы — саркоплазма — содержит митохондрии и эн-
доплазматический ретикулум, как это и подобает
цитоплазме. Структура миофибриллы показана на рис. 176. На
рис. 177 приведен электронно-микроскопический снимок
миофибриллы.
Миофибриллы
Рис. 175. Схема строения
локна.
мышечного во-
Полоса А
А.
Н-зона
Рис. 176. Структура миофибриллы.
МЫШЕЧНАЯ ДЕЯТЕЛЬНОСТЬ 433
Как показывает экспериментальное исследование, все
основные сократительные свойства мышцы присуши отдельной мио-
фибрилле. В этом случае мы легко добираемся до клеточного
уровня. А раз так, то естественны поиски молекулярного
механизма мышечной деятельно-,,
сти. Нужно прежде всего
ознакомиться с
молекулярным составом и строением
миофибриллы.
(Основными веществами
мышцы являются, конечно,
белки. Они могут быть
разбиты на четыре группы.
Растворимые белки мышцы,
белки саркоплазмы,
участвуют в метаболизме, но не
в сокращении мышцы.
Белки гранул, входящих в
саркоплазму — митохондрий,
ядер и рибосом участвуют
в мышечной деятельности,
но не являются рабочим
веществом мышцы —
сократительными белками. Так
называемые белки стромы
входят в состав сарколеммы
и Z-мембран; это белки,
подобные коллагену, также
несократительные.
Сократительные мышечные белки —
фибриллярные. Они-то и
представляют наибольший
интерес [15]. Это, во-первых,
МИОЗИН— белок с молеку- рис. 177. Электронно-микроскопический
лярным весом 400000— снимок миофибриллы.
500 000, образующий диме-
ры с молекулярным весом 850000. Его молекулы сильно
асимметричны, имеют длину порядка 1600 А и ширину 37—47 А.
Второй важнейший белок — актин, фигурирующий в двух формах—
G-актин и F-актин. Молекулы G-актина—глобулы с
молекулярным весом порядка 57000 (в отсутствие ионов) или 70000
(в 0,6 М KJ). .F-актин полимеризуется в G-актин и образует
фибриллярный белок весьма большого молекулярного веса
(1,5—3'106). Переход G-актин — F-актин происходит в
присутствии солей. При смешении растворов актина и миозина полу-
28 М. В. ВолькенштеЙн
434 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
чается белковый комплекс — актомиозин с молекулярным весом
порядка 2« 107' 1 г актина взаимодействует с 4—5 г миозина,
что означает, что F-актин с молекулярным весом 3-Ю6
соединяется с 25—30 молекулами миозина.
Помимо этих двух белков, служащих рабочими веществами
в мышечной машине, миофибрилла содержит еще в
относительно малом количестве тропомиозин (молекулярный вес
порядка 60000) и парамиозин (молекулярный вес порядка
137000). Роль этих белков в мышечной деятельности неясна.
Замечательной особенностью миозина является его
ферментативная активность, обычно несвойственная фибриллярным
я
•7 ft 7 |
9йцтА
WMWWMWMMMMM
Миозин
Т 1 а
%.40Л
Рис. 178. Молекулярное строение миофибриллы.
белкам. Она была открыта Энгельгардтом и Любимовой,
показавшими, что миозин является АТФ-азой, он расщепляет АТФ,
извлекая из этого вещества энергию [2, 16].
Открытие советских биохимиков легло в основу всех
современных представлений о природе мышечного сокращения; оно
имеет важнейшее значение для молекулярной биофизики.
Актин не является АТФ-азой, но актомиозин обладает
соответствующей ферментативной активностью. Извлеченная
миофибрилла, погруженная в солевой раствор, содержащий ионы
Mg++, сокращается при добавлении АТФ —это очень наглядный
лекционный опыт. Ясно, что любая теория мышечной
деятельности должна учитывать роль АТФ, более того, необходимо
выяснить, не является ли эта роль определяющей.
Миозин и актин располагаются в миофибрилле весьма
специфическим упорядоченным способом. Хаксли и Хэнсон провели
детальное электронно-микроскопическое исследование миофиб-
рилл [17] (ср. рис. 177 и 179). Участок миофибриллы между
двумя Z-мембранами распадается на несколько зон (рис. 178).
Центральная зона (А) является анизотропной, двоякопрелом-
ляющей, к ней примыкают симметрично с двух сторон
изотропные зоны (/)• В поперечно-полосатой мышце миозин составляет
30—40%, актиц—10—J5% всего белка. Согласно Хаксли и
МЫШЕЧНАЯ ДЕЯТЕЛЬНОСТЬ
435
А
Рис. 179. Схема сокращения миофибриллы.
Хэнсон, в Л-зоне располагаются протофибриллы миозина
толщиной примерно в 100 А и длиной в 10 000 А, а между ними,
целиком занимая часть Л-зоны и /-зоны, находятся более
тонкие (диаметром 40А) протофибриллы актина. При сокращении
мышцы актиновые волокна вдвигаются между миозиновыми —
Л-зона не изменяет своих размеров, а /-зона уменьшается,
вплоть до полного исчезновения (рис. 179). Двойное
лучепреломление мышечного
волокна при этом умень- - /
шается — оно становится
более изотропным. Надо
отметить, что такое
толкование замечательных
электронно -
микроскопических картин не может
считаться однозначным и
окончательным [18, 19].
В результате
многолетних биохимических и
физиологических
исследований основные
химические явления,
происходящие при мышечном
сокращении, сейчас известны [20—22]. С самого начала надо
отметить чрезвычайную сложность процесса и большие трудности,
с которыми встречаются все попытки связать эти химические
явления в единую картину.
Мышца находится в покое. Этому состоянию отвечает
определенная длина мышечного волокна. Затем под действием
нервного импульса (природа этого действия еще во многом неясна
[23]) возникает сокращение мышцы. Слово «сокращение»
употребляется в учении о мышце в расширенном смысле. Мышца,
подымающая груз, укорачивается, тогда мы говорим об
изотоническом сокращении, выражающемся в укорочении, в
уменьшении длины. Мышца удерживает груз, не сокращаясь, но и не
удлиняясь под его действием —тогда мы говорим об
изометрическом сокращении, выражающемся в развитии напряжения в
мышце. После выполнения мышцей ее работы она должна
вернуться в состояние покоя. Такое возвращение называется
процессом релаксации.
Можно считать установленным, что для сокращения
мышечного волокна в жидкой среде необходимо выполнение
следующих условий:
1) рН должно быть физиологическим, близким к
нейтральному (от 6,5 до 8);
28*
436 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
2) ионная сила должна также отвечать физиологическим
условиям, быть больше 0,15;
3) должны присутствовать ионы Mg++;
4) должна присутствовать АТФ в концентрации, не
превышающей 5-103 М\
5) АТФ должна достаточно быстро расщепляться.
Эти условия были установлены в результате исследования
свойств изолированных мышечных волокон, полученных
обработкой мышцы глицерином. Такие волокна прекрасно
моделируют поведение мышцы в целом.
Доказано, что исходный биохимический процесс состоит
в ферментативном расщеплении АТФ актомиозином. Другие
нуклеозидтрифосфаты также вызывают сокращение
изолированного волокна in vitro, но оказываются гораздо менее
эффективными. Необходимая скорость расщепления не меньше
0,02 \1МОЛя/мг белка в минуту. Роль АТФ двоякая — с одной
стороны она расщепляется, являясь тем самым источником
энергии и работы, с другой стороны служит пластификатором,
размягчает мышцу, облегчая и сокращение и релаксацию. Для
сокращения мышцы необходимы ионы Mg++, активирующие
фермент актомиозин и, следовательно, играющие роль кофактора
(стр. 387). АТФ расщепляется на АДФ и фосфат. Кстати, АДФ
также работает как хороший пластификатор в присутствии
ионов Mg++ [24].
Каким же образом восстанавливается расщепленная АТФ,
как ёновь заряжается этот аккумулятор химической энергии?
Это, естественно, происходит в результате метаболизма, в
конечном счете — окислительного фосфорилирования. В мышце
присутствуют помимо АТФ и другие фосфагены, вещества,
содержащие макроэргические фосфатные связи, в частности, кре-
атинфосфат (КФ):
НР04 • HN • CNH • N(CH3) • СН2СООН.
Применив очень чувствительный спектроскопический метод,
Чэнс обнаружил, что в сокращающейся мышце АДФ появляется
в очень малом количестве — не более 2—3% от ожидаемой
величины [25]. Это, однако, не опровергает расщепления АТФ, так
как АДФ немедленно регенерируется до АТФ посредством КФ
(см. [23]):
АТФ—> АДФ + Ф*
АДФ + КФ —> АТФ + К.
Релаксация мышечного волокна определяется действием
специального фактора, природа которого еще неясна. Этот фактор
МЫШЕЧНАЯ ДЕЯТЕЛЬНОСТЬ 437
Марша — Бендалла содержится в гранулах, находящихся в
саркоплазме и, возможно, является каким-то ферментом.
Релаксирующий фактор также активируется ионами Mg++. В
невозбужденной мышце этот фактор активен, напротив АТФ-азная
активность отсутствует. Он, следовательно, каким-то образом
ингибирует расщепление АТФ. Релаксирующий фактор в свою
очередь дезактивируется ионами Са++, которые, по-видимому,
взаимодействуют с ним во время сокращения. Во время покоя
мышцы ионы Са++, вероятно, связаны с миозином.
Существенна определенная концентрация АТФ. Если
концентрация АТФ очень мала, релаксирующий фактор не влияет как
ингибитор расщепления даже в отсутствие Mg++ и происходит
необратимое сокращение мышцы — rigor mortis, трупное
окоченение. Напротив, при избытке АТФ она не расщепляется — в
этом случае АТФ как субстрат ингибирует фермент — АТФ-азу
(актомиозин).
Основной факт состоит в том, что сокращение мышцы и
АТФ-азная активность развиваются параллельно. Имеется
корреляция между скоростью сокращения и развиваемой
мощностью мышцы, т. е. в конечном счете расщеплением АТФ [26].
Вопрос о зависимости расщепления от взаимодействия актина
с миозином, в результате которого образуется актомиозин,
остается, однако, невыясненным. Здесь предложен ряд гипотез
(см. следующий параграф).
Такова в кратком изложении сложная биохимическая
картина мышечной деятельности. Она в какой-то степени
дополняется непосредственными электронно-микроскопическими
наблюдениями. Спрашивается, как проявляется работа мышцы,
каким энергетическим закономерностям она подчиняется?
Очевидно, что молекулярная биофизика мышцы может быть
построена лишь на основе учета всех фактов — биохимических,
структурных и термомеханических.
Термомеханические свойства мышцы были изучены в работах Хилла [27].
С помощью очень чувствительной электрокалориметрической методики Хилл
исследовал теплоотдачу мышцы при ее сокращении с различными скоростями
и при различных нагрузках. При сокращении мышцы происходит выделение
энергии — механическая работа А и выделение тепла Q. Общее изменение
энтальпии мышцы в изобарическом процессе, согласно первому началу
термодинамики, равно
bH=Q-A. (9.18)
Хилл нашел простую зависимость между скоростью сокращения v и
напряжением (нагрузкой) р. Это — гиперболическая зависимость
(p + a)v=b(p0-p), (9.19)
представленная на рнс. 180. Уравнение (9.19)—характеристическое уравнение
Хилла. Напряжение Ра — напряжение, развиваемое в мышце, подвергнутой
438
ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
тетаническому сокращению. Тетанус означает столбняк. Если сообщать
мышце очень частые возбуждающие импульсы, например, электрическим
током, то она приходит в тетаническое состояние.
Из рис. 180 видно, что Ро, отвечающее v = 0, есть максимальное
напряжение, выдерживаемое мышцей — при р > р0 о<0, т. е. мышца уже не
сокращается, а растягивается. Напротив, в отсутствие нагрузки, при р = 0,
скорость сокращения
максимальна и равна
_, Ьр±
а
»т-
а и Ь — константы.
Уравнение Хилла
переписать в виде
„__ bpo — av
р~ v + b
(9.20)
можно
(9.21)
О 10 20 30 40 SO ВО р
Рис. 180. Зависимость скорости
сокращения мышцы-от нагрузки.
Мощность мышцы, т. е.
механическая работа,
производимая ею за 1 сек, равна
A = dA = pv^ v<bPo — av\
dt
v + b
(9.22)
Таким образом, скорость сокращения контролирует скорость выделения
механической энергии. Чем больше нагрузка, тем больше выделяемая
мощность.
Одновременно происходит выделение тепла. Зависимость количества
выделенного тепла от времени показана на рис. 181. Эти результаты,
полученные Хиллом, относятся к мышце длиною в 29,5 мм, которая начинала
укорачиваться под постоянной нагрузкой через 1,2 сек после стимуляции. Кривая А
0,2 сек
Рис. 181. Выделение тепла при сокращении мышцы.
отвечает изометрическому сокращению (укорочение равно нулю),
кривые В, С, D — сокращению на 1,9; 3,6 и 5,2 мм. При укорочении скорость
продукции тепла сначала возрастает по сравнению с этой скоростью для
изометрического сокращения, но, поскольку в дальнейшем кривые В, С, D
ндут параллельно Ач скорость продукции тепла в укороченном состоянии
та же, что и в соответствующем изометрическом состоянии. Смещения
кривых В, С, D относительно Л, т. е. добавочное тепло, связанное с укорочением,
пропорциональны степени укорочения,
МЫШЕЧНАЯ ДЕЯТЕЛЬНОСТЬ
439
Теплота, выделяемая той же мышцей, укорачивающейся на постоянное
расстояние при различных нагрузках, показана на рис. 182. Мышцу отпускали
через 1,2 сек после стимуляции; окончание укорочения показано стрелками.
Кривая Е отвечает изометрическому сокращению. Так как кривые /, Я, G и F,
соответствующие различным нагрузкам, одинаково смещены от £, общий
избыток тепла по сравнению с изометрическим не зависит от нагрузки р и,
0,2сек
Рис. 182. Выделение тепла при сокращении мышцы.
следовательно, от скорости сокращения v. Он линейно зависит от степени
укорочения Л/., но не от произведенной работы,
— Q = q0 + а ДА, (9.23)
где до—количество тепла, выделяемое при изометрическом сокращении, я,
как показывает опыт, та же константа, что и в уравнении Хилла (9.19) *).
Следовательно, скорость выделения тепла пропорциональна скорости
укорочения
— О = Яо + оя>> (9.24)
так как
Таким образом, деятельность мышцы своеобразна и совершенно не
сходна, скажем, с сокращением пружины. Пружина подчиняется закону
сохранения энергии
AH=Q — A;
»
чем больше она производит работы, тем меньше выделяется тепла, и
наоборот, так как А// постоянно. В мышце освобожденная энергия равна
сумме активационной теплоты q0 (отвечающей изометрическому сокращению),
теплоты укорочения a&L и произведенной работы p&L;
&H = — q0 — aM — p M. (9.25)
*) Уже после того, как была написана эта книга, Хилл опубликовал
новые работы, в которых экспериментально, на основе усовершенствованной
методики, показано, что константы а в уравнениях (9.19) и (9.23) совпадают
только по порядку величины [А. V. Hill, Proc. Roy. Soc. B159, 297, 319, 589,
596 (1964)]. Это, конечно, меняет последующие выкладки, но сохраняет
общую связь между параметрами сокращения мышцы. В целом
термомеханические свойства мышцы еще нельзя считать, окончательно исследованными.
440 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
Так как теплота укорочения не зависит от работы, величина ЛЯ или AH-\-q0
не является постоянной. Мышца работает как электрический мотор, который
потребляет тем больший ток, чем больше нагрузка в сети. Мышца — открытая
система, она черпает свою энергию из химического источника.
Таким образом, выделяемое в единицу времени количество энергии
равно
_Af}^-IS^D. = q0 + v(p + a). (9.26)
Избыточное по сравнению с изометрическим количество энергии в секунду
-д#—«m.-q0=v{p+a) (9.27)
и, в силу (9.19),
— AU'=v(p + a)=b(p0 — py (9.28)
Это — второе соотношение Хилла, независимое, очевидно, от
характеристического уравнения. К уравнениям (9.19) и (9.28) надо добавить эмпирические
соотношения между константами
q0 = ab, (9.29)
Ро = 4я- (9.30)
Из (9.28). (9.29) и (9.30) следует
— bft=ab + v(p + a) = b(a + p0 — p) (9.31)
и из (9.21) и (9.30)
Мышца — механохимическая система. Источником выделяемой энергии ЛЯ
является какая-то химическая реакция, протекающая в тем большей степени,
чем больше укорочение, чем больше произведенная работа. По отношению
к внешней работе мышца есть открытая система, получающая источник
энергии в виде химических реагентов. Можно представить ЛЯ в виде [28, 29]
ЛЯ = 1К (9.33)
где \ — степень прохождения реакции, h — удельное количество энергии.
выделяемое при g— 1. Из (9.31). (9.32) и (9.33) следует
_ ih = ЯоЬ+йо+^ + Ро))\ (9.з4)
Это уравнение связывает скорость реакции g с механической скоростью v)
При f = 0 в изометрическом сокращении
|0 &-. (9.35)
При максимальном значении скорости
L=io(i+-^-) (азе)
V, в силу (9.29), (9.30),
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ 441
т. е. максимальная скорость реакции при укорочении в отсутствие груза
в 5 раз больше, чем при изометрическом сокращении.
Обозначив отношение скоростей
V»JL «.. (9.38)
. 1 -l-24v
6-ь-пр?- <9-39>
получаем
Зависимость скорости химической реакции от скорости укорочения
является гиперболической.
Укажем, наконец, на зависимость скорости укорочения от самой
величины укорочения AZ.. Она была найдена Ульбрехтами [26] и оказалась скорее
экспоненциальной, чем гиперболической. Надо отметить, что Хилл работал
с поперечнополосатой скелетной мышцей — сарториусом лягушки, а Уль-
брехты с гладкой мышцей — с так называемым желтым аддуктором
моллюска Anodonta.
Задача молекулярной биофизики состоит в поисках процесса,
протекающего в мышце, который находился бы в согласии, с
одной стороны, с результатами биохимических и структурных
исследований, с другой — со своеобразными
термомеханическими свойствами мышцы. Задача эта оказывается весьма
трудной, ее решению посвящено множество работ, предложен ряд
теорий, ни одна из которых не может считаться исчерпывающей,
а некоторые неверны. Как пишет Сент-ДьерДьи: «В настоящее
время мышца находится в положении священного слона,
имеющего девяносто девять имен, причем настоящим является лишь
сотое, известное ему одному» ([30], стр. 75).
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Теории мышечной деятельности, в зависимости от их
исходных предпосылок, распадаются на несколько групп:
1. Основное предположение — естественная после
знакомства со свойствами полиэлектролитов идея — мышечное
волокно в покое состоит из заряженных полиэлектролитных молекул.
Сокращение вызывается нейтрализацией зарядов волокна,
которое при этом сворачивается.
2. Основное предположение — опять-таки естественная после
знакомства с конформационными превращениями белка идея —
белки мышечного волокна в покое имеют (J-форму, при
сокращении происходит переход в а-форму, которой отвечает
меньшая длина цепи.
3. Исходное предположение основывается не на известных
свойствах других макромолекул, а на морфологической
электронно-микроскопической картине. Об этом уже говорилось
(стр. 434). Изменения конформаций цепей не происходит,
442 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
сокращение мышцы определяется скольжением одних цепей
относительно других — цепи актина вдвигаются между цепями
миозина.
4. Сокращение мышцы определяется изменением гидратации
белка, изменением структуры воды, связанной с белком.
Процесс осуществляется АТФ, энергия которой переносится,
мигрирует по водной структуре.
5. Сокращение мышцы определяется кооперативным
переходом типа плавления кристаллического полимера.
6. Сокращение мышцы определяется кооперативным
переходом типа полимеризации.
Теории типов 1 и 3 не включают представлений о
кооперативных процессах, теории типов 2,5,6 говорят о резких
кооперативных переходах, теория типа 4, в отличие от всех прочих, должна
быть квантовомеханической, так как она трактует резонансную
передачу энергии по протяженной молекулярной системе. Мы
видим, что «имена священного слона» достаточно разнообразны.
Рассмотрим эти теории по порядку.
1. Полиэлектролитная модель сократительного элемента
мышцы исследовалась в ряде теоретических работ. Кирквуд и
Райзман [31] предполагали, что такой моделью является
гибкая белковая нить, заряд которой изменяется при фосфорили-
ровании остатков Сер и Тре за счет АТФ. При этом нить
заряжается отрицательно и удлиняется, что объясняет релаксацию.
При расщеплении АТФ актомиозиновая нить дефосфорилирует-
ся, утрачивает свои отрицательные заряды и сокращается. Мо-
ралес и Боттс [32] (см. также [29]) предположили, что рабочим
элементом мышцы является положительно заряженная цепь,
отрицательные заряды которой компенсированы ионами Mg"4".
Сокращение вызывается адсорбцией АТФ, фосфатные группы
которой нейтрализуют положительные заряды. Модель
объясняет роль ионов Mg"14", но исходит из того, что для сокращения
существенно не ферментативное расщепление АТФ, роль
которого не раскрывается, а сорбция анионов АТФ на поликатионе.
Сокращение является в этой модели не энергетическим, а
энтропийным— упругая сила в мышце становится подобной упругой
силе в каучуке.
Эта и другие работы, исходящие из полиэлектролитной
гипотезы (см., например, [33, 34]), не согласуются с рядом
опытных фактов. Электронно-микроскопическая картина не
свидетельствует в пользу свертывания нитей при сокращении.
Количественно весьма трудно совместить электростатические
эффекты в среде, представляющей децинормальный раствор соли,
с большими мышечными силами. Скелетная мышца развивает
напряжение порядка нескольких килограммов на квадратный
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ 443
сантиметр — достаточно вспомнить достижения тяжелоатлетов.
Термомеханические свойства мышцы противоречат
представлению об энтропийной силе. Нельзя не отметить, что ни в
одной из работ, рассматривавших полиэлектролитную модель, не
дается истолкования уравнений Хилла.
2. Теория переходов а^р в мышце развивалась Астбери [35]
на основе работ Полинга и Кори (ср. стр. 192). Поведение
мышечного белка рассматривается по аналогии со свойствами
фибриллярных белков — кератина, эпидермина, фибриногена,
фибрина. Переход миозина в а-форму, по идее Астбери,
происходит при полимеризации глобулярного G-актина в
фибриллярный r-актин, в комплексе с которым миозин сокращается. Ни
биохимические процессы, ни термодинамические свойства
мышцы в этих работах не рассматриваются. Тем не менее сама идея
представляет несомненный интерес и в измененной форме
может быть, по-видимому, использована при построении будущей
теории мышечной деятельности.
Опираясь до некоторой степени на представления Астбери,
Френкель предложил рассматривать мышечное волокно по
аналогии с резиной [36]. Сокращение волокна возникает вследствие
увеличения модуля упругости. Как известно, модуль упругости
резины тем больше, чем выше степень ее вулканизации, т. е. чем
больше сшивок введено между цепями. Френкель предположил,
что сшивки в мышце создаются молекулами АТФ. Идея
заманчивая, но гипотеза не согласуется ни с биохимическими, ни со
структурными, ни с термодинамическими свойствами мышцы.
Впрочем большинство этих свойств не было еще известно, когда
Френкель эту гипотезу выдвигал.
3. Основываясь на электронно-микроскопической картине,
полученной Г. Хаксли и Хансон, однофамилец первого из них
А. Хаксли предложил скользящую молекулярную модель
мышечного волокна [37] (см. также [14, 28]).
Модель А. Хаксли показана на рис. 183. Втягивание актина
между фибриллами миозина определяется взаимодействием
неких активных групп актина и миозина, изображенных
символически. Пружины символизируют броуновское тепловое
движение. Записываются уравнения реакций:
A-f~M —► AM (константа скорости /),
AM -f АТФ —► А ■ АТФ + М (константа g),
А-АТФ—> А + АДФ + Ф,
А — актин, М — миозин, AM — актомиозин. Константа /
определяет сцепление активных групп А и М, константа g — их
разъединение. Расщепляющая АТФ активность приписывается актину.
444 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
Первая реакция начинается под действием возбуждения и
регулируется «пружинами» — относительными расстояниями и
тепловым движением. Приходится предположить, что модель
асимметрична — g велико слева от центральной точки, затем
падает и затем медленно возрастает слева направо.
Константа / равна нулю слева от центра, затем линейно растет вплоть
до некоторого расстояния +ft, после чего опять падает до нуля.
Справа / больше g на расстоянии 0 — h.
Миозин
ллллл£~Зллл/^
Англии '
—ж
Миозин
Рис 183. Модель Хаксли.
При этих весьма специальных предположениях удается
вывести термодинамические свойства мышцы, описываемые
соотношениями, подобными соотношениями Хилла из кинетики
написанных реакций.
Вебер предложил биохимическую интерпретацию
«скользящей» модели [21]. Его схема показана на рис. 184. Кислотная
группа актина фосфорилируется при расщеплении АТФ и
становится способной реагировать с сульфгидрильными и гидро-
ксильными группами миозина. Благодаря этому оказывается
выгодным относительное перемещение двух белков. Чем больше
нагрузка на мышце, тем чаще актиновая нить со своей
активной группой сдвигается грузом в начальное положение. Это
увеличивает число стадий сдвига, необходимых для сокращения
фибриллы. В изометрических условиях укорочения нет, так как
при высоком напряжении нити актина оттягиваются в
начальное положение после каждого сдвига. Исходное предположение
состоит в линейном расположении функциональных групп
белка. Наглядная биохимия Вебера не связывается, однако, с
наблюдаемыми энергетическими соотношениями в мышце.
Модель А. Хаксли вызывает ряд возражений. Нет способа
обосновать асимметрию взаимодействия. Расчетные формулы
содержат большое число параметров, значение которых подго-
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
445
няется к согласию с опытом, а не находится из независимых
молекулярно-физических соображений. Достоинство модели,
учитывающей построение мышцы из двух типов белковых
волокон, состоит в том, что она непосредственно объясняет
зависимость скорости движущей химической реакции от скорости
1
2
|Кислоти. rpj
SH ОН ОН SH ОН
м
+АТФ
АДФ
|Кшштн.гр
*SH ОН ОН SH ОН
I I I I
[Кислот гр.|
S ОН ОН SH ОН
4
(Кислотн. rpj
ф
SH О
J L
ОН SH ОН
1_
5
1КИСЛ0ТН ГР1
+ Н,0
6
|Кислотн.гр.|
SH ОН О SH ОН
II II |_
SH ОН ОН SH ОН
I
Рис. 184. Модель Вебера.
укорочения. Основная идея состоит в том, что скорость
биохимического процесса, снабжающего мышцу энергией,
определяется скоростью взаимодействия
толстой и тонкой нити. Тогда
скорость этого взаимодействия должна
зависеть от скорости укорочения.
Однако с такой картиной
совместимо не только скольжение, но и
свертывание нитей одного из
белков [28, 38] (рис. 185). И в том и в
другом случае реализуется своего
рода обратная связь между
химическим и механическим процессом.
Интересное явление быстрого
падения напряжения после
удаления нагрузки — значительно более быстрого, чем последующее
укорочение, с равным успехом объясняется двухнитевой
моделью со скольжением и со свертыванием, но не может быть
объяснено моделью с одной свертывающейся нитью. В этом
случае нужно предположить, что скользящая модель состоит из
последовательно соединенного сократительного элемента и
пассивного упругого элемента (рис. 185). Если сократительный
185.
Офощ
ноя
связь
б)
Три модели
щения.
а) простое свертывание; б) сократи'
тельный элемент соединен с пассивно
эластическим: в) свертывание с ме-
ханохнмическоп обратной связью.
446
ГЛ. 9, МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
элемент укорачивается со скоростью, зависящей от
мгновенного напряжения, но не может укорачиваться быстрее
чем ут, то сближение концов мышцы с большей скоростью
уничтожит напряжение в упругом элементе. Напряжение
исчезнет, если упругий элемент полностью отрелаксирует и
появится вновь только при дальнейшем укорочении
сократительного элемента. В двухнитевой модели со свертыванием при
v<vm взаимодействие нитей поддерживает постоянное
напряжение (рис. 185,6); Однако, поскольку для взаимодействия
нитей нужно конечное время, при
АТФ-азнь/е
участии.
f ё • •
Места связывания АТФ
Рис. 186. Модель Подольского.
v>vm механохимическая
обратная связь приводит к
падению напряжения.
Подольский [38] предложил
специальный вариант
двухнитевой модели, показанный на
рис. 186. Тонкая нить здесь
является положительно
заряженным полиэлектролитом.
При возбуждении на нее
осаждаются анионы АТФ, и нить
начинает свертываться. Участки АТФ-азной активности на
толстых нитях снимают молекулы АТФ с тонкой нити, так что
число связанных молекул АТФ и, значит, напряжение,
развиваемое тонкой нитью, должно зависеть от соотношения скорости
связывания АТФ и скорости ее разложения. Из этой
специальной модели вытекают соотношения, подобные найденным Хил-
лом. Очевидно, что модель Подольского есть «свертывающаяся»
двухнитевая модель, сочетающая идею Хаксли с
полиэлектролитным механизмом. Прямое молекулярное обоснование этой
весьма «хитрой» модели отсутствует, и против нее могут быть
выдвинуты те же возражения, что и против других
полиэлектролитных моделей-
В недавней работе Эйдуса [39] дается новое молекулярное
толкование модели скользящих нитей. Предполагается, что
мышечное сокращение обусловлено силами поверхностного
"натяжения, возникающими в капиллярной системе соприкасающихся
миозиновых и актиновых нитей, погруженных в саркоплазму.
Актиновые нити вдвигаются между миозиновыми, так как
поверхностная энергия <7ам на границе актина и миозина меньше,
чем сумма энергий на границах актин-саркоплазма (Сас) и
миозин-саркоплазма (<7мс). Оценка разности энергий а=аАС+
+<тмс — (Там дает 30—60 эрг/см2.
Выделение теплоты сокращения, пропорциональной
укорочению, объясняется наличием скрытой теплоты образования
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
447
единицы поверхности — Т
do
Удается получить разумное
количественное согласие с данными Хилла, относящимися к
пропорциональности максимального напряжения и теплоты
сокращения. Теплота активации объясняется выделением тепла при
полимеризации актина — при G—►Лпереходе. В модели Эйдуса
(она изображена на рис. 187) химическая энергия используется
только в энергии активации —
сокращение же происходит за г sm eAf1 sAC
счет поверхностного
натяжения.
Эта модель является
наиболее обоснованной из всех
моделей, исходящих из
представления о скользящих
белковых нитях. Ее уязвимым
пунктом является отсутствие
независимой оценки о— эта
величина определяется в
конечном счете из известной
величины напряжения р:
Р
а =
2nrNK'
(9.40)
Рис. 187. Модель Эйдуса.
где г — радиус, N — число нитей на 1 см2 поперечного сечения,
К — коэффициент, учитывающий дискретность их стенок. Эйдус
принимает
р = 1,5 кг/см2; /С=0,02— 0,05; г=1,5-150А;
7V=1,57- 10п:2,2.
Превращение актина и АТФ-азная активность миозина
рассматриваются лишь в качественной форме, на основе некоторых
гипотез.
4. Предположения, высказанные Сент-Дьердьи [30], имеют
?овершенно иной характер и исходят из круга идей; связанного
с миграцией энергии. Частицы миозина поддерживаются в
растянутом состоянии специфически расширенной водной
структурой; укорочение происходит путем разрушения этой водной
структуры, а ее восстановление означает релаксацию. Энергия,
необходимая для разрушения водной структуры, подается АТФ,
причем для достаточно быстрого превращения необходимо
считать, что энергия, выделенная АТФ, переходит от одной
молекулы воды к другой, мигрирует по квазикристаллической
сетке молекул воды. Это, конечно, скорее идея, чем теория. Она
не подкрепляется никакими расчетами, попытка согласовать ее
448 гл. э. механохимические процессы
с термомеханическими свойствами мышцы отсутствует. Идея
в достаточной степени спекулятивна — нет никаких
доказательств существования специальной водной структуры в мышце
и никаких доказательств миграции энергии в ней. Надо
сказать, что большие скорости и резкий характер («все или
ничего») ряда биологических процессов приводили многих, и в
том числе Сент-Дьердьи, к мысли о квантовомеханическом
резонансном взаимодействии, о миграции энергии. Мы еще будем
говорить об этом в последней главе. Сейчас же скажем, что во
всех описанных в этой книге явлениях эти особенности
биологических процессов определяются макромолекулярной коопера-
тивностью, а не миграцией энергии. Можно думать, что
сказанное относится и к мышце.
5. В 1948 г. Энгельгардт высказал очень интересную
физическую идею о природе, сокращения мышцы [40].
Предполагается, что в покоящейся мышце белок находится в
упорядоченном кристаллическом состоянии. Сокращение мышцы
определяется плавлением белкового кристалла. Отсюда следует, что
активной фазой мышечной деятельности является расслабление,
релаксация, а не сокращение. Роль активного мышечного ве*
щества состоит не в упругом натяжении, а в сопротивлении
сжатию; роль АТФ надо искать в воздействии либо на процесс
кристаллизации, либо на процесс плавления. Позднее сходная
идея была высказана Прайором [41].
Эти представления особенно заманчивы в свете
исследований конформационных свойств биополимеров, описанных в этой
книге. Кристаллизация и плавление белка — кооперативные
конформационные превращения. Идея Энгельгардта, изложен*
ная в общей форме, имеет, конечно, нечто общее с частными
предположениями Астбери.
Дальнейшее развитие этой идеи связано с работами Флори
[12, 42, 43]. О них нужно рассказать подробнее.
Флори отмечает сходство в поведении мышцы с
фибриллярными белками, в частности с коллагеном (стр. 205). Такие
белки имеют упорядоченную, ориентированную, близкую к
кристаллической, структуру. При плавлении структуры линейные
размеры образца сокращаются в направлении первоначальной
ориентации цепей. Очевидно, что фазовый переход такого рода
мог бы быть в принципе использован для превращения тепловой
энергии в механическую работу в тепловой машине с рабочим
веществом — кристаллизующимся полимером. Если этот
полимер имеет функциональные группы, легко изменяющиеся при
изменении химического окружения, то плавление (и
кристаллизация) могли бы вызываться уже не нагреванием, а изменением
химических потенциалов и мы имели бы дело не с тепловой,
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ 449
а с механохимической машиной. Такая система, поскольку ее
функционирование зависит от резкого фазового перехода,
должна быть гораздо чувствительнее к химическим процессам, чем
полиэлектролитная система, в которой химические реакции
вызывают появление лишь небольших изотропных сил.
Действительно, можно показать, что при определенных
условиях химические реакции могут сильно менять температуру
плавления кристаллического полимера, т. е. вызывать его
плавление при неизменной, скажем, комнатной температуре [42].
Особенно интересная ситуация возникла бы, если бы
полимер или часть его обладали ферментативной активностью. Тогда
волокно само по себе могло бы влиять на природу и
концентрацию реагентов в окружающей среде. Это в свою очередь
повлияло бы на химические потенциалы звеньев полимера и
сместило бы равновесие кристалл — аморфное вещество [43].
Наличие внешней силы должно сказываться как на
переходах типа кристаллизации и плавления, так и на химических
свойствах полимера. Мы видели, что внешняя сила влияет на
переход спираль—клубок, т. е. на «внутримолекулярное
плавление» (стр. 431). С другой стороны, представления о природе
ферментативной активности, изложенные в гл. 8, заставляют
ожидать ее изменений в условиях принудительного изменения
конформаций цепей (стр. 401).
Идея тем самым ясна. Сокращение стимулированной мышцы
может быть интерпретировано как смещение равновесия между
кристаллическими и аморфными областями. Предполагается,
что АТФ образует комплекс с белком в его расплавленном, а
не в кристаллическом состоянии, в последнем белок менее
реакционно-способен.
Некоторые подтверждения этих представлений получены при
исследовании поведения глицеринизированных мышечных
волокон в растворах АТФ. Дефосфорилирование АТФ
действительно происходит в такой системе, но вызывает сокращение
волокна лишь при подходящих условиях. Варьировались
температура и состав раствора — соотношение в нем глицерина и воды.
Достаточно резкое сокращение происходило лишь в тех
случаях, когда концентрация глицерина уменьшалась до 50%.
В растворе, содержавшем 35% этиленгликоля в воде,
сокращение начиналось при 6° С [44]. Эти данные свидетельствуют
о сходстве сокращения мышечного волокна с фазовым
переходом.
Наиболее существенно в работах Флори представление о
фазовом переходе, т. е. о кооперативном характере
сокращения. Независимо от того, связано ли сокращение с плавлением
кристаллов или с каким-либо иным процессом, например
29 М. В. Волькенштейн
450 ■'- ' ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
с полимеризацией или деполимеризацией (см. далее), его
кооперативная природа объясняет быстроту и резкость реакции
мышцы на изменение условий — на химизм и нагрузку. Отпадает
необходимость поисков специальных механизмов типа миграции
энергии.
В работах Флори нет, однако, попытки связать
предложенный механизм с биохимическими, структурными и
термомеханическими данными. Такая попытка описана далее. Прежде чем
изложить ее, нужно остановиться на другом возможном типе
кооперативного сокращения мышцы.
+Соль
~~^ ооооо
^—^ F
-Соль
— о-о
Рис. 188. Схема G-+F превращения актина.
6.. Японские ученые — Оосава, Асабура и Оои подвергли
дальнейшему исследованию один из мышечных белков — актин
[45]. Как уже указывалось, актин способен полимеризоваться.
Это G ->■ /^-переход, происходящий в растворе в присутствии
солей, в частности Mg++. Для полимеризации необходима АТФ,
присоединяющаяся, по-видимому, к молекулам G-актина — по
две молекулы АТФ на один G-актин. Во время полимеризации
происходит дефосфорилирование (рис. 188). Выше говорилось,
что актин не имеет АТФ-азной активности. Дело в том, что
актин сам изменяется, полимеризуется в ходе расщепления АТФ
и поэтому не является ферментом в истинном смысле этого
слова. Легко видеть, однако, что при повторном добавлении и
удалении солей каждая молекула G-актина может
катализировать расщепление АТФ многократно.
Между G- и /^-актинами устанавливается динамическое
равновесие, смещаемое при изменении концентрации солей.
Скорость расщепления АТФ максимальна примерно при равных
концентрациях G- и /^-актина. Переход G -> F является
кооперативным — в равновесии находятся «мономеры» G- и очень
длинные (до нескольких \i) нити f-актина. Полимеризация на-
о
°0
о о
G
Q—АТФ
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
451
чинается при некоторой критической концентрации -F-актина.
Скорость расщепления АТФ сильно зависит от начальной
концентраций G-актина и растет пропорционально [G]3
или [G]4.
Это означает, что расщепление АТФ не есть
независимая реакция на каждой молекуле G-актина, но
требует кооперации более чем двух таких молекул.
Полимеризация не является линейной, по-видимому,
образуется спиральный полимер, каждое звено
которого связано с соседними вдоль цепи и
одновременно с третьим предшествующим и третьим
последующим звеньями (рис. 189). Очевидно, что в
принципе возможен и линейный полимер актина,
обладающий другой длиной цепи. Спиральный полимер
перейдет в линейный при разрыве связей между
несоседними звеньями. Переход может происходить при
изменении условий среды и должен сопровождаться
удлинением цепи (рис. 190). В растворе в отсутствие
солей действительно удалось обнаружить
сравнительно короткие полимеры актина со свойствами,
отличными от /^-актина — с другим знаком
электрического двулучепреломления.
Японские ученые предполагают, что такие нити в
мышечном волокне представляют собой линейные
полимеры актина, которые при сокращении мышцы
превращаются в спиральные /^-полимеры в результате
взаимодействия с миозином (рис. 191). Источником энергии является по-
прежнему АТФ. Качественная
картина согласуется с результатами
i
Рнс. 189.
Спиральный
/•'-актии.
В
А+В
А
Рис. 190. Связи типа А и В.
А+В — спиральный полимер, В и
А—линейные полимеры.
N
М
М
м
Модель Оосава, Асабура
и Оон.
электронно-микроскопических исследований Хаксли и Хансон.
В работе [46] дана количественная теория кооперативной
29*
452 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
спиральной агрегации актина — термодинамики и кинетики
процесса.
Асакура, Танигучи и Оосава [47] подробно исследовали ме-
ханохимическое поведение актина. Они подвергали его растворы
действию ультразвука, вызывавшего обратимое превращение
^-актина в структурно измененную форму полимерного белка,
обозначаемую как /-актин, f-цепи длиннее /''-цепей; F-гктин—
спиральный, а f-актин может быть линейным полимером. Таким
образом, механическое воздействие стимулирует переход f -> F.
В присутствии АТФ происходит обратный, сократительный
переход / -> Fy сопровождаемый расщеплением АТФ.
Возможно, что удастся сочетать эти результаты со
скользящей моделью, исходя из предположения, что лишь одна из двух
форм полимерного актина может взаимодействовать с
миозином. Возможно также, что кооперативный, «фазовый» переход,
рассмотренный Флори, является не плавлением
кристаллического белка, но кооперативным переходом от одного типа
полимера к другому.
7. В работе [48] была предпринята попытка связать
представления Флори и японских авторов с биохимией и
термодинамикой мышечного сокращения. На основе идеи об изменении
ферментативной активности белка при его сокращении, в
предположении о стационарности соответствующего химического
процесса, удалось получить соотношения, подобные
соотношениям Хилла. Однако эта работа имеет чисто качественный
характер, и сделанные в ней допущения требуют дальнейшей
проверки.
Последняя по времени модельная теория мышечной
деятельности была предложена Дэвисом [49]. Она заслуживает особого
внимания, так как находится в качественном согласии с
большей частью известных фактов. Расскажем о ней подробнее.
Модель соответствует скольжению актина (А) относительно
миозина (М). Взаимодействие А—М происходит в
определенных участках на поверхности М, в которых расположена АТФ,
связанная с М (Я-меромиозином) тремя положительными
зарядами. Это, вероятно, положительные заряды трех ионов Mg""".
В отсутствие А конформация комплекса М—АТФ такова, что
АТФ удалена от участка М, обладающего АТФ-азной
активностью. Удаление определяется электростатическим
отталкиванием отрицательно заряженных групп (рис. 192, рис. 193, а).
При активации мышцы в нее поступают ионы Са**, создающие
хелатные связи между АТФ, соединенной с М и АДФ,
соединенной с /^-актином (F-A). Ионы Са++ нейтрализуют
отрицательный заряд вытянутой группы М—АТФ (рис. 193,6).
Исчезает кулоновское отталкивание, и функциональная группа
Молекулярные теории мышечной деятельности
453
М—АТФ изменяет свою конформацию, возможно, свертываясь
в сь-спираль (рис. 193, в). При этом происходит сокращение в
мостике А—М и развивается напряжение.
В новой конформации А—М АТФ-азная активность М
срабатывает и АТФ комплекса М—АТФ расщепляется на АДФ и
фосфат. Связь А—М разрывается (рис, 193, г), Напряжение
сдвигает А относительно М. М—АДФ рефосфорилируется цито-
плазматической АТФ и креатинфосфатом (рис. 193, д) и
благодаря электростатическому отталкиванию конформация
М—АТФ возвращается к
исходному состоянию
(рис. 193, е). Далее
происходит новое
взаимодействие с А и процесс
повторяется многократно.
Активное состояние
мышцы прекращается в
результате всасывания
ионов Са++ назад, в сарко-
плазматический ретику-
лум. Это—процесс
активного транспорта,
требующий расхода энергии
АТФ и, следовательно,
участия специфического
фермента — релаксирую-
щего фактора.
Согласно этой модели
АТФ-азная активность
миозина проявляется только в узлах взаимодействия А—М.
Модель Дэвиса разумно сочетает представления о конформацион-
ной зависимости ферментативной активности и о
кооперативном конформационном превращении миозина со структурными
данными. Скольжение комбинируется с конформационным
свертыванием. Дэвис приходит к ряду выводов, согласующихся
с опытом,
Количество Са**, введенного в мышцу, чтобы вызвать
максимальное сокращение, должно быть по меньшей мере равно
числу поперечных мостиков А—М. Количественная оценка дает
0,09 молей/г Са++. Опытные данные близки к этой величине
(0,125 молей/г).
Латентный период отвечает времени перехода Са** из сарко-
плазматического ретикулума к активным участкам. Опытная
продолжительность латентного периода 10 мсек согласуется
с константой диффузии ионов Са++ в воде (примерно 1 \i).
це#тр J
4ГФ-аз& i
/
/
Миозин
Ш/////////,
Рнс. 192. Функциональный участок
молекулы мнознна, присоединившей АТФ
(по Дэвнсу).
30 М* В. Волькенштейн
ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
А
АДФ0
АДФ0
а)
У///У////У//А
'/////////////////////s////////tfs.
^"\
,SSJ'*S*-*S&S*S&rMWfSS*rj&S'S-S**f'S**'
/Са++'
' е /
///////// ' Я///////////
'////S///////^ у//////////У//////Л
АДФ 0
Ск++
ф е
,'АДФ;
*;
7/. ' '/////////////
'//////////////////////////////Л
/Ca+V
в)
V///SS/S/S////SS/S//SSS/SSS/S//S.
АДФ 0
с;а++
ф 0
8)
0
i
'SSSSSSSSSSSSSSSSSSXSSSSSSSSSSSSa
адф е
Са++
ф 0
777Ш
^т
АДФ ©
Са++
*)
W////W//*
,////,/////////////////////////,
Рис. 193. Мслекулярная модель сокращения мышечного волокна
(по Дэвису).
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ 455
Теплота активации мышцы отвечает теплоте диссоциации
Са++ от саркоплазматического ретикулума. Если принять, что
Са++ связан ионами фосфата, то это величина порядка
5 ккал/моль, что дает 0,9 мкал/г мышцы. Опытная величина
1 — 1,5 мкал/г.
Поддержание напряжения само по себе не требует большого
распада АТФ. АТФ распадается лишь в том случае, если
происходит перемещение мостиков А—М. Число таких мостиков,
образующихся в единицу времени на единицу длины, больше
при малых скоростях укорочения с тяжелым грузом, чем при
больших скоростях укорочения с малым грузом. Количество
полученной работы определяется расщеплением АТФ.
Количественные оценки согласуются с опытом. Теплота сокращения
есть теплота образования большого числа межмолекулярных
связей, она не должна зависеть от длины и нагрузки.
Сходная модель независимо предложена в работе [50].
Проведем некоторые расчеты.
Прн конечной скорости образования мостнка А—М его возникновение
зависит от скорости и относительного движения А и М.
Прн больших и вероятность образования мостнка А—М меньше. До-
пустим, что смещение активного участка А относительно активного участка М
равно х. Вероятность того, что взаимодействие данной пары участков уже
произошло, равна п. Вероятность того, что такое взаимодействие произойдет
за время dt, равна
dn={\—n)k{x)dt (9.41)
(ср. [28]). Так как путь, проходимый за время dtt есть udty имеем
dx
dn = (l—n)k(x)~. (9.42)
w
Интегрируем (9.42). k(x)—достаточно острая функция от х—мостнк
образуется лишь прн малом расстоянии между активными участками А н М,
Обозначив
+ СО
Х= Г k(x)dx, (9.43)
—оо
имеем
я=1—*-*^. (9.44)
Прн м=0 я=1, прн возрастании и п убывает от 1 до 0.
Скорость и связана со скоростью сокращения мышцы (измеряемой в
длинах мышцы в секунду) соотношением
и—тр (9.45)
где s — длина саркомера. Если расстояние между активными участкам*
есть /, то число контактов А—М в единицу времени будет и/1. Скорост
взаимодействия на единицу длины мышцы составляет Мип/l, где М — чнок
30*
456 ГЛ. 9. МЕХАНОХЙМИЧЕСКИЕ ПРОЦЕССЫ
активных участков на 1 смг мышцы. Следовательно, скорость химической
реакции равна
i i ■ Мип — * i Msv li Л~"*М тлел
6== 6<H j— = So "T—2/— V — /'
При соответствующем подборе параметров соотношение (9.46) дает
зависимость i/b) от v> согласующуюся с опытными данными Хнлла [27].
Величина X в соответствии с моделью Дэвнса должна зависеть от
концентрации ионов Са++. Считая, что процессы, изображенные на рис. 193,
Ф
к*
АТФ
*Sr
АДФ
**5
Рис. 194. Схема превращении мнознна при
стационарном процессе в соответствии с
моделью Дэвнса.
удовлетворяют условию стационарности, получаем следующую схему
(рис. 194) Здесь М, — исходное состояние М—АТФ, отвечающее рнс. 193, а,
М2 — комплекс М—АТФ—Са—АДФ—А (рис. 193,6), М3 — конформацнонно-
нзменнвшнйся комплекс М—АТФ (рнс. 193,в), М4 — комплекс М—АДФ
(рнс. 193,г), М5—рефосфорнлнрованный комплекс (рнс. 193,<Э). Решая
уравнение стационарной кинетики, находим
*—Г8™ ТТ ЩЧ Г. (9-47)
%м{ -ТГ-+[Са++111+-^+М5Т+*7)
iel
где [5] — концентрация АТФ в растворе. Зависимость k от х определяется
зависимостью k\ н &_i от х; k{ отлично от нуля лишь в узком интервале
значений х. Общий характер зависимости укорочения мышцы от времени
следует из (9.44).
Длина укорачивающейся мышцы
L=L0 — ДА, (9.48)
где укорочение ДА пропорционально числу мостиков А—М, образовавшихся
за время t:
М = Ц — L = Lxn (t)t (9.49)
Li — фактор пропорциональности. Подставляя (9.44), получаем
-/*<«
At-L,(l-#-^-.LAl-« ° /=Ml~*~*'0. (9*50)
МОЛЕКУЛЯРНЫЕ ТЕОРИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ 457
где
t
k' = у / k (x) dU
о
Скорость укорочения
v„ _^L = ^JfeV*'' = k* (Li - ДА). (9.51)
Выражения (9.50) н (9.51) качественно согласуются с опытом.
Несмотря на плодотворность модели Дэвиса, теорию
мышечной деятельности нельзя считать построенной. Это —
молекулярная модель, но не молекулярная теория. Необходимо
проведение детальных расчетов, учитывающих как изменение
состояния миозина, так и превращения актина при сокращении.
Задача теории состоит в количественном определении
параметров уравнений Хилла на основе молекулярной модели. А это
еще не сделано.
Самого серьезного внимания заслуживают результаты,
полученные в последнее время в Институте биофизики Академии
наук СССР Франком и его сотрудниками [5 ]. Показано, что
наряду со скольжением белковые нити способны и к активному
сокращению. Франк считает малоправдоподобным сокращение
мышцы только за счет тонких мостиков между актином и
миозином. Он предполагает, что вдвижение актиновых нитей между
миозиновыми — сложный ступенчатый процесс, в ходе которого
происходит прямое укорочение толстых нитей, подтягивающих
в промежутки между ними тонкие нити. При этом создаются
контакты и комплексообразование. Далее следует расслабление
толстых нитей и т. д. Для исследования процесса сокращения
во времени в лаборатории Франка был развит оригинальный
метод дифракции в видимом свете, позволяющий регистрировать
изменение структуры мышцы, при ее одиночном сокращении,
через каждую тысячную долю секунды. Действительно, с
помощью этого метода удалось обнаружить периодичность,
«зубчатость» процесса сокращения. Пока еще нет модельной картины,
учитывающей эти важные факты.
Несмотря на то, что «имя священного слона» остается
неизвестным, наметились пути к раскрытию этой тайны.
По-видимому, кооперативные процессы изменения высших уровней
структуры белка играют важную роль в сокращении мышцы.
Трудности, стоящие перед молекулярной теорией, очень
велики. Они, очевидно, определяются гетерогенностью мышечного
волокна, наличием в нем надмолекулярной структуры и
соответственно большой сложностью биохимических реакций.
Успехи в развитии теории будут выражаться в ее способности
458 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
продиктовать постановку направленных экспериментов. В
идеале разгадка мышечной деятельности должна привести не только
к решению очень важной биологической проблемы, но и к
созданию специальных механохимических модельных систем,
необходимых для техники.
ДВИЖЕНИЯ КЛЕТОК И МИТОЗ
Мышечная деятельность — механохимический процесс,
наблюдаемый непосредственно и знакомый каждому. Однако если
заглянуть в микроскоп, то мы увидим целый ряд других
движений клеток как целого и внутриклеточных движений.
Сперматозоид перемещается в результате движений его длинного
хвоста — жгутика. Туфелька и ряд других одноклеточных
плавают вследствие движения жгутиков и ресничек, причем
аналогичный процесс используется и макроскопическими
организмами как для перемещения, так и для пропускания тока
жидкости, содержащей необходимые для жизни вещества. Гребневики
регулируют ориентацию своего тела согласованным движением
ресничек, ток жидкости создается в жабрах двустворчатых
моллюсков и в трахее человека. Внутриклеточное движение
реализуется в сокращениях митохондрий, в митозе и мейозе и в
течении протоплазмы, доставляющем органоидам клетки нужные
им материалы. Во всех этих движениях производится
механическая работа за счет химической энергии, запасенной обычно
в АТФ.
Мы не будем останавливаться на движении протоплазмы,
подробно изученном Камия [52]. Ограничимся указанием на то,
что энергия для этого движения получается, по-видимому, в
результате неокислительного ферментативного разложения
глюкозы. Сформулированы гипотезы, связывающие движение
протоплазмы с возникающей вследствие сжатия гелеобразного
вещества разностью давлений или со сдвиговой силой,
заставляющей молекулы эндоплазмы скользить друг относительно друга.
Во всех гипотезах существенно предположение об изменении
механических свойств геля при его движении, т. е. о тиксо-
тропии вещества протоплазмы. Молекулярная теория этих
явлений пока не построена, и они требуют дальнейшего изучения.
Движение ресничек происходит весьма своеобразно. Оно
схематически показано на рис. 195. Ресничка движется
несимметрично сначала в одну, потом в другую сторону. Возможный
механизм определяется специальным строением реснички,
состоящей из девяти пар нитей, расположенных по окружности,
и двух нитей в середине цилиндрического тела реснички. Брэд-
филд предположил, что 5 из 9 пар нитей на одной стороне од-
ДВИЖЕНИЯ КЛЕТОК И МИТОЗ 459
линдра быстро и одновременно сокращаются. Обратное
движение связано с медленным сокращением остальных четырех пар.
Центральные нити служат для передачи необходимого
сообщения (см. [53, 54]). Еще более сложно волнообразное движение
жгутиков (рис. 196). И жгутики и реснички движутся
согласованно как в смысле процессов, происходящих внутри
отдельного цилиндрического тела, так и в смысле координации
движений совокупности жгутиков и ресничек.
Энгельгардт с сотрудниками выделили из сперматозоидов
белок, сходный с актомиозином, названный ими спермозином
\ N
\ : /
\ i
ч
/ Л
■ ' ' ' X /
'/////////////У//////////////.
А Ф
Рнс. 195. Схема движения Рис. 196. Схема двнже-
ресннчкн. ння жгутика.
[55]. Это — сократительный белок. Существенно, что жгутики
оказались содержащими фермент, имеющий свойства АТФ-азы,
способный выделять энергию из АТФ. Нельсон показал, что
АТФ-азной активностью обладают внешние 9 пар нитей, но не
2 центральные. Сокращение и в этом случае происходит за
счет АТФ, и можно думать, что после решения проблемы
мышечной деятельности будет раскрыта природа движения
жгутиков и ресничек. Ясно, что мышечная деятельность легче
поддается изучению. В то же время имеются черты сходства
между мышечным движением и движением жгутиков и ресничек.
Деление клеток — процесс фундаментальной важности для
жизни индивидуума и вида, будь то одноклеточные или
многоклеточные организмы. Митоз лежит в основе жизни,
обеспечивая сохранение и размножение клеток. Очевидно, что клетка не
может расти неограниченно — без деления. Такой рост
неизбежно привел бы к нарушению гомеостатического состояния, к
перегреву и гибели клетки. Отсутствие роста и деления
означало бы отсутствие жизни, важнейшей особенностью которой
является самовоспроизведение.
Ясно, что проблемы, относящиеся к природе митоза и мей-
оза, непосредственно связаны с самыми глубокими вопросами
биологии — с общей проблемой жизни, старения и смерти,
с регуляцией и внутренней связью процессов в сложной.
460
ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
упорядоченной надмолекулярной структуре клетки, с
явлениями дифференциации. Мы встречаемся здесь с целостным
поведением клетки, изучение которого выходит за пределы
современной молекулярной биофизики. Однако из весьма сложного и еще
недостаточно изученного процесса митоза могут быть выделены
события, к пониманию которых не только можно, но и
необходимо подойти, руководствуясь молекулярной теорией.
При делении клетки производится механическая работа
перемещения хромосом и материала цитоплазмы. Это опять-таки
механохимический процесс—не подлежит сомнению, что
источником работы являются химические реакции, протекающие в
изотермических и изобарических условиях. Только этот процесс
нас здесь и интересует.
Наиболее глубокое и детальное исследование митоза
проведено в ряде работ Мэзиа (см. [56, 57]). Мэзиа представляет
общий план митоза в виде схемы, показанной на рис. 197 [56].
В интерфазе и профазе происходит подготовка к митозу,
удвоение центриолей (см. стр. 55), удвоение количества ДНК в
клетке, приводящее к образованию дочерних или сестринских
хромосом. Синтезируются вещества, из которых строится мито-
тический аппарат — видимые под микроскопом тяжи,
соединяющие друг с другом центриоли и хромосомы с центриолями.
Постройка этого аппарата завершается в метафазе.
Одновременно происходит рост клеточной массы. Мы знаем еще очень
мало о процессе постройки хромосом из ДНК, гистонов и,
возможно, других веществ. Более того, способ, которым
укладываются эти макромолекулы в хромосоме, пока также
неизвестен. Имеются экспериментальные данные, указывающие на то,
что запасание химической энергии, необходимой для
последующей механической работы, происходит не во время митоза, а
в период подготовки к нему. «С точки зрения экономики клетки
стоимость митоза в энергии выплачивается до того, как начался
митоз» (Мэзиа). Энергия, вероятно, запасается в макроэргиче-
ских фосфатных связях — если не в АТФ, то в других нуклео-
зидтрифосфатах, но, по-видимому, нельзя думать, что
механохимический процесс происходит в результате непосредственного
выделения этой энергии, так как уровень НТФ, сначала
возросший, резко падает до деления.
Необходимо подчеркнуть большое морфологическое
сходство между центриолями и основаниями жгутиков и ресничек —
механохимических устройств. Более того, показано, что жгутики
сперматозоидов вырастают именно из центриолей и кинетохо-
ров хромосом.
Основное рабочее вещество механохимического процесса в
деляющейся клетке находится в митотическом аппарате. Он
Репродукция хромосом
Хромосомная РНК
«Конденсация»
хромосом
Разрыв
ядерной
мембраны
* Вытягивание
л хромосом
Линетохары
прикреплены
к полюсам
Ж.
14
Разделение
сестринсних
хромосом
Синтез веществ
ахроматической фигуры.
Резервуар
энергии
чтехаждение
центриолей к
^ полюсам
Развитие
звезд
Образование
веретена
Удваенае и расщегг*
ление центриалс "
Резервуар
энервии
со
S
т
х
S
т
н
о
н
о
w
Деление
Подготовка
Анафаза
Метафаза
Время *-
Рис. 197. Последовательность событий при митозе (по Мэзиа).
Деление
462 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
состоит в основном из белка, до 11 % всего белка клетки входит
в митотический аппарат. Мэзиа удалось выделить митотический
аппарат из клетки и исследовать его. Аппарат обладает
двойной структурой — системой связей, соединяющих полюс с
полюсом, именуемой центральным веретеном, и системой связей
хромосом с полюсом, устанавливающейся в конце профазы.
Белок митотического аппарата иммунологически отличен от акто-
миозина, но его состав имеет определенные черты сходства
с актином. В отличие от белка мышц или ресничек, этот белок
представляет собой неустойчивую гелеобразную структуру. Его
I I
Рнс. 198.' Схема полимеризации в мнтотнческом аппарате (по Мэзиа).
механохимическая активность связана, по-видимому, с
возникновением и распадом надмолекулярной структуры —
происходит своего рода полимеризация митотического белка из
белковых молекул меньшего размера, а также его
деполимеризация. Возможно, что этот процесс в какой-то мере сходен с
переходами G-+F актина. Белок содержит тиольные группы;
характерно, что число растворимых SH-групп в клетке убывает
до метафазы, а затем снова возрастает. Мэзиа предложил
гипотезу, согласно которой образование митотического белка
происходит путем превращения внутримолекулярных дисуль-
фидных связей в межмолекулярные. В первой стадии процесса
уменьшается количество растворимых SH-групп, т. е.
уменьшается содержание глутатиона — трипептида Глу—Цис—Гли
СН2—SH
I
-ООС—СН2—СН2—CH(NHg)—CONH—СН—CONH—СН2—СООН
При этом разрываются внутримолекулярные дисульфидные
связи. На второй стадии образуются межмолекулярные S—S
связи, т. е. белок полимеризуется, а глутатион возвращается в раствор
(рис. 198). Полимеризованнын митотический аппарат —
веретено обладает оптической анизотропией и хорошо виден поэтому
в поляризационном микроскопе. Двойное лучепреломление ве-
ДВИЖЕНИЯ КЛЕТОК И МИТОЗ
463
ретена зависит от температуры. При очень низкой температуре
(4—6°) оно исчезает. Инуэ предполагает, что двойное
лучепреломление пропорционально количеству ориентированного
материала и, следовательно, температура влияет на константу
равновесия К между ориентированным и неориентированным
материалом [53].
Считая общее количество митотического белка А0
постоянным в метафазе, имеем равновесие
А0-В*=£ В,
где В — ориентированный белок. Константа равновесия равна
К=-х£в='-ь"№' (9-52)
где А/7 — соответствующая разность свободных энергий.
Действительно, в результате изучения зависимости двулуче-
преломления белка от температуры соотношение (9.50) под-
тверждается; In ^ _Б оказывается линейной функцией 1/7*:
ы в д/? д// 1 AS /о соч
ln^ZTg- = —W = --W+—' <9-53)
Полученные, таким образом, значения термодинамических
величин: AF= — 1,8 ккал/моль, Д#=28,4 ккал/моль, AS =
= 101 кал >моль~1 • град'1. Изменение свободной энергии мало,
что и указывает на большую лабильность митотического белка
в веретене, а большая теплота реакции АН объясняется
большой положительной энтропией. Последнее, возможно, связано
с «таянием» структурированной воды, присоединенной к
неориентированным белковым молекулам. Освободившись от
воды, молекулы лучше ориентируются.
Таким образом, в митотическом белке, вероятно, происходят
процессы полимеризации и ориентации. К теоретическому
рассмотрению последних следует, очевидно, привлечь идеи Флори
о спонтанном упорядочении макромолекул, обладающих
достаточной жесткостью (стр. 208). Имеющийся экспериментальный
материал не позволяет, однако, начать построение теории.
Если описанная картина' правильна, то при еще более
высокой температуре ориентация белковых молекул должна вновь
разрушаться и двойное лучепреломление — падать. Но,
возможно, этого нельзя наблюдать, так как повышение
температуры может привести к деструкции белка.
Как же связаны эти процессы, с движением хромосом? Для
объяснения этого движения предлагался ряд теорий или,
скорее, гипотез. Говорилось об автономности хромосом и их
464 ГЛ. 9. МЕХАНОХИМИЧЕСКИЕ ПРОЦЕССЫ
способности к самостоятельному движению. Были предложены
электрические и магнитные теории, исходящие из
соответствующего притяжения хромосом к полюсам и отталкивания
сестринских хромосом друг от друга. Реальных доказательств этого
нет. Магнитные поля с напряженностью вплоть до 43 000 гаусс
никак не влияют на митоз. Удивляться этому не приходится:
в биологических явлениях, как правило, мы не встречаемся
с какими-либо специфическими магнитными свойствами, за
исключением определяемых железом тема и подобных ему
групп. Говорилось о диффузионных силах, вызывающих
движение хромосом, но высокая организованность и упорядоченность
этого движения не могут быть объяснены на такой основе. То
же относится к течению протоплазмы. Бернал еще в 1940 г.
высказал соображения о тактоидной природе веретена, т. е. о том,
что оно образуется из растворенных белковых молекул
наподобие жидкокристаллического агрегата [59]. Это — картина, уже
приближающаяся к изложенной. Однако митотический аппарат
образуется не только путем совместной ориентации
макромолекул, но и путем полимеризации.
Согласно Мэзиа, расхождение хромосом к полюсам не
связано с сокращением митотических волокон, соединяющих кине-
тохоры хромосом с центриолями по типу скручивания белковых
цепей. Волокна при таком сокращении не утолщаются.
Поэтому есть основания думать, что сокращение определяется
деполимеризацией. Волокно укорачивается в результате
выпадения части материала. Напротив, при расхождении полюсов
волокно удлиняется за счет полимеризации и расталкивает цен-
триоли. Кинетохоры хромосом соединены с волокном
непосредственно. Таким образом, движение при митозе сводится к
расталкиванию и стягиванию хромосом и центриолей не
специальными силами, а волокнами белкового вещества. Механохими-
ческий характер процесса доказывается, в частности, тем, что
добавление АТФ вызывает удлинение митотического аппарата.
Скорость удлинения при митозе составляет 1,5 \х/мин — она
невелика.
Это — специфическая механохимия, отличная от
обеспечивающей мышечную деятельность и, по-видимому, движение
ресничек и жгутиков, хотя морфологическое сходство их базальных
тел с центриолями примечательно. Укажем попутно, что палочки
и колбочки сетчатки глаза, т. е. ее светочувствительные
элементы, также морфологически родственны ресничкам —
структура «9+2» имеет достаточно широкое распространение [60].
Представляет актуальный интерес теоретическое
рассмотрение модельного полимеризационного и деполимеризационного
процесса, как источника механического движения. Однако мы
движения клеток и митоз 465
еще очень далеки от понимания митоза в целом. Но можно
думать, что дальнейшие исследования приведут в конце концов
к идеальной ситуации, к полному объяснению последовательно
и закономерно развивающихся явлений и их взаимосвязи.
Укажем вновь, в заключение этой главы, на механохимиче-
ские процессы в митохондриях (стр. 143). Весьма вероятно, что
здесь мы встречаемся с механохимией более сходной с
мышечной — определяемой конформационными изменениями
ферментов [61].
Нейфах выделил из митохондрий сократительный белок,
подобный актомиозину [62]. Процесс окислительного фосфорили-
рования в митохондриях связан со сложной механохимией.
С еще одним примером сократительной белковой системы мы
встречаемся при изучении фагов. «Хвост» фаговой частицы
является, по-видимому, сократительным органом, действием
которого и объясняется введение ДНК фаговой частицы в
бактериальную клетку [63].
»
ГЛАВА 10
ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ БИОФИЗИКИ
МАКРОМОЛЕКУЛЫ И БИОЛОГИЯ
Подведем некоторые итоги. Эта книга в основном посвящена
физике и биологической функциональности макромолекул
белков и нуклеиновых кислот. В свое время Шредингер дал
обоснованный ответ на им же поставленный вопрос — почему
организмы содержат большое число атомов? Пойдем теперь далее
и зададимся другим вопросом — почему важнейшие
биологически-функциональные вещества макромолекулярны [1]?
Из всего рассказанного выше с очевидностью следует, что
жизнь в той ее форме, в какой она существует на нашей
планете, требует именно макромолекул. Живой организм —
саморегулирующаяся, самовоспроизводящаяся, открытая система.
Для осуществления этих свойств необходимо выполнение
молекулами ряда биологических функций.
Должна запасаться генотипическая и фенотипическая
информация.-Простейший способ для этого, который может быть
придуман человеком, состоит в создании линейного текста. Но
человек является частью природы и способ его мышления в
конечном счете определяется общебиологическими
закономерностями. Поэтому, вероятно, не следует удивляться тому, что и
запасание информации в клетке происходит тем же способом —
в первичной структуре биологических макромолекул — длинных
линейных образований.
Эта информация трансформируется и перекодируется в
биосинтетических процессах. Самовоспроизведение требует
матричного синтеза, обеспечивающего передачу информации
образующимся молекулам. Мы уже приводили соображения в пользу
именно линейной макромолекулярной матрицы (стр. 327).
Сохранность информации, имеющая в то же время не
абсолютный характер (мутации), обеспечивается структурой
макромолекулярной цепи, сохраняющейся, как целое, при изменениях
отдельных звеньев.
. Конформационная лабильность макромолекул определяет
возникновение высших уровней структуры, начиная со
вторичной. Это — свойство, необходимое для биологически функцио-
МАКРОМОЛЕКУЛЫ И БИОЛОГИЯ
467
нальных молекул, так как биологическая специфичность
связана со структурными соответствиями (гл. 8). Возможность
создания из макромолекул весьма разнообразных полностью или
неполностью упорядоченных надмолекулярных структур играет
важнейшую роль в организации внутриклеточных процессов.
Мы видели, что специфичность и эффективность биохимических
реакций определяется особенностями строения макромолекул
ферментов и, в частности, их конформационными свойствами.
Ясно, что в низкомолекулярной системе возможности конформа-
ционных превращений химически неизменяемого вещества очень
ограничены по сравнению с системой макромолекулярной.
Следует отметить, что конформационная лабильность дает
добавочные возможности участия в необратимых процессах,
протекающих в открытой системе, связанные со степенями свободы
внутреннего вращения.
Та же конформационная лабильность макромолекул
обеспечивает, как указывалось (стр. 406), специальные возможности
передачи информации в регуляторных процессах, в частности,
в явлении аллостеризма. Вещества, играющие роль
регуляторов— репрессоры белкового синтеза, инициаторы редупликации
нуклеиновых кислот, — макромолекулярны. Аллостерический
способ регуляции присущ только живым системам, он
обеспечивается структурными соответствиями и их изменениями.
Можно думать, что аллостеризм — одно из ключевых явлений
жизни, поэтому исключительно важными представляются его
дальнейшие исследования.
Способность полужестких макромолекул к
самопроизвольной упорядоченности в отсутствие специфических сил
взаимодействия существенна, очевидно, для создания внутриклеточных
структур. Свойство организма быть «апериодическим
кристаллом» на всех уровнях строения, начиная с молекулярного
и кончая организмом в целом, заложено в строении
макромолекул. Нам неизвестны апериодические, но высокоупорядочен-
ные системы, построенные из малых молекул, и такие системы
трудно себе представить. Существенно, что совокупность малых
молекул может быть упорядоченной лишь в твердой фазе и
при условии весьма ограниченного химического разнообразия.
Напротив, совокупность макромолекул упорядочена всегда уже
в силу линейного строения каждой полимерной цепи.
Определенная упорядоченность присуща макромолекулам и их
агрегатам и в растворе, и в расплаве, и в состоянии аморфного
твердого тела. В то же время макромолекулы обладают
необходимой конформационной лабильностью.
Жизнь невозможна без механического движения. Мы уже
говорили о специальной роли макромолекул, как рабочих
468 гл. ю. проблемы молекулярной биофизики
веществ механохпмических процессов (стр. 425). Макромоле-
кулярная механохимия может быть весьма разнообразной, как
об этом свидетельствует хотя бы большое число гипотез о
природе мышечной деятельности (стр. 441). К способности
макромолекул претерпевать конформационные превращения н
образовывать надмолекулярные структуры здесь следует добавить
полимеризационные процессы, реализуемые, вероятно, в
G-+F переходах актина и в механике митоза.
Жизнь возникла и существует в солевых растворах.
Определенная концентрация малых ионов, определенные значения
рН отрегулированы в живых клетках. Природа использует
изменения концентрации ионов и их перемещение для реализации
ряда биологических процессов. Эти, возникшие на очень
ранней стадии эволюции, возможности определяются
полиэлектролитным характером биологических полимеров. Взаимодействие
живых систем с окружающей их средой — прежде всего с
морской водой, должно было осуществляться в значительной
степени посредством сорбции и переноса ионов. Можно думать,
что в этом состоит одна из причин образования живых существ
из макромолекул полиэлектролитов — белков и нуклеиновых
кислот.
Вернемся к «апериодическому кристаллу». Любые
изменения в состоянии биологических систем представляют собой
изменения состояния упорядоченности. На молекулярном уровне
примерами таких изменений являются переходы спираль —
клубок и, следовательно, любые изменения вторичной и
третичной структуры белков, реализующиеся при взаимодействии
фермент — субстрат, фермент — продукт, фермент — аллостери-
ческий ингибитор. Изменения упорядоченности происходят при
механохимических процессах и при матричном биосинтезе
белков и нуклеиновых кислот, на сходство которого с
кристаллизацией уже давно обращалось внимание (см., например, [2, 3]).
Процессы упорядочения и разупорядочения в неживом
веществе хорошо известны физике. Это — кооперативные
процессы фазовых переходов, существенным образом зависящие
от взаимодействия элементов рассматриваемой системы —
атомов и молекул. Конечно, кооперативное взаимодействие
проявляется не только в фазовых переходах, но и во многих
других явлениях. Так, например, при размягчении отожженного
полимерного стекла энтальпия меняется очень резким
скачком — этот процесс имитирует плавление кристалла [4]. Между
тем никакого фазового перехода в термодинамическом смысле
здесь нет. Структура стекла подобна структуре жидкости, а его
отличие от жидкости объясняется не термодинамическими,
а кинетическими причинами — чрезвычайно большими време-
МАКРОМОЛЕКУЛЫ И БИОЛОГИЯ
469
нами перестройки молекулярной структуры при температуре
более низкой, чем температура стеклования. Стекло находится
в неравновесном состоянии. Несомненно, однако, что в фазовых
переходах кооперативность проявляется с особенной яркостью.
Но если биологические процессы столь тесно связаны
с явлениями упорядочения и разупорядочения или, говоря на
языке теории информации, с накоплением, потерей и передачей
информации, то ясно, что в основе молекулярной биофизики
находится теория кооперативных процессов [5].
Кооперативность, с которой мы встречаемся в живых системах, есть
выражение кооперативных свойств макромолекул — этих
своеобразных цепей Маркова (стр. 161).
Биологический смысл кооперативности в живых системах
определяется, с одной стороны, в термодинамическом аспекте
необходимой высокой упорядоченностью этих систем и тем,
что любое движение в них (в общем, а не механическом
значении этого слова) означает какие-то изменения
упорядоченности. С другой стороны, биологическая система может жить,
только если она очень точно и согласованно реагирует на
изменения внешней и внутренней среды. Такие реакции
осуществляются кооперативным образом, протекая как своего рода
автокаталитические процессы. Следовательно, кооперативность
биологических макромолекул существенна и в кинетическом
отношении.
Понимание этого обстоятельства снимает ряд вопросов,
относящихся, например, к мышечной деятельности и к нервной
проводимости. Почему мышечное волокно срабатывает как
целое, почему нервная клетка реагирует на возбуждение по
принципу «все или ничего»? Для объяснения этих и других
подобных явлений часто привлекаются концепции, связанные
с квантовой механикой, представления о миграции энергии
и т. д. [6]. Можно думать, однако, что истинное объяснение
таких процессов должно основываться на рассмотрении
кинетических и термодинамических кооперативных свойств
биополимеров. О соотношении молекулярной биофизики и квантовой
механики рассказано далее (стр. 471). Автокаталитический
характер кооперативных процессов означает наличие некоторой
обратной связи. Действительно, поскольку элементы
рассматриваемого ансамбля — скажем, звенья полимерной цепи —
взаимодействуют и это взаимодействие приводит к изменению
■состояния системы, оно в свою очередь изменяет
взаимодействие.
Таким образом, жизнь на Земле макромолекулярна,
молекулярная биофизика — это макромолекулярная биофизика. Этим
раскрывается современный физический смысл справедливых
470 ГЛ. 10. ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ БИОФИЗИКИ
слов Энгельса: «Жизнь есть форма существования белковых
тел...».
Пофантазируем немного. Попытаемся представить себе
живую систему, т. е. открытую, саморегулирующуюся и
самовоспроизводящуюся систему, построенную не из макромолеку-
лярных, а из других материалов.
Очевидно прежде всего, что организованная
низкомолекулярная система должна быть кристаллической, а не жидкой
или, тем более, газовой. Неупорядоченная система не может
обеспечить закономерных взаимодействий с внешней средой,
хранения и передачи информации и т. д. Изменения состояния
элементов низкомолекулярного кристаллического «живого
существа» могли бы в принципе происходить в результате частичного
плавления и кристаллизации или превращений кристаллической
решетки, т. е. фазовых переходов. Другая возможность
состояла бы в изменении намагниченности и электризации
кристаллов — т. е. также в изменении упорядоченности.
Такая система не являлась бы замкнутой — она вполне могла
бы обмениваться энергией и информацией, т. е. энтропией,
с окружающей средой, но обмен веществом был бы сильно
затруднен, так как химические реакции в твердой фазе требуют
больших энергий активации, хотя бы уже потому, что
молекулам трудно в нее диффундировать. Наша система была бы
в этом смысле достаточно инертной.
Однако, при наличии проводниковых или
полупроводниковых свойств, «кристаллический организм» мог бы весьма быстро
реагировать на изменения во внешней среде и осуществлять
сложные функции, подобные функциям реальных, макромоле-
кулярных организмов. Он мог бы воспринимать любую
информацию, запасать и перерабатывать ее, выполняя сложные
движения. Он мог бы приобретать условные рефлексы,
производить всевозможные виды работ. Он мог бы редуплнцироваться
и, более того, эволюционировать, строя из материалов
окружающей среды себе подобные и более совершенные системы.
Мы естественным образом пришли к фантазии о
кибернетическом роботе будущего. Создание немакромолекулярной
системы, моделирующей живой организм, действительно
возможно.
Но могла ли бы такая система быть создана без участия
человека, мог ли бы кристаллический низкомолекулярный
организм, хотя бы и примитивный, возникнуть самопроизвольно,
в результате естественной эволюции?
Это представляется невероятным именно в силу большой
инертности подобной системы в процессах обмена веществом
и энергией. Макромолекулы могут создаваться в результате
МОЛЕКУЛЯРНАЯ БИОФИЗИКА И КВАНТОВАЯ МЕХАНИКА 471
полимеризационных процессов из малых молекул, вначале
присутствовавших на Земле — в ее атмосфере и гидросфере — и,
надо думать, на других планетах. Далее они могут уже
образовывать надмолекулярные структуры и живые организмы. Но
нельзя научно обосновать возможность самопроизвольного
эволюционного превращения низкомолекулярных, металлических
и полупроводниковых кристаллов в живые системы. Макро-
молекулярность организмов неразрывно связана с их
эволюционным происхождением, с тем, что живое когда-то возникло
из неживого. Это, может быть, наиболее важное соображение,
дающее ответ на вопрос о том, почему организмы макромоле-
кулярны.
Следовательно, кибернетическая немакромолекулярная
машина, воспроизводящая жизнь, могла бы и может быть
создана на Земле только человеком. Дальше она может
совершенствоваться и самосовершенствоваться в принципе
неограниченно. В построении кибернетических машин проявляются
особенности современного этапа биологического и социального
развития homo sapiens, в нем выражается неограниченная
творческая и познавательная мощь человеческого разума.
Биологическая эволюция человека, по-видимому, закончилась: в
результате общественной жизни человек уже не подчиняется
закону биологического естественного отбора. Мозг человека
настолько совершенен, что может познать природу жизненных
явлений и организовать их искусственное воспроизведение.
Дальнейшее развитие кибернетики связано с социальной
эволюцией человека и в этом смысле не только не принижает его
роли, но обещает сделать его творцом жизни в прямом смысле
этого слова.
МОЛЕКУЛЯРНАЯ БИОФИЗИКА И КВАНТОВАЯ МЕХАНИКА
Молекулярная биофизика— новая, необычайно интересная
область физики. Она изучает молекулярные явления в живых
системах. Естественным образом возникает мысль о
специфических квантовомеханических свойствах таких систем.
Можно привести соображения в пользу этой идеи.
Во-первых, все современное развитие областей физики, изучающих
вещество — атомы, молекулы, кристаллы, — неразрывно
связано с квантовой механикой, без которой нельзя было бы
объяснить важнейших явлений — строения и спектров атомов и
молекул, химическую связь и дисперсионные межмолекулярные
силы, свойства полупроводников и сверхпроводимость,
ферромагнетизм и электропроводность металлов. Мы не говорим уже
о свойствах элементарных частиц и строении атомного ядра.
472 ГЛ. 10, ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ БИОФИЗИКИ
Микросистемы подчиняются не классическим, а квантовым
закономерностям. Так как многие важнейшие биологические
явления определены строением и свойствами молекул, естественно
думать, что они также не могут быть объяснены без помощи
квантовой механики.
Во-вторых, известен ряд несомненно квантовых
биологических процессов. Мы знаем, что мутации вызываются квантами
коротковолновой радиации. В основе фотосинтеза и
зрительного восприятия лежат фотохимические процессы,
начинающиеся с поглощения кванта, в соответствии с основным законом
фотохимии, открытым Эйнштейном и сыгравшим важную
роль при установлении квантовой природы излучения.
В-третьих, существует чисто психологический эффект,
определяемый громадными достижениями квантовой физики.
Представляется особенно интересным и заманчивым применить
квантовомеханические представления в новой области — в
биологии.
Следует, однако, отвлечься от любых психологических
моментов и трезво подойти к проблеме соотношения квантовой
механики и молекулярной биофизики или даже еще более
широко — биологии в целом.
Лонгет-Хиггинс развивает в связи с этой проблемой идеи,
которые нельзя не принять [7]. Специальные квантовые
эффекты заметны только, если кванты энергии, которыми
обмениваются различные части системы, велики по сравнению с
тепловой энергией kT. Однако, за немногими исключениями,
процессы, протекающие в живом веществе, представляют собой
«темновые реакции» — они идут без участия радиации, без
больших квантов энергии. Действительно, это полностью
справедливо для всех явлений, рассмотренных в предыдущих
главах — для денатурации и биосинтеза биополимеров, для
ферментативной и иммунологической активности, для механохими-
ческих процессов. Ранее уже приводились соображения,
опровергающие попытки истолковать синапсис хромосом или
сокращение мышечного волокна как специфические квантовые
явления (стр. 418, 447). «Темновыми реакциями» являются все
основные биохимические процессы, а также процессы
активного и пассивного транспорта, участвующие в физиологической
функции.
Квантовыми процессами в норме являются, как уже
сказано, фотосинтез, первичный акт зрительного восприятия и
биолюминесценция. Это — явления, состоящие в поглощении и
испускании видимого света, т. е. больших квантов,
следовательно — явления электронные.
МОЛЕКУЛЯРНАЯ БИОФИЗИКА И КВАНТОВАЯ МЕХАНИКА 473
Несомненно, квантовая механика определяет в конечном
счете все свойства биологических молекул, равно как и
любых других молекул — больших или малых. Само
существование молекулы, существование химической связи не может быть
понято без квантовой механики. То же относится к
дисперсионным межмолекулярным силам. В этом смысле вся химия
неразрывно связана с квантовой механикой. А значит и
биология. Вопрос состоит в другом — проявляются ли в свойствах
биологических систем, биологических молекул специальные
квантовые эффекты сверх того, что уже заложено в химии?
Иными словами, являются ли основные молекулярно-биологи-
ческие процессы электронными процессами?
Применительно к перечисленным «темповым реакциям» на
этот вопрос следует ответить отрицательно. С особыми
электронными свойствами молекул в целом мы встречаемся,
например, в тех случаях, когда молекулы содержат электроны,
не локализованные в отдельной химической связи, а
обобществленные. Это происходит, например, при сопряжении
химических связей. Простейшая молекула с сопряженными
связями — 1, 4-бутадиен
Н2С = СН—СН = СНг*
Велико число сопряженных связей в порфириновом цикле
(стр. 143), в каротине — красящем веществе моркови,
провитамине А. Приводим его схематическую структурную формулу
/
\А
Витамин А создается в организме животного, получившего
каротин в пище, в результате разрыва длинной молекулы
каротина на две равные половины и присоединений к
образовавшимся концам дбух атомов водорода и одного атоМа кислорода.
Молекулы с сопряженными связями до некоторой степени
подобны проводникам электрического тока, так как электроны
в них моГут перемещаться вдоль всей цепи сопряжения.
Квантовая механика применяет для теоретического рассмотрения
таких молекул «металлическую» модель, непосредственно
учитывающую делокализацию электронов (см., например, [8]). Если
бы белки и нуклеиновые кислоты, углеводы и липиды
представляли собой цепи сопряженных связей, то, ввиду их большой
длины, можно было бы ожидать появления специфических
3] М. В. Волькенштейп
474 ГЛ. 10. ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ БИОФИЗИКИ
электронных квантовофизических свойств — такие молекулы
были бы своеобразными проводниками, их взаимодействие друг
с другом и с иными молекулами могло бы оказаться весьма
своеобразным. Однако в биополимерах никакого сопряжения
нет, это типичные диэлектрики.
Иногда говорят об особых полупроводниковых свойствах
белков. Это — недоразумение, белки не являются
полупроводниками в своем основном, невозбужденном состоянии. Для
электронного возбуждения белка нужны кванты энергии,
значительно большие kT. В этом смысле биополимеры не отличаются
от подавляющего большинства известных науке синтетических
полимеров. С полупроводниковыми свойствами полимеров
приходится встречаться в немногих случаях специально
синтезируемых цепей с сопряженными связями, с сопряженными
бензольными кольцами. Конечно, эти случаи представляют большой
теоретический и практический интерес.
Грубым критерием отсутствия сопряжения в длинной цепи
служит отсутствие поглощения света в видимой области, одно
из специальных свойств сопряженных систем — их цветность,
легко объясняемая с помощью «металлической» модели.
Каротин имеет интенсивную красно-оранжевую окраску. Белки и
нуклеиновые кислоты, углеводы и липиды — бесцветны, они
поглощают свет в достаточно далекой ультрафиолетовой области
спектра.
Но гемоглобин-го ведь окрашен. Его окраска связана,
однако, не с белковой частью молекулы, а с группой тема,
содержащей порфириновое кольцо. Биологическая функция
гемоглобина состоит в переносе кислорода. Здесь нет специального
квантового эффекта, существенно отличного от известных
В обычной химии неживого — переход гемоглобина в оксигемо-
глобин и его восстановление объясняются прежде всего
химическими свойствами тема, а не полимерной молекулы.
Как мы видели, физика макромолекул и, следовательно,
физика биологических макромолекул строится, исходя из кван-
товомеханичесКоГо факта Их существования, на классической
основе.
Специфические свойства биологических макромолекул
определяются в первую очередь их конформационной кооператив-
ностью, а не электронными явлениями. Необходимым
аппаратом теории здесь является не квантовая механика, а
классическая статистическая физика и кинетика. Именно таким
неквантовым проблемам и посвящена эта книга.
Мы видели, что и процессы матричного синтеза белков и
нуклеиновых кислот «классичны», если, конечно, отвлечься от
чисто химических явлений ферментативного катализа.
МОЛЕКУЛЯРНАЯ БИОФИЗИКА Н КВАНТОВАЯ МЕХАНИКА 475
Можно, казалось бы, ожидать проявлений особых квантовых
свойств у организованных надмолекулярных структур. В самом
деле, такие структуры подобны кристаллическим твердым
телам. Для понимания некоторых свойств низкомолекулярных
кристаллов квантовая механика необходима. Однако квантовые
проводниковые и полупроводниковые свойства,
интерпретируемые зонной теорией проводимости, не присущи молекулярным
кристаллам, т. е. телам, в узлах кристаллической решетки
которых находятся молекулы с насыщенными химическими связями.
Такие кристаллы являются обычно диэлектриками
(полупроводниковые свойства кристаллов антрацена связаны с примесными
центрами), их строение можно хорошо объяснить, исходя из
принципа плотной упаковки молекул, характеризуемых ван-
дер-ваальсовыми поверхностями [9]. С квантовомеханическими
свойствами таких систем мы встречаемся только при их
электронном возбуждении. Упорядоченные структуры, построенные
из макромолекул, и в этом смысле «классичны».
С другой стороны, упорядоченная структура хлоропласта
растительной клетки предназначена для взаимодействия ее
электронов со светом, и соответствующая теория должна быть
квантовой. Но ведь здесь речь идет уже не о «темновой реакции».
В то же время существует множество биохимических
проблем первостепенной важности, решение которых требует
квантовомеханических методов. Сегодня можно уже говорить о
квантовой биохимии [10, 11, 12]. Речь вдет о квантовомеханических
исследованиях свойств биологически функциональных молекул
и их частей, хотя бы и не связанных в общую цепь сопряжения.
Квантовая химия дала много ценного химии неживого —
органической и неорганической — и нет никаких оснований
сомневаться в ее возможностях в области биохимии. Перечислим
некоторые задачи, к которым квантовая химия уже применялась —
и не без успеха [11].
Несмотря на отсутствие сопряжения в макромолекулах
биополимеров в целом, в ряде случаев их функциональные группы
являются сопряженными системами. Для понимания
химических свойств таких групп необходима квантовая химия. Это
относится к пуринам и пиримидинам в ДНК и РНК, к Фен, Три,
Тир в белках. Наличие сопряжения в азотистых основаниях
нуклеиновых кислот проявляется, в частности, в их
устойчивости по отношению к ионизующей и ультрафиолетовой
радиации. Все химические свойства указанных групп имеют разумное
квантовохимическое истолкование.
Мы уже говорили о значении таутомерии азотистых
оснований в проблеме мутагенеза. Очевидно, что теоретический анализ
этого явления также должен быть квантовохимическим.
31*
МОЛЕКУЛЯРНАЯ БИОФИЗИКА Н КВАНТОВАЯ МЕХАНИКА 475
Можно, казалось бы, ожидать проявлений особых квантовых
свойств у организованных надмолекулярных структур. В самом
деле, такие структуры подобны кристаллическим твердым
телам. Для понимания некоторых свойств низкомолекулярных
кристаллов квантовая механика необходима. Однако квантовые
проводниковые и полупроводниковые свойства,
интерпретируемые зонной теорией проводимости, не присущи молекулярным
кристаллам, т. е. телам, в узлах кристаллической решетки
которых находятся молекулы с насыщенными химическими связями.
Такие кристаллы являются обычно диэлектриками
(полупроводниковые свойства кристаллов антрацена связаны с примесными
центрами), их строение можно хорошо объяснить, исходя из
принципа плотной упаковки молекул, характеризуемых ван-
дер-ваальсовыми поверхностями [9]. С квантовомеханическими
свойствами таких систем мы встречаемся только при их
электронном возбуждении. Упорядоченные структуры, построенные
из макромолекул, и в этом смысле «классичны».
С другой стороны, упорядоченная структура хлоропласта
растительной клетки предназначена для взаимодействия ее
электронов со светом, и соответствующая теория должна быть
квантовой. Но ведь здесь речь идет уже не о «темновой реакции».
В то же время существует множество биохимических
проблем первостепенной важности, решение которых требует кван-
товомеханических методов. Сегодня можно уже говорить о
квантовой биохимии [10, 11, 12]. Речь вдет о квантовомеханических
исследованиях свойств биологически функциональных молекул
и их частей, хотя бы и не связанных в общую цепь сопряжения.
Квантовая химия дала много ценного химии неживого —
органической и неорганической — и нет никаких оснований
сомневаться в ее возможностях в области биохимии. Перечислим
некоторые задачи, к которым квантовая химия уже применялась —
и не без успеха [11].
Несмотря на отсутствие сопряжения в макромолекулах
биополимеров в целом, в ряде случаев их функциональные группы
являются сопряженными системами. Для понимания
химических свойств таких групп необходима квантовая химия. Это
относится к пуринам и пиримидинам в ДНК и РНК, к Фен, Три,
Тир в белках. Наличие сопряжения в азотистых основаниях
нуклеиновых кислот проявляется, в частности, в их
устойчивости по отношению к ионизующей и ультрафиолетовой
радиации. Все химические свойства указанных групп имеют разумное
квантовохимическое истолкование.
Мы уже говорили о значении таутомерии азотистых
оснований в проблеме мутагенеза. Очевидно, что теоретический анализ
этого явления также должен быть квантовохимическим.
31*
476' ГЛ. 10. ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ БИОФИЗИКИ
Такому же анализу подлежат химические явления
ферментативного катализа—-взаимодействие субстрата с белком —
ферментом и превращение комплекса фермент-субстрат.
Характерно, что коферменты и простетические группы — порфирины,
каротиноиды и т. д. — являются сопряженными системами.
Окислительно-восстановительные процессы, идущие с
участием ДПН, цитохромов и др., представляют интересную кван-
товохимическую проблему. Здесь чрезвычайно важно понять
электронно-донорные и электронно-акцепторные свойства
рассматриваемых соединений. Несмотря на то, что биохимик и
биофизик могут исходить из существования макроэргическои связи
в АТФ, как из факта, исследование особой электронной
структуры этой связи [11, 13, 14] означает нечто большее, чем
удовлетворение научной любознательности.
Нельзя, однако, согласиться с мнением Пюльманов [11],
говорящих, что основные проявления жизни глубоко связаны с
существованием сильно сопряженных соединений. Все изложенное
выше показывает, что дело не в этом.
Трудно также придавать серьезное значение попыткам
объяснить канцерогенные свойства бензпирена и подобных ему
соединений путем расчета электронных плотностей и порядков
связей в таких молекулах. К чему бы не сводился канцерогенез —
к созданию соматических мутаций или к изменению пока еще
непонятных регуляторных процессов или, вернее всего, к тому
и другому, он не может быть объяснен электронными
свойствами канцерогенов в отрыве от общих биологических причин,
определяющих злокачественный рост клеток.
Во всех перечисленных задачах мы не выходим за пределы
обычных применений квантовой механики в химии. Законно
говорить о квантовой биохимии, но не следует переоценивать
общебиологическое значение квантовой механики.
Конечно, физические свойства биополимеров, связанные с
движением электронов, требуют для своего истолкования
квантовой механики, квантовой химии. Это целиком относится к
оптическим свойствам ДНК и белков — к гипохромному эффекту,
к изменениям оптической активности при переходах спираль —
клубок. В этом смысле биополимеры специфичны, но их
квантовая химия не отличается принципиально от квантовой химии
какой-либо другой группы соединений.
Нельзя утверждать, что дальнейшее развитие молекулярной
биофизики и биологии в целом не потребует создания
существенно новых физических теорий и представлений — в частности,
квантовомеханических. Но все, что мы знаем сейчас в этой
области, не свидетельствует в пользу такой возможности, и ее
обсуждение поэтому пока лишено содержания,
476' ГЛ. 10. ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ БИОФИЗИКИ
Такому же анализу подлежат химические явления
ферментативного катализа—-взаимодействие субстрата с белком —
ферментом и превращение комплекса фермент-субстрат.
Характерно, что коферменты и простетические группы — порфирины,
каротиноиды и т. д. — являются сопряженными системами.
Окислительно-восстановительные процессы, идущие с
участием ДПН, цитохромов и др., представляют интересную кван-
товохимическую проблему. Здесь чрезвычайно важно понять
электронно-донорные и электронно-акцепторные свойства
рассматриваемых соединений. Несмотря на то, что биохимик и
биофизик могут исходить из существования макроэргической связи
в АТФ, как из факта, исследование особой электронной
структуры этой связи [11, 13, 14] означает нечто большее, чем
удовлетворение научной любознательности.
Нельзя, однако, согласиться с мнением Пюльманов [11],
говорящих, что основные проявления жизни глубоко связаны с
существованием сильно сопряженных соединений. Все изложенное
выше показывает, что дело не в этом.
Трудно также придавать серьезное значение попыткам
объяснить канцерогенные свойства бензпирена и подобных ему
соединений путем расчета электронных плотностей и порядков
связей в таких молекулах. К чему бы не сводился канцерогенез —
к созданию соматических мутаций или к изменению пока еще
непонятных регуляторных процессов или, вернее всего, к тому
и другому, он не может быть объяснен электронными
свойствами канцерогенов в отрыве от общих биологических причин,
определяющих злокачественный рост клеток.
Во всех перечисленных задачах мы не выходим за пределы
обычных применений квантовой механики в химии. Законно
говорить о квантовой биохимии, но не следует переоценивать
общебиологическое значение квантовой механики.
Конечно, физические свойства биополимеров, связанные с
движением электронов, требуют для своего истолкования
квантовой механики, квантовой химии. Это целиком относится к
оптическим свойствам ДНК и белков — к гипохромному эффекту,
к изменениям оптической активности при переходах спираль —
клубок. В этом смысле биополимеры специфичны, но их
квантовая химия не отличается принципиально от квантовой химии
какой-либо другой группы соединений.
Нельзя утверждать, что дальнейшее развитие молекулярной
биофизики и биологии в целом не потребует создания
существенно новых физических теорий и представлений — в частности,
квантовомеханических. Но все, что мы знаем сейчас в этой
области, не свидетельствует в пользу такой возможности, и ее
обсуждение поэтому пока лишено содержания,
МОЛЕКУЛЯРНАЯ БИОФИЗИКА И КВАНТОВАЯ МЕХАНИКА 477
Рассмотрим теперь некоторые биофизические проблемы,
связанные уже не с «темновыми реакциями», а с процессами
электронного возбуждения. Миграция энергии посредством
резонансного взаимодействия или других механизмов неоднократно
привлекалась для объяснения биофизических и биохимических
процессов [10, 12, 15]. Как уже сказано, нет оснований говорить
о наличии достаточно близких обобществленных электронных
уровней у биополимеров. Нет также оснований для миграции
электронного возбуждения по структурированной воде —
водородные связи не создают никакого сопряжения.
В то же время, миграция энергии, по-видимому, происходит
в фотохимических биологических процессах. Молекулы
хлорофилла, регулярно упакованные в хлоропластах, образуют своего
рода кристаллическую структуру, и поглощение каждого фотона
может вызвать коллективное возбуждение всего агрегата.
Такие возбуждения действительно быстро распространяются в
обычных молекулярных кристаллах, в частности в кристаллах
ароматических соединений. Поглощенный квант вызывает
появление экситона — своего рода квантовой частицы, перемещение
которого и означает миграцию возбуждающей энергии по
кристаллу. Так, например, в каком-то месте кристалла фотон
вырывает электрон из атома или из молекулы, образуется экситон —
комбинация электрона и «дырки», т. е. места, в котором
электрона не хватает. В результате резонансного
взаимодействия (см. стр. 227) электрон перемещается по кристаллу до
места, в котором имеется акцептор электрона — ловушка для него
или ловушка для дырки — донор электрона. Распространение
экситона, с одной стороны, приводит к быстрой миграции
энергии, с другой — к специальным оптическим явлениям — к
изменению спектров люминесценции и поглощения света [10, 12,
15—17]. Понятие экситона было введено в физику Френкелем
[18]. Для интерпретации соответствующих процессов квантовая
механика совершенно необходима. Здесь имеется ряд
нерешенных вопросов. Например, являются ли мигрирующие экситоны
синглетными или триплетными, т. е. равен ли суммарный спин
экситона нулю или единице? Может ли один экситон вызвать
химические изменения, или хлоропласт должен запасти много
квантов до того, как пройдет реакция?
Рассмотрение явлений фотосинтеза относится к
молекулярной биофизике, но выходит за рамки этой книги. Во-первых,
потому, что благодаря трудам Кальвина, Теренина и других
изучение фотосинтеза стало обширной областью биофизики,
требующей самостоятельного изложения; во-вторых, потому,
что книга посвящена «темновым» свойствам биологических
МОЛЕКУЛЯРНАЯ БИОФИЗИКА И КВАНТОВАЯ МЕХАНИКА 477
Рассмотрим теперь некоторые биофизические проблемы,
связанные уже не с «темновыми реакциями», а с процессами
электронного возбуждения. Миграция энергии посредством
резонансного взаимодействия или других механизмов неоднократно
привлекалась для объяснения биофизических и биохимических
процессов [10, 12, 15]. Как уже сказано, нет оснований говорить
о наличии достаточно близких обобществленных электронных
уровней у биополимеров. Нет также оснований для миграции
электронного возбуждения по структурированной воде —
водородные связи не создают никакого сопряжения.
В то же время, миграция энергии, по-видимому, происходит
в фотохимических биологических процессах. Молекулы
хлорофилла, регулярно упакованные в хлоропластах, образуют своего
рода кристаллическую структуру, и поглощение каждого фотона
может вызвать коллективное возбуждение всего агрегата.
Такие возбуждения действительно быстро распространяются в
обычных молекулярных кристаллах, в частности в кристаллах
ароматических соединений. Поглощенный квант вызывает
появление экситона — своего рода квантовой частицы, перемещение
которого и означает миграцию возбуждающей энергии по
кристаллу. Так, например, в каком-то месте кристалла фотон
вырывает электрон из атома или из молекулы, образуется экситон —
комбинация электрона и «дырки», т. е. места, в котором
электрона не хватает. В результате резонансного
взаимодействия (см. стр. 227) электрон перемещается по кристаллу до
места, в котором имеется акцептор электрона — ловушка для него
или ловушка для дырки — донор электрона. Распространение
экситона, с одной стороны, приводит к быстрой миграции
энергии, с другой — к специальным оптическим явлениям — к
изменению спектров люминесценции и поглощения света [10, 12,
15—17]. Понятие экситона было введено в физику Френкелем
[18]. Для интерпретации соответствующих процессов квантовая
механика совершенно необходима. Здесь имеется ряд
нерешенных вопросов. Например, являются ли мигрирующие экситоны
синглетными или триплетными, т. е. равен ли суммарный спин
экситона нулю или единице? Может ли один экситон вызвать
химические изменения, или хлоропласт должен запасти много
квантов до того, как пройдет реакция?
Рассмотрение явлений фотосинтеза относится к
молекулярной биофизике, но выходит за рамки этой книги. Во-первых,
потому, что благодаря трудам Кальвина, Теренина и других
изучение фотосинтеза стало обширной областью биофизики,
требующей самостоятельного изложения; во-вторых, потому,
что книга посвящена «темновым» свойствам биологических
478 ГЛ. 10. ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ БИОФИЗИКИ
молекул — белков и нуклеиновых кислот. Ограничимся
ссылками на некоторые статьи и монографии [19—22].
По схбдным причинам мы не касаемся проблем физики
зрения (см. [23, 24]) и биолюминесценции (см. [25]). За рамки этой
книги выходят также проблемы радиобиологии (для
первоначального ознакомления см. [26]) и молекулярно-физические
вопросы, связанные с возникновением свободных радикалов
в биохимических реакциях, в биологических системах (см.
[27—29]).
ЗАКЛЮЧЕНИЕ
В этой книге рассмотрено много вопросов — на различных
уровнях сложности и с различной степенью полноты.
Наибольшее внимание уделено строению и свойствам важнейших
биополимеров— белков и нуклеиновых кислот. Их рассмотрение
объединено общей идеей о кооперативных конформационных
превращениях, как основных явлениях, изучаемых
молекулярной биофизикой.
Исследования биологических процессов, протекающих на
молекулярном уровне, проведенные за последние годы, раскрыли
поразительное единство механизмов, действующих во всех
биологических системах, начиная от бактериофага и кончая
человеком.
Рабочими веществами важнейших молекулярно-биологиче-
ских процессов служат белки и нуклеиновые кислоты. В основе
их взаимодействий, определяющих явления жизни, находятся
структурные соответствия молекул. Ими обеспечиваются
главные молекулярные и надмолекулярные соотношения.
Нет надобности повторять здесь рассказанное выше.
Резюмируя, можно сказать, что, несмотря на исключительную
сложность проблем, изучаемых молекулярной биофизикой, сейчас
можно считать установленными общие принципы этой области
науки, общие подходы для проникновения в биологию,
реализуемые в этой области.
Ряд важнейших проблем, сегодня уже решаемых
молекулярной биофизикой, в книге не затронут. Таковы все проблемы,
связанные с действием излучения — радиобиология, фотосинтез,
зрение, биолюминесценция. Не рассмотрены и многие темновые
процессы. Ограничимся перечислением некоторых из них.
К молекулярной биофизике относятся многочисленные
проблемы, связанные с проницаемостью клеточных мембран (см.
[30—33]). Хотя клеточная мембрана является сложной
надмолекулярной структурой, возникли и реализуются возможности
связать особенности ее поведения со строением и свойствами
отдельных молекул. С функциями мембран тесно связано
480
ЗАКЛЮЧЕНИЕ
распространение нервного возбуждения, определяемое
изменениями мембранного потенциала для ионов Na+ и К+. Нервный
импульс распространяется в результате действия весьма
совершенного релейного механизма с обратной связью между
изменением потенциала для ионов Na+ и падением мембранного
потенциала.
Несомненно, что процессы, происходящие в нервном волокне,
кооперативны — перемещение ионов зависит от того, сколько
частиц уже преодолело некий потенциальный барьер (см. [34—39]).
Теория нервного возбуждения развивается, это — важный
раздел молекулярной биофизики. Ключ к молекулярным процессам,
ответственным за передачу нервного импульса, вероятно,
следует искать в ионнообменных свойствах биополимеров, которых
мы также не касались.
Полинг предложил весьма изящную молекулярную теорию
общего наркоза [40]. Имеется ряд наркотизирующих веществ,
состоящих из инертных молекул, которые не образуют ни
водородных, ни тем более химических связей с биологическими
молекулами. Таковы хлороформ СНС1з, закись азота N20, CO2,
этилен С2Н4 и даже благородные газы Аг и Хе, вызывающие
наркоз при повышенном давлении. Полинг предположил, что
их наркотизирующее действие, т. е. способность прервать
передачу нервного импульса от одного нервного окончания к
другому, определяется образованием кристаллогидратов —
например,. 8Хе • 46Н20, СНС13 • 17Н20. Такие кристаллогидраты
неустойчивы, для их образования нужно повышенное давление.
Однако в биологической системе они могут стабилизоваться
аминокислотными остатками белков. Действительно, оказалось,
что логарифм анестезирующего парциального давления газа
пропорционален логарифму равновесного парциального
давления того же газа над его кристаллогидратом. Более 10 веществ
укладывается на найденную таким образом прямую.
В связи с этим надо еще раз подчеркнуть фундаментальную
роль воды в биологических процессах. Мы неоднократно
говорили о воде, об образуемых ею водородных связях, о
гидрофобных взаимодействиях. Упоминалось о структурированном
характере воды, окружающей биополимерную молекулу, а также
малые ионы. Это ^самостоятельная большая проблема
молекулярной биофизики (см. [41]).
Общие особенности реакций живой биополимерной системы
на внешние воздействия (см. монографии Насонова и
Александрова [42] и Насонова [43]) также требуют сегодня
молекулярного истолкования. Кооперативные свойства таких систем, по-
видимому, и здесь играют определяющую роль.
ЗАКЛЮЧЕНИЕ
481
Таким образом, эта книга должна служить лишь введением
в молекулярную биофизику, а не претендующим на полноту
обзором ее современного состояния.
Физик, занявшийся биологическими проблемами, попадает
в новую для него ситуацию. В физике неживых тел многое уже
совершенно ясно, раскрыты закономерности, которым
подчиняется обширный круг явлений, ставших достоянием строгой
теории. Не так-то легко найти новую задачу, решение которой
означало бы крупное научное открытие. Это в особенности
относится к «классическим» областям молекулярной физики.
Сегодня загадочны события в мире элементарных частиц, не
решены проблемы квантовой электродинамики или релятивистской
космологии. Но мы не видим сейчас великих тайн в мире
молекул.
Сказанное не означает, конечно, что завтра не будет сделан
новый рывок вперед и что мы не увидим уже ставшие
привычными явления в совершенно новом свете.
Особенность ситуации, встречающей физика в биологии,
состоит в том, что здесь все таинственно и бесконечно интересно.
Исследование этой территории только начинается. На карту
нанесены отдельные контуры, но размеры белых пятен неизмеримо
больше, чем размеры изученных областей. А что таится там,
дальше, за Геркулесовыми Столпами?
Казалось бы, что основная задача физика, вступающего в
биологию, заключается в том, чтобы, выбрав одну
определенную проблему, отграничить себя от неисчерпаемого множества
других не менее интересных вопросов. Однако это не так.
Речь идет о биологии. Физик может здесь идти только вслед
за биологами и биохимиками. Ввиду сложности биологических
процессов большинство из них еще недоступно физическому
исследованию и тем более невозможно построение
сколько-нибудь законченной физической теории соответствующих явлений.
На страницах этой книги говорилось о недостаточности
имеющихся биологических и биохимических данных, относящихся,
например, к таким проблемам, как редупликация ДНК и митоз.
Физик должен умело выбрать такое биологическое явление,
сущность которого действительно может быть в какой-то мере
выяснена средствами его науки.
И тем не менее молекулярная биофизика рождена и быстро
растет. Залог ее дальнейшего развития —тесное сотрудничество
физиков с биологами и биохимиками, чьи усилия делают
сегодня биологию важнейшей областью естествознания второй
половины XX века.
ЛИТЕРАТУРА
К главе 1
1. Н. В. Тимофеев-Ресовский, Цитология 2, 45 (i960).
2. Ф. Энгельс, Диалектика природы, Госполнтнздат, 1955.
3. П. П. Лазарев, Гельмгольц, Изд. АН СССР, 1959.
4. Ннльс Бор, Атомная физика и человеческое познание, ИЛ, 1961.
5. A. Meyer -Abie h, Acta biotheoretica 11, Pars II, 1955.
6. Ннльс Бор, Успехи фнз. наук 76, вып. 1, 21 (1962).
7. В. И. Л е и н и, Философские тетради, Госполнтнздат, 1947.
8. Эрвнн Шредннгер, Что такое жнзнь с точки зрения физики, ИЛ,
1947.
9. А. Г. Пасынскнй, Биофизическая химия, «Высшая школа», 1963.
10. W. М. Е 1 s a s s e r, The Physical Foundation of Biology, Pergamon Press,
1958.
11. H. H. Семенов, Вопросы философии, № 10, 95 (1959).
12. О сущности жизни (сборник), «Наука», 1964.
13. Р.- С т е й с и, Д. Уильяме, Р. М а к - М о р р и с, Основы биологической
и медицинской физики, ИЛ, 1959.
14. В. Б а й е р, Биофизика, ИЛ, 1962.
15. М. В. Волькенштейн, Строение и физические свойства молекул, Изд.
АН СССР, 1955.
16. Н. Ф. Гамалея, И. И. Мечников, К. А. Тимирязев, Л. Пастер,
Изд. АН СССР, 1946.
17. Th. De Donder, L'Affinite, P.I (1928), P.II (1931), P.III (1934), Paris,
Gauthier-Vi liars.
18. И. Прнгожнн, Введение в термодинамику необратимых процессов, ИЛ,
1961.
19. А. Г. Пасынскнй, Успехи совр. бнол. 43, № 3, 263 (1957).
20. Л. И. Мандельштам, Полное собрание трудов, т. 2, стр. 176, Изд.
АН СССР, 1947.
21. И. Прнгожнн, Труды Симпозиума «Возникновение жнзнн на Земле»,
Изд. АН СССР, 1961.
22. А. А. Ляпунов, Проблемы кибернетики, вып. 1, стр. 5, Фнзматгнз, 1958.
23. Г. К а с т л е р, Азбука теории информации, Сборник «Теория информации
в биологии», стр. 9, ИЛ, 1960.
24. А. М. Я г л о м и И. М. Я г л о м, Вероятность и информация, Гостехиздат,
1957.
25. L. S г i 11 a f d, Zs. Phys. 53, 840 (1929).
26. Л. Брнллюэн, Наука и теория информации, Фнзматгнз, 1960.
27. П. Элнас, Кодирование и теория информации, Сборник «Проблемы
современной биофизики», т. \л ИЛ, 196}.
ЛИТЕРАТУРА 483
28. М. Л и и д а у э р, Процессы регулирования в сообществах насекомых,
Сборник «Процессы регулирования в биологии», стр. 178, ИЛ, I960.
29. И. И. Шмальгаузен, Проблемы кибернетики, вып. 4, стр. 121, Физ-
матгнз, I960.
30. Н. В. Тнмофеев-Ресовскнй н Р. Р. Ромпе, Проблемы
кибернетики, вып. 2, стр. 213, Фнзматгнз, 1959.
31. К. А и ф н и с е н, Молекулярные основы эволюции, ИЛ, 1962,
К главе 2
1. Н. J. Morowitz, M. E. Tourteiiotte, The Smallest Living Cells,
Scientific American, март, 1962. (Русский перевод — Г. Моровнтц и
М. Тур тело тт, Мельчайшие жнвые клетки, Сборник «Структура и
функции клетки», «Мир», 1964.)
2. Ж. Браше, Живая клетка, ^Сборник «Жнвая клетка», ИЛ, 1962.
3. А. Л е и н и г е р, Превращение энергии в клетке, Сборник «Живая
клетка», ИЛ, 1962.
4. Е. де Робертнс, В. Новинский, Ф. Саэс, Общая цитология, ИЛ,
1962.
5. Д. Мэзна, Как клетки делятся, Сборник «Живая клетка», ИЛ, 1962.
6. J. Haas, Das Lebensprobiem heute, Beitrag der Zeiiforschung zur Philo-
sophie des Organischen, Munchen — Salzburg — Koln, 1958.
7. В.Я.Александров, Цитология 4, № 1, 3 (1962).
8. Д. М е з и а, Митоз н физиология деления клеток, ИЛ, 1963.
9. К. Вилл н, Биология, «Мир», 1964.
10. М. Фншберг и А. Блэклер, Как клетки специализируются, Сборник
«Жнвая клетка», ИЛ, 1962.
11. Р. Вагнер и Г. Мнтчелл, Генетика и обмен веществ, ИЛ, 1958.
12. К. Уоддннгтон, Организаторы и гены, ИЛ, 1947; Морфогенез н
генетика, «Мир», 1964.
13. Труды Симпозиума «Возникновение жнзнн на Земле», Изд. АН СССР,
1961.
14. А. И. Опарин, Возникновение жнзнн на Земле, Изд. АН СССР, 1957.
15. «Итоги науки», Биологические наукн, т. 4, Актуальные вопросы
вирусологии, Изд. АН СССР, 1960.
16. A. Gierer, G. Schramm, Zs. Naturforsh. lib, № 3, 138 (1956).
17. H. Fraenkel-Conrat, J. Amer. Chem. Soc. 78, 822 (1956).
18. M. А д а м с, Бактериофаги, ИЛ, 1961.
19. G. S. Stent, Molecular Biology of Bacterial Viruses, W. Freeman and Co.,
1963. (Русский перевод — Г. С. Стент, Молекулярная биология
вирусов бактерий, «Мир», 1965.)
20. Е. Geissier, Bafcteriophagen, Akademie-Veriag, 1962.
21. А. Н. Колмогоров, Об одном новом подтвержденнн законов Менделя,
ДАН СССР 27,38 (1940).
22. Т. Г. Морган, Экспериментальные основы эволюции, Бномедгнз, 1936.
23. Дж. Ннль н У. Шэлл, Наследственность человека, ИЛ, 1958.
24. Л. Хог бен, Основы биологии животных, ИЛ, 1948.
25. М. Е. Л о б а ш е в, Генетика, Изд. ЛГУ, 1963.
26. А. М ю и т ц н и г, Генетические исследования, ИЛ, 1963.
27. И. В. Мичурин, Принципы н методы работы, Соч., т. 1, Сельхозгнз,
1948.
28. Г. А. Надсон, Г. С. Филиппов, С. г. Soc. Biol. 93, Paris, 1925
29. Н. J. M u 11 е г, Artificial transformation of the gene, Science, 1927.
30. H. В. Тнмофеев-Ресовскнй, Biol. Rev. 9, 1934.
31. H. В. Тнмофеев-Ресовскнй, Le mechanisme des mutations et la
structure du gene, Paris, 1939.
484 ЛИТЕРАТУРА
32. Н. В. Тимофеев-Ресовский, Цитология 2, 45 (i960).
33. Шарлотта Ауэрбах, Генетика в атомном веке, Атомнздат, 1959.
34. Н. П. Дубинин, Проблемы раднацноннон генетики, Госатомиздат,
1961.
35. «Итоги наукн», Биологические наукн, т. 3, Ионизирующие излучения н
наследственность, Изд. АН СССР, I960.
36. Б. Л. Астауров, Успехи совр. биол. 25, № 1, 49 (1948); Природа, № 4,
55 (1962).
37. .Р. X а г е м а и, Плазматическая наследственность, ИЛ, 1962.
38. Н. П. Дубинин, В. В. Хвостов а, Н. Л. Делоне, Статья в
сборнике [35].
39. В. В. Сахаров, Жури. общ. бнол. 1, № 3 (1932).
40. М. Е. Л о б а ш е в, ДАН СССР 2, № 5 (1934).
41. И. А. Рапопорт, Бюлл. эксп. биол. мед. 6, 737 (1938); ДАН СССР 54,
65 (1946); 60, 469 (1948).
42. С. И. А л и х а н я и, Химический мутагенез, Жури. Всесоюзи. хнм. о-ва
им. Менделеева 6, № 3, 285 (1961).
43. S. Luria, M. Deibruck, Genetics 39, 169 (1954).
44. С. Е. Б р е с л е р, Введение в молекулярную биологию, Изд. АН СССР,
1963.
45. В. Я. Александров, Цнтофнзнологнческне и цнтоэкологнческне
исследования устойчивости растительных клеток к действию высоких и низких
температур, Труды Ботанического института, Изд. АН СССР, 1955.
46. Ф. Жакоб, Э. Вольман, Пол и генетика бактерий, ИЛ, 1963.
47. Генетика и селекция микроорганизмов, под ред. С. И. Алнханяна,
«Наука», 1964.
48. J. Lederberg, Science 122, 920 (1955); J. Bacterid. 71, 497 (1956).
49. С. Б е и з е р, Элементарные единицы наследственности, Сборник
«Химические основы наследственности», ИЛ, 1960; Тонкая структура гена,
Сборник «Молекулярная генетика», ИЛ, 1963.
50. Н. R is, В. Chandler, Cold Spring Harbor Symposia 28, 1 (1963).
К главе 3
1. Д. Онклн, Химические свойства белков, углеводов и пептидов, Сборник
«Современные проблемы биофизики», т. 1, ИЛ, 1961.
2. Г. В. Самсонов, Хроматография, Применение в бнохнмнн, Медгнз,
1955.
3. Д ж. Б э й л и, Методы хнмнн белков, «Мир», 1965.
4. Н. И. Г а в р и л о в, Химия белка, Изд. МГУ, 1961.
5. В. В. Ал п а то в, Природа, № 4, 49 (1947).
6. А. И. Опарин, Возникновение жизни на Земле, Изд. АН СССР, 1957.
7. М. В. Волькенштейн, Молекулярная оптика, Гл. И, Гостехнздат,
1951.
8. W. Kuhn, E. Braun, Naturwiss. 17, 227 (1929).
9. W. Kuhn, E. Knopf, Zs. Phys. Chem. B7, 292 (1930).
10. T. Davis, J. Acker man, J. Amer. Chem. Soc. 67, 486 (1945).
11. E. И. Клабуновскнй, Асимметрический синтез, Госхнмнздат, 1960.
12. Е. D armo i s, С. r. Acad. Sci., Paris 237, 124 (1953).
13. Г. Ф. Г а узе, Асимметрия протоплазмы, Изд. АН СССР, 1940.
14. Н. Eyring, L. Jones, J. Spikes, The Significance of Absolute
Configuration in Optical Rotation and in Catalysis, Статья в сборнике
«Horizons in Biochemistry», Academic Press, 1962. (Русский перевод
—«Горизонты в бнохнмнн», «Мнр», 1964.)
15. С. Е. Б рее л ер, Введение в молекулярную биологию, Изд. АН СССР,
1963,
ЛИТЕРАТУРА
485
16. L. Pauling, H. A. It a no, S. J. Sanger, 1. С Wells, Science 110,
543 (1949).
17. V. At I n gram, Nature 180, 326 (1957); The Hemoglobins in Genetics and
Evolution, Columbia Univ. Press, 1963
18. В. П. Эфранмсон, Жури. Всесоюзн. хим. о-ва им. Менделеева 6, № 3,
314 (1961).
19. В. А. Энгельгардт, Некоторые проблемы современной бнохнмнн. Изд.
АН СССР, 1959.
20. Ф. Ш о р м, Белкн, нх структура н функция, Пленарная лекция на V
Международном биохимическом конгрессе в Москве, Труды V
Международного биохимического конгресса, Изд. АН СССР, 1962.
21. К. Hofmann, H. Yajima, Сборник «Polyaminoacids, Polypeptides and
Proteins», Proa of an Internet. Symposium, Univ. of Wisconsin Press, 1962,
стр. 21.
22. J. N о g u с h i, Т. S a i t о, Там же, стр. 313.
23. Т. G i 11, P. D о t у, Там же, стр. 367.
24. Scientific American, декабрь, 1963, стр. 72.
25. J. Davidson, The Biochemistry of the Nucleic Acids, Methuen, I960.
26. А. С. Спнрнн, А. Н. Белозерский, Н. В. Шугаева, Б. Ф.
Ванюшин, Биохимия 22, 744 (1957)-.
27. А. Н. Белозерский, Труды V Международного биохимического
конгресса, Симпозиум 3, Изд. АН СССР, 1962.
28. А. Н. Белозерский, А. С. Спнрнн, Химия нуклеиновых кнелот
микроорганизмов, Сборник «Нуклеиновые кислоты», ИЛ, 1962.
29. Н. К. Кочетков, Э. И. Б у д о в с к и й, В. Н. Шибаев, Изв. АН
СССР, серия бнол., N° 4, 512 (1964).
30. А. Л е и н и г е р, Преобразование энергии дыхания, Сборник
«Современные проблемы биофизики», т. I, ИЛ, 1961.
31. Г. Кребс, Г. Корнберг, Превращения энергии в живых системах,
ИЛ, 1959.
32. D. А г пои, Scientific American, ноябрь, I960.
33. Н. Blum, Time's Arrow and Evolution, Princeton Univ. Press, 1951.
34. Л. А. Блюменфельд, М. И. Темкнн, Бнофнзнка 7, 731 (1962).
35. A. Lehninger, Mechanochemical Changes in Mitochondria, Статья в
сборнике «Horizons in Biochemistry», 1962. (Русский перевод —
«Горизонты в бнохнмнн», «Мир», 1964).
36. М. К а л ь в н и, Получение н передача энергии при фотосинтезе, Сборник
«Современные проблемы биофизики», т. I, ИЛ, 1961.
К главе 4
1.С. М и д з у с н м а, Строение молекул и внутреннее вращение, ИЛ,
1957.
2. М. В. Волькенштейн, Конфигурационная статистика полимерных
цепей, Изд. АН СССР, 1959.
3. М. В. Волькенштейн, ДАН СССР 78, 879 (1951); Журн. фнз. хнм.
26, 1072 (1952).
4. И. И. Н о в а к, Жури. техн. фнз. 24, 85 (1955).
5. М. В Волькенштейн и О. Б. Птнцын. Журн. техн. фнз. 25, 649,
662 (1955).
6. В. Н. Никитин, М. В. Волькенштейн. Б. 3. Волчек. Жури,
техн. физ. 25, 2486 (1955).
7. В. Н. Никитин, Б. 3. Волчек, М. В. Волькенштейн, Груды
X совещания по спектроскопии. Изд. Львовского ун-та 1, 411 (1957).
8. Б. 3. Волчек, В. Н. Никитин, Журн. техн. фнз. 28, 1753 (1958),
9. A. Ciferri, С. Hoeve, P, Flo г у, J, Amer. Chem. Soc. 83, 1015 (1961)*
486 ЛИТЕРАТУРА
10. Т. М. Бнрштейи, О. Б. Птнцын, Конформации макромолекул,
«Наука», 1964.
11. Б. Г. Гейлнкман, Статистическая теория фазовых превращений,
Гостехнздат, 1954.
12. Н. N. V. Temper ley, Changes of State, Cleaver-Hume Press Ltd*,
1956.
13. E. I s i n g, Zs. Phys. 31, 253 (1925).
14. G. Newell, E. Montroll, Rev. Mod. Phys. 25, 353 (1953).
15. Ю. Б. Р у м е р, Успехи фнз. наук 53, 245 (1954).
16. В. Г. Левнч, Курс теоретической фнзнкн, т. 1, Фнзматгнз, 1962.
17. В. И. Смирнов, Курс высшей математики, т. 3, ч. 1. Гостехнздат,
1956.
18. М. Диксон и Э. У э б б, Ферменты, ИЛ, 1961.
19. Я. И. Френкель, Кинетическая теория жидкостей, Собрание
избранных трудов, т. 3, Изд. АН СССР, 1959.
20. О. Б. Птнцын, Ю. А. Шаронов, Жури. техн. фнз. 27, 2744, 2762
(1957).
21. Н. П. Борисова, М. В. Во л ьке и штей н, Жури, структурн. хим. 2,
469 (1961).
22. Н. П. Борисова, Т. М. Б нр штейн, Высоко молекул, соеднн. 5, 279
(1963).
23. С. A. Hoeve, J. Chem. Phys. 32, 888 (1960); 35, 1266 (1961).
24. P. Flory, Proc. Roy. Soc. A234, 60 (1956). (Русский перевод —
«Проблемы современной фнзнкн», № 12, 1956.)
25. В. А. Каргнн, А. И. Китайгородский, Г. Л. Слонимский,
Колл. журн. 19, 131 (1957).
26. Е. A. D i М а г г i о, J. Chem. Phys. 35, 658 (1961).
27. М. В. Во л ькенште йн, Ю. Я. Готлнб, О. Б. Птнцын. Высоко-
молек. соеднн. 1, 1056 (1959).
28. В. А. К а р г и н, Coll. Czechoslovak. Chem. Commun, Special issue 22, 50
(1957); Высокомолекул. соеднн. 1, 1812 (1959); 2, 931, 1280 (1960).
29. Дж. Б е р н а л, Труды Симпозиума «Возникновение жнзнн на Земле»,
Изд. АН СССР, 1961.
30. J. Bern а 1, в сборнике «Horizons in Biochemistry». (Русский перевод —
«Горизонты в бнохнмнн», «Мир», 1964.)
31. P. Flory, Principles of Polymer Chemistry, Cornell Univ. Press, 1953,
32. Ф. Бнльмейер, Введение в химию и технологию полимеров, ИЛ, 1958.
33. Н. A Stuart, Das Makromoiekui in Losungen, Springer, 1953
34. E. M Frith, R. F. Tuckett, Linear Polymers, Longmans, Green and
C°, 1951.
35. M. В. Волькенштейн, Молекулярная оптика, Гостехнздат, 1951.
36. П. Д о т и, Фнзнко-хнмнческне характернстнкн макромолекул, Проблемы
современной биофизики, т. 1, ИЛ, 1961.
37. В. Н. Цветков, В. Е. Эскнн, Я. И. Френкель, Структура
макромолекул в растворах, «Наука», 1964.
38. Е. Мнсловнцер, Определение концентрации водородных нонов в
жидкостях, Госхнмтехнздат, 1932.
39. А. К a t с h а 1 s k у, О. К и п z 1 е, W. К и h n, J. Polymer Sci. 5, 283 (1950);
Helv. Chim. Acta 31, 1994 (1948).
40. A. Katchalsky, S. Lifson, J. Polymer Sci. 11, 409 (1953).
41. О. Б. Птнцын, Высокомолекул. соеднн. 3, 1084 (1961).
42. О. Б. Птнцын, Высокомолекул. соеднн. 3, 1252 (1961).
43. Ф. Г а у р о в н ти, Хнмня и биология белков. ИЛ. 1953.
44. Ф. Гельфер их, Иониты ИЛ. 1962,
45. Г. В Самсонов, Сорбция и хроматография антибиотиков, Изд. АН СССР,
I960.
ЛИТЕРАТУРА 487
К главе 5
1. Л. Оженстнн, Статья в сборнике «Теория информации в биологии»,
ИЛ, i960.
2. Н. Д. Соколов, Статья в сборнике «Водородная связь», «Наука», 1964*
3. С. A. Couison, Research 10, 149 (1957).
4. Л. Op гель, Водородная связь, Сборник «Современные проблемы
биофизики», т. 1, ИЛ, 1961.
5. Дж. Пименте л, О. Мак-Клеллан, Водородная связь, «Мир», 1964.
6. L. Pauling, R. Corey, Proc. Roy. Soc. B141, 10 (1953).
7. Л. П о л н и г, Статья в сборнике «Современные проблемы бнохнмнн»,
ИЛ, 1957.
8. С. Е. Б р е с л е р, Введение в молекулярную биологию, Изд. АН СССР,
1963.
9. Т. Miyazawa, Сборник «Polyamino Acids, Polypeptides and Proteins»,
стр. 201, Univ. of Wisconsin Press, 1962.
10. E. R. В lout, Там же, стр. 275.
11. Б. 3. В о л ч е к, А. В. П у р к и н а, Биофизика, 1965.
12. Г. Сэзерленд, Статья в сборнике «Современные проблемы биофизики»,
т. I, ИЛ, 1961.
13. A. Wad а, Сборник «Polyamino Acids, Polypeptides and Proteins», стр. 131,
Univ of Wisconsin Press, 1962.
14. H. K. Schachman, Cold Spring Harbor Symposia 28, 409 (1963).
14a.С. Е. Бреслер, Д. Л. Талмуд, ДАН СССР 43, 326, 367 (1944);
С. Е. Бреслер, Биохимия, 14, 180 (1949)*
146. G. Nemethy, H. A. Scheraga, J.Am. Chem. Soc. 62f 1773 (1962);
J. Chem. Phys. 36, 3401 (1962).
15. А. И. Китайгородский, Рентгеноструктурный анализ, Гостехнздат,
1950.
16. Б. К. В айнштейн, Дифракция рентгеновых лучей на цепных
молекулах, Изд. АН СССР, 1963.
17. Дж. К е и д р ь ю, Трехмерная структура глобулярных белков, Сборник
«Современные проблемы биофизики», т. I, ИЛ, 1961.
18. Дж. Кендрью, Труды V Международного биохимического конгресса,
Симпозиум 1, Изд. АН СССР, 1962.
19. Дж. Б е р и а л, Градации структурных единиц при бнопоэзе, Труды
Симпозиума «Возникновение жнзнн на Земле», Изд. АН СССР, 1961.
20. А. Р и ч, Молекулярное строение сннтетнческнх полимеров и полимеров
биологического происхождения, Сборник «Современные проблемы
биофизики», т. I, ИЛ, 1961.
21. A. Elliott, E. M. Bradbury, A. R. Downie, W. Е. Н а п b у,
Сборник «Polyamino Acids, Polypeptides and Proteins», стр. 255, Univ. of
Wisconsin Press, 1962.
22. M. И. Мил л но нова, Н. С. Андреева, Биофизика 3, 259 (1958);
4,374 (1959).
23 P. Flo г у, Proc. Roy. Soc. A234, 60 (1956).
24. Н. A. Scheraga, Сборник «Polyamino Acids, Polypeptides and
Proteins», стр. 241, Univ. of Wisconsin Press, 1962.
25. J. A. S с h e 11 m a n, Compt. Rend. trav. lab. Carlsberg, Ser. Chim. 29,
223, 230 (1955).
26. П. Л. Привалов, Биофизика 8, 308, 511 (1963).
27. В. Г. А л д о ш и н, С. Е. Б р е с л е р, Е. М. С о м и н с к и й, Высокомо-
лекул. соеднн. 4, 118 (1962).
28. G. Nemethy, I. Steinberg, H. Scheraga, Biopolymers 1,43
(1963).
29. О. Б. П т и Ц ы н, Ю, Е. Э и з и е р, Биофизика 10, 3 (1965),
488
ЛИТЕРАТУРА
30. П. Д о т и, Сборник «Современные проблемы биофизики», т. I, ИЛ, 1961.
31. P. Doty, Coil. Czehoslov. Commun., Special issue 22, 5 (1957).
32. M. В. Волькенштейн, Конфигурационная статистика полимерных
цепей, Изд. АН СССР, 1959.
33. Т. М. Б и р ш т е й н, О. Б. П т и ц ы н, Конформацнн макромолекул,
«Наука», 1964.
34. В. Н. Zimm, J. К. Bragg, J. Chem. Phys. 28, 1246 (1958); 31,546 (1959).
35. J. H. Gibbs, E. A. Di Marzio, J. Chem. Phys. 28, 1247 (1958); 30,
271 (1959).
36. S. A. Rice, A. W a d a, E. P. G e i d u s с h e k, Disc. Faraday Soc. 25,
130 (1958).
37. T. L. H i 11, J. Chem. Phys. 30, 383 (1959).
38. L. Peiier, J. Phys. Chem. 63, 1194 (1959).
39. Л. Д. Ландау, Е. М. Лнфшнц, Статистическая физика, «Наука», 1964.
40. В. Н. Zimm, S. A Rice, Mol. Phys. 3, 391 (1960).
41. I. T i п о с о, А. Н а 1 р е г п, W. Т. Simpson, Сборник «Polyamino
Acids, Polypeptides and Proteins», стр. 147, Univ. of Wisconsin Press, 1962.
42. H. Г. Бахшнев, Оптика и спектроскопия 7, 52 (1959): 10, 717 (1961).
43. S. Yanari, F. А. Во vey, J. Biol. Chem. 235, 2818 (1960).
44. А. С. Давыдов, Теория поглощения света в молекулярных кристаллах,
Изд. АН УССР, 1951.
45. М. В. Волькенштейн, Молекулярная оптика, Гостехнздат, 1951.
46. W. М о f f i 11, J. Chem. Phys. 25, 467 (1956).
47. H. De Voe, Biopoiymers, Symposia № 1, 251 (1964).
48. У. К03май, Введение в квантовую химию, ИЛ, 1960.
49. Е. R. В lout, P. Doty, J. Т. Yang, J. Amer. Chem. Soc. 79, 749 (1957).
50. P. Doty, R. D. Lund berg, Proc. Nat. Acad. Sci. US 43, 213 (1957).
51. R. D. Lundberg, P. Doty, J. Amer. Chem. Soc. 79, 3961 (1957).
52. J. T. Yang, P. Doty, J. Amer. Chem. Soc. 79, 761 (1957).
53. С. Чандрасекар, «Проблемы современной фнзнкн», № 5, ИЛ, 1955.
54. К. Д ж е р а с с и, Дисперсия оптического вращения, ИЛ, 1962.
55. J Kirkwood, J. Chem. Phys. 5, 479 (1937).
56. M. В. Волькенштейн, ДАН СССР 71, 447 (1950).
57. D. Fitts, J. Kirkwood, Proc. Nat. Acad. Sci. US 42, 33 (1956);
J. Amer. Chem. Soc. 78, 2650 (1956).
58. W. M о f f i 11, J. Chem. Phys. 25, 467 (1956).
59. W. Moffitt, J. T. Yang, Proc. Nat. Acad. Sci. US 42, 596, 736 (1956).
60. W. Moffitt, D. Fitts, J. Kirkwood, Proc. Nat. Acad. Sci. US
43, 723 (1957).
60a. A. McLachlan, M. Ball, J. Mol. Phys. 8, 581 (1964).
606. G. Holzwarth, P. Doty, J. Amer. Chem. Soc. 87, 218 (1965).
61. В. М. Аслан ян, М. В. Волькенштейн, Оптика и спектроскопия
7, 208 (1959).
62. J. A. Scheiimann, P. Oriel, J. Chem. Phys. 37, 2114 (1962).
63. I. Tinoco, J. Chem. Phys. 33, 1332 (1960).
64. I. Tinoco, R. W. Woody, J. Chem. Phys. 32, 461 (1960).
65. I. Tinoco, Adv. Chem. Phys. 4, 113 (1962); J. Amer. Chem. Soc. 86,
297 (1964).
66. С Tan ford, P. De, V. Taggart, J. Amer. Chem. Soc. 82, 6028 (1960).
67. E. Shechter, E. R. В lout, Proc. Nat. Acad. Sci. US 51, 695, 1029(1964).
68. E. R. В lout, L. St rye r, Proc. Nat. Acad. Sci. US 45, 1591 (1959);
J. Amer. Chem. Soc. 83, 1411 (1961).
69. S. Bevchok, E. R. В lout, J. Mol. Biol. 3, 769 (1961).
70. И. А. Болотина, М. В. Волькенштейн, Молекулярная биофизика,
сборник, «Наука», 1965.
71. I. Tinoco, J. Amer. Chem. Soc. 81, 1540 (1959).
ЛИТЕРАТУРА 489
К главе 6
1. J. N. Davidson, The Biochemistry of the Nucleic Acids, Methuen, John
Wiley, I960.
2. Э. Ill p e д и н г е р, Что такое жизнь с точки зрения физики?, ИЛ,
1947.
3. S. Zamenhof, R. D e Giovanni, R. J. Rich, Bacteriology 71, 60
(1956).
4. О. Т. Avery, С. М. McLeod, M. McCarty, J. Exp. Med. 79, 137
(1944),
5. R. D. Hotchkiss, Cold Spring Harbor Symposia 16, 457 (1951).
6. P. X о ч к и с, Количественные критерии генетической трансформации,
Сборник «Химические основы наследственности», стр. 251, ИЛ, I960.
7. С. Заменгоф, Свойства трансформирующих факторов, Сборник
«Химические основы наследственности», стр. 277, ИЛ, I960.
8. В. S. S t r a u s s. An Outline of Chemical Genetics, W. В. Saunders and
Co, 1961.
9. Ф. Г а р т м а н, Трансдукция, Сборник «Химические основы
наследственности», стр. 324, ИЛ, I960.
10. Ф. Ж а к о б и Э. Уолмен, Генетические аспекты лизогенности,
Сборник «Химические основы наследственности», стр. 376, ИЛ, I960.
11. Г. С тент, Молекулярная биология вирусов бактерий, «Мир», 1965.
12. Р. X е р р и о т т, Вирулентные Т-четные фаги, Сборник «Химические
основы наследственности», стр. 317, ИЛ, I960.
i3. H. Fraenkel-Conrat, J. Amer. Chem. Soc. 78, 882 (1956).
14. A. G i e r e r, G. S с h r a m m, Nature 177, 702 (1956).
15. Г. Френкель-Конрат, В. Сингер, Р. Вильяме, Природа
потомства вируса, реконструированного из белка и нуклеиновой кислоты
различных штаммов вируса табачной мозаики, Сборник «Химические
основы наследственности», стр. 404, ИЛ, I960.
i6. М. Н. Е. Wilkins, A. R. Stokes, H. R. W i 1 s о п, Nature 172, 759
(1953).
17. R. Franklin, R. G. G о s 1 i n g, Nature 171, 156, 740 (1953).
18. J. D. Watson, F. H. С Crick, Nature 171, 737, 964 (1953).
19. F. H. С Crick, Scientific American, октябрь, 1954.
20. Ф. Крик, Структура ДНК, Сборник «Химические основы
наследственности», стр. 428, ИЛ, I960.
21. Дж. Джосс, Труды V Международного биохимического конгресса,
Симпозиум 1, стр. 100, Изд. АН СССР, 1962.
22. С. Levi nth а 1, С. Thomas, Biochim. et Biophys. Acta 23,453(1957).
23. A. P и ч, Молекулярная структура нуклеиновых кислот, Сборник
«Современные проблемы биофизики», т. I, ИЛ, 1961.
24. D. Luzzati, А. N i с о 1 a i e f f, F. Masson, J. Mol. Biol. 3, 185
(1961).
25. П. Д о т и, Конфигурации биологически важных макромолекул в
растворе, Сборник «Современные проблемы биофизики», т. I, ИЛ, 1961.
26. О. Б. П т и ц ы н, Ю. Е. Э й з н е р, Высокомолекул. соедин. 3, 1863
(1961).
27. J. E. Hearst, W. H. S t о с k m а у е г, J. Chem. Phys. 37, 1425 (1962).
28. Ш. С а д р о н, Дезоксирибонуклеиновые кислоты, как молекулы,
Сборник «Нуклеиновые кислоты», ИЛ, 1962.
29. О. Б. П т и ц ы н, Б. А. Ф е д о р о в, ДАН СССР, 1965.
30. М. Meselson, F. W. St a h 1, J. V i п о g r a d, Proc. Nat. Acad. Sci.
US 43,581 (1957).
31. С. Е. Бреслер, Введение в молекулярную биологию, Изд. АН СССР,
1963. *
32 М. В. Волькенштейн
490
ЛИТЕРАТУРА
32. М. Grunberg-Manago, S. Ос ho a, J. Amer. Chem. Soc. 77, 3165
(1955).
33. J. R. Fresco, B. M. Alberts, Proc. Nat. Acad. Sci. US 46,311 (1960).
34. J. R. F г e s с о, В. M. A 1 b e г t s, P. D о t y, Nature 188, 98 (1960).
35. А. С. С п и р и н, Некоторые проблемы макромолекулярной структуры
нуклеиновых кислот, Изд. АН СССР, 1963.
36. М. S р е п с е г, W. F u 11 е г, М. Н. F. W i 1 k i п s, G. L. В г о w n,
Nature 194, 1014 (1962).
37. М. Spencer, Cold Spring Harbor Symposia 28, 77 (1963).
38. В. Н. Цветков, Л. Л. Киселев, Л. Ю. Фролова, С. Я. Л ю-
б и н а, Высокомолекул. соедин. 6, 568 (1964); В. Н. Цветков,
Л. Л. Киселев, Л. Ю. Фролова, С. Я. Люби на, С. И. К
Ленин, Н. А. Никитин, В. С. Сказка, Биофизика 9, 257 (1964).
39. J. M a r m u r, R. R о w п d, С. L. S с h i 1 d k r а и t, Denaturation and Rena-
turation of Deoxyribonucleic Acid. Progress in Nucleic Acid Research, т. I,
Academic Press, 1963 (Русский перевод — Нуклеиновые кислоты, сборник,
«Мир», 1965)..
40. М. Meselson, F. Stahl, Proc. Nat. Acad. Sci. US 44, 671 (1958).
41. J. Eigner, Dissertation, Harvard Univ., 1960.
42. С A. T h о m a s, K- I- В e r n s, J. MoL Biol. 3, 277 (1961).
43. J. Marmur, P. Doty, Nature 183, 1429 (1959).
44. J. Gibbs, E. Di Marzio, J. Chem. Phys. 28, 1247 (1958); 30, 271 (1959).
45. S. A. R i с e, A. W a d a, J. Chem. Phys. 29, 233 (1958).
46. Т. Н i 11, J. Chem. Phys. 30, 383 (1959).
47. R. S t e i n e r, J. Chem. Phys. 32, 215 (1960).
48. B. Zimm, J. Chem. Phys. 33, 1349 (1960); S. L if son, B. Zimm, Bio-
polymers 1, 15 (1963).
49. Т. М. Бир штейн и О. Б. Птицын, Конформации макромолекул,
«Наука», 1964.
50. D. J о г d a n, The Nucleic Acids, т. I, стр. 447, 1955.
51. Т. М. Бир штейн, Биофизика 7, 513 (1962).
52. Б. И. Сухорукое, Ю. Ш. Мошковский, Т. М. Бир штейн,
В. И. Л ысцов, Биофизика 8, 294 (1963).
53. О. Б. Птицы н, Биофизика 7, 257 (1962).
54. P. Doty и др., Proc. Nat. Acad. Sci. US 45, № 4 (1959).
55. M. В e e r, J. T h о m a s, J. Mol. Biol. 3, 699 (1961).
56. I. Ti по со, J. Amer. Chem. Soc. 82, 4785 (I960).
57. A. R i с h, I. T i п о с o, J. Amer. Chem. Soc. 82, 6409 (1960).
58. H. De Voe, I. Tinoco, J. Mol. Biol. 4, 518 (1962).
59. W. Kuhn, Experientia 13, 301 (1957).
60. H. С Longuet-Higgins, B. H. Zimm, J. Mol. Biol. 2, 1 (1960).
61. M. Fixman, J. Mol. Biol. 6, 39 (1963).
62. J. Marmur, P. Doty, J. Mol. Biol. 3, 585 (1961).
63. J. Marmur, С L. Schildkraut, P. Doty, Biological and Physical
Aspects of Reversible Denaturation of Deoxyribonucleic Acids. The
Molecular Basis of Neoplasia, стр. 9, University of Texas Press, 1962.
64. A. H. Белозерский и А. С. Спирин, Химия нуклеиновых кислот
микроорганизмов, Сборник «Нуклеиновые кислоты», ИЛ, 1962.
65. Н. De Voe, I. Tinoco, J. Mol. Biol. 4, 500 (1962).
66. M. В. Волькенштейн, Строение и физические свойства молекул, Изд.
АН СССР, 1955.
67. М. Дельбрюк, Г. С тент, О механизме воспроизведения ДНК,
Сборник «Химические основы наследственности», стр. 562, ИЛ, 1960.
68. М. Meselson, F. W. Stahl, Proc. Nat. Acad. Sci. US 44, 671 (1958).
69. А. А. Прокофьева-Бельговская, Ю. Ф. Богданов, Журн,
рсесоюзн. хим. о-ва им. Менделеева 8, № 1, 33 (1963),
ЛИТЕРАТУРА
491
70. С. D. D а г 1 i n g t о п. Nature 176, 4494 (1955).
71. Г. Рис, Структура хромосом, Сборник «Химические основы
наследственности», стр. 25, ИЛ, I960.
72. Дж. Г. Тэйлор, Репликация и организация ДНК в хромосомах,
Сборник «Молекулярная генетика», т. 1, «Мир», 1964.
73. R. L. Sinsheimer, J. Mol. Biol. 1, 43 (1959); Scientific American, июль,
1962.
74. D. E. Bradley, Nature 195, 622 (1962).
75. J. С a ir ns, Cold Spring Harbor Symposia 28, 43 (1963).
76. А. К о р и б е р г, Биосинтез нуклеиновых кислот, Сборник' «Современные
проблемы биофизики», т. 1, стр. 257, ИЛ, 1961.
77. A. Kornberg, Enzymatic Synthesis of DNA, John Wiley & Sons, 1961.
78. M. В. Вол ькен штейн, ДАН СССР 130, 889 (I960), Труды V
Международного биохимического конгресса, Симпозиум 1, стр. 121, Изд. АН
СССР 1962.
79. М. В.'Волькенштейн, А. М. Ельяшевич, ДАН СССР 131, 538;
132, 565 (1960); Биофизика, 6, 513 (1961).
80. М. В. Вол ькен штейн, А. М. Ельяшевич, ДАН СССР 136, 1216
(1961).
81. А. Г. Па сын с кий, Биофизика 5, 16 (1960).
82. J. A die г, Proc. Nat. Acad. Sci. US 44, 641 (1?58).
83. К. С. At wood, Science 132, 617 (1960).
84. H. V. Aposhian, A. Kornberg, J. Biol. Chem. 237, 519 (1962).
85. F. J. Bo Hum, J. Biol. Chem. 235, 2399 (1960).
86. R. S i n s h e i m e r, J. Chem. Phys. 58, 986 (1961); J. Mol. Biol. 4, 142 (1962).
87. С Weissmann и др., Proc. Nat. Acad. Sci. US 49, 407 (1963); Science
142, 1188 (1963).
88. R. Rolfe, Proc. Nat. Acad. Sci. US 49, 386 (1963).
89. N. Sueoka, H. Yoshikawa, Cold Spring Harbor Symposia 28, 47
(1963).
90. H. Ris, B. Chandler, Cold Spring Harbor Symposia 28, 1 (1963).
91. С Levi nth a 1, H. R. Crane, Proc. Nat. Acad. Sci. US 42, 436 (1956).
92. M. В. Вол ькен штейи, Н. М. Годжаев, Ю. Я. Го тли б,
Биофизика 7( 16 (1962).
93. М. В. В о л ь к е н ш т е й н, Н. М. Годжаев, Ю. Я. Г о т л и б,
О. Б. Птицы н, Биофизика 8, № 1 (1963).
94. А. Н. О р л о в, С. Н. Ф и ш м а н, ДАН СССР 3, 700 (1960).
95. М. В. Вол ькенштейн, Ю. Я. Готлиб, О. Б. Птицын, Физика
твердого тела 3, 396 (1960).
96. Н. К. Schachman, J. Adler, С. М. R a d d i n g, I. R. Lehman,
А. К о г п b e r g, J. Biol. Chem. 235, 3242 (1960).
К главе 7
1. G. Gamow, Der Kongelige Danske Videskabernis Selstab. Biologishe
Meddelelser 22, № 3 (1954).
2. Э. Шредингер, Что такое жизнь с точки зрения физики?, ИЛ, 1948.
3. G. Gamow, Nature 173, 318 (1954).
4. Г. Г а м о в, А. Р и ч, М И ч а с, Проблема передачи информации от
нуклеиновых кислот к белкам, Сборник «Вопросы биофизики», стр. 203,
ИЛ, 1957.
5. Е. Н. С. Crick, J. S. Griffith, L. E. Orgel, Proc. Nat. Acad. Sci.
US 43,416 (1957).
6. Г. Г. В и т т м а н, Труды V международного биохимического конгресса,
Симпозиум 1, стр. 274, Изд. АН СССР, 1962.
32»
492
ЛИТЕРАТУРА
7. A, Tsugita, H, Fraenkel-Conrat, Proc. Nat. Acad. Sci. US 46,
636 (i960).
8. M. Ичас, Белковый текст, Сборник «Теория информации в биологии»,
стр. 72, ИЛ, i960.
9. Л. Оже истин, Структура белка и количество информации, Сборник
«Теория информации в биологии», стр. 104, ИЛ, I960.
10. S. Brenner, Proc. Nat. Acad. Sci. US 43, 687 (1957),
11. G. Gamow, M. Yeas, Proc. Nat. Acad. Sci. US 41, 1011 (1955).
12. A. H. Белозерский, А. С. Спирин, Nature 182, 111 (1958).
13. E. Volkin, L. Astrakhan, Virology 2, 149, 433 (1956).
14. Э. Фолькин, Л. Астрахан, Обмен РНК в клетках, зараженных
фагом. Сборник «Химические основы наследственности», стр. 556, ИЛ, I960.
15. Ф. Гро, X. X и а т т, Труды V Международного биохимического
конгресса, Симпозиум 1, стр. 191, Изд. АН СССР, 1962.
16. А. Рич, Анализ взаимосвязи между ДНК и РНК, Сборник
«Современные проблемы биохимии», стр. 252, ИЛ, 1961.
17. В. D. Hall, S. Spiegelman, Proc. Nat. Acad. Sci. US 47, 137 (1961).
18. S. S p i e g e 1 m a n, B. D. H a 11, R. S t г о с k, Proc. Nat. Acad. Sci. US 47,
1135 (1961).
19. H. M. Schulman, D. M. В о п п е r, Proc. Nat. Acad. Sci. US 48,53 (1962).
20. S. B. Weiss, Proc. Nat. Acad. Sci. US 46, 1020 (I960).
21. S. Ochoa, D. P. Burma, H. Kroger, J. D. Weill, Proc. Acad. Sci.
US 47, 670 (1961).
22. M. Ch amber 1 in, P. Berg, Proc. Nat. Acad. Sci. US 48, 81 (1962).
23. M. H а у a s h i, M. N. H а у a s h i, S. Spiegelman, Science 140, 1313
(1963); Proc. Nat. Acad. Sci. US 50, 664 (1963); 51 (1964); B.
Chandler, M. Hayashi, M. N. Hayashi, S. Spiegelman, Science 143,
47 (1964); S. Spiegelman, Scientific American, май, 1964, стр. 48.
24. G. P. Tocchini-Valentini и др., Proc. Nat. Acad. Sci. US 50, 935
(1963).
25. C. G r e e n s p a n, J. M a r m u r, Science 142, 387 (1963).
26. O.'Maaloe, J. Mol. Biol. 3, 144, 156 (1961).
27. J. R. Warner, A. Rich, С. Е. Hall, Science 142, 399 (1963); Scientific
American, февраль, 1963, стр, 66.
28. J. R, Warner, P, M. Knopf, A. Rich, Proc. Nat. Acad. Sci. US 49,
122 (1963),
29. Д. Уотсон, Роль РНК в синтезе белка, Биофизика 8, 401 (1963).
30. Н. Noll, Т. Staehelin, F, We tt stein, Nature 198, 632 (1963).
31. M.B. Волькенштейн, С. Н.Фишман, ДАН СССР 160,1407 (1965),
32. Ф. Крик, О синтезе белка, Сборник «Биологическое воспроизведение
макромолекул», стр. 209, ИЛ, 1960.
33. М. В. Но a gland, Е. В. Keller, Р, С, Zamecnik, J. Biol. Chem.
218, 345 (1956),
34. A. M а й с т е р, Исследование биосинтеза белков, Сборник «Современные
проблемы биофизики», т. II, стр. 270, ИЛ, 1962.
35. М. X о г л е н д, Ферментативные реакции между аминокислотами и
рибонуклеиновыми кислотами как промежуточные ступени синтеза белка,
Сборник «Современные проблемы биохимии», стр. 270, ИЛ, 1961,
36. Ф. Л и п м а н н, Труды V Международного биохимического конгресса,
Симпозиум 1, стр. 147, Изд. АН СССР, 1962.
37. U, Lager k vis t, P, Berg, J. Mol. Biol. 5, 139, 159 (1962).
38. R. Hoi ley, J, Ар gar и др., Cold Spring Harbor Symposia 28, 555
(1963).
39. H. G. К h о г а п a, Chemical synthesis in study of the nucleic acids,
Материалы VI Международного биохимического конгресса, Секция 1,
Симпозиум 1, Нью-Йорк, 1964,
ЛИТЕРАТУРА 493
40. S. S p i e g e 1 m a n. M, H а у a s h i, Cold Spring Harbor Symposia 28, 161
(1963).
41. H. M. Dintzis, Proc. Nat. Acad. Sci. US 47, 247 (1961).
42. F. H. С Crick, L. В a r n e 11, S. Brenner, R. J. W a 11 s - T о b i n,
Nature 192, 1227 (1961). (Русский перевод — Сборник «Молекулярная
генетика», ИЛ, 1963.)
43. S. Brenner, L. В а г n e 11, F. Н. С. Crick, А. О г g е 1, J. Mol. Biol. 3,
121 (1961).
44. С. Л е в и н т а л ь, А. Г е й р е н, Ф. Р о т м а н, Труды V
Международного биохимического конгресса, Симпозиум 1, стр. 222, Изд. АН СССР,
1962.
45. М. В. Н и р е н б е р г, Г. М а т т е и, Труды V Международного
биохимического конгресса, Симпозиум 1, стр. 211, Изд. АН СССР, 1962.
46. J. H. M a 11 h a e i, M. W. N i г е п b e r g, Proc. Nat. Acad. Sci. US 47,
1580 (1961).
47. M. W. Nirenberg, J. H. Matthaei, Proc. Nat. Acad. Sci. US 47,
1588 (1961). (Русский перевод — сборник «Молекулярная генетика», ИЛ,
1963.)
48. P. Lengyel, J. F. Speyer, S. Ochoa, Proc. Nat. Acad. Sci. US 47,
1936 (1961).
49. J. Speyer, P. Lengyel, C. Basilio, S. Ochoa, Proc. Nat. Acad.
Sci. 48, 63 (1962).
50. P. Lengyel, J. Speyer, J. B. S h e 11 о n, S. Ochoa, Proc. Nat. Acad.
Sci, US 48, 282 (1962).
51. J. Speyer, P. Lengyel, C. Basilio, S. Ochoa, Proc. Nat. Acad.
Sci. US 48, 411 (1962). (Русский перевод — сборник «Молекулярная
генетика», ИЛ, 1963.)
52. С. Basilio, A. W a h b a, P. Lengyel, J. Speyer, Proc. Nat. Acad.
Sci. US 48, 613 (1962).
53. R. S. Gardner, A. Wahba, C. Basilio, R. Miller, P. Lengyel,
J. Speyer, Proc. Nat. Acad. Sci. US 48, 2087 (1962).
54. A. Wahba, R. S. Gardner, С Basilio, R. Miller, J. Speyer,
P. Lengyel, Proc. Nat. Acad. Sci. US 49, 122 (1963).
55. A. Wahba, R. Miller, R. S. Gardner, P. Lengyel, J. Speyer,
Proc. Nat. Acad. Sci. US 49, 880 (1963).
56. J. H. Matthaei, O. W. Jones, R. G. Martin, M. W. Nirenberg,
Proc. Nat. Acad. Sci. US 48, 666 (1962).
57. O. Jones, M. Nirenberg, Proc. Nat. Acad. Sci. US 48, 2115 (1962).
58. J, Speyer, P. Lengyel, С Basilio, A. Wahba, R. Gardner,
S. О с h о a, Cold Spring Harbor Symposia 28, 559 (1963).
59. M. N i r e n b e r g, O. J о n e s, P. L e d e г, В. С1 a r k, W. S 1 y, S. P e s t k a,
Cold Spring Harbor Symposia 28, 549 (1963).
60. E. L, Smith, Proc. Nat. Acad. Sci, US 48, 677, 859 (1962)*.
61. A. Tsugita, H. Fraenckel-Conrat, M. W. Nirenberg,
J. H. M a 11 h a e i, Proc. Nat. Acad. Sci. US 48, 846 (1962).
62. N. Sueoka, Cold Spring Harbor Symposium on Quantitative Biology
26, Ceiiuiary Regulatory Mechanisms, стр. 35, 1961, (Русский перевод —
сборник «Регуляторные механизмы клетки», «Мир», 1964.)
63. N. S u е о k a, Proc, Nat. Acad. Sci. US 48, 582 (1962).
64. M. В, Волькенштейн, Биофизика 8, 394 (1963).
65. F. L a n n i, Proc. Nat, Acad. Sci. US 48, 1623 (1962).
66. J. B. W e i n s t e i n, A, N. S с h e с h t e r, Proc. Nat. Acad, Sci. US 48,
1686 (1962).
67. R. Wall, Nature 193, 1268 (1962).
68. В. Ю, Г а в р и л о в, Ю. Н. 3 о г р а ф, Успехи физич. наук 76, № 4, 597
(1962).
494
ЛИТЕРАТУРА
69. A. J. W a h b а, С. В a s i 1 i о, J. S. S p e у е г, P. L e n g у e 1, R. S. M u 1-
ier, S. Ochoa, Proc. Nat. Acad. Sci. LIS 48, 1683 (1962).
70. T. H. Jukes, Proc. Nat. Acad. Sci. US 48, 1809 (1962).
71. F. H. С Crick, Recent Excitement in the Coding Problem. Progress in
Nucleic Acid Research, Academic Press, 1962 (Русский перевод —
Нуклеиновые кислоты, сборник, «Мир», 1965).
72. Ф. Крик, К расшифровке генетического кода, Сборник «Живая клетка»,
ИЛ, 1962.
73 А. А. Баев, Журн, Всесоюзного хим. об-ва им. Менделеева 8, № I, 2
(1963).
74. J. D a v i e s, Proc. Nat. Acad. Sci. US 51, 659 (1964).
75. E. Cox, J. White, J. Flaks, Proc. Nat. Acad. Sci, US 51, 703 (1964).
76. J. Da vies, W. Gilbert, L. Gorini, Proc. Nat. Acad. Sci. US 51,883
(1964).
77. W. S z e r, S. О с h о a, J. Mol. Biol. 8, 823 (1964).
78. E. Freese, J. Mol. Biol. 1, 8 (1959).
79. Э. Фриз, Труды V Международного биохимического конгресса,
Симпозиум 1, стр. 231 (1962).
80. D. F. Bradley, M. К. Wolf, Proc. Nat. Acad. Sci. US 45, 944 (1959).
81. A. G i e r e r, K. W, Mundry, Nature 182, 1457 (1958); Zs. Vererbungslehre
89, 614 (1958).
82. С. И, Вавилов, Микроструктура света, Изд, АН СССР, 1950,
83. П. П. Феофилов, Поляризованная люминесценция атомов, молекул и
кристаллов, Физматгиз, 1959.
84. Е. В. Ануфриева, М. В. Волькенштейн, Т. В. Шевелева,
Биофизика, 7, 554 (1962).
85. Ф. Крамер, Соединения включения, ИЛ, 1958.
86. V. LuzattI, J. Chim, Phys. 58, 899 (1961).
87. А. Гире р, Труды V Международного биохимического конгресса,
Симпозиум 3, стр. 191 (1962).
88. A. Gierer, S. Schramm, Zs. Naturforsch. lib, 138 (1956).
89. H; Schuster, S. Schramm, Zs. Naturforsch. 13b, 697 (1958).
90. X. Виттман, Сборник «Молекулярная генетика», ИЛ, 1963.
91. Э. Фриз, Сборник «Молекулярная генетика», «Мир», 1964.
92. Д. X о г н е с с, Современные проблемы биофизики, т. 1, стр. 330, ИЛ, 1961.
93. В. Rotman, S. Spiegelman, J. Bacterid. 68, 419 (1954).
94. Ф. Ж а к о б, Ж- М о н о, Труды V Международного биохимического
конгресса, Симпозиум 1, стр. 157, Изд. АН СССР, 1962.
95. F. Jacob, J. Mo nod, Elements of Regulatory Circuits in Bacteria,
Доклад на Симпозиуме ЮНЕСКО по биологической организации,
сентябрь, 1962.
96. О. М а а 1 о е, J. Cellular Сотр. Physiol. 52, 31 (1963).
97. F. Jacob, S. Brenner, F. Cuzin, Cold Spring Harbor Symposia 28,
329 (1963).
98. P. Б. Хесин, М. Ф. Шемякин и др., Биохимия 27, 761, 1092 (1962);
28, 1070 (1963).
99. V. Allfrey, A. Mirsky, Cold Spring Harbor Symposia 28, 247' (1963).
100. V. Allfrey, R. Fauikn-ef, A. Mirsky, Proc. Nat. Acad. Sci. US 51,
786 (1964).
101. Т. М. Sonneborn, Proc. Nat. Acad. Sci. US 51, 915 (1964).
102. W. Beerman, U. Clever, Scientific American, апрель, 1964, стр. 50.
103. M. Фишберг, А. Блэклер, Как клетки специализируются, Сборник
«Живая клетка», ИЛ, 1962.
104. Дж. Г. Тэйлор, Сборник «Молекулярная генетика», т. 1, «Мир», 1964.
105. Р. Г. Буте н ко, Культура изолированных тканей и физиология
морфогенеза растений, «Наука», 1964,
ЛИТЕГАТУРА 495
106. F. С. Stewart, Scientific American, октябрь, 1963, стр. 104.
107. СЕ. Б р е с л е р, Введение в молекулярную биологию, Изд. АН СССР, 1963.
108. Ж. А. Медведев, Биосинтез белков и проблемы онтогенеза, Медгиз,
1963.
К главе 8
1. В. Бойд, Введение в иммунохимическую специфичность, ИЛ, 1963.
2. К. В и л л и, Биология, стр. 275, «Мир», 1964.
3. Дж. Ни ль, У. Шэлл, Наследственность человека, ИЛ, 1958.
4. Л. А. 3 и л ь б е р, Основы иммунитета, Медгиз, 1948.
5. S. К. Landsteiner, The Specificity of Serological Reactions, Harvard
Univ. Press, 1945.
6. O. W e s t p h a 1, Naturwiss. 46, № 2, 50 (1959).
7. D. Pressman, L. Sternberger, J. Immunology 66, 609 (1951)*
8. У. К а у з м а н, Химическая специфичность в биологических системах,
Сборник «Современные проблемы биофизики», т. 2, ИЛ, 1961.
9. J. R. М arrack, E. S. Orians, Steric factors in Immunochemistry,
Сборник «Progress in Stereochemistry», т. 2, стр. 228, London, 1958.
10. L. Pauling, J. Amer. Chem. Soc. 62, 2643 (1940); Nature 161, 707 (1943).
11. L. Pauling, D. H. Campbell, D. Pressman, Physiol. Rev. 23, 203
(1943).
12. L. Pauling, D. Pressman, A. L. Grossberg, J. Amer. Chem.
Soc. 66, 784 (1944).
13. D. Pressman, J. Т. М а у п а г d, A. L. Grossberg, L. Pauling,
J. Amer. Chem. Soc. 65, 728 (1943).
14. D. Pressman, A. B. Pardee, L. Pauling, J. Amer. Chem. Soc. 67,
1602 (1945).
15. D. Pressman, Molecular Complementariness in Antigen-Antibody
Systems, Сборник «Molecular Structure and Biological Specificity», стр. 1,
Washington, 1957.
16. S. J. Singer, J. Cellular Сотр. Physiol. 50, Suppl. 1, 51 (1957).
17. S. 1. Epstein, P. Doty, W. С Boyd, J. Amer. Chem. Soc. 78, 3306
(1956).
18. Ф. Гауровитц, Химия и биология белков, ИЛ, 1953.
19. F. Haurowitz, Nature and Formation of Antibodies, Сборник
«Molecular Structure and Biological Specificity», стр. 18, Washington, 1957.
20. F. Haurowitz, The theories of Antibodies Formation, Сборник «The
Nature and Significance of the Antibody Response», Columbia University
Press, 1953.
21. Ф. Вернет, Целостность организма и иммунитет, «Мир», 1964.
22. N. К. Je г пе, Proc. Nat. Acad. Sci. US 41, 849 (1955).
23. L. Sziiiard, Proc. Nat. Acad. Sci. US 46, 277, 293 (I960).
24. В. П. Э ф р а и м с о н, Журн. Всесоюзн. хим. о-ва им. Менделеева 6, Ms 3,
314 (1961).
25. P. Gros, J. Coursaget, M. Macheboeur, Bull. Soc. Chim. Biol. 34,
1070 (1952).
26 H. Green, H. S. Anker, Biochim. et Biophys. Acta 13, 365 (1954).
27. P. Шви т, Р. Оуэн, Теории синтеза белка и образование антител,
Сборник «Современные проблемы биохимии», стр. 324, ИЛ, 1961.
28. Н. Е i s е п, Proc. Nat. Acad. Sci. US 45, 862 (1959).
29. J. Led er berg, Science 129, 1649 (19sS9).
30- С. Е. Б р е с л е р, Введение в молекулярную биологию, Изд. АН СССР,
1963.
31. Ж- Же р мен, Гетерогенный катализ, ИЛ, 1961.
32. А. А. Баландин, Журн. физ. хим. 31, 745 (1957); Успехи химии 31,
|265 (1962); Мультипдетная теория катализа, Изд. МГУ, 19Q3.
496
ЛИТЕРАТУРА
33. М. Диксон, Э. Уэбб, Ферменты, ИЛ, 1961.
34. И. А з и м о в, Химические агенты жизни, ИЛ, 1958.
35. Дж. Брей, К. Уайт, Кинетика и термодинамика биохимических
процессов, ИЛ, 1959.
36. Р. О л б е р т и, Механизм действия ферментов, Сборник «Современные
проблемы биофизики», т. 1, стр. 228, ИЛ, 1961.
37. В. С h а п се, D. Н е г b е г t, Biochem. J. 42, 402 (1950).
38. V. М a s s е у, Biochem. J. 53, 72 (1953).
39. R. Lumry, Some Aspects of the Thermodynamics and Mechanism of En-
zymic Catalysis, Сборник «The Enzymes», т. 1, Academic Press, 1959.
40. R. A. A1 b e г t y, W. G. Miller, H. F. Fisher, J. Amer. Chem. Soc. 79,
3973 (1957).
41. X. Б. Анфинсен, Некоторые замечания об основных принципах
«конструкции» белковых молекул, Труды V Международного биохимического
конгресса, Симпозиум 4, Изд. АН СССР, 1962.
42. С. Е. Бреслер, Об активном центре ферментов, Труды V
Международного биохимического конгресса, Симпозиум, 1, Изд. АН СССР, 1962.
43. К. Анфинсен, Молекулярные основы эволюции, ИЛ, 1962.
44. В. С т а й н, СМ у р, Взаимосвязь между структурой и активностью рибо-
нуклеазы, Труды V Международного биохимического конгресса,
Симпозиум 4, Изд. АН СССР, 1962.
45. К. Linderstrom-Lang, J. Schellman, Protein Structure and Enzyme
Activity, Сборник «The Enzymes», т. 1, Academic Press, 1959.
46. В. Н, О р е x о в и ч, Химическое строение протеолитических ферментов и
специфичность их действия, Сборник «Актуальные вопросы современной
биохимии», Медгиз, 1962.
47. D- E. Koshiand, Ргос. Nat. Acad. Sci. US 44, 98 (1958); Mechanisms
of Transfer Enzymes, Сборник «The Enzymes», т, 1, Academic Press, 1959.
48. D. E. К о s h 1 a n d, Cold Spring Harbor Symposia 28, 473 (1963).
49. A. E. Б р а у н ш т е й н, Современные представления о природе активных
центров ферментов, Сборник «Актуальные вопросы современной
биохимии», Медгиз, 1962.
50. С. G. Swain, J. F. Brown, J. Amer. Chem. Soc. 74, 2538 (1952).
51. F. К a r u s h, J. Amer. Chem. Soc. 72, 2705 (1950).
52. H. Gutfreund, J. M. Sturtevant, Proc. Nat. Acad. Sci. US 42, 719
(1956); Biochem. J. 63, 656 (1956).
53. B. L a b о u e s s e, В. Н. Havsteen, G. P. Hess, Proc. Nat. Acad. Sci.
US 48, 2137 (1962).
54. И. А. Болотина, М. В. Волькенштейн, О. Чикалова-Лу-
зина. Биохимия 30 (1965).
55. А. Е. Браунштейн, Ю. М. Торчинский, Л. Г. Коренева,
Материалы VI Международного биохимического конгресса, Нью-Йорк,
1964; Биохимия 28, 1087 (1963); 29, 534 (1964).
56. D. E. Koshiand, J. A. Yankeelov, J. A. Thorn a, Feder. Proc. 21,
№ 6, 1031 (1962).
57. M. В. Волькенштейн, ДАН СССР 160, 468 (1965).
58. А. А. Баландин, ДАН СССР 144, 1008 (1957); Биохимия 23, 475 (1958).
59. А. А. Баландин, Е. И. К л а бу но веки й, Журн. физ. хим. 33, 2492
(1959).
60. J. Kirkwood, J. Shu maker, Proc. Nat. Acad. Sci. US 38, 855 (1952).
61. J. Kirkwood. Discuss. Faraday Soc. 20, 3 (1965); Сборник «The
Mechanism of Enzyme Action» John Hopkins Press, 1954.
62. A. E. Браунштейн, Журн. Всесоюзн. хим. о-ва им. Менделеева 8»
№ 1, 81 (1963).
63. Г. М а р к и Н. Г е й л о р д, Линейные и стереорегулярные полимеры, ИЛ,
1962. " ' - ....... , .
ЛИТЕРАТУРА 497
64. А. Г. ПасынскнЙ, Биофизическая химия, «Высшая школа», 1963.
65. М. В. В о л ь к е н ш т е й н, Молекулярная биофизика, сборник, «Наука»,
1965.
66. A. Novick, L. Szilard, Experiments with the chemostat on the rates
of aminoacid synthesis in bacteria, Princeton Univ. Press, 1954.
67. H. E. Umbarger, Science 123, 848 (1956); Cold Spring Harbor
Symposia on Quantitative Biology 26, 301 (1961).
68. J. Gerhard t, A. Pardee, Cold Spring Harbor Symposia 28, 491 (1963).
69. J. Mo nod, J. Wyman, J. — P. Changeux, J. Mol. Biol. 12, 88 (1965).
70. F. J а с о b, J. M о п о d, Elements of Regulatory Circuits in Bacteria, Unesco
Symposia on «Biological Organization», сентябрь, 1962; Cold Spring
Harbor Symposium on Quantitative Biology 26, 389 (1961).
71. L. P a u 1 i n g, Proc. Nat. Acad. Sci. US 21, 186 (1935).
72. Л. А. Блюменфельд, Гемоглобин и обратимое присоединение
кислорода, Советская наука, 1957.
73. J. W у m а п, D. А11 е п, J. Polymer Sci. 7, 499 (1951).
74. R. В е п е s h, R u t h В е п е s h, J. Mol. Biol. 6, 498 (1963).
75. J. Wyman, Cold Spring Harbor Symposia 28, 483 (1963).
76. H. Muirhead, M. Perutz, Nature 199, 633 (1963); Cold Spring Harbor
Symposia 28, 451 (1963).
77. M. В. Вол ькен штейн, А. К- Шемелин, Биохимия 30, 148 (1965).
78. R. В. Drysdale, A. R. Pea cocke, Biol. Rev. 36, 537 (1961).
79. М. Н. F. Wilkin s, Cold Spring Harbor Symposia on Quantitative
Biology 21, 75, 1956; Biochem. Soc. Symp. 14, 13 (1956).
80. G. Z u b a y, P. D о t y, J. Mol. Biol. 1, 1 (1959).
81. F. H. С. С r i с к, J. D. W a t s о п, Nature 177, 473 (1956).
82. R. W. Home, Scientific American, январь, 1963.
83. А. С. Спирин, Н. А. Киселев, Р. С. Ш а к у л о в, А. А. Богданов,
Биохимия 28, 920 (1963).
84. P. Jordan, Phys. Zs. 39, 711 (1938); Zs. Phys. 113, 431 (1939); Naturwiss.
29, 89 (1941).
85. P. Jordan, Eiweisstnolekule, Stuttgart, 1947.
86. B. X. Штокмайер, Силы взаимодействия между макромолекулами,
Сборник «Современные проблемы биофизики», т. 1, стр. 132, ИЛ, 1962.
87. L. P a u 11 п g, M. D е 1 b г и с k, Science 92, 77 (1940).
88. Н. Jehle, Proc. Nat. Acad. Sci. US 36, 238 (1950); J. Chem. Phys. 18,
1150 (1950).
89. J. M. Yos, W. L. Bade, H. Jehle, Specificity of the London-Eisenschitz-
Wang Force, Сборник «Molecular Structure and Biological Specificity»,
Washington, 1957.
90. П. С. Зырянов, Цитология 2, 62 (1960); Биофизика 6, 495 (1961).
91. Е. М. Л и ф ш и ц, ЖЭТФ 29, 94 (1954).
92. С. Э. Хайкин, Физические основы механики^ § 124, Физматгиз, 1962.
93. Н. К а м и я, Движение протоплазмы, ИЛ, 1962.
94. J. A m о о г е, М. Rubin, J. Johnston, Proc. of the Sci. Sect, of the
Toilet Goods Association, Spec. Suppl. to, N° 37, октябрь, 1962.
95. J. Atnoore, J. Johnston, M. Rubin, Scientific American, февраль,
1964, стр. 42.
К главе 9
1. A. Katchalsky, S. Lifson, 1. Michaeli, M. Zwick, Elementary
Mechanochetnical Processes, Сборник «Contractile fcolymefs», fcergamori
Press, 1960.
2. В. А. Энгельгардт, М. Н. Любимова, Биохимия 4, 716 (1939);
Nature 144, 668 (1939); Биохимия 7, 205 (1942).
3-W. Kuhn, A. Katchalsky, H. Eisenberg, Nature 166, 514 (1950).
498
ЛИТЕРАТУРА
4. A. Katchaisky, J. Polymer Sci. 7, 393 (1951); Progr. Biophys. and
Biophys. Chem. 4, 1 (1954).
5. W. Kuhn, B. Hargitay, Experientia 7, 1 (1951).
6. А. Пасынский, В. Блохи на, ДАН СССР 86, 1171 (1952).
7. В. И. Воробьев, ДАН СССР 137,972 (1961).
8. S. Lif son, J. Chem. Phys. 26, 727 (1957); 29, 89 (1958).
9. О. Б. Птицын, Высокомолекул. соедин. 2, 463 (1960).
10. О. Б. Птицын, Высокомолекул. соедин. 1, 715 (1954).
И. Т. М. Бир штейн, В. И. Воробьев, О, Б. Птицын, Биофизика 6,
524 (1961).
12. P. Flo г у, Science 124, 53 (1956).
13. Т. М. Б и р ш 1 е й н, Высокомолекул. соедин. 4, 605 (1962).
14. R. В. Set low, E. С. Pollard, Molecular Biophysics, Addison — Wesley
Publishing Company, 1962. (Русский перевод — «Мир», 1964.)
15. A. Szen t-G yorgy i, Proteins of the Myofibril, Сборник «The Structure
and Function of Muscle», т. II, гл. 1, Academic Press, 1960.
16. В. А. Энге л ьга р д т, Успехи совр. биол 14, 177 (1941).
17. J. Hanson, H. E. Huxley, Symposia Soc. Exptl. Biol. 9, 228 (1955);
H. E. Huxley, Scientific American 199, 67 (1958).
18. Г. Бен нет, Структура мышечных клеток, Сборник «Современные
проблемы биофизики», т. 2, ИЛ, 1962.
19. А. Ходж, Фибриллярные белки мышц, Сборник «Современные проблемы
биофизики», т. 2, ИЛ, 1962.
20. И. И. Иванов, В. А. Юрьев, Биохимия и патобиохимия мышц, Медгиз,
1961.
21. Н. Weber, The Motility of Muscle and Cells, Harvard University Press,
1958.
22. D. M. Needham, Biochemistry of Muscular Action, Сборник «The
Structure and Function of Muscie», т. II, гл. 2, Academic Press, 1960.
23. D. Nachmansohn, The Neuromuscular Function, Сборник «The
Structure and Function of Muscle», т. II, гл. 5, Academic Press, 1960.
24. В. А. Энгельгардт, Advances in Enzymoiogy 6, 147 (1956).
25. B. Chance, С M. Connelly, Nature 179, 1235 (1957); B. Chance,
F. Jobs is, Nature 184, 195 (1959).
26. G. Uibrecht, M, Uibrecht, Biochim. et Biophys. Acta 11, 138(1953).
27. A. V. Hill, Proc. Roy. Soc. B126, 136 (1938); B127, 297, 434 (1939);
Nature 167, 377 (1951); Brit. Med. Bull. 12, 174 (1956).
28. R. J. P о d о 1 s k y, Thermodynamics of Muscle, Сборник «The Structure
and Function of Muscle», т. II, гл. 7, Academic Press, 1960.
29. M. M о р а л е с, Механизм мышечного сокращения, Сборник «Современные
проблемы биофизики», т. 2, ИЛ, 1962.
30. А. С е н т - Д ь е р д ь и, Биоэнергетика, Физматгиз, 1960.
31. J. Rise man, J. Kirk wood, J. Amer. Chem. Soc. 70, 2820 (1948).
32. J. Botts, M. Morales, J. Cellular Сотр. Physiol. 37, 27 (1951); Arch.
Biochem. Biophys. 37, 283 (1952).
3a W. К u h п, В. Н a r g i t а у, Zs. Elektroch. 55, 410 (1951).
34. E. W 6 h 1 i s с h, Naturwiss. 28, 305, 326 (1940).
35. W. As t bury, Proc. Roy. Soc В137, 58 (1950).
36. Я. И. Френкель, ДАН СССР 20, 129 (1938); 9, 251 (1938); Собрание
избранных трудов, т. 3, стр. 456—458, Изд. АН СССР, 1959.
37. A. F. Huxley, Progr. in Biophys. and Biophys. Chem. 7, 255 (1957).
38. R. J. Podolsky, The Living Muscle Fiber, Сборник «Conference on
Contractility», Pittsburgh, Pennsylvania, 27—30, январь, 1960.
39. Л. X. Эйд у с, Биофизика, 7, 683 (1962).
40. В. А. Энгельгардт, Мышечные белки и функция мышцы, Сборник
докладов совещания по белку, Изд. АН СССР, 1948.
ЛИТЕРАТУРА 499
41. М. G. Pry or, Progress in Biophysics, т. i, стр. 216, Academic Press, 1950.
42. P. Flory, J. Cell, anil Compar. Physiology 49, Suppl. 1, 175 (1957).
43. P. Flory, J. Polymer Sci. 49, 105 (1961)-
44. C. A. J. Hoeve, P. Flory, Evidence for a Phase Transition in Muscle
Contraction, Сборник «Conference on Contractility», Pittsburgh,
Pennsylvania, 27—30, январь, I960.
45. ROosawa, S. A s a b u г а, Т. О о i, Physical Chemistry of Muscle Protein
«Actin», Supplement of the Progress of theoretical Physics, № 17 (1961).
46. F. Oosawa, M. Kasai, J. Mol. Biol. 4, 10 (1962).
47. S. Asakura, M. Taniguchi, F. Oosawa, J. Mol. Biol. 7, 55 (1963).
48. M. В. Вол ькен штейн, ДАН СССР 146, 1426 (1962).
49. R. E. Da vies, Nature 199, 1068 (1963).
50. Ю. Т о н о м у р а, Т. К а н а з а в а, К- С е к и я, Молекулярная биология,
Сборник к 70-летию В. А. Энгельгардта, «Наука», 1964.
51. G. M. Fr an k, Proc. Roy. Soc. B160, 473 (1964).
52. H. К а ми я, Движение протоплазмы, ИЛ, 1962.
53. Ш. Инуэ, Подвижность ресничек и жгутиков и механизм митоза,
Сборник «Современные проблемы биофизики», т. 2, ИЛ, 1961.
54. Т. X а я ш и, Как движутся клетки, Сборник «Живая клетка», ИЛ, 1963.
55. В. А. Энгельгардт, С. А. Бурнашева, Биохимия 22, 554 (1957).
56. D. М а г i a, Mitosis and the Physiology of Cell Division, Сборник «The
Cell», т. З, гл. 2, Academic Press 1961. (Русский перевод —Д. Мэзиа,
Митоз и физиология деления клеток, ИЛ, 1963.)
57. Д. М э з и а, Биофизические и биохимические исследования клеточного
деления, Сборник «Вопросы биофизики», ИЛ, 1957.
58. Д. Мэзиа, Как делятся клетки, Сборник «Живая клетка», ИЛ, 1963.
59. D. Bern a 1, Publ. Am. Assoc. Advance Sci, 14, 199 (1940).
60. E. де Р о б е р т и с, В. Новинский, Ф. С а э с. Общая цитология,
стр. 398, ИЛ, 1962.
61. А. Л. Ленингер, Сборник «Горизонты в биохимии», «Мир», 1964.
62. С. А. Нейфах ,Т. Б. Казакова, ДАН СССР 152, 471 (1963); Nature
197, 1106 (1963).
63. Г. С тент, Молекулярная биология вирусов бактерий, «Мир», 1965.
К главе 10
1. М. В. Волькенштейн, Изв. АН СССР, Сер. биол. № 1, 3 (1958).
2. Ф. Г а у р о в и т ц, Химия и биология белков, ИЛ, 1953.
3. Р. С. Caldwell, С. Hinshelwood, J. Chem. Soc, 3156, 1950.
4. Ю. А. Шаронов, М. В. Волькенштейн, Высокомолекул. соедин. 4,
917 (1962); Физика твердого тела 5, 590 (1963).
5. М. В. Волькенштейн, Биофизика 6, 257 (1961); Сборник «Вопросы
биофизики» (Материалы I Международного биофизического конгресса),
«Наука», 1964.
6. А. Сент-Дьердьи, Биоэнергетика, Физматгиз, 1960.
7. Г. Лонгет-Хиггинс, Сборник «Вопросы биофизики», «Наука», 1964.
8. М. В. Волькенштейн, Строение и физические свойства молекул,
Изд. АН СССР, 1955.
9. А. И. Ки т а й г о р о д с к и й, Органическая кристаллохимия, Изд. АН
СССР, 1955.
10. А. Сент-Дьердьи, Введение в субмолекулярную биологию, «Наука»,
- 1964. '
11. A. Pullman, В. Pullman, Quantum Biochemistry, Interscience
Publishers, 1963 (Русский перевод, «Мир», 1965).
12. М. Kasha, Quantum Chemistry in Molecular Biology, Сборник «Horizons
in Biochemistry», Academic Press, 1962 («Горизонты в биохимии», «Мир»,
1964). Р
500
ЛИТЕРАТУРА
13. В. Pullman, A. P u 1 im a п,Radiation Research, Suppl. 2, 160 (1960).
14. Л. Ингрэм, Механизмы биохимических реакций, «Мир», 1964.
15. С. Рид, Возбужденные электронные состояния в химии и биологии, ИЛ,
1960.
16. М. В. В о л ь к е н ш т е й н, Молекулярная оптика, гл. 12 Гостехиздат,
1951.
17. М. Каша, Зависимость между экситонными полосами и полосами
проводимости в молекулярных пластинчатых кристаллах, Сборник
«Современные проблемы биофизики», т. 1, ИЛ, 1961.
18. Я. И. Френкель, Phys. Rev. 37, 17, 1276 (1931); Phys. Zs. Sowjetunion
9, 158 (1936).
19. E. Рабинович, Фотосинтез, т. I, ИЛ, 1951; т. II, ИЛ, 1953.
20. М. Кальвин, Получение и передача энергии при фотосинтезе, Сборник
«Современные проблемы биофизики», т. 1, ИЛ, 1961.
21. А. Н. Теренин, Фотохимия красителей, Изд. АН СССР, 1947.
22. Механизм фотосинтеза, Труды V Международного биохимического
конгресса, Симпозиум 6, Изд. АН СССР, 1962.
23. R. В. Set low, E. С. Pollard, Molecular Biophysics, Addison—Wesley,
1962. (Русский перевод — «Мир», 1964.)
24. X. Хартлайн, Рецепторные механизмы и интеграция сенсорной
информации в сетчатке глаза, Сборник «Современные проблемы биофизики»,
т. 2, ИЛ, 1961.
25. А. Г. Па сыне кий, Биофизическая химия, «Высшая школа», 1963.
26. Н. П. Дубинин, Проблемы радиационной генетики, Госатомиздат, 1959.
27. М. Кальвин, Свободные радикалы в фотосинтетических системах,
Сборник «Современные проблемы биофизики», т. 1, ИЛ, 1961.
28. Г. А н д р о э с, М. К а л ь в и н, Сборник «Вопросы биофизики», «Наука», 1964.
29. Сборник «Свободные радикалы в биологических системах», ИЛ, 1963.
30. Дж. Робертсон, Молекулярная биология клеточных мембран, Сборник
«Молекулярная биология», ИЛ, 1963.
31. A. Katchalsky, Membrane Permeability and the Thermodynamics of
Irreversible Processes, Материалы Симпозиума по мембранному
транспорту и метаболизму, Прага, 1961.
32. A. Katchalsky, О. Kedem, Biophys. J. 2, № 2, г. 2, 53 (1962).
33. О. Kedetn, A. Katchalsky, Trans. Faraday Soc. 59, 1918, 1931, 1941
(1963).
34. Ф. Ш м и т т, Молекулярная организация нервного волокна, Сборник
«Современные проблемы биофизики», т. 2, ИЛ, 1961.
35. Б. Катц, Как клетки общаются друг с другом, Сборник «Живая клетка»,
ИЛ, 1962.
36. Б. Катц, Природа нервного импульса, Сборник «Современные проблемы
биофизики», т. 2, ИЛ, 1961.
37. Б. Катц, Механизм синаптической передачи, Сборник «Современные
проблемы биофизики», т. 2, ИЛ, 1961.
38. Г. Э й р и н г, Физическая химия нервного возбуждения, Сборник
«Молекулярная биология», ИЛ, 1963.
39. И. У и л с о н, Некоторые вопросы молекулярной основы нервной
активности, Сборник «Молекулярная биология», ИЛ, 1963.
40. L. Pauling, Science 134, 3471 (1961).
41. I. Klotz, Water, Сборник «Horizons in Biochemistry», Academic Press,
1962 (Русский перевод «Горизонты в биохимии», «Мир», 1964).
42. Д. Н. Насонов, В. Я. Александров, Реакция живого вещества на
внешнее воздействие, Изд. АН СССР, 1940.
43. Д. Н. Насонов, Местная реакция протоплазмы и распространяющееся
возбуждение, Изд. АН СССР, 1962,
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автотрофы 47. 135
Адаптация 14, 87, 88
Аденин 122 и д.
Аденозин 124 и д.
Адренокортикотропин 105, 116, 120. 393
Адсорбция 112, 384 и д.
— фага 64, 65, 415
АДФ — аденозиндифосфорная кислота 49,
125, 134—143 и д.
Активность оптическая 107, ПО. 198, 215—
217, 225, 230-243. 409-411, 476
Актин Ш и д.
Аллель 70. 71, 79, 83
Аллергия 366
Аллостеризм 361, 404—411, 467
а-спираль 191, 192, 195, 441
Аминоациладенилат 328
Аминокислоты 16, 86, 99—106 и д., 147, 185
и д.
Андрогенез 82
Анемия 117, 118
Антиген 365 и д.
Антипод оптический 108 и д., 192, 404
Антитело 365 и д.
Аппарат Гольд ж и 51. 52
— митотнческий 55, 460—464
Асимметрия 106—114. 192. 231 и д., 403,404
АТФ — аденозинтрифосфорная кислота 48,
49, 125, 134—143, 328, 331, 429 и д.
Бактерии 48. 49, 85-98 и д.
Бактериофаги 63—69, 85—98, 248, 249. 277
и д.
Белок II, 12, 16, 18, 27, 28, 114—120, 188
и д.
— глобулярный 194, 197, 200 и д.. 386
— фибриллярный 193. 197, 203-207, 433 и д.
р-форма белков 192—194, 197, 203, 204, 441
— скрещенная 194. 204
Вирусы 44. 63 и д., 249, 332, 414, 415
Витализм 13, 17. 18. 57
Витамины 135, 201. 473
Возбуждение нервное 480
Волокно 28, 145, 167. 168, 209, 210, 429 и д.
Вращение внутреннее в молекулах 150, 153
и д.
ВТМ — вирус табачной мозаики 63, 64,116,
128, 202, 248, 249, 316, 351-354, 414
Вы со ко эластичность 147, 152, 158 и д.
Вязкость 178, 179, 196, 257, 267
Газ идеал ьн ый 148. 149. 280
— реальный 23, 214, 38Q
Гамета 45, 58—61, 70 и д.. 84
Гаптен 370 и д.
Тем 140. 143. 202, 407. 409. 464. 474
Гемоглобин 20. 27, 116—118. 143, 144, 201,
202. 213, 216, 241, 352. 353, 407-411, 474
Гемофилия 73
Геи 72, 76, 80. 81, 93 и д., 338 и д.
Генетика 28, 29, 43—45. 69-98 и д.
Генотип 71 и д.
Гетерозиготность 71 и д., 118
Гетеротрофы 47, 135
Гибкость макромолекул 152 и д., 209
Гибридизация ДНК 278, 279
Гиперхромизм 229
Гипохромизм 229. 260 и д., 272, 276, 476
Гистон 362. 363, 412, 413
Гликоген 61, 133
Гликолиз 137
Глобула 197, 202, 213, 214, 386
Глюкоза 31. 48, 135—137, 397, 398
Гомеостазис 42
Гомози готн ость 71 ид.
Группа амидиая 194—198, 226-229
— крови 367, 368
— простетическая 135, 387, 476
Гуании 122 и д.
Гуанозин 125 и д.
Двулучепреломление в потоке 181, 259,263,
266
Деление клеток 49, 54 и д, (см. Митоз,
Мейоз)
Делеция 98, 333, 360
Демон Максвелла 40
Денатурация белков 163, 208 и д.. 227.393
— нуклеиновых кислот 259, 264. 266 и д.
Деятельность мышечная 49, 143, 185. 425
и д.. 468
Дифосфопиридиннуклеотид 137—141, 476
Дифференциация клеток 47, 55, 61, 62,207,
362-364. 382—384, 460
Дихроизм инфракрасный 194—198
— круговой III. II2, 233. 242
ДНК — дезоксирибонуклеиновая кислота
54, 63 и д., 120—130, 244 и д.
Доминантность 69 и д., 79
Дрозофила 54, 73—79, 81, 85
Дыхание 48, 135
Escherichia Coll 55, 55, 89, 92, 245 и Д.,
358—360
Жгутики 49. 54, 431, 458-460
Жизнь 11—17. 19, 27, 45, 64, III, ИЗ, 174,
404, 459 и Д,
502
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Закон Аррениуса 25, 26, 81, 385
— Ваит-Гоффа 176
— сохранения энергии 12, 31. 439
— Эйнштейна (диффузия) 176
(фотохимия) 472
Законы Менделя 69—72, 83, 117» 368
Запах 420-423
Зигота 45, 60, 62, 69 и д.
Изомерия поворотная 153 и д., 169 и д.,
398
Иммунитет 28, 365 и д.
Иигибироваиие фермента 391—393, 405—407
Иисулии 18, 103, 115, 116, 118, 120, 204,216,
241,
Информация 16, 17, 36—44, 54, 55, 62, III,
114, 130, 188, 311, 322, 332, 411, 412, 466,
470
Ион диполяриый 100, 185, 186
Ионизация 182 и д.
Иоиит 187
Канцерогены 348, 350, 476
Каротии 473
Карта геииая 76, 77, 88, 92, 95, 98, 333
Катализ 35, 112, 114, 384—386 и д., 426
— ферментативный 19, 27, 29 и д., 384
и д.
Каучук 28, 145, 147—149, 232, 398, 443
Кибернетика 19, 36 и д.
Кинетика 24—26. 131, 153 и Д., 273—275,
306—309, 387-389 и д.
Кииетосома 54
Кииетохор 464
Кислоты нуклеиновые II, 12, 27, 28, 120—
130, 244 и д.
Клетка 27, 33, 45—63 и д.
Клетки гаплоидные 54, 55, 60, 70
— диплоидные 54 и д.
Клубок, статистический 151, 152, 157, 195—
197, 199, 208, 210, 214 и д., 267 и Д.
Код генетический 97, 259, 310 и д,
Кодирование 41 и д., 130 и д.
Кодой ы 337 и д.
Колебания молекул 21, 155, 157 и д.
Коллагеи 193, 205—207, 433
Константа диссоциации 183, 184, 224, 270,
271, 376
— равновесия 24, 25, 130—132, 375—378,463
Конфигурация абсолютная ПО
Коиформация 151, 153 и д.
Конъюгация бактерий 88, 89, 361
^оперативность 23. 26, 62, 160—167, 171
и Д., 214 и д., 269 и д., 400, 406 и Д.,
429-431, 449 и д., 467 и д.. 480
Копирование выборочное 89, 90
Кофактор 387
Кофермеит 135, 387
Коэффициенты вириальиые 176, 178
— феноменологические 33
Кристалл 39—41, 107, 112, 162, 163, 167 и д.,
197 и д.
«Кристалл апериодический» 16, 30, 225.
467, 468
Кристаллизация 16, 21—23, 39—41, 63, ИЗ,
167 и д., 275, 448 и д.
Кроссииговер см. Перекрест
Летальность 79, 80
Лизис 67, 68, 366
Лизогеиия 68, 69. 91, 93, 248, 359, 360
Лизосома 52
Липиды 49, 50, 61, ИЗ, 190
Люминесценция 348, 349, 472
Мейоз 58-60, 416, 419, 431, 458
Мембрана клеточная 45, 49, 50, -54, 168,
361, 479, 480
Мерозигота 91
Метаболизм II, 27, 29 и д.
Механика квантовая 13, 15, 21, 28. 29,80
417-419, 471-477
Мехаиохимия 29, 185, 327, 424-455
Миграция энергии 29, 227, 442, 447, 448
477
Миоглобии 20, 116, 200—202, 216, 241, 409-
411
Миозин 203, 216, 241, 433 и д.
Миофибрилла 203, 204, 432- и далее
Митоз 54—58, 354, 425, 431, 458-455, 468
Митохондрии 46, 50^52, 143, 465
Модель Дэвиса (мышца) 452—457
— Изиига (кооперативные явления) 163—
167, 218—224, 269—271. 296-302
— Кошлаида (ферменты) 398—399
— Куиа (оптическая активность) 232
Модификации 78, 88
Модуль упругости 148, 401, 443
Мозаики 85
Момент дипольиый 21, 175, 198, 227, 280-
282
— переходный дипольиый 228, 232
магнитный 232
М-РНК, матричная РНК 128, 250, 310. 311,
320 и д.
Мутагенез радиационный 81, 82, 84, 245
— химический 84, 245, 246, 316, 345-354
Мутации 77—85 и Д., 245, 247, 248, 294—
296, 333 и д., 466
— соматические 85, 350, 380
Мутои 94, 98, 335, 338
Мышца 28, 29, 49, 143, 185, 425 и д., 468
Наркоз 480
Наследственность 14, 16, 28, 29, 69 и д.
— цитоплазм этическая 83, 93
Начало второе термодинамики 30 и д., 40,
112
Негэитропия 16, 39 и д., Ill, 4II
Нуклеозиды 124, 128, 143
Нуклеопротеиды 67, 168, 412—420
Нуклеотиды 125, 128, 129 и д.
Обмен веществ II, 12, 27, 29 и д,
— изотопный 191, 216
Овогенез 60
Окисление 48, 52, 135 и д.
Оператор (геи) 357 и д.
Оперой 357 и д.
Оплодотворение 60, 82
ОППП — наименьшие живые клетки 50
Осмометрия 176
Партеногенез 61
ПБГ — полибеизилгпутамат 215, и д., 235,
236
ПГК — полиглутамииовая кислота 105, 215
и д., 229
Перекрест 74—76, 90
Переход глобула — клубок 214
— спираль — клубок 214 и д., 229, 267 и д.
— фазовый 21, 23, 162, 223, 225, 448, 450»
468 и д.
ПРЕДМЕТНЫЙ
Петли (в ДНК) 262 и д., 294, 295
Пиримидин 121
Пиррол 144
Плавление 22. 172. 173, 214 и д., 267 и д..
448, 449
Пол 73
— у бактерий 89 и д.
Полиамиды 193
Поли аминокислоты 105. 106, 214—217, 229,
235. 236
Полиизопрен 146
Поликоидеисация 100, 105, 132, 306
Полимеры кристаллические 167—174, 193
и д.
стереорегуляриые 146, 147
полииуклеотиды 129, 143, 259—262, 271,290,
335—338, 341. 342
Полиплоидия 84
Полисома 323—327
Полиспермия 82
Полистирол 145-147
Полиэлектролиты 182—187, 224, 243, 270,
425, 429, 430, 441—443
Полиэтилен 145, 147, 158, 161, 168, 169
Поляризуемость 21, 177, 237—239, 281. 417
Порфирины 143, 144, 474
Постоянная диэлектрическая 185, 281
Потенциал химический 32. 223
Правила Чаргаффа 128, 129, 253, 254
Принцип дополнительности 13—15, 18
— неопределенности 13
Происхождение жизни 58, 64, III, ИЗ и д.,
468, 471
Протамины 412, 413
Протоплазма 46 и д., 419, 425
Профаг 68, 69, 91, 93, 360
Псевдоаллелизм 94
Пурии 122
Радиоавтография 286
Радиоспектроскопия 20
Рак 29, 350, 364, 476
Раскручивание ДНК 272—275, 304—306
Рассеяние нейтронов 21
— рентгеновых лучей 181, 257, 259, 350
— света 20, 177—181, 257
Растяжение макромолекул 158 и д., 164—
167, 425 и д.
Реакции экзергоииые и эидергоииые 131
Регулятор (ген) 357 и д.
Регуляция И, 43, 44, 57 и д., 354—364,405,
405, 412
Редупликация ДНК 249, 283—309 и д., 416
— конвариантная II, 284
— Хромосом 286—289, 360-363, 416
Резонанс квантовомеханический 29, 228,
417, 448
Резус-фактор 368
Рекомбинация 76, 89, 90, 93 и д.
Рекой 94—98, 335
Реиатурация ДНК 275—280
Рентгенография 20, 167, 169, 200—202, 206,
250, 257, 409
Репликой 361, 362
Репрессор 357 и д.
Реснички 49, 54, 431, 458—460
Ретикулум эндоплазматический 51, 52
Рецессивность 69 и д., 79
Рибоиуклеаза 116, 216, 241, 393-395
Рибосомы 52, 55, 128, 319, 320, 323-327,
415, 416
РНК — рибомукленновые кислоты 52, 63,
и д., 120-130, 250 и д.
УКЛЗППЛЬ 503
Связь водородная 188 и д , 210 и Д , 255,
275 391 480
— гидрофобная 208, 210-214, 391, 480
— иоииая 67, 391
— макроэргическая 49. 327
— обратная 19, 42, 43, 62, 406, 445, 469
— пептидная 100, 106, 132, 192, 197
Седиментация 175, 176. 257. 276—279
— в градиенте плотности 258 и д., 267,
285, 320
Сила вращения 233, 234, 410, 411
— осциллятора 228—230, 233, 272
Синапсис хромосом 58, 59, 416—420, 472
Синтез белка 18, 27, 119, 319 и д.
— ДНК 253 и д., 287 и д.
— М-РНК 322
— полииуклеотидов 259, 260
— ферментов индуцированный 354-361,
380-384
Система открытая II, 31—36, 47, 134
Смесь рацемическая 108— ПО, ИЗ
Соединение включения 349, 480
Состояние стационарное 34—36, 388, 392
Спектры инфракрасные 21, 155, 157, 159,
190, 194-198, 207, 226
— комбинационные 21
— электронные 21, 225—230, 243, 260, 272,
399, 418, 477
Сперматогенез 60
Сперматозоид 45, 60, 82, 244, 251, 424
Спираль двойная ДНК 250 и д.
Среда минимальная 86
Сродство 32
Стекло 468, 469
Структура белка вторичная 188 и д.
первичная 114—120, 188, 208, 317, 318
— — третичная 200 и д.
четвертичная 202 и д.
— надмолекулярная 27, 30, 62, ИЗ, 168,
169, 173, 174 и д.
Сумма статистическая 22, 23, 164, 220-222,
224, 297-301
Таутомерия 25, 80, 123, 124, 265, 346, 348,
475
Термодинамика открытых систем 31—36
Тимидии 125
Тимин 121 и д.
Точка изоэлектрическая 186, 187
Траисдукция 69, 91, 248, 279
Трансформация 246-248, 279
Т-РНК — транспортная РНК 128, 250, 266,
329-332
Углеводы 49, 61, ИЗ. 132—134, .190
Ультра цен три фуг а 175
Уравнение Ваи-дер-Ваальса 23, 44, 214
— Михаэлиса — Ментеи 388, 389, 404
— Хилла (гемоглобин) 408, 409
Уравнения Хилла (мышца) 437—441
Урацнл 122 и д.
Фат к 97, 359
- Т2 65, 90, 256. 320
- Т4 66, 90, 95, 333 и д.
- ФХ174 129, 303, 322
Фенотип 71, 77, 78 и д.
Ферменты 19, 27, 29, 52, 85. 104, 115, 135,
247, 384-407 и д.
Ферромагнетизм 162—167
Флуктуации 16, 87, 112, 114, 177, 207, 400,
504
Предметный указатель
Формула Друде 234
— Моффита 236, 237, 240, 241
Фосфорилироваиие 135—143, 436 и д,
Фотосиитеа 47, 48, 112, 135, 143, 472, 477,
479
Фрагментация хромосом 90
Хлоропласт 47, 52, 53. 135, 475, 477
Хлорофилл 47, 52, 143, 261
Хроматография 104, 105, 115, 127
Хромосомы 54 и д., 70 и Д., 83, 168, 244,
256, 283-289, 360 и д., 413-416 и д.,
460 и Д.
Целлюлоаа 134, 168
Цеитриоли 45. 52—55, 459 и д.
Цепи Маркова 161-163, 469
Цикл Кребса 136 и д,
— мехаиохнмнческий 427 и д,
Цис — траис тест 94, 95
Цистрон 72, 94 и д., 333, 335
Цитидии 125
Цитоэин 121 и Д.
Цитоплазма 44, 50 и д., 128 и д,345,460
Цитохромы 116, 137 и д,
Частицы каппа 83
Шелк 193, 203, 210
Шумы 42
Эволюция 43. 57, 58. 60, 64, из, Ц4, П9,
332. 339, 341, 470, 471
Экситои 228, 477
Электронография 20, 169
Электрофореа 117, 186. 187, 243, 254
Эписома 93, 361
Эффект Вора 408
— Коттоиа III, 112, 233, 242
— Максвелла 181, 259, 263, 266
— Фарадея 243
Ядро клетки 44, 54, 82, 83
Ядрышко 46, 55
Яйцеклетка 60, 61, 82