Author: Колесникова И.С.
Tags: заболевания дыхательной системы хирургия
ISBN: 5-255-01655-3
Year: 1988
Text
Руководство является фундаментальным трудом, обобщающим современные достижения в хирургии легких и плевры.
В книге изложены вопросы хирургической анатомии и клинической физиологии органов дыхания, знание которых необходимо в лечении больных пульмонологического профиля. Приведены подробные данные об этиологии, патогенезе, клиническом течении заболеваний легких и плевры, рассмотрены показания и противопоказания к хирургическому лечению больных, наиболее существенные детали оперативной техники. Особое внимание уделено острым гнойно-деструктивным поражениям легких, эмпиеме плевры, бронхоэктазиям, раку и другим опухолям, которые занимают в настоящее время ведущее место в структуре хирургических заболеваний дыхательной системы. Достаточно полно приводятся также сведения о других, менее часто встречающихся болезнях — врожденной патологии, паразитарных, грибковых поражениях.
Существенное место отведено в руководстве проблеме обеспечения безопасности оперативных вмешательств на легких и плевре — предоперационной подготовке больных, анестезиологическому пособию, реаниматологии, профилактике и лечению послеоперационных осложнений. •
Руководство иллюстрировано оригинальными рисунками и рентгенограммами.
Книга предназначена для хирургов, реаниматологов, терапевтов, рентгенологов и врачей других специальностей, имеющих отношение к диагностике и лечению больных хирургическими заболеваниями легких и плевры.
ХИРУРГИЯ
ЛЕГКИХ И ПЛЕВРЫ
РУКОВОДСТВО ДЛЯ ВРАЧЕЙ
Под редакцией
академика АМН СССР И. С. Колесникова
и профессора М. И. Лыткина
Ленинград «Медицина» Ленинградское отделение 1988
ББК 54.5
Х50
УДК 616.24+616.25 [-089 (035)
Рецензент: академик АМН СССР зав. кафедрой хирургии I ЛМИ им. акад. И. П. Павлова Углов Ф. Г.
Хирургия легких и плевры: Руководство для врачей / Под Х50 ред. И. С. Колесникова, М. И. Лыткина.— Л.: Медицина, 1988.— 384 с.: ил., [3] л. ил.
ISBN 5—225—01655—3
В руководстве освещены вопросы оперативной хирургии, топографической анатомии легких и плевры, а также клинической физиологии легких. Рассмотрены клиника, течение, диагностика хирургических заболеваний легких и плевры, показания к оперативному лечению, степень оперативного риска.
4113000000-048 039(00-88
174-87
ББК 54.5
ISBN 5—225—01655—3
(g Издательство «Медицина», Москва, 1988 г.
ОГЛАВЛЕНИЕ
Предисловие .................................. 6
Глава 1. Хирургическая анатомия легких (акад.
И. С. Колесников)............................... 7
Глава 2. Клиническая физиология легких и плевры (д-р мед. наук А. Л. Костюченко, канд. мед. наук
В. И. Буравцов) ................................56
Глава 3. Общие принципы обследования больных заболеваниями легких и плевры (д-р мед. наук С. А. Шалаев, д-р мед. наук А. Л. Костюченко, канд. мед. наук Б. К. Савченко, канд. мед. наук Ю. А. Попов) ...........................................80
Глава 4. Подготовка больных к операции (д-р мед. наук А. Л. Костюченко, д-р мед. наук С. А. Шалаев, д-р мед. наук Л. С. Лесницкий).................111
Глава 5. Аномалии развития легких (проф. М. И. Лыткин, канд. мед. наук Ю. А. Попов, канд. мед. наук Ю. Л. Шевченко)................................119
Глава 6. Острые абсцессы и гангрена легких (акад.
И. С. Колесников, проф. М. И. Лыткин, д-р мед. наук Л. С. Лесницкий, канд. мед. наук Б. К. Савченко) 141
Глава 7. Хронические абсцессы легких (акад.
- И. С. Колесников, проф. М. И. Лыткин, д-р мед. наук Л. С. Лесницкий)...............................172
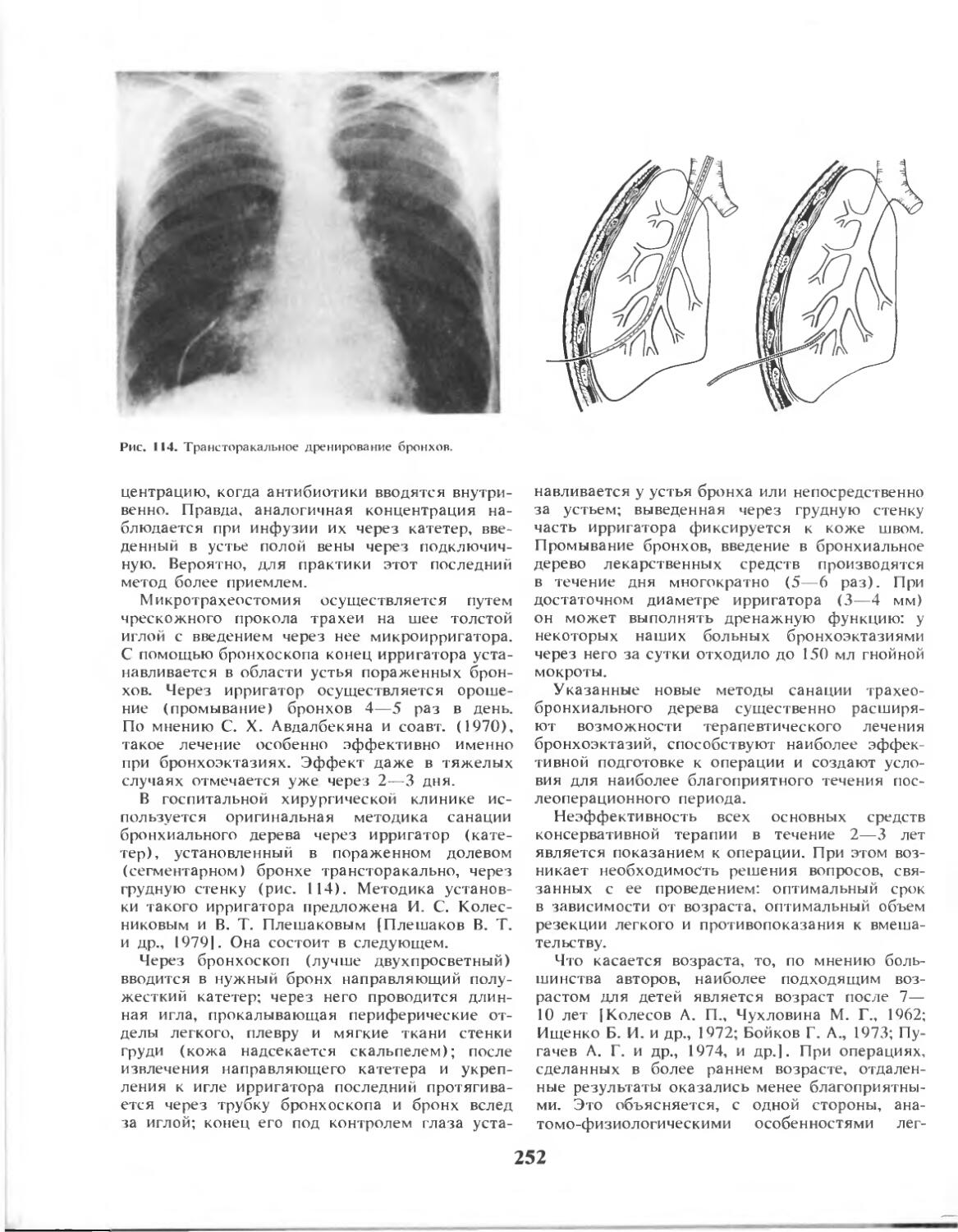
Глава 8. Острая эмпиема плевры и пиопневмото-ракс (акад. И. С. Колесников, проф. М. И. Лыткин, канд. мед. наук Г. С. Чепчерук, д-р мед. наук Л. С. Лесницкий, С. В. Гришаков)........................186
Глава 9. Хроническая эмпиема плевры и бронхиальные свищи (акад. И. С. Колесников, проф. М. И. Лыткин, канд. мед. наук Г. С. Чепчерук).......... 210
Глава 10. Опухоли плевры (проф. М. И. Лыткин, канд.
мед. наук Г. С. Чепчерук)......................228
Глава 11. Бронхоэктазии (акад. И. С. Колесников, д-р мед. наук В. Т. Плешаков, д-р мед. наук Л. С. Лесницкий) .......................................234
Глава 12. Пневмомикозы (проф. М. И. Лыткин, канд. мед. наук Ю. Л. Шевченко, канд. мед. наук И. А. Ча-лисов) ........................................255
Глава 13. Паразитарные заболевания легких (акад.
И. С. Колесников , д-р мед. наук С. А. Шалаев) . . 261
Глава 14. Рак легкого (акад. И. С. Колесников, проф.
М. И. Лыткин, д-р мед. наук С. А. Шалаев) ... 272
Глава 15. Саркома легких (проф. М. И. Лыткин) . . 303
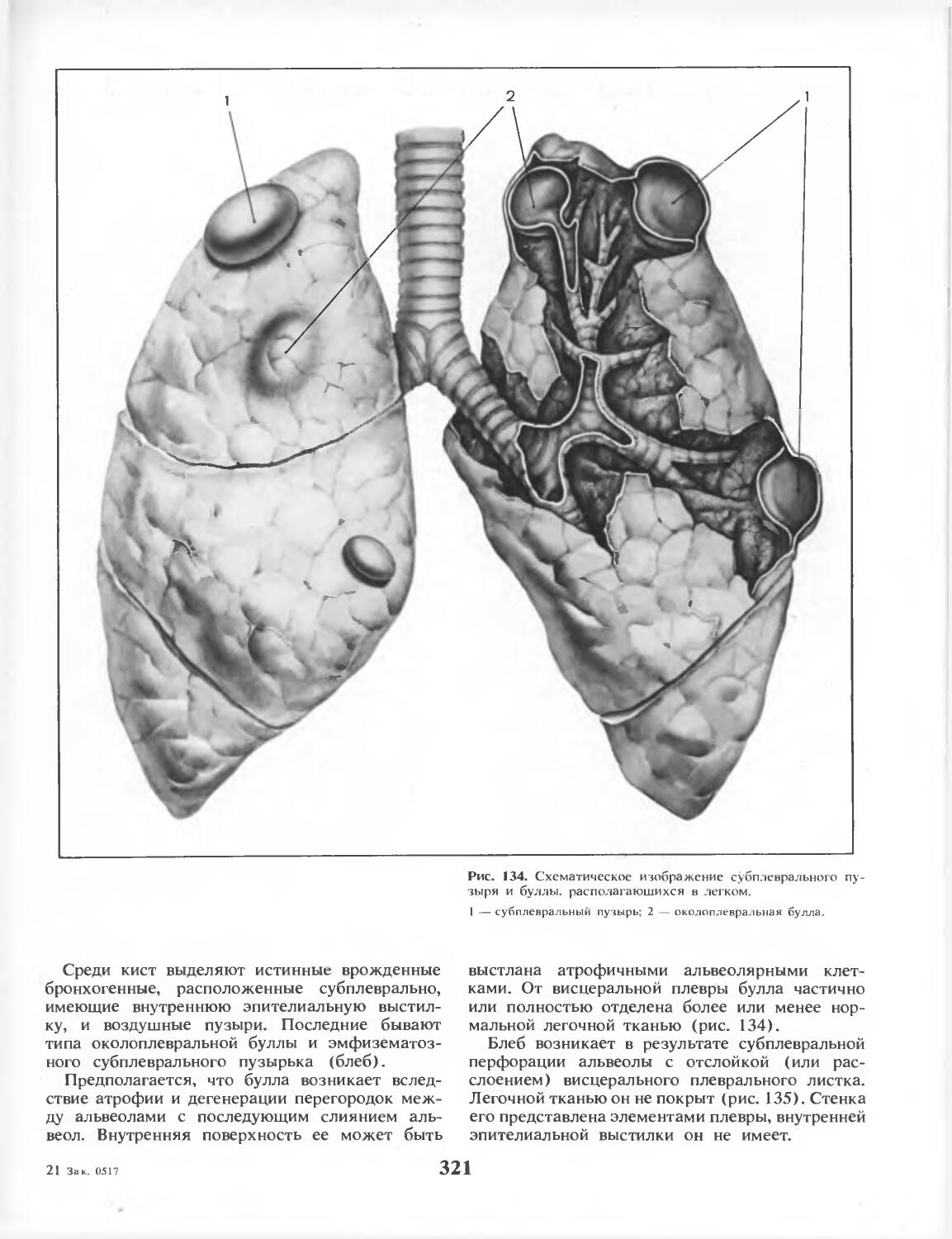
Глава 16. Доброкачественные новообразования и кисты легких (д-р мед. наук С. А. Шалаев, канд. мед.
наук С. Ф. Малахов, канд. мед. наук Б. К. Савченко) 308
Глава 17. Спонтанный пневмоторакс (акад. И. С. Колесников, д-р мед. наук В. Т. Плешаков, д-р мед. наук Л. С. Лесницкий)........................ 320
Глава 18. Обеспечение безопасности операций по поводу заболеваний легких и плевры (д-р мед. наук А. Л. Костюченко, д-р мед. наук Г. А. Ливанов, д-р мед. наук В. Т. Плешаков, канд. мед. наук М. Я. Ма-тусевич, канд. мед. наук О. И. Жуков)...............332
Глава 19. Интенсивная терапия и местное лечение больных после операций на легких и плевре (д-р мед. наук А. Л. Костюченко, канд. мед. наук В. И. Бу-
ровцов, канд. мед. наук А. Н. Тулупов)............350
Список литературы ................................ 373
CONTENTS
Preface ............................................... 6
Chapter 1. Surgical anatomy of the lungs (Academician /. 5. Kolesnikov)...................................... 7
Chapter 2. Clinical physiology of the lungs and pleura (Doctor of Medical Sciences A. L. Kostyuchenko, Candidate of Medical Sciences V. I. Buravtsov) .... 56
Chapter 3. General principles of examination of patients suffering from the lung and pleura illnesses (Doctor of Medical Sciences 5. A. Shalaev, Doctor of Medical Sciences A. L. Kostyuchenko, Candidate of Medical Sciences В. K. Savchenko, Candidate of Medical Sciences Yu. A. Popov)....................................80
Chapter 4. Preparation of the patients to operation (Doctor of Medical Sciences A. L. Kostyuchenko, Doctor of Medical Sciences 5. A. Shalaev, Doctor of Medical Sciences L. S. Lesnitsky).........................Ill
Chapter 5. Anomalies in development of the lungs (Professor M. I. Lytkin, Candidate of Medical Sciences Yu. A. Popov, Candidate of Medical Sciences Yu. L. Shevchenko) ..............................................119
Chapter 6. Acute abscesses and gangrene of the lungs (Academician /. 5. Kolesnikov, Professor M. I. Lytkin, Doctor of Medical Sciences L. S. Lesnitsky, Candidate of Medical Sciences В. K. Savchenko).....................141
Chapter 7. Chronic abscesses of the lungs (Academician /. 5. Kolesnikov, Professor M. 1. Lytkin, Doctor of Medical Sciences L. S. Lesnitsky).......................172
Chapter 8. Acute empyema of the chest and pyopneumothorax (Academician /. S'. Kolesnikov, Professor M. I. Lytkin, Candidate of Medical Sciences G. S'. Chep-cheruk. Doctor of Medical Sciences L. S. Lesnitsky, S. V. Grishakov)......................................186
Chapter 9. Chronic empyema of the chest and bronchial fistulas (Academician /. S'. Kolesnikov, Professor M. I. Lytkin, Candidate of Medical Sciences G. S'. Chep-cheruk) ..............................................210
Chapter 10. Tumors of the pleura (Professor M. 1. Lyt-
kin, Candidate of Medical Sciences G. S'. Chepcheruk) 228
Chapter 11. Bronchiectases (Academician /. S. Kolesnikov, Doctor of Medical Sciences V. T. Pleshakov, Doctor of Medical Sciences L. S. Lesnitsky)..............234
Chapter 12. Pneumomycoses (Professor M. I. Lytkin, Candidate of Medical Sciences Yu. L. Shevchenko, Candidate of Medical Sciences /. A. Chalisov) . . 255
Chapter 13. Parasitogenic diseases of the lungs (Academician /. S'. Kolesnikov, Doctor of Medical Sciences S'. A. Shalaev).......................................261
Chapter 14. Cancer of the lungs (Academician /. S. Kolesnikov, Professor M. I. Lytkin, Doctor of Medical Sciences S'. A. Shalaev)..............................272
Chapter 15. Sarcoma of the lungs (Professor M. I. Lytkin) 303
Chapter 16. Benign neoplasms and cysts of the lungs (Doctor of Medical Sciences 5. A. Shalaev, Candidate of Medical Sciences 5. F. Malakhov, Candidate of Medical Sciences В. K. Savchenko)......................308
Chapter 17. Spontaneous pneumothorax (Academician /. 5. Kolesnikov, Doctor of Medical Sciences V. T. Ple-schakov. Doctor of Medical Sciences L. S. Lesnitsky) 320 Chapter 18. How to ensure safity of operations performed in connection ’vith the lungs and pleura diseases (Doctor of Medical Sciences G. A. Livanov, Doctor of Medical Sciences A. L. Kostyuchenko, Doctor of Medical Sciences V. T. Pleshakov, Candidate of Medical Sciences M. Ya. Matusevich, Candidate of Medical Sciences О. I. Zhukov)..........._...................332
Chapter 19. Intensive therapy and local treatment of patients after operations performed in the lungs and pleura (Doctor of Medical Sciences A. L. Kostyuchenko, Candidate of Medical Sciences V. I. Buravtsov, Candi-
date of Medical Sciences A. N. Tulupov....................350
Bibliography..............................................373
5
ПРЕДИСЛОВИЕ
Хирургия легких и плевры в настоящее время перестала быть уделом отдельных крупных клиник и все шире проникает в периферийные хирургические стационары. Развитию ее в определяющей степени способствовали прогресс в анестезиологии и реаниматологии, исследования в области клинической физиологии дыхания и кровообращения, а также совершенствование методов диагностики и лечения хирургических заболеваний легких.
В основу настоящего руководства положен многолетний опыт коллектива госпитальной хирургической клиники Военно-медицинской академии им. С. М. Кирова в лечении заболеваний легких и плевры. Этот опыт убедил авторов в необходимости прочных знаний хирургической анатомии и физиологии легких и плевры в процессе как диагностики, так и лечения больных пульмонологического профиля, что нашло отражение в структуре и содержании предлагаемого руководства.
Читатель найдет в этой книге сведения об этиологии и патогенезе, описание клинической картины и особенностей диагностики, предоперационной подготовки и лечения хирургических заболеваний легких и плевры. Особенно большое внимание уделено раку легкого, абсцессам и гангрене легких, острой и хронической эмпиеме плевры. Достаточно подробно изложены также сведения о грибковых и паразитарных заболеваниях, бронхоэктазиях, спонтанном пневмотораксе, кистах легких и других более редких болезнях. На основании большого опыта коллектива клиники подробно изложены вопросы анестезиологического и реаниматологического обеспечения при операциях на легких.
При описании осложнений особое внимание уделялось анализу тех из них, которые служат наиболее частой причиной тревог и грустных размышлений хирурга и реаниматолога в послеоперационном периоде. К ним относ ятся недостаточность основных систем жизнеобеспечения — дыхания и кровообращения, тромбозы и тромбоэмболии, перфузионные и вентиляционные нарушения в оставшейся части легкого, несостоятельность культи бронха и тяжелые инфекционные осложнения.
В предлагаемом руководстве сознательно опущены главы, касающиеся травмы груди и легочных кровотечений, так как ограниченный объем издания не позволяет изложить этот раздел с должной степенью детализации. Не включено также и хирургическое лечение туберкулеза легких, ныне выделившееся в отдельную специальность — фтизиохирургию.
В изложении материала авторы стремились не только представить свой личный опыт, но и сообщить все новое и полезное из доступной им отечественной и иностранной литературы. Мы отчетливо сознаем, что не все получилось одинаково удачно и, вероятно, не все разделы представлены с такой степенью детализации, какую хотелось бы видеть читателю. Поэтому авторы будут искренне признательны за все критические замечания, которые послужат делу дальнейшего укрепления здоровья населения нашей страны.
Глава ± ХИРУРГИЧЕСКАЯ АНАТОМИЯ ЛЕГКИХ
Лечение различных заболеваний легких хирургическими методами получило в настоящее время широкое распространение. Это явилось толчком к детальному изучению анатомии легких. Появился ряд фундаментальных исследований в этом направлении и, прежде eceio, работы В. М. Сергеева (1956), Е. Boyden (1947, 1958), G. Heberer (1953), G. Cordie, C. Cabrol (1955), Д. Надь, И. Каласи (1959) и ряда других. В этих работах, а также в нашем «Руководстве по легочной хирургии» (1969) изложены систематические данные о строении легкого. К ним мы и отсылаем читателя. Нам же хотелось в этой главе изложить анатомию легких в прикладном аспекте, избегая деталей, которые не имеют большого практического значения.
Деление легкого на доли, сегменты, субсегменты и более мелкие дольки известно. Аэрация легких и кровообращение в них происходят довольно автономно.
Следует подчеркнуть определенную закономерность, относящуюся как к бронхам, так и к сосудам: чем периферичней располагается структурная единица органа дыхания, тем больше отклонений в его строении от типичного, чаще всего встречающегося. В корне легкого этих отклонений мало, их больше в корнях долей, еще больше в корнях сегментов и субсегментов. Детальное изучение анатомии легкого показало, что в бронхах такого разнообразия вариантов строения меньше, чем в артериях, а в последних меньше, чем в венах. Это — вторая закономерность. Бронхи никогда не анастомозируют друг с другом, артерии — очень редко и только самые мелкие, вены же анастомозируют чаще, чем предыдущие две системы; это — третья закономерность.
В последнее время большое внимание уделено изучению лимфатической системы легких и средостения. Эта система так же, как и описанные выше, автономна. Лимфоток идет по пути, определяемому анатомическим строением легкого. Анастомозирование этой системы еще выше, чем венозной. Имеется множество анастомозов не только между лимфатическими
сосудами ткани легкого, но и вне ее, в средостении. Это — четвертая закономерность.
Меньше внимания уделено системе бронхиальных (питательных) сосудов и еще меньше— иннервации. В частности, значение тех или иных нервов для функции отдельных структурных анатомических элементов легкого остается еще малоизвестным.
При изучении межсегментарных плоскостей в легком установлено, что у эмбриона легкое разделено на сегменты. При дальнейшем развитии плода они сливаются, остаются разделенными лишь доли. Этим объясняется нередко встречающееся у взрослых сохранение щелей и их зачатков между сегментами, которых в норме нет (например, щель между Se и пирамидой). В то же время этим процессом воссоединения следует объяснить не выраженность и даже полное отсутствие междолевых щелей (например, отсутствие главной междолевой щели в левом легком, которое нам пришлось наблюдать).
Практика показывает, что разъединение междолевых пространств при хирургических вмешательствах, как бы анатомично оно сделано ни было, для легкого (а следовательно, и для больного) — ущерб, рана. Поэтому пироговское понятие сберегательных действий не всегда будет относиться к сегментэктомиям, а тем более к субсегментэктомиям. Это следует понимать с точки зрения не только характера и распространенности патологического процесса, но и последующей реакции травмированных тканей легкого. Удаление хорошо отделенной щелями доли может быть менее травматичной операцией, чем резекция одного какого-либо сегмента, окруженного со всех сторон другими сегментами.
В результате подробного изучения строения бронхов легкого различными исследователями было предложено около 30 схем их систематизации. Однако большинство хирургов в настоящее время придерживаются номенклатуры, утвержденной международным конгрессом анатомов и гистологов в Париже (1955), согласно которой бронхи делятся дихотомически, определяя сегментарное строение легкого. Однако ряд сегментов имеет три субсегмента (рис. 1).
По этой номенклатуре бронхи долей и сегментов легкого обозначаются следующим образом:
7
Правое легкое
Верхняя доля Верхушечный (В,)
Средняя доля Задний (В2) Передний (В3) Наружный (В4)
Нижняя доля Внутренний (Вв) Верхний (В«)
Внутренний, паракардиальный (В7) Переднебазальный (В8) Наружнобазальный (В9) Заднебазальный (Вт) Левое легкое
Верхняя доля Верхушечно-задний (Bi 2)
Передний (В3)
Верхнеязычковый (В4)
Нижнеязычковый (Bs)
Нижняя доля Верхний (Be)
Переднебазальный (В8)
Наружнобазальный (В9) Заднебазальный (Вт)
Номенклатура бронхов субсегментов парижской конференции не предусмотрена. По данным литературы и нашему опыту, ее можно представить в следующем виде:
Правое легкое
Верхушечный (В|) Верхушечный (В|а) Передний (В,ь)
Задний (Вз) Задний (В2а)
Наружный (В2Ь)
Передний (Вз) Наружный (В3а)
Передний (Взь)
Наружный (В4) Задний (В4а)
Передний (В4Ь)
Внутренний (В5) Верхний (В5а)
Нижний (В5Ь)
Верхний (Be) Внутренний (В6а)
Верхний (В6Ь)
Наружный (В^)
Внутренний,
паракардиальный (В?) Передний (Б;,,)
Задний (В7Ь)
Переднебазальный (Вв) Наружный (В8а)
Базальный (В8Ь)
Наружнобазальный (В9) Наружный (В9а)
Базальный (В9Ь)
Заднебазальный (Вт) Наружный (В10а)
Внутренний (В1оь)
Левое легкое
Верхушечный (Bi) Верхушечный (В1а)
Передний (В1Ь)
Задний (В2) Верхушечный (В2а)
Задний (В2Р
Передний (Вз) Наружный (В3а)
Передний (Взь)
Верхнеязычковый (В4) Задний (В4а)
Передний (В4Ь)
Нижнеязычковый (Вв) Верхний (В5а)
Нижний (В5Ь)
Верхний (Be) Внутренний (В6а)
Верхний (В6Ь)
Наружный (В6с)
Переднебазальный (Be) Наружный (В8а)
Базальный (В8Ь)
Наружнобазальный (В9) Наружный (В9а)
Базальный (В9Ь)
Заднебазальный (Вт) Наружный (В1Га)
Внутренний (В1оь)
Номенклатура артерий, как говорилось выше, такая же, как бронхов.
Номенклатур вен много. В практическом отношении наиболее удобна номенклатура Е. Boyden (1947, 1948), предусматривающая сегментарное строение легких:
Правое легкое
Вены I сегмента (V1) Центральная вена (Vla)
Вены II сегмента (V2) Межсегментарная вена между I и III сегментами (Vlb) Межсегментарная вена между I
Вены III сегмента (V3) и II сегментами (V2a) Центральная вена (V2b) Межсегментарная вена между II и III сегментами (V2c) Центральная вена (V Ja)
Вены IV сегмента (V4) Межсегментарная вена между III и V сегментами (V3b) Центральная вена (V4a)
Вена V сегмента (V6) Межсегментарная вена между IV и V сегментами (V4b) Центральная вена (V5a)
Вены VI сегмента (V8) Межсегментарная вена между
Вены VII сегмента (V?) верхним и внутренним субсегментами (V6a) Межсегментарная вена между внутренним и наружным субсегментами (V6b) Межсегментарная вена между VI и X сегментами (V6c) Центральная вена (V7a), иногда
Вены VIII сегмента (Ve) их несколько (V7a, V7b, V7c) Межсегментарная вена между
Вена IX сегмента (V9) VII. VIII и IX сегментами <v8a) Центральные, впадающие в меж- сегментарные (Vgb, V8c) Центральная вена (V9a)
Вена X сегмента (V ю) Центральная вена (V10a)
Левое легкое Вены I (верхушечного) Центральная вена (Vla)
сегмента (V0 Вены III сегмента (V3) Межсегментарная вена между I и III сегментами (Vlb) Межсегментарная вена между I и II сегментами (Vic) Центральная вена (V3a)
Вены IV сегмента (V4) Межсегментарная вена между III и IV сегментами (V3b) Межсегментарная вена между IV
Вена V сегмента (Vs) и V сегментами (V4a) (наружная) Межсегментарная вена между IV и V сегментами (внутренняя) <v4b) Центральная вена (V5a)
Вены VI сегмента (Vs) Межсегментарная вена между
Вена VIII сегмента (V8) верхним и внутренним субсегментами (V6a) Межсегментарная вена между верхним и наружным субсегментами (V6b) Межсегментарная вена между VI и X сегментами (V6c) Центральная вена (V8)
Вена IX сегмента (V9) Центральная вена (V9)
Вена X сегмента (V ю) Центральная вена (Vm)
8
Рис. 1. Сегментарное строение бронхиального дерева.
1 —верхушечный сегментарный бронх (Bt); 2 — задний сегментарный бронх (В2); 3 — передний сегментарный бронх (Вз); 4 — наружный сегментарный бронх справа (В4) J 5 — внутренний сегментарный бронх справа (В5); 6 — верхний сегментарный бронх (Вь); 7 — медиобазальный сегментарный бронх (Вт); 8 — переднебазальный сегментарный бронх (Вв); 9 — наружнобазальный сегментарный бронх (В9); 10 — заднебазальный сегментарный бронх (Bio); 11 —верхнеязычковый сегментарный бронх слева (В4); 12 — нижнеязычковый сегментарный бронх слева (В5).
Вены базальных сегментов ввиду крайне редко возникающей необходимости в резекции их по отдельности, не приводятся Е. Boyden (1947, 1958). Они подробно представлены у G. Cordie, С. Cobrol (1955). Последними авторами показано, что венозная система сегментов средней
доли справа и язычка слева, а также базальных сегментов обоих легких построена в основном так же, как и в других сегментах, т. е. с постоянством межсегментарных и субсегментарных вен и непостоянством центральных. Однако порой возникает нужда к удалению IV (наружного)
9
сегмента средней доли справа или V (нижнего) сегмента язычка слева. В то же время изредка требуется удалить VII сегмент.
Важной особенностью строения легкого является резкое уменьшение диаметра бронхов, артерий и вен к периферии органа. Эта зона мелких и мельчайших бронхов в различных участках легкого неодинакова по расстоянию от висцеральной плевры. В паракостальных и диафрагмальных участках она достигает 3—4 и даже 5 см; в медиастинальных, междолевых и ближе к корню толщина этой зоны может уменьшаться до 1 см и даже менее. Знание глубины зоны расположения мелких и мельчайших бронхов, а также сосудов на тех или иных участках легкого важно для проведения атипичных краевых и клиновидных его резекций.
В отличие от артерий и вен малого круга кровообращения, о которых говорилось выше, обеспечивающих в основном функцию газообмена при дыхании, в легких имеется самостоятельная система сосудов большого круга кровообращения, называемых бронхиальными сосудами. Они несут в основном функцию «питания» и обмена в тканях органа. Этой системе в последние годы придается большое значение, в частности потому, что после перевязки артерий малого круга кровообращения наблюдается резкое увеличение бронхиальных артерий.
Примером может служить один из наших больных (В.), обследованный через 27 лет после операции по поводу гангренозного абсцесса верхней доли правого легкого, которому вначале была сделана пневмотомия. Через месяц после этой операции из-за аррозионного кровотечения в крайне тяжелом состоянии при экстренном повторном вмешательстве успели перевязать лишь общий ствол артерии легкого. Больной выздоровел без дополнительных операций. За все последующее время не болел, был работоспособным. В клинику приехал для очередного обследования. На рентгенограмме видна ложная киста верхней доли правого легкого. На ангиограмме легочной артерии отчетливо обозначается культя главного ствола правой легочной артерии, а ангиограмма бронхиальных артерий указывает на извитость и резкое расширение бронхиальной артерии в зоне этой кисты (рис. 2).
Подобные наблюдения указывают на тесную связь обеих систем кровообращения в легком. Более глубокое изучение функциональной значимости бронхиальных сосудов как анатомической, так и функциональной — дело будущих исследований.
Лимфатическая система легких представлена поверхностными лимфатическими сосудами плевры и глубокими, внутрилегочными лимфатическими сосудами. Поверхностная лимфатическая сеть состоит из крупных петель, соответствующих контурам оснований долек легкого и мелких петель, располагающихся на поверхности оснований долек. Степень развития поверхностной лимфатической сети, форма и раз
меры лимфатических капилляров находятся в прямой зависимости от функциональной активности различных отделов легкого. В области менее вентилируемых сегментов легкого (верхушечного, заднего, верхнезадней части переднего и латерального базальных сегментов) лимфатические капилляры выражены слабее, а в области нижних долей, на диафрагмальной поверхности легких, петлистость поверхностной лимфатической сети всегда выражена хорошо, представлена широкими, петлистыми сосудами.
Истоки глубокой лимфатической системы легких представлены лимфатическими капиллярами, расположенными вокруг респираторных и терминальных бронхиол, в межлобулярных перегородках, слизистой оболочке бронхов.
Обе сети лимфатических капилляров (поверхностная и глубокая) широко анастомозируют между собой, и поэтому деление лимфатической системы легких на поверхностную и глубокую весьма условно. Связи между ними хорошо развиты как на периферии, так и у корня легких. Соединяясь между собой, лимфатические капилляры образуют лимфатические сосуды, направляющиеся к корню легкого. Вместе с лимфатическими узлами многочисленные лимфатические сосуды формируют основные лимфатические коллекторы легких, по которым происходит регионарный ток лимфы. Все лимфатические узлы, принимающие лимфу от различных отделов легких, условно распределяют в несколько основных групп: внутрилегочные, корневые, медиастинальные и надключичные; последние являются завершающим этапом тока лимфы от легких перед поступлением ее в венозную систему (рис. 3).
Внутрилегочные (бронхопульмональные) лимфатические узлы располагаются по ходу сегментарных и долевых бронхов и сосудов, а также под плеврой — между долями легких. Основная масса внутрилегочных лимфатических узлов располагается у места деления главных, долевых и сегментарных бронхов в клетчатке между бронхами и ветвями легочной артерии и вены. В практическом отношении важным является выделение групп внутрилегочных лимфатических узлов в основании каждого из долевых бронхов, а также междолевых (верхних и нижних — для правого легкого, междолевых — в левом легком).
Корневые лимфатические узлы располагаются в области корней правого и левого легких. Граница между внутрилегочными и корневыми лимфатическими узлами регионарных лимфатических коллекторов легких условна. Принято считать, что ею является плоскость, мысленно проведенная через ворота легкого. Другим признаком такого разделения может являться отношение лимфатических узлов к легочной ткани:
10
Рис. 2. Рентгенологическая картина через 27 лет после перевязки легочной артерии справа.
а -— обзорная рентгенограмма; б — бронхограмма; в — ангиопуль-монограмма; г — селективная ангиограмма бронхиальных артерий.
если она со всех сторон окружает лимфатический узел, то он относится к внутрилегочным, если узел или группа узлов лишь частично прикрыта легким, то к корневым. По отношению к элементам корня легкого последние делят на верхние, нижние, передние и задние. Обычно лучше выражены и представлены большим числом передняя и верхняя корневые группы узлов регионарных лимфатических коллекторов. Нижние корневые лимфатические узлы без четкой границы переходят в лимфатические узлы легочных связок.
Медиастинальные лимфатические узлы, принимающие лимфу от легких, наиболее многочисленны и располагаются в клетчаточных пространствах средостения. Здесь выделяют передние, задние и трахеальные группы лимфоузлов.
В свою очередь, в каждой из этих групп различают лимфатические узлы, принимающие лимфу преимущественно из правого или левого легкого.
На передней поверхности верхней полой вены и отчасти — правой плечеголовной вены рас-
11
Рис. 3. Расположение основных групп узлов регионарных лимфатических коллекторов легких.
Внутрилегочные: 1 — верхнедолевые; 2 — среднедолевые; 3 — нижнедолевые; 4 — верхние междолевые правые; 5 — нижние междолевые правые; 6 — междолевые левые. Корневые: 7 —
правые; 8 — левые; 9 — легочных связок. Медиастинальные: 10 — трахеобронхиальные; 11 — паратрахеальные; 12 — бифуркационные; 13 — претрахеальные; 14 — преаортокаротидные; 15 — превенозные; 16 — околопищеводные. Надключичные: 17 — глубокие яремные (нижние, средние, верхние); 18 — по ходу поперечной артерии шеи; 19 — по ходу добавочного нерва.
12
полагаются лимфатические узлы, объединяемые в правую переднюю медиастинальную или превенозную группу.
Слева, на передней поверхности дуги аорты, начинаясь несколько ниже, близ артериальной связки, и достигая основания левой сонной артерии, группируются левые передние медиастинальные или преаортокаротидные лимфатические узлы.
Среди них нередко выделяют один, наиболее крупный лимфатический узел, именуемый «узлом боталлова протока». Последний прилежит к нижней гортанной ветви левого блуждающего нерва, восходящей вдоль трахеи к мышцам левой половины гортани.
Непостоянно выражены в переднем средостении лимфатические узлы поперечной цепи, располагающиеся вдоль левой плечеголовной вены, и преперикардиальные — вдоль диафрагмального нерва.
В заднем средостении основная масса лимфатических узлов лежит вдоль пищевода — передней и боковых его поверхностей. Самые нижние из околопищеводных лимфатических узлов могут достигать пищеводного отверстия диафрагмы.
Трахеальная группа медиастинальных лимфатических узлов наиболее многочисленна и расположена у трахеи и начальных отделов правого и левого главных бронхов.
В клетчаточном пространстве, ограниченном нижними полуокружностями правого и левого главных бронхов, сзади — пищеводом, спереди — перикардом левого предсердия, постоянно находятся бифуркационные лимфатические узлы.
Как правило, они группируются вдоль правого главного бронха, располагаясь, в основном, на его внутренней поверхности.
Выше, на передней поверхности трахеи, в виде своеобразного «мостика» встречаются претра-хеальные лимфатические узлы. Они связаны многочисленными лимфатическими сосудами с лимфатическими узлами боковых поверхностей трахеи.
Вдоль задней поверхности трахеи, ее мембранозной части, непостоянно выделяют ретротра-хеальные лимфатические узлы. Правые трахеобронхиальные лимфатические узлы занимают клетчаточное пространство, ограниченное углом трахеи с правым главным бронхом и выше — между боковой поверхностью трахеи и медиастинальной плеврой. Условной границей между ними и вышележащими правыми паратрахеаль-ными лимфатическими узлами является место впадения непарной вены в верхнюю полую. Нередко расположенный здесь один из крупных лимфатических узлов именуют «узлом непарной вены».
Верхней границей правых паратрахеальных лимфатических узлов является проходящий здесь плечеголовной артериальный ствол у места отхождения правой подключичной артерии. Многочисленные лимфатические сосуды от правых паратрахеальных лимфатических узлов направляются далее вверх — к надключичному отделу регионарных коллекторов.
Левая трахеобронхиальная группа лимфатических узлов ограничена боковой поверхностью трахеи и левым главным бронхом, сзади — дугой аорты, снаружи — артериальной связкой. По направлению вверх, вдоль трахеи они переходят в немногочисленную группу левых паратрахеальных лимфатических узлов, имеющих связь с лимфатическими узлами, расположенными в глубоких клетчаточных пространствах левой половины шеи.
На шее передние пре- и паратрахеальные лимфатические узлы прилежат непосредственно к трахее. Глубокие боковые лимфатические узлы шеи, принимающие часть лимфы от легких, наиболее многочисленны и занимают главным образом область надключичных клетчаточных пространств, органиченных фасциальными футлярами.
Глубокие лимфатические узлы боковых поверхностей шеи справа и слева подразделяются на внутренние и наружные. Внутренние расположены вдоль яремной вены от уровня сосцевидного отростка до места ее слияния с подключичной веной. Эту группу узлов именуют внутренними яремными. Нижние из них наиболее многочисленны, являются связующим звеном с лимфатическими коллекторами средостения и нередко называются надключичными. Среди лимфатических узлов этой группы выделяют один узел, именуемый «узлом Труазье» [Troisier, 1889]. Он довольно крупный, занимает место слияния внутренней яремной вены с подключичной.
Наружные глубокие лимфатические узлы менее многочисленны. Их подразделяют по анатомическим образованиям этой области, вдоль которых они группируются, и соответственно именуют лимфатическими узлами добавочного нерва и поперечной артерии шеи.
Выносящие лимфатические сосуды принимают участие в формировании правого лимфатического протока и грудного лимфатического протока, впадающих в венозную систему.
Физиологическое состояние лимфатической системы и отводящих лимфатических коллекторов легких определяет регионарный отток лимфы. В нормальных условиях от различных отделов легких лимфа направляется к регионарным для них группам лимфатических узлов, несмотря на существование обширных связей в лимфатической системе этого органа.
13
По существующим представлениям, легочная долька и сегмент не являются основными структурными единицами для лимфатической системы легкого: от рядом расположенных сегментов лимфа поступает в одни группы лимфатических узлов и даже в отдельные лимфатические узлы. Лишь в отношении каждой из долей легкого наиболее полно и строго выдерживается принцип регионарного оттока лимфы. Движение лимфы в легких ориентировано в направлении от дистальных отделов к корню. Пройдя эти группы лимфатических узлов в пределах медиастинальной части регионарных коллекторов, лимфа движется главным образом по сосудам одноименной правому или левому легкому стороны в восходящем направлении. Ток лимфы вниз, к забрюшинным лимфатическим узлам, расценивается как дополнительный, встречающийся менее чем в 10 % наблюдений [Hoffman A., Jiinemann L., 1968].
Следуя по регионарным коллекторам от каждой из долей легкого, лимфа последовательно проходит через внутрилегочные, корневые, медиастинальные, надключичные группы лимфатических узлов. Согласно «закону Москаньи» [Moccagni R., 1787], все лимфатические сосуды на пути от органа до венозной системы проходят по крайней мере один лимфатический узел. Важно, что для легкого такой лимфатический узел или группа узлов могут располагаться на разном удалении от истоков: нередко лишь в пределах средостения. Имеются сведения о том, что отдельные лимфатические сосуды легких на всем протяжении до кровеносной системы не имеют ни одного лимфатического узла. Последнее может существенно влиять на распространение патологического процесса в легком.
В общем виде ток лимфы от каждой из долей легкого в нормальных условиях выглядит следующим образом.
Верхняя доля правого легкого. Наиболее постоянны два пути:
1) переднемедиальный (внутренний) —через внутрилегочные, междолевые верхние, корневые, правые трахеобронхиальные, паратра-хеальные, превенозные и правые надключичные лимфатические узлы;
2) заднелатеральный (наружный) — через верхнедолевые, верхние междолевые к задней и нижней группам корневых и далее вверх через правые трахеобронхиальные или бифуркационные лимфатические узлы в надключичную область.
Средняя доля правого легкого. Лимфа поступает через среднедолевые и верхние междолевые внутрилегочные лимфатические узлы к корневым, правым трахеобронхиальным и бифуркационным лимфатическим узлам.
Нижняя доля правого легкого. Формируются два пути оттока лимфы:
1) верхний — через нижнедолевые, нижние междолевые, корневые группы узлов — к трахеобронхиальным и далее вверх;
2) нижний путь тока лимфы — через нижнедолевые, нижние корневые к бифуркационным, претрахеальным, правым трахеобронхиальным, правым паратрахеальным — к надключичным.
Верхняя доля левого легкого. Имеются два пути оттока лимфы:
1) верхний — через верхнедолевые, верхние корневые к преаортокаротидным лимфатическим узлам и далее в левые надключичные;
2) нижний — преимущественно от язычковых сегментов — через верхнедолевые, междолевые, бифуркационные к левым трахеобронхиальным, преаортокаротидным и далее вверх.
Нижняя доля левого легкого. Известны три основных направления оттока лимфы. Верхний и средний из них проходят через нижнедолевые, междолевые, корневые к преаортокаротидным и левым трахеобронхиальным группам лимфатических узлов.
Нижний путь регионарного тока — через нижнедолевые, междолевые (или их минуя), нижние корневые, узлы левой легочной связки, к околопищеводным и бифуркационным, а затем — через левые трахеобронхиальные и пре-аортокаротидные — в надключичные и далее к грудному протоку.
Многочисленные связи в лимфатических коллекторах средостения (в том числе — поперечные), установленные методом наливок при проведении морфологических исследований, равно как и коллатерали, в нормальных условиях, при отсутствии патологических изменений в лимфатических коллекторах, находятся в состоянии функционального покоя, «включаясь» лишь при возникновении препятствия или особенно интенсивного движения лимфы, при которых регионарные коллекторы не в состоянии обеспечить отток лимфы от отдельных участков легкого.
Легкие иннервируются из симпатических нервных стволов и из блуждающего нерва. Нервы проходят в корень легкого иидут сначала позади главных бронхов, у их мембранозной части и далее, сопровождая их, до мельчайших разветвлений. Считается доказанным, что в нервных стволах как чревного нерва, так и симпатической цепочки проходят смешанные волокна симпатического и парасимпатического действия. Однако данных о влиянии тех или иных нервных стволов на различное функционирование легочной ткани, бронхов, сосудов, по сути, нет. Практическая зависимость пересечений их неясна.
14
Рис. 4. Границы сегментов правого легкого (вид с внутренней стороны).
Верхняя доля: 1 — верхушечный; 2 — задний; 3 — передний. Средняя доля: 4 — наружный; 5 — внутренний. Нижняя доля: 6 — верхний; 7 — внутренний (паракардиальный); 8 — переднебазальный; 9 — наружнобазальный; 10 — заднебазальный.
15
Рис. 5. Границы сегментов правого легкого (вид с наружной стороны).
Верхняя доля: 1 — верхушечный; 2 — задний; 3 — передний. Средняя доля: 4 — наружный; 5 — внутренний. Нижняя доля: 6 — верхний; 7 — переднебазальный; 8 — наружнобазальный; 9 — заднеб а зал ьн ый.
16
Рис. 6. Границы сегментов левого легкого (вид с наружной стороны).
Верхняя доля: 1,2 — верхушечнозадний; 3 — передний; 4 — верхнеязычковый; 5 — нижнеязычковый. Нижняя доля: 6 — верхний; 7 — переднебазальный; 8 — наружнобазальный; 9 — заднебазальный.
2 Зак. 0517
17
I
Рис. 7. Границы сегментов левого легкого (вид с внутренней стороны).
Верхняя доля: 1,2 — верхушечнозадний; 3 — передний; 4 — верхнеязычковый; 5 — иижнеязычковый. Нижняя доля: 6 — верхний; 7 — переднебазальный; 8 — наружнобазальный; 9 — заднебазальный.
Хирурга прежде всего интересует строение корней органа в целом, его долей и сегментов, а также анатомические ориентиры, позволяющие возможно точно разделить легкое по межсегментарным плоскостям. Следует отметить,
что эти плоскости имеют довольно сложную конфигурацию (рис. 4—7) и разделение их, конечно, происходит довольно грубо. Чем лучше знание границ сегментов, тем меньше ущерб легкому при их разделении.
18
ПРАВОЕ ЛЕГКОЕ
КОРЕНЬ ПРАВОГО ЛЕГКОГО
После вскрытия грудной полости по четвертому или пятому межреберью, в зависимости от намечаемого характера вмешательства, хирург обнаруживает медиастинальную поверхность легкого и средостения. Отчетливо видны верхняя полая вена, латеральная поверхность предсердия и желудочка, диафрагмальный нерв с сосудами перикарда и диафрагма.
Дорсально и выше корня легкого справа в полую вену впадает непарная вена, делящаяся к периферии на1 две ветви: верхнюю и нижнюю. Непарная вена собирает кровь из межреберных вен правой стороны. Корень правого легкого находится каудальнее непарной вены и прикрывается со всех сторон плеврой и корневой фасцией под ней. После вскрытия плевры и фасции, что лучше делать на месте переходной складки плевры корня с плеврой, покрывающей средостение, первой обнаруживается верхняя легочная вена. Она нередко частично покрывает легочную артерию, лежащую дорсальнее и крани-альнее вены. При препаровке вены следует помнить, что на месте прохождения ее в полость перикарда она «увлекает» его за собой, образуя муфту. При неосторожных манипуляциях хирурга эта муфта может быть повреждена и полость перикарда напрасно вскрыта.
Нередко верхняя (краниальная) часть верхней легочной вены довольно плотно сращена с легочной артерией, и выделить ее, не повреждая артерии, можно лишь препарируя вену с нижней (каудальной) и задней ее поверхностей. Сращения не всегда являются следствием воспалительного процесса, чаще — это вариант нормального развития. Корневая фасция, перекидываясь с вены на артерии, довольно прочно их спаивает. Не так редко вена заднего (II) сегмента соединяется с общим стволом верхней легочной вены у самого средостения, при так называемом заднем типе венозного оттока. В этих случаях выделение вены грозит повреждением ее. Выделять верхнюю легочную вену нужно, сдвинув медиально перикардиальную муфту, т. е. как можно ближе к сердцу, а в трудных условиях — даже внутриперикардиально.
Верхняя легочная вена образуется из трех истоков: верхнего — вены III (переднего) сегмента и частично верхушечного, заднего — вены II сегмента и частично субсегментарной ветви I сегмента и нижнего — среднедолевой вены.
Следует отметить, что среднедолевая вена может не оказаться на месте, где она чаще всего вливается в верхнюю легочную вену. В этих случаях V4iJ впадает либо в нижнюю легоч
ную вену, либо самостоятельным стволом — в левое предсердие. Это можно выяснить лишь препаровкой корня легкого вниз (каудальнее). Опаснее дистальное слияние средней долевой вены с общим стволом верхней легочной. Перевязка последней в таких случаях нарушает венозный отток из средней доли. При удалении только верхней доли правого легкого перевязка V41J в таких случаях может привести либо к напрасному удалению средней доли (если ошибка замечена во время операции), либо к тяжелым осложнениям (болезни средней доли) после операции.
Нижняя легочная вена собирает кровь из нижней доли. Иногда, как указывалось выше, в нее вливается V4iJ; тогда кровь собирается и из средней доли.
Нижняя легочная вена расположена ниже и кзади от верхней легочной вены. Кзади (дорсально) и медиальнее от нее проходят нижняя ветвь непарной вены, блуждающий нерв и еще медиальнее — пищевод.
Выделение нижней легочной вены не представляет большой трудности. Исключение участия в ее формировании среднедолевой вены обеспечивается прослеживанием основного ствола к периферии.
Обычно нижняя легочная вена образуется тремя истоками: Ve, идущей сзади и снаружи, минуя среднюю долю, верхней базальной веной (У7 и V8), идущей спереди вниз и латеральней этой последней, и нижней базальной веной (Vg и Vio), идущей снизу и снаружи. Отклонения от этого типичного расположения легочных вен встречаются очень редко. Все же следует указать на одно из них: раннее слияние вен в один мощный ствол. Препаровка такой общей вены к периферии позволяет установить эту особенность и избежать ошибки.
Ниже (каудальнее) вен легкое связано со средостением легочной связкой, представляющей два листка плевры с клетчаткой между ними и лимфатическими узлами, лежащими по наружной поверхности пищевода. Эта связка должна быть разъединена тупо или остро (с перевязкой ее элементов). При врожденной аномалии развития и образовании участков нижней или средней доли, снабжаемых кровью из большого круга кровообращения, в легочной связке могут проходить довольно крупные артериальные стволы, идущие непосредственно от аорты. При неосторожном рассечении легочной связки эти артерии могут быть пересечены, и их центральные концы тогда уходят глубоко в средостение, давая большое кровотечение.
Легочная артерия лежит выше и кзади от верхней легочной вены. Спереди артерия прикрыта верхней полой веной, частично, как указывалось, верхней легочной веной, а краниальнее ее, сни-
2*
19
Рис. 8. Сосуды корня правого легкого из полости перикарда.
зу вверх, идет непарная вена, впадающая в верхнюю полую вену. Тут же локализуется и лимфатический узел, называемый «узлом непарной вены». Нередко он резко увеличен (при метастазе рака, гнойном лимфадените), плотно спаян с артерией. Это затрудняет выделение артерии. Кроме того, к нижней ее поверхности прилежит нередко плотно сращенный с ней верхний междолевой лимфатический узел. В этих случаях выделение легочной артерии затруднено не только из-за наличия сращения ее с патологически измененными лимфатическими узлами, но и вследствие изменения стенки артерии. Эти изменения в стенке артерии, как правило, больше выражены к периферии и меньше — к центральной части ее. Поэтому препарирование легочных артерий в подобных случаях следует вести ближе к средостению, сместив полую вену медиально и отпрепарировав вначале перикард внутрь, к сердцу.
1 — легочная артерия; 2 — верхняя легочная вена; 3 — нижняя легочная вена; 4 — ушко сердца; 5 — верхняя полая вена; 6 — V. azygos.
Следует иметь в виду, что метастаз рака в тот или иной лимфатический узел и сращение его с легочной артерией не указывают еще на прорастание ее раковой опухолью. В большинстве случаев это свидетельствует лишь о развитии параканкрозных воспалительйых и дегенеративных изменений вокруг лимфатического узла. Это подтверждается свободным отделением артерии от измененных лимфатических узлов.
Главный бронх правого легкого, отойдя от трахеи, направляется вниз, кнаружи и несколько кзади, располагаясь кзади от легочной артерии, плотно прилегая к ней. Он служит как бы продолжением трахеи. Снизу (каудально) бронх граничит с клетчаткой и бифуркационными лимфатическими узлами, сзади (дорсально) — с пищеводом; сверху его огибает непарная вена. К периферии он делится на верхнедолевой и промежуточный бронхи. Между ними находится верхний междолевой лимфатический узел.
20
Выделение главного бронха правого легкого не представляет обычно большой трудности.
Следует помнить одну особенность — отхождение сегментарного верхушечного бронха (В,) выше места бифуркации, непосредственно от трахеи. Таких случаев в практике клиники встретилось два.
Внутриперикардиально препарировать элементы корня легкого приходится в тех случаях, когда вне перикарда имеются метастазы рака или грубые воспалительные изменения в лимфатических узлах корня, не позволяющие свободно выделить сосуды легкого без риска повреждения их. В то же время характер поражения легкого дает возможность сделать предположение об операбельности больного.
Вскрывается перикард кзади от диафрагмального нерва, как можно ближе к передней поверхности верхней легочной вены. В полости перикарда сверху обнаруживается легочная артерия. Она направляется поперечно, чуть вверх. Ниже нее строго поперечно идет верхняя легочная вена, а еще ниже — нижняя (рис. 8). Все сосуды корня легкого в полости перикарда лежат, как правило, мезоперикар-диально, будучи окутаны перикардом неполно, иногда образуя складку двух листков перикарда по задней поверхности сосудов (по типу брыжейки). Выделение сосудов тупым способом в случае полного окутывания их листками перикарда не представляет больших затруднений. Если же сосуды расположены таким образом, что 1 /4 или даже 1 /з их на задней поверхности оказывается лежащей вне перикарда, то разделение одного листка перикарда, прохождение инструментом по задней поверхности сосуда, а затем — второго листка довольно затруднительны и опасны. О том, как обезопасить этот этап препаровки сосудов, будет указано ниже. Анатомической особенностью расположения сосудов корня легкого в полости перикарда является образование углублений его между сосудами: верхнее и нижнее углубление (reces-sus) легочной артерии и такие же углубления около вен.
ДОЛИ ПРАВОГО ЛЕГКОГО
ВЕРХНЯЯ ДОЛЯ
ПРАВОГО ЛЕГКОГО
Доступ к корню верхней доли правого легкого — переднебоковой, через четвертое межреберье. Первой видна верхняя легочная вена. Для выделения и препаровки артерий верхней доли вена может быть взята на провизорную лигатуру (без вены средней доли) и смещена книзу или перевязана и пересечена. Перевязка вены без обработки артерии не приводит, как
правило, к застою в верхней доле, что доказывается достаточностью венозных анастомозов между венами верхней доли с венами средней (Vs) и нижней (Vc) долей.
При выделении верхней легочной вены следует, как указывалось выше, проследить за отхождением V•>, помня о том, что иногда она вливается в общий ствол близко у перикарда. В то же время тщательная препаровка истоков верхней легочной вены может обнаружить особенности впадения в нее вены средней доли. Это предупредит перевязку вен верхней и средней долей. Случаи впадения в верхнюю легочную вену У7 в хирургической практике встречаются очень редко.
Для выделения артерий верхней доли следует сначала отпрепарировать общий ствол правой легочной артерии. Она, покинув полость перикарда, отдает ветвь в виде мощного ствола, отходящего от передней поверхности ее и называемого передним или верхним стволом легочной артерии. Этот ствол снабжает кровью верхушечный (Si) и передний (S3) сегменты. После отхождения переднего ствола артерия уходит вниз и кзади и называется междолевым стволом. Задний сегмент снабжается кровью в большинстве случаев (80—90 %) по артерии, отходящей от междолевого ствола и идущей позади верхнедолевого бронха, на месте разделения его на верхний и промежуточный бронхи. Эта артерия может в сложных анатомических условиях служить при выделении верхнедолевого бронха ориентиром разделения бронхов. Здесь же локализуется верхний междолевой лимфатический узел.
Нередко верхушечный и передний сегменты снабжаются кровью самостоятельными ветвями легочной артерии, т. е. вместо одного, крупного, переднего ствола отходят две артерии — А| и Аз, т. е., отпрепарировав артерию, отходящую вперед от основного ствола, но имеющую диаметр, не соответствующий калибру переднего ствола (0,8—1,2 см), следует искать вторую артерию, обычно отходящую от боковой поверхности основного ствола (А|). Если оказывается, что этот последний имеет диаметр, значительно больший, чем предыдущая артерия (Аз), то это должно указывать хирургу, что периферичней от нее и кзади будет отходить ветвь к заднему сегменту или субсегменту. В этих случаях рекуррентной артерии, отходящей от междолевого ствола, либо не будет совсем, либо она будет небольшой, субсегментарной.
В случаях, когда имеется особенность развития с отхождением сегментарного или субсегментарного бронха от трахеи, его, как правило, сопровождает и артерия, отходящая от ствола правой легочной артерии у выхода из полости перикарда.
21
Рис. 9. Центральная вена (V3a) является ориентиром между передним (S3) и внутренним (Ss) сегментами правого легкого.
Бронх верхней доли правого легкого лучше всего препарируется после перевязки и пересечения вен и артерий этой доли. При небольших патологических изменениях в корне доли или паренхиме легкого выделение бронха нетрудно. Однако чаще всего при удалении верхней доли по поводу опухоли в ней, метастазов в лимфатических узлах корня доли и легкого, а также при воспалительных изменениях в тканях вокруг бронха определение и выделение его могут представить большие трудности. В определении места отхождения верхнедолевого бронха от главного может, как говорилось выше, помочь направление рекуррентной Аг. Вторым важным признаком является прослеживание пальцем сзади за ходом хрящевых колец: если идти к периферии, отчетливо определяет
ся место разделения главного бронха на верхнедолевой и промежуточный. Наконец, третьим признаком является место расположения верхнего междолевого лимфатического узла.
Передний сегмент верхней доли имеет широкую взаимосвязь с S5 средней доли. Разделение их по межсегментарной плоскости возможно, если ориентироваться на проходящую почти под плеврой со стороны средостения V3c (рис. 9) и на поперечную междолевую щель. Поперечная междолевая щель никогда не отделяет S3 от S5 полностью, но довольно часто бывает недостаточно глубокой. При отсутствии или при недоразвитии ее, т. е. при почти полном слиянии S3 и S5, разделение их следует вести, ориентируясь по ходу межсегментарной вены (V3c). Однако в ряде случаев целесообразней
22
Рис. 10. Истоки верхней легочной вены правого легкого.
произвести верхнюю билобэктомию, чем разъединять два сегмента, потеряв четкую границу между ними. Разъединение легочной перемычки между S2 и Se не представляет трудностей, так как в ней нет сколько-нибудь значительных сосудистых образований.
СРЕДНЯЯ ДОЛЯ
ПРАВОГО ЛЕГКОГО
При препаровке корня правого легкого спереди, из переднебокового разреза, сделанного по четвертому межреберью, из элементов корня средней доли обнаруживается прежде всего среднедолевая вена. Она, как указывалось выше, чаще впадает одним или двумя стволами в верхнюю легочную вену, реже — в нижнюю и совсем
редко — в левое предсердие самостоятельным стволом. Иногда вена одного сегмента (Vs) впадает в верхнюю легочную вену, а вена другого сегмента (V4) — в нижнюю.
Спереди от вены и ниже ее имеются небольшое количество жировой клетчатки и один или двд лимфатических узла, принимающих лимфу как от средней, так и от верхней (S3) долей. Их увеличение и особенно наличие метастазов рака затрудняют препаровку вены, а иногда указывают на широкое распространение опухолевого процесса, требующего удаления всего легкого. Среднедолевая вена имеет своими истоками две сегментарные вены (V4 и V5). V4 является межсегментарной веной между IV и V сегментами, a V5 — центральной веной V сегмента (рис. 10).
23
Рис. 11. Раздельное отхождение артерий средней доли (А^ и Аз) от междолевого артериального ствола.
Вторым элементом, требующим препаровки до разделения межсегментарной щели, является среднедолевая артерия. Ее лучше всего препарировать из главной междолевой щели. Плевра вскрывается ближе к месту соединения косой и поперечной щелей. Верхняя доля отводится вверх, средняя — кпереди, задняя — книзу и кнаружи. Препарируется междолевой ствол легочной артерии (от Аг до А44.5). Первой ветвью, отходящей от передней поверхности междолевого ствола, является А4 5. Она направляется вверх и кнаружи и вскоре делится на две ветви. Иногда она отходит двумя стволами (рис. 11).
Другие варианты, которых не так много, большого практического значения не имеют.
Бронх средней доли отходит от промежуточного бронха, от передненаружной его поверхности, и направляется вверх и наружу. Длина его варьирует от 0,5 до 3 см. Далее он делится на два сегментарных бронха: В4 и В5. В5 аэрирует внутренний (V) сегмент средней доли, В4 — наружный (IV) сегмент. Его препарируют спереди, после перевязки и пересечения V4, 5.
У места отхождения с ре дне до левого бронха расположен нижний междолевой лимфатический узел, собирающий лимфу как из средней, так и из нижней долей. Увеличение его с развитием в нем рубцовой ткани и карнификации может вести к сдавлению мембранозной части среднедолевого бронха и ателектазу доли.
24
Межсегментарная поверхность у средней доли имеется лишь между S5 и S3. Ориентиром для разделения ее, как это изложено выше, является V3c. Ею же следует руководствоваться при препаровке в случае рудиментарной поперечной щели.
нижняя доля
ПРАВОГО ЛЕГКОГО
Препаровку корня нижней доли правого легкого следует вести из переднебокового доступа через пятое межреберье, со стороны средостенной щели. Здесь обнаруживается нижняя легочная вена, собирающая кровь только из нижней доли (о случаях слияния ее со среднедолевой или только с V4 указывалось выше). Препаровка вены связана с рассечением легочной связки и обнажением параэзофагеальных лимфатических узлов и наружной стенки пищевода.
Артерия нижней доли является продолжением междолевого ствола. Ее легче всего обнаружить в главной междолевой щели, сместив верхнюю долю вверх, оттянув среднюю вперед и медиально, а нижнюю оттеснив вниз и кнаружи. Под плеврой у места отхождения средне-долевого бронха локализуется, как это уже сообщалось, нижний междолевой лимфатический узел. Здесь же отходит среднедолевая артерия. После этого артерия считается нижнедолевой. Несколько периферичней в половине случаев отходит артерия верхнего (VI) сегмента нижней доли. Не так уж редко Ag отходит на одном уровне со среднедолевой артерией и даже выше ее. Часто отпрепарировать эту развилку артерий не позволяет увеличенный нижний междолевой лимфатический узел. В этих случаях следует сначала осторожно выделить узел и только после этого препарировать артерию с ее ветвями. Далее, при типичном делении артерии, от ее передней поверхности отходит артерия паракардиального сегмента (А7), а ниже — переднебазальная артерия (А8); затем артерия делится на два ствола: А9 и А)0 (рис. 12). Нередко при рассыпном типе ветвления артерии после отхождения Ag базальная артерия сразу делится на все или почти на все свои сегментарные ветви (А7, А8, А9 и Аю). При необходимости перевязать нижнедолевую артерию приходится перевязывать и пересекать все сегментарные артерии по отдельности либо группами — А(„ Aj, в и А.д io-
Бронх нижней доли правого легкого начинается ниже отхождения от промежуточного ствола среднедолевого бронха. Типично периферичней кзади и кнаружи отходит бронх верхнего (VI) сегмента (Bg). Bg, как правило, отходит на одном уровне со среднедолевым бронхом, а
иногда — выше его. Для точного ориентирования при препаровке нижнедолевого бронха важно найти вначале место отхождения среднедолевого бронха, а затем Bg. В дальнейшем, препарируя базальный бронх к периферии, находят отходящий от передней поверхности базального бронха В? и тем убеждаются в полноте выделения нижнедолевого бронха.
СЕГМЕНТЫ ПРАВОГО ЛЕГКОГО
В верхней доле правого легкого чаще всего удаляются задний (II) и верхушечный (I) сегменты. Редко резецируется передний (III) сегмент. При туберкулезе легкого часто удаляются I и II сегменты вместе, производится бисегмент-эктомия. Поэтому целесообразно рассмотреть анатомию корней всех трех сегментов верхней доли правого легкого.
ВЕРХУШЕЧНЫЙ (I) СЕГМЕНТ
ПРАВОГО ЛЕГКОГО
При переднебоковом доступе через четвертое межреберье, препарируя легкое по медиастинальной поверхности, первой, как и при препаровке корня легкого, встречается верхняя легочная вена с ее двумя истоками. Верхний исток образуется центральной веной (Vi). Она расположена в верхнем отделе верхней легочной вены и слагается из двух ветвей V,a и Уц (рис. 13). Обе эти ветви межсегментарные, расположенные между Si и S2; в межсегментарной плоскости между S, и S3 проходит ветвь от V3 — V3b. Часто, однако, верхний исток (Vi) у места деления верхней легочной вены отсутствует и Vi вливается в V2 позади бронха (задний отток). Этот вариант, с точки зрения хирургической, неопасен, так как при удалении верхушечного сегмента в этих случаях Vi выделяется и перевязывается последней. Зон, лишенных венозного оттока, не остается.
Редко встречающийся (5 %) передний тип венозного оттока может быть опасным в хирургическом отношении. В этих случаях V2 «исчезает» со своего места. В нижней части легочной вены (адней сегментарной вены не обнаруживается. Она вливается в верхушечную вену, образуя необычно мощный ствол верхнего истока (рис. 14). Перевязка ее при удалении верхушечного сегмента грозит затруднением оттока крови из заднего сегмента, его болезнью в послеоперационном периоде.
Вариантом, требующим большого внимания хирурга, являются также раннее слияние Vi и V3 и впадение их общего ствола в верхнюю легочную вену. Перевязка и пересечение этого общего ствола могут привести к затруднению оттока крови из S3.
25
Рис. 12. Ветвление артерий и вен нижней доли правого легкого.
26
Рис. 13. Вены верхушечного сегмента правого легкого спереди.
1 —артерия верхушечного сегмента (Ai); 2 — артерия переднего сегмента (Аз); 3 — вена верхушечного сегмеита; 4 — центральная вена (Vla); 5 — межсегментарная вена между верхушечным и передним сегментами (VjB ); 6 — вена заднего сегмента (Vj).
Перевязка и пересечение Vi позволяют перейти к препаровке артерий сегмента.
Кзади и краниально от верхней легочной вены локализуются артерии верхней доли, в том числе и верхушечная (Ai).
Передний ствол в типичных случаях делится на две ветви: Ai и Аз. Аг отходит от междолевого ствола легочной артерии в виде одной или двух так называемых рекуррентных артерий. Артерия верхушечного сегмента в дальнейшем делится на две ветви, которые и направляются к обоим субсегментам. Однако часто этот верхний ствол (Ai) несет кровь не только к верхушечному сегменту, но и ко всему задне
му сегменту или одному из субсегментов его. Это, как правило, может быть распознано по калибру этой артерии.
Обычно Ai и Аз, отходящие от переднего ствола, одинаковы по диаметру. Имея в виду, что Аз довольно стабильна, от нее очень редко отходят ветви к другим сегментам, она может считаться как бы эталоном определения диаметра и для других артерий. В случае слияния Ai и Аг (или одной из субсегментарных артерий заднего сегмента) верхушечная артерия оказывается более мощной по сравнению с Аз-Следовательно, при удалении Si она должна отпрепарироваться вглубь легочной паренхи-
27
Рис. 14. Вариант «полного» венозного оттока верхней доли правого легкого.
мы на 0,5—1 см, и здесь обнаружится отходящая от нее кзади ветвь &.>. Перевязывать и пересекать А| в этих случаях надо периферичней отхождения Аг- Следует указать, что ошибки, т. е. перевязка А[, 2 у ее устья, нарушают, конечно, функцию S2 или одного из его субсегментов, но не приводят к каким-либо тяжелым послеоперационным осложнениям.
После идентификации, перевязки и пересечения артерии верхушечного сегмента кзади от переднего ствола легочной артерии определяется верхнедолевой бронх. Он делится на 3 сегментарные ветви: В|, В2 и Вз. Верхушечный сегментарный бронх (В,) находится кзади и краниально от места отхождения переднего сегментарного бронха, направляется вверх и несколько кнаружи. В дальнейшем он делится на две субсегментарные ветви (В1а и Вц,).
Верхушечный сегмент (Si) широко взаимосвязан с S2 и S3. Межсегментарные плоскости между этими сегментами хотя неправильной формы, но все совершенно четкие. Связь между сегментами рыхлая, легко разъединяемая. В межсегментарной плоек сти и между Si и S2 проходит V2a, а в плоскости между Si и S3 собирает кровь Vib.
ЗАДНИЙ (II) СЕГМЕНТ
ВЕРХНЕЙ ДОЛИ ПРАВОГО ЛЕГКОГО
Корень заднего (II) сегмента как из переднебокового, так и бокового доступов отпрепарировать труднее, чем корень Si. При препаровке корня легкого верхняя легочная вена встречается и выделяется первой. Вена заднего протока наибольшая из всех протоков верхней легочной вены. Она собирает кровь порой не только из So, но и из других сегментов верхней доли и даже из S6. При типичном оттоке крови из верхней доли задняя вена образуется из слияния следующих венозных стволов: межсегментарной вены между S, и So — V2a, центральной вены S2 — V2b и межсегментарной вены между So и S3 — V2c. Часто в нее впадают небольшие вены из S3 (в 60 % случаев) и из Sfi (в 5—10 %).
Межсегментарная вена V2a, собирающая кровь из S, и So, расположена субплеврально спереди и хорошо видна. Она служит ориентиром при препаровке межсегментарной плоскости. V2 вливается в общий ствол задней вены позади бронха II сегмента (рис. 15). Ее перевязывать не следует из-за большого числа и довольно значительных притоков к ней из переднего остающегося сегмента. Центральная вена — V2b — при типичном, наиболее частом ветвлении проходит вдоль бронха и артерии и вливается вблизи от устья V2a, т. е. позади долевого бронха, вблизи и кпереди отхождения В2. Межсегментарная вена — V2c — собирает кровь из S2 и Si и вливается в уже объединенную вену V2a и V2b медиальней их. После этого образуется общий ствол V2. Он впадает в этих случаях в общий ствол верхней легочной вены по его задней поверхности.
При другом варианте, так называемом заднем типе ветвления, в верхнюю легочную вену впадает вена двух сегментов — S, и S2. Только после слияния этих вен в образовавшийся общий ствол впадает межсегментарная вена между S, и S2 — V2a. Через междолевую щель также можно отпрепарировать основной ствол V2. V2a и V2c, являясь межсегментарными венами, могут быть ориентиром при разделении сегментов по их межсегментарным плоскостям.
Сверять правильность определения вариантов ветвления вен при удалении заднего сегмента возможно прежде всего выделением верхней легочной вены, прослеживанием ее истоков к периферии, а также распрепарировав корень верхней доли через поперечную междолевую щель.
Рис. 15. Истоки вены II сегмента (V2) верхней доли правого легкого.
28
29
Рис. 17. Вариант раздельного отхождения артерий верхушечного (А|), заднего (Аг) и переднего (А3) сегментов.
Рис. 16. Частный вариант кровоснабжения заднего (S?) сегмента общим отхождением передней (А,) и задней (Аз) сегментарных артерий.
Задний сегмент в большинстве случаев снабжается кровью из малого круга кровообращения через артериальный ствол, выходящий из междолевой артерии (так называемой рекуррентной артерии). Она обнаруживается путем препаровки легочной артерии. Артерия, отдав передний ствол, далее идет вниз и кнаружи. Этот ствол называется междолевым. От переднего, или, как его называют, иногда, верхнего, ствола отходят артерия переднего сегмента Аз, идущая вверх и наружу, и артерия верхушечного сегмента А,. Иногда от А, и ее субсегментарной ветви отходит небольшой ствол ко второму сегменту S2.
Наряду с этим вариантом ветвления легочной артерии, существуют и другие.
Вторым вариантом по частоте является отхождение от переднего ствола крупной артерии — до 1,2 см в диаметре, являющейся объединенным стволом А, и Аг. От этого общего ствола отходят сначала верхушечная артерия — А, и две ее ветви — А1а и А1в, а затем кзади и кнаружи — Аг. Реже Аг отходит от одной из субсегментарных артерий S|. Направление и диаметр могут подсказать, является ли это
стволом или часть крови идет в S2 через рекуррентную артерию (рис. 16).
Третьим и самым редким вариантом ветвления артерии является отхождение от переднего (верхнего) ствола легочной артерии трех самостоятельных сегментарных артерий: Aj, Аг и Аз. Тогда рекуррентной артерии нет (рис. 17). Хирург при препаровке переднего ствола легочной артерии, увидев ветвление его на две одинаковые артерии диаметром примерно около 0,5— 0,9 см, может с уверенностью утверждать, что S2 снабжается кровью из междолевого ствола, и найдет Аг отходящей от него вскоре (0,5— 1 см) от его начала. Аг имеет направление кзади и кнаружи, под верхнедолевой бронх у места отхождения от главного. Если же от переднего ствола отходит одна артерия диаметром примерно 0,6—0,8 см, а вторая оказывается калибром вдвое большим, это означает, что Аг отходит от этого крупного ствола и рекуррентной артерии либо нет. либо она очень маленькая. Когда от переднего ствола отходят три почти равные по калибру артерии и одна из них направляется книзу и кнаружи, это свидетельствует, что она представляет собой часть Аг.
30
Наряду с этими методами идентификации артерий, наиболее верными являются препаровка того или иного ствола к периферии и прослеживание его направления.
В корне II сегмента при препаровке его из переднебокового доступа бронх встречается последним, т. е. он расположен кзади и несколько краниальней от вен и артерий. Верхнедолевой бронх в большей части случаев делится на три сегментарных бронха: В|, В2 и В3. Задний сегментарный бронх отходит кзади и кнаружи, и, как у других сегментарных бронхов, калибр его колеблется от 0,7 до 1,2 см, длина — от 0,3 до 1,5 см. Далее он делится на две субсегментарные ветви.
Однако, наряду с таким типичным делением и отхождением В2, существуют и другие варианты деления. Долевой бронх иногда образует не трифуркацию, а бифуркацию. Происходит объединение сегментарных бронхов. Bi объединяется с В2 или В2 — с В3. При этом объединенный бронх всегда имеет калибр, вдвое больший, чем обычный сегментарный бронх. Окончательное определение варианта возможно лишь при препаровке увеличенного в диаметре бронха к периферии. Отходящий от него кзади и кнаружи бронх и будет являться В2. Наконец, в самых затруднительных случаях идентификация бронха может быть получена пережатием его мягким зажимом и раздуванием легкого. Ателектаз типичного для S2 участка легкого будет служить несомненным доказательством такого варианта строения.
S2 имеет широкую межсегментарную связь с Si и S3. С верхним сегментом (Sb) нижней доли легочная перемычка сохраняется ближе к корню легкого. Это соединение редко бывает значительным, трудностей при разъединении S2 и Se обычно не бывает. В этой плоскости иногда проходит небольшая вена Vx2a или Vx6a.
Плоскость между S2 и S< довольно обширна. Межсегментарная вена V2a проходит глубоко, со стороны плевры она не видна. Поэтому препаровку и прослеживание V2a можно проводить только после перевязки и пересечения У2Ь, А2 и обработки бронха. Прослеживая V2a( препарируют тем самым межсегментарную плоскость.
То же самое следует сказать и про препаровку V2c, идущей между S2 и S3.
ПЕРЕДНИЙ (III) СЕГМЕНТ
ВЕРХНЕЙ ДОЛИ ПРАВОГО ЛЕГКОГО
Корень переднего сегмента лучше всего препарируется спереди, из переднебокового доступа.
После обнаружения и препаровки верхней легочной вены, как указывалось выше, видно впадение в нее в типичных, чаще всего встречаю
щихся случаях, вен всех трех сегментов. Вена переднего сегмента наиболее стабильна. Она находится ниже (каудальнее) от Vi и V2. Вена верхушечного сегмента (Vi) находится выше всех, a V2 — посредине между Vi и V3 (рис. 18). Самым нижним истоком верхней легочной вены является вена средней доли (V4 S). При препаровке V3 к периферии вскоре обнаруживается деление ее на две ветви: V3a и V3b. V3b является межсегментарной между S3 и S5. Она расположена на поверхности почти под плеврой. V,a является центральной веной S3 и собирает кровь из ткани переднего сегмента между его субсегментами. Между S3 и S4, если существует легочная перемычка между ними (при невыраженное™ поперечной щели), находится V3c, впадающая либо в общий ствол V3, либо в субсегментарную ветвь V]. Чаще же всего при достаточной выраженности поперечной щели этой вены нет.
Для того, чтобы увидеть артерию переднего сегмента (А3), следует отпрепарировать передний ствол легочной артерии и отодвинуть книзу верхнюю легочную вену. Нижняя ветвь переднего ствола и является Аз. Она имеет длину примерно 1,4 см, диаметр — 0,7 см (рис. 19) и делится на две субсегментарные ветви: А3а и Азь, как правило, сопутствующие соответствующим бронхам.
Бронх переднего сегмента (В3) открывается при препаровке спереди лишь после перевязки и пересечения V3 и А3, смещения переднего ствола вверх (краниально), а верхней легочной вены — вниз (каудально). При этом в глубине виден верхнедолевой бронх с отходящим от него бронхом переднего сегмента (рис. 20). Он редко варьирует, делясь сразу на субсегментарные бронхи.
Варианты деления субсегментарных бронхов встречаются не так уж редко. Иногда от одного из субсегментарных бронхов может отходить субсегментарный бронх к Si, реже — к S2. Выявление этих вариантов, очень важных с хирургической точки зрения, возможно при пережатии мягким зажимом В3 и раздувании легкого. Зона ателектаза (при знании примерных границ сегмента), распространяющаяся на соседние сегменты, может указать на тот или иной вариант ветвления. Это может быть обнаружено и при препаровке субсегментарных бронхов к периферии. Обычно отхождение субсегментарных бронхов соседних сегментов происходит не далее 0,5—1 см, максимум 1,5 см, от места деления сегментарного бронха на субсегментарные.
Межсегментарные плоскости между S3 и S5 обозначаются, кроме зоны ателектаза после пересечения В3, часто видимой поверхностно расположенной межсегментарной веной V3b.
31
Рис. 18. Формирование вены Ill сегмента.
Между Si и Sv межсегментарные вены (Vla и V3c) находятся в глубине легочной ткани, и их можно обнаружить только после отделения сегментов, т. е. после полной обработки корня легкого. Тогда делается видным направление Vib и V3c. Препарируя их, постепенно обнаруживают межсегментарную плоскость. Вены, идущие из S3, перевязывают. Стволы Vib и V3c по возможности оставляют не перевязанными.
ВЕРХУШЕЧНЫЙ (S1) И ЗАДНИЙ (S2)
СЕГМЕНТЫ ПРАВОГО ЛЕГКОГО
Удаление Si —|— S2 имеет ряд особенностей, что заставляет изложить строение этих двух сегментов отдельно. Повторение необходимо,
исключая некоторые детали строения сегментов, которые излагались выше.
Обнажение корня двух сегментов при переднебоковом доступе начинается с препаровки вен Sj. При этом, изолируя Vi, нужно отпрепарировать два ее истока — Vja и Vib- Vja может быть перевязана и пересечена. Vib следует иметь ориентиром при препаровке межсегментарной плоскости между Si и S3 (рис. 21).
После этого препарируются передний ствол легочной артерии и ее верхняя ветвь — А|. Часто (см. калибр ее) от нее отходит и Аг. В тех случаях, когда Ai имеет обычный для сегментарной артерии диаметр (0,3—0,6 см), Аг следует искать отходящей от междолевого ствола (рекуррентная артерия).
32
Рис. 19. Препаровка сосудов корня верхней доли правого легкого.
Рис. 20. Препаровка переднего сегментарного бронха (Вз) правого легкого.
3 Зак. 0517
33
Рис. 21- Вены верхней доли правого легкого.
34
Перевязка А, 2 и пересечение ее позволяют легко отпрепарировать бронх. Первым стволом, отходящим в верхней части верхнего долевого бронха, является В,. Иногда от него вскоре отходит и В2. Однако чаще всего В2 отходит самостоятельно. Его можно отпрепарировать спереди, с медиастинальной плоскости, обработав сначала В|. После пересечения В| снизу делается легкодоступным для препаровки и В2. Удобно также препарировать В2 и В| в обратном порядке из междолевой главной щели. Из междолевой щели легко препарировать и V2. В нее вливаются V2a — центральная вена заднего сегмента — и V2b — вена между S2 и S3. Межсегментарные плоскости между S, и S2 препарируются в соответствии с вышесказанным.
НАРУЖНЫЙ (IV) СЕГМЕНТ
СРЕДНЕЙ ДОЛИ ПРАВОГО ЛЕГКОГО
При препаровке корня S4 спереди первой обнаруживается верхняя легочная вена, нижним истоком которой является среднедолевая вена. Обычно вблизи устья V2 определяются два ее истока: V5 и V4. Вена внутреннего (V) сегмента вливается в общий ствол V2 медиальней и выше, а устье V4 расположено несколько ниже и кнаружи. Чтобы не ошибиться, следует V 4 взять на провизорную лигатуру. Вена наружного сегмента является одновременно и межсегментарной веной между S4 и S5.
Артерию IV сегмента (А4) лучше всего препарировать из главной (косой) междолевой щели. После разведения ее, при поднятой вперед и вверх средней доле, смещении верхней доли краниально и оттягивании нижней доли книзу и наружу следует рассечь плевру, удалить нижний междолевой лимфатический узел, выделить первую нижнедолевую артерию. Кверху от нее отходит среднедолевая артерия (А4 5). Вскоре она делится на два ствола — А4 и А5. Направление А4 определяет ее принадлежность. Эта ветвь артерии перевязывается и пересекается (рис. 22).
Здесь же обнаруживается и среднедолевой бронх с делением его на В4 и В5. Иногда они отходят двумя отдельными стволами. Выделение и обработка бронха наружного сегмента средней доли возможны как со стороны междолевой щели, так и спереди, с медиастинальной поверхности. При последнем методе требуется сначала перевязать и пересечь V4, взятую ранее на провизорную лигатуру, а затем обработать В4. Он, так же как и V4, определяет направление к наружному сегменту. Препаровка элементов корня легкого к периферии позволяет избежать ошибки и не нанести ущерб оставляемому S5.
ВЕРХНИЙ (VI) СЕГМЕНТ
НИЖНЕЙ ДОЛИ ПРАВОГО ЛЕГКОГО
Корень верхнего сегмента лучше всего обнаруживается после широкого разведения главной (косой) междолевой щели. Для этого верхнюю и среднюю доли приподнимают вверх и кпереди, а нижнюю — низводят вниз и кнаружи. У места слияния косой и поперечной щелей и находится корень VI сегмента. После рассечения плевры и удаления нижнего междолевого лимфатического узла первым обнаруживается артериальный ствол с отходящей кзади и кнаружи Аб. Несколько выше отходит А4 s. Ниже места отхождения А6 препарируются базальные сегментарные артерии. А(| довольно постоянна, диаметр ее колеблется от 1,1 до 2,2 мм, длина до ветвления на субсегментарные артерии равна 0,5—1,5 см. Варианты отхождения ее от основного ствола по отношению к устью среднедолевой артерии указаны выше.
Далее, как правило, Ас делится на три ветви: Аба, Абь и Абс Они идут к внутреннему, верхнему и наружному субсегментам.
Однако нужно отметить варианты, имеющие хирургическое значение. Иногда от междолевого ствола легочной артерии одной довольно мощной ветвью отходит А2+6. Вскоре он ветвится. Одна из ветвей направляется вверх, в оттянутую туда верхнюю долю, вторая — кзади и вниз, к Sb. Перевязывать этот общий (А2 6) ствол не следует.
Встречается вариант ветвления, когда субсегментарные артерии Sb отходят самостоятельно, без слияния в общий ствол Аб.
После выделения, идентификации артерий, перевязки и пересечения их препарируется бронх.
Вб постоянен, отходит от задненаружной поверхности нижнедолевого бронха. Диаметр его колеблется от 0,8 до 1,2 см. Длина до деления на субсегментарные бронхи равна 0,2— 1,2 см. Так же как и артерия, бронх может отходить либо ниже отхождения В4 5, либо на одном уровне и даже выше уровня среднедолевого бронха.
Однако направление бронха книзу и кнаружи и расположение под артерией указывают на то, что препарируется именно Вв- Редким, но в хирургическом отношении важным вариантом является отхождение к VI сегменту от основного ствола нижнедолевого бронха раздельно двух и даже трех бронхов. Обработка их должна производиться раздельно.
Вена верхнего (VI) сегмента нижней доли правого легкого может быть отпрепарирована либо через междолевую щель, либо спереди через медиастинальную плоскость. В первом случае культю артерии (Ав) и бронха (BR) следует от-
3*
35
Рис. 22. Выделение артерий средней доли (А< и As) и VI сегмента (As) правого легкого.
1 —артерия наружного сегмента (А,); 2 — артерия внутреннего сегмента (АО; 3 — бронх средней доли (В4 5).
вести книзу и кнаружи, тогда откроется Ve, вливающаяся верхним истоком в нижнюю легочную вену. Она вскоре делится на V6a, V6b и V 6с. V6a — межсегментарная вена, расположенная между верхним и внутренним субсегментами. V6b — также межсегментарная, расположенная между наружным и верхним субсегментами. V6c — межсегментарная вена, собирающая кровь из Se и базальных сегментов. Первые две вены могут быть легко перевязаны и пересечены. V6c нужно сохранить как ориентир при препаровке межсегментарной плоскости между Se и базальными сегментами.
При препарировании вен спереди находят сначала нижнюю легочную вену. Она имеет три истока: Ve, верхнюю базальную вену (V7, Ve) и нижнюю базальную вену (Ve, V10). Ve представляет собой самый верхний исток. При препаровке ее к периферии выявляются все ее ветви, в том числе V6c.
Препарируя V6c, разделяют межсегментарную плоскость между Se и базальными сегментами. Вверху Se нередко имеет довольно широкую легочную перемычку с S2, особенно в медиальной их части. В этих случаях кровь из обоих сегментов собирает V2c. В редких случаях V6a
36
и V6b впадают одним или двумя стволами через легочную перемычку между S2 и Se во вторую вену. В этих случаях разделение межсегментарной плоскости должно производиться осторожно, чтобы не повредить или не перевязать мощный ствол V2. Это грозит застоем крови в S2.
ВНУТРЕННИЙ (ПАРАКАРДИАЛЬНЫЙ) СЕГМЕНТ НИЖНЕЙ ДОЛИ ПРАВОГО ЛЕГКОГО
Корень паракардиального (внутреннего) сегмента следует препарировать спереди, через переднебоковой доступ по пятому межреберью. Парамедиастинально препарируется вначале нижняя легочная вена. Выделяется ее верхний
Рис. 23. Выделение и обработка артерий и бронха VII сег-мента.
базальный исток (V? + V8). Эта вена берется на провизорную лигатуру, затем раскрывается главная междолевая щель.
Так же как и при препаровке корня верхнего (VI) сегмента, в верхней части щели рассекается плевра, удаляется нижний междолевой лимфатический узел (если он увеличен и мешает препаровке артерии) и выделяется нижнедолевая артерия у места ее ветвления на А4, А5 и А6. Препарируя артериальный ствол далее, к периферии, первой с медиальной поверхности базальной артерии отходит А7. Ее длина равна 0,3—0,7 см, диаметр — 0,3—0,6 см. Эта артерия вскоре делится на две субсегментарные артерии.
37
Рис. 24. Ветвление базальной артерии правого легкого (Д7, Ag, Ач и А[п).
1 — артерия средней доли; 2 — артерия верхнего сегмента (Аг,); 3 — медиобазальная сегментарная артерия (А7); 4 — переднебазальная сегментарная артерия (Ак); 5 — наружнобазальная сегментарная артерия (Ач): 6—заднебазальная сегментарная артерия (А|0); 7 — бронх верхнего сегмента (В6); 8 — заднебазальный бронх (Ви,); 9 — передне- и наружнобазальный сегментарные бронхи (Be, 9).
Под артерией локализуется бронх паракар-диального сегмента, выделение которого облегчается после перевязки и пересечения А? (рис. 23).
Вт отходит от нижнедолевого бронха, отступя на 0,5—1,2 см от места отхождения Вб, и вскоре делится на два субсегментарных бронха.
Обработка бронха и пересечение его открывают доступ к вене сегмента. Вена VII сегмента вливается в большинстве случаев в верхнебазальный ствол. Однако нередко она двумя самостоятельными ветвями вливается и в верхнюю, и в нижнюю базальные вены. Их легко идентифицировать, прослеживая в направлении сегмента.
Межсегментарной веной между Sy и базальными сегментами является V,o, т. е. все вены VII сегмента могут быть без ущерба перевязаны и пересечены.
БАЗАЛЬНЫЕ СЕГМЕНТЫ
НИЖНЕЙ ДОЛИ ПРАВОГО ЛЕГКОГО
Корни базальных сегментов (S7, S8, Sq и Sm) препарируются так же, как и корни Se и Sy, т. е. из переднебокового доступа по пятому межреберью.
Вначале целесообразно выделить нижнюю легочную вену и ее притоки: Ve, верхнюю и нижнюю базальные вены.
38
Рис. 25. Отделение базальных сегментов от VI сегмента правого легкого
После этого широко раскрывается главная (косая) междолевая щель. Препарируется нижнедолевая артерия. Нужно обязательно выделить А6 и А4 5. Периферичней этих артерий открывается ствол базальных сегментов. В этом можно убедиться также при препаровке артерии. Первой внутрь и книзу отходит А?, второй вперед и книзу — Ав. Далее артериальный ствол делится на ветви, идущие к девятому и десятому сегментам — Аэ и Ащ (рис. 24).
1 —культя базального бронха (В7 8 g 10 ); 2 — культя артериального ствола сегментов базальной пирамиды; 3 — вена между верхним и внутренним субсегментами (V6a).
Для препаровки базальных вен в междолевой щели необходимо не только перевязать и пересечь базальную артерию и бронх, но и разделить легочную связку. Тогда открываются нижняя легочная вена и ее три истока — Ve, верхняя и нижняя базальные вены. Это можно сделать и с медиастинальной стороны.
Межсегментарная поверхность между базальными сегментами и Se, как указывалось выше, разделяется, ориентируясь на V6a (рис. 25).
39
ЛЕВОЕ ЛЕГКОЕ
Строение корня левого легкого отличается от правого. Вблизи корня левого легкого расположены такие образования, как аорта, разветвление общей легочной артерии на правый и левый ее стволы; нередко наблюдается раннее слияние легочных вен. Редко, но все же встречается незаращенный артериальный (боталлов) проток. Под аорту уходит вблизи артериального протока, ответвляясь от блуждающего нерва, возвратная ветвь его, иннервирующая левую половину гортани. Поэтому препаровка корня левого легкого представляет ряд особенностей.
КОРЕНЬ ЛЕВОГО ЛЕГКОГО
При переднебоковом доступе по четвертому межреберью на средостенной поверхности видны диафрагмальный нерв с перикардо-диафрагмальными сосудами и блуждающий нерв. Иногда видна возвратная его ветвь, отходящая от него медиально и огибающая дугу аорты у аортальной связки. Отчетливо видны дуга аорты и отходящая от нее подключичная артерия, корень легкого.
При препаровке корня следует рассечь плевру, субплевральную фасцию и клетчатку под ней. Первой обнажается верхняя легочная вена. В нее сверху, почти у перикарда, впадает вена верхушечного и заднего сегментов (Vj 2), идущая вверх и несколько кнаружи, перекрывая поперечно легочную артерию и ее ветви (рис. 26—28). Вблизи устья V1>2 обнаруживаются V3 и V4>5.
Краниально и несколько кзади от легочной вены находится левая легочная артерия. Артерия вскоре после выхода ее из полости перикарда отдает общий ствол Alt 2, идущий вверх и несколько кнаружи. Второй артерией, отходящей здесь же, у устья А, 2, является артерия переднего (III) сегмента (Аз). После этого так называемый междолевой ствол направляется назад, огибая левый главный бронх. При препаровке легочной артерии в сторону средостения встречается прежде всего лимфатический узел — первый узел корня легкого, собирающий лимфу из верхней зоны его. За ним, медиаль-ней, препарируется артериальная связка — заращенный артериальный проток. Поэтому узел получил название «узла боталловой связки» (по аналогии с лимфатическим узлом непарной вены справа). Важным элементом корня легкого, требующим специальной препаровки, является возвратная ветвь блуждающего нерва. Для обнаружения ее необходимо рассечь плевру средостения по ходу этого нерва. Препарируя осторожно тупфером нерв, удается на передней поверхности дуги аорты увидеть отхо
дящий от него медиально ствол нижнего гортанного нерва. Он, как указывалось выше, огибает аорту у аортальной связки и уходит вверх. Повреждение его ведет к параличу левой голосовой складки, потере голоса и нарушению кашля. При препаровке левой легочной артерии к периферии обнаруживается первой А, 2. Она уходит вверх и кнаружи и несколько дорсально, направляясь к верхушечному сегменту. Часто (в 80—90 %) вскоре от нее отходит ствол кзади и кнаружи; это — А2.
Второй ветвью, отходящей от основного ствола левой легочной артерии, является Аз. Она направляется вперед и кнаружи, к переднему сегменту. Изредка спереди от легочной артерии отходит третий ствол и направляется вниз и наружу к язычковым сегментам. Это А4 s (или только А4). После этого легочная артерия, как указывалось выше, направляется вниз, огибая главный левый бронх.
Ниже и несколько кзади от верхней легочной вены обнаруживается нижняя легочная вена с ее истоками от сегментов нижней доли.
Под верхней легочной веной и ниже (каудаль-нее) артерии находится главный бронх левого легкого. Он вскоре по выходе из средостения делится на две ветви — верхнедолевой и нижнедолевой бронхи. Под бронхом, в клетчатке, локализующейся на мембранозной части его, проходят бронхиальные сосуды и нервы. Кзади (дорсально) при препаровке по направлению к средостению под бронхом сверху вниз идут пищевод и блуждающий нерв по латеральной поверхности последнего.
Часто, особенно при далеко зашедших формах рака легкого, с метастазами в лимфатические узлы корня, для определения возможности удаления легкого, требуется ориентироваться в полости перикарда.
Перикард вскрывается кзади (дорсально) от диафрагмального нерва. В полости перикарда видна левая легочная артерия, сливающаяся с правым стволом. Верхняя легочная вена находится ниже, направляется поперечно и вливается в левое предсердие. Еще ниже обнаруживается нижняя легочная вена. Так же как и справа, сосуды легкого располагаются мезопе-рикардиально. Здесь также имеются углубления перикарда, отмеченные выше, при описании правой стороны (рис. 29).
Такое расположение сосудов легкого слева требует особой осторожности в выделении их. Надо иметь в виду прежде всего близость общего ствола легочной артерии. Поэтому при выделении левой легочной артерии диссектором может быть повреждено место отхождения правой легочной артерии или захвачен в лигатуру общий ствол ее, т. е. центральней места отхождения правой легочной артерии. При незара-
40
Рис. 26. Анатомическое взаимоотношение элементов корня верхней доли правого легкого.
1 — бронх; 2 — артерия; 3 — вена.
41
Рис. 27. Вены верхней доли левого легкого.
1 — верхняя легочная вена; 2 — нижняя легочная вена; 3 — легочная артерия.
42
Рис. 28. Артерии левого легкого.
43
Рис. 29. Сосуды корня левого легкого из полости перикарда. 1 — легочная артерия; 2 — верхняя легочная вена; 3 — нижняя легочная вена; 4 — ушко сердца.
щенном артериальном протоке, что встречается очень редко, имеется отчетливое увеличение диаметра левой легочной артерии, видно усиление пульсации, прослеживается пульсирующий кровоток.
Верхняя легочная вена внутри полости перикарда проходит также мезоперикардиально. Между артерией и веной в перикарде образуется углубление (recessus) с заворотами выше и ниже вены. У предсердия вена часто лежит свободно. Здесь легче обойти ее инструментом и лигировать.
Нижняя легочная вена в полости перикарда находится почти на одном уровне с верхней, располагаясь чуть ниже последней. Ее отно
шение к перикарду такое же, как и верхней легочной вены.
Иногда вены, прежде чем войти в левое предсердие, сливаются вместе. Это происходит либо в полости перикарда, либо вне его, что не только создает трудности в выделении массивного общего венозного ствола, но также опасно при наложении лигатуры из-за прорезывания стенки сосуда. Лучше в этих случаях общий венозный ствол обеих вен прошивать прошивателем ушка сердца.
При внутриперикардиальном препарировании сосудов левого легкого выделение бронха возможно только после рассечения заднего листка перикарда.
44
ДОЛИ ЛЕВОГО ЛЕГКОГО
ВЕРХНЯЯ ДОЛЯ
ЛЕВОГО ЛЕГКОГО
Доступ к корню верхней доли левого легкого— переднебоковой через четвертое межреберье.
Первой, как и при препаровке корня легкого, встречается верхняя легочная вена, собирающая кровь из всей верхней доли. Первой ветвью ее сверху является V ] +2, второй ветвью, находящейся несколько ниже первой,— вена переднего сегмента (V3). Третьим истоком верхней легочной вены является ствол, обнаруживаемый наиболее каудально,— вены язычка (V4,5).
Для препаровки артерии и ветвей ее к верхней доле лучше всего перевязать и пересечь верхнюю легочную вену. Главный ствол левой легочной артерии может быть отпрепарирован и после отведения верхней легочной вены книзу.
Препарируя артерию к периферии, первой ветвью ее встречается артерия верхушечного сегмента (А>). Это бывает в ’/з случаев. Чаще же стволом, отходящим выше других, является объединенный ствол I и II сегментов (Аг 2) (рис. 30), а порой и переднего сегмента (А3). Тогда этот общий ствол, так же как и справа, целесообразно называть передним, или верхним, стволом легочной артерии.
В 50 % случаев встречается ветвление артерий с объединением А, и А2 — А,. 2, А3 отходит самостоятельно и лучше всего обнаруживается после перевязки и пересечения верхней легочной вены. Она направляется вверх, кнаружи и кпереди. Иногда ее (А3) лучше обнаружить в верхней части междолевой щели, когда артерия отходит от наружной поверхности артериального ствола.
Артерии язычка препарируют из междолевой щели. Верхняя доля и язычок отводятся вперед и вверх, нижняя доля и Se — вниз и кнаружи.
Препаровку проходящего в нижней части щели артериального ствола часто затрудняет увеличенный междолевой лимфатический узел. Его нужно осторожно отпрепарировать и удалить. От отпрепарированной артерии отходят А 4 5 и Ае- Вариантов отхождения язычковой артерии и артерии верхнего сегмента нижней доли существует три: 1) А4> 5 отходит выше устья А6; 2) А4 5 отходит на одном уровне с А6 (рис. 31) и 3) А4 5 отходит ниже устья Ае. Все это можно наблюдать на протяжении 1—2 см.
А4_5, отойдя от общего ствола, направляется к язычку. Идентификация ее труда не представляет. Она вскоре делится на две ветви — А4 и А3. Нередко эти артерии отходят от основного ствола самостоятельно.
Рис. 30. Взаиморасположение сосудов и бронхов верхней доли левого легкого.
Не так редко А4 и А3 отходят, как указывалось выше, от передней поверхности легочной артерии, после ответвления Ai, 2 и Аз. Направляются они книзу под веной верхушечного сегмента и кпереди от бронха (передний тип кровоснабжения). Иногда одна из артерий язычка (А4) идет впереди бронха, другая (А5) — сзади.
Бронх верхней доли левого легкого лучше всего препарировать спереди после перевязки верхней легочной вены, артериальных ветвей, идущих к сегментам верхней доли. При этом, так же как и при препаровке корня легкого, обнаруживается сначала главный бронх. При его препаровке к периферии освобождается его бифуркация, верхнедолевой и нижнедолевой бронхи.
Со стороны междолевой щели обнаружить верхнедолевой бронх можно только после перевязки А4 5, если она отходит позади бронха, а также А3 и А2, в случае их задней локализации. Для идентификации верхнедолевого бронха надо убедиться в отхождении нижнедолевого.
От бронха верхней доли левого легкого, ниже на 0,5—1,5 см, ответвляется Вь Слева, в отличие от ветвления верхнедолевого бронха справа,
45
Рис. 31. Препаровка артерий наружного и внутреннего сегментов в междолевой щели.
1 —артерия наружного сегмента (А4); 2 — артерия внутреннего сегмента (Ай); 3 — артерия верхнего сегмента нижней доли (Ак).
Bi часто вскоре отдает ветвь к заднему (S2) сегменту. Поэтому его обозначают Вь 2 (рис. 32). Вторым бронхом, отходящим от верхнедолевого бронха, является Вз. Его устье расположено рядом с устьем В, 2, несколько ниже и спереди от него. Вз идет вверх и кнаружи, аэрируя передний сегмент верхней доли левого легкого.
Третьим бронхиальным стволом, отходящим от верхнедолевого бронха, является В4 5. Он вскоре делится на два бронха — В4 и Bg.
Межсегментарной поверхностью верхней доли является легочная перемычка с Sg. Она, как правило, выражена слабо, сосуды в ней незначительные, и разделить ее обычно не трудно.
46
Рис. 32. Наиболее часто встречающееся строение бронха верхней доли левого легкого.
1 — верхушечный сегментарный бронх (В|); 2 — задний сегментарный бронх <В-2>; 3 — передний сегментарный бронх (В3);
4 — верхнеязычковый сегментарный бронх (В*); 5 — нижнеязычковый сегментарный бронх (Вб).
НИЖНЯЯ доля
ЛЕВОГО ЛЕГКОГО
Корень нижней доли левого легкого лучше препарировать через переднебоковой доступ по пятому межреберью или через боковой доступ тоже по пятому межреберью. Бронх и артерии хорошо доступны через междолевую щель, а нижняя легочная вена — спереди, с медиастинальной поверхности легкого.
Начинать препаровку следует с поиска и обнажения нижнедолевой артерии. Это делается так же, как было описано при препаровке А4 5.
Нужно иметь в виду (об этом указывалось выше), что Ав может отходить не только ниже места отхождения А4 5 (это типично), но и на одном уровне с местом отхождения этой артерии и даже выше ее. Изолирование, перевязка и пересечение Ае у базальной артерии позволяют перейти к препаровке нижней легочной вены. Это лучше сделать с медиастинальной поверхности легкого. Для этого легкое отводят кнаружи, а сердце осторожно смещают медиально.
Легочная связка разделяется частично тупо, частично — остро с перевязкой сосудов в ней. Вена выделяется без особого труда, препаровка ее к периферии дает возможность увидеть ее истоки: Ve, верхнюю и нижнюю базальные вены. Вена перевязывается и пересекается.
Бронх лучше изолировать из междолевой щели. После удаления нижнего междолевого лимфатического узла, перевязки и пересечения Ае и базальной артерии бронх нижней доли легко определить, препарируя бифуркацию главного бронха. Надо иметь в виду вариант отхождения бронха Se от главного бронха вместе с отхождением базального бронха, т. е. тогда, когда главный бронх образует не бифуркацию, а трифуркацию. Возможно также деление базального бронха сразу на сегментарные бронхи — Be, Bg и В io. В этих случаях стремление наложить шов на базальный бронх (даже если Be прошивается отдельно) может привести к сужению верхнедолевого бронха. Поэтому приходится обрабатывать каждый сегментарный бронх отдельно.
Межсегментарная поверхность доли описана выше.
СЕГМЕНТЫ ЛЕВОГО ЛЕГКОГО
ВЕРХУШЕЧНЫЙ И ЗАДНИЙ СЕГМЕНТЫ
ЛЕВОГО ЛЕГКОГО
Имея в виду особенность строения левого легкого, считают, что типичного, как это имеет место в правом легком, заднего сегмента слева нет.
Поэтому практически, если есть необходимость в удалении задних отделов верхней доли, резецируется этот участок вместе с верхушечным сегментом. Это оправдывает себя в подавляющем большинстве случаев и потому, что патологический процесс в так называемом S2 или в заднем субсегменте верхушечного сегмента, как правило, захватывает и какие-то участки Si.
Доступ к корню этого Sb 2—переднебоковой, через четвертое межреберье. Первой обнаруживается верхняя легочная вена. Препарируются истоки ее. Изолируется V, 2. Крайне желательно, если позволяет патологический процесс, найти ее ветвление и выделить Vlc. Она является межсегментарной и может служить хорошим ориентиром при разделении межсегментарной плоскости между Si и S3. Vla следует перевязать и пересечь, так как она мешает препарировать артерии к S1>2.
Препарировать артерии S, 2 можно из переднебокового доступа. После изоляции основного ствола левой легочной артерии препарируют ее ветви. Первой, отходящей вверх и кнаружи,
47
является А, 2, второй, идущей вверх и кнаружи,— Аз. А,_ 2 перевязывается и пересекается. Можно хорошо отпрепарировать А|>2 и со стороны междолевой щели, вверху ее. После отделения от нижней доли, т. е. разделения легочной перемычки между S2 и Se, в щели прощупывается, а затем выделяется артериальный ствол. Сдвигая верхушку легкого (Si) кпереди и книзу, обнаруживают А, 2. Она изолируется и перевязывается.
После перевязки и пересечения Vi (без Vlb) и артерии (Аь 2) бронх легко обнаруживается. Это нетрудно теперь сделать из любого доступа.
ПЕРЕДНИЙ (III) СЕГМЕНТ ЛЕВОГО ЛЕГКОГО
Корень переднего сегмента лучше всего представляется при переднебоковом доступе через четвертое межреберье. При препаровке верхней легочной вены средний коллектор ее и является веной переднего сегмента (V3). Она вскоре делится на три ветви: V3a, V3b и V3c. Самая верхняя вена V3a — центральная вена сегмента. Она может быть перевязана и пересечена. V3b и У3с являются межсегментарными между S3 и S4. При этом V3b собирает кровь из двух сегментов (S3 и S4) с медиальной стороны, a V3c— с латеральной. Иначе говоря, ориентируясь по УЗЬв можно довольно точно распрепарировать межсегментарную плоскость с медиальной стороны, т. е. со стороны средостения, а ориентируясь на ход V3c,— со стороны междолевой щели (рис. 33). Кровь из Si и S3 по межсегментарной плоскости собирается в Vlb.
Артерия переднего сегмента может быть отпрепарирована с медистинальной стороны, при отведении прикрывающих ее вен, а также и со стороны междолевой щели (рис. 34). Артерия третьего сегмента (Аз) — довольно постоянная артерия. Случаи отхождения от нее ветви к переднему субсегменту Si очень редки и практического значения не имеют.
Между ветвями V3 и V,+2, несколько глубже их ветвления, находится бронх III сегмента. Он далее разделяется на два ствола, аэрируя наружный и задний субсегменты.
После перевязки и пересечения Аз и V3a производится обработка бронха переднего сегмента. Межсегментарные плоскости можно распрепарировать, как говорилось выше, ориентируясь с медистинальной поверхности легкого, между S2 и S3, на вену I сегмента — V| а, а между S3 и S4 — на вену III сегмента (V3b). Со стороны междолевой щели, между Si и S3, ориентиром является вена III сегмента — V3 с субсегментарной ветвью V3c, а между S3 и S4 — V3c (рис. 35).
ВЕРХУШЕЧНЫЙ (ЗАДНИЙ) И ПЕРЕДНИЙ СЕГМЕНТЫ ЛЕВОГО ЛЕГКОГО
Удаление трех сегментов верхней доли (SL 2>3) предпринимается в тех случаях, когда длительно текущий патологический процесс в них приводит к уменьшению их объема и компенсаторно к увеличению объема S4 и S5. Сморщенные, патологически измененные, потерявшие свою функциональную ценность верхние сегменты требуют для успеха лечения заболевания их удаления, а здоровый, увеличенный язычок удалять нецелесообразно. Такая тактика подкрепляется неполным развитием междолевой щели, т. е. при наличии выраженной легочной перемычки между язычком и нижней долей. Иногда этому способствует наличие в легком S7.
Отсюда естествен интерес к анатомическому строению корня S, 2 и S3.
При переднебоковом доступе по четвертому межреберью препарируется верхняя легочная вена, перевязываются и пересекаются V( 2 и ее ветви. Ветви вены III сегмента (V3b и V3c) собирают кровь из межсегментарных поверхностей между S3 и S4, a V3a является центральной веной сегмента. Поэтому перевязать и пересечь целесообразно лишь V3ai препарируя легкое по ходу V3b, разделяя тем самым межсегментарную плоскость между S3 и S4.
Истоки V3 имеют вариант, при котором Уз сливается полностью с Vi. Перевязка этого общего ствола может вести к напрасной перевязке и пересечению V3b и V3c. Такая перевязка ранее считалась очень опасной, нарушающей венозный отток из S4. Опыт не подтвердил этого. Однако перевязывать без нужды вены оставляемого участка легкого все же нежелательно.
Вторым вариантом, который может встретиться, является слияние У3с У4,» Этот вариант не грозит перевязкой Узь и У3с.
Существует вариант ветвления У3, при котором одна субсегментарная вена впадает в Vi, а другая — в У4 5. У казанные варианты можно определить не только по ветвлению вен, но и по калибру коллекторов, вливающихся в верхнюю легочную вену.
Следующим слоем корня SL 2> 3 является артерия.
После перевязки и пересечения V i открывается легочная артерия с ее ветвями к S^ 2 и S3.
Однако, прежде чем приступить к их обработке, следует проследить ветвление их к периферии, поскольку и в артериальной системе возможны различные варианты. Так, нередко Аз сливается с А4 5, образуя вначале общий нижний ствол, до того, как легочная артерия проследует кзади, огибая бронх. Объединение А3 с Аг при удалении Sj 2 и S3 значения не имеет.
48
7 4 3 12
Однако и этот вариант следует иметь в виду. Более важным является объединение А3 только с А4. Ar отходит при этом самостоятельным стволом дорсально от язычкового бронха. Только после тщательного изучения ветвления артерий А12 и А3 перевязываются и пересекаются. Нередко А2 (А1с) лучше выделить из междолевой щели. После этого открываются бронхи.
Чаще всего верхнедолевой бронх ветвится на три ствола: В, , 2, В3 и В4 5. В, 2 отходит самым верхним стволом. Следующим от него отходит и В2 или, как его называют некоторые авторы,
Рис. 33. Препаровка сосудов корня левого легкого. Выделена вена переднего сегмента (Уз).
1 —легочная артерия; 2 — артерия верхушечного сегмента (А>); 3 — артерия переднего сегмента (А3); 4 — верхняя легочная вена: 5 — вена верхушечнозаднего сегмента (V>); 6 — вена переднего сегмента (Уз); 7 — вена нижнеязычкового сегмента (V$).
В1С, т. е. образуется трифуркация. Однако иногда бронх переднего сегмента сливается с бронхом язычка, и тогда верхнедолевой бронх представляет бифуркацию. Существуют и другие, правда, очень редкие варианты отхождения сегментарных и субсегментарных бронхов, не имеющие большого практического значения.
Нужно указать, что ошибка в перевязке и пересечении той или иной ветви артерии лишает участок легкого его функции — газообмена. Перевязка и пересечение вены более опасны: развивается застой крови в участке, из которого
4 Зак. 0517
49
Рис. 34. Препаровка артерии левого легкого в междолевой щели.
Перевязана артерия переднего сегмента (АЛ.
по этой вене происходит отток крови. Однако с тем и другим дефектами техники организм больного справляется. Общий газообмен не нарушается, кровообращение восстанавливается. Ошибочная перевязка и пересечение того или
иного бронха ведут к спадению аэрируемой этим бронхом участка легкого и нередко к раз витию воспаления. Препаровка межсегментар ных плоскостей представлена выше при описа нии корня Si, 2 и S>2.
50
ЯЗЫЧКОВЫЕ СЕГМЕНТЫ
ЛЕВОГО ЛЕГКОГО
Доступ к корню язычка — переднебоковой, через четвертое межреберье. Обнаруживается верхняя легочная вена. V4, 5 вливается в нее нижним стволом. В этих случаях ее следует отпрепарировать и взять на провизорную лигатуру. Длина ее — 0,5—1 см. Далее она ветвится, образуя V4 и Vs. Часто обе эти вены вливаются в нижний участок верхней легочной вены от
Рис. 35. Выделение переднего сегмента (S3). Видны V3b и V,.
дельными стволами. Иногда, как указывалось выше, нижний язычковый венозный исток сливается или со всей V3, или с одной из ее ветвей, в том числе и межсегментарными — между S3 и S4 или V3b и V3c.
Артерию язычковых сегментов лучше всего препарировать из междолевой щели. At, 5 может прослеживаться и спереди, после перевязки и пересечения V4, 5 и обработки В4, 5.
Вариантов ветвления язычковой артерии много. Чаще всего А4 и As отходят самостоя
4*
51
тельными стволами. Проследить этот вариант большого труда не составляет. Труднее выявить варианты различного рода слияний. Чаще всего встречается слияние язычковой артерии с Аз. Тогда они образуют один ствол диаметром до 0,8—1,2 см и делятся, обычно отойдя от общего ствола легочной артерии на 2—3 см. Перевязка и пересечение такого ствола ведут к лишению функции газообмена S3. Иногда это слияние происходит лишь с субсегментарной артерией III сегмента (А3с).
Нередко встречается менее опасный вариант, когда только А4 отходит от Аз. В этих случаях А5 можно принять за общий ствол А4 5.
Язычковый бронх (В4> 5) отходит обычно общим стволом от нижней части верхнедолевого бронха. Препаровка его возможна спереди только после перевязки и пересечения язычковой вены. Выделение язычкового бронха можно сделать и из междолевой щели после перевязки и пересечения язычковой артерии. Однако этот последний метод имеет свой недостаток — углубление раны и опасность повреждения ствола междолевой артерии.
Спереди легче проследить варианты отхождения язычкового бронха. Из них следует отметить три, чаще всего встречающиеся. Первый из них — отхождение от верхнедолевого бронха В4 и Вз раздельно. После перевязки сосудов ко всему язычку можно ошибочно далее разделить межсегментарную поверхность между S4 и Sg и удалить только V сегмент, оставив без снабжения кровью S4. Избежать этой ошибки можно лишь проследив ход V3b и V3c — межсегментарных вен между S3 и S4.
Второй вариант — отхождение В4 от Вз. Только правильная препаровка по межсегментарной плоскости между S3 и S4 обнаружит и эту ошибку.
Более опасен третий вариант, когда с В41 5 сливается один из субсегментарных бронхов от переднего сегмента или весь передний бронх В3 отходит вместе с В4> 5. Тогда перевязка этого бронха лишает аэрации часть или весь передний сегмент и удаление язычка может превратиться в удаление всей верхней доли.
Межсегментарная плоскость препарируется так же, как и при удалении переднего (III) сегмента.
V СЕГМЕНТ ВЕРХНЕЙ ДОЛИ ЛЕВОГО ЛЕГКОГО
IV сегмент язычка отдельно не удаляется. Удаляется, хотя и редко, один V сегмент. Его поражение, не позволяющее ограничиться краевой резекцией, и в то же время хорошее состояние IV сегмента могут потребовать резекции лишь V сегмента. Это тем более оправдано,
Рис. 36. Выделение артерии V сегмента (As) левого легкого.
1—артерия заднего субсегмента (А2); 2 — артерии язычковых сегментов (Ад 5 ); 3 — артерия верхнего сегмента (Аь); 4 — артерия сегментов базальной пирамиды (Ag q ю )•
так как удаление его мало чем технически отличается от экстирпации всего язычка.
Корень V сегмента лучше всего начать препарировать спереди, с венозного слоя.
Препаровка и идентификация Vg производятся так же, как и препаровка корня всего язычка. Надо иметь в виду, что межсегментарной веной между S4 и Sg является V4 с ее ветвями V4a и V4b. При этом V4a собирает кровь из S4 и Sg, располагаясь по задней межсегментарной поверхности, a V4b — по передней поверхности ее.
Одна из ветвей Vg (V5a) является центральной, a V5b—субплевральной. Vg может быть перевязана и пересечена. Из вариантов, которые заслуживают внимания, является вливание всей язычковой вены или одной Vg в нижнюю легочную вену, а также слияние язычковой вены с V2, о чем говорилось выше.
Для препаровки бронха V сегмента целесообразно V5 перевязать и пересечь. Bg является во всех вариантах самым последним из ветвей верхнедолевого бронха, каудально расположенным. Он легко идентифицируется. Под ним кзади (дорсально) обнаруживается артерия V сегмента. Однако ее лучше найти из междолевой щели (рис. 36).
Межсегментарную щель препарируют, ориентируясь на границу спадения S5 при раздувании легкого, а также на V4 в V4c.
ВЕРХНИЙ (VI) СЕГМЕНТ
НИЖНЕЙ ДОЛИ ЛЕВОГО ЛЕГКОГО
Корень VI сегмента, в отличие от сегментов верхней доли, лучше препарировать из междолевой щели. Одинаково хорош как переднебоковой, так и боковой доступ. При препаровке корня VI сегмента из переднебокового доступа первой препарируется нижняя легочная вена. Сердце при этом отводится несколько медиальнее. Препаровка с медиастинальной стороны нижней легочной вены дает возможность в большинстве случаев обнаружить три или две ветви ее. Верхняя, меньшая (0,3—0,8 см), является веной VI сегмента, а нижняя, почти вдвое толще (0,6—1,4 см),—базальная вена. Дальнейшее выделение вены представляет трудности.
Рис. 37. Этапы обработки корня верхнего сегмента нижней доли левого легкого.
а — вена VI сегмента; б — перевязана артерия VI сегмента. 1 — культя артерии VI сегмента (А6); 2 — VI сегментарный бронх (Во); 3 — вены VI сегмента.
52
б
53
Рис. 38. Отделение VI сегмента (S6). Видна межсегментарная вена (V6b).
1 — культя бронха верхнего сегмента (В6 ); 2 — культя артерии верхнего сегмента (А6); 3 — культи вен верхнего сегмента (V6a 6в); 4 — артерия заднего субсегмента (А2); 5 — артерии язычковых сегментов (А4 5 ); 6 — артерии сегментов базальной пирамиды (Ag 9 |g).
Поэтому целесообразно взять Ve на провизорную лигатуру.
Препарирование следует предпринять из междолевой щели. Это делается так же, как и при препарировании корня язычка. Как указывалось выше, артерия VI сегмента отходит от междолевого ствола легочной артерии от задненаружной ее поверхности, несколько дистальней отхождения язычковой артерии и направляется кзади и кнаружи. Нередко она отходит на одном уровне с язычковой или выше ее. Тогда по сути дела междолевого ствола как такового нет.
Далее артерия отдает три ствола: Аб, А^и А<,с, идущие к соответствующим субсегментам — внутреннему, верхнему и наружному. Не так уж редко Ав отходит двумя стволами (Аба-|-АбЬ и Абе).
Бронх верхнего сегмента нижней доли отходит от нижненаружной поверхности нижнедолевого бронха и прослеживается либо рядом с артерией, чуть глубже ее, либо под артерией. В этом последнем случае бронх может быть хорошо отпрепарирован только после перевязки и пересечения артерии (рис. 37). Бронх,
54
так же как и артерия, делится на три ствола, соответственно субсегментам, либо сначала на два (В6а и Вьь), а затем отдает третий — Ебс. Бронх может быть обработан и пересечен, так как вариантов, угрожающих выключением соседних сегментов слева, не встречается.
Последней препарируется вена. V8 образуется из трех истоков: V6a) V6b и V6c. Первые две собирают кровь из субсегментов VI сегмента, т. е. идут по межсегментарным плоскостям; они могут быть перевязаны и пересечены. V6c является межсегментарной веной между VI и базальным сегментом. Поэтому при препаровке межсегментарной поверхности между Se и базальным сегментом V6c является хорошим ориентиром (рис. 38).
БАЗАЛЬНЫЕ СЕГМЕНТЫ НИЖНЕЙ ДОЛИ ЛЕВОГО ЛЕГКОГО
Корень базальных сегментов, как и VI, может быть хорошо распрепарирован и из переднебокового, и из бокового доступов. Он препарируется так же, как и корень VI сегмента. При этом на провизорную лигатуру берется нижний исток нижней легочной вены — базальная вена.
Далее препаровка ведется через междолевую щель. Вначале изолируется ствол легочной артерии с ее ветвями: А4 5, Аб и А8 9 10. Последняя, как правило, отходит одним стволом. Первой от ее передней поверхности отходит артерия переднебазального сегмента (Ае), а затем продолжение ее делится в виде бифуркации на Ад, отходящую вниз и кнаружи, и Ащ, идущую вниз и кзади.
Иногда при рассыпном типе ветвления базальной артерии как таковой нет, а сегментарные артерии отходят самостоятельными ветвями. Так же как и у бронхов, у базальных артерий связи с верхней артерией нет. Поэтому один ствол базальной артерии или все сегментарные артерии раздельно перевязываются и пересекаются.
После этого удается легко отпрепарировать бронх, который представляет собой ствол, за
ключенный между устьями верхнедолевого бронха и верхнего сегментарного бронха нижней доли (В6).
Длина его бывает от 0,6 до 1,4 см. Различия в длине нижнедолевого бронха зависят чаще всего от уровня отхождения Вб.
Как и справа, ветвление нижнедолевого бронха подвержено индивидуальным различиям. В большинстве случаев после отхождения Вб нижнедолевой бронх продолжается в базальный. Под бронхиальным стволом базальной пирамиды слева следует понимать отрезок бронха нижней доли, заключенный между устьем Вб и местом деления базального бронха на сегментарные ветви. Его длина колеблется от 0,7 до 2,1 см. Обычно базальный бронх оканчивается ветвлением на передневнутренний сегментарный (Вб) и задненаружный бронхиальный ствол, который разделяется на наружнобазальный (Вд) и заднебазальный (Вю) сегментарные бронхи.
Бронх передневнутреннего сегмента (Be) отходит от передневнутренней поверхности базального бронха и имеет направление книзу, кпереди и немного кнутри. Иногда он отходит общим стволом сВ9 (4 %). Длина В8 колеблется в пределах от 0,1 до 1,5 см.
Бронх верхнего сегмента нижней доли левого легкого отходит от задней поверхности нижнедолевого бронха, направляется кзади и несколько книзу. Длина Be колеблется в пределах от 0,1 до 1,5 см. От наружной поверхности задненаружного бронхиального ствола отходит бронх наружнобазального сегмента (Вд). Иногда он отходит совместно с В8. Во всех случаях длина В9 не превышает 1,5 см.
Бронх заднебазального сегмента (В 15) представляет собой заднюю ветвь задненаружного ствола базального бронха. Он направляется кзади, книзу. Обычно длина его колеблется в пределах от 0,1 до 2,5 см.
Обнажается нижняя легочная вена с ее ветвями: V8 и общий ствол V8, 9, ю.
Межсегментарной веной между V8 и V8> 9, )0 как указывалось выше, является Vec • Поэтому перевязка и пересечение базальной вены не могут нанести ущерб оставляемому VI сегменту.
Глава Zs КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ ЛЕГКИХ
И ПЛЕВРЫ
Структурные особенности легких позволяют выделить в нем две основные функциональные зоны. В одной из них, воздухопроводящей, осуществляется движение газов из окружающей среды к диффузионной или дыхательной мембране и от нее. Она представлена в основном бронхиальным деревом с окружающей его стромой. В другой, респираторной, зоне происходит сам процесс газообмена через дыхательную мембрану. Она содержит как воздухоносные пути, так и саму диффузионную мембрану. Деление легкого на две зоны во многом определяет и особенности его патологии, и особенности органного обмена.
ОБМЕН ВЕЩЕСТВ В ЛЕГКИХ
Биоэнергетика легких. Утилизация кислорода самой легочной паренхимой происходит тремя путями (схема 1). Основной — это митохондриальная система дыхательных ферментов (трансферрин и оксидазы), обеспечивающая синтез АТФ. Менее 10 % потребляемого в легких кислорода идет на синтез биологически активных веществ и на детоксикацию токсинов и лекарственных препаратов. При различных заболеваниях (воспалениях, опухолях, туберкулезе) поглощение кислорода паренхимой легких возрастает; на фоне острой кровопотери оно увеличивается в 8—9 раз.
В обычных условиях кровоснабжения в легких представлены как аэробный, так и анаэробный пути синтеза макроэргических соединений; отмечается относительно низкая активность ферментов цикла Кребса при высокой активности лактатдегидрогеназы (ЛДГ) [Бубнова Н. И., Узбекова Д. Г., 1964]. Процессы аэробного окисления активируются при нарушении кровообращения в легких. При значительной тканевой гипоксии начинают преобладать процессы анаэробного гликолиза, что выражается в повышении активности ЛДГ, в том числе и органоспецифичного изофермента
ЛДГз, при снижении активности МДГ [Соловьев Г. М. и др., 1970]. Изменение биоэнергетики легкого при возникновении в нем патологического процесса или повреждении подтверждается методикой суммарного определения продуктов промежуточного обмена (вакат-кисло-рода) в смешанной венозной (притекающей) и артериальной (оттекающей от легких) крови.
Избыточное поступление кислорода с вдыхаемым воздухом (при гипербарической оксигенации) приводит к образованию в легких радикалов Оа, активирующих свободное окисление липидов, что при длительной экспозиции ведет к накоплению токсических продуктов, дестабилизации клеточных мембран и нарушению окислительных процессов в митохондриях. Отсутствие функционально отчетливого повреждения легких при короткой экспозиции гипербарической оксигенации [Буравцов В. И. и др., 1983] определяется тем, что в клетках респираторной зоны существует ферментная система противоокислительной защиты, главную роль в которой играет специфический фермент— супероксиддисмутаза, превращающая анион Ог в перекись водорода и воду, а также происходит активация гликолиза и пентозного шунта. Это предупреждает гипероксическое повреждение респираторной зоны и способствует поддержанию различных видов обмена, нарушенных операцией или травмой [Козлов И. А. и др., 1983].
Углеводный обмен в легких по интенсивности соответствует таковому в головном мозге и сокращающемся сердце [Cristall N., 1976]. Для утилизации глюкозы легкими инсулин не нужен. Глюкоза здесь используется не только в цикле Кребса, но и в биосинтезе аминокислот и липидов (схема 2). Потребление глюкозы легкими резко возрастает на фоне гипоксии [Горовенко Г. Г. и др., 1969]. Около 20 % глюкозы окисляется до углекислого газа, на что затрачивается значительная часть потребляемого легкими кислорода. Остальная часть обеспечивает синтез АТФ путем анаэробного гликолиза, что важно именно для альвеолоцитов, бедных митохондриями. Таким путем около 40 % всей потребленной глюкозы превращается в лактат, что служит показателем активности анаэробного метаболизма в легких, но не является следствием дефицита кислорода в тканях организма.
56
Схема 1. Поступление и использование кислорода в легких.
Свободные жирные кислоты
Глюкоза
Триглицериды
Глицерин + Свободные жирные кислоты
Липаза »
Ct—{3 — Диглицериды + холин
Дипапьметил — лецитин
Схема 3. Синтез дипальмитиллецитина — основы поверхностно-активных веществ легких.
До 5 % потребляемой легкими глюкозы включается в синтез липидов, главным образом фосфолипидов. И, наконец, 10—15 % глюкозы, поступающей с кровью в респираторную зону, идет на синтез аминокислот [Козлов И. А. и ДР-, 1983].
Обмен белков в легких не менее активен, чем углеводов. При острой гипоксии и падении содержания кислорода в притекающей к легким крови катаболизм белков и аминокислот (неоглюкогенез) усиливается [Александрович А. Г. и др., 1972]. Наоборот, в адаптированном к гипоксии организме легкие значительно усиливают синтез нуклеиновых кислот и белков, что облегчает регенерацию и ведет к гипертрофии легочной ткани на фоне усиленного поступления аминокислот. Одновременно синтезируются белки, которые составляют протеиновую основу поверхностно-активных веществ легких, покрывающих всю диффузионную мембрану [Gacad G. et al., 1972]. Эти данные могут послужить физиологическим обоснованием необходимости усиленного белкового питания больных, перенесших вмешательства на легких.
Установлено, что легкие могут как захватывать, так и секретировать в кровоток белки (альбумины, иммуноглобулины, некоторые ферменты). В патологических условиях (при интоксикации, воспалении) белковый обмен извращается и идет не в направлении избыточного синтеза белков для восстановления клеточных структур, а для формирования коллагена межуточного вещества с развитием интерстициального фиброза.
Жировой обмен в легких идет по двум основным путям: утилизации жира как энергетического субстрата и синтезу поверхностно-активных веществ. Как и в отношении углеводов, интенсивность захвата жира из притекающей к легким крови зависит от особенностей снабжения кислородом респираторной зоны, особенностей кровообращения и концентрации липидов в крови. Захват повышается при введении инсулина, снижается при ваготомии и ги-персимпатикотонии [Никулина М. Н., 1956]. Кроме нейтральных жиров, легкие способны захватывать холестерин и свободные или не-эстерифицированные жирные кислоты (НЭЖК). В обычном состоянии в легких происходят гидролиз нейтральных жиров с образованием НЭЖК как энергетического субстрата и расщепление холестерина. Особенности обмена НЭЖК (и нейтральных жиров) зависят от характера питания: при голодании они активно окисляются, а при избыточном введении (вливании жировых эмульсий) резко возрастает синтез фосфолипидов (схема 3).
При избыточном введении жира парентеральным путем синтез фосфолипидов в легких
57
увеличивается в 3—4 раза, тогда как в печени— не более чем в 2 раза. Этот процесс замедляется при снижении легочного кровотока и отеке легких, что можно объяснить нарушением питания респираторной зоны и снижением вследствие этого продукции энергии, необходимой для такого высокоэнергетического процесса, каким считается синтез липидов [Лейтес С. М., Лаптев Н. Н., 1967]. По-видимому, от регионарных колебаний перфузии легких зависят и эффекты, наблюдаемые при однолегочной вентиляции: в выключенном, а особенно в намеренно коллабированном легком синтез фосфолипидов ингибируется и депонируется холестерин, тогда как в вентилируемом легком процесс расщепления жиров усиливается [Карнаухов И. Ф. и др., 1978]. Из жирных кислот в таких обстоятельствах и даже на фоне относительной гипоксемии особенно интенсивно захватывается пальмитат. Лишь продолжительное нарушение перфузии паренхимы легкого (при эмболии, тромбозе в сосудах малого круга) замедляет синтез фосфолипидов, ограничивает восстановление поверхностно-активных веществ.
Естественно эмульгированный жир, поступающий в кровоток по грудному лимфатическому протоку, под влиянием липопротеиновых липаз почти полностью гидролизуется в легких, не проникая далее легочных капилляров. Эти ферменты продуцируются клетками эндотелия легочных сосудов и являются главной ферментной системой гидролиза. Липолитическая активность легких возрастает при гипоксии и гиперкате холами нем ии, при введении экзогенного гепарина и тормозится адреноли-тиками, в частности фенотиазинами. Даже при введении неэмульгированного жира блокада капиллярного русла респираторной зоны несущественна и быстро разрешается [Gold R. et al., 1965]. В случаях ишемического или гипоксического повреждения респираторной зоны активность липопротеиновых липаз снижается настолько, что функциональные и клинические проявления жировой эмболии становятся отчетливыми.
ГАЗООБМЕННАЯ ФУНКЦИЯ ЛЕГКИХ
Выделяя легочный газообмен как специфическую функцию легких, понимают, что она возможна благодаря происходящим в легких процессам обновления газа над диффузионной мембраной (вентиляции), диффузии газов в кровь и перфузии органа газотранспортной средой (кровью).
Диффузионная мембрана расположена в виде громадного числа конечных структурнофункциональных элементов, воздухоносные
пространства которых представляют первичную дольку — ацинус. Он начинается с дыхательной бронхиолы и включает помимо последней альвеолярные мешки, альвеолярные ходы и собственно альвеолы. Этому элементу дали название «респирон» [Шанин Ю. Н., Костюченко А. Л., 1969]. Выделение такой единицы облегчает понимание физиологии легких и основано на следующих особенностях этого структурно-функционального элемента:
1) клеточное строение респирона резко отличается от выстилки бронхиального дерева и обладает рядом уникальных особенностей;
2) респирон имеет значительный собственный объем воздухоносных пространств (одни альвеолярные ходы занимают более 30 % общего объема легких);
3) обмен газов над диффузионной мембраной происходит не в силу смешивания и вытеснения (конвекции), а в силу диффузии из дыхательных бронхиол и альвеолярных ходов;
4) респирон снабжается кровью только из легочной артерии, а соединения между большим и малым кругом находятся за пределами респираторной зоны;
5) респирон практически лишен иннервации, так как эффекторные нервные окончания простираются не далее дыхательной бронхиолы и сопутствующей ей артериолы.
ВНЕШНЕЕ ДЫХАНИЕ
В процессе легочного газообмена выделяют внешнее дыхание, или собственно вентиляцию легких, и обмен газов через альвеолярно-капиллярную диффузионную мембрану. Вентиляция обеспечивается аппаратом внешнего дыхания, включающим в себя не только воздухопроводящую зону легкого, но также костномышечные структуры грудной клетки и диафрагму.
Действие дыхательных мышц. В физиологических условиях система грудная клетка — легкие выводится из равновесия в фазе вдоха сокращением дыхательной мускулатуры. Объем грудной клетки увеличивается вследствие опускания диафрагмы и подъема ребер. На изменение объема грудной клетки оказывают влияние изгиб позвоночника и положение головы. Вдох происходит наиболее легко при выпрямленном позвоночнике и несколько откинутой голове и затруднен при кифозе, опущенном на грудь подбородке. Такое положение весьма опасно в послеоперационном периоде.
Во время вдоха нижняя часть грудной клетки увеличивается в поперечнике больше, чем верхняя. Эта особенность биомеханики объясняет значение уровня перелома ребра, при торакотомии — разреза для нарушения внешнего ды
58
хания: чем ниже уровень повреждения каркаса грудной клетки, тем больше оснований для нарушения вентиляции.
Главной дыхательной мышцей считается диафрагма. Сокращение диафрагмы и смещение ее в сторону брюшной полости увеличивают объем грудной клетки в вертикальном направлении и расширяют ее нижнюю апертуру. Расширение нижней апертуры объясняют куполообразной формой диафрагмы: волокна диафрагмы начинаются от сухожильного центра и прикрепляются к нижним ребрам. Поэтому ее сокращение, смещая. сухожильный центр книзу, поднимает нижние ребра.
Кроме ритмического сокращения диафрагмы, в биомеханике дыхания существенную роль играет постоянная тоническая активность ее мышечной части в течение выдоха. Если сокращения обоих куполов диафрагмы определяют величину нарастания отрицательного давления в замкнутой полости плевры и растяжение легкого, то ее тоническая активность противодействует силам выдоха, в результате чего чередование отрицательного давления происходит плавно.
Увеличение объема грудной клетки, вызываемое сокращением диафрагмы, обеспечивает 2/з жизненной емкости легких, т. е. почти весь объем максимального вдоха. Поэтому понятно, как ухудшаются условия вентиляции при слабости диафрагмы, парезе диафрагмального нерва или увеличении внутрибрюшного давления (при метеоризме, асците), когда вентиляцию обеспечивают преимущественно межреберные мышцы. И, наоборот, при выраженной эмфиземе легких, но сохраненной дееспособности диафрагмы наложение пневмоперитоне-ума восстанавливает ее куполообразную форму и улучшает вентиляцию.
Функциональная роль диафрагмы не ограничивается ее участием в вентиляции легких. Кашель, чиханье, рвота, возврат крови из органов живота — вот далеко не полный перечень физиологических актов, в большей или меньшей степени зависящих от сократительной способности диафрагмы. Благодаря ее иннервации из Сз—С5 сохраняются дыхательные движения даже при высоком повреждении спинного мозга.
Активность межреберных мышц во время вдоха зависит от величины дыхательного объема (ДО). При возрастании ДО до 80 % жизненной емкости легких (ЖЕЛ) активны все мышцы. Включение их на вдохе происходит в нисходящем порядке от I до XI (что увеличивает выраженность эффекта диафрагмы), как и выключение к моменту пассивного выдоха. Форсированный выдох происходит с участием всех межреберных мышц, и включение их про
исходит в восходящем порядке. Нижний отдел грудной клетки сужается раньше верхнего, чему способствует не только тяга тонически активной диафрагмы, но и возрастание напряжения мышц живота. Этот же механизм обеспечивает и кашель [Зильбер А. П., 1977].
Вспомогательные дыхательные мышцы (мышцы плечевого пояса) принимают участие лишь при необходимости гипервентиляции и значительном сопротивлении дыханию у больных с патологией легких или грудной клетки.
В дыхательной паузе мышцы вдоха практически расслаблены, возникает состояние равновесия, при котором проявляется действие эластичности системы грудная клетка — легкие. Эластические структуры легочной паренхимы стремятся уменьшить объем легких и содержащегося в них воздуха, а эластические структуры грудной клетки — увеличить их. Эти силы противоположно направлены и в потенциальной плевральной полости создают результирующее отрицательное давление, которое прижимает легкое к париетальной плевре и расправляет его. Расправлению легкого способствуют и силы сцепления жидкости в плевральной щели, которые исчезают, как только нарушается ее герметичность и в нее попадает воздух. При сокращении основных дыхательных мышц грудной клетки соответственно увеличивается действие сил, растягивающих легкие. Давление в воздухоносных путях падает, и воздух из атмосферы поступает в легкие по воздухоносным путям, увеличивая содержание газа в них.
Основное изменение объема газовой среды зависит от колебаний объема воздухоносных пространств респиронов. Доказано, что при спокойном дыхании объем альвеол не изменяется, однако расширяется вход в них и изменяется их форма [Storey J., Staub Р., 1962]. Расправленное состояние альвеол определяется главным образом внутренними факторами, действие которых зависит от состояния диффузионной мембраны. Однако следует учитывать и состояние воздухопроводящей зоны легкого. Во время вдоха трахея удлиняется, увеличиваются длина и диаметр бронхов, причем наибольшее удлинение происходит в дистальной части бронхиального дерева. Во время спокойного выдоха объем воздухоносных пространств респиронов уменьшается, размер бронхов возвращается к исходному. Уменьшению объема бронхиального дерева, составляющего воздухопроводящую зону легкого, при выдохе способствует и укорочение бронхов за счет согласованного с дыханием сокращения их собственных мышц.
В процессе вентиляции силы, вызывающие изменения объема грудной клетки и легких, преодолевают неэластическое и эластическое
59
сопротивления дыханию, величина, которых определяет механику дыхательного акта и особенности регуляции вентиляции.
Общее неэластическое сопротивление дыханию складывается из аэродинамического сопротивления газотоку в дыхательных путях, динамического сопротивления трения всех перемещаемых во время дыхания тканей легких и грудной клетки (его называют деформационным, вязкостным или фрикционным), а также инерционного сопротивления перемещаемой тканевой массы. Учитывая незначительную величину инерционного сопротивления (не более 5 % неэластического сопротивления), обычно под неэластическим подразумевают сумму аэродинамического и фрикционного сопротивлений.
Аэродинамическое сопротивление является важнейшим компонентом общего респираторного сопротивления. Оно определяется величиной трения как между молекулами движущейся по бронхиальному дереву газовой смеси, так и между молекулами газа и стенкой воздухоносных путей.
Аэродинамическое сопротивление создается главным образом в зоне дыхательных бронхиол, общее сечение которых в 400 раз повышает сечение трахеи. На фоне спокойного дыхания сопротивление воздухоносных путей слегка уменьшается во время вдоха (возможно, за счет расширения бронхиол под влиянием тракции паренхимы легких) и слегка возрастает к концу выдоха. К концу максимального выдоха аэродинамическое сопротивление возрастает значительно.
Фрикционное сопротивление дыханию наибольшего значения достигает при максимальной вентиляции; в конце вдоха и выдоха оно, как и аэродинамическое, равно нулю.
Неэластическое сопротивление возрастает при системном поражении стромы легкого (диффузном легочном фиброзе, перибронхите, интерстициальном отеке и др.). Однако наибольшую роль в изменении неэластического сопротивления играют нарушения бронхиальной проходимости, которые, имея различный генез, в конечном счете приводят к сужению просвета с изменением его конфигурации, нарушающей обычное для данного уровня поведение газотока. В крайних случаях обструкция достигает высокой степени, вплоть до полной закупорки (дистелектаз, ателектаз).
Эластическое сопротивление дыханию. Достаточные эластические свойства легких и грудной клетки — непременное условие эффективности легочного газообмена. В целом под эластичностью понимается способность сохранять и восстанавливать прежние форму и раз
меры вопреки деформации, совершаемой под воздействием любой внешней силы (сокращение дыхательных мышц, воздействие аппарата ИВ Л, работающего по принципу вдувания, и др.).
Знание динамики вышеописанных сил позволяет врачу понять положение грудной клетки при различных патологических состояниях (эмфизема, фиброз легких, ожирение, пневмоторакс, ателектаз) и оценить влияние различных факторов на отдельные компоненты всей системы грудная клетка — легкие. Эластические свойства этой системы определяют их эластическое сопротивление к растяжению, что чаще всего выражается через соотношение между объемом и давлением газа в легких, когда обе эти величины сравниваются с состоянием покоя. Это соотношение можно обозначить как растяжимость или податливость дыхательной системы грудная клетка — легкие.
Значение податливости грудной клетки в создании эластического сопротивления дыханию хотя и меньше, чем значение податливости легких, но все же достаточно существенно, особенно за пределами нормального состояния организма. Так, при ожирении податливость грудной клетки уменьшается примерно в 2—3 раза. У таких людей определенное значение имеет и инерционность грудной клетки, которую можно не принимать во внимание у худых больных. Кроме того, этот функциональный показатель может изменяться под влиянием других факторов, оказывающих воздействие на эластичность грудной клетки. В частности, имеют значение деформации ее костно-суставного аппарата, повышение внутрибрюшного давления, затрудняющего смещение диафрагмы.
Следует подчеркнуть, что податливость легких феноменологически обратно пропорциональна эластичности. Если легкое теряет свою эластичность (например, при эмфиземе), то оно становится более податливым для растяжения. И, наоборот, при уплотнении легких (фиброзе, воспалении) легкие становятся менее податливыми. Понятно, что в силу многих причин величина податливости легких изменяется с возрастом. В известной мере она может зависеть от неэластического сопротивления, повышение которого понижает податливость при форсированном дыхании у больных с обструктивными нарушениями вентиляции. Растяжимость легких прежде всего определяется состоянием эластических структур респиронов, а также плевры, бронхов и кровеносных сосудов, тонусом гладкой мускулатуры бронхов и количеством бронхиальной слизи, даже при отсутствии отчетливой бронхообтурации. Однако более чем наполовину эластичность легких зависит от стремления к спадению влажной поверхности
60
Альвеолярный воздух
Фосфолипиды
Воздушногипофазная
граница
^7777777777777777777777777777777777777777^99^9
^^Фосфолипиды, КОЛЛОИДЫ
(альбумин, иммуноглобулин G) .ТТЛ
^углеводы (глукопротеины)^Й*>>
'/шчциацшицiimitiin/tni/iliiu (////А
Углеводы, иммуноглобулин, ферменты
Гипофаза
Гипофазно-кле-точная греница
Легочная паренхима
es______£>
Схема 4. Строение сурфактантной системы легких.
диффузионной мембраны под действием силы поверхностного натяжения.
Стремлению к спадению противодействуют поверхности о-a ктивные вещества легких — сурфактанты, вырабатываемые клетками альвеолярного эпителия [Pattie R., Clement Y., 1957]. Они снижают поверхностное натяжение влаги на диффузионной мембране более чем в 10 раз и поддерживают респираторную зону в расправленном состоянии даже при отсутствии дыхательных движений, в состоянии апноэ. Именно эти вещества обеспечивают не только антиателектатический, но и противоотечный эффект в легочной паренхиме, лишенной практически интерстициальной ткани, а также стабилизируют форму мелких воздухоносных путей вплоть до терминальных бронхиол [MacLem Р. et al., 1970].
Толщина пленки поверхностно-активных веществ, покрывающих изнутри дыхательную мембрану,— всего 0,02—0,04 мкм. Структура ее неоднородна и представлена тремя слоями [Scarpelli Е., 1977]. Внутренний, находящийся на воздушно-гипофазной границе, состоит из фосфолипидов, придающих всей мембране поверхностное натяжение, близкое к нулю. Гипофаза — второй слой — содержит все компоненты сурфактантной системы и служит источником восполнения внутреннего слоя (схема 4). Третий слой — гипофазно-клеточная граница — состоит из углеводов и является местом секреции иммуноглобулинов (IgA), некоторых ферментов (фосфолипазы).
Дефицит поверхностно-активных веществ вследствие диффузного повреждения сурфактантной системы резко изменяет механические свойства легких, нарушая возможность осуществления легочного газообмена не только при спонтанном дыхании, но даже и на фоне ИВЛ методом вдувания. Эти изменения могут возникать вследствие прямого повреждения легкого (при травме, инфекции и т. п.), а также в результате нарушения метаболизма и микро
циркуляции в респираторной зоне. Гиповолемия и гипоциркуляция любого происхождения, эмболия легочной артерии, отек легких замедляют репродукцию, а может быть, способствуют разрушению сурфактантов. Этому же способствуют курение табака, длительное вдыхание кислорода в высокой концентрации, воспалительные процессы в легочной паренхиме.
Несомненное влияние на продукцию и распад сурфактантов оказывают некоторые факторы операции и анестезия. Прекращение кровоснабжения и вентиляции отдельных участков легких, травматизация легочной паренхимы, чрезмерное растяжение легких снижают активность сурфактантов. В коллабированном легком синтез их падает, что может привести к усилению процессов ателектазирования в послеоперационном периоде [Карнаухов И. Ф. и др., 1976]. Жирорастворимые анестетики (фторотан, метоксифлуран) уменьщают активность сурфактанта и увеличивают поверхностное натяжение бронхиального секрета [Scarpelli Е., 1977]. Даже небольшое количество жидкости на поверхности диффузионной мембраны или в терминальных бронхиолах блокирует сурфактантную систему, вызывает повышение поверхностного натяжения со спадением респиронов, что ощущается сразу по изменению податливости легкого, особенно при ручном методе ИВЛ.
Статические и динамические легочные объемы. При спокойном вдохе количество воздуха, поступившего в воздухоносные пути, обычно не превышает объема, при котором эластические структуры грудной клетки полностью расслаблены. Уровень максимального вдоха определяется взаимодействием между усилиями дыхательных мышц и противоположно направленной тягой легких и грудной клетки, в которой ведущим является эластическое сопротивление легких. Уровень максимального выдоха ограничивается все возрастающим (по мере уменьшения объема газа в легких) сопротивлением сжатию грудной клетки. Перечисленные уровни разделяют весь объем газа, находящийся в легких в положении максимально возможного вдоха, общую емкость легких (ОЕ) на ряд статических легочных объемов и емкостей (рис. 39).
Дыхательный объем (ДО) — объем воздуха, вдыхаемый или выдыхаемый при каждом дыхательном цикле. Резервный объем вдоха (РОВД) — максимальное количество воздуха, которое можно вдохнуть после обычного вдоха. Резервный объем выдоха (РОВЫД) — максимальный объем воздуха, который можно выдохнуть после обычного выдоха. Остаточный объем легких (ОО) — количество воздуха, остающееся в легких даже после максимального выдоха.
61
Рис. 39. Изменение объемов легких в различные фазы дыхательного цикла.
ДО — дыхательный объем; РОВД — резервный объем вдоха; РОВЫД — резервный объем выдоха; ОО — остаточный объем; ОЕЛ — общая емкость легких; ЖЕЛ — жизненнвя емкость легких; Евд — емкость вдоха; ФОЕ — функциональная остаточная емкость.
Наибольшее количество воздуха, которое может быть выдохнуто после максимального вдоха, достигаемого с помощью мышечного усилия, представляет собой жизненную емкость легких (ЖЕЛ). РОВЫД и ОО вместе составляют функциональную остаточную емкость (ФОЕ), а часть общей емкости легких (ДО и РОВД) принято называть емкостью вдоха (Еад).
Представленные уровни деления объема газа, содержащегося в легких, определяют не только статические легочные объемы, но и соотношение величины транс пульмонального и трансбронхиального давления и создаваемой им объемной скорости газотока в воздухопроводящей системе. Эти соотношения нелинейны, и эта нелинейность прогрессивно увеличивается при возрастании воздушного потока. При форсированном полном вдохе из положения максимального выдоха транспульмональное давление плавно увеличивается и достигает максимума на высоте вдоха. Поток воздуха, несмотря на продолжающееся увеличение усилия после выдоха 50 % ЖЕЛ, прогрессивно снижается, достигая нуля на высоте давления.
При форсированном выдохе максимальный поток достигается при уровне 70—80 % ЖЕЛ на фоне прогрессирующего прироста давления. После достижения этого предела поток уменьшается и падает до нуля гораздо резче, чем при вдохе. Уменьшение потока газа при одновременном нарастании давления указывает на увеличение сопротивления газотоку. В результате величина транспульмонального давления во время выдоха относительно больше, чем во время вдоха. Уменьшение объемной скорости газотока во время форсированного выдоха, несмотря на увеличение транспульмонального давления, свидетельствует об изменении механических свойств легких на выдохе.
На высоте форсированного вдоха в связи с падением внутриплеврального давления развивается градиент давления по направлению от рта к респиронам. Поскольку наибольшее отрицательное давление создается в респираторной зоне легкого, то в воздухоносной зоне трансбронхиальное давление будет тем выше, чем больше калибр бронха, в результате чего и происходит расширение воздухопроводящих путей, наиболее выраженное в их проксимальном отделе. Во время форсированного выдоха внутриплевральное давление становится положительным, а давление в респираторной зоне наибольшим. По ходу воздухоносной зоны легких трансбронхиальное давление снижается до атмосферного в ротовой полости. Следовательно, на протяжении дыхательных путей должна быть точка, в которой транспульмональное давление равно нулю; она называется точкой равных давлений. Эта точка делит дыхательные пути на два сегмента: в периферическом сегменте трансбронхиальное давление положительное, в центральном — отрицательное. В бронхах, расположенных нейтральнее точки равного давления, создаются условия для спадения бронхов, приводящие к физиологическому экспираторному стенозу. Степень такого бронхостеноза будет зависеть от эластических свойств бронхиальной стенки и соотношения статического и динамического давлений в потоке, сумма которых является постоянной величиной. Поэтому снижение линейной скорости газотока приводит к увеличению статического давления потока, поддерживающего стенку бронха.
В процессе форсированного выдоха точка равного давления смещается от трахеи к дистальным, периферическим отделам воздухопроводящих путей. Так, после выдоха, равного 50 % ЖЕЛ, точка равного давления располагается сразу за долевыми бронхами, после выдоха 75 % ЖЕЛ она располагается в бронхах с сечением менее 3 мм, которые легко спадаются на фоне отрицательного давления. Таковы соотношения, лежащие в основе экспираторного закрытия дыхательных путей. Любая легочная и внелегочная патология, ведущая к потере эластичности дыхательных путей и ускорению газотока на выдохе, неизбежно усиливает экспираторное закрытие [Щелкунов В. С. и др., 1980]. Существенную роль в возникновении его на операционном столе играет режим ИВЛ, характеризующийся укорочением выдоха или созданием активного выдоха. Экспираторное закрытие дыхательных путей считается одним из ведущих механизмов в возникновении послеоперационной гипоксемии, резистентной к ингаляциям Ог, что требует специальных методов лечения.
62
Работа дыхания. Для понимания достаточности газообменной функции легких важно определение трех сторон работы дыхания: общей механической работы, выполняемой по ходу одного дыхательного акта или в единицу времени, отношения между общим количеством работы и той ее частью, которая затрачивается на вентиляцию воздухоносных пространств и потребление кислорода дыхательными мышцами.
Величина работы дыхания характеризует общее усилие дыхательной мускулатуры и зависит от МОД.
Работа дыхания может быть разделена на ряд компонентов соответственно характеру сопротивления: рестриктивный, обструктивный и инерционный. На преодоление эластического ' сопротивления в норме приходится 2/з, а неэластического— */з всей работы дыхания. В случае ожирения, большой массы грудной клетки и живота существенное значение начинает играть инерционный компонент. Многообразные механизмы регуляции дыхания обеспечивают оптимальный дыхательный объем и частоту дыхания при наименьшем расходе энергии на вентиляцию. Расстройства регуляции дыхания могут привести к нарушению этого соответствия даже при нормальном состоянии собственно аппарата дыхания. Когда податливость легких уменьшается (при фиброзе, застойных явлениях), дыхание становится частым и поверхностным, так как при произвольном углублении вдоха будет резко возрастать работа по преодолению эластического сопротивления. При возрастании неэластического сопротивления в случаях диффузной обструкции бронхиального дерева дыхание становится медленным и глубоким, так как учащение дыхания приведет к резкому возрастанию затрат энергии на преодоление неэластического сопротивления току воздуха.
Соотношение МОД и той его части, которая используется в газообмене (так называемой альвеолярной вентиляции), позволяет определить полезную работу дыхания, которая будет меняться в зависимости от кислородного запроса организма. По мере увеличения вентиляции работа дыхания возрастает в логарифмической зависимости. Предельное значение общей работы дыхания у здоровых при максимальном МОД равно 51,6+18 кгм у мужчин и 33,2+13 кгм у женщин [Кадиев Н. Н., Кузнецова В. К., 1976]. Предельные значения работы дыхания у больных с легочной патологией значительно снижены. Работа в 8—12 кгм может оказаться непосильной для пациентов с обструктивными нарушениями в силу значительного снижения предела увеличения вентиляции.
У здоровых людей эффективный предел увеличения вентиляции не превышает 60—70 % максимально возможной вентиляции легких. Дальнейший прирост вентиляции не обеспечивает дополнительного поступления кислорода в ткани вследствие того, что весь дополнительно поступивший кислород потребляется самими дыхательными мышцами, что, таким образом, лимитирует выполнение физических нагрузок. О потреблении кислорода дыхательными мышцами судят по величине так называемой «кислородной цены дыхания», которая определяется по количеству кислорода, потребляемого дыхательными мышцами при вентиляции 1 л воздуха.
Следует отметить, что при спокойном дыхании дыхательные мышцы здоровых людей используют лишь 5 % потребляемого организмом Ог и только при значительной гипервентиляции (более 50 л/мин) потребление кислорода дыхательными мышцами возрастает до 20 %.
Обтурационные нарушения вентиляции, ригидность грудной клетки и легких, ограничение подвижности диафрагмы при различных заболеваниях и повреждениях аппарата дыхания приводят к значительному увеличению кислородной цены дыхания: уже при сравнительно невысокой гипервентиляции (15— 20 л/мин) потребление кислорода дыхательными мышцами в этих условиях составляет 25—40 % кислородного дебита организма [Levilhson Н., Cherniak R., 1968]. Высокая кислородная цена дыхания может стать крайне опасной для больного после резекции легкого или при уменьшении диффузионной возможности его в связи с послеоперационными осложнениями.
ФИЗИОЛОГИЯ РЕСПИРАТОРНОЙ ЗОНЫ ЛЕГКИХ
При дыхании вдыхаемый воздух увлажняется и согревается в верхних дыхательных путях, носовых ходах, трахее и крупных бронхах и по воздухопроводящей системе, емкостью 150—180 мл, поступает в респираторную зону, емкость которой в норме составляет около 1300 мл. Специальные исследования показали [Weibel J., 1970], что скорость газового потока резко падает при переходе из дыхательных путей, содержащих хрящи, в пути мембранозного строения, составляя в них 0,1—0,01 скорости потока в трахее. По ходу воздухоносных путей возникает послойная неравномерность состава газовой среды, концентрация основных компонентов в которой меняется от уровня вдыхаемого воздуха до уровня, находящегося в альвеолах.
63
Четкой границы между воздухопроводящей зоной, где нет контакта между воздухом и легочными капиллярами, и респираторной зоной нет. Скорее можно выделить переходную, или транзиторную, зону, где наряду с проведением воздуха происходит и газообмен в малочисленных (не более 2 % от общего числа) альвеолах, расположенных на поверхности бронхиол. Объем воздуха, содержащийся в транзиторной зоне, составляет около 200 мл. Эта зона непостоянна по объему и положению, ибо смещается по бронхиальному дереву в зависимости от режима дыхания и в первую очередь от скорости вдоха.
В связи с небольшим диаметром респиронов (0,45 мм на вдохе и 0,35 мм на выдохе) газы быстро диффундируют между дыхательной бронхиолой и диффузионной мембраной. Коэффициент диффузии газов очень высок: кислород диффундирует в газовую среду в 300 тыс. раз быстрее, чем в воду, а углекислый газ — соответственно в 13 тыс. раз. Поэтому газы с одинаковой скоростью диффундируют через слой воздуха в 0,45 мм (450 мкм) при разнице парциальных давлений в 1 мм рт. ст. и через альвеолярно-капиллярную мембрану в 2 мкм при градиенте давлений в 60 мм рт. ст. для кислорода и 6 мм рт. ст. для углекислого газа. Неподвижность газа над диффузионной мембраной предохраняет нежнейшие структуры легких от термического повреждения и сохраняет жизнь человеку в экстремальных условиях. При этом имеет значение не только респираторная зона с ее неподвижной газовой средой, но и так называемое «мертвое» пространство, в котором происходят согревание, очищение и увлажнение вдыхаемого воздуха.
До последнего времени величина «мертвого» пространства учитывалась для оценки эффективности обновления газа в респираторной зоне, исходя из знания величины ДО. Однако оказалось, что некоторое количество воздуха поступает в респироны и в тех случаях, когда до гораздо меньше объема анатомического «мертвого пространства» (150 мл). Дело в том, что вдыхаемый газ движется по воздухоносным путям не прямоугольным, а коническим фронтом. Переходная зона в таких случаях смещается к трахее. Кроме того, процесс поддержания постоянства состава газа над диффузионной мембраной определяется не только общим объемом вентиляции, но и равномерностью распределения газа в легких.
Даже в здоровом организме различное участие верхних и нижних долей в вентиляции, разное положение тела, неодинаковая податливость долей и т. п. способствуют неравномерному распределению вдыхаемого газа. При различных поражениях бронхиального дерева и
респираторной зоны вдыхаемый газ распределяется еще более неравномерно.
Наряду с неравномерностью распределения газотока необходимо учитывать и неравномерность распределения крови по другую сторону от диффузионной мембраны, в капиллярах легкого. Доказано, что даже при спокойном дыхании кровоток в легких неравномерен: хорошо известны периодические «спонтанные» колебания открытых капилляров в одном и том же отделе легких, большая скорость кровотока в периферических отделах легких по сравнению с центральными, возрастание ее в направлении от верхних отделов к нижним. При глубоком дыхании разница в кровоснабжении различных отделов легких уменьшается.
В «идеальных» условиях суммарное отношение вентиляции к кровотоку равно 0,8, так что в респираторной зоне легких в минуту обновляется в среднем 4 л воздуха и 5 л крови. Поэтому создание адекватного вентиляционноперфузионного отношения, которое быстро меняется в физиологических условиях и легко выходит за оптимальные пределы при патологических состояниях, является основным условием оптимальности легочного газообмена.
К настоящему времени накоплено много данных о наличии координации между вентиляцией и кровотоком на уровне респирона. Основное значение в этой регуляции придается зависимости тонуса легочных артериол от состава газовой среды над диффузионной мембраной в каждом отдельном респироне, в частности от парциального давления кислорода [Савицкий Н. Н., Трегубов А. А., 1940; Fich-man J., 1961; Staub P„ 1963]. Влияние повышенного содержания углекислого газа на тонус и кровоток в легочных сосудах выражено менее четко. Определенное значение имеет изменение тонуса мускулатуры дыхательных бронхиол, меняющих не только «вход» в респирон и диффузию газа к дыхательной мембране, но и давление в респироне, что оказывает влияние на кровоток. Существует еще один местный механизм регуляции отношения вентиляции к кровотоку, в роли которого выступают поверхностно-активные вещества. Поскольку в состоянии покоя в газообмене участвуют не все респироны, то в «закрытых» респиронах идет накопление этих веществ, тогда как в активно функционирующих респиронах их запасы истощаются. Это приводит к выключению «дышащих» респиронов и включению «недышаших», но имеющих сохраненный, хотя и редуцированный, кровоток.
По этим причинам количественные изменения минутного объема дыхания (МОД) малоинформативны для диагностики дыхательных нарушений у больного заболеваниями легких.
64
В патологических условиях регионарные изменения отношения вентиляции к кровотоку могут создать две крайние ситуации, при которых нарушается оксигенация крови в легких. Первая напоминает вентиляцию «мертвого пространства» и приводит к увеличению отношения выше 0,8. При такой ситуации уменьшено число функционирующих капилляров или имеется гипервентиляция одного из отделов легких с нормальным кровотоком. Насыщение крови кислородом происходит на фоне уменьшенного эффективного объема вентиляции, при котором значительная часть газа не достигает диффузионной мембраны, а напряжение кислорода в газовой среде респиронов постепенно снижается. Второе крайнее состояние связано с появлением значительного количества нсвентилируемых респиронов и подобно шунтированию крови: отношение вентиляции к кровотоку ниже 0,8. В невентилируемых респиронах кровь оксигенируется незначительно, сохраняет свойства венозной и смешивается на пути оттока с полностью оксигенированной из хорошо вентилируемых респиронов. Если число последних достаточно, то задержки углекислого газа нет. Возможна и истинная примесь венозной крови.
Ингаляция кислорода ликвидирует шунтоподобный эффект неравномерности обновления газа над диффузионной мембраной.
Диффузия газов. Освещение процессов газообмена будет неполным, если не учитывать особенности диффузии кислорода и углекислого газа через дыхательную мембрану. Аэро-гематический барьер, через который диффундируют эти газы в легких, имеет толщину около 2 мкм и включает в себя альвеолярный эпителий, межтканевую жидкость, эпителий капилляров, плазму крови, стенку и внутриклеточную жидкость эритроцита. В функциональном отношении этот барьер не является инертным воднотканевым слоем, а представляет собой активно функционирующую преграду с неравновесной структурой. Скорость прохождения газов через нее зависит не только от градиента парциальных давлений, определяющего диффузию газов, но и от направления диффузии. Углекислый газ быстрее выделяется из крови, чем проникает в нее, хотя скорость диффузии для углекислого газа в кровь примерно в 20 раз выше, чем для кислорода. Наоборот, растворимость кислорода в липидах поверхностно-активных веществ выше, чем в других органических веществах и растворах [Березовский В. А., Горчаков В. Ю., 1982]. В модельных экспериментах пленка сурфактанта проявляла отчетливую способность ускорять перенос кислорода из газовой среды, что позволяет рассматривать сурфктантную систему как конденсатор кислорода, облегчающий его транспорт через аэрогематический барьер.
5 Зак. 0517
Это особенно важно, так как время пребывания крови в легочном капилляре всего вдвое больше времени, достаточного для установления равновесия между напряжением кислорода в газовой среде респиронов и в легочной капиллярной крови.
Другая особенность обмена кислорода в легких состоит в том, что процесс его переноса через аэрогематический барьер считается завершенным лишь после того, как молекулы кислорода вступят в химическую связь с гемоглобином, причем на этапе этой реакции имеется дополнительное сопротивление транспорту кислорода в связи с положением кривой диссоциации оксигемоглобина, которое определяется рядом факторов, как неспецифических (концентрацией Н и К', напряжением углекислого газа, температурой тела), так и специфических для эритроцитов (концентрацией гемоглобина, органических фосфатов, глютатиона). Это дополнительное сопротивление может иногда вдвое замедлить поступление кислорода в кровь при отсутствии существенных изменений условий транспорта углекислого газа.
Поэтому, говоря о нарушениях диффузии в легких, имеют в виду в основном нарушение диффузии кислорода. Кривая диссоциации связанного углекислого газа крутая во всех уровнях. Уравновешивание напряжения углекислого газа в респироне и в легочных капиллярах происходит за 0,072 с, в то время как эритроцит находится в капилляре 0,1—0,3 с. Поэтому значительное нарушение диффузии углегисло-го газа должно сочетаться с таким нарушением обмена кислорода, при котором жизнь невозможна.
Следует различать диффузионную способность легких и нарушения диффузии, ведущие к расстройству легочного газообмена. Уменьшение размеров диффузионной мембраны в силу повреждения респиронов при острых и хронических воспалительных процессах в легких, выключении части капиллярного русла, удалении значительной части функционирующей диффузионной мембраны при резекции легких мало сказывается на процессах оксигенации крови и элиминации углекислого газа вне связи с нарушениями вентиляционно-перфузионного соотношения.
Простейший тест на существование диффузионных нарушений — наличие гипоксемии без-гиперкапнии и увеличение гипоксемии при произвольной гипервентиляции [Зильбер А. П., 1977].
Снижение Ро в артериях большого круга кровообращения может быть результатом одного или нескольких изменений функционирования респираторной зоны. Среди них можно выделить следующие ситуации:
65
1) гиповентиляция всех или большинства респиронов, тотальное нарушение обновления газовой среды респираторной зоны (в этом случае гипоксемии способствуют задержка углекислого газа, гиперкапния);
2) неравномерное соотношение вентиляции и перфузии в различных отделах легких (напряжение углекислого газа в артериальной крови в таких случаях может быть пониженным, нормальным или повышенным в зависимости от способности организма к гипервентиляции в ответ на гипоксемию);
3) сброс крови из малого круга в большой вследствие шунтирования крови через внутри-легочный или внутрисердечный шунты (в этих случаях напряжение углекислого газа нормально или снижено, так как легкие практически здоровы, а аппарат внешнего дыхания способен к гипервентиляции, но существенное значение приобретает состояние легочного сосудистого русла).
ГАЗООБМЕН
И ЛЕГОЧНЫЙ КРОВОТОК
По сравнению с циркуляцией крови в большом круге кровообращения легочный кровоток имеет ряд характерных особенностей. Малый круг кровообращения относится к системе низкого давления, для которой характерны низкое сосудистое сопротивление и большая растяжимость сосудов. Во время систолы сердца крупные разветвления легочной артерии вмещают кровь, которая во время диастолы поступает в периферическое разветвление легочных сосудов, что поддерживает равномерность кровотока в легком.
Легочные артериолы имеют диаметр 60 — 80 мкм, т. е. они в 5—6 раз шире, чем в большом круге. Вследствие этого величина сосудистого сопротивления в легких может быть в 6—8 раз меньше, чем сопротивление сосудов большого круга. При этом распределение сопротивления по ходу кровотока также различно: в большом круге кровообращения основное сопротивление оказывают артериолы, в малом значительную часть (до 30 %) составляет сопротивление в венозном отделе.
Объем крови в легких, составляющий в покое примерно ‘/4 часть всей массы циркулирующей крови, может легко изменяться без существенных изменений давления в сосудах легкого. При кровопотере кровь из легких быстро мобилизуется в большой круг. Наоборот, при быстром вливании растворов значительная ее часть немедленно оказывается в сосудах легких. Все сосудосужающие факторы, повышающие сопротивление кровотоку в большом круге (катехоламины, боль, гиперкапния, гипоксемия и
др.), увеличивают легочный объем крови на 40— 50 %.
Растяжимость легочных сосудов обеспечивает постоянство давления в капиллярах, несмотря на значительные колебания МОК. Хотя давление в артериях малого круга в 6—7 раз ниже, чем в соответствующих отделах большого круга кровообращения, увеличение МОК в 2—3 раза не повышает давление в легочной артерии. Некоторое повышение наблюдали только при увеличении кровотока через легкие в 5—6 раз [Reemstma А., 1961].
Наличие артериовенозных анастомозов диаметром до 400 мкм при усиленном кровенаполнении малого круга обеспечивает ток крови в обход респиронов в легочные вены, предотвращая перегрузку правого сердца при нарушениях кровообращения в легких. При этом возникает различной степении гипоксемия, зависящая от объема шунтируемой крови.
Тонус легочных сосудов и кровоток через малый круг регулируется нервными и гуморальными механизмами в зависимости от имп^ль-сации с рецепторов легочных сосудов, изменения сердечной деятельности, тонуса сосудов большого круга кровообращения. Именно с этих позиций следует оценивать многие стороны клинических проявлений таких патологических состояний, как отек легких или тромбоэмболия легочной артерии. Решающую роль в процессе циркуляции играет трансмуральное давление, т. е. разность между давлением крови и давлением, прилагаемым к сосуду снаружи. Для вен и артерий легкого трансмуральное давление представляет градиент между давлением в этих сосудах и внутриплевральным давлением, для легочных капилляров — между капиллярным и внутрилегочным, альвеолярным давлением. Так как и альвеолярное, и внутриплевральное давление изменяются в течение дыхательного цикла, то даже их небольшие изменения могут оказывать существенное влияние на трансмуральное давление, а следовательно, просвет и сопротивление в зоне микрососудов.
Не вдаваясь в подробности обширной области физиологии легочного кровотока при изменении функционирования сердца, следует подчеркнуть, что для кровообращения и, прежде всего, кровообращения в малом круге большое значение имеют механизмы и процессы, обеспечивающие легочный газообмен.
Легочные капилляры занимают более 80— 85 % диффузионной мембраны и находятся в тесном контакте с газовой средой респиронов. Капиллярная сеть обеспечивает воздухоносные пространства двух соседних альвеол одного и того же или разных респиронов. Если в других паренхиматозных органах стромой является опорная соединительная ткань, то в легких она
66
находится практически вне респираторной зоны, в области расположения более крупных сосудов и бронхов. Роль опорной ткани в основном выполняет воздух, содержащийся в респиронах. Интерстициальному (тканевому) давлению в других органах, которое противостоит транссудации и отеку, в легких соответствует альвеолярное давление. Роль этого давления проявляется и в определенных структурных особенностях более крупных разветвлений легочного сосудистого русла.
Легочные артериолы относительно бедны мышечными элементами, тогда как дыхательные бронхиолы, играющие роль регуляторов воз-духонаполненности респиронов, снабжены мышцами, многочисленными нервными элементами. Под влиянием нервных и гуморальных стимулов сократительные структуры бронхиол могут действовать как сфинктер.
В мышцах и других внутренних органах эритроциты большой силой гидростатического давления проталкиваются через узкие капилляры диаметром 5—6 мкм, т. е. меньше диаметра эритроцита. В капиллярах легких гидростатическое давление низкое, но ток крови возможен, потому что их просвет больше диаметра эритроцита (20—25 мкм). Однако этот просвет решающим образом зависит от давления газа в респироне. При сужении бронхиолы и выключении респирона из вентиляции он спадается, капилляры суживаются, и циркуляция в значительной части капиллярного ложа прекращается в связи с возрастанием сопротивления в этой сосудистой зоне. При увеличении вентиляции и раскрытии большей части респиронов капилляры открываются, диффузионная поверхность увеличивается. В силу большого резерва функционирующих капилляров ни острое увеличение кровотока через малый круг, ни трансфузионная эмболия микросгустками при быстром массивном переливании консервированной крови, ни уменьшение кровеносного русла даже наполовину (при пульмонэктомии) не вызывают сколько-нибудь длительного и значительного повышения давления в легочной артерии.
Вентиляция оказывает влияние и на такие факторы, обеспеч"вающие кровоток через легкие, как сила сокращения правого желудочка, градиент давления между легочными артериями и венами, вазомоторный тонус. Количество крови, выбрасываемое правым желудочком, будет колебаться в зависимости от фаз дыхательного цикла. Ритмический характер колебаний давления в легком облегчает приток крови в капилляры во время обычного вдоха и опорожнение во время выдоха. При чрезмерно глубоком вдохе влияние отрицательного внутрилегочного давления сказывается на сосудах большого и среднего калибра. Капилляры сжимаются вслед-
5 *
ствие растяжения межальвеолярных перегородок, сопротивление кровотоку в малом круге частично перемещается в зону капилляров.
Во время вдоха ударный объем правого желудочка возрастает (на 15—40 %). Одновременно снижаются ударный объем левого желудочка сердца (на 10—15 %) и пульсовое давление в аорте. Это зависит от увеличения притока крови к сердцу с возрастанием диастолического наполнения правого предсердия и с растяжением легочных вен, стенка которых связана с паренхимой легкого. Значительное увеличение емкости этих вен уменьшает приток крови к левому предсердию, а следовательно, и ударный объем левого сердца. Чем больше размахи транспульмонального давления, отражающие изменения механических свойств легких, тем более выражены колебания ударного объема сердца. Высокая корреляция показателей механики дыхания и колебаний ударного объема крови на протяжении дыхательного цикла позволяет воспользоваться индексом дыхательных изменений ударного объема как одним из критериев оценки состояния механики дыхания [Страшнов В. И. и др., ] 980; Тищенко М. И. и др., 1982].
Если в этой части функциональных связей легочного газообмена и кровообращения основное значение имеет пассивное изменение притока крови к сердцу, просвета легочных капилляров и вен, то существует и вторая, более активная сторона взаимодействия дыхания и перфузии легких, а именно: влияние на кровообращение состава газовой среды респираторной зоны в целом и отдельных респиронов в частности. Компенсаторное перераспределение крови из плохо вентилируемых отделов в хорошо вентилируемые, где сопротивление току меньше, может осуществляться и через вегетативную нервную систему, по типу аксон-рефлекса или под влиянием гуморальных воздействий, как следствие анаэробной инверсии обменных процессов в легочной ткани, приводящих к местному образованию сосудосуживающего фактора. Более сложные рефлекторные воздействия на вазомоторный тонус и перераспределение крови в легких включаются в регуляцию перераспределения кровотока лишь при крайних отклонениях нормального функционирования дыхательной системы или при патологических состояниях.
Обычно низкий уровень кровяного давления в сосудах малого круга кровообращения приводит к выраженным влияниям на распределение кровотока в легких гравитационных факторов. Легко выделяются три зоны [Зильбер А. П., 1971]. При вертикальном положении испытуемого среднее легочное артериальное давление на уровне сердца составит около 25—20 мм рт. ст. В артериальных сосудах верхних отделов
67
легких оно снижено на величину гидростатического столба крови и приближается к нулю. Внутриальвеолярное давление в верхушках легких в этих условиях больше артериального и венозного, в результате чего капилляры при спокойном дыхании спадаются и кровоток практически прекращается. В отделах легких, расположенных ниже уровня сердца, происходят противоположные явления: внутрисосудистое, а значит и трансмуральное давление повышено, просвет сосудов расширен, кровоток усилен. Если испытуемого положить на спину или на бок, то гравитационные изменения равномерности кровообращения в легком будут также прослеживаться: в вышележащем легком кровоток падает, в то время как в нижележащем — возрастает.
При хирургическом лечении больных, когда премедикация и анестезия нарушает ауторегуляцию сосудистого тонуса, ИВЛ и операционный пневмоторакс сообщают распределению легочного кровотока большую неравномерность. Создаются все условия для существенного нарушения вентиляционно-перфузионных отношений, что требует обязательного обогащения вдыхаемого газа кислородом для устранения возможной гипоксемии. В нормальных условиях существует тонкое и быстрое регулирование соответствия между распределением вдыхаемого воздуха и циркулирующей крови в легких, что обеспечивает эффективность оксигенации крови. Это привело к предположению о существовании специальных механизмов, обеспечивающих соответствие локального кровотока и вентиляции отделов легких (рефлекс Эйлера — Лилиестранда). Основное значение в этой регуляции имеет высокая чувствительность тонуса легочных сосудов к изменению состава газовой среды респиронов.
Существующее в нормальных условиях тонкое соответствие между распределением газа и крови в респиронах обеспечивает почти нормальное насыщение гемоглобина кислородом при значительном снижении МОД и минимальном МОК. Сужение артериол в ответ на падение Ро. в респиронах представляет до некоторой степени биологически полезную реакцию, устраняющую несоответствие между вентиляцией и кровотоком. В таких условиях давление в легочной артерии меняется в зависимости от состава газовой среды респираторной зоны [Nahas G., 1956]. Однако полезность этой реакции относительна, так как снижение Ро, во многих респиронах обусловливает спазм артериол с развитием гипертензии в малом круге. При этом определенную роль могут играть не только артериолы, но и посткапиллярные отделы легочного сосудистого русла и легочные вены [Gordon N., Katz S., 1962].
На определенном этапе дыхательных расстройств эта реакция становится независимой. При полном прекращении дыхательных движений сохраняются и кровоток через легочные сосуды, и поглощение кислорода, но не выводится углекислый газ, что послужило физиологическим обоснованием так называемого диффузионного дыхания. Другим доказательством независимости легочного кровотока от вентиляции является развитие первичной легочной гипертензии с затруднением кровотока через респираторную зону без изменения функции внешнего дыхания.
Необходимо подчеркнуть, что второстепенным в развитии легочной гипертензии является увеличение МОК в ответ на значительное и длительное падение насыщения гемоглобина в артериальной крови до 80—85 %. Прямое действие гиперкапнии, как было сказано выше, играет незначительную роль в реакциях сосудов малого круга. Наоборот, увеличение содержания углекислого газа в крови, раздражая рецепторы аортальной и синокаротидной зон, может привести к рефлекторному расширению легочных сосудов.
Уменьшение объема функционирующего сосудистого русла при обструктивной эмфиземе, обострение хронического воспалительного процесса в легких, нарушение отношения вентиляции к кровотоку с развитием артериальной гипоксемии могут привести у таких больных к развитию гипертензионного криза в малом круге при повреждении легкого. Особенно опасно вмешательство на легких у больных, уже имеющих отчетливую легочную гипертензию.
Имеется еще одна особенность кровотока в легких. Дело в том, что активная реакция легочной паренхимы бодее основная, чем реакция притекающей к легким крови. Градиент концентрации [-Р в крови и тканях в случаях ацидоза в системной артериальной крови снижается во всех органах и тканях, но повышается в легких (при поступлении кислой венозной крови): изменение просвета органных сосудов на фоне ацидоза будет иметь различную биохимическую основу. Расширение легочных сосудов при нарушении процессов окисления и накоплении недоокисленных продуктов облегчает оксигенацию крови и кислородное обеспечение организма.
Этот ионный механизм дает возможность по-новому интерпретировать некоторые защитно-приспособительные механизмы, связанные с особенностями коллатерального кровотока в легких. Кроме анастомозов, обеспечивающих связь между сосудами малого и большого кругов (сброс «справа налево»), на уровне респиронов в легких имеются также бронхолегочные анастомозы: бронхиальная артериола — легоч
68
ная артериола — капилляр — венула — легочная вена. Основной особенностью этих анастомозов является то, что они представляют единственное место, где кровь из большого круга кровообращения непосредственно переходит в малый. В этих коммуникациях всегда одно направление тока крови, несмотря на любые колебания давления в малом круге. По-видимому, стенки бронхолегочного анастомоза играют роль химически регулируемых клапанов, пропуская менее кислую кровь из большого круга и не пропуская в последний более кислую легочно-капиллярную кровь.
При тяжелой физической нагрузке или гипоксии, вызванной недостатком кислорода во вдыхаемом воздухе, открывается путь для поступления крови из большого круга непосредственно в расширенные сосуды респираторной зоны, что обеспечивает дополнительную экспозицию недостаточно оксигенированной крови и более полную (исходя из возможностей легкого) ее оксигенацию [Парин В. В., 1946].
РЕГУЛЯЦИЯ ЛЕГОЧНОГО ГАЗООБМЕНА И ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Физиологические и анатомические изыскания позволили выдвинуть предположение, что управление внешним дыханием осуществляет центральный аппарат регуляции, обозначаемый термином «дыхательный центр». Основное проявление активности дыхательного центра — ритмогенез, формирование длительности и частоты фаз вдоха и выдоха, что определяет в итоге МОД, который соответствует интенсивности метаболизма в широком диапазоне изменений жизнедеятельности. Дыхательный ритм формируется в результате взаимодейстия между функционально различными группами дыхательных нейронов.
Структурно-функциональная схема регуляции дыхания содержит два основных контура регулирования: механорецепторный и хеморе-цепторный. Оба контура, кроме центрального регулятора, имеют единый эффекторный выход. Эфферентная импульсация из дыхательного центра продолговатого мозга поступает к мотонейронам спинного мозга, а затем по диафрагмальным и межреберным нервам передается к дыхательным мышцам, вызывая их сокращение. Степень растяжения легких и сокращения дыхательных мышц контролируется механорецепторами. Импульсы с этих рецепторов поступают по межреберным нервам, восходящим путям спинного мозга и по блуждающим нервам, достигают дыхательного центра, замыкают контур механорецепторного регулирования. Этот контур работает по принципу управления по отклонению. Установлена прямая линейная
зависимость между активностью эфферентной импульсации с механорецепторов и воздухо-наполненностью легких [Жданов В. А., 1976].
Второй контур регулирования дыхания — хе-морецепторный. Его отличительная черта — наличие датчиков, способных информировать дыхательный центр о конечном физиологически активном результате легочного газообмена — о газовом составе внутренней среды организма. Выделяют периферические (артериальные) и центральные (медуллярные) хеморецепторы. Артериальные хеморецепторы (гломус дуги аорты и каротидные гломусы) служат аварийным механизмом стимуляции дыхания при снижении напряжения кислорода, росте напряжения углекислого газа и концентрации ионов водорода в артериальной крови. Медуллярные хеморецепторы воспринимают изменения концентрации ионов Н и Рсо спинномозговой и внеклеточной жидкости мозга. Интеграция центральных и периферических стимулов осуществляется структурами моста головного мозга, причем предпочтение отдается медуллярным хемочувствительным структурам [Loescheke F., 1974]. Хеморецепторный контур работает по принципу обратной связи: отклонение регулирующих параметров воздействует так или иначе на дыхательный центр, а изменения дыхания приводят к уменьшению возникших отклонений.
В системе регуляции дыхания реализован и еще один принцип регулирования — по возмущению [Шик Л. Л., 1970]. Он заключается в том, что изменения вентиляции могут происходить еще до отклонения в газовом составе крови. Данные, полученные в ходе физических нагрузок, позволяют утверждать, что изменение активности внешнего дыхания до начала мышечной деятельности предупреждает предстоящие изменения легочного газообмена. Управление внешним дыханием по принципу возмущения осуществляется с помощью более центральных (в том числе и корковых) механизмов и может совершенствоваться путем тренировок. С этих позиций понятно значение методически правильно построенной дыхательной гимнастики во время предоперационной подготовки и в послеоперационном периоде, когда особое значение имеют оптимальный ритм и глубина дыхания при минимальных энерготратах.
Полагают, что, кроме указанных, существует и другой аспект построения регуляции дыхания. В его основе лежит принцип оптимальности функционирования при минимизации работы. Регуляция направлена на выбор оптимальной частоты и глубины дыхания и осуществляется поисковым способом. Параметры последующего дыхательного цикла программируются по результатам предыдущего. При этом дыхательный
69
центр контролирует эффект по механо- или хеморецепторным данным и возвращает всю систему в исходное состояние за минимальное время и при затрате минимума энергии [Dieuse L. et al., 1976]. Этот подход нуждается в дальнейшем экспериментальном обосновании.
Рефлекторные влияния с висцеральной плевры и рецепторов воздухоносных путей, баро- и хеморецепторов крупных сосудов, проприоре-цепторов скелетных мышц способствуют быстрой перестройке работы аппарата дыхания, наступающей раньше, чем изменится состав газовой среды респиронов (например, при стенозировании воздухоносных путей) или изменится состав крови в связи с поступлением кислых продуктов из областей нарушенного обмена.
С проблемой регуляции внешнего дыхания тесно связано клиническое понятие дыхательной недостаточности. Поскольку основной эффект внешнего дыхания и газообменной функции легких — артериализация венозной крови и удаление избытка углекислого газа — контролируется аппаратом регуляции, то реализация физиологического результата легочного газообмена будет зависеть от деятельности самого аппарата, возможностей внешнего дыхания и структурно-функционального состояния респираторной зоны легкого. Это, наряду с характером и продолжительностью патологического процесса в легких, выраженностью патологических последствий анестезии и операции, определяет пределы компенсации нарушения внешнего дыхания. Исходя из этих положений под дыхательной недостаточностью понимают «...состояние организма, при котором не обеспечивается поддержание нормального газового состава артериальной крови либо последнее достигается ненормальной работой аппарата внешнего дыхания, приводящей к снижению функциональных возможностей организма». Это определение дано 15-м Всесоюзным съездом терапевтов. Многие трудности интерпретации накопленных в последующем данных и разногласия в определении этого понятия обусловлены прежде всего тем, что при оценке нарушений дыхания опираются на выявление различного конечного физиологического результата, постоянство которого поддерживается дыханием: газовым составом артериальной крови, величиной реального транспорта кислорода, эффективностью тканевого обмена. Однако, опираясь только на исследование результата без изучения механизмов компенсации нарушения, которые снижают функциональные возможности организма, невозможно установить опасность нарушения для данного конкретного больного. Это утверждение особенно верно в случаях острого развития дыхательной недостаточности, которая в таких обстоятель
ствах сводится к нарушению легочного газообмена.
Острота возникновения дыхательных расстройств и их природа определяют необходимость выбора и интенсивности лечебных мероприятий. В некоторых случаях молниеносное (минуты) прогрессирование острой дыхательной недостаточности ставит под угрозу жизнь больного и вынуждает проводить реанимационные мероприятия с дополнением их специальными пособиями по восстановлению эффективного легочного газообмена. Нередко дыхательная недостаточность протекает остро (часы) и признаки ее прогрессирования заставляют наращивать объем лечебных мероприятий. Чаще она протекает подостро (дни) с постепенным регрессом нарушений легочного газообмена, особенно при профилактическом лечении. Реже дыхательная недостаточность носит приступообразный характер (при бронхиальной астме, повторных тромбоэмболиях) или возникает на фоне хронического легочного заболевания с нестойкой компенсацией дыхательных расстройств.
Точная диагностика вида острой дыхательной недостаточности проходит три этапа: определение глубины нарушений легочного газообмена, выявление основного функционального расстройства, определяющего развитие дыхательной недостаточности, полная патофизиологическая характеристика этого состояния. В большинстве случаев дыхательной недостаточности первостепенное значение имеет исследование РСОг и Ро. артериальной крови. По этим данным можно установить характер нарушения легочного газообмена (вентиляционное или паренхиматозное) и его глубину [Шанин Ю. Н., Костюченко А. Л., 1982]. Быстродействующие газоанализаторы (масс-спектрографы, хроматографы, капнографы) выдыхаемого воздуха, пневмотахографы и малоинерционные спирографы на следующем этапе функциональной диагностики позволяют определить ряд непосредственных и произвольных критериев, уточняющих особенности дыхательных расстройств. Эффективность и напряжение вентиляции определяют по величинам дыхательного объема, форсированного выдоха, мощности выдоха, коэффициенту использования кислорода, а также электрической активности дыхательных мышц и коэффициенту дыхательных изменений ударного объема при исследовании центральной гемодинамики с помощью интегральной реографии тела. Последовательное определение Рао, при дыхании воздухом, затем Ра0, и Расо при дыхании 100 % кислородом в течение 20 мин позволяет определить альвеолярно-артериальное различие для РОг, которое возрастает при увеличении «истинного» шунтирования крови в легких.
70
Такое сочетание клинического обследования больного и углубленного функционального исследования не всегда возможно даже в условиях специализированных пульмонологических стационаров. Более доступен ограниченный объем исследований, например анализ артериальной крови, результаты которого не следует абсолютизировать. Так, один и тот же уровень артериальной гипоксемии (при паренхиматозных нарушениях) может неодинаково переноситься различными больными и обусловливать необходимость различных по интенсивности лечебных мероприятий. При остром развитии артериальной гиперкапнии в 60 мм рт. ст. вопрос о необходимости немедленного перевода больного на ИВЛ не вызывает сомнений, а при хронической легочной недостаточности с таким уровнем РаСОг больные живут долго, во всяком случае, до следующего обострения. Поэтому наряду с определением степени нарушения легочного газообмена, которое соответствует обычному понятию дыхательной недостаточности, следует использовать понятие «несостоятельность дыхания».
Несостоятельность дыхания — это клиническая характеристика патологических явлений, при которых физиологические механизмы достижения конечного результата функции дыхания (обеспечение тканевого обмена 0%) при данном уровне нарушений легочного газообмена стали несостоятельными и прогрессируют в направлении глубоких расстройств жизненно важных функций (кровообращения, нервной деятельности) с опасностью развития терминального состояния. Темп развития этих явлений и возможности восстановления физиологических механизмов достижения конечного результата дыхания определяют прогноз лечения данного больного.
Для понимания расстройств газообменной функции легких необходимо иметь представление не только об участии в ее осуществлении аппарата внешнего дыхания и аппарата регуляции дыхания, но и о состоянии защитных факторов легких.
ЗАЩИТНЫЕ ФАКТОРЫ ЛЕГКИХ
Различают неспецифические и специфические (иммунные) защитные механизмы. К первым относят аэродинамическую фильтрацию, кашель, движение слизи по воздухоносным путям за счет физических законов или благодаря активности мерцательного реснитчатого или цилиарного эпителия, растворение, детоксикацию и склеивание ингалированных частиц постоянными фагоцитами и легочными альвеолярными макрофагами [Трещинский А. И., Тро-цевич В. А., 1979].
Турбулентность, возникающая при прохождении воздушного потока через дыхательные пути, способствует удалению значительного количества механических частиц диаметром более 2—3 мкм. В результате инерционного столкновения они быстро укрупняются и оседают на поверхности слизистой оболочки бронхов. Анатомическая особенность бифуркационно-трубчатой архитектоники бронхиального дерева способствует такой аэродинамической фильтрации. Попутно в крупных бронхах из вдыхаемого воздуха адсорбируются и раздражающие газы (аммиак, двуокись серы, хлор). Все это защищает диффузионную мембрану от большинства крупных частиц, взвешенных в воздухе. Аэродинамичесая фильтрация может быть изменена рядом факторов окружающей среды. Увлажнение вдыхаемого воздуха усиливает гигроскопичность частиц с отложением их в более верхних отделах бронхиального дерева. Большинство более мелких частичек и часть крупных эвакуируются мукоцилиарным покрытием бронхов и кашлевым механизмом. Эти два механизма защиты взаимосвязаны.
Мукоцилиарный эскалатор — важнейший защитный фактор легких. Плотно прилегая друг к другу, реснитчатые эпителиальные клетки выстилают внутреннюю поверхность воздухопроводящей зоны от трахеи до терминальных бронхиол. В месте перехода терминальных бронхиол в дыхательные реснитчатый эпителий резко обрывается и переходит в однослойный плоский. Эти особенности определяют и различия очищения воздухопроводящей и респираторной зон. В тех случаях, когда частицы оседают на слизистой оболочке, покрытой реснитчатым эпителием, они переносятся к трахее течением слизи вдоль дыхательных путей за счет волнообразного мерцания ресничек: биение каждой реснички сочетается с последовательным сокращением другой.
Деятельность ресничек осуществляется циклически: их активные движения чередуются с паузами в соотношении 1:4. Количество слизи, ее вязкость, другие физические свойства, определяющие способность к ретракции комка слизи, имеют значение для систематического ритмичного мерцания. Оно направлено в одну сторону: от респираторной зоны до межчерпаловидного пространства гортани, где слизь выкашливается или заглатывается. Примерно 90 % осевших на бронхиальной слизи частиц эвакуируется (при нормальном состоянии мукоцилиарного эскалатора) в первый час после оседания [Nagaishi С., 1976], что обеспечивается большой скоростью движения слизи: 0,5— 1 мм/мин в бронхиолах и 15—20 мм/мин в трахее. При этом слизь может транспортировать частицы массой до 10—12 мг.
71
Реснички не могут сокращаться без покрывающей их слизи. В то же время показано, что мукоцилиарная активность зависит от ритмичного перистальтического сокращения бронхов, связанного с дыханием. Именно деятельность цилиарного эпителия и одновременной перистальтики бронхов образует защитный механизм, который носит название мукоцилиарного «эскалатора».
По современным представлениям, слизистый компонент мукоцилиарного эскалатора представляется не в виде непрерывного «слизистого одеяла», а распределен дискретно в форме микрочастиц, состоящих из двух слоев — внутреннего серозного, жидкого — золя и внешнего (по отношению к стенке бронха), густого — геля. Толщина золя может варьировать от мо-номолекулярного до такого, в который погружена вся ресничка. Частицы геля транспортируются на уровне кончиков ресничек.
Продуцентами слизи служат секреторный эпителий слизистых и серозных желез крупных бронхов и бокаловидные клетки — мелких. В состав слизи, кроме того, входит сурфактант, поступающий из респираторной зоны, составные части плазмы (альбумин, фибриноген) и секретируемые местно белки: иммуноглобулины, протеазы, а также муцин, который представлен гликопротеидами с низким содержанием белка, значительным количеством сиаловой кислоты, и нуклеиновые кислоты, в частности ДНК. Введение атропина и дыхание сухими газовыми смесями в течение длительного времени приводят к высушиванию слизистой оболочки даже при отсутствии системной дегидратации и угнетают мукоцилиарную активность (Burton J., 1962; Annis Р. et al., 1976). Высыхание слизи ведет к разрушению эскалатора, а его «обломки» (корки высохшей слизи) обтурируют дыхательные пути.
Мукоцилиарный эскалатор значительно повреждается при курении: табачный дым не только парализует деятельность ресничек на несколько часов после каждой выкуренной папиросы, но и нарушает архитектонику эпителиальной выстилки бронхов. Метаплазия цилиарного эпителия в плоский под влиянием хронического курения заметно и на долгий срок нарушает мукоцилиарную активность после полного прекращения курения.
Незначительное механическое воздействие (например, проведение по слизистой оболочке хлопковой нитью) влечет за собой потерю ресничек; действие эскалатора в этом месте прерывается. Более значительное повреждение (простое введение аспирационного катетера) сопровождается отторжением всей толщи цилиарного эпителия, нарушением архитектоники всего многорядного слоя, обширной десквама-
цией в первые часы после повреждения. А на репарацию его требуется более 3 сут. Это доказывает необходимость самого дифференцированного подхода в показаниях к эндобронхиальным манипуляциям («слепой» назотрахеальной аспирации, промыванию бронхов, чрескожной катетеризации трахеи, бронхоскопии и др.), которые еще недавно широко пропагандировались для борьбы с гиперсекрецией и задержкой мокроты. Большим вниманием должны пользоваться методы, повышающие эффективность естественных механизмов очищения бронхиального дерева.
При уменьшении эффективности мукоцилиарного эскалатора кашель становится основным механизмом эвакуации бронхиального секрета. С физиологической точки зрения, кашель — мощный рефлекторный выдох через частично суженную голосовую щель. Он вызывается раздражением окончаний блуждающего нерва в крупных и средних бронхах скопившейся слизью, патологическим материалом и ингалированными частицами. Чем ближе к респираторной зоне легкого, тем менее выражена чувствительность к раздражению. Кашель также может быть произвольным или вызываться раздражением слизистой оболочки глотки, пищевода, плевры, выстилки наружного слухового прохода. Надавливание на передний край трапециевидной мышцы, надбровье или введение пальца за грудину (прием Cullen) также вызывают кашель.
В силу наличия коллатеральной вентиляции и действия поверхностно-активных веществ при глубоком вдохе в первую фазу кашлевого акта объем газа в респиронах возрастает даже при обтурации бронхиол. Последующее воздействие спадающейся грудной клетки и быстрый подъем диафрагмы настолько увеличивают давление в респиронах, что пробки из бронхиол выдавливаются в воздухоносные пути большего калибра, откуда они удаляются при последующих кашлевых толчках. Возможность смещения пробок лежит в основе эффектов перкуссионного или вибрационного массажа, широко применяемого в практике интенсивной тепапии для предупреждения и лечения микроателек-тазирования [Шанин Ю. Н. и др.„ 1978; Гологорский В. А. и др., 1981].
Для выполнения совершенного кашля больной должен иметь возможность значительно повышать объем легких, плотно закрывать голосовую щель и иметь достаточно мощные в функциональном отношении мышцы выдоха при фиксированном каркасе грудной клетки. Поэтому у больных с диффузным фиброзом легких или ограничением вдоха другого генеза, с параличом голосовых связок, при повреждении диафрагмального нерва или костного остова груд
72
ной клетки, с дряблой или поврежденной передней стенкой живота, некупированным болевым синдромом эффективность кашлевого акта значительно снижена и нередко полностью отсутствует. Принуждение таких больных к кашлю или использование рефлекторных способов его стимуляции совершенно бесполезны.
Механизмы очищения респираторной зоны существенно отличаются от характерных для воздухопроводящей зоны. Очищение легочных структур, расположенных дистальнее терминальных бронхиол, занимает от нескольких дней до нескольких лет. Выделяют следующие возможности очищения респираторной зоны.
Нерастворимые частицы могут выноситься током альвеолярной жидкости из просвета респиронов к мерцательному эпителию терминальных бронхиол с дальнейшим транспортом на мукоцилиарном эскалаторе. Они могут поглощаться в просвете респиронов альвеолярными макрофагами, которые затем мигрируют через интерстиций в специализированные лимфоэпителиальные структуры, расположенные на уровне терминальных бронхиол на поверхности мукоцилиарного эскалатора. В противоположность этому хорошо растворимые вещества проникают в кровеносные сосуды; при этом кислоты нейтрализуются в связи с основной реакцией легочной паренхимы [Murrow Р., 1971]. Еще один путь — адсорбция в интерстиций и перенос к конечным лимфатическим сосудам, в последующем — к прикорневым и паратрахеаль-ным лимфатическим узлам. Некоторые из частиц перемещаются по току интерстициальной жидкости к плевре и задерживаются на долгий срок в субплевральной периваскулярной и интерстициальной ткани воздухопроводной зоны, создавая особые формы легочной патологии (гемосидероз, антракоз, асбестоз и т. д.). Наконец, некоторые из частиц могут располагаться внутри альвеолоцитов.
Этим не исчерпываются неспецифические защитные факторы легких. Так, бронхиальная слизь имеет защитное значение не только как необходимое условие действия мукоцилиарного эскалатора, но и в силу своей антибактериальной и противовирусной активности. В значительной степени эта функция слизи определяется компонентами ферментной защиты, к которым относят лизоцим, лактоферрин, интерферон, пирогены, неспецифические ингибиторы протеиназ и др. Эти факторы секретируются клетками слизистой оболочки бронхов, макрофагами, нейтрофилами и лимфоцитами.
Наличие воспалительного вала (шов бронха, пролежень выстилки трахеи или бронха на месте стояния интубационной трубки) не только прерывает движение слизи, но и создает условия для размножения в ней микроорганизмов.
Вместе с экссудатом, разрушенными клеточными элементами и активными полинуклеара-ми слизь приобретает новое качественное состояние — она становится мокротой. Значение микробного компонента в такой трансформации существенно, и чаще всего оно определяется дефицитом иммунных факторов защиты легких.
К общим иммунным факторам защиты легких относят естественные антитела и комплемент, обычно содержащиеся в бронхиальной слизи. Основная их роль — контроль за микрофлорой дыхательных путей, ограничение ее размножения и рассеивания из верхних в нижние отделы воздухопроводящей зоны. В норме непатогенные микроорганизмы (коменсалы, сапрофиты) легко фагоцитируются и разрушаются макрофагами именно благодаря действию естественных антител. Они же осуществляют защиту от патогенных микроорганизмов путем их прямого лизиса при участии системы комплемента. Антимикробное действие этих факторов: фагоцитоз альвеолярных макрофагов и нейтрофилов слизистой оболочки воздухоносных путей, наличие в слизи естественных антимикробных субстанций (лизоцим, лактоферрин и др.) — усиливается наличием специфических иммунных факторов защиты легких.
Местные иммунные механизмы легких и дыхательных путей играют важную роль в защитном ответе на антигенную информацию. С другой стороны, повышенная местная чувствительность к антигенам, поступающим с ингалированным воздухом или по кровотоку, может привести к патологическим процессам, нарушающим функцию легочного газообмена (аллергический альвеолит, бронхиальная астма и другие формы бронхоспастического синдрома) [Комаров Ф. И. и др., 1979]. Макрофаги принимают участие лишь в подготовке антигенов к превращению их в иммуногенную форму. Наиболее существенна роль лимфоидной ткани, которая размещена вдоль всей воздухопроводящей зоны — от носоглотки до дыхательных бронхиол.
Местные иммунные ответы в легких отличаются от системных, что определяется действием как гуморальных, так и клеточных факторов. Местный гуморальный иммунитет рассматривают как доминирующий защитный механизм против дыхательной пиогенной инфекции, в то время как клеточный имеет большое значение в реакции организма против внутрилегочных (бактериальных и вирусных) возбудителей.
Полагают, что причиной нарушения специфических защитных механизмов легких чаще являются вторичные, т. е. приобретенные, иммунодефициты. К числу возможных этиологических факторов приобретенной иммунной недо
73
статочности относят хронические лимфопролиферативные заболевания, злокачественные опухоли, белковую недостаточность, лучевое поражение, влияние некоторых лекарственных препаратов.
В реакциях клеточного иммунитета в легких имеют значение не только подвижные клетки. Исследования J. Laweryns, J. Baert (1977) показали существенную роль фиксированных клеток и эндотелия конечных лимфатических сосудов. Именно клетки лимфатических сосудов, а не эндотелий кровеносных капилляров, обладают высокой эндоцитотической активностью, включая абсорбцию, аккумуляцию и переваривание абсорбированного материала, что считается их важным функциональным отличием. Это позволило сравнивать эндотелиальные лимфатические клетки легких с купферовскими клетками печени и считать, что они относятся к РЭС или к так называемой мононуклеарной фагоцитарной системе.
Специфические факторы защиты снижаются (несмотря на свою многогранность) под действием многих экзогенных и эндогенных факторов — алкоголизма, кортикоидной терапии, высокой концентрации кислорода, уремии, ацидоза. Такие факторы, как стресс, падение периферического кровотока в легких при шоке, применение вазопрессоров, общая анестезия, лекарственная терапия, могут изменять и извращать иммунные реакции у оперированных больных.
НЕГАЗООБМЕННЫЕ ФУНКЦИИ ЛЕГКИХ
ТЕПЛООБРАЗУЮЩАЯ
И ТЕПЛОРЕГУЛИРУЮЩАЯ
ФУНКЦИЯ ЛЕГКИХ
Теплопродукция в целостном организме связана с определенными биохимическими превращениями энергетического материала в процессах, сопряженных с дыханием. В обычных условиях химическая теплопродукция зависит от сокращения произвольных и непроизвольных мышц (терморегуляционный тонус мышц, холодовая дрожь) и от так называемого несократительного термогенеза [Иванов К. П., 1965]. Считается, что для оптимальной теплопродукции необходимо достаточное обеспечение кислородом и энергетическими субстратами мышц. Тем не менее свойство поддерживать постоянство температуры внутренней среды у человека сохраняется и при значительных нарушениях этого обеспечения (при гипоксии, голодании).
Долгое время легкое и воздухоносные пути рассматривали только как орган терморегуляции, при котором отдача тепла происходит за счет испарения с огромной поверхности раздела с воздушной средой. Сейчас доказано, что
Рис. 40. Терморадиационный эффект легких при травматическом шоке.
К — контроль; Шв — у пострадавших с шоком, но выживших; ШуМ — у пострадавших с шоком, но умерших. 1 — выделяемое тепло, кал/мин; 2 — средняя температура выдыхаемого воздуха, °C.
в отличие от других органов, теплопродукция которых зависит от окисления углеводов и аминокислот, легкие являются органом химической теплопродукции, сопровождающей обменные процессы в этом органе. Имея низкий основной обмен, легкие могут повышать его в 8—9 раз при развитии гипоксических состояний, задерживая и расщепляя жиры и окисляя НЭЖК.
Именно этой особенностью функционирования легких объясняется «гипоксический парадокс»— явление неизменного или повышенного потребления организмом Ог в условиях гипоксии.
Участию легких в тепловыделении отводится более скромная роль: на это приходится всего 15 % тепла, теряемого организмом. Однако тепловой поток из легких концентрируется в узком коридоре, образуемом дыхательными путями. Это позволяет регистрировать его и использовать с диагностической целью при критических состояниях. Ю. Н. Цыбин, В. Н. Лапшин (1982) показали возможность использования теплорадиационной возможности легких для оценки тяжести травматического шока и степени повреждения респираторной зоны (рис. 40). Изменение функционирующей диффузионной поверхности в связи с прямым повреждением легких мало отразится на температуре крови в легочной артерии, но в силу изменения теплообразующей функции легких существенно повлияет на количество выделяемого при дыхании тепла, среднюю температуру выдыхаемых газов. Также возрастает разница между средней и максимальной температурой в газовом потоке, поступающем из легких при выдохе (рис. 41).
74
Рис. 41. Терморадиационный эффект легких у пострадавших со скелетной травмой (СТ) и изолированной травмой грудной клетки, осложненной шоком (ТТ).
Обозначения те же, что на рис. 40.
Из вышеизложенного вытекает ряд практических выводов для ведения послеоперационного периода после травм легкого и вмешательств на легких. Больной с тяжелой гипоксией в остром периоде должен часто получать горячие ингаляции или находиться в теплой влажной атмосфере, чтобы уменьшить теплоотдачу с поверхности дыхательных путей. Перегрузки рациона жиром или вливание жировых эмульсий следует применять осторожно, чтобы не усиливать «гипоксический парадокс» и не повышать кислородное голодание других тканей. Наоборот, после купирования острой гипоксии необходимы свежий воздух и увеличение жирового компонента диеты.
ВОДНО-СОЛЕВОЙ ОБМЕН
И ЛЕГКИЕ
В обычных условиях путем перспирации теряется 0,5—0,75 л воды за сутки. Пропотевая из сосудов малого круга в респираторную зону и из большого — в воздухопроводящую зону, это количество жидкости удаляется из организма в процессе вентиляции. Гипервентиляция, дыхание ртом или через трахеостому могут увеличить это количество жидкости в 5—6 раз.
Водно-солевой обмен в самих легких определяется движением жидкости через альвеолярно-капиллярную мембрану и зависит как от особенностей тканевого дыхания в этом органе, так и от состава циркулирующей жидкости. Он определяется также особенностями паракапил-лярной циркуляции в зоне легочных капилляров. Установлено, что все биохимические систе
мы, регулирующие это перемещение, метаболически зависимы и поэтому в ряде случаев изменение обмена воды в легочной перенхиме может стать причиной отека легких, и, наоборот, отек легких, нарушая продукцию поверхностноактивных веществ, расстраивая тканевой обмен, вторично углубляет задержку воды в легочной паренхиме.
При нормальном состоянии легких вода, попавшая в респираторную зону, быстро, в течение минут, может всасываться в кровоток, чему способствует различие между онкотическим (25—30 мм рт. ст.) и гидростатическим (8— 10 мм рт. ст.) давлениями крови в легочных капиллярах. Эта способность поглощать воду исключает необходимость традиционных приемов удаления воды из легких при утоплении и является обоснованием введения медикаментов в легкие при недоступности вен. Через легкие можно вводить атропин, адреналин, инсулин, лазикс и другие водорастворимые препараты с помощью ингаляции мелкодисперсного аэрозоля, несколько хуже — вливая раствор в интубационную трубку или путем прокола трахеи, что следует использовать и при проведении реанимации [Цыбуляк Г. Н., 1979].
Легкие оказывают влияние на осмолярность внутренней среды организма в связи со значительной осмоэкскрецией: в течение суток через легкие удаляется 15—30 осмомолей углекислого газа по сравнению с 0,5—1 осмомолем всех солей, удаляемых почками. Не меньшее влияние оказывают легкие на кислотно-основное состояние [Шанин Ю. Н., Костюченко А. Л., 1969], с которым теснейшим образом связан транспорт углекислого газа в организме.
Среди трех механизмов, стойко удерживающих активную реакцию крови на постоянном уровне,— буферной емкости крови, экскреторной функции почек и вентиляции легких,— последний является наиболее мощным. Возможно, и эта сторона деятельности организма способствует внутриорганной нормализации водного баланса.
В связи с легочным кровотоком и общим балансом воды и электролитов в организме в легких постоянно образуется так называемая вне-сосудистая вода, состоящая из межклеточной жидкости и жидкостного слоя, выстилающего альвеолы. Ее количество составляет не менее 60 % от массы легких [Зильбер А. П., 1977]. Как только изменяется легочный кровоток, изменяется и объем внесосудистой воды в легких. Так, при постгеморрагической гипотензии, сопровождающейся повышением легочно-сосудистого сопротивления, этот показатель возрастает до 88 % от массы органа, хотя общее количество воды в организме практически не изменяется.
75
Для нормализации содержания внесосудистой жидкости определенное значение имеет лимфатический дренаж легких, который в значительной степени регулирует объем межклеточной жидкости, белковый и электролитный обмен в этом органе.
В физиологических условиях фильтрация, абсорбция и лимфатический дренаж уравновешены, поддерживая достаточно стабильный объем интерстициальной и внутриальвеолярной жидкости. Нарушения этого равновесия при трансфузионной микроэмболии приводят к задержке жидкости, ухудшая механические свойства легкого, нарушая условия газообмена и кислородного транспорта [Лыткин М. И. и др., 1980].
ФИЛЬТРАЦИОННАЯ
ФУНКЦИЯ ЛЕГКИХ
Легкие являются мощным фильтром, очищающим смешанную венозную кровь от конгломератов клеток, свертков фибрина, капель жира, пузырьков воздуха и других эндогенных и экзогенных субстратов. Расположение легких между правой и левой половинами сердца и прохождение через легкие практически всей массы циркулирующей крови обеспечивают очистку крови от механических примесей, предупреждая эмболизацию ими сосудов большого круга.
Легочная сосудистая сеть стабилизирует уровень лейкоцитов и тромбоцитов в крови, легко иммобилизуя аллогенные кровяные клетки. Отсюда сомнения относительно ценности применения лейкотромбовзвеси, приготовленной из донорской крови.
Этот фильтр задерживает даже бактерии, размер которых отчетливо меньше сечения легочного капилляра. Такое свойство легочных капилляров объясняется их способностью изменять диаметр и форму сечения, возможностью увеличивать адгезивность эндотелиальной стенки, наличием особых «шпор» в области бифуркации микрососудов, позволяющих отклонять ток крови и закрывать их просвет [Поликар А., Гали П., 1972].
Но легкие — не просто фильтр механической очистки: задержанные органические субстанции подвергаются в легких перевариванию.
РОЛЬ ЛЕГКИХ В РЕГУЛЯЦИИ СВЕРТЫВАНИЯ И ФИБРИНОЛИЗА КРОВИ
Легкие существенно влияют на свертывание крови не только благодаря своему регулирующему влиянию на концентрацию тромбоцитов. Этот орган богат тромбопластином — фосфоли
пидным комплексом, способствующим превращению протромбина в тромбин. Некоторые авторы даже связывают большую частоту тромбоэмболических осложнений при раке легких именно с повышенной продукцией пораженными легкими этого вещества. Легкие продуцируют и другие кофакторы свертывания (антиге-мофильный глобулин А, фактор VI).
В то же время этот орган богат и факторами антисвертывающей системы, прежде всего гепарином, который продуцируется тучноклеточным аппаратом респиронов. Гипоксия, ацидоз, воспаление приводят к недостаточности продукции эндогенного гепарина, усиливают гиперкоагуляцию, адгезию и агрегацию форменных элементов в зоне легочной микроциркуляции. Отсюда понятна целесообразность применения заместительной терапии экзогенным гепарином при длительно не разрешающихся пневмониях, прогрессирующем уплотнении легкого при шоке и т. д.
В легких содержатся в большом количестве и активаторы, превращающие тканевой и кровяной плазминоген в плазмин. Тем самым легкие и приобретают свойство воздействовать на задержанные в них тромбы. Одновременно этот механизм поддерживает фибринолитическую активность всей циркулирующей крови: в критических ситуациях, протекающих с гипоксией, на фоне несовершенного обезболивания [Плешаков В. Т„ 1964; Соловьев Г. М. и др., 1970, и др.] развивается фибринолизный криз. Нарушения внутрилегочных механизмов регуляции свертывающей системы крови играют важную роль в развитии тромбоэмболии и тромбоза ветвей легочной артерии, жировой эмболии легких, синдрома дыхательных расстройств при травматическом или септическом шоке.
ЛЕГКИЕ И БИОЛОГИЧЕСКИ
АКТИВНЫЕ ВЕЩЕСТВА
Пропуская через себя всю циркулирующую кровь, легкие служат местом приложения действия биологически активных веществ и участвуют в их метаболизме [Cillis С., 1973]. Как и в отношении регуляции свертывающей системы, легкие играют роль функционального фильтра, регулируя содержание в крови гистамина, серотонина, катехоламинов, кининов и простагландинов. Многие стороны этого явления до конца не раскрыты, но значение такой регуляции для функционирования легких и всего организма несомненно.
Так, легкие синтезируют гистамин из гистидина [Гончарова В. А., Сыромятникова Н. В., 1978], но инактивируют лишь небольшое количество этого амина, поступившего с венозной кровью. Не вызывает сомнения участие гиста
76
мина и других биологически активных полипептидов в механизмах и клинических проявлениях отека легких, бронхиальной астмы [Заль-бер А. П., 1977]. Гистамин влияет и на механику дыхания: даже у здоровых людей он отчетливо повышает неэластическое сопротивление легких, снижает объем форсированного выдоха и жизненную емкость [Newhall J., Keiser S„ 1973].
Легкие синтезируют и одновременно избирательно извлекают из циркулирующей крови серотонин, инактивируя, в отличие от гистамина, 95 % вещества, поступившего в малый круг кровообращения. Скорость этой реакции зависит от температуры тела, интенсивности окислительных реакций и гликолиза в легочной ткани: инактивирование серотонина требует значительных затрат энергии [Gzuby L. er al., 1971; Steinberg R. et al., 1975].
Фенотиазины, опиаты, ингибиторы монооксидаз и трициклические антидепрессанты тормозят инактивацию серотонина, особенно на фоне гиперкоагуляции, когда снижена концентрация его естественного антагониста — гепарина. При тромбоэмболии происходит локальное освобождение серотонина из тромбоцитов, особенно значительное при продолженном тромбозе. Снижение метаболизма серотонина в респираторной зоне на фоне ишемии ухудшает течение патологического процесса вследствие усиления агрегации тромбоцитов, генерализованного бронхиолоспазма, сосудистого коллапса в большом круге кровообращения, активной вазоконстрикции легочных артерий и вен. Уже поэтому оправданно в таких ситуациях срочное введение антагонистов серотонина и, прежде всего, гепарина.
Патология легких различного характера может замедлять процессы инактивации серотонина и увеличивать выброс гистамина, что может влиять на кровообращение в легком во время операции [Гимельфарб Г. Н. и др., 1981]. Так, при хронических гнойных заболеваниях легких (в отличие от опухолевых) отмечено снижение инактивации серотонина. Поэтому к концу операции у этих больных концентрация полипептида в артериальной крови возрастает. Обнаружена положительная корреляция между средним давлением в легочной артерии и концентрацией этого вазоактивного вещества в крови.
Легкие могут как синтезировать катехоламины, так и регулировать их содержание в крови. В респираторной зоне легкого обнаружены все основные компоненты биосинтеза этих гормонов и все необходимые ферменты [Гончарова В. А., Сыромятникова Н. В., 1969]. Оказалось, что дофамин и адреналин свободно проходят через легочный сосудистый фильтр, а нор
адреналин задерживается и довольно быстро разрушается в легочной паренхиме. Легкие извлекают за один кругооборот крови 20—25 % норадреналина. Гипотермия, наркоз, искусственное кровообращение, адреноблокаторы снижают метаболическую активность легких в отношении норадреналина, усиливают гипоксическую легочную вазоконстрикцию. При этом, чем глубже наркоз, тем больше норадреналина проходит через легкие. Системная адреноблокада, как и регионарная симпатическая блокада (перидуральная анестезия), увеличивает альвеолярный шунт, снижая Рао [Соловьев Г. М. и др., 1973].
Легкие играют существенную роль в обмене кининов: они обладают высокой калликреино-вой активностью и содержат в больших количествах как кининоген, так и ингибитор калли-креина — трасилол, способный к образованию и инактивации брадикинина. Выброс брадикинина происходит под влиянием различных патологических состояний, включая отек легких, анафилактический, геморрагический и септический шок [Лыткин М. И. и др., 1981]. Пароксизмальный выброс брадикинина наблюдается при карциноидном синдроме, клинические проявления которого во многом определяются уровнем концентрации брадикинина в крови [Oates S. et al., 1974]. Кинины могут вызвать выделение катехоламинов легкими, принимают активное участие в реализации реакций, сопровождающих тромбоэмболию. Они действуют избирательно на легочный кровоток: в небольшом количестве увеличивают давление в сосудах (артериолах и венах) малого круга кровообращения, в большом — снижают его. Это различие в действии зависит, по-видимому, от того, что ферментная инактивация кининов в легких определяется ангиотензин-конверта-зой, которая принимает участие в образовании другого вазоактивного полипептида — ангиотензина II из неактивного ангиотензина 1. Легкие считаются единственным крупным органом, не инактивирующим ангиотензин II, поэтому загрузка ферментной системы избытком кинина выключает синтез этого вазоактивного вещества со снижением легочного сосудистого давления.
В инактивации кининов, наряду с кининоингибирующими ферментами, важную роль играют поверхностно-активные вещества. Однако, если в условиях здорового организма их количество в гипофазе достаточно для инактивации полипептидов, попавших в легкие с током крови, то при септических процессах, когда уровень кининов и протеолитических ферментов в венозной крови резко возрастает, сам сурфактант начинает разрушаться, не успевая справляться с избытком кининов [Ивашкевич Н. Г., Хим
77
ка А. С., 1983]. Можно думать, что замедление расправления легкого, оперированного до подавления активности распространенного гнойного процесса в нем, имеет тот же генез.
К негазообменным функциям легких следует отнести синтез и инактивацию простагландинов — жироподобных веществ, производных пропионовой кислоты, являющихся по своей структуре ненасыщенными жирными кислотами.
Легкие играют исключительную роль в метаболизме циркулирующих простагландинов. Установлено, что до 85—90 % простагландинов Е и Е2опри прохождении через малый круг кровообращения исчезают из крови, тогда как простагландины Ai и Аг остаются в артериальной крови в неизменной концентрации.
Существенна роль простагландинов в формировании газообменной функции легких в условиях гипоксии, микроэмболии в системе легочной артерии при воспалительных процессах в легких.
КЛИНИЧЕСКАЯ
ФИЗИОЛОГИЯ ПЛЕВРЫ
Плевре принадлежит важная роль в функциональной организации внешнего дыхания и нормальном функционировании респираторной зоны легких.
Плевре придается важное значение в осуществлении всей биомеханики дыхательного акта. Особенно четко это прослеживается при патологических процессах, захватывающих плевру.
Отрицательное давление, равномерно распределяющееся по всей свободной плевральной щели во время вдоха, играет существенную роль в присасывающем действии грудной клетки, влияет на крово- и лимфоток в легких, так же как и на деятельность сердечно-сосудистой системы. Как только это давление исчезает (например, вследствие скопления жидкости или воздуха), нарушается не только биомеханика дыхания, но и снижаются барьерные возможности плевры.
Плевра обладает функцией гистогематиче-ского барьера, защищающего организм от токсических веществ, образующихся при системных или местных нарушениях тканевого обмена. Париетальный и висцеральный листки плевры объединены общностью барьерной функции, которая неразрывно связана с циркуляцией внутриплевральной жидкости. Оба плевральных листка осуществляют свою барьерную функцию с помощью бесклеточных структур (в том числе и эластических и коллагеновых волокон), клеточных элементов мезотелия и
сосудистого эндотелия, а также мигрирующих сюда (при воспалении и других патологических состояниях) клеточных элементов, выполняющих функцию защиты. К этим элементам могут быть отнесены как ретикулиновые клетки, так и образующиеся из них гистиоциты с высокими адсорбционными фагоцитарными и детоксикационными свойствами [Билец-кий В. К., 1966].
Хотя защитное действие фиксированных и подвижных клеток плевры по отношению к токсинам и микроорганизмам представляется довольно четко, роль бесклеточного вещества плевры также несомненна. Так, ретикулярные волокна серозных оболочек в результате поверхностного натяжения задерживают в своей мелкоячеистой сети тканевую жидкость при ее избыточном образовании. Базальная мембрана мезотелия с ее аморфным межуточным веществом может выполнять роль мощного фильтра, в котором задерживаются и накапливаются продукты обмена. Субмезотелиальный слой ретикулярной ткани выполняет реактивную и защитную функции в случаях десквамации и декомплексации мезотелия и при нарастании воспалительного процесса на плевре. Именно этот слой выполняет пластическую роль в процессах, изолирующих инфекционный очаг и ограничивающих его распространение по плевральной щели. Соединительнотканные структуры плевры и мезотелий играют решающую роль в защитных иммунологических реакциях.
При просачивании через них экссудата они задерживают и обезвреживают токсические продукты и микробы, препятствуя их поступлению в общую циркуляцию.
Париетальная плевра в обычных условиях представляет собой редуцированный барьер в силу наличия в ней «люков», что облегчает всасывание из плевральной щели. Но как только возникает воспаление и на поверхности плевры откладываются пласты фибрина, люки закрываются, и барьерная функция ее возрастает [Теппер П. А., 1960] вследствие увеличения времени воздействия факторов обезвреживания инфекта и токсинов, а также уменьшения резорбции микробов и продуктов их жизнедеятельности. Наоборот, быстрое восстановление всасывательной способности париетальной плевры уменьшает ее барьерные свойства, что проявляется повышением температуры тела и другими признаками интоксикации. Одномоментное поступление значительного количества бактериальных токсинов и продуктов тканевого распада может резко усилить интоксикацию, вызвать различные ответные реакции организма вплоть до развития септического шока.
78
Барьерная функция плевры неразрывно связана с циркуляцией внутриплевральной жидкости.
Висцеральная плевра является продуцентом плевральной жидкости, которая поступает непрерывно из зоны микрососудов. Передвижение тканевой жидкости из глубины на поверхность легкого постоянно; оно регулируется дыхательными движениями грудной клетки и легкого. При физическом напряжении и углублении дыхания количество транссудата увеличивается. Одновременно возрастает и его всасывание париетальной плеврой. При вдохе и растяжении грудной клетки компактно прикрепленные к ребрам участки плевры остаются неизмененными, плевра межреберий, так же как и диафрагмальная плевра, на которой имеются «люки», широко растягивается, создавая «мик-ровакуумы» в этих зонах. Сюда устремляются потоки жидкости из плевральной полости, заполняя камеры «люков». При выдохе и спадении растянутой на вдохе плевры эти камеры сдавливаются, а скопившаяся в них жидкость скользящим движением плевры вдавливается в «люки». Степень присасывания и интенсивность транссудации больше в более низких отделах плевры. При наличии только микроскопического слоя жидкости, обеспечивающего тесный контакт париетального и висцерального листков плевры, последние соединяются в единый функциональный комплекс — «грудная клетка — париетальная плевра — висцеральная плевра — легкое». Нарушение этого функционального единства в силу усиления транссудации жидкости легкими или замедления ее всасывания вследствие блокады «люков», попадания воздуха, крови, хилезной жидкости разъединяет оба листка, изменяет градиенты давления в полости плевры и может способствовать избыточному накоплению жидкости.
Введенные в плевральную полость бактерии в незначительной степени проникают в легочную и медиастинальную плевру, а удаляются из плевральной щели через всасывающие «люки» реберной плевры. Закрытие «люков» фибрином и размножение бактерий в полости плевры резко усиливают пропотевание жидкости в связи с действием бактериальных токсинов на состояние бесклеточного вещества обоих плевральных листков и на проницаемость стенки микрососудов. Мигрирующие в полость клетки крови, прежде всего нейтрофилы и лимфоциты, превращают транссудат в экссудат, причем париетальная плевра (как и висцеральная) в силу фиксации бактерий в «люках» и фиброэластическом слое становится источником поступления инфекта в плевральную полость, поддерживает воспалительный процесс. Это считается
обоснованием необходимости ранней плевр-эктомии у больных с гнойным плевритом [Горшков Ю. И. и др., 1981].
Но даже при самых глубоких расстройствах циркуляции плевральной жидкости (при эмпиеме после пневмонэктомии) плевральная полость сохраняет определенные возможности саморегуляции состава этой жидкости. Попытки навязать этот состав, смоделировать по своему желанию после самого тщательного промывания и заполнения искусственным коллоидным кровезаменителем оказались безуспешными. На другой день после такой процедуры солевой, белковый и углеводный и даже клеточный состав экссудата близко соответствовал тому, который был установлен до промывания.
Проблема воздействия на всасывательную способность плевры смыкается еще с одной, важной для практики хирургии легких и плевры функциональной особенностью этой структуры. Это способность серозных оболочек грудной клетки сообщать крови, излившейся в полость плевры, сохранять жидкое состояние за счет разрушения образующегося в процессе поступления крови фибрина. Такая особенность серозных оболочек, по мнению некоторых хирургов-пульмонологов [Вагнер Е. А., Тавров-ский В. М., 1977], должна быть соотнесена прежде всего с проблемой интраоперационных и послеоперационных внутриплевральных кровотечений.
Характер изменений крови, изливающейся в закрытую плевральную щель в связи с травмой или операцией (после ее завершения), определяется прежде всего интенсивностью внутриплеврального кровотечения. Для эффективности дефибринирования, при котором излившаяся в плевру кровь становится жидкой, имеют значение несколько факторов: темп поступления крови, степень повреждения грудной клетки и соответственно тканей висцеральной и париетальной плевры в процессе выделения легкого, глубина дыхательных движений. Несомненное значение имеют и коагуляционная активность циркулирующей крови [Чепчерук Г. С., 1976] и тканевой тромбопластин, поступающий из раневых полей, которые образуются при разделении плоскостных сращений либо при экстраплевральном выделении легкого.
В таких случаях восстановление плевральной щели и удаление остатка пропотевающей крови в процессе расправления легкого приводят в плоскостному выпадению фибрина, который не только оказывает гемостатическое действие, покрывая тонким слоем париетальную плевру и легкое, но и способствует адгезии, а в последующем и сращению обоих плевральных листков с облитерацией плевральной щели.
79
Глава «.J ОБЩИЕ ПРИНЦИПЫ ОБСЛЕДОВАНИЯ БОЛЬНЫХ ЗАБОЛЕВАНИЯМИ ЛЕГКИХ И ПЛЕВРЫ
Обследование больных заболеваниями легких и плевры в хирургической клинике решает две основные задачи: 1) диагностика основного заболевания и оценка связанных с ним сопутствующих патологических изменений; 2) выяснение состояния основных систем жизнеобеспечения, необходимое для оценки резервных возможностей организма больного и степени его функциональной операбельности.
ДИАГНОСТИКА
ОСНОВНОГО ЗАБОЛЕВАНИЯ
ОСНОВНЫЕ МЕТОДЫ
ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ
Несмотря на то, что возможности оказания помощи больным заболеваниями легких во многом расширились с внедрением в клиническую практику специальных приемов, появление которых обусловлено последними достижениями в области физики, электроники, оптики и других областях знаний, роль и место субъективных и объективных общеврачебных методов обследования сохранили свое значение до настоящего времени.
Расспрос больного, изучение его жалоб, особенностей возникновения и развития заболевания, сведений о перенесенных болезнях, образе жизни и работе, вредных привычках часто являются отправным пунктом для построения плана дальнейшего специального, более углубленного и направленного обследования, определения последовательности применения как простых (физикальных), так и более сложных (инструментальных) методов диагностики.
Наиболее доступные методы исследования — осмотр, пальпация, перкуссия, аускультация — нередко позволяют отметить совокупность приз
наков или отдельные симптомы, с большой достоверностью характеризующие развитие изменений, которые в сочетании с данными анамнеза дают возможность правильно решить вопрос не только о диагнозе, но зачастую — и лечебной тактике. Так, появление конгломератов надключичных лимфатических узлов, развитие на передней поверхности туловища сети расширенных подкожных вен, увеличение окружности шеи, одутловатость лица, отмеченные при осмотре и физикальном обследовании больного заболеванием легких, могут с большой долей вероятности свидетельствовать о распространенном бластоматозном процессе с вовлечением медиастинальных и надключичных лимфатических коллекторов, крупных кровеносных сосудов средостения. Полученные сведения позволяют не делать более сложные, часто сопряженные с определенным риском инструментальные исследования.
Нарастающая одышка, расстройства сердечной деятельности, появление подкожной эмфиземы, развившиеся в течение короткого времени вслед за болевыми ощущениями в груди, сочетающиеся с отсутствием или резким ослаблением дыхательных шумов над одним легким, коробочный звук при перкуссии в этой области груди дают возможность распознать спонтанный напряженный пневмоторакс.
Среди основных специальных методов обследования больных заболеваниями легких ведущее место принадлежит рентгенологическому исследованию.
Р ЕНТГЕНОЛОГИ Ч ЕСКОЕ
ИССЛЕДОВАНИЕ
Обязательным условием рентгенологического исследования больных заболеваниями легких следует считать рентгеноскопию. Применение электронно-оптических преобразователей и использование реитгенотелевидения значительно уменьшили лучевую нагрузку на обследуемого пациента и медицинский персонал, по сравнению с аппаратами обычного типа, увеличили яркость и разрешаемость рентгеновского изображения.
Появилась возможность документировать результаты исследования на кино- или магнитной ленте.
80
Рис. 42. Электрорентгенограмма грудной клетки. Норма.
В первую очередь рентгенологическая диагностика включает ориентировочный осмотр легочных полей, при этом определяются сторона и объем поражения. Обращается внимание на подвижность купола диафрагмы, состояние реберно-диафрагмальных синусов, прозрачность легочных полей, структурность корней легких, размеры и конфигурацию срединной тени, формируемой органами средостения.
Последующее рентгенографическое обследование должно углублять и расширять представления о характере изменений в легких и грудной полости. Эти исследования проводят в прямой (переднезадней) и боковой проекциях, дополняя их при необходимости снимками в косых проекциях и прицельными рентгенограммами. Важным достоинством рентгенографии являются объективность и достоверность полученных результатов, возможность сопоставления с данными ранее проведенных рентгенографических обследований, т. е. возможность динамического наблюдения. Последнее нередко является одним из важнейших факторов для установления правильного диагноза.
Рентгенографическое обследование в двух проекциях позволяет с наибольшей точностью определить локализацию и распространенность поражения легких, изменения в средостении, состояние междолевых щелей. Оценка и сопоставление степени прозрачности участков легкого в различных его отделах позволяют установить возможные отклонения от нормы.
Рентгенограммы, выполненные с прямым увеличением изображения, позволяют выявить мел
Рис. 43. Электрорентгенограмма грудной клетки. Слева в базальных отделах — остаточная полость
кие и мельчайшие очаговые тени, что особенно ценно при проведении дифференциального диагноза между туберкулезом легких, саркоидозом, пневмокониозом и другими заболеваниями, дающими исходные рентгенологические изменения.
Для улучшения визуализации трахеобронхиального дерева и уплотненных лимфатических узлов средостения используются так называемые переэкспонированные снимки грудной полости. На них особенно четко определяются элементы корня легкого на фоне как бы выведенного на «второй план» легочного рисунка.
В последние годы для получения первой, наиболее общей, информации о характере рентгенологических изменений в легких и грудной полости (наряду с флюорографией) стала использоваться электрорентгенография. Важнейшим достоинством метода электрорентгенографии являются его высокая экономическая эффективность, исключение расходов на оснащение специальных фотолабораторий и реактивов, необходимых для рентгенографии. Процесс электрорентгенографии не зависит от водоснабжения, получение крупноформатных снимков происходит на свету. Изображение воспроизводится на селеновой пластине и затем переносится на бумагу (рис. 42, 43).
Электрорентгенография имеет неоспоримые преимущества при проведении неотложной рентгенологической диагностики.
Томографическое (послойное) исследование органов грудной полости дает возможность выделить участки легкого с предполагаемыми зонами поражения в любой заранее рассчи-
6 Зак. 0517
81
Рис. 44. Компьютерная томография органов грудной клетки. Норма.
тайной глубине. Томографическое исследование органов грудной полости также выполняется в прямой и боковой проекциях. Количество томограмм, выполняемых при различных патологических изменениях в органах грудной полости, зависит от поставленных задач и определяется для каждого больного индивидуально. При необходимости томограммы, сделанные в прямых проекциях, могут быть дополнены томограммами в косых проекциях. Оптимальными срезами считаются срезы в промежутке от 8 до 12 см, отступя от остистых отростков позвонков.
Выполнение томографического исследования позволяет уточнить данные, полученные при обзорной рентгенографии: определяются точная локализация и характер патологического процесса в легком, его распространенность, отношение к сосудам и бронхам легкого, плевре и органам средостения. С помощью томографии удается оценить проходимость трахеи и бронхов, выявить в просвете дыхательных путей новообразования, инородное тело. Томография служит важным вспомогательным приемом для изучения характера изменений в лимфатических узлах средостения, в костных образованиях, формирующих каркас грудной полости.
Возможности рентгенологической диагностики заметно расширились за счет становления и клинического использования компьютерной рентгенотомографии. По сравнению с обычной рентгенографией компьютерная рентгенография имеет в десятки раз большую разрешающую способность и позволяет различать ткани с разностью по плотности до 0,5 %. Это
Рис. 45. Компьютерная томография органов грудной клетки. Эмфизема легких.
дает возможность четко определять границу между нормальной и патологически измененной легочной тканью. На компьютерных томограммах органов грудной полости удается не только локализовать патологический очаг, но и определить его размеры, оценить плотность и однородность, соотношение с соседними анатомическими образованиями и органами [Перельман М. И. и др., 1981].
Компьютерная томография дает возможность получить наиболее полную рентгенологическую информацию об опухолях и кистах средостения, сосудистых изменениях в легких, аневризмах, о состоянии трахеобронхиального дерева, характере и структуре «шаровидных образований в легких», патологических изменениях в плевре, грудной стенке, особенно при ее злокачественных поражениях (рис. 44—46).
БРОНХОСКОПИЯ
Эндоскопическому обследованию трахеобронхиального дерева в настоящее время придается очень большое значение, так как с его помощью у большинства больных получают достоверную информацию о характере изменений в трахеобронхиальном дереве, что особенно важно в диагностике опухолевых заболеваний трахеи и бронхов.
Диагностические возможности бронхоскопии расширялись по мере совершенствования и создания новых моделей бронхоскопов. Бронхоскопы конструкции Брюнингса, Мезрина постепенно уступили место более удобной и безопасной модели бронхоскопа системы Фриделя.
82
Рис. 46. Рак верхней доли левого легкого.
а — прямая рентгенограмма; б — боковая рентгенограмма; в — компьютерная томограмма.
Последний обеспечивает адекватную вентиляцию легких во время бронхоскопии. Бронхоскопы этой конструкции (так называемые «дыхательные») до настоящего времени широко используются в бронхологической, пульмонологической и хирургической практике.
Применение оптических приставок в сочетании с надежной, устойчивой вентиляцией легких, снабжение дыхательных бронхоскопов источниками «холодного» света во многом определили широкое применение жестких моделей бронхоскопов. Несомненным достоинством дыхательных бронхоскопов является возможность выполнения с их помощью не только
диагностических, но и некоторых лечебных манипуляций на бронхах (удаление инородных тел и небольших доброкачественных опухолей при помощи набора щипцов, обработка слизистой оболочки лекарственными препаратами, в том числе лечение бронхиальных свищей). Дыхательные бронхоскопы жесткой конструкции позволяют выполнить длинной иглой пункционную трансбронхиальную биопсию бифуркационных и некоторых групп внутрилегочных лимфатических узлов. В последние годы с помощью дыхательных бронхоскопов выполняют лечебные окклюзии бронхиального дерева при гнойно-деструктивных поражениях легких,
6*
83
пневмотораксе, а также осуществляют дренирование бронхов. Есть все основания полагать, что применение дыхательных бронхоскопов в пульмонологической практике будет необходимо на протяжении еще длительного периода времени.
Вместе с тем диагностические возможности жестких моделей бронхоскопов ограничиваются пределами главных, долевых и начальными отделами сегментарных бронхов, т. е. центрально расположенными отделами дыхательных путей. Это обусловлено жесткостью конструкции и относительно крупными их размерами. Оптические приставки позволяют только осмотреть начальные отделы сегментарных бронхов и исключают возможность выполнения биопсии. Кроме того, повышенная травматичность исследования трахеобронхиального дерева с помощью жестких моделей бронхоскопов вынуждает прибегать при их применении к общему обезболиванию.
Дальнейшее развитие возможностей бронхоскопической диагностики появилось в связи с созданием и использованием волоконно-оптических эндоскопов — фибробронхоскопов.
К числу наиболее важных достоинств фибробронхоскопов относятся высокая эластичность прибора, небольшие размеры диаметра диагностического тубуса (до 6 мм), надежная система мощного потока «холодного света». Диагностический канал фибробронхоскопа и набор биопсийных щипчиков и скарификаторов позволяют получать материал для морфологического исследования не только из отделов трахеобронхиального дерева, доступных визуальному контролю, но и из более дистальных. С помощью волоконно-оптических моделей фибробронхоскопа стали возможны детальный осмотр бронхиального дерева и получение материала для морфологического изучения вплоть до сегментарных, субсегментарных, а для отдельных долей (нижней, средней, части сегментов верхних долей) — и суб-субсегментарных бронхов.
Практически важным является то положение, что эффект оптического увеличения при осмотре через фибробронхоскоп требует специального навыка при выполнении диагностических исследований. Достоверность визуальной диагностики несколько снижается по мере продвижения тубуса фибробронхоскопа к зонам субсегментарного деления бронхиального дерева. Диагностическая ценность фибробронхос копии заметно повышается при дополнении визуального исследования взятием материала для морфологического (гистологического и цитологического) изучения: щипцовой и скарификационной биопсией, направленной аспирацией промывных вод из участков предполагаемого поражения легкого.
При выполнении этих условий, как показали исследования, проведенные в клинике госпитальной хирургии [Шариф М. С., 1980], точность диагностики с помощью фиброгастроскопии при раке легкого достигает 90—95 %.
Конструкция современных волоконно-оптических бронхоскопов позволяет широко проводить обследование трахеобронхиального дерева с использованием местного обезболивания. Это во многом расширяет диапазон их применения в поликлинической практике, в специально приспособленных бронхологических кабинетах.
Проведению бронхологических обследований на амбулаторном уровне способствует также появление новых терминальных анестетиков, обладающих широким диапазоном терапевтического действия и невысокой токсичностью (лидокаин, тримекаин). Они пришли на смену ранее использовавшимся для этих целей препаратам типа дикаина, нередко вызывавшим у обследуемых тяжелые общие расстройства.
Для местного обезболивания при фиброброн-хоскопии в амбулаторной практике применяется следующая методика. За 10—15 мин до начала обезболивания больным вводят 1 мл 2 % раствора пантопона и 1 мл 0,1 % раствора атропина. Затем с помощью пипетки в носовые ходы больного вводят 2,5 % раствор тримекаи-на по 10—12 капель с каждой стороны. Уже спустя 2—3 мин наступает обезболивающий эффект. В течение этого времени оценивают состояние больного — выявляют нежелательные общие реакции как проявление индивидуальной непереносимости тримекаина. Опыт госпитальной хирургической клиники в этом направлении, превышающий более 2500 исследований, показал безопасность метода: ни в одном из наблюдений не было отмечено нежелательных расстройств, обусловленных применением тримекаина, потребовавших специального лечения или прекращения процедуры.
После анестезии слизистой оболочки носовых ходов с помощью трансназально введенного резинового катетера достигают надсвязочного пространства гортани и орошают голосовые связки 2—3 мл раствора тримекаина. Затем проводят катетер в трахею и с помощью шприца вводят еще 10—12 мл раствора, достигая анестезии слизистой оболочки дыхательных путей. Кашель, закономерно возникающий в ответ на проведение конца катетера в подскладочное пространство, прекращается в течение 20—30 с. С потоком воздуха на вдохе раствор тримекаина достигает уровня долевых и сегментарных бронхов. Наступающая вслед за этим местная анестезия является вполне достаточной для проведения фиброброихоскопии. Общее количество 2,5 % раствора тримекаина, расходуемого для выполнения обезболивания,
84
составляет обычно 13—15 мл. Продолжительность местной анестезии при этом обеспечивается в течение 15—20 мин, что вполне достаточно для обследования трахеобронхиального дерева.
Перспективным для применения в амбулаторных условиях является местное обезболивание ингаляцией аэрозоля 5 % раствора триме-каина. Такое обезболивание в еще меньшей степени причиняет неудобства больным. Ингаляционную аэрозольную анестезию удобно выполнять при помощи передвижного ультразвукового аэрозольного ингалятора, который обеспечивает создание аэрозольного потока раствора. После анестезии носовых ходов раствор тримекаина через сменный загубник или маску глубоко вдыхается в течение 9—10 мин и распределяется на поверхности слизистых оболочек трахеи и бронхов. Как правило, к моменту завершения обезболивания появляются чувство «неловкости при глотании» и своеобразное ощущение «облегчения глубины вдоха».
Несмотря на достоинства фибробронхоскопии под местным обезболиванием, полностью отказаться от применения наркоза при этом исследовании не представляется возможным. У многих больных только под наркозом, в условиях полной релаксации, обеспечивается доступность визуальной диагностики изменений в трахеобронхиальном дереве. К числу таких больных относятся лица с неустойчивой, эмоционально-лабильной психикой, дети, а также больные с признаками аллергизации к препаратам, используемым для местного обезболивания. Кроме того, бронхологическое обследование целесообразно выполнять под наркозом в тех случаях, когда диагностика затруднительна: обследование продолжается длительное время или требуется совместный осмотр и обсуждение выявленных изменений несколькими специалистами. Считается оправданным выполнение бронхоскопии под наркозом у медицинских работников, особенно если имеется подозрение на опухолевый процесс.
При разработке методов фибробронхоско-пии под наркозом в клинике в полной мере был обобщен и использован значительный (более 10 000 исследований) опыт проведения общего обезболивания при обследованиях, выполненных с помощью дыхательных моделей жестких бронхоскопов. Некоторые изменения в эту методику были внесены с учетом конструктивных особенностей и возможностей волоконно-оптических эндоскопов, которые по замыслу их создателей были предназначены для обследования только под местным обезболиванием. Поэтому появилась необходимость в разработке приемов для проведения обследований фибробронхоскопом под наркозом с учетом следующих двух основных положений.
Во-первых, в процессе бронхологического обследования под наркозом, как и в условиях местного обезболивания, должна сохраняться полная возможность использования всех преимуществ и достоинств фибробронхоскопа, предусмотренных его конструкцией.
Во-вторых, при проведении наркоза с миорелаксантами искусственная вентиляция легких должна осуществляться непрерывно, быть эффективной и исключать возможность развития гипоксических расстройств (фиброброн-хоскоп в конструктивном отношении не рассчитан на обеспечение вентиляции легких).
Указанным требованиям отвечает проведение искусственной вентиляции легких под наркозом с миорелаксантами инжекционным методом, принцип которого разработал R. Sanders (1967).
В сравнении с другими способами искусственной вентиляции инжекционный метод имеет то преимущество, что не требуется герметизации системы аппарат — легкие. Напротив, свободное сообщение просвета дыхательных путей через инжекционное устройство с атмосферой является одним из непременных условий проведения эффективной инжекционной вентиляции легких в состоянии миорелаксации. Для проведения инжекционной искусственной вентиляции легких в процессе выполнения фибро-бронхоскопии наиболее удобно использовать специальную приставку-инжектор к эндотра-хеальной трубке, разработанную в госпитальной хирургической клинике. Открытый доступ в просвет дыхательных путей позволяет, не нарушая ритма и не снижая эффективности вентиляции легких, вводить в трахеобронхиальное дерево тубус фибробронхоскопа.
Выполнять фибробронхоскопию под наркозом наиболее удобно в специально оборудованном бронхологическом кабинете на бронхоскопическом столе конструкции Г. К. Орджоникидзе (1965). Канюлируя локтевую вену, вводят 0,5 мг атропина и 0,5 г глюконата кальция. Через 3—5 мин после инсуффляции кислорода масочным способом внутривенно медленно вводят 2 % раствор тиопентал-натрия или гексе-нала (в среднем 0,4 г) до исчезновения роговичного рефлекса. Затем внутривенно вводится 20 мг 2 % раствора диплацина и в последующем — деполяризующие миорелаксанты в дозе 0,75 мг/кг. Необходимость дополнительного введения раствора тиопентал-натрия или гексенала и миорелаксантов диктуется длительностью исследования.
Интубацию трахеи при фибробронхоскопии под наркозом выполняют эндотрахеальной трубкой без надувной манжеты, чтобы исключить возможность повреждения легких кислородом под давлением. К трубке присоединяют
85
приставку-инжектор. Подавая кислород прерывисто в инжекционное устройство с частотой 18—20 раз в 1 мин, осуществляют искусственную вентиляцию легких. На вдохе кислород под давлением проходит по инжекционной системе, засасывая воздух через открытую часть приставки (эффект Вентури), и расправляет легкие. Когда воздушно-кислородная смесь перестает поступать, происходит пассивный выдох.
Через открытый конец приставки-инжектора вводят тубус фибробронхоскопа, осуществляют эндоскопическое исследование с фотографированием, биопсию, скарификацию слизистой оболочки, аспирацию патологического содержимого трахеобронхиального дерева, введение лекарственных препаратов. При этом, не нарушая эффективности инжекционной искусственной вентиляции легких, имеется возможность неоднократно вводить и извлекать фиброброн-хоскоп, если в этом возникает необходимость в процессе исследования.
После завершения бронхологического обследования фибробронхоскоп извлекают, а искусственную вентиляцию инжекционным способом продолжают по вспомогательному типу — до восстановления адекватного самостоятельного дыхания. Показанием к экстубации, помимо эффективного самостоятельного дыхания, является способность больного поднимать голову и удерживать ее в этом положении. Минимальное время, необходимое для выполнения фиброброн-хоскопии под наркозом, составляет в среднем 10—15 мин. После экстубации под наблюдением врача-анестезиолога больной самостоятельно переходит для отдыха на кушетку, находящуюся в эндоскопическом кабинете. Через 20—30 мин после завершения обследования всем больным проводят парокислородные ингаляции с лекарственными травами (ромашкой, мятой, чабрецом, листом эвкалипта) или медикаментозными препаратами (ароматическими маслами, антибиотиками, бронхорасширяющими, мокроторазжижающими и другими средствами). Спустя 10—15 мин после контрольной оценки состояния больного ему разрешается покинуть бронхоскопический кабинет. При такой организации выполнение фибробронхоскопии под наркозом с миорелаксантами и инжекционной искусственной вентиляцией легких является практически безопасным исследованием и может выполняться в амбулаторных условиях.
Распознавание изменений в трахеобронхиальном дереве, определение и оценка признаков развития заболевания представляют весьма ответственную задачу и требуют применения специальных методических приемов. Это тем более важно, что информация, получаемая в процессе осмотра трахеобронхиального дерева,
во многом определяет весь ход последующего бронхологического обследования, а иногда — и лечебную тактику. Поэтому при осмотре через фибробронхоскоп следует придерживаться единой системы, предусматривающей получение наиболее полных данных о состоянии и изменениях в трахеобронхиальном дереве.
В обязательном порядке оценивается состояние всех доступных осмотру отделов трахеобронхиального дерева. Особое внимание уделяется области тех изменений, которые отмечены при рентгенологическом обследовании.
После проведения тубуса фибробронхоскопа в гортань тщательно осматривают голосовые связки. При этом оценивают характер и степень их подвижности: ограничение подвижности (парез) голосовой складки может свидетельствовать о вовлечении в патологический процесс возвратной ветви блуждающего нерва.
В трахее детально осматривают ее стенки (передняя, задняя, боковые) на всем протяжении — от подскладочного пространства до бифуркации — места ее деления на правый и левый главные бронхи.
Информация, получаемая на этом этапе бронхоскопии, может быть несколько расширена за счет приема, позволяющего оценить подвижность отдельных участков трахеи и бронхов (стенок, гребешков). Если при проведении исследований жесткими моделями бронхоскопов смещение стенок и гребешков трахеи и бронхов тубусом эндоскопа выполняется без особого труда, то для эластичных эндоскопов с волоконной оптикой это трудновыполнимо. В клинике разработан и применяется специальный методический прием. Используются подвижная секция и тяги фибробронхоскопа. Изменяя положение рычага управления подвижной секцией фибробронхоскопа, удается получать информацию о степени подвижности стенок трахеи, бронхов, гребешков в местах их деления. Правильная интерпретация получаемых при этом ощущений ригидности, передаваемых через тяги фибробронхоскопа, сложнее, чем в жестких моделях эндоскопов, но с опытом удается получить весьма важные сведения о характере изменений в тканях и образованиях вблизи бронхов, трахеи.
Завершив осмотр трахеи, переходят к изучению киля ее бифуркации, начальных отделов главных бронхов. При этом, наряду с оценкой состояния слизистой оболочки бифуркации, специальное внимание уделяют ее конфигурации. Так, уплощение или «развертывание» киля бифуркации трахеи, отклонение его в сторону, ограничение или отсутствие подвижности чаще всего свидетельствуют о значительных изменениях в расположенных рядом группах лимфатических узлов средостения: их увеличении,
86
формировании плотных малоподвижных конгломератов. Все это позволяет судить о распространенности патологических изменений в легких, органах средостения.
После обследования бифуркации трахеи переходят к осмотру бронхов. Методически правильно начать его с изучения просвета дыхательных путей легкого, в котором не предполагается патологических изменений. Такой подход позволяет сформировать общее представление о состоянии слизистой оболочки просвета дыхательных путей у данного конкретного больного (хронический бронхит, атрофический бронхит и т. п.). Тогда, зная эти «фоновые» изменения, при осмотре слизистой оболочки бронхов пораженного легкого легче обнаружить даже небольшие изменения, вызванные заболеванием (признаки воспаления, перестройки рельефа).
В пределах легкого осмотр главных бронхов, отходящих от него долевых и далее — сегментарных, субсегментарных и более мелких осуществляют по единой системе, с обязательной регистрацией состояния гребешков в зонах их деления, а также респираторных движений бронхов, степени сократительной способности их устьев. Осмотр бронхиального дерева в пределах каждого легкого производят сверху вниз: от верхнедолевых бронхов до бронхов базальной пирамиды.
При скоплении в просвете дыхательных путей патологического содержимого, препятствующего проведению осмотра, затрудняющего интерпретацию полученных данных, его удаляют с помощью электроотсоса. При необходимости бронхиальное дерево промывают изотоническим раствором натрия хлорида или раствором антисептика (фурацилин 1:5000).
Уже на основании только осмотра при фибро-бронхоскопии имеется возможность получить точное представление о характере патологических изменений в легких более чем у 60 % больных. Так, при опухоли в просвете бронха определяется «плюс-ткань» в виде бугристых грибовидных, папилломатозных, гранулематозных, полиповидных разрастаний; при наличии инфильтратов стенки бронха видно плоское или бугристое с гладкой или шероховатой поверхностью выбухание, а также сужение просвета бронха с какой-либо стороны или концентрического характера. Как правило, в зоне изменений слизистая оболочка также изменена: рыхлая, легко кровоточащая, лишенная респираторной подвижности. Документировать результаты осмотра при фибробронхоскопии позволяет фотографирование выявленных изменений в трахеобронхиальном дереве.
Наряду с детальным осмотром и определением патологических изменений в трахеоброн
хиальном дереве эндоскопическое обследование больных с заболеваниями легких обеспечивает взятие материала для морфологической верификации заболевания. У большинства больных это позволяет успешно завершить этиологическую и топическую диагностику заболевания. Особенно важными становятся результаты морфологической диагностики при подозрении на рак легкого. Предпринятые в начальном периоде обследования больного, они дают возможность в короткое время установить правильный диагноз и определить показания к наиболее рациональному лечению.
Большое практическое значение результатов морфологических исследований материала, получаемого при бронхоскопии, определило разработку и усовершенствование специальных приспособлений для его получения. К ним относятся наборы биопсийных щипцов, кюретки, щеточки-скарификаторы, иглы для выполнения чрезбронхиальной биопсии, всевозможные аспираторы.
Как убеждает опыт, применение фибробронхоскопа, несмотря на достоинства прибора, не позволяет ответить на вопрос о протяженности патологических изменений за пределами видимых бронхов. Фактические границы их распространения, особенно при раке легкого, как правило, бывают более значительными, чем можно предполагать на основании данных эндоскопического обследования.
Это определяет необходимость дальнейшего совершенствования способов диагностики, применение различных, взаимно дополняющих друг друга методов обследования больных.
ДИАГНОСТИЧЕСКАЯ ПУНКЦИЯ ПЛЕВРАЛЬНОЙ ПОЛОСТИ
Пункция плевральной полости относится к числу широко распространенных диагностических приемов при заболеваниях легких и плевры. Получаемая при этом информация нередко позволяет судить о характере патологических изменений и определяет последующую лечебную тактику. Кроме того, освобождение плевральной полости от экссудата или воздуха чаще всего позволяет предпринять последующее обследование с применением более сложных приемов и методов как за счет улучшения состояния больных, так и вследствие восстановления нормальных анатомических взаимоотношений органов грудной полости, расправления коллабированного или ателектазированного легкого.
Показания к пункции определяют при выявлении физикальными и рентгенологическими методами обследования скопления жидкости или газа в плевральной полости. В зависимости
87
от характера этих находок уточняются место и задачи плевральной пункции.
При скоплении в плевральной полости жидкости пункция выполняется в положении больного сидя с опорой-подставкой под руку со здоровой стороны туловища. Место для пункции намечают сзади, в нижних отделах грудной полости, чаще всего — по ходу седьмого межреберья между среднеподмышечной и лопаточной линиями.
В намеченной для пункции точке выполняют послойную анестезию тканей грудной стенки. Обязательным условием плевральной пункции является предупреждение сообщения полости с внешней средой — в плевральную полость не должен попасть воздух. С этой целью павильоны иглы соединяют со шприцем через специальный переходник-краник, с помощью которого обеспечивается герметичность иглы при отсоединении шприца.
Вид и характер жидкости в полости, ее количество уже в процессе проведения пункции нередко решают многие вопросы диагностики (гной, хилезная жидкость, кровь, серозный экссудат). Тем не менее принципиально важным является специальное изучение жидкости. Определяются ее плотность, биохимический и цитологический состав, характер микрофлоры и чувствительность ее к антибиотикам. Часть жидкости рекомендуется оставить в пробирке на сутки для макроскопической оценки осадка.
При наличии в плевральной полости воздуха пункцию выполняют спереди во втором межреберье по среднеключичной линии. Использование при этом пневмотораксного аппарата позволяет не только удалить из плевральной полости воздух и установить его количество, но и уточнить характер сообщения плевральной полости с воздухоносными путями. Это часто является определяющим при решении вопросов последующей лечебной тактики. Для этой цели используют плевроманометрию, дающую возможность на разных этапах эвакуации воздуха определить степень и устойчивость отрицательного даыения в плевральной полости.
При скоплении в плевральной полости воздуха и жидкости чаще всего требуется выполнение плевральных пункций из нескольких точек. Выбор места пункции определяется областью скопления жидкости или газа, диагностированных при рентгенологическом исследовании. Пункцию плевральной полости рекомендуется завершать контрольным рентгенологическим исследованием, которое позволяет судить об эффективности пункции, а также может дать дополнительную информацию о характере изменений в легких или плевральной полости, получение которой ранее — на фоне экссудата или воздуха — было затруднительно.
ДОПОЛНИТЕЛЬНЫЕ МЕТОДЫ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ
ДИАГНОСТИЧЕСКИЙ ПНЕВМОТОРАКС
Диагностический пневмоторакс применяется для уточнения места расположения солидных образований, изучение которых при рентгенографии или томографии не позволяет решить: исходят ли они из средостения и других образований, формирующих грудную полость, или располагаются в легком. С помощью диагностического пневмоторакса можно уточнить наличие или отсутствие сращений в плевральной полости, степень фиксации ими легкого.
На рентгенограммах, выполненных после наложения пневмоторакса, удается установить, отошло ли образование вместе с легким, или же осталось связанным с грудной стенкой, диафрагмой, средостением.
Наиболее удобным местом для пункции плевральной полости с целью наложения диагностического пневмоторакса являются второе межреберье по среднеключичной линии (в положении больного сидя) или третье — пятое межреберья по средней подмышечной линии (в положении больного лежа на здоровом боку).
В намеченной точке на всю глубину грудной стенки выполняется послойная местная анестезия. На то, что игла находится в плевральной полости, указывают свободное поступление анестезирующего раствора из шприца, самопроизвольные перемещения его поршня в ритме дыхания больного; на подключенном пневмотораксном аппарате регистрируются перепады давления на манометре.
Убедившись в том, что игла находится в плевральной полости, с помощью пневмотораксного аппарата в нее дозированно вводится 750— 1000 мл воздуха или кислорода. При этом на манометре регистрируется «положительное — положительное» давление. Игла извлекается.
Больному придается положение, необходимое для оттеснения легкого газом от той или иной части стенки грудной полости. Затем выполняется рентгенологическое исследование.
После завершения исследования газ из плевральной полости удаляется.
ДИАГНОСТИЧЕСКИЙ
ПНЕВМОПЕРИТОНЕУМ
Показанием к введению воздуха или кислорода в брюшную полость с последующим рентгенологическим обследованием являются образования, прилежащие к нижним долям легких и куполу диафрагмы, когда не удается ответить на вопрос: располагаются ли они в легком, исходят из диафрагмы или находятся в под-
88
Рис. 47. Доброкачественная опухоль правого легкого в условиях искусственного пневмоперитонеума.
а — прямая рентгенограмма; б — боковая рентгенограмма.
диафрагмальном пространстве, например в пе-чени (рис. 47).
Методика наложения пневмоперитонеума состоит в следующем. В положении больного на спине в точке, располагающейся на 2—3 см выше и левее пупка, на всю глубину брюшной стенки выполняется послойная местная анестезия. В момент прокола париетальной брюшины появляется ощущение свободного, без сопротивления вытекания обезболивающего раствора из шприца даже при отсутствии давления на поршень. После этого иглу присоединяют к пневмотораксному аппарату и в брюшную полость дозированно в течение 3—5 мин вводят 1000—1200 мл кислорода, воздуха или закиси азота. Последний удобен ввиду быстрого рассасывания и некоторого анальгезирующего эффекта. Больному на 20—30 мин придается положение на здоровом боку с несколько приподнятой верхней частью туловища. При этом введенный газ перемещается под купол диафрагмы, оттесняя его кверху. На рентгенограммах удается четко дифференцировать нижнюю поверхность диафрагмы. В удалении газа из брюшной полости необходимости нет. В течение
3—8 сут воздух рассасывается самостоятельно. Кислород и закись азота исчезают раньше, обычно к исходу первых суток.
ДИАГНОСТИЧЕСКИЙ
ПНЕВМОМЕДИАСТИНУМ
Пневмомедиастинография применяется для уточнения расположения образований, которые на рентгенограммах и томограммах прилежат к органам средостения, сливаясь с ними. Кроме того, этот метод может быть использован для более четкого выявления различных новообразований средостения, уточнения их взаимоотношения с расположенными здесь органами. Оттесняя медиастинальную плевру со стороны средостения, удается уточнить расположение новообразований по отношению к легкому в случаях, когда сращения в плевральной полости не позволяют наложить пневмоторакс.
Для наложения переднего пневмомедиасти-нума больного укладывают на спину с небольшим валиком под лопатками и отведенной кзади головой. В области яремной вырезки грудины делают местную анестезию кожи и под
89
кожной клетчатки. За грудину вводят тонкую иглу, предпосылая раствор анестетика. Убедившись, что конец иглы находится в клетчатке средостения, а не в сосуде, к павильону ее присоединяют пневмотораксный аппарат и медленно, дозированно в течение 7—10 мин, вводят 500—750 мл воздуха или кислорода. Больному придается положение на спине с приподнятым ножным концом, а затем — на здоровом боку, что необходимо для более направленного распределения газа в пределах клетчаточных пространств. После этого выполняется рентгенологическое обследование.
При наложении заднего пневмомедиастинума используют пресакральный доступ, откуда газ по клетчатке забрюшинного пространства достигает задних отделов средостения.
Для этого в положении больного на животе ниже верхушки копчика выполняют местную послойную анестезию. Длинную тонкую иглу, предпосылая раствор анестетика, проводят под копчик и далее выше в направлении к передней поверхности крестца. Убедившись в том, что конец иглы располагается в пресакральной клетчатке, а не в прямой кишке, с помощью пневмотораксного аппарата поэтапно вводят до 1500— 2000 мл воздуха (не кислорода!). После завершения этого этапа исследования больной в течение часа находится в вертикальном или полу-сидячем положении. Периодически рентгенологическим методом уточняется перемещение газа в восходящем направлении к заднему средостению. После достижения им клетчаточных пространств заднего средостения выполняется рентгенологическое обследование.
БРОНХОГРАФИЯ
На протяжении многих лет клинического использования показания к применению бронхографии при разных заболеваниях легких многократно пересматривались, уточнялись. Основными показаниями к применению этого метода в настоящее время являются: подозрение на аномалию трахеи и бронхов, бронхоэктазии, другие хронические нагноительные заболевания легких, туберкулез, некоторые формы пневмос клерозов.
Для успешного выполнения бронхографии требуется специальная предварительная подготовка больных, особенно отделяющих значительное количество мокроты, так как в этом случае получить хорошее заполнение бронхов не представляется возможным.
Для освобождения трахеобронхиального дерева от патологического содержимого применяются как медикаментозные средства (отхаркивающие, мокроторазжижающие, спазмолитические), так и специальные методы — па
ровые ингаляции, ингаляции с муколитиками, ферментами, эндотрахеальные вливания, лечебные бронхоскопии. Только убедившись в полноценности и эффективности предпринятой подготовки, приступают к исследованию. В качестве контрастного вещества наиболее удобной является смесь сульфата бария и порошка из корня алтея. Как показали наши наблюдения, эта смесь не вызывает аллергических реакций, явлений йодизма, хорошо удаляется из просвета дыхательных путей. Перед введением смесь подогревается до 36—37 °C.
В большинстве случаев исследование проводится под местным обезболиванием. Для этой цели используют препараты дикаина, растворы новокаина, тримекаина.
Для введения контрастной смеси применяют стандартные управляемые катетеры Розен-штрауха — Смулевича.
После анестезии верхних дыхательных путей проводится обезболивание бронхиального дерева исследуемой стороны в различных положениях больного: на спине, на животе, на боку с опущенным головным концом. В дальнейшем, в зависимости от поставленных задач, проводят исследование бронхиального дерева всего легкого, его доли или сегмента. Заполнение бронхов производится под контролем рентгенотелевизионного экрана. Рентгенограммы выполняются в прямой, боковой и косых проекциях в положении больного стоя или лежа на лате-роскопе.
После завершения исследования бронхиальное дерево с помощью электроотсоса, присоединяемого к введенному в просвет бронхов катетеру, по возможности максимально освобождают от контрастного вещества, промывают теплым антисептическим раствором. В течение последующих суток больному выполняются паровые ингаляции. На следующий день целесообразна контрольная рентгеноскопия. Она позволяет судить о полноте освобождения бронхиального дерева от контрастного вещества, а также, что не менее важно, может выявить изменения, не обнаруженные в ходе исследования (остаточные полости, кисты, в которых задерживается контрастное вещество).
Бронхография легких может быть выполнена под наркозом. Особенность ее проведения заключается в том, что больной лежит на спине, осуществляется искусственная вентиляция легких в условиях миорелаксации. Контрастное вещество вводят через интубационную трубку и в период кратковременного апноэ выполняют рентгенограммы обоих легких в прямой и косых проекциях (рис. 48).
Перспективным представляется применение аэрозольных бронхографий с использованием в качестве контрастного вещества порошка тан-
90
Рис. 48. Поднаркозная бронхография у ребенка. Косая проекция. Норма.
тала. Экспериментальные работы J. Nadel и соавт. (1968) показали, что при этом не возникает каких-либо серьезных осложнений.
Тантал, покрывая слизистую оболочку трахеи и бронхов, позволяет с большой четкостью выявить детали ее строения — складки, железистый аппарат.
Клинические наблюдения А. А. Криштафо-вича и соавт. (1961), Р. М. Рабиновича (1981), М. Zammel и соавт. (1970) убеждают в простоте техники танталовой аэрозольной бронхографии. Контрастное вещество в виде мелкодисперсного порошка вводится в просвет дыхательных путей при помощи специального устройства — распылителя. Отмечены хорошая переносимость процедуры больными, высокая информативность полученных результатов.
По мнению А. А. Криштафовича и соавт. (1982), аэрозольная бронхография особенно предпочтительна в тех случаях, когда необходимо точно оценить рельеф слизистой оболочки трахеобронхиального дерева, диагностировать стенозы трахеи и крупных бронхов, особенно у больных с низкими функциональными резервами, в том числе у лиц, перенесших операции на легких.
Несмотря на определенные достоинства аэрозольной бронхографии, она еще не получила широкого распространения в клинической практике, что связано с отсутствием заводского производства порошковых композиций, необходимых для ее проведения.
ПЛЕВРОГРАФИЯ И ФИСТУЛОГРАФИЯ
Плеврография — метод исследования, с помощью которого удается выявить, точно локализовать, определить размеры и конфигурацию остаточной плевральной полости при эмпиемах, ригидном легком, спонтанном пневмотораксе и т. п.
Фистулография выполняется для определения направления и протяженности свищевых ходов, распознавания поддерживающих их причин (инородное тело, остеомиелит ребра), а также для выяснения формы и размеров остаточной полости при сообщении ее с просветом бронхиального дерева.
В качестве контрастного вещества используются водорастворимые вещества — кардиотраст, уротраст и др.
В плевральную полость контрастное вещество вводят путем пункции в точке, ранее намеченной по рентгенограммам или при рентгеноскопии, а в случае плеврокожного свища — через введенный в свищевой ход катетер или иглу с булавовидным концом. После заполнения полости наружное отверстие свища закрывают полоской лейкопластыря.
Рентгенографию выполняют стоя (в двух проекциях) и лежа на латероскопе. Плеврография и фистулография в настоящее время являются наиболее распространенными из методов, дающих возможность определить, локализовать и оценить размеры остаточной плевральной полости. Необходимо иметь в виду, что размеры полостей, как правило, превышают их контрастное изображение на рентгенограммах.
АНГИОПУЛЬМОНОГРАФИЯ
Ангиопульмонография — способ контрастного исследования сосудов малого круга кровообращения. Чаще всего показания к ангио-пульмонографии определяются как дифференциально-диагностические: при пороках развития легкого, нагноительных заболеваниях, бластоматозном процессе. Она дает также возможность определить функциональное состояние паренхимы легкого, оценить гемодинамику.
Различают четыре способа ангиопульмоно-графии: 1) общую ангиопульмонографию, выполняемую путем внутривенного введения контрастного вещества или посредством ангиокар-
91
Рис. 49. Ангиопульмонография.
а — артериальная фаза; б — капиллярная фаза; в — венозная фаза.
диографии из правого желудочка сердца; 2) селективную ангиопульмонографию, выполняемую из ствола или ветвей легочной артерии; 3) суперселективную ангиопульмонографию, включающую контрастирование из долевых, сегментарных ветвей легочной артерии; 4) окклюзионную ангиопульмонографию, выполняемую при заклинивании субсегментарной или лобулярной ветви легочной артерии концевой частью сердечного катетера или при блокировании баллоном катетера магистральной ветви легочной артерии.
Ангиопульмонография производится в рентгенооперационных, обеспечивающих телевизионный рентгенологический и физиологический контроль, оснащенных автоматическими инъекторами для быстрого, дистанционного и синхронного с рентгенографией введения контрастного вещества (уротраст, верографин и др.) в сосуды и сердце.
Сердечный катетер вводится в сосуды, как правило, чрескожно-чрезбедренным способом. При этом применяется телевизионный контроль,
92
катетер устанавливается в правом предсердии, правом желудочке, легочной артерии.
При анализе ангиопульмонограмм обращают внимание на пофазовое продвижение контрастного вещества по различным регионам легкого: легочной артерии, капиллярного русла, венозной системы малого круга кровообращения (рис. 49).
По комбинации ангиографических признаков представляется возможным охарактеризовать вид и распространенность патологического процесса (при двухпроекционной сериогра-фии — посегментарно) в легком, при этом обращается внимание на наличие деформации сосудов, смещение, контуры, разреженность сосудистого рисунка (рарефикацию), степень развития сосудов отдельных сегментов, долей, легкого, характер расположения камер сердца, ротацию сердца и др.
Качественная диагностика ангиопульмонограмм может быть дополнена количественной оценкой регионарного легочного кровотока с помощью способа, разработанного в клинике [Лыткин М. И. и др., 1984], при котором уточняется, в каких сегментах сохранено и преимущественно осуществляется кровообращение в малом круге и в каком количественном объеме.
Комплексная оценка ряда показателей (давление в правых камерах сердца и системе легочной артерии, насыщение кислородом артериальной и смешанной венозной крови, а также в различных регионах малого круга и др.) позволяет определить резервные возможности малого круга кровообращения и рационально планировать лечение пульмонологических больных. В сочетании с количественной оценкой регионарного легочного кровотока, определение легочных объемов крови значительно расширяет и углубляет представления о резервных возможностях организма.
При селективной ангиографии бронхиальных артерий катетер вводится в грудную аорту и далее — до устья бронхиальных сосудов; введение контрастного вещества осуществляется с помощью автоматического инъектора. Серио-графия, проводимая, как правило, в переднезадней проекции, может быть дополнена рентгенограммами в боковой или косой проекциях в зависимости от задач исследования (рис. 50).
При анализе бронхиальных ангиограмм определяются уровень и тип анатомического ветвления сосудов, положение, форма, диаметр, характер контуров сосуда, извитость его и проходимость, характер и уровень окклюзии, степень развития коллатеральных ветвлений и их взаимосвязь с легочной артерией. Учитываются уровни анастомозирования двух систем кровообращения легких (субсегменты, сегменты, доли или лобулярные ветви легочной артерии) и сте-
Рис. 50. Селективная ангиография бронхиальных артерий.
пень выраженности артериального шунтирования в легочную артерию. Изучается состояние сосудов контрастированных сегментов легочной артерии.
Бронхиальную артериографию целесообразно выполнять в сочетании с катетеризацией легочной артерии и изучением показателей давления, оксиметрией в регионах выше и ниже выявляемых анастомозов двух систем кровообращения легких.
При контрастном исследовании сосудов средостения можно установить признаки поражения расположенных здесь лимфатических узлов при раке легкого.
Контрастное исследование сосудов средостения включает в себя флебографию и аортографию. Флебография выполняется с учетом характера патологического процесса, выявляемого при помощи рентгенографии, томографии, бронхографии. При указании на вероятное поражение лимфатических узлов переднего средостения выполняют верхнюю кавографию и контрастное исследование внутренних грудных вен, а при подозрении на поражение лимфатических узлов заднего средостения — азигографию. Аортография при заболеваниях легких выполняется в случаях предположения о распростране-
93
Рис. 52. Флебограмма внутренних грудных вен.
Рис. 51. Верхняя кавография. Контрастированы верхняя полая вена, безымянная вена и правое предсердие.
нии патологического процесса на аорту или ее ветви. Верхняя кавография наиболее часто выполняется путем пункции локтевых вен или их катетеризации. Другим вариантом верхней кавографии является ретроградная катетеризация верхней полой вены через нижнюю полую вену и правое предсердие. При введении контрастного вещества регистрируется продвижение его по венам переднего средостения, а также сосудам малого круга (рис. 51).
Контрастное исследование внутренних грудных вен выполняется введением контрастного вещества в грудину на уровне четвертого межреберья. На флебограммах внутренние грудные вены видны в виде двух контрастируемых сосудов, расположенных параллельно обеим сторонам грудины (рис. 52). Признаками, указывающими на наличие увеличенных лимфатических узлов парастернальной области, считают локальные сужения просвета вен вплоть до полного блока, появление ретроградного кровотока, коллатеральных ветвей, участков расширения вен на ограниченном протяжении.
Контрастное исследование непарной и полунепарной вен — азигография — может быть выполнено как с помощью внутрикостного введе
ния контрастного вещества, так и посредством прямой катетеризации устья непарной вены.
Для внутрикостного введения обычно используют остистый отросток одного из нижнегрудных позвонков, а также задние сегменты IX и X ребер. При этом контрастное вещество заполняет, кроме непарной вены, полунепарную и вены позвоночных сплетений.
При прямой катетеризации устья непарной вены катетер с проводником вводится в нижнюю полую вену, правое предсердие, верхнюю полую вену. Проводник удаляется. Концевая часть катетера, имеющая двойной изгиб, в верхней полой вене принимает исходно приданную ему форму. Конец катетера устанавливают в устье непарной вены, а затем производят ретроградное заполнение ее. Тугое и интенсивное заполнение всей системы непарной и полунепарной вен, а также восходящих поясничных вен получают при введении 20—30 мл контрастного вещества с объемной скоростью до 15 мл/с (рис. 53).
Интерпретацию ангиографических признаков анатомических и функциональных изменений венозной системы средостения проводят с учетом вариантов развития и индивидуаль
94
ных особенностей строения безымянной, плечеголовной, верхней полой, непарной и полунепарной вен. При метастазировании рака легкого в средостение податливые венозные сосуды оттесняются увеличенными лимфатическими узлами и их конгломератами. Нарушение кровотока в системе верхней полой вены приводит к расширению сосудов непарной вены, которая становится основным коллатеральным путем оттока.
Наиболее характерные ангиографические признаки, указывающие на увеличение лимфатических узлов средостения, можно по данным флебографии охарактеризовать следующим образом: дефекты наполнения, блок сосуда, сужение различной степени и протяженности, изменение конфигурации сосуда, смещение и вынужденно фиксированное его положение, различные формы обструкции сосудов, развитие коллатерального кровотока и степени его выраженности, сопровождающееся расширением сосудов, повышенной их извитостью.
Флебография позволяет дифференцированно оценить органические и функциональные изменения вен средостения, однако для этого необходимо отчетливо представлять физиологические места сужений верхней полой вены (у места впадения в правое предсердие), внутренних грудных вен (на уровне грудино-реберного сочленения) и др. При выявлении дефекта наполнения оценивается его форма (округлый одиночный или полициклический, ровный или изъеденный контур сосуда). Если для сдавления вены характерен ровный контур, то для прорастания ее стенки — изъеденный, неровный. Полицикличность контуров сосуда и цир-кулярность сужения вены указывают на распространенность процесса в средостении. Полная блокада вены выявляется в виде различных форм ее культи: цилиндрической, конусообразной, округло-выпуклой или с округло-вогнутым контуром. Форма культи может косвенно указывать на характер и причину окклюзии — сдавление, сдавление-тромбоз или прорастание опухолью. Если блок расположен в районе опухоли, то изменения сосуда наиболее вероятно связаны с ней. Обструкция вены на значительном расстоянии от опухоли указывает на ее тромбоз. Неровность нижнего контура левой плечеголовной вены патогномонична для увеличения преаортокаротидных лимфатических узлов и смещения кверху и кпереди дуги аорты. Близкое положение дуги аорты к плечеголовной вене создает передаточную пульсацию на ее нижнюю стенку, что при ангиографии проявляется неровностью контура сосуда. Различным уровням обстукции сосудов средостения соответствуют определенные варианты коллатерального кровообращения.
Рис. 53. Флебограмма непарной и полунепарной вен.
При аортографии удается определить отношение патологического процесса в средостении к аорте и ее магистральным ветвям. В соответствии с данными флебографии средостения (кавографиц, азигографии и др.) это дает возможность более полно оценить степень распространенности процесса в лимфатических узлах переднего и заднего средостения.
РАДИОИЗОТОПНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЛЕГКИХ
Радиоизотопные методы исследования легких основаны на регистрации излучения радиоактивных изотопов, введенных в организм больного через дыхательные пути или кровеносную систему. При проведении вентиляционной радиографии легких используют радиоактивный изотоп ксенона (133Хе). Вдыхание смеси ксенона с кислородом дает возможность судить о состоянии бронхиального дерева, оценить участие в вентиляции различных отделов паренхимы легкого. Однако применение радиоактивных газов не позволяет получить картину сосудистого русла легких.
Об интенсивности легочного кровотока, диффузионной способности альвеол судят по ска
95
нограммам, полученным при введении радиоактивных препаратов в кровеносное русло. Для этой цели используется альбумин человеческой сыворотки, меченный радиоактивными изотопами 131I, |251, 51Сг, 9(>Гс. Сразу же после внутривенного введения меченый альбумин с частицами размерами не более 10 мкм задерживается в капиллярном русле легких. у-Излучение изотопа, которым мечен альбумин, регистрируется сканером. В результате исследования получают точную информацию о характере капиллярного кровотока в различных участках легкого.
Радиоизотопное сканирование легких позволяет оценить различные нарушения кровообращения, особенно при тромбоэмболических поражениях сосудов, при бластоматозных поражениях. В этих случаях на сканограммах обнаруживаются сужение легочных полей и разрежение или полное отсутствие записи в зоне расположения опухоли, что может быть решающим для диагноза.
При тромбоэмболиях сосудов малого круга кровообращения в остром периоде сканирование позволяет диагностировать и оценить объем нарушения легочного кровообращения. Повторные исследования дают возможность контролировать степень и характер восстановления легочного кровообращения.
Возможности отдельных методов, используемых при обследовании больных заболеваниями легких, могут быть расширены за счет их сочетанного использования.
Так, в клинической практике получило признание сочетание эндоскопического и рентгенологического методов обследования. В случае необходимости направленного взятия материала для морфологического изучения из участков легкого, расположенных в дистальных отделах бронхиального дерева, недоступных визуальному контролю через фибробронхоскоп, биопсийные щипчики или щеточки-скарификаторы направляются к патологическому очагу под контролем рентгеновского экрана. Подобный прием возволяет сделать биопсию наиболее периферических отделов легкого.
Используя аналогичный прием, возможна катетеризация субсегментарных бронхов и селективная, строго направленная в отношении измененных участков легкого бронхография.
Следует отметить, что выполнение подобных исследований пока еще ограничивается специализированными пульмонологическими стационарами, имеющими необходимое оснащение и подготовленный для проведения такого обследования персонал.
Для выполнения сочетанных исследований следует также применять специальный (экранированный) фибробронхоскоп.
ДИАГНОСТИЧЕСКИЕ ОПЕРАТИВНЫЕ ВМЕШАТЕЛЬСТВА
ТРАНСТОРАКАЛЬНАЯ ИГЛОВАЯ БИОПСИЯ ПЛЕВРЫ
Показанием к выполнению пункционной биопсии плевры чаще всего является предположение о туберкулезном или бластоматозном ее поражении.
В точке, намеченной по рентгенограммам и томограммам, проводится послойное местное обезболивание грудной стенки, после чего с помощью специально предложенной для этой цели иглы Эбрамса [М. Abrams], имеющей наружный диаметр 4 мм, вращательным движением высекается цилиндрик мягких тканей грудной стенки с париетальной плеврой. Полученный материал направляется для гистологического изучения.
Принципиальным недостатком этого метода является то, что выполняется он, по существу, вслепую. Поэтому при свойственном плевральным листкам очаговом характере поражения при определении этиологического диагноза учитывать следует лишь положительный результат исследования.
ТРАНСТОРАКАЛЬНАЯ ПУНКЦИОННАЯ
БИОПСИЯ ЛЕГКОГО
Показанием к пункционной биопсии является формирование в периферических отделах легкого так называемых «шаровидных образований», морфологическая структура которых неясна, а торакотомия сопряжена с повышенным риском.
Биопсия выполняется в рентгеновском кабинете под контролем экрана электронно-оптического преобразователя. Определяется кратчайшее расстояние от поверхности кожи до образования в легком, и в намеченной точке выполняется послойная анестезия тканей грудной стенки. Для пункции используются игла Силь-вермена или различные ее модификации. В клинике для этой цели применяется игла-троакар с концом, заточенным в виде фрезы. Под контролем рентгеновского экрана игла с троакаром вводится в образование в легком. Убедившись в правильном расположении конца иглы, троакар извлекают, а иглу медленно продвигают вперед, вращая по часовой стрелке. Режущий фрезевой конец высекает участок образования. Затем с помощью шприца создается небольшой вакуум, удерживающий в просвете иглы биопсийный материал, и игла извлекается. Полученный материал подлежит морфологическому изучению.
Из наиболее частых осложнений трансторакальной биопсии легкого следует отметить:
96
пневмоторакс, небольшое кровохарканье; при инфицированном исследуемом образовании (формировании в нем абсцесса) возможен перенос инфекции по ходу иглы с развитием флегмоны грудной стенки. Возникновение имплантационных метастазов при пункции злокачественной опухоли относится к числу очень редких осложнений.
ТОРАКОСКОПИЯ
Этот диагностический прием имеет значение при обследовании больных туберкулезом легких, спонтанным пневмотораксом. Кроме того, с помощью торакоскопии возможны уточнение локализации и характера бронхоплевральных свищей при хронической эмпиеме плевры, а также осмотр париетальной и висцеральной плевры при подозрении на поражение их опухолью с направленным взятием материала для морфологического изучения. Исследование выполняется в перевязочной или операционной. Перед торакоскопией на стороне поражения накладывается пневмоторакс.
Больной укладывается на здоровый бок с заведенной за голову рукой. Наиболее удобным местом для введения прибора является область пересечения третьего — пятого межреберий со средней подмышечной линией, но в зависимости от целей исследования и характера рентгенологических изменений оно может быть соответственно изменено. При сформировавшемся плеврокожном свище эндоскоп вводится в плевральную полость по этому каналу.
Кожа после обезболивания прокалывается остроконечным скальпелем, а через остальные слои грудной стенки проходят в плевральную полость с помощью троакара с мандреном из комплекта торакоскопа. После извлечения мандрена через троакар проводится торакоскоп. Вращая торакоскоп вокруг оси и изменяя угол его наклона, производят осмотр легкого, висцеральной и париетальной плевры. С помощью биопсийных щипчиков направленно, под контролем зрения, берется материал для морфологического изучения.
В качестве торакоскопа может быть использован фибробронхоскоп, небольшой наружный диаметр которого, системы надежного и интенсивного освещения и управления, а также устройства для выполнения биопсии расширяют возможности метода.
После окончания исследования эндоскоп и троакар извлекаются, на грудную стенку накладываются швы. Удаляется воздух из плевральной полости. В числе возможных осложнений торакоскопии иногда отмечают формирование реактивного выпота, лечение которого осуществляется пункциями.
7 Зак. 0517
АБСЦЕССОСКОПИЯ
Волоконно-оптический эндоскоп может быть использован для оценки состояния полости абсцесса легкого, осмотра дренирующего бронха, динамического контроля за процессами очищения и заживления гнойной полости.
Для выполнения исследования эндоскоп в полость абсцесса вводится через сформировавшийся свищевой ход или путем торакоцентеза.
Перед проведением троакара следует убедиться в том, что легкое в зоне расположения абсцесса спаяно с париетальной плеврой. После этого выполняется пункция полости абсцесса. По ходу иглы через стенку грудной полости проводится троакар с мандреном. После извлечения мандрена с помощью резинового катетера и электроотсоса удаляется гнойное содержимое, промывается полость. Через троакар проводится эндоскоп. Полость осматривается, берется материал для морфологического и микробиологического исследований.
БИОПСИЯ НАДКЛЮЧИЧНЫХ
ЛИМФАТИЧЕСКИХ УЗЛОВ
Показанием к выполнению этого диагностического приема чаще всего является оценка распространения опухоли легкого или других органов грудной полости. Определенное значение биопсия надключичных лимфатических узлов имеет для дифференциальной диагностики с заболеваниями, при которых имеются внешне сходные изменения в лимфатическом аппарате (лимфогранулематоз, туберкулез).
Для выяснения состояния нижних шейных лимфатических узлов применяют прескален-ную биопсию [Daniels А., 1949]. При этом под местным обезболиванием или под наркозом удаляется клетчатка с расположенными в ней лимфатическими узлами второго клетчаточно-го пространства шеи. Эта анатомическая область ограничена внутренней яремной и подключичной венами у места их слияния в плечеголовной венозный ствол и нижним брюшком лопаточно-подъязычной мышцы. Располагающиеся здесь лимфатические узлы (нижние глубокие яремнце) иссекаются и подвергаются гистологическому исследованию. По данным А. Н. Ма-тыцина (1969, 1977), О. Brantigan и соавт. (1976), метастазы опухоли легкого при этом в увеличенных лимфатических узлах обнаруживаются в 17—32 % наблюдений, а в неуве-личенных, внешне не измененных, не определяемых при пальпации — в 6—12 %.
Возможным вариантом морфологической оценки состояния надключичных лимфатических узлов является пункционная биопсия. Этот менее травматичный прием используется глав-
97
ным образом для исследования измененных лимфатических узлов — увеличенных, четко пальпируемых. По мнению А. С. Павлова и соавт. (1979), выполнение этого простого в методическом отношении диагностического приема дает возможность при цитологическом исследовании материала обнаружить у 66,6 % больных раком легкого метастазы опухоли.
МЕДИАСТИНОСКОПИЯ
Выполнение медиастиноскопии предназначено для решения вопроса о состоянии лимфатических узлов средостения (паратрахеальных, трахеобронхиальных, претрахеальных, бифуркационных) путем их визуального исследования, инструментальной пальпации и взятия пункционной или прямой биопсии. Таким образом, основной задачей медиастиноскопии является оценка характера и степени распространенности бластоматозного процесса. Именно с этой целью она была разработана Е. Carlens в 1959 г.
Исследование выполняется под наркозом. В положении больного на спине, с валиком, подложенным под лопатки, и отведенной кзади головой над яремной вырезкой грудины делается поперечный разрез кожи, рассекаются фасциальные образования. Тупо, с помощью пальца и инструментов расслаивается клетчатка за грудиной и в переднем средостении, формируется канал для введения эндоскопа (медиастиноско-па). Осматриваются анатомические образования переднего средостения, расположенные здесь группы регионарных лимфатических узлов. С помощью иглы, биопсийных щипчиков или зажимов измененные или подозрительные в отношении поражения патологическим процессом ткани и лимфатические узлы берут для морфологического изучения. Исследование завершается гемостазом, наложением швов на рану.
Медиастиноскопия может сопровождаться рядом осложнений. По сводным данным Е. Adler (1976), на 7000 исследований в 0,1 % возникли тяжелые кровотечения, в 0,32 % — парез возвратного нерва, в 0,04 % — повреждение пищевода. Имелись случаи развития медиастинита, пневмоторакса.
По данным А. М. Авдеева (1968, 1971), медиастиноскопия, предпринятая у больных раком легкого, позволила в 18,3 % наблюдений установить метастазы в медиастинальных группах лимфатических узлов. Выполнение медиастиноскопии у больных раком легкого, имевших рентгенологические признаки метастазов в лимфатических узлах средостения, увеличивает этот показатель до 32—43,4 % [Вагнер Р. И., Волков О. Н., 1969; Павлов А. С. и др., 1979].
Однако необходимо иметь в виду, что медиастиноскопия не может дать полного представления о состоянии средостения на всем протяжении. Затруднено исследование задних его отделов, лимфатических узлов области «аортального окна»; не всегда возможно определить отношение первичной опухоли к сосудам корня легкого, перикарду.
ПАРАСТЕРНАЛЬНАЯ (ПЕРЕДНЯЯ) МЕДИАСТИНОТОМИЯ
Определенная неудовлетворенность возможностями и результатами исследования средостения с помощью медиастиноскопии по Е. Carlens (1959) явилась основанием для разработки и предложения диагностической парастернальной (передней) медиастинотомии [Пирогов А. И., Чхиквадзе В. Д., 1970, 1973; Stemmer L. et al., 1965; Fajgeli F., 1968; Overholt R. et al., 1970].
Парастернальная медиастинотомия обеспечивает лучший доступ к лимфатическим узлам средостения, дает возможность исследования клетчаточного пространства впереди от верхней полой вены и дуги аорты, «аортального окна» и корня легкого, более свободного визуального контроля, широкого пальпаторного исследования средостения и взятия для изучения нескольких лимфатических узлов из различных участков регионарных коллекторов.
Исследование выполняется в операционной. В большинстве наблюдений, когда при медиастинотомии принимается решение о радикальной операции, сразу же после ее завершения приступают к торакотомии [Павлов А. И. и др., 1979].
Под наркозом, в положении больного на спине, с валиком под плечами и головой, справа или слева от края грудины, параллельно и отступя от него кнаружи на 1 см, выполняется вертикальный разрез кожи между I—III ребрами. Послойно достигают хряща II ребра, который поднадхрящнично резецируется на протяжении 2,5—3 см. При необходимости углубленного исследования нижнего края корня легкого и околопищеводных групп лимфатических узлов дополнительно резецируется также хрящ III ребра. Выделяются и перевязываются внутренние грудные артерии и вены. Тупо отслаивается кнаружи медиастинальная плевра. Из образованного доступа проводится обследование средостения и расположенных в нем органов (верхняя полая вена, аорта, регионарные лимфатические узлы, элементы легкого). При необходимости клетчатка и отдельные лимфатические узлы берутся для гистологического исследования. Исследование завершается гемостазом, а при нарушении целости медиастинальной плевры и развитии пневмоторакса — дре
98
нированием плевральной полости. После медиа-стинотомии проводится контрольное рентгенологическое исследование.
диагностическая' торакотомия
В тех случаях, когда иными методами установить точный диагноз или распространенность патологических изменений не представляется возможным, особенно у больных, совокупность результатов обследования у которых не позволяет исключить развитие рака легкого, оправдана диагностическая торакотомия.
Во время торакотомии выполняются срочная биопсия очага поражения, лимфатических узлов или резекция измененного участка легкого (лобэктомия, сегментэктомия, атипичная резекция) в целях морфологического изучения.
Обнаружение при этом рака легкого делает диагноз достоверным и позволяет судить о распространенности бластоматозного поражения. Чаще всего такое диагностическое оперативное вмешательство сразу же переходит в лечебное.
По понятным причинам выполнение диагностической торакотомии противопоказано у больных, не подлежащих хирургическому лечению вследствие тяжести общего состояния, обусловленной основным или сопутствующими заболеваниями. В этих случаях диагностические трудности преодолеваются путем использования более щадящих методов, применяемых в процессе динамического наблюдения и симптоматического лечения.
ДИАГНОСТИКА ОТДАЛЕННЫХ
МЕТАСТАЗОВ РАКА ЛЕГКОГО
Метастазы рака легкого чаще всего локализуются в печени, почках, надпочечниках, головном мозге, костях. Поэтому определение состояния органов брюшной полости, которые при раке легкого стоят на втором месте после поражения лимфатических коллекторов средостения, имеет важное значение.
Среди специальных методов исследования печени, предпринимаемых для этой цели, наиболее часто используются радиоизотопная гепа-тография и гепатосканирование. Метод позволяет обнаружить в печени образования, имеющие поперечные размеры более 3 см [Зубовский Г. А. и др., 1976]. Однако, как свидетель-сгвуют данные A. De Priest и соавт. (1973), с абсолютной точностью поражение печени метастазами опухоли можно предсказать лишь у 52,6 % больных с патологическими изменениями в ней, выявленными при сканографии.
Для определения метастазирования опухоли в ткань печени используются также термография [Mansfield V. et al., 1970], ультразвуковая
эхолокация [Упырев А. 3., 1968; Lavac-Jeantet Е. et al., 1975], ангиография [Марморштейн С. Я., Гелонский В. М., 1972; Viallet R. et al., 1976]. Перспективным является применение компьютерной рентгенотомографии.
При больших изменениях в печени, выявленных с помощью неинвазивных методов исследования, для установления этиологического диагноза выполняется пункционная биопсия. По данным С. Conn, A. Gesner (1963), у половины обследованных больных раком легкого подтверждается ее бластоматозное поражение.
Выявление и гистологическая верификация метастазов опухоли в печень возможны с помощью лапароскопии [Бидяк И. В., 1974; Пирогов А. И. и др., 1976; Cuschieri J., 1975]. Однако существенным недостатком лапароскопии является недоступность для обозрения органов, расположенных в забрюшинном пространстве.
Диагностическая лапаротомия при раке легкого дает возможность наиболее полно оценить состояние органов брюшной полости и забрюшинного пространства. Впервые с этой целью она была применена R. Bell и соавт. в 1963 г., а в последующем ею пользовались и другие авторы.
По мнению А. С. Павлова и соавт. (1979), представивших анализ 148 лапароскопий и лапаротомий у больных раком легкого, эти исследования вносят коррективы в результаты, полученные при радиоизотопном исследовании печени, и позволяют уточнить распространенность опухолевого процесса. Однако широкого распространения диагностическая лапаротомия при раке легкого не получила.
В последние годы для оценки состояния надпочечников у больных раком легкого при подозрении на развитие в них метастазов опухоли предложена прямая супрареноскопия [Маты-цин А. Н„ 1983].
С помощью специального прибора — супра-реноскопа — удается осмотреть органы забрюшинного пространства — почки, надпочечники. При необходимости визуальная диагностика может быть расширена взятием материала для морфологического изучения.
ОЦЕНКА ФУНКЦИОНАЛЬНОЙ ОПЕРАБЕЛЬНОСТИ БОЛЬНЫХ
ОЦЕНКА ФУНКЦИИ
ВНЕШНЕГО ДЫХАНИЯ
Учитывая то обстоятельство, что операция на легких и плевре усугубляет прежде всего функциональные изменения в системе внешнего дыхания, о состоянии последнего определен
ную информацию представляют анамнез и данные обычного клинического обследования.
Быстрая утомляемость, одышка во время ходьбы и при движениях, учащение дыхания с участием вспомогательных мышц в покое, цианоз слизистых оболочек и кожи, нарастающий во время умеренной физической нагрузки, указывают на предельное снижение резервов дыхания. Медленное прогрессирование дыхательных расстройств может быть не замечено пожилыми больными, так как с возрастом постепенно ограничивается физическая активность. Поэтому субъективное ощущение переносимости нагрузок, например возникновение одышки при ходьбе, должно быть подкреплено объективными исследованиями.
У больных старшей возрастной группы используется простой тест: реакция больного на подъем по лестнице с этажа на этаж. Преодоление двух-трех маршей лестницы в обычном темпе (рядом с врачом) без значительного учащения дыхания и выраженной одышки свидетельствует об отсутствии существенных расстройств дыхания. Если частота дыхания и пульса восстанавливается через 2—3 мин после этой пробы, то больной, как правило, переносит резекцию одной или двух долей легкого без тяжелых функциональных последствий.
Пробы с задержкой дыхания на вдохе (Штанге) и на выдохе (Саабразе — Генча) позволяют оценить достаточность дыхания (при задержке более 35—40 с). В то же время уменьшение времени задержки до 10—15 с еще не дает возможности сделать обоснованное заключение о функциональной неоперабельности, так как на результаты этих проб влияет субъективный фактор.
Для оценки степени снижения функциональных резервов дыхания используются, величины жизненной емкости легких (ЖЕЛ), минутного объема дыхания (МОД), максимальной минутной вентиляции (ММВ) и коэффициента использования кислорода (КИОг). Определение подразделений ЖЕЛ не дает каких-либо дополнительных критериев, хотя предельное снижение резервного объема выдоха до нуля и появление симптома «воздушной ловушки» (при спокойном, нефорсированном выдохе после глубокого вдоха) свидетельствуют о значительных эмфизематозных изменениях легких. Считается, что уменьшение ЖЕЛ до 50 % от должной величины является предельным, при котором возможна обширная резекция легких. Опыт клиники убеждает, что больные, которые успешно переносили пневмонэктомию, нередко имели ЖЕЛ, составлявшую 40—45 % от должной. Определение односекундной ЖЕЛ (той части, которая выдыхается в первую секунду) наиболее ценно для определения выраженности об
структивных процессов в конечных разветвлениях бронхиального дерева. Для выяснения степени скрытого бронхоспазма в случаях значительного снижения ЖЕЛ необходимо проводить пробы с бронхолитиками (новодрином, эуспираном и др.) или fi-блокаторами (обзи-даном). Заметное увеличение этого показателя спирограммы на фоне действия бронхолитика позволяет более уверенно оценивать функциональную обеспеченность внутригруд-ного вмешательства.
Для оценки обструктивных изменений внешнего дыхания целесообразно использовать пнев-мотахометрические способы с учетом субъективного фактора: снижение функциональной жизненной емкости до 60 % и уменьшение максимальной скорости выдоха ниже 3 л/с указывают на значительное уменьшение вентиляционных возможностей легких. Важным показателем является соотношение скорости выдоха и вдоха. Г. Плаушенене (1967) установила, что величина этого соотношения соответствует изменениям остаточного объема легких: если она снижается до 0,7—0,6, то остаточный объем легких составляет 54 % от общей емкости, т. е. уровня, при котором удаление части функционирующей легочной паренхимы или даже временное снижение легочной функции (торакотомия) считается, непереносимым.
Достаточно информативной является оценка связи между производными показателями ЖЕЛ в процентах к должной и отношения максимальной скорости выдоха к абсолютной величине ЖЕЛ, что позволяет определять тип и степень нарушения внешнего дыхания (рис. 54). Определение МОД и КИОг мало дополняет оценку спирограммы, хотя снижение КИОг до 20—25 при увеличении МОД следует рассматривать как предельное, при котором допустимо оперативное вмешательство на легком.
При оценке показаний к вмешательству необходимо ориентироваться не только на выраженность обструктивных и рестриктивных изменений внешнего дыхания, но и на величину дыхательного резерва (отношения ММВ к МОД), а также на раздельное определение функции каждого легкого в ходе общей спирографии латеральным тестом J. Bergan (1960), а иногда и раздельной спирографией при сомнениях в функциональной операбельности больного [Гаврилова Н. И., Ребане Л. Е., 1967]. Резкое снижение общей ЖЕЛ и незначительное участие в вентиляции непораженного легкого ставят под сомнение возможность проведения не только минимального по объему радикального вмешательства, но даже и диагностической торакотомии.
В сомнительных случаях необходимо еще до операции определить показания к проведе-
100
I II
III
Рис. 54. Диаграмма для определения вида и выраженности нарушений внешнего дыхания (по Т. И. Черницкому, 1973).
I—III — степени рестриктивных нарушений; 1—3 — степени обструктивных нарушений.
МВЛ %
нию профилактической ИВЛ, используя моди-фицированную гипервентиляционную пробу [Шанин Ю. H., Костюченко А. Л., 1975], или даже применить «функциональную пульмон-эктомию»: бронхоспирометрию с блокадой соответствующего бронха и ветви легочной артерии. Временная окклюзия бронхов поролоновой пломбой позволяет производить «функциональную резекцию» (нижняя доля, все легкое) и оценивать переносимость вмешательства в менее острой ситуации. Аналогичные задачи позволяет решить использование искусственного пневмоторакса (при незапаянной плевральной щели), наложенного за 2—3 дня до предполагаемой операции,— приема, хорошо известного и незаслуженно забытого.
Эффективность легочного газообмена по напряжению газов артериальной крови (РаОг и Расо.) определяется за несколько дней до оперативного вмешательства с тем, чтобы получить исходные данные, ориентируясь на которые можно оценивать состояние легочного газообмена во время вмешательства или после него. Для этого следует учитывать возрастную норму для Раог по специальным формулам. Наиболее корректна формула, предлагаемая Н. В. Путовым и В. С. Щелкуновым (1978): РаО! (мм рт. ст) = 102,6 — 0,32Х В, где В — возраст больного. Следует отметить, что при отсутствии очевидной причины гипервентиляции (лихорадка, интоксикация) сочетание гипоксемии с гипокапнией указывает на значительное напряжение дыхания, а гипоксемия даже с умеренной гиперкапнией (50 мм рт. ст.) свидетельствует о явной недостаточности легочного газообмена и необходимости специальной подготовки и лечения в послеопераци-
Рис. 55. Диаграмма для определения степени вентиляционных нарушений и функциональной операбельности по индексу вентиляции.
ИВ — индекс вентиляции (произведение МВЛ и ЖЕЛ в % к должным величинам); ПО — полная операбельность; УО — удовлетворительная операбельность; СО — сомнительная операбельность; ПНО — практически неоперабельны.
онном периоде, если показания к операции на легких абсолютные.
Наиболее трудным является определение ближайшего прогноза, когда выявленные функциональные изменения дыхания не укладываются в те величины, которые названы предельными. При использовании различных показателей: спирографии, пневмотахографии, общей плетизмографии и др.— как отечественные, так и зарубежные пульмонологи считают, что ни один из тестов в отдельности и ни одна из их комбинаций не дают разительных преимуществ перед обычными клиническими методами определения функциональной операбельности.
Вариантом решения такой задачи представляется подход, предлагаемый М. Я. Авруцким и соавт. (1978), которые на основании данных дооперационного обследования больных в сопоставлении с послеоперационными оценками состояния составили нелинейные шкалы информативных показателей. Прогноз определяется суммированием величины баллов: 3—4 балла указывают на благоприятное течение послеоперационного периода; 4—8 баллов — на возможность осложнений средней тяжести: более 9 баллов — на реальное развитие тяжелого состояния из-за легочных осложнений с несостоятельностью дыхания. Прогноз совпадал с послеоперационной оценкой в 2/з наблюдений.
Подобный подход предложили М. Ю. Репин и И. Я. Цукерман (1980), которые прогнози
101
руют функциональные исходы операций на основании графического метода оценки основных показателей спирограммы, исходя из вычисления индекса вентиляции (ИВ), представляющего произведение процентных значений ЖЕЛ и ММВ, отнесенных к должным величинам (рис. 55). Выделено пять степеней вентиляционных расстройств. Номограмма одновременно позволяет определить исходный тип этих нарушений: часть графика внизу и справа от центрального сектора соответствует зоне преимущественно обструктивных нарушений, а вверху и слева от сектора — преимущественно рестриктивным расстройствам. Если при I—II степени ИВ летальный исход наблюдали у 8,4 % больных, то при IV—V степенях ИВ ниже уровня границ переносимости — 2/3 больных, несмотря на все меры интенсивной терапии, включая вспомогательную ИВЛ. Повышение ИВ после курса специальной предоперационной подготовки свидетельствует о возможности расширения показаний к операции, так как объем ее не играет ведущей роли как фактор риска. Более того, наименьший риск представляют пневмонэктомии, после которых выраженность нарушений легочного газообмена в послеоперационном периоде будет меньше, чем после лобэктомии (см. гл. 2).
ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ КРОВООБРАЩЕНИЯ
Наряду с определением функциональной операбельности по состоянию внешнего дыхания важно также оценить компенсаторные возможности системы кровообращения: сократительную способность миокарда, степень патологических изменений сосудистой системы как в целом, так и в отдельных ее бассейнах (в малом круге, коронарное, мозговое кровообращение).
У ряда больных до операции выявляется так называемая энергодинамическая недостаточность миокарда, которая возникает в связи с глубокими нарушениями обмена в мышце сердца под влиянием раковой или гнойной интоксикации, гипопротеинемии, анемии и гипокалиемии. Появление значительной одышки при подъеме по лестнице у больного с отсутствием выраженных расстройств вентиляции и газообмена позволяет заподозрить именно такой вариант недостаточности кровообращения. Более точные доказательства ее дает проба с дозированной физической нагрузкой на велоэргометре: удлинение более чем на 9 мин времени восстановления исходной величины МОД, КИОг и выделения углекислого газа. Если период восстановления этих показателей превышает 12 мин, то резекция легких непереносима [Bie N. et al., 1960].
Застойная сердечная недостаточность в анамнезе или непосредственно в предоперационном периоде обязывает к углубленному изучению ее причин и выяснению возможностей ее устранения.
Если наблюдавшаяся в свое время сердечная недостаточность была обусловлена гипертонической болезнью или ишемической болезнью сердца и ее удавалось устойчиво компенсировать медикаментозной терапией, то можно надеяться на возможность предотвращения рецидива сердечной недостаточности рационально спланированным интенсивным лечением. Высокая артериальная гипертензия в момент осмотра не является противопоказанием к вмешательству по поводу заболевания легких и плевры, так как в определении операционного риска имеет значение не только первоначальный уровень системного АД, но особенно его снижение под влиянием терапии, включающей гипотензивные средства, транквилизаторы, ограничение соли в пище, салуретики.
Если недостаточность кровообращения протекала прежде с декомпенсацией по типу правожелудочковой недостаточности в результате хронического легочного заболевания, то внутри-грудное вмешательство и удаление части сосудистой сети малого круга еще больше нарушат кровообращение в нем и неизбежно вызовут рецидив недостаточности. Выраженная правожелудочковая недостаточность является основным проявлением «хронического легочного сердца» и давно считается противопоказанием к резекции значительного объема легочной паренхимы [Муравьев М. В. и др., 1961; Ап-сит С. О. и др., 1965]. В стадии компенсации и субкомпенсации признаки правожелудочковой недостаточности выявляются при исследовании показателей внешнего дыхания.
Более точно выраженность легочной гипертензии определяют прямым исследованием давления в системе легочной артерии, к которому следует прибегать при сниженных резервах дыхания, электрокардиографических признаках перегрузки правого сердца и при таком распространении процесса в легком, по поводу которого необходима значительная по объему частичная резекция или пневмонэктомия. W. Adams и соавт. (1962) установили, что больные со средним легочным артериальным давлением выше 30 мм рт. ст. могут перенести операцию такого объема только при полной гарантии неосложненного течения послеоперационного периода. Н. В. Антелава и соавт. (1968) пришли к выводу, что если после нагрузки среднее давление в легочной артерии поднимается выше 50 мм рт. ст., показания к распространенной резекции следует ставить с особой осторожностью. W. Hartel и соавт. (1970) установили зна
102
чение не только подъема, но и нормализации уровня легочного давления: замедленный возврат к исходному уровню после значительного подъема всегда указывает на необходимость возможного сокращения объема вмешательства.
Электрокардиография дополняет данные клинического обследования, позволяет уточнить диагноз ишемической болезни сердца и наличие склеротических изменений в миокарде. Однако данные электрокардиографии, свидетельствующие об очаговых изменениях в миокарде и постинфарктных рубцах, далеко не всегда являются основанием для отказа от обширного внутри-грудного вмешательства. Они указывают на вероятность развития выраженной циркуляторной гиподинамии с угнетением сократительной способности и нарушениями трофики миокарда, но при соответствующей предоперационной подготовке, анестезиологическом пособии и послеоперационном лечении тяжесть операции у больных с отчетливой ишемической болезнью существенно не отражается на ее непосредственном исходе [Шанин Ю. Н., Костюченко А. Л., 1975; Лебедева Р. Н. и др., 1977].
Недостаточность кровообращения мозга, перенесенные ранее инсульты значительно повышают риск оперативного вмешательства даже средней тяжести, особенно если операция проводится на стороне ранее перенесенного пареза. Стабильность кровообращения по ходу вмешательства, послеоперационная терапия с достижением адекватной оксигенации, предотвращением циркуляторной гиподинамии, снижением системного АД и выраженной гиперкоагуляции уменьшают опасность повторных нарушений мозгового кровообращения, однако гемипарез с нарушением функции дыхательных мышц является противопоказанием к резекции легких даже при относительно мало измененных показателях внешнего дыхания.
Однократное исследование минусного объема кровообращения (МОК) методом Фика или одним из методов разведения индикатора (краски, меченного радионуклидами альбумина или терморазведения) мало что добавляет к оценке гемодинамики у обследуемых больных. Тем не менее его определение оправдано в экстренных ситуациях (травма легкого, легочное кровотечение, прогрессирующая гангрена легких), когда гемодинамика особенно неустойчива.
Интегральная реография тела по М. И. Тищенко позволяет более глубоко оценить резервы гемодинамики.
Кроме возможности оценить в плане предоперационного обследования реакцию кровообращения (УО, частота пульса, МОК) на дозированную физическую нагрузку (10 раз сесть из положения лежа в произвольном темпе),
метод позволяет выяснить состояние тонуса сосудов большого круга кровообращения (по коэффициенту интегральной тоничности), определить наличие повышения резистентности сосудов малого круга и степень задержки воды в организме, а также оценить степень гемодинамической обеспеченности недостаточности внешнего дыхания [Колесников И. С. и др.].
По мере нарастания нарушений внешнего дыхания увеличивается сердечная недостаточность (за счет снижения УО). Вероятно, эти изменения обусловлены перегрузкой правого желудочка, так как параллельно им нарастают качественные проявления легочной гипертензии. Гипердинамический эффект расстройств дыхания выявляется у части больных с умеренными изменениями, но на фоне других факторов повреждения миокарда (при гнойной интоксикации, например) он уступает место сердечной недостаточности, особенно при переходе к выраженным изменениям внешнего дыхания.
Заслуживает внимания повышение сис темного артериального тонуса, которое у больных с длительно текущими заболеваниями легких наступает заметно чаще, чем сердечная недостаточность, что подтверждает правильность представлений о существовании «пульмоно-генной» артериальной гипертензии [Мухарля-мов А. М. и др., 1974]. При выраженных нарушениях внешнего дыхания, компенсированных кровообращением, уровень системного объемного кровотока (МОК) у больных в 1,5—1,9 раза превышает их индивидуальные нормальные величины.
По мере углубления дыхательных расстройств увеличивается неравномерность значений ударного объема по его изменениям внутри дыхательного цикла — коэффициенту дыхательных изменений (КДИ), отношению наибольшего УО к наименьшему.
В оценке наблюдаемых взаимосвязей дыхания и кровообращения особого внимания заслуживает показатель напряженности дыхания, который представляет собой произведение частоты дыхания на коэффициент дыхательных изменений У О. При умеренной напряженности внешнего дыхания этот показатель более 26,5, а в случаях выраженной напряженности он превышает 36,5. Есть основание полагать, что показатель напряженности дыхания косвенно характеризует увеличение энерготрат на работу дыхания.
На основании кросс-корреляционного анализа связанных изменений показателей внешнего дыхания и гемодинамики наибольший интерес представляют взаимосвязи ЖЕЛ и КДИ, резерва дыхания (РД — отношения ММВ к МОД) и коэффициента резерва гемодинамики
103
ЖЕЛ ДЖЕЛ
100 -
80 -
60 -
40 -
1. ЖЕЛ = 240- 116 ИДИ
2. ЖЕЛ = 167-68 К ДИ
20
X I I I I I .__I__I_I__I_I__I__I_I__I-J--1--1-1-----
1,20 1.30 1,40 1,50 1,60 1.70 1,80 1,90 2,00 2,10
КДИ
Рис. 56. Уравнение ,инейной регрессии, выражающее связь ЖЕЛ — КДИ.
1 — у больных раком легкого; 2 — у больных хроническим нагноением легкого; 3 — у больных острыми гнойно-деструктивными заболеваниями легких.
Рис. 57. Уравнение линейной регрессии, выражающее связь резерва дыхания (РД) и коэффициента гемодинамического резерва (КР).
1 — у больного раком легкого;" 2 — у больного хроническим нагноением легкого; 3 — у больного острым гнойно-деструктивным заболеванием легкого.
(КР отношения МОК к должному). На основании проведенных исследований появилась возможность количественно характеризовать указанные взаимосвязи с помощью уравнений линейной регистрации для каждой из основных групп заболеваний легких: рак, хронические неспецифические заболевания и острые гнойнодеструктивные процессы в легких [Колесников И. С. и др., 1982]. Раздельные графические изображения корреляционных связей ЖЕЛ-КДИ и РД-КР (рис. 56) могут быть использованы в качестве номограмм для приблизительного (с учетом доверительного интервала) вычисления значения одного из взаимосвязанных показателей по величине другого в соответствующих группах больных. Практический смысл уравнений ЖЕЛ-КДИ заключается в том, что, располагая только данными интегральной рео-графии, можно на основании КДИ косвенно
оценить степень снижения ЖЕЛ. Зная величину резерва дыхания данного больного, можно рассчитать величину гемодинамического резерва (рис. 57), необходимого для компенсации имеющейся дыхательной недостаточности. Если фактическое значение КР конкретного больного меньше математически ожидаемого, то это дает возможность не только констатировать «легочное сердце», но и оценить степень декомпенсации кровообращения.
Специальные исследования, проведенные у различных категорий больных, показали, что устойчивость системы кровообращения по отношению к неблагоприятным воздействиям анестезии и операции определяется достаточностью объема циркулирующей крови (ОЦК) и его компонентов: плазмы ЩО) и эритроцитов (ЭО). Значительное снижение ОЦК с уменьшением ЭО и содержания плазменного белка повышает чувствительность гемодинамики к различным факторам операции и послеоперационного стресса с падением сердечного выброса и нарушением кровообращения на уровне микрососудов. Более редким волемическим расстройством является гиперволемия. Превышение величины ОЦК на 20 % и более может зависеть от право желудочковой недостаточности и должно учитываться при определении функциональной операбельности как один из признаков «легочного сердца» [Балезина 3. Н. и др., 1978].
У больных без отчетливых функциональных нарушений кровообращения и явлений интоксикации отклонения ОЦК составляют примерно 10 %, преимущественно за счет ЭО. Изменения в сторону гиповолемии такой степени выраженности характерны для физиологической гиповолемии пожилых [Haxbe J., 1969]. Однако и более значительный дефицит ОЦК не следует считать патологией, он не всегда является показанием к немедленной трансфузионной коррекции. Величина ОЦК у здоровых и малоистощенных больных в пожилом возрасте при гиподинамии и хроническом нагноении легких в стадии ремиссии может отличаться от «должной», так как циркуляторный гомеостаз переходит у них на другой уровень функционирования.
Сочетание гиповолемии со значительным дефицитом циркулирующего гемоглобина является неблагоприятным признаком: при раке легких это один из косвенных признаков распространенности процесса. Нарастание гиповолемии, несмотря на попытки уменьшить вредное воздействие патологического процесса в легком средствами общей и местной детоксикации, усиленным питанием, устойчивость к трансфузионной коррекции этих расстройств, является показанием лишь к паллиативной опе,-рации или даже выполнению ее в несколько этапов.
104
ВОДНО-ЭЛЕКТРОЛИТНОГО ГОМЕОСТАЗА
В случаях волемических расстройств при заболеваниях легких обычно наблюдаются изменения и водно-электролитного равновесия, в значительной степени снижающие сократительную способность миокарда, усложняющие коррекцию гипопротеинемии и санацию бронхиального дерева. Эти изменения могут стать одной из причин нарушений легочного газообмена и кровообращения во время операции или сразу после нее.
При оценке операбельности и подготовленности больного по этим критериям следует ориентироваться на результаты исследования концентрации основных электролитов в плазме циркулирующей крови и в моче.
На фоне хирургических заболеваний легких и плевры, особенно гнойно-деструктивных, отмечается расширение внеклеточного жидкостного пространства организма (преимущественно его интерстициального сектора) со снижением концентрации натрия, несмотря на задержку его ионов в организме.
Регрессия воспаления под влиянием эффективного лечения сопровождается восстановлением плазменной концентрации натрия. Показатели концентрации других естественных осмотически активных веществ (глюкозы и мочевины) сохраняются примерно на одном уровне на всех этапах заболевания. Поэтому одновременно с гипонатриемией отмечается и снижение осмоляльности, хотя задержка натрия в организме отчетлива. Синдром гипоосмии, обусловленной гипонатриемией в сочетании со снижением экскреции натрия с мочой и одновременным расширением внеклеточного пространства, характерен и для ряда невоспалительных заболеваний легких.
При этом необходимо учитывать факт, что с возрастом постепенно ослабевают энергетически зависимые процессы, поддерживающие ионную асимметрию в организме: калий — преимущественно в клетках, натрий — во внеклеточном жидкостном пространстве. Нарастает тенденция к перемещению калия во внеклеточную жидкость с потерей его ионов через почки, а натрий поступает в клетки [Шведов К. И., Крохалев А. А., 1968]. Процесс трансминерализации усиливается при нарушении биоэнергетики клеток (при гипоксии, гнойной интоксикации, лихорадке, истощении).
Клиника недостаточности вну гриклеточного калия выявляется при крайних степенях дефицита его ионов в организме (снижение калий-уреза) на фоне длительного голодания и интенсивных потерь с мокротой и гнойным плевральным экссудатом. Электрокардиографические
снижением концентрации калия в плазме: при умеренном дефиците ионов К наблюдают снижение интервала S — Т ниже изолинии, удлинение Q — Т, уплощение и инверсию зубца Т.
Участие калия в тканевых энергетических и синтетических процессах сказывается и на изменениях циркуляторного гомеостаза.
В. В. Мазинову (1971) удалось показать существование высокой зависимости между дефицитом ОЦК и концентрацией калия в плазме и эритроцитах при длительном течении заболевания легких. Значительное снижение содержания калия в плазме соответствует дефициту его ионов в организме, тогда как нормальная или даже повышенная концентрация еще не исключает дефицита. Исследование в таких случаях внешнего баланса калия по калийурезу после пероральной нагрузки 4,5—6 г калия хлорида (60—80 ммоль) в сочетании с определением трансмембранного потенциала эритроцитов по калию (отношение калия в эритроцитах к калию в плазме) позволяет более точно выявить дефицит К+. У больных с хирургическими заболеваниями легких он встречается чаще, чем регистрируется при исследовании ионограммы плазмы.
Иногда дефицит внутриклеточного калия сочетается с дефицитом других внутриклеточных ионов, например магния. Диагностика этого нарушения гомеостаза еще более трудна, тогда как роль магния в процессах жизнедеятельности не уступает значению калия. При дефиците магния в организме ухудшается синтез белка, нарушая восстановление белкового равновесия, снижаются утилизация глюкозы в мышцах и эффективность мышечного сокращения, функционирования мукоцилиарного эскалатора.
Нарушения содержания электролитов при заболеваниях легких и плевры нередко сочетаются с расстройствами кислотно-основного состояния. Только в случаях острейших состояний (кровотечение) или при значительных нарушениях функции почек (амилоидоз) они протекают по типу недыхательного ацидоза. Более часто возникает недыхательный, метаболический алкалоз, что связано с нарушением кислородного обеспечения организма.
СОСТОЯНИЕ ПИТАНИЯ И БЕЛКОВОГО ОБМЕНА
Основным внешним проявлением белковой недостаточности считаются анемия и гипопротеинемия с характерной диспротеинемией в виде уменьшения содержания альбуминов и повышения a-фракций глобулинов, а по мере развития заболевания — у-фракций, что особенно четко
105
выявляется в концентрационном выражении (в г/л плазмы). При сохраненном энтеральном поступлении белка и отсутствии значительных внесосудистых потерь протеинов (экссудат, мокрота) основными факторами, от которых зависит выраженность гипоальбуминемии, считаются тяжесть и длительность существования патологического процесса в легком, по поводу которого выполняется операция.
В возникновении и прогрессировании белковой недостаточности имеют значение повышение проницаемости капилляров, ускорение распада лабильных белков в условиях воспаления и опухолевого роста, потери белка с экссудатом. Одновременно снижается темп наработки альбумина из-за недостаточности энтерального поступления пищевого белка (снижение аппетита) и непосредственного нарушения белоксин-тезирующей функции печени. Снижение концентрации альбумина сопровождается повышением концентрации си- и особенно «2-глобу-линов и входящих в состав этих фракций гликопротеидов. Динамика содержания у-глобули-нов (фибриногена, участвующего в процессах гемостаза и репарации; пропердина и комплемента, играющих важную роль в формировании неспецифического иммунитета; специфических иммуноглобулинов и т. д.) отражает состояние защитной реакции организма. В силу перераспределения белковых фракций величины концентрации и содержания общего белка могут оказаться нормальными, несмотря на прогрессирующий деструктивный процесс в легком [Федоров Б. П., Воль-Эпштейн Г. Л., 1976; Лес-ницкий Л. С., 1984].
Полное представление о степени декомпенсации белкового обмена можно получить, зная абсолютные величины содержания плазменных белков, так называемую массу циркулирующего белка, а также отношение концентрации аг- и у-глобулинов к концентрации альбумина.
Гипоальбуминемия порядка 30 г/м2 свидетельствует о тяжелой белковой недостаточности, особенно если она сочетается с признаками энергетической несостоятельности организма (пониженная концентрация холестерина сыворотки, низкая активность сывороточной холинэстеразы, снижение выделения рибофлавина с мочой и пр.). При уровне альбумина плазмы в 20 г/м2 (норма — 50 г/м2) больные гангреной легких еще переносят радикальные вмешательства, но погибают от многочисленных осложнений, несмотря на заместительную терапию альбумином (по 30—50 г/сут на протяжении первых 3—5 дней). По величине абсолютной концентрации белков плазмы можно судить о водоудерживающей функции плазменного белка, поскольку 1 г альбуминов удерживает
16 мл воды, air глобулинов — 7 мл [Linden-schmidt S., Cartensen О., 1966].
Использование такого подхода при оценке состояния белкового обмена больного с заболеваниями легких и плевры во многом раскрывает динамику волемических изменений в случаях отностельно медленного течения заболевания — когда каждому уровню диспротеине-мии соответствует определенное состояние ОЦК и его компонентов. В стадии белкового истощения и декомпенсации белкового обмена снижаются концентрация и содержание фибриногена, что может сказаться на коагуляционной активности крови.
СИСТЕМА ГЕМОСТАЗА
И ЭНДОКРИННЫЙ ФОН
При изучении анамнеза и обследовании больного следует выяснить, нет ли признаков геморрагического диатеза (частые носовые кровотечения, значительные подкожные кровоизлияния при легких ушибах и т. п.). Исследование коагулограммы при заболеваниях легких и плевры считаем правилом; оно включает определение количества тромбоцитов, времени свертывания крови или рекальцификации плазмы, концентрации факторов протромбинового комплекса и фибриногена, активности фибриназы (фХШ), уровня спонтанного фибринолиза. При более углубленном обследовании стандартную коагулограмму желательно дополнить исследованием концентрации гепарина в крови, продуктов деградации фибрина. Снижение уровня протромбина до 60 % и ниже, низкий уровень фибриногена (ниже 2 г/л и 3 г/м2 поверхности тела больного), активность фибриназы менее 40 с говорят о том, что больной находится в состоянии гнойного истощения и декомпенсации, при которых опасность кровотечения во время и после операции весьма реальна. Сдвиг в сторону гиперкоагуляции, наблюдающийся у большинства больных раком легких и гнойно-деструктивными заболеваниями: высокий уровень протромбина, концентрация фибриногена выше 8 г/л, снижение содержания гепарина и предельное угнетение фибринолиза — должен настораживать в отношении тромботических осложнений, особенно при наличии хронического тромбофлебита.
Обязательно следует оценить состояние вен нижних конечностей, патологические изменения которых (варикозная болезнь, тромбофлебит в анамнезе) предрасполагают к возникновению тромбоэмболических осложнений. Степень тромбоопасности может быть уточнена жгутовой пробой Б. А. Кудряшова [Дедко-ва Е. М., Лукомский Г. И., 1969]. Отсутствие повышения спонтанного фибринолиза и кон
106
центрации гепарина в крови, взятой из вены локтевого сгиба после венозного застоя под жгутом в течение 15 мин, позволяет считать такого больного «тромбоопасным» при прочих осложняющих факторах и заставляет заранее наметить план профилактики неизбежной патологической гиперкоагуляции после обширного вмешательства на легких и плевре.
Функциональная операбельность в определенной степени может определяться эндокринным статусом больного, что требует клинической оценки и соответствующих медикаментозных воздействий. Тяжелый гипертиреоз с психическими и висцеральными проявлениями необходимо уменьшить до допустимых пределов лекарственными воздействиями при плановом вмешательстве, и необходимо быть готовым к профилактике и лечению гипертиреоидного криза в ходе срочного вмешательства с помощью дроперидола, 6-блокаторов и глюкокортикоидов.
Среди других нарушений, сопутствующих заболеваниям легких и плевры, следует выявлять скрытую надпочечниковую недостаточность, которая может проявиться иногда только на фоне стресса. Обычно ей способствуют деструкции в области надпочечников (туберкулез, метастаз опухоли легкого) или хроническое легочное нагноение с длительной интоксикацией. Значительное уменьшение массы тела больного, анорексия и мышечная слабость, быстрая утомляемость, пигментация кожи щек, век, тыльной поверхности пальцев, необычная для пожилого возраста артериальная гипотензия и тахикардия, упорные запоры позволяют заподозрить поражение надпочечников. Предположение подтверждается низкой концентрацией натрия и хлора в плазме, повышением плазменной, а иногда и эритроцитарной концентрации калия, низким содержанием 17-ок-сикортикостероидов в крови и 17-кетостерои-дов в моче. Разительное уменьшение симптомов при пробном введении гидрокортизона еще больше подтверждает их надпочечниковую природу и обязывает быть готовым к необычным изменениям состояния больного во время вмешательства и в послеоперационном периоде.
Сахарный диабет изменяет течение легочного заболевания, особенно если оно осложняется гнойной инфекцией. Очаг гнойной деструкции в легком вызывает декомпенсацию диабета, что неблагоприятно сказывается на обменных процессах, замедляя репарацию и регенерацию тканей [Генес С. Г., 1968; Соколовский В. Д., 1968, и др.]. В условиях диабета даже ограниченный гнойный процесс протекает с повышением температуры тела до 39-4-40° С, высокой гипергликемией (12 ммоль/л), глюкозурией и кетонурией. Порочный круг иногда становится
настолько прочным, что компенсации диабета (а иногда и ликвидации кетоацидоза) можно добиться только при устранении очага инфекции в легком. У больного диабетом раковая опухоль увеличивается относительно быстрее при одновременном снижении гипергликемии и глюкозурии, смягчении основных проявлений эндокринопатии, но при прогрессировании расстройств гомеостаза в виде выраженной гипокалиемии, диспротеинемии, причем степень гипокалиемии имеет значение при решении операбельности больных. Учитывая нарастание частоты скрытого диабета с возрастом, исследование уровня гликемии и глюкозурии должно быть правилом при планировании обследования больных с хирургическими заболеваниями легких и плевры. Рак легких может вызывать и другие эндокринопатии, которые иногда являются масками неопластического процесса, например миастеноподобный синдром или состояние, напоминающее несахарный диабет с высокой полиурией и стойкой гипонатриемией.
Установлено, что, кроме типичных эндокринных заболеваний, которые нередко диагностируются у таких больных задолго до клинических проявлений опухолевого роста, необходимо учитывать и возможность эндокринопатий, которые связаны с самим заболеванием (чаще всего злокачественным) и приводят к так называемому карциноматозному гормоногенезу [Ross J., 1980]. Гормоны, выделяемые опухолями легких, бронхов и плевры, в таких случаях не только систематически определяются в крови, но их уровень резко снижается при успешном лечении заболевания с помощью хирургического вмешательства, лучевой терапии или цитотоксических препаратов. Частота эндокринопатий такого типа может достигать 10 %, но клинически выраженные проявления наблюдаются значительно реже.
Гиперсекреция опухолью легких кортикотропина (АКТГ) проявляется локализованными отеками в области локтей и лодыжек, иногда— артериальной гипертензией в связи с задержкой натрия, мышечной слабостью из-за усиленной экскреции калия. Избыток циркулирующего кортизола приводит к гипергликемии и глюкозурии, иногда — к изменению поведения больного, которое может прогрессировать вплоть до выраженного психоза. Кардинальным биохимическим признаком «эктопического АКТГ-синдрома» является гипокалиемический алкалоз как результат интенсивных потерь калия с мочой и калом. Плазменная концентрация кортизола постоянно высокая и продолжает нарастать по мере развития опухоли легких, достигая уровня, заведомо (в 3—4 раза) выше той, которую наблюдают при классическом синдроме Иценко — Кушинга (200 мкг/л). Ко
107
лебания уровня кортизола на протяжении суток, характерные для обычного состояния надпочечников, у больных с опухолями легких отсутствуют [Буравцов В. И„ 1976].
Другой тип карциноматозного гормоногене-за связан с выделением активных субстанций, напоминающих антидиуретический гормон (АДГ), что приводит к неспособности экскретировать воду и может привести к водному «отравлению». Клиника этого синдрома состоит в проявлениях гипергидратации клеточного и внеклеточного жидкостных пространств, но особенно четко проявляется в отношении мозга: его нарастающий отек приводит к психическим нарушениям, повышенной возбудимости, затем к летаргии, а в последующем — к судорогам, мозговой коме и смерти. Так как плазменный компонент крови обычно увеличен, у больных не бывает нарушений гемодинамики, как при натриевом истощении. Наоборот, артериальное давление часто повышено. Ключом к диагнозу в этих случаях является обнаружение гипонатриемии разведения, которая зависит скорее от задержки воды, чем от потерь натрия, так характерных для надпочечниковой недостаточности. Все концентрационные константы плазмы снижены: уровень натрия, хлора, мочевины, креатинина. Осмолярность плазмы низкая (ниже 270 мосмомоль/л), тогда как в моче этот показатель значительно выше (350 мосмомоль/л). Клубочковая фильтрация почек остается нормальной или даже превышает нормальный уровень. Полипептид, повышающий активность АДГ в плазме крови и пунктатах опухоли, идентичен гипоталамическому аргинин-вазопресси-ну. Состояние таких больных можно улучшить или даже вернуть их к привычным бытовым нагрузкам введением больших доз (2—10 мг в день) ингибитора АДГ-флюрогидрокортизо-на, особенно при одновременном введении препаратов калия.
Паратиреоидный тип карциноматозного гор-моногенеза опухолью легкого имеет типичные клинические признаки избытка этого гормона. Гиперкальциемия, как правило (в отличие от состояний, связанных с метастазами в кости), сочетается с гипофосфатемией без повышения активности щелочной фосфатазы. Клинические проявления эндокринопатии этого типа обычны для гиперкальциемии любого происхождения, а именно: жажда, полиурия и никтурия в сочетании с мышечной слабостью и гипотонией, миоклонус, анорексия, схваткообразные боли в животе, рвота и запоры, психические расстройства вплоть до выраженного психоза. Гормоноподобная субстанция, которая выделяется опухолью легких, не идентична (по молекулярному строению) той, которая секретируется паращитовидными железами. Она пред
ставляет полипептидную цепь из 84 аминокислот (паратгормон — полипептидная цепь которого состоит всего из 34 аминокислот). Следует отметить, что гиперкальциемия может наблюдаться и при отсутствии эктопического гормо-ногенеза, например при избыточной секреции простагландинов Е или витамин D-подобной субстанции.
Более редко обнаруживаются другие эндо-крйнопатии, например гипертиреоидизм с типичной клиникой потери массы тела, несмотря на повышение аппетита, непереносимостью тепла, нервозностью и раздражительностью, жаждой, мышечной слабостью и тахикардией, которые корригируются ингибиторами типа мерказоли-ла. Спонтанная гипогликемия более характерна для опухолей, в основном мезенхимального происхождения, включая фибросаркому, лейомиосаркому и другие новообразования разных типов. Около 25 % этих опухолей локализуются в пределах плевральной полости, но такого рода эндокринопатия может возникнуть и при плоскоклеточном раке легких с ороговением. По-видимому, снижение активности диабета при других формах рака легких связано с усиленной продукцией опухолевой тканью инсулиноподобных субстанций. Все эти данные должны учитываться при обследовании больных, и окончательное решение об операбельности может быть принято после консультации эндокринолога, знакомого с клиникой опухолевых эндо-кринопатий.
ЭНДОГЕННАЯ ИНТОКСИКАЦИЯ
И ФУНКЦИОНАЛЬНАЯ ОПЕРАБЕЛЬНОСТЬ
Наиболее часто значение имеет интоксикация инфекционного происхождения (при гнойнодеструктивных процессах в легочной паренхиме или в плевре), которая обусловлена не только недостаточной дезактивацией и накоплением в очагах деструкции токсинов бактерий, грибов или вирусов, но и токсическим воздействием продуктов распада легочной ткани, изменившейся регуляцией уровня биологически активных веществ в крови (серотонина, гистамина, кининов и пр.). В связи с этим проявляются совокупно или доминируют в отдельности три основных фактора: деструкции, резорбции и потери. Последний фактор (потери с мокротой, гнойным плевральным экссудатом) приводит к тому, что вне соответствующих терапевтических и хирургических воздействий на очаг нагноения синдром гнойно-резорбтивной лихорадки может перейти в синдром гнойно-резорбтивного истощения и хирургическое вмешательство в этой фазе окажется непереносимым. Взаимодействие перечисленных факторов характеризуется значительным возрастанием процессов катаболиз
108
ма [Лукомский Г. И. и др., 1982]. В условиях своевременного местного лечения и вспомогательного парентерального питания наибольшее значение в выраженности эндогенной интоксикации приобретают факторы резорбции.
В клинической практике глубину интоксикации определяют по психоэмоциональному статусу больного (по эйфории, возбуждению или угнетению), по выраженности тахипноэ и тахикардии, особенно при субнормальной величине ОЦК и МОК, если эти проявления не обусловлены значительным нарушением легочного газообмена. Существенным критерием глубины может быть лейкоцитарный индекс интоксикации [Кальф-Калиф Я. Я., 1947; Волков В. Е„ 1983].
Другим ориентиром выраженности интоксикации считаются признаки нарушений функций печени по общедоступным биохимическим тестам — содержанию сывороточных белков и фибриногена, активности факторов протромбинового комплекса, степени билирубинемии и ее фракционному составу, по активности трансаминаз (с определением отношения Ас АТ/ АлАТ), альдолазы. В отличие от других категорий хирургических больных активность щелочной фосфатазы отражает преимущественно степень деструктивного процесса в легком, чем поражение печени [Колесников И. С. и др., 1983].
Наряду с нарушениями антитоксической функции печени на течение интоксикации, особенно при прогрессирующем развитии патологического процесса в легком, существенно влияют нарушения выделительной функции почек. Гломерулонефрит и уремия в анамнезе, пиелонефрит, изостенурия и никтурия должны учитываться при составлении плана обследования больного. Низкая относительная плотность мочи в сочетании с патологическими включениями в мочевом осадке (протеинурия, цилиндр-урия) в предвидении тяжелого хирургического вмешательства служат показанием для углубленного исследования функции почек (проба Зимницкого, исследование парциальных функций почек и др.). При этом следует учитывать, что значительные нарушения функции почек несвойственны даже больным гангреной легких, а изменения анализа мочи, которые выявляются, неспецифичны.
Считается, что деструктивный процесс в легком создает все условия для избыточного накопления в организме осмотически активных метаболитов (исходя из действия фактора резорбции), что приводит к возникновению значительных нарушений осмоляльности наряду с существенными расстройствами водно-электролитного обмена [Шаталюк Б. П., Чернобровый Н. П., 1970; Путов Н. В. и др., 1977].
Рис. 58. Состояние азотовыделительно и функции почек по клиренсу эндогенного креатинина (1) в мл/мин и по клиренсу мочевины (2) в % к должной величине. Зависимость от фазы воспалительного процесса в легких.
А — острое воспаление; Б — разрешение воспаления; В — остаточные явления.
Проведенные в нашей клинике исследования [Костюченко А. Л. и др., 1983] привели к заключению, что на фоне острой фазы нагноитель-ного процесса в легком или плевре в циркулирующей крови практически отсутствуют осмотически активные метаболиты, хотя их наличие можно предположить, учитывая интенсивный процесс тканевой деструкции. При появлении же в связи с нагноением изолированного жидкостного пространства (плевральный экссудат) содержание осмотически активных метаболитов в экссудате возрастает в 4 раза. Наличие их в плевральной полости и отсутствие их в циркулирующей крови позволяют предположить, что организм больного активно освобождается от этих метаболитов, используя наиболее обычный путь детоксикации — через почки. При отсутствии олигурии почки удовлетворительно справляются с ролью регулятора внутренней среды, хотя содержание мочевины и натрия в моче в острой фазе существенно ниже, чем при разрешении нагноения, особенно в фазе остаточных явлений. Таким показателем изменения содержания осмотически активных веществ, как и для крови, считаем разницу между рассчитанной по соответствующим формулам и измеренной осмоляльностью мочи (рис. 58). Косвенным подтверждением усиленной экскреции продуктов тканевого распада по мере их поступления во внутреннюю среду является низкий клиренс осмотически свободной воды (менее 1 мл/мин) на фоне острой фазы нагноения, тогда как фильтрация и клиренс мочевины остаются в пределах нормальных величин (рис. 59).
109
Рис. 59. Состояние азотовыделительной функции почек по осмотическому клиренсу (Cosm) и клиренсу осмотически свободной воды (Сн,о) в зависимости от фазы воспалительного процесса в легких.
Обозначения те же. что и на рис. 58.
Такая интерпретация проведенных исследований не означает, что почки не повреждаются при сохранении эндогенной интоксикации. У некоторых больных гангреной легких клубочковая фильтрация падает до критических величин (20—25 мл/мин) при одновременном снижении интенсивности реабсорбции (до 96 %). После успешного удаленйя очага интоксикации, его эффективного дренирования выделительная функция почек восстанавливается.
ФУНКЦИОНАЛЬНАЯ ОПЕРАБЕЛЬНОСТЬ И ВОЗРАСТ
На основании статистического анализа до-операционной оценки и исходов большой группы больных, оперированных в нашей клинике [Буравцов В. И. и др., 1984], пришли к выводу, что состояние легочного газообмена и кровообращения, а также возраст больного имеют прогностическую значимость и должны учитываться лишь при определении функциональной операбельности конкретного больного. Однако ни один из них не может служить абсолютным противопоказанием к операции. В значительной части случаев больные старше 65 лет с выраженными функциональными нарушениями внешнего дыхания и гемодинамики оперировались с благоприятным исходом. Не удалось убедительно с помощью вычислительной техники прогнозировать и развитие смертельно опасных осложнений на основании функциональных исследований. Лишь у больных с выраженными рестриктивными нарушениями (равномерное снижение ЖЕЛ и ФЖЕЛ) после операции чаще развивается пневмония, приводящая к летальному исходу.
Окончательное решение о функциональной операбельности в нашей клинике принимают хирург и анестезиолог (иногда с привлечением клинического физиолога) при совместном обсуждении данных проведенного обследования. Признаками иноперабельности при пуль-монэктомии, следует считать:
1. Непереносимость обычной двигательной нагрузки.
2. Предельное уменьшение резервов внешнего дыхания: снижение ЖЕЛ до 40 % должной величины с равномерным распределением вентиляционной функции между легкими; односекундная ЖЕЛ менее 1 л, составляющая 50 % от форсированной ЖЕЛ; соотношение между максимальной скоростью выдоха и вдоха менее 0,7, несмотря на применение бронхолитиков; КИОг ниже 20; индекс вентиляции по Репину— Цукерману ниже 1225, резерв дыхания (отношение ММВ:МОД), равняющийся 3—4, с отрицательным или иногда нулевым результатом гипервентиляционной пробы.
3. Клинически выраженная и резистентная к терапии право желудочковая недостаточность, подтвержденная исследованиями ЭКГ и ИРГТ, при отчетливом повышении сопротивления в легочных сосудах, возрастающем при нагрузке (среднее давление в легочной артерии выше 45 мм рт. ст.).
4. Тяжелый атеросклероз коронарных сосудов с частыми приступами стенокардии покоя с нарушениями ритма и признаками сердечной недостаточности, которая не поддается короткому курсу терапии дигиталисом, препаратами калия, мочегонными.
5. Гипертоническая болезнь Пб—III стадии с постоянно высоким уровнем АД, явлениями сердечной недостаточности и мозговыми расстройствами, которые не поддаются направленному медикаментозному лечению.
6. Тяжелая анемия (концентрация гемоглобина менее 90 г/л), гипопротеинемию и гипо-альбуминемию (менее 20—25 г/л) на фоне значительной потери массы тела, устойчивые к инфузионно-трансфузионной терапии и вспомогательному парентеральному питанию.
7. Значительные нарушения выделительной функции почек (азотемия, превышение измеренной осмоляльности над расчетной на 25— 30 мосмомоль/л), а также глубокие расстройства внутренней среды другой природы (гипокалиемия, метаболический алкалоз), которые не удается корригировать.
8. Последствия перенесенного мозгового инсульта с выраженными паретическими изменениями скелетной и дыхательной мускулатуры.
Показания к лобэктомии и экономным резекциям легких, к вмешательствам на плевре и грудной клетке ставят более свободно.
Глава Т ПОДГОТОВКА БОЛЬНЫХ К ОПЕРАЦИИ
В наиболее общем виде подготовка больного к операции на легких и плевре должна опираться на решение трех кардинальных задач: добиться правильного отношения больного к хирургическому лечению (психологическая подготовка), улучшить компенсаторные возможности легкого как органа, наиболее повреждаемого прямым воздействием операционной травмы (органная подготовка), и повысить резистентность основных систем жизнеобеспечения, функциональное состояние которых может быть нарушено операцией и послеоперационной болезнью (системная подготовка).
Психологической подготовке часто не уделяют достаточно внимания. А между тем от нее зависит не только само согласие больного на операцию, но и его доверие ко всем действиям персонала после нее, коммуникабельность, активное участие в лечебном процессе. Для достижения этой цели необходимо применить все доступные средства убеждения в необходимости именно данного варианта хирургического лечения и устранить излишние опасения больного. Больной должен получать правдивую информацию о своей болезни, предполагаемой операции и послеоперационном состоянии от врача — иначе его дезинформируют некомпетентные лица. Индивидуальные беседы ординатора или начальника отделения с больным, контакт с его родственниками и близкими, внимательное отношение персонала, хороший уход, предоперационный осмотр анестезиолога с уточнением многих сторон подготовки больного к предстоящей операции и в послеоперационном периоде, обязательное использование письменной инструкции «Что надо знать больному»— это тот арсенал приемов, которые необходимо использовать всегда.
Неправильно скрывать от больного, что хирургическое вмешательство связано с определенными физическими страданиями и риском осложнения. При современном общем уровне информации такие попытки обречены на неудачу и подрывают доверие к врачу, тем более,
что исключить контакт с больными, уже перенесшими такое вмешательство, при современной организации лечения в стационарах невозможно. Но, откровенно утверждая, что операция на легких небезопасна, врач должен разъяснить пациенту, насколько опаснее оставленная без хирургического лечения болезнь.
При злокачественных опухолях или подозрении на злокачественность поражения последним аргументом является общеизвестная неизлечимость рака. Следует считать ошибочным существующее мнение, что надо скрыть от больного истинный диагноз и одновременно предлагать ему под другим предлогом тяжелую операцию (например, пульмонэктомию), да еще в ближайшие дни. Такая противоречивая позиция лишь порождает сомнения в компетенции врача, независимо от его званий и служебного положения. Если больной операбелен по функциональным критериям, то и обоснованное предположение, и бесспорный характер рака легких могут быть доведены до его сведения. Тяжесть такого сообщения уравновешивается тут же предлагаемым выходом — операцией, а мыслям о смертельности заболевания лечащий врач противопоставляет тезис об излечимости своевременно выявленного рака.
Необходимость считаться с психологией иногда длительно болеющего человека уже сама по себе обязывает возможно раньше наметить конкретный план его обследования и лечения. Больной должен быть с самого начала посвящен в этот план и сроки его осуществления, учитывая современный культурный уровень больных, которые не приемлют врачебных действий, если они не аргументированы. Нередко особенности поведения и настроения больного должны быть учтены в первую очередь и им подчинены все специфические обстоятельства предоперационной подготовки. Иногда следует прибегать к помощи психоневрологов, консультация которых позволяет определить наиболее рациональный выбор психомиметиков.
Ставя задачу улучшить компенсаторные возможности самого болеющего органа — легких, преследуют прежде всего две цели: уменьшить активность сопутствующего бронхита и снять воспаление в легочной паренхиме, окружающей очаг поражения.
111
Обычно этот компонент предоперационной подготовки включает в себя дыхательную гимнастику, ингаляции и интратрахеальные вливания антибиотиков (соответственно спектру микрофлоры) и антисептиков (солафур, димек-сид) в комбинации с бронхолитиками (эфедрин, новодрин, алупент) и муколитиками (протеолитические ферменты, ацетилцистеин). Использование ультразвуковых туманообразователей обеспечивает поступление лекарственных веществ к самой респираторной зоне легкого и ускоряет разрешение воспалительных изменений [Королев Б. А., Шмерельсон М. Б., 1975].
Однако только лишь рациональное откашливание в дренажном положении и вибрационный массаж грудной клетки оказывают существенное и быстрое благоприятное влияние на механику дыхания и легочный газообмен [Гологорский В. А. и др., 1981].
Отсюда немаловажное значение дыхательной гимнастики.
Дооперационная лечебная физкультура под контролем методиста улучшает газообмен, тренирует дыхательные мышцы. В ходе ее больные обучаются рациональному дыханию и дыхательным упражнениям раннего послеоперационного периода. Обучение диафрагмальному дыханию, дренажным положениям, эффективному кашлю закрепляется упражнениями, которые больные самостоятельно выполняют несколько раз в день.
В отдельных случаях (при значительном уменьшении жизненной емкости легких и резерва дыхания, высоком коэффициенте дыхательных изменений УО (более 2) и одновременном «гипоксическом» МОК (более 4 л/м2 в 1 мин) показано использование сеансов вспомогательной искусственной вентиляции легких через загубник с помощью стандартных объемных аппаратов типа РО (адаптация «повиса-нием на респираторе») илй аппаратов ИВ Л с откликающимися устройствами (Бёрд Марк-8) по 1—2 ч в сутки на протяжении 2 нед. Сеансы вспомогательной искусственной вентиляции повышают функциональные возможности внешнего дыхания у 50—60 % больных с крайне ограниченными резервами [Юревич В. М. и др., 1969; Репин Ю. М., Цукерман И. Я., 1981].
Механическое удаление мокроты, так называе -мая санация бронхиального дерева с помощью курса бронхоскопий с одновременной инстилляцией антибактериальных препаратов и муко-литиков, позволяет ускорить разрешение воспалительного процесса в бронхах, улучшает эвакуацию мокроты за счет прицельной аспирации ее из устья дренирующего бронха. Одновременный систематический осмотр слизистой оболочки бронхиального дерева позволяет судить о темпе снижения остроты бронхита, умень
шении его макроскопических проявлений при фибринозно-гнойном воспалении слизистой оболочки.
В некоторых случаях стойких воспалительных изменений на периферии бронхиального дерева показано транстрахеальное или чрескожное трансторакальное введение санирующего катетера в пораженные отделы легких. Катетеризация бронхов используется для систематической (на протяжении нескольких дней) санации бронхиального дерева за счет вливания муколитиков и стимуляции кашля. Исследования, проведенные в клинике, показали, что в некоторых случаях хронических легочных нагноений чрескожное трансторакальное дренирование бронха пораженной доли обеспечивает быстрое и надежное уменьшение остроты воспаления, может сократить период подготовки внутригрудной операции либо послужить основанием для эффективного местного лечения [Плешаков В. Т. и др., 1979; Воронцов С. А., 1981 ].
Начальное системное, парентеральное применение антибиотиков широкого спектра действия с переходом на целенаправленную антибактериальную терапию после установления чувствительности флоры из очага или смывов бронхов не всегда оказывается эффективным. Использование так называемых «птитиков» (нитрофурановые препараты, малые дозы цитостатиков) при обширном перифокальном воспалении повышает эффективность антибактериальной терапии. Благотворно сказывается также внутривенное вливание 1 % раствора кальция хлорида по 300—400 мл (1—2 раза в день), особенно у больных с ретростенотическим распадом и выраженным хроническим бронхитом [Дмитришен Л. Г., 1968, и др.].
Перспективным представляется метод местного антибактериального воздействия с помощью внутритканевого электрофореза [Соколов С. Б. и др., 1981], разработанный в Ялтинском НИИ курортологии и физических методов лечения им. И. М. Сеченова.
Этот метод основан на принципе электроэмиссии лекарственных препаратов (антибиотиков) через кожу груди и благоприятном влиянии электрического поля на воспаленную легочную паренхиму, что ускоряет рассасывание воспалительной инфильтрации.
Для гальванизации используются аппарат типа «Поток-1» (АПГ-32), свинцовые электроды площадью 300 см2, фланелевые прокладки толщиной 1 см. Электроды размещают на грудной клетке в переднезаднем направлении. Плотность тока на электродах — 0,05 мА/см2. Гальванизацию начинают после внутривенного капельного вливания 1/з лечебной смеси, состоящей из суточной дозы бактерицидного анти
112
биотика, растворенного в 400 мл изотонического раствора электролитов. Длительность сеанса — 30—50 мин.
Г. Г. Горовенко и соавт. (1982) реализовали идею гальванизации воспаленной легочной ткани при другом пути введения антибиотика: капельно со скоростью 10 кап/мин через микротрахеостому. И этими авторами отмечена быстрая и четкая положительная динамика клинических и рентгенологических показателей, свидетельствующая об уменьшении перифокального воспаления: нормализация температуры тела, содержания лейкоцитов, лейкоцитарной формулы, протеинограммы.
Конкретный выбор пути введения антибиотика определяется условиями и особенностями лечения больного.
Как только температура тела нормализовалась или стала субфебрильной, значительно уменьшились изменения показателей крови (концентрации лейкоцитов, СОЭ, лейкоцитарного индекса, выраженность воспаления в бронхиальном дереве), количество мокроты существенно снизилось, а рентгеновские тени в легком обрели стабильность, можно считать, что цель местной подготовки достигнута и может быть назначено оперативное вмешательство. Повторное исследование внешнего дыхания или показателей интегральной реографии тела, определяющих связь внешнего дыхания и гемодинамики, позволяет объективизировать функциональный эффект противовоспалительной терапии и подтвердить готовность больного к вмешательству.
Необходимо подчеркнуть, что стихание воспалительного процесса в респираторной зоне благотворно сказывается на состоянии легочной гемодинамики, уменьшает проявления правожелудочковой недостаточности сердца. Улучшению показателей легочной гемодинамики способствует и проведение лечебной физкультуры (особенно в кислородной маске). Снижение перегрузки правого сердца достигается внутривенным одновременным вливанием эуфиллина по 0,24 г 1—2 раза в день в течение 5—7 дней.
Если воспаление не поддается консервативному лечению в течение 10—15 дней (при явных показаниях к операции), то дальнейшая противовоспалительная терапия не оправданна. Некупируемый консервативно деструктивный процесс или даже его прогрессирование заставляют использовать единственный выход — радикальное вмешательство, когда вместе с очагом деструкции удаляются и окружающие воспаленные ткани, иногда противопоставляя лобэктомии или комбинированным резекциям пульмонэктомию. Еще более веским доводом в пользу решения о срочной операции явля
ются ухудшение состояния на фоне многокомпонентной терапии или непереносимость лекарств, необходимых для консервативного лечения.
Так же не может быть поводом к продлению подготовки и острое воспаление легочной паренхимы, сопровождающее рак легкого (при параканкрозной пневмонии, ретростенотиче-ском абсцессе). Противовоспалительное лечение проводится в таких случаях в пределах времени, затрачиваемого на обследование и решение вопроса об операции.
Не все хирурги разделяют необходимость использования в предоперационном периоде антибиотиков для снятия перифокального воспаления, так как нередко можно добиться уменьшения его выраженности или даже разрешения нагноения, используя только санацию очага антисептиками через дренаж, введенный в полость деструкции торакоцентезом [Лес-ницкий Л. С., 1970]. Более того, ряд авторов предлагают использовать дренирование ограниченных гангренозных полостей как альтернативу лобэктомии [Cameron Е., Whitton J., 1977; Vainrub В. et al., 1978] или считают целесообразным воспользоваться практически одним дренированием, чтобы подготовить больного гангреной легких к резекции [Вагнер Е. А. и др., 1980].
Другие считают более важным повышение иммунорезистентности, учитывая нередкие иммунодефициты у больных с заболеваниями легких. Отсюда возникает проблема стимуляции иммунной защиты за счет увеличения содержания в крови лимфоцитов при значительных лимфопениях (тималином или леакадином), в том числе и активных Т-лимфоцитов. Второе направление — применение препаратов, повышающих (активно или пассивно) уровень гуморального иммунитета. Для этого используют анатоксин, специфический бактериофаг, антистафилококковый глобулин или гипериммунную плазму. Результаты использования последнего подхода показали определенный успех консервативной терапии острых легочных нагноений (чаще полное выздоровление, реже — переход в хроническую форму), но применение иммунных препаратов не позволило улучшить непосредственные результаты оперативного лечения [Стручков В. И. и др., 1981].
Наряду со снятием воспаления для улучшения компенсаторных возможностей легких перед операцией необходимо добиться стойкого уменьшения выраженности бронхоспастического синдрома, особенно при сопутствующей бронхиальной астме. Курсовое применение интала, бриканила, сальбутамола не всегда эффективно. Выраженные изменения тонуса бронхиальной мускулатуры иногда заставляют
8 Зак. 0517
113
в качестве подготовительного мероприятия применить гломусэктомию с синокаротидной денервацией по Накаяма — Рудовскому [ Ру-довски Е. М„ 1971; Репин Ю. М., Цукерман И. Я., 1981].
Повышение состоятельности систем жизнеобеспечения должно проводиться по разным направлениям.
Выбор гипотензивного препарата (при гипертензии) определяется видом артериальной гипертензии: идиопатическая (гипертоническая болезнь) или симптоматическая (почечная гипертензия, феохромоцитома, болезнь Ицен-ко — Кушинга), эффектом предшествующего медикаментозного лечения. В ходе предоперационной подготовки важно снизить системное артериальное давление до такой степени, чтобы устойчиво устранить общие проявления артериальной гипертензии.
Большие дозы изобарина, препаратов рау-вольфии в силу их длительного последействия существенно влияют на выбор анестезии, а потому должны применяться с осторожностью и обязательной отменой за 2 дня до операции. Особенно трудны для подготовки больные, у которых артериальная гипертензия сочетается с ишемической болезнью сердца. В этих случаях выход состоит в том, чтобы проводить лечение, направленное на коррекцию основных компонентов, определяющих нарушение кровообращения: высокое артериальное давление и повышение периферического сосудистого сопротивления, депрессия инотропной функции миокарда и нарушенная трофика мышцы сердца в связи с ишемической болезнью миокарда. Препаратом выбора для регуляции артериальной гипертензии может быть клофелин (гемитон, катапресан) либо метилдофа (допегит), так как эти препараты умеренно действуют на сосудодвигательный центр и не истощают депо катехоламинов в организме [Prys-Roberts N. et al., 1971].
Одновременное использование транквилизатора усиливает действие гипотензивных средств, купируя психоэмоциональное напряжение, оказывает непосредственное коронарорасширя-ющее действие [Ikram S. et aL, 1973]. Опыт клиники позволяет полностью солидаризироваться с В. А. Гологорским и соавт. (1977), Ch. Pinaud и соавт. (1979) в том, что сердечные гликозиды следует назначать до операции на легком не только при клинически отчетливой сердечной недостаточности, но и при ее латентных формах, которые могут быть диагностированы с помощью интегральной реографии тела при УИ менее 35 мл/м2.
На таком фоне данные ЭКГ, свидетельствующие об очаговых изменениях в миокарде и постинфарктных рубцах, не являются основа
нием для отказа от радикального вмешательства, но указывают на необходимость систематического применения коронаролитиков (длительно действующих нитритов — сустака, ни-тронга, нитросорбита) и препаратов, снижающих потребление кислорода миокардом (ин-тенсаин, рибоксин) с одновременным улучшением коллатерального кровообращения — дипиридамолом (персантин, курантил). В случаях значительного нарушения трофики миокарда (при истощении, эндогенной интоксикации) необходимо включать препараты, повышающие пластические свойства миокарда (оротат калия, анабиотики, панангин и др.). Медикаментозная терапия небезупречных по гемодинамическим резервам больных оказывается эффективной только при ее проведении по всем трем направлениям [Архипов И. В. и др., 1983].
В таких условиях вазоконстрикция, возникающая от использования сердечных гликозидов, и возможность увеличения постнагрузки на миокард [Вотчал Б. Е., Слуцкий М. Е., 1973] нивелируются действием вазодилататоров (метилдофа, нитриты, дипиридамол), тогда как изолированное систематическое применение нитритов, снижая сосудистое сопротивление и в системном кровотоке, может нарушить перфузию миокарда [Чазов Е. И., Руда М. Я., 1979]. Направленное лечение нарушений ритма сердца на фоне такой терапии сопутствующих заболеваний сердечно-сосудистой системы позволяет больным переносить самые тяжелые операции.
На основании исследований и клинических наблюдений, проведенных за последние годы в клинике госпитальной хирургии и в других лечебных учреждениях, показано, что включение в программу предоперационной подготовки сеансов гипербарической оксигенации в терапевтической барокамере (OKA-МТ) оказывает несомненный благоприятный функциональный эффект. Патогенетическая обоснованность применения гипербарической оксигенации для профилактики инфекции и при гнойно-септических заболеваниях базируется на устранении кислородной недостаточности (чаще всего гемодинамического типа), непосредственного влияния на возбудителя инфекции (анаэробной флоры), восстановлении иммунного гомеостаза макроорганизма и возможности потенцирования действия медикаментозной (в том числе и антибактериальной) терапии [Белокуров Ю. Н., Рыбачков В. Р., 1981; Бурав-цов В. И. и др., 1981]. Однако использование гипербарической оксигенации в лечении гнойно-деструктивных заболеваний легких и плевры сдерживается существующими представлениями о токсическом действии гипербарической оксигенации на легочную паренхиму и возмож
114
ности развития баротравмы легкого при декомпрессии.
На основании проведенных экспериментов и клинических исследований установлено, что декомпрессия не вызывает баротравмы легкого, пораженного острой пневмонией. Наличие абсцесса в легком или пневмоторакса не является противопоказанием к проведению этого метода. В том случае, если в полости абсцесса или плевры находился дренаж, больного помещали в камеру с водозапорным клапаном; в последующих сеансах дренажную трубку просто герметично закрывали. В барокамере больной обязательно должен иметь возможность собрать мокроту, поскольку во время сеанса у большинства больных отмечается увеличение ее отхождения.
В парных исследованиях до и после одного сеанса гипербарической оксигенации (при давлении кислорода 1,8 ата и экспозиции 45 мин) с помощью известных методик [Винницкая Р. С. и др., 1976; Редхамер Р„ 1976] не установлено статистически значимых отличий в диффузионной способности легких и не обнаружено ухудшения вентиляционно-перфузионных соотношений в легочной паренхиме, что подтверждает отсутствие токсического действия кислорода при такой экспозиции.
У большинства больных (у 84 %) обнаружены отчетливые признаки клинического улучшения общего состояния, которого не удавалось добиться до того многокомпонентным лечением в пульмонологическом отделении. Они проявлялись в улучшении общего состояния, нормализации нарушенного сна и аппетита, исчезновении раздражительности, уменьшении или исчезновении одышки в покое, в позитивном отношении больного к данному методу лечения и уверенности в благоприятном исходе необходимой операции, нормализации температуры тела, улучшении физикальных данных, характеризующих основное состояние патологии легких. Одновременно улучшается механика дыхания, возрастают ЖЕЛ и КИОг, снижается работа дыхания, что было подтверждено положительной динамикой показателя напряженности дыхания по данным интегральной рео-графии: даже после одного сеанса гипербарической оксигенации он снижается до пределов нормальных величин. Анализ полученных в динамике данных интегральной реографии показал, что при исходном высоком уровне МОК его снижение до должных величин для условий физиологического покоя является правилом. Уже в ходе одного сеанса удавалось устранить гемодинамические проявления недостаточности легочного газообмена, если считать, что прямым путем компенсации гипоксемии, возникающей при нарушениях внешнего дыхания,
8 *
является повышение объемной скорости кровотока. После гипербарической оксигенации восстанавливается трофика миокарда. Показателем нормализации метаболизма миокарда служит исчезновение сердечных аритмий, а снижение повышенного МОК происходит за счет достоверного снижения частоты сердечных сокращений. При наличии сердечной недостаточности гипербарическая оксигенация, наоборот, способствует достоверному повышению У О. Необходимо отметить и благоприятный эффект повышения толерантности гликозидной терапии сердечной недостаточности, в том числе и в тех случаях, когда воспалительный или опухолевый процесс в легких сочетается с приобретенным пороком сердца.
После 5—7 сеансов гипербарической оксигенации уменьшается характерное для легочных воспалительных процессов извращение белкового обмена, деятельности окислительных ферментных систем (лактатдегидрогеназа), процессов метаболизма аминокислот, полностью исчезают нарушения кислотно-основного состояния [Булынин В. И. и др., 1982]. По-видимому, улучшение тканевого кислородного обеспечения приводит к преодолению прежде всего истощения биоэнергетики, что проявляется ликвидацией гипохолестеринемии, переходом катаболизма в анаболизм и значительным уменьшением деструкции легочной ткани. Улучшение пластических процессов в организме приводит к нормализации синтеза гемоглобина. Достоверное, хотя и умеренное, повышение концентрации гемоглобина в цельной крови, при неизменности его концентрации в одном эритроците, одновременно служит доказательством отсутствия ингибирующего действия высокого напряжения кислорода во вдыхаемом воздухе на эритропоэтическую функцию костного мозга. Отсутствует и воздействие кислорода на интимные механизмы кислородтранс-портной функции крови, что подтверждается сохранением положения кривой диссоциации оксигемоглобина.
Обеспечивая восстановление, пусть временное, кислородного режима организма, гипербарическая оксигенация изменяет метаболический фон, на котором развивается заболевание легких, стабилизирует жизненно важные функции, повышает возможность механизмов естественной детоксикации. Под действием короткого курса происходит не только снижение лейкоцитарной реакции на воспалительный процесс, но и изменяется лейкоцитарная формула, что приводит к снижению высокого лейкоцитарного индекса интоксикации по Кальф-Калифу. Одновременно отмечено относительное повышение содержания лимфоцитов в тех случаях, когда с уверенностью можно думать об имму-
115
но депрессии. Средняя концентрация лимфоцитов у таких больных повышалась от 0,34± ±0,09 • 109/л до 1,66±0,26 • 109/л. Одновременно уменьшились явления дизрегуляции гуморального иммунитета, которые характеризовались повышением уровня IgA при уменьшенном содержании IgM на фоне нормального или повышенного уровня IgG, снижением микробной обсемененности кожи по Н. Н. Клемпарской. Все эти функциональные сдвиги не только способствуют эффективности комплексного лечения больных с гнойно-деструктивными поражениями легочной паренхимы, но могут стать решающим звеном такой терапии.
Естественно, что эффективность такого лечения и переносимость последующей операции во многом определяются выраженностью волемических расстройств, состояния кислородной емкости крови. Для плановых больных с заболеваниями легких характерно отсутствие существенных различий основных показателей циркулирующего эритрона, как концентрационных, так и объемных. Умеренное снижение этих показателей связано лишь с возрастом, некоторой гиподинамией таких больных: циркуляторный гомеостаз, как указывалось выше, у таких больных переходит на другой уровень функционирования. Попытки корригировать так называемую «гиповолемию» и несколько сниженный ЭО трансфузиями крови, как правило, оказывались безуспешными. Умеренный дефицит ОЦК сохраняется, а навязанный объем крови быстро снижается до исходного уровня при поступлении в стационар. Иногда состояние таких больных после переливания крови даже ухудшается.
Лишь при острых заболеваниях (при гангрене легких, тотальном пиопневмотораксе), не говоря о легочных и внутриплевральных кровотечениях, снижение кислородной емкости может стать критическим и потребовать переливаний свежей крови, учитывая неблагоприятные влияния инфекции, особенно грамотри-цательной, на восстановление сродства гемоглобина к Ог. С неменьшим успехом может использоваться в таких случаях и компонентная трансфузия: размороженные эритроциты и альбумин. Но и при этих обстоятельствах нет необходимости стремиться к «полному» восстановлению нормальной концентрации гемоглобина. Достаточно добиться тенденции к возрастанию этого показателя (на фоне действия и других компонентов предоперационной подготовки) с относительной стабилизацией содержания гемоглобина на уровне 120 г/л и 320— 360 г/м2.
Данные длительного использования в клинике рутинного контроля волемии на различных этапах хирургического лечения больных с
заболеваниями легких [Мороз В. В., 1969; Малахов С. Ф., 1972; Брюсов П. Г., 1971] позволили начать с 1972 г. исследования по изучению возможностей предоперационного забора крови или плазмы (при условии проведения плазмафереза) у больных для последующего возмещения этими средами операционной кровопотери [Колесников И. С. и др., 1979|.
Клинические наблюдения и исследование реакции гемодинамики показали, что при отдаленном резервировании аутокрови наиболее целесообразным следует считать забор 400— 600 мл крови за 5—6 дней до вмешательства, причем, по данным О. И. Жукова и соавт. (1980), гемодинамическая реакция на такую заготовку аутокрови даже у больных переходного и пожилого возраста со скомпрометированной сердечной деятельностью минимальна, что позволяет использовать заготовку аутокрови в легочной хирургии довольно широко.
Отсутствие гипопротеинемии у большинства больных раком легких позволяет, как оказалось, использовать предоперационный период у них и для заготовки аутоплазмы (до 800— 1000 мл/нед). Аутоплазма может быть применена как компонент инфузионно-трансфузионной терапии во время внутригрудного вмешательства и в ближайшем послеоперационном периоде. Двойной плазмаферез у больных раком легких не вызывает нарушений гемодинамики. Наблюдаемые функциональные сдвиги не носят патологического характера, хотя и выражаются в менее выраженной реакции на нагрузку. С учетом нарушений системного артериального тонуса сроком планового оперативного вмешательства или повторного плазмафереза следует считать 4—5-й день. Операцию на легких или повторный плазмаферез у таких больных можно проводить на 3—4-й день после последнего забора.
Одним из существенных подготовительных мероприятий к оперативному лечению заболеваний легких и плевры может явиться заготовка аутологичной костномозговой взвеси. В течение последнего десятилетия в клинике накоплен определенный опыт трансфузий аутологичного костного мозга для стимуляции регенерации эритроцитов в послеоперационном периоде, учитывая возможность развития длительной анемии гипорегенераторного характера, плохо поддающейся после ее возникновения обычной инфузионно-трансфузионной и медикаментозной терапии [Малахов С. Ф. и др., 1982].
Более совершенной со всех точек зрения является методика миелоцитафереза с криоконсервацией костномозговых клеток в жидком азоте при —196 °C. Криоконсервация дает возможность производить заготовку костного мозга задолго до оперативного вмешатель
116
ства, вскоре после поступления больного в стационар.
Кроме коррекции волемических расстройств, необходимо обратить внимание и на выраженность нарушений водно-электролитного равновесия, которые в значительной степени могут снижать эффективность предоперационной подготовки, нарушая сократительную способность миокарда, санацию трахеобронхиального дерева, пассаж пищи. При неглубоких нарушениях, умеренном дефиците калия обычно использовали энтеральный путь насыщения этим электролитом, вводя в рацион богатые калием продукты (творог, сухофрукты, фруктовые соки) и подкрепляя их введением оротата калия и панангина. Безусловно, действие последнего выходит за пределы простой коррекции гипокалиемии, так как, уменьшая поляризацию мембран миоцитов и активируя клеточное фосфорилирование, панангин (аспаркам, инцолен) считается одновременно средством профилактики отрицательных эффектов сердечных гликозидов.
При выраженной гипокалиемии и гнойной интоксикации, активном дренировании гнойного экссудата из плевральной полости прибегали к парентеральному введению 3—6 г калия хлорида в составе полиионных глюкозированных растворов с инсулином. Длительность терапии определялась динамикой концентрационных и ЭКГ-показателей калиевого обмена и контролировалась исследованием калийуреза. Наличие магния в оптимальных соотношениях с кальцием в составе разработанных в клинике полиионных растворов [Шанин Ю. Н. и др., 1978] обеспечивало более полную коррекцию нарушений внутренней среды, учитывая, кроме того, и влияние на биоэнергетику организма больного вводимой глюкозы с инсулином, стимуляцию анаболических и пластических процессов.
Чаще всего в дооперационном периоде избегают непосредственной коррекции белкового состава плазмы за счет переливаний альбумина, протеина или донорской плазмы (нативной, лиофилизированной). Лишь на фоне белковой недостаточности у истощенных пациентов используется инфузионная терапия с включением аминокислотных препаратов при соответствующем соотношении пластических и энергетических компонентов парентерального питания: 1 г аминоазота или 6,25 г аминокислот на 150—200 ккал, поступающих с энергетическими компонентами (глюкоза, сорбит , жировые эмульсии). Эффект такого лечения дополняется другими компонентами терапии, позволяющими подавить как причину гнойной интоксикации (антибиотики, иммунотерапия), так и воздействие интоксикации на энергетический обмен и катаболизм (анаболиты). При высокой лихо
радке нужно добиваться ее снижения вплоть до применения наружного охлаждения на фоне адреноблокады, поскольку действие бактериальных токсинов на фоне гиперпирексии возрастает в несколько десятков раз по отношению к нормальному уровню температуры тела [Atwood F„ Kass R., 1964]. Одновременно на фоне лихорадки усиливается распад эритроцитов [Harms А., 1966]. Если этими мерами удается преодолеть катаболизм или хотя бы свести обмен к уровню анаболизма, то динамика фаз белково-волемического состояния организма определяет более благоприятный прогноз такого заболевания и вмешательства.
На фоне такой «энергетической» парентеральной терапии уменьшается и выраженность сердечной недостаточности, разрешаются явления метаболического ацидоза или алкалоза, снижается эндогенная интоксикация. Основную роль в уменьшении проявлений фактора резорбции должны играть различные приемы активного дренирования очага интоксикации (полости абсцесса, плевральной гнойной полости), которые позволяют в значительной степени «выбросить» токсические продукты наружу, не допуская их поступления во внутреннюю среду больного.
Сохранность функции почек по выведению продуктов тканевого распада и бактериальных токсинов редко заставляет применять специальные методы активной детоксикации у таких больных (форсированный диурез, гемодиализ) даже при гнойных процессах в легких. В случаях тяжелых деструктивных процессов и при септическом состоянии легочного происхождения достаточным оказывается инфузия детоксикационных кровезаменителей — гемодеза, полидеза. Особенно эффективны полифункцио-нальные растворы (полидез-глутамат, поливи-солин), которые не только образуют комплексоны с эндотоксинами и продуктами тканевого распада, но и оказывают нормализующее влияние на биоэнергетику за счет естественных компонентов, содержащихся в таких растворах (глюкоза, глутамат).
В случаях наиболее выраженной эндогенной интоксикации, обусловленной прежде всего фактором резорбции во внутреннюю среду организма, рекомендуют применить гемосорбцию на активированном угле, что позволяет элиминировать среднемолекулярные тканевые и микробные гидрофобные токсины или даже микробные тела, если они интенсивно поступают в кровоток. Показано, что наряду с субъективным улучшением состояния в ближайшие дни после одного-двух сеансов гемосорбции больные становились более активными, у них улучшался аппетит, значительно уменьшалось количество гнойной мокроты и плеврального отде
117
ляемого, исчезал зловонный запах [Луком-ский Г. И. и др., 1982]. Одновременно снижалась температура тела, иногда до нормального уровня, нормализовалась величина лейкоцитарного индекса интоксицации. В то же время уровень гемоглобина в крови сохранялся, существенно не менялись электролитный состав крови и другие константы гомеостаза. Рентгенологически не только уменьшалась инфильтрация легочной ткани вокруг очагов деструкции, но и происходило существенное уменьшение размеров полостей.
Среди эндокринопатий, сопутствующих заболеваниям легких, наибольшую трудность в подготовке к операции представляет сахарный диабет. Это большая проблема как в тех случаях, когда он выявляется в процессе обследования, так и у тех больных, у которых диабет диагностирован давно и откорригирован за счет диетического питания и регулярного приема антидиабетических сульфаниламидов. Особую «диабетическую» настороженность следует проявлять у больных старше 50 лет с гнойно-деструктивными процессами в легких.
Не лечившиеся больные или пациенты с недостаточно компенсированным диабетом не должны подвергаться риску плановой операции без предварительного лечения, определяемого с участием эндокринолога. Ацетонурия не считается абсолютным противопоказанием даже к срочному вмешательству, так как нередко удаление патологического очага облегчает нормализацию углеводного обмена. Наблюдения многих эндокринологов показывают, что чем стабильнее и ниже гликемические показатели перед вмешательством на легком, тем легче регулировать уровень сахара на операции и после нее [Плотников М. Н и др. 1978|. Допускается сохранение уровня гликемии не выше 10—11 ммоль/л (180—200 мг %), а глюкозурии — 5 % от углеводной ценности суточного рациона при отсутствии ацетона в моче и диабетических жалоб.
Использование преимущественно белковой диеты наиболее выгодно только у тучных больных, так как белки способствуют повышению основного обмена и снижению массы тела. У истощенных пациентов приходится использовать в питании и жиры, и углеводы. При сахарном диабете тяжелой степени ежесуточно необходимо три инъекции простого инсулина или две инъекции простого и одна — суспензии инсулина (в случаях повышения уровня сахара к утру и появления диабетических жалоб). Суточная доза инсулина должна быть адекватной количеству принимаемых углеводов с учетом двигательной активности больного.
У некоторых пациентов с тяжелой степенью диабета иногда наблюдаются явления недыха
тельного ацидоза с ацетонурией и соответствующими клиническими проявлениями, несмотря на использование значительных доз инсулина. Ацидоз затрудняет подбор дозы инсулина от суток к суткам, так как на фоне ацидоза эффективность действия гормона падает. В таких случаях показано вливание 100—150 мл 5 % раствора гидрокарбоната натрия, 400 мл гемодеза и 500 мл 10 % раствора глюкозы с 20 ME инсулина, лучше в виде раствора Лабори. Из диеты временно исключаются жиры и назначаются липотропные продукты (овсянка, творог), витамины комплекса В. При компенсированном (с помощью сульфаниламидов или суспензии инсулина) диабете необходимо незадолго до операции «перевести» больного на простой инсулин, распределив его дозу на протяжении суток таким образом, чтобы при диетическом питании гликемия оставалась на таком же уровне, как при обычном состоянии больного. Следовой эффект антидиабетических сульфаниламидов, занижая вначале истинную потребность в инсулине, может дезориентировать врача, поэтому перевод на введение инсулина желателен за несколько дней до операции. В таком варианте можно считать предоперационную подготовку законченной, что должно быть отмечено в предоперационном осмотре анестезиолога.
Во время предоперационного осмотра, который проводится незадолго до операции, следует уточнить такое важное для послеоперационного лечения обстоятельство, как непереносимость или повышенная чувствительность к медикаментам (прежде всего к антибиотикам). Исходя из плана предстоящей операции, опроса больного и результатов определения переносимости именно анестезиологу необходимо выбрать антибактериальные препараты, которые будут использоваться во время вмешательства.
Совершенно необходимо непосредственно перед операцией еще раз разъяснить больному значение глубокого дыхания, эффективности кашля, ранней двигательной активности для профилактики осложнений и быстрейшего выздоровления, проверить знания приемов смены положения в постели, элементов дыхательной гимнастики. Больным еще раз следует объяснить, что подвижность зоны вмешательства, несмотря на начальную боль, уменьшает дискомфорт, связанный с повреждением грудной клетки, безопасна для заживления операционной раны и обеспечивает раннее вставание. При предельном снижении вентиляционных показателей пациента предупреждают о возможности профилактической искусственной вентиляции легких. В процессе окончательного осмотра определяются характер и состав непосредственной премедикации к анестезии.
Глава kJ АНОМАЛИИ РАЗВИТИЯ ЛЕГКИХ
К аномалиям развития легких в настоящее время относят более 50 различных пороков. Для удобства рассмотрения можно классифицировать их следующим образом.
Классификация аномалий развития легких
Пороки легких, связанные с их недоразвитием: пороки отсутствия (апневмия, агенезия или аплазия легких, агенезия или аплазия трахеи и бронхов, агенезия или аплазия сосудов малого круга кровообращения); стенозы легочной артерии; стенозы трахеи и бронхов; аневризмы легочной артерии; варикозное расширение вен малого круга кровообращения; артериовенозные аневризмы легких; аневризмы бронхиальных артерий; варикозное расширение бронхиальных вен; расширения трахеи, бронхов, бронхиол: лобарная эмфизема («исчезающее легкое»).
Пороки легких, обусловленные избыточным развитием тканей или элементов легких: добавочное легкое (интраабдо-минальное, интраторакальное, трахеальное).
Пороки развития легких, обусловленные внутрилегоч-ным аномальным делением и перемещением элементов легкого; сепарация и транспозиция бронхов; добавочные бронхи; аномалии отхождения сегментарных и субсегментарных ветвей легочной артерии; аномалии развития междолевых щелей легких; добавочная доля легкого.
Сочетанные пороки развития легких: гипоплазия легких («простая» или «кистозная»); поликистоз легких; секвестрация легких; синдром Зиверта—Картагенера.
Зеркальное легкое.
Патологические сообщения элементов легких с другими органами: пищеводно-трахеальный, пищеводно-бронхиальный, аортолегочный свищи, открытый артериальный проток, коммуникация легочной артерии с предсердием, аномалии впадения легочных вен.
Внутрилегочное изолированное аномальное развитие тканей легкого и других органов: тератомы, гамартохонд-ромы, дермоидные кисты легких.
Пороки развития лимфатической системы легких: лим-фангиоэктазии легких; недостаточность клапанов лимфатических сосудов легких.
Врожденные дефекты иммунологической системы легких: муковисцидоз легких (альвеолярный протеиноз); болезни гиалиновых мембран (врожденные дефекты сурфактантной системы легких); врожденная эмфизема легких, обусловленная наследственным дефицитом а, -антитрипсина; аномалии развития местного иммунитета легких.
Агенезия или аплазия легкого. Двусторонняя апневмия, агенезия и аплазия легких несовместимы с внеутробной жизнью.
Агенезия и аплазия легкого с одной стороны встречаются у одного из 15 тысяч новорожденных. В мировой литературе описано около 230 таких случаев [Стручков В. И. и др., 1969; Пи-пия В. И. и др., 1971; Daurnovo Р., 1976; На-sche Е., 1978, и др.].
Подавляющее большинство наблюдений относится к детям и подросткам, причем в 50— 60 % случаев аплазия и агенезия легкого сочетались с аномалиями других органов и сердечно-сосудистой системы [Долецкий С. Я., 1963; Сазонов А. М. и др., 1981]. У девочек агенезия и аплазия отмечаются чаще, чем у мальчиков, преобладает левосторонняя локализация. Летальность при агенезии и аплазии легких высокая: к пятилетнему возрасту погибает 50 % детей.
Клиническая картина зависит от степени выраженности легочной и сердечно-сосудистой недостаточности. Состояние больных может быть удовлетворительным, но чаще имеются признаки декомпенсации в виде выраженной одышки в покое, затруднения дыхания и цианоза губ.
Нередко уже в первые дни и месяцы жизни ребенка отмечается одышка, может присоединиться инфекция дыхательных путей. Если в этот период времени проводится рентгенологическое исследование, то выявляется тотальное затенение на стороне поражения.
Обзорная и полипозиционная рентгенография и томография позволяют выявить или заподозрить отсутствие легкого. На обзорных рентгенограммах обнаруживается смещение сердца в одну из плевральных полостей, а при полипозиционном исследовании — легочная грыжа в переднем средостении, переходящая нередко на сторону отсутствующего легкого (рис. 60).
Для окончательного диагноза требуются бронхоскопия с бронхографией, а также катетеризация сердца с контрастным исследованием малого круга или ангиокардиографией из правого желудочка сердца. Следует подчеркнуть, что применение инструментальных методов исследования у больных с агенезией и аплазией легкого, находящихся в стадии декомпенсации, представляет подчас большой риск.
При бронхоскопии в случаях агенезии обнаруживается отсутствие бифуркации трахеи
119
Рис. 60. Агенезия нижнедолевого бронха левого легкого.
а — обзорная рентгенограмма: б — бронхограмма. Видно отсутствие нижней доли легкого.
Рис. 61. Ангиопульмонография при агенезии левого легкого.
Контрастирована широкая правая ветвь легочной артерии. Левая ветвь отсутствует.
и нет второго главного бронха, а при аплазии — бифуркация трахеи едва намечаема; имеется небольшой рудиментарный бронх в виде мешочкообразного, слепо заканчивающегося выпячивания. Главный бронх контралатерального легкого является непосредственным продолжением трахеи.
Катетеризация сердца позволяет выявить состояние нижней полой вены, положение сердца, его поворот в сторону отсутствующего легкого. Анализ газов крови исключает пороки развития сердца (дефект междпресердной и межжелудочковой перегородок). Ангиопульмонография (рис. 61) выявляет широкий развернутый ствол легочной артерии контралатерального лег
кого и округлой формы мешочкообразную «культю» с ровными контурами, указывающую на отсутствие легкого.
Агенезия и аплазия легкого не подлежат оперативному лечению, если эти пороки развития не сочетаются с другой патологией, например диафрагмальной грыжей, пороком сердца. Больные агенезией и аплазией легких даже в состоянии компенсации являются ограниченно трудоспособными (инвалидами III—II групп).
Агенезия и аплазия трахеи и бронхов относятся к порокам развития бронхиального дерева. Изолированное отсутствие бронхов может быть диагностировано с помощью бронхологических методов, включая бронхографию.
120
Остановка развития трахеи наблюдается у эмбриона в возрасте 28—32 дней, когда прекращается дальнейшее развитие бронхопульмональной почки [Streeter G., 1951]. У эмбриона 32—34 дней изолированная остановка развития бронхопульмональной почки ведет к образованию агенезии долевого бронха и доли легкого. Изолированная остановка развития бронхиального дерева на 10--14-й неделе может привести к агенезии сегментарных и субсегментарных бронхов, так как в этот период происходит наиболее активное развитие бронхиального дерева внутри сегментов [Путов Н. В. и др., 1982].
Агенезия или аплазия сосудов малого круга кровообращения сопутствуют этому пороку развития бронхиального дерева, но могут быть и самостоятельным пороком. Прижизненное распознавание изолированной агенезии сосудов малого круга возможно с помощью селективной ангиографии. Отсутствие правой или левой ветви легочной артерии сопровождается расширением легочной артерии и ее ветвей в контралатеральном легком, которые представляют собой все артериальное русло малого круга.
Обычно степень развития сосудов малого круга, в частности легочной артерии, соответствует степени развития бронхиального дерева соответствующего легкого, так как эмбриологически развитие сосудов малого круга следует за развитием бронхиального дерева. Однако при гипоплазии легкого недоразвитие бронхиального дерева и сосудов малого круга не всегда совпадает; как правило, отмечается более выраженное недоразвитие легочной артерии и сосудов малого круга.
Изолированная агенезия долевых, сегментарных сосудов может быть выявлена только при серийной двухпроекционной ангиопульмоно-графии. Эта аномалия характеризуется дисплазией прилежащих долевых и сегментарных сосудов, расширением их просвета и увеличенной васкуляризацией периферических отделов этих сегментов. В зоне аплазии легочной артерии выявляется культя сосуда с ровными контурами (рис. 62).
Изолированная агенезия долевой или сегментарной артерии может сочетаться с гипоплазией прилежащих ветвей легочной артерии. Поэтому при полипозиционном исследовании сосудистого рисунка легкого и на обзорных рентгенограммах можно по изолированной зоне васкуляризации только предположить этот порок развития малого круга, так как его клинико-рентгенологические признаки весьма схожи с признаками изолированной гипоплазии, бронхоэктазий, воздушной кистой легкого и дифференциальная диагностика невозможна без обследования, включающего бронхографию и контрастное исследование сосудов легких.
Рис. 62. Ангиопульмонография при гиноп.ы ши артерий нижней доли правого легкого.
Широкие сегментарные ветви артерий верхней доли, суженные ветви артерий нижней доли; артерии средней доли отсутствуют.
Клинически изолированные формы агенезии долевых и сегментарных ветвей легочной артерии, как правило, ничем себя не проявляют. Общее состояние больных удовлетворительное, нет признаков дыхательной и сердечной недостаточности, а сопутствующая патология бронхов в виде бронхоэктазий и кистозных изменений иногда выступает на первый план, являясь основанием для углубленного обследования, при котором выявление агенезии долевых и сегментарных ветвей легочной артерии обнаруживается случайно. В литературе этот порок развития малого круга рассматривается как редчайшая казуистика.
Изолированная агенезия легочной артерии всего легкого в клинике наблюдалась у одной больной (рис. 63), у которой она сочеталась с гипоплазией бронхиального дерева правого легкого. На бронхограммах у этих больных выявлялось сформированное бронхиальное дерево с признаками гипоплазии сегментарных и субсегментарных бронхов, которые местами имели булавовидные расширения. Во время операции агенезия легочной артерии правого легкого была подтверждена, кровоснабжение легкого осуществлялось из сосудов бронхиальной системы. Венозный отток происходил в левое предсердие через не измененные вены.
121
Рис. 63. Агенезия легочной артерии правого легкого, сочетающаяся с гипоплазией бронхиального дерева.
а — прямая ангиопульмонограмма, артериальная фаза; б — прямая ангиопульмонограмма, венозная фаза; в — бронхограмма.
Стенозы легочной артерии. Под стенозами легочной артерии понимают локальные одиночные или множественные сужения просвета сосуда, расположенные как проксимальнее, так и дистальнее клапана легочной артерии.
Нарушение эмбриологического развития перегородки артериального ствола, обусловленное отклонением его в сторону формирующегося ствола легочной артерии, ведет к образованию сужения легочной артерии. Подклапанный
стеноз образуется вследствие усиленного разрастания мышечных волокон в области конуса легочной артерии, а усиленное развитие закладок клапанного аппарата формирует ее клапанный стеноз. Множественные периферические стенозы легочной артерии формируются к концу 6-й недели развития эмбриона вследствие нарушения закладки и развития ветвей этого сосуда в период появления бронхолегочных сегментов [Малишевская В. А., 1967].
122
Стенозы легочной артерии могут быть самостоятельной патологией или сочетаться с различными пороками сердца. По данным Н. Rink (1970), эта патология легких наблюдается нередко, составляя 0,5 % среди различных пороков сердечно-сосудистой системы.
Особенностью кровообращения малого круга больных со стенозами легочной артерии является затрудненный приток крови к альвеолам, обусловленный сужениями магистральных ветвей легочной артерии на различных уровнях. При множественных периферических стенозах возникает гемодинамическая ситуация многоступенчатого блока, приводящая к значительному снижению не только пульсового, но и среднего давления. Возникающее дополнительное сопротивление в системе легочной артерии приводит к гипертрофии правого желудочка сердца, увеличению его полости и к гипертрофии папиллярных мышц, что обнаруживается при ангиокардиографии. В зависимости от уровня расположения стеноза при контрастном исследовании выявляются сегментарно суженные участки легочной артерии, сочетающиеся с прилежащими сегментами расширения легочной артерии. Такая картина обусловлена эффектом гидродинамического действия протекающей крови. В суженной части артерии линейная скорость кровотока значительно выше, чем в расширенной. При значительном сужении сосуда поток крови осуществляется через суженный сегмент в виде тонкой струи, которая при изгибе сосуда ударяется в одну из его стенок, вызывая ее дилатацию. Применение двойного контрастного исследования (углекислый газ и жидкое контрастное вещество типа урографина) позволяет выявить этот эффект, сопровождающийся турбуленцией в зонах расширения сосудов (рис. 64).
Больные нередко поступают в клинику для обследования по поводу порока сердца, который при катетеризации и ангиокардиографии отвергается. На ЭКГ у больных со стенозом легочной артерии выявляется гипертрофия правого желудочка с неполной блокадой правой ножки пучка Гиса. Эти изменения обусловлены систолической перегрузкой правого желудочка.
В зависимости от степени выраженности стенозирования у больных может быть цианоз в состоянии покоя или только при физической нагрузке.
Единичные стенозы подлежат хирургической коррекции, больные с множественными сужениями, распространяющимися на долевые и сегментарные ветви, обычно пользуются лишь симптоматическим лечением.
Аневризма легочной артерии. Врожденные аневризмы легочной артерии являются чрезвычайно большой редкостью, и причины их воз-
Рис. 64. Ангиопульмонограмма при стенозах легочной артерии.
никновения неясны, но наиболее вероятной предполагается неполноценность стенки легочной артерии врожденного генеза. Обычно аневризма захватывает ствол легочной артерии и главные ветви, реже — долевые и сегментарные.
Патофизиологические изменения при этом пороке связаны с образованием зоны второго течения (вихревых потоков), поддерживаемых энергией транзитной струи крови. Возникающая турбулентность кровотока в зоне аневризмы и на некотором расстоянии дистальнее ее ведет к значительным изменениям гемодинамики легочных сегментов. Механическое воздействие турбулентных потоков создает повышенное боковое давление на ее стенки, которое значительно превышает боковое давление нерасширенных ветвей сосуда. Высокое давление и турбулентные потоки крови в аневризматическом мешке ведут к прогрессированию дистрофических изменений в аневризматической стенке, угрозе расслаивания и разрыва ее.
Состояние больных аневризмой легочной артерии зависит от ее локализации, степени выраженности, особенностей регионарного кровообращения в малом круге. При аневризме ствола легочной артерии у больных развива-
123
Рис. 65. Аневризма артерии переднего сегмента верхней доли правого легкого.
а — прямая ангиопульмонограмма; б — боковая ангиолулъмоно-грамма.
ется недостаточность ее клапанов. Наблюдается появление диастолического шума в четвертом — пятом межреберье слева от грудины. Шум низкочастотный, дующего характера.
При селективной ангиопульмонографии контрастируется резко расширенный ствол легочной артерии, и контрастное вещество через недостаточные пульмональные клапаны поступает в период диастолы в полость правого желудочка сердца.
На обзорных рентгенограммах выявляется резко расширенная вторая дуга левого контура тени органов средостения. В боковой проекции определяется высокая вторая дуга и сужено ретростернальное пространство за счет выступающего вперед легочного конуса.
При локализации аневризмы легочной артерии в правой или левой ветви рентгенологическая диагностика затруднена и окончательный диагноз устанавливается с помощью селективной ангиопульмонографии, если имеет место
резкое, превышающее двукратное сечение сосуда, расширение просвета его.
Распознавание аневризмы легочной артерии, исходящей из долевых или сегментарных сосудов, на первых этапах диагностики проводится с помощью полипозиционной рентгенографии и селективной ангиографии сосудов малого круга, позволяющих выявить булавовидное расширение легочной артерии (рис. 65).
Аневризмы легочной артерии являются показанием к оперативному лечению, так как они могут прогрессировать и сопровождаться внезапным кровотечением. При аневризмах ствола легочной артерии проводят коррекцию ствола и клапана. При периферической локализации аневризмы применяют сегментарные резекции или реконструкцию сосуда — резекцию его сегмента.
Варикозное расширение вен малого круга кровообращения. Изолированное варикозное расширение вен малого круга кровообраще
124
ния — чрезвычайно редкий вид сосудистой патологии легких.
Варикозное расширение вен малого круга кровообращения протекает бессимптомно; больные, как правило, жалоб не предъявляют, и заболевание обнаруживается «случайно», при рентгенологическом исследовании. Однако рентгенологическое исследование позволяет лишь заподозрить данную патологию, так как рентгенологически выявляемая тень в легком по своей гомогенности, четкости контура и локализации схожа с туберкулемой, раком легкого, артериовенозной фистулой и другими периферическими округлыми образованиями легких. Только селективное контрастное исследование сосудов позволяет установить истинную природу заболевания. В наблюдении клиники у одной больной было варикозное расширение вен III сегмента правого легкого, диагностированное с помощью селективной ангиопуль-монографии с применением сериографии и киноангиографии [Попов Ю. А., Ловягин Е. В., 1970] (рис. 66).
Патогенез заболевания неясен. Можно только предположить, что в отдельных сосудах ацинарной зоны легкого образуются патологические сообщения бронхиальных артерий с легочной веной. Возникающее при этом повышенное давление крови из системы бронхиальных сосудов приводит к локальным изменениям, расширениям венозных стволиков на уровне лобулярной легочной вены. Образовавшаяся бронхиально-венозная коммуникация представляет лево-левый шунт, который, вероятно, существенного влияния на общую гемодинамику не оказывает.
Прогрессирование заболевания, сопровождающееся увеличением размеров варикса, является показанием к хирургическому лечению. Хирургическое вмешательство может быть ограничено иссечением варикса, сочетающегося с регионарной перевязкой бронхиальных артерий, или производится сегментарная резекция легкого.
Артериовенозные аневризмы легких. Артериовенозные свищи легких — порок развития сосудов, вследствие которого возникает патологическое сообщение между артериями и венами легкого. В результате появляется сброс венозной крови в артериальное русло, приводящий к той или иной степени гипоксии. По данным литературы, величина артериовенозного шунта может быть весьма значительной и достигать 85 % от минутного объема малого круга.
В мировой литературе имеются сообщения почти о 400 наблюдениях прижизненной диагностики артериовенозной аневризмы легкого; в отечественной литературе описано около 50 наблюдений.
Рис. 66. Варикозное расширение вен III сегмента правого легкого. Ангиопульмонограмма, венозная фаза кровотока.
М. И. Перельман и соавт. (1965) в зависимости от морфологических особенностей различают три типа артериовенозных сообщений в легких: 1) единичные соустья, располагающиеся между ветвями сосудов легкого крупного колибра, по типу артериовенозных свищей; 2) множественные мелкие соустья, непосредственно связывающие артерии и вены среднего калибра; 3) обширная ангиоматозная сеть или целый конгломерат сосудов, иногда мешковидно расширенных по типу аневризм, которые как бы вставлены между мелкими артериями и венами.
У большинства больных первые признаки заболевания появляются в период полового созревания, и полная клиническая симптоматика формируется обычно в возрасте 20—30 лет, а иногда и позднее.
Через патологический шунт часть крови из легочной артерии, минуя легочные капилляры, поступает непосредственно в легочные вены. Если величина артериовенозного сброса превышает ’/з всей массы крови, то развиваются выраженные симптомы кислородного голодания. Содержание кислорода в периферической артериальной крови у таких больных, особенно при физической нагрузке, снижается иногда до очень низких цифр. С течением времени развивается компенсаторная эритроцитемия.
Патологический шунт в малом круге кровообращения приводит к увеличению минутного объема кровообращения, к различной степени выраженности артериальной гипоксемии.
125
Рис. 67. Систоло-диастолический шум при артериовенозной аневризме нижней доли правого легкого. Фонограмма в четвертом межреберье^ справа по среднеключичной линии.
Страдающие артериовенозной аневризмой жалуются на слабость, быструю утомляемость, одышку, усиливающуюся при физической нагрузке. Не исключено, что некоторые неврологические нарушения обусловлены воздушной эмболией сосудов головного мозга [Craford С., 1950], но большинство авторов считают, что в основе их лежат гипоксия и полицитемия. Нередким симптомом артериовенозной аневризмы является кровохарканье, наступающее при разрыве телеангиэктазий слизистой оболочки трахеобронхиального дерева или разрывах расширенных и дегенеративно измененных легочных сосудов.
Важно подчеркнуть, что цианоз кожи и слизистых оболочек у больных усиливается при физической нагрузке. Почти у половины больных на коже и слизистых оболочках отмечаются множественные телеангиэктазии. У большинства наблюдается деформация ногтевых фаланг по типу «барабанных палочек», реже выявляется генерализованная форма остеоартропатии.
Патогномоничным симптомом артериовенозной легочной аневризмы является экстра-кардиальный систоло-диастолический шум, выслушиваемый над теми отделами легкого, где локализуется поражение (рис. 67).
Имеется несомненная патогенетическая связь артериовенозных легочных аневризм с врожденными геморрагическими телеангиэктазиями (болезнь Рендю — Ослера — Вебера). Сочета
ние этих заболеваний наблюдается приблизительно у половины больных, поэтому некоторые авторы считают артериолегочную аневризму частной формой болезни Рендю — Ослера— Вебера.
Рентгеноскопия и рентгенография грудной клетки выявляют различной формы и размера достаточно четко контурированную гомогенную, иногда пульсирующую тень аневризмы в легком. Порой отмечается уменьшение тени во время форсированного выдоха при закрытой голосовой щели (феномен Вальсальвы). Абсолютно доказательным методом рентгенологической диагностики артериовенозных аневризм легких, особенно при множественных поражениях, является ангиопульмонография.
При дифференциальной диагностике нужно иметь в виду первичную полицитемию или эритремию (болезнь Вакеза). Иногда ошибочно диагностируется врожденный порок сердца. Необходимо помнить о возможности сочетания этих заболеваний.
Наиболее опасным осложнением артериовенозной аневризмы является массивное легочное кровотечение, которое возникает внезапно вследствие разрыва бронхиальных сосудистых сплетений, непосредственно связанных с аневризмой.
В клинике наблюдался больной, у которого артериовенозная аневризма нижней доли правого легкого (рис. 68) вызывала дважды обильное легочное кровотечение, сопровождавшееся коллапсом с потерей сознания. После проведенных реанимационных мероприятий и последующего комплексного обследования больному успешно выполнена пульмонэктомия.
Лечение больных артериовенозными аневризмами хирургическое.
При локализованных одиночных артериовенозных аневризмах проводится частичная резекция легкого, при обширных аневризмах — пульмонэктомия.
В случаях распространенных и локализованных в обоих легких артериовенозных аневризм показана эндоваскулярная окклюзия с помощью катетеризационных методов. Это лечение может быть выполнено сразу после проведения диагностической ангиографии с использованием катетера, подведенного к аневризме. Эмболи-зирующий материал (спирали типа Гиантурко, спангостан) вводится через катетер в зону аневризмы. Добиваются ее окклюзии (тромбоза). Консервативное лечение больных с артериовенозными аневризмами бесперспективно.
Аневризмы бронхиальных артерий. Аневризматическое расширение бронхиальных артерий как порок развития в мировой литературе описывается как казуистика. Так, А. А. Вишневский, Н. К. Галанкин (1962) лишь у 1 на 1000 больных с врожденными пороками сердечно-
126
Рис. 68. Артериовенозная аневризма нижней доли правого легкого. Ангиопульмонограмма. Артериальная фаза.
сосудистой системы встретили эту патологию. В клинике наблюдалась одна больная с такой патологией.
Аневризматическое расширение бронхиальных сосудов чаще наблюдается при сочетанных пороках развития легкого, таких как гипоплазия легкого, поликистоз и секвестрация. В этих случаях расширенные бронхиальные артерии, как правило, локализуются в правом легком и выполняют функцию транзита крови в систему периферических ветвей легочной артерии, обеспечивая кровообращение в паренхиме отдельных зон гипоплазированного или поликистозно измененного легкого (рис. 69).
Клинические проявления порока развития бронхиальных сосудов во многом определяются величиной сброса артериальной крови в малый круг кровообращения. Значительный сброс крови может вести к развитию легочной гипертензии не только регионарного характера, но также общего, вызывая перегрузку правого и левого желудочков сердца, которая выявляется в виде их гипертрофии и изменений миокарда дистрофического характера. Прогрессирующее расширение бронхиальных артерий приводит к образованию новых коммуникаций в бронхиально-пульмональной системе, нередко сопровождающемуся их разрывами,
кровохарканьем и легочными кровотечениями. При бронхиальной ангиографии выявляется расширенная и извитая бронхиальная артерия с несколькими бронхиально-легочными коммуникациями и перетоком контрастного вещества в систему легочной артерии и легочной вены. При изучении бронхиальных сосудов с помощью селективной ангиографии у больных с заболеваниями легких можно выделить два различных вида аневризматического расширения сосудов. В первой группе — это аневризма, локализованная у места отхождения бронхиальной артерии от аорты, а во второй группе— в периферических отделах и центральном сегменте. Могут наблюдаться при этом участки с нормальным диаметром бронхиальных сосудов в зоне магистральной бронхиальной артерии, и тогда они представляются на ангиограммах в виде сегментарных стенозов сосуда (рис. 70).
Лечение аневризматического расширения бронхиальных артерий хирургическое. Диагностическая катетеризация бронхиальных артерий (после установления, диагноза) может быть использована для лечебной цели — ее окклюзия с помощью спиралей типа Гиантурко в сочетании с введением фрагментов спанго-геля или спангостана. Адекватность окклюзии аневризматически расширенной бронхиальной артерии контролируется в момент эмболизации фракционным введением контрастного вещества (урографин, уротраст). В случае невозможности эмболизирующей окклюзии прибегают к торакотомии и открытой перевязке измененных бронхиальных артерий.
Консервативное лечение аневризмы бронхиальных артерий бесперспективно.
Варикозное расширение бронхиальных вен чаще наблюдается у больных с сочетанными пороками развития легких. Ангиографически эта разновидность патологии встречается в виде гроздевидного ячеистого характера скопления контрастного вещества в стенке бронха. Варикозное расширение бронхиальных вен может рассматриваться как один из видов порока развития сосудистой системы легких. Эта патология чаще всего сопутствует таким порокам развития легких, как гипоплазия и поликистоз (рис. 71).
Трахеобронхомегалия (синдром Мунье — Куна, трахеобронхоэктазии) представляет собой порок развития, характеризующийся значительным расширением трахеи и крупных бронхов, сопровождающийся инфекцией дыхательных путей. Порок довольно редкий: в мировой литературе описано около 80 наблюдений этой аномалии [Долецкий С. Я., Климко-вич И. Г., 1966; Эпштейн Г. Л., 1967].
Трахеобронхомегалия рассматривается большинством авторов как результат врожденного
127
Рис. 70. Аневризматическое расширение бронхиальных артерий верхней доли левого легкого. Селективная ангиограмма бронхиальной артерии.
Видны сегментарные стенозы сосуда.
Рис. 69. Аневризматическое расширение бронхиальных артерий нижней доли правого легкого. Селективная ангиограмма бронхиальной артерии. Шунтирование контрастного вещества в легочную артерию.
недоразвития эластических и мышечных воло-кон трахеи и бронхов. Сопутствующий воспалительный процесс накладывает свой морфологический отпечаток. Трахеобронхомегалия часто сопровождается бронхоэктазиями, хронической пневмонией, бронхитом, пневмосклерозом.
Как правило, все больные имеют длительный «легочный анамнез». Клиническими симптомами заболевания являются кашель с гнойной мокротой, кровохарканье, одышка, частые повышения температуры тела.
Расширение главных бронхов плохо заметно на обычных рентгенограммах. Томография дает возможность получить более отчетливое представление о размерах трахеи и бронхов.
При бронхоскопии определяются необычно большие размеры трахеи и крупных бронхов, что порой затрудняет ориентировку. В результате пролабирования задней стенки трахеи и большого диаметра ее бронхов возникает недостаточная освещенность при исследовании. У некоторых больных в мембранозной
части трахеи обнаруживаются мешковидные впячивания, но нередко эти изменения при эндоскопии ускользают от внимания исследователя.
Основным методом диагностики является бронхография. Расширенные трахея и бронхи медленно заполняются контрастным веществом. Дыхательные движения трахеобронхиального дерева отсутствуют или мало заметны. При этом хорошо видны очертания трахеи и бронхов, а также мешковидных выпячиваний в их мембранозной части, содержащих «лужицы» контрастного вещества.
В редких случаях трахея бывает обычных размеров, а расширены только главные бронхи. Возможна и обратная картина.
Хирургическое лечение трахеобронхомега-лии, как правило, не показано из-за распространенности процесса.
Дивертикулы трахеи и бронхов. Когда недоразвитие эластических и мышечных волокон носит локальный, а не диффузный характер, образуется не трахеобронхомегалия, а дивер-
128
Рис. 71. Варикозное расширение бронхиальных вен. Селективная ангиограмма бронхиальных сосудов.
тикулы трахеи или бронхов, которые описаны как трахеоцеле, воздушный зоб, трахеальная грыжа [Феофилов Л. Т., 1964; Addington Е., 1944; Andersen Н., 1953]. При дивертикуле бронха, так же как и трахеи, иногда отмечаются кашель, кровохарканье и легочные кровотечения, Заболевание необходимо дифференцировать от бронхонодулярного и бронхопищеводного свища.
В случаях осложнений при дивертикуле бронха показана циркулярная или клиновидная его резекция.
Врожденная лобарная эмфизема легких описана в литературе под различными названиями: обструктивная эмфизема, гигантская эмфизема, гипертрофическая эмфизема.
Большинство авторов врожденную эмфизему связывают с нарушением проходимости бронхов вследствие дефектов развития их хрящей [Степанов Э. А., 1963]. Указывается на значение механизма, аналогичного клапану, возникающего при гиперплазии слизистой оболочки бронха, сдавлении бронха извне артериальным
протоком или расширенной веной [Fischer Н. et al., 1952]. Предполагается также наличие врожденного дефекта сурфактанта, при котором легкое не спадается на выдохе.
В результате увеличения эмфизематозной доли остальные отделы легкого сдавливаются и выключаются из дыхания. Органы средостения смещаются в противоположную сторону. В ряде случаев раздутая доля пролабирует в другую половину грудной клетки через переднее средостение, сдавливая противоположное легкое.
Диагностика трудностей не представляет. Дифференцировать врожденную эмфизему следует от обтурационной эмфиземы, возникшей при аспирации инородного тела, напряженной кисты легкого, спонтанного пневмоторакса, диафрагмальной грыжи. Лечение заключается в удалении измененной доли легкого.
Трахеальный бронх. Трахеальный бронх возникает из боковых выростов трахеи, которые в онтогенезе обычно подвергаются обратному развитию. Как правило, такой бронх отходит от правой стенки трахеи и устье его располагается в 5—6 см над бифуркацией. Частота этой аномалии составляет 0,5—2 % среди прочих аномалий.
Трахеальный бронх может заканчиваться слепо, образуя дивертикул на правой стенке трахеи, но чаще он вентилирует участок верхней доли или добавочную трахеальную дольку. Клинических проявлений обычно не наблюдается. Практическое значение трахеального бронха состоит в том, что в добавочной трахеальной дольке часто возникают туберкулез или бронхоэктазии.
Знание этой аномалии позволяет избежать во время операции случаев повреждения главного бронха и сосудов.
Нарушение структуры легочных борозд встречается часто и не является аномалией в полном смысле. Добавочные щели и борозды не имеют существенного практического значения, в то время как слияние отдельных долей затрудняет выполнение лобэктомии.
Практическое значение имеет так называемая доля непарной вены (lobus venae azygos). Она образуется вследствие смещения дуги непарной вены в легочную паренхиму и снабжается бронхами и сосудами переднего или верхушечного сегмента [Гаджиев С. А., 1953; Богач Г. Ф., 1959]. Непарная вена покрыта складкой плевры в виде брыжейки, образуя плевральный мешок, в котором находится участок легочной ткани верхней доли.
Рентгенологически эта аномалия развития выявляется в виде затенения, располагающегося в верхнемедиальной части правого легкого над его корнем.
9 Зак. 0517
129
Рис. 72. Трахеобронхомегалия.
а — прямая бронхограмма; б — боковая бронхограмма.
При подозрении на долю непарной вены во время операции следует осторожно выделять из сращений верхнюю долю, чтобы не повредить непарную вену.
Гипоплазия легких. Гипоплазия легкого — порок развития, связанный с нарушением формирования всех элементов его, недоразвитием бронхов и паренхимы, сосудов малого круга в сочетании с гипертрофией системного кровообращения.
Гипоплазия легкого может быть в форме «кистозной» или «простой» (без наличия кист легкого). Нарушения развития малого круга кровообращения в гипоплазированном легком наблюдаются в виде гипоплазии кровеносных сосудов (изолированной или всего легкого), а также их аплазии. Гипоплазия бронхов может сочетаться с кистозными их изменениями, причем локализация этих изменений довольно мозаична и может охватывать долевые, сегментарные и субсегментарные бронхи на различных уровнях.
Гипоплазия легкого сопровождается рядом функциональных расстройств в системе дыха
ния и кровообращения, обусловленных неполноценной вентиляционной способностью сегментов легкого. При этом большое значение имеют объем и степень недоразвития бронхиального дерева и паренхимы гипоплазиро-ванных участков легких, адекватность кровотока в них и степень редукции малого круга кровообращения (рис. 72).
Течение заболевания обычно доброкачественное, однако в случае присоединения инфекции в гипоплазированном легком развивается стойкий, трудно поддающийся консервативному лечению гнойный очаг. Течение инфекционного процесса, как правило, хроническое, и больные обращаются к врачу с жалобами на субфебрильную температуру тела, кашель с мокротой, недомогание. В анамнезе обычно выявляются частые простудные заболевания.
Аускультативно над легкими могут определяться рассеянные или локализованные влажные хрипы. Других патологических изменений при локальной или изолированной гипоплазии легкого может не наблюдаться. У больных с распространенной формой гипоплазии выяв
130
ляется своеобразная клиническая симптоматика в виде смещения границ в сторону недоразвитого легкого. Над грудиной можно определить тимпанит, а при аускультации тоны сердца выслушиваются лучше со стороны спины и в подлопаточной области (на стороне гипоплазии). Над легкими определяется ослабленное везикулярное дыхание, причем на стороне поражения оно ослаблено и жесткое. Как правило, над гипоплазированным легким при простой форме гипоплазии дыхание не определяется. При кистозной гипоплазии над легким определяются значительно ослабленное дыхание и множественные влажные разнокалиберные хрипы при кашле; при перемене положения больного изменяются тембр и количество хрипов.
На обзорных рентгенограммах при изолированной гипоплазии находят мало выраженную деформацию сосудистого рисунка легких и может наблюдаться небольшое усиление рисунка корня легкого. При кистозной гипоплазии выявляется затенение одной стороны, обусловленное смещением сердца. Позвоночник, как правило, оказывается на стороне здорового легкого оголенным. В верхних отделах легочного поля можно отметить небольшие просветления.
Диагноз гипоплазии уточняется при бронхографии. При кистозной гипоплазии бронхографическая картина характеризуется наличием развитого бронхиального дерева, в котором бронхи кистозно изменены на различных уровнях и в различных сегментах (поликистозное легкое). Для уточнения диагноза заболевания и дифференциальной диагностики кистозной гипоплазии легкого от приобретенных бронхоэктазий необходимо более глубокое обследование, включающее селективную ангиографию легких.
При катетеризации сердца у больных простой гипоплазией проведение катетера в правое предсердие и правый желудочек выявляет необычность его положения. При гипоплазии правого легкого катетер оказывается смещенным резко вправо, в зону пораженного легкого. Для проведения его в легочную артерию необходимо концевой отдел катетера переместить вращательным движением по часовой стрелке влево. При гипоплазии левого легкого наблюдается картина смещения сердца влево; при этом ствол легочной артерии резко расширен и непосредственное продолжение его представляет широкая ветвь легочной артерии здорового легкого. Легочная артерия располагается за тенью сердца. Она узкая, с малым числом ветвлений, контрастируется не интенсивно (рис. 73). Обусловлено это тем, что в гипоплазированном легком происходит замещение кровотока недоразви-
Рис. 73. Гипоплазия правого легкого. Ангиопульмонограмма.
Видно резкое сужение правой ветви легочной артерии.
того малого круга посредством системного кро-вообращения из бронхиальных сосудов. Возникающий ретроградный ток крови блокирует кровоток в малом круге.
В клинической картине гипоплазии легкого особенности взаимоотношений двух систем его кровообращения имеют существенное значение. Возникновение легочных кровохарканий и кровотечений на фоне хронического воспалительного процесса — явление не редкое и наблюдается примерно у каждого пятого больного. Источником таких кровотечений являются зоны артериовенозных и артериоартериаль-ных коммуникаций двух систем кровообращения в легких, располагающихся в подслизистом слое бронхиальной стенки (рис. 74).
Возникающие расширения бронхиальных сосудов, высокое давление в аорте обусловливают значительный по объему сброс артериальной крови в малый круг. Такая компенсация кровообращения имеет свои пределы, за которыми происходит декомпенсация.
При кистозной форме гипоплазии сосуды малого круга в периферических отделах легких представляются редуцированными, а лобулярные, прелобулярные и терминальные артерии охватывают кистозные образования в легком. Поэтому на ангиограммах становятся более видными рельеф и контуры множественных
9
131
Рис. 75. Кистозная гипоплазия левого легкого. Ангиопуль-монограмма. Периферические ветви легочной артерии располагаются по контурам кист.
Рис. 74. Гипоплазия правого легкого. Селективная ангиограмма бронхиальных артерий.
мозаично расположенных кист (рис. 75). При наличии эмфизематозных изменений в паренхиме легкого может наблюдаться увеличение углов ветвления сосудов до 90—120°. Паренхиматозная форма кровотока в пораженных отделах легкого резко ослаблена, а капиллярная фаза, как правило, не прослеживается. При бронхиальной ангиографии наблюдается переток контрастного вещества в систему малого круга на различных уровнях с образованием зон регионарной легочной гипертензии, устанавливаемой оксиметрией и барометрией [Попов Ю. А„ 1973]. Особенности гемодинамики малого круга кровообращения с образованием шунта крови слева — направо на уровне малого круга приводят к развитию легочной гипертензии и гипертрофии обоих желудочков сердца. Длительное существование такого шунта ведет к полному блоку малого круга гипоплазирован-ного легкого.
У больных не отмечается цианоза даже при поражении всего легкого, в отличие от больных с аналогичной посегментарной распрост
раненностью патологического процесса при приобретенных бронхоэктазиях. Длительное существование значительного артериального сброса крови в малый круг кровообращения приводит первоначально к регионарной, а затем общей гипертензии в малом круге кровообращения, гипертрофии правого желудочка сердца и развитию легочно-сердечной недостаточности.
Лечение больных, как правило, оперативное, заключающееся в удалении гипоплазирован-ных сегментов, доли (при изолированной форме) или всего легкого (при распространенной форме простой и кистозной гипоплазии).
Секвестрация легкого. Секвестрация легкого — это врожденный порок развития, обусловленный аномальным развитием части паренхимы легкого, васкуляризация которой осуществляется посредством артерии, отходящей от аорты. При этом отсутствует и функциональный кровоток в секвестрированном легком.
Существует множество синонимов этого заболевания: бронхиопульмональная диссоциа
132
ция, бронхиопульмональная секвестрация, врожденная бронхопульмональная киста, внут-ридолевая секвестрация с аномальным легочным сосудом, внутридолевая секвестрация легкого, кистозное заболевание легкого с кровоснабжением артериальной системой, бронхолегочная секвестрация и др.
Современное представление о характере порока легкого, обусловленного его секвестрацией, нашло отражение в классификации М. Мег-lier и соавт. (1970). Авторы выделяют типичные внутридолевые и внедолевые формы секвестрации легкого, а также атипичные формы; последние могут быть неполными — в виде чистой артериальной или чистой бронхопаренхиматозной. Кроме неполной формы, выделяют комплексную и неклассическую атипичные секвестрации легких.
Внутридолевая секвестрация легкого локализуется в его паренхиме, а внедолевая — располагается внелегочно, представляя собой аберрантное легкое.
Частота секвестрации легкого среди врожденной патологии составляет 6,4 %, а среди больных с неспецифическими заболеваниями легких — 0,04 % [Coman С. et al., 1973].
Существует несколько теорий формирования этого порока развития легкого. Причиной секвестрации легочной ткани одни авторы считают частичную или полную агенезию сегментарной ветви легочной артерии. Вследствие этого происходит формирование кровоснабжения этого участка легкого за счет плодных бронхиальных артерий, отходящих от первичной дорсальной аорты. Один из добавочных сосудов в последующем развитии плода гипертрофируется благодаря повышенному давлению в аорте, а соответствующий участок легочной ткани претерпевает фиброзную трансформацию с образованием в нем кист.
Другая распространенная теория [Pryce D., 1946] объясняет отделение бронхолегочной ткани при секвестрации аномалийной артерии, идущей от аорты. Первичным в развитии патологии считается артериальный компонент секвестрации (добавочная артерия), а отделение паренхимы — вторичным явлением.
Нарушение кровообращения в секвестрированном легком связано с тем, что васкуляризация его осуществляется артериальным сосудом.
При этом венозный отток происходит двумя путями: либо в легочную вену, либо в систему полунепарной или непарной вены. При венозном оттоке в легочную вену венозная кровь из секвестрированной зоны легкого смешивается с артериальной кровью в легочных венах, и эта венозная примесь поступает в девые камеры сердца. Если такой сброс значителен, то в кли
нической картине будут признаки хронической артериальной гипоксемии, а также признаки перегрузки левого желудочка сердца.
В случаях венозного оттока из секвестрированной зоны в систему непарной и полунепарной вен признаков артериальной гипоксемии не будет, так как сброс венозной крови из легкого происходит в правые камеры сердца. У больных могут наблюдаться признаки гипертрофии правого желудочка.
В патогенезе секвестрации легкого вентиляционных нарушений не наблюдается. В случае присоединения инфекции в зоне секвестрации развивается нагноительный процесс. Возможен прорыв гнойного содержимого в бронх с отхождением через трахеобронхиальное дерево.
Больные с секвестрацией легкого, как правило, жалоб це предъявляют до тех пор, пока не развивается воспаление. Признаки заболевания обычно впервые появляются в юношеском или зрелом возрасте. Различают три этапа развития патологического процесса: 1) до прорыва кисты в бронх и развития нагноения; 2) после развития нагноения и образования сообщения с бронхиальным деревом; 3) после перехода воспалительного процесса на окружающую легочную паренхиму с развитием пневмосклеротических изменений и бронхоэктазий.
До прорыва кисты в бронх и развития нагноения в ней больные обычно предъявляют жалобы на кашель, как правило, сухой, реже со скудным отделением слизистой мокроты, слабость, одышку, потливость. Иногда наступают нерезко выраженные обострения с подъемами температуры тела, расценивающиеся как пневмония. Физикальные данные скудные. Нередко отмечаются лишь укорочение перкуторного звука под углом лопатки на стороне пораженного легкого и ослабление дыхания на этом участке.
После прорыва одной из кист в бронхиальное дерево и развития нагноения в ней классические проявления заболевания характеризуются в различной мере выраженными признаками хронического нагноительного процесса. Такие больные предъявляют жалобы на кашель с отделением гнойной, иногда зловонной мокроты, боли в груди, слабость, одышку. Периодически наступают обострения процесса, сопровождающиеся длительной лихорадкой и увеличением количества мокроты.
В типичных случаях на рентгенограммах выявляются затенение ячеистого характера или воздушные кисты, локализующиеся, как правило, в заднебазальных отделах легкого. На томограммах наблюдается связь указанного затенения с аортой в виде дорожки. При бронхографии сегментарные бронхи могут огибать кистозные образования; при этом зона секвест-
133
Рис. 76. Секвестрация правого легкого.
а — прямая рентгенограмма; б — боковая томограмма: в — бронхограмма. На томограмме виден сосуд, отходящий от аорты; на бронхограмме зона секвестрации не контрастируется.
рации не контрастируется или выявляется культя бронха, идущего в зоне «секвестра» (рис. 76). В случаях нагноения и прорыва содержимого в трахеобронхиальное дерево при бронхографии можно получить заполнение некоторых кистозных образований.
При селективной ангиографии малого круга в одних случаях в зоне секвестрации выявляется гипоплазия сосудов с равномерным сужением сегментарных артерий, в других — недоразвитие сосудов.
Прямым доказательством секвестрации легкого является контрастное исследование добавочного сосуда, отходящего от аорты. Для этого применяют аортографию в грудном ее отделе или селективное контрастирование добавочного сосуда, васкуляризирующего зону секвестрации легкого (рис. 77). Анатомическое положение этого сосуда вариабельно: он может отходить как от грудной, так и от брюшной аорты, но во всех случаях проходит в легочной связке.
Дооперационная диагностика внутридолевой секвестрации особенно важна, так как при выполнении хирургического вмешательства повреждение аберрантного сосуда приводит к внезапному профузному кровотечению во время операции. Поврежденный сосуд сокращается и уходит в средостение к аорте. Если сечение сосуда значительное, то кровотечение бывает смертельным.
Лечение больных с внутридолевой секвестрацией легкого оперативное. Оно является радикальным методом, позволяющим добиться стойкого выздоровления. Типичной операцией
134
Рис. 77. Секвестрация правого легкого. Селективная ангиограмма аберрантного сосуда, отходящего от аорты.
а — прямая рентгенограмма; б — боковая ангиограмма.
у таких больных является лобэктомия. При выполнении резекции легкого разделяют сращения в легочной связке и перевязывают аномальный сосуд.
Внедолевая секвестрация легкого представляет собой полную эктопию или экстрадолевое над- или поддиафрагмальное положение фрагмента легочной паренхимы, связанного с аортой посредством артериальных сосудов. Паренхима секвестра может быть кистозно изменена.
Внедолевая секвестрация легкого имеет синонимы: медиастинальное легкое, добавочное легкое, абдоминальное легкое. Вместе с тем добавочным легким следует называть аберрантную легочную ткань, которая сообщается с трахеей или главным бронхом, имеет легочное кровоснабжение и отдельную плевральную полость. Findlay, Mair (1951) сообщили о 19 больных, у которых аберрантная легочная ткань располагалась около диафрагмы. В 17 наблюдениях она находилась между нижней долей левого легкого и диафрагмой; во всех случаях она была полностью покрыта плеврой, которая не имела сращений. Артериальное кровоснабжение осуществлялось в 14 наблюдениях от нисходящей
части грудной аорты, в 2 — от брюшной аорты и по одному наблюдению — отхождение питающего сосуда от межреберной артерии, диафрагмальной артерии и артерии, идущей от надпочечника.
Кисты при внедолевой секвестрации могут быть как единичными, так и множественными. Изнутри они выстланы кубическим или цилиндрическим эпителием. Стенки их содержат элементы бронхов и фиброзную ткань. Полость кисты может быть заполнена шоколадного цвета жидкостью или гноем, но иногда содержит только воздух. Окружающая легочная паренхима может быть неизмененной, но в тех случаях, когда в кисте развивался нагноительный процесс, в легочной ткани возникают в различной мере выраженные инфильтративные и склеротические изменения.
Кистозно-измененные участки легкого снабжаются кровью по одной или нескольким аномальным артериям. Венозный отток происходит либо в нижнюю легочную вену, либо в непарную вену. Возможен и смешанный тип венозного оттока.
При внедолевой секвестрации в случае развития нагноительного процесса показано хирур-
135
гическое лечение — удаление вне долевого секвестра.
Трахео- и бронхопищеводные свищи представляют собой один их тяжких пороков развития. По данным литературы, они встречаются у одного из 2500 новорожденных [Баиров Г. А., 1963].
Наличие врожденного соустья между пищеводом и трахеей без других аномалий этих органов бывает очень редко. Различают разные варианты таких свищей. Среди них чаще встречается короткий и широкий свищевой ход. Свищи, как правило, локализуются высоко, на уровне VII шейного или I грудного позвонка. Наличие свищевого хода между пищеводом и трахеей неминуемо ведет к аспирации жидкости и развитию ателектаза и пневмоний. Своевременно не распознанный и не леченный свищ обычно является причиной гибели ребенка в первые дни после рождения. Только очень узкое соустье иногда протекает бессимптомно. В таких случаях дети могут жить длительное время.
Чаще приходится иметь дело с сочетанием трахеопищеводного свища с врожденной непроходимостью (атрезией) пищевода. Обычно наблюдается атрезия пищевода со слепым верхним сегментом и сообщающимся с дыхательными путями нижним (95 %). Расположение свища непостоянно, но чаще он бывает на 1 —1,5 см выше бифуркации трахеи. Иногда нижний отрезок пищевода сообщается с бифуркацией трахеи, и очень редко с трахеей сообщается только верхний сегмент, а нижний заканчивается слепо.
Первым признаком атрезии пищевода, сочетающейся со свищом трахеи, является выделение из носа и рта большого количества пенистой слизи. Слизь временами имеет желтушную окраску, что зависит от забрасывания желчи в трахею через свищ дистального сегмента пищевода. В этих случаях сразу же выявляются и признаки нарушения дыхания (цианоз, обильные хрипы в легких) и аритмия. Развивается пневмония.
При подозрении на атрезию пищевода и трахеопищеводный свищ диагностика осуществляется с помощью зондирования пищевода. Продвижение при этом резинового катетера по пищеводу встречает сопротивление, а при введении воздуха через катетер он выходит с шумом через нос или через рот. Диагноз подтверждается контрастным исследованием пищевода.
Лечение этой аномалии оперативное. Успех вмешательства во многом зависит от состояния новорожденного и подготовки к операции.
Операция состоит в ликвидации бронхопищеводного свища и наложении прямого анастомоза концов пищевода. При бронхиальном диастазе между верхним и нижним сегментами
пищевода на первом этапе разъединяют трахеопищеводный свищ и верхний сегмент пищевода, который выводят на шею. Одновременно проводят гастростомию для питания ребенка. На втором этапе выполняют пластику пищевода тонкой кишкой.
У взрослых бронхопищеводные свищи встречаются редко. Больные предъявляют жалобы на кашель, возникающий преимущественно после приема жидкой пищи. Редко они откашливают твердую пищу. В анамнезе обычно отмечается рецидивирующая пневмония. Диагноз подтверждается эзофагоскопией. При бронхографии свищ не всегда заполняется контрастным веществом. Нередко выявляются вторичные бронхоэктазии в нижней доле. Лечение оперативное, состоит в разъединении свища, а при необходимости — и резекции доли легкого.
Аномальное впадение легочных вен. Впадение легочных вен в общую венозную систему представляет сравнительно редкую аномалию, которая встречается примерно у 1 % больных с пороками развития легких.
Различают полный и частичный аномальный дренаж легочных вен. В свою очередь, каждая из этих групп подразделяется на следующие подгруппы: 1) аномальное впадение легочных вен в левую безымянную или верхнюю полую вену, а также в одну из ветвей последней; 2) впадение легочных вен в правое предсердие или коронарный синус; 3) соединение легочных вен с системой воротной вены или непосредственно с нижней полой веной; 4) комбинированное впадение легочных вен на двух или трех уровнях (рис. 78).
Аномальное впадение нескольких легочных вен в правое предсердие, как правило, сочетается с дефектом межпредсердной перегородки, но может быть и в изолированном виде.
Наиболее часто встречается аномальное впадение одной или двух правых легочных вен в правое предсердие или в верхнюю полую вену, реже — в нижнюю полую вену, персистирующую левую безымянную вену, коронарный синус. Аномальное впадение левых легочных вен наблюдается редко.
При аномальном дренировании крови из легочных вен гемодинамика во многом сходна с таковой при нарушениях кровообращения, которые наблюдаются у больных с изолированными дефектами межпредсердной перегородки. Однако величина сброса крови слева направо у этих больных обычно значительнее, чем у больных с изолированным дефектом межпредсердной перегородки.
Заболевание обнаруживается в раннем детском возрасте. Выявлению порока нередко способствует воспаление легкого, имеющего нормальное дренирование вен. У таких больных
136
нарушение процессов оксигенации крови в пораженном легком сопровождается более тяжелыми расстройствами дыхания и кровообращения, что нередко приводит к летальному исходу.
Рентгенологическое исследование позволяет выявить ряд симптомов, патогномоничных для аномального впадения легочных вен. При рентгеноскопии таких больных видно, что корни легких, легочный ствол и правый желудочек усиленно пульсируют. Легочный рисунок за счет переполнения артериального русла значительно усилен. На обзорных рентгенограммах в корне правого легкого определяются гомогенные тени, которые переходят непосредственно в тень правого предсердия. Часто удается обнаружить расширенные легочные вены,
Рис. 78. Схематическое изображение вариантов аномального впадения легочных вен.
I — верхняя легочная вена впадает в верхнюю полую вену; II — верхняя легочная вена впадает в правое предсердие; III — нижняя легочная вена впадает в нижнюю полую вену; IV — легочная вена впадает в коронарный синус; V — легочная вена впадает в безымянную вену; VI — легочная вена впадает в правое предсердие, имеющее дефект межпредсердной перегородки; VII — легочная вена впадает в печеночную вену.
слившиеся в ствол, который впадает в нижнюю полую вену; легочный венозный ствол располагается параллельно правому нижнему контуру сердца. Корень правого легкого более расширен по сравнению с левым. Часто выявляются дополнительные сосудистые тени в корне и паренхиме легкого, которые сливаются с тенью правого предсердия. Предсердие увеличено, верхняя полая вена и аномально дренирующиеся легочные вены расширены. Сердце расширено в обе стороны. Легочная артерия значительно расширена и выбухает по левому контуру сердца.
Данные зондирования сердца представляются наиболее ценными для диагностики этого порока. Особую достоверность диагноза представляет факт проведения зонда из полых вен в одну из легочных вен; при этом конец зонда
137
появляется вне сердечно-сосудистой тени. Анализ крови, взятой в этой позиции зонда, убедительно показывает, что его конец находится в аномально впадающей легочной вене. При ангиокардиографии из легочной артерии или правого желудочка происходит одновременное контрастирование обоих предсердий. Заполнение легочных вен контрастным веществом позволяет проследить с большей точностью их топографию и определить уровень их дренирования. Косвенным признаком этого порока является длительная циркуляция контрастного вещества в малом круге кровообращения.
Хирургическая коррекция этого порока возможна лишь в условиях искусственного кровообращения и заключается в пластическом переводе венозного коллектора из правого предсердия в левое. Однако в ряде случаев аномальное впадение легочных вен может быть ликвидировано прямой пересадкой их устьев в левое предсердие. В редких случаях, при высоком впадении правой верхнедолевой легочной вены в верхнюю полую вену, когда исключается техническая возможность восстановления правильного оттока венозной крови, может быть выполнена верхняя лобэктомия. Правосторонняя нижняя лобэктомия может быть предпринята в ситуации сложного низкого впадения нижнедолевой легочной вены в нижнюю полую.
Поскольку аномальное впадение легочных вен часто сочетается в различными видами дефектов межпредсердной перегородки, коррекция порока требует одновременного устранения межпредсердного соустья.
Лимфангиэктазии. Этиология заболевания неясна. Оно наблюдается чаще у новорожденных. Существуют несколько терминов для обозначения этой болезни (диффузный ангиоматоз легких, врожденная дилатация лимфатической системы легких и др.).
Как показывает анализ литературных данных, дети с врожденной дилатацией лимфатической системы легких рождаются в тяжелом состоянии одышки и цианоза, которые прогрессируют; острая дыхательная недостаточность приводит к гибели детей, как правило, в ближайшие сутки после рождения (63 %). На протяжении 2 мес погибает 88 % новорожденных, лишь единицы доживают до 5-летнего возраста.
В основном этот порок обнаруживается у недоношенных детей. Роль наследственных факторов не установлена.
Высказывается гипотеза о том, что лимфатические эктазии легких образуются, так же как и кисты бронхиального дерева, вследствие инволюции висцеральной плевры.
Лимфатическая система легких в норме занимает положение субплевральной ткани и
междольковой субстанции. Предполагается поэтому, что лимфатическая система легких играет определенную роль в формировании долей легких и нарушение развития ее влечет за собой образование лимфатических кист, интимно связанных с сосудами и бронхами [Fronstin М. et al„ 1967]. Можно предположить, что в патогенетической цепи развивающейся катастрофы у новорожденных с дилатацией их лимфатической системы имеют значение особенности перфузионных соотношений легких на уровне его микроциркуляционного звена, при котором высокий приток и образование лимфы сочетаются с неадекватным ее оттоком. Это способствует дилатации лимфатических сосудов и развитию перемещения жидкостных сред из лимфатических щелей в альвеолы.
Заболевание протекает остро, сопровождается тяжелой одышкой и цианозом с момента рождения ребенка. Симптомы острого респираторного заболевания прогрессируют, и, несмотря на проводимую интенсивную терапию, больные погибают.
Прогноз заболевания неблагоприятный. Лечение — симптоматическое.
Недостаточность клапанов лимфатических сосудов легких. Заболевание по механизму развития в известной степени может быть сравнено с патологией, обусловленной недостаточностью клапанов вен конечностей. Теоретическое рассмотрение вопроса указывает, что в процессе акта дыхания не происходит адекватного перемещения лимфы от альвеолярной зоны к сосудам области средостения и в их лимфатические узлы. Возникновение обратного тока лимфы, лимфостаза в зоне недостаточности клапанов лимфатических сосудов может сопровождаться развитием локальной гипертензии лимфатической системы легких.
Клинические проявления заболевания сходны с врожденной дилатацией лимфатической системы легких, однако они менее выражены, так как процесс лимфостаза легких носит, как правило, локализованный характер. Степень выраженности одышки и цианоза зависит от распространенности патологических изменений.
При рентгенологическом исследовании грудной клетки выявляются локальные зоны понижения прозрачности легочной ткани. В случае развития пневмонии выявляются очаги инфильтрации, соответствующие фокусам воспаления.
Лечение до настоящего времени остается преимущественно консервативным, направленным на борьбу с гипоксией, на нормализацию КОС, pH крови, ликвидацию дыхательной недостаточности, профилактику бактериальной пневмонии.
138
Первичный иммунодефицит легких может проявляться в виде гуморальной, клеточной и комбинированной форм.
Гуморальные формы иммунодефицита характеризуются тем, что в организме больных не происходит адекватного ответа на инфекционное начало вследствие того, что нет выработки антител ко многим видам бактерий. Поэтому у новорожденных со 2—3-го месяцев жизни развивается клиническая картина хронического септического процесса с локализацией первичного очага, как правило, в легких.
Клинические проявления сопровождаются лейкоцитозом, снижением или полным отсутствием у-глобулиновой фракции белков. Воспалительные процессы в легких могут сочетаться с бронхиальной астмой; развиваются гнойные
очаги в костях, суставах, отит, менингит.
Для дисгаммаглобулинемии характерно развитие рецидивирующих бронхолегочных заболеваний воспалительной природы, а также кишечные инфекции, которые по клиническим признакам селективного дефицита иммуноглобулинов разделяют на три типа: дефицит IgG и IgA с повышением IgM (первый тип), сниже-
ние IgM и IgA (второй тип) или изолированный дефицит IgA (третий тип). У больных
развивается предрасположенность к аутоим- развиваются гепатолиенальныи синдром, одыш-мунным процессам, нередко сопровождающая- ка, общее отставание в развитии.
ся поражением почек, апластической или гемо- Бронхолегочная форма характеризуется литической анемией, тромбоцитопенией. признаками поражения органов дыхания, воз-
При развитии аплазии вилочковой железы, полной клеточной иммунологической недостаточности, часто сочетающейся с врожденными пороками сердца (синдром Di George), дети погибают в первые два года жизни от инфекции.
Наследственный алимфоцитоз обусловлен нарушением процессов созревания лимфоцитов. В результате у детей в раннем возрасте развивается септикопиемия с проявлением гнойных очагов в легких и других внутренних органах, а также на коже. Нередко у таких больных присоединяется кандидоз различных органов.
Лимфопеническая агаммаглобулинемия может протекать с полным или частичным поражением клеточных и гуморальных факторов иммунитета. Диагноз заболевания устанавливается при полном иммунологическом обследовании. Заболевание проявляется в первые месяцы жизни ребенка, сопровождается диареей, пневмониями и другими инфекционными проявлениями. Прогноз заболевания неблагоприятный, лечение симптоматическое.
Муковисцидоз (альвеолярный протеиноз легких) — наследственное заболевание, вызванное нарушением функции эндокринных желез и сопровождающееся образованием сли
зи повышенной вязкости, сочетающееся с изменениями ее электролитного состава.
Этиология заболевания неясна. Затруднение элиминации патологически измененной слизи сопровождается закупоркой выводных протоков железистого органа, в частности желудочно-кишечного тракта и (или) бронхиального дерева. В результате нарушения выведения секрета в пораженном органе развивается вторичное воспаление. Значительные изменения при этом претерпевают бронхиальное дерево и легкие в целом, так как застой секрета бронхиального дерева приводит к возникновению тяжелого воспалительного процесса в слизистой оболочке бронхов, что в большей степени ухудшает дренажную функцию бронхов. В повышении вязкости мокроты и брон
хиального секрета известную роль играют снижение в них концентрации натрия и калия и повышение фосфора.
Различают четыре разновидности клинического течения муковисцидоза: мекониальный илеус, кишечную форму, легочно-кишечную форму и бронхолегочную форму.
Легочно-кишечная форма характеризуется
сочетанием поражения желудочно-кишечного тракта и бронхолегочной системы. У детей
никающими с первых лет жизни ребенка. Длительно текущие повторные, плохо поддающиеся лечению пневмонии и бронхиты выступают на передний план в клинической картине заболевания. При этом кашель носит навязчивый характер с приступами. Мокрота может быть слизисто-гнойной или гнойной, что зависит от степени выраженности воспалительного процесса. При бронхоскопии выявляется эндобронхит, причем считается характерным наличие гнойных пробок в устьях расширенных бронхиальных желез.
Лечение муковисцидоза симптоматическое. Применяется лаваж бронхов с муколитиками. У больных с локализованной формой заболевания, развитием бронхоэктазий показано оперативное лечение.
Нарушение сурфактантной системы легких (болезнь гиалиновых мембран). Этиология заболевания неясна. Патогенез его связан с иммунологическим дефектом развития альвеолярных клеток II типа, которые вырабатывают сурфактант. До 36 нед беременности продукция его низкая, а активный синтез осуществляется только в поздние сроки — с 36-й недели. По этой причине у новорожденных (как правило, рожденных преждевременно) часто развивается недостаточность сурфактантной системы
139
легких, сопровождающаяся респираторным дистресс-синдромом.
В нарушении продукции и обмена веществ в легких большое значение имеет изменение кровообращения в системе легочной артерии. Различного рода нарушения притока крови из системы легочной артерии к альвеолярной ткани оказывают влияние на тканевой обмен и функцию альвеолярных клеток типа И, ответственных за продукцию сурфактанта легких. Гипоксия альвеол приводит к нарушению продукции сурфактанта. Гипоксия может зависеть и от многих других факторов (особенностей течения поздних сроков беременности, особенностей родов).
После рождения у ребенка с низким уровнем сурфактанта легких не происходит адекватного расправления легкого при первом крике, как это наблюдается в норме, и развиваются явления респираторного дистресс-синдрома, характеризующиеся прогрессирующей дыхательной недостаточностью, гипоксией, метаболическим и респираторным ацидозом. У новорожденного наблюдается короткий вдох, хотя дыхательные
мышцы развивают большое усилие. Высокое сопротивление для растяжения легких (из-за низкого уровня сурфактанта) ведет к развитию ателектазов, образованию в альвеолярных ходах и респираторных альвеолах пленок, которые препятствуют нормальному газообмену. Эти пленки и называют гиалиновыми мембранами.
Заболевание носит прогрессирующий характер, и большинство новорожденных, несмотря на проводимую интенсивную терапию, погибают в первые 2—5 сут.
Интенсивная терапия направлена на поддержание вентиляции легких, коррекцию метаболизма, кровообращения и, в частности, легочного кровотока. Кроме медикаментозных средств, направленных на нормализацию легочного кровотока, у новорожденных с открытым артериальным протоком проводят по срочным показаниям оперативное его закрытие.
Профилактические меры по предупреждению развития недостаточности сурфактантной системы должны проводиться на всех этапах родовспоможения.
Глава kz
ОСТРЫЕ АБСЦЕССЫ И ГАНГРЕНА ЛЕГКИХ
До настоящего времени отсутствуют общепринятые критерии, по которым острые деструктивные процессы в легких можно было бы отнести к той или иной классификационной категории (гангрена, гангренозный абсцесс, абсцесс).
Анализ материала клиники госпитальной хирургии, охватывающего наблюдения за 509 больными с острыми гнойными абсцессами и 170 больными гангреной легких, позволяет высказать собственную точку зрения на существо патологического процесса при гангрене и абсцессе.
Г ангрена легкого — это гнойно-гнилостный некроз значительного участка легочной ткани, чаще доли, 2 долей или всего легкого, без четких признаков демаркации, имеющий тенденцию к дальнейшему распространению и проявляющийся крайне тяжелым общим состоянием больного.
Гангренозный абсцесс — гнойно-гнилостный некроз участка легочной ткани, но имеющий тенденцию к секвестрации и отграничению от непораженных участков легочной ткани, что является свидетельством более благоприятного, чем гангрена, течения заболевания и позволяет определить его как ограниченную гангрену.
Когда говорят об абсцессе легких, имеют в виду гнойный или гнилостный распад некротических участков легочной ткани, чаще в пределах сегмента с наличием одной или нескольких полостей деструкции, заполненных густым или жидким гноем и окруженных перифокальной воспалительной инфильтрацией легочной ткани. Эта гнойная полость, как правило, отграничена от непораженных участков легкого пиогенной капсулой и в отличие от гангренозного абсцесса не содержит секвестра.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Причины, способствующие возникновению острых нагноений легких. Анализ обширной литературы и наблюдений клиники с очевидностью показывает, что причины и пути развития
легочных нагноений многообразны. Однако, рассматривая механизм развития различных по патогенезу видов легочных нагноений, нельзя не обратить внимания на обязательное присутствие трех основных факторов, участвующих в развитии легочных нагноений: 1) нарушения бронхиальной проходимости; 2) острого инфекционного воспалительного процесса в легочной паренхиме и 3) нарушения кровоснабжения, обусловливающего некроз легочной ткани.
На состоявшемся в 1976 г. в Сан-Франциско симпозиуме, посвященном проблемам лечения легочных нагноений, были выделены следующие основные состояния организма, способствующие возникновению аспирационных поражений: алкоголизм, наркомания, эпилепсия, травмы головы, сопровождающиеся длительным бессознательным состоянием, краниоваскуляр-ные расстройства, общая анестезия, т. е. состояния, сопровождающиеся более или менее выраженным нарушением сознания, а также заболевания пищевода.
Значительно более частое возникновение абсцессов и гангрены у алкоголиков и лиц, злоупотребляющих алкоголем, отмечено многими авторами [Даниленко М. В. и др., 1974; Ми-тюк И. И., 1974; Углов Ф. Г., 1975; Федоров Б. П., Сахаров В. А., 1977; Васюков В. Я., 1980]. Характерной особенностью гнойных осложнений крупозной пневмонии у алкоголиков является быстрое, в течение первых дней, расплавление легочной ткани с образованием больших абсцессов.
Хроническая алкогольная интоксикация не только способствует возникновению аспирационных легочных нагноений из-за подавления кашлевого рефлекса и снижения уровня сознания, но и пагубно влияет на течение уже развившегося гнойного процесса в легких. Исследованиями W. MacFerland, Е. Libre (1963) доказано, что у алкоголиков, страдающих инфекционными процессами, значительно снижен гранулоцитарный резерв костного мозга, подавлены механизмы фагоцитоза и других защитных реакций организма. У лиц, страдающих хроническим алкоголизмом, острые легочные нагноения, как правило, характеризуются массивностью поражения легочной ткани, чаще возникающими пиопневмотораксом и эмпие
141
мой, а также интоксикационными психозами [Барков В. А. и др., 1982].
Наши наблюдения подтверждают положение о том, что острая алкогольная интоксикация является одной из главных причин развития аспирационных пневмоний, переходящих в абсцесс или гангрену. Так, 50,3 % из наблюдавшихся нами больных с острыми абсцессами легких (509 человек) злоупотребляли алкоголем, а 11,7% — страдали хроническим алкоголизмом. Среди 170 больных гангреной злоупотребляли алкоголем 55,4 %, страдали хроническим алкоголизмом — 12,5 %. У 23,2 % больных гангрена легких диагностирована после перенесенного алкогольного делирия.
Существует прямая зависимость между частотой возникновения аспирационных легочных нагноений и наличием инфекционных очагов в полости рта — кариозные зубы, пародонтоз, хронический тонзиллит, синуситы [Bartlett J. et al., 1975]. Гангренозные процессы в зубах резко меняют соотношение между анаэробной и аэробной флорой полости рта в сторону значительного преобладания анаэробов и, следовательно, увеличивают возможность аспирации анаэробной микрофлоры.
Как видно из вышеизложенного, пусковым механизмом в патогенезе острых легочных нагноений чаще всего являются нарушения бронхиальной проходимости. Только в условиях безвоздушной легочной ткани, т. е. ателектаза, деятельность микробной флоры может привести к расстройству кровообращения, некрозу и легочному нагноению. Не случайно подавляющее большинство абсцессов и гангрен являются аспирационными или постпневмоническими, а при этих типах легочных нагноений заболевание начинается с нарушений бронхиальной проходимости и ателектаза.
С целью изучения состояния бронхиальной проходимости и ее влияния на течение гнойного процесса в легких контрастированием деструктивной полости через дренажную трубку была в динамике изучена проходимость дренирующих бронхов у 55 больных острыми абсцессами и гангреной легких [Лесницкий Л. С., 1970]. Из них у 44 больных сразу же после дренирования торакоцентезом с помощью кардиотраста, введенного в полость через дренаж, обнаружить проходимость дренирующих бронхов не удалось. Эти данные подтверждают положение о том, что в начальный период абсцесса и гангрены легких тяжесть состояния больных определяется главным образом гнойной интоксикацией из-за невозможности эвакуации гноя и некротических масс из полостей деструкции естественным путем через дренирующие бронхи, проходимость которых нарушена вследствие воспалительного отека слизистой, обтурации
густым гноем, детритом и мелкими секвестрами легочной ткани. Если иметь в виду, что ни у одного из больных этой группы антибиотики не применялись ни местно в полость абсцесса через дренаж, ни парентерально, то станет очевидным, что острый гнойный процесс в легочной ткани можно ликвидировать главным образом методами, максимально способствующими постоянной эвакуации гноя и некротических тканей и обеспечивающими хорошее сообщение полостей деструкции с внешней средой через дренирующие бронхи.
Нарушения бронхиальной проходимости у совершенно здоровых людей встречаются, по-видимому, очень редко, и аспирация инфицированного материала в трахеобронхиальное дерево не представляет опасности благодаря нормально функционирующим механизмам самоочищения. Иные условия создаются при хронических заболеваниях органов дыхания — бронхите, эмфиземе, пневмосклерозе, бронхиальной астме, хронической пневмонии.
Из хронических заболеваний легких чаще всего острым нагноениям легких сопутствует хроническая пневмония. По данным В. Д. Вышегородцевой (1942), 25 % больных гангреной легких страдали хронической пневмонией. М. Д. Тушинский (1960) отметил различные хронические легочные заболевания у половины из 101 больного гангреной. Все эти больные наблюдались автором в период, когда не применялись антибиотики и сульфаниламидные препараты. Среди наблюдавшихся нами больных острыми абсцессами и гангреной хроническая пневмония отмечена соответственно у 39 % и 22,9 %.
На связь острых нагноений легких с тяжелыми хроническими системными заболеваниями указывали С. Попкиров (1974), Ф. Г. Углов, В. Ф. Егиазарян (1976), W. Vainrub и соавт. (1978). Длительное течение этих заболеваний приводит к значительному угнетению защитных сил организма и неблагоприятному течению возникшего гнойно-деструктивного процесса в легких. Нередко такие условия создаются при лечении других заболеваний стероидными гормонами. Гормональная терапия повышает чувствительность организма к инфекции, способствует возрастанию устойчивости микробной флоры к антибиотикам, снижает уровень воспалительных реакций, клеточного и гуморального иммунитета, обусловливает замедленное заживление ран вследствие уменьшения пролиферации капилляров, образования фибробластов и отложения коллагена [Fishman N. et al., 1977]. Ф. Г. Углов (1975) наблюдал 10 больных бронхиальной астмой, у которых гормональная терапия осложнилась тяжелыми поражениями легких с большими участками
142
деструкции легочной ткани. Мы наблюдали 10 случаев гангрены легких у больных бронхиальной астмой и заболеваниями крови, леченных кортикостероидными гормонами. Шестеро из этих больных погибли.
Таким образом, легочные нагноения, а особенно наиболее тяжелая форма их — гангрена— развиваются чаще всего на фоне ослабленного общего состояния организма, вызванного алкогольной интоксикацией хроническими воспалительными заболеваниями органов дыхания, тяжелыми системными заболеваниями, а также преклонным возрастом. В этих условиях и реализуется деятельность патогенной микробной флоры, которая во взаимодействии с нарушениями бронхиальной проходимости и местного кровообращения являются одной из главных причин возникновения легочных нагноений.
Микробная флора. Данные литературы последних лет свидетельствуют о существенном изменении видового состава микробной флоры, определяемой в качестве возбудителя острых гнойно-деструктивных поражений легких и плевры. «Повинны» в этом прежде всего антибиотики, широкое использование которых привело к значительному уменьшению менее патогенных микроорганизмов (пневмококк, в меньшей степени стрептококк), к увеличению анти-биотикоустойчивости патогенной микрофлоры, вначале стафилококка, а затем после широкого внедрения в практику антистафилококковых антибиотиков, грамотрицательной и анаэробной флоры [Федоров Б. П., Воль-Эпштейн Г. Л., 1976; Стручков В. И. и др., 1978; Sherman М. et al., 1977, и др.]. За период с середины 30-х до начала 70-х годов частота выделения из мокроты и гноя пневмококков уменьшилась с 50 до 12 %, в то время как частота обнаружения стафилококков в этих случаях увеличилась с 22 до 35 %, а грамотрицательной микрофлоры — с 10 до 56 %.
За период, наступивший после внедрения антибиотиков в широкую клиническую практику, изменились не только соотношения частоты обнаружения различных видов патогенных микробов при гнойно-деструктивных поражениях легких. Появились и имеют тенденцию к увеличению качественно другие виды патогенной микробной флоры. Данные литературы свидетельствуют о том, что острые абсцессы и гангрена вызываются чаще всего стафилококком, грамотрицательной флорой и анаэробами.
Ведущее место среди возбудителей острых гнойно-деструктивных поражений легких занимает гемолитический стафилококк [Сазонов А. М. и др., 1972; Силинын И. А. и др., 1975].
В течение последних 40 лет накопилось достаточно доказательств, чтобы считать анаэробную инфекцию одной из основных причин в
этиологии абсцессов и гангрены легких [Кузин М. И. и др., 1983]. Л. Г. Кузьмина и В. Ф. Еги-азарян (1972) при микробиологическом обследовании 200 больных острыми и хроническими неспецифическими заболеваниями легких в 32 % обнаружили различную анаэробную флору, но об особенностях клинического течения заболевания не упоминают. Представители патогенных видов Clostridia найдены в 5 % случаев. Стафилококки у этой группы больных высевались как в аэробных, так и в анаэробных условиях. Интересно, что в 23 % наблюдений первичный рост стафилококков отмечен лишь в анаэробных условиях.
Доминирующим микроорганизмом, встречающимся у больных острыми абсцессами и гангреной легких, является, по нашим данным, стафилококк. В случаях ассоциации микроорганизмов чаще всего встречается сочетание кокковой флоры и дрожжевых грибов опять же со стафилококком. Среди наблюдавшихся нами больных гангреной легких грамотрица-тельная микробная флора встретилась в 40,4 % случаев. Микробная флора оказалась нечувствительной ко всем из применявшихся антибиотиков у 57,1 % больных. Чаще всего нечувствительными были кишечная и синегнойная палочки.
По данным многих авторов, абсцессы легких часто развиваются как осложнение гриппозных пневмоний. Было замечено, что вирус гриппа не только поражает эпителий бронхов, но и нарушает их дренирующую способность [Пигалев-ский Б. Е., 1959]. Вызванный вирусом язвенный бронхиолит и массивный легочный отек с кровоизлияниями облегчают проникновение патогенной бактериальной флоры. Развитию некробиотических и некротических изменений в легочной паренхиме способствует и тромбоз легочных сосудов, часто возникающий при гриппозных пневмониях [Давыдовский И. В., 1939; Бекерман Л. С., 1946]. Анализируя 32 случая острых абсцессов легких, развившихся после гриппозных пневмоний, Б. П. Федоров, Г. Л. Воль-Эпштейн (1976) высказывают предположение о прямом участии гриппозного вируса в процессе абсцедирования.
К небактериальным инфекционным агентам, вызывающим пневмонию, относится и микоплазма [Levis J., Sheptin С., 1972; Siegler D., 1973; De Vos M., 1976]. Так же как и вирус гриппа, микоплазма, вероятнее всего, играет «подготовительную» роль — облегчает бактериальную инвазию благодаря поражению эпителия верхних дыхательных путей и уменьшению резистентности организма [Злыдников Д. Н. и ДР-, 1971].
Пути возникновения абсцессов и гангрены легких. Абсцессы и гангрена, развивающиеся
143
как осложнение пневмонии, встречаются чаще всего — от 63 до 95 % [Спасокукоцкий С. И., 1938; Андрианов Ю. А. и др., 1980; Стручков В. И., 1981, и др.]. Гнойными процессами могут осложняться как бактериальные (крупозная, очаговая), так и небактериальные (гриппозная, микоплазмоидная) пневмонии, протекающие по очаговому или интерстициальному типам, а также смешанные пневмонии (вирусно-бактериальные).
Исход в нагноение при крупозной пневмонии связывается с гиперергическим характером воспаления и резким нарушением местного кровообращения. А. И. Абрикосов (1947), А. И. Струков (1961) полагали, что сам пневмококк может вызвать образование абсцессов, а И. В. Давыдовский и др. (1956) связывали абсцедирование при крупозной пневмонии с вторичным инфицированием патогенной флорой — стафилококками, стрептококками. Следствием вторичной инфекции, по мнению этих авторов, является также и гангрена легких, которая развивается в результате активного внедрения в ткани анаэробных возбудителей, вызывающих некроз.
Осложнения абсцессом и гангреной очаговых пневмоний в прошлом наблюдались даже чаще, чем крупозных [Этингер Н. Г., 1939]. В. Д. Вышегородцева (1942) отметила, что у 11 % из 1092 больных очаговой пневмонией наблюдались абсцессы и гангрена легких. По данным Н. С. Молчанова, В. В. Ставской (1971), гнойные осложнения очаговых пневмоний встречались редко. Резкое снижение частоты гнойных осложнений при очаговых пневмониях в настоящее время связано, вероятнее всего, с использованием антибактериальных препаратов [Kuhn Н. et aL, 1971].
Среди различных видов бактериальных пневмоний особенно часто осложняются гнойнодеструктивными процессами стафилококковые и фридлендеровские пневмонии.
Стафилококковая пневмония может возникнуть в любом возрасте, однако наиболее тяжелое, нередко молниеносное течение чаще наблюдается у детей, пожилых и больных, страдающих хроническими заболеваниями. По данным С. Л. Либова, К. Ф. Ширяевой (1973) среди больных стафилококковой пневмонией взрослые составляли всего 2 %. В последние годы участились случаи таких пневмоний у взрослых [Кахидзе С. Я. и др., 1980; Ратнер Г. Л. и др., 1980].
Главной особенностью стафилококковых пневмоний считается их склонность к раннему образованию кортикальных гнойно-некротических очагов в легких, часто прогрессирующих и приводящих к перфорации участков нагноения в плевральную полость.
Частота фридлендеровских пневмоний в настоящее время колеблется в пределах 0,5—4 % в структуре причин воспалений легких [Мерзлякова М. Т„ 1972].
Заболевание чаще всего возникает у мужчин в возрасте старше 40 лет, случаи заболевания у детей очень редки. Характерной особенностью фридлендеровских пневмоний является очень частое их осложнение распространенным некрозом легочной ткани [Цинзерлинг В. Д., Цин-зерлинг А. В., 1963; Sharma G., Chandhry В., 1967]. Заболевание часто протекает с массивной секвестрацией омертвевших участков легкого [Cameron Е., Whitton J., 1977]. Известны случаи, когда секвестрировались и отделялись с гноем или во время операции целые доли легкого и даже все легкое.
Выяснение причин осложненных пневмоний и тенденции к затяжному их течению является центральным вопросом в пульмонологии, так как обусловливает основные тактические принципы лечения и профилактики заболевания. Еще М. П. Кончаловский (1937), С. И. Спасокукоцкий (1938), И. В. Давыдовский (1939) считали, что нагноительный процесс в легком чаще всего развивается при неразрешившейся затяжной пневмонии. Затяжными считаются остро-возникшие пневмонии, которые не удалось излечить в течение 3 нед с момента возникновения заболевания [Сильвестров В. П., 1982]. Б. С. Брусиловский, Л. Ф. Курная (1975), анализируя причины затяжного течения пневмонии у 200 больных, выделили следующие наиболее вероятные факторы, способствующие такому течению: несвоевременно начатое или неправильно проводимое лечение, наличие сопутствующих внелегочных заболеваний и перенесенных в прошлом заболеваний легких, угнетение иммунобиологической активности организма. На затяжное течение острых пневмоний влияют также профессиональные вредности (пыль, загазованность, переохлаждение) и, в меньшей степени, локализация воспаления в легком.
Исходя из ведущей роли нарушений бронхиальной проходимости в возникновении и течении острых и затяжных пневмоний, лечение их может считаться современным, если в перечень обязательных лечебных мероприятий включаются методы, направленные на восстановление и улучшение дренажной функции бронхов: лечебные бронхоскопии, ингаляции лекарственных препаратов, промывания трахеобронхиального дерева, бронхоспазмолитики, с помощью которых нередко удается предотвратить развитие абсцесса или гангрены легких и купировать процесс на стадии абсцедирующей пневмонии [Данович Б. 3., 1971; Кокосов А. Н. и др., 1972; Лохвицкий С. В., Ильи
144
на Л. Б., 1975]. Под абсцедирующей пневмонией следует понимать отдельную между пневмонией и абсцессом форму нагноения в легочной ткани, клинически характеризующуюся признаками осложненной пневмонии, а морфологически — представляющую собой мелкие, до 0,3—0,5 см в диаметре, множественные очаги гнойно-некротической деструкции, которые или могут полностью разрешиться (опорожнившись при благоприятных условиях через бронхи), или привести к формированию более крупных очагов некроза и деструкции путем слияния мелких, т. е. к образованию абсцесса (гангрены).
Если взять пневмонии в целом, не разделяя их по этиологическому и клинико-морфологическому признакам, то, по данным различных авторов, абсцедирование наблюдается в 1,2— 4,3 % случаев [Гукасян А. Г., 1964; Камень-щик Ю. М., Кананина Л. В., 1972; Сорокина Г. А., 1975]. По данным Б. П. Федорова, Г. Воль-Эпштейна (1976), у 37,4 % больных абсцедирование возникло в период амбулаторного лечения, которое чаще всего ошибочно проводилось по поводу гриппа или катара дыхательных путей, а пневмония не была диагностирована.
Патогенез постпневмонических абсцессов и гангрены можно представить следующим образом. Бронхогенное (чаще всего), гематогенное или лимфогенное инфицирование легочной ткани вызывает воспаление паренхимы и мелких бронхов. Нарушение проходимости мелких бронхов из-за спазма, отека или обтурации секретом имеет следствием ателектаз участков легкого. Инфильтрация и прогрессирующий отек тканей вследствие воспаления приводят к прямому сдавлению воспалительным инфильтратом мелких кровеносных сосудов и капилляров, что сопровождается расстройством кровообращения в воспаленном и безвоздушном участке легкого. Нарушения кровообращения зависят также и от токсического воздействия продуктов жизнедеятельности микробов и воспаления на стенки капилляров с поражением их структур, от изменения нервной регуляции кровообращения и трофики легочной ткани. При дальнейшем прогрессировании воспаления в легком и сдавлении мелких сосудов и капилляров нас тупает резкое замедление циркуляции крови, доходящее до стаза и тромбоза кровеносных сосудов с возникновением некроза участков легочной паренхимы. Вероятнее всего, эти морфологические изменения в легком имеют своим клиническим эквивалентом стадию затяжной, осложненной пневмонии. Инвазия в омертвевшие участки легкого патогенной микрофлоры непосредственно из обтурированного бронха, из верхних дыха
тельных путей и полости рта, лимфогенно или гематогенно приводит к начинающемуся гнойному или гнилостному распаду участков омертвевшего легкого (стадия абсцедирующей пневмонии). Преобладание в патокинезе процесса элементов некроза или гнойного расплавления предопределяет развитие заболевания по типу абсцесса или гангрены легкого, что во многом зависит от состояния реактивности организма больного.
Аспирационный механизм развития патологического процесса является одним из ведущих в патогенезе острых нагноений легких. Так же как и при постпневмонических поражениях, аспирационные легочные нагноения развиваются вследствие бронхогенного попадания инфекционного начала в легкое. Но если при постпневмонических нагноениях патологический процесс обычно начинается с воспаления в паренхиме и бронхах, ведущего к нарушению бронхиальной проходимости, ателектазу, расстройству кровообращения, некрозу и гнойному расплавлению, то в случаях аспирационных легочных нагноений патологический процесс начинается с аспирации инфицированного материала, фиксации его в мелких бронхах или бронхиолах и ателектаза. Воспалительный процесс и все последующие стадии его течения вплоть до нагноения развиваются вторично. В клинической практике нередко очень трудно отличить постпневмонические нагноения от аспирационных. Исключение составляют лишь случаи заболевания, где факт аспирации точно известен в анамнезе.
Поскольку в патогенезе и течении нагнои-тельных процессов легких ведущая роль принадлежит нарушению проходимости бронхов, аспирационные абсцессы и гангрена легких развиваются значительно быстрее, чем постпневмонические, формирующиеся в течение 3— 4 нед от начала заболевания. Многочисленными экспериментальными данными доказано, что аспирационный гнойник в легком формируется через 8—14 дней после аспирации.
Частота аспирационных абсцессов и гангрен легких, по данным различных авторов, колеблется от 20 до 75 % в структуре вероятных механизмов их развития. Поскольку факт аспирации удается установить далеко не всегда, можно предположить, что аспирационные легочные нагноения встречаются еще чаще.
В пользу преобладания аспирационного механизма развития острых нагноений легких свидетельствуют и данные, полученные при изучении частоты поражения правого и левого легкого, а также их сегментов. Абсцессы и гангрена значительно чаще развиваются в правом легком, короткий и широкий главный бронх которого, являясь как бы продолжением трахеи,
10 Зак. 0517
145
увеличивает вероятность попадания аспирированного материала именно в правое легкое. Среди более 1100 больных, наблюдавшихся в госпитальной хирургической клинике, поражение правого легкого отмечено у 66,2 % больных. Многочисленными исследованиями, основанными на большом количестве личных наблюдений, было подтверждено более частое поражение задних сегментов верхних долей и верхушечных сегментов нижних, бронхи которых, отходя кзади и кнаружи, являются наиболее доступными для попадания и фиксации в них аспирированного материала, если человек лежит на спине или на боку.
Механизм развития аспирационных абсцессов и гангрены легких представляется следующим образом: аспирация в трахеобронхиальное дерево инородного материала (слизь или слюна из носоглотки, рвотные массы, желудочное содержимое и др.) при условии снижения уровня сознания приводит к фиксации их в мелких бронхах и развитию ателектаза. Кроме наличия инфицированного материала (чаще всего анаэробной инфекции из полости рта) и перечисленных выше состояний организма, снижающих уровень сознания, большое значение также имеют сопутствующие хронические заболевания легких, изменяющие их нормальную функцию и способствующие развитию нарушений дренажной функции бронхов и кровообращения. Начинающийся в бронхах воспалительный процесс еще больше нарушает бронхиальную проходимость и приводит к развитию ателектаз-пневмонии. Некоторые авторы эту стадию заболевания называют пневмонитом [Smith L., 1976], которая часто просматривается, так как не имеет четких клинических признаков. Лишь указания в анамнезе на возможность аспирации могут помочь заподозрить эту стадию заболевания.
Если в стадии ателектаз-пневмонии патогенетическая терапия отсутствует или начата с опозданием, патологический процесс в ате-лектазированном участке легкого прогрессирует. Возникает некроз безвоздушной легочной ткани из-за нарушения кровообращения вследствие тромбоза и сдавления мелких сосудов воспалительным инфильтратом. Под воздействием микробов и продуктов их жизнедеятельности начинается гнойный или гнилостный (в зависимости от резистентности организма и вида микробной флоры) распад мертвых тканей с образованием множественных мелких очагов деструкции.
Среди наблюдавшихся в госпитальной хирургической клинике 509 больных острыми абсцессами и 170 больных гангреной легких аспирационная природа заболевания установлена соответственно в 65 и 32,9 %.
Частота гематогенн о-э м б о л и ч е-с к и х легочных нагноений относительно невелика и, по клиническим данным различных авторов, колеблется от 0,8 до 9 % [Спасокукоцкий С. И., 1938; Васютков В. Я и др., 1980; Григорян А. В. и др., 1980]. По секционным данным, частота абсцессов после инфарктов легких составляет 0,6—4,9 % [Davison А., 1958]. Среди больных, лечившихся в нашей клинике, лишь у 0,9 % оказалось возможным предположить гематогенно-эмболическую природу абсцессов и гангрены легких.
Легочные нагноения развиваются значительно чаще, если инфаркт легочной ткани вызывается септическим эмболом, так как при этом вследствие нарушения кровообращения и бактериального обсеменения тканей происходит быстрая дезинтеграция инфицированного участка легкого. J. Macmillan и соавт. (1978), анализируя результаты обследования 60 больных с абсцессами легких, развившихся вследствие септического легочного эмболизма, указал на следующие наиболее частые источники эмболов: септический эндокардит, гнойные тромбофлебиты вен конечностей и таза, флебиты после длительной катетеризации периферических вен, абсцессы различной локализации. Отрыву инфицированных эмболов и заносу их в легкие могут способствовать оперативные вмешательства на инфицированных тканях.
Считается, что развитие гнойных метастазов в легких и плевре у больных сепсисом наблюдается сравнительно редко. Описаны метастатические гнойные поражения легких у больных с гинекологическим сепсисом [Мельник А. И., 1971; Полякова Л. М., 1972]. Нами наблюдались 11 больных с острыми гнойно-деструктивными поражениями легких и плевры, развившимися как осложнение сепсиса [Лесницкий Л. С., 1979].
Литературные данные последних лет свидетельствуют о все возрастающем числе гемато-генно-эмболических нагноений легких, что связано, вероятно, с общим ростом заболеваемости сепсисом вообще. За период с 1975 по 1980 г. в отечественной литературе опубликованы сведения о 548 случаях метастатических гнойных поражений легких при сепсисе с летальностью 36 % [Мустафин Д. Г., 1980].
Асептические инфаркты значительно реже осложняются нагноением. Более того, асептическая эмболия не всегда приводит к развитию самого инфаркта из-за обилия коллатерального кровообращения. Если инфаркт участка легочной паренхимы и наступает, то развитие нагноения происходит вследствие вторичного бронхогенного инфицирования.
Механизм развития гематогенно-эмболических легочных нагноений можно представить
146
следующим образом: закупорка тромбом и тромбоз мелких ветвей легочной артерии приводят к клиновидному геморрагическому инфаркту участка легочной паренхимы с последующим ее некрозом. Зона некроза подвергается гнойному или гнилостному распаду вследствие обсеменения ее флорой, попавшей в область некротических тканей или вместе с септическим эмболом, или вторично, бронхогенно, причем в этом случае нагноительный процесс может развиться и в зоне асептического инфаркта. Нарушения кровообращения, способствующие некрозу легочной паренхимы, являются одним из центральных звеньев патогенеза острых легочных нагноений. Однако до настоящего времени не выяснены механизмы возникновения некроза.
Доказано в эксперименте и подтверждено в клинике [Углов Ф. Г., 1948; MacMilian J. et al., 1978], что перевязка ветвей легочной артерии или всего ее ствола не вызывает инфаркт легкого вследствие функционирования прекапиллярных анастомозов между легочной и бронхиальной артериями. В то же время изолированная перевязка легочных вен ведет к более выраженным изменениям: чаще всего к геморрагическому инфаркту легких, кровоизлияниям в паренхиму, но тоже не всегда к некрозу, хотя случаи омертвения легкого вследствие тромбоза вен известны в клинической практике. Некроз и влажная гангрена легкого значительно чаще возникают при одновременной перевязке вены и артерии.
Трудно определенно судить о том, нарушения в какой системе легочного кровотока — артериальной (включая бронхиальную) или венозной — играют ведущую роль в возникновении некроза легочной ткани. Предположительно можно считать, что потенциально более опасными для развития некроза легочной ткани являются нарушения венозного оттока. Тромбоз легочных вен чаще имеет патологические последствия еще и потому, что ведет к расстройству бронхиального кровотока, поскольку отток крови из бронхиальных сосудов осуществляется, как правило, в легочные вены [Плешаков В. Т., 1949].
Все это с очевидностью определяет необходимость более глубоких специальных исследований кровотока в сосудах легких при воспалении, некрозе и нагноении. Селективная ангиография с целью изучения кровотока в пораженном легком нами была выполнена у 57 больных (из них у 13 была распространенная гангрена). Легочная артерия пораженного легкого катетеризировалась через бедренную вену. Во всех случаях были обнаружены признаки резкого нарушения кровообращения: обрыв артерии, питающей пораженную долю, с аваску-
ляризацией пораженных участков легкого. Аналогичные данные получены Е. В. Ловягиным (1973), И. Гулачи (1981). На основании полученных данных судить о причине непроходимости артериальных сосудов пораженной доли при остром абсцессе и гангрене не представляется возможным; вероятнее всего, она обусловлена тромбозом, а не нарушением структурной целостности артерий. Тромбоз сосудов легкого, пораженного деструктивным процессом, ведет к редукции малого круга кровообращения, увеличению общего и легочно-сосудистого сопротивления, повышению давления в легочной артерии и нагрузки на правый желудочек сердца, что подтверждается проведенными в клинике исследованиями центральной гемодинамики.
Под обтурационным нагноением легких принято понимать гнойно-деструктивный процесс, обусловленный закупоркой бронха каким-либо случайно попавшим в него инородным телом, доброкачественной или злокачественной опухолью, развивающейся из стенки бронха, или опухолью, сдавливающей бронх извне, а также стенозом бронха вследствие различных воспалительных процессов в его стенке.
Частота легочных нагноений вследствие обтурации бронха инородным телом колеблется от 1,5 до 23 % от общего количества наблюдавшихся больных [Бакулев А. Н., Колесников Р. С., 1955; Shinoi К., 1960; Bernard W. et al., 1962]. Сообщения последних лет, вышедшие из специализированных клиник, где более широко применялся бронхоскопический контроль, свидетельствуют о малой частоте обтурационных абсцессов и гангрен после аспирации инородных тел. Так, среди наблюдавшихся в нашей клинике больных с абсцессами легких аспирация инородных тел как причина заболевания отмечена лишь у 0,3 %.
Значительно чаще легочные нагноения развиваются вследствие опухолевой обтурации бронхов и ателектаза. Так, среди 477 больных, наблюдавшихся R. Brock (1952), рак бронха был причиной абсцессов у 83 (17,5 %) пациентов. По наблюдениям D. Waterman и соавт. (1967), из 464 больных с абсцессами легких у 187 (40,5 %) были «раковые» абсцессы. В настоящее время, когда диагностика рака легкого стала более совершенной и, следовательно, более ранней, число таких абсцессов сократилось. По материалам нашей клиники, такие обтурационные легочные нагноения отмечены лишь у 0,4 % больных.
Гораздо реже встречаются и поэтому труднее диагностируются обтурации бронха доброкачественными опухолями, а также стенозы бронха, вызванные различными воспалитель-
10 *
147
ними процессами. Рубцовый стеноз бронха часто возникает на почве туберкулезного бронхоаденита. Наиболее уязвимым для сдавления лимфатическими узлами является бронх средней доли. Вследствие стеноза среднедолевого бронха в средней доле может возникнуть ателектаз с последующим развитием в ней нагноения. Аналогичный механизм возникновения обтурационного абсцесса и при окклюзии других участков бронхиального дерева.
Посттравматические абсцессы и гангрену легких можно разделить на две группы: после повреждений непроникающих (ушибы, сотрясения и сдавления) и после проникающих ранений (пулевые, осколочные, ранения холодным оружием). По данным Е. А. Вагнера и соавт. (1981), посттравматические легочно-плевральные нагноения составляют 10 % от гнойных заболеваний легких и плевры.
Закрытая травма грудной клетки очень редко сопровождается развитием нагноения в легочной паренхиме. Даже при множественных переломах ребер с повреждением легкого гемоторакс чаще всего стерилен. Нагноение может возникнуть, если будут повреждены крупные бронхи, в которых, как правило, имеется микрофлора. Анализируя материал периода Великой Отечественной войны, А. О. Берзин (1950) ни разу не отметил возникновение острых гнойников легкого после закрытой травмы грудной клетки. Среди больных, наблюдавшихся в клинике, развитие абсцессов было связано с закрытой травмой груди лишь у 5 (0,5 %) больных.
Абсцессы и гангрена легких, развивающиеся на почве огнестрельных ранений, также встречаются редко. По данным, опубликованным в «Опыте советской медицины в Великой Отечественной войне 1941 —1945 гг.», они составили 0,47 % от всех ранений в грудь и 1,1 % по отношению к проникающим ранениям в грудь. Среди раненых с открытым пневмотораксом абсцессы и гангрена отмечены в 1,9 % случаев [Колесников И. С., 1950].
Сроки возникновения легочных нагноений после огнестрельных ранений различны. Частота ранних абсцессов легких за период второй мировой войны составила 0,24—2 % от всех ранений в грудную клетку [Тальман И. М., 1946; Jakobs S., Barke L„ 1946]. Ранние легочные нагноения часто остаются нераспознанными, так как имеются условия для спонтанного опорожнения сформировавшегося гнойника в плевральную полость с образованием эмпиемы плевры или бронхиального свища.
Абсцессы после огнестрельных ранений могут возникнуть через несколько месяцев и даже лет после травмы. Одним из наиболее частых источников инфекции, ведущих к образованию
поздних абсцессов, являются инородные тела, застрявшие по ходу раневого канала (ранящий снаряд, костные осколки, обрывки одежды), содержащие в 60—80 % случаев самую разнообразную патогенную аэробную и анаэробную микрофлору.
Мелкие инородные тела нередко «вживают» и долго ничем не проявляют себя клинически. Вокруг крупных инородных тел (чаще всего осколков), как правило, постоянно поддерживается воспалительный процесс, который может закончиться нагноением и формированием хронического абсцесса с полостью, на дне или в стенке которой находится инородное тело. Частота таких абсцессов колеблется от 4,8 до 17 % [Колесов А. П., Толузаков В. Л., 1966, и др.]. Среди наблюдавшихся в клинике больных они составили 4,2 %.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
И ДИАГНОСТИКА
Клиническая симптоматика острых абсцессов и гангрены легких разнообразна и зависит от индивидуальных особенностей организма, объема некротизированной легочной ткани, характера и интенсивности его распада, стадии заболевания, возникающих осложнений, наличия или отсутствия сопутствующих заболеваний.
Вначале заболевание чаще всего расценивается как грипп или респираторное заболевание, а у больных хронической пневмонией — как очередное ее обострение. Неэффективность амбулаторного лечения в течение нескольких дней, продолжающаяся высокая температура, усиление болевых ощущений в грудной клетке, а иногда и отхождение гнойной мокроты в такие ранние сроки вынуждают госпитализировать больных в терапевтические стационары. Отмечаются высокая температура, слабость, боли в грудной клетке, укорочение перкуторного звука над зоной поражения, ослабление дыхательных шумов — признаки, которые всегда должны настроить врача в отношении возможности дальнейшего прогрессирования патологического процесса, трактуемого в этот период чаще всего как сливная пневмония, и перехода ее в нагноение.
Первый тип абсцедирования характеризуется поначалу благоприятной динамикой пневмонического процесса, наступлением кризиса, после чего вновь возникают ухудшение состояния, повышение температуры, усиление болей в грудной клетке с последующим выделением гнойной мокроты. Абсцесс при этом формируется через 12—20 дней после начала пневмонии. Второй тип клинического течения при абсцедировании характеризуется симптомами затянувшейся пневмонии и безуспешностью про
148
водимого лечения: температура тела в течение длительного времени держится на высоких цифрах, постепенно появляется и увеличивается количество гнойной мокроты. Формирование легочного гнойника происходит в течение 20—30 дней от начала пневмонии. Третий тип абсцедирования характеризуется быстротой развития гнойно-деструктивного процесса в легком, когда у больных уже с первых дней заболевания отмечается выделение гнойной, нередко зловонной мокроты, не характерной для типичной пневмонии. В связи с этим высказывались предположения, что такие гнойники являются самостоятельным заболеванием, с самого начала развивающимся как острое нагноение в паренхиме легкого. Анализ наших наблюдений свидетельствует, что первый и второй типы абсцедирования свойственны постпневмоническим абсцессам, третий — аспирационным.
Аспирационный механизм является, по-ви-димому, преобладающим в патогенезе гангрены легких. По наблюдениям госпитальной хирургической клиники, некроз и гнойно-гнилостный распад участков легкого наступают обычно через 5—10 сут.
Позднее, на 3—4-й неделе заболевания, наступление некроза и распада легкого отмечено лишь у 6 из 170 наблюдавшихся нами больных гангреной легких.
Состояние больных в стадии некроза и распада тяжелое. Оно определяется выраженной интоксикацией вследствие резорбции продуктов распадающейся мертвой ткани, жизнедеятельности микробных клеток и их токсинов. Клиническими признаками, свидетельствующими о наступлении этой стадии нагноения, являются высокая с гектическими размахами температура и появление гнилостного запаха изо рта при дыхании. Реже, особенно у больных с абсцессами легких, неприятный запах изо рта может вообще отсутствовать.
Спустя несколько дней после появления запаха начинается выделение гнойной или гнойно-гнилостной мокроты, что свидетельствует о возникновении сообщения очагов распадающихся некротических тканей с бронхами и начавшемся их опорожнении. Количество мокроты может достигать более 500 мл в сутки.
В мокроте часто .определяется примесь крови. Запах мокроты может быть очень неприятным, напоминающим запах от кариозного зуба. Иногда, особенно при гангрене, запах бывает настолько резким, что пребывание окружающих в одном помещении становится невозможным. Мокрота у больных гангреной чаще имеет грязно-серый, иногда (от примеси крови) шоколадный цвет. Она — жидкой водянистой консистенции, пенистая. При отстаивании делится
на три слоя: нижний состоит из крошковатого осадка, представляющего обрывки легочной ткани и пробок Дитриха, средний слой, наиболее выраженный,— мутный, жидкий, верхний слой — слизисто-гнойный, пенистый. Обнаруженные при микроскопическом исследовании мокроты эластические волокна, жировые капли, клеточные элементы и бактерии подтверждают продолжающийся распад легочной ткани. Эластические волокна обнаруживаются не всегда из-за ферментативного их расплавления в процессе жизнедеятельности бактерий. У больных с абсцессами легких запах мокроты может отсутствовать; нередко она бывает более густой, чем при гангрене, консистенции, белого или серовато-белого цвета.
Количество мокроты зависит не только от объема поражения легочной ткани, но и от сопутствующего бронхита. Выделение мокроты чаще наблюдается в утренние часы, после ее накопления в легких в более спокойное ночное время, сопровождается приступами мучительного и болезненного кашля, изнуряющего больного.
Повышение температуры тела считается одним из характерных симптомов острых нагноений легких, но выраженность температурной реакции может быть различной. Высокая температура с гектическими размахами всегда наблюдается в стадии некроза и распада легочной ткани. Когда очаги деструкции начинают дренироваться через бронхи, температура обычно снижается и в дальнейшем определяется условиями дренирования. Быстрая секвестрация некротических участков, их гнойно-гнилостный распад и эвакуация кашлем приводят к стойкому снижению и нормализации температуры. Продолжающийся некроз легочной ткани, формирование множественных или одиночных крупных, а также краевых секвестров, подвергающихся дезинтеграции в условиях микробного обсеменения, обычно сопровождаются выраженной температурной реакцией. Нередко период снижения температуры сменяется резким и стойким ее повышением, что чаще всего связано с появлением новых участков некроза или недостаточной эвакуацией гноя через дренирующие бронхи. При благоприятном течении заболевания и отграничении гнойно-деструктивного процесса улучшение общего состояния, снижение температуры и уменьшение количества мокроты идут параллельно. При прогрессировании патологических изменений в легких, особенно при возникновении новых очагов некроза, уменьшение количества мокроты может сопровождаться повышением температуры тела и ухудшением общего состояния.
После наступления гнойно-гнилостного распада изменяются физикальные признаки. При
149
формировании участков деструкции перкуссией можно определить наличие полости в легочной ткани. Аускультация при начинающемся распаде дает больше информации: стойкие, локализованные в определенных участках влажные хрипы подтверждают распад некротизированных тканей и указывают на расположение очага некроза. Над зоной, соответствующей деструктивному участку, дыхание делается ослабленным, реже — с бронхиальным оттенком. При формировании больших полостей деструкции может прослушиваться дыхание с амфорическим оттенком. При тотальном поражении легкого чаще прослушивается ослабленное бронхиальное или жесткое дыхание. Крупнопузырчатые хрипы выслушиваются при абсцессах легких; при гангрене они не звучны и чаще очень скудны. Отсутствие при аускультации признаков амфорического дыхания объясняется тем, что полости заполнены гнойным содержимым, некротическими тканями, а в окружности их имеются размягченные участки легкого, пропитанные гноем.
Если гной, образовавшийся вследствие лизиса омертвевших и секвестрировавшихся участков легочной ткани, полностью эвакуируется через дренирующие бронхи, остается сухая остаточная полость, по размерам соответствующая омертвевшей части легкого. Это конечная стадия благоприятно протекающего нагноения легких. Сроки образования сухой остаточной полости зависят от влияния многих факторов: состояния больного, проводимого лечения, локализации нагноения и размеров секвестрированных участков легочной ткани. Мелкие секвестры расплавляются быстрее. Гной, скапливающийся в верхних отделах, эвакуируется легче, поэтому сухие остаточные полости как конечные стадии нагноения чаще всего формируются в верхних долях легких, особенно справа.
Когда секвестрируются крупные участки легочной ткани, особенно при нижнедолевой локализации нагноения, процесс нередко принимает затяжное течение с периодическими обострениями и ремиссиями. Крупные секвестры фрагментируются, образуют густой гной и детрит, эвакуация которых через дренирующие бронхи затруднена. В таких случаях некротизированная легочная ткань может в течение многих месяцев выполнять сформировавшуюся полость, не подвергаясь расплавлению.
Легочные секвестры периодически закрывают дренирующие бронхи, вызывая резкое повышение температуры, ознобы, признаки общей интоксикации организма. Такую стадию нагноения можно назвать хронической ограниченной гангреной или хроническим гангренозным абсцессом.
Наиболее характерным клиническим признаком у больных с абсцессом и гангреной легких является интоксикация вследствие резорбции продуктов гнойно-гнилостного распада некротических тканей. Степень интоксикации бывает различной: от незначительно выраженной при хорошо дренируемом абсцессе до тяжелейшей при прогрессирующем течении распространенной гангрены легких. Интоксикация проявляется слабостью и адинамией, анемией и снижением массы тела. Проведенными исследованиями (Лукомский Г. И., 1981] установлено, что при острых абсцессах и гангрене легких вследствие усиленного катаболизма наблюдаются массивные белковые потери, достигающие 11г азота в сутки, что адекватно распаду 275 г мышечной массы. По мнению J. Bartlett, S. Finegold (1974), выраженная анемия и быстрая потеря массы тела являются наиболее характерными признаками распространенной гангрены легких. Наблюдения, проведенные в клинике, в значительной мере подтверждают это положение. Исследование функционального состояния эритрона у больных гангреной легких обнаружило значительное снижение пролиферативной активности эритроидных клеток костного мозга и отчетливое усиление костномозговой деструкции клеток.
Изменения крови у больных нагноениями легких характеризуются также нейтрофильным лейкоцитозом со сдвигом лейкоцитарной формулы влево, токсической зернистостью нейтрофилов. При прогрессирующем течении деструктивного процесса в легочной ткани нередко обнаруживается лимфопения.
Постоянно наблюдаются изменения белкового спектра крови, выражающиеся в гипопротеинемии и, особенно, диспротеинемии со снижением альбуминовых фракций белка, нередко доходящих до критических уровней (менее 35 г/м2).
В тесной связи с нарушениями белкового обмена находятся изменения объема циркулирующей крови и ее компонентов. У большинства больных при показателях объема крови, близких к нормальным,’ выявляется отчетливая тенденция в гиперплазмии как защитной и компенсаторной реакции организма на анемию и интоксикацию. Глобулярный объем в пределах нормальных величин встречается лишь в отдельных случаях. У подавляющего большинства наблюдавшихся больных с абсцессами и гангреной легких отмечается значительное снижение этого показателя, подтверждающее тяжелую анемию, выраженную общую и местную тканевую гипоксию. Прогрессирование деструктивного процесса в легочной ткани, развитие гнойных осложнений в плевральной полости приводят к истощению компенсаторных
150
механизмов и развитию токсико-резорбтивного истощения, для которого характерным является дефицит всех компонентов объема крови.
Нагноительный процесс в легких при острых абсцессах и, особенно, гангрене легких приводит к выраженным функциональным нарушениям систем дыхания и кровообращения. По данным спирографии, как правило, наблюдаются тахипноэ, значительное снижение жизненной емкости легких, снижение максимальной вентиляции легких, резкое (особенно в случаях распространенной гангрены) снижение жизненного показателя. Для большинства больных острыми нагноениями легких весьма характерными являются значительные гемодинамические расстройства. Информативным методом для их выявления является интегральная реография тела по М. И. Тищенко (1973). Особенно резко выражены расстройства гемодинамики у больных гангреной легких, что подтверждается значительно повышенными показателями коэффициента резерва, представляющего отношение фактического минутного объема кровообращения к индивидуальной должной величине в условиях покоя. Значительную напряженность функционирования миокарда при абсцессах и гангрене легких подтверждают постоянно наблюдающаяся тахикардия и повышение коэффициента дыхательных изменений ударного объема, являющегося отношением максимального значения ударного объема крови к минимальному за дыхательный цикл.
Проведенный анализ изменений внешнего дыхания и центральной гемодинамики у больных острыми абсцессами и гангреной легких позволяет высказать предположение, что ведущую роль в патогенезе легочно-сердечной недостаточности играют расстройства в системе внешнего дыхания и легочного газообмена.
Большое значение в последнее время придается изучению активности воспалительного процесса и реактивности организма при острых абсцессах и гангрене легких. М. И. Лыткин исоавт. (1983) обнаружили резкое (в 8—10 раз) повышение активности кислой и щелочной фосфатаз лизосом лейкоцитов крови, достоверно более выраженное у больных гангреной легких, а также значительное снижение у большинства (65 %) из них титров естественных антител сыворотки крови а- и 6-гемагглютининов), что, вероятно, является одной из причин, способствующих возникновению, развитию и распространению острого гнойно-деструктивного процесса в легком.
О большом напряжении механизмов защиты у больных с острыми абсцессами и гангреной легких свидетельствует также значительное возрастание агрегационных свойств крови, воз
можно, из-за ее перегрузки иммунными комплексами, которые можно определить с помощью реакции везикулообразования (РВО), модифицированной в нашей клинике В. И. Печерским. Число всех везикулоподобных элементов у больных с наиболее тяжелой формой острых нагноений легких — гангреной — было увеличено почти в 2 раза; число лейкоцитов, участвующих в РВО, больше, чем у здоровых людей, в 2,8—3,4 раза, а сливных элементов — в 4—5 раз. Одновременно с этим у больных острыми нагноениями легких значительно повышаются агрегационные свойства эритроцитов и тромбоцитов, определяемые микроскопией суспензии эритроцитов в собственной плазме и фотоэлектрометрией [Тулупов А. Н., 1983]. Полученные данные подтверждают необходимость проведения у больных с острыми абсцессами и гангреной легких дезагрегационной и противосвертывающей терапии.
С целью выяснения роли состояния организма в развитии острых нагноений легких в последние годы стали проводиться исследования различных факторов иммунитета больных. Так, исследованиями иммунологической реактивности у больных с острыми абсцессами, осложненными эмпиемой, Б. А. Королев и соавт. (1980) выявили резкое угнетение Т-системы иммунитета, нарушение регуляции В-системы, отсутствие адекватной реакции на циркуляцию стафилококкового антигена, выраженную микробную сенсибилизацию, дисфункцию фагоцитарной системы. С. Н. Захаровым и соавт. (1980) у 52 больных острыми абсцессами и гангреной легких изучена патогенетическая роль аутоагрессии. Авторы нашли, что при этих заболеваниях наблюдается дисбаланс между общими и местными проявлениями иммунитета. Он может проявиться в виде снижения неспецифических иммунных сил организма при высоком напряжении местного иммунитета с преобладанием явлений аутоагрессии с участием про-тиволегочных аутоантител, что сопровождается прогрессированием деструкции легочной ткани. Л. М. Недвецкой (1970), а также Б. П. Федоровым, Г. Л. Воль-Эпштейном (1976) отмечено значительное повышение титра противолегоч-ных антител в сыворотке крови у больных с распространенными деструктивными процессами в легких, что свидетельствует об агрессивности аутоантител и вносит новые элементы в объяснение патогенеза острых легочных нагноений.
Клинико-иммунологические исследования Я. Э. Ламм и соавт. (1983), проведенные у 147 больных с острыми абсцессами легких, обнаружили выраженные изменения иммунологических реакций, проявляющиеся в значительном напряжении гуморального иммунитета (повышение титров основных классов иммуноглобу
151
линов—А, М, G), свидетельствующем о способности организма к иммунокомпетентному ответу. Обнаружено, что высокие титры IgG сохранялись при переходе процесса в хронический. В зависимости от состояния гуморального звена иммунитета С. Н. Захаров и соавт. (1982) выделяют три типа течения острых абсцессе и гангрены легких: гипоергический, нор-моергический и гиперергический, встречающийся чаще всего.
Исследования гуморального иммунитета у наблюдавшихся в нашей клинике больных с острыми абсцессами и гангреной легких по определению титров иммуноглобулинов А, М, G подтвердили литературные данные о наиболее часто встречающемся гиперергическом типе течения заболевания. Это определяет необходимость в назначении таким больным препаратов типа азатиоприна, подавляющих аутоагрессию. Относительная лимфопения, а у больных прогрессирующей гангреной легких — резкая абсолютная лимфопения, требует коррекции назначением стимуляторов лимфопоэза (леака-дин, левамизол и др.).
Специфических нарушений функции почек у больных острыми нагноениями легких нет [Колесников И. С. и др., 1983]. Примерно в 50 % наблюдений может быть отмечена протеинурия, встречающаяся и при других видах гнойной инфекции. Почечная недостаточность чаще развивается при переходе процесса в хроническую фазу или длительном осложненном (эмпиемой, сепсисом) течении острого нагноения.
Определение основных тенденций в течении гнойно-деструктивного процесса (прогрессирование, регрессия или стабилизация) имеет большое практическое значение, так как является определяющим при выборе метода лечения, но практическое решение этой задачи весьма затруднительно, так как нередко намечающаяся было положительная динамика клинических и рентгенологических симптомов сменяется ухудшением состояния больного.
Анализ клинико-рентгенологических исследований у 509 больных с острыми абсцессами легких позволил выявить следующие варианты клинического течения: 1. Регрессирующее течение, характеризующееся удовлетворительным общим состоянием, отсутствием или незначительной выраженностью гнойной интоксикации, нормальной или субфебрильной температурой, наличием полости деструкции в легком с небольшим количеством жидкости и незначительной зоной перифокальной инфильтрации окружающей легочной ткани, что свидетельствовало о хорошей проходимости дренирующих бронхов,— у 27,5 % больных. 2. Непрогрессирующее течение, которому были свойственны отчетливые признаки гнойной интокси
кации, постоянная лихорадка и изменения в крови, а рентгенологически — признаки полости с широким горизонтальным уровнем жидкости и выраженными перифокальными воспалительными изменениями, свидетельствующими о недостаточной проходимости дренирующих бронхов,— у 51,1 % больных. 3. Прогрессирующее течение, характеризовавшееся резкими признаками гнойной интоксикации, дыхательной недостаточности, высокой лихорадкой, выраженными изменениями крови воспалительного характера, а рентгенологически — массивной инфильтрацией легочной ткани с множественными полостями деструкции или без видимой деструкции (так называемые блокированные абсцессы),— у 9,9 % больных. Это — группа больных с нарушенной проходимостью дренирующих бронхов. 4. Группа больных, у которых острый абсцесс легких осложнился пиопневмотораксом,— 11,1 %. Множественные абсцессы были у 14,9 % больных, двусторонние — у 8 %.
Течение гангрены легких отличается большим разнообразием. Предоставленное естественному течению заболевание быстро прогрессирует, развиваются необратимые изменения и истощение защитных сил, вследствие чего летальный исход становится неизбежным вне зависимости от способов лечения.
Из 170 больных гангреной, переведенных в клинику из терапевтических отделений больниц, лишь у 32 (18,8 %) после проведенного там лечения отмечено улучшение общего состояния, но при отсутствии положительной рентгенологической динамики деструктивного процесса. У остальных терапевтическое лечение оказалось неэффективным. Эти данные убедительно показывают необходимость срочного перевода больных в специализированные хирургические стационары, как только диагноз гангрены легких становится очевидным. Все же 24 (16,6 %) больных в силу разных причин переведены в клинику с запущенной гангреной легких. Продолжительность заболевания их до перевода была от 4 до 8 нед. Все эти больные были крайне истощены, и 79 % из них умерли.
Гангрена легких чаще всего (58,6 %) характеризовалась неблагоприятным течением заболевания, нарастанием клинической и рентгенологической симптоматики и развитием осложнений, несмотря на проводимую интенсивную терапию. Стабилизация клинического течения гангрены легких отмечена у 32,5 % больных. Течение заболевания в этих случаях отличалось монотонностью, отсутствием прогрессирующей интоксикации. У этих больных нередко было несоответствие между умеренно выраженной клинической симптоматикой и распространенностью деструктивных изме
152
нений в легких, определяемых на рентгенограммах и томограммах.
Регрессирующее течение гангрены легких отмечено всего лишь у 8,9 % больных. Характерным в клинической картине заболевания у них было не только улучшение клинической симптоматики (снижение температуры, появление аппетита, уменьшение или исчезновение гнойной мокроты, нормализация клинических и биохимических показателей крови), но и положительные рентгенологические изменения, подтверждающие уменьшение и отграничение деструктивных изменений в легких.
Вместе с увеличением общей заболеваемости гангреной легких в последние годы возросло и количество бурно протекающих, молниеносных форм этого заболевания, когда гнойнодеструктивный процесс неуклонно прогрессирует и приводит больных к гибели в первые недели заболевания. Ю. И. Горшков (1976), анализируя течение гангрены легких у 55 больных, отметил следующие характерные особенности: довольно высокий процент «молниеносных» форм (9 %), частые двусторонние поражения (у 12,7 %), большая частота осложнений эмпиемой (53 %) и кровотечением (14,6 %).
Среди наблюдавшихся в клинике больных бурно прогрессирующая форма гангрены легких наблюдалась у 12,7 % больных; 65 % из них умерли.
Осложнения острых легочных нагноений. Наиболее частыми осложнениями легочных нагноений являются пиопневмоторакс, поражения противоположного легкого и легочные кровотечения. Другие осложнения (сепсис, пневмоперикардит, острая почечная недостаточность) встречаются реже.
Частота пиопневмоторакса после острых абсцессов легких составляет, по литературным данным, от 10,6 до 38,5 % [Булынин В. И. и др., 1980; Толузаков В. Л„ Егиазарян В. Ф., 1984, и др.]. Гангрена легких осложняется пио-пневмотораксом значительно чаще — в 18,7— 89 % [Лукомский Г. И., 1975; Горшков Ю. И., 1975; Вагнер Е. А. и др., 1982, и др. |. Такие различия в частоте пиопневмоторакса объясняются различной продолжительностью заболевания, а также элементами субъективизма в трактовке существа нагноительного процесса в легких при определении его как абсцесс или гангрена.
В госпитальной хирургической клинике за последние 12 лет лечились 128 больных с пио-пневмотораксом. В большинстве наблюдений абсцессы и гангрены, осложнившиеся пиопнев-мотораксом, имели аспирационный и постпнев монический генез, о чем косвенно свидетельствует более частая локализация легочных деструктивных очагов в правом легком (58,6 %).
Чаще всего перфорировали в плевральную полость и вызывали пиопневмоторакс гнойно-некротические процессы в нижних долях легких (61,7 %). Причина этого, вероятнее всего, заключается в большей подвижности нижних долей легких при дыхательных экскурсиях, препятствующих образованию спаек и облитерации плевральной полости в базальных отделах, а также в затрудненных условиях опорожнения гнойников нижних долей естественным путем.
Симптомы перфорации гнойников легкого в плевральную полость могут быть различными: от ярко выраженных, указывающих с несомненностью на наличие перфорации, до стертых и совсем незаметных, выявляемых нередко лишь рентгенологически. Острая форма пиопневмоторакса отмечена лишь у 6,5 % наблюдавшихся больных. Анализ анамнестических данных и сопоставление длительности заболевания с рентгенологическими изменениями позволили прийти к заключению, что это осложнение чаще всего развивается на 3-й неделе заболевания (у 76,6 % больных).
Эмпиема плевры при острых абсцессах и гангрене легких, развивающаяся per continuita-tem, встречается значительно реже. Среди 170 больных гангреной легких, наблюдавшихся в нашей клинике, эмпиема плевры была отмечена всего у 3 больных.
Поражение противоположного легкого при острых нагноительных заболеваниях легких возникает довольно часто, но патологический процесс в «здоровом» легком обычно развивается у длительно болеющих, лежачих и ослабленных пациентов. Возникновение в таких случаях контралатеральных пневмоний или абсцессов чаще всего связано с аспирацией гнойной мокроты из пораженного деструктивным про-цесом легкого.
По нашим данным, двусторонние поражения легких при острых абсцессах отмечены у 8 % больных, а при гангрене легких — в 12,2 % случаев. Частота легочных кровотечений у больных с острыми абсцессами составляет 6—12 %. Среди 688 больных с острыми абсцессами, наблюдавшихся Ю. М. Лубенским и соавт. (1980), легочные кровотечения были у 11,3 %. По данным В. И. Астафьева (1980), из 132 больных с осложненным течением острого абсцесса у 39 диагностировано легочное кровотечение (29,6 %).
У больных гангреной легких кровотечение, по данным литературы, встречается чаще, чем при абсцессах легких,— в 10,7—53,1 % [Углов Ф. Г., 1971; Митюк И. И., 1974; Горшков Ю. И., 1975, и др.]. Еще чаще встречается кровохарканье. В. Ф. Егиазарян (1975) наблюдал кровохарканье более чем у половины
153
больных гангреной легких. При кровохарканье основным субстратом, выделяющимся из легкого, является мокрота с примесью того или иного количества крови. Выделение с мокротой крови в количестве более 50 мл можно считать кровотечением, которое бывает малым (до 100 мл), средним (до 500 мл) и обильным (более 500 мл). Массивное легочное кровотечение приводит к острой сосудистой недостаточности, анемии и асфиксии, чаще всего являющейся причиной смерти. Аспирация небольших количеств крови вызывает обтурационные ателектазы и аспирационные пневмонии. Среди наблюдавшихся в госпитальной хирургической клинике больных с острыми абсцессами и гангреной легких легочные кровотечения отмечены соответственно у 7,6 и 4,9 % пациентов.
Симптомы начального сепсиса — «пресепсиса» (высокая с гектическими размахами лихорадка, ознобы и т. п.) часто наблюдаются при острых абсцессах и гангрене легких, но сепсис в виде септицемии или септикопиемии редко выявляется при жизни больных, страдающих этими заболеваниями. На первом месте по частоте стоит поражение головного мозга. Так, по сводным данным И. Е. Мацуева (1952), метастатические абсцессы мозга при сепсисе пневмогенного происхождения наблюдались в 83 %, а из других органов — лишь в 17 % случаев. Из наблюдавшихся в нашей клинике больных с абсцессами легких поражение головного мозга было лишь у 0,7 % , а осложнение гангрены легких сепсисом возникло всего у 2 больных. Основной причиной относительно редкого возникновения сепсиса при острых гнойно-деструктивных поражениях легких являются, по-видимому, относительно более высокий уровень местного тканевого антиинфек-ционного иммунитета при отграниченных процессах и быстрая гибель (до развития сепсиса) при распространенных формах поражений.
Редким, но очень опасным осложнением, которое мы наблюдали всего у 2 больных гангреной легких, является прорыв гнойно-деструктивных очагов легкого в полость перикарда — пневмоперикардит. Клиническая картина пневмоперикардита характеризуется внезапным резким ухудшением состояния, появлением нарастающей подкожной эмфиземы верхней половины туловища, шеи, головы, коллапсом. По характеру морфологических изменений и возникающим гемодинамическим расстройствам это осложнение является, по существу, смертельным. Оба наблюдавшиеся нами больные погибли.
Диагностика и дифференциальная диагностика. Диагноз острого абсцесса или гангрены легких ставят по данным анамнеза, оценки общего состояния организма больного, клинических,
лабораторных, функциональных, иммунологических и рентгенологических методов обследования. В целом ряде случаев по клиническим и рентгенологическим признакам очень трудно отдифференцировать острый абсцесс от гангрены легких. Сопоставления клинического течения заболевания у больных с острыми абсцессами и гангреной легких, проведенные в клинике, показали, что при гангрене легких оно более часто характеризуется прогрессированием и возникновением осложнений, быстрее приводит к выраженному истощению, анемии, значительной легочно-сердечной недостаточности. Однако ни один из перечисленных показателей клинической картины заболевания не может служить тем надежным критерием, с помощью которого можно было бы легко отличить абсцесс от гангрены. Больше данных в этом отношении дают рентгенологические методы исследований, особенно в динамике и сопоставлении с клиническими проявлениями. В том и другом случаях начальным рентгенологическим проявлением заболевания является пневмонический фокус, изначально захватывающий участок легочной ткани в пределах анатомически обособленной части легкого. При остром абсцессе легкого такой частью обычно является сегмент или два сегмента, реже — доля и совсем редко — все легкое, т. е. для острого абсцесса характерно изначальное сегментарное распространение воспаления и последующего некроза. Гангрена легкого как правило, развивается после воспаления, распространяющегося на целую долю, реже — на две доли, и еще реже — на все легкое, т. е. для гангрены легкого характерно изначальное долевое распространение воспаления и последующего некроза.
Типичным рентгенологическим симптомом этой начальной стадии заболевания является гомогенное, по плотности напоминающее жидкость, затенение (рис. 79). В литературе эта стадия заболевания вне зависимости от распространенности поражения называется лобитом, пневмонитом [Bartlett J., Fingold S., 1974], «плотной консолидацией с увеличением доли» [Danner Р., 1974; O’Reilli G., 1978]. Все эти термины не лишены условности. Поскольку патологический процесс в пораженном участке легкого на этой стадии определяется нарушениями бронхиальной проходимости и воспалением, правильнее, как нам кажется, называть эту начальную стадию острого легочного нагноения ателектаз-пневмонией. В случаях ателектаз-пневмонии доли легкого последняя обычно увеличена в объеме, границы ее четко видны. Нередко можно наблюдать провисание главной и поперечной междолевых щелей. На томограммах в этой стадии видна плотная консолидация легочной ткани и отсутствие деструкции.
154
Рис. 79. Ателектаз-пневмония верхней доли левого легкого — начальная стадия гангрены.
а — прямая рентгенограмма; б — боковая рентгенограмма. Плотное гомогенное затенение верхней доли легкого.
С возникновением некроза и распада легочной ткани на рентгенограмме легких появляются мелкие, величиной от 0,2 до 2—3 см в диаметре, участки просветления на фоне гомогенного затенения. Эти участки местами разобщены инфильтрированной легочной тканью, местами сливаются между собой (рис. 80). При прогрессировании распада мелкие полости сливаются между собой, образуя более крупные, с уровнями жидкости или без них (рис. 81). В этой стадии заболевания процессы продолжающегося некроза и распада идут одновременно. Количественное их соотношение зависит от резистентности организма, вирулентности микробной флоры и проводимой терапии.
Бурное прогрессирование некроза может быстро привести к гибели больного. При более благоприятном течении процесс в легком начинает отграничиваться, окончательно локализуясь в пределах пораженной доли или сегментов. Мелкие некротические участки легкого лизируются и откашливаются в виде гнойногнилостной мокроты. Крупные секвестры, для расплавления которых необходимо больше времени, остаются в полости. Они могут быть пристеночными, фиксированными к одной из стенок полости, или свободно перемещающимися в полости распада. Секвестры легочной ткани хорошо видны на рентгенограммах и, особенно, на томограммах. Секвестрация некротических
участков легкого и образование демаркации — следующая стадия благоприятно протекающего острого легочного нагноения (рис. 82). В этот период заболевание чаще всего определяется как гангренозный абсцесс или ограниченная гангрена, имея в виду, что в начале заболевания процесс был распространенным, начавшимся с долевой ателектаз-пневмонии. Распространенная гангрена после сегментарных ателектаз-пневмоний, как правило, не встречается. Если после такой ателектаз-пневмонии некроз и развивается, то, будучи небольшими по объему, некротические участки быстро лизируются, и формируется типичный острый абсцесс легкого (рис. 83). В случаях, когда процессы секвестрации и дезинтеграции омертвевших участков протекают медленно, формируется гангренозный абсцесс (ограниченная гангрена) (рис. 84, 85). Ограниченная гангрена, таким образом, может возникать после воспаления, локализующегося также в пределах анатомически обособленной, но меньшей, чем при распространенной гангрене, части легкого — сегменте, двух сегментах. Гангрена поэтому может быть ограниченной с самого начала, а может быть стадией благоприятно протекающей распространенной гангрены.
Важное место среди рентгенологических методов диагностики острых абсцессов и гангрены легких принадлежит томографии, позво-
155
80
Рис. 80. Прямая рентгенограмма легких того же больного, что на рис. 79.
На фоне инфильтрации видны множественные участки просветления — некроз и распад легочной ткани.
Рис. 81. Прямая рентгенограмма легких того же больного, что на рис. 79.
Прогрессирование процесса. Слияние мелких полостей и образование более крупных участков деструкции.
Рис. 82. Прямая томограмма того же больного, что на рис. 79. Стадия секвестрации омертвевших участков легкого.
Рис. 83. Острый абсцесс нижней доли левого легкого.
а — прямая рентгенограмма; б — боковая рентгенограмма. Видна полость деструкции с горизонтальным уровнем, окруженная перифокальной инфильтрацией.
82
83
156
Рис. 84. Ограниченная гангрена (гангренозный абсцесс) правого легкого.
а — прямая томограмма; б — боковая томограмма.
Рис. 85. Ограниченная гангрена верхней доли правого легкого (препарат).
ляющей определить структуру пораженного участка легкого на различной глубине, проходимость дренирующих бронхов, выявить секвестры. Легочные секвестры не только способствуют переходу процесса в хроническую форму, но аспирация их в более мелкие бронхи здоровых отделов легкого может вызвать нагноение или способствовать возникновению аспирационных гнойников в ранее непораженных участках легочной ткани. Секвестры выявляются на томограммах в 3,5 раза чаще, чем при рентгеноскопии, рентгенографии и на суперэкспонированных снимках, если их величина не менее 0,8 см в диаметре. Секвестры могут быть одиночными и множественными, различной формы и вели-
чины: от мелких обрывков легочной ткани до громадных массивов, соответствующих целой секвестрированной доле (рис. 86). Такие крупные секвестры, заполняя полость деструкции, придают ей на томограмме характерный вид: на фоне округлого затенения у одного из полюсов или на отдельных участках определяются зоны просветления в виде «полумесяца», «серпа» или прерывистого щелевидного сферического ободка. Пристеночные секвестры, а также неот-торгнувшиеся некротические массы рентгенологически проявляются неровностью и бахромчатым выбуханием внутренних контуров полости. Отделившиеся крупные секвестры могут свободно перемещаться в полости деструкции.
157
Рис. 87. Гангрена правого легкого. Прямая томограмма. Видны множественные секвестры легочной ткани.
Рис. 86. Гангрена верхней доли правого легкого. Прямая томограмма.
Видна секвестрация огромного участка легочной ткани.
Мелкие секвестры, представляющие собой крошковидный детрит, определяются по бесформенным просветлениям, образующимся из за скопления воздуха вокруг крошек детрита (рис. 87).
Если омертвевшие участки легкого быстро лизируются, то формируется большая полость, содержащая жидкий гной с горизонтальным уровнем. В этих случаях по рентгенологической картине обычно диагностируется абсцесс легкого, а затем, после его опорожнения через бронхи — большая сухая остаточная полость (рис. 88, 89).
В случаях осложнения острым абсцессом или (реже) гангреной очаговых пневмоний последние начинаются в виде небольших очагов, чаще множественных, реже — одиночных. Иногда воспалительный процесс начинается в бронхе в виде бронхита, а затем переходит на альвеолярную ткань. В других случаях наблюдается бронхогенная инфекция легочной ткани без предшествующего бронхита. Поэтому для острого нагноения, развивающегося на фоне очаговой пневмонии, характерно отсутствие массивного поражения легочной ткани. Множественные очаги некроза могут локализоваться или в пределах одной доли, но они разделены непораженной легочной тканью, или в различных долях легкого.
Важную характеристику функционального состояния пораженного абсцессом или гангреной легкого можно получить с помощью метода сканирования (рис. 90, 91). Анализ полученных в клинике результатов позволил заключить, что в целом имеется соответствие объема поражения легочной ткани, определяемого клинокорентгенологически, зонам пониженного накопления радиоактивного препарата на сканограммах. Отсутствие накопления альбумина 131i в пораженных участках легочной ткани, обнаруженное у всех обследованных больных, подтверждает данные ангиографии о регионарной блокаде легочного кровотока в зоне деструктивных изменений. Отсутствие накопления ингалированного 133Хе в зонах деструкции свидетельствует о тяжелых анатомических повреждениях легочных структур (бронхиолы, альвеолы) , обеспечивающих вентиляцию легких. Сопоставление рентгенологических и сканографических данных показало, что зоны, где не накапливается радиоактивное вещество, несколько больше по объему, чем рентгенологически определяемые области поражения. По-видимому, в участках легочной ткани, непосредственно не пораженных деструктивным процессом, но примыкающих близко к очагам деструкции, имеются выраженные функциональные изме-
158
Рис. 88. Гангрена верхней доли правого легкого в стадии гигантского абсцесса.
Рис. 89. Гангрена верхней доли правого левого легкого в стадии гигантского опорожнившегося абсцесса.
а — прямая рентгенограмма; б — боковая рентгенограмма.
Рис. 91. Гангрена правого легкого. Вентиляционная сканограмма того же больного, что на рис. 90.
Отсутствие вентиляции легкого.
Рис. 90. Гангрена правого легкого. Перфузионная сканограмма.
Почти полное отсутствие кровотока в пораженном легком.
159
нения, заключающиеся в нарушении кровообращения и вентиляции. Это предположение косвенно подтверждается результатами электронно-микроскопического исследования здоровых участков легкого у больных острыми легочными нагноениями. Изучение ультраструктуры и микроциркуляции легкого показало, что нагноительный процесс сопровождается изменениями в отдаленных от деструктивных очагов участках легочной ткани, характеризующимися нарушением альвеолярной и хромосомной структуры, что способствует снижению интенсивности газообмена вследствие замедления микроциркуляции, несмотря на сохраненную вентиляцию легких |Митюк И. И., 1974].
Таким образом, диагностика острого легочного нагноения как такового не сложна. Труднее разграничить отдельные его формы — гангрену, гангренозный абсцесс, гнойный абсцесс, а также своевременно распознать начинающееся нагноение. В этом отношении весьма информативным может быть метод цветной термографии [Иванов Р. В. и др., 1980], основанный на регистрации распространяющихся из очагов гипертермии тепловых потоков. С помощью холестерических термои иди катеров, нанесенных на грудную клетку, выявляется тепловая топография кожного покрова. Участки гипертермии соответствуют воспалению (пневмония, абсцедирование), «холодные» зоны — уже сформировавшимся полостям деструкции. Метод цветной термографии прост, безвреден, бескровен и не требует применения контрастных веществ.
Многообразие клинической и рентгенологической симптоматики острых абсцессов и гангрены легких нередко делает дифференциальную диагностику этих и некоторых других легочных заболеваний весьма трудной. Многочисленные данные литературы свидетельствуют о наиболее частых трудностях дифференциальной диагностики острых нагноений и рака легкого. Среди больных, находившихся на лечении в госпитальной хирургической клинике по поводу абсцессов и гангрены легких, у 12.1 % до поступления в клинику диагностировался рак легкого. В то же время у 3,5 % больных раком легкого заболевание протекало с клинической и рентгенологической симптоматикой острого легочного нагноения.
Решающее значение в дифференциальной диагностике опухолевых и нагноительных заболеваний легких принадлежит эндоскопическим и рентгенологическим методам исследований. При центрально расположенных раках, протекающих с клинической симптоматикой абсцесса или гангрены, сомнения разрешает диагностическая бронхоскопия с последующим гистологическим изучением биоптата. В случаях пери
ферических «полостных» форм рака всегда необходимой оказывается пункционная биопсия с последующей гистологической верификацией диагноза.
В диагностически неясных случаях обсервационная тактика нецелесообразна. У таких больных показана диагностическая торакотомия, после которой для уточнения диагноза и определения в связи с этим объема оперативного вмешательства всегда необходимо вначале удалить и подвергнуть срочному гистологическому исследованию один или несколько подозрительных лимфатических узлов корня легкого.
Большие трудности может представлять дифференциальная диагностика острых абсцессов и гангрены легких с кавернозной и некоторыми другими формами туберкулеза легких. Среди .больных с острыми абсцессами, наблюдавшихся в госпитальной хирургической клинике, 10,7% первоначально госпитализировались во фтизиатрические стационары. Из 170 больных, поступивших в клинику с гангреной легких, фиброзно-кавернозная форма туберкулеза выявлена у 3,4 %.
Клинические проявления неспецифических острых легочных нагноений и специфических туберкулезных поражений во многом очень схожи. Дифференциальная диагностика в таких случаях основывается главным образом на данных динамики патологического процесса в легочной ткани и обнаружении в мокроте микобактерий туберкулеза. Если заболевание протекает с типичной клинической и рентгенологической картиной легочного нагноения, а многократные исследования мокроты, в том числе методом флотации, и промывных вод бронхов микобактерий туберкулеза не выявили, от диагноза туберкулеза можно отказаться. В случаях, когда отсутствует эффект от проводимой терапин острого легочного нагноения, а при рентгенологических исследованиях в динамике выявляется бронхогенная диссеминация и обнаруживаются свежие туберкулезные очаги, следует настойчиво искать бактериологические подтверждения специфичности процесса. Выявление микобактерий туберкулеза разрешает все сомнения. Необходимо, однако, помнить, что и у больных острыми легочными нагноениями в мокроте нередко обнаруживаются трудно-отлнчнмые от микобактерий кислотоупорные палочки. В таких случаях дальнейшая лечебная тактика и организационные вопросы лечения больных решаются совместно с фтизиатром.
Очень сложной в диагностическом отношении является трактовка так называемых сочетанных поражений, при которых неспецифический и специфический процессы существуют одновременно. Варианты сочетанного течения этих заболеваний могут быть различными.
160
Анализ клинического течения заболевания у наблюдавшихся в клинике больных, у которых абсцесс легкого сочетался с туберкулезом, показал, что чаще наблюдалось вторичное присоединение туберкулезного процесса к уже существовавшему острому нагноительному. Реже острый нагноительный процесс наслаивался на ранее существовавший и длительно протекавший без обострений специфический туберкулезный.
Диагностика сочетанных поражений весьма трудна. Определенное значение имеют анамнез заболевания, указания на контакты в прошлом с туберкулезными больными, ранее диагностированный туберкулез легких. Микобактерии туберкулеза в случаях сочетанных поражений обнаружить трудно. Анаэробная микробная флора, которой в последнее время отводится ведущая роль в этиологии острых нагноений легких, приводит к гибели микобактерий туберкулеза.
Тяжесть клинического течения острых нагноений легких, сочетающихся с туберкулезом, плохой прогноз и трудности диагностики часто вынуждают прибегать к резекциям легких и гистологическим исследованиям препарата.
Нередко возникает необходимость дифференцировать абсцессы легких от нагноившихся легочных кист, имеющих врожденное происхождение. Из 63 больных кистами легких, находившихся в госпитальной хирургической клинике, нагноение отмечено в 34, из них 13 пациентов поступили с диагнозом направления «абсцесс легкого».
Инфицирование кисты чаще всего происходит бронхогенным путем. Воспаление, развивающееся в полости кисты, а при повторных обострениях — ив окружающей легочной тканн, приводит к бронхиальной непроходимости, задержке гнойного экссудата и интоксикации, клинически и рентгенологически проявляющейся симптомами, весьма типичными для острого абсцесса легкого. Реже нагноение начинается незаметно, клиническая симптоматика нарастает постепенно. Поскольку, как и при абсцессах легких, течение заболевания при нагноении кисты определяется состоянием проходимости дренирующих бронхов, в клинической картине периоды обострения могут чередоваться с периодами ремиссии. Частота обострений, их продолжительность и клинически выраженные признаки хронической гнойной интоксикации свойственны неблагоприятно текущим хроническим абсцессам легких.
В дифференциальной диагностике нагноившихся кист и абсцессов легкого важное место принадлежит рентгенологическим методам исследования. Полость нагноившейся кисты на рентгенограммах чаще имеет шаровидную или
овальную форму с тонкими ровными стенками. Окружающая кисту легочная паренхима в ранние ст начала нагноения сроки не изменена. Кисты могут быть множественными. В таких случаях рентгенологически определяются кольцевидные тонкостенные полости, наслаивающиеся друг на друга и создающие картину сетчатого рисунка легкого. В диагностике множественных кист большое значение имеет бронхография.
В клинической практике часто приходится дифференцировать острые абсцессы легких от гнойных процессов в плевральной полости (эмпиема и пиопневмоторакс).
Тщательный анализ рентгенологических данных позволяет чаще всего разграничить пиопневмоторакс и абсцесс легкого. Очень широкий горизонтальный уровень (более 8—10 см) в одной из проекций или в двух проекциях, прилегающий вплотную к внутренней поверхности грудной клетки, свидетельствует в пользу пиопневмоторакса. В отличие от абсцесса легкого, стенки деструктивной полости которого и перифокальную воспалительную инфильтрацию можно очертить со всех сторон, в том числе и снизу, при пиопневмотораксе ниже горизонтального уровня обычно определяется зона гомогенного затенения, простирающаяся вниз до диафрагмы, обусловленная скоплением жидкости в плевральной полости. Купол диафрагмы при этом чаще всего не дифференцируется. Иногда отличить внутрилегочную полость от плевральной при пиопневмотораксе можно по форме (при пиопневмотораксе вытянутая в краниокаудальном направлении, а не шаровидная или овальная, как при абсцессе), по толщине стенок полости (более толстая медиальная при пиопневмотораксе, образованная кол-лабированным легким, и одинаковые по толщине при абсцессе).
В случаях, когда легочный гнойник, перфорировавший в плевральную полость, опорожнился не полностью, на рентгенограммах можно заметить два (а иногда и больше) уровня жидкости, находящейся на разной высоте: один, располагающийся в полости абсцесса, и другой, пристеночный, находящийся в плевральной полости.
Особенно трудна, а иногда и вообще невозможна дифференциальная диагностика абсцесса легкого и прорвавшейся в бронхи междолевой эмпиемы плевры. Рентгенологическое исследование, выявляющее расположенный в междолевой щели гнойник, и диагностическая пункция с введением а полость рентгеноконтрастных растворов помогают распознать такую разновидность ограниченной эмпиемы плевры, но не всегда позволяют выявить абсцесс легкого, явившийся ее причиной.
11 Зак. 0517
161
В клинической практике приходится дифференцировать абсцессы легких от нагноившегося эхинококка этого органа. Нагноение при эхинококке легкого может развиваться вокруг эхинококковой кисты, в самой кисте до прорыва ее в бронх и в полости, остающейся в легком после прорыва эхинококковой кисты. Клиническая картина нагноившегося эхинококка легкого (повышение температуры тела, боли в грудной клетке, выделение гнойной мокроты) очень напоминает абсцесс легкого. Обнаружение в мокроте обрывков хитиновой оболочки паразита, наличие эхинококкоза в анамнезе, а также постановка специфических серологических реакций (реакция латекс-агглютинации, реакция непрямой гемагглютинации и аллергической пробы Кацони) помогают установить правильный диагноз. Тень хитиновой оболочки бывает отчетливо видна на рентгенограмме.
С острым абсцедированием может протекать и актиномикоз легких. Описаны истинные актиномикотические абсцессы легких |Осповат В. Л., 1963]. Актиномикоз может присоединиться и к вульгарному нагноительному процессу. Распознавание актиномикоза в таких случаях является трудным. Окончательный диагноз актиномикоза основывается только на данных лабораторных исследований, когда в мокроте обнаруживают Друзы и мицелии гриба. Необходимо иметь в виду, что в мокроте могут обнаруживаться сапрофитные формы актиномицета, в то время как при типичном актиномикозе друзы и мицелии могут отсутствовать вследствие дегенеративных изменений и спонтанного лизиса. Для исключения диагностических ошибок подобные исследования должны выполняться в специализированных микологических лабораториях.
ЛЕЧЕНИЕ
Исходя из главного принципа лечения любого больного — патогенетичности, терапия острых нагноений легких должна строиться по следующим основным направлениям:
1. Максимально полное и по возможности постоянное дренирование гнойных очагов легкого.
2. Лечебное воздействие на микробную флору очагов нагноений.
3. Стимуляция защитных реакций организма.
Предложено много методов, обеспечивающих естественное (через бронхи) или искусственное (наружное с помощью оперативных вмешательств) отведение гноя из очагов деструкции. Успех или неудача любого такого вида лечения зависит в конечном счете от того, насколько быстро и полноценно восстановится естественный дренаж гнойной полости. В слу
чаях острых абсцессов легких, содержащих жидкий гной и мелкие секвестры, этого добиться легче. При гангренозных процессах в легочной ткани, где основным морфологическим субстратом являются крупные омертвевшие участки легкого, консервативных методов лечения, как правило, оказывается недостаточно, и в таких случаях приходится прибегать к оперативным методам лечения. Следовательно, при выборе метода лечения нужно ориентироваться на особенности патологического процесса, определяющие исход заболевания. Такими особенностями, влияющими на течение заболевания, а поэтому и на выбор метода лечения, являются состояние проходимости дренирующих полость гнойника бронхов и наличие в ней некротическик секвестров легочной ткани.
Определяя лечебную тактику при остром абсцессе легкого, целесообразно, исходя из вышеизложенного, выделять следующие группы острых абсцессов легких:
1) с хорошим бронхиальным дренажем;
2) с недостаточным бронхиальным дренажем;
3) с полностью нарушенным бронхиальным дренажем.
Лечение больных, полость абсцесса у которых самостоятельно хорошо дренируется, не составляет трудной задачи. С помощью методов санации трахеобронхиального дерева можно устойчиво поддерживать хорошую проходимость дренирующих бронхов. Консервативное лечение больных с недостаточным бронхиальным дренажем, о чем свидетельствуют сохраняющийся уровень жидкости в полости абсцесса и признаки интоксикации, должно преследовать цели восстановления полноценного бронхиального дренажа. В этих случаях необходимо начинать лечение с методов санации и стремиться к тому, чтобы легочный гнойник опорожнился естественным путем через бронхи. При отсутствии эффекта от такого лечения часто бывает необходимо прибегнуть к одному из способов искусственного наружного дренирования (пункция легочного гнойника, дренирование его с помощью торакоцентеза или пневмотомии). Лечебная тактика по отношению к больным с острыми абсцессами легких, бронхиальный дренаж которых полностью нарушен (блокированные абсцессы), такая же.
Среди предложенных методов консервативного лечения, способствующих оттоку гнойного содержимого из гнойных полостей легкого, постуральный дренаж или дренаж положением является простейшим и наименее обременительным для больного. Выбрать постуральное положение для больного с одиночным абсцессом легкого нетрудно — стандартные положения для постурального дренажа детально разработаны. При гангрене легких поражение чаще
162
иосит долевой характер. Нередко имеется поражение двух долей» всего легкого, а также двусторонние поражения. Поэтому «дренажное» положение в этих случаях должен найти сам больной, которому в доступной форме следует объяснить смысл этой процедуры. Целесообразно принимать дренажное положение как можно чаще и по возможности более продолжительное время, но так, чтобы не вызвать чрезмерного утомления больных мучительным кашлем. Если это возможно, то крайне желательно сохранять дренажное положение и во время сна, для чего приподнимается головной или ножной конец кровати. Постуральный дренаж целесообразно сочетать с дыхательными упражнениями, а также массажем и поколачиванием грудной клетки. Следует особенно настаивать, чтобы постуральный дренаж проводился утром, сразу же после пробуждения, чтобы очистить бронхи от скопившейся за ночь мокроты, и вечером перед сном.
Для улучшения проходимости дренирующих бронхов уже давно применялись ингаляции, интратрахеальные вливания различных лекарственных веществ, а также отхаркивающие средства. Чаще используются распространенные антисептические растворы (фурацилин, солафур и 3 % раствор соды).
Эффективность санации трахеобронхиального дерева у больных легочными нагноениями значительно увеличилась после внедрения в клиническую практику протеолитических ферментов: трипсина, химопсина, эластазы, гиалуронидазы, рибонуклеазы [Злыдников Д. М., 1961; Веремеенко К. Н., 1967; Стручков В. И., Лохвицкий С. В., 1972]. Ферменты при любом способе их введения в трахею и бронхи растворяют мелкие секвестры, гнойные пробки, разжижают мокроту, способствуя более полному механическому удалению гнойного содержимого. Обладая противовоспалительным действием, ферменты приводят к уменьшению воспаления и отека дренирующих бронхов. Наиболее часто применяют трипсин (20—40 мг), химо-псин (30—40 мг) и дезоксирибонуклеазу (2500—5000 ЕД). В указанных количествах ферменты растворяют в 30—40 мл солафура или другого антисептика, после чего они ингалируются или вводятся в трахею с помощью катетера, проведенного через нижний носовой ход.
Последний способ является одним из наиболее эффективных- Интратрахеальная санация может выполняться как врачом, так и специально обученной сестрой.
Если санация трахео-бронхиального дерева с помощью постурального дренажа, ингаляций и интратрахеальных вливаний в течение 3—5 дней оказывается неэффективной и в полости
деструкции сохраняется уровень жидкости, необходимо прибегнуть к более активным инструментальным методам дренирования и санации бронхов и трахеи.
Весьма эффективным является метод сегментарной катетеризации бронхов. Формоустойчивый рентгеноконтрастный управляемый катетер вводится в дренирующий абсцесс сегментарный бронх или непосредственно в полость абсцесса во время поднаркозной бронхоскопии или под местной анестезией трансназально под контролем рентгенотелевидения. Затем производятся отсасывание гнойного содержимого, промывание полости гнойника, заканчивающиеся введением в нее протеолитических ферментов и антибиотиков, после чего катетер удаляется [Углов Ф. Г., Егиазарян В. Ф„ 1976; Перельман М. И. и др., 19801.
Осуществлять сегментарную катетеризацию дренирующих абсцесс бронхов можно используя методику чрескожной катетеризации трахеи. Последнюю можно пунктировать над яремной вырезкой толстой иглой типично по Сель-дингеру. Через иглу в просвет трахеи, а затем сегментарный бронх проводится рентгеноконтрастный катетер, который фиксируется к коже. Катетер может оставаться на месте в течение нескольких суток для многократной санации.
У больных, выделяющих большие количества мокроты, а также при множественных абсцессах и гангрене легких широко используется бронхоскопическая санация, во время которой под визуальным контролем удается максимально аспирировать гнойную мокроту, промыть трахею и бронхи антисептическими растворами. Бронхоскопическая санация является сейчас обязательным элементом комплексного лечения больных абсцессами и гангреной легких.
Если мокроты много, лечебные бронхоскопии целесообразно проводить жестким бронхоскопом, под наркозом, поскольку местной анестезией у таких больных обычно не удается достичь хорошего обезболивания. Весьма удобной является разработанная в нашей клинике методика санационной бронхоскопии под наркозом с искусственной вентиляцией легких инжекционным способом [Костин Э. Д. и др., 1979]. Важно осуществлять аспирацию из трахеобронхиального дерева при пробуждении больного от наркоза и появлении кашля, когда в просвет долевых бронхов и трахеи выделяется гнойный экссудат из сегментарных и субсегментарных бронхов.
Бронхоскопический метод лечения позволяет не только санировать пораженное легкое, но и контролировать эффективность проводимой терапии по визуально определяемой степени интенсивности воспалительных изменений брон
11 *
163
хов. Опыт, накопленный госпитальной хирургической клиникой, свидетельствует, что частоту и количество производимых лечебных бронхоскопий необходимо индивидуализировать в зависимости от состояния больного и динамики клинического течения нагноительного процесса в легком. Обычно число лечебных бронхоскопий не превышает 2 процедур в неделю и 3—5 — за курс лечения.
Лечебное воздействие на микробную флору очагов нагноения в легких осуществляется антибактериальной терапией, эффект которой значительно усиливается, если одновременно используются методы, обеспечивающие адекватное дренирование гнойных полостей. Эффективность антибактериальной терапии значительно возрастает, если удается создать высокую концентрацию лекарственных препаратов непосредственно в очаге нагноения и окружающей легочной ткани. По этой причине практически не назначаются антибиотики внутрь и внутримышечно. Высокую концентрацию антибиотиков в крови можно создать лишь их введением в сосудистое русло.
Внутривенное круглосуточное введение больших доз антибиотиков (пенициллин — до 80 млн. ЕД в сутки, морфоциклин — 1 млн ЕД, олеморфоциклин — 1000 мг, сигмамицин — 1500 мг. метициллин — 10 г, гентамицин — 180 мг, цепорин — 8—10 г и др.) может обеспечить клинический эффект.
Одним из методов, позволяющих длительно поддерживать высокие концентрации лекарственных препаратов в патологически измененных тканях легкого, является регионарная инфузия антибиотиков в легочную артерию. Этот метод для лечения абсцессов легких начал широко применяться во ВНИИ пульмонологии М3 СССР с 1967 г. [Углов Ф. Г. и др., 1968]. Широкому внедрению этого метода, как н родственного ему способа введения антибиотиков в бронхиальные артерии [Озолс А. Я., Михельсон М. О., 1972; Астафьев В. И. и др., 1980J, препятствуют технические сложности практического использования, а также недостаточность их теоретических обоснований. Проведенными в Московском институте антибиотиков исследованиями М. И. Перельмана (1970) установлено, что концентрация антибиотиков в легочной ткани бывает одинаковой как при внутривенном их введении, так и введении в легочную артерию.
Продолжаются поиски оптимальных путей подведения антибиотиков к очагам нагноения и деструкции в легких с целью создания там их максимальной концентрации. Предлагаемый А. В. Алексеенко и соавт. (1980), С. Б. Соколовым и соавт. (1982) для лечения острых абсцессов и абсцедирующих пневмоний метод внутри
тканевого электрофереза основан на принципе электроэлиминации — перемещении в ткань легкого лекарственных препаратов (антибиотиков), циркулирующих в сосудистом русле, воздействием на грудную клетку больного поля постоянного электрического тока.
В последние юды широкое распространение в лечении острых нагноений легких получила антибактериальная терапия в сочетании с димек-сидом. Установлено [Брусиловский Б. М. н др., 1983], что, связываясь с демиксидом несколькими функциональными группами, пенициллин и другие антибиотики удерживаются в очаге поражения более длительно и в более высокой, троекратной концентрации.
Подводя итог изложению вопросов антибактериальной терапии абсцессов и гангрены легких, можно считать, что отказываться от нее, особенно в остром периоде заболевания, нет основания. Однако не следует переоценивать ее возможности. У подавляющего большинства больных с острыми абсцессами и гангреной легких, лечившихся в госпитальной хирургической клинике, антибиотики не применялись. В тех случаях, где лечение антибиотиками было проведено, каких-либо преимуществ такой терапии мы отметить не смогли. К таким же выводам пришли и другие. Так, В. И. Стручков и соавт. (1978) с 1968 г. полностью исключили антибиотики из арсенала лечебных средств у больных с острыми абсцессами и гангреной легких.
Консервативным лечением удается добиться полного или клинического выздоровления практически у всех больных с острыми абсцессами легких с хорошим бронхиальным дренажем в течение 1—2 нед. У больных с острыми абсцессами с недостаточным бронхиальным дренажем такая терапия, как показали наши наблюдения, оказалась эффективной в 81,2 % случаев. Однако ликвидация клинических признаков легочного нагноения наступала даже у излеченных больных медленнее, чем в предыдущей группе, обычно в период 3—4-й недели от начала лечения. Кроме того, у 18,8 % больных различными способами санации добиться выздоровления не удалось, что вынудило прибегнуть к способам наружного искусственного отведения гноя: пункции легочных гиойииков, дренированию с помощью торакоцентеза илн пневмотомии. С этих же методов необходимо начинать лечение больных с острыми блокированными абсцессами.
Пункционный метод лечения острых абсцессов легких является пограничным между терапевтическим и хирургическим. Важное преимущество его заключается в возможности быстрой одномоментной эвакуации жидкого гноя из полости деструкции, промывания ее и введения непосредственно в очаг нагноения
164
лекарственных препаратов. Основным фактором, определяющим лечебный эффект такой процедуры, является уменьшение воспаления в окружающей легочной ткани н дренирующих бронхах, наступающее после аспирации гноя и способствующее восстановлению их проходимости. К недостаткам метода следует отнести невозможность эвакуации густого гноя, детрита и секвестров, необходимость в повторных пункциях, опасность развития осложнений (флегмона мягких тканей грудной стенки, травматический пневмоторакс, воздушная эмболия). Более чем на 1500 пункций, произведенных нами у 213 больных, пневмоторакс наблюдался у 6 больных, флегмона грудной стенки — у 3, воздушная эмболия — у 1 пациента, который умер. По данным Ф. Г. Углова, В. Ф. Егиазаря-на (1976), при проведении 908 пункций осложнения имелись в 0,8 % случаев.
Техника пункции легочного гнойника несложна. Прежде всего необходимо точно локализовать место скопления гноя в легком и обозначить на коже место наиболее близкого прилегания абсцесса к грудной стенке. Это делается при многоосевом рентгеновском просвечивании грудной клетки с врачом, производящим пункцию. При этом ориентируются на уровень жидкости в полости абсцесса, а при его отсутствии — на центр воспалительного инфильтрата.
Свидетельством правильности положения пункционной иглы является получение гноя, который максимально аспирируется, после чего полость обильно промывается каким-либо антисептическим раствором. Процедуру можно завершить введением в полость абсцесса антибиотиков. Для профилактики флегмоны грудной стенки при извлечении иглы целесообразно надеть на нее чистый шприц с заранее заготовленным раствором антибиотиков и инфильтрировать им мягкие ткани по ходу извлечения иглы.
Иногда в процессе пункции и в течение некоторого времени после нее наблюдается умеренное кровохарканье, обычно прекращающееся самостоятельно. Пункции производят ежедневно или через день до восстановления проходимости дренирующих бронхов и исчезновения горизонтального уровня жидкости в полости абсцесса. После этого целесообразно перейти к лечению одним из методов санации бронхиального дерева. При лечении пункциями выздоровели 88,2 % больных из наблюдавшихся в клинике, у которых этот метод был применен.
У больных гангреной легких из-за распространенности и множественности деструкции, наличия некротических участков легочной ткани добиться выздоровления методами санации бронхиального дерева или пункциями, как правило, не удается. Однако, как показал опыт
нашей клиники, лечение большинства больных гангреной легких необходимо начинать с консервативного, в основу которого должны быть положены принципы интенсивной терапии.
Объем и продолжительность консервативного лечения у больных гангреной зависят от тяжести состояния больного и динамики патологического процесса. Показания к консервативному лечению как основному и часто единственному виду терапии:
— запущенные формы гангрены легких с выраженной легочно-сердечной недостаточностью и двусторонним поражением, когда резекция легких противопоказана;
— трансформация гангренозного абсцесса в обычный адекватно дренируемый острый абсцесс;
— неосложненная гангрена легких с отчетливой благоприятной клинико-рентгенологической динамикой заболевания на фоне проводимого лечения.
В остальных случаях гангрены легкого интенсивная терапия должна рассматриваться как составная часть предоперационной подготовки больного к хирургическому лечению, наиболее эффективным видом которого является резекция легких.
Гангрена легких, осложненная кровотечением или повторяющимся кровохарканьем, является показанием к срочному оперативному вмешательству (резекции легкого). Во всех остальных случаях резекции должны выполняться после консервативного лечения и интенсивной терапии на протяжении не менее 7—10 сут. Этот срок может быть сокращен у больных бурно прогрессирующей гангреной легких.
Существенной частью интенсивной терапии больных гангреной легких является инфузионная терапия с целью парентерального питания, коррекции волемических нарушений, улучшения реологических свойств крови, поддержания энергетического баланса и дезинтоксикации.
Необходимое для введения количество энергетических и питательных растворов определяется индивидуально для каждого больного в зависимости от массы тела, величины потерь белка, воды и электролитов, динамики патологического процесса в легких. Парентеральное питание у больных гангреной и осложненными абсцессами легких проводили по программе, разработанной в клинике для оперированных по поводу рака и хронических нагноительных заболеваний легких [Шанин Ю. Н., Костюченко А. Л., 1975] - Поддержание энергетического баланса при этом обеспечивается введением концентрированных (25—40 %) растворов глюкозы в дозе от 1 до 2 л/сут, а также чистого 96 % этилового спирта в дозе до 100 мл/сут в виде слабых растворов.
165
Восполнение белковых потерь чаще всего осуществляется с помощью белкового гидролизата аминопептнда, который вводится в смеси с концентрированной глюкозой. Доза аминопептида подбирается с таким расчетом, чтобы обеспечить не менее 40—50 % потребности в белках (аминокислотах), т. е. 0,9—1,2 л/сут. Вспомогательное парентеральное питание должно обеспечить поступление в организм больного не менее 7—10 г азота и 1500—2000 ккал/сут.
Усвоение вводимого азота повышается при одновременном введении анаболических гормонов (неробол, ретаболил) и витаминов, особенно группы В и С.
При гангренах и неблагоприятно протекающих абсцессах легких высокая протеолитическая активность сыворотки крови, обычно сочетающаяся с общей гиперферментемией, усугубляет воздействие интоксикации и определяет необходимость применения ингибиторов протеолиза: контрикала в дозе до 80 тыс. ЕД/сут или гордокса в дозе 200—300 тыс. ЕД/сут, которые вводятся в течение 5—7 дней.
Для дезинтоксикации и улучшения реологических свойств крови, улучшения капиллярного кровообращения применяют инфузии гемодеза и реополиглюкина. Доза гемодеза — 2—5 мл/кг массы тела 2 раза в неделю. Оправдано применение больным с абсцессами и гангреной легких внутривенных вливаний 1 % раствора хлористого кальция по 300—400 мл 2 раза в неделю. Этот препарат обладает противовоспалительным действием, понижает всасывающую способность капилляров, способствует нормализации функции почек.
В коррекции гипопротеинемии и анемии важная роль принадлежит гемотрансфузиям, производимым 1—2 раза в неделю. Предпочтительнее переливать свежецитратную кровь, которая не только корригирует гиповолемию н гипопротеинемию, но и уменьшает гипоксию тканей.
Для профилактики и лечения легочно-сердечной недостаточности у больных с острыми абсцессами и гангреной легких обычно применяются коргликон, строфантин и эуфиллин. Используются также кордиамин и камфорное масло.
Развитие острого гнойно-деструктивного процесса в легочной ткани на фоне сниженной реактивности организма определяет необходимость проведения у таких больных терапии, способствующей повышению специфической и неспецифической иммунореактивности. Для этих целей используют стафилококковый бактериофаг (ежедневные или через день внутримышечные инъекции в возрастающей дозировке — 0,5—1 — 1,5—2 — 2,5 мл), стафилококковый анатоксин (подкожно в возрастающей дозировке 0,1—0,3—0,6—0,8—1 мл и т. д. до 2 мл
с интервалами между введениями 3 дня), анти-стафилококковый полиглобулин внутримышечно по 9 мл в течение 3 дней, а также препараты неспецифической иммунизации — гаммаглобу-лин внутримышечно из расчета 0,2 мл/кг массы тела 1 раз в 2 нед. Для стимуляции лейкопоэза и лейкоцитоза назначают пентоксил, лимфопоэза — леакадин. Н. Б. Егорова и соавт. (1983) для лечения больных с острыми абсцессами легких применили вакцину, состоящую из антигенных комплексов клебсиеллы, протея, кишечной палочки и стафилококка. Вакцинация способствовала улучшению состояния и сопровождалась ростом титров гемагглютининов ко всем антигенам, входящим в комплекс. В качестве эффективных иммуностимуляторов могут быть использованы диуцифон, бактериофаги [Ермаков Е. В. и др., 1983]. По данным В. И. Стручкова и Л. М. Недвецкой (1983), в группе больных, где в комплекс лечения была включена пассивная и активная иммунизация, полное выздоровление наступило у 32,7 %, клиническое — у 61,3 %, процесс перешел в хроническую форму — в 6 % случаев. У больных, лечившихся только антибиотиками, результаты намного хуже: 18,8 %; 43,4 %; 33,7 % соответственно.
Больным с абсцессами и гангреной легких показана симптоматическая терапия. Применение наркотических анальгетиков (пантопон, морфин) с целью снятия болевых ощущений нецелесообразно из-за резкого угнетения ими дыхательного центра и кашлевого рефлекса. Для этого чаще используют ненаркотические анальгетики (50 % раствор анальгина внутримышечно). Применяют также жаропонижающие средства, препараты, нормализующие сон, повышающие аппетит, снимающие раздражительность.
Выраженная гипоксия паренхиматозного и циркуляторного происхождения является одной из главных причин тяжелого состояния больных с абсцессами и. особенно, гангреной легких, а также одним из основных противопоказаний к оперативному лечению гангрены легких. Она занимает ведущее место в структуре причин летальных исходов после резекций. В госпитальной хирургической клинике, в течение многих лет занимающейся разработкой проблемы лечения нагноительных заболеваний легких, это обстоятельство определило необходимость поиска более эффективных, чем обычная оксигенотерапия, методов борьбы с гипоксией. Данные, полученные в эксперименте и в клинической практике, показали [Лыткин М. И. и др., 19821, что гипербарическая оксигенация в определенных режимах безопасна у больных с острыми абсцессами и гангреной легких в отношении развития баротравмы
166
легких (даже при отсутствии наружного дренирования полости) и не нарушает механизмов, обеспечивающих газообмен в функционирующей зоне легочной паренхимы. Обеспечивая восстановление кислородного режима организма во время сеанса, она изменяет метаболический фон, на котором развивается острый нагноитель-ный процесс, стабилизирует жизненно важные функции, повышает возможности механизмов естественной детоксикации и переводит организм на наиболее экономичный режим использования энергетических ресурсов. Клинический эффект был достигнут у 72 % больных с острыми абсцессами и гангреной легких, у которых она применялась.
Вопрос о выборе хирургического метода лечения острых нагноений легких встает всякий раз, когда консервативная терапия, с которой всегда начинается лечение, оказывается неэффективной. Нередко этот вопрос возникает значительно раньше, сразу же после поступления больного в хирургический стационар, особенно в случаях бурно прогрессирующего и осложненного течения заболевания.
Применяющиеся методы хирургического лечения острых абсцессов и гангрены легких делятся на две группы: дренирование и резекции. Дренировать гнойно-деструктивные полости в легких можно или менее травматичным и щадящим способом — с помощью торако-центеза и дренажной трубки, или более травматичным — торакотомией и пневмотомией. Каждый из способов оперативного дренирования имеет свои преимущества и недостатки. Операции как дренирования, так и резекции предпринимаются с одной целью — обеспечить быстрое и по возможности максимально полное освобождение больного от гноя и омертвевших участков легочной ткани. Если последние преобладают, задача полнее решается резекцией пораженного участка легочной ткани или всего легкого. Резекция легкого, однако, является весьма травматичным оперативным вмешательством. Дренирующие операции менее продолжительны и намного менее травматичны. Они переносимы даже тяжелобольными. Однако положительный эффект их менее выражен, особенно у больных, у которых имеются множественные полости деструкции и некротические ткани, часто еще не отторгнувшиеся, которые вскрыть и дренировать полностью обычно не удается.
Относительная простота и безопасность, но меньшая эффективность дренирующих операций, технически большая сложность, травматичность и риск, но более высокая эффективность резекций и определяют трудности, с которыми сталкивается хирург, выбирая оптимальный метод хирургического лечения у каждого конкретного больного.
Щадящую методику дренирования патологических полостей в легких путем введения дренажа через троакар у больных с абсцессами и гангреной легких впервые в нашей стране разработал и начал использовать в госпитальной хирургической клинике академии Л. С. Лес-ницкий (1968).
Показания к использованию торакоцентеза для дренирования острых абсцессов легких возникают у больных, у которых обычные методы санации бронхиального дерева или пункции легочных гнойников не позволяют в течение 1—2 нед. добиться хорошего опорожнения абсцессов через дренирующие бронхи. Опыт клиники в применении этого метода показывает, что он может быть с успехом использован как при множественных абсцессах в одном легком, так и у больных с абсцессами в обоих легких. При этом каждый гнойник дренируется отдельно либо одномоментно, либо с интервалом между операциями в несколько дней.
Анализ результатов лечения гангрены легких методом дренирования торакоцентезом показал, что в качестве самостоятельного он может применяться лишь у больных с конечными стадиями гангрены, т. е. с большими деструктивными полостями, содержащими жидкий гной или мелкие секвестры. В последних случаях целесообразно введение через дренаж ферментов для ускорения лизиса омертвевших участков легочной ткани. Дренирование торакоцентезом может быть использовано у тех больных гангреной легких, у которых резекции и даже пневмотомия представляют большой риск. Использование дренирования торакоцентезом для подготовки к резекции малооправданно из-за опасности осложнений и формирования торакального свища, для устранения которого необходимо дополнительное, хотя и небольшое, но нежелательное в условиях острой гнойной инфекции оперативное вмешательство.
Техника дренирования торакоцентезом проста, но требует определенных навыков и опыта. Вначале длинной толстой иглой производятся пункция гнойника и аспирация гноя. Далее определяют глубину, на которую нужно ввести троакар. Это можно сделать с помощью второй иглы такого же размера, как и введенная в полость, по разнице их длины.
Рядом с иглой производится разрез кожи и поверхностной фасции длиной около 1,5 см, через который по игле в межреберье и легкое вводится троакар. Через трубку троакара в полость гнойника проводится дренаж- Показателем успешного дренирования служат свободный отток гноя или отхождение воздуха через дренажную трубку. Кожная рана ушивается швами, концы которых завязываются и фиксируют дренажную трубку.
167
Рис. 92. Гангрена верхней доли правого легкого в стадии гигантского абсцесса, полость которого дренирована посредством торакоцентем.
Рис. 93. Рентгенограмма того же больного, что на рис. 92. Большая сухая остаточная полость в верхней доле правого легкого. на дне которой ви 1на дренажная трубка.
После дренирования местоположение дренажа контролируется рентгеноскопией. Для оценки формы и размеров гнойника, а также состояния проходимости дренирующих бронхов через дренаж вводится водорастворимое контрастное вещество (кардиотраст, диодон) в количестве 10—20 мл. Эти данные нужны для суждения об особенностях патологических изме
нений и их динамики при контрольных исследованиях в процессе лечения (рис. 92, 93). Рентгеноскопия сразу после дренирования необходима и для своевременной диагностики пневмоторакса, являющегося наиболее частым осложнением этого ме года дренирования.
Чтобы обеспечить постоянное отхождение гноя через дренаж, последний можно оставлять открытым под толстой ватно-марлевой повязкой, впитывающей гной, или соединять с другой дренажной трубкой, опущенной под воду, по Бюлау — Петрову. Можно использовать и вакуумное дренирование с разрежением, не превышающим 20—30 см вод. ст. Более высокая степень разрежения в деструктивной полости может спровоцировать аррозионное кровотечение.
При промывании полости через дренаж необходимо соблюдать ряд правил: количество одномоментно вводимого через дренаж раствора зависит от размеров полости, но, как правило, при первых промываниях не должно превышать 10—30 мл. Раствор следует вводить под очень малым давлением, он должен поступать в полость свободно. По реакции больного на введение первой порции раствора можно судить о степени проходимости дренирующих гнойник бронхов: если они проходимы, сразу же откашливаются гнойная мокрота и вводимый раствор. Если бронхи непроходимы, введенный раствор вместе с гноем оттекает только через дренаж. Промывать полость нужно до тех пор, пока последние порции оттекающего через дренаж раствора не станут прозрачными, не содержащими детрита и фибринных пленок. Если в течение 5—7 дней такой санации уменьшается количество гнойного отделяемого по дренажу и изменяется его характер, уменьшается количество и изменяется характер мокроты (нередко вначале зловонная и густая, она постепенно становится более жидкой, слизистогнойной, а затем слизистой без запаха), снижается температура и улучшается общее состояние больного, то дренирование торакоценте-зом можно считать эффективным. Дренаж может быть удален, как только нормализуются температура и картина крови, прекратится отделение гнойной мокроты и гноя через дренаж, а рентгенологическим исследованием будут установлены исчезновение воспалительной инфильтрации в окружности полости, уменьшение ее размеров при отсутствии в ней горизонтального уровня жидкости. Весьма интересным и перспективным является метод лечения острых и гангренозных абсцессов, предложенный М. Л. Шулутко и Г. Л. Некрич (1983), являющийся усовершенствованным способом тора-коцентеза и дренирования. После торакоцен-теза через троакар выполняется торакоабсцес-соскопия с помощью стержня-носителя с теле-
168
скопом и манипулятором для дробления и удаления секвестров, коагуляции мелких сосудов и обработки стенок полости. По эффективности эта процедура близка к пневмотомии, однако не усугубляет тяжести функциональных расстройств и не сопровождается развитием брон-хоплевроторакального свища.
Метод дренирования торакоцентезом был использован нами у 80 больных с острыми абсцессами и 27 больных гангреной легких У 10 больных первой группы полость абсцесса зажила к моменту их выписки из клиники. 70 больных выписались без клинических признаков легочного нагноения с сухими остаточными полостями: у 29 из них полости в последующем исчезли, у 39 они остались стойкими, но без признаков рецидива нагноительного процесса; 2 пациента вернулись в клинику с обострением нагноительного процесса. Результаты лечения дренированием с помощью торакоцентеза больных гангреной легких намного хуже. Из 27 больных у 20 дальнейшее течение заболевания потребовало изменения лечебной тактики: 10 пациентам была сделана пневмотомия, у остальных 10 произведена резекция легкого. Только у 7 больных гангреной легких в стадии гигантского абсцесса дренирование торакоцентезом было окончательным методом лечения и оказалось эффективным. Причины неудач применения этого метода при гангрене легких чаще всего заключались в прогрессировании гангрены, наличии множественных полостей распада и крупных секвестров легочной ткани. Упорствовать в лечении больных гангреной таким дренированием очень опасно, так как процесс в легком может прогрессировать довольно быстро и наиболее благоприятный момент для выполнения резекции легкого окажется упущенным.
Остаточная полость, представляющая собой один из вариантов эволюции острых абсцессов легких, встречается очень часто — у 25—85 % больных (Дубенский Ю. М. и др., 1980; Мустафин Д. Г., 1980]. Мнение о том, что остаточная полость ввиду потенциальной угрозы развития хронического нагноительного процесса является показанием к радикальной операции, не подтвердилось временем. Общепризнанной сейчас является точка зрения, согласно которой остаточные полости подлежат динамическому наблюдению, а к оперативному лечению необходимо прибегать лишь в случаях обострения нагноительного процесса или возникновения повторяющихся кровохарканий или кровотечения. Среди 374 больных, лечившихся в госпитальной хирургической клинике консервативно, 68,5 % были выписаны с сухой остаточной полостью, которая у большинства из них (78,8 %) ликвидировалась после выписки в течение 2— 12 мес. Лишь у 3,4 % больных через I1/?—5 мес
после выписки наблюдался рецидив нагнон-тельного процесса, и они были подвергнуты оперативному лечению. У 17,8 % больных остаточные полости стали стойкими и при сроках наблюдения от 1 года до 10 лет оставались бессимптомными. Скорее всего произошла эпите-лизация внутренней поверхности этих полостей из устьев дренирующих бронхов, и они превратились в кистоподобные образования.
К дренирующим операциям при острых нагноениях легких относится и пневмотомия. В настоящее время пневмотомия является операцией выбора при гангренозных абсцессах легких с крупными секвестрами в деструктивных полостях, а также в запущенных случаях абсцессов и гангрен, где консервативное лечение бесперспективно, а резекции противопоказаны.
Клиника располагает опытом применения пневмотомии у 42 больных с острыми абсцессами и 25 пациентов — гангреной легких. Умерли соответственно 6 и 28 % оперированных больных. Выписано из клиники после пневмотомии 85 % больных. Казалось бы, результат хороший. И это в действительности так, если оценивать его с точки зрения сохраненной больному жизни. Но больной, вернувшийся к жизни, стремится к тому, чтобы она была полноценной. А этому мешают осложнения, с большим постоянством возникающие после пневмотомии н омрачающие ее непосредственный хороший результат. Так, лишь у 3 больных, которым были вскрыты небольшие полости деструкции, бронхокожный свищ закрылся в стационаре и в дальнейшем обострений нагноительного процесса не было. Все остальные выписаны со стойкими бронхоплеврокожными свищами.
Наличие стойких торакальных свищей и необходимость в постоянном амбулаторном лечении вынуждают больных, перенесших пневмотомию, настаивать на повторных оперативных вмешательствах. Ликвидировать свищ, не прибегая при этом к резекции части легкого, в которой локализуется полость, или всего легкого, очень трудно. Мы безуспешно пытались это сделать у 3 больных.
Более надежным способом ликвидации свища после пневмотомии является резекция части легкого, несущей свищ, или всего легкого. Однако на эту травматичную операцию и больному, и хирургу решиться не всегда просто. В сроки от 5 мес до 1'/2 лет мы выполнили 5 таких операций: две пневмонэктомии и две правосторонние нижние билобэктомии, правостороннюю верхнюю лобэктомию. Больные выздоровели.
Другим осложнением пневмотомии является аррозивное кровотечение, наблюдавшееся нами у 3 больных и явившееся причиной смерти у одного из них. Двое других подверглись резекциям легких по этому поводу.
169
Наш опыт резекций легких у больных, которым в прошлом производилась пневмотомия, еще невелик. Однако он показал, что в области торакального свища всегда имеются обширные плотные сращения, затрудняющие вскрытие плевральной полости и выделение легкого. Выделение же и обработка элементов корня легкого бывают чаще всего технически даже более простыми, чем в острой фазе абсцесса или гангрены легких, так как пневмотомия, обеспечивая хорошее дренирование гноя, способствует уменьшению перифокального воспаления и лимфаденита в корне легкого. Поэтому для закрытия броихокожных свищей, а также в случаях аррозивных кровотечений следует, если позволяет состояние больного, чаще прибегать к резекции легкого.
Тяжелым, но, к счастью, редким осложнением пневмотомии у больных с абсцессами и гангреной легких является флегмона грудной стенки. В литературе имеются лишь единичные сообщения об этом осложнении [Логвиненко П. И., 1954). Мы встретились с ним у 2 больных, которые погибли. Чтобы предупредить распространение нагноения на мышцы грудной стенки, целесообразно изолировать их, сшивая края рассеченной кожи с поверхностной фасцией или париетальной швартой.
Необходимость резекций легких у больных гангреной не вызывает сомнений. Однако единодушия взглядов нет, когда речь заходит о показаниях к резекциям легких у больных с острыми абсцессами. У же говорилось о том, что подавляющее большинство больных с острыми абсцессами легких излечиваются консервативными методами или оперативным дренированием. Следовательно, на долю резекций легких остается та небольшая часть больных с острыми абсцессами легких, у которых перечисленные методы лечения в конце концов оказались неэффективными.
В связи с этим встает очень важный вопрос о критериях эффективности консервативного лечения и сроках, в течение которых затянувшееся легочное нагноение может считаться хроническим и поэтому подлежащим радикальному хирургическому лечению. Сухая остаточная полость как ближайший благоприятный исход острых абсцессов легких большинством хирургов не рассматривается показанием к резекции. В этом убеждает и многолетний опыт госпитальной хирургической клиники.
При трактовке нагноительного процесса в легких как острого или хронического нужно ориентироваться не столько на временные сроки существования патологического процесса в легочной ткани, сколько на клинические проявления его, общую направленность течения заболевания, функциональные изменения органов
и систем. При неблагоприятном течении острого абсцесса легкого важное значение имеет комплексная оценка клинических и рентгенологических данных. Трактовка последних должна проводиться строго дифференцированно и обязательно в динамике. Так, длительное существование сформировавшейся после острого абсцесса сухой остаточной полости, даже очень большой, но протекающей бессимптомно, допускает возможность дальнейшего активного наблюдения за больным. Невозможность купировать острый нагноительиый процесс в легком консервативным лечением или оперативным дренированием, прогрессирование заболевания по клиническим и рентгенологическим данным, множественный характер поражения, повторяющиеся кровохарканья или кровотечение, сохраняющаяся вокруг полости деструкции перифокальная инфильтрация или уровень жидкости в полости, рецидив нагноительного процесса в сухой остаточной полости в любые сроки определяют необходимость в оперативном лечении — резекции легкого.
Целесообразность ранних (в сроки от 3 до 6 нед от начала заболевания) резекций легких при острых абсцессах [Чернобровый Н. П. и др.. 1970; Воронов А. А. и др., 1983] не подтверждается анализом наших наблюдений. Использование ранних резекций у больных с острыми абсцессами легких принесет больше вреда, чем пользы. Любые резекции, выполняемые в остром периоде заболевания, являются операциями повышенного риска. Частое их применение сопряжено с реальной опасностью роста летальности и будет дискредитировать идею радикальных вмешательств среди врачей и больных. Кроме того, ориентация на ранние резекции у больных с острыми абсцессами легких препятствует своевременному использованию оперативного дренирования легочных гнойников, т. е. более щадящего и безопасного метода, позволяющего излечить большую часть больных, у которых консервативное лечение оказалось неэффективным.
Однако наряду с этим не подлежит сомнению, что полный отказ от резекций в острой фазе был бы неправильным. Бурное прогрессирование заболевания или массивное легочное кровотечение уже в ранние сроки делают очевидной бесперспективность самой энергичной консервативной терапии или щадящих вмешательств. По данным П. М. Кузюковича (1978), среди 353 больных с острыми абсцессами легких необходимость в радикальных операциях в остром периоде заболевания возникла только у 3 % лечившихся пациентов.
Показания к ранним резекциям у таких больных расширяются при подозрении на новообразование.
170
Уже первый опыт использования резекций легких при гангрене поставил на повестку дня несколько важных практических вопросов, а именно: выбор оптимального срока резекции, а также целесообразность (если да, то продолжительность) предоперационной подготовки. Успешно выполненные ранние резекции, в том числе и по поводу гангрен, осложненных кровотечением, вселяли оптимизм и уверенность в оправданности резекции в ближайшие дни после установления диагноза гангрены легких [Амосов Н. М., 1958; Пастухов Н. А., 1975]. Неудачи, которых не удалось избежать ни одному из хирургов, оперировавших больных гангреной, заставляли смотреть на резекцию легких при гангрене как иа операцию необходимую, но возможную лишь после стабилизации состояния больного с помощью консервативной терапии [Вагнер Е. А. и др., 1971; Даниленко М. В. и др., 1974, н др.].
Мнение о необходимости радикального хирургического вмешательства при распространенной гангрене легких становится в настоящее время господствующим среди хирургов. Что касается тактики при запущенных формах гангрены легких и ограниченной гангрене (гангренозном абсцессе), то точки зрения по этому вопросу довольно разноречивы. При ограниченных формах гангрены легких предлагаются ранние резекции [Цыбырнэ К. А., 1982], дренирование тора-коцентезом [Кузюкович П. М., 1978 [.
Опыт лечения гангрены легких резекциями, накопленный в последние годы, особого оптимизма, однако, не вызывает. Смертность продолжает оставаться высокой — от 27 до 70 % |Григорян А. В. и др., 1980; Цыбырнэ К. А. и др., 1980; Вагнер Е. А. и др., 1980, и др.|. Поэтому продолжается поиск наименее травматичных и наиболее надежных способов лечения. Так, А. Н. Кабанов и Л. А. Ситко (1980), К. Н. Сазонов и др. (1984) предлагают придерживаться тактики ран
них паллиативных вмешательств (пневмотомии, торакотомии), поэтапных, после стабилизации состояния, радикальных вмешательств, бронхологических методов санации и интенсивной терапии. Такая тактика лечения у 48 больных позволила им снизить летальность до 23 %. У больных гангреной легких, находящихся в тяжелом состоянии, риск резекции у которых очень велик, предлагается трансперикардиальная окклюзия бронха на стороне поражения и перевязка легочных очагов деструкции [Цыбырнэ К. А. и др., 1982]. Такая операция предупреждает кровотечение и аспирацию гноя в противоположное легкое. В последующем, когда состояние больного стабилизируется, может быть выполнено радикальное вмешательство. Легкое может быть оставлено и in situ, как биологическая пломба.
Опыт клиники госпитальной хирургии, охватывающий наблюдения за 170 больными гангреной легких, 110 из которых подверглись резекциям, позволил прийти к выводу, что лишь гангрена легких, осложненная кровотечением или повторяющимся обильным кровохарканьем, является показанием к срочной резекции. Во всех остальных случаях резекции должны выполняться после консервативной терапин и интенсивного лечения на протяжении не менее 7—10 сут. Этот срок может быть даже сокращен у больных с бурно прогрессирующей формой заболевания. Гангрена легких, осложненная пиопневмото-раксом или эмпиемой плевры, не является противопоказанием для резекции.
Среди 144 больных гангреной легких, подвергшихся в госпитальной хирургической клинике различным методам хирургического лечения, общая летальность составила 26,3%. Летальность после резекций легких составила 27,2%, после пневмотомии — 26,9% и после дренирования торакоцентезом — 12,5%. Среди всех 170 больных, в том числе и лечившихся консервативно, умерли 49 (28,8%).
Г лава /
ХРОНИЧЕСКИЕ АБСЦЕССЫ ЛЕГКИХ
Острый абсцесс легкого в ряде случаев не заканчивается выздоровлением, не наступает своевременного адекватного его дренирования, и течение заболевания затягивается. Некоторые авторы выделяют в таких случаях подострые абсцессы легких, характеризующиеся вялотекущим течением, когда имеются незначительные сдвиги к улучшению в определенные моменты времени. Выздоровление, однако, не наступает, и в конечном итоге болезнь принимает хронический характер с типичными ремиссиями и обострениями.
ПУТИ РАЗВИТИЯ
ХРОНИЧЕСКИХ АБСЦЕССОВ
ЛЕГКИХ
Трансформацию острого абсцесса в хронический определить подчас очень трудно, а иногда и невозможно. Существующие морфологические критерии не могут, к сожалению, использоваться в клинической практике. Общепринятый календарный срок — 4—6 нед. (по некоторым данным — 3—4 нед.) часто не является верным, так как не отражает всегда существо морфологических изменений, большая вариабельность которых определяется особенностями клинического течения заболевания у каждого конкретного больного.
Если при остром абсцессе легких основным морфологическим признаком является полость с гноем, стенки которой состоят из самой легочной ткани, то при хроническом абсцессе они образованы соединительной тканью. По данным И. К. Есиповой (1952), образование соединительнотканной капсулы можно отметить к исходу 6—8-й недели от начала болезни. Образовавшаяся капсула утолщается за счет разрастающейся соединительной ткани. Она делается ригидной. Уплотняется также легочная ткань вокруг полости деструкции. Продолжающийси нагноительный процесс в полости абсцесса и сочетанный воспалительный в окружающей паренхиме взаимно поддерживают друг друга.
Постепенно происходит гнойная инфильтрация окружающей хронический гнойник легочной ткани. В окружности его могут возникать вторичные гнойники, что ведет к распространению гнойного процесса на ранее не пораженные участки легкого. Вскрываясь в бронхиальное дерево, множественные гнойники способствуют генерализации процесса по бронхам. Развиваются диффузный бронхит, панбронхит и перибронхит. Нагноительный процесс начинает распространяться и по бронхам, стенки которых перерождаются, теряют свою эластичность. Нарушение перистальтики бронхов, закупорка их просвета гноем приводят к образованию очаговых ателектазов и вторичных бронхоэктазий.
Возникает типичный хронический нагноительный процесс в легком, основными компонентами которого являются плохо дренируемый хронический абсцесс, периферично расположенные вторичные бронхоэктазии, а также разнообразные изменения легочной ткани в виде выраженного склероза, деформации бронхов, бронхита и др. При этой форме поражения весь деструктивный комплекс локализован участком легочной ткани, в центре которого находится основной очаг — первичный хронический абсцесс легкого.
В результате длительного течения хронического нагноительного процесса образуется своеобразный порочный круг, когда возможностей для спонтанного заживления и разрешения заболевания практически не остается. Усиливающиеся процессы пневмосклероза ведут к нарушению трофнки легочной ткани, что усугубляет течение заболевания и способствует непрекра-шающемуся воспалительному процессу, который, в свою очередь, является причиной дальнейшего развития и распространения деструктивных изменений.
Большое практическое значение представляет изучение причин перехода острого абсцесса в хронический, наблюдавшегося в 4,7—12,1 % случаев [Захаров Н. А. и др., 1980; Егиаза-рян В. Ф., Толузаков В. Л., 1980; Мустафин Ф. Г., 1980, и др.]. Значительно чаще — в 32,7 % — переходят в хронические острые осложненные абсцессы легких [Марчук И. К., 1980]. Несомненно, существенную роль играет неполноценное лечение в остром периоде. У большинства наблюдавшихся в госпитальной хирургической
172
клинике больных с хроническими абсцессами лечение в остром периоде, проводившееся в терапевтических стационарах, сводилось только к парентеральному введению антибиотиков.
Все же не подлежит сомнению, что у ряда больных особенности острого патологического процесса не позволяют ликвидировать его даже при интенсивном комплексном консервативном лечении. Причинами, способствующими переходу острого абсцесса в хронический, являются: I) недостаточный отток гноя из полости абсцесса через бронхи вследствие нарушения проходимости последних; 2) наличие в полости абсцесса секвестров, закрывающих устья дренирующих бронхов и постоянно поддерживающих нагноение в самой полости и воспаление вокруг нее; 3) повышенное давление в полости абсцесса; 4) образование плевральных сращений в зоне пораженных абсцессом сегментов легких, препятствующих раннему спадению и облитерации полости; 5) эпителизация полости из устьев дренирующих бронхов.
Наибольшее значение, по-видимому, имеет недостаточное опорожнение абсцесса от гноя, чему способствует положение дренирующего бронха в полости абсцесса. Считается, что по этой причине хронические абсцессы чаще развиваются в нижних долях. Среди наблюдавшихся в клинике больных с острыми абсцессами, которые лечились консервативно, частота перехода в хронические была одинаковой при локализации абсцессов как в верхних, так и в нижних долях. Однако среди больных с хроническими абсцессами все же отмечалось выраженное преобладание изолированных или сочетанных поражений задних сегментов (II и VI справа — у 71,5 % и VI слева — у 73,2 % больных), бронхи которых отходят кзадн, что создает неблагоприятные условия для оттока гноя при положении больного на спине. По-видимому, это обстоятельство, учитывая редкое использование методов санации бронхиального дерева и постурального дренажа, могло иметь определенное значение. В то же время частота хронических абсцессов в I и III сегментах верхней доли правого легкого и III сегмента верхней доли левого легкого, находящихся в наилучших условиях естественного дренирования, была даже большей, чем в базальных сегментах, условия дренирования которых наименее благоприятны. Эти факты свидетельствуют о том, что при правильном лечении отношение дренирующего бронха к полости гнойника, по-видимому, не играет существенной роли.
Недостаточное опорожнение гноя чаще всего зависит от нарушений проходимости дренирующих бронхов в остром периоде заболевания. Так, из 55 больных с острыми абсцессами легких, у которых методом контрастирования поло
сти гнойника изучена проходимость дренирующих бронхов, в 80 % наблюдений жидкий кардиотраст, введенный в полость, дренирующие бронхи из-за их стойкой непроходимости не заполнил. Среди наблюдавшихся больных с хроническими абсцессами рентгенологическим исследованием, включавшим бронхографию, а также макроскопическим изучением препаратов после резекций легких более чем у половины были найдены нарушения проходимости дренирующих бронхов. У части этих больных полость абсцесса вообше ие имела сообщения с дренирующими бронхами, т. е. была блокированной. Среди больных с острыми абсцессами переход их в хронические также отмечался главным образом у больных, у которых консервативным лечением не удалось восстановить нарушенную проходимость дренирующих бронхов. Раннее восстановление бронхиального дренажа всегда обеспечивало благоприятное течение легочного гнойника при консервативном лечении.
Свободные секвестры легочной ткани, препятствующие заживлению острого абсцесса и поддерживающие хроническое нагноение, были обнаружены у 12 из 95 больных, оперированных в сроки от 2 до 6 мес от начала заболевания [Колесников И. С., Вихриев Б. С., 1973). У многих больных роль секвестров играет густой замазкообразный гной. Он не может свободно оттекать через дренирующие бронхи, закупоривает их, чем и обусловливает неблагоприятное течение процесса при консервативном лечении. Среди оперированных в госпитальной хирургической клинике больных с хроническими абсцессами легких такого рода гнойники были обнаружены почти у 25 % пациентов.
Причины образования такого гноя неясны. Высказывалось предположение, что гнойное расплавление некротизированных тканей в полости абсцесса происходит медленнее у больных, которые лечатся антибиотиками, вследствие угнетения жизнедеятельности микрофлоры и снижения ее ферментативного воздействия на омертвевшие ткани.
Клапанный механизм в устье дренирующих бронхов, препятствующий заживлению острого абсцесса, отмечен нами у 13 % больных с острыми абсцессами легких. Об этом свидетельствовали огромные полости деструкции в начале заболевания, которые в процессе консервативного лечения очень быстро уменьшались. Повышенное давление в полости абсцесса, если оно не является стойким, по-видимому, не является ведущей причиной перехода острого абсцесса в хронический, поскольку среди больных с острыми абсцессами, у которых клапанный механизм в устьях дренирующих бронхов был заподозрен, хроническое течение заболевания
173
в последующем было отмечено лишь в 2,3 % случаев.
Эпителизация полости острого абсцесса из устьев дренирующих бронхов, наступающая при больших его размерах и длительном течении, способствует возникновению хронического абсцесса потому, что образовавшаяся в результате этого ложная киста самостоятельно никогда не ликвидируется и постоянно таит в себе угрозу рецидива нагноения, т, е. перехода заболевания в хроническую форму. Развитие хронического абсцесса на фоне сухой эпителизированной полости как исхода острого абсцесса, по данным различных авторов, отмечается в 5—10 % наблюдений.
В. Ф. Егиазарян, В. Л. Толузаков (1980) обследовали в отдаленные сроки 111 больных с сухими остаточными полостями: у 55 (49,5 %) из них полости продолжали сохраняться, у 50 (45 %) — закрылись, и лишь у 6 (5,5 %) больных наступал рецидив нагноения.
Вероятность возникновения нагноения в сухой остаточной полости увеличивается при ее больших размерах. По данным Г. Л. Некрич (1983), при анализе отдаленных результатов у 83 больных с гигантскими абсцессами (более 6 см в диаметре) рецидивирующее течение процесса отмечено у 15,7 %.
Возможность развития хронического абсцесса возрастает также в случаях множественных острых абсцессов, когда влияние неблагоприятных факторов, способствующих переходу острого процесса в хронический, делается более вероятным [Федоров Б. П., Воль-Эпштейн Г. Л., I976J. Среди больных, лечившихся в госпитальной хирургической клинике, хронические абсцессы были множественными намного чаще одиночных (соответственно 47 и 16,6 %).
Таким образом, наиболее часто хронический абсцесс легкого представляет собой вариант исхода острого абсцесса. Этому способствуют перечисленные выше неблагоприятные факторы, а также дефекты проводимого консервативного лечения. Характерным патологоанатомическим признаком такого исхода острого абсцесса является ограниченность поражения, чаще всего бронхолегочным сегментом или долей. Длительное существование хронического абсцесса постепенно приводит к образованию пневмосклероза, ателектазов и вторичных бронхоэктазий.
Хронический нагноительный процесс в легочной ткани с образованием в ней таких же морфологических элементов может развиваться и по другому, более длительному пути. Этот путь — перенесенная в детском возрасте затянувшаяся крупозная, гриппозная или коклюшная пневмония с последующими периодическими обострениями, диагностируемыми как бронхопневмония. С течением времени обострения наступают
все чаще, а периоды ремиссии становятся все короче. Частые обострения приводят к склерозированию легочной ткани и вовлечению в воспалительный процесс всех ее элементов — альвеол, интерстиция, бронхов. Поражение бронхов на всю глубину (развитие панбронхита) приводит к нарушению их дренажной функции, застою воспалительного секрета. Постоянно поддерживающийся воспалительный процесс спососбствует лимфогенному распространению инфекции и образованию воспалительных инфильтратов. Некротические изменения в центре их приводят к образованию множественных гнойников.
Следовательно, чаще всего можно проследить два пути развития хронического нагноительного процесса в легочной ткани [Бакулев А. Н., Колесникова Р. С., 1961]. В первом случае, как это было показано еще С. И. Спасокукоцким, одиночный или множественный острый абсцесс легкого вследствие длительного течения и возникновения склероза легочной ткани переходит в хроническое нагноение в виде одиночных или множественных абсцессов, к которым затем, при переходе воспаления на бронхиальное дерево, присоединяются бронхоэктазии. При возникновении хронического нагноения по второму пути оно является результатом длительного хронического воспаления легких с поражением бронхиального дерева и заканчивается образованием гнойных полостей распада (абсцессов) и бронхоэктазий.
В конечном итоге при развитии хронического нагноения по любому пути морфологические изменения легочиой ткани нивелируются, становится сходной и клиническая картина заболевания.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
И ДИАГНОСТИКА
Симптоматика и варианты клинического течения хронических абсцессов легких были подробно изучены в клинике | Вихриев Б. С., 1970]. Заболевание обычно протекает с чередованием обострения и ремиссий. Наиболее постоянным симптомом является кашель с отделением гнойной мокроты, количество которой может быть различным: от незначительного до обильного, достигающего 500—600 мл и более в сутки. Количество мокроты увеличивается в период обострений, в это же время она часто бывает зловонной. Однако у 15 % больных (по материалам клиники) мокрота не отделяется совсем или ее количество незначительно. При обильном выделении мокроты организм теряет большое количество белка и других продуктов обмена, что приводит к гипопротеинемии и истощению. В мокроте часто обнаруживается при-
174
месь крови (у 9 % наблюдавшихся в клинике больных).
Больные с хроническим абсцессом жалуются на слабость, плохой аппетит, бессонницу, различной интенсивности боли в соответствующей половине грудной клетки. Часто отмечают одышку в покое, усиливающуюся при физических нагрузках.
При осмотре нередко можно заметить бледность кожных покровов, неприятный запах изо рта при дыхании, пастозность лица. В далеко зашедших случаях, когда развиваются пневмосклероз и ателектаз, отмечаются изменения формы грудной клетки: западение ее с больной стороны, втяжение межреберных промежутков и некоторое сближение ребер, а также отставание «больной» половины грудной клетки, особенно хорошо заметное при сравнении подвижности ее со здоровой стороны.
Пальцы в виде барабанных палочек являются одним из самых постоянных признаков хронического гнойного процесса в легких и наблюдаются в 85—95 % случаев. Следует, однако, иметь в виду, что этот симптом встречается и при других заболеваниях, сопровождающихся выраженной гипоксией тканей (митральный порок сердца, бронхиальная астма и др.). Вместе с утолшением ногтевых фаланг обращает на себя внимание и деформация ногтевых пластинок по типу «часовых стекол». Через 6—12 мес после радикальных вмешательств изменения пальцев подвергаются обратному развитию, и нормальный их вид может свидетельствовать о хороших отдаленных результатах резекции.
Хроническая гнойная интоксикация, наблюдающаяся при длительно протекающих абсцессах легких, нередко приводит к поражению длинных трубчатых костей с развитием склероза костной ткани и поражению суставов. Патогенез этих нарушений еще неясен.
Симптоматика, выявляемая при физикальном обследовании грудной клетки, весьма разнообразна, определяется локализацией поражения, фазой течения заболевания, тяжестью анатомических изменений в легочной ткани, наличием или отсутствием сопутствующих изменений в плевральной полости. Перкуторно выявляются зоны укорочения, однако при глубоком расположении гнойника укорочения перкуторного звука может не быть. Перкуторные изменения более выражены при осложнении нагноения в легком эмпиемой плевры. В фазе обострения и формирования гнойника при аускультации слышны влажные хрипы, бронхиальное дыхание. Сопутствующий плеврит иногда проявляется шумом трения плевры. После прорыва абсцесса в бронх определяются полостные симптомы. При поверхностном рас
положении гнойника нередко выслушивается амфорическое дыхание.
Хроническая гнойная интоксикация является характерным симптомом этого заболевания и проявляется неспецифическими, свойственными и другим нагноениям легких признаками. Быстро изменяется морфологический состав крови, характеризующийся высоким лейкоцитозом и нейтрофилезом, сдвигом лейкоцитарной формулы влево, анемией. В периоды ремиссии эти изменения выражены неотчетливо.
При хронических абсцессах легких всегда наблюдаются гипопротеинемия и диспротеи-немия. Анализ наблюдений, проведенный в клинике, позволил выявить статистически достоверную значимость между содержанием белков плазмы и степенью выраженности нагноительного процесса в легочной ткани.
Исследования свертывающей и фибринолитической систем крови обнаруживают склонность к тромбозам (Плешаков В. Т., 19641; изменения электролитов крови характеризуются гипокалиемией (В. П. Гончаров). Клинически дефицит калия проявляется слабостью, адинамией, гипотонией, нарушениями сердечного ритма. Дефицит натрия менее характерен для больных с хроническими нагноениями легких и выявляется лишь при тяжелых и длительно протекающих формах заболевания. Клиническая картина дефицита натрия зависит от величины и длительности его потерь: головные боли, тахикардия, гипотония.
Часто встречающиеся при хронических абсцессах нарушения функции почек характеризуются альбуминурией (у 3,1 % наблюдавшихся больных), а также цилиндрурией, изменениями при пробе Зимницкого. Тяжелые, длительно протекающие формы хронических абсцессов легких, сопровождающиеся амилоидозом внутренних органов, вызывают более глубокие изменения функции почек, выражающиеся в нарушении минутного диуреза, клубочковой фильтрации и др.
Выявляемые спирографически низкие показатели жизненной емкости легких, снижение компенсаторных возможностей легких в сочетании с гипервентиляцией свидетельствуют об уменьшении резервов дыхания у многих больных с хроническими абсцессами легких (52 %). Степень изменения показателей внешнего дыхания находится в прямой пропорциональной зависимости от тяжести состояния, продолжительности заболевания и распространенности нагноительного процесса в легком.
Изменения органов кровообращения у больных с хроническими абсцессами легких являются следствием нарушений гемодинамики малого круга кровообращения — гипертензии в артериях пораженных отделов легкого и ле-
175
точной артерии в целом, развития коллатералей между артериями большого и малого круга, создания сосудистого шунта, обусловливающего нарушение отношения вентиляция / кровоток, что усугубляет дыхательную недостаточность и сопровождается развитием «легочного сердца». Дистрофические изменения сердечной мышцы, отмеченные у 18 % больных, являются следствием прямого токсического действия из очагов гнойного распада в легких. Характерной для больных с хронической гнойной интоксикацией является гипотония.
Проведенные в клинике наблюдения [Вих-риев Б. С., 1970] позволили выделить 4 основных типа течения хронических абсцессов легких. Иногда (7,2 % больных) острый абсцесс легкого переходит в хронический незаметно, без отчетливого клинического улучшения состояния больного после проводимого лечения. При этом продолжают сохраняться высокая температура тела и отделение гнойной мокроты. Стойко сохраняются полость деструкции и перифокальная -воспалительная инфильтрация легочной ткани. Причина такого течения заболевания, как показал проведенный анализ, чаще всего кроется в условиях затрудненного опорожнения гноя ествественным путем через дренирующие бронхи. Нередко причиной этому служат мелкие секвестры. Признаки хронического нагноительного процесса появляются у таких больных уже в конце 2-го — начале 3-го месяца. Течение заболевания при этом характеризуется развитием осложнений (пиопневмоторакс и эмпиема плевры, кровохарканье и кровотечение, септические осложнения).
У большинства наблюдавшихся в клинике больных с хроническими абсцессами (54,7 %) развитие хронического нагноительного процесса было более постепенным. Исходом острого абсцесса у этих больных было клиническое выздоровление (формирование сухой остаточной полости) или значительное улучшение. Большинство больных были выписаны на амбулаторное лечение или в домашние условия и считались выздоровевшими, но ретроспективный анализ клинико-рентгенологических данных этого периода все же позволил выявить симптомы, которым не было придано должного внимания. К числу таких симптомов относятся жалобы на общую слабость, иногда возникающая субфебрильная температура тела, а также сохраняющаяся на рентгенограммах и, особенно, томограммах перифокальная воспалительная инфильтрация легочной ткани вокруг «сухой» полости. Достигнутая у таких больных ремиссия оказывается непродолжительной, и спустя 1 —3 мес наступает выраженное обострение заболевания, проявляющееся прежде всего внезапным повышением температуры, появле
нием неприятного запаха выдыхаемого воздуха и зловонной гнойной мокроты. После лечения в стационаре нагноительный процесс стихает, но полностью не ликвидируется. Через несколько месяцев обострение вновь рецидивирует и затем повторяется 2—4 раза в году и даже чаще.
В случаях таких абсцессов при рентгенологическом исследовании часто определяется зона пневмосклероза легочной ткани, на фоне которой хорошо видны одна или несколько полостей деструкции, заполненных гноем (рис. 94, 95). В отличие от острых абсцессов при хронических полость деструкции часто имеет неровные внутренние контуры и неправильную форму в целом, что делает необходимым дифференциальный диагноз с полостными формами периферического рака легкого. Клиническая симптоматика заболевания у больных в этот период определяется нарушениями бронхиальной проходимости, так как заполнить полости деструкции контрастным веществом во время бронхографии, как правило, не удается.
В отличие от только что описанной группы больных, течение заболевания у которых характеризуется частыми обострениями нагноительного процесса, примерно у */s наблюдавшихся в клинике больных (21,1 %) заболевание протекало с редкими после ликвидации острого нагноения обострениями, частота которых не превышала 1 —2 раз в год. Клиническая симптоматика заболевания в период обострения была выражена незначительно, признаки хронической гнойной интоксикации отсутствовали, а если и развивались, то поздно и в более отдаленные сроки. Такие больные длительное время, годами, болеюп и к хирургам обычно попадают поздно. Следует, однако, иметь в виду, что длительные «светлые» промежутки между обострениями не исключают возможность развития тяжелых форм заболевания с глубокими изменениями гомеостаза. При рентгенологическом исследовании в этих случаях обнаруживают полости деструкции, иногда сухие, иногда с небольшим количеством жидкости на дне. Как правило, определяется склероз легочной ткани, окружающей гнойник. Вне обострения полости могут быть выделены иногда только с помощью томографии, суперэкспонированных снимков, иногда при бронхографии. В отдельных случаях для более точной диагностики полезны селективная бронхография и использование управляемых катетеров.
Наконец, нередко (у 17 % больных) после стихания явлений нагноения в период формирования острого абсцесса заболевание в дальнейшем длительное время протекает спокойно, а иногда вообще бессимптомно, и больные жалуются лишь на ноющие боли в грудной клетке,
176
Рис. 94. Хронический абсцесс нижней доли правого легкого, а — прямая рентгенограмма; б — боковая рентгенограмма. Видна полость с толстыми стенками на фоне пневмосклероза и инфильтрации.
Рис. 95. Хронический абсцесс левого легкого. Прямая рентгенограмма.
Видны множественные полости с толстыми стенками и перифокальная инфильтрация.
потливость, склонность «к простудным» заболеваниям. Мокроты нет или ее очень немного, слизистого или слизисто-гнойного характера. Признаки хронической гнойной интоксикации у этих больных или отсутствуют вовсе, или выражены очень незначительно, и нередко единственным симптомом заболевания является кровохарканье, реже — легочное кровотечение, которые вынуждают обратиться к хирургу.
Рентгенологические проявления заболевания у таких больных не типичны. Чаще всего определяются локальный пневмосклероз и сухие тонкостенные полости, лучше видимые на томограммах. Деформация бронхов в зоне поражения и склеротические изменения легочной ткани лучше выявляются бронхографически.
Осложнения хронических абсцессов чаще наблюдаются в период обострений заболевания и при длительном его течении в виде вторичных бронхоэктазий, легочных кровотечений, септикопиемии, амилоидоза паренхиматозных органов.
Вторичные бронхоэктазии встречаются, по данным различных авторов, у 10—25 °о больных хроническими абсцессами легких. Изучение частоты возникновения вторичных бронхоэктазий при хронических абсцессах, проведенное в клинике госпитальной хирургии, подтвердило точку зрения большинства авторов о том, что бронхоэктазии являются наиболее частым осложнением хронических абсцессов легких — они были обнаружены у 8(> (31,7 °-о)
12 Зак. 0517
177
из 271 наблюдавшегося больного, которым были выполнены тщательные бронхографические исследования.
Анализ этих наблюдений показал, что частота бронхоэктазий закономерно возрастает с увеличением продолжительности заболевания: при сроках болезни до б мес они выявлены у 20,8 %, а свыше 2 лет — у 43,9 % больных.
Вторичные бронхоэктазии чаще всего развивались в базальных сегментах легких, реже — в средней доле и язычковых сегментах левого легкого. Часто наблюдалось сочетанное поражение бронхоэктазиями IV—V и базальных сегментов. Преимущественное поражение бронхоэктазиями нижних отделов легких позволяет предположить, что у большинства больных они возникают вследствие аспирации мокроты и гноя. При вторичных бронхоэктазиях наблюдались цилиндрические бронхоэктазии. Мешотчатые бронхоэктазии отмечены лишь у 3,3 % больных.
Кровохарканье и кровотечение в большинстве случаев сопровождают обострения хронических абсцессов легких и наблюдаются, как показали оперативные вмешательства, предпринятые по поводу легочных кровотечений, у больных с обширными изменениями легочной ткани и мощными плевральными сращениями [Григорьев М. С., 1960]. По данным В. И. Стручкова (1967), среди больных с хроническими нагноениями легких кровохарканье и кровотечение отмечены у 70 %, из них сильные кровотечения — у 14 %. Наши наблюдения подтверждают такую частоту этого симптома. Нельзя исключить связь между возникновением легочных кровотечений и повышением давления в системе легочной артерии вследствие образования коллатералей между большим н малым кругом кровообращения, в том числе и через плевральные сращения, всегда образующиеся при длительном течении хронического нагноительного процесса в легочной ткани.
Поставить диагноз легочного кровотечения при хроническом абсцессе легких нетрудно. Сложнее выявить'источник кровотечения, что необходимо для ^определения объема резекции. Очень трудно это сделать на фоне продолжающегося кровотечения, особенно массивного, так как данные рентгенологического исследования при этом обычно недостаточны для топического диагноза. Продолжающееся легочное кровотечение опасно не только анемией, но и аспирацией крови в легкие и асфиксией, поэтому в таких случаях необходимы срочная бронхоскопия, освобождение трахеи и бронхов от жидкой крови и сгустков с последующей временной окклюзией соответствующего бронха, срочной резекцией пораженного участка легкого.
Среди наблюдавшихся в госпитальной хирургической клинике больных с хроническими абсцессами легких 15 пациентов были оперированы по срочным показаниям из-за развившегося легочного кровотечения. Все они благополучно перенесли резекцию и выздоровели.
Хронические нагноительные процессы в легких могут стать причиной септикопиемии, которая, по данным различных авторов, возникает у 3—5 % больных и сопровождается высокой летальностью. Чаще сепсис возникает в периоды обострений, когда легочный гнойник плохо дренируется. В таких случаях нередко (у 1—3 % больных) появляются метастатические абсцессы в головном мозге. Среди больных, наблюдавшихся в нашей клинике, такие абсцессы головного мозга были выявлены у 7 больных, и все они погибли. Диагностика метастатических абсцессов головного мозга также трудна, но это осложнение можно заподозрить по появлению мучительных головных болей на фоне ухудшающегося состояния больного и нарастания гнойной интоксикации. В более поздние сроки появляются головокружение, рвота и спутанность сознания.
Амилоидоз, так же как и другие осложнения хронических абсцессов, чаще возникает при длительном течении заболевания и частых тяжелых обострениях. Вначале возникает токсический нефрит, а затем может развиться амилоидно-липоидный нефроз. Прогноз у таких больных плохой — они погибают от почечной недостаточности. При глубоких изменениях в почках отмечаются увеличение печени, нарушение антитоксической ее функции, а также увеличение селезенки. Появляются необратимые изменения всех звеньев гомеостаза. Прогноз для жизни в таких случаях становится неблагоприятным при всех видах лечения.
Диагноз хронического абсцесса нетруден и ставится на основании данных клинических, лабораторных и рентгенологических исследований, изложенных здесь и в предыдущей главе. К дополнительным диагностическим методам, к которым часто приходится прибегать при подозрении на хронический абсцесс легких, относятся бронхоскопия и бронхография. При бронхоскопии всегда имеется возможность визуального изучения и оценки состояния слизистой оболочки трахеи и бронхов, а с помощью направленной бронхоскопии можно детально обследовать отдельные бронхолегочные сегменты, исключить или подтвердить наличие опухоли легкого. Бронхоскопия у больных с хроническими абсцессами легких является и важной лечебной процедурой, позволяющей проводить эффективную санацию трахеобронхиального дерева. Бронхоскопия часто проводится также с целью последующего направленного контра
178
стирования бронхиального дерева, а также для аспирации контрастной массы после бронхографии.
Весьма ценным диагностическим методом у больных с хроническими нагноительными процессами в легких является бронхография. С помощью этого исследования определяется топический диагноз поражения, а также состояние бронхиального дерева на больной и здоровой стороне. Прежде чем произвести бронхографию больным, откашливающим большое количество мокроты, необходима настойчивая и тщательная санация трахеи и бронхов. Исследование пораженного легкого обычно производят через 7—10 дней после исследования противоположного легкого, оцениваемого как здоровое. Бронхография противопоказана больным с хроническими абсцессами легких, осложненными легочными кровотечениями, декомпенсацией сердечной деятельности, распространенным двусторонним поражением, острым перифокальным воспалением.
Дифференциальную диагностику хронических абсцессов легких необходимо проводить прежде всего с другими хроническими нагноительными заболеваниями легких, симптоматика которых. особенно в далеко зашедших стадиях заболевания, весьма схожа. Большое значение здесь имеют анамнез, жалобы, а также данные клинических и рентгенологических исследований. Особенно часто ошибки в дифференциальной диагностике допускаются, когда речь идет о хронических абсцессах легких и бронхоэктазиях. Последние нередко развиваются вторично, являясь частым осложнением длительно и неблагоприятно текущих хронических абсцессов. В далеко зашедших стадиях заболевания четкое разграничение хронических абсцессов легких и бронхоэктазий — наиболее часто встречающихся форм хронических нагноений легких — подчас весьма затруднительно еще и потому, что отсутствует единая общепризнанная классификация нагноений легких.
Так, среди больных, находившихся в госпитальной хирургической клинике по поводу хронических абсцессов, 2,7 % поступили с диагнозом «бронхоэктазии». Наряду с этим 8,2 % больных бронхоэктазиями были направлены для госпитализации с диагнозом «абсцесс легкого».
Бронхоэктазии в отличие от хронических абсцессов чаще встречаются в молодом возрасте, причем одинаково часто у мужчин и женщин. Хронические абсцессы чаще поражают мужчин зрелого возраста. Тщательно собранный анамнез позволяет выяснить обстоятельства, характерные для развития бронхоэктазий: частые воспаления легких в детском возрасте и бронхит, сохраняющийся в промежутках между обострениями. Периоды обострений у больных
с хроническим абсцессом редко сопровождаются отхождением очень большого количества мокроты, что весьма типично для больных бронхоэктазиями. при обострении которых мокрота отходит «полным ртом», особенно по утрам после сна. В мокроте больных бронхоэктазиями эластические волокна обнаруживаются очень редко, тогда как при хронических абсцессах их находят почти всегда. Длительность заболевания у больных с хроническим абсцессом чаще невелика, зато тяжесть состояния и интоксикация в период очередного обострения выражены намного больше. Больные бронхоэктазиями, даже захватывающими обширные зоны легкого или все легкое, нередко чувствуют себя вполне удовлетворительно. Абсцессы легких чаще всего локализуются в задних сегментах верхних и нижних долей, особенно справа. Нередко при поражении верхней доли в воспалительный процесс вовлекается соседний участок нижней и наоборот. При бронхоэктазиях чаще поражаются нижние доли легких, а также средняя доля н язычковые сегменты. Поражение почти всегда ограничивается анатомически обусловленной частью легкого — сегментом, долей и редко проникает в соседние доли легкого. Разрешить сомнения помогает рентгенологическое исследование, так как даже очень длительное существование хронического абсцесса не приводит к распространенным поражениям бронхов и на бронхограммах определяются большие, неправильной формы полости. При бронхоэктазиях хорошо видны цилиндрические, мешотчатые и смешанные расширения бронхов. Расширенные бронхи, дающие рентгенологически картину полостей, чаще имеют ровные контуры. Очень трудно отдифференцировать хронический абсцесс легкого от абсцедирующих бронхоэктазий, но и в этих случаях тщательно собранный анамнез, особенности течения заболевания и рентгенологические данные помогают поставить правильный диагноз.
Другим хроническим неспецифическим заболеванием легких, с которым иногда необходимо дифференцировать хронические абсцессы, является хроническая неспецифическая пневмония, протекающая с частыми обострениями и абсцедированием. Здесь также важен анамнез. При рентгенологическом исследовании обычно отмечается сплошное затенение доли или всего легкого с множественными мелкими полостями деструкции.
Весьма трудной может быть дифференциальная диагностика хронических абсцессов и туберкулеза легких, особенно при сочетанных поражениях легких, неспецифических и специфических процессах. По сводным данным В. Н. Молоткова и соавт. (1982), сочетание туберкулеза легких с хроническими нагноитель-
12*
179
ними заболеваниями колеблется от 4,6 до 21,9 %. Отмечается рост числа таких сочетанных поражений. Если в 1965 г. они диагностированы у 10,1 % больных, то в 1981 г.— у 17,6 % [Зыскин Л. Ю. и др., 1982]. Среди больных, подвергшихся в нашей клинике резекциям легких по поводу типичных хронических абсцессов, у 33 % гистологическими исследованиями препаратов, наряду с неспецифическим процессом, были выявлены изменения, характерные для туберкулеза [Вихриев Б. С., 1970].
Все вышеизложенное определяет необходимость тщательного комплексного обследования больных с хроническими абсцессами легких до операции с целью определения характера, динамики и распространенности нагноения легких и выявления степени нарушения функций основных систем жизнеобеспечения организма.
ЛЕЧЕНИЕ
Консервативное лечение применяется в настоящее время у большинства больных с хроническими абсцессами легких, однако оно рассматривается как основнаи часть предоперационной подготовки. Реже, в запущенных случаях заболевания, когда резекции противопоказаны, консервативная терапия может быть единственно возможным методом лечения.
При наличии показаний центральным вопросом хирургического лечения больных с хроническими абсцессами легких является выбор оптимального времени для проведения оперативного вмешательства. Принимая решение подвергнуть больного резекции легкого, чаще всего исходят из плохого прогноза заболевания при других методах лечения. В связи с этим большой практический интерес представляет изучение отдаленных исходов у больных с хроническими абсцессами легких, которые по тем или иным причинам были выписаны без операции. Анализ таких исходов у 123 больных с хроническими абсцессами легких, проведенный Б. С. Вихриевым, показал, что они были наиболее неблагоприятными у больных, у которых заболевание протекало без выраженных ремиссий. Плохие отдаленные результаты отмечены и у больных, у которых заболевание протекало с частыми тяжелыми обострениями (из 22 больных с таким течением заболевания в сроки наблюдения до 2 лет практически здоровым остался лишь один больной; 8 человек продолжали болеть, 3 — вынуждены были подвергнуться операциям, а 10 — погибли вследствие прогрессирования заболевания). Лучше отдаленные исходы были у неоперировавшихся больных, течение заболевания у которых характеризовалось редкими легкими обострениями.
Из 47 больных этой группы от прогрессирования заболевания умерли только 5, а 21 оставались практически здоровыми. Большинство больных (40 из 50), у которых заболевание протекало без выраженных обострений, а изменения в легких (сухая остаточная полость с незначительно выраженными явлениями пневмосклероза) выявлялись только при рентгенологическом исследовании, в течение длительного времени, от 2 до 16 лет после выписки, оставались в хорошем состоянии. Рецидив нагноительного процесса развился лишь у 3 больных этой группы.
Данные литературы и опыт клиники позволяют считать, что при определении показаний к резекции легкого у больного с хроническим абсцессом следует исходить из тяжести состояния, распространенности нагноительного процесса, длительности заболевания, наличия или отсутствия осложнений, а также динамики течения нагноительного процесса в легочной ткани под влиянием проводимой консервативной терапии.
Необходимость резекции не вызывает сомнений при хронических одиночных и множественных абсцессах, протекающих с частыми тяжелыми обострениями и прогрессирующей хронической гнойной интоксикацией, однако эти больные нуждаются в интенсивной предоперационной подготовке, с помощью которой необходимо стремиться устранить обострение нагноительного процесса и выполнить оперативные вмешательства с минимальным риском генерализации инфекции.
Тем не менее иногда, несмотря на проводимую терапию, состояние больных не только не улучшается, а, наоборот, прогрессирует. Такое течение заболевания нередко бывает при осложнениях хронического абсцесса вторичными бронхоэктазиями и эмпиемой плевры. Плохой прогноз при отказе от операции в этих случаях очевиден, а резекция в то же время крайне рискованна. Определить правильную лечебную тактику в подобных ситуациях очень непросто. Резекции легких у таких больных допустимы только в специализированных хирургических стационарах при условии их выполнения хирургами, имеющими большой личный опыт в легочной хирургии и хорошо поставленной анестезиологической и реаниматологической службе.
По данным Ю. Н. Лубенского и соавт. (1980), из 134 больных, перенесших резекции легкого по поводу хронического абсцесса, предоперационная подготовка позволила добиться улучшения состояния лишь у 63 (47 %) больных, а у остальных 71 (53 %) она оказалась неэффективной. По мнению авторов, отчетливый благоприятный эффект давала инфузия антибиотиков в легочную артерию.
180
Спорным остается вопрос о тактике хирурга при абсцессах в обоих легких. По мнению В. И. Стручкова (1967), резекции легких при двусторонних абсцессах противопоказаны, когда с одной стороны поражено все легкое или большая его часть, а с другой — одна доля или более. Если поражено по одной доле с каждой стороны — возможно поочередное их удаление. В. И. Кукош и соавт. (1981) выполнили 35 одномоментных и 20 двухэтапных резекций легких больным хроническими нагноениями легких. После предельно допустимой резекции легочной ткаии в оставшихся долях легких происходит морфологическая перестройка. Предпочтительнее, по мнению авторов, двухэтапная резекция с оптимальным интервалом между вмешательствами 4—7 мес. При первой операции авторы рекомендуют выполнять больший объем резекции, что способствует более активному включению компенсаторно-приспособительных механизмов, повышающих устойчивость организма к резекции второго легкого. Установлена эффективность гипербарической оксигенации при обширных резекциях легких.
Опыт клиники госпитальной хирургии убеждает, что большинство таких больных с двусторонними абсцессами часто неоперабельны. В лучшем случае у них можно ограничиться пневмотомией острого абсцесса, развившегося в контралатеральном легком как осложнение ранее существовавшего хронического. В дальнейшем, если наступит заживление острого абсцесса, можно вернуться к обсуждению вопроса о допустимости резекции по поводу хронического абсцесса.
Резекции легких при хронических абсцессах не показаны при неосложненном течении заболевания с редкими легкими обострениями, особенно если есть условия для систематического наблюдения и оказания квалифицированного лечения в случае необходимости. Бесперспективны резекции у больных хроническими абсцессами с резкими нарушениями сердечной деятельности и явлениями декомпенсации, с тяжелым амилоидозом внутренних органов.
Осложнение хронического абсцесса легкого кровотечением большинство хирургов считают показанием к резекции [Колесов В. И., 1960; Григорян А. В. и др., 1966; Кузин М. И., Волынский Ю. Д., 1978; Стручков Б. И. и др., 1982, и др.]. Продолжающееся кровотечение всегда вынуждает к срочной резекции после диагностической бронхоскопии на операционном столе и тампонады бронха. В случаях, когда кровотечение остановилось, решиться на резекцию труднее. Всегда сохраняется реальная угроза повторного массивного кровотечения, при котором даже срочная резекция может оказаться запоздалой. В то же время резекция
будет более безопасной для больного, если она будет выполнена после остановки кровотечения и ликвидации его последствий. Поскольку кровотечения обычно связаны с прогрессированием нагноительного процесса в легких и поэтому склонны к рецидивированию, предоперационная подготовка после остановившегося кровотечения не должна превышать 8—12 ч. Имевшие место в анамнезе больного с хроническим абсцессом легкого легочные кровотечения являются дополнительным аргументом в пользу резекции. Целью операции является удаление пораженных отделов легкого вместе с источником кровотечения. В последние годы для остановки легочных кровотечений в клиническую практику внедряется метод эмболизации бронхиальных артерий [Перельман М. И., 1977; Кузин М. И., Волынский Ю. Д., 1978]. Широкого распространения он, однако, не получил.
При абсцессах, осложненных хронической эмпиемой плевры и бронхиальным свищом, вопрос о необходимости резекции должен решаться в зависимости от характера поражения легкого. При продолжающемся хроническом нагноительном процессе в легочной ткани любые оперативные вмешательства с целью устранения только плеврального очага нагноения будут обречены на неуспех. После стабилизации состояния больного в таких случаях показаны резекции пораженных отделов легкого, несущих свищ, с одновременной плеврэктомией.
Больные с хроническими абсцессами легких, за исключением бурно прогрессирующих форм и осложненных кровотечением, как правило, нуждаются в интенсивном консервативном лечении, преследующем цели подготовки к радикальному оперативному вмешательству. Основными задачами предоперационной подготовки больных с хроническими абсцессами легких являются следующие.
1. Уменьшение гнойной интоксикации и ликвидация обострения нагноительного процесса в легких.
2. Коррекция нарушенных патологическим процессом функций систем дыхания и кровообращения, ликвидация белковых, волемических, электролитных нарушений и анемии.
3. Повышение общей иммунологической сопротивляемости организма.
Решение первой задачи обеспечивается проведением комплекса лечебных мероприятий, воздействующих на патогенетические механизмы заболевания. Имея в виду ведущую роль в патогенезе и течении нагноительных заболеваний легких нарушений бронхиальной проходимости, большое внимание необходимо уделить комплексной санации трахеобронхиального дерева с целью создания условий для мак
181
симально полного и по возможности постоянного оттока гноя из полости деструкции. Способы бронхологической санации подробно изложены в предыдущей главе. Следует остановиться лишь на некоторых особенностях санации у больных с хроническими абсцессами легких. Длительное течение нагноительного процесса в легочной ткани, сопутствующий обострению нагноения разлитой трахеобронхит определяют необходимость проведения более длительных курсов санационной терапии. При хронических абсцессах ле1 ких в устье бронха пораженного сегмента нередко развивается массивный рубцовый процесс, который значительно затрудняет эвакуацию гнойного содержимого с помощью массивных методов санации. Поэтому, не отказываясь от постурального дренажа, ингаляций и интратрахеальных вливаний лекарственных препаратов, более эффективной следует считать бронхоскопическую санацию кате-теризационным бронхоскопом, позволяющим проводить зондирование гнойных полостей, аспирацию гнойного содержимого, промывание и введение лекарственных препаратов. По механизму своего действия они делятся на несколько групп: механически очищающие (изотонический раствор хлорида натрия, слабые растворы новокаина), антисептические вещества (фурацилин, риванол, фурагин, солафур и др.), химиотерапевтические вещества (сульфаниламидные препараты и антибиотики), вещества, уменьшающие поверхностное натяжение слизи (адегол, тахоликвин), противовоспалительные вещества (протеолитические ферменты, антипирин). Использование веществ, уменьшающих поверхностное натяжение слизи («моющих»), является, по мнению Г. И. Луком-ского (1973), весьма перспективным.
Проведенными исследованиями этого автора установлено, что в бронхах при хроническом нагноении легких имеются оптимальные условия для действия протеолитических ферментов и, в частности, химопсина. Необходимость длительной экспозиции этою препарата (3— 4 мин) заставляет у больных, находящихся в тяжелом состоянии, предпочесть ему ацетилцистеин, выраженное действие которого наступает уже через 1 мин. Протеолитические ферменты способствуют растворению детрита, густого гноя, слизистых пробок, уменьшению Отека слизистой оболочки бронхиального дерева, потенцируют лечебное действие антибактериальных препаратов, обеспечивающих лучший контакт с воспаленными тканями. По мнению большинства специалистов, бронхоскопическая санация должна заканчиваться введением антибиотиков. Следует иметь в виду, что многие больные с хроническими абсцессами, как правило, получают большие дозы различных анти
бактериальных средств на всех этапах лечения и поэтому микробная флора подавляющего большинства из них нечувствительна к наиболее часто применяющимся антибиотикам. Это вынудило некоторых авторов (Стручков В. И. и др., 1978] полностью исключить антибиотики из арсенала лечебных средств больных с абсцессами легких и шире использовать более активные антисептики, особенно иитрофуранового ряда. Антибиотики, особенно широкого спектра действия, остаются у таких больных резервными препаратами послеоперационного периода. По-видимому, полностью отказываться от применения антибактериальных препаратов у больных с хроническими абсцессами легких не следует. Трудности идентификации изменившегося за последние годы спектра микробной флоры и целенаправленного подбора антибиотиков в соответствии с данными антибиотикограммы необходимо преодолевать совершенствованием бактериологических методик и способов забора материала для исследования. Оптимальным из них является получение содержимого пораженных участков легкого стерильным аспиратором во время катетеризационной бронхоскопии. Наиболее эффективными комбинациями антибактериальных препаратов у больных с хроническими абсцессами легких являются, как показал опыт нашей клиники, сочетания аминогликозидов (канамицин, гентамицин) с полусин-тетическими пенициллинами (оксациллин, метициллин, карбенициллин и др.). Эффективны также антибиотики цефалоспориновой группы.
При тяжелой интоксикации в последние годы в период подготовки к операции стали применять эндолимфатическое введение антибиотиков, а также гемосорбцию | Маневич В. Л. и др.. 1982], но оценить преимущества и недостатки этих методов на основании имеющихся сообщений не представляется возможным.
Для снятия гнойной интоксикации и ликвидации обострения у больных с хроническими абсцессами легких могут использоваться и способы оперативного дренирования легочных гнойников, особенно если они одиночны и поверхностно расположены. Дренирование полости хронического абсцесса с этой целью было предпринято нами у 13 больных. Во всех случаях был достигнут выраженный положительный клинический эффект. Шести больным в последующем была выполнена резекция доли, троим— мышечная пластика полости. Четверо больных выписаны без операции, и при сроках наблюдения от 1 года до 12 лет выраженных обострений заболевания у них не было. Длительность санации полости хронического абсцесса через дренажную трубку в среднем составила 3 нед.
Пневмотомия у больных с хроническими абсцессами легких не является операцией, позво
182
ляющей добиться выздоровления. Об осложнениях и недостатках этой операции подробно говорилось выше. Однако в определенных случаях она может оказаться необходимой: при поверхностно расположенных больших хронических гнойниках, особенно содержащих секвестры, пневмотомия может использоваться для подготовки к резекции; у больных, резекции которым из-за тяжести состояния и распространенности процесса противопоказаны, а консервативной терапией купировать обострение нагноительного процесса не удается, эта операция может быть паллиативной, уменьшающей интоксикацию.
В госпитальной хирургической клинике пневмотомия была использована для подготовки к резекции у 39 больных с хроническими абсцессами легких. Анализ этих наблюдений показал, что добиться улучшения состояния больных, как правило, не удавалось в случаях множественных хронических абсцессов, а также при наличии хронических гнойников, осложненных вторичными бронхоэктазиями. При одиночных хронических абсцессах, в том числе гангренозных и осложненных эмпиемой плевры, пневмотомия способствовала быстрому (в течение 1—2 нед.) уменьшению гнойной интоксикации и создавала более благоприятные условия для выполнения в последующем резекции пораженной части легкого.
Опыт резекции легкого у 17 больных, которым в прошлом производилась пневмотомия, показал, что в области торакального свища всегда формируются обширные плотные сращения, затрудняющие вскрытие плевральной полости и выделение легкого из сращения. Выделение и обработка элементов корня легкого бывают даже технически более простыми, чем у больных, оперируемых в фазе обострения заболевания.
С целью предоперационной подготовки больных с хроническими абсцессами легких в комплексе с методами бронхологической санации осуществляются лечебные мероприятия для нормализации функции сердечно-сосудистой и дыхательной систем, коррекции волемических, белковых, электролитных и иммунологических нарушений. Для борьбы с гипоксией должна широко применяться гипербарическая оксигенация. С целью ликвидации анемии предпочтение должно отдаваться переливанию свежеконсервированной крови, а также прямым гемотрансфузиям. Содержание лечебных мероприятий, обеспечивающих решение поставленных выше задач, подробно изложено в предыдущей главе.
Рациональным консервативным лечением у большинства больных с хроническими абсцессами легких удается добиться существенного
улучшения их состояния и тем самым значительно уменьшить риск резекции. Однако иногда эффект подготовки бывает недостаточным или вообще отсутствует, в связи с этим возникает вопрос о допустимом сроке подготовки к операции. Опыт клиники госпитальной хирургии свидетельствует о том, что вполне достаточным сроком, по истечении которого можно судить об эффективности проводимого лечения, являются 2—3 нед. Если к окончанию этого срока комплексная консервативная терапия не дает существенного улучшения, продолжать ее нецелесообразно. У таких больных для подготовки к резекции можно или прибегнуть к одному из методов оперативного дренирования хронического абсцесса, или избрать резекцию, риск которой в этих условиях возрастает.
Ориентировочный объем резекции у больных с хроническими абсцессами легких планируется на основании данных рентгенографии и томографии. При этом заболевании часто развиваются вторичные изменения легочной ткани (брои-хоэктазии и пневмосклероз). Это определяет необходимость в бронхографии.
Чаще всего поражение легочной ткани при хроническом абсцессе ограничивается одной долей (у 69,5 % из 498 больных, оперировавшихся в госпитальной хирургической клинике). Поражение легкого с наличием множественных полостей отмечено лишь у 5,9 % больных. В 15,2 % наблюдений хронический нагноитель-ный процесс захватывал смежные сегменты разных долей (чаще всего II—VI сегменты правого легкого и I—VI сегменты левого). Абсцессы, ограниченные пределами одной доли при наличии пневмосклероза и вторичных бронхоэктазий в других долях, отмечены у 9,4 % больных.
Решение об окончательном объеме резекции при хронических абсцессах легких принимается только после выделения легкого из сращений и его ревизии. Чаще всего прибегают к лобэктомии (у 41,3 % больных, оперировавшихся в нашей клинике). Несмотря на то, что поражение легкого при хроническом абсцессе у большинства больных ограничивается долей, к пневмонэктомиям приходится прибегать почти так же часто, как и к резекциям доли (у 34,7 % больных). Кроме случаев множественных абсцессов легких в разных долях, к пневмонэктомии нередко вынуждают воспалительные изменения в участках легкого, непосредственно не пораженных деструктивным процессом, невозможность выполнения планировавшейся долевой резекции из-за выраженного спаечного процесса в корне легкого и плевральной полости, интраоперационные осложнения (кровотечения, повреждения легочной паренхимы), связанные с техническими трудностями, обусловленными теми же причинами.
183
При сочетанном поражении верхней доли и верхушечного (VI) сегмента нижней доли чаще прибегают к удалению всего легкого. Комбинированная резекция пораженной доли и сегмента в этих случаях технически сложнее и рискованнее с точки зрения возможности развития послеоперационных осложнений (несостоятельности легочной раны, формирования остаточной плевральной полости и эмпиемы плевры). Пневмонэктомию выполняют всегда при сочетанном поражении нижних долей и II (справа) и I (слева) сегментов верхних.
При часто встречающемся распространении воспалительных изменений с верхней доли на среднюю долю правого легкого избежать билобэктомии можно, прибегнув к типичному удалению верхней и атипичной резекции пораженного участка средней доли. При хронических абсцессах, локализующихся в верхушечном (VI) сегменте нижней доли левого легкого, и вторичных бронхоэктазиях в язычковых сегментах верхней доли хорошие результаты дает комбинированная резекция нижней доли и язычковых сегментов верхней доли. Различные варианты комбинированных резекций легких при хронических абсцессах были выполнены у 7,7 % оперировавшихся в госпитальной хирургической клинике больных.
Билобэктомии у больных с хроническими абсцессами легких выполняются нечасто (у 7,9 % больных). К этим операциям приходится прибегать при невозможности разделить междолевые щели, в случаях распространения воспалительного инфильтрата на корень легкого или резко выраженных рубцовых изменений в нем. Иногда к правосторонней нижней билобэктомии приходится прибегать у больных с хроническим абсцессом средней доли, когда из-за воспалительных или рубцовых изменений невозможно выделить артерию и бронх средней доли, а также в случаях повреждения междолевого ствола легочной артерии.
Резекции сегментов при хронических абсцессах легких производить нецелесообразно, хотя нагноительный процесс при этом нередко имеет сегментарное распространение. Во время оперативных вмешательств почти всегда обнаруживаются воспалительные и рубцовые изменения в корне легкого, исключающие возможность сегментэктомии. Среди больных с хроническими абсцессами легких, оперировавшихся в госпитальной хирургической клинике, сегментарные резекции были сделаны лишь 6,5 % пациентов. Еще реже прибегают к атипичным резекциям (у 1,9 % больных по данным клиники).
Резекции легких у больных с хроническими абсцессами в большинстве случаев не имеют существенной специфики, однако не лишены некоторых своих особенностей. В техническом
отношении эти операции сложнее, чем у больных с острыми нагноениями легких, и трудности определяются главным образом выраженными сращениями в плевральной полости и в корне легкого. При длительном существовании патологического процесса значительные трудности может представить вскрытие плевральной полости при торакотомии из-за сближения ребер и мощных шварт. Характерной особенностью, определяющей трудности и травматичность резекций у больных с хроническими абсцессами легких, является наличие плевральных сращений, которые при длительном течении нагноительного процесса и особенно в случаях осложнения его эмпиемой бывают очень мощными. Среди оперировавшихся в клинике больных полная облитерация плевральной полости плотными сращениями отмечена в 38 % случаев. Чаще всего сращения были наиболее выражены в задних отделах плевральной полости.
Весьма перспективным может быть использование лазерного ножа при резекциях легких по поводу их хронических нагноительных заболеваний. Лазерный скальпель обеспечивает бескровное и значительно более легкое разделение плотных и рубцовых тканей, оказывает бактерицидное воздействие на возбудителей хирургической инфекции (Кабанов А. Н. и др., 1982].
Из-за выраженных рубцовых изменений в корне легкого и невозможности в связи с этим типичной раздельной обработки элементов корня легкого у больных с хроническими абсцессами чаще приходится прибегать к виутриперикар-диальной перевязке сосудов (у 5 % больных, перенесших пневмонэктомию). Технические трудности, обусловленные сращениями в корне легкого, определяют значительную частоту повреждений крупных сосудов, особенно при частичных резекциях (отрыв сегментарных артерий от места их отхождения, ранение междолевого ствола легочной артерии). В таких случаях для остановки кровотечения приходится прибегать к вынужденной перевязке осиовиого ствола легочной артерии и расширять объем резекции до пневмонэктомии. При повреждении легочной артерии оправдано наложение сосудистого шва. Для разделения междолевых щелей и легочных перемычек целесообразно чаще прибегать к аппаратному способу.
Опыт лечения больных с хроническими абсцессами легких, перенесших резекции, показал, что в послеоперационном периоде большинство из них нуждаются в интенсивной терапии и интенсивном наблюдении. Основной задачей лечения в ближайшем послеоперационном периоде (24—48 ч) является восстановление и поддержание нарушенных болезнью и оперативным вме-
184
шателъством главных систем жизнеобеспечения — дыхания и кровообращения. После стабилизации дыхания и гемодинамики основным содержанием интенсивной терапии становится профилактика инфекционных осложнений с одновременной настойчивой поддерживающей и корригирующей терапией. Ранний послеоперационный период можно считать благополучно завершенным, когда расправляется оперированное легкое, нормализуются показатели крови и больной может свободно вставать и ходить. В поздний послеоперационный период проводят симптоматическую терапию, местное лечение и продолжают лечение осложнений, если их не удалось купировать ранее. В это время наступает устойчивая стабилизация функций систем дыхания и кровообращения, а также обменных процессов. Более подробно содержание мероприятий интенсивной терапии по профилактике и лечению недостаточности дыхания и кровообращения, а также коррекции других систем гомеостаза в том объеме, как это применяется в госпитальной хирургической клинике, будут изложены в соответствующем разделе настоящего руководства.
Несмотря на успехи легочной хирургии, летальность среди больных с хроническими абсцессами легких после резекций остается высокой. Совершенствование техники оперативных вмешательств, а также прогресс анестезиологии и реаниматологии позволили снизить летальность после резекций легких при хронических абсцессах до 7—10 %. [Богатов А. И., Мустафин Д. Г., 1980; Маневич В. Л. и др., 1982, и др.1.
Среди 498 больных с хроническими абсцессами легких, подвергшихся резекциям в госпи
тальной хирургической клинике, умерли 60 (12 %) больных. Самой высокой смертность была после пневмонэктомий (17,9 %). После частичных резекций летальность была вдвое ниже (8,6 %).
Наиболее частыми причинами гибели больных были дыхательная и сердечная недостаточность (14,8 %), эмпиема плевры (11,9 %) и кровотечения (6,5 %). Довольно высокая общая летальность после резекций у больных с хроническими абсцессами легких в госпитальной хирургической клинике — 12 % —объясняется тем, что оперативные вмешательства часто выполнялись у больных с осложненными формами абсцессов легких, а также у пожилых и страдавших тяжелыми сопутствующими заболеваниями пациентов. Многим таким больным отказывали в операции в других стационарах. В то же время сократилось количество больных, оперированных по поводу легко протекавших неосложненных абсцессов легких. У многих больных, которым по характеру заболевания раньше широко производились резекции, в настоящее время выздоровление достигается без операции, и длительное наблюдение за ними свидетельствует о стабильности достигнутого результата.
Анализ причин летальных исходов после резекций легких у больных с хроническими абсцессами, а также характера послеоперационных осложнений позволяет прийти к выводу о том, что улучшить результаты лечения можно более тщательной предоперационной подготовкой больных к операции, совершенствованием техники оперативного вмешательства, своевременным предупреждением и лечением развивающихся послеоперационных осложнений.
Глава О ОСТРАЯ ЭМПИЕМА
ПЛЕВРЫ И ПИОПНЕВМОТОРАКС
Эмпиема плевры (гнойный плеврит) — это ограниченное или диффузное воспаление висцеральной и париетальной плевры, протекающее с накоплением гноя в плевральной полости и сопровождающееся признаками гнойной интоксикации и нередко дыхательной недостаточности. В большинстве случаев эмпиема плевры является осложнением воспалительных и гнойнодеструктивных процессов в легких, а также травм и оперативных вмешательств на органах груди.
ЭТИОЛОГИЯ, ПАТОГЕНЕЗ
И ЧАСТОТА ОСТРОЙ ЭМПИЕМЫ
Острая эмпиема плевры является полиэтио-логическим заболеванием. Характер течения острого инфекционного процесса в плевре зависит от вида и вирулентности возбудителя, от аиатомо-физиологических особенностей плевральных листков и органов дыхания, от состояния иммунобиологической защиты организма.
Возбудителями эмпиемы плевры могут быть различные микроорганизмы. В зависимости от этиологии различают специфическую, не-специфическую и смешанную эмпиемы.
Специфическая эмпиема плевры вызывается микобактериями туберкулеза, которые проникают в висцеральную или париетальную плевру контактным, лимфогенным или гематогенным путем из туберкулезных очагов в легких, лимфатических узлов, позвоночника. Иногда наблюдается первичный туберкулезный плеврит. Некоторые авторы [Кузин М. И. и др., 1976] к специфическим относят грибковые эмпиемы (актиномикотические, кандидамикотические, аспергиллезные). К специфическим относят также сифилитический плеврит [Теппер П. А., 1960|, однако в настоящее время он встречается крайне редко. Смешанной эмпиему считают в тех случаях, когда в плевральном экссудате находят и микобактерии туберкулеза, и какие-либо из бактерий или грибков.
Чаще наблюдается неспецифическая эмпиема плевры, вызываемая различными гноеродными или гнилостными микроорганизмами. До применения антибиотиков в гное из плевральной полости чаще всего находили пневмококки, стрептококки и диплококки. За последние десятилетия соотношение микробных возбудителей гнойных процессов заметно изменилось. Чаще других в гнойной плевральной жидкости обнаруживаются стафилококки — до 77 % IЛуценко С. М., Тарасова Е. И., 1975]. Это объясняется выраженной вирулентностью стафилококка и устойчивостью его к большинству антибактериальных средств.
Очень часто, до 30—45 % случаев [Королев Б. А. и др., 1982; Kessler Б. et al., 1974], при посевах гноя из плевральной полости получают рост грамотрицательиых микроорганизмов: различные штаммы кишечной, синегнойной палочки, протея. Как правило, эта микрофлора малочувствительна или устойчива к воздействию большинства распространенных антибактериальных средств. В некоторых случаях в плевральном гное обнаруживают несколько микробов. Эмпиемы с полиморфной микробной флорой отличаются более тяжелым течением.
Следует отметить, что нередко гной из плевральной полости оказывается «стерильным», несмотря на явные признаки гнойного процесса. Отсутствие роста микробов в этих случаях объясняется проводимой до посева общей и местной антибактериальной терапией, а также тогда, когда не делался посев анаэробной флоры. Как показали исследования отечественных и зарубежных авторов, в гное из плевральной полости анаэробные микробы при специальном исследовании можно найти в 20—76 % случаев [Кочетков А. В., 1983; Shermann М. et al., 19771. Наиболее частыми возбудителями среди них являются неклостридиальные микроорганизмы — бактероиды, фузобактерии, пептококки, пептострептококки и др.
Патогенетически различают первичную и вторичную эмпиемы плевры. При первичной эмпиеме очаг воспаления с самого начала локализуется в плевральной полости, при вторичной — он является осложнением какого-либо другого гнойно-воспалительного заболевания, чаще всего легочного [Спасокукоцкий С. И., 1938].
186
Первичная эмпиема возникает на фоне неизмененных, здоровых плевральных листков, в результате нарушения их барьерной функции с занесением микрофлоры. Это обычно бывает при открытой травме груди, после операций на легком, а также при наложении искусственного пневмоторакса.
Развитие эмпиемы после ранений груди обусловлено тяжестью и характером повреждений органов и тканей грудной клетки, наличием инородных тел и гемотораксом. По «Опыту Великой Отечественной войны 1941 —1945 гг.», острая эмпиема плевры наблюдалась у 14 % раненых с огнестрельными проникающими повреждениями груди (Куприянов П. А., 1946]. При ранениях с малым гемотораксом эмпиема возникала в 3 %, при среднем гемотораксе в 21,2 %, при большом — в 34,7 % случаев [Бочаров А. А.. 1950|. В развитии эмпиемы большую роль играют сроки первичной хирургической помощи. Так, при оказании квалифицированной хирургической помощи раненым с открытым пневмотораксом в первые 6 ч эмпиема развилась у 26,4 % раненых, а после обработки. произведенной позже 48 ч,— у 41,5 %. В мирное время имеется возможность раннего полноценного хирургического вмешательства, поэтому эмпиема плевры наблюдается значительно реже, чем это было во время войны: после проникающих ранений груди — около 10—15 %, при закрытых повреждениях — не более 5 % [Вагнер Е. А.. 19811.
В связи с развитием торакальной хирургии и расширением показаний к оперативным вмешательствам на органах груди особый интерес представляет патогенез острых послеоперационных эмпием плевры. Инфицирование плевральной полости во время оперативных вмешательств происходит в основном при вскрытии полости абсцесса, выделении легкого из сращений, обработке культи бронха или наложении анастомозов при операциях на пишеводе. В отдельных случаях причиной эмпиемы является несостоятельность швов культи бронха, пищеводно-желудочного анастомоза. После оперативных вмешательств на органах груди без повреждения легкого острая эмпиема плевры наблюдается у 2—3 % больных [Аблицов Н. П., 19761, после операций на легких — от 5 до 31 % [Колесников И. С. и др., 1965; Boyd A., Spenser F., 1972], а после операций по поводу острых гнойно-деструктивных заболеваний легких — до 50 % [Горшков Ю. И., 1976}.
Различают также так называемые криптогенные первичные эмпиемы, когда источник инфекции плевры выявить не удается [Кузин М. И. и др., 1976].
По данным Г. И. Лукомского (1976), в 88 % случаев вторичная эмпиема плевры явилась
осложнением пневмоний, острых и хронических гнойных заболеваний легких. Пневмония может с самого начала протекать с развитием гнойного плеврита (пара- или синпневмоническая эмпиема), или же эмпиема развивается на исходе пневмонии и приобретает характер самостоятельного заболевания (метапневмоническая эмпиема). Парапневмоническая эмпиема диагностируется очень редко, так как маскируется клиникой воспаления легкого. В период до применения антибиотиков и новых антибактериальных средств эмпиемы развивались примерно у 6—7 % больных [Buschmann О., Hackerott Н., 19531, а при крупозной пневмонии — у 21,8 % [Фомина А. С., 1977}. С применением антибиотиков для лечения пневмонии частота гнойного плеврита уменьшилась до 1 %, однако за последние годы вновь воспаление легких значительно чаще осложняется эмпиемой плевры (от 2 до 5 %). При абсцессах легких эмпиема развивается у 8—11 % больных [Стручков В. И., 1967; Колесников И. С., Вихриев Б. С., 19731, а при гангрене легкого - у 55—90 % больных [Горшков Ю. И., 1977; Колесников И. С. и др., 1983]. В единичных случаях эмпиема может развиться как осложнение нагноившейся врожденной или паразитарной кисты легкого, распадающегося рака, спонтанного пневмоторакса.
Вторичная эмпиема плевры может развиваться и в результате распространения воспалительного процесса на плевру из тканей грудной стенки и соседних органов (при нагноении ран груди, остеомиелите ребер, позвоночника, грудины, хондрите, лимфадените, медиастините, перикардите). Источником инфицирования плевры в редких случаях могут быть острые воспалительные и гнойные заболевания органов брюшной полости (поддиафрагмальцый абсцесс, холецистит, панкреатит, перфоративная язва желудка и др.). Проникновение микробов из брюшной полости на плевру происходит по лимфатическим сосудам и через щели в диафрагме. Возможен также гематогенный путь распространения инфекции при тромбофлебите, остеомиелите, аборте, послеродовом сепсисе.
Патогенез развития острого гнойного процесса в плевре сложен и определяется не только и даже не столько проникновением микроорганизмов в плевру, сколько образовавшимися условиями обитания этих микробов в плевральной полости и снижением местной и общей иммунобиологической реактивности организма.
Изменения в плевре могут нарастать остро или постепенно с развитием фибринозного, экссудативного или фибринозно-гнойного плеврита. Нарушения функции дыхания обусловлены не только воспалительным или деструктивным процессом в легком, но и сдавлением легкого накапливающейся в плевральной поло
187
сти жидкостью. При значительном количестве жидкости происходит смещение средостения в здоровую сторону и появляются гемодинамические расстройства.
Тяжелая гнойная интоксикация ведет к нарушениям функций миокарда, почек, печени, эндокринных органов. Большое значение в развитии ряда изменений имеют потери с гноем белка и электролитов. В связи с этим падает онкотическое давление крови и уменьшается объем циркулирующей крови. Этому способствует активация кининовой системы, наступающая в результате действия продуктов аутолиза бактерий и некроза тканей. В результате гнойной интоксикации, нарастающей гипо- и диспротеи-иемни понижаются активность защитных иммунных реакций и репаративные способности организма.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ПИОПНЕВМОТОРАКС А
Пиопневмоторакс — острый гнойный процесс, развивающийся вследствие прорыва гнойника легкого в плевральную полость. Он может возникнуть чаще всего в результате прогрессирования гангрены легкого, реже — острого абсцесса и еще реже —- при прорыве хронического гнойника легкого в стадии обострения.
Прорыв абсцесса легкого в плевральную полость сопровождается поступлением в нее гноя и воздуха. При отсутствии сращений между париетальной и висцеральной плеврой развивается тотальный пиопневмоторакс с тяжелой клинической картиной за счет раздражения огромного рецепторного поля плевры и значительной всасываемости токсинов. При наличии плевральных спаек, что бывает чаще в верхних отделах плевры, а также при хронических гнойно-деструктивных процессах в легких может развиться ограниченный пиопневмоторакс. В зависимости от того, сохраняется ли сообщение вскрывшегося абсцесса с бронхом или оно прикрывается, различают пиопневмоторакс с бронхиальным свищом или без него. Если же сообщение бронха легкого с плевральной полостью имеет клапан
ный механизм, то развивается клапанный пио-пневмоторакс. Роль клапана могут выполнять наружная стенка полости абсцесса, детрит, фибрин, отечная слизистая оболочка бронха.
КЛАССИФИКАЦИЯ ЭМПИЕМ ПЛЕВРЫ
Сознавая трудность создания полной и практически значимой классификации эмпием плевры, мы обобщили и частично изменили предложенные ранее классификации В. М. Сергеева (1967), М. И. Кузина и соав^. (1976), Г. И. Лу-комского (1976) и В. И. Маслова (1976).
Подразделение эмпием в зависимости от их этиологии и патогенеза представлено ниже. Из множества факторов, положенных в основу классификации эмпием плевры, важнее всего выбрать те, которые определяют тактику оказания помощи и выбора дальнейших диагностических и лечебных мероприятий. Наиболее существенными определяющими факторами являются наличие или отсутствие деструкции легкого, распространенность процесса, сообщение с внешней средой и характер его, клиническое течение заболевания.
Пиопневмоторакс как одна из разновидностей эмпиемы с деструкцией легочной ткани выделен нами в классификации в связи с особой тяжестью клинических проявлений и своеобразной лечебной тактикой, особенно в начальной стадии заболевания.
Различие острых и хронических эмпием плевры на основании календарного срока заболевания носит противоречивый и условный характер.
По нашему мнению, деление эмпием по характеру течения заболевания имеет важное практическое значение, так как острые и хронические эмпиемы различаются и по клинической картине, и по методам лечения. Основными дифференциальными критериями являются морфологические изменения плевры, особенно висцерального листка, которые определяют возможность или невозможность расправ-
Клиническое течение
Острые (до 3 мес)
Хронические (свыше
3 мес)
Классификация эмпием плевры Определяющим фактор
Деструкция Сообщение с внешней
легкого средой
Эмпиема без деструкции легкого (простая)
Эмпиема с деструкцией лег-
кого
Пиопневмоторакс
Закрытые
Открытые:
с бронхоплевральным свищом
с плеврокожным свищом
с бронхоплеврокожным свищом
с решетчатым легким
с другими полыми органами
Распространенность
Ограниченные
Распространенные
188
Рис. 96, Грануляционная ткань с обилием сосудов и круглоклеточным инфильтратом.
капиллярных
Рис. 97. Зрелая грануляционная ткань с явлениями начинающегося склероза.
Гематоксилип-эозин. Ув. 70.
Гематоксилин-эозип. У в. 140.
ления легкого и ликвидации эмпиемной полости. Многочисленными клиническими наблюдениями и гистологическими исследованиями материала, полученного во время плеврэкто-мий, декортикаций и резекций легкого, доказано, что на 2—3-м месяце от начала эмпиемы на плевре, преимущественно на париетальном листке, имеются значительные фибринные напластования. Воспалительная реакция плевры в эти сроки чаще всего носит уже репаративный характер: прорастают фибробласты, формируется грануляционная ткань. Однако последняя еще не уплотнена, нет зрелых коллагеновых волокон. Грануляционная ткань имеет вид тонкой прослойки из круглых голоядерных клеток между сохранившимися слоями плевры и фибринозно-гнойными напластованиями (рис. 96, 97). В большинстве случаев только с 10—12-й недели начинается интенсивное созревание грануляционной ткани, нарастают склеротические изменения, которые постепенно распространяются с париетальной плевры на грудную стенку, а с висцеральной — на легкое. И лишь к концу 3-го месяца заболевания и далее формируются основные морфологические признаки хронической эмпиемы плевры: ригидная остаточная плевральная полость и плеврогенный склероз легкого [Policard A., Gaby Р., 1970].
Исходя из этого мы считаем оправданным в клинической практике относить к хроническим эмпиемам те случаи, которые продолжаются более 3 мес и имеют характерные клини
ческие признаки — фазность заболевания, т. е. периоды затихания и обострения гнойного процесса. В большинстве случаев в сроки от 1 до 3 мес от начала острой эмпиемы клиническая симптоматика обусловлена остаточными проявлениями гнойной интоксикации и умеренными дыхательными нарушениями, но с отчетливой тенденцией к улучшению. Выбор рационального плана лечения в таких случаях значительно отличается. По данным литературы и нашим клиническим наблюдениям, в сроки до 3 мес от начала заболевания почти всегда имеется реальная возможность добиться клинического выздоровления путем активных консервативных мероприятий. Сроки и исходы лечения больных в этой стадии значительно улучшились с внедрением в клиническую практику современных протеолитических ферментов и методов систематической санации плевральной полости промываниями с активной вакуумной аспирацией. При хронической эмпиеме плевры эти методы позволяют заметно улучшить состояние больного, но ликвидировать остаточную плевральную полость можно только операцией.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ ОСТРОЙ ЭМПИЕМЫ И ПИОПНЕВМОТОРАКСА
Общие проявления в клинике различных форм острой эмпиемы плевры начинаются прежде всего с появления резких болей иа стороне пора-
189
же ни я, с признаков гнойной интоксикации и часто дыхательной недостаточности.
Признаки дыхательной недостаточности при острой эмпиеме плевры обусловлены не только накоплением жидкости в плевральной полости и сдавлением легкого, но и гнойно-деструктивным процессом легочной паренхимы, шунтированием крови из коллабированных отделов легкого, нарушением гемодинамики и бронхоспастическими реакциями.
У всех больных имеются боли в груди, кашель, нередко с выделением значительного количества мокроты, одышка. Одышка может быть выражена в большей или меньшей степени. Естественно, что при большом накоплении жидкости в плевральной полости или пиопневмото-раксе с коллапсом легкого II—III степени одышка будет значительной даже в покое. Однако одышка может наблюдаться и при ограниченной эмпиеме, особенно при базальном гнойном плеврите, когда дыхательные движения заметно ограничены из-за резких болей при глубоком дыхании. Чаще при острой эмпиеме боль в груди носит постоянный ноющий характер, усиливается при глубоком дыхании, кашле, иногда при перемене положения тела. При вовлечении в воспалительный процесс межреберных мышц и нервов болевой синдром напоминает межреберную невралгию.
Из-за болей и одышки положение больного в постели нередко вынужденное. При ограниченной эмпиеме болевой синдром менее выражен и часто больные лежат на больном боку, так как при этом дыхательные экскурсии пораженной половины грудной клетки ограничены. Иногда больные предпочитают полусидячее положение.
Кашель у больных с острой эмпиемой плевры может быть сухим (в начальной стадии гнойного плеврита) или с выделением мокроты. Так как большинство острых эмпием являются вторичными, т. е. осложнениями гнойно-деструктивных заболеваний легких, кашель у этих больных сопровождается выделением значительного количества гнойной мокроты (нередко до 500 мл/сут). При наличии бронхоплеврального свища особенно много откашливается мокроты в положении больного на здоровом боку.
При осмотре больного в большинстве случаев отмечается ограничение дыхательных движений одной половины грудной клетки. При тотальных и распространенных острых эмпиемах плевры нередко имеются сглаженность межреберных промежутков, местный отек кожи и подкожной клетчатки над областью скопления гноя в плевральной полости. Пальпаторно можно определить, что на больной стороне складка кожи несколько толще, чем на симметричных участках грудной клетки, и болезнен
ная. В дальнейшем ткани грудной стенки в этой зоне становятся плотными, усиливается болезненность, появляется гиперемия кожи.
При перкуссии всегда над скоплением жидкости в плевральной полости определяется притупление, причем по распространенности укороченного звука можно ориентировочно судить о количестве экссудата в полости. При отсутствии воздуха и сращений в плевральной полости верхняя граница тупости соответствует линии Эллиса — Дамуазо, а над зоной тупости отмечается тимпанический звук из-за сдавления части легкого (признак Шкоды). При ограниченной эмпиеме с небольшим скоплением гноя в полости перкуторные данные скудны.
При аускультации отмечается ослабление везикулярного дыхания вплоть до полного отсутствия его над большим количеством жидкости в полости. Над зоной поджатого легкого— бронхиальное дыхание, иногда выслушиваются разнокалиберные влажные хрипы, может быть слышен шум трения плевры из-за фибринозного плеврита вокру! полости эмпиемы. Если имеется бронхоплевральный свищ и полость хорошо дренируется через бронх, то может выслушиваться амфорическое дыхание. Очень характерно усиление бронхофонии над областью скопления жидкости.
Степень гнойной интоксикации может быть различной, начиная от легкой до тяжелой и даже септической формы. Она зависит преимущественно от распространенности гнойного процесса, вирулентности микрофлоры и индивидуальной реактивности больного. В большинстве случаев заболевание начинается с повышения температуры тела, недомогания, познабливания, ухудшения аппетита. Так как эмпиема плевры чаще всего является вторичным заболеванием, эти признаки нередко объясняют обострением воспалительного процесса в легком, нагноением раны после ранения или оперативного вмешательства. В течение нескольких дней температурная реакция как один из важнейших признаков гнойно-резорбтивного процесса становится ремиттирующей, появляются ознобы. При гнилостной эмпиеме лихорадка часто имеет гектический характер с суточными колебаниями около 3 °C, сопровождается резкими ознобами, потливостью, тяжелым общим состоянием, иногда рвотой. В связи с широким применением антибактериальных препаратов для лечения воспалительных заболеваний гектнческая температура в последние годы наблюдается нечасто. У большинства больных эмпиемой плевры температура повышается до 384-38,5 °C, причем она сохраняется без значительных колебаний в течение нескольких суток. Нередко температурная реакция является единственным насторажи
190
вающим признаком, требующим проведения повторного рентгенологического исследования и плевральной пункции с целью обнаружения скопления гноя.
У многих больных с острой эмпиемой плевры гнойная интоксикация проявляется нервно-психическими расстройствами различной степени выраженности: от головных болей, раздражительности, бессонницы, быстрой утомляемости до психомоторного возбуждения, делириозного синдрома, комы.
Гнойная интоксикация приводит к дистрофии миокарда и энергодинамической недостаточности сердца (Василенко В. X., 1960]. Одновременно может развиться сосудистая недостаточность из-за нарушения функции надпочечников. Сердечно-сосудистая недостаточность проявляется тахикардией, неприятными ощущениями в области сердца, сердцебиением, артериальной гипотензией и замедлением циркуляции, акроцианозом. При обследовании определяется глухость тонов сердца, иногда экстрасистолия, на верхушке сердца выслушивается систолический шум. В последующем при сохранении гнойной интоксикации развивается легочно-сердечная недостаточность с нарастающей декомпенсацией кровообращения и гипертензией в малом круге, о чем свидетельствуют акцент II тона на легочной артерии, надчревная пульсация в связи с гипертрофией правого желудочка, сдвиг электрической оси сердца вправо на электрокардиограмме.
Как следствие гнойной интоксикации появляются признаки нарушений функций органов, богатых ретикулоэндотелиальной тканью (печень, почки, селезенка, костный мозг), так как именно они принимают основное участие в дезинтоксикации организма. При обследовании больных определяется увеличение печени, иногда небольшая иктеричность склер и кожных покровов. Появляются признаки нарушения белковообразующей функции печени (значительное уменьшение альбумина), уменьшается содержание холестерина, протромбина, значительно повышается содержание трансаминаз и фибриногена. Некоторые больные отмечают ноющие боли в поясничной области, усиливающиеся припоколачивании в области почек. У многих больных с острой эмпиемой выявляются признаки токсической нефропатии в виде умеренной протеинурии, лейкоцитурии, микрогематурии и цилиндрурии, иногда отмечается гипо-изостенурия. Воздействие интоксикации на ретикулоэндотелиальную систему костного мозга приводит к значительному угнетению эритропоэза и к нарастанию анемии, несмотря на проводимую терапию.
Убедительными признаками гнойной интоксикации являются лейкоцитоз и изменение лей
коцитарной формулы. В типичных случаях острой эмпиемы плевры наблюдаются повышение числа лейкоцитов до (154-20) - 109/л при значительном нейтрофилезе (свыше 80 %) и повышение лейкоцитарного индекса интоксикации по Я. Я. Кальф-Калифу в среднем до 7,0+0,8 [Костюченко А. Л. и др.. 1983]. При дальнейшем нарастании гнойно-деструктивного процесса в плевре абсолютное число лейкоцитов может уменьшиться, но сохраняется нейтрофи-лез, развивается лимфопения, что является неблагоприятным прогностическим признаком.
Большое значение в оценке состояния больных с острой эмпиемой имеют признаки белковых, электролитных и волемических нарушений. Небла! ©приятное влияние на развитие и течение острой эмпиемы плевры оказывают три основополагающих фактора: фактор нагноения, фактор резорбции и фактор потерь белка. Воздействие этих факторов приводит к гипоальбуминемии и диспротеинемии, которые являются ведущим компонентом в развитии волемических, электролитных расстройств, а также иммунологических нарушений. Чем интенсивнее нагноение плевры и легочной ткани, тем больше белковые потери, отчетливее диспротеинемия и уменьшение абсолютного количества альбуминов, тем быстрее развиваются расстройства водно-электролитного обмена. В первый период развития эмпиемы организм еще компенсирует уменьшение количества альбумина повышением глобулинов. По мере утяжеления состояния глобулины не могут уже покрыть дефицита альбумина. Это приводит к нарушению коллоидно-осмотических свойств плазмы, способности ее удерживать воду. Абсолютное содержание натрия плазмы вначале несколько понижено (соответствует снижению плазменного объема), а затем повышается. Гипернатрийплаз-мия объясняется увеличением секреции альдостерона, так как у таких больных под влиянием длительной гипоксии развивается гиперплазия клубочковой зоны коры надпочечников [Клименко Г. А. и др., 1965]. При тяжелом течении увеличивается калий плазмы, что объясняется распадом тканей и гибелью клеток. Во всех фазах имеется отчетливая гипокалийурия, обусловленная потерями калия с гноем. Гипонатрий-урия объясняется задержкой натрия в тканях.
Изменения водных секторов прогрессируют по мере утяжеления процесса. Постепенно происходит расширение всех водных секторов, что проявляется вначале скрытыми отеками, а в дальнейшем — явными.
В клинической картине некоторых форм острой эмпиемы плевры, кроме признаков дыхательной недостаточности, гнойной интоксикации и типичных данных физикального обследования, имеются дополнительные симптомы.
191
При ограниченной эмпиеме клиника во многом определяется локализацией скопления гноя. При этом различают верхушечное, пристеночное, наддиафрагмальное, междолевое и парамедиастинальное расположение гнойника.
При верхушечной эмпнеме могут наблюдаться отечность надключичной области и плеча, плексит, иногда триада Горнера. Эти симптомы развиваются в связи с вовлечением в воспалительный процесс регионарных лимфатических и венозных сосудов, а также нервных стволов.
Для пристеночных эмпием характерны более выраженные болевые ощущения и ограничение амплитуды дыхательных движений на стороне поражения, сглаженность межреберных промежутков, отечность подкожной клетчатки, укорочение перкуторного звука и ослабление дыхания над областью скопления гноя.
При базальной (наддиафрагмальной) эмпиеме боли чаще бывают в нижней части грудной клетки и в подреберье. Они усиливаются при глубоком вдохе, нередко иррадиируют в область шеи н плеча. Иногда боли иррадиируют в эпигастральную область и подреберье из-за раздражения нижних межреберных нервов. В связи с этим иногда бывает трудно дифференцировать базальную эмпиему от поддиафрагмального абсцесса и других хирургических заболеваний органов брюшной полости.
Парамедиастинальная эмпиема может проявляться симптомами сдавления верхней полой вены.
В дифференциальной диагностике ограниченных эмпием плевры важное значение имеют рентгенологические методы исследования и пункции плевральной полости.
Клиническое течение посттра в м этических острых эмпием определяется прежде всего характером повреждения грудной стенки, легкого и других внутренних органов.
При закрытых травмах груди, ранениях без повреждения легкого и с незначительным повреждением тканей грудной стеикн эмпиема развивается как нагноение гемоторакса. Клиническая картина в таких случаях типичная, течение относительно благоприятное.
Эмпиема плевры после ранений с повреждением легкого протекает более тяжело, что обусловлено степенью повреждения легкого, наличием и характером бронхоплевральных сообщений. Чаще всего гнойный процесс начинается в плевральной полости как нагноение инфицированного гемоторакса. Однако нагноение может развиваться и в плевре, и в поврежденном легком. Клиническая картина в таких случаях соответствует клинической картине эмпиемы, протекающей с деструкцией легкого.
В некоторых случаях гнойный процесс начинается с нагноения ушитой раны грудной стенки, а в дальнейшем развивается пиопневмоторакс.
Наиболее тяжело протекают эм пнем ы после ранений с широко открытым пневмотораксом. Гнойный процесс в таких случаях характеризуется бурным клиническим течением по типу раневого сепсиса, переходит на грудную стенку с развитием флегмоны. Прогноз часто неблагоприятный.
Клиническая симптоматика послеоперационных эмпием зависит ие только от степени загрязнения плевральной полости, но и от характера перенесенного вмешательства, анатомических взаимоотношений органов в итоге сложных торакальных операций и наличия сообщения с легким или другими органами. В связи с этим различают 4 группы послеоперационных эмпием плевры: 1) после пневмонэктомии; 2) после частичной резекции легкого; 3) после операций на пищеводе; 4) после кардиохирургических и других операций без повреждения легкого и других полых органов. Особенности клинического течения и диагностика этих форм острых эмпием плевры будут рассмотрены дальше.
Анаэробные эмпиемы плевры отличаются крайне тяжелым течением. Они могут быть молниеносными, быстропрогрессирующими и торпиднымн. Молниеносные и быстро-прогрессирующие формы анаэробной эмпиемы протекают с резчайшей интоксикацией, тахикардией до 120—140 уд/мин, гектической температурой тела, психоэмоциональными расстройствами вплоть до коматозного состояния.
Торпидные формы анаэробной эмпиемы тоже отличаются тяжелой общей интоксикацией. Отмечаются резкая бледность, желтушность склер и кожи, нарастающая одышка. При осмотре чаще выявляются отек подкожной клетчатки и кожи на пораженной стороне грудной клетки, усиление болезненности по ходу межреберий. При газообразующих формах анаэробных возбудителей можно уже в ранних стадиях обнаружить при аускультации характерный хруст газа в подкожной клетчатке грудной клетки.
Важную роль в диагностике анаэробной эмпиемы играет пункция плевральной полости, при которой из иглы выделяется зловонный газ. Гной обычно грязно-серого цвета, иногда с геморрагическим оттенком, всегда с гнилостным запахом. Диагноз подтверждается специальными бактериологическими исследованиями.
Клиническая картина пиопневмоторакса определяется, прежде всего, распространенностью гнойного процесса в плевральной полости, степенью деструкции легкого и
192
характером бропхоплевральных сообщений. По тяжести клинического течения различают острую, мягкую и стертую формы пиопневмоторак-са (Спасокукоцкий С. И., 19381.
Острый пиопневмоторакс наступает при прорыве гнойно-деструктивного очага легкого в свободную плевральную полость. Чаще всего это встречается при острых абсцессах и гангрене легкого, когда плевральная полость у больных не заращена.
Перфорация абсцесса происходит нередко во время сильного кашля и проявляется острыми болями в груди, резчайшей одышкой, бледностью кожных покровов, липким потом, цианозом кожи и слизистых оболочек. Артериальное давление при этом снижается до 50—70 мм рт. ст., пульс становится нитевидным.
Наиболее тяжело острый пиопневмоторакс протекает при сочетании с напряженным пневмотораксом. Из-за нарастающей одышки положение больного становится вынужденным — обычно он сидит, оперевшись руками о край кровати. Одна половина грудной клетки меньше участвует в акте дыхания, межреберные промежутки расширены, голосовое дрожание ослаблено, перкуторно определяется коробочный звук, при аускультации — бронхиальное дыхание с амфорическим оттенком. Иногда шок и легочно-сердечная недостаточность нарастают так стремительно, что спасти больного может только экстренное хирургическое вмешательство.
Если клапанного механизма нет, то состояние больного постепенно стабилизируется, гемодинамические нарушения и дыхательная недостаточность несколько уменьшаются. Дальнейшее течение заболевания в основном зависит от течения гнойно-деструктивного процесса в легком. Если острый пиопневмоторакс развился на фоне гангрены легкого, то она будет иметь тенденцию к ухудшению. Если же острый пиопневмоторакс явился осложнением острого абсцесса, то нередко после опорожнения гнойника в плевральную полость деструктивный процесс в легком стихает, а после эвакуации гноя из полости плевры наступает улучшение. В дальнейшем течение эмпиемы будет зависеть от характера сообщения плевральной полости с бронхом, а следовательно, возможности расправления легкого.
Мягкая форма пиопневмоторакса развивается при перфорации в плевральную полость небольшого периферического абсцесса легкого. Больные отмечают усиление болей в груди, одышки и кашля, повышение температуры тела и другие признаки умеренной гнойной интоксикации. Так как сообщения с крупным бронхом в таких случаях, как правило, нет и воздух поступает в плевральную полость в небольшом количестве, процесс локализуется в основном
в зоне прорыва гнойника. Это ведет к ограниченному пиопневмотораксу.
Стертая форма пиопневмоторакса может быть при прорыве небольшого деструктивного очага легкого в хорошо отграниченную спайками часть плевральной полости. Чаще это встречается при хронических нагноительных заболеваниях легких. Перфорация гнойника в полость может произойти незаметно для больного. Клиническая картина будет определяться в основном предшествующими изменениями в легком.
Внешний вид больного при ограниченном пиопневмотораксе обычно не изменяется. Физикальные данные разнообразны. Голосовое дрожание на стороне поражения ослаблено. Как правило, определяется укорочение перкуторного звука вплоть до абсолютной тупости над зоной скопления экссудата. Выше зоны укороченного перкуторного звука будет зона тимпанита, причем взаиморасположение участков тупости и тимпанита меняется при изменении положения больного. Дыхание над жидкостью ослаблено или не прослушивается.
Нередко ограниченный пиопневмоторакс диагностируется только при рентгенологическом обследовании, когда определяются более или менее выраженное коллабирование легкого и часто горизонтальный уровень жидкости в плевральной полости. Величина и форма эмпиемной полости зависят от наличия и характера сращений между париетальной и висцеральной плеврой, от количества гноя и воздуха, поступивших в полость, а также от эластичности легочной ткани. Иногда в плевральной полости сразу же образуются множественные горизонтальные уровни, так как спайки удерживают легкое от полного спадения и разграничивают полость на несколько частично или полностью изолированных камер (многокамерный пиопневмоторакс).
Дальнейшее течение заболевания при ограниченном пиопневмотораксе, как и при распространенном, определяется характером нагноительного процесса в легком и наличием бронхоплеврального сообщения. Возможны следующие клинические варианты. У одних больных нагноение легочной тканн после перфорации прогрессирует, нарастает гнойный процесс в плевральной полости и сохраняется бронхоплевральное сообщение. У других больных абсцесс легкого частично опорожняется в плевру, легкое спадается и бронхоплевральное сообщение закрывается; гнойный процесс продолжается и в легком, и в плевральной полости, но без сообщения между ними. У некоторых больных абсцесс легкого опорожняется полностью и гнойный процесс в нем регрессирует; сохраняется бронхоплевральный свищ; клини-
13 Зак 0517
193
Рис. 98. Левосторонняя эмпиема плевры.
а прямая рентгенограмма; б — боковая рентгенограмма. Видно скопление жидкости в заднебазальных отделах грудной полости.
ческая картина определяется в основном эмпиемой плевры. Наконец, у части больных после опорожнения абсцесса дефект на поверхности легкого закрывается и заживает, гнойный процесс регрессирует после аспирации гноя и воздуха из плевральной полости.
В диагностике острой эмпиемы плевры и пио-пневмоторакса большое значение имеют рентге
нологические, инструментальные, эндоскопические и лабораторные методы исследований.
Важнейшими в исследовании больных острой эмпиемой плевры являются рентгенологические методы: рентгеноскопия, рентгенография, латероскопия и латерография, плеврография, фистулография, томография и бронхография.
Рентгеноскопия дает возможность определить объем и локализацию жидкости в плевральной полости, провести ряд функциональных тестов. Так, при ограниченных эмпиемах определяются тени различной формы (округлой, полушаровидной, треугольной) в зависимости от локализации скоплений гноя и характера сращений в плевральной полости. Важно отметить изменение контуров тени при изменении положения тела, при дыхательных движениях. Многоосевое исследование позволяет определить наиболее удачное место для пункции плевральной полости (рис. 98).
При отсутствии сращений в плевральной полости значительное количество экссудата (более 300 мл) определяется в виде характерной треугольной тени с дугообразной (косой) верхней границей в прямой проекции при вертикальном положении больного. Интенсивность тени изменяется при дыхании. При большом количестве жидкости происходит смещение средостения в здоровую сторону, что особенно заметно при вдохе. При затенении всей половины грудной клетки иногда можно выявить более светлый участок овальной формы в медиальном отделе подключичной области, где находится поджатое экссудатом легкое. Прозрачность этого участка изменяется при глубоком дыхании больного.
Значение рентгеноскопии при обследовании больных эмпиемой плевры особенно велико в связи с возможностью частых повторных исследований, иногда даже два раза в день — до и после пункции.
Рентгенография позволяет регистрировать эти изменения. На рентгенограммах видны более тонкие структурные изменения в плевральной полости и в легком, особенно после аспирации гноя.
Исследование в вертикальном положении позволяет определить лишь поперечные размеры гнойной полости. Для оценки ее вертикальных размеров необходимо исследовать в латеро-позиции (рис. 99), когда экссудат перемещается вниз от купола диафрагмы в наружные отделы грудной клетки и образует горизонтальный уровень (феномен Ленка). При этом можно обнаружить даже небольшое количество жидкости (100—150 мл), что очень важно для дифференциальной диагностики с плевральными спайками или облитерацией полости в зоне реберно-диафрагмального синуса (Фрид-
194
Рис. 99. Левосторонняя тотальная острая эмпиема.
а - прямая рентгенограмма; б боковая рентгенограмма; в рентгенограмма в латеропозиции.
кин В. Я., 1962]. Латероскопия и особенно латерография в положении на стороне поражения дают возможность также выявить характер патологических изменений в нижних отделах легкого, которые были прикрыты плевральной жидкостью при исследовании в вертикальном положении. Кроме того, используя методику «перемещения газового пузыря» [Санпитер И. А., 1976] при пиопневмотораксе или путем пункционного введения небольшого количества воздуха в остаточную полость, рентгенограммы в положении на боку, на спине и на животе позволяют оценить все стенки полости эмпиемы.
Для уточнения размеров полости и конфигурации ее стенок используется плеврорентгенография после введения рентгеноконтрастных веществ пункционно или через дренаж.
В ряде случаев острая эмпиема протекает по типу фибринозно-гнойного плеврита и уже в начале заболевания определяется резкое утолщение стенок полости, причем утолщение париетальной плевры чаще всего обусловлено фиб-ринными напластованиями, а утолщение висцеральной плевры отражает суммацию тени умеренных напластований фибрина и коллабиро-ванной легочной паренхимы. Конгломераты фибрина на плевре могут быть самой различной формы, они могут образовывать многочисленные мелкие полости с уровнями экссудата (рис. 100).
У некоторых больных стенки эмпиемной полости остаются тонкими и ровными длительное время по типу пиогенной капсулы. Иногда плеврорентгенография позволяет выявить нали-
13 *
195
Рис. I (JO. Правосторонняя эмпиема плевры с множествен-
ными уровнями жидкости и частичным коллапсом легкого.
Рис. 101. II. ie npoi ра м ма (фи с туя см ра м ма) п ри эм п и е ме плевры с бропхоплеврокожным свищом после пневмонэктомии.
чие, локализацию и даже размеры бронхиальных свищей.
При эмпиеме с плеврокожным свищом важную информацию можно получить используя фистулографию (рис. 101).
С целью оценки характера и распространенности деструктивного процесса в легком важно томографическое исследование. По томограммам можно уточнить также характер изменений стенок плевролегочной или плевральной полости. В ряде случаев для оценки патологических изменений бронхиального дерева и уточнения локализации бронхиального свища проводится бронхография после тщательной санации бронхиального дерева и полости эмпиемы. Томография и бронхография позволяют решить вопрос об объеме предстоящего оперативного вмешательства, особенно при хронической эмпиеме плевры.
Пункция пзевры должна быть произведена во всех случаях, когда при физикальном или рентгенологическом обследовании больного возникло подозрение на наличие гноя или экссудата в полости.
Методика проведения плевральной пункции общеизвестна и в типичных случаях проста. Обычно при метапневмонической эмпиеме пункцию плевры производят в восьмом межреберье по задней подмышечной линии. При атипичной локализации гноя и ограниченной эмпиеме плевры точку для пункции необходимо наметить при тщательном физикальном обследовании и многоосевой рентгеноскопии. Плевра тьную жидкость максимально аспирируют, при этом определяют количество ее, цвет, запах, наличие
хлопьев. После аспирации экссудата необходимо установить наличие или отсутствие вакуума в полости. В сомнительных случаях проводят манометрию плевральной полости, для чего к пункционной игле присоединяется манометр пневмотораксного аппарата. Осуществляя поочередно аспирацию воздуха и манометрию, можно ориентировочно судить о диаметре сообщения с бронхом. Аспирацию гноя завершают обильным промыванием плевральной полости любым антисептическим раствором.
Первое суждение о характере процесса в полости можно сделать по виду плевральной жидкости. Прозрачный, слегка опалесцирующий желтоватый экссудат будет при серозном плев рите, геморрагический экссудат часто свидз тельствует о карциноматозе плевры или ин фаркт-пневмонии, мутный экссудат — об эмпи еме плевры. При пневмококковой эмпиеме гной желтый, вязкий, нередко ослизненный, пр' стрептококковой — сероватого цвета, водяш сто-жидкий, при стафилококковой — желтьп сливкообразный, при гнилостной — грязно серый, с резким запахом, иногда с геморрагическим оттенком, при анаэробной — зловонный. Чем длительнее существует эмпиема, тем гуще становится гной, особенно в нижних отделах полости.
Посев экссудата обычно осуществляют на жидкую питательную среду и ставят в термостат при 37 С на сутки. Затем пересевают материал на чашки Петри с 5 °о кровяным агаром и укладывают диски с антибиотиками. Еще через сутки жспозиции в термостате учитывается
196
результат. Идентифицировать микрофлору можно при микроскопии отдельных колоний из чашки Петри. В хиругической практике заслуживает внимания метод Г. И. Богословского (1972): пунктат засевают на чашку Петри с 5 °0 кровяным агаром и в пробирку с сахарным бульоном. Чашку и пробирку помещают на 2—3 ч в термостат, затем тампоном или петлей подсевают на чашку материал из пробирки и сразу же размещают на агар диски с антибиотиками. Через 12 ч экспозиции в термостате можно учитывать результат. Этот метод сокращает срок исследования до 1 сут.
Однако бактериологические исследования гноя нередко оказываются безрезультатными. По данным нашей клиники, классическими методами в аэробных условиях при первом посеве гноя из плевральной полости не получен рост микроорганизмов у 48,3 % больных, при трехкратном посеве — у 37,4 °0. В таких случаях важное значение имеет бактериоскопия мазка из осадка экссудата при специальной окраске его. По количеству микробов в мазке экссудата и активности фагоцитоза можно судить о характере течения гнойного процесса, особенно при повторных исследованиях.
Большое значение для дифференциальной диагностики процесса по характеру экссудата имеет цитоморфологическое исследование осадка плевральной жидкости. Чаще всего в экссудате определяются нейтрофилы, моноциты, лимфоциты, гистиоциты, плазматические клетки, клетки мезотелия и др. При нарастающем воспалительном процессе в плевре число лейкоцитов экссудата увеличивается до их содержания в циркулирующей крови, а при гнойном плеврите лейкоцитоз экссудата значительно превышает количество лейкоцитов крови. Чем больше нейтрофилез экссудата (80 % и более от числа всех клеток), тем более выражен воспалительный процесс. При нейтрофилезе свыше 90 % и значительных дегенеративных изменениях клеток следует диагностировать эмпиему.
Биохимические исследования экссудата менее информативны. Имеет значение лишь изучение содержания белков и их фракций, сахара, электролитов, диастазы и холестерина. Однако и эти показатели можно учитывать только при их корреляции с данными клинического течения заболевания.
Бронхоскопия при эмпиеме является косвенным методом исследования. По степени воспалительных изменений слизистой оболочки бронхов можно судить о характере гнойнодеструктивного процесса в легком, ориентировочно определить локализацию бронхиального свища (по количеству гноя, аспирируемого из доли или сегмента). Точнее можно определить местоположение бронхиального сообщения.
если ввести в полость эмпиемы раствор метиленового синего, придать больному дренажное положение на 20—30 мин, а затем выполнить бронхоскопию. При бронхоплевральном сообщении бронхоскопия должна выполняться только при сохраненной проходимости плеврального дренажа.
Торакоскопия (особенно современным аппаратом модели Фриделя) позволяет детально оценить внутреннюю поверхность эмпиемной полости, ее границы, характер плевральных напластований, а также способность подлежащих отделов легкого к расправлению (по подвижности внутренней стенки полости).
Важной задачей обследования больных эмпиемой плевры является установление степени функциональных нарушений дыхания и кровообращения, так как это нередко имеет решающее значение в определении лечебной тактики, особенно при выборе того или иного вида хирургического вмешательства. Наиболее существенными из них являются спирография, определение газового состава крови и кислотно-основного состояния, электрокардиография и интегральная реография тела по М. И. Тищенко (1971). Уменьшение ЖЕЛ и МВЛ при спирографии более чем на 25 30 °о от дотжных величин, снижение КИО ниже 25,0 при снижении насыщения артериальной крови кислородом менее 90 % и сокращении артериовенозной разницы по кислороду требуют особого внимания при определении показаний к сложному хирургическому вмешательству.
Электрокардиография должна выполняться у всех больных в динамике заболевания.
Интегральная реография тела позволяет получить более информативные данные оценки производительности сердца. В тяжелых случаях эмпиемы наблюдаются уменьшение ударного объема крови, увеличение коэффициента дыхательных изменений его [Колесников И. С. и др., 19811.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ОСТРОЙ ЭМПИЕМЫ
Хотя в типичных случаях диагностика острой эмпиемы плевры несложна, однако примерно 25—33 % больных поступают в хирургическую клинику с ошибочным диагнозом [Стручков В. И. и др., 1966; Муромский Ю. А. и др., 1968; Лукомский Г. И., 197б|.
Трудности дифференциальной диагностики с пневмонией обусловлены тем, что острая эмпиема часто является осложнением пневмонии, протекающей с явлениями большего или меньшего затенения легочного поля при рентгеноло-
197
гическом исследовании. Если при этом имеется смещение средостения в здоровую сторону, следует думать об эмпиеме. Если же средостение не смещено (что возможно при ограниченной эмпиеме), то диагностика значительно труднее. При эмпиеме плевры в таких случаях чаще можно выявить частичное выбухание и расширение межреберных промежутков, локальные боли при пальпации, ослабление голосового дрожания, притупление легочного звука, ослабленное дыхание, усиленную бронхофонию. Иногда межреберные промежутки, наоборот, сужены и уплощены, но в отличие от ателектаза легких средостение не смещено или слегка смещено в здоровую сторону. Решающее значение в дифференциальной диагностике имеют многюосевая рентгеноскопия, томография легких и пункция плевральной полости.
Трудности в дифференциальной диагностике с ателектазом легкого возникают в связи с тем, что и при обтурационном ателектазе бывает выпот в плевральную полость, а компрессионный ателектаз может быть следствием сдавления части легкого плевральным экссудатом. Ведущими в диагностике являются бронхоскопия (при обтурационном ателектазе) и пункция плевральной полости (при компрессионном коллапсе). В ряде случаев помогают разобраться суперэкспонированные рентгенограммы и томограммы; при обтурационном ателектазе периферические отделы менее интенсивно затенены, чем центральные, при компрессионном — интенсивность тени преобладает на периферии из-за суммации тени жидкости и слоя поверхностного коллапса легочной паренхимы. Иногда на суперэкспонированных рентгенограммах видны дополнительные линейные или дугообразные вертикальные тени на фоне сплошного затенения этой половины грудной клетки. Наличие этого симптома дает основание исключить не только ателектаз, но и опухоли плевры.
Очень трудной является дифференциальная диагностика ограниченной базально-пристеночной эмпиемы и ателектаза базальной пирамиды, так как при этих состояниях нередко имеются сходные рентгенологические признаки: затенение нижних отделов грудной полости, смещение сердца в сторону поражения и подъем диафрагмы. Для дифференциальной диагностики необходимы пункция плевральной полости и бронхоскопия.
Опухоли легких могут проявляться в виде периферического затенения легочного поля с переходом на грудную стенку, что может быть поводом для ошибочного диагноза ограниченной эмпиемы. При отсутствии клиники гнойного процесса основным методом диагностики будет трансторакальная пункционная биопсия легочной ткани.
Опухоли плевры по характеру затенения иногда напоминают эмпиему, особенно при большой площади соприкосновения с грудной стенкой. Однако при эмпиеме плевры характер тени изменяется при изменении положения больного. Важное значение в дифференциальной диагностике имеют анамнез и клиническая картина заболевания: при опухоли плевры могут быть субфебрильная температура тела и недомогание, но нет выраженных признаков гнойной интоксикации.
Опухоли и кисты средостения могут представлять трудности при дифференциальной диагностике с парамедиастинальной ограниченной эмпиемой плевры. Важное место в диагностике опухолей и кист средостения имеют многоосевая рентгеноскопия и томография, в некоторых случаях — пневмомедиастинография.
Плевральные шварты очень часто являются поводом для предположения о наличии ограниченных эмпием, особенно при сочетании с клиникой воспалительного процесса органов дыхания. Трудно дифференцировать ограниченную эмпиему и острый фибринозный плеврит, нередко развивающийся при периферических воспалительных очагах в легком. Диагноз уточняется при пункциях плевры (нередко многократных), плеврографии и бронхографии.
Абсцесс легкого, абсцедирующие пневмонии, особенно при наличии нескольких полостей, очень часто представляют значительные трудности при дифференциальной диагностике с острой эмпиемой плевры в связи с общностью клинической и рентгенологической картины. Решающее значение в дифференциальной диагностике имеет бронхография: оттеснение бронхиальных ветвей, их деформация характерны для эмпиемы плевры, а обрыв их у полости свидетельствует об абсцессе легкого.
Кисты легкого могут вызывать трудности в дифференциальной диагностике при редко встречающейся субплевральной локализации, тем более, что нагноившаяся киста иногда осложняется эмпиемой плевры. В типичных случаях кисты легкого (и неспецифические, и паразитарные) чаше множественные, с тонкими ровными стенками, иногда с наличием обызвествления.
Диафрагмальные грыжи, особенно посттравматические, могут быть причиной диагностических ошибок, так как при них в груди выявляется полость или полости с уровнем жидкости, часто пристеночно. Диагностика затруднена именно в тех случаях, когда имеются клинические признаки пневмонии. Однако при детальном обследовании выявляется деформация диафрагмы, иногда дополнительные тени в грудной клетке, обусловленные кишечными гауст-рами, сальником. Характерно значительное из
198
менение этих теней при исследовании на лате-роскопе. Основным в дифференциальной диагностике является контрастное исследование желудочно-кишечного тракта.
ЛЕЧЕНИЕ ОСТРОЙ ЭМПИЕМЫ
Лечение больных острой эмпиемой плевры должно состоять из мероприятий местного и общего характера.
ОБЩЕЕ ЛЕЧЕНИЕ
Дезинтоксикационная терапия в той или иной степени показана во всех случаях, когда заболевание сопровождается синдромом гнойной интоксикации. Учитывая патогенез эндогенной интоксикации при острой эмпиеме плевры, дезинтоксикационную терапию проводят в следующих основных направлениях.
Во-первых, она направлена на выведение из организма токсических веществ. С этой целью применяют обильное питье и инфузионную терапию. Последняя проводится преимущественно внутривенной инфузией изотонических растворов солей, глюкозы и дезинтоксикациониых средств (гемодеза и др.). Количество и темп введения жидкостей устанавливают в зависимости от клинического состояния больного и волемических нарушений.
Во-вторых, она направлена на коррекцию микроциркуляции в тканях и органах, на устранение гиповолемии внутривенным введением реологически активных низкомолекулярных растворов типа реополиглюкина, реомакродек-са и т. п. Эти препараты назначают по 500 мл через день или ежедневно (при значительной интоксикации и гиповолемии). Суточная доза их ограничивается в связи с побочным действием.
Ускорение выведения токсических веществ с мочой особенно эффективно достигается введением реологически активных препаратов и форсированным диурезом. Форсированный диурез вызывается маннитом или фуросемидом (лазиксом). Проведение форсированного диуреза не всегда безопасно из-за тяжелых волемических нарушений и возможной дезорганизации электролитного обмена.
Следует избегать чрезмерной гиперволемии и гипергидратации из-за опасности декомпенсации кровообращения с развитием отека легких, головного мозга. Нельзя допускать также значительной гиповолемии и дегидратации с падением артериального давления в связи с опасностью уменьшения диуреза вплоть до анурии, появления флеботромбозов нз-за гемоконцентрации, угрожающих эмболиями сосудов малого круга кровообращения.
За последние годы вновь больше внимания уделяется методам внепочечного кровоочищения при проведении дезинтоксикационной терапии, в частности гемосорбции. Сорбционным методом можно удалить из крови не только микробные токсины и микробные тела, но и эндогенные токсины, метаболиты.
Учитывая значительные потери белков, электролитов и жидкости при тяжелых формах острой эмпиемы плевры, удовлетворительная коррекция развивающихся расстройств возможна только при использовании принципов и методов парентерального питания. Вводятся альбумин, протеин, плазма, свежеконсервированная кровь. Готовые белки плазмы утилизируются организмом через 16—26 дней, однако они имеют важную роль в поддержании онкотического давления в сосудистом русле и этим улучшают возможности коррекции волемических расстройств.
Чаще всего используются аминокислотные смеси (полиамин, мориамин) и белковые гидролизаты (аминопептид, гидролизат казеина и др.) из расчета 1—2 г белка на 1 кг массы тела. Энергетические потребности обеспечиваются, в основном, 20—40—50 % растворами глюкозы (примерно 15—25 ккал/кг массы) в зависимости от волемических расстройств. В глюкози-рованные растворы обязательно добавляют инсулин, некоторые электролиты (калнй, магний, кальций, фосфор) и витамины для лучшего усвоения вводимого азота и более полноценного белкового синтеза.
Как источник энергии иногда используют жировые эмульсии (интралипид, липофундин и др.), этиловый спирт (1—1,5 г/кг через день или ежедневно). Усвоение вводимого азота повышается при использовании анаболических гормонов (нероболил, ретаболил).
Общая антибактериальная терапия является важным звеном комплексного лечения острой эмпиемы плевры. Она может быть успешной только при достаточном дренировании гнойной полости и рациональном назначении антибактериальных препаратов, включая и местное, и общее лечение, используя при этом антисептики, антибиотики и иммунные препараты.
Местное антибактериальное лечение заключается прежде всего в тщательном систематическом промывании гнойной полости антисептическими растворами с последующим внутриплевральным введением антибиотиков для подавления вегетации микроорганизмов на стенках полости. При простой эмпиеме плевры (без деструкции легочной тканн) этого бывает достаточно для достижения успеха. Однако, учитывая вторичный характер подавляющего числа Эмпием плевры, в большинстве случаев необходимо проводить и общую антибактериальную терапию. Большое значение имеет пра
199
вильный подбор антибиотиков соответственно чувствительности возбудителей гнойного процесса у данного больного. Если посевы гноя отрицательные, то оправданно назначение антибиотиков широкого спектра действия. Чаще всего комбинируют препараты двух групп — аминоглюкозиды (гентамицин, амикоцин, кана-мицин) с полусинтетическими пенициллинами (метициллин, оксациллин, ампициллин, кар-бенциллин). Нередко хороший эффект можно получить при назначении цефалоспоринов, линкомицина.
При подозрении на анаэробную эмпиему необходимо назначить антибиотики пенициллинового ряда, левомицетин, линкомицин в зависимости от вида возбудителя. Так, пептококки, пептострептококки, фузобактерии в большинстве случаев чувствительны к пенциллину, левомицетину, цефалоспоринам, клиндамицину, линкомицину, менее чувствительны к эритромицину и тетрациклину, не чувствительны к аминоглюкозидам и полипептидам (полимиксин, колимицин). Бактероиды чувствительны к левомицетину, линкомицину, клиндамицину, карбенициллину и доксициклину, в меньшей степени — к тетрациклинам и цефалоспоринам, не чувствительны к пенициллинам, аминоглюкозидам и полипептидам (Ивченко В. Н., Мельник В. М., 19831. При анаэробной эмпиеме доказана необходимость назначения метронидазола, обладающего бактерицидным действием на большинство анаэробов, за исключением корине-бактерий, актиномицетов. Препарат назначают по 500 мг 3—4 раза в день [Вишневский А. А. и др., 1980; Сажин В. П. и др., 19811. Таким же действием обладают тинидазол или орнидазол.
Чаще всего курс лечения избранной комбинацией антибиотиков продолжают 5—7 дней. При отсутствии эффекта необходимо сменить антибиотики, обязательно учитывая при этом результаты повторных бактериологических исследований.
Важное значение в общей антибактериальной терапии имеет назначение иммунных препаратов. Начинают с пассивной иммунизации введением поливалентного иммуноглобулина. Препарат вводят внутримышечно по 3 мл через 1 —2 дня, всего 3—5 инъекций. Б. В. Петровский и Ч. С. Гусейнов (1971) рекомендуют вводить иммуноглобулины по 12—15 мл (0,2 мл/кг массы тела) с повторными инъекциями через 2 нед, так как этот срок введенный у-глобулин сохраняется в циркулирующей крови. При значительной недостаточности антител в крови по рекомендации Комитета экспертов ВОЗ (1068) у-гло-булин можно вводить по 1,2—1,8 мл/кг массы внутримышечно один раз в месяц. При подтверждении стафилококковой этиологии эмпиемы хороший эффект можно получить введением
антистафилококкового у-глобулина. При смешанной инъекции его необходимо вводить сочетанно с антибиотиками. Доказано также, что введение у-глобулина, кроме пассивной иммунизации, способствует стимуляции факторов неспецифического иммунитета, в том числе усилению фагоцитарной активности лейкоцитов, увеличению титра лизоцима и комплементарной активности [Земскова М. В. и др., 1969; Голосова Т. В. и др., 1974].
Хорошими средствами пассивной иммунизации являются специфическая гипериммунная плазма и бактериофаги. Известны антистафи-лококковая плазма, аитисинегнойная плазма и плазма с повышенным содержанием антител к протею. Антистафилококковую плазму при острой эмпиеме переливают по 200—250 мл через 1—2 дня, .3—5 раз.
Известно, что пассивная иммунизация может подавлять выработку собственных иммуноглобулинов. Поэтому ее необходимо подкреплять активной иммунизацией. Так, при стафилокко-ковой эмпиеме введение стафилококкового анатоксина способствует выработке специфических антитоксинов (антистафилолизина, антигиалуронидазы и др.).
Используют сокращенную схему из трех инъекций анатоксина: 0,5—1 мл с интервалом 2—3 дня. По данным В. Г. Ус (1972), Л. Н. Сидареико и соавт. (1972), титр антитоксинов повышался в 4 раза.
Активная иммунизация аутовакциной, приготовленной из возбудителя, применяется реже из-за трудности получения препарата.
При проведении иммунотерапии необходимо учитывать состояние иммунобиологической реактивности больного. При гиперреактивности, о чем свидетельствуют в том числе и высокие титры изогемагглютининов, О-стрептолизи-на и иммуноглобулинов, показаны десенсибилизирующая терапия, введение прогестерона. При пониженной реактивности больного нередко, наряду с проведением пассивной и активной иммунизации, показана стимуляция Т-системы иммунитета и неспецифических защитных сил организма. Чаще всего это достигается введением декариса (левамизола), тимизола, лео-кадина.
Большое значение в коррекции иммунных нарушений имеют переливание свежеконсервированной крови или прямые гемотрансфузии, а также нормализация белковых и волемических расстройств.
При лечении дыхательной недостаточности особое внимание уделяется санации бронхиального дерева путем ингаляций, стимуляции откашливания, промывания бронхиальных путей. Снятие болей при дыхании достигается с помощью ненаркотических анальгетиков,
200
снятие спазма легочных артериол — введением эуфиллина, папаверина, но-шпы и др. Для повышения парциального давления кислорода во вдыхаемом воздухе производится инсуффляция увлажненного кислорода через носоглоточные катетеры. За последние годы доказана высокая эффективность гипербарической терапии, так как при этом увеличивается количество растворимого в плазме кислорода до 6 об %, что полностью удовлетворяет все физиологические потребности организма в кислороде даже при значительной сопутствующей анемии.
Исследования В. И. Буравцева, проведенные в клинике госпитальной хирургии, показали, что оптимальным является 6—7 сеансов.
Общеукрепляющая и симптоматическая терапия при острой эмпиеме плевры включает полноценное питание, уход за больным, мероприятия по лечению сопутствующих заболеваний и предупреждению возможных осложнении
МЕСТНОЕ ЛЕЧЕНИЕ
Современные способы лечения острых эмпием плевры можно кратко представить в виде следующей схемы:
после удаления гноя полость заполняется антисептическим раствором, и сразу же раствор вместе с остатками гнойного экссудата аспирируется обратно. Количество раствора, вводимого одномоментно в плевральную полость, зависит от методики промывания и размеров полости, что определяется количеством удаленного гноя. Чаще всего вводят 20—60 мл раствора шприцем, несколько меняя направление иглы, чтобы струей раствора механически омывать доступные стенки полости. При такой методике нередко аспирируется не только жидкий гной, но и многочисленные хлопья фибрина и детрит, имбиби-рованные микроорганизмами. Чередование введения раствора в полость и аспирации его повторяют до получения почти чистой жидкости.
При больших размерах гнойной полости промывание может быть эффективным, если использовать методику санации «в две иглы», принцип которой предложен еще в (896 г. русским врачом С. В. Левашовым: после рентгенологического контроля пунктируют плевру у дна полости и второй иглой в максимально верхнем отделе ее. Через нижнюю иглу полость заполняется антисептическим раствором до тех пор, пока из верхней открытой иглы после выхож-
Консерватисное лечение
Систематические пленральпые пункции с аспирацией гноя, промыванием полости, введением фибринолитических и антибактериальных средств
Оперативное лечение
Дренирование плевральной полости:
закрытое:
активное
открытое:
с резекцией ребра
пассивное
без резекции ребра
Удаление очага инфекции и ликвидация полости:
декортикация и цлецрэктомия
сочетание декортикации легкого с /дополнительными вмешательствами
плевройневмонэктом ия
КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
Наиболее простым и доступным методом санации плевральной полости при эмпиеме является пункция. Аспирация гноя из полости должна быть максимально полной. При этом важно установить наличие или отсутствие вакуума в плевральной полости. В сомнительных случаях проводится манометрия с помощью пневмотораксного аппарата. При отсутствии легочно-плевральных сообщений пункционная санация гнойной полости в большинстве случаев весьма эффективна, особенно при ранних и систематических пункциях.
Предложено несколько методик санации промыванием плевральной полости (при отсутствии плевролегочного сообщения). Как правило,
дения воздуха не станет поступать промыаная жидкость. Этим устраняется воздушная подушка и достигается контакт антисептического раствора со всеми стенками гнойной полости. Затем краник верхней иглы закрывают, а через нижнюю промывную жидкость аспирируют шприцем или электроотсосом. Такую процедуру повторяют несколько раз, используя при этом до 5—6 л раствора.
Для промывания полости эмпиемы применяются различные антисептические растворы, допустимо также использовать изотонический раствор натрия хлорида. При подтверждении этиологии эмпиемы плевральную полость лучше промывать антисептиками с учетом чувствительности возбудителя к ним. Чаще всего используют фурацилин (0,02 % раствор), со-
201
лафур (0,1 %), диоксидин (1 %), хлоргексиди-на биглюконат (0,02 %), борную кислоту (3— 5 %), перманганат калия, йодннол, димексид, раствор Дакена.
В конце пункции необходимо стремиться наиболее полно аспирировать промывной раствор, создать вакуум в плевральной полости с целью максимально возможного расправления коллабированных отделов легкого. Пункция завершается введением в остаточную полость антибиотиков иногда вместе с 50—70 % димек-сидом, который способствует проникновению их в имбнбированные гноем фибринные напластования на стенках полости и потенцирует действие антибактериальных средств {Даниленко М. В. и др., 1977].
Для достижения успеха пункционная санация плевральной полости должна проводиться ежедневно в первые 5—7 дней, затем через 1 — 2 дня. Последующие контрольные пункции делают в зависимости от данных клинического и рентгенологического обследования.
Возможности пункционной санации плевральной полости при острой эмпиеме значительно расширились в связи с применением современных протеолитических ферментов, особенно при гнойно-фибринозном плеврите и нагноении свернувшегося гемоторакса. Стала возможной так называемая биохимическая декортикация легкого [Громова Л. С., 1959; Rross W., Garbinski J., 19521.
Известны многочисленные сообщения об успешном применении стрептазы, фибринолизина, препаратов трипсинового ряда в санации плевральной полости. Наши экспериментальные и клинические исследования доказали высокую эффективность отечественного препарата тер-рилитина при свернувшемся гемотораксе и гнойно-фибринозном плеврите [Чепчерук Г. С. и др., 1981 [. Препаратами выбора для местной фибринолитической терапии при острой эмпиеме являются террилитин и стрептокиназа. Эти протеолитические ферменты обладают значительно большей активностью, чем фибнинолизин, трипсин, химотрипсин и рибонуклеаза.
Ферменты вводят в полость после аспирации гноя и промывания антисептическими растворами. Дозы препарата подбираются в зависимости от предполагаемого количества сгустков в полости. Террилитин обычно вводят по 600— 1000 ПЕ, стрептазу (стрептолиазу) — по 250— 500 тыс ЕД, фибринолизин — по 20—40 тыс ЕД, препараты трипсинового ряда — до 100—150 мг. Фермент разводится антисептическим раствором, в который добавляется суточная доза избранного антибиотика.
На следующий день во время очередной пункции аспирируют образовавшуюся от лизиса сгустков жидкость, промывают плевральную
полость и при необходимости вводят фермент и антибактериальные препараты повторно. Чаще всего достаточно 2—3 внутриплевральных введений протеаз.
Следует отметить, что лизис сгустков иногда усиливает резорбцию токсических продуктов нз плевральной полости, что сопровождается нестойким повышением температуры тела, ознобом. После повторного промывания гнойной полости эти явления проходят. Исследования, проведенные в клинике госпитальной хирургии, показали, что внутриплевральное введение ферментов сопровождается повышением протеолиза плевральной жидкости в 2—3 раза по сравнению с циркулирующей кровью. Повышения протеолитической активности крови не наблюдается. Число лейкоцитов плеврального экссудата после лизиса сгустков в полости резко увеличивается, и повышается их фагоцитарная активность. Повторные посевы плевральной жидкости чаще всего оказываются стерильными, однако у 10 % больных, у которых до введения препарата посевы плеврального экссудата были стерильны, после лизиса сгустков в аспирируемой из полости жидкости находили микроорганизмы, вероятно, освободившиеся из фибринозно-гнойных напластований.
Результаты санации полости с использованием протеаз при острой эмпиеме плевры тем лучше, чем раньше начата местная фибринолитическая терапия. При нагноившемся посттравматическом и послеоперационном свернувшемся гемотораксе оптимальным сроком для применения ферментов является 4—10-й день. Введение ферментов в первые дин после операции нежелательно из-за опасности развития повторного кровотечения в полости. В то же время в более отдаленные сроки (через 3—4 нед) получить полный лизис сгустков трудно из-за их уплотнения н организации. Но даже в этих случаях террилитин или препараты стрептокиназы растворяют рыхлые гнойно-фибринозные массы на шварте, содержащие, как правило, патогенную микрофлору. Аспирация образующейся жидкости и промывание полости антисептическими растворами с последующим введением антибиотиков приводили к санации полости, а оставшиеся фибринозные напластования на плевре постепенно рассасывались самостоятельно или под воздействием физиотерапевтических процедур. Нарушения внешнего дыхания у этих больных постепенно уменьшались, показаний к оперативному лечению, как правило, не возникало.
Осложнения при плевральной пункции наблюдаются редко. Наиболее опасными из них являются воздушная эмболия, повреждения легкого, крупных сосудов, сердца, диафрагмы и органов брюшной полости.
202
К осложнениям пункций гнойной плевральной полости следует отнести нагноение грудной стенки, что чаще встречается при гнилостной эмпиеме. С целью подавления развития инфекции по ходу пункционного канала для анестезин используется анестетик на антисептическом растворе или же при извлечении иглы вводится небольшое количество раствора антибиотиков. Профилактической мерой является создание отрицательного давления в плевральной полости, так как при положительном давлении инфицированное содержимое полости может поступать в ткани грудной стенки через поврежденную париетальную плевру.
К ошибкам пункционной санации полости следует отнести неоправданно длительное лечение только этим методом, когда не удается расправить легкое, а скопление гноя в интервалах между пункциями отягощает состояние больного, поддерживая признаки гнойной интоксикации, введение антибиотиков может способствовать избыточному развитию грануляций на висцеральной плевре, которые как бы «инкапсулируют» коллабированное легкое. Поэтому при отсутствии отчетливой тенденции к расправлению легкого периодическими пункциями уже через 5—7 дней следует ставить вопрос о показаниях к активному дренированию.
ОПЕРАТИВНОЕ ЛЕЧЕНИЕ .
Оперативные методы лечения острой эмпиемы плеары применяются, как правило, после консервативного лечения пункциями. Показаниями к оперативным вмешательствам, наряду с безуспешностью применения метода пункционной санации в течение 5—7 дней, являются: 1) острая эмпиема плевры с деструкцией легочной ткани и бронхоплевральным сообщением; 2) тотальная эмпиема с резкой гнойной интоксикацией; 3) длительное (2—3 мес) существование острой эмпиемы с угрозой перехода в хроническую.
Во всех случаях оперативное лечение острой эмпиемы плевры начинается с дренирующих вмешательств. Дренирование гнойной плевральной полости позволяет удалять гной из плевральной полости постоянно, а не периодически, как при пункционной санации, фракпионно или постоянно промывать антисептиками, вводить антибиотики, создавать разрежение с помощью вакуумных устройств.
Известны несколько методик дренирования плевральной полости. Наиболее часто используется торакоцентез при помощи троакара по Бюлау, являющийся простым и малотравматичным.
При торакоцентезе и дренировании плевральной полости в избранном месте грудной стенки,
соответствующем нижнему отделу гнойной полости, делается пробная пункция. В месте пункции делается небольшой разрез кожи, через который в плевральную полость вводится троакар. Прохождение инструмента в полость ощущается в виде «провала», после чего стилет троакара удаляется, а через трубку в плевральную полость вводится дренаж с 1—2 боковыми отверстиями. Трубку троакара удаляют, придерживая дренаж. Положение дренажа и его функцию контролируют пробной аспирацией шприцем Жане и после этого фиксируют его к коже.
Введение дренажа с помощью троакара обеспечивает достаточно длительное сохранение герметичности плевральной полости, так как рана грудной стенки соответствует диаметру трубки. При отсутствии троакара большого диаметра (трудные условия работы врача) дренажную трубку можно провести в плевральную полость с помощью длинного изогнутого кровоостанавливающего зажима.
Методика с резекцией участка ребра для дренирования плевральной полости применяется крайне редко, лишь при очень узких межреберных промежутках. Некоторые хирурги после резекции ребра производят малую торакотомию, очищают гнойную полость от сгустков крови, фибрина, секвестров, после этого полость дренируют, а рану ушивают до дренажа. Недостатком этого метода является почти неизбежное нагноение раны грудной стенки вокруг дренажа с нарушением герметичности плевральной полости. Иногда развивается остеомиелит ребра, что значительно затрудняет дальнейшее лечение. Однако одномоментная санация гнойной полости под контролем зрения весьма привлекательна.
При необходимости длительного дренирования гнойной полости большое значение имеет материал, из которого изготовлены дренажные трубки. Наиболее выгодны силиконовые дренажи, так как они не обладают реактогенными свойствами по отношению к тканям организма, в связи с чем значительно реже развивается нагноение раны грудной стенки вокруг дренажной трубки. Еще выгоднее использовать для длительного дренирования специальные многоканальные креминйорганические медицинские трубки, выпускаемые отечественной промышленностью (рис. 102).
Решающее значение в эффективности лечения острой эмпиемы закрытым дренированием имеет активная аспирация с помощью различных вакуумных устройств. Чаще всего используются различные электроотсосы, рассчитанные на длительную непрерывную работу. Наиболее доступным из них является переоборудованный микровиброкомпрессор, позволяющий
203
Рис. 102. Двухпросветныс кремнийоргаиические медицинские трубки с диаметром широкого просвета 6. 8 и 11 мм.
создать разрежение до 80 мм рт. ст. Очень удобным является специальный отсасыватель ОП-1 (Лавринович Л. Л., 1978] с регулируемым разрежением от 20 до 120 см вод. ст. и индикатором, позволяющим судить о наличии или отсутствии вакуума в плевральной полости. В условиях специализированного стационара лучшей вакуумной установкой является централизованная система с электромотором (компрессоры Казанского завода медоборудования) и индивидуальными вакуумметрами у постели больного. Она обеспечивает вакуум от 15 до 800 мм рт. ст.
Степень разрежения, необходимого при активной аспирации для расправления легкого, зависит от сроков заболевания, наличия и величины бронхоплевральных сообщений. При герметичной плевральной полости обычно достаточно создать вакуум около 50 мм рт. ст. Если коллабированные отделы легкого покрыты фиб-ринными напластованиями, но еще сохраняют способность к расправлению, ликвидировать остаточную полость можно при разрежении до 150 мм рт. ст., причем требуется длительная непрерывная аспирация экссудата, периодически разжижаемого протеолитическими ферментами в антибактериальных растворах.
Для первых промываний полости, когда неизвестен возбудитель гнойного процесса, применяются любые растворы, в том числе изотонический раствор натрия хлорида или стерильная кипяченая вода. Основная задача первых промываний состоит в удалении гноя и детрита. Некоторые авторы [Чистихин В. С. и др., 1973| используют для этого до 7—9 л раствора в сутки. В последующем при уточнении этиологии эмпиемы используются антисептические растворы целенаправленно с учетом чувствительности микрофлоры. Так, при гнилостной эмпиеме чаще применяются раствор перман
ганата калия, раствор Дакена и другие дезодоранты в сочетании с совместимыми антибиотиками и протеолитическими ферментами. При обнаружении стафилококков, стрептококков, кишечной палочки чаще используют 0,1 % раствор солафура, 1 % раствор диоксидина, йодинол. На стафилококк хорошо действует 0,25 % раствор хлорфиллипта. При синегнойной эмпиеме применяют 3—5 % раствор борной кислоты, 1 % раствор диоксидина, 0,02 % раствор хлор-гексидина биглюконата. При длительном лечении полезно практиковать смену антисептиков, используемых для промывания.
Промывание гнойной полости шприцем Жане является весьма эффективным методом ее санации, так как через дренаж удается аспирировать не только жидкость, но и множество имбиби-рованных гноем фибриниых хлопьев, детрит. Однако промывание 1-—2 раза в сутки при пассивном дренировании между промываниями часто не может обеспечить расправление легкого.
Более эффективными являются фракционное промывание и непрерывная аспирация через двухпросветную дренажную трубку. Схема такого промывания плевральной полости с использованием двухпросветного дренажа и вакуумного устройства ОП-1 представлена на рис. 103. Через узкий просвет двухпросветного дренажа (1) при закрытом широком просвете ниже переходной трубки (2) плевральная полость капельно заполняется антисептическим раствором примерно наполовину ее объема. Во время экспозиции, которая длится 30— 60 мин (при добавлении протеаз — около 3 ч), больной осторожно меняет положение в постели для перемещения воздуха в полости и обеспечения контакта раствора со всеми стенками ее. После этого дренаж открывается и содержимое аспирируется. Такие промывания продолжаются многократно до получения относительно чистого раствора из полости. После такого сеанса продолжается постоянная активная аспирация.
Фракционное промывание позволяет удалить гной, очистить и стерилизовать стенки полости, а непрерывная активная аспирация способствует расправлению легкого и ликвидации остаточной плевральной полости. За последние годы благодаря разработке отечественного командного электромеханического программного устройства (КЭП-12-У) стали применять автоматическое промывание гнойных полостей через двухпросветный дренаж до 48 раз в сутки (Кан-шин Н. П., 1983]. Такие промывания с помощью автоматизированной системы позволяют в короткие сроки очистить полость эмпиемы.
Критериями эффективности санации гнойной полости при эмпиеме являются клинические
204
Рис. 103. Промывание плевральной полости через двупросветный дренаж с использованием вакуумного устройства ОП-1.
данные (снижение температуры тела, уменьшение или полное исчезновение признаков гнойной интоксикации), стерильность плеврального экссудата при повторных бактериологических исследованиях и уменьшение лейкоцитоза экссудата. Продолжительность дренирования зависит от эффективности такой санации у данного больного и темпа расправления легкого. Результаты лечения можно считать хорошими, если инфекционный процесс в плевре ликвидирован или резко подавлен, а легкое расправилось полностью или остается небольшая остаточная полость, объемом не более 20—40 мл. Дренаж в таких условиях можно удалить с герметичным ушиванием раневого канала. Дальнейшая судьба такой остаточной полости, как правило, благоприятная с исходом в ограниченный фиброторакс.
Промывание полости при острой эмпиеме без бронхиального свища с последующей постоянной активной аспирацией ведет к выздоровлению примерно в 60—90 % случаев (Маслов В. И., 1976; Уткин В. В., Башко Я. Я., 1978;
Королев Б. А. и др., 1980]. При наличии легочноплевральных сообщений или бронхиального свища активное дренирование плевральной полости может стать окончательным методом лечения только у 20- 25 % больных (Сергеев В. М., 1967]. В остальных случаях этим методом удается значительно быстрее подготовить больных к более сложным вмешательствам.
Одним из методов санации плевральной полости при острой эмпиеме с пнопневмотораксом в случаях со стойким бронхоплевральиым сообщением является искусственная герметизация бронхиального дерева (Гераськин В. А. и др„ 1974; Rafinski R., 1968].
Временная окклюзия бронхов выполняется во время бронхоскопии под наркозом. В качестве пломбы для окклюзии используется поролоновая губка или специальная коллагеновая саморассасывающаяся пломба отечественного производства. Герметизация бронхиального дерева позволяет в ряде случаев провести эффективную санацию гнойной полости методом фракционного лаважа с непрерывной активной аспирацией через двухпросветный дренаж. После 2—3-дневного интенсивного промывания полости эмпиемы продолжается только активная аспирация с разрежением около 120—150 мм рт. ст., иногда до 400—500 мм рт. ст.
Проведенные в нашей клинике исследования (Гришаков С. В. и др., 1983] показали, что уже в первые часы после временной окклюзии бронха улучшается насыщение артериальной крови кислородом, уменьшается парциальное напряжение СОу, уменьшается дефицит оснований. Окклюзия пораженного бронха создает условия для закупорки периферических отделов бронхиального дерева слизью, фибрином, а также для образования сращений пораженных отделов легкого с париетальной плеврой и ликвидации плевральной полости.
Временную окклюзию бронха сохраняют др 2 3 нед. Признаков обострения гнойного процесса в плевре и легком в связи с окклюзией обычно не наблюдается. Нередко имеется повышение температуры тела, что обусловлено, вероятно, повышенной резорбцией из бронхов герметизированной доли. Удаление пломбы производится при бронхоскопии и обязательно сопровождается тщательной санацией бронхиального дерева. После этого температура тела обычно нормализуется. Активную аспирацию из плевральной полости через дренаж сохраняют еще 2—3 дня, затем выполняют плеврографию и, убедившись в расправлении легкого, дренаж удаляют. Раневой канал герметизируется одним — двумя швами.
Безуспешное лечение дренированием бывает при значительных бронхиальных свищах, обычно большого диаметра.
205
Формирование остаточной полости эмпиемы может быть обусловлено несколькими причинами. К ним относятся ошвартование колла-бированных отделов легкого плотными организованными фиброзными массами, не поддающимися литической терапии, значительное уплотнение и склероз легочной ткани, несоответствие объемов резецированного легкого и плевральной полости, ателектаз части легкого из-за обструкции бронхиального дерева слизью, детритом. Когда расправить легкое из-за этого изложенными выше методами не удается, возникает вопрос о показаниях к оперативному лечению: декортикации легкого, торакопластике или мышечной пластике остаточной полости. Следует отметить, что декортикация не всегда возможна в связи с плотными сращениями фиброзных напластований с висцеральной плеврой. Иногда и после декортикации не удается расправить легкое из-за выраженных склеротических изменений его. Показания к торакопластике, операции травматичной и резко деформирующей грудную клетку, за последние годы значительно сужены [Земсков Н. Н. и др., 1979; Слепуха М. М., Мельник В. М., 1982; Чухриенко Д. П., 1982]. Мышечная пластика возможна лишь при наличии хорошо развитых мышц рядом с остаточной полостью эмпиемы.
Более перспективным нам представляется использование биологической пломбы, приготовленной из раствора фибриногена. Возможность такой пломбировки подсказана наблюдениями за судьбой плевральной полости после пневмонэктомии. Как известно, полость в таких случаях постепенно заполняется экссудатом, из которого выпадет фибрин на стенках полости и в виде лентовидных спаек, пересекающих остаточную полость. Организация экссудата с утолщением фибринных пленок и наслоений фибрина на стенках приводит в различные сроки (от 2*/г до 12 мес по данным Б. Э. Абарба-нель, 1962) к формированию фибриноторакса. В дальнейшем происходит прорастание фибробластов из стенок полости и преобразование фибрина в глыбчатый коллаген [Есипова И. К., Рыжков Е. В., 1957]. Эти наблюдения, а также проведенные нами экспериментальные исследования позволили Г. С. Чепчеруку применить фибринную пломбу для заполнения стойкой остаточной плевральной полости у 24 больных: 7 из них перенесли эмпиему после пневмонэктомии, у 5 была эмпиема после частичных резекций легкого, у 2 — эмпиема после ранений груди и у 8 — постпневмоническая эмпиема плевры. У всех больных после санации эмпиемы сформировалась стойкая остаточная полость, которая была заполнена антибактериальной фибринной пломбой. Для предупреждения ре-
цидива эмпиемы фибриноген растворяли антисептическим раствором (солафур, диоксидин) и добавляли большие дозы антибиотиков с учетом чувствительности высеваемых ранее у этого больного микроорганизмов (рационализаторское предложение № 4620 от 21.09.81 г.).
Методика пломбировки состоит в следующем. 1 г лиофилизированного фибриногена, выпускаемого отечественной медицинской промышленностью, растворяют антисептическим раствором. Пункционно через две иглы или через дренаж и иглу (нгла в верхнем отделе полости необходима для удаления воздуха) остаточную полость полностью заполняют раствором фибриногена, затем вводят высшие суточные дозы 2—3 антибиотиков с учетом антибиотикограммы и после этого — тромбинкальциевую смесь 125 ЕД тромбина и 10 мл 10% раствора кальция хлорида.
Раствор фибриногена свертывался, и в остаточной полости оставалась антибактериальная фибринная пломба.
Оценка отдаленных результатов (от 3 мес до 3 лет) показала, что при применении антибактериальной фибринной пломбы у 19 из 24 больных удалось ликвидировать остаточную плевральную полость и предупредить рецидив эмпиемы. У 5 больных фибринная пломба в последующем нагноилась. Причиной рецидива эмпиемы плевры у трех больных была вторичная несостоятельность культи бронха, а у двух, вероятно, недостаточная санация стенок полости от фибринозно-гнойных напластований перед пломбировкой. Анализ наших наблюдений позволяет сделать заключение, что важнейшими условиями успешного применения антибактериальной фибринной пломбы для ликвидации стойкой остаточной полости и предупреждения рецидива эмпиемы плевры являются тщательная санация стенок полости и ликвидация бронхоплеврального свища.
Следует подчеркнуть простоту и безопасность этого метода пломбировки стойкой остаточной плевральной полости. Применение раствора фибриногена с большими концентрациями антибактериальных средств позволяет заполнить полость даже через пункционную иглу с последующим свертыванием его и формированием фибринной пломбы с депо антибиотиков. В случае рецидива эмпиемы не требуется повторного оперативного вмешательства для удаления пломбы, а необходимо лишь введение протеолитических ферментов для лизиса фибрина и санации полости с целью подготовки к повторной пломбировке или же к торакопластике.
К оперативным методам относится открытое дренирование плевральной полости. Сущность заключается в искусственном создании стойкого торакального свища с целью быстрейшей
206
очистки гнойной полости, расправления легкого или подготовки к радикальному оперативному вмешательству (Л. С. Лесницкий и др., 1987).
Известны различные методы открытого дренирования плевральной полости. Дренирование без резекции ребра в настоящее время не применяется из-за быстрого закрытия раневого дефекта сближающимися ребрами.
Открытый дренаж с резекцией одного или нескольких ребер был предложен W. Roser (1859) и F. Konig (1864) и получил широкое распространение. По сводным данным В. М. Сергеева (1967), с внедрением этого метода удалось сократить летальность при острой послеоперационной эмпиеме с 80—90 % до 15—30 %. Однако все еще высокая летальность и большое число (свыше 20 %) хронических эмпием с незаживающими торакальными свищами значительно сократили показания к открытому дренированию плевральной полости. В настоящее время это вмешательство при острой эмпиеме производится в основном по жизненным показаниям при распространенном нагноитель-ном процессе в плевре и легком, когда предварительными пункциями и активным закрытым дренированием не удалось очистить полость от гноя и уменьшить явления гнойной интоксикации, а радикальное вмешательство крайне рискованно из-за тяжести состояния больного.
В связи с наличием бронхиального свища и опасностью аспирации гноя из полости в другое легкое торакостомия нередко выполняется в положении больного сидя под внутривенным обезболиванием (рис. 104). Разрезом длиной 12—15 см между средней подмышечной и лопаточной линиями у дна гнойной полости обнажается и поднакостнично резецируется участок ребра (чаще VIII или IX) длиной до 10 см. Небольшим разрезом через ложе ребра вскрывают полость эмпиемы, аспирируют гной, промывают полость, предохраняя от загрязнения рану мягких тканей. После промывания полости рассекают реберное ложе н утолщенную париетальную плевру. Стенки полости эмпиемы вторично промывают, удаляют детрит, секвестры, фибринные сгустки. Затем стенки осторожно выскабливают острой ложкой Фолькмана при наличии значительных фибринозно-гнойных напластований. Для формирования достаточного торакального свища край надкостницы ребра подшивают к фасции [Clagett J., Geraci J., 19631 или к коже (Маслов В. И., 1976]. Последнее предложение выгоднее, так как позволяет лучше изолировать рану мягких тканей от прямого контакта с гноем. Нередко то-ракостома получается очень узкая, щелевидная. Поэтому при большой гнойной полости открытое дренирование будет эффективнее, если резецировать фрагменты двух, иногда трех ребер
Рис. Ю4. Положение больного на операционном столе цля выполнения торакостомии.
Рис. 105. Сформированная торакостома у больного с эмпиемой и свищом культи бронха после пневмонэктомии.
(рис. 105). В таких случаях ткани межреберного промежутка между резецированными ребрами иссекаются как при операции Коннорса [Connors J., 1931]. Наши наблюдения показывают, что оперативное закрытие широкого плеврокожного свища, планируемое заранее, в последующем производится так же, как и после торакостомии с резекцией одного ребра. Рекомендуемая Eloesser (1935), Р. Symbas и соавт. (1971) торакостомия с подшиванием кожно-подкожно-фасциального лоскута к диафрагме и внутригрудной фасции не имеет преимуще-ществ. В то же время она более травматична и ликвидировать ее технически труднее.
207
Преимуществами открытого дренирования являются техническая простота и возможность эффективной санации гнойной полости даже у тяжелобольных.
Ведение больных с торакостомией может быть разным. Чаще всего в первые дни делаются ежедневные перевязки, промывания полости антисептическими растворами. Хороший эффект дают ультразвуковая обработка с протеолитическими ферментами, тампоны с полиэтиленгликолем. Стенки полости очищаются, а под воздействием дыхательной гимнастики легкое частично расправляется, остаточная полость уменьшается. Через 2—3 нед больного можно выписать иа амбулаторное лечение. Постепенно стенки полости покрываются грануляциями.
Показания к ликвидации торакального свища обычно ставят через 1—2 мес [Подзолов В. В., 1963; Clagett J., Geraci J., 1963]. Края свища иссекают и рану грудной стенки послойно ушивают. Остаточную полость эмпиемы, если нет бронхиального свища, ведут пункционноаспирационным способом до формирования ограниченного фиброторакса.
Некоторые хирурги после торакотомии с резекцией ребра применяют тампонаду полости по А. В. Вишневскому (1938): полость заполняют масляно-бальзамическими тампонами, которые меняют через 2 нед. Постепенно полость уменьшается, количество тампонов уменьшают и так продолжают длительное время до выполнения полости грануляциями с последующим развитием фиброзной ткани.
Открытое дренирование плевральной полости имеет ряд существенных недостатков: наличие открытого пневмоторакса иногда ведет к увеличению коллапса легкого и флотированию средостения, особенно при торакостомии в ранней стадии острой эмпиемы; постепенно легкое фиксируется швартами в спавшемся состоянии, что ведет к плеврогенному склерозу легочной паренхимы; операция не обеспечивает быстрого расправления легкого, требует длительного лечения и повторных оперативных вмешательств; торакостомия малоэффективна при продолжающемся деструктивном процессе в легком. Именно поэтому показания к открытому дренированию гнойной плевральной полости весьма ограниченны. Торакостомию следует рассматривать не как самостоятельный метод лечения, а как временный и очень важный этап, спасающий жизнь больных в тех случаях, когда консервативное лечение неэффективно, а сложные операции невозможны.
Операции на плевре и легких с целью тщательной санации полости, мобилизации колла-бированных отделов легкого н удаления очага инфекции показаны в тех случаях, когда пунк
ционной санацией или закрытым дренированием с активной аспирацией не удалось расправить легкое и ликвидировать эмпиему. Чаще всего из таких операций применяется декортикация легких. Эта операция является восстановительной, органосохраняющей, так как после мобилизации коллабированные отделы легкого расправляются и постепенно их функция нормализуется.
Эффективность декортикации определяется прежде всего сроком заболевания. Наиболее успешна она в первые 3—4 нед, так как в более поздние сроки фибринозные напластования глубоко прорастают в плевру и их удаление становится возможным только вместе с плеврой, т. е. необходима плеврэктомия. Клиническими наблюдениями и патоморфологическими исследованиями доказано [Громова Л. С.. 1959], что при эмпиеме плевры напластования фибрина на висцеральной плевре меньше, чем на париетальной, их сращения с плеврой не столь глубоки, поэтому удаление происходит только с поверхностными слоями плевры. Основные слои ее (глубокий коллагеновый и эластическая мембрана) остаются на легком, поверхность его сохраняется герметичной, эластичной. Склеротические изменения париетальной плевры в эти же сроки более выраженны, сращения ее с фиброзными швартами плотнее, поэтому удалить их чаще всего удается вместе с париетальной плеврой, отделяя их от внутригрудной фасции.
Техника операции состоит в следующем. Под эндотрахеальным наркозом осуществляется переднебоковая, боковая или заднебоковая торакотомия в зависимости от локализации полости эмпиемы. При острой эмпиеме не удается удалить весь эмпиемный мешок целиком, поэтому полость обычно сразу вскрывают, аспирируют гнойный экссудат, салфетками удаляют детрит, сгустки крови, рыхлые фибринозно-гнойные напластования, а стенки гнойной полости тщательно промывают (раствором пер-вомура с изотоническим раствором натрия хлорида в соотношении 1:3) или обрабатывают 5 % спиртовым раствором йода. После этого меняют инструменты, перчатки, отграничивающие салфетки и приступают к декортикации легкого. В ранние сроки заболевания (до 2—3 нед) фибрин! ibie пленки с легкого снимаются легко, иногда с помощью салфетки и тупфера. Шварты на висцеральной плевре рассекают осторожными движениями скальпеля, чтобы не повредить легочную ткань. Край шварты отделяют от висцеральной плевры и отсепаровывают в виде полос различной ширины. Отслойку шварты производят тупфером или пальцем, надавливая на фиброзную ткань, а не на легкое. Важнейшее правило декортикации — это проникновение в слой между фиброзной швартой
208
и плеврой. Это значительно облегчается при использовании гидравлической препаровки. Расширяя зону декортикации, постепенно удается высвободить легкое. Однако нельзя стремиться выполнить декортикацию всех отделов легкого, если имеются очень плотные сращения, так как это. как правило, сопровождается повреждением легочной паренхимы, что потребует ее ушивания, герметизации и может свести на нет все, достигнутое декортикацией. Плотные участки сращений лучше оставлять на легком. В некоторых случаях плотные шварты на висцеральной плевре рассекают параллельными и перпендикулярными разрезами на расстоянии 1,5—2 см друг от друга, не повреждая легкое [Маслов В. И., 1971]. Образующиеся участки шварты иссекают параллельно легочной поверхности, наиболее плотно фиксированные участки шварты остаются на легком.
Декортикация будет эффективнее, и легкое лучше расправится после операции, если разделить междолевые щели и произвести мобилизацию всего легкого (пневмолиз). Для этого необходимо рассечь и иссечь переходные складки эмпиемного мешка с участком париетальной плевры, рассечь легочную связку, освободить диафрагмальную поверхность легкого, удалить костодиафрагмальные шварты. По мнению В. И. Маслова (1976), декортикация должна обязательно сочетаться с диафрагмолизом, т. е. освобождением от шварт и мобилизацией диафрагмы. Восстановление подвижности диафрагмы имеет большое значение для ближайших и отдаленных результатов операции. Удаление париетальной плевры (плеврэкто-мия) вместе с фиброзными швартами на ней рекомендуется не всеми хирургами. При острой эмпиеме плевры толщина фиброзных на-швартований относительно небольшая, и достаточно их высвободить.
Декортикация и плеврэктомия завершаются тщательным гемостазом и восстановлением герметичности легкого. Небольшие повреждения легочной паренхимы можно герметизировать с помощью медицинского клея МК-6 или МК-7. Перед ушиванием торакотомной раны полость обильно промывают антисептическим раствором, нередко с использованием ультразвуковой обработки стенок, устанавливают два дренажа с последующей активной аспирацией и расправлением легкого.
Декортикация легкого и плеврэктомия в чистом виде могут быть выполнены очень ограниченному контингенту больных при отсутствии значительной деструкции легкого и бронхоплевральных свищей. Чаще всего эту операцию необходимо сочетать с дополнительными вмешательствами: резекцией пораженных отделов легкого, ушиванием небольших бронхиальных
свищей, реампутацией культи бронха, корригирующей торакопластикой и др.
Сочетание декортикации с частичной резекцией легкого показано при наличии деструктивного процесса в нем (абсцессы, бронхоэктазии, множественные бронхиальные свищи) или выраженной карнификации доли легкого. Необходимость одновременной резекции легкого планируется еще до операции на основании рентгенографических и бронхографических исследований, а объем резекции окончательно определяется после визуального и пальпаторного исследования легкого во время вмешательства. Обычно в таких случаях выполняется лобэктомия, реже — билобэктомия с декортикацией оставшихся отделов легкого и частичной плевр-эктомией (по показаниям). Лишь в исключительных случаях при небольшой периферической деструкции легкого допустима атипичная клиновидная резекция.
Небольшие бронхиальные свищи при отсутствии деструкции легочной паренхимы можно ушить атравматичными иглами вместе с соседней легочной тканью, желательно с дополнительной мышечной пластикой свища и небольшой остаточной полости. Реампутация культи бронха показана при послеоперационной эмпиеме, если размеры культи превышают 1 см. Такое вмешательство можно выполнить ручным способом или с помощью аппарата УК Б, обязательно завершая его тщательной плевризацией культи, декортикацией остающихся отделов легкого и диафрагмолизом, чтобы обеспечить быстрое расправление легкого.
Некоторые хирурги после сочетанной декортикации с частичной резекцией легкого, особенно после плевробилобэктомии, выполняют корригирующую торакопластику или перемещение купола диафрагмы во время операции [Кабанов А. Н. и др., 1978]. Оправдано с целью уменьшения размеров плевральной полости выполнить тщательную мобилизацию диафрагмы во время операции и наложить пневмоперитонеум в ближайшие 1—2 дня после вмешательства.
Плевропневмонэктомия является наиболее тяжелым вмешательством, предпринимаемым только при распространенном деструктивном процессе в легком, чаще всего гангрене, осложненной пиопневмотораксом.
Иногда плевропневмонэктомия выполняется при острой эмпиеме плевры, развившейся как осложнение хронического гнойио-деструктив-ного заболевания легкого, если во время операции устанавливается, что поражены две доли легкого. Поэтому во всех случаях оперативного лечения, планируемого вначале как частичная резекция, нужно иметь в виду возможность вынужденного расширения объема вмешательства вплоть до удаления всего легкого.
14 Зак 0517
209
Глава 2? ХРОНИЧЕСКАЯ
ЭМПИЕМА ПЛЕВРЫ
И БРОНХИАЛЬНЫЕ СВИЩИ
ХРОНИЧЕСКАЯ ЭМПИЕМА
ПЛЕВРЫ
Хроническая эмпиема плевры — гнойно-деструктивный процесс в остаточной плевральной полости с грубыми и стойкими морфолотиче-скими изменениями, характеризующийся длительным течением с периодическими обострениями.
Возникновение хронической эмпиемы отмечается у 4—20 % больных острой эмпиемой [Колесов В. И., 1955; Стручков В. И., 1967; Маслов В. И., 1976J. Большие различия в частоте хронической эмпиемы такого происхождения обусловлены прежде всего отсутствием единого представления о критериях перехода острой формы этого заболевания в хроническую. Гистологическими исследованиями материала, полученного во время плеврэктомий, декортикаций и резекций легкого, доказано, что стойкие и необратимые морфологические изменения плевры и подлежащих тканей развиваются лишь к исходу 2—3 мсс от начала заболевания. В эти же сроки чаще появляются признаки нарушения регенеративных механизмов и обострения гнойного процесса.
Исходя из этого мы считаем наиболее оправданным относить к хроническим эмпиемам те случаи, когда эмпиема существует более 3 мес и течение заболевания имеет характерные клинические признаки — периоды затихания и обострения гнойного процесса.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Хроническая эмпиема плевры может поддерживаться различными микроорганизмами. В отличие от острой эмпиемы значительно чаще встречается смешанная флора с преобладанием грамотрицательных бактерий (кишечной, си-нешойной палочек).
Основными условиями развития хронической эмпиемы плевры являются недостаточное рас
правление легкого с формированием стойкой остаточной плевральной полости и поддержание инфекции в стенках этой полости. Главными поддерживающими факторами служат бронхиальные свищи, хондриты, склеротические изменения коллабировапных отделов легкого, а при послеоперационных эмпиемах — несоответствие размеров оставшегося после резекции легкого объему плевральной полости.
Бронхоплевральные свищи являются наиболее частой причиной развития стойкой плевральной полости и хронической эмпиемы плевры.
Нередко причиной хронической эмпиемы плевры являются патологические изменения легкого с продолжающимся в нем инфекционным процессом (бронхоэктазии, хронический абсцесс, пневмосклероз) инородные тела в плевральной полости, периферических отделах легкого, 1 рудной стенке. Инородными телами чаще всего являются осколки от снарядов, пули, которые длительное время сохраняются в полости после огнестрельных ранений.
Иногда хроническая эмпиема поддерживается остеомиелитом илн хондритом ребра (.чаще после огнестрельных ранений или оперативных вмешательств). В таких случаях формируются небольшие пристеночные полости, в которых имеются секвестры и костные отломки.
Инфекционный процесс в стенках полости может длительное время сохраняться из-за несвоевременной и плохой санации от фибринозно-гнойных напластований па плевральных листках, в которых развиваются патологические грануляции с участками повторной деструкции и образованием мелких полостей. Кроме того, такие напластования способствуют развитию пневмосклероза и сохранению гнойной полости.
В основе всех этих причинных факторов, способствующих или ведущих к развитию хронической эмпиемы плевры, лежат несвоевременное или недостаточное лечение острой эмпиемы, ошибки в лечебной тактике, тяжелые деструктивные изменения в легком, плевре и грудной стенке.
Известны случаи развития хронического гнойного процесса в плевральной полости после пневмонэктомии, несмотря на неосложненное течение раннего послеоперационного перио-
210
да. Иногда эмпиема плевры диагностируется впервые через несколько лет после удаления легкого. Следовательно, у таких больных остаточная полость после пневмонэктомии не облитерировалась, воспаление сохранялось, но протекало торпидно. При понижении сопротивляемости организма произошло клиническое обострение. Такие эмпиемы плевры следует считать первично-хроническими. При диагностике эмпиемы в таких случаях уже определяются все морфологаческие признаки хронического процесса вплоть до обызвествления стенок полости.
Возможно развитие хронической эмпиемы плевры как результат специфических хронических инфекций — туберкулеза, актиномикоза. Она также нередко диагностируется поздно, уже в хронической стадии.
Патоморфологические изменения при хронической эмпиеме развиваются не только в поверхностных слоях плевры, как при остром процессе, а захватывают все слои плевры, ткани легкого, грудной стенки, органов средостения, вызывая значительные функциональные нарушения.
На основании клинико-морфологических признаков различают три стадии хронической эмпиемы плевры |Линберг Б. Э., 1945: Сергеев В. М., Катковский Г, Б., 1975].
I стадия, продолжительностью до 5 мес от начала острой эмпиемы, характеризуется затиханием воспалительного процесса в плевре и постепенным утолщением плевральных листков за счет развивающейся грануляционной ткани в плевре и фибринозных напластованиях. Вокруг остаточной полости формируются массивные внутриплевральные шварты, отграничивающие гнойный очаг. Форма и размеры полости эмпиемы различные: чаще всего образуется пристеночная или базально-пристеночная ограниченная эмпиема, реже — верхушечная эмпиема плевры, еще реже — междолевая. Емкость гнойной полости, как правило, 100- 300 мл, и лишь в редких наблюдениях (примерное 10 % случаев от числа всех хронических эмпием) встречается субтотальная эмпиема. Тотальная эмпиема возникает обычно после пневмонэктомии.
В I стадии хронической эмпиемы плевральные шварты представляют собой зрелую, обильно инфильтрированную гистиолимфоцитарными клетками соединительную ткань. Постепенно происходит дальнейшее созревание и фиброзирование соединительной ткани. При прогрессировании гнойного процесса могут образоваться новые наложения фибрина и формируется слой более молодой грануляционной соединительной ткани. Деструктивный процесс распространяется в более глубокие слои плевры, окружающие ткани и органы. От париетальной плевры отхо
дят фиброзные тяжи за пределы внутригрудной фасции и в межреберные промежутки, вызывая сдавление и облитерацию кровеносных сосудов, ишемию с постепенным прогрессирующим фиброзом внутреннего слоя мышц.
II стадия (от 5 мес до года) проявляется клиническими признаками хронической интоксикации с более редким, чем в нервом периоде, обострением гнойного процесса. Патоморфологические изменения более выражены: толщина фиброзных шварт на париетальной плевре достигает 3—4 см и более, межреберные мышцы сморщиваются и замещаются соединительной тканью, межреберные промежутки суживаются, диафрагма уплощается из-за массивного ошвар-тования ее, объем плевральной полости уменьшается. В толщине шварт волокнистая фиброзирующая соединительная ткань становится плотнее, кровоснабжение ее уменьшается и происходит склерозирование ее с гналинозом. Воспалительный процесс распространяется на надкостницу ребер и ребра.
Висцеральная плевра также уплотняется, однако толщина фиброзных шварт здесь не превышает 0,5—1 см. Грануляционная ткань выражена слабо, на поверхности имеется гнойный налет. Барьерная функция висцеральной плевры между гнойно-фибринозными наложениями и тканью легкого нарушена: по междольковым перегородкам в легочную ткань прорастают фиброзные тяжи. Изменения в легком постепенно прогрессируют, в процесс вовлекается пернброн-хиальная ткань, что ведет к деформации бронхов и нарушению их дренажной функции. Хронический воспалительный процесс в легком нарастает, и развиваются пневмофиброз, бронхоэктазии. Нередко в поверхностных слоях легкого образуются мелкие абсцессы. Значительное сдавление легкого швартами и прогрессирующий нневмофиброз ведут к выраженным дыхательным расстройствам.
III стадия хронической эмпиемы плевры протекает с еще более выраженными морфологическими и клиническими проявлениями. Кол-лагенизация и гиалиноз плевральных шварт сопровождаются отложением солей кальция и формированием костных структур («плевральные кости» или «кальциевые пластинки плевры»), В легочной паренхиме нарастают дегенеративные изменения, на фоне которых развиваются вторичные гнойные процессы по тип} бронхоэктазий. Нередко перибронхит и бронхо эктазии развиваются и в другом легком [Вайль С. С., 1946].
Зона плеврогенного склероза распространяется еще глубже, в ткани грудной стенки. Рубцовое перерождение мышц, почти полное сближение ребер, изменение их формы и подвижности, наряду с резким нарушением подвижно
14*
211
сти диафрагмы и значительным прогрессированием патологических изменений в легком, обусловливают нарастающую дыхательную недостаточность.
Деформация грудной клетки и уменьшение объема плевральной полости ведут к смещению средостения, иногда к вторичному перикардиту, к стойкому перегибу крупных сосудов (полых вен, легочной артерии и вен), что сопровождается гемодинамическими расстройствами.
Хроническая гнойная интоксикация приводит к развитию амилоидоза внутренних органов.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
Клиническая картина хронической эмпиемы определяется прежде всего величиной гнойной полости, наличием или отсутствием бронхоплеврального и плеврокожного свищей, морфологическими изменениями плевры и подлежащих тканей, т. е. стадией эмпиемы. Переход острой эмпиемы в хроническую происходит постепенно. Основными признаками такого перехода являются снижение температуры тела до нормальной или субфебрильной, улучшение самочувствия, уменьшение гнойного отделяемого и стабилизация объема остаточной плевральной полости. В I стадии хронической эмпиемы состояние больного удовлетворительное, боли в груди уменьшаются или исчезают, почти нет признаков гнойной интоксикации и дыхательной недостаточности. Только наличие стойкой остаточной полости с небольшим количеством гноя или скудные гнойные выделения из плеврокожного свища свидетельствуют о хроническом воспалительном процессе. Лабораторные признаки гнойного процесса также мало выражены: сохраняются лишь умеренное повышение СОЭ, незначительная анемия, диспротеине-мия.
Однако благополучие это кажущееся, так как нагноительный процесс продолжается и медленно прогрессирует, устойчивость организма к инфекции понижается, и при малейших неблагоприятных обстоятельствах (охлаждение, переутомление, сопутствующие заболевания) развивается обострение.
Во время обострения повышается температура тела, появляются ознобы, усиливаются боли в груди, нарастают признаки гнойной интоксикации (особенно при наличии большой эмпием-ной полости), увеличивается количество гнойных выделений из плеврокожного свиша или количество гнойной мокроты (при эмпиеме с бронхоплевральным свищом). Нарастают анемия и диспротеинемия, повышаются число лейкоцитов в крови и нейтрофильный сдвиг влево. В плевральной жидкости резко увеличивается число лейкоцитов (до 15 • 10ч/л), причем ней-
трофилез экссудата достигает 95—99%; значительно увеличено количество разрушенных клеток.
II стадия хронической эмпиемы плевры характеризуется более тяжелой клинической картиной, так как длительное течение нагноительного процесса отражается на общем состоянии больного, усиливаются общее недомогание, разбитость, ухудшается аппетит, нарастают одышка и сердцебиение. При сопутствующем процессе в легком значительно усиливается кашель, увеличивается количество гнойной мокроты. Боли в груди непостоянны, часто колющего характера, возникают или усиливаются при физической нагрузке. При переходе воспаления на ткани грудной стенки и вовлечении в процесс нервных стволов боли могут иррадиировать в руку, лопатку, живот.
При осмотре таких больных обращает на себя внимание их бледность, иногда цианоз. Грудная клетка неравномерно участвует в акте дыхания. Пальпаторно нередко определяются отечность и инфильтрация мягких тканей над полостью эмпиемы, особенно при наличии плеврокожного свища. Данные перкуссии и аускультации различные в зависимости от положения и величины гнойной полости, количества жидкости в ней. толщины шварт. Чаще всего определяется значительное притупление перкуторного звука в нижних отделах полости, переходящее в тимпанит над воздушной подушкой. Дыхание над проекцией жидкости резко ослаблено или не выслушивается. Вне полости нередко выслушиваются разнокалиберные хрипы. Тахикардия более стойкая, чем в I стадии, что объясняется не только гнойной интоксикацией, но и смещением средостения. Границы сердца могут быть смещены. При электрокардиографии и интегральной рео-графии тела определяются гемодинамические нарушения с признаками легочной гипертензии.
В III стадии хронической эмпиемы (с продолжительностью заболевания более года) отмечается значительная деформация грудной клетки, ребра на стороне поражения малоподвижны, межреберные промежутки резко сужены, надплечье опущено. Почти всегда имеется плеврокожный свищ, нередко остеомиелит ребра или хондрит. Закрытые хронические эмпиемы могут протекать бессимптомно из-за плотного осумкования гноя. В таких случаях только внимательное клиническое и рентгенологическое обследование ослабленного больного позволяет заподозрить наличие гнойного очага, а пункция остаточной плевральной полости подтверждает наличие эмпиемы. В клинической картине этой стадии преобладают явления длительной дыхательной недостаточности и хронической гнойной интоксикации. При обострении гнойного процесса и нарушении оттока из полости состояние больных значительно ухудша-
212
ется, нарастает интоксикация. Длительное течение гнойного процесса сопровождается развитием истощения больного, анемией, иногда амилоидным перерождением почек и других внутренних органов.
ДИАГНОСТИКА
Диагностика хронической эмпиемы, как правило, несложна. Решающее значение имеют рентгенологические методы исследования (рис.106). Обычно исследование начинается выполнением стандартных рентгенограмм грудной клетки в двух проекциях, в ряде случаев необходима латерография. Характер содержимого остаточной плевральной полости устанавливается при пункции ее.
Для уточнения локализации и размеров гнойной полости, конфигурации ее стенок показаны плеврография, фистулография. Большое значение для оценки состояния легкого и выбора лечебной тактики имеют томография, бронхография и ангиопневмография. При длительном существовании хронической эмпиемы в колла-бированном легком наступают необратимые морфологические изменения, значительно нарушающие функциональные возможности легкого.
Бронхография дает возможность выявйть состояние бронхиального дерева, определить локализацию и характер бронхоплевральных свищей, установить причину хронического течения процесса (бронхоэктазии, хронический абсцесс и т. п.). Бронхографическими признаками тяжелых изменений в легких являются: 1) наличие «пустой зоны» из-за неконтрастируемых бронхов в спавшихся отделах легкого; 2) сближение бронхов с уменьшением углов разветвления их; 3) различные виды деформаций, перегибов бронхиального дерева, нередко с образованием бронхоэктазий [Сергеев В. М., Катков-ский Г. Б., 1975].
Ангиопульмонография (общая или селективная) показана лишь в тех случаях, когда неинвазивные методы исследования не дают четкого представления о состоянии легкого над швар-той. При получении серийных ангиопневмограмм всех трех фаз контрастирования сосудов (артериальной, капиллярной и венозной) надо считать, что в легком отсутствуют необратимые склеротические изменения, функция его после декортикации и плеврэктомии может восстановиться. Если же капиллярная фаза отсутствует, а ветви легочных сосудов не только сближены, но и деформированы, сужены, причем контрастное вещество задерживается в сосудах легкого более 10 с, то это свидетельствует о развившемся плеврогенном склерозе легкого. В таких случаях плеврэктомия может быть
Рис. 106. Хроническая эмпиема плевры. Прямая рент|ено-грамма.
выполнена лишь в сочетании с частичной резекцией легкого.
Наиболее полное представление об изменениях в легочной паренхиме дает сопоставление данных бронхографии и ангиопневмографии. По данным В. М. Сергеева (1967), обнаружение грубого деформирующего бронхита или бронхоэктазий соответствует значительной деформации сосудов легкого и отсутствию капиллярной фазы на ангиопневмографии.
Тензометрия в системе легочных артерий и в правых полостях сердца значительно дополняет данные ангиопневмографии. Если давление в легочных артериях нормальное, то изменения в легких еще обратимы. Легочная гипертензия указывает на отсутствие резервных возможностей легочных сосудов.
Электрокимография используется для изучения легочного кровообращения. Этим методом можно получить более объективную информацию, чем ангиографическим исследованием [Марморштейн С. Я., Абарбанель Е. Э., 1966].
Сканирование легких дает возможность изучить легочное кровообращение (перфузионное сканирование) и легочную вентиляцию (вентиляционное сканирование).
213
ЛЕЧЕНИЕ
Лечение хронической эмпиемы плевры состоит из мероприятий общего характера, направленных на организм больного в целом, и мероприятий по санации и ликвидации гнойного очага.
При обострении гнойного процесса задачи общего лечения те же, что и при острой эмпиеме плевры. В стадии ремиссии, когда заболевание проявляется в основном наличием плеврокож-ного свища без признаков интоксикации и выраженных нарушений гомеостаза, проводится лишь общеукрепляющее лечение и лечение сопутствующих заболеваний, если таковые имеются. Длительность и объем предоперационной подготовки определяются индивидуально для каждого больного. При этом должны быть использованы все средства, способствующие устранению задержки гноя в полости, очищению стенок эмпиемы и уменьшению размеров остаточной плевральной полости.
При отсутствии бронхиального свища эмпием-ную полость можно санировать пункциями с максимальной аспирацией гноя и промыванием антисептическими растворами, а также активным вакуумным дренированием полости. Местная фибринолитическая терапия внутриплевральным введением протеаз с последующими систематическими промываниями позволяет ликвидировать рыхлые гнойно-фибринозные напластования на стенках полости. Однако расправить коллабированное легкое удается редко из-за плотных организованных шварт на висцеральной плевре, не поддающихся лизису. Поэтому чаще устанавливаются показания к более сложным оперативным вмешательствам.
Задачи хирургического лечения хронической эмпиемы плевры сводятся к устранению очага инфекционного процесса и ликвидации стойкой остаточной плевральной полости.
Декортикация легкого при хронической эмпиеме по сравнению с острой значительно затруднена в связи с плотными сращениями фиброзных шварт с висцеральной плеврой. Техника декортикации и особенности ее выполнения в зависимости от срока заболевания изложены в разделе о лечении острой эмпиемы плевры.
После декортикации, пневмолиза и диафраг-молиза обязательно выполняется плеврэктомия, т. е. удаление париетальной плевры и фиброзных напластований на ней. Удаляются не только фиброзные напластования с поверхности плевры, но и фиброзно-измененная, имби-бированная гноем плевра. Необходимость удаления резко утолщенной плевры при хронической эмпиеме доказана в работах Л. К. Бо
гуша (1961 ), В. И. Маслова (1970, 1976), М. Williams (1950), р. Herzog (1967) и др. Плеврэктомия может быть полной или частичной.
Отслаивание шварты при полной плеврэкто-мии производится широко во всех направлениях, плотные сращения рассекаются ножницами или скальпелем. Во многих случаях отделение плевры и фиброзных шварт облегчается гидравлической препаровкой. Особенно осторожно необходимо манипулировать на месте перехода париетальной плевры в висцеральную, чтобы избежать повреждения легкого, а также при выделении шварт у купола плевральной полости, где велика опасность повреждения подключичных сосудов.
Удаление эмпиемного мешка без вскрытия его, т. е. идеальная плеврэктомия и декортикация легкого, удается редко. Чаще производится планируемое вскрытие полости эмпиемы с аспирацией всего содержимого, очищением и промыванием стенок полости, обработкой их 3-5 % спиртовым раствором йода или первомуром, а после этого выполняются поэтапная декортикация легкого, плеврэктомия и диафрагмолиз. Удаление париетальной шварты через полость эмпиемы безопаснее, так как доступ к опасным зонам у средостения и купола плевры шире, чем при удалении эмпиемного мешка целиком.
При наличии гнойно-деструктивных очагов в легком (абсцесс, бронхоэктазии, множественные бронхиальные свищи), поддерживающих хронический гнойный процесс в плевре, плеврэктомия сочетается с частичной резекцией легкого. Чаще всего производится лобэктомия с декортикацией остающихся отделов легкого. При периферически расположенных небольших участках деструкции легкого может быть выполнена атипичная клиновидная резекция с помощью аппарата УКЛ.
У больных с остеомиелитом ребер, а также при наличии инородных тел в остаточной полости эффективная санация и ликвидация полости возможны только после удаления этих очагов инфекционного процесса.
В некоторых случаях при обострении хронической эмпиемы с резкой гнойной интоксикацией и особенно при наличии бронхиального свища, затрудняющего санацию полости через дренаж, показано открытое дренирование гнойной полости с резекцией фрагментов ребер и части париетальных шварт, формированием широкой торакостомы путем подшивания кожи к надкостнице ребра или к внутригрудной фасции.
При длительном существовании хронической эмпиемы плевры происходят необратимые изменения в коллабированных отделах легкого (карнификация), и оно теряет способность к расправлению даже после декортикации. В таких
214
случаях ликвидировать остаточную полость можно лишь торакопластикой или мышечной пластикой.
Экстраплевральная торакопластика, предложенная J. Estlander (1879), модифицированная М. С. Субботиным (1888), А. В. Лекторским (1893), Вубгк (1956) и др., в настоящее время практически не применяется из-за недостаточной эффективности, так как при этом не иссекаются париетальная и висцеральная шварты и после операции, как правило, сохраняется щелевидная гнойная полость. Экстраплевральная торакопластика может быть эффективной только при небольших остаточных полостях боковой локализации без значительного изменения плевральных листков, и то при условии обязательного дренирования эмпиемной полости отдельным разрезом в самом низком ее отделе.
Интраплевральная торакопластика (Schaede, 1890] предусматривает резекцию не только ребер, но и париетальной шварты с межреберными мышцами, сосудами и нервами.
Техника операции состоит в том, что разрезом от края большой грудной мышцы на уровне IV ребра вниз до X ребра, затем по ходу X ребра до лопаточной линии и поворачивая кверху рассекают все мягкие ткани по внутреннему краю лопатки; огромный кож ио-мышечный лоскут отпрепаровывают и отворачивают кверху, Обнаженные ребра вместе с тканями межреберных промежутков и париетальной швартой иссекают единым блоком. После тщательного гемостаза кожно-мышечный лоскут помещают на свое место, фиксируя отдельными швами к висцеральной шварте, особенно в зоне бронхиального свища. Под лоскут подводят несколько дренажей, и рану послойно ушивают с наложением давящей повязки с пелотом.
Эта операция позволяет успешно ликвидировать полость даже при запущенной хронической эмпиеме, однако высокая летальность (от 20 до 50 % по данным В. 14. Колесова, 1955), чрезвычайная травматичность и неизбежная инвалидизация больных из-за резкой деформации скелета значительно сократили показания к этому вмешательству. Некоторые хирурги (Ратнер Ю. А., 1935; Богуш Л. К., Громова Л. С., 1961] для уменьшения травматичности предложили расчленить операцию на несколько этапов, выполняемых через 1—2 мес. Это позволило сократить летальность до 10,9 % [Маслов В. И., 1976], однако длительное лечение и частые рецидивы плеврокожных свищей при сохранении небольших щелевидных полостей не удовлетворяют клиницистов.
Лестничная торакопластика по Heller (1912) и Б. Э. Линбергу (1945) является одной из
разновидностей интраплевральной торакопластики.
При этой операции обнажают и поднакост-нично резецируют ребро над полостью эмпиемы. Через ложе резецированного ребра вскрывают полость. Определяют размеры эмпиемы и резецируют остальные ребра, заходя за край полости на 2—3 см. Рассекают надкостницу и вскрывают полость по ходу резецированных ребер, иссекают париетальную шварту, выскабливают внутреннюю стенку эмпиемного мешка.
Образовавшиеся «перекладины» тканей межреберных промежутков при глубокой полости (свыше 3 см) рассекают поочередно: одну спереди, другую сзади. Образовавшиеся лоскуты погружают до висцеральной плевры.
После тщательною гемостаза в каждый разрез рыхло вводят тампон, не подводя его под «перекладины». Кожно-мышечный лоскут фиксируют швами и накладывают давящую повязку.
А. Н. Кабанов и соавт. (1972, 1978) сочетают торакопластику с перемещением диафрагмы. Это уменьшает объем костно-пластического вмешательства и улучшает косметический результат, но в условиях эмпиемы перемещение диафрагмы опасно в связи с возможностью инфицирования брюшной полости.
Большое распространение получили методы мышечной пластики полости эмпиемы, предложенной F. Konig (1878) для ликвидации верхушечной остаточной полости и А. А. Абража-новым (1899) для закрытия легочно-плеврального свища. В зависимости от локализации эмпиемной полости и состояния мышц грудной стенки можно использовать большую грудную мышцу, широчайшую мышцу спины, реже — ромбовидную, зубчатую или длинные мышцы спины. Техника таких вмешательств разнообразна в зависимости от расположения, величины и характера остаточной полости. Сущность операции заключается в выкраивании мышечного лоскута па ножке соответственно кровоснабжению и с таким расчетом, чтобы величина лоскута соответствовала размеру полости, а при повороте его для заполнения остаточной полости не нарушалось кровоснабжение мышечной ткани.
Во всех случаях оперативное вмешательство заканчивается активным дренированием полости и раны мягких тканей, что наряду с герметичным ушиванием раны и давящей повязкой обеспечивает хорошее соприкосновение тканей и облитерацию полости.
Выбор метода пластики определяется в зависимости от локализации, размеров и формы остаточной плевральной полости, от величины и характера бронхоплевральных свищей. Все же большинство костно-пластических операций
215
на грудной стенке имеют существенные недостатки, связанные с резкой деформацией грудной клетки, снижением функции плечевого пояса и нарастающими необратимыми функциональными расстройствами дыхания и сердечнососудистой деятельности (Сергеев В. М., 1967], В связи с этим заслуживают внимания попытки ликвидации стойкой остаточной плевральной полости с помощью биологической пломбы. По нашему мнению, наиболее эффективной, простой и безопасной является антибактериальная фибринная пломбировка полости, так как фибрин является хорошим стимулятором репаративных процессов, а депо антибиотиков в пломбе предупреждает развитие рецидива эмпиемы, если устранен источник повторного инфицирования плевры (бронхиальные свищи, инородные тела, остеомиелит ребер). Техника пломбировки эмпиемной полости изложена выше, в разделе «Острая эмпиема плевры».
Оперативные вмешательства при хронической эмпиеме в большинстве случаев являются очень травматичными, что требует определенного опыта и достаточной ориентировки хирурга в изменениях топографии органов грудной полости, вызванных длительно существующим гнойным процессом. Плотные сращения и значительное смещение органов груди нередко являются ведущей причиной развития грозных осложнений во время операций.
Наиболее частым из них является кровотечение из сращений и сосудов грудной стенки, иногда из сосудов легкого, средостения и диафрагмы.
Кровотечение из множественных мелких сосудов сращений напоминает паренхиматозное и может приводить к значительной кровопотере (700—1000 мл).
При повреждениях непарной вены, подключичных сосудов, сосудов корня легкого необходимо прижать кровоточащий сосуд пальцем или тупфером, затем продолжать мобилизацию легкого или отделение шварты для обеспечения достаточного доступа к поврежденному сосуду.
При повреждении вен малого круга кровообращения возможно поступление воздуха в сосудистое русло из остаточной плевральной полости или полости в легком, особенно при положительном давлении воздуха в этих полостях. Это чаще встречается во время промывания полости или при выделении легкого из сращений. Воздух поступает в левую половину сердца, откуда разносится по сосудам большого круга. Наиболее опасна воздушная эмболия сосудов мозга.
Опасным осложнением во время оперативных вмешательств является острая дыхательная недостаточность вследствие закупорки брон
хиального дерева гноем, слизью или кровью. Меры предупреждения сводятся к санации бронхиального дерева и гнойных полостей в легких, правильному положению больного на операционном столе, своевременной эвакуации мокроты через интубационную трубку.
Повреждение легкого во время пневмолиза и декортикации диагностируется сразу же по усилению кровотечения и прохождению воздуха из мест разрыва легочной паренхимы. Кровотечение останавливается диатермокоагуляцией или лигированием сосудов, а зона повреждения легкого ушивается атравматичными швами или же герметизируется с помощью медицинского клея (МК-6, МК-7 и др,). При недостаточной герметизации легочной ткани возникают трудности в расправлении легкого после операции.
Повреждение диафрагмы, перикарда, пищевода встречаются редко. В связи с опасностью проникновения инфекции из плевральной полости и развития тяжелых гнойных осложнений (перитонит, перикардит, медиастинит) очень важно своевременно диагностировать эти повреждения и восстанавливать целость поврежденного органа тщательным ушиванием его.
В первые часы и дни после операции наиболее частым осложнением является кровотечение. Как правило, оперативное вмешательство заканчивается дренированием плевральной полости. Диагностика продолжающегося кровотечения основана на оценке клинической картины, а также количества и характера аспирируемой через дренаж жидкости. Важное значение в постепенном уменьшении кровотечения из раны и стенок полости после травматичных вмешательств имеют рациональное дренирование без чрезмерного разрежения в первые часы, контроль за проходимостью дренажей и тугая повязка с пелотом над областью торакопластики. Опыт нашей клиники показал, что проходимость дренажей легче сохранить при использовании двухпросветных трубок.
Если же в течение 2—3 ч после операции количество геморрагического экссудата и его гематокритное число не уменьшаются, то диагностируется продолжающееся или возобновившееся кровотечение. В таких случаях продолжается гемостатическая терапия (в том числе переливание свежеконсервированной крови) и делается повторное оперативное вмешательство.
Иногда через дренаж выделяется мало геморрагического экссудата и гематокритное число его может быть небольшим (меньше 0,05—0,1 л/л), однако определяются все клинические признаки внутренней кровопотери (нарастающая тахикардия,- падение артериального давления, бледность, жажда и др.). В таких случаях следует думать о свернувшемся гемотораксе.
216
Тяжелым осложнением послеоперационного периода является аррозионное кровотечение из-за некроза и разрушения стенки культи сосуда под действием ферментов гноя в условиях эмпиемы (чаще гнилостной). Обычно аррозионное кровотечение наступает на 3—4-й неделе .после операции из культи артерий, так как организация тромба в артерии происходит медленнее, чем в вене, а иногда они в них совсем не образуются [Ярушевич А. Д., 1955]. Предвестником аррозионного кровотечения служит кровохарканье, так как разрушение культи сосуда часто сочетается с образованием бронхиального свища. Нередко массивное кровотечение развивается после кашля или перевязки со сменой тампонов или дренажа. В большинстве случаев аррозионное кровотечение заканчивается летальным исходом. Лишь иногда удается при срочном оперативном вмешательстве найти и перевязать кровоточащий сосуд.
Опасным осложнением послеоперационного периода являются кровотечение и затекание крови в бронхиальное дерево в зоне ушитого свища или мышечной пластики его. Кровотечение в таких случаях может быть небольшим и диагностируется на основании нарастающей дыхательной недостаточности и кровохарканья. Если санация бронхиального дерева и гемостатическая терапия неэффективны, то необходимы бронхоскопия и окклюзия бронха поврежденной доли или сегмента поролоновой губкой. Через 1—2 дня после остановки кровотечения (о чем свидетельствует отсутствие выделения крови из полости через дренаж) и стабилизации гемодинамических показателей пломба удаляется, проводится осторожная санация бронхиального дерева.
Ателектаз легкого и пневмония, развивающиеся после оперативных вмешательств по поводу хронической эмпиемы, значительно удлиняют послеоперационный период, а нередко и угрожают жизни больного. Причиной ателектаза является, в основном, закупорка бронхиального дерева мокротой, слизью или кровью.
Профилактика пневмонии заключается прежде всего в санации бронхиального дерева перед операцией, обязательно перед завершением ее и в послеоперационном периоде. Важное значение имеют энергичное откашливание мокроты, дыхательная гимнастика.
Остаточные полости плевры и рецидив эмпиемы являются частыми осложнениями после оперативного лечения хронической эмпиемы плевры. Предупреждение образования остаточной полости зависит от особенностей оперативного вмешательства. После декортикации и плеврэктомии необходимо тщательное выполнение мероприятий, обеспечивающих расправление легкого (герметизация легкого перед
завершением операции, тщательная санация стенок полости, вакуумное дренирование плевральной полости с рациональным разрежением в течение 3—5 дней после операции, пневмо-перитонеум, санация бронхиального дерева, дыхательная гимнастика, хорошая аналгезия и др.). После торакопластики и мышечной пластики большое значение имеют заполнение всех отделов полости жизнеспособными тканями и дренирование полости и раны мягких тканей грудной стенки для аспирации экссудата, а также давящая повязка с пелотом для соприкосновения тканей со стенками полости. Повязка должна быть сохранена в течение 2—3 нед после операции.
Иногда и после этих мероприятий полость не удается ликвидировать полностью, а остается щелевидное или другой формы пространство, в котором может рецидировать эмпиема. Наличие стойкой остаточной полости без бронхоплеврального или плеврокожного свища, без инородного тела, остеомиелита, хондрита или другого очага, поддерживающего хронический гнойный процесс, не является показанием к повторному оперативному вмешательству. По данным клиники, в таких случаях необходимо после пункционной санации заполнить полость антибактериальной фибринной пломбой для предупреждения рецидива эмпиемы и стимуляции репаративных процессов.
При рецидиве эмпиемы необходимо тщательное обследование с целью выявления причины рецидива. Повторное оперативное вмешательство должно быть направлено на устранение очага хронического гнойного процесса с одновременной тщательной санацией и ликвидацией полости одним из методов мышечной или торакопластики. Иногда оперативное лечение при рецидиве эмпиемы должно быть проведено в два этапа: 1) устранение очага инфекции, поддерживающего хронический гнойный процесс (удаление инородного тела, осколков, фрагментов ребер при остеомиелите, хондрите) ; 2) ликвидация полости с помощью торако-миопластики или пломбировка ее.
Редкими осложнениями после оперативных вмешательств при хронической эмпиеме плевры являются тромбозы и эмболии легочных сосудов, метастатические септические гнойники мозга, почек и других органов. Течение этих осложнений при эмпиеме такое же, как и при других гнойных заболеваниях.
К поздним осложнениям хронической эмпиемы плевры следует отнести бронхиальные свищи, сопутствующие изменения в поджатом швартами легком (абсцедирование, бронхоэктазии, карнификация легкого), а также амилоидоз внутренних органов, тяжелое истощение, «легочное» сердце.
217
БРОНХИАЛЬНЫЕ СВИЩИ
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Бронхиальный свищ — стойкое сообщение бронха с плевральной полостью, внутренним органом или с поверхностью грудной стенки, развившееся в результате повреждения или патологического процесса в легком. Крайне редко встречаются врожденные бронхопищеводные или трахеопищеводные свищи (0,03— 0,04 % от числа новорожденных). Приобретенные бронхиальные свищи после проникающих повреждений груди развиваются примерно у 0,9 % раненых (Джанелидзе Ю. Ю., 1948]. В мирное время наиболее часто встречаются бронхиальные свищи после оперативных вмешательств на легких (в среднем около 7—15 %).
Различают несостоятельность культи бронха, бронхоплевральные или легочно-плевральные сообщения и бронхиальные свищи. Бронхиальный свищ — это стойкое сообщение, состоящее из фиброзной ткани, покрытой грануляциями или эпителием. Выделение бронхиальных свищей как самостоятельной нозологической единицы обусловлено тем, что стойкие свищевые ходы, в отличие от несостоятельности бронха или легочной ткани, значительно труднее поддаются консервативным лечебным мероприятиям и требуют, как правило, оперативного лечения. Говоря о терминологии, следует подчеркнуть, что классическое определение «бронхиальный свищ» подразумевает лишь те случаи, когда патологический процесс в легком и в плевральной полости в основном уже закончен, а сохраняется стойкое непосредственное бронхокожное сообщение. Если же бронхиальный свищ открывается в плевральную полость или в полость легкого, следует говорить об эмпиеме плевры или абсцессе легкого с бронхиальным свищом.
По опыту клиники госпитальной хирургии, наиболее рациональной является классификация бронхиальных свищей, в которой учтены лишь те факторы, которые имеют важное значение в выборе лечебной тактики.
Патогенез бронхиальных свищей после ранений груди представляется следующим образом.
Проникающие ранения груди, как правило, сопровождаются повреждением легкого с нарушением целости более или менее крупных бронхов. Подтверждением этого являются почти неизбежное кровохарканье, спадение легкого и иногда подкожная эмфизема, а при открытом пневмотораксе — и прохождение воздуха из поврежденного легкого через рану грудной стенки. Некоторые авторы [Джанелидзе Ю. Ю., 1948, и др.] называют такие повреждения воздухоносных путей первичными бронхиальными свищами. Более оправданно мнение М. С. Григорьева (1955), считающего, что бронхиальный свищ и свежее повреждение бронхиального дерева представляют собой два различных патологических состояния и не могут быть отождествлены. Известно, что в большинстве случаев отверстия в поврежденном небольшом бронхе и раневой канал в легочной ткани заполняются сгустками крови и герметизм поврежденного легкого восстанавливается. При асептическом течении процесса и хорошей резистентности организма кровяные сгустки уплотняются, раневой канал рубцуется. В легком при этом некоторое время могут сохраняться полости («травматические каверны»), которые заживают [Колесников И. С., 1949].
В патогенезе бронхиальных свищей ведущее значение имеет инфекция. Микробное загрязнение плевры и поврежденных участков легкого происходит извне по ходу раневого канала или из поврежденных бронхов. Развитию инфекционного процесса в значительной степени способствуют инородные тела в легком и в плевральной полости (пули, осколки, костные отломки, обрывки одежды, занесенные с ранящим снарядом). Чаще инфекция развивается в плевральной полости как нагноение гемоторакса. В некоторых случаях эмпиема развивается как
Сообщение с внешней средой
Наружные: бронхокожные бронхоплеврокожные
Внутренние: бронхоплевральные бронхолегочные бронхоорганные (бронхопищеводные, бронхожелудочные, бронхокишечные, бронхопеченочные)
Классификация бронхиальных свищей
Определяющий фактор
Количество Характер изменений легочной
свищей ткани
Одиночные Без значительных изменений
Множественные С резкой инфильтрацией легочной ткани
С гнойно-деструктивным процессом в легком
С карнификацией легкого
218
следствие нагноения раны грудной стенки и вторично открывшегося пневмоторакса. Эмпиема плевры ведет к распространению гнойного процесса в зону раневого канала легкого и способствует возникновению сообщения бронха с плевральной полостью. Образующийся свищевой ход постепенно покрывается многослойным эпителием из бронха, и формируется бронхиальный свищ. Нередко гной из плевральной полости, особенно при эмпиеме с бронхиальным свищом, прорывается наружу через рану грудной стенки, и формируется бронхоплеврокожный свищ.
Развитие бронхиальных свищей зависит, кроме инфекционного процесса в плевре и раневом канале легкого, от степени разрушения легочной паренхимы, диаметра поврежденного бронха, состояния бронхиального дерева (бронхит), а также от особенностей лечения развившейся эмпиемы плевры и сопротивляемости организма больного.
Бронхиальные свищи нетравматического происхождения чаще всего развиваются при абсцессах и гангрене легкого. Абсцессы легкого в большинстве случаев вскрываются в бронхиальное дерево с последующим формированием внутреннего бронхолегочного свища. Большие абсцессы могут дренироваться через несколько бронхиальных свищей. Множественные бронхолегочные свищи чаще образуются при гангренозных абсцессах.
Иногда бронхоплевральный свищ развивается как осложнение эмпиемы плевры, которая протекает с вторичной деструкцией периферических участков легкого. В редких случаях бронхиальный свищ возникает как следствие распадающегося рака легкого, спонтанного пневмоторакса, актиномикоза, прорыва в бронх эхинококковой или другой кисты, туберкулезной каверны.
Бронхиальные свищи являются одним из наиболее тяжелых осложнений после операций на легких. Частота послеоперационных бронхиальных свищей колеблется, по данным отечественных и зарубежных авторов, от 3 до 15 % [Раков А. И., Вагнер Р. И., 1965; Амбатьел-ло Г. П., 1973; Цыбырнэ К. А. и др., 1975; Акжи-гитов Г. Н. и др., 1982; Roy S. et aL, 1971; Bazelly В. et al., 1981; Aubert M., Latreille R„ 1981]. Это зависит прежде всего от характера патологического процесса, явившегося показанием к оперативному вмешательству. Так, по данным клиники госпитальной хирургии, после операций по поводу острых гнойно-деструктивных заболеваний легких (гангрена, множественные абсцессы, осложненные абсцессы) бронхиальный свищ развился у 9 % больных, при хронических нагноительных заболеваниях легких — у 2 %, а при раке легкого — у 6,6 %,
причем бронхиальные свищи после лобэктомий наблюдались чаще, чем после пневмонэктомий.
Послеоперационные бронхиальные свищи являются следствием несостоятельности культи бронха, которая может быть первичной или вторичной. Основными причинами первичной несостоятельности культи бронха являются следующие: 1) некроз стенки бронха в связи с чрезмерным раздавливанием браншами аппарата при наложении механического шва или из-за нарушения питания стенки культи после скелетирования бронха; 2) тяжелые патологические изменения стенки бронха в зоне шва при гнойно-деструктивных заболеваниях легких, раке бронха; 3) наложение механического шва на утолщенную или склерозированную стенку бронха без дополнительных узловых швов и плевризации культи; 4) другие технические погрешности ушивания культи бронха; 5) нарушение репаративных процессов у истощенных больных.
Первичная несостоятельность культи образуется обычно в течение первых дней после операции, а в более поздние сроки может наблюдаться вторичная несостоятельность в условиях уже развившейся эмпиемы плевры. Из работ Л. Л. Дорфман (1938), Ю. А. Муромского (1963) известно, что танталовые скрепки и швы сохраняют герметизм культи бронха в течение 10— 14 дней. В дальнейшем они могут прорезаться, но герметичность бронха обычно сохраняется благодаря фибринным напластованиям поверх культи и прорастания в них фибробластов. Под воздействием ферментов гнойного экссудата при эмпиеме фибрин лизируется, репаративные процессы нарушаются, возникает вторичная несостоятельность культи. И первичная, и вторичная несостоятельности культи бронха поддерживает гнойный процесс в плевральной полости и чаще всего заканчивается формированием бронхиального свища.
В зависимости от состояния первичного патологического процесса, вызвавшего образование свища, и степени вторичных изменений окружающих тканей различные формы бронхиальных свищей отличаются особой патоморфоло-гической характеристикой.
Наружный бронхокожный свищ может образоваться после ранения или после вскрытия абсцесса легкого при облитерированной плевральной полости. Различают [Джанелидзе Ю. Ю., 1948; Григорьев М. С., 1955] два вида бронхокожных свищей: губовидный и трубчатый или каналовидный. Губовидный бронхиальный свищ открывается или непосредственно на кожу, или при помощи короткого канала, стенки которого выстланы многослойным цилиндрическим и плоским эпителием, развившим
219
ся за счет метаплазии эпителия бронха, переходящего в эпителиальный покров кожи. Трубчатый бронхиальный свищ сообщает просвет бронха с внешней средой через более длинный и извилистый канал, покрытый грануляционной тканью. Наличие грануляционной ткани, не покрытой эпителием, при благоприятных условиях дает возможность окончательного заживления свища без оперативного вмешательства. Трубчатый бронхокожный свищ может сформироваться как исход бронхоплеврального свища, если плевральная полость постепенно облитерируется вплоть до свищевого хода, проходящего через плевральные шварты.
Бронхокожные свищи могут быть и множественными, если в результате ранения или патологического процесса произошла значительная деструкция легочной ткани с повреждением многих ветвей бронхиального дерева. В таких случаях может образоваться и «решетчатое легкое» [Sauerbruch, 1934], когда бронхиальные свищи открываются не на кожу, как при множественных бронхокожных свищах, а в углубления, бухты и карманы, выстланные многослойным плоским эпителием из бронхов и разделенные гребешковыми перекладинами из сосудов, бронхов и соединительнотканных элементов легкого.
Бронхоплевральные свищи могут быть наружными (бронхоплеврокожными) и внутренними, сообщающимися лишь с остаточной плевральной полостью. Бронхоплевральные свищи также бывают одиночными и множественными. Эпителий, выстилающий бронхоплевральные свищи, как и при бронхокожных свищах, метаплазируется в многослойный плоский, который выходит на поверхность легкого и покрывает его на небольшой площади вокруг свища. При множественных бронхоплевральных свищах на ограниченном участке легкого эта поверхность иногда вся покрывается многослойным плоским эпителием, который препятствует облитерации плевральной полости. Как показали исследования П. П. Движ-кова (1945), С. С. Вайля (1948), М. С. Григорьева (1955), многослойный эпителий бронхиальных свищей расположен на плотной соединительнотканной основе, так как изменения в бронхах при свищах носят характер хронического воспалительного процесса по типу панбронхита. Стенка бронха значительно утолщена за счет инфильтрации лейкоцитами и лимфоидными элементами, которая распространяется и на легочную паренхиму. Мышечный слой бронха из-за воспалительной инфильтрации разъединяется на отдельные волокна, которые затем атрофируются. Хрящ бронха подвергается дегенеративным изменениям. В результате перибронхита и развития соединительной тка
ни стенки бронхиального свища становятся ригидными, не спадаются. В окружающей свищ легочной ткани, особенно при множественных бронхиальных свищах, развивается интерстициальный процесс с утолщением альвеолярных перегородок, разрастанием соединительной ткани, утолщением стенок сосудов и сужением их просвета, в дальнейшем с исходом в пневмосклероз (карнификацию легкого). Во многих случаях в легочной ткани развиваются небольшие гнойные полости, сливающиеся между собой и открывающиеся в просвет бронхов по типу бронхоэктазий.
Бронхолегочные свищи представляют собой сообщение бронха с одной или несколькими полостями в легких, образовавшимися или в результате абсцесса, или по ходу раневого канала, или вокруг инородного тела. Стенки длительно существующих полостей в легком иногда покрыты метаплазированным эпителием бронха, что препятствует их облитерации. Изменения в легочной ткани вокруг полости и бронхиального свища могут быть различными: от воспалительной инфильтрации до пневмосклероза или даже до гнойно-деструктивного процесса в легком. Это имеет важное значение в выборе лечебной тактики.
М. С. Григорьев (1955) различает наружные и внутренние бронхолегочные свищи, а также бронхолегочно-плевральные наружные и внутренние свищи. По опыту клиники, свои специфические особенности имеют только внутренние бронхолегочные свищи. Наружные бронхолегочные и бронхолегочно-плевральные свищи практически не отличаются соответственно от бронхокожных и бронхоплеврокожных свищей с гнойно-деструктивным процессом в легком, а внутренний бронхолегочно-плевральный свищ идентичен внутреннему бронхоплевральному с распадом в легком.
В очень редких случаях, преимущественно после торакоабдоминальных ранений, бронхолегочные свищи могут соединяться с полостными и неполостными органами и образуются бронхоорганные свищи (бронхожелудочные, бронхокишечные, бронхопищеводные, бронхопеченочные). Встречаются приобретенные бронхопищеводные свищи после операций на пищеводе.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
И ДИАГНОСТИКА
Клиническая картина складывается из общих проявлений заболевания, обусловленных воспалительными и гнойно-деструктивными изменениями в плевре и легком, и из местных симптомов, определяющихся видом бронхиального свища, размером дренируемой им
220
полости, а также степенью воспалительных изменений стенок полости и тканей грудной стенки.
Общие клинические проявления могут быть следствием острой или обострения хронической эмпиемы плевры и выражаются признаками гнойной интоксикации и дыхательной недостаточности (высокая температура тела, ознобы, общая слабость, плохой аппетит, головные боли, раздражительность, боли в груди, одышка, кашель с выделением гнойной мокроты, иногда кровохарканье). Это наблюдается при образовании бронхоплеврального или бронхолегочного свища в результате прорыва содержимого полости эмпиемы в бронхиальное дерево или гноя из абсцесса легкого в бронх или в плевральную полость. В дальнейшем формируется бронхиальный свищ, полость очищается от гноя и общие проявления уменьшаются.
В большинстве случаев бронхиальный свищ представляет собой хроническое страдание и диагностируется преимущественно на основании местных симптомов и специальных методов исследования в зависимости от вида свища.
Наружные бронхиальные свищи (бронхокожные, бронхоплеврокожные) диагностируются прежде всего на основании жалоб больного (наличие торакального свища со слизисто-гнойным или слизистым отделяемым, прохождение воздуха через свищ при кашле, натужива-нии, иногда и при дыхании, усиление кашля в положении больного на здоровом боку из-за затекания содержимого полости в бронхиальное дерево, невозможность купаться из-за попадания воды в свищ с резким приступом кашля вплоть до удушья).
При больших наружных бронхиальных свищах больные плохо переносят снятие повязки, так как у них усиливается кашель, нарастают одышка, цианоз, иногда наступает афония из-за невозможности создания повышенного давления в бронхиальном дереве, необходимого для вибрации голосовых связок. Кашель, одышка и нарастающий цианоз обусловлены спазмом бронхов вследствие раздражения их слизистой оболочки холодным воздухом, проникающим через свищ. Эти явления развиваются не у всех больных. У некоторых при открытом наружном бронхиальном свище и закрытой носоглотке возможно даже дыхание через свищ.
При бронхокожных трубчатых свищах из-за извитого и узкого свищевого хода, частично выполненного грануляциями, не всегда наблюдается прохождение воздуха при кашле. Иногда это удается определить простыми приемами: запотеванием зеркала, приставленного к отверстию свища, колебанием пламени свечи или горящей спички, поднесенными к наружному отверстию бронхиального свища, выхождением дыма через свищ у курящего больного. Если
эти данные недостаточно убедительны, то характер наружного бронхиального свища необходимо подтвердить специальными методами исследования.
Зондирование свища (лучше тонким резиновым катетером) иногда позволяет дифференцировать бронхиальный свищ от плеврокожного или свища грудной стенки, так как возникновение кашлевого рефлекса свидетельствует о связи свища с бронхиальным деревом. Однако при извилистых свищевых ходах зондом не всегда можно достигнуть бронха. В таких случаях целесообразно через катетер ввести в свищ 2—3 мл водного раствора метиленового синего. Откашливание окрашенной мокроты сразу или через некоторое время после введения раствора подтверждает наличие бронхиального свища. У многих больных проводится промывание свищевого хода или дренируемой им полости антисептическими растворами. Это имеет и диагностическое значение, так как появление кашля и привкуса лекарства свидетельствует о несостоятельности легочной ткани или небольшом бронхиальном свище. При большом размере свища больной откашливает мокроту с примесью антисептического раствора. Следует помнить, что отрицательная проба с введением красящего раствора или отсутствие кашля при промывании не исключают наличия бронхиального свища, который в момент исследования может быть закрыт слизью или гноем.
Фистулография является ценным методом исследования при наружных свищах, так как позволяет уточнить характер свищего хода, наличие и конфигурацию полостей, выявляет связь с ребрами, пораженными остеомиелитом. Во многих случаях удается получить также селективную бронхограмму и уточнить локализацию и размеры бронхиального свища, что имеет важное значение в выборе плана и объема оперативного вмешательства.
Техника фистулографии проста. Через свищевой ход вводится катетер соответственно диаметру свища. Для герметизации свищевого хода накладывается кисетный шов вокруг катетера. С целью предупреждения кашля в свищ через катетер вводятся 1—2 мл раствора три-мекаина или смесь Гирша. Через 2—3 мин под контролем рентгеноскопии вводится контрастное вещество и делаются полипозиционные рентгенограммы. Герметизация свищевого хода иногда может быть достаточной и без наложения кисетного шва, если после введения контрастного вещества сразу удалить катетер и в наружное отверстие свища ввести плотную марлевую пробку, пропитанную вазелиновым маслом. Эта методика герметизации показана тогда, когда поверхность вокруг наружного отверстия свища легкоранима и швы прорезаются.
221
По опыту клиники, наиболее выгодны для фистулографии водорастворимые контрастные вещества (кардиотраст, уротраст, верографин и др.), однако в некоторых случаях можно использовать и масляные контрастные растворы (йодолипол), подогретые до температуры тела.
При фистулографии и ретроградной селективной бронхографии не всегда удается выяснить состояние бронхиального дерева и легочной ткани вокруг свища. Поэтому в ряде случаев для определения плана лечения необходима бронхография.
Важное диагностическое значение имеет бронхоскопия, предпринимаемая для оценки состояния слизистой оболочки бронхиального дерева, так как при выраженном гнойном бронхите ушивание или пластика свища, как правило, обречены на неудачу.
Торакоскопия допустима в тех случаях, когда через свищ в грудной стенке можно ввести в полость торакоскоп. Использование фиб-роторакоскопа иногда позволяет уточнить количество бронхиальных свищей, их локализацию, диаметр, а также оценить характер изменений стенок полости [Сергеев В. М., Катковский Г. Б., 1975].
Внутренние бронхиальные свищи диагностируются на основании клинической картины и специальных методов исследования. Так, для бронхолегочных и внутренних бронхоплевральных свищей характерно увеличение количества откашливаемой мокроты при изменении положения больного. Важное значение имеют рентгенологические методы исследования для оценки состояния легкого, в том числе и томография. Особенно ценны данные бронхографического исследования.
Наличие внутренних бронхоплевральных свищей определяется при пункции и манометрии плевральной полости. Для манометрии используется пневмотораксный аппарат. Невозможность создания отрицательного давления при отсасывании воздуха из плевральной полости указывает на наличие сообщения ее с бронхиальным деревом. Манометрия плевральной полости особенно важна для ранней диагностики послеоперационных бронхиальных свищей. Если полость дренирована, то диагностика бронхиальной несостоятельности основывается на невозможности создания разрежения в плевральной полости при подключении дренажа к вакуумному устройству. Очень удобен в этом отношении послеоперационный отсасыватель ОП-1 Лавриновича — Каншина, так как наличие индикаторной лампочки позволяет ориентировочно судить о диаметре открывающегося в плевральную полость бронха.
Бронхо органные свищи имеют специфические особенности клинической картины: кашель или
поперхивание при приеме пищи укажут на бронхопищеводный свищ, а при изменении положения больного — на бронхожелудочный или бронхокишечный свищ. Окончательная диагностика их становится возможной благодаря селективной бронхографии, контрастным рентгенологическим исследованиям желудочно-кишечного тракта, а также по данным эзофаго-гастроскопии.
ЛЕЧЕНИЕ
В большинстве случаев одновременно с обследованием больного проводится общее лечение, направленное на ликвидацию или значительное уменьшение гнойной интоксикации, коррекцию важнейших нарушений, вызванных основным патологическим процессом. Следует помнить, что нередко свищевой ход является дренажем для оттока гноя из патологических полостей. Преждевременные попытки закрытия этих свищей приводят лишь к неоправданной деформации грудной клетки. Нельзя закрывать бронхиальные свищи при наличии инородных тел, поддерживающих гнойный процесс. Удаление таких инородных тел может привести к самопроизвольному заживлению свища.
Наиболее благополучное течение наблюдается при бронхокожных трубчатых свищах, которые могут заживать самостоятельно или после несложного консервативного лечения. Губовид-ные свищи более стойкие и, как правило, требуют настойчивого консервативного или. даже оперативного лечения. Наружные бронхоплеврокожные. свищи под воздействием консервативного лечения в результате облитерации плевральной полости могут превращаться в трубчатые бронхокожные свищи сложной конфигурации, при которых чаще всего показано оперативное закрытие свища.
Известные способы консервативного лечения наружных бронхиальных свищей следует разделить на две группы: способствующие санации гнойных полостей и стенок свищевых ходов и разрушающие эпителиальную выстилку свищей, стимулирующие разрастание соединительной ткани.
К первой группе относится промывание гнойной полости антисептическими растворами. Как правило, это делается через свищевой ход. При значительной задержке гноя в полости и плохом дренировании через свищ проводятся тора-коцентез и активное вакуумное дренирование плевральной полости в наиболее выгодном нижнелатеральном отделе ее. Систематическая санация полости через свищ или через дренаж приводит к быстрому уменьшению интоксикации, очищению стенок полости и свищевого хода, что очень важно в плане подготовки
222
к оперативному лечению. Антибиотики в плевральную полость целесообразно вводить только с учетом чувствительности к ним микроорганизмов. В результате такой санации небольшие остаточные полости иногда облитерируются за счет фибринных напластований, сохраняется лишь бронхокожный трубчатый извилистый свищевой ход. Если он поддерживается сообщением с маленьким бронхом, то устье его может закрыться и свищ заживает.
При больших бронхиальных свищах эффективное промывание гнойной полости затруднено или невозможно из-за аспирации раствора в бронхиальное дерево. В таких случаях целесообразно выполнить временную окклюзию бронха, имеющего свищ, поролоновой пломбой. Последующий фракционный лаваж и постоянная активная аспирация из полости позволяют за сравнительно короткое время подготовить больного к оперативному закрытию бронхоплеврального свища и остаточной плевральной полости.
Консервативные мероприятия второй группы применяются в более отдаленные сроки при сформировавшихся наружных бронхиальных свищах и удовлетворительном состоянии больных. К этим мероприятиям относятся: прижигание свища химическими компонентами, физическими средствами, лучевое и механическое воздействие на свищ.
Из химических компонентов в разное время применялись палочки, кристаллы и растворы нитрата серебра, спиртовой раствор йода, карболовая кислота, протаргол в комбинации с генцианвиолетом и др. Наибольшее распространение получили 30—50 % растворы нитрата серебра.
Электрокоагуляция свища, прижигание аппаратом Пакелена также приводит к разрушению эпителиальной выстилки бронхиального свища, что способствует развитию грануляционной ткани и при благоприятных условиях может закончиться выздоровлением. М. Iselin (1944) при небольших бронхокожных свищах рекомендовал электроножом освободить устье свища от окружающих тканей, а сам свищ после этого прижигал электроножом. Иногда прижигание повторяется многократно до окончательного закрытия свища.
Благоприятные результаты рентгенотерапии при наружных бронхиальных свищах отмечал Б. Э. Линберг (1945), а С. Garre еще в 1904 г. описал успешное заживление стойкого бронхиального свища введением радия в свищевой ход. Клинические наблюдения лучевого воздействия на бронхиальный свищ единичны.
Несколько чаще применяется выскабливание свища острой ложечкой [Джанелидзе Ю. Ю., 1948 и др.] с последующими асептическими
перевязками на фоне общеукрепляющего лечения (анаболическими гормонами, пиримидиновыми производными, витаминами).
Сроки заживления наружных бронхиальных свищей при консервативном лечении длительные — в среднем 3—4 мес. Примерно в половине случаев различные методы консервативного лечения не приводят к стойкому заживлению, и требуется оперативное лечение [Джанелидзе Ю. Ю„ 1948; Муромский Ю. А., 1963].
Сроки оперативного закрытия наружных бронхиальных свищей колеблются от 4—6 нед до 5—6 мес от момента образования свища. Некоторые хирурги советуют еще больше выжидать с оперативным вмешательством в расчете на стойкое заживление свища под влиянием консервативного лечения. По опыту клиники оперативное закрытие наружных бронхиальных свищей следует предпринимать тогда, когда нет признаков гнойной интоксикации и задержки гноя в полости, стихли воспалительные явления в легком и окружающих свищ тканях, нет инородных тел или остеомиелита ребер, поддерживающих гнойный процесс, а также отсутствует дальнейшая положительная динамика, несмотря на продолжающееся консервативное лечение. Чрезмерное затягивание консервативного лечения приводит лишь к уплотнению рубцовой ткани в легком и вокруг свищевого хода и затрудняет выполнение операции.
Объем хирургического вмешательства определяется в зависимости от вида наружного свища, его локализации, наличия и величины стойкой остаточной плевральной полости, а также от характера изменений тканей, окружающих свищевой ход. Различают три группы способов оперативного закрытия наружных бронхиальных свищей: 1) ушивание бронхиального свища; 2) свободная пластика бронхиального свища различными тканями; 3) пластика бронхиального свища мышечным лоскутом на ножке.
Ушивание бронхиального с в и-щ а может быть без иссечения и с иссечением его. Менее всего оправдано наложение швов на склеротически измененные ткани бронхиального свища, так как плохое кровоснабжение этих тканей способствует развитию инфекции и рецидиву свища. Более эффективно ушивание свища после иссечения рубцово-измененных тканей. Это возможно при бронхокожных свищах.
По ходу операции свищ отсепаровывают от окружающей рубцовой ткани, слизистую оболочку бронха в области устья выскабливают острой ложечкой или выжигают электрокоагуляцией, бронх перевязывают у основания, и свищевой ход отсекают. Бронх, освобожденный от фиксирующих его рубцовых тканей, после этого частично втягивается в легочную ткань. Рану легкого и грудную стенку ушивают.
223
Свободная пластика различными тканями при бронхиальных свищах имеет лишь историческое значение. Для этих целей использовали раньше надкостницу из соседних ребер [Mayer W., 1909], фасцию [Hirano J., 1913], мышцы [Смирнов С. А., 1924]. Наиболее впечатляющие результаты получил Н. Neuhof (1937), который применил свободную пересадку жиром при множественных бронхиальных свищах у 17 больных: у 11 из них получено полное излечение.
Мышечная пластика на ножке для лечения бронхиальных свищей предложена отечественным хирургом А. А. Абражановым (1899). Автор описал технику своего способа мышечной пластики свищей и подчеркнул, что для успеха операции необходимы два условия: объем полости должен быть невелик, и секвестры, омертвевшая клетчатка, поддерживающие гнойный процесс, следует удалить. Длина свищевого хода не является противопоказанием к операции, так как его можно заполнить двумя мышечными лоскутами через отдельные отверстия.
В последующие годы пластика различных бронхиальных свищей мышечным лоскутом на ножке с успехом использовалась многими отечественными и зарубежными хирургами. Следует подчеркнуть важное предложение А. П. Крымова (1924): не разъединять сращения легкого с грудной стенкой, если они имеются, а лишь подвести мышечный лоскут к просвету бронхиального свища и закупорить его (как горлышко бутылки пробкой), укрепив сверху несколькими швами.
В зависимости от локализации бронхиального свища и состояния окружающих свищевой ход тканей для пластики могут быть использованы mm. pectoralis, latissimus dorsi, serratus anterior, romboideus, erector spinae и др. Мышечный лоскут следует выкраивать на широком основании, сохраняя ветви основных артерий мышцы. Следует помнить, что мышечный лоскут после пересечения дистального конца сокращается почти вдвое. Нельзя допускать значительного натяжения и перегиба лоскута в момент перемещения для пластики или поворота его по плоскости до прямого угла [Богуш Л. К., Диденко В. Ф., 1975]. При длинном бронхоплеврокожном свище и отсутствии остаточной плевральной полости можно использовать неизмененные межреберные мышцы после поднадкостничной резекции фрагментов двух соседних ребер. При наличии остаточной полости плевры мышечный лоскут должен полностью заполнить все ее карманы, причем мышцу фиксируют не только в зоне бронхиального свища, но и ко дну и стенкам полости швами, не нарушая ее кровоснабжения (швы накладываются не поперек, а по ходу
сосудистого пучка мышечного лоскута). Операция заканчивается дренированием полости и раны мягких тканей через отдельные контрапертуры, герметичным ушиванием раны мягких тканей и наложением давящей повязки с пелотом (ватно-марлевым, а лучше — из поролоновой губки).
Наиболее трудная хирургическая задача стоит при лечении больных с «решетчатым» легким. Предложены различные оперативные вмешательства, которые можно объединить в 4 группы: 1) мышечная пластика «решетчатого» легкого с иссечением или без иссечения его эпителиальной выстилки; 2) торакопластика или ее сочетание с мышечной пластикой «решетчатой» поверхности легкого; 3) резекция «решетчатого» легкого в сочетании в торакопластикой; 4) пневмонэктомия.
Объем операции определяется прежде всего характером изменений легочной паренхимы вокруг множественных бронхиальных свищей, а также состоянием мышц и других тканей грудной стенки, которые могут быть использованы для пластики. Пластическое закрытие «решетчатой» поверхности возможно лишь при незначительных патологических изменениях легкого. При наличии гнойно-деструктивного процесса в легком и бронхах по типу бронхоэктазий или хронических абсцессов, как правило, необходима резекция легкого в сочетании с торакопластикой, а также удаление всего легкого. Для закрытия «решетчатого» легкого или множественных бронхоплевральных свищей применяется несколько модификаций способа А. А. Абражанова.
При операции Лебше [Lebsche М., 1925] окаймляющим разрезом рассекают ткани на границе между кожей и «решетчатой» поверхностью легкого, проникают вглубь до плевры и хорошо распознаваемой легочной ткани. Уплотненный край тканей отсепаровывают со всех сторон и срезают вокруг свищей. Частыми швами тонким шелком легкое погружают так, чтобы швы не проникали в просвет инвагини-руемого слизистого мешка. Рана покрывается лоскутом жира или мышцы на ножке, под лоскутом оставляется дренаж на 1—2 дня, который вводится через отдельный разрез. Кожа мобилизуется на достаточном протяжении и ушивается с оставлением нескольких насечек для предупреждения образования гематомы.
При операции Ниссена [Nissen R., 1932] окаймляющим разрезом обнажают и резецируют фрагменты ребер для полного открытия «решетчатой» поверхности легкого. Отсепаровывают и отсекают только рубцовые края полости, эпителиальную выстилку на легком не удаляют. Мобилизуют мышечный лоскут на широком основании, покрывают им «решетчатую» по-
224
верхность легкого и фиксируют кетгутовыми швами. Полость под лоскутом дренируют, рану ушивают.
Приживление мышечного лоскута к «решетчатой» поверхности легкого происходит медленно. Вначале значительно увеличивается количество отделяемого по дренажу, что обусловлено, вероятно, слущиванием эпителиального покрова. Через 14—28 дней восстанавливается герметизм легкого, и постепенно рана окончательно заживает.
При аналогичной операции в модификации Лециуса [Lezius А., 1938] резецируют фрагменты ребер не только над «решетчатым» легким, а значительно шире — на 7—10 см от свищей. Кроме того, иссекаются краевые спайки и соединительнотканные тяжи. Этим уменьшается напряжение рубцов на висцеральной плевре и сокращаются размеры «решетчатой» поверхности легкого.
Операция Л. К. Богуша [Богуш Л. К., Диденко В. Ф., 1975], наоборот, заключается в наиболее полном выделении латеральной поверхности легкого со свищами, иссечении рубцовых и нежизнеспособных тканей, выскабливании «решетчатой» поверхности легкого. Устья свищей обрабатываются 80 % раствором трихлоруксусной кислоты и зашиваются отдельными П-образными капроновыми швами. После этого выделенная поверхность легкого с герметично ушитыми свищами «гофрируется» поперечными кисетными швами на расстоянии 1 —1.5 см один от другого, а сверху плевризу-ется дополнительным рядом узловых швов. Ушитая поверхность легкого покрывается мышечным лоскутом на ножке с фиксацией его не только по краям, но и в центре несколькими толстыми капроновыми лигатурами, предварительно проведенными достаточно глубоко под линией швов легкого и выведенными через подкожно-кожный массив наружу. Под мышечным лоскутом оставляют микроирригатор для введения антибиотиков в течение 2—3 дней после операции. Рану ушивают. Свободные концы капроновых лигатур туго завязывают над марлевыми валиками на коже, плотно придавливая кожно-подкожно-мышечный массив к поверхности легкого.
Торакопластика и ее сочетание с мышечной пластикой «решетчатого» легкого применяются при больших размерах остаточной плевральной полости.
При значительных патологических изменениях легочной ткани и бронхов, когда клиническая картина обусловлена не столько наличием бронхоплевральных или бронхокожных свищей, сколько гнойно-деструктивным процессом в легких, пластическое закрытие свищей может лишь ухудшить состояние больного.
В этих случаях показана резекция доли или всего легкого.
Консервативное лечение внутренних бронхиальных свищей начинается, как правило, с мероприятий, которые преследуют две основные задачи: санацию полостей, очагов гнойного процесса и ликвидацию свищей, патологических полостей.
Следует подчеркнуть, что при наличии внутреннего бронхоплеврального свища санация гнойной полости значительно затруднена, иногда невозможна без оперативного вмешательства. Так, при эмпиеме с бронхоплевральным свищом, сопровождающейся выраженной гнойной интоксикацией, эффективная санация полости возможна лишь при открытом дренировании ее одним из методов торакостомии с последующим ведением как при наружных бронхоплеврокожных свищах. При бронхолегочных свищах наличие стойкого сообщения бронхиального дерева с полостью абсцесса в легком позволяет санировать ее через дренирующий бронх.
Вопрос о ликвидации стойких внутренних бронхиальных свищей должен решаться только после тщательной санации полости и основного очага гнойного процесса.
За последние годы возросла роль эндоскопических мероприятий с целью ликвидации внутренних бронхиальных свищей, особенно при несостоятельности или свище культи бронха после операций на легких. Различают три группы мероприятий, которые могут быть выполнены через бронхоскоп [Белкин В. Р., 1973]. К 1-й группе относится удаление лигатур из культи бронха, так как они при развившемся бронхиальном свище поддерживают хроническое воспаление в стенке бронха. Удаление лигатур иногда ведет к заживлению культи. 2-я группа мероприятий — прижигание слизистой оболочки культи бронха в области свищевого отверстия химическими препаратами (30—50 % раствором нитрата серебра, 40—50% раствором гидрата окиси натрия и др.), разрушающими эпителиальную выстилку свища и стимулирующими рост грануляционной ткани. Манипуляции повторяются через 3—4 дня, всего 5—7 и более сеансов за курс лечения. При небольших отверстиях (2—3 мм в диаметре) эти мероприятия нередко ведут к заживлению свища. 3-я группа мероприятий направлена на эндобронхиальное закрытие дефекта культи бронха с помощью цианакрилатного клея и биологических пластических материалов.
В клинике госпитальной хирургии для этих целей использовали клеевые композиции МК-6 или МК-7 и коллагеновые пломбы, приготовленные в Центральной научно-исследовательской лаборатории по изучению и применению коллагена в медицине I Московского медицин
15 Зак. 0517
225
ского института имени И. М. Сеченова. Цианакрилатные клеевые композиции, по данным В. Р. Белкина (1969), А. Я. Акимовой и соавт. (1973), обладают адгезией к тканям в условиях относительной влажности, нетоксичны, не препятствуют нормальному течению репаративных процессов, имеют антибактериальные свойства, подвергаются постепенному гидролизу и рассасыванию в тканях. Коллагеновые пломбы являются пористыми губками, которые прорастают фибробластами из краев дефекта и постепенно рассасываются. Добавление антибиотиков (мономицина) и стимуляторов репаративных процессов (метилурацила) в процессе приготовления коллагеновых пломб усиливает их благоприятное воздействие на ткани.
При любой методике заклеивания культи бронха большое значение имеет строгое соблюдение ряда условий. Во-первых, необходима заблаговременная подготовка вспомогательных инструментов и пломбы, размер которой должен быть несколько большим, чем диаметр дефекта культи. Во-вторых, надо тщательно подсушить слизистую оболочку культи и быстро выполнить все последующие манипуляции. В-третьих, клеевую композицию необходимо наносить тонким слоем и лишь в зоне дефекта культи. В-четвертых, коллагеновую пломбу необходимо в течение 30—40 с плотно прижимать к дефекту.
Перед удалением бронхоскопа повторяется анестезия слизистой оболочки культи, карины и подсвязочного пространства для подавления кашля. В последующем кашель желательно подавлять приемом противокашлевых средств — глауцина, текодина, кодеина и др. После заклеивания дефекта культи обязательно продолжается санация остаточной плевральной полости с введением антисептиков и антибиотиков для подавления инфекционного процесса. Нельзя допускать задержки гноя в полости, однако промывание ее должно быть очень осторожным, лучше через двухпросветный дренаж.
В клинике использовали эту методику у больных с послеоперационными свищами культи долевых (у 11) и главного (у 9) бронхов. Окончательно ликвидировать свищ удалось у 16 больных. У остальных наступило отторжение или расплавление пломбы раньше, чем в нее прорастала грануляционная ткань культи. Однако и в этих неудачных случаях временное закрытие дефекта культи способствовало лучшей санации полости эмпиемы, снятию интоксикации, уменьшению дыхательной недостаточности. У некоторых больных эндобронхиальное закрытие дефекта культи бронха проводили повторно, а у трех его сочетали с широкой торакостомией. Открытое ведение полости эмпиемы у этих больных позволило хорошо очистить ее
стенки и способствовало окончательному закрытию культи бронха грануляциями и фибринны-ми напластованиями со стороны полости.
Анализ этого материала позволяет выделить следующие основные причины неудачных попыток эндобронхиального заклеивания дефектов культи бронха: 1) большие дефекты культи — более 5 мм в диаметре; 2) недостаточно разрушенная эпителиальная выстилка бронхиального свища и отсутствие грануляционной ткани в зоне дефекта; 3) выраженный гнойный или эрозивный эндобронхит; 4) недостаточное просушивание слизистой оболочки в зоне культи и несоблюдение других принципов эндобронхиального заклеивания дефектов бронха; 5) плохая санация эмпиемы до момента заклеивания культи и задержка гноя в полости в первые дни после окклюзии свища; 6) очень активное, неосторожное промывание полости через дре-над после заклеивания культи до заживления ее дефекта. Можно предположить, что разработка новых клеевых композиций с лучшими адгезивными свойствами в условиях относительной влажности живых тканей, создание более совершенных инструментов и усовершенствование методики позволят чаще с успехом использовать эндобронхиальное закрытие внутренних бронхиальных свищей.
Оперативное лечение внутренних бронхиальных свищей. Задачей оперативного вмешательства является не только устранение бронхиального свища, но и ликвидация остаточной плевральной полости.
При небольших бронхоплевральных свищах, удовлетворительном состоянии легочной ткани, не очень плотных фибринных напластованиях на висцеральной плевре, хорошо санированной полости операцией выбора является декортикация легкого с ушиванием и инвагинацией бронхиального свища. Если же декортикация невозможна, выполняется торакопластика, нередко в сочетании с одним из методов мышечной пластики бронхиального свища. Оперативное вмешательство при множественных бронхоплевральных свищах осуществляется по тем же принципам, что и при «решетчатом» легком. Наличие бронхиального свища и выраженного гнойно-деструктивного процесса в легком по типу хронических абсцессов, бронхоэктазий является показанием к р е-зекции доли или всего легкого.
Наиболее сложная задача стоит при лечении больных со свищом культи бронха после пневмонэктомии. При первичной несостоятельности культи в первые 1—2 дня (до развития эмпиемы) выполняются реторакотомия и повторное ушивание культи главного бронха с обязательной тщательной плевризацией ее. При
226
длинной культе целесообразно произвести выделение ее до карины и ушить повторно аппаратом УКБ с иссечением периферических краев культи и дополнительным ушиванием П-образны'ми или узловатыми швами. В ряде случаев, особенно после пневмонэктомии по поводу рака главного бронха, культи бронха нет, а швы подчас наложены прямо на стенку трахеи. Ушить дефект у таких больных невозможно, хотя описаны единичные успешные лйЛжданмя цррхуляряр» розотщии трахеи с наложением анастомоза между трахеей и главным бронхом другого легкого [Харченко В. IL, Чхиквадзе В. Д., 1981].
Если же диагностирована вторичная несостоятельность культи главного бронха, ушивание ее и тем более операции на трахее в условиях острой эмпиемы плевры бесперспективны. В таких случаях необходимо срочное дренирование плевральной полости для обеспечения оттока экссудата (гноя) и предупреждения аспирации его в бронхи другого легкого. При выраженной гнойной интоксикации и недостаточном опорожнении полости через дренаж показано открытое дренирование с резекцией фрагментов 1—2 ребер в нижнелатеральном отделе плевральной полости. Оперативное закрытие свища культи главного бронха предпринимается только после тщательной санации полости эмпиемы и значительного улучшения состояния больного.
Известны три группы оперативных вмешательств на главных бронхах при бронхиальных свищах после пневмонэктомии: 1) операции на культе бронха через полость эмпиемы: 2) операции на главных бронхах через средостение; 3) операции из контралатерального доступа со стороны другой плевральной полости.
Большинство хирургов при вмешательствах через полость эмпиемы производят реампутацию и ушивание культи главного бронха в сочетании с 7—10-реберной торакопластикой [Богуш Л. К. и др., 1963; Бабашев Б. С., Нуркабаев Ч., 1970, и др.], Учитывая чрезмерную травматичность этого вмешательства и резкую деформацию грудной клетки с инвалидизацией больного даже при успешном закрытии бронхиального свища, И. С. Колесников и ф. И. Горелов (1965) разработали метод реампутации и ушивания культи бронха через полость эмпиемы с одномоментным частичным или полным удалением эмпиемного мешка без торакопластики. Плевральную полость затем продолжают санировать пункционно или через дренаж до купирования инфекционного процесса с последующей облитерацией полости за счет постепенной организации экссудата.
Операции на главных бронхах через средостение осуществляют трансстерналь
ным доступом [Перельман М. И., Богуславская Т. Б., 1963; Богуш Л. К. и др., 1972; Abruz-zini Р., 1963]. В большинстве случаев при этом вскрывают перикард, выделяют и перевязывают культю легочной артерии, а после этого тупым и острым путем выделяют основание культи главного бронха и ушивают его аппаратом У О или УКБ. Ушитую культю бронха отсекают от трахеи, затем дренируют средостение двумя дренажами: от бифуркации трахеи через полость перикарда и через отдельный прокол около мечевидного отростка.
Контралатеральный доступ, по мнению М. И. Перельмана и Г. П. Амбатьело (1968), несколько проще трансстернального доступа к культе левого главного бронха, а к правому главному бронху он сложнее из-за необходимости мобилизации дуги аорты. Само вмешательство на главных бронхах заключается в выделении и ушивании аппаратом основания культи, отсечении ушитой культи от трахеи и ушивании отверстия в периферическом отделе культи. Линию швов на трахее плевризируют.
Бронхолегочные свищи могут ликвидироваться самостоятельно в процессе комплексного консервативного лечения острых абсцессов легкого, дренирующихся через бронх. В таких случаях речь идет не о стойком бронхиальном свище, а о сообщении полости абсцесса с бронхом без характерной для свища эпителиальной выстилки свищевого хода и стенок полости. Лишь у 10 % больных острые сообщения полостей деструкции в легком с бронхиальным деревом превращаются в стойкие бронхолегочные свищи, которые поддерживаются хроническим гнойно-деструктивным процессом в легком (множественные абсцессы, бронхоэктазии).
Задачей оперативного лечения у таких больных является не закрытие бронхолегочного свища, а удаление гнойного очага, т. е. выполняются частичная резекция легкого или же пневмонэктомия. В единичных случаях из-за крайне тяжелого состояния больного может быть выполнена широкая пневмотомия с раскрытием и наружным дренированием гнойных полостей в легком. В последующем, при улучшении состояния больного, выполняется радикальное оперативное вмешательство: резекция легкого или же мышечная пластика образовавшихся множественных бронхиальных свищей («решетчатого» легкого).
При бронхоорганных свищах патологический процесс в легком поддерживается и нарастает из-за попадания содержимого желудочно-кишечного тракта или желчных путей в бронхиальное дерево. Поэтому при длительном существовании бронхоорганных свищей производится не только разъединение свища, но и резекция части легкого вплоть до пневмонэктомии.
15*
227
Глава 1 0 ОПУХОЛИ
ПЛЕВРЫ
Опухоли плевры относятся к числу относительно редких заболеваний: примерно один больной на 100 больных раком легкого [Богданов А. В. и др., 1970|. По секционным данным [Давыдовский И. В., 1940; Палешников Г. С., 1966; Бондаренко Б. Б., Бойкова Н. В., 1975. и др.], они встречаются от 0,024 до 0,4 % от всех вскрытий. Частота опухолей в правой и левой плевральной полости одинаковая. Двусторонняя локализация встречается очень редко, однако у 2 из 5 больных с мезотелиомой, наблюдавшихся в клинике госпитальной хирургии за последние годы, была поражена не только плевра обеих половин грудной клетки, но и перикард, а у одного пациента — и брюшина. По данным литературы, несколько чаще опухоли плевры наблюдаются у мужчин пожилого возраста, но описаны случаи заболеваний и у детей [Че-пик О. Ф„ Журавлев А. В., 1979].
Различают первичные и вторичные опухолевые поражения плевры. В данной главе будут рассмотрены преимущественно первичные опухоли, так как вторичными являются метастатические поражения плевры при злокачественных процессах в легких, молочной железе и других органах.
В зависимости от источника опухолевого роста различают два вида первичных опухолей [В. М. Сергеева, 1967]: 1) мезотелиальные и 2) мезенхимальные. Мезотелиальные опухоли чаще всего развиваются из мезотелия, значительно
реже — из соединительнотканной стромы плевры и ее сосудистых элементов. Мезенхимальные опухоли происходят из тканей субмезотелиального слоя плевры. Большинство мезотелиальных опухолей являются злокачественными, мезенхимальные опухоли плевры, как правило, доброкачественные. Некоторые авторы все опухоли из субмезотелиального слоя относят к опухолям грудной стенки, а опухолями плевры считают лишь мезотелиомы [Fojanini G., Picciocchi А., 1960].
Классификацию опухолей плевры можно представить следующим образом (см. ниже).
МЕЗОТЕЛИАЛЬНЫЕ ОПУХОЛИ ПЛЕВРЫ
По гистогенетическому принципу большинство первичных опухолей плевры объединяют в один вид — мезотелиомы. Известны многочисленные синонимы (злокачественная эпителиома плевры, карциноматозная эндотелиома, саркоматозная эндотелиома, целетелиома, рак плевры и др.— всего около 40, по данным В. М. Сергеева 1967), что обусловлено чрезвычайным полиморфизмом их микроструктур. Мезотелиальные клетки, покрывающие серозные оболочки, в процессе роста способны развиваться как в эпителиальном, так и в соединительнотканном направлении. Некоторые авторы признают возможность перехода соединительнотканных клеток в мезотелиальные. Различают диффузную и локализованную (узловатую) формы мезотелиом.
Локализованные или фиброзные мезотелиомы относят к условно доброкачественным опухолям, так как они отличаются медленным ростом в виде четко отграниченного узла, заключенного в богато васкуляризованную капсулу.
Опухоли плевры
Первичные
Мезотелиальные Мезенхимальные
(чаще злокачественные) (преимущественно доброкачественные)
Локализованные мезотели- Диффузные мезотелиомы Фибромы, липомы, омы (условно-доброкачест- (злокачественные) невриномы, хондромы, ос-
венные) теофибромы. ангиомы
Вторичные
Тератомы (метастатические поражения плевры при опухолях легких, молочных желез и других органов)
228
Обычно эти опухоли не дают метастазов, однако нередко встречаются местные рецидивы после удаления опухоли [Benoit Н. et al., 1953]. Фиброзные мезотелиомы могут исходить из любого листка плевры, однако из париетальной плевры они развиваются в 3 раза чаще, чем из висцеральной [Clagett О. et al., 1952]. Эти опухоли могут возникать у людей обоего пола и в любом возрасте. Иногда узловатые мезотелиомы достигают больших размеров и массы. Ю. Н. Коноваловым (1976) описана мезотелиома размерами 21X 14X9 см и массой 2200 г. Макроскопически различают две формы локализованных мезотелиом: 1) свободно расположенные в плевральной полости — обычно доброкачественные; 2) сращенные с легочной тканью — чаще злокачественные. Последние имеют менее выраженную капсулу. Ткань опухоли чаще плотная, на разрезе — слоистая, белого, желтоватого или красноватого цвета, иногда дольчатого строения или кистозная. Злокачественные узловатые мезотелиомы обычно мягкой тестоватой консистенции.
Гистологический диагноз локализованных мезотелиом затруднен, так как опухоль представлена фиброзной тканью, иногда местами гиалинизированной, с очагами некроза. Строение ее напоминает многокамерную фиброму, и только в культуре ткани удается доказать мезотелиальное происхождение клеток опухоли. Злокачественные мезотелиомы отличаются большим полиморфизмом клеток, их митозами. Опухолевые клетки иногда образуют беспорядочные пучки, иногда приобретают округлую или звездчатую форму. Многие авторы подчеркивали чрезвычайную вариабельность гистологических структур злокачественных мезотелиом плевры по сравнению со злокачественными опухолями легких.
Диффузные опухоли плевры являются более злокачественными и встречаются в 10 раз чаще, чем локализованные мезотелиомы. Сведения о частоте этих опухолей трудно считать достоверными, так как деление на злокачественные и доброкачественные мезотелиомы в известной мере условно. Кроме того, многие опухоли плевры без достаточных оснований были отнесены к диффузным мезотелиомам, а в действительности они являлись вторичными метастатическими поражениями плевры [Willis R., 1953]. Нередко диффузная мезотелиома разрастается по обоим плевральным листкам, иногда прорастает в перикард, брюшину. Описан даже случай инфаркта миокарда, вызванного прорастанием мезотелиомы в сердце и сдавлением венечной артерии [Бабушкин Г. А., 1971].
Макроскопически для этого вида мезотелиом характерным является диффузное утолщение париетального, реже — висцерального (иногда
и того и другого) листков, достигающих толщины нескольких сантиметров и окружающих легкое или сердце в виде плотного панциря. Серозная полость также может быть выполнена мягкими, сочными опухолевыми массами. Если серозная полость не подверглась облитерации, то в ней скапливается экссудат, быстро возобновляющийся после пункции и удаления его. Экссудат в ранние сроки заболевания серозный или серозно-фибринозный, но вскоре становится серозно-геморрагическим вследствие десквамации пораженного мезотелия и частичного распада опухоли. L. Borek и соавт. (1965) выделяют три стадии развития диффузной мезотелиомы: I — проявляется возникновением специфического экссудативного плеврита; II — неравномерным или пластинчатым утолщением плевры; III — агрессивным распространением опухоли в окружающие органы, сопровождающимся сморщиванием периферических отделов легкого и деформацией тканей грудной стенки.
Злокачественная мезотелиома склонна к быстрой диссеминации по лимфатическим сосудам. В результате этого возможны возникновение опухолевого лимфангита, образование мелкоузелковых высыпаний и возникновение метастазов в регионарных лимфатических узлах. Опухоль часто прорастает в подлежащий орган (легкое, диафрагму) с образованием мелких узелков и тяжистой опухолевой ткани. При образовании в плевре или легком одиночного крупного узла всегда возникает подозрение на метастаз опухоли из другого органа.
При гистологическом исследовании мезотелиом обнаруживается весьма разнообразное их строение. Наиболее частой формой мезотелиом следует считать эпителиоподобную (первичный рак плевры). Клетки таких мезотелиом имеют разнообразную величину, уплощенную кубическую, реже — низкопризматическую форму, чаще неправильную, • весьма склонны к дискомплексации. Эпит лиоподоб-ная форма мезотелиом часто имее преимущественно тубулярное или сосочк .вое строение. По гистологической классификации [Чепик О. Ф., Журавлев А. В., 1979] различают: 1) мо-нофазные злокачественные мезотелиомы — а) из эпителиоподобных клеток; б) из фибробластоподобных клеток; 2) бифазные злокачественные мезотелиомы, в которых сочетаются эпителио- и фибробластоподобные клетки.
Описаны мезотелиомы саркоматозного, ан-гиоматозного строения. Среди первичных злокачественных опухолей некоторые авторы выделяют самостоятельную подгруппу — первичные саркомы, которые происходят из субмезотелиальной ткани или из мезотелия вследствие его трансформации в соединительнотканном
229
направлении [Головин Д. И.. 1953]. В. М. Сергеев (1967) на основании данных литературы и собственных наблюдений описал 20 случаев первичной саркомы плевры и считает, что их соотношение к первичным ракам плевры равно 1:6,4. Отличительной особенностью сарком плевры является диффузное распространение бластоматозного процесса по ходу сосудов плевры и легкого с прорастанием в их просвет [Рыжкова Е. В., 1958], а также более интенсивный рост опухоли, что ведет к смещению средостения в здоровую сторону, сглаженности межреберий и выбуханию соответствующей половины грудной клетки.
Гистологический диагноз мезотелиом и первичной саркомы плевры возможен на основании изучения материалов биопсий и безусловного исключения первичной опухоли легкого.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
И ДИАГНОСТИКА
Клинические проявления в начальный период заболевания отсутствуют или имеют стертый характер. Общее состояние больных при первичных опухолях плевры, в отличие от метастатических поражений ее, длительное время остается удовлетворительным. Это затрудняет диагностику опухолей плевры в ранних стадиях развития заболевания, так как больные поздно обращаются к врачу.
Наиболее частыми признаками поражения плевры являются боли в груди, одышка при небольшой физической нагрузке и скопление жидкости в плевральной полости. Боли при опухолях плевры в начале заболевания не связаны с дыхательными экскурсиями грудной клетки, что отличает их от болей другого происхождения. Чаще всего боли постоянные, ноющего характера. В некоторых случаях болевой синдром проявляется по типу межреберной невралгии, иногда с иррадиацией в плечо; реже бывают приступообразные, опоясывающие боли. Характерно усиление болей после пункции плевры, что, по мнению А. Я. Могилевича (1929), обусловлено тракцией утолщенной плевры или трением плевральных листков после аспирации экссудата.
Одышка у больных мезотелиомой, в отличие от экссудативного плеврита, не уменьшается после эвакуации плеврального выпота. Она усиливается в вертикальном положении больного. Развитие одышки обусловлено не только скоплением экссудата в плевральной полости и коллапсом легкого, но и раздражением рецепторов плевры, имеющих важное значение в механизме дыхательных движений. Нередко наблюдаются также сухой, болезненный кашель, чувство сдавления в груди.
Очень характерным симптомом мезотелиомы является специфический экссудативный плеврит, особенно при диффузных опухолях. Описаны случаи скопления в плевральной полости одномоментно до 10 л геморрагического экссудата [Baylac М„ 1924]. Важным признаком опухолевого генеза экссудата является также его быстрое накопление после аспирации [Мар-морштейн С. Я. и др., 1976]. Узловатые мезотелиомы могут протекать без экссудата.
При локализации опухоли в области купола плевры, как и при раке верхушки легкого, может быть триада Панкоста [Pancoast Н., 1924]: боли с иррадиацией в плечо, иногда отек руки, синдром Горнера, связанные с поражением плечевого сплетения, верхнего грудного и нижнего шейного симпатических ганглиев.
У одной из наблюдавшихся нами больных первыми проявлениями мезотелиомы был упорно рецидивирующий спонтанный пневмоторакс.
Данные физикального обследования таких больных различны в зависимости от локализации и распространенности опухолевого процесса, интенсивности экссудации в полость плевры. При осмотре может быть выявлено отставание пораженной половины грудной клетки в акте дыхания, иногда западение и сужение межреберных промежутков, в запущенных случаях — сколиоз из-за обширного рубцового процесса, сопутствующего опухолевому росту. В редких случаях при саркоматозных поражениях плевры и тканей грудной стенки наблюдается, наоборот, сглаженность или выбухание межреберий. Голосовое дрожание, как правило, ослаблено. Пер-куторно определяется значительное притупление легочного звука на стороне поражения, сохраняющееся и после аспирации экссудата из плевральной полости. Дыхание над этим легким ослаблено. По мере прогрессирования процесса физикальные данные нарастают, появляются общие признаки злокачественного бластоматозного поражения (значительное недомогание, быстрая утомляемость, потливость, похудание, бледность, субфебрильная температура тела и др.). Иногда из-за распространения опухоли на окружающие органы и ткани могут определяться признаки легочной и сердечно-сосудистой недостаточности, реже— симптомы сдавления верхней полой вены (набухание шейных вен, одутловатость лица и др.), признаки распространения процесса на брюшину (боли в животе, асцит).
Диагностика мезотелиомы на основании клинических признаков возможна преимущественно в поздней стадии заболевания. Лишь тщательная оценка всех проявлений его, особенно притупления легочного звука в отделах, не характерных для экссудативного плеврита,
230
Рис. 107. Локализованная мезотелиома плевры.
а — прямая рентгенограмма; б — боковая рентгенограмма.
Рис. 108. Диффузная мезотелиома плевры.
а — прямая рентгенограмма; б — боковая рентгенограмма.
231
и быстрое накопление экссудата в плевральной полости позволяют в более ранние сроки заподозрить наличие опухоли плевры.
Большое диагностическое значение имеют рентгенологические исследования, особенно после аспирации плеврального экссудата, когда на полипозиционных рентгенограммах определяются утолщенная плевра или патологические тени разной величины и формы в периферических отделах грудной клетки (рис. 107, 108). В большинстве случаев тень средостения смещается в здоровую сторону, причем это смещение не исчезает и после удаления плеврального экссудата. Для установления топического диагноза внутригрудного пристеночного поражения Л. С. Розенштраух и М. Г. Виннер (1968), Ю. Н. Соколова и П. А. Спасская (1971) рекомендуют тщательно оценить характер перехода патологического образования в контур смежных с ним отделов органов грудной стенки и легкого. Так, тупой или прямой угол, образующийся в этой переходной зоне, свидетельствует о внеле-гочной локализации патологического процесса, а острые углы дают основание предполагать наличие пристеночной опухоли в легком. Согласно наблюдениям Ю. А. Романычева (1977), определение характера углов переходных зон имеет относительное значение, а в диагностике опухолей плевры следует учитывать особенности их роста и распространения. Г. И. Варновиц-кий и Ю. А. Романычев (1981) подчеркивают значение так называемого симптома «кулис» в дифференциальной диагностике пристеночных плевритов и опухолей плевры. Так, при плевритах интенсивность затенения латерального отдела становится меньшей в горизонтальном положении больного из-за смещения жидкости, причем при экссудативном плеврите симптом «кулис» имеет ровные стенки, а при опухолях плевры контуры тени волнистые, особенно если опухоль дольчатого строения. По данным Б. Г. Шустерова и соавт. (1977), важную роль в дифференциальной диагностике между доброкачественными и злокачественными мезотелиомами имеет оценка контуров тени опухоли в оптимальной для каждого случая проекции: четкие, ровные контуры опухоли при отсутствии перифокальных воспалительных изменений свидетельствуют о ее экспансивном росте. При злокачественных опухолях плевры определяется выраженное утолщение плевры без четких границ из-за инфильтрирующего роста опухоли и реактивных изменений окружающих тканей [Варновицкий Г. М., Романычев Ю. А., 1981].
Иногда применяются рентгенопневмографические методы исследования для исключения связи патологического образования с органами средостения (пневмомедиастинография) и ор
ганами брюшной полости (пневмоперитонео-графия), а также для более точной оценки распространенности опухоли по плевральным листкам (исследование в условиях диагностического пневмоперитонеума, плеврография с помощью йодсодержащих контрастных веществ), но эти исследования результативны лишь при отсутствии сращений в плевральной полости.
Важнейшее значение в ранней диагностике опухолей плевры имеет исследование плеврального экссудата. Экссудат в большинстве случаев геморрагического характера, содержит обилие эритроцитов. Серозный экссудат по клеточному составу является лимфоцитарноэозинофильным. Количество эозинофилов в нем достигает 60 %, а нейтрофилов — не превышает 27 % [Ожогина Е. П., Комарова Н. Г., 1975]. Несомненным признаком опухолевого процесса является обнаружение атипичных клеток в экссудате с выраженным полиморфизмом ядер и патологическими митозами. Часто клетки больших размеров (до 40—60 мкм, т. е. в 2 раза больше неизмененных мезотелиальных клеток), имеют округлую форму и большое ядро, окаймленное протоплазмой в виде узкого ободка. Эти клетки способны к фагоцитозу неповрежденных клеток, нередко содержат вакуоли, образуя так называемые «перстневидные клетки». 3. Ф. Климанова (1971) описала три типа цитологических картин экссудата, характерных для мезотелиомы: 1) клеточный состав экссудата сходен с таковым при раке; 2) клетки имеют сходство с мезотелием при регенеративно-пролиферативных процессах; 3) смешанный тип.
Однако и в настоящее время следует признать справедливым замечание W. Giese (1960) о том, что цитологическая картина не является несомненным признаком наличия или отсутствия опухоли плевры. Нередко требуются трансторакальная пункционная биопсия и гистологическое исследование полученного материала. Если пункционная биопсия была сомнительной, а плевральная полость не облитерирована, то выполняются торакоцентез и плевроскопия [Богуш Л. К. и др., 1975], при которой может быть выявлена опухолевая ткань бархатистого вида на висцеральной плевре с более выраженным утолщением париетальной плевры. В сложных случаях решающее диагностическое значение имеет эксплоративная торакотомия, производимая с таким расчетом, чтобы ее можно было расширить для радикальной операции с удалением опухоли.
ЛЕЧЕНИЕ
Наиболее радикальным методом лечения локализованных фиброзных мезотелиом является хирургическое удаление опухоли. При диффуз
232
ных мезотелиомах это возможно лишь в редких случаях ранней диагностики их. Первым из отечественных хирургов успешное удаление мезотелиомы выполнил С. И. Спасокукоцкий в 1925 г. По сводным данным отечественных и зарубежных хирургов [Сергеев В. М., 1967], лишь около 10 % больных мезотелиомами были оперированы, остальные признаны неоперабельными из-за значительного распространения опухолевого процесса. За последние годы процент операбельности этих больных и результаты лечения существенно не изменились.
Объем оперативного вмешательства определяется в зависимости от распространенности процесса. При фиброзных мезотелиомах чаще всего прибегают к резекции опухоли с прилежащим участком грудной стенки и частичной резекцией легкого.
Резекция грудной стенки производится под наркозом. Разрез проводится через все мягкие ткани грудной стенки до ребер. Отсепаровы-вается овальный кожно-мышечный лоскут, который поднимается над местом расположения опухоли кверху или кзади. Производится резекция двух ребер, лежащих выше и ниже опухоли. Пересекаются ребра и межреберные ткани кпереди от опухоли и кзади от нее. Образовавшийся «реберный» лоскут откидывается кзади. Если опухоль париетальной плевры не сращена с ребрами и межреберными мышцами, то ее удаляют вместе с плеврой и внутригруд-ной фасцией, а «реберный» и кожно-мышечный лоскуты укладывают на место, дренируют плевральную полость и рану грудной стенки зашивают. Если опухоль прорастает в ткани «реберного» лоскута, то его удаляют вместе с опухолью. При переходе опухоли на висцеральную плевру и легкое производят одновременно соответствующую резекцию легкого, иногда выполняют лобэктомию или пневмонэктомию. Размеры радикальной операции определяются в зависимости от площади распространения опухолевого процесса с обязательным соблюдением современных принципов абластичности вмешательства.
Следует отметить, что при диффузных мезотелиомах большие операции по типу плевропневмонэктомии с обширной резекцией грудной стенки не всегда оправданны из-за высокой послеоперационной летальности и плохих отдаленных результатов [Богуш Л. К. и др., 1976]. Рекомендовавшиеся ранее операции по типу декортикации легкого и плеврэктомии в большинстве случаев нерадикальны, и все больные погибают в течение 2—5 мес от местных реци
дивов опухоли [наблюдения Brunner W., 1953; Lob А., 1953, и др.].
Лучевая терапия при мезотелиомах тоже мало эффективна. Лишь при саркоматозной форме описан очевидный лечебный эффект после воздействия радиоактивного золота [Miilly К., 1956]. О перспективности лучевой терапии писали Л. С. Розенштраух и Л. А. Гуревич (1973).
В подавляющем большинстве случаев при злокачественных мезотелиомах показано только симптоматическое лечение, направленное на уменьшение болей, удаление плеврального экссудата, а также химиотерапия внутриплевральным введением тиофосфамида или эмбихина, 5-фторурацила, хинакрина, делагила, деграно-ла и других цитостатических препаратов [Брацлавский И. Ф. и др., 1966; Бычков М. Б., 1978; Groy F. et al., 1962; Dollinger M. et aL, 1967, и др.]. X. А. Абисатов и У. Ш. Шайхиева (1971) показали возможность получения благоприятных результатов комбинированной химиотерапии при злокачественных опухолях плевры: общей (внутривенно) и местной (внутриплеврально). Сочетанное применение дегранола или 5-фторурацила внутривенно и тиофосфамида внутриплеврально при одновременном симптоматическом лечении дает возможность облегчить страдания больных, замедляя или прекращая накопление плеврального экссудата. М. Б. Бычков (1978), подводя итоги лечения 28 больных, показал преимущество внутриплеврального введения делагила при раковых плевритах, так как он не угнетает кроветворения, а по эффективности в основном не уступает другим химиопрепаратам.
Прогноз при диффузной мезотелиоме плохой. Опухоль быстро распространяется по плевре и окружающим тканям, рано дает метастазы в регионарные лимфатические узлы и в лимфатические узлы средостения. Трудности ранней диагностики этих опухолей в настоящее время не разрешены, поэтому радикальное лечение у большинства больных невозможно. Отдаленные результаты хирургического лечения редко превышают 6—12 мес. Даже при оперативном удалении фиброзной мезотелиомы 5-летний срок жизни после операции отмечен лишь в единичных случаях [Савицкий А. М., 1967; Stoebner Р. et al., 1970]. Необходимо стремиться к более ранней диагностике опухолей плевры, когда имеется возможность радикального оперативного вмешательства и предупреждения рецидива и метастазирования после операции при комплексном лечении в послеоперационном периоде (химиотерапия, лучевая терапия).
Глава JL X БРОНХОЭКТАЗИИ
К бронхоэктазиям следует отнести заболевание легкого с преимущественным поражением бронхов тяжелого воспалительно-деструктивного характера, распространяющимся на всю толщу бронха, окружающую клетчатку, кровеносные и лимфатические сосуды, ведущим к расширению просвета бронхов, утрате ими дренажной функции. Бронхоэктазии имеют достаточно четко очерченную клиническую картину.
Известны наблюдения, когда расширение бронхов, даже значительное, ничем себя клинически не проявляет. Об этом свидетельствуют данные патологоанатомических вскрытий, показавших, что расширения бронхов у умерших встречаются значительно чаще, чем диагностируются при жизни. Есть наблюдения, когда расширения бронхов обнаруживались случайно при обследовании больных, страдавших каким-либо другим легочным заболеванием (например, бронхиальной астмой). Однако такое расширение бронхов — не более чем аномалия развития бронхиального дерева, но не болезнь. К бронхоэктазиям как к нозологической форме его отнести нельзя.
Бронхоэктазии могут сопровождаться другой самостоятельной патологией легких. Они могут возникать на фоне какого-либо другого легочного заболевания, например туберкулеза, острого или хронического абсцесса, опухоли, инородного тела бронха. С другой стороны, бронхоэктазии могут осложниться каким-либо другим легочным страданием, к примеру абсцессом. В связи с этим некоторые авторы рассматривали особо вторичные и осложненные бронхоэктазии. Однако, строго говоря, исходя из приведенного определения, бронхоэктазии всегда вторичны, они всегда являются следствием воспаления бронхиального дерева.
Существует мнение, что бронхоэктазии — форма течения или стадия развития хронической пневмонии или бронхита. Однако большинство хирургов считают, что руководствоваться этой точкой зрения в практической работе нельзя [Горовенко Г. Г., Брусиловский Б. М.,
1973; Колесов А. П., Гаджиев С. А., 1973; Королев Б. А., 1973; Путов Н. В., 1973, и др.]. Хроническая пневмония и бронхоэктазии, как полагает большинство, являются самостоятельными заболеваниями, имеющими самостоятельную клиническую картину и течение. Наблюдения М. Р. Рокицкого (1972) показали, что, скрываясь под неопределенным диагнозом хронической пневмонии, значительная часть больных бронхоэктазиями (до 15 %) долго и безуспешно лечатся консервативными методами, тогда как им показано хирургическое вмешательство.
Таким образом, бронхоэктазии следует рассматривать как самостоятельную патологию, которая возникает вторично и может сочетаться с другими заболеваниями легких или осложняться ими.
ЧАСТОТА
Существующие противоречивые взгляды в вопросе определения бронхоэктазий как нозологической формы, отсутствие единой общепринятой классификации хронических неспецифических воспалительных заболеваний легких затрудняют выявление истинной частоты бронхоэктазий.
Статистические данные, основанные на клинико-рентгенологическом обследовании (включавшем флюорографию) больших групп населения, проведенные в 50-е годы [Куприянов П. А., Колесов А. П., 1960; Колесников И. С., Ермолаев В. Р., 1969], свидетельствовали о том, что бронхоэктазии встречаются у 0,1—0,13 % взрослых и у 0,5—0,6 % детей. Авторы считают эти цифры преуменьшенными, поскольку в то время еще недостаточно широко применялся основной метод диагностики бронхоэктазий — бронхография.
Оценить частоту бронхоэктазий в настоящее время с учетом данных бронхографии можно косвенно, зная частоту заболеваемости хроническими неспецифическими воспалительными процессами (хроническими пневмониями, бронхитом), с одной стороны, и частоту бронхоэктазий, выявляемых у них при углубленном обследовании, включающем бронхографию,— с другой.
По данным ВНИИ пульмонологии М3 СССР [Волкова Л. П. и др., 1971], хронические неспе
234
цифические воспалительные заболевания легких среди населения выявляются в 4,08 %; из них хроническая пневмония составляет 1,4 % и хронический бронхит— 1,7 %. Углубленное обследование этого контингента показало, что бронхоэктазии среди них в виде типичных цилиндрических и мешотчатых форм, По наблюдениям А. Я. Цигельника (1971), выявляются у 36,7 % больных, а по данным Н. П. Чернобрового (1976) — у 38,7 %. Следовательно, при тщательном обследовании клинически проявляющиеся расширения бронхов могут быть выявлены примерно у 0,5 % населения. По сообщению Б. И. Давыдова (1964), при обследовании 20 672 детей хроническая пневмония обнаруживается у 1,53 %, а бронхоэктазии после углубленного обследования — у 0,15 %.
Таким образом, данные как прежних, так и более современных авторов говорят о том, что бронхоэктазии — заболевание нередкое.
Частоту бронхоэктазий может характеризовать также процент оперированных больных бронхоэктазиями к числу оперированных с хроническими неспецифическими воспалительными заболеваниями легких вообще. Он достаточно высок: по материалам А. П. Колесова, С. А. Гаджиева (1971, 1973), охватывающим более 3000 наблюдений, составляет 61,9 %, по материалам Я. У. Булгакова (1975) — 52,5 %. Аналогичные цифры приводят и другие авторы [Дорофеева А. И., Бойков Г. А., 1969; Чернобровый Н. П., 1971; Коваленко П. П., Анисимова А. Т., 1972, и др.].
Частоту бронхоэктазий характеризует еще одна цифра: по данным экспертизы трудоспособности больных с хроническими заболеваниями легких в восьми ВТЭК Ленинграда больные бронхоэктазиями составляют 20 % [Ци-гельник А. Я., 1971].
Согласно многочисленным литературным данным, бронхоэктазии чаще наблюдаются у мужчин, чем у женщин. По наблюдениям клиники госпитальной хирургии, среди находившихся на обследовании 624 больных мужчин было 385 (61,7 %), женщин — 239 (38,3 %).
Довольно закономерна локализация бронхоэктазий в легких. По материалам клиники, бронхоэктазии слева наблюдались у 55,1 % больных, справа — у 44,9 %. Самой частой локализацией бронхоэктазий слева является нижняя доля (94 %). Справа нижняя доля также поражается чаще других долей — в 63 % наблюдений; однако справа чаще, чем слева, поражаются и другие доли. Распространенные, поражающие все легкое бронхоэктазии слева отмечены в 34,7 % случаев, справа — в 19,2 %.
Двустороннее поражение среди больных клиники наблюдалось у 26,1 % человек. С такой же частотой двусторонние бронхоэктазии отме
чали и другие авторы [Колесов А. П., Гаджиев С. А., 1971; Цуман В. Г. и др„ 1976; Cooper J., Grillo Н„ 1969; Pineyro 1. et al., 1975].
Существенно важным обстоятельством, часто определяющим объем оперативного вмешательства по поводу бронхоэктазий, является весьма частое одновременное поражение нижней доли и язычка слева (у 74,6 % больных) и нижней и средней долей справа (у 50,5 % больных). По мнению Ф. Г. Углова и соавт. (1971), средняя доля или язычок легкого (IV — V сегменты) при хронической пневмонии и бронхоэктазиях поражаются практически всегда. Более того, авторы считают, что именно с этих сегментов легкого начинается всякое хроническое неспецифическое воспаление. На основании этой концепции рекомендуется широкое удаление язычка и средней доли легкого, даже тогда, когда они внешне кажутся неизмененными.
Следует отметить также, что при вораже-нии нижних долей страдают преимущественно сегменты базальной пирамиды, тогда как верхушечный (VI) сегмент в большинстве случаев остается интактным.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Бронхоэктазии — заболевание полиэтиоло-гичное.
Вероятно, у некоторой части больных имеется врожденная предрасположенность к заболеванию бронхоэктазиями на почве аномалий развития бронхов. Такие бронхоэктазии называют дизонтогенетическими (постнатальными).
В качестве подтверждения этой точки зрения приводят случаи семейных наследственных бронхоэктазий, сообщения о которых нередки. Имеются сведения о бронхоэктазиях в трех поколениях одной семьи — у дедушки, отца и детей; есть наблюдения бронхоэктазий у близнецов, в том числе однояйцевых [Рыжков Е. В., 1968; Стручков В. И. и др., 1969]. Подобные наблюдения касаются отнюдь не только полики-стоза легких. В случаях семейных бронхоэктазий выявлялись расширения бронхов самого разнообразного характера — цилиндрические, мешотчатые и смешанные. Следует отметить, что, во-первых, различный характер расширения бронхов наблюдался у членов одной и той же семьи; они бывали разными даже у однояйцевых близнецов и даже у одного и того же человека — в одних отделах легкого были мещот-чатые (или кистоподобные) бронхоэктазии, а в других отделах — цилиндрические; во-вторых, как правило, семейные наследственные бронхоэктазии проявлялись клинически не в первые дни и месяцы после рождения ребенка, а, как правило, в первые годы жизни, часто спустя 5—
235
10 лет и более; в-третьих, семейные бронхоэктазии нередко сочетались с другими пороками развития, которые в этих семьях также передавались по наследству и наследственная природа их не оспаривается: с добавочными долями легкого, аномалиями сосудов (легочных артерий и вен), воздушными кистами (пузырями) легкого, трапециевидной формой грудной клетки, гиперкератозом, инверсией внутренних органов.
Врожденный характер расширения бронхов подтверждается сочетанием его с заболеваниями, врожденное происхождение которых не вызывает сомнений. Классическим примером этого служит триада Картагенера: расширение бронхов, хронический синусит и обратное расположение внутренних органов. Описано расширение бронхов в сочетании с врожденным расширением в других органах (кисты в почках, дивертикулы мочевого пузыря, кишечника), с врожденными пороками развития легкого (дермоидные кисты, тератомы, агенезия, аплазия), с врожденными заболеваниями пищевода (атрезия, мегалия), пороками сердца и крупных сосудов, скелета (череп, позвоночник, конечности, грудная клетка), аномалиями мягких тканей (расхождение мышц живота), недоразвитием половых органов, крипторхизмом, добавочными сосками молочной железы [Рыжков Е. В., 1968; Стручков В. И. и др., 1969; Гаджиев С. А. и др., 1974]. Нередко при таких расширениях бронхов выявлялись врожденные наследственные болезни обмена веществ — ксантоматоз, фиброз печени, дисгаммаглобулинемия (врожденная недостаточность иммуноглобулинов класса G), муковисцидоз [Валентинович А. А., 1973, и др.]. По мнению ряда авторов, при тщательном обследовании больных бронхоэктазиями врожденные заболевания могут быть выявлены у каждого 4—5-го больного.
Приведенное перечисление врожденных заболеваний, сопутствующих расширению бронхов, не только представляет интерес для уточнения природы происхождения бронхоэктазий, но также преследует цель обратить внимание на своевременное выявление этих заболеваний и их лечение, коль скоро они обнаружены. Особенно настойчиво надо искать патологию обмена веществ, иммунодефицитные состояния, без коррекции которых (а такая возможность имеется) окажется недостаточно эффективным местное лечение бронхоэктазий, в том числе оперативное.
К патогистологическим признакам врожденной предрасположенности к заболеванию бронхоэктазиями Е. В. Рыжков (1968) относил наличие облитерированных крупных бронхов, гипоплазию, отсутствие хрящевой ткани при правильно сформированных элементах других тканей
бронха, беспорядочное расположение хрящевых клеток в хрящевых пластинках (как в хондромах), гипоплазию эластической ткани, перемычки бронхов, наличие жировой ткани между ними. Такие признаки автор обнаружил в 12 случаях из 311 мертворожденных детей (в 3,7%). Однако весьма сходные патогисто-логические данные были получены рядом исследователей у больных бронхоэктазиями явно приобретенного характера — после пребывания в бронхах взрослых инородного тела, при послеоперационных рецидивных бронхоэктазиях в долях, где они до того не обнаруживались [Колесов А. П., 1960; Ермолаев В. Р., 1965, и др.].
Врожденную предрасположенность к заболеванию бронхоэктазиями полностью отвергнуть невозможно, но надо полагать, что такая предрасположенность наблюдается все же не часто. По разным авторам, она с большей или меньшей вероятностью может быть констатирована не больше чем у 0,5—5 % больных [Цигель-ник А. Я., 1948; Гланцберг Н. А., 1970; Королев Б. А., Корепанова Н. В., 1972, и др.].
Для возникновения бронхоэктазий, как свидетельствуют клинические наблюдения и экспериментальные данные, необходимо два основных условия: нарушение вентиляции легкого и инфекция [Куприянов П. А., Колесов А. П., 1960; Колесников И. С., Ермолаев В. Р., 1969; Струков А. И., Колодова И. М., 1970, и др.]. Существенно важным является также нарушение крово- и лимфообращения [Логинов А. П., Головин Ю. А., 1971]. Сочетание этих условий наиболее часто возникает при ателектазах легкого различного происхождения.
Возникновение бронхоэктазий при жизни чаще всего наблюдается в детском возрасте, особенно в раннем детстве. Согласно данным литературы, подтвержденным материалами клиники, больше чем у 2 / з больных заболевание началось до 20 лет, у '/г — до 5 лет и у '/з из них — на первом году жизни. Это обстоятельство объясняется тем, что, с одной стороны, легкое в первые годы жизни ребенка еще не завершило своего развития, в нем еще не окончательно сформирована соединительная ткань, недоразвиты эластические структуры и оно представляет собой сравнительно легко ранимый орган, склонный, в частности, к ателектазам, а с другой стороны, сопротивляемость к инфекциям в детском возрасте, как известно, понижена.
Говоря о значении неполного развития легкого ребенка в возникновении бронхоэктазий, уместно привести данные Б. И. Ищенко и соавт. (1972), согласно которым рецидивы бронхоэктазий после резекции легкого у детей младше 10 лет (т. е. у лиц, у которых постнатальное
236
развитие этого органа егце не закончено) бывает при прочих равных условиях в 2 раза чаще, чем у детей, оперированных в возрасте старше 10 лет.
Наиболее частой причиной бронхоэктазий детского возраста (85 %) являются острые бронхопневмонии, бронхиты и катары верхних дыхательных путей, особенно повторные [Гланц-берг Н. А., 1970; Пугачев А. Г. и др., 1970, 1974; Гауян Я. К. и др., 1976]. Для пневмоний детского возраста характерны стойкие ателектазы, которые возникают даже при сравнительно легком клиническом течении болезни более чем в 20 % случаев. Этому способствуют не только анатомо-физиологические особенности детского легкого, но и часто наблюдавшиеся у детей бронхоадениты, нарушающие проходимость бронхиального дерева сдавлением его извне.
Часто выявляющиеся в анамнезе у детей предшествующие пневмониям или сопутствующие им острые респираторные заболевания, синуситы, аденоиды, тонзиллиты нарушают вентиляцию легких, способствуют возникновению и поддержанию бронхита и пневмонии, рецидивирующему их течению. Рецидивирующая пневмония, со своей стороны, поддерживает воспалительный процесс в верхних дыхательных путях. Создается своеобразный порочный круг. А. Я. Цигельник (1971) важную роль в возникновении бронхоэктазий при инфекции верхних дыхательных путей отводит сенсибилизации бронхиального дерева и паренхимы легкого.
Среди пневмоний детского возраста особо выделяют коревые и коклюшные пневмонии, а в последнее время также пневмонии другой вирусной природы, после которых бронхоэктазии развиваются особенно часто (у 15 % больных). Предполагается, что в этих случаях важную роль в возникновении бронхоэктазий играют интоксикация, токсические нервно-сосудистые расстройства, токсическое поражение бронхиального дерева.
Довольно частой причиной бронхоэктазий у детей служат инородные тела бронхов (у 0,3— 0,5 % больных). Даже сравнительно непродолжительное пребывание инородного тела в бронхе (от нескольких дней до 2—3 нед) может привести к возникновению бронхоэктазий вследствие присоединения инфекции [Либов С. Л. и др., 1963].
Определенную роль в возникновении бронхоэктазий играет туберкулез, при котором первичное нарушение вентиляции легкого связано со сдавлением бронхов увеличенными лимфатическими узлами, а в последующем — склерозированными перибронхиальными тканями; имеет значение также и существенное нару
шение при первичном туберкулезе лимфообращения и кровоснабжения бронхиального дерева [Эртли А. А., Агкацев Т. В., 1973]. Вероятно, важную роль играет также присоединяющаяся вторичная инфекция. Бронхоэктазии после туберкулеза обнаруживаются обычно в переднем сегменте верхней доли или в переднем и язычковых сегментах слева, среднедолевых сегментах справа [Ермолаев В. Р., 1965]. Бронхоэктазии в верхней доле легкого чаще всего бывают посттуберкулезной этиологии.
Инфекция дыхательных путей и легкого играет важную роль в возникновении бронхоэктазий и у взрослых, однако на первый план в этом возрасте выступает хроническое воспаление, особенно бронхит. Н. П. Чернобровый и соавт. (1976) наблюдали 106 больных с хроническими воспалительными процессами в бронхах в течение 7 лет, используя периодически бронхоскопию и бронхографию. Авторами установлено, что при недостаточно регулярном лечении бронхит рецидивировал в виде гнойно-язвенной формы с постепенным переходом в склеротическую форму с образованием бронхостенозов, с возникающими на этой почве рецидивами пневмонии. При 3—4-летнем наблюдении у 41 больного (в 38,6 %) с таким неблагоприятным течением развились типичные цилиндрические и смешанные бронхоэктазии, а у 14 — мешотчатые.
По наблюдениям Ф. Г. Углова и соавт. (1971 — 1976), существенную роль в возникновении бронхоэктазий у взрослых играет неспецифическое поражение бронхолегочных лимфатических узлов. В силу особенностей анатомического взаимоотношения бронхов средней доли или язычка с расположенными в этой области узлами, а также особенностями вентиляции этих отделов нарушение дренажной функции и воспаление начинаются прежде всего в IV— V сегментарных бронхах, приобретают хроническое рецидивирующее течение и приводят к склеротическому процессу, распространяющемуся на близлежащие отделы, в первую очередь на бронхи базальной пирамиды. Постепенно вовлекаются последовательно VII, VIII, IX и X сегменты. По степени вовлечения в процесс сегментов базальной пирамиды авторы выделяют стадии бронхоэктазий, именуемые ими хронической деструктивной пневмонией. Стадийность нарушения дренажной функции бронхов при ней прослежена в динамике с помощью кинобронхографии и подтверждена авторами при исследовании препаратов удаленных легких, высокой эффективностью хирургического лечения бронхоэктазий, обязательно включающего удаление средней доли и язычка, даже тогда, когда они внешне казались неизмененными.
237
Распространение бронхоэктазий по такому типу, по-видимому, действительно встречается нередко. Об этом свидетельствует частое сочетание поражения бронхоэктазиями нижних долей и IV—V сегментов. Однако такой тип распространения нельзя считать универсальным. Бронхоэктазии, как было изложено выше, не так уж редко поражают только лишь нижние доли (или отдельные сегменты базальной пирамиды), а бронхи IV—V сегментов остаются интактными. Нередко встречаются также бронхоэктазии средней доли и язычка (особенно средней доли) при совершенно здоровых нижних долях. В клинике госпитальной хирургии Б. П. Лапиным изучена в динамике бронхографическая картина при бронхоэктазиях средней доли у 34 больных на протяжении 5—10 лет. Ни у одного из них (это были взрослые люди) распространения воспалительного процесса (в том числе в деструктивной форме) на бронхи других отделов не наблюдалось. Не наблюдалось также изменения характера бронхоэктазий в пораженных отделах. Аналогичные данные приводят М. Л. Шулутко и соавт. (1970). Склонность к распространению бронхоэктазий более характерна для детского возраста, когда для этого имеются соответствующие предпосылки, о которых говорилось выше.
У взрослых, в отличие от детей, бронхоэктазии в сочетании с другими заболеваниями легких или после них наблюдаются чаще. Р. Kes-zler (1969) у больных, среди которых более 50 % были пожилые люди, бронхоэктазии такого происхождения выявил в 70 %. Р. И. Плиш-ко (1973) у лиц старше 20 лет такие бронхоэктазии отметил в 25 % случаев. Бронхоэктазии после острых абсцессов зарегистрированы Н. П. Чернобровым (1971) у 28,9 % человек. Б. А. Королев и Н. В. Корепанова (1972) сообщают о бронхоэктазиях у взрослых после абсцесса легкого у 3,6 %, после гнойного плеврита — у 1,7 %, после хронического фибрознокавернозного туберкулеза — у 1 %. Довольно частой причиной (у 3 % больных), по их данным, были инородные тела.
О механизме развития бронхоэктазий и их патогенезе можно говорить лишь предположительно. Механизм их возникновения при различных причинах имеет много общего. Выше говорилось, что он обязательно включает воспаление, нарушение вентиляции легкого, а также крово- и лимфообращения. В зависимости от преобладания того или иного фактора, степени их выраженности и распространенности в каждом конкретном случае в конечном итоге возникают разнообразные патоморфологические изменения в бронхах.
Возникновение бронхоэктазий с учетом клинико-экспериментальных данных разных авто
ров и наблюдений клиники можно представить следующим образом.
При ателектазе легкого, будь он обтурационного, пневмонического, токсического или иного происхождения, с самого начала нарушаются дренажная функция бронхов, кровоснабжение и лимфоотток. В просвете бронхов скапливается секрет. Стенка кровеносных сосудов постепенно гипертрофируется, просвет их суживается, они начинают напоминать сосуды замыкающего типа. Лимфатические щели расширяются с образованием лимфатических узелков — лимфом. Нарушение кровообращения и оттока лимфы ведет к частичной атрофии элементов стенки бронха и легочной паренхимы с последующей частичной резорбцией и организацией этих участков. В бронхе разрастается соединительная ткань, эпителий приобретает склонность к аденоматозному росту, т. е. возникают изменения, напоминающие таковые при гипоксии. Они обратимы полностью или частично, если не присоединяется инфекция.
Воспалительный процесс в ателектазирован-ном легком может возникать как в бронхе, так и в паренхиме, захватывать всю долю или сегмент или располагаться гнездно. Следствием воспаления является стойкий склероз, а при уменьшении объема органа — цирроз. Склерозированный расширенный бронх навсегда утрачивает дренажную функцию.
Расширения бронхов могут быть самыми разнообразными по форме (рис. 109). Они могут заканчиваться слепо или частично сообщаться с воздушной тканью легкого. Если наряду с воспалением в бронхе имело место длительное воспаление и в паренхиме, она равномерно склерозирована. Если воспаление ограничилось преимущественно бронхом, то в паренхиме имеется обычно более или менее выраженная равномерная эмфизема. Доля (или сегмент) при таких бронхоэктазиях резко уменьшены в размерах.
Несколько другой, по-видимому более частый, механизм развития бронхоэктазий наблюдается при первоначальном лишь частичном нарушении проходимости дренирующего бронха, без распространенного ателектаза, например при сдавлении его лимфатическими узлами, рубцами, частичной закупорке инородным телом, слизью, гноем, что часто бывает при хроническом бронхите. При этом воспаление, как правило,- начинается в бронхе и преобладает над воспалением в паренхиме; в последней оно, как и нарушение крово- и лимфообращения, носит вторичный характер. Вследствие такого механизма стенки расширенного бронха всегда резко утолщены, вокруг них имеется массивное разрастание соединительной ткани, а в паренхиме — зоны склероза чередуются с зона-
238
Рис. 109. Коррозионные слепки бронхов при бронхоэктазиях, а мешотчатые бронхоэктазии; б — мешотчатые и цилиндрические (смешанные) бронхоэктазии.
ми эмфиземы, участками ателеказа, а также нормальной легочной тканью. Частично она может вентилироваться. Пораженная доля или сегмент при таком механизме могут иметь нормальные размеры, резкого уменьшения нет. Отличить их при наружном осмотре от непораженных отделов бывает подчас затруднительно. Обращается внимание на то, что пораженное легкое имеет более светлую, розовую или с вишневым оттенком окраску, зависящую от измененных условий кровообращения, а также отсутствие пигментации пылью как следствие нарушения вентиляции.
Развитие бронхоэктазий после абсцесса легкого или на его фоне, при фиброзно-кавернозном туберкулезе, при длительном сдавлении легкого извне (например, при длительно существующем спонтанном пневмотораксе, при эмпиеме) может идти по тому или другому из изложенных механизмов с преобладанием какого-нибудь из них.
Эти (схематично изложенные) механизмы патогенеза бронхоэктазий в комбинации дают довольно пеструю морфологическую картину, которая еще более усложняется по мере периодических обострений воспалительного процесса.
Для практики сохраняет свое значение подразделение бронхоэктазий по форме расшире
ния на цилиндрические, мешотчатые и смешанные. П. А. Куприянов, А. П. Колесов (1960) разделяют бронхоэктазии на ателектатические и неателектатические. И. С. Колесников. В. Р. Ермолаев (1969) рассматривают следующие морфологические формы: кистоподобные, преимущественно встречающиеся в верхних долях, бронхоэктазии с преимущественным перибронхиальным склерозом и бронхоэктазии с истонченной склеротической стенкой на фоне выраженной эмфиземы. Кистоподобные бронхоэктазии от истинных кист отличаются тем, что при истинных кистах, как правило, сохраняется более или менее нормальное бронхиальное дерево. Для бронхоэктазий с выраженной эмфиземой характерно наиболее тяжелое клиническое течение; они часто сопровождаются картиной легочного сердца.
Изменения в органах при бронхоэктазиях касаются прежде всего изменений в легких вообще, а не только в пораженных отделах. Эти изменения выражаются в виде вторичного диффузного пневмосклероза и эмфиземы на почве прогрессивно нарастающей легочной гипертензии, ведущей к системному сосудистому поражению малого круга (или являющейся ее следствием). По мере прогрессирования страдание приводит в конце концов к хрониче
239
ской правожелудочковой сердечной недостаточности, к «легочному сердцу», что и является основной причиной смерти больных бронхоэктазиями при несвоевременно предпринятых мерах профилактики и лечения.
Изменения в других органах — печени, почках — развиваются в связи с возникающим амилоидозом, хотя амилоидоз сейчас встречается редко.
КЛИНИЧЕСКАЯ КАРТИНА, ДИАГНОСТИКА
Первые признаки заболевания, как указывалось, появляются преимущественно в детском и даже раннем детском возрасте. В настоящее время оно в детском возрасте обычно и диагностируется. Больные в зрелом и пожилом возрасте в хирургические стационары поступают сейчас все реже и реже. Это объясняется более ранней, чем прежде, диагностикой бронхоэктазий и своевременно предпринятым еще в детском возрасте хирургическим лечением в показанных случаях.
Основными жалобами при бронхоэктазиях являются кашель с мокротой и периодически возникающее ухудшение общего состояния, зависящее от обострения инфекционного процесса и связанной с этим интоксикацией.
Характерен постоянный, упорный, персистирующий кашель. Лишь изредка он бывает сухим. Чаще это кашель со слизистой, слизистогнойной и гнойной мокротой до 50—200 мл/сут. Какое-то количество мокроты больной может откашлять по просьбе в любое время, но наибольшее количество выделяется по утрам, во время утреннего туалета. После этого в течение дня кашель может особенно не беспокоить больного.
У некоторых больных, чаще при поражении передних сегментов, средней доли, кашель беспокоит по ночам, в положении лежа на спине.
Больные даже без специальных расспросов часто обращают внимание на то, что для более эффективного откашливания мокроты им приходится принимать вынужденное положение: свесившись с кровати вниз головой, перегнувшись через спинку стула, край ванны. Особенно характерно такое положение для поражения бронхоэктазиями нижних долей. Как правило, больные хорошо знают положение тела, при котором мокрота отходит лучше всего, и это имеет определенное значение для предварительной топической диагностики.
Мокроты бывает то больше, то меньше. Характернее тоже меняется. Слизистого характера мокрота периодически делается гнойной, приобретает неприятный запах, становится обильной. Такое состояние может продолжаться довольно долго, месяцами. Из-за неприятного
запаха изо рта больные нетерпимы в коллективах, что весьма их угнетает. Относительно большое количество мокроты с гнилостным запахом в настоящее время встречается нечасто, это свойственно главным образом распространенным мешотчатым бронхоэктазиям.
Довольно частым симптомом является кровохарканье. На небольшое кровохарканье (на наличие примеси, прожилок крови в мокроте) жалуются примерно треть больных. Нередко наблюдается также легочное кровотечение — у 10 % больных. Однако обильные легочные кровотечения в общем для бронхоэктазий не характерны. Жизни они, как правило, не угрожают. Тем не менее кровохарканье и, особенно, кровотечение часто являются именно тем симптомом, который приводит больного к врачу.
Причину кровохарканий и легочных кровотечений при бронхоэктазиях усматривают в гиперемии рыхлой, гипертрофированной и легко райимой слизистой оболочки в области поражения, в ее изъязвлениях, наличии грануляций, сосуды которых местами имеют варикозные изменения.
В отдельных случаях кровохарканье — единственный симптом наличия бронхоэктазий («сухие бронхоэктазии» по А. Я. Цигельнику, 1948).
На боли в груди жалуются половина больных. Обычно боли соответствуют области (стороне) поражения. Они более или менее постоянны, тупого характера, умеренные по интенсивности. Наличие болей объясняют спаечным процессом. Отмечается также, что боли становятся меньше после того, как больной хорошо откашливает мокроту.
К постоянным жалобам надо отнести также одышку. Обычно она появляется при нагрузке. Особенно характерна одышка для детей. Именно одышка у них может вызвать беспокойство родителей в первую очередь, так как на боли маленькие дети часто пожаловаться неспособны, а мокроту проглатывают. Одышка является характерным симптомом и для стариков. У них она является следствием не только дыхательной, но и сердечно-сосудистой недостаточности. Сильная одышка — неблагоприятный признак, свидетельствующий о распространенном и далеко зашедшем процессе.
В любом возрасте может присоединиться астматическое состояние по типу бронхита с астматическим компонентом: приступы одышки с затрудненным выдохом. Этот компонент при бронхоэктазиях выявляется довольно часто — у 25 % больных [Виноградов В. Н., Лейзеровская Э. Г., 1962]. Иногда такое состояние требует оказания неотложной помощи. Однако истинная аллергическая бронхиальная астма бронхоэктазиям сопутствует редко: по данным клинки, на 624 больных она наблю
240
далась у 3 человек (0,02 %). Другие авторы [Углов Ф. Г. и др., 1971; Seely W. et al., 1966] приводят более высокие цифры. Существует даже теория инфекционно-аллергического происхождения бронхиальной астмы, обусловленной, в частности, хронической деструктивной пневмонией, т. е. бронхоэктазиями [Углов Ф. Г. и др., 1971].
Периодические обострения при бронхоэктазиях характеризуются прежде всего ухудшением общего состояния: появляются слабость, вялость, быстрая утомляемость, расстраивается внимание. Нередко больные отмечают, что в период обострений у них «все валится из рук». Дети становятся адинамичными, взрослые — нетрудоспособными. Как правило, в этот период увеличивается количество мокроты и она приобретает гнойный характер. Для периода обострения характерно также учащение кровохарканья. Усиливается одышка.
Закономерной в период обострения является температурная реакция. Однако высокой (до 38 °C и больше) температура тела бывает редко и чаще наблюдается в начальной стадии развития бронхоэктазий, особенно у детей. Это обусловлено тем, что у детей при еще сохраненной в значительной части легочной паренхиме обострения протекают с явлениями интерстициальной пневмонии. У взрослых температура тела в основном носит субфебрильный характер, с отдельными температурными «свечками», или даже характер так называемого «субнормального субфебрилитета» — значительных, в пределах градуса, колебаний, но не выше нормальных цифр.
Такое состояние обострения может длиться довольно долго — неделю, месяц, два и больше. Оно отчетливо носит сезонный характер — начинается в предвесенний и послеосенний периоды. Иногда основные симптомы заболевания проявляются только в периоды обострения.
В основе обострений бронхоэктазий лежит интоксикация, связанная с воспалением в бронхах (реже — в паренхиме легкого). Поскольку бронхоэктазиям свойственно более или менее выраженное отграничение местного очага, обострения бурно не проявляются.
Тем не менее в периоды обострений обычным является диагноз пневмонии, затянувшейся пневмонии, обострения хронической пневмонии.
Своеобразное начало заболевания, которое, как говорилось, относится к детскому, а чаще раннему детскому возрасту, связь начала заболевания с пневмонией, особенно послекоревой или послекоклюшной, характерные изложенные жалобы, волнообразное течение с довольно типично протекающими обострениями позво
ляют с довольно большой вероятностью поставить правильный диагноз. Этому помогают некоторые дополнительные сведения, а также данные физикального обследования, которые выявляют отдельные характерные особенности.
Детям, больным бронхоэктазиями, свойственно отставание в физическом и умственном развитии. Для взрослых более характерна склонность к худобе, чем к полноте.
Из анамнеза у детей можно установить, что ребенок сравнительно поздно начал ходить, разговаривать, читать. Можно выяснить отставание от других детей при занятиях в школе. По данным клиники, эти признаки установлены у 25 % больных детей.
Очень часто (у 1 /3 больных) масса тела детей меньше нормальной возрастной, вторичные половые признаки у них не соответствуют возрасту. При осмотре можно отметить некоторую бледность кожных покровов и слизистых оболочек, легкую одутловатость век, шелушение на груди, локтях, коленях, голенях.
Патогномоничным признаком считалось наличие деформации пальцев кистей и стоп в виде «барабанных палочек». При бронхоэктазиях этот симптом сейчас встречается сравнительно редко. Не менее часто он наблюдается при других хронических заболеваниях, сопровождающихся интоксикацией и гипоксией,— туберкулезе, хроническом абсцессе, пороках сердца, остеомиелите. У взрослых он нередок при хроническом бронхите. Генез этого симптома не вполне ясен. Обращается внимание на возможность обратного развития этого симптома в случае своевременно предпринятого и успешного лечения.
Отставание грудной клетки при дыхании, западение ее на стороне поражения, деформация позвоночника могут наблюдаться при тяжелых распространенных формах, особенно когда заболевание началось в раннем детстве и прогрессировало по мере развития ребенка.
При опросе, осмотре и пальпации не надо забывать о возможности встретить явные признаки какой-либо наследственной патологии — деформацию скелета, добавочные соски молочной железы, крипторхизм, ксантоматоз и др.
Аускультативные данные могут быть весьма характерными, но полностью зависят от формы, распространенности бронхоэктазий, от фазы течения заболевания. Наиболее типичны постоянные звучные разнокалиберные хрипы на фоне жесткого дыхания на стороне поражения, над пораженными отделами легких. Важно отметить, что хрипы можно выслушать не только в фазе обострения, но и в фазе ремиссии. В общем, степень выраженности аускультативных данных отчетливо коррелирует с количеством отделяемой мокроты.
16 Зак. 0517
241
Рис. 110. Кистозные бронхоэктазии верхней доли правого легкого. Прямая рентгенограмма.
Рис. 111. Бронхоэкта ити нижнем доли левого легкого. Брон-
хография под местной анестезией
Однако следует помнить, что данные физикального объективного обследования представляют для врача меньшую ценность, чем жалобы и анамнез. Очень нередко больной обращается к врачу, будучи внешне совершенно здоровым.
При рентгеноскопии и рентгенографии в большинстве случаев только при очень внимательном исследовании и известном опыте можно выявить некоторые косвенные признаки бронхоэктазий. Исключение составляют кистозные бронхоэктазии и бронхоэктазии с выраженным пневмосклерозом, которые на рентгенограммах видны довольно хорошо: в первом случае виден ячеистый рисунок, во втором — долевое или сегментарное затенение (рис. 110).
К косвенным рентгенологическим признакам бронхоэктазий относят усиленный легочный рисунок или, напротив, обедненный рисунок (как бы «пустота»— свидетельство эмфиземы или кист без выраженного склероза), смещение тени сердца, диафрагмы, средостения (в результате цирроза легкого, уменьшения его в размерах), нечеткость контуров сердца, сглаженность сердечно-сосудистых дуг (указывающее на шварту). При рентгеноскопии можно видеть дыхательную деформацию диафрагмы, легочного рисунка, что бывает при плевральных сращениях.
Рентгенотомография добавляет для диагностики бронхоэктазий немного. Она показана у пожилых больных, у которых имеется ателектаз (или сегментарный склероз, трудно отличимый от ателектаза) и у которых в связи с этим возникают подозрения на опухоль. Томография показана при подозрении на инородное тело.
Диагноз ставится окончательно только после бронхографического исследования.
Бронхография выполняется под местной анестезией или под наркозом, используются различные контрастные вещества. Поднаркозную бронхографию одномоментно с двух сторон рекомендуется делать детям. У взрослых многие предпочитают бронхографию под местной анестезией с помощью управляемого катетера, поочередно для каждого из легких. Опыт клиники госпитальной хирургии, где использованы различные методы, говорит, что любые из них приемлемы и дают хорошие результаты при известном навыке. Бронхография под местной анестезией проще. Она более пригодна в повседневной практической работе. При ней, однако, невозможно получить одномоментно хорошие двусторонние бронхограммы. Одномоментная двусторонняя поднаркозная бронхография сложнее организационно. Тем не менее такая бронхография делалась в клинике амбулаторно 3—4 больным за амбулаторный утренний прием. При поднаркозной бронхогра-
242
фии, имеющей целью контурное контрастирование всего бронхиального дерева, не всегда удается хорошо заполнить бронхи пораженных долей, так как они плохо вентилируются; однако ориентировочная картина выявляется достаточно хорошо (рис. 111, 112). В последние годы в клинике используется метод поднаркозной контурной бронхографии, дополняемой при надобности тугой наливкой пораженных отделов бронхиального дерева с помощью управляемого катетера (рис. 113). Рентгенографию производят в прямой и косой проекциях, а также с выведением пораженных отделов в наиболее выгодное для обзора положение; делаются снимки на вдохе и на выдохе, позволяющие судить о степени податливости бронхов разных отделов.
По-видимому, перспективным методом исследования бронхиального дерева является кинобронхография [Углов Ф. Г. и др., 1972]. Возможно, получит признание метод бронхографии воздушной взвесью танталовой пыли. Некоторые ценные данные можно, вероятно, получить при использовании так называемой терминальной бронхографии жидкими контрастными смесями [Феофилов Г. Л. и др., 1973|, при которой, надо полагать, создаются возможности для выявления степени сообщения бронхоэктатических полостей с вентилируемой легочной паренхимой, чего при обычной бронхографии сделать никогда не удается.
Какой бы метод бронхографии при диагностике бронхоэктазий ни использовался, должно быть соблюдено основное правило: надо получить достоверные сведения о состоянии бронхов всех отделов легких с обеих сторон.
Противопоказанием к бронхографии служат тяжелое состояние, выраженная дыхательная недостаточность. Не следует делать бронхографию при легочном кровотечении — кашель во время исследования или после него может усилить кровотечение. При большом количестве мокроты перед исследованием надо провести курс санации бронхиального дерева — наличие мокроты снижает качество бронхограмм, служит причиной ложных заключений.
Следует отметить, что бронхография — не безопасное для больного исследование. Даже если она выполнена в наиболее щадящем варианте и на высоком профессиональном уровне, после нее всегда наступает обострение воспалительного процесса в легких, повышается температура тела, усиливается дыхательная недостаточность. Поэтому другие исследования, направленные на уточнение диагноза или предпринимаемые для оценки общего состояния больного, следует делать прежде бронхографии или спустя некоторый промежуток времени после нее, когда спровоцированное обо-
lb *
Рис. 112. Бронхоэктазии нижнем доли левого легкого. Бронхография под наркозом.
113. Бронхография под наркозом с селективным заполнением пораженных бронхоэктазиями отделов легких.
243
стрение стихает, что обычно происходит не ранее чем через 1—2 нед.
Ценным дополнительным диагностическим методом является бронхоскопия. Она абсолютно показана при подозрении на опухоль или наличие инородного тела в бронхе. Бронхоскопия проясняет картину при бронхолитах, являясь при этом часто решающим диагностическим (а иногда и лечебным) мероприятием.
По данным бронхоскопии оценивается состояние слизистой оболочки доступных обозрению бронхов, выявляются воспаление и его особенности, локализация поражения, распространенность его. Кроме того, при бронхоскопии можно оценить подвижность устьев сегментарных бронхов. Согласно данным Г. К. Орджоникидзе, В. М. Матасова (1971), отсутствие подвижности устья бронха, его сокращения при дыхании и кашле — один из ранних диагностических признаков бронхоэктазий данного отдела; он указывает на то, что бронх уже утратил свою дренажную функцию.
До недавнего времени существовало мнение, что лабораторное и функциональное обследование больных бронхоэктазиями для диагностики заболевания не имеет большого значения. С этим нельзя согласиться. Круг этих исследований в специализированных стационарах и поликлиниках в последнее время существенно расширен и, как показал опыт, является важным подспорьем в уточнении диагноза, а главное — прогноза заболевания, что имеет большое значение для выбора метода лечения. Данные лабораторного обследования становятся особенно ценными, если они делаются систематически, когда больной находится под постоянным врачебным наблюдением. По мнению В. И. Куко-ша, С. Н. Захарова (1976), лабораторная и функциональная диагностика на современном этапе имеет не меньшее значение, чем топическая.
Общеклинический анализ крови в большинстве случаев довольно характерен: это умеренная анемия и умеренное повышение СОЭ. Углубление анемии при динамическом исследовании — свидетельство нарастающей интоксикации, даже если анемия сравнительно невелика. СОЭ бывает существенно увеличена при распространении воспаления на легочную паренхиму; чаще это бывает у детей.
Анализ мочи долгое время остается нормальным. Стойкое появление в ней белка — неблагоприятный признак, свидетельствующий о поражении почек. Следует обратить внимание и на плотность мочи, при необходимости провести пробу Зимницкого.
Общий белок сыворотки при бронхоэктазиях изменяется мало. Чаще имеет место диспро-теинемия — уменьшение альбуминов в крови и повышение глобулиновых фракций. Это на
стораживает, так как гипоальбуминемия всегда является отражением нарушения белковосинтетической функции печени. Это может быть ранним признаком амилоидоза, однако чаще является следствием хронической гипоксии. Гиперглобулинемия за счет a-фракций отражает степень реакции организма на воспаление; об этом же свидетельствуют гипергаммаглобу-линемия и повышение содержания фибриногена в крови [Вакалюк П. М. и др., 1971].
Углубленное исследование глобулиновых фракций белка представляет большую ценность для выявления иммунодефицитных состояний, особенно дефицита иммуноглобулинов класса А. Это укажет на целесообразность иммунотерапии, которая в ряде случаев может оказаться весьма эффективной [Штейнгард Б. П. и др., 1975].
Дефицит IgA может быть обнаружен и в слюне, и в мокроте, даже тогда, когда их уровень в сыворотке крови нормальный.
Многое, как говорилось выше, может прояснить исследование основных электролитов слюны и пота. При этом может быть выявлен скрыто протекающий муковисцидоз.
Исследование изоферментов лактатдегидрогеназы сыворотки (ЛДГ) способствует дифференцировке форм бронхоэктазий: повышение ЛДГз говорит о преимущественно деструктивных процессах в легких, ЛДГ4 5—о поражении печени, ЛД1\ 2—об интоксикации, протекающей в скрытой форме.
Много внимания уделялось в последнее время изучению неспецифического и специфического иммунитета [Луценко С. М., Рыбаков А. И., 1970; Невецкая Л. М. и др., 1971]. Стойкое снижение титра комплемента, фагоцитарной активности нейтрофилов, изо- и гетерофильных антител, стрепто- и стафилолизинов, антипнев-мококковых антител является неблагоприятным признаком, указывающим на то, что заболевание имеет склонность к обострениям, которые, если не были частыми в прошлом,— участятся в будущем. Такие состояния укажут на целесообразность применения в процессе лечения (в том числе оперативного) средств стимуляции иммунных механизмов защиты — проди-гиозана, антистафилококкового глобулина, анатоксина и др.
Весьма неблагоприятным прогностическим признаком, даже при общем кажущемся вполне удовлетворительном состоянии, служит обнаружение в сыворотке противолегочных антител. Выше указывалось, что противолегочная аутоиммунизация является существенно важным звеном патогенеза заболевания: при ней возникает угроза распространения деструктивного процесса [Китаев М. И., Морозов В. Л., 1970; Невецкая Л. М., Прозоровская К. Н., 1970].
244
Выделение и идентификация микробной флоры бронхиального дерева в настоящее время уже не рассматриваются как дополнительный метод — сейчас это делается повсеместно в обязательном порядке, особенно в хирургических стационарах; обязательным является определение чувствительности выделенной микрофлоры к наиболее распространенным антибиотикам. При сборе мокроты для посева важно, чтобы она не была загрязнена микрофлорой полости рта. Рекомендуют делать посевы смыва с бронхов через бронхоскоп; достаточным средством является также полоскание полости рта перед сбором мокроты растворами антисептиков (перманганат калия и др.).
Важным этапом обследования больных является определение показателей внешнего дыхания, центральной и легочной гемодинамики.
Изучение внешнего дыхания, несмотря на простоту исследования, дает много ценной информации, особенно если это делается систематически в период поликлинического наблюдения (1—2 раза в год) и во время санации бронхиального дерева (до и после курса лечения). Наибольшую ценность из общедоступных показателей представляет определение дыхательных объемов легких (жизненной емкости), максимальной вентиляции и пневмотахометрия [Ан-телава Н. В. и др., 1970; Хлопотова Г. П., Лифшиц Н. А., 1973; Углов Ф. Г., Джафаров Ч. М., 1974; Ермолаев В. Р. и др., 1976; Pande J. et al., 1971, и др.]. Для бронхоэктазий характерны преимущественно рестриктивные нарушения, довольно четко коррелирующие со степенью распространенности процесса, развитием склероза и эмфиземы, т. е. со степенью выраженности необратимых изменений. Сдвиги в показателях обструктивных изменений отражают в основном степень воспаления слизистой оболочки, гипертрофию ее, а также бронхоспастический копонент, обычно связанный с воспалительным процессом.
Правильная оценка рестриктивных изменений возможна вне фазы обострения воспаления и после снятия бронхоспазма. Прогрессирующее снижение дыхательных объемов, определенное при этих условиях, свидетельствует о, продолжающемся распространении основного патологического процесса и может являться одним из показаний к операции. Вместе с тем при выраженных изменениях (уменьшение ЖЕЛ более чем на 50 % от должной величины) могут возникнуть противопоказания к вмешательству. По степени уменьшения сдвигов в показателях обструктивных нарушений судят об эффективности консервативной терапии.
Более сложные исследования аппарата внешнего дыхания, в частности бронхоспиромет
рия, при бронхоэктазиях мало что добавляют к данным простых методик, по крайней мере в тех вариантах, в которых бронхоспирометрия предлагалась до сих пор,— уточнение показателей внешнего дыхания непораженного легкого по сравнению с пораженным с целью уточнения функциональной полноценности легкого здоровой стороны [Помелов В. С. и др., 1971]. Этот метод, кстати, может быть заменен более простым определением степени участия в дыхании каждого из легких с помощью известного латерального теста Бергена. Бронхоспирометрия могла бы быть более информативной, если бы она была использована для оценки степени сохранения функции не интактных, а пораженных отделов легкого в случаях, когда в них имеются цилиндрические бронхоэктазии с частично сохранившейся вентилируемой легочной паренхимой. Вероятно, иногда это помогло бы воздержаться от хирургического лечения в варианте, когда показания к операции представляются спорными, способствовало бы сберегательному направлению в данном разделе хирургии. В этом отношении может представить интерес разработка селективной долевой и сегментарной бронхоспирометрии с газовым анализом.
Изменения со стороны сердечно-сосудистой системы служат в основном для оценки функциональной операбельности. В этом отношении главным общепризнанным критерием является степень легочной гипертензии. Стойкое увеличение среднего давления в легочной артерии выше 35 мм рт. ст. свидетельствует о далеко зашедших диффузных изменениях, о развитии легочного сердца, о большом операционном риске. Наиболее надежным методом определения давления в легочной артерии является метод прямого измерения его при зондировании сердца, к которому следует прибегать в сомнительных случаях [Кукош В. И., Захаров С. Н., 1976].
В последние годы для оценки степени нарушений легочного кровообращения стали более широко применять метод сканирования легких и ангиопульмонографию [Маневич В. Л. и др., 1971, 1972; Сергеев В. М., Стахов С. Н., 1972]. По данным авторов, при его использовании, как правило, выявляются более распространенные изменения в легких, чем обнаруженные при бронхографии. Вопрос о том, должно ли это служить показанием к расширению объема вмешательства, если таковое предпринимается, пока остается открытым.
Оценка нарушений функции сердечно-сосудистой системы и дыхания у больных бронхоэктазиями производится в клинике в последнее время с использованием метода интегральной реографии тела по М. И. Тищенко (1970). Этот
245
метод дает возможность выявить одновременно и бескровно функциональные резервы сердца, степень гемодинамической обеспеченности дыхательной недостаточности, оценить податливость легких и ориентировочно судить о степени легочной гипертензии. Важно, что это может быть сделано в динамике и с дозированной нагрузкой. При использовании метода сравнительно легко и без какого-либо вреда для больного можно рассчитать весьма информативный «индекс сократительной способности миокарда» [Кукош В. И., Захаров С. Н., 1976], представляющий отношение процента прироста ударного объема крови к проценту учащения пульса после стандартной нагрузки. Отставание увеличения ударного объема от частоты пульса, снижение индекса, по данным этих авторов, свидетельствуют о низких функциональных резервах; уменьшение его до 0,3 и меньше может служить одним из противопоказаний к оперативному вмешательству.
Бронхоэктазии могут возникнуть, как указывалось, сравнительно быстро. Однако течение заболевания длительное, обострения бывают сначала легкими, непродолжительными, а периоды ремиссии, напротив, продолжаются месяцы и годы. Большинство пациентов на протяжении многих лет может сохранять вполне удовлетворительное состояние и быть трудоспособными, не меняя образа жизни.
Постепенно все же наступает ухудшение. Обострения становятся более частыми, более тяжелыми и более продолжительными, а в периоды ремиссий полного благополучия уже нет — продолжается кашель, выделяется мокрота, периодически она становится гнойной, может наблюдаться кровохарканье.
При обследовании больных с таким относительно благоприятным течением обычно обнаруживаются преимущественно цилиндрические бронхоэктазии, часто еще вентилируемые, с сохраненными периферическими ветвями. В большинстве случаев они ограничиваются одной-двумя долями и лишь редко бывают с двух сторон. Клинически дыхательной недостаточности нет. Она может быть выявлена при определении показателей внешнего дыхания.
По И. С. Колесникову, В. Р. Ермолаеву (1969), такую форму течения можно назвать начальной и легкой. Обычно она бывает у детей, особенно в подростковом возрасте. Называя эту форму, «начальной», авторы подчеркивают возможное стадийное развитие бронхоэктазий, протекающих в таком варианте, что подтверждается клиническим анализом течения заболевания и данными повторных обследований больных. При несвоевременно предпринятом или нерегулярном лечении цилиндрические бронхоэктазии у больных этой группы могут
становиться мешотчатыми, могут появляться расширения бронхов в ранее не пораженных долях, что для бронхоэктазий вообще не характерно. Именно у больных этой клинической группы чаще, чем у больных других групп, возникают рецидивы заболевания после оперативного лечения.
Легкая форма клинического течения заболевания постепенно может перейти в более тяжелую с выраженными клиническими симптомами, что может быте, однако, и с самого начала возникновения бронхоэктазий. Эта группа больных с выраженными клиническими проявлениями является самой многочисленной в хирургических стационарах пульмонологического профиля.
Для больных этой группы характерны все клинические признаки бронхоэктазий — постоянный кашель, постоянное выделение мокроты, которой периодически становится много, она приобретает гнойный характер, наблюдается кровохарканье; обострения становятся регулярными, сезонными, а иногда возникают и чаще чем 2—3 раза в год. Дети школьного возраста с данной формой течения заболевания подолгу не посещают школьные занятия, взрослые часто нетрудоспособны по нескольку месяцев в году.
Для больных этой формы характерна постоянная дыхательная недостаточность, выраженная в большей или меньшей степени в зависимости от фазы обострения или ремиссии. Появляются и признаки интоксикации — головная боль, раздражительность, слабость, потливость.
При рентгенологическом исследовании, как правило, обнаруживаются заканчивающиеся слепо цилиндрические и мешотчатые бронхоэктазии. Степень их распространения может быть различной, но именно у этой группы больных часто (примерно у 25 %) выявляются двусторонние поражения. Изменения легочной паренхимы — фиброз, ателектаз, эмфизема — имеют место всегда.
Данные лабораторных и специальных исследований весьма характерны. Они описаны выше. Особенно характерны сдвиги со стороны внешнего дыхания. В фазе ремиссии отчетливо выявляются признаки рестриктивной дыхательной недостаточности; в фазе обострения недостаточность рестриктивного типа углубляется, присоединяется недостаточность обструктивного типа.
Консервативное лечение больных этой группы дает обычно лишь временный эффект. Несмотря на достаточно интенсивную терапию, заболевание постепенно прогрессирует. Ухудшение состояния, как правило, не является следствием распространения бронхоэктазий или
246
изменения их патоморфологической формы, а является результатом все более нарастающих диффузных изменений в легких, хронической гипоксии и интоксикации.
Постепенно заболевание приобретает тяжелую и очень тяжелую формы течения, для которых характерна сердечно-легочная недостаточность по типу легочного сердца, высокая легочная гипертензия, дистрофические изменения внутренних органов, прежде всего почек. Может развиться амилоидоз. Прогноз у подавляющего большинства больных этой группы неблагоприятный.
Таким образом, по клиническому течению можно выделить три основные типичные формы заболевания: легкую, форму выраженных (умеренных и более отчетливых) клинических проявлений и тяжелую.
В числе особых клинических форм выделяют так называемые «сухие бронхоэктазии» [Ци-гельник А. Я., 1948], для которых характерны постоянный персистирующий кашель, кровохарканье и легочные кровотечения, а также нарастающая одышка, дыхательная недостаточность.
Другой своеобразной формой заболевания являются бронхоэктазии с выраженным астматическим компонентом. В клиническом течении у этих больных преобладает дыхательная недостаточность по типу бронхиальной астмы. Такое течение бронхоэктазии могут приобрести в любом возрасте и при любой форме первоначальных проявлений. Природа его, по-видимому, инфекционно-аллергическая. Астматические приступы особенно часты в периоды обострений.
Своеобразной клинической формой течения бронхоэктазий являются бронхоэктазии, осложненные язвой желудка или двенадцатиперстной кишки, склонной к кровотечениям. Подобные формы течения хронических неспецифических воспалительных заболеваний легких нередки, служат предметом обсуждения в литературе [Иоселиани Г. Д., Ефремов А. В., 1976, и др.].
Как отмечалось ранее, для бронхоэктазий детского возраста в общем характерны сравнительно частые, но кратковременные обострения, протекающие с выраженной общей реакцией. У детей особенно часто бронхоэктазиям сопутствуют синуситы. Бронхоэктазии у пожилых людей протекают с более выраженными явлениями дыхательной и сердечно-сосудистой недостаточности, у них чаще бывают кровохарканья и легочные кровотечения. Эти особенности у пожилых лиц обусловлены не только самим заболеванием, но также возрастной эмфиземой, пневмосклерозом, возрастными изменениями сердечно-сосудистой системы.
Из осложнений течения бронхоэктазий следует упомянуть о спонтанном пневмотораксе, абсцессе легкого, эмпиеме плевры, метастатическом абсцессе мозга и раке. Спонтанный пневмоторакс иногда бывает при кистоподобных бронхоэктазиях. На 624 больных, находившихся под наблюдением в клинике, он возник у 1 больного.
Абсцесс легкого — более частое осложнение: он отяготил течение бронхоэктазий у 9 больных этой группы. Абсцесс обычно развивался в здоровых долях или сегментах, не пораженных бронхоэктазиями; нередко он локализуется в VI сегменте. Причину абсцесса следует усматривать в затекании мокроты в здоровые отделы бронхиального дерева.
Эмпиема плевры как следствие нагноения выпотного плеврита наблюдалась у 6 больных. Абсцесс мозга возник у 1 человека.
Рак легкого как осложнение течения бронхоэктазий у пожилых больных не так уж редок [Брауде В. И., 1971; Arrigoni М. et al., 1971, и др.]. Здесь надо подчеркнуть, что речь идет не о раке, вызвавшем бронхоэктазии, а об опухоли, возникшей на фоне длительно протекавшего хронического воспаления с преимущественным исходом в пневмосклероз. Такие опухоли иногда являются случайной находкой при резекции легкого по поводу бронхоэктазий. Происхождение опухоли в этом случае, по-видимому, близко к известному из литературы «раку из рубца» [Robe R., 1966].
Дифференцировать бронхоэктазии у детей и лиц молодого возраста приходится прежде всего от туберкулеза легких: особенности течения бронхоэктазий у детей весьма напоминают туберкулез. Неудивительно, что почти половина детей, больных бронхоэктазиями, сначала длительное время наблюдаются и лечатся у фтизиатров [Кухаренко С. Д., 1972, и др.].
В пользу бронхоэктазий говорят отсутствие эпидемиологического анамнеза, сравнительно длительное течение, характерные сезонные обострения, постоянное выделение гнойной мокроты, а также преимущественно нижнедолевая локализация процесса. Физикальные аускультативные данные при туберкулезе обычно скудны, тогда как при бронхоэктазиях довольно ярко выражены, особенно в периоды обострений. Важны в дифференциальной диагностике результаты туберкулиновых проб, наличие (или отсутствие) при повторных исследованиях микобактерий туберкулеза в мокроте. О бронхоэктазиях с наибольшей достоверностью свидетельствуют результаты бронхографического исследования, хотя и при установленных бронхоэктазиях исключить туберкулез бывает трудно, так как туберкулез может
247
предшествовать бронхоэктазиям, быть их причиной, сопутствовать им.
Посттуберкулезные бронхоэктазии у взрослых требуют исключения активного специфического процесса. Это подчас тоже трудная задача, решить которую сразу удается далеко не всегда. В таких случаях наряду с лечением бронхоэктазий проводят полный курс противотуберкулезной терапии.
Дифференцировать бронхоэктазии у взрослых часто приходится с хроническим бронхитом. При этом надо иметь в виду, что хронический бронхит — частое заболевание, а бронхоэктазии — значительно более редкое, что хронический бронхит имеет совсем другое клиническое течение. Для бронхита более характерны постоянный кашель со скудной мокротой, постепенно нарастающая одышка, а периоды обострений протекают по типу воспаления легкого, т. е. совершенно не так, как при бронхоэктазиях. Решить вопрос помогает бронхография, хотя и после нее могут остаться сомнения, так как при деформирующем бронхите могут быть обнаружены отдельные расширенные бронхи. Два важных рентгенологических признака более характерны для бронхита: распространенность, диффузность поражения легких и сохранение вентилируемой легочной паренхимы; последняя претерпевает эмфизематозные изменения, но не склеротические, а тем более не цирротические.
Довольно частым при бронхоэктазиях является диагноз хронической пневмонии. Он отпадает сразу же после бронхографического исследования, устанавливающего типичное расширение бронхов. При отсутствии же бронхоэктазий у таких больных, как правило, выявляются признаки бронхита. Таким образом, для хронической пневмонии как самостоятельной нозологической формы в легочной патологии практически не остается места [Колесов А. П., Гаджиев С. А., 1973; Ржаницин В. В., 1975, и др.].
Бронхоэктазии иногда по течению трудно отличить от хронического абсцесса легких, особенно от более или менее хорошо дренирующейся полости (или полостей). При абсцессе правильной диагностике способствуют типичные анамнестические данные — острое начало, эпизод внезапного отхождения большого количества мокроты и др. Полости абсцесса хорошо выявляются при томографическом исследовании, они имеют типичную для абсцесса локализацию — в задних сегментах легкого. При бронхографии эти полости часто не заполняются контрастным веществом, а если заполняются, то видны дренирующие абсцесс бронхи, как правило, небольшого диаметра; большая часть бронхиального дерева при этом из
менена незначительно, т. е. бронхи не расширены, лишь деформированы; отсутствует типичный для бронхоэктазий сегментарный характер поражения.
При обследовании больных нередко встает вопрос: бронхоэктазии или локальный пневмосклероз? Локальный пневмосклероз бывает различного происхождения, а следовательно, дифференцировать необходимо от бронхоэктазий пневмосклероз разного характера.
Одним из таких склерозов является склероз средней доли (или язычка) легкого — форма так называемого среднедолевого синдрома. При такого рода пневмосклерозе обычно выявляются и бронхоэктазии IV—V сегментарных бронхов. Клиника, течение, последствия и методы лечения при этом совершенно аналогичны бронхоэктазиям (легкой форме). Поэтому пневмосклероз средней доли следует считать одной из форм течения бронхоэктазий.
Другого характера пневмосклероз наблюдается после перенесенного абсцесса легкого. Если при этом сохраняется полость (как правило, сухая), но есть угроза рецидива абсцесса в хронической форме (особенно когда эта угроза в той или иной степени реализуется) — эту форму следует отнести к хроническому абсцессу [Колесников И. С., Вихриев Б. С., 1973]. В случае, когда сухая полость после абсцесса протекает бессимптомно, можно говорить о ложной кисте; в этом случае нет возражений также против термина «пневмосклероз после абсцесса».
Локальный пневмосклероз в легком может быть следствием полностью зажившего абсцесса или пневмонического очага с исходом в рубец. Иными словами, это результат благоприятного течения острого воспаления. Однако, как всякий рубец, такой склероз может причинять некоторые беспокойства, становясь уже сам по себе болезнью. Клиника госпитальной хирургии имеет опыт наблюдения за такими больными. Чаще всего они поступали с диагнозом рака, а иногда и оперировались с подозрением на это заболевание.
Обычно это были пожилые пациенты, склонные к диффузному пневмосклерозу вообще, который у них, наряду с локальным, и выявляется. Они жаловались на одышку; это была наиболее частая жалоба. Другим проявлением было кровохарканье, изредка довольно обильное, типа кровотечений. Третьей жалобой была жалоба на боль в груди. Боли в груди, по-ви-димому, были следствием спаечного процесса в плевральной полости. При бронхографии у таких пациентов бронхоэктазии не обнаруживаются, но находят изменения, напоминающие хронический деформирующий бронхит, хотя клиники бронхита у них нет. Поскольку нет ни клиники бронхита, ни клиники бронхоэкта
248
зий, ни к тому ни к другому заболеванию эту патологию отнести нельзя. Оперативному лечению такие больные не подлежат. Случайно оперированные (с подозрением на рак), особенно которым сделаны обширные резекции, послеоперационный период из-за распространенного пневмосклероза переносили, как правило, тяжело, а в отдаленном периоде у них выявлялась выраженная дыхательная недостаточность.
Бронхоэктазии с астматическим компонентом иногда принимают за бронхиальную астму и наоборот. Несмотря на общность этиологического фактора (инфекционного) — это разные болезни. Астматические приступы при бронхоэктазиях могут быть совершенно идентичны приступам при астме. Однако в промежутках между ними клиника бронхоэктазий все же сохраняется. При астме же ее нет. Разное у этих категорий больных и течение заболевания. Анализ клиники и течения, а также данные бронхографического исследования позволяют разграничить эти страдания. Бронхография при длительно текущей бронхиальной астме может дать картину периферического расширения бронхиол (бронхиолэктазий Лешке). Но они совершенно не похожи ни на одну из патоморфологических форм типичных бронхоэктазий.
Иногда возникает необходимость дифференциальной диагностики нагноившихся кист легкого и кистозных бронхоэктазий, а также нагноившихся полостей при внутридолевой секвестрации и при других врожденных аномалиях. Дифференцировать эти заболевания часто можно только на основании данных бронхографии, при которой в случае кист бронхиальное дерево может иметь практически нормальный вид. При аномалиях типа секвестрации поможет ангиография, которая выявит атипичное (из болыцого круга кровообращения) артериальное кровоснабжение пораженного участка.
Не всегда бывает легко дифференцировать бронхоэктазии и рак легкого [Шеляхов-ский М. М., 1960; Воропаев М. М., Адамян А. А., 1971]. Бронхоэктазии, с одной стороны, могут быть следствием опухоли, а с другой стороны, опухоль может возникнуть на фоне бронхоэктазий. При диагностических трудностях такого рода в ходе диагностики у пожилых больных, особенно у мужчин, надо идти по пути исключения рака. Особенно трудна дифференциальная диагностика опухоли средней доли (или язычка) и бронхоэктазий этой области. Отправными пунктами для суждений являются данные томографии, бронхоскопии, бронхоскопической биопсии и исследований мокроты (промывных вод бронхов) на атипичные клетки;
данные бронхографии здесь не являются решающими. И все же окончательно диагноз без операции иногда установить не удается. В сомнительных случаях показана эксплоративная торакотомия.
ЛЕЧЕНИЕ
Учитывая, что при бронхоэктазиях имеют место необратимые изменения, а течение заболевания характеризуется в основном прогрессирующим ухудшением состояния, развитием тяжелых расстройств, приводящих в конечном итоге к глубокой инвалидности и преждевременной смерти, основным методом лечения бронхоэктазий следует считать хирургический. В этом вопросе сейчас противоречивых мнений нет. Однако существуют разные взгляды на показания и противопоказания к операции, выбор метода оперативного лечения при различных формах заболевания, при различных вариантах течения. Не решен окончательно также вопрос о том, какой возраст при бронхоэктазиях у детей и у взрослых является наиболее подходящим для хирургического вмешательства.
Показания к операции, очевидно, должны прежде всего учитывать прогноз в разных группах больных, особенности течения заболевания у них, а также возможности консервативной терапии.
Показания к операциям неотложного характера могут возникнуть при осложнениях, прежде всего при легочном кровотечении. Профузное легочное кровотечение, как указывалось, в общем для бронхоэктазий не характерно. Однако оно все же бывает и среди больных хроническими неспецифическими заболеваниями легких занимает не последнее место. Согласно сводным данным литературы [Семенова Л. П., 1960; Абдуллаев Г. И. и др., 1974; Домбаев М. Д., 1975; Чернобровый Н. П. и др., 1976], массивное легочное кровотечение, требующее неотложных мероприятий, при хронических неспецифических воспалениях наблюдается в 6—8 % случаев; из них почти половина (20—42 %) — больные бронхоэктазиями.
Опыт показал, что консервативное лечение (переливание крови, гемостатические препараты, лекарства, угнетающие кашель, и др.) в такой ситуации малоэффективны. Кровотечение удается остановить лишь у немногих пациентов, причем в большинстве случаев не окончательно. Летальность при консервативной терапии достигает 50 % и более [Палиашвили В. А., 1972; Juhasz L., Ungar J., 1970, и др.]. Причиной смерти лишь отчасти является кровотечение как таковое; главным образом — это дыхательная недостаточность и пневмония,
249
развивающиеся вследствие аспирации крови в здоровые участки легкого.
В случае профузного легочного кровотечения (при потере крови до 0,5 л/сут и более) показания к операции могут быть неотложными (на высоте кровотечения), срочными (в ближайшие несколько дней, при стихающем кровотечении) и поздними (после остановки кровотечения). Наилучшие результаты получены при операциях, выполненных по срочным показаниям: кровотечение удавалось остановить практически всегда, ближайшие исходы у 95 % больных оказались хорошими. У большинства больных при этом было достигнуто и полное выздоровление. Исключение составляли случаи, когда операции с целью остановки кровотечения производились при двусторонних бронхоэктазиях.
Основным видом операции является резекция пораженных отделов легкого, которые на операции хорошо видны, так как пропитаны кровью. Перед операцией необходимо точно установить, из какого легкого происходит кровотечение, а также дифференцировать, не являются ли источником кровотечения верхние дыхательные пути, желудочно-кишечный тракт. В решении этих вопросов помогают простейшее рентгенологическое исследование и бронхоскопия. При бронхоскопии в некоторых случаях в качестве временной меры, предупреждающей затекание мокроты и крови в здоровые отделы легких, целесообразна тампонада бронхов. Для остановки кровотечения рекомендовали и более сложные приемы, например временную окклюзию легочной артерии на стороне поражения с помощью специальных сердечных зондов с манжеткой [Натадзе Д. А. и др., 1973]; данное предложение пока имеет немного сторонников. Бронхоскопия после операции является обязательной.
Другим показанием к срочному оперативному вмешательству при бронхоэктазиях служат гнойные осложнения — острые абсцессы, особенно склонные к гангрене, пиопневмоторакс, а также спонтанный пневмоторакс с явлениями напряженного пневмоторакса или выраженного гемоторакса. При бронхоэктазиях такие осложнения встречаются редко. Лечение их описано в соответствующих разделах монографии.
Для оценки прогноза в разных группах больных бронхоэктазиями наибольшую ценность представляют материалы о судьбе пациентов, находившихся под наблюдением длительное время и лечившихся консервативно, а также материалы о судьбе больных, которые находились в хирургических стационарах и которым была предложена операция, но они были выписаны по тем или иным причинам.
По данным Н. П. Чернобрового (1973), при диспансерном наблюдении за 612 больными бронхоэктазиями в течение 10 лет периодически проводившееся консервативное лечение оказалось эффективным у 487 человек (у 81,2 %). Обострения у них либо прекратились, либо стали редкими и кратковременными, а периоды ремиссии, наоборот, продолжительными; заболевание стало мало беспокоить, они занимались обычным для себя трудом. В эту группу входили в основном больные с умеренным расширением бронхов, однако какое-то число и со значительным расширением тоже — со смешанными и мешотчатыми формами. Независимо от характера расширения бронхов заболевание у этой группы больных с самого начала протекало в сравнительно легкой форме или в форме выраженных клинических проявлений, но без тяжелой клинической картины. У 16,8 % больных либо не наблюдалось улучшения, либо отмечалось ухудшение состояния. У этих больных, как правило, выявлялись мешотчатые формы, заболевание с самого начала протекало с выраженными клиническими проявлениями и часто тяжело. У некоторых из них наблюдались осложнения в виде легочных кровотечений, абсцедирования, развития легочного сердца, амилоидоза. Автор считает, что именно эта вторая, меньшая группа больных подлежит хирургическому вмешательству.
С. В. Сахаров и соавт. (1970) при длительном наблюдении и интенсивной терапии отказались от операции у 58,2 % больных. Это также были пациенты в основном с относительно легким клиническим течением.
Результаты отдаленных наблюдений (в течение более чем 10 лет) за больными, выписанными из клиники госпитальной хирургии по разным причинам, показали [Ермолаев В. Р., 1972], что среди отказавшихся от операции улучшение состояния или состояние без изменений (бронхоэктазии с относительно легким течением и с выраженной клинической формой) наблюдались у 37 % больных, ухудшение — у 31 %; остальные были в последующем оперированы. Среди выписанных в связи с предполагавшейся неоперабельностью из-за тяжести состояния и распространенности процесса (бронхоэктазии с выраженной и тяжелой формами клинического течения) улучшение или относительно удовлетворительное состояние без ухудшения отмечено у 27 % больных, умерли 57 %; остальные находились на момент осмотра в крайне тяжелом состоянии.
Приведенные данные свидетельствуют о том, что настойчивая консервативная терапия может быть определенным объективным критерием оценки показаний к операции. При этом выявляется, что, с одной стороны, почти у половины
250
больных в операции настоятельной необходимости нет и вопрос о ней может вообще отпасть, а с другой стороны, у второй половины операция оказывается безусловно необходимой. Как в той, так и в другой группах могут находиться пациенты и с относительно легким клиническим течением, и с выраженной, а также тяжелой формой заболевания.
Учитывая эти данные и принимая во внимание то, что больные бронхоэктазиями в подавляющем большинстве не требуют оказания срочной хирургической помощи, вопрос о показаниях к хирургическому лечению должен решаться только после достаточно длительного курса интенсивного терапевтического лечения.
Терапевтическое лечение включает обязательную санацию верхних дыхательных путей и полости рта (зубов). Больные должны соблюдать строгий режим поведения, «следить за своим здоровьем». Этот режим отрабатывается индивидуально, но предусматривает в качестве необходимого компонента дыхательную гимнастику с постуральным дренажем, дозированную физкультуру.
В предвесенний и послеосенний периоды (перед обычными в это время обострениями, но независимо от них) они проходят курс эндобронхиальной санации. В относительно легких случаях это делается амбулаторно — проводится ежедневное промывание (лаваж) трахеобронхиального дерева через назотрахеальный катетер. В более тяжелых случаях показано стационарное лечение в специализированных пульмонологических отделениях, где при необходимости делается также санация через бронхоскоп. Курс санации занимает обычно 10—14 дней.
При лаваже используются теплый изотонический раствор натрия хлорида, фурацилин, йодинол, новокаин, натрия бикарбонат (5 %) с последующим введением протеолитических ферментов, разжижающих мокроту (ацетилцистеин, химопсин, рибонуклеаза и др.), гидрокортизона, а в особо упорных случаях — антибиотиков с учетом чувствительности к ним микрофлоры бронхов [Углов Ф. Г., Джафаров Ч. М., 1974; Чернобровый Н. П., 1972; Булгаков Я. У., 1975; Ramizer R., 1966, и др.].
После лаважа и в промежутках между сеансами его (а также в амбулаторных условиях и при необходимости дома) делаются систематические паровые ингаляции.
Из лекарственных препаратов больные получают эуфиллин, витамины, экстракт алоэ, пен-токсил. При наклонностях к бронхоспазму назначаются бронхолитики.
В борьбе с инфекцией, наряду с антибиотиками и местными антисептическими средствами, могут использоваться также такие препара
ты специфического действия, как аутовакцина, приготовленная из микрофлоры бронхов [Мальцев А. М. и др., 1971], стафилококовый анатоксин, антистафилококковая сыворотка [Нед-вецкая Л. М. и др., 1973]. Для стимуляции неспецифического иммунитета рекомендуют пирогенал, продигиозан [Луценко С. М. и др., 1970; Чекин С. Т., Рыбалко С. И., 1974] и пр.
У пожилых больных с сопутствующей патологией, например с сердечно-сосудистыми заболеваниями, она требует лечения и этих заболеваний по соответствующим показаниям.
Для всех больных желательно санаторно-курортное лечение не реже одного раза в год. Условия климата решаются индивидуально.
Интенсивная терапия проводится в течение 2—3 лет. Контроль эффективности ее осуществляется как по клиническим данным, так и по данным лабораторного и специального обследования, предпринимаемого периодически. Лабораторное и специальное обследование делается обычно перед курсом санации бронхов и после него.
В обязательном порядке делается общеклинический анализ крови и мочи, определяется содержание белка в сыворотке. Желательна проба на С-реактивный белок. При использовании для лечения антибиотиков каждый раз определяется чувствительность к ним микрофлоры мокроты и ставятся аллергические пробы.
Важным показателем эффективности проводимой терапии является исследование внешнего дыхания; крайне желательно иметь данные об изменениях давления в малом круге кровообращения.
Контрольная бронхография делается по весьма ограниченным показаниям. Она показана у больных с выраженными проявлениями заболевания, у которых не удается добиться улучшения состояния, или при ухудшении его. Как правило, повторная бронхография показана в предвидении оперативного лечения.
Интенсивно проводимое терапевтическое лечение является одновременно хорошим (и необходимым) методом подготовки к операции, коль скоро таковая предстоит. В этом случае средства терапии могут быть расширены за счет использования некоторых новых специальных методов. С. А. Гаджиев и соавт. (1966), Ф. Г. Углов и соавт. (1969), С. X. Авдакбелян и соавт. (1970), Р. А. Галкин (1970), С. Т. Чекан, Л. И. Рыбалко (1974) и мн. др. настойчиво рекомендуют введение антибиотиков в ветви легочной артерии и санацию трахеобронхиального дерева через микротрахеостому.
И. И. Неймарк, Ю. К. Норкайтис (1973) установили, что при введении антибиотиков в ветви легочной артерии в легком создается концентрация их, превышающая в 4,5 раза кон-
251
центрацию, когда антибиотики вводятся внутривенно. Правда, аналогичная концентрация наблюдается при инфузии их через катетер, введенный в устье полой вены через подключичную. Вероятно, для практики этот последний метод более приемлем.
Микротрахеостомия осуществляется путем чрескожного прокола трахеи на шее толстой иглой с введением через нее микроирригатора. С помощью бронхоскопа конец ирригатора устанавливается в области устья пораженных бронхов. Через ирригатор осуществляется орошение (промывание) бронхов 4—5 раз в день. По мнению С. X. Авдалбекяна и соавт. (1970), такое лечение особенно эффективно именно при бронхоэктазиях. Эффект даже в тяжелых случаях отмечается уже через 2—3 дня.
В госпитальной хирургической клинике используется оригинальная методика санации бронхиального дерева через ирригатор (катетер), установленный в пораженном долевом (сегментарном) бронхе трансторакально, через грудную стенку (рис. 114). Методика установки такого ирригатора предложена И. С. Колесниковым и В. Т. Плешаковым [Плешаков В. Т. и др., 1979|. Она состоит в следующем.
Через бронхоскоп (лучше двухпросветный) вводится в нужный бронх направляющий полу-жесткий катетер; через него проводится длинная игла, прокалывающая периферические отделы легкого, плевру и мягкие ткани стенки груди (кожа надсекается скальпелем); после извлечения направляющего катетера и укрепления к игле ирригатора последний протягивается через трубку бронхоскопа и бронх вслед за иглой; конец его под контролем гла за уста
навливается у устья бронха или непосредственно за устьем; выведенная через грудную стенку часть ирригатора фиксируется к коже швом. Промывание бронхов, введение в бронхиальное дерево лекарственных средств производятся в течение дня многократно (5—6 раз). При достаточном диаметре ирригатора (3—4 мм) он может выполнять дренажную функцию: у некоторых наших больных бронхоэктазиями через него за сутки отходило до 150 мл гнойной мокроты.
Указанные новые методы санации трахеобронхиального дерева существенно расширяют возможности терапевтического лечения бронхоэктазий, способствуют наиболее эффективной подготовке к операции и создают условия для наиболее благоприятного течения послеоперационного периода.
Неэффективность всех основных средств консервативной терапии в течение 2—3 лет является показанием к операции. При этом возникает необходимость решения вопросов, связанных с ее проведением: оптимальный срок в зависимости от возраста, оптимальный объем резекции легкого и противопоказания к вмешательству.
Что касается возраста, то, по мнению большинства авторов, наиболее подходящим возрастом для детей является возраст после 7— 10 лет [Колесов А. П„ Чухловина М. Г., 1962; Ищенко Б. И. и др., 1972; Бойков Г. А., 1973; Пугачев А. Г. и др., 1974, и др.]. При операциях, сделанных в более раннем возрасте, отдаленные результаты оказались менее благоприятными. Это объясняется, с одной стороны, анатомо-физиологическими особенностями лег
252
кого у детей младшей возрастной группы, которые обусловливают склонность к послеоперационным ателектазам, инфекции и возникновению рецидива заболевания, а с другой стороны, у маленьких детей часто трудно достаточно четко отграничить зону поражения, что является причиной остаточных (резидуальных) бронхоэктазий. Нельзя не считаться также с тем мнением, что у части детей при интенсивном терапевтическом лечении некоторые формы бронхоэктазий в процессе роста ребенка как бы подвергаются обратному развитию с восстановлением нормальной картины бронхов — так называемые «динамические формы бронхоэктазий» [Рошаль М. Н., 1969; Макаров И. А., 1969; Никулин К. Г. и др., 1970]. Показания к операции у детей раннего возраста могут быть расширены только при тяжелом течении, при отсутствии эффекта от терапевтического лечения и при четко ограниченных смешанных и мешотчатых формах поражения [Пугачев А. Г. и др., 1974|.
Возрастные ограничения у взрослых менее определенны. Здесь применима формула: «чем раньше оперируется больной — тем лучше». Отдаленные функциональные результаты в общем у больных старше 40 лет хуже, чем у лиц более молодого возраста. Однако после операций, сделанных по правильным показаниям, с хорошо проведенной предоперационной подготовкой, функциональные показатели в отдаленном периоде после вмешательства всегда выше, чем до него, даже у больных, оперированных в весьма преклонном возрасте — 60— 74 года [Избинский А. Л. и др., 1971; Ермолаев В. Р. и др., 1975|. Следует подчеркнуть, что преклонный возраст больных не исключает у них необходимости длительной предоперационной консервативной терапии, а, напротив, предполагает ее.
Вопрос об объеме резекции легкого при бронхоэктазиях обсуждался в течение многих лет.
Вполне понятно стремление к ограничению объема операции, к максимальному сохранению функционирующей легочной паренхимы [Ермолаев В. Р., 1962; Герасименко Н. И., Пирогов А. И., 1967; Пугачев А. Г. и др., 1970, 1972; Исаков Ю. Ф. и др., 1973, и др.|. Особенно важно это при двусторонних поражениях. Стремление к таким «сберегательным» операциям реализовалось в расширении показаний к комбинированным сегментарным резекциям — удалению базальной пирамиды и одного из сегментов (V) средней доли, одного или двух сегментов язычка с оставлением VI сегмента, удалению средней доли и отдельных сегментов базальной пирамиды (VII, например). Отдаленные результаты показали, однако, что такие сберегательные операции довольно часто были
недостаточно оправданны, так как оставление участков легкого с измененными в виде деформирующего бронхита и даже пневмосклероза, распространившегося с соседних сегментов (с X на VI, например), практически неминуемо вело к рецидиву заболевания, необходимости повторных вмешательств.
Другой крайностью являются недостаточно оправданное расширение объема операции, удаление участков легкого, которые, по данным предварительного обследования и при осмотре во время операции, кажутся здоровыми, но в которых часто наблюдается рецидив. По мнению Л. М. Рошаля (1969), Ф. Г. Углова (1976), удаление базальной пирамиды, как правило, должно сочетаться с удалением IV—V сегментов, если даже они кажутся здоровыми. По мнению многих, оставлять кажущийся здоровым VI сегмент при удалении сегментов базальной пирамиды нецелесообразно. Вряд ли такая точка зрения может быть оправдана. В указанных сегментах действительно часто наблюдается рецидив заболевания, но лишь при недостаточной предоперационной подготовке, при дефектах, допущенных во время операции и в послеоперационном периоде.
При определении объема резекции, по-видимому, наиболее правильной тактикой будет стремление к максимальному удалению пораженной части легкого, необратимо утратившего свою функцию, и в то же время стремление к максимальному сохранению малоизме-ненных отделов [Ермолаев В. Р., 1971; Гаджиев С. А. и др., 1972; Кухаренко С. Д., 1973; Га-уен Я. К. и др., 1976: Thumann Н. et al„ 1971, и др.].
Для уточнения размеров и локализации пораженных участков во время операции В. А. Кли-манский [Климанский В. А., Ревис М. Г., 1971] предложил пробу на эластичность легочной ткани: после раздувания легкого с помощью наркозного аппарата делается резкая аспирация содержимого бронхов; пораженные отделы при этом не спадаются. Во время операции допустима и срочная биопсия периферических отделов участков легкого, сомнительных в морфологической и функциональной полноценности. Удалению подлежат сегменты, в которых обнаруживаются выраженные необратимые (склеротические) изменения: они всегда указывают на необратимые изменения в бронхах. Участки с обратимыми изменениями в виде остаточных явлений воспаления паренхимы сохраняются. По данным В. А. Климанского (1971), благодаря такой методике удалось существенно сократить объем резекции у 22 больных из 131.
Важную роль в успешности таких операций играет оперативная техника. Резекция долж
253
на производиться строго анатомично. Применение сшивающих аппаратов для ткани легкого должно быть исключено [Колесников И. С. и др., 1965]. Свободные межсегментарные плоскости желательно прикрыть лоскутом плевры (можно использовать лоскут с удаляемой части легкого). Длинные культи бронхов оставлять нельзя. Герметизация швов обязательна. Последнее контролируется раздуванием легкого в жидкости, налитой в плевральную полость.
Успех операции может быть обеспечен только тогда, когда после зашивания раны грудной стенки остаток легкого полностью расправится без перерастяжения легочной ткани, перегибов бронхов, сдавления отдельных участков. Расправление легкого обеспечивается в первую очередь соответствием его эластичности и объема объему полости плевры. Важно, чтобы были сохранены хорошая вентиляция, хороший крово- и лимфоток. Для предупреждения перегибов бронхов, перекручивания их иногда приходится зафиксировать периферические отделы: сегменты язычка и средней доли имеют склонность завернуться кзади, в задний костно-диафрагмальный синус; поэтому их следует фиксировать спереди к перикарду. При явном несоответствии объема остатка легкого объему плевральной полости рекомендуются френико-алкоголизация, френикоэкзерез. В таких случаях показано также наложение искусственного пневмоперитонеума немедленно по окончании операции.
Лечение в ближайшем послеоперационном периоде проводится как обычно у торакальных больных. Предупреждение послеоперационных осложнений — важнейшее условие профилактики послеоперационных рецидивов. Другое, не менее важное, условие — лечение в период реабилитации.
Оно, в основном, проводится по той же схеме, как и в период предоперационной подготовки.
Сопутствующие заболевания редко являются противопоказанием к операции. Среди них могут быть, например, болезни сердца, в том числе приобретенные и врожденные пороки. Операция на легком противопоказана, как выяснилось, только в случаях тяжелого декомпенсированного порока, при котором терапия любыми средствами бесперспективна. Если порок подлежит хирургическому лечению и показана резекция легкого по поводу бронхоэктазий, то возникает вопрос: какую операцию раньше делать? Вопрос этот решается строго индивидуально. Как свидетельствует опыт, допустимы и одномоментные вмешательства на сердце и легком [Колесников И. С., Ермолаев В. Р., 1969]: У больных, которым предстоит коррекция сердечного порока в условиях экстракорпорального кровообращения, лучше сначала сде
лать операцию на легком [Колесов А. П., Кутушев Ф. X., 1963].
У больных бронхоэктазиями с тяжелой и очень тяжелой формой течения решить вопрос о противопоказаниях к операции нелегко. С одной стороны, это больные, которым никакое другое лечение не поможет, а с другой стороны, риск операции слишком велик; к тому же операция у такого рода пациентов в большинстве не облегчает их страдания. Нефропатия и амилоидоз как осложнения течения бронхоэктазий рассматривать в качестве абсолютных противопоказаний нельзя, так как в начальных фазах и нефропатия, и даже амилоидоз, по-видимому, обратимы. Главным противопоказанием является такое течение бронхоэктазий, при котором имеют место диффузные поражения легкого в виде пневмосклероза, эмфиземы, органической формы легочной гипертензии («легочного сердца»). При этом надо ориентироваться на показатели внешнего дыхания и данные измерения давления в малом круге. Снижение дыхательных объемов (ЖЕЛ) ниже 50 % от должных величин со стойким повышением давления в легочной артерии (выше 25 мм рт. ст.) говорит о том, что риск планируемой операции превышает возлагаемые на нее надежды.
Наличие двусторонних бронхоэктазий уже само по себе настораживает. Однако, значительная часть больных с такой формой заболевания могут быть успешно оперированы. К этой категории относятся больные бронхоэктазиями, поражающими лишь нижние отделы обоих легких, а также больные выраженными и распространенными бронхоэктазиями с одной стороны и незначительными и ограниченными — с другой. В первом варианте операция может быть сделана сначала на одной стороне, а потом, по выздоровлении, через несколько месяцев,— на другой (одномоментные двусторонние операции сейчас уже не практикуются). Бывает так, что после операции на одной стороне (с большим поражением) больные чувствуют себя настолько хорошо, что вопрос о повторном вмешательстве уже не возникает. Во втором варианте допустимы так называемые паллиативные вмешательства — резекции легкого только на стороне наибольшего поражения. Такая операция заведомо не излечит больного, но может значительно облегчить его состояние. Принято считать, что допустимым объемом "резекции при таких двусторонних операциях является резекция не более 11 —13 сегментов легких у детей и не более 8 сегментов у взрослых при условии сохранения в целости верхних долей.
У больных с противопоказаниями к операции остается единственный путь облегчения страдания — упорная санирующая терапия.
I
Глава -L ПНЕВМОМИКОЗЫ
АКТИНОМИКОЗ
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Актиномикоз — хроническое инфекционное неконтагиозное заболевание человека и животных, вызываемое лучистыми грибами.
Актиномицеты устойчивы к различным неблагоприятным условиям внешней среды — споры их сохраняются жизнеспособными в течение 15—20 лет, выдерживают высушивание, прямое воздействие солнечных лучей, нагревание до 60 °C. Среди огромного количества видов актиномицетов, распространенных в природе, лишь немногие патогенны. Вначале была доказана роль актиномицета в развитии заболевания у крупного рогатого скота, затем у человека [Israel, 1878].
Различают два вида патогенных актиномицетов: аэробный (тип Бострема, имеющий длинный разветвленный мицелий, легко образующий споры) и анаэробный (тип Вольф — Из-раеля, состоящий из палочек со слабым ветвлением, способный образовывать друзы). Наиболее патогенной является анаэробная форма, приспособившаяся к паразитированию в организме. Аэробная форма обычно бывает сапрофитной. Возможен переход одной формы в другую, а у больных актиномикозом чаще всего выделяют обе формы гриба.
Экзогенная теория заражения утратила к настоящему времени доминирующее признание. В развитии актиномикоза у человека основное значение придается эндогенному способу заражения, так как патогенные штаммы возбудителя часто обнаруживаются у здоровых людей в полости рта, желудочно-кишечном тракте, верхних дыхательных путях и т. д. Инкубационный период актиномикоза точно не установлен. Экспериментальные исследования и отдельные клинические наблюдения показывают, что он колеблется в очень широких пределах — от 1—3 нед до нескольких лет.
Внедрение актиномицета в ткани и развитие типичного патологического процесса возможны лишь при травме, в том числе и в определен
ных условиях. Твердо установлена роль неспецифической микрофлоры, которая, вызывая нагноительный процесс, как бы создает «почву» для развития специфического процесса. Изредка возможно развитие актиномикоза и без участия неспецифической микрофлоры. Несомненно также, что течение заболевания и характер патологических изменений определяются, наряду с биологическими свойствами возбудителя, местными и общими защитными реакциями организма.
Актиномикозом могут поражаться почти все органы и ткани. Поражение легких встречается в 15—33 % по отношению ко всем формам актиномикоза. Обычно патологический процесс в легких является вторичным вследствие распространения его через клетчатку средостения при первичной локализации на шее в забрюшинном пространстве, через диафрагму из брюшной полости, а также гематогенным или лимфогенным путем, причем очаги первичного поражения часто остаются скрытыми и не выявляются при клиническом, а иногда даже и патологоанатомическом исследовании.
Характерной особенностью актиномикоза является способность гриба поражать прежде всего соединительную ткань. Развивающиеся при этом изменения имеют много общего с теми, которые наблюдаются при туберкулезе, что рассматривается как одно из доказательств биологической близости возбудителей этих заболеваний. Однако, в отличие от туберкулеза, при актиномикозе более выражена тенденция к распространению патологического процесса на соседние ткани и органы контактным путем. На месте внедрения гриба развивается специфическая гранулема — узелок, состоящий из грануляционной ткани с круглыми эпителиоидными клетками, участком гнойного расплавления и друзами актиномицета в центре. Периферические отделы гранулемы образованы рубцующейся грануляционной тканью разной степени зрелости. Для актиномикоза довольно типично появление в очагах поражения клеток соединительной ткани, имеющих мелкие липоидные включения,— так называемых ксантом-ных клеток. Если количество клеток становится значительным, то пораженные ткани приобретают желтую окраску, что дает возможность определить природу заболевания по внешнему
255
виду измененных тканей даже без их гистологического исследования. Обычно преобладают пролиферативные процессы, а очаги распада имеют небольшие размеры. Значительно реже более выражены экссудативные явления и распад, что сопровождается образованием крупных гнойников.
Возможны регрессии и спонтанное исчезновение специфических актиномикотических гранулем. В таких случаях друзы гриба им-прегнируются солями кальция или отделяются через свищи с гноем, а полость заполняется рубцовой тканью. Наряду с изменениямй в легких, имеющими характер специфической бронхопневмонии, часто возникает серозно-фибринозный или гнойный плеврит, а позднее образуются очень прочные, толстые шварты. При переходе процесса на грудную стенку формируются множественные свищи и натечные абсцессы. При гематогенном поражении легкого образуется множество мелких очагов, наряду с наличием крупных узлов и гнойников. Почти постоянное участие в патологическом процессе неспецифической инфекции объясняет наблюдаемый иногда выраженный вторичный распад пораженных тканей и гангренозный характер изменений. В зависимости от механизма развития актиномикоза и особенностей течения заболевания следует различать: 1) стадию актиномикотического бронхита, 2) начальную форму легочного или легочно-плеврального актиномикоза, 3) распространенную, инфильтративно-пневмоническую форму и, наконец, 4) форму, протекающую с метастазами в другие органы и ткани.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
И ДИАГНОСТИКА
Бронхиальная форма легочного актиномикоза, или, как ее иногда называют, поверхностный актиномикоз, рассматривается и как самостоятельная форма, и как стадия в развитии заболевания.
Клинические и рентгенологические симптомы в таких случаях не отличаются от обычного бронхита. Есть указания, что при этом отмечается наклонность к кровохарканьям и развитию воспалительного стеноза бронхов. Диагноз устанавливается лишь на основании длительного многократного обнаружения патогенных грибов в мокроте.
Начальная форма легочного актиномикоза крайне редко является следствием аэрогенного заражения. При этом обычно в легком выявляется образование, напоминающее по рентгенологической картине опухоль легкого. Чаще всего начальная форма развивается вследствие распространения процесса из брюшной
полости или забрюшинной клетчатки. Заболевание начинается постепенно. Появляются общее недомогание, субфебрильная температура тела, боли в пораженной половине грудной клетки, постепенно разрастающие и достигающие значительной интенсивности. При рентгенологическом исследовании выявляется облитерация реберно-диафрагмального синуса. Обычно в это время заболевание расценивается как плеврит или туберкулез. Картина становится более ясной при появлении воспалительного инфильтрата в мягких тканях грудной стенки, в особенности после формирования свищей. Иногда диагноз облегчает обнаружение патогенных форм гриба в пунктате из плевральной полости.
Клинические и рентгенологические проявления распространенной инфильтративно-пневмонической фор-м ы легочного/ актиномикоза во многом определяются сопутствующей неспецифической инфекцией. Заболевание начинается обычно постепенно, с появлением общего недомогания, похудания, субфебрильной температуры тела, болями в грудной клетке. При распространении процесса на париетальную плевру боли становятся особенно интенсивными. При рентгенологическом исследовании выявляется более или менее распространенный инфильтрат в легком, локализация которого в известной мере позволяет судить о первичной локализации очага, из которого процесс распространился на легкое.
В ряде случаев актиномикоз с самого начала протекает по типу хронической интерстициальной пневмонии. Наступают резкое выраженный склероз легочной паренхимы и деформация бронхиального дерева, развиваются вторичные бронхоэктазии, не достигающие, однако, очень значительной степени.
Такие больные предъявляют жалобы на кашель с небольшим количеством мокроты и частым кровохарканьем, иногда бывают легочные кровотечения.
При рентгенологическом исследовании определяется грубосетчатый рисунок легочной стромы, на фоне которого могут выявляться множественные мелкие очаги деструкции, окруженные зоной инфильтрации. Довольно типичны плевродиафрагмальные сращения в случаях вторичного поражения трансдиафрагмальным путем или парамедиастинальные шварты при распространении процесса из средостения. В случаях аэрогенного заражения поражаются периферические отделы легкого.
При преобладании экссудативного процесса с распадом ткани и образованием гнойника в легком клиническая и рентгенологическая картина не отличается от обычного абсцесса
256
легкого, и лишь микологические исследования мокроты позволяют распознать природу заболевания в ранние сроки. И в этих случаях нельзя исключить, что актиномицет является, либо вторичной инфекцией, осложнившей обычный абсцесс, либо сапрофитом, не оказывающим влияния на течение процесса.
Поражение легких специфическим процессом может быть вторичным, когда наиболее выражены клинико-рентгенологические проявления актиномикоза органов средостения (медиастинальной клетчатки, перикарда, пищевода) . В ряде случаев на первый план выступают признаки сдавления органов средостения. В этих случаях при рентгенологическом исследовании обнаруживаются расширение тени средостения и инфильтративные изменения в легких. Диагноз облегчается при выявлении очага первичного поражения на лице, шее или в брюшной полости, а также при наличии типичных свищей.
Актиномикоз легких может быть как вторично-метастатического характера, так и сопровождаться гематогенным и лимфогенным метастазированием в другие органы и ткани. Метаста-статические поражения легких при актиномикозе характеризуются инкапсуляцией, четкой очерченностью очага, изредка с мелкопятнистым обсеменением обоих легких. Нередко наблюдается перифокальное воспаление вокруг гематогенно развившихся очагов.
Обычно поражение легких сопровождается выраженным воспалительным процессом в плевральной полости с образованием грубых шварт. Тем не менее наблюдается прорыв актиномикотического очага в свободную плевральную полость с развитием типичного пневмоторакса или эмпиемы.
При далеко зашедшем процессе, распространившемся на грудную стенку, диагностика облегчается характерными рентгенологическими симптомами поражения скелета (декальцинация и остеопороз, иногда изменения позвоночника, для которых характерно отсутствие секвестров и деформации тел позвонков). Патологический процесс в этих случаях никогда не распространяется на межпозвоночные диски.
Следует отметить, что распознавание актиномикоза на ранних стадиях развития заболевания представляет большие трудности. Диагноз обычно ставится методом исключения и до подтверждения специальными исследованиями остается лишь предположительным.
Наибольшие трудности возникают в дифференциальной диагностике с туберкулезом легких, опухолями и неспецифическим нагноитель-ными процессами. Однако, в отличие от туберкулеза легких, в мокроте при актиномикозе почти никогда не бывает эластических волокон.
Не следует переоценивать данные лабораторного исследования. Отсутствие в мокроте выявляемых при бактериоскопии друз и мицелия гриба, а также отрицательные результаты посевов могут быть обусловлены дегенеративными изменениями мицелия гриба в тканях. Наряду с этим грибковая флора может обнаруживаться вследствие попадания ее из полости рта. Кроме того, в ряде случаев она может находиться в очагах нагноения как сапрофит. Наконец, лабораторные данные следует считать достаточно достоверными лишь в тех случаях, когда они получены в учреждениях, имеющих специальную квалификацию и опыт в проведении таких исследований.
Диагностика облегчается нахождением в мокроте типичных для актиномикоза ксантомных клеток. Получение анаэробной культуры при посеве, в особенности если в ней выражены явления лизиса,— весьма ценное доказательство ее патогенной природы. Выделение же нелизи-рующихся спороносных анаэробных культур имеет диагностическую ценность лишь при многократном их обнаружении.
В ряде случаев правильный диагноз может быть поставлен на основании данных, полученных при пункционной биопсии легкого.
ЛЕЧЕНИЕ
До недавнего времени прогноз при легочном актиномикозе был крайне неблагоприятным и смертность достигала 90—95 %. В настоящее время большинство больных актиномикозом легких стойко излечиваются даже при тяжелых, запущенных формах. Успехи в лечении актиномикоза достигнуты благодаря применению антибиотиков и сульфаниламидных препаратов. Наилучшие результаты достигаются при инфильтративных, очаговых или диссеминированных поражениях. Лечебный эффект объясняется как подавлением неспецифической гнойной микрофлоры, так и прямым воздействием антибиотиков на актиномицеты.
Учитывая биологическую близость актиномицета к микобактериям туберкулеза, рекомендуют применять специфическую антибактериальную терапию фтивазидом в течение 1—3 мес, лучше в комплексе с антибиотиками. Иммунотерапия при легочном актиномикозе, проводимая актинолизатом, малоэффективна. Акти-нолизотерапию целесообразно применять и после клинического излечения, чтобы предупредить рецидив заболевания.
Независимо от метода лечения огромное значение имеет общеукрепляющая терапия — полноценное, богатое витаминами питание. Велика роль систематических переливаний крови или эритроцитной массы, позволяющих ликвиди
17 Зак. 0517
257
ровать анемию и истощение, стимулировать иммунобиологические защитные реакции.
Оперативные методы лечения этого заболевания сейчас занимают скромное место. Изредка приходится прибегать к вскрытию и дренированию изолированных гнойников, в частности при актиномикозе, осложненном эмпиемой плевры или пиопневмотораксом. При ограниченных поражениях операция обычно производится в случаях, когда ошибочно диагностируются хронический нагноительный процесс или опухоль легкого, а природа патологического процесса выясняется после изучения препарата. У таких больных после операции необходима энергичная антибактериальная терапия для профилактики рецидива.
КАНДИДОЗ
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Кандидоз легких вызывается дрожжеподобными грибами рода Candida. В виде первичного заболевания он встречается, как правило, при различных иммунодефицитных состояниях, а также на фоне лечения больных антибиотиками, глюкокортикостероидами, антиметаболитами и цитостатиками. Однако в большинстве случаев кандидоз легких является вторичным и возникает как осложнение имеющегося патологического процесса в этом органе. В том и другом случае кандидоз легких может протекать остро и носить затяжной характер.
Первичный кандидоз легких локализуется в нижних и средней долях легких, однако процесс может распространяться и на верхние доли. При остром кандидозе легких, который развивается вслед за поражением бронхов и распространением процесса по протяжению или гематогенно, в патологических очагах, в альвеолах образуется лейкоцитарный экссудат с примесью фибрина или наблюдаются фибринозно-некротические изменения.
Морфологические изменения при затяжном кандидозе разделяют на три стадии: при I стадии в центре пораженного участка легкого обнаруживают лейкоциты, окруженные эпителиоидными, плазматическими и единичными гигантскими клетками; для II стадии характерно разрастание грануляционной ткани в очагах поражения; в III стадии превалируют фиброзные изменения.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
Клинически кандидоз легких может протекать в легкой и тяжелой формах. Тяжесть течения зависит от распространенности деструктивных изменений в легких. В начальной стадии
болезни и в легко протекающих случаях кандидоз легких напоминает бронхит (бронхомикоз). Отмечаются сухие хрипы, мучительный кашель со скудной, сероватого цвета мокротой, иногда имеющей запах дрожжей. Больные жалуются на слабость, недомогание, понижение работоспособности, головную боль. Температура тела, как правило, нормальная. Однако в ряде случаев заболевание начинается внезапно с подъема температуры до высоких цифр. Затем появляется кашель, обычно сухой, «царапающий», сопровождающийся болями в груди. Рентгенологически при этом определяется небольшое усиление легочного рисунка.
В поздние стадии и при тяжелом течении кандидоз легких проявляется очаговой или лобарной пневмонией. Общее состояние больных обычно тяжелое, наблюдается высокая или умеренно повышенная температура тела, почти всегда постоянный кашель, сопровождающийся отделением обильной мокроты, кровохарканьем и часто болями в груди. В затяжных случаях кандидоза пневмония осложняется плевритом с соответствующей симптоматикой.
Рентгенография при затяжном течении процесса выявляет неясную пятнистость, небольшие пневмонические очаги и ателектазы. Более крупные очаги локализуются, как правило, в нижних долях легких. Нередко при кандидо-пневмОнии рентгенологически определяются милиарные затенения («снеговые хлопья»), тяжистые тени от очагов затенения к бронхолегочным (корневым) лимфатическим узлам, нередки случаи распада инфильтратов с образованием единичных крупных или множественных мелких полостей. В этом случае рентгенологическая картина напоминает кавернозный туберкулез легких. Однако для нее характерны быстрое возникновение тонкостенных полостей, увеличивающихся в размерах, и сравнительно быстрая их регрессия вплоть до полного исчезновения под влиянием противомикотической терапии. Рентгенологические данные о распаде легочной ткани, связанные с действием самого гриба, должны всегда подкрепляться исследованием всего «микробного пейзажа», так как распад может быть обусловлен другими микроорганизмами, ассоциирующимися с грибом.
Изменение картины крови при кандидозе может отсутствовать. В тяжелых случаях выявляются лейкопения, базофилия, эозинофилия, нейтрофилез, лимфопения с моноцитозом, увеличение СОЭ.
При вторичном кандидозе легких, несмотря на терапию основного заболевания, изменения в легких прогрессируют, температура тела становится гектической, возникает озноб, ночные поты, общее состояние больных резко ухудшается.
258
Для постановки диагноза кандидоза недостаточно одних клинических симптомов. Необходимы микроскопические, культуральные и серологические исследования.
ЛЕЧЕНИЕ
Лечение кандидоза легких проводят амфо-глюкамином, микогептином, нистатином. При тяжелом течении применяют натриевую соль леворина и амфоглюкамина в виде ингаляций. В ряде случаев применяется хирургическое лечение.
АСПЕРГИЛЛЕЗ
Аспергиллез легких — наиболее частая висцеральная форма аспергиллеза. Заражение происходит при вдыхании спор грибка. Первичный аспергиллез легких встречается редко, вторичный развивается у ослабленных больных на фоне других легочных болезней (туберкулез и рак легкого, бронхоэктазии и т. д.), а также при длительном лечении антибиотиками, глюкокортикостероидами, цитостатиками.
Первичный острый бронхолегочный аспергиллез может протекать по типу тяжелой пневмонии, бронхита. На легочную ткань процесс переходит вследствие радиарного роста концевых отделов мицелия гриба, который проникает через стенки бронхов, межальвеолярные перегородки, стенки капилляров, артерий и вен. В участках секвестрации аспергиллезной пневмонии иногда формируется аспергиллома легкого, которая представляет собой шарообразное распространение гриба (Fungus boll) с последующим образованием полости. Внедрение мицелия в стенку полости, сопровождающееся фиброзно-гнойной экссудацией, обозначается как инвазивная аспергиллома.
В начале заболевания наблюдаются сухой, мучительный кашель, одышка, озноб и лихорадка. В дальнейшем присоединяется кровохарканье, нарастают слабость, астения, анорексия. Над поверхностью легких выслушиваются множественные разнокалиберные хрипы. Рентгенологически определяются участки инфильтрации легочной ткани, склонные к распаду с образованием полостей, увеличиваются бронхолегочные лимфатические узлы.
При отсутствии лечения заболевание принимает хроническое течение с ремиссиями и обострениями. Постепенно увеличивается количество мокроты, которая становится кровянистогнойной. Периоды обострения сопровождаются гектической лихорадкой, ознобом, ночными потами, похуданием. Перкуторно определяют коробочный звук и его притупление при суб
плевральном расположении очага поражения, аускультативно — сухие и влажные хрипы.
При вторичном аспергиллезе легких довольно часто (в 70 % случаев) развивается аспергиллома, которая формируется в санированных туберкулезных кавернах, бронхоэктазиях, полостях, образовавшихся после абсцессов, гангрены легких, вскрывшейся эхинококковой кисты.
Аспергиллома представляет собой полость, сообщающуюся с просветом бронха и содержащую плотные сплетения нитей гриба в виде тяжей серого цвета и грануляционную ткань, легко кровоточащую при перемещении.
Заболевание проявляется постепенным нарастанием слабости, понижением аппетита, неправильной лихорадкой, ознобом и повышенной потливостью. Характерный признак — приступообразный кашель с отделением обильной мокроты без запаха, содержащей зеленоватосерые хлопья (скопления мицелия гриба) и прожилки крови. Могут возникать повторное кровохарканье, иногда значительное, боли в груди, одышка. При отсутствии бронхолегочного дренажа характерные симптомы не наблюдаются.
Физикальное обследование больного выявляет признаки имеющейся в легком полости.
Рентгенологически вначале определяется утолщение стенок полости, затем секвестроподобное затенение, окруженное серповидным просветлением («нимб», «ореол», «полумесяц»), которое может смещаться при перемещении тела больного (симптом «погремушки») или всплывать при заполнении полости рентгенконтрастным веществом (симптом «поплавка») .
Аспергиллез легких может протекать с поражением плевры. Иногда разросшийся мицелий гриба выполняет плевральную полость. В других случаях развивается выпотной плеврит.
При постоянном вдыхании спор гриба может наблюдаться аспергиллезный аллергический альвеолит.
Для лечения аспергиллеза легких применяют амфотерицин В, препараты йода в постоянно возрастающих дозах, нистатин, леворин в виде ингаляций.
При локализованных формах бронхолегочного аспергиллеза общепризнанным является оперативное удаление очагов деструкции в виде клиновидной резекции, сегментэктомий, лобэктомий или пневмонэктомии в случаях обширных поражений. Непосредственные результаты таких вмешательств многими авторами оцениваются как хорошие, несмотря на довольно частые осложнения в виде бронхиальных свищей, эмпиемы плевры, кровотечений. Что касается отдаленных результатов, то данные литературы очень немногочисленны. А. X. Керимов и А. Ф. Мали-
17 *
259
невский (1985) обследовали 17 больных в сроки от 1 года до 10 лет после оперативного вмешательства по поводу первичного аспергиллезного поражения легких. У всех обследованных в указанные сроки были обнаружены различные осложнения или рецидивы заболевания: аспер-гиллезная мицетома с наличием бронхиального свища в области бывшей операции (3), хронический бронхит (10), поликистоз на фоне диффузных изменений оставшейся части легкого (3). Один больной умер от легочного кровотечения через 6 лет после операции.
Авторы отмечают, что у 10 больных в мокроте и смывах из просвета бронхов обнаружены Aspergillus fumigatus, а у 6 — ассоциации Aspergillus niger, Mucor и Candida albicans. Следовательно, оперативное вмешательство позволило устранить очаги деструкции, но не предотвратило обсеменения грибами оставшихся участков легкого. Поэтому больные, подвергающиеся оперативному лечению по поводу аспергиллезных поражений легких, в дальнейшем должны не менее 3 лет находиться под диспансерным наблюдением, включающим повторные клиникорентгенологические и микологические обследования, а также консервативную терапию анти-фунгальными препаратами.
ГИСТОПЛАЗМОЗ
Г истоплазмоз (ретикулоэндотелиальный цитоплазмоз, болезнь Дарлинга) — глубокий микоз, протекающий в виде ограниченного процесса или генерализованного заболевания. Первично поражаются клетки ретикулоэндотелиальной системы органов и тканей.
Гистоплазмоз легких может быть первичным, связанным с вдыханием спор гриба, и вторичным — в результате лимфогематогенного распространения гриба из других органов.
Исследование резецированных легких позволило изучить динамику ранних гистопатологических изменений при гистоплазмозе. Очаги поражения в легких чаще бывают двусторонними, расположенными в нижних долях.
В настоящее время выделяют особую форму гистоплазмоза легких — гистоплазмому,
которая может быть удалена при резекции части или доли легкого.
Макроскопически гистоплазмома представляет собой шаровидный плотный очаг, обычно расположенный под висцеральной плеврой. Размеры этого опухолевидного очага варьируют от 0,5 до 3,5 см в диаметре, плотной, упругой консистенции. На разрезе ткань очага слоистая, она четко отграничена от почти неизменной легочной паренхимы. Центральная часть гистоплазмомы мягковатая, зернистая, иногда с наличием творожистых масс.
Микроскопически гистоплазмома по периферии окружена плотной коллагеновой тканью, в которой обнаруживаются отдельные фиброциты. Ближе к центру располагается тонкий слой из эпителоидных клеток. Внутри него имеется широкая капсула из коллагеновых волокон, которая окружает некротические массы с отложением солей извести. В некоторых гисто-плазмомах среди казеозных масс выявляется сохранившийся альвеолярный каркас. Гистологически диагностика гистоплазмомы бывает достоверной только при обнаружении дрожжевых клеток гриба в центральной части очага.
Первичный гистоплазмозный комплекс является источником лимфогематогенной диссе-минации.
ЛЕЧЕНИЕ
Этиотропная терапия гистоплазмоза легких состоит в применении сульфаниламидных препаратов (норсульфазол 4—6 г в сутки), нистатина (4—6 млн ЕД в сутки), амфотерицина Б (1,0—1,5 мг на 1 кг массы тела в сутки) и его дериватов (амфоглюкамин по 200—500 тыс. ЕД 2 раза в сутки, микогепин — по 280 мг 2 раза в сутки). В качестве общеукрепляющей терапии показаны гемотрансфузии, введение плазмы крови, донорского гамма-глобулина. Оперативное лечение может оказаться необходимым при непреодолимых трудностях этиологического диагноза в случаях гистоплазмомы, рентгенологическая картина при которой трудноотличима от таковой при раке легкого, а также при стойком или рецидивирующем синдроме средней доли, вызванным гистоплазмозным лимфаденитом.
Глава ± ПАРАЗИТАРНЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
ЭХИНОККОКОЗ ЛЕГКИХ
Однокамерный или гидатидозный эхинококк — объект хирургического лечения при развитии его в легких человека — является личиночной стадией развития червя Echinococcus granulosus. Поражение им внутренних органов человека носит название эхинококкоза.
Эхинококкоз относят к одной из тяжелейших форм антропозоонозов. Он распространен в Южной Америке, Австралии, Турции, Албании, а в нашей стране — в республиках с преимущественно сухим и жарким климатом, где интенсивно развито скотоводство: в Молдавии, Азербайджане, Киргизии и др. [Цыбырнэ К. А. и др., 1979; Манафов С. С., 1974; Ахунбаева Н. И., 1972].
Легкие стоят на втором месте после печени по частоте поражения эхинококком, и легочный эхинококкоз встречается от 6 до 35 % по отношению к другим локализациям этого паразита. Наряду с множественным поражением эхинококковыми пузырями одного легкого, встречаются и двусторонние формы заболевания, а также с одновременным поражением других органов, чаще всего — печени [Вахидов В. В., Исламбеков Э. С., 1972].
Паразит существует в двух формах — ленточной и личиночной. В ленточной форме он обитает в кишечнике собак, волков, шакалов, лисиц и других хищных млекопитающих, являющихся для глиста окончательным хозяином. Личиночная (гидатидозная) форма гельминта паразитирует во внутренних органах и тканях более чем у 60 видов млекопитающих (крупный и мелкий рогатый скот, свиньи, олени, обезьяны и др.), а также в организме человека, являющегося для него промежуточным хозяином. Известны два цикла развития эхинококка. Полный жизненный цикл совершается со сменой двух хозяев: промежуточного и окончательного.
Неполный (бесполый) цикл развития паразита происходит только в органах промежуточ
ного хозяина в результате загрязнения органов и тканей носителя зародышевыми элементами эхинококка.
Пути загрязнения внешней среды — с каловыми массами больного животного. Обладая способностью к самостоятельному передвижению, зародыш — онкосфера — забирается на стебельки растений или располагается в шерсти животного и благодаря выделяемому клейкому веществу прочно прикрепляется. Заражение травоядных животных происходит на пастбищах.
Проникновение онкосфер в организм человека возможно двумя основными путями: при употреблении в пищу зараженных яйцами паразита овощей, фруктов, воды или путем переноса яиц паразита с шерсти зараженных эхинококком собак при несоблюдении правил личной гигиены.
Доказана также возможность непосредственного попадания онкосфер в дыхательные пути с вдыхаемой зараженной пылью [Потапов В. Г., 1938; Ганжулевич Т. Ф., 1947]. При благоприятных условиях — достаточной влаге и оптимальной температуре — в яйцах паразита происходит рост зародыша. Это создает повышенное внутри скорлупы давление. Она разрушается, и шестикрючный зародыш выходит наружу [Скрипниченко Д. Ф., Цыбырнэ К. А., 1959]. Онкосферы, лишенные оболочки, обладают подвижностью и при помощи трех пар крючьев проникают в толщу слизистой оболочки верхних отделов тонкой кишки. Внедрившись в кровеносные капилляры через систему воротной вены, они проникают в печень, легкие и разносятся по всему организму. Застряв в капиллярах органа, онкосферы проникают в окружающую ткань, где продолжают развитие в форме гидратидозного эхинококка.
Взрослый, сформировавшийся эхинококковый пузырь имеет вид кисты, окруженной фиброзной капсулой (капсула носителя), которая образуется в результате постоянного давления растущим паразитом и реактивных изменений в окружающих тканях легкого. Оболочка самого паразита состоит из двух слоев — внутреннего, или зародышевого (герминативного), и наружного, или хитинового (кутикулярного); фиброзная капсула не имеет прочной связи с хитиновой оболочкой. От последней она отде
261
лена щелевидным перипаразитарным пространством, заполненным тканевой жидкостью. Через фиброзную оболочку происходит обмен веществ между организмом человека и паразитом. Рост эхинококка связан с герминативной оболочкой. Ее клетки имеют беспредельную способность к размножению и образуют выводковые капсулы и сколексы. Последние, попав в кровеносные капилляры (при нарушении целости материнской кисты), свободно проходят через их стенки и, внедрившись в окружающие ткани, развиваются в виде пузыря. Этот путь распространения паразита называют вторичным, или метастатическим.
Полость эхинококковой кисты наполнена питательной жидкостью, в которой плавают дочерние пузыри, выводковые капсулы и сколексы. Встречаются и бесполые формы эхинококковых кист, не содержащие зародышевых элементов.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
Симптоматика и течение заболевания при эхинококкозе зависят от стадии развития, изменений в паразитарной кисте и характера расстройств в легком и организме больного. В клинической картине неосложненного эхинококкоза легкого нет ни единого патогномоничного симптома, основываясь на котором можно было бы установить достоверный диагноз [Мана-фов С. С., 1974]. Вопрос о сроках появления основных клинических признаков для диагностики болезни до последнего времени остается не уточненным. По мнению В. С. Гамова (1960), Н. И. Ахунбаевой (1972), своеобразием патогенеза заболевания при развитии эхинококка в легком является то, что рост паразита происходит здесь гораздо быстрее, чем в печени и других органах. Это обусловлено более высокой податливостью и эластичностью паренхимы легкого, вследствие чего при своем росте эхинококковый пузырь встречает относительно небольшое сопротивление.
Изучение патологических изменений в организме больных эхинококкозом легких, своеобразия клинического течения и особенностей хирургического лечения позволяет выделять 4 стадии заболевания [Ахунбаева Н. И., 1972]:
1. Латентная стадия, которая может продолжаться до 5 лет. В этой стадии развития паразит не причиняет заметных расстройств, которые могли бы проявляться какими-либо клиническими признаками, свидетельствующими о наличии эхинококкового паразита в легком.
2. Стадия начала клинических проявлений. Клинические признаки возникают как следствие прогрессирующего роста эхинококковой кисты, механического давления ее на ткань легкого: альвеолы, бронхи, висцераль
ную плевру. Чаще всего одним из первых симптомов бывают боли в груди различной интенсивности и характера, напоминающие межреберную невралгию или вызывающие чувство необъяснимой «тяжести в груди». Спустя непродолжительное время к этим ощущениям присоединяется кашель, чаще всего сухой или с небольшим количеством мокроты слизистого вида. Деструкция тканей в зоне формирования фиброзной капсулы паразита может сопровождаться нарушением целости капилляров, мелких кровеносных сосудов. Тогда в отделяемой мокроте можно отметить прожилки измененной и свежей крови. В этот период развития болезни возможно появление общих расстройств в виде недомогания, слабости, потливости, периодического повышения температуры тела до субфебрильных цифр, изредка — аллергической крапивницы.
Обследование, проведенное в период начальных клинических проявлений эхинококкоза легких, может выявить патологические изменения лишь при значительных размерах эхинококковой кисты, обычно при периферическом ее расположении. При этом в зоне локализации паразита можно отметить укорочение перкуторного звука и ослабленное дыхание, а при воспалительном процессе в легочной паренхиме — крепитирующие и влажные мелкопузырчатые хрипы. У детей и больных молодого возраста иногда появляется асимметрия — выпячивание отдельных участков грудной стенки. Межреберные промежутки на стороне пораженного легкого несколько сглаживаются, и эта половина груди отстает в акте дыхания. При выслушивании над зоной «выпячивания» слышен шум трения плевры. Гораздо реже могут появиться признаки, характеризующие смещение органов средостения в здоровую сторону.
3. Стадия развитых клинических проявлений. Этот период характеризуется дальнейшим нарастанием клинических расстройств: усилением болей в груди, более постоянным кашлем, часто с отделением крови. Возникает и прогрессивно нарастает одышка, более выраженными становятся гемодинамические расстройства, обусловленные сдавлением и смещением органов средостения. Многое определяется при этом локализацией паразита в том или ином участке легкого.
4. Стадия возникновения осложнений. Возникновение различных осложнений, к которым почти неотвратимо приводят прогрессирующее развитие эхинококковой кисты в легком, характеризуется тяжелым течением заболевания и наиболее выраженными его клиническими проявлениями.
Наиболее частыми из этих осложнений являются прорыв и опорожнение эхинококковой
262
кисты в бронх. Как правило, в бронх прорываются центрально расположенные кисты и значительно реже — из периферических отделов легкого. Прорыв эхинококковой кисты сопровождается отхождением с кашлем значительного количества прозрачной жидкости. В ней могут содержаться элементы хитиновой оболочки паразита, иногда — дочерние кисты. Если прорыву предшествовало нагноение кисты, то отделяемая жидкость может быть гнойной, зловонной. Нарушение фиброзной капсулы приводит к появлению в жидкости небольшого количества крови.
Опорожнение большой эхинококовой кисты, значительные размеры соустья ее с просветом бронхиального дерева могут вызвать быстрое и одномоментное поступление большого количества жидкости с явлениями тяжелой асфиксии. Возможно и постепенное опорожнение в бронх содержимого эхинококковой кисты через небольшое отверстие. Тогда это происходит почти незаметно для больного, лишь увеличивается количество отделяемой мокроты.
У части больных всасывание эхинококковой жидкости из просвета дыхательных путей сопровождается появлением аллергических реакций — крапивницы.
С момента сообщения эхинококковой кисты с просветом дыхательных путей данные, получаемые при физикальном обследовании больных, становятся более многочисленными и многообразными. Это объясняется тем, что прорыв эхинококкового пузыря в бронх сопровождается периодом воспаления легкого вокруг кисты, формированием участков гиповентиляции, иногда — ателектазом сегмента или доли в результате закрытия дренирующего бронха кусочком хитиновой оболочки. Кровохарканье может достигать интенсивности легочного кровотечения [Ахунбаева Н. И., 1972].
Самостоятельное заживление полости в легком после вскрытия эхинококковой кисты в бронх и самоизлечение наступают редко. По данным В. С. Гамова (1960), подобный исход отмечен не более чем у 1 /5 части больных. Обычно в сформировавшейся полости развивается нагноительный процесс. Тогда последующее течение заболевания, клиническая и рентгенологическая симптоматика приобретают черты абсцесса легкого.
При нарушении целости эхинококкового паразита всегда следует иметь в виду возможность бронхогенной диссеми нации сколексов с развитием множественных эхинококковых пузырей в других отделах легких, а при их проникновении в кровеносное русло — выход процесса за пределы грудной полости.
Прорыв в плевральную полость относится к более редким осложнениям течения эхино
коккоза легких. Однако клинические проявления при этом характеризуются значительной тяжестью. Это обусловлено коллабированием легкого, нарастающей дыхательной недостаточностью, которая при одновременном сообщении кисты с просветом дыхательных путей нарастает. Тогда появляется симптоматика, характерная для пневмоторакса, часто — напряженного. Быстрая резорбция эхинококковой жидкости плевральными листками может привести к тяжелому анафилактическому шоку. Опорожнение в плевральную полость нагноившейся эхинококковой кисты усугубляет течение болезни клиническими проявлениями, характерными для тяжелого пиопневмоторакса.
В числе нередких осложнений эхинококкоза легких отмечают гибель паразита, его разложение и нагноение. Процесс нагноения является следствием попадания гноеродной инфекции гематогенным или бронхогенным путями внутрь хитиновой оболочки и вокруг нее. Клиническая картина нагноения отличается относительной «доброкачественностью», но может протекать по типу блокированного абсцесса легкого.
Множественное поражение одного или обоих легких эхинококковыми кистами наблюдается в 8—22 % случаев. Большое количество кист является результатом одновременного инвази-рования в легкое значительного количества онкосфер — первично-множественный эхинококкоз.
При развитии в одном или обоих легких большого количества эхинококковых кист клинические проявления заболевания выражены ярче, а состояние больных бывает тяжелее. Это объясняется в первую очередь уменьшением дыхательной поверхности легкого, явлениями легочной гипертензии. Ведущими жалобами таких больных являются одышка, кашель, различные проявления гипоксии.
Латентная стадия течения болезни при множественном эхинококкозе легких имеет более короткий период. Паразитарные кисты редко достигают огромных размеров. Прорыв кист при множественном эхинококкозе происходит довольно часто, несмотря на небольшие их размеры. Это объясняется тем, что дыхательная поверхность легкого резко уменьшается в результате развития в нем нескольких кист. Больные вынуждены затрачивать больше усилий для обеспечения нормального газообмена, делать глубокие вдохи. Это приводит к сдавлению кист и вызывает их прорыв. Возможно, для этого имеются и другие, более глубокие изменения взаимосвязи между человеком и паразитом.
При обследовании больных множественным эхинококкозом легких обращает на себя вни-
263
мание то, что данные объективного исследования у них чаще всего не отражают тех выраженных изменений, которые развиваются в легких. Между тем изучение показателей функции внешнего дыхания, гемодинамики почти, во всех случаях множественного эхинококкоза свидетельствует о значительных нарушениях.
Как показали исследования К. А. Цыбырнэ и соавт. (1979), до 50 % больных легочным эхинококкозом имеют одновременное поражение печени. Естественно, патология этого органа вносит дополнительные черты в клиническое течение заболевания, что следует учитывать при решении вопросов диагностики распространенности болезни, выборе лечебной тактики.
ДИАГНОСТИКА
Своеобразие клинических проявлений эхинококкоза легких, особенно в ранних стадиях развития заболевания, дает мало патогномоничных симптомов, которые могут быть выявлены с помощью физикальных приемов обследования.
Это определяет значение и роль рентгенологического исследования для диагностики и решения вопросов лечебной тактики (рис. 115, 116).
Из специальных методов диагностики эхинококкоза легких широкую известность получила кожная аллергическая проба — реакция Кац-цони [Cacconii L., 1912]. Она сводится к внутрикожному введению на предплечье 0,1—0,2 мл эхинококковой жидкости, полученной из паразита, выращенного во внутренних органах экспериментального животного. Для контроля в кожу другого предплечья вводится такое же количество изотонического раствора натрия хлорида. Появление красноты на месте введения антигена в период до 6 ч может свидетельствовать о наличии в организме больного паразита. Ю. А. Волох (1953, 1959), И. Г. Гурбаналиев (1970) считают, что с помощью этой пробы правильный диагноз может быть установлен в 80,5 % наблюдений. Определенное значение имеет постановка этой реакции в эозинофильно-аллергическом варианте: с подсчетом числа эозинофилов в крови больного до и спустя 24 ч после введения антигена. Увеличение их процентного содержания патогномонично для эхинококкоза.
Следует иметь в виду, что проба Каццони может сопровождаться тяжелыми аллергическими реакциями, а также активизацией процесса с прорывом эхинококкового пузыря в бронх.
В последние годы стали отдавать предпочтение методам иммунологической диагностики
эхинококкоза — постановке реакции непрямой микрогемагглютинации. Реакция проводится между эритроцитарным эхинококковым диа-гностикумом (очищенным антигеном из эхинококковой жидкости QT овцы) и СЫВ£фОТ£рЙ больного. Она исключает неблагоприятные ответные реакции в организме больного и, по мнению К. А. Цыбырнэ и соавт. (1979), при положительном результате позволяет поставить точный диагноз эхинококкоза.
ЛЕЧЕНИЕ
В последние годы проводятся интенсивные работы в области изыскания препаратов, действующих на личиночную форму Echinococcus granulosus. Появились отдельные сообщения о возможности консервативного лечения эхинококкоза с помощью препарата вермокса.
Однако, по общему признанию, в настоящее время единственным методом, решающим проблему лечения больных эхинококкозом легких в социальном аспекте, остается хирургический [Милонов О. Б. и др., 1983].
Оперативный метод лечения легочного эхинококкоза должен применяться возможно раньше, как только установлен диагноз. Лишь абсолютные противопоказания, обусловленные тяжестью общего состояния больного при наличии сопутствующих заболеваний, могут быть причиной отказа от операции.
Оптимальной операцией, к выполнению которой следует стремиться во всех случаях, является удаление паразита без вскрытия пузыря. Такое удаление, вылущивание из фиброзной капсулы паразита в хитиновой оболочке, не нарушая ее целости, называют «идеальной эхи-нококкэктомией».
Легочная ткань надсекается в месте наиболее поверхностного залегания кисты, и пузырь тупо вылущивается. Как правило, он легко отслаивается от фиброзной капсулы, для чего удобно использовать тупую ложку (чайную или столовую — в зависимости от размеров паразита), а также периодически создавать повышенное давление газовой смеси в замкнутой системе «наркозный аппарат — легкие». После удаления пузыря полость дважды обрабатывается 5 % раствором формалина в глицерине, дважды 96 % этанолом и промывается антисептическим раствором. Это делается для того, чтобы уничтожить сколексы, которые могут находиться в фиброзной капсуле или попасть в нее из небольших надрывов пузыря, оставшихся незамеченными при его выделении.
Нередко при крупных эхинококковых пузырях удалить их без опорожнения не представляется возможным, так как имеется реальная опасность разрыва капсулы при выделении.
264
Рис. 115. Эхинококковая киста легкого.
а прямая рентгенограмма; б боковая рент!енограмма. Видно обызвест-
Рис. 116. Множественные эхинококковые кисты легких, а прямая рентгенограмма; б боковая рентгенограмма.
вление стенок кисты.
Тогда осуществляется пункция пузыря толстой иглой с краником и аспирация содержимого в замкнутую систему. При этом следует всячески предупредить попадание жидкости из пузыря в плевральную полость, что может привести к развитию тяжелого анафилактического шока вплоть до смертельного исхода и, вследствие попадания сколексов, к возникновению эхинококка плевры. Для предупреждения попа
дания жидкости из пузыря в рану перед пункцией следует дополнительно ограничить этот участок легкого салфетками (сухими или смоченными гипертоническим раствором или раствором какого-либо антисептика). После завершения максимально возможного освобождения кисты паразита от содержимого в нее вводят 5 % раствор формалина в глицерине на срок не менее 5 мин — достаточный для уничтоже
265
ния оставшихся сколексов. После этого рассекается фиброзная капсула и предпринимается попытка удалить опорожненный эхинококковый пузырь. В случае невозможности это сделать — рассекается хитиновая оболочка, полость паразита осушается, он отделяется от фиброзной капсулы и удаляется. Фиброзная капсула дополнительно обрабатывается формалином и спиртом.
При невозможности отделить хитиновую оболочку от фиброзной капсулы паразит удаляется вместе с ней, т. е. выполняется так называемая «радикальная эхинококкэктомия» [Волох Ю. Н., 19651. При этом необходимо тщательно обрабатывать все мелкие сосуды и бронхи, идущие в капсулу. Особенно тщательно следует выделить и обработать бронх, находящийся в наиболее глубоко расположенной части капсулы — в области ее «дна».
Полость, оставшаяся после удаления пузыря, может ликвидироваться самостоятельно, если она небольших размеров. Однако лучше произвести ее облитерацию путем наложения кисетных кетгутовых швов в несколько этажей, начиная с наиболее глубоких отделов. После завязывания они обеспечивают тесное соприкосновение стенок полости.
При значительных по размеру полостях, остающихся после удаления гигантских эхинококковых кист, возможно использование приема, предложенного А. А. Вишневским (1956). Производится частичное иссечение фиброзной капсулы, а затем ее края обшиваются непрерывным кетгутовым швом. После расправления легкого стенка полости, составляющая ее «дно», несколько растягивается, выпрямляется, как бы превращаясь в поверхность легкого, соприкасается с париетальной плеврой, а в дальнейшем — припаивается к ней.
Эти методы оперативных вмешательств обычно применяются либо при закрытых кистах, либо после вскрытия их в бронх, до развития гнойных осложнений.
В последнее время, с появлением новых антибактериальных средств, эхинококкэктомия с ушиванием полости используется и в случаях, осложненных нагноением.
Если органосохраняющая операция невозможна, то выполняются клиновидные резекции, удаление доли или всего легкого [Львов А. Н., 1956].
Хирургические вмешательства по поводу множественного эхинококкоза имеют существенные особенности, но наибольшие трудности возникают при оказании помощи больным с двусторонним поражением.
Одновременное двустороннее оперативное вмешательство по поводу эхинококкоза легких, впервые выполненное в СССР С. Л. Либо-
вым, правомочно. Однако риск его слишком велик. Большая часть хирургов, имеющих опыт лечения эхинококкоза легких [Гамов В. С., 1960; Ахунбаев И. К., 1972, и др.], полагают, что предпочтительнее последовательное удаление паразитов сначала из одного, а затем из другого легкого. Интервал между операциями определяется общим состоянием больных, восстановлением и стабилизацией функциональных показателей систем дыхания и кровообращения. В среднем он составляет I1 /г—2 мес.
Определяя очередность оперативного лечения при двустороннем эхинококкозе, учитывают распространенность поражения. Вначале следует оперировать со стороны наиболее измененного легкого. Тогда больные легче переносят послеоперационный период: основная нагрузка по обеспечению газообмена ложится на наименее пораженное легкое. Затем предпринимается второй этап операции.
АЛЬВЕОКОККОЗ ЛЕГКИХ
Многокамерный эхинококк — личиночная стадия развития другого самостоятельного вида эхинококка — Alveococcus multilocularis. Заболевание, вызываемое им при поражении внутренних органов, называют альвеококкозом.
Альвеококкоз распространен в южных районах ФРГ, Австрии, Швейцарии. В нашей стране — главным образом в районах Сибири, Якутии, Алтая и Дальнего Востока [Брегадзе И. Л., 1961; Коган А. С., 1962; Кузнецов Ю. В., 1966].
Несмотря на то, что альвеолярный эхинококк известен в медицине уже более 125 лет [Virchow R., 1956], лишь относительно недавно — в 60-х годах — был окончательно решен вопрос о самостоятельности этого вида паразита и особенностях его эпидемиологии.
Цикл развития Alveococcus multilocularis во многом повторяет развитие Echinococcus granulosus. При этом постоянным хозяином половозрелой — ленточной — формы паразита являются песцы, лисы, собаки. Промежуточным хозяином, в организме которого происходит формирование личиночной (альвеолярной) стадии паразита, служат мышевидные грызуны. Человек заболевает альвеококкозом при употреблении в пищу ягод, грибов, овощей, зараженных экскрементами больных животных, носителей онкосфер, а также при обработке их шкур.
Активно проникая из кишечника в кровеносную систему, зародыш паразита всегда первично закрепляется в печени, где находит оптимальные условия для дальнейшего роста.
Личиночная стадия альвеолярного эхинококка представляет большое количество мелких
266
круглых пузырьков, расположенных в соединительнотканной капсуле. Оболочка альвеолярного эхинококка чаще всего состоит из одного слоя. На разрезе паразит имеет ячеистое строение. Альвеолы-ячейки достигают 1—5 мм в поперечнике. В них содержится желтоватая или коричневато-желтая студенистая масса. При микроскопическом изучении видно, что альвеолы имеют кутикулярную оболочку, а в их содержимом обнаруживаются выводковые капсулы и сравнительно редко — сколексы и крючья. В личиночной стадии паразит размножается почкованием по типу «неукротимого роста». Дочерних пузырей альвеолярный эхинококк не имеет. Метастатическое распространение может происходить как гематогенным, так и лимфогенным путем, а также по желчным протокам. Метастазы возникают в легких, мозге, почках и других органах.
Изменения в тканях, пораженных альвеокок-ком, по внешнему виду напоминают бластоматозное поражение с очень плотными участками неправильной конфигурации. На разрезе видны очаги некроза, чередующиеся с фиброзными прослойками. Распад тканей сопровождается образованием полостей, которые содержат гноевидную жидкость, детрит, желчные пигменты и т. д., а также мелкие пузырьки альвеококка.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
Альвеолярный эхинококкоз наблюдается почти одинаково часто у мужчин и женщин в возрасте от 20 до 50 лет. В очень редких случаях бывает инвазия в детском возрасте.
Первые признаки заболевания скудны и неопределенны, причем даже при значительном поражении печени боли и общие расстройства могут отсутствовать длительное время.Жалобы сводятся к нерезким болевым ощущениям, чувству тяжести в надчревной области. Непосредственной причиной обращения к врачу обычно является обнаружение самим больным плотной «опухоли» в правом подреберье.
Вследствие медленного развития и многолетнего бессимптомного течения диагностика альвеококкоза трудна. Поражение легкого обычно происходит путем перехода процесса с печени, диафрагмы или заносом метастазов. К этому времени в клинической картине преобладают симптомы, более характерные для поражения органов брюшной полости. Имеются увеличение печени, изменение ее конфигурации. Одним из ранних и сравнительно частых симптомов альвеококкоза является желтуха (по данным И. Д. Даниляк, Ю. А. Волоха — в 85— 90 %), в основе которой лежат поражение печеночной паренхимы и нарушение оттока желчи по внутрипеченочным желчным ходам.
Дифференциальная диагностика альвеокко-за с бластоматозным процессом даже при лапароскопии, а нередко и при лапаротомии представляет большие трудности вследствие своеобразия изменений как в самом паразите, так и близлежащих тканях.
Возможности серологической диагностики с использованием антигена, полученного от однокамерных форм эхинококка (реакция Каццони), по данным В. С. Семенова (1960), не превышает 70—73 %.
Прогноз лечения альвеококкоза, особенно при вторичном поражении легких, неблагоприятен. При невозможности выполнить резекцию из-за обширности распространения паразита в организме используют консервативные методы лечения. Наряду с симптоматическими, с 1958 г. предпринимаются попытки патогенетического воздействия — препаратами тимола. Препарат «тэпаль» (тимоловый эфир пальмитиновой кислоты) вводится внутримышечно по 1 мл через день, 5 инъекций на цикл. Курс лечения включает 5 циклов, проводимых с интервалами от 6 до 14 дней. Установлено, что лечение «тэпалем» снижает паразитарную активность при альвеококкозе.
Г. А. Моргунов (1962) отметил у больных альвеококкозом, не подлежавших оперативному лечению, улучшение под влиянием терапии «тэпалем».
ЦИСТИЦЕРКОЗ ЛЕГКИХ
Поражение внутренних органов человека цистицерками (финнами) — личиночной формой развития свиного (Taenia solium) или бычьего (Taenia saginata) цепней — носит название цистицеркоза.
Широкого распространения заболевание не имеет, но наблюдается всюду, где развито скотоводство. В СССР цистицеркоз встречается в Белоруссии, Западной Украине, на Дальнем Востоке [Коновалова Л. М„ 1964], а также в Армении, Азербайджане, Якутии, Бурят-Монго-лии, Тувинской автономной области [Плотников Н. Н„ 1965].
В стадии половой зрелости цепень паразитирует только в тонкой кишке человека. Свиньи, крупный рогатый скот являются промежуточными хозяевами паразита и заражаются финнозом (цистицерками), поедая корм, загрязненный фекалиями инвазированного цепнем человека.
В организм человека цистицерки попадают при употреблении в пищу сырого или недостаточно термически обработанного финнозного мяса. В просвете тонкой кишки они развиваются в половозрелого ленточного гельминта.
267
Формирование взрослого гельминта происходит в течение 3 мес. В кишечнике человека паразиты могут жить более 10 лет. По мере созревания зрелые членики, располагающиеся в терминальной части глиста, отделяются и пассивно выделяются наружу. Возможно их активное выползание из анального отверстия и перемещение по телу, белью.
За сутки больной выделяет до 28 члеников, а с ними каждый раз до 5 млн. яиц (онкосфер) цестод [Бердыев X. Б., Мухамадиев М. М„ 1983].
При несоблюдении правил личной гигиены, проглатывании с продуктами питания, загрязненными выделениями больного кишечным тениозом или тениаринхозом онкосфер свиного или бычьего цепней, а также проникновения онкосфер из кишечника в желудок ретроградным путем — с рвотными движениями — происходит их освобождение от оболочки. После перехода вместе с содержимым желудка в тонкую кишку онкосферы внедряются в ее стенку и током крови разносятся по всему организму, поражая внутренние органы. Формирующиеся здесь цистицерки приводят к появлению различных клинических расстройств. Цистицеркоз относится к числу тяжелых осложнений тенио-за и тениаринхоза.
Излюбленной локализацией цистицерков являются головной мозг, глаза. Значительное их количество продолжает развитие в подкожной клетчатке, мышцах, в языке, сердце, легких.
Цистицерки, развивающиеся в легких, длительное время не приводят к выраженным клиническим расстройствам. Когда они достигнут размеров 1—2 см, их рост останавливается, происходит гибель паразитов с омелотворением капсулы. Этот признак при проведении рентгенологического обследования позволяет отличить цистицеркоз от эхинококкоза и от развития метастазов опухоли в легких. На рентгенограмме видны множественные, четко очерченные образования до 2 см в поперечнике, многие из которых содержат включения извести.
Одновременное обнаружение цистицерков в глазу при офтальмоскопии, а также клинические проявления поражения центральной нервной системы (эпилептиформный, неопластический, психический, менингеальный симптомо-комплексы) дают возможность установить точный диагноз.
В качестве специальных методов лабораторной диагностики цистицеркоза в клинической практике получили распространение реакция непрямой гемагглютинации и реакция флюоресцирующих антител с антигеном из цистицерков. Разрешающие возможности этих реакций, по данным Л. М. Коноваловой (1964), являются весьма высокими.
В большинстве наблюдений при локализованной форме легочного цистицеркоза как хирургическое, так и терапевтическое лечение не требуется.
Осложнения со стороны других внутренних органов — головного мозга, глаза, развивающиеся при цистицеркозе, являются показанием к выполнению оперативных вмешательств.
Для профилактики осложнений кишечного тениоза цистицеркозом основное значение имеют ранняя диагностика и лечение этого гельминтоза.
ПАРАГОНИМОЗ ЛЕГКИХ
Парагонимоз — заболевание, возникающее при поражении организма человека гельминтом трематодой — легочной двуусткой (Paragoni-mus westermani). Эндемические очаги болезни расположены главным образом на территории Японии, Китая, Кореи, Индии. В СССР парагонимоз встречается среди населения, проживающего в районах Дальнего Востока: в низовье Амура, на Южном побережье Охотского моря.
Цикл развития парагонимуса сложен. Он включает двух промежуточных и окончательного хозяина. Последним чаще всего являются кошки, собаки, свиньи, лисицы, барсуки, выдры, а также человек. Являясь строгим аэрофилом, в теле окончательного хозяина, в том числе и у человека, парагонимус может достичь полного развития только в легких. В других органах вследствие отсутствия доступа кислорода воздуха цикл развития парагонимуса приостанавливается на различных стадиях.
Оплодотворенные яйца паразита, выделяющиеся с мокротой больного животного или человека, для своего дальнейшего развития должны обязательно попасть в воду. Здесь из них при благоприятных температурных условиях через месяц выходят личинки — мирацидии. Ми-рацидии активно внедряются в тело первого промежуточного хозяина — речных моллюсков — и в них проходят несколько фаз развития, превращаясь в церкарии. Церкарии покидают тело моллюсков и свободно плавают в воде, проникая в организм второго промежуточного хозяина — пресноводных крабов или раков. Здесь церкарии превращаются в цисты.
Заражение происходит при употреблении в пищу сырых или недостаточно термически обработанных крабов, раков, а также с питьевой водой.
В организме человека для выхода парагонимуса из цист важное значение имеет сочетанное воздействие температуры тела, влажности и щелочной реакции кишечного содержимого.
268
Под их влиянием происходит активация, выход незрелых форм паразита из цист. Вышедшие в просвет тонкой кишки незрелые парагони-мусы перфорируют ее стенку и проникают в свободную брюшную полость. Обладая способностью к активному передвижению, парагони-мусы мигрируют в забрюшинное пространство, печень, селезенку, заднее средостение. Подавляющее число паразитов проникает в диафрагму и достигает плевральных полостей. Здесь часть парагонимусов может задержаться, а большинство через висцеральную плевру достигает периферических отделов легкого, где и паразитирует, завершив полный цикл развития. Длина зрелого парагонимуса достигает 8—16 мм, ширина — 4—8 мм [Даниленко М. В., 1963].
Сравнительно крупные размеры, которых паразит достигает в организме человека после выхода из цисты, активная миграция на пути к легкому с повреждением кишок, органов брюшной полости, плевральной полости, а также легочной ткани, приводят к возникновению своеобразных морфологических изменений в этих органах.
В тканях по ходу миграции молодых гельминтов образуются паразитарные ходы с некрозом и кровоизлияниями.
С течением времени в легких — на конечном этапе миграции паразита — формируются сообщающиеся с бронхами кисты, «каверны». Иногда эти образования могут быть закрытыми. Диаметр этих образований — 1—6 см и больше; внутри кисты обнаруживается 1—2 гельминта. Одиночные каверны и кисты располагаются обычно в верхней и язычковой долях левого легкого (правое легкое поражается реже), множественные — в нижней.
Микроскопически ранние каверны напоминают геморрагический инфаркт, в центре которого имеется участок расплавления. Зрелые имеют гладкие стенки серо-красного цвета, обычно они располагаются субплеврально. Паразитарные каверны первично возникают в паренхиме легкого и только с течением времени вскрываются в бронх и эпителизируются. Каверны, сообщающиеся с мелкими бронхами, напоминают мешотчатые бронхоэктазии. Стенка каверны имеет зоны некроза, грануляций и инфильтратов. Просвет каверны заполнен казеозной массой серобелого цвета или жидкостью шоколадного, красноватого цвета, иногда слизью, в которой имеется примесь гноя. При благоприятном течении пара-гонимоза каверны и кисты замещаются соединительной тканью. В плевральной полости часто развиваются спайки.
Вокруг яиц гельминта и продуктов их распада в тканях легкого образуются гигантоклеточные гранулемы.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
Несмотря на то, что клиническая картина парагонимоза описана еще в прошлом столетии, современные представления об этом заболевании расширились мало. Наиболее часто встречаются лишь отдельные наблюдения с описанием признаков хронического парагонимоза легких [Постников В. В., 1956].
Детальные представления о морфологических и клинических проявлениях парагонимоза сформировались на основании работ Ю. Д. Бацуро (1958, 1964), М. В. Даниленко (1963), показавших все многообразие симптомов заболевания, обративших внимание нередкими неблагоприятными исходами его течения.
Парагонимозом чаще болеют взрослые люди в возрасте до 45 лет, т. е. наиболее трудоспособная часть населения. Относительно высока заболеваемость и в детском возрасте (более 20 % из всех больных имеют возраст до 16 лет).
Своеобразие патогенеза заболевания, миграции паразита в человеческом организме определяют последовательность появления и развития его клинических симптомов.
Принято выделять 4 основные клинические формы парагонимоза: 1) острую абдоминальную, 2) острую плевролегочную, 3) хроническую легочную, 4) осложненную легочную.
Нередко последовательность развития каждого из периодов развития заболевания может являться основой для распознавания болезни. Однако строго разграничить каждый из периодов парагонимоза не всегда удается ввиду того, что выход генераций паразитов из цист происходит в несколько этапов. Абдоминальные расстройства наслаиваются на плевролегочные.
Клинические проявления абдоминальной фазы парагонимоза включают симптомы, более характерные для энтерита, гепатита. Перитониты парагонимозного происхождения нередки, но они протекают значительно легче, чем бактериальные, так как в большинстве наблюдений являются асептическими.
При проникновении паразитов в плевральную полость возникают клинические признаки острой плевролегочной фазы парагонимоза. При этом симптоматика плеврита мало отличается от парапневмонического.
Клиника острого легочного парагонимоза характеризуется повышением температуры тела, возникновением болей в груди, появлением кашля. Вначале кашель сопровождается отделением небольшого количества слизистой мокроты, которая вскоре становится гнойной, часто содержит примесь измененной и свежей крови. По истечении 3—4 мес такого острого или подострого течения парагонимоз переходит в фазу хронического поражения легкого.
269
К этому времени все паразиты покидают кишечник, достигают внутренних органов — печени, селезенки, средостения (где ввиду отсутствия доступа воздуха прекращают свое развитие) и легких, в которых имеются благоприятные условия для роста паразита.
При хроническом легочном парагонимозе клинические проявления заболевания обусловлены главным образом развитием паразита в паренхиме легкого. Плеврит в этот период встречается сравнительно редко, а если бывает, то имеет слабо выраженные признаки, не сопровождается болями и повышением температуры тела. Как показали исследования Б. Зографски и Г. Тезиева (1957), в происхождении плеврита в этот период, наряду с ответной реакцией плевры на поражение легкого, определенное значение имеет ремиграция пара-гонимусов в плевральную полость.
Течение хронического легочного парагони-моза медленное, с периодами обострения и относительной ремиссии. Прогрессивно ухудшается состояние больных.
Наряду е расстройствами, обусловленными разрушением парагонимусом ткани легкого, определенное значение имеют инфекционноаллергические изменения в организме, явления интоксикации продуктами жизнедеятельности паразитов.
В период обострения повышается температура тела, достигая 38—39 °C. Усиливаются боли в груди, кашель. При этом значительно увеличивается количество отделяемой гнойной мокроты, в ней появляется примесь крови. Кровохарканье — весьма характерный симптом парагонимоза — может достигать значительной интенсивности, переходить в кровотечения, которые нередко обильны и угрожают жизни больных. Наряду с легочными кровотечениями возможно развитие пиопневмоторакса вследствие нарушения целости паразитарной кисты.
В периоды ремиссий температура тела сохраняется на субфебрильных цифрах, может быть нормальной. Больные обычно отмечают тяжесть и подострые боли в груди, кашель с отделением гнойной мокроты.
Инфекционно-аллергические признаки и интоксикация проявляются в виде поражения преимущественно центральной нервной системы и сопровождаются головной болью, головокружениями, рассеянностью, снижением памяти. Астенический синдром включает нарушение сна и аппетита, снижение работоспособности, развитие быстрой утомляемости.
При хроническом парагонимозе легких отмечают также остаточный абдоминальный синдром, выражающийся болями в животе, увеличением и болезненностью печени. Известны эндокринные расстройства — увеличение щитовид
ной железы или ее долей, нарушение менструального цикла у женщин.
Ухудшение состояния, обострения хронического легочного парагонимоза наступают весной и осенью, и их можно считать сезонными. Тяжелые физические нагрузки, прием алкоголя также приводят к декомпенсации состояния больных парагонимозом.
В терминальном периоде заболевания при осложненном легочном парагонимозе имеется метастатическое поражение других органов. Наиболее часто и закономерно в процесс вовлекается головной мозг. Сюда заносятся яйца паразита из легких.
Клиническое течение мозгового парагонимоза тяжелое, сопровождается слепотой, параличами, судорожными приступами с потерей сознания.
ДИАГНОСТИКА
До настоящего времени диагностика парагонимоза легких представляет большие трудности. Важное место при этом отводят учету данных анамнеза, особенностей быта, питания, пребывания на территориях, относимых к эндемическим очагам парагонимоза.
Наряду со своеобразием клинических проявлений в разные периоды заболевания, диагностическую ценность представляет характер экссудата, полученного из плевральной полости: в острой плевролегочной фазе он содержит примесь измененной и свежей крови. В экссудате и мокроте при микроскопическом ее изучении возможно обнаружение парагониму-сов.
Экссудат в фазе хронического течения легочного парагонимоза желтовато-мутноватый. При его центрифугировании в осадке имеются большое количество кристаллов холестерина, капель жира, лейкоциты и эритроциты.
Как показали исследования Ю. Д. Бацура (1962), в мокроте больных хроническим парагонимозом легких закономерно обнаруживаются ромбовидные кристаллы, являющиеся продуктом распада яиц гельминтов. Напоминая по внешнему виду кристаллы Шарко — Лейдена, они отличаются от последних не только тем. что возникают в связи с непосредственным пребыванием половозрелого гельминта в тканях окончательного хозяина при его жизни, но и значительной устойчивостью к воздействию хлороформа, спирта, эфира, бензола, растворов щелочей и кислот. Выявление ромбовидных кристаллов в мокроте считается достоверным признаком парагонимоза, даже при отсутствии яиц гельминта.
Серологические реакции в диагностике парагонимоза еще не нашли широкого практиче
270
ского применения. R. Ando (1916) предложил для этой цели реакцию связывания комплемента. По мнению М. В. Даниленко (1963), внутрикожная проба с антигеном, полученным из легочных двуусток (1:100), может облегчить раннюю диагностику заболевания при массовых обследованиях населения. Реакция ставится и оценивается аналогично реакции Кац-цони.
ЛЕЧЕНИЕ
Большинство больных легочным парагони-мозом может быть излечено консервативными методами.
С наибольшим эффектом лечение больных парагонимозом проводится эндотрахеальным и внутривенным введением гидрохлорида эми-тина с антибиотиками и раствора кальция хлорида. Пятидневные курсы с перерывами в 10 сут повторяются 2—3 раза.
Показанием к оперативному лечению параго-нимоза легких является отсутствие эффекта при использовании консервативных средств, особенно при одностороннем расположении
паразитарной кисты. Частые и тяжелые легочные кровотечения также являются основанием для выполнения резекции легкого.
Формирование больших кист, содержащих значительное количество гноя, угрожающих инфицированием здоровых участков легкого, прорывом в плевральную полость, является показанием к оперативному лечению. Известно, что первая операция при парагонимозе легкого была выполнена L. Amreino (1923) в связи с прорывом большой нагноившейся кисты в плевральную полость.
При выборе объема и характера предпринимаемой резекции легкого всегда руководствуются данными о распространенности процесса. Своеобразие проникновения парагонимуса в легкое — через висцеральную плевру в периферические его отделы с формированием субплевральных полостей — позволяет у большинства больных предпринять экономные операции: удаление сегмента, выполнение краевой резекции.
При значительных изменениях объем вмешательства может быть расширен до резекции доли и даже всего легкого.
Глава 1 4 РАК ЛЕГКОГО
Среди всех опухолей легких рак встречается наиболее часто — в 90—95 % наблюдений. Со времени первых сведений о частоте этого заболевания [Bayle К., 1805; Laennec R.-T., 1837] заболеваемость раком легкого быстро и прогрессивно увеличивалась.
В США только в 1980 г. зарегистрировано 117 000 новых заболеваний раком легкого и 101 300 случаев смерти от него [Hardy J. et al., 1981]. За 70-е годы в СССР число ежегодно заболевающих злокачественными заболеваниями возросло с 430,2 тыс. в 1970 г. до 530,4 тыс. в 1979 г. При этом значительный рост частоты опухолей среди населения нашей страны, определяющий увеличение этого общего показателя, связан в первую очередь со значительным учащением рака легкого [Напалков Н. П., 1982]. В 70-е годы показатель заболеваемости раком легкого на 100 000 человек населения составил в среднем 24,5.
этиология
К настоящему времени накоплено значительное количество данных, свидетельствующих о том, что злокачественная трансформация клеток может наступить от воздействия различных причин. Установлено, что в одинаковых условиях один и тот же канцерогенный фактор может вызвать развитие опухоли в значительном числе случаев, но может и не вызвать: многое зависит от реакции организма в целом. Определение понятия «канцерогенные факторы», их разнообразные классификации (по происхождению, механизму действия, делению на химические, физические, биологические и др.) весьма условны. Однако это не мешает считать доказанной способность многих хорошо идентифицированных агентов самим по себе и в сочетании с другими факторами достоверно повышать вероятность развития злокачественных новообразований [Напалков Н. П., 1982]. Многочисленные наблюдения позволяют установить причины возникновения так называемых «про
272
фессиональных раков». По данным A. Huper (1956), если среди 1000 мужчин, занятых в сельском хозяйстве, смертность от рака легкого составляет всего 0,82, то среди занятых в производстве железа и стали — 2,18, пластмасс и резины — 2,34, графита — 2,91, цветных металлов — 3,22.
Высока заболеваемость раком легкого у работников шахт и рудников, асбестовых предприятий.
Достоверно доказано, что в городах рак легкого встречается гораздо чаще, чем среди жителей сельской местности. Источниками загрязнения атмосферы городов являются отопительные системы, выхлопные газы автомобилей, пыль асфальтовых дорог, выброс в воздух химических продуктов производственными предприятиями. Среди канцерогенных веществ, содержащихся в атмосферном воздухе промышленных городов и областей, наиболее важную роль приписывают 3,4-бензпирену. Несомненно, неблагоприятное воздействие оказывают на эпителий слизистой оболочки дыхательных путей такие канцерогенные вещества, как радиоактивные соединения, производные хрома, мышьяка, никеля. Развитие очагов воспаления в дыхательных путях вокруг отложившихся механических частиц в присутствии канцерогенов создает условия для взаимодействия их со структурными элементами клеток, избыточной клеточной пролиферации и атипии эпителия, с последующей их опухолевой трансформацией.
Одним из факторов, нарушающих, угнетающих процессы самоочищения бронхов, является табачный дым. Канцерогенное действие табачного дыма и его конденсата доказано в опытах на животных. При исследованиях, проведенных на секционном материале, установлено, что у курящих в бронхах развиваются обширные метапластические изменения, степень выраженности которых находится в прямой зависимости от интенсивности курения. У больных раком легкого эти изменения выражены особенно сильно. С этих позиций хронический бронхит курильщиков можно рассматривать как предраковое состояние — тот фон, на котором часто возникает рак легкого. Заболеваемость раком легкого у длительно курящих людей примерно в 20 раз выше, чем у некурящих.
Трудности эпидемиологического или клинического выявления агентов вирусной природы, канцерогенных для человека, во многом понятны, учитывая существующие представления о механизме вирусного канцерогенеза. Автор вирогенетической теории Л. А. Зильбер, начиная с рабочей гипотезы, разработал стройную систему, подтвержденную в настоящее время многочисленными экспериментальными данными.
Вирусы широко распространены в природе. Их известно более 600 видов. Считается, что примерно 150 из них обладают онкогенным действием и могут вызвать в организме животных особый вид клеточной пролиферации, ведущей к развитию опухолевого роста.
Экспериментальные данные свидетельствуют о том, что вирусный онкогенез — сложный макромолекулярный процесс, протекающий в несколько стадий с участием как вирусных, так и клеточных генов и их ферментных систем.
Хронические воспалительные процессы, сопровождающиеся образованием очагов избыточной пролиферации с атипией эпителия, подготавливают слизистую оболочку бронхов к развитию злокачественной опухоли. Отмечено, что рост заболеваемости раком и хроническими воспалительными заболеваниями дыхательных путей происходит параллельно.
При тщательном исследовании слизистой оболочки бронхов у лиц, болевших хроническими заболеваниями легких, нередко обнаруживают начальные признаки рака легкого. Сходные изменения отмечены у лиц, болевших туберкулезом. В то же время у больных, погибших от рака легкого, очень часто в слизистой оболочке бронхов выявляются отчетливые признаки хронического воспаления, а также пневмосклероз.
К числу заболеваний, имеющих известное значение в этиологии рака легкого, относят также грипп [Doll R„ 1955].
Все изложенное позволяет определить основные направления профилактики рака легкого. Они сводятся к устранению причин, ведущих к нарушению гигиены дыхания. Можно выделить три направления: 1) социальное — борьба за чистоту атмосферы городов, перевод на новые, менее вредные для организма человека виды энергетического обеспечения предприятий, автомобильного транспорта, создание высокоэффективных очистных сооружений; 2) гигиеническое — отказ от курения, использование мер индивидуальной защиты при выполнении специальных работ в помещениях с высокой степенью загазованности, запыленности; 3) клиническое — выявление, своевременное и полноценное лечение и учет лиц, болеющих хроническими воспалительными заболеваниями легких.
ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
Рак легкого развивается из метаплазирован-ного эпителия бронхов и бронхиальных желез. Возникновение опухолевого роста из респираторного эпителия не доказано. Формы рака, которые раньше называли паренхиматозными или альвеолярными, по мнению многих исследователей, возникают не из метаплазированных альвеолярных клеток, а их эпителия мельчайших, терминальных бронхов, бронхиол.
Степень анаплазии клеток опухоли является морфологическим выражением ее злокачественности — различий в темпе роста, взаимоотношения с анатомическими образованиями легкого, интенсивностью лимфогенного и гематогенного метастазирования [Петерсон Б. Е., 1971; Пирогов А. И. и др., 1978]. Поэтому классификация гистологических типов рака легкого имеет большое практическое значение при решении вопросов лечебной тактики.
Учитывая исследования ряда авторов [Чис-тович А. Н„ 1963; Малая Л. Т„ 1965; Weiss W. et al., 1970], а также опыт многолетней работы клиники госпитальной хирургии, в практическом отношении оправдано выделение трех основных гистологических типов рака легкого: эпидермоидного, недифференцированного и аденокарциномы. Так как рак легкого является органоспецифической опухолью и степень его дифференцировки определяется сохранением признаков эпителиальной ткани, входящей в его состав, то подобное распределение вполне обоснованно. К дифференцированным опухолям относятся аденокарцинома и плоскоклеточный рак с ороговением и без него. В этих опухолях сохранен ряд признаков зрелой ткани: слизооб-разование в аденокарциноме, стратификация и образование кератина — в плоскоклеточных раках. Утрата этих свойств указывает на снижение дифференцировки опухоли.
Наиболее удобной для клинической практики является гистологическая классификация рака легкого, разработанная в 1966 г. академиком АМН СССР Н. А. Краевским и его сотрудниками [Краевский Н. А., 1969, 1976; Ягубов А. С., 1969, 1971]. Эта классификация выделяет: 1) плоскоклеточный рак (с ороговением и без ороговения); 2) аденокарциному (высокодифференцированную, железисто-солидную, малодифференцированную) ; 3) недифференцированный рак (мелкоклеточный «овсяно-клеточный», мелкоклеточный «лимфоцитоподобный», крупноклеточный).
Каждый гистологический тип рака легкого характеризуется своеобразными чертами клинического развития. Плоскоклеточный рак растет относительно медленно, не склонен к раннему и обширному метастазированию. Адено-
18 Зак. 0517
273
карциномы развиваются сравнительно медленно, но отличаются ранней гематогенной диссемина-цией. Недифференцированные раки рано и широко метастазируют.
Своеобразием рака легких является нередко встречающийся полиморфизм их гистологического строения. Так, опухоль, имеющая в основной своей массе строение, характерное для плоскоклеточного рака, в отдельных участках может быть сходна с мелкоклеточными его типами. При низкодифференцированных раках встречаются зоны, более характерные по строению для плоскоклеточных типов опухоли, местами — для аденокарциномы. Это подтверждает известное положение об условности границ разделения отдельных гистологических типов рака легкого, обусловливает трудности, с которыми встречаются при проведении патогисто-логической диагностики, ответственность при установлении морфологической принадлежности опухоли.
Аденокарциномы встречаются наиболее редко, составляя 10—-12 % от всех наблюдений. Лишь в последние годы отмечено некоторое увеличение числа больных аденокарциномой. Одной из причин этого явления считают увеличение заболеваемости раком легкого среди женщин, у которых аденокарциномы развиваются более чем в 3 раза чаще, чем у мужчин.
Раки легкого плоскоклеточного типа заметно преобладают у мужской части больных, направляемых в хирургические стационары, составляя до 60 %. Недифференцированные раки легкого встречаются примерно у 30% хирургических больных, распределяясь, в равном соотношении среди мужчин и женщин.
Важным критерием при решении вопросов лечебной тактики признается величина первичной опухоли в легком. Все современные классификации рака легкого учитывают этот показатель как составной элемент общей характеристики распространенности бластоматозного процесса.
О состоянии и возможностях диагностики заболевания, ее своевременности нередко судят по частоте выявления небольших по размерам раковых опухолей [Вагнер Р. И. и др., 1967; Jashar J., 1975]. Принято считать, что с увеличением размеров опухоли исходы хирургического лечения ухудшаются. Однако, как показывают многочисленные наблюдения, взятый изолированно, этот признак не всегда позволяет достоверно определить прогноз заболевания. Нередки случаи успешного удаления огромных опухолей с благоприятным исходом и множественного гематогенного и лимфогенного метастазирования так называемых «маленьких раков», сводящего на нет все попытки помочь больным [Шеляховский М. В., 1964].
На объем и вид оперативных вмешательств у больных раком легкого, особенности хирургической техники оказывает влияние характер роста и развития первичной опухоли в легком.
По данным П. А. Куприянова и соавт. (1963), Л. Т. Малой (1965), Р. И. Вагнера, А. С. Барчука (1978), каждой опухоли легкого присуща анатомическая форма и направленность роста: относительно ограниченная с выраженными границами (узловато-эндобронхиальная) или инфильтративная без четких границ (преимущественно перибронхиальная и перивазаль-ная). Встречаются и смешанные, имеющие черты каждой из двух крайних типов, формы роста раковой опухоли.
Вовлечение в бластоматозный процесс при перибронхиально и перивазально растущих раках различных внелегочных анатомических образований грудной полости и средостения во многом определяет своеобразие резекции при выполнении оперативных вмешательств.
Большинство современных классификаций бронхогенных раков делит их на центральные и периферические [Ганул В. Л., 1963; Савицкий А. И., 1967; Гарин Н. Д. и др., 1968; Alber-tini А., 1951, 1955]. Как показали исследования А. С. Барчука (1967), периферические раки склонны рано прорастать висцеральную плевру, выходить за пределы легкого. Скрытое течение заболевания при периферических формах роста опухоли определяет, как полагает И. А. Максимов (1967), поступление в хирургические стационары примерно каждого третьего больного с III стадией развития рака легкого. Это дало основание В. И. Варгузиной (1972) заключить, что в силу особенностей местного роста периферических раков резекта-бельность при них выше, а техника операций проще, но отдаленные результаты хуже, чем при центрально расположенных опухолях. Своеобразие роста и развития центральных, прикорневых раков легкого и периферических, исходящих из эпителия слизистой оболочки мельчайших бронхов, находит свое отражение в особенностях и возможностях диагностики каждой из этих форм. В хирургические клиники примерно в два раза чаще направляются больные с центральными формами опухоли, относительно рано проявляющими себя развитием сопутствующих ателектазов или воспалительных процессов в легких.
Значительные изменения при развитии опухоли в легком претерпевает его регионарный лимфатический аппарат. К моменту обращения за помощью лимфогенные метастазы рака имеются у 65—70 % больных. При этом процессы метастазирования центральных и периферических раков легкого происходят по общим правилам и одинаково часто.
274
Детальное изучение характера и направленности лимфогенного метастазирования рака легкого позволило установить некоторые закономерности этого процесса, которые положены в основу разработки расширенных оперативных вмешательств.
Как показали исследования сотрудников клиники С. А. Шалаева (1969, 1983) и Д. Сухээ (1972), в начальном периоде развития заболевания распространение лимфогенных метастазов происходит в наибольшем соответствии с представлениями о нормальном движении лимфы от каждой из долей легкого.
Как правило, вначале поражаются расположенные ближе к опухоли внутрилегочные группы узлов, затем — корневые, медиастинальные и, наконец, надключичные. Процесс метастазирования рака легкого имеет общую тенденцию — от периферических отделов легкого к средостению. Правда, наличие прямых связей между отдельными участками регионарных лимфатических коллекторов, а также формирование коллатеральных сосудов допускают возможность поражения метастазами лимфатических узлов последующих порядков, минуя предыдущие. Такое метастазирование носит название «скачущего». Так как основная масса лимфатических узлов регионарных лимфатических коллекторов легких сосредоточена в средостении, это определяет особенно частое поражение их метастазами — в 46—52 % наблюдений.
В пределах средостения с восходящим током лимфы, по хорошо развитым лимфатическим сосудам метастазы достигают лимфатических коллекторов надключичных областей.
В практическом отношении важно, что длительное время, до полного поражения лимфатических узлов, регионарных для легкого, в котором развивается опухоль, процесс метастазирования в пределах средостения происходит по одноименной его стороне. Лишь при обширном метастазировании, сопровождающимся полной блокадой лимфатических коллекторов средостения со стороны пораженного легкого и при полной дезорганизации оттока лимфы из этой области, метастазы развиваются и на противоположной стороне средостения.
Распространяясь в восходящем направлении, метастазы рака легкого достигают лимфатических коллекторов надлючичных областей, поражая расположенные здесь группы лимфатических узлов. Детальные исследования сотрудника клиники Д. Сухээ (1972) показали, что поражение метастазами надключичных регионарных лимфатических коллекторов всегда происходит вслед за медиастинальными.
С наибольшим постоянством лимфатические узлы надключичных областей поражаются
18 *
метастазами рака легкого одноименной с опухолью стороны. Наиболее часто в бластоматозный процесс вовлекаются группы лимфатических узлов надключичных областей при поражении опухолью верхних долей, что обусловлено их анатомической близостью и полностью соответствует существующим представлениям о направлении тока лимфы из этих отделов легких.
Распространение рака легкого по лимфатическим коллекторам средостения и надключичных областей взаимосвязано. Метастазирование в надключичные группы лимфатических узлов с закономерным постоянством происходит вслед за поражением наиболее верхних участков лимфатических коллекторов, расположенных в средостении.
Поражение метастазами надключичных лимфатических узлов противоположной опухоли в легком стороны или с двух сторон всегда свидетельствует о далеко зашедшем, двустороннем развитии лимфогенных метастазов рака в пределах средостения.
Весьма важными в практическом отношении являются неспецифические воспалительные параканкрозные изменения, выявляемые при патоморфологическом изучении в легком и грудной полости у больных раком легкого. Так, В. И. Ляшенко (1974, 1978), детально изучив распространенность опухолевого процесса при вскрытии у 100 больных раком легкого, которым были выполнены пробные торакотомии, установил, что среди них в 11,2 % наблюдений причиной отказа от радикальной операции явились увеличенные, спаянные в конгломераты лимфатические узлы средостения, которые были расценены как проявление множественного метастазирования. При гистологическом изучении в этих группах лимфатических узлов были установлены только воспалительные изменения. В 15 % наблюдений спаяние легкого с соседними образованиями также было расценено как прорастание опухоли, в то время как процесс не распространялся за пределы органа и больные могли бы быть радикально оперированы.
Параканкрозные изменения возникают как в непосредственной близости к первичной опухоли, так и в более удаленных отделах легкого и в регионарных лимфатических коллекторах, пораженных и не пораженных ее метастазами.
Особое значение имеет гистологическое изучение пограничных зон опухолевого роста в легком [Гуревич М. А., 1967; Onuigbo W., 1973]. Согласно данным А. В. Григоряна (1962), вокруг опухоли в легком вначале формируется довольно толстый фиброзный слой, который постепенно, по мере приближения к терминальной стадии заболевания замещается раковой
275
тканью. М. Д. Моисеенко (1966) также показал, что при развитии опухолевого узла даже в глубине легкого висцеральная плевра всегда отвечает реактивным процессом; при этом границы бластоматозных изменений не доходят до нее подчас на 2—3 см. Происходит утолщение самой плевры за счет разрастания соединительной ткани, образование вначале рыхлых, а затем более грубых сращений между ее листками.
Развитие раковой опухоли в легком, как правило, сопровождается изменениями в регионарных лимфатических коллекторах. Как показали наши исследования, эти изменения характеризуются поражением лимфатических узлов не только метастазами, но и воспалительным процессом. Установлено, что примерно в каждом 10-м лимфатическом узле, внешне неизмененном, формируется метастаз опухоли. В то же время в лимфатических узлах, достигающих иногда значительных размеров и даже спаянных в конгломераты, в трети наблюдений при самом тщательном гистологическом исследовании установлено лишь воспаление.
Процессы, происходящие в лимфатических узлах при поражении их метастазами рака, весьма своеобразны. Небольшой метастаз, формирующийся в лимфатическом узле под капсулой, в краевом синусе, растет главным образом в направлении к его центру, за счет паренхимы. Капсула лимфатического узла длительное время является своеобразным барьером для его роста. Она претерпевает воспалительные изменения, несколько утолщается, формируется зона периаденита, лимфатические узлы сливаются между собой и с расположенными рядом бронхами, сосудами. Лишь в поздней фазе развития, при прогрессирующем увеличении, когда метастаз почти полностью выполняет собой пораженный лимфатический узел, происходит его выход за пределы соединительнотканной капсулы, прорастание рядом расположенных анатомических образований.
Гематогенное метастазирование рака легкого проявляет себя формированием очагов бластоматозного роста чаще всего в печени, почках, надпочечниках, головном мозге, костях и реже— в других органах.
При распознавании такого обширного, выходящего за пределы грудной полости, распространения опухоли пребывание больных в хирургических стационарах не оправданно.
КЛАССИФИКАЦИЯ РАКА ЛЕГКОГО
Для классификации рака легкого детальное патогистологическое изучение операционного и секционного материала требует особого вни
мания. На основании полученных данных складываются наиболее полные и точные представления о характере и распространенности опухолевых изменений, что определяет как возможности и эффективность предпринятого лечения, разработку и совершенствование хирургических приемов и методов, так и общее решение задачи оказания помощи этой категории онкологических больных.
Это решается путем тщательной маркировки в ходе оперативных вмешательств всех удаляемых образований, отделов регионарных лимфатических коллекторов по отношению к основным топографо-анатомическим ориентирам грудной полости, средостения, с последующим их патогистологическим исследованием.
Полученные при таком исследовании сведения дают возможность с высокой степенью достоверности распределить оперированных больных по стадиям развития заболевания.
При этом руководствуются общепризнанными в стране классификациями: по клиническим стадиям (утвержденной Президиумом Ученого совета М3 СССР в 1956 г.) и международной — по системе TNM (разработанной Всемирным комитетом по классификациям в 1965 г. и согласованной Программой кооперативного изучения рака легкого в рамках СЭВ в 1975 г.). Значения символов TNM общеизвестны. Ниже приведены основные критерии оценки опухолевого роста, определяющие принадлежность больных к каждой из принятых стадий рака легкого.
Следует отметить, что нередко степень распространения процесса у больных раком легкого принято определять до начала лечения, сохраняя ее неизменной в течение всего периода дальнейшего наблюдения. При установлении стадий развития заболевания у хирургических больных более правильным является, сохранив их структуру и градации, руководствоваться результатами патогистологического изучения операционного материала. Такой подход дает возможность более точно характеризовать распространенность рака легкого и в наибольшей степени отвечает потребностям хирургической клиники.
До последнего времени в хирургические клиники все еще поступает подавляющее число больных (60—65 %), имеющих далеко зашедшие стадии рака легкого, среди которых основное место занимают лица с III стадией развития заболевания.
Четкое выделение группы больных, относимых к III стадии рака легкого, несмотря на тщательность морфологических исследований, все еще представляет сложную задачу. По некоторым признакам, характеризующим местное распространение бластоматозных изменений,
276
Показатели распространенности рака легкого при распределении больных по стадиям развития заболевания
Характеристика бластоматозных изменений при раке легкого Клиническая классификация М3 СССР Международная классификация по системе TNM
Опухоль до 3 см в диаметре, не вышедшая за пределы места поражения. Нет метастазов в лимфатических узлах I стадия T1N0M0
Опухоль 3,1—5 см в диаметре, не выходит за пределы пораженной доли легкого. Метастазы в долевых лимфатических узлах, одиночные метастазы в междолевых и корневых лимфатических узлах II стадия T1N1M0 T2N0M0 T2N1M0
Опухоль 5.1 см и более, вышла за пределы легкого, прорастает в соседние органы и образования. Множественные метастазы во внутрилегочные и корневые лимфатические узлы, метастазы в лимфатические узлы средостения III стадия T1N2M0 T2N2M0 T3N0M0 T3N1M0 T3N2M0
Опухоль вышла за пределы легкого, широко прорастает в соседние органы с множественными метастазами в лимфатические узлы средостения своей и противоположной стороны, метастазы в надключичные лимфатические узлы, диссеминация по плевре, гематогенные метастазы в органы IV стадия T4N1M0 T4N2M0 T4N2Mla T4N2Mlb T4N2M1C
III стадия рака легкого весьма сходна с IV стадией. В частности, к ним относится выход опухоли за пределы легкого в виде прорастания ее в соседние с легким образования грудной полости и средостения. При этом могут формироваться качественно новые пути лимфогенного и гематогенного метастазирования — по сосудам сращений в систему большого круга кровообращения, что, естественно, отражается на отдаленных результатах лечения.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
И ДИАГНОСТИКА
Раком легкого болеют главным образом мужчины. Среди более чем 3000 больных, оперированных в клинике, соотношение между женщинами и мужчинами стойко составляло 1:9. Это полностью соответствует большинству статистических данных о заболеваемости раком легкого преимущественно мужской части населения [Шкроб О. С„ 1967, 1972; Напалков Н. П. и др., 1977, 1978, 1982; Мерабишвили В. М. и др., 1982].
По общему признанию, рак легкого является заболеванием второй половины жизни человека [Давыдовский И. В., 1938, 1958; Багаудинов К. Г., 1975; De Bakey М. et al., 1952; Heine F. et al., 1974]. Его появление в молодом возрасте относительно редко, но тогда сопровождается особенно бурным развитием с ранним и обширным метастазированием [Зельманович А. Я., 1955; Gupta A. et al., 1965; Kolling Н., Schulz G„ 1969].
Скрытность течения рака легкого, иногда на протяжении довольно длительного срока, не
позволяет с большой точностью определить начало заболевания. Наиболее обычным, общепризнанным, при исчислении давности развития болезни принято считать время возникновения первых клинических симптомов или рентгенологических признаков, которые вначале могут нередко приниматься за различные проявления неспецифических воспалительных изменений.
Наиболее часто в начале заболевания больные раком легкого отмечают повышение температуры тела. Это, как правило, связано с развитием воспалительных изменений в пораженной опухолью части легкого (как следствие нарушения дренажной функции располагающихся в зоне бластоматозных изменений бронхов). Такое лихорадочное состояние является наиболее частым источником диагностических и тактических ошибок. Большинству больных назначается противовоспалительное лечение по поводу «гриппа», «острых респираторных заболеваний», «бронхита», «пневмонии» и даже «туберкулеза». При этом улучшение состояния и самочувствия, наступающее на фоне приема антибактериальных средств, очень часто дает повод для завершения лечения и прекращения обследования, снятия больного с врачебного наблюдения.
Именно поэтому всякое повышение температуры тела у лиц старше 50 лет, особенно развившееся «без видимой причины», требует проведения тщательного анализа и изучения для точного выяснения причин лихорадки.
Одним из ведущих симптомов рака легкого является кашель. При вовлечении в бластоматозный процесс долевых и, особенно, главных
277
бронхов интенсивность и характер кашля весьма своеобразны. Он превращается в мучительный, беспокоящий как в дневное, так и ночное время, становится надсадным, или, как его называют, «лающим». Возникновение кашля обусловлено переходом опухоли на особенно чувствительные — «туссогенные» — области бронхиального дерева, со сгруппированными здесь рецепторами афферентных нервных окончаний.
Мокрота, отделяемая с кашлем в начальном периоде заболевания, обычно не бывает обильной, имеет характер слизистой, позднее — гноевидной. Примесь прожилок крови в мокроте, а тем более кровохарканье или отделение мокроты, напоминающей по виду «малиновое желе», редко является ранним признаком развития опухоли и чаще сопутствует далеко зашедшему бластоматозному процессу.
Боли в груди часто тревожат больных раком легкого. Они могут быть обусловлены как воспалительной реакцией плевры при ателектазе или гиповентиляции части легкого вследствие обтурации дренирующего бронха, так и переходом опухоли, чаще периферической, на анатомические образования грудной стенки. Характер болей зависит от локализации и величины опухоли. Они могут быть тупыми, давящими, колющими. Боли, обусловленные вовлечением в опухолевый процесс нервов, чаще всего носят постоянный, с большим трудом поддающийся действию анальгетиков, характер. Такие боли не усиливаются при движении, кашле. Расположение периферической опухоли в верхушечном сегменте верхней доли легкого, переход ее на плевру, плечевое сплетение вызывают тяжелые, мучительные боли, входящие в триаду признаков, характеризующих эту разновидность рака легкого — типа Пенкоста (верхушечное расположение опухоли, шейный плексит и синдром Горнера).
Одними из проявлений рака легкого могут быть нарастающее чувство нехватки воздуха, дыхательный дискомфорт, развитие одышки — вначале при физической нагрузке, а позднее и в покое. Иногда одышка сопутствует возникновению относительно небольших эндобронхиально растущих раков, являясь следствием вторичного эндобронхита, бронхоспазма.
Общая слабость, недомогание, как правило, сопровождают развитие раковой болезни и не являются специфичными для опухолей легкого. Они отражают неблагоприятное действие на организм человека продуктов опухолевого метаболизма, изменяя течение обменных процессов. Общая слабость редко может быть первым проявлением развития рака легкого. Как и кахексия, она чаще всего свидетельствует о значительном распространении бластоматозного поражения.
Реже в качестве общих проявлений развития рака легкого наблюдаются различные нарушения функции желез внутренней секреции по типу надпочечниковой недостаточности, дисфункции щитовидной железы, системного осси-фицирующего периостоза с мучительными суставными болями (синдром Бамбергера — Пьера Мари).
Распространение первичной опухоли или сдавление ее метастазами в лимфатических узлах средостения вызывает расстройства функции различных анатомических образований и даже изменяет топографо-анатомические взаимоотношения в этой области. При сдавлении или прорастании пищевода больные предъявляют жалобы на дисфагию, при поражении возвратных ветвей блуждающих нервов — на осиплость голоса, при компрессии верхней полой вены наблюдается увеличение объема шеи и нарастающая одутловатость лица.
Метастазирование опухоли за пределы грудной полости, во внутренние органы (головной мозг, печень, почки), кости позвоночника или конечностей ведет к появлению своеобразных клинических симптомов, присущих нарушению функции соответствующих органов. Отчасти поэтому многие больные, впервые обращаясь за помощью к различным специалистам, в качестве первых признаков развития рака легкого указывают на эти наиболее беспокоящие их внелегочные симптомы заболевания. Эти признаки не могут удовлетворить врача, так как диагноз ставится обычно уже в неоперабельной стадии.
Детальное изучение различных проявлений рака легкого, анализ клинических вариантов течения его дали возможность составить довольно четкое представление о клинических проявлениях ранних форм рака легкого.
Кашель как один из часто встречающихся признаков рака легкого в зависимости от местоположения опухоли, степени прорастания стенки бронха опухолью, стадии заболевания имеет различную интенсивность и характер. Так, в начальных стадиях развития бластоматозного поражения легкого характерно появление сухого, мучительного кашля. Особенно должно настораживать изменение характера «привычного» кашля у курильщика: его особое упорство, изменение вида отделяемой с кашлем мокроты— вначале слизистой, тягучей, позднее — слизисто-гнойной, с неприятным запахом.
Боли в груди, наблюдаемые у больных раком легкого, могут быть самыми разнообразными: проходящими или постоянными, относительно острыми и тупыми, локализованными или разлитыми, неопределенными. Это обусловлено как вовлечением в опухолевый процесс различных анатомических образований (плевры, груд
278
ной стенки, диафрагмы, нервов, трахеи и крупных бронхов, сосудов), так и сопутствующим параканкрозным воспалительным процессом. Боли не всегда являются проявлением далеко зашедшей, крупной опухоли. Нередко они возникают в ранний период, когда первичная опухоль легкого невелика, а заболевание относится к I—II стадии развития.
Повышение температуры тела часто сопутствует воспалительным параканкрозным изменениям в легком при обтурации опухолью различных отделов воздухоносных путей. Чаще это возникает при распространенном бластоматозном процессе. Однако у части больных, имеющих относительно небольшую, расположенную в периферических отделах шаровидную опухоль, причина лихорадки кроется в распаде самой опухоли, развитии инфекционных изменений в полости распада, абсцедировании. Важно, что повышение температуры тела может встречаться даже в сравнительно ранней стадии опухолевого процесса.
Сопоставление отдельных клинических симптомов или их сочетания с результатами специальных методов обследования позволяют в настоящее время правильно и своевременно поставить диагноз рака легкого и направить больного в специализированный стационар.
Наиболее успешно лечение рака легкого осуществляется больным, у которых заболевание выявлено в I—II стадиях развития. Так, по данным Б. Е. Петерсона и соавт. (1980), непосредственные и отдаленные результаты хирургического лечения рака легкого в стадии T1N0M0 составляют 83 % пятилетней и 67 % десятилетней выживаемости. Однако распознавание таких ранних форм рака легкого все еще сопряжено со значительными трудностями, и число больных, выявляемых в период I—II стадий развития заболевания, по материалам больших статистик, составляет лишь 6—21 % [Панков А. К. и др., 1980].
Совершенствование и внедрение в жизнь системы диспансерного обследования населения призвано решить эту трудную задачу. Ведущим методом своевременного выявления онкологических заболеваний легких остается массовая флюорография. Опыт, накопленный в течение ряда десятилетий, убеждает в том, что так называемые «сплошные флюорографические обследования населения» без определенной системы отбора себя не оправдывают. Увеличение эффективности массовой флюорографии ожидается с переходом от сплошных к дифференцированным рентгенофлюорографическим обследованиям лиц с повышенной вероятностью заболевания раком легкого, а также с одновременным улучшением качества ранней диагностики в амбулаторных условиях.
Целенаправленное обследование различных категорий лиц, выделенных в группу «повышенного риска» в отношении рака легкого, позволяет при проведении диспансеризации повысить удельный вес распознавания заболевания в I—II стадиях развития (более чем у 50 % всех выявленных больных) [Денисов Л. Е. и др., 1980]. При формировании групп лиц «повышенного риска» учитывают основные этиологические и патогенетические факторы, предрасполагающие к развитию заболевания. Направленному обследованию подлежат даже при отсутствии признаков заболевания легких следующие группы больных: мужчины старше 50 лет; все больные, связанные в настоящее время или в прошлом с производственными вредностями (силикатная, асбестовая, хромовая промышленность, автопредприятия и т. д.); интенсивно и в течение более 20 лет курящие; часто болеющие респираторными заболеваниями. К группе повышенного риска относят также всех, страдающих хроническими заболеваниями легких •— хронической пневмонией, туберкулезом, бронхоэктазиями, пневмокониозом, очаговым пневмосклерозом, хроническим бронхитом. К этой же категории следует отнести больных с неясным диагнозом при появлении у них каких-либо симптомов легочного заболевания. Использование современной крупнокадровой флюорографии, направленной томографии открывает новые возможности эффективного решения проблемы ранней диагностики рака легкого.
Диагностика рака легкого в амбулаторных условиях может быть заметно улучшена организацией на базе пульмонологических учреждений и специализированных поликлиник консультативных комиссий, впервые созданных в Ленинграде по инициативе академика АМН СССР профессора А. И. Ракова и успешно работающих уже более 15 лет. В состав комиссии входят рентгенолог, фтизиатр, пульмонолог-онколог. При таком коллегиальном обсуждении больным в необходимых случаях осуществляется рентгенологическое исследование в двух проекциях, томография. При показаниях проводится бронхологическое обследование (амбулаторное или в стационаре).
Анализ целенаправленной и многолетней работы консультативных комиссий убедительно показал, что выявление больных раком легкого увеличилось с 15 до 38 %. При этом более чем у половины больных со скрыто протекающим заболеванием установлены начальные — I и 11 — стадии его развития. Это позволило повысить операбельность с 11,1 до 38 %. Полученные результаты убеждают в заметных преимуществах такой организационной формы распознавания рака легкого в амбулаторных условиях [Вагнер Р. И. и др., 1980].
279
Рис. 117. Центральный рак левого легкого.
а — прямая рентгенограмма; б — боковая рентгенограмма; в — боковая томограмма.
В последние годы в целях диагностики ранних, доклинических форм рака легкого разрабатываются новые лабораторные методы исследования. Среди них весьма перспективным представляется изучение иммунологических изменений у этой категории больных. В присутствии
ракового антигена отмечается торможение миграции лимфоцитов, что является одним из важных признаков возникновения злокачественной опухоли. Работы Л. К. Богуша и соавт. (1980) убеждают, что иммунологические реакции являются высокоспецифичными для онко
280
логических больных и могут быть весьма перспективными для диагностики ранних стадий заболевания.
Ведущими методами диагностики, используемыми в торакальных стационарах для решения вопроса о характере, распространенности бластоматозных изменений в легком при раке, являются рентгенологический и эндоскопический.
Рентгенологическое обследование, наряду с выполнением обзорных снимков органов грудной полости, в обязательном порядке включает томографическое исследование. На основании этих данных получают сведения о локализации инфильтративных изменений в легких, их интенсивности и распространенности, проходимости различных отделов дыхательных путей, состоянии регионарных лимфатических узлов, вероятности их вовлечения в опухолевый процесс, характере и выраженности сопутствующих параканкрозных изменений (рис. 117—121).
Вместе с тем разрешающие возможности рентгенологического метода обследования, особенно у больных раком легкого с сопутствующими параканкрозными изменениями, не позволяют с высокой степенью точности судить о стадии развития опухоли.
В числе специальных приемов рентгенологического обследования больных, особенно с предполагаемым далеко зашедшим опухолевым процессом в легком, для ориентировки в отношении состояния бифуркационных и около-пищеводных групп лимфатических узлов, весьма информативным является контрастирование пищевода. Его деформации, оттеснения в сторону от обычного места расположения могут свидетельствовать о поражении метастазами близлежащих лимфатических узлов средостения.
Эндоскопические исследования значительно расширяют возможности диагностики и оценки распространенности этого заболевания.
Важным является правило: каждое эндоскопическое обследование по поводу рака легкого или подозрения на него должно в обязательном порядке включать не только полную визуальную диагностику состояния просвета дыхательных путей, но и взятие материала для морфологического изучения: щипцовую биопсию, скарификацию слизистой оболочки измененных или подозрительных участков, направленную аспирацию промывных вод бронхов.
Такое планомерное проведение эндоскопического исследования дает возможность правильно распознать рак легкого у 93,6 % больных.
Следует отметить, что эндоскопическое изучение состояния просвета дыхательных путей у больных раком легкого позволяет обнаружить признаки, характеризующие распространенность бластоматозных изменений. Наиболее
118. Периферический рак левого легкого.
а — прямая рентгенограмма; б — боковая рентгенограмма.
выраженные из них, такие как разрастание опухолевой ткани в трахее, прорастание бифуркации или ее «развертывание» в связи с метастазированием в расположенные здесь группы лимфатических узлов, устанавливаются без особого труда и часто свидетельствуют о весьма ограниченных возможностях оказания хирургической помощи таким больным.
281
Рис. 119. Рак средней доли лет кого.
а — прямая рентгенограмма; б — боковая рентгенограмма.
Рис. 120. Верхушечный рак легкого справа (типа Пен коста). а — прямая рентгенограмма; б — боковая рентгенограмма.
282
Некоторые специальные методы исследования лимфатических коллекторов и органов средостения: азигография, медиастиноскопия, парастернальная медиастинотомия — в клинике не получили развития и большого практического применения. Это связано с тем, что верифицированное поражение метастазами расположенных в средостении регионарных групп лимфатических узлов, встречающееся у половины из всех больных, обращающихся за помощью. не является, по нашим представлениям, противопоказанием к выполнению расширенных оперативных вмешательств, так же как и вовлечение в бластоматозный процесс на ограниченном протяжении пищевода, верхней полой вены, предсердия, начальных отделов главных бронхов, перикарда, блуждающего и диафрагмального нервов и т. п., о чем можно предполагать на основании специальной оценки состояния средостения при медиастиноскопии или при контрастировании расположенных здесь сосудов.
Проблема хирургического лечения больных раком легкого во многом определяется не только распространенностью бластоматозных изменений, но и состоянием функциональных и резервных возможностей их организма. Поэтому изучению состояния жизненно важных систем и органов, характера сопутствующих заболеваний и расстройств придается большое значение.
Состояние функциональных и резервных возможностей органов дыхания оценивается, начиная с простейших клинических тестов, определяющих реакцию организма больного на умеренную физическую нагрузку (ходьба по лестнице). Для более точного суждения о функциональной операбельности больных раком легкого по состоянию газообмена проводится общая спирография с определением легочных объемов и вентиляции. Степень обструктивных изменений в легких может быть оценена с помощью пневмотахометрически х методов. При этом наиболее целесообразно учитывать полученные показатели не по абсолютным величинам скорости вдоха и выдоха, а рассчитывать их соотношения на фоне введения бронхолитиков (эуфиллина, сальсолина) или предшествующего курсового лечения ими. Компенсаторные возможности здорового легкого могут быть определены использованием латерального теста по F. Bergan (1464), который позволяет дать в процессе спирографии сведения об участии в газообмене каждого легкого.
Рис. 121. Пневмониеподобиый (альвеолярноклеточный) рак правого легкого.
а — прямая рентгенограмма: б — боковая рентгенограмма, в — боковая томограмма.
283
Функциональное состояние сердечно-сосудистой системы у больных раком легкого оказывает существенное влияние на возможности и характер хирургического лечения. Выраженная правожелудочковая недостаточность, легочная гипертензия как одно из составляющих синдрома «хронического легочного сердца» может стать противопоказанием к резекции легкого.
Информацию, отвечающую на этот вопрос, получают при электрокардиографическом исследовании. Точнее показатели легочной гипертензии можно определять после торакотомии прямым измерением давления в легочной артерии. При этом изучаются деятельность сердца и показатели дыхания до и после пережатия сосудов легкого турникетами. Такой завершающий диагностический прием дает наиболее полные сведения, позволяющие решить вопрос об объеме резекции легкого [Матусевич М. Я. и др., 1974].
Количественные характеристики гемодинамики и ее взаимосвязи с внешним дыханием позволяют определить метод интегральной реографии тела, разработанный сотрудником клиники М. И. Тищенко (1966, 1973).
Каждому из больных необходимо проводить развернутое изучение показателей свертывающей и фибринолитической систем крови, обращая внимание не столько на склонность к тромбообразованию, которая при раке у пожилых больных всегда имеет место [Соловьева О. В., 1972], сколько на возможную гипокоагуляцию.
Исследуются также показатели объема циркулирующей крови, его компонентов и реологические свойства крови. Состояние водно-электролитного баланса оценивается путем определения концентрации электролитов в циркулирующей крови. При выявленных сдвигах показано их лечение. Может оказать помощь изучение глюкокортикоидной функции коры надпочечников определением концентрации кортизола в плазме, 17-оксикортикостероидов в моче [Бу-равцев В. И., 1977].
Суммарная оценка иммуногенетического статуса больных раком легкого позволяет более полно учитывать состояние защитных сил организма, течение репаративных процессов в плевральной полости, планировать гемотрансфу-зионнную терапию, подбор доноров для возмещения операционной кровопотери.
ЛЕЧЕНИЕ
В настоящее время единственным и наиболее надежным методом лечения больных раком легкого является своевременно выполненная радикальная операция.
Накоплены и обобщены многочисленные наблюдения, позволяющие проследить судьбу больных раком легкого, не получавших оперативного лечения. По данным Л. Е. Денисова (1972), Г. А. Ефимова и соавт. (1980), из числа больных, отказавшихся от предложенной операции, более 5 лет жили лишь 4 %. Больные раком легкого, отказавшиеся от операции, как правило, живут не более 2 лет, а с распространенным опухолевым процессом в легких — III стадией развития заболевания — от 4 до 9 мес [Lanzotti V. et al., 1977].
Для лечения больных раком легкого, которым по распространенности процесса или по другим причинам не могло быть оказано хирургическое лечение, в онкологической практике применяется химиотерапевтическое и лучевое лечение, а также их сочетание. Сведения об эффективности этих методов лечения, оценка их различными исследователями неоднозначны.
По мнению Б. Е. Петерсона (1971), М. Л. Шу-лутко и соавт. (1972), L. Lince, D. Lulu (1971), применение химиотерапевтических средств как самостоятельного метода лечения в подавляющем большинстве наблюдений обречено на неудачу. Правда, под влиянием химиотерапии в опухоли и ее метастазах в регионарных лимфатических узлах были отмечены дистрофические изменения. А. С. Павлов и соавт. (1979) указывают на то, что, несмотря на малую избирательность действия существующих цитостатических препаратов, при их использовании в ряде случаев можно продлить жизнь больных раком легкого с далеко зашедшим опухолевым процессом.
Более широкое использование при раке легкого получило применение лучевой терапии [Страшинин А. И., 1968; Алейников Г. Е., 1975; Напалков Н. П. и др., 1977, .1978]. Подобно хирургическому, большинство лучевых воздействий принадлежит к числу местных, направленных на основной опухолевый очаг и не влияющих на . более отдаленные проявления бластоматозного процесса [Блохин Н. Н., 1970; Cohen М., 1975]. Как показали исследования Р. Kirsh и соавт. (1976), средняя продолжительность жизни больных, получавших лучевую терапию, составила 7,7 мес. С. С. Ярицын и Э. Я. Друкин (1980) проследили судьбу 1240 больных раком легкого, взятых на учет в течение одного года и леченных различными методами. При этом отдаленные результаты от лучевой терапии оказались не лучше, чем в группе больных, отказавшихся от операции или признанных неоперабельными. По этим соображениям Б. Е. Петерсон (1971) считает, что лучевое лечение, как правило, не дает возможности надеяться на радикальное излечение. Можно лишь рассчитывать на замедление про
284
грессирования опухоли. Тем не менее вполне справедливо положение, выдвинутое и обоснованное И. А. Переслегиным и соавт. (1977, 1980), о том, что применение современных методов лучевой терапии рака легкого, их дальнейшее совершенствование следует считать, несомненно, оправданным, особенно у больных, которым хирургическое лечение не показано или не может быть осуществлено.
До настоящего времени остается справедливым положение, согласно которому основным показанием к операции при раке легкого является, по существу, само заболевание.
Руководствуясь принятыми в клинической практике классификациями, распределяющими больных в отдельные группы, по общему признанию, наиболее успешно хирургическое лечение проводится при I—II стадиях рака легкого [Родионов В. В., Максимов И. А., 1967, 1968; Перельман М. И. и др., 1969|.
Разработка и совершенствование техники оперирования определили наиболее рациональную тактику в лечении таких больных — выполнение им сберегательных операций, частичных резекций легкого. Важно отметить, что принципиальной чертой таких операций —лобэктомий — является удаление вместе с пораженной долей легкого регионарных лимфатических узлов [Родионов В. В., 1968, 1970; Меже-викин Н. И., 1979). Специальное внимание при этом уделяется препаровке медиастинальных лимфатических коллекторов [Колесников И. С., Межевикин Н. И., 1974]. Радикализм таких частичных резекций при раке легкого I—II стадии не уступает пневмонэктомии [Пирогов А. И., Блохина Н. Г., 1965]. Разработка методов выполнения частичных резекций с реконструктивными и пластическими элементами на бронхах позволила выполнять операции даже при расположении опухоли вблизи юлевых бронхов [Пирогов А. И., Харченко В. П., 1977; Перельман М. И. и др., 1981; Харченко В. П., Чхиквадзе В. Д., 1983].
Долевые резекции позволяют сохранить значительные участки паренхимы легкого, а это обеспечивает хорошие функциональные результаты в отдаленном периоде и сокращает послеоперационные осложнения. Так, у U. Gottschalk, Е. Usbeck (1967) летальность после операций по поводу рака легкого I—II стадий составила до 18,8 %, a D. Paulson и I. Reisch (1976), с особой тщательностью отбиравшие больных для оперативного лечения, преимущественно с периферическими опухолями (они составили до 75 % всех наблюдений), добились снижения послеоперационной летальности при частичных резекциях легких до 4 %.
Эффективность и целесообразность хирургического лечения больных раком легкого опре
деляются конечным результатом, т. е. продолжительностью их жизни. У больных с начальными проявлениями заболевания этот показатель наиболее благоприятен. По данным А. Г. Куницына (1973, 1975), более трех лет после операций по поводу рака легкого I стадии живут 64 % больных. С. Nagaishi, I. Okada (1968) отметили пятилетнюю выживаемость после операций у 50 % больных с предполагавшейся I стадией рака легкого, а Т. Shields и соавт. (1980) — в 54,4 % наблюдений. По нашим данным, показатель пятилетней выживаемости при раке легкого I—II стадий составляет 52 %.
Таким образом, хирургическое лечение у больных с начальными проявлениями опухолевого роста весьма эффективно. Однако возможности диагностики рака легкого все еще таковы, что в ранней стадии развития заболевания в хирургические стационары поступает не более 20— 25 % таких больных. Остальные к этому времени имеют более распространенный процесс, когда возможности эффективной хирургической помощи заметно ограничены или совсем невыполнимы [Стручков В. И., 1977; Miihe Е., WeiBmann R., 1975].
Для больных с далеко зашедшими стадиями заболевания, относимых к IV стадии развития рака легкого, в настоящее время особых разногласий не существует. Число их все еще остается значительным, составляя до 25 % от всех обследованных [Раков А. И., 1971; Дру-кин Э. Я., 19751.
Больных с IV стадией развития рака легкого, как правило, не направляют в хирургические стационары, а тем из них, у кого далеко зашедший опухолевый процесс устанавливают после торакотомии и ревизии органов грудной полости, операции на этом завершают или ограничиваются паллиативным вмешательством.
Следует отметить, что если генерализация опухолевого процесса считается в настоящее время абсолютным признаком неоперабель-ности, то все остальные критерии являются относительными противопоказаниями к хирургическому лечению. Пределы оперативных вмешательств также широко варьируют. Это вполне закономерно и обусловлено как различиями во взглядах хирургов на возможности оперативного лечения таких больных, так и состоянием развития методов и приемов хирургической техники. Так, в клинике госпитальной хирургии в начальный период разработки расширенных оперативных вмешательств у больных раком легкого, в начале 50-х годов, установление метастазов в медиастинальных лимфатических узлах расценивалось как веское основание для прекращения операции, а уже с 1957 г. подобное распространение бластоматозного процесса не было препятствием для пневмон
285
эктомии с ревизией средостения и удалением измененных лимфатических узлов. А. С. Савицкий (1959) считает вполне рациональным при выходе опухоли за пределы легкого расширение границ операции за счет иссечения ограниченных участков перикарда, ребер, диафрагмы. В. П. Харченко и Б. Э. Валехов (1969, 1970, 1975), В. И. Маслов (1982), Р. Keszler (1980) не останавливаются перед резекцией и пластикой бифуркации трахеи в случае прорастания в нее опухоли или метастазов из бифуркационных лимфатических узлов.
Прорастание опухолью грудной стенки, так же как вовлечение в опухолевый процесс возвратного нерва, как полагают Ф. Г. Углов (1957), М. Jamieson и соавт. (1979), хотя и затрудняет выполнение операции и иногда омрачает отдаленный результат, тем не менее не исключает возможности удаления легкого вместе с частью грудной стенки, образованиями средостения.
Все изложенное свидетельствует о том, что до настоящего времени наиболее сложной и ответственной категорией больных для решения лечебной тактики, уточнения показаний к хирургическому вмешательству являются больные в III стадии развития процесса. III стадия рака легкого характеризуется выходом опухоли за пределы пораженного легкого: метастазированием в медиастинальные группы регионарных лимфатических узлов, переходом бластоматозных изменений на внелегочные анатомические образования грудной полости и средостения.
Такие больные составляют большинство из всех, впервые обращающихся за помощью. Даже среди больных, у которых опухоль выявлена при профилактических осмотрах, рак III стадии составляет около 35 %, а из числа направленных в хирургические стационары этот показатель достигает 43—53 % [Королев Б. А. и др., 1976; Giitgemann A. et al., 1976; Irlich G. et al., 1976].
Среди больных, которым предпринимаются оперативные вмешательства по поводу, казалось бы, ограниченного (I—II стадия) опухолевого процесса в легких, также оказывается значительное число с III стадией развития болезни, что устанавливается после торакотомии и проведения срочных морфологических исследований [Куницын А. Г., Алейников Г. Е., 1978].
Различия, существующие в оценке роста и развития опухоли, отражаются на рекомендациях в отношении лечебной тактики у больных раком легкого III стадии развития заболевания. Так, L. Brand и соавт. (1980), Н. Jakita и соавт. (1981), D. Weissberg (1981) убеждены, что при раке легкого III стадии, местнораспространенном процессе, метастазировании опухоли в лимфатические узлы средостения един
ственно эффективным методом лечения продолжает оставаться только хирургический. D. Keiser (1979), В. Maafien, D. Greschuchner (1982) полагают, что такие операции оправданны лишь у части больных — при опухолях высокодифференцированного строения. Подобная позиция обосновывается тем, что при распространении бластоматозных изменений на образования, расположенные за пределами легкого, метастазировании опухоли в лимфатические узлы средостения заметно повышается вероятность ее гематогенной диссеминации. Последняя во многом определяет неблагоприятные исходы хирургического лечения больных даже при менее распространенных бластоматозных изменениях.
Прослежено, что частота гематогенного метастазирования возрастает параллельно с распространенностью опухолевых изменений в легких, особенно с вовлечением в процесс различных отделов регионарных лимфатических коллекторов [Шеляховский М. В., 1961, 1964]. А. И. Пирогов и соавт. (1976) обнаружили гематогенные метастазы у 32 из 174 больных, скончавшихся после операций по поводу рака легкого. При этом I—II стадии заболевания до операции были признаны у 6,2 % из них, а III стадия — у 20,4 %. A. Mirra, J. Miziara (1978) установили гематогенные метастазы опухоли в органы брюшной полости у 9,8 % больных раком легких из числа с предполагаемыми I—II стадиями заболевания. Сроки возникновения гематогенных метастазов при раке легкого остаются неизвестными, а сам процесс — неизученным и непрогнозируемым.
Отказ же в оперативном лечении больных с распространенным бластоматозным поражением легких, при III стадии развития заболевания только ввиду вероятности гематогенного метастазирования опухоли значительно сокращает возможности лечебной помощи большинству больных раком легкого.
Проблема оказания хирургической помощи больным раком легкого в клинике госпитальной хирургии изучается с 50-х годов. Начиная с 1957 г., наряду с разработкой приемов и методов наиболее эффективного лечения больных раком легкого с начальной стадией развития опухоли, специальное внимание было уделено обоснованию целесообразности хирургического лечения больных с далеко зашедшими стадиями рака.
При этом расширение показаний к оперативному лечению данной тяжелой и многочисленной категории больных велось в направлении разработки приемов и методов выполнения комбинированных и расширенных резекций легкого по поводу III стадии рака и сокращения отказов в операциях больным повышенного функционального риска, пожилого возраста.
286
Такой подход определил организацию, направленность и содержание лечения больных на всех этапах их пребывания в клинике.
Принадлежность больных раком легкого к далеко зашедшим стадиям развития заболевания всегда верифицировалась проведением детальных морфологических исследований. Эти исследования показали, что более чем у половины оперированных больных (в 52,6 %) метастазы опухоли достигали медиастинальных отделов регионарных лимфатических коллекторов, а у трети (33,4 %) бластоматозные изменения переходили на внелегочные анатомические образования грудной полости и средостения. Чаще всего оба эти показателя, характеризующие распространенность опухолевых изменений, сочетались.
Всем больным были выполнены расширенные, с широким удалением лимфатических узлов и клетчатки средостения, или комбинированные, дополненные резекцией вовлеченных в процесс анатомических образований и органов (перикарда, части грудной стенки, диафрагмы, стенки верхней полой вены, трахеи, пищевода, предсердия и т. д.), операции. Нестандартные, высокотравматичные, часто значительно изменяющие функционирование основных систем и органов оперативные вмешательства требовали разработки специальной системы организации лечения больных в послеоперационном периоде. Общепринятые мероприятия не подходили для этой сложной категории больных. Это во многом определило летальные исходы у части из них в послеоперационном периоде в первые годы работы. Показатель летальности составлял 22,1 %. В последние годы вместе с планомерным внедрением разработанных организационных принципов лечения больных с далеко зашедшими стадиями рака легкого показатель летальности снизился до 16,1 %.
Изучение отдаленных результатов у больных, оперированных в клинике по поводу III стадии рака легкого, показало, что свыше 5 лет живут более 26% из них [Шалаев С. А., 1983].
Следует отметить, что оценка отдаленных результатов хирургического лечения больных в зависимости от гистологического строения опухоли показала, что 5 и более лет живут 27,5 % из числа имевших недифференцированные типы рака легкого. Это заметно ниже, чем в группе больных с высокодифференцированными типами опухоли: показатель пятилетней выживаемости у последних превышает 40 %. Тем не менее можно утверждать, что результаты хирургического лечения больных раком легкого с недифференцированными типами гистологического строения опухоли вполне удовлетворительные, чтобы считать малообоснованным отказ им в оперативном лечении.
Гистологический тип опухоли не может служить единственным критерием, на основании которого оправдано решение всех вопросов лечебной тактики, часто определяющих судьбу больных раком легкого.
КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ
Комбинированное лечение при раке легкого проводится с использованием облучения перед операцией или в послеоперационном периоде. Лучевая энергия, подведенная к месту расположения опухоли и зонам ее лимфогенного метастазирования, вызывает некробиоз раковых клеток, снижает их митотическую активность. При предоперационном облучении уменьшается биологическая активность первичной опухоли, уменьшаются сопутствующие воспалительные изменения [Блохин Н. Н. и др., 1971; Петровский Б. В., Перельман М. И., 1972; Перельман М. И. и др., 1977, 1982]. Как показали исследования Ф. Г. Углова, Т. Т. Богдана (1973), И. А. Переслегина и соавт. (1977), J. Sulzer и соавт. (1971), при комбинированном лечении больных раком легкого с предоперационным облучением отмечено увеличение выживаемости в случаях с метастазированием опухоли в регионарные лимфатические узлы при сроках наблюдения 2—3 года. Однако, по мнению И. А. Максимова (1967), Т. С. Глади-новой (1974), М. Roeslin и соавт. (197,6), благоприятное действие предоперационного облучения у больных с III стадией рака легкого проявляется только в эти первые 2—3 года. В дальнейшем результаты только хирургического и комбинированного лечения почти не отличаются.
А. Г. Куницын, Г. Е. Алейников (1978) отметили после лучевой терапии у оперированных по поводу рака легкого больных даже более низкие показатели пятилетней выживаемости (24,8 %) в сравнении с только хирургическим их лечением (38,6 %). Отчасти это связано с возникновением различных, нередко тяжелых осложнений, сопутствующих как пред-, так и послеоперационному облучению, которые сказываются на конечных результатах комбинированного лечения. К ним относятся часто возникающие у больных раком легкого, получавших предоперационное облучение, бронхиальные свищи, развитие эмпиемы плевры, гнойные осложнения со стороны раны. Согласно данным И. А. Переслегина и соавт. (1977), увеличение осложнений после курса предоперационной лучевой терапии повышается у больных, перенесших долевые резекции легкого. Они проявляются возрастанием частоты ателектазов, развитием пневмонии в оставшейся части легкого, обусловленной расстройством дренажной функции бронхов.
287
При проведении комбинированного лечения больным раком легкого, оперированным в клинике госпитальной хирургии, использовали главным образом послеоперационный вариант облучения. Начинали лучевое лечение спустя 11/2—2 мес после операции, когда наступала стойкая стабилизация состояния больных. Лучевую терапию проводили в Центральном научно-исследовательском рентгенорадиологическом институте М3 СССР с использованием мегавольтных источников излучения: «ЛУЧ», РОКУС, ЛУ-4,3 МэВ.
Результаты многолетних наблюдений за судьбой больных раком легкого, получивших комбинированное лечение, позволили выработать собственное отношение к его проведению, уточнить показания в зависимости от стадии развития заболевания.
Так, у больных с относительно ограниченными проявлениями опухолевого процесса, I—II стадиями рака легкого комбинированное лечение не увеличило показателя пятилетней выживаемости по сравнению с только оперированными больными. В I—II стадиях рака легкого относительно ограниченный опухолевый процесс позволяет без труда, широко, с полным соблюдением онкологических принципов фут-лярности и зональности метастазирования выполнить оперативные вмешательства в пределах установленных анатомических ориентиров. По существу, после таких операций в грудной полости не остается мест явного или вероятного развития бластоматозных изменений, т. е. объекта для лучевой терапии. Учитывая высокую степень вероятности развития лучевого пневмосклероза в остающихся после частичных резекций долях легкого (а при I—II стадиях рака легкого выполняются преимущественно долевые резекции) с последующей декомпенсацией дыхания и кровообращения, гораздо больше оснований воздержаться от комбинированного лечения, чем считать его показанным у таких больных.
В то же время у больных, оперированных по поводу рака легкого III стадии, комбинированное лечение позволяет достоверно увеличить показатель пятилетней выживаемости с 25,8 до 30,1 % наблюдений. Объясняется это тем, что при выходе опухоли или ее метастазов за пределы пораженного легкого, что характеризует стадию развития бластоматозных изменений у этой категории больных, строго выдержать все правила абластики при выполнении расширенных и комбинированных оперативных вмешательств гораздо сложнее. В отдельных наблюдениях не удается избежать нарушения целости фасциальных футляров, путей лимфооттока, достаточно далеко отступить от видимых границ опухолевого роста. В этих условиях про
ведение дополнительного местного противоопухолевого воздействия — куоса лучевой терапии — представляется оправданным и целесообразным.
У больных с IV стадией рака легкого, перенесших паллиативные резекции, облучение зон расположения не удаленных при операциях участков опухоли не дало ожидаемого эффекта. Однако облучение способствовало продлению жизни части из них. Для большинства таких больных действие лучевого лечения выразилось в уменьшении наиболее тягостных проявлений местного прогрессирующего роста опухоли: компрессии верхней полой вены, сдавления пищевода, болевого синдрома.
ОСОБЕННОСТИ
ОПЕРАТИВНОЙ ТЕХНИКИ
ПРИ ХИРУРГИЧЕСКОМ ЛЕЧЕНИИ РАКА ЛЕГКОГО
Основополагающие общие принципы выполнения операции при злокачественных новообразованиях — учет футлярности и зональности метастазирования — были сформулированы Н. Н. Петровым (1958). Их соблюдение при хирургическом лечении больных раком легкого также составляет основную задачу, решение которой потребовало разработки специальных технических и методических приемов оперирования, уточнения границ вмешательства в пределах регионарных лимфатических коллекторов, различных внелегочных анатомических образований грудной полости и средостения.
Расширенные оперативные вмешательства у больных раком легкого в клинике госпитальной хирургии разрабатываются с начала 50-х годов. Опыт, накопленный в этом направлении, превышающий 3000 оперативных вмешательств, подтвердил обоснованность и онкологическую целесообразность широкого удаления вместе с пораженным опухолью легким или его частью регионарного лимфатического аппарата [Колесников И. С., 1957—1982].
ТОРАКОТОМИЯ
Как показывает опыт клиники, возможности выполнения расширенных и комбинированных резекций легкого по поводу рака, особенно при выраженных бластоматозных и параканкроз-ных изменениях, безопасность препаровки элементов корня легкого, анатомических образований грудной полости и средостения у больных далеко зашедшим раком легкого достигаются боковым доступом. При этом создаются наибольшие возможности для удобной, а значит, и более безопасной препаровки анатомических образований, расположенных как кпереди.
288
так и кзади от элементов корня легкого, в пределах плевральной полости и, особенно, в средостении. Несколько большая травматичность боковой торакотомии в сравнении с переднебоковой полностью оправдывает себя сокращением продолжительности наиболее ответственного, медиастинального, этапа операции.
Обследование, ревизия органов грудной полости после торакотомии при раке легкого по существу является завершающим этапом диагностики: оценки распространенности опухолевых изменений, принятия решения о возможности выполнения радикального оперативного вмешательства. Следует отметить, что, как убеждает опыт, при этом, как правило (в 50,9 % наблюдений), представления о стадии развития заболевания, сложившиеся на основании данных предоперационного обследования, приходится пересматривать.
Поэтому обязательным элементом подобной ревизии является препаровка различных анатомических образований корня легкого, средостения, выполняемая (в зависимости от конкретной ситуации) в различных уровнях: в плевральной полости, в средостении, в полости перикарда.
Ревизия легкого и анатомических образований грудной полости после торакотомии включает, как правило, выделение, перевязку и пересечение непарной или полунепарной (в зависимости от стороны операции) вены, широкое рассечение медиастинальной плевры. Препарируются клетчатка и лимфатические узлы средостения, рассекается (а при необходимости даже частично иссекается) перикард. Под сосуды корня легкого подводятся лигатуры. Перевязка сосудов пораженного опухолью легкого до принятия окончательного решения о выполнении радикальной операции не делается. С подобных позиций следует выяснять распространенность бластоматозных изменений по бронху, трахее, верхней полой вене, аорте, перикарду, легочным артериям, венам, пищеводу. Более точной ориентировке помогает использование повторных срочных гистологических исследований.
Общим правилом препаровки различных образований, подозрительных в отношении вовлечения в опухолевый процесс, является выделение их, начиная с участков, наименее измененных— где можно легче ориентироваться в нормальных соотношениях фасциальных и клетчаточных образований. Выбрав для препаровки нужный анатомический слой, тупым и острым путем, контролируя каждый этап, продвигаются (нередко в зоне периаденита, воспалительной пролиферации соединительной ткани) в направлении явных или предполагаемых бластоматозных изменений.
При препаровке сосудов корня легкого не всегда следует стремиться к их перевязке или пережатию: выделение крове наполненных, пульсирующих сосудов хотя и более рискованно ввиду возможности кровотечения, но, как правило, дает возможность более точно разобраться в соотношении тканей, оценить пределы видимого распространения опухоли, воспалительных параканкрозных изменений. Препаровка, осуществляемая с нескольких направлений, позволяет точно локализовать пределы опухолевых поражений, решить вопрос о возможности резекции.
В ходе торакотомии используются некоторые приемы, позволяющие окончательно уточнить функциональную переносимость операции с учетом данных о распространении опухоли в объеме, отвечающем основным принципам онкологического радикализма. Для этой цели в ходе торакотомии производится «отключение» планируемых к удалению участков или всего легкого, оцениваются функциональные изменения, наступающие при этом в сердечнососудистой системе, газообмене.
УДАЛЕНИЕ ПРАВОГО ЛЕГКОГО
Техника выполнения удаления правого легкого как с обработкой его сосудов в пределах плевральной полости, так и внутриперикар-диально не имеет существенных отличий или своеобразных черт в случаях, когда эти образования не вовлечены в бластоматозный процесс и отсутствуют значительные параканкроз-ные воспалительные изменения в окружающих тканях. Наиболее существенным, принципиальным для онкологических больных этапом является широкая препаровка регионарных лимфатических коллекторов средостения. Онкологически более оправданным является выполнение этого этапа операции вначале таким образом, чтобы клетчатка и лимфатические узлы средостения удалялись «одним блоком» с правым легким. Однако соблюдение этого положения удается выдержать далеко не всегда ввиду частого развития значительных бластоматозных и параканкрозных изменений в средостении. Тогда для облегчения препаровки в этой сложной анатомической области, обеспечения более удобного доступа вначале выполняется удаление легкого, а затем, следующим этапом — препаровка медиастинальных отделов регионарных лимфатических коллекторов.
Медиастинотомию справа начинают с выделения непарной вены непосредственно у места ее впадения в верхнюю полую и несколько ниже — у формирующих ее венозных стволов грудной стенки. Непарную вену перевязывают
19 Зак. 0517
289
Рис. 122. Выделение непарной и верхней полой вен из конгломерата правых трахеобронхиальных лимфатических узлов.
1 — непарная вена; 2 — верхняя полая вена; 3 — правые трахеобронхиальные лимфатические узлы; 4 — культя переднего артериального ствола; 5 — культя вены верхней доли правого легкого.
и пересекают (рис. 122, 123). Затем медиастинальная плевра рассекается вверх до купола. Этим обеспечивается удобный доступ к правым трахеобронхиальным, паратрахеальным, преве-нозным группам лимфатических узлов. Слегка потягивая за культю правого главного бронха, выводя его в плевральную полость, удается надежно, под контролем зрения отделить клет-чаточный блок с регионарными лимфатическими узлами от верхней полой вены. Выполнению этого приема по югает оттеснение этого сосуда в медиальном направлении зажимом, наложенным на культю непарной вены у места ее
впадения в полую. Препаровка клетчатки вдоль верхней полой вены в верхних отделах завершается непосредственно у правой подключичной вены и проходящего здесь правого артериального плечеголовного ствола. Отдельные клетча-точно-фасциальные перемычки, идущие в направлении к правой надключичной области, пережимаются кровоостанавливающими зажимами, пересекаются и перевязываются. После отделения клетчаточного блока в глубине, за полой веной, становятся видимыми боковая стенка дуги аорты, а также огибающий подключичную артерию правый нижний гортанный
290
нерв. Завершается препаровка правых трахеобронхиальных, паратрахеальных и превеноз-ных групп лимфатических узлов отделением клетчатки, в которой они расположены, от переднебоковой стенки трахеи, а сзади — от ствола правого блуждающего нерва. При этом отдельные его легочные ветви пересекаются.
Следующим этапом вмешательства на средостении является препаровка претрахеальных, расположенных над бифуркацией трахеи, групп лимфатических узлов с лигированием проходящих здесь бронхиальных артерий. Препаровка в направлении от правого главного бронха к би
Рис. 123. Прошивание и пересечение непарной вены у верх= ней полой вены.
1 — непарная вена; 2 — культя переднего артериального ствола.
фуркации трахеи и начальным отделам левого главного бронха обеспечивает мобилизацию бифуркационных и верхних околопищеводных групп лимфатических узлов (рис. 124). После этого, отделяя клетчаточный блок с расположенными в нем регионарными лимфатическими узлами спереди — от заднего листка перикарда, а сзади — от передней поверхности пищевода, препаровку осуществляют вниз, к диафрагме, полностью удаляя околопищеводные группы лимфатических узлов. На завершающем этапе операции медиастинальная плевра восстанавливается наложением узловых швов.
19 *
291
Рис. 124. Препаровка бифуркационных и околопищевод-ных лимфатических узлов.
I — трахея; 2 — правый главный бронх; 3 — левый главный бронх; 4 — культя легочной артерии; 5 — культя верхней легочной вены; 6 — культя нижней легочной вены; 7 — культя непарной вены.
УДАЛЕНИЕ ВЕРХНЕЙ ДОЛИ
ПРАВОГО ЛЕГКОГО
При расположении опухоли в верхней доле, когда представляется возможным выполнить ее резекцию, операцию начинают с препаровки регионарных лимфатических коллекторов, расположенных в пределах легкого. При этом окончательное решение об объеме операции — правомочности выполнения верхней лобэктомии или необходимости в более обширной резекции — принимается после срочного гистологического изучения верхнедолевых (расположен
ных в основании бронха, дренирующего пораженную долю) лимфатических узлов и, особенно, верхних междолевых (рис. 125).
Препаровка и иссечение этих групп лимфатических узлов заметно облегчаются при предварительном выделении, перевязке и пересечении сосудов верхней доли. Это дает возможность хорошо осмотреть и с наибольшей безопасностью отпрепарировать прилежающие к междолевому стволу легочной артерии участки регионарного лимфатического коллектора.
Отсутствие метастазов в удаленных лимфатических узлах подтверждает обоснованность
292
и онкологическую целесообразность выполнения верхней лобэктомии. Препаровка верхних корневых и медиастинальных групп лимфатических узлов осуществляется по общим правилам и в объеме, описанном выше.
УДАЛЕНИЕ СРЕДНЕЙ ДОЛИ
ПРАВОГО ЛЕГКОГО
Изолированное удаление средней доли правого легкого при развитии в ней раковой опухоли производится не часто. Своеобразие оперативного вмешательства при этом определяется необходимостью точно определить границы
Рис. 125. Препаровка внутрилегочных лимфатических узлов.
1 — передний артериальный ствол; 2 — культя среднедолевого бронха; 3 — верхнедолевой бронх; 4 — верхнедолевой лимфатический узел.
бластоматозных изменений, степень вовлечения в процесс регионарных лимфатических коллекторов. Для этого необходимо оценить состояние внутрилегочных лимфатических коллекторов принимающих лимфу как от верхней, так и от нижней долей легкого. Как правило, выделение для исследования одного или нескольких верхних передних и нижних корневых лимфатических узлов не составляет особого труда. Вместе с тем удаление внутрилегочных лимфатических узлов, расположенных в основании долевых бронхов, а также верхних и нижних междолевых представляет некоторые особенности.
293
Рис. 126. Препаровка нижних междолевых лимфатических узлов правого легкого.
1 — верхняя доля; 2 — средняя доля; 3 — нижняя доля; 4 — базальная артерия; 5 — лимфатические узлы.
Для удаления лимфатических узлов в корне верхней доли средняя и верхняя доли отводятся кзади. При этом становятся видимыми магистральные сосуды. Ориентируясь на них, тупо и острым путем отделяют прилежащие к междолевому артериальному стволу, бронху и верхней легочной вене расположенные здесь лимфатические коллекторы.
Наибольшую сложность представляет удаление внутрилегочных лимфатических узлов, расположенных между средней и верхней долями (верхних междолевых), особенно ближе к корню средней доли. Это обусловлено прохождением здесь долевых сосудов. Для облегчения
этого этапа операции возможно предварительное удаление средней доли, что обеспечивает удобство доступа для препаровки лимфатических коллекторов.
Группа нижних междолевых лимфатических узлов после удаления средней доли препарируется вместе с нижними корневыми. Последние часто интимно спаяны с базальным стволом нижнедолевой артерии, и отделение их сопряжено с опасностью повреждения этого сосуда. В этих случаях целесообразно рассечь медиастинальную плевру над узлами и сместить лоскут ее кнутри, после чего становятся видимыми места близкого прилегания лимфатических
294
узлов и стенки базального ствола нижнедолевой артерии.
Отсутствие метастазов при срочном гистологическом исследовании в удаленных лимфатических узлах служит основанием для того, чтобы сохранить верхнюю и нижнюю доли. Медиастинальный этап операции выполняется по общим правилам.
УДАЛЕНИЕ НИЖНЕЙ ДОЛИ ПРАВОГО ЛЕГКОГО
После оценки протяженности опухолевого процесса, когда становится очевидной возможность изолированной резекции нижней доли, приступают к первому этапу операции — иссечению лимфатических узлов в корне легкого и- внутрилегочных (нижнедолевых и междолевых).
Особое внимание следует уделять препаровке нижних междолевых лимфатических узлов, прилежащих к нижнедолевой артерии и нередко достигающих ее междолевого ствола, где часто они интимно спаяны с ее адвентицией (рис. 126). Доступ к этой группе лимфатических узлов — междолевой. Он обеспечивается разделением на всем протяжении главной междолевой щели. Узлы располагаются в области корня, на нижнедолевой артерии. Осторожное, тщательное иссечение этой части регионарного лимфатического коллектора дает возможность сохранить междолевой артериальный ствол и артерию средней доли. После удаления этих узлов препарируют и иссекают узлы в области передней поверхности корня средней доли. Операция завершается иссечением передних и нижних корневых групп лимфатических узлов, широким удалением лимфатических узлов и клетчатки средостения.
УДАЛЕНИЕ ВЕРХНЕЙ И СРЕДНЕЙ ДОЛЕЙ ПРАВОГО ЛЕГКОГО
Своеобразие оперативного вмешательства при раке, выполняемого в таком объеме, заключается в тщательной препаровке внутрилегочных лимфатических коллекторов, регионарных для нижней доли. Иссечение нижнедолевых лимфатических узлов, расположенных в корне нижней доли, производится из междолевой щели. После разделения междолевой щели в корне нижней доли обнаруживается эта группа лимфатических узлов, расположенных в непосредственной близости с нижнедолевой артерией и чаще всего интимно спаянных с ней. Отделение группы лимфатических узлов от стенки артерии определяет наибольшую сложность этого этапа операции. Междолевые лимфатические узлы после этого удаляются.
После удаления пораженных опухолью верхней и средней долей правого легкого переходят к препаровке и иссечению медиастинальных отделов регионарных лимфатических коллекторов.
УДАЛЕНИЕ НИЖНЕЙ И СРЕДНЕЙ ДОЛЕЙ ПРАВОГО ЛЕГКОГО
В качестве одного из первых этапов операции при раке, включающей удаление нижней и средней долей правого легкого, производят препаровку корневых лимфатических узлов и узлов, расположенных между верхнедолевым и промежуточным бронхами, т. е. верхних междолевых. Тщательно препарируются также собственно верхнедолевые лимфатические узлы. Выполнение этой части операции облегчает выбор уровня резекции по промежуточному бронху, обработку ствола междолевой артерии.
После удаления нижней и средней долей выполняется широкая препаровка лимфатических узлов и клетчатки средостения.
УД ЗЛЕНИЕ ЛЕВОГО ЛЕГКОГО
Широкое удаление лимфатических узлов средостения, регионарных для левого легкого, заметно отличается от аналогичного этапа операции справа, что обусловлено особенностями анатомического строения этой области.
Медиастинальная плевра рассекается до купола плевральной полости между диафрагмальным и блуждающим нервами (рис. 127). При этом нередко требуется выделить, перевязать и пересечь полунепарную вену, идущую в поперечном направлении под плеврой средостения.
После широкого разведения краев рассеченной медиастинальной плевры создается удобный доступ к артериальной связке (заращенному артериальному протоку). Пересечение этого образования позволяет полностью, в пределах клетчаточных пространств, выделить и удалить лимфатические коллекторы, включающие преаортокаротидные, левые трахеобронхиальные, левые паратрахеальные группы лимфатических узлов (рис. 128). При выполнении этой части операции специальное внимание следует уделить препаровке блуждающего нерва выше и на уровне отхождения от него левой возвратной ветви. Последняя, огибая артериальную связку среди расположенных здесь лимфатических узлов (в том числе так называемого «узла боталлова протока»), далее направляется вдоль боковой поверхности трахеи.
Препарируя клетчатку по ходу внутренней поверхности дуги аорты, в «аортальном окне»,
295
1 4 2 7 5 3 6
Рис. 127. Препаровка преаортокаротидных лимфатических узлов. Рассечение медиастинальной плевры.
1 — диафрагмальный нерв; 2 — легочная артерия; 3 — аорта; 4 — верхняя легочная вена; 5 — возвратный нерв; 6 — блуждающий нерв: 7 — лимфатические узлы.
следует выделить и перевязать отходящую здесь бронхиальную артерию.
Технические приемы, используемые при препаровке бифуркационных и околопищеводных групп лимфатических узлов, существенно не отличаются от используемых при выполнении мециастинотомии справа. Своеобразие заключается лишь в том, что для обеспечения удобного доступа к этой части регионарных лимфатических коллекторов требуется дозированное отведение левых отделов сердца в медиальном направлении, что необходимо выполнять с помощью широкого эластичного ретрактора.
УДАЛЕНИЕ ВЕРХНЕЙ ДОЛИ ЛЕВОГО ЛЕГКОГО
Для решения вопроса о возможности и онкологической целесообразности выполнения частичной резекции легкого при раке верхней доли на начальном этапе операции следует убедиться в состоянии междолевой группы внутрилегочных лимфатических узлов. Выполняется разделение легкого по междолевой щели. Это обеспечивает доступ к междолевым лимфатическим узлам, которые осторожно отделяются
296
Рис. 128. Препаровка преаортокаротидных лимфатических узлов. Выделение артериальной связки.
1 — артериальная связка; 2 — культя легочной артерии; 3 — аорта; 4 — культя бронха; 5 — культя верхней легочной вены; 6 — культя нижней легочной вены; 7 — клетчатка с лимфатическими узлами; 8 — блуждающий нерв; 9 — возвратный нерв.
от нижнедолевой артерии и ее ветвей, отходя-щей здесь артерии язычковых сегментов (рис. 129). Препарируются и направляются для срочного гистологического исследования также корневые лимфатические узлы, расположенные между верхней и нижней легочными венами, и лимфатические узлы легочной связки. Убедившись в том, что бластоматозный процесс локализован пределами верхней доли, выполняется ее резекция с широким удалением лимфатических узлов и клетчатки средостения.
УДАЛЕНИЕ НИЖНЕЙ ДОЛИ
ЛЕВОГО ЛЕГКОГО
Как и при удалении верхней доли, предполагая выполнить нижнюю лобэктомию, вначале оценивают состояние внутрилегочных лимфатических коллекторов — междолевых и верхнедолевых лимфатических узлов.
Для иссечения в целях срочного гистологического исследования верхнедолевых лимфатических узлов, расположенных на передней поверхности верхнедолевого бронха и прикры-
297
Рис. 129. Препаровка внутрилегочных лимфатических узлов слева.
1 -— верхняя доля; 2 — нижняя доля; 3 — легочная артерия; 4 — артерия VI сегмента; 5 — базальные артерии; 6 — артерия язычковых сегментов; 7 — междолевые лимфатические узлы.
тых сверху стволом левой легочной артерии или ее ветвями, последние лопаточкой Буяль-ского несколько смещаются кверху. Расположенную здесь же верхнюю легочную вену оттесняют книзу. При этом становятся хорошо видны и доступы для препаровки клетчатка и лимфатические узлы, расположенные в области устья верхнедолевого бронха. При выполнении этой части операции следует учитывать, что часть лимфатических узлов имеет тесную связь с корневыми, а лимфатический коллектор в проксимальном направлении уходит под ствол легочной артерии.
Убедившись в том, что внутрилегочные и корневые группы лимфатических узлов, регионарные для верхней доли левого легкого, не поражены метастазами опухоли, выполняют нижнюю лобэктомию с широким удалением лимфатических узлов и клетчатки средостения.
УДАЛЕНИЕ ЛИМФАТИЧЕСКИХ УЗЛОВ НАДКЛЮЧИЧНЫХ ОБЛАСТЕЙ
В отдельных наблюдениях, при поражении метастазами рака легкого медиастинальных отделов лимфатических коллекторов, особенно
298
самых верхних из них — паратрахеальных, преаортокаротидных, превенозных — для повышения радикализма вмешательства на регионарном лимфатическом аппарате легкого возможно и целесообразно широкое удаление лимфатических узлов надключичных областей. При определении показаний к такого рода операциям нужно исходить из того, что между медиастинальными и надключичными лимфатическими коллекторами имеются обширные связи и с восходящим током большая часть лимфы поступает в эту область.
К подобному расширению объема операций побуждает также нередкое, часто изолированное, поражение метастазами рака легкого надключичных лимфатических узлов. Согласно данным А. Н. Матыцина (1963, 1969), при пре-скаленных биопсиях отмечено закономерное
Рис. 130. Препаровка клетчатки и лимфатических узлов правой надключичной области.
1 — внутренняя яремная вена; 2 — подключичная вена (частично); 3 — нижние глубокие яремные лимфатические узлы.
вовлечение в бластоматозный процесс внутри-грудных и надключичных лимфатических узлов, что согласуется с существующими представлениями о последовательности и этапности метастазирования рака легкого. Это было изучено и обосновано исследованием сотрудника нашей клиники Д. Сухээ (1972).
Удаление лимфатических узлов и клетчатки надключичных областей чаще всего выполняется спустя 10—12 сут после внутригрудного этапа операции, когда проведением детальных патогистологических исследований точно устанавливается распространенность бластоматозных изменений в легком, регионарных лимфатических коллекторах, особенно — в пределах верхних отделов средостения. Это дает возможность уточнить показания к выполнению шейной лимфаденэктомии.
299
Под наркозом в положении больного на спине, с неколько отведенной кзади головой, широким разрезом над ключицами открываются надключичные клетчаточные пространства с расположенными в них глубокими лимфатическими коллекторами шеи — конечным этапом продвижения лимфы перед впадением в венозную систему.
Выделяют и отводят кнаружи проходящую здесь лопаточно-подъязычную мышцу, пересекают наружную ножку грудиноключично-сосцевидной мышцы (рис. 130). Последовательно, в пределах границ клетчаточного пространства, препарируют расположенные здесь лимфатические коллекторы: вначале — ориентируясь на внутреннюю яремную вену, вдоль сосудистонервного пучка, до места формирования плечеголовной вены, затем — кнаружи по ходу подключичной вены и вверх — к трапециевидной мышце. Выделяются группы лимфатических узлов, расположенные вдоль поперечной артерии шеи, по ходу добавочного нерва. По задней поверхности клетчатку с лимфатическими узлами отделяют от лестничных мышц, стараясь не повредить плечевое нервное сплетение. Как правило, при этом в области венозного угла удается достичь верхних отделов средостения.
Операция завершается послойным зашиванием раны, дренированием ее с помощью отсоса (по Редону) в течение первых 2 сут.
Поражение метастазами надключичных групп лимфатических узлов — признак неблагоприятный, сокращающий возможности хирургического лечения больных раком легкого. Однако полагаем, что благоприятных отдаленных результатов у этой категории больных можно добиться в 8—10 % наблюдений. Вопрос требует дальнейшей разработки и накопления фактического материала.
КОМБИНИРОВАННЫЕ ОПЕРАЦИИ ПРИ РАКЕ ЛЕГКОГО
Под комбинированными операциями следует понимать такие, при которых, наряду с пораженным легким или его частью, производится резекция вовлеченных в опухолевый процесс анатомических образований, органов грудной полости и средостения [Петерсон Б. Е„ 1980]. При этом объем вмешательства на регионарном лимфатическом аппарате остается типичным и осуществляется в описанных выше онкологически обоснованных пределах. Оперативные вмешательства такого масштаба нередко вынужденно предпринимаются у больных с далеко зашедшими стадиями рака легкого.
Краевая резекция легкого. При периферическом расположении опухоли возможно вовле
чение в бластоматозный процесс плевры или паренхимы рядом расположенной доли легкого. Тогда, если при ревизии лимфатических коллекторов, образований корня легкого и средостения представляется возможным и обоснованным выполнение расширенной лобэктомии, в целях повышения радикализма вмешательства выполняется краевая резекция оставляемой части легкого. В зависимости от конкретной ситуации эта часть операции делается вначале или на завершающем ее этапе. При плоскостных атипичных резекциях зажим или прошивающий аппарат накладывается на подлежащую резекции часть доли легкого от края до края. Если длина аппарата не позволяет это сделать, то пережатие, прошивание и отсечение удаляемого участка производятся поэтапно. После отсечения пораженной части легочной ткани, прошитой с помощью аппарата (УКЛ-60), осуществляется дополнительная плевризация легкого 8-образными швами с помощью атравматических игл.
Резекция грудной стенки. Прорастание периферической опухоли легкого в грудную стенку требует выполнения расширенной резекции в комбинации с пораженными участками париетальной плевры, внутригрудной фасции, мышцами и ребрами. Для того чтобы операция была выполнена абластично, вовлеченный в опухолевый процесс участок грудной стенки иссекается вместе с легким одним блоком, без нарушения целости самой опухоли. При выполнении комбинированной операции такого типа вначале обрабатывают элементы корня легкого.
После пересечения сосудов и бронха легкое остается фиксированным лишь в той части, где опухоль прорастает в грудную стенку. Париетальную плевру, фасцию и мышцы грудной стенки отслаивают в пределах здоровых тканей и достигают поверхности соответствующих ребер. Ребра последовательно пересекают к зади (у позвоночника) и кпереди от опухоли, на удалении 5—6 см от видимых границ ее роста. Для того чтобы удалить опухоль в пределах заведомо здоровых тканей, следует резецировать, помимо явно пораженных участков ребер, также и фрагменты соседних с ними: по одному выше и ниже.
Аналогичным образом следует поступать и при опухоли типа Пенкоста — верхушечном варианте периферического рака легкого. Близость подключичных сосудов и образований плечевого нервного сплетения, выполнение тщательной, осторожной их препаровки составляют своеобразие и сложность комбинированной резекции такого типа.
Резекция диафрагмы. При прорастании опухоли нижней доли в диафрагму предпринимается ее резекция. При этом руководствуются
300
теми же правилами, что и при выполнении резекции грудной стенки. Значительная пластичность диафрагмы дает возможность иссекать большие ее участки, до 10Х 15 см, без особой сложности закрывая образовавшийся дефект.
В пределах неизмененных тканей мышечная часть диафрагмы прошивается двумя П-образ-ными швами, подтягивается в плевральную полость и рассекается. При этом разрез должен быть достаточным, чтобы обеспечить возможность ревизии пораженной части диафрагмы со стороны брюшной полости: следует убедиться, что бластоматозный процесс не переходит на нижерасположенные органы и образования (печень, надпочечники). Только после этого последовательно, в пределах здоровых тканей иссекается пораженная часть диафрагмы. Края ее дефекта сводятся с использованием провизорных швов-держалок, накладывается однодвухрядный шов. При этом важно убедиться в полной герметичности вновь сформированной грудобрюшной преграды, отсутствии дефекта для поступления плеврального экссудата в брюшную полость.
Резекция медиастинальной плевры с фрагментами диафрагмального и блуждающего нервов. При центральной локализации опухоли в легком, особенно перивазальном и периброн-хиальном ее росте, метастазировании в корневые и преперикардиальные группы лимфатических узлов, как правило, вместе с подлежащим резекции легким или его частью подлежит удалению участок медиастинальной плевры. При переходе опухолевого процесса на проходящие в области корня легкого спереди диафрагмальный, а сзади — блуждающий нервы предпринимается их резекция. Выше и ниже места поражения нервы с сопровождающими их кровеносными сосудами выделяют с помощью диссектора, перевязывают и пересекают. Медиастинальная плевра в этих случаях рассекается кпереди от диафрагмального нерва и кзади — от блуждающего. Мобилизованный таким образом ее участок вместе с фрагментами пораженных бластоматозным процессом нервов смещается к удаляемому легкому. После завершения операции дефект в средостении закрывают лоскутом париетальной плевры на широком основании, располагающемся у позвоночника. Это необходимо для разобщения плевральной полости и культи бронха в средостении.
Резекция перикарда. В том случае, если опухоль инфильтрирует стенки легочной артерии или вен, при наличии увеличенных, интимно спаянных с сосудами корневых лимфатических узлов, а также вовлечении в бластоматозный процесс перикарда показано его вскрытие, а при необходимости — широкое иссечение.
После рассечения перикарда нередко удается достаточно радикально оперировать больных раком легкого, вначале представляющихся неоперабельными. Если опухоль прорастает в сердечную сорочку, то пораженные участки перикарда должны быть широко иссечены. Образующийся при этом дефект в перикарде следует обязательно закрыть, так как в противном случае создается предпосылка для развития тяжелого осложнения — «вывиха» сердца в плевральную полость с резким нарушением его деятельности. Предложено много способов закрытия дефекта перикарда. Наиболее часто используется лоскут париетальной плевры, взятой на ножке или свободно вместе с вну-тригрудной фасцией. По нашему мнению, более удобным является использование для этой цели специальной антимикробной сетки («ампок-сен»), созданной в Народной Республике Болгарии [Василев Н. В. и др., 1982]. Подшитая по краю иссеченного перикарда, она надежно предохраняет сердце от перемещения, не препятствует его работе. К исходу двух лет после операции сетка полностью резорбируется, замещаясь соединительной тканью.
Резекция легочной артерии. При распространенном бластоматозном процессе даже вну-триперикардиальная обработка сосудов легкого бывает затруднительна. Особенно часто большие трудности возникают при обработке легочной артерии. Как показали наши наблюдения, чаще всего не оправданно стремление по возможности раньше перевязать и пересечь этот крупный кровеносный сосуд в расчете на то, чтобы несколько позднее, после удаления легкого, резецировать ее культю выше и по возможности дальше от видимых границ роста опухоли. Такой тактический прием таит большую опасность: недостаточно широко мобилизованная легочная артерия остается фиксированной у легкого конгломератами лимфатических узлов, а у общего легочного ствола — фасциальными образованиями и отчасти перикардом. В момент перевязки этот тонкостенный сосуд, находясь в натянутом состоянии, может быть рассечен лигатурой. Только осторожное, поэтапное выделение легочной артерии с пересечением артериальной связки (если операция предпринята при раке левого легкого) позволяет установить пределы ее поражения, а главное — без особого риска перевязать и пересечь.
При операциях на правом легком надежную культю легочной артерии можно сформировать, наложив лигатуру медиальнее верхней полой вены. Для этого верхнюю полую вену выделяют из окружающих тканей, мобилизуют и отводят кнаружи. Становится доступной правая легочная артерия непосредственно у места ее отхождения от общего ствола. Здесь с помощью дис
301
сектора под нее подводится лигатура и осуществляется перевязка. Если выделение ее медиальнее верхней полой вены затруднительно или задняя поверхность легочной артерии имеет широкое внеперикардиальное расположение и выделение ее представляет опасность, то целесообразно пересечь грудину в поперечном направлении, что дает возможность надежно— под контролем зрения и из хорошего доступа— выполнить этот прием.
Резекция легочных вен по предсердию. При перивазальном росте опухоли, а также переходе метастазов из пораженных лимфатических узлов на сосуды могут возникнуть трудности выделения вен легкого. Даже широкое рассечение перикарда не позволяет в этих условиях надежно, абластично обработать каждую из вен — верхнюю или нижнюю — отдельно. Выделение и мобилизацию этих сосудов выполняют выше — в проксимальном направлении — в месте формирования общего венозного ствола, непосредственно у предсердия. Перевязка широкого тонкостенного общего венозного ствола представляет значительный риск ввиду возможности прорезывания его лигатурой. Удобными являются подведение механического прошивателя ушка сердца, максимальное смещение его к предсердию или даже непосредственно на него (это определяется степенью местного распространения опухоли) и наложение здесь скрепочных швов.
С целью повышения их надежности еще до отсечения сосуда несколько проксимальнее, отступя 3—5 мм от первой линии швов, накладывают второй. Дополнительного укрепления при такой резекции двойной механический аппаратный шов не требует и является вполне надежным.
Резекция верхней полой вены. При поражении опухолью верхней доли правого легкого с метастазированием в медиастинальные группы лимфатических узлов в бластоматозный процесс нередко вовлекается также и верхняя полая вена. Чаще всего таким местом является уровень впадения в нее непарной вены. В подобной ситуации надо решить вопрос: отказаться от операции или предпринять резекцию верхней полой вены. Опыт клиники в этом направлении, анализ неудач оперативного лечения позволяют сдержанно отнестись к использованию сосудистых протезов и выполнению с их помощью реконструктивных вмешательств на верхней полой вене.
Изучение характера и особенностей паракан-крозных воспалительных изменений, сопутствующих развитию опухоли и ее метастазов в лимфатических узлах, показало, что у большинства больных с предполагаемым широким поражением верхней полой вены опухолью ис
тинное прорастание ее оказывается значительно меньшим по протяженности. Детальной препаровкой стенку вены чаще всего можно выделить из параканкрозных изменений в окружающих тканях, уточнить и локализовать границы роста опухоли, выполнить краевую резекцию с помощью аппаратного или ручного сосудистого шва. Следует отметить, что начинать препаровку верхней полой вены в подобной ситуации всегда следует со стороны неизмененных ее отделов: сверху — от места слияния плечеголовных вен, а снизу — от предсердия.
Резекция трахеи. Поражение трахеи при раке легкого может явиться следствием прорастания опухоли со стороны главного бронха, а также распространения метастазов из бифуркационных или трахеобронхиальных лимфатических узлов. Предварительное широкое удаление лимфатических узлов и клетчатки средостения дает возможность точнее оценить и локализовать распространенность бластоматозных изменений в области трахеи, мобилизовать ее. При поражении боковой стенки трахеи разрез проводят от киля бифуркации кверху, на 1 — 1,5 см выше края опухоли. Центральнее уровня предполагаемого разреза на боковую стенку трахеи и на область бифуркации накладывают узловые швы-держалки. Фиксируя и выводя за швы-держалки трахею в рану, пересекают вначале переднюю, а затем заднюю ее стенки. Дефект ушивают узловыми швами, которые сближают переднюю и заднюю стенки трахеи. Если после иссечения пораженных участков образуется дефект, закрыть который с помощью обычных швов, не рискуя вызвать стеноз трахеи, невозможно, то используются подшивание к стенке трахеи внутреннего края устья противоположного главного бронха и восстановление целости воздухоносных путей таким образом. При переходе опухоли на киль бифуркации трахеи у больных может быть выполнена пневмонэктомия с резекцией бифуркации.
Резекция пищевода. Топографо-анатомическая близость нижних долей легких к пищеводу, метастазирование опухоли в бифуркационные и особенно околопищеводные группы лимфатических узлов с выходом за их пределы нередко обусловливают вовлечение этого органа в бластоматозный процесс. При подобном распространении рака легкого оперативные вмешательства выполняют в комбинации с резекцией мышечной части стенки пищевода. Протяженность таких резекций может достигать 7—8 см. Образующийся дефект без особого труда закрывается узловыми швами. Особенности кровоснабжения различных слоев стенки пищевода обусловливают при неповрежденной слизистой оболочке хорошее заживление таких обширных дефектов мышечной его части.
Глава ± САРКОМА ЛЕГКИХ
Мезенхимальный компонент структуры легкого редко служит местом развития бластоматозного процесса, который чаще своим источником имеет эпителиальные элементы бронхов и бронхиол. Вероятно, это в какой-то степени связано с более частым воздействием онкогенных факторов непосредственно на эпителиальные структуры, в то время как мезенхимальные образования защищены эпителиальным покровом и, будучи тесно связанными с кровеносными и лимфатическими сосудами, подвергаются воздействию экзогенных факторов онкогенеза опосредованно. Не отмечено влияния на частоту первичных сарком легкого пола, курения, действия проникающей радиации, и предполагается наиболее вероятным влияние эндогенного предрасположения к возникновению бластоматозного процесса и злокачественному перерождению доброкачественных новообразований (фибром). Роль травмы в генезе первичных сарком легкого дискутабельна [Gebauer Chr.,. 1978, 1979].
Первое подробное описание первичной саркомы легких относится к 1856 г. [Poisson, Robin].
В отечественной литературе первое сообщение об этом заболевании принадлежит М. А. Львову (1899), наблюдавшему первичную саркому легких у 46-летнего больного. К 1979 г. в мировой литературе опубликовано около 500 случаев первичной саркомы легкого [Eskenasy А., 1979], но данные о частоте этого заболевания довольно разноречивы. Так, Mallory (1936) обнаружил один случай первичной саркомы легкого на 8000 вскрытий, Ellis (1939) — на 7282 вскрытия, a Jitu Vasilin, Damello — на 9000 вскрытий. По отношению к саркомам других локализаций первичная саркома легких составляет менее 2 % [Денисова О. П. и др., 198Ц.
Наиболее крупная работа о первичной саркоме легких в нашей стране была выполнена в Институте клинической и экспериментальной хирургии [Бабашев Б. С., 1971], где в период с 1956 по 1970 г. наблюдалось 40 больных этим заболеванием. Внедрение в широкую врачебную практику оперативных методов лечения
заболеваний легких и плевры несколько изменило представления о частоте первичной саркомы легких и показало, что это заболевание может возникнуть в любом возрасте и наблюдается значительно чаще, чем это предполагалось ранее. По отношению к раку легкого частота первичной саркомы этого органа, по данным отечественных авторов, колеблется в пределах от 1 на 100 случаев рака легкого [Лукомский Г. И. и др., 1960] до 1 на 20 [Бабашев Б. С., 1971]. Возможной причиной таких различий в частоте первичной саркомы легких являются нередкие трудности морфологической диагностики источника и характера бластоматозного процесса. Кроме того, некоторые авторы (Б. С. Бабашев) к саркоме легких относят и болезнь Бенье—Бека, что вряд ли обоснованно в свете современных представлений о сущности этого заболевания.
A. Eskenasy (1979) опубликовал сообщение о 118 больных первичной саркомой легкого, наблюдавшихся в отделении торакальной хирургии Научно-исследовательского института туберкулеза в Бухаресте. Он отмечает, что количество случаев первичной саркомы легкого увеличивалось параллельно числу больных раком легкого, но соотношения между этими злокачественными новообразованиями оставались постоянными, составляя 1:(304-35) в течение 30-летнего периода.
По опыту нашей клиники, охватывающему более 1000 гистологически исследованных препаратов легких, удаленных по поводу злокачественных новообразований этого органа, первичная саркома легкого была обнаружена лишь у 4 больных, несмотря на то, что все гистологические исследования проводились высококвалифицированными морфологами. Такое положение отражает трудности и разноречивость в трактовке морфологических данных в поздних стадиях развития опухолевого процесса, что обнаруживалось у подавляющего большинства больных, оперированных за этот период в клинике. Многие случаи, первоначально принимавшиеся за саркому легких, при углубленном морфологическом исследовании оказывались недифференцированным раком легкого.
Классификация. Предложен ряд классификаций первичной саркомы легкого, основанных
303
на различных классификационных признаках, однако общепризнанной единой классификации этого заболевания до настоящего времени нет. Б. С. Бабашев (1971) на основании анализа данных литературы и 40 собственных наблюдений предложил классификацию, учитывающую морфологические и клинико-рентгенологические критерии. Это первая попытка создания классификации, охватывающей практически все формы саркомы легких и выгодно отличающейся полнотой и критериями различий, что имеет практическое значение.
Морфологическая классификация первичной саркомы легких [Бабашев Б. С., 1971]
По характеру и форме роста опухоли: Шаровидная (периферическая, центральная). Инфильтративная (центральная, периферическая, пери-бронхиальная, параваскулярная).
Эндобронхиальная (диффузная, полиповидная).
По гистологическим признакам:
Дифференцированные саркомы легких (ангиосаркома, хондросаркома, лимфосаркома, нейросаркома, миксосар-кома, ретикулосаркома, лейомиосаркома и др.).
Недифференцированные саркомы легких (круглоклеточная, веретенообразно-клеточная, полиморфно-клеточная).
Смешанная саркома легких (карциносаркома).
Первичная саркома плевры.
Саркоидоз легких (болезнь Бенье — Бека)
Клинико-рентгенологическая классификация первичной саркомы легких [Бабашев Б. С., 1971]
Локализация
Периферическая шаровидная саркома легких
Центральная саркома легких (шаровидная, пнев-моподобная, полиповидная)
Патогенетическая характеристика
I стадия. Стадия местного инкапсулированного экспансивного роста
II стадия. Осложнения, связанные с опухолевым ростом (периферический и центральный распад опухоли, компрессионные ателектазы, бронхоэктазы)
III стадия. Опухолевый рост переходит в инфильтративную стадию (прорастание опухоли в плевру, диафрагму, ребро, пищевод, перикард) и метастазирует в регионарные бронхопульмональные лимфатические узлы
IV стадия. Кроме указанных выше местных проявлений имеются отдаленные метастазы
I стадия. Местный ограниченный опухолевый процесс
II стадия. Инфильтративный рост и деструкция опухоли, прорастание и закупорка бронха с последующим образованием ателектазов
III стадия. Опухоль .прорастает в органы средостения, имеются регионарные метастазы в лимфатические узлы средостения
IV стадия. Обширное метастазирование в отдаленные органы, геморрагический плеврит
Первичная саркома плевры
Саркоидоз легких (бо-
лезнь Бенье — Бека)
ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ ПЕРВИЧНОЙ САРКОМЫ ЛЕГКИХ
В большинстве случаев первичная саркома легких имеет вид массивного опухолевого узла, занимающего часть или всю долю легкого, нередко поражая и все легкое. Опухоль может быть отграниченной от окружающих тканей вследствие ее экспансивного роста, но может и инфильтрировать их, прорастая в крупные бронхи. Определение исходной ткани, в которой первоначально возник очаг саркоматозного роста в легком, нередко весьма затруднительно, и суждения по этому вопросу довольно разноречивы. Так, Lorbek (1955) считает первичную саркому легкого происходящей из саркомы бронха, различая эндобронхиальные саркомы (фибросаркомы) и саркомы, инфильтрирующие в легочную ткань (легочная саркома). Макроскопическое различие этих видов сарком возможно лишь в ранних стадиях заболевания. Отмечено также, что при истинных первичных саркомах легкого метастазирование и генерализация процесса происходят медленнее, чем при раковом поражении этого органа.
Наиболее часто, особенно при локализации в периферических отделах легкого, патологические изменения имеют вид шаровидного образования, иногда достигающего больших размеров, нередко отчетливо отграниченного от окружающей паренхимы. Инфильтративный рост опухоли наблюдается значительно реже, и в основе его лежит распространение бластоматозного процесса на перибронховаскулярные структуры долевых бронхов. В этих случаях опухоль нередко прорастает в грудную стенку, клетчатку и лимфатические узлы средостения. Что касается гистогенеза первичных сарком легких, то в ряде случаев не исключается возможность трансформации рака легкого в саркомоподобные разрастания (карциносаркомы), причем метастазы таких опухолей могут иметь строение как рака, так и саркомы. Однако многие авторы источником развития таких сарком считают межальвеолярную соединительную ткань.
При гистологическом исследовании препаратов при всех видах первичной саркомы легкого отмечается выраженная связь морфологической структуры опухоли с кровеносными
304
капиллярами. Обычно имеется и обилие новообразованных сосудов, ограниченных эндотелием, однако фибробластическая дифференциация ретикулярных элементов иногда настолько интенсивна, что приводит к фибросаркоматозным разрастаниям [Бабашев Б. С., 1971J. При гистологическом исследовании препаратов, полученных из опухоли легкого, удаленного во время операции или при патологоанатомическом вскрытии, что обычно производится уже в поздних стадиях развития бластоматозного процесса, определить структурные элементы, послужившие первоисточником опухолевого роста, весьма трудно, а часто и невозможно. Поэтому термин «ангиосаркома легких» до известной степени является понятием собирательным, объединяющим все саркомы легкого, первоначально исходящие из различных элементов стенки кровеносных сосудов. Возможно, по этой причине ангиосаркома является наиболее частым видом первичной саркомы легких.
Следующей по частоте указывается фибросаркома легких, исходящая из соединительнотканных элементов бронхов или перибронхиаль-ных тканей. По своей структуре первичная фибросаркома легкого обычно состоит из фибробластических элементов и простых коллагеновых волокон. Далее по частоте следуют первичные лимфосаркомы легких, исходящие из лимфатических узлов бронхолегочной системы.
Нейросаркомы, хондросаркомы и другие виды дифференцированных и недифференцированных первичных сарком легкого встречаются значительно реже.
Особое место среди первичных сарком легкого занимает карциносаркома. Этот вид саркомы, по данным литературы [Черемных А. А., 1976, 1983; Diaconta J., 1978, и др.], встречается крайне редко. Как указывалось выше, опухоль характеризуется одновременным сочетанием мезенхимального и эпителиального компонентов, обычно при неоднородном клеточном составе. Эпителиальные участки опухоли представлены часто очагами мелкоклеточного недифференцированного или эпидермоидного рака, иногда с выраженными признаками кера-тинизации. Опухоль может содержать хондроидную, остеоидную и пластинчатую костную ткань. Значительно реже встречаются участки железистого рака. Саркоматозный (мезенхимальный) компонент опухоли весьма разнообразен. Чаще всего формируются структуры фибросаркомы. Описаны опухоли, в которых раковая ткань имела местами строение аденокарциномы, местами — плоскоклеточного рака, местами — мелкоклеточного рака, и наряду с этим основная тканевая масса новообразования имела строение веретеноклеточной саркомы.
Макроскопически карциносаркома представлена узлом различной величины: 2,5Х4Х8 см [Федотова А. П. и др., 1983], 5X6X8 см [Черемных А. А., 1983], интимно связанным со стенкой бронха, который она прорастает, обтурируя или сдавливая его просвет. Одной из разновидностей карциносарком является полиповидная интрабронхиальная опухоль. Чаще она возникает в крупных бронхах и хорошо выявляется при бронхобиопсии. Взятый биоптат позволяет диагностировать сложную опухоль. Растут эти опухоли медленно, экзофитно, хотя могут иметь и эндофитный рост и легко кровоточат.
Прогноз при карциносаркоме легкого более благоприятный, чем при бронхогенном (легочном) раке. Метастазируют опухоли и рецидивируют в пределах грудной полости.
Отмеченная выше закономерность частоты отдельных видов первичных сарком легких прослеживается во всех более крупных статистических данных. Так, из 40 больных, описанных Б. С. Бабашевым (1971), ангиосаркомы были у 12, фибросаркомы — у 8, лимфосаркомы — у 8, нейросаркомы — у 2, хондросаркомы — у 3, кропноклеточные саркомы — у 3, веретенообразные саркомы — у 3, полиморфноклеточные саркомы — у 2. Из 118 случаев первичной саркомы легкого, опубликованных A. Eskenasy (1979), эндотелиосаркомы и ретику-лоэндотелиосаркомы (т. е. опухоли, входящие в группу ангиосарком) были у 40 больных, гисто-и ретику логистиоцитарные саркомы — у 18 больных, гемангио- и гемангиоперицитосарко-мы — у 5, фибробластические саркомы — у 33, полиморфно-клеточные — У 7, лимфоидно-клеточные — у 10 и лимфосаркомы — у 5 больных.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
Клинические проявления первичной саркомы легких аналогичны симптоматике рака легкого и имеют мало специфических признаков. Истинная природа патологических изменений в легких часто выясняется при длительном безуспешном лечении предполагавшейся пневмонии, или гомогенное затенение в легких обнаруживается случайно при профилактических осмотрах и флюорографии.
В клинике первичной саркомы легких нередко на первый план выступают не симптомы поражения этого органа, а остеоартропатии в виде прогрессирующего утолщения костей конечностей, периоститов, полиневритов, увеличения объема и болезненности чаще в голеностопном и лучезапястном суставах (синдром Мари — Бамбергера). Причины таких системных пораже
20 Зак. 0517
305
ний недостаточно выяснены: предполагают, что в их происхождении имеют значение интоксикация, гипоксемия, эндокринные нарушения и воздействия других факторов, так как эти поражения не являются специфичными для первичной саркомы легких и наблюдаются при ряде других заболеваний.
Изменения в периферической крови могут отсутствовать или выражаться в виде анемии, увеличенной СОЭ, лейкоцитоза. Большое значение придается изменению тромбоцитарной формулы периферической крови, в которой отмечается увеличение числа старых форм кровяных пластинок [Углов Ф. Г., 1962; Бабашев Б. С., 1971].
Большое значение в диагностике первичной саркомы легких имеет рентгенологическое исследование. Рентгенологические признаки заболевания зависят от локализации опухоли (центральная, периферическая), наличия или отсутствия сопутствующих изменений и осложнений (ателектаз, воспаление в окружающей паренхиме легкого, метастазы), характера ее роста (эндобронхиальный, перибронхиальный, внутрилегочный). Рентгенологическое исследование в этих случаях должно быть комплексным и, помимо рентгенотомографии, нередко включающим и ангиопульмонографию. Дифференцированные саркомы (за исключением мик-сосаркомы, ретикулосаркомы, ангиосаркомы и лимфосаркомы, которые отличаются быстрым ростом и ранним метастазированием) растут преимущественно экспансивно и медленно, причем метастазирование этих опухолей возникает лишь в поздних стадиях развития новообразования. Описаны случаи, когда первичная саркома легких распознавалась при гистологическом исследовании кусочков опухолевых масс, отошедших с мокротой при кашле или цитологическом исследовании мокроты, плевральной жидкости при III—IV стадиях развития бластоматозного процесса.
Недифференцированным саркомам легких, за исключением веретенообразно-клеточной, свойственны быстрый инфильтрирующий рост и раннее метастазирование.
Периферические саркомы в I стадии, как правило, бессимптомны и обнаруживаются случайно при профилактических обследованиях. В последующих стадиях развития саркомы появляются клинические симптомы, обусловленные механическим давлением и ростом опухоли, имеющим обычно инфильтративный характер. В этих стадиях опухоль нередко прорастает в прилегающие органы и анатомические образования (пищевод, трахею, крупные кровеносные сосуды, грудную стенку, клетчатку средостения, перикард и др.), что проявляется соответствующими клиническими симптомами.
Клинико-рентгенологическая симптоматика центральной саркомы легкого аналогична клинической картине первичного рака легкого. Она во многом определяется размерами и характером роста опухоли (эндобронхиальный, перибронхиальный, внутрилегочный). При центральной саркоме III стадии иногда на первый план выступают не симптомы поражения легкого, а клинические признаки распространения бластоматозного процесса на соседние органы в виде дисфагии, синдрома сдавления верхней полой вены, геморрагического перикардита, геморрагического плеврита и т. д.
В процессе клинико-рентгенологического обследования должна быть проведена дифференциальная диагностика первичной саркомы легкого с эхинококкозом, раком легкого, ту-беркуломой и непаразитарными кистами. Реже возникает необходимость дифференциальной диагностики центральной саркомы со злокачественной или доброкачественной тимомой.
ЛЕЧЕНИЕ
Основной метод лечения первичных сарком легкого — оперативный, что обосновывается отсутствием метастазов почти у половины больных, подвергающихся оперативному вмешательству. Однако с позиций современной онкологии основным принципом лечения больных первичной саркомой легких должна быть комплексная терапия, т. е. сочетание оперативного вмешательства с лучевой и химиотерапией.
В зависимости от положений и стадии саркомы операция состоит в лобэктомии или пневмонэктомии, причем многие авторы отмечают, что отдаленные результаты оперативного лечения первичных сарком легкого значительно лучше, чем рака такой же локализации. Так, Б. С. Бабашев (1971) сообщает о 30 оперированных больных; только 3 из них произведена пневмонэктомия, 17 — лобэктомия и 2 — сегментарные резекции. У 8 оперированных больных опухоль оказалась неоперабельной. Из числа больных, у которых произведено радикальное оперативное вмешательство, через 5 лет были живы после пневмонэктомии 2 человека, после лобэктомии — 3 и после сегментарной резекции один больной жил более 2 и один— более 4 лет. На основании анализа данных литературы и собственных наблюдений Б. С. Бабашев рекомендует пользоваться следующими критериями для определения объема оперативного вмешательства по поводу первичной саркомы легкого.
— при периферической шаровидной саркоме легких I и II стадии показана лобэктомия;
— при периферической шаровидной саркоме
306
легких III стадии — расширенная лобэктомия, билобэктомия или пневмонэктомия;
— при прорастании опухоли в соседние органы и анатомические структуры — комбинированная резекция легких с удалением пораженной части органа, в который прорастает опухоль;
— при центральной саркоме легких I—II стадии — расширенная пневмонэктомия с удалением лимфатических узлов средостения.
A. Eskenasy (1979) сообщает об оперативном лечении 112 из 118 наблюдавшихся им больных первичной саркомой легкого. У 45 — была выполнена пневмонэктомия, у 33 — лобэктомия и у 34 — атипичная резекция легкого или операционная биопсия. Отдаленных результатов не приводится.
Анализ данных литературы позволяет счи-та гь, что прогноз при первичной саркоме легких „зависит не только от ее гистологической структуры, но и от локализации опухолевого очага в легких, степени вовлечения в бластоматозный процесс плевры, средостения и грудной стенки.
При рецидиве саркомы легкого оправдано повторное оперативное вмешательство.
Среди сарком легких выделяется в отдельную патологическую форму полипоидная саркома ствола легочной артерии, впервые описанная Mandelstamm в 1923 г. В отечественной литературе об этом заболевании сообщал С. В. Рыжков (1957). К 1980 г. в мировой литературе имелись сообщения о 60 таких наблюдениях.
Источником образования опухоли являются клапаны легочной артерии или ее стенки как в области ствола, так и правой или левой легочных артерий. Однако определить первичный источник опухолевого роста часто невозможно, так как макроскопически опухоль имеет вид полипообразного образования, тесно связанного с клапанами легочной артерии или ее основанием, распространяясь довольно часто на правую и левую легочные артерии. Во многих случаях опухоль прорастает адвентицию легочной артерии и проникает в аорту, ткани эпикарда и средостения, давая метастазы в паренхиму легких и лимфатические узлы. Отдаленные метастазы (поджелудочная железа, головной мозг, надпочечник и др.) возникают значительно реже. Инфильтрация полулунного клапана легочной артерии, форма опухоли, напоминающая боль
шой палец кисти, и полипоидный ее вид являются характерными признаками, позволяющими заподозрить описываемое новообразование уже при макроскопическом исследовании. Другими макроскопическими критериями диагноза являются: 1) рост опухоли из полулунного клапана или ствола легочной артерии; 2) отсутствие первичной саркомы костей, мышц и других мягких тканей или лимфатических узлов; 3) отсутствие первичных опухолей, от которых могли бы идти метастазы к стволу легочной артерии [Bieisch V. R., Kraus F. Т., 1980].
Микроскопическая картина полипоидной саркомы ствола легочной артерии весьма разнообразна, но наиболее часто характеризуется признаками недифференцированной саркомы, лейомиосаркомы, миосаркомы, фибросаркомы и мик-сосаркомы.
Описаны также и рабдомиосаркомы этой локализации. V. R. Bleisch и F. Т. Kraus считают возможным отнести полипоидные саркомы ствола легочной артерии к мезенхимальным саркомам.
Клинические проявления полипоидной саркомы ствола легочной артерии весьма вариабельны, но наиболее частыми симптомами являются: одышка, боли в груди, кровохарканье, систолический шум без четкой локализации в прекар-диальной области и цианоз. Среди больных преобладают люди пожилого (50—55 лет) возраста, преимущественно женщины. Продолжительность симптомов заболевания может быть от нескольких месяцев до 20 лет. Наиболее информативной является рентгеноконтрастная ангиокардиопуль-монография, при которой обнаруживаются дефекты наполнения в стволе легочной артерии или главных ее ветвях. Однако прижизненная диагностика заболевания остается весьма трудной и оказывается возможной примерно лишь у 1 /4 больных.
Основной метод лечения оперативный в сочетании с последующей химиотерапией. При выполнении оперативного вмешательства рекомендуется учитывать эмбриологические особенности этого отдела сосудистого русла и возможность очагов опухолевого роста в нескольких участках. Прогноз заболевания следует признать неблагоприятным, так как подавляющее большинство больных погибает в течение года после появления описанных выше симптомов.
Глава
16
ДОБРОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ И КИСТЫ ЛЕГКИХ
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ЛЕГКИХ
Доброкачественные опухоли легких, представляющие собой обширную группу новообразований, различных по происхождению, относятся к числу редко встречающихся заболеваний, составляя от 7 до 10 % всех опухолей этой локализации [Перельман М. И. и др., 1981].
К доброкачественным относят несколько типов опухолей легких, что обусловлено особенностями их гистогенеза. Однако, несмотря на различия гистологического строения, все они характеризуются медленным, на протяжении многих лет, ростом, отсутствием или минимальными клиническими проявлениями заболевания в течение длительного времени, до возникновения осложнений, максимальным морфологическим сходством с тканями, из которых они произошли, отсутствием или большой редкостью озлокачествления.
В настоящее время в клинической практике применяется классификация доброкачественных опухолей легких, основанная на принципах анатомического, гистологического и клинического подходов, одобренная в 1973 г. на заседании пульмонологической секции Хирургического общества Москвы и Московской области [Ефимов Б. И., Бирюков Ю. В., 1973]. По этой классификации доброкачественные опухоли легких группируются следующим образом.
I. Анатомические особенности:
а) центральные опухоли (эндобронхиальные и экс-трабронхиальные);
б) периферические опухоли (субплевральные и глубокие).
II. Гистологическое строение:
а) эпителиальные опухоли (аденомы, папилломы);
б) нейроэктодермальные опухоли (невриномы, нейрофибромы),
в) мезодермальные опухоли (фибромы, липомы, миомы, сосудистые, гистиоцитомы, ксантомы);
г) дизэмбриогенетические опухоли (гамартомы, тератомы).
III. Особенности клинического течения:
а) центральные опухоли: бронхостеноз I—II степени, клапанный бронхостеноз, окклюзия бронха;
б) периферические опухоли: бессимптомное течение, начальные клинические проявления, выраженные клинические проявления;
в) осложнения (для опухолей всех локализаций); пневмофиброз, ателектаз, бронхоэктазии, абсцедирующая пневмония, компрессионный синдром, кровотечение, малигнизация, метастазирование.
Достоинством приведенной классификации является то, что формулируемый в соответствии с ней развернутый диагноз доброкачественной бронхолегочной опухоли обязательно предполагает четкое определение центральных и периферических форм, гистологической структуры, а также ведущих клинических проявлений (включая осложнения).
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
И ДИАГНОСТИКА
Своеобразие развития доброкачественных опухолей легких составляет большие трудности для диагностики и дифференциальной диагностики, в первую очередь со злокачественными опухолями.
Доброкачественные опухоли наблюдаются одинаково часто у мужчин и женщин. Чаще всего их распознают у лиц молодого возраста — до 30—35 лет. Наиболее важным, но не всегда доступным для оценки признаком является значительный срок с момента появления первых признаков заболевания, особенно если диагноз был поставлен рентгенологически.
Симптомы доброкачественных опухолей легких многообразны. Они зависят от расположения опухоли, направленности ее роста, степени нарушения бронхиальной проходимости, а иногда — своеобразным воздействием продуктов метаболизма на течение общих обменных процессов в организме больных.
Кашель при развитии опухоли в долевых или главных бронхах встречается у 80—82 % больных. Обычно он существует длительное время, часто мало беспокоит. Его обычно долго объясняют явлениями «хронического бронхита», повторными «респираторными заболеваниями».
Если опухоль не нарушает проходимости бронхиального дерева, то мокрота с кашлем
308
почти не отделяется или бывает скудной, слизистой. По мере роста опухоли, нарушения проходимости бронха, наряду с усилением кашля, увеличивается и количество мокроты, изменяется ее характер, она становится гноевидной.
Повышение температуры тела при доброкачественных опухолях является следствием воспалительной реакции в легком из-за нарушений дренажной функции бронхов, присоединения инфекции. Если при этом сохраняется частичная проходимость бронха, дренирующего пораженный участок легкого, то такие эпизоды или периоды лихорадочных реакций могут самостоятельно или под воздействием противовоспалительного лечения проходить. Повторную лихорадку на протяжении ряда лет диагностируют как «хроническую пневмонию».
Одышка обычно сопутствует полному нарушению бронхиальной проходимости вследствие увеличения опухоли до значительных размеров. Степень дыхательных расстройств может быть различной, что определяется объемом «выключенной» из участия в вентиляции части легкого. Одышка является одним из поздних признаков болезни, когда и другие симптомы становятся более отчетливыми.
Боли в груди пои доброкачественных опухолях легких могут беспокоить «без видимых причин» на протяжении длительного времени. Чаще всего, однажды появившись, они носят постоянный характер, становятся «привычными», возникающими в ответ на придание определенного положения телу, некоторые виды физической нагрузки. Локализация таких болей неопределенна. Зачастую их расценивают как проявление «коронарной недостаточности», «остеохондроза позвоночника», «межреберной невралгии», «спаечного процесса в плевральной полости» и т. п.
Кровохарканье — не частый, но всегда вызывающий большое беспокойство у больных признак опухолевого роста. При доброкачественных опухолях первое кровохарканье может возникнуть в виде легочного кровотечения, подчас неожиданного, на фоне полного благополучия. Это настойчиво побуждает к проведению специального обследования.
Ведущими методами из используемых в специализированных лечебных учреждениях при обследовании больных доброкачественными заболеваниями легких являются рентгенологические и эндоскопические.
Несмотря на многообразие видов доброкачественных опухолей легких, для многих из них при проведении внимательного клинического и инструментального обследования можно выявить патогномоничные признаки, которые помогут установлению диагноза и решению вопроса о хирургическом лечении.
Аденома бронха (аденоид, базально-клеточная карцинома, карциноид, цилиндрома) среди доброкачественных опухолей встречается наиболее часто — в 60—65 % наблюдений. Описано 4 основных типа аденом бронхов: карциноидный, цилиндроматозный, мукоэпидермоидный и смешанный (сочетающий в себе признаки карциноидного и цилиндроматозного типов).
По вопросу о гистогенезе аденом существуют различные мнения. Наши наблюдения [Эль-Шарех М„ 1970] в основном подтверждают точку зрения R. Willis (1960), согласно которой аденомы происходят из слизистых желез бронхов. Нередкое формирование железистых трубок, иногда со слизистым содержимым, также говорит о генетической связи аденомы со слизистыми железами.
Начиная развиваться в толще бронхиальной стенки, аденомы чаще всего растут экспансивно в просвет бронха, отодвигая слизистую оболочку, но не прорастая ее. В дальнейшем, при полной закупорке просвета бронха сдавление слизистой оболочки приводит к ее атрофии, а иногда и полному исчезновению. Значительно реже отмечается рост опухоли кнаружи (экст-рабронхиальные формы). При этом опухоль растягивает наружные слои бронхиальной стенки, которая атрофируется. Этому может способствовать свойство аденомы инфильтрировать стенку, тем самым разрыхляя и разрушая ее.
Эндобронхиальный рост аденомы ведет к нарушению проходимости бронха вплоть до полного закрытия его просвета, что сопровождается развитием ряда патологических процессов — ателектаза, хронической пневмонии с частыми обострениями, нагноения, пневмосклероза, бронхоэктазий.
М. И. Перельман и соавт. (1981) указывают, что особой разновидностью аденом является рост их в виде гантели, песочных часов или айсберга, когда эндобронхиальная и экстраброн-хиальная части опухоли разделены перетяжкой между разрушенными и раздвинутыми бронхиальными хрящами.
Наиболее часто размеры аденом составляют 2—3 см в поперечнике. Поверхность их гладкая, иногда мелкобугристая, розовато-красного цвета. Периферические аденомы обычно имеют выраженную капсулу.
Микроскопически аденомы имеют строение мукоэпидермоидных опухолей, цилиндроматозных и смешанных, в которых сочетается строение карциноидов и цилиндром.
Аденомы карциноидного типа развиваются из низкодифференцированных клеток, так называемых клеток Кульчицкого, имеющих отношение к нейроэндокринным клеткам нейроэктодермального происхождения. Их характерными свойствами являются накопление пред
309
шественников биогенных аминов с последующим их декарбоксилированием и выработкой биологически активных производных (адреналин, серотонин, мелатонин и т. д.), а также поли-пептидных гормонов. Система нейроэндокринных клеток, рассеянных по организму человека, названа APUD-системой — по первым буквам английских слов Amin Precursore Uptake and Decarboxylation. Клетки APUD-системы встречаются как в эндокринных железах, так и в различных органах, не имеющих специфической эндокринной функции: желудочно-кишечном тракте (энтерохромаффинные клетки), параганглиях (каротидный гломус, тельца в области дуги аорты и ее бифуркации), бронхах (аргентаффинные клетки).
Клинические проявления аденомы зависят от локализации опухоли, степени нарушения бронхиальной проходимости, выраженности развившихся осложнений.
Секреция опухолью гормонов и других активных веществ, характерные нарушения в организме больных, не связанные с прямым механическим действием аденомы, проявляются в виде карциноидного синдрома. Он характеризуется периодически возникающими приливами крови к лицу, шее, голове, появлением розовато-красных пятен на коже лица, приступом болей в животе, частым водянистым стулом, развитием астмоидных приступов, резкими колебаниями артериального давления. У женщин при аденомах бронха в период гормональных изменений, связанных с месячными циклами, может наблюдаться кровохарканье.
Следует отметить, что при развитии опухоли в бронхе карциноидный синдром встречается в 4—5 раз реже, чем это бывает при карциноидах желудочно-кишечного тракта.
Основные же клинические симптомы при аденоме бронха обусловлены главным образом нарушением бронхиальной проходимости и вторичным неспецифическим воспалительным процессом в тех отделах легкого, которые аэрируются пораженным аденомой бронхом. Реже на первый план выступают нарушения, связанные с изъязвлением и некрозом слизистой оболочки бронха над опухолью, ведущие к кровохарканью.
У подавляющего большинства больных истинная природа патологического процесса распознается поздно, спустя много месяцев или лет от начала первых клинических проявлений.
Основными рентгенологическими признаками центральной аденомы бронха являются симптомы нарушения бронхиальной проходимости. В зависимости от выраженности стеноза бронха различают три степени таких изменений — гиповентиляцию участка легкого, вентильную эмфизему и ателектаз. Прямые признаки опухо
ли — рост ее в просвет бронха или его обтурация — выявляются главным образом при использовании специальных методов рентгенологического исследования (томографии, бронхографии). При периферическом расположении опухоли определяется округлая тень с четкими контурами без признаков распада и очаговых изменений вокруг нее.
Бронхоскопия в большинстве наблюдений позволяет точно поставить диагноз и локализовать изменения в легком. Уже при выполнении визуальной части эндоскопического обследования обращает на себя внимание характерный вид аденомы бронха. Она выглядит округлым, розовым или бледно-розовым образованием с гладкой блестящей или мелкобугристой поверхностью. Опухоль нередко бывает весьма подвижна, что определяется вариантом ее роста — на ножке. В случаях, когда аденома бронха имеет широкое основание или растет в виде «запонки», «айсберга», смещение ее при бронхоскопии невозможно. Взятие материала для гистологического исследования позволяет верифицировать опухоль, уточнить показания к хирургическому лечению.
Гамартома (гамартохондрома, хондрома, гамартобластома, липохондроаденома, аденохондрома) представляет собой порок развития элементов мезо- и эктодермы [Сазонов А. М. и др., 1981].
После аденомы гамартома является второй по частоте доброкачественной опухолью легких и первой среди периферических образований этой локализации. Эндобронхиальные и множественные гамартомы чрезвычайно редки.
Многочисленные синонимы гамартомы, приведенные выше, связаны с обнаружением при микроскопическом исследовании опухоли преимущественного наличия тех или иных тканей (хрящевой, соединительной, фиброзной, мышечной, жировой, сосудистой). Растут гамартомы обычно медленно и могут достигать гигантских размеров; озлокачествлению они подвергаются редко [Базарон Э. Г., 1966; Стручков В. И. и др., 1969].
Локализуются гамартомы чаще в передних сегментах легкого. В крупных бронхах они бывают очень редко. Различают локальную гамартому, которая при патогистологическом исследовании представлена всеми тканевыми компонентами бронхиальной стенки, и диффузную гамартому. Последняя обычно выявляется у маленьких детей. Образование может занимать целую долю легкого. В группе локальных гамартом различают хондроматозную, липоматозную, фиброматозную, ангиоматозную и орга-ноидную. При последней имеется сочетание различных тканей. Растут гамартомы очень медленно.
310
Частое расположение в периферических отделах легкого во многом определяет бессимптомность ее клинического течения. Подавляющее число таких больных обычно выявляют при проведении профилактических рентгенологических обследований.
По мере роста опухоли, вовлечения в процесс бронхов, висцеральной плевры первыми клиническими признаками заболевания становятся боли в груди, кашель, редко — кровохарканье.
Диагноз ставится главным образом на основании рентгенологической картины, так как на рентгенограммах и особенно томограммах выявляются характерные признаки гамартом (рис. 131, 132). Так, Б. А. Алексеев (1970) выделяет следующие варианты рентгенологической картины этих образований: 1) гомогенные, бугристые и гладкие тени средней интенсивности; 2) негомогенные, с обызвествлением, бугристые и гладкие тени средней интенсивности; 3) негомогенные средней интенсивности тени со слоистым обызвествлением или с уплотнением в центре; 4) негомогенные высокой интенсивности тени с массивной инкрустацией. Характерно отсутствие изменений легочной ткани вокруг гамартомы.
Расположение опухоли в периферических отделах легких делает весьма затруднительной эндоскопическую диагностику заболевания. Морфологическая верификация опухоли становится возможной при взятии материала во время сочетанного эндоскопического и рентгенологического обследования больных либо путем трансторакальной пункционной биопсии.
Папиллома (фиброэпителиома) по микроскопическому строению представляет собой опухоль, состоящую из соединительнотканной стромы с многочисленными папиллярными выростами, покрытыми кубическим или мета-плазированным многослойным эпителием.
Папиллома локализуется только в бронхах, растет экзофитно, иногда обтурирует полностью просвет бронха. Макроскопически опухоль имеет вид полиповидного образования на тонкой ножке или на широком основании. Поверхность неровная, мелко- или крупнобугристая. Опухоль розового, красного, темно-красного цвета. По внешнему виду папиллома напоминает «цветную капусту» или «ягоду малины».
Клинические проявления заболевания характеризуются развитием кашля, иногда — с бронхоспастическим компонентом, небольшим кровохарканьем. В последующем могут появиться симптомы, характерные для обструкции бронха. Структура и особенности расположения опухоли делают весьма сложной интерпретацию рентгенологических находок. Как правило, диагноз подтверждается при бронхоскопии с биопсией опухоли.
Фибромы легких встречаются среди других доброкачественных опухолей этой локализации в 1—7,5 % случаев [Перельман М. И. и др., 1981; Balogh A. et al., 1978]. Это соединительнотканная опухоль. Выделяют твердые (плотные) и мягкие формы опухоли. Макроскопически фиброма представляет собой плотный опухолевый узел белесоватого цвета с ровной гладкой поверхностью. Опухоль имеет хорошо сформированную капсулу, на разрезе в ткани иногда встречаются участки оссифика-ции и кистовидные полости.
Микроскопически фиброма состоит из переплетающихся пучков коллагеновых волокон, между которыми расположены вытянутые соединительные клетки — фиброциты, фибробласты, от количества которых зависит плотность опухоли. Обычно фибромы не озлокачествля-ются.
Локализуются фибромы главным образом в обоих легких, достигая 2—3 см в диаметре. Иногда они достигают гигантских размеров, занимая почти половину грудной полости. Различают два вида фибром: центральные (при локализации в крупных бронхах) и периферические (при локализации в периферических участках легкого). Периферические фибромы встречаются значительно чаще, чем центральные.
Заболевание возникает преимущественно у мужчин.
При бронхоскопическом исследовании эндобронхиальная фиброма имеет белесоватый или красноватый цвет вследствие гиперемии слизистой оболочки. На слизистой оболочке, покрывающей фиброму, иногда можно видеть изъязвления. При внутрилегочном положении фиброма может достигать весьма больших размеров. Нами оперирована больная, у которой имелась мягкая фиброма массой 600 г, связанная пятью сосудистыми ножками с диафрагмальной поверхностью нижней доли правого легкого, у другого больного имелся распространенный нейрофиброматоз правого легкого.
Липома — опухоль из жировой ткани. Чаще липомы грудной полости исходят из средостения. Однако известны случаи интрабронхиаль-ной локализации липом [Стручков В. И., Григорян А. В., 1964; Перельман М. И. и др., 1981].
Обычно опухоль развивается внутри крупных бронхов, имеет округлую форму, гладкую поверхность бледно-желтого цвета, покрыта неизмененной слизистой оболочкой. Микроскопически опухоль состоит из жировой ткани с признаками атипии и соединительнотканными перегородками. Клинические проявления заболевания нарастают по мере нарушения дренажной функции пораженных отделов легкого с характерными для этого симптомами.
311
Рис. 131. Гамартома правого легкого.
а — прямая рентгенограмма; б — боковая рентгенограмма. Видны известковые включения в аиде зерен.
Рис. 132. Фиброма правого легкого.
а — прямая рентгенограмма; б — боковая рентгенограмма; в — компьютерная томограмма.
312
Рис. 132, в (продолжение).
Рентгенологические изменения не имеют характерных черт, отличных от других доброкачественных опухолей.
При осмотре через бронхоскоп опухоль выглядит в виде гладкостенного образования округлой формы, бледно-желтого цвета.
Лейомиома относится к числу редких доброкачественных опухолей легких, развивающихся из гладкомышечных волокон, входящих в состав стенки бронха или кровеносных сосудов. Она имеет хорошо выраженную капсулу. Центральные опухоли имеют вид полипа на ножке или широком основании, иногда наблюдается и перибронхиальный рост. Периферические опухоли могут быть в виде множественных узлов. На разрезе ткань опухоли розоватого цвета, поверхность зернистая, со спиралеобразной волокнистостью. В соединительнотканной строме выявляются псевдожелезистые структуры и кистовидные образования.
Все сосудистые опухоли имеют округлую форму, плотную консистенцию и соединительнотканную капсулу. Размеры опухоли различные, иногда очень большие [Перельман М. И. и др., 1981].
Доброкачественная гемангиоэндотелиома чаще всего наблюдается в детском возрасте. Располагается в виде одиночного узла в глубоких отделах легочной паренхимы, микроскопически состоящего из скоплений эндотелиальных клеток, комплексы которых окружены тонкими аргирофильными волокнами. Количество оформленных капилляров незначительно, и они видны лишь в некоторых участках.
Доброкачественная гемангиоперицитома макроскопически имеет вид плотного четко отгра
ниченного узла красноватого цвета, встречается редко, может возникать в любом возрасте, но чаще бывает у детей.
Микроскопически характерно наличие большого количества широких капилляров или сину-соидов, выстланных эндотелием и окруженных широкими муфтами из овальных, округлых или веретенообразных клеток с темными ядрами и светлым ободком цитоплазмы. Клеточные муфты оплетены густой сетью аргирофильных волокон.
Тератома — образование дизэмбриональ-ного происхождения. Макроскопически она имеет вид кисты или плотной опухоли. Тератома легких встречается довольно редко. Локали -зуется тератома преимущественно в верхней доле левого легкого, растет медленно, почти никогда не малигнизируется.
Опухолевидные тератомы имеют круглую форму, бугристую поверхность, четко выраженную капсулу. Размер образования обычно 5—6 см, но может достигать 15—18 см в поперечнике. В полости кист содержатся коричневатые жироподобные массы, волосы, элементы кожи, зубы и другие производные зародышевых листков. Плотная тератома может содержать и органоидные образования. При прорыве в просвет бронха или плевральную полость вследствие вторичного инфицирования развивается клиническая картина абсцесса, эмпиемы. После прорыва в бронх в мокроте, отделяемой с кашлем, могут быть обнаружены волосы, сальные массы.
При точно установленном диагнозе тератомы показания к операции следует считать относительными. При не вполне ясном диагнозе, особенно у мужчин пожилого возраста, следует удалить образование путем вылущения или экономной резекцией легочной ткани с немедленным гистологическим исследованием препарата. При относительных противопоказаниях к торакотомии допустимо динамическое наблюдение за больным на протяжении нескольких месяцев, и вопрос о вмешательстве решается в зависимости от наличия или отсутствия заметного увеличения тени на рентгенограммах.
Вопрос об отнесении псевдоопухолей в рассматриваемую группу спорен. Однако трудности, а подчас полная невозможность установить правильный диагноз при четко выраженных рентгенологических, а иногда и клинических проявлениях вынуждают предпринять оперативное вмешательство.
Согласно гистологической классификации опухолей и опухолеподобных образований (Хроника ВОЗ, 1974), в группу неопухолевых или сомнительных опухолевых поражений, представляющих интерес вследствие сходства с истинными новообразованиями, включена группа ксантом, в которую входят фиброксан-
313
тома (фиброзная гистиоцитома) и ксантома — образования, которые встречаются в паренхиме легких и подвергаются оперативному удалению.
Современное учение об иммунной системе и происхождении составляющих ее клеток заставляет пересмотреть многие существующие в онкологии гистогенетические представления. Это относится прежде всего к группе гистиоцитом и ксантом. Гистиоциты, по современным данным, возникают в костном мозге из клеток-предшественников, попадая в кровь, превращаются в моноциты. Последние, проникая в ткани, становятся гистиоцитами. При особых функциональных условиях эти клетки превращаются в макрофаги.
Фиброзная гистиоцитома — довольно редкое опухолевидное образование легких, возникающее на фоне длительно существующего воспалительного очага. Микроскопически образование построено преимущественно из гистиоци-тарных клеток, фибробластов и многочисленных сосудов, встречаются гигантские клетки Тутона.
Ксантома — это сборная группа соединительнотканных и, реже, эпителиальных образований, клетки которых содержат холесте-ринэстеры, нейтральные жиры и железосодержащий пигмент. Ткань образования обычно имеет желтовато-бурый цвет. Форма — округлая, консистенция — мягкая. Образование заключено в фиброзную капсулу.
При гистологическом исследовании выявляются гистиоциты, цитоплазма которых заполнена каплями жира, клетки воспаления и коллагеновые волокна.
Плазмоцитарная гранулема (плазмоцитома) — четко очерченное опухолеподобное образование, возникающее на фоне нарушения белкового обмена. Микроскопически образование представлено типичными плазматическими клетками, часто с отложениями амилоида. Ее не следует смешивать с очагами миеломной опухоли (плазмоцитомой, миеломной болезнью, болезнью Рустицкого — Калера).
ЛЕГОЧНЫЕ КИСТЫ
Кистозные поражения легких представляют разнородную группу заболеваний, различных по происхождению и морфологическому строению. Общим для них является формирование тонкостенной полости, частично или полностью заполненной жидким содержимым или воздухом. Известно до 28 синонимов поражения такого типа: кистозное легкое, поликистозное легкое, мелкокистовидная дегенерация легкого, врожденные бронхоэктазии, альвеолярные бронхоэктазии и т. п. Это отражает определенные трудности классификационного
и клинического подходов при выборе лечебной тактики у таких больных.
В зависимости от происхождения кисты легких могут быть врожденными (истинные) и приобретенными (ложные) [Лимберг Б. Э., 1951; Осипов Б. К., 1964].
Так называемые истинные легочные кисты образуются в результате нарушения процессов формирования легкого в эмбриональном или постнатальном периодах. Как полагает А. И. Абрикосов, в развитии истинных кист легких основную роль в ряде случаев играют агенезия альвеол и расширение терминальных бронхов, в других — задержка развития касается периферического отдела бронхов с расширением более дистальных их участков, не содержащих в стенке хрящевой ткани. Более частой разновидностью истинных легочных кист являются бронхогенные, обнаруживаемые у взрослых и всегда содержащие в своей стенке хаотично расположенные элементы бронха. Реже, обычно у детей, встречаются альвеолярные кисты, происходящие из тканей альвеол. Характерным для истинных кист легких является то, что их стенка изнутри практически всегда имеет эпителиальную выстилку. Однако, по данным В. Doesal (1968), Г. М. Лукомского и соавт. (1982), и ложные кисты могут постепенно выстилаться бронхиальным эпителием за счет его распространения из дренирующего бронха. С другой стороны, при хронических нагноениях истинных легочных кист бронхиальный эпителий постепенно разрушается и замещается сначала грануляционной, а затем рубцовой тканью. В ряде случаев кисты имеют сообщение с бронхом и называются тогда открытыми в противоположность закрытым, «отшнурованным» от бронхиального дерева.
Кистозная гипоплазия — один из наиболее часто встречающихся пороков развития легких. Как показали исследования Ю. Н. Левашова, В. Л. Толузакова (1981), Н. В. Путова и соавт. (1982), она обусловлена антенатальным недоразвитием легочной паренхимы сосудов и бронхов и формированием кистозных полостей на различных уровнях бронхиального дерева, расположенных дистальнее субсегментарных бронхов.
Порок развития, характеризующийся формированием бронхогенных кист с кровоснабжением из аорты, выделяют как внутридолевую секвестрацию легкого.
Особую группу дизонтогенетических легочных кист представляют тератодермоиды. Однако с точки зрения клинической целесообразности их следует рассматривать в ряду доброкачественных опухолей.
В отличие от истинных, ложные кисты или кистоподобные образования легких являются
314
приобретенными, и в их основе лежит какое-то другое, бывшее ранее заболевание: абсцесс, эхинококк, туберкулезная каверна, внутриле-гочная гематома. С точки зрения патогенеза эти кисты надо было бы рассматривать в соответствующих разделах. Однако нередко их клинико-рентгенологическая симптоматика идентична таковой при истинных кистах, и даже гистологическое исследование не всегда позволяет провести четкую границу между ними [Колесников И. С., 1969; Сазонов А. М. и др., 1981]. В большинстве своем ложные кисты являют собой исход благоприятного течения и излечения основного заболевания.
От истинных кист и кистоподобных полостей следует отличать воздушные полости в легких, формирующиеся на почве очаговой эмфиземы. Их главным отличительным признаком является отсутствие эпителиальной выстилки стенки полости.
Клиническая классификация кистозных поражений легких, учитывающая все многообразие клинических и морфологических проявлений, сложна и в настоящее время продолжает уточняться и совершенствоваться. Удобной представляется классификация, разработанная в 1969 г. В. И. Пужайло. В соответствии с ней кисты легкого разделены на три основные группы.
I. Врожденные кисты:
1. Поликистоз легких (кистозная гипоплазия легких).
2. Микрокистозное легкое (бронхиолярная эмфизема легких).
3. Внутридолевая секвестрация.
4. Добавочное кистозное легкое.
5. Гигантская киста у новорожденных и детей раннего детского возраста.
II. Дизонтогенетические кисты:
1. Солитарная бронхогенная киста легкого.
2. Гигантская бронхогенная киста у взрослых.
3. Дермоидная киста легкого.
4. Солитарная бронхогенная кистаденома легкого.
III. Приобретенные кисты:
1. Абсцесс, эхинококк, туберкулезная каверна.
2. Пневматоцеле.
3. Прогрессирующая эмфизематозно-буллезная дистрофия легких («исчезающее легкое» Бурке, гигантская эмфизематозная киста).
4. Эмфизематозно-буллезная секвестрация.
5. Буллезная эмфизема.
Легочные кисты, как правило, не имеют «излюбленных мест» расположения в легких. В большей степени это относится к истинным кистам. Приобретенные, особенно сформировавшиеся после абсцесса, чаще занимают задние отделы легких, а возникшие на почве санированных туберкулезных каверн — верхушечно-задние отделы верхних долей. Эмфизематозные буллы также формируются в верхних долях легких [Лукомский Г. И. и др., 1982].
Размеры кист значительно варьируют: встречаются как очень маленькие, так и гигантские — занимающие почти долю или все легкое.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
По существу, кистозно-измененное легкое становится местом наименьшего сопротивления организма для возникновения приобретенных бронхолегочных заболеваний. Поражение кист чаще всего носит вторичный характер, однако, являясь резервуаром инфекции, они поддерживают порочный круг воспалительного процесса в бронхах и окружающих тканях.
Клинические проявления при кистах легкого чаще всего возникают в молодом возрасте — до 20 лет. Для врожденных кист является характерным отсутствие признаков воспаления или повторных пневмоний в детском возрасте. По-видимому, в момент возникновения бронхогенные легочные кисты представляют собой образования секретирующего вида, имеющие тенденцию к росту. По мере их развития наступает сообщение с просветом бронха, окончательно формирующее воздушные или гидровоз-душные полости. С течением времени появляются и прогрессируют клинические проявления, обусловленные наличием легочных кист. В зависимости от тяжести этих проявлений принято разделять три основные формы течения кист легкого: легкую, средней тяжести и тяжелую.
Жалобы больных и данные объективного исследования малоинформативны и скудны. Тем не менее при внимательном опросе и физикальном обследовании в ряде случаев можно получить полезные для диагностики сведения. Больные могут предъявлять жалобы на неопределенные боли в груди, более или менее выраженный сухой кашель, иногда с отделением скудной мокроты без запаха, в которой могут быть прожилки крови. Иногда отмечается одышка, усиливающаяся при физической нагрузке. По данным А. А. Вишневского и А. А. Адамяна (1977), наиболее яркой клиническая симптоматика бывает у детей, так как даже маленькая киста может вызвать у них сдавление дыхательных путей.
Данные, получаемые при физикальном обследовании больных, зависят от величины кисты, глубины залегания в легком, характера ее содержимого и отношения к просвету бронхиального дерева. При больших кистах можно отметить отставание больной половины грудной клетки при дыхании, иногда даже расширение межреберных промежутков. При перкуссии, в зависимости от наличия вышеперечисленных факторов, выявляются укорочение перкуторного звука либо тимпанит. Дыхание над этими
315
отделами легких ослабленное, а при наличии сообщения кисты с бронхом иногда приобретающее амфорический оттенок.
Наиболее частым осложнением легочных кист является их нагноение. По нашим данным, это осложнение отмечается более чем у половины больных, поступающих для хирургического лечения в клинику. Однако для ложных, в частности постпневмонических, кист нагноение значительно менее характерно.
При развитии нагноительного процесса в закрытой, не сообщающейся с просветом бронхов кисте клиническая картина весьма сходна с развитием острого абсцесса легкого: характерная температурная реакция, боли в груди, выраженная общая слабость. При прорыве гнойника в бронх начинает выделяться гнойная, иногда зловонная мокрота, часто в большом количестве. Состояние больного после этого резко ухудшается. В других случаях, что особенно характерно для открытых кист, воспалительный процесс начинается исподволь, протекает по типу обострения хронического бронхита: с субфебрильной температурой тела, при общем вполне удовлетворительном состоянии больного. Количество отделяемой гнойной мокроты нарастает постепенно.
Одним из неблагоприятных вариантов течения заболевания является прорыв кисты с поступлением гноя в свободную плевральную полость и развитием эмпиемы плевры, что значительно ухудшает состояние больных и прогноз, особенно если в последующем формируется стойкий бронхоплевральный свищ.
Если при прорыве нагноившейся кисты обеспечивается адекватное дренирование гнойной полости через бронх, то острые болезненные проявления могут довольно быстро идти на убыль, но в дальнейшем поддерживается вяло текущий воспалительный процесс. Тогда периодически возникают обострения, связанные с нарушением дренажной функции бронха и скоплением гноя в замкнутой полости. Своеобразием хронически протекающего воспаления сообщающихся с просветом бронха легочных кист, в отличие от типичных хронических абсцессов, является длительный период отсутствия признаков общей гнойной интоксикации. Это связывают с защитной ролью эпителизирован-ной стенки кисты. Со временем, особенно при частых обострениях, ткани, составляющие стенку кисты, претерпевают дистрофические изменения вплоть до некроза, что усугубляет общие расстройства в течении заболевания, а также приводит к развитию вторичных изменений в близлежащих бронхах и легочной паренхиме: бронхоэктазий и пневмосклероза.
Формирование так называемой «напряженной» кисты, что чаще наблюдается у детей, ведет
к тяжелым расстройствам дыхания и кровообращения вплоть до летального исхода. Причиной осложнения, как показали исследования И. А. Зворыкина (1955), служит развитие вентильного механизма. Это объясняется тем, что мелкие дренирующие бронхи проходят в толще стенки кисты по касательной линии. При вдохе воздух свободно поступает внутрь кисты, а при выдохе устья бронхов оказываются сжатыми из-за повышения давления в окружающей кисту ткани легкого. Постепенное увеличение кисты вызывает сдавление легкого и смещение средостения в здоровую сторону, что сопровождается нарастающей дыхательной и сердечнососудистой недостаточностью. Больной ведет себя беспокойно, жалуется на нехватку воздуха, чувство стеснения в груди. У него появляются выраженная одышка, тахикардия, цианоз. Объективная картина осложнения дополняется отставанием пораженной половины грудной клетки при дыхании, иногда даже выбуханием ее. Границы сердечной тупости смещаются в здоровую сторону. Области ослабления или полного отсутствия дыхательных шумов соответствует выявляемый перкуторно тимпанит.
Описываемый клапанный механизм может проявить себя однократно, и дальнейшего увеличения кисты не происходит, так как сдавленные мелкие бронхи постепенно облитерируются и воздух в дальнейшем не проникает в полость кисты. Однако невозможно исключить и рецидивы клапанного механизма, что вновь будет приводить к ухудшению состояния больного вследствие дальнейшего растяжения полости кисты. Тогда подобные эпизоды могут повторяться в течение многих лет.
Другим осложнением, приводящим к развитию дыхательной недостаточности, являются разрыв кисты и возникновение спонтанного пневмоторакса. В зависимости от количества воздуха, проникшего в плевральную полость, а также наличия или отсутствия клапанного механизма отмечается та или иная степень коллапса легкого и смещения средостения в здоровую сторону, что определяет тяжесть гемодинамических и дыхательных расстройств. Физикально и рентгенологически выявляются все типичные признаки спонтанного пневмоторакса (коробочный перкуторный звук, резкое ослабление дыхания, смещение сердечной тупости в здоровую сторону, коллапс легкого и воздух в плевральной полости). Однако следует иметь в виду, что нередко со сходной симптоматикой в клинику поступают больные, имеющие на самом деле не пневмоторакс, а гигантские воздушные полости (буллы).
Не очень частым, но весьма серьезным осложнением легочных кист является кровохарканье, иногда приобретающее характер легочного
316
кровотечения. Обычно оно присоединяется к развивающемуся в кисте воспалительному процессу.
Наиболее редким осложнением является злокачественное перерождение кист, на что указывают в своих работах И. А. Зворыкин (1955), Б. К. Осипов (1964), Л. А. Ситко и соавт. (1972). Это побуждает к расширению показаний к оперативному лечению кист [Колесников И. С. и др., 1969].
ДИАГНОСТИКА
Ведущая роль в диагностике легочных кист принадлежит рентгенологическому методу. При этом необходимо бывает дифференцировать заболевания, проявляющиеся двумя группами рентгенологических синдромов: шаровидные или округлые образования и тонкостенные полости. Следует иметь в виду, что дифференциально-диагностический ряд весьма обширен, особенно для шаровидных образований (рис. 133). По данным A. Ravelli (1951), 72 легочных и внелегочных заболевания могут давать сходную рентгенологическую картину.
Дифференциальная диагностика легочных кист наталкивается подчас на непреодолимые трудности [Розенштраух Л. С., Рождественская А. И., 1968; Лукомский Г. М. и др., 1982]. В связи с этим большая часть больных легочными кистами длительное время наблюдается и лечится с неправильными диагнозами, и даже углубленное обследование в торакальном стационаре зачастую не изменяет этого положения.
Основными заболеваниями, которые следует дифференцировать с закрытыми кистами легких, являются периферические злокачественные и доброкачественные опухоли, солитарные метастазы, эхинококк, туберкулема, блокированный абсцесс, междолевой плеврит, а также некоторые шаровидные образования, исходящие из средостения, диафрагмы и грудной стенки.
Рентгенологически закрытая врожденная киста легкого представляется обычно в виде одиночного округлого или овального образования, иногда вытянутого по ходу бронхов, расположенного на фоне неизмененного легочного рисунка. Интенсивность тени зависит от величины образования, но в большинстве случаев она меньше, чем при опухоли такого же размера. Контуры кисты обычно довольно четкие, но не такие «прочерченные», как, например, при гамартохондромах. Структура легочной кисты однородна, изредка отмечается краевое обызвествление. Л. С. Розенштраухом, А. И. Рождественской (1968) описан симптом «известкового мениска», связанный с присутствием зерен извести на дне полости. Однако сами
Рис. 133. Истинная, содержащая жидкость, закрытая киста правого легкого. Прямая рентгенограмма.
авторы отмечают его редкость. Считавшийся ранее патогномоничным для кистозных образований легких симптом Эскудеро — Неме-нова (вытягивание кисты при вдохе и уплощение при выдохе) при более внимательном изучении оказался малоинформативным, так как суть явления оказалась связанной со смещением длинной оси кисты при дыхании по отношению к экрану.
Весьма специфична рентгенологическая картина приобретенных ретенционных кист [Шу-лутко М. А. и др., 1967; Розенштраух Л. С., Рождественская А. И., 1968]. Если врожденной бронхогенной кисте присуща округлая форма, то здесь преобладают грушевидные, веретенообразные, часто причудливые очертания (колбы, реторты, грозди винограда). При этом длин-ник образования соответствует ходу бронхов, а проксимальный полюс его ориентирован в сторону корня легкого. Следует отметить, что, в отличие от врожденных, ретенционные кисты зачастую обнаруживаются на фоне бронхоэктазий, туберкулеза легких, хронической пневмонии, пневмосклероза. Нередко (около
317
25 %, по данным М. Л. Шулутко и соавт., 1967) в стенках ретенционных кист отмечается обызвествление. Существенную помощь в диагностике оказывают томо- и бронхография. Диагноз становится практически очевидным, когда на томограммах видны округлые, наслаивающиеся друг на друга образования, а бронхографически определяются ампутация подходящего к образованию бронха и деформация соседних бронхиальных ветвей.
Открытые легочные кисты рентгенологически представляют собой округлые, чаще всего одиночные полости с тонкими четко очерченными стенками, содержащие только воздух или, кроме того, какое-то количество жидкости с уровнем. Окружающий фон при неосложненных кистах обычно интактен. Гигантские воздушные полости иногда при рентгенологическом исследовании проявляются как бы только наличием воздуха в плевральной полости без четко определяемой кольцевидной тени стенки, благодаря чему можно подумать о спонтанном пневмотораксе. Помогает установке правильного диагноза томография, позволяющая определить стенки полости. Кроме того, особенно при локализации над диафрагмой, верхневнутренний край легочной ткани представляется вогнутым, а при спонтанном пневмотораксе — выпуклым. Постпневмонические ложные кисты чаще локализуются в задних отделах легких и представляют собой овальные или неправильной формы полости с выпячиваниями, перетяжками, карманами и т. п. Внутренние контуры стенок обычно гладкие, но толщина ик часто неодинакова в разных отделах, в результате чего внешний контур такой полости обычно неровный. В окружающей легочной ткани часто имеются очаговые или диффузные склеротические изменения. При бронхографии можно обнаружить несколько мелких дренирующих бронхов, что считается весьма характерным для постпневмонических кист [Лукомский Г. М. и др., 1982]. Тонкостенные санированные каверны обычно располагаются в верхушечнозадних сегментах верхних долей легких на фоне туберкулезных изменений паренхимы в виде старых очагов и кальцинатов.
При нагноении легочных кист рентгенологическая картина во многом напоминает картину острого или хронического абсцесса, но отличается от нее значительно менее выраженной зоной перифокальной воспалительной инфильтрации. При хроническом течении нагноительного процесса в результате разрушения стенки кисты происходит выход воспаления за ее пределы; в дальнейшем стенки утол-лцаются за счет разрастания фиброзной ткани и грануляций и становятся неотличимыми от стенок хронического абсцесса.
ОСОБЕННОСТИ
ОПЕРАТИВНОГО ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ И КИСТ ЛЕГКОГО
Хирургическое лечение показано большинству больных доброкачественными новообразованиями легких, особенно при осложнениях, сопутствующих их прогрессивному росту. Важным фактором, который следует также учитывать при решении вопроса об оперативном лечении, является то положение, что окончательный, морфологически верифицированный диагноз при этих заболеваниях чаще всего можно установить лишь после торакотомии. Срочное гистологическое исследование позволяет тогда исключить рак легкого, озлокачествле-ние доброкачественной опухоли. Полученные данные дают возможность спланировать резекцию в оптимальном для больного объеме: с учетом местного роста и особенностей доброкачественной опухоли, а также тяжести и характера развившихся осложнений в легком.
При точно верифицированной доброкачественной опухоли наиболее обоснованным является самый экономный вариант резекции. Такой подход определяет разработку многочисленных оперативных вмешательств при доброкачественных бронхолегочных новообразованиях.
ЭНДОСКОПИЧЕСКИЕ ОПЕРАЦИИ
Удаление опухоли на ножке с использованием бронхоскопа имеет относительно узкий круг показаний, главным образом ввиду того, что многие полиповидные опухоли не могут быть иссечены при этом радикально — без оставления опухолевых элементов в стенке бронха, а иногда — ив перибронхиальной зоне. После подобных операций больные требуют длительного наблюдения с повторным эндоскопическим обследованием зоны отсеченной опухоли, морфологическим контролем места расположения ее основания.
БРОНХОТОМИЯ
Детальное изучение после торакотомии характера изменений в легком, в области сосудов и бронха, в просвете которого располагается доброкачественная опухоль, дает возможность точнее оценить границы патологических изменений. Бронхотомия обеспечивает радикальное удаление опухоли, полное иссечение ее основания. При необходимости предпринимается окончатая резекция бронха с последующим, ушиванием дефекта. В организационном отношении важным является возможность в ходе бронхотомии использовать эндоскопический
318
контроль. Наиболее удобен для этой цели фибробронхоскоп, введенный через приставку-инжектор к эндотрахеальной трубке. При этом не возникает расстройств вентиляции легких и сохраняется возможность осуществлять совместные манипуляции хирурга и эндоскописта в течение длительного времени. Такие совместные действия, как убеждает опыт, часто необходимы при операциях, предпринимаемых по поводу мягкотканных небольших опухолей, пальпаторное уточнение места эндобронхиального расположения которых, особенно при сопутствующем лимфадените, трудно. Эндоскопический контроль помогает наметить место для бронхотомии и проконтролировать полноту удаления опухоли.
PEKOHCTPYK'MlBHO-
ПЛАСТИЧЕСКИЕ ОПЕРАЦИИ
Доброкачественные новообразования легких, имеющие широкое основание, могут быть удалены пру реконструктивно-пластических операциях, выполненных по одному из вариантов.
Варианты наиболее хорошо отработанных реконструктивно-пластических резекций при доброкачественных опухолях следующие:
— циркулярная резекция бронха доли легкого с наложением межбронхиального анастомоза;
— циркулярная резекция бронха с удалением одной-двух долей легкого и наложением анастомоза;
— циркулярная резекция главного или промежуточного бронха и наложение межбронхиального анастомоза.
ОПЕРАЦИИ
ПРИ ПЕРИФЕРИЧЕСКИХ ОПУХОЛЯХ
К операциям при периферических опухолях относятся: энуклеация, клиновидная резекция легкого, сегментэктомия, лобэктомия.
Следует отметить, что вне зависимости от вида, размеров и даже гистологического строения доброкачественной опухоли, ввиду вероятности ее перерождения следует отпрепарировать и направить для гистологического изучения один из лимфатических узлов регионарного для пораженной части легкого лимфатического коллектора.
При легочных кистах, как справедливо полагают Н. В. Путов и соавт. (1982), резекция легкого у большинства больных является единственным радикальным методом лечения, избавляющим их от вторичной гнойной инфекции.
Такие операции имеют своеобразные черты. Так, следует учесть, что у многих больных к этому времени уже сформирована так называемая «легочная грыжа» и при разделении плевральных сращений или трудностях в ориентировке относительно анатомических образований возможно вскрытие противоположной плевральной полости с возникновением двустороннего пневмоторакса.
При оперативных вмешательствах по поводу внутридолевой секвестрациии следует иметь в виду добавочный сосуд от аорты, идущий к этой солитарной бронхогенной кисте. Чаще всего она формируется в нижних долях легкого, а добавочный сосуд располагается среди элементов легочной связки. Место отхождения артериального сосуда от аорты, по нашим данным, может размещаться в пределах как его грудного, так и брюшного отделов. Случайное повреждение этого добавочного сосуда вызывает интенсивное кровотечение, что резко затрудняет, а иногда делает невозможным его лигирование.
Поэтому легочную связку следует разделять под контролем зрения, порциями захватывая инструментами и прошивая. Добавочный сосуд, который при этом, как правило, удается увидеть, дополнительно лигируют.
Глава А / СПОНТАННЫЙ ПНЕВМОТОРАКС
Спонтанный пневмоторакс — это состояние, обусловленное внезапным попаданием воздуха в плевральную полость вне связи с травмой или какой-либо хирургической манипуляцией (например, пункцией). Его выделяют особо из-за своеобразной клинической картины, характерного течения, свойственных этому состоянию осложнений, определенной лечебной тактики, которая, как стало ясно в последнее время, нередко требует оперативного вмешательства.
ЧАСТОТА
Судить о частоте спонтанного пневмоторакса среди населения трудно. Обстоятельных работ на эту тему нет. Более определенно можно высказаться о частоте этой патологии при заболеваниях легких. По сообщению А. Мейера и соавт. (1964), многолетние наблюдения показали, что среди обратившихся за консультативной помощью в отделение заболеваний дыхательных путей спонтанный пневмоторакс с 1927 по 1937 г. составил 0,06 %, а с 1949 по 1954 г.— 0,3 %. В последующем частота спонтанного пневмоторакса среди легочных больных продолжала расти. Об этом свидетельствуют публикации последних лет, обобщающие десятки и сотни наблюдений спонтанного пневмоторакса у больных, находившихся в лечебных учреждениях легочного профиля за период времени от 3 до 10 лет [Чудновский П. Д., 1967; Бондаренко В. А., 1968; Гинсбург М. А., Медведевский Б. И., 1976, и др.]. Рост частоты спонтанного пневмоторакса, вероятно, отражает улучшение его диагностики, раннее выявление клинически стертых форм.
Спонтанный пневмоторакс примерно в 10 раз чаще встречается у мужчин, чем у женщин. Об этом свидетельствуют данные публикаций и наблюдения клиники госпитальной хирургии. Среди 105 больных, находившихся с этим диагнозом в клинике, мужчин было 94 (89,5 %), женщин— 11 (10,5 %).
Пневмоторакс возникает преимущественно у молодых людей, в возрасте 20—40 лет, хотя известны случаи его у новорожденных детей и лиц глубокого старческого возраста [Гембиц-кий Е. В., 1961; Мейер А. и др., 1964]. Отмечено, что особенно часто спонтанный пневмоторакс возникает у людей, занимающихся физическим трудом [Мышкин К. И., Слесаренко С. С., 1976].
По данным клиники, среди лечившихся от спонтанного пневмоторакса больных в возрасте до 20 лет было 6 человек, от 21 года до 30 лет — 41, от 31 года до 40 лет — 30, от 41 года до 50 лет— 18 и старше 51 года— 10. Больные в возрасте 20—40 лет составили 67,6 %.
Правая сторона хотя и незначительно, но закономерно поражается чаще, чем левая. По сводным литературным данным [Ходжашви-ли Э. В., 1968], на 315 больных пневмоторакс справа наблюдался у 181 (57,5 %) и слева — у 125 (39,7 %); у 9 больных (2,8 %) он возник с обеих сторон. Небезынтересно отметить, что при наложении искусственного пневмопери-тонеума спонтанный пневмоторакс, по имеющимся в литературе данным, возникает исключительно справа.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Как указывалось, спонтанный пневмоторакс полиэтиологичен. Почти всегда он является осложнением какого-либо заболевания легких.
Чаще всего он возникает при кистах и кистоподобных заболеваниях. По сводным данным А. Мейера и соавт. (1964), Э. В. Ходжашвили (1968), В. С. Савельева, Г. Д. Константиновой (1969), М. А. Гинсбурга, Б. И. Медведевского (1976), на 893 случая спонтанного пневмоторакса кисты и кистоподобные образования легких оказались его причиной у 280 больных (31,4 %). У детально обследованных пациентов, у которых причина спонтанного пневмоторакса была установлена более или менее точно, кисты занимали еще большее место: по данным В. С. Савельева, Г. Д. Константиновой (1969) —у 55,7 % больных, по сообщению М. А. Гинсбурга, Б. И. Медведовского (1976) — у 44,7 %. Согласно сводной литературной статистике Э. В. Ходжашвили (1968), кисты во время операций по поводу спонтанного пневмоторакса были обнаружены в 84,6 % случаев. 208 (84,6 %).
320
Рис. 134. Схематическое изображение субплеврального пузыря и буллы, располагающихся в легком.
1 — субплевральный пузырь; 2 — околоплевральная булла.
Среди кист выделяют истинные врожденные бронхогенные, расположенные субплеврально, имеющие внутреннюю эпителиальную выстилку, и воздушные пузыри. Последние бывают типа околоплевральной буллы и эмфизематозного субплеврального пузырька (блеб).
Предполагается, что булла возникает вследствие атрофии и дегенерации перегородок между альвеолами с последующим слиянием альвеол. Внутренняя поверхность ее может быть
выстлана атрофичными альвеолярными клетками. От висцеральной плевры булла частично или полностью отделена более или менее нормальной легочной тканью (рис. 134).
Блеб возникает в результате субплевральной перфорации альвеолы с отслойкой (или расслоением) висцерального плеврального листка. Легочной тканью он не покрыт (рис. 135). Стенка его представлена элементами плевры, внутренней эпителиальной выстилки он не имеет.
21 Зак. 0517
321
Рис. 135. Тонкостенные кисты (буллы) в верхней доле правого легкого. Прямая рентгенограмма.
Воздушные кисты, в отличие от истинных, не содержат жидкости. Они бывают одиночными, но чаще множественными (особенно пузырьки).
Относительно прохождения пузырей в легком существует две точки зрения. Согласно одной из них, они генетически обусловлены, относятся к дизонтогенетической патологии, т. е. к врожденной неполноценности легочных соединительнотканных структур. Подтверждением этого является установленный наследственный спонтанный пневмоторакс на почве пузырей. Однако таких наблюдений мало — к настоящему времени опубликовано только 38 случаев спонтанного пневмоторакса в 17 семьях [Гинсбург М. А., Медведевский Б. И., 1976]. Кроме того, далеко не всегда в этих наблюдениях удавалось точно установить, возникло это осложнение на почве истинной кисты или же пузыря. Согласно другой точке зрения, пузырчатые образования — это приобретенная патология. Сторонники ее указывают на часто обнаруживаемые в области пузырей последствия ранее перенесенного воспаления: спайки, рубцы, специфические туберкулезные изменения. Однако надо иметь в виду, что первичный характер последствий воспаления, в результате которого предположительно возник пузырь, недоказуем.
Спайки и рубцы плевры некоторыми авторами рассматриваются как самостоятельная своеобразная причина спонтанного пневмоторакса вне зависимости от наличия кист. В. С. Савельев, Г. Д. Константинова (1969) ставят их среди прочих этиологических факторов пневмоторакса на второе место.
Важную роль в возникновении спонтанного пневмоторакса играет диффузная или локальная интерстициальная эмфизема легких. Анализ литературных данных показал, что среди больных со спонтанным пневмотораксом эмфизема легких как причина его выявляется в 4 % случаев. Среди лиц с пневмотораксом в пожилом возрасте частота этого этиологического фактора существенно возрастает. С. Maclin (1939) предложил и экспериментально обосновал теорию патогенеза интерстициальной эмфиземы. По данным этого автора, при давлении в легком, превышающем 20 мм рт. ст. (как это может быть, например, во время кашля), воздух может диффундировать из альвеол в интерстициальное пространство в виде мельчайших пузырьков, распространяясь под плевру.
Поскольку эмфизема легких чаще всего возникает на почве хронического бронхита, последний следует рассматривать в числе этиологических факторов пневмоторакса. По тем же мотивам к ним относят и бронхиальную астму. Vervaad (1963) при тщательном обследовании 170 больных со спонтанным пневмотораксом те или иные проявления астматического характера (включая бронхит с астматическим компонентом) констатировал у них в 23,5 % случаев.
Активные формы туберкулеза легких, по данным некоторых авторов [Грунтфест Н. С., 1963; Белицкий Ф. С., 1965; Стручков В. И. и др., 1965], выявляются у 6—12 % больных. Последствия туберкулеза в виде рубцов и спаек, ведущих к образованию пузырей и локальной эмфиземы, встречаются значительно чаще.
В возникновении спонтанного пневмоторакса определенное место отводят острым воспалительным заболеваниям — пневмонии, острому бронхиту, острому абсцессу легкого, стафилококковой деструкции; изредка он возникает на фоне инфаркта легкого. Известно учащение случаев спонтанного пневмоторакса в период эпидемии гриппа, вспышек острых респираторных заболеваний. По данным клиники госпитальной хирургии, воспалительные явления со стороны верхних дыхательных путей, бронхов и легкого предшествовали спонтанному пневмотораксу у 7,6 % больных.
Редко спонтанный пневмоторакс возникает при опухолях — раке, аденоме бронха, доброкачественных новообразованиях легкого и плевры. Известны случаи его при эозинофильных инфильтратах, саркоидозе, при бронхоэктазиях, силикозе, бериллиозе.
Совсем редко никакой болезни, которая могла бы повлечь за собой спонтанный пневмоторакс, выявить не удается. Тогда говорят о «пористой плевре» и т. п.
Какую-то роль в возникновении спонтанного пневмоторакса играют эндокринные факторы.
322
Этим отчасти можно объяснить существенное преобладание этой патологии у мужчин. Известны случаи пневмоторакса, повторяющегося у женщин в периоды беременности, а также отчетливо связанные с началом менструального цикла.
Возникновению спонтанного пневмоторакса способствуют все факторы, которые приводят к более или менее резким колебаниям давления в дыхательных путях. Это физическое и нервно-психическое напряжение, и кашель, и травматические повреждения локализации, при которой невозможно повреждение плевральных листков на стороне пневмоторакса. Это также и пребывание в самолете, в барокамере. К этим факторам относят и искусственную вентиляцию легких.
Значение физического напряжения подтверждено многочисленными наблюдениями. Анализ больных, поступивших в клинику госпитальной хирургии, показал, что связь возникновения спонтанного пневмоторакса с физическим напряжением имелась в половине случаев. Есть предположение, что при физическом напряжении не только повышается внутриле-гочное давление, но также наступает перерастя-жение плевры при форсированном вдохе, обычно предшествующем физическому напряжению.
Аналогичный механизм — нарушение акта дыхания — имеет место, по-видимому, и при нервно-психическом напряжении. К этому примешиваются, возможно, нервно-сосудистые расстройства, ведущие к ишемии, а также бронхоспастический компонент.
Механизм пневмоторакса при травме косвенной локализации, например при ушибе груди на другой стороне, при наложении контралатерального пневмоторакса, при блокаде звездчатого узла и т. п., надо полагать, близок к механизму при физическом и нервно-психическом напряжении. Нередки случаи спонтанного пневмоторакса, как указывалось выше, при наложении искусственного пневмоперитонеу-ма. Остается неясным, почему при этом он бывает всегда на правой стороне.
Случаи спонтанного пневмоторакса в самолете, а также в барокамере не так уж часты. Однако о них упоминается постоянно. То же можно сказать о пневмотораксе при искусственной вентиляции легких во время наркоза. Следует отметить, что пневмоторакс при наркозе возникает скорее всего в результате нарушения техники проведения искусственной вентиляции (повышение давления в бронхах выше 20 мм рт. ст.). Правда, пневмоторакс при этом, как правило, возникает на фоне имеющейся легочной патологии. Так, R. Jones и соавт. (1983) наблюдали спонтанный пневмоторакс при искусственной вентиляции легких у 4,5 % ново
21 *
рожденных; в большинстве случаев он возник тогда, когда имел место идиопатический респираторный дистресс-синдром.
Патофизиологические нарушения при спонтанном пневмотораксе обусловлены тремя основными факторами: наличием воздуха в плевральной полости, характером и особенностями легочно-плеврального сообщения и степенью коллапса легкого.
Воздух, а также иногда кровь вызывают раздражение плевры, способствуют накоплению в ней жидкости.
Легочно-плевральное сообщение может быть достаточно больших размеров, например при краевой деструкции легкого. Но чаще оно невелико, а нередко настолько мало, что обнаружить его не удается даже при непосредственном осмотре после торакотомии. Иногда дефект в легком не находят, когда причина пневмоторакса не вызывает сомнений. Так бывает, например, при воздушных кистах.
После возникновения пневмоторакса легочноплевральное сообщение может быстро ликвидироваться (закрыться фибрином, сгустком крови); постепенно оно может зарубцеваться. Тогда говорят о закрытом пневмотораксе. Однако сообщение может сохраняться и длительное время, поддерживая пневмоторакс, способствуя хроническому его течению. Такой пневмоторакс называют открытым или сообщающимся. Наконец, сообщение может действовать как клапан. При этом возникает клапанный пневмоторакс, в определенных условиях приводящий к напряженному пневмотораксу.
Спадение легкого в большинстве случаев является основной причиной общих расстройств. За счет спадения легкого уменьшаются дыхательные объемы, снижаются резервы дыхания и максимальная минутная вентиляция, ускоряется, а затем замедляется легочный кровоток, изменяется ударный объем крови, повышаются давление в малом круге и центральное венозное давление, снижается оксигенация артериальной крови [Гилевич Ю. С. и др., 1976].
По степени спадения легкого следует различать малый, средний и большой пневмотораксы. Малый пневмоторакс — это спадение легкого примерно на 1 /з, средний — на 1 /г и большой — спадение больше чем на 1 /г перво начального объема.
По степени компенсации патофизиологических сдвигов можно выделить фазу стойкой компенсации пневмоторакса (обычно при малом и среднем пневмотораксах), фазу неустойчивой компенсации (при спадении легкого больше чем наполовину) и фазу недостаточной компенсации.
В фазе компенсации внешних проявлений дыхательной недостаточности и сердечно-сосудистых расстройств обычно не бывает, хотя
323
Рис. 138. Спонтанный пневмоторакс справа. Газ виден только в положении больного на боку.
а — прямая рентгенограмма в вертикальном положении; б — прямая рентгенограмма в латеропозиции.
Рис. 139. Схема для планиметрического определения степени спадения легкого по рентгенограмме (по Киршнеру и Швартцелю).
A BCD — площадь правой половины грудной клетки; abed — площадь спавшегося легкого.
щую достаточно большой просвет, производится измерение внутриплеврального давления. Лучше всего при этом использовать аппарат для наложения спонтанного пневмоторакса.
При первичном измерении внутриплеврального давления возможны следующие варианты показателя манометра: колебание столба его около нуля, отрицательное давление и положительное давление. Колебание около нуля чаще бывает при закрытом пневмотораксе, отрицательное давление — в равной мере часто как при закрытом, так и при открытом (сооб
щающемся) пневмотораксе, положительное давление — только при клапанном пневмотораксе.
После аспирации 0,4—0,5 л воздуха и повторном измерении давления (в течение 5 мин) при закрытом пневмотораксе создается стойкое отрицательное давление на уровне —6...—10 см вод. ст., свидетельствующее о беспрепятственном расправлении легкого. Стойкое отрицательное давление на уровне —18...—20 см вод. ст. говорит о закрытом пневмотораксе и о том, что расправление легкого происходит
326
с трудом либо вовсе не происходит. Как правило, это бывает при его ошвартовании. Нестойкое отрицательное давление, возвращение его к исходному уровню наблюдаются при открытом легочно-плевральном сообщении небольших размеров. Если отрицательное давление создать не удается, то имеется большой дефект в легком. Данные, полученные при пункции с манометрией, учитываются при определении лечебной тактики.
После пункции следует произвести контрольную рентгеноскопию, сравнив полученную картину с рентгенологическим исследованием при первичном осмотре. Нередко при этом констатируется полное или почти полное расправление легкого. Лечение в таких случаях на этом часто заканчивается, больной подлежит лишь наблюдению.
При наличии б плевральной полости жидкости во время пункции она аспирируется и направляется для цитологического исследования. Она может оказаться кровью, экссудатом или гноем- при эбзинфильных инфильтратах легкого в ней обнарз вается большое количество эозинофилов, при злокачественном поражении легкого или плевры — атипичные клетки. Во всех случаях показан посев полученной жидкости с выявлением микрофлоры и чувствительности ее к антибиотикам.
Последующие специальные методы обследования больных направлены на уточнение причины спонтанного пневмоторакса, когда она еще неясна, распространенности поражения и на оценку общего состояния, особенно если предстоит оперативное вмешательство.
У больных, у которых легкое после пункции не расправляется, у больных с подозрением на поражение плевры (туберкулезом, опухолевым процессом), при рецидивирующем спонтанном пневмотораксе, а также в трудных для диагностики основного заболевания случаях, особенно тогда, когда не предстоит оперативное вмешательство, показана торакоскопия, являющаяся при спонтанном пневмотораксе ценным диагностическим приемом.
Для торакоскопии обычно используют тора-коскоп, который вводят с помощью троакара, как правило, в той же точке, где делают пункцию, в положении больного на боку с подложенным под поясницу валиком. Используют боковую оптику. Применяют для этой цели также и волоконные оптические системы с освещением (предназначенные для бронхоскопии).
При торакоскопии можно увидеть субплевральные кистозные образования и спайки, степень их выраженности, особенности расположения и распространения. Кроме того, оценивается состояние плевры и легкого: наличие
или отсутствие воспаления (гиперемия, отек, наложения фибрина на плевре), утолщение висцерального плеврального листка (шварта), туберкулезные бугорки, карциноматоз, антракоз легкого, участки ателектаза. Торакоскопия позволяет отдифференцировать пневмоторакс от некоторых других состояний, например от гигантских кист. Дефект в легком при торакоскопии можно обнаружить только тогда, когда он большой.
При торакоскопии, сделанной в клинике госпитальной хирургии у 45 больных, буллы и субплевральные пузыри выявлены у 30 человек, гиперемия плевры и фибринозные наложения на ней — у 34, наличие спаек, ограничивающих спадение легкого,— у 15; дефект в легком не был выявлен ни разу.
Данные торакоскопии имеют подчас большое значение, так как в ряде случаев позволяют поставить диагноз основного заболевания, когда с помощью других методов это сделать невозможно [Кукош В. И. и др., 1983].
Из других дополнительных методов обследования применяются бронхоскопия и бронхография. Бронхоскопию надо делать всегда, когда есть хоть малейшее подозрение на рак легкого. Показанием к ней служит также подозрение на туберкулез: при туберкулезе легких бронхоскопия, как известно, примерно в 5—6 % случаев позволяет диагностировать его с уверенностью. Показания к бронхографии более ограниченны. При множественных, выявляемых рентгеноскопически и рентгенографически кистах бронхография делается для исключения или подтверждения бронхоэктазий. При выявлении бронхоэктазий на стороне пневмоторакса целесообразно произвести бронхографию и противоположного легкого; это нужно делать обязательно, если предстоит оперативное лечение.
Из методов оценки общего состояния заслуживает внимания исследование функции внешнего дыхания. При этом желательна раздельная бронхоспирометрия или хотя бы латеральная спирометрия по Бергену, при которой можно получить ориентировочные сведения о функции непораженного легкого. Если позволяет состояние больного, то исследование внешнего дыхания производится с нагрузочными пробами, которые выявляют скрытую дыхательную недостаточность.
Изменения показателей внешнего дыхания, в общем, соответствуют степени спасения легкого. Об этом говорилось выше. Заслуживает внимания установленный в клинике факт: при спадении легкого до 50 % от его нормального объема наблюдается не уменьшение, а увеличение резервного объема вдоха; при большей степени коллапса резервный объем вдоха начи
327
нает нормализоваться. Снижение этого показателя, как оказалось, говорит о неспособности легкого к расправлению.
Характерной особенностью течения спонтанного пневмоторакса является его упорно рецидивирующий характер. По литературным данным, частота рецидивирующей формы колеблется от 5 до 50 %; по материалам клиники, она составляет 13,3 %.
Интервалы между рецидивами бывают от нескольких недель до нескольких лет. Рецидивы часто возникают при различного характера воздушных полостных образованиях в легком (больше чем у половины больных).
Рецидив заболевания проявляется теми же симптомами, что и первичный пневмоторакс. Можно отметить только, что он протекает обычно в несколько более легкой форме. Диагностические ошибки при этом, однако, бывают редко, так как больной о своем шболевании знает.
Осложнения спонтанного пневмоторакса (как первичного, так и рецидивирующего) делят на ранние и поздние.
Среди ранних осложнений самым грозным является напряженный пневмоторакс, встречающийся не так уж редко — в 2—7 % случаев, хотя в тяжелой форме он проявляется намного реже. Основным признаком напряженного пневмоторакса является нарастающая одышка с цианозом, учащением пульса, иногда со снижением артериального давления. Тяжелое состояние больных является причиной нередких в этих случаях диагностических ошибок. Диагноз устанавливается после пункции плевральной полости с манометрией.
Другое тяжелое раннее осложнение — внутриплевральное кровотечение. Если кровотечение легкой степени при пневмотораксе представляет собой обычное явление, то массивная кровопотеря наблюдается редко. Как правило, она бывает следствием отрыва хорошо васкуляризованных сращений от грудной стенки. Клиническая картина кровотечения складывается из симптомов пневмоторакса и кровопотери. Диагностика этого осложнения подчас представляет значительные трудности, так как кровотечение в этих случаях происходит из сравнительно мелких сосудов и кровопотеря нарастает постепенно. Самопроизвольная остановка кровотечения может долгое время не наступить из-за того, что сосуды грудной стенки находятся в постоянном движении, зияют, тромбы, образующиеся в них, быстро подвергаются лизису, обусловленному повышенной фибринолитической активностью тканей грудной стенки и жидкости плевральной полости. Медленно нарастающая кровопотеря сравнительно долго остается компенсированной и не распознается, поскольку клинические признаки
ее (бледность кожи и слизистых оболочек, учащение дыхания и пульса) маскируются признаками сердечно-легочной недостаточности, свойственными пневмотораксу. Лечение кровопотери, предпринимаемое с запозданием, представляет нелегкую задачу. Поэтому смертность при массивной кровопотере достигает 50 % [Соловьев В. С., Константинова Г. Д., 196<Д.
К ранним осложнениям некоторые авторы относят одномоментный двусторонний спонтанный пневмоторакс. Как говорилось выше, он диагностируется у 2—3 % больных. Клиническая картина зависит от степени пневмоторакса. Чаще он протекает в относительно благоприятной форме, так как значительное спадение легкого с двух сторон отмечается сравнительно редко. Но при двустороннем коллапсе более чем на 50 % наблюдается картина тяжелой острой дыхательной недостаточности. Из-за редкости этого осложнения оно не всегда диагностируется своевременно: причину дыхательной недостаточности ищут не в пневмотораксе, а в чем-либо другом.
К поздним осложнениям спонтанного пневмоторакса относят реактивный плеврит (сухой или экссудативный) и эмпиему плевры. Эмпиема развивается в результате инфицирования экссудата, а также крови. Естественно, она возникает всегда, когда спонтанный пневмоторакс является следствием прорыва в плевральную полость острого абсцесса легкого, полости стафилококковой деструкции. Благоприятные условия для развития эмпиемы имеются в случае, когда он осложняет пневмонию.
В случае длительного, в течение 2—3 мес, нерасправления легкого при спонтанном пневмотораксе наступает его ошвартование, что следует отнести к позднему осложнению, требующему специального лечения. Такое осложнение иногда называют хроническим спонтанным пневмотораксом. Причинами нерасправления легкого являются поздняя диагностика пневмоторакса, трудности расправления легкого у пожилых больных из-за эмфиземы и пневмосклероза, а главным образом — стойкое плевролегочное сообщение, которое со временем превращается в плевролегочный свищ.
При длительном нерасправлении наступают изменения в коллабированном легком: при повторяющихся воспалениях в нем может развиться пневмосклероз, возникнуть бронхоэктазии, оно функционально гибнет; воспаление экссудата приводит к вторичной эмпиеме.
Несмотря на то, что спонтанный пневмоторакс сейчас диагностируется сравнительно рано, а лечение его проводится довольно активно, длительное нерасправление легкого при спонтанном пневмотораксе встречается отнюдь не
328
как исключение — оно наблюдается у 15—20 % больных.
Клиническая картина этого позднего осложнения характеризуется признаками различной степени выраженности хронической легочносердечной недостаточности и явлениями воспаления в полости плевры и в легком.
ЛЕЧЕНИЕ
Практиковавшееся ранее в легких случаях симптоматическое лечение, рассчитанное на самоизлечение, в настоящее время почти полностью оставлено. Опыт показал, что при таком подходе слишком велики сроки выздоровления (до 9() сут), а также возрастает опасность поздних осложнений, в том числе опасность длительного нерасправления легкого, с вытекающими из этого последствиями.
Выжидательная тактика — наблюдение и симптоматическая терапия в течение 1—2 нед, необходимых, как полагали, для заживления легочно-плеврального сообщения,— также себя не оправдала: заживления дефекта в легком за этот срок, как правило, не наступает, а результаты последующего лечения с применением более активных методов, начатого с запозданием, оказались хуже, чем предпринятого в более ранние сроки.
Лечение следует начинать, как указывалось, с лечебно-диагностической пункции. Если легкое после нее расправилось и при последующем наблюдении спадения его не наступает, то на этом лечебные мероприятия заканчиваются.
В случае, когда после первой пункции в плевральной полости остается еще много воздуха или имеется жидкость, а также в случае, когда потом воздух появляется вновь (это может произойти на 2—Я-й день), пункцию повторяют 2—3 раза.
Пункционным методом удается ликвидировать пневмоторакс у 2/ > больных. Если через 7—10 дней легкое расправить не удалось, то целесообразно перейти к следующим, более активным методам. Они включают дренирование плевральной полости, а также тампонаду бронхов пораженной доли (или всего легкого), сочетающейся с активной аспирацией воздуха (и жидкости) из полости.
Дренирование в настоящее время — наиболее распространенный метод.
Лечение начинают сразу с дренирования плевральной полости, когда при первой пункции не достигается отрицательного давления, а также при рецидивирующем спонтанном пневмотораксе и в случаях, когда больной поступает с уже длительно нерасправившимся легким. Обычно легкое в таких случаях бывает спавшимся больше чем на [ / л.
Дренаж устанавливается с помощью троакара обычно в пятом межреберье по средней подмышечной линии. Дренажная трубка направляется концом вверх; необходимо надежно фиксировать ее к коже швом.
Заслуживает внимания предложение J. Cales, J. Lafforgue (1983) о дренировании с использованием пластикового подключичного катетера, который вводится в плевральную полость по методике Сельдингера через пункционную иглу по проводнику. Плотные стенки катетера исключают спадение его в тканях грудной стенки. Инфицирование их, а также опасность бактериального загрязнения плевральной полости сводятся при этой методике к минимуму. Такая методика может быть приравнена к пункционному методу лечения.
При дренировании установка дистального конца дренажа под воду (по Бюлау) или присоединение его к специальным клапанным устройствам, рассчитанным на пассивный сброс воздуха из плевральной полости при повышении давления в ней, редко приводят к излечению, а поэтому используются лишь как временная мера на период транспортировки больного из перевязочной в палату или когда нет возможности сразу же перейти к активной аспирации.
Основная цель дренирования — попытка расправить легкое активной постоянной аспирацией воздуха из полости. Дренаж присоединяется к отсосу, снабженному манометром. Отрицательное давление не должно превышать 20—25 мм рт. ст. Если легкое способно расправиться, оно не ригидно, не покрыто швартой, если легочно-плевральное сообщение невелико и воздух через него поступает медленнее, чем аспирируется из полости, то такого давления для ликвидации полости почти всегда достаточно. Более форсированную аспирацию делать не следует во избежание увеличения дефекта в легком или дополнительного повреждения его, что вполне возможно, например, при наличии множественных субплевральных пузырей.
Методом постоянной аспирации удается ликвидировать пневмоторакс у большинства больных, у которых лечение пункциями оказалось безуспешным. Обычно легкое расправляется через 2—3 дня. Удаление дренажа после этого можно сделать через сутки — двое. За это время обеспечивается достаточно надежная фиксация легкого к грудной стенке.
Раньше для более надежной фиксации, с целью предупреждения рецидива пневмоторакса предлагалось введение в плевральную полость различных раздражающих химических веществ — 40 % раствора глюкозы, раствора нитрата серебра, масла, взвеси талька, гипертонических растворов хлорида натрия или кальция
329
и др. Вопрос об эффективности этого мероприятия остается открытым. В литературе имеется немало примеров рецидива пневмоторакса после применения раздражающих средств. Кроме того, сильно раздражающие вещества малопригодны,, из-за того что могут вызвать нежелательную общую реакцию. Сейчас этот метод практически оставлен, хотя применение безвредных раздражающих средств, всегда имеющихся под рукой (солевых гипертонических растворов, спиртового раствора йода), противопоказаний не имеет.
Появившийся недавно метод временной окклюзии бронха, вентилируемого легкого, в котором имеется легочно-плевральный дефект [Гераскин В. И. и др., 1976; Штыхно О. Ф., 1978; Астафуров В. Н., 1979, 1980; Кабанов А. Н. и др., 1979, 1980; Путов Н. В. и др., 1981, 1983], заслуживает внимания и, как показал опыт клиники госпитальной хирургии [Гришаков С. В., 1983; Чепчерук Г. С., Гришаков С. В., 1984], может применяться наряду с дренированием плевральной полости сразу же вслед за пункционным методом лечения. Этот метод рассчитан на то, что после окклюзии бронха поступление воздуха через легочно-плевральное сообщение в плевральную полость прекратится и при создании отрицательного давления в ней наступит ликвидация полости за счет растяжения частично воздушного легкого, а также за счет смещения средостения и диафрагмы.
Применяющаяся в клинике методика окклюзии бронха состоит в следующем. Окклюзия производится после дренирования плевральной полости, под наркозом, через бронхоскоп. В процессе процедуры осуществляется аспирация воздуха через дренаж с помощью аппарата Л. Л. Лавриновича, позволяющего создать дозированное разрежение. Об изменениях воздушного потока судят по показаниям ротаметра.
Сначала производится поисковая окклюзия, целью которой является установление локализации дефекта в легком. Она сочетается с продуванием исследуемого бронха, для чего используется обтуратор типа Мэгилла или В. И. Слипченко. Если при обтурации исследуемого бронха в плевральной полости создается вакуум, а при продувании бронха вакуум исчезает, то следует считать, что дефект имеется только в зоне легкого, вентилируемой исследуемым бронхом; в случае, когда вакуум в плевральной полости не создается ни при обтурации, ни при продувании его, можно считать, что имеются дефекты в легком, вентилируемом исследуемым бронхом, и в других отделах; наконец, когда при обтурации бронха вакуум не создается, а при продувании он устанавливается, можно думать о дефектах в других отде
лах легкого, но не в зоне обтурированного бронха.
После того как с помощью поисковой окклюзии с продуванием точно устанавливается локализация легочно-плеврального сообщения, приступают к окклюзии на продолжительный срок. Для этого в просвет бронха вводят крупнопористую поролоновую губку, пропитанную рент-генконтрастным веществом (йодолиполом) Диаметр губки должен превышать просвет обтурируемого бронха в 2—3 раза, что обеспечивает полную герметизацию его и надежную фиксацию губки, исключающую ее миграцию. При использовании в качестве обтуратора коллагеновых пломб были установлены раннее их ослизнение, недостаточная герметизация бронха и фиксация в нем.
После обтурации через 2—3 дня наступает ателектаз легкого и, как правило, ликвидируется пневмоторакс. У многих больных это сопровождается некоторым ухудшением состояния, повышением температуры тела, что связано с явлениями воспаления в зоне ателектаза. Однако, как показали экспериментальные исследования и клинические наблюдения [Гришаков С. В., 1984], это воспаление носит обратимый характер и хорошо поддается медикаментозной терапии.
Дренаж плевральной полости удаляется через 2—3 дня после процедуры. Продолжительность окклюзии бронха у взрослых составляет 14— 21 день.
В настоящее время надо считать, что только после того, как указанные методы лечения спонтанного пневмоторакса оказались неэффективными, следует ставить вопрос об операции. Оперативное лечение чаще показано при рецидивирующем и осложненном спонтанном пневмотораксе. Изредка показания к операции возникают экстренно. Причиной для экстренного оперативного вмешательства обычно служит продолжающееся внутриплевральное кровотег чение, а также клапанный напряженный пневмоторакс.
Основной же целью операции являются устранение сообщения легкого с плевральной полостью. создание условий для расправления его и предупреждение рецидива. Объем вмешательства по возможности должен бьиь минимальным.
Найти дефект в легком, как говорилось, даже во время операции бывает не всегда легко. Тогда прибегают к раздуванию легкого с помощью наркозного аппарата с заполнением плевральной полости жидкостью.
Наиболее простым и в то же время достаточно надежным методом устранения дефекта в легком является экономное иссечение участка его в пораженной части — краевая атипичная
330
Рис. 140. Пластика висцеральной плевры листком париетальной плевры по И. С. Колесникову.
а — вид легкого с множественными субплевральными пузырьками; б — подшивание к нему лоскута париетальной плевры на ножке.
резекция с ушиванием легочной ткани. Резекция может производиться аппаратом УКЛ, наложение швов — атравматичными иглами.
При множественном буллезном поражении висцеральной плевры эффективна операция пластики ее париетальным листком по И. С. Колесникову, при которой производятся отслойка париетального листка от грудной стенки и подшивание лоскута его на ножке к пораженному висцеральному листку с наложением швов в шахматном порядке (рис. 140).
При утолщении висцеральной плевры, препятствующем расправлению легкого, производится операция декортикации легкого. При этом уда
ляются лишь те участки измененной плевры, которые препятствуют расправлению.
В редких случаях возникает необходимость в лобэктомии или пневмонэктомии. Целесообразно удалить долю легкого, например, при диффузной, чаще врожденной, лобарной эмфиземе, при поликистозе, при бронхоэктазиях доли, при пневмосклерозе вследствие длительного пребывания в бронхе инородного тела.
На заключительном этапе операции производится проверка герметичности легочной ткани раздуванием легкого под водой.
Послеоперационное лечение проводится по правилам ведения торакальных больных.
Глава ± О ОБЕСПЕЧЕНИЕ БЕЗОПАСНОСТИ ОПЕРАЦИЙ ПО ПОВОДУ ЗАБОЛЕВАНИЙ ЛЕГКИХ И ПЛЕВРЫ
ЗАЩИТА ОРГАНИЗМА ОТ ВОЗДЕЙСТВИЙ
ОПЕРАЦИОННОЙ ТРАВМЫ
В первый период развития легочной хирургии в нашей стране решение задач обезболивания достигалось использованием местной анестезии, техника которой была разработана А. В. Вишневским, И. С. Колесниковым, В. И. Стручковым, ф. Г. Угловым. При правильном соблюдении всех тактических приемов этот метод обезболивания позволял выполнять у относительно крепких больных значительные по объему операции на легких. Местная анестезия в некоторых ситуациях сохраняет свое значение и сейчас. В общем она производится следующим образом.
После послойной местной анестезии 0,25 % раствором новокаина (в современных условиях — лучше раствором тримекаина) зоны тора-котомной раны и вскрытия плевральной полости он вводится в клетчатку средостения с целью анестезии нервных сплетений, диафрагмального и блуждающего нервов. Вслед за этим тщательно инфильтрируется корень легкого. Следующим этапом является введение раствора субплеврально в межреберные промежутки, тут же у позвоночника, для блокады не только межреберных нервов, но и грудной симпатической цепочки. После выделения и перевязки сосудов корня удаляемого отдела легкого тщательно инфильтрируется раствором анестетика околобронхиальная клетчатка по задней и передней поверхности бронха. Только после этого выделяется, пережимается и пересекается бронх. Перед зашиванием раны грудной стенки следует повторно инфильтрировать клетчатку средостения в области блуждающего и диафрагмального нервов и ввести анестетик в межреберные промежутки.
Опасности нарушений дыхания и кровообращения, связанные с пневмотораксом и кровопотерей, привели к отказу от местного обезбо
ливания в хирургии легких и плевры. К этому методу хирургического обезболивания ныне обращаются в основном при некоторых относительно небольших операциях (резекция ребер) и дренирующих манипуляциях (пункция, установка дренажа). Некоторые моменты вну-тригрудной местной анестезии (блокада переднего средостения, подплевральная межреберная анестезия перед закрытием торакотом-ной раны) являются необходимым компонентом операции на легких под ингаляционным наркозом.
В последние 20 лет операции на легких и плевре в абсолютном большинстве случаев проводят под различными видами общей, чаще — комбинированной анестезии.
Премедикация начинается вечером накануне операции и чаще всего включает снотворное (ноксирон, радедорм), антигистраминный препарат (димедрол, тавегил), траквилизатор (седуксен, сибазон). Только больным с отчетливым психоэмоциональным напряжением транквилизаторы до операции назначаются 3 раза в день в течение 2—3 дней.
В день операции, за 1 — l'/г ч до транспортировки в операционную, больной получает те же средства, но без снотворных. Наркотические анальгетики (морфин, промедол) в последние годы для премедикации не используются.
Специальные задачи премедикации редки. Лишь у больных с неустойчивым ритмом сердца, наклонностью к экстрасистолиям целесообразно использовать в премедикации дропери-дол (0,1—0,15 мг/кг массы), но не с целью седатации или противорвотного действия, а потому, что он надежно уменьшает последствия гиперадреналинемии, которая реализуется в том числе и в развитии сердечных аритмий. У больных с установленными признаками адренокортикоидной недостаточности, а также получавших глюкокортикоиды на протяжении последних 6 мес в значительных дозах, необходимо использовать как компонент премедикации введение 100—250 мг гидрокортизона внутримышечно за 1'/2—2 ч до начала анестезии.
Механическая подготовка к наркозу проводится согласно общепринятым правилам. Итог ее заключается в том, чтобы ни один больной не поступал в операционную с наполненным
332
желудком, мочевым пузырем или толстой кишкой. Эти проблемы решаются на лечебно-диагностическом отделении персоналом отделения. О необходимости ограничения питания накануне операции, очистки кишки слабительным и клизмой больной должен быть поставлен в известность анестезиологом.
Для вводного наркоза чаще всего используются тиопентал и гексенал. При этом учитывается способность барбитуратов вызывать угнетение кровообращения с падением сердечного выброса вследствие прямого угнетающего действия на миокард и вазоплегии с уменьшением притока крови к сердцу [Хныкина В. И., 1970; Dobkin A. et al., 1957, и др.]. Поэтому одним из непременных условий безопасного проведения барбитуратного наркоза является вдыхание больным кислорода и «инфузионный подпор», компенсирующий относительную недостаточность объема циркулирующей крови вследствие вазоплегии. Барбитураты инъецируют вслед за введением 10 мл официнального раствора хлорида или глюконата кальция. Предварительное введение препаратов кальция смягчает прямое угнетающее действие барбитурата на сердце. Такой же эффект оказывает и пиридоксин (витамин Вс,).
При относительной дооперационной гиповолемии вводному наркозу предшествует вливание 0,5—1 л рингер-бикарбоната и 0,4 л по-лиглюкина. «Инфузионный подпор» перед началом наркоза и операции всегда следует рассматривать как эффективный способ предупреждения воздействия анестетика на кровообращение. Темп вливания должен быть достаточно высок, так как вводный наркоз можно начинать через 2—3 мин ингаляции кислорода. К этому времени в основном завершается де-нитрогенация газовой среды респираторной зоны. Непосредственной инъекции вводного анестетика предшествует введение раствора глюкозы и 0,5—1 мг атропина, который, не вызывая значительной тахикардии, ослабляет вагальные рефлексы на интубацию. В случаях исходной тахикардии атропину следует предпочесть введение 0,2 мг гликопирролата (гастро дина).
Лишь у некоторых больных (при экстренных операциях на фоне кровотечения) для вводного наркоза предпочтение отдается кетамину (1,5—2 мг/кг массы тела), эффективность которого в таких случаях несоответствия объема крови емкости сосудистого русла доказана.
Следует осторожно относиться к применению фторотана для вводного наркоза (как и для поддержания анестезии), хотя этот анестетик обладает рядом свойств, благоприятных для обеспечения безопасности операции у больных
с патологией легких, особенно опухолевого генеза [Фрид И. А. и др., 1982]. Однако опасность гипотонии и аритмий, снижение производительности сердца, гепатотоксические проявления, особенно выраженные на фоне гипоксии и гиперкапнии (развитие последних всегда реально при операциях на легких), доказанные Г. А. Рябовым и соавт. (1972), Rusy М. и соавт. (1971), В. Е. Богдатьевым и соавт. (1978) и многими другими, не позволяют ставить широко показания к фторотановому наркозу у тяжелых больных с исходной гиповолемией и скрытой или явной миокардиальной, дыхательной и печеночной недостаточностью.
Современная общая анестезия при внутри-грудных операциях предусматривает (в большинстве случаев) полное расслабление всей скелетной мускулатуры сразу после введения в наркоз и до окончания анестезии. Исходя из фармакодинамики миорелаксантов и многолетних наблюдений, миорелаксацию после завершения вводного наркоза следует начинать введением антидеполяризующего препарата в явно не релаксирующей дозировке (5 мг тубокурарина или 1 мл панкурониума бромида). Затем на фоне их слабого действия, для быстрого наступления апноэ инъецируется 50—60 мг сукцинилхолина (дитилин, листенон, миорелаксин), создающего идеальные условия для интубации трахеи. Нерелаксирующая доза антидеполяризующего миорелаксанта предотвращает гиперкалиемию, мышечные пс^ ргивания и другие побочные эффекты деполяризующих препаратов.
При значительной исходной гиперкалиемии перед вводным наркозом можно вести внутривенно 1—2 г магния сульфата в виде 25 % раствора, который, по мнению С. Aldrete и соавт. (1970), не только препятствует (как туберин или павулон) взрывной деполяризации концевых пластинок и уменьшению суммарного количества ацетилхолина, освобождаемого нервными окончаниями, но и отчетливо снижает уровень калия в плазме. В некоторых клиниках миорелаксацию предпочитают достигать использованием антидеполяризующих миорелаксантов на всем протяжении операции [Гинтере Я. Я. и др., 1974], используя для этого диоксоний. Быстрота наступления действия (1,5—3 мин), отсутствие побочных вегетативных реакций, постоянный уровень релаксации и отсутствие остаточной кураризации после введения небольших доз антихолинэстеразных препаратов позволяют рекомендовать этот препарат для широкого применения в хирургии легких.
Важным этапом развития проблемы обезболивания при операциях на легких явилось введение в широкую практику фармакологических средств для внутривенного наркоза и,
333
прежде всего, препаратов для нейролептанал-гезии.
Механизм действия нейролептика а-адрено-литического действия дроперидола и анальгетика фентанила описан во многих ранее опубликованных работах, в которых обстоятельно изложена методика комбинированного обезболивания с применением этих средств. Однако необходимо остановиться на некоторых положениях, относящихся к особенностям анестезиологического обеспечения операций на легких.
Фентанил в первоначальной дозе 0,5—0,7 мг и при последующем введении по 0,1 мг каждые 20—30 мин на фоне действия дроперидола (20—25 мг) и закиси азота (в соотношении с кислородом 5:2 по полузакрытому контуру) обеспечивает в большинстве случаев удовлетворительную центральную аналгезию.
При возникновении расстройств дыхания с необходимостью увеличения концентрации кислорода во вдыхаемой смеси закись азота может быть заменена натрия оксибутиратом (100—120 мг/кг массы внутривенно).
На фоне действия таких доз фентанила расходуется относительно мало сукцинилхолина— 200—300 мг на 4—6-часовую операцию. Увеличение необходимой дозы миорелаксантов свидетельствует о недостаточной аналгезии. Последствия неадекватной защиты от операционной агрессии проявляется во время либо после операции вегетативными расстройствами, нестабильным кровообращением, слабостью миокарда, повышенной кровоточивостью в плевральную полость, склонностью к тромбозам и инфекционным осложнениям, динамическим расстройствам моторно-эвакуаторной деятельности желудка и кишок.
Результаты многочисленных гемодинамических и биохимических исследований показали, что нейролептаналгезия в таком варианте является одним из наиболее надежных видов обезболивания при операциях на легких и плевре, предупреждающих в период операции возникновение изменений в жизненно важных функциях, выходящих за пределы физиологических колебаний. Стабильность гемодинамики вследствие довольно выраженного адреноблокирующего и умеренного вазодилатирующего эффекта анестезии, а также аналгезия являются факторами, предупреждающими, по мнению А. А. Бунятяна и соавт. (1973), нарушения центральной гемодинамики, которые вместе с защитным перераспределением крови представляют типичный ответ на любую хирургическую травму. Стабилизирующее воздействие дроперидола на гемодинамику позволяет применять нейролептаналгезию и на фоне тяжелых гиповолемических эпизодов в связи с одномомент
ной тяжелой кровопотерей. Препараты для нейролептаналгезии уменьшают потребление кислорода и выделение углекислого газа, снижают температуру тела.
На основании результатов физиологических исследований, проведенных на клиническом материале, А. А. Бунатян (1973), В. А. Гологорский и соавт. (1973) считают возможным применять нейролептаналгезию даже у больных с выраженным хроническим бронхитом и обструктивной эмфиземой в силу незначительного влияния препаратов на механику дыхания.
Противопоказанием к нейролептаналгезии являются бронхиальная астма и астматический бронхит из-за опасности развития тяжелого бронхоспазма.
Несмотря на очевидные достоинства нейролептаналгезии как метода обезболивания при операциях на легких, нельзя не отметить недостаточно полную блокаду болевых импульсов на отдельных этапах хирургических вмешательств. Поэтому продолжается поиск методов, предупреждающих патологические воздействия из зоны операции и реакции на них.
Исследования по проблеме адекватной защиты организма от шокогенных влияний внутриплевральной операции привели к внедрению в практику легочной хирургии еще одного варианта анестезии — фракционного введения местного анестетика через катетер, находящийся в верхнегрудном отделе эпидурального пространства (эпидуральная блокада), на фоне наркоза и искусственной вентиляции легких.
Эпидуральная блокада достигается фракционным введением 2,5 % раствора тремикаина (или 2 % раствора лидокаина), первая инъекция которого (не считая тест-дозу) должна быть сделана сразу же после вводного наркоза (10—20 мл). Количество раствора зависит от возраста больного, степени выраженности общего атеросклероза (утолщенные и извитые сосуды периду-рального пространства уменьшают его количество), характеристики волемии и других факторов. Нередко пожилым больным достаточно ввести 7—10 мл анестетика, чтобы получить широкую зону аналгезии с умеренным снижением системного артериального давления. Сознание может быть выключено закисью азота в 50—65 % концентрации или внутривенной инъекцией оксибутирата (80—100 мг/кг) иногда на фоне препаратов нейролептаналгезии в средних дозах.
Повторные инъекции тримекаина следует производить не в связи с появлением клинических признаков ослабления аналгезии, а каждые 50—60 мин, ибо достоинство полной аналгезии именно в ее непрерывности.
Динамические исследования концентрации сахара, неэстерифицированных жирных кислот,
334
показателей кислотно-основного состояния крови, фибринолиза у больных при операциях на легких с эпидуральной блокадой в качестве основного компонента анестезии подтвердили надежность защиты организма от операционной травмы. К концу самых продолжительных вмешательств сдвиг буферных оснований практически отсутствовал или не превышал 1 — 1,2 ммоль/л; мало изменялся и такой важный показатель реакции организма на операционный стресс, как феномен нарушения равномерности тока клеток крови (секвестрация эритроцитов), естественно, при условии адекватного восполнения операционной кровопотери.
Эти данные, как и наблюдения за больными, убеждают в том, что эпидуральная анестезия, несмотря на определенные трудности и опасности катетеризации перидурального пространства, занимает исключительное место как метод обезболивания при операциях на легких. Ее достоинства определяются блокадой афферентного звена рефлексов, предупреждающей само возникновение ноцицептивных реакций «на дальних подступах» к центральной нервной системе. Весьма важно и благоприятное влияние эпидуральной блокады на бронхоспастический компонент воздухоносных путей — снятие бронхоспазма. Сегментарная периферическая вазодилатация предупреждает развитие метаболических нарушений, расстройств микроциркуляции и реологических свойств крови.
Однако периферическая вазодилатация при эпидуральной анестезии на фоне выраженной гиповолемии, а возможно, и частичной блокады передачи нервного возбуждения по сердечным нервам [Stephen G. et al., 1960; Bonica J. et al., 1970] может вызвать гемодинамический ответ в виде падения сердечного выброса. Иногда эта реакция достигает степени коллапса [Щелкунов В. С. и др., 1973; Соколов С. Б. и др., 1978]. Поэтому невосполненная кровопотеря, особенно одномоментная, является противопоказанием к повторному введению анестетика. В такой ситуации до восстановления эффективного объема крови струйной трансфузией соответствие между ним и емкостью сосудистого русла приходится восстанавливать введением изотуро-ния или эфедрина (30—50 мг). Эти препараты не нарушают органный кровоток и, устраняя гипотензию, не оказывают существенного влияния на эффективность легочного газообмена [Ярош Б., Вальчак 3., 1978].
Кроме гиповолемических состояний, противопоказанием для эпидуральной блокады как метода аналгезии при операции на легких являются значительные деформации позвоночника, затрудняющие пункцию и катетеризацию эпидурального пространства, а также наличие
торакальных гнойных свищей и плевральных дренажей у больных гнойно-деструктивными заболеваниями, когда значительное бактериальное загрязнение кожи создает угрозу инфицирования эпидурального пространства.
Из методов обезболивания, используемых при хирургическом лечении заболеваний легких, отдельного рассмотрения заслуживает внутривенный наркоз кеталаром. Его применение при обширных вмешательствах, за исключением случаев, когда операцию приходится проводить на фоне выраженной гиповолемии, едва ли оправдано. Но при дренирующих операциях типа плевростомии с резекцией ребер этот метод анестезии часто становится методом выбора. Поводом для такого рода вмешательств часто являются гнойные заболевания, абсцессы, эмпиема плевры, располагающиеся в нижних отделах грудной полости, часто сообщающиеся с бронхом. Радикальные операции в связи с тяжестью состояния больных и особенностью патологического процесса, как правило, невыполнимы. Для анестезиологического обеспечения таких паллиативных вмешательств наркоз представляется не простой задачей как из-за общего состояния пациента, так и из-за опасности затекания гнойного содержимого из патологического очага в здоровые отделы легких. В прежнее время операции такого рода проводили под местным обезболиванием в положении больного сидя на операционном столе. С появлением в арсенале анестезиологов препаратов, подобных каталару, вновь стало возможным делать такие операции в наиболее безопасном положении, т. е. сидя, но под наркозом. На фоне 10 мг седуксена кеталар в обычной дозе (первая — 2—3 мг/кг массы, а затем по 0,5—1 мг/кг капельно внутривенно) обеспечивает возможность проведения вмешательства и избежать нарушений дыхания и кровообращения.
ЗАЩИТА ВОЗДУХОНОСНОЙ
ЗОНЫ ЛЕГКИХ
Более чем у 90 % больных с заболеваниями легких эндотрахеальная интубация трубкой соответствующего размера вполне отвечает задачам анестезии и выполнению оперативного вмешательства на легком. Обязательное использование трубок с герметизирующей манжетой (или с двумя — для попеременного раздувания) устраняет возможность затекания слюны и слизи из верхних отделов дыхательных путей и позволяет четко регулировать эффективность искусственной вентиляции. Манжета должна быть раздута минимально, только до прекращения выхождения воздуха при форсированном вдохе аппарата искусственного
335
дыхания, что предупреждает ишемические повреждения слизистой оболочки трахеи.
У больных со значительным количеством патологического отделяемого из бронхов (гной, детрит, кровь, распадающаяся ткань опухоли) интубация трахеи не предупреждает опасности патологического отделяемого в «здоровые» отделы легких. При нагноительных заболеваниях миорелаксация приводит к выделению значительного количества патологического содержимого даже при тщательной и настойчивой предоперационной подготовке, что вызывает тяжелые дыхательные расстройства. То же может возникнуть при операциях по поводу нарушенного множественного эхинококкоза.
Придание больному дренажного или анти-дренажного положения, как и обычно применяемое периодическое отсасывание мокроты, является паллиативной мерой. Лечебная бронхоскопия, проводимая по поводу операции или во время нее, также не может у некоторых больных обезопасить вмешательство, тем более, что бронхоскопию не всепда можно сделать в критический момент операции. Поэтому в таких случаях предпринимаются специальные меры защиты непораженных отделов легких.
Наибольшей популярностью пользуются три основных метода такой защиты. Простым и достаточно надежным методом, особенно при долевых резекциях, является интубация трахеи с предварительным заведением в пораженный отдел легкого (вне просвета эндотрахеальной трубки) пластикового, достаточно ригидного дренажа с двумя боковыми отверстиями на конце для периодической аспирации.
Раньше его устанавливали под контролем рентгена, в настоящее время делается поднаркозная бронхоскопия, позволяющая дренировать под контролем зрения именно бронх пораженного отдела, а затем производить интубацию трахеи с надежной фиксацией трубки и дренажа к коже костных выступов черепа пластырем. При всех достоинствах защиты такого рода при ней возможны определенные трудности и ошибки. Деформации бронхов, смещения, сужения или сдавливание их просвета извне затрудняют катетеризацию бронха. Возможен перегиб катетера в процессе интубации трахеи, а также развитие тяжелой респираторной гипоксии, вызванной обструкцией бронхов на вводном наркозе.
Более надежной, хотя и не столь простой, является защита бронхиального дерева путем эндобронхиальной интубации «здорового» легкого с обтурацией устья главного бронха пораженного легкого манжетой той же трубки, Этот метод применяется чаще и мало чем отличается от интубации трахеи. Для интубации
левого главного бронха используем обычные или специальные удлиненные интубационные трубки, для интубации правого — предпочтительно трубки с грушевидным скосом на конце, открытым в правую сторону.
Эндобронхиальная интубация, как правило, проходит быстро и может быть проведена при любом виде вводного наркоза с помощью прямой ларингоскопии. В то же время интубация левого главного бронха может быть сложна из-за значительной деформации бифуркации. В этом случае приходится использовать дыхательный бронхоскоп, на малый тубус которого надевается трубка. С помощью фибробронхоскопа на фоне инсуляции кислорода через его канал еще более точно можно установить эндобронхиальную трубку, в том числе и в правом бронхе, не перекрывая устья верхнедолевого бронха.
Основным недостатком эндобронхиальной интубации и однолеточной вентиляции считается возникновение значительного артериовенозного шунта, который приводит к гипоксемии в случаях возникновения расстройств вентиляции по ходу вмешательства и невозможности аспирации патологического отделяемого из бронхов блокированного легкого.
Существенным условием безопасного проведения однолегочного наркоза считается колла-бирование оперируемого легкого. Б. К. Экгольм (1966, 1971) оправдывал полное выключение из операции оперированного легкого тем, что уже через 20—30 мин после его коллабирования роль шунтов (по данным исследования газов артериальной крови больного) значительно уменьшается.
Отработанная техника раздельной интубации бронхов 2-просветными трубками Карленса или Кипренского, контроль правильного положения трубки по экскурсиям грудной клетки и аускультации легкого с последовательным перекрытием каналов трубки для каждого легкого обеспечивает надежность раздельной интубации. Вводный наркоз и миорелаксацию в таких случаях следует дополнять поверхностной анестезией тримекаином или лидокаином с помощью распылителя. Иногда в трахею предварительно заводят тонкий катетер для орошения нижних отделов воздухоносных путей местным анестетиком с нафтизином или ' димедролом, что снижает бронхоспастические реакции и предупреждает патологические рефлексы на последующую интубацию бронхов [Долина О. А., Дубова М. Н., 1974].
Раздельная интубация бронхов эффективно защищает здоровое легкое от попадания инфицирующего материала в самых сложных анестезиологических ситуациях, в том числе и на высоте легочного кровотечения и при ре
336
конструктивных операциях на бронхах. К достоинствам этого метода защиты следует отнести возможность поддержания адекватной вентиляции при нарушении герметизма дыхательных путей оперированного легкого, сочетание надежной изоляции с независимой (по ритму и объему) вентиляцией каждого легкого, благоприятные технические условия для операции (малоподвижность оперируемого легкого), профилактику имплантационных метастазов [Экгольм Б. К., 1966].
Однако раздельная интубация также не является идеальным вариантом защиты при пуль-монэктомии, так как перед прошиванием бронха трубка должна быть подтянута, чтобы исключить попадание в шов «шпоры» ее при правостороннем вмешательстве. Кроме того, после окончания основного этапа операции необходима реинтубация трахеи обычной, однопросветной трубкой. В этот момент возможен заброс патологического отделяемого в здоровое легкое [Дарбинян Т. М., Авруцкий М. Я., 1967].
При частичной резекции легких метод раздельной интубации главных бронхов также не всегда устраняет попадание инфицированного материала в здоровые отделы легких. Временное коллабирование легкого во время операции и периодическая аспирация бронхиального содержимого хотя и полезны, но не предупреждают шунтоподобных изменений газообмена на самом ответственном этапе вмешательства. Интубация 2-просветными трубками трудновыполнима при стенозах трахеи и деформациях бронхов, при маленькой голосовой щели или глубоком ее расположении.
Узкие каналы 2-просветных трубок создают большое сопротивление току газа, что в известной степени затрудняет вентиляцию легких. Вследствие этого раздельная интубация главных бронхов противопоказана при резко сниженных резервах внешнего дыхания, когда даже небольшое дополнительное сопротивление нарушает выведение углекислого газа со всеми последующими эффектами избытка углекислоты на продукцию бронхиальной слизи (гиперсекреция), бронхиальную мускулатуру (спазм) на легочное кровообращение и миокард. Относительно узкие каналы трубки легко закупориваются кровью и слизью, его перекрывает аспирационный катетер большого диаметра во время эпизода отсасывания содержимого, что может вызвать коллапс легкого при относительно высокой мощности отсасывателя с резким возрастанием шунта.
Поэтому в настоящее время рассматриваются показания еще к одному методу защиты легких во время резекции этого органа — к периферической блокаде бронха пораженного отдела легкого, но уже на новом уровне, чем ранее
[Шанин Ю. Н., Сипченко В. И., 1965]. Блокаду производят круглым куском поролоновой губки (диаметр в 2—3 раза больше сечения бронха), который заводят через бронхоскоп. В отличие от других видов блокады бронхов, применение которых осталось ограниченным из-за отсутствия надежных способов фиксации и опасности смещения бронхоблокатора [Долина О. А., 1975], тугая обтурация бронха поролоновой губкой позволяет добиться надежной фиксации. В большинстве случаев блокатор может оставаться на месте до конца удаления препарата и удаляется вместе с ним. Исключение составляют поражения верхних долей легких. Этот вариант защиты все чаще становится методом выбора.
ПОДДЕРЖАНИЕ
ЛЕГОЧНОГО ГАЗООБМЕНА
В обеспечении безопасности радикального вмешательства при заболеваниях легких особое значение придают адекватной вентиляции.
Выбор метода искусственной вентиляции легких при резекции легких в настоящее время решается однозначно. Основным считают вентиляцию легких под перемежающимся положительным давлением с пассивным выдохом. Несмотря на физиологические отличия данного метода от самостоятельного дыхания, у большинства больных он обеспечивает достаточную оксигенацию оттекающей от легких крови и удаление избытка углекислоты. Отрицательное влияние перемежающегося давления на венозный возврат к сердцу и непосредственно на сердце (так называемая «функциональная тампонада»), а также на легочное кровообращение минимально сказывается на гемодинамике при достаточных функциональных возможностях системы кровообращения и правильном выборе параметров искусственной вентиляции. Наилучшие условия для данного режима составляют быстрое раздувание легких с соотношением времени вдоха и длительности выдоха примерно 1:2, низкое сопротивление в дыхательных путях и уменьшение до минимума мертвого пространства системы «аппарат — больной».
При открытой плевральной полости повышение внутрилегочного давления даже несколько выше оптимальных (-)-15...-)-20 см вод. ст.) уже не влияет на венозный возврат к сердцу и не сдавливает его. Несмотря на периодическое оттеснение легкого хирургом, газообмен в нем улучшается, так как широкая торакотомия сводит на нет эластическое сопротивление грудной клетки и легкое расправляется на вдохе больше.
22 Зак. 0517
337
При современном развитии отечественной анестезиологической техники основным способом искусственной вентиляции легких считают автоматическую искусственную вентиляцию с помощью аппаратов типа РО, регулируемых по объему. Аппараты искусственной вентиляции с другими принципами регуляции могут использоваться и в легочной хирургии, так же как и ручная вентиляция, которая позволяет проводить любые по травматичности вмешательства у больных со сниженными функциональными резервами [Дамир Е. А., 1964]. У части больных, например при выраженной бронхиальной экссудации («влажное легкое»), некоторые авторы [Андреева В. Н., 1966] предпочитают пользоваться ручным способом, что, по их мнению, дает возможность более оперативно улавливать нарастание бронхиальной обтурации.
Специальные коннекторы для раздельной интубации [Вишневская М. А., 1963; Юревич В. М. и др., 1968] позволяют аспирировать секрет из бронхов одного легкого, не прекращая вентиляцию другого, создавать так называемый управляемый коллапс оперируемого легкого. Кроме ограничения объема вентиляции на стороне операции с одновременным увеличением вентиляции неоперируемого легкого, возможны и другие варианты участия легких в газообмене независимо друг от друга. Хорошие условия для работы хирурга создаются при вентиляции неоперируемого легкого в полном объеме и инсуффляции кислорода в выключенное оперируемое легкое. Тем самым в нем создаются условия, характерные для диффузного дыхания. Следующий вариант состоит в независимой вентиляции каждого легкого. Для этого обычно к неоперируемому легкому подсоединяют дыхательный автомат (РО-5 или РО-6), а вентиляция оперируемого легкого осуществляется вручную мехом или дыхательным мешком. На ответственном этапе вмешательства ручная вентиляция создает управляемость участия легкого в газообмене. Наконец, возможна асинхронная вентиляция легких с помощью специального аппарата ИВЛ — АП-1, который дает возможность вентилировать оба легких асинхронно с минимальным влиянием на кровообращение до и после торакотомии, а также широко изменять объем вентиляции оперируемого легкого в широких пределах, создавая оптимальные условия для выполнения легочной операции.
При выборе минутного объема вентиляции (МОВ) и частоты дыхания ориентируются на исходные показатели внешнего дыхания, зарегистрированные на спирограмме, и результаты расчетов по общепризнанным номограммам. На практике последнее время используем про
стую формулу, предложенную Т. М. Дарбиня-ном:
мтеля МОВ (л/мин) =-----к 1.
10
Во всех случаях величину минутного объема вентиляции следует проконтролировать показателями волюметра, установленного на магистрали выдоха аппарата. Предпочитают избрать умеренную гипервентиляцию с увеличением МОВ в 1,5—2 раза по сравнению с доопера-ционной величиной минутного объема дыхания [Лебедев Е. М., Дмитриенко А. В., 1970] и до 140—150 % расчетной величины.
Само грудное вмешательство на легких, переливание значительного количества холодной консервированной крови существенно меняют биомеханику дыхания уже по ходу операции: увеличивается функциональное «мертвое пространство», снижается податливость, возрастает неэластическое сопротивление дыханию, что может не сразу быть уловлено анестезиологом. В трудных ситуациях предпочтительнее контролировать адекватность вентиляции по напряжению газов артериальной крови.
Обязательными условиями сохранения биомеханики дыхания, наряду с другими приемами (согревание переливаемой крови, увлажнение и согревание вдыхаемой смеси газов), считается не только периодическая санация бронхиального дерева, но и периодическое дыхание (не реже 1 раза в 25—30 мин) удвоенным или утроенным дыхательным объемом. В некоторых респираторах предусмотрено автоматическое раздувание легких каждые 7—8 мин, что позволяет не только расправлять спавшие участки легочной паренхимы, но и способствовать поддерживанию активности сурфактантной системы.
Тем не менее адекватность выбранной в начале операции искусственной вентиляции постепенно снижается, и появляется сдвиг напряжения углекислоты в сторону гиперкапнии. Среди прочих причин имеют значение снижение активности поверхностно-активных веществ и повышение аэродинамического сопротивления дыханию из-за развития бронхиоло-спазма.
Некоторое изменение режима искусственной вентиляции должно определяться последовательностью обработки элементов корня легкого: при длительном периоде от момента перевязки легочных сосудов до пережатия соответствующего зоне резекции бронха необходимо увеличение МОВ на 15—20 % с целью предупреждения расстройств дыхания в ответ на острое возрастание «мертвого пространства».
Выбранная частота дыхания не должна значительно отличаться от той, какая зарегистри-
338
Рис. 141. Схема мембранного обогатителя воздуха кислородом (па рмеатера).
1 — вентилятор; 2 — блок мембран из ПВТМС; 3 — вакуум-насос; 4 — сборник конденсатора; 5 — показатель концентрации кислорода; 6 — ротаметр; 7 — аппарат И ВЛ.
рована в дооперационном периоде, и не выхо-дить за пределы 16—20 циклов в 1 мин.
Учитывая исходные и интраоперационные нарушения газообмена на уровне респиронов, следует считать обязательным обогащение выдыхаемой смеси кислородом до 40—50 об %. При правильно выбранном режиме автоматической вентиляции такая степень обогащения газовой смеси обеспечивает нормальный уровень напряжения кислорода в крови на различных этапах вмешательства.
Анестезия с помощью внутривенных анестетиков позволяет проводить при необходимости искусственную вентиляцию легких газовой смесью с высоким содержанием О2 и предотвращать гипоксию при различных обстоятельствах операции на легком, например при ушивании «открытой» культи главного бронха. В таких случаях закись азота не выгодна, так как снижение концентрации кислорода в газонаркотической смеси (иногда до 25 об%) во время операции у больных с выраженными изменениями легочной паренхимы небезопасно из-за усугубления гипоксии. В условиях внутривенной анестезии можно отказаться полностью от подачи газов из баллонов и обогащать вдыхаемый воздух до 38—40 % кислорода с помощью пер-меатора, мембранного обогатителя воздуха кислородом, подключенного к аппарату искусственной вентиляции [Жилин Ю. Н., 1983; Уваров Б. С. и др., 1983].
Принцип действия пермеатора (рис. 141) состоит в том, что воздух с помощью вентилятора пропускается через селективно проницаемую для кислорода непористую мембрану из поливинилтриметилсилана, за которой расположен вакуум-насос. Благодаря большой скорости диффузии кислорода по сравнению с азотом по другую сторону мембраны воздушная смесь имеет повышенную (почти в 1,5 раза по сравнению с атмосферным воздухом) концентрацию кислорода.
Несомненно, что анестезиологическое пособие с полной аналгезией, нейровегетативной блокадой и эффективным легочным газообменом защищает систему кровообращения от стрессорных влияний внутригрудного вмешательства при адекватном объеме циркулирующей крови. На фоне эффективно возмещенной кровопотери основной причиной острых нарушений кровообращения, развития сердечной слабости могут быть только недиагностирован-ные клинически нарушения газообмена [Лебедев Е. М., Жилин Ю. Н., 1972].
ВОСПОЛНЕНИЕ ОПЕРАЦИОННОЙ КРОВОПОТЕРИ И ПОДДЕРЖАНИЕ ГЕМОДИНАМИКИ
Одномоментная острая кровопотеря из-за повреждения крупных артериальных и венозных стволов наблюдается редко. Обычно она проявляется как медленно нарастающая потеря крови вследствие повреждения сосудов спаек и плевральных шварт, воспаленных и инфильтрированных тканей корня, медиастинальной клетчатки и легочной ткани. Реже она связана с нарушением свертывания крови в ране.
Значительную операционную кровопотерю в известной мере предупреждают анатомичность оперирования и хороший гемостаз по ходу вмешательства. Тщательное планомерное лигирование сосудов, прижигание интенсивно кровоточащих тканей, несомненно, уменьшают операционную потерю крови. Однако даже при самом тщательном гемостазе кровопотеря при легочных вмешательствах все же остается большой. Величина этой «неизбежной» кровопотери в основном связана с эффективностью спонтанного гемостаза за счет образования тромбов в местах повреждения мелких сосудов.
Уменьшение неизбежной кровопотери за счет провокации спазма сосудов (аппликация стерильного льда, инфильтрация зоны кровоточивости раствором новокаина с адреналином), ускорение образования тромбов за счет прикладывания салфеток, смоченных горячим солевым раствором, раствором тромбина или гемостатической губкой, оказались недостаточно эффективными, а иногда и опасными из-за возможности развития осложнений в области операционной раны. После спазма мелких сосудов под действием этих средств наступает их паралитическое расслабление, которое усиливается местным ацидозом и сегментарной симпатической блокадой (при эпидуральной анестезии). Гемостатическая губка пропитывается кровью, и сгустки образуются на поверхности раны, а кровотечение продолжается под сгустком. В последующем губка может забить дре
22*
339
наж, послужить местом развития инфекции, учитывая микробное загрязнение плевральной полости.
Более перспективным оказалось использование средств, резорбтивно воздействующих на фибринолиз и свертывание крови, истекающей в рану, тем более, что операции на легком могут вызывать существенные сдвиги в этой сфере гомеостаза [Терентьева Л. М., 1963; Кантор Л. Ф., 1967; Вагнер Е. А., Тавровский В. М., 1977, и др.]. Исследования, проведенные в клинике [Плешаков В. Т., 1964], показали, что при резекциях легких обычно ускоряется свертывание, умеренно снижается концентрация фибриногена и ускоряется фибринолиз на фоне повышения толерантности плазмы к гепарину. Ускорение свертывания более всего выражено в середине операции — в момент манипуляций на корне легкого или сразу после них. Эти изменения не связаны с поступлением в общий кровоток тканевого тромбопластина из легочной ткани, а происходят главным образом вследствие увеличения контактной активации свертывания крови и снижения активности антисвертывающих факторов.
Ускорение фибринолиза, определяющееся снижением активности антифибринолизина, носит нейрорефлекторный характер и, в меньшей степени, зависит от поступления в кровоток активаторов из паренхимы легких и плевры. Наблюдавшееся уменьшение концентрации фибриногена скорее всего определяется стойким повышением потребления этого фактора при ускоренном свертывании [Плешаков В. Т., 1964; Назаретян Т. М., 1972] и является защитно-приспособительным механизмом, обеспечивающим нужные условия гемостаза и, возможно, укрепляющим сосудистую стенку.
Ускорение фибринолиза, даже если оно носит скрытый, «лабораторный» характер, может нарушить гемостаз, особенно на фоне относительного дефицита факторов свертывания в связи с массивной гемотрансфузией. По мере нарастания кровопотери появляется тенденция к замедлению свертывания в результате истощения реакции антисвертывающей системы на травму. Не исключается и то, что при этом нарушается протромбинообразовательная функция печени со снижением активности факторов протромбинового комплекса или приобретает значение скрытый дефицит фибриназы. В таких условиях даже умеренное повышение фибринолитической активности (более 60 %) заметно усиливало неизбежную кровопотерю.
Резкое повышение активности фибринолиза наблюдали, как правило, в тех случаях, когда операция сопровождалась существенными нарушениями кровообращения (аритмия со стойкой гипотонией, кратковременная асистолия),
явлениями гипоксии другого происхождения, т. е. при возникновении «шока», прогрессирование которого большинство исследователей связывают с развитием фибринолизного криза [Степанян Е. П., Смиренко Е. М., 1966; Adamski et al., 1969]. Поэтому атравматичная техника оперирования, предупреждение выраженной артериальной гипотонии и гипоксии сами по себе являются наиболее надежным средством уменьшения объема «неизбежной» кровопотери.
Капельное внутривенное введение 5—6 г е-аминокапроновой кислоты или 1—2 г параами-нобензойной кислоты перед наиболее травматичным этапом вмешательства не только предупреждает повышение фибринолитической активности, но и уменьшает «неизбежную» операционную кровопотерю, а также потери по дренажам в ближайшем послеоперационном периоде. В случаях переливания 2,5—3 л консервированной крови, т. е. при возмещении, равном 50 % объема циркулирующей крови и более, применение профилактической дозы е-аминокапроновой кислоты надо считать правилом, особенно если по ходу операции возникает эпизод гипотонии и гипоксии. Доза ее в 5—6 г оптимальна во всех случаях, когда по обстоятельствам вмешательства и по характеру кровотечения в ране анестезиолог заподозрит развитие острого фибринолиза.
Экспресс-диагностика нарушений свертывания и фибринолиза по ходу операции должна включать определение времени свертывания, концентрации фибриногена, активности протромбина и фибриназы, спонтанной фибринолитической активности крови. Этих показателей достаточно, и они могут быть определены за 30—40 мин в двух пробирках с венозной кровью.
Эффект на введение аминокапроновой кислоты (обязательно на фоне стабилизации гемодинамики) и полученные результаты исследования коагулограммы определяют дальнейшую программу действия. Когда причиной нарушения свертывания является гиперантитромбинемия (время свертывания более 16 мин), хороший эффект дает введение 50 мг протамина сульфата. При критической концентрации фибриногена необходимо использовать вливание 2 г фибриногена или 3—4 флаконов одногруп-пной лиофилизированной плазмы, которую вводят в концентрированном виде (в 400— 500 мл растворителя). При низкой активности фибриназы (ниже 30 с) необходимо использовать большие дозы преднизолона (2—5 мг/кг массы тела больного). В тяжелых случаях кровоточивости при сочетании низкой концентрации фибриногена со 100 % фибринолизом следует одновременно с фибриногеном при
340
менить антипротеолитические ферменты типа пантрипсина, трасилола (250—300 тыс. КиЕ) или гордокса (300—500 тыс. КиЕ), которые при капельном введении подавят активность циркулирующего плазмина. Очень важно своевременное начало лечения, а поэтому взаимодействие оперирующего хирурга и анестезиолога играет решающую роль в выборе момента необходимости регулирующего коагуляцию лечения.
Необходимо подчеркнуть, что возникновение кровоточивости без достаточных для этого оснований всегда должно настораживать анестезиолога и трансфузиолога (возможна несовместимая трансфузия, которая не имеет других клинических проявлений на фоне общего обезболивания) [Филатов А. Н„ 1975]. Как правило, при этом проявляются признаки распространенных расстройств гемостаза: кровоточат не только стенки плевральной полости и ткани средостения, но и торакотомная рана, места инъекций. Повышение фибринолитической активности крови носит вторичный характер как защитная реакция на диссеминированное внутрисосудистое свертывание крови. В таких случаях, наряду с забором пробы крови для экстренной коагулограммы, необходимо перепроверить совместимость перелитой к этому моменту донорской крови, используя снятые флаконы.
Укорочение времени свертывания до 5 мин и менее, критическое снижение концентрации фибриногена и появление резко положительной реакции на фибриноген Б, высокая активность спонтанного фибринолиза делают диагноз синдрома диссеминированного свертывания определенным. По данным М. С. Мачабели (1976), в таких случаях необходимо инактивировать избыток тромбина гепарином (10— 15 тыс. ME), а затем уже вводить фибриноген и ингибиторы фибринолиза.
При кровоточивости локального характера показано введение дицинона (500 мг внутривенно и 250 мг внутримышечно), который повышает функциональную активность циркулирующих тромбоцитов. Инфильтрация кровоточащих тканей 2% раствором Е.-аминокапроно-вой кислоты с новокаином (для чего разводят стандартный флакон примерно в 2,5 раза) останавливает местное кровотечение иногда более надежно и длительно, чем такие гемостатики местного действия, как дицинон и гемофобин.
Определение величины кровопотери по ходу терапии считается обязательным для ориентировки в объеме необходимой трансфузии при любом обширном вмешательстве на органах груди [Анахасян В. Р. и др., 1978; Левитэ Е. М., 1978; Савельев В. С., Гологорский В. А., 1980, и др.,]. Простота весового метода [Виноградов В. В., Рынейский С., 1954; Мамедова Р. Г.,
Жилис Ю. Н., 1962, и др.], позволяет определять без особого труда кровопотерю каждые 15—20 мин. Возможно более точное взвешивание смоченного кровью перевязочного материала и сопоставление полученных данных с величиной должного или истинного объема крови больного обеспечивают ориентировку в выборе программы адекватного восполнения кровопотери. Катетеризация верхней полой вены создает реальную возможность необходимого темпа крове-возмещения и контроля реакции сердечнососудистой системы на быстрое вливание (по величине центрального венозного давления).
Многолетние исследования динамики объема циркулирующей крови в связи с резекцией легких, проведенные в клинике, а также опыт других лечебных учреждений показали, что стойкое поддержание волемии во время операции или сразу после нее достигается в тех случаях, когда при совершенном обезболивании крово-восполнение составляет 130—140 % от величины определенной весовым методом кровопотери и не отставало от нее по темпу (даже предшествовало ей).
Принципиальный подход к восполнению операционной кровопотери в настоящее время состоит в моделировании процессов физиологической гемодилюции, сжатых по времени в пределах операционного периода. Безопасность начала анестезии и операции обеспечивается быстрой инфузией кристаллоидного кровезаменителя (400—1000 мл), за которой следует вливание полиглюкина или другого коллоидного кровезаменителя с учетом его непосредственного волемического действия [Шанин Ю. Н. и др., 1978; Брюсов П. Г., Костюченко А. Л., 1980]. «Инфузионный подпор» на этапе вводного наркоза не только защищает систему кровообращения от неблагоприятного действия вводного наркотика, но одновременно создает резерв внеклеточной жидкости в организме, несмотря на вынужденное голодание перед операцией и благодаря быстрому перераспределению вливаемых солевых растворов между внутрисосудистым и интерстициальным секторами внеклеточного пространства. Дальнейшее восполнение кровопотери, желательно до момента удаления препарата, обеспечивается попеременным вливанием солевых и коллоидных кровезаменителей в соотношении 2:1, если кровопотеря за это время не превысит 20 % объема циркулирующей крови (15—16 мл/кг массы больного).
Выбор составляющих инфузионной программы определяется возможностями учреждения, но отдается предпочтение растворам декстрана и желатина перед другими кровезаменителями. У большинства больных такая программа обеспечивает наведенную гемодилюцию, облег
341
чающее действие которой на кровообращение доказано не только данными клинических наблюдений, но и специальных исследований [Гологорский В. А., Шестопалов А. Е., 1982; Климанский В. А., Рудаев Я. А., 1982; Брюсов П. Г., 1983, и др.|.
При некоторых видах обезболивания — эпидуральной блокаде — «инфузионный подпор» является обязательным, а его эффективность контролируется реакцией артериального кровяного давления и сердечного выброса на введение очередной дозы анестетика (по величине снижения).
При внезапном увеличении интенсивности кровопотери может быть принято решение об увеличении темпа инфузии, повышении волемического эффекта кровезаменителей или о начале переливания крови, ибо обычный «инфузионный подпор» оказывается уже несостоятельным.
Определенным шагом вперед в решении задачи крововосполнения одномоментной кровопотери является использование гиперосмолярных кровезаменителей. В качестве одного из них при плановых операциях на легких может быть использована размороженная сорбитная аутогенная плазма. Последняя заготавливается в период предоперационной подготовки от больных методом двойного повторного плазмафереза и замораживается в морозильной камере бытового холодильника. С целью улучшения волемического эффекта аутоплазма обогащается сорбитолом для инъекций из расчета 6 % концентрации [Плешаков В. Т. и ДР-, 1982]. Предполагается, что после достижения гиперволемии за счет осмотического эффекта сорбитол будет метаболизироваться и использоваться организмом как дополнительный источник энергии. Это позволит исключить перегрузку сосудистого русла даже при значительном количестве осмотически активного вещества (осмолярность сорбитной аутоплазмы составляет 800—900 мосмоль/л).
Вливание такого комбинированного кровезаменителя способствует быстрому, почти одномоментному с инфузией, переходу значительного количества внеклеточной жидкости в сосуды, что проявляется (при гипотонии) быстрым восстановлением уровня систолического артериального давления и производительности сердца. Возрастание объема плазмы сочетается с увеличением эритроцитарного компонента циркулирующей крови, хотя к этому моменту операции эритроцитсодержащие среды еще не переливались, а кровопотеря составляла уже около 15—20 % от объема крови больного. Очевидно, происходила мобилизация секвестрированных эритроцитов (рис. 142). Некоторое повышение осмолярности циркулирующей крови
Рис. 142. Изменения волемических показателей (ОП и ОЭ) при возмещении кровопотери с применением гиперосмолярной (сорбитной) аутоплазмы (А) и традиционным методом — донорской кровью (В)
Исх.— исходные данные; 1 — во время операции при переливании трансфузионных сред; 2 — через 6 ч после операции; 3 — через сутки после операции.
после переливания сорбитной плазмы не привело к увеличению объема внеклеточной жидкости за счет перемещения из клеточного пространства. Показатели свертывания и фибринолиза отличались исключительной стабильностью, не свойственной операции на легких: не было отмечено ни сколько-нибудь значительного ускорения свертывания крови, ни снижения концентрации фибриногена. Особенно характерно, что не наблюдалось обычного в середине операции увеличения фибринолитической активности: очевидно, нормальный спонтанный фибринолиз на этом этапе операции есть отражение волемического обеспечения и хорошей микроциркуляции, несмотря на операционную травму. Подтверждением этого является отсутствие сколько-нибудь значительных изменений нарушений парциальных функций почек, сдвигов водно-электролитного гомеостаза. Полученные данные доказали оптимальность использования гиперосмолярных кровезаменителей на основном этапе вмешательства на легком. Подобный эффект можно получить и с помощью других кровезаменителей этого типа, например реоглюмана, представляющего 10 % композицию низкомолекулярного декстрана в 6 % растворе маннитола, либо приготовить гиперосмолярный кровезаменитель, по мере надобности разводя до такой концентрации лиофилизированный маннитол в донорской плазме или полиглюкине.
Нарастание темпа кровопотери по ходу выделения препарата, после удаления его или с началом окончательного хирургического гемостаза может поставить вопрос о восстановлении кислородной емкости крови за счет перелива
342
ния гемотрансфузионных сред. О необходимости гемотрансфузии объективно ориентирует показатель гематокрита, который не должен быть ниже 0,28 л/л по ходу операции и 0,32— 0,33 л/л к концу ее. Такая степень гемо дилюции на фоне искусственной вентиляции легких газовой смесью, обогащенной кислородом, не оказывает существенного влияния на кислородное обеспечение организма. Улучшая реологию крови, гемодилюция способствует ускорению кровотока в зоне микрососудов.
Оптимальная степень гемодилюции, при которой уже отчетливо уменьшается вязкость крови, достигается при снижении гематокрита ниже 0,36 л/л. Хотя с возрастанием гемодилюции сердечный выброс нарастает, работа сердца не повышается, так как значительно снижается периферическое сосудистое сопротивление [Replogle R., Merile Е., 1966; Fogarty J. et al., 1967]. Такая степень гемодилюции может быть опасна у пожилых больных, учитывая малую способность коронарных и мозговых сосудов у них увеличивать объемный кровоток. У молодых больных некоторые исследователи считают допустимым кратковременное снижение гематокрита до 0,20—0,25 л/л [Климан-ский В. А., Рудаев Я. М., 1982].
В большинстве трансфузионных программ восполнения операционной кровопотери в хирургии легких и плевры основной средой остается консервированная донорская кровь или ее эритроцитсодержащие компоненты. Сопоставление клинических наблюдений с динамическим определением объема циркулирующей крови, показателей кислотно-основного равновесия с микроциркуляцией (визуальным наблюдением за кровотоком в сосудах бульбарной конъюнктивы), а также определение степени участия эритроцитов в кровообращении с помощью метки их 5|Сг проведены сотрудниками клиники почти у 500 больных. Исследования показали, что переливание, казалось бы, достаточного количества донорской крови даже небольших сроков хранения не обеспечивает стойкого волемического эффекта. Превышение объема трансфузии на 15—20 % по сравнению с кровопотерей тоже не восстанавливает нормальную микроциркуляцию. Поэтому показано сочетание трансфузий гомологичной крови с вливанием реологически активных кровезаменителей, например реополиглкжина, альбумина, благоприятное влияние которых на системное и легочное кровообращение хорошо известно [Дубова М. Н. и др., 1976].
При тяжелых одномоментных кровопотерях, особенно в случаях отставания темпа трансфузии от кровопотери, быстрое переливание цитратной крови может вызывать значительные расстройства жизненно важных функций. Ос
новной опасностью считается возникновение недостаточности правого сердца, которая возникает вследствие рефлекторного спазма артериол легких под влиянием кислой, холодной крови, а также непосредственного действия цитрата на сердечную мышцу. Известное значение имеет и повышение тонуса бронхиальной мускулатуры из-за повышенной концентрации в крови углекислоты, что при струйной трансфузии можно зарегистрировать по увеличению давления на вдохе и снижению напряжения кислорода. Поэтому при быстром переливании крови для выведения избытка углекислого газа, содержащегося в ней и образующегося при метаболизации цитрата и лактата, надо увеличить минутный объем вентиляции. Если скорость трансфузии превышает 10 мл/мин, то для выведения избытка углекислого газа и сохранения концентрации Н-ионов объем вентиляции следует увеличивать на 10—15 %. В условиях режима умеренной гипервентиляции легких анестезиолог для этого обладает нужным запасом времени.
Следующей неблагоприятной стороной действия консервированной крови на кислородное обеспечение организма являются нередко низкий уровень приживаемости консервированных эритроцитов и неспособность их сразу после трансфузии включаться в эффективный транспорт кислорода из-за уменьшения в них концентрации 2,3-дифосфоглицерата. Роль этого биологического шунта состоит в повышении сродства перелитых эритроцитов к кислороду: они не способны отдавать его тканям.
Важно учитывать не только непосредственные, но и отдаленные неблагоприятные эффекты значительного по объему переливания консервированной крови: нарушение микроциркуляции в малом круге, накопление воды в ин-терстиции респиронов, повреждение ультраструктуры легочной ткани, сурфактантной системы легких. Помимо перечисленных причин посттрансфузионных нарушений газообменной функции легких, следует отметить и микроэмболию легочных сосудов фибринно-клеточными агрегатами (свертками), содержащимися в консервированной крови [Лыткин М. И. и др., 1981; Симбирцев С. А., Беляков Н. А., 1982]. Нередки посттрансфузионные реакции негемолитического типа, обусловленные несовместимостью по антигенам лейкоцитов, тромбоцитов, белков плазмы крови [Шабалин В. А., Серова Л. Д., 1982]. Почти 2 % всех совместимых по AB0 переливаний сопровождаются реакциями и осложнениями, обусловленными конфликтами по другим антигенным системам.
К неблагоприятным последствиям переливания донорской крови следует отнести также
343
жизненная емкость легких и максимальная минутная вентиляция уменьшены до 75 % от нормы. Ударный объем крови и минутный объем кровообращения увеличены на 20—25 %, легочный кровоток ускорен, объем крови в легких уменьшен.
В фазе неустойчивой компенсации наблюдаются одышка и тахикардия при физической нагрузке. Показатели внешнего дыхания уменьшены в большей степени, чем в фазе компенсации. Ударный объем крови и минутный съем кровообращения имеют тенденцию к снижению, но не выходят за рамки нормальных показателей. Оксигенация крови еще не нарушается.
В фазе декомпенсации имеется одышка в покое и резко учащается пульс, появляется цианоз губ и слизистых оболочек. Показатели внешнего дыхания уменьшены на 2/з нормальных величин, ударный объем крови уменьшен, кровоток замедлен (на 50 % и больше), венозное давление, по сравнению с нормой, увеличено более чем в 2 раза. На ЭКГ регистрируются признаки перегрузки правого сердца. Насыщение крови кислородом снижается до 85 % и ниже.
Изложенные патофизиологические сдвиги свидетельствуют, что уже в фазе неустойчивой компенсации лечение должно быть активным.
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
И ДИАГНОСТИКА
По особенностям проявления первых симптомов спонтанного пневмоторакса выделяются скрытая, типичная и стертая формы его.
Скрытая форма спонтанного пневмоторакса, которая, как правило, бывает при малой, а иногда и при средней степенях спадения легкого, особенно когда дефект в нем небольшой и быстро ликвидируется, протекает без клинических проявлений. Заболевание в этих случаях в подавляющем большинстве остается нераспознанным. Такая форма выявляется обычно в результате случайного рентгенологического исследования или тогда, когда уже возникают поздние осложнения.
Типичное течение спонтанного пневмоторакса вначале характеризуется болью в груди, одышкой и кашлем.
Боль в груди на стороне поражения — наиболее частая жалоба. Она возникает внезапно, обычно бывает умеренной по интенсивности, колющей или сжимающей. Через несколько минут или часов после возникновения она, как правило, проходит или стихает. Какой-либо типичной иррадиации боли не отмечается. Однако иногда боль с самого начала может появиться не в груди, а в эпигастральной области, в пояснице, подреберье, за грудиной, в надплечье,
спине. Локализация боли в животе может быть причиной ошибочно диагностируемой патологии органов брюшной полости, а боль за грудиной, в надплечье и лопатке — ошибочного предположения об ишемической болезни сердца.
Одышка обращает на себя внимание реже. Она также умеренная и довольно быстро проходит, но может появляться при физической нагрузке. Обычно одышка возникает одновременно с болью. Очень редко начало заболевания связывают с появлением не боли, а одышки. Стойкая и сильная одышка наблюдается при осложненном течении спонтанного пневмоторакса.
Редкий сухой кашель — еще менее постоянная жалоба.
Боль и кашель при спонтанном пневмотораксе являются следствием раздражения плевры, носят рефлекторный характер. Одышка — проявление скрытой легочно-сердечной недостаточности. Сильная одышка, особенно сопровождающаяся цианозом, говорит о большом пневмотораксе, а нарастающая одышка — о напряженном пневмотораксе.
При стертых формах спонтанного пневмоторакса заболевание может начаться не остро, а постепенно, основные симптомы проявляются как бы исподволь: боль — только при глубоком вдохе, одышка — только при значительном физическом напряжении. Стертые формы могут быть причиной диагностических ошибок и поздней госпитализации больных. По данным клиники госпитальной хирургии, они встречаются при спонтанном пневмотораксе у 15 % больных.
Следующий за первыми проявлениями пневмоторакса период, характеризующийся в типичных случаях стиханием всех симптомов, называется латентным периодом, или периодом относительного благополучия. В это время лишь одышка при нагрузке может говорить о том, что человек нездоров. Иногда наблюдается температурная реакция, обычно как следствие наличия жидкости в плевральной полости, как результат асептического воспаления. Повышение температуры тела, впрочем, может и предшествовать пневмотораксу, поскольку, как указывалось, он нередко возникает на фоне острых респираторных заболеваний. Тем не менее повышенная температура тела, легкое недомогание довольно часто являются основанием для первичного обращения к врачу.
Начало спонтанного пневмоторакса в общем достаточно характерно, и если при первичном осмотре о нем возникает мысль, то правильный диагноз устанавливается всегда. Этому способствуют типичные данные физикального обследования: тимпанит при перкуссии на стороне поражения, ослабленное дыхание и отсутствие
324
голосового дрожания. Ошибки после этого обследования встречаются очень редко и, по-видимому, не имеют практического значения, так как они возможны лишь при малом пневмотораксе, склонном к самоизлечению.
Своеобразный диагностический признак спонтанного пневмоторакса был описан Э. В. Ходжашвили (1968) у мужчин: сосок молочной железы у них на стороне поражения очень часто располагается выше, чем на здоровой стороне. Автор объяснил это рефлекторным сокращением большой грудной мышцы. Интересно отметить, что этот симптом сохраняется спустя много дней после начала заболевания.
Окончательный диагноз устанавливается после рентгенологического обследования, при котором уточняются степень и характер спадения легкого, расположение газового пузыря в плевральной полости (при наличии сращений), имеется ли в ней жидкость (рис. 136, 137). Рентгенологическое исследование с самого начала должно быть направлено также на выявление основной патологии, послужившей причиной спонтанного пневмоторакса: кистозного поражения легких, буллезной эмфиземы, туберкулеза и др.
Производится многоосевая рентгеноскопия, так как газ может располагаться кпереди от легкого или кзади от него. Бывает затруднена рентгеновская диагностика наличия газа в области купола плевральной полости. В этом случае он обнаруживается довольно легко в положении больного на боку: перемещенный газовый пузырь появляется в костодиафрагмальном синусе (рис. 138).
Рентгеноскопические находки обязательно фиксируются на рентгенограмме, которая, с одной стороны, является диагностическим документом, а с другой стороны, по ней можно довольно точно рассчитать степень коллапса легкого. Рентгенограмма служит основным отправным ориентиром оценки эффективности последующего лечения. По данным рентгенографии степень коллапса легкого рассчитывается планиметрическим способом по Киршнеру и Швартцелю (рис. 139).
Среди больных, поступивших в клинику госпитальной хирургии, которым это исследование было сделано (99 человек), спадение легкого на 30 % наблюдалось у 5 человек, на 31 — 50 % — у 39, на 51—70 % — у 34 и более чем на 70 % — у 24. Как видно из приведенных цифр, число больных со значительным пневмотораксом было достаточно большим.
До последнего времени высказывается мнение, что у некоторой части больных со спонтанным пневмотораксом, а именно у больных с малым пневмотораксом, дальнейшее обследование может быть прекращено, так как такая
Рис. 136. Спонтанный пневмоторакс слева. Прямая рентгенограмма.
Рис. 137. Напряженный спонтанный пневмоторакс справа. Прямая рентгенограмма.
категория нуждается лишь в симптоматической терапии. С этим нельзя согласиться.
Опыт говорит, что вслед за рентгенологическим исследованием обязательно всем больным должна быть сделана лечебно-диагностическая пункция. Основная цель пункции — уточнение характера плевролегочного сообщения. Пункция делается, как правило, сбоку по средней аксиллярной линии в пятом межреберье, в положении больного сидя с закинутой за голову рукой. Через пункционную иглу, имею-
325
сохраняющуюся опасность переноса инфекционных, особенно вирусных, заболеваний (гепатита, СПИДа и др.).
Что касается других «традиционных» опасностей гемотрансфузий, например цитратной интоксикации, то их роль становится все более сомнительной. Гипокальциемия, даже при переливании 2—2,5 л цитратной крови за короткое время, как правило, не возникает. При более медленном темпе трансфузии, по имеющимся данным, концентрация кальция плазмы обычно повышалась, поэтому препараты типа кальция хлорида или глюконата следует применять не для инактивации цитрата, а с целью снятия легочного сосудистого спазма и предупреждения расстройств гемодинамики миокардиального генеза. Согревание крови в момент трансфузии и буферирование ее при необходимости струйного переливания (добавлением 5—8 мл 5 % раствора гидрокарбоната на каждые 250 мл крови) уменьшают потребность в препаратах кальция до 1 г вещества на каждые 2,5 л переливаемой крови.
Одним из способов исключения цитратной интоксикации является переливание крови, стабилизированной с помощью сорбента — фосфата целлюлозы [Буглов Е. Д. и др., 1971]. В клинике установлено, что морфологические и биохимические изменения сорбентной крови в процессе хранения существенно не отличаются от изменений цитратной крови. Переливание такой среды оказывало достаточно выраженное волемическое и стойкое возмещающее действие и, что характерно, четко уменьшало СОЭ. Последнее, по мнению Г. М. Соловьева, Г. Г. Радзивила (1972), является косвенным показателем стабильности микроциркуляции за счет улучшения реологических показателей.
Эффективным в хирургии легких оказалось применение донорских эритроцитов в растворе декальцинированного желатиноля (эритроцитарного трансфузата), который, наряду с восполнением операционных потерь эритроцитов, по-видимому, оказывал дезагрегирующее действие на фоне возникшей до вмешательства агрегации клеток крови (кровотечение, гнойно-дест-' руктивный процесс). Волемический эффект этой среды, особенно в случаях переливания больших его объемов при тяжелых операциях, был достаточно четким. Положительной стороной эритроцитарного трансфузата (приготовленного из эритроцитов группы 0(1) (Rh—) является относительная универсальность, что позволяет переливать его в критических ситуациях (легочном или внутриплевральном кровотечении) без проведения изосерологических проб.
Весьма эффективно переливание донорских эритроцитов, хранившихся в замороженном состоянии при сверхнизких температурах при
комбинации их с нативной плазмой, альбумином и синтетическими коллоидами, совместно оказывающими отчетливое заместительное действие. Более четкий функциональный эффект при меньшем объеме среды определяется способностью размороженных эритроцитов транспортировать кислород сразу после переливания в связи с сохранением ими активности 2,3-ди фосфоглицерата.
Учитывая неблагоприятные последствия применения большого количества консервированной крови средних и поздних сроков хранения при травматичных вмешательствах с тяжелой кровопотерей, оправданно применение прямых гемотрансфузий [Клур В. Ю., 1968; Левитэ Е. М., Богданова Л. Н_, 1977]. Установлено, что волемический эффект прямых гемотрансфузий сохраняется дольше, а неблагоприятное влияние на микроциркуляцию — отчетливо меньше. Поэтому прямые переливания крови в 1,5 раза уменьшают количество крови, необходимой для удержания исходного объема крови, не только во время, но и после операций на легких [Брюсов П. Г., 1972]. Показанием к прямому переливанию крови (или трансфузий свежестаби-лизированной крови) во время операций на легких следует считать медленно нарастающую кровопотерю, превышающую к моменту удаления препарата 50—60 % от объема циркулирующей крови (т. е. когда взвешенная кровопотеря составляет 2,5—3 л). Однако для широкого внедрения такой трансфузионной среды необходима специальная аппаратура, возникают определенные трудности организационного характера, связанные с подбором и обследованием доноров. В клинике госпитальной хирургии вопрос решен созданием нештатного отделения переливания крови и разработкой надежного аппарата для прямых переливаний [Колесников И. С. и др., 1979]. Частичная автоматизация процесса трансфузии, наличие следящей фотоэлектрической системы обеспечивали безопасность переливания крови, причем не только непосредственно от доноров. Тот же аппарат использовался для нагнетания консервированной крови при критических обстоятельствах, связанных со значительной одномоментной кровопотерей. На базе оригинального аппарата АППК-ЗМ (созданного в клинике) Ленинградское объединение «Красногвардеец» разработало и выпускает серийно аппарат АТ-193.
Даже прямые трансфузии при всей их гемодинамической эффективности не исключают развития общих циркуляторных, метаболических и органных расстройств, объединяемых в так называемый «синдром гомологичной крови» [Соловьев Г. М., Радзивил Г. Г., 1967— 1973; Рудаев Я. М. и др., 1976]. Отмеченные
344
нарушения не возникают при аутогемотрансфузиях, возможности которых в хирургии легких усиленно изучались в нашей клинике с 1972 г. [Колесников И. С. и др., 1979].
Одним из реальных вариантов аутогемотрансфузии является реинфузия крови, излившейся в плевральную полость. Этот метод приемлем не только при ранениях и травмах груди и при операциях на сердце. При плановых операциях на легких методический сбор крови отлаженным с целью реинфузии отсосом уменьшает потребность в гомологичной трансфузии.
Другой вариант аутотрансфузии обеспечивается резервированием крови больного непосредственно перед вмешательством с одновременным вливанием кровезамещающих растворов (желатиноля с полиглюкином, альбумина с рингер-бикарбонатом или рингера с маннитной плазмой) [Полушин Ю. С. и др., 1983]. Количество резервированной крови может достигать 20—30 % от объема циркулирующей крови (1 —1,5 л). Основной этап операции проводят на фоне гемодилюции с поддержанием объема сосудистого сектора кровезаменителями и небольшим количеством крови при снижении гематокрита ниже 0,28 л/л. По мере выведения кровезаменителя через почки объем крови поддерживается резервированной кровью больного. На фоне искусственной вентиляции газовой смесью, обогащенной кислородом, возникающая при этом гемодилюция опасности не представляет, но на 20—25 % уменьшает потерю собственных эритроцитов. Аутогемотрансфузия в таком варианте улучшает спонтанный гемостаз, ускоряет выведение из наркоза, восстановление дыхания, эффективного кровообращения и двигательной активности, минимально нарушает легочный газообмен и функцию почек даже у больных с исходной недостаточностью функции этих жизненно важных органов.
Наконец, для восполнения операционной кровопотери сейчас стали широко применять кровь, заготовленную заблаговременно. Доза аутокрови, заготовленной на стандартных цитратных консервантах, у большинства больных не может быть более 400—600 мл. Даже у самых крепких из них не удается заготовить в короткое время I —1,5 л аутокрови, что практиковали Н. Langston и соавт. (1970), W. Dadgett и соавт. (1970) у больных туберкулезом легких после длительного лечения в санатории. Попытки увеличить дозу на протяжении в среднем 2 нед обычной предоперационной подготовки оказались несостоятельными. Повторный забор усиливает гемодинамические расстройства в ответ на эксфузию и ведет к снижению объема эритроцитов в большей степени, чем масса забранных. Выходом из положения отчасти являются
последовательный (с интервалом в 4—6 дней) забор аутокрови и сеанс двойного плазмафереза.
Детальный анализ возможностей всех применяющихся в клинике вариантов аутогемотрансфузии показал, что при использовании реинфузии крови необходимый объем трансфузии крови доноров сокращается в 2,6 раза, при возмещении кровопотери аутокровью, заготовленной до операции,— в 3,1 раза. За счет только лишь аутоплазмотрансфузии потребности в донорской крови уменьшаются в 2,4 раза. При комбинированных вариантах (реинфузия с аутогемотрансфузией или аутоплазмотранс-фузией и др.) практически можно обойтись без применения донорских гемотрансфузионных сред даже тогда, когда операционная кровопотеря превышает 2 л. Все это позволяет считать, что аутогемотрансфузия уже на современном этапе может рассматриваться в качестве основы гемотранс фузионной терапии кровопотери при вмешательствах на легких и плевре, а применение донорских гемотрансфузионных сред — как дополнение ее. По опыту клиники, наилучшей донорской гемотрансфузионной средой, выступающей в дополнение к аутогемотрансфузии, является взвесь эритроцитов в растворе модифицированного деионизированного желатина, как относительно ареактоген-ной среды, обеспечивающей транспорт кислорода и обладающей гемодинамическим, а также благоприятным реологическим действием.
Независимо от конкретной трансфузионной программы соответствие темпа кровезамеще-ния темпу потерь должно поддерживаться на протяжении всего операционного периода, что предупреждает внутрисосудистую потерю крови в связи с патологическим депонированием ее на фоне операционного стресса. Пусковым механизмом депонирования могут стать и функциональная гиповолемия в самом начале операции, и неадекватность обезболивания, и воздействие холодной крови и вливаемых кровезаменителей на температурный режим организма, но наиболее часто этот процесс запускает отставание в крововосполнении.
Контроль гемодинамических показателей позволяет ориентироваться в достаточности обеспечения операции на легком и плевре. По ходу операции состояние гемодинамики особо привлекает внимание анестезиолога во время манипуляций на корне легкого, выполнения медиастинотомии и лимфаденэктомии. Кровообращение контролируют по цвету кожных покровов, наполнению кожных вен, быстроте исчезновения пятна после надавливания пальцем на кожу лба (норма I—2 с), основным показателям кровообращения (пульсу, артериальному давлению), ЭКГ и, что очень важно при наиболее тяжелых операциях, по темпу диуре-
345
за, который должен быть не ниже 0,5 мл/кг массы в час или 1—2 мл в 1 мин. Во всяком случае прекращение или возобновление диуреза свидетельствуют об ухудшении или восстановлении тканевой перфузии либо об уровне болевой реакции.
Поддержание аффективного объема крови инфузионно-трансфузионным воздействием, регуляция темпа сердечных сокращений (атропин при брадикардии), использование эуфил-лина и панангина поддерживают перфузию тканей если не на фоне, то после завершения наиболее травматичного этапа вмешательства. Введение сердечных гликозидов короткого действия (коргликон) надо считать обязательным не только по завершении любого обширного вмешательства, но и в процессе операции. Особенно необходим такой прием при массивных по объему и форсированных по темпу трансфузиях, но только после остановки кровотечения [Kittmeyer S., 1970].
Некоторым больным при подозрении на кортикоадреналовую недостаточность (стойкая гипотония, сохраняющаяся на фоне высокого темпа трансфузии) следует одномоментно ввести 250 мг гидрокортизона или 60—90 мг преднизолона. Г. М. Соловьев, Г. Я. Гебель (1968—1969) и др. полагают, что глюкокортикоиды не только увеличивают при этом сердечный выброс, что подтверждено и в клинике госпитальной хирургии в ходе систематического гемодинамического контроля во время операции на легких с помощью интегральной реографии тела по М. И. Тищенко, но и расширяют сосуды малого круга у больных с легочной гипертензией.
ИНТРАОПЕРАЦИОННАЯ ТЕРАПИЯ МЕТАБОЛИЧЕСКИХ РАССТРОЙСТВ
Известное значение для стабилизации центральной гемодинамики и периферического кровотока имеет коррекция метаболического ацидоза, что, по нашим данным, показано всегда при эфирном и фторотановом наркозах, а также при нейролептаналгезии с умеренной (0,25— 0,30 мг дроперидола на 1 кг массы тела) ней-ролепсией. Неизбежность ацидоза в этих случаях позволила выдвинуть предположение о необходимости его «слепой» коррекции на основном этапе операции, если нет возможности оперативного контроля кислотно-основного состояния крови.
Исходя из исследований показателей кислотно-основного состояния крови по ходу вмешательства на легких [Костюченко А. Л., 1968], определен средний сдвиг буферных оснований, составляющий за операцию 5—6 ммбль/л кро
ви. Эта величина описывается и другими анестезиологами [Островский В. Ю. и др., 1980]. Исходя из такой величины сдвига, следует использовать 2,5—3 мл 5 % раствора гидрокарбоната натрия или 5—6 мл 0,3 М раствора трисаминола.
В последние годы показано, что создание инфузионного подпора по ходу операции, когда проводят не компенсацию, а профилактику гиповолемии, уменьшает выраженность ацидотиче-ского сдвига (за счет ускорения вводимого с кровью лактата и цитрата). Это происходит благодаря переводу гиподинамического режима кровообращения, характерного для травматичных вмешательств под наркозом, в гипердинамический, который уменьшает выраженность микроциркуляторных расстройств. Эффект может быть усилен введением глюкозы с инсулином, витаминами С (100—150 мг) и Be (50 мг), кокарбоксилазы (100 мг) и пананги-ном, что, по данным Т. С. Монченко, Н. И. Прут-цевой (1969), ускоряет направленную нормализацию нарушенного кислотно-основного равновесия.
Для стабилизации обменных процессов в случаях возникновения критических ситуаций (тяжелый гипоксический эпизод, связанный с нарушением газообмена, длительная гиповолемия с гипотонией, аритмогенный коллапс, остановка сердца) с отчетливым быстрым успехом реанимационных мероприятий используются вещества, повышающие устойчивость организма больного к гипоксии. Среди них достаточно эффективным оказался амтизол, производное гутимина, разработанный коллективом кафедры фармакологии ВМедА им. С. М. Кирова. Амтизол вводили капельно в дозе 150— 300 мг вместе с любой инфузионной средой при проведении неотложных лечебных мероприятий. На основании более 50 наблюдений применения амтизола по различным показаниям, накопленных за последние годы, установлено, что амтизол не только усиливает эффект мероприятий по восстановлению и нормализации обменных процессов, но и облегчает выведение больного из анестезии. Для некоторых анестетиков (кетамин, оксибутират натрия) он является активным антинаркотиком, ликвидируя посленаркозную депрессию сознания.
ВЫВЕДЕНИЕ ИЗ АНЕСТЕЗИИ
После окончания операции у большинства больных принимаются меры к быстрому восстановлению самостоятельного дыхания. Первое необходимое условие — достижение непрерывности и полноты обезболивания области торакотомией раны. При наркозе или при неудовлет-
346
верительной анестезии другими методами хирург по просьбе анестезиолога должен выполнить тщательную подплевральную анестезию 0,25—0,5 % раствором тримекаина (в пяти межреберьях) у головок ребер с введением 30 мл анестетика за грудину и в области плевральных дренажей, особенно нижнего. Одновременно, незадолго до окончания наркоза, вводится внутривенно ненаркотический анальгетик — ба-ралгин или анальгин (по 2 г активного вещества) .
В случаях операций под перидуральной анестезией обязательность местного обезболивания области нижнего дренажа сохраняется, несмотря на введение последней дозы анестетика перидурально перед самым окончанием операции. Реакция кровообращения на ее введение может служить критерием завершенности программы восполнения операционной кровопотери, а полная анестезия зоны вмешательства облегчает перемещение больного из операционной в палату интенсивной терапии.
Другим условием восстановления полноценного самостоятельного дыхания является быстрое пробуждение больного. Только в таких обстоятельствах больной способен ориентироваться в окружающей среде, возможность чего была временно утрачена под действием общих анестетиков. Поэтому в случае какого-либо осложнения, вызвавшего угнетение центральной нервной системы, с экстубацией спешить нельзя, даже при наличии эффективного по клиническим и функциональным тестам дыхания.
При эфирном наркозе подачу наркотика прекращали за 10—15 мин до наложения кожных швов. При наркозе фторотаном и азеотропной смесью это делается за 3—5 мин. Элиминация наркотика продолжается за счет сохранения умеренной гипервентиляции во время завершения обработки кожной раны, фиксации повязки, снятия стерильных простыней. При использовании гипнотиков последнюю дозу препарата вводят за 40—60 мин, а при нейролептаналгезии фентанил инъецируют не позже 25— 30 мин до завершения операции. Преждевременное восстановление сознания легко предотвращается ингаляцией анальгетических доз закиси азота с кислородом (1:1). Иногда последнее введение фентанила заменяют инъекцией препарата с более длительным (3—6-часовым) болеутоляющим действием, а именно 50 мг фортрала (лексира), который, будучи антагонистом с фентанилом в действии на одни и те же участки дыхательного центра, ликвидирует депрессию дыхания и не снимает, как налор-фин, анальгетическое последействие фентанила.
После выполнения этих условий и отсасывания слюны и слизи из носоглотки и полости рта больные обычно приходят в себя и начинают
удовлетворительно дышать. Верными критериями восстановления адекватного дыхания считается восстановление ясного сознания, способность пожать руку и поднять голову так, чтобы подбородок касался груди. Среди указанных признаков важнейшим является свободный подъем головы. Без присутствия этих реакций больного экстубировать нельзя, но, как считает Ю. Н. Шанин (1982), когда они есть в полной мере, то опасаться нечего: выраженного гипноз не будет. Восстановление сознания ограничивает показания для введения аспирационного катетера в трахею и бронхи при экстубации: полная аналгезия не сопровождается скоплением мокроты в дыхательных путях, а быстрое восстановление естественного и щадящего защитного механизма — кашля — намного эффективнее и безвреднее для бронхиального дерева.
Полная аналгезия по ходу и в конце операции и отказ от антидеполяризующих миорелаксантов, прежде всего тубарина, позволяют избежать во многих случаях декураризации.
Массаж грудной клетки и брюшного пресса способствует переводу относительного гипноз в эйпноэ. Одновременно желательно провести массаж всего тела больного с участием анестезиолога и помогавшей ему сестры. При проведении массажа по выведению из наркоза и релаксации наибольшее значение придается растиранию и разминанию кожных покровов в зоне наложения электродов и суставов, больших мышечных групп конечностей, брюшной стенки, спины. Можно предполагать, что этим достигается повышение возбудимости нервной системы, устраняются регионарные нарушения лим-фо- и кровообращения, неизбежно возникающие при неподвижном положении больного в течение нескольких часов на жестком операционном столе.
Только в случаях выраженного трахеобронхита и подозрения на недостаточность защиты бронхиального дерева экстубации предваряют промывание бронхиального дерева теплым содовым раствором антибиотиков с одновременным вибрационным массажем грудной клетки. По ходу промывания больного следует побуждать к кашлю или применить аппарат искусственного кашля. После экстубации и туалета верхних дыхательных путей больной в течение 3—5 мин дышит через маску, затем его перемещают в отделение интенсивной терапии. При частичных резекциях во время перевода плевральные дренажи не должны быть закрыты, а подключены к водозапорному клапану.
Если же, несмотря на все меры, самостоятельное дыхание остается недостаточным, что подтверждают клиника и исследование газов артериальной крови, то больного лучше пере
347
вести в послеоперационное отделение для продолжения искусственной вентиляции объемным респиратором с целью неосложненного восстановления дыхания.
В настоящее время в терапии послеоперационных дыхательных расстройств сохраняется тенденция к возможно более раннему, профилактическому применению длительной искусственной вентиляции легких для преодоления критического периода адаптации внешнего дыхания к новым условиям функционирования после резекции легких. Давно показано, что результаты позднего использования этого метода, когда в нем возникла абсолютная необходимость, значительно хуже, чем при профилактическом проведении.
С целью облегчения адаптации больного к респиратору используется продолженное выведение из анестезии, для чего не уменьшается доза анестетика до конца вмешательства и не производится декураризация. Вентиляция продолжается через ту же трубку, которая использовалась для анестезии или заменялась (например, при раздельной интубации бронхов) на пластиковую однопросветную оро- или назотрахеальную. Во время перевода больного в палату вентиляцию легких целесообразно поддерживать с помощью самораздувающегося мешка (ДП-10) или дыхательного меха.
В палате больной укладывается в постель, согретую электрическим пледом или феном, в функционально выгодное положение. Дренажи присоединяются к отсасывающей системе и проверяются на проходимость. Затем на больного надевают чистую согретую рубашку, протирают рот раствором фурацилина. Больным с самостоятельным дыханием дают полоскание (стоматологический антисептический раствор или зубной эликсир с фурацилином), вводят носоглоточные катетеры или носовые канюли для ингаляции кислорода. Они принимают внутрь димедрол или дипразин (пиполь-фен), анастман, вентолин (сальбутамол) или другой бронхолитик.
Ровное дыхание с возможностью произвольного изменения его глубины и частоты, наличие кашля, стабильные показатели пульса и артериального давления, умеренное количество отделяемого по дренажам при изменении положения позволяют передать больного дежурному реаниматологу для дальнейшего проведения интенсивной терапии.
В тех случаях, когда анестезиолог непосредственно не занят на следующей операции, он должен остаться в отделении на 1 —2 ч, чтобы завершить оформление документации и участвовать в коррекции нарушений, которые проявляются у доставленных больных в непосредственном периоде после протекавшей без осложне
ний анестезии. Это касается остаточного действия компонентов обезболивания, психических расстройств, тошноты и рвоты, нарушений терморегуляции, которые начинаются еще на операции (наведенная гипотермия), но проявляются в полной мере сразу после нее в виде интенсивной мышечной дрожи.
Установлено, что генерализованные мышечные подергивания, которые наблюдаются довольно часто (80 %) после любых видов общей анестезии, могут быть выражены значительно и сопровождаться серьезными нарушениями жизненно важных функций и - изменениями метаболизма [Лебанидзе Я. Г. и др., 1978].
Плавное выведение больного из состояния анестезии, полная аналгезия имеют немаловажное значение в профилактике мышечной дрожи. Согревание газовой смеси и вводимых инфузионных сред, обдувание больного электрофеном в конце операции, помещение в нагретую постель в значительной степени предотвращают возникновение дрожи и при очень длительных операциях со вскрытием плевральной полости. Однако предотвратить послеоперационный озноб удается не всегда.
Другое направление использует медикаментозные воздействия, направленные на подавление мышечной дрожи или на нормализацию диссоциации симпатико-адреналовой системы и функциональной активности ретикулярной формации и мотонейронов спинного мозга, которые, по предположению некоторых исследователей, являются причиной развития этого синдрома [Lim Т., 1960].
Мефедол, являясь центральным миорелаксантом, надежно снимает мышечную дрожь, особенно при эффективном наружном согревании [Шанин Ю. Н. и др., 1970]. Близкий эффект, хотя и менее отчетливый, оказывает внутривенное введение сульфата магнезии (25— 30 мг/кг массы тела), однако ее действие непродолжительно, и нередко приходится повторять введение той же дозы препарата.
В некоторых случаях снятия мышечной дрожи можно достигнуть за счет короткого курса ганглионарной блокады (пентамин 0,2 мг/кг массы тела). Фенотиазины — аминазин, а лучше левопромазин (тизерцин) — примерно в той же дозе (0,5 мл 2,5 % раствора) оказывают не-сомненний эффект в таких обстоятельствах, обеспечивая потенцирование анальгезии (особенно тизерцин), расширяя периферические сосуды, оказывая противорвотное действие и вызывая некоторую седатацию больного, которая иногда необходима при постнаркотическом возбуждении (эфирный наркоз). Все эти препараты снижают активацию симпатико-адреналовой системы, препятствуют проведению импульсов в высшие отделы терморегуляции, способ
348
ствуют уменьшению температурных градиентов благодаря перераспределению кровотока из внутренностей в кожу. Отсюда и благоприятный эффект перидуральной блокады тримекаи-ном, если она непрерывна.
СПЕЦИАЛЬНЫЕ
АНЕСТЕЗИОЛОГИЧЕСКИЕ РЕШЕНИЯ ПРИ ОПЕРАЦИЯХ НА ЛЕГКИХ
И ПЛЕВРЕ
Наряду с обычными условиями проведения операции в хирургии легких и плевры, существуют обстоятельства, при которых проведение искусственной вентиляции и ингаляционного наркоза затруднено в силу особенностей поражения легких, наличия дооперационной негерметичности воздухоносных путей или возникновения ее во время операции, когда обычные способы защиты бронхиального дерева оказываются несостоятельными. К таким обстоятельствам следует отнести необходимость широкого вскрытия плевральной полости в случаях значительной бронхоплевральной коммуникации или пластических операций на бронхах в дистальном отделе трахеи (резекция карины).
Исходя из опыта широкого применения кетамина (калипсола) для хирургического обезболивания и учитывая некоторые стороны действия этого наркотика при широком вскрытии плевральной полости, используется кетаминовый наркоз в положении сидя, с самостоятельным дыханием больного.
Восстановительные и реконструктивные операции на главных бронхах нередко связаны с необходимостью их длительного и широкого вскрытия или полного пересечения. В этих условиях важное значение имеют методы поддержания газообмена на протяжении основного этапа операции, который может длиться несколько десятков минут. Основным методом обеспечения газообмена во время таких one раций является искусственная вентиляция (одного или долей) легкого через системы «шунт — дыхание». Сущность этого метода состоит в том, что после вскрытия или пересечения главного бронха хирург вводит в каудальный отдел бронхиального дерева со стороны операционной раны трубку, которая соединяется с аппаратом. Система «шунт — дыхание» позволяет проводить практически все операции на главных бронхах, но имеет один существенный недостаток: интубационная трубка, введенная со стороны операционной раны, мешает накладывать швы во время формирования трахеобронхиальных анастомозов. С целью прецизионного наложения швов трубку обычно приходится на время извлекать из бронха, а затем вводить снова, чере-
Рис. 143. Схема инжекторной вентиляции «здорового» легкого при пластике трахеи.
дуя периоды апноэ и гипервентиляции [Перельман М. И. и др., 1981; Харченко В. П„ Чхиквадзе В. Д., 1981]. В условиях использования внутривенной анестезии и гипервентиляции чистым кислородом перерывы в вентиляции не могут превышать 4—5 мин, без развития тяжелых нарушений газообмена. Безопасные периоды выключения вентиляции могут быть увеличены до 10— 12 мин, если такое вмешательство проводить в условиях гипербарической оксигенации чистым кислородом при давлении в камере 3 атм [Перельман М. И. и др., 1981]. К сожалению, создание таких условий возможно далеко не в каждом стационаре.
Другой выход — использовать при реконструктивных операциях на трахее и бронхах инжекционную вентиляцию, например в случаях циркулярной или клиновидной резекции трахеи [Альтман Э. И. и др., 1977] (рис. 143). Первый этап анестезиологического обеспечения — торакотомия, обработка сосудов корня легкого, пересечение трахеи или главного бронха — выполняется через обычную оротрахеальную трубку. После пересечения трахеи или главного бронха через интубационную трубку проводят стерильный катетер (с наружным диаметром 3 мм) с множественными отверстиями на дистальном конце. С помощью хирурга анестезиолог продвигает катетер в устье главного бронха остающегося легкого и начинает инжекционную вентиляцию 100 % кислорода с частотой 20—25 циклов в 1 мин. Вдох, как обычно, осуществляется подачей газа под давлением в 3— 4 ата. После наложения анастомоза инжектор удаляют и операцию заканчивают при вентиляции через оротрахеальную трубку. Наложение трахеобронхиального анастомоза в таких условиях не составляет трудности, так как создаются оптимальные условия для работы хирурга.
349
Глава ± У ИНТЕНСИВНАЯ ТЕРАПИЯ И МЕСТНОЕ ЛЕЧЕНИЕ БОЛЬНЫХ ПОСЛЕ ОПЕРАЦИЙ НА ЛЕГКИХ И ПЛЕВРЕ
Динамичность развития патологических явлений, нередко скрытый их характер, маскирование одних функциональных нарушений внешними проявлениями других ведут к тому, что в ближайшем и раннем послеоперационном периодах после вмешательств на легких и плевре необходимо оперативно менять интенсивность и основное направление лечебных мероприятий, входящих в терапию таких больных. Иногда это необходимо производить в короткий срок и даже немедленно. Несмотря на очевидность этого положения, врачебный контроль за состоянием тяжелобольных чаще всего осуществляется визуальным наблюдением дежурного персонала отделения, где после операции лечатся больные.
Для реализации эффективного интенсивного наблюдения в клинике госпитальной хирургии применяется оперативный врачебный контроль — непрерывная (или с определенной периодичностью) оценка текущего состояния больного, основанная на применении методов и средств функционального исследования. Опыт клиники [Волков Ю. Н„ 1975; Шанин Ю. Н. и др., 1978] и других лечебных учреждений [Бурановский В. И. и др., 1978; Гойко И. В., 1983] доказал реальность такого контроля в хирургии легких и плевры с высокой степенью надежности оценки состояния и прогноза у послеоперационных больных при современном уровне развития вычислительной техники.
ЛЕЧЕНИЕ ПОСЛЕОПЕРАЦИОННЫХ НАРУШЕНИЙ ЛЕГОЧНОГО ГАЗООБМЕНА
Исследованиями, проведенными в госпитальной хирургической клинике, показано, что успех профилактики и лечения дыхательных рас
стройств на различных этапах послеоперационного периода определяетс я прежде всего знаниями о причинах и путях их развития. Они могут быть либо вентиляционными, либо (что наблюдается чаще) паренхиматозными.
Интенсивная терапия паренхиматозной дыхательной недостаточности должна быть направлена на устранение артериальной гипоксемии, купирование локального бронхоспазма с разжижением мокроты и повышением эффективности ее удаления. Артериальной гипоксемии способствует поверхностное дыхание (с постоянным дыхательным объемом), увеличивающее экспираторное закрытие мелких дыхательных путей на выдохе [Щелкунов В. С. и др., 1980]. Поэтому для профилактики гипоксемии необходимо использовать методы, изменяющие сам характер вентиляции легких созданием сопротивления на выдохе или спонтанного дыхания с положительным давлением в конце выдоха.
В ближайшем послеоперационном периоде обязателен систематический (не реже одного раза в день) рентгенологический контроль. С первого дня на протяжении недели, проводя его, лечащий врач получает информацию о степени расправления оперированного легкого, наличии воздуха и жидкости в плевральной полости, правильности стояния плевральных дренажей, воздушности респираторной зоны с ранним выявлением участков гиповентиляции, частичной бронхиальной проходимости, явлений дис-телектаза и ателектаза.
Исследование напряжения газов артериальной крови, равно как и состава выдыхаемого воздуха с помощью быстродействующих анализаторов, уточняет выраженность нарушений легочного газообмена. Развитие несостоятельности дыхания и эффект проводимого лечения можно контролировать с помощью интегральной реографии тела по М. И. Тищенко (1972): по величине коэффициента дыхательных изменений ударного объема сердца и производному от него показателю напряженности дыхания, представляющему произведение коэффициента дыхательных изменений на частоту дыхания. Нарастание этого показателя после пневмонэктомии, превышающее обычный уровень в 2— 2,5 раза, отсутствие снижения его к концу раннего послеоперационного периода свидетель
350
ствуют о возникновении стойкого нарушения механики дыхания с уплотнением единственного легкого гораздо раньше клинико-рентгенологических проявлений этого осложнения.
Артериальную гипоксемию после внутриплевральных вмешательств следует устранять (даже при условии сохранения причин ее возникновения) с помощью кислородной терапии, основным видом которой следует считать непрерывную, проводимую в течение 24—48 ч, ингаляцию увлажненного кислорода через носоглоточный катетер. Показанием для использования головного кислородного тента с подачей 15—20 л О2 в 1 мин Ю. Н. Шанин и соавт. (1972) считают присоединение к микроателектазированию легкого уплотнения его или трансфузионную легочную эмболию после переливания во время операции более 3—4 л консервированной крови поздних сроков хранения.
Несколько особняком в кислородной терапии стоит ингаляция гелиево-кислородных смесей в соотношении гелия и кислорода 2:1, которые подаются через ротаметры наркозного аппарата. Относительно низкая плотность таких смесей изменяет условия газотока в мелких дыхательных путях, уменьшает неэластическое сопротивление дыханию, а следовательно, энерготраты на вентиляцию и кислородную цену дыхания.
Основные причины послеоперационной дыхательной недостаточности, наблюдаемой после операций на легких и плевре (высокая вязкость и значительное количество мокроты, бронхиоло-спазм, нарушения отношения между вентиляцией и кровотоком) требуют простых, но систематических воздействий. Они быстро устраняются периодическим проведением парокислородных ингаляций с лечебными травами (чаб рец, ромашка, эвкалиптовый лист), которые чередуются с сеансами самостоятельного дыхания под положительным давлением смесью воздуха и фитонцидами (лук, хвойный экстракт) через испаритель стандартных наркозных аппаратов или со вспомогательной искусственной вентиляцией.
Появление в распоряжении клиницистов ультразвуковых туманообразователей (типа УУГА) позволяет широко варьировать воздействие протеолитических ферментов (хемопсин, гигролитин) или ацетилцистеина (мукомист, мукосолвон) на уровне дыхательных бронхиол. Добавление в раствор для ингаляций непосредственно перед ее проведением В-адреностиму-ляторов (новодрин, алупент), использование после ингаляции раствора муколитика, постурального дренажа, вибрационного массажа грудной клетки и настойчивого побуждения к откашливанию по завершении сеанса всегда повышает Рао, с последующей положительной
рентгенологической динамикой частичной бронхиальной обтурации (дистелектаза).
Эффективность кашля определяется общей тенденцией к ранней двигательной активности больного перед операцией на легких и плевре и качеством послеоперационного обезболивания. На основании клинических наблюдений и определения вентиляционного эффекта наркотических анальгетиков (пантопон, морфин, промедол и др.) на фоне дремотного состояния [Шанин Ю. Н. и др., 1969] установлено, что свободное назначение таких препаратов после вмешательства на легких не оправданно в связи с вызываемой ими отчетливой депрессией дыха-. ния. Настороженно следует относиться и к новым анальгетикам — пентазацину (фортрал, лексир), дипидолору, трамадолу (трамалу), в эквипотенциальных дозах лишенных многих побочных сторон действия морфинных препаратов.
Лучшим методом послеоперационного обезболивания в хирургии легких и плевры надо считать длительную эпидуральную аналгезию тримекаином. Применение ее непрерывно в течение первых 3—4 сут после операции изменило течение недостаточности легочного газообмена: оксигенация крови в легких стала нормализоваться на 2—3-й день после пульмонэктомии, а вентиляционные расстройства не наблюдались даже в первые часы после оперативного вмешательства.
К сожалению, метод перидуральной аналгезии не получил широкого распространения при хирургическом лечении больных с гнойно-деструктивными заболеваниями легких и плевры из-за опасности инфицирования перидураль-ного пространства в связи с микробным загрязнением кожи спины. У таких больных, а также у тех, у которых не удается применить пери-дуральную аналгезию, следует применять ненаркотические анальгетики (анальгин, реопирин, баралгин) в комбинации с антигистаминными препаратами (димедрол, супрастин) и небольшими дозами нейролептиков (дроперидол).
В отличие от паренхиматозных нарушений легочного газообмена вентиляционные нарушения возникают либо сразу после операции, либо в более поздние сроки в связи с послеоперационными осложнениями, в основном легочного характера (пневмония, тромбоэмболия легочной артерии). Отсюда настоятельная необходимость патогенетического направления интенсивной терапии за счет повышения функциональных механизмов самостоятельного дыхания благодаря полному восстановлению сознания, применению своевременной декураризации, непрерывному болеутолению и использованию эффективных аналептиков дыхания, каким является этимизол.
351
Лишь иногда следует избрать другое направление интенсивной терапии вентиляции. расстройств, состоящее в профилактической искусственной вентиляции легких, о показаниях к которой говорилось в предыдущей главе.
У больных с распространенным воспалением в бронхиальном дереве (острые гнойно-деструктивные заболевания легких) показания к продолженному выведению из анестезии следует ограничивать. Даже при соблюдении всех условий ухода продолжительная искусственная вентиляция (более 6—8 ч) у больных с гангреной легких, а особенно переход к вентиляции через трахеостому спустя 24—48 ч, становится иногда основным фактором, угрожающим жизни больного. Значительное бактериальное обсеменение бронхов «здоровых» отделов легких, повреждение мукоцилиарного «эскалатора» создают опасность бурного прогрессирования послеоперационного трахеобронхита. Это заставляет стремиться к достижению максимальной готовности таких больных к поддержанию спонтанного дыхания сразу после операции.
Выраженность недостаточности легочного газообмена после частичных резекций легких и корригирующих операций на висцеральной плевре зависит от состояния оперированного легкого, воздушность которого во многом определяется полнотой и темпом расправления и плотностью прилегания остатка к стенкам плевральной полости — одного из условий эффективности кашля. Поставленная цель может быть в значительной степени достигнута при достаточной герметичности легочной раны, удовлетворительной проходимости крупных бронхов и непрерывной аспирации по плевральным дренажам воздуха и экссудата. Однако даже при соблюдении этих условий расправление оперированного легкого во многом определяется растяжимостью его ткани и соответствием объема и конфигурации остатка легкого емкости плевральной полости.
При несоответствии объема остатка легкого емкости плевральной полости целесообразно наложить пневмоперитонеум. Это мероприятие следует применять не только при наличии так называемой пострезекционной полости, которая выявляется при раздувании остатка легкого с помощью наркозного аппарата, но и в тех случаях, когда остающаяся доля склеротична и имеется отчетливое инфицирование плевральной полости при выделении легкого [Шалимов А. А., Веллер Д. Г., 1970]. Последнее время пневмоперитонеум стали накладывать еще более широко, как только спустя сутки после вмешательства обнаруживается несоответствие остатка легкого и сохраняется значительная негерметичность легочной раны, несмотря на временный перевод на пассивное расправление.
Изменение положения диафрамы с подъемом ее до уровня HI—IV ребра достигается за счет введения в полость брюшины воздуха или кислорода в количестве 20—30 мл газа на 1 кг массы тела больного. Как 'правило, такое количество газа полностью снимает отрицательное давление в поддиафрагмальном пространстве и на фоне активной аспирации по дренажам приводит к преимущественному подъему диафрагмы на стороне операции. Локализация вмешательства (верхняя или нижняя доля) не имеет существенного значения для эффекта пневмоперитонеума.
Эффективность расправления легкого на фоне пневмоперитонеума с точки зрения предупреждения формирования стойкой плевральной полости оказалась недостаточной у 9 из 173 больных. Во всех этих случаях были произведены комбинированные резекции легкого, что потребовало повторных дренирований и корригирующих вмешательств.
Иногда, при небольшой несостоятельности легочной раны, пневмоперитонеум можно дополнить временной окклюзией бронха, что ускоряет контакт ткани легкого со стенками плевральной полости.
Наибольшего успеха в лечении послеоперационной недостаточности легочного газообмена удается достигнуть при проведении перечисленных мероприятий на фоне режима ранней двигательной активности. Больным разрешается садиться, спустив ноги с кровати, в день операции, а ходить — к исходу первых суток. По многолетним наблюдениям, более 70 % больных, перенесших пневмонэктомию, могут вставать и ходить в первые 36—48 ч. Плевральные дренажи не являлись противопоказанием к раннему вставанию. При необходимости постоянного дренирования плевральной полости во время вставания можно использовать носимый водозапорный клапан.
Отсутствие четкого эффекта обычной системы лечебных мероприятий, сохранение признаков недостаточности легочного газообмена в связи с задержкой мокроты, появление рентгенологической картины дистелектаза (затенение легочной ткани на фоне предшествовавшего усиления легочного рисунка) или выявление долевой бронхообтурации заставляют расширять программу лечения. В таких случаях используют либо назотрахеальную аспирацию мокроты либо аспирацию бронхиального содержимого под контролем зрения во время лечебной бронхоскопии, либо промывание бронхиального дерева антисептическим раствором при сохраненной кашлевой активности.
Такие пособия особенно показаны, когда нарушается самостоятельное очищение бронхов из-за перерыва слизистой оболочки (шов брон-
352
ха) или в связи со слабостью кашлевого акта (повреждение возвратного нерва). Иногда невозможно достичь полноценного «сотрудничества» с больным в произвольном откашливании из-за нарушений психического статуса (послеоперационный психоз, алкогольный делирий и т. п.).
Показанием к бронхоскопии надо считать ателектаз с закупоркой крупного бронха, шов бронха, наличие большой остаточной полости, когда отсутствие полного контакта остатка легкого с грудной клеткой не позволяет полноценно откашливать мокроту при сохраненной силе дыхательных мышц. Прицельная аспирация мокроты через бронхоскоп с последующей пункцией или катетеризационным дренированием остаточной полости (по принципу сосудистой катетеризации по Сельдингеру) для постоянной эвакуации воздуха и плеврального экссудата создают условия для полного восстановления воздушности периферических отделов легких. Лечебный эффект бронхоскопии усиливается промыванием бронхиального дерева растворами антисептика с бронхо- и муколити-ками.
Хотя благодаря систематическому проведению превентивного лечения дыхательной недостаточности необходимость в бронхоскопии удалось уменьшить в несколько десятков раз [Шанин Ю. Н. и др., 1970], о ее своевременном, раннем применении следует помнить всегда, несмотря на любую тяжесть больного. Использование инжекционного метода искусственной вентиляции легких при проведении бронхоскопии [Шалаев С. А. и др., 1980] наиболее рационально с точки зрения предупреждения осложнений, которые могут возникнуть во время бронхоскопии на фоне некупированной гипоксемии (тяжелые нарушения сердечного ритма, остановка сердца). Бронхоскопия с инжекционной искусственной вентиляцией сохраняет непрерывность кислородной терапии (рис. 144), которая у больных данной категории должна проводиться и более длительно, и более скрупулезно.
Хорошие функциональные результаты при периферических, субсегментарных вариантах бронхиальной обтурации или отсутствии возможностей для проведения бронхоскопической аспирации оказывает промывание трахеобронхиального дерева фракционным (по 5—10 мл) введением теплых антисептических растворов через назотрахеальный катетер. Условиями эффективности и безопасности этого мероприятия являются: достаточно полное расправление оперированного легкого, сохраненная кашлевая активность, подача 5—6 л Ог через другой носовой ход и предварительное введение 0,5 мг атропина.
Перечисленные возможности санации брон-
Рис. 144. Эффективность легочного газообмена на фоне бронхоскопии под местной анестезией (А) и на фоне инжекционной искусственной вентиляции легких (Б). 1 — Рцо ; 2 — Pifco2-
хиального дерева удерживают от широкого использования стимуляции кашля с помощью чрескожной катетеризации трахеи по Radigan — King—Keawn, которая до последнего времени пропагандируется некоторыми легочными хирургами. Чрескожную катетеризацию трахеи следует применять лишь в редких случаях у малокоммуникабельных больных, при анатомическом перерыве мукоцилиарного «экскалатора» (межбронхиальный анастомоз), но без резкого снижения эффективности рефлекторного кашля.
При появлении признаков несостоятельности дыхания и сохранении выраженных нарушений легочного газообмена показано применение вспомогательной искусственной вентиляции легких через загубник с помощью респирато-ров-ассисторов с откликающейся системой, либо с помощью обычных объемных респираторов с адаптацией методом «повисания на респираторе», предложенного В. М. Юревичем и соавт. (1973). Адаптация в последнем случае облегчается предоперационной тренировкой больного при прогнозировании несостоятельности дыхания. Как показали исследования В. А. Гологорского и соавт. (1980), именно сеансы вспомогательной искусственной вентиляции — фактор быстрой нормализации механики дыхания у послеоперационных больных.
ЛЕЧЕНИЕ НАРУШЕНИЙ
ЦИРКУЛЯТОРНОГО ГОМЕОСТАЗА
Самое рациональное крововосполнение не исключает у большинства больных возможность последующего развития гиповолемии. Она возникает из-за экссудации — геморрагии (дре-
23 Зак. 0517
353
Рис. 145. Динамика объема циркулирующей крови (ОЦК) и эритроцитарного объема (ЭО) в л/м" в зависимости от трансфузионной программы в 1-е сутки после операции.
1 — при переливании крови по клиническим показаниям; 2 — при использовании превентивной гемотрансфузии в первые 5—6 ч после вмешательства.
нажные потери), из-за промывания плевральной полости растворами антисептиков при ее инфицировании, а также вследствие действия факторов, усиливающих катаболизм (боль в ране, гипоксемия, лихорадка, озноб, интоксикация, анорексия).
Ранее было показано [Шанин Ю. Н. и др., 1975], что при появлении клинических признаков гиповолемии усиливается внутрисосудистая потеря эритроцитов, что обусловливает снижение транспорта кислорода к тканям. Учитывая неизбежность развития гиповолемии и анемии, несмотря на полное восполнение операционной кровопотери, уже в первые часы после операции целесообразно переливать 0,4—0,5 л эритроцитосодержащих сред в сочетании с во-лемически и реологически активными кровезаменителями (полиглюкин, реополиглюкин, альбумин). Общий объем трансфузий — около 1 л. Естественно, что при усилении экссудации (более 500 мл за 4—6 ч) объем такой превентивной трансфузии должен быть увеличен. Ближайшим эффектом такого мероприятия явились отсутствие клинически отчетливых расстройств кровообращения в первую ночь и на утро следующего дня после операции, отчетливо более свободная двигательная активность больного уже на следующий день, что облегчает естественную санацию трахеобронхиального дерева, способствует восстановлению функции кишечника и мочевого пузыря, обеспечивает полноценное энтеральное питание. Конкретно показания к такой превентивной трансфузии могут быть уточнены (так же как реально оценена ее эффективность) при интенсивном наблюдении за больным с помощью информа
ционных систем оперативного врачебного контроля [Костюченко А. Л. и др., 1981].
Эффект превентивной трансфузии проявлялся в более отдаленные сроки стабилизацией эритроцитарного объема крови и концентрации гемоглобина даже у больных самых тяжелых категорий (гангрена, рак легкого с обширным распадом в ретростенотической зоне). Это подтверждается данными динамического исследования объема циркулирующей крови и его компонентов в сопоставимых группах больных в среднем с одинаковой кровопотерей и тактикой крововосполнения во время операции (рис. 145).
Проведенными исследованиями показано, что для удержания достаточного уровня гемоглобина уже на фоне проявившейся гиповолемии приходилось переливать в 3—4 раза больше донорской крови, чем при профилактической трансфузии, при которой переливание в день операции нередко оказывалось единственным.
Наблюдение за больными в послеоперационном периоде показало, что при неосложненном течении резекции легких кровопотеря около 35 % должного объема крови с восполнением ее в первые сутки «капля за каплю» развивается умеренная анемия. Она носит нормохромный характер с некоторым увеличением объема одного эритроцита и этим отличается от постгеморрагической — гипохромной. Другой характерной чертой анемии после резекции легких оказалось гипорегенераторное состояние эритропоэтической функции костного мозга в виде задержки созревания эритроцитов на стадии базофильного эритробласта. Пытались представить послеоперационную анемию проявлением «синдрома гомологичной крови», но она была такой же по характеру и при аутогемотрансфузиях.
Исследования, проведенные в разные годы в клинике госпитальной хирургии [Малахов С. Ф., 1972; Плешаков В. Т. и др., 1978; Лыткин М. И. и др., 1983], позволили выявить основные звенья патогенеза послеоперационной анемии, которые, вероятно, можно рассматривать как общие и для других операций и повреждений. Уменьшение содержания гемоглобина и эритроцитов в циркулирующей крови следует считать результатом снижения поступления эритроцитов из костного мозга в кровь, продукции неполноценных эритроцитов эритроидным ростком костного мозга и повышенным разрушением эритроцитов, находящихся в циркулирующей крови. Эти процессы возникают на фоне операционной травмы, кровопотери и трансфузии, и их выраженность будет во многом зависеть от «шо-когенности» операции и ближайшего послеоперационного периода и потому определяется возможностями интенсивной терапии, коррек
354
ции белковой недостаточности и подавления катаболизма.
Послеоперационной анемии способствует нарушение обмена железа, необходимого для синтеза гемоглобина, которое следует связывать не только с потерями его во время операции и разведением крови, но и с функциональной неполноценностью органов — депо микроэлементов, а также с изменением функционального состояния транспортных белков плазмы под воздействием операции. В конечном счете решающее значение для синтеза гемоглобина имеет состояние белкового обмена. Именно этим объясняются прежние неудачные попытки корригировать анемию с помощью назначения парентеральных препаратов железа (ферби-тол, эктофер, феррум лек). Плазменный пул железа особенно быстро восстанавливается одним-двумя вливаниями по флакону (400 мл) полифера, комбинированного кровезаменителя, сочетающего волемический эффект полиглюки-на с быстрым насыщением организма за счет содержащегося в полифере железа (рис. 146).
Естественно, что возникновение инфекционного осложнения (плевролегочного или раневого) и эндогенной интоксикации поддерживает катаболизм и белковую недостаточность, неблагоприятно воздействует на пролиферативную активность эритрона и внутрикостномозговую деструкцию предшественников эритроцитов. Одновременно неблагоприятно действует нередкий в случаях осложнений метаболический алкалоз, что также будет усугублять анемию и замедлит восстановление циркулирующего эритрона.
Выявленные в процессе исследований патогенеза послеоперационной анемии изменения позволяют выделить основные направления лечения, предотвращающие нарастание дефицита гемоглобина в крови и сохраняющие достаточную массу циркулирующего гемоглобина на протяжении всего послеоперационного периода примерно на одном уровне. Наряду с предупреждением микроциркуляторных расстройств и нейровегетативной блокадой ноцицептивных реакций из зоны вмешательства, профилактикой дыхательных расстройств другого генеза, существенное значение будут иметь предотвращение и коррекция послеоперационной белковой недостаточности. Противоанемиче-ский эффект такой коррекции наибольший в сочетании с применением препаратов железа, если снижение его плазменной концентрации значительно.
Значение может иметь также реплантация аутогенного костного мозга, заготовленного в предвидении тяжелого кровотечения. Ауто-миелотрансфузия усиливает эффект общих воздействий, направленных на повышение ре-
23 *
Рис. 146. Динамика концентрации сывороточного железа при парентеральной нагрузке препаратами железа после резекции легких в дозе 170—180 мг за первые 3 дня.
1 — с помощью полифера; 2 — раздельным применением препаратов «феррум-ЛЕК» и полиглюкина.
зистентности организма к факторам послеоперационной болезни, снимает (особенно при массивных трансфузиях) угнетение пролиферативной активности костного мозга [Малахов С. Ф. и др., 1981].
ЛЕЧЕНИЕ НАРУШЕНИЙ
ЦЕНТРАЛЬНОЙ ГЕМОДИНАМИКИ
На основании проведенных в клинике госпитальной хирургии и в других лечебных учреждениях [Соколов Е. А., Цветков В. А., 1979] исследований выявлены два основных типа реакции кровообращения, которые проявляются на фоне неизбежной умеренной гиповолемии и анемии сразу же после операции. У больных до 40 лет, без существенных дооперационных изменений жизненно важных функций до операции и без выраженной эндогенной интоксикации в течение первой недели послеоперационного периода характерным является увеличение минутного объема кровообращения в среднем на 20 %. Ударный объем крови достоверно снижался только в первые сутки, но минутный объем все равно поддерживался за счет тахикардии со значительным уменьшением времени полного кругооборота крови, которое определяется отношением объема циркулирующей крови к минутному объему кровообращения. Увеличение производительности сердца приводило к снижению периферического сосудистого сопротивления, что облегчало периферический кровоток и кислородное снабжение тканей на фоне умеренной анемии. Такой гемодинамиче
355
ский режим является наиболее благоприятным и при отсутствии значительной и длительной гиперкатехоламинемии обеспечивает неосложненное течение послеоперационного периода.
У больных более старшего возраста, особенно при явлениях исходной сердечной недостаточности и эндогенной интоксикации, динамика основных показателей кровообращения оказалась другой. Несмотря на избыток катехоламинов (адреналина), она характеризовалась падением минутного объема кровообращения. Ударный объем крови оставался постоянно сниженным, а учащение сердечных сокращений (иногда до 120—130 уд/мин) не компенсировало этого снижения в сердечном выбросе. Время кругооборота крови практически не изменялось. Более того, начиная с 3-х суток полный кругооборот крови даже удлинялся, учитывая восстановление объема крови к этому времени. Установлено повышение периферического сосудистого сопротивления с одновременной тенденцией к уменьшению центрального или внут-ригрудного объема крови, что ухудшало условия оксигенации крови в легких.
Циркуляторную гиподинамию, а именно так следует характеризовать этот гемодинамический режим, нельзя связать только с гиповолемией, хотя последняя может усилить его до «синдрома малого сердечного выброса». Четкой корреляции между дефицитом объема крови, центральным венозным давлением и сердечным выбросом установить не удалось.
Значение имеют и прямое повреждение миокарда избытком катехоламинов, нарушение в связи с этим обмена в миоцитах и развитие энергодинамической недостаточности кровообращения.
У больных с тяжелыми гнойно-деструктивны-ми заболеваниями легких и плевры (даже в случаях длительной и настойчивой предоперационной подготовки) влияние бактериальных токсинов и продуктов тканевого распада к моменту операции приводит к значительным дистрофическим изменениям мышцы сердца, что подтверждается исследованием ЭКГ и центральной гемодинамики.
Отсутствие повышения или даже снижение минутного объема кровообращения при низком объеме циркулирующих эритроцитов — одна из основных причин тяжелого состояния больных после резекции легких. Именно в таких обстоятельствах выявляется несостоятельность дыхания.
К концу раннего послеоперационного периода даже при исходных достаточных резервах миокарда преимущественное значение в развитии циркуляторной гиподинамии приобретает углубление нарушений обмена в мышце сердца на почве гипоксемии и послеоперационной
анемии, расстройств обмена электролитов (калия, магния), белковой недостаточности.
Результаты клинических наблюдений и исследований гемодинамики послужили основанием для построения программы интенсивной кардиотонизирующей терапии. Ее применяли, как только возникала убежденность в возможности развития энергодинамической недостаточности: при значительной тахикардии (несмотря на восстановление объема циркулирующей крови и полноценное болеутоление), признаках метаболического повреждения миокарда на ЭКГ, при уменьшении минутного объема кровообращения (по отношению к дооперационным данным).
Кардиотонизирующая терапия включала внутривенное насыщение большими дозами коргликона (до 2,4 мг/сут и более), реже — быструю дигитализацию изоланидом или дигоксином. Вместе с гликозидами в течение последующих 5—6 дней назначались препараты, позволяющие получить более совершенное энергетическое и пластическое обеспечение миокарда: оротат калия, фолиевую кислоту, витамин В12. Одновременно с глюкозо-калие-выми смесями в терапию включали панангин (по 20—30 мл/сут), на этом фоне использовали систематическое (3—4 раза в сутки) вливание 0,24—0,48 г эуфиллина (диафиллина), добиваясь одновременно увеличения емкости малого круга и выраженного бронходилататорного эффекта.
Сохранение высокой тахикардии (более 100 уд/мин) при отсутствии выраженной гиповолемии и ЭКГ-признаках гиперкатехоламинемии побуждает к использованию В-адреноблока-торов (обзидана или корданума) в дозе 0,5— 1 мг на 10 кг массы тела больного.
У больных с исходно дистрофически измененным миокардом (гнойно-деструктивные процессы, генерализованная инфекция) В-блока-торы сразу после операции назначать не следует. При синусовых тахикардиях и тахиаритмиях обычно применяется верапамил (изоптин) по 5 мг внутривенно. Такая дозировка препарата в течение 1—2 ч снижала частоту сердечных сокращений на 10—15 уд/мин и способствовала перестройке гемодинамики. Повторным введением препарата добиваются замедления сердечных сокращений до уровня 90— 100 уд/мин, при котором не возникает опосредованного эффекта тахикардии на производительность и метаболизм миокарда.
При тахисистолической форме мерцательной аритмии и предсердной экстрасистолии, наряду с изоптином, препаратом выбора является аймалин (гилуритмал). Его вводят внутривенно медленно по 50 мг без каких-либо осложнений даже при нескольких повторных вливаниях.
356
Появление желудочковых экстрасистол заставляет выбирать лечебную тактику в зависимости от генеза данного расстройства нарушения ритма сердца. Чаще используется капельное введение лидокаина или тримекаина, хотя правильнее предупреждать эти расстройства, особенно если они связаны с гипокалиемией или передозировкой гликозидов.
Гипокалиемия исключается в случаях систематического применения глюкозированных полиионных растворов. Лишь в критических ситуациях приходится прибегать к инфузионной нагрузке калием. Назначение донатора сульфгидрильных групп — унитиола (по 10 мл 50 % раствора в мышцу или внутривенно 2 раза в день) — спустя 2—3 дня после начзла интенсивной гликозидной терапии преследует цель предотвратить побочные эффекты высоких, часто запредельных для традиционного лечения, доз коргликона или дигоксина. Наблюдение за ЭКГ у таких больных оперативно выявляло первые признаки дигитализации, так как даже 3—5 мл официнального раствора коргликона в сутки (до 3 мг) у больных данной категории не оказывает существенного урежения пульса.
Контрольные исследования гемодинамики показали, что большие дозы коргликона в сочетании с препаратами, поддерживающими энергетические и пластические процессы в миокарде, формируют четкую гипердинамическую реакцию кровообращения с первых часов после резекции легких. По крайней мере, такие медикаментозные воздействия предупреждают циркуляторную гиподинамию, ведущую к несостоятельности дыхания и застойной недостаточности кровообращения (рис. 147).
Наиболее трудны для проведения эффективной кардиотонизирующей терапии тяжелая гнойная интоксикация, гнойно-резорбтивное истощение в сочетании с массивной гемотрансфузией. Обычные приемы нормализации обменных процессов в миокарде — вливание полиионных растворов с высокими дозами инсулина (до 1 ME на 2 г глюкозы), повторное введение сердечных гликозидов, медикаментозная регуляция темпа и ритма сердечных сокращений — обычно оказывались малодейственными, что заставляло прибегать к поискам специальных решений. Таким решением может явиться использование антигипоксантов, например производного гутимина — амтизола, который оказался в условиях наиболее драматичного этапа послеоперационного периода достаточно эффективным.
В случаях угрозы несостоятельности дыхания и развития тканевой гипоксии целесообразно фракционное введение амтизола, равно как и его капельная инфузия. Начиная с наиболее
Рис. 147. Изменения показателей центральной гемодинамики (сердечного индекса — СИ. работы левого желудочка сердца — Рлж ) после резекции легких.
1 — на фоне применения обычных доз сердечных гликозидов: 2 — при полной программе кардиостимулирующей терапии.
травматичного этапа операции или с момента профузного кровотечения с развитием геморрагического шока, вводится по 150—300 мг препарата каждые 3 ч в первые сутки вмешательства. В последующем продолжается введение амтизола в таких же разовых дозах 3—4 раза в день на протяжении раннего периода. Включение препарата в медикаментозную программу позволило отчетливо преодолеть эффекты несостоятельности дыхания и ранней гипоксии. Даже при крайне неблагоприятных обстоятельствах радикальной операции на легком такие больные быстро восстанавливают двигательную активность. Это позволяет отказаться во многих случаях от использования профилактической искусственной вентиляции легких. На фоне действия амтизола более четко выявляется влияние глюкозированных растворов с инсулином на производительность миокарда.
Метаболические процессы в миокарде, поврежденном эндогенной интоксикацией в связи с заболеванием легких и плевры и неблагоприятными факторами операции у наиболее тяжелых больных, стабилизируются введением значительных доз глюкокортикоидов в ночь вмешательства (гидрокортизон 250—400 мг или преднизолон 60—120 мг), иногда с назначением половинной дозы препарата на следующие сутки. Необходимость введения значительных, хотя и однократных, доз гормонов коры надпочечников определяется прежде всего вероятностью проявления скрытой надпочечниковой недостаточности, исходно существующей у некоторых больных. Имеет значение также возросшее потребление этих биологических веществ организмом, несмотря на сохранение суточного ритма продукции кортизола. Концент
357
рация последнего даже в стабильном состоянии значительно падает в первую четверть суток до предельного уровня [Буравцов В. И., 1977]. Это может сказаться на производительности миокарда.
При проведении кардиотонизирующей терапии в послеоперационном периоде учитывается также, что снижение сердечного выброса может определяться не только гомеостатическими расстройствами метаболизма миокарда, но и существенными нарушениями коронарного кровообращения. Они тем более серьезны, что ишемическая болезнь нередко сопутствует заболеванию легких. Хотя инфаркт миокарда после резекции легких возникает редко, известную настороженность терять нельзя, особенно при необходимости вмешиваться у больных со стенокардией покоя или в первые 6 мес после перенесенного инфаркта миокарда.
В случаях длительного сохранения гиповолемии, гемоконцентрации или, наоборот, резкой анемии, выраженной тахикардии и аритмии, заметно нарушающих эффективность коронарного кровотока и снабжения миокарда кислородом, на ЭКГ могут появиться признаки субэпикардиальной ишемии и другие признаки миокардиального повреждения. В дифференциальной диагностике его имеет значение эффективность мероприятий, направленных на восстановление объема крови и микроциркуляции на органном уровне, коррекцию электролитных нарушений, эффект гипербарической оксигенации.
Производительность сердца после резекции легких может также нарушать острое или подострое возникновение дополнительного препятствия в малом круге кровообращения, создаваемого тромбозом или тромбоэмболией мелких ветвей легочной артерии. К сожалению, клинические признаки этого состояния малоинформативны, особенно в тех случаях, когда она не прогрессирует и самостоятельно разрешается.
Что касается методов диагностики тромбоза, то необходимо указать на рентгенологическое исследование органов грудной клетки, особенно если оно проводится в динамике и внимание рентгенолога акцентируется клиницистом на возможности развития этого осложнения.
Попытки использовать для диагностики биохимические критерии, ферментную диагностику оказались малоинформативными. Не удалось выделить достоверных критериев, чтобы разделить послеоперационную гиперкоагуляцию и прогрессирующий тромбоз при самом широком исследовании коагулограммы [Лебедева Р. Н. и др., 1970; Соловьева О. В., 1977]. Исключение составляет появление резко положительной реакции на фибриноген Б на фоне выраженной гиперкоагуляции с высоким уровнем протром
бина (более 90 %). Сочетание этих показателей с клиникой эмболии или тромбоза позволяет выдвинуть обоснованное предположение о связи гиперкоагуляции и внутрисосудистого свертывания и немедленно ввести 20—25 тыс. ME гепарина с последующей поддерживающей ге-паринотерапией.
Эффект гепаринотерапии контролируется реакцией на фибриноген Б и определением протромбиновой активности.
КОРРЕКЦИЯ
ВОДНО-ЭЛЕКТРОЛИТНОГО
РАВНОВЕСИЯ
Электролитные расстройства в ответ на операционную травму выявляются у всех больных.
Типичным изменением водного баланса организма следует считать снижение плазменного объема крови за счет сужения внутрисосудистого сектора и расширение интерстициального сектора внеклеточного жидкостного пространства, которые сочетаются с тенденцией к олигурии. К концу раннего послеоперационного периода (до 3—5 сут) неосложненного течения после операции на легком плазменный объем и диурез восстанавливаются, а интерстициальный сектор остается расширенным. При интенсивной по объему гемоплазморрагии по дренажам плазменный сектор сужен примерно в той же мере, тогда как интерстициальный уменьшается.
Эффективная нейровегетативная блокада реакций из зоны вмешательства препятствует такому перераспределению жидкости. При дополнении спонтанной гидратации (свободное питье через рот) вливаниями глюкозиро-ванных полиионных растворов с таким расчетом, чтобы общее количество введенной жидкости за первые .18—20 ч составило около 1,5 л/м2 поверхности тела больного, использование ней-ровегетативной блокады (дроперидол, эпидуральная анестезия) стабилизировало оба сектора внеклеточного пространства при высоком темпе (до 1 мл/кг массы тела в час) диуреза без его медикаментозной стимуляции. Использование нейровегетативной блокады при проведении анестезии и послеоперационного болеутоления оказывает влияние и на другую характеристику метаболической реакции на травму: не выявляется обычное для таких операций накопление натрия в организме, что определяется по величине внеклеточного содержания этого иона (рис. 148) и уменьшению тенденции к гипернатриемии после наиболее травматичных операций.
Специальными исследованиями показано, что для обеспечения неосложненного течения
358
До операции 6 ч 1 3 сут
После операции
Пневмонэктомия
I____।—L
До 6ч 1 операции
После операции б
Рис. 148. Динамика плазменного объема (ПО) в процентах к должной величине и содержание внеклеточного натрия в ммоль/м2 в зависимости от эффективности нейровегета-тивной защиты после операций на легких.
а — лобэктомия; б — пневмонэктомия. 1 — при обычных методах послеоперационного обезболивания; 2 — на фоне непрерывной перидуральной анестезии тримекаином.
послеоперационного периода в хирургии легких и плевры существенное значение приобретает своевременная коррекция обмена калия и магния, нарушение которого возникает уже во время операции. Оно определяется не только видом анестезии, но и травматичностью вмешательства, тяжестью кровопотери и эффективностью кровезамещения. В тяжелых случаях отчетливая задержка натрия в организме сочетается с наклонностью к плазменной гипокалиемии, длительным снижением содержания калия в активно функционирующих тканях (эритроцитарная гипокалиемия, миокардиальная гипокалиемия) с падением трансмембранного потенциала по калию (отношению К.)р/Кпл) и умеренным снижением трансминерализации клеток по уменьшению отношения K^/Na^. Одновременно с признаками гипокалиемии выявлялся высокий темп потерь калия с мочой.
При присоединении гнойных плевральных осложнений с необходимостью промывания плевральной полости потеря калия возрастает существенно.
Данные о состоянии водно-электролитного равновесия после операций на легких, полученные на большом клиническом материале [Гончаров В. П., 1971; Костюченко А. Л., 1968— 1983], позволили сформулировать два основных положения корригирующей терапии. Первое —• это отказ от широкого использования натрийсодержащих растворов (изотонический раствор натрия хлорида, рингер-ацетат, лактасол) в
раннем послеоперационном периоде, за исключением тех случаев, когда плевральная экссудация и потери по дренажам в первые сутки значительны. Но и в последних обстоятельствах предпочтение следует отдавать коллоидным растворам, содержащим натрий (полиглюкин, рео-полиглюкин, полифер, желатиноль). Второе — применение в инфузионных программах без-натриевых полиионных растворов на основе 20—25 % раствора глюкозы с оптимальным соотношением калия, кальция, магния, обеспечивающих коррекцию электролитных расстройств, если они возникают. Одновременно эти растворы облегчают предупреждение и коррекцию основного нарушения кислотно-основного состояния после операций на легких — метаболического алкалоза.
Метаболический алкалоз развивается у 15— 20 % оперированных больных. Умеренный сдвиг буферных оснований внеклеточной жидкости в сторону алкалоза, не превышающий 5 ммоль/л, не представляет особой опасности для организма и является отражением перенесенного во время операции лактоацидоза и метаболизации экзогенного лактата, поступившего с переливаемой консервированной кровью. Опасен более выраженный и стойкий метаболический алкалоз в связи с такими функциональными эффектами этого нарушения внутренней среды, как тенденция к гиповентиляции и гиперкапнии, недостаточная эффективность кашля, а также неадекватность реакции дыхательного центра на обычные дозы наркотических анальгетиков. Одновременно отмечается устойчивость застойной сердечной недостаточности к обычной терапии на фоне выраженного метаболического алкалоза.
На основании многолетних клинических наблюдений установлено, что сохранение метаболического алкалоза следует считать результатом недостаточной эффективности всей системы интенсивной терапии. Показано, что эффективное превентивное лечение циркуляторной гиподинамии начиная с первых часов после вмешательства на легких может предотвратить развитие этого расстройства. В случаях его возникновения или в случаях предположения о его развитии следует использовать коррекцию метаболического алкалоза с помощью ингибиторов карбоангидразы, подавляющих реабсорбцию бикарбоната в почках. Одно-двукратный прием 0,5 г (из расчета 7—10 мг/кг массы тела больного) диакарба или фонурита неизменно приводил в таких случаях к увеличению диуреза в 2,5 раза, сдвигал BE крови на 6—7 ммоль/л. Нормализация биохимических показателей сочеталась с улучшением общего состояния больных, повышением двигательной активности, уменьшением одышки и тахикардии без значи
359
тельных изменений показателей электролитного обмена. Потери калия с мочой при этом возрастали всего на 25—30 %, тогда как натрий-урез увеличивался в 1,7—1,8 раза. Восстанавливался аппетит, что облегчало восстановление белкового равновесия, неизбежно нарушаемого операцией.
ВОЗМОЖНОСТИ ПРЕДОТВРАЩЕНИЯ И ЛЕЧЕНИЯ БЕЛКОВОЙ
НЕДОСТАТОЧНОСТИ
Наблюдения над динамикой массы тела больных, исследования у них концентрации лабильных белков крови и других показателей, характеризующих белковый обмен (мочевины мочи, холинэстеразы сыворотки крови), выявили, что восстановление белкового равновесия, неизбежно нарушаемого основным заболеванием и операцией на легких и плевре, не может быть достигнуто энтеральным путем. Несовершенство такой тактики очевидно, так как потери белка после операции на легком значительны, а возможности энтерального питания в первые дни обычно снижены из-за снижения аппетита и функциональных желудочно-кишечных расстройств (кишечный стаз, метеоризм, обострение заболевания желудка и желчевыводящих путей).
Результаты изучения содержания лабильных белков крови по этапам послеоперационного периода побудили к внедрению в программу послеоперационного лечения двух основных корригирующих мероприятий (в дополнение к доказанной ранее необходимости послеоперационной нейровегетативной блокады). Первое состоит в подавлении избыточного катаболизма за счет назначения анаболизирующих стероидов (метиландростендиола, неробола и неро-болила, ретаболила и др.) на фоне восстановления энергетического обеспечения и коррекции дефицита калия глюкозированными поли-ионными растворами с большими дозами инсулина.
Оптимальный подбор дозы инсулина (в том числе и на фоне исходного диабета) позволяет добиться не только полной утилизации сахара, вводимого парентерально. Правильным выбором дозы и пути введения инсулина удается снять гипергликемию, которая считается обычным ответом как на операционную травму, так и на стрессорные факторы. К сожалению, подбор доз инсулина при использовании концентрированных растворов глюкозы не так прост.
Второе корригирующее мероприятие в программе лечения послеоперационной белковой недостаточности состоит в обязательности парентерального использования сред, содержащих
аминокислоты, из расчета не менее 0,5 г условного белка на 1 кг массы тела больного. Чаще использовали гидролизаты белков (аминопептид, амикин, аминозол, аминон), которые вводили в сочетании с энергетическими растворами в течение 3—4 дней до восстановления аппетита и ликвидации кишечного стаза и метеоризма.
У исходно стабильных в отношении белкового равновесия больных на фоне такого лечения быстрее разрешалась гипопротеинемия. Во многих случаях такая программа парентерального питания оказалась эффективной и у больных с тяжелой исходной белковой недостаточностью, которую не удавалось корригировать интенсивной предоперационной подготовкой. Динамическое исследование содержания сывороточного белка, фибриногена и альбумина у больных данной категории (с обычными потерями по дренажам) подтверждает эффективность такого лечебного воздействия (рис. 149).
У пациентов, оперированных на фоне исходно тяжелой белковой недостаточности, опасны стойкие дренажные потери. При замедленном расправлении резецированного легкого, раннем внутриплевральном применении протеолитических ферментов, длительном (на протяжении нескольких дней) и обильном промывании плевральной полости самая «совершенная» программа парентерального питания оказывалась несостоятельной: потери плазменного белка значительно превосходили возможности его синтеза. Это заставило использовать в инфузионных программах и заместительную терапию вливаниями альбумина по 30—40 г/сут. Восстановление таким образом белкового пула позволяет проводить инфузионную терапию в необходимом объеме даже у больных с крайними степенями белково-волемических нарушений.
На фоне такой комбинированной инфузионной терапии (аминокислотные препараты и альбумин) одновременно с уменьшением клинических проявлений белковой недостаточности стабилизировалось общее состояние больных, расширялся двигательный режим, активизировались процессы репарации в ране.
Не следует думать, что у больных, оперированных на легких и плевре, парентеральное питание противопоставляется энтеральному. Наоборот, сохранение энтерального питания, его поэтапное расширение и стимуляция аппетита позволяют скомпенсировать относительную несбалансированность компонентов парентерального питания по энергоемкости и пластическим свойствам.
Оптимальная диететика послеоперационного периода должна находиться под постоянным врачебным контролем. Велико значение вклю-
360
Рис. 149. Динамика содержания плазменных белков после резекции легких по поводу гангрены.
а — на фоне частичного парентерального безбелкового питания глюкозированными полиионными растворами: б — на фоне парентерального питания с аминокислотными смесями; в — на фоне парентерального питания и заместительной терапии большими дозами альбумина. ОБ — общий белок; Ф — фибриноген; СБ — сывороточный белок; ЦАЛ — циркулирующий альбумин.
чения в рацион питания продуктов, богатых белками и витаминами, а также медикаментов (поливитамины, препараты меди и цинка), особенно необходимых у истощенных больных. Лишь иногда, у пациентов с анорексией, а также при полном отказе от приема пищи через рот (острый психоз) бе—'овая недостаточность быстро прогрессирует, возникает необходимость в полном, сбалансированном по своим компонентам, парентеральном питании до выведения больного из такого критического состояния.
ИНТЕНСИВНОЕ ЛЕЧЕНИЕ
ОПАСНЫХ ДЛЯ ЖИЗНИ ОСЛОЖНЕНИЙ
Маневр методами интенсивной терапии от самых простых, не требующих непосредственного участия врача, до наиболее ответственных (бронхоскопия, применение В-стимуляторов, электростимуляция сердца при стойкой брадикардии и др.) значительно уменьшает частоту такого некогда грозного осложнения для больных, оперированных на легких, как сердечно-легочная недостаточность. Так, после создания научных и организационных основ системы интенсивного лечения таких пациентов в клинике госпитальной хирургии к концу 60-х годов частота смертельных исходов от сердечно-легочной недостаточности, не имеющей определенной морфологической основы, после пуль-монэктомии снизилась почти в 5 раз, хотя противопоказания к операции по функциональным критериям ставились все реже.
Тем не менее возможность такого осложнения остается полем поисков новых диагностических и лечебных решений. Не следует забывать и о возможностях тяжелых, опасных для жизни осложнений, имеющих определенную морфологическую основу, которые проявляются как сердечно-легочная недостаточность: обширная пневмония «здорового», часто единственного легкого, массивная тромбоэмболия, послеоперационный инфаркт миокарда и т. д. К лечению таких осложнений следует быть готовым даже при благоприятном, на первый взгляд, послеоперационном течении послеоперационного периода.
Тяжесть дооперационной эндогенной интоксикации, психический стресс, глубокие гуморальные расстройства в связи с операцией создают условия для проявления послеоперационных психических расстройств. Их возникновение во многом зависит от исходного состояния психики пациента и требует обязательного учета во время предоперационного осмотра анестезиологом. Так, около трети больных, оперированных в клинике по поводу гангрены легких, потребовали по ходу своего лечения вмешательства психиатра в связи с различными нарушениями психической деятельности: от резкой астенизации до соматогенного психоза с патологической продукцией психики (ажитация, бред, галлюцинация и т. д.). Послеоперационные психические расстройства могут быть следствием острого гипоксического эпизода, перенесенного во время операции или сразу после нее. Случается истинный алкогольный делирий. Иногда больной внешне кажется нормальным, а возникшая установочная реакция психики может толкнуть его на необдуманные решения.
361
В случаях галлюциноза задача персонала отделения становится особенно трудной. С одной стороны, необходимость активного лечения недостаточности легочного газообмена, предупреждения тромбозов и эмболий, расширения энтерального питания, нормализации моторики кишок и функции мочевого пузыря требует постоянной активизации больного. С другой стороны, двигательное беспокойство, появление навязчивых идей и галлюцинаций требуют постоянной медикаментозной седатации. Нередко патологические изменения психики возникают не в первые дни после операции, как следствие операционной травмы и интоксикации, а сопутствуют нагноению торакотомной раны или в плевре, спустя несколько дней «благополучного течения».
Определение исходного психического состояния при осмотре анестезиологом перед операцией, правильный, нестандартный выбор схемы премедикации, выявление расстройств гомеостаза, которые могут послужить причиной психоза (гиперосмолярность) или очага эндогенной интоксикации, позволяют выбрать оптимальную лечебную тактику. Иногда достаточно обеспечить 10—12-часовой медикаментозный сон (оксибутират натрия, седуксен с пирацетамом) в сочетании с инфузионным или медикаментозным форсированием диуреза [Ливанов Г. А., 1976], чтобы вывести больного из соматогенного психоза с последующей двигательной активизацией для полного успеха интенсивной терапии.
Ателектаз крупных отделов легких редко осложняет послеоперационное течение у больных, оперированных на легких и плевре, на фоне превентивной терапии нарушений легочного газообмена в связи с анестезией и операцией. Несостоятельность врачебного контроля и несвоевременность лечебных мероприятий могут способствовать задержке мокроты в крупных бронхах (долевых, промежуточном) и прогрессированию скрытого локального бронхоспазма. Реже ателектаз возникает уже во время операции в силу неоправданного перекрытия эндо-трахеальной трубкой устьев бронхов.
Ателектазы оперированного легкого развиваются постепенно. Они могут не сопровождаться необычной одышкой, цианозом, тахикардией. Необычна иногда только высокая лихорадка: для неосложненного течения при радикальных торакальных операциях характерен безлихорадочный ранний послеоперационный период. Заподозрить ателектазирование удается по притуплению перкуторного звука над зоной ателектаза, резкому ослаблению дыхательных шумов при расправленном легком (по предыдущим данным) с проходимыми, но не функционирующими плевральными дренажами. Окон
чательное уточнение диагноза дает рентгенологическое исследование.
Лечение дистелектаза и ателектаза крупного отдела (доли) или всего легкого состоит из двух этапов: немедленное восстановление бронхиальной проходимости с эвакуацией обтурирующего бронх материала (например, с помощью бронхоскопии и промывания бронха) и предупреждение рецидива, учитывая тот факт, что рецидивирует каждый второй дистелектаз [Вагнер Е. А., Тавровский В. М., 1977]. Поэтому после эффективной бронхоскопии необходимы настойчивое проведение ингаляционной терапии с использованием муколитиков и мукокинети-ков, применение сеансов самостоятельного дыхания под положительным давлением, обеспечение полноценного обезболивания с нейрове-гетативной блокадой (высокая эпидуральная анестезия местными анестетиками), побуждение к откашливанию и стимуляция кашля. Если в основе дистелектаза лежит анатомическое нарушение проходимости бронхов, их перегиб либо межбронхиальный анастомоз, бронхоскопии следует проводить повторно, пока воздушность оперированного легкого не стабилизируется.
Более редкие контралатеральные ателектазы (особенно при молниеносном развитии) имеют более яркую клиническую картину: несостоятельность дыхания с тяжелой гипоксемией, выраженные нарушения сердечного ритма. Иногда возникает острая боль на неопериро-ванной стороне груди, которая сочетается с невозможностью глубокого вдоха в связи с резким повышением внутриплеврального давления. Успех неотложного лечения состоит в аспирации обтурирующего бронх материала. Для этого следует провести «слепую» назотрахеальную аспирацию или бронхоскопию с инжекционной искусственной вентиляцией легких, не ожидая рентгенологического исследования.
Как и ателектаз, пневмония оперированного легкого нарушает состояние больного постепенно. Оно ухудшается по мере распространения воспалительного уплотнения по паренхиме, нарастания эндогенной интоксикации и появления деструкции в зоне уплотнения. Особую опасность представляют двусторонние пневмонии или пневмония «единственного» легкого. Они становятся причиной летального исхода чаще всего в тех случаях, когда больной переносит ранний период после операции [Родионов В. В. и др., 1981].
Пневмония «здорового» легкого знаменует либо несостоятельность системы превентивных лечебных мероприятий, использованных у данного больного, либо недостаточность противо-инфекционных защитных механизмов организма в целом и респираторной зоны в частности.
362
Даже при современном уровне развития интенсивной медицины частота пневмоний единственного легкого составляет 2—3 % после плановых пневмоний, возрастая в геометрической прогрессии у больных, нуждающихся в срочных и особенно экстренных операциях на легких [Стрельцов В. П., 1974].
Кроме деления на раннюю и позднюю, обычно выделяют следующие клинические варианты пневмонии единственного легкого. В основе обтурационно-ателектатической пневмонии или бронхопневмонии лежит некупированное ателектазирование на уровне респираторной зоны. Происхождение аспирационной пневмонии связывают с аспирацией гнойного детрита при недостаточной защите бронхов «здорового» легкого во время операции или крови при легочном кровотечении. Отек-пневмония возникает на ф°не редкого, но возможного отека легких, инфаркт-пневмония — как исход тромбоэмболии или тромбоза мелких ветвей легочной артерии. Кроме того, выделяют терминальную пневмонию, которая может быть гипостатической (как следствие постреанимационного отека легких, резистентной к лечению легочносердечной недостаточности, декомпенсации функции почек при амилоидозе и т. д.) или токсико-септической. Последняя возникает вследствие прогрессирования острой эмпиемы, перикардита и медиастинита либо сепсиса, происхождение которого не обязательно может быть связано с очагом инфекции в легких и плевре.
Потеря даже небольшой части функционирующей респираторной зоны в таких случаях ставит больного на грань катастрофы, которая может надвигаться относительно быстро. Клинические проявления пневмонии единственного легкого, особенно ранней (первые 5 дней после операции), как правило, завуалированы клиникой послеоперационной болезни. Секционные данные показывают, что она может развиться уже через 5—9 ч [Коробков В. В., Репина И. Ф., 1966], особенно при включении в патогенез осложнения нейро дистрофического фактора (отека мозга).
В более поздние сроки пневмония начинается как ухудшение общего состояния с подъемом температуры тела (без признаков плеврального осложнения на стороне операции), одышки с признаками несостоятельности дыхания, с тахикардией, не соответствующей лихорадке и волемии. Непостоянными признаками являются цианоз, затруднение откашливания мокроты, пенистый ее характер, гиперлейкоцитоз. По рентгенологическим данным пневмоническая инфильтрация обычно возникает в базальных отделах легких и проявляется как крупноочаговые тени. Дальнейшее развитие рентгеноло
гической картины осложнения независимо от его начала идет через образование инфильтративных конгломератов, появление гомогенного затенения, захватывающего нижнюю долю, а при прогрессировании процесса приводит к переходу на другие доли легкого вплоть до тотального поражения органа.
При инфаркт-пневмонии начальный фокус соответствует зоне инфаркта, и если удается остановить процесс воспаления эффективной терапией, то очаг подвергнется либо уплотнению и сморщиванию, либо абсцедированию. Особняком стоят специфические пневмонии у больных с сопутствующим туберкулезом, чаще всего имеющие позднее начало и медленное развитие, тогда как для неспецифических пневмоний характерно раннее начало.
Лечение пневмоний после операций на легкйх и плевре всегда представляет нелегкую задачу. Антибактериальная терапия должна быть максимально широкой, если возбудитель неизвестен, либо узко направленной, массивной. Рациональное антибактериальное лечение, как правило, затрудняется несвоевременностью получения результатов бактериологического контроля бронхиального содержимого. Успех достигается не только массивностью терапии (2—3 антибиотика в максимальных дозах) в сочетании со средствами пассивной иммунизации (иммунная плазма или полиглобулин). Имеет значение и путь введения бактериальных препаратов: преимущество должно быть отдано внутривенному пути.
Для ускорения рассасывания пневмонической инфильтрации, наряду с физическими методами лечения, необходимо использовать малые дозы глюкокортикоидов (триамцинолон) и гепаринотерапию, особенно в тех случаях, когда по клинической каптине можно заподозрить рецидивирующую тромбоэмболию легочной артерии. Последняя нередко является маской послеоперационной пневмонии, наслаивается на нее или предшествует ей. Следует помнить о таком течении, если пневмоническая инфильтрация в легком мигрирует или рецидивирует, несмотря на ингаляционную и антибактериальную терапию. Кроме того, необходимо помнить о возможности тромбоэмболии в следующих клинических ситуациях: появление субфебрилитета или фебрильной температуры, если ее нельзя объяснить состоянием раны, плевральной полости или бронхообструкцией; внезапное развитие одышки, генез которой неясен; появление острой боли в груди, слабости, артериальной гипотензии; беспричинное углубление или развитие сердечной недостаточности на фоне терапии гликозидами в сочетании с аритмиями. Наконец, внимание должно привлечь ухудшение течения другого, часто гной
363
ного послеоперационного осложнения (эмпиема плевры, плевролегочный сепсис), которое до того поддавалось направленному лечению [Аншелевич Ю. В„ Сорокина Т. А„ 1983]. Нередко развитие тромбоэмболического осложнения в системе легочной артерии становится решающим для исхода.
Тромбоэмболия легочной артерии может стать с самого начала одним из наиболее грозных состояний, если происходит закупорка ствола или долевых ветвей легочной артерии. Она занимает важнейшее место среди причин, вызывающих внезапную смерть после резекции легких. Переносимость закупорки определяется объемом оставшегося сосудистого русла легких, возрастом больного, длительностью эндогенной интоксикации, выраженностью недостаточности кровообращения. Исходя из сводной статистики 10 отечественных авторов за последние 25 лет (более 18,5 тыс. операций), средняя частота смертей от тромбоэмболии легочной артерии после резекции легких составляет 0,85.
Источником тромбоэмболии может быть не только нефиксированный, рыхлый тромб в системе нижней полой вены (в основном бедренно-подвздошный сегмент), но и в культе легочной артерии, из которой тромб смещается в сосуды контралатерального легкого. Возникновение эмболии даже мелких ветвей на фоне патологической гиперкоагуляции может приводить к последующему прогрессирующему тромбозу. Иногда тромбоз в системе легочной артерии развивается первично, но протекает остро.
По тяжести и остроте развития клинической картины различают молниеносную форму тромбоэмболии с продолжительностью жизни больного 10—15 мин, острую форму — от 1—3 ч до суток, подострую — от 24—48 ч до нескольких дней и хроническую форму, которая может принимать рецидивирующее течение.
При молниеносной форме осложнения вслед за развитием тяжелой одышки, сопровождающейся цианозом и тахикардией, кратковременным набуханием шейных вен, быстро следуют потеря сознания, коллапс, остановка дыхания и сердечной деятельности. При более медленно развивающейся клинической картине основные перечисленные симптомы сохраняют свое значение. Клиническая картина определенно зависит от локализации и размеров тромбов, объема резекции легких, емкости незакупоренного сосудистого русла, состояния миокарда. Обычно при начальном обследовании такого больного обращают на себя внимание одышка с тахипноэ (40—50 в 1 мин), цианоз лица и верхнего отдела туловища, набухание шейных вен, тахикардия, доходящая до степени пароксизма.
Срочная диагностика острой или подострой форм в обычных клинических условиях должна включать три основных мероприятия: рентгенологическое обследование грудной клетки, ЭКГ во всех отведениях и прямое исследование давления в правых отделах сердца. Одностороннее расширение и деформация корня легкого, которого не было сразу после операции, локальное просветление легочного поля, высокое стояние и ограничение подвижности купола диафрагмы, патологические тени в легких, плевральный выпот и другие обнаруживаемые рентгенологические симптомы должны всегда учитываться, если нет принципиальных оснований для их возникновения.
На ЭКГ можно видеть признаки острой перегрузки правого желудочка.
Основу интенсивной терапии тяжелой послеоперационной тромбоэмболии составляет применение тромболитических препаратов, лучше стрептокиназы (стрептаза, стрептолиаза, стреп-тодеказа) или урокиназы на фоне действия массивных доз гепарина (до 40—50 тыс. МЕ/сут). Учитывая рыхлость структуры легочного эмбола и неполное прекращение кровотока, быстрое действие современных тромболитиков, можно рассчитывать на проникновение их внутрь свежего тромба с его полным лизисом. Подведение тромболитиков прямо к зоне эмболии, разрушение эмболов кончиком катетера усиливают быстроту восстановления кровотока в легочном русле и полноту лизиса сгустка [Петровский Б. В., 1975].
В отсутствие тяжелых гемодинамических расстройств, но при четких рентгенологических данных об этом осложнении, характерных изменениях легочного газообмена, патологической гиперкоагуляции, создающей опасность продолженного тромбоза в сосудах малого круга, надо использовать только гепарин в сочетании с неспецифическими фибринолитиками (компла-мин, теоникол, ксантин).
Контралатеральный пневмоторакс в легочной хирургии описывается чаще всего как спонтанный. Однако нередок (об этом чаще умалчивают) артифициальный, ятрогенный пневмоторакс, связанный с дефектами пункции постпнев-монэктомической полости [Диденко В. Ф., 1967; Вагнер Е. А., Тавровский В. М., 1977] или пункции притоков верхней полой вены во время кавокатетеризации. Быстро развивающаяся картина асфиксии, причина которой выявляется простым выслушиванием соответствующей половины грудной клетки, требует немедленной пункции плевральной полости с аспирацией воздуха, а затем дренирования плевральной полости.
Отек легких по своему происхождению следует считать многофакторным патологическим
364
состоянием и нередким осложнением послеоперационного периода в легочной хирургии. В условиях артериальной гипоксемии повышается сосудистый застой в малом круге кровообращения. Реакции, связанные с повреждением во время вмешательства нервных сплетений средостения, изменение активности гипоталамо-гипофизар-но-адреналовой системы при несовершенной анестезиологической защите организма, увеличение в крови концентрации травматических медиаторов (гистамина, серотонина) — все это может привести к выпотеванию жидкости в просвет респиронов. Жидкость на поверхности диффузионной мембраны легких устраняет действие легочного сурфактанта, что резко снижает податливость легкого. Переход поверхностно-активных веществ в выпотевающую жидкость образует устойчивую пену. Заполнение пенистым отделяемым воздухоносных путей еще больше нарушает распределение газа в легких и вместе с гипоксемией создает картину послеоперационного отека легких.
Сейчас большинство склоняются к мысли, что развитие послеоперационного отека легких должно быть отнесено к прямому воздействию факторов, определяющих несостоятельность дыхания, на сердечную мышцу. Поэтому центр тяжести в интенсивной терапии отека легких должен лежать в мероприятиях по предупреждению и лечению послеоперационных нарушений легочного газообмена.
Инфаркт миокарда после операций на легких и плевре является крайним проявлением нередкой ишемии мышцы сердца, которая может иметь различную выраженность от мелкоочагового субэпикардиального повреждения до крупноочагового трансмурального некроза. По мнению Л. К. Вронской (1973) и соавт., наибольшую вероятность развития такого осложнения имеют больные с перенесенным ранее инфарктом миокарда, причем такое патологическое состояние возникает более часто, чем диагностируется. Следует, однако, отметить, что глубокие ишемические изменения миокарда и развитие крупноочагового инфаркта наблюдаются очень редко. По данным клиники, за последние 20 лет у 287 больных старше 55 лет с клинически выраженной ишемической болезнью сердца (у 39 из них в прошлом был инфаркт миокарда) возникновение такого осложнения после резекции легких наблюдалось только у трех. Его возникновение можно было поставить в связь с крайней травматичностью оперативного вмешательства. Известную настороженность в этом отношении нельзя терять и при оценке состояния больных после более легких операций на легких, особенно в случаях гиповолемии, гемоконцентрации или, наоборот, значительной анемии, заметно нарушающих эффек
тивность коронарного кровотока в отношении снабжения миокарда кислородом.
Как правило, послеоперационный инфаркт миокарда протекает без типичного болевого приступа. Поэтому возникновение коллаптоид-ного состояния или аритмии, не соответствующих течению послеоперационного периода, обязывают к экстренному ЭКГ-контролю и ферментной диагностике (лактатдегидрогеназы и -ее изоферментов, трансаминаз). Ферментную диагностику особенно настойчиво необходимо использовать при наличии анатомических и клинических признаков ишемической болезни до операции, тяжелых дыхательных расстройств. Иногда это осложнение развивается предельно остро и может проявляться не столько тахикардией, падением системного артериального давления и тяжелыми нарушениями ритма, сколько общим недомоганием, головокружением и оглушенностью. При недостаточной интенсивности послеоперационного наблюдения за больным инфаркт миокарда протекает как отек легких или регистрируется внезапная клиническая смерть на фоне внешнего благополучия.
Лечение больного с послеоперационным инфарктом миокарда — одна из наиболее трудных задач при осложненном течении послеоперационного периода: возникает противоречие между необходимостью ранней активизации больного для профилактики дыхательных расстройств и значительного ограничения подвижности на фоне инфаркта миокарда. Наряду с использованием традиционной программы лечения такого больного (анальгетики, коронаро-литики, антиаритмические препараты), в таких случаях следует более широко использовать средства, повышающие устойчивость миокарда и всего организма больного к гипоксии (интен-саин, амтизол, глио-6 и др.), гипербарическую оксигенацию с рациональным разрешением анемии переливанием эритроцитов.
Диагноз такого осложнения, как дислокация или «вывих» сердца, определяется прежде всего знанием возможности такого осложнения, исходя из особенностей вмешательства. Оно присуще исключительно вмешательствам при раке легкого с распространением операции на перикард и напоминает одномоментную тяжелую кровопотерю. Дислокация и ущемление сердца в дефекте перикарда приводят к тяжелейшим, часто необратимым расстройствам кровообращения, которые не поддаются обычной поддерживающей терапии и непрямому массажу сердца.
Это осложнение возникает при пневмонэктомии в конце вмешательства или в первые часы после него, значительно реже — в раннем послеоперационном периоде. Его развитию спо
365
собствуют выраженное изменение внутриплеврального давления во время экстубации больного, приступ кашля, создание отрицательного давления при плевральной пункции или активном дренировании, резкое изменение положения больного при перекладывании. Ущемление сердца в дефекте перикарда при право- и левостороннем вмешательстве однотипно и вызывает угловое смещение крупных сосудов со сдавлением путей оттока, скручиванием полых вен. Именно это приводит к внезапному падению сердечной деятельности и клинически проявляется цианозом, который не соответствует глубине и частоте дыхания и не устраняется кислородной ингаляцией. Одновременно наблюдается набухание шейных вен. Резко снижается артериальное давление. В отдельных случаях дислокация и ущемление сердца проявляются только стойкой гипотензией.
Верхушечный толчок смещается в сторону операции и при левостороннем вмешательстве может достигать средней подмышечной линии. Рентгенологически отмечается появление плотной тени на стороне операции без смещения противоположной границы средостенной тени. Иногда может быть видна небольшая выемка между тенью сердца и тенью больших сосудов. Срочная пункция плевральной полости позволяет разрешить сомнения в отношении одномоментного значительного внутриплеврального кровотечения. Обоснованное предположение о таком осложнении, неотложная диагнрстика и незамедлительная реторакотомия с вправлением сердца и пластикой перикарда являются единственным путем восстановления стабильной гемодинамики.
Послеоперационное внутриплевральное кровотечение является следствием одного из двух дефектов гемостаза: хирургического и биохимического. Вопрос о характере внутриплеврального кровотечения очень важен, поскольку частота тяжелых кровотечений после резекции легких достигает 4—7 % [Вагнер Е. А., Тав-ровский В. М., 1977; Брюсов П. Г., Токмов-цев Б. Я., 1981].
При недостаточном хирургическом гемостазе обычно кровоточит крупный сосуд. Интенсивная кровопотеря приводит к коллапсу кровообращения, темп кровотечения значительно снижается и кажется, что кровотечение остановилось. Но как только артериальное давление в ходе лечения гиповолемии нормализуется, кровотечение возобновляется. Повторные эпизоды гипотензии и поступления крови через дренажи, отсутствие тенденции к постепенному прекращению такого поступления со стабилизацией кровообращения — характерные черты чисто «хирургического» кровотечения. Так как темп поступления крови в плевральную по
лость велик, механизм дефибринирования крови в плевральной полости под влиянием дыхательных движений диафрагмы и грудной клетки, сердечных сокращений не успевает сработать, и плевральная пункция не позволяет надежно уточнить особенности дефекта гомеостаза — не удается забрать достаточного количества внутриплеврального содержимого. Быстрое образование сгустков в плевральном содержимом может нарушить проходимость по дренажам. Поэтому ориентировка в величине кровопотери по объему дренажных потерь не всегда информативна. Приходится ориентироваться на соответствие состояния кровообращения особенностям проводимого лечения: если на фоне консервативной терапии наружного кровотечения гемодинамика стабилизируется, то следует думать, что оно носило «биохимический» характер.
В основе «биохимического» внутриплеврального кровотечения может лежать одна или несколько причин, из которых наибольшее внимание следует уделить дефициту факторов свертывания (плазменных и тромбоцитарных), избытку антикоагулянтов, высокой фибринолитической активности. В последнее время в генезе послеоперационных кровотечений существенное значение придается фибринстабилизи-рующему фактору (фибриназе). По мнению Е. А. Хрущевой, М. И. Титовой (1974), уже только одно изолированное .снижение активности фибриназы при нормальных остальных показателях коагулограммы может стать причиной операционного и послеоперационного кровотечения. Более того, фибринолитические и гипофибриногенемические кровотечения, возникая на фоне патологического снижения активности фибриназы, как правило, протекают тяжело, трудно поддаются корригирующей терапии и часто заканчиваются гибелью больного [Авруцкий М. Я., Титова М. И., 1978]. Кроме того, что нестабилизированные сгустки фибрина не могут тампонировать мелкие сосуды, дефицит фибриназы может оказать влияние на проницаемость и резистентность капилляров, поскольку фибриназа является плазменным кофактором активизации тромбоцитов.
Поэтому стандартная коагулограмма, кровь для которой следует забрать, как только возникло подозрение на «биохимическое» кровотечение, должна включать определение времени свертывания (гепаринемия), уровня протромбина, концентрации фибриногена, активности спонтанного фибринолиза и фибриназы. Продолжительность исследования в пределах 1 ч позволяет получить информацию о характере нарушения свертывания и фибринолиза, точно выбрать направление корригирующей терапии. За это время проводится дифференциальная
366
диагностика характера внутриплеврального кровотечения по клиническим признакам.
Постепенное снижение интенсивности дренажных потерь на протяжении первых 3—8 ч, отсутствие коллапсов на фоне обычной превентивной инфузионной терапии в сочетании с низким гематокритным числом отделяемого свидетельствуют о «биохимическом» характере кровотечения, даже если начальный темп поступления плеврального содержимого высок.
Деление внутриплевральных кровотечений несколько условно, особенно для больных, перенесших пневмонэктомию, так как возможно про 1 рагированное медленное паренхиматозное кровотечение из сосудов клетчатки средостения, грудной стенки, которое не будет давать яркой клинической картины. В этих условиях умеренные расстройства коагуляционной активности крови будут способствовать значительной потере крови в свободную плевральную полость. Дренирование плевральной полости даже толстым дренажем в таких условиях не всегда точно информирует о темпе кровопотери, как и не предохраняет от образования сгустка, даже если в течение первого дня после операции по дренажу отделяется значительное количество кровянистого экссудата. Это заставляет использовать дополнительные пути диагностики, например внешнюю радиометрию грудной клетки после введения меченного |311 альбумина или меченных 51Сг эритроцитов.
Ни одно из послеоперационных осложнений при вмешательствах на легких и плевре не вызывает столько сомнений и разочарований от необдуманных и в то же время неоправданных решений, как внутриплевральное кровотечение.
Бесспорная необходимость оперативного лечения основывается прежде всего на раннем появлении коллапса при, казалось бы, адекватном восполнении кровопотери. Важно приготовить все для проведения срочного вмешательства в оптимальных условиях. Обязательно должен быть организован стерильный сбор крови, оттекающей по дренажам, в банки с цитратным стабилизатором, катетеризирована центральная вена. Струйное вливание кровезаменителей (лучше коллоидных и гиперосмолярных), консервированной крови и реинфузия позволяют поднять давление до субнормальных величин, произвести реторакотомию и выявить кровоточащий сосуд. После того как кровоточащий сосуд найден, захвачен зажимом, прошит и перевязан, проводится возмещение кровопотери в полном объеме, обращая внимание на качественные стороны восстановления объема крови. Реинфузия крови, вычерпанной или собранной аспиратором из раны, позволяет значительно снизить трансфузию крови доноров и быстрее стабилизировать гемодинамику.
Если при реторакотомии на фоне высокого артериального давления явного источника кровотечения найти не удалось, а выявлены множественные кровоточащие поверхности, то следует признать, что диагноз «хирургического» кровотечения был ошибочен. Длительные попытки добиться совершенства гемостаза прижиганием, использованием подплевральных инъекций с адреналином бесполезны. Наоборот, необходимы возможно более быстрое закрытие плевральной полости и переход к консервативной стимуляции гемостаза.
Основой врачебной тактики в случаях установленного или даже предполагаемого «биохимического» кровотечения (при темпе кровопотери до 0,5 л/ч) следует считать выжидание в расчете на восстановление нормальной свертываемости крови, при адекватной перфузии тканей и корригированном метаболическом ацидозе. Это решается инфузионно-трансфузионной программой, включающей свежую кровь, плазму или фибриноген, трисаминол или гидрокарбонат натрия в растворе, солевые среды. Регулярное определение темпа кровопотери, почасового диуреза, а при возможности и измерение сердечного выброса и температурного градиента наряду с безусловным измерением частоты дыхания, пульса и артериального давления информируют врача о состоятельности гемодинамики и позволяют дифференцированно вмешиваться в циркуляторный гомеостаз.
Одновременно следует стремиться к направленному гемостатическому воздействию, хотя на практике в таких случаях используют стандартное введение хлорида кальция, а вслед за ним инфузию е-аминокапроновой или пара-аминобензойной кислоты в сочетании с лиофилизированной плазмой. Такой стандартный подход вряд ли оправдан при сегодняшних знаниях о факторах, определяющих «биохимический» характер послеоперационного внутриплеврального кровотечения.
Только при очень интенсивном поступлении крови по дренажам возможно применение всего 5 г е-аминокапроновой кислоты до получения ответа из лаборатории о состоянии фибринолитической системы, особенно если используют реинфузию дренажной крови. Лабораторная информация (коагулограмма по основным показателям) позволяет выбрать один из следующих вариантов корригирующей терапии.
Дефицит протромбинового комплекса и тромбоцитарных факторов следует покрывать за счет переливания свежестабилизированной крови или прямых гемотрансфузий. Активность собственных тромбоцитов больного усиливается за счет введения дицинона 0,25—0,5 г с интервалом в 6 ч (до остановки кровотечения) или гемофобина.
367
Выраженная гипофибриногенемия (ниже 1 г/л плазмы) требует переливания фибриногена в дозе не менее 3 г или (в его отсутствие) концентрированной лиофилизированной плазмы (до 1 л). При выявлении фибринолиза, гипофибриногенемии и высокого уровня фибриногена Б эффективным может оказаться сочетание переливания фибриногена с гепарином (10—15 тыс. ME) с последующим введением ингибиторов протеаз. Для восстановления активности фибриназы необходимо ввести преднизолон [Авруцкий М. Я., Титова М. И., 1978].
Сочетание адекватной инфузионно-трансфузионной терапии с избирательными гемостати-ками позволяет стабилизировать гемодинамику и проводить больного к активному откашливанию, к проведению лечебной гимнастики в полусидячем положении и даже применять перидуральную анестезию. Отсутствие значительного снижения артериального давления на фоне перидуральной анестезии тримекаином является критерием адекватности трансфузионной терапии по объему и позволяет использовать другие благоприятные стороны действия на организм непрерывной блокады зоны вмешательства. Последующее лечение свернувшегося гемоторакса и санации полости плевры с помощью ферментного лизиса во многих случаях позволяет отказаться от реторакотомии — еще недавно единственно обоснованного лечебного пособия [Маневич В. Л. и др., 1971; Перельман М. И. и др., 1974]. Значительный опыт, накопленный в нашей клинике и других учреждениях по этой проблеме, позволяет реализовать положение о том, что реторакотомия при медленных протрагированных внутриплевральных кровотечениях должна стать обоснованным исключением [Костюченко А. Л., Чепчерук Г. С., 1976; Брюсов П. Г., 1981, и др.].
’ В случаях значительного объема переливания крови после операции, особенно в сочетании с реинфузией дренажной крови, контроль за динамикой коагуляционной активности циркулирующей крови должен быть особенно тщательным. Гемостатическая медикаментозная терапия в сочетании с переливаниями крови, богатой тромбопластином, может стать основой развития тромбозов периферических сосудов. Своевременное использование антикоагулянтов, наряду с активным двигательным режимом больных после операции, позволяет значительно уменьшить возможность тромбоэмболических осложнений. Следует еще раз подчеркнуть, что бесконтрольное избыточное применение гемостатиков при явно хирургическом характере кровотечения на фоне гиповолемии, гемоконцентрации и циркуляторной гиподинамии может привести к тромбозам легочных сосудов, тромбозам в других жизненно важных органах
с развитием инфарктов кишечника (у пожилых больных), лобулярных некрозов печени и кортикального некроза в почках.
Острая почечная недостаточность при соблюдении основных положений послеоперационной интенсивной терапии — большая редкость при вмешательствах на легких и плевре. Возможны ранний и поздний варианты почечной недостаточности. Ранняя почечная недостаточность является «осложнением осложнений», главным образом циркуляторного характера, возникших на операции или в первые сутки после нее, особенно если почки исходно скомпрометированы в отношении выделительной функции. Наблюдение за темпом диуреза и, по возможности, за градиентами моча/плазма по креатинину, мочевине и осмоляльности позволяет принять своевременные меры и предотвратить переход транзиторной олигурии в анурию. Гидратация больного солевыми растворами, буферирование внутренней среды гидрокарбонатом натрия и струйное введение маннита или сорбита из расчета 1 —1,5 г сухого вещества на 1 кг массы тела больного на фоне эпидуральной блокады тримекаином во многих случаях восстанавливают функцию почек даже тогда, когда нарушение возникло на фоне несовместимой трансфузии. Труднее лечить больного в тех случаях, когда значительное падение кровотока в почках сочетается с тяжелой гипоксемией. В этих обстоятельствах поражается печень, нарастает билирубинемия и нарушение приобретает форму печеночно-почечной недостаточности.
Неудача стимуляции диуреза осмодиуретиками, а затем большими дозами салуретиков (не менее 300 мг лазикса при первом введении) заставляет перейти к консервативной терапии. Она состоит в резком ограничении объема инфузии, использовании концентрированных растворов глюкозы с инсулином, в коррекции электролитных сдвигов под контролем содержания основных электролитов в крови и моче, подавлением катаболизма белка анаболическими гормонами, включением в программу внепочечных методов очищения организма (промывания желудка, искусственная диарея за счет дачи солевого слабительного). Такая программа лечения позволяет замедлить нарастание гиперкалиемии и азотемии до момента возможного применения гемодиализа (5—8-й день), учитывая опасность необходимой гепаринизации. На фоне острой почечной недостаточности желательно избегать переливания крови.
При снижении гемоглобина ниже 80—90 г/л приходится использовать гомологичные среды, желательно в виде взвеси свежих отмытых эритроцитов.
368
Поздний вариант почечной недостаточности развивается более медленно. Он является либо проявлением гнойного осложнения, либо реакцией организма на полипрагмазию, особенно неумеренное использование нефротоксичных антибиотиков, аминогликозидов. У больных со стойкими нарушениями дыхания и кровообращения, с сохраненной интоксикацией плевролегочного происхождения падение клубочковой фильтрации в почках всегда сопровождается снижением канальцевой реабсорбции, иногда ниже 95 %. Клинически это проявляется выделением достаточного количества мочи, но с низкой плотностью.
В процессе функционального изучения послеоперационного периода у больных с тяжелыми гнойно-деструктивными заболеваниями легких и плевры удалось показать, что снижение фильтрации и нарушение реабсорбции до уровня почечной недостаточности у таких пациентов возникают не сразу после операции, а к концу 1-й недели после нее. Нарушения функции почек закономерно возникают на фоне казалось бы обычно протекающего послеоперационного периода как проявление скрытого гнойного осложнения. Своевременное выявление гнойного очага, дренирование его, отказ от настойчивого применения массивных доз антибиотиков позволяют нередко больному выйти самостоятельно из почечной недостаточности.
АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ
К настоящему времени выработаны три основные программы профилактики гнойных плевролегочных осложнений. Первая представляет приложение известного принципа «защищенного кровяного сгустка», возродившегося в методе «single dose» зарубежных авторов [Pollock A. et al., 1977]. Для этого с началом операции по ходу инфузионной терапии внутривенно вводится значительная доза антибиотиков (близкая к максимальной суточной). Препарат соответствует чувствительности выделенной из мокроты микрофлоры или просто выбирается антибиотик широкого спектра действия (левомицетина сукцинат, тетраолеан или олемор-фоциклин, цефалоспорины, один из современных аминогликозидов — гентамицин, амикацин, тобрамицин и т. д.).
В случаях операций средней травматичности, с небольшой кровопотерей, быстрым (в течение 10—16 ч) и полным расправлением оперированного легкого этой дозы антибиотика достаточно для профилактики раневой инфекции. Однократная доза антибиотика дополняется введением разовой дозы препарата в плев
ральную полость перед закрытием раны. Дальнейшего назначения антибактериальных препаратов не требуется.
Вторая программа антибактериальной терапии начинается так же, как и первая. Однако в случаях значительных плевральных сращений, трудности их разделения, травматизации остающейся легочной ткани и явной негерметичности легочной раны она продолжается в виде систематической антибактериальной терапии (лучше внутривенным путем) до 3—4-го дня после операции. В случаях пневмонэктомий, особенно со вскрытием средостения и медиастинальной лимфаденэктомией, при тяжелом спаечном процессе проводят систематическое насыщение экссудата во время плевральных пункций препаратами широкого спектра действия, отличным от тех, которые использовали для системной антибактериальной терапии.
Третья программа антибактериальной терапии после операций на легких и плевре применяется в тех случаях, когда операция идет со вскрытием гнойно-деструктивного очага и угроза развития послеоперационного гнойного процесса реальна. Особенно опасно массивное микробное обсеменение в тех случаях, когда образуется стойкая остаточная полость с накоплением экссудата, возникает его свертывание. Даже при использовании 3—4 антибактериальных препаратов — одного в виде системного введения, метронидазола внутрь, а двух (чаще антибиотик и антисептик) местно, внутриплеврально — развитие эмпиемы плевры становится неизбежным. Нередко этому способствует свернувшийся гемоторакс в связи с протрагированным кровотечением в плевральную полость из тканей грудной клетки и средостения. В случаях массивного бактериального загрязнения экссудата значительно ускоряется и быстро становится тотальным раннее разграничение экссудата пленками фибрина на отдельные полости, с образованием свернувшегося фибриноторакса. Это разграничение затрудняет насыщение плеврального экссудата антибактериальными средствами и создает угрозу развития эмпиемы [Плешаков В. Т. и др., 1975].
Попытки использовать в случаях значительного инфицирования плевральной полости ее проточного или фракционного промывания антисептическими растворами в первые часы и дни послеоперационного периода не уменьшили частоту ни раннего свертывания экссудата, ни развития эмпиемы. Если после операции по поводу опухолей легких и плевры на фоне свернувшегося гемоторакса нередко удается предотвратить развитие гнойного процесса за счет систематического трансторакального введения антибактериальных средств из разных точек, то при гангрене легких такой уверен
24 Зак. 0517
369
ности в успехе нет. Ранняя торакотомия и удаление через ограниченное отверстие сгустков крови, пленок фибрина и жидкого плеврального содержимого значительно не ухудшают состояния больного. Это послужило основанием для широкого внедрения ранних реторакотомий в практику ведения больных, оперированных на легких [Колесников И. С., 1960; Николаев Н. М., Дегтярев И. П., 1971, и др.]. Тем не менее это решение не исключает возможности развития эмпиемы.
В настоящее время применяется неоперативное лечение свернувшегося гемоторакса [Костюченко А. Л., Чепчерук Г. С., 1978] в практике ведения больных с реальной угрозой развития острой эмпиемы. Для этого используется ферментный лизис сгустков фибрина у всех больных, оперированных по поводу гангрены легкого, у которых возникло раннее разграничение плеврального экссудата, причем вместо пока еще дефицитных стрептокиназы или урокиназы в большинстве случаев используется отечественный препарат террилитин (по 800— 1000 ПЕ на введение). В отличие от активаторов фибринолиза, террилитин оказался эффективным и у тех пациентов, у которых на первом этапе местного лечения воспалительного процесса применяли интенсивное промывание плевральной полости. Гораздо менее эффективны широко известные протеолитические ферменты животного происхождения (трипсин, хемопсин, фибринолизин), но и с их помощью можно добиться отчетливого успеха в превентивной санации плевральной полости [Плешаков В. Т. и др., 1975]. У части больных (гемоторакс, значительное обсеменение плевры, наличие неудаленной шварты при пиопневмотораксе) террилитин приходилось применять повторно, через несколько дней после первого введения фермента, в связи с рецидивом разграничения или неполным развертыванием фиб-риноторакса.
По мере накопления опыта выявились некоторые особенности тактики применения ферментного лизиса. Во-первых, не следует стремиться использовать ферменты слишком рано (оптимальный срок — середина первой недели после операции), сдерживая до того распространение инфекции за счет систематического внутриплеврального введения антибактериальных препаратов. Во-вторых, проведенные в клинике исследования [Чепчерук Г. С. и др., 1980] выявили оптимальные комбинации протеаз и антибактериальных средств, которые определяют выбор медикаментозных программ в каждом отдельном случае. При этом учитывается, что применение террилитина только с антибиотиками группы тетрациклина ведет к торможению лизиса фибринного сгустка в отличие
от фибринолизина и его активаторов, у которых такого торможения нет. В то же время сочетание фибринолизина с метициклином, в меньшей степени с другими пенициллинами, цефалоспоринами, стрептомицином, некоторыми аминогликозидами (мономицин), ристомицином, левомицетином и полимиксином, а также нитрофурановыми антисептиками полностью лишает протеазу фибринолитического действия.
В последние годы все большее применение находят протезы, иммобилизированные на водорастворимом полимерном носителе. Первый опыт использования иммобилизированного террилитина после пульмонэктомии показал возможность более раннего применения такого препарата для профилактики преждевременного свертывания плеврального экссудата, учитывая постепенность отщепления фермента от матрицы-носителя и длительность действия [Лишенко В. В., Чепчерук Г. С., 1984]. Такой выбор препарата обеспечивает устойчивость антибактериального эффекта антибиотиков и антисептиков, вводимых в плевральную полость в комбинации с протезами, без снижения специфической активности протеазы, с минимальными проявлениями ее токсичности и антигенности.
Послеоперационная эмпиема плевры может возникнуть не только в результате несостоятельности бронхиального шва (наиболее часто), прорыва прикультевого абсцесса или распространения инфекции по плевре в результате ее интраоперационного обсеменения при несовершенстве интраоперационной санации. Иногда ее причиной становится инфекция, развивающаяся в самой операционной ране, тем более, что даже после «чистых» операций на легких и плевре частота нагноения операционной раны сохраняется на уровне 3—5 %. В то же время у больных, радикально оперированных по поводу гангрены легких, частота нагноения в ране возрастает примерно в 10 раз. Обработка в этих случаях плевральной полости и краев раны растворами различных антисептиков кардинально не решает проблемы предупреждения раневой инфекции.
Существенное значение в предупреждении раневой инфекции имеют тщательный гемостаз и совершенное послойное ушивание торакотомией раны, исключающее образование гематом и скоплений серозной жидкости, которые могут служить основой образования гнойных очагов в подкожных и межмышечных пространствах. Одним из важных путей попадания микроорганизмов в эти скопления становится инфицирование нитей кожных швов. Поэтому при малейших местных признаках раневой инфекции (отечность раны, появление капель мутной жидкости при надавливании, флотировании кожномышечного лоскута над межреберьем, через которое осуществлялся доступ в плевральную
370
полость) считали необходимым наложить глубокие, достигающие передней поверхности ребер, поперечные П-образные опорные швы на трубках на протяжении всей раны. Это позволяло полностью или частично снять кожные швы до обычного срока, удалив тем самым инородные тела из раны. Особенно важно проведение такой «коррекции» торакотомной раны после пневмонэктомии, когда через частично негерметичную рану начинает поступать плевральный экссудат. Удаление кожных швов позволяет свободно дренировать подкожную клетчатку без опасности прорыва экссудата, обрывает гнойное воспаление, ускоряет репаративные процессы за счет применения специальных мазей, ультразвука и т. д.
К сожалению, не во всех случаях ранняя диагностика нарушения заживления операционной раны является простой. Раневая инфекция в многослойно ушитой торакотомной ране нередко протекает на фоне отсутствия лихорадочной реакции, а обычные явления воспаления (отечность, болезненность области раны при ощупывании) иногда долго скрывают скопления гноя в глубине раны, в субпекторальном и предло-паточном пространствах. Ориентировка на общую реакцию организма, гематологические показатели, иммунологические и ферментные критерии дают возможность обоснованно заподозрить инфекционное осложнение только при динамическом и комплексном контроле. Эти критерии подвержены индивидуальным колебаниям, их изменения зависят не только от нагноения раны, но и от нередкого воспаления в бронхиальном дереве и легочной паренхиме. Однако определенные тенденции в изменениях лабораторных показателей дают опорные основания для более настойчивого поиска гнойного очага.
К таким критериям следует отнести не столько более высокий и стойкий лейкоцитоз в циркулирующей крови, сколько сохранение относительной лимфопении на фоне клиники гнойной интоксикации. Даже на 3—5-й дни после операции у больных с нагноением раны, которое выявилось позднее, абсолютная концентрация лимфоцитов оказалась значительно ниже 1 • 109/л крови. Кроме того, у них всегда наблюдали более высокий и длительно сохраняющийся ЛИИ, даже при ограниченном нагноении и своевременном дренировании выявленного очага. В тех случаях, когда гнойное осложнение развилось вскоре после операции, а антибактериальной терапией ограничить нагноение не удалось, лимфопения продолжала нарастать, несмотря на сохранение гиперлейкоцитоза, а ЛИИ на протяжении всей первой недели послеоперационного периода оставался выше 8.
Как правило, такие показатели являются прогностически неблагоприятными. Только ра
дикальным воздействием на гнойный очаг иногда удавалось остановить прогрессирование гнойного процесса в ране и плевре, предотвратить переход его на средостение и перикард с развитием фатального медиастинита и перикардита. Этого добивались либо путем широкого раскрытия и надежного дренирования очага в толще раны, либо путем интенсивного промывания плевральной полости, если именно она становилась источником гнойной интоксикации (лихорадка с суточными размахами температуры тела, ознобы, повторное снижение аппетита, нарастание общей слабости, снижение двигательной активности больного).
Устойчивость лимфопении со снижением абсолютной концентрации лимфоцитов ниже 0,5 • 10у/л в последнее время считаем показанием для назначения стимулятора лимфопоэза — леакадина, разработанного в НИИ фармакологии АН ЛатвССР. Введение этого препарата в дозе 0,3—05 г внутримышечно или внутривенно на протяжении 3 дней у большинства больных приводило к возрастанию концентрации лимфоцитов более чем в 3 раза, причем эффект лимфостимуляции сохранялся на протяжении недели. Наоборот, отсутствие лимфостимулирующего эффекта леакадина свидетельствовало о недостаточности дренирующих мероприятий или о том, что инфекция в ране или плевральной полости находится на грани генерализации.
Исходя из опыта применения радиопротектора цистамина как стимулятора репаративных процессов в ранах мягких тканей, опубликованного Г. А. Ряжкиным и соавт. (1978), мы попытались использовать его как профилактическое средство: по 0,6 внутрь на протяжении первых 3—4 дней после операции. Клинически удалось отметить более гладкое заживление раны у больных с опухолевыми процессами в легких. Раневой рубец, как правило, был более тонок, воспалительный отек уменьшался очень быстро. Снятие кожных швов к концу первой недели после операции ни у одного больного не привело к расхождению краев раны.
Удалось отметить более совершенное заживление торакотомной раны и у больных с гангреной легких: лишь у '/4 из них (при слепом опыте) отмечены небольшие, неопасные для жизни больного и не нарушающие в целом заживления операционной раны, участки ее нагноения. На фоне применения цистамина отмечена более благоприятная динамика и гематологических показателей. Первичное снижение абсолютного содержания лимфоцитов к 3-му послеоперационному дню до 1,43+0,06 • 109/л крови сменяется его повышением примерно на 30 % исходной величины, причем тенденция к повышению сохраняется до конца 2-й недели после операции.
24 *
371
Эти данные могут свидетельствовать о влиянии препарата на местные репаративные процессы через механизмы клеточного иммунитета. Можно утверждать перспективность рутинного назначения цистамина с профилактической целью, наряду с доказанным ранее влиянием на течение раневого процесса в гнойной ране [Ряжкин Г. А. и др„ 1978].
Попытки расширить арсенал прогностических критериев нагноения в ране или в плевральной полости на основании динамики протеинограммы и особенностей перераспределения глобулинов не дали ощутимых результатов даже при гангрене легких. Некоторые исследователи пытаются представить эту динамику как существенную возможность оценить изменение особенности течения раневого процесса или активность воспалительных изменений в легочной паренхиме [Веселова А. М., 1974; Ковалев М. М. и др., 1982]. Исходя из различий в генетическом коде продукции плазменного белка у конкретных больных, абсолютный разброс концентрации аг- и у-глобулинов оказался настолько велик, что перекрывает средние колебания, связанные с течением раневого процесса. Определенная информация может быть получена лишь при изучении производных показателей, характеризующих диспротеинемию. Это позволяет разделить воспалительные изменения (по отношению А/аг) и иммунные изменения протеинограммы (по отношению А/у-глобулины). Такую возможность подчеркивают и другие клиницисты, занимавшиеся оценкой воспалительных изменений протеинограммы [Пономаренко А. А., 1982; Соколов С. Б. и др., 1983]. При осложнении послеоперационного периода выраженным нагноением раны величина этих показателей всегда гораздо ниже, чем при практически неосложненном течении после вмешательств по поводу гангрены легких.
Попытка использования для прогнозирования нагноения в ране или в плевральной полости наиболее интегральных показателей гуморального иммунитета доказала определенную информативность таких критериев, как концентрация изогемагглютининов. Прогностически неблагоприятными следует считать снижение титра до 1:4—1:8 уже в дооперационном периоде и прогрессирование этого снижения после резекции легких, в том числе и в тех случаях, когда концентрация изогемагглютининов в плазме крови была исходно субнормальной. При гангрене легких нагноение раны наблюдали у 3/4 таких боль-' ных.
Установлено, что своевременное выявление критического снижения титра естественных антител и стимуляция их выработки с помощью 2—3 инъекций продигиозана приводили к отчетливой нормализации этого показателя и обес
печивали более благоприятное течение раневого процесса. Применение продигиозана на фоне уже четко выявляемого очага. малоэффективно, а иногда даже опасно, учитывая возможность тяжелых пирогенных реакций. В таких случаях предпочтение отдавали левамизолу (декарису), назначение которого внутрь по 150 мг в день 3 дня подряд способствовало нарастанию титра естественных антител с соответствующим изменением концентрации Т-лимфоцитов и благоприятным изменением течения раневого процесса.
Прогностическое значение титра анти-0-стрептолизина относительно невелико. Так, повышение титра этих антител в крови выше 1:1250 заставляет более настойчиво искать источник поступления тканевого детрита. Нарастание титра до 1:3000 и выше при отчетливых признаках нагноения раны или остаточной полости свидетельствует о недренированном очаге, опасности генерализации инфекции и требует более радикального воздействия на очаг и активной антибактериальной терапии. Следует отметить, что на фоне ферментного лизиса плеврального экссудата или применения левамизола повышение титра анти-0-стрептолизина даже до 1:3000 следует считать прежде всего признаком сохранной реактивности организма больного.
Другие показатели гуморального иммунитета (например, концентрация иммуноглобулинов классов М, G, А) прогностически малосущественны, так же как обычные методы ферментной диагностики тканевой деструкции, например активность щелочной фосфатазы сыворотки крови. Хотя критические подъемы этого показателя до 300—360 ЕД/л иногда и сопровождали послеоперационные гнойные осложнения, подобные изменения активности наблюдали и без выраженной клиники осложнений, например при ферментном лизисе свернувшегося гемоторакса или фибриноторакса. Напряженность воспалительного процесса в ране и плевральной полости более четко определяют лизосомальные ферменты, щелочная и кислая фосфатаза лейкоцитов [Лыткин М. И. и др., 1983]. При развитии гнойного осложнения длительно наблюдаются высокая активность лизосомальных ферментов и низкие титры естественных антител в плазме крови.
Опыт дифференцированного подхода к оценке напряженности воспалительного процесса в ране заставляет стремиться к поиску таких критериев, получение информации об изменении которых достаточно оперативно (часы): реакция везику-лообразования по В. С. Кислякову, исследование уровня лизосомально-катионных белков в плевральном экссудате, фагоцитарной активности нейтрофилов и т. д.
372
СПИСОК ЛИТЕРАТУРЫ
Абисатов X. А., Шайхиев У. Ш. К диагностике и лечению мезотелиомы плевры.— Тер. арх., 1971, № 3, с. 103—106.
Аблицов Н. П. Ранняя диагностика воспалительных осложнений, развивающихся в плевральной полости после трансторакальных операций.— Клин, хир., 1976, № 7, с. 23—26.
Авруцкий М. Я., Виницкая Р. С., Романова Л. С., Юрков Е. Ф. Информативность функциональных показателей внешнего дыхания для прогноза легочных осложнений после операций на легких.— Анестезиол. и реаниматол., 1978, № 6, с. 56—59.
Авруцкий М. Я., Титова М. И. Острые послеоперационные кровотечения, обусловленные дефицитом XIII фактора свертывания.— Анестезиол. и реаниматол., 1978, № 1„ с. 64—67.
Акжигитов Г. Н., Бессарабов В. И., Андреев Д. А. Лечение послеоперационных бронхиальных свищей у детей.— Грудн. хир., 1982, № 3, с. 37—39.
Алексеева М. Е., Некорыснова М. С. Показатели белкового обмена у больных раком легкого.— Грудн. хир., 1980, № 5, с. 57—59.
Алексеенко А. В. Эффективность хирургического лечения хронических воспалительно-нагно-ительных заболеваний легких.— Сов. мед., 1979, № 4, с. 51—55.
Альтман Э. И., Борщев А. Б., Гогишвили Ш. Г. Искусственная вентиляция легких инжекционным методом при реконструктивных операциях на трахео-бронхиальном дереве.— Анестезиол. и реаниматол., 1977, № 5, с. 44—46.
Альтман Э. И., Некрич Г. Л. Торакоабсцессоскопия.— В кн.: Бронхопульмонология. М„ 1982, с. 364—369.
Анахасян В. Р., Айтаков Э. Н„ Голосков П. Н. и др. Оценка поэтапного определения кровопотери и проблема ее рационального возмещения у больных со злокачественными новообразованиями легких и желудка.— Анестезиол. и реаниматол., 1978, № 2; с. 22—25.
Антелевич Ю. В., Сорокина Т. А. Рецидивирующая тромбоэмболия легочных артерий и ошибки ее диагностики.— Сов. мед., 1983, № 9, с. 93—96.
Архипов И. В., Багдатьев В. Е„ Голъфанд Б. Р., Лапшина И. Ю. Предоперационная подготовка и послеоперационная терапия хирургических больных с сопутствующими заболеваниями сердечно-сосудистой системы.— Анестезиол. и реаниматол., 1983, № 1, с. 9—12.
Афанасьев В. С., Тагер И. Л. Рентгенодиагностика тромбоэмболии легочной артерии.— Ташкент, 1976.
Бабашев Б. С. Саркома легких.— Алма-Ата, 1971.
Багудинов К. Г. Особенности клинического течения и возможности хирургического лечения рака легкого в пожилом и старческом возрасте.— В кн.: Актуальные вопросы современной хирургии. М., 1975, с. 68—72.
Баженов Л. Г., Исхакова X. И. Бактероидные инфекции в хирургии.— Вести, хир., 1983, № 3, с. 120—123.
Баиров Г. А. Неотложная хирургия детей.— Л., 1973.
Балезина 3. Н., Хвастунов Р. М., Черняк М. М. Прогнозирование острой послеоперационной дыхательной и сердечной недостаточности у больных туберкулезом легких.— Пробл. туберк., 1978, № 7, с. 42—46.
Барчук А. С., Вагнер Р. Н., Карачунский М. С., Богданович В. С. Возможности выявления ранних форм рака легкого в условиях поликлиники.— В кн.: Ранняя диагностика рака легкого. Л., 1980, с. 15—17.
Белокуров Ю. Н. Гипербарическая оксигенация при гнойно-септических заболеваниях.— Ярославль, 1981.
Белокуров Ю. Н., Рыбачков В. Р. Клиническое применение гипербарической оксигенации.— Сов. мед., 1981, № 2, с. 70—72.
Бердыев X. Б., Мухамедиев М. М. Тениаринхоз и бовисный цистицеркоз в Таджикистане и меры борьбы с ними.— Душанбе, 1983.
Березовский В. А., Горчаков В. Ю. Поверхностно-активные вещества легкого.— Киев, 1982.
Биркун А. А., Нестеров Е. А., Кобозев Г. В. Сурфактант легких.— Киев, 1981.
Богач Г. Ф. Резекция легких при туберкулезе.— Воен.-мед. журн., 1958, № 6, с. 31—35.
Богданов А. В., Стоногин В. Д., Макарова К. А. Редкие опухоли плевры.— Сов. мед., 1970, № 3, с. 52—57.
Богданов А. В., Стоногин В. Д. Хирургическая тактика при тяжелых и осложненных формах на-гноительных заболеваний легких.— Грудн. хир., 1983, № 3, с. 64—68.
Богословский Г. И. Антибиограммы в условиях хирургической практики.— Хирургия, 1972, № 9, с. 73—78.
373
Богуш Л. К., Травин А. А., Семенков Ю. Л. Доступы к культе бронха при бронхиальных фистулах.— Хирургия, 1971, № 2, с. 126—129.
Богуш Л. К., Диденко В. Ф. Лечение больных туберкулезом с пострезекционными бронхиальными свищами.— Алма-Ата, 1975.
Бондаренко Б. Б., Бойкова И. В. Прижизненная диагностика мезотелиомы плевры.— Тер. арх., 1975, № 10, с. 116—119.
Брегадзе И. Л. Альвеолярная форма эхинококковой болезни.— В кн.: Альвеолярный эхинококкоз и некоторые вопросы частной хирургии: Труды Новосибирск, гос. мед. ин-та, 1961, т. XXXVI, с. 15—20.
Брегадзе И. Л., Константинов В. М. Альвеолярный эхинококкоз.— М., 1963.
Бреслав И. С., Глебовский В. Д. Регуляция дыхания.— Л., 1981.
Брюсов П. Г. Трансфузионная программа восполнения операционной кровопотери.— Воен.-мед. журн., 1983, № 3, с. 25—27.
Брюсов П. Г., Беляев В. С. Применение растворов альбумина и протеина при операциях на легких.— Грудн. хир., 1977, № 6, с. 53—57.
Брюсов П. Г., Костюченко А. Л. Эффективность современных кровезаменителей в стабилизации объема циркулирующей крови.— Пробл. гематол. и перелив, крови. 1980, вып. 10, с. 32—36.
Брюсов П. Г., Токмовцев Б. Я. Консервативное лечение послеоперационного свернувшегося гемоторакса.— Грудн. хир., 1980, № 6, с. 52—55.
Бу латин В. И., Кошелев П. И.. Алексеева Л. Н. и др. Гипербарическая оксигенация при лечении больных с нагноительными заболеваниями легких.— Хирургия, 1982, № 9, с. 50—59.
Бунатян А. А., Выжигана М. А., Флеров Е. В. Многокомпонентная внутривенная анестезия на основе инфузии кетамина в хирургии легких и средостения.— Анестезиол. и реаниматол., 1982, № 5, с. 16—20.
Буравцев В. И. Состояние глюкокортикоидной функции надпочечников при хирургическом лечении больных раком легкого: Автореф. дис. канд.— Л., 1977.
Буравцев В. И. Характер и динамика суточных ритмов экскреции суммарных 17-ОКС у хирургических больных.— Вести, хир., 1977, № 8, с. 82—85.
Бутенко А. Г. Функциональные аспекты операбельности рака.— Здравоохр. Казахстана, 1980, № 2, с. 43—46.
Бычков М. Б. Лечение опухолевых плевритов делагилом.— Вопр. онкол., 1978, № 2, с. 85—88.
Вавилин Г. И., Ермолова Т. П., Раскина Э. С. К вопросу о патологоанатомической диагностике плесневых микозов.— Труды Лен. науч, об-ва патологоанатомов, 1971, вып. XII, с. 202—208.
Вагнер Е. А. Хирургия повреждений груди.— М., 1981.
Вагнер Е. Л. Хирургическое лечение гангрены легких.— Грудн. хир., 1982, № 4, с. 59—62.
Вагнер Р. Н., Барчук А. С. Итоги и перспективы диагностики и лечения рака легкого.— В кн.: Патогенетические основы диагностики и лечения злокачественных опухолей. Л., 1976, с. 36—45.
Вагнер Е. А., Тавровский В. М. Ошибки, опасности и осложнения в легочной хирургии.— Пермь, 1977.
Вагнер Е. А., Субботин О. М., Кубариков А. П. Хирургическое лечение гангрены легких.— Грудн. хир., 1982, № 4, с. 59—62.
Вагнер Е. А., Редькин А. П., Заугольников В. С. Нарушения газообмена в легких при некоторых критических состояниях.— Грудн. хир., 1983, № 1, с. 53—55.
Варновицкий Г. И., Романычев Ю. А. Дифференциальная диагностика ограниченных опухолей плевры и осумкованных плевритов.— Вести, рентгенол. и радиол., 1981, № 1, с 34—38.
Васильев Н., Пенчев Р., Георгиев А., Маринов В. Применение болгарской антибактериальной поли-капроамидной сетки и нити при резекции печени в эксперименте.— Вести, хир., 1982, № 3, с. 45—48.
Вахидов В. В., Исламбеков Э. С. Эхинококкоз легких.— Ташкент, 1972.
Вишневский А. А., Галанкин Н. К. Врожденные пороки сердца и крупных сосудов.— М., 1962.
Вишневский А. А., Адамян А. А., Хирургия средостения.— М., 1977.
Вишневский А. А., Маршак А. М., Кашин Ю. Д., Луначарская Т. В. Лечение анаэробных плевропульмональных заболеваний.— Вести, хир., 1980, № 2, с. 19—21.
Волох Ю. А. Эхинококковая болезнь у детей.— Фрунзе, 1959.
Гамов В. С. Однокамерный эхинококк органов грудной полости.— М., 1960.
Гембицкий Е. В. Клиника, диагностика и лечение идиопатического спонтанного пневмоторакса.— Сов. мед., 1961, № 10, с. 11—16.
Гераськин В. И., Мензул В. А., Романов А. В. и др. Способ определения локализации периферических бронхо-плевральных свищей при пиопневмотораксе и пневмотораксе у детей.— Грудн-хир., 1983, № 6, с. 41—43.
Граськин В. И., Степанов Э. А., Штыхно О. Ф. и др. Возможности лечения пиопневмоторакса и пневмоторакса у детей.— Грудн. хир., 1976, № 6, с. 59—64.
Гераськин В. И., Штыхно О. Ф., Кулешов Б. В. Временная окклюзия бронхов в лечении поджатого легкого.— Хирургия, 1974, № 7, с. 36—41.
Гилевич Ю. С., Натрашвили Г. С., Никулин Г. М., Назаренко В. П. Вопросы патофизиологии спонтанного неспецифического пневмоторакса и выбор метода его лечения.— Грудн. хир., 1976, № 5, с. 56—60.
Гиммельфарб Г. А., Нигматуллиева М. X., Клейнерман В. Е. и др. Влияние искусственной вентиляции легких с постоянным положительным давлением на кровообращение в малом круге при некоторых видах общей анестезии.— Анестезиол. и реаниматол., 1980, № 5, с. 43—46.
Гиммельфарб Г. Н., Исламбеков Э. С., Герасимов Н. М. Метаболизм серотонина и гистамина при различной их хирургической патологии.— Грудн. хир., 1981, № 4, с. 76—79.
Гинзбург М. А., Медведовский Б. И. Семейный спонтанный пневмоторакс.— Грудн. хир., 1976, № 2, с. 54—57.
374
Гологорский В. А., Вишневская Д. Н., Гриненко Т. Ф. Влияние нейролептанальгезии на механику дыхания у хирургических больных с сопутствующими обструктивными заболеваниями легких.— Анестезиол. и реаниматол., 1979, № 2, с. 8—10.
Гологорский В. А., Гриненко Т. Ф., Багдатьев В. Е., Соколова Н. П. Сравнительная оценка влияния вводного наркоза кетамином, таламоналом и тиопенталом натрия на сердечно-сосудистую систему.— Анестезиол, и реаниматол., 1979, № 1, с. 34—38.
Гологорский В. А., Багдатьев В. Е„ Андреев Ю. В., и др. Влияние ультразвуковых аэрозолей и вспомогательной искусственной вентиляции легких на механику дыхания и газообмен в послеоперационном периоде.— Сов. мед., 1981, № 7, с. 53—57.
Гологорский В. А., Багдатьев В. Е., Андреев Ю. В. Влияние оксигенотерапии, дыхательной гимнастики, массажа грудной клетки на газообмен и механику дыхания в послеоперационном периоде.— Анестезиол. и реаниматол.. 1982, № 2, с. 51—54.
Гологорский В. А., Шестопалов А. Е. Тактика трансфузионной терапии острой кровопотери.— Анестезиол. и реаниматол., 1982, № 5, с. 66—70.
Гончарова В. А., Сыромятникова И. В. Участие легкого в обмене биологически активных соединений,— Тер. арх., 1975, № 3, с. 143—149.
Гончарова В. А., Клемент Р. Ф„ Лаврушин А. А. Биологически активные вещества и оксигенация крови при заболеваниях легких.— Клин, мед., 1981, No 12, с. 21—25.
Гордеева Т. Я., Егиазарян В. Ф„ Гулачи А. Ближайшие и отдаленные результаты лечения острых гангренозных абсцессов легких.— Грудн. хир., 1979, № 4, с. 24—31.
Горковенко Г. Г., Юхамец В. А., Алексеенко А. В. Применение эндобронхиального электрофореза в комплексной предоперационной подготовке больных с неспецифическими заболеваниями легких.— Клин, хир., 1982, № 10, с. 35—37.
Горшков Ю. И. Резекция легких при гангрене.— Хирургия, 1974, № 8, с. 68—71.
Горшков Ю. И., Захаров Н. П., Нестеров В. И. Ранняя плеврэктомия по поводу гнойного плеврита у больных с повышенным риском.— Вестн. хир., 1981, № 10, с. 17—18.
Гребенникова А. Т., Костюченко А. Л. Обтурация бронхов слизью как причина послеоперационной дыхательной недостаточности.— Клин, хир., 1976, № 4, с. 41—45.
Григорьев М. С. Бронхиальные свищи.— В кн.: Гнойные заболевания плевры и легких / Под ред. П. А. Куприянова. Л., 1955, с. 436—485.
Григорян А. В., Недвецкая Л. М., Бочарова В. М. Оперативное лечение гангрены легких.— Грудн. хир., 1974, № 4, с. 46—51.
Гуска Н. И., Файтельберг-Бланк В. Р. Физиология и патология плевры.— Кишинев, 1978.
Даниленко М. В., Митюк И. И., Даниленко А. М. Лечение острых и осложненных абсцессов легких.— Грудн. хир., 1974, № 2, с. 51—57.
Данилюк В. М., Гуч А. А. Лечение острых и осложненных абсцессов легких.— Врач, дело, 1977, № 7, с. 57—59.
Дворецкий Д. П. Кровоток и вентиляция в оптимизации легочного газообмена.— Успехи физиол. наук, 1977, № 2, с. 112—131.
Денисова О. П., Гузков Г. И., Замет Н. Ю. Первичная фибросаркома легкого.— Арх. пат., 1981, № 10, с. 45—48.
Дерябин И. И., Хавинсон В. X., Гуревич К. Я. Зависимость эффективности массивных гемотрансфузий от состояния клеточного и гуморального иммунитета при тяжелой механической травме.— Вестн. хир., 1979, № 8, с. 92—96.
Догоспитальная реанимация.— Л., 1979.
Дубилей П. В., Тенюков В. В. Энергообеспечение процессов инактивации серотонина в легких.— Патол. физиол. и экспер. тер., 1981, вып. 4, с. 69—73.
Дубова М. Н., Заркашев С. Р. Коррекция нарушений кровообращения при хирургических заболеваниях легких введением реополиглюкина и гемодеза.— Грудн. хир., 1981, № 6, с. 53—58. Ефимов Б. И., Бирюков Ю. В. О классификации доброкачественных опухолей легких.— Грудн. хир., 1973, № 5, с. 122—123.
Ефимов Г. А., Краснов Ю. О., Чигиринский Л. М., Продолжительность жизни больных раком легкого, отказавшихся от операции.— Вопр. онкол., 1980, № 12, с. 79—84.
Жилин Ю. Н. Применение мембранных обогатителей кислорода в легочной хирургии и послеоперационной интенсивной терапии.— Грудн. хир., 1983, № 1, с. 55—59.
Захаров С. Н., Островский В. К. Метастатические абсцессы легких.— Вестн. хир., 1981, № 9, с. 8—11.
Земсков Н. Н., Левина В. П., Дугальный В. С. и др. Выбор метода и хирургическая техника поздних повторных операций на легких и плевре.— Вестн. хир., 1979, № 5, с. 11 —15.
Зильбер А. П. Клиническая физиология для анестезиологов.— М., 1977.
Иванов А. И. Гистоплазмоз (обзор литературы).— Воен.-мед. журн.. 1971. № 8, с. 53—57.
Ивашкевич Н. Г., Химка А. С. Кининовая система крови и легочный сурфактант при перитоните.— Вестн. хир., 1983, № 6, с. 56—58.
Ивченко В. Н., Мельник В. М. Анаэробная неспорообразующая плевропульмональная инфекция.— Сов. мед., 1983, № 2, с. 64—67.
Иммунологические аспекты легочной патологии.— М., 1980.
Кабанов А. Н„ Павлов В. В., Данилевский Ю. П. Частичные резекции легких и пульмонэктомия как повторные операции.— Сов. мед., 1975, № 1, с. 118—122.
Кабанов А. Н., Ситко А. А., Астафуров В. Н., Казырь А. М. Применение временной окклюзии бронхов в пульмонологии.— Грудн. хир., 1979, № 5. с. 38—41.
Каншин Н. Н. Закрытое лечение нагноительных процессов методом активного промывного дренирования.— Хирургия, 1980, Ne 11, с. 18—22.
Капаев Н. Н., Кузнецова В. К. Работа дыхания в покое и при различных уровнях вентиляции в возрасте 20—60 лет.— Физиология человека, 1976, № 4, с. 667—672.
375
Карнаухов Н. Ф„ Шепелев А. П., Литвинова В. Н. Влияние внелегочной вентиляции на показатели обмена липидов в легких и в крови малого круга.— Грудн. хир., 1976, № 6, с. 96—99.
Касьяненко Н. В., Пирогов А. И., Муровская Г. В. Лечение больных в далеко зашедших стадиях рака легкого.— Вопр. онкол., 1982, № 2, с. 56—61.
Кахидзе С. Я., Колпакчи М. И., Никифорова С. К., Грязнова 3. Н. Стафилококковые заболевания у взрослых.— Клин, мед., 1980, № 4, с. 43—45.
Керимов А. X., Малиновский А. Ф. Отдаленные результаты оперативного лечения больных аспергиллезом легких.— Вести, хир., 1985, № 10, с. 15—19.
Климанский В. А. Современные принципы инфузионно-трансфузионного обеспечения операций на легких.— Пробл. гематол. и перелив, крови, 1978, вып. 5, с. 9—13.
Климанский В. А.. Рудаев Л. А. Гемодилюция как современный метод лечения острой кровопотери.— Вести, хир., 1982, № 10, с. 67—71.
Колесников И. С. Резекция легких.— Л., 1960.
Колесников И. С., Соколов С. Н. Профилактика и лечение эмпием плевры после резекции легких.— Л., 1960.
Колесников И. С., Путов Н. В., Соколов С. Н. Экономные резекции легких при туберкулезе.— Л., 1965.
Колесников И. С., Плешаков В. Т., Шанин Ю. Н. и др. Гемодинамика после резекции легкого с восполнением кровопотери аутогемотрансфузией.— Вести, хир., 1973, № 10, с. 116—121.
Колесников И. С., Вихриев В. С. Абсцессы легких.— Л., 1973.
Колесников И. С., Щерба Б. В., Межевикин Н. И., Шалаев С. А. Оперативные вмешательства при раке легкого.— Л., 1975.
Колесников И. С., Лыткин М. И., Плешаков В. Т. Аутотрансфузия крови и ее компонентов в хирургии.— Л., 1979.
Колесников И. С., Лыткин М. И.. Лесницкий Л. С., Чепчерук Г. С. Клеевая пневмопексия в хирургии легких и плевры.— Воен.-мед. жури., 1981, № 6, с. 28—31.
Колесников И. С., Тищенко М. И. Взаимоотношения показателей внешнего дыхания и гемодинамики при хирургических заболеваниях органов груди.— Вести, хир., 1981, № 3, с. 114—121.
Колесников И. С., Лыткин М. И., Лесницкий Л. С., Чепчерук Г. С. Некоторые вопросы этиологии, патогенеза и лечения острых нагноений легких.— Вести, хир., 1982, № 8, с. 3—7.
Колесников И. С., Шалаев С. А. Возможности оперативного лечения далеко зашедших форм рака легкого.— Вести, хир., 1982, № 1, с. 5—10.
Колесников И. С., Лыткин М. И., Лесницкий Л. С. Гангрена легкого и пиопневмоторакс.— Л., 1983. Колесов А. П., Кутушев Ф. X.. Либов А. С., Майстеренко Н. А. Возможности фибробронхоскопии в диагностике новообразований легкого.— В кн.: Ранняя диагностика рака легкого. Л., 1980, с. 33—34.
Кольцун С. С. Прогнозирование послеоперационного состояния больных с хроническими неспецифическими заболеваниями легких.— М., 1981.
Коновалов Ю. Н. Локализованная мезотелиома плевры.— Труды Лен. науч, об-ва патологоанатомов, 1976, вып. 17, с. 94—96.
Королев Б. А., Карпов М. Ф., Широкова А. И. Опыт тысячи операций по поводу первичного рака легкого.— Грудн. хир., 1976, № 5, с. 40—44.
Королев Б. А., Карпов М. Ф., Тевит Б. М. Послеоперационная эмпиема плевры и бронхиальный свищ у больных первичным раком легкого.— Хирургия, 1982, № 5, с. 81—85.
Костюченко А. Л., Чепчерук Г. С. Превентивная санация плевральной полости после пневмонэктомии с использованием фибринолитических препаратов.— Клин, хир., 1975, № 11, с. 23—27.
Костюченко А. Л., Яковлева А. М., Волков Ю. Н.. Николаева И. П. Оперативный врачебный контроль и некоторые вопросы автоматической диагностики гиповолемии в ближайшем послеоперационном периоде.— Анестезиол. и реаниматол., 1981, № 2, с. 24—27.
Костюченко А. Л., Тулупов А. Н., Лесницкий Л. С. Осмометрия как метод контроля гомеостаза при острых гнойно-деструктивных заболеваниях легких и плевры.— Вестн. хир., 1983, № 3, с. 29—34.
Костюченко А. Л., Лесницкий Л. С., Чепчерук Г. С. и др. Обеспечение расправления оперированного легкого при резекциях легких по поводу гангрены.— Вестн. хир., 1984, № 11, с. 63—68.
Костюченко А. Л., Лесницкий Л. С., Чепчерук Г. С. и др. Предупреждение раневой инфекции при операциях на легких по поводу гангрены.— Вестн. хир., 1984, № 5, с. 11—16.
Кочетков А. В., Кочеровец В. И. Клинико-микробиологическая диагностика неклостридиальных анаэробных плевро-легочных инфекций.— В кн.: Неклостридиальная анаэробная инфекция. Л., 1982, с. 55—58.
Кочетков А. В., Кочеровец В. И. Неклостридиальные анаэробные плевролегочные инфекции.— Грудн. хир., 1983, № 5, с. 76—80.
Краевский Н. А. О гистологической классификации рака легкого.— Вестн. АМН СССР, 1976, № 3, с. 15—16.
Криштафович А. А., Колешко Л. Е., Ребане Л. Е. Первый опыт применения бронхографии порошком тантала при раке легкого.— В кн.: Ранняя диагностика рака легкого. Волгоград, 1980, с. 54—55.
Кузин М. И., Шкроб О. С., Помелов В. С., Исаев Н. М. Острая эмпиема плевры.— Ташкент, 1976.
Кузин М. И., Вишневский А. А., Волынский Ю. Д. Легочное кровотечение.— Грудн. хир., 1981, № 3, с. 43—49.
Куницин А. Г., Алейников Г. Е. Послеоперационное облучение при раке легкого.— Вопр. онкол., 1978, № 2, с. 67—73.
Кутушев Ф. X., Дваладзе Н. А., Андожская И. В. Использование аутогемотрансфузий при операциях по поводу рака легкого.— Вестн. хир., 1976, № 8, с. 32—35.
376
Кутушев Ф. X., Иванов В. И. О послеоперационных осложнениях при хирургическом лечении рака легкого.— Вести, хир., 1979, № 8, с. 3—6.
Кутушев Ф. X., Дваладзе Н. А. Возможности аутогемотрансфузии в трансфузионном оперативном вмешательстве по поводу рака легкого.— Вести, хир., 1982, № 10, с. 80—84.
Кутушев Ф. X., Либов А. С. Возможности хирургии в лечении рака легкого.— Вести, хир., 1983, № 12, с. 3—6.
Ламм Я. А. Клинико-иммунологическая характеристика острых абсцессов легких.— Здравоохр. Казахстана, 1983, № 6, с. 51—54.
Лебанидзе Н. Г., Мещеряков А. В., Винницкий Л. И. и др. Нарушения терморегуляции во время анестезии и операции и их проявления в непосредственном посленаркозном периоде.— Анестезиол. и реаниматол., 1978, № 3, с. 36—40.
Левашов Ю. И., Толузаков В. Л. Кистозная гипоплазия легких (диагностика и лечение).— Л., 1981.
Левитэ Е. М., Богданова Л. М., Мочалова Г. А. и др. Динамика объема циркулирующей крови в связи с хирургической операцией.— Экспер. хир. и анестезиол., 1975, № 5. с. 77—80.
Левитэ Е. М., Сгибнева Е. В. Динамика объема циркулирующей крови в связи с операцией у облученных онкологических больных.— Анестезиол. и реаниматол., 1978, № 5, с. 58—60.
Леоско В. А., Мошко И. А. Состояние сурфактантной системы и послеоперационные легочные осложнения.— Вестн. хир., 1980, № 8, с. 9—13.
Лесницкий Л. С. Оперативное лечение острых гнойно-деструктивных поражений легких при сепсисе.— Вестн. хир., 1979, № 7, с. 13—17.
Лесницкий Л. С., Чепчерук Г. С. Пиопневмоторакс в хирургической клинике.— Вестн. хир., 1982, № 11, с. 80—86.
Лесницкий Л. С., Буравцов В. И. Гипербарическая оксигенация в лечении больных острыми гнойно-деструктивными поражениями легких и плевры.— Вестн. хир., 1983, № 7, с. 36—42.
Лесницкий Л. С., Тулупов А. Н., Костюченко А. Л. и др. Торакостомия в лечении эмпиемы плевры.— Вестн. хир., 1987, № 3, с. 19—22.
Ливанов Г. А. Особенности инфузионной терапии у больных с тяжелыми формами алкогольного делирия.— В кн.: Форсированный диурез в хирургической клинике. Л., 1976, с. 88—94.
Лыткин М. И., Костин Э. Д., Костюченко А. Л., Терешин И. М. Септический шок.— М.: Л., 1980.
Лыткин М. И., Костюченко А. Л., Тулупов А. Н. Легочная гемотрансфузионная микроэмболия и ее влияние на основные жизненно важные функции организма.— Вестн. хир., 1981, № 7, с. 3—7.
Лыткин М. И., Костюченко А. Л. Инфузионно-трансфузионное обеспечение торакальных вмешательств.— Вестн. хир., 1982, № 10, с. 71—76.
Лыткин М. И., Малахов С. Ф., Епифанов М. В. Патогенез анемии после обширных оперативных вмешательств на легких.— Вестн. хир., 1983, № 8, с. 3—7.
Лыткин М. И., Чепчерук Г. С., Печерский В. И., Лесницкий Л. С. Энзимологические иммунологические показатели активности воспалительного процесса при острых гнойно-деструктивных заболеваниях легких и плевры.— Вестн. хир., 1983, № 6, с. 40.
Лыткин М. И., Кишковский А. Н., Попов Ю. А., Вашкевич М. П. Ангиографический способ исследования скорости и объема регионарного кровотока.— В кн.: Вопросы лучевой диагностики, актуальные для военно-медицинской службы. Л., 1984, с. 70—72.
Лубенский Ю. М., Раппопорт Ж. Ж. Интенсивная терапия в пульмонологии.— Л., 1977.
Лукомский Г. И. Неспецифическая эмпиема плевры.— М., 1976.
Лукомский Г. И., Алексеева М. Е., Маусымбаев К. М. Парентеральное питание больных с гнойными заболеваниями легких и плевры.— Грудн. хир., 1976, № 2, с. 57—62.
Лукомский Г И., Алексеева М. Е., Ялышева Н. И. Лечение септико-пиемических нагноений легких.— Грудн. хир., 1981, № 2, с. 40—43.
Лукомский Г. И., Шулутко М. Л., Виннер М. Г., Овчинников А. А. Бронхопульмонология.— М., 1982.
Лукомский Г. И., Алексеева М. Е. Общие закономерности волемических изменений у больных с хирургическими заболеваниями.— Хирургия, 1983, № 12, с. 95—100.
Луценко С. М., Тарасова Е. И. Клинико-иммунологические сдвиги при эмпиеме плевры у больных разного возраста.— Вестн. хир., 1975, № 5, с. 37—40.
Маджуга А. В., Варламова О. А., Бокарев И. А. и др. Роль внутрисосудистого свертывания крови в патогенезе послеоперационных пневмоний у больных раком легкого.— Анестезиол. и реаниматол., 1978, № 2, с. 62—65.
Малахов С. Ф., Костюченко А. Л., Плешаков В. Т. Послеоперационная анемия в хирургии легких.— Вестн. хир., 1977, № 1, с. 107—111.
Малахов С. Ф., Меншикова Е. А., Телухин В. А., Багаутдинов III. М. Применение трансфузий аутологичного костного мозга для профилактики и лечения послеоперационной анемии.— Вестн. хир., 1982, № 12, с. 93—97.
Марморштейн С. Я., Варновицкий Г. И., Романычев Ю. А. К дифференциальной диагностике диффузных мезотелиом плевры и туберкулезных плевритов.— Вестн. рентгенол. и радиол., 1976, № 1, с. 3—11.
Марчук И. К. Лечение и исходы неосложненных абсцессов легких.— Клин, хир., 1980, № 10, с. 58—61.
Маслов В. И. Лечение эмпиемы плевры.— Л., 1976.
Маслов В. И. Лечение острых септических абсцессов легких.— Вестн. АМН СССР, 1983, № 8, с. 88—92.
Матыцин А. Н. Клиническая оценка местного и регионарного распространения рака легкого.— Вопр. онкол., 1977, № 4, с. 24—30.
377
Мерабишвили В. М., Церковный Г. Ф„ Демидов В. П. Современное состояние тенденции заболеваемости раком легкого и смертности от него в СССР и за рубежом.— Вопр. онкол., 1982, № 2, с. 15—18.
Милонов О. Б., Смирнов В. А., Кальченко Б. Л., Османов А. О. О так называемом неоперабельном эхинококкозе органов брюшной полости.— Хирургия, 1983, № 10, с. 82—84.
Муромский Ю. А. Бронхиальные свищи после резекции легких.— М., 1963.
Муромский Ю. А., Ляшенко В. И., Соловьева И. Д. Патогенез и лечение острых деструктивных процессов легких стафилококковой этиологии.— Хирургия, 1981, № 2, с. 42—48.
Муромский Ю. А., Сумбатов Л. А., Юновыдова Л. И. Токсические свойства крови и состав микрофлоры у больных с острыми нагноительными процессами в легких.— Хирургия, 1982, № 2, с. 70—73.
Мустафин Д. Г. Исходы стафилококковой деструкции легких у взрослых.— Клин, мед., 1975, № 12, с. 36—40.
Мустафин Д. Г. Гнойно-деструктивные поражения легких при сепсисе.— Клин, мед., 1980, № 12, с. 41—45.
Мышкин К. И., Слесаренко С. С. Выбор метода лечения больных со спонтанным пневмотораксом.— Грудн. хир., 1976, № 6, с. 50—53.
Напалков Н. П., Церковный Г. Ф., Мерабишвили В. М., Преображенская М. Н. Злокачественные новообразования в СССР в 1975 году.— Вопр. онкол., 1977, № 1, с. 3—12.
Напалков Н. П., Барчук А. С., Джиоев Ф. К. Профилактика рака легкого.— Вопр. онкол., 1982, № 12, с. 10—15.
Некрич Г. Л. Опыт лечения гигантских абсцессов легких.— Грудн. хир., 1982, № 2, с. 61—66. Ожогина Е. П., Комарова Н. Г. О мезотелиоме плевры.— Сов. мед., 1975, № 1, с. 149—150. Орешников В. Н., Садчиков Д. В. Влияние вида обезболивания и параметров однолегочной вентиляции на величину венозного шунта при операциях на легких.— Вестн. хир., 1979, № 5, с. 105—108.
Осипов В. К., Свитич Ю. М., Вебер В. Р. Лейкоцитарный индекс интоксикации при острых гнойных и воспалительных заболеваниях.— Вестн. хир., 1983, № 11, с. 21—24.
Островский В. Ю., Морозов А. И., Куликова Л. П. Изменение центральной гомодинамики и некоторых показателей гомеостаза при операциях на легких.— Анестезиол. и реаниматол., 1980, № 1, с. 9—12.
Павлов А. С., Пирогов А. И., Трахтенбург А. X. Лечение рака легкого.— М., 1979.
Павлов В. А. Особенности газообмена при компенсации кровопотери после резекции легких.— Грудн. хир., 1981, № 2, с. 67—70.
Перельман М. И. Лечение абсцессов легких после острых пневмоний.— Тер. арх., 1979, № 2, с. 116—121.
Перельман М. И., Переслегин И. А., Филькова Е. М. и др. Комбинированное лечение рака легкого.— Вопр. онкол., 1977, № 2, с. 60—67.
Перельман М. И., Ефимов Б. И., Бирюков Ю. В. Доброкачественные опухоли легких.— М., 1981.
Перельман М. И., Григорьева С. П., Добровольский С. Р. Резекция и пластика бронхов в хирургии рака легкого.— Грудн. хир., 1981, № 2, с. 36—40.
Перельман М. И., Григорьева С. П., Иванов А. Н. Хирургическое лечение рака легкого с предоперационным облучением на бетатроне.— Вопр. онкол., 1982, № 2, с. 48—50.
Переслегин И. А., Куницын А. Г., Алейников Г. Е. Комбинированное лечение больных раком легкого с предоперационным облучением.— Мед. радиол., 1977, № 6, с. 3—8.
Переслегин И. А., Розенштраух Л. С., Гуревич Л. А. Современные возможности ранней рентгенодиагностики рака легкого.— Вестн. рентгенол. и радиол. 1978, № 2, с. 3—10.
Петерсон Б. Е. Общие принципы хирургического лечения рака легкого.— Вестн. АМН СССР. 1976, № 3, с. 35—37.
Петерсон Б. Е. Биологические подходы в хирургическом лечении злокачественных опухолей.— Хирургия, 1977, № 2, с. 36—42.
Петерсон Б. Е. Рак легкого — важнейшая проблема современной онкологии.— Сов. мед., 1977, № 4, с. 7—15.
Петровский Б. В. Эмболия легочной артерии.— Хирургия, 1975, № 5, с. 33—38.
Петровский Б. В., Гусейнов И. С. Трансфузионная терапия в хирургии.— М., 1971.
Пирогов А. И., Трахтенбург А. X., Ерохов В. Ф. О выявлении метастазов рака легкого.— Вопр. онкол., 1976, № 6, с. 3—8.
Пирогов А. И., Трахтенбург А. X., Ерохов В. Ф. Лапароскопия и лапаротомия при раке легкого.— Вопр. онкол., 1976, № 11, с. 113—114.
Пирогов А. И., Харченко В. П. Показания к лобэктомии с резекцией и пластикой бронхов при раке легкого.— Сов. мед., 1977, № 8, с. 35—39.
Пирогов А. И., Трахтенбург А. X., Кадиров А. М. и др. Особенности клинического течения и прогноз при железистом раке легкого.— Вопр. онкол., 1978, № 2, с. И —17.
Пирогов А. И., Лактионов К. А., Абрамов В. Ф. Легочная вентиляция и газовый состав крови и их динамика у больных раком легкого после радикальной операции.— Грудн. хир., 1981, № 4, с. 67—71.
Плешаков В. Т., Костюченко А. Л., Чепчерук Г. С. Влияние свернувшегося гемоторакса и раннего фиброторакса на состояние больных после пневмонэктомии.— Вестн. хир., 1975, № 10, с. 71—75.
Плешаков В. Т., Картавенко А. И., Воронцов С. А. Чрезбронхиальная трансторакальная санация хронических гнойных очагов в легких.— Вестн. хир., 1979, № 5, с. 7—11.
Плешаков В. Т., Полушин Ю. С., Костюченко А. Л. и др. Применение гиперосмолярной аутогенной плазмы с целью возмещения кровопотери.— Вести, хир., 1982, № 10, с. 76—80.
378
Плотников М. Н., Лякина С. И., Никитин Н. Д., Чурцов Е. Л. Хирургические вмешательства на легких у больных сахарным диабетом.— Вестн. хир., 1978, № 10, с. 6—13.
Путов Н. В., Щелкунов В. С., Варламов В. В. Волемические нарушения и их коррекция у больных с острыми нагноительными заболеваниями легких.— Грудн. хир., 1977, № 3, с. 107—112.
Путов Н. В., Федосеев Г. В. Руководство по пульмонологии.— Л., 1978.
Рабкин И. X. О систематизации аневризм легочных сосудов.— Кровообращение, 1968, № 1, с. 45—51.
Репин Ю. М., Пушкарева Н. С., Чуркин Ю. С. Резервирование аутокрови и внутрисосудистая гемодилюция с гипотензией при операциях на легких.— Грудн. хир., 1975, № 3, с. 70—74.
Репин Ю. М., Цукерман И. Я. Функциональная операбельность при заболеваниях, осложненных выраженной дыхательной недостаточностью.— Вестн. хир., 1981, № 3, с. 11—15.
Родионов В. В., Куницын А. Г., Артемьев Н. Г. Осложнения после лобэктомии с резекцией и пластикой бронхов при раке легкого.— Грудн. хир., 1981, № 1, с. 57—62.
Розенштаух Л. С., Рождественская А. И. Доброкачественные опухоли легких.— М., 1968.
Романычев Ю. А. О трудностях диагностики ограниченных опухолей плевры.— Вестн. радиол, и рентгенол., 1967, № 5, с. 24—31.
Руководство по легочной хирургии / Под ред. И. С. Колесникова.— Л., 1969.
Рыжков С. В. Первичная саркома легочной артерии,— Арх. пат., 1957, № 20, с. 19.
Рябов Г. А., Гологорский В. А. Общая анестезия и кровообращение.— Анестезиол. и реаниматол., 1978, № 6, с. 3—10.
Савельев В. С., Константинов Г. Д. Нетуберкулезный спонтанный пневмоторакс.— М., 1969.
Савельев В. С., Гологорский В. А., Гриненко Т. Ф. и др. Опыт анестезии и реанимации при эмболэктомии из легочных артерий.— Грудн. хир., 1982, № 6, с. 21—24.
Савоничева И. П., Брауде В. И., Бовкун Е. Г. Патогенез и профилактика послеоперационной пневмонии единственного легкого.— Грудн. хир., 1981, № 4, с. 72—75.
Сажин В. П-, Коровин А. Я., Сорокин В. М., Сипченко А. Я. Метронидазол в профилактике и лечении раневой инфекции.— Вестн. хир., 1981, Ne 12, с. 14—15.
Сазонов А. М., Цуман В. Г., Романов Г. А. Аномалии развития легких и их лечение.— М., 1981. Самсонов В. П. Инфузия антибиотиков в легочную артерию.— Хирургия, 1980, № 3, с. 103—107. Санпитер И. А. Рентгенобронхологическая диагностика неспецифических эмпием плевры.— Грудн. хир., 1976, № 3, с. 120—121.
Сафонов В. А., Ефимов В. Н„ Чумаченко А. А. Нейрофизиология дыхания.— М., 1980.
Сергеев В. М. Патология и хирургия плевры.— М., 1867.
Серов В. В., Шамов И. А. Амилоидоз.— М., 1977.
Сигал А. Е. Реабилитация больных абсцессами легких.— Ташкент, 1977.
Скрипниченко Д. Ф., Цыбырнэ К. А. Диагностика и лечение эхинококкоза легкого. - Кишинев, 1959.
Слепуха И. М., Мельник В. М. Результаты операций на главных бронхах при эмпиеме плевры с бронхиальным свищем.— Вестн. хир., 1982, № 2, с. 8—11.
Соколов С. Б. Лечение абсцессов легкого и абсцедирующих пневмоний с использованием внутритканевого электрофореза.— Грудн. хир., 1981, № 4, с. 61—65.
Соколов Е. А., Цветков В. А. Состояние центральной гемодинамики после операции на легких.— Сов. мед., 1979, № 4, с. 55—58.
Спасокукоцкий С. И. Хирургия гнойных заболеваний легких и плевры.— Л., 1938.
Стручков В. И. Гнойные заболевания легких и плевры.— М., 1967.
Стручков В. И. Актуальные вопросы рака легкого.— Хирургия, 1977, № 7, с. 8—13.
Стручков В. И. Лечение острых абсцессов и гангрен легкцх.— Грудн. хир., 1981, № 3, с. 40—43.
Стручков В. И., Григорян А. В. Опухоли легких.— М., 1964.
Стручков В. И., Воль-Эпштейн Г. Л., Сахаров В. А. Пороки развития легкого у человека.— М., 1969.
Стручков В. И., Недвецкая Л. М„ Заркешев С. Р. Иммунологические препараты в лечении острых легочных нагноений.— Грудн. хир., 1981, № 2, с. 32—35.
Стручков В. И., Прозоровская К. Н., Недвецкая Л. М. Иммунология в профилактике и лечении гнойных хирургических заболеваний.— М., 1978.
Толузаков В. Л., Егиазарян В. Ф. Консервативное лечение острых легочных нагноений.— Л., 1984.
Трещинский А. И., Троцевич В. А. Иммунные защитные механизмы дыхательных путей.— Анестезиол. и реаниматол., 1980, № 3, с. 3—6.
Уваров Б. С., Палагин В. С., Унту Ф. И. и др. Использование селективных мембран для обогащения воздуха кислородом при искусственной вентиляции легких.— Анестезиол. и реаниматол., 1983, № 1, с. 20—23.
Углов Ф. Г. Рак легкого.— Л., 1962.
Углов Ф. Г. Абсцесс и гангрена легких.— Вестн. хир., 1975, № 7, с. 133—141.
Углов Ф. Г., Егиазарян В. Ф. Абсцессы и гангрена легких.— В кн.: Основы пульмонологии. М„ 1976, с. 211—232.
Уткин В. В., Башко Я. Я. Современные принципы лечения неспецифических эмпием плевры.— Грудн. хир., 1978, № 5, с; 83—88.
Федоров Б. П., Воль-Эпштейн Г. Л. Абсцессы легких.— М., 1976.
Федоров Б. П., Сахаров В. А. Вопросы патогенеза и лечения абсцессов легких.— Грудн. хир., 1977, № 3, с. 54—59.
Федорова А. П., Сережин Б. С., Якубович А. А. О так называемой карциносаркоме легкого.— В кн.: Морфологические основы иммунопатологических процессов. Л., 1983, с. 146—148.
Федосеев Г. Б., Лаврова Т. Р., Жихарев С. С. Клеточные и субклеточные механизмы защиты и повреждения бронхов и легких.— Л., 1980.
Фомина А. С. Плевриты.— Л., 1977.
379
Характер Ж. 3., Мажак К. Д. Исследование изоферментного спектра лактат и малатдегидрогеназы при хирургических вмешательствах на легких.— Пробл туберк., 1981, № 2, с. 36—39.
Харченко В. П., Чхиквадзе В. Д. Ликвидация бронхиального свища после пневмонэктомии.— Хирургия, 1981, № 2, с. 100—102.
Харченко В. П„ Гончарова И. М., Сутягин А. Г. Некоторые показатели гемодинамики и внешнего дыхания у больных раком легкого при комбинированном и хирургическом лечении.— Грудн. хир., 1982, № 1, с. 66—70.
Харченко В. П., Чхиквидзе В. Д. Резекция легкого с иссечением устья бронха.— Вестн. хир., 1984, № 1, с. 21—26.
Цветнова Л. Д., Тулупов А. Н., Лесницкий Л. С. Внешнее дыхание и центральная гемодинамика при гнойно-деструктивных заболеваниях плевры и легких.— Вестн. хир., 1982, № 7, с. 115— 118.
Цыбырнэ К. А., Гонцов И. А., Андон Л. Г. Некоторые аспекты патогенеза послеоперационных эмпием при бронхоэктатической болезни.— Грудн. хир. 1975. № 3, с. 66—70.
Чепик О. Ф., Журавлев А. В. Мезотелиома плевры у детей и взрослых.— Вопр. онкол., 1979, № 10, с. 64—67.
Чепчерук Г. С., Костюченко А. Л., Радаев А. А. Влияние антибиотиков и антисептиков на фибринолитическую активность протеаз.— Вестн. хир., 1980, № 6, с. 79—82.
Чепчерук Г. С., Костюченко А. Л., Лесницкий Л. С. Местная фибринолитическая терапия терри-литином при свернувшемся гемотораксе и эмпиеме плевры.— Вестн. хир., 1981, № 10, с. 13—16.
Чучалин А. Г., Шмушкович Б. И., Апульцина И. Д., Копылев И. Д. Органы дыхания и простагландины.— Тер. арх., 1979, № 4, с. 102—112.
Чухриенко Д. П., Мильков Б. О., Березницкий Я. С. и др. Лечение эмпиемы плевры.— Грудн. хир., 1982, № 2, с. 72—75.
Шабалин В. П„ Серова Л. Д. Иммунология посттрансфузионных осложнений.— Вестн. хир., 1982, № 10, с. 89—72.
Шалаев С. А., Шариф М. С., Костюченко А. Л. Легочный газообмен при диагностической бронхоскопии у больных раком легкого.— Грудн. хир., 1982, № 3, с. 52—55.
Шалимов А. А., Шифрин В. А. Современные методы ганглиоплегии в хирургии и анестезиологии.— Киев, 1975.
Шанин Ю. Н. Условия достижения эффективной и минимальной анестезии.— Вестн. хир., 1982, № 1, с. 112—117.
Шанин Ю. И., Костюченко А. Л., Королев Б. А., Таруашвили Г. И. Показания и объем кардиотонизирующей терапии после резекции легких.— Вестн. хир., 1974, № 10, с. 6—11.
Шанин Ю. Н., Костюченко А. Л., Брюсов П. Г. Нарушения микроциркуляции после операций на легких.— Грудн. хир., 1975, № 3, с. 94—97.
Шанин Ю. Н., Волков Ю. Н., Костюченко А. Л., Плешаков В. Т. Послеоперационная интенсивная терапия.— Л., 1978.
Шустеров Б. Г., Сомоков Ю. Л., Залит Л. И. и др. К рентгенодиагностике опухолей плевры.— Вестн. рентгенол. и радиол., 1977, № 4, с. 23—30.
Щелкунов В. С. Перидуральная анестезия.— Л., 1976.
Щелкунов В. С., Черный С. М., Николаева И. П. Экспираторное закрытие дыхательных путей как причина гипоксемии после резекции легких.— Вестн. хир., 1980, № 7, с. 30—34.
Шулутко М. Л., Виннер М. Г., Лобанов И. А. Доброкачественные опухоли и образования легких.— Свердловск, 1967.
Ярицын С. С., Друкин Э. Я. О продолжительности жизни больных раком легкого, зарегистрированных в течение одного года в Ленинграде.— Вопр. онкол., 1980, № 2, с. 119—120.
Abruzzini Р. Chirurgische Behandlung der Eisteln des Hauptbronches.— Thoraxchirurgie, 1963, Bd. 10, H. 3. S. 259—264.
Adler E. Die Mediastinoscopie.— Therapiewoche, 1976, Bd. 26, S. 787—790.
Alexander J. C., Wolfe W. G. Lung abscess and empyema thorax.— Surg. Clin. N. Am., 1980, v. 60, N 4, p. 835—849.
Aubert M.. Lafreille R. Incidences de la suture bronchique mecanique sur les fistules agres pueumo-nectomie. Sur serie de 173 malades dont 50 traites par suture mecanique.— Ann. Chir., 1981, t. 35, N 8, p. 677—678.
Bader G. Die viszeralen Mykosen (Pathologi, Klinik und Therapie).— Jena, 1965.
Balfour S. N., Lyle H. H Respiratory physiology.— Saint Louis, 1976.
Balogh A., Neures A., Toth L., Repasy G. A tiido-fibroma.— Ort. hetil., 1978, t. 119, p. 909—910.
Bartlett J., Finegold S. Anaerobic infections of the lung and pleural spase.— Am. Rev. Resp. Dis., 1974, v. 110, N 1, p. 56—77.
Bartlett J. G., Gorbach S. L. Treatment of aspiration pneumonia and primary lung abscess.— JAMA, 1975, v. 234, N 9, p. 935—937.
Bazelly B., Donzeau-Gonge P., Daussy M., Dammet Ph. Etude comparative de la suture mecanique et manuele. Sur une serie de 306 malades dpnt 145 traites par suture mecanique.— Ann Chir., 1981, t. 35, N 8, p. 676—677.
Bjork V. O. The osteoplastic wall thoracoplasty after pneumonectomies.— J. Thorac. Surg., 1956, v. 31, N 5, p. 515—526.
Bieselt R., Eule H. Lungenresektion wegen karzinoma im hoheren Lebensalter-Einflu Kardiopulmo-naler Risikofaktoren suf die Operationsindikation.— Zbl. Chir., 1983, Bd. 108, H. 22, S. 1422— 1427.
Boyd A. D., Speucer F. G. Bronchopleural fistulas: how often should they occur?— Ann. Thorac. Surg., 1972, N 13, p. 195—196.
Brand U., Huber O., Megevand R., Spiliopoulos A. Survie des cancers bronchopulmonaires operes. Resultats a 5 ans.— Helv. chir. Acta, 1980, t. 47, N 1, p. 41—45.
380
Brantigan О. C. Pretreatment clinical staging of carcinoma of the lung.— Am. Surg., 1976, v. 42, N 1, p. 66—70.
Brock R. Lung abscess.— Oxford, 1952.
Bronet G. Les carcinoides: synthese, nosologique.— Rev. granc. Mai resp., 1973, t. 1, p. 329—334.
Buri P., Wysep J. Die bronchopleurale Tistel nach Lungenresektion.— Helv. Chir. Acta, 1976, Bd. 43, N 1—2, S. 23—25.
Cameron E. WWhitton J. Perentaneaus drainage in the treatment of Klebsiella pneumonial lung abscess.— Thorax, 1977, v. 32, N 6, p. 673—676.
Carpenter J., Covelli M. Treatment of anaerobic pleuropulmonary and soft-tissue infections.— JAMA, 1980, v. 244, N 2, p. 134—135.
Cherniack R., Cherniack L., Meimark A. Respiration in health and disese.— Philadelphia; London; Toronto, 1972.
Clagett О. T., Geraci J. E. A procedure for the management of postpneumonectomy empyema.— J. Thorac. cardiovasc. Surg., 1963, v. 45, IS 2, p. 141 —145.
Coman C., Stan A., Georgescu G. et al. Les problemes actuels des segnestrations pulmonares intra-et extra-lobaires.— Poumon et coeur. 1973, t. XXIX, В 2, p. 211—220.
Concannon J. P., Dalbow M. H., Eng С. P., Conway I. Immunoprofile Studies for Patients with Bronchogenic carcinoma.— Int. J. Radial. Oncol. Biol. Phys., 199, v. 2, N 5/6, p. 447—454.
Cordie C. Cabrol les pedirales segmentatres du poumon.— Paris, 1955, v. I, 2.
Daddi G. J. tumori primitive della pleura.— Minerva chir., 1981, t. 36, N 23/24, p. 1689—1690.
Danner P., McFarland M., Felson M. Massive pulmonary gangrene.— Am. J. Roengenol., 1968, v. 103, N 3. p. 548—554.
Diaconita G. Sur 1’histogenese des carcinosarcomes bronchopulmonaires. Etude histopathologique de 15 cas.— Morphol. Embryol. (Bucuresti), 1978, t. 24, N 4, p. 349—354.
Dumont F. A., Piche C. Electron microscopic Study of Human histoplasmosis.— Arch. Path., 1969, v. 87, N 2, p. 168.
Engelmann C„ Thamm W. Klinischen Beitrag zum diffusen Pleuramesothelion.— Zbl. Chir., 1975, Bd. 100, N 5, S. 266—276.
Eskenasy A. Primary lung sarcomas. A histopathologic study of 118 cases.— Morphol. Embryol., (Bucuresti), 1979, t. 25, № 1 p. 27.
Even F.. Caubarrere T., Boutillier J. et al. Biologie des Carcinoides des Bronches.— Rev. franc. Mai resp., 1973, t. 1, p. 239—298.
Gebauer C. Sarcome der Lungen und des Endothorax.— Prax. klin. Pneumol., 1980, Bd. 34, N. 3, S. 123—143.
Gebauer C. Zur Atiologie des primaren Lungensarkoms in Gegeniiberstellung zum Lungenkarzi-nom.—Zschr. Erkr. Atmunsorg., 1979, Bd. 152, H. 1, S. 51—60.
Giitgemann A., Kreutzberg B., Lichtenhaler /., Savic B. Ergebnisse und Erfagrungen zum Bron-chialkarzinom. Studie uber 20 Jahre.— Med. Welt, 1976, Jg. 27, N 18, S. 835—839.
(Hagglir U.) Хегглин Ю. Хирургическое обследование.— M., 1980.
Hagen Н„ Hein К. Varixknoten tm Lungulaast des Vena pulmonalis.— Forschr. Rontgenstr. Nucl. Med., 1960, Bd. 39, H. 2. S. 151 — 158.
Hansen H. H. Management of lung Cancer.— Med. Clin. N. Am., 1977, v. 61, N 5, p. 979—990.
Hardy I., Ewing H., Neely W. Lung carcinoma. Survey of 2286 cases with emphasis on small cell type.— Ann. Surg., 1981, v. 193, N 5, p. 593—596.
Heffron R. Pneumonia with Special Reference to Pneumococcus Lobar Pneumonia.— Harvard, 1979.
Hertzog P. Repair of long-term cavernostomies and parieto-pleurectomies usip myoplasty and cutaneous autoplasty.— Ann. Chir., 1980, v. 34 N 8, p. 631—635.
Jamieson M. P., Walbaum P. R., McCormack R. I. Surgical management of bronchial carcinoma invading the chest wall.— Thorax, 1979, v. 34, N 5, p. 612—615.
Johanson W. G. Aspiration pneumonia, anaerobic infections and lung abcsess.— Mes. Clin. N. Am., 1980, V. 64, N 3, p. 385—394.
Irlich G„ Schulte H., Schappei K. Behandlungsergebnisse beim Bronchialkarzinom mit histologisch positivem Befund bei der Mediastinoskopie.— Thoraxchirurgie, 1976, Bd. 24, N 5, S. 345—349.
Kaiser D. Die operative Bechandlung des Bronchialkarzinoms.— Therapiewoche, 1979, Bd. 29, N 43, S. 7213—7214.
Kessler E., Kampmann G„ Wernitsch W. Die chirurgische Behandlung des Pleuraempyems.— Thorax chirurgie, Vaskulare Chirurgie, 1974, H. 5, S. 414—420.
Lanzotti V.. Thomas A. R.. Bogle L., Smith T. Survival with Inoperable Lung Cancer. An Integration of Prognostic variables Based on Simple Clinical.— Cancer, 1977, v. 39, N 1, p. 303—313.
LeFrock J. L., Clark T., Davies B. Aspiration Pneumonia: a ten-years Review.— Am. Surg., 1979, v. 45, N 5, p. 305—313.
Lung abscess. Medical Staff Conference, University of California, San Francisco.— West. J. Med., 1976, v. 124, N 6, p. 476—482.
Maa (Sen W., Greschuchna D. Operative Behandlung des Bronchialkarzinoms.— Atemwegs. Lun-genkrg., 1891, Bd. 7, N 6, S. 343—345.
Maa Ben W., Greschuchna D. Grezen und Moglichkeiten der chirurgischen Therapie beim Bronchialkarzinom.— Med. Welt, 1982, Bd. 33, N 2, S. 310—312.
Merlier M., Rockaiuzamir A., Rojas-Miranda H. et al. Aspects anatomocliniques des sequestrations lupmonaires.— Ann. Chir. thorac. cardio-vasc., 1970, v. 24, N 19/20, p. 511—514.
Nagaishi C. Functional Anatomy and Histology of the lung.— London, 1972.
Negroni P. Histoplasmosis. Diagnosis and Treatment.— N. Y„ 1965.
Oderholt R. H„ Neptune W. B., Ashraf M. M. Primary cancer of the Lung. A 42-Year Experience.— Ann. Thorac. Surg., 1975, v. 20, N 5, p. 511—519.
381
Paulson D. L., Reisch I. S. Long-Term Survival After Resection for Bronchogenic Carcinoma.— Ann. Surg., 1976. v. 184, N 3, p. 224—332.
Pollock A. V., Leafer D. I., Evans M. Single dose intra-incisional antibiotic prophilaxis of surgical wound sepsis.— Brit. J. Surg., 1977, v. 64, N 3, p. 322—328.
Pontoppidan H., Geffin B., Lowenstein E. Acute respiratory failure in the adult.— Boston, 1973. Rafinski R. Uber die Behandlungsmoglichkeit des Spontanpneumothorax von Kindern mit einer zeitweiligen Plombirung des sogenannten Drainagebronchus.— Praxis Pneumol., 1965, Bd. 19, H. 12, S. 736—746.
Roeslin N., Witz I. P., Morand G., Irrmann-Rapp Ch. Traitement chirurgical par excisin “monobloc" des cancers bronchiques envahissant la paroi-thoracique.— Ann. Chir. Thorzc. Cardiovasc., 1976, t. 15, N 1, p. 19—24.
Roy S., Roy M., Chatterjee В. P. Etiological Aspect of Bronchopleural Fistula.— Indian J. Surg., 1971, v. 33, N 8, p. 303—312.
Scarpelli E. M. The surfactant system of the Lung.— Int. Anesth. Clin., 1977, v. 15, p. 19—60.
Schachter E., Kreisman H., Putman C. Diagnostic problems in Suppurative lung diseases.— Arch. Int. Med., 1976, v. 136, N 2, p. 167—171.
Seki S., Fukushima YGotok Y. et al. Facilitation of intratheracic operations by means of high-frequency ventilation.— J. Thorac. cardiovasc. Surg., 1983, v. 86, N 3, p. 388—397.
Sherman M. M., Subramanian V., Berger R. Z. Management of Thoracic Empyema.— Am. J. Surg., 1977, v. 133, p. 474—479.
Shields T. W. Classification and prognosis of surgically treated patients with bronchial carcinoma: analysis of vasog studies.— Int. J. Radit. Oncol. Biol. Phys., 1980, v. 6, N 8, p. 1021 —1027.
Sjostrand U. H., Smith R. B. Overview of high frequency ventilation.— Int. Anest. Clin., 1983, v. 21, N 3, p. 1 — 10.
Smith £. Lung abscess.— West. J. Med., 1976, v. 124, N 6, p. 476—482.
Symmers W. S. Histopathological observations (Fungous diseases and their treatment) /Ed. R. W. Ridell a. G. T. Stewart.— London, 1958.
Takita H. Edgerton F., Conway D. Surgical treatment of locally far-advanced lung carcinoma.— J. Surg. Res., 1981, v. 17, N 3, p. 283—286.
The biochemical Basis of pulmonary function / Ed. by R. G. Crystale.— New York, 1976.
Wagner J. C. Treatment affecting the rate of asbestos-induced mesotheliomas.— Brit. J. Cancer, 1980, v. 41, N 6, p. 918—922.
Wei-i Li, Hammar S„ Jolly Ph. et al. Unpredictable course of small cell undifferentiated lung carcinoma.— J. Thorac. Cardiovasc. Surg., 1981, v. 81, N 1, p. 34—43.
Weissberg D. Extended resections of locally advanced stage III lung cancer.— Thorac. Cardiovasc. Surg., 1981, v. 29, N 4, p. 238—241.
Willis R. Pathology of tumors.— London, 1960.
Vaghmal I. Agenesis of the lung.— Am. J. Roentgenol., 1970, v. 108, p. 564—568.
Vainrub B., Musher D., Guinn G. Percutaneous drainage of lung abscess.— Am. Rev. Resp. Dis., 1978, v. 117, N 1, p. 153—160.
Vincent R. G., Rickren I. W., Lane W. W. The changing Histopathology of Lung Cancer. A Review of 1682 cases.— Cancer, 1977, v. 39, N 4, p. 1647—1655.
Zenker R„ Heberer G., Lohr H. H. Die Lungenresektionen.— Berlin, 1954.
Surgery of the Lung and Pleura. A manual for Doctors / Ed. by 1. S. Kolesnikov and M. I. Lytkin.— Leningrad: Meditsina Publishers, 1987.— 384 p., il.
I. S. Kolesnikov — Hero of Socialist Labor, Lenin’s and State Prizes winner. Honored Scientist of the RSFSR, Full-Fledged Member of the USSR Academy of Medical Sciences; Prof. M. 1. Lytkin — Honored Scientist of the RSFSR, USSR Council of Ministers Prize winner.
The manual discusses problems of operative surgery, topographic anatomy of the lung and pleura and clinical physiology of the lung. Clinical picture, course, diagnostic procedures for pulmonary and pleural diseases requiring surgery, indications for surgical treatment risk involved in surgery, prevention and therapy for postoperative complications are also considered. Illustrations of original figures and radiograms are provided.
The manual is intended for surgeons, intensive care personnel, therapists, roentgenologists and other doctors concerned with diagnosis and treatment of pulmonary and pleural diseases requiring surgery.
ХИРУРГИЯ ЛЕГКИХ И ПЛЕВРЫ
Зав. редакцией В. Л. Ларин
Редактор В. Т. Плешаков
Рисунки выполнены художником В. В. Бабияком
Оформление художника А. И. Приймака
Художественный редактор Н. Д. Наумова
Технический редактор Э. П. Выборнова
Корректор А. Р. Лукичева
ИБ № 2741. ПРАКТИЧЕСКОЕ РУКОВОДСТВО
Сдано в набор 21.03.86. Подписано в печать 01.10.87. Формат бумаги 84Х Ю8'/1б- Бумага мелованная офсетная. Гарнитура тайме. Печать офсетная. Усл. печ. л. 40,32. Усл. кр.-отт. 87,78. Уч.-изд. л. 44,93. Тираж 20 000 экз. Заказ № 0517. Цена 6 р. 80 к.
Ленинград, ордена Трудового Красного Знамени издательство «Медицина», Ленинградское отделение.
191104, Ленинград, ул. Некрасова, д. 10.
Ленинградская типография № 3 Головное предприятие дважды ордена Трудового Красного Знамени Ленинградского производственного объединения «Типография имени Ивана Федорова» Союзполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли. 191126, г. Ленинград, ул. Звенигородская, д. 11.