Author: Болотов В.В. Жукова Т.В. Микитенко Е.Е. Свечникова Е.Н. Сыч Ю.В. Костина Т.А.
Tags: аналитическая химия химия
ISBN: 966-615-132-4
Year: 2002
Text
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ
НАЦИОНАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ УКРАИНЫ
©
В. В. Болотов, Т. В. Жукова, Е. Е. Микитенко, Е. Н. Свечникова, Ю. В. Сыч, Т. А. Костина, И. Ю. Петухова, В. П. Мороз
АНАЛИТИЧЕСКАЯ ХИМИЯ В СХЕМАХ И ТАБЛИЦАХ
СПРАВОЧНИК
Харьков Издательство НФАУ "Золотые страницы" 2002
УДК 543.06(075)
ББК 24.44я2-2
А64
Рекомендовано Научно-методической комиссией по фармации Министерства образования и науки Украины (протокол № 5 от 18.10.2001 г.)
Рецензенты: доктор фармацевтических наук, профессор В. И. Ка-бачный (Национальная фармацевтическая академия Украины); доктор фармацевтических наук, профессор В. С. Бондарь (Национальная фармацевтическая академия Украины)
Довщник мостить таблиц) та схеми, що стосуються загальних i окремих питань я^сного та к!льк!сного анализу, в!домост! про р!вноваги в гомогенних та гетерогепних системах. Наведен! приклади розв’язаппя типових задач, таблиц!, як! м!стять вщомосп для виконання розрахунюв при розв’язашп задач i проведены! лабораторных роб!т.
Призпачепо для студенпв фармацевтичпих вуз!в i факультета за спе-гцалыюстями “Фармац!я”, “Технология фармацевтичпих препарата”, “Юпшч-на фармащя”, “Технолог!# парфумсрпо-космстичних засоб!в”, “Бютехноло-пя”, “Лаборатория диагностика”.
Аналитическая химия в схемах и таблицах: Справочник для студ. А64 фармац. вузов / В. В. Болотов, Т. В. Жукова, Е. Е. Микитенко и др.;
Под общ. ред. В. В. Болотова. - X.: Изд-во НФАУ: Золотые страницы, 2002 - 172 с.
ISBN 966-615-132-4
ISBN 966-80-32-36-5 _ ,
Справочник содержит таблицы и схемы, касающиеся общих и частных вопросов качественного и количественного анализа, сведения о равновесиях в гомогенных и гетерогенных системах. Приведены примеры решения типовых задач, таблицы, содержащие сведения для выполнения расчетов при решении задач и проведении лабораторных работ.
Предназначен для студентов фармацевтических вузов и фармацевтических факультетов по специальностям «Фармация», «Технология фармацевтических препаратов», «Клиническая фармация», «Технология парфюмерно-косметических средств», «Биотехнология», «Лабораторная диагностика».
УДК 543.06(075)
ББК 24.44я2-2
ISBN 966-615-132-4
ISBN 966-80-32-36-5
© Болотов В.В., Жукова Т.В., Микитенко Е.Е. и др., 2002
© НФАУ, 2002
СОДЕРЖАНИЕ
ВВЕДЕНИЕ........................................................6
КАЧЕСТВЕННЫЙ АНАЛИЗ.............................................7
Таблица 1. Структура современной аналитической химии............8
Таблица 2. Классификация методов анализа в зависимости от количества анализируемого вещества..............................9
Таблица 3. Типы качественною анализа............................9
Таблица 4. Аналитические признаки реакций......................10
Таблица 5. Методы аналитической классификации катионов.........10
Таблица 5.1. Классификация катионов по сероводородному методу анализа................................................11
Таблица 5.2. Классификация катионов по кислотно-основному методу анализа...............................................12
Таблица 5.3. Классификация катионов но аммиачно-фосфатному методу анализа...............................................12
Таблица 6. Систематический ход анализа катионов I аналитической группы.........................................13
Схема 1. Схема систематического хода анализа катионов I аналитической группы.........................................14
Таблица 7. Систематический ход анализа катионов II аналитической I руппы .......................................15
Схема 2. Схема систематического хода анализа катионов II аналитической группы.................................16
Таблица 8. Систематический ход анализа катионов III аналитической группы........................................17
Схема 3. Схема систематического хода анализа катионов III аналитической группы................................19
Таблица 9. Систематический ход анализа катионов IV аналитической группы ...................................... 20
Схема 4. Схема систематического хода анализа катионов IV аналитической 1руппы.........................................22
Таблица 10. Систематический ход анализа катионов V аналитической группы .........................................23
Схема 5. Схема систематического хода анализа катионов V аналитической группы..........................................25
Таблица 11. Систематический ход анализа катионов VI аналитической группы ........................................26
Схема 6. Схема систематического хода анализа катионов VI аналитической группы.........................................28
Таблица 12. Этапы систематическою хода анализа смеси катионов J-VI аналитических групп без осадка.............................29
Схема 7. Схема анализа смеси катионов I- VI аналитических групп без осадка..............................................36
Таблица 13. Аналитическая классификация анионов, основанная па различной растворимости солей Ва2+ и Ag+........................37
Таблица 14. Анноны, образующие газообразные продукты при действии сильных кислот.........................................37
Таблица 15. Классификация анионов по окислительно-восстановительным свойствам........................38
Таблица 16. Реагенты, используемые для дробного обнаружения
анионов I-III группы и соответствующие продукты реакций......................................39
Таблица 17. Реакции катионов II-VI аналитических групп при приготовлении содовой вытяжки....................................42
Таблица 18. Систематический ход анализа смеси серусодержащих анионов.........................................................43
Схема 8. Схема анализа SO/ , SO32', S2O32 S2‘ при их совместном присутствии.....................................................44
Таблица 19. Систематический ход анализа смеси i ало1 енид-иоиов.45
Схема 9. Схема анализа смеси галогенид-ионов (СГ, Вт", Г).......46
Таблица 20. Система гический ход анализа смеси азотсодержащих анионов.........................................................47
Схема 10. Схема анализа смеси анионов: NO2’, NO3’...............48
Равновесия в растворах электролитов.............................49
Равновесия в растворах кислот и оснований.......................53
Равновесия в гетерогенных системах..............................57
Равновесия в растворах гидролизующихся солей....................59
Равновесия в буферных растворах.................................62
Равновесия в растворах комплексных соединений...................65
Окислительно-восстановительные процессы.........................67
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ...........................................71
Схема 1. Классификация методов количественного анализа..........72
Схема 2. Классификация титриметрических методов анализа по типу химической реакции, лежащей в основе метода.............73
Схема 3. Классификация титриметрических методов анализа по способу титрования...........................................74
Схема 4. Классификация титриметрических методов анализа по способу фиксирования точки эквивалентности...................75
Таблица 1. Гравиметрический метод анализа.......................76
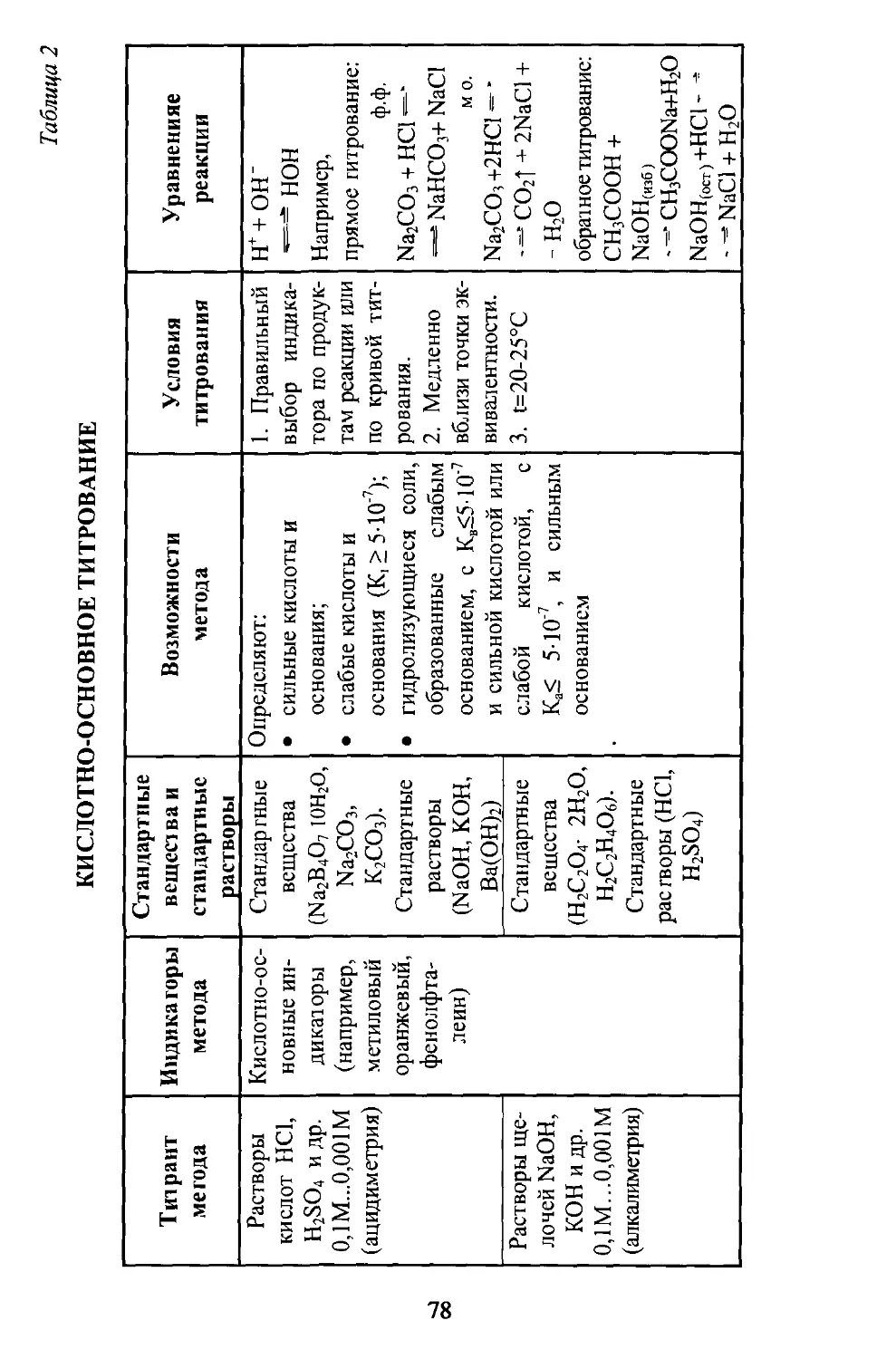
Таблица 2. Кислотно-основное титрование.........................78
Таблица 3. Осадительное титрование..............................79
Таблица 4. Меркуриметрическое титрование........................81
Таблица 5. Комплексоиометрическое [икроваиие................... 82
Схема 5. Методы окислительно-восстановительного титрования......84
Таблица 6. Перманганатометрнческое титрование...................85
Таблица 7. Йодометрическое гигрование...........................86
Таблица 8. Йодхлориметрическое тироваине........................88
Таблица 9. Броматометрическое титрование........................89
Таблица 10. Нигритометрическое титрование.......................90
Таблица 11. Хроматомегрическое титрование.......................91
Таблица 12. Периметрическое титрование..........................92
Расчетные формулы в титриметрическом анализе....................93
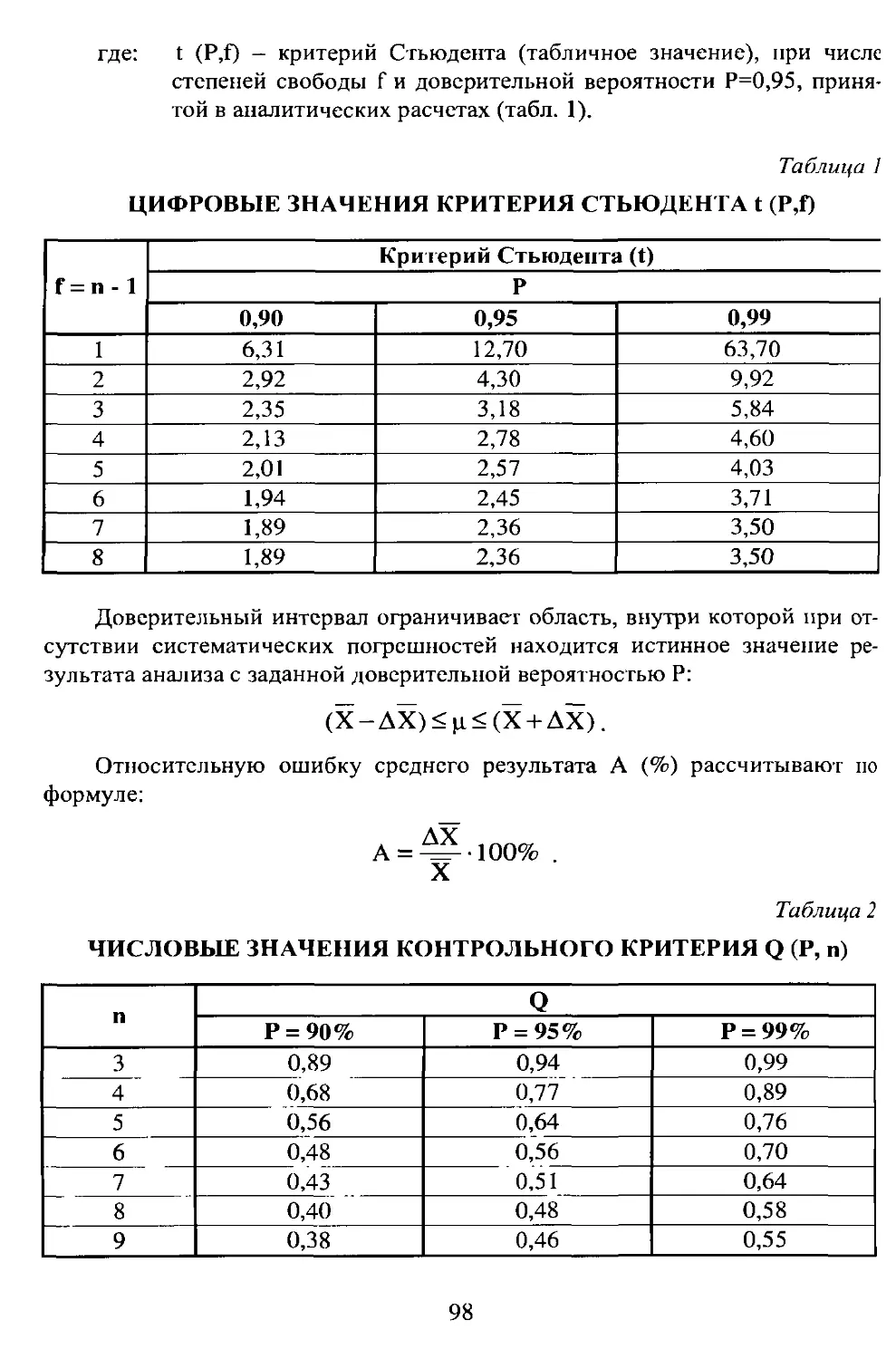
Примеры решения типовых задач по геме «Статистическая обработка результатов»..........................97
Основные статистические характеристики....................... 97
Оценка доверительного интервала результатов анализа...........97
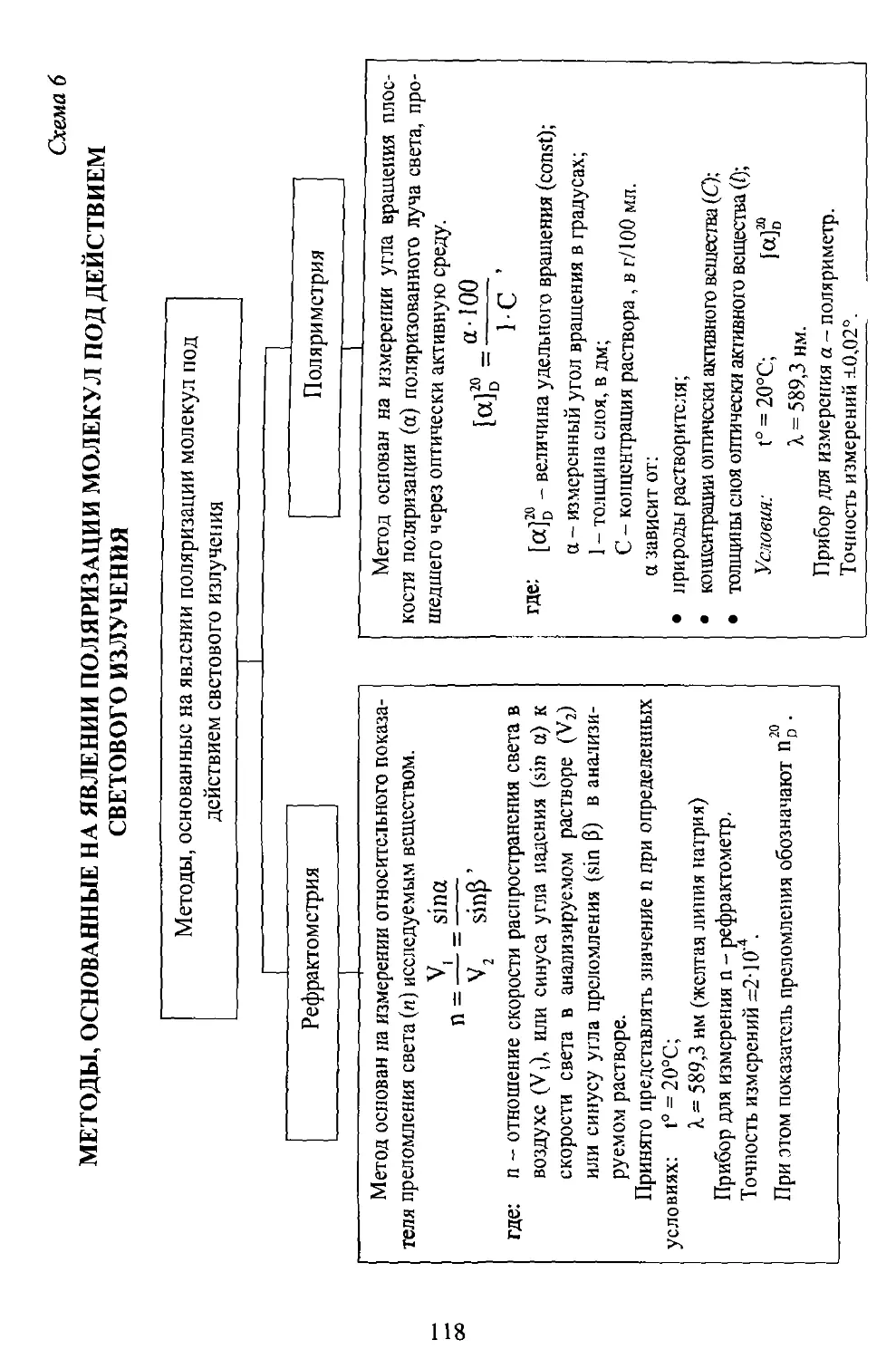
Оптические методы анализа......................................102
Схема 1. Классификация оптических методов анализа..............102
Схема 2. Методы молекулярно-абсорбционного анализа.............103
4
Таблица 1. Характеристика методов колориметрии и фогоэлектроколоримегрии.......................................104
Таблица 2. Применение ИК- и УФ-спектроскопии в анализе...........105
Схема 3. Классификация колебательных ИК-спектров.................106
Основные термины и понятия в методах спектроскопии...............107
Таблица 3. Характеристические частоты колебаний некоторых структурных элементов и углерод-углеродных связей в ИК-области...........................................108
Таблица 4. Длины волн спектра и соотве!ciвующие им окраски.......111
Таблица 5.......................................................111
Таблица 5.1....................................................111
Схема 4. Эмиссионные методы анализа.............................112
Таблица 6. Эмиссионный спектральный анализ......................113
Таблица 7. Эмиссионная пламенная фотометрия......................114
Таблица 8. Флуориметрия..........................................115
Схема 5. Методы, основанные на измерении интенсивности света при взаимодействии со взвешенными частицами в растворе........116
Таблица 9. Способы количественного определения в методах турбидиметрии и нефелометрии...................................117
Схема 6. Методы, основанные па явлении поляризации молекул под действием светового излучения.........................118
Таблица 10. Возможности методов рефрактометрии и поляриметрии...119
Основные методы определения концентраций в фотометрии............120
Таблица 11. Показатели преломления спирто-водных растворов, концентрация которых выражена в об.%..........................123
Таблица 12. Факторы показателей преломления (F) водных растворов лекарственных средств с весо-объемной кон цен грацией..........124
ПРИЛОЖЕНИЯ.......................................................129
Таблица 1. Ионное произведение воды Кн2о при различной температуре.................................................. 130
Таблица 2. Плотность и концентрация некоторых растворов кислот и шелочей (t=20°C)............................................130
Таблица 3. Константы ионизации кислот (константы кислотности)...134
Таблица 4. Константы ионизации оснований (константы основности) .136
Таблица 5. Буферные смеси........................................137
Таблица 6. Термодинамические (ПРТ) и концентрационные (ПРК) произведения растворимости, растворимость (S) некоторых электролитов .......................................140
Таблица 7. Стандартные окислительные потенциалы в водных растворах по отношению к водородному электроду................144
Таблица 8. Комплексы с neopi аиическими лигандами и их константы устойчивости (р) .............................................155
Таблица 9. Комплексы с органическими лигандами и их константы устойчивое!и (р) ............................................ 159
Таблица 10. Вычисление результатов титриметрических определений.161
Таблица 11. Характеристики кислот ио-основпых индикаторов........164
Таблица 12. Характеристики адсорбционных индикаторов.............165
Таблица 13. Характеристики металлохромных индикаторов............166
Таблица 14. Характеристики окислительно-восстановительных индикаторов...................................................170
ЛИТЕРАТУРА.......................................................171
5
ВВЕДЕНИЕ
Аналитической химии отводится важное место в системе подготовки специалистов с высшим фармацевтическим образованием, т.к. она является основой для изучения таких специальных дисциплин, как фармацевтическая химия, фармакогнозия, технология лекарств и др.
Одним из факторов, способствующим усвоению материала но любой дисциплине, является наглядность в преподавании. При изучении аналитической химии значительная доля времени отводится разнообразным методам вычислений, относящихся к химическому анализу. Обучение этим методам сводится в основном к самостоятельной работе студентов и требует наличия разнообразного фактического справочного материала.
Справочники по аналитической химии (например, Ю.Ю.Лурье "Справочник по аналитической химии".— М.: Изд. «Химия», 1989) стали к настоящему времени библиографической редкостью.
Предлагаемый справочник составлен группой преподавателей кафедры аналитической химии Национальной фармацевтической академии Украины.
Справочник состоит из трех разделов: качественный анализ, количественный анализ, приложения.
В разделе качественный анализ приведены в виде схем данные, касающиеся общих вопросов аналитической химии, таблицы и схемы по систематическому качественному анализу катионов (кислотно-основный метод), анализу анионов, основные сведения и примеры расчетов равновесий в гомогенных и гетерогенных системах, а также задачи для самостоятельной работы.
Раздел количественный анализ включает схемы, отражающие классификацию методов анализа, и таблицы с основными сведениями о классической титримегрии и гравиметрии.
Приведены основные расчетные формулы по объемному и гравиметрическому анализу, основные сведения и примеры расчетов по статистической обработке результатов количественных определений. В заключительной части этого раздела приведены основные данные по оптическим методам анализа и необходимый для расчетов информационный материал.
В разделе приложения приведены таблицы, содержащие фактический материал, необходимый при проведении химико-аналитических определений.
Справочник содержит лишь минимум необходимых сведений по аналитической химии и для освоения предмета студенты должны пользоваться соответствующими учебниками, руководствами, монографиями.
6
качественный анализ
Таблица 1
СТРУКТУРА СОВРЕМЕННОЙ АНАЛИТИЧЕСКОЙ ХИМИИ
8
Таблица 2
КЛАССИФИКАЦИЯ МЕТОДОВ АНАЛИЗА В ЗАВИСИМОСТИ ОТ КОЛИЧЕСТВА АНАЛИЗИРУЕМОГО ВЕЩЕСТВА
Название метода анализа Анализируемое вещество
масса пробы, г объем Пробы, мл
Макроанализ Грамм-метод 1-10 10-100
Полумикроанализ Сантиграмм-метод 0,05-0,5 1-10
Микроанализ Милл шрамм-метод 0,01-10'6 0,1-10'4
Ультрамикроанализ Микрограмм-метод 1(Г6-10'9 104-10'6
Субмикроанализ 11анограмм-метод 10’9-1()'2 1О’7-1О10
Таблица 3
ТИПЫ КАЧЕСТВЕННОГО АНАЛИЗА
Дробный анализ Систематический анализ
В дробном анализе состав вещества определяют специфическими реакциями, которые позволяют обнаружить анализируемый ион в присутствии других ионов В систематическом анализе сложную смесь ионов сначала разделяют с помощью групповых реагентов на несколько отдельных групп, затем в пределах каждой Еруппы обнаруживают отдельные ионы характерными реакциями, в определенной последовательности Групповой реагент - это реагент, который используют для обнаружения и отделения аналитической ipyппы ионов Требования к групповому реагенту: 1. Должен отделять ионы группы практически полностью СоСт<10 5 моль-л’1 2. Отделенная под действием группового реагента аналитическая группа должна легко подвергаться аналитической обработке 3. Избыток 1руппового реагента не должен мешать дальнейшему анализу
9
Таблица 4
АНАЛИТИЧЕСКИЕ ПРИЗНАКИ РЕАКЦИЙ
Аналитические признаки Пример
1. Образование характерного осадка 3Fez+ + 2[Fc(CN)6]3' а lFe3[Fe(CN)6]2 (свсжеосажденный синий осадок)
2. Изменение окраски раствора Cu2+ + 4NH3 * [Cu(NII3)4]2+ (голубой раствор)
3. Выделение газа FeS + 2Н+ te Fe2+ + |H2S (характерный запах)
4. Выделение или поглощение тепла HCN + NaOH -> NaCN + Н2О (с выделением тепла) CaSO4 + 2Н2О -> CaSO4*2H2O (с поглощением тепла)
Таблица 5
МЕТОДЫ АНАЛИТИЧЕСКОЙ КЛАССИФИКАЦИИ КАТИОНОВ
Метод анализа На чем основан метод анализа
Сероводородный метод анализа (табл.5.1) Кислотно-основной метод анализа (табл.5.2) Аммиачно-фосфатный метод анализа (табл.5.3) На различной растворимости сульфидов ме-т аллов Па различном отношении катионов к кислотам (НС1, H2SO4) и основаниям (NaOH, NH3- Н2О) На различной растворимости фосфатов катионов в воде и растворе аммиака
10
Таблица 5.1
КЛАССИФИКАЦИЯ КАТИОНОВ
ПО СЕРОВОДОРОДНОМУ МЕТОДУ АНАЛИЗА
Группа Катионы Групповой реагент Растворимость соединений
I К+, Na+, NH4+, Mg2+ Отсутствует Сульфиды, карбонаты , хлориды и гидроксиды , растворяются в воде
II Ва2+, Sr2+, Са2+ (NH4)2CO3, NH3 H2O+NH4C1, pH=9,25 Карбонаты, не растворяются в воде
III Fe2+, Fe3+, Cr3+, Al3+, Mi?, Ni2+, Zn2+, Co2+, (NH4)2s, NH3H2O4-NH4C1, pH=9,25 Сульфиды, нс растворяются в воде , но растворяются в разбавленных минеральных кислотах
IV Cu2+, Hg2+, Bi3+, Sn2+, Sn (IV), Sb (III), Sb (V), As (III), As (V) H2S, HC1, pH=0,5 Сульфиды, не растворяются в воде и разбавленных минеральных кислотах
V Ag+, Pb2+, Hg22+ HC1 Хлориды, не растворяются в воде и разбавленных минеральных кислотах
* - исключая Mg +.
** - сульфиды Сг3+, А13+ разлагаются водой и в растворе не существуют.
11
Таблица 5.2
КЛАССИФИКАЦИЯ КАТИОНОВ
ПО КИСЛОТНО-ОСНОВНОМУ МЕТОДУ АНАЛИЗА
Группа Катионы Групповой реагент Растворимость соединений
1 Na+, К+, NH4+ Отсутствует Хлориды, сульфаты и гидроксиды, растворяются в воде
И Ag+, Pb+, Hg22* HC1 2M р-р Хлориды, нс растворяются в воде
III Ba2*, Sr2*, Ca2* H2SO4 1М р-р + + C2H5OH Сульфаты, не растворяются в воде
IV Al3*, Zn2*, Cr3*, Sn (II), Sn (IV), As (III), As (V) Избыток конц. NaOH 6М р-р + + 3% Н2О2 Гидроксиды нс растворяю гея в воде, но растворяются в избытке щелочи
V Fe2*, Fe3*, Mg2*, Mn2*, Bi3*, Sb (III), Sb (V) Избыток конц. NH3-H2O Гидроксиды, не растворяются в воде, избытке щелочи и аммиаке
VI Co2*, Ni2*, Cd2*, Cu2*, Hg2* Избыток конц. NH3H2O Гидроксиды, не растворяются в воде, избытке щелочи, но растворяются в избытке аммиака
Таблица 5.3
КЛАССИФИКАЦИЯ КАТИОНОВ ПО АММИАЧНО-ФОСФАТНОМУ МЕТОДУ АНАЛИЗА
Группа Катионы Групповой реагент Растворимость соединений
I Ag*, Pb2*, Hg?* HC1 Хлориды, не растворяются в воде
II Sn2+, Sn (IV), Sb (III), Sb (V) HNO3 Мстасурьмяная и метаоло-вянная кислоты, не растворяются в воде
III Ba2*, Sr2*, Ca2+, Mg2*, Mn2+, Fe2', Al3', Cr3', Fe3* (NH4)2HPO4, конц. NH3 H2O Фосфаты, не растворяются в воде и в избытке раствора аммиака
IV Cu2*, Cd2*, Hg2*, Co2*, Ni2*, Zn2* (NH4)2HPO4, конц. NH3-H2O Фосфаты, не растворяются в воде, но растворяются в избы тке рас твора аммиака
V Na*,K*,NH4* Отсутствует Хлориды, нитраты и фосфаты, растворяются в воде
12
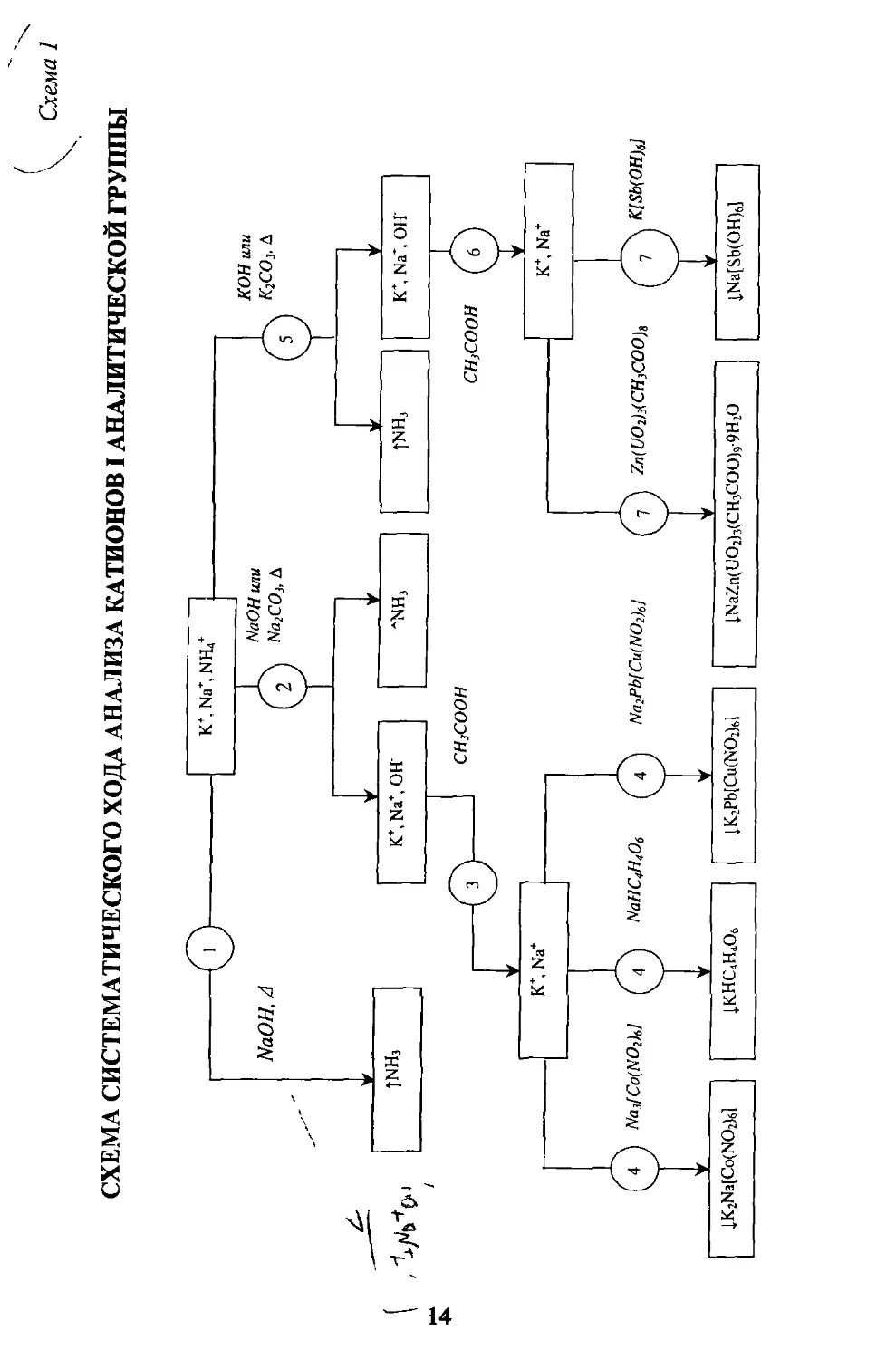
Таблица 6
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА КАТИОНОВ I АНАЛИТИЧЕСКОЙ ГРУППЫ
К+, Na+, NH?
№ этапа Этапы исследования
1 Обнаружение ионов NI14+ в отдельной пробе действием раствора щелочи при нагревании: NaOH, Д NH/ > NH3?
2 Удаление ионов NH4+ из отдельной пробы перед обнаружением ионов К+ действием раствора NaOH или Na2CO3 при нагревании: NaOH (Na2CO3), Д NHZ > NH3T
3 Нейгрализация раствора 2 уксусной кислотой.
4 Обнаружение ионов К+ в растворе 3 реагентами NaHC4H4O6, Na3[Co(N02)6] , Na2Pb[Cu(NO2)6] : NaHC4H4O6 К+ > KHC4H4O6X Na3[Co(N02)6J К+ > K2NafCo(NO2)6]>L Na2Pb[Cu(NO2)6] K+ > K2Pb[Cu(NO2)6]l
5 Удаление ионов NH4+ из отдельной пробы перед обнаружением ионов Na+ действием раствора КОН или К2СО3 при нагревании: КОН (К2СО3), Д NH/ > NH3T
6 Нейтрализация раствора 5 уксусной кислотой.
7 Обнаружение ионов Na+ в растворе 6 реагентами K[Sb(OH)6], Zn(UO2)3(CH3COO)8: K[Sb(OH)6] Na+ > Na[Sb(OH)6]J, Zn(UO2)3(CH3COO)8 Na+ > NaZn(UO2)3(CH3COO)9- 9H2O1
13
Схема 1
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ I АНАЛИТИЧЕСКОЙ ГРУППЫ
Таблица 7
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА КАТИОНОВ II АНАЛИТИЧЕСКОЙ ГРУППЫ
Ag+, Pb2+, Hg22+
№ этапа Этапы исследования
1 Осаждение катионов II аналитической iруппы действием 2М НО: НС1 Ag* > AgCl J- IlPAgCi = 1,78-10"’ НС1 Pb2+ > PbCl2i FlPpbCi; =1,6-1 O'5 HC1 Hg22' >Hg2Cl2l nPHg2Ch=l,31018 Промывание осадка водой, содержащей IIC1
2 Отделение катионов свинца промыванием осадка 1 горячей водой: Н2О, А PbCl2i > Pb2+
3 Обнаружение катионов РЬ2+ в центрифугате 2 действием растворов К2СгО4 или KI: К2СгО4 РЬ2+ > РЬСгОД KI РЬ2+ —> Pbl2i
4 Отделение катионов Ag+ и обнаружение катионов I Ig22+ действием на осадок 2 раствора NH3: NH3 Н2О AgCli > [Ag(NH3)2]+ + СГ (раствор) NH3- Н2О Hg2ClJ > |HgNH2]Cli + Hgi
5 Обнаружение катионов Ag+ действием на раствор 4 конц.НМ03: конц. HNO3 [Ag(NH3)2]+ + СГ AgCli
15
Схема 2
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ II АНАЛИТИЧЕСКОЙ ГРУППЫ
16
Таблица 8
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА КАТИОНОВ III АНАЛИТИЧЕСКОЙ ГРУППЫ
Ва2+, Sr2+, Са2+
№ этапа Этапы исследования
1 Осаждение катионов III аналитической группы действием 1М H2SO4 в присутствии C2H5OII при нагревании: H2SO4, А Ва2+ >BaSO4X nPBaso4=1,11010 H2SO4, Д Sr2+ > SrSO4>L nPsrso4=3,210'7 H2SO4, C2H5OII, A Ca2+ > CaSO4J- nPcaSO4=2,5 10'5 Промывание осадка водой, содержащей H2SO4
2 Переосаждение осадков сульфатов катионов III аналитической группы в осадки их карбонатов действием насыщенного раствора Na2CO3 при кипячении: Na2CO3, А BaSOj > BaCO3J- ПРваСО3=4,0Ю10 Na2CO3, А SrSO4i > SrCO3J- nPsrCOj-l.llO'10 Na2CO3, Д CaSO4i > СаСОзХ ПРсаСО}-3,8-10 9 Промывание осадка водой
3 Растворение осадка 2 действием раствора СИ3СООН: СН3СООП ВаСОзХ > Ва2+ СНзСООН SrCOji > S?+ СН3СООН СаСО.,Х > Са2+
1 Чвц101*альи?!
Продолжение табл. 8
№ этапа Этапы исследования
4 5 6 7 Обнаружение катионов Ba2t в отдельной порции раствора 3 действием раствора К2СгО4: К2СгО4 Ва2+ > ВаСгОД Если присутствие Ва2+ доказано, то его отделяют из раствора 3 действием раствора К2СгО4 Обнаружение катионов Sr2+ в отдельной порции центрифугата 4 действием насыщенного раствора кальция сульфата (гипсовая вода): нас. раствор CaSO4 Sr2+ > SrSOj гипсовая вода Отделение катионов Sr2+ из центрифугата 4 действием конц. раствора (NH4)2SO4: koiiu.(NH4)2S04 Sr2+ > SrSOj kohu.(NH4)2SO4 Ca2t »|Ca(SO4)2J2' Обнаружение катионов Ca2+ в цен грифугаге 6 действием раствора (NH4)2C2O4: (NH4)2C2O4 Са2+ > CaC2O4i СНзСООН
18
Схема 3
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ III АНАЛИТИЧЕСКОЙ ГРУППЫ
19
Таблица 9
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА КАТИОНОВ IV АНАЛИТИЧЕСКОЙ ГРУППЫ
Al3+, Zn2+, Сг3+, Sn2+, Sn (IV), As (III), As (V)
№ этапа Этапы исследования
I Обнаружение ионов As (III), As (V) в отдельной пробе действием металлического цинка в среде НС1: Zn; НС1 As (III), (V) > AsH3? AsH3T Бумажка, смоченная AgNO3 > AgsL (черный) 1 (реакция Гутцайта) ’ AsII3| AsH(HgCl)2| Бумажка, смоченная [HgCl2]“ (реакция Зангер-Блека) As(HgCl)3] As2Hg3| (желто-бурый)
2 Действие избытка 6М NaOII в присутствии Н2О2 на катионы IV аналитической группы при нагревании: NaOH изб. NaOH А13+ > А1(ОН)Д > [А1(ОН)6]3' NaOH изб. NaOH Zn2+ > Zn(OH)2i > [Zn(OH)4]2' NaOH изб. NaOH, H2O2, A Cr3+ > Cr(OH)3X > CrO42 NaOH изб. NaOH, H2O2, Д Sn2+ > Sn(OH)2i > [Sn(OH)6|2‘ NaOH изб. NaOH Sn (IV) > Sn(OH)4X > [Sn(OH)6]2 NaOH H2O2, A As (III) > AsO33 > AsO43’ NaOH H2O2, A As (V) > AsO43' > AsO43‘
20
Продолжение табл. 9
№ этапа Этапы исследования
3 Отделение гидроксоанионов [А1(ОН)6]3; [Sn(OH)6]2' из раствора 2 действием кристаллического NH4C1 при нагревании: nh4ci, а [А1(ОН)6]3' > А1(ОН)3Х NH4C1, а [Sn(OH)6]2' > Sn(OH)4>l
4 Растворение осадка 3 действием 2М НС1: НС1 А1(ОН)3>1 > А13+ НС1 Sn(OH)J > [SnCl6]2
5 Обнаружение ионов А13* действием на раствор 4 ализарина или натрия ацетата: НО ОН Х А1 Ализарин, NII4OH А13+ > | | О CH3COONa А13+ > А1(ОН)2СН3СОСй
6 Выявление ионов Sn (IV) действием раствора соли ртути (II) на раствор 4, предварительно прокипяченный с железными стружками в среде НС1: Fc, НС1; A HgCl2 [SnCl6]2 > Sn2+ > HgX
7 Обнаружение катионов Zn2+ в центрифугатс 3 действием раствора дитизона, или K4[Fe(CN)6]: C6H5-N:., /C=N-NH-C6H5 ДИТИЗОН II \ .S 1 [Zn(NH3)4]2+ > N N I \ I' C6H5-NH-N=CZ ':n“C6h5 K4[Fe(CN)6] [Zn(NH3)4]2+ > K2Zn3[Fe(CN)6]2i
21
Схема 4
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ IV АНАЛИТИЧЕСКОЙ ГРУППЫ
22
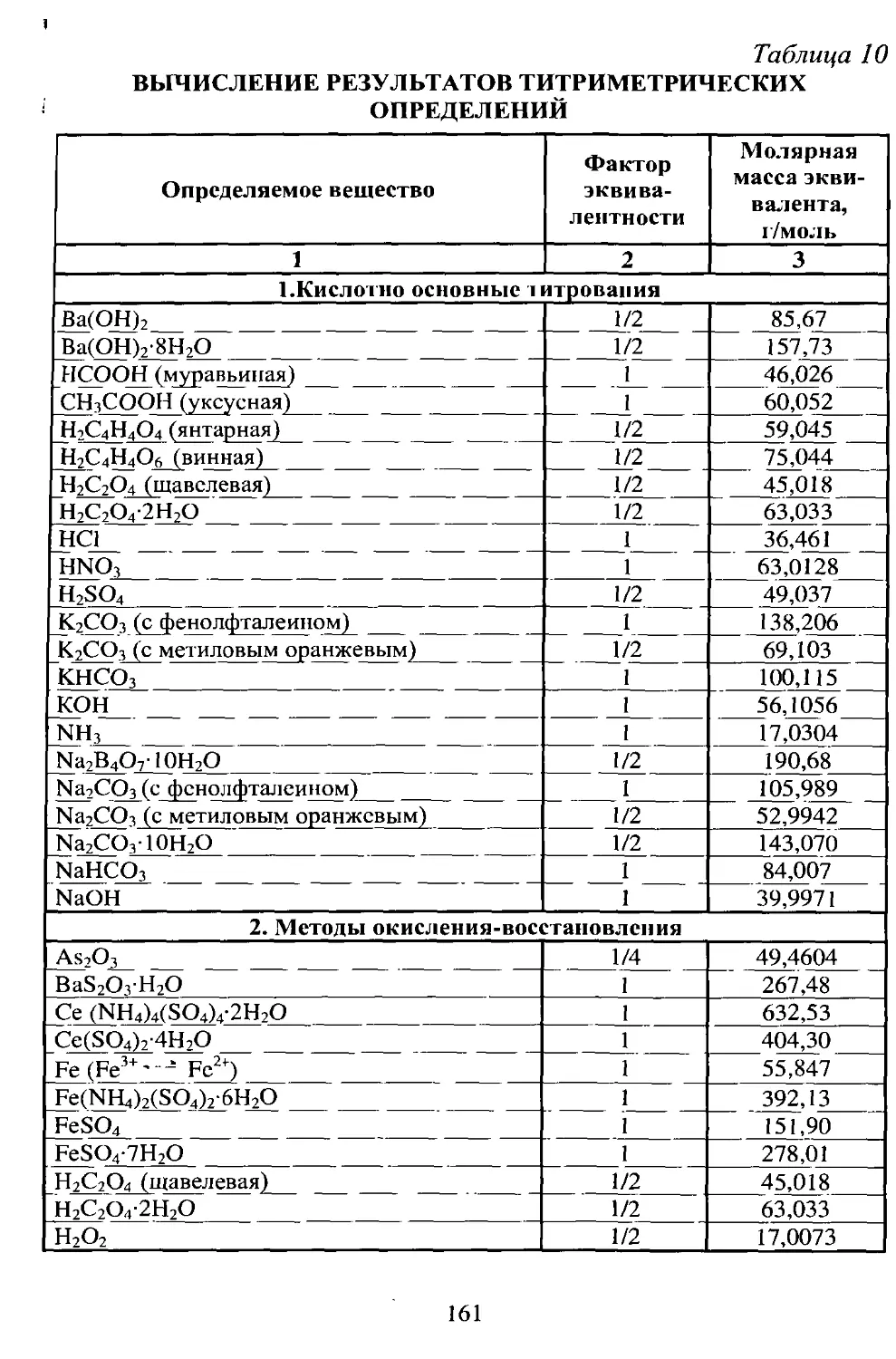
Таблица 10
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА КАТИОНОВ V АНАЛИТИЧЕСКОЙ ГРУППЫ
Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb (III), Sb (V)
№ этапа Этапы исследования
1 Обнаружение ионов Fe (II), Fe (III) в отдельной пробе с реагентами Кз[Гс(СЫ)б] и КДРе(СМ)6] соответственно: K3[Fe(CN)6] Fe2+ > Fe3[Fe(CN)6]2i K4[Fe(CN)6] Fe3+ > Fc4[Fe(CN)6]4i
2 Отделение ионов Sb (III) и Sb (V) действием HNO3 c H2O2: HNO3 Sb (III), Sb (V) HSbO3J, HNO3 Fc2+ Fe3+
3 Растворение осадка 2 в растворе НС1: НС1 HSbOji > [SbCl6r
4 Обнаружение ионов Sb (V) в растворе 3 действием цинка на никелевой пластинке: Zn [SbCl6] >Sbi
5 Осаждение катионов V аналитической группы из центрифугата 2 действием конц. NH3 H2O: NH3 - Н2О Mg2+ > Mg(OH)2J< NH3 • I12O Мп2* > Mn(OII)2i NH3 • H2O Fe3+ > Fe(OH)3J< NH3 H2O Bi3+ > BiONOj
23
Продолжение табл.М
№ этапа Этапы исследования ।
6 Отделение катионов Mg2+ действием на осадок 5 раствором NH4C1 + 3% р-р Н2О2: NH4CI | Mg(OH)2i > Mg2+ 3% Н2О2 Мп(ОН)2Ф > MnO2nH2Oj, Состав осадка 6: MnO2nII2Oj,, BiONO3, Fe(OH)3
7 Обнаружение ионов Mg2+ в центрифугате 6 действием Na2HPO4 в присутствии аммиачного буферного раствора: Na2HPO4, NH3-H2O + NH4CI Mg2+—— —- — —>MgNII4PO4>L _
8 Отделение катионов Bi3+ и Fe3+ действием раствора HNO3 на осадок 6; HNO3 BiONO3l > Bi3+ HNO3 Fe(OH)3X > Fe3+ В осадке MnO2nH2Oj,
9 Растворение осадка MnO2 • n H2O, полученного по п.8, действием раствора HNO3 в присутствии Н2О2: HNO3; Н2О2 МпО2 • п Н2Оф > Мп +
10 Обнаружение ионов Мп2' действием на раствор 9 (NII4)2S2O8: (NH4)2S2O8; HNO3; AgNO3
Мп2 > MnO4
И Обнаружение ионов Bi3+ в центрифугате 8 действием свежеприготовленного [8п(ОН)б]4-: [Sn(OH)6]4' Bi3+ > BiJ,
24
Схема 5
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ V АНАЛИТИЧЕСКОЙ ГРУППЫ
35
Таблица 11
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА КАТИОНОВ VI АНАЛИТИЧЕСКОЙ ГРУППЫ
Cu2+, Hg2+, Со2+, Ni2+
№ этапа Этапы исследования
1 * 2* 3* Взаимодействие катионов VI аналитической 1руппы с групповым реагентом (изб. NH3-H2O): изб. NH3H2O Cu2+ > [Cu(NH3)4]2+X изб. NH3 H2O Hg2+ > [Hg(NH3)4J2+i изб. NH3 H2O Co2+ > ICo(NH3)6]2+1 изб. NH3H2O Ni” - ~ [Ni(NH3)6l2T Разрушение аммиакатов действием 2M H2SO4 Отделение ионов Cu2+ и Hg2+ от других катионов VI аналитической группы действием Na2S2O3 на раствор 2: Na2S2O3; А Си2+ > Cu2Sl Na2S2O3; А Hg2+ > HgSl
4 Отделение Cu2S от HgS при частичном растворении осадка 3 в разб. HNO3 при нагревании: HNO3; А Cu2Sl >Cu2+
5 Обнаружение ионов Си2+ в растворе 4 действием конц. NH3H2O: NH3H2O Cu” — > [Cu(NH3)4]2+
6 Растворение осадка 4 действием бромной воды в присутствии IIC1, или в царской водке: Br2; НС1 HgSi > [HgCI2J + si конц. HNO3, конц. НС1 Hgsi > |Hgci2]
7 _ Отделение [HgCl2] от Si центрифугированием
26
№ этапа
8
10
Продолжение табл. 11
__________Эганы исследования _____________ ______________
Обнаружение ионов Hg2+ в центрифугатс 7 действием раствора SnCl2:
9
SnCl2
________________fHgCl2[^^ ____________________________
Обнаружение ионов Со2+ в центрифугате 3 действием раствора
NH4SCN в присутствии амилового спирта:
NH4SCN
Со2+--------> (NH4)2[Co(SCN)4]
_____________________С5НцОН___________________________
Обнаружение ионов Ni2+ в центрифугатс 3 действием реактива Чугаева (димстилглиоксима):
ОНО
диметилглиоксим
Ni2+---------------->-
Ni
он-о
*Этапы 1-3 выполняют в систематическом ходе анализа смеси катионов I-IV аналитических групп.
27
Схема t
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ VI АНАЛИТИЧЕСКОЙ ГРУППЫ В ПРИСУТСТВИИ КАТИОНОВ ДРУГИХ АНАЛИТИЧЕСКИХ ГРУПП
28
Таблица 12
ЭТАПЫ СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА СМЕСИ КАТИОНОВ I-VI АНАЛИТИЧЕСКИХ ГРУПП БЕЗ ОСАДКА
№ этапа Этапы исследования
1 Обнаружение ионов NH4+ в отдельной пробе действием раствора щелочи при нагревании: , NaOH, А NH4+ > NH3?
2 — 3 Обнаружение ионов железа (11) в отдельной пробе действием раствора K3[Fe(CN)6]: K3[Fe(CN)6] Fe2+ > Fe3[Fe(CN)6]2>L Обнаружение ионов железа (III) в отдельной пробе действием раствора K4[Fe(CN)6]: K4[Fe(CN)6] Fe3+ > Fc4[Fe(CN)6|3>L
4 Удаление ионов NH4+ из отдельной пробы перед обнаружением ионов К+ действием раствора Na2CO3 при нагревании: Na2CO3, А NH4+ > NH3? Na2CO3, А Me + > осадки оксидов, гидроксидов, карбонатов и основных солей катионов II, III, V, VI аналитических групп
5 Нейтрализация раствора 4 раствором СН3СООН до рН~7. При этом разрушаются гидроксоанионы IV аналитической группы и образуют осадок, который отделяют центрифугированием и в дальнейшем анализе нс используют: СН3СООН [Мс(ОН)6]6 п > Ме(ОН)Д
6 Обнаружение ионов К+ в растворе 5 реагентами NaIIC4H4O6, Na3[Co(NO2)6] , Na2Pb[Cu(NO2)6] : NaHC4H4O6 к+ > KHC4H4O61 Na3[Co(NO2)6] К+ > K2Na[Co(NO2)6]J- Na2Pb|Cu(NO2)6] K+ > К2РЬ[Си(КЮ2)6Д
29
Продолжение табл. 1
№ этапа Этапы исследования
7 Удаление иоиов NH4+ из отдельной пробы перед обнаружением ионов Na+ действием раствора К2СО3 при нагревании: К2СО3, Д NH? > NH3T К2СО3, Д Me + > осадки оксидов, гидроксидов, карбонатов и основных солей катионов II, 111, V, VI аналитических групп
8 Нейтрализация раствора 7 раствором CII3COOH до рН~7. При этом разрушаются гидроксоанионы IV аналитической 1руппы и образуют осадок, который отделяют центрифугированием и в дальнейшем анализе не используют: СН3СООН [Ме(ОН)6Г" > Ме(ОН)п1
9 Обнаружение ионов Na+ в растворе 8 реагентами K[Sb(OH)6], Zn(UO2)3(CH3COO)8: KfSb(OH)6] Na+ > Na[Sb(OH)6]J- Zn(UO2)3(CH3COO)8 Na+ > NaZn(UO2)3(CH3COO)9- 9H20i
10 Отделение катионов II аналитической 1руппы из исходного раствора действием 2М раствора НС1: НС1 Ag+ > AgCli НС1 Pb2+ > РЬС12Х HC1 Hg22+ —> Hg2cU
Промывание осадка водой, содержащей НС1.
11 Исследование осадка 10 проводят по схеме систематического
хода анализа смеси катионов II аналитической группы
30
Продолжение табл. 12
№ этапа Этапы исследования
12 Осаждение катионов III аналитической группы, и ионов РЬ2+ из центрифугата 10 действием раствора H2SO4 в присутствии С2Н5ОН при нагревании: H2SO4, А Ва21 > BaSOj H2SO4, А Sr2+ > SrSOj H2SO4, C2H5O1I, A Ca2+ > CaSOj H2SO4, A Pb2+ > PbSO4i Промывание осадка водой, содержащей H2SO4
13 Отделение PbSO4>L от осадка 12 действием 30% раствора NH4CH3COO с последующим центрифугированием: NH4CH3COO PbSOj > [PbSO4 Pb(CH3COO)2] После центрифугирования исследуют осадок сульфатов катионов III аналитической группы по схеме систематического хода анализа смеси катионов III аналитической группы
14 Исследование осадка 13 по схеме систематического хода анализа смеси катионов III аналитической группы
15 Отделение катионов IV группы от катионов V, VI аналитических групп действием избытка 6М раствора NaOH в присутствии 3% Н2О2: NaOH изб. NaOH А13+ > А1(ОН)31 > |А1(ОН)6]3' NaOH изб. NaOH Zn2+ > Zn(OH)2X > fZn(OH)4]2 NaOH изб. NaOH, H2O2 Cr3+ > Cr(OH),l >CrO42' NaOH изб. NaOH, H2O2 Sn2+ > Sn(OH)2i > [Sn(OH)6]2’ NaOH изб. NaOH Sn (IV) > Sn(OH)4X > fSn(OH)6]2 NaOH H2O2 As (III) > AsO33 > AsO4 NaOH H2O2 As (V) AsO4 AsO4 При этом катионы V, VI аналитических групп образуют осадки: Fe(OH)3, Mg(OH)2, MnO2 • nH2O, BiOCl, SbO2Cl, Cu(OH)2, HgO, Ni(OH)2, Co(OH)3
31
Продолжение табл. 11
№ этапа Этапы исследования
16 Обнаружение ионов As (V) в отдельной порции центрифугата 15 действием металлического цинка в среде НС1 (обнаружению мешают ионы Sb (III), Sb (V)): Zn; HC1 As (III), (V) > AsHjT AsH3 Бумажка, смоченная AgNO3 > Agsl (черный) (реакция Гутцайта) AsH2(HgCI)| Бумажка, смоченная [HgCy (реакция Зангср-Блска) As(llgC,)3l As2Hg3| (желто-бурый)
17 Отделение гидроксоанионов [А1(ОН)б]3'; [5п(ОН)б]2 из центрифугата 15 действием кристаллического NH4C1 при нагревании: NH4C1, А [А1(ОН)6]3 > А1(ОН)з4- NH4CI, А fSn(OH)6]2" > Sn(OH)4J-
18 Растворение осадка 17 действием 2М НС1: НС1 А1(ОН)3Х > А13+ НС1 Sn(OH)4J, > [SnCl6]2
19 Обнаружение ионов А13+ действием на центрифугат 18 растворов ализарина или натрия ацетата: по он А1 СГ \) Ализарин, NaOH Al3* > 1 II ll 1 1 О CH3COONa А13+ > А1(ОН)2СНзСОО4,
32
Продолжение табл. 12
№ этапа Этапы исследования
20 Обнаружение ионов Sn (IV) действием раствора соли ртути (11) на предварительно прокипяченный раствор 18 с железными стружками в среде НС1: Fc, НС1; A HgCl2
[SnCl6]2' - > Sn2* — > Hgi
21 Обнаружение катионов Zn2+ в центрифугате 17 действием растворов дитизона, или K4[Fe(CN)6]: дитизон C6H5’N\ / C^N-NH-Cgll^ [Zn(NH3)4]2+ > || Ч /S ' N Zh N / X II 1 s \ 11 C6H5-NH-N=CZ ':N ~C6h5 K4[Fe(CN)6]
[Zn(NH3)4J2+ > K2Zn3[Fe(CN)6]2X
22 Отделение ионов Sb (V) от других катионов V, VI аналитических групп действием HNO3 с Н2О2 на осадок 15: HNO3; Н2О2 SbO2Cl > HSbO3l При этом другие нерастворимые соединения катионов V, VI ipynn растворяются с восстановлением следующих катионов: HNO3, Н2О2 МпО2 • пН2О1- >Мп2+ HNO3, Н2О2 Со(ОН)4 > Со2+
23 Растворение осадка 22 в растворе НС1: НС1 HSbOj > [SbClftJ
24 Обнаружение Sb (V) в растворе 23 действием металлического цинка на никелевой пластинке: Zn [SbCl6r > Sbi
33
Продолжение табл. 12
№ этапа Этаны исследования
25 Осаждение катионов V аналитической ipyinibi из центрифугата 22 действием конц. NH3H2O: NH3 Н2О Mg2+ » Mg(OH)2J, NH3 • H2O Mn2+ > Mn(OH)2X NH3 H2O Fe3+ > Fe(OH)3J- NH3 • H2O Bi3+ : > BiONOjX При этом катионы VI аналитической группы остаются в растворе в виде аммиакатов: NH3 Н2О Cu(OH)2-l : > [Cu(NH3)4]2+ NH3 Н>О HgO4- > fHg(NH3)4]2+ NH3 H2O Co(OH)2X > fCo(NH3)6]2" NH3 - H2O Ni(OH)3X > [Ni(NH3)6]2+
26 Отделение катионов Mg2+ действием на осадок 25 раствора NH4C1 + 3% Н2О2: NH4CI Mg(OH)2X > Mg2+ 3% Н2О2 Мп(ОН)2 > МпО2 пН2О^ Состав осадка: MnO2nH2Oi, Fc(OH)3
27 Обнаружение ионов Mg2+ в центрифугатае 26 действием Na2HPO4 в присутствии аммиачного буферного раствора: Na2HPO4, NH3 Н2О + NH4C1 Mg2* > MgNII4PO4i
28 Отделение катионов Bi3+ и Fe'^ действием раствора HNO3 на осадок 26: HNO3 BiONO3l > Bi3+ HNO3 Fc(OH)3X > Fe3+ В осадке MnO2nH2OX
29 Растворение осадка MnO2 • n H2O, полученного по п.28, действием раствора IINO3 в присутствии Н2О2: HNO3; Н2О2 МпО2 пН2ОХ > Мп2+
34
Продолжение табл. 12
№ этапа Этапы исследования
30 Обнаружение ионов Мп2+ действием на раствор 29 (NH4)2S2O«: (NH4)2S2O8; HNO3; AgNO3 Mn2+ >MnO4
31 _ 32 _ _ 33 34 ’"'зЗ 36 37 ~~~38 39 Обнаружение ионов Bi3+ в центрифугате 28 действием свежеприготовленного Na4[Sn(OH)6I: Na4[Sn(OH)6] Bi3+ — > Bi J, Разрушение аммиакатов_в растворе^25действ Отделение ионов CiF+ и Hgs от остальных катионов VI аналитической группы действием Na2S2O3 на раствор 32: Na2S2O3; H2Oi Д Cu2+ > Cu2Sj, Na2S2O3; H2O; Д Hg^_- > HgSjL Отделение Cu2S от HgS из осадка 33 действием разб. HNO3 при нагревании: HNO3; Д Cu2Si >Cu2+ HgS *J?2™\X9^242\He2^T52P?PIc.5.. Обнаружение ионов Ci?+ в центрифугате 34 действием конц. NH3H2O: NH3H2O Cu2+ > [Cu(NH3)4]2+ Растворение осадка 34 действием бромной воды в присутствии НО при нагревании, или в царской водке: Вг2; НС1, Д HgSJ- > [HgCl2] + si конц. HNO3, конц. НС1 Hgsl -»[HgCl2] Обнаружение ионов I Ig2+ в центрифугате 36 действием раствора SnCl2: SnCl2 [HgChl >_Hgl Обнаружение ионов Co_+ в центрифугате 33 действием раствора NH4SCN в присутствии амилового спирта: NH4SCN Со2+ > (NH4)2[Co(SCN)4] С5Н11ОН Обнаружение ионов Ni2+ в центрифугате 33 действием реактива Чугаева (диметилглиоксима): о но 1 1 п3с-с--^ ^-=с-сн3 p-в Чугаева 1 1 Ni2+ 1 2 > Н3с-с=у ^с-сн3 (диметилглиоксим) он-о
35
СХЕМА АНАЛИЗА СМЕСИ КАТИОНОВ I-VI АНАЛИТИЧЕСКИХ ГРУПП БЕЗ ОСАДКА
36
Таблица 13
АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ АНИОНОВ, ОСНОВАННАЯ НА РАЗЛИЧНОЙ РАСТВОРИМОСТИ
СОЛЕЙ Ва2+ И Ag+
Аналитическая группа Анионы Групповой реагент Свойства осадков
I SO? , SO32’, S2O32’, СО32’, AsO?", AsO33”, С2оЛ СгОД (Cr2oA SiO32”, BO2“ (B4O72-), F , IO3 , IO4 ,РОЛ, C4H4O62- ВаС12 или Ba(NO3)2 Осадки солей бария не раствори мы в воде, но растворимы в кислотах (кроме BaSO4)
II СГ,Вг’,Г,СКГ, SCKT, C6H5COO’, S2’ AgNO3 в HNO3 Осадки солей серебра не растворимы в воде и азотной кислоте
III NO3”, no2~ ch3coo~, C1O4", B1O3” ИСТ Осадки солей бария и серебра растворимы в воде
Таблица 14
АНИОНЫ, ОБРАЗУЮЩИЕ ГАЗООБРАЗНЫЕ ПРОДУКТЫ ПРИ ДЕЙСТВИИ СИЛЬНЫХ КИСЛОТ
Анион, содержащийся в растворе Выделяющийся газ (продукт) Способ обнаружения
СО32’; НСО< СО2 Помутнение известковой воды
SO32’; S2O32’ so2 Запах горящей серы
NO2' no2 Красно-бурые пары
S2-; SO?’; S2O32’ H2S Запах тухлых яиц
CH3COO" СНзСООН Запах уксуса
Br“ (с окислителем) Br2 Красно-бурые пары
СГ HC1 Удушливый газ, помутнение раствора AgNO3
37
Таблица 15
КЛАССИФИКАЦИЯ АНИОНОВ ПО ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМ СВОЙСТВАМ
00
Анноны-окислители Анноны-восстановители
Cr2O72“; AsO?“; NOf; IO4lOf Вг’,Г , S2“, С2О42, AsO? , SO? , S20? ,N02
Проба на присутствие в растворе
При действии KI появляется окраска 12 При действии 12 или КМлО4 раствор обесцвечивается
Примеры
+2с + AsO4 + 2Н 44 As Оз + Н2О 1 -2е + ЗГ -—* [И]' L, -2e + SO?~ + H20 —— S0/4-2IT +2е + [L}’ ЗГ _ _ _ 1 1
AsO?' + 2Н+ + ЗГ AsO33’ + Н20 + [13Г (в среде конц. НС1) +6е + Сг2О/ + 14Н+ -=* 2Сг* + 7Н2О 1 SO?" + Н20 + [13 Г ’ SO42’ + 2Н+ + 31 -2с + С2О42' 2СО2Т +5е + МпО/ + 8 FT -—- Мп2+ + 4Н,0 15 12
-2е + 311 _*=—t. _ .3 5С,О? + 2М пО/ + 16Н+ *=* 1 ОСО Л + 2Mn2+ + RW.O
Сг2О?2' + 14Н+ + 91" '—в 2Сг3+ + 7Н2О + З[13]’ £. ~ п v ‘ v ~ t -2е + AsO?" + 20Н ’ -—“ AsO?' + Н20 +2е + Щ]" в₽=^ 31 1 1 1 1
AsO33"+2OH‘ +[13] AsO43’+3I +1 (в среде NaHCO3) При действии конц. H2SO4 выделяется 12 и Вг2 -2е + 2Г 12 +8е + SO? + 10Н+ ’—fe H,S + 4Н,0 l20 4 1
8 I + SO42’ + 10Н+ —=*“ 4I2f + H2S? +4H2O ~2e + 2Br 4 Br2 +2e + S0?~ + 4H+ "—- 50э + H20 [1 JJ
2Br‘+SO? +4H+ -—a Br2+SO2 + H2O
Таблица 16
РЕАГЕНТЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДРОБНОГО ОБНАРУЖЕНИЯ АНИОНОВ ЫН ГРУПП И СООТВЕТСТВУЮЩИЕ ПРОДУКТЫ РЕАКЦИЙ
Анионы Реагенты (условия реакции) Продукт реакции, аналитический эффект
SO? so32' Ва2+ (в среде минеральной кислоты) BaSO4| (белый осадок, нерастворим в кислотах и щелочах)
Sr2+ (в среде минеральной кислоты) SrSO4j, (белый осадок, нерастворим в кислотах)
н+ Из]’ _§ОгТ (запах) Р (обесцвечивание раствора йода)
s2o32 СО32" НСО3- [hl Ag+ (избыток) SO2T (запах) + SJ, (белый осадок) 1“ (обесцвечивание раствора йода) Ag2S2O3| (белый осадок, при разложении чернеет Ag2Sj)
н+ .Mg2: фенолфталеин Mg2+ (при кипячении) сод MgCO3| (белый осадок) малиновое окрашивание MgCO3| (белый осадок) + CO2f
фенолфталеин не даст окрашивания
РО43' MgCl2; NH4OH; NH4CI (магнезиальная смесь) MgNH4pO4| (белый осадок)
Ag+ Ag3PO4| (желтый осадок, растворим в HNO3; NH4OH)
с2о42- Са2+ CaC2O4j, (белый осадок, нерастворим в уксусной кислоте)
МпО4" (в среде H2SO4) СО2? (обесцвечивание раствора КМпО4)
39
Продолжение табл. 16
Анионы Реагенты (условия реакции) Продукт реакции, аналитический { эффект
AsO43' MgCl2+ nh4oh + NH4CI (магнезиальная смесь) MgNH4AsO4| (белый осадок)
Ag+ Ag3AsO4j, (шоколадный осадок, растворим В HNO3 И NH4OH) |
Г (в среде НС1 в присутствии CHCI3) [1зJ - красно-фиолетовый цвет хлороформного слоя j
AsO33- S2- As2S31 (желтый осадок, нерастворим в конц. НС1; растворим в NH4OH) 1
Ag+ Ag3AsO3J, (желтый, растворим в NH4OH и kohu.IINO3)
[13Г (в среде NaHCO3) Г (обесцвечивание раствора йода)
СгОЛ (Сг2О72-) Ва2+ BaCrO4j, (желтый осадок)
Г (в среде НС1 в присутствии СНС13) [1зГ - красно-фиолетовый цвет хлороформного слоя
SiO32‘ Ва2+ BaSiO3| (белый осадок, при действии кислот разлагается с образованием H2SiO3|)
в4о72- H2SO4; С2Н5ОН Ва2+ (С2Н5О)3В - окрашивает пламя в зеленый цвет
р BaF2i (белый осадок, растворим в NH4OH, в минеральных кислотах)
H2SO4, (SiO2-H2O) H2SiO3| (гель)
СГ Ag+ AgCl| (белый осадок, растворим в (NH4)2CO3 и NH4OH)
Вг“ Ag+ AgBrj, (желтый осадок, частично растворим В NH4OH)
С12 (в кислой среде в присутствии СНС13) Вг2 (хлороформный слой окрашивается в бурый цвет)
40
Продолжение табл. 16
Анионы Реагенты (условия реакции) Продукт реакции, аналитический эффект
г S2* NO3 Ag+ &2 (в кислой среде в присутствии СНС13) изб. С12 .Agl Н+ Cd2+ Fe (II) (в среде конц. H2SO4) дифениламин Agl| (желтый осадок, растворим в NH4OH) [1з1- - хлороформный слой окрашивается в красно-фиолетовый цвет Юз' - обесцвечивание хлороформного слоя Ag2S| (черный осадок) H2Sf (запах) CdSj (желтый осадок) [Fe(NO)JSO4 (бурое кольцо) / \ / \ // \ W >=NM; > HSO4 (синее окрашивание)
no2 Н+ NO2T + NOT (бурый газ)
антипирин МпО4“ (в кислой сре-_дс) NH4C1, t° нитрозоантипирин (изумрудно-зеленый цвет) обесцвечивание раствора КМпОд N2T
СН3СОО“ FF С2Н5ОН; H2SO4 Те (III) СН3СООН (запах уксуса) СН3СООС2Н5 (запах яблок) [(СН3СОО)бРе(ОН)2]+ (красно-бурый цвет)
41
Таблица l\
РЕАКЦИИ КАТИОНОВ II-VI АНАЛИТИЧЕСКИХ ГРУПП ПРИ ПРИГОТОВЛЕНИИ “СОДОВОЙ ВЫТЯЖКИ”
Аналитическая группа Уравнение реакции '
II III IV A 1 2А_£ + СО? AgiQi^COj? 2₽ь? +JLCQ? + н2о ~ (рьон)2со3? + co2t 1 Hg22+ + CO?' - • Hg2CO3J- - • HgOX + Hg? +_co2T Ba2+ + CO32 ~ ‘ BaCO? Sr2+ + CO? SrCO3? ’l Ca2++ СОз^^СаСОз? 2 Al? + зсо3? +зн2о_— гдконьХ^зсогТ Д1(ОН)4 + ЗОН' -> f AI(OH)6?‘
2Cr3+ + 3CO32' + 3H2O ‘ 2Cr(OH)3X + 3CO2T
V Cr(OH)3J- + ЗОН' -> [Cr(OH)6|3~ Sn2++ CO32 + H2O ~tl_SjT£OH)22L+^O2T Sn(OH)4 + 4OH—> [Sn(OH)6]4' JSnCl6]? + 2CO?' 4^2^O^-2_Sr^I£)4£+2CO2? + 6СГ Sn(OH)4? + 2OH" [Sn(OH)6]2" Zn? + CO? + H2O ^^(OHhij^COzT ZnioHhi^OH^ lzn(OH)4?; Fe2+ + CO32" FeCO3>l быстро буреет на воздухе с обра- зованием Fe(OH)3 по уравнению:
4FeCO3X + 6Н2О + О2 -+ 4Fe(OH)3i + 4СО2?
2Fe3+ + ЗСО?' + Н2О 2Fe(OH)3>l + ЗСО2Т
Мп2+ + СО32 —* MnCOji
— 2Mg2+ + 2СО?~ + Н2О —' (MgOH)2CO3'l + СО2Т 2Bi3+ + 3СОз?+_Н2О_- J, 2ВiOHCO? + СО2? 2[SbCl6J3 + ЗН2О + ЗСО? ' J ' ‘ 2Sb(OH)3'l + СО2Т + 12СГ
1 Ilf 1 1 1 1 [SbCl6]“ + ЗСО? + Н2О - 1? IlSb23?+ 6CJ"±2СО21+_НСО3 2Со2+ + 2СО? + Н2О -- ‘ (СоОН)2 СО3<1 + СО2Т Ni2+ + СО?~ 12_'_№СОз? 2Cu2+jl2CO?^+_Н2О_'21 (CuOHhCOjJ,_+ СО2Т ^^j^COj^+JbOj-^KHgOHJzCOrl^^T (HgOH)2CO3i 2HgOi + СО2? + Н2О
42
Таблица 18
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА СМЕСИ СЕРУСОДЕРЖАЩИХ АНИОНОВ
S2, S2O32, SO42 , SO32
№ этапа Этапы исследования
1 Обнаружение S2 -ионов в отдельной порции исходного раствора действием Na2[Fe(CN)5NO] в слабощелочной среде: Na2[Fe(CN)5NO] S2' ———: > Na2[Fe(CN)5NOS]4' Красно-фиолетовое окрашивание свидетельствует о присутствии
S" -ионов _ _
2 Отделение S^-ионов из отдельной порции исходного раствора действием раствора СбСОз: CdCO3 S2‘ > CdSX Осадок CdS отделяют центрифугированием
3 Разделение S2O32' и SO32, SO/'-ионов действием раствора соли стронция на центрифугат 2: Sr(NO3)2 SO,2 > SrSO3X Sr(NO3)2 SO?' > SrSO4r Осадок SrSO3, SrSO4 отделяют центрифугированием
4 Обнаружение SO32 и SO42 -ионов действием 2М раствора НС1 на осадок 3: НС1 SrSO3i > SO2T Определение 8Оз2‘-ионов действием раствора йода: Ь so2? > SO42' НС1 Раствор йода обесцвечивается. Неполное растворение осадка 3 свидетельствует о присутствии SO42 -ионов
5 Обнаружение БэОз^-ионов действием раствора НС1 и раствора йода на центрифугат 3: НС1 s2o32T > si 2 S2O3 X > раствор йода обесцвечивается НС1
43
Схема $
СХЕМА АНАЛИЗА SO42, SO32, S2O32, S2 ПРИ ИХ СОВМЕСТНОМ ПРИСУТСТВИИ
Na2[Fe(CN)5NO]
44
Таблица 19
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА СМЕСИ ГАЛОГЕНИД-ИОНОВ
СГ, Вг, Г
v № этапа Этапы исследования
1 Осаждение в отдельной порции исходного раствора СГ, Вг, Г-ионов действием подкисленного HNO3 раствора AgNO3: AgNO3 СГ > AgCli HNO3 AgNO3 В г > AgBri HNO3 AgNO3 I > Agli HNO3 Осадок отделяют центрифугированием. Цснтрифугат не анализируют
2 Отделение СГ-ионов действием на осадок 1 12% раствора (NH^COy (NH4)2CO3, 12% AgClX > [Ag(NH3)2]+, СГ Осадок AgBr, Agl отделяют центрифугированием и не анализируют
3 Обнаружение СГ-ионов действием раствора HNO3 на центрифугат 2: HNO3 [Ag(NH3)2]+, СГ > AgClJ,
4 Обнаружение Г и Вг“-ионов из отдельной порции исходного раствора действием хлорной воды в присутствии хлороформа: С12 I > 12 (красно-фиолетовая окраска хлороформного слоя) С12
Вг - > Вг2 (исчезновение красно-фиолетовой окраски и появление оранжевой окраски хлороформного слоя)
45
Схема S
СХЕМА АНАЛИЗА СМЕСИ ГАЛОГЕНИД-ИОНОВ (СГ, Br, I)
46
Таблица 20
СИСТЕМАТИЧЕСКИЙ ХОД
АНАЛИЗА СМЕСИ АЗОТСОДЕРЖАЩИХ АНИОНОВ
NO2, NO3
У$ этапа Этапы исследования
Обнаружение NO2-hohob в отдельной порции подкисленного исходною расэвора действием кристаллического антипирина: ЬЬєї-С—NO антипирин | | NO2 > НоС—N С—О Н+ Изумрудно-зеленая окраска
2 Удаление NO2“-hohob из отдельной порции исходного раствора действием кристаллического NH4C1 при нагревании: NH4CI, А no2 > n2T
3 Обнаружение NO3-ионов в растворе 2 действием FeSO4 в присутствии конц. H2SO4: FeSO4, H2SO4 NO3 > [Fe(NO)]SO4 бурое кольцо Если в растворе присутствуют Вг' или Г-ионы, их предварительно удаляют действием хлорной воды в присутствии раствора НС1 при нагревании: С12, А Вг > Вг2Т НС1 С12, А г > 12? НС1
47
Схем
СХЕМА АНАЛИЗА СМЕСИ АНИОНОВ: NO2, NO3
48
Равновесия в растворах электролитов
В основе теоретического обоснования равновесных процессов в растворах электролитов лежит закон действующих масс, который в наиболее общем виде формулируют следующим образом: скорость химической реакции в каждый момент времени пропорциональна произведению действующих, активных масс (концентраций) реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам.
Для обратимой реакции ЬА + сВ ~ dD + еЕ
скорость прямой реакции (v,) выражают уравнением:
Krt Ь „ с 1 ‘ >
а скорость обратной реакции (v2) уравнением:
v = К. -а^ -Зр,
где: К) - константа скорости прямой реакции;
К2 - константа скорости обратной реакции;
а - активность (эффективная действующая концентрация), проявляющая себя в химических процессах в качестве реально действующей концентрации в отличие от теоретической концентрации (С) вещества в растворе.
а = C-f, где: а
f - коэффициент активности, f — —. с
Коэффициент активности учитывает взаимодействие частиц данного вещества с окружающей средой. Величина f как правило меньше единицы и лишь при бесконечном разбавлении (с<10‘6 моль-л1) приближается к единице.
Активность иона зависит не только от его концентрации, но также от концентрации всех других ионов, находящихся в растворе.
Для характеристики зависимости активности иона от концентрации всех находящихся в растворе электролитов введено понятие - ионная сила раствора (ц). Ионная сила раствора равна полусумме произведений концентраций ионов на квадрат их зарядов:
иЦхад.
где: С, - концентрация i-того иона в растворе,
Z (- заряд указанного иона.
С увеличением ионной силы раствора коэффициент активности данного иона уменьшается. Зависимость коэффициента активности очень разбавленного раствора от ионной силы раствора выражается формулой:
Igf = -O,5Z27h.
49
С увеличением концентрации раствора эта зависимость усложняется.
В случае обратимых процессов в момент равновесия скорость прямой реакции (v,) становится равной скорости обратной реакции (v2):
vi =V2;
К, аьЛ-а' = К2-Яр-а'.
К, adD at
Отношение —- = называют константой равновесия и обозначают
К । ад • ав
Кр. Кр показывает во сколько раз скорость прямой реакции больше скорости обратной реакции.
Состояние химического равновесия в растворах электролитов характеризуют с помощью константы равновесия Кр:
BmAn mBn+ + пАт‘,
₽ [ВтАп]
Константу равновесия для воды выражают формулой:
[Н’][ОН ]
Кр--- так как воДа являстся очснь слабым электролитом, тс
[Н2О] является величиной практически постоянной.
В связи с этим процесс ионизации воды характеризуют ионным произведением воды Kw:
KW = KP[H2O] = [H+][OHJ.
При комнатной температуре (25°С) Kw = 1-1014.
В нейтральном водном растворе
[Н,] = [ОН ] = Л0ТГГ = 10-7моль л1.
Так как концентрации [Н+] и [ОН ] в водных растворах выражаются малыми величинами, которыми неудобно пользоваться, то введена логарифмическая форма их выражения:
-IgFFT] = pH,
-lg[OH ] = рОН, lgKw = -lg[H+] - lg[OH ], lgKw = pH + pOH.
Многие растворители, применяемые в аналитической химии неводных растворов, подвергаются подобно воде автопротолизу, например:
Н2О + Н2О ==i: Н3О+ +ОН ’,
С2Н5ОН + С2Н5ОН *=* С2Н5ОН2* + С2Н5О, 2H2NCH2CH2NH2 ' H2NCH2CH2NH3+ + H2NCH2CH2NH, 2(CH3)2SO —=* (CH3)2SOH+ + CH3—SO—CH2’.
50
В общем виде эти процессы можно представить уравнением: 2НМ *=* Н2М+ + М“.
Катионы, образующиеся в процессе самодиссоциации растворителей, ведут себя по отношению к сильным основаниям как кислоты, анионы по отношению к сильным кислотам - как основания. Равновесие, устанавливающееся в процессе самодиссоциации растворителя, характеризуется константой автопротолиза Ks:
Ks =а -ам. (термодинамическая константа автопротолиза)
или
KS=[H2M+][M“] (концентрационная константа автопротолиза)
Кислотно-основное равновесие автопротолиза зависит от природы растворителя и его склонности к образованию водородных связей, от донорноакцепторного характера, сольватирующей способности и т.д.
Показатель константы автопротолиза (pK=-lgKs) служит мерой протяженности шкалы кислотности данного растворителя (для воды - 14, для этанола - 18,75, для димстилформамида - 27,0, для ацетонитрила - 33,3 и т.д.), представляющей собой предельный диапазон значений pH данного растворителя) от рН=О (аНгМ‘ — 1) до pH, численно достигающего значения pKs ( ам. = 1).
С увеличением кислотности одного и того же типа растворителя закономерно уменьшается его pKs. Например, для группы растворителей, представленных ниже, pKs изменяется в таком порядке: СНзСООСбН^ > СН3СООС5НЦ > СН3СООС4Н9> СН3СООС3Н7> СН3СООС2Н5 > СН3СООСН3 > СНзСООН > нсоон. Интересно, что в том же порядке увеличивается диэлектрическая проницаемость (е*) этих растворителей (табл.).
Константу равновесия в растворах слабых кислот выражают через Ка: НА Н+ + А, _[Н+][А]
К. а -
[НА]
Константу равновесия в растворах слабых оснований выражают через Kt,: ВОН —~ В+ + ОН ,
к [В*][ОН] ь [ВОН]
Для оснований состояние ионного равновесия также может быть описано кислотной константой ионизации. Например, аммиак - основание, которое, присоединяя протон, образует ион аммония.
51
Таблица
ДИЭЛЕКТРИЧЕСКАЯ ПРОНИЦАЕМОСТЬ (£*) И ПОКАЗАТЕЛИ КОНСТАНТ АВТОПРОТОЛИЗА (pKs) НАИБОЛЕЕ ВАЖНЫХ НЕВОДНЫХ РАСТВОРИТЕЛЕЙ, ПРИМЕНЯЕМЫХ В АНАЛИТИЧЕСКОЙ ХИМИИ
Растворитель в* при 25°С pKs
Спирты Метанол 32,6 17,31
Этанол 24,3 18,54
//-Пропанол 20,1 19,46
Изопропанол 18,3 20,30
Эфиры Мстилацстат 6,7 22,50
Этилацетат 6,0 22,83
Кетоны Ацетон (димстилкстон) 20,9 21,40
Метилэтилкетон 18,4 21,53
Кислоты Жидкий HF Серная кислота Уксусная кислота Муравьиная кислота 84(0°С) 100,5 6,2 57,0 (20°С) 11,7 3,62 12,22 14,45 6,66
Азотсодержащие соединения Формамид 1М,1Ч-Димстилформамид Аммиак 109,5 36,71 22,7(-50°С) 17,0 23,10 32,72
Серусодержащие соединения Диметилсульфоксид Сульфолан 45,0 42,0 33,3 25,45
Однако ион аммония (NH4+) можно рассматривать и как слабую кислоту, которая способна частично ионизировать в водном растворе, давая ионы водорода и молекулы аммиака:
NH4+ NH3 + H+.
52
Поэтому:
_[H4][NH3] а [nh;j
Экспериментально было найдено, что эта константа равна 5,5-1010 (при 25°С). Приведенное уравнение может быть изображено в более общем виде:
к JH+][B] а [ВН+] *
Такое использование констант кислотности для характеристики оснований было введено в 1923 г. Бренстедом, который показал, насколько удобно выражать степень ионизации кислот и оснований в одной шкале, подобно тому, как значение pH одинаково хорошо характеризует и кислотность, и основность. Следовательно, кислоты и основания могут быть количественно охарактеризованы по их сродству к протону. Эта взаимосвязь требует использования единых констант кислотности (Ка) для кислот и оснований.
Для растворов электролитов показательной является величина степени ионизации(а), которая количественно характеризует состояние электролита и определяется соотношением:
_ число ионизированных молекул
~общее число растворенных молекул
Между величинами константы ионизации (Kj), степенью ионизации (а) и концентрацией (С) существует зависимость, которая выражается законом раз-. ~ IZ Са 2
оавления Оствальда: К =-----.
' 1-а
У очень слабых электролитов (а <0,05, т.е. 5%) величина а очень мала и разность 1-а можно принять равной единице. Поэтому для их растворов принимают сокращенный вид закона разбавления Оствальда: К, = С а 2. Из закона разбавления Оствальда следует, что при разбавлении растворов слабых электролитов их степень ионизации увеличивается.
Равновесия в растворах кислот и оснований
Кислотность водных растворов определяется концентрацией в них ионов водорода и характеризуется величиной pH, связанной с концентрацией ионов водорода следующим выражением:
pH = -lg[H+], аналогично:
рОН =-lg[OH“].
Обе эти величины связаны между собой соотношением:
рН + рОН = 14 (при 25°С).
53
Сильные кислоты и основания в водных растворах ионизируют полностью. Например:
НС1^Н+ +Cl-
или
NaOH -► Na+ + ОН".
Следовательно, в таких растворах:
[Н+] - Са = [Ап-] (для одноосновной кислоты)
[ОН ] = Сь = [Kat+] (для однокислотного основания)
Расчет концентрации ионов [РР] в 0,001 М водном растворе 1ICI:
Н2О Н+ + ОН ; Kw=[H+][OH ] = 10’14 НС1->Н+ + С1 .
В 0,001М водном растворе НС1 концентрация ионов [Н+] равняется 10-3 моль-л"1, но так как произведение равновесных концентраций [Н+][О1Г] = 10-14 остается величиной постоянной, концентрация [ОН-] в водном растворе умснь-Ю~14 _ц _| шается и равняется [ОН ] - 3 -10 моль-л .
Следовательно, в любом водном растворе кислоты [Н+] > [ОН-] - среда раствора кислая.
Расчет концентрации ионов [РР] в 0,001Мрастворе NaOH: Н2О Н+ + ОН ; Kw=[H’|[OH 1 = 10’14, NaOH -> Na+ + ОН-.
Учитывая рассуждение, приведенное выше, в 0,001М растворе NaOH концентрация ионов [ОН-] равняется 10-3 моль-л *, но произведение равновесных концентраций [Н+] [ОН ] = 10"14 остается постоянным, тогда концентра-10"14 и ч ция [Н+] уменьшается и равняется [Н+ ] = 3 = 10 моль • л".
Следовательно, в водном растворе щелочи [Н+] < [ОН ] - среда раствора щелочная.
Среду водного раствора удобно характеризовать не [Н+], а pH.
Расчет значений pH: в воде [Н+] = [ОН-] = 10-7 моль-л \
тогда pH =7 - среда нейтральная.
В 0,001М растворе НС1: [Н+] = 10 3 моль-л1, pH = -IglO 3 = 3. Произошло резкое изменение pH раствора на 4 единицы, что отвечает измене-10"3
нию [Н+] = — = 104 = 10000 раз,
pH < 7 - среда кислая.
54
В 0,001М растворе NaOH: [Н+] = 10-11 моль-л-1, pH = -IglO"11 = 11.
Произошло резкое изменение pH раствора также на 4 единицы, что отвечает из-in-7
мепсиию [НЧ = — = 1(Г= 10000 раз,
pH > 7 - среда щелочная.
Следовательно, если: pH = 7 - среда нейтральная, pH < 7 - среда кислая, pH > 7 - среда щелочная.
Слабые кислоты и основания в водных растворах ионизируют частично. Например:
СНзСООН ЬГ + СНзСОО"
или
NH3- Н2О ОН" + NH/.
Равновесия в растворах таких кислот и оснований характеризуются соответствующими константами равновесия. Для приведенных выше кислоты и основания:
NH , Н :О
JHT[CH3COO] СЮСООП [СН,СООН] ’ [ОН ] [NH4 ]
NH,Ib0 [NH3-H2O] *
Из выражения для констант равновесия слабой кислоты или слабого основания могут быть получены формулы для расчета равновесных концентраций [Н+] и [ОН ]:
Значения Ка и Кь для многих кислот (Ка) и оснований (Кь) приведены в справочниках, в том числе в настоящем издании.
При известных начальных концентрациях кислоты (Са) или основания (Сь) и их степени ионизации (а) значения [Н+] или [ОН ] в их растворах могут быть вычислены но формуле:
[НМ = аСа;
[ОН"]=а -Сь.
В буферных растворах, представляющих собой смесь слабой кислоты и соли этой же кислоты или слабого основания и соли этого же основания, значения [Н+] или [ОН-] зависят не только от констант ионизации кислоты и основания, но и от соотношения концентраций кислоты и ее соли или основания и его соли:
[Н+] = Ка -Ь-.
'"'соли
55
[ОН-] = КЬ-^-.
'~'соли
Следует помнить, что при решении задач по указанным выше формула* концентрации кислот, оснований и ионов должны быть выражены в моль-л"1.
Задача 1. Константа ионизации циановодородной кислоты равн; 7,9-10“10 Рассчитать степень ионизации кислоты в 0,001М растворе, pH раство ра и долю иеионизированной части кислоты.
Пример решения. Поскольку константа ионизации HCN очень мала то для вычисления степени ионизации воспользуемся формулой закона разбав ления Оствальда в сокращенном виде:
(К / 7 О 10 10
а = М-=. ’ =8,9 -10 4, или 8,9-10~2%.
Ус У 1-ю-’ I а
Доля иеионизированной части, очевидно, равна 100% - а = 100 - 0,089 = = 99,91%.
Расчет [Н+] удобно в данном случае вести по формуле [Н+ ] = а • Са:
[Н+] = 8,910 4-1-10“3 = 8,9-10“7 моль-л 1
Отсюда, pH = -1g 8,9-10 ~7 = 6,05.
Задача 2. Вычислить pH 0,4% раствора натрия гидроксида.
Пример решения. Рассчитаем концентрацию NaOH в моль-л1: 10-W-p 10-0,4-1
Скюн = ю = °>1 МОЛЬ • Л ,
м
где: р - плотность раствора NaOH (г/см3), принятая равной единице из-за
малой концентрации раствора;
W- концентрация раствора, %;
Мм - молярная масса NaOH, г.
Так как NaOH сильное основание, то [OH"J =CNaOH = 0,1 моль-л-1.
Тогда рОН = -lg 0,1 = 1,0. pH = 14 - рОН = 14 - 1 = 13.
Задача 3. Чему равна концентрация гидроксид-ионов в растворе, рЕ которого равно 10,80?
Пример решения. Расчитываем рОН:
рОН = 14 - pH = 14 - 10,80 = 3,20.
Отсюда, —lg[OH“] = 3,20, или lg[OH ] =-3,20; [ОН] = IO’3,2 I
Отсюда: [ОН ] = 6,31Ю“4 моль-л *.
Решить самостоятельно следующие задачи.
Задача 4. Степень ионизации муравьиной кислоты в 0,2М растворе равна 3%. Определить константу ионизации кислоты и значение pH.
Задача 5. Сколько воды нужно прибавить к 600 мл 0,2М раствора уксусной кислоты, чтобы степень ионизации кислоты удвоилась?
56
Задача 6. Вычислить pH раствора уксусной кислоты, если ее концентрация равна 0,01М, а степень ионизации 4,2%.
Задача 7. Во сколько раз концентрация ионов водорода в крови (pH = 7,36) больше, чем в спинномозговой жидкости (pH = 7,53)?
Задача 8. Чему равна концентрация раствора уксусной кислоты, pH которого равен 4,8?
Равновесия в гетерогенных системах
В водных растворах, насыщенных относительно малорастворимого электролита АаВь, устанавливается равновесие между твердой фазой и раствором ее ионизированной части:
|АаВь аАь+ + ЬВа“.
Это равновесие описывается константой равновесия, называемой произведением растворимости:
ПР = [Аь+]а-[Ва“]ь
Приведенное уравнение позволяет рассчитать растворимость электролита (S, моль-л"1) по величине ПР:
q ь ПР
Vaabb
а также по известной растворимости электролита рассчитать значение его ПР. Кроме того, знание значений величин ПР позволяет решить вопрос о возможности образования осадка или его растворения.
Условие образования осадка: произведение концентраций ионов в степенях, соответствующих их стехиометрическим коэффициентам должно превысить произведение растворимости:
СаАЬ,С>ПР.
Условие растворения осадка: произведение концентраций ионов в степенях соответствующих их стехиометрическим коэффициентам должно стать меньше ПР за счет связывания одного из ионов в менее растворимое соединение, слабый электролит или газообразный продукт, что описывается следующим соотношением:
С1ь.-СЬ._<ПР.
Значения ПР большинства малорастворимых электролитов приведены в справочниках, в том числе в настоящем издании.
При решении задач с использованием приведенных формул следует помнить, что концентрация малорастворимых электролитов и ионов в растворах должна быть выражена в моль-л'1.
Задача 1. Произведение растворимости свинца йодида при 20°С равна 8,0-10 "9. Вычислить растворимость соли в моль л’1 и гл'1 при указанной температуре.
57
г
Пример решения. В насыщенном растворе свинца йодида устава* ливается равновесие между осадком и ионами: 2х
|РЫ2 РЬ2+ + 2Г. м0
Обозначим искомую растворимость S моль-л'1. В соответствии с приве - ио
денным уравнением равновесия в насыщенном растворе свинца иодида содсг жится S моль-л'1 ионов свинца и 2S моль-л’1 йодид-ионов. ।
Тогда, ПРРЬ12 = [Pb2+][I“l2 =S(2S)2 = 4S3.
Отсюда, S = VnPfbЛ = V8 10’/4 = 1,310’ моль • л‘1 }
Молярная масса свинца йодида равна 461 г-моль'1. Тогда растворимосл осадка в г-л'1 будет равна: 4611,3-1O"3 = 0,6 г-л’1.
Задача 2, В 250 мл насыщенного раствора содержится 2,6O1O”5i стронция фосфата. Вычислить произведение растворимости данной соли.
Пример решения. В насыщенном растворе стронция фосфата устанавливается равновесие между твердой фазой соли и се ионизированной частью: |Sr3(PO4)2 3Sr2+ + 2РО43
Тогда выражение для произведения растворимости данной соли следующий вид:
к:
имеет
с и
моль .
npSn(ro.k=[Sr2r[P0t]2.
Рассчитаем растворимость стронция фосфата в г-л'1 из пропорции:
0,25 л содержит 2,60-10”5 г стронция фосфата;
1 л содержит х г стронция фосфата.
2,60-10’5-1 1Л. 1Л_4 х = --------= 1,0410 гл .
0,25
Выразим полученную концентрацию в моль-л'1:
х 1,121-10" __ 1П_7
S =---------=---------= 2,3 10 моль л .
х MSrj(POj2 452,803
Здесь MSri(POjj2 - молярная масса стронция фосфата, равная 452,803 г-
Из уравнения равновесия стронция фосфата в его насыщенном растворе следует, что из S моль-л’1 стронция фосфата образуется 3S моль-л'1 ионов стронция и 2S моль-л'1 фосфат-иоиов. Тогда, nPSrj{PO4)2 = (3S)3(2S)2 = 108S5.
Подставим значение S в уравнение ПР:
ПР = 108(2,310 7)5 = О,71О‘31.
Задача 3. Во сколько раз растворимость свинца йодида в 0,1М растворе калия йодида меньше, чем в воде?
Пример решения. Растворимость свинца йодида в воде была вычислена в задаче 1. Рассчитаем растворимость той же соли в 0,1М растворе калия йодида, обозначив ее х . Тогда, как следует из уравнения (см. задачу 1), концентрация ионов свинца тоже будет равна х, а концентрация йодид-ионов составит
58
12хтО,1, Предположим, что 2х « 0,1, тогда величиной 2х по сравнению с 0,1 I можно пренебречь и [I ] = 0,1 моль-л'1.
I Подставив полученные значения концентраций ионов свинца и йодид-I ионов в выражение для ПР свинца йодида, получим:
j ПРрьь = х (0,1)2.
I ПР Я. 1 о-9
I Отсюда, Х=-—— = 8-10”7моль • л'.
I (0,1)2 0,01
I Следовательно, растворимость свинца йодида в присутствии калия йо-I дада уменьшилась в 1,3-10 3/8-10 -7 — 1,6 103 раз.
I Задача 4. Смешаны равные объемы 5-Ю"3 М раствора кальция хлорида I и натрия сульфата. Образуется ли осадок кальция сульфата (ПРСа801 =2,5-105)?
I Пример решения. Для ответа на этот вопрос необходимо сравнить I произведение концентраций ионов Сса1н и Cs0,_ с произведением растворимости I кальция сульфата, т.е. проверить выполнимость условия С ,. - С , > nPcaso • В Сa SO4 4
I При смешении равных объемов растворов кальция хлорида и натрия I сульфата концентрации ионов Са2+ и SO42 по сравнению с исходными умень-I шаются вдвое и станут равными 2,5-10-3 моль-л"1 для каждого иона. Тогда I CSoj = 2,510 “3-2,510“3 = 6,2510”6, т.е. полученная величина меньше I ПР^ > и, следовательно, осадок не образуется.
I Решить самостоятельно следующие задачи.
I Задача 5. Для растворения 1,16 г РЫ2 потребовалось 2 л воды. Найти произведение растворимости соли.
I Задача 6. Вычислить объем воды, необходимой для растворения 2 г бария сульфата при температуре 25°С.
Задача 7. Образуется ли осадок свинца хлорида, если к 0,1 М раствору свинца нитрата добавить равный объем 0,3 М раствора натрия хлорида?
Задача 8. Как изменится растворимость кальция фторида в 0,05М растворе кальция хлорида по сравнению с растворимостью в воде (HPCaF3 = 4 10“)?
Задача 9. Произведение растворимости магния гидроксида равно 6 IO"10. При каком значении pH начнет осаждаться магния гидроксид из 1,610" 4М раствора магния хлорида?
Равновесия в растворах гидролизующихся солей
Многие растворимые соли в водных растворах подвергаются гидролизу, что приводит к возникновению кислой или щелочной реакции раствора.
Если гидролизу подвергается соль, образованная слабым основанием и сильной кислотой (например, NH4CI), то среда раствора станет кислой. При
SO
гидролизе соли, образованной слабой кислотой и сильным основанием (наир мер, СН3СООК), среда раствора будет щелочной. При гидролизе соли, образ< ванной слабым основанием и слабой кислотой, среда раствора определяет, соотношением констант ионизации соответствующих кислот и оснований и v жет быть нейтральной (например, при гидролизе CH3COONH4), слабощслочнс (NH4CN) или слабокислой (NH4F).
При решении задач необходимо определить, к какому типу относится гидролизующаяся соль.
Следует помнить, что при расчетах концентрации ионов и солей должк* быть выражены в моль-л'1 (таблица).
Задача 1. Вычислить степень гидролиза и pH раствора калия ацсча. в 100 мл которого содержится 0,9814 г соли.
Пример решения. Калия ацетат диссоциирует по уравнению: СНзСООК -> СНзСОО + к+.
Так как калия ацетат образован слабой кислотой и сильным основание гидролиз идет но аниону:
СН3СОО “ + Н2О СНзСООН + ОН“.
ТАБЛИЦА ДЛЯ РАСЧЕТА ПАРАМЕТРОВ ГИДРОЛИЗА
Соль Константа гидролиза Кг Степень гидролиза h [H+] [OH]
Образованная сильной кислотой и слабым основанием si л 1 1 S -О L~— \ Kb Ik -Kh V cBA
Образованная слабой кислотой и сильным основанием К W к а Kw |K,'K. /kw-cb<
ук0-сВА i cBA V K.
Образованная слабой кислотой и слабым основанием К-к.кь f к 1 w VK -К. 11 a b Ik -k 1 w a ILdk
V Kb У Ka
1JK- -VK -K. fa b
Примечание: К w - ионное произведение воды, СВА - концентрация соли, моль-л1.
Степень гидролиза определяется по формуле:
60
Рассчитываем концентрацию соли в моль-л'1:
m 0,9814
=------=-----------= 0,1 моль • л ,
тели M-V 98,143 0,1
где: m - масса соли, г;
V - объем раствора, л;
М - молярная масса соли, г-моль'1.
Находим значение KCHjC00H = 1,74 10'5. Подставим полученные значения в формулу для расчета степени гидролиза:
( 1 • 10 [4
h = J ------------7,58-10 5~7,6- 10”5.
V 1,74 Ю’5-0,1
Из приведенного выше уравнения гидролиза ацетат-ионов следует, что концентрация образующихся гидроксид-ионов равна концентрации ацетат-ионов. Тогда, [ОН~] = |СН3СОО”] = 1гСсоли = 7,6-10 50,1 = 7,610”6 моль-л'1. Отсюда, рОН = -1g 7,6-10'6 = 5,12 и pH = 14 - 5,12 = 8,88.
Задача 2. Вычислить константу гидролиза аммония хлорида и pH его 0,1 моль-л'1 раствора.
Пример решения. Аммония хлорид ионизирует по уравнению: NH4C1 NHZ + СГ.
Так как данная соль образована слабым основанием и сильной кислотой,
гидролиз идет по катиону:
NH? + Н2О NH4OH + Н+.
Для расчета константы гидролиза соли подобного типа следует воспользоваться формулой:
v 1 о-14
К = — w = —------------= 5,68-10-'°.
' 1,76-105
Значение величины [Н+] в растворе аммония хлорида найдем по форму
ле:
[Н+] = jKt-Cc~ = Дбв-Ю’1<01 = 7,63 1 О’6моль л“‘.
Тогда, pH = -1g 7,53-10“6 = 5,12.
Задача 3. Во сколько раз увеличится степень гидролиза аммония ацетата, если его раствор нагреть с 25° до 60°С? (Kw - 10”13 при 60°С. Константы ионизации уксусной кислоты и аммония гидроксида считать не изменяющимися с температурой).
Пример решения. Ацетат аммония ионизирует по уравнению: CH3COONH4 -► СПзСОО” + NH/.
Так как данная соль образована слабым основанием и слабой кислотой, то гидролиз идет по катиону и аниону:
СНзСОО” +NH4+ + H2O CH3COOH + NH3- Н2О.
61
Из таблицы следует, что для расчета степени гидролиза таких солей еле дует воспользоваться формулой:
1
1+ —*— VKa-Kb I а b
Рассчитаем степень гидролиза при температурах:
25°С
1014
V1?74 1(F1?76-1O7 3
п 25<,с = — , =5,74-10 .
ю'4
1,74-10s-1,76-Ю"5
10 13
60°С
^6О°С
\1,74-105-1,76-Ю-5 _]891П-2
--------------------- — 1 ,04 1U
10п 1,74 105 1J6-40’5 h60.c _1,82-10"2
Следовательно, степень гидролиза возросла в --- 3
п25оС 5,74-10
= 3,17 раза,
Решить самостоятельно следующие задачи.
Задача 4. Вычислить pH 0, 01 М раствора аммония хлорида.
Задача 5. При 60°С ионное произведение воды равно 1()"13. Считая что константа ионизации хлорноватистой кислоты не изменяется с температурой, вычислить pH 0,001М раствора КОС1 при 25° и 60°С и рассчитать, вс сколько раз возросла степень гидролиза соли.
Задача 6. Сколько граммов аммония хлорида нужно взять, чтобы получить 100 мл раствора, имеющего величину pH = 5,12?
Равновесия в буферных растворах
В самом широком смысле буферными называют системы, поддерживающие определенное значение какого-либо параметра при изменении состава. Буферные растворы могут быть кислотно-основными - поддерживают постоянное значение pH при введении кислот или оснований; окислительно-восстановительными - сохраняют постоянным потенциал систем при введении окислителей или восстановителей; известны мсталлобуферные растворы, в ко
62
торых поддерживается постоянное значение рМе. Буферный раствор представляет собой сопряженную пару; в частности кислотно-основные - сопряженную кислотно-основную пару. Например, ацетатный буферный раствор состоит и: СН3СООН и СНзСООМа, аммонийный - из МНз*Н2О и NH4C1, фосфатный - и-NaH2PO4 и Na2HPO4.
pH буферных растворов, состоящих из слабой кислоты и ее соли рассчитывают по уравнению:
pH = pKa-lg^^.
pH буферных растворов, состоящих из слабого основания и его соли рассчитывают по уравнению:
С pH = 14 - рКв + 1g основа,,ия-. ^соля
Задача. Вычислить pH ацетатной буферной смеси, содержащей в 1 л раствора по 0,2 моль каждого компонента. Как изменится pH при добавлении в 1 л смеси:
а) 0,01 моль НС1;
б) 0,01 моль NaOH.
Пример решения. В состав ацетатной буферной смеси входят СНзСООН и CH3COONa.
СН3СООН - СН3СОО” + Н+ (слабый электролит: ионизирует обратимо)
CH3COONa —► СН3СОО” + Na+ (сильный электролит: диссоциирует нацело)
В присутствии одноименных ионов (СН3СОО') ионизация СН3СООН глубоко подавлена. Поэтому концентрацию неионизироваипой части кислоты можно принять равной ее начальной концентрации, т.е.
[СНзСООН] - C™™™.
Практически все ацетат-ионы образуются вследствие диссоциации соли, т.е. [СН3СОО ] = Ссоли.
рН = рК. pH = 4,76-lg^| = 4,76
а) если прибавить 0,01 моль НС1, то произойдет реакция между НС1 и CH3COONa:
СН3СОО“ +Н+ СНзСООН,
и концентрация уксусной кислоты возрастет и станет равной 0,2 + 0,01 = 0,21 молыл"1, а концентрация соли понизится до: 0,2 - 0,01 =0,19 моль-л"1.
0 21
pH = 4,76-1g—= 4,72
0,19
63
б) если прибавить 0,01 моль NaOH, то произойдет реакция между NaOH и СНзСООН:
СН3СООН” + ОН” СН3СОО” + Н2О, и концентрация уксусной кислоты станет равной 0,2 - 0,01 =0,19 моль л-1, а концентрация соли увеличится: 0,2 + 0,01 = 0,21 моль л”1.
0 19
pH = 4,76 -1g— = 4,80
0,21
Ответ.pH = 4,76; а) pH = 4,72; б) pH =4,80.
Очевидно, что добавлять сильную кислоту или сильное основание к буферному раствору и надеяться на несущественное изменение pH можно лишь в определенных пределах. Каждый буферный раствор характеризуется сопротивляемостью к изменениям. Количественно ее выражают буферной емкостью л. Она определяется числом молей эквивалентов сильной кислоты или основания, которые нужно добавить к 1 л раствора, чтобы изменить pH раствора на единицу: de л = — кисл-dpH
где de - прирост концентрации сильной кислоты (dcKHCJ1) или основания (dCocji)» вызвавший изменение dpH (знак минус указывает на уменьшение pH при добавлении сильной кислоты НА). Бесконечно малый прирост концентрации сильной кислоты (dcKHCJ1) приводит к образованию такого же количества слабой кислоты d[HA], а бесконечно малый прирост концентрации сильного основания (dcOCH) приводит к появлению такого же количества слабого основания d(A~], только в первом случае pH немного уменьшается, а во втором увеличивается. Суммарная концентрация компонентов смеси СбУф не меняется.
Буферную емкость рассчитывают по формулам:
de и л = —
dpH
осн.
л = 2,3-[Н + ]--:---^—,или
(К,+[Н'])2
_ « п СНЛСд-Л = Z,3-- —,
C-iA +СА-
где: Сна и Са- — концентрации компонентов сопряженной кислотно-основной пары;
Сбуф Ссоли 4" С к-ты( осн.)*
К1 = Ка (для слабых кислот), К
К! = —- (для слабых оснований).
кь
Зная буферную емкость, можно найти изменение pH раствора при добавлении сильной кислоты или основания, определить состав буферной смеси и решать другие вопросы.
64
Задача. Рассчитать буферную емкость аммонийной буферной смеси, содержащей О, ЮМ NH3 и 0,20М NH4C1 (pH = 8,96). Как изменится pH при добавлении к 1 л буферной смеси 110'2 моль НС1?
Пример решения.
pH - 8,96 соответствует [Н+] =1,1- 109 моль л-1
Рассчитываем буферную емкость раствора:
5 7 1О~10 0 30 л = 2,3 • 1,1 • 10”9--- = 0,15моль л”1
(5,7 10 +1,1-10 )
0,10 0,20 или я =2,3------------= 0,15 моль л .
0,10 + 0,20
При добавлении к 1 л этого раствора 1,0-10”2 моль НС1:
АрН = - = 1,0 1° = -6,7 • 10~2.
л 0,15
pH раствора после введения НС1 стал 8,96 - 6,7*10”2 = 8,89.
Ответ, л = 0,15 моль-л”1; pH = 8,89.
Решить самостоятельно следующие задачи.
Задача 1. Вычислить pH ацетатной буферной смеси, содержащей в 1 л раствора 0,2М CH3COOONa, 0,2М СН3СООН. Как изменится pH этого раствора при добавлении 0,01 М НС1?
Задача 2. Бензоатная буферная смесь содержит 0,35 моль СбН5СООН и 0,35 моль СбН5СООМа в 1 л раствора. Вычислить pH буферного раствора.
Задача 3. К 25 мл 0,1 М раствора СН3СООН прибавили 25 мл 0,1М раствора CH3COONa. Вычислить pH полученного раствора. Как изменится pH этого раствора при добавлении 0,0IM NaOH?
Задача 4. Вычислить pH аммиачной буферной смеси, содержащей по 0,5 моль NH3 H2O и NH4C1 в I л раствора. Как изменится pH этого раствора при добавлении 0,2М NaOH?
Задача 5. Вычислить pH раствора, содержащего 0,5 моль муравьиной кислоты и 0,5 моль натрия формиата в 1 л.
Задача 6. Каким должно быть соотношение между компонентами в ацетатном буферном растворе, pH которого равно 5,0?
Равновесия в растворах комплексных соединений
Комплексы - химические соединения состоящие из центральной частицы (комплексообразователь), которая связана с одним или несколькими ионами (молекулами), называемыми лигандами.
65
При описании равновесий комплексообразования следует помнить, чтс ионы в растворе всегда сольватированы. Поэтому образование комплексов можно представить как последовательное замещение молекул растворителя (S) m молекулы или ионы лиганда (L): l
MSn+ L = MSn.jL+S I
MSnjL + L = MSn.2L2 + S I
MSUjlk L = М17 + s
Необходимым условием возможности таких процессов является более высокая по сравнению с растворителем донорная способность лиганда и стсри-ческая доступность. I
Поскольку в разбавленных растворах активность растворителя практиче( ски постоянна, а точное число молекул растворителя, сольватирующего ион, не? всегда известно, то равновесия комлексообразовапия обычно представляют в следующем виде:
Ступенчатые Суммарные
М + L = ML М + L = ML I
ML + L = ML2 M + 2L = ML2
MLn-i + L = MLn M+ nL = MLn I
В соответствии с законом действующих масс ступенчатое образование комплексов можно представить набором соответствующих термодинамических ступенчатых констант устойчивости:
a
MI.
a M a L a МЧ
3 ML 3 L a
0
2
ML,
к:
3 MLB_, а I.
Константы соответствующих суммарных равновесий называют общими (суммарными) константами устойчивости и обозначают символом р:
р» = к" = —
а М а L а ml2 а М а I _ а МЬП „ „ п
а к, а 1 М L
p° = K“K“
0 n
66
Задача. Вычислить равновесные концентрации ионов серебра (1) и молекул аммиака в 0,05 М растворе [Ag(NH3)2]Cl.
Пример решения. Диссоциация соли представлена уравнениями:
[Ag(NH3)2]CI -> [Ag(NlI3)2]+ +СГ (1)
[Ag(NH3)2]+ Ag++ 2NH3 (2)
Для второго обратимого процесса запишем выражение константы равновесия (константы нестойкости):
к = [Ag'HNH, ]2 [[Ag(NH3)2rf
= 7,23, следовательно, 0 = 10723 = 1,7-107, Кнесг = = 5,9 • 10 \ н
Обозначим [Ag+] = х моль-л'1, тогда из уравнения (2) [NH3] = 2х моль-л”a [[Ag(NH3)2]+] = С - х моль-л”Подставим эти обозначения в выраже
ние:
к _х-(2х)2 4^
С-х С *
flCTc 1Л_3
х = з —-----= з-----------—= 0,9-10 ;
V 4 V 4
[Ag+] = х = 0,9-10 3 моль-л”1;
[NH3] = 2х = 1,8-10"3 моль-л”1.
Ответ. [Ag+] =0,9-10”3 моль-л 1
[NH3] = 1,8-10”3 моль-л 1
Решить самостоятельно следующие задачи.
Задача 1. Вычислите [Сн2+] и [NH3] в 0,1М растворе [Cu(NH3)4] SO4.
Задача 2. Вычислите [Со2+] и [NH3] в 0,1М растворе [Co(NH3)6] SO4.
Задача 3. Вычислите [Hg2+J, [Г], [К+] в 0,2М раствореK2[HgI4].
Задача 4. Вычислите [Fe3+], [CN‘], [K+J в 0,05М растворе K3[Fe(CN)6J.
Задача 5. Вычислите [Bi3+], [I’J, [К+] в 0,25Мрастворе K[BiI4J.
Окислительно-восстановительные процессы
Окислительно-восстановительные реакции - реакции, происходящие с участием электронов и приводящие к изменению степени окисления элементов реагирующих систем.
Oxi + пё ’ " Redi
__Red2 - пё ~~ Ох2
Oxj + Red2 = Redi + Ох2
67
Способность отдавать и принимать электроны у разных веществ различна Для оценки этой способности может служить константа равновесия реакции выраженная через активности:
£ _ **0x2 ‘ **Redl I
**0х[ ’ ^Red2
Для оценки окислительно-восстановительной способности более удобно! оказалась другая термодинамическая величина - потенциал. Это связано с уникальной особенностью данного типа реакций: полуреакции окисления и восста новления можно разделить в пространстве, поскольку при переносе электронов возникает электрический ток. Следовательно, энергию химической реакции можно преобразовать в электрическую. Практически такое преобразование осуществляется в гальваническом элементе. Поэтому можно количественно описывать окислительно-восстановительные реакции нс константой равновесия, а электродвижущей силой гальванического элемента - потенциалом.
Зависимость окислительно-восстановительного потенциала от концентрации и температуры рассчитывают по уравнению Пернста:
RT . а*
Е = Е +-----In-jr-. ।
nF а’
red I
где: Е - реальный редокс-потенциал системы, В;
Е° — стандартный редокс-потенциал системы , В;
Т - абсолютная температура, К;
п - количество электронов, которые участвуют в окислительно-восстановительном процессе;
R - универсальная газовая постоянная, равная 8,312 Дж/(моль К);
F - постоянная Фарадея, равная 96 500 Кл;
аОх - ared - активности окисленной и восстановленной форм рсдокс-пары в степенях их стехиометрических коэффициентов соответственно, моль-л'1.
Часто постоянные величины объединяют в одну константу, а натуральный логарифм заменяют десятичным. Тогда при 25°С:
Е=Е. + 2да1Е4. п а . гео
Если реакция окисления-восстановления проходит с участием протонов водорода, то скорость ее увеличивается с увеличением их концентрации, согласно закону действующих масс.
Стандартный редокс-потенциал системы - потенциал системы, в которой все участники по-лурсакции находятся в стандартном состоянии (при активности, равной единице), а растворенные вещества - в стандартном растворе.
68
В этом случае увеличивается и реальный редокс-потенциал системы. Например, для системы полуреакции:
+ Зе + МпО4 + 4Н+ МпО2Г + 2Н2О (1)
Е = Е° + lg[MnO4 ] [Н* ]4 (при 25°С),
(2)
а для системы полуреакции:
+ 5е + МпО4 + 8Н+ ' Mn2+ + 4Н2О
Е=Ео+_ода,81мпОЦ[нП* * 8(лр|1250С)
5 [Мп2+]
Величина Е значительно зависит от концентрации кислоты, и в присутст-вии концентрированной H2SO4 ее значение увеличивается от + 1,51 В до + 1,9 В (для реакции 2).
Изменение концентрации Н+ или ОН “-ионов влияет не только на изменение величины редокс-потенциала, но иногда и на направление хода реакции. Так, взаимодействие арсснит-ионов с йодом возможно только в среде натрия гидрокарбоната (pH = 9) согласно уравнения:
- 2е + AsO2 + 4ОН' ' ’ AsO43“ + 2Н2О 1
+ 2е + [13Г — ЗГ_____________________1
AsO2“ + [I3J “ + 4ОН AsO43“ + ЗГ + 2Н2О
В кислой среде такое взаимодействие невозможно, так как
E0h3asO4/hasO2 = 0’56 В, что больше Е°цэ]~/з I = 0,545 В и потому изменяется
Ео = 0,545 В
направление протекания реакции:
+ 2е + H3AsO4 + 2Н+ " HAsO2 + 2Н2О 1 Eq = 0,56 В
-2е + ЗГ — [13]~______________________1 Ео = 0,545 В
H3AsO4 + 31 + 2Н+ HAsO2 + [1з1 + 2112О
На величину редокс-потенциала оказывают влияние кислотно-основные взаимодействия, реакции комплексообразования и образования малорастворимых соединений, т.к. эти процессы влияют на форму существования ионов и как следствие на их концентрацию.
Значительное влияние на скорость окислительно-восстановительных реакций, кроме концентрации реагентов и температуры, оказывает введение катализаторов и ингибиторов. Катализатором может служить постороннее вещество, а также одип из продуктов реакции (автокатализ). Например, катализатором реакции восстановления щавелевой кислотой перманганат-иопов до Мп2+ являются катионы марганца (II), то есть продукт реакции.
Полнота протекания окислительно-восстановительных реакций зависит от следующих факторов:
• ЕДС реакций - разности редокс-потснциалов взаимодействующих систем; обычно количественно протекают реакции, ЭДС которых больше 0,4 В.
69
• величины константы равновесия редокс-реакции, которую рассчитываю по уравнению:
а п(Е"-Е") , „ п(Е°-Е°)
Кр=10,где а= (при 25°С), или lgKp=— ——,
u,uj7
де: п - количество электронов, которые принимают участие в процессе;
ЕО г? О
1, В2 - стандартные редокс-потенциалы системы окислителя и восста новителя соответственно, В.
70
количественный анализ
Схема 1
КЛАССИФИКАЦИЯ МЕТОДОВ КОЛИЧЕСТВЕННОГО АНАЛИЗА
КЛАССИФИКАЦИЯ ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ АНАЛИЗА ПО ТИПУ ХИМИЧЕСКОЙ РЕАКЦИИ, ЛЕЖАЩЕЙ В ОСНОВЕ МЕТОДА
73
Схема 3
КЛАССИФИКАЦИЯ ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ АНАЛИЗА ПО СПОСОБУ ТИТРОВАНИЯ
Прямое титрование Обратное титрование Заместительное титрование
К раствору определяемого вещества непосредственно добавляют раствор титранта К раствору определяемого вещества добавляют точно отмеренный избыток одного титранта, а не вступивший в реакцию его остаток оттитро-вывают вторым титрантом К раствору определяемого вещества добавляют вспомогательный реагент, с которым оно образует в эквивалентном количестве новое соединение -заместитель. Концентрацию последнего определяют прямым титрованием
Пример: H2C2O4 + 2NaOH — Na2C2O4 + 2Н2О Пример: СНзСООН + NaOH (изб.) ,₽я"* —- CH3COONa + H2O NaOH (ост.) + НС1 — 4—- NaCl + Н2О Пример: +6е + Сг2О72' + 14Н+ * 2Сг3+ + 7Н2О 1 -2е + 31“ —[13]- 3
Сг2О72' + 14Н+ + 91”—» 2Сг3+ + 7Н2О + З[13]” -2е + [13]- — ЗГ -2e + 2S2O32- S4O62-
Пз]'+2820з2”—» 31" +SXV-
.и
КЛАССИФИКАЦИЯ ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ АНАЛИЗА ПО СПОСОБУ ФИКСИРОВАНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
75
Таблица 1
ГРАВИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Гравиметрический метод анализа основан на точном измерении массы определяемой составной части вещества, выделенной в свободном виде или в виде соединения определенного состава
Методы осаждения Методы отгонки
В методах отгонки определяемый компонент количественно отгоняют в виде летучего соединения
Прямые методы отгонки Косвенные методы отгонки
1 2 3
В методах осаждения определяемый компонент количественно осаждают в виде малорастворимого химического соединения строго определенного состава. Например, - при определении их осаждают ионами Ва2+: Ва2++ SO42' *=* BaSOU осажденная форма - после прокаливания: А BaSO4| > BaSO4 гравиметрическая форма Метод отгонки называют прямым, если массу отогнанного продукта измеряют непосредственно. Например, определение СО2 после разложения навески кальция карбоната и поглощения СО2 трубкой с натрия гидрооксидом: А СаСО3;* 2Н+ > ССМ + Са2+ + Н2О СО2 + 2NaOH > Na2CO3 + Н2О Содержание СО2 вычисляют по увеличению массы поглотительной трубки, наполненной натронной известью (NaOH + СаО). Метод отгонки называют косвенным, если массу отогнанного вещества определяют по разности массы проб до и после отгонки. Например, при определении влажности материалов, кристаллизационной воды в кристаллогидратах, потерь при прокаливании: А ВаС12'2Н2О ► ВаС12 + Н2О1
Продолжение табл. 1
1 2 3
В этом случае осажденная и гравиметрическая формы совпадают: - при определении Са2+ -ионов их осаждают (NH4)2C2O4 Са2+ + С2О42- ' СаС2О41 осажденная форма - после прокаливания: СаС2оД -> СаО + СО2? + СО? гравиметрическая форма Расчеты результатов определений по методу осаждения: _ гПгр.ф. -F-100 со, % = Шн где: со - содержание анализируемого вещества, %; т!? ф, - масса гравиметрической формы, г; F - гравиметрический фактор; тк - масса навески анализируемого вещества, г Расчеты результатов определения по методу прямой отгонки: ~ ГПгр.ф.-100 со, % = ПЪ где: св - содержание анализируемого вещества, %; тн - масса навески анализируемого вещества, г; Шгр ф. - масса гравиметрической формы, которую определяют по увеличению массы поглотительного прибора, г Расчеты результатов определения по методу косвенной отгонки: (ти-тгр.ф)-100 (О, % = - ----- ПЪ где: со - содержание анализируемого вещества, %; - масса навески исследуемого вещества, г; 1Пгр. ф - масса высушенного или прокаленного анализируемого вещества после удаления летучих компонентов, г
Таблица 2
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ
00
Титрант метода Индикаторы метода Стандартные вещест ва и стандартные растворы Возможности метода Условия титрования Уравненияе реакции
Растворы кислот НС1, H2SO4 и др. 0,1М...0,001М (ацидиметрия) Кислотно-основные индикаторы (например, метиловый оранжевый, фенолфталеин) Стандар гные вещества (Na2B4O710Н2О, Na2CO3, К2СО3). Стандартные растворы (NaOH, КОН, Ва(ОН)2) Определяют: • сильные кислоты и основания; • слабые кислоты и основания (K^S-IO7); • гидролизующиеся соли, образованные слабым основанием, с Кв<5 10'7 и сильной кислотой или слабой кислотой, с Ка< 5-10'7, и сильным основанием 1. Правильный выбор индикатора по продуктам реакции или по кривой титрования. 2. Медленно вблизи точки эквивалентности. 3. t=20-25°C Н+ + ОН" нон Например, прямое титрование: ф.ф. Na2CO3 + НС1 — NaHCO3+ NaCl М 0. Na2CO3+2HCl^’ — С02] + 2NaCl + -H20 обратное титрование: СНзСООН 4- NaOH^g) —’ CH3COONa+H2O NaOH(OCT)+HCb ^NaCl + H2O
Растворы щелочей NaOH, КОН и др. 0,1М...0,001М (алкалиметрия) Стандартные вещества (Н2С2О4- 2Н2О, Н2С2Н4О6). Стандартные растворы (НС1, H2SO4)
Таблица 5
ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ
Название метода Титранты метода Стандартные вещества Индикаторы метода Возможности метода Условия титрования Уравнения реакций
1 2 3 4 5 6 7
Аргентометрическое титрование по методу Мора Раствор AgNO3, 0,1М или 0,05М Стандартные вещества и стандартные растворы NaCl, КС1 К2С1О4-5% раствор Определяют СГ иВг” Титрование проводят: 1) pH 6,3-10,5; 2) отсутствие: Ва2+, СО32-, Pb2+, Hg22+, РО4 (образуют осадки с титрантом или индикатором) Ag+ +СГ — AgCU 2Ag+ + CrO42’ ' — Ag2CrO4|
Аргентометрическое титрование по методу Фольгарда (тиоциа-натомет-рия) Прямое титрование; раствор nh4ncs (KNCS) или раствор AgNO3, концентрация которых 0,05 М или 0,1М Обратное титрование: оба вышеуказанных титранта Стандартные вещества и стандартные растворы AgNO3, КС1 и NaCl, KNCS Насыщенный раствор железоаммонийных квасцов NH4[Fe(SO4)2] Определяют прямым титрованием Ag+ , Hg2+ и с титрантом раствора KNCS Вг“,Г. Определяют обратным титрованием: СГ,Вг" 1. Титрование проводят в кислой среде. 2. Отсутствие солей Hg(I), которые осаждают NCS' -ионы и F"-ионов, образующих комплекс с Fe3+; Fe3+ + 6F~ — [FcF6|3~ 3. При определении Г-ионов - индикатор добавляют в конце титрования, т.к.возможно протекание реакции: 2Ре^+2Г — + Ц Прямое титрование: Ag+ + NCS — — AgNCSJ, 3NCS" + Fcu — [Fe(NCS3)] Обратное титрование: Ag+ + СГ ' ' AgCU Ag++ NCS" — AgNCSJ, Fe3+ + 3NCS“ — — [Fe(NCS3)]
Продолжение табл. 3
1 2 3 4 5 6 7
I-, S2', AsO43', со,2; с2о42; ncs; роД CN, сю? 4. При определении СГ-ионов добавляют ССЦ, CHCI3 или C6H5NO2 или отфильтровывают AgClj,, возможна обменная реакция: AgClj+NCS“^ — AgNCSp- СГ
Аргентометрическое титрование по методу Фаян-са-Хода-кова Раствор AgNO3,0,lM или 0,05М Стандартные вещества и стандартные растворы NaCI, КС1 Адсорбционные индикаторы, например: эозин (рН=2), флуоресцеин (рН=7-10) и др. (см. табл. 12 приложения) Определяют СГ, Вг ,1 NCS” Титрование проводится при определенном значении pH, зависящем от выбора применяемого индикатора Ag+ + Г Agl|
Меркуро-метри чес-кий метод Раствор Hg2(NO3)2 0,1М Стандартные вещества и стандартные растворы NaCI, КС! Железа (111) тиоцианат [Fe(NCS>3], дифенилкарбазон /N Н "N Н "С gH 5 С =0 -СбН5 Определяют СГ,ВГ,Г Титрование проводят в кислой среде Hg22+ + 2C1' ’ Hg2ci2;
Таблица 4
МЕРКУРИМЕТРИМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Титрант метода Стандартные вещества Индикаторы метода Возможности метода Условия титрования Уравнения реакции
Раствор Hg(NO3)2, ОДМв HNO3 Стандартные вещества и стандартные растворы NaCl, КС1 Раствор натрия нитропруссида (Na2[Fe(CN)5NO]). Раствор ди фенил карбаз и да NH —NH— СбН5 с^о NH-NH-QH5 или дефинилкарб-азона /NH -NH -С6Н5 с =о =N -С6Н5 Безындикаторный -при определении 1~ Определяют С1", Br\r,CN‘, NCS" Определение проводят в кислой среде (HNO3) Hg2+ + 2СГ [HgChl Hg2+ + 2Br’ [HgBr2] Hg2+ + 2NCS' [Hg(NCS)2] Hg2++ [Fe(CN)5NO]2' Hg[Fe(CN)5NO][ или окрашенные комплексы Hg2* с дифенилкаразидом или дифеникарбазоном Hg2+ + 4F—[Hgl4]2-[Hgl4]2- +Hg2+ — 2HgI4
Таблица 5
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Титрант метода Стандартные вещества Индикаторы метода Возможности метода Условия титрования Уравнения реакций
1 2 3 4 5 6
Прямое титрование: раствор трилона Б (Na2H2L) 0,05М... 0,1М Стандартные вещества Zn, ZnO, СаСО3. Стандартные растворы ZnSO4, MgSO4 Металло-хромные индикаторы: эриохром черный Т, мурексид и др. (см. табл. 13 приложения) Определяют Си2+, Со2+, Pb2+, Ni2+, Sr2+, Fe3+, Al3+, Ва2+, Zn2+, Са2+, Mg2+ и др. Определение проводят при фиксированном значении pH раствора H2L2 + Me2+ [MeL]2 + 2H+ К раствору, содержащему катионы металла, прибавляют амиачный буферный раствор, индикаторную смесь и титруют стандартным раствором трилона Б до изменения окраски. N^CH2COO' ги хсн2соон 7 -IT 2 Н21? = | 2 сн2 xN <сн2соон СН2СОО'
Продолжение табл, 5
1 Г 2 3 4 5 6
Обратное титрование: 1. Раствор гри-лона Б 0,05М...0,1М 2. Растворы MgSO4 или ZnSO4 0,05 М.,.0,1 М 1. Отсутствие подходящего индикатора. 2. Образование осадка катионов в буферном растворе. 3. Медленное протекание комплексообразования. 4.Определение катионов в осадках, нерастворимых в воде (СаСзОд, MgNH4PO4 и др.) Определение проводят при фиксированном значении pH раствора H2L2;„36.)+ Ме2+ [MeL]2'+ 2Н+ H2L2(OCT)+ Mg2+ —‘ [MgL]2’+ 2Н+ К раствору, содержащему катионы металла, прибавляют избыток раствора трилона Б, который оттитро-вывают раствором соли магния или цинка с металлохромными индикаторами
Заместительное титрование; раствор три-лона Б 0,05 М.,.0,1 М Определение металлов —1| — Ме2+ + [MgL]2’ — [MeL]2’ + Mg2+ H2L2 + Mg2+ [MgL]2’+2H+ В раствор вводят избыток комплекса грилона Б с магнием или цинком. Определяемый катион с трилоном Б образует более прочный комплекс, выделяя эквивалентное количество Mg2+ или Zn2+, которое отитровывают раствором трилона Б
Кислотно-основное титрование: 1. Раствор три-лона Б 0,05 М; 2. Раствор КОН (NaOH)0,lM Кислотно-основные индикаторы Определение металлов Me2v + [H2L]2’ ' ‘ [MeL]2’ + 2Н+ 2Н++2ОН’’==5 2Н2О
Схема 5
МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
Методы окислительно-восстановительного титрования
Оксидиметрия
Метод основан на определении восстановителей путем их титрования стандартными растворами окислителей:
перманганатометрия (титрант КМпО4),
броматометрия (титрант КВгО3),
дихроматометрия (титрант К2СГ2О7),
йодометрия (титрант 12 в К1),
йодхлориметрия (титрант IC1) и др., нитритометрия (титрант NaNO2), периметрия (титрант -
растворы солей Се4')
____________Ж___________ Редуктометрия
Метод основан на определении окислителей путем их титрования стандартными растворами восстановителей: йодометрия (титрант Na2S2O3),
нитритометрия (титрант NaNO2), гидразинометрия (титрант N2H< H2SO4), аскорбинометрия (титрант С6Н8О6), ферромстрия (титрант FeSO4) и др.
84
ПЕ РМ АНГ АН АТОМЕТРИЧЕСКОЕ ТИТРОВАН ИЕ
Таблица б
Титранты метода Индикаторы метода Стандартные вещества Возможности метода Условия титрования Уравнения реакций
Раствор КМпОд 0,1М; 0,05М 1. Безындикаторный: - по появлению не исчезающей в течение 30 секунд розовой окраски при добавлении одной избыточной капли титранта; 2, Индикаторный: - редокеиндикаторы, например ферроин нйси- адэ Na2C2O4, As2Oj, Fe (мет.), (NHibFefSO^. • 6Н2О. Стандартные растворы Н2С2О4 и NaAsO2 Определяют 1) восстановители: - С2О42’; Fe2+; Н2О2; NO2” прямым титрованием; Са2+ в различных препаратах - обратным или заместительным титрованием. 2) окислители: - МпО2; РЬО2; K2Cr2O7; S2O82 обратным титрованием (2-ой стандартный раствор - раствор Н2С2О4 или NaAsO2); 3) Са2+, Sr2+, Ва2+, РЬ2+ - заместитель-ным титрованием (возможно обратное титрование) Титрование проводят: а) в сильнокислой среде (среда H2SO4); б) при нагревании (t = 60-70°С) или комнатной темпе- ратуре; в) титруют медленно, каждую последующую каплю титранта добавляют после обесцвечивания предыдущей + 5е+МпО4’ + 8Н+ Мп2+ + 4Н Е°= 1,51В; Определение Са2+ методом обра ного титрования 1 ,Са" + С2О4 (изб.) ь СаС2О4Ф - + С2О42’ (ост.) 2. -2е + С2О42 + — 2СО2 Т +5е+МпО4+8Н+« - Мп2++4Н2О т- 5 2
2МпО4 + С2О42’(ост.) + 16Н+ -> —> 2Мп2++ 8Н2О + 10СО2? Определение Са"+ методом заме тигельного титрования 1 ,Са2+ + С2О42 - - СаС2ОД 2.СаС2ОД + 2Н" - Са2+ + Н2С2< 3,-2е + Н2С2О4 - * 2COJ + 2FT +5е+MnO4+8ЬГ - - Мп2++4Н,О с- э4 5 2
2МпО4’ + 5Н2С2О4 + 6Н+ -> -> 2Мп2+ + 8Н2О + 10CO2t
Таблица 7
ЙОДОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Титранты метода Индикаторы метода Стандартные вещества Возможности метода Условия титрования Уравнения реакций
1 2 3 4 5 6
1. Раствор 12 в К1 0,1М - 0,05 М 2. Раст- вор Na2S2O3 1,Безынди-каторный: избыточная капля титранта (Ь) окрашивает раствор в светло-желтый цвет или слой хлороформа -в краснофиолетовый цвет As2O3; n2h4- - H2SO4, BaS2O3 и стандартный раствор Na2S2O3 для стан-дартизаци и раствора 12вК1 Определяют: 1) слабые окислители (12) - прямым титрованием раствором Na2S2O3; 2) восстановители Na2S2O3, As2O3 - прямым титрованием раствором 12 в KI; 3) сильные окислители -по способу замещения (КВгО3, К2Сг2О7, активный хлор, Н2О2 и др.); 1. На холоде, т.к. йод летуч, при нагревании также понижается чувстви-тель-ность индикатора - крахмала. 2. Среда титруемого раствора должна быть нейтральной, слабокислой или слабощелочной. а) в сильнощелочной среде происходит побочная реакция диспропорционирования йода I2+ 2ОН' Ю' + Г + Н2О б) в силыюкислой среде идут побочные реакции: hv 4Г+О2+4Н+ —- 212+2Н2О И S2O?+2H+-> SO2t+S|+H2O 1) +2е + И' ЗГ 1 -2е + 2S?O32~ S4O? 1
[I3] +2S2O32 S4O62 +3F 2) -2е+AsO33’+2ОН’ AsO?+H2O +2е + Пл! 31
AsO34[I3I+2OH’ AsO4v+3I+H2O 3) +6e+Cr2O72+14H+ 2Cr3++7H2O 1 - 2е + ЗГ — |1,Г 3
Сг2О72>14Н++9Г—>2Сг3++7! +2е + [13] *= 31 -2е + 2S2O32 540б Н2О+3[1зГ 1 1
[I3]'+2S2O32’ S4O62'+3r
Продолжение табл. 7
1 2 3 4 5 6
Раствор Na2S2O3 0,1 м-0,05 М 2. Индикатор -0,5% раствор крахмала К2СГ2О7, КВгО3, КЮ3 K3[Fe(CN)6] и стандартные растворы 12 в KI, КМпО4 для стандартизации раствора Na2S2O3 4) сильные кислоты -прямым титрованием, слабые - обратным титрованием; 5) ароматические и гетероциклические соединения (фенолы, дифснолы, ароматические амины); 6) ненасыщенные углеводороды 3. При определении сильных окислителей методом замещения необходимо прибавлять избыток калия йодида для растворения выделившегося йода в результате комплексообразования: 12 + Г [13]- ; после прибавления KI реакционную смесь выдерживают 10-15 минут в темном месте 4) +10е +2Ю/+12Н+ 12+6Н2О 1 - 2е + 2Г 12 5 Ю3+6Н+ + 5Г->312 + ЗН2О зь+ зг — згы~ Юз' + 6ЬГ + 8Г -► З[13г + ЗН2О Выделяется йод в количестве эквивалентном сильной кислоте, который отгитровывают раствором Na2S2O3
Таблица 8
ОС 00
ИОДХЛОРИМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Титранты метода Индикаторы метода Стандартные вещества Возможности метода Условия титрования Уравнения реакций
Раствор IC1 0,1 М 1 .Раствор крахмала 2.Безындика-торный: образовавший ся йод окрашивает раствор в светло-желтый цвет или слой хлороформа- в красно-фиолетовый цвет As2O3, N2H4- H2SO4, K4[Fe(CN)6] и стандартные растворы KI; Na2S2C>3 Определяют: 1) Sn2+, NCS’, SO32\ аскорбиновую кислоту, антипирин -прямым титрованием; 2) Hg2+, Fe2+ - об-ратным титрованием; 3) KI - заместительным титрованием Титрование проводят в кислой среде (НС1) Приготовление титранта -2ё + Г+СГ ₽=* IC1 2 +4ё +Ю3’ +6Н+ +СГ —“ IC1 + ЗН2О 1
2Г + Ю3 +6Н+ +ЗСГ 3IC1 + ЗН2О +2ё + IC1 — Г + СГ Е° = +0,795 В (при Е<0,4 В) +2ё + 21С1 — 12 + 2СГ Е° = +1,06 В (при Е<0,6 В) - 2е + SO32' + Н2О — SO42' + 2Н+ 1 + 2е + IC1 — Г + СГ 1
SO32+Н2О+1С1 -> so42+2H++cr + Г IC1 + 2Г -> Пз]’ + СГ
Таблица 9
БРОМАТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
ОС чо
Титранты метода Индикаторы метода Стандартные вещества Возможности метода Условия титрования Уравнения реакций
Раствор КВгО3 0,1 М Кислотноосновные индикаторы (метиловый красный, метиловый оранжевый), которые необратимо окисляются избыточной каплей титранта Стандартное вещество AS2O3. Стандартный раствор Na2S2O3 (стандартизуют титрант йодометрическим методом замещения) Определяют: а) восстановители N2H4*H2SO4, Sb(III), Sn2+, As2O3, As(III) путем их прямого окисления; б) фенолы: фенол, резорцин (обратное титрование), тимол, салициловая кислота -путем их бромирования; в) ароматических амины, например, стрептоцид Кислая среда а) +6ё + В1О3 + 6Н* • Вг + ЗН2О - 2е + AsO? + Н,О —ь AsOZ+lbT 1Е°=1,45В ЗЕ°=0^6В
BrOj + 3AsO3 —Вг + 3AsO4 б) -2с + 2Вг -— Вг2 +10ё+2ВгО/+12Н+ —' Вь + 6Н>0 5Е°=1,087В 1Е°= 1,52 В
ВгОз' + 5Вг + 6Н+ '— ЗВг2 + ЗН2О Цг^^Вг lOj+ЗВгг “^ГОI + ЗНВг Вг где R = -ОН; -NH2
Таблица 10
НИТРИТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Титранты метода Индикаторы метода Стандартные вещества Возможности метода Условия титрования Уравнения реакций
Раствор NaNO2 0,1М; 0,05М 1. Внешние: йодкрахмальная бумага. 2. Внутренние: дифениламин, тропеолин-00, нейтральный красный и их смеси с метиленовым синим (фон) п-Аминобен-зойная кислота, сульфаниловая кислота, гидразина сульфат. Стандартные растворы: КМпО4 (обратное титрование), гидразина сульфата Определяют а) окислители: КМпО4, Се (IV), активный хлор, Н2О2; б)восстановители: сульфаминовую кислоту, гидразина суль-фат, Sn2+, Fe2+, A.S2O3; в) первичные и вторичные ароматические амины (стрептоцид, норсульфазол, сульфацил и др.) 1. Кислая среда (2,5 - 3-х кратный избыток НС1). 2. «На холоду» или при 1° ~ 20-25°С. 3. Титруют медленно, особенно в конце титрования. 4. Добавляют в качестве катализатора КВ г в случае диазотирования а) Окисление: -2e+HNO2 + H20 ^МОз’ + ЗН* Е° = 0,94 В. б) Восстановление: +6e+2HNO2+6H+ ’=s N2'|’+4Н2О Е°=1,44В. в) Диазотирование: R-NH2 +NaNO2 +2НС1 -=== -== [R —N -N]Cl'+NaCl +2H2O Нитрозирование: R-NH-R’ + NaNO2 + HC1 —* —-R-N(NO)R’ + NaCl + H2O
Таблица 11
ХРОМАТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Титранты метода Индикаторы метода Стандартные вещества Возможности метода Условия титрования Уравнения реакций
Раствор К2СГ2О7 0,1 М 0,05 М 1. Редокс-индикаторы: дифениламин, дифениламин осульфокис-лота, дифе-нилантрони-ловая кислота. 2.Безындика-торный (раст-вор Сг -зеленый цвет; Сг2О72' - желтый). 3. Внешний индикатор -йодкрахмальная бумага Стандартное вещество: (NH4)2Fe(SO4)2-•6Н2О. Стандартный раствор Na2S2O3 (стандартизуют йоди-метрически методом замещения) Определяют: 1) восстановители SO32’, Fe2+, Г, Sn2+, AsO33\ [Fe(CN)6]4’, метанол, аскорбиновую кислоту - обратным титрованием; 2) малорастворимые хроматы (Ва2+, РЬ2+, Ag+); 3) окислители (NO3 ) после предварительного восстановления при действии солей Fe2+, избыток которых оттитровывают стандартным раствором К2Сг2О7 Титрование проводят в кислой среде в присутствии НС1, H2SO4, Н3РО4 Е°Сг2О,27Сг3‘ - +1,33 В 1) -le+Fe2+ — Fe3* 6 +6ё+Сг2О72 +14Н+ 2СР+ +7Н2О ]
6Fe2++Сг2О72"+14Н+ — бРе^+гСг3* + +7Н2О 2) Ва2+ + СЮ? ВаСЮ41 2ВаСЮД+ 4Н+ ->2Ва2+ + Сг2О72’ +2Н2О Сг2О? оттитровывают Fe2+ 3) 3Fe2++NO3’ +4Н+ 3Fe3++NO|+2H2O 6Fe2++Cr2O? + 14Н+ -> бРе3* + 2С? + +7Н2О
Таблица! 2
ПЕРИМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Титранты метода Индикаторы метода Стандартные вещества Возможности метода Условия титрования Уравнения реакций
Раствор Ce(SO4)2-4H2O, (NH4)2Cc(SO4)3-2H2O 0,1 м 0,01М 1. Редокс-индика-торы (например: ферроин, о-фе-нантролин, дифениламин). 2. Безындикатор-ный метод - растворы Се4+ имеют желтую окраску. 3. рН-индикаторы (метиловый оранжевый, метиловый красный) -необратимое окисление Na2C2O4, (NH4)2C2O4 Стандартизацию титранта проводят йодометрическим методом (заместительное титрование) Определяют: As(III). Fe2+, Sb(IIl), Sn2+ [Fe(CN)6]4’, H2O2, C2O42’ NO2’ - органические соединения: фенолы, амины, аминокислоты, органические кислоты, углеводы (аскорбиновая кислота) Титрование проводят в кислой среде (НС1О4) Се4++ с Се3+ Е° в среде НС1О4 =+1,70 В. Стандартные окислительно-восстановительные потенциалы редокс-пар комплексных солей церия зависят от природы анионов: E0[Ce(SO4)3]27Ce3" = 1,44 В, EO[Cc(NO06]27Ce3+ = 1,61 В, Е°[СеС16]27Се3+ = 1,28 В. Например: - 2е + Н2С2О4 * 2СО2Т + 2ЬГ 1 + е + Се4+ Се3+ 2
Н2С2О4 + 2Ce4t —>2СО2Т + гсе^+гы
Расчетные формулы в титриметрическом анализе
Способ отдельных навесок
1. Согласно молярной массе эквивалента:
• массу навески химически чистых веществ ГП(НХЧ.), которые используют для стандартизации титрантов, рассчитывают по формуле:
/ т(н.х.ч.) = —--------~
< 1000
'I
где: V - объем титрованного раствора, приблизительно 20 см .
• массу навески исследуемого вещества (тн) рассчитывают по форму-
ле:
CMVEM100
ГП= М-------------
( ) 1000 со
где: V - объем титрованного раствора, приблизительно 20 см3; со - массовая доля определяемого вещества в образце.
• молярность титранта См рассчитывают по формуле:
r _ m (..лн)1000
м Е V
Ем v
где: V - объем тигрованного раствора, пошедший на титрование на-з
вески п\н х ч), см .
• массовую долю определяемого вещества в анализируемом образце (со) рассчитывают по формуле:
СО % - / X
и) > /о-----“ (прямое и заместительное титрование),
1000 • то»
_(СМ V,-CM2V2) EM100
СО, /о--------------------------- (обратное титрование),
1000 • Ши,
где: CMj и См? - молярность титранта 1 и 2 соответственно (моль/дм3), V] и V2 - объемы растворов титранта 1 и 2 соответственно (см3).
2. По величине титра титранта по определяемому веществу:
• массовую долю определяемого вещества в исследуемом растворе рассчитывают по формулам:
_T(t/„)-K-V-1001
со? /о — " (прямое и заместительное титрование),
Н1(п)
93
Tctm-CK.V.-K.VJ 100 m(H)
(обратное титрование),
где: Т(т/о) - титр титранта по определяемому веществу в прямом и заместительном титровании, г/см3;
Ткт/о) - титр титранта 1 по определяемому веществом, который непосредственно взаимодействует с определяемым веществом (в обратном титровании), г/см3;
К, Ki, К2 - поправочные коэффициенты к молярности:
М(практ.)
(теор.)
М(теор.)
(практ.)
Способ пипетирования
1. Согласно молярной массе эквивалента:
• массу навески химически чистых веществ (т(НХЧ)), которые используют для стандартизации титрантов, рассчитывают по формуле:
* V • Ем
ГП(н.х.ч.) “
V(mjg)
1000 V(n)
где:
V - объем титрованного раствора, приблизительно 20 см3;
V(MJC) - объем мерной колбы, в которой растворена навеска х.ч, вещества, см3;
V(ll) - объем пипетки, которую используют для отмеривания аликвоты раствора, см3.
• массу навески определяемого вещества (пЗ(Н)) рассчитывают по фор-
муле:
ГП(н) =
См V EM -Уккэ-ЮО
1000 • V(n) • co
где: V - объем титрованного раствора, приблизительно 20 см3;
V(MK.) - объем мерной колбы, в которой растворена навеска х.ч. вещества, см3;
V(„) - объем пипетки, которую используют для отмеривания аликвоты раствора, см3.
• молярность титранта (См) рассчитывают по формуле:
с _ -у(П) ЮОО
М EM-V(MK)-V ’
где: V - объем титрованного раствора, израсходованный на титрование аликвоты раствора стандартного вещества, см3;
94
V(M,K ) - объем мерной колбы, в которой растворена навеска х.ч. вещества, см3;
V([1) - объем пипетки, которую используют для отмеривания аликвоты раствора, см3.
• массовую долю определяемого вещества в исследуемом образце (со) рассчитывают по формулам:
0 См V EM 'V(m.k.)*100
= 1000 гщ V (прямое и заместительное титрование),
где: V - объем титрованного раствора, израсходованный на титрование, см3.
О/_(СМ V,-CM V2)-Em V(m«).1OO
/о" 1 000 • m(H) v(n) (обратнос титровапие)’
где : V] - объем добавленного в избытке титрованного раствора 1, см3;
V2 - объем титрованного раствора 2, израсходованный на титро-з
вание, см .
2. По величине титра титранта по определяемому веществу:
Т(т/О)-К-У-У(мк)-100
’ /с mV (прямое и заместительное титрование),
т(ч) * V(n)
Т(Т,о)-КУ-У(мк)100 т(к) • V(n)
(обратное тигрованис).
При установлении молярности титранта по титрованному раствору известной концентрации расчеты ведут по формуле:
где: М(о) - молярность раствора, по которому устанавливают концентрацию, моль/дм3;
V(O) — объем раствора, по которому устанавливают концентра-з
цию, см ;
V — объем раствора, молярность которого определяют, см3.
95
При определении массы вещества в граммах в объеме мерной колбы расчеты ведут по формулам:
1. Согласно молярной массе эквивалента:
к? _ • V*EM V(M.)
i / v (м.к.) (прямое и заместительное титрование),
1 000 • V(n)
(м.к.)
1000-V(n)
(обратное титрование).
2. По величине титра титранта по определяемому веществу:
(прямое и заместительное титрование),
(обратное титрование).
96
Примеры решения типовых задач по теме «Статистическая обработка результатов»
Основные статистические характеристики
В теории ошибок доказывается, что при выполнении нормального закона распределения случайных величин (закон Гаусса) среднее арифметическое всех результатов анализа (X ) является лучшей оценкой истинного значения результата анализа р:
Xi + Х2 + ... + Х„
п
±Х
Это среднее значение приблизительно равно истинному значению результатов анализа: X Ц.
Рассеяние результатов анализа относительно среднего значения принято характеризовать дисперсией S2:
п ____ п _
X(Xi-x)2 xXi -пх2
где: f - число степеней свободы, f = n-1.
Затем вычисляют среднее квадратичное отклонение S, которое рассматривают как оценку случайной ошибки, характерной для данной выборки:
s = vs2
п _____ п
X(Xi-X)2 £Xi 2-nX2
i = l il i-1
Стандартное отклонение среднего результата Sx рассчитывают по уравнению:
Оценка доверительного интервала результатов анализа
Результаты анализа характеризуются доверительным интервалом среднего значения ДХ , которые рассчитывают по формуле:
AX=t(P,f)’Sx,
97
где: t (P,f) - критерий Стьюдента (табличное значение), при числе степеней свободы f и доверительной вероятности Р=0,95, принятой в аналитических расчетах (табл. 1).
Таблица 1
ЦИФРОВЫЕ ЗНАЧЕНИЯ КРИТЕРИЯ СТЬЮДЕНТА t (P,f)
Критерий Стьюдента (t)
Р
0,90 0,95 0,99
1 6,31 12,70 63,70
2 2,92 4,30 9,92
3 2,35 3,18 5,84
4 2,13 2,78 4,60
5 2,01 2,57 4,03
6 1,94 2,45 3,71
7 1,89 2,36 3,50
8 1,89 2,36 3,50
Доверительный интервал ограничивает область, внутри которой при отсутствии систематических погрешностей находится истинное значение результата анализа с заданной доверительной вероятностью Р:
(X-АХ)<ц<(Х + АХ).
Относительную ошибку среднего результата А (%) рассчитывают по
формуле: АХ А = ^100% . X Таблица 2
ЧИСЛОВЫЕ ЗНАЧЕНИЯ КОНТРОЛЬНОГО КРИТЕРИЯ Q (Р, п)
п Q
Р = 90% Р = 95% Р = 99%
3 0,89 0,94 0,99
4 0,68 0,77 0,89
5 0,56 0,64 0,76
6 0,48 0,56 0,70
7 0,43 0,51 0,64
8 0,40 0,48 0,58
9 0,38 0,46 0,55
98
Таблица 3
ЧИСЛОВЫЕ ЗНАЧЕНИЯ КРИТЕРИЯ ФИШЕРА F(P, fb f2) ПРИ Р - 99%
>2 1 2 3 4 5 6 8 10 12 16 20
1 4052 4999 5403 5625 5764 5859 5981 6056 6106 6169 6208
2 98,49 99,00 99,17 99,25 99,30 99,33 99,36 99,40 99,42 99,44 99,45
3 34,12 30,81 29,46 28.71 28,24 27,91 27,49 27.23 27,05 26,83 26,65
4 21,20 18,00 16,69 15,98 15,52 15,21 14,80 14,54 14.37 14,15 14,02
5 16,26 13,27 12,06 11,39 10,97 10,77 10,27 10,05 9,89 9,68 9,55
6 13,74 10,92 9,78 9.15 8,75 8,47 8,10 7,87 7,72 7,52 7,39
7 12,25 9,55 8,45 7,85 7,46 7,19 6,84 6,62 6,47 6,27 6,15
8 11,26 8,65 7.59 7,01 6,63 6,37 6,03 5,82 5,67 5,48 5,36
9 10.56 8,02 6,99 6,42 6,06 5,80 5.47 5,26 5,11 4,92 4,80
10 10.04 7,56 6,55 5,99 5,64 5.39 5.06 4.85 4,71 4.52 4.41
11 9,65 7,20 6,22 5,67 5,32 5,07 4,74 4,54 4,40 4,21 4,10
12 9,33 6,93 5.95 5,41 5,06 4,82 4,50 4,30 4,16 3,98 3,86
13 9,07 7.70 5.74 5,20 4,86 4,62 4,30 4,10 3,96 3,78 3,67
14 8,86 6,51 5,56 5,03 4,60 4,46 4,14 3,94 3,80 3,62 3,51
15 8.68 6,36 5,42 4.89 4,56 4,32 4,00 3,80 3,67 3,48 3,36
16 8.53 6,23 5,29 4,77 4.44 4,20 3,89 3,69 3,55 3,37 3,25
17 8,40 6,11 5,18 4,67 4,34 4,10 3,79 3,59 3,45 3,27 3,16
18 8,28 6,01 5,09 4,58 4,25 4,01 3,71 3,51 3.37 3,19 3.07
19 8,18 5,93 5,01 4,50 4,17 3,94 3,63 3,43 3,30 3,12 3,00
20 8,10 5,85 4,94 4,43 4,10 3,87 3,56 3,37 3,23 3,05 2,94
25 7,77 5,57 4,48 4,18 3.86 3,63 3,32 3,13 2,99 2,81 2,70
30 7,56 5,39 4.51 4.02 3,70 3,47 3,17 2,93 2,84 2,66 2,55
40 7,31 5,18 4,31 3,83 3,51 3,29 2,99 2,80 2,66 2,49 2,37
60 7,08 4,98 4,13 3,65 3,34 3,12 2,82 2,63 2,50 2,32 2.20
Для сравнения воспроизводимости двух методов анализа с дисперсиями Sj2 и S22 (S]2 > S22) рассчитывают критерий Фишера (F), который характеризует достоверность разницы Sj2 и S22:
Рассчитанное значение F сравнивают с табличным значением F (Р, fb f2), при Р = 99 %. Если F > Fra6jl., то разность дисперсий S(2 и S22 статистически значима с вероятностью 99%, а если Sj2 < S22, то более высокую воспроизводимость имеет второй метод, который в этом плане имеет преимущество.
Пример 1. При определении содержания щавелевой кислоты в анализируемой пробе методом нейтрализации получены результаты; 69,87; 69,83; 69,87; 69,80; 69,92; 70,06; 70,05; 70,01; 70,38 (%). При этом истинное значение ц=70,05%.
Рассчитайте содержание щавелевой кислоты и решите вопрос о наличии или отсутствии систематической ошибки.
Решение.
1. Располагаем результаты эксперимента в порядке возрастания: 69,80; 69,83; 69,87; 69,87; 69,92; 70,01; 70,05; 70,06; 70,38, п=9.
99
2. Определяем размах варьирования (R) по уравнению:
R=|Xi-X9|, где Xi-69,80; Х9=70,38; R=I69,80-70,381=0,58.
3. Определяем контрольный критерий для идентификации грубых ошибок (Q), исходя из величины размаха варьирования (R);
|Х, - х8| _ |70,06- 70,38|
= 0,55.
R 0,58
Выборка признается однородной, если значение Qn нс превышает табличное значение Q(P,n), найденное для доверительной вероятности Р^95% (табл. 2).
Q(P,n)=Q(95%,9)="0,46, что меньше Q9=0,55, следовательно, результат 70,38 отбрасываем. Для получения выборки уменьшенного объема выполняется новый цикл вычислений с целью проверки се однородности:
n=8, Qi=0,11; ... Q7=0,04; R=| X|-X8I=I69,80-70,061=0,26.
Q(95%,8)=0,48; 0,04<0,l l<0,48, следовательно, выборка однородна. В этом случае для результатов 69,80; 69,83; 69,87; 69,87; 69,92; 70,01; 70,05; 70,06 проводят вычисление следующих величин:
4. _
X = 69,93
S2 = 102,7 -10 4
S = 10,13-10"2 Х± АХ =69,93 ±0,08
Sx = 3,58 • 10’2 69,85 < X < 70,01
А X = ±0,08
А,% = 0,11
ц=70,05%, среднее арифметическое X = 69,93% .
5. Для решения вопроса о наличии или отсутствии систематической ошибки вычисляем критерий Стьюдента t:
t Jh-x|-VK~
s
|70,05 - 69,93| V8
10,13 • 10"2
= 3,32.
Табличное значение tTa6n(P,f)=2,36, при f=8 (табл. 1).
6. Если 1>ибл(Р,0, 3,32>2,36, то полученные результаты отягощены систематической ошибкой, относительную величину которой (5) вычисляют по формуле:
6 = . |00;5 . -69-93 - 70 05 . Ю0 = -о.17%,.
ц 70,05
Эта ошибка меньше относительной ошибки данного метода.
Ответ: содержание щавелевой кислоты 69,93%; систематическая ошибка статистически нс значима.
100
Пример 2. При определении щавелевой кислоты перманганатометрически (1) и методом кислотно-основного титрования (2) получены следующие результаты:
1.99,04; 99,07; 99,23; 99,25; 99,36 (%).
2.99,18; 99,20; 99,23; 99,24; 99,26 (%).
Оценить воспроизводимость двух методов.
Решение.
1. Исходя из величины размаха варьирования R, проверяем однородность выборки результатов, полученных двумя методами:
R1=199,04-99,361=0,32;
R2=I99,18-99,261=0,08.
2. Рассчитываем значение контрольного критерия Q для идентификации грубых ошибок:
99,04 - 99,07 п _ Л 99,25-99,36
1) Qi = -—’ ’—1 = 0,09; 0,32 199,18-99,201 2) Qi = -— ^-Л = 0,25; 0,08 Q2 = J= 0,30 -0,32 199,26 - 99,24| Q2 = L = о,25 0,08
Выборка признается однородной, если ни одно из значений Q не превышает QTa6ji(P,n)= Q(95%,5)=0,64 (табл. 2).
Выборка (1) и (2) однородны, так как 0,09<0,30<0,64; 0,250,64,
3. Мерой воспроизводимости результатов, представленных в данной выборке, является величина дисперсии S2.
1) Х1 = 99,19;S* =178 -10^; 2) Х2 = 99,22;S2 = 10,25 10 4.
При сравнении воспроизводимости двух методов анализа с оценками дисперсии Sj , S22 (S|2>S22) вычисляем критерий Фишера F:
S2 _ 178 Ю-4
S2 10,25-10’4
= 17,37
и сравниваем с табличным значением F^(P,fi,f2)=6,39 при Р=95% (табл. 3).
Если F>FTaGjl(P,f],f2), различие дисперсий S/ и S22 признается статистически значимой величиной (17,37>6,39).
Ответ: более воспроизводимы результаты кислотно-основного определения щавелевой кислоты.
101
ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Схе.
КЛАССИФИКАЦИЯ ОПТИЧЕСКИХ МЕТОДОВ АНАЛИЗА
102
Схема 2
МЕТОДЫ МОЛЕКУЛЯРНО-АБСОРБЦИОННОГО АНАЛИЗА
Таблица 1
104
ПРИМЕНЕНИЕ ИК- И УФ-СПЕКТРОСКОПИИ В АНАЛИЗЕ
ИК- спектроскопия УФ-спектроскопия
Качественный анализ
Метод применим для идентификации веществ: - по характерным максимумам в области «отпечатков пальцев» при соответствующих характеристических частотах (600-1500 см'1); - путем сравнения спектра анализируемого вещества со спектром вещества-стандарта. Для определения структуры органических и неорганических соединений по характерному поглощению (максимуму в спектре) для каждой группы атомов (см. табл. 3) Метод используют для: - установления структуры органических соединений (по характерным для отдельных групп химических связей длин волн максимумов или минимумов поглощения, по интенсивности поглощения); - изучение межмолекулярного взаимодействия, образования комплексов с переносом зарядов (я-комп-лексов); - для идентификации веществ по величине £ в точке максимума для растворов с известной концентрацией и по величине полуширины волны полосы поглощения; - для характеристики энергетических уровней электронов в органических соединениях
Количественный анализ
Определения основаны на использовании закона Бугера-Ламберта-Бера, однако это затруднительно, т.к. величина 1 очень мала (измерения проводят в узкой кювете). 1) метод градуировочного графика; 2) метод базовой линии. В основе определения лежит закон Бу гора-Ламберта-Бера. Определение концентрации веществ проводят одним из методов, приведенных в табл. 2. Анализ возможен и для смеси поглощающих веществ.
Таблица 2
ХАРАКТЕРИСТИКА МЕТОДОВ КОЛОРИМЕТРИИ И ФОТОЭЛЕКТРОКОЛОРИМЕТРИИ
Колориметрия Фотоэлектроколориметрия
Метод используют для приближенной оценки концентрации окрашенных растворов. Если вещество нс имеет окраски, проводят фотометрическую реакцию, которая сопровождается образованием окрашенного соединения. Не требуется соблюдение закона Бугера-Лам-бсрта-Бера. Количественные определения проводят: 1. Методом уравнивания окраски: изменяя толщину слоя исследуемого и стандартного раствора, добиваются равной интенсивности их окраски. Расчет концентрации исследуемого раствора (Сх) проводят по формуле: С 1 Г' ст СТ ’ I, ’ где: Сст- концентрация стандартного раствора; 1ст , 1х - толщина слоя стандартного и исследуемого растворов соответственно 2. Методом стандартных серий: готовят серию стандартных растворов с точно известной концентрацией анализируемого вещества и сравнивают интенсивность окрасок с интенсивностью окраски анализируемого раствора. Концентрация анализируемого раствора равна концентрации стандартного раствора с равной интенсивностью окраски. 3. Колориметрическое титрование: в равных условиях добавляют фогометричский реагент к исследуемому раствору и к воде. Затем из бюретки к воде прибавляют стандартный раствор определяемого вещества. Одновременно в сосуд с анализируемым раствором вводят воду, чтобы объемы жидкостей все время были одинаковыми и добиваются уравнивания окраски двух растворов. Метод применим для определения концентраций окрашенных растворов путем измерения оптической плотности (А) или пропускания (Т) раствора. Соблюдение закона Бугсра-Ламбсрта-Бера обязательно. A = lgj!--, 1 = 10 10 я'; А = сС1; Т_1. а-ьД- Е’*=^- i0 ’ ёт’ с Г c i е - молярный коэффициент свстопоглощения, равен оптической плотности (А), раствора с концентрацией С = 1 моль/л и толщиной слоя 1= 1 см. Е’^1 - удельный коэффициент светопоглощения, равен оптической плотности А раствора с концентрацией С = 1% и толщиной слоя 1 с.м. М £ = Е]см —, где М - молекулярная масса вещества. Определение концентрации проводят: 1. Методом градуировочного графика. 2. По среднему значению коэффициент (е). 3. Методом добавок. 4. Методом дифференциальной фотометрии. 5. Экстракционно-фотометрическим методом.
106
Схема 3
КЛАССИФИКАЦИЯ КОЛЕБАТЕЛЬНЫХ ИК-СПЕКТРОВ
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ В МЕТОДАХ СПЕКТРОСКОПИИ
Спектр поглощения - кривая зависимости интенсивности поглощения (А или е) или пропускания (Т) от длины волны (X) или волнового числа (v).
Характеристики спектра: число максимумов (полос поглощения); их положение на шкале длин волн (или частот); высота максимумов (интенсивность); форма полос поглощения.
Колебательный спектр (ИК-спектроскопия) - характерные максимумы в области от 4000^-00 см'1, обусловленные атомными колебаниями в химических связях и переходом с одного колебательного уровня энергии на другой, более высокий; связан с поглощением энергии.
Характеристические частоты - характерные длины волн, которые соответствуют строго определенным связям и атомным группировкам и мало меняются при изменении структуры молекулы. (Интервал 2000-4000 см 1 характерен для валентных колебаний С - Н; О - Н; N - Н; интервал 1500 - 1950 см'1 - для валентных колебаний связей С = О; С = С; С — N; N = N). Позволяют судить о качественном составе вещества и структуре молекулы.
Область «отпечатков пальцев» (ИК-спектроскопия) - набор полос в спектре поглощения в интервале (600-1500 см1), который трудно интерпретируется и содержит характерные максимумы для данного вещества (используется для идентификации).
Электронный спектр (УФ-спектроскоп и я) связан с возбуждением электронной системы вещества. При поглощении кванта света (излучения со строго определенной энергией) электрон переходит в возбужденное состояние вследствие перехода с одного энергетического уровня на другой (со связывающей орбитали на разрыхляющую)._______________________
Переход Соединения
о—»о* метан, этан, ненасыщенные уиюводоро-ДЫ
п—»о* спирты, эфиры, хло-рорганическне соединения
л—» л* п—>л* ароматические соединения, соединения с сопряженными связями
Схема электронных уровней и энергия возможных электронных переходов
Батохромпое смещение - смещение полосы поглощения в область более длинных волн.
Гипсохромное смещение - смещение полосы поглощения в область более коротких длин волн.
107
Таблица 3
ХАРАКТЕРИСТИЧЕСКИЕ ЧАСТОТЫ КОЛЕБАНИЙ НЕКОТОРЫХ СТРУКТУРНЫХ ЭЛЕМЕНТОВ И УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ В ИК-ОБЛАСТИ
Волновое число, см'1 Тип колебаний и соответствующий структурный элемент Вещества
1 2 3
3700 ... 3600 (узкая полоса) 3500 ... 3300 (широкая полоса) Валентное, -О-Н (свободная, неассициированная ipyiпiа) Вален г ное, —О-I I (связанная группа) Спирты, фенолы, кислоты, оксикетоиы, эфиры оксикислот
3550 ... 3350 Валентное, -N-H (пеассиниированная группа) Первичные (дважды выраженные колебания,2
3500 ... 3100 Валентное, -N-H (ассициированная группа) полосы) и вторичные амины и амиды
3300 ... 3270 Валентное, sC—Н Монозамсщспные производные ацетилена
3350 ... 3150 (широкая полоса) Валентное, -NHj* Гидрохлориды аминов и аминокислот
3300 ... 2500 (очень широкая полоса) Валентное, —О-Н (ассициированная ipynna) Карбоновые кислоты, хелаты
3100 ... 3000 Валентное, =С-Н Ароматические углеводороды, олефины
3000 ... 2800. Валентное, -С-П Парафины, циклопарафины
2962, 2872 Валентное, -СНз Парафины
2926, 2853 Валентное, -СН2- Парафины
2900 ... 2400 Валентное, -О-D, -N-D Амины, спирты
2820 Валентное, -O-CII3 Простые метиловые эфиры
2820 ... 2730 Валентное, N-CH3 N-метиламин
2820 ,.. 2720 Валентное, ОС-П Альдегиды
2600 ... 2550 Валентное, -S-H Меркаптаны, тиофснолы
2300 ... 2100 Валентное, -С=Х (Х=С, N, О) Ацетилены, нитрилы, оки-сид углерода
2270 ... 2000 Валентное, —Y—С—X, -N3 (Y=N, С; Х=О, S) Изоциопаты,кетоны
2260 ... 2190 Валентное, -С=С- 1,2-Дизамсщенные производные ацетилена
2260 Валентное, -N+=N Производные солей диа-зония
2245 ... 2220 Валентное, -ON Нитрилы
2185 ... 2120 Валентное, -N=C- Изонитрилы
2140 ... 2100 Валентное, -С=С— Монозамещенныс ацетилены
1900 ... 1600 Валентное, -С=О Карбонильные соединения
108
Продолжение табл. 3
1 2 3
1850 ... 1740 Валентное, -С-О Галогснапгидриды карбоновых кислот
1840 ... 1780 ... 1780 1720 Валентное, — С=О Ангидриды карбоновых кислот (2 полосы)
1780 ... 1760 ... 1750 1700 Валентное, -С=О Валентное, -С=О Фснилкарбоновые кислоты, виниловые эфиры карбоновых кислот
1750 ... 1730 Валентное, -С-О Алкиловые эфиры насыщенных карбоновых кислот
1730 ... 1710 Валентное, -С-О Насыщенные альдегиды и кетоны, эфиры а,р-нена-сыщенных ароматических карбоновых кислот
1745 Валентное, -С=О Циклопентанон
1715 Валентное, -С-О Циклогексанон
1705 Валентное, -С_О Циклогептанон
1715 ... 1680 Валентное, -С О а,р-Нснасы1ценные и ароматические альдегиды
1690 ... 1630 Валент ное, -C=N Азометины, оксираны и др.
1690 ... 1660 Валентное, -С=О а,р-Ненасыщенные и ароматические кетоны
1680 ... 1630 Валентное, -С~О Первичные, вторичные и третичные амиды карбоновых кислот (полоса амид 1)
1660 ... 1600 Валентное, -С=С- Ароматические соединения ,олефины
1650 ... 1620 Деформационное, -NH2 11ервичные амиды карбоновых кислот (полоса амид 11)
1650 ... 1580 Деформационное, -N-H Первичные и вторичные амины
1630 ... 1615 Деформационное, Н-О-Н Кристализационная вода в гидратах
1610 ... 1590 Углерод-углеродные связи в ароматическом кольце Ароматические соединения
1570 ... 1510 Деформационное, -N-H Вторичные амиды карбоновых кислот (полоса амид II)
1560 Валентное, -NO2 Алифатические нитросоединения
1518 Валентное, -NO2 Ароматические питросос-динения
1500 ... 1480 Углерод-углеродные связи в ароматическом кольце Ароматические соединения
1480 ... 1430 Деформационное, -СНз 1-СН2- Углеводороды, сложные эфиры и др.
1420 ... 1340 Деформационное, -ОН Спирты, фенолы, карбоновые кислоты
109
Продолжение табл. 3
1 2 3
1390 ... 1370 Деформационное, -С1П Углеводороды
1360 ... 1030 Валентное, -C-N^ Амиды, амины
1350 ... 1240 Валентное, -NO2 Алифатические и ароматические нитрососдинсния
1335 ... 1200 ... 1310 1 130 Валентное, -SO2 Органические сульфоны
1290 ... 1050 Валентное, -С—О Простые эфиры, спирты, лактоны, кетали, ацетали
1250 ... 1200 Валентное, -С-О- Фенолы
1250 ... 1180 Валентное, -С-О- Эфиры насыщенных карбоновых кислот
1200 ... 1150 Валентное, -С-О- Третичные спирты
1150 ... 1080 Валентное, -С-О- Вторичные спирти
1050 ... 1010 Валентное, -С-О- Первичные спирти
1070 ... 1030 Валентное, -S=O Сульфоксиды
970 ... 960 Деформационное, =С-Н 1,2-Дизамещенные производные этилена (транс-изомеры)
995 ... 915 ... 985 905 Деформационное, -С-Н Монозамсщенные производные этилена
900 ... 810 ... 860 750 Деформационное, -С-Н 1,3-Дизамсщснныс производные бензола
725 ... 885 ... 680 855 Деформационное, =С-Н 1,1-Дизамсщенныс производные этилена
860 ... 800 Деформационное, ~С-Н 1,4-Дизамсщснные производные бензола
780 ... 500 Валентное, С-На! Ароматические и алифатические галогенпроизводные
770 ... 735 Деформационное, =С-Н 1,2-Дизамещеппые производные бензола
770 ... 730 Деформационное, =С-Н Монозамещенные производные бензола
710 ... 780 ... 690 720 Деформационное, -С-Н н-Парафины, которые содержат больше чем четыре группы -СН2-
705 ... 550 Валентное, -С—S Органические серусодер-жащие соединения (меркаптаны, тиоэфиры и др.)
730 ... 680 Деформационное, _С-Н 1,2- Дизамещепныс производные этилена (цис-изомеры)
670 Деформационное, ^С-Н Бензол
110
Таблица 4
ДЛИНЫ ВОЛН СПЕКТРА И СООТВЕТСТВУЮЩИЕ ИМ ОКРАСКИ
Интервалы длин волн поглощаемого света, им Цвет поглощаемого излучения Дополнительный цвет (наблюдаемый цвет раствора)
400-435 Фиолетовый Желто-зеленый
435-480 Синий Желтый
480-490 Зеленовато-синий Оранжевый
490-500 Сине-зелспый Красный
500-560 Зеленый Пурпурный
560-580 Желто-зеленый Фиолетовый
580-595 Желтый Синий
595-605 Оранжевый Зеленовато-синий
605-730 Красный Сине-зеленый
730-760 Пурпурный Зеленый
Таблица 5
Длина волны X Частота v, Гц Волновое число <т, см’1
м мкм нм
ю-7 0,1 100 3- ю15 105
106 1 1000 3- ю14 ю4
10 5 ю 10000 3- 1013 101
Таблица 5.1
Переход Что надо сделать
от к
0, см1 v, Гц о умножить на 3- 1О10
X, мкм v, Гц 3- 1014 разделить на X
X, нм v, Гц 3- 1017 разделить на X
X, мкм о, см'1 1014 разделить на X
v, Гц X, мкм 3- 1014 разделить на v
v, Гц 0, см'1 v разделить на 3- 1010
0, см'1 X, мкм 104 разделить на v
Примечание: о - волновое число; v - частота колебаний; X- длина волны.
111
Схема 4
ЭМИССИОННЫЕ МЕТОДЫ АНАЛИЗА
Эмиссионные методы анализа
Эмиссионный спектральный анализ
~ -|
Пламенная фотометрия
Методы основаны на измерении длины
волны излучения и его мощности возбужденных в высокотемпературных источниках света (электрическая дуга, электрическая искра) атомов анализируемых веществ.
ьэ
В основе метода лежит использование спектрального излучения возбужденных в газовом пламени атомов определяемых элементов. Применяется для анализа щелочных и щелочно-земельных элементов талия.
Флуориметрия
Метод основан на измерении интенсивности флуоресценции анализируемых веществ. Люминесценцией (холодное свечение) называют свечение, которое возникает под действием на некоторые вещества электромагнитного излучения и сразу прекращается после удаления источника излучения. Люминесценция возникает в результате электронного перехода при возвращении частиц из возбужденного состояния в нормальное, т.е. молекула вещества преобразует поглощенную энергию в собственное излучение. В возбужденное сосюяпие частицы вещества могут переходить под действием:
• свега - флуоресценция;
• решгеновскою излучения - рентге-полюминесцснция;
• химической реакции - хемилюминесценция.
Таблица 6
ЭМИССИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
Качественный анализ Количественный анализ
Основой метода является свойство возбужденного химического атома анализируемого элемента излучать линейчатый спектр. Задача качественного анализа - отыскать линии определяемого элемента в спектре пробы. Принадлежность аналитической линии данному элементу устанавливается по длине волны и интенсивности линии. Предел обнаружения 10'2-10'5%. В основе метода - связь между интенсивностью спектральной линии и концентрацией элемента. Обычно используют интенсивность не отдельной линии, а отношение двух спектральных линий, принадлежащих разным элементам. В качестве свойства, связанного с концентрацией элемента, используют отношение интенсивности аналитической линии определяемого компонента к интенсивности аналитической линии другого компонента (внутреннего стандарта) в этом же спектре (линия сравнения). В зависимости от способа оценки интенсивности различают следующие методы количественного эмиссионного спектрального анализа: • визуальные; • фотографические; • фотоэлектрические. Предел обнаружения - до 0,1%, до 10'7-10'9 г.
Таблица 7
ЭМИССИОННАЯ ПЛАМЕННАЯ ФОТОМЕТРИЯ
Качественный анализ Количественный анализ
Основой метода является возбуждение в пламени спектра атомов определяемых элементов. Используют пламя газовой смеси, состоящей из газа-топлива и газа-окислителя (например: ацетилен + кислород). Излучение определяемого атома элемента выделяется с помощью светофильтра или монохроматора. Светофильтр выбирают так, чтобы максимум его пропускания совпадал с длиной волны спектральной линии атомов определяемого элемента. Анализ проводят по спектрам атомов, испускаемым в пламени. Определяют в основном щелочные и щелочноземельные элементы, талий. - Определение элемента основано на функциональной зависимости интенсивности спектральной линии (I) от концентрации элемента в растворе (С). Основное уравнение: Igl = Iga + b-lgC, где: а - коэффициент пропорциональности (зависит от температуры источника возбуждения, его стабильности); b - коэффициент самопоглощения, учитывающий поглощение квантов света невозбужденными атомами. Количественные определения проводят: • методом градуировочного графика (линейная зависимость Igl - f(lgC)); • методом добавок. Средний предел обнаружения 10“3-10'4%.
Таблица 8
ФЛУОРИМЕТРИЯ
Качественный анализ Количественный анализ
Анализ основан на способности анализируемого вещества в соответствующих условиях люминесцировать. Идентификацию органических соединений проводят по спектральным характеристикам флуоресценции или по цвету флуоресцентного излучения. Для неорганических ионов используют реакцию образования комплексных соединений с органическими реагентами, которая приводит к появлению люминесценции. Пример: натрий-цинк-уранилацетат люминесцирует зеленовато-желтым цветом. При анализе смеси люминесцирующих веществ применяют светофильтры для выделения люминесценции определенной длины волны. Анализ основан на зависимости интенсивности флуоресценции растворов от концентрации флуоресцирующих веществ. Интенсивность флуоресценции для разбавленных растворов в области концентрации 10'7-10'4 моль/дм3 определяют по формуле: F = 10-2,3-с-С-Ь-ф, где: F - интенсивность флюоресценции, квант-с'1; 10 - интенсивность возбуждающего света, квант-с1; С - концентрация раствора, моль-л ’; е - молярный коэффициент поглощения; b - толщина флуоресцирующего слоя; Ф - квантовый выход флуоресценции, зависящий от природы вещества. Предел обнаружения 10-7 моль/дм3. Экстракционно-люминесцентынй количественный анализ используют в анализе веществ, содержащих примеси, мешающие определению. Исследуемое вещество экстрагируют органическим растворителем и определяют описанным выше способом.
Схема 5
МЕТОДЫ, ОСНОВАННЫЕ НА ИЗМЕРЕНИИ ИНТЕНСИВНОСТИ СВЕТА ПРИ ВЗАИМОДЕЙСТВИИ СО ВЗВЕШЕННЫМИ ЧАСТИЦАМИ В РАСТВОРЕ
Таблица 9
СПОСОБЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ В МЕТОДАХ ТУРБИДИМЕТРИИ И НЕФЕЛОМЕТРИИ
_________Турбидиметрия__________
1. Метод градуировочного графика
На основании данных турбидиметрических измерений серии стандартных растворов с известной концентрацией строят график зависимости А = f (С) (зависимость нелинейная).
2. Турбидиметрическое титрование
Метод основан на реакции образования осадков малорастворимых соединений титранта с раствором анализируемого вещества.
В точке эквивалентности наблюдается максимум помутнения. Дальнейшее прибавление титранта не изменяет степень мутности.
Кривая турбидиметрического титровании
__________Нефелометрия__________
/. Метод градуировочного графика
По результатам нефелометрических определений серии стандартных растворов с известной концентрацией строят 1рафик:
С увеличением концентрации увеличивается число рассеивающих частиц, и интенсивность рассеивающего света возрастает.
б) зависимости Акаж = f(lgC).
Кажущаяся оптическая плотность Акаж уменьшается с ростом концентрации.
117
Схема 6
МЕТОДЫ, ОСНОВАННЫЕ НА ЯВЛЕНИИ ПОЛЯРИЗАЦИИ МОЛЕКУЛ ПОД ДЕЙСТВИЕМ СВЕТОВОГО ИЗЛУЧЕНИЯ
----------------------------------------------------_—
Методы, основанные на явлении поляризации молекул под действием светового излучения
Рефрактометрия
Поляриметрия
Метод основан на измерении относительного показателя преломления света (и) исследуемым веществом.
V. sina п = — =--------
V2 sin|i ’
где: п - отношение скорости распространения света в воздухе (VJ, или синуса угла падения (sin а) к скорости света в анализируемом растворе (V2) или синусу угла преломления (sin р) в анализируемом растворе.
Принято представлять значение п при определенных условиях: t° = 20°С;
X = 589,3 нм (желтая линия натрия) Прибор для измерения п - рефрактометр. Точность измерений -2-10‘4.
При этом показатель преломления обозначают п^0. _________________________________________________
Метод основан на измерении угла вращения плоскости поляризации (а) поляризованного луча света, прошедшего через оптически активную среду.
[а]“ = 1С ’
где' [а]р - величина удельного вращения (const);
а - измеренный угол вращения в градусах;
1 - толщина слоя, в дм;
С - концентрация раствора , в г/100 мл.
а зависит от:
• природы растворителя;
• концентрации оптически активного вещества (Q;
• толщины слоя оптически активного вещества (0;
Условия: t° = 20°C;
Х = 589,3 нм.
Прибор для измерения а - поляриметр.
Точность измерений ±0,02°.
Таблица 1(.
ВОЗМОЖНОСТИ МЕТОДОВ РЕФРАКТОМЕТРИИ И ПОЛЯРИМЕТРИИ
Рефрашомеврия Поляриметрия
Качественный анализ Качественный анализ
1. Идентификация веществ по величине п. 2. Определение чистоты соединений, в том числе и лекарственных препаратов. 1. Идентификация оптически активных веществ по величине [а]р°. Измеряют величину а, по формуле вычисляют Га!20 D сравнивают с табличным значением.
Количественный аналит Количественный анализ
Учитывая, что показатель преломления раствора п является величиной аддитивной, определение концентрации анализируемых вещее I в (Сх) проводят по формуле: _п-п0 ‘ F ’ 1. Определяют концентрацию он т ически активных веществ по формуле: с_ а -100 [<С 1’ 2. По калибровочному трафику:
где: п - показатель преломления анализируемого вещества;
По - показаюль преломления растворителя;
F - рефрактометрический фактор (const) для определенной концентрации, показывает прирост показателя преломления при увеличении концентрации вещества на 1% (табл. 12).
2. Определение концентраций веществ в двух- и многокомпонентных смесях проводят по формуле:
(2 — п п ° ~ Fi С t
2 " р
2
где: С[ - концентрация компонента, определенная независимым методом;
F[ - рефрактометрический фактор вещества, концентрация которого определена независимым методом;
F2 - рефрактометрический фактор второго определяемою компонента анализируемого вещества.
3. По калибровочному графику:
I
I
I
или по данным табл. 11
119
ОСНОВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ В ФОТОМЕТРИИ
1. Метод градуировочного графика
(применим только для монохроматического излучения).
А = е-1-С
А = f(C)
сх с
2. Метод определения по среднему значению молярного коэффициента поглощения
(в области исследуемых концентраций обязательно подчинение закону Бугера-Ламберта-Бера: А = Е-1-С).
где: Аст - оптическая плотность стандартного раствора;
Сст - концентрация стандартного раствора;
£ср — среднее значение молярного коэффициента поглощения. Определяют А нескольких стандартных растворов ACi Для каждого раствора, рассчитывают £ и находят £ср, измеряют Ах и находя!' Сх по формуле.
3. Метод добавок
(применяют при анализе растворов сложного состава),
Ах = £-1-Сх,
где: Ах - оптическая плотность анализируемого раствора; Сх - концентрация анализируемого раствора.
где: Ах+ст - оптическая плотность анализируемого раствора с добавкой стандартного раствора;
Сст - концентрация стандартного раствора.
или
120
Сх=с
В мегоде добавок Сх можно также найти по графику в координатах Ах, = f(CCT).
4. Метод дифференциальной фотометрии
(применяют для анализа интенсивно окрашенных растворов).
Варианты расчетов: I
Градуировочный график дифференциальной фотометрии
где: Л[ - прирост поглощения;
С} - прирост концентрации;
Со - концентрация окрашенного раствора с известной копцентраци (раствор сравнения);
Ао - оптическая плотность раствора сравнения;
Сх - концентрация анализируемого вещества в растворе;
Ах - оптическая плотность анализируемого вещества в растворе.
II
(Сх-С0)
сх - Со + Ax-Fcp.
где: F - аналитический фактор;
Со - содержание вещества в растворе сравнения;
Ап - поглощение ряда растворов с известной концентрацией;
Ах - поглощение анализируемого раствора.
121
5. Метод фотометрического титрования
(основан на фотометрическом способе индикации точки эквивалентности, применяют для определения больших количеств анализируемого вещества в пробе).
Кривая фотометрического титрования по величине поглощения анализируемым веществом
Кривая фотометрического тизрования по величине поглощения титрантом
Кривая фотометрического титрования по величине поглощения продуктом реакции
6. Метод многоволновой спектрофотометрии (применяют для анализа многокомпонентных смесей)
_ Ах' -ер -А*2 -е/'
1 X, л2 л, х2 , £1 *е2 -£1 *е2
_ /С2 -Е,1' — АХ| -е/2
где: А, - первая аналитическая длина волны;
Х2 - вторая аналитическая длина волны;
Л — оптическая плотность смеси при длине волны
А - оптическая плотность смеси при длине волны Х2;
Ci - концентрация компонента 1;
С2 — концентрация компонента 2;
Е^1 je*2 ;е*2 ;Е2* - молярные коэффициенты поглощения компонентов 1 и
2 при длинах волн X] и А2 соответственно.
122
Таблица 11
ПОКАЗАТЕЛИ ПРЕЛОМЛЕНИЯ СПИРТО-ВОДНЫХ РАСТВОРОВ, КОНЦЕНТРАЦИЯ КОТОРЫХ ВЫРАЖЕНА В ОБ.%
Концентрация спирта Показатель преломления при 20°С Поправка показателя преломления на 1% спирта Температурный коэффициент
0 1,33300 1-Ю4
1 1,33345 4,5-10’4 1-10 4
2 1,33400 5,5-10'4 1-10 4
3 1,33444 4,4-104 1,1-104
4 1,33493 4,9-104 1,1-104
5 1,33535 4,24 О4 1,2-10 4
6 1,33587 5,2-1О4 1,2-10 4
7 1,33641 5,4-10'4 1,3-104
8 1,33700 5,9-104” 1,3-10 4
9 1,33760 6,0-10 4 1,3-1 о4
10 1,33808 4,8-10'4 1,4-1О4
И 1,33870 6,2-10 1,4-104
12 1,33924 5,4-1О4 1,4-104
13 1,33977 5,3-10 4 1,4-10 4
14 1,34043 6,6-10 4 1,4-104
15 1,34096 5,3-10 4 1,5-104
16 1,34158 6,2-10^ 1,5-104
17 1,34209 5,1-10^ 1,5-10 4
18 1,34270 6,1-10^ 1,5-10 4
19 1,34330 6,0- Ю4” 1,5-10 4
20 1,34390 6,0-1 о4 1,6-10 4
21 1,34452 6,2-1О4 1,6-10 4
22 1,34512 6,0-10^ 1,7-1О4
23 1,34573 6,1-10^ 1,8-10 4
24 1,34635 6,2-1О4 1,9-10 4
25 1,34697 6,2-104 2,0-104
30 1,35000 6,0-1 о-4 2,0-104
35 1,35320 6,4-1О4 2,1-104
40 1,35500 4,0-1044 2,4-104
45 1,35700 4,0-10^ 2,4-104
50 1,35900 4,0-10 4 2,6-104
55 1,36060 3,2-1О4 2,6-104
60 1,36180 2,4-10'4 3,4-104
65 1,36300 2,4-10 4 3,6-104
70 1,36380 1,6-10^" 3,8-104
75 1,36450 1,4-10^ 4,0-104
123
Таблица 12
ФАКТОРЫ ПОКАЗАТЕЛЕЙ ПРЕЛОМЛЕНИЯ (F) ВОДНЫХ РАСТВОРОВ ЛЕКАРСТВЕННЫХ СРЕДСТВ С ВЕСО-ОБЪЕМНОЙ КОНЦЕНТРАЦИЕЙ
Концентрация, % Факторы показателей преломления для растворов
Раствор аммиака Анальгин Антипирин Барбамил
1 Для 1-5% кон- 0,00190 0,00225 0,00181
2 центраций 0,00190 0,00225 0,00180
3 0,00050 0,00180 0,00226 0,00180
4 0,00185 0,00226 0,00180
5 0,00192 0,00226 0,00180
6 0,00188 0,00226 0,00179
7 0,00186 0,00226 0,00179
8 0,00187 0,00227 0,00178
9 0,00187 0,00227 0,00178
10 0,00192 0,00227 0,00178
Концентрация, % Барбитал-натрия Гексамети-лен-тстрамип Глюкоза безводная Глюкоза, с содержанием влаги 10%
1 Для всех коп- 0,00164 Для всех кон- Для всех кон-
2 центраций 0,00164 центраций центраций
3 0,00182 0,00165 0,00142 0,00129
4 0,00165
5 0,00165
6 0,00165
7 0,00165
8 0.00166
9 0,00166
10 0,00166
124
Продолжение табл. 12
Концентрация, % Изониазид Калия ацетат Калия бромид Калия йодид
1 0,00200 0,00130 0,00121 Для всех кон-
2 0,00215 0,00125 0,00120 цснтраций
3 0,00213 0,00123 0,00120 0,00130
4 0,00215 0,00120 0,00119
5 0,00214 0,00116 0.00119
6 0,00213 0,00113 0,00119
7 0,00211 0,00110 0,00118
8 0,00210 0,00111 0,00118 •
9 0,00210 0,00110 0,00117
10 0,00210 0,00110 0,00117
Конценг- Калия Кальция Кальция хло- Кислота ами-
рация, % хлорид глюконат рид*6Н2О нокапроиовая
1 0,00140 0,00164 0,00120 Для всех кон-
2 0,00135 0,00163 0,00120 центраций
3 0,00133 0,00162 0,00120 0,00185
4 0,00132 0,00161 0,00117
5 0,00132 0,00160 0,00116
6 0,00131 0,00159 0,00116
7 0,00131 0,00158 0,00116
8 0,00130 0,00157 0,00115
9 0,00130 0,00156 0,00115
10 0,00130 0,00155 0,00115
125
Продолжение табл. 12
Концентрация, % Кислота аскорбиновая Кислота борная Кислота никотиновая Кодеина фосфат
1 0,00160 Для всех кон- Для всех кон- Для всех кон-
2 0,00160 центраций центраций центраций
3 0,00160 0,00067 0,00210 0,00180
4 0,00159
5 0,00159
6 0,00158
7 0,00158
8 0,00158
9 0,00157
10 0,00157
Концентрация, % Кофеинбензоат натрия Магния суль-фат-7Н2О Натрия бензоат Натрия бромид
1 Для всех кон- Для всех кон- 0,00211 0,00130
2 центраций центраций 0,00211 0,00130
3 0,00192 0,00090 0,00210 0,00133
4 0,00210 0,00133
5 0,00210 0,00134
6 0,00210 0,00133
7 0,00210 0,00133
8 0,00209 0,00133
9 0,00209 0,00132
10 0,00209 0,00132
126
Продолжение табл. 12
Концентрация, % Натрия гидрокарбонат Натрия йодид Натрия салицилат Натрия тетраборат
1 Для всех кон- Для всех кон- 0,00206 0,00110
2 центраций центраций 0,00206 0,00110
3 0,00125 0,00143 0,00206 0,00110
4 0,00206 0,00107
5 0,00206 0,00106
6 0,00205 0,00103
7 0,00205 0,00100
8 0,00205 0,00100
9 0,00205 0,00100
10 0,00205 0,00100
Концентрация, % Натрия тиосульфат Натрия хлорид Натрия гидроцитрат Натрия цитрат
1 0,00120 0,00170 0,00100 0,00120
2 0,00120 0,00170 0,00150 0,00120
3 0,00130 0,00170 0,00140 0,00120
4 0,00127 0,00170 0,00150 0,00120
5 0,00122 0,00170 0,(Х)140 0,00118
6 0,00117 0,00170 0,00136 0,00120
7 0,00123 0,00170 0,00143 0,00120
8 0,00125 0,00165 0,00137 0,00120
9 0,00122 0,00164 0,00144 0,00118
10 0,00121 0,00165 0,00140 0,00118
т
Продолжение табл. 12
Концент-ация, % Новокаин Новокаин- амид Норсульфазол -натрия безводный Пилокарпина гидрохлорид
1 0,00221 Для всех кон- 0,00239 0,00160
2 0,00221 центраций 0,00238 0,00165
3 0,00221 0,00230 0,00238 0,00166
4 0,00221 0,00238 0,00167
5 0,00220 0,00237 0,00166
6 0,00220 0,00237 0,00166
7 0,00220 0,00237 0,00166
8 0,00220 0,00236 0,00166
9 0,00220 0,00236 0,00166
10 0,00220 0,00235 0,00166
Концентрация, % Резорцин Сульфацил-натрия Стрептоцид растворимый
1 Для 1-5% 0,00198 0,00190
2 концентраций 0,00195 0,00190
3 0,00200 0,00197 0,00190
4 0,00197 0,00190
5 0,00198 0,00188
6 0,00198 0,00188
7 0,00198 0,00188
8 0,00198 0,00188
9 0,00198 0,00188
10 0,00197 0,00188
128
ПРИЛОЖЕНИЯ
Таблица 1
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ Кн2о ПРИ РАЗЛИЧНОЙ ТЕМПЕРАТУРЕ
t°c Кн2о аН+=аО1Г t°C Кн2о а!Г=аОН
0 0,13-10 14 0,36-10 7 28 1,62-Ю14 1,27-10'7
5 0,21-10 14~ 0,46-10 7 29 1,76-Ю'14 1,33-107
10 0,36-10 14 0,59-10'7 30 1,891О14 1,3710 7
15 0,58-1014 0,76 10 7 35 0,27-10‘13 1,65-10’7
16 0,63-1014 0,7910‘7 40 0,38-10‘13 1,95-10'7
17 0,68-10 14 0,82-10'7 50 0,5610 й 2,4-10^
18 0,74-10'14 0,8610 ' 60 1,26-10'13 3,55-10’7
19 0,79-10'4 0,89-10'7 70 2,10-10 13 0,49-1О'6
20 0,86-10 14 0,93-107 80 3,40-10'13 0,58-1О'6
21 0,93-Ю'14 0,96-10 7 90 0,5210’12 0,72-10‘б
22 1,00-10'14 1,00-10 7 100 0,74-1012 0,86-10"6
23 1.10-10'14 1,05-10‘7 120 1,25-Ю12 1,12-Ю'6
24 1,19-Ю'14 1,09-10’7 140 1,80-10712 1,34-10 6
25 1,27-10'14^ г 1,13-10 7 160 2,50-1012 1,58-10 ь
26 1,38-10 14 1,17-10'' 180 3,20-1012 1,80-10'6
27 1,50-Ю'14 1,23 -10 7 200 0,40-10 й 2,0-10'6
Таблица 2
ПЛОТНОСТЬ И КОНЦЕНТРАЦИЯ НЕКОТОРЫХ РАСТВОРОВ КИСЛОТ И ЩЕЛОЧЕЙ (t=20°C)
Кислоты: Азотная
Плотность, кг/м3 Массовая доля,% Молярность, моль/л Плотность, кг/м3 Массовая доля,% Молярность, моль/л
1,000 0,333 0,052 1,280 45,27 9,195
1,020 3,982 0,645 1,300 48,42 9,990
1,040 7,530 1,243 1,320 51,71 10,83
1,060 10,97 1,845 1,340 55,13 11,72
1,080 14,31 2,453 1,360 58,78 12,68
1,100 17,58 3,068 1,380 62,70 13,73
1,130 22,38 4,012 1,400 66,97 14,88
1,150 25,48 4,649 1,420 71,63 16,14
1,170 28,51 5,293 1,440 76,71 17,53
1,190 31,47 5,943 1,460 82,39 19,09
1,200 32,94 6,273 1,480 89,07 20,92
1,210 34,41 6,607 1,500 96,73 23,02
1,220 35,93 6,956 1,510 99,26 23,79
1,240 39,02 7,679 1,513 100,00 24,01
1,260 42,14 8,426
130
Продолжение табл. 2
Серная
Плотность, кг/м3 Массовая доля, % Молярность, мол ь/л Плотность, кг/м3 Массовая доля, % Молярность, мол ь/л
1,000 0,261 0,027 1,340 44,17 6,035
1,020 3,242 0,337 1,360 46,33 6,424
1,040 6,237 0,661 1,380 48,45 6,817
1,060 9,129 0,987 1,400 50,50 7,208
1,080 11,96 1,317 1,420 52,51 7,603
1,100 14,73 1,652 1,440 54,49 8,000
1,120 17,43 1,990 1,460 56,41 8,397
1,140 20,08 2,334 1,480 58,31 8,799
1,160 22,67 2,681 1,500 60,17 9,202
1,180 25,21 3,033 1,520 62,00 9,608
1,200 27,72 3,391 1,580 67,35 10,85
1,220 30,18 3,754 1,640 72,52 12,13
1,240 32,61 4,123 1,700 77,63 13,46
1,260 35,01 4,498 1,750 82,09 14,65
1,280 37,36 4,876 1,800 87,69 16,09
1,300 39,68 5,259 1,820 91,11 16,91
1,320 41,95 5,646 1,835 95,72 17,91
Фосфорная
Плотность, кг/м3 Массовая доля,% Молярность, мол ь/л Плотность, кг/м3 Массовая доля, % Молярность, мол ь/л
1,000 0,296 0,030 1,340 50,66 6,928
1,020 4,000 0,416 1,380 П 55,28 7,84
1,040 7,643 0,811 1,420 59,74 8,658
1,060 11,19 1,210 1,460 64,03 9,541
1,080 14,60 1,609 1,500 68,10 10,42
1,100 17,87 2,005 1,540 72,00 11,32
1,120 21,03 2,403 1,580 75,76 12,22
1,140 24,07 2,800 1,620 79,40 13,12
1,160 27,05 3,203 1,660 82,96 14,06
1,180 29,94 3,606 1,700 86,38 14,98
1,200 32,75 4,010 1,740 89,72 15,93
1,220 35,50 4,420 1,780 92,97 16,89
1,240 38,17 4,829 1,820 96,15 17,85
1,260 40,79 5,245 1,840 97,71 18,34
1,280 43,37 5,655 1,860 99,24 18,84
1,300 45,88 6,087 1,870 Г- 100,00 19,08
131
Продолжение табл. 2
Хлористоводородная
Плотность, кг/м3 Массовая доля, % Молярность, моль/л Плотность, кг/м3 Массовая доля, % ' Молярность, моль/л
1,000 0,360 0,099 1,110 22,33 6,796
1,010 2,364 0,655 1,120 24,25 7,449
1,020 4,388 1,227 1,130 26,20 8,118
1,030 6,433 1,817 1,140 28,18 8^809
1,040 8,490 2,421 1,150 30,14 9,505
1,050 10,52 3,029 1,160 32,14 10,225
1,060 12,51 3,638 1,170 34,18 10,97
1,070 14,50 4,253 1,180 36,23 11,73
1,080 16,47 4,878 1,190 38,32 12,50
1,090 18,43 5,510 1,198 40,00 13,14
1,100 20,39 6,150
Хлорная
Плотность, кг/м3 Массовая доля, % — Молярность, моль/л Плотность, кг/м3 Массовая доля, % Молярность, моль/л
1,005 0,00 0,100 1,300 40,10 5,189
1,020 3,61 0,366 1,350 44,81 6,021
1,060 10,06 1,061 1,400 49,23 6,860
1,100 16,00 1,752 1,450 53,27 7,689
1,140 21,64 2,456 1,500 57,06 8,519
1,180 26,82 3,150 1,550 60,78 9,377
1,220 31,61 3,839 1,600 64,50 10,27
1,260 36,03 Г 4,519 1,675 70,15 11,70
Щелочи:
Раствор аммиака
Плотность, кг/м3 Массовая доля, % Молярность, моль/л Плотность, кг/м3 Массовая доля,% Молярность, моль/л
0,880 34,35 17,75 0,940 14,88 8,21
0,884 32,84 17,05 0,958 9,87 5,55
0,888 ’ 6,892 31,37 30,00 16,36 0,960 9,34 5,23
15,71 0,980 4,27 2,46
0,896 28,67 27,33 15,08 0,990 1,89 1,10
0,900 14,44 0,994 0,98 0,57
0,908 24,68 13,16 0,998 0,05 0,03
0,920 20,88 11,28
132
Продолжение табл. 2
Гидроксид калия (Едкое кали)
Плотность, кг/м3 Массовая доля, % Молярность, моль/л Плотность, кг/м3 Массовая доля, % Молярность, моль/л
1,000 0,20 0,035 1,330 33,97 8,05
1,005 0,74 0,133 1,400 40,37 10,07
1,050 5,66 1,06 1,450 44,79 11,58
1,080 8,89 1,71 1,500 49,10 13,13
1,095 10,49 2,05 1,510 49,95 13,45
1,110 12,08 2,39 1,520 50,80 13,76
1,200 21,38 4,57 1,530 51,64 14,08
1,290 30,21 6,95 1,535 52,05 14,24
Гидроксид натрия (Едкий натр)
Плотность, кг/м3 Массовая доля, % Молярность, моль/л Плотность, кг/м3 Массовая доля, % Молярность, моль/л
1,000 0,159 0,040 1,330 30,20 10,04
1,005 0,602 0,151 1,400 36,99 12,95
1,050 4,655 1,222 1,450 42,07 15,25
1,080 7,38 1,992 1,500 47,33 17,75
1,095 8,74 2,391 1,510 48,38 18,26
1,110 10,10 2,802 1,520 49,44 18,78
1,200 18,26 5,476 1,530 Г 50,50 19,31
1,290 26,48 8,539
133
Таблица 3
КОНСТАНТЫ ИОНИЗАЦИИ КИСЛОТ (КОНСТАНТЫ КИСЛОТНОСТИ)
Название кислоты Формула Ка ! pKa=-igKa
Одноосновные
Азотистая hno2 6,2-10"4 3,21
Йодноватая Н1О3 1,7-10"' 0,77
Перекись водорода Н2О2 2,6-1О"12 11,58
Роданистоводородная HSCN 1,4-10"' 0,85
Фгористоводородная HF 6,5-10"4 3,19
Хлористая НСЮ2 1,1-102 1,97
Хлорноватистая нею 3,2-1О"8 7,50
Цианистоводородная HCN 6,5-10"'° 9,19
Аминоуксусная (Глицин) Бензойная NH2CH2COOH 1,7-10'° 9,77
С6Н5СООН 1,62 10"6 5,79
Гликолевая СН2(ОН)СООН 1,5-104 3,83
Глюконовая СН2ОН(С1ЮН)4СООН 1,4-10"4 3,86
Кротоновая (р-метилакриловая) СН3СП = снсоон 2,0-10’5 4,69
Лауриновая CH3(CH2)ioCOOH 1,110 s 4,95
Молочная СНзСНОНСООН 1,38-10"4 3,86
Муравьиная НСООН 1,78-10"4 3,75
о-Нитробснзойная O2NC6H4COOH(1,2) 6,8-10"3 2,17
Пикриновая HOC6H2(NO2)3 4,2-10"' 0,38
Пропионовая CH3CH2COOH 1,35-10 s 4,87
Уксусная СНзСООН 1,75-10"5 1,05-10"'° 4,75 9,98
Фенол С6Н5ОН
Хлоруксусная СН2С1СООН 1,41-Ю3 2,85
Двухосновные
Сернистая Ki к2 H2SO3 1,3-10"2 6,8-108 1,87 7,27
Сероводородная Ki к2 H2S 1,0-10"7 1,3-10"'3 7,00 12,89
Угольная К1 К2 Н2СОз 4,5-10"7 5,0-10" 6,35 10,30
Хромовая К, к2 Н2СгО4 2,1-10"' 3,2-10"7 0,67 6,50
134
Продолжение табл. 3
Название кислоты Формула К„ рК,=-1КК»
Винная К, к2 Н2С4Н4О6 1,05-10'3 1,5710 5 2,98 4,34
Щавелевая к, К2 Н2С2О4 5,62-10'2 5,89-10'5 1,25 4,23
Янтарная Ki к2 Н2С4Н4О4 6,17-10'5 2,29-10'6 4,21 5,64
Трехосновные
Борная к. H3BO3 5,75-Ю’10 9,24
Мышьяковая (орто) Ki к2 К3 H3ASO4 6,46-1О'3 1,15-Ю'7 3,161012 2,19 6,94 11,50
Мышьяковистая Kj К2 H3ASO3 5,00-1О'10 3,2-1014 9,30 13,50
Фосфорная (орто) к, к2 к? Н3РО4 7,08-10'3 6,17-10'8 4,68-Ю13 2,15 7,21 12,33
Фосфористая К2 Н3РО3 2,5-10'2 2,0-10‘7 1,6 6,7
Четырехосновные
Этилендиамин-тетрауксусная К] к2 К3 CH2N(CH2COOH)2 1 CH2N(CH2COOH)2 1,0-10’2 2,1-103 6,9-10'7 5,5-Ю11 1,99 2,67 6,16 10,26
135
Таблица 4
КОНСТАНТЫ ИОНИЗАЦИИ ОСНОВАНИЙ (КОНСТАНТЫ ОСНОВНОСТИ)
Название основания Формула Kb pKb=-lgKb
Однокислотные
Аммиак NH3H2O 1,76-1 O'5 4,76
Лития гидроксид LiOH 6,8-10 1 0,17
Анилин c6h5nh2 3,31-Ю10 9,48
Бутиламин CH3(CH2)2CH2NH2+ Н2О 6,0-IO'4 3,22 1
Диметиламин (CH3)2NH 7,24-10 4 3,14
Димстиланилин C6H5N(CH3)2 2,4-IO10 9,62
Диэтил амин (C2h5)2nh 9,55-10 4 3,02
Метиламин ch3nh2 5,37-IO'4 3,27
Пиридин c5h5n l,5110-9 8,82
Триэтиламин (C2I15)3N +h2o 1,0-1 O'3 2,99
Хинолин c9h7n 8,7110'° 9,06
Этил амин c2h5nh2 I 4,68-10 4 3,33
Этиланилин c6h5nhc2h5 4,0-IO10 9,40
Двухкислотные
Бария гидроксид к2 Ba(OH)2 2,29-10’1 0,64
Кальция гидроксид к2 Ca(OH)2 4,27-10’2 1,37
Свинца гидроксид Ki К2 Pb(OH)2 8,71-10'4 1.5110'8 3,06 7,82
Цинка гидроксид к2 Zn(OH)2 1,5-1 O’9 8,82
Г идразин к, К2 N2H4 9,33-1 O'7 1,86-10'14 6,03 13,73
Г идроксиламин nh2oh 9,33-109 8,03
Пиразин N -CHCH=NCH=CH + H2O 4,5-10'14 13,35
Пурин N^> NH 2,45-10‘12 11,61
Тиомочевина CS(NH2)2+H2O 1,1-10 12 11,97
Фснилгидразип c6h5nhnh2 + H2O 1,6-10 9 8,80
136
Таблица 5
БУФЕРНЫЕ СМЕСИ Универсальная буферная смесь 100 мл смеси Н3РО4, СН3СООН, Н3ВО3 (раствор в отношении каждой из них 0,04М) + а мл 0,2М NaOH
а pH а pH
0 1,81 50,0 6,80
2,5 1,89 52,5 7,00
5,0 1,98 55,0 7,24
7,5 2,09 57,5 7,54
10,0 2,21 60,0 7,96
12,5 2,36 62,5 8,36
15,0 2,56 65,0 8,69
17,5 2,87 67,5 8,95
20,0 3,29 70,0 9,15
22,5 3,78 72,5 9,37
25,0 4,10 75,0 9,62
27,5 4,35 77,5 9,91
30,0 4,56 80,0 10,38
32,5 4,78 82,5 10,88
35,0 5,02 85,0 11,20
37,5 5,33 87,5 11,40
40,0 5,72 90,0 11,58
42,5 6,09 92,5 11,70
45,0 6,37 95,0 11,82
47,5 6,59 100,0 11,98
137
Продолжение табл. 5
Уксусно-ацетатная буферная смесь
Для приготовления буферного раствора требуемого значения pH отмеряют указанный объем 1 М раствора уксусной кислоты, прибавляют 50,0 мл 1 М раствора едкого натра и разбавляют дистиллированной водой до 500 мл
pH Уксусная кислота, 1 М, мл pH Уксусная кислота, 1 М, мл pH Уксусная кислота, 1 М, мл
3,8 421,5 4,67 100,0 5,5 57,4
3,9 345,1 4,7 96,8 5,6 55,9
4,0 284,4 4,8 87,2 5,7 54,7
4,1 236,2 4,9 79,5 5,8 53,7
4,2 197,9 5,0 73,4 5,9 53,0
4,3 167,4 5,1 68,6 6,0 52,3
4,4 143,3 5,2 64,8 6,1 51,9
4,5 124,1 5,3 61,7 6,2 51,5
4,6 108,9 5,4 59,3 6,3 51,2
Буферные растворы индивидуальных веществ
Вещество pH
0,05 М раствор тетраоксалата калия дигидрата (КН3С4О8- 2Н2О; М.м. 254,19) 1,679 (25°С)
11асыщснный раствор гидротартрата калия (=0,025 М) (КНС4Н4О6; М.м. 188,178) 3,567 (25°С)
0,05 М раствор дигидроцитрата калия (C4H12N2HPO4- Н2О; М.м. 202,147) 3,776 (25°С)
0,05 М раствор гидрофталата калия (КНС8Н4О4; М.м. 204,22) 4,008 (25°С)
Насыщенный раствор пиперазинфосфата* (~0,065 М) (КНС4Н4О6; М.м. 188,178) 6,36 (16°С); 6,34 (18°С)
0,05 М раствор тетрабората натрия (Na2B4O7- ЮН2О; М.м. 381,37) 9,18 (25°С); 9,07 (38°С)
* Пиперазинфосфат готовят смешением при комнатной температуре эквимолекулярных количеств пиперазина и фосфорной кислоты с последующей перекристаллизацией выделившихся белых пластинчатых кристаллов.
138
Продолжение табл. 5
Фосфатная буферная смесь смесь а мл 1/15М Na2HPO4 и (100 - а) мл 1/15М КН2РО4
pH > а рн а
4,80 0,35 6,45 28.70
4,85 0,45 6,50 31,30
4,90 0,60 6,55 34,10
4,95 0,75 6,60 37,10
5,00 0,95 6,65 40,00
5,05 1,15 6,70 43,00
5,10 1,35 6,75 46,00
5,15 1,55 6,80 49,20
5,20 1,80 6,85 52,20
5,25 2,05 6,90 55,20
5,30 2,30 6,95 58,20
5,35 2,65 7,00 61,20
5,40 3,00 7,05 64,20
5,45 3,45 7,10 67,00
5,50 3,90 7,15 69,80
5,55 4,35 7,20 72,60
5,60 4,90 7,25 75,40
5,65 5,50 7,30 77,70
5,70 6,20 7,35 79,90
5,75 7,00 7,40 81,80
5,80 7,90 7,45 83,50
5,85 8,80 7,50 85,20
5,90 9,80 7,55 86,90
5,95 10,80 7,60 88,50
6,00 12,10 7,65 89,90
6,05 13,50 7,70 91,20
6.10 15,00 7,75 92,40
6,15 16,70 7,80 93,60
6,20 18,40 7,85 94,60
6,25 20,10 7,90 95,50
6,30 22,10 7,95 96,20
6,35 24,20 8,00 96~90
6,40 26,40
139
Таблица 6
ТЕРМОДИНАМИЧЕСКИЕ (ПРТ) И КОНЦЕНТРАЦИОННЫЕ (ПРК) ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ, РАСТВОРИМОСТЬ (S) НЕКОТОРЫХ ЭЛЕКТРОЛИТОВ
Формула соединения ПР1 1 ПРК Sm? моль/л ^г/100 мл
Арсенаты
Ag3AsO4 1,12-10zu 3,59-Ю6 ‘ 1,27-10'8 1,66-Ю4 2,10-Ю'7
A1AsO4 1,6-10“’ 1,6-10'"’
Ва3( AsO4)2 7,76-10'3' 3,73-10 11 2,57-10 9
BiAsO4 4,37-10'lu 2,09-Ю'3 7,27-10'4
Ca3(AsO4)2 6,76-10'19 9,11-103 3,62-10’
Co3(AsO4)2 7,6-1 O'29 2,34-Ю'6 1,06-10 4
CrAsO4 7,8-Ю2' 7,8-1 O'21 8,33-10“ 1,69-10 9
Cu3(AsO4)2 7,6-1 O'ih 7,6-10'96 9,32-10 s 4,37-10 6 1,48 Тб:’ 1,59-10 3
FeAsO4 5,8-1 O'21 5,8-10'21 7!61-1O11 4,54-Ю'5" ”
Mg3(AsO4)2 2,09-IO'20
Mn3(AsO4)2 1,9 1029 1,9-10'29 7,07-Ю'7 3,13-10 3
Ni3(AsO4)2 3,1- 10'26 3,1-10'26 3,10-10'6 1,41104 2,95 10'6
Pb3(AsO4)2 4,1 •10'”’ 4,1-IO'96 3,28-Ю'8
Sr3(AsO4)2 1,62-10"' 1,09-1 О'4 5,8710'1
Zn3(AsO4)2 1,07-1 O'2' l,07-10'2' 1,58-Ю'6 7,50-10'4
Арсениты
Ag3AsO3 Бромиды 1,0-lQ'1' | 1,22-10'1' 2,60-10' 5,99-Ю'4
AgBr* 4,90-IO'13 4,90-10'13 7,12-10'/ 1,34-Ю'3
CuBr 5,25-10'y 5,25-10'9 7,24-Ю'3 1,04-109
Hg2Br2 —5,75-10n 5,75-IO'29 1,38-Ю'6 7,73-10'3
PbBr2 9,12-10'6 2,76-10'' 2,73-Ю'2 1,00
Гидроксиды (гидроокиси)
AgOH* 1,6010 s l,63-10's 1,61-Ю'4 2,01-10'9
A1(OH)3 1,10-10'" 1,10-10" 2,52-Ю'9 1,97-10'8
Bi(OH)3 4,27-IO'91 4,27-10'J1 1,12-Ю'8 2,92-1 О''
Ca(OH)2> 5,49-10b 7,96-10'6 1,26-10 2 9,32-10'2
Cd(OH)2 цеакт. форма 3,98-Ю1' 3,9810',:> 1,07-10'3 1,57-10'4
Ce(OH)3 6,32-1 O'22 6,32-10'22 2^21-Ю'6 1,16-10'5 4,20-10'3
Co(OH)2 голуб. 6,31-ю1' 6,31-10'15 1,08-10^
Co(OH)2, розов.свеж. 1,59- 1013 1,59-10'"’ 7,35-Ю'6 6,83-10'3
Co(OH)2. розов.после стар, 2,00- 1016 2,00-IO'16 3,68-Ю'6 3,42-10 3
Со(ОН)3 1,00-10-43 l,00-10'4j 7,80-Ю12 8,58-10'71-
Сг(ОН)з 6,31 10'3i 6,31 10" 1,24-10'8 1,27-10’7
Fe(OH)2' 7,94-Ю'6 7,94-IO'16 1,05-10' 9,45 -10 3
Fe(OH)3‘ 3,72-10’4U 3,72-10"’ 1,80-Ю'9 1,93 -10 8
Hg2(OH)2 (Hg2O) l,6010'23 1,60-10" 1,59-Ю'8 6,92-10 '
Hg(OH)2 (HgO) 3,0-10'26 3,0-10'2b 1,95-Ю'8 4,57-1077-
140
Продолжение табл. 6
Формула соединения ПР1 ПРк S\b моль/л S,/ЮО мл
ион* 4,0-10“ 6,251О-2 0,3425 0,8202
Mg(OH)2, стаб.форма 1,12-10 11 1,32-10“ 1,49-10-4 8,67-Ю'4
Мп(ОН)2 1,59-1О13 1,70-10“ п J/ч 1 л-5 ^111^-4
J V э, 1 1 1U
Ni(OH)2’ 3,16- 101Ь 3,16-10 16 4,40-10ь 4,08-10'3
Ni(OH),’ CCTilD ' 6,3-10ls 6,3-1018 1,17-Ю’6 1,0810’3
Pb(OH)2* ’— Pb2+ + 2OH 1,0-1О'20 1,0 -10 20 1,36-Ю’7 3,29-10'6
Pb(OH)2* — PbOH+ + OH 8,7-Ю’14 8,710 й 2,96-10’7 7,13-Ю'6
Pt(OH)2 1,0-10“3 1,0-10’3 1,23-1012 2,82-10'“
Pt(OH)4 (PtO2) 1,6-10 1,6-10 '2 1,44-1015 3,79-Ю'14
Sb(OH)/ 3,99-1 О’42 3,99-Ю"2 2,010" 3,45-10'4
Sn(OH)2* Sn2+ + 2OH" 1,41-10'28 1,41-10 28 1,39-10’7 2,12-10'6
Sn(OH)2* — SnOH+ + OH 4,6-10'15 4,6-1015 2,84-10’6 4,34-10'5
Sn(OH)4* Zll(OH)2 , стаб. форма 1,0-10"7 1,0-10’3' 1,31 -1012 2,45-10'"
1,20-10 1' 1,20-10 12 3,84-106 3,82-10'3
Йодаты
AgIO3* Ва(Ю3)2 3,09-10'8 1,5110'9 3,22-10'8 2,05-10 9 1,79-10’4 7,99-10'4 5,07-103 3,89-10'2
Се(Ю3)з 3,16- Ю’10 1,15-10* 2,56-Ю’3 1,70-Ю'1
Pb(IO3)2 2,6310 13 2,83-10“ 4,14-10" 2,30-10“
Йодиды
Agl* 9,9810_,/ 9,981017 1,0310'8 2,41-10'/
Cui 1,10-Ю'12 1,10-10 12 1,05-10° 2,00-10'3
Hg2I2 4,47-10'2У 4,47-1О'29 2,24-10'1и 1,46-10'8
Pbl2* 8,71-10* 1,34-10'8 1,51 -10 3 6,9610'2
Карбонаты
Ag2CO3 8,13-10 12 9,49-1012 1,33-10'4 7,70-10'3 3,68 10-’ 1,52-10“
BaCO3 5,13-10* 5,93-10 9
СаСОз 2,88-10* 3,26-10'9 5,7110" 5,72-10'4
CdCO3 5,25-Ю'12 5,25-1О'9 2,29106 3,95-10'3
СоСОз 1,451013 1,45-10“ 3,80-10 2 3,94-10'6
СиСОз 2,34-10‘|и 2,34- 10 ю 1,37-10'3 1,69-10'4
FeCO3 2,0910" 2,0910“ 4,57-1 О’” 5,30-10'3
НЙ2СО3 MgCO3-3H2O 8,91 101/ 8.91-101' 2,81-10ь 1,30-10'4
1,0010" 3,08-103 5,55-10'3 7,68-10'2
МпСОз 5,01101и 5,1110 го 2,26-10" 2,60-10'4
NiCO3 1,35-10_/ 1,63-10“ 4,03-10'4 4,79-10“
РЬСОз 7,41-10'^ 7,41-Ю'14 2,72-10'' 7,27-10'6
SrCO3 1,10-10 10 1,10-10ш 1,05-10" 1,5510'4
ZnCO3 1,45-10" 1,45-10" 3,80-10'6 4,77-10'3
141
Продолжение табл. 6
Формула соединения ПРГ ПРК Sm) моль/л S[-/l 00 мл
Оксалаты
Ag2C2O4 3,57-Ю11 4,10-Ю11 2,27-Ю'4 6,89-10J
ВаС2О4 1,10-10 ' 1,4910" 3,85-10'4 8,68-10J
СаС2О4 2,29-10'4 2,60-Ю’у 4,86-10" 6,22-10'4
CdC2O4 1,5910 s 1,96-10'8 1,40-Ю’4 2,81-10J
СоС2О4 6,31-10 й 8,5310 й 2,92- Ю'4 4,29-10"
СиС2О4 3,16108 4,10-10'8 2,02-10" 3,06-10"
FeC2O4 2,00-10'' 3,05-10' 5,52-Ю'4 7,94-10"
Hg2c2o4 1,00-10” 1,00-1 о” 3,16-10’' 1,55-10’
MgC2O4 7,94-10'" 1,47*1О'4 1,65-10’2 0,1852
MnC2O4 2,00-10'6 4,88-10” 3,50-10’3 5,01-IO'2
NiC2O4 3,98-10'lu 4,42-10"и 2,11-10" 3,10-10"
PbC2O4 4,79-10’IU 5,32-Ю10 глыо5 6,82-104””
SrC2O4 5,63-10‘8 7,61-1О"8 2,41-10’4 4,23-10"
ZnC2O4 1,59 109 1,77-104 2,64-108 4,05-10 4
Сульфаты
Ag2SO4 1,455-10" 5,02-10" 2,32-10 2 0,7244
BaSO4 1,05-10 10 1,05-10ш 1,02-10 5 2,39-10'4
CaSO4 9,12-106 2,30-10" 4,79-10'5 6,52-10'2
Hg2so4 6,76-10"' 1.11-10’6 1,0510'" 5,22-Ю'2
PbSO4 1,59-10 й 1,96-10'8 1,40 10 4 4,24-10"
SrSO4 3,47-10"' 5,29-10 7 7,27'Ю24 1,34-Ю'2
Сульфиды
Ag2S 6,3110"° 6,31-10 2,51-Ю'1' 6,22-Ю'1Ь
CdS 7,94-10'2/ 7,94-Ю'2/ 8,91-Ю14 1,15-Ю12-
CoSa 3,98-10'21 3,98-Ю'21 6,31Ю1Т 5,74-Ю|и
CoSD 2,00-1 O'25 2,00-Ю'2" 4,471 О'J 4,06-Ю12
CuS 6,3110"" 6,31 - 10Jb 2,51-Ю18 2,40-10"
Cu2S 2,51-IO'48 2,51-Ю"48 8,56-Ю1' 1,36-10”
FeS 5,13-1 O'18 5,13-10'1й 2,27-10” 1,99-Ю"8
HgS, черп. (1,59-1 O'82) (1,59-Ю'52)
HgS, красн. (3,98-10"J) (3,98-Ю'"5)
MnS розов 2,51 -10 lu 2,51-101и 1,59-10s 1,38-10 4
MflS зелен. 2,5110 й 2,5110 IJ 5,01 -Ю7 4,36-10”
NiSa 3,16-10 ly 3,16-10 19 5,62-101и 5,10-10’
NiSp 1,00-1 O’24 1,0010'24 1,00-10 12 9,08-10 12
NiS? 2,00-10'2b 2,00-Ю'2Ь l,41-101J 1,28-Ю"2
PbS 2,51-10'2/ 2,51-Ю'2/ 5,04-10 14 1,20-10"2
SnS 1,001 O'" 1,00-10'2" 3,16-10 14 4,77-Ю"2
ZnSa 1,591 O'24 1,59-10'24 1,26-10 12 1,23-10"'
ZnSB 2,51 -IO'22 2,51-Ю'22 1,5910 11 1,54-10 "°
142
Продолжение табл. 6
Формула соединения ПРТ ПРК Sm, моль/л Sr/100 мл
Сульфиты
Ag2SO_3 BaSO3 CaSO3 Hg2SO3 MgSO3 1,51-Ю'14 7,94-10’' 1,29-16^ 1,00- КГ27" 3,16-10 1,51-Ю’14 1,31-10° Г 1,591 O’8 1,00-IO’2' 1,88-1 O’2 1,56-10’ 1,14-10’2 1,26-1 O’4 3,16-10 14 0,14 4,61-IO’4 2,48-1 O’2 1,51-10’’ 1,52-10 12 1,43
SrSO3 3,98-10 s 5,14-1 O’8 2,27-1 O'4 3,81-10 ’
Фосфаты
Ag,PO4_ l,29-10’-u 1,29-10zu 4,67-10° 1,96-1 O'4
A1PO4 5,75-10'19 5,75-10'19 6,61 10iU 8,06-10y
BaHPO4 Ba3~(PO4)2 BiPO4 1,29-10'23 9,12-1 O’8 3,39-IO’22 j 1,29-1 O’22 3,02-1 O'4 1,26-10 ’ 3,59-IO’12 _7,05-10’2 7,57-IO’4 1,09-IO’10
CaHPO4* 2,75-10’' 4,20-1 O'' 8,58-10'4 1,17-10 2
Ca3(PO4)2 _J l,00-10’2° 2,47-10° 7,67-1 O'4
Cd3(PO4)2 2,51 -10JJ 2,51-IO’22 1,18-10' 6,24-10°
COHPO4 2,00-10’' 7,03-10’' 6,73-10'4 1,04-1 O'2
Co3(PO4)2 2,00-10’2’ 2,00-1 O’2’ 4,50-1 O'8 1,65-10°
СгРО4, зелен. 2,40-1 O'23 4,90-10'12 7,20-10’"
CfPO4 фполет. 1,00-1 O'1' 3,16- J0'y 4,65- 10 s
Cu3(PO4)2 1,26-10”*' 1,26-1 O’27 1,63-108 6,22-IO'7
PePO4 1,29-1 O’22 1,29-1 O’22 1,14-10 11 1,71-1O'10
MgNH4PO4 2,51-10 i3 6,31-JO'5 8,66-1 O'4
Ni3(PO4)2 PbHPO4 _5,OHO’JI 5,01-10’21 Г i,4i-io10- 3,41-IO'7 1,19-10’ 1,25-10’ 3,60-1 O’4
Pb3(PO4)2 7,94-IO’4’* 7,94-1 O’41 1,49-10 v 1,21-10 7
SrHPO4 5,75-10'' 7,59-1 O'4 1,39-1 O'2
Sr3(PO4)2 4,07-1 O’22 1,30-10° 2,82-IO3
Zn3(PO4)2 9,12-10 22 9,12-10’2' 1,5310 ' 5,92-10°
Фториды
BaF2 CaF2 1,05-1 O’20 3,98-Ю’11 2,43-10° 4,70-Ю’11 8,47-1O'J 2,27-1 O’4 1,48-10 J 1,78-Ю'3
SrF2 2,46-1 O’9 3,37-IO'9 9,44-1 O'4 l,19102
Хлориды
AgCl* Hg2Cl2 1,78- 1O’1U l,32-10’18 l,78-10’lu 1,32-10 18 1,35* IO'" 6,91 10 7 1,93-10 3,25-10"5
PbCl2 1,74- 10’’ 6,02-10’ 4,13-102 1,15
Хроматы
Ag2CrO4 1,29-10 1,44-1 O'12 7,12-10':> 2,36-10'
BaCrO4 l,18-10iU l,1810'lu 1,08*1 O'3 2,75-IO'4
CaCrO4 7,10-1 O’4 3,671 O'3 6,06-1 O'2 9,45-1 O'1
Hg2CrO4 5,00-10 9 1,13-10’8 1,06-1 O'4 5,50-IO’2
PbCrO4 l,18-10’14 l,18-1014 1,33-10'' 4,31-10°
SrCrO4 2,24-10’’ 4,73-Ю’2 9,63-1 O'2
143
Таблица 7
СТАНДАРТНЫЕ ОКИСЛИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ В ВОДНЫХ РАСТВОРАХ ПО ОТНОШЕНИЮ К ВОДОРОДНОМУ ЭЛЕКТРОДУ (в таблице приведены значения потенциалов для t=25°C при ц=0)
Элемент Уравнение полуреакции E°,B
Ag Ag* + е AgTB + 0,799
Ag2+ + е Ag* +1,998
AgO* + 2H+ + e ' Ag2* + H2O +2,016
2 AgOTB + 2H++ 2e — Ag2O + H2O +1,41
2 AgOTB + H2O + 2e Ag2O + OH +0,599
Ag2O1B + 2H + 2e 2AgTB + H2O + 1,173
Ag2OTB + H2O + 2e - 2AgTB + 2OH +0,342
Ag2CrO4TB + 2e 2AgTB + CrO4 +0,447
Ag2STB + 2H++2e — 2AgTB + H2Sr -0,036
Ag2STB + 2e Ag гв + S2 -0,712
AgClTB + e 2Ag IB + Cl +0,222
AgBiTB + e " Антв + Bi +0,071
AgIIH + e Agin +1 -0,152
Al Al3* + 3e ~—55 A1TB -1,66
АГ3* + 2e 1 Al* -2,76
Al + e A1TB -0,55
A1O2‘ + 4H* + 3e -— A1tb+2H2O -1,262
A1(OH)3tb + 3e Alye + зон -2,31
[A1F6]3 +3e -—- A1TB+6F -2,07
As H3ASO4 + 3H + 2e " AsO+ + 3H2O +0,55
H3 AsO4 + 2H* + 2e — " HAsO2 + 2H2O +0,559
H2AsO4” + 3H+ + 2e - * HAsO2 + 2H2O +0,666
HAsO42 + 4H*+2e - w HAsO2 + 2H2O +0,881
HAsO42 + 3H*+2e ' AsO2 + 2H2O +0,609
AsO43“ + 2H2O + 2e ' AsO2 + 4OH -0,67
2H3AsO4 + 4H+ + 4e ’ As2O3ra + 5H2O +0,58
2H2AsO4 + 6H+ + 4e As2O3tb+ 5H2O +0,687
2HAsO42” + 8H*+4c As2O3tb+5H2O +0,901
2AsO43 + 10H*+4e = As2O3tb + 5H2O +1,27
AsO43” + 8H*+5e As-j-b + 4H2O +0,648
As2O3tb + 6H + 6e 2Astb+3H2O +0,234
AsO+ + 2H++3e As1B + H2O +0,254
HAsO2+3H++3c — As-тв + 2H2O +0,248
AsO2 + 4H++3c Astb + 2H2O +0,429
AsO2” + 2H2O + 3e — AsTB + 4011 -0,68
144
Продолжение табл. 7
Элемент Уравнение полуреакции E°, В
Au AsTB+3H++3e AsH3>r Au3+ + 2e ' Au+ -0,608 +1,41
— Au_l+_3e " _AUrв Au+ + e ~~ Аир, _ +1,50 _ _+L68_
AuC14 + 2e A11CI2 + 2CI +0,926
AuBr4 + 2e AuBr2 + 2Br +0,805
AuC14 + 3e ** AurB + 4C1 + 1,002
AuBr4 + 3e AuTB + 4Br _ _ +0,858
— — _AuCh^t_e AuTB + 2C1 AuBr2 + e - AuTB + 2Br + 1,154 +0,963
В Н3ВО3 + ЗН++Зе -BTB + 3H2O -0,869
H2BO3 ' + 4H+ + 3e BTB + 3H2O -0,687
HBO32 + 5H++3e —BTB + 3H2O -0,437
BO33’ + 6H+ + 3e BTB + 3H2O -0,165
. — — B(OH)3 + 3H+ + 3e Вта + 3H2O -0,87
1_ВЕ1Г+_Зе_->_ 2. 5iBjtIf -1,04
H2B4O7 + 12H+ + 12e 4BTB + 7H2O -0,836
B4O72’ + 14H++ 12e ’ “ 4B1B + 7H2O -0,792
Ва Ba2+ + 2e - BaIB -2,905
BaO + 2H+ + 2e = Вата + H2O -2,166
Be Be + 2e ' BeTB -1,85
Bi Be^O^+JBHjOj- 4e 2BeT„+6OH" Bi3+ + 3e b BiTB +0,215
— BiOH2+ + H+ + 3e 88 BiTL, + H2O BiO+ + 2H+ + 3e BiTfl + H2O +0,254 +0,320
BiOClTB + 2H+ + 3e = BiTB + H2O + Cl' +0,160
Bi2O31B + 3H2O + 6e * 2BiTB + 6OH -0,46
Bi2O5 TB + 10H+ + 4e 2Bi3+ + 5H2O +1,759
Bi2O51B + 8H+ +4e 2BiOH2++ 3H2O + 1,700
Bi2O5,TB + 6H+ + 4e 2BiO+ + 3H2O + 1,605
NaBiO31B + 4H++2e BiO++ Na++ H2O >+1,8
BiTB + 3H++3e ” BiH3,r -0,800
Br , . Вг2,ж + 2e 2Br JBrJ + 2e 3Br _+L09_ ^h05_
HBrO3 + 5H++6e [Br] + 3H2O +1,42
ЗНВгОз + 15H++ 16e Br3 +9H2O + 1,462
BrO3 + 3H2O + 6e Br + 6OH +0,61
2HBrO2+10H++lOe Вг21Ж+6Н2О +1,48
145
Продолжение табл. 7
Элемент Уравнение полуреакции E°, В
НВгОз + 4Н++4с НВгО + 2Н2О НВгО3 + ЗН++ 4е =* ВгО + 2Н2О +1,46 +1,33
2НВЮ + 2Н+ + 2е —- Вг2,ж + 2Н2О + 1,59
2ВгО +4Н++ 2с -—- Вг2.ж+ 2Н2О +2,09
С 2ВгО + 2Н2О + 2е Вг?ж+ 4OII _ВгО + Н2О + 2е -—~ Вг + 2ОН ~ СО2,Г + 2Н+ + 2е СО,Г + Н2О +0,45 +0,76 -0,12
2СО21, + 2Н+ + 2е - Н2С2О4 -0,49
СО2л+2Н++2с 15 НСООН -0,20
Са CNO + 2Н2О + 2е CN" + 2ОН ’ -0,97
— — 2HCNO + 2Н+ + 2е 2Н2О + (CN)2,r (CN)2.t + 2Н++ 2е 2HCN Са2+ + 2е ~ Са,„ СаОгидр + 2Н + 2е ~1 Сатв + Н2О +0,33 +0,37 -2,87 -2,19
- СаОб/в + 2Н+ + 2с *—“Са1В+Н2О -1,90
Са(ОН)2,тв + 2с " Сатв + 2ОН -3,03
Cd Cd2++ 2е Cd^ Cd(CN)42' + 2е J- ** Cd™+4CN -0,40 -1,09
[Cd(NH3)4]2++ 2e CdrB + 4NH3 -0,61
Cd(OH)2.TB + 2c 1 * Cd,„+2OH -0,81
CdS.TB + 2c Cd,„ + S2 -1,17
Се Ce3' + 3e Cc -2,48
[Ce(OH)2]2+ + 2H++ e Ce3+ + 2H2O + 1,73
[Ce(OH)]3+ + H+ + e == Ce3+ + H2O + 1,71
[Cc(ClO4)6]2 + e Cc3+ + 6C1O4 + 1,70
[Ce(NO3)6]2’ + e '—M Ce3+ + 6NO3 +1,60
[Cc(SO4)3]2’ + e ' - Ce3+ + 3SO42’ + 1,44
С1 Cl2,r + 2e 2СГ + 1,35
С12,воДн + 2e 20 +1,39
C104 + 2H++2e 51 C1O3 + H2O + 1,19
CIO4 + H2O + 2e *—- CIO3 + 2OH" +0,36
2C1O4 + 16H+ + 14e Cl2>r + 8H2O + 1,39
C103 + 3H+ + 2c HC1O2 + H2O + 1,21
C1O3 + H2O + 2c C1O2’ + 2OH +0,33
- C1O2 + H2O + 2e " СЮ +2OH' +0,66
— 2НСЮ + 2H+ + 2e Cl2,r + H2O 2C1O + 2H2O + 2e С12л + 4ОЫ’ +1,63 +0,40
Со Co3+ + e Co2+ +1,81
146
Продолжение табл. 7
Элемент Уравнение полуреакции Е®, В
Со3ь + е Со2+ + 1,30
Со2+ + 2е Сотв -0,28
Со3О4зв + 8Н + 2е s ЗСо2+ + 4Н2О +2,11
Со2Оз,7В ~ь 6Н + 2е 55 2Со2+ + ЗН2О + 1,75
Со(ОН)2,1в + 2е Согп + 2ОН -0,73
[Co(NH3)6]3+ + е — [Co(NH3)6]2+ +0,1
СоО(ОН),та + Н2О + е “* Со(ОН)2,тв + ОН +0,17
Сг Сг3+ + е Сг2+ -0,41
Сг3+ + Зе —=* Сгтв -0,74
Сг2+ + 2с • Сгтв -0,91
Сг2О2 + 14Н++6е * 2Сг3+ + 7Н2О + 1,33
Сг2О22 + 12Н++6е 2СгОН2++ 5Н2О + 1,26
Сг2О72 + 10Н++6е 2Сг(ОН)2+ + ЗН2О + 1,14
Сг2О72 + 14Н+ + 12е 2Сгтв + 7Н2О +0,29
НСгО4 +7Н++Зе = • - Сг3+ + 4Н2О + 1,20
СгО42 + 4Н2О + Зе Сг(ОН)31ТВ + 5ОН” -0,13
НСгО4 + 6Н++Зе • • 55 СЮН2+ + ЗН2О + 1,28
СгО42 + 7Н++Зе - СгОН2+ + ЗН2О + 1,40
СгО42 ‘ + 6Н++ Зе ~ " Сг(ОН)2+ + 2Н2О + 1,28
СгО42 +4Н++Зе - " СгО2 + 2Н2О +0,95
СгО42 + 2Н++Зе ~ " СгО33” + Н2О +0,36
Си Си2+ + е -—- Си+ +0,16
Cu2+ + 2е Ситв +0,34
Си + е ' Ситв +0,52
НСиО, + ЗН++е — Си+ + 2Н2О +1,73
СиО22 + 4Н+ + е — Си+ + 2Н2О +2,51
НСиО2 + ЗН++2е Ситв + 2Н2О + 1,13
СиО22’ + 4Н++2е ' Ситв + 2Н2О + 1,52
2Си2++ Н2О + 2е — ' Си2Отв + 2Н+ +0,20
2НСиО2” + 4Н++2е Си2Отв + ЗН2О +1,78
2СиО22 + 6Н+ + 2е - '—* Си2Огв + ЗН2О +2,56
СиО + 2Н+ + с * Си+ + Н2О +0,62
Си2 + Вг + е ' СиВгтв +0,64
Си2+ + С1 + е СиС1тв +0,54
Си + I + е Си1тв +0,86
[Cu(NH3)4]2+ + е — [Cu(NH3)2]+ + 2NH3 -0,01
[Cu(NH3)2]++ е “ Ситв+ 2NH3 -0,12
[Cu(NH3)4]2++ 2е — Ситв+ 4NH3 -0,07
147
1
Продолжение табл. 7
Элемент Уравнение полуреакции E°, В
F F2,r + 2Н+ + 2е 2HF +2,81
F2,r + 2е -—- 2F" +2,87
F2O + 2Н++ 4е ' 55 2HF + H2O +2,12
F2O + 2H++4e 2F' + H2O +2,15
F2O + 2H++2e F2,r + H2O +1,44
Fe Fe3+ + e Fe2+ +0,77
Fe3++ Зе Fe™ -0,04
Fe2 + 2e ' FeTB -0,44
Fe(OH)2++ H++e Fe23 + H2O +0,91
Fe(OH)2+ + 2H+ + e - Fe2++ 2H2O +1,19
FeO42 + 8H++3e — - Fe3++ 4H2O +1,70
FeO? + 7H+ + 3e — Fe(OH)2+ + 3H2O + 1,65
FeO? + 6H++3e — Fe(OH)2+ + 2H2O +1,56
FeO42 +5H++3e HFcO2 + 2H2O + 1,00
HFeO2 + 3H++2e — Fere + 2H2O +0,49
[Fe(CN6)]3 + e [FefCNfi)]4" +0,36
Fe(C12H8N2)33+ + e — Fe(C|2H8N2)32+ +1,06
Н 2H++ 2e H2.r ±0,0000
2Н+(10'7m)+2e -—* H2.r -0,41
H2,r + 2c - 2H -2,25
2H2O + 2e H2 r + 2OH -0,83
H2O2 +2H++ 2c ' 2H2O +1,77
HO2" +H2O+ 2e ЗОН’ +0,88
Hg 2Hg2+ + 2e J > Hg2 2+ +0,91
Hg22+ + 2e 2Hg; +0,79
HgOTB + H2O + 2e “* Hg» + 2OH" +0,10
HgOTB + 2H++2e -— - Hg» + H2O +0,93
2Hg(OH)2 TB + 4H+ + 2e ’ 15 Hg22+ + 4H2O + 1,28
Hg2Cl2,TB + 2e “*• 2Hg)K + 2C1 +0,27
Hg2Br2la + 2e 2Hg» + 2Br +0,14
Hg2I2.TB + 2e ' 2Hg» + 21" -0,04
Hg2C2O4 TB + 2e 2Hg» + C2O42" +0,42
HgSjBMcpn + 2e Hg» + s2- -0,67
HgS ,тв,КраСн + 2e Hg» + s2 -0,70
[Hg(CN)4]2 + 2e Hg» + 4CN~ -0,37
I [I3] +2e 31 -0,536
12,водн ~b 2e _1 21 +0,621
3I2 + 2e == 2[I3]- +0,789
148
Продолжение табл. 7
Элемент Уравнение полуреакции Е®, В
': 1 Н51О6 + Н++2е ~ Ю3~ + ЗН2О ЩОЛл_ЗН4 + 2е - - 1О3_ + 2НгО^ HLQsi +_8К ±_6е__ЩО±4НгО 2НЮ52”+ 18Н+ + 14е 12.тв + ЮН2О +1,6 + 1,898 + 1,389 + 1,384
! । 1 1 ' । ! । I ! ЗШО?^ 271Г + 22е_—2. 11? 1 _+ ЦНз? Н1ОЛ+ 21Г_ + 8е X + 5НзО + н2о Ю4 + 2Н+ + 2е Юз’ + Н2О +1,357 _+]Д?8_2 +1,626 + 1,653
НЮ4 + 6Н+ + бе —* НЮ + ЗН2О + 1,290
Ю4 + 7Н+ + бе НЮ + ЗН2О + 1,235
— JHIO4+J4PT + _14е —~Z к.в_±.8Н2О ЗНЮ4_+ 21ЬЦ+_22е_~277_ |IJ2+ НЮ4 + 7Н+ + 8е Г + 4Н2О + 1,300 +1,276 +1,215
Юз’ + 6Н+ + 4е Г + ЗН2О +1,155
Ю3 + 4Н+ + 4е Ю + 2Н2О +0,972
2НЮ3 + ЮН+ + 10е 12 + 6Н2О + 1,169
— _ЗН1О^+15Н jL16e JLtiHjO HIO3 + 5Н+ + бе I + ЗН2О + 1,145 + 1,0777
2НЮ + 2Н+ + 2е = 12тв + 2Н2О + 1,354
210“ + 4Н+ + 2е 12тв + 2Н2О +2,005
ЗНЮ + ЗН+ + 4е [1зТ + ЗН2О +1,213
ЗЮ “ + 6Н+ + 4е [13]“ + ЗН2О + 1,701
ДО£ + 2FT + 2е " Г + Н2О 21С13дв + 6с 12дв + 6С1 + 1,313 +0,987 + 1,28
1С1ТВ + 2с " Iz.tb + 2С1 + 1,22
IC1 + 2е 12,тв + 2СГ + 1,19
2IBrDOAH + 2е 12,тв + 2Вг +1,02
2 я J 1 ! JC+_^.TT±_Kzb Li+ + е _ Ъ1гв W ' + 2с -2,925 Г -3,03 -2,37
Mg(OH)TK 4- 2с ’ MgTn + 2ОН -2,69
MgO,B.,H.ro + 2Н + 2е Mg-,в + Н2О -1,869
MgOTB,6/B + 2Н+ + 2е ' MgTB + Н2О -1,722
Мп Мп2+ + 2е Мптв MnIV + е Мп111 (3,5М H2SO4) -1,18 + 1,65
Мп111 + е Мп11 (3,5М H2SO4) +1,59
МпОд + е - МпО4 | +0,576
149
Продолжение табл. 7
Элемент Уравнение полуреакции CQ 0
МпО4 + 2Н2О + Зс MnO21B + 4ОН +0,588
МпО4 + 4Н+ + Зе — м nO2.a.T„ + 2Н2О + 1,695
МпО4 + 4Н + Зе ~ М п О 2,в,тн + 2Н2О + 1,679
МпО4” + 8Н+ + 4е — Мп3+ + 4Н2О +1,506
МпО4” + 8Н+ + 5е — Мп2+ + 4Н2О + 1,507
МпО42 + 4Н+ + 2е - МпО2,тв + 2Н2О +2,257
МпО42 + 5Н+ + 4е НМпО2 + 2Н2О + 1,234
МпО42- + 2Н2О + 2е *—- MnO2.TB + 4ОН +0,51
МпО2тв + 2Н2О + 2е Мп(ОН)2+2ОН -0,05
МпО2.т„ + 4Н+ + 2е - ~ Мп2++2Н2О + 1,23
МпО2тв + 4Н + е — Мп3++2Н2О +0,948
Мп(ОН)3тв + е - _ Мп(ОН)2тв+ ОН +0,1
Мп2+ + 2е - Мн, ГВ -1,18
Мп(ОН)2,„ + 2е Мп тв + 2ОН -1,55
НМпО2 + ЗН+ + 2е " Мптв + 2Н2О -0,163
N NO3 + 2Н+ + с NO2,r + Н2О +0,775
2NO3 + 4Н+ + 2е — N2O4,( + 2Н2О +0,80
NO3~ + ЗН+ + 2е hno2 + Н2О +0,94
NO3 + 2Н+ + 2е -— no2 + Н2О +0,835
NO3 + 4Н+ + Зс =-= ” NO2 + 2Н2О +0,96
NO2a + е “* NO2 +0,893
NO2.r + Н+ + е hno2 + 1,093
NO2iI + 2Н+ + 2е '—; NO,r + Н2О + 1,049
2NO2t + 6Н+ + бе — — N2O,r + ЗН2О +1,229
2NO2u + 8Нь + 8е — N2j_+ 4Н_2О + 1,363
NO2 + 2Н+ + е NOr + H2O +1,202
HNO2 + Н + е NO,r + H2O + 1,004
2NO2 + 6Н+ + 4е — n2o_, + 3H2O + 1,396
2HNO2 + 4Н+ + 4е — N2O,r + 3H2O + 1,297
2NO2' + 8Н+ + бе — N2j + 4H2O + 1,520
2HNO2 + 6Н+ + бе — N2,r + 4H2O _ + 1,454
NO2‘ + 7Н+ + бе NH3a + 2H2O +0,789
HNO2 + 7Н+ + бе ~ NHZ + 2H2O +0,864
N2r + 6H+ + 6e 55 2NH3r +0,057
N2.r + 2Н2О + 6Н+ + бе ’—- 2NH-H2O +0,092
N2t + 8Н+ + бе = 2NH4+ +0,275
Na Na+ + е * Na™ -2,713
Ni Ni2+ + 2е * NiTB -0,250
150
Продолжение табл. 7
Элемент Уравнение нолуреакции
NiO2,TB + 4Н+ + 2е — N12" + 2Н2О + 1,593
№О2>ТВ + 2Н2О + 2е ’ —- Ni(OH)2TB + 2ОЫ” +0,49
Ni2O3.1B + 6Н+ + 2с 2Ni2+ + ЗН2О + 1,753
Ni3O4,1B + 2Н2О + 2с 3HNiO2 + Н+ -0,718
Ni3O4iTB + 8Н+ + 2с ' 3Ni2+ + 4Н2О + 1,977
HNiO2 + ЗН+ + 2е - Ni1B + 2Н2О +0,648
[Ni(NH3)6)2+ + 2е NirB + 6NH3 -0,49
О О2л + 4Н + 4с 2Н2О + 1,229
О211 + 2Н2О + 4е 4ОН” +0,401
О3д + 2Н+ + 2е о2г + Н2О +2,076
О3,г + 6Н+ + бе ’ ЗН2О +1,501
О3г + Н2О + Зе О2.( + 2ОН + 1,24
О2_, + 2Н+ + 2е Н2О2 +0,69
Н2О2 + 2Н+ + 2е 2Н2О + 1,776
Р Ркр + ЗН 4- Зе РН3., -0,111
Рбел + ЗН+ + Зе РН3.,. -0,063
РО43 + ЗН+ + 2е -— ~ НРО32 + Н2О +0,121
НРО42 + 2Н+ + 2е -= НРОз2- + Н2О -0,234
Н2РО42 + Н+ + 2е — НРО32 +Н2О -0,447
Н2РО4- + 2Н+ + 2е -= - Н2РО32’ + Н2О -0,260
Н3РО4 + Н+ + 2е Н2РО3 + Н2О -0,329
Н3РО4 + 2Н+ + 2е — Н3РО3 + Н2О -0,276
РО43 + 8Н+ + 5е - Ркр + 4Н2О -0,128
РО43 + 8Н+ + 5е -= Р6сл + 4Н2О -0,156
НРО42 + 7Н+ + 5е — Рте + 4Н2О —0,288
НРО42 +7Н+ + 5е -= Рбел + 4Н2О -0,316
Н2РО4" + 6Н+ + 5е *= РкеЛ 4Н2О -0,358
Н2РО4 +6Н+ + 5е Рбел + 4Н2О -0,386
Н3РО4 + 5Н+ + 5е — Ркп + 4Н2О -0,383
Н3РО4 + 5Н+ + 5е — Рбел + 4Н2О -0,411
Н3РО3 + 2Н+ + 2е в Н3РО2 + Н2О -0,499
НРОз2- + 5Н+ + Зе -= Ркр + зн2о -0,298
НРО32’ + 5Н+ + Зе — Рбел + ЗН2О -0,346
Н2РО3’ + 4Н+ + Зе = Ркр + ЗН2О -0,419
Н2РО3 + 4Н+ + Зе ₽ Рбел + ЗН2О -0,467
Н3РО3 + ЗН+ + Зе — Ркр + ЗН2О -0,454
Н3РО3 + ЗН+ + Зе — Рбел + ЗН2О -0,502
Н4Р2О6 + 2Н+ + 2е = 2H3PO3 +0,38
151
Продолжение табл. 7
Элемент Уравнение полуреакции E°, В
* 2Н3РО4 + 2Н‘ + 2е_2 H4P2O6 + 2H2O -0,94
РЬ РЬ21 + 2е '—55 РЬТВ -0,126
РЬ4++ 2е * РЬ2+ + 1,694
PbO2,IB + 4Н +2е ' Pb2+ + 2H,O + 1,455
РЬО2.ТВ + 4Н+ + SO42- + 2e “* PbSO4lB + 2H2O +1,685
PbO2iTB + Н + 2е HPbO2 +0,621
ЗРЬО32- + 10Н+ + 4е ' Pb3O4.1B + 5H2O +2,515
РЬО32 + 4Н+ + 2е = PbOTB + 2H2O +2,001
РЬО32 + ЗН+ + е — HPbO2’ + H2O + 1,547
РЬО32 + 6Н+ + 2с — “ Pb2+ + 3H2O +2,375
РЬзСЦ.тв + Н2О + 2е 2PbOTB + 2OH” +0,249
РЬ3О4тв + 8Н + 2е ' 3Pb2+ + 3H2O +2,094
+0,390
РЬ3О4.1В + 2Н2О + 2е '—- 3HPbO2 + H+
РЬОТВ + 2Н+ + 2е PbTB + H2O +0,249
PbSO4.TB + 2е ' PbTB + SO42 -0,335
HPbOf + ЗН+ + 2е - PbrB + 2H2O +0,702
-1,507
РЬТВ + 2Н + 2е = РЬН2
Pt Pt2+ + 2е '—- Pt™ + 1,2
PtO2 тв + 2Н + 2е Pt(OH)2.TB + 1,1
Pt(OH)2tTB + 2е PtTB + 2OH ” +0,15
Pt(OH)2.rB + 2Н+ + 2е Р^гв + 2H2O +0,98
S SO42 + 4Н++ 2е -— H2SO3 + H2O +0,17
— SO42 + 4Н2О + 2е — SO42 + 8Н+ + бе '— " SO32 +2OH' STB + 4H2O -0,93 +0,357
HSO4 + 7Н+ + 6с — STB + 4H2O +0,339
SO42- + 8Н+ + 8е — S2 +4H2O +0,149
SO? + 9Н+ + 8с ’— HS + 4H2O +0,252
SO42 + 10Н+ + 8е — H2S, + 4H2O +0,303
HSO4 + 9Н+ + 8е — H2Sr + 4H2O +0,289
— _S2O82 + 2е * 2SO? S2O82’ + 2Н+ + 2е " * 2HSO4” +2,010_ +2,123
S4O62 + 2е ' 55 2S2O32 +0,219
— _S4O62 + 12Н++ 10е ” 4S1B + 6H2O S2Ofi2 + 2e 2SO32~ +0,416 +0,026
+0,451
SO2.r + 4H+ + 4e “ STB + 2H2O
H2SO3 + 4H+ + 4e — STB + 3H2O +0,449
2SO32” + 6РГ + 4c — S2O32’ + 3H2O +0,705
2HSO3~ + 4H+ + 4e - ~ S2O32 +3H2O +0,491
152
Ln
оо 3 сл 1—1 Sb Элемент
00 3 р NJ 1 + СР X + + to о If X 00 3 О го 1 + х to о 00 3_ + to CD 1 00 ? и 00 3_ < + о J If 00 3 й 00 3 < + ьо CD If оо 3_ и* cz> Tl Ох to + А CD If 00 а + Ох У 00 н^ • ф + 4^ я + + 4^ CD If 00 F я го 00 О + 00 X + + 00 CD If 00 X + СР X о I 00 6 W 1 + 40 X + + 2? CD If оо я ч + СР X N) О оо р to 1 + »—* о я + + 00 CD If 00 X “J + я to о 00 О ]ч> ш + 00 X + + 00 CD If 00 IF ч + to X to О X ьо сл р + 4^ X + + o’ If 00 н^ • сс + СР X го О X 00 О to 1 + Ln X + + со" If 00 а + я to о GO р to 1 + 04 X + + cd" If 00 н^ • to + СР X to О сл и- • р + 4^ X + + сг" If сл L*-' W + to X to о 00 Р* + СР X + + СР CD If 00 X ч 1 & О lm ч □3 + Ох X + + Ох CD If to 00 •F 0 + СР X to О 00 (О О ас + 4^ X + + 4^ CD If CZ) ст р ч + to X О X 00 О ю + СР X + + СР CD Г & И + ь-> X О оо О го 1 + X + + СР CD Г у + ЬР X to О ьэ 00 сг р w 1 + ох X + + г 00 сг to р □3 + СР X го о 00 О to + + b-> X + + bJ CD Г cz> О + X to о 00 p + X + + b-> CD r cz> О + + to X to О oo p 1 + CP X + + to CD fl If X 00 o-О го + X to о cz> p 1 + to X + to CD If cz> О to l + X N) О 00 О + + io X + + CP CD JI 1 00 O' w + X to о 00 cr to p 07 + Ox X + + 4^ CD If to 00 О + cz> °< + to CD If 00 or. Ln 2 X n 00 °< + to CD If 00 CT_ ox '2 X n 1 00 Lrt KJ + Ln X + + 00 CD If Ln X 00 уз + X + + Ох CD If 4L X 00 1 GO + СР X + + 4L CD 1 It я 00 G0 и 1 + to CD If to GO 1 00 bJ + to X + + to CD If bo X 00 cz> DC + to X + + to CD If X N> cz> 1 00 Й + X + + to CD lr НИ 00 1 GO to + to CD 1 GO rxj 00 О LU + Ox X + + Ox CD If 00 N) 1 + CP X N) О 4L X 00 О i + 00 X + + ox CD If cz> -Й. О O' tjj + Os X fxj о 4! о я z CD s CD О ia -o CD W 2 >4 s s
+ р СР 4^ л СР Ох + р о + р м i о to р ср СР 40 р ьо ох Ln р Ох X. i> оо о i ох СР Ь-> 1“ i Si Ln р 00 0\ 1 р сп о + р СЛ to + о Ох 4D Ь-> + р ь-> СР о + о 4^ Ох £ г5 + p to о + p о 4^ + Ox 00 + p CP U1 CP + p bJ 1—b bJ + p LCl 00 k—1 4^ Ox £ 00 00 + о о о СР + о о СР СР + о о О Ln bo 4L to 4D 00 ' + p 1—‘ 4D-to о Ox Ln О 4^ OX + b-> CP + p Ln OO я w
Продолжение табл. 7
Продолжение табл. 7
Элемент Уравнение полуреакции ©
SnO32 + 6Н+ + 2е -2Z _ Sn2++ ЗН2О +0,844
HSnOf + ЗН+ + 2е — SnTB + 2Н2О +0,333
SnTB + 4Н+ + 4с - SnH4.r -1,074
Sr Sr2+ + 2e SrTs -2,89
Zn Zn + + 2е ZnTB -0,763
ZnO22 + 4Н+ + 2е — Zrtb + 2H2O +0,441
HZnO2 + ЗН+ + 2е — ZnTB + 2H2O -0,054
ZnO22' + 2Н2О + 2е — ZnTB + 4OH -1,216
Zn(OH)2,TB + 2е - ZnTB + 2OH- -1,245
ZnSTB + 2е ZnTB + S2’ -1,40
[Zn(NH,)4]2+ + 2е '— ZnTB + 4NH3 -1,04
[Zn(CN)4J2+ + 2е '—= Zn„ + 4CN' -1,26
154
Таблица 8
КОМПЛЕКСЫ С НЕОРГАНИЧЕСКИМИ ЛИГАНДАМИ И ИХ КОНСТАНТЫ УСТОЙЧИВОСТИ (р)
Комплексный ион 01 1g 01 ! 02 1g 02 03 1g Рз 04 | 1g 04 fe 1g 05 fe 1g fe
Аммиачные
[Ag(NH3)2]+ 2,09-103 3,32 1,62-107 7,21 “Г
[Cd(NH,)4]2* 3,24-102 2,51 2,95-104 4,47 5,89-Ю5 5,77 3,63-ю6 6,56
|Co(NH3)6]2+ 97,7 1,99 3,16-Ю3 3,50 2,69-Ю4 4,43 1,18-Ю5 5,07 1,35-Ю30 5,13 2,45-Ю4 4,39
[Co(NH3)6]3+ 2,00-107 7,3 Г1,оо-Ю14 14 1,26-1020 '20,1 5,01-Ю25 25,7 6,31-Ю30 30,8 4,57-1033 33,66
ICu(NH3)2|+ 8,5110s 5,93 5,50-108 8,74
[Cu(NH3)4]2+ 9,77-103 3,99 2,14-Ю7 7,33 1,15-Ю10 10,06 1,07-1012 12,03
[Fe(NH3)4]2' 25,1 1,4 1,59-102 2,2 5,01-103 3,7
[Hg(NH3)4]2* 6,31-108 8,8 3,16-Ю17 17,5 3,16-Ю18 18,5 1,82-1019 19,26
[Ni(NH3)6]2+ 4,68-102 2,67 4,17-Ю4 4,62 2,51-Ю5 6,40 2,09-107 7,32 1,26-108 8,10 1,02-108 8,01
[Zn(NH3)4]2+ 1,51-102 2,18 2,69-104 4,43 5,50-106 6,74 2,51-Ю0 9,40
Бромидные
fAgBi-s]4 2,40-104 4,38 2,19-Ю7 7,34 7,08-Ю8 8,85 5,01-Ю8 8,70 2,00-109 9,30
[BiBr6]3 1,82-102 2,26 2,82-104 4,45 2,14-Ю6 6,33 6,61-1 о7 7,82 2,63-Ю9 9,42 5,01-10° 9,70
lCdBr4]2 1,70-102 2,23 Г 6,31-ю2 2,80 3,98-103 3,60 5,01-103 3,70
|HgBr4]2’ 1,12-10° 9,05 2,14-Ю17 17,33 5,50-Ю19 19,74 4,37-Ю21 21,64
[PbBr4]2’ 1,70-102 2,23 3,02-102 2,48 1,82-103 1 3,26 2,00-Ю3 3,30
[SnBr3T 5,37 0,73 Г 13,8 1,14 22,39 1,35
Г И Д p о к с о -
[Ag(OH)3]2‘ 2,00-102 2,30 1,00-1 о4 4,0 1,59-105 5,2
[А1(ОН)4] 1,10-109 9,04 1,00-1033 33,0
lBi(OH)4] 2,51-Ю12 12,4 6,31-1015 15,8 1,59-1035 35,2
[Cd(OH)4]2- 1,48-104 4,17 2,14-Ю8 8,33 1,05-10’ 9,02 3,98-Ю8 8,6
[Со(ОН)зГ 2,51-Ю4 4,4 3,98-104 4,6 3,16-Ю10 10,5
1Сг(ОН)4Г 1,26-1010 10,1 6,31-Ю17 17,8 7,94-1029 29,9
Продолжение табл. 8
Комплексный нон Pl lg Pl Рз lg Р2 Рз 1g Рз Р4 1g р4 Рз 1g Рз Рб 1g Рб
[Си(ОН)4]2' 1,00-ю7 7,0 4,79-1013 13,68 1,0-1017 17,0 3,16-Ю18 18,5
[Fc(OH)4]2' 3,63-id5- 5,56 5,89-109 9,77 4,68-109 9,67 3,63-1 о8 8,56 4
[Fe(OH)3] 7,41-IO11 11,87 l,48 1021 21,17 4,68 Ю30 30,67
[Hg(OH)3r 2,00-IO10 10,30 5,01-IO21 21,70 1,59 1 021 21,20 1
[Ni(OH)3]’ 9,33-104 4,97 3,55-108 8,55 2,14-10“ 11,33
[Pb(OH)3]’ 7,9410й 6,9 6,31-IO10 10,08 2,00-10“ 11,3
[Sb(OH)4]' 2,00-1024 24,3 5,01-1036 36,7 2,00-1038 38,3
[Sn(OH)3p 7,24-1041 11,86 4,37-1020 20,64 1,35-1025 25,13
[Zn(OH)4]2- 2,51-10^ 4,40 2,00-1011 11,30 1,38-Ю13 13,14 4,57-1014 14,64
[Zr(OH)4| 2,09-IO14 14,32 1,82-1028 28,26 8,131041 41,91 1,86-10” 55,27
Йодатные
[AgdOjfer 4,27 0,63 79,4 1,90
Й о д и д н ы e
[Agb]3' 3,80-106 6,58 5,50-10" 11,74 4,79-1013 13,68 1,00-1014 14,00
7,76-Ю2 2,89 8,91 -1014 14,95 6,31-Ю16 16,8 1,26-1019 19,1
[Cdl4]2- l,91-102 2,28 2,69-103 3,43 3,09-104 4,49 2,57-105 5,41
IHgU]2' 7,41-1012 12,87 6,61-IO23 23,82 3,98-1027 27,60 1,51-Ю30 30,18
[Pbl4]2- 18,2 1,26 1,41-103 3,15 8,32-103 3,92 2,95-104 4,47
Нитритные
[Ag(NO2)2]’ 75,9 1,88 6,76-102 2,83 —
[Cd(NO2)4]2' 63,1 1,80 1,02-103 3,01 6,46-103 3,81 1,26Ю3 3,1
[Cu(NO2)3r 18,2 1,26 36,3 1,56 14,45 1,16
Роданидные
[Ag(SCN)4]3~ 5,62-104 5,75 6,03-1 о9 9,78 ; 1,51-Ю11 11,18
[Bi(SCN)6f 14,1 1,15 83,18 1,92 5,50-102 2,74 2,51-lQ7- 3,40 . 1,70 104 4,23
[Co(SCN)4]2‘ 1,00-103 3,0 1,00-103 3,0 2,00-102 2,3 1,5910- 2,2
Продолжение табл. 8
LSI
Комплексный ион Pl 1g Pl Pi igP2 Рз >g Рз Р4 1g Рз Рз | 1g Рз р« 1g Рз
[Cr(SCN)6]-'- l,2010J 3,08 6,31-Ю4 4,80 6,31-Ю’ 5,8 1,26-Ю6 6,1 2,5110’ 1 5,4 6,31-ю’ 3,8
[Cu(SCN)6)y l,29-10'2 12,11 7,94-10° 9,90 1,2310'° 10,09 3,89-10° 1 9,59 1,86-10° 9,27
[Cu(SCN)4]2" 2,00-102 2,30 4,47-10’ 3,65 1,55-10’ 5,19 3,31-Ю6 6,52 | 1 J
fFe(SCN)6]J- 1,07-10’ 3,03 2,14-Ю4 4,33 3,27-Ю4 4,63 3,39-104 4,53 1,70-Ю4 1 4,23 1,70-10’ 3,23
[Hg(SCN)3r 1,51 Ю" 29,18 2,00-10’° 30,3 "1
lNi(SCN)3r 15,14 1,18 43,65 1,64 64,57 1,81
[Zn(SCN)4]2' 50,12 1,7 1,48-102 2,17 2,19-Ю2 2,34 1,02-102 2,01 1
5,03-1 О’ 3,7
Сульфитные
_[Ag(SO3).,r 3,98-10’ 5,60 4,79-10s 8,68 1,0-10у 9,00
[Cu(SO3)3]’ 7,08-10z 7,85 5,01-10* 8,70 2,29- 10у 9,36
fHg(SO.,)3J4- 1,18-Ю24 24,07 9,12-Ю74 24,96 1 1
Тиосульфатные
IAg(S2O3)3]’‘ 6,6110s 8,82 2,88-Ю1’ 13,46 1,41-Ю'4 14,15 1
[Cd(S2O3)3]4- 8,71-10’ 3,94 3,02-10° 6,48 1,59-108 8,20
lCu(S2d3)3f- 1,86-10'° 10,27 1,66-ю12 12,22 6,92-10” 13,84
- [Hfi(S2O3)4f 7,24-Ю” 29,86 1,82-10” 32,26 4,07-10” 33,61
(Pb(S2O3)4Jb’ 5,01-Ю2 2,7 I^-IO' 5,13 2,24-Юь 6,35 1,59-10' 77,20
[Zn(S26^T 1,95-102 2,29 3,89 104 4,59 4,0 0,6
Фосфатные
[AKH2PO4)3] I О’ 3 2,00-10’ 5,3 3,98-Ю' 7,6
fFe(H2PO4)4]- З,16-1О3 3,5 1,41-10° 9,15
Фторидные
[AgFl 2,29 0,36
[A1F6]5' 1,26-10' 7,10 9,55-10" 11,98 6,76-1бг’ 15,83 3,39-Ю” 18,53 1,59-102° 20,20 г 4,68-1020 20,67
[CrF3] 1,59-10*’ 5,20 3,47-10s 8,54 1,05-10" 11,02 Г
[FeFsF' 1,1-Ю6 6,04 5,50101и 10,74 5,5-10” 13,74 5,5-10” 15,74 1,261016- 16,10
Продолжение табл. 8
Ul 00
Комплексный ион Pl lg Pi Pl 1g Рг Рз 1g Рз Р-1 1g Рд Рз 1g Рз рб 1g Рз
Хлоридныс
[AgCUI3' 1,1O-IO3 3,04 1,74-Ю5 5,24 1,10-105 5,04 1,38-106 6,14
[BiCl6]3 2,69 102 2,43 5,01-Ю4 4,7 1,00-Ю5 5,0 3,98-Ю5 5,6 1,26-106 6,1 2,63-106 6,42
[CdCl4|2* 1.12-102 2,05 3,98-Ю2 2,60 2,51-Ю2 2,40 7,94102 2,90
[FeCb] 2,29 0,36 2,51 0,40 1 (
[FeCh] 28,18 1,45 1,26-102 2,10 12,6 1,10
IHgCU]2' 5.50-106 6,74 1,66-ID13 13,22 1,18-Ю14 14,07 1,66-1016 16,22
[PbCl4]2 41,70 1,62 2,75-102 2,44 1,10-Ю2 2,04 10,0 1,00
[SnCUJ2 32,4 1,51 1,74-102 2,24 1,07-102 2,03 30,20 1,48 :
[SnCkf 6,61 0,82
lSbCl6]3- 3,09-103 3,49 1,57-104 4,18 5,25-Ю4 4,72 5,25-104 4,72 1,29-Ю4 4,11
Цианидные
|Ag(CN)4]3 7,08-1019 19,85 3,55-1О20 20,55 2,63-Ю19 19,42
rCd(CN)4]2‘ 1,51-Ю5 5,18 3,98-109 9,60 8,32-1013 13,92 1,29-Ю17 17,11
[Co(CN)6]4- 1,23-1019 19,09
(Co(CN)6]3 1,0010м 64
[CiUCNM3" 1,00-Ю24 24,0 3,98-Ю28 28,6 2,00-1030 30,3
[Fe(CN)6]4' 1,00-Ю24 24,0
lFe(CN)6]3- 1,00-Ю31 31,0
[Hg(CN)4]2' 1,001018 18,00 5,01-1034 34,70 3,16-1038 38,53 3,24-1041 41,51
Таблица 9
КОМПЛЕКСЫ С ОРГАНИЧЕСКИМИ ЛИГАНДАМИ И ИХ КОНСТАНТЫ УСТОЙЧИВОСТИ (р)
Комплексный ион 1g Pi Pl 1g Pi Рз 1g Рз Р4 lg Р4 - Рз 1g Рз 1g Рб
Ацетатные (L - С Н 3 С О О) ‘
(AgL,]- 5,37 0,73 4,37 0,64 1
[CdL4]2' 20,0 1,30 l, 91-102 2,28 2,63-Ю2 2,42 1,0-102 2,00
[CoL2J 85,10 1,93
[CuL2] 1,74-Ю2 2,24 2,00-103 3,30
[FeL3r 1,59-Ю3 3,2 1,26-106 6,1 2,0-108 8,3
[HgL2] 2,62-108 8,43 —
[NiL2] 13,2 1,12 64,57 1,81
[PbL4]2‘ 3,31-Ю2 2,52 8,91-IO3 3,95 2,51 -106 6,40 3,16-108 Г 8,50 ’
Оксалатные (L -с2о„2 )
[AIL,]3' 2,0-Ю7 7,3 1,00-Ю15- 13,0 2,0-1016 16,3 ,ип
[CdL2?~ 1,00-Ю4 4,0 4,5710s 5,66
[C0L3]4- 5,01 Ю4 4,7 5,01-106 6,7 5,01-109 9,7
[CuL2]2- 5,01 Ю6 6,7 2,51-16’ 9,4
[Feb/ 5,01-Ю4 4,7 1,66-1 о5 5,22
fFeL3l3- 2,51-10’ 9,4 1,59-IO16 16,2 3,98-10” 19,6
lMgL2]2~ 3,55-102 2,55 2,40-104 4,38
[MnL,]2' 6,61-103 3,82 1,78-Ю5 5,25
[NiL3?' -2-105 -5,3 -3-Ю6 6,5 40й 44
[PbL2]2‘ 3,47-106 6,54
[ZnL3J4- 1,0-105 5,0 2,29-107 7,36 1,41-Ю8 8,15
Салицилатные (L - С 6 Н4(СОО)О2)
[CuL2]2" 3,98- Ю'° 10,6 2,82-1018 18,45
|FcL2]2 3,55-106 6,55 1,78-Ю1' 11.25
Продолжение табл. 9
160
Комплексный ион Pl lg Pi Р2 lg Р2 Рз 1g Рз Р4 lg Р4 Рз 1g Рз Рб 1g Рб
[FeL3l3- 3,02l016 16,48 1,44-1028 25,16 6,92-1036 36,84
INiUl2 8,91 IO6 6,95 5,62-10” 11,75 1
Сульфосалицилатныс (Ь-СбНзО(СОО)(5Оз)3‘)
[AIL3]6- 1,59-Ю13 13,20 6,76-1022 ' 22,83 7,76-1028 28,89
ICuL2]4- 3,31109 9,52 2,82-1016 16,45 1
[FeUJ4- 7,94-105 5,90 7,94-10’ 9,90
[Fem6' 1,05 Ю15 15,02 5,75-1025 25,76 3,98-Ю32 32,60
[MnL2]4- 1,74-105 5,24 1,74-108 8,24
Тартратные (Ь-(СНОН)2(СОО)22')
[AlLjp 3,98-Ю8 9,6
[BaL] 3,47-102 2,54
[BiL2]' 2,00-1011 11,3
[CaLj]2' 9,55-102 2,98 1,02-10’ 9,01
[CdL] 5,01102 2,7 1
fCoL] 6,31-Ю2 2,8
[CuL4F 1,00-Ю3 3,0 1,29-105 5,11 5,75-Ю5 5,76 1,59-Ю6 6,20
[FeL2]2 6,31-Ю4 4,8
IFeUK 3,09-107 7,49 7,94 10" 11,9
IMgL] 22,91 1,36
[MnLJ 7,94-102 2,9
[NiL2]2‘ 2,51-Ю5 5,4
[PbL] 6,03-103 3,78
[SrL] 38,90 1,59
IZnL] 1,20-102 2,08
Таблица 10
ВЫЧИСЛЕНИЕ РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКИХ ОПРЕДЕЛЕНИЙ
Определяемое вещество Фактор эквивалентности Молярная масса эквивалента, i/моль
1 2 3
1.Кислотно основные эитровапия
Ва(ОН)г j 1/2 85,67
Ва(ОН)2-8Н2О 1/2 157,73
НСООН (муравьиная) 1 46,026
СНзСООН (уксусная) 1 60,052
Н2С4Н4О4 (янтарная) 1/2 59,045
Н2С4Н4О6 (винная) 1/2 75,044
Н2С2О4 (щавелевая) 1/2 45,018
Н2С2О4-2Н2О 1/2 63,033
НС1 1 36,461
HNO3 1 63,0128
H2SO4 1/2 49,037
К2СО3 (с фенолфталеином) 1 138,206
К2СО3 (с метиловым оранжевым) 1/2 69,103
КНСОз 1 100,115
КОН 1 56,1056
NH3 1 17,0304
Na2B4O7- ЮН2О 1/2 190,68
Na2CO3 (с фенолфталеином) 1 105,989
Na2CO3 (с метиловым оранжевым) 1/2 52,9942
Na2C0310H20 1/2 143,070
NaHCO3 1 84,007
NaOH 1 39,9971
2. Методы окисления-восстановления
As2O3 1/4 49,4604
BaS2O3H2O 1 267,48
Се (NH4)4(SO4)4-2H2O 1 632,53
Ce(SO4)2-4H2O 1 404,30
Fe(Fe3+'- Fc2t) 1 55,847
Fe(NH4)2(SO4)2-6H2O 1 392,13
FeSO4 1 Г 151,90
FeSO4-7H2O 1 278,01
H2C2O4 (щавелевая) 1/2 45,018
H2C2O42H2O 1/2 63,033
H2O2 1/2 17,0073
161
Продолжение табл. 10
1 2 3
H2S (иодометрически) 1/2 17,04
12 1/2 126,9045
IC1 1/2 81,1785
КВгО3 1/6 27,833
КС1О3 1/6 20,425
К2СгО4 1/3 64,730
К2Сг2О7 1/6 49,031
K3Fc(CN)6 1 329,25
K4Fe(CN)6 1 368,35
K4Fe(CN)6-3H2O 1 422,40
KIO3 1/6 35,6668
КМпО4 1/5 31,6068
kno2 1/2 42,552
NaAsO2 1/2 69,955
Na2HAsO3 1/2 84,954
Na2C2O4 1/2 67,000
NaNO2 1/2 34,4977
Na2S (S2‘ ->S°) 1/2 39,02
Na2SO3 1/2 63,02
Na2S2O3 1 158,10
Na2S2O3 5H2O 1 248,18
Аскорбиновая кислота 1/2 88,063
Резорцин (броматометрически) 1/6 18,35
Стрептоцид (броматометрически) 1/4 43,05
Стрептоцид (нитритометрически) 1 172,21
Сульфаминовая кислота 1 97,09
Сульфаниловая кислота 1 209,24
Фенол (броматометрически) 1/6 15,69
3. Методы осаждения и комплексообразования
AgNO3 1 169,873
НВг 1 80,912
HCN (по Мору, Фольгарду, Фаянсу) 1 27,026
НС1 1 36,461
HI 1 127,9124
HNCS (по Фольгарду) 1 59,09
Hg(NO3)2-H2O 1/2 171,31
Hg2(NO3)2-2H2O 1/2 280,61
KBr 1 119,002
KCN (по Мору, Фольгарду, Фаянсу) 1 65,116
КС1 1 74,551
К2СгО4 1 97,095
162
Продолжение табл. 10
1 2 3
KNCS 1 97 J 8
KI 1 166,0027
NH4C1 1 53,491
NH4NCS 1 76,12
NaBr 1 102,894
NaCl 1 58,443
Nal 1 149,8942
4. Методы титрования ЭДТА (этилендиамиптетраацетатом натрия, комплексоном III, трилоном Б)
ВаС12 1 208,24
Ba(NO3)2 1 261,34
Bi(NO3)3 1 394,995
BiONO3-H2O 1 305,000
СаСОз 1 100,09
СаС12 1 110,99
СаС12-6Н2О 1 219,08
Ca(NO3)2 1 164,09
СаО 1 56,08
CuSO4 1 159,60
_Hg(NO3)2 1 324,60
MgCl2 1 95,211
Mg(NO3)2 1 148,314
MgSO4 1 120,36
Na2H2C10H12O8N2 (ЭДТА) 1 336,209
Na2H2C,0H,2O8N2-2H2O (ЭДТА - дигидрат) 1 372,239
Zn 1 65,38
ZnCl2 1 136,29
Zn(NO3)2 1 189,39
Zn(NO3)2-6H2O 1 297,48
ZnO 1 81,38
ZnSO4 1 161,44
ZnSO47H2O 1 287,54
163
Таблица 11
ХАРАКТЕРИСТИКИ КИСЛОТНО-ОСНОВНЫХ ИНДИКАТОРОВ
Название индикатора Интервал pH перехода окраски в воде Изменение окраски
Метиловый фиолетовый (1-й переход) 0,13-0,5 желтая - зеленая
Метиловый зеленый 0,1-2,0 желтая - зеленая
Метиловый фиолетовый (2-й переход) 1,0-1,5 1,2-2,8 зеленая - синяя
Тимоловый синий (1-й переход) красная - желтая
Тропеолин 00 1,4-3,2 красная — желтая
Метиловый фиолеговый (3-й псре-ход) 2,0-3,0 синяя - фиолетовая
р-Динитрофенол 2,4-4,0 бесцветная — желтая
а-Динитрофенол 2,8-4,4 бесцветная - желтая
Метиловый оранжевый 3,0-4,4 красная - желтая
Бромфеноловый синий 3,0-4,6 желтая - синяя
Конго красный 3,0-5,2 сине-фиолетовая -красная
Ализариновый красный S (1-й переход) 3,7-5,2 желтая - фиолетовая
у-Динитрофенол 4,0-5,4 бесцветная - желтая
Метиловый красный 4,4-6,2 красная - желтая
к-Нитрофенол 5,6-7,6 бесцветная - желтая
Бромтимоловый синий 6,0-7,6 желтая - синяя
Нейтральный красный Тропеолин ООО 6,8-8,0 красная - желтая
7,6-9,0 коричнево-желтая -малиново-красная
Тимоловый синий (2-й переход) 8,0-9,6 желтая — синяя
Фенолфталеин 8,2-10,0 бесцветная - красная
Тимолфталеин 9,4-10,5 бесцветная - синяя
Тропеолин 0 11,0-13,0 желтая - оранжево-коричневая
Индигокармин 11,6-14,0 синяя - желтая
1, 3, 5-Тринитробснзол 12,2-14,0 бесцветная -оранжевая
164
Таблица 12
ХАРАКТЕРИСТИКИ АДСОРБЦИОННЫХ ИНДИКАТОРОВ
Название Определяемые ионы Титрант Изменение окраски
Ализариновый красный (ализаринсульфокислота) [Fc(CN)6]4' SCN' Pb2+ Ag+ желтая - розовокрасная
Бромфениловый синий (тетрабромфенолсульфоф-талеин) Tl+ Hg2+ SCN Г, Cl Br' Г cr Ag+ Ag+ Hg22+ желтая - зеленая сиреневая — желтая фиолетовая - сине-зеленая
Дифенил карбазид CN СГ, Br' Ag+ Hg22+ желто-зеленая — синс-зслсная бесцветная — фиолетовая
Дифенилкарбазон СГ, Г, CN СГ Bf, Г SCN + (N + + + ox) ox) ox) I < < < красная - фиолетовая желтая - зеленая розовая - синяя
2,7-Дихлорфлуоресцеин cr, Br; г Ag+ желто-зеленая -розово-красная
Родамин 6Ж (этиловый эфир диэтиламино-о-карбоксифенил-ксантенил-хлорида) Br' Ag+ желто-красная — фиолетовая
Конго красный (Дифенил-бис-( 1 -амино-2-нафтилазо- 4-сульфокислота) СГ, Bf, г Ag+ красно-синяя
Флуоресцеин (резорцин-фталеин) cr, Bf, Г, SCN' Ag+ желто-зеленая -розовая
Эозин (тетрабромо (R) флуоресцеин) Г, Br Ag+ оранжевая - краснофиолетовая
Эритрозин (дииодо (R) флуоресцеин) Г MoO4' Ag+ Pb2+ оранжевая — темнокрасная
165
166
ХАРАКТЕРИСТИКИ МЕТАЛЛОХРОМНЫХ ИНДИКАТОРОВ
Таблица 13
Название индикатора Рациональное название индикатора Рекомендуется для определения элементов Интервал перехода окраски, pH Изменение окраски
комплекс с элементом индикатор
Ализарин (ализариновый красный, сульфоализарин) 1,2-диоксиантрахинон-З-суль-фокислота Th Sc Y 2,3-3,4 2 5 розовая красная розовая желтая зеленая желтая
Арсеназо I (уранон) 2-(о-арсенофенилазо)-1,8-диок-синафталин-3,6-дисульфокисло- та U (IV), Th (IV) Са, Mg 1,7-3,0 10 синяя фиолетовая розовая краснооранжевая
Арсеназо III 1,8-диоксинафталин-3,6-дисуль-фокислота-2,7-бис-(-азо-1 )-2-фениларсоновая кислота U, Th, Zn сильно кислая сине-зеленая красная
Бром-пирогалловый красный 3 3" -дибромсульфогаллеин Bi Pb Cd, Ni (II) Mg, Mn 2-3 5-6 9,3 10 винно-красная синяя синяя синяя оранжевожелтая красная красная фиолетовая
Г лицинкрезоловы й красный 3,3' -бис- (А-карбоксиметил аминометил )-о-крезолсульфо-фталеин (натриевая соль) Cu (II) 5-6 красная желтая
Глицинтимоловы й синий 3,3' -ди- (А-карбоксиме-тил)аминомстил-тимолсульфо-фталеин (натриевая соль) Cu (II) 5-5,5 синяя желтая или зеленовато-желтая
Дитизон 2-Фснилгидразин-фенилазотио-муравьиная кислота Pb, Zn, Cd Bi 4,7-5,4 2,5-5,0 красная красная сине-зслсная сине-зслсная
Продолжение табл. 13
167
Название индикатора Рациональное название индикатора Рекомендуется для определения элементов Интервал перехода окраски, pH Изменение окраски
комплекс с элементом индикатор
Крезолфталсксон 3,3'-бис-(/У, /V-дикарбоксиме-тил)амипометил-о-крезолфта-леип (натриевая соль) Са, Ba, Sr 10-11 пурпуровая розовая
Ксиленовый оранжевый 3,3'-бис-(М /V-дикарбоксиме-тил)аминометил тимолсульфофталеин Bi, Fe (III) Th Pb, Zn, Cd Hg (II), Co Mn, Mg, Ca 1-2 2,5-3,5 5-6 10 красно-фиолетовая красно-фиолетовая краснофиолетовая фиолетовая желтая желтая желтая серая
Метилтимоловый синий 3,3'-6hc-(/V, W-дикарбокси-метил )аминометил тимолсульфо-фталсин (натриевая соль) Pb, Cd, Mn, Zn Hg (II), La, Sc Pb, Zn, Cd, Mg, Cu, Ca, Ba, Sr 5-6,5 11,5-12,5 синяя синяя желтая серая или серо-желтая
Морин 2 3,4’, 5,7-пентаоксифлавон Ga, Tn 4,5-6 зеленая флуоресц. флуоресц. гасится
Мурексид 5,5'-нитрилодипурпуровая кислота, аммонийная соль Mn (II), Ni (II) Co (II), Zn, Cd Ca 9-10 >12 от желтой до красной от желтой до красной фиолетовая фиолетовая
Нафтоловый фиолетовый 4-(4-нитрофенилазо) -2-бис-(карбоксиметил) аминометил-1-нафтол Bi Си (П), Zn, Cd, Co (II), Mg, Mn (II) 1-2 10-11 краснофиолетовая краснофиолетовая краснооранжевая синяя
Продолжение табл. 13
Название индикатора Рациональное название индикатора Рекомендуется для определения элементов Интервал перехода окраски, pH Изменение окраски
комплекс с элементом индикатор
ПАН 1 -(2-пиридилазо)-2-нафтол Си (II), Zn, Cd Ni (II) Си (II) Bi 5-7 4 <2,5 1-3 розово-красная розово-красная розово-красная розово-красная желтая желтая желтая желтая
ПАР 4-(2-пиридилазо)-резорцин Bi, T1 (III) Al, Hg (II) 1-2 3 6-11 оранжевая или красная зелено-желтая
Прокатехиновый фиолетовый 3,3', 4'-триоксифуксин-2"-суль-фоновая кислота Bi, Th, Ga Sn, Pb Fe, Си (II) Zn, Mg,Cd,Co(II) Мп (II) Ni (II), 2-3 4,5-5,5 5,5-6,5 9-11 синяя синяя синяя синяя желтая желтая желтая краснофиолетовая
Пирогалловый красный Пирогаллол-сульфофталеин Bi Pb Ni (П), Co (II) 2-3 5-6 9 красная фиолетовая синяя оранжево-желтая красная красная
Салициловая кислота о-оксибензойная кислота Fe (III) 1,8-3 фиолетовая желтая
Тимол фталсин-комплексон 3,3-бис-(М А-дикарбокси-ме-тил)-аминометилфталеин (натриевая соль) Ca, Ba, Sr Ag, Мп (II) 10-11 синяя б/цв.
Продолжение табл. 13
169
Название индикатора Рациональное название индикатора Рекомендуется для определения элементов Интервал перехода окраски, pH Изменение окраски
комплекс с элементом индикатор
Тирон 1,2-диоксибензол-3,5-ди-сульфокислота (натриевая соль) Fe (III), Ti (IV) 2-3 синяя желтая
Флуорексон (флуорссцеин-комплексон, кальцеин) бис-(А, А-дикарбоксиметил)-аминометил-флуорссцеин (натриевая соль) Са, Ba, Sr Cu (II), Мп (II) >10 10-11 желто-зеленая флуоресц. красная или красно-фиолетов. флуоресц. гасит.; р-р розов, желто-зеленая флуоресц.
Хром азу рол S 3"-сульфо-2", 6"-дихлор-3, 3'-димстил-4-оксифуксон-5, 5'-дикарбоновая кислота Fe (III), Th, Zr Al, Ce, La Cu (II) Ni (II) Ca, Mg 2-3 4-5 6-6,5 7,5 10-11 краснофиолетовая или фиолетовосиняя желтая, оранжевая или желто-зеленая
Эриохром цианин R 2"-сульфо-3, 3'-диметил-4-ок-сифуксон-5, 5'-дикарбоновая кислота Zr Th, Fe (III) Al Mg, Cu (II) Ca 1,4 2-3 5-6 10 11,5 розовая пурпурная фиолетовая желтая оранжевая желтая
Эриохром черный - Т 1 -(1 -окси-2-нафтилазо-6-нит-ро-2-нафтол-4-сульфокислота (натриевая соль) лантаниды Pb, Zn, Mg Ca, Ba, Мп (II) Fe(III), Cd,Hg(II) 8-9 8-10 винно-красная синяя
СПАДНС 2-(4-сульфофенилазо)-1,8-ди-оксинафталин-3,6-дисульфокислота Zr Th 1,5-2,5 2,5-3,5 пурпурнорозовая сине-фиолетовая желтая пурпурно-красная
Таблица 14
ХАРАКТЕРИСТИКИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ИНДИКАТОРОВ
Название индикатора Eoh,IPM рН = 0 Изменение окраски
окисл. восст.
Сафранин-Т 0,24 красная бесцвсгная
11сйтральпый красный 0,24 красная синяя бесцветная
Индигомоносульфоновая кислота 0,26 бесцветная
Индиготсграсульфоновая кислота 0,37 синяя бесцветная
Метиленовая синяя 0,53 зеленовато-голубая синяя бесцветная
2-6- Дихлорфснолиндо-фснол 0,64 бесцветная
2-6- Дибромбензолиндо-фепол 0,67 синяя бесцветная
Дифениламин (дифенил-бензидин) 0,76 фиолетовая бесцветная
Дифениламинсульфоно-вая кислота N-фенилантраниловая кислота 0,85 1,08 краснофиолетовая фиолетово- красная бесцветная бесцветная
1,10-Фенаптролин-Ре (11)-комплекс 1,06 бледно-голубая красная
Нитро-о-фенантролин- Fe (П)-комплекс 1,25 бледно-голубая фиолетовокрасная
170