Author: Врублевский А.И.
Tags: химия химические науки подготовка к экзаменам
ISBN: 978-985-507-250-9
Year: 2007
Text
А. И. Врублевский
УДК 54(075.3)
ББК 24я721
В83
Врублевский, А. И.
В83 Химия. 6000 новых тестов для старшеклассников и
абитуриентов / А. И. Врублевский. — 2-е изд., перераб. —
Минск: Юнипресс, 2007. — 976 с.
ISBN 978-985-507-250-9.
Книга содержит примерно 6000 разноуровневых тестовых воп-
росов с ответами по всем разделам базового школьного курса хи-
мии. В книге в максимальной степени учтены требования, предъяв-
ляемые к знаниям абитуриентов при сдаче тестирования по химии.
Рекомендуется педагогам и учащимся средних общеобразователь-
ных школ, лицеев, гимназий, специализированных классов, слушате-
лям подготовительных отделений и курсов. Неоценимую помощь кни-
га окажет тем, кто самостоятельно готовится к сдаче конкурсных ис-
1 пятаний и тестирования по химии.
УДК 54(075.3)
ББК 24я721
© Врублевский А. И.. 2007
ISBN 978-985-507-250-9 © Оформление. ЧУП «Изд-во Юнипресс», 2007
ОТ АВТОРА
В настоящее время основной формой сдачи вступительных ис-
пытаний в вузы по химии является тестирование, которое в широ-
ких масштабах проводится с 2004 года. В связи с этим резко возрос
и продолжает расти спрос на литературу соответствующего про-
филя. особенно на сборники тестов.
За последние годы в системе базового школьного химического
образования произошли существенные изменения. Во-первых резко
повысился статус тестирования, которое вышло на уровень общего-
сударственного централизованного мероприятия. Во-вторых, прспо-
дование химии в школе целиком базируется на учебниках, написан-
ных отечественными авторами.
Таким образом, к настоящему времени назрела насущная необхо-
димость в пособии, которое, с одной стороны, опиралось бы на мате-
риалы новых школьных учебников, а с другой стороны, удовлетворяло
требованиям, предъявляемым к тестам по химии на централизован-
ном тестировании, этот уровень достаточно высок и пока нс достиг-
нут имеющимися в продаже учебно-методическими пособиями.
Как раз такое фундаментальное пособие Вы, читатель, и держите
в руках. При се написании автор стремился:
— сохранить все то положительное, что выдержало испытание
временем и оправдало себя в пособиях 11 - 5] .
— учесть все те изменения, которые произошли в школьном хи-
мическом образовании за последние годы:
— максимально обобщить свой педагогический опыт препода-
вания химии абитуриентам;
— учесть опыт проведения тестирования по химии.
Книга включает примерно 6000 тестовых вопросов по всем те-
мам школьного базового курса химии. Каждое Тестовое задание со-
стоит из десяти вопросов. На каждый тестовый вопрос предлагаются
четыре ответа, из которых правильными могут быть один наиболее
общий, два или три (но не четыре!). По мнению ведущих специалис-
тов в области тестовых технологии [6], такая методика является наи-
более прогрессивной для тестов данного типа, так как она сводит к
минимуму вероятность простого угадывания правильного ответа. В
каждой теме тестовые вопросы расположены в порядке постепенно-
го усложнения. В книге использована традиционная для русскоязыч-
ной литературы номенклатура неорганических соединений.
В расчетах следует использовать округленные до целого числа зна-
чения относительных атомных масс элементов, однако А(С1) = 35,5.
Постоянная Авогадро NA = 6,02 102’ моль атомная единица массы
а.е.м. = 1,66 10 24 г = 1,66 10 27 кг. Разрешается поль юваться табли-
цей элементов Д. И. Менделеева, таблицей растворимости, электро-
химическим рядом напряжений металлов, но нс таблицей электро-
отрицательности атомов элементов.
На все тестовые вопросы в конце пособия даны правильные отве-
ты, что позволяет адресовать книгу нс только опытным педагогам,
но и всем, кто желает самостоятельно проверить свои знания и под-
готовиться к тестированию по химии.
Любой сборник тестов по химии, тем более такой объемный, нс
свободен от недостатков, поэтому' автор с благодарностью примет
все доброжелательные замечания, способствующие улучшению ка-
чества данной книги.
4
ТЕОРЕТИЧЕСКИЕ
ОСНОВЫ ХИМИИ
ТЕМА 1
Вещество. Вещества простые и сложные.
Физические и химические явления.
Закон сохранения массы.
Физические и химические свойства веществ.
Смеси
ТЕСТ1
1. Укажите название химического вещества:
1) снежинка; 2) лед; 3) вода; 4) снег.
2. Химическим веществом можно назвать:
1) катион водорода; 2) атом водорода;
3) молекулу водорода; 4) порцию водорода массой 5 г.
3. Названия соответственно физического тела и хи-
мического вещества приведены под номером:
1) пробирка и спиртовка; 2) медь и алюминий;
3) колба и железо; 4) вода и туман.
4. Два простых и одно сложное вещества перечисле-
ны в ряду:
1) озон, белый фосфор, фуллерен;
2) ромбическая сера, алмаз, пирит;
3) графит, карборунд, силан;
4) моноклинная сера, магнетит, киноварь.
5
5. Чистым веществом, а не смесью можно считать:
1) соляную кислоту; 2) дистиллированную воду;
3) молоко; 4) одеколон.
6. О химических свойствах воды говорится в утвер-
ждениях:
1) вода — бесцветная жидкость (20°С, нормальное
давление);
2) при смешивании воды с натрием выделяется газ;
3) при нормальном давлении вода закипает при тем-
пературе 100°С;
4) под действием постоянного электрического тока
вода разлагается на кислород и водород.
7. Укажите химические явления:
1) растворение кислорода в воде;
2) возгонка сухого льда;
3) сгорание дров в камине;
4) плавление чугуна в конверторе.
8. Соответственно однородной и неоднородной сме-
сью будут:
1) бензин и водопроводная вода;
2) столовый уксус и шоколад;
3) молоко и минеральная вода;
4) сладкий чай и томатный сок.
9. Однородную смесь можно получить при смешивании:
1) подсолнечного масла и воды;
2) уксусной эссенции и воды;
3) речного песка и сахара;
4) сахара и воды.
10. Укажите природные химические явления:
1) высыхание луж после дождя;
2) лесной пожар;
3) фотосинтез в растениях;
4) синтез полиэтилена.
— 6 —
ТЕСТ 2
1. Химические явления наблюдаются при:
1) грозовых разрядах;
2) смешивании формальдегида и воды;
3) нагревании смеси железных опилок и серы;
4) фильтровании томатного сока.
2. Из одного химического вещества состоит физичес-
кое тело:
1) автомобиль; 2) телевизор;
3) мельхиоровая ложка; 4) медная проволока.
3. Растворением в воде можно очистить:
1) железные опилки от примеси древесных опилок;
2) медные опилки от примеси железных опилок;
3) натрий от примеси калия;
4) хлорид натрия от примеси нитрата калия.
4. Магнит можно использовать для разделения на от-
дельные компоненты смесь, состоящую из:
1) серы и красного фосфора;
2) железных и древесных опилок;
3) речного песка и питьевой соды;
4) поваренной соли и сахара.
5. В воде размешали глину. Разделить полученную
неоднородную смесь на отдельные компоненты (воду и
глину) можно:
1) фильтрованием на бумажном фильтре; 2) дистил-
ляцией; 3) отстаиванием; 4) с помощью магнита.
6. Фильтрование на бумажном фильтре можно исполь-
зовать для разделения на отдельные компоненты смесь,
состоящую из:
1) воды и уксуса; 2) мела и воды;
3) бензина и воды; 4) воды и сахара.
7
7. С помощью воды и фильтрования можно разделить
на отдельные компоненты смесь:
1) поваренной соли и сахара;
2) сахара и древесных опилок;
3) поваренной соли и муки;
4) гексана и гептана.
8. О протекании химического явления обязательно
свидетельствует:
I) выделение энергии;
2)появление запаха;
3) образование новых веществ;
4) изменение агрегатного состояния вещества.
9. Появлением запаха сопровождаются химические
явления, протекающие вследствие:
1) растворения сульфида калия в соляной кислоте;
2) пропускания углекислого газа в известковую воду;
3) грозовых разрядов;
4) растворения питьевой соды в серной кислоте.
10. Образованием осадка сопровождаются химичес-
кие явления, протекающие в результате:
I) смешивания водных растворов КОН и НС1;
2) пропускания СО, в водный раствор Ва(ОН),;
3) растворения SO, в Н,О;
4) смешивания водных растворов Na,SO4 и ВаС1,.
ТЕСТЗ
1. Изменением окраски сопровождаются химические
явления, протекающие при:
1) ржавлении железа;
2) смешивании водных растворов Na3PO4 и AgNO3;
3) растворении кусочка натрия в воде;
8
4) нейтрализации серной кислоты водным раствором
гидроксида натрия в присутствии лакмуса.
2. С помощью нагревания и последующего охлаждения
можно полностью разделить на отдельные компоненты:
1) жидкую смесь азота и кислорода;
2) твердую смесь Li и Cs;
3) раствор сахара в воде;
4) твердую смесь карбоната кальция и поваренной соли.
3. Укажите названия химических веществ:
I) дым; 2) озон; 3) туман; 4) нитрат калия.
4. В каких случаях говорится о химическом явлении?
1) при кипячении воды наблюдается выделение газа;
2) при нагревании нитрата калия образуется кислород;
3) при открывании флакона с духами в помещении
распространяется запах;
4) с наступлением осени листья на деревьях желтеют.
5. Химические явления наблюдаются при:
1) дистилляции смеси воды и спирта;
2) фильтровании смеси воды и мела;
3) нагревании смеси карбоната кальция и питьевой соды;
4) взрыве смеси водорода и кислорода.
6. Другое сложное вещество, но с тем же качественным
и количественным составом образуется в результате:
1) нагревания карбоната кальция;
2) изомеризации бутана в изобутан;
3) нагревания нитрата меди (II);
4) превращения кислорода в озон.
7. Укажите химические свойства кислорода:
1) бесцветный газ (25 °C, нормальное давление);
2) плохо растворим в воде;
3) соединяясь с металлами, образует оксиды;
4) в кислороде сгорают метан и другие углеводороды.
9
8. Справедливыми будут утверждения:
1) из одного сложного вещества можно получить не-
сколько простых веществ;
2) из нескольких простых веществ НЕЛЬЗЯ получить
одно сложное вещество;
3) из одного сложного вещества можно получить одно
новое сложное вещество;
4) из одного сложного вещества можно получить но-
вые простое и сложное вещества.
9. К химическим относятся явления:
1) образование инея на траве во время утренних за-
морозков;
2) образование пузырьков газа на стенках сосуда при
стоянии газированной воды в теплом помещении;
3) образование накипи на стенках чайника при дли-
тельном кипячении воды;
4) поседение волос.
10. Укажите схемы процессов, отражающие химичес-
кие реакции:
1) СО,.. СО2) Zn + Fe2+ -> Zn2+ + Fe;
3) НО ч Н,О, ; 4) пентен-1 пентен-2.
7 2 (г) 2 (ж)’ 7
ТЕСТ 4
1. Укажите четвертое «лишнее» в перечне:
1) лед; 2) снежинка; 3) айсберг; 4) дым.
2. Отметьте химические вещества:
1) углекислый газ; 2) стакан; 3) крахмал; 4) сосулька.
3. Физические тела — это:
1) гвоздь; 2) железо; 3) алюминий; 4) ложка.
4. Содержание примесей максимально в воде:
1) морской; 2) речной;
3) дождевой; 4) дистиллированной.
— 10 —
5. Выберите четвертое «лишнее» в перечне:
1) кислород; 2) азот; 3) туман; 4) углекислый газ
6. Для разделения смеси водород — водяной пар может
быть использовано различие компонентов смеси в:*
1) размере молекул,
2) магнитных свойствах,
3) температуре кипения,
4) окраске.
7. Метан содержит примеси водяного пара, от кото-
рого освобождаются охлаждением смеси Этот способ
основан на различии метана и водяного пара в.
1) теплопроводности;
2) температуре кипения;
3) плотности;
4) размерах молекул.
8. Разделение смесей путем их фильтрования можно
проводить:
1) и на космической станции, и на Земле;
2) на космической станции, но не на Земле;
3) ни на космической станции, ни на Земле;
4) на Земле, но не на космической станции.
9. Физическим и химическим явлениями соответ-
ственно будут:
1) испарение бензина и горение бензина;
2) растворение сахара и морской прилив;
3) образование глюкозы в растениях и дыхание растений;
4) свечение электролампочки и скисание молока
10. При некотором воздействии на вещество выде-
лился газ. Это явление:
1) обязательно физическое;
2) обязательно химическое,
3) может быть как химическим, так и физическим,
4) не является ни физическим, ни химическим
* Учтите существование молекулярных сит.
11
8. Справедливыми будут утверждения:
1) из одного сложного вещества можно получить не-
сколько простых веществ;
2) из нескольких простых веществ НЕЛЬЗЯ получить
одно сложное вещество;
3) из одного сложного вещества можно получить одно
новое сложное вещество;
4) из одного сложного вещества можно получить но-
вые простое и сложное вещества.
9. К химическим относятся явления:
1) образование инея на траве во время утренних за-
морозков;
2) образование пузырьков газа на стенках сосуда при
стоянии газированной воды в теплом помещении;
3) образование накипи на стенках чайника при дли-
тельном кипячении воды;
4) поседение волос.
10. Укажите схемы процессов, отражающие химичес-
кие реакции:
1) СОад СО2(г); 2) Zn + Fe2+ -> Zn2+ + Fe;
3)НО , —» FLO, ’ 4) пентен-1 пентен-2.
' 2 (г) 2 (ж)’ '
ТЕСТ 4
1. Укажите четвертое «лишнее» в перечне:
1) лед; 2) снежинка; 3) айсберг; 4) дым.
2. Отметьте химические вещества:
1) углекислый газ; 2) стакан; 3) крахмал; 4) сосулька.
3. Физические тела — это:
1) гвоздь; 2) железо; 3) алюминий; 4) ложка.
4. Содержание примесей максимально в воде:
1) морской; 2) речной;
3) дождевой; 4) дистиллированной.
— 10 —
5. Выберите четвертое «лишнее» в перечне:
1) кислород; 2) азот; 3) туман; 4) углекислый газ
6. Для разделения смеси водород — водяной пар может
быть использовано различие компонентов смеси в:*
1) размере молекул,
2) магнитных свойствах;
3) температуре кипения;
4) окраске.
7. Метан содержит примеси водяного пара, от кото-
рого освобождаются охлаждением смеси. Этот способ
основан на различии метана и водяного пара в:
1) теплопроводности,
2) температуре кипения;
3) плотности;
4) размерах молекул.
8. Разделение смесей путем их фильтрования можно
проводить:
1) и на космической станции, и на Земле;
2) на космической станции, но не на Земле;
3) ни на космической станции, ни на Земле;
4) на Земле, но не на космической станции.
9. Физическим и химическим явлениями соответ-
ственно будут:
1) испарение бензина и горение бензина,
2) растворение сахара и морской прилив,
3) образование глюкозы в растениях и дыхание растений;
4) свечение электролампочки и скисание молока.
10. При некотором воздействии на вещество выде-
лился газ. Это явление:
1) обязательно физическое;
2) обязательно химическое;
3) может быть как химическим, так и физическим;
4) не является ни физическим, ни химическим.
* Учтите существование молекулярных сит
11
ТЕСТ 5
1. При некотором воздействии на вещество выдели-
лась теплота. Это явление:
1) обязательно химическое;
2) обязательно физическое;
3) не является ни химическим, ни физическим;
4) может быть как химическим, так и физическим.
2. Пероксид водорода Н7О7 — сложное вещество, так
как его молекула состоит из:
1) двух атомов водорода и молекулы кислорода;
2) атомов разных химических элементов;
3) молекул разных веществ — водорода и кислорода;
4) четырех атомов.
3. Правильными являются утверждения:
1) хлор — простое вещество;
2) молекула хлора желто-зеленого цвета;
3) молекула хлора состоит из двух атомов;
4) при н. у.* молекула хлора находится в газообраз-
ном агрегатном состоянии.
4. Укажите схемы химических реакций:
1) 2‘«Ро -» 2£РЬ + «Не;
2) Н707 -> Н7О + 07;
3) О; -э О3; ’
4) н2с = СП - сн7 - сн3 -> сн3 - сн = сн - сн3.
5. В ходе химической реакции разрушаются:
1) атомы, но не молекулы;
2) молекулы, но не атомы;
3) и атомы, и молекулы;
4) ядра атомов.
* н. у. — нормальные условия
12
6. Среди перечисленных свойств оксида серы (IV)
выберите химические:
1) тяжелее воздуха (н. у.);
2) растворяется в воде с образованием сернистой кис-
лоты;
3) при температуре -10°С сжижается в прозрачную
жидкость;
4) может быть как окислителем, так и восстановителем.
7. При испарении некоторой порции воды НЕ изме-
няются ее:
1) масса;
2) качественный состав;
3) химическое количество;
4)объем.
8. В результате протекания любой химической реак-
ции НЕ изменяются:
1) общее число молекул;
2) общее химическое количество веществ;
3) масса (в пределах точности измерения);
4) общее химическое количество атомов.
9. Смесями (а не индивидуальными веществами) все-
гда являются:
1) соляная кислота; 2) воздух;
3) фосфорная кислота; 4) морская вода.
10. Сложными веществами являются все:
1) органические вещества;
2) аллотропные модификации;
3) кристаллогидраты;
4) фуллерены.
13
ТЕМА 2
Атом. Химический элемент. Аллотропия.
Химические формулы. Химические уравнения.
Закон постоянства состава. Молекула. Ион.
Вещества молекулярного
и немолекулярного строения.
Относительные атомная и молекулярная масса
ТЕСТ1
1. Для понятия «атом» справедливы утверждения:
1) в химических реакциях может изменяться состав ядра;
2) в химических реакциях состав ядра не изменяется;
3) в большинстве случаев состоит из протонов, нейт-
ронов и электронов;
4) в химических реакциях может отдавать или при-
нимать электроны.
2. Укажите единицы масс атомов и молекул:
1) а.е.м; 2) г; 3) кг; 4) моль.
3. Выберите правильные записи:
1) Ar (Н) = 1 г/моль; 2) Аг (О) = 16;
3) т[ (Na) = 23 г; 4) m'a (F) = 3,15 • 10 26 кг.
4. Под химическим элементом следует понимать:
1) вид атомов с одинаковой массой;
2) вид атомных частиц с одинаковым положительным
зарядом ядра;
3) мельчайшую химически неделимую частицу вещества;
4) электронейтральную частицу, состоящую из про-
тонов, нейтронов и электронов.
5. Укажите справедливые утверждения для молекулы:
14
1) носитель химических свойств вещества;
2) имеет тот же качественный состав, что и вещество,
состоящее из данных молекул;
3) в химических реакциях может сохраняться;
4) в химических реакциях всегда разрушается.
6. Для относительной атомной массы элемента спра-
ведливы утверждения:
1) величина безразмерная;
2) приведена в периодической системе;
3) учитывает наличие изотопов элемента;
4) показывает, во сколько раз масса (средняя масса)
атома элемента больше массы нуклида '-С.
7. Для молекул Н,0 и Н,О2 одинаковым (одинаковой)
будет:
1) количественный состав; 2) качественный состав;
3) цвет; 4) масса.
8. Укажите правильные утверждения. В состав моле-
кулы воды входят:
1) два атома Н и один атом О;
2) молекула Н2 и один атом О;
3) атомы Н и О в массовом отношении соответствен-
но 1:8;
4) атомы разных химических элементов.
9. Как молекула, так и вещество характеризуются:
1) качественным составом;
2) теплопроводностью;
3) агрегатным состоянием;
4) химическими свойствами.
10. Вещество обладает, а молекула — нет такими свой-
ствами (характеристиками), как:
1) масса; 2) электрическая проводимость;
3) окраска; 4) растворимость.
15
ТЕСТ 2
1. Укажите правильные записи:
l)Mr(H,) = 2; 2)m (F)=19u;
3) Mr (F,) = 38 г/моль; 4) Mr (H,SO4) = 98 г.
2. Укажите число элементов, входящих в состав пе-
речисленных веществ — силан, фуллерен, карборунд,
графит:
1)4; 2)3; 3)2; 4) 1.
3. О химическом элементе (а не о простом веществе)
водород речь идет в утверждениях:
1) самый распространенный во Вселенной;
2) не имеет запаха;
3) входит в состав всех кислот*;
4) в воде массовая доля равна 11,1%.
4. Отметьте утверждения, в которых говорится о про-
стом веществе (а не о химическом элементе) кислород:
1) входит в состав всех оксидов;
2) участвует в процессе дыхания растений и животных;
3) плохо растворим в воде;
4) имеет несколько изотопов.
5. Как простое вещество, так и химический элемент
отражает запись:
1) О,; 2) О2; 3) Си; 4) 2НГ
6. Химический элемент характеризуется:
1) распространенностью в природе;
2) массовой долей атомов в веществе;
3) принадлежностью к определенному типу семейств
(5-,р-, J-,/-);
4) температурой плавления.
* Кислоты понимаются по определению С. Аррениуса.
--- 16 ----
7. Простое вещество характеризуется:
1) валентностью;
2) способностью к намагничиванию;
3) зарядом ядра;
4) растворимостью.
8. Как атом, так и простое вещество характеризуются:
1) размерами;
2) массой;
3) электроотрицательностью;
4) валентными возможностями.
9. Зная химическую формулу вещества, можно:
1) рассчитать массовые доли атомов элементов;
2) найти относительную молекулярную (формульную)
массу;
3) определить среднюю массу молекулы вещества;
4) предсказать растворимость любого вещества в воде.
10. Две молекулы кислорода показывает запись:
1)20; 2) О2; 3) 2О2; 4) |ОГ
ТЕСТЗ
1. Укажите правильную запись для химического ве-
щества:
1) А (К) = 39 г/моль; 2)Аг(Не)=4;
3)М(О2) = 32; 4) М( Н,) = 2 г/моль.
2. Между собой молекулы кислорода и водорода раз-
личаются:
I) массой;
2) температурой плавления;
3) качественным составом;
4) числом атомов.
17
3. Для молекул азота и водорода одинаковы (одинакова):
1) электрическая проводимость;
2) количественный состав;
3) окраска;
4) размеры.
4. Укажите справедливые утверждения:
1) если элемент представлен одним нуклидом, то его
относительная атомная масса численно равна массе ато-
ма (в а. е. м.);
2) если элемент представлен несколькими нуклида-
ми, то его относительная атомная масса численно равна
массе (в а е. м.) самого тяжелого нуклида;
3) если элемент представлен несколькими нуклида-
ми, то его относительная атомная масса рассчитывается
с учетом мольного содержания нуклидов,
4) для любого химического элемента относительная атом-
ная масса всегда численно равна массе атома (в а. е. м ).
5. Укажите формулы аллотропных модификаций кис-
лорода:
1)О2; 2) ,б8О;3)О3; 4) О2
6. Атом водорода и молекула водорода отличаются
между собой:
1) массой; 2) числом протонов;
3) температурой плавления; 4) размерами
7. Два атома водорода, входящие в состав молекулы,
отражают записи:
1) 2Н; 2) Н,О, 3) Н,; 4) 1Ц),
8. НЕЛЬЗЯ составить определенную химическую фор-
мулу для:
1) веществ немолекулярного строения,
2)воздуха,
3) нестехиометрических соединений;
4) чугуна.
18
9. Два свободных (химически не связанных) атома во-
дорода отражает запись:
1) 2Н,; 2) 2Н; 3) Н2; 4) Н2О.
10. Простым веществам, а не химическим элементам
отвечают формулы:
1)Си; 2) О,;3)Н,О; 4)РД.
ТЕСТ 4
1. Молекулярное строение (н. у.) имеют:
1) вода; 2) хлорид натрия; 3) алмаз; 4) аммиак.
2. О формульных единицах, а не о молекулах (н. у)
следует говорить в случае:
1) оксида кремния (IV); 2) метана;
3) кислорода; 4) сульфата натрия.
3. Укажите справедливые утверждения. Аллотропные
модификации элемента:
1) всегда имеют одинаковый качественный состав;
2) могут отличаться числом атомов в молекуле;
3) имеют одинаковые физические свойства;
4) могут различаться химическими свойствами.
4. Укажите справедливые утверждения. Простых веществ:
1) меньше, чем химических элементов;
2) жидких меньше, чем газообразных (н. у);
3) среди неметаллов больше, чем среди металлов;
4) твердых больше, чем газообразных (н. у.).
5. Массу, равную 1,494 • 10~26 кг, имеет атом элемента
(все элементы представлены одним нуклидом):
l)Na; 2)F;3)Cs; 4) Be.
6. Для молекулы справедливы утверждения:
1) может состоять как из двух, так и очень большого
числа атомов;
19
2) имеет все те же физические Свойства, что и соот-
ветствующее вещество;
3) молекула сложного вещества состоит из молекул
различных простых веществ;
4) молекула простого вещества состоит из атомов од-
ного вида.
7. Укажите правильные выражения:
1) атом калия;
2) молекула хлорида натрия (н. у.);
3) формульная единица воды;
4) молекула углекислого газа.
8. НЕВЕРНЫ выражения:
1) формульная единица гидроксида калия (н. у.);
2) молекула карбоната кальция;
3) хлорид-ион;
4) молекула воздуха.
9. Из перечисленных свойств — электрическая про-
водимость, окраска, распространенность в природе, мас-
совая доля в веществе, валентность, температура плав-
ления — простое вещество характеризуют:
1) шесть свойств; 2) пять свойств;
3) четыре свойства; 4) три свойства.
10. Укажите верные выражения:
1) атом воды; 2) атом брома;
3) ион аммония; 4) атом алмаза.
ТЕСТ 5
1. Молекулярное строение (н. у.) имеют все вещества ряда:
1) иод, вода, оксид кремния (IV);
2) метан, аммиак, гидроксид калия;
3) кислород, хлороводород, сульфат натрия;
4) водород, белый фосфор, озон.
20
2. Немолекулярным строением (н. у.) характеризуют-
ся все вещества ряда:
1) алмаз, графит, фуллерен;
2) оксид кремния (IV), медь, оксид калия;
3) черный фосфор, ромбическая сера, нитрат натрия;
4) глюкоза, гелий, кремний.
3. Как изменились бы по сравнению с приведенны-
ми в периодической системе относительные атомные
массы элементов, если бы за единицу атомной массы
приняли 1/16 часть массы нуклида 16О?
1) практически не изменились;
2) возросли в 16/12 = 4/3 раза;
3) уменьшились в 16/12 = 4/3 раза;
4) возросли на 16 - 12 = 4 единицы.
4. Эталоном единицы атомной массы является вели-
чина, равная:
1) ш (*Н); 2) та (12С); 3) (1/12) m (12С); 4) 1/Яд.
5. Примерно во сколько раз масса атома цезия боль-
ше массы атома натрия?
1) 5,78; 2) 5,00; 3) 12,09; 4) 2,39.
6. Относительная молекулярная масса какого вещества
равна относительной атомной массе элемента неона?
1) воды; 2) фтороводорода; 3) аммиака; 4) метана.
7. Средняя масса иона РО43" приблизительно равна:
1) 95 и; 2) 98 и; 3) 1,577 • 10~22 г; 4) 1,627 10 22 г.
8. Химическое уравнение можно составить для про-
цессов:
1) получение кислорода из жидкого воздуха;
2) горение серы в кислороде;
3) перегонка нефти;
4) растворение карбоната кальция в соляной кислоте.
21
9. При сгорании вещества в кислороде образуются
углекислый газ, вода и натрий. В состав вещества НЕ
обязательно входит элемент, символ которого:
1) С; 2) Na; 3) Н; 4) О.
10. К характеристикам (свойствам) химического эле-
мента НЕ относятся:
1) относительная атомная масса;
2) относительная молекулярная масса;
3) химический знак;
4) запах.
ТЕСТ 6
1. Укажите сумму всех стехиометрических коэффици-
ентов в уравнении реакции, схема которой Р + Оэ —> Р,О5:
1)2; 2) 4; 3) 5; 4) 11.
2. Отметьте характеристики (характеристику) хими-
ческого элемента:
1) металл или неметалл;
2) имеет химическую формулу;
3) обладает определенной молярной массой;
4) может находиться в твердом, жидком или газооб-
разном агрегатных состояниях.
3. При записи химического уравнения обязательны-
ми являются условия:
1) сохранение общего числа молекул (формульных
единиц);
2) равенство общего числа атомов;
3) неизменность природы атомов;
4) равенство суммарного химического количества ве-
щества.
22
4. Способ получения НЕ влияет на количественный
состав и свойства:
1) аммиака; 2) сульфида железа (II);
3) воды; 4) оксида титана (II).
5. Нестехиометрическими являются вещества:
1) карбид железа; 2) углекислый газ;
3) нитрид ванадия; 4) оксид фосфора (V).
6. Уравнение химической реакции N + 3H,(r) 2NH3(r)
позволяет судить о:
1) мольном отношении реагентов и продуктов;
2) объемном отношении реагентов и продуктов;
3) выходе продукта;
4) степени превращения азота.
7. Отметьте название сложного вещества молекуляр-
ного строения, которое при температуре 20°С и нормаль-
ном давлении находится в твердом агрегатном состоянии:
1) иод; 2) вода; 3) хлорид натрия; 4) сахароза.
8. Укажите название сложного вещества молекулярного
строения, которое при температуре 20°С и нормальном
давлении находится в газообразном агрегатном состоянии:
1) оксид кремния (IV); 2) вода; 3) аммиак; 4) кислород.
9. Выберите название простого вещества немолекуляр-
ного строения, которое при температуре 20°С и нормаль-
ном давлении находится в жидком агрегатном состоянии:
1) бром; 2) ртуть; 3) аммиак; 4) водород.
10. Для веществ молекулярного строения характерны
физические свойства:
1) высокая твердость;
2) сравнительно низкие температуры плавления;
3) высокая электрическая проводимость;
4) летучесть.
23
ТЕСТ 7
1. В порции соединения цезия с кислородом массой
15,08 г содержится 1,505 1023 атомов кислорода. Ука-
жите формулу вещества:
1) CsO3; 2) CsO7; 3) Cs^O; 4) CsO.
2. В соединении рубидия с кислородом масса ато-
мов рубидия равна 1,275 г, а число атомов кислорода —
1,806 1022. Формула соединения:
1) RbO3; 2) RbO; 3) Rb?O; 4) RbO,.
3. Для соединения, молярная масса которого 222 г/моль,
находили массовую долю (%) атомов серы. Укажите но-
мер правильного результата анализа:
1) 25,83; 2) 26,83; 3) 27,83; 4) 28,83.
4. Эмпирическая (простейшая) формула совпадает с
молекулярной для:
1) ацетилена; 2) этана;
3) оксида углерода (IV); 4) пероксида водорода.
5. Эмпирическая (простейшая) формула НЕ совпада-
ет с молекулярной для:
1) бензола; 2) аммиака; 3) воды; 4) этилена.
6. Масса порции газа объемом 2,0 дм3 (н. у.) такая же,
как и порции водорода объемом 44 дм3 (н. у.). Укажите
формулу газа:
1) СН4; 2) С2Н6; 3) C3Hg; 4) С4Н,0.
7. Одинаковое число атомов кислорода содержит оди-
наковые массы веществ, формулы которых:
1) H,SO4 и Си(ОН)э; 2) Н3РО4 и H,SO4;
3) Н3РО3 и Р2О3; 4) H2SO4 и Na2SO4.
8. Равные массы H,SO4 и Н3РО4 имеют одинаковое:
1) общее число атомов; 2) число молекул;
3) химическое количество; 4) число атомов кислорода.
24
9. В атомах, входящих в состав формульной единицы
карбида кальция, содержится столько же электронов, как
и в атоме:
1)серы; 2) германия;
3) олова; 4) кремния.
10. В природе химические элементы могут находиться:
1) только в составе простых веществ;
2) только в составе сложных веществ;
3) только в виде свободных атомов;
4) как в виде свободных атомов, так и в составе про-
стых и сложных веществ.
ТЕСТ 8
1. Выберите правильные выражения для расчета мас-
сы молекулы ты:
1)т =ш/п; 2)жы=Мг-и;
3)/и =M/N.; 4)/и =М • N..
2. Каково отношение соответственно чисел атомов О и
Н в веществе, формула которого Fe4 (РОД (ОН)3 • 12 Н,О?
1)1 : 1; 2) 27: 24; 3)9: 1; 4) 12:24.
3. Молярную массу вещества всегда можно опреде-
лить, если известна(ы) только его:
1) плотность (для газов);
2) масса молекулы;
3) простейшая (эмпирическая) формула;
4) формульная единица.
4. В сплаве углерода и железа на три атома железа при-
ходится один атом углерода. Укажите массовую долю (%)
железа в сплаве:
1) 6,67; 2) 93,33; 3) 75,00; 4) 25,00.
25
5. В результате превращения в кислород озонирован-
ного кислорода в закрытом сосуде давление в результате
реакции:
1) увеличится;
2) уменьшится;
3) не изменится,
4) может как увеличиться, так и уменьшиться
6. Укажите правильные выражения:
1) молекула дыма;
2) молекула оксида углерода (II);
3) атом углерода,
4) формульная единица аммиака.
7. Отметьте правильные выражения или соотношения:
1) относительная молекулярная масса сульфата натрия
равна 142;
2) относительная формульная масса гидроксида на-
трия равна 40;
3)Mr(HF) = A(Ne);
4)M(HF)= | А (Са).
8. Укажите число атомов в порции белого фосфора Р4
массой 6,2 г:
1)3,01 1022; 2) 6,02 • 1022; 3)4,816- 1023; 4)1,204 10”
9. Для одинаковых по объему (н. у) порций кислорода
и озона, находящихся при одинаковых условиях, равны:
1) масса; 2) общее число электронов в атомах;
3) число атомов; 4) число молекул.
10. Порция жидкой воды (нормальное давление) объе-
мом 18 см3 содержит:
1) 6,02 • 1023 молекул;
2) 4,837 • 1020 молекул;
3) 1,806 1024 атомов О и Н в сумме;
26
ТЕСТ 9
1. Во сколько раз масса атома натрия больше массы — и?
1)23,0; 2) 92,0; 3)5,75; 4) 46,0.
2. Сколько а. е. м. содержится в 1 г?
1) 6,02 1023; 2) 6,02 1024; 3) 1; 4) 1000.
3. Продуктами сгорания вещества в хлоре являются
азот, хлороводород и хлорид серы (II). В состав веще-
ства не обязательно входит элемент:
1) Н; 2)N; 3) S; 4) Cl.
4. Нагрели смесь, состоящую из равных масс алюми-
ния и серы. Полученный порошок после завершения
реакции представляет собой:
1) только A1,S3;
2) A1,S3 с примесью серы;
3) A1,S3 с примесью алюминия;
4) A1,S3 с примесью серы и алюминия.
5. Одинаковый качественный состав имеют вещества:
1) оксид углерода (IV) и оксид кремния (IV);
2) вода и пероксид водорода;
3) белый фосфор и черный фосфор;
4) силикагель и силан.
6. По химической формуле вещества можно установить:
1) качественный состав вещества;
2) температуру плавления вещества;
3) массовые доли атомов элементов в веществе;
4) изотопный состав элементов.
7. В некотором веществе, молекула которого содержит
два атома серы, массовая доля атомов серы равна 2%.
Укажите молярную массу (г/моль) вещества:
1)320; 2) 160; 3) 1600; 4) 3200.
8. Молярная масса вещества, в состав которого вхо-
дят атомы фосфора, равна 448 г/моль. Укажите число
27
атомов фосфора в молекуле вещества, если массовая доля
атомов фосфора в веществе равна 13,84%:
1)4; 2)3; 3)2; 4) 1.
9. В соединении H,S,O мольная доля атомов О рав-
на 63,64% Укажите значение х:
1)2; 2)3; 3)6; 4)7.
10. Для двух порций озона и кислорода N(Q,) = N(On).
Справедливыми будут соотношения.
1) N (О) в О, = N (О) в О,; 2) m (О.) = m (OJ;
3)V(O,) = V(O:); ’ 4) n (О?) = n (OJ.
ТЕМА 3
Моль. Молярная масса. Закон Авогадро.
Молярная концентрация газа
ТЕСТ1
1. Укажите соответственно единицу молярной массы
и единицу молярного объема:
1) г; дм3; 2) г/моль; дмУмоль;
3) дм’/моль; г; 4) г/моль; а. е. м
2. Единица химического количества — это.
1) г/моль; 2) дм3/моль;
3) моль; 4) а. е м.
3. Можно сказать, что моль — это.
1) масса одной молекулы,
2) масса 6,02 • 1023 молекул;
3) отношение массы вещества к его химическому ко-
личеству,
— 28 —
4) химическое количество вещества, содержащее
6,02 1023 его структурных единиц.
4. Молярная масса вещества (в г/моль) численно рав-
на массе (в г):
1) одной молекулы вещества;
2) 6,02 1023 структурных единиц вещества;
3) газа объемом 22,4 дм3 (нормальные условия);
4) одного моля вещества.
5. Для постоянной Авогадро справедливы утверждения:
1) безразмерная величина;
2) единица измерения моль ';
3) численно равна числу молекул в порции F, мас-
сой 38 г;
4) численно равна числу молекул в одном моле вещества.
б.Укажите справедливые математические выражения:
1) М(В) = т(В) / п(В); 2) N (В) = п (В) Vm;
3) п (В) = N(B) / Na; 4) V(B)=[m(B)/n (В)] Vm.
7. Укажите наиболее общее утверждение. Один моль
вещества содержит 6,02 1О23... вещества:
1) атомов;
2) молекул;
3) формульных единиц;
4) элементарных структурных единиц.
8. Масса вещества (в г) химическим количеством 1
моль численно равна:
1) массе одной молекулы вещества (в а. е. м.);
2) относительной молекулярной массе;
3) постоянной Авогадро;
4) молярной массе вещества (в г/моль).
9. Укажите правильные математические выражения:
1) М (Н,) = 1 г/моль; 2) М (F) = 19 г/моль;
3) М (В) = тм (В) • Na; 4) Mr (С1,) = 2 А (С1).
29
10. При температуре 25°С и нормальном давлении
одинаковый объем имеют порции веществ химическим
количеством 2 моль:
1)кислород; 2)иод;
3) аммиак; 4) вода.
ТЕСТ 2
1. Наибольший объем при температуре 20°С и нор-
мальном давлении занимает порция вещества химичес-
ким количеством один моль:
1) водород; 2) иод; 3) ртуть; 4) вода.
2. При одинаковых массах и внешних условиях наи-
больший объем занимает газ:
I) озон; 2) азот; 3) кислород; 4) углекислый газ.
3. При одинаковых массах и внешних условиях ( t =
= 25°С;/? = 101 кПа) наименьший объем занимает 1 моль:
1) аммиака; 2) брома; 3) метана; 4) хлора.
4. Наибольшее число атомов содержит 1 моль:
1) метана; 2) углекислого газа;
3) аммиака; 4) озона.
5. При одинаковых массах наибольшее число атомов
содержи! порция:
I) озона; 2) кислорода; 3) метана; 4) аммиака.
6. При одинаковых массах одинаковое число атомов
содержат порции:
1) азота и водорода; 2) кислорода и озона;
3) метана и аммиака; 4) углекислого газа и пропана.
7. При одинаковых объемах и внешних условиях (t =
= 4°С; /9=101 кПа) наибольшее число молекул содержит
порция:
1) озона; 2) кислорода; 3) воды; 4) аммиака.
30
8. При одинаковых объемах и внешних условиях (t =
= 25°С; /2=101 кПа) наибольшую массу имеет порция:
1) водорода; 2) воды; 3) метана; 4) аммиака.
9. В сосудах одинакового объема молярные концент-
рации О, и СН4 будут равны, если:
1) т (О,) = т (СН4); 2) т (О,) = 2m (СН4);
3) т (СН4) = 2т (О,); 4) N (OJ = 2N (СН4).
10. Методом вытеснения воды НЕЛЬЗЯ собирать газы:
1) аммиак; 2) кислород; 3) хлороводород; 4) водород.
ТЕСТЗ
1. Укажите молярную концентрацию (моль/дм3) Н,
массой 3 г, помещенного в сосуд объемом 5 дм3:
1)0,1; 2) 0,2; 3)0,3; 4) 0,4.
2. Один моль воды (t = 4°С,/2 =101 кПа) содержится в
ее порции объемом:
1) 22,4 дм3; 2) 0,18 дм3; 3) 36 дм3; 4) 18 см3.
3. Наибольшее число молекул (t = 25°С; р = 101 кПа)
содержится в порции*:
1) азота химическим количеством 3 моль;
2) углекислого газа массой 440 г;
3) воды объемом 36 см3;
4) озона объемом 400 дм3.
4. В реакции синтеза аммиака из простых веществ
объем азота относится к объему водорода как:
1) 1 : 1;2) 1 :2; 3) 1 : 3; 4) 1:4.
5. Плотность (н. у.) какого газа равна 1,964 г/дм3?
1) метана; 2) кислорода;
3) озона; 4) углекислого газа.
* Молярный объем газа при +25 °C считайте равным
22,4 дм3/моль.
31
6. Относительная плотность по гелию равна 12 для газа:
1) оксида углерода (II); 2) оксида углерода (IV);
3) озона; 4) кислорода.
7. Относительная плотность газа по гелию равна 4.
Чему равна относительная плотность газа по водороду?
1)2; 2) 8; 3) 16; 4) 32.
8. Один моль содержат порции веществ:
1) 22,4 дм3 жидкой воды;
2) 22,4 дм3 кислорода (н. у.);
3) 48 г озона;
4) 233 г сульфата бария.
9. Выберите правильные утверждения. При одинако-
вых условиях в порциях кислорода и озона равного объе-
ма содержится:
1) одинаковое число атомов;
2) одинаковое число молекул;
3) одинаковая масса;
4) разная масса.
10. Выберите правильные утверждения. При одинако-
вых условиях порции озона и кислорода равной массы:
1) содержат одинаковое число атомов;
2) содержат одинаковое число молекул;
3) занимают равный объем;
4) содержат одинаковое суммарное число протонов в
атомах.
ТЕСТ 4
1. Укажите справедливые утверждения:
1) в порции любого газа объемом 22,4 дм3 при н. у.
заключен 1 моль вещества;
2) 6,02' • 1О23 молекул любого газа при н. у. занимают
объем, равный 22,4 дм3;
32
3) равные химические количества различных газов
при н. у. всегда имеют объем, равный 22,4 дм3;
4) в равных объемах различных газов при н. у. всегда
содержится одинаковое число атомов.
2. Какие из перечисленных газов в воздухе поднима-
ются вверх?
1) неон; 2) аммиак; 3) углекислый газ; 4) метан.
3. Плотность простейшего летучего водородного со-
единения некоторого элемента такая же, как и у кисло-
рода. Назовите элемент:
1) углерод; 2) кремний; 3) хлор; 4) азот.
4. Одинаковое число молекул содержат порции веществ:
1) 2 г N, и 2 г О2;
2) 1 моль О, и 1 моль О3;
3)1 дм3 Н2 и 1 дм3 Н,0 (t = 25°С; р = 101 кПа);
4) 2 моль О, и 56 г N,.
5. Плотность некоторого газа такая же, как и у молеку-
лярного азота. Укажите формулу газа:
1) СО,; 2) СО; 3) О,; 3) О3.
6. Даны порции хлороводорода, азота, ацетилена, эти-
лена и кремния, каждая массой 28 г. Укажите число ве-
ществ, содержащих одинаковое химическое количество:
1)2; 2)3; 3)4; 4)5.
7. Понятие «моль» применимо, а понятие «молеку-
ла» — нет для веществ (н. у):
I) черный фосфор; 2) оксид углерода (IV);
3) карборунд; 4) хлорид кальция.
8. Оба понятия «моль» и «молекула» применимы к
веществам (нормальные условия):
1) алмаз; 2) аммиак; 3) оксид кремния (IV); 4) метан.
9. При н. у. 22,4 дм3 — это:
1) объем одного мол? воды;
2 Зак. 1530
33
2) объем 6,02 1023 молекул любого газа;
3) объем порции любого газа массой 1 г;
4) объем порции азота массой 28 г.
10. Наименьшее число атомов содержит порция мас-
сой 1 г:
1) белого фосфора (Р4); 2) озона;
3) ромбической серы (S ); 4) азота.
ТЕСТ 5
1. Укажите формулу газа, если его относительная плот-
ность по неону равна 2,3:
1) N,; 2) NO; 3) N,O; 4) NO,.
2. Некоторую порцию озона полностью превратили
в кислород. Укажите справедливые утверждения для
этого процесса:
1) масса смеси возросла в 1,5 раза;
2) объем смеси возрос в 1,5 раза;
3) число молекул возросло в 1,5 раза;
4) число атомов не изменилось.
3. Правильными являются утверждения:
1) химическое количество газа в объеме 5 см3 при мо-
лярной концентрации 0,01 моль/дм3 равно 5 • I0 4 моль;
2) число атомов в порции аммиака массой 1,7 г такое
же, как и в порции ацетилена объемом (н. у.) 2,24 дм3;
3) при переходе порции жидкой воды массой 20 г в
газообразное состояние ее объем возрастает примерно
в 1244 раза;
4) масса двухсот молекул воды такая же, как и семиде-
сяти пяти молекул озона.
4. При собирании каких газов методом вытеснения
воздуха пробирку держат горлышком вверх?
1)водород; 2)кислород;
34
3) хлороводород; 4) углекислый газ.
5. Одинаковое число молекул SO3 образуется, когда
между собой реагирует:
1) 200 молекул SO, и 200 молекул О,;
2) 200 молекул SO, и 100 молекул О,;
3) 300 молекул SO, и 300 молекул О,;
4) 500 молекул SO, и 100 молекул О,.
6. Порция метана химическим количеством 0,1 моль
содержит:
1) 6,02 • 1022 атомов С;
2) атомы водорода массой 0,4 г;
3) 6,02 • 1024 молекул;
4) атомы углерода массой 1,2 г.
7. Наибольшую массу имеет порция вещества, содер-
жащая:
1) 100 молекул Н,О;
2) 50 атомов Fe;
3) 100 молекул О3;
4) 50 формульных единиц Са3(РО4),.
8. Для реакции 2С + О, = 2СО углерод будет в недо-
статке, если между собой реагируют:
1) 100 атомов С и 100 молекул О,;
2) 5 моль С и 2 моль О,;
3) 1,75 моль С и 1 моль О,;
4) 6 г С и 11,2 дм3 (н. у.) О,.
9. Относительная плотность газа А по газу В равна X.
Относительная плотность газа В по газу А составляет:
1) X2; 2) 2Х; 3) 1/Х; 4) (1/2)Х.
10. При возгонке некоторой порции иода НЕ ИЗМЕ-
НЯЮТСЯ:
1) качественный состав вещества;
2) природа связей в молекуле;
35
3) химическое количество вещества;
4) объем вещества.
ТЕСТ 6
1. Относительная плотность некоторого газа по озо-
ну равна X. Укажите относительную плотность этого газа
по кислороду:
1)(3/2)Х; 2)(2/3)Х;
3)1/X; 4)(1/3)Х.
2. Порции, содержащие равные химические количе-
ства газообразных фтороводорода и неона (условия оди-
наковые), отличаются:
1) массой; 2) числом атомов;
3) числом молекул*; 4) плотностью, г
3. Объем порции NH3 (дм3, н.у.), в которой содержит-
ся 6,02 1033 атомов Н и N в сумме, равен:
1)2,8; 2) 5,6; 3) 8,4; 4) 11,2.
4. Наименьшую плотность (н. у.) имеет:
1)озон; 2) водород;
3) кислород; 4) аммиак.
5. Одинаковую плотность (н. у.) имеют:
1) кислород и озон;
2) углекислый газ и оксид азота (I);
3) аммиак и метан;
4) азот и этилен.
6. Порция кислорода массой 60 г и порция озона мас-
сой 90 г отличаются:
1) числом молекул; 2) числом атомов;
3) числом электронов в атомах; 4) объемом.
* В случае благородных газов понятия «атом» и «молеку-
ла» являются синонимами.
36
7. Масса порции газа объемом 2 дм3 (н. у.) равна 2,5 г.
Укажите справедливые утверждения:
1) этим газом может быть азот;
2) молярная масса газа 2,5 г/моль;
3) молярная масса газа 28 г/моль;
4) 3,01 • 1023 молекул газа имеют массу 14 г.
8. Наибольшее число атомов (н. у.) содержится в:
1)8 дм3 SO,; 2) 15 дм3 Аг;
3)10 дм3 О'; 4) 8 дм3 NH3.
9. Одинаковое число атомов содержат:
1) 1,1 г СО, и 2,4 г О3;
2) 3,20 г СН4 и 4,25 г NH3;
3) 1 дм3 Н2О (жидкая) и 1 дм3 (н. у.) N,;
4) 1,8 см3 Н,0 (жидкая) и 1,7 г NH3.
Ю.Имеются порции газов (н. у.) СО, и N,O, содержа-
щие атомы углерода массой 1,2 г и атомы азота массой
2,8 г. Для порций газов одинаковыми будут:
1) масса атомов кислорода;
2) число атомов;
3) число молекул;
4) число электронов в атомах.
ТЕСТ 7
1. Какие объемы (дм3, н.у.) соответственно NH3 и СО,
будут иметь примерно одинаковую массу?
1) 1,000 и 2,588; 2) 1,000 и 5,888;
3) 5,888 и 3,000; 4) 2,588 и 1,000.
2. Какие массы (кг) соответственно СО, СО, и С,Н6
будут содержать примерно одинаковое число молекул?
1) 7,466; 7,999; 11,732; 2) 7,999; 11,732; 7,466;
3) 7,466; 11,732; 7,999; 4) 11,732; 7,999; 7,466.
37
3. Молярная масса вещества состава Х3(РО4)2 равна
601 г/моль. Укажите символ элемента X:
l)Mg; 2) Sr; 3)Ва; 4) Са.
4. Образец сложного вещества химическим количе-
ством 0,15 моль имеет массу 3,0 г. Формула вещества:
1) Ne; 2) HF; 3) СН4; 4) Н,О.
5. Укажите число атомов углерода в порции фуллере-
на Cso массой 2,0 г:
1) 1,00 1023; 2) 1,25 • 1021;
3) 2,00 1023; 4) 2,25 • 1023.
6. Во сколько раз объем СН4 должен быть больше объе-
ма О,, чтобы эти газы при одинаковых условиях имели
одинаковую массу?
1) в 1,5 раза; 2) в 2,0 раза; 3) в 3,0 раза; 4) в 4,0 раза.
7. Во сколько раз объем О2 должен быть больше объе-
ма СН4, чтобы эти газы при одинаковых условиях со-
держали одинаковое число атомов?
1) в 1,5 раза; 2) в 2,0 раза;
3) в 2,5 раза; 4) в 3,0 раза.
8. Дана смесь газов СО, СО,, Н, и СН4 с одинаковы-
ми массовыми долями каждого из них. Наибольшую
объемную долю в смеси имеет газ:
1) СО; 2) СО,; 3) Н,; 4) СН,.
9. Объемные доли СО, NH3, Не и О2 в их смеси одина-
ковы. Наибольшую массовую долю в этой смеси имеет газ:
1) СО; 2) NH3; 3) Не; 4) О,.
10. Укажите молярную массу (г/моль) газовой смеси,
состоящей из равных объемов Н, и О,:
1) 15; 2) 16; 3) 17; 4) 18.
38
ТЕСТ 8
1. Для случая т (03) = т (О,) справедливыми будут
соотношения:
a) V(O3) = V(O,) (н. у.); б) N(O,) = N(O,);
в) N(O) в О, = N(O) в О,; г) V(O,) 7 V(O3) =1,5/1.
1) а,б,в; 2) б,в,г; 3) б,в; 4) в,г.
2. При равных массах газов C3Hg и СН4 их объемы
соответственно относятся как:
1) 4 : 11; 2) 11:4; 3) 11 : 5;4)5 : 11.
3. Если объемы газов С,Н4 и NH3 одинаковы, то их
массы соответственно относятся как:
1) 17 : 28; 2) 2: 1; 3) 1 : 2; 4) 28 : 17.
4. Как должны относиться соответственно массы га-
зов СО, и C3Hg, чтобы числа атомов в газах были оди-
наковы?
1)3: 11; 2) 11 :3;3) 1 : 11; 4) 11 : 1.
5. Если т (СО,) = т (N,O), то справедливыми будут
соотношения:
a) n (СО,) = n (N,O);
б) V (СО,) = V (N,O);
в) N (СО’) = N (N,O);
г) N (С +‘О) в СО2 = N (N + О) в N,O.
1) а,б,в,г; 2) а,б,в; 3) б,в,г;-4) а,в,г.
6. Для случая V (СН4) = V (СО) справедливыми будут
соотношения:
1) т (СН4) / т (СО) = М (СН4) / М (СО);
2) т (СН4) / /7/ (СО) = М (СО) / М (СН4);
3) N (С + Н) в СН4 = N (С + О) в СО;
4) п (СН4) = п (СО).
7. Укажите число молекул в порции любого газа объе-
мом 1 дм3 (н. у):
1) 2,69 1022; 2) 2,69 1023;
— 39 —
3)2,69 IO24; 4) 2,69-IO25.
8. Во сколько раз смесь двух объемов СО, и одного
объема аргона тяжелее воздуха?
1) в 1,45; 2) в 1,47;
3) в 1,49; 4) в 1,51.
9. В смеси газов С3Н8 и NH3 числа атомов С и Н отно-
сятся соответственно, как 3 : 20. Объемы С,Н8 и NH3 в
этой смеси относятся соответственно как;
1) 1 : 1; 2) 1 :2; 3) 1 : 3; 4) 1 :4.
10. В смеси равных объемов газов С,Н6 и СО, числа
атомов С, Н, О относятся соответственно, как:
1)2: 8:3; 2)1 :3: 1; 3)3 : 6 : 2; 4) 3:8:2.
ТЕМА 4
Типовые расчетные задачи
(в случае централизованного тестирования
такие несложные задачи обычно предлагаются в
части А тестового задания)
Содержание задач:
— связь между физико-химическими величинами;
— нахождение массовых и мольных долей атомов
элементов в веществе;
— установление эмпирической (простейшей) и мо-
лекулярной формул веществ;
— простейшие расчеты по уравнению химической ре-
акции;
— задачи на темы «Избыток-недостаток», «Примеси»,
«Выход продукта»;
— определение состава газовых смесей;
40
— определение плотности и относительной плотно-
сти газов и их смесей;
— расчет объемных отношений газообразных веществ
по уравнению химической реакции.
Напоминаем связь между единицами массы и объема:
1 дм3 = 1000 см3; 1 м3 = 1000 дм3; 1 кг = 1000 г; 1т =
= 1000 кг.
1. Смешали серу массой 6,40 г с цинковыми опилка-
ми химическим количеством 0,15 моль и смесь нагрели.
Найдите массу (г) полученного продукта.
2. Смешали кислород массой 10 г и водород массой
0,20 г и полученную смесь газов подожгли. Найдите чис-
ло образовавшихся молекул воды.
3. Найдите массу аммиака (г), которая образуется при
взаимодействии 9,03 • 1023 молекул Н7 и азота объемом
(н. у) 13,44 дм3.
4. Масса молекулы фосфора при некоторых условиях
равна 1,03 10-22г. Укажите число атомов фосфора в его
молекуле.
5. Масса молекулы вещества равна 5,32 • 10 23 г. Рас-
считайте молярную массу (г/моль) вещества.
6. Масса паров вещества объемом (н. у.) 2,00 дм3 рав-
на 2,50 г. Найдите молярную массу (г/моль) вещества.
7. Образец вещества массой 6,6 г содержит 9,03 • 1022
молекул. Рассчитайте молярную массу (г/моль) вещества.
8. Смешали равные объемы О, и С7Н2. Найдите отно-
сительную плотность полученной газовой смеси (н. у.)
по водороду.
9. Рассчитайте массовую долю (%) атомов элемента фос-
фора в составе оксида фосфора (V) с точностью до десятых.
10. Найдите массу (г) атомов элемента кислорода в
фосфорной кислоте массой 19,6 г.
41
11. Рассчитайте массу атомов элемента водорода в
порции метана, содержащей 3,01 1023 молекул.
12. Найдите число атомов углерода в порции пропа-
на C3Hg химическим количеством 0,01 моль.
13. Какое химическое количество (моль) озона содер-
жит 5,04 • 1023 атомов кислорода?
14. В какой массе (г) медного купороса CuSO4 5 Н2О
содержатся атомы кислорода массой 1,60 г?
15. В какой массе (г) пропана С,Н8 масса атомов угле-
рода такая же, как и в порции этена С,Н4 массой 2,80 г?
16. Рассчитайте массу (г) атомов хлора в порции хло-
рида алюминия массой 13,35 г.
17. Найдите массу (г) магнетита Fe3O4, из которой
можно получить железо массой 5,6 г при его выходе 80%.
18. В каком объеме (дм3, нормальные условия) бутана
С4Н|0 содержатся атомы водорода химическим количе-
ством 0,5 моль?
19. Найдите общее число атомов в порции этана объе-
мом (нормальные условия) 5,6 дм3.
20. Масса молекулы газообразного вещества равна
5,32 10-23 г. Рассчитайте относительную плотность газа
по воздуху.
21. Массовая доля атомов кислорода в кристаллогид-
рате A1,(SO4)3 хН,0 равна 68,82%. Найдите число мо-
лекул воды х в формульной единице кристаллогидрата.
22. Плотность смеси NH3 и Н, равна 0,458 г/дм3 (н. у.).
Рассчитайте объемную долю (%) NH3 в смеси.
23. Объемная доля NH3 в смеси с О, равна 40%. Чему
равна массовая доля (%) О2 в смеси?
24. Массовая доля кислорода в его смеси с гелием рав-
на 80%. Рассчитайте объемную долю (%) гелия в смеси.
42
25. Чему равна относительная плотность СО, по га-
зовой смеси, в которой на одну молекулу N, приходится
две молекулы О,?
26. Какую массу (г) фосфора можно получить из фос-
фата кальция массой 100 г с массовой долей примесей
10% при выходе продукта 95%?
27. Масса молекулы серы при некоторых условиях
равна 4,25 • 10 22 г. Найдите число атомов серы в соста-
ве молекулы.
28. Рассчитайте объем (см3) порции воды, содержа-
щей 3,612 1024 молекул при температуре +4 °C и нор-
мальном давлении.
29. Какая масса (г) Н, содержит столько же молекул,
сколько их находится в порции кислорода объемом (нор-
мальных условиях) 5,6 дм3?
30. Рассчитайте химическое количество атомов кис-
лорода в составе соли КСЮ3 массой 12,25 г.
31. В какой массе (г) сульфата натрия содержатся ато-
мы кислорода массой 3,2 г?
32. Массовая доля атомов хлора в его оксиде равна
47,02%. Укажите формулу оксида.
33. Рассчитайте мольную долю (%) атомов кислоро-
да в составе серной кислоты.
34. Мольная доля атомов хлора в составе его оксида
равна 0,4. Установите формулу оксида.
35. Установите формулу вещества, в котором массо-
вые доли (%) атомов К, С1 и О соответственно равны
36,62; 33,33; и 30,05.
36. Рассчитайте число атомов в порции озона мас-
сой 4,8 г.
37. Относительная плотность паров фосфора по воз-
духу равна 4,276. Установите формулу молекулы фосфора.
43
38. Плотность газа (н. у.) равна 1,964 г/дм3. Чему рав-
на его относительная плотность по гелию?
39. Относительная плотность газа по аргону равна 1,1.
Рассчитайте массу (г) молекулы газа.
40. Массовая доля атомов элемента в оксиде Э3О4
равна 72,4%. Что это за элемент?
41. Между собой реагируют азот объемом (н. у.) 10
дм3 и водород объемом (н. у.) 18 дм3. Найдите объем (н.у,
дм3) оставшегося после реакции исходного газа (какого?).
42. Какая масса (г) СО останется в избытке после ре-
акции между СО объемом 30 дм3 (н. у.) и О2 объемом
8,0 дм3 (н. у.)?
43. Рассчитайте число молекул в любом газе объемом
(н. у.) 1 см3.
44. Какова масса (г) порции газа объемом 2,8 дм3
(н. у.), если его относительная плотность по воздуху рав-
на 1,931?
45. Масса порции газа объемом 5 дм3 (н. у.), равна
3,571 г. Найдите молярную массу (г/моль) газа.
46. Какова масса (г) образца уксусной кислоты
СН^СООН, в котором содержится такое же число ато-
мов, как и в порции серной кислоты массой 4,9 г?
47. Даны образцы О, и СН4 с одинаковой массой. Во
сколько раз больше атомов в одном из образцов?
48. Даны образцы хлора и аммиака, каждый объемом
(н. у.) 2,24 дм3. Во сколько раз число атомов в одном из
образцов больше?
49. Найдите массу (г) нитрата калия, при нагревании
которой можно получить кислород химическим количе-
ством 1,5 моль.
50. Какую массу (г) H,SO4 можно теоретически полу-
чить, имея пирит массой 10,0 г?
44
51. Смешали азот и кислород в объемном соотноше-
нии 1: 3 соответственно. Найдите массу (г) порции этой
смеси объемом 2,24 дм3 (н. у.).
52. В порции газа массой 0,028 г содержится
0,602 1021 молекул. Найдите относительную плотность
газа по водороду.
53. В газовой смеси массой 10,0 г содержится 6,02 • 1022
молекул. Укажите массу (г) порции данной смеси хими-
ческим количеством 0,05 моль.
54. Смесь газов содержит одинаковое число молекул
Н,, СО и СО,. Укажите относительную плотность сме-
си по гелию.
55. Смесь газов содержит одинаковое число молекул
NH3, О, и СН4. Найдите плотность (г/дм3) этой смеси.
56. Газы кислород и азот смешали в массовом отно-
шении 1: 3 соответственно. Найдите массу (г) такой сме-
си объемом (н. у.) 100 дм3.
57. Газы СН, и NH, смешали в массовом отношении
1 : 2 соответственно. Найдите объем (н. у., дм3) такой
смеси массой 20 г.
58. Массовая доля атомов серы в техническом пирите
равна 40%. Найдите массовую долю (%) FeS, в пирите.
59. При анализе некоторой серебросодержащей руды был
получен хлорид серебра (I) массой, в точности равной мас-
се руды. Рассчитайте массовую долю (%) примесей в руде.
60. Какая масса технического известняка с массовой
долей примесей 8% была обработана избытком соляной
кислоты, если при этом выделился газ объемом (н. у.)
1,12 дм3 с выходом 80%?
61. Какова масса (г) порции СО,, занимающей такой
же объем (н. у.), как и 1,25 • 1022 молекул N,?
45
62. При полном сжигании 2 дм3 паров вещества по-
лучили СО, объемом 4 дм3 и воду объемом 2 дм3. Объем
кислорода, затраченный на сжигание, равен 5 дм3. Уста-
новите формулу вещества (все объемы измерены при
температуре 120°С и нормальном давлении).
63. В смеси NH3 и СН4 на каждый атом N приходится
одиннадцать атомов Н. Рассчитайте плотность этой сме-
си (г/дм3).
64. Смешали равные массы газов СН4 и N2. Найдите
относительную плотность этой газовой смеси по хлору.
65. Найдите относительную плотность по аргону сме-
си газов О„ СН4 и N,, в которой объемные доли газов
одинаковы.
66. Найдите относительную плотность по водороду
смеси газов С,Н„ С,Н6 и N, с равными массовыми до-
лями каждого газа.
67. Молярная масса смеси трех газов, состоящей из
О,, N, и неизвестного газа равна 32,8 г/моль. Объемные
доли азота и кислорода в ней равны по 40%. Найдите
молярную массу (г/моль) неизвестного газа.
68. В каком объеме СО, (дм3, н. у.) содержится столько
же электронов в атомах, как и в порции N, массой 1,40 г?
69. В смеси СО, и О, объемом (н. у.) 31,36 дм3 количе-
ство электронов равно 27,2 моль. Укажите объемную
долю (%) СО, в смеси.
70. В образце технического доломита массой 2,5 г со-
держатся атомы кислорода массой 1,2 г. Укажите массо-
вую долю (%) примесей в доломите.
71. Чему равна масса (г) смеси Н, и NH3 объемом 100
дм3 (н. у.), если в ней на каждую молекулу Н, приходится
три молекулы NH3?
46
12. Какой объем (дм3, н.у.) имеет газовая смесь мас-
сой 50 г, в которой на каждые 20 молекул О, приходится
1 молекула О3?
73. Плотность смеси СН4 и О, равна 1,250 г/дм3 (н. у.).
Найдите массовую долю (%) СН4 в смеси.
74. Какой должна быть массовая доля СН4 в его сме-
си с Н,, чтобы такая смесь была в 10 раз легче воздуха?
75. Рассчитайте массу (г) 2,00 дм3 (н. у.) газовой сме-
си, в которой на каждую молекулу N, приходится две мо-
лекулы СО,.
76. Чему равна относительная плотность по Аг газо-
вой смеси, содержащей 3,01 1025 молекул СО и метан
массой 96 г?
77. Массовая доля А1,О3 в некотором минерале равна
21,5%. Рассчитайте массовую долю (%) алюминия в этом
же минерале.
78. В соединении CxHyN7 мольная доля атомов N равна
10%, а мольная доля атомов Н в 3,5 раза больше моль-
ной доли атомов С. Установите эмпирическую формулу
вещества.
79. Объемы порций О, и N, равны. Найдите отноше-
ние массы кислорода к массе азота.
80. Массы порций О, и СО равны. Найдите отноше-
ние объема СО к объему О,.
47
ТЕМА 5
Строение ядер атомов. Изотопы. Нуклиды.
Явление радиоактивности.
ТЕСТ1
1. Сложность строения атома доказывают:
1) химические превращения веществ;
2) изменение агрегатного состояния вещества при
нагревании;
3) явление радиоактивности;
4) электролиз водных растворов и расплавов веществ.
2. Нуклоны — это общее название:
1) протонов и электронов; 2) протонов и нейтронов;
3) нейтронов и электронов; 4) стабильных нуклидов*.
3. Укажите суммарный относительный заряд смеси,
состоящей из 5 протонов, 6 нейтронов и 2 электронов:
1)4-1; 2) 4-2; 3) 4-3; 4)+4.
4. Укажите примерную массу смеси, состоящей из
10 протонов, 5 нейтронов и 12 электронов:
1) 27 а.е.м; 2) 15 а.е.м; 3) 4,48 10-26 кг; 4) 2,49 10-26кг.
5. Смесь, состоящая из 6 протонов и 3 нейтронов име-
ет приблизительно такую же массу, как и средняя масса
атома элемента:
1) цезия; 2) бериллия; 3) натрия; 4) фтора.
6. Масса атома определяется массой:
1) ядра; 2) протонов и электронов;
3) протонов и нейтронов; 4) нейтронов и электронов.
* Нуклид—это электронейтральный или заряженный атом
с определенными значениями атомного номера (заряда ядра)
и массового числа.
48
7. Заряд ядра определяется числом:
1) нейтронов; 2) электронов;
3) протонов и электронов; 4) протонов.
8. В электронейтральном атоме число протонов все-
гда равно:
1) числу нейтронов;
2) числу электронов;
3) сумме чисел нейтронов и электронов;
4) разнице между нуклонным числом и числом ней-
тронов.
9. Массовое число нуклида позволяет определить:
1) приблизительную массу нуклида (в г);
2) число элементарных частиц в нуклиде;
3) число нейтронов в нуклиде;
4) число изотопов элемента.
10. Атомы* химического элемента между собой мо-
гут различаться:
1) массой; 2) числом протонов;
3) нуклонным числом; 4) числом электронов.
ТЕСТ 2
1. Атомы данного химического элемента превраща-
ются в атомы другого химического элемента, если они:
1) теряют нейтроны; 2) приобретают нейтроны;
3) приобретают электроны; 4) теряют протоны.
2. Приобретая два электрона электронейтральный атом
серы превращается в:
1) один из других нуклидов серы;
2) атом кремния;
* Напоминаем, что атомы могут быть электронейтраль-
ными или заряженными (простыми ионами)
49
3) атом аргона;
4) ион серы с электронной оболочкой аргона.
3. Химический элемент это совокупность:
1) только химически несвязанных атомов с одинако-
вым зарядом ядра;
2) изотопов с одинаковым зарядом ядра;
-3) нуклидов с одинаковым нуклонным числом;
4) нуклидов с одинаковым протонным числом.
4. Изотопами называются:
1) радиоактивные нуклиды;
2) нуклиды, имеющие одинаковые массовые числа,
но разные протонные числа;
3) стабильные нуклиды;
4) нуклиды, имеющие различные нуклонные числа,
но одинаковые протонные числа.
5. Нуклиды элемента называются:
1) нуклонами; 2) изомерами;
3) аллотропными модификациями; 4) изотопами.
6. Укажите правильные утверждения:
1) химический элемент водород в природе представ-
лен тремя нуклидами;
2) число различных нуклидов равно числу химичес-
ких элементов;
3) большинство химических элементов в природе со-
стоит из нескольких нуклидов;
4) относительная атомная масса любого элемента в
точности равна нуклонному числу нуклида (элемент
представлен одним нуклидом).
7. Чем различаются между собой нуклиды 79Вг и 81Вг?
1) массой; 2) числом нейтронов;
3) протонным числом; 4) числом электронов.
50
8. Что одинаково для нуклидов 40К и 39К?
1) массовое число; 2) число протонов;
3) число электронов; 4) масса.
9. Укажите число нейтронов в нуклиде 79Вг:
1)79; 2) 35; 3) 114; 4) 44.
10. Укажите число всех элементарных частиц в нук-
лиде 40Аг:
1)40; 2) 18; 3)58; 4) 98.
ТЕСТЗ
1. Электронейтральный атом азота содержит 1р и 7е.
Ион N 3 содержит:
1) 1р и 7е; 2) Юр и 7е; 3) 1р и 10е; 4) 4р и 10е.
2. Электронейтральный атом кальция содержит 20р
и 20е. Ион Са2+ содержит:
1) 20р и 20е; 2) 18р и 20е; 3) 20/; и 18е; 4) 20/? и 22е.
3. Больше электронов, чем протонов содержит час-
тица, символ которой:
1) С; 2) О-; 3) А13+; 4) '«О.
4. Больше протонов, чем электронов содержит час-
тица, символ (формула) которой:
1) NH4+; 2) Мп; 3) S2-; 4) О,.
5. Число протонов равно числу электронов в части-
це, формула которой:
1) NH4; 2) Т,О; 3) Н,О; 4) SO2-.
6. Массовое число в точности равно относительной
атомной массе для нуклида:
1)65Си; 2)|2С; 3) 35С1; 4) 23Na.
7. Электронейтральный атом какого элемента содер-
жит столько же электронов, сколько их содержится в двух
ионах NH*?
1) N; 2) F; 3) Ne: 4) Са.
51
8. Укажите символ самой тяжелой частицы:
1) сс; 2)р; 3)D;4)T.
9. Сколько различных по изотопному составу молекул
водорода можно получить из нуклидов 'Н, D и Т?
1)4; 2) 6; 3) 8; 4) 10.
10. Сколько различных по изотопному составу моле-
кул воды можно получить из нуклидов 1Н, D, Т и |6О?
1)2; 2) 4; 3)6; 4) 8.
ТЕСТ 4
1. Один из нуклидов меди содержит 36 нейтронов.
Массовое число этого нуклида равно:
1)29; 2) 65; 3)36; 4) 94.
2. Два нейтрона в ядре содержат атомы:
1) протия; 2) гелия; 3) трития; 4) дейтерия.
3. Укажите число нейтронов в нуклиде l3SBa:
1)56; 2) 82; 3) 138; 4) 194.
4. Одинаковое число протонов содержат атомы:
1) гелия; 2) трития; 3) протия; 4) дейтерия.
5. Укажите атомный номер элемента 41Э, в ядре ато-
ма которого находятся 20 нейтронов:
1)20; 2)21; 3)41;4) 61.
6. Укажите число протонов в молекуле NO,:
1)7; 2) 16; 3)23; 4) 46.
7. Четыре нейтрона содержатся в ядре нуклида:
1)4Не; 2) 7Li; 3) 3Н; 4)2Н.
8. Электронейтральный нуклид содержит 16 нейтро-
нов и 15 электронов. Массовое число нуклида равно:
1) 1; 2) 15; 3) 16; 4) 31.
9. Укажите массу нуклида 40Са2*:
1) 18 и; 2) 20 и; 3)38 и; 4) 40 и.
52
10. Массовое число электронейтрального нуклида рав-
но 130 и число электронов в нем составляет 54. Число
протонов и нейтронов в нуклиде соответственно равно:
1) 54 и 130; 2) 54 и 76; 3) 76 и 54; 4) 54 и 184.
ТЕСТ 5
1. Электронейтральный атом какого элемента имеет
столько же электронов, как и молекула Н,О?
1) F; 2) Аг; 3) Ne; 4) С.
2. Когда электронейтральный атом превращается в
катион,то:
1) заряд ядра уменьшается;
2) возрастает число электронов в атоме;
3) заряд ядра не изменяется;
4) уменьшается число электронов в атоме.
3. Когда электронейтральный нуклид превращается в
анион, то:
1) заряд ядра возрастает;
2) увеличивается число электронов в атоме;
3) возрастает массовое число;
4) нуклонное число не изменяется.
4. Укажите справедливые утверждения:
1) масса нуклида |бО равна 8 и;
2) масса нуклида 32S равна 5,312 10-23 г;
3) масса 12,04 1020 нуклидов С-12 равна 24 мг;
4) масса молекулы D, равна 1/6 та 12С.
5. Число протонов в электронейтральном нуклиде:
1) всегда равно числу нейтронов;
2) всегда равно числу электронов;
3) равно атомному номеру элемента в периодической
системе;
53
4) равно разности между нуклонным числом и чис-
лом нейтронов.
6. По 18 электронов содержат частицы.
1)HS-;2)H2S;3)H2O; 4) PH*.
7. В молекуле Э2 содержатся 32 электрона. Укажите
символ элемента Э:
1) О; 2) Р; 3) Se; 4) S.
8. Укажите массу молекулы 3|РТЧ
1) 31 и; 2) 34 и; 3)37 и; 4) 40 и.
9. Для атома Ne, катиона Na+ и аниона F равны:
1) масса; 2) число нейтронов;
3) число электронов; 4) число протонов.
10. В молекуле Sx содержатся 64 электрона. Укажите
значение х:
1) 1; 2) 2; 3)3; 4) 4.
ТЕСТ 6
1. Массовая доля атомов водорода наибольшая в сос-
таве молекулы, формула которой:
1) Т38О; 2) ;Н’7О; 3) D’8O, 4) 2Н|Н|8О.
2. Массовая доля атомов кислорода наибольшая в сос-
таве молекулы, формула которой:
1) ЦбО; 2) Т;8О; 3) DT17O; 4) ;НО,6О.
3. Укажите массу иона Т,18О*:
1)24 и; ’2) 23 и;
3)3,984 -10’23 г; 4) 3,818 - 10 23.
4. Укажите символы элементарных частиц:
1)!Н;2)/?; 3) а; 4) е.
5. Укажите массу электронейтрального нуклида (г), в
состав которого входят 55 электронов и 78 нейтронов:
1) 129,48 10-24; 2) 182,6- 10 24;
54
3) 312,08 IO24; 4) 220,78 IO’24.
6. Чем различаются между собой нуклиды 32S и 32S2~?
1) числом электронов;
2) числом протонов;
3) числом нейтронов;
4) общим числом элементарных частиц;
7. Что одинаково для нуклидов 27А1 и 27А13+?
1) протонное число;
2)нуклонное число;
3) общее число элементарных частиц;
4) число электронов.
8. Укажите формулу самой тяжелой частицы:
1) 14№Н3; 2) 15N'H3; 3) 14N'HD7; 4) l5N'HT7.
9. Общее число электронов и нейтронов в нуклиде
45Sc равно:
1)21; 2) 24; 3) 45; 4) 66.
10. Масса электронейтрального нуклида равна
210,82 10 24 г, а в электронной оболочке содержатся
53 электрона. Укажите число нейтронов в нуклиде:
1)53; 2) 74; 3) 127; 4) 180.
ТЕСТ 7
1. Укажите сумму всех элементарных частиц в нукли-
де ll9Sn:
1)50; 2) 119; 3) 169; ;) 219.
2. Сумма всех элементарных частиц в нуклиде 78Se2-
равна:
1)80; 2) НО; 3) 112; 4) 114.
3. Укажите сумму всех элементарных частиц в нукли-
де 152Sm3+:
1)59; 2) 149; 3)211; 4) 214.
55
4. Чему равна разница между числом нейтронов и
числом электронов в нуклиде |25Те2 ?
1) 18; 2) 19; 3)20; 4) 21.
5. Найдите разницу между числом нейтронов и чис-
лом электронов в нуклиде 173Yb3\
1) 103; 2) 33; 3)36; 4) 106.
6. Образец галлия имеет относительную атомную мас-
су элемента галия 69,7 и состоит из нуклидов 69Ga и 71Ga.
Найдите мольную долю (%) нуклида71 Ga в этом образце:
1)35; 2) 45; 3)55; 4) 65.
7. Укажите число протонов и электронов в ионе NH^:
1) 18/?, 18е; 2) 18/?, 17е; 3) 11/?, Не; 4) 11/?, 10е.
8. Образец рубидия содержат нуклиды toRb и 87Rb.
Мольная доля нуклида 87Rb равна 25%. Рассчитайте от-
носительную атомную массу элемента рубидия в этом
образце:
1)84,5; 2) 85,5; 3) 86,5; 4) 87,5.
9. Число электронов и число протонов в ионе HSO3
соответственно равно:
1) 82е, 81/?; 2) 83е, 81/?; 3) 42е, 42/?; 4) 42е, 41/?.
10. Укажите число всех элементарных частиц в моле-
куле 17*0,:
1)40; 2) 50; 3) 60; 4) 70.
ТЕСТ 8
1. Какова масса (г) протонов в атомах для образца кис-
лорода объемом 3,36 дм3 (н. у.)?
1) 1,2; 2) 2,4; 3)3,6; 4) 4,8.
2. Найдите массу (г) нейтронов в атомах для образца
23Na массой 4,6г:
1)4,8; 2)3,6; 3)2,4; 4) 1,2.
56
3. В состав нуклида входит 78 нейтронов. Отноше-
ние числа нейтронов к числу протонов равно 1,418. Ука-
жите химический знак нуклида:
1) Rb; 2) Sr; 3) Cs; 4) Ba.
4. В образце металла химическим количеством 0,10
моль количество протонов в атомах равно 1,1 моль. Ука-
жите символ металла:
l)Mg; 2) Na; 3)К; 4) Са.
5. В образце галогена химическим количеством 0,02
моль в атомах содержатся протоны количеством
1,4 моль. Укажите формулу галогена:
1)F2; 2) С!,; 3)Вг,;4) 12.
6. Укажите символ частицы X в уравнении ядериой
реакции «Fe + = 1р + Х:
1) «Мп; 2) «Мп; 3)«Fe; 4) «Fe.
7. Выберите символ частицы X в уравнении ядерной
реакции '*N + X = + \р:
1)ё; 2)i«; 3)сс; 4) у.
8. Отметьте символ частицы X в уравнении ядерной
реакции « Со = X + ®е:
l)«Fe;2) «Ni; 3)«Ni; 4)56 Fe.
9. В некотором образце на один атом нуклида ” Э
приходится три атома нуклида « Э. Укажите приблизи-
тельную относительную атомную массу элемента Э в
этом образце:
1)33,5; 2) 35,5; 3)36,5; 4) 37,5.
10. Образец водорода содержит нуклид 'Н массой 2 г
и нуклид 2Н массой 4 г. Укажите приблизительную от-
носительную атомную массу элемента водорода в этом
образце:
1)1,0; 2) 1,5; 3)2,0; 4) 2,5.
57
ТЕСТ 9
1. Сколько различных по изотопному составу молекул
аммиака можно получить из изотопов l4N, 15N, 2Н и 3Н?
1)6; 2) 8;3) 14; 4) 16.
2. Укажите символ частицы, содержащей равное чис-
ло протонов и нейтронов:
1) 14NT3; 2) l4ND4; 3) ,20Те; 4) 82Se2
3. Для природной воды различного изотопного со-
става возможны относительные молекулярные массы:
1) 17; 2) 19,3)24; 4)27
4. Рассчитайте число нейтронов в ионе 34S,7O2~:
1)45; 2) 43,3)47; 4)51.
5. В природе наиболее распространены молекулы во-
дорода состава:
1) 2Н2; 2) ’Ц, 3) Т2; 4) DT.
6. В природе НЕ существуют молекулы воды массой:
1) 2,822 • IO’23 г; 2) 3,154 10 23 г,
3)25 и; 4)3,569 10 23 г.
7. В природе из перечисленных больше всего содер-
жится молекул воды состава:
1) Т *7О; 2) 2Н’*О;
3) 2Н17О; 4) Т18О
8. Меньше всего из числа указанных в природе со-
держится молекул воды массой (г):
1) 2,988- 10 23, 2) 3,154- 10’23;
3) 3,320 10~23; 4) 3,652 10 23.
9. Укажите массовую долю (%) протонов в нуклиде 97Мо:
1)31,1; 2) 71,9; 3)43,3; 4) 85,4.
10. Рассчитайте массовую долю (%) нейтронов в
нуклиде 80Se2:
1)57,5; 2) 58,1; 3)59,0; 4) 60,4.
58
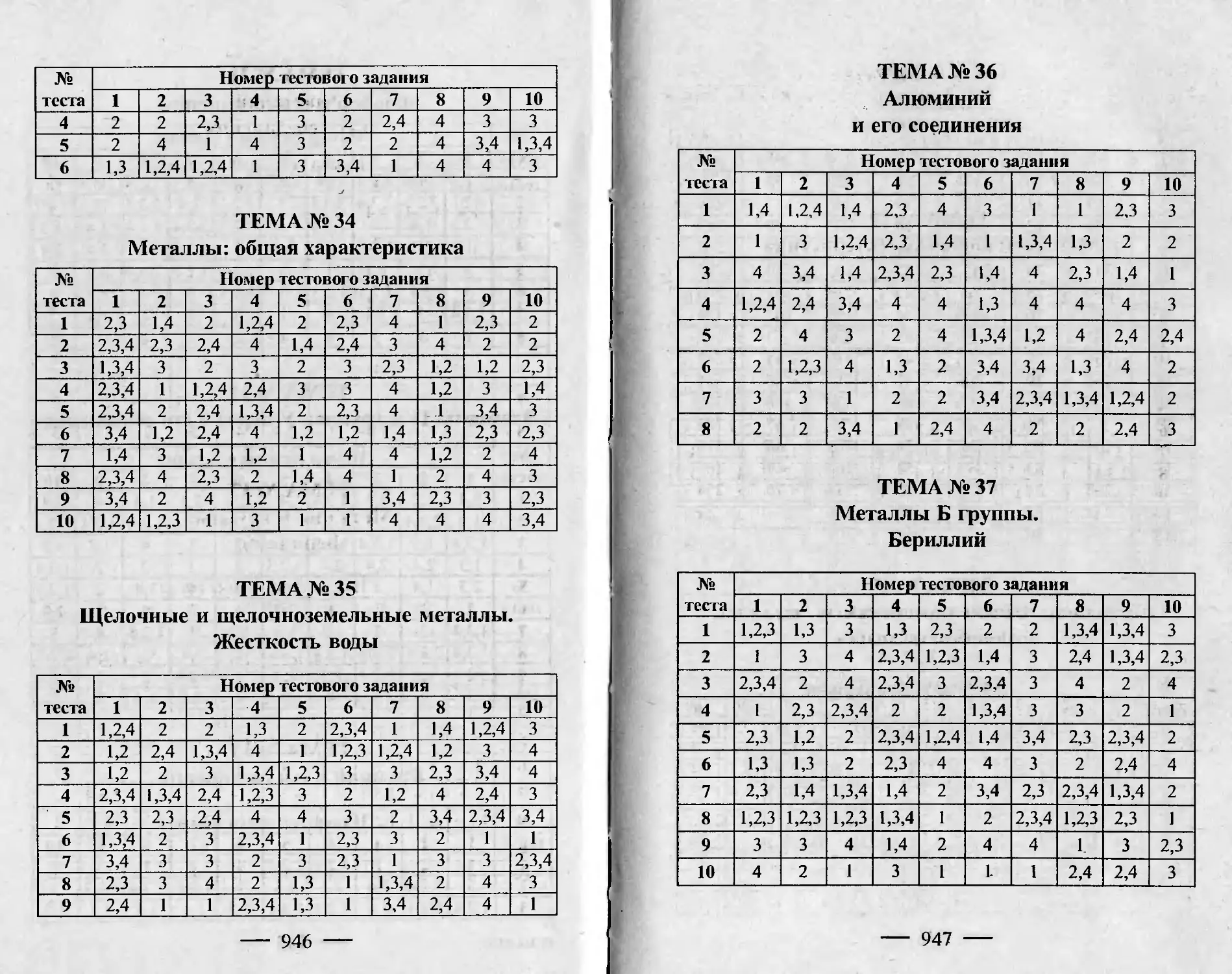
ТЕСТЮ
1. Атомы, входящие в состав формульной единицы
33N2, содержат 182 протона. Укажите химический знак
элемента Э:
l)Mg; 2) Ba; 3)Са;4) Sr.
2. Относительная молекулярная масса серной кисло-
ты состава D,SI8O4 равна ПО. Укажите массовое число
нуклида серы:
1)32; 2) 33; 3)34; 4) 36.
3. Суммарное число всех элементарных частиц в ато-
мах для порции 3IPD3 массой 7,4 г равно:
1) 5,117-1024; 2)6,9832 1024;
3) 6,6220 • 1024; 4) 1,2040 1023.
4. Укажите число нейтронов в атомах для образца
l5NT3 массой 2,4 - 10 3 г:
1) 8,000-1017; 2) 8,428 1018;
3)6,622 1018; 4)6,020 1018.
5. Образец сероводорода состава D,S химическим ко-
личеством 0,1 моль содержит в атомах нейтроны коли-
чеством 2,0 моль. Укажите массовое число нуклида серы:
1)32; 2) 33; 3)34; 4)36.
6. Период полураспада нуклида 13|1 равен 8 суток. Ка-
кая часть (%) иода от исходной распадается за 16 суток?
1)25; 2) 45; 3)55; 4) 75.
7. Период полураспада некоторого нуклида равен 28 лет.
За сколько лет распадается 87,5% нуклида от исходной?
1)28; 2) 56; 3)70; 4) 84.
8. Для какого нуклида отношение числа нейтронов к
числу протонов равно 1,353?
1) б5Си; 2) 80Se; 3) 97Мо; 4) l73Yb.
59
9. Укажите массовую долю (%) нейтронов в молеку-
ле Т'*О:
1) 58,3; 2) 57,3; 3)41,7; 4) 42,7.
10. В состав ядра электронейтрального атома входят
44 нейтрона, а отношение числа электронов к числу ней-
тронов равно 0,773. Укажите символ элемента:
1) S; 2) Se; 3)Те; 4) As.
ТЕСТ 11
1. В каком объеме (дм3, н.у.) |ХО, содержится столько
протонов в атомах, сколько нейтронов содержится в ато-
мах для порции Dy'O массой 4,2 г?
1) 1,08; 2) 2,08; 3)3,08; 4) 4,08.
2. Имеется смесь нуклидов серы с массовыми числа-
ми 32, 33, 34, 36 и мольными долями соответственно
(%) 95; 0,75; 4,2; 0,05. При взаимодействии нуклидов
между собой больше всего из перечисленных образует-
ся молекул состава:
1) 32S36S; 2)33S33S; 3)33S34S; 4)34S34S.
3. Во сколько раз масса а-частицы больше массы нук-
лида D?
1) в 1,5 раза; 2) в 2 раза;
3) в 2,5 раза; 4) в 3 раза.
4. Укажите природу частицы X для радиоактивного
превращения: 236U —> 137I + 97Y + 2Х:
1)'1Р;2)е;3);И;4)4Не.
5. Укажите символ частицы X для ядерной реакции
238U + l4N -» X + 4 Jn:
1) 24!iEs; 2) 246Es; 3) 24sCf; 4)241iFm.
6. Моноклинная сера химическим количеством
0,100 моль, образованная только одним нуклидом, со-
60
держит в атомах элементарные частицы количест вом 39,2
моль. Укажите символ нуклида:
1) 32S; 2) 33S; 3) 34S; 4) 36S.
7. В порции ионов Э2+ химическим количеством
0,30000 моль содержится 50,568 102’ электронов. Ука-
жите символ элемента Э:
1) N; 2) О; 3) Р; 4) S.
8. В порции ионов Э2' химическим количеством
0,1 моль содержится 3,4 моль электронов. Укажите сим-
вол элемента Э:
1)0; 2) Р; 3) Se; 4) S.
9. Некоторые анионы состава ЭО3 химическим коли-
чеством 0,10000 моль содержат 2,5284 1024 электронов
в атомах. Укажите символ элемента Э:
1)N; 2) С1; 3) Вт; 4) I.
10. Сколько различных по изотопному составу молекул
воды можно образовать, имея нуклиды 'Н, D, Т, |6О и |7О?
1)4; 2)6; 3) 8; 4) 12.
ТЕМА 6
Строение электронных оболочек атомов
ТЕСТ1
1. Укажите электронную схему атома * хлора:
1) 2, 8, 5; 2) 2, 8, 6; 3) 2, 8, 7; 4) 2, 8, 8.
2. Какова электронная схема аниона S2 ?
1) 2, 8, 5; 2) 2, 8, 6; 3) 2, 8, 7; 4) 2, 8, 8.
* Во всех случаях (если специально не оговорено) имеется
в виду основное состояние электронейтрального атома.
61
3. Катиону Al3" отвечает электронная схема:
1)2, 8,3; 2) 2, 8, 4; 3) 2, 8, 2; 4) 2,8.
4. Электронная схема 2, 8, 5 отвечает распределению
электронов по слоям в атоме:
I) А1; 2) Si; 3)Р; 4)S.
5. Электронную схему 2, 8, 8 имеют:
I) атом Аг и катион Na*; 2) атом Аг и анион СГ;
3) атом Аг и катион К"; 4) анион СГ и катион К".
6. Число электронов на внешнем электронном слое
атома Р равно:
1)5; 2) 4; 3) 3; 4) 2.
7. На внешнем электронном слое по 6 электронов
имеют атомы элементов с порядковыми номерами:
1)7; 2) 8; 3) 15; 4) 16.
8. Три электронных слоя и шесть электронов на внеш-
нем электронном слое имеет атом элемента:
1)0; 2) S; 3) Se; 4) Те.
9. Два электронных слоя и один электрон на внеш-
нем электронном слое имеет атом элемента:
l)Li; 2) Na;3)K; 4) Rb.
10. Число электронов на внешнем электронном слое
атомов возрастает в ряду элементов:
I) Be, Mg, Са; 2) О, S, Se; 3) Al, Si, Р; 4) F, О, N.
ТЕСТ 2
1. Укажите электронную конфигурацию атома элемен-
та с протонным числом 15:
1) ls22s22p63s2; 2) ls22s22p63s23p';
3) ls22s22/?b3s23p2; 4) ls22s22p63s23p3.
2. Какова сокращенная электронная конфигурация ато-
ма элемента с порядковым номером 20?
1) [Ar] 4s1; 2) [Ne] 3s1; 3) [Ar] 4s2; 4) [Ne] 3s2.
62
3. Укажите электронную конфигурацию нуклида 2Н:
1) 1s1; 2) Is2; 3) ls22s‘; 4) ls22s2.
4. Сколько неспаренных электронов содержит нуклид
l5N в основном состоянии?
1) 1; 2) 2; 3)3; 4) 4.
5. Укажите сокращенную электронную конфигурацию
основного состояния атома марганца:
1) [Ar] 3J34s2; 2) [Ar] 3J54s’;
3) [Ar] 3t754s2. 4) [Ar]3J64s‘.
6. Число неспаренных электронов в атоме фосфора в
основном состоянии равно:
1)5; 2) 4; 3)3; 4) 2.
7. Наибольшее число вакантных (незаполненных) ор-
биталей на внешнем электронном слое в основном со-
стоянии имеет атом:
l)Na; 2) Al; 3)Р;4) Cl.
8. Укажите число незаполненных 3</-орбиталей в ос-
новном состоянии атома V:
1)4; 2)3; 3)2; 4) 1.
9. Число неспаренных электронов в основном состо-
янии атома Сг равно:
1)6; 2) 5; 3) 4; 4)3.
10. Укажите суммарное число s-электронов в основ-
ном состоянии атома Си:
1)8; 2) 6; 3)7; 4) 5.
ТЕСТЗ
1. Укажите электронно-графическую схему внешнего
электронного слоя нуклида 1SO в основном состоянии:
3 s Зр 2s 2р
п t t
63
3л 3p 2s 2р
tl tl tl
tl tl ti
2. Одинаковые электронные конфигурации в основ-
ном состоянии имеют:
1) анион Вг и атом Кг; 2) анион F и атом Na,
3) анион S2- и катион Са2+; 4) атом С и атом Si.
3. Укажите символы НЕВОЗМОЖНЫХ энергетичес-
ких подуровней:
1) 2р, 2) 5s; 3) \р, 4) 2d.
4. В основном состоянии наибольшее число наполо-
вину заполненных орбиталей имеет атом элемента:
1)В; 2) C;3)N; 4) О.
5. Укажите сокращенную электронную конфигурацию
иона Sc3+ в основном состоянии:
1) ... 3s23p63d'4s2; 2) ... 3s23^3d;
3) ... 3s23p6, 4) ... 3s23//4s2.
6. Отметьте электронные конфигурации возбужден-
ных состояний атомов:
1) \s22s'2p\ 2) ls22s22p\ 3) ls22s22p53.s'; 4)ls22s22p63s1.
7. Среди приведенных электронных конфигураций
укажите невозможные:
1) ls22s22p7, 2) ls22s22p63s23p',
3) ls22522//3s23/?5; 4) ls22s22p63s23p64s23d".
8. В основном состоянии наибольшее число неспа-
ренных электронов имеет нуклид.
1) Т; 2) l5N; 3) |7О; 4) 34S.
9. В основном состоянии наименьшее число неспа-
ренных электронов имеет нуклид:
1) D; 2) 18О; 3) 36S; 4) 15N. (
10. Укажите символ энергетического подуровня с наи-
большей энергией:
1) 2s, 2) 3s- 3) Зр, 4) 3d.
---- 64 ---
*
I
ТЕСТ 4
1. Укажите число орбиталей на четвертом энергети-
ческом уровне:
1)4; 2)9; 3) 16; 4) 25.
2. Число энергетических подуровней на третьем энер-
гетическом уровне составляет:
1)2; 2)3; 3)9; 4) 16.
3. Укажите число электронов на внешнем электрон-
ном слое иона S2-:
1)2; 2) 4; 3)6; 4) 8.
4. Сколько р-электронов содержится в основном со-
стоянии в ионе СГ ?
1)6; 2) 11; 3) 12; 4) 18.
5. Укажите число /7-электронов в основном состоя-
нии в катионе А13+:
1)2; 2) 4; 3)6; 4) 7.
6. Атом какого элемента может иметь электронную
конфигурацию 1л,22л22/76Зл,|3/7|?
1) С; 2) Mg; 3) Са; 4) Sc.
7. Укажите число электронных слоев в электронной
оболочке атома Вг в основном состоянии:
1) 2; 2) 3; 3) 4; 4) 5.
8. Укажите число нейтронов в молекуле 35С12:
1)36; 2) 34; 3) 104; 4) 140.
9. Октет электронов на внешнем электронном слое
содержат частицы, символы которых:
1) Са; 2) О2; 3) Те2-; 4) Na+.
10. Укажите число неспаренных электронов в атоме
марганца в основном состоянии:
1) 1; 2)3; 3)4; 4) 5.
3 Зак. 1530
65
ТЕСТ 5
1. Один неспаренный электрон на внешнем электрон-
ном слое в основном состоянии содержат атомы:
1)С1; 2)Cr; 3)Си; 4) Мп.
2. Катион некоторого элемента Э3+ имеет электрон-
ную конфигурацию 1№2522р6. Укажите электронную кон-
фигурацию электронейтрального атома Э:
1) 1№2s22/73; 2) 1522522/?63523p‘;
3) 1л22л-2/У’Зл-2; 4) ls22s22p62s23p2.
3. Анион Э2- некоторого элемента имеет электронную
конфигурацию ls22s22pb3s23pb. Укажите химический знак
элемента:
1)S; 2) Аг; 3) Cl; 4) Р.
4. Два электрона на внешнем электронном слое в ос-
новном состоянии содержат атомы:
1) Т; 2) D; 3) Не; 4) Са.
5. Одинаковую электронную конфигурацию имеют
частицы:
1) ион О2-; 2) атом Ne;
3) ион N+5; 4) ион СГ7.
6. Десять электронов на третьем энергетическом уров-
не в основном состоянии содержит атом элемента:
1) Са; 2)Ti;3)Ar;-4)Cl.
7. Укажите число незаполненных (полностью свобод-
ных) орбиталей на внешнем электронном слое в атоме
кремния:
1) 1; 2)3; 3)5; 4) 6.
8. Число неспаренных электронов в основном состо-
янии атома элемента, ядро которого содержит 26 прото-
нов, равно:
1)5; 2) 4; 3)3; 4) 2.
66
9. Электронная конфигурация ls22522p63s23p64.s2 от-
вечает:
1) нуклиду 20Ne;
2) основному состоянию атома Sc;
3) основному состоянию атома Са;
4) возбужденному состоянию атома Са.
10. Число протонов в атоме элемента с сокращенной
электронной конфигурацией ... Зс^л2 равно:
1)27; 2) 26; 3)30; 4) 32.
ТЕСТ 6
1. Заполнение р-подуровня происходит в атомах эле-
ментов:
1) К; 2) S; 3) А1; 4) ТЕ
2. Укажите число р- электронов на внешнем элект-
ронном слое в атоме серы:
1)2; 2)4; 3)6; 4) 8.
3. Иону СТ5 отвечает электронная конфигурация:
1) 1522№2р6352; 2) 1522j22p53s23p3;
3) 1.С2г’2р6; 4) l.s22C2p(’3.s'3p\
4. Элемент, в атоме которого в основном состоянии
впервые появляется d-электрон, — это:
1)Сг; 2) Са;
3)Аг; 4) Sc.
5. Сколько орбиталей полностью заполнено электро-
нами в основном состоянии атома кремния?
1) две; 2) три; 3) шесть; 4) семь.
6. Укажите число соответственно протонов и элект-
ронов в ионе А13+:
I) 13 и 13; 2) 13 и 10;
3)10 и 13; 4) 10 и 10.
67
7. В основном состоянии атомов каких элементов
число пар спаренных электронов равно числу неспарен-
ных электронов?
1) Si; 2) Li, 3) С; 4) S.
8. Укажите протонное число атома с сокращенной
электронной конфигурацией ... 3</4У:
1)21; 2) 22; 3) 23; 4) 24.
9. Укажите электронно-графическую схему основно-
го состояния атома:
t t t
2) tl
tt t t
3) Щ |t|t|t| 4) Щ tl f
10. Укажите электронно-графические схемы невоз-
можных состояний атома:
1) [й] Itltitl 2) ® Itltlt
3) tt
t t t
4) tl
tl t
ТЕСТ 7
1. Внешний электронный слой завершен в атомах:
1)0; 2) Не; 3)Аг;4) Са.
2. Максимальное число электронов на внешнем элек-
тронном слое как правило равно:
1)4; 2) 6; 3)8; 4) 18.
3. Укажите число полностью заполненных энергети-
ческих уровней в атоме Fe:
1)4, 2)3; 3)2; 4)1.
4. Укажите число полностью заполненных энергети-
ческих подуровней в атоме Sc:
1)7; 2) 6; 3)5; 4) 4.
68
5. Сколько элементов 3-го периода в основном состо-
янии атома содержат один неспаренный электрон?
1)4; 2)3; 3)2; 4) 1.
6. НЕВОЗМОЖНЫ электронные схемы атомов в ос-
новном состоянии:
1)2, 8, 3,2)2, 6, 4; 3)2, 8, 11; 4) 2, 10, 1
7. Исходя из электронных схем, укажите возбужден-
ное состояние атома:
1) 1, 1; 2) 2, 8, 1,3)2, 8, 3; 4) 2, 8, 8.
8. Одна (и не больше) полностью незаполненная
/2-орбиталь имеется на внешнем электронном слое в ос-
новном состоянии атома:
1)Ве; 2)А1;3)С; 4) Sc.
9. Пять неспаренных электронов появляются при воз-
буждении электронов внешнего электронного слоя
вследствие образования химической связи в атоме:
1) Li; 2)B;3)N; 4)Р.
10. Укажите сокращенную электронную конфигурацию
иона Fe3+:
1) [Ne] 3s23/263tf4s2; 2) [Ne] 3.v3//'3tW;
3) [Ne] 3.y23/?63^4.v2, 4) [Ne] 3s23p63cA
ТЕСТ 8
1. Предпоследний электронный слой заполняется в
атомах элементов:
l)Mg; 2) Cl; 3) Сг, 4) Sc.
2. Одинаковое число р- электронов на внешнем элек-
тронном слое в основном состоянии содержат атомы
элементов.
1) С и Si; 2) Na и Mg; 3) О и S, 4) Ne и Аг.
69
3. Максимальное число неспаренных d-электронов на
данном энергетическом уровне равно:
1)5; 2) 4; 3)3; 4) 2.
4. Укажите максимальное число неспаренных элек-
тронов на данном энергетическом ^-подуровне:
1) 1; 2)3; 3)5; 4) 7.
5. В атоме элемента с электронной схемой в основном
состоянии 2, 8, 5 число неспаренных электронов равно:
1)4; 2)3; 3)2; 4) 1.
6. Ион Sc34 имеет столько же электронов, как и атом-
ные частицы:
1)К; 2)Аг;3)СГ5; 4) СТ1.
7. В основном состоянии все электроны спарены в
атомных частицах:
1)Со;2) Ne; 3)С1; 4) Хе.
8. Ион S2“ содержит:
1)16 протонов и 16 электронов;
2) 14 протонов и 16 электронов;
3) 14 протонов и 18 электронов;
4) 16 протонов и 18 электронов.
9. Укажите порядок заполнения энергетических под-
уровней в атоме скандия:
1) 4л4/?; 2) 3d4s; 3) 4.S.3/X 4) 4s3d.
10. Когда Зр-подуровень заполнен, следующий элек-
трон заполняет подуровень:
1) 3d; 2) 4р; 3) 4.v; 4) 4/
ТЕСТ 9
1. НЕ содержит нейтронов атом:
1)Не;2) ‘H;3)D;4)T.
2. Электронейтральные атомы серы отличаются от
70
электронейтральных атомов других элементов периоди-
ческой системы:
1) номером периода;
2) числом электронов;
3) числом электронов на внешнем электронном слое;
4) числом протонов.
3. Одинаковую электронную конфигурацию имеюг
атомные частицы:
1) Са+2 и СГ7; 2) Sc+3 и СТ; 3) Na и Ne; 4) Не и S+6.
4. Один электрон содержат частицы:
1)Н,; 2) Н;;3)Н+; 4) [Н.
5. Укажите число незаполненных 3<7-орбиталей в ос-
новном состоянии атома Ti:
1)4; 2)3; 3)2; 4) 1.
6. Электронную конфигурацию благородного газа
имеют ионы;
1) Mg2+; 2) Н-; 3) О2~; 4) N~2.
7. Электронейтральный нуклид содержит 21 протон
и 23 нейтрона. Укажите сокращенную электронную кон-
фигурацию нуклида в основном состоянии:
1) ...4л2ЗсР; 2) ...4s24p'; 3) ...4523J'; 4) ...4524/23.
8. Укажите химический знак элемента, в атоме кото-
рого число электронов на 2 больше, чем в ионе S2-:
1) Si; 2) Аг; 3)Са; 4) К.
9. Энергетический 3<7-подуровень заполнен наполо-
вину в основном состоянии атома:
1) V; 2) Сг; 3) Fe; 4) Zn.
10. В порядке возрастания энергии орбитали в атоме
хлора перечислены в ряду:
1) 15, 25, 2/2, 3/2, 3$; 2) 1л, 2s, 2р, 3s, Зр, 3d, 45;
3) 15, 25, 2/2, 35, Зр, 45, 3d', 4) 15, 25, 2/2, 3d, 3s, Зр.
71
ТЕСТ 10
1. На каких энергетических подуровнях могут распо-
лагаться электроны третьего энергетического уровня?
1)5; 2)р; 3)J;4)/
2. Каков заряд ядра атома с сокращённой электронной
конфигурацией в возбужденном состоянии [Ne] Зл'Зр’ЗсР?
1) 16; 2) 18; 3) 19; 4) 20.
3. Такое же число электронов, как и молекула метана,
содержит частица, формула которой:
1) ВН3; 2) ВН4; 3) ВД; 4) ВН4+.
4. Одинаковое число электронов содержат молекулы
(формульные единицы):
l)NaCl;2) F2; 3)NaF; 4) KF.
5. Три энергетических уровня полностью заполнены
электронами в атомных частицах, символы которых:
1)Аг; 2) Br;3)S2-; 4)Rb.
6. Внешний электронный слой полностью заполнен
электронами в атомных частицах, символы которых:
1) Аг; 2) S2-; 3)Мп; 4) Se.
7. Две молекулы азота имеют столько же электро-
нов, как и :
1) 7 молекул Н,; 2) 14 молекул Н2;
3) атом Ni; 4) ион As+5.
8. Чем между собой различаются электроны, находя-
щиеся на 25-подуровне?
1) энергией; 2) формой орбитали;
3) размером орбитали; 4) ориентацией спина.
9. На 15- и Зр- подуровнях находятся по одному элек-
трону. Чем они различаются или могут различаться?
а) энергией; б) ориентацией спина;
в) формой орбитали; г) размером орбитали.
I) а, в, г; 2) б, в, г; 3) а, б, в, г; 4) а, б, в.
72
10. На третьем энергетическом уровне 8 электронов
содержат в основном состоянии атомные частицы, сим-
волы которых:
1)Аг; 2) Са; 3) Sc; 4) S+2.
'ТЕСТИ
1. На 2р-подуровне в основном состоянии атома на-
ходятся два электрона. Что для них одинаково?
1) энергия;
2) ориентация спина;
3) форма орбитали;
4) ориентация орбитали.
2. С ядром наиболее прочно связан электрон, распо-
ложенный на орбитали:
1) 15; 2) 2s; 3) 2р; 4) 35.
3. Наибольшую энергию имеет электрон, расположен-
ный на орбитали:
1) 15; 2) 2s; 3)35; 4)3/?.
4. На внешнем электронном слое число пар спарен-
ных электронов равно числу неспаренных электронов в
основном состоянии атома:
1) С; 2) Se; 3)Мп; 4) Si.
5. Строение атомов элементов третьего периода в
основном состоянии характеризуется:
1) отсутствием 5-орбиталей;
2) отсутствием р-орбиталей;
3) наличием J-орбиталей;
4) отсутствием /-орбиталей.
6. Молекула ]HD отличается от молекулы DT:
1) массой; 2) числом протонов;
3) числом электронов; 4) числом нейтронов.
73
7. На волновые свойства электрона указывают такие
его характеристики (свойства), как.
1) масса;
2) атомная орбиталь;
3)заряд;
4) вероятностный характер движения.
8. Разный заряд ядра, но одинаковое число электро-
нов имеют частицы:
1) атом О и ион F-; 2) атом S и катион Са2+;
3) ион S2- и атом Аг; 4) катион К+ и атом Аг.
9. Укажите число различных характеристик для суль-
фид-иона и сульфит-иона: заряд, масса, массовая доля
атомов серы, общее число электронов:
1)4; 2)3; 3)2; 4) 1.
10. Укажите число электронов в атомах для образца
Mg2+ массой 1,200 г:
1) 3,010 1022; 2) 1,806 • 1023;
3) 3,010-1023; 4) 3,612 - 1023.
ТЕМА 7
Периодическая система химических элементов
ТЕСТ1
1. По химическим свойствам наиболее близки элементы:
1) С и N; 2) В и С; 3) С и Si; 4) Cl и Аг.
2. Укажите физический смысл номера периода в пе-
риодической системе:
1) равен числу протонов в атоме;
74
2) равен общему числу электронов в атоме;
3) показывает число энергетических уровней, на кото-
рых находятся электроны в основном состоянии атома*;
4) равен числу валентных электронов** в атоме.
3. Выберите символы элементов /2-семейства:
1)А1;2)Не; 3)Аг;4)С1.
4. К семейству «/-элементов относятся элементы, сим-
волы которых:
1)К; 2)Fe;3)Cr; 4) Хе.
5. Элемент с атомным номером 88 относится к се-
мейству:
1)5;2)А 3)4 4)/
6. В периодической зависимости при увеличении за-
ряда ядра на единицу изменяются:
1) относительная атомная масса элемента;
2) энергия ионизации атома;
3) восстановительные и окислительные свойства ато-
мов элементов;
4) радиус атомов.
7. В ряду элементов Na, Mg, Al восстановительные
свойства атомов:
1) возрастают;
2) уменьшаются;
3) сначала уменьшаются, затем возрастают;
4) сначала возрастают, затем уменьшаются.
8. В ряду элементов N, О, F окислительные свойства
атомов:
1) уменьшаются;
* Такие энергетические уровни называются электронны-
ми слоями.
** Для элементов групп А это электроны внешнего электрон-
ного слоя; для «/-элементов — это 5-электроны внешнего элект-
ронного слоя и «/-электроны предвнешнего электронного слоя.
75
2) нарастают;
3) сначала нарастают, затем уменьшаются;
4) не изменяются.
9. В группах А расположены элементы:
1) только 5- и р-семейств;
2) только металлы;
3) как металлы, так и неметаллы;
4) только р- и (/-семейств.
10. В группах В расположены элементы:
1) только (/-семейств;
2) только металлы;
3) как металлы, так и неметаллы;
4) как d-, так и /^семейств.
ТЕСТ 2
1. В малых периодах расположены элементы:
1) только металлы;
2) только 5- и р-семейств;
3) только групп А;
4) как главных, так и побочных групп.
2. Укажите физический смысл номера группы в пе-
риодической системе:
1) равен числу электронных слоев в атоме;
2) как правило, равен числу валентных электронов в
атоме;
3) для элементов групп А равен числу электронов на
внешнем электронном слое;
4) равен общему числу электронов в атоме*.
* Здесь и далее, если специально не оговаривается, име-
ются в виду электронейтральные атомы.
76
3. Восстановительные свойства атомов элементов по-
степенно уменьшаются в ряду:
1) В, С, Si; 2) Si, С, В; 3) Si, С, N; 4) С, Si, N.
4. В одном периоде находятся элементы:
1) с подобными химическими свойствами атомов;
2) с одинаковым числом валентных электронов в
атоме;
3) с одинаковым числом электронных слоев в атоме;
4) с одинаковой энергией ионизации атома.
5. Общую формулу летучих водородных соединений
ЭНЧ имеют элементы группы:
1)ПА;2)ША; 3)IVA; 4)VA
6. Какова общая формула летучих водородных соеди-
нений элементов VIА группы?
1) НЭ; 2) Н,Э, 3) ЭН3; 4) ЭН4.
7. Укажите общую формулу высших оксидов элемен-
тов IV А группы:
1) ЭО; 2) Э2О3; 3) ЭО,; 4) Э,О_.
8. Общую формулу высших оксидов Э,О7 имеют эле-
менты группы:
1) III А; 2) IV А, 3) V А; 4) VII А.
9. Укажите символы элементов, формула высших ок-
сидов которых Э,О3:
1)Са, 2) В; 3) Sc; 4) S.
10. В больших периодах расположены элементы:
1) только d- и /-семейств;
2) элементы л-, р-, d- и /-семейств,
3) только А групп;
4) как А, так и В групп.
77
ТЕСТЗ
1. Химический элемент, электронная схема атомов ко-
торого 2, 8,18,2, в периодической системе расположен в:
1) 3-м периоде, IIВ группе;
2) 2-м периоде, IV А группе;
3) 4-м периоде, IIА группе;
4)-4-м периоде, IIВ группе
2. Химический элемент, электронная схема атомов
которого 2, 8, 11, 2, расположен в:
1) 3-м периоде, IIA rpyrtne;
2) 4-м периоде, IIВ группе;
3) 4-м периоде, IIА группе;
4) 4-м периоде, V В группе.
3. В третьем периоде с увеличением атомного номе-
ра химического элемента в целом происходит:
1) уменьшение атомного радиуса;
2) уменьшение энергии ионизации атома;
3) увеличение энергии ионизации атома;
4) увеличение высшей валентности атомов.
4. Радиус атомов возрастает в рядах элементов:
1) Н, Li, Na, 2) Li, Be, В; 3) F, О, N; 4) Se, S, O.
5. В группах А с увеличением атомного номера эле-
ментов наблюдается:
1) усиление восстановительных свойств атомов;
2) увеличение числа валентных электронов;
3) увеличение атомного радиуса;
4) рост числа электронных слоев в атоме.
6. В третьем периоде с увеличением числа электро-
нов на внешнем электронном слое атомов химических
элементов наблюдается:
1) периодическое изменение свойств атомов;
2) рост числа электронных слоев,
78
3) увеличение заряда ядра атома;
4) последовательное изменение формулы водородно-
го соединения, начиная с ЭН до ЭН7, с нарастанием чис-
ла атомов водорода в молекуле на единицу
7. Общее число электронов в атоме элемента с наибо-
лее выраженными окислительными свойствами равно:
1) 1; 2) 7; 3) 8; 4) 9.
8. Укажите символ химического элемента, атом кото-
рого имеет 4 электронных слоя и образует летучее водо-
родное соединение состава ЭН4:
1)С;2) Ge; 3) Si; 4) As.
9. Укажите символ химического элемента, атом кото-
рого имеет 5 электронных слоев и образует высший ок-
сид состава ЭО3:
1)S; 2) Se;3)Te; 4) Sb.
10. Химические элементы с атомными номерами 16 и
34 сходны между собой:
1) формулой высшего оксида;
2) формулой летучего водородного соединения;
3) числом валентных электронов в атоме;
4) числом электронных слоев в атоме.
ТЕСТ 4
1. Укажите атомный номер элемента, образующего
высший оксид и летучее водородное соединение соста-
ва Э2О5, ЭН,:
1) 1; 2) 14; 3) 15; 4) 23.
2. Электроотрицательность последовательно возра-
стает в ряду атомов, символы которых:_
1)C,N, Si; 2) С, Si, N; '
3) N, С, Si; 4) Si, C, N.
79
3. Укажите ряд, в котором символы элементов указа-
ны в порядке возрастания энергии ионизации атомов:
1)N, С, Si; 2) Si, С, N;
3) С, Si, N; 4) C, N, Si.
4. С последовательным возрастанием окислительных
свойств атомов химических элементов электроотрица-
тельность:
1) уменьшается, 2) не изменяется,
3) увеличивается; 4) изменяется периодически.
5. Укажите электронную конфигурацию атома элемен-
та с наиболее выраженными восстановительными свой-
ствами (и > 1):
1) ns1, 2) п&пр2-, 3) n.s’2wp4; 4) ns2np'.
6. Укажите электронную конфигурацию атома элемен-
та с наиболее выраженными окислительными свойства-
ми (и> 1):
1) ns2np?\ 2) ns2np\ 3) п&пр2', 4) ns2.
7. Энергия сродства к электрону наибольшая у ато-
мов химического элемента:
1)Ве; 2) C;3)N; 4)Е
8. Энергия сродства к электрону последовательно
возрастает в ряду атомов элементов, химические сим-
волы которых:
1) Р, S, С1; 2) Р, Cl, S; 3) Cl, S, Р; 4) S, Р, Cl
9. Укажите электронную конфигурацию атома элемента с
наиболее выраженными восстановительными свойствами:
1) 1л'22л,22/?6, 2) l.s22.v22/?63.s'23/?f’3</4.s'2;
3) 1л-22522/?5; 4) 1я22л’22рбЗл’23/Л
10. Укажите электронную конфигурацию атома элемента
с наиболее выраженными окислительными свойствами:
1) [Ne] 3523р5; 2) [Ne] 3s23/?2;
3) [Ne] 3л23/?4, 4) [Ne] 3.s23/A
80
ТЕСТ 5
1. По химическим свойствам наиболее резко отлича-
ются элементы с атомными номерами:
1) 7 и 15; 2) 11 и 17; 3) 18 и 36; 4) 16 и 17.
2. Укажите электронно-графическую схему атома эле-
мента с наиболее выраженными восстановительными
свойствами:
2.v 2р
2s 2р
t
з) |Ц ЕЛ
4) Щ ГИТЕ
3. Укажите электронно-графическую схему атома эле-
мента с наиболее выраженными окислительными свой-
ствами:
3.V 3/2
2) ГЙ] |
Зл- Зр
tl t t
t
t t
4. Радиус атомов возрастает в ряду химических эле-
ментов, знаки которых:
1) Si, К, Na; 2) Na, К, S; 3) Si, Na, К; 4) К, Na, Si.
5. Укажите сокращенную электронную конфигурацию
атомов элементов V А группы:
1) ns'-ripP, 2) ns2np\ 3) ns2np\ 4) (р - 1) dns2.
6. Укажите сокращенные электронные конфигурации
атомов элементов IV В группы:
1) ... 3J24s2; 2) ... 3s'3p\
3) ... (и - 1) d-ns\ 4) ... ns2np2.
7. Укажите верные характеристики элемента, электрон-
ная конфигурация атома которого \s22s22p4 5 6 73s23p63d4s2\
1) металл;
2) находится в 3-м периоде;
81
3) имеет 5 валентных электронов;
4) расположен в группе V В.
8. Укажите правильные характеристики элемента, элек-
тронная конфигурация атома которого 1522.s,22p63s23p5:
1) имеет семь валентных электронов;
2) расположен в 3-м периоде, VIIВ группе;
3) расположен в 4-м периоде, VIIА группе;
4) неметалл.
9. Электронные конфигурации атомов элементов
V А группы — это:
1) [Ne] З.гЗр2; 2) [Ar] 4s24p3;
3) [Ne] 3V3p3; 4) [Ar] 3dAs2.
10. Сходными химическими свойствами обладают
элементы, атомы которых имеют электронные схемы:
1) 2, 8, 3; 2) 2, 3; 3) 2, 8, 5; 4) 2, 8, 6.
ТЕСТ 6
1. Зная положение элемента 1—3-го периодов в пе-
риодической системе, можно предсказать:
1) максимальную валентность атома;
2) число изотопов элемента;
3) формулу высшего оксида;
4) формулу водородного соединения.
2. Кислотные свойства наиболее выражены у окси-
да, формула которого:
1)А19О3; 2)SiO,;
3) РД; 4) SO3“.
3. Основные свойства наиболее выражены у оксида,
формула которого:
1)ВеО; 2)MgO;
3) Na,O; 4)Al2Or
82
4. Электронная конфигурация атома элемента
ls22s22//3s23/j>3. Укажите формулу его водородного соеди-
нения:
1) ЭН; 2) ЭН,; 3) ЭН3; 4) ЭН,.
5. Электронная конфигурация атома элемента
Is22s22p63s23/r. Укажите формулу его высшего оксида:
1) Э,О; 2) ЭО; 3) Э,О3; 4) ЭО,.
6. Высший оксид состава Э,О7 образуют элементы,
электронные конфигурации атомов которых:
1) [Не] 2s22p5; 2) [Ne] 3s23p5;
3) [Ar] 3J54s2; 4) [Ar] 3<P4s2.
7. Водородные соединения состава ЭН, образуют эле-
менты, электронная конфигурация атомов которых:
1) [Не] 2s1; 2) [Ne] 3s2; 3) [Ar] 4s1; 4) [Ar] 4s2.
8. В какой группе периодической системы может нахо-
диться элемент, высший оксид которого имеет состав Э,О7?
1) III А; 2) VII А; 3) V В; 4) VII В.
9. Каковы формулы высшего оксида и отвечающего
ему гидроксида элемента с атомным номером 52?
1) Э,О7; 2) ЭО3; 3) Н,ЭО3; 4) Н6ЭО6.
10. Число элементов 3-го периода, образующих кис-
лотные оксиды, равно:
1)5; 2) 4; 3)3; 4) 2.
ТЕСТ 7
1. Легче остальных перечисленных электрон теряет
атом:
l)Na; 2) Mg; 3)А1;4) Si.
2. Какие утверждения справедливы для последова-
тельности элементов С, N, О?
I) слева направо уменьшается радиус атома;
83
2) слева направо уменьшается электроотрицатель-
ность атомов;
3) справа налево возрастает число электронных слоев;
4) слева направо увеличивается число валентных
электронов.
3. Атом элемента 3-го периода в основном состоя-
нии содержит три неспаренных электрона. Каковы фор-
мулы летучего водородного соединения и высшего ок-
сида элемента?
1) ЭН, и ЭД;. 2) ЭН, и Э,0,;
3) ЭН; и ЭД; 4) ЭН, и Э^о’.
4. Расположенные в одном и том же периоде хими-
ческие элементы Са и Se различаются между собой:
1) числом валентных электронов в атоме;
2) радиусом атома;
3) формулой высшего оксида;
4) числом электронных слоев в атоме.
5. Формула высшего оксида элемента Э,0_. Укажите
формулу его летучего водородного соединения:
1) ЭН; 2) ЭН; 3) ЭН,; 4) ЭН4.
6. Катион некоторого элемента Э3+ имеет электрон-
ную конфигурацию ls22s22p^3s23p6. К какому семейству
относится элемент Э?
1).s;2)7?; 3)J;4)/
7. К какому семейству относш ся элемент, катион которо-
го Э2+ имеет электронную конфигурацию Ь22л,22//Зл,23/Х?
1)5; 2)3)<7;4)/
8. Зная только номер группы А, в которой располо-
жен элемент, можно для него предсказать:
1) формулу водородного соединения;
2) число энергетических уровней в атоме;
3) формулу высшего оксида;
84
4) число валентных электронов в атоме.
9. Фоомула высшего оксида элемента Э,О7. Укажите
электронную конфигурацию валентных электронов ато-
ма элемента:
1) ns2np2', 2) ns2np3; 3) ns2np\ 4) ns2np5.
10. Плотность простейшего водородного соединения
некоторого элемента такая же, как и у кислорода. Ука-
жите сокращенную электронную конфигурацию атома
элемента:
1) ...2s22p2-, 2) ... З.гЗр4; 3) ... З.гЗр2; 4) ... 2s22p\
ТЕСТ 8
1. Формула водородного соединения одинакова для
атомов химических элементов, имеющих сокращенную
электронную конфигурацию:
1) ...35’;2) ... Зл^Зр3; 3) ... З.гЗр4; 4) ... 2s22p3.
2. С ростом атомного номера элементов в VIIА груп-
пе возрастают:
1) радиус атома;
2) число валентных электронов;
3) число электронных слоев в атоме;
4) энергия ионизации атома.
3. Аниону Э2- отвечает электронная конфигурация
атома аргона. Укажите формулы летучего водородного
соединения и высшего оксида элемента:
1) ЭН3 и Э,О_; 2) ЭН, и ЭО3;
3) ЭН и Э,Ь7; 4) ЭН, и ЭО,.
4. В строении атомов S, Se и Сг и их соединений оди-
наково:
1) число электронных слоев в атоме;
2) число валентных электронов в атоме;
85
3) формула высшего оксида;
4) число протонов в атоме.
5. Атомы К отличаются от катионов КГ:
1) размерами; 2) числом протонов;
3) числом электронов; 4) химическими свойствами.
6. Укажите сокращенные электронные конфигурации
атомов элементов металлов:
1) ... 3d’4л2; 2) ... 4s24p4- 3) ... 3s23p5- 4) ... 3d'°4s2.
7. Укажите сокращенные электронные конфигурации
атомов элементов, образующих простейшие водородные
соединения, которые легче воздуха:
1) ...3л23р4; 2) ... 2s22p2; 3) ... 2s22p2; 4) ... 3s23p\
8. Сколько характеристик из числа перечисленных
различны для атома Са и катиона Са2+: радиус, заряд ядра,
число 5-электронов, число р-электронов, число прото-
нов, энергия ионизации?
1)6; 2) 5; 3)4; 4)3.
9. Укажите число справедливых утверждений:
энергия ионизации анионов СГ больше, чем атомов
С1; элементы всех четырех семейств представлены в
5-м периоде; энергия сродства к электрону для атомов
С1 больше, чем для ионов СГ; радиус аниона СГ больше,
чем радиус атома С1:
1)4; 2)3; 3)2; 4) 1.
10. Энергия отрыва второго электрона будет наиболь-
шей для атома элемента:
1) Si; 2) Na; 3)Mg; 4)S;
ТЕСТ 9
1. Укажите символ иона с наименьшим радиусом:
1) Se2“; 2) Вг; 3) Rb+; 4) Sr2+.
86
2. В каком ряду элементов, химические знаки которых
приведены ниже, растет радиус атома?
1) К, Са, Zn, Rb; 2) Са, Zn, К, Rb;
3) Zn, Са, К, Rb; 4) К, Zn, Са, Rb.
3. Номер группы для элементов Мп и С1 одинаков,
так как:
1) оба элемента — металлы;
2) оба элементы — неметаллы;
3) в атомах одинаковое число валентных электронов;
4) радиус атомов обоих элементов одинаков.
4. Катион Li+ и анион Н содержат одинаковое число
электронов. Что вы можете сказать относительно ради-
усов R этих частиц?
1)R(LP)>R(H);
2) R (Н ) > R (Li+);
3) R (Li+) = R (Н);
4) для ответа недостаточно данных.
5. Радиус частиц возрастает в ряду:
1) К, К+, Аг; 2) К+, Аг, К; 3) К, Аг, К+; 4) Аг, К+, К.
6. В порядке увеличения радиусов символы частиц
записаны в рядах:
l)Na,Na+,Cl; 2) Cl, СР, Cl;
3)Li+,F,Na; 4) СР, Cl, СР.
7. В порядке возрастания радиусов символы ионов
приведены в ряду:
1) Са2+, СР, К+; 2) Са2+, К+, СР;
3) К+, Са2+, СР; 4) К+, СР, Са2+.
8. В каких парах радиус первой частицы электро-
нейтрального атома или иона больше, чем второй?
1) Li, С; 2) СР7, СР3; 3) Na, Na"; 4) СР, Cl.
9. Наибольший радиус имеет частица, символ которой:
1)С1; 2) СР; 3) СР; 4)S.
87
10. Укажите символ частицы с наименьшим радиусом:
1)О2"; 2) О; 3) F; 4) Li.
ТЕСТ 10
1. Элементы как d-, так и/^семейств находятся в:
1) 5-м периоде; 2) 6-м периоде;
3) V В группе; 4) IIIВ группе.
2. Радиус частиц последовательно уменьшается в рядах:
1) К, Са, Са2+; 2) К, К+, Са; 3) К, Са, К+; 4) К, К+, Са2+.
3. Энергия ионизации зависит от:
а) заряда ядра атома; б) числа отрываемых электронов;
в) радиуса атома; г) для иона от его заряда.
1) а, б, в; 2) б, в, г; 3) а, б, г; 4) а, б, в, г.
4. В ряду химических элементов N, Р, As, Cl НЕ являет-
ся химическим аналогом остальных элементов этого ряда:
1)N;2) Р; 3)As; 4) Cl.
5. Укажите НЕСПРАВЕДЛИВЫЕ утверждения:
1) во всех периодах 1—6 неметаллов больше, чем ме-
таллов;
2) все периоды начинаются щелочным металлом;
3) не все периоды содержат р- элементы;
4) все элементы без исключения в периодической си-
стеме расположены в порядке возрастания А,.
6. Сколько элементов третьего периода образуют гид-
роксиды, которые в химических реакциях могут прояв-
лять кислотные свойства?
1)6; 2) 5; 3)4; 4)3.
7. Сколько элементов третьего периода образуют гид-
роксиды, которые в химических реакциях могут прояв-
лять основные свойства?
1)4; 2)3; 3)2; 4) 1.
88
8. НЕ образует летучих водородных соединений (н. у.)
элемент:
1) С; 2) Cl; 3)N; 4) Na.
9. К естественному семейству элементов можно от-
нести:
1) легкоплавкие металлы; 2) цветные металлы;
3) благородные газы; 4) галогены.
10. Укажите справедливые утверждения:
1) элементов металлов больше, чем элементов неме-
таллов;
2) каждый период содержит ^-элементы;
3) элементы s-, р-, d- и /^семейств представлены в
IIIВ группе;
4) VIIА группа состоит только из ^-элементов.
ТЕСТ 11
1. Свойства гидроксидов в последовательности амфо-
терный — кислотный — основный изменяются в ряду:
1) H,SiO3, Ве(ОН)„ КОН;
2) H,SiO3, КОН, Ве(ОН)2;
3) А1(ОН)3, Н3РО4, Са(ОН)2;
4) Zn(OH)2, Ва(ОН),, H,SO4.
2. Свойства оксидов в последовательности основный,
амфотерный, кислотный изменяются в ряду:
1) Na,О, SO3, А1,О3; 2) Na,О, А1,О3, SO3;
3) SiO,, CaO, ZnO; 4) Bab, P,65, C12O_.
3. Энергия связи в молекуле дейтерия равна440 кДж/моль,
а энергия ионизации атомов дейтерия составляет 1330
кДж/моль. В процессе D —» 2D+(r) для молекул дейте-
рия массой 1,0 г затрачивается количество энергии (кДж):
1) 442,5; 2) 665,0; 3) 775,0; 4) 1770.
89
4. Укажите справедливые утверждения:
1) для элементов 3-го периода число гидроксидов с
кислотными свойствами больше, чем число гидрокси-
дов с основными свойствами;
2) в третьем периоде свойства гидроксидов изменя-
ются в последовательности: щелочь —> нерастворимое
основание —> амфотер —> кислота;
3) число известных элементов s-семейства больше, чем
число известных элементов /7-семейства;
4) все элементы J-семейства относятся к металлам
5. Справедливыми будут утверждения:
1) все элементы/?-семейства относятся к неметаллам,
2) среди известных элементов /7-семейства больше не-
металлов, чем металлов;
3) не все элементы s-семейства являются металлами;
4) элементы s-семейства находятся только в группах
1АиПА.
6. Число элементов 3-го периода, в атомах которых в
основном состоянии содержатся два неспаренных элек-
трона, равно:
1)4; 2)3; 3)2; 4) 1
7. Число элементов 3-го периода, в атомах которых в
основном состоянии НЕТ неспаренных электронов, рав-
но:
1)4; 2)3; 3)2; 4) 1.
8. Сколько характеристик будут разными для атома С1 и
иона С1“: энергия ионизации, радиус, энергия сродства
к электрону, заряд ядра, число электронных слоев?
1)5; 2) 4; 3)3; 4) 2.
9. Наибольшее число неспаренных электронов содер-
жится в основном состоянии атома элемента:
1)Мп; 2) N;3)C1; 4) Сг.
/
90
т
10. Энергия связи в молекуле брома равна 190 кДж/моль,
а энергия сродства к электрону атомов брома составля-
ет 325 кДж/моль. В процессе Вг2(г) —> 2Вт(г) для брома
массой 1,6 г:
1) выделяется 6,5 кДж энергии;
2) поглощается 6,5 кДж энергии;
3) выделяется 4,6 кДж энергии;
4) поглощается 4,6 кДж энергии.
ТЕСТ 12
1. Атом металла имеет электронную конфигурацию
[Ne]3y!3pl. Укажите формулу сульфата металла:
1) Me2SO4; 2) MeSO4; 3) Me2(SO4)3; 4) Me(SO4)2.
2. Укажите формулу сульфида металла, электронная
конфигурация атомов которого [ Аг]4л ':
1) Me2S; 2) MeS; 3) Me2S3; 4) MeS2.
3. Укажите формулу фосфата металла с электронной кон-
фигурацией внешнего электронного слоя атома [ Аг]3б/'4№:
1) Ме3РО4; 2) Ме3(РО4)2; 3) МеРО4; 4) Ме3(РО4)4.
4. Укажите число одинаковых характеристик для ато-
мов элементов Na, Al, Р: число электронных слоев, энер-
гия ионизации, радиус, число х-электронов, число ва-
лентных электронов, число 2/;-электронов:
1)5; 2) 4; 3)3; 4) 2.
5. Число одинаковых характеристик из перечисленных
(радиус атома, число электронных слоев, число валент-
ных электронов, формула летучего водородного соедине-
ния, энергия ионизации) для элементов Cl, Br, I равно:
1)5; 2)4; 3)3; 4) 2.
6. Основные свойства наименее выражены у оксида:
1) MgO; 2) А12О3; 3) ВаО; 4) ЦО.
91
7. Укажите формулу оксида дейтерия:
1) DO; 2) D,O; 3) D,O3; 4) DO,.
8. Укажите символ элемента, образующего ион ЭО3
и соединение Ва3Э,:
1)N;2) Р; 3) S; 4) Si.
9. Справедливыми являются утверждения:
1) энергия сродства к электрону для атомов С1 боль-
ше, чем для ионов С1~;
2) энергия отрыва второго электрона для атомов ка-
лия больше, чем для атомов кальция;
3) энергия ионизации ионов Na+ больше, чем атомов Na;
4) радиус иона Са2" больше, чем радиус атома Аг.
10. Укажите справедливые утверждения:
1) радиус иона Na+ больше радиуса иона Li+;
2) радиус иона Mg2+ меньше радиуса иона Na";
3) радиус иона S2 больше радиуса иона S+6;
4) радиус иона As+3 меньше радиуса иона As+5.
ТЕМА 8
Природа и типы химических связей.
Ковалентная связь
ТЕСТ1
1. Укажите формулы соединений с ковалентной связью:
1) Н,О; 2) NaCl; 3) NH3; 4) К,О.
2. Ковалентная связь образуется, когда между собой
взаимодействуют атомы элементов:
1)НиС; 2)NhN;
3) N и О; 4) Li и F.
92
3. Формулы трех веществ с ионной связью приведе-
ны в ряду:
1) NaCl, КОН, Cs,O; 2) K,SO4, RbCl, HF;
3) NH4NO3, CaSO4, N,; 4) K,O, Cs3PO4, НэОэ.
4. Общие электронные пары формируются при взаи-
модействии между собой атомов элементов:
1) Н и О; 2) К и F; 3) N и Н; 4) Cs и О.
5. Ковалентная неполярная связь образуется между:
1) атомами металлов;
2) атомами разных неметаллов;
3) атомами типичного металла и типичного неметалла;
4) атомами одного неметалла.
6. Укажите формулы веществ с ковалентной неполяр-
ной связью:
I) N2; 2) NH3; 3) NO; 4) О2.
7. Ионная связь образуется между:
1) атомами металлов;
2) атомами различных неметаллов;
3) атомами типичного металла и типичного неметалла;
4) атомами одного неметалла.
8. Укажите тип химической связи в KF:
1) металлическая;
2) ионная;
3) ковалентная неполярная;
4) ковалентная полярная.
9. Ковалентная полярная связь образуется между
атомами:
1) металлов;
2) одного неметалла;
3) разных неметаллов;
4) активных металлов и активных неметаллов.
10. При взаимодействии между собой атомов элемен-
тов с электронными конфигурациями 1522522р635‘ и
— 93 —
l.s22.s’23p5 образуется химическая связь:
1) металлическая; 2) ковалентная полярная;
3) ионная; 4) ковалентная неполярная.
ТЕСТ 2
1. Укажите тип химической связи в соединении кис-
лорода с элементом, атом которого имеет электронную
схему 2, 8,4:
1) металлическая; 2) ковалентная полярная;
3) ионная; 4) ковалентная неполярная.
2. Посредством ковалентной неполярной связи обра-
зовано вещество:
1) хлороводород; 2) оксид серы (IV); 3) бром; 4) вода.
3. Только ковалентная полярная связь образуется в
веществах, формулы которых:
1) NH3, СО,; 2) NO, N,; 3) F,, KF; 4) K,SO4, H,SO4.
4. Только ионная связь образуется в веществах, фор-
мулы которых:
1) HF, KF; 2) КОН, КС1; 3) CaO, CaF,; 4) NaOH, Н,О.
5. Укажите ряд, в котором представлены формулы ве-
ществ последовательно с ковалентной полярной, кова-
лентной неполярной и ионной связями:
1)HC1,F„KC1; 2) Вг„ НВг, КВг;
3) NH3, NaF, N,; 4) N,', N,O3, CaO.
6. Химическому элементу Э, образующему соедине-
ние с ионной связью состава Э2О, отвечает электрон-
ная конфигурация:
1) ls22.v'; 2) 1522522//’3523p4;
3) ls22s22p('3s23p3; 4) ls225’22p(’3523//.
7. Химическому элементу Э, образующему с кислоро-
дом бинарное соединение с ковалентной полярной свя-
94
зью, отвечает электронная конфигурация:
1) 1№25’'; 2) 1л'225'22р63л'2;
3) ls22s22p5; 4) ls22s22p63s23p64s’.
8. Укажите число общих электронных пар в молекуле NH3:
1)4; 2)3; 3)2; 4) 1.
9. Три общие электронные пары образуются в каждой
из молекул, формулы которых:
1) СН4 и Н2О; 2) NH3 и N,; 3) H,S и РН3; 4) О, и СОЭ.
10. Химическому элементу Э, образующему с фтором
соединение с ионной связью состава 3F„ отвечает элек-
тронная конфигурация:
1) 1х22х22р4; 2) 1522522/2635';
3) 1522s22p6352; 4) 1522522р63523р:’.
ТЕСТЗ
1. Одна общая электронная пара образуется в моле-
кулах:
1) NH3 и НС1; 2) Н2 и Вг2; 3) НС1 и N2; 4) N2 и СН4.
2. Укажите формулу соединения с ковалентной поляр-
ной связью, в молекуле которого образуются три общие
электронные пары:
1) N,; 2) NH3; 3) СН4; 4) Н7О.
3. В молекуле углекислого газа число общих электрон-
ных пар равно:
1)4; 2)3; 3)2; 4) 1.
4. Укажите электронную формулу молекулы азота*:
1) N :: N ; 2) • N ::: N •; 3) : N ::: N :; 4) : N :: N : .
5. Электронную формулу m: n: m имеет молекула:
1) углекислого газа; 2) воды;
* В подобных заданиях с помощью точек показаны все
связывающие и неподеленные пары электронов.
95
3) фторида кислорода (II); 4) оксида хлора (I).
6. Укажите электронную формулу молекулы аммиака:
1) m : п : ш; 2) m :: п :: ш; 3) m : п : ш; 4) m : п : ш.
m m m m
7. Электронной формуле m :: n :: m отвечает моле-
кула:
1) аммиака; 2) воды;
3) углекислого газа; 4) оксида брома (I).
8. Укажите электронную формулу молекулы хлорово-
дорода:
2)m::n:; 3)m:n«; 4)m:ii:.
9. Электронной формуле : ii: ii: отвечает молекула:
1) водорода; 2) кислорода; 3) азота; 4) хлора.
10. Укажите электронную формулу молекулы метана:
m m
2)m-n«m;
m m
™ m -
3)m::n::m; 4) : m : n : m :.
m “
ТЕСТ 4
1. Электронной формуле [n]_| [: m :]_| отвечает форму-
ла вещества:
1)Н,О; 2) HF;
3) KF; 4) NH3.
2. Укажите электронную формулу молекулы водорода:
1) m:: m; 2): m: m:; 3) m : m; 4) m : m .
96
3. Электронной формуле [п]+2 отвечает
формула вещества:
1) SiO2; 2) СО,; 3) СаС1,; 4) СаО.
4. За счет перекрывания между собой только 5-орби-
талей ковалентная связь образуется в молекуле:
1) HF; 2) Н,; 3) NH3; 4) Н,О.
5. Только р-орбитали перекрываются между собой,
когда образуется ковалентная связь в молекуле:
1)Н,; 2)СН4;3)С12; 4) НС1.
6. За счет перекрывания 5- и р-орбиталей образуется
химическая связь в молекулах:
1) С12; 2) HF; 3)Н,О;4) Н2.
7. Одна неподеленная пара электронов содержится в
молекуле:
1)Н,; 2)NH3;3) СН4; 4) Н2О.
8. Не имеют неподеленных электронных пар молекулы:
1) аммиака; 2) воды; 3) водорода; 4) метана.
9. Две неподеленные электронные пары содержатся
в молекуле:
1) аммиака; 2) воды; 3) метана; 4) хлора.
10. Укажите число неподеленных электронных пар в
молекуле хлора:
1)6; 2) 5; 3)4; 4)3.
ТЕСТ 5
1. Укажите число неподеленных электронных пар в
молекуле углекислого газа:
1)5; 2) 4; 3)3; 4) 2.
2. Наибольшее число неподеленных электронных пар
содержит молекула:
1) воды; 2) хлора; 3) метана; 4) аммиака.
4 Зак, 1530
97
3. Соответственно одна, две и четыре неподеленные
электронные пары содержатся в молекулах, формулы
которых:
1) Н„ И,О, NH3; 2) NH3, Н,О, СО,;
3) HF, С1„ СН4; 4) NH3, BF, SO,.'
4. Одинаковое число неподеленных электронных пар
содержат молекулы:
1)НС1иС1,; 2) NH3 и Н,О;
3) СО, и Н,О; 4) СО и Н,Ь.
5. Пять неподеленных электронных пар содержит
молекула:
1) BF; 2) СО,; 3) SO,; 4) НВг.
6. Укажите электронную формулу молекулы СО:
1):С::О:;2)С :::О;3):С ::: О :; 4) С::: О .
7. При образовании молекулы азота между собой пе-
рекрываются орбитали типа:
1) 5; 2) /?; 3) <7; 4) 5- и р-.
8. Укажите химические знаки элементов, с которыми
атом хлора образует ковалентные полярные связи:
1) Са; 2) С; 3) Н; 4) О.
9. К образованию ковалентных связей наиболее скло-
нен элемент, символ которого:
1) Li; 2) Mg; 3)Ве; 4) Na.'
10. При перекрывании между собой s-орбиталей мо-
жет (могут) образоваться химическая связь (связи):
1) только а- типа; 2) только л-типа;
3) а- и л-типа; 4) 5-типа.
98
ТЕСТ 6
1. При перекрывании между собой ^-орбиталей мо-
жет (могут) образоваться химическая связь (связи) типа:
1) только а; 2) только я; 3) а и л; 4) 5.
2. Общие электронные пары смещены к атому кисло-
рода в молекулах:
1)Н2О; 2) NO;3)OF2; 4) С12О.
3. Сколько в сумме электронов от атома азота и водо-
рода участвуют в образовании химической связи в мо-
лекуле аммиака?
1)8; 2) 6; 3)4; 4) 2.
4. Все связи a-типа в молекулах:
1)Н2О; 2)N2;
3)NH3; 4) СО2.
5. Две a-связи содержатся в молекулах:
1)Н2; 2) СО2;3)Н2О; 4) N,.
6. Связь л-типа содержится в молекулах:
1)СН4; 2) N7;
3) NH3; 4) СО2.
7. Связь л-типа образуется во всех молекулах ряда:
1) N2, СО,, СН4; 2) SO2, SO3, СО7;
3)Н2,НС1,Н2О; 4)СС14,СН4,С12.
8. Связи обоих типов (а- и л-) присутствуют в моле-
кулах:
1)Н2; 2) CH4;3)N2;4) СО2,
9. Все связи ковалентные полярные в молекулах:
1) СН4; 2) Н2О; 3) NH3; 4) Н2О7.
10. Охарактеризуйте связь в молекуле азота:
1) тройная; 2) 2а и 1л;
3) 1 а и 2л; 4) ковалентная неполярная.
99
ТЕСТ 7
1. Охарактеризуйте связь в молекуле воды:
1) водородная; 2) ковалентная полярная;
3)2а; 4) 1а и 1л.
2. Число ковалентных связей наибольшее в молекуле:
1) NH3; 2) СН4; 3) Н,О; 4) N,.
3. Число ковалентных связей одинаково в молекулах:
1) СН4 и NFL; 2) СН4 и СО2; 3) N2 и NFL; 4) BF и Н2О2.
4. Охарактеризуйте химические связи в молекуле СОЭ:
1) 1а и 1л; 2) 2а и 2л; 3) 1л и За; 4) 4а.
5. Укажите формулу молекулы, содержащую За- и 371-
связи:
1) СО2; 2) SO2; 3) SO3; 4) NH3.
6. Две а- и две л-связи содержат молекулы:
1) N,; 2) СО?; 3) Н2О2; 4) HCN.
7. Одновременно ионные и ковалентные связи содер-
жатся в:
1) хлориде бария; 2) гидроксиде калия;
3) хлориде аммония; 4) сульфате натрия.
8. Укажите формулы веществ, содержащих как ион-
ные, так и ковалентные связи:
1) KF; 2) NH4NO3; 3) NaOH; 4) BaO.
9. Меньше электронов, чем протонов, содержат час-
тицы:
1) метильный радикал; 2) ион гидроксония;
3) катион аммония; 4) сульфид-ион.
10. Только ионные связи присутствуют в:
1) оксиде калия; 2) фосфате натрия;
3) гидроксиде натрия; 4) фториде цезия.
— 100 —
ТЕСТ 8
1. Только по обменному механизму ковалентные свя-
зи образованы в:
I) молекуле воды;
2) ионе аммония;
3) молекуле аммиака;
4) молекуле фторида бора (III).
2. По донорно-акцепторному механизму химическая
связь образуется в молекулах (ионах):
1) H3N BF3; 2) Н3О+; 3) NH3; 4) СО7.
3. Атом с электронной конфигурацией 1 л22№2/?3 может
образовать ковалентных связей по обменному механизму:
1) четыре; 2) три; 3) две; 4) одну.
4. Атом с электронной конфигурацией 1 .s22.v22p4 может
образовать ковалентных связей по обменному механизму:
1) четыре; 2) три; 3) две; 4) одну.
5. Только одну ковалентную связь по обменному ме-
ханизму могут образовать атомы элементов:
1)N; 2)Н;3)С1;4)О.
6. Три связи по обменному механизму и одну по до-
норно-акцепторному может образовать атом:
1) С; 2) О; 3) N; 4) Е
7. Две связи по обменному механизму и две по до-
норно-акцепторному может образовать атом:
1) Н; 2) F; 3) О; 4) Li.
8. При образовании химической связи в роли акцеп-
тора электронной пары могут выступать:
1) атом Н; 2) ион Н+; 3) анион Н~; 4) молекула BFr
9. При образовании химической связи в качестве до-
нора электронной пары могут выступать:
1) атом Н; 2) анион Н ;
101
3) молекула NH3; 4) молекула СН4.
10. Связь, образованная по донорно-акцепторному
механизму, присутствует в частицах*:
1) HNO3; 2) Н,О; 3) NH3; 4) СО.
ТЕСТ 9
1. Ковалентная связь, образованная по донорно-ак-
цепторному механизму, присутствует в частицах:
1) H3N • BF3; 2) BF; 3) СО,; 4) NHr
2. Сколько частиц из числа указанных [CH3NH3]C1,
HNO3, СО, (СН3),0 • BF, СО,, BF содержат ковалентную
связь (связи), образованную по донорно-акцепторному
механизму?
1) шесть; 2) пять; 3) четыре; 4) три.
3. Укажите число ковалентных неполярных связей в
молекуле гидразина:
1)4; 2)3; 3)2; 4) 1.
4. В ионе аммония:
1) содержатся 10 электронов;
2) все связи образованьгпо обменному механизму;
3) все связи о-типа;
4) одна связь образована по донорно-акцепторному
механизму, а три — по обменному.
5. Ион гидроксония содержит:
1) 11 электронов;
2) 2а- и 1л- связь;
3) За- связи;
4) связи, образованные только по донорно-акцептор-
ному механизму.
* Строение молекулы HNO3 рассматривайте с позиций
школьного учебника.
--- 102 ----
6. Укажите формулы частиц, в которых две связи об-
разованы по обменному механизму, а одна по донорно-
акцепторному:
1) Н3О+; 2) СО; 3) BF; 4) NH4+.
7. Одинаковое число неподеленных пар электронов
содержат молекулы:
1) N?H4 и BF; 2) NH,OH и СО,;
3) SO, и NH,OH; 4) N,H4 и СО.
8. Охарактеризуйте химическую связь в молекуле BF:
1) донор электронов - атом F;
2) все связи образованы по обменному механизму;
3) одна связь образована по обменному механизму, а
две — по донорно-акцепторному;
4) две связи образованы по обменному механизму, а
одна — по донорно-акцепторному.
9. Укажите формулы полярных молекул ( диполей):
1) НС1; 2) Н,; 3) N,; 4) NO.
10. Неполярными являются молекулы:
1)СО2; 2)NH3;
3) Н2О; 4) СН4.
ТЕСТЮ
1. Укажите суммарное число общих электронных пар
в молекуле оксида серы (VI):
1)3; 2) 4; 3)5; 4) 6.
2. Сколько электронов в сумме участвует в образова-
нии химических связей в молекуле серной кислоты?
I) 12; 2) 14; 3) 16; 4) 18.
3. Связи полярные, а молекула — нет в случаях:
1)ВеС1,; 2)NH3;
3)BF3;’ 4) СН4.
103 —
4. Укажите число ковалентных полярных связей в
молекуле гидроксил амина:
1)4; 2)3; 3)2; 4) 1.
5. Формулу правильного тетраэдра имеют частицы:
1) СН3С1; 2) NH4+; 3) СН,С1,; 4) СВг4.
6. Формулу искаженного тетраэдра имеет частица:
1) СН4; 2) NH3; 3) NH4+; 4) CHBr,.
7. Ядра всех атомов лежат на одной прямой в моле-
куле:
1) Н,О; 2)NH3;3) СО,; 4) СН4.
8. В одной плоскости находятся ядра всех атомов в
случае:
1)NH3; 2)NH4+; 3) BF3; 4) Н3О+.
9. Сколько электронов участвует в образовании 71-свя-
зей в молекуле BF?
1)2; 2) 4; 3) 6; 4)8.
10. Линейное строение имеют молекулы:
1) Н,О; 2) ВеС12; 3) СО,; 4) HCN.
ТЕСТ 11
1. Формулу плоского треугольника имеют частицы:
1) SO3; 2) NH3; 3) BF3; 4) Н3О\
2. Атом кислорода является акцептором электронной
пары в составе:
1) СО; 2) HNO3; 3) Н,О+; 4) Н,О,.
3. Атом кислорода является донором электронной
пары в составе частиц, формулы которых:
1) СО; 2) Н,0 ; 3) Н3О+; 4) СО,.
4. Ковалентная связь по донорно-акцепторному ме-
ханизму образуется при взаимодействии между собой:
1) атомов Н и С1;
104 ----
2) молекулы ВН3 и аниона Н
3) молекул BF3 и NH3;
4) атомов К и F.
5. Длина связи углерод-кислород возрастает в ряду
молекул:
1) СО, СО,, СН,ОН; 2) СО, CFL.OH, СО,;
3) СН3ОН, СО2, СО; 4) СО,, СО, СН3ОН.
6. Имеет линейное строение и неполярна молекула:
1) HCN; 2) СО,; 3) СН4; 4) BF3.
7. Неспаренный электрон содержат частицы, форму-
лы которых:
1) С1О2; 2) NH/; 3) NO; 4) NO,.
8. Связь Э-Н наиболее прочная в молекуле:
1) NH3; 2) РН3; 3) AsH3; 4) BiH3.
9. Наибольшее число (5-связей содержится в молекуле:
1)H,SO4; 2) Н3РО4; 3) IF7; 4) Sg.
10. Укажите формулу наименее термически устойчи-
вого водородного соединения:
1) Н2О; 2) H2S; 3) H2Se; 4) НДе.
ТЕСТ 12
1. Охарактеризуйте ковалентную связь:
1) направленная;
2) ненасыщенная;
3) может быть G- и д-типа;
4) может быть только о-типа.
2. Число общих электронных пар равно числу непо-
деленных электронных пар в молекуле:
1) NH3; 2) СО,; 3) SO,; 4) СО.
3. Укажите электронную формулу молекулы SO2:
1)6: S:O; 2)6::S::O;
•• • • •• ••
105 ----
3)0::S::0; 4)0::S::0.
4. Кратные связи имеются в составе молекул:
1) HCN; 2) РН3; 3) НС1; 4) NO.
5. Длина связи уменьшается при переходе от:
l)CH4KSiH4; 2)PF5kPC15;
3) BrF3 к C1F3; 4) SiCl4 к SnCl4.
6. Степень полярности связи последовательно воз-
растает в рядах молекул:
1) НС1, НВг, HF; 2) H2Se, H,S, Н7О;
3) Н,О, H2S, H2Se; 4) HI, НВг, НЕ
7. Эффективный заряд на атоме водорода последова-
тельно возрастает в ряду молекул:
1) РН3, Н,О, NH3; 2) H2Se, H,S, Н2О;
3) СН4, NH3, HF; 4) СН,, SiH4, NH3.
8. Одинаковое число л-связей содержат молекулы:
1)Р4; 2)N2; 3) СО; 4) СО2.
9. В ряду молекул SiH4, SnH4, СН4 их термическая ус-
тойчивость:
1)растет;
2) уменьшается;
3) сначала растет, затем уменьшается;
4) сначала уменьшается, затем растет.
10. Степень полярности и энергия связи в ряду мо-
лекул H2Se, H,S, Н,О:
1) уменьшаются;
2) возрастают;
3) полярность связи растет, а энергия уменьшается;
4) полярность связи уменьшается, а энергия растет.
106 —
ТЕСТ 13
1. Все связи ковалентные полярные в составе соеди-
нений, формулы которых:
1) Н2О; 2) Н,О2; 3) N2H4; 4) CO(NH2)2.
2. Укажите формулу молекулы с наибольшим числом
ковалентных связей:
1)NH,;2)CH4;3)P4;4)N2.
3. Одинаковое число ковалентных связей содержится
в молекулах (ионах):
1) N, и BF; 2) CO(NH,)7 и H7SO4;
3) Н2о2 и Н3О"; 4) сн4 и H3N • BFr
4. Только a-связи содержатся в молекулах (ионах):
1) Н,О+; 2) BF; 3) BF3 • NH3; 4) NH4. *
5. Йаибольшее число связей, образованных по донор-
но-акцепторному механизму, содержится в составе:
1) СО; 2) BF; 3) HNO3; 4) NH4.
6. Столько же электронов, как и молекула метана, со-
держат частицы:
1)ВН3;2) ВН4“; 3) ВН4+;4)Н2О.
7. Прочность химической связи в ряду молекул F2,0,,
N,последовательно:
1) уменьшается;
2)возрастает;
3) сначала уменьшается, затем возрастает;
4) сначала возрастает, затем уменьшается.
8. Только ковалентные полярные связи содержатся в
составе:
1) гидроксида бария; 2) углекислого газа;
3) нитрата аммония; 4) оксида фосфора (V).
9. Какая связь в молекуле гидроксилам ина NH,OH
наиболее полярна?
1)Н —N; 2)0 —N;
107 ----
3) Н — О; 4) полярность связей одинакова.
10. Энергия связи возрастает в ряду молекул (обнару-
жены в газовой фазе):
1) HgCl — HgBr—HgF; 2) HgBr — HgCl — HgF;
3) HgF — HgCl — HgBr; 4) HgCl — HgF — HgBr.
ТЕСТ 14
1. Связь H - элемент наиболее поляр на в составе мо-
лекулы:
1)СН4; 2) НС1; 3)H,S;4) Н,О.
2. Одинаковое число л-связей содержат молекулы: <
1)СО; 2) СО,; 3) BF; 4) NO.
3. Энергия химической связи зависит от:
1) длины;
2) кратности;
3) способа перекрывания орбиталей;
4) массы взаимодействующих атомов: чем она боль-
ше, тем связь прочнее.
4. Пирамидальное строение имеют:
1) NH3 и BF3; 2) NH3 и Н3О+;
3) Н3О+ и СО2; 4) СО, и BF3.
5. Энергия связи в молекуле трития равна 443 кДж/моль.
Согласно уравнению Эйнштейна для процесса 2Т —» Т,(г)
с участием атомов трития массой 120 г масса молекул три-
тия меньше массы атомов трития на (в г):
1) 1,968-10 7; 2) 9,84 10-8;
3)9,84-10-7; 4) 1,968-ЮЛ
6. В ряду молекул SiCl4 — РС13 — SCI, степень поляр-
ности химической связи:
1)растет;
2) уменьшается;
--- 108 ----
3) сначала растет, затем уменьшается,
4) сначала уменьшается, затем растет.
7. В составе перманганата калия присутствуют связи:
1) металлические; 2) ионные;
3) ковалентные полярные; 4) водородные.
8. Прочность связи Н - элемент сначала растет, а за-
тем ослабевает в рядах молекул:
1) HF, НС1, НВг; 2) NH3, РН3, SbH3;
3) Н,Те, Н2О, H2S, 4) SiH4, СН4, GeH4
9. Длина связи возрастает в рядах молекул:
1) F2, BrCl, Br,; 2)I2,Br,,F„
3) Cl,, BrCl, IC1; 4) СО, BO,'SiO.
10. В каких молекулах атом, символ которого выде-
лен, НЕ содержит неподелениых пар электронов?
1) PF3; 2) SO3, 3) СН4; 4) Н2О.
ТЕСТ 15
1. Акцепторами электронной пары при образовании
химической связи могут выступать атомы элементов:
1) F; 2) С; 3) О; 4) В.
2. Донорами электронной пары при образовании хи-
мической связи могут выступать частицы:
1) атом Н; 2) Fy; 3) N; 4) ОН.
3. Связи л-типа с участием атома серы образуются в
молекулах:
1) H,S; 2) H,SO4, 3)SO3; 4) S8.
4. Связи л-типа с участием атома азота образуются в
молекулах:
1) N2H4; 2) HNO3; 3) NH2OH; 4) NO.
5. Атом углерода участвует в образовании л-связей в
молекулах:
1) СН4; 2) СО; 3) СО2, 4) СД
— 109 —
6. Энергия связи последовательно уменьшается в ряду
молекул:
1) F,, О2, СО; 2) СО, F2, О2;
3) 6,, СО, F,; 4) СО, О,, F,.
7. Укажите формулы полярных молекул:
1) СН3С1; 2) СВг4; 3) BF3; 4) SO,.
8. Неполярными являются молекулы:
1) NH3; 2) BeF,; 3) ВС13; 4) SO3.
9. Кратные связи присутствуют в молекулах:
1)H,N BF3; 2) СО;
3)BF; 4)СН,С1,.
10. Как донором, так и акцептором электронов при
образовании химической связи могут в молекулах выс-
тупать атомы элемента:
1)0; 2)Н; 3) F; 4) Не.
ТЕСТ 16
1. Диполями являются обе частицы:
1) O2N —<О>— он и NHJ;
2) Н3О+ и ЫН4;
3) Cl —С1 и СН,С1,;
4) СН3ОН и NO2.
2. Одновалентный атом кислорода имеется в составе:
1) Н2О,; 2) HNO3; 3) Н3О+; 4) СО.
3. Угловое строение имеют молекулы:
1) Н,О; 2) SO,; 3) ВеН,; 4) СО,.
4. Строение в виде плоского треугольника имеют мо-
лекулы:
1)Н,О,; 2) BF3; 3) SO3; 4) Р4.
НО —
5. Одинаковыми для молекулы NH3 и иона NH,' яв-
ляется (являются):
1) число неподеленных пар электронов;
2) валентность атома азота;
3) степень окисления атома азота;
4) общее число протонов в атомах.
6. Что одинаково для молекул N, и NI13?
1) степень окисления атома азота;
2) механизм образования связей;
3) валентность атома азота;
4) число неподеленных пар электронов.
7. Для реакции NH3 + HBr = NH4Br укажите верные
утверждения:
1) аммиак — донор электронов;
2) аммиак — окислитель;
3) степень окисления атома азота не изменяется;
4) валентность атома азота возрастает на единицу.
8. Донорами электронной пары при образовании хи-
мической связи могут быть молекулы или ионы:
1) Н2О и СН4; 2) NH3 и Н,О;
3) Н+ и Н ; 4) Н- и СО?
9. Число ковалентных связей, образованных по донор-
но-акцепторному механизму, одинаково в частицах:
1) СО и Н3О+; 2) Н3О" и NH4+;
3) BF и (СН3)2О • BF3; 4) HNO, и [CH3N+H3]CF.
10. Охарактеризуйте строение и свойства иона ам-
мония:
1) НЕ может быть донором электронов;
2) ион является диполем;
3) все связи образованы по обменному механизму;
4) содержит столько же электронов, как и атом неона.
Ill
ТЕСТ 17
1. Укажите число л-связей в молекуле высшего гид-
роксида элемента с электронной конфигурацией атома
[Ne] 3s23p5:
1)4; 2)3; 3)2; 4) 1.
2. Максимальное число орбиталей, которые атом кис-
лорода может использовать для образования химичес-
ких связей, равно:
1)4; 2)3; 3)2; 4) 1.
3. Кратные связи в молекуле могут образоваться, ког-
да между собой с образованием бинарных соединений
взаимодействуют атомы:
1)HhN; 2) С и О;
3) N и N; 4) С и Н.
4. Кратные связи в молекуле НЕ могут сформировать-
ся, когда между собой с образованием бинарных соеди-
нений взаимодействуют атомы: '
1) S и О; 2) Н и S; 3) О и О; 4) С и F.
5. Между собой по прочности меньше всего различа-
ются связи в молекулах:
1) F2 и О2; 2) СО и F,;
3) N, и F,; 4) СО и N,.
6. Сколько частиц из перечисленных содержат трехва-
лентные атомы: Р4, Н3О+, Н,О2, СО, СО,, BF, H3N BF3,
NH +, NH HNO,?
1)6; 2) 5; 3)4; 4)3.
7. Укажите справедливые утверждения. В кристалли-
ческом кремнии:
1) длины всех связей Si — Si одинаковы;
2) длина связи Si — Si больше, чем С — С в алмазе;
3) энергия связи Si — Si меньше, чем С — С в алмазе;
4) энергия связи Si — Si больше, чем С — Св алмазе.
— 112 —
8. Укажите число неподеленных пар электронов в
молекуле HS — СН, — СН — СООН:
NH,
1)7; 2) 6; 3)5; 4) 4.
9. Энергия связи Н — Н равна 7,18 • 10'19 Дж. Какую
энергию (кДж) нужно затратить для осуществления про-
цесса Н3(г) 2Н. если объем Н, (н. у.) равен 3,36 дм3?
1) 32,4; 2) 432; 3) 64,8; 4) 864.“
10. При образовании одной молекулы дейтерия выде-
ляется 7,31- 1 О '4 Дж энергии. Какая масса (г) молекул дей-
терия должна образоваться, чтобы выделилось 5,00 кДж
энергии?
1) 4,54 • 102) 4,54 • 10 -; 3) 2,27 • 10 '; 4) 2,27 • 10 2.
ТЕСТ 18
1. Длина связи С — С1 равна 0,165 нм. Меньшими бу-
дут длины связей:
1)С —С; 2)С —Вг; 3)С-1;4)С-Н.
2. Неспаренный электрон содержится в частицах, фор-
мулы которых:
1)ОН-; 2) ОН; 3) Na; 4) BF;.
3. Укажите число G-связей в молекуле Р,О5:
1)9; 2) 8; 3)7; 4) 6.
4. Прочность связи увеличивается в ряду молекул (об-
наружены в парах):
1) К„ Li„ Na,; 2) Na„ К,, Li,;
3) K,J, Na,, Li,; 4) Li,, Na,, K,.
5. Наибольшее число неподеленных пар электронов
содержит молекула:
1) C1F; 2) НВг; 3) Н,О; 4) NHy
— 113 —
6. Одинаковое число неподеленных пар электронов
содержат молекулы (ионы):
1)СОиСО?; 2)C1FhO,;
3)М2Н4иНД; 4) Н2О2 hCO(NH2),.
7. Донорами электронов могут быть молекулы (ионы).
I) СО, Н,О, NH4; 2) NH2OH, И,, Н3О+;
3) N2H4, NH2OH, СО, 4) F , Н, Н+. '
8. Кратная связь полярна в молекулах:
1) этена и этина;
2) пропена и бутена — 2;
3) серной кислоты и азота;
4) синильной кислоты (HCN) и пропина
9. Укажите справедливые утверждения:
1) при образовании химической связи энергия всегда
выделяется;
2) л-связь НЕ может образоваться при перекрывании
5-орбиталей;
3) а-связь образуется при перекрывании только .s-op-
биталей ( но не р- или </-);
4) за счет перекрывания /2-орбиталей данный атом мо-
жет максимально образовать три л-связи.
10. Верными являются утверждения:
1) связь тем прочнее, чем больше общих электронных
пар участвует в ее образовании;
2) в ионе аммония связь, образованная по донорно-
акцепторному механизму, короче связей, образованных
по обменному механизму,
3) одинарная связь всегда G-типа;
4) если связи в молекуле полярные, то и молекула все-
гда полярная.
114 —
ТЕМА 9
Ионная связь. Металлическая связь.
Типы кристаллических решеток.
Межмолекулярное взаимодействие.
Водородная связь
ТЕСТ1
1. Только ионная связь присутствует в веществах, фор-
мулы которых:
1) КС1; 2) КОН; 3) KNO3; 4) К2О.
2. Укажите формулы веществ с ионной связью:
1) NH3; 2) NH4NO3; 3) K2SO4; 4) H2SO4.
3. Ионная связь может образоваться между нитрат-
ионом и ионом:
1)NH4; 2)Н+; 3) РО’ ; 4) Na+.
4. Как ионные, так и ковалентные полярные связи
присутствуют в веществах, формулы которых:
1) К2СО3; 2) КБ; 3) SiO,; 4) Са(ОН)2.
5. Ионная связь образуется, когда между собой взаи-
модействуют атомы:
])НиО; 2)NanCl; 3) К и О. 4)NhO.
6. Металлическая связь присутствует в:
1) меди;
2) сплаве калия и натрия;
3) хлориде меди (II);
4) дуралюминии.
7. Степень ионности связи наибольшая в веществе,
формула которого:
1) ВеС12; 2) КС1; 3) CsF; 4) СаВг2.
115 —
8. Металлическая связь образуется, когда между со-
бой взаимодействуют атомы с сокращенной электрон-
ной конфигурацией:
1) ... 2s22p2 и ... 2.г2р4; 2)... 3<W и ... 3cZ64.v2;
3)... 3s1 и ... 3s23p5; 4) ... 3№3/Т* и ... 2s22p>.
9. Укажите суммарное число электронов в ионе SO42-:
1)96; 2) 98; 3)48; 4) 50.
10. Одинаковое число электронов содержат частицы:
1) NHJ и Н.О; 2) ВНД и атом Ne;
3) Н3О+ и BF"; 4) ВН- и NH;.
ТЕСТ 2
1. В жидком состоянии водородная связь образуется
между молекулами:
1) воды; 2) метиламина;
3) углекислого газа; 4) фтороводорода.
2. Укажите наиболее прочную водородную связь:
1)Н —О--Н; 2)Н — F • • Н;
3)Н —N-Н; 4)Н — С1---Н.
3. Между молекулами воды образуется связь:
1) ионная; .2) водородная;
3) ковалентная неполярная; 4) металлическая.
4. Молекулярное строение при обычных условиях
(20°С, давление нормальное) имеют вещества:
1) вода; 2) хлорид калия;
3) аммиак; 4) оксид кремния (IV).
5. Простыми веществами немолекулярного строения
будут:
1) алмаз; 2) водород; 3) натрий; 4) азот.
6. Укажите сложные вещества молекулярного строения:
1) метан; 2)кислород;
— 116 —
3) оксид кремния (IV); 4) оксид углерода (IV).
7. Сложными веществами немолекулярного строения
будут:
1) графит; 2) гидроксид калия;
3) хлорид бария; 4) черный фосфор.
8. Укажите простые вещества молекулярного строения:
1) золото; 2) белый фосфор;
3) фуллерен; 4) ромбическая сера.
9. О формульных единицах, а не молекулах следует
говорить в случае (н. у.):
1) оксида кремния (IV); 2) гидроксида калия;
3) сульфата бария; 4) серной кислоты.
10. Катионы и анионы находятся в узлах кристалли-
ческой решетки:
1) нитрата аммония; 2) хлората калия;
3) кремнезема; 4) гидроксида натрия.
ТЕСТЗ
1. Укажите электронную конфигурацию атома калия
в составе сульфата калия:
1) 1522522/?635237?64л2; 2) \s22s22p63s23p64s23d'’,
3) 1522522/?63s23p6; 4) ]s22s22p63s23p64s23d2.
2. Сложными веществами атомного строения яв-
ляются:
1) метан; 2) оксид кремния (IV);
3) алмаз; 4) карборунд.
3. Молекулярную кристаллическую решетку в твердом
состоянии имеют:
1) азот и латунь;
2) ромбическая сера и кристаллический кремний;
3) сахароза и флюорит;
117 —
4) фуллерен и аргон.
4. Укажите формулу сложного вещества с металличес-
кой связью:
1) FeClv 2) Fe; 3) AuCu?; 4) CuSO4.
5. Основываясь на температурах плавления*, укажите,-
металл с самой прочной металлической связью:
1) ртуть; 2) медь;
3) вольфрам, 4) алюминий.
6. Металлическая связь наименее прочная в металле:
1) золото; 2) железо;
3) ртуть; 4) калий.
7. Укажите электронные конфигурации атомов эле-
ментов, простые вещества которых имеют (могут иметь)
атомное строение (н. у):
1) \s22s22p\ 2) ls22s22p63s23p2,
3) 1У2х22/?5, 4) \s22s22p2.
8. Укажите электронные конфигурации атомов эле-
ментов, простые вещества которых имеют (могут иметь)
молекулярное строение (н. у):
1) 1s22№2/?6351; 2) \s22s22p\
3) 1У2У27/3523/;5; 4) \s22s22pb3s23p\
9. Рассчитайте суммарное число ионов в образце суль-
фата железа (III) массой 4,00 г:
1) 3,01 - 1022; 2) 3,01 • 102’;
3)6,02-1022; 4) 6,02-1021.
10. Укажите массу (г) фосфат-ионов в образце фосфа-
та кальция массой 3,10 г:
1) 1,84; 2) 1,90; 3) 1,96, 4) 2,00
* Температуры плавления металлов приведены в школь-
ных учебниках «Химия. 9 класс» и «Химия. 10 класс» .
118 ----
ТЕСТ 4
1. Водородную связь принимают во внимание для
объяснения таких свойств воды, как ее:
1) способность реагировать с некоторыми металлами;
2) температура кипения;
3) способность реагировать с оксидами;
4) теплоемкость.
2. В большинстве случаев наименее прочной являет-
ся связь:
1) металлическая; 2) водородная;
3) ионная; 4) ковалентная.
3. Образование мгновенных диполей полностью
объясняет межмолекулярное взаимодействие в веще-
ствах:
L) фтороводород; 2) бром; 3) вода; 4) ксенон.
4. Притяжение полярных молекул следует учитывать
для объяснения межмолекулярного взаимодействия в
случае:
1) хлора;
2) оксида азота (II);
3) жидкой смеси хлороформа и воды;
4) метана.
5. Межмолекулярное взаимодействие наиболее силь-
ное в случае простого вещества:
1) водорода; 2) азота; 3) кислорода; 4) хлора.
6. Укажите простое вещество с наиболее слабым меж-
молекулярным взаимодействием:
1) азот; 2) гелий; 3) хлор; 4) бром.
7. В каком веществе межмолекулярное взаимодействие
наиболее сильное?
1) хлор; 2) вода; 3) аммиак; 4) аргон.
119 —
8. Укажите ряды, в которых вещества перечислены в
порядке возрастания межмолекулярного взаимодействия:
1) водород, кислород, азот;
2) водород, азот, кислород;
3) хлор, бром, иод;
4) иод, бром, фтор.
9. Образование индуцированных диполей следует
учитывать для объяснения межмолекулярного взаимо-
действия между молекулами:
1) кислорода и азота; 2) азота и водорода;
3) ксенона и аргона; 4) хлороводорода и бензола.
10. В скобках для веществ указаны температуры плавле-
ния: N,O3 (-102°С); SiCl4 (-70°С); SiC (2830°С); CS, (-112°С);
SiF4 (-86°С). Сколько из этих веществ имеет молекуляр-
ное строение?
1)5; 2) 4; 3)3; 4) 2.
ТЕСТ 5
1. В твердом агрегатном состоянии молекулярную
кристаллическую решетку имеют:
1) аргон; 2) оксид кремния (IV);
3) белый фосфор; 4) оксид фосфора (V).
2. Наибольшую температуру плавления имеет:
1) сахар; 2) поваренная соль; 3) вода; 4) иод.
3. Температура плавления веществ последовательно
возрастает в рядах:
1) азот, вода, графит;
2) медь, ртуть, сахар;
3) кислород, бром, оксид кремния (IV);
4) водород, хлор, фторид калия.
4. Наличие запаха следует ожидать у вещества:
120 —
1) золото; 2) оксид кремния (IV);
3) фторид калия, 4) белый фосфор.
5. Температура кипения веществ последовательно
возрастает в ряду:
1) сероводород, вода, селеноводород,
2) вода, сероводород, селеноводород;
3) сероводород, селеноводород, вода;
4) вода, селеноводород, сероводород.
6. Молекулярную кристаллическую решетку могут об-
разовать вещества со связью:
1) металлической; 2) ковалентной полярной;
3) ковалентной неполярной; 4) ионной.
7. Атомную кристаллическую решетку имеют:
1) алмаз; 2) сахароза;
3) поваренная соль; 4) черный фосфор.
8. Укажите тип кристаллической решетки вещества,
образованного атомами элементов с сокращенными элек-
тронными конфигурациями ... 2.< и ... 2№2//:
1) атомная, 2) ионная,
3) молекулярная; 4) металлическая.
9. Сколько веществ из перечисленных имеют ионную
кристаллическую решетку: карборунд, нитрат калия, гра-
фит, фуллерен, гидроксид натрия, медь, оксид цезия?
1)6; 2) 5; 3)4; 4)3.
10. Вещества с молекулярной кристаллической решет-
кой в твердом состоянии образуются при взаимодействии
атомов элементов с сокращенными электронными кон-
фигурациями:
1) Ь1 и ... 2s22p\
2) ... 2s22// и... 2s22/?2;
3) ... 2х22/?4 и .. З.СЗ/?2 ( в высшей степени окисления);
4) ... 3<7IO4.S’2 и ... ЗбЛ4л-2.
121
ТЕСТ 6
1. Вещества с атомной кристаллической решеткой
могут образовать вещества с типами связей:
1) металлической;
2) ковалентной полярной;
3) ковалентной неполярной;
4) ионной.
2. Укажите вещества одновременно с атомной кристал-
лической решеткой и ковалентными полярными связями:
1) черный фосфор; 2) карборунд;
3) оксид кремния (IV); 4) сульфат натрия.
3. Укажите вещества молекулярного строения с кова-
лентными неполярными связями:
1) моноклинная сера;
2) фтороводород (в твердом агрегатном состоянии);
3) белый фосфор;
4) алмаз.
4. Для атомных кристаллов характерны свойства:
1) большая твердость;
2) низкие температуры плавления;
3) плохая растворимость в воде;
4)летучесть.
5. Некоторое вещество обладает следующими физи-
ческими свойствами: небольшая твердость, летучесть,
низкая температура плавления. Укажите тип кристалли-
ческой решетки вещества:
1) атомная; 2) ионная;
3) металлическая; 4) молекулярная.
6. Температура плавления последовательно возраста-
ет в ряду веществ, формулы которых:
1) HF, F,, NaF; 2) F2, HF, NaF;
— 122 —
3) F2, NaF, HF; 4) NaF, HF, F,.
7. Вещества соответственно с молекулярной, атом-
ной и ионной кристаллическими решетками перечис-
лены в ряду:
1) алмаз, фторид калия, медь;
2) белый фосфор, карборунд, сульфат аммония;
3) фтор (тв.), вода (тв.), оксид кремния (IV);
4) черный фосфор, азот (тв.), оксид рубидия.
8. Укажите тип кристаллической решетки вещества,
которое очень хорошо проводит электрический ток и
пластично:
1) атомная; 2) металлическая;
3) ионная; 4) молекулярная.
9. В ряду веществ, формулы которых Nal, NaCl, NaF,
температура плавления:
1) последовательно уменьшается;
2) последовательно возрастает;
3) сначала растет, затем уменьшается;
4) сначала уменьшается, затем растет.
10. Межмолекулярная водородная связь образуется
между молекулами:
1) HF и Н,О; 2) СН4 и Н,О; 3) NH3 и Н,О; 4) F, и Н,.
ТЕСТ 7
1. Водородная связь образуется между атомом водо-
рода и:
1) атомом с низким значением электроотрицательности;
2)катионом;
3)анионом;
4) атомом, электроотрицательность которого гораздо
выше, чем атома водорода.
123 —
2. Для водородной связи справедливы утверждения:
]) приводит к повышению температур кипения ве-
ществ,
2) обусловлена только межмолекулярным притяжением
разноименно заряженных участков молекул (молекулы);
3) присутствует в белках;
4) имеет вклад ковалентной связи, образованной по
донорно-акцепторному механизму.
3. Какую химическую связь можно охарактеризовать
как коллективную и ненаправленную?
1) водородную; 2) ионную;
3) металлическую; 4) ковалентную.
4. Укажите справедливые утверждения.
1) межмолекулярное взаимодействие возможно только
между полярными молекулами (диполями),
2) усиление межмолекулярного взаимодействия при-
водит к понижению летучести вещества;
3) как правило, межмолекулярное взаимодействие
усиливается с возрастанием массы молекулы вещества,
4) увеличение степени полярности молекулы приво-
дит к усилению межмолекулярного взаимодействия.
5. Укажите НЕСПРАВЕДЛИВЫЕ утверждения:
1) чем слабее связь между молекулами, тем вещество
химически более активно,
2) чем прочнее связь в молекуле, тем выше темпера-
тура кипения вещества;
3) с усилением межмолекулярного взаимодействия,
как правило, наблюдается закономерный переход аг-
регатного состояния вещества от газообразного к жид-
кому, а затем твердому,
4) при наличии водородной связи вещество с мень-
шей массой молекул может иметь более высокую темпе-
124 —
ратуру кипения по сравнению с веществом, у которого
масса молекул больше.
6. Наиболее слабое межмолекулярное взаимодействие
в веществе, формула которого:
1)РН3;2) H,S;3)N,; 4)NHr
7. Одна из указанных температур (°C) равна темпера-
туре плавления карборунда. Укажите ее:
1)—185;. 2) 0; 3)+2830; 4) +80.
8. Температуры плавления хлора и иода соответствен-
но равны (°C) -101 и +114. Следовательно, температура
плавления брома будет:
1) выше, чем 114°С;
2) ниже, чем -101 °C;
3) находится между +114°С и -101 °C;
4) примерно такой же, как и у фтора.
9. Температура плавления последовательно возраста-
ет в ряду веществ, формулы которых:
1) NO,, N,O, NO; 2) NO, N,O, NO,;
3) NO’, NO, N,O; 4) N,O, NO, NO*.
10. Последовательности температур плавления (°C)
-94, -117, -133 соответствует ряд веществ:
l)PH3,AsH3, SbH3;
2) SbH3, РН3, AsH3;
3)AsH3,PH3, SbH3;
4) SbH3, AsH3, PH3.
ТЕСТ 8
1. В порядке понижения температуры плавления ве-
щества перечислены в ряду:
1) вода, сахар, кислород, алмаз;
2) алмаз, сахар, вода, кислород;
125 —
3) кислород, сахар, вода, алмаз;
4) алмаз, вода, сахар, кислород.
2. Укажите формулу вещества с наибольшей темпера-
турой плавления:
1)<О^°Н;
Х:оон
3) ноос —(Q
3. Только молекулярное строение имеют простые ве-
щества, образованные атомами элементов группы:
1) IV А; 2) V А; 3) VII А; 4) III А.
4. Что можно сказать о температурах плавления веществ
СООН(А)иНО
СООН(Б):
I) больше у вещества А; 2) больше у вещества Б;
3) одинаковы; 4) затрудняюсь ответить.
5. Температура кипения уменьшается в ряду веществ,
формулы которых:
1) О3, О7, Н,О; 2) Н,О, О3, О,;
3)О2,О3Н2О; 4)Н'О,О2,О3
6. Образование водородных связей следует учитывать
при анализе температуры кипения:
1) этанола; 2) метана; 3) фтороводорода; 4) фосфина.
7. Внутримолекулярная водородная связь может об-
разоваться в молекулах:
1) СН2 (ОН) — СН (ОН) — СН3;
126 —
он
он
8.Температура кипения возрастает в ряду веществ,
формулы которых:
1) СН4, Н,О, РН3, NH3; 2) СН4, РН3, NH3, Н,О;
3) Н2О, NH3, РН3, СН4; 4) СН4, NH3, РН3, Н*О.
9. Укажите формулу вещества с наибольшей темпера-
турой плавления:
1)N,;2)NH3; 3) РН3; 4) О2.
10. Немолекулярное строение (н. у.) имеют:
l)CH3ClnSiC; 2)S8hP4;
3) SiC и SiO2; , 4) Вг2 и Си.
ТЕСТ 9
1. Температура плавления веществ возрастает в ряду:
1) алмаз, ромбическая сера, озон;
2) ромбическая сера, алмаз, озон;
3) озон, ромбическая сера, алмаз;
4) озон, алмаз, ромбическая сера.
2. Наименьшую температуру плавления имеет:
1) ртуть; 2) иод; 3) сахар; 4) ромбическая сера.
3. Металлическая связь наиболее прочная в простом
веществе, образованном атомами металла с электрон-
ной конфигурацией:
l)[NeJ3s'; 2)[Ar]4.v';
3) [Хе] 4/145Jl0652; 4) [Аг] Зс/Мл1.
127 —
4. Температуры кипения жидких СН4 и GeH4 соответ-
ственно равны -161 °C и -88°С. Из приведенных ниже
температур укажите температуру кипения SiH4:
1) -190°С; 2) -40°С; 3) -20°С; 4) -112°С.
5. Температуры кипения жидких НС1 и НВг соответ-
ственно равны -85°С и -67°С. Укажите температуру
кипения HI:
1) -100°С; 2) -35°С; 3) -70°С; 4) -150°С.
6. Склонность к димеризации проявляет каждая из
частиц; формулы (символы) которых
1)СО7иСО; 2) • СН, и NO;
3) Н7О и СН/'ООН, 4) HF и NH4+.
7. Наибольшую температуру кипения имеет простое ве-
щество, атомы которого имеют электронную конфигурацию:
1) \s22s22p4, 2) [Ne]3523//; 3) \s22s22p6; 4) [Ne]3.s23/^2.
8. Простые вещества как молекулярного, так и атом-
ного строения (при н. у) известны для элементов:
1) кислорода; 2) кремния,
3) углерода; 4) фосфора
9. На температуру кипения веществ влияют:
1) масса молекул;
2) степень полярности связей;
3) прочность связей в молекулах;
4) наличие водородных связей.
10. Температуры кипения (°C) бутана, гексана, гепта-
на и октана соответственно равны (округлены до цело-
го числа): -1, +69, +98 и +126. Укажите температуру ки-
пения пентана (°C):
1)-5; 2)+20; 3)+36; 4)+140.
--- 128 ----
ТЕМА 10
Валентность. Степень окисления.
Координационное число
ТЕСТ1
1. Постоянную степень окисления, равную +1, в слож-
ных соединениях проявляют атомы элемента:
1) водорода; 2) калия; 3) фтора; 4) хлора.
2. Единственную степень окисления в сложных со-
единениях, равную -1, проявляет атом элемента:
1) фтора; 2) кислорода; 3) азота; 4) алюминия.
3. Постоянную степень окисления, равную +2, в слож-
ных соединениях проявляют атомы элементов:
1) меди; 2) железа; 3) кальция; 4) цинка.
4. Степени окисления, равные только 0, +1 и -1, про-
являет атом элемента, символ которого:
1)С; 2)О;3)Н; 4) С1.
5. Степень окисления атома алюминия в устойчивых
сложных соединениях постоянная и равна:
1)+1; 2) + 2; 3)+3; 4)+4.
6. Переменная степень окисления в соединениях ха-
рактерна для атомов элементов:
1) фтора; 2) железа; 3) натрия; 4) серы.
7. Высшая положительная степень окисления атома
элемента, как правило, равна:
1) номеру группы в периодической системе;
2) числу валентных электронов;
3) разнице: номер группы - 8;
4) номеру периода в периодической системе.
5 Зак 1530
129 ----
8. Высшая степень окисления атомов элементов пра-
вильно указана в случаях*:
1) N+5; 2) S+4; 3) Mn+7; 4) Сг+6
9. Низшая степень окисления атомов элементов IV А
- VIIА групп 2—3-го периодов равна:
1) числу валентных электронов;
2) разнице: 8 - номер группы,
3) разнице: номер группы - 8;
4) числу электронных слоев в атоме.
10. Низшая степень окисления правильно указана в
случаях:
1) S1; 2) С11; 3) О2; 4) С"5.
ТЕСТ 2
1. Только положительные степени окисления в устой-
чивых сложных соединениях проявляют атомы каждо-
го из элементов, символы которых.
1) AI и С1; 2) Са и Na; 3) О и F; 4) Fe и Н.
2. Как положительные, так и отрицательные степени
окисления в соединениях проявляют атомы элементов,
символы которых.
1) А1 и С1; 2) N и О; 3) Ва и К; 4) С1 и S.
3. Соответственно низшая и высшая степени окисле-
ния правильно указаны для атомов элементов:
1) N : -3, +5; 2) CI: -1, +7; 3) О: -2, +6; 4) Р: -3, +7.
4. Свою низшую степень окисления атом серы про-
являет в составе.
1) FeS2, 2) H2S; 3) KHS; 4) SCI,.
* Здесь и далее под высшей степенью окисления понима-
ется высшая положительная, а под низшей — низшая отри-
цательная степени окисления.
130 —
5. Укажите формулу вещества, в составе которого атом
марганца проявляет свою высшую степень окисления:
1)МпО; 2)Мп,О7;
3) МпО,; 4) К,МпО4.
6. Своп соответственно низшую и высшую степени
окисления атомы хлора проявляют в составе веществ,
формулы которых:
1) НС1 и РОС13; 2) SCI, и КСЮ,;
3) С1,О7 и FeCl3; 4) НСЮ и НС1О4.
7. Степень окисления атома азота одинаковая в со-
ставе веществ, формулы которых:
1) NH3; 2) HNO3; 3) N,OS; 4) NO,.
8. Высшая и низшая степени окисления численно рав-
ны для атомов элементов, символы которых:
1)0; 2)0; 3)С. 4) N.
9. Укажите ряд, в котором степень окисления атома
серы в веществах увеличивается в последовательности
-2, +2, +4, +6:
1) FeS„ SCI,, S03, K,SO3;
2) CuS, SO, H,SO3, CaSO4;
3) H,S, SO,, S03, KHSO3;
4) KHS, FeS„ H,S,O7, H,SO4.
10. Степень окисления атома фосфора одинаковая в
составе веществ, формулы которых:
1) Н3РО,; 2) Р4О,0; 3) Н4Р2О7; 4) Н3РО3.
ТЕСТЗ
1. Химический элемент 3-го периода, степень окисле-
ния атома которого в высшем оксиде равна +5, называется:
1)азот; 2) сера;
3) фосфор; 4) хлор.
131
2. Химический элемент 3-го периода, степень окис-
ления атома которого в летучем водородном соедине-
нии равна -2, называется:
1) хлор; 2) сера; 3) фосфор; 4) селен.
3. В соединениях с металлами постоянную степень
окисления, равную -1, проявляют атомы химических
элементов:
1) I, О, С1; 2) S, F, N; 3) Cl, Br, F; 4) Br, I, С.
4. Химическому элементу, степень окисления атома
которого в высшем оксиде равна + 6, отвечает электрон-
ная конфигурация атома:
1) l.v22.v22/?2; 2) 1л22^22р5;
3) ls'225'22p63s,23/?3; 4) ls22s22p63s23p4.
5. Укажите электронную конфигурацию атома элемен-
та, который в простейшем водородном соединении имеет
степень окисления -2:
1) ls22s'; 2) ls22s22p2; 3) k22.y22p3; 4) ls22s22/?63s23p4.
6. Высшая степень окисления атомов элементов рав-
на + 4. Укажите электронные конфигурации атомов этих
элементов:
1) ls22s2; 2) ls22s22p2; 3) [Аг]ЗЛ2; 4) [Ne]3s23/?3.
7. Низшая степень окисления атомов элементов рав-
на-3. Укажите электронные конфигурации атомов этих
элементов:
1) Н22№2р3; 2) ls22s'; 3) [Ne]3s23p3; 4) [Ar]3s23p5.
8. Высшую степень окисления атом углерода прояв-
ляет в бинарных соединениях с элементами, символы
которых:
1)Са; 2)С1;3)А1;4) О.
9. Низшую степень окисления атом серы проявляет в
бинарных соединениях с элементами, символы которых:
1)0; 2) Н;3)А1;4)Е
— 132 —
10. Степень окисления атомов последовательно воз-
растает в оксидах, формулы которых:
1) К7О, CaO, Fe?O3, MgO, 2) Li,O, MgO, АЦО3, PbO7;
3) Fe2O3, K2O, MgO, SnO2; 4) Feb, Fe,O„ A1’O3, Na2O.
ТЕСТ 4
1. Укажите степень окисления атома марганца в со-
ставе иона МпО4:
1)+2;2) +4; 3)+6,4)+7.
2. В составе какого иона степень окисления атома
фосфора равна + 1?
1) Н2РО2; 2) НРО2Ч-; 3) Р2О74-; 4) Н2РО4~.
3. Укажите ряд, в котором формулы соединений и
ионов записаны в порядке последовательного увеличе-
ния степени окисления атомов хрома:
1) СгО4~, Сг2О2-. [Сг(ОН)6]’~;
2) [Сг(ОН)6]3- Сг7О3, К,Сг2О7;
3) СгО, СгО;, Сгб42-;
4) К3[Сг(ОН)б], Na2CrO4, Cr2(S04)3.
4. Степень окисления атома водорода равна -1 в со-
ставе соединений, формулы которых:
1) NaBH4 и SiH4; 2) LiAlH4 и NH4C1,
3) КН и N,H; 4) СН и СаН7
7 2 4’ 7 4 2
5. Степень окисления атома азота в составе гидра-
зина N7H4 и гидроксиламина NH70H соответственно
равна:
1) -2 и-3; 2) —1 и 0; 3)-2 и-1; 4) +2и+1.
6. Такую же степень окисления, как и в ионе аммо-
ния, атом азота имеет в составе:
1) NF„ 2) [CH3NH3]C1; 3) HNO3; 4) NH3.
--- 133 —
7. Степень окисления атома металла последователь-
но возрастает в ряду ионов:
1) FeS„ СгО2, МпО4;
2) КЛ, KFeO„ [Zn(OH)4]2~;
3) Na,[Be(OH)4], K7FeO4, Fc(NO,),;
4) Na3[Al(OH)J, Na2MnO4, MnO2.
8. Степень окисления атома углерода в составе СН4
такая же, как и атома кремния в соединении, формула
которого:
1) SiH4; 2) Ca,Si; 3) SiF4; 4) SiO2.
9. Свои соответственно максимальную и минималь-
ную степени окисления атом хлора проявляет в составе
частиц:
1)C1FhC1O3; 2)С1О4иВгС1;
3) С12о7 и С1,О; 4) НС1О4 и Са(С1О)2.
10. Даны формулы соединений кремния: K,Si2O5, SiH4,
Mg2Si, SiF4. Число соединений, в которых степень окис-
ления атома кремния одинакова, равно:
1)4; 2)3; 3)2; 4) 1.
ТЕСТ 5
1. Степень окисления атома азота одинаковая в составе:
1)NH4+; 2) Ca3N?;
3) C6H5NH2; 4) N2H4.
2. Укажите формулы ионов, содержащих атомы со сте-
пенью окисления +4:
1) HSO"; 2) Н,Р,О72 ; 3) S2O2“; 4) TiO2~.
3. Такую же степень окисления, как и атом кислорода
в составе пероксида водорода, атом серы проявляет в
веществах, формулы которых:
1) CuS; 2) Cu2S; 3) FeS,; 4) KJS,.
--- 134 ----
4. В составе иона гидроксония степень окисления ато-
ма кислорода такая же, как и у атома азота в соедине-
нии, формула которого:
1) NH,OH; 2) N,H4; 3) NO; 4) N2O3.
5. В соединении, строение которого приведено ниже,
укажите степени окисления атомов углерода, отмечен-
ных соответственно цифрами 1,2,3:
НО Н
I II I
н н
1) +3, +3, -3; 2) -3, +3, -3; 3) -3, +3, -2; 4) +3, +3, -2.
6. В соединении, строение которого показано ниже,
укажите номер атома углерода, имеющего такую же
степень окисления, как и атом углерода в составе угар-
ного газа:
НН Н
I I I
н-^-с^с—о-н
н ci о н
1)4; 2)3; 3)2; 4) 1.
7. В соединении, строение которого показано ниже,
укажите номера атомов углерода с одинаковой степенью
окисления:
Н Н Н
I© © 1@ I© /н
с—с —с—с—о—с—К
нх I II | I ХН
Н О С1 о —н
1) 1 и 2; 2)2 и 3; 3)4 и 5; 4) 1 и 4.
8. Степень окисления атома хлора одинаковая в ряду:
I) С1О2, СЮ', NaClO; 2) КС1, СЮ , РС15;
— 135 —
3) CIO,, CIO;, РОС13; 4) СЮ;, С1,О7, Ва(С1О4),.
9. Степень окисления атома азота последовательно
возрастает слева направо в ряду:
1) NF3, NH;, HNO„ N2O5;
2) nh;, n,h4, NH,OH,"no,;
3) NO;, NO,, NH,OH, N,H4;
4) NH3, NH,OH, HNO3, NH3- H,O.
10. Степень окисления атома углерода последователь-
но уменьшается слева направо в рядах:
1) СО,, Н,С,О4, СаС„ СН4;
2) СО;", НСООН, CO, CF4;
3) Н,СО3, Н,СО, СаС„ СН4;
4) НСО3, Be, С, С,О;~, SiC.
ТЕСТ 6
1. Постоянную валентность, равную I, в соединениях
проявляет атом:
1) кислорода; 2) водорода; 3) азота; 4) углерода.
2. Укажите число валентных электронов в атоме азота*:
1)5; 2) 4; 3)3; 4) 2.
3. Чему равна высшая валентность атома элемента с
электронной конфигурацией l.v22.v22//3.v23//?
1)2; 2) 4; 3)6; 4)8.
4. Укажите число валентных электронов в атоме эле-
мента с электронной конфигурацией kv22s22//’3.v23J54.v2?
1)7; 2)6; 3)5; 4) 4.
5. Три (и не больше) валентных электрона содержат
атомы элементов с электронной конфигурацией:
1) ls22s22p63s,23p63c?l452; 2) ls'22s'22p63s'237?;
* Напоминаем: валентными называются электроны, способ-
ные принимать участие в образовании химических связей.
136 —
3) 1№2№; 4) 1522s22p3.
6. Высшую валентность, равную VII, в соединениях
проявляют атомы элементов, символы которых:
1)Сг; 2) Мп; 3)С1;4)Е
7. Для атомов всех элементов 2-го периода (исклю-
чая неон) высшая валентность равна:
1) VII; 2) VI; 3)V;4)IV
8. Высшую валентность, равную номеру группы, мо-
гут проявлять атомы элементов, знаки которых:
1) С; 2) О. 3) F; 4) С1.
9. НЕ могут проявлять высшую валентность, равную
номеру группы, атомы элементов:
1)Р; 2)0; 3) F; 4) N.
10. Высшую валентность, превышающую номер груп-
пы, могут проявлять атомы элементов:
1)0; 2) В; 3)Ве; 4) N.
ТЕСТ 7
1. Высшую валентность, меньшую, чем номер группы
в периодической системе, проявляют атомы элементов:
1) Р; 2) О; 3)N; 4)Е
2. Валентность атома азота равна III в составе соеди-
нений (ионов), формулы которых:
1) HNO3; 2) N2H4; 3) NH4; 4) NH,OH.
3. Укажите формулы частиц, в составе которых вален-
тность атома азота равна IV:
1)NH4+; 2)N?H4;
3) N2O5; 4) HN03.
4. В составе молекулы оксида углерода (II) валентность
атома углерода равна:
1) IV; 2) III; 3)11; 4) I.
--- 137 ----
5. Трехвалентные атомы входят в состав молекул
(ионов), формулы которых:
1) Н2О2; 2) BF; 3) Н3О+; 4) HNO3.
6. Атом кислорода НЕ может проявлять степени окис-
ления, равные:
1)-1/2; 2) - 1/3; 3) + 3; 4)-3.
7. Чему равна высшая валентность атома элемента со
следующим строением валентного энергетического уров-
t
1) IV; 2) III; 3) II; 4) I.
8. Степень окисления атома элемента равна 0, а ва-
лентность — III в молекуле:
1)H,;2)N,; 3) О2; 4) СН2О.
9. По абсолютной величине (численно или по моду-
лю) степень окисления и валентность атома азота равны
в составе частиц:
1) NH4+; 2) N2; 3) NH3; 4) HNOr
10. Степень окисления атома кислорода наименьшая
в составе частицы, формула которой:
1)О2; 2) О*; 3) О3; 4) O2F2.
ТЕСТ 8
1. Укажите соответственно валентность и степень
окисления атома кислорода в пероксиде водорода Н2О2:
1) II и -1; 2) II и 4-2; 3) II и -2; 4) II и 0.
2. В молекуле Р4 валентность и степень окисления
атома фосфора соответственно равны:
1) IV и 0; 2) III и -3; 3) III и 0; 4) IV и -3.
* Это уровень (уровни), на котором (которых) расположе-
ны валентные электроны.
--- 138 ----
3. Укажите соответственно валентность и степень
окисления атома кислорода в молекуле СО:
1) II и +2; 2) II и -2; 3) III и -2; 4) III и +2.
4. Высшая валентность превышает номер группы для
атомов элементов:
1)Си; 2) С; 3) О; 4) В.
5. Валентность атома углерода равна IV, а степень
окисления — 0 в составе молекулы:
1) СН2О; 2) СН4; 3) СО2; 4) СО.
6. Укажите справедливые утверждения для иона гид-
роксония и молекулы аммиака:
1) валентность атома кислорода равна валентности
атома азота;
2) число связей в обоих частицах одинаково;
3) степень окисления атома кислорода равна степени
окисления атома азота;
4) в обоих частицах все связи образованы по обмен-
ному механизму.
7. На каких орбиталях могут находиться валентные
электроны атома хлора?
1) 2s; 2) 3s; 3) Зр; 4) 3d.
8. Укажите суммарное число валентных электронов
атомов серы и кислорода, которые участвуют в образо-
вании химических связей в молекуле SO/
1) 2; 2) 4; 3) 6; 4) 8.
9. Одинаковое общее число валентных электронов
участвует в образовании химической связи в частицах:
1) СО и СО/ 2) NH3 и NHJ;
3) СО и N,; 4)Н3О+иВЕ
10. Валентность атома азота равна IV в составе час-
тиц, формулы которых:
1) N,; 2) NH3 BF3; 3) [C6H5N+H3]Br; 4) HNO3.
139 —
ТЕСТ 9
1. Из перечисленных наибольшую валентность в со-
единениях может проявлять атом:
1) кислорода, 2) фтора, 3) азота, 4) хлора.
2. Одинаковую высшую валентность в соединениях
проявляют атомы:
1) азота и бора, 2) азота и фосфора;
3) фтора и хлора; 4) хлора и брома.
3. Какова максимальная валентность нуклида трития
в соединениях?
1) IV; 2) III; 3) II; 4) I.
4. Валентность атома хлора в соединении состава
С12О7 описывает электронно-графическая схема:
1)Щ Itlltll11 | | I I I
2)Щ | tl| t | t | |t| | | |
3)g] ItItItI |t|t| I I
4) Ш I t | t | t | | T | T | T | |
c 3P ж 3d
5. Электронно-графическая схема
_____описывает валентное
За' Зр 3d
состояние атома серы в соединении, формула которого:
1) H,S; 2) H,SO4, 3) SO, 4) SO2.
6. На каких атомных орбиталях могут находиться ва-
лентные электроны атома бериллия?
1) 1s; 2) 2s- 3) 2р- 4) 3s
7. Одинаковую валентность в своем высшем оксиде и
водородном соединении проявляют атомы элемента,
символ которого:
1)N, 2) С; 3) S; 4) Cl.
— 140 —
8. На валентные возможности атомов элементов в
общем случае влияет число:
1) неспаренных электронов в основном состоянии;
2) изотопов;
3) неподеленных пар электронов;
4) вакантных орбиталей.
9. Укажите справедливые утверждения:
1) во втором периоде с ростом атомного номера эле-
мента от 2 до 9 максимальная валентность атомов оста-
ется постоянной и равной IV;
2) с ростом атомного номера элементов в группе VIА
число валентных электронов нс изменяется;
3) йалентность атома водорода в молекуле D, равна II;
4) высшая валентность атома трития больше, чем ато-
ма протия.
10. Укажите сокращенные электронные конфигурации
атомов элементов, высшая степень окисления которых
равна +7:
1)... 3s23p4; 2)... 4V3d5; 3)... 2s22p5; 4)... 3s23p5.
ТЕСТЮ
1. Укажите формулы частиц, в составе которых име-
ются атомы с валентностью, равной валентности атома
фтора в соединении BF:
1) СО,; 2) СО; 3) Н3О+; 4) NH*.
2. Укажите формулы частиц, в составе которых име-
ются атомы с валентностью, равной валентности атома
бора в соединении NH3 • BF,:
1) HNO3; 2) Nil- 3) CO,; 4) P4.
3. В каких соединениях валентность и степень окис-
ления атома фосфора численно равны?
1) Р4; 2) PF3; 3) Н3РО4; 4) РС15.
---- 141
4. Степеням окисления атомов элементов НЕ соот-
ветствуют формулы:
1) K,[Zn(OH)J; 2) ZnO;-; 3) NH;; 4) SO;.
5. Степень окисления атома серы одинакова в частицах:
1) SF*; 2) HS3) HSO;; 4) SCI*.
6. Алгебраическая сумма степеней окисления атома
азота в составе нитрита аммония равна:
1)0; 2)+1;3)+2;4)Ч.
7. Укажите степень окисления атома бора в составе
соединения NH, • BF3:
1)0; 2) +3;3)-3;4) +5.
8. Четырехвалентные атомы имеются в составе час-
тиц, формулы которых:
1) NH3 • ВН3; 2) ВН4; 3) СО; 4) [C2H.N*H3]Br.
9. Верными являются утверждения:
1) высшая степень окисления атома элемента может быть
меньше, чем номер группы в периодической системе;
2) степень окисления и валентность атома элемента
в одном и том же соединении численно могут не сов-
падать;
3) как валентность, так и степень окисления могут быть
дробными;
4) степень окисления может быть отрицательной, а
валентность — нет.
10. Степень окисления атома элемента в высшем ок-
сиде равна +6. Укажите степень окисления атома эле-
мента в летучем водородном соединении:
1)-1; 2)-2; 3)-3; 4)—4.
--- 142 ----
ТЕСТ 11
1. Электроны только внешнего электронного слоя яв-
ляются валентными в атомах:
l)Fe; 2)Р;3)С1; 4) Ст.
2. Укажите координационное число атома кремния в
карборунде:
1)4; 2)6; 3) 8; 4) 10.
3. Интервал изменения степеней окисления правильно
указан в случаях:
l)N:-4... + 5; 2) Sb: - 3 ... + 5;
3)Se:-3 ... +6; 4)Cl:- 1 ... + 7.
4. В молекуле гидразина алгебраическая сумма степе-
ни окисления и валентности атома азота равна:
1)-1;2)+1; 3)-2; 4) +2.
5. Валентность и степень окисления атома азота чис-
ленно равны в составе молекул:
1) NH2OH; 2) N2H4; 3) NH3; 4) CH3NH,.
6. Высшая степень окисления для атомов элементов
2-го периода равна:
1) + 6; 2)+ 5; 3) + 4; 4) + 3.
7. Высшая степень окисления атома серы меньше, чем
атома хлора, так как:
1) радиус атома С1 меньше радиуса атома S;
2) средняя масса атомов С1 больше средней массы
атома S;
3) электроотрицательность атома С1 больше электро-
отрицательности атомов Р;
4) на внешнем электронном слое в атоме С1 больше
электронов, чем в атоме S.
8. Электроны как внешнего, так и предвнешнего элек-
тронных слоев могут быть валентными в случае атомов
элементов:
1) С1; 2) Gd; 3)As; 4) Мп.
--- 143 ----
9. Степень окисления атома серы НЕ является низ-
шей в составе:
1)НЛ; 2)H,S;
3)SC12; 4)KHS.
10. Степень окисления атома хлора НЕ является выс-
шей в составе:
1) C1F; 2) С1,О7; 3) Ва(С1О4)2; 4) РС1у
ТЕСТ 12
1. Степень окисления атомов углерода последовательно
возрастает в ряду соединений (ионов), формулы которых:
1) СО,, СС14, NaHCO3;
2) СО' СС14, СаС,;
3) СаС,, СО, НСО;;
4) CF4,'CO32, А14С3.
2. Свои соответственно максимальную и минималь-
ную степени окисления атом брома проявляет в составе:
1) НВгО2 и КВг; 2) ВгО; и BrF;
3) BrF7 и GaBr3; 4) BrCl и ВгО3.
3. Для реакции NH3 + Н,РО4 = NH4 + НРО^ укажите
верные утверждения:
1) атом азота -— донор электронов;
2) атом азота — акцептор протонов;
3) валентность атома азота не изменяется;
4) степень окисления атома азота не изменяется.
4. Что изменяется в результате протекания реакции,
схема которой: Mg2Si + Н,0 —> Mg (ОН), + SiH4?
1) степень окисления атомов Si;
2) степень окисления атомов Н;
3) химическое количество веществ;
4) степень окисления атомов Mg.
— 144 —
5. Укажите соответственно валентность и степень
окисления атома азота в молекуле анилина
Ж
1) IV и -3; 2) IV и -2; 3) III и -3; 4) III и -2.
6. Степень окисления атомов серы последовательно
возрастает в ряду:
1) PbS, SC1?, SF4, SO,;
2) Na?SO4, SO2, НД, HS~;
3) HSO- HSO4, SC1?, Ca,S;
4) FeS2, H7S2, H2S, HS2. '
7. Молекулы H?O и H7O7 между собой различаются:
1) валентностью атомов О;
2) степенью окисления атомов О.
3) массой;
4) массовой долей атомов О.
8. Степень окисления атома кислорода положитель-
ная в составе:
1)С12О5, 2) OF2; 3) O2F2; 4) Н2О2.
9. Максимальная степень окисления равна номеру
группы для атомов:
1) Си и С1; 2) N и S; 3) Si и О; 4) О и Е
10. Укажите координационное число ионов С1 в хло-
риде натрия:
1) 6; 2) 4; 3) 8; 4) 5.
ТЕСТ 13
1. Степень окисления атома элемента восстановите-
ля в реакции, схема которой SiH4 + О7 —> SiO2 + Н7О,
изменяется в интервале:
1) -4 и +4; 2)-1 и +1; 3) 0 и +2; 4) +1 и-1.
145 —
2. Укажите последовательность изменения степеней окис-
ления атомов углерода в соединении Н3ССНС1С(О)СН,ОН,
начиная с крайнего справа:
1)-3,0,+2,-1, 2)+3,-2, +2, +1;
3)-1,+2, 0,-3; 4) + 1,+2,-2,+3.
3. Алгебраическая сумма степеней окисления атомов
азота в составе аммиачной селитры равна:
1) — 1; 2) —2; 3) 0; 4) +2.
4. Степень окисления атома хлора последовательно
уменьшается в ряду соединений, формулы которых:
1) NOCI, BrCl, НС1О; 2) C1F, SO.CL PCI,;
3) NC13, С12О„ CIBr; 4) С1,О7, NC13, BrCl.
5. Степень окисления атомов серы последовательно
возрастает в составе ионов:
1) HS- HS-, SCI*; 2) S,O2, SFr, SF*
3) HSO- HSO4, SCI"; 4) HS~, HS ’ S,O2 .
6. Валентность атома бора равна IV в составе:
1) BF, 2) BF;; 3) H3N • BF3, 4) Н3ВО3.
7. Трехвалентные атомы имеются в составе всех час-
тиц рядов:
1) СО, BF, Н3О+, NH4+; 2) Н3О+, HNO3, СО, BF;
3) СО, BF, Н3О+, NH3; 4) NH3, N,, Р4, НС1О2.
8. Укажите степень окисления атома азота в составе
молекулы BF3 • NH3:
1)-4; 2)-3; 4)-2; 4) —1.
9. Четырехвалентные атомы азота имеются в составе:
1)[(CH3)4N]C1; 2)H3N-A1C13,
3) H3N • BF3; 4) N?H4.
10. Степень окисления и валентность для одного из
атомов численно не совпадают в составе частиц:
1)Н2О2; 2)NH4;3)CO2; 4) N2H4.
146 ----
ТЕСТЫ
1. Степень окисления атомов серы последовательно
возрастает в рядах частиц, формулы которых:
1) SO?, SF4, SO2-; 2) S.O; , S,O?, SF,;
3) SF4, S2O;, S,O~-; 4) HS , HS;, SF4
2. Алгебраическая сумма высшей валентности и низ-
шей степени окисления равна 1 для атома элемента:
1)N; 2) С; 3) О; 4) С1.
3. Сколько атомов углерода в молекуле 2- метил-3-
хлорпентана имеют одинаковую степень окисления?
1)5,2) 4; 3)3; 4) 2.
4. В каких анионах степень окисления атома элемен-
та, связанного с кислородом, численно равна его выс-
шей валентности?
1) СО2’; 2) SeO2-; 3) HSO3; 4) С1О4.
5. Степень окисления атома азота последовательно
возрастает в рядах частиц, формулы которых:
1) NH4\ NH2, HCONH,; 2) NH;, NC13, N,O,;
3) HCONH2, NO, N20‘; 4) (NH,),CO, NF3, HNO3.
6. В соединении азота с кремнием кремний проявля-
ет свою высшую степень окисления Укажите формулу
нитрида кремния:
l)Si3N; 2) SiN4;3)Si,N4;4) Si4N3.
7. В одной из частиц степень окисления атома хлора
иная, чем во всех других указанных. Укажите формулу
частицы:
1) C1F, 2) КСЮ, 3) Ва(СЮ),; 4) ICI
8. Высшая степень окисления одного из атомов про-
является во всех соединениях набора
1) H,SeO3, AsF3, PCL; 2) S2O2, BF3, С1Ю5;
3)IBr,CH4,N2O5; 3 4) IF7, KC1O4, OF,
— 147 —
9. Для атома азота НЕВОЗМОЖНЫ степени окис-
ления:
1) - 1 и + 3; 2) - 2 и + 5; 3) - 4 и +6 ; 4) - 3 и + 4.
10. В алмазе координационное число атомов углеро-
да равно:
1) VI; 2)V;3) IV; 4) III.
ТЕМА 11
Оксиды
ТЕСТ1
1. Укажите формулы оксидов:
1) СаО; 2) СО,; 3) РО*~; 4) Н,О.
2. Формулы только кислотных оксидов приведены в ряду:
1) СО,, Р,о5, Na,О; 2) SO,, SiO„ СО32 ;
3) N2O_, Р,О5, СгО3; 4) N,O3, N,O, Mn,O7.
3. Укажите ряд, в котором приведены формулы соот-
ветственно основного, кислотного и несолеобразующе-
го оксидов:
1) ВаО, А1,О3, СО; 2) К,О, SO3, NO;
3) Na,O, ZnO, P,O5; 4) MgO, SO,, Mn,O7.
4. Формулы только основных оксидов приведены в ряду:
1) ВаО, К,О, СпО; 2) К,О, СаО, СгО3;
3) А1,О3, MgO, К,О; 4) ВеО, СаО, SrO.
5. Укажите ряд, в котором каждый оксид является со-
леобразующим:
1) А1,О3, СпО, SiO,; 2) MgO, SO,, N,O;
3) P,O5, SO3, NO; ’ 4) Mn,O7, CrO3, SiO.
148 ----
6. Амфотерными будут оксиды:
1) А1,О3 и SO,; 2) ZnO и А1,О3;
3) Веб и Р,О5‘; 4) А1,О3 и SiO,.
7. С водой (20°С) взаимодействует каждый из окси-
дов, формулы которых приведены в ряду:
1) СаО, К,О, SiO,; 2) К,О, CuO, SO,;
3) СО,, А1,О3, SO,; 4) Na,O, Р,О5, N,O5.
8. С водой НЕ взаимодействует каждый из оксидов
ряда (температура 20 °C):
1) SiO,, CuO, N,O; 2) А1,О3, ZnO, СО,;
3) Веб, FeO, SO3; 4) Fe,O3, NO, Mn,O7.
9. Г азообразными при температуре 20 °C и нормаль-
ном давлении являются все оксиды ряда:
1) СО,, SO,, Р,О5; 2) СО,, SO,, СО;
3) NO', NO, CuO; 4) Н,б, SOj, SiO,.
10. Твердыми при температуре 20 °C и нормальном
давлении являются все оксиды ряда:
1) SiO,, CuO, Р,О5; 2) К,О, СаО, NO,;
3) А1,б3, ZnO, СО,; 4) MgO, ВаО, СО.
ТЕСТ 2
1. Оксид серы (IV) реагирует с веществом, формула
которого:
ОКОН; 2) НВг;
3)ВаС1,; 4) Р,О_.
2. Оксид серы (VI) реагирует с каждым из веществ,
формулы которых приведены в ряду:
1) Н,О, Са(ОН)„ К,О; 2) NaOH, Н,О, СО,;
3) ВаО, КОН, Р,О5;' 4) Na,O, Ва(ОН)„ НС1.
3. Оксид кальция реагирует с:
1) Ва(ОН),; 2) AgNO3; 3) HNO3; 4) К,О.
— 149 —
4. Оксид калия реагирует с каждым из веществ, фор-
мулы которых приведены в ряду:
1) SO3, HNO3, Ва(ОН),; 2) Н,О, SO,, H,SO4;
3) Р2О5, НС1, КОН; ‘ 4) SiO2, N,O5, Na,O.
5. Оксид алюминия взаимодействует с:
1) Н,0 и НС1; 2) HNO3 и NaOH;
3) H2SO4 и КС1; 4) КОН и Н2О.
6. С оксидом натрия взаимодействуют:
1) SO, и NaOH; 2) Р,О5 и НС1;
3) Н,Ь и Са(ОН),; 4) H,SO4 и ВаО.
7. С хлороводородом в водном растворе взаимодей-
ствуют:
1) СаО и А1,О3; 2) ВаО и SiO2;
3) А1,О3 и SO2; 4) CuO и Р,О5.
8. С оксидом фосфора (V) взаимодействуют:
1) КОН и ВаО; 2) Na2O и СО,;
3) СаО и N2O5; 4) К2О и SiO,?
9. С Ва(ОН), реагируют:
1) СО2 и К2Ь; 2) SO, и СаО;
3) А1,О3 и Na,O; 4) СО, и SiO,.
10. Как с NaOH, так и с H,SO4 взаимодействуют:
1) К,0 и СО,; “ 2) СО, и ВаО;
3) А1,О3 и ZnO; 4) Р,Ь5 и SiO,.
ТЕСТЗ
1. Между собой могут взаимодействовать:
1) А1,О3 и Na,О; 2) СаО и H,SO4;
3) ZnO и Н,О; 4) SO, и О,'
2. Как с сильными кислотами, так и щелочами реа-
гируют оксиды:
1) А1,О3; 2) ВаО; 3) ВеО; 4) Сг2О3.
150 —
3. Три типа оксидов (кислотный, основный, амфотер-
ный) образуют элементы, символы которых:
1) Cl; 2)Мп;3)Сг; 4) S.
4. Основный и кислотный оксиды образуются при
нагревании:
1) СаСО3; 2) Cu(NO3),; 3) KNO3; 4) NaOH
5. Между собой НЕ реагируют.
1) СиО и НД 2) ВеО и КОН;
3) СаСО3 и SiO2(/°); 4) КОН и ВаО.
6. Укажите формулу четвертого «лишнего» оксида:
1) Na2O; 2) КД; 3) ВаО; 4) РД.
7. Гидроксиды состава Н,ЭО3 образуются при раство-
рении в воде:
1) SiO2; 2) СО,; 3) С1Д; 4) SO,.
8. Сколько веществ из перечисленных (HNO3, НД
А1Д, КОН, SO3) может реагировать с ВаО?
1)5; 2) 4; 3)3; 4)2.
9. Основными свойствами обладают оксиды:
1) МпО; 2) ZnO; 3) ВеО; 4) СгО3.
10. Кислотными свойствами обладают оксиды:
1) СгД; 2) А1Д; 3) ВаО; 4) КД
ТЕСГ4
1. Охарактеризуйте оксид кремния (IV):
1) твердое вещество (н. у);
2) кислотный оксид;
3) амфотерный оксид;
4) не реагирует с водой (20°С).
2. Число оксидов, формулы которых СО2, КД SiO,, А1Д,
СиО, РД, вступающих в реакцию с водой (20°С), равно:
1)6; 2) 5; 3) 4; 4)3.
151 ----
3. Основный оксид образуется при нагревании веще-
ства, формула которого:
l)H2SiOv 2)Cu(OH)„
3)А1(ОН)3; 4)Zn(OH)2
4. Укажите символы элементов, каждый из которых
образует как кислотные, так и основные оксиды:
1)0 и Си; 2)РиСа;
3)СгиМп; 4)ShA1.
5. Наиболее выраженными кислотными свойствами
обладает оксид, формула которого:
1) SiO2; 2) Р2О5; 3) SO3,4) С12О7.
6. Кислотные свойства оксидов постепенно ослабе-
вают слева направо в ряду:
1) N,OS, As2O5, Р2О5; 2) N7OS, P90s, As,Os;
3) P2O5, As2O5, N2O_; 4) As7Os, P,OS, N,O5
7. Кислотные свойства оксидов постепенно усили-
ваются слева направо в ряду:
1) СО2, SO3, ОД; 2) С1,о7, SO3, С09;
3) СО2, С1„О7, SO3; 4) SO3, С17О7, СО9.
8. НЕПРАВИЛЬНО составлено название оксида.
1) CuO оксид меди (II); 2) Р7О. оксид фосфора;
3) К2О оксид калия; 4) SO, оксид серы (IV).
9. Основные свойства оксидов последовательно воз-
растают слева направо в ряду:
1) А19О3, MgO, ВеО; 2) А1,О3, MgO, ВаО,
3) MgO, А12О3, ВаО; 4) ВаО, MgO, А12О3.
10. С какими веществами реагирует СаО, но НЕ реа-
гирует Р,О5?
1) вода, 2) хлороводород (водн. р-р);
3) гидроксид натрия; 4) углекислый газ
— 152 —
ТЕСТ 5
1. В ряду оксидов К2О, MgO, ВеО их основные свой-
ства слева направо:
1) усиливаются;
2) ослабевают;
3) не изменяются;
4) сначала уменьшаются, затем возрастают.
2. Укажите ряд, в котором формулы оксидов записа-
ны в порядке последовательного усиления их кислот-
ных свойств слева направо:
1) СО,, SiO,, Р,О.; 2) SiO,, Р,О5, СО,;
3) SiO2, СО,, Р,О.; 4) Р,О5, СО2, SiO2.
3. В ряду оксидов SO,, SO3, С1,О7 их кислотные свой-
ства слева направо:
1) ослабевают;
2) не изменяются;
3) усиливаются;
4) сначала усиливаются, затем ослабевают.
4. Основные свойства оксидов сначала усиливаются,
а затем ослабевают в ряду:
1) MgO, А12О3, ВеО; 2) ВеО, А1,О3, MgO;
3) А1,О3, ВеО, MgO; 4) А12О3, MgO, ВеО.
5. Кислотные свойства оксидов сначала усиливают-
ся, а затем ослабевают в ряду:
1) SiO,, А1,О3, СО,; 2) А1,О3, SiO,, СО,;
3) SiO*, СО,, А120'3; 4) СО2, SiO,, А1,О3.
6. В порядке последовательного усиления кислот-
ных свойств слева направо формулы оксидов приве-
дены в ряду:
1) Al,O3, SO3, SO,, С1,О7; 2) Al,О,, SO,, SO3, С1,О7;
3) А1'О3, С12О7, SO,, SO3; 4) SO,, А1,О3, SO-, С1,О7.
153 ----
7. Оксид серы (VI) взаимодействует, а оксид калия —
нет с веществами, формулы которых:
1) СаО; 2) Н,О; 3) НВг; 4) NaOH.
8. Только основный (а не кислотный или амфотер-
ный) оксид образует элемент:
1) марганец; 2) алюминий; 3) магний; 4) азот.
9. НЕ образует основных оксидов элемент, химичес-
кий символ которого:
l)Cu; 2)S;3)Mn; 4) Ва.
10. Из солеобразующих оксидов только кислотные
оксиды (оксид) образует элемент:
1) алюминий; 2) марганец; 3) хлор; 4) хром.
ТЕСТ 6
1. Число соединений из указанных (Н2О, H2SO4, Р,О.,
Na2O, КОН, SiO2), с которыми взаимодействует оксид
азота (V), равно:
1) 6; 2) 5; 3) 4; 4) 3.
2. Соль образуется, когда с соляной кислотой реагируют:
1) СО,; 2) СаО; 3) SO2; 4) А1,О3.
3. Укажите формулы веществ, при взаимодействии
которых с Мп,О7 образуется соль:
1) К,О; 2) HNO3; 3) NaOH; 4) Н2О.
4. Соль образуется, когда оксид хрома (VI) реагирует с:
1) Н,О; 2) NaOH; 3) H2SO4; 4) СаО.
5. Основные свойства могут проявлять оксиды:
1) SO,; 2) А1,О3; 3) СаО; 4) Р,О..
6. С водой при 20°С обратимо взаимодействуют оксиды:
1) Р2О5; 2) СО,; 3) SO2; 4) SO3.
7. Соль образуется, когда оксид кальция реагирует с:
1) водой; 2) оксидом серы (VI);
154 —
3) оксидом калия; 4) фосфорной кислотой.
8. Кислота образуется, когда с водой по отдельности
реагируют все оксиды ряда (20°С):
1) SO3, Р.О., Мп?О7, СгО3;
2) N,O5, SO,, SO3, ZnO;
3) CO,, РД, N?O5, SiO,;
4) SO3, CrO3, K2O, A1,O3.
9. Основный характер оксида меди (II) показывают
схемы реакций:
1) СиО —> Си,0 + О,; 2) CuO + НС1 —» СиС1? + Н,О;
3) СиО + SO3 CuSO4; 4) СиО + Н, -> Си + Н,О.'
10. Кислотный характер оксида кремния (IV) показы-
вают схемы реакций:
1) SiO, + С —> Si + СО;
2) SiO' + К,О -> K2SiO3;
3) SiO' + NaOH -> Na2SiO3 + Н2О;
4) SiO' + Mg —>Si + MgO.
ТЕСТ 7
1. Укажите формулу оксида, которому отвечает кис-
лота состава НС1О3:
1) С1,О; 2) С12О3; 3) С1,О.; 4) С12О7.
2. Оксиду С1,О7 отвечает кислота, формула которой:
1) НС1О4; 2) НС1О3; 3) НСЮ,; 4) НС1О.
3. Укажите сокращенные электронные конфигурации
атомов элементов, высшие оксиды которых имеют фор-
мулу Э2О7:
1) ..' 2s22p5; 2) ... 3л23/э5; 3) ... 3d54s2; 4) ... 3J34s2.
4. Кислотные свойства проявляют оксиды:
1) А1,О3 и К,О; 2) А1,О3 и SO3;
3) SO3 и Р,6.; 4) С1'О7 и ZnO.
155 ----
5. Высшие оксиды состава ЭО3 образуют элементы,
сокращенные электронные конфигурации атомов которых:
1)... 2s22p2; 2)... 3s23/?4; 3)... 2s22p\ 4)... 3J4s‘.
6. Основные свойства наиболее выражены у оксида
элемента, атом которого имеет сокращенную электрон-
ную конфигурацию:
1) ... 3s23p'; 2) ... 3.V2; 3) ... 5s1; 4) ... 2s2.
7. Укажите справедливые утверждения:
1) оксиды металлов НЕ могут обладать кислотными
свойствами;
2) оксиды неметаллов НЕ могут быть основными;
3) наиболее выраженными основными свойствами
обладают оксиды металлов I А группы периодической
системы;
4) слева направо по второму и третьему периодам про-
исходит постепенное ослабление основных свойств ок-
сидов.
8. Укажите формулы возможных продуктов реакции
между СгО3 и водным раствором КОН:
1) КСгО,; 2) К [Сг(ОН)4]; 3) К^СгО,; 4) К,Сг2О?.
9. Свойства оксидов от основных до кислотных че-
рез амфотерные изменяются в ряду:
1) MgO, А1?О3, SO3; 2) SO3, А17О3, MgO;
3) MgO, SO3, A12O3; 4) А1Д, SO3, MgO.
10. Соль образуется, когда основные оксиды реаги-
руют с:
1)водой;
2) щелочами;
3) кислотными оксидами;
4) амфотерными оксидами.
156 —
ТЕСТ 8
1. Взаимодействуя как с кислотами, так и со щелоча-
ми, соль образуют оксиды, формулы которых:
1) СаО, 2) А1Др 3) ВеО, 4) ZnO.
2. Только основные свойства проявляют оксиды:
1) К2О, 2) Л1Д, 3) СаО; 4) ВеО.
3. Укажите формулу оксида с атомной кристалличес-
кой решеткой:
1) Na2O; 2) SiO,; 3) РД.; 4) Rb,O.
4. Немолекулярное строение (н. у.) имеют оксиды, фор-
мулы которых:
1) СО,; 2) SiO,; 3) ВаО; 4) РД0.
5. Сколько элементов 3-го периода периодической
системы образуют оксиды, которые могут реагировать
со щелочами?
1)5; 2) 4; 3)3; 4) 2.
6. В оксиде элемента, образующего с водородом со-
единение состава ЭН4, массовая доля атомов кислорода
53,3%. Охарактеризуйте свойства этого оксида:
1) кислотный; 2) амфотерный;
3 ) реагирует со щелочами; 4) не реагирует с водой (20°С).
7. Оксид серы (IV) в реакциях с другими веществами
проявляет свойства:
1) кислотные;
2) окислительные, а не восстановительные;
3) восстановительные, а не окислительные;
4) и окислительные, и восстановительные.
8. Одинаковую валентность в своем высшем оксиде и
летучем водородном соединении проявляет:
1) сера; 2) кремний; 3) хлор; 4) азот.
9. Между собой реагируют оксиды в парах:
1) SiO , и ВаО (/°); 2) Na,0 и А1Д (/°);
3) SiO, и ДО (20°С); 4) SO, и РД\.
157 —
10. Укажите формулы оксидов, которые можно исполь-
зовать на практике в качестве осушителей:
1) СиО; 2) Р2О_; 3) СаО; 4) FeO.
ТЕСТ 9
1. Укажите число возможных реакций между попар-
но взятыми веществами, формулы которых: H,O, SiO,,
NaOH, К,О, SO,:
1)6; 2) 5; 3)4; 4)3.
2. Укажите число возможных реакций между попарно
взятыми веществами состава Н,О, H,SO4, ZnO, NaOH, N,O_:
1)6; 2) 5; 3)4; 4)3.
3. Растворы с pH > 7 образуются, когда с водой реаги-
руют оксиды, формулы которых:
1) К,О; 2) N,O_; 3) SO,; 4) BaO.
4. Растворы с pH < 7 образуются, когда с водой реаги-
руют оксиды, формулы которых:
1) С12О7; 2) Na,O; 3) N,O; 4) Р2О_.
5. Солеобразующие и несолеобразующие оксиды об-
разует элемент, символ которого:
1)К; 2)N;3)Zn; 4)Ва.
6. Укажите формулу оксида с наиболее выраженны-
ми основными свойствами:
1) Мп2О7; 2) МпО7; 3) МпО; 4) МпО,.
7.0 каком оксиде идет речь: тугоплавок, атомная кри-
сталлическая решетка, растворим в щелочах?
1) оксид кальция; 2) оксид алюминия;
3) оксид кремния (IV); 4) оксид бария.
8. Основные свойства наименее выражены у оксида,
формула которого:
1) К,О; 2) СаО; 3) MgO; 4) А1,О,.
158 ----
9. В каких группах периодической системы могут нахо-
диться элементы, формулы высших оксидов которых ЭО3?
1) VI А; 2) VII А; 3) VI В; 4) VII В.
10. Укажите формулы высшего оксида и отвечающего
ему гидроксида элемента с атомным номером 25:
1) ЭО3 и НЭО4; 2) ЭД и Н,ЭО3;
3) Э2О7 и НЭО4; 4) ЭО2 и Н2~ЭО3.
ТЕСТЮ
1. Оксид алюминия реагирует, а оксид натрия — нет
с веществами, формулы которых:
1) Н2О; 2) ВаО; 3) H,SO4; 4) КОН.
2. Каковы формулы высшего оксида и отвечающего
ему гидроксида элемента с атомным номером 52?
1) ЭД; 2) Н2ЭО3; 3) ЭО3; 4) Н6ЭО6.
3. Укажите формулы веществ, которые можно полу-
чить в одну стадию из оксида меди (II):
1) Си; 2) Си (ОН)2; 3) СиС12; 4) CuSO4.
4. При взаимодействии оксида состава ЭО3 с NaOH
(р-р) может образоваться соль, формула которой:
1) Na33O4; 2) Na23O4;
3) Na23O3; 4) Na3O3.
5. При взаимодействии оксида с КОН (р-р) образу-
ется соль состава КЭО4. Укажите формулу оксида:
1) ЭО2; 2) ЭО3; 3) ЭД; 4) ЭД.
6. Гидроксиды состава Н2ЭО4 образуются при раство-
рении в воде оксидов, формулы которых:
1) SO3; 2) SeO,; 3) С1Д; 4) СД.
7. Оксид калия реагирует, а оксид меди (II) — нет с
веществом, формула которого:
1) НС1; 2) НД 3) H2SO4; 4) Ва(ОН)?.
159 —
8. Оксид алюминия НЕ реагирует, а оксид серы (VI)
реагирует с веществом, формула которого:
1) NaOH; 2) Н,О; 3) HNO3; 4) КД
9. Как оксид цинка, так и оксид фосфора (V) реагиру-
ют с веществами, формулы которых:
1) Н,О; 2) NaOH; 3) H,SO4; 4) Na,О.
10. Как оксид алюминия, так и оксид бария реагиру-
ют с веществами, формулы которых:
1) КОН; 2) Н,О; 3) HNO.; 4) SO..
ТЕСТИ
1. Оксид алюминия проявляет кислотные свойства,
реагируя с:
1) Н2О; 2) HNO,; 3) КОН; 4) Na2O.
2. Оксид меди (II) и оксид цинка проявляют основ-
ные свойства, реагируя с:
1) Н2; 2) НС1; 3) НД 4) СО.
3. Укажите формулы оксидов, которые могут взаимо-
действовать с кислородом:
1) СО2; 2) СО; 3) РД; 4) SO2.
4. В пробирки, содержащие оксиды А1Д, SO3, РД,
КД SiO2, добавили воду. Лакмус приобретает красную
окраску в пробирках с оксидами:
1)A1,O3,SO3; 2)SO3, РД;
3) КД РД; 4) SO., РД, SiO2.
5. Между собой могут взаимодействовать оксиды,
образованные элементами с атомными номерами:
1) 1 и 13; 2)4и11;
3)1 и 30; 4) 12 и 16.
6. В пробирки, содержащие оксиды ВаО, CuO, N2O_,
Na2O и ZnO, добавили воду. Число пробирок, в которых
160 —
лакмус приобретает синюю окраску, равно:
1)5; 2) 4; 3)3; 4) 2.
7. С кислородом НЕ могут взаимодействовать оксиды:
1) А1,О3; 2) СО; 3) SO,; 4) Н,О.
8. При взаимодействии какого оксида с водным ра-
створом КОН образуется соль состава К[Э(ОН)4]?
1) МпО,; 2) N,O,; 3) Сг,О,; 4) СгО,.
9. Укажите формулу оксида, молекула которого содер-
жит четыре неподеленные пары электронов:
1) SO,; 2) СО,;
3) SO3; 4) Н,6.
10. В порядке последовательного увеличения числа
неподеленных пар электронов в молекуле формулы ок-
сидов записаны в ряду:
1) Н,О, SO,, SO3, СО,; 1) Н2О, SO,, СО,, SO3;
3) Hj0, SOp SO^, СО'; 4) Н2О, СО", SO', SO3.
ТЕСТ 12
1. Основный и кислотный оксиды образуются при
нагревании:
1) KNO,; 2) H,SiO3; 3) СаСО,; 4) Н,О,.
2. Наиболее выраженными основными свойствами
обладает оксид, формула которого:
1) МпО; 2) МпО,; 3) Мп,О7; 4) А1,О,.
3. Оксид хлора (V) с водным раствором Ва(ОН), об-
разует соль состава:
1)ВаС1О3; 2)Ва(С1О3),;
3)Ва(С1ОД; 4) Ва(С1О2)'2..
4. При взаимодействии со щелочами кислую соль НЕ
образуют оксиды:
1) Р2О5; 2) NO2; 3) С1,О7; 4) Мп,О?.
6 Зак.1530
161
5. Через склянку с водным раствором щелочи пропу-
стили смесь NO, NO2 и SO,. На выходе из склянки будет:
I) только NO, 2) смесь NO и NO,;
3) смесь NO, и SO,, 4) смесь NO и SO,
6. Сколько оксидов из перечисленных реагируют с во-
дой при 20°С: SiO,, СаО, P,OS, CuO, СО,, СО?
1)6; 2) 5; 3)4; 4)3.
7. Оксиды состава Э2О7 и кислоты состава НЭО4 об-
разуют элементы в высшей степени окисления атома:
1) Сг; 2)Мп; 3) С1; 4) S
8. Сколько веществ из перечисленных (малахит, кино-
варь, пирит, доломит, мел) при сильном нагревании в ат-
мосфере кислорода образуют оксид (оксиды), обладаю-
щий (ие) основными свойствами?
1)5; 2) 4, 3)3; 4) 2.
9. Соль состава КЭО, образуется, когда с КОН (водн.
р-р) реагирует:
1) С1,О5; 2) N2O3; 3) Сг2О3; 4) А1,О3.
10. Соль состава Na[3(OH)4] образуется, когда с NaOH
(водн. р-р) реагирует:
1) ZnO; 2) Сг,О3; 3) А1,О3; 4) ВеО.
ТЕСТ 13
1. Окислительно-восстановительными будут реакции
между оксидами:
1) Н2О и Р,О5; 2) Н2О и NO,;
3) СаО и СО2; 4) FeO и СО (/°)
2. Кислотный оксид образуется при взаимодействии:
1) О, и избытка С;
2) С и избытка О,;
3) Си и HNO3 (концентрированная);
162 ----
4) Ag и H2SO4 (разбавленная).
3. Несолеобразующий оксид можно получить при
взаимодействии:
1) N, и О,; 2) О, и избытка С;
3) Si и избытка О,; 4) H2SO4 и P2OS.
4. В качестве осушителей влаги могут использоваться
оксиды:
1) CuO; 2) РД; 3) СаО; 4) SiO,.
5. Укажите формулу оксида, кислотно-основные свой-
ства которого похожи на таковые для оксида серы (VI):
1) ZnO; 2) СгО3; 3) SiO; 4) ВаО.
6. Оксиды, обладающие основными свойствами, об-
разуются при сильном нагревании в атмосфере кисло-
рода веществ, формулы которых:
1) Ag,S; 2) HgS; 3) СаСО3 • MgCO3; 4) Cu(OH),.
7. Оксид можно получить непосредственным окис-
лением кислородом:
1)Си; 2) Cl2; 3)Au;4)Ag.
8. Кислотные оксиды образуются, когда в атмосфере
кислорода нагревают:
1) киноварь; 2) пирит;
3) малахит; 4) чилийскую селитру.
9. Основные свойства последовательно возрастают
слева направо в ряду оксидов:
1) А1Д, К,О, MgO; 2) А1,О3, MgO, К,О;
3) КД MgO, А1Д; 4) MgO, А1Д, КД
10. Между собой взаимодействуют высшие оксиды
элементов с электронными конфигурациями атомов:
1) [Аг] 3</4s2 и [Ne] 3s1; 2) [Ne] 3s23^ и 1s1;
3) [Ne] 3s13p1 и Is1; 4) [Ne] 3s23^' и [Ar] 4s1.
163 —
ТЕМА 12
Основания
ТЕСТ1
1. Укажите формулу двухкислотного основания:
1) Са(ОН),; 2) А1(ОН),; 3) КОН; 4) Мп(ОН)4. У
2. Формула щелочи — это:
1) Zn(OH),; 2) КОН; 3) Си(ОН),; 4) Mg(OH),.
3. Хорошо растворимы в воде все основания группы:
1) NaOH, Ва(ОН)„ Си(ОН),; 2) КОН, Са(ОН)„ NaOH;
3) LiOH, КОН, А1(ОН)3; ' 4) NaOH, КОН, Ва(ОН),.
4. Гидроксид калия в водном растворе реагирует по
отдельности со всеми веществами группы:
1) СО,, Na,SO4, А1,О3; 2) А1,О,, SO,, CuCl,;
3) SiO~, Al, KNO3 ’ 4) Zn(OH)2, Сг2О3, СаО.
5. Формула соли, с которой реагирует NaOH (р-р),—это:
1) CuSO4; 2) СаСО,; 3) FeS; 4) Ba(NO3),.
6. Укажите формулу гидроксида, реагирующего как с
сильными кислотами, так и со щелочами:
1) Са(ОН)2; 2) HNO,; 3) NaOH; 4) А1(ОН)3.
7. В ряду оснований NaOH, Mg(OH),, А1(ОН)3 их сила
слева направо:
1) уменьшается;
2) увеличивается;
3) практически постоянна;
4) изменяется немонотонно.
8. Формула самого сильного основания из числа ука-
занных — это:
1) КОН; 2) Mg(OH),; 3) Ве(ОН),; 4) А1(ОН)3.
— 164 —
9. Укажите, в какой паре первый гидроксид обладает
более сильными основными свойствами, чем второй:
1) Fe(OH)3 и Fe(OH)?;
2) Cu(OH)2 и NH3 • Н,О;
3) Mg(OH), и Ва(ОН),;
4) Мп(ОН)" и Мп(ОН)4.
10. Основание образуется при взаимодействии:
1) Zn и Н,О; 2) Na,SO4 и Ва(ОН),(р-р);
3) K,SO4 и NaOH(p-p); 4) СиО и Н,О.
ТЕСТ 2
1. Укажите формулы оснований: ,
1) КОН; 2) CuOHCl; 3) (HO),SO,; 4)NH3 • Н,О.
2. Отметьте формулы щелочей:
1) Ва(ОН),; 2) Fe(OH)3; 3) NaOH; 4) Mg(OH)2.
3. НЕПРАВИЛЬНО названы основания:
1) Си(ОН)2 гидроксид меди;
2) Fe(OH), гидроксид железа;
3) КОН гидроксид калия;
4) Ва(ОН)2 гидроксид бария.
4. В воде нерастворимы все основания ряда:
1) Fe(OH)2, Zn(OH)„ КОН;
2) Fe(OH)3, Pb(0H)7~, Ва(ОН),;
3) Mn(OH)„ Cr(OH)3, NaOH;
4) Mg(OH)', Cu(OH)2, Al(OH),.
5. Непосредственным растворением в воде соответ-
ствующих оксидов можно получить основания:
1)NH,H,O; 2)Ва(ОН)?;
3)Сп(6н)2; 4) КОН.
6. Сравнительно легко при нагревании разлагаются:
1) Fe(OH)3; 2) NaOH; 3) КОН; 4) NH3 • Н2О.
165 —
7. В растворах щелочей окраска фенолфталеина:
1) желтая, 2) синяя;
3) красная; 4) малиновая.
8. В водных растворах каких веществ лакмус фиоле-
товый приобретает синюю окраску?
1) НС1; 2) КОН; 3) H,SO4, 4) NH3.
9. Укажите формулы оснований, которые реагируют как
с кислотами, так и со щелочами (разб. р-р):
1)Си(ОН)2, 2)А1(ОН),;
3)Zn(OH)2; 4)NH3.
10. В ряду гидроксидов Ве(ОН),, Mg(OH),, NaOH их
основные свойства слева направо:
1) уменьшаются,
2) усиливаются,
3) не изменяются;
4) сначала уменьшаются, затем растут.
ТЕСТЗ
1. Гидрат аммиака проявляет основные свойства, ре-
агируя с:
1) КОН; 2) HNO3; 3) KNO3; 4) Ва(ОН),.
2. Основания образуются при взаимодействии с во-
дой оксидов:
1) А12О3; 2) ВаО, 3) SO3; 4) К2О
3. Укажите пары, в которых основные свойства пер-
вого гидроксида выражены сильнее, чем у второго:
1) NH3 • Н,0 и Си(ОН)„ 2) Fe(OH)? и Fe(OH)3;
3) Mg(OH)2 и Ва(ОН)2; ' 4) КОН и Мп(ОН)2
4. С образованием оснований с водой реагируют ме-
таллы:
l)Fe; 2) К; 3)Ва; 4) Си.
166 —
5. По типу реакции обмена между собой с образова-
нием основания могут реагировать:
1) Na и Н,О; 2) CuSO4 (р-р) и NaOH (р-р);
3) ВаО и ЩО; 4) К,СО, (р-р) и Са(ОН), (р-р).
6. По типу реакции замещения между собой с образо-
ванием основания взаимодействуют:
1)СииН,О;
2) Ва и 11,0;
3) MgSO4 (р-р) и КОН (р-р);
4) Na,CO3 (р-р) и Ва(ОН)2 (р-р).
7. Для твердых щелочей характерен тип кристалли-
ческой решетки:
1) молекулярная; 2) ионная;
3 ) атомная; 4) металлическая.
8. Гидроксид цинка проявляет кислотные свойства,
реагируя с:
1) H,SO4; 2) КОН; 3) HNO3; 4) ВаО.
9. Амфотерными свойствами обладают оба вещества
в парах:
1) А1(ОН)3 и КОН; 2) А1(0Н), и ZnO;
3) Zn(OH), и А12О3; 4) Ве(ОН)2 и Mg(OH)2.
10. Основные свойства НЕ характерны для гидроксидов:
1) Mg(OH)2; 2) РО(ОН)3; 3) SO2(OH)2; 4) Ва(ОН)2.
ТЕСТ 4
1. По типу реакции соединения между собой с обра-
зованием основания взаимодействуют:
1) ВаО и Н,О; 2) CuCl, (р-р) и Ва(ОН), (р-р);
3) К2О и 11,0; 4) Na иН,О.
2. Щелочь может образоваться при взаимодействии:
1) Na2CO3 (р-р) и Ва(ОН)2 (р-р);
167 —
2) CuCl2 (р-р) и КОН (р-р);
3) А1С13 (р-р) и NH3 • ЩО;
4) К2О и Н2О.
3. Основание образуется, когда между собой взаимо-
действуют:
1) 1 моль А1С13 и 3 моль КОН (водные р-ры);
2) A12(SO4), (р-р) и NaOH (р-р, избыток);
3) ZnO и Н,О; !
4) СаСО3 и КОН (р-р).
4. Гидрат аммиака можно получить при взаимодействии:
1)NH3hO,; 2)NH3hH,O;
3) NH4C1 икон (р-р); 4) (NH4)2 SO, и Ва(ОН)2(р-р).
5. Щелочи могут взаимодействовать с:
1) солями аммония;
2) всеми кислотами;
3) амфотерными гидроксидами;
4) основными оксидами.
6. Гидроксид меди (II) может образоваться при взаи-
модействии:
1) CuO и Н,О; 2) Си и Н2О;
3) Cu(NO3)' (р-р) й КОН (р-р); 4) Си и NaOH (р-р).
7. Нитрат натрия можно получить при взаимодей-
ствии NaOH (р-р) с веществами, формулы которых:
1) HNO3; 2) Cu(NO3)2; 3) N2O5; 4) N2O3.
8. Укажите группы, в которых приведены формулы ве-
ществ, каждое из которых взаимодействует со щелочами:
1) SO,, Zn(OH),, КС1; 2) Р Д, Н3РО4, А1(ОН)3;
3) Cu(NO3)2, NH4C1, СО2; 4) FeCL, H2SO3, CuS.
9. Как с кислотными оксидами, так и с растворимыми
солями меди (II) могут реагировать вещества, формулы
которых:
1) HCl(p-p); 2) NaOH; 3) Ва(ОН)2; 4) NH3 • Н2О.
— 168 —
10. В отличие от гидроксида натрия гидроксид алю-
миния реагирует с веществом, формула которого:
l)HCl(p-p); 2) Ва(ОН)2 (р-р);
3) H2so4 (р-р); 4) SO3.
ТЕСТ 5
1. Гидроксид алюминия образуется при взаимодей-
ствии (электролиты взяты в виде водных растворов):
1)А1,О3иН2О;
2) А1~О3 и КОН;
3) A1(NO3)3 (4,26 г) и Ва(ОН), (5,13 г);
4) A12(SO4)3 (3,42 г) и КОН (6,72 г).
2. Между собой взаимодействуют (сильные основа-
ния взяты в виде водных растворов):
1) НС1 и Ва(ОН)2; 2) NaOH и Be (ОН)2;
3) КОН и NaCl; 4) Са(ОН)2 и SO3.
3. С разбавленным раствором NaOH реагирует каж-
дое из веществ в группах:
1) Al, КС1, (NH4)2SO4; 2) Р2О_, А1(ОН)3, СиС12;
3) Mn2O7, ZnO, Н3РО4; 4) SO2, FeCl3, Zn(OH)2.
4. Щелочи реагируют со всеми:
1) растворимыми солями;
2) кислотами;
3) оксидами;
4) амфотерными гидроксидами.
5. Основание можно получить при взаимодействии:
1) Fe,O3 и Н2О;
2) MgSO4 (р-р) и NaOH (р-р, избыток);
3) Zn(NO3), и КОН (р-р, избыток);
4) К и Н Д
--- 169 ----
6. Нитрат меди (II) образуется, когда между собой ре-
агируют (электролиты взяты в виде водных растворов):
1) CuO и HNO3;
2) Cu(OI I), и HNO3;
3) CuCL, и NaNO3;'
4) Cu(OH), и KNO3.
7. Оба реагента — H2SO4 (разб.) и КОН (разб.) — вза-
имодействуют с:
1) СиС12; 2) AljO3; 3) Cr(OH)3; 4) СаО.
8. Гидроксид натрия образуется при взаимодействии:
1) NaCI и КОН (р-р); 2) Na и Н2О;
3) Na2O и Н2О; 4) Na2SO4 и Ва(ОН)2(р-р).
9. При комнатной температуре гидроксид меди (II)
реагирует с:
1) NaCI (р-р); 2) FeO; 3) H2SO4; 4) HNO3.
10. Гидроксид цинка и оксид алюминия по отдельно-
сти взаимодействуют с (25°С):
1) соляной кислотой и магнием;
2) серной кислотой и гидроксидом натрия;
3) азотной кислотой и хлоридом калия;
4) гидроксидом бария ц нитратом натрия
ТЕСТ 6
1. Сколько веществ из указанных (CuO, ВеО, P9OS,
CuSO4, Na,SiO3) реагируют с КОН (р-р)?
1) 5; 2) 4; 3) 3; 4) 2.
2. Щелочь образуется при взаимодействии:
1) Na, О и ЩО; 2) NaNO3 и Са(ОН). (р-р);
3) КН и Н2б, 4) FeSO4 и КОН (р-р).
3. В отличие от гидроксида натрия гидроксид цинка
в водном растворе реагирует с:
1) CuSO4; 2) СаСЦ 3) КОН; 4) H,SO4.
170 ---
4. Гидроксид железа (II) можно получить при взаи-
модействии:
1) Fe и Н2О; 2) FeO и Н2О;
3) FeCl, и КОН (р-р); 4) Fe и КОН (р-р).
5. С гидроксидом калия в водном растворе реагирует
каждое из веществ в рядах:
1) Al, А1(ОН)3, CuCl,; 2) А1,О3, SO3, FeSO4;
3) А1,О3, Na,SO4, CO2; 4) рД,’ H2SO4, СгД.
6. Гидроксид алюминия может образоваться при вза-
имодействии:
1)А12О3иН2О;
2) A1,(SO4)3 и NH3 • Н9О (избыток);
3) А1СГ иNaOH (избыток);
4) А1Д и КОН (р-р).
7. Кислотные свойства Ве(ОН), проявляет, реагируя с:
1) НС1; 2) H2SO4; 3) NaOH; 4) Ва(ОН)2.
8. Основные свойства Сг(ОН)3 проявляет, реагируя с
водными растворами:
1) HNO3; 2) КОН; 3) НС1; 4) NaOH.
9. Укажите формулы веществ, с которыми в водном
растворе реагирует Си(ОН)2:
1) KNO3; 2) НС1; 3) NaOH (разб.); 4) H2SO4.
10. Химическое взаимодействие возможно между:
1) КОН и SiO2; 2) А1,О3 и NaOH;
3) Fe(OH)2 и K^SO, (р-р); 4) Са(ОН)2 (р-р) и Р2О5.
ТЕСТ 7
1. Сколько различных оснований можно получить с
помощью одностадийных реакций, используя только:
Н2О, К,О, CuO, Ba, NaOH, MgSO4?
1)4;"2)3; 3)2; 4)1.
--- 171
2. Основные свойства постепенно возрастают слева
направо в ряду:
1) Cu(OH)9, NH3 • Н,О, А1(0Н)3;
2) КОН, Cu(OH)9, NH, • Н,О;
3) NH3 • H P, Си(ОН)„ Мп(ОН)4;
4) Fe(OH)‘, NH3 • нД NaOH.
3. Смешали раствор NaOH объемом 10 см3 с моляр-
ной концентрацией щелочи 5 моль/дм3 и раствор H2SO4
объемом 15 см3 с молярной концентрацией кислоты
3,5 моль/дм3. Укажите окраску лакмуса фиолетового в
растворе после реакции:
1) синяя; 2) фиолетовая; 3) красная; 4) зеленая.
4. Лакмус фиолетовый не изменит окраску в растворе,
полученном при взаимодействии растворов, содержащих:
1) 4 г NaOH и 4,9 гНД;
2) 0,1 моль КОН и 0,2 моль H,SO4;
3) 1,71 г Ва(ОН), и 1,26 rHNO3;
4) 1,42 г NaOH й 1,095 г НС1.
5. Щелочной будет среда в растворах, полученных при
взаимодействии растворов, содержащих:
1) 0,1 моль H2SO4 и 0,2 моль NaOH;
2) 4,9 г H2SO4 и 10,26 г Ва(ОН),;
3) 2,84 г NaOH и 0,071 мольЖО,,
4) 5,13 гВа(ОН)2 и 1,095 г НС1.
6. Основные свойства гидроксидов постепенно ос-
лабевают в ряду:
l)Fe(OH)3, Fe(OH)p Са(ОН)9;
2) Fe(OH)3, Са(ОН);, Fe(OH),;
3) Fe(OH);, Fe(OH)3, CaCOH),';
4) Ca(OH)2, Fe(OH)2, Fe(OH)3.
7. Гидроксид калия в водном растворе НЕ реагирует с:
1) OsO4; 2) Na[Cr(OH)J; 3) SeO3; 4) Br,
172 —
8. Со щелочами взаимодействует каждое из веществ
в группах:
l)Al,O3,Zn,K3[Al(OH)6];
2) ВеО, СгД, CL,;
3)Zn(OH);Al,bC2[Zn(OH)4];
4)Сг(ОН)3, Ве(ОН)2,Ве.
9. Охарактеризуйте свойства гидроксида элемента в
степени окисления атома +3 с электронной конфигура-
цией электронейтрально го атома [Ar] 3Js4.s':
1) реагирует с HNO3, но не реагирует с NaOH;
2) реагирует с NaOH, но не реагирует с HNO3;
3) реагирует как с HNO3, так и с NaOH;
4) при нагревании разлагается.
10. Гидроксид натрия НЕЛЬЗЯ получить при смеши-
вании:
1) NaH и ICO; 2) Na3S04 и КОН;
3) Na и Н2О; 4) Na’CO3 и Ва(ОН),.
ТЕМА 13
Кислоты
ТЕСТ1
1. Укажите формулы кислот:
1) НС1; 2) NaH; 3) HNO3; 4) KNO3.
2. Формулы только сильных кислот приведены в рядах:
1) H2SO4 (разб.), HNO3, НС1; 2) HBr, HI, HF;
3) СН,СООН, HBr, H2SO3; 4) HCI, HBr, HI.
3. Слабой является каждая из кислот в наборах:
1) HF, HNO2, Н2СО3;
173 —
2) H2SO3, H3PO4, HBr;
3) HNO3, H,SO4 (разб.), H,SiO3;
4)H3PO4,HNO2, H3AsO4.‘
4. Непосредственным растворением соответствую-
щих оксидов в воде можно получить кислоты:
1) серную; 2) кремниевую; 3) азотную; 4) фосфорную.
5. Укажите формулы кислот, которым отвечает оксид
серы (VI):
1) H2SO3; 2) H2SO4; 3) H2S2O3; 4) H2S2O7.
6. Азотистой кислоте HNO, отвечает оксид, формула
которого:
1) NO; 2) N2O3; 3) N2O; 4) N,O5.
7. Двухосновными являются кислоты:
1) соляная; 2) серная; 3) фосфорная; 4) сероводородная.
8. Укажите формулы кислот, которым отвечает оксид
фосфора (V):
1) Н3РО3; 2) НРО3; 3) Н3РО4; 4) Н4Р2О7.
9. В раствор, содержащий 0,2 моль КОН, пропустили
хлороводород объемом (н. у.) 4,0 дм3. Укажите окраску
лакмуса в полученном растворе:
1) синяя; 2) красная; 3) желтая; 4) малиновая.
10. С разбавленной соляной кислотой взаимодейству-
ет каждое из веществ, формулы которых приведены в
группах:
1) Zn, Fe(OH)3, NaNO3; 2) CuO, KOH, Na?CO3;
3) K2O, Ag, Cu(OH)2; 4) AgNO„ KF, NH3.
ТЕСТ 2
1. Формулы кислот в порядке последовательного уве-
личения их силы слева направо записаны в рядах:
1) HF, НС1, HI; 2) H2SiO3, Н2СО3, HNO3;
174 ---
3) НС104, нею, H2so4; 4) H3AsO4, Н.РО,, HNO3.
2. Первый гидроксид обладает более выраженными
кислотными свойствами, чем второй, в парах:
1) НС1О3 и НСЮ; 2) H,SiO3 и Н,СО3;
3) Н3РО4 и H3AsO4; 4) HNO3 и HNO,.
3. Соляная кислота взаимодействует с веществами,
формулы которых:
1) AgNO3; 2) KNO3; 3) К2СО3, 4) CuSO4.
4. Кислота образуется при взаимодействии:
1) ВаС12 (р-р) и H2SO4 (разб.); 2) SiO, и Н2О;
3) N,O3 и Н2О; 4) СО и Н2Ь (20°С).
5. Разбавленная серная кислота взаимодействует с ве-
ществами, формулы которых:
1) NaCl; 2) Си; 3) Fe; 4) Ba(NO3),.
6. Как хлороводород (в водном растворе), так и оксид серы
(VI) взаимодействуют с веществами, формулы которых:
1) КОН; 2) СаО; 3) Р2О5; 4) KF.
7. Влажная лакмусовая бумажка краснеет в сосудах,
содержащих:
1) NH3; 2) НС1; 3) SO2; 4) NO.
8. Оксиду хлора (I) соответствует кислота, формула
которой:
1) НСЮ; 2) НСЮ2; 3) НСЮ3; 4) НСЮ4.
9. Укажите формулы кислот, анион которых в окисли-
тельно-восстановительных реакциях с другими вещества-
ми проявляет только окислительные свойства:
1) НМпО4; 2) H2SO3; 3) HNO3; 4) H2SO4.
10. Только восстановительные свойства в окисли-
тельно-восстановительных реакциях проявляет анион
кислот:
1)соляной; 2) сероводородной;
3) серной; 4) азотистой.
— 175 —
ТЕСТЗ
1. Водный раствор высшего оксида элемента с атом-
ным номером 25 взаимодействует с:
1) азотной кислотой; 2) гидроксидом калия;
3) оксидом кальция; 4) оксидом кремния (IV).
2. Разбавленная серная кислота по отдельности реа-
гирует с:
l)ZnnCuO; 2) Mg и KNO,;
3) Cu(OH), и NaF; 4) ВаС1? и Си.
3. Между собой реагируют (электролиты взяты в виде
водных растворов):
1) НС1 и AgNO,; 2) H2SO4 и К,СО3;
3) Mg и НВг; J 4)HNO3hSO3.
4. Азотную кислоту можно получить взаимодействием:
1) N2O3 и Н2О; 2) KNO3 (р-р) и НС1; .
3) N2O5 и Н2О; 4) NaNO3 (р-р) и H2SO4 (разб.).
5. Разбавленный водный раствор высшего оксида эле-
мента с атомным номером 16 взаимодействует с веще-
ствами, формулы которых:
1) NaOH; 2) ВаО; 3) К2СО3; 4) HNO,.
6. Нитрат образуется, когда азотная кислота реагирует с:
1) КО; 2) CuO; 3) NH,; 4) Fe(OH)3.
7. Более сильными, чем фосфорная, будут кислоты,
формулы которых:
1) H,AsO4; 2) H2SO4; 3) H,SiO,; 4) НС1О4.
8. Укажите формулу самой сильной кислоты из при-
веденных:
1) НСЮ,; 2) HNO,; 3) H,SO4; 4) НС1О4.
9. Заряд каких кислотных остатков равен 2-?
1) гидрофосфат-ион; 2) дигидрофосфат-ион;
3) сульфид-ион; 4) гидросульфит-ион.
— 176 —
10. Заряд, равный 1-, имеют кислотные остатки:
1)сульфат-ион; 2) нитрат-ион;
3) гидрокарбонат-ион; 4) силикат-ион.
ТЕСТ 4
1. Укажите формулу одноосновной кислоты:
1) H,S; 2) H2SO4; 3) HNO,; 4) Н3РО4.
2. Водород выделяется при взаимодействии:
1) Си и H2SO4 (конц.); 2) Zn и H2SO4 (разб.);
3) Fe и HNO, (конц.); 4) Ag и HNO, (разб.).
3. С серной кислотой в разбавленном растворе реа-
гирует:
1) Си; 2) NaCI (разб.); 3) CH3COONa; 4) СОГ
4. Формула соли, с которой реагирует соляная кисло-
та, — это:
1) KNO3; 2) BaSO4; 3) CH3COONa; 4) K2SO4.
5. Отметьте ряд, все вещества которого по отдельнос-
ти реагируют с Н28О4(разб.):
1)А1,СаО,Си;
2) А12О,, Fe(OH),, Zn;
3) KNO, (разб.)/ваС1,, Na,CO3;
4) СН,СООК, Ba(OH)„ Ag.
6. Кислота образуется при взаимодействии:
1) КС1 и HNO, (разб.); 2) NaNO3 (разб.) и НС1;
3) Р2О. и Н?О; 4) ВаО и Н?О.
7. Укажите формулу самой слабой кислоты из числа
указанных:
1) Н,РО4; 2) H2SiO3; 3) H,SO4; 4) НС1О4.
8. Формула соли, с которой реагирует угольная кис-
лота, — это:
1) K2SiO3; 2) CH,COONa; 3) Na,SO,; 4) Ca(NO3)r
— 177 —
9. В ряду кислот H,S, H,SO3, H,SO4 их сила слева на-
право:
1) уменьшается; 2) растет; 3) практически не изменя-
ется; 4) изменяется немонотонно.
10. Укажите, в какой паре первая кислота более силь-
ная, чем вторая:
1) HF и НС1; 2) H2SO, и H,SO4;
3) HNO3 и HNO2; 4) НСЮ, и НСЮ4.
ТЕСТ 5
1. При взаимодействии NaOH и Н3РО4 НЕЛЬЗЯ по-
лучить соль состава:
1) NaH2PO4; 2) Na3PO4; 3) Na2HPO3; 4) Na,HPO4.
2. Формулы только слабых кислот приведены в ряду
1) H,SO4, НС1О4, HNO3; 2) СН3СООН, Н,СО3, H,S;
3) НС1, HBr, HF; 4)HI,HF,H2S.
3. Формулы только сильных кислот приведены в ряду:
1)HF,HC1,HNO3; 2) НС1, HNO3, H„SO4;
3) Н3РО4, НСЮ4, НС1; 4) H2SO3, H2SO4, CH3COOH.
4. Укажите формулы кислот, которые могут образовы-
вать кислые соли:
1) H2S; 2) СН3СООН; 3) Н3РО4; 4) H.SO,.
5. Нитрат образуется, когда разбавленная азотная
кислота реагирует с:
1) СО2; 2) К3[А1(ОН)б]; 3) NaCl, 4) А1,О3.
6. Заряд каких кислотных остатков равен 1—:
1) гидросульфид-ион; 2) гидросульфат-ион;
3) гидрофосфат-ион; 4) гидросульфит-ион.
7. При растворении оксида азота (III) в холодной воде
образуется:
1) HNO3; 2) HNO2,
178 —
3) смесь HNO3 и HNO2; 4) смесь HNO, и NO
8. Непосредственным взаимодействием воды и кис-
лотного оксида можно получить кислоты:
1) серную; 2) фосфорную; 3) уксусную; 4) соляную.
9. Кислота образуется при смешивании:
1)8Ю2иН2О;
2) AgNO3 (разб.) и Н3РО4(разб),
3) BaCL, иЮЮ3 (разб);
4) NO и Н2О.
10. Газ выделяется, когда между собой реагируют:
I) КС1 (т) и H,SO4 (конц.);
2) К,СО; и СН,СООН;
3) CaSO, и НС1 (конц );
4) КС1 (т) и HNO3 (разб ).
ТЕСТ 6
1. Водород и соль образуются при взаимодействии
l)H2SO4nCu; 2) НС1 (р-р) и Zn;
3) HNO3 и К2СО3; 4) А1 и H2SO4 (разб ).
2. Укажите формулу кислоты, в которой связь Н —- О
наиболее полярна:
1) СН3СООН; 2) НСЮ; 3) HNO2; 4) НСЮ4.
3. С ростом степени окисления кислотообразующего
элемента сила кислот:
1) возрастает; 2) уменьшается;
3) не изменяется; 4) изменяется немонотонно.
4. Укажите графические формулы двухосновных кислот:
н— СГ ,^() н— сг .о
1) /Р ; 2) ;
н н н—о "и
179 ----
н— О. Л)
3)
н—о
4)Н — С'
О— н
5. Как H,SO4, так и КОН могут реагировать с веще-
ствами, формулы которых:
1) ВаО; 2) А1Д; 3) СО,; 4) Сг(ОН),.
6. Гидроксид состава Н3ЭО4 образуется при раство-
рении в воде
1) оксида хлора (VII); 2) оксида фосфора (III);
3) оксида серы (VI); 4) оксида фосфора (V).
7. С какими веществами реагирует высший гидроксид
элемента с сокращенной электронной конфигурацией
атома ... 2s,22p>’?
1) гидроксидом калия; 2) оксидом цинка;
3) силикатом натрия; 4) оксидом углерода (IV).
8. Кислотные свойства могут проявлять вещества,
формулы которых: '
1) А1(ОН)3; 2) H,SO4; 3) Mg(OH),; 4) SO2.
9. Укажите графическую формулу четырехосновной
кислоты:
Н —
1)Н —О —Р = О ;
Н —
Н —О о—н
2) /Р —О —Р.
н-о II II о-н
о о
н
1
3)Н —С--С ;
I О— Н
Н—О.
4)
Н—О "О
н
10. Для кислоты справедливы утверждения:
1) в реакциях со щелочами акцептор протонов;
2) в реакциях со щелочами донор протонов;
— 180 —
3) электролит, образующий при диссоциации в каче-
стве катионов только ионы водорода;
4) сложное вещество, состоящее из ионов водорода и
кислотных остатков.
ТЕСТ 7
1. Одноосновным кислотам отвечают все кислотные
остатки (заряд не указан):
1) СН3СОО, SO4, S; 2) NO3, NO2, СН3СОО;
3) NO,, SO3, NO3; 4) CH3COO' PO4, Cl.
2. Укажите формулу четвертой «лишней» кислоты:
1)НС1; 2) НВг;3)Н1; 4) НЕ
3. Сероводород образуется, когда между собой реа-
гируют:
1) НС1 (р-р) и сульфат натрия;
2) HNO3 (конц.) и сульфид калия;
3) НС1 (р-р) и сульфид натрия;
4) H2SO4 (разб.) и сера.
4. Различить пробирки с разбавленными соляной и
серной кислотами можно с помощью:
1) питьевой соды; 2) гидроксида калия;
3) гидроксида бария; 4) меди.
5. Разбавленные водные растворы НС1 и Н3РО4 мож-
но различить с помощью:
1) NaNO3; 2) AgNO3; 3) Са(ОН),; 4) Na,CO3.
6. Формула кислоты, отвечающей высшей степени
окисления атома элемента, Н4Э,О7. Какие еще кислоты
соответствуют такой степени окисления элемента?
1) Н2Э2О7; 2) НЭО3; 3) Н.ЭО6; 4) Н3ЭО4.
7. Как H,SO4 (разб.), так и НО (разб.) реагируют с:
1) СиО; 2) A1(NO3)3; 3) Ве(ОН)2; 4) Ag.
181
8. Пробирки с разбавленными H2SO4 и Н3РО4 можно
различить с помощью:
1) КОН; 2) MgO; 3) Си; 4) лакмуса.
9. Кислоты образуются при растворении в воде ок-
сидов элементов семейств:
1)у-и/?-; 2)/?-и^-;
3) 5- и J-; 4) s-, р-, d-.
10. Кислотные свойства соединений постепенно на-
растают в группах:
1) HF, H,SO4, НСЮ4; 2) H,SO4 HF, НСЮ4;
3) НАЮ", Н,СО3, HNO3; 4) Н‘СО3, HA1O2, HNO3.
ТЕМА 14
Соли
TECT1
1. Укажите формулы солей:
I) KNO3; 2) HNO3; 3) CuSO4; 4) H2SO4.
2. Формулы только средних солей представлены в ряду:
1) CuCL,, Na,CO3, КНСО3;
2) К2СО3, NaCI, (CuOH)Cl;
3) Са3(РО4)„ CuSO4 5Н,О, Fe(NO3)3;
4) К3РО4, Ba(NO3)2, FeCl3.
3. Отметьте формулы кислых солей:
1) (MgOH)NO3; 2) NaHSO4;
3)К3[А1(ОН)6]; 4) Са(Н2РО4)2.
4. Укажите формулу основной соли:
1)(СиОН)С1; 2)Си(ОН),;
3) СиС12 • 5Н,О; 4) SO2(OH)2.
— 182 —
5. НЕПРАВИЛЬНО записаны формулы солей:
1) ВаН,РО4; 2) KNaSO4; 3) NH4A1(SO4)2; 4) СаНСОу
6. Укажите формулу гидросульфида бария:
1) Ba(HSO3)2; 2) Ba(HSO4)2; 3) Ba(HS),; 4) BaHS.
7. Правильно составлены названия солей:
1) сульфат железа; 2) сульфат бария;
3) нитрат алюминия; 4) хлорид меди.
8. Укажите правильно составленные формулы солей:
1)Ва[А1(ОН)6]2; 2) Ba[Zn(OH)4]; 3) Na3[AlFJ; 4) К, ZnO,.
9. Отметьте формулы солей:
1) HJSiFJ; 2) FeSO4 7Н2О; 3) Na,ZnO2; 4) Si(CH3)4.
10. Укажите формулы соответственно дигидроорто-
фосфата кальция и гидроортофосфата железа (II):
1) СаНРО4 и Fe(HPO4),; 2) Са,Р,О7 и Fe,(HPO4)3;
3) Са(Н2РО4)2 и Fe(H2PO4)2; 4) Са(Н2РО4)2 и FeHPO4.
ТЕСТ 2
1. Выберите формулу дигидрофосфата железа (II):
1) Fe(H2PO4)2; 2) FeHPO4; 3) Fe(HPO4)2; 4) FeH2PO4.
2. Укажите, какой металл вытесняет железо из водно-
го раствора FeSO4:
1) Pb; 2) Zn; 3) Си; 4) К.
3. Отметьте формулу соединения, с которым реагиру-
ет водный раствор NaHCO3:
1) КС1; 2) СаС12; 3) Ba(NO3)2; 4) H2SO4.
4. Укажите формулу соли, с которой реагирует вод-
ный раствор КС1:
1) Ba(NO3),; 2) Na,SO4; 3) AgNO3; 4) Са(НСО3),.
5. Определите, с какой солью реагирует водный ра-
створ углекислого газа:
1) СаС12; 2) СаСО3; 3) NaHCO3; 4) KNO3.
183 —
6. Укажите формулу соли, с которой взаимодействует
водный раствор NaOH:
1) KNO3; 2) NaCl; 3) CuCl2; 4) K2SO4.
7. С соляной кислотой реагирует соль:
1) KNO3; 2) CuSO4; 3) NaHCO3; 4) Fe(NO3)3.
8. Соль аммония образуется при взаимодействии:
1) NH3 и Н,О; 2) NH4C1 и КОН;
3) (NH4)2CO3 и Н3РО4; 4) NH4NO3 и NaCl.
9. Дигидрофосфат натрия получается в результате ре-
акции (коэффициенты расставлены), левая часть уравне-
ния которой:
1) Р7О5 + 2NaOH (р-р) =; 2) Р2О5 + 4NaOH (р-р) =;
3) РД + 6NaOH (р-р) =; 4) 2К0Н (р-р) + Н3РО4(р-р) =
10. Кислую соль НЕЛЬЗЯ получить при взаимодей-
ствии:
1) NaOH и HNO3; 2) NaOH и СО2;
3) Са(ОН)2 и РД; 4) K2SO3 и H2SO3.
ТЕСТЗ
1. НЕПРАВИЛЬНО составлены формулы солей:
1) (A1OH)NO3; 2) CaNH4PO4;
3)MgHSO3; 4) NaHSO4.
2. Осадок является конечным продуктом реакции, ког-
да между собой реагируют:
1) аммиак и соляная кислота;
2) углекислый газ и избыток известковой воды;
3) избыток углекислого газа и известковая вода;
4) водные растворы сульфата натрия и хлорида кальция.
3. Хлорид железа (III) можно получить при взаимо-
действии:
l)FenHCl(p-p); 2)РеиСЦ
3) Fe(NO3)3 и НС1 (р-р); 4) Fe(OH)' и НС1 (р-р).
— 184 —
4. Кислая соль образуется при взаимодействии (элек-
тролиты взяты в виде водных растворов):
1) NH4HCOj(1 моль) и КОН (1 моль);
2) NaHCO3 (1 моль) и HNO3 (1 моль);
3) КОН (1 моль) и СО2(1 моль);
4) Ва(ОН)2(1 моль) и SO, (2 моль).
5. Соль НЕЛЬЗЯ получить при взаимодействии меж-
ду собой:
1) Ba(NO3)2 и Na2SO4 (р-р); 2) FeO и СО (t°);
3) KNO3 и НС! (р-р); 4) Н3РО4 (р-р) и NH3.
6. Карбонат кальция образуется, когда СаС12 (р-р) ре-
агирует с:
1) КНСО3; 2) К,СО3;
3) СО2(изб.); 4) NH4HCO3.
7. С известковой водой взаимодействуют:
l)MgCl7; 2) Са(НСО3)2;
3)NaCl; 4) K2SO4.
8. НЕ реагируют с дигидрофосфатом аммония (р-р):
1) аммиак; 2) фосфорная кислота;
3) угольная кислота; 4) щелочи.
9. Отметьте формулы веществ, с которыми реагирует
водный раствор гидрокарбоната аммония:
1)НС1; 2) Н7СО3;
3) ВаС12; 4) КОН.
10. Укажите формулу соли, при обработке которой как
разбавленной кислотой, так и щелочью выделяется газ:
l)NaHCO3; 2) Na,S;
3)NH4C1; 4) (NH4)2CO3.
185 —
ТЕСТ 4
1. Кислые соли в реакциях со щелочами может обра-
зовать кислота:
1) уксусная; 2) хлорная;
3) пирофосфорная; 4) хлорноватистая.
2. В реакциях со щелочами НЕ могут образовать кис-
лые соли кислоты:
1) хлорноватая; 2) угольная; 3) сернистая; 4) азотистая.
3. Два типа кислых солей в реакциях со щелочами
образует кислота:
1) угольная; 2) сероводородная;
3) фосфорная; 4) хлористая.
4. Укажите формулы дигидроортофосфатов:
1) Na3PO4; 2) Са(Н2РО4),;
3) NH4H2PO4; 4) ВаН2Р2О7.
5. Кислая соль (соли) может образоваться, когда со
щелочами реагируют:
1) СО2; 2) С12О7; 3) N.O.; 4) Р2О5.
6. Три различных типа солей в реакциях с КОН обра-
зует оксид, формула которого:
1)N2O3;2)P2O5;3)SO2;4)C12O7.
7. Только средние соли образуются, когда с NaOH ре-
агируют:
1) H2S; 2) N2O5; 3) С12О7; 4) SO2.
8. Как кислые, так и средние соли могут образовать-
ся, когда со щелочами реагируют:
1) НС1; 2) N2O3; 3) SO3; 4) Р2О5.
9. Соли состава К,РО4, (CuOH)Cl и Na,HPO4 являют-
ся соответственно:
1) средней, кислой и основной;
2)средней, основной и кислой;
— 186 —
3) кислой, средней и основной;
4) основной, кислой и средней.
10. Укажите формулы солей, которые можно назвать
кристаллогидратами:
1) H,SO4 2Н,О; 2) FeSO4 7Н,О;
3) [Сг(Н2О)6] С13; 4) Na,CO3 • 10Н?О.
ТЕСТ 5
1. Соль образуется, когда с H2SO4 (разб.) реагируют:
I) КС1 (р-р); 2) Na2CO3; 3) Си; 4) Са(ОН),.
2. Укажите ряд, в котором каждое из веществ в реак-
ции с соляной кислотой образует соль:
1) Zn, А1,О3, K?SO3; 2) А1(ОН)3, ZnO, BaSO4;
3) NaNO,, KF,’Ca(NO3),; 4) CuO, NaOH, SO3.
3. Даны формулы веществ: Mg, Mg(OH)2, MgCO3, MgO.
Сколько из них в реакции с азотной кислотой образуют
соль(соли?)
1)4; 2)3; 3)2; 4) 1.
4. С образованием соли с водным раствором сульфа-
та меди (II) реагируют металлы:
l)Zn;2)Hg;3)Ag;4)Fe.
5. В водном растворе химическое взаимодействие
возможно между солями:
1) Na,S и СиС12; 2) СаС1, и Na,CO3;
3) Ba(NO3)2 и КС1; 4) AgNO3 и NaF.
6. Соль образуется, когда к раствору ВаС12 добавляют:
1) азотную кислоту; 2) серную кислоту; 3) сульфат ка-
лия; 4) нитрат натрия.
7. В водном растворе осуществимы реакции между:
1) NaCl и ВаСО3; 2)ZnSO4HKOH;
3) Zn(NO3)2 и Си; 4)FeSnHCL
187 —
8. Соль можно получить при взаимодействии.
1) ZnSO4 (р-р) и Mg; 2) АЦО3 и HNO,;
3) Fe(OH), и КС1 (р-р); 4) ВаСО, и NaNO3 (р-р).
9. Сульфат кальция образуется, когда водный раствор
хлорида кальция реагирует с:
1) NaHSOr 2) BaSO4; 3) Na2SO4; 4) IG,SO3.
10. Соль аммония можно получить при взаимодействии:
1) аммиака и воды;
2) аммиака и разбавленной серной кислоты,
3) сульфата аммония и хлорида бария;
4) хлорида аммония и нитрата серебра (I).
ТЕСТ 6
1. В каких группах указаны формулы веществ, каждое
из которых реагирует с водным раствором CuCl,?
1) AgNO,, Na,CO3, Au; 2) NaOH, K3PO4, Fef
3) Na2S, HNO', Zn; 4) Ba(OH)2, Na2CO3, AgNO3.
2. Соль можно получить взаимодействием:
1) оксидов металлов с кислотами;
2) металлов с кислотами,
3) различных солей;
4) оксидов металлов с водородом
З.Соль НЕЛЬЗЯ получить взаимодействием:
1) металлов с неметаллами;
2) металлов с солями;
3) кислотных оксидов со щелочами;
4) оксидов с водой.
4. С каждым из веществ, формулы которых Fe, AgNO3,
K,S, взаимодействует соль (электролиты взяты в виде
водных растворов):
1) нитрат калия; 2) хлорид цинка;
3) сульфат меди (II); 4) хлорид бария
— 188 —
5. Сульфат можно получить при взаимодействии:
1) меди с серой при нагревании;
2) железа с разбавленной серной кислотой;
3) железа с водным раствором сульфата меди (II);
4) водных растворов сульфита натрия и хлорида бария.
6. Реакция между солью и основанием возможна при
смешивании:
1) CuSO4 (р-р) и Са(ОН)2 (р-р);
2) Са3(РО4), и NaOH (р-р);
3) FeCL, и NH3 Н,О;
4) KNO3(p-p) и Ва(ОН), (р-р).
7. Соль, которая называется сульфид, можно получить
при взаимодействии:
1) цинка и серы при нагревании;
2) водных растворов сульфата меди (II) и сероводорода;
3) водных растворов нитрата бария и сульфида натрия;
4) сульфида цинка и соляной кислоты.
8. Соль угольной кислоты можно получить при взаи-
модействии:
1) КОН (р-р) и СО2;
2) ВаО, и Na,CO3 (р-р);
3) Na,CO3 (р-р) и KNO3 (р-р);
4) СО, и СаО.
9. Реакция между двумя солями возможна при сме-
шивании:
1) NaCI (р-р) и CuSO4 (р-р);
2) К,СО3 (р-р) и Ca(NO3), (р-р);
3) BaSO4 и FeCl, (р-р);
4) Zn(NO3), (р-р) и K,S (р-р).
10. Кислота и соль между собой реагируют при сме-
шивании:
1) CuCl, (р-р) и H2SO4 (разб );
— 189 —
2) ВаС12 (р-р) и H2SO4 (разб.);
3) AgNO3 (р-р) и Н3РО4 (разб.);
4) Na,SO4 (р-р) и HNO3 (конц.).
ТЕСТ 7
1. Укажите формулы веществ, которые образуют соль
(соли), реагируя как с соляной кислотой, так и водным
раствором гидроксида бария:
1) Cu(NO,),; 2) Na,CO3; 3) А1,О3; 4) Zn(OH)2.
2. Соль азотной кислоты образуется при взаимодей-
ствии:
1) N,O3 и КОН; 2) N.O. и К,О;
3) CuCl, и HNO3; 4) N2O5 и Ва(ОН)2.
3. Даны вещества, формулы которых КС1, Na,CO3, HNO3,
Ва(ОН)2, AgNO3. Сколько различных по составу средних
солей можно получить, используя только эти вещества?
1)6; 2) 5; 3)4; 4)3.
4. Обе соли — карбонат натрия и сульфат натрия —
взаимодействуют с водными растворами:
I) HNO3; 2) ВаС12; 3) НС1; 4) Са(ОН)'.
5. Сульфат меди (II) реагирует, а хлорид цинка — нет
с веществами, формулы которых:
1) Fe; 2) Na2S; 3) Ba(NO3),; 4) КОН.
6. Соль состава КЭО4 образуется, когда в водный ра-
створ щелочи добавляют:
1) N2O5; 2) Р2О5; 3) SO3; 4) С1,О7.
7. Соль состава КЭО3 образуется, когда между собой
реагируют КОН (р-р) и:
1) НСЮ4; 2) С1,О5; 3) НС1О3; 4) N2O_.
8. Сульфат магния образуется при взаимодействии:
I) Mg(OH), и Na2SO4 (р-р); 2) Mg(OH), и H2SO4;
190 —
3) MgO и so3; 4) MgO и H2SO4
9. Хлорид меди (II) НЕЛЬЗЯ получить взаимодей-
ствием:
1) Си и С!,; 2) СиО и НС1 (р-р);
3) Cu(NO3), и НС! (р-р); 4) Си и НС! (разб.).
10. Соль можно получить при взаимодействии:
1) KNO3 и НС! (р-р); 2) СиО и СО (t°);
3) H2SO4 и NH.; 4) А1,О. и Ва(ОН)2 (р-р).
ТЕСТ 8
1. Укажите формулы кислых солей:
l)(MgOH),SO4; 2) КН,РО4;
3) (NH4)2HPO4; 4) К2Н2Р2О7.
2. Кислые соли образуются, когда со щелочами взаи-
модействуют кислоты:
1) серная, ортофосфорная, сероводородная;
2) сернистая, азотистая, хлористая;
3) ортофосфорная, метафосфорная, хлорная;
4) угольная, хлорноватистая, двуфосфорная.
3. Гидрокарбонат калия образуется при взаимодействии
(электролиты взяты в виде водных растворов):
1)1 моль КОН и 1 моль СО,;
2) 2 моль КОН и 1 моль СО,;
3) 1 моль КОН и 2 моль СО,;
4) NaHCO, и КОН (изб.).
4. Укажите формулы веществ, с которыми может взаи-
модействовать гидрокарбонат калия в водном растворе:
1) НС!; 2) СаС!,; 3) СО2; 4) КОН.
5. Кислая соль будет конечным продуктом реакции
при взаимодействии водных растворов:
1) КОН (изб) и H,SO4; 2) H,SO4 (изб.) и КОН;
— 191 —
3) К,СО3 и СО,; 4) NaHCO3 и Ca(NO3),.
6. Гидрокарбонат натрия в водном растворе можно
превратить в карбонат натрия с помощью:
1) нагревания; 2) СО,; 3) Ва(ОН),; 4) СаСО3.
7. Карбонат натрия в водном растворе можно пере-
вести в гидрокарбонат натрия с помощью:
1) Са(НСО3),; 2) СО,; 3) КНСО3; 4) нагревания.
8. К3РО4 реагирует, а КН,РО4 — нет с веществами,
формулы которых:
1) H,SO4; 2) CaCi,; 3) Са(ОН),; 4) Н3РО4.
9. КН,РО4 реагирует, а К3РО4 — нет с веществом,
формула которого:
1) HNO3; 2) Ва(ОН)2; 3) NaOH; 4) Н3РО4.
10. Как К3РО4, так и К,НРО4 реагирует с веществами,
формулы которых:
1) Ca(NO3),; 2) Ва(ОН),; 3) Н3РО4; 4) NaNO3.
ТЕСТ 9
1. Как Na2HPO4, так и NaH2PO4 реагирует с:
1) H,SO4; 2) Ва(ОН),; 3) Н3РО4; 4) СаС1,.
2. Дигидроортофосфат калия образуется при взаимо-
действии (электролиты взяты в виде водных растворов):
1) 1 моль КОН и 1мольН3РО4;
2) 1 моль КОН и 2 моль Р,О5;
3) 2 моль КОН и 1 моль Р,О.;
4) 4 моль КОН и 1 моль Р,О..
3. Кислые соли образуются при взаимодействии
(электролиты взяты в виде водных растворов):
1) 1 моль Ва(ОН), и 1моль СО,;
2) 1 моль Ва(ОН), и 2 моль СО,;
3) 3 моль СаО и 2 моль Н3РО4;
192 —
4) 1 моль СаО и 2 моль Н,РО4.
4. Гидрофосфат кальция в дигидрофосфат кальция пе-
реводит вещество, формула которого:
1) КОН; 2) Ca(NO3)2; 3) Н3РО4; 4) Ва(ОН),.
5. Дигидрофосфат кальция в гидрофосфат кальция
могут перевести вещества, формулы которых:
1) Н3РО4; 2) Са(ОН)2; 3) КОН; 4) HNO3.
6. Ортофосфат бария можно перевести в дигидроор-
тофосфат бария с помощью:
1) Н2О; 2) Н3РО4; 3) КН,РО4; 4) H2SO4 (конц.).
7. Карбонат кальция в качестве конечного продукта
может образоваться при взаимодействии известковой
воды с:
1) оксидом углерода (II);
2) гидрокарбонатом натрия;
3) карбонатом калия;
4) избытком углекислого газа.
8. Гидроксид натрия в водном растворе реагирует с
веществами, формулы которых:
1) K^SiO^ 2) NaHCO3; 3) CuCl2; 4) Al2(SO4)r
9. Между собой НЕ взаимодействуют (электролиты
взяты в виде водных растворов):
I) Cu(NO3), и НС1;
2) Na,SO4 и HNO3;
3) ВаСО, и СО, (водный раствор);
4) NaHCO3 и СО2 (водный раствор).
10. Возможно взаимодействие между веществами,
формулы которых (электролиты взяты в виде водных ра-
створов):
I) Са(Н,РО4), и Н3РО4; 2) К,НРО4 и Н3РО4;
3) NaH2PO4 и NaOH; 4) Na,SO4 и Н3РО4.
7 Зак.1530
--- 193 -----
ТЕСТЮ
1. Реакция между солью и кислотой осуществима, ког-
да взаимодействуют водные растворы:
1) КНСО3 и НС1; 2) AgNO3 и HF;
3) КС1 (р-р) и H2SO4 (разб); 4) К2НРО4 и Н3РО4.
2. Реакция между солью и основанием осуществима,
когда взаимодействуют:
-1) CuSO4 и Са(ОН), (р-р);
2) Са3(РО4), и NaOH (р-р);
3) Са(Н,РОД, и КОН (р-р);
4) NaNO3 и КОН (р-р).
3. Осадок будет конечным продуктом реакции, когда
между собой взаимодействуют:
1) NH3 и H,SO4;
2) CuSO4 и H2S (р-р);
3) СО2 и Са(ОН)2 (избыток; р-р);
4) Ba(NO3)2 и Na2SO4 (р-р).
4. Между собой взаимодействуют водные растворы:
1) К3РО4 и КН,РО4; 2) Na2HPO4 и NaH,PO4;
3) К3РО4 и К2НРО4; 4) К?НРО4 и Н3РО4.
5. В водном растворе между собой НЕ взаимодействуют:
1) KHS и H,S; 2) KHS и НС1;
3) K2S и H2S; 4) KHS и КОН.
6. Дигидрофосфат аммония в водном растворе может
реагировать с веществами, формулы которых:
1) NH3; 2) Ва(ОН)2; 3) Н3РО4; 4) KNO3.
7. Укажите формулу конечного продукта реакции меж-
ду известковой водой и избытком углекислого газа:
1) СаСО3; 2) (СаОН),СО3;
3) Са(НСО3)2; 4) СаС,.
194 —
8. Гидрокарбонат аммония в водном растворе может
реагировать с:
1) СО2; 2) НС1; 3) Ca(NO3),, 4) КОН.
9. Укажите формулу соли, которая реагирует как со
щелочами, так и сильными кислотами:
I) NaCI; 2) Са3(РО4)2; 3) NaHCO3; 4) K,S.
10. Соль образуется при взаимодействии:
1) А1(ОН)3 и КОН(р-р);
2) ZnO и NaOH (т), /°;
3) Са(НСО(), и Са(ОН)2(р-р);
4) Са(Н2РО4)2иН,Р04(р-ры).
ТЕСТИ
1. Гидросульфит натрия можно перевести в сульфат
натрия с помощью.
1) щелочи, 2) соляной кислоты^
3) серной кислоты; 4) сернистой кислоты.
2. При взаимодействии водного раствора Ва(ОН), и
избытка SO, конечным продуктом будет вещество, фор-
мула которого:
1) (BaOH)2SO3; 2) Ba(HSO3)2; 3) BaSO3; 4) Ba(HSO4)2.
3. При взаимодействии Р,О5 и избытка известковой воды
конечным продуктом будет вещество, формула которого:
1) Са(Н2РО4)2; 2) СаНРО4; 3) Са3(РО4)2; 4) Са3Р2.
4. При пропускании избытка СО, в водный раствор
Ва(ОН), последовательно образуются:
1) Ва(НСО3), и ВаСО3; 2) ВаСО3 и Ва(НСО3)2,
3) ВаСО3 и ВаО, 4) Ва(НСО3), и ВаО.
5. В водный раствор Н,РО4 по каплям добавляют из-
быток раствора Ва(ОН),. При этом последовательно об-
разуется:
1) Ва3(РО4)2, ВаНРО4,Ва(Н2РО4)2,
--- 195 ----
2) Ва(Н,РО4)„ ВаНРО4, Ва3(РО4),;
3) Ва3(РОД, Ва(Н,РО4)„ ВаНРО4;
4) ВаНРО4, Ва(Н2РО4)2, Ва3(РО4)2.
6. Только средняя (а не кислая или их смесь) соль об-
разуется при взаимодействии (электролит взят в виде
водного раствора):
1) 1 моль КОН и 0,7 моль СО,;
2) 1 моль КОН и 1 моль СО,;
3) 1 моль КОН и 2 моль СО,;
4) 2 моль КОН и 1 моль СО,.
7. Только кислая (а не средняя или их смесь) соль об-
разуется при взаимодействии (электролиты взяты в виде
водных растворов):
1)1 моль NaOH и 2 моль SO,;
2) 1 моль Са(ОН), и 1,5 моль СО,;
3) 1 моль Р,О5 и 6 моль КОН;
4) 1 моль K,SO3 и 0,5 моль НС1.
8. Смесь двух кислых солей образуется при взаимо-
действии (электролиты взяты в виде водных раство-
ров):
1)1 моль Na,SO3 и 0,5 моль НС1;
2) 1 моль Na,CO3 и 3 моль НС1;
3) 1 моль Р,О5 и 3 моль КОН;
4) 1 моль Н,РО, и 1,5 моль NaOH.
9. Основные соли можно рассматривать как продук-
ты неполного замещения групп ОН в многокислотных
основаниях кислотными остатками. Основная соль мо-
жет образоваться, когда между собой реагируют:
1)1 моль Сн(ОН), и 1 моль НС1;
2) 1 моль А1С13 и 2 моль NaOH;
3) 1 моль Mg(OH), и 1 моль H,SO4;
4) 1 моль FeCl3 и 3 моль КОН.
— 196 —
10. Укажите формулу реагента, который переводит
(CuOH)Cl в CuCl,:
1) NaOH; 2) НС1; 3) NaCl; 4) Си (О И),.
ТЕСТ 12
1. В водный раствор Ва(ОН), по каплям добавляют ра-
створ Н3РО4. При этом последовательно образуются соли:
1) ВаНРО4, Ва(Н,РО4),, Ва3(РОД;
2) Ва(11,РО4)„ ВаНРО4, Ва3(РОД;
3) Ва3(РО4)„ ВаНРО4, Ва(Н,РОД;
4) Ва3(РО4)2.Ва(Н2РО4)2, ВаНРО4.
2. Водный раствор аммиака насытили углекислым
газом. Укажите формулу конечного продукта реакции:
1) NH4HCO3; 2) (NH4)2CO3; 3) (NH2)2CO; 4) CH3NH,.
3. Три соли будут присутствовать в конечном водном
растворе, когда между собой реагируют:
1) 1 моль Р,О5 и 2,5 моль NaOH;
2) 1 моль K,SO3 и 0,5 моль НС1;
3) 1 моль Н3РО4 и 2,7 моль КОН;
4) 0,2 моль NaOH и 0,3 моль Р2О5.
4. Карбонат калия реагирует, а гидрокарбонат калия —
нет с водными растворами веществ:
1) СО,; 2) СаС1?; 3) HNO3; 4) NaNO3.
5. Взаимодействуют растворы, содержащие 0,02 моль
Ва(ОН), и 0,04 моль Н3РО4. Укажите массу (г) получен-
ной соли:
1) 12,02; 2) 6,62; 3) 4,66; 4) 9,32.
6. При полном термическом разложении нитрата алю-
миния потеря массы составит (%):
1)46,1; 2) 56,1; 3)66,1; 4) 76,1.
197 —
7. Сколько веществ из перечисленных реагирует с NaOH
в водном растворе: Ва(НСО3)2, А1,О3, Na2[Zn(OH)4],
(CuOH)Cl, Cl,, FeCl3?
1) 6; 2) 5; 3) 4; 4) 3.
8. При обработке как щелочью, так и сильной кисло-
той при нагревании газ выделяется в случае:
1) КНСО3; 2) NH4HCO3;
3) Na2CO3; 4) (NH4)2SO3.
9. НЕ могут существовать соли состава:
1)(AIOH)2SO4; 2)Ba,ZnO2;
3) Ва3[А1(ОН)6]2; 4) NH4A1(SO4)2.
10. Комплексное соединение образуется, когда между
собой реагируют:
1) ZnCl2 и КОН (р-р, изб.);
2) 1 моль ZnCl2 и 2 моль NaOH (р-р);
3) 1 моль A1,(SO4)3 и 12 моль КОН;
4) СгС13 и КОН (р-р, изб.).
ТЕСТ 13
1. Пробирки с сухими солями MgSO4, A12(SO4)3, K,SO4
и (NH4)2SO4 можно различить с помощью водного ра-
створа:
1) НС1; 2) KNO3; 3) ВаС12; 4) NaOH.
2. Водные растворы AgNO3 и AgF можно различить с
помощью:
1) NaNO3; 2)НС1;
3) (СН3СОО)2Са; 4) H,SO4 (разб.).
3. Кислая соль НЕ может образоваться, когда с NaOH
реагируют:
1) СО,; 2)N2O5; 3) NO,; 4) N,O3.
--- 198 -—
4. Только средняя соль образуется, когда с раствора-
ми, содержащими различное химическое количество
NaOH, реагируют по отдельности:
1) МгцО7 и Р2О.; 2) С1,О7 и Мп7О7;
3) SO’и С17О5; 4) СО2 и SO,.
5. В свободном состоянии (25°С) НЕ выделены ве-
щества, формулы которых:
1) NH4OH; 2) HNO3; 3) H^SO,; 4) Н2СО,.
6. Одним из конечных продуктов будет осадок, когда
между собой реагируют:
1) 1 моль A12(SO4), и 6 моль КОН (р-р);
2)А14С3иН2О;
3) A1(NO,)3 (р-р) и NaOH (изб );
4) Са(ОН)2 (р-р) и Р2О5 (изб ).
7. НЕ образуется твердый остаток при нагревании:
1) КНСО3; 2) NH4HCO3; 3) ВаСО,; 4) Cu(NO3)2.
8. Дигидрофосфат бария образуется при взаимодей-
ствии водных растворов, содержащих:
1) 0,2 моль Н3РО4 и 0,1 моль Ва(ОН)7;
2) 0,3 моль Ва(ОН)2 и 0,1 моль Р,О5;
3) 0,1 моль Ва3(РО4)2 и 0,6 моль Н,РО4;
4) 0,1 моль Ва3(РО4)2 и 0,1 моль Н3РО4.
9. Смесь кислой и средней солей образуется при взаи-
модействии (электролиты взяты в виде водных растворов):
1) КОН и избытка SO7;
2) SO, и избытка Ва(ОН)2;
3) 0,1 моль Ва(ОН)2 и 0,15 моль SO7;
4) 0,1 моль Р2О5 и 0,25 моль Ва(ОН)2.
10. Смесь К2СО3, ВаСО3 и КОН образуется, когда
между собой реагируют растворы, содержащие 1,71 г
Ва(ОН)2 и КНСО, массой (г):
1) 1,00; 2) 2,00; 3) 1,50; 4) 2,50.
199 —
ТЕСТ 14
1. Основная соль — это:
1) киноварь; 2) доломит;
3) мирабилит; 4) малахит.
2. Комплексные соединения (соли) образуются при
взаимодействии:
1) Сг,О3 и NaOH (р-р); 2) Мп,О7 и КОН (р-р);
3) ZnO и NaOH (т) (t°); 4) СгС13 и КОН (р-р, изб.).
3. При длительном нагревании малахита на воздухе
образуются:
1) Си, СО,, Н,О; 2) Си(ОН)2, Н2СО3;
3) СиО, СО,, Н,О; 4) Си2О, СО2, Н,О.
4. Основную соль можно получить при взаимодействии:
1) 1 моль А1(ОН)3 и 1 моль H2SO4 (р-р);
2) 1 моль Сп(ОН)2 и 1 моль НС1 (р-р);
3) 1 моль (MgOH) Cl и 1 моль НС1;
4) 1 моль К3[А1(ОН)6] и избытка HNO3.
5. В растворе, содержащем Н3РО4 массой 4,9 г, раство-
рим Na2O массой 1,55 г. Укажите формулу и химическое
количество продукта реакции:
1) 0,250 моль NaH,PO4; 2) 0,050 моль Na,HPO4;
3) 0,100 моль Na3PO4; 4) 0,050 моль NaH,PO4.
6. Между собой взаимодействуют:
1) Na,[Be(OH)4] и КОН (р-р);
2) (CuOH) С1 и КОН (р-р);
3) Са(НСО3), и СО, (р-р);
4) K,SO4 и HNO3 (р-р).
7. Раствор сернистого газа в воде насытили аммиа-
ком. Укажите формулу конечного продукта реакции:
1) NH4HSO3; 2) (NH4),SO3;
3)NH4HS; 4)(NH4)>
--- 200 ---
8. В раствор Ва(ОН), добавляли Р2О5 до прекращения
реакции. Укажите формулу конечного продукта:
1)Ва3Р7; 2)Ва3(РОД;
3)ВаНРО4; 4) Ва(Н,РО4),.
9. Комплексными соединениями являются:
1) медный купорос;
2) доломит;
3) тетрагидроксоцинкат калия;
4) гексагидроксоалюминат бария.
10. Оксид фосфора (V) можно использовать для осу-
шения газов:
1)HC1;2)NH3; 3) O2;4)SO2.
ТЕМА 15
Связь между классами неорганических веществ
ТЕСТ1
1. Осуществимо взаимодействие между веществами
в обеих парах (электролиты взяты в виде водных ра-
створов):
1) NaOH и CuCl,; К2СО3 и НС1;
2) Zn(OH), и HNO3;"KNO3 и BaSO4;
3) А1(ОН)3 и КОН; ВеО и КОН;
4) Са(НСО3), и Ва(ОН); Na,SiO3 и СО,.
2. С гидроксидом калия в водном растворе реагиру-
ет каждое из веществ, формулы которых приведены в
группах:
l)NH4Cl,MgCl,,Ca(HCO3),;
--- 201
2) NH4NO3, C02, KNO3;
3) Fe9(SO4), A1(OH)3, ZnO;
4) NaHCO3, H3PO4, (CuOH)CL
3. Оба гидроксида — NaOH и A1(OH)3 — в водном
растворе взаимодействуют с:
1) KNO3; 2) КОН; 3) H2SO4; 4) КС1.
4. С соляной кислотой реагирует каждое из веществ,
формулы которых приведены в группах:
1) Al, NaHCO3, KNO3;
2) А12О3, Zn(OH),, Са(НСО3),;
3) ВаО, Na,S, KHS;
4) Ва(ОН)2, (MgOH)Cl, AgNO3.
5. При термическом разложении каких солей можно
получить основный оксид?
1) карбонат кальция; 2) нитрат серебра (J);
3) нитрат алюминия; 4) нитрат меди (II).
6. Между собой в присутствии воды прореагируют:
1) СаСО3 и SO3; 2) Са(НСО3), и НС1;
3) (СиОН)С1 и НС1; 4) (MgOH)NO3 и NaNO3.
7. Взаимодействием между собой каких веществ, фор-
мулы которых приведены ниже, можно получить нит-
рат?
1) NaOH и HNO3;
2) N,O5 и Са(ОН), (р-р);
3) (CuOH)NO3 и КОН (р-р);
4) CuSO. и HNOV
8. Укажите формулы веществ, которые можно исполь-
зовать для очистки воздуха от примесей оксида серы (IV):
1) NaOH; 2) Р2О5; 3) СаО; 4) СаС12.
9. Укажите формулы веществ, с помощью которых
можно осушить от влаги углекислый газ:
1) NaOH; 2) Р2О5; 3) СаО; 4) СаС1,.
--- 202 ----
10. С гидроксидом натрия в водном растворе взаи-
модействует каждое из веществ, формулы которых при-
ведены в группах:
1) СО,, К2СО3, H2SO4;
2) Zn(OH)2, КНСО3, K2SiO3;
3) SO3, Н3РО4, NH4C1;
4) А12О3, Mg(HCO3)2, Zn(OH),.
ТЕСТ 2
1. Осуществимо взаимодействие между веществами
в обеих парах (электролиты взяты в виде разбавленных
водных растворов):
1) СаСО3 и СО, (р-р); KHS и H,SO4;
2) NaCl и H,SO4; Са(НСО3), и Ва(ОН),;
3) СаС1, и СО, (р-р); K,SO4 и Ba(NO3)2;
4) AgNO3 и НС1; AgNO3 и Н3РО4.
2. Укажите формулы оксидов, для которых подходят
характеристики: твердые вещества (н. у.), не реагируют с
водой, хорошо растворимы в щелочах и соляной кислоте:
1) SiO,; 2) А1,О3; 3) СиО; 4) ZnO.
3. Формулы веществ, каждое из которых реагирует с
хлоридом меди (II) в водном растворе, указаны в группах:
1) Fe, КОН, HNO3; 2) Zn, NaOH, K,S;
3) Ba(OH),, Na,CO3, K,SO3; 4) AgNO3, K3PO4, Ag.
4. Прямым синтезом (в одну стадию) из оксида алю-
миния можно получить:
1) А1(ОН)3; 2) A1,(SO4)3; 3) Na3[Al(OH)6]; 4) КА1О2.
5. Ошибки допущены при написании формул солей:
1)(A1OH)SO4; 2)(NH4),MgPO4;
3)K3[Zn(OH)4]; 4) Са(СЮ)С1,.
—- 203 ----
6. С серной кислотой в разбавленном растворе реа-
гирует каждое из веществ, формулы которых приведены
в группах:
1)К0Н, Zn, Си; 2) Fe, Fe(OH),, BaO,
3)NaHCO3, ВаС12,А1(ОН),; 4) K2CO3, CO2, Na2SO3.
7. В пробирки с водой добавили по 0,1 г веществ,
формулы которых приведены ниже. Фенолфталеин ок-
расится в малиновый цвет в пробирках с:
I) К2О, 2) SiO2, 3) NaOH; 4) Al,Or
8. С хлороводородом в разбавленном растворе реагирует
каждое из веществ, формулы которых приведены в группах
1) NaHCO,, AgNO„ NH, 11,0,
2) Cu(OH)2, CuSO4, CuO,
3) Zn, A1(OH)3, BeO;
4) BaO, (MgOH)Cl, AgF.
9. Непосредственным растворением в воде соответ-
ствующих оксидов могут быть получены гидроксиды,
формулы которых:
1) H2SO4; 2) Cu(OH)2; 3) Н3РО4; 4) Zn(OH)2
10. В водных растворах как хлороводород, так и гидро-
ксид калия реагируют с веществами, формулы которых.
1) СиО, 2) Zn; 3) Сг(ОН)3; 4) А1,О3.
ТЕСТЗ
1. Укажите ряды, в которых приведены формулы ве-
ществ, которые попарно реагируют друг с другом:
1) MgO, СО2, Р2О3; 2) ZnO, SO,, N„OS;
3) А12О3, СаО, H2SO4; 4) А12О3, SO,, NaOH.
2. Между собой попарно реагирую! все вещества,
формулы которых приведены в группах:
1) NaHCO,, КОН, НС1; 2) КС1, AgNO„ HF;
--- 204 ---
3) SO,, H,0, BaO; 4) A1(OH)3, H,SO4, NaOH.
3. Сколько элементов из перечисленных (Ba, С, Сг,
Мп, С1) образуют кислотные оксиды?
1)5; 2) 4; 3)3; 4) 2.
4. Гидроксид пинка реагирует, а гидроксид магния —
нет с веществом, формула которого:
1) HNO3; 2) KNO3; 3) Ва(ОН),; 4) NaCl.
5. С гидроксидом калия в водном растворе реагирует каж-
дое из веществ, формулы которых приведены в группах:
1)А1,О3, CrO3, Zn(OH),;
2) Р Д, Mn,O7, NaNO3;
3) NaHCO3, (MgOH)Cl, CuSO4;
4) ZnO, Be(OH)2, C1,O7.
6. Свежеосажденные осадки Mg(OH), и A1(OH)3 мож-
но различить между собой с помощью:
1) соляной кислоты;
2) водного раствора нитрата калия;
3) водного раствора щелочи;
4) серной кислоты.
7. Укажите формулу реактива, с помощью которого
можно различить пробирки с растворами Na2SO4,
NH4NO3, CuC12 и A12(SO4)3:
1) НС1; 2) HNO3; 3) KOH; 4) BaCl2.
8. Как с разбавленной серной кислотой, так и с раство-
рами щелочей реагируют вещества, формулы которых:
1)Са(НСО3),; 2)А1,О3;
3)Zn(OH)2; ' 4)СиС12.
9. Осуществимо взаимодействие между веществами в
обеих парах (соли, кислоты и основания взяты в виде вод-
ных растворов):
1) KHS и Са(ОН),; К2О и А1,О3;
2) КОН и А1(ОН)3; Zn(OH), й КС1;
--- 205 ----
3) Са3(РО4), и Н3РО4; К,НРО4 и H,SO4;
4) NaH,PO4 и Н3РО4; NH4HCO3 и NH3.
10. НЕ могут совместно находиться в водном раство-
ре вещества, формулы которых:
1) KHS и H,S; 2) K,S и H,S;
3) Ва(ОН), и Са(Н,РО4)2; 4) NaH,PO4 и Н3РО4.
ТЕСТ 4
1. Могут совместно находиться в водном растворе
вещества, формулы которых:
1) (MgOH)Cl и НС1; 2) (CuOH)NO3 и КОН;
3) NH4HCO3 и NH3 • Н,О; 4) NaHCO3 и Н2СО3.
2. С каждым из веществ, формулы которых О,, КОН,
Н,О, взаимодействует:
1) аммиак; 2) оксид серы (VI);
3) оксид серы (IV); 4) оксид магния.
3. С КОН (р-р) реагирует каждое из веществ, форму-
лы которых приведены в рядах:
1) СО,, Р2О5, NaHCO3, А1(ОН)3;
2) ZnO, Fe(OH),, ВаС1„ H,SO4;
3) А1,О3, Ca(HSO3)„ Zn(OH),, N,O5;
4) CuCl,, SO3, BeO, SiO,.
4. Дигидроортофосфат аммония в водном растворе ре-
агирует с веществами, формулы которых:
1) NH3; 2) КОН; 3) Н3РО4; 4) H,SO4.
5. Для осуществления перехода Ca(HSO3), —> CaSO3
необходимо взять:
1) H,SO3; 2) КОН; 3) H,SO4; 4) Са(ОН),.
6. Для осуществления перехода NaHSO3 —> Na,SO4
необходимо взять:
1) H,SO3; 2) КОН; 3) H2SO4; 4) K,SO4.
— 206 —
7. Карбонат кальция реагирует, а сульфат калия - нет,
с водным раствором:
1) NaCI; 2) СО2, 3) HNO3; 4) NH4NO3.
8. При нагревании соли могут образоваться:
1) кислотный и основный оксиды,
2) другая соль и простое вещество;
3) кислота и щелочь;
4) два газообразных (н. у.) вещества.
9. В водном растворе возможно взаимодействие меж-
ду веществами, формулы которых:
1) К2СО3 и СаС12; 2) Zn и CuSO4,
3) Си и Zn(NO3)2; 4) H2S и CuSO4
10. Укажите формулы веществ, при нагревании ко-
торых образуются соединения, которые могут реагиро-
вать с разбавленными растворами щелочей с образо-
ванием солей:
1) KNO3; 2) А1(ОН)3; 3) СаСО3,4) Си(ОН)2.
ТЕСТ 5
1. Укажите формулы основных солей, которые можно
получить при взаимодействии Fe(OH)3 и H2SO4:
1) (FeOH)SO4; 2) (FeOH),SO4;
3) [Fe(OH)2]2SO4; 4) [Fe(OH)2]SO4.
2. Соль НЕЛЬЗЯ получить при взаимодействии:
1) Fe,O3 и СО; 2) КС1 (р-р) и H,SO4 (разб );
3) NH3 и NH4H2PO4; 4) KHS и H,S.
3. Конечным продуктом будет осадок, когда между собой
реагируют (электролиты взяты в виде водных растворов):
1) AgNO3 и HF; 2) NaHCO3 и Са(ОН), (изб ),
3) Са(ОН)2 и SO2 (изб ), 4) A1CL, и NaOH (изб.)'
--- 207 ---
4. Для всех кислот характерно взаимодействие с:
1) металлами; 2) солями;
3) щелочами; 4) оксидами неметаллов.
5. Кислую соль в качестве конечного продукта можно
получить при взаимодействии (электролиты взяты в
виде водных растворов):
1) Ва(ОН), и СО2 (изб ); 2) P2OS и КОН (изб );
3) NaOH и N2O5 (изб.); 4) ВаСО3 и SO, (р-р, изб.)
6. Хлорид меди (II) НЕЛЬЗЯ получить взаимодей-
ствием (электролиты взяты в виде разбавленных вод-
ных растворов):
1) СиО и НС1; 2) (СиОН)С1 и НС1;
3)СииНС1; 4) Cu(NO3)2 и НС1.
7. С каждым из веществ, формулы которых NaOH,
А12О3, Ba(NO3)2, взаимодействует:
1) гидроксид калия; 2) хлорид натрия;
3) серная кислота; 4) соляная кислота.
8. Даны вещества, формулы которых: А1,О3, СО2,
NaHCO3, CuCl2, СиО, Р2О5. Сколько из них взаимодей-
ствуют с гидроксидом натрия в водном растворе?
1)6; 2) 5, 3)4; 4)3.
9. С каждым из веществ, формулы которых Ba(NO3)„
Fe, Cu(OH), , будет реагировать (электролиты взяты в
виде разбавленных растворов):
1) хлорид магния; 2) гидроксид натрия;
3) серная кислота; 4) сульфат цинка.
10. Даны вещества, формулы которых H,S, НО, CuSO4.
С каждым из них взаимодействуют (электролиты взяты
в виде водных растворов):
1) нитрат цинка; 2) гидросульфид натрия;
3) сульфид калия; 4) гидроксид бария.
— 208 —
ТЕСТ 6
1. Через склянку с избытком водного раствора щело-
чи пропустили смесь газов SO,, СО,, NO и N,O. На вы-
ходе из склянки обнаружатся:
1) SO, и NO, 2) NO и N,O;
3) СО' и N,O; 4) SO, и СО,.
2. Сколько из оксидов, формулы которых А1,0 СгО3,
NO, Мп,О7 и ВеО, проявляют кислотные свойства в ре-
акциях со щелочами?
1)5; 2) 4; 3)3; 4) 2.
3. Укажите справедливые утверждения:
а) основность кислоты всегда равна числу атомов Н в
ее молекуле;
б) сила кислот оценивается по их окислительной спо-
собности;
в) амфотерные оксиды НЕ реагируют с водой (25°С);
г) вещества, проявляющие свойства основания, НЕ
обязательно, содержат металл.
1) в, г; 2) а,б, г; 3) а, в; 4) б, в.
4. Через склянку с избытком водного раствора щело-
чи пропустили смесь газов НО, SO, и СО, каждый из
которых взят химическим количеством 0,010 моль. Как
изменится масса склянки?
1) возрастет на 0,920 г;
2) не изменится;
3) возрастет примерно на 1,01 г;
4) возрастет на 0,645 г.
5. Гидрокарбонат натрия в водном растворе реагирует
с каждым из веществ, формулы которых приведены в ряду:
1) NaOH, СО,, НС1; 2) Ва(ОН)„ HNO„ KNO3;
3) Са(ОН)„ H,SO4, HNO3; 4) КОН, КНСО3, КС1.
--- 209 ---
6. Обе соли — КНСО3 и К2СО3 — реагируют с вод-
ными растворами:
1) СаС12; 2) НС1; 3) СО2; 4) Ва(ОН)2.
7. Сульфат меди в водном растворе реагирует с каж-
дым из веществ, формулы которых приведены в ряду:
1) Fe, ВаС1„ Mg(NO3)7; 2) Mg, КОН, HNO3;
3) NaOH, (NH4)2S, FeCl,; 4) Zn, K2S, Ba(OH)2.
8. Переход NH4HCO3 (NH4)2CO3 можно осуще-
ствить с помощью:
1) нагревания; 2) аммиака;
3) щелочи; 4) водного раствора углекислого газа.
9. Как NaOH, так и НС1 взаимодействуют с вещества-
ми, формулы которых (электролиты взяты в виде вод-
ных растворов):
1) NaHCO3; 2) А12О3; 3) (NH4)2CO3; 4) Cu(NO3)2.
10. Укажите число реакций между попарно взятыми
веществами, формулы которых: Н2О, N,O5, ZnO, К,0 и
NaOH (р-р):
1)8; 2) 7; 3)6; 4) 5.
ТЕСТ 7
1. Укажите формулы соответственно веществ X, У и
Z для цепочки превращений, протекающих по схеме
Ba BaO Ва(ОН), BaSO4:
1) О„ Н,О, SO,; ' 2) О„ Н,О, SO3;
3) Н2О, КОН, H2SO4; 4) О', Н'О, MgSO4.
2. Укажите формулы натрийсодержащих веществ со-
ответственно X, У и Z для цепочки превращений, проте-
кающих по схеме NaHCO3 -Д X +Ва(ОН)-> У +so=(|j36-)> 7
1) Na,O, NaOH, NaHSO3;
2) Na’CO3, NaOH, Na2SO3;
— 210 —
3) Na,CO3, NaOH, NaHSO3;
4) NaJC03, NaOH, NaHSO4.
3. В цепочке одностадийных превращений, протека-
ющих по схеме Э —> ЭО —> Э (ОН),, химическим эле-
ментом Э может быть:
1) углерод; 2) натрий; 3) цинк; 4) барий.
4. В цепочке одностадийных превращений, протека-
ющих по схеме Э —> ЭО, —> Н,ЭО3, химическим элемен-
том Э может быть:
1) кремний; 2) сера; 3) фосфор; 4) барий.
5. Разбавленная серная кислота выступает в роли
окислителя и участвует в образовании соли, реагируя с.
1) КНСО3; 2) Си; 3) СиО; 4) Zn.
6. Укажите сумму (г/моль) молярных масс углеродсо-
держащих веществ Б и Г в цепочке превращений, про-
текающих по схеме
1 моль NaHCO3 +НС1(из61 A Б Д В ч
+ I моль КОН (p-pj^
1)200; 2) 238; 3)262; 4) 300.
7. Укажите суммарное число атомов всех химических эле-
ментов в формульных единицах фосфорсодержащих веществ
У и Z для цепочки превращений, протекающих по схеме
1 МОЛЬ Р + °’ (Из6~/ .¥+ 0,5 моль Ва<онЬ (Р-Р^ у + 0,5 м<ть Ва(ОН)г (р-рХ у.
1)7; 2) 15; 3) 22; 4) 28.
8. Укажите сумму молярных масс (г/моль) медьсодер-
жащих веществ Y и Z для цепочки превращений, протека-
ющих по схеме
1 МОЛЬ СиО +н^°<(Разб-изб) X +1 мопь NaOH (р-^ у )
-ь 0,5 моль H2SOj (p-g^l
1) 196; 2) 258; 3)356; 4)418.
9. Смесь двух кислых солей образуется, когда между
собой реагируют водные растворы, содержащие:
1) 0,1 моль Ва(ОН)2 и 0,2 моль Н3РО4;
— 211
2) 0,05 моль Ва(ОН), и 0,05 моль Н3РО4;
3) 0,024 моль Ва(ОН), и 0,016 моль Н3РО4;
4) 0,08 моль Ва(ОН), и 0,12 моль Н3РО4.
10. Укажите сумму молярных масс (г/моль) натрийсо-
держащих веществ Б и В для цепочки превращений, про-
текающих по схеме
1 моль Na,О +Н^°<ИЗЧ А +2мольН=роъ Б +4M0JlbNa0H> В:
1) 164; 2) 262; 3)284; 4) 306.
ТЕСТ 8
1. Укажите формулы соответственно веществ X, Y, Z
для цепочки одностадийных превращений
Fe,(SO4)3 Fe(OH)3 -2^ FeCl3 FePO4:
1) NaOH, НС1, P,O5;
2) H,O, HC1, Na3PO4;
3) NaOH, HC1, K3PO4;
4) NaOH, KC1, Na3PO4.
2. В уравнении реакции 2H3PO4 + ЗК,СО3 = X + Y +
+ ЗН2О следует вместо ХиУ соответственно записать:
1) 2К,НРО4 и ЗСО2;
2) 2К3РО4 и ЗСО,;
3) КН2РО4 и 2СО,;
4) K.PQ, и 4СО,.
3. Укажите формулы соответственно веществX, YnZ
для цепочки одностадийных превращений
СО, -2U К,СО3 -2U КНСО3 СаСО3:
1) КОН, Н,СО3, СаС1,;
2) К,О, Н,СО3, Са(ОН),;
3) КОН, Н,СО3, Са(ОН),;
4) КНСО3, Н2СО3, Са(ОН),.
— 212 —
4. Укажите формулы соответственно веществ X, У и
Z для цепочки одностадийных превращений
ZnO ZnSO4 Zn(OH), —?->K,[Zn(OH)4]:
1) H,SO4, КОН, К,О;
2) K’SO4, NaOH, КОН;
3) SO,, NaOH, KOH;
4) SO", NaOH, KOH.
5. Укажите формулы соответственно веществ X, У и Z
для цепочки одностадийных превращений
A1,(SO4)3 А1(ОН)3 А1С13 А1ОНС12:
1) NaOH, AgCl, КОН;
2) Н,О, НС1, NaOH;
3) NH3 • Н,О, НС1, Ва(ОН),;
4) КОН, НС1, NaOH.
6. Укажите формулы соответственно веществ X, Y и Z
для цепочки одностадийных превращений
Са3(РО4)9 Н3РО4 -2^ СаНРО4 -2U Са(Н2РО4)2:
1) H2S, Са(ОН)2, Н3РО4;
2) H,SO4, СаО, Н3РО4;
3) H2SO4, Са(ОН)2, Са(ОН)2;
4) H2SO4, Са(ОН)2, Н3РО4.
7. Укажите формулы соответственно веществ X, Y и Z
для цепочки одностадийных превращений
Са(Н,РО4), Са3(РО4), -2^ СаНРО4 -U Са3(РО4),:
1) Н3РО4, Н3РО4, Са(ОН),;
2) Са(ОН)„ Н3РО4, Са(ОН),;
3) Са(ОН)9, Са(ОН)9, Н3РО4;
4) К3РО4, Н3РО4, Ва(ОН)2.
8. Укажите формулы соответственно веществ Л, У и Z
для цепочки одностадийных превращений
CuCl, (CuOH)Cl -2^ Cu(OH)2 (CuOH)Cl:
1) НС1, NaOH, НС1;
--- 213 ----
2) NaOH, HC1, HC1;
3) KOH, NaOH, HC1;
4) KOH, HC1, NaOH.
9. Укажите формулы соответственно веществ X, Y и Z для
цепочки одностадийных превращений
CuCl, Си CuSO4 CuS:
l)Na, H,SO4 (конц.), K,S;
2) Zn, H,SO4 (разб.),Na,S;
3) Fe, H,SO4 (конц.), H,S;
4) K, H,SO4 (конц.), (NH4)2S.
10. Укажите формулы соответственно веществ X, У и Z
для цепочки одностадийных превращений
NaHSO3 -2U Na2SO4 -Л» NaCl -Ь NaNO3.
1)H,SO4, BaCl,, AgNO3;
2) NaOH, BaCl,, HNO3;
3) H,SO4, BaCl’, HNO3;
4) H,SO4, BaCl’, KNO3.
ТЕСТ 9
В каждом задании укажите формулу вещества X
1. СаСО3 + НС1 -> СаС1,+ Н,0 + А;
А + NaOH (изб.) X + н‘,0.
2. Al + НС1 —> А + Н,;
А + КОН (изб.)—> А.
3. Fe,O3 + Н, (изб.) —> А + Н,О;
А + С1, —
4. Fe2O3 + СО (изб.) —> А + СО,;
А + НС1->%+Н .
5. Fe + Cl, -> А;
А + КОН (разб., изб.) —> КС1+Х
6. Fe + HCl —>А + Н,;
--- 214 ---
A + NaOH (р-р, изб.) -> NaCl + X.
7. Na,CO., + HNO3 —> A + NaNO3 + H.O,
NaOH + А (изб. )
8. CaO + H,0 -> A;
A + CO, "(изб.) —> X.
9. ВаО + H2O -> A,
А (изб.) + CO, —> %+H,0
10. CaCO3 + H,0 + CO, -> A;
A + Ca(OH)~ —> Jf + H2O.
ТЕСТЮ
1. He менее двух различных по составу солей может
образоваться, когда с водным раствором КОН реагируют:
1)Н4Р2О7; 2)С12; 3) СиС12; 4) С1,Об.
2. С образованием кислой соли концентрированная
серная кислота может реагировать с:
1) РД; 2) Са3(РО4)2; 3) K2SO4; 4) NaCl(T).
3. Как щелочи, так и нерастворимые в воде основания:
1) взаимодействуют с водными растворами солей;
2) сравнительно легко разлагаются при нагревании;
3) изменяют окраску индикатора;
4) реагируют с сильными кислотами. -
4. Водные растворы щелочей практически НЕ реаги-
руют с:
1) фенолом;
2) сложными эфирами;
3) насыщенными одноатомными спиртами;
4) аминокислотами.
5. Соль и амфотерный оксид образуются при нагре-
вании:
1) доломита; 2) перманганата калия;
--- 215 ----
3) норвежской селитры; 4) поташа.
6. Формулы кислот одного класса приведены в ряду:
1) HF, HBr, H2S; 2) HBr, H7S, HNO3;
3) НС1, HNO3, H3PO4; 4) H7S, H>04, H2SO4.
7. Осадок, нерастворимый в разбавленных сильных
кислотах, образуется в качестве конечного продукта при
взаимодействии (электролиты взяты в виде водных ра-
створов):
1) железного купороса и сероводорода;
2) медного купороса и сероводорода;
3) нитрата серебра и фосфорной кислоты;
4) хлорида алюминия и избытка щелочи.
8. Схеме «соль + слабая кислота —> соль + сильная
кислота» отвечает реакция между (электролиты взяты в
виде разбавленных водных растворов):
1) ВаС12 и H2SO4; 2) CuSO4 и H2S;
3) FeS и HNO3; 4) CH3COONa и HC1.
9. Из водного раствора Ва(НСО3)2 осадок выпадает,
когда к раствору добавляют:
1) Na2O; 2) Са(ОН)2; 3) СО2; 4) SO3.
10. Укажите справедливые утверждения:
1) в состав всех кислот входит атом водорода (по оп-
ределению С. Аррениуса);
2) соединения, обладающие основными свойствами,
обязательно содержат атом металла;
3) оксиды неметаллов НЕ могут иметь атомную кри-
сталлическую решетку;
4) НЕ всегда основность кислоты равна числу атомов
водорода в молекуле.
— 216 —
ТЕМА 16
а< s.-
Классификация химических реакций
ТЕСТ1
1. Укажите схемы реакций соединения:
1) Fe(OH)3 -> Fe,O3 + Н,О;
2) AgNO, -> Ag + NO, + О,;
3) SO2 + О, —» SO3;
4) NO, + б2 + H2O -> HNO3.
2. Укажите схемы реакций, для проведения которых
используется катализатор:
1) КОН + H2SO4 -> K,SO4 + Н2О;
2)N2 + H2^NH3;
3) NH3 + О2 -> NO + Н2О;
4) NH3+O2->N2 + H2O.
3. Выберите уравнения или схемы гетерогенных ре-
акций:
1) СаСО3(т) = СаО(т) + СОад;
2)СН4(г) + О2(г)->СО2(г) + Н2О(ж);
з) FeS2(T) + FeA(T) + scW
4) КОН(р-р) + HNO3 (р-р) = KNO, (р-р) + Н2О(ж).
4. Отметьте уравнения или схемы реакций разложения:
1) HNO3 Н2О + NO2 +0,;
2) Fe + Cu(NO3)2 = Fe(NO3)2 + Си;
3) NaOH + HC1 = NaCl + H,0;
4) H,02 -> H,0 + O,.
5. Выберите уравнения или схемы гомогенных реакций:
l)K(T+H2Ow^KOH(p-p) + H2(r-
2)N2(r) + H2(r)-^NH3(r);
--- 217 —
3) ВаС12 (р-р) + H,SO4 (р-р) = BaSO4(T) + 2НС1 (р-р);
4) Са(ОН), (р-р) + НС! (р-р) -> Н,0(ж) + СаС12 (р-р).
6. Укажите уравнения или схемы реакций замещения:
1) Zn + 2AgN0, = Zn(NO3X + 2Ag;
2) Fe + H2SO4 = FeSO4 + H7;
3) CaCl2 + Na,CO3 = CaCO' + 2NaCl;
4) A1(NO3)3 4 A1,O3 + NO2 + O2.
7. Отметьте уравнения или схемы экзотермических
реакций:
1) N, + Н2 —> NH3 + Q;
2) SO2 + О, - £ -> SO3;
3) С + О2 = СО, + 369 кДж;
4) СаСО3 = СаО + СО, - 157 кДж.
8. Укажите уравнения или схемы реакций обмена:
1) NaOH + H,SO4 -> Na7SO4 + Н2О;
2) Ba(NO3)2 + К, SO, -> BaSO4 + KNO3;
3) N2o5 + H2o 4 HNO3;
4) CuO + 2HNO3 = Cu(NO3)2 + H2O.
9. Отметьте уравнения или схемы окислительно-вос-
становительных реакций:
1) А1 + СЦ—>А1С13;
2) ВаСО3 = ВаО + СО,;
3) Н,О, -> Н2О + О2; ’
4) Си + AgNO3 -> Cu(NO3), + Ag.
10. Укажите уравнения или схемы необратимых реакций:
1)N7 + 3H7 2NH3;
2) Ва(ОН) > H,SO4 -э- BaSO4 + Н,О;
3) NaOH + НС! = NaCI + Н,О;
4) SO, + О7 t; SO3.
218 —
ТЕСТ!
1. Число продуктов реакции всегда больше числа ис-
ходных веществ в случае реакций:
1) разложения; 2) обмена;
3) соединения; 4) замещения.
2. Число продуктов реакции всегда меньше числа ис-
ходных веществ в случае реакций:
1) обмена; 2) соединения;
3) разложения; 4) замещения.
3. Окислительно- восстановительной в неорганичес-
кой химии всегда является реакция:
1) разложения; 2) обмена;
3) замещения; 4) соединения.
4. В неорганической химии реакция замещения про-
текает между:
1) двумя простыми веществами;
2) двумя сложными веществами;
3) простым и сложным веществами;
4) двумя как простыми веществами, так и двумя слож-
ными веществами.
5. Окислительно-восстановительными могут быть
реакции:
1) замещения; 2) обмена;
3) разложения; 4) соединения.
6. Без изменения степени окисления атомов элемен-
тов всегда протекают реакции:
1) обмена; 2) соединения;
3) разложения; 4) замещения.
7. В реакцию обмена между собой вступают вещества:
1) простое и сложное;
2) два простых;
3) два сложных;
4) как два простых, так и два сложных.
--- 219 ---
8. В результате реакции разложения могут образоваться.
1) только простые вещества;
2) только сложные вещества;
3) или только простые, или только сложные вещества;
4) одновременно простые и сложные вещества.
9. В реакцию соединения между собой могут вступать
вещества:
1) только простые;
2) только сложные;
3) как простые, так и сложные;
4) простое со сложным.
10. Укажите справедливые утверждения:
1) в результате реакции разложения образуется не бо-
лее двух новых веществ,
2) в реакции обмена число различных по составу
продуктов всегда равно числу различных по составу
исходных веществ;
3) в реакции соединения число различных по составу
исходных веществ всегда больше, чем продуктов;
4) в неорганических реакциях замещения число раз-
личных по составу исходных веществ равно числу раз-
личных по составу продуктов.
ТЕСТЗ
1. Укажите схему или уравнение окислительно-вос-
становительной реакции разложения:
1) СаСО3 = СаО + СО?;
2)Н2О2-^Н2О + О2; ‘
3) Си + О, -> СиО;
4) NaHCO, -> Na2CO3 + Н2О + СО2
2. Отметьте уравнения или схемы окислительно-вос-
--- 220 ---
становительных реакций соединения: -
1) SO, + О, -> SO3;
2) NO* + Н*О -> HNO3 + NO;
3) NO* + О, + Н,0 HNO,;
4) SO,*+ NaOH = NaHSO3. ’
3. Укажите схемы или уравнения окислительно-вос-
становительных реакций замещения:
1) Fe + CuSO4 = FeSO4 + Си;
2) Fe(OH)2 + НС1 -> FeCl2 + H,O;
3) Zn + H7SO4 = ZnSO4 + H,T; *
4) Fe2O3 + H2 -> Fe + H,O.’
4. Реакция HE может быть одновременно:
1) обмена и окислительно-восстановительной;
2) окислительно-восстановительной и разложения;
3) замещения и окислительно-восстановительной;
4) соединения и окислительно-восстановительной.
5. Гомогенными могут быть:
1) только реакции обмена;
2) только реакции соединения;
3) только реакции разложения;
4) все вышеназванные реакции, а также реакции за-
мещения.
6. Укажите наиболее общее необходимое условие от-
несения реакций к гетерогенной:
I) в одном агрегатном состоянии находятся продукты
реакции;
2) в одном агрегатном состоянии находятся исходные
вещества;
3) в одном агрегатном состоянии находятся как ис-
ходные вещества, так и продукты реакции;
4) как исходные вещества, так и продукты реакции
должны находиться в газообразном состоянии.
— 221 —
7. Отметьте уравнения или схемы гомогенных реак-
ций соединения:
1)СаО(т) + СОэд = СаСО3(т);
2) СО(г) + О2(г) СО2(г
3) NO2(r) + Н2О(ж) + O2(r) HNO3(;k-•
4) SOXa) + Н2О(жГ H2SOto).
8. Укажите уравнения или схемы гомогенных окис-
лительно-восстановительных реакций разложения:
I) CU(NO,),(t| -> CuO,„ +NO2(„ + Ода;
2) SO.,, -> SO,,, + О„
3) NH4NO3(t) -> N2o(r) + Н20(ж-
4) 2NH,(r) = N,(r) + ЗН2(г).
9. Отметьте уравнения или схемы гетерогенных окис-
лительно-восстановительных реакций:
l)Na(T) + H2O(jK)—> NaOH (р-р)+ Н2(г);
2)Н2(и + СнО(тГСи(т) + Н2О(г);
3) N02(r) + С0(т) N,(r) + С02(г •
4) Н + N.,0. — N + Н О
10. Укажите схему или уравнение гетерогенной экзо-
термической реакции обмена:
1) NaOH (р-р) + НС1 (р-р) -> NaOH (р-р) + Н2О(ж) + Q;
2) Ва(ОН),(р-р) + H7SO4 (р-р) = BaSO4(T) + 2Н2О + Q;
3)N2 + H2(r)^NH3(r) + Q;
4) H2(r) + I,(o HI(|)-Q.
ТЕСТ 4
1. Даны схемы реакций получения SO,:
a)FeS2(n + O2(oX Fe2°3(T)+SO2(r,;
б) NaHSO 3 (р-р) + НС1 (р-р) Л NaCl (р-р) + Н2О(ж)+SO^;
B)S(T) + °2(r)^SO2(0’
Г) MS4)1(O^Fe2O3(O+S(:)2(O+O2(O-
--- 222 ---
Из них гетерогенными окислительно-восстановитель-
1 ными будут реакции:
1) а, б, в; 2) а, б, г; 3) б, в, г; 4) а, в, г.
2. Даны реакции: а) обжиг пирита; б) обжиг известня-
ка; в) фотосинтез; г) взаимодействие водных растворов
сульфата натрия и хлорида бария. Окислительно-восста-
новительными реакциями из перечисленных будут:
1) а, б; 2) а, в; 3) а, г; 4) б, в.
3. Экзотермической реакцией соединения будет:
1) обжиг пирита; 2) реакция нейтрализации;
3) фотосинтез; 4) синтез аммиака.
4. Для описания реакции обжига пирита подходят
определения:
1) гомогенная;
2) гетерогенная;
3) разложения;
4) окислительно-восстановительная.
5. Для описания реакции нейтрализации подходят
признаки:
1) всегда гомогенная;
2) обмена;
3) продукты — как правило соль и вода;
4) может быть гомогенной и гетерогенной.
6. Даны вещества, формулы которых: Zn, ZnO, Zn(OH),,
ZnCOp SO2. Укажите число веществ, которые могут реа-
гировать с H,SO4 (разб.) по типу реакции обмена:
1)5; 2) 4; 3)3; 4) 2.
7. Даны вещества, формулы которых: А1,О3, А1, А1(ОН)3,
Na3[AI(OH)6], A1(NO3)3, SO,, Р,О5. Число веществ, с ко-
торыми водный раствор КОН может реагировать по типу
реакции соединения, равно:
1)6; 2) 5; 3)4; 4)3.
— 223 —
8. Укажите формулу вещества, с которым водный ра-
створ CuSO4 реагирует по типу реакции обмена:
1) Zn; 2) KNO,; 3) КОН; 4) НС1.
9. Даны вещества, имеющие формулы: Fe,O3, NaHS,
Fe(OH)3, Ba(NO3),, NaHSO4, Na,[Zn(OH)4J. Число ве-
ществ, с которыми H,SO4 (разб.) реагирует по типу реак-
ции обмена, равно:
1)6; 2) 5; 3)4; 4)3.
10. К реакциям соединения следует отнести реакции
между:
1) K,S (р-р) и H7S;
2) Сг(ОН)3 и NaOH (р-р);
3) K3[A1(OH)J и НС1 (р-р);
4) А12О3 и КОН (т).
ТЕМА 17
Окислительно-восстановительные реакции
ТЕСТ1
1. Укажите электронные уравнения процессов восста-
новления:
1)С°-4ё = С+4; 2) N+5 + 2ё = N+3;
3) N° + 6ё = 2N-3; 4) 2S1 - 10ё = 2S4
2. Отметьте электронные уравнения процессов окис-
ления:
1)Н»-2ё = 2Н"; 2) О2° + 4ё = 2О 3;
3) N3 - 5ё = N+2; 4) 20 1 - 2ё = 0°.
— 224 —
3. Укажите электронные уравнения, в которых атомы
водорода или азота выполняют роль восстановителя:
1)Н° + 2ё = 2Н-‘; 2)Н«-2ё = 2Н+‘;
3) N*4 + 2ё = N"2; 4) 2N"3 - 6ё = N°.
4. Отметьте электронные уравнения, в которых ато-
мы серы являются окислителями:
1) S0 - 4ё = S"4; 2) S+6 + 8ё = S2;
3) 2S ]10e = 2S^4; 4)S~4 + 4e = S°.
5. Укажите схему реакции, в которой степень окисле-
ния атома серы изменяется от -1 до +4:
1) H,SO4 + Си -> CuSO4 + SO, + Н,О;
2) FeS, + О, —> Fe,O3 + SO,; '
3) H,S + O,‘-> SO,’ + H,O; "
4) KHS + HC1 -> KC1 + H2S.
6. Отметьте схемы реакций, в которых степень окис-
ления атома азота изменяется от -3 до 0:
1) NH3 + О, -> NO + Н,О; 2) NH3 + О, -> N, + Н,О;
3) NH4NO2“-> N, + Н,б; 4) NH4NO3 N,0 + Н2О.
7. Укажите схемы реакций, в которых степень окис-
ления атома углерода повышается:
1) СО2 + Са(ОН), СаСО3 + Н2О;
2) С + О, -> СО;
3) СО + Fe,O3 -> Fe + СО,;
4) СО, + Mg MgO + С.'
8. Отметьте схемы реакций, в которых степень окис-
ления атома хлора понижается:
1) Cl, + Fe -> FeCl3; 2) КС1О3 КС1 + О,;
3) С12 + KI -> КС1 + I,; 4) КС1 + F, —> KF + С1,.
9. Молекула кислорода в окислительно-восстанови-
тельных реакциях может максимально присоединить
электронов:
1) два; 2) четыре; 3) шесть; 4) восемь.
8 Зак. 1530
--- 225 ----
10. Укажите формулу молекулы, которая в окислитель-
но-восстановительной реакции может максимально от-
дать 10 электронов:
1)О2; 2)N2; 3) С12; 4)Н,.
ТЕСТ 2
1. Укажите максимальное число электронов, которые
может отдать молекула хлора в окислительно-восстано-
вительных реакциях:
1) 10; 2) 12; 3) 14; 4) 16.
2. Укажите формулы молекул, которые в окислитель-
но-восстановительных реакциях могут максимально
присоединить два электрона:
1) Cl2; 2)N2;3)H2; 4) О2.
3. Отметьте схемы процессов окисления:
1) С12 -> 2С1О-; 2) NO; —> NO;
3) Сг2О72- -> 2СгО2; 4) SO~-> SO2.
4. Укажите схемы процессов восстановления:
1) НРО2- Н2РО;; 2) SO2- -э H2S;
3) МпО4 -э МпО2 ; 4) Сг,О2 -э 2Сг+3.
5. Сера—окислитель, реагируя с:
1) медью; 2) хлором; 3) фосфором; 4) водородом.
6. Фосфор — восстановитель, реагируя с:
1) кальцием; 2) серой; 3) кислородом; 4) хлором.
7. Окислительные свойства атомов галогенов увели-
чиваются слева направо в ряду:
1)Г»Н,,СЦ; 2) I,, Cl„ F,;
3)Br2,F2,Cl2; 4)F2,C12,I2.
8. Только восстановительные свойства в окислитель-
но-восстановительных реакциях проявляет:
1) азот; 2) сера; 3) натрий; 4) фосфор.
— 226 —
9. Самым сильным окислителем из простых веществ
является:
1) кислород; 2) фтор; 3) азот; 4) золото.
10. Окислительные свойства простых веществ слева
направо возрастают в ряду:
1) углерод, сера, кислород; 2) кислород, сера, углерод;
3) кремний, фтор, иод; 4) фосфор, кислород, сера.
ТЕСТЗ
1. Коэффициент 2 перед формулой SO, следует по-
ставить в окислительно-восстановительной реакции,
схема которой:
1) Ag + H,SO4 -+ Ag,SO4 + SO, + H,O;
2) Си + H2SO4 CuSO4 + SO2 + H2O;
3) SO2 + H,S -> S + H,O;
4) SO, + О, -> SO3.
2. Коэффициент 4 перед формулой HNO3 следует по-
ставить в уравнениях окислительно-восстановительных
реакций, схемы которых:
1) Ag + HNO3 AgNO3 + NO + H,O;
2) Си + HNO3 Cu(NO3), + NO, + H2O;
3) NO, + O, + H,0 HNO3;
4) Mg + HNO3 -> Mg(NO3), + NH4NO3 + H2O.
1) 2, 3, 4; 2) 1, 2, 3; 3) 1, 2, 4; 4) 1, 3, 4.
3. В уравнении химической реакции Си + 2H,SO4 =
= CuSO4 + SO, + 2H,0 серная кислота:
1) только окислитель;
2) только восстановитель;
3) окислитель и солеобразователь*;
* Этот термин означает, что вещество участвует в реак-
ции образования соли.
--- 227 ----
4) восстановитель и солеобразователь.
4. В уравнении химической реакции 2KBr + Cl = 2КС1 +
+ Вт, атомы элемента брома:
I) понижают степень окисления;
2) повышают степень окисления;
3) выступают в роли окислителя;
4) выступают в роли восстановителя.
5. В процессе превращения S+6 —> S2 атомы серы:
1) отдают электроны, окисляются;
2) принимают электроны, окисляются;
3) отдают электроны, восстанавливаются;
4) принимают электроны, восстанавливаются.
6. В процессе превращения N-3 —> N"2 атомы азота:
1) отдают электроны, окисляются;
2) отдают электроны, восстанавливаются;
3) принимают электроны, окисляются;
4) принимают электроны, восстанавливаются.
7. Электронной схеме S ~2 —» S 4 соответствует урав-
нение химической реакции:
1) 2NaOH + SO2 = Na,SO3 + Н2О;
2) 2H,S + О2 = 2Н,0 + 2S;
3) 2H~S + ЗО2 = 2Н2О + 2SO,;
4) Си + 2H2SO4 = CuSO4 + 2SO2 + 2Н2О.
8. Сущность превращения PbS PbSO4 отражается
электронным уравнением:
1) S+4-2e=S+6; 2)S2-8e = S+6;
3) S° + 2ё = S 2; 4) S° + 4ё = S4.
9. Сущность какого превращения отражается электрон-
ным уравнением 20 1 - 2ё = 0“?
1) Н,0 —> Н, +О,;
2) CuS + О, -> CuO + SO,;
3) Н,0, + PbS -э Н,0 + PbSO4;
4) Н20, + КМпО4 + H,SO4 О, + MnSO4 + K,SO4 + Н,0.
--- 228 ----
10. Сущность химического превращения С1 +
+ КОН —> КС1 + КС1О3 + Н,0 отражают электронные
уравнения реакций:
1) С1° + ё = С11. С1° - Зё = С1+3;
2) С1° + ё = С1 '. С1° - 7ё = СГ7;
3) С1° + ё = С1 1. С1° - 5ё = СГ5;
4) С1° - ё = С1 '. С1° + 5ё = СК
ТЕСТ 4
1. При окислении степень окисления атома элемента:
1) понижается;
2) возрастает;
3) остается без изменения;
4) может как повышаться, так и понижаться.
2. Процесс восстановления имеет место, когда:
1) нейтральные атомы превращаются в катионы;
2) нейтральные атомы превращаются в анионы;
3) положительный заряд простого иона возрастает;
4) положительный заряд простого иона уменьшается.
3. Укажите уравнения процессов, в которых атом окис-
лителя принимает 5 электронов:
1) МпО, + 4Н+ = Мп2+ + 4НЭО;
2) MnO4 + 8Н+ = Mn2+ + 4Н,О;
3) ВгСГ + 6Н+ = Вг° + ЗН,О;
4) N, + 4Н.0 = 2NH,OH + 2ОН .
4. Отметьте уравнения процессов, в которых восста-
новитель отдает 4 электрона:
1) N, + 4ОН = 2NO + 2Н,О;
’ 2) N.O + ЗН,0 = 2HNO, + 4НТ;
3) S,Of + 6ОН- = 2SO2' + ЗН,О;
4)С1 + 4Н7О = С1О4 + 8Н+.
--- 229 ---
5. Укажите уравнения процессов, в которых окисли-
тель принимает 8 электронов (в расчете на один атом
элемента окислителя):
1)2С1О~ + 16Н+ = Cl7 + 8Н7О;
2) С1О“ + 8Н+= СГ + 4Н7О;
3) 2SO2 + 10Н+ = S7O2 + 5Н7О;
4) SO2 + 10Н+ = H7S + 4Н7О
6. Превращение NH3 + Н+ = NH* сопровождается:
1) окислением атома азота;
2) восстановлением атома азота;
3) увеличением валентности атома азота с III до IV;
4) образованием катиона аммония.
7. В результате превращения Н2О + Н+ = Н3О+:
1) степень окисления атома кислорода увеличивается;
2) степень окисления атома кислорода уменьшается;
3) степень окисления атома кислорода не изменяется;
4) валентность атома кислорода возрастает с II До III.
8. При восстановлении степень окисления атома эле-
мента:
1) повышается;
2) понижается;
3) остается без изменения;
4) может как повышаться, так и понижаться.
9. Процесс окисления имеет место, когда:
1) нейтральные атомы превращаются в катионы;
2) нейтральные атомы превращаются в анионы;
3) положительный заряд простого иона уменьшается;
4) положительный заряд простого иона возрастает.
10. Укажите схемы реакций, в которых вода является
окислителем:
1)С12 + Н7О->НС1 + НС1О3;
2) Са + н'О -> Са(ОН)7 + Н7;
--- 230 ---
3) СаС, + Н,0 -> Са(ОН), + С,Н7;
4) NaH + Н70 —> NaOH + Н7. ‘
ТЕСТ 5
1. Укажите уравнение реакции, в результате которой
степень окисления атомов азота понижается с 0 до -2*:
‘ 1) N7 + 4Н7О = N7H4 + 4ОН ;
2) N7 + 4Н7О = 2NH7OH + 2ОН ;
3) N +61Г = 2NH3;
4) N2 + 8Н+ = 2NH/.
2. Отметьте уравнение реакции, в результате которой
степень окисления атомов хлора повышается с 0 до +7:
1)НС1 + 2Н7О = СЮ2 + 5Н+;
2) С17 + 6Н2О = 2С1О3 + 12Н+;
3) С1' + 8Н2О = 2С1О4 + 16Н+;
4) 2НС1 + Н2О = С12О + 4Н+.
3. Укажите схемы реакций, в результате которых сте-
пень окисления атомов хрома понижается с +6 до +3:
1) СгО; + 4Н+ = СгО2 + 2Н7О;
2) СгО;- + 4Н7О = Сг(ОН)3 + 5ОН~;
3) Сг2О72- + 14Н+ = 2Сг3+ + 7Н,О;
4) СгО2- + 8Н+ = Сг + 4Н2О.
4. Отметьте схемы или уравнения, в которых перок-
сид водорода является восстановителем:
1) Н7О7 + 2Н+= 2Н7О;
2) Н70'7 = О7 + 2Н+;
3) нД + KMnO4 + H,SO4 -> MnSO4 + K7S04 + О, + Н2О;
4) PbS’+ Н7О7 -> PbSO4 + Н,О.
* Здесь и далее в подобных заданиях числа отданных или
принятых электронов не указаны.
--- 231
5. Укажите уравнения реакций, в которых степень
окисления атомов фосфора понижается с +3 до +1:
1) Н3РО3 + 2Н+ = Н3РО, + Н,О;
2) Н3РО4 + 4Н+ = Н3РО~ + 2Н2О;
3) НРО2 + 2Н,0 = Н,РО; + ЗОН;
4) РО’- + 2Н,0 = НРО2 + 2ОН-.
6. Все элементы какого ряда окисляются в окислитель-
но-восстановительной реакции, представленной схемой
Cr,S + Mn2+ + NO " + СО,2- -> СгО 2- + МпОЛ + NO +
+ СО, + SO42-?
1) С, S, Сг; 2) Мп, N, S;
3) Мп, S, Сг; 4) Сг, S, N.
7. Укажите символы элементов, которые окисляются
в реакции, схема которой FeS, + HNO3 —> Fe(NO3)3 +
+ H,SO4 + NO + H,O:
1) Fe; 2) N; 3) S; 4) O.
8. В реакции, уравнение которой Cr,O72 + 14Н+ + 6CF =
= ЗС1, + 2Cr3+ + 7Н,О, окислителями являются атомы
элемента, символ которого:
1)С1; 2) Сг; 3) Н; 4)0.
9. Укажите уравнения процессов окисления:
1) Cr(OH)3 + 50Н- = СгО2- + 4Н2О;
2) СЮ- + 20Н- = С103 + Н20;
3) ZnO2 + 2Н,0 = Zn° + 40FI;
4) Н2РО2 + Н+‘= Н3РО2.
10. При нагревании нитрата серебра (I) восстанавли-
ваются атомы элемента(ов):
1)только серебра;
2) только азота;
3) серебра и азота;
4)серебра и кислорода.
— 232 —
ТЕСТ 6
1. Только восстановительные свойства в окислитель-
но-восстановительных реакциях проявляют ионы, фор-
мулы которых:
1) S2-; 2) SO2~; 3) SO2-; 4) I.
*2. Только окислительные свойства в окислительно-
восстановительных реакциях с другими веществами про-
являют ионы, формулы которых:
1) МпО4; 2) SO2-; 3) NO3; 4) Cr,O2-.
3. Свойства как окислителя, так и восстановителя в
окислительно-восстановительных реакциях с другими
веществами проявляют вещества, формулы которых:
1) НС1; 2) SO,; 3) Н,О,; 4) КМпО4.
4. Окислительно-восстановительная реакция НЕ мо-
жет протекать между:
1) H,S и О,; 2) КМпО4 и SO2;
3) HNO3 и HF; 4) H,S и HI.
5. Только окислительные свойства в окислительно-
восстановительных реакциях с другими веществами про-
являют:
1) FeCl2; 2) К,СгО4; 3) КМпО4; 4) HNO3.
6. За счет атома азота только восстановительные свой-
ства в окислительно-восстановительных реакциях с дру-
гими веществами проявляет:
1) NH,OH; 2) NH3; 3) HNO3; 4) NO.
7. Двойственные окислительно-восстановительные
свойства могут проявлять:
1)НВги8; 2) Н,О, и H2SO4;
3) SO, и N,O3; 4) КМпО4 и SO3.
* В подобных заданиях не рассматривайте реакции со
фтором.
--- 233 ----
8. Укажите схемы реакций, в которых водород — вос-
становитель:
1)К + Н2—>КН;
2) Fe,O3 + Н, -> Fe + Н,О;
3)N, + H, —>NH3;
4) С + Н,-> СН4.
9. Отметьте схемы реакций, в которых углерод—окис-
литель:
l)Si + C—>SiC;
2) С+ HNO3 -> СО, + NO, + Н,О;
3) С + Н, —» СН4; '
4) А! + С -> А14С3.
10. НЕВОЗМОЖНА окислительно-восстановитель-
ная реакция между:
1) КОН и НС1; 2) К,Сг2О7 и H,SO4;
3) H2S и HNO3 (конц.); 4) Р и HNO3.
ТЕСТ7
1. В реакции, схема которой НВг + КН —> КВг + Н2,
бромоводородная кислота играет роль:
1) только восстановителя;
2) только окислителя;
3) восстановителя и солеобразователя;
4) окислителя и солеобразователя.
2. В реакции, протекающей с участием веществ SO,,
КМпО4 и H,SO4 (р-р), восстановителем будет:
1)SO,; ’ 2)КМпО4;
3) H2SO4; 4) Н2О.
3. Переход NO N, можно осуществить с помощью
вещества, формула которого:
1)КМпО4; 2)^0,; 3) О,; 4) С.
--- 234 ---
4. Переход НВг —> Вг, можно осуществить с помощью
веществ, формулы которых:
1) Н,; 2) H,SO4 (конц.); 3) НС1; 4) С1,.
5. Найдите химическое количество (моль) азотной кис-
лоты, расходуемой на солеобразование в реакции с уча-
стием 4 моль Ag, схема которой Ag + HNO, AgNO3 +
+ NO + H,O:
1)5; 2)4; 3)3;4)2.
6. Какая масса (г) азотной кислоты расходуется на со-
леобразование в реакции с участием 0,111 моль Fe, схе-
ма которой Fe + HNO3 —> Fe(NO3), + NH4NO3 + H,O:
1) 15, 73; 2) 63,00; 3) 126,00; 4) 31,50.
7. При восстановлении серной кислоты химическим
количеством 0,04 моль атомы серы присоединили
1,9264 1023 электронов. Укажите формулу продукта вос-
становления кислоты:
1)SO2;2) S; 3) H,S; 4) SO3.
8. При восстановлении азотной кислоты химическим
количеством 0,025 моль атомы азота присоединили
1,204 1023 электронов. Укажите формулу продукта вос-
становления кислоты:
1) NH3; 2) NO; 3) NO,; 4) N,O.
9. При восстановлении азотной кислоты химическим
количеством 0,1 моль атомы азота присоединили
0,5 моль электронов. Укажите формулу продукта восста-
новления кислоты:
1) N,O3; 2) N,O; 3) N,; 4) NO,.
10. При окислении сероводорода химическим количе-
ством 0,025 моль атомы серы отдали 9,03 1022 электро-
нов. Укажите формулу продукта окисления сероводорода:
1) S; 2) SO2; 3) SO3; 4) SO.
--- 235 —
ТЕСТ 8
1. Укажите схемы реакций, в которых атомы окисли-
теля и восстановителя находятся в составе одного и того
же вещества:
1) КС1О3 + НС1 КС1 + CI, + Н,О;
2) КС1О3 -> КС1 + О,;
3) NH4NO3 N,0 + Н,О;
4) FeS, + О, -> Fe,O3 +'SO?.
2. Отметьте схемы реакций, в которых роль окисли-
теля и восстановителя выполняют атомы одного и того
же элемента:
1) С1, + Н2О —>НС1 + О2;
2) С1’ + КОН -э КС1 + КС1О3 + Н,О;
3) S + NaOH -> Na,S + Na,SO3 + Н,О;
4) KMnO4 + НС1 ->~С12 + КС1 + МпС1, + Н,О.
3. Для окислительно-восстановительной реакции, про-
текающей по схеме Sn + HNO3 —> Sn(NO3)2 + NH4NO3 +
+ H,O, укажите степени окисления атома элемента окис-
лителя соответственно до и после реакции (в восста1
новленной форме):
1) 0 и 4-2; 2) +5 и +3; 3) +5 и -3; 4) +4 и -3.
4. Окислительно-восстановительными являются про-
цессы:
1) обжиг пирита;
2) переход глюкозы из линейной формы в циклическую;
3) гашение извести;
4) ржавление железа.
5. Укажите алгебраическую сумму степеней окисле-
ния атомов элемента окислителя до и после реакции (в
восстановленной форме), протекающей по схеме Zn +
4- H,SO4 -э ZnSO4 4- H?S 4- Н,О:
1) 4-2; 2) 4-4; 3) 4-6; 4) 0.
— 236 —
6. Выберите ряд, в котором указаны символы элемен-
тов, атомы которых окисляются в реакции, протекаю-
щей по схеме Cr2S3 + KNO3 + Na2CO3 —> К,СгО4 + NO +
+ CO,+Na„SO/ '
1) N, S; 2) S, Cr; 3) C, N; 4) Cr, N.
7. Отметьте схемы окислительно-восстановительных
реакций с участием гипохлорита кальция:
• 1) Са(СЮ), -> СаО, + Са(СЮ3),;
2) Са(СЮХ + Н,0 + СО2 -э СаСО3 + НСЮ;
3) Са(С1О)2 + НС1 -э С1, + СаО, + Н,О;
4) Са(СЮ)2 + H2SO4 -> CaS04 + НСЮ.
8. Какое количество (моль) электронов перейдет от ато-
мов кислорода к атомам хлора при разложении бертоле-
товой соли массой 12,25 г по схеме КСЮ3 —> КО + О,?
1) 0,2; 2) 0,4; 3) 0,6; 4) 0,8.
9. Укажите схемы реакций, в которых соляная кисло-
та является и окислителем, и солеобразователем:
1) Ca2Si + НС1 -> СаО, + SiH4;
2) КМпО4 + НО -> О, + КС1 + МпО, + Н,О;
3)Fe + HCl^FeO2+H2;
4)НО + 02->Н20 + 0~
10. Отметьте схему реакции, в которой бромоводород
является и восстановителем, и солеобразователем:
1) НВг + О2-> Н2О + Вг2;
2) HBr + K2Cr,O7 + H2SO4 -> Br2 + K,SO4 + Cr,(SO4)3 +
+ Н,О;
3) HBr + Zn -> Zn Br2 + H,;
4) HBr + КСЮ -э Br2 + КС1 + НЮ.
--- 237 ---
ТЕСТ 9
1. Укажите формулу вещества, в составе которого ато-
мы кислорода могут проявлять только окислительные (а
не восстановительные) свойства:
1) НД; 2) OF2; 3) КД; 4) НД
2. Исходное вещество окисляется в ходе превращений:
1) NH,OH —> N7H4;
2) С.Н.СООН С.Н.СОООН;
3) CO(NH,)7 -> (NH4),CO3;
4) (NH4)2SO4 -> NH,OH.
3. Методом электронного баланса расставьте коэффи-
циенты в ОВР, протекающей по схеме: Mg + НЬД —>
—> Mg(NO3)2 + N,0 + НД Найдите химическое количе-
ство (моль) кислоты, которая расходуется на солеобра-
зование при окислении металла массой 4,8 г:
1)0,2; 2) 0,4; 3) 0,6; 4) 0,8.
4. Укажите наименьшее общее кратное чисел отдан-
ных и принятых электронов для ОВР, протекающей по
схеме Р + КСЮ3 —> РД + КС1:
1)15; 2) 20; 3) 25; 4) 30.
5. Методом электронного баланса расставьте коэффи-
циенты в ОВР, протекающей по схеме Си + HNO3
—> Cu(NO3)2 + NO + НД Какая масса (г) меди была окис-
лена, если на солеобразование израсходовалась кислота
массой 21 г?
1) 10,7; 2) 9,7; 3) 11,7; 4)8,7.
6. Какой объем (дм3, н. у.) кислорода выделился в ре-
акции термического разложения AgNO3, если от атомов
элемента восстановителя к атомам элементов окисли-
телей перешло 0,4 моль электронов?
1)0,448; 2) 1,12; 3)2,24; 4) 3,36.
— 238 —
7. Расставьте методом электронного баланса коэффици-
енты в ОВР, протекающей по схеме FeS + О, —> Fe,O3 +
+ SO,. Укажите наименьшее общее кратное чисел отдан-
ных и принятых электронов:
1)28; 2) 4; 3)12; 4) 7.
8. В реакции магния с серной кислотой израсходована
кислота массой 9,8 г и выделился сероводород. Какое чис-
ло электронов в этой реакции присоединила кислота?
1) 1,204-IО22; 2) 2,408 1022;
3)4,816 1022; 4) 9,632 • 1022.
9. В реакции цинка с азотной кислотой израсходова-
на кислота массой 15,75 г и выделился азот. Какое коли-
чество (моль) электронов присоединила кислота?
1) 0,104; 2) 0,208; 3) 0,312; 4) 0,416.
10. В реакции магния с серной кислотой непосредствен-
но в окислительно-восстановительном процессе израсхо-
дована кислота массой 4,9 г, которая приняла 1,806 • 1023
электронов. Какая масса (г) магния вступила в реакцию?
1)3,6; 2) 2,4; 3) 1,2; 4) 0,6.
ТЕСТ 10
1. Методом электронного баланса расставьте коэффи-
циенты в ОВР, протекающей по схеме Са(СЮ) , + НО
—> СаО, + О, + Н,О. Укажите коэффициент перед фор-
мулой окислителя:
1)4; 2)3; 3)2; 4) 1.
2. Методом электронного баланса расставьте коэффици-
енты в ОВР, протекающей по схеме КСЮ, + Вг, + КОН —>
—> К,СгО4 + КВг + Н,О. Укажите сумму коэффициентов
перед формулами исходных веществ:
1)11; 2) 12; 3)13; 4) 15.
--- 239 ----
3. Методом электронного баланса расставьте коэффи-
циенты в ОВР, протекающей по схеме КМпО4 + Н,О, +
+ H,SO4 -> MnSO4 + IC,SO4 + О, + Н2О. Укажите коэф-
фициент перед формулой восстановителя:
1) 3; 2) 5; 3) 7; 4)9.
4. Методом электронного баланса расставьте коэффи-
циенты в ОВР, протекающей по схеме K,Cr,O7 + KNO2 +
+ H,SO4 -> Cr,(SO4)3 + KNO3 + K,SO4 + H2O. Укажите
коэффициент перед формулой воды:
I) 1; 2) 2; 3)3; 4) 4.
5. Методом электронного баланса расставьте коэффици-
енты в ОВР, протекающей по схеме KI + H,SO4 + КЮ3 —»
—> K.,SO4 +1, + Н,О. Укажите сумму коэффициентов пе-
ред формулами всех веществ:
1) 18; 2) 16; 3)15; 4) 13.
6. Методом электронного баланса расставьте коэффици-
енты в ОВР, протекающей по схеме K,MnO4 + H,SO4 —>
—> КМпО4 + MnO, + K2SO4 + Н2О. Укажите сумму коэф-
фициентов перед формулами продуктов реакции:
1) 7; 2) 5; 3) 13; 4) 9.
7. Методом электронного баланса расставьте коэффици-
енты в ОВР, протекающей по схеме K2Cr,O7 + NO +
+ H2SO4 -> Cr,(SO4)3 + HNO3 + K,SO4 + H,O. Укажите сум-
му коэффициентов перед формулами исходных веществ:
1)5; 2) 14; 3) 7; 4) 9.
8. Методом электронного баланса расставьте коэффи-
циенты перед формулами всех веществ в ОВР, протекаю-
щей по схеме As,S3 + HNO3 —> H3AsO4 + NO, + H2SO4 +
+ H2O. Укажите сумму коэффициентов перед формулами
всех веществ:
1)50; 2) 60; 3) 70; 4) 80.
— 240 —
9. Методом электронного баланса расставьте коэффи-
циенты в ОВР, протекающей по схеме Cu,S + HNO3 —>
—> Cu(NO3), + NO, + SO, + H,O. Укажите сумму коэффи-
циентов перед формулами всех веществ:
1)30; 2) 25; 3) 15; 4) 10.
10. Методом электронного баланса расставьте коэффи-
циенты в ОВР, протекающей по схеме FeS, + HNO3 —>
—> Fe(NO3)3 + NO + H,SO4 + H,O. Укажите сумму коэф-
фициентов перед формулами всех веществ:
1) 15; 2) 17; 3) 19;4)21.
ТЕМА 18
Тепловой эффект химической реакции
ТЕСТ1
1. Реакция будет экзотермической, если:
1) она протекает с поглощением теплоты;
2) суммарная энергия химических связей в продуктах
больше, чем в исходных веществах;
3) она протекает с выделением энергии;
4) суммарная энергия химических связей в исходных
веществах больше, чем в продуктах.
2. Укажите термохимические уравнения:
1)2Н2(г) + О-г) = 2Н2О(г-
2) N,(r) + O,(r) = 2NO(r)-180,8 кДж;
3)Н„ + CL -е = 2НС1, :
4) Ва(ОН)2 + Na,SO4 = BaSO4sL + 2NaOH.
— 241
3. Тепловой эффект реакции зависит от:
а) агрегатного состояния веществ;
б) химического количества веществ;
в) температуры;
г) природы веществ.
1) а, б, в; 2) б, в, г; 3) а, б, в, г; 4) а, в, г.
4. При растворении H,SO4 в воде выделяется 92,0
кДж/моль теплоты. Укажите тепловой эффект (кДж)
процесса смешивания, если готовится раствор массой
200 г с массовой долей кислоты 30%:
1)56,3, 2) 46,3; 3)66,3; 4) 36,3.
5. Теплота образования какого оксида химическим ко-
личеством 1 моль наименьшая?
1) 2Mg(T( + O,(r) = 2MgO(T(+ 1200 кДж;
2) 2Си(т) + О,(г) - 309,6 кДж = 2СиО(т);
3) Zn + 0,5 O2(r( = ZnO(T) + 350 кДж;
4) 2А1, + 1,5 О = А1,О,. +1600 кДж.
6. При сгорании глюкозы С6Н|?О6 массой 1 г выделя-
ется 15,6 кДж теплоты. На основании этих данных ука-
жите правильно записанное термохимическое уравнение:
1) С6НрО6 + 6ОЭ = 6СО2 + 6Н„О + 15,6 кДж;
2) С6НПО6 + 60' = 6СО, + 6Н^О + 1404 кДж;
3) 6СО' + 6Н,0 = С6Н12О6 + 60, - 2808 кДж;
4) 6СО2 + 6Н2О = С6Н12О6 + 6OJ + 2808 кДж.
7. На основании термохимического уравнения СаСОад =
= СаО(г) + СО,(г) - 157 кДж укажите тепловой эффект
(кДж) реакции разложения известняка массой 1 кг:
1) +1570; 2) -1570; 3) +785; 4) -785.
8. Тепловой эффект реакции ЗН, г) + N2(o = 2NH3(r) Ра-
вен 90 кДж, а энергии связей Н — Н и N — Н равны
соответственно (кДж/моль) 435 и 390. Укажите энергию
связи (кДж/моль) в молекуле азота:
1) 472,5; 2) 945,0; 3) 236,3; 4) 1890.
— 242 —
9. При взаимодействии 2 дм3 (н. у.) хлора с избытком
водорода выделяется 16,4 кДж теплоты. Теплота обра-
зования (кДж) 1 моль НС1 из простых веществ равна:
1)89,2; 2) 90,2; 3)91,8; 4) 92,8.
10. При разложении аммиака химическим количеством
2 моль на простые вещества поглощается 92 кДж тепло-
ты. Укажите тепловой эффект (кДж) реакции образова-
ния аммиака химическим количеством 1 моль:
1) -46; 2) +46; 3) -92; 4) +92.
ТЕСТ 2
1. Отметьте уравнения реакций, для которых величи-
на теплового эффекта будет примерно одинаковой:
1) КОН (р-р) + НС1 = КС1 (р-р) + Н,О(ж);
2) N, = N + N;
3) NaOH (р-р) + HNO3 (р-р) = NaNO, (р-р) + Н70(ж;
4) СаСОЧ(т)=СаО(т) + СО2(г).
2. Укажите схемы эндотермических процессов:
1)О + О = О„;
2) НО ^-эНО
7 2 (ж) 2 (г)’
3) 2KNO3(t) = 2KNO2(T)+O2(r);
4) Al (ls22s22p63s23/?) -> Al (Ls22522p63sJ3/r).
3. Укажите схемы экзотермических процессов:
1) С (l.s-22s‘2p3) -> С (Ls22.v72/?2);
2) F + F -> F,,
3) СбН,2Оад + 6Оад=6СОад + 6Н,ОМ;
4) N, + О, = 2NO.
4. Отметьте уравнения процесса, протекающего с наи-
большим выделением теплоты:
1)2Н2(г) + О2(г) = 2Н,О(т);
--- 243 ----
2)2Н2(г) + Оад = 2Н2О(ж);
3)2Н2(г) + Оэд = 2Н2О(г);
4) СО,(т) —> СО, (г).
5. На основании термического уравнения реакции
горения пропена С3Н6(г) + 9/2ОДг) -> ЗСО,(г) + ЗН,О(г) +
+ 2060 кДж укажите тепловой эффект (кДж) реакции го-
рения смеси С3Н6 и О., химическим количеством 1 моль
со стехиометрическим соотношением объемов реаген-
тов:
1) 1498; 2) 1124; 3) 374,5; 4) 187,3.
6. Укажите экзотермические процессы:
+ 2) Н1(г, —» 2Н,„;
3) Mg,,, -4 Mg* + 2ё; 4) Са- + 2е = Са,,,.
7. Эндотермическими будут процессы:
3)Hg(T)-> Нё(ж); 4)Cl‘r) + e^q-r).
8. Энергия связи Н — Cl равна 431 кДж/моль, а энер-
гии связей Н — Н и С1 — С1 соответственно равны
436 кДж/моль и 242 кДж/моль. На основании этих дан-
ных рассчитайте тепловой эффект (кДж), реакции обра-
зования 1 моль хлороводорода из простых веществ:
1) +92; 2) +184; 3) -^92; 4) -184.
9. Энергия химической связи Н—Н равна 7,24 • 10 19 Дж.
Укажите тепловой эффект (кДж) реакции превращения
в атомы молекулярного водорода массой 4 г:
1) + 435,8; 2) + 871,7; 3) - 871,7; 4) - 435,8.
10. Первая энергия ионизации атома хлора равна
20,8 10 19 Дж. Найдите энергию (кДж) которую надо
затратить для перевода в катионы всех атомов, содер-
жащихся в порции атомарного хлора массой 7,1 г:
1) 62,6; 2) 125,2; 3) 187,8; 4) 250,4.
--- 244 ---
ТЕМА 19
Скорость химической реакции
и химическое равновесие
ТЕСТ1
1. Укажите единицы скорости химической реакции:
моль с дм3 , моль
I) —3—;2)---------г;3) —----;4)-------у.
дм с моль-дм’ моль-с мин-дм
2. За время, равное 5 с, молярная концентрация веще-
ства А изменилась с 3,15 моль/дм3 до 3,00 моль/дм3. Ука-
жите среднюю скорость реакции по веществу А:
моль
1)0,01—5—
дм -с
моль
3)0,03—^"
дм -с
3. На скорость химической реакции влияют (влияет):
а) природа реагирующих веществ;
б) концентрация реагирующих веществ;
в) температура;
1) а, б, в; 2) только а, б; 3) только б, в; 4) только а, в.
моль
4. Скорость некоторой реакции равна 0,0012 —3. В
моль „ дм с
единицах 3-----скорость этой реакции составляет:
дм мин
моль
2)0,02—5—
дм’ с
моль
4)0,04-^-
дм -с
1) 2 10-5; 2) 4 10 5; 3) 0,072; 4) 0,036.
5. Имеются два сосуда одинакового объема. В первом
сосуде химическое количество вещества А за 10 с изме-
нилось с 5 моль до 2 моль, а во втором за 20 с с 10 моль
до 5 моль. Какое (ие) утверждение (я) справедливо (спра-
ведливы)?
1) средняя скорость реакции выше во втором сосуде;
— 245 -----
2) средняя скорость реакции выше в первом сосуде в
1,2 раза;
3) средняя скорость реакций в обоих сосудах одина-
кова;
4) средняя скорость реакции в первом сосуде выше в
1,5 раза.
6. Среднюю скорость гомогенной реакции по изме-
нению молярной концентрации (с) или химического ко-
личества (п) исходных веществ можно рассчитать по фор-
мулам (t — время, V— объем):
ДС ДС Д/7 д/?
1)г=+— ;2)г=- —;3)г=+—;4) г=-—
д/ д/ Г-д/ ГД7
7. Для гомогенной реакции, протекающей в объеме,
равном 2 дм3, химическое количество исходного веще-
ства за 10 с изменилось с 4 моль до 2 моль. Укажите
среднюю скорость реакции по этому веществу:
моль моль моль моль
1)0,1 —j—; 2) 0,2 —3 ; 3) 0,3 ~ —; 4) 0,4 —3 -
дм -с дм -с дм -с дм -с
8. Укажите наиболее типичную зависимость скорос-
ти прямой реакции от времени:
9. Равновесие процесса 2SO,(r( + 0,5О,(г) Уд0^'"-р> 2SO3(r) +
+ Q сместится в сторону продукта реакции, если:
1) в качестве катализатора использовать платину;
--- 246 ----
2) понизить температуру;
3) повысить давление;
4) увеличить концентрацию оксида серы (IV).
10. Равновесие процесса N2 + 3H,(r) 2NH3([) + Q
сместится в сторону исходных веществ, если:
1) повысить температуру;
2) понизить давление;
3) понизить концентрацию аммиака;
4) повысить концентрацию водорода.
ТЕСТ 2
1. При одинаковых молярных концентрациях кислот
наиболее медленно цинк будет растворяться в кислоте:
1)соляной; 2) уксусной;
3)серной; 4) азотной.
2. При комнатной температуре и атмосферном давле-
нии практически мгновенно протекает реакция между
веществами, формулы которых:
1)Сии S;
2) Fe и Н2О;
3) NaOH (р-р) и НС1 (р-р);
4) K2SO4 (р-р) и Ba(NO3)2 (р-р).
3. С наибольшей скоростью с водой при температуре
20 °C взаимодействует металл:
1) железо; 2) цинк; 3) магний; 4) калий.
4. Скорость выделения Нэ будет максимальной, когда
между собой взаимодействуют:
1) магний и соляная кислота;
2) олово и соляная кислота;
3) магний и уксусная кислота;
4) олово и уксусная кислота.
--- 247 ---
5. Скорость разложения Н,О, можно повысить, если:
1) увеличить температуру;
2) добавить МпО.,,
3) разбавить его водой;
4) понизить температуру.
6. Скорость химической реакции между газами с по-
вышением давления, как правило:
1) увеличивается; 2) уменьшается;
3) не изменяется; 4) возможны все три зависимости.
7. Увеличить скорость прямой реакции процесса N +
+ ЗН, , 2NH,,, + О можно, если повысить:
1) температуру; 2) давление;
3) концентрацию водорода; 4) концентрацию аммиака.
8. Для смещения химического равновесия процесса
N + О 2NO(r) - Q в сторону образования моноок-
сида азота необходимо:
1) повысить давление;
2) повысить температуру;
3) понизить температуру;
4) уменьшить концентрацию азота.
9. На смещение химического равновесия процесса
Fe Ож , + 4FL,. tl 3Fe., + 4НО . НЕ влияет:
1) введение в систему катализатора;
2) изменение давления;
3) изменение содержания Fe3O4;
4) увеличение концентрации водорода.
10. Скорость реакции магния с соляной кислотой уве-
личится, если:
1) измельчить магний;
2) повысить температуру раствора;
3) понизить температуру раствора;
4) добавить в раствор иодоводород.
--- 248 ---
ТЕСТЗ
1. Для процесса 2SO,(r) + О 2SO3(r) + Q повыше-
ние температуры приведет к:
1) смещению равновесия в сторону исходных веществ;
2) повышению скорости прямой реакции;
3) понижению скорости обратной реакции;
4) повышению скорости обратной реакции.
2. Для процесса N + O,(r) 2NO(r) - Q понижение
температуры приведет к:
1) смещению равновесия в сторону исходных веществ;
2) повышению скорости обратной реакции;
3) понижению скорости прямой реакции;
4) понижению скорости обратной реакции.
3. Сместить в сторону образования СО, равновесие
процесса 2СО, + О,,, tz 2СО,,, + Q можно, если:
1) понизить температуру;
2) повысить давление;
3) повысить температуру;
4) увеличить концентрацию кислорода.
4. Давление НЕ влияет на смещение равновесия про-
цессов:
L tz 2НС1 ;
2(0 ~7 (г)’
, tz 2HI ;
2(т) —* (г)’
DFeO(T) + CO(r)^Fe(T) + CO2(r);
2)H2(r) + CL '
3)Н2юН„
4)Ч(Г) + ЗН2Ю^ЖН3(ГУ
5. Уменьшение давления смещает равновесие в сто-
рону продуктов реакции для процессов:
О FeO(T) + H2(r) Fe(T) + H2O(r);
2) СаСО3(т) СаО(т) + СО2(г);
3)СО(Г) + С(Т>^2СОю’
4) N2(r) + 3H2(r) 2NH3(r).
--- 249 ---
6. Увеличение концентрации водорода сместит рав-
новесие в сторону исходных веществ для процессов:
1)N . + 3H,.lt»2NH„
f 2(г) 2(г) 7 3(г)’
2) Fe, +НД ,^FeO, + Н„ :
3)2Н2О(г)^2Н2(г) + Оад;
4)H2(o+An^2HV
7. В сторону исходных веществ увеличение темпера-
туры смещает равновесие для процессов:
DN2(rl + O2(r)^2NO(r,-Q;
2)2NH3(r)^N2(r) + 3H2(r)-Q;
3) 2Н2(г) + О2(г) 2Н2О(г) + Q;
4) СаО,, + СО7, . СаСО,, , + Q.
8. Сместить в сторону исходных веществ равновесие
процесса Н70(ж) + СОП(г) Н2СО3 (р-р) + Q можно, если:
I) понизить давление;
2) повысить температуру;
3) увеличить концентрацию углекислого газа;
4) повысить давление.
9. В сторону продуктов реакции равновесие процес-
са С.. + 2N,O,, tr 2N7,, + СО„, + О смещают каждый из
факторов по отдельности:
1) повышение давления; понижение температуры;
2) понижение давления; увеличение концентрации N,O;
3) повышение давления; понижение концентрации СО2;
4) понижение температуры; понижение концентра-
ции N2.
10. С наибольшей скоростью протекает реакция окис-
ления:
1) меди на воздухе при обычных условиях;
2) меди в чистом кислороде при нагревании;
3) магния на воздухе при обычной температуре;
4) магния в кислороде при нагревании.
— 250 —
ТЕСТ 4
1. Увеличить выход продуктов обратимой реакции N +
+ ЗН2(г) 2NH3(rj + Q можно:
1) повышая давление,
2) используя катализатор,
3) увеличивая концентрацию водорода,
4) повышая температуру.
2. В наибольшей степени сместить в сторону образо-
вания продукта равновесие в системе 28Оэ(г + Оад
2SO3(r) + Q можно, если одновременно:
1) повысить и давление, и температуру;
2) понизить и давление, и температуру;
3) понизить давление, повысить температуру,
4) повысить давление, понизить температуру.
3. Равновесие SO^r + Н О «г- HSO;, + ОН; -Q
можно сместить вправо, если:
I)добавить кислоту;
2) добавить воду;
3) добавить щелочь;
4) повысить температуру
4. Уменьшение объема сместит в сторону исходных
веществ равновесие процессов:
1)СаСО3(т)^СаО(т) + СО2(г);
2)СО2(г) + Н2О(ж)^ Н2СО3(р-р);
3)H2SO3(p-p)^H2Ow + SO2(r);
4) 2NH 3 N + ЗН v
5. Увеличение объема сместит равновесие в сторону
продукта (продуктов) реакции в случае процессов:
1) N,f. + О,,, tz 2NO v
2) 2С + О,,. 2СО .,
’ (т) 2(г) —7 (г)’
3) 2SO , tl 2SO , + v
> 3(г) 2(г) 2(г)’
--- 251 ----
4) ВаО(т) + С02(г) ВаСО3(т).
6. В сторону образования сероводорода равновесие про-
цесса H,S (р-р) Н+ (р-р) + HS (р-р) - Q сместится при:
1) добавлении в раствор NaHS;
2) подкислении раствора;
3) понижении температуры;
4) подщелачивании раствора.
7. При повышении температуры:
I) возрастает скорость как экзотермических, так и эн-
дотермических реакций;
2) скорость экзотермических реакций возрастает, а
эндотермических — уменьшается;
3) скорость экзотермических реакций уменьшается, а
эндотермических — возрастает;
4) уменьшается скорость как экзо-, так и эндотерми-
ческих реакций.
8. Равновесие процесса СО2(г) + Н,О(ж) Н,СО3 (р-р) +
+ Q в сторону образования угольной кислоты смещают:
1) повышение давления;
2) повышение температуры;
3) увеличение концентрации углекислого газа;
4) понижение давления.
9. Изменение химического количества вещества А НЕ
повлияет на скорость реакции:
')W% 2)2А,г|+В„=АгВ|г,;
3) 2А„, + 2В„, = 2 АВ„4) А,,, + 2В|г - А В, ,
10. Скорость гомогенной экзотермической реакции
синтеза аммиака можно увеличить, если:
1) повысить температуру;
2) использовать катализатор;
3) увеличить давление;
4) понизить температуру.
--- 252 ---
ТЕСТ 5
1. Уменьшение объема сместит равновесие в сторону
продукта (продуктов) реакции для процессов:
1) распада аммиака на простые вещества;
2) образования фосгена СОС1,( при взаимодействии
со(Г)иС12<г);
3) окисления SOn(i) кислородом с образованием SO3(r);
4) получения Си(т) взаимодействием СпО(т) и Н2(г) с
образованием Н?О(г).
2. Укажите справедливые утверждения для состояния
химического равновесия:
1) масса продуктов реакции всегда равна массе ис-
ходных веществ;
2) концентрации исходных веществ и продуктов ре-
акции со временем не изменяются;
3) скорости прямой и обратной реакций всегда равны;
4) концентрация продуктов реакции всегда равна кон-
центрации исходных веществ.
3. Для зависимости скорости одностадийной реакции
А + В = АВ от концентрации вещества А наиболее
типичен график:
с (А) с (А)
4. Укажите основную причину увеличения скорости
реакции при повышении температуры:
--- 253 ----
1) рост числа столкновений молекул;
2) увеличение энергии активации;
3) уменьшение энергии активации;
4) рост числа активных молекул.
5. Катализатор увеличивает скорость реакции, так как:
1) увеличивает энергию активации;
2) уменьшает энергию активации;
3) уменьшает число активных молекул;
4) увеличивает тепловой эффект реакции.
6. Введение катализатора увеличивает скорость реак-
ции (реакций):
I) только прямой;
2) только обратной;
3) как прямой, так и обратной;
4) как гетерогенных, так и гомогенных.
7. При движении системы к состоянию химического
равновесия:
1) увеличивается скорость прямой и обратной ре-
акций;
2) увеличивается скорость прямой и уменьшается ско-
рость обратной реакции;
3) уменьшается скорость прямой и увеличивается ско-
рость обратной реакции;
4) энергия активации постепенно снижается.
8. Вправо сместить равновесие процесса Си2 (р-р) +
+ Н,О, , tx СиОН+ + Н* - Q можно, если:
1) подкислить раствор;
2) добавить в раствор немного щелочи;
3) повысить температуру;
4) понизить температуру.
9. Диссоциация уксусной кислоты описывается урав-
нением СН3СООН (р-р) + Н,О(ж) СН3СОО (р-р) +
--- 254 ---
+ Н3О~(р-р) - Q. Увеличить степень диссоциации кис-
лоты можно, если:
1) разбавить раствор водой;
2) повысить температуру;
3) повысить концентрацию кислоты;
4) добавить в раствор немного щелочи.
10. При повышении температуры равновесие процес-
са N2(r) + ЗН Д 2NH r) + Q смешается в сторону исход-
ных веществ, так как:
1) скорость обратной реакции увеличивается, а пря-
мой — уменьшается;
2) скорость обратной реакции уменьшается, а пря-
мой — увеличивается;
3) увеличиваются скорости обеих реакций, но в боль-
шей степени — обратной;
4) уменьшаются скорости обеих реакций, но в боль-
шей степени —- прямой.
ТЕСТ 6
1. Растворение сероводорода в воде можно описать
схемой H,S(r) + Н^О(ж) Д H2S (р-р) + Q. Повышению ра-
створимости H,S в воде способствуют:
1) повышение давления;
2) понижение температуры;
3) понижение давления;
4) повышение температуры.
2. Растворение хлорида аммония в воде можно опи-
сать схемой NH4CI(t)+ Н2О(ж) ЫНДр-р) + С1 (р-р) - Q.
Увеличить растворимость соли в воде можно, если:
1) повысить температуру;
2) понизить температуру; ।
— 255 ------
3) измельчить соль;
4) интенсивно перемешивать раствор.
3. Укажите процессы, для которых повышение давле-
ния смещает равновесие влево, а повышение темпера-
туры — вправо:
1)2NH + 3H7f -Q-,
2) 2SO + О7(, 2SO , + Q-,
' 2(г) 2(г| 7 3(г)
3) СО ,,+С <^2СО -£;
4) СаСО„ , СаО,, + СО,,, - Q.
4. В сторону продуктов реакции (т.е. усилить диссоци-
ацию азотистой кислоты) равновесие процесса HNO, +
+ НОН tz Н,ОТ + NO, - Q можно сместить, если:
1) понизить температуру;
2) повысить температуру;
3) подкислить раствор;
4) разбавить раствор водой.
5. В сторону исходных веществ равновесие процесса
СО,, + 2Н„ , tz СН,ОН, , - О смещается при:
1) понижении давления;
2) повышении давления;
3) понижении температуры;
4) увеличении концентрации СО.
6. Повышение давления и понижение температуры
по отдельности смещают равновесие в одном направ-
лении для реакций:
DN2(r( + O2(r)^2NO(r)-e;
2) 2SO2(r) + О7(г| 2SO3(r) + 2;
3) 2СО + О„ , 2СО + Q-
4) N , + ЗН„ , 2NH ,, + Q.
7. Понижение давления и повышение температуры
по отдельности смещают равновесие в одном направ-
лении для реакций:
— 256 —
1)H +CL,tz2HCL +2;
2) 2CO , + O„ , <Z 2CCL , + p;
3) N. + О,. Л 2NO , - 0;
’ 2(r) 2(r) 7 (r> ii’
4) 2S0„ + 0„ , 2S0„ , + Q.
8. Промышленный синтез оксида серы (VI) 2SO2(r) +
+ О2 ; 2SO3(r) + Q проводят при повышенной темпе-
ратуре, чтобы:
1) сместить равновесие вправо;
2) сместить равновесие влево;
3) увеличить скорость реакции;
4) снизить энергию активации процесса.
9. В сторону продуктов реакции равновесие процес-
са 2HgO(T) 2Hg(T) + O,(r) - Q можно сместить, если:
1) повысить температуру;
2) повысить давление;
3) увеличить концентрацию кислорода;
4) понизить давление.
10. В сторону продуктов реакции равновесие процесса
FeO, + Н,,, Fe,. + Н,О,, + Q можно сместить, если:
1) повысить давление;
2) понизить температуру;
3) увеличить химическое количество FeO;
4) уменьшить концентрацию водяных паров.
ТЕСТ 7
1. С наименьшей скоростью протекает процесс, схе-
ма которого:
1) Fe + О2 —» Fe,O3 (на воздухе, 20°С);
2)Ее,т, + 2НС1,„ = ЕеС1,(р-р) + Нип;
3) Fe + О2 —» Fe,O3 (при нагревании на воздухе);
4) Fe + Н,О —> Fe3O4 + Н2 (при нагревании).
9 Зак. 1530
--- 257 ---
2. С наименьшей (нулевой) энергией активации про-
текает реакция, схема которой:
1) KNO3 -> KNO, + О,;
2) • СН3 + • С1 —» СН3С1;
3) Fe + О, —> Fe3O4;
4) N, + Н, -» NH3.
3. Скорость выделения Н, наименьшая в реакции (пло-
щадь поверхности металлов и молярная концентрация
кислот одинаковы), схема которой:
l)Zn + HCl—>ZnCl,+ Н,;
2) Zn + СН3СООН Д Zn(CH3COO), + Н2;
3) Zn + H2SO4 (разб.) -» ZnSO4 + Н,~;
4) Sn + СН3СООН -> Sn(CH3COO)2 + Н2.
4. Средняя скорость протекающей при постоянном дав-
моль
лении гомогенной реакции А + В = АВ равна 0,03 , а
начальная концентрация вещества А составляет 2,0 моль/дм3.
Укажите время (с), через которое концентрация вещества
А станет равной 0,8 моль/дм3:
1) 10; 2) 20; 3)30; 4) 40.
5. Средняя скорость протекающей при постоянном
моль
объеме гомогенной реакции А + В = АВ равна 0,04 3 ,
а начальная концентрация вещества А составляет
^моль
Со . Укажите время (с), через которое вещество А
полностью израсходуется:
1)40; 2) 30; 3)20; 4) 10.
6. Средняя скорость протекающей при постоянном
моль
объеме гомогенной реакции А + В =- АВ равна 0,04 ,
а начальная концентрация вещества АВ составляет
1,8 моль/дм3. Через какое время (с) концентрация веще-
ства АВ станет равной 2,2 моль/дм3?
--- 258 ----
1)40; 2) 30; 3)20; 4) 10.
7. Средняя скорость протекающей при постоянном
_ „ моль
объеме гомогенной реакции А + В = АВ равна 0,02 —у—,
а начальная концентрация вещества А составляет
моль
1,2 . Рассчитайте концентрацию (моль/дм3) веще-
ства А через 10 с после начала реакции:
1)0,4; 2) 0,6; 3) 0,8; 4) 1,0.
8. Скорость реакции 2А = А, ниже в том случае, где
моль
концентрация вещества А, равная вначале 1,0 —у , че-
рез минуту составит (моль/дм3):
1) 0,02; 2) 0,03; 3) 0,04; 4) 0,05.
9. При взаимодействии Н, с С12, Вг, и I, в сосудах оди-
накового объема, но в разных условиях через 5 с образу-
ется по 20 г продукта. Скорость реакции:
1) выше для О2; 2) выше для Вг,;
3) выше для 12; 4) одинакова во всех сосудах.
10. При взаимодействии Н, с С12, Вг, и I, в сосудах
одинакового объема, но в разных условиях через одина-
ковый промежуток времени образуется 7,1 г НС1, 10,5 г
НВг и 14,8 г HI. Скорость реакции:
1) выше для С12; 2) выше для Вг,;
3) выше для I,; 4) одинакова во всех сосудах.
ТЕСТ 8
1. Укажите справедливые утверждения:
1) чем выше энергия активации реакции, тем больше
скорость реакции;
2) чем меньше энергия активации, тем больше ско-
рость реакции;
--- 259 ----
3) скорость реакции от энергии активации не зависит;
4) тепловой эффект реакции НЕ зависит от числа про-
межуточных стадий.
2. Укажите тепловой эффект Q (кДж) реакции А + В =
= АВ, используя энергетическую диаграмму.
ход реакции i
1)+25; 2)-25; 3)+50; 4) -50.
3. В растворе установилось равновесие HF Н" + F".
При добавлении к этому раствору соляной кислоты:
1) равновесие сместится влево;
2) равновесие сместится вправо;
3) концентрация фторид-ионов возрастает;
4) концентрация фторид-ионов уменьшается.
4. Укажите тепловой эффект Q (кДж) реакции АВ =
= А + В, используя энергетическую диаграмму:
Е,кДж
ход реакции
1) +50; 2)-50; 3) +25; 4)-25.
5. Для реакции 2NO, = 2NO(i) + О2(г) изменению кон-
центраций соответственно NO и О, со временем отве-
чают линии:
--- 260 ---
1) 1 и 2; 2) 3 и 2; 3) 2 и 3; 4) 2 и 4.
6. Укажите тепловой эффект Q (кДж) реакции А + В =
= АВ, используя энергетическую диаграмму:
£,кДж
ход реакции
1) +75; 2) —75; 3) +50; 4)-50.
7. Как изменится скорость реакции выделения водо-
рода Mg + 2НС1 = MgCl2 + + Н2, если кусочек магния массой
1 г измельчить на 1000 одинаковых кубиков?
1) не изменится;
2) возрастет примерно в 10 раз;
3) возрастет примерно в 100 раз;
4) возрастет примерно в 1000 раз.
8. На основании энергетической диаграммы рассчи-
тайте энергию активации (кДж) реакции А + В = АВ:
1)25; 2) 50; 3) 75; 4) 100.
— 261
9. Для реакции 2S0,(r) + O,(r) = 2SO3(r) изменению кон-
центраций соответственно SO, и О, отвечают линии:
1) 2 и 3; 2) 2 и 4; 3)3 и 4; 4)4иЗ.
10. На основании энергетической диаграммы укажи-
те справедливые утверждения для обратимой реакции
A + BtzAB:
1) прямая реакция экзотермическая;
2) прямая реакция эндотермическая;
3) обратная реакция экзотермическая;
4) обратная реакция эндотермическая.
ТЕСТ 9
1. Равновесие реакции N } + 3H,(r) 2NH3(r) + Q сме-
щается в сторону образования продукта реакции при
добавлении в систему:
1) аммиака; 2) хлороводорода;
3) азота; 4) водорода.
2. Для реакции А(г) + В(г) = АВ(г) дана зависимость кон-
центрации вещества АВ от времени:
--- 262 ---
с (AB)
Скорость реакции максимальная в момент времени:
I) t- 2) t-, 3) 4) tx.
3. Три реакции, уравнения которых:
Ч(г1 + 3H2(r) S 2NH3(r);
2SO2(r) + O2(r) S 2SO3(r
2H2(r) + O2(ri 2H,O(r),
протекают в сосудах одинакового объема. Через некото-
рый одинаковый промежуток времени образуется 1,5 моль
NH3, 104 г SO3 и 35,84 дм3 (н. у.) Н7О. Что можно сказать
о скорости образования продуктов:
1) с наибольшей скоростью протекает реакция обра-
зования аммиака;
2) с наибольшей скоростью протекает реакция обра-
зования оксида серы (VI);
3) с наименьшей скоростью протекает реакция обра-
зования оксида серы (VI);
4) скорости всех трех реакций одинаковы.
4. Для одностадийной реакции А2(г) + В2(г) = 2АВ(г) за-
висимость скорости реакции от концентраций реаген-
тов описывается уравнением:
l)r = fc2(A,); 2)v = kc(\)c(B^
3) v = НА,) • с2(В2); 4) v = МА,) с(В2).
5. Зависимость скорости реакции от температуры опи-
сывается уравнением (у — температурный коэффици-
ент реакции):
--- 263 ----
1) г(Т,) = г(Т.) у;
2) г(Т2) = г(Т,) у(Т2-Т1);
3)
4) г(Т2) = г(Т,)-ут-т-™
6. Укажите уравнение одностадийной реакции, за-
висимость скорости которой от концентраций описы-
вается уравнением v = кс(А.э):
|)Вад + Ааг=2АВ(г,; ' 2)2Ва„ + АЯг, = 2ВДг,;
3) Вм + А,,,, - ВАЯ„; 4) 2ВАЛ, + A,,, = 2ВА,,,.
7. Отметьте правильное выражение для скорости од-
ностадийной реакции 2А + 2В2(г) = 2АВ4(1):
1) v = к с2(А) С2(В,);Т 2) 'v = к • с(В2)2;
3) v = /«^(А); 4) v = к с(2В2).
8. Для зависимости скорости реакции от температу-
ры наиболее типичен график:
9. Скорость прямой реакции А2(г( + ЗВЭ(г) = 2АВад, рас-
считанная по изменению концентрации вещества А, рав-
МОЛЬ [ МОЛЬ ]
на 0,01 3 . Укажите скорость реакции ^дмз CJ, рас-
считанную соответственно по изменению концентра-
ции веществ В, и АВ3:
1) 0,02 и 0,01'; 2) 0,03 и -0,02;
3)0,03 и 0,02; 4) 0,02 и 0,04.
— 264 —
10. Скорость реакции А + В = АВ(г) равна 0,04
моль
дм’ - с
а начальная концентрация вещества АВ составляет
моль ( моль \
1,2 с • Укажите концентрацию I —,— I вещества АВ
через 10 с после начала реакции:
1)0,8; 2) 1,4; 3) 1,6; 4) 1,8.
ТЕСТЮ
1. Во сколько раз увеличится скорость одностадийной
реакции А, + В,(г) = 2АВ{ж) при увеличении концентра-
ции вещества А, в 3 раза?
1)3; 2) 6; 3)9; 4) 12.
2. При уменьшении концентрации вещества А, в 3 раза
скорость одностадийной реакции 2А,(г) + В,(г) = 2А2В(г):
1) увеличивается в 3 раза;
2) уменьшается в 3 раза;
3) увеличивается в 9 раз;
4) уменьшается в 9 раз.
3. Во сколько раз нужно увеличить внешнее давление,
чтобы скорость одностадийной реакции А(|) + 2В(г) -
= 2АВ,(г) возросла в 125 раз?
1)5; 2) 25; 3) 100; 4) 125.
4. Как изменится скорость одностадийной реакции
А(1) + В(г) = АВ(т) при увеличении давления в 4 раза?
1) не изменится;
2) возрастет в 8 раз;
3) возрастет в 4 раза;
4) возрастет в 16 раз.
5. Для какой одностадийной реакции увеличение кон-
центрации вещества А в 2 раза приведет к увеличению
скорости в 4 раза?
— 265 —
OA2(r) + B2(r) = 2AB(r);
2)А2(г, + В(т) = ВА2(т);
3)2Аз(Г) = В(ГР
4) 2А, =В +2С r
6. Объем выделяющегося в единицу времени Н, в реак-
ции Fe и H,SO4 (разб.) при измельчении железного кубика
массой 10 г на 125 одинаковых кубиков увеличивается в:
1) 2 раза; 2) 5 раз; 3) 15 раз; 4) 125 раз.
7. Чему равен температурный коэффициент реакции
у, если при повышении температуры на 30°С скорость
химической реакции возрастает в 64 раза?
1)2; 2)3; 3)4; 4)5.
8. Во сколько раз надо увеличить концентрацию веще-
ства А, чтобы при уменьшении концентрации вещества
В в два раза скорость одностадийной реакции А (р-р) +
+ 2В (р-р) = С (р-р) не изменилась?
1)2; 2) 4; 3)6; 4) 8.
9. В состоянии равновесия реакции 2SO2(r) + О2(г)
t^2SO3(r) молярные концентрации SO,, О, и SO3
соответственно равны 0,2; 0,1 и 0,4. Укажите исход-
ные молярные концентрации (моль/дм3) соответствен-
но веществ SO, и О,:
1) 1 и 0,5; 2) 0,4 и 0,2; 3) 0,6 и 0,3; 4) 1,2 и 0,6.
10. Скорость химической реакции при 50°С равна
моль
2 з . Укажите ее скорость
температурный коэффициент реакции равен 2:
1)4; 2) 8;3) 16; 4) 24.
моль
дм3
моль
—-— при 80 С, если
дм с)
— 266 -----
ТЕМА 20
Растворы
ТЕСТ1
1. Неоднородные смеси образуются, когда с водой
смешиваются:
1) глина; 2) сахар; 3) мел; 4) серная кислота.
2. Укажите однородные смеси:
1) пыль; 2) туман; 3) воздух; 4) керосин.
3. Суспензию можно получить при смешивании с
водой:
1) масла; 2) глины; 3) мела; 4) углекислого газа.
4. Укажите эмульсии:
1) смесь растительного масла с водой; 2) молоко;
3) дым; 4) туман.
5. Туман и пыль можно назвать:
1) взвесью; 2) эмульсией;
3) аэрозолью; 4) пеной.
6. Пена — это взвесь:
1) твердого вещества в жидком;
2) жидкого вещества в газе;
3) газа в жидкости;
4) жидкого вещества в жидкости.
7. Взвесь твердого вещества в жидкости называется:
1) эмульсией; 2) пеной;
3) суспензией; 4)аэрозолью.
8. В случае пыли между собой смешаны:
1) газ и жидкость; 2) две жидкости;
3) твердое вещество и газ; 4) два газа.
— 267
9. Туман можно рассматривать как взвесь:
1) газа в жидкости;
2) жидкости в газе;
3) твердого вещества в жидкости;
4) двух жидкостей.
10. Пену можно получить при растворении в воде:
1) сахара; 2) поваренной соли;
3) мыла; 4) стирального порошка.
ТЕСТ 2
1. Растворителями могут быть вещества:
1) только жидкие;
2) только газообразные;
3) только твердые;
4) все три перечисленные.
2. Растворы подобно чистым веществам:
1)однородны;
2) устойчивы;
3) имеют постоянный состав;
4) могут быть бесцветными или окрашенными.
3. Раствор, в котором при данных условиях можно ра-
створить дополнительную порцию вещества, может
быть:
1) концентрированным; 2) разбавленным;
3) насыщенным; 4) ненасыщенным.
4. При внесении в раствор дополнительной порции
вещества оно (вещество) не растворилось. С увереннос-
тью можно утверждать, что исходный раствор является:
1) разбавленным; 2) концентрированным;
3) насыщенным; 4) ненасыщенным.
5. На растворимость твердых веществ в жидкостях
влияют:
--- 268 ----
1) температура; 2) природа вещества;
3) природа жидкости; 4) перемешивание.
6. При перемешивании растворимость твердых ве-
ществ в жидкости:
1) возрастает;
2) уменьшается;
3) нс изменяется;
4) возможны все три перечисленных случая.
7. Растворимость газа в жидкости зависит от:
1) природы газа;
2) температуры;
3) давления;
4) скорости, с которой газ пропускают в жидкость.
8. С увеличением скорости пропускания газа в жид-
кость его растворимость:
1) не изменяется;
2) уменьшается;
3) возрастает;
4) возможны все три перечисленных случая.
9. Скорость растворения определенной порции твер-
дого вещества в жидкости зависит от:
1) температуры;
2) перемешивания;
3) природы жидкости;
4) формы сосуда с жидкостью.
10. Одинаковые порции сахара растворяют по отдель-
ности в воде массой 100 г и в воде массой 200 г. Ско-
рость растворения сахара:
1) практически одинакова;
2) в сосуде с большей массой воды в 2 раза больше;
3) в сосуде с меньшей массой воды в 2 раза меньше;
4) в сосуде с большей массой воды в 4 раза больше.
--- 269 ---
ТЕСТЗ
1. Смесь гидроксида меди (II) с водой называется:
1) раствором; 2) эмульсией;
3) суспензией; 4) аэрозолью.
2. В отличие от взвесей растворы:
1) устойчивы;
2) всегда бесцветны;
3) однородны;
4) всегда состоят только из двух (и не более) компо-
нентов.
3. Как взвеси, так и растворы:
1) неоднородны;
2) устойчивы;
3) могут состоять из двух и более компонентов;
4) непостоянны по составу.
4. Назовите вещества, которые будут хорошо раство-
ряться в воде:
1) азот; 2) сульфат калия; 3) фтороводород; 4) метан.
5. Плохо растворимы в воде вещества, формулы ко-
торых:
1) С6Н6; 2) HF; 3) Sg; 4) SOr
6. Растворы —* это всегда:
1) нашатырный спирт; 2) нашатырь; ___
3) соляная кислота; 4) фосфорная кислота.
7. Раствор, в котором при данной температуре веще-
ство больше не растворяется, называется:
I) насыщенным; 2) концентрированным;
3) разбавленным; 4) ненасыщенным.
8. Растворимость вещества определяют по его содер-
жанию в растворе:
1) концентрированном; 2) разбавленном;
3) ненасыщенном; 4) насыщенном.
--- 270 ---
9. Изменить растворимость твердого вещества в воде
можно:
1) дроблением вещества;
2) повышением температуры;
3) небольшим повышением давления;
4) небольшим понижением давления.
10. Растворимость данного газа в воде можно повысить:
1) понизив температуру воды;
2) увеличив внешнее давление,
3) пропуская газ в воду с большей скоростью;
4) повысив температуру воды.
ТЕСТ 4
1. Неоднородными будут смеси:
1) дым; 2) воды и аммиака;
3) пыль; 4) гидроксида железа (III) и воды.
2. Насыщенный раствор можно сделать ненасыщен-
ным, если:
1) изменить (повысить или понизить) температуру;
2) внести в раствор дополнительную порцию вещества;
3) увеличить массу растворителя;
4) частично упарить раствор.
3. Смесь растительного масла и воды называется:
I) эмульсией; 2) аэрозолью; 3) суспензией; 4) пеной.
4. Ненасыщенный раствор можно сделать насыщен-
ным, если:
1) его частично упарить,
2) увеличить массу растворителя;
3) добавить необходимую порцию растворенного ве-
щества;
4) изменить (повысить или понизить) температуру.
--- 271
5. Все перечисленные свойства— неустойчивость во
времени, неоднородность, непостоянство состава —
характеризуют:
1) растворы; 2) эмульсию; 3) взвесь; 4) туман.
6. Сколько свойств из перечисленных характеризуют
раствор: однородность; всегда окрашены; устойчивы во
времени; имеют постоянный количественный состав;
могут находиться в различном агрегатном состоянии?
1)5; 2)4; 3)3; 4) 2.
7. Бензол — неполярный растворитель, поэтому луч-
ше, чем вода, будет растворять:
1) хлорид натрия; 2) иод; 3) кислород; 4) серу
8. Вода — полярный растворитель, поэтому лучше,
чем неполярный четыреххлористый углерод, будет ра-
створять:
1) бензол; 2) сульфат калия; 3) азот; 4) гидроксид натрия.
9. Укажите факторы, которое влияют на раствори-
мость твердых веществ в жидкости:
а) масса жидкости;
б) природа жидкости;
в) температура;
г) природа вещества;
д) интенсивность перемешивания раствора;
е) степень измельчения вещества;
ж) масса вещества.
1) все из перечисленных; 2) б, в, г;
3) б, в, г, д, е; 4) б, в, г, ж.
10. На скорость растворения твердых веществ в жид-
костях влияют: а) температура; б) природа вещества;
в) степень измельчения вещества; г) интенсивность пе-
ремешивания раствора; д) природа жидкости; е) форма
сосуда:
1) а, б, в, г, д; 2) б, в, г, д; 3) а, в, г, д; 4) а, б, г, д, е.
--- 272 ---
ТЕСТ 5
1. Укажите верные утверждения:
1) при образовании растворов энергия может как вы-
деляться, так и поглощаться;
2) концентрированный раствор всегда является насы-
щенным;
3) насыщенный раствор может быть разбавленным;
4) при увеличении температуры растворимость газов
в жидкостях как правило уменьшается.
2. Химическое взаимодействие (20°С) влияет на ра-
створимость в воде веществ, формулы которых.
1) N2; 2) SO,; 3) СО; 4) СО,.
3. Образование водородных связей оказывает влия-
ние на растворимость в воде.
1) аммиака; 2) бензола;
3) фтороводорода, 4) сульфата калия.
4. Растворимость веществ в воде всегда увеличивает-
ся при:
1) их химическом взаимодействии с водой,
2) понижении давления (для газов);
3) образовании водородных связей между молекула-
ми воды и растворенного вещества;
4) повышении температуры.
5. Необходимо как можно быстрее растворить кусо-
чек сахара в воде. Для этого необходимо:
1) охладить воду; 2) подогреть воду;
3) раздробить сахар, 4) перемешивать раствор.
6. Хуже всего в воде растворяется:
1) пропанол-1; 2) пропановая кислота;
3) пропаналь; 4) пропанол-2.
7. Даны растворы KBr, KNO3, СаС12 и Na,SO4 с оди-
наковой плотностью и одинаковой молярной концент-
--- 273 ---
рацией. Наибольшей будет массовая доля раствора:
1) КВг; 2) KNO3; 3) СаС12; 4) Na,SO4.
8. Укажите формулы веществ, насыщенные растворы
которых будут разбавленными:
1) N2; 2) HF; 3) CaSO4; 4) KNO3.
9. В воде наименее растворим газ, формула которого:
1)НС1;2) SO,; 3) О,; 4)NH3.
10. Раствор образуется, если с водой массой 50 г сме-
шать 50 г:
1) этанола; 2) азотной кислоты; 3) бензола; 4) мела.
ТЕСТ 6
1. Укажите справедливые утверждения для насыщен-
ного раствора:
1) может быть разбавленным;
2) не может быть разбавленным;
3) всегда является концентрированным;
4) не всегда является концентрированным.
2. Насыщенными могут быть водные растворы ве-
ществ, формулы которых:
1) СаСО3; 2) NaCl; 3) N,; 4) HNO3.
3. Насыщенными НЕ могут быть растворы в воде:
1) H2SO4; 2) NH3; 3) С,Н5ОН; 4) Н3РО4.
4. Укажите формулы веществ, насыщеннее растворы
которых будут концентрированными:
1)С„Н2,ОИ (сахар); 2)AgNO3;
3) AgCl; 4) BaSO4.
5. Длительное время в контакте с кристаллами раство-
ренного вещества могут находиться растворы:
1) разбавленные; 2) насыщенные;
3) ненасыщенные; 4) концентрированные.
--- 274 ---
6. Укажите справедливые утверждения:
1) насыщенный раствор может быть разбавленным;
2) разбавленный раствор не может быть насыщенным;
3) насыщенный раствор всегда будет концентрирован-
ным;
4) концентрированный раствор может быть ненасы-
щенным.
7. Дополнительную порцию вещества при данной
температуре никогда нельзя растворить в растворе:
1) разбавленном; 2) концентрированном,
3) насыщенном; 4) ненасыщенном.
8. Раствор, содержащий NaCl и Н,О, можно разделить
на отдельные компоненты:
1) электролизом; 2) фильтрованием;
3) выпариванием; 4) центрифугированием.
9. Укажите формулу кристаллогидрата (t = 20°С):
l)C(H,O)m; 2) CuSO4 • 5НЛО;
3)H2SO4-H2O; 4)Cu2+(H2O)4
10. Растворы никогда не бывают: -
1) твердыми; 2) жидкими,
3) газообразными; 4) неоднородными.
ТЕСТ 7
1. Укажите формулы гидратов:
1) СН4 6Н,О; 2) H7SO4 • 2Н7О;
3)Си2+(Н2О)4; 4)СС14-СбН,
2. Сколько веществ из указанных (NaHCO3, NH3 • Н,О,
нею, Са(НСО3)„ H2SO3, Н3РО4) существуют только в
водных растворах (25°С)?
1)6; 2) 5; 3)4, 4)3.
--- 275 ---
3. Какие явления происходят при растворении крис-
таллического сульфата меди (II) в воде?
• 1) разрушение кристаллической решетки соли;
2) гидратация ионов Сн2+ и SO2-;
3) хаотическое движение гидратированных ионов
Си2+ и SO2;
4) направленное движение в противоположных на-
правлениях гидратированных ионов Сн2+ и SO2-.
4. В водном растворе нитрата калия отсутствуют час-
тицы:
1) атомы калия и натрия;
2) молекулы KNO3;
3) гидратированные ионы К+ и С1 ;
4) негидратированные ионы К+ и С1 .
5. В водном растворе сульфата меди (II) присутству-
ют частицы, формулы которых:
1) CuSO4; 2) Си0; 3) Си2+ и SO2;
4)Cu2+(H2O)vhSO2--(H2O)v.
6. Процесс гидратации лежит в основе:
1) отвержения цемента;
2) растворения бензола в гексане;
3) отвердения алебастра;
4) образования кристаллогидратов.
7. НЕЛЬЗЯ утверждать, что:
1) растворение—процесс исключительно физический;
2) физические свойства раствора всегда представля-
ют собой сумму физических свойств отдельных компо-
нентов раствора;
3) объем жидкого раствора всегда равен сумме объе-
мов смешиваемых жидкостей;
4) объем газообразного раствора практически равен
сумме объемов отдельных газов.
--- 276 ---
8. Свойства отдельных компонентов всегда проявля-
ются практически независимо друг от друга в случае ра-
створов:
1) твердых; 2) жидких;
3) газообразных; 4) всех перечисленных.
9. За величину и знак теплового эффекта при раство-
рении твердых веществ в воде отвечают явления:
1) гидратация;
2) диффузия частиц растворенного вещества в воде;
3) разрушение кристаллической решетки вещества;
4) все три отмеченных явления.
10. Теплота всегда выделяется при растворении в воде
веществ:
1) кристаллогидратов; 2) кристаллических;
3) газов; 4) жидких.
ТЕСТ 8
1. Укажите справедливые утверждения:
1) при образовании раствора всегда наблюдается элек-
тролитическая диссоциация;
2) не всегда растворение вещества в воде сопровож-
дается образованием водородных связей;
3) основная причина плохой растворимости в воде
газообразных простых веществ — неполярность моле-
кул газа;
4) в любом концентрированном растворе нельзя до-
полнительно растворить порцию вещества.
2. Концентрированными ненасыщенными могут быть
растворы в воде:
1) гипса; 2) доломита;
3) сахара; 4) гидроксида калия.
--- 277 ---
3. Укажите НЕВЕРНЫЕ утверждения. С увеличени-
ем степени измельчения твердого вещества:
1) повышается его растворимость;
2) повышается скорость растворения;
3) уменьшается тепловой эффект растворения;
4) увеличивается энергия гидратации.
4. Укажите НЕВЕРНЫЕ утверждения. При переме-
шивании раствора:
1) увеличивается тепловой эффект растворения;
2) увеличивается растворимость вещества;
3) увеличивается скорость растворения;
4) уменьшается энергия кристаллической решетки ра-
створяемого твердого вещества.
5. Наиболее устойчивая гетерогенная система — это:
1) пивная пена; 2) туман; 3) дым; 4) шоколад.
6. Наименее устойчивой гетерогенной системой яв-
ляется:
1) молоко; 2) шоколад;
3) мыльная пена; . 4) твердый бетон.
7. Растворение некоторого вещества в воде — про-
цесс эндотермический. Насыщенный раствор вещества
можно сделать ненасыщенным:
1) повышая температуру; 2) добавляя воду;
3) понижая температуру; 4) выпаривая часть воды.
8. Растворение некоторого вещества — процесс экзо-
термический. Насыщенный раствор вещества можно
сделать ненасыщенным:
1) понижая температуру; 2) выпаривая часть воды;
3) добавляя воду; 4) повышая температуру.
9. Если при растворении вещества теплота выделя-
ется, то растворимость вещества можно повысить:
1) повышением температуры;
--- 278 ---
2) понижением температуры;
3) перемешиванием;
4) дроблением.
10. Если при растворении вещества теплота погло-
щается, то его растворимость понижается при:
1) понижении температуры,
2) повышении температуры;
3) перемешивании;
4) использовании более крупных кусочков вещества.
ТЕСТ 9
1. Теплота всегда поглощается при растворении в воде
веществ:
1) газов; 2) твердых;
3) кристаллогидратов; 4) всех перечисленных
2. Осадок некоторого вещества и его раствор находятся
в равновесии. Справедливыми будут утверждения:
1) раствор является насыщенным;
2) при данной температуре дополнительная порция
вещества не растворится;
3) раствор может быть как концентрированным, так
и разбавленным;
4) раствор обязательно является насыщенным
3.0 химической стороне растворения свидетельствует:
1) изменение энергии;
2) диффузия частиц растворенного вещества;
3) изменение окраски раствора;
4) все перечисленные явления
4. Если при растворении соли в воде энергия выде-
ляется, (<2раст > 0), то между абсолютными значениями
энергий разрушения кристаллической решетки (£? ) и
--- 279 ---
энергией гидратации (2 ) справедливо соотношение:
1) |2 1 = 12 I; "ЛР 2)|<2 |>|2 I;
7 ’-^разр.1 |Х-' гидр.1’ 7 '^разр.1 |Х-тидр.”
3)|2 1<12 I; 4)Ю | = |2 1 + ю |.
5. Эндотермическая составляющая теплового эффек-
та твердого вещества растворения обусловлена:
1) разрушением кристаллической решетки;
2) гидратацией ионов;
3) диффузией гидратированных ионов;
4) всеми перечисленными явлениями.
6. При растворении в воде гидроксида натрия тепло-
та выделяется. Это свидетельствует о том, что:
1) растворение щелочи — экзотермический процесс;
2) абсолютная величина энергии кристаллической
решетки меньше абсолютной величины энергии гидра-
тации ионов;
3) абсолютная величина энергии кристаллической
решетки больше абсолютной величины энергии гидра-
тации ионов;
4) абсолютные значения указанных энергий равны.
7. Растворение вещества будет эндотермическим про-
цессом, если (см. задание № 4 данного теста):
1)12 1<12 I; 2)12 1 = 12 I;
7 ,х>гидрЭ ’^разр.” 7 •*-'ГИдр.1 >*^разр.”
3)12 1>12 I; 4)12 1 = 12 1 + 12 I-
7 ’^гидр.' |Х>разр.” 7 •*-'гндр.' |Х-'раст/ ’^разр.1
8. Плохую растворимость некоторых твердых веществ
в воде можно объяснить:
1) неполярностью связей в веществе;
2) большой энергией связи между ионами в кристал-
ле вещества;
3) малой энергией гидратации ионов вещества;
4) отсутствием движения молекул воды.
9. Даны растворы KBr, KNO3, СаС12 и Na,SO4 с оди-
наковой плотностью и массовой долей. Наибольшей бу-
--- 280 ---
дет молярная концентрация соли, формула которой:
1) КВг; 2) KNO3; 3) CaCl,; 4) Na,SO4.
10. Концентрированным и ненасыщенным может
быть раствор в воде:
1) хлороводорода; 2) фосфорной кислоты;
3) серной кислоты; 4) углекислого газа.
ТЕСТ 10
1. В воде объемом 1 дм3 растворили фтороводород
объемом 500 дм3 (н. у). Укажите массовую долю HF (%)
в полученном растворе:
1)31; 2) 32; 3)33; 4) 34.
2. В воде массой 300 г растворили глицин массой 10 г.
Укажите массовую долю (%) глицина в полученном ра-
створе:
1) 1,2; 2) 2,2; 3)3,2; 4) 4,2.
3. Медный купорос массой 10 г растворили в воде
массой 50 г. Укажите массовую долю (%) CuSO4 в полу-
ченном растворе:
1) 10,7; 2) 9,7; 3) 8,7; 4) 7,7.
4. В воде массой 50 г при некоторой температуре мак-
симально можно растворить 20 г вещества. Насыщен-
ным будет раствор, в котором массовая доля (%) веще-
ства равна:
1) 27,6; 2) 28,6; 3) 29,6; 4) 30,6.
5. Для приготовления водного раствора массой 150 г
с массовой долей NaOH 30% необходимо взять:
1) 105 г Н,0 и 45 г NaOH; 2) 45 г Н,0 и 105 г NaOH;
3) по 75 г Н?О и NaOH; 4) 30 г NaOH и 120 г Н2О.
6. Массовая доля соли в насыщенном растворе при
некоторой температуре равна 30%. Какая масса соли (г)
— 281
может максимально раствориться при этой температу-
ре в воде массой 150 г?
1)61,2; 2) 62,2; 3)63,2; 4) 64,2.
7. В воде массой 150 г растворили калий массой 19,5 г.
Укажите массовую долю (%) вещества в полученном
растворе:
1) 16,49; 2) 16,52; 3) 16,57; 4) 17,15.
8. Растворимость соли (на 100 г воды) при темпера-
турах 80°С и 10°С соответственно равна 50 г и 20 г. Най-
дите массу соли (г), которая выпадает в осадок при
охлаждении от 80°С до 10°С насыщенного при 80°С
раствора массой 800 г:
1) 120; 2) 140; 3) 160; 4) 180.
9. Энергия кристаллической решетки NaOH равна
884 кДж/моль, а энергии гидратации ионов Na+ и ОН
соответственно равны 410 кДж/моль и 511 кДж/моль.
На основании этих данных рассчитайте тепловой эф-
фект (кДж) растворения в воде гидроксида натрия хи-
мическим количеством 2 моль:
1) +37; 2) +74; 3)-37; 4)-74.
10. Растворение 1 моль безводной соли происходит с
выделением 100 кДж теплоты, а реакция гидратации с
образованием 1 моль кристаллогидрата соли — с выде-
лением 130 кДж теплоты. Найдите тепловой эффект (кДж)
реакции растворения двух молей кристаллогидрата соли:
1) -30; 2)-60; 3) 200; 4) 260.
ТЕСТ И
1. В какой массе воды (г) следует растворить оксид
калия массой 9,4 г, чтобы получить раствор с массовой
долей КОН 10%?
1) 9,4; 2) 196,6; 3) 102, 6; 4) 100,8.
--- 282 ---
2. Какую массу воды (г) нужно добавить к раствору
КС1 массой 200 г с массовой долей соли 20%, чтобы
получить раствор с массовой долей соли 10%?
1)50; 2) 100; 3)150; 4)200.
3. Какую массу воды (г) следует испарить из раствора
NaOH массой 50 г с массовой долей щелочи 10%, чтобы
увеличить массовую долю щелочи в 2 раза?
1) 10; 2) 20; 3)25; 4) 50.
4. В какой массе воды (г) следует растворить калий,
чтобы получить раствор массой 300 г с массовой долей
гидроксида калия 5,6%?
1) 283,2; 2) 5,4; 3) 305,4; 4) 288,6.
5. Какая масса (г) Н3РО4 содержится в ее растворе
объемом 200 см3, если молярная концентрация кислоты
равна 3 моль/дм3?
1)48,8; 2)58,8; 3)68,8; 4) 78,8.
6. Определите молярную концентрацию (моль/дм3)
NaCl в его растворе с массовой долей соли 24% (плот-
ность 1,18 г/см3):
1)2,84; 2) 3,84; 3)4,84; 4) 5,84.
7. Какую массу (г) медного купороса нужно взять для
приготовления 2 дм3 раствора с молярной концентра-
цией CuSO4, равной 0,1 моль/дм3?
1)50; 2) 25; 3) 75; 4) 100.
8. При растворении в воде 1 моль кристаллического
КОН выделяется 60 кДж теплоты. Энергия кристалли-
ческой решетки КОН равна 790 кДж/моль, а энергия гид-
ратации ионов К+ составляет 339 кДж/моль. Найдите
энергию гидратации (кДж/моль) гидроксид-ионов:
1)511; 2) 730; 3) 1129; 4) 399.
9. При растворении в воде 1 моль KNO3 выделяется
35 кДж теплоты. Энергии гидратации ионов К+ и NO3
равны соответственно 339 кДж/моль и 310 кДж/моль.
--- 283 ---
Рассчитайте энергию (кДж/моль) кристаллической ре-
шетки соли:
1)345; 2)374; 3)614; 4) 649.
10. Теплота растворения некоторой безводной соли
равна 100 кДж/моль, а теплота растворения ее кристал-
логидрата составляет -40 кДж/моль. Рассчитайте теп-
лоту гидратации (кДж/моль) соли с образованием этого
же кристаллогидрата:
1) + 40; 2) + 60; 3)'+ 140; 4) - 60.
ТЕМА 21
Электролитическая диссоциация
ТЕСТ1
1. Укажите формулы электролитов:
1) С12Н22ОП; 2) КОН; 3) H2SO4; 4) 12.
2. Формулы только простых ионов указаны в ряду:
1) К+, Cl", СО2-; 2) S2-, Са2+, F ;
3) Na+, NH+ Br; 4) Ва2+, I", NO"
3. Укажите формулы сложных анионов:
1) NH+; 2) SO2; 3) NO3; 4) S2~.
4. Отметьте формулы сложных катионов:
1) РО4; 2) NH4; 3) Н3О+; 4) Fe3+.
5. Формулы только слабых электролитов указаны в ряду:
1) НС1, НВг, HF; ' 2) Н,О, HNO„ H.S;
3) NaOH, КОН, Си(ОН)7; 4) Н,СО3, H7SO3~ HNO3.
6. Укажите ряд, в котором приведены формулы толь-
ко сильных электролитов:
1) С|2Н22Он КОН, H2SO4; 2) HNO3, K7SO4, NaOH;
--- 284 --
3) КС1, NH4CI, NH3 H,0, 4) AgNOv HI, H,PO4.
7. Неэлектролитами являются все вещества, формулы
которых приведены в ряду:
1) СГН„О1Р С2Н5ОН, I,; 2) НО, NH, Н,О, HNO,;
3) KNOp K,SO4, КОН; 4) CuSO4, Си, CuCl,.
8. При включении постоянного электрического тока к
катоду будут перемещаться ионы, формулы которых:
l)Na+;2)NH4+;3)SO;;4)S2-.
9. При включении постоянного электрического тока к
аноду будут перемещаться ионы, формулы которых:
1) SO2-; 2) NH;, 3) РОф; 4) АР+
10. Электрический ток проводят
1) кристаллический нитрат натрия,
2) водный раствор нитрата натрия;
3) расплав хлорида калия;
4) раствор глюкозы в тщательно очищенной воде.
ТЕСТ 2
1. Образованием гидратированных ионов в раство-
ре, первоначально их (ионов) не содержащих, сопровож-
дается растворение в воде:
1) сахара; 2) гидроксида натрия;
3) хлороводорода, 4) азотной кислоты.
2. Вода НЕ принимает участия в образовании сво-
бодных ионов при растворении в ней веществ, форму-
лы которых:
1) КОН; 2) НВг; 3) H,SO4, 4) Na,SO4.
3. Укажите уравнение электролитической диссоциа-
ции:
1)H,SO3^H2O + SO,;
2) 2Н,0 = 2Н, + О,,
--- 285 ----
3) NH3 + H+ = NH4+;
4) nh3 н2о nh; + он.
4. Отметьте формулу вещества, в водном растворе ко-
торого содержатся гидратированные ионы Fe3+ и NO~:
1) Fe(NO3)2; 2) Fe(NO2)3; 3) Fe(NO3)3; 4) Fe(NO2)2.
5. В водных растворах распадаются на ионы (диссо-
циируют) вещества, формулы которых:
1) С6Н6; 2) С12; 3) НС1; 4) СН3СООН.
6. Содержат как в индивидуальном состоянии, так и
в водном растворе одинаковые ионы (без учета гидра-
тации) вещества, формулы которых:
1) NaCl; 2) КОН; 3) K2SO4; 4) НС1.
7. Для веществ электролитов характерны типы хими-
ческих связей:
1) металлическая;
2) ионная;
3) ковалентная неполярная;
4) ковалентная сильнополярная.
8. В водных растворах вещества диссоциируют бла-
годаря:
1) действию постоянного электрического тока;
2) полярности молекул воды;
3) гидратации частиц растворенного вещества водой;
4) движению катионов к катоду, а анионов к аноду.
9. Общие химические свойства водных растворов
кислот объясняются наличием:
1) анионов ОН ;
2) катионов Н+ (Н3О+);
3) катионов Н+ и анионов кислотных осадков;
4) катионов Н+ и анионов ОН .
10. Общие химические свойства водных растворов
щелочей объясняются наличием:
I) катионов Н+ (Н3О+);
--- 286 ---
2) анионов ОН ;
3) катионов металла и анионов ОН ;
4) катионов металла и катионов Н1 (Н3О+).
ТЕСТЗ
1. В водном растворе практически необратимо дис-
социируют все вещества, формулы которых указаны в
ряду:
1) NaOH, Na,SO4, Н7СО3;
2) KNO3, LiOH, H2SO3;
3) HNO3, HC1, KOH;
4) nh4ci, nh4no3, hno2.
2. В водном растворе обратимо диссоциируют все
вещества, формулы которых приведены в ряду:
1) NH3 - Н70, Н7СО3, HNO7;
2) H2SO3, HF, HI;
3) H'S, H2Se, K,S;
4) CH3COOH, H2SO3, K^.
3. Ступенчато в водном растворе диссоциируют:
1) азотная кислота; 2) сернистая кислота;
3) гидрат аммиака; 4) гидроксид алюминия.
4. НЕВЕРНО составлено уравнение электролитичес-
кой диссоциации (без учета гидратации ионов):
1) K,SO4 = 2К+ + SO4;
2) NH3 Н7О = NH4 + ОН ;
3) СН3СООН СН3СОО + Н+;
4) Ca(NO3)2 = Са2+ + 2NO"
5. При одинаковой молярной концентрации солей
наибольшее химическое количество ионов содержится
в водном растворе вещества, формула которого:
1) FeSO4; 2) A12(SO4)3; 3) СаС12; 4) Na3PO4.
--- 287 ---
6. В три стадии протекает электролитическая диссо-
циация:
1) сернистой кислоты; 2) фосфорной кислоты;
3) хлорида бария; 4) фосфата калия.
7. При одинаковой молярной концентрации электри-
ческий ток лучше всего проводит водный раствор:
1) гидроксида лития; 2) гидрата аммиака;
3) гидроксида калия; 4) гидроксида бария.
8. Хлорид-ионы образуются при диссоциации ве-
ществ, формулы которых:
1) NH4C1; 2) КС1О4; 3) NaCI; 4) (СаОН)С1.
9. Сколько молекул электролита продиссоциируют из
каждых 200 внесенных в раствор, если степень диссо-
циации равна 20%?
1)40; 2) 60; 3) 80; 4) 100.
10. Из каждых 300 внесенных в раствор молекул элек-
тролита на ионы распадается только 15. Укажите сте-
пень диссоциации (%) электролита:
1)2; 2)3; 3)5; 4) 15.
ТЕСТ 4
1. Укажите НЕВЕРНЫЕ утверждения:
1) распад хлорида натрия в воде на свободно движу-
щиеся ионы обусловлен действием электрического тока;
2) чем лучше вещество растворимо в воде, тем выше
для него степень электролитической диссоциации;
3) степень диссоциации нитрата натрия в этаноле
выше, чем в воде;
4) между растворимостью вещества и его способнос-
тью к электролитической диссоциации прямая зависи-
мость отсутствует.
--- 288 —
2. В растворе ортофосфорной кислоты соответствен-
но наибольшей и наименьшей будет молярная концент-
рация ионов:
1)Н+иРО4~; 2)Н+иНРО;-;
3)Н+иН2РО4; 4) Н2РО4 и РО2’.
3. В растворе с pH = 2 будут растворяться:
1) Fe и SiO2; 2) ZnO и AgCl;
3) NaHCO3 и BaSO4; 4) CuO и А1(0Н)3
4. Отметьте формулу аниона, молярная концентрация
которого в растворе Н3РО4 будет наибольшей:
1) РО-; 2) НРО42-; 3) H,PCr 4) РО] .
5. При равных молярных концентрациях веществ элек-
трический ток лучше всего проводит раствор:
1) сахарозы; 2) хлорида калия,
3) сульфата алюминия; 4) нитрата натрия.
6. В растворе некоторого вещества химическое коли-
чество анионов в 1,5 раза больше химического количе-
ства катионов Укажите формулу вещества:
I) Na2CO3; 2) Ва(ОН)2; 3) A1,(SO4)3,4) А1С1,.
7. В растворе некоторого вещества число катионов в три
раза больше числа анионов. Укажите формулу вещества:
1) А1(ОН)3; 2) Na3PO4; 3) К^СО,; 4) Fe2(SO4)3.
8. Раствор некоторой соли содержит 1 моль катионов
металла и ионы CF массой 106,5 г. Укажите формулу соли:
1) СаС12; 2) КС1; 3) А1С13; 4) NaCI
9. В разбавленном растворе H2SO4 наибольшая мо-
лярная концентрация частиц:
1) H2SO4; 2) HSO4; 3) Н+; 4) SO2-.
10. В насыщенном водном растворе сероводорода со-
ответственно больше и меньше всего содержится частиц:
I) Н+ и S2; 2) H2S и HS ; 3) HS и S2; 4) H2S и S2~
10 Зак 1530
--- 289 ---
ТЕСТ 5
1. Несмотря на наличие в водных растворах электро-
литов заряженных частиц, раствор в целом электроней-
трален. Это объясняется тем, что:
1) ионы в растворах гидратированы;
2) число анионов всегда равно числу катионов;
3) ионы в растворе движутся хаотически;
4) суммарные электрические заряды катионов и ани-
онов численно равны.
2. Водные растворы электролитов проводят электри-
ческий ток за счет:
1) только электронов; 2) катионов и электронов;
3) анионов и электронов; 4) катионов и анионов.
3. Какую роль играет вода при растворении хлорида
калия?
1) превращает электронейтральные атомы калия в ка-
тионы калия;
2) превращает электронейтральные атомы хлора в
анионы хлора;
3) высвобождает ионы калия и хлора из кристалли-
ческой решетки;
4) гидратирует ионы калия и хлора.
4. Атом хлора и анион хлора между собой различаются:
1) размерами; 2) химическими свойствами;
3) числом электронов; 4) зарядом ядра.
5. pH раствора возрастает, когда в воде растворяют:
1) глицин; 2) CH3NH,;
3) жидкое мыло; 4) А14Су
6. Электролитическая диссоциация угольной кисло-
ты обратима, так как эта кислота:
1) слабая; 2) неустойчивая;
3) сильная; 4) нерастворима в воде.
— 290 —
7. Окраска лакмуса изменяется в:
1) воде; 2) водном растворе NaCl;
3 ) водном растворе НО; 4) водном растворе КОН.
8. pH раствора уменьшается, когда в воде по отдель-
ности растворяют:
1)HC1hNH3; 2) SO, и К,О;
3) NH4C1 и Na,PO4, 4) NaHSO4 и P2OS.
9. В разбавленном водном растворе азотной кислоты
присутствуют частицы:
1) Н2О; 2) Н+; 3) HNO,; 4) NO,.
10. В разбавленном водном растворе сульфата желе-
за (III) отсутствуют частицы:
1) электронейтральные атомы железа;
2) гидратированные ионы Fe3+;
3) формульные единицы Fe2(SO4),;
4) негидратированные ионы SO4
ТЕСТ 6
1. При растворении в воде свободно движущиеся гид-
ратированные ионы образуются для всех веществ в
группе:
1) сахар, иод, серная кислота;
2) этанол, уксусная кислота, гидроксид калия,
3) нитрат калия, карбонат натрия, хлорид бария,
4) сульфат меди (II), этаналь, оксид углерода (IV).
2. Концентрация гидроксид-ионов наименьшая в ра-
створе, pH которого равен:
1)5,2) 2; 3) 7; 4) 13.
3. Анион HS- образуется при электролической диссо-
циации вещества, формула которого:
1) CuS; 2) H2SO3; 3) Na2S; 4) H2S
— 291 —
4. Метилоранж изменит окраску на желтую в водном
растворе:
1) хлороводорода; 2) хлорида натрия;
3) нитрата натрия; 4) гидроксида натрия.
5. Лакмус — фиолетовый, фенолфталеин — бесцвет-
ный, метилоранж — оранжевый в:
1) NaOH (р-р); 2) HNO3 (р-р); 3) КС1 (р-р); 4) Н,О.
6. Вещества, растворы которых окрашивают фенол-
фталеин в малиновый цвет, относятся к:
1) кислотам; 2) щелочам;
3) кислотным оксидам; 4) амфотерным гидроксидам.
7. При равных молярных концентрациях электричес-
кий ток лучше всего проводит водный раствор:
1)этанола; 2)сахарозы;
3) уксусной кислоты; 4) этаналя.
8. В водном растворе аммиака лакмус приобретает цвет:
1) зеленый; 2) синий;
3) красный; 4) желтый.
9. Фенолфталеин — бесцветный, а метилоранж —
красный в водном растворе:
1) NaNO3; 2) H2SO4; 3) K2SO4; 4) NaOH.
10. Раствор хлорида калия бесцветен, а раствор пер-
манганата калия КМпО4 окрашен в фиолетовый цвет.
Какой частицей вызвана окраска раствора КМпО4?
1) Н3О+; 2) К+; 3) МпО4; 4) Н,О.
ТЕСТ 7
1. Растворы некоторых солей натрия имеют окраску.
Она обусловлена:
1) катионами Н3О+; 2) водой;
3) анионами соли; 4) ионами Na+.
--- 292 ---
2. Наибольшее число ионов С1” находится в водном
растворе:
1) НС1О4; 2) NH4C1; 3) КС1О3; 4) С,Н5С1.
3. В сероводородной воде содержится набор частиц
растворенного вещества (выберите наиболее полный
ответ):
l)H,S, S--, Н+; 2)H,S, HS , Н+;
3) Н;, HS-, S2-; 4) H,S, HS , Н\ S2 .
4. НЕ реагируют с водой и НЕ диссоциируют в ней
все газы ряда:
1) Н„ HBr, N„ Ne; 2) НС1, О„ СО,, СО;
3) О', N„ СО, HF; 4) N,, Ar, Н,, СО.
5. Щелочная среда образуется при растворении в
воде газа:
1)N,; 2) SO,; 3) НС1; 4)NH3.
6. Наибольшее химическое количество ионов РО4
образуется при диссоциации 0,2 моль:'
1) NaH,PO4; 2) Na2HPO4; 3) НОД; 4) Na3PO4.
7. Наименьшее химическое количество ионов РО4
образуется при диссоциации 0,1 моль:
1) КН2РО4; 2) К,НРО4; 3) К3РО4; 4) Н3РО4.
8. Укажите формулу электролита с ковалентной по-
лярной связью (другие виды связей отсутствуют):
1) NaOH; 2) НС1; 3) СО; 4) ОДОН.
9. Укажите формулу электролита ионного строения:
1) ОДВг; 2) КОД; 3) HF; 4) H,SO4.
10. При диссоциации А1С13 в водном растворе НЕ
образуются ионы (без учета гидратации):
1) AlClj; 2) CF; 3) АР'; 4) А1С12".
— 293 —
ТЕСТ 8
1. Ступенчато в водном растворе диссоциируют:
1) Na3PO4; 2) NaH2PO4; 3) А1(ОН)3; 4) A12(SO4)3.
2. Водный раствор вещества хорошо проводит элект-
рический ток и не изменяет окраску индикатора. Ука-
жите формулу вещества:
1) С,Н.ОН; 2) K2SO4; 3) H,SO4; 4) КОН.
3. В водном растворе углекислого газа присутствуют
частицы, формулы которых наиболее полно приведены
в ряду:
1) СО,, Н2СО3, НСО3;
2) СО', Н2СО3, Н+;
3) СО', ^СОз, НСО- Н+;
4) СО2, Н2СО3, Н+, НСОГ СО32“.
4. Число катионов в три раза больше числа анионов в
водном растворе;
1) Н3РО4; 2) К3РО4; 3) КН2РО4; 4) Na2SO4.
5. В водном растворе К,НРО4 наибольшей будет кон-
центрация ионов:
1) К+; 2) Н2РО4~; 3) НРО2-; 4) РО3.
6. В водном растворе КН2РО4 наименьшей будет кон-
центрация ионов:
1) Н,РО4; 2) К+; 3) НРО2-; 4) РО43-.
7. Одинаковое число ионов на первой стадии элект-
ролитической диссоциации образуется в случае (моляр-
ные концентрации веществ одинаковы):
1) NaHCO3 и H2S; 2) NH4HCO3 и К,НРО4;
3) К,НРО4 и Ba(HS),; 4) H,SO3 и NaH,PO4.
8. Одинаковое число ионов образуется при диссоци-
ации (молярные концентрации веществ одинаковы):
1) NaCl и KNO3; 2) Na,SO4 и СаС12;
3) Са(НСО3)2 и NaHCO3; 4) H2SO4 (разб.) и HNO3.
— 294 —
9. В водном растворе NaH2PO4 из числа указанных
наименьшей будет концентрация ионов:
1) Н+; 2) Na+; 3) Н2РО4; 4) HPOf.
10. В водном растворе Na,HPO4 из числа указанных
наименьшей будет концентрация частиц:
l)Na"; 2) НРО2 ;
3) РО4_; 4) Н,О.
ТЕСТ 9
1. В водном растворе SO, присутствуют частицы;
формулы которых наиболее полно указаны в ряду:
1) SO,, H,SO„ Н+, HSO;;
2) SO', H,SO3, Н+, SO2’;
3) SO;, h;SO3, H+, HSO-, SO2-;
4) so;, h;so3, H+, HSO- SO32-.
2. Ионы водорода образуются при диссоциации ве-
ществ, формулы которых:
1) NaOH; 2) 112SO,;
3) Na,SO4; 4) NaHCO3.
3. Водные растворы каких веществ имеют pH > 7?
1) NaCl; 2) NaOH; 3) НС1; 4) CH,N11,
4. Водные растворы каких веществ имеют pH < 7?
1) хлороводород; 2) аммиак;
3) сернистый газ; 4) азот.
5. В разбавленный водный раствор Ва(ОН), по кап-
лям добавляют избыток серной кислоты. При этом элек-
трическая проводимость раствора:
1) сначала возрастает, затем уменьшается;
2) постоянно уменьшается;
3) постоянно возрастает;
4) сначала уменьшается, затем возрастает.
--- 295 ----
6. В качестве катионов только катионы металлов об-
разуются при диссоциации:
l)Cu(OH),, 2) NaHCO3;
3) Cu(NO()2, 4) СН3СООК
7. В качестве катионов только ионы Н+ при диссоци-
ации образуют:
1) KHSO3; 2) НС1; 3) H2SO4; 4) Ca(HS)2.
8. В водном растворе NaHCO3 наименьшей будет кон-
центрация частиц:
1) Na+; 2) НСО;; 3) Н,О; 4) СО3.
9. В разбавленном водном растворе КНСО3 пример-
но одинаковой будет концентрация частиц (гидролиз и
диссоциацию воды не учитывайте):
1)К'иНССГ 2)НСО;иН+;
3) Н+ и СО2’; 4)К+и СО2-.
10. В качестве анионов только гидроксид-ионы обра-
зуются при диссоциации:
1) воды;
2)гидроксида калия;
3)хлорида гидроксомагния;
4)гидрокарбоната калия.
ТЕСТЮ
1. Ионы водорода образуются при электролитичес-
кой диссоциации веществ, формулы которых:
1) К2СО3; 2) КНСО3; 3) Н2О; 4) НС1.
2. Укажите уравнение реакции, в которой фосфорная
кислота ведет себя как двухосновная:
1) Н3РО4 + 3 КОН = К3РО4 + ЗН2О;
2) 2Н(РО4 + Ва(ОН)2 = Ва(Н2РОД + 2Н,О;
3) Н3РО4 + 2КОН = К,НРО4 + 2НО,
4) Н3РО4 Н++Н2РО4-.
--- 296 --
3. Укажите ряд, в котором при диссоциации 1 моль веще-
ства число ионов в растворе последовательно возрастает:
l)KNO3,Fe,(SO4)3,A!Cl3;
2) NH4C1, К,СО3, HNO3;
3) КС1, СаС1„ A1,(SO4)3;
4) A1(NO3)3, A1,(SO4)3, FeCl3.
4. Одинаковое число ионов образуется при полной
диссоциации:
1) 1 моль СаС12 и 1,5 моль HNO3;
2) 1 моль A12(SO4)3 и 2 моль K,SO4;
3) 0,05 моль Na,SO4 и 0,05 моль Ba(NO3)2;
4) 0,1 моль А1С13 и 0,2 моль NH4C1.
5. Учитывая взаимодействие ионов электролита с
водой, укажите, какие частицы присутствуют в водном
растворе K2S:
1) K2S; 2) КОН; 3) HS ; 4) S2\
6. Учитывая взаимодействие ионов электролита с во-
дой, укажите, какие частицы присутствуют в водном ра-
створе Cu(NO,),:
1) HNO3; 2) CuOH+; 3) Cu(NO3)2; 4) Cu2+.
7. pH наименьшее в водном растворе:
1) Na3PO4; 2) Na,HPO4; 3) NaH2PO4; 4) NH3.
8. Учитывая возможность взаимодействия ионов
электролита с водой, укажите, какие частицы отсутству-
ют в водном растворе Na,S:
1) Na+; 2) NaOH; 3) HS; 4) S2“.
9. В концентрированном растворе H,SO4 наибольшей
будет концентрация частиц:
1) Н+; 2) HSO4; 3) H,SO4; 4) SO].
10. С образованием катионов двух типов в водном
растворе диссоциируют:
1) KNaSO • 2) КНСО3; 3) K,SO4; 4) Н SOd.
z 4 ' 5 ' 2. 4 ' Z 4
--- 297 ---
ТЕСТ 11
1. После растворения в воде по 0,5 моль трех солей
раствор содержит 0,5 моль ионов Mg1', 1,5 моль ионов
К+, 1,5 моль ионов О и 0,5 моль ионов SO2 . Этим дан-
ным удовлетворяет ряд солей:
1) MgSO4, K,SO4, КС1;
2) MgCl,, MgSO4, K,SO4;
3) MgCl „ KC1, K,SO4;
4)MgCl2,MgSO4*KCl.
2. В водном растворе Ca(NO3), одинакова концентра-
ция ионов:
l)Ca2+nNO3; 2) NO” и Н+;
3)НиОН; 4) Са^иОН”.
3. Концентрация ионов водорода наибольшая в раз-
бавленном водном растворе (химические количества ра-
створенных веществ одинаковы):
1) NaHCO3; 2) Са(НСО3)2; 3) НС1; 4) H,SO4.
4. Как одноосновные в водном растворе могут про-
являть себя кислоты:
а) серная; б) соляная; в) фосфорная; г) азотная.
1) а, б, в, г; 2) только а, г; 3) только б, в, г; 4) только б, г.
5. Как двухосновные в водном растворе могут прояв-
лять себя кислоты:
1) фосфорная; 2) азотная; 3) сернистая; 4) серная.
6. Смешали растворы, содержащие по 1 моль BaCl, и
H,SO4. После завершения реакции в водном растворе
преимущественно будет находиться пара ионов:
1)Ва^и8О42”; 2)Ва2+иС1;
3)Н+иСГ; 4) SO42 ” и Cl”.
7. В водном растворе КОН одинаковая концентрация
частиц:
1) К+ и Н+; 2) К+, Н" и ОН; 3) Н* и ОН”; 4) ОН” и К+.
--- 298 --
8. Укажите ряд, в котором формулы ионов в водном
растворе NaH,PO4 записаны в порядке увеличения их
молярной концентрации:
1) РО’, Н+, НРО;, Н,РО4, Na+;
2) РО-’ , НРО’, Н+, П РО,, Na';
3) РО4, Н,РО4,1 Г,НРО', Na+;
4) РО;, FT, Н,РО4, НРО;, Na\
9. Вещество, при диссоциации которого образуются
катионы К' и Н', а также анионы SO;, является:
1) кислотой; 2) щелочью;
3) кислой солью; 4) средней солью.
10. Ступенчато в водном растворе диссоциируют:
1) А1(ОН)3; 2) КН2РО4; 3) К3РО4; 4) А1С13.
ТЕСТ 12
1. Как по типу кислоты, так и по типу основания дис-
социируют:
1) НС1; 2) А1(ОН)3; 3) Zn(OH)2; 4) Ва(ОН)2.
2. В качестве анионов только гидроксид-ионы обра-
зуются при диссоциации:
1) КОН; 2) А1(ОН)3; 3) КНСО3; 4) K,SO4.
3. В качестве катионов только ионы водорода образу-
ются при диссоциации:
1) амфотерных гидроксидов; 2) кислых солей;
3) щелочей; 4) кислот.
4. В три стадии протекает диссоциация электролитов:
1) А1С13; 2) КН2РО4; 3) Fe(OH)3; 4) Н3РО4.
5. В две стадии протекает диссоциация электролитов:
1) СаС1,; 2) NaHCO3; 3) H,S; 4) Na,HPO4.
6. Влажная лакмусовая бумажка покраснеет в пробир-
ках, содержащих газы:
1)NH3; 2) НС1; 3) SO,; 4) СО.
--- 299 ---
7. Влажная лакмусовая бумажка посинеет в пробир-
ках, содержащих:
1) метиламин; 2) аммиак; 3) азот; 4) оксид серы (IV).
8. При диссоциации в качестве ионов образуются как
ионы водорода, так и гидроксид-ионы в случае:
1) кислот; 4 2) амфотерных гидроксидов;
3) оснований; 4) кислых солей.
9. Когда оценивают силу электролита, то во внима-
ние принимают его:
1) окислительные свойства;
2) термическую устойчивость;
3) степень электролитической диссоциации;
4) способность растворять металлы.
10. Укажите связь, которая будет подвергаться иони-
зации в водном растворе кислоты, графическая формула
которой Н — О \ р :
1) Н — Р; 2) О — Р; 3) Н — О; 4) Р = О.
ТЕСТ 13
1. Три (и не больше) различных по составу иона обра-
зуются при диссоциации:
1)КОН; 2)A17(SO4)3;
3) Н,РО4; 4) КНСО3.
2. Только два различных по составу аниона образуют-
ся при диссоциации:
1) NaHSO,; 2) Na7HPO4; 3) Н3РО4; 4) КН,РО4.
3. Ступенчато в водном растворе диссоциируют:
1)NH3 H2O; 2) NaKSO4;
3)H2S; ‘ 4) КН2РО4.
— зоо —
4. pH раствора серной кислоты равен 4. Считая дис-
социацию полной по обеим стадиям, укажите массу кис-
лоты (г) в растворе объемом 10 дм3:
1) 0,49, 2) 0,098; 3) 0,049; 4) 0,98.
5. В водном растворе Са(НСО2), наибольшей будет
концентрация ионов:
1) Са2+; 2) НСО-; 3.) Н+; 4) СО;
6. В качестве анионов только гидроксид-ионы обра-
зуются при диссоциации
1)NH4H,PO4; 2)Ва(НСО,),;
3)(MgOH)Cl; 4) Н,0
7. В растворе A1,(SO4)3 содержится 0,3 моль ионов
SO| Химическое количество (моль) ионов А131 в этом
же растворе составляет:
1)0,2; 2) 0,3; 3)0,1; 4) 0,5.
8. При растворении в воде HNO, химическим коли-
чеством 1,0 моль общее химическое количество ионов
Н' и NO2 составляет 0,3 моль. Степень диссоциации кис-
лоты равна:
1)0,05; 2) 0,10; 3)0,15; 4) 0,30.
9. Определите, какое химическое количество (моль)
соли Fe2(SO4)3 было растворено, если общее химичес-
кое количество ионов Fe3+ и SO2 в растворе составляет
0,10 моль (ос= 1):
1)0,01; 2) 0,02; 3) 0,03,4) 0,04.
10. Масса (г) ионов О в растворе при полной дис-
социации ВаС12 химическим количеством 0,200 моль
равна:
1)3,55; 2) 7,10; 3) 14,2, 4)71,0.
— 301 —
ТЕСТ 14
1. Все ионы, которые образуются при диссоциации
гидрокарбоната кальция, приведены в ряду:
1) Са2+, НСО3; 2) Са2+,Н+, НСО3;
3) Са2т,Н+, НСО3, СО24) Са2+,Н+, СО2.
2. Укажите схему (или уравнение) реакции нейтрали-
зации:
1) SO, + КОН = KHSO3;
2) CuCl, + AgNO3 -> Cu(NO3), + AgCll;
3) Mg(OH), + HNO3 -» Mg(NO3), + H,O;
4) KHSO4 = K~ + H; + SO2’.
3. Одинаковое число ионов образуется при диссоци-
ации солей, формулы которых (химическое количество
солей одинаковое):
1) KNO3 и Ва(НСО3)2; 2) СаС1, и Fe,(SO4)3;
3) A1,(SO4)3 и К3РО4; 4) Na3PO4 и A1(NO3)3.
4. В очень разбавленном водном растворе NaI[SO4
примерно одинаковой будет молярная концентрация
ионов (диссоциацией воды пренебрегаем):
1) Na+ и HSO4; 2) HSO4 и SO2-;
3) ОН и SO42; 4) Н+, Na+ и SO2-.
5. Раствор с молярной концентрацией соли Na3PO4,
равной 0,1 моль/дм3, содержит столько же ионов, сколь-
ко их содержит раствор (с — молярная концентрация):
1) ВаС1,; с = 0,3 моль/ дм3;
2) KNO3; с = 0,2 моль/ дм3;
3) Na,SO4; с = 0,05 моль/ дм3;
4) СгС13; с = 0,1 моль/ дм3.
6. В 500 см3 Н,0 растворили 1,12 дм3 (н. у.) HCI. Пре-
небрегая изменением объема, укажите pH полученного
раствора (диссоциация полная):
1) 1; 2) 2; 3) 7; 4) 13.
— 302 —
7. Степень диссоциации HNO., максимальна в случае
системы (концентрация кислоты постоянна):
1)HNO,+ Н,О;
2) HNO>H'O + HC1;
3) HNO~ + Н,0 + KNO,;
4) HNO' + Н'О + H,SO4 (разб.).
8. Хлорид-ионы НЕ образуются при диссоциации:
1) СН,С1 — СООН; 2) [(C,H.),NH,]C1;
3)КС1О; 4)FeCl3.
9. Учитывая взаимодействие ионов электролита с
водой (гидролиз), укажите, в водных растворах каких
солей рН> 7:
1) Na,SO4; 2) Na,S; 3) К,СО3; 4) CuCl,.
10. С учетом взаимодействия ионов электролита с
водой (гидролиз) укажите, в водных растворах каких
солей pH < 7:
1) NH4C1; 2) A1,(SO4)3; 3) KNO3; 4) Na3PO4.
ТЕСТ 15
1. Лакмус НЕ изменяет окраску в водном растворе
соли (учтите взаимодействие ионов соли с водой):
1) Na2S; 2) CuSO4; 3) KNO,; 4) NH4NO3.
2. Электрическая лампочка для определения электри-
ческой проводимости загорится, если электроды помес-
тить в:
1) жидкий бромоводород; 2) твердый K,SO4;
3) расплав NaCI; 4) жидкий азот.
3. Ионы гидроксония образуются при растворении в
воде:
1)КНСО3; 2) СН3СООН;
3) Na,SO4; 4) НС1.
--- 303 —
4. В растворе с pH = 13 будут растворяться:
1) А1,О3 иВе(ОН),; 2)ZnnCuO;
3) А1(0Н)3 и СаСО3; 4) Сг(ОН)3 и Си.
5. Степень диссоциации уксусной кислоты увеличит-
ся, если:
а) нагреть раствор;
б) разбавить раствор водой;
в) добавить в раствор ацетат натрия;
г) добавить в раствор немного щелочи;
д) добавить в раствор НС1.
1) а, б, д; 2) а, б, в; 3) а, б, г; 4) б, в, д.
6. В разбавленном растворе K,[Zn(OH)4] наименьшей
будет концентрация частиц:
1) К+; 2) Zn2+; 3) ОН; 4) Н?О.
7. С учетом взаимодействия ионов электролита с во-
дой укажите, в растворе какой соли концентрация ионов
гидроксония будет наибольшей:
1) Na2SO4; 2) Na2CO3; 1) NH4C1; 1) Na3PO4.
8. С учетом взаимодействия ионов электролита с во-
дой укажите, в растворе какой соли концентрация ионов
Н+ будет наименьшей:
1) K,S; 2) K2SO4; 3) CuCl7; 4) KNO3.
9. Концентрация гидроксид-ионов будет максималь-
на в водном растворе соли (учтите взаимодействие
ионов электролита с водой):
1) NaCl; 2) Na2CO3; 3) A12(SO4)3; 4) NaNO3.
10. Концентрация ионов гидроксония будет минималь-
ной в водном растворе соли (учтите взаимодействие
ионов электролита с водой):
1) К3РО4; 2) K2SO4; 3) КС1; 4) NH4NO3.
--- 304 ---
ТЕСТ 16
1. В водном растворе установилось равновесие
HNO, Н+ + NO;. При добавлении к этому раствору
нитрита калия:
1) концентрация ионов Н* возрастет;
2) равновесие сместится влево;
3) концентрация ионов Н" уменьшится;
4) равновесие сместится вправо.
2. В результате диссоциации гидроксида железа (III) по
второй стадии образуется катион, заряд которого равен:
1)+1; 2) +2; 3)+3; 4)+4.
3. В раствор Ва(ОН), добавляют избыток SO3. Ука-
жите, как при этом будет изменяться электрическая про-
водимость раствора Л, от массы добавленного оксида:
4. В растворе содержатся ионы К , Na+ и С1“. Хими-
ческое количество ионов К+ равно 0,2 моль, а ионов
С1~ — 0,4 моль. Укажите химическое количество (моль)
ионов Na+ в этом растворе:
1)0,1; 2) 0,2; 3) 0,3; 4) 0,4.
5. В раствор Ва(ОН), с молярной концентрацией ще-
лочи 0,01 моль/дм3 пропустили СО, объемом (н. у.)
— 305 —
0,224 дм3. Укажите график изменения электрической
проводимости Л, раствора от объема добавленного газа:
6. К раствору азотной кислоты постепенно добавля-
ют избыток раствора гидроксида калия. Укажите воз-
можный интервал последовательного изменения pH от
объема добавленной щелочи:
1)7—13; 2) 2—7; 3)2—13; 4) 13—7.
7. К раствору КОН постепенно добавляют избыток
раствора НС1. Укажите возможный интервал последо-
вательного изменения pH от объема добавленного ра-
створа НС1:
1) 13—7; 2) 13—2; 3) 7—13; 4) 2—13.
8. Как будет изменяться интенсивность свечения лам-
почки для определения электрической проводимости
при добавлении к раствору Са(ОН), избытка углекисло-
го газа?
1) сначала усиливаться, затем ослабевать;
2) постепенно усиливаться;
3) сначала ослабевать, затем усиливаться;
4) постепенно ослабевать.
9. При добавлении избытка азотной кислоты к раство-
ру щелочи pH раствора:
1) не изменяется;
— 306 —
2) постепенно увеличивается;
3) постепенно уменьшается;
4) сначала уменьшается, затем растет.
10. При добавлении избытка NaOH к раствору H,SO4
pH раствора:
1) постепенно увеличивается;
2) постепенно уменьшается;
3) сначала увеличивается, затем уменьшается;
4) сначала уменьшается, затем увеличивается.
ТЕСТ 17
1. При полной диссоциации 0,05 моль гидроксида
бария химическое количество (моль) гидроксид-ионов
(составляет:
1)0,05; 2) 0,10; 3)0,15; 4) 0,20.
2. В растворе сульфата натрия молярная концентра-
ция сульфат-ионов равна 0,10 моль/дм3. Укажите моляр-
ную концентрацию (моль/дм3) ионов натрия в этом же
растворе:
1)0,05; 2) 0,10; 3)0,15; 4) 0,20.
3. В 1дм3 раствора основания ЭОН содержится 0,5 моль
в сумме ионов Э+ и ОН" и 1 моль молекул ЭОН. Укажите
степень диссоциации (%) основания:
1)20; 2) 25; 3)30; 4) 50.
4. Укажите химическое количество (моль) ионов Н+ в
растворе, в котором растворили 0,2 моль HF, если сте-
пень диссоциации кислоты равна 20%:
1) 0,02; 2) 0,04; 3) 0,08; 4) 0,10.
5. На каждые 20 нераспавшихся молекул кислоты НХ
приходится 5 ионов Н+ и 5 ионов X". Укажите степень
диссоциации кислоты:
1)0,05; 2) 0,10; 3) 0,15; 4) 0,20.
--- 307 ----
6. В растворе сульфата калия находится 0,5 моль ионов
SO2-. Укажите массу ионов К+ в этом же растворе:
1)78,0; 2) 39,0; 3) 19,5; 4) 13,0.
7. Степень диссоциации кислоты НХ равна 0,25. Ка-
кое суммарное число ионов Н+ и Х“ приходится в ее ра-
створе на каждые 100 нераспавшихся молекул (ответ
округлите до целого числа)?
1) 16; 2) 33; 3)67; 4) 85.
8. Укажите химическое количество (моль) всех ионов,
которые находятся в растворе, полученном при раство-
рении в виде 0,25 моль A1,(SO4)3 (диссоциация полная):
1)0,50; 2) 0,75; 3) 1,00; 4) 1,25.
9. Степень диссоциации основания ХОН равна 20%.
Какое число ионов ОН приходится в ее растворе на каж-
дые 40 нераспавшихся молекул основания?
1)50; 2)25;3) 20; 4) 10.
10. В растворе соли МеО, содержится 3,01 -1022 ионов
С1 и 1,0 г ионов металла Ме2+. Укажите химический знак
металла (диссоциация полная):
1) Mg; 2) Са; 3) Sr; 4) Ва.
ТЕСТ 18
1. Рассчитайте общее химическое количество (моль)
ионов и молекул в растворе, полученном при раство-
рении в воде 0,8 моль HF (степень диссоциации рав-
на 30%):
1)0,24; 2) 0,48; 3) 0,56; 4) 1,04.
2. В 1 дм3 раствора, полученного растворением сме-
си КВг и NaBr, содержится 3 моль ионов Вг и 1 моль
ионов К+. Укажите химическое количество (моль) ионов
Na+ в этом же растворе:
1)0,5; 2) 2,0; 3)1,0; 4) 1,5.
--- 308 ----
3. В 1 дм3 раствора СаС1, с молярной концентрацией 0,2
моль/дм3 общее химическое количество ионов Са2+ и С1 со-
ставляет 0,57 моль. Укажите степень диссоциации (%) соли:
1)0,92; 2) 0,93; 3) 0,95; 4) 0,97.
4. Найдите, сколько молекул воды приходится на одну
распавшуюся на ионы молекулу воды в ее объеме, рав-
ном 1 дм3, если число ионов Н" в этом объеме равно
6,02 • 1016:
1)5,56-10s; 2) 2,78 - L0b;
3) 5,56 106 * * 9; 4) 2,78 109.
5. Укажите график, на котором правильно описана
зависимость электрической проводимости Л, концентри-
рованной серной кислоты от объема V добавленной
воды:
6. В 1 дм3 раствора содержится 0,2 моль LiNO3 и
0,1 моль Na,SO4. Для приготовления 1 дм3 такого же
раствора необходимо взять:
1) 0,05 моль NaNO3 и 0,1 моль Li,SO4;
2) 0,1 моль NaNO3 и 0,1 моль Li,SO4;
3) 0,2 моль NaNO3 и 0,1 моль Li,SO4;
4) 0,2 моль NaNO3 и 0,2 моль Li,SO4.
— 309 —
7. В 1 дм3 раствора содержится 0,1 моль NaCl и
0,05 моль К,СО3. Для приготовления 1 дм3 такого же
раствора необходимо взять:
1) 0,10 моль КС1 и 0,05 моль Na,CO3;
2) 0,10 моль КС1 и 0,10 моль Na,CO3;
3) 0,05 моль КО и 0,05 моль Na,CO3;
4) 0,05 моль КО и 0,10 моль Na,CO3.
8. Смешали водные растворы, содержащие 0,1 моль
Bad, и 0,05 моль K,SO4. В полученном растворе наи-
большим будет химическое количество ионов:
1) Ва2+; 2) К+; 3) СГ; 4) SO2.
9. Смешали водные растворы, содержащие 0,2 моль BaCi,
и 0,05 моль Na,SO4. Укажите отношение л(С1 )/п(Ва2+) в
полученном растворе:
1)0,67; 2) 1,67; 3)2,67; 4)3,67.
10. Смешали водные растворы, содержащие 0,2 моль
AgNO3 и 0,1 моль NaCl. Найдите отношение ??(NO3 )/ n(Ag+)
в этом растворе:
1) 1,0; 2) 1,5; 3)2,0; 4)2,5.
ТЕМА 22
Ионные уравнения реакций
ТЕСТ1
1. При записи ионных уравнений реакций в виде
ионов НЕ представляют формулы:
l)BaSO4; 2) КОН;
3)ВаО,; 4)Н,О.
— 310 —
2. Необратимая химическая реакция протекает при
сливании водных растворов:
1) ZnSO4 и НС1; 2) ZnSO4 и КОН;
3) MgCl2 и HNO,, 4) СаС12 и КДЮ,.
3. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между растворами СаСЦ и Na2COv
I) 1,2) 2; 3)3; 4) 4.
4. Сокращенное ионное уравнение Fe2+ + 2ОН =
= Fe(OH\X соответствует взаимодействию веществ:
1) FeSO4 (р-р) и Си(ОН)2; 2) FeO и Ва(ОН)„ (р-р),
3) FeCl2 (р-р) и Na(OH) (р-р); 4) FeO и НПО.
5. НЕ могут совместно находиться в водном растворе
в значительных количествах пары ионов:
1) Н+ и ОН ; 2) К+ и SO2-; 3) Н4 и С1; 4) Н+ и S2 .
6. Одинаковым сокращенным ионным уравнением
описывается взаимодействие:
1) HNO3 (р-р) и NaOH (р-р);
2) Cu(OH), hHNO3 (р-р);
3) H2SO4 (р-р) и КОН (р-р, изб );
4) FL,S (р-р) и NaOH (р-р, изб ).
7. При сливании водных растворов СаС1э и Na4PO4 в
образовании осадка участвует пара ионов:
1) Са2+ и CF; 2) Са2+ и РО2, 3) Na+ и CF; 4) Na4 и РО2
8. Осадок образуется при сливании растворов:
1) NaOH и H2SO4; 2) Zn(NO?), и НС1;
3) K2SO4 и CuCl2; 4)CuSO4 hH2S.
9. Сокращенному ионному уравнению Ba2' + SO2- =
= BaSO4'l соответствует левая часть уравнения химичес-
кой реакции:
1) ВаСОч + К,SO. = , 2) Ва(ОН)2 + H ,SO4 = ;
3)BaO + H2SO4 = ; 4) ВаС12 + K2SO_j = .
--- 311
10. Укажите формулы веществ, которые реагируют друг
с другом согласно сокращенному ионному уравнению
2Н+ + СО;- = Н,0 + СО,Т:
1) СаСО3 и HCf; ‘ 2) Са(ОН), и Н,СО3;
3) Na,CO3 и HNO3; 4) NaOH и СО,.
ТЕСТ 2
1. При записи ионных уравнений реакций в виде
ионов НЕ представляют формулы:
1) СО,; 2) КНСО3; 3) H,S; 4) H,SO3.
2. Необратимая химическая реакция протекает при
сливании растворов:
1) Cu(NO3), и НС1; 2) Na,CO3 и КС1;
3) CuCl, и KNO3; 4) AgNO3 и NaCI.
3. Сумма коэффициентов в сокращенном ионном
уравнении реакции между растворами сероводорода и
избытка гидроксида калия равна:
1)2; 2) 4; 3) 6; 4) 8.
4. Сокращенное ионное уравнение реакции NH4+ +
+ ОН- = NH3T + Н,О соответствует взаимодействию
веществ:
1) NH4NO3 и Н,О; 2) NH3 и Н,О;
3) NH4NO3 и КОН; 4) NH3 и HNO3.
5. Одновременно в растворе в значительных количе-
ствах НЕ могут находиться пары ионов:
l)Ag+nCl-; 2)Ca2+nNO;;
3) Н+ и НСО;; 4) NH4+ и SO2-.
6. Одинаковым сокращенным ионным уравнением
описывается взаимодействие:
1) СаСО3 и НС1 (р-р); 2) СаСО3 и HNO3 (р-р);
3) СаСО3 и H,SO4 (р-р, разб.); 4) СаСО3 и Н3РО4 (р-р).
— 312 —
7. При сливании водных растворов CuCl, и КОН в
образовании осадка участвует пара ионов:
1) Сп2+ и ОН’; 2) Сп2+ и С1; 3) К+ и ОН ; 4) Си2+ и К+.
8. Газ выделяется при взаимодействии растворов:
1) MgCl, и КОН; 2) Na,CO3 и НС1;
3) NaOH и НС1; 4) Ba(NO3), и К3РО4.
9. Сокращенному ионному уравнению Н" + ОН- = Н,О
соответствует левая часть уравнений химических реакций:
1) ВаСО3 + 2HNO3 = ; 2) 2NaOH + H,S = ;
3) 2NaOH + H2SO4 = ; 4) KOH + HNO3 = .
10. Укажите формулы веществ, которые реагируют
между собой согласно сокращенному ионному уравне-
нию Pb2+ + S2- = PbS:
1) РЬ(ОН), и H,S; 2) Pb(NO3), и H,S;
3) Pb(NO3), и K2S; 4) РЬ(СН3СОО)2 и (NH4)2S.
ТЕСТЗ
1. Молекулярному уравнению КОН + HNO3 = KNO3 +
+ Н2О отвечает сокращенное ионное:
1) К+ + NO3 = KNO3; 2) Н+ + ОН- + Н2О;
3) КОН + Н+ = Н2О + К+; 4) К+ + HNO3 = KNO3 + Н+.
2. Сокращенному ионному уравнению Н+ + ОН-=Н2О
отвечает молекулярное:
1) Zn(OH), + 2НС1 = ZnCI, + 2Н,О;
2) NaOH + СН3СООН = CH3COONa + Н,О;
3) 2А1(ОН)3 + 3H7SO4 = A1,(SO4)3 + 6Н,О;~
4) Ва(ОН)2 + 2HNO3 = Ba(NO3), + 2H,b.
3. При записи ионных уравнений в виде ионов не
расписывают:
1) HNO3; 2) HF; 3) HNO2; 4) КНСО3.
— 313 —
4. Определите, какая пара ионов участвует в образова-
нии осадка при сливании водных растворов ВаС12 и Na3PO4:
1) Ва2+ и СГ; 2) Na+ и С1; 3) Ва2+ и РО’ ; 4) Ва2+ и Na+.
5. Установите, совместно с какими катионами НЕ мо-
гут находиться в водном растворе в значительных коли-
чествах анионы СО2:
1) Н+; 2) К+; 3) Ва2+; 4) NH4+.
6. Определите, совместно с какими анионами НЕ мо-
гут находиться в водном растворе в значительных коли-
чествах катионы Ва2+:
1) SO2-; 2) СГ 3) NO;; 4) ОН .
7. Найдите, какая пара ионов может использоваться
для составления молекулярного уравнения, которому
отвечает ионное 2Н+ + S2" = H2S:
1) Cu2+ и Н+; 2) Zn2+ и SO2"; 3) К+ и СР; 4) Fe2+ и СО2".
8. Нейтрализация какого основания и какой кислоты от-
ражается ионным уравнением реакции Ме(ОН)х + хН+ =
= Мех+ + хН2О:
1) оба электролита сильные;
2) оба электролита слабые;
3) сильная кислота, слабое основание;
4) слабая кислота, сильное основание.
9. Краткому ионному уравнению НСО; + ОН" =
= СО2- + Н2О отвечает взаимодействие между:
1) K,SO3 и Н2СО3; 2) К НСО, и НС1;
3) КНСО3 и КОН; 4) Са(НСО;)? и Са(ОН)2.
10. Смешали растворы, содержащие по 1 моль Ba(NO3),
и Na2COr Установите, какая пара ионов преимуществен-
но находится в растворе после окончания реакции:
1) Ва2+ и СО2"; 2) Ва2+ и NO;;
3) Na+ и NO;; 4) СО2" и Na’.
— 314 —
ТЕСТ 4
1. Сокращенное ионное уравнение Н+ + ОН = Н2О
отвечает взаимодействию:
1) Ва(ОН), и H,SO4; 2) Ва(ОН), и НС1;
3) КОН и HNO,; 4) Fe(OH\ и H,SO4
2. Реакция ионного обмена протекает до конца в ре-
зультате образования осадка между:
1) Са(ОН), и избытком СО2;
2) СО2 и избытком Ва(ОН),;
3) MgCL, и избытком КОН;
4) 1 моль ВаС12 и 1 моль H2SO4.
3. Определите, в каких из следующих пар в водном
растворе между ионами нет химического взаимодействия:
1) Na+ и NO,-; 2) НСО, и ОН ; 3) Н4 и S2,4) Са2+ и С1.
4. Одинаковым сокращенным ионным уравнением
описываются реакции между:
1) Fe(OH), и НС1 (избыток);
2) NaOH и НС1;
3) Fe(OH)2 и H2SO4 (разб.);
4) КОН и СН,СООН.
5. Определите, какие пары ионов можно использо-
вать для составления молекулярного уравнения, которо-
му отвечает ионное СО,2 + 2Н+ = СО2 + Н,О:
1) Na+ и S2-; 2) К+ и NO;, 3) Na+ и С1~; 4) Са2+ и SO2-.
6. Установите, с каким веществом Na,S реагирует со-
гласно сокращенному ионному уравнению Cu2+ + S2- =
=CuSi:
1) Cu(OH)2; 2) CuO; 3) CuSO4; 4) CuCO,.
7. При записи ионных уравнений реакций НЕ запи-
сывают в виде ионов:
1) А1(0Н),; 2) AgF; 3) СаНРО4; 4) Са(Н,РО4)2.
8. Укажите формулы веществ или ионов, являющихся
слабыми электролитами:
1) HS-; 2) H^SiO^ 3) HJ’O,; 4) СН3СООК.
9. Совместно с какими анионами в водном растворе
могут находиться в значительных количествах катионы Си2+:
1) Cl"; 2) ОН-; 3) SO;"; 4) РО3
10. Укажите, совместно с какими катионами в вод-
ном растворе могут находиться в значительном количе-
стве анионы РО’-:
l)Fe3+; 2)Н+; 3)Na+; 4)К+.
ТЕСТ 5
1. При записи ионных уравнений реакций в виде
ионов НЕ представляют формулы:
1) А12О3; 2) Н3РО4; 3) Са(НСО3)2; 4) СН3СООН.
2. Гидроксид бария вступает в реакцию ионного об-
мена с веществами, формулы которых:
1) NaCl; 2) A12(SO4)3; 3) HNO3; 4) KNO3.
3. Химическая реакция возможна между веществами:
])MgCl2 (р-р) и K,SO4 (р-р);
2) Na,S (р-р) и CuCl2 (р-р);
3) КНСО3 (р-р) и НС1 (р-р);
4) СаСО3 и HNO3 (р-р).
4. Сокращенному ионному уравнению NH + + ОН~ =
= NH3T + Н,0 отвечает взаимодействие веществ:
1) NH4NO3 и Ва(ОН),; 2) NH3 • ЦО и HNO3;
3) (NH4)?SO4 и Ва(ОН)2; 4) NH4C1 и А1(ОН)3. '
5. Сущность реакции ионного обмена между H2SO4 и
NaOH (изб ), НС1 (изб.) и Са(ОН)2, HNO3 (изб.) и Ва(ОН)2
отражает сокращенное ионное уравнение:
1) Ва2+ + SO2 = BaSO4; 2) Н+ + ОН = Н2О;
— 316 —
3) Н+ + NO" = HNO3; 4) Ca2+ + 20H = Ca(OH)2.
6. Одновременно в растворе в значительных количе-
ствах НЕ могут находиться пары ионов:
1) НСО" и ОН"; 2) Н+ и SiO;";
3) Cu2+ и S2"; 4) NH4 и NO3.
7. Одинаковым сокращенным ионным уравнением
описываются молекулярные уравнения реакции:
1) CuCl, + 2К0Н = Си(ОН)э + 2КС1;
2) CuO + 2НС1 = СиСф + Н.,0;
3) CuSO4 + Ва(ОН)2 = С'и(ОН), + BaSO4;
4) Cu(NO3)2 + Ва(ОН)2 = Си(ОН)2 + Ba(NO3),.
8. Слабый электролит образуется при сливании вод-
ных растворов:
1) CuC'L и HNO3; 2) Са(ОН), и НС1;
3) NH4C1 и КОН; 4) К3РО4 и NaCl.
9. Сумма всех коэффициентов в полном и сокращен-
ном ионных уравнениях реакций нейтрализации
КОН (изб.) и H,SO3 соответственно равна:
1) 10 и 4; 2) 9 и 5; 3) 6 и 3; 4) 6 и 6.
10. Сокращенному ионному уравнению 2Н+ + S2- =
= H2S соответствует взаимодействие веществ:
1) Na2S (р-р) и НС1 (р-р);
2) CuS и HNO3 (р-р);
3) K,S (р-р) и CuSO4 (р-р),
4) (NH4)2S и H2SO4 (р-р, разб ).
ТЕСТ 6
1. Нельзя составить сокращенное ионное уравнение,
когда между собой реагируют:
1) Na3PO4 и Ва(ОН)2; 2) СаСО3 и НС1;
3) Na2CO3 и HNO3; 4) Mg(OH)2 и HF.
— 317 —
2. Во всех случаях сокращенное ионное уравнение дает
информацию о:
1) природе веществ, вступивших в реакцию;
2) тепловом эффекте химической реакции;
3) скорости химической реакции;
4) сущности протекающей в водном растворе реакции.
3. В водном растворе НЕТ химического взаимодей-
ствия между ионами:
1) НСО3 и К+; 2) HSO3 и ОН ;
3) НСО3 и Н+; 4) НСО3 и NH*.
4. Химическая реакция протекает между:
1) КС1 (р-р) и NaNO3 (р-р);
2) CuCl, (р-р) и NaOH (р-р);
3) Cu(NO3)2 (р-р) и H2SO4 (р-р);
4) Na,S (р-р) и НС1 (р-р).
5. Сокращенному ионному уравнению Н+ + NO,~=HNO2
отвечает взаимодействие водных растворов веществ:
1) KNO, и Са(ОН),; 2) KNO, и НС1;
3) KNO2 и NaHCO3; 4) NaNO2 и HNO3.
6. Одинаковыми сокращенными уравнениями описы-
ваются молекулярные уравнения реакций, левые части
которых:
1)КОН + НС1 = ;
2) Ва(ОН), + 2H,SO4 = ;
3) Ba(OH)>2HNO3 = ;
4) 2КОН + H,SO4= .
7. Взаимодействию водных растворов гидрокарбона-
та калия и гидроксида калия отвечает сокращенное урав-
нение:
1) СО2- + 2Н+ = Н,0 + СО,;
2) НСО3 + ОН- = СО2“ + Н,О;
3) Н+ + ОН- = Н2О;
--- 318 ----
4) КНСО3 + ОН- = К+ + СО;’ + Н7О.
8. Какие пары ионов можно использовать при состав-
лении молекулярных уравнений, которым отвечает со-
кращенное ионное 2Н+ + СО;- = Н7О + С07Т?
1) К+ и S2-; 2) Na+ и NO;;
3)Ва2+иСГ; 4) NH4+ и SO2".
9. Какие вещества надо взять, чтобы осуществить пре-
вращение, которому отвечает сокращенное ионное урав-
нение реакции А13+ + ЗОН~ = А1(ОН)3 >1?
1) A17(SO4)3 и Н2О; 2) А17О3 и Н70;
3) А1С13 и NaOH; 4) A17(SO4)3 и Ва(ОН)2.
10. Газ выделяется при взаимодействии ионов:
1)Н+иОН-; 2)NH4+hOH;
3) Н+ и НСО;; 4) НСО; и ОН".
ТЕСТ 7
1. При добавлении в раствор сульфат-ионов осадок
выпадает, а при добавлении хлорид-ионов — нет. Это
возможно, если в растворе присутствует катион:
1) Ag+; 2) Н+; 3) Ва2+; 4) Mg2+.
2. Растворы соляной и серной кислот можно разли-
чить с помощью:
1) индикатора; 2) хлорида бария;
3) гидроксида калия; 4) карбоната натрия.
3. Укажите формулы веществ, с помощью которых
можно различить водные растворы карбоната калия и
хлорида калия:
1) NaOH; 2) NaNO3; 3) HNO3; 4) Ca(NO3)7.
4. С разбавленным раствором гидрокарбоната каль-
ция взаимодействуют вещества, формулы которых:
1) КС1; 2) КОН. 3) Са(ОН)7; 4) НС1.
— 319 —
5. Укажите схемы реакций ионного обмена:
l)Zn + HCl—>ZnCl2 + H,;
2) AgNO3 + КС1 -> AgCl + KNO3;
3) CO, + NaOH Na,CO3 + H,O;
4) K,CO3 + HNO3 KNO3 + H,0 + CO,.
6. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между раствором КОН и избыт-
ком H,S:
1)2; 2) 4; 3)6; 4) 8.
7. Укажите схемы реакций нейтрализации:
1) К,0 + НС1 КС1 + Н2О;
2) КОН + НС1 КС1 + Н,О;
3) Cu(OH), + HNO3 Cu(NO3), + Н2О;
4) NaHCO3 + H2SO4 Na,SO4 + H,0 + CO2.
8. Отметьте формулы веществ, с которыми сульфид
калия взаимодействует согласно сокращенному ионно-
му уравнению Cu2+ + S2" = CuSl:
1) Cu(OH)2; 2) CuO; 3) CuSO4; 4) CuCl2.
9. Различить растворы ВаС12 и Ba(NO3)2 можно с по-
мощью веществ:
1) лакмуса; 2) CH3COOAg; 3) NaOH; 4) H2SO4.
10. Чтобы различить белые осадки BaSO4 и ВаСО3, в
пробирки следует добавить раствор:
1) NaOH; 2) КС1; 3) HNO3; 4) NH4NO3.
ТЕСТ 8
1. Взаимодействию угольной кислоты и карбоната ка-
лия соответствует сокращенное ионное уравнение реакции:
1) К+ + НСО" = КНСО3;
2) СО2" + Н2О + СО2 = 2НСО~;
3) К2соз + 2Н+ + СО2" = 2К+ + 2НСО3;
— 320 —
4) С02“ + Н20 = НСО- + ОН-.
2. Укажите сокращенное ионное уравнение реакции,
которое соответствует взаимодействию водных раство-
ров гидрокарбоната калия и гидроксида калия:
1) НСО3- + Н+ = Н,0 + СО2;
2) НСО3- + ОН- = СО32- + Н,О;
3) КНСО3 + ОН’ = К + Н,0 + СО32~;
4) КНСО3 + Н+ = К + Н,б + СО,.
3. Взаимодействию водных растворов гидрокарбона-
та натрия и хлороводорода соответствует сокращенное
ионное уравнение реакции:
1) НСО3 + ОН’ = Н,0 + СО2-;
2) NaHCO3 + Н+ = Na+ + Н,0 + СО,;
3) НСО3 + Н+ = Н,0 + СО2;
4) NaHCO3 + ОН = Na+ + Н2О + СО2.
4. Укажите формулы реактивов, с помощью которых
можно перевести в осадок (осадить) находящиеся в вод-
ном растворе ионы РО2~:
1) КОН; 2) ВаС12; 3) AgNO3; 4) K^SO^
5. В присутствии хлорид-ионов осадить только фос-
фат-ионы можно с помощью:
1) нитрата серебра (I);
2) нитрат бария;
3) гидроксида натрия;
4) серной кислоты.
6. В кислой среде в значительных количествах НЕ
могут существовать ионы, формулы которых:
1) S2-; 2) СГ; 3) Си2+; 4) НСО~
7. В щелочной среде в значительных количествах НЕ
могут существовать ионы, формулы которых:
1) НСО3; 2) Na+; 3) Cu2+; 4) РО2 .
И Зак. 1530
--- 321 ----
8. Находящиеся в разных пробирках водные раство-
ры сахарозы и гидроксида натрия можно различить с
помощью:
1) индикатора;
2) хлорида меди (II);
3) измерения электрической проводимости;
4) различия в их окраске
9. Сокращенное ионное уравнение HSO3 + ОН” =
= SO2- + Н2О отвечает взаимодействию:
1)K,SO3 и H2SO3; ь
2) KHSO3hHC1;
3) KHSO3 и КОН;
4) NaHSO3 и Ва(ОН)2(изб.).
10. В водном растворе совместно в значительных ко-
личествах могут присутствовать все ионы, формулы ко-
торых приведены в ряду:
1) Ва2+, NO” NH4+, Cl, SO2”;
2) Zn2+, SO2, OH , K+, S2”;
3) Fe2+, Cl, NH+, SO2’, NO3;
4) Fe3+, NO- OH, S2”, Cu2+.
ТЕСТ 9
1. Сульфат-ионы HE могут находиться совместно в
значительных количествах со обоими ионами, формулы
которых приведены в ряду:
1)Ва2+, Mg2+; 2)Ва2+,РЬ2+,
3) РЬ2+, К+; 4) Ва2\ NH*.
2. Согласно сокращенному ионному уравнению НСО3 +
+ ОН = Н О + СО2” между собой взаимодействуют.
I) Са(НСОД и Си(ОН)2;
2) NaHCO3 nNaOH;
--- 322 ---
3) Са(НСО3), и Са(ОН), (р-р);
4) NaHCO3иКОН.
3. Согласно сокращенному ионному уравнению НСО; +
ИГ Н.О + СО2 между собой взаимодействуют:
1) NaHCO. и NaOH;
2) КНСО. и НС1;
3)Са(НСО3)., hHNO,;
4) Ва(НСО3Х и H.SO4.
4. Укажите ряд, в котором приведены формулы ионов,
каждый из которых НЕ может существовать в значитель-
ных количествах в среде с pH < 7:
I) НСО,, ОН , РО; ,
2) Си2+, СОф, NO;;
3) Na+, СНСОО- С1;
4) Вг, СР, К
5. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между 1 моль Са(НСО3), и
2 моль NaOH:
1)7; 2) 9; 3) 11; 4) 13.
6. Не могут существовать в значительных количествах
в среде с pH > 7 все ионы, формулы которых приведены
в ряду:
1) ОН , Н , Ва2+;
2) Н+, НСО;, NH4;
3) РОф, SO; , Mg2+;
4) Na+, CH,COO , NH4+.
7. Смешали растворы, содержащие равные химичес-
кие количества Na3PO4 и NaH,PO4. Укажите сумму ко-
эффициентов в сокращенном ионном уравнении проте-
кающей при этом реакции:
1)6; 2) 5; 3)4; 4)3
--- 323
8. Даны ионы, формулы которых НСО3, ОН", Н+, Mg2+
и F". Число возможных реакций между попарно взяты-
ми ионами равно:
1)8; 2) 7; 3)6; 4) 5.
9. Совместно в значительных количествах в водном
растворе могут находиться все ионы, формулы которых
приведены в ряду:
1) ОН", К+, S2", Na+, Cu2+;
2) НСО;, К\ Са2+, SO2", ОН";
3) Н+, Cl, К+, Ва2+, NO;;
4) HSO3, Na+, Н+, Cl", OH -
IO. Осадок НЕ выпадает, когда в воде растворяют все
вещества, формулы которых приведены в ряду:
1) NaHCO3, КС1, AgNO3;
2) КНСО3, NaCI, MgSO4;
3) NaF, KNO3, CaCl2;
4) Na3PO4, KNO3, CaCl2.
ТЕСТЮ
1. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между растворами, содержащи-
ми 1 моль NaHSO3 и 1 моль Ва(ОН)2:
1)3; 2) 4; 3)5; 4) 6.
2. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между растворами, содержащи-
ми 1 моль NaHCO3 и 0,5 моль Ва(ОН)2:
1) 3^2) 5; 3) 7; 4) 9.
3. Сумма коэффициентов в сокращенном ионном
уравнении реакции между раствором Ва(ОН)2 и избыт-
ком Н3РО4 равна:
1)2; 2)3; 3)4; 4)5.
— 324 —
4. Раствор Ва(ОН)2 насыщают углекислым газом. Ука-
жите сумму коэффициентов в сокращенном ионном урав-
нении реакции образования конечного продукта:
1)3; 2) 4; 3)5; 4) 6.
5. Укажите сумму коэффициентов в сокращенном урав-
нении реакции Na3PO4 с избытком Н3РО4:
1)2; 2)4; 3) 6; 4) 8.
6. Раствор Ва(ОН)э насыщают оксидом фосфора (V).
Укажите сумму коэффициентов в сокращенном ионном
уравнении реакции образования конечного продукта:
1)6; 2) 5; 3)4; 4)3.
7. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между сульфатом цинка массой
3,22 г и гидроксидом натрия массой 3,2 г:
1)4; 2) 5; 3)6; 4)7.
8. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между хлоридом хрома (III) мас-
сой 1,59 г и гидроксидом калия массой 2,24 г:
1)5; 2) 6; 3)3; 4) 4.
9. Даны ионы, формулы которых НСО-, Н+, К+, ОН-.
Число возможных реакций между попарно взятыми
ионами равно:
1)6; 2) 5; 3)4; 4)3.
10. Даны ионы, формулы которых SO2-, Н+, Ва2+, ОН-.
Число возможных реакций между попарно взятыми
ионами равно:
1)3; 2) 4; 3) 5; 4)6.
ТЕСТИ
1. В растворах с pH =12 будет растворяться:
1) А1(ОН)3; 2) ВеО; 3) Mg(OH)2; 4) FeO.
--- 325 ----
2. В растворах с pH = 7 будут растворяться:
1) Си(ОН),; 2) Na2SO4; 3) Fe2O3; 4) Na,CO3.
3. Краткое ионное уравнение HSOj + Ва2+ + ОН- =
= BaSO31 + Н2О отвечает взаимодействию:
1) 1 моль KHSO3 и 2 моль Ва(ОН)2;
2) 1 моль Ca(HSO3)2 и 1 моль Ва(ОН)2;
3) 1 моль NaHSO3 и 1 моль Ва(ОН)2;
4) 2 моль KHSO3 и 1 моль Ва(ОН)2.
4. Краткое ионное уравнение 2HCOJ + Ва2+ + 2ОН‘ =
= СО2- + ВаСО31 + 2Н2О отвечает взаимодействию:
1) 0,84 г NaHCO3 и 6,855 г Ва(ОН)2;
2) 1,68 г NaHCO3 и 1,71 г Ва(ОН)2;
3) 1 моль Са(НСО3)2 и 1 моль Ва(ОН)2;
4) 1 моль Ва(НСО3)2 и 2 моль NaOH.
5. Между собой реагируют водные растворы веществ:
NaOH (0,02 моль) и H2SO4 (0,01 моль), Ва(ОН)2 (0,05 моль)
hH2S04(0,01 моль), Ва(ОН)2(0,01 моль)иНМ03(0,02 моль),
NaOH и СН3СООН. Число одинаковых сокращенных
ионных уравнений реакций равно:
1)4;2)3;3) 2; 4) 1.
6. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между 0,1 моль К3[А1(ОН)6] и
0,3 моль HNO3:
1) 10; 2)8;3) 6; 4)4.
7. Какова сумма коэффициентов в сокращенном ион-
ном уравнении реакции между K2[Zn(OH)4] и избытком
разбавленной серной кислоты?
1) 10; 2) 8; 3) 6; 4)4.
8. Одинаковыми сокращенными ионными уравнения-
ми описывается взаимодействие растворов, содержащих:
1) 0,2 моль NaHSO3 и 0,1 моль Ва(ОН)2;
2) 0,01 моль Ba(HSO3)2 и 0,02 моль NaOH;
— 326 —
3) 0,02 моль Ва(ОН)2 и 0,02 моль SO2;
4) 0,01 моль Ва(ОН), и 0,02 моль SO2.
9. Сокращенное ионное уравнение нельзя записать
для случая, когда между собой реагируют водные раство-
ры, содержащие:
1) 0,01 моль ВаСО3 и 0,02 моль НС1;
2) 0,05 моль Са(НСО3), и 0,05 моль Ва(ОН),;
3) 1 моль Ва(ОН), и 1 моль H,SO4;
4) 0,1 моль Ва(ОН), и 0,1 моль НС1.
10. Сокращенное ионное уравнение ZnO;- + 2Н+ =
= Zn(OH),X отвечает взаимодействию:
1) Na,ZnO2 и избытка HNO3;
2) 1,43 г Na2ZnO, и 0,73 г НС1;
3) 1,43 rNa2ZnO2 и 1,46 г НС1;
4) 0,05 моль К,ZnO, и 4,9 г H,SO._
7 ’ 2 2’ 24
--- 327 ---
ХИМИЯ ЭЛЕМЕНТОВ
ТЕМА 23
Неметаллы: общая характеристика
электронного строения атомов,
физических и химических свойств
простых веществ и соединений
ТЕСТ1
1. Большинство атомов элементов неметаллов на
внешнем электронном слое содержат электронов:
1) 1—2; 2) 2—3; 3) 3—4; 4) 4—8.
2. Укажите символ элемента, который можно отнес-
ти к элементам как IA, так и VIIА групп:
1)Н; 2) В; 3) Не; 4) С.
3. Три электрона на внешнем электронном слое в ос-
новном состоянии содержит атом неметалла, символ ко-
торого:
1)Не; 2) А1; 3)В;4)1п.
4. К неметаллам ^-семейства относятся:
1) Н и В; 2) Не и С; 3) С и N; 4) О и Ne.
5. Укажите символы неметаллов 5-семейства:
1)Н; 2)В;3)Аг; 4) Не.
6. Внешний электронный слой полностью завершен
в атомах элементов неметаллов, символы которых:
1)Н; 2) Не; 3) С1; 4) Кг.
7. Укажите формулы соединений, в составе которых
атомы неметаллов VIIA группы имеют положительную
степень окисления:
— 328 ------
1) НС1; 2) НСЮ; 3) OF,; 4) NClr
8. Отрицательную степень окисления атомы элемен-
тов неметаллов VIA группы проявляют в составе соеди-
нений, формулы которых:
1) O,F,; 2) FeS,; 3) K,Se; 4) SF4.
9. Минимальная отрицательная степень окисления ато-
мов неметаллов IVA—VIIА групп определяется по формуле:
1) № группы +8; 2) № группы -7;
3) № группы -8; 4) 8 — № группы.
10. Максимальную положительную степень окисле-
ния, равную номеру группы в периодической системе,
НЕ проявляют атомы неметаллов, символы которых:
1) N; 2) F; 3) О; 4) С1.
ТЕСТ 2
1. Укажите справедливые утверждения:
1) для атомов всех неметаллов IIIА—VIIА групп выс-
шая валентность равна номеру группы;
2) элементы неметаллы отсутствуют среди элементов
d- и f-семейств;
3) во всех периодах элементов металлов содержится
больше, чем элементов неметаллов;
4) все элементы неметаллы 2—6-го периодов отно-
сятся кр-семейству.
2. Неметаллы при взаимодействии с металлами мо-
гут образовать:
1) основания; 2) соли; 3) кислоты; 4) оксиды.
3. В периодической системе элементы неметаллы рас-
положены:
1) в левом нижнем углу; 2) в правом верхнем углу;
3) в группах А и В; 4) только в группах А.
--- 329 ---
4. Укажите сокращенные электронные конфигурации
атомов неметаллов:
1) [Ne]3s23//; 2) [Аг]3
3) [Аг]Зб/|О4лМ//, 4) [He]2s22/A
5. Укажите названия естественных семейств элемен-
тов неметаллов:
1) благородные газы; 2) халькогены,
3) органогены, 4) галогены.
6. Валентность, равную номеру группы, проявляют
атомы элементов неметаллов, символы которых:
1) С; 2) N; 3) Р; 4) О.
7. НЕ может проявлять валентность, равную номеру
группы, атом элемента неметалла:
1) хлора; 2) фтора; 3) кремния; 4) фосфора.
8. Энергия ионизации атомов элементов неметаллов
последовательно возрастает в ряду:
1) С, F, О; 2) С, О, F; 3) F, О, С; 4) О, С, F
9. Радиус атомов элементов неметаллов последова-
тельно уменьшается в рядах:
1) Р, Cl, S; 2) Р, S, С1; 3) О, S, Se; 4) Вг, Cl, F.
10. Укажите символ элемента неметалла, высшая ва-
лентность атома которого превышает номер группы:
1)N; 2) С; 3) В; 4) О.
ТЕСТЗ
1. Самым сильным окислителем среди простых ве-
ществ неметаллов является:
1) водород; 2) углерод; 3) фтор; 4) азот.
2. В ряду водород— кислород — фтор окислительная
способность простых веществ неметаллов:
1) возрастает,
— ззо —
2) уменьшается;
3) сначала возрастает, затем уменьшается;
4) сначала уменьшается, затем возрастает.
3. Молекулярное строение (н. у) имеют простые ве-
щества элементов неметаллов, названия которых:
1) бор; 2) хлор; 3) азот; 4) кремний.
4. Самый распространенный в земной коре элемент
неметалл — это:
1) кремний; 2) углерод; 3) кислород; 4) азот.
5. Немолекулярное строение (н. у.) характерно для про-
стых веществ неметаллов, символы которых:
1)С1; 2)В;3) Si; 4) О.
6. К элементам органогенам относятся:
1) углерод и азот;
2) фосфор и хлор;
3) кислород и водород;
4) бор и сера.
7. При н.у. газами являются простые вещества:
1) фосфор; 2) кислород; 3) бор; 4) хлор.
8. Температура плавления простых веществ последо-
вательно возрастает в рядах:
1) бор, азот, кислород;
2) азот, кислород, бор;
3) фтор, хлор, бром;
4) бром, хлор, фтор.
9. При н.у. жидкое простое вещество образует элемент
неметалл:
1) иод; 2) бром; 3) ртуть; 4) углерод.
10. Укажите, атом какого элемента второго периода
имеет наибольшую степень окисления и чему равна эта
степень окисления:
1) В, +3; 2) С, +4; 3) N, +5; 4) F, +7.
— 331
ТЕСТ 4
1. Элементы полуметаллы — это:
1) С, В, N; 2) В, Si, As; 3) Ge, Те, S; 4) I, P, S.
2. Укажите формулы соединений, названия которых
имеют окончание «ид»:
1) Ca3N2; 2) CaSO4; 3) СаО; 4) СаН,.
3. В качестве восстановителей для получения ме-
таллов из оксидов используются простые вещества
неметаллы:
1) углерод; 2) азот; 3) кремний; 4) водород.
4. Минимальная отрицательная степень окисления
атома неметалла в соединениях равна:
1)—5; 2)-4; 3)-3;4)-2.
5. Максимальная положительная степень окисления
атома неметалла в соединениях равна:
1) + 8; 2) +7;3)+10; 4) +5.
6. Только окислительные свойства в реакциях с дру-
гими веществами проявляет простое вещество:
1) углерод; 2) азот; 3) фтор; 4) фосфор.
7. Как положительные, так и отрицательные степени
окисления в соединениях проявляют атомы элементов
неметаллов, символы которых:
1) S; 2) О; 3)F; 4) N.
8. Единственную степень окисления в сложных ве-
ществах всегда проявляет атом:
1) фтора; 2) кислорода; 3) азота; 4) углерода.
9. Укажите общую формулу летучих водородных со-
единений элементов неметаллов VIIA группы:
1)НЭ; 2)Н2Э; 3) ЭН3; 4) ЭН4.
10. Неизвестны (пока?) химические соединения для
элементов неметаллов, символы которых:
1) Не; 2) Хе; 3) Кг; 4) Ne.
--- 332 ----
ТЕСТ 5
1. Для атомов неметаллов в химических реакциях ха-
рактерны свойства:
1) только окислительные;
2) только восстановительные;
3) и окислительные, и восстановительные;
4) ни окислительные, ни восстановительные.
2. При растворении в воде кислоты образуются в слу-
чае летучих водородных соединений элементов неме-
таллов групп:
1) IVA; 2) VA; 3) VIA; 4) VIIA.
3. Укажите общую формулу высшего оксида атомов
элементов неметаллов VA группы:
1) Э2О3; 2) ЭО2; 3) Э2О5; 4) Э2О7.
4. Кислотные свойства водородных соединений эле-
ментов неметаллов последовательно возрастают в рядах:
1) РН3, H7S, НС1; 2) HBr, НС1, HF;
3) HF, HC1, HI; 4) H2Te, H2Se; H2S.
5. Только в форме одноатомных молекул в природе
существуют элементы неметаллы группы:
1) VIIIA; 2) VIA; 3) VIIA; 4) VA.
6. В виде атомных кристаллов (н. у.) могут существо-
вать в природе элементы неметаллы:
1) азот; 2) фосфор; 3) бор; 4) кремний.
7. Только молекулярное строение (н. у.) характерно для
простых веществ неметаллов, названия которых:
1) фосфор; 2) углерод; 3) азот; 4) хлор.
8. Как молекулярное, так и немолекулярное строение
(н. у.) могут иметь простые вещества элементов неме-
таллов, символы которых:
1) С; 2) Р; 3) О; 4) N.
— 333 —
9. Обо всех простых веществах, образованных элемен-
тами неметаллами, можно сказать:
1) их температура плавления ниже, чем у простых ве-
ществ металлов;
2) при н. у. они являются только газами или жидко-
стями;
3) они имеют молекулярную кристаллическую решетку;
4) между их атомами или молекулами отсутствуют
водородные связи.
10. Сумма высшей валентности и низшей степени окис-
ления равна двум для атомов элемента неметалла:
1) азота; 2) кислорода;
3) хлора; 4) серы.
ТЕСТ 6
1. Укажите число верных утверждений из приведенных:
— все водные растворы летучих водородных соеди-
нений элементов неметаллов являются кислотами;
— с ростом молярной массы простейшего водород-
ного соединения элемента неметалла температура ки-
пения соединения не всегда монотонно возрастает;
- — не все высшие оксиды элементов неметаллов реа-
гируют с водой;
— все оксиды элементов неметаллов являются кис-
лотными;
— не все оксиды элементов неметаллов имеют моле-
кулярную кристаллическую решетку (н. у.);
— восстановительные свойства в реакциях с други-
ми веществами могут проявлять все водородные соеди-
нения, формулы которых: НВг, HI, H2S, HF.
1)6; 2) 5; 3)4; 4)3.
--- 334 ----
2. В формульной единице атомов, входящих в состав
карбида кальция, содержится столько же электронов, как
и в атоме элемента:
1) Gd; 2)U; 3)Pu; 4) Ge.
3. Взаимодействуют друг с другом неметаллы:
1) углерод и водород; 2) кремний и водород;
3) кислород и хлор; 4) фосфор и хлор.
4. Степень полярности связи возрастает, а кислот-
ные свойства уменьшаются в паре соединений, фор-
мулы которых:
1) HF, HI; 2) НВг, HF; 3) H,S, Н,Те; 4) H2S, НС1.
5. Степень полярности связи уменьшается, а кислот-
ные свойства возрастают в парах соединений, формулы
которых:
1) НС1, HF; 2) NH3, H2S; 3) HF, НВг; 4) H,S, H2Se.
6. Укажите верные утверждения:
1) при н.у. все простые вещества неметаллы—твердые;
2) большинство простых веществ неметаллов — ди-
электрики;
3) с увеличением атомного номера элемента неметал-
ла в периодах 2 — 5 кислотные свойства водородных
соединений усиливаются;
4) не всегда более кислотными свойствами облада-
ет водородное соединение неметалла с более поляр-
ной связью.
7. В природе элементы неметаллы могут встречаться:
1) в виде простых веществ только молекулярного
строения;
2) в виде простых веществ молекулярного и немоле-
кулярного строения;
3) в составе солей;
4) в виде одиночных атомов.
--- 335 ----
8. Для твердых веществ неметаллов характерны типы
кристаллических решеток:
1) ионная; 2) атомная;
3) молекулярная; 4) металлическая.
9. Отрицательную степень окисления атомы элемен-
тов неметаллов третьего периода проявляют в составе:
1) SiH4; 2) Са3Р2; 3) H2S; 4) CIBr.
10. Принадлежность химических элементов к метал-
лам или неметаллам главным образом определяется:
1) числом нуклидов;
2) относительной атомной массой;
3) числом электронных слоев в атоме элемента;
4) строением внешнего электронного слоя атомов.
ТЕМА 24
Водород. Вода
ТЕСТ1
1. Укажите, какие характеристики роднят водород с
галогенами:
1) число валентных электронов в атоме;
2) возможность проявлять в соединениях степень
окисления, равную -1;
3) число электронов, недостающих до полного завер-
шения внешнего электронного слоя;
4) число электронов на внешнем электронном слое.
2. Водород выделяется при взаимодействии:
1) Си и НС1 (разб.); 2) Zn и Н?8О4(разб.);
— 336 —
3) NaH и H2O; 4) С и Н,О (t°).
3. Степень окисления атома Н равна -1 в составе:
1)SiH4hNH3; 2)СН4иСаН7;
3) 1лА1Н4 и SiH4; 4) НС1 и НД.
4. Водород -— восстановитель, реагируя с:
1) СиО; 2) К; 3) О,; 4) С,Н4.
5. При взаимодействии с водой гидрид кальция про-
являет свойства:
1)окислителя;
2) восстановителя;
3) ни окислителя, ни восстановителя;
4) окислителя и восстановителя.
6. Укажите общую формулу гидридов щелочноземель-
ных металлов:
1) МеН; 2) МеН2; 3) МеН3; 4) МеН4.
7. Отметьте символ металла, которого нужно меньше
всего по массе для получения одного моля водорода в
реакции с разбавленной серной кислотой:
l)Mg; 2) Al; 3) Fe; 4) Zn.
8. С водой может реагировать каждое из веществ в
паре:
1) Fe и Си; 2) КН и Н2; 3) NH3 и Zn; 4) Са и Fe.
9. НЕ взаимодействует с водой каждое из веществ в
паре:
1) СаО и SiO2; 2) Р,С\ и SO3; 3) Кр и СаН,; 4) Н, и SiO,.
10. При температуре 20 °C вода реагирует с металлами:
1) Са, Na, Al (амальгамированный); 2) К, Ba, Zn;
3) Li, Sr, Be; 4) Rb, Cs, Fe.
--- 337 ---
ТЕСТ 2
1. Укажите, какие характеристики роднят водород со
щелочными металлами:
1) число валентных электронов в атоме;
2) возможность проявления в соединениях степени
окисления +1;
3) в атоме Н до завершения внешнего энергетическо-
го уровня также не хватает одного электрона;
4) как и для щелочных металлов, для водорода в хими-
ческих реакциях характерны восстановительные свойства.
2. Водород выделяется в результате:
1) электролиза водного раствора К.С1;
2) нагревания пероксида водорода в присутствии МпО,;
3) растворения хлора в воде (20 °C);
4) конверсии метана с водяными парами.
3. Степень окисления атома Н положительная в составе:
1) Ва(ОН),; 2) NH3; 3) С,Н4; 4) SiH4.
4. В качестве сырья для получения водорода в про-
мышленности используют:
1) Zn и Н^ОДразб.); 2) СН4 и Н,О;
3) FenHCl (р-р); 4) С и НД
5. Для водорода НЕВЕРНЫ утверждения:
I) элемент водород не имеет изотопов;
2) между молекулами Н, образуются водородные связи;
3) в химических реакциях водород только восстано-
витель;
4) водород — самый распространенный во Вселен-
ной элемент.
6. В палладии объемом 0,1 дм3 (плотность палладия
12,0 г/см3) растворили водород объемом 80 дм3 (н. у).
Укажите массовую долю (%) водорода в полученном
образце:
1)0,59; 2) 0,49; 3) 0,39; 4) 0,29.
--- 338 ---
7. Укажите характеристики простого вещества водород:
1) при н.у. — газ;
2) состоит из трех природных изотопов;
3) плохо растворим в воде;
4) входит в состав гидридов.
8. Даже при нагревании вода НЕ реагирует с каждым
из металлов:
1) Zn и Fe; 2) Си и Ag; 3) Ni и Na; 4) Мп и Са.
9. Вода — окислитель, реагируя с:
1) С12 (5 °C); 2) С (С); 3) SO,; 4) ВаО.
10. Укажите, какое максимальное число водородных
связей образует данная молекула воды с другими моле-
кулами воды:
1) 1; 2) 2; 3)3; 4) 4.
ТЕСТЗ
1. Катализатор используется, когда вода реагирует с:
1) оксидом калия; 2) хлором;
3) этеном; 4) этилацетатом.
2. Химическая связь в молекуле водорода:
1) ковалентная неполярная; 2) G-типа;
3) двойная; 4) водородная.
3. Для атома водорода НЕВОЗМОЖНА степень окис-
ления:
1)0; 2)+1; 3)-1; 4)+2.
4. Гидрид-ион Н и атом Н различаются:
1) числом протонов;
2) окислительно-восстановительными свойствами;
3) числом нейтронов;
4) числом электронов.
— 339 —
5. Электронную конфигурацию Is2 имеют:
1) гидрид-ион Н ; 2) атом Не; 3) атом 2Н; 4) катион Т+.
6. Водород ни при каких условиях НЕ реагирует с:
1)СО; 2) NH3, 3) СН4; 4)Ti.
7. Во сколько раз водород легче воздуха?
1) 12,5; 2) 13,5; 3) 14,5; 4) 15,5.
8. Максимальное число водородных связей, кото-
рые может образовать атом кислорода в молекуле
воды, равно:
1)4; 2)3; 3)2; 4) 1.
9. НЕВЕРНЫ утверждения:
1) при нормальном давлении плотность воды макси-
мальна при температуре О °C;
2) в ряду Н,О, H,S, H,Se температура кипения веществ
последовательно нарастает;
3) молекула воды — диполь;
4) со всеми металлами вода реагирует только при на-
гревании.
10. Гидроксиды образуются, когда с водой реагируют:
l)Zn; 2) SO3;3)LiH, 4) Са.
ТЕСТ 4
1. Летучие (н. у.) водородные соединения водород об-
разует с элементами:
1) С; 2) Na; 3) S; 4)N.
2. Вода образует водородные связи с веществами,
формулы которых:
1) СН4; 2) НСНО (формальдегид); 3) NH3, 4) HF.
3. В воде лучше других из перечисленных растворя-
ется газ:
1) кислород; 2) азот, 3) водород; 4) аммиак.
4. На поверхности Земли элемент водород находится
--- 340 ---
4. На поверхности Земли элемент водород находится
в основном в составе молекул:
1) СН4; 2) Н,О; 3) NH3; 4) Н2.
5. Для эффективного собирания Н, открытую пробирку
располагают:
1)горизонтально;
2) вертикально, отверстием вниз;
3) вертикально, отверстием вверх;
4) в любом положении.
6. Газ выделяется, когда с водой реагируют (20 °C):
1) СаН2; 2) СаС,; 3) А14С3; 4) СаО.
7. Только при нагревании с водой реагируют:
1) кокс; 2) барий; 3) цинк; 4) гидрид натрия.
8. Водород — восстановитель, реагируя с:
1) С1,; 2) Са; 3) N,; 4) S.
9. Оксид образуется, когда с водой при нагревании
реагируют:
1)К;2) Zn; 3) Fe; 4) С.
10. Одинаковое число электронов содержат частицы:
1) Н; 2)Н ;3)Н+; 4) II,.
ТЕСТ 5
1. Укажите верные утверждения. При взаимодей-
ствии молекул D2 и ,6О2 образуется продукт, молекула
которого:
1)неполярна;
2) содержит 10 электронов;
3) содержит 12 нейтронов;
4) содержит 10 протонов.
2. Катион 3Н+ и атом 2Н различаются:
1) числом электронов; 2) числом протонов;
3) числом нейтронов; 4) размерами.
— 341
3. Восстановительные свойства атомы водорода мо-
гут проявлять, находясь в составе:
1) H2SO4; 2) СаН2; 3) Н2; 4) NaBH4.
4. Только окислительные свойства атомы водорода
проявляют в составе соединений, формулы которых:
1) НС1; 2) КН; 3) Н2О; 4) NH3.
5. В промышленности водород НЕ используют для
получения:
1) металлов; 2) аммиака; 3) метанола; 4) воды.
6. Больше всего примесей содержит вода:
1) морская; 2) дистиллированная;
3) дождевая; 4) родниковая.
7. Частичный положительный заряд на атоме водо-
рода последовательно возрастает в ряду соединений,
формулы которых:
1) HF, НО, НВг; 2) NH3, Н9О, HF;
3) Н2О, H2S, H2Se; 4) NH3, СН4, РН3.
8. Укажите формулу а-частицы:
1) 'Н2; 2) Т2; 3) Не2+; 4) Не*
9. Катион Н+ и анион Н“ отличаются:
1) размерами; 2) числом протонов;
3) числом электронов; 4) числом нейтронов.
10. Температура кипения возрастает в ряду веществ,
формулы которых:
1)'H?,D„'HD; 2) *Н,,'HD, D,;
3)D2,'HD,'H2; 4)'HD,‘Н2, D2.
ТЕСТ 6
1. Формулы соответственно дейтерида натрия и ок-
сида трития приведены в паре:
l)Na'H, Т2О; 2)T2O,Na'H;
--- 342 ----
3) Na2H, T20; 4) Na2H, D,O.
2. Укажите коэффициент перед формулой FF в уравне-
нии реакции, схема которой NO3 + Н+ + 8е —> NH3 + Н,О:
1)7; 2) 8; 3)9; 4) 10.
3. Вода проявляет свойства основания (т.е. донора
электронов или акцептора протонов), реагируя с:
1)NH3; 2) HC1;3)HF;4) СН4.
4. Наиболее кислым будет раствор, для которого pH
равно:
1) 7,0; 2) 8,3; 3) 5,2; 4) 2,8.
5. С образованием ионов Н+ (Н3(У) в водном раство-
ре диссоциируют:
1) С3Н7ОН; 2) НС1; 3) NaHSO4; 4) СН4.
6. Для получения водорода в лаборатории обычно
используют:
1) Na и Н28О4(разб.); 2) Zn и Н,8О4(разб.);
3) Zn и СН3СООН; 4) Fe и н'О.
7. Физический (а не химический) процесс происхо-
дит при очистке воды с помощью:
1)катионитов; 2)озонирования;
3) хлорирования; 4) отстаивания.
8. К химическим свойствам воды НЕ ОТНОСЯТСЯ:
1) плотность;
2) способность реагировать с оксидами;
3) цвет;
4) температура кипения.
9. Имея только воду, можно различить между собой
пробирки с веществами одинакового цвета, формулы ко-
торых:
1) SiO, и СаО; 2) Na,SO4 и KNO3;
3) CuSO4 и СаС12; 4) H,SO4 и бензол.
--- 343 ----
10. Укажите НЕВЕРНЫЕ утверждения. Водород мо-
жет реагировать:
1) только с простыми веществами;
2) только с неметаллами;
3) только со сложными веществами;
4) со всеми перечисленными выше веществами.
ТЕСТ 7
1. Вода образуется при взаимодействии:
1) H,SO4 и Р,О.; 2) СаО и H,SO4;
3) Fe3O4 и Н~; ’ 4) NaOH и H,SO4.
2. Укажите коэффициент перед формулой восстано-
вителя в уравнении реакции между силицидом кальция
и водой:
1) 1; 2) 2; 3)3; 4) 4.
3. Бинарные соединения водорода с металлами на-
зываются:
1) гидридами; 2) оксидами;
3)гидратами; 4)гидроксидами.
4. Наибольшее химическое количество Н, выделяет-
ся, когда с Н78О4(разб.) взаимодействует 1 г металла:
l)Fe;2)Mg;3)Al;4)Zn.
5. Водород никогда не входит в состав:
1) щелочей; 2) оксидов; 3) солей; 4) интерметаллидов.
6. Гидрид кальция растворили в воде. Укажите Окраску
лакмуса в полученном растворе:
1) синяя; 2) фиолетовая; 3) красная; 4) желтая.
7. Только восстановительными свойствами в окисли-
тельно-восстановительных реакциях обладает частица,
формула которой:
1) Н2; 2) Н-; 3) Н+; 4)Н.
— 344 —
8. Наибольшее химическое количество Н, выделится,
когда с Н,8О4(разб.) реагирует 1 моль металла:
l)Mg;2) Fe; 3) Al; 4) Zn.
9. Укажите, сколько веществ из перечисленных (цик-
логексен, этан, оксид молибдена (VI), кремний, аммиак,
оксид алюминия, натрий) могут взаимодействовать с во-
дородом:
1)6; 2) 5; 3)4; 4)3.
10. В воде растворили гидрид калия. Какие вещества
могут реагировать с полученным раствором?
l)Zn(OH),; 2)А1,О3;
3)Mg(OH)2; 4)Na2[Zn(OH)J.
ТЕСТ 8
1. Подобно калию водород:
1) хорошо проводит электрический ток (н. у.);
2) взаимодействует с водой;
3) легко окисляется кислородом при температуре 20 °C;
4) взаимодействует с хлором.
2. Подобно хлору водород:
1) реагирует со щелочноземельными металлами;
2) реагирует с водой;
3) сильный окислитель;
4) газ (н. у.).
3. Вода — окислитель, реагируя с:
1) F,; 2) СаС2; 3) Mg2Si; 4) С12 (20 °C).
4. Водород НЕ используется для-
1) получения Mg из MgO;
2) синтеза аммиака;
3) получения метана в промышленности;
4) получения твердых жиров.
— 345 —
5. Растворимость веществ в воде последовательно
возрастает в ряду:
1)N„CO„NH3; 2) N„ NH3, СО,;
3) NH3, СО,, N,; 4) CO,, N2, NHy
6. Укажите верные утверждения:
1) плотность морской воды такая же, как и речной;
2) температура замерзания воды не зависит от ее
массы;
3) температура кипения морской воды выше, чем род-
никовой;
4) смесь воды с глицерином имеет более низкую тем-
пературу замерзания, чем водопроводная вода.
7. В качестве осушителей влаги можно использовать:
!)CuSO4HFeO; 2) Р,О5 и SiO,;
3) СаО и CuSO4; 4) H2SO4 и А1'О3.
8. Наименьшей электрической проводимостью обла-
дает вода:
1) дистиллированная; 2) морская;
3) речная; 4) океаническая.
9. Размер частиц сначала возрастает, а затем умень-
шается в ряду:
1) Н,, Н , Н; 2) Н, Н-, Н,; 3) Н,, Н, Н~; 4) Н , Н,, Н.
10. Гидрид-ион Н и катион Li+ отличаются:
I) размерами; больше радиус у Н ;
2) размерами; больше радиус у Li+;
3) числом электронов;
4) окислительно-восстановительными свойствами.
— 346 —
ТЕМА 25
Галогены. Хлор и его соединения
ТЕСТ1
1. Укажите справедливые утверждения для галогенов:
1) молекулы двухатомны (н. у);
2) высшая валентность атомов всех галогенов равна VII;
3) в соединениях с кислородом степень окисления
атомов всех галогенов положительная;
4) электронная конфигурация внешнего электронно-
го слоя атомов в основном состоянии — ns2np5 (и — но-
мер периода, в котором расположен элемент галоген).
2. Свою максимальную валентность атом хлора про-
являет в составе:
1) НС1О4; 2) C1F3; 3) НС1; 4) С12О7.
3. С разбавленной соляной кислотой реагирует каж-
дый из металлов ряда:
l)Fe,Cr,Au; 2)Al,Co,Hg;
3) Mg, Ni, Pt; 4) Zn, Mn, Fe.
4. Соляная кислота — окислитель, взаимодействуя с
веществами, формулы которых:
1) МпО2 и КМпО4; 2) Zn и Fe;
3) CuO и NaHCO3; 4) КС1О3 и А1,О3.
5. Наиболее сильными окислительными свойствами
обладает атом, сокращенная электронная конфигурация
которого:
I)... 2s22p5; 2)... 3s23ps; 3)... 4.г4р5; 4)... 5л25р5.
6. Сильвинит реагирует с:
1) H,SO4 (конц.); 2) НЫО3(конц.);
3) AgNO3 (р-р); 4) Ва(ОН)2 (р-р).
--- 347 —
7. Хлороводород в водном растворе по отдельности
реагирует со всеми веществами, формулы которых при-
ведены в ряду:
1) NaHCO3, KMnO4, NaNO3;
2) K^SO,, КНСО3, NaHSO4;
3) К3РО4, MnO„ KHSO3;
4) CH3COONa, K,S, РД.
8. Для атома хлора в соединениях НЕВОЗМОЖНЫ
степени окисления:
1)-1;2)-2; 3) +7; 4) +8.
9, Хлор по отдельности может реагировать со всеми
веществами, формулы которых приведены в ряду:
1) Н,О, КОН, КВг; 2) Са(ОН)„ KI, KF;
3) Fe, СН4, О2; 4) Sb, Н2, Ne.
10. Галогеноводород образуется при взаимодействии:
1) NaI(T) и H,SO4 (конц.); 2) КВг(т) и H2SO4 (конц.);
3) КЦт) и H2SO4 (конц.); 4) CaF^ и H2SO4 (конц.).
ТЕСТ 2
1. Укажите справедливые утверждения:
1) в каждом периоде из простых веществ наиболее
сильными окислителями являются галогены;
2) все простые вещества галогены имеют молекуляр-
ное строение (н. у.);
3) в ряду галогеноводородов наибольшую температу-
ру кипения имеет HI;
4) высшая степень окисления атомов всех галогенов
равна +7.
2. Галоген образуется в результате:
1) нагревания бертолетовой соли;
2) взаимодействия КВг (р-р) и С1,;
--- 348 ----
3) электролиза водного раствора СаС!,;
4) взаимодействия КМпО4 и НС1 (конц. р-р).
3. Хлорат калия образуется при взаимодействии:
1) С12 и КОН (р-р) (5 °C); 2) КМпО4 и НС1 (конц.);
3) КОН и НС1; 4) КОН (р-р) и Cl, (t°).
4. Водный раствор карналлита реагирует с вещества-
ми, формулы которых:
I) HNO3; 2) AgNO3; 3) КОН; 4) H,SO4 (разб.).
5. Сколько веществ, формулы которых HI, О,, Н„
H,SO4, KF, NH3, НЕ реагируют с хлором?
1)6; 2) 5; 3)4; 4)3.
6. Возможна химическая реакция между веществами:
1) С1, и KF (р-р); 2) Са(С1О), (р-р) и Н2СО3;
3) KNO3 и НС1 (р-р); 4) KI (р-р) и Вг,.
7. Укажите, сколько веществ, формулы которых
Na3[Al(OH)6], Zn(NO3)2, К^ВеО,, Ca(HSO3)2, NaHSO4, NH
Си, могут реагировать с разбавленной соляной кислотой:
1)7; 2) 6; 3)5; 4) 4.
8. Смесь солей хлорноватистой и соляной кислот об-
разуется при взаимодействии:
1) КМпО4 и НС1 (конц.);
2) С1, и КОН (5 °C);
3) С1, и NaOH (t°);
4) МпО, и НС1 (конц.) (t°).
9. Фтор входит в состав:
1) сильвинита; 2) флюорита;
3) криолита; 4) карналлита.
10. Массовая доля (%) атомов фтора в составе плави-
кового шпата равна:
1)38,7; 2) 48,7; 3) 58,7; 4) 68,7.
— 349 —
ТЕСТЗ
1. Укажите справедливые утверждения:
1) соединения галогенов с типичными металлами
имеют ионное строение;
2) в ряду галогеноводородных кислот самой сильной
является HF;
3) в ряду F2, Cl2, Br2, I, окислительная способность
галогенов возрастает;
4) в ряду KI, KBr, КО, KF температура плавления
увеличивается.
2. Иод можно получить:
I) электролизом водного раствора KI;
2) обработкой KI (т) концентрированной серной кис-
лотой;
3) обработкой водного раствора Nal хлорной водой;
4) действием раствора КВг на раствор Nal.
3. Бром и иод между собой различаются:
1) окраской простых веществ;
2) агрегатным состоянием простых веществ (20 °C,
нормальное давление);
3) числом электронных слоев в основном состоянии
атома;
4) общей формулой летучего водородного соединения.
4. Бромид калия можно получить при взаимодействии-
1) K2so4 (р-р) и НВг; 2) KI (р-р) и Вг2;
3) AgBr и KNO3 (р-р); 4) КНСО3 (р-р) и НВг.
5. В отличие от других галогенов фтор реагирует с:
I ) водородом; 2) водой;
3 ) оксидом кремния (IV); 4) цинком.
6. Как водород, так и хлор реагируют с:
1) водой; 2) натрием; 3) аммиаком; 4) серой.
— 350 —
7. Укажите формулу основного активного компонен-
та белильной (хлорной) извести:
1) КСЮ; 2) СаС!,; 3) Са(С1О)2; 4) Са(С1О3),.
8. Хлориды образуются при взаимодействии:
1) BaSO4 и НС1 (р-р); 2) NaBr (р-р) и С1,;
3) AgNO3 (р-р) и HCI; 4) хлорной воды и К1.
9. При нагревании бертолетовой соли в присутствии
катализатора образуются:
I) С1,О; 2) КС1; 3)0,; 4) С!,.
10. При взаимодействии бертолетовой соли с крас-
ным фосфором образуются:
1) Н3РО4; 2) Р2О5; 3) КС1; 4) С!,.
ТЕСТ4
1. Для хлора НЕВЕРНЫ утверждения:
1) желто-зеленая жидкость (н. у.);
2) в природе в основном встречается в виде соеди-
нений;
3) в соединениях с кислородом имеет отрицательную
степень окисления;
4) в реакции хлора с железом (нагревание, избыток
хлора) образуется хлорид железа (II).
2. Как с хлором, так и разбавленной соляной кисло-
той реагируют вещества, формулы которых:
1) Са(ОН),; 2) Zn; 3) Nal; 4) Ag.
3. Хлор реагирует, а разбавленная соляная кислота—
нет с веществами, формулы которых:
1) КВг; 2) NaOH; 3) Cal,; 4) NaHCO3.
4. Галоген образуется при взаимодействии:
1) Zn и НС! (р-р); 2) КМпО4 и HI (конц. р-р);
3) СаО и НС! (р-р); 4) НВг(р-р) и МпО, (/°).
--- 351
5. С участием галогеноводородов НЕВОЗМОЖНА
реакция, схема которой:
1) НВг+О, —> Н,О + Вг,;
2) НО + О’—» н’О + С1,;
3) HI + О, Н,О + I,; ’
4) HF + О’, -> Н,О + F,.
6. Восстановительные свойства наиболее выражены
у одноатомного аниона, сокращенная электронная кон-
фигурация которого:
l)[...2s22p6] ; 2) [...З^Зр6]-;
3)[...4s24p6] ; 4)[...5s25p6] .
7. Степень окисления атома хлора изменяется от 0 до
-1 и + 5 в результате реакции, протекающей при:
1) нагревании КС1О3 в присутствии МпО,;
2) пропускании хлора в холодный раствор КОН;
3) пропускании хлора в горячий раствор NaOH;
4) взаимодействии хлора с раствором KI.
8. Температура плавления галогенов последователь-
но возрастает в ряду соединений, формулы которых:
l)Br2,Cl2,I,; 2)1„Вг2, С12;
3)С1,,12,Вг2; 4)С1,,Вг2,12.
9. При нагревании до 1000°С 30% HI распадается на
простые вещества. Укажите объемную долю (%) I, в сме-
си при данной температуре:
1) 10; 2) 15; 3)20; 4) 25.
10. Степень окисления атома хлора последовательно
уменьшается в ряду соединений, формулы которых:
1) СН3С1, Ва(СЮ4)„ Са(СЮ),;
2) Са(СЮ),, СН3С1' Ва(С1О4)‘;
3) СН3С1, Са(С1О)„ Ва(С1О4)';
4) Ва(С1О4)2, Са(С1О)2, СН3С1.
--- 352 ---
ТЕСТ 5
1. Для хлора верными являются утверждения:
1) атомы хлора отличаются от атомов всех остальных
элементов зарядом ядра;
2) атомы хлора отличаются от атомов других галоге-
нов числом валентных электронов;
3) в ряду галогенов простое вещество хлор — самый
сильный окислитель;
4) межмолекулярное взаимодействие в простом ве-
ществе хлор менее эффективно, чем в простом веществе
бром. -
2. Хлорноватая кислота имеет формулу НС1О3, а оксид
лантана—Ьа2О3. Укажите формулу хлората лантана:
1) La2C103; 2) LaC103; 3) La2(C103)3; 4) La(C103)3.
3. Как KI, так и КВг в водном растворе реагируют с:
1) Ва(ОН)2; 2) С12; 3) AgNO3; 4) НО.
4. Укажите формулу наиболее сильного восстано-
вителя:
1)С12;2)12;3)С1-;4)1-.
5. С иодоводородной кислотой реагируют по отдель-
ности все вещества, формулы которых приведены в ряду:
1) Cl2, KHSO3, НС1; 2)Br„NH,,AgNO3;
3) ZnO, CuO, NaHSO4; 4) A1(OH)3, Al, CO2.
6. Для осушения хлороводорода НЕЛЬЗЯ исполь-
[ зовать:
1) Р2О5; 2) СаС12; 3) СаО; 4) Н^О/конц).
7. Хлорная вода реагирует с:
1) KF и NaNO3; 2) K.SO3 и Na9SO4;
3)H2SnAgF; 3)AgNO3nNH3
8. Связь Н-галоген наименее полярная в молекуле:
1) HI; 2) НВг; 3)HC1;4)HF.
I 12 Зак. 1530 --- 353 --
9. Соляная кислота-— восстановитель, реагируя с:
1) Ba(HSO3),; 2) КМпО4; 3) МпО,; 4) NH3.
10. Хлороводород или соляная кислота образуются при
взаимодействии:
1)№С1(р-р)иН28О4(разб.); 2)КС1 (т)иН,8О4(конц.);
3) ВаС1,(р-р)и Н,8О4(разб.); 4) СН4и С1, (освещение).
ТЕСТ 6
1. Температура кипения последовательно возрастает
в ряду веществ, формулы которых:
1) Н,О, С1„ HF; 2) Н,О, HF, С1,;
3) Cl,, HF, , Н,О; 4) HF, С12, Н,О.
2. Атомы 35С1 и 79Вг между собой отличаются:
1) массой;
2) размерами;
3) числом валентных электронов;
4) числом электронных слоев в основном состоянии.
3. Кислые соли могут образовывать обе кислоты:
1) хлористая и угольная;
2) хлорноватая и сероводородная;
3) плавиковая и фосфорная;
4) хлорноватистая и угольная.
4. Хлорид меди (II) образуется при взаимодействии:
1) Си и НС1 (р-р); 2) (CuOH)Cl и НС1;
3) (CuOH)Cl и КОН (р-р); 4) CuSO4 (р-р) и ВаС1,.
5. Степень окисления атома хлора равна +5 в частицах:
1) C1F4+; 2)€1О4; 3) PCL; 4) СЮ"
6. В ряду соединений PF3; РС13, РВг3 степень поляр-
ности связи Р-галоген:
1) сначала возрастает, затем уменьшается;
2) сначала уменьшается, затем возрастает;
--- 354 ---
3) монотонно уменьшается;
4) монотонно увеличивается.
7. Укажите схему реакции получения хлора в промыш-
ленности:
1) МпО, + НС1 -> MriCl, + С12 + НЭО;
2) NaCl Na + Cl’;
3) KMnO4 + НС! -> KC1 + MnCl, + Cl, + H,O;
4) KC1O3 + НС1 -э КС1 + Cl, + H2O.
8. Иод наименее растворим в:
1)воде; 2)бензоле;
3) гексане; 4) бензине.
9. Укажите, какие явления с участием галогенов будут
физическими:
1) растворение брома в воде;
2) возгонка иода;
3) сжижение хлора;
4) нагревание смеси алюминия и иода в присутствии
воды.
10. Атомы хлора выполняют функцию как окислите-
ля, так и восстановителя в реакции между:
1) О, и Н,О; 2) С1, и КОН (р-р);
3) КС1О3 и Р4; 4) КСЮ и Н,СО3.
ТЕСТ 7
1. Укажите НЕВЕРНЫЕ утверждения:
1) атомы фтора имеют самую большую электроотри-
цательность среди атомов всех элементов;
2) в природе элемент фтор находится главным обра-
зом в составе молекул фтора;
3) фтор — наиболее сильный окислитель из всех га-
логенов;
--- 355 ----
4) атомы фтора — самые легкие из атомов химичес-
ких элементов.
2. Массовая доля атомов хлора наибольшая в составе:
1) нашатыря; 2) каменной соли;
3) сильвинита; 4) хлористой кислоты.
3. Укажите свойства, присущие хлору:
1) ядовит; 2)легче воздуха;
3) сильный окислитель; 4) желто-зеленый газ (н. у).
4. Хлор реагирует с веществами, формулы которых:
1) S; 2) Н,О; 3) O2;4)H2S.
5. Укажите степень окисления атома хлора в молеку-
ле NC1V учитывая, что в реакции, схема которой NC1,
+Н,О —» NH. + НС1О, его степень окисления не изменяется:
1) + 3;2)+1;3)-1;4)-3.
6. Переход (MgOH)Cl —> MgCl, можно осуществить с
помощью:
1) КС1; 2) Н2О; 3) КОН; 4) НС1.
7. Укажите формулы соответственно веществ X и У в
схеме превращений: КВг Вг, —U. НВг:
1) С12, Н,; 2) 12, Н2; 3) Cl,, НС1; 4) I,, Н,О.
8. Атомы всех галогенов проявляют в соединениях
степень окисления:
1)+7; 2)4-5; 3)4-1; 4)—1.
9. Все галогеноводороды в растворе вступают в реак-
цию с:
1) бромом; 2) нитратом серебра (I);
3) оксидом марганца (IV); 4) гидроксидом калия.
10. Наиболее полно хлор поглощает:
1) вода;
2) раствор хлорида кальция;
3) разбавленная серная кислота;
4) концентрированный раствор гидроксида калия.
--- 356 ---
ТЕСТ 8
1. Плавиковая кислота в отличие от соляной реагирует с.
1) SiO2,2) AgNO,, 3) Ca(NO3)2,4) КВг.
2. Соляная кислота реагирует, а плавиковая — нет с:
1) KI; 2) AgNO3, 3) Са(ОН)2; 4) K2SO4
3. В отличие от хлора фтор реагирует с
1) SiO2,2) Н2О; 3) NaBr(p-p); 4) КС!(р-р).
4. Появление бурой окраски свидетельствует о проте-
кании реакции между:
1) КВг (р-р) и С12;
2)А1(ОН)3 иНС1(р-р);
3)NaC! (т) и H2SO4 (конц.);
4) КВг (т) и H2SO4 (конц.)
5. Выделение газа свидетельствует о протекании ре-
акции между.
1)ПаВг(р-р)иС12,
2) КС1(т) и H2SO4 (конц );
3) ВаС12(р-р) и H2SO4 (разб),
4) AgNO3 и КС! (р-р).
6. После протекания реакции между какими вещества-
ми в растворе смесь окрашивается крахмалом в синий цвет?
1) НС! и MgCO3,2) С12 и KI; 3) С12 и NaBr; 4) МпО2 и НС1.
7. Укажите последовательность реагентов и условия,
которые позволяют осуществить превращения по схеме
KI -> КС! -> НС! С12 -> КСЮ:
1) Cl2, H2SO4(pa36 ), Mnd2, КОН (5 °C);
2) Cl2, H,SO4 (конц.), KMnO4, KI;
3) Cl,, H2SO4 (конц.), КМпО4, КОН,
4) Cl,, H2SO4 (конц ), МпО2, КОН (/°)
8. Для разделения анионов F и С! используются ка-
тионы:
1) NH4; 2) Ag+; 3) Cu2+; 4) Mg2+.
9. Белильную (хлорную) известь получают из реагентов:
1) КОН и С1,; 2) Са(ОН), и НС1;
3) Са(ОН)2 и С1,; 4) КОН и НС1.
10. Укажите график изменения от времени t массы
твердого остатка т при длительном нагревании берто-
летовой соли:
ТЕСТ 9
1. С наибольшей скоростью соляная кислота реагиру-
ет с металлом:
l)Mg; 2)Zn; 3)Fe; 4) Sn.
2. С наибольшей скоростью протекает реакция между
соляной кислотой и:
1) Fe; 2) NaOH (р-р); 3) Zn; 4) СаСО3.
3. Укажите уравнение качественной реакции на хло-
рид-ион:
1) Na+ + Cl" = NaCI; 2) Н+ + Cl = НС1;
3) Ag+ + Cl"=AgCl; 4) 2C1~ + F2 = 2F” + Cl,.
4. Соляная кислота является восстановителем и уча-
ствует в образовании соли, когда она реагирует с:
1) CuO; 2) МпО,; 3) NH3; 4) КМпО4.
--- 358 ---
5. Соляная кислота является окислителем и участвует
в образовании соли, когда она реагирует с:
1) Zn; 2) Ca,Si; 3) КН; 4) КМпО4.
6. Через раствор, содержащий KF, КВг и KI, пропус-
кают избыток хлора. При этом образуются
1) I,, Br,, F,, КС1; 2) только I, и КС1;
3) только Вг2 и КС1; 4) I2, Br9, КС1.
7. Хлор НЕ может реагировать с веществами, форму-
лы которых:
1) HF; 2) 01,0,; 3) СС14; 4) О,.
8. Ковалентная связь наименее полярна в молекуле:
1)HF; 2) SF6;3)OF2; 4) NF,.
9. Хлорноватистая кислота образуется при взаимо-
действии:
1) С12 и Н2О (С); 2) С12 и Н2О (5 °C);
3)Н2иС12(/°); 4) NaOH (р-р) и НС1.
10. Степень окисления атома хлора отрицательная во
всех его соединениях с элементами:
1) VIIA группы; 2) VIA группы,
3) ПА группы; 4) 3-го периода (кроме Аг).
ТЕСТЮ
1. В разбавленной соляной кислоте можно без остат-
ка растворить:
1) чугун; 2) латунь; 3) феррохром, 4) мельхиор.
2. Какая часть массы (%) НС1 расходуется на образо-
вание соли в реакции между НО (конц.) и КМпО4?
1)36,5; 2) 37,5; 3)38,5; 4) 39,5.
3. При пропускании газа через водный раствор КВг
появилось красно-бурое окрашивание Укажите форму-
лу газа:
--- 359 —
4. Окислительно-восстановительная реакция проте-
кает при взаимодействии:
1) SiO, и HF (р-р); 2) SiO, и F2;
3) Н,б и F,; 4) С1, и NaOH(p-p, 5 °C).
5. Реакция хлора с холодной водой обратима. Чтобы
сделать ее необратимой, необходимо добавить в воду:
1) НС1; 2) Аг; 3) КОН; 4) СН4.
6. Укажите формулу газа, при пропускании которого
через бромную воду интенсивность окраски, присущей
брому, усилится:
1)НС1; 2) С12;3)Н,;4)С2Н4.
7. Склянка с бромной водой обесцветится, если через
нее пропускать:
1) азот; 2) водород; 3) кислород; 4) этен.
8. В свежеприготовленной холодной хлорной воде
содержатся частицы:
1)Н+, НС1, НСЮ, С1„ СЮ ;
2)Н+, НСЮ, С1„ СГ, О2-;
3) Н+, С1, СЮ , НСЮ, С1,;
4)Н+, НСЮ, С12, СЮ,О2=.
9. Отбеливающие свойства белильной (хлорной) из-
вести обусловлены частицами:
1) молекулами НС1;
2) молекулами О,;
3) атомарным кислородом;
4) атомами хлора в степени окисления +1.
10. Укажите формулы частиц, которые будут содержать-
ся в хлорной воде после ее длительного нагревания:
1)С1,;2)СЮ ; 3)Н^;4)С1 .
— 360 —
ТЕМА 26
Общая характеристика элементов VIA группы.
Кислород
ТЕСТ1
1. Укажите верные утверждения для элементов VIA
группы:
1) высшая валентность атомов всех элементов равна VI;
2) все элементы являются неметаллами;
3) с ростом атомного номера металлические свойства
усиливаются;
4) низшая степень окисления атомов равна -2.
2. Восстановительные свойства анионов последова-
тельно нарастают в ряду:
1) О2, S2-, Se2-; 2) S2, О2-, Se2;
3) Se2-, S2-, О2-; 4) О2-, Se2’, S2.
3. Окислительные свойства веществ последователь-
но ослабевают в ряду:
1) теллур, сера, селен; 2) сера, теллур, селен;
3) сера, селен, теллур; 4) селен, сера, теллур.
4. Элемент VIA группы с водородом образует летучее
соединение, в котором массовая доля атомов водорода
равна 2,47%. Укажите символ элемента:
1) О; 2) S; 3) Se; 4) Те.
5. Для атомов S и Сг одинаково число:
1) протонов;
2) электронных слоев;
3) валентных электронов;
4) всех электронов.
— 361
6. Высшая степень окисления правильно указана в
случаях:
1) Сг+6; 2) Se+4; 3) О+2; 4) S"2.
7. Формулы веществ в порядке увеличения темпера-
туры кипения записаны в ряду:
1) О3, О„ НД 2) О„ НД О3;
3) О3, Н,О, О,; 4) О2, О3, Н2О.
8. Температура кипения последовательно нарастает в
ряду веществ, формулы которых:
1) Н7, Н Д Н?О7, О7; 2) Н,, О7, Н7О, Н7О7;
3) Н2, О2, Н2б2, НД 4) О2, Н2, НД НД.
9. В атмосфере кислорода не сгорают газы, формулы
которых:
1)СН4; 2) СО; 3) СО2; 4) SF6.
10. Кислород выделяется при нагревании:
1) малахита; 2) перманганата калия;
3) оксида ртути (II); 4) хлората калия.
ТЕСТ 2
1. Укажите справедливые утверждения для элемен-
тов VIA группы:
1) с увеличением атомного номера возрастает число
электронных слоев в атоме;
2) энергия связи в водородных соединениях с уве-
личением заряда ядра атома уменьшается;
3) кислотные свойства оксидов состава ЭО3 с увели-
чении атомного номера элемента усиливаются;
4) кислотные свойства водородных соединений со-
става Н2Э с увеличением заряда ядра атома ослабевают.
2. Степень окисления атомов кислорода равна —1 в
составе:
1) ОД; 2)КД2; 3) КО2; 4) РеД.
-------------------- 362 --
3. При равных массах разложение какого вещества при
нагревании даст наибольший объем кислорода?
1) Н2О,; 2) КС1О3; 3) КМпО4; 4) HgO.
4. Укажите возможные степени окисления атома кис-
лорода в соединениях:
1)—2; 2) +2;3)+6;4)-1.
5. Слева направо сила кислот последовательно нара-
стает в ряду:
1) Н,ТеО3, H,SO3, H,SeO3;
2) H;SO3, H,SeO3, НДеО3;
3) Н>О3, Н,ТеО3, H,SO3;
4) Н'ТеО3, H~SeO3, H,SO3.
6. Озон — это:
1) изомер кислорода;
2) изотоп кислорода;
3) аллотропная модификация кислорода;
4) соединение кислорода с водородом.
7. В описании кислорода верны характеристики:
1) самый распространенный на Земле элемент;
2)легче воздуха;
3) связи в молекуле О, образованы за счет перекры-
вания Зр-орбиталей;
4) плохо растворим в воде.
8. Кислород может реагировать с веществами, фор-
мулы которых:
1) S и Au; 2) Н2 и С1,; 3) С и Pt; 4) Си и Si.
9. Кислород образуется при нагревании:
1) AgNO3; 2) Н,О, (в присутствии МнО2);
3) (CuOH),CO3; 4)NaHCO3.
10. Укажите схему реакции, обеспечивающей накоп-
ление кислорода в природе:
1) Н,О -> Н, + О,; 2) СО, + Н,О -> С6Н„О6 + О,;
3) О3 -> О,; 4) Na,O, + СО, -> Na2CO3 + О,.
— 363 —
ТЕСТЗ
1. Укажите справедливые утверждения для элемен-
тов VIA и VIB групп:
1) атомы элементов обеих групп содержат шесть ва-
лентных электронов;
2) оксид серы (VI) в отличие от оксида хрома (VI) ре-
агирует со щелочами;
3) все элементы группы VIA — неметаллы, a VIB —
металлы;
4) элементы VIA группы относятся к /^-семейству, а
VIB — к б/-семейству.
2. Кислород и озон между собой различаются:
1) агрегатным состоянием (н. у.);
2) химической активностью;
3) плотностью (н. у.);
4) температурой кипения.
3. Атомы кислорода являются и окислителями, и вос-
становителями в процессах, схемы которых:
1) К,О + СО2 -> К,СО3;
2) КО, + СО, -> К,СО3 + О,Т;
3) К,О, + СО, -» к,СО3 + О,;
4) Н,О, + KMnO4 + <SO4 -> 6, + MnSO4 + K,SO4 + Н,О.
4. Укажите схемы реакций горения:
1) КС!О3 —> КС! + О,; 2) СН4 + О, -> СО, + Н,О;
3) N, + О, NO; ‘ 4) Н, + О, —> Н,О.
5. В промышленности кислород получают:
1) из воздуха;
2) нагреванием бертолетовой соли;
3) разложением пероксида водорода при нагревании;
4) нагреванием перманганата калия.
6. Кислород можно обнаружить с помощью:
1) раствора щелочи; 2) тлеющего уголька;
— 364 —
3) углекислого газа; 4) соляной кислоты.
7. Для эффективного собирания газа Оэ открытую про-
бирку держат:
1) вертикально, отверстием вниз;
2)горизонтально;
3) вертикально, отверстием вверх;
4) в любом из указанных положений.
8. НЕ существует(ют) анион(ы):
1) О| ; 2) О2; 3) О3; 4) О3.
9. При обычных условиях (20°С) сколь угодно долго в
смеси с кислородом могут находиться газы, формулы ко-
торых:
1)N2; 2) H,S; 3)NO; 4) Ne.
10. Укажите плотность (г/дм3) кислорода (н. у.):
1)0,71; 2) 1,25; 3) 1,43; 4) 2,41.
ТЕСТ 4
1. В виде простого вещества кислород содержится в:
1) солях; 2) атмосфере; 3) оксидах; 4) гидроксидах.
2) В атмосфере кислорода НЕ способны окисляться:
1) SO2; 2) H2S; 3) SO3; 4) Р2О5.
3. Кислород обязательно входит в состав:
1)солей; 2)гидроксидов; 3)кислот; 4)оксидов.
4. Кислород может окислить вещества, формулы которых:
1) N2 и F2; 2) S и Аг; 3) С и Si; 4) Н,и Си.
5. Степень окисления атома кислорода минимальна
в составе вещества, формула которого:
1) O2F2; 2) КОЭ; 3) К2О2; 4) CsO3.
6. Одинаковые объемы О, и озонированного кисло-
рода (н. у.) по массе отличаются на ш г. Укажите массу
(г) О3 в озонированном кислороде:
1) 1,5 ш; 2) 2,0 ш; 3) 3,0 т; 4) 3,5 т.
— 365 —
7. Какой объем (дм3, н.у.) О, выделился в процессе
фотосинтеза, если при этом образовалась глюкоза мас-
сой 3,6 г?
1)3,69; 2)2,69;
3)4,69; 4)1,79.
8. С наибольшей скоростью железо окисляется:
1) на воздухе, t = 20 °C;
2) в атмосфере О„ t = 20 °C;
3) на воздухе, t = 600 °C;
4) в атмосфере О2, t = 600 °C.
9. Экзотермическими будут процессы, схемы которых:
1) О, —» О3;
2) СО, + Н,О-э С6Н,,О6 + О,;
3) СН4 + О2 -> СО, + Н,О;
4) Н2 + О2-*Н2О.‘
10. Объемная доля О, в воздухе равна 21%. Какую
массу воздуха (г) нужно взять для получения кислорода
массой 10 г (условия нормальные)?
1)43,2; 2)42,2;
3)41,2; 4)40,2.
ТЕСТ 5
1. Участие кислорода обязательно в процессах:
1)окисления;
2) ржавления железа на воздухе;
3)горения;
4) фотосинтеза.
2. Имеются порции равных объемов О, и О3. Укажи-
те, чему равно отношение ;и(О3)//и(О,):
1) М(О3)/М(О,); 2)2/3;
3)3/2; ' 4) М(О2)/М(О3).
— 366 —
3. Укажите, сколько веществ из перечисленных
(H,SO4, Cl,, СН4, SiO,, Р,О3, Fe3O4) могут реагировать с
кислородом:
1)5; 2) 4; 3)3; 4) 2.
4. В смеси О, и О3 на 1 молекулу О3 приходится 10 ато-
мов О. Объемная доля (%) О, в смеси равна:
1)47,8; 2) 57,8; 3) 67,8; 4) 77,8.
5. Без участия кислорода могут протекать процессы:
1) дыхания живых организмов и растений;
2) горения;
3)гниения;
4)окисления.
6. Имеются порции равных масс О, и О3. Укажите,
чему равно отношение К(О,)/И(О3):
1) М(О3)/М(О,); 2) М(О,)7М(О3); 3) 3/2; 4) 2/3.
7. В уравнении реакции PbS + 4О3 = X + 40, формула
вещества X — это:
1) РЬ; 2) PbS,;
3) PbSO4; 4) PbSO3.
8. При разложении одного моля какого вещества вы-
деляется наибольший объем кислорода?
1) КМпО4; 2) Н,О,; 3) КС1О3; 4) KNO3.
9. Укажите ряд, в котором формулы веществ записаны
в порядке возрастания их окислительной способности:
1) Н„ О3, О,; 2) Н„ О„ О3;
3) О,, О3, Н,; 4) О„ Н2, О3.
10. Какой объем (дм3, н.у.) озона потребуется для окис-
ления серебра массой 1,08 г (один из продуктов — Ag,O)?
1) 0,112; 2) 0,224; 3) 0,336; 4) 0,448.
-— 367 —
ТЕМА 27
Сера и ее оксиды. Сероводород. Сульфиды
ТЕСЛ
1. Молекулярную кристаллическую решетку в твердом
состоянии имеют вещества, формулы которых:
1) K,S и SO,; 2) Na2SO3 и SO3; 3) SO, и H2S; 4) SO3 и S8.
2. Сера — восстановитель, реагируя с:
1) О, и Р; 2) Р и С12; 3) О, и С1,; 4) F, и Си.
3. Сера может реагировать с каждым из веществ, фор-
мулы которых приведены в рядах:
1)О2,Н2, С12, Си;
2) Ag, HNO3 (конц.), Fe, Au;
3)С12, С, HCl(p-p);Pt;
4) Hg, HNO3 (конц.), H2SO4 (конц.), KNO3(/°).
4. Оксид серы (IV) образуется в качестве конечного
продукта при взаимодействии:
1) CuS и О2 (изб.); 2) О2 и H2S (изб.);
3) KHSO3 и НС1 (р-р); 4) Ag и H2SO4 (конц.).
5. SO, — окислитель, реагируя с:
1) О2; 2) H2S; 3) С; 4) Н,О.
6. Массовая доля атомов серы наибольшая в составе:
1) киновари; 2) пирита;
3) свинцового блеска; 4) медного блеска.
7. Сероводородная кислота может реагировать с ве-
ществами, формулы которых:
1) Na2S; 2) NaHS; 3) HNO3 (конц.); 4) КС1.
8. Оксид серы (IV) НЕ образуется в результате:
1) обжига пирита;
2) обжига известняка;
— 368 —
3) сгорания сероводорода в избытке кислорода;
4) взаимодействия цинка и разбавленной серной
кислоты.
9. Сера — окислитель, реагируя с:
1) ртутью; 2) фосфором;
3) хлором; 4) концентрированной азотной кислотой.
10. Сера проявляет свою минимальную степень окис-
ления в составе:
1) сульфатов; 2) сульфидов; 3) сульфитов; 4) пирита.
ТЕСТ 2
1. Укажите справедливые утверждения:
1) демеркуризация — это получение серы из кино-
вари;
2) плотность ромбической серы выше, чем моно-
клинной;
3) сера подобно фосфору входит в состав тканей орга-
низмов животных;
4) в природе отсутствует соединение серы PuS.
2. Присутствие в водном растворе сульфид-ионов
можно доказать с помощью катионов:
1) К+; 2) Си2+; 3) РЬ2+; 4) Na+.
3. Сера образуется при взаимодействии:
1) SO, и H2S; 2) H,S и О2 (избыток);
3) О, и H2S (избыток); 4) K^S и НС1 (р-р).
4. Сульфид можно получить при взаимодействии:
1) CuSO4 (р-р) и H,S ; 2) K,S и NaOH (р-р);
3) Fe и S (/°); ' 4) KHS и КОН (р-р).
5. Гидросульфиты образуются, когда между собой ре-
агируют:
1) 1 моль SO3 и и 1 моль КОН (р-р);
— 369 —
2) 2 моль КОН (р-р) и 1 моль H2S;
3) 1 моль SO, и 1 моль NaOH (р-р);
4) 3 моль SO, и 1 моль Ва(ОН)2 (р-р).
6. Сероводород можно получить при взаимодействии:
1) KHS и КОН (р-р); 2) S и Н, (С);
3) K,S и HNO3 (конц.); 4) NaHS (р-р) и НС1.
7. Через раствор Ва(ОН), пропускают избыток серо-
водорода. При этом последовательно образуются:
l)Ba(HS),, BaS; 2)BaS,BaSO3;
3) BaS, Ba(HS),; 4) BaS, Ba(HSO3)2.
8. Через раствор KOH пропускают избыток оксида
серы (IV). При этом последовательно образуются:
1)K2S, KHS; 2) K,S, KHS;
3) K2SO3, KHSO3; 4) KHSO3, K2SO3,
9. В химических реакциях для оксида серы (VI) харак-
терны свойства:
1) окислителя; 2) кислотного оксида;
3) восстановителя; 4) амфотерного оксида.
10. Кислотные свойства оксид серы (IV) проявляет,
взаимодействуя с:
1) СаО; 2) H2S; 3) О2; 4) Ва(ОН)2.
ТЕСТЗ
1. Оксид серы (IV) может реагировать с:
1) О,; 2) H2S; 3) K2SO4 (р-р); 4) Na2SO3 (р-р).
2. Оксид серы (VI) может по отдельности взаимодей-
ствовать со всеми веществами, формулы которых:
1) КОН, СаО, О„ Н,О;
2) Н,О, Ва(ОН)2' H,S, К,О;
3) NaOH, Ca(OH)„ HNO3, H,S;
4) Н,О, ВаО, LiOH, HNO3.
--- 370 ---
3. Водный раствор горькой соли в отличие от водно-
го раствора глауберовой соли реагирует с:
1)ВаС12; 2) NaOH;
3) Pb(NO3)2; 4) HNO3 (конц.).
4. Степень окисления атома серы равна +6 в составе:
1) SO2C12; 2) H2S2O7; 3) SF6; 4) NH4HSO3.
5. Водный раствор оксида серы (IV) реагирует с ве-
ществами, формулы которых:
1) CaSO3; 2) NaHSO3; 3) Na2SO4; 4) H,S.
6. В насыщенном водном растворе сероводорода при-
сутствуют частицы, формулы которых в порядке убыва-
ния молярной концентрации приведены в ряду:
1) Н2О, H7S, Н+, S2, HS ;
2) Н2О, H,S, Н+, HS, S2-;
3) H2S, Н2’О, Н+, HS , S’;
4) H2S, Н2О, HS , Н+, S2-.
7. В водном растворе с ®?(H2SO4) = 98% присутству-
ют частицы, формулы которых в порядке возрастания
молярной концентрации приведены в ряду:
1) SO2', FT, HSO4, H,SO4, Н2О;
2) SO2’, Н\ HSO,, Н2О, H7SO4;
3) SO2-, HSO4, Н+, Н,О, H7SO4;
4) SO2’, H2SO4, HSO", H+, H2O.
8. Молекулярное строение (н. у.) имеют:
1) H2S; 2) K2S; 3) SO2; 4) KHSO3.
9. Сульфид свинца (II) образуется, когда с разбавлен-
ным водным раствором K,S реагируют:
1) РЬ(СН3СОО)2; 2) РЬ; 3) Pb(NO3)2; 4) РЬ(НСОО)2.
10. Укажите число реагентов (бром, хлорная вода, кис-
лород, оксид серы (IV), концентрированная серная кисло-
та), которые могут взаимодействовать с сероводородом:
1)5; 2) 4; 3) 3; 4) 2.
— 371
ТЕСТ 4
1. Минимальную степень окисления атомы серы про-
являют в составе:
1) SCI,; 2) K2S; 3) FeS,; 4) HS;. '
2. В смеси Ss и Р4 на один атом S приходится 5 ато-
мов Р. Укажите массовую долю (%) Sg в смеси:
1) 16,1; 2) 17,1; 3) 18,1; 4) 19,1.
3. В водном растворе сернистого газа соответствен-
но максимальна и минимальна концентрация ионов:
1)H+hSO2~; 2)IKhHSO3;
3) HSO; и SO2-; 4) ОН и 1-Г.
4. Как сульфид натрия, так и сульфит натрия реаги-
руют с:
1) КС1 (р-р); 2) H2SO4; 3) HNO3; 4) Pb(CH3COO)2(p-p).
5. В водном растворе сульфид натрия реагирует, а суль-
фат натрия — нет с веществом, формула которого:
1) FeCl,; 2) НС1; 3) KNO3; 4) NaOH.
6. НЕ могут находиться совместно в значительных
количествах в водном растворе ионы:
1) IГ и S2-; 2) HS и ОН’; 3) ОН и S2-; 4) К' и SO32’.
7. В насыщенном растворе KHS минимальна концен-
трация частиц:
1) К+; 2) Н’; 3) HS; 4) S2-.
8. Атом серы отличается от атомов остальных элемен-
тов VIA группы:
1) числом электронных слоев;
2) числом валентных электронов;
3) зарядом ядра;
4) размерами.
9. Как кислород, так и сера проявляют окислитель-
ные свойства, реагируя с:
1)Н2; 2)Р4; 3)C12;4)F2.
--- 372 ---
10. Сера может образоваться, когда с HNO3 реагирует:
1) H,S; 2) SO2; 3) SO3; 4) H2SO4.
ТЕСТ 5
1. Краткое ионное уравнение SO| + 2Н+ = Н,0 + SO,
отвечает взаимодействию:
I) CaSO3 и НС1 (р-р); 2) Na,SO3 и Н,8О4(разб.);
3) KHSO3 и H,SO4(разб.); 4) Na’SO3 и НС1 (р-р).
2. Осадок вначале образуется, а затем растворяется,
когда к водному раствору Ва(ОН), приливают избыток
концентрированного раствора:
1) H2SO4; 2) HNO3; 3) K,SO4; 4) NaCl.
3. Соляная кислота реагирует с соединениями серы:
1) сульфитом калия; 2) гидросульфитом натрия;
3) гидросульфатом калия; 4) сульфидом железа (II).
4. Степень окисления атома серы повышается, когда
между собой реагируют:
I) FeS, и О,; 2) S и Н,;
3) S и HNO3 (конц.); 4) KHSO3 и НС1 (р-р).
5. Степень окисления атома серы понижается, когда
между собой реагируют:
I) Си и S; 2) H,S и О2; 3) H,S и С1,(р-р); 4) SO, и С (С).
6. Водные растворы Na,S, Na2SO3 и Na,SO4 можно
различить с помощью:
I) KNO3; 2) КОН; 3) НС1; 4) NaBr.
7. Как окислительные, так и восстановительные свой-
ства в реакциях с другими веществами в окислительно-
восстановительных реакциях проявляют:
1) оксид серы (IV); 2) сера;
3) сульфат-ион; 4) сульфид-ион.
— 373 —
8. Смесь кислой и средней соли образуется, когда
КОН и SO, реагируют в мольном отношении, соответ-
ственно равном:
1)2: 1,2)1 : 2; 3)3 : 1,4) 1,5: 1.
9. Смесь кислой и средней соли может образоваться,
когда с раствором щелочи взаимодействуют.
1)H2S, 2) С12О7; 3) SO,; 4) SOr
10. Сероводородная кислота — это:
1) слабый электролит;
2) сильный восстановитель,
3) сильная кислота;
4) типичный амфотерный электролит.
ТЕСТ 6
1. Осушать сероводород от влаги можно с помощью:
1) СаО; 2) Р,О5;
3) SiO2; 4) H2SO4 (конц).
2. Средняя соль сернистой кислоты в качестве конеч-
ного продукта образуется при взаимодействии:
1) СаО и SO,;
2) FeS, и О2;
3) SO2 и избытка КОН (р-р),
4) Ва(ОН)2 (р-р) и SO, (изб).
3. Осадок будет конечным продуктом реакции при
взаимодействии:
1) CuSO4 (р-р) и K,S; 2) Са(ОН), и SO? (избыток);
3) KHS и КОН(р-р); 4) SO, и Са(ОН), (р-р, избыток).
4. Оксид серы (IV) окислитель, реагируя с:
1)0,; 2)H,S;
3)С- 4) Н28О4(конц)
--- 374 ---
5. Укажите число веществ из перечисленных, реагируя
с которыми, SO проявляет свойства восстановителя —
С, О3, Н„ KMnO4, H2S, HNO3, K2Cr,O7:
1)7; 2) 6; 3)5; 4) 4.
6. Как окислительные, так и восстановительные свой-
ства в реакциях с другими веществами атом серы про-
являет в составе:
1)S8; 2) SO3; 3) H2SO3; 4) ^8.
7. Сероводород образуется при действии на сплав
цинка и серы:
1) HNO3 (конц.); 2) НС1 (конц.);
3) H2SO4 (разб.); 4) H2SO4 (конц.).
8. Для осуществления одностадийного перехода H2S —>
—> S следует воспользоваться:
1) О2(изб.); 2) С12(р-р); 3) НС1 (р-р); 4) SO2.
9. При длительном хранении сероводородная вода
мутнеет из-за образования:
1) сульфита натрия; 2) сульфата натрия;
3) серы; 4) сульфата кальция.
10. Концентрация сульфид-ионов будет наибольшей
в насыщенном растворе:
I) H2S; 2) PbS; 3) Na,S; 4) CuS.
ТЕСТ 7
1. С учетом взаимодействия ионов электролита с во-
дой укажите, в водных растворах каких веществ лакмус
имеет синюю окраску:
1) K2SO4; 2) K,S; 3) KHS; 4) KHSO4.
2. При добавлении соляной кислоты к водному ра-
створу K2S концентрация сульфид-ионов:
1) увеличится;
--- 375 ----
2) уменьшится;
3) не изменится;
4) может как увеличиться, так и уменьшиться.
3. Для наиболее полного разделения ионов S2 и SO;
можно воспользоваться реактивом, содержащим ион:
1)К+; 2)Pb2+; 3)Cu2+; 4)Ag+.
4. При добавлении щелочи к раствору H,S концен-
трация сульф ид-ионов:
1) не изменится;
2) увеличится;
3) уменьшится;
4) может как возрасти, так и уменьшиться
5. Концентрация гидросульфид-ионов уменьшится,
когда к водному раствору NaHS добавить:
1) воду; 2) соляную кислоту;
3) гидроксид натрия; 4) гидросульфид калия.
6. Концентрация гидросульфит-ионов практически не
изменится, когда к водному раствору SO, добавить:
1) соляную кислоту;
2) воду,
3) гидросид натрия;
4) немного сульфата натрия.
7. Укажите схемы реакций, в которые вступает избы-
ток H2S:
1)H2S + O2->S+H2O;
2) H2S + КОН -> KHS + Н2О;
3) H2S + NaOH -» Na,S + H,O;
4) H2S + Ca(OH)2 -> Ca(HS), + H,O.
8. Осадок, нерастворимый в разбавленных сильных
кислотах, образуется при взаимодействии:
1) ВаС12 и K2SO4 (р-р); 2) ВаС1, и K,SO3 (р-р),
3) СиС12 (р-р) и H2S; 4) КОН и H,S (избыток).
--- 376 ---
9. Взаимодействие сульфита калия с горячей концен-
трированной серой кислотой — это реакция:
1) замещения;
2) обмена;
3) окислительно-восстановительная;
4) разложения.
10. В воде вначале растворили К,0 массой 5 г, а за-
тем — SO3 массой 5 г. Укажите окраску лакмуса фиоле-
тового в растворе после завершения реакции:
1) синяя; 2) красная; 3) фиолетовая; 4) зеленая.
ТЕСТ 8
1. Наименьшее химическое количество сульфид-ионов
образуется при растворении в 1 дм3 воды 0,05 моль:
1) H,S; 2) K2S; 3) Na2S; 4) KHS.
2. Одинаковое химическое количество сульфид-ионов
образуется при растворении в 1 дм3 воды 0,01 моль:
1) Ca(HS)2 и NaHS; 2) NaHS и K,S;
3) H2S и Na2S; 4) KHS и NaHS.
3. Наибольшее химическое количество ионов HS об-
разуется при растворении в 1дм3 воды 0,05 моль:
1) H2S; 2) K^S; 3) Ca(HS)2; 4) KHS.
4. Избыток K2S внесли в раствор H2S. Укажите окрас-
ку лакмуса фиолетового в конечном растворе (учтите
взаимодействие ионов электролита с водой):
1) фиолетовая; 2) синяя;
3) красная; 4) зеленая.
5. Сероводород полностью реагирует с хлорной водой.
Укажите окраску метилоранжа в конечном растворе:
1) красная; 2) оранжевая;
3) желтая; 4) зеленая.
— 377 —
6. Смешали равные объемы SO2 и H,S и смесь нагрели
в отсутствие кислорода. Укажите молярную массу (г/моль)
полученной газовой смеси при температуре 120 °C
1)30,3; 2) 31,3; 3)33,3,4) 35,3.
7. Смешали равные массы Zn и S и смесь нагрели в
отсутствие кислорода. Полученная твердая масса пред-
ставляет:
1) только ZnS; 2) смесь ZnS и S,
3) смесь ZnS hZh; 4)cMecbZnHS.
8. Смешали SO, массой 5 г и H,S массой 5 г, смесь
нагрели в отсутствие кислорода Укажите массу (г) по-
лученного твердого вещества (н. у.):
1)3,53; 2) 7,50; 3) 7,06; 4) 3,75.
9. При нагревании пятая часть H2S распадается на
простые вещества. Укажите объемную долю (%) H2S в
образовавшейся газовой смеси (н. у):
1) 80; 2) 70; 3) 60; 4) 50.
10. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ Б и Г в цепоче химических превраще-
ний: CuS +о’-(изб)< А Б В Г:
1)32; 2) 64; 3)96; 4) 98.
ТЕМА 28
Серная кислота и ее соли
ТЕСТ1
1. Водород из Н28О4(разб.) вытесняют металлы:
1) Hg; 2) Zn;3)Fe; 4) Си.
--- 378 ---
2. Соли серной кислоты могут образоваться при вза-
имодействии:
1) CuSO4 и ВаС1,(р-р);
2) KNO3 (разб.) и H,SO4 (разб.);
3) NaCl (т) и Н,5О4(конц.);
4) Са3(РО4)2 и H2SO4(kohu.).
3. С Н28О4(разб.) взаимодействуют:
1) MgCO3; 2) K,S; 3) NaHSO4; 4) NaHSO3.
4. Сульфат калия в водном растворе реагирует с:
1) ВаС12; 2) НС1; 3) HNO3; 4) Mg(NO3)2.
5. Газ выделяется при взаимодействии:
1) Fe и Н28О4(конц.) (20 °C);
2) Fe и H2SO4 (разб.);
3) KHSO3 (р-р) и H2SO4 (конц.);
4) K2SO4 (разб.) и ВаС12(разб.).
6. Сульфат образуется при взаимодействии (электро-
литы взяты в виде водных растворов):
1) Са(ОН)2 и SO3; СаО и SO2;
2) Na2SO3 и H2SO4; Zn и H2SO4 (конц.);
3) CuSO4 и NaOH; MgCO3 и H2SO4 (разб.);
4) MgCl, (т) и H2SO4 (конц.); А1(ОН)3 и Na2SO4.
7. С H,SO4 (разб.) реагирует каждое из веществ, фор-
мулы которых:
I) ВаС12, СаСО3, Hg; 2) FeS, Mg, NH3;
3) NaHCO3, KOH, KHS; 4) A1(OH)3, Al, Fe2O3.
8. При обжиге пирита в промышленном производ-
стве серной кислоты в основном образуются:
1) FeO и SO3; 2) Fe,O3 и SO3;
3) Fe2O3 и SO2; 4) Feb и SO2.
9. Сульфат-ион можно обнаружить с помощью:
1) ВаС12; 2) КС1; 3) NaNO3; 4) РЬ(СН3СОО)2.
--- 379 ---
10. Водные растворы K,S и K,SO4 можно различить с
помощью:
1) индикатора; 2) НО; 3) CuCl,; 4) NaCl.
ТЕСТ 2
1. Укажите схемы качественных реакций на сульфат-
ной:
1) CuSO4 + Fe -> FeSO4 + Си;
2) K,SO4 + Pb(HCOO), -> PbSO4 + HCOOK;
3) KNO, + KMnO. +' H ,SO, -> KNO + MnSO. +
+ K,SO4 + H,O;
4) Na2SO4 + BaCl, -> BaSO4 + NaCl.
2. Сульфат меди (II) в водном растворе реагирует с
веществами, формулы которых:
1) HNO3; 2) NH3; 3) Fe; 4) НС1.
3. Концентрированная серная кислота может реаги-
ровать с веществами, формулы которых:
1) Р; 2) H,S; 3) Nal; 4) SO,.
4. Укажите схемы реакций, в которых взята H2SO4 (конц.):
1) С12Н2,Он + H2so4 -> 12С + H,SO4 • 11Н2О;
2) NaNO3 + H,SO4 -> HNO3T + ...;
3) КВг + H,SO4 —> Br, + ...;
4) Fe + H,SO4 —> H, + ....
5. Укажите схемы реакций, в которых взята H,SO4 (разб.):
1)H,SO4 = 2H+ + SO;4
2) Си + H,SO4 —» SO, + ...;
3) NaNO3 (т) + H,SO’^>;
4) КС1 + H,SO4 —» НС1? + ....
6. При нагревании киновари в атмосфере кислорода
преимущественно образуются:
1) SO3; 2) Hg; 3) SO,;4)HgO.
--- 380 ----
7. При получении H,S04 из пирита в промышленности
используются реакции:
1)каталитические;
2) обмена,
3) окислительно-восстановительные,
4) экзотермические.
8. Водные растворы всех трех солей (K2S, K;SO3 и
K2SO4) реагируют с:
1) О2; 2) HNO3; 3) Pb(NO,)2; 4) НС1.
9. Сульфат меди (II) в отличие от сульфата железа (II)
в водном растворе реагирует с:
1) Zn; 2) Ni; 3) AgNO3; 4) КОН
10. Оба вещества — CuSO4 и FeCL, — в водном ра-
створе реагируют с:
1) Zn, 2) NaOH; 3) HNO3; 4) AgNO3
ТЕСТЗ
1. C H2SO4 (разб.) реагируют:
1) магнетит, 2) поташ, 3) доломит; 4) сильвинит.
2. Как гидроксид калия, так и разбавленная серная
кислота реагируют с:
1) А12Оз; 2) Ве(ОН)2; 3) K3[A1(OH)J; 4) СОГ
3. Окислительные свойства наиболее выражены у
вещества:
1) НД 2) H2SO4 (разб ), 3) H2SO4 (конц ); 4) КД.
4. Пробирки с H2SO4 (конц.) и НС1 (конц.) можно раз-
личить с помощью:
I) индикатора; 2) воды; 3) хлорида бария; 4) магния.
5. Массовую долю H,SO4 в ее разбавленном растворе
можно повысить добавлением в раствор:
1) олеума; 2) оксида серы (VI);
— 381
3) цинковых опилок; 4) щелочи.
6. При взаимодействии цинка с серной кислотой раз-
личных концентраций можно получить:
1) Н„ S, H2S, SO,, ZnSO4; 2) Н„ S, SO,, ZnS, SO3;
3) H", H,S, ZnSO4, SO3, S; 4) H~, H2S, S, SO,, ZnS.
7. Охарактеризуйте свойства H2SO4 (разб.):
I) сильный электролит;
2) реагирует с металлами, расположенными в элект-
рохимическом ряду до водорода;
3) при взаимодействии с железом образуется сульфат
железа (П1);
4) не реагирует с разбавленным раствором нитрата
натрия.
8. Укажите символы металлов, которые реагируют с
H2SO4 (конц.), но не реагируют с Н28О4(разб.):
l)Zn; 2) Си; 3) Ag; 4) Fe.
9. С H2SO4 (разб.) реагирует каждое из веществ, фор-
мулы которых приведены в ряду:
1) КОН, Na3[Al(OH)6], KHSO4;
2) NH3, KHSO3, Na2[Zn(OH)4];
3) KNO3 (разб.), (NH4)2CO3, Zn;
4) NH3 H2O,K2S, Au.
10. Серная кислота может образоваться в результате:
1) окисления серы концентрированной азотной кис-
лотой;
2) окисления кислородом водного раствора SO,;
3) взаимодействия водных растворов H,S и медного
купороса;
4) реакции между водными растворами Na,SO4 и
НО (конц.).
--- 382 ---
ТЕСТ 4
1. Концентрированная серная кислота в отличие от
разбавленной серной кислоты:
1) при температуре 20 °C реагирует с железом и алю-
минием;
2) окислитель за счет ионов S+6 (SO2 );
3) окислитель за счет ионов Н' (Н3О');
4) вытесняет из твердых нитратов HNO3.
2. Средняя соль серной кислоты в качестве конечного
продукта образуется при взаимодействии:
1) KHSO4 и КОН;
2) КОН (конц.р-р) и SO3 (избыток);
3) Fe(OH)2 и Na2SO4(p-p);
4) H2SO4(kohu.) и Ва(ОН)2 (избыток).
3. Окисление SO3 в SO3 при промышленном произ-
водстве серной кислоты проводят:
1) при обычной температуре;
2) в присутствии катализатора;
3) при повышенном давлении;
4) при нагревании.
4. При температуре 20 °C разбавленная соляная кис-
лота реагирует, а концентрированная серная кислота —
нет с металлами:
1) А1; 2) Zn; 3) Fe;4) Си.
5. Охарактеризуйте реакцию обжига пирита при про-
мышленном производстве серной кислоты:
1) обратимая; 2) окислительно-восстановительная;
3) гетерогенная; 4) соединения.
6. В растворе с массовой долей Na,SO4 10% одинако-
ва молярная концентрация ионов:
1) Na+ и SO2*; 2) Н+ и SO2; 3) Н+ и ОН ; 4) Na+ и ОН .
--- 383 ----
7. Оксид серы (IV) можно осушать с помощью:
1) СаО; 2) SiO2; 3) Р2О5; 4) CuSO4.
8. При взаимодействии меди с серной кислотой раз-
личных концентраций НЕЛЬЗЯ получить:
1) CuSO4; 2) Н2; 3) SO,; 4) CuS.
9. Серная кислота является окислителем за счет суль-
фат-ионов в случаях, когда между собой реагируют:
1) H2SO4 (разб.) и Zn;
2) H2SO4(kohij.) и Р;
3) H,SO4 (разб.) и FeO;
4) Си и Н28О4(конц.).
10. Сульфат железа (II) образуется при взаимодействии:
1) Fe и Н28О4(конц.) (20 °C);
2) Fe и H,SO4 (разб.);
3) Fe(OH)2 и H2SO4 (разб.);
4) FeO и H,SO4 (конц.).
ТЕСТ 5
. 1. Сульфаты образуются при взаимодействии:
1) 1 моль Na2[Zn(OH)4] и 2 моль H2SO4;
2) 1 моль K2[Zn(OH)4] и 1 моль H,SO4;
3) S и H2SO4 (конц.) (г°);
4) А1 и Н,8О4(конц.) (20 °C).
2. Концентрированная серная кислота играет роль
окислителя и участвует в образовании соли, реагируя с:
1) Си; 2) СиО; 3) Р; 4) K2S.
3. С помощью Н28О4(конц.) можно осушать газы:
1)СО2; 2) НС1; 3)С12; 4)NH3.
4. При взаимодействии Hg и Н28О4(конц.) образуются:
1) HgSO4 и SO3; 2) HgSO4, SO2 и Н2О;
3) HgSO4 и H2S; 4) HgSO4 и Н2.
--- 384 ---
5. При нагревании H2SO4 (конц.) с углем образуются
два газа (н.у.). Укажите их формулы:
1) H,S; 2) SO2; 3) СО,; 4) SO3.
6. Различить между собой пробирки с Н,8О4(конц.) и
Н,8О4(разб.) можно с помощью:
1) поташа; 2) гидроксида калия;
3) деревянной лучинки; 4) железных опилок.
7. Серную кислоту НЕЛЬЗЯ получить при взаимо-
действии:
1) SO3 и Н2О; 2) S и HNO3 (конц.);
3) FeSO4 и НС1 (р-р); 4) H,SO3 и О,.
8. Сила кислот последовательно возрастает в ряду:
1) H2S, H2SO4, H2SO3; 2) H2SO3, H2S, H,SO4;
3) H,S, H2SO3, H2SO4; 4) H,SO3, H2SO4, H,S.
9. В раствор, содержащий ионы S2~, SO2- и SO2-, до-
бавляют избыток ВаС12, осадок отделяют и обрабатыва-
ют азотной кислотой при кипячении. В конечном ра-
створе после кипячения будут обнаружены ионы:
1) Ва2+, S2", SO| , SO4~; 2) Ва2+, S2-, SO2-, NO3;
3) Ва2+, NO;; 4) Ва2+, NO3, S2~.
10. Укажите правильную зависимость химического ко-
личества (моль) п осадка от объема V раствора Ba(NO3)2,
•з Зак. 1530
— 385 —
ТЕСТ 6
1. В воде массой 20 г растворили оксид серы (VI) мас-
сой 80 г и получили:
I) раствор с ffi’(H2SO4) = 98 %;
2) безводную серную кислоту;
3) олеум с k.’(SO3) = 2 %;
4) олеум с zt’(SO3) = 10 %.
2. Степень восстановления концентрированной сер-
ной кислоты (т.е. число электронов, принятых ее моле-
кулой) возрастает, если:
1) разбавить раствор водой;
2) использовать в реакции более активный металл;
3) добавить в раствор оксид серы (VI);
4) использовать в реакции менее активный металл.
3. В реакции с Zn массой 0,20 г израсходовалась H2SO4
(конц.) массой 0,49 г. При этом образуется:
1) только SO3; 2) смесь SO2 и S;
3) только S; 4) смесь S и H2S.
4. Укажите массовую долю (%) H2SO4 в растворе, в
котором химические количества Н2О и H2SO4 относятся
соответственно как 10:1:
1)35,3; 2) 36,3; 3)37,3; 4) 38,3.
5. Влажную смесь газов О2, HI, H2S, НО, С12 пропусти-
ли через склянку с H2SO4 (конц.). В результате произошло:
1) осушение всех газов;
2) поглощение всех газов;
3) осушение газов О2, НО и С12; поглощение газов
HI, H2S;
4) осушение газов HI и H,S; поглощение газов О2, НС1
иО2.
--- 386 —
6. В промышленности при получении серной кисло-
ты оксид серы (VI) поглощают:
1)водой;
2) разбавленным раствором H,SO4;
3) концентрированным раствором H,SO4;
4) концентрированным раствором K2SO4.
7. Какие два вещества прореагировали между собой,
если образовались ZnSO4, S и Н,О?
1) ZnO и H,SO4 (разб.); 2) ZnO и H,SO4 (конц.);
3) Zn и H,SO4 (разб.); 4) Zn и H2SO4 (конц.).
8. Очистить CaSO4 от примесей СаСО3 можно с по-
мощью:
I) С12; 2) Н2О; 3) НС1 (р-р); 4) Ba(NO3)2 (р-р).
9. Укажите схемы реакций, иллюстрирующие свой-
ства H,SO4, общие для всего класса кислот:
1) H2SO4 + H2S -> S + Н2О;
2) H2SO4 + Р-> SO, + Н3РО4 + Н,О;
3) H,SO4 + NaOH Na,SO4 + Н2‘О;
4) H2SO4 + К2О -> K,SO4 + Н2О.
10. Смешали равные объемы растворов H2SO4 и КОН
с одинаковыми молярными концентрациями кислоты и
щелочи. Укажите окраску лакмуса фиолетового в полу-
ченном растворе:
1) красная; 2) синяя; 3) фиолетовая; 4) желтая.
ТЕСТ 7
1. Смешали равные объемы растворов H,SO и Ва(ОН),
с равными молярными концентрациями кислоты и ще-
лочи. Укажите окраску лакмуса фиолетового в получен-
ном растворе:
1) фиолетовая; 2) красная; 3) синяя; 4) малиновая.
— 387 -----
2. Влажную смесь газов СО,, СО, О„ NH3 и N2 про-
пустили через склянку с H2SO4 (конц.), а затем через
склянку с гранулами щелочи. В результате произошло
осушение газов:
1) СО,, О„ N,; 2) СО, О„ N,;
3) NH’, N,, СО; 4) СО, NH3, О2.
3. Концентрированную серную кислоту НЕЛЬЗЯ ис-
пользовать для осушения каждого из газов в наборах:
1) NH3, СО,, О„ С1,; 2) H,S, HI, НВг, NH3;
3) N,, SO,, NO’, H,S; 4) HC1, HI, NO, COi
4. Концентрированную серную кислоту можно ис-
пользовать для осушения каждого из газов в наборе:
1) С1,, О„ N„ SO,; 2) СН4, С,Н6, С,Н4, НВг;
3) NO, NO,, СО, HI; 4) СО,, HF, SF6, Аг.
5. Смешали равные объемы растворов H,SO4 и NaOH с
одинаковыми молярными концентрациями кислоты и ще-
лочи. При этом образовалась (образовались) соль (соли):
1) только Na,SO4;
2) только NaHSO4;
3) смесь равных химических количеств Na2SO4 и
NaHSO4;
4) смесь Na,SO4 и NaHSO4 с преобладанием хими-
ческого количества кислой соли.
6. При растворении серной кислоты в воде выделяет-
ся 92 кДж/моль теплоты. Сколько теплоты (кДж) выде-
лится при смешении H2SO4 и Н,О с образованием ра-
створа массой 100 г с массовой долей кислоты 20%?
1) 18,8; 2)36,8; 3)55,2; 4) 73,6.
7. Укажите общие затраты кислорода (дм3, н.у.) при
получении раствора H,SO4 массой 200 г с масовой до-
лей кислоты 90% по схеме FeS, —> SO, —э SO3 H2SO4:
1)71,1; 2) 73,1; 3)75,1; 4) 77,1.
--- 388 ----
8. Даны вещества, формулы которых: НС1, KI, NaBr,
SO,, Р, NaHSO4, H,S, NaF, Cl,, Na,SO3, FeS,. Укажите,
сколько из них может вступать в окислительно-восста-
новительную реакцию с Н,8О4(конц.):
1) четыре; 2) пять; 3) шесть; 4) семь.
9. Укажите общие затраты (дм3, н.у.) кислорода при по-
лучении H,SO4 из пирита массой 12,0 г по схеме: FeS, -э
SO, -> SO’ -» H,SO4:
1)8,4; 2) 7,4; 3) 6,4; 4) 5,4.
10. Смешали растворы, содержащие одинаковые массы
H,SO4 и КОН. При этом образовалась(лись) соль (соли):
1) только FC2SO4;
2) только KHSO4;
3) смесь K,SO4 и KHSO4 с преобладанием химичес-
кого количества K,SO4;
4) смесь K,SO4 и KHSO4 с преобладанием химичес-
кого количества KHSO,.
4
ТЕМА 29
Общая характеристика элементов VA группы.
Азот. Оксиды азота. Аммиак. Соли аммония
ТЕСТ1
1. Для элементов VA группы справедливы утвер-
ждения:
1) высшая валентность атомов всех элементов равна V;
2) все элементы являются неметаллами;
3) формула высшего оксида всех элементов Э,О_;
— 389 —
4) с ростом атомного номера элемента возрастают
металлические свойства.
2. Укажите формулу оксида с наиболее выраженны-
ми кислотными свойствами:
1) As2O3; 2) Bi,O3; 3) Sb2O3; 4) Р2О3.
3. Кислотные свойства оксидов последовательно на-
растают в ряду:
1) As?O5, As,O3, Р,О5; 2) As,O3, As7O5, Р,О5;
3) АбД, РД, АбД; 4) РД, AsД As2O3.
4. С водой при температуре 20 °C реагируют:
1) NO; 2) NO7; 3) N2O3; 4) N2O5.
5. Объемная доля азота в воздухе равна 78,0%. Ука-
жите массовую долю (%) азота в воздухе:
1) 72,3; 2) 73,3; 3) 74,3; 4) 75,3.
6. Молекулярное строение (н. у.) имеют:
1) азот; 2) черный фосфор;
3) белый фосфор; 4) аммиак.
7. Температура плавления веществ последовательно
нарастает в ряду:
1) азот, черный фосфор, аммиак, белый фосфор;
2) азот, аммиак, черный фосфор, белый фосфор;
3) азот, аммиак, белый фосфор, черный фосфор;
4) аммиак, азот, белый фосфор, черный фосфор.
8. Электроотрицательность атомов сначала возрастает,
а затем уменьшается в ряду элементов, символы которых:
1) N, Р, Sb; 2) N, Sb, Р; 3) Р, Sb, N; 4) Р, N, Sb.
9. Охарактеризуйте реакцию между простыми веще-
ствами азотом и кислородом:
1) окислительно-восстановительная;
2) обратимая;
3) эндотермическая;
4) протекает при слабом нагревании.
— 390 —
10. Кислотные свойства проявляют оксиды элемен-
тов VA и VB групп:
1)V2O5; 2) N,O; 3)NO2; 4)N2O3.
ТЕСТ 2
1. Укажите справедливые утверждения для элемен-
тов VA группы и их соединений:
1) атомы всех элементов имеют вакантные d-орбитали;
2) общая формула водородных соединений ЭН3;
3) с ростом атомного номера прочность связи Э—Н в
водородных соединениях состава ЭН3 уменьшается;
4) все оксиды состава Э2О. можно получить непос-
редственным окислением простых веществ.
2. Атом азота в составе аммиака может проявлять
свойства:
1) только окислителя;
2) только восстановителя;
3) донора электронов;
4) акцептора протонов (Н+).
3. Укажите формулу оксида с наиболее выраженны-
ми основными свойствами:
1) As2O3; 2) Bi2O3; 3) Sb,O3; 4) Bi2O5.
4. Оксид азота (IV) НЕЛЬЗЯ получить при нагревании:
1) нитрата серебра (I); 2) нитрата аммония;
3) нитрата натрия; 4) нитрата цинка.
5. Бинарные (двухэлементные) соединения металлов
с азотом называются:
1) карбиды; 2) нитраты; 3) нитриты; 4) нитриды.
6. Смесь О, и NH3 можно разделить с помощью:
1)Н2О; ’ 2) НС! (г);
3) СаО; 4) Р,О. (в присутствии влаги).
— 391 —
7. Справедливы следующие утверждения для моле-
кулы аммиака:
1) неполярна;
2) плоская;
3) может быть донором электронов;
4) все связи образованы по обменному механизму.
8. Валентность атома азота равна III в составе:
1) молекулы азота;
2) молекулы азотной кислоты;
3) молекулы азотистой кислоты;
4) иона аммония.
9. Укажите формулу оксида, для которого отсутствует
кислота с такой же степенью окисления атома элемента
VA группы, как и в оксиде:
1)N2O3;2)NO2; 3) Р2О5; 4) N2O,.
10. Атом азота имеет промежуточную степень окис-
ления (т.е., между высшей и низшей) в составе:
1) нитритов; 2) нитратов; 3) нитридов; 4) аминов.
ТЕСТЗ
1. Укажите справедливые утверждения для атомов
элементов VA группы или их соединений:
1) с ростом заряда ядра основные свойства водород-
ных соединений состава ЭН3 ослабевают;
2) все простые вещества имеют молекулярное строе-
ние (н. у);
3) с увеличением атомного номера возрастает число
электронных слоев в атоме;
4) электронная конфигурация внешнего электронно-
го слоя атомов всех элементов в основном состоянии
п&пр* (и — номер периода).
— 392 —
2. Простое вещество азот менее реакционноспособен,
чем простое вещество кислород, так как:
1) молекулы N, имеют меньшую массу;
2) атомы N имеют меньший заряд ядра;
3) азот не имеет аллотропных модификаций;
4) атомы в молекуле N, связаны более прочной свя-
зью, чем атомы в молекуле О,.
3. Атом азота имеет высшую степень окисления в со-
ставе:
1) нитратов; 2) нитритов; 3) аминов; 4) нитридов.
4. Укажите схемы качественных реакций на ион ам-
мония:
1) NH4NO2 Д N,? + Н2О;
2) NH4C1 + Са(ОН)7 Д NH3? + СаС12 + Н2О;
3) NH3 + H2SO4 -> NH4HSO4;
4) NH4NO3 + KOH Д NH3T + KNO3 + H2O.
5. Какие пары ионов можно взять для составления
молекулярных уравнений, которым отвечает ионное
NH4+ + ОН- NH3 • Н2О?
1)Си2+иСГ; 2) К+и NO3;
3) Ва2+ и СО2'; 4) Na+ и SO2".
6. Оксид азота (IV) образуется при:
1) взаимодействии Си и HNO3 (конц.);
2) взаимодействии Ag и HNO3 (разб.);
3) нагревании KNO3;
4) нагревании Hg(NO3)r
7. Азот образуется в результате:
1) нагревания азида натрия;
2) горения метиламина на воздухе;
3) горения черного пороха;
4) нагревания нитрата калия с серой.
— 393 —
8. Укажите число частиц из перечисленных, облада-
ющих основными свойствами, — NH4, C,H.NH2,
[CH3NH3]C1, N2H4, NH,OH, [(CH3)4N]Br:
1) пять; 2) четыре; 3) три; 4) две.
9. С хлоридом аммония в водном растворе взаимо-
действуют:
I)HNO3; 2)AgNO3;
3) КОН; 4) РЬ(СН3СОО)2.
10. Степень окисления атома азота равна -1 в составе:
I) гидразина; 2) гидроксиламина;
3) нитрида кальция; 4) хлорида аммония.
ТЕСТ 4
1. Укажите справедливые утверждения:
1) простое вещество азот наиболее химически акти-
вен среди всех простых веществ элементов VA группы;
2) атомы азота содержат наименьшее число протонов
среди всех элементов VA группы;
3) химическая связь в молекуле N, непрочная;
4) в образовании химической связи в молекуле N,
участвуют шесть электронов.
2. Возможны химические реакции между:
1) NH4CI (р-р) и CH3COOAg;
2) NH4HCO3 и Ва(ОН), (р-р);
3) NH3 • Н9О и HNO3; ’
4) NH4H2PO4(p-p) и K2SO4.
3. Степень окисления атома азота минимальна в составе:
1) нашатыря; 2) нитритов;
3) аминов; 4) калийной селитры.
4. Охарактеризуйте реакцию промышленного синте-
за аммиака:
— 394 —
1) обратимая и каталитическая;
2) экзотермическая и окислительно-восстановительная;
3) соединения и гомогенная*;
4) эндотермическая и гетерогенная.
5. В основном оксид азота (II) образуется при взаимо-
действии:
1) Си и HNO3 (разб.);
2) Ag и HNO3 (конц.);
3) Zn и HNO3 (очень разб.);
4) NH3 и О, (Kat, С).
6. Охарактеризуйте свойства оксида азота (IV):
1) бесцветный газ (н. у); 2) ядовит;
3) реагирует с водой; 4) кислотный оксид.
7. При какой степени окисления атома азота массовая
доля атомов азота в оксиде наибольшая?
1)+1;2) +2; 3) +3;4)+4.
8. Соль аммония можно получить при взаимодействии:
1) NH4C1 и КОН (р-р);
2)NH3hH3PO4(p-P);
3) NH3NO3 (р-р) и КС1;
4) (NH4)2SO4 и Ba(NO3)2 (р-р).
9. Охарактеризуйте реакцию, уравнение которой
NH +HC1 = NHC1:
3 4
1) атом азота — донор электронов;
2) степень окисления атома азота изменяется от-3 до -4;
3) реакция соединения;
4) атом азота — акцептор протонов.
10. Основные свойства аммиака проявляются в реак-
циях, схемы которых:
1) NH} + CuO -> N7 + Си + Н7О;
2) NH3 + Н2О-> NH3 • Н2О;
* Агрегатное состояние катализатора не учитывайте.
--- 395 ----
3) NH3 + HNO -> NH NO •
7 3 3 4 3'
4) NH3 + O2 -> N2 + H2O.
ТЕСТ 5
1. Для азота справедливы утверждения:
1) высшая валентность атома азота равна IV;
2) высшая степень окисления атома азота равна + 4;
3) в природе элемент азот находится только в свобод-
ном виде;
4) все нуклиды азота в ядре содержат семь протонов.
2. Азот—окислитель, реагируя с:
1) О2; 2) Са; 3) Н2; 4) Si.
3. Укажите схему реакции, в которой аммиак — окис-
литель:
1) NH3 + CuO -> Си + N7 + Н7О;
2) NH3 + К -> K2NH + Н7;
3) NH3 + С12 —> N2 + НО;
4)NH3 + H3PO4->(NH4)2HPO4.
4. Аммиак — восстановитель, реагируя с:
1)Н2О; 2) С12; 3) О2;4)Н3РО4.
5. Нашатырный спирт — это:
1) раствор NH4C1 в Н70; 2) раствор NH3 в Н7О;
3) раствор NH4NO3 в Н7О; 4) твердый NH4C1.
6. Водный раствор нашатыря реагирует с:
1) AgNO3; 2) NaNO3; 3) (HCOO)7Pb; 4) КОН.
7. Карбонат аммония в водном растворе реагирует с:
1) НС1; 2) СаС12; 3) KNO3; 4) NH3.
8. Аммиак можно получить при:
1) взаимодействии Ca3N7 и Н7О;
2) нагревании (NH4)7CO3;
3) взаимодействии соли аммония со щелочью;
— 396 —
4) взаимодействии гидрокарбоната аммония с силь-
ной кислотой.
9. Кислотные свойства оксидов постепенно нараста-
ют в рядах:
1) SiO2, Р,О., SO3; 2) As,O5, P.O., N,O5;
3) N2O5, P,O5, As,O.; 4) As,O3, N,O3, N,O,.
10. Азот — восстановитель, реагируя с:
1)F,; 2) Mg; 3)0,; 4) P.
ТЕСТ 6
1. В лаборатории азот получают:
1)из воздуха;
2) нагреванием нитрита аммония;
3) нагреванием нитрата аммония;
4) взаимодействием меди с концентрированной азот-
ной кислотой.
2. Гидрокарбонат аммония в водном растворе реаги-
руете:
1) СО,; 2) НС1; 3) NaOH; 4) Ca(NO3),.
3. Нуклиды l5N и l5N3- имеют одинаковое число:
1) электронов; 2) протонов; .
3) нейтронов; 4)нуклонов.
4. Аммиак выделяется при нагревании солей аммо-
ния, формулы которых:
I) NH4H,PO4; 2) NH4NO,; 3) NH4NO3; 4) NH4HCO3.
5. Одно простое и одно сложное вещество образуется
при нагревании:
1) (NH4),CO3; 2) NH4NO3 (200 °C);
3) NH4NO,; 4) KNO3.
6. Сульфат аммония в водном растворе реагирует с:
1) Ва(ОН),; 2) СаС1,; 3) НС1; 4) HNO3.
— 397 —
7. Атом азота проявляет положительную степень
окисления в бинарных соединениях с:
1) кислородом; 2) хлором; 3) фтором; 4) углеродом.
8. Непосредственно из азота (в одну стадию) можно
получить:
1) аммиак; 2) оксид азота (II);
3) нитрид кальция; 4) азотную кислоту.
9. Только окислительные свойства в реакциях с дру-
гими веществами атом азота проявляет в составе:
1) оксида азота (II); 2) азотной кислоты;
3) азотистой кислоты; 4) аммиака.
10. Относительная плотность N, по какому-то газу
равна 0,966. Что это за газ?
1) водород; 2) воздух; 3) углекислый газ; 4) кислород.
ТЕСТ 7
1. Соль аммония образуется при взаимодействии:
1) Zn и HNO3 (очень разб.); 2) NH3 и Н,О;
3) NH3 Н,О и HNO3; 4) (NH4),CO3 и КОН(р-р).
2. Растения получают азот из почвы главным обра-
зом в виде:
1) NH4+ и NO/; 2) NH4+ и NO/;
3) N, и NO,'; 4) N, и NO/.
3. При комнатной температуре (20 °C) оксид азота (II)
реагирует с:
1) Н2О; 2) КОН (р-р); 3) О,; 4) НС1 (р-р).
4. В описании свойств аммиака верными являются
характеристики:
1) без запаха;
2) его водный раствор окрашивает лакмус в синий цвет;
3) с кислотами реагирует по типу реакции соединения;
4) в реакциях с кислотами выступает в роли основания.
— 398 —
5. Для лабораторного получения аммиака можно ис-
пользовать:
1) нагревание нитрита аммония;
2) взаимодействие водных растворов нашатыря и га-
шеной извести;
3) нагревание карбоната аммония;
4) взаимодействие гидрокарбоната аммония и соля-
ной кислоты.
6. Между собой реагируют:
1) водный раствор NH3 и СО,;
2) (NH4),CO3 и HNO3;
3) NH3 • Н,О и НС1;
4) NH HSO4 и H,SO4.
7. Аммиак, реагируя с соляной кислотой, выступает в
роли:
1) кислоты;
2) основания;
3) акцептора протона;
4) донора электронной пары.
8. В ряду элементов N — Р — Sb уменьшаются:
1) радиус атома;
2)электроотрицательность;
3) окислительная способность простых веществ;
4) энергия связи Э — Н в соединениях ЭН3.
9. В промышленности азот получают:
1) из воздуха;
2) нагреванием нитрита аммония;
3) кипячением водной смеси нашатыря и гашеной
извести;
4) из мочевины.
10. Аммиак можно осушать с помощью:
1) СаО (т); 2) H,SO4 (конц.); 3) SiO,; 4) Р2О_.
— 399 —
ТЕСТ 8
1. Укажите справедливые утверждения. В ряду NH3 —
РН3 —AsH3:
1) длина связи возрастает;
2) энергия связи уменьшается;
3) основные свойства ослабевают;
4) повышается термическая устойчивость.
2. В ряду атомов элементов VA группы с ростом заря-
да ядра возрастают:
1)радиус;
2) энергия ионизации;
3) металлические свойства;
4) число электронных слоев.
3. При растворении NO2 в холодной воде в отсутствие
О, образуются(ется):
1) только HNO3; 2) только HNO2;
3) смесь HNO3 и HNO2; 4) смесь HNO2 и NH3 • Н,О.
4. Степень окисления атома азота равна -3 в составе:
1) нитрида магния; 2) аммиака;
3) нитрита калия; 4) хлорида аммония.
5. Возможны химические реакции между водными
растворами:
1) NH4C1 и AgNO3; 2) NH3 и Н3РО4;
3) NH3 и СиС12; 4) (NH4)2SO4 и Н3РО4.
6. Для солей аммония справедливы утверждения:
1) большинство из них хорошо растворимы в воде;
2) все соли аммония реагируют со щелочами;
3) все соли аммония при нагревании разлагаются с
выделением аммиака;
4) степень окисления атома азота в составе иона ам-
мония равна -3.
— 400 —
7. В химических реакциях аммиак может проявлять
свойства (учтите взаимодействие аммиака с металлами):
1) только окислителя;
2) только восстановителя;
3) и окислителя, и восстановителя;
4) основания.
8. Химическая реакция возможна между NH4HCO3
(Р-Р)и:
1) NH3; 2) СО,; 3) Ва(ОН)2; 4) KNO3.
9. Водный раствор аммиака реагирует с:
1) KNO3; 2) СО2; 3) А1С13; 4) NH4H,PO4.
10. Аммиак с кислотами-неокислителями (НС1, НВг,
H2SO4 (разб.), Н3РО4 и т. д.) реагирует по типу реакции:
1) обмена; 2) соединения;
3) замещения; 4) разложения.
ТЕСТ 9
1. Температура кипения уменьшается в ряду веществ,
формулы которых:
1)NH3,N„PH3; 2) NH3, РН3, N2;
3) РН3, NH3, N,; 4) РН3, N2, NH3.
2. При полном сгорании гидразина в кислороде об-
разуются:
1) NO и Н,О; 2) N, и Н,О; 3) N,O. и Н,О; 4) NH3 и NO.
3. Растворимость веществ в воде последовательно
возрастает в ряду:
1) N„ NO, NH3; 2) N„ NH3, NO;
3) NO, N„ NH3; 4) NH3, N„ NO.
4. Гидрат аммиака в водном растворе диссоциирует с
образованием ионов:
1) N3- и Н+; 2) Н+ и ОН"; 3) NH4 и Н+; 4) NH* и ОН*.
— 401
5. При образовании водородной связи между молекула-
ми NH3 и Н2О атом азота и атом водорода (в Н,О) являются:
1) азот — донором электронов;
2) водород — акцептором электронов;
3) азот — акцептором электронов;
4) водород — донором электронов.
6. Катион аммония имеет форму:
1) треугольника; 2) квадрата;
3) правильного тетраэдра; 4) искаженного тетраэдра.
7. В водном растворе аммиака присутствуют частицы:
1) NH3, NH4+, ОН , NH3 Н,О;
2) только NH4 и ОН ;
3) только NH3 • НД NH4+ и ОН ;
4) только NH3, NH4 и ОН-.
8. Две соли разных кислот могут образоваться, когда
со щелочью реагирует(ют):
1) СО,; 2) NO,; 3) SO2; 4) CI, (5 °C).
9. При взаимодействии NO, с КОН (5 °C, кислород
отсутствует) образуется (образуются):
1) только KNO3;
2) только KNO,;
3) KNO3 и NO;
4) смесь равных химических количеств KNO3 и KNO,.
10. Укажите число окрашенных газов в наборе: хлор,
аммиак, оксид азота (IV), азот, водород:
1)5; 2) 4; 3) 3; 4) 2.
ТЕСТ 10
1. Учитывая взаимодействие ионов электролитов с во-
дой, укажите, в водных растворах каких солей среда кислая:
1) NH4NO3; 2) KNO3; 3) Ba(NO3),; 4) NH4C1.
--- 402 ---
2. Аммиак используется для получения:
1) аминокислот; 2) водорода;
3) анилина; 4) нитробензола.
3. Основные свойства веществ последовательно воз-
растают в ряду:
1) NH„ NH2OH, NF,; 2) NH,OH, NF3, NH,,
3) NF3, NH2OH, NH3; 4) NF3, NH3, NH,OH.
4. Основные свойства веществ последовательно
уменьшаются в ряду:
])NH3,AsH3,PH3; 2) РН3, AsH3, NH3,
3}AsH3, РН3, NH3; 4) NH3, PH3, AsH3.
Г5. p сторону образования NO2 равновесие реакции
Н Ч°4(Ж) смещают:
1) повышение давления; 2) понижение давления;
3) уменьшение концентрации NO?;
4) увеличение концентрации NO.,.
{ 6. В красный цвет лакмус окрашивают водные раство-
ры веществ:
1) NH3; 2) NO; 3) NO2; 4) N2O3.
7. Для аммиака справедливы утверждения:
1) бесцветный газ (н. у);
2) плохо растворим в воде,
3) с водой образует водородные связи;
4) имеет высокую теплоту испарения.
8. Аммиак используется в холодильных установках,
поскольку:
1) хорошо растворим в воде;
2) сжижается под небольшим давлением и имеет вы-
сокую теплоту испарения;
3) сжижается под высоким давлением и имеет низ-
кую теплоту испарения;
4) сжижается под небольшим давлением и имеет низ-
кую теплоту испарения.
— 403 -----
9. Азотистая кислота может образоваться при раство-
рении в воде.
1) N,O3; 2) N,OS; 3) NO2; 4) N,O.
10. К смеси газов Nr NO, NO, добавили избыток О,
и затем пропустили через раствор щелочи. На выходе
обнаружили:
1) N„ NO; 2) только N2; 3) N2, NO2; 4) NO, NO2.
ТЕСТ 11
1. Равновесие процесса NH^r)+ Н,О(ж)«н> NH3 • H,O(p p)<->
NH,+, , + OH- , можно сместить вправо:
1) повышением температуры;
2) повышением давления;
3) подкислением раствора;
4) подщелачиванием раствора.
2. Водные растворы NH3 и НС1 можно различить с
помощью:
1) индикатора;
2) хлорида меди (II);
3) нитрата калия;
4) разбавленной серной кислоты.
3. Водные растворы NH4C1 и НС1 можно различить с
помощью:
1) KNO3; 2) HNO3 (разб ); 3) КОН; 4) Na,SO4.
4. Влажную смесь газов NH3, О2, СО, и N, пропусти-
ли через склянку с H2SO4 (конц ), а затем через склянку с
гранулами NaOH. НЕ поглотилась при этом смесь:
1)NH3hCO,; 2)0, nN,;
3)NH,hN2; 4) СО, и О,.
5. НЕ существуют (н. у) соединения, формулы которых:
1) NH3 • Н2О; 2) NH4OH; 3) NF7; 4) Ca,N3.
--- 404 ---
6. Осадок может выпасть при добавлении аммиака к
водным растворам:
1) NaNO3; 2) Zn(NO3)2; 3) A17(SO4)3; 4) КС1.
7. Для обнаружения иона аммония в растворе можно
использовать:
1) Ba(NO3)3; 2) AgNO3; 3) КОН; 4) НС1.
8. НЕ взаимодействуют с аммиаком:
1) О2; 2) NaHCO3(p-p); 3) КОН (р-р); 4) Н2.
9. Атомы N и Р отличаются:
1) размерами;
2) зарядом ядра;
3) числом валентных электронов;
4) энергией ионизации.
10. Степень окисления атома азота повышается при
взаимодействии:
1)NH3hO2; 2) NH3 и HNO3 (разб.);
3) Са и N2; 4) N, и О2.
ТЕСТ 12
1. Атомы азота одновременно являются и окислите-
лями и восстановителями в реакции:
1) между N2 и Са;
2) между NH3 и О2;
3) разложения NH4NO, при нагревании;
4) разложения (NH4),CO3 при нагревании.
2. Соединение, в котором степень окисления атома
азота иная, чем в других указанных веществах, -— это:
1) NC13; 2) NH3; 3) NH4C1; 4) N?O3.
3. При окислении аммиака кислородом в различных
условиях НЕЛЬЗЯ получить:
1) N,O.; 2) N,; 3) NO; 4) HNO3 (в отсутствие воды).
— 405 —
4. Свойства как окислителя, так и восстановителя в
реакциях с другими веществами атом азота может про-
являть в составе:
1) аммиака; 2) нитрита калия;
3) нитрата натрия; 4) азотной кислоты.
5. Основными свойствами обладают все частицы,
формулы которых указаны в ряду:
1) [C,HsNHJBr, N2H4, NH2OH, NH3;
2) nh4,n,h4, nh3, c,hsnh2,
3) N2H4, NH„ NH2OH, CH,NH„
4) [(CH3)4N]C1, nci3, nf3, nh3.
6. В окислительно-восстановительных реакциях атом азо-
та в молекуле NH3 может максимально отдать электронов:
1)8; 2) 6; 3)4; 4)2.
7. Валентность и степень окисления атома азота в
молекуле мочевины соответственно равны:
1) III и -2; 2) IV и -3; 3) III и -3; 4) IV и -2.
8. Избыток азота из организма человека выводится в
виде соединения, формула которого:
1) NH4NO2; 2) (NH,\CO;
3) (NH4)2CO3; 4)NH3 H2O.
9. Энергия связи последовательно уменьшается в ряду
молекул, формулы которых:
1)P„P4,N2; 2)P?,N„P4;
3)N2,P2,P4; 4)N2,P4,P2.
10. Такую же электронную конфигурацию, как и нит-
рид-ион N-3, имеют частицы:
l)Ne, 2) О2’; 3) Na‘;4)N'2.
— 406 —
ТЕМА 30
Азотная кислота и ее соли. Азотные удобрения
ТЕСТ1
1. Охарактеризуйте свойства азотной кислоты:
1) сильный электролит (разбавленная);
2) летучая;
3) устойчива к нагреванию;
4) сильный окислитель в концентрированных ра-
створах.
2. Азотная кислота образуется при взаимодействии:
1) NO, и Н,О (5 °C); 2) N,O. и Н,О;
3) N,O3 и Н,О; 4) KNO3(t) и H,SO4 (конц.) (/°).
3. При комнатной температуре (20 °C) концентриро-
ванная азотная кислота реагирует с металлами:
1) Си и Zn; 2) Ag и Fe; 3) Hg и Al; 4) Mg и Sn.
4. Соль азотной кислоты образуется при взаимодействии
обоих веществ в парах:
1) СаО и N,O5; КОН (р-р) и N,O3;
2) K,SO4 (р-р) и Ba(NO3)2; Na2SO4 (р-р) и HNO3 (р-р);
3) NH3 и HNO3 (р-р); Zn и HNO3 (конц.);
4) Fe и AgNO3 (р-р); HNO3 (р-р) и NaHCO3 (т).
5. Укажите химические формулы селитр:
1) KNO3; 2) NH4NO3; 3) A1(NO3),; 4) NaNO3.
6. Чем различаются между собой азотная и азотистая
кислоты?
1) степенью диссоциации (массовая доля обоих кис-
лот 15%);
2) основностью;
--- 407 ---
3) степенью окисления атома азота;
4) строением молекул.
7. Разные по химическому составу продукты образу-
ются, когда НМЭДконц.) или НИОДразб.) по отдельно-
сти реагируют с:
1) Na,CO4; 2) Си; 3) K,SiO3, 4) ZnO
8. С выделением смеси двух газов (н. у.) при нагрева-
нии разлагаются.
1) KNO,, 2) Fe(NO3),; 3) AgNO,; 4) NH4NO?(200°C).
9. Укажите, какое химическое количество (моль)
HNO3 расходуется на солеобразование при окислении
магния массой 2,4 г по схеме: Mg + HNO3 —> Mg(NO?), +
+ N,0 + H,O?
1)0,2; 2) 0,3; 3) 0,4,4) 0,5.
10. Азотная кислота проявляет общие свойства кис-
лот, реагируя с:
1)СаО,2) Р; 3) S; 4) КОН.
ТЕСТ 2
1. Укажите схемы реакций, в которых участвует кон-
центрированная азотная кислота:
l)Cu + HNO3—»NO+...;
2) Zn + HNO3 -> NH4NO3 + ...;
3) Ag + HNO3NO, + '...,
4) Cr + HNO37».
2. Найдите, какая масса (г) HNO3 расходуется непос-
редственно на окисление (без учета солеобразования) в
реакции Zn массой 0,650 г с очень разбавленной азот-
ной кислотой:
1) 0,158; 2) 0,250; 3) 1,42; 4) 1,72.
--- 408 ---
3. Только окислительные свойства в реакциях с дру-
гими веществами проявляет:
1) N,; 2) NO; 3) NH3; 4) HNO3 (конц.).
4. Оксид азота (IV) образуется при взаимодействии:
I) NO и О2; 2) N, и О2;
3) Си и НМЭ3(конц.); 4) Ag и HNO3 (разб.).
5. Массовая доля атомов азота наибольшая в составе:
1) аммиачной селитры;
2) мочевины;
3) калийной селитры;
4) натриевой селитры.
6. Азотную кислоту можно очистить от примесей сер-
ной с помощью:
1) поташа; 2) медного купороса;
3) аммиака; 4) хлорида бария.
7. Оксид металла образуется при нагревании:
1) AgNO3; 2) A1(NO3)3; 3) KNO3; 4) Hg(NO3)2.
8. Реакция получения NO при промышленном про-
изводстве HNO3 из аммиака является:
1) эндотермической;
2) каталитической;
3) обратимой;
4) окислительно-восстановительной.
9. Нитраты образуются при взаимодействии:
1) Mg(NO3)2 (р-р) и К2СО3; Ag и HNO3 (разб.);
2) HNO3 и SiO2; BaSO4 и HNO3 (конц.);
3) СаС12 (р-р) и AgNO3; Na,[Zn(OH)4] и HNO3 (р-р);
4) Na2CO3 и HNO3 (разб.); А1(ОН)3 и KNO3 (р-р).
10. Укажите формулу (символ) частицы, которая вос-
станавливается в реакции, протекающей по схеме: Си +
+ Н+ + NO' -» Си2+ + NO + Н,О:
1) NO; 2) Н+; 3) NO3; 4) Си.
— 409 —
ТЕСТЗ
1. Газ, относительная плотность которого по неону
равна 2,3, выделяется при взаимодействии:
1) Zn и H?SO4 (разб.); 2) Си и HNO3 (конц.);
3) Ag и HNO3 (разб.); 4) S и HNO3 (конц.).
2. В отличие от разбавленной соляной кислоты раз-
бавленная азотная кислота реагирует с:
1) доломитом; 2) серебром;
3) гидроксидом натрия; 4) оксидом цинка.
3. Концентрированная азотная кислота НЕ реагиру-
ет, а концентрированная серная кислота — реагирует с:
1) А1 (20 °C); 2) КС1 (т); 3) NaNO3 (т); 4) КНСО3 (р-р).
4. При взаимодействии цинка с раствором HNO3 об-
разуется только одна соль и только одно простое веще-
ство. Укажите сумму коэффициентов в уравнении реак-
ции:
1) 10; 2) 20; 3) 29; 4) 32.
5. При разбавлении степень восстановления азотной кис-
лоты (т.е. число электронов, принятых молекулой кислоты):
1) увеличивается;
2) уменьшается;
3) не изменяется;
4) может как возрастать, так и уменьшаться.
6. Наиболее глубоко разбавленная азотная кислота
восстанавливается, реагируя с:
1) Mg; 2) Си; 3) Ag; 4) Hg.
7. Смесь бурого газа и кислорода образуется при на-
гревании:
1) KNO3; 2) Cu(NO3),; 3) AgNO3; 4) NH4NOr
8. Концентрированная азотная кислота реагирует, а
концентрированная соляная — нет с:
1) Р; 2) Zn; 3) S; 4) Na2SO4.
--- 410 ---
9. С разбавленной азотной кислотой реагируют:
1) КО; 2) NH4HS; 3) К,СОЧ; 4) (NH4),SO4.
10. В реакциях Zn с HNO3 различных концентраций
можно получить:
1) NO,; 2) NH4NO3; 3) Zn3N2; 4) N,O.
ТЕСТ 4
1. Соль азотной кислоты можно получить при взаи-
модействии:
1) NaNO, (р-р) и AgCl;
2) KCI и AgNO3 (р-р),
3) Na [А1(ОН)Л и HNO (р-р);
4) BaCl, и HNO3 (разб ).
2. Массовая доля атомов азота равна 35% в составе:
1) аммиачной селитры; 2) мочевины;
3) калийной селитры, 4) натриевой селитры.
3. При взаимодействии Mg с очень разбавленной азот-
ной кислотой преимущественно образуется(ются):
1) Mg(NO,),; 2) NH4NO3; 3) NO,; 4) Mg(NO,),.
4. Азотная кислота проявляет окислительные свой-
ства, реагируя с:
1) Си, 2) Са(НСО3)2; 3) Ва(ОН),; 4) Р
5. Вспышка наблюдается при контакте с раскаленным
углем:
1) фосфатов; 2) нитратов, 3) сульфатов; 4) карбонатов.
6. Нужно растворить один моль цинка. Больше всего
(по химическому количеству) для этого потребуется кис-
лоты (в расчете на чистое вещество):
1)НС1(разб);
2) HNO, (конц.) (выделяется NO,);
3) ННО3(разб.) (выделяется NO);
4) H,SO4 (конц.) (выделяется SO,).
— 411 —
7. Укажите число веществ, которые могут вступать в
окислительно-восстановительную реакцию с HNO3
(конц.) — SF6, K,S, НС1 (конц.), СН4, SO,, СаСО3, S, Р:
1) семь; 2) шесть; 3) пять; 4) четыре.
8. Под влиянием микроорганизмов мочевина в почве
превращается в:
1) нитрат калия; 2) карбонат аммония;
3) нитрат натрия; 4) нитрит калия.
9. К числу минеральных азотных удобрений относятся:
1) компост; 2) карбамид; 3) калийная селитра; 4) торф.
10. Укажите схемы последовательных превращений,
лежащих в основе промышленного производства азот-
ной кислоты, исходя из азота:
1) N , NH,OH -> NH3 -> NO -> NO, -> HNO3;
2) N2 -> NH3 -> NO, -> HNO3;
3) N2 -> N,H4 -> NO -> NO, -> HNO3;
4) N, -> NH, —> NO —> NO,HNO,.
X. J x. J
ТЕСТ 5
1. При взаимодействии азотной кислоты с медью
нельзя получить:
1) NH4NO3; 2) NO; 3) N2O5; 4) NO,.
2. Соль и кислород образуются при нагревании нит-
ратов:
1) калия; 2) меди; 3) серебра; 4) натрия.
3. Азотная кислота считается сильной, так как она:
1) растворяет даже серебро;
2) сильный окислитель;
3) полностью диссоциирована в разбавленном вод-
ном растворе;
4) термически неустойчива.
— 412 —
4. В отличие от большинства других кислот азотная
кислота
1) сильная;
2) бесцветная;
3) хорошо смешивается с водой;
4) при взаимодействии с металлами редко выделяет
водород.,
5. НЕЛЬЗЯ приготовить насыщенный раствор азот-
ной кислоты в воде, так как она:
1) летучая; 2) сильная; 3) неустойчивая; 4) неограни-
ченно растворяется в воде.
6. Укажите схемы реакций, в которых азотная кисло-
та проявляет специфические свойства:
1) HNO3 + Р —> NO, + Н3РО4 + Н,О,
2) HNO3 NO, + Н,0 + О,;
3) HNO3 + Ва(ОН), Ba(NO3), + Н,О;
4) HNO, + К2О —» KNO, + Н,б.
7. Из амм’иака объемом 1,00 м3 (н.у.) теоретически
можно получить азотную кислоту массой (кг):
1) 1,82,2) 2,81; 3)2,18; 4)3,04
8. Рассчитайте объем кислорода (м3, н.у), затраченный
на всех стадиях производства HNO, по схеме: NH3
—> NO 2Ж NO, +о”+н'? HNO3, если израсходован амми-
ак объемом 10 м3 (н. у):
1) 10; 2) 15; 3) 20; 4)25.
9. В разбавленной азотной кислоте объемом 500 см3
содержится 5,6 • 1020 ионов водорода. Укажите массу (г)
HNO3 в таком растворе объемом 5 дм3:
1) 0,59, 2) 0,49; 3) 0,39; 4) 0,29.
10. Азотную кислоту от примесей хлороводорода мож-
но очистить с помощью:
1) K,SO4; 2) NaOH; 3) AgNO3; 4) Р,О5
--- 413 ----
ТЕСТ6
1. Азотную кислоту от примеси нитрата бария можно
очистить с помощью:
1) AgNO3; 2) КОН; 3) K2SO4; 4) КС1.
2. Укажите график изменения от времени t массы т
твердого остатка при нагревании нитрата алюминия:
3. Укажите формулу соли, при нагревании которой до
постоянной массы масса твердого остатка составит
61,8% от исходной массы соли:
1) KNO3; 2) AgNO3; 3) Fe(NO3)3; 4) Hg(NO3)2.
4. Газ только одной формулы (н.у.) выделяется при на-
гревании:
1) NH4NO2; 2) KNO3; 3) Cu(NO3)2; 4) Zn(NO3),.
5. Азотная кислота на свету и при нагревании разла-
гается на:
1) N,O5, Н,О; 2) NO, NO,, Н,О;
3) N*O3, Н2О; 4>NO,, О2, Н2О.
6. Укажите формулы всех продуктов разложения
Hg(NO3), при нагревании:
l)HgO,NO„O,; 2)Hg, NO,, О,;
3) Hg, NO, О,; 4) HgO, NO, О,.
— 414 —
7. Свойства как окислителя, так и солеобразователя
HNO3(kohlj.) проявляет, реагируя с:
l)P;2)CuO;3)Zn;4)C6H6. '
8. Желтая окраска HNO3 (конц.) обусловлена содер-
жанием в ней:
1) О2; 2) NO,; 3) NO, и О,; 4) N, и О,
9. Наибольший объем О, выделится при нагревании
одного моля.
1) KNO,; 2) Cu(NO3)2; 3) A1(NO3)3, 4) AgNO3.
10. Наибольший объем О, выделится при нагревании
100 г соли, формула которой:
1) NaNO3; 2) Zn(NO3)2; 3) Fe(NO,),; 4) Hg(NO3),.
ТЕСТ 7
1. На полное растворение магния массой 0,48 г из-
расходовалась азотная кислота химическим количеством
0,050 моль. При этом могли образоваться:
1) N2O; 2) NO,, 3) NH4NO3, 4) N,.
2. Пробирки c HNO3 (конц), НС1 (конц.) и H,SO4 (разб.)
можно различить с помощью одного реактива, формула
которого:
1) КОН; 2) ВаС12; 3) РЬ; 4) К,СО3.
3. Укажите коэффициенты соответственно a, b, с, е,
/ перед формулами веществ в ОВР, схема которой
«Zn + Ж1 + cNO3 = <7Zn2+ + eNH4 +/Н,О:
1)4,10,4,1,4,3; 2)4,10,1,1,3,4;
3)4,10,1,4,1,3; 4)4,10,2,4,3,2.
4. Укажите коэффициент перед Н+ в уравнении реак-
ции, схема которой NO3 + Н" —> NH4 + Н,О:
1) 10, 2) 8,3)6; 4)4
--- 415
5. С помощью HNO3 (конц.) при температуре 20 °C
можно полностью растворить смеси веществ:
1) Zn, CuO, Au; 2) А1,О3, Mg, Fe,O3;
3) K,CO3, Cu, MgO; 4) КОН, FeCO3,Fe.
6. Тлеющий уголек вспыхнет, если на него нанести
немного вещества, формула которого:
1) NaNO3; 2) Na,SO4; 3) NaCl; 4) NaOH.
7. Какая масса (г) воздуха потребуется для получения
азота объемом 2,24 дм3 (н.у.), если объемная доля азота в
воздухе равна 78%?
1)3,72; 2) 3,67; 3)3,58; 4) 3,41.
8. Чему равна объемная доля (%) кислорода в смеси
газов, образующихся при нагревании нитрата серебра (I)?
1)22,2; 2) 33,3; 3)55,5; 4) 66,7.
9. В окислительно-восстановительную реакцию с
HNO3 (конц.) вступает каждое из веществ в наборе:
1) SiO„ Си, Fe(OH)3, HI, MgO;
2) HI, SO,, S, P, K,S;
3) Ag, P, S, Na,S, NaHCO3;
4) H2S, C, CuCl,, NH3, NaOH.
10. При восстановлении азотной кислоты массой 3,15г
атомы азота присоединили 2,408 • 1023 электронов. Ука-
жите формулу продукта восстановления кислоты:
1) N2; 2) NO,; 3) NH3(NH,NO3); 4) NO.
ТЕСТ 8
1. Новая кислота образуется, когда с HNO3 (конц.) реа-
гируют:
1)ShCu; 2) S и Р;
3) Zn и СиО; 4) А1(ОН)3 и КС1.
— 416 —
2. Какую массу (г) HNO, можно теоретически полу-
чить из нитрата калия массой 7,50 г?
1)4,53; 2) 4,68; 3)4,81,4) 5,08.
3. Массовая доля HNO, в растворе повысится, если:
1) нагревать раствор (при 100°С),
2) добавить в раствор аммиак;
3) добавить в раствор нитрат калия;
4) добавить в раствор оксид азота (IV) (в присут. ОД
4. Окислительно-восстановительная реакция при
обычных условиях или при нагревании протекает меж-
ду ИМОДконц.) и:
1) Na,[Be(OH)4], 2) Cu,S; 3) FeO, 4) Hl
5. Различить между собой пробирки с разбавленны-
ми кислотами — соляной, азотной и серной — можно с
помощью:
l)H,OnAgNO,; 2) AgNO, и BaCl,;
3) К,СО, и КОН; 4) Na,SO4 и BaCl,.
6. Массовая доля концентрированной HNO, в раство-
ре уменьшится, если:
1) добавить в раствор поташ;
2) добавить в раствор оксид азота (V);
3) нагреть раствор;
4) пропустить в раствор сероводород.
7. На полное растворение цинка массой 3,25 г израс-
ходовалась HNO, химическим количеством 0,150 моль.
При этом получили:
1) только NO; 2) смесь NO и NO,;
3) только NO,; 4) только N,.
8. Три различных элемента изменяют степень окис-
ления в ОВР, протекающей при нагревании:
I) NH4NO,; 2) KNO,; 3) A1(NO,),; 4) Hg(NO,),
<4 Зак. 1530 --- 417 ---
9. Укажите формулу продукта восстановления HNO3
в ОВР, протекающей при нагревании кислоты:
1) NO; 2) Н,О; 3) О,; 4) NO,.
10. Степень окисления атома металла повышается, ког-
да с горячей концентрированной азотной кислотой реа-
гируют соединения:
1) Си (I); 2) Al (III); 3) Fe (II); 4) Zn (II).
ТЕСТ 9
1. При взаимодействии как с HNO3 (конц.), так и
Н,8О4(конц.) новая кислота образуется в случае:
1) оксида серы (IV); 2) фосфора;
3) бензола; 4) оксида кремния (IV).
2. В раствор AgNO3 добавляли СаС1, до прекращения
выпадения осадка, который затем отфильтровали. Кон-
центрация каких ионов будет наибольшей в фильтрате?
1) Са2+; 2) NO3; 3) Ag+; 4) CF.
3. При взаимодействии золота массой 1,970 г с царс-
кой водкой расходуется хлороводород массой (г):
1) 1,075; 2) 1,085; 3) 1,095; 4) 1,105.
4. В уравнении реакции, описывающей процесс взры-
ва черного пороха, укажите сумму коэффициентов пе-
ред формулой(ами) восстановителя(ей):
1)5; 2) 4; 3)3; 4) 2.
5. В смеси газов, образовавшихся после прокалива-
ния нитрата, объемная доля кислорода равна 33,3%. Это
могут быть нитраты, формулы которых:
1) AgNO3; 2) Cu(NO3)2; 3) A1(NOS)3; 4) Hg(NO3)r
6. Пробирки c H,SO4 (конц.) и HNO3 (конц.) можно
различить с помощью:
1) сахара; 2) медных опилок;
3) индикатора; 4) деревянной лучинки.
— 418 —
7. Азотная концентрированная кислота НЕ реагиру-
ет, а серная концентрированная кислота — реагирует с:
1)Си; 2) K2SO4(t); 3) S; 4) Р.
8. Сила кислот сначала возрастает, а затем ослабевает
в рядах:
1) H,SO4 (конц.), HNO3 (конц.), HNO3 (разб.);
2) HNO. (конц.), HNO3 (разб.), H,SO4 (конц.);
3) H3SO4 (конц.), HNO3 (разб.), HNO3 (конц.);
4) HNO, (конц.), H2SO4 (конц.), HNO3 (разб.).
9. На нижеприведенном рисунке укажите линии, опи-
сывающие изменение во времени концентраций соот-
ветственно NO, и О2 при нагревании HNO,:
I) 1 и 2; 2)2 и 3; 3)3 и 4; 4) 1 и 4.
10. К раствору ВаС1, добавляли раствор AgNO3. Ука-
жите отношение n(AgNO3)/n(BaCl,), отвечающее изло-
му на нижеприведенном графике:
п (ВаС12)
1) 1 : 1;2) 1 :2;3)2: 1;4) 1 : 3.
п (AgNO3)
— 419 —
ТЕМА 31
Фосфор. Оксиды фосфора. Фосфорная кислота
и ее соли. Фосфорные удобрения
ТЕСТ1
1. Фосфор — восстановитель, реагируя с:
1) Mg; 2) КС1О3; 3) С1,; 4) HNO,.
2. Органические вещества могут обугливаться под дей-
ствием:
1) НС1 (разб.); 2) Р4О|0; 3) H2SO4 (конц.); 4) Р4О6.
3. Между собой белый и черный фосфор отличаются:
1) типом кристаллической решетки;
2) химической активностью;
3) качественным составом;
4) физическими свойствами.
4. Свою максимальную степень окисления атом фос-
фора проявляет в составе:
1) фосфидов; 2) фосфина;
3) ортофосфатов; 4) метафосфатов.
5. Укажите формулы соединений с одинаковой сте-
пенью окисления атома фосфора:
1) Н4Р2О7; 2) Ва(РО3)2; 3) СаН2Р2О7; 4) Са3Р,.
6. С ортофосфорной кислотой могут реагировать:
1) NH3; 2) К2НРО4; 3) NaH,PO4; 4) Ва(ОН)2.
7. Охарактеризуйте свойства фосфорной кислоты:
1) твердое вещество (н.у.);
2) НЕ вступает в реакцию этерификации;
3) сильнее угольной, но слабее серной;
4) взаимодействует только с теми металлами, которые
--- 420 --
в электрохимическом ряду стоят до водорода.
8. Укажите формулы веществ, с которыми в водном
растворе взаимодействует дигидрофосфат аммония:
1) КОН; 2) NH3; 3) Р2О5; 4) H,SO4 (конц.).
9. Как HNO3 (конц.), так и Н.РО4 реагируют с:
1) Си; 2) КНСО3; 3) K,S; 4) (NH4)2CO3.
10. Валентные углы в молекуле белого фосфора равны:
I) 120°; 2) 109°; 3)60°; 4) 90°.
ТЕСТ 2
1. Формулы соответственно фосфина и фосфида—это:
1) РН3 и РС15; 2) РН3 и Са3Рп;
3) РН3 и Р2О5; 4) РН3 и РД.'
2. Укажите формулу кислоты, которой соответствует
оксид фосфора (III):
1) Н,РО,; 2) Н3РО3; 3) НРО3; 4) Н4Р2О7.
3. Для свойств белого фосфора справедливы утвер-
ждения:
1) тугоплавкий;2)летуч; 3) ядовит;
4) химически более активен, чем черный фосфор.
4. Как фосфор, так и сера — восстановители, реаги-
руя с:
I) магнием; 2) азотной кислотой;
3)хлором; 4)кислородом.
5. Белый фосфор более активен, чем азот, так как:
1) заряд ядра атомов фосфора меньше;
2) молекулы фосфора имеют большую массу;
3) энергия связи в молекуле белого фосфора меньше,
чем в молекуле азота;
4) элемент фосфор (в отличие от элемента азота) не
имеет изотопов.
— 421
6. Укажите коэффициент перед формулой восстано-
вителя в уравнении реакции промышленного получе-
ния фосфора*:
1)6; 2) 5; 3)4; 4)3.
7. Дигидрофосфат кальция является составной частью
удобрений:
1) фосфоритная мука; 2) аммофос;
3) простой суперфосфат; 4) двойной суперфосфат.
8. Концентрированная азотная кислота реагирует, а
фосфорная—нет с:
1)А1;2)Сп; 3) Р; 4) S.
9. Низшую степень окисления фосфор проявляет в
составе:
1) Р2О5; 2) РС13; 3) СаД; 4) Н3РО2.
10. Белый фосфор—легкоплавкое и летучее вещество,
так как имеет кристаллическую решетку:
1) молекулярную; 2) металлическую;
3) атомную; 4) ионную.
ТЕСТЗ
1. Фосфор — окислитель, реагируя с:
1) бертолетовой солью; 2) хлором;
3) магнием; 4) серой.
2. Фосфорная кислота по отдельности реагирует со все-
ми веществами, формулы которых приведены в рядах:
1) NH4HCO3, K2SiO3, СаНРО4, NH3, K,S;
2) К,НРО4, Na,CO3, Mg, К,О, NaH,PO4;
3) КОН, NH3 Н,О, К3РО4, К,СО,, Na,SO4;
4) Ва(ОН),, AgNO3, Na3PO4, KHS, NH4HS.
* Формулу фосфора записывайте как Р.
--- 422 ---
3. Дигидрофосфат натрия в водном растворе реаги-
рует, а фосфат натрия — нет с:
1) Са(ОН),; 2) H,SO4 (конц.);
3)Н3РО4/ 4)NH3.
4. Фосфорную кислоту можно получить взаимодей-
ствием:
1) дигидрофосфата кальция с концентрированной сер-
ной кислотой;
2) оксида фосфора (III) с водой;
3) оксида фосфора (V) с горячей водой;
4) воды и метафосфорной кислоты.
5. Укажите формулы дигидрофосфатов:
I) КН2РО3 и NH4H,PO4;
2) MgH,P2O7 и КН2РО4;
3) Са(Н,РО4)7 и NH4H,PO4;
4) КН2РО2 и NaII2PO4.
6. Укажите число веществ из указанных (Н„ КС1О3,
HNO3 (конц.), S, О„ H,SO4 (конц.), Са, С12), с которыми
может реагировать фосфор:
1) 8; 2) 7; 3) 6; 4) 5.
7. Для атома фосфора в соединениях возможны сте-
пени окисления:
1)-4; 2)—3; 3)+3; 4) +5.
8. Свою максимальную степень окисления атом фос-
фора проявляет в составе:
1)РС15; 2) Р4О|0; 3) Са3Р2; 4)Н4Р2О7.
9. Соль ортофосфорной кислоты НЕЛЬЗЯ получить
при взаимодействии:
1) Н3РО4 (р-р) и NH3;
2) BaO, (р-р) и Na3PO4 (р-р);
3) Р4иСа;
4) Р,О3иКОН (р-р).
--- 423 ---
1
10. С образованием осадка разбавленный водный ра-
створ Na3PO4 реагирует с:
1) AgNO3; 2) H,SO4; 3) СаС17; 4) Н,РО4.
ТЕСТ 4
1. Дигидрофосфат образуется при взаимодействии
(электролиты взяты в виде водных растворов):
1) 1 моль Р7О, и 2 моль КОН;
2) 1 моль Р7О5 и 1 моль Ва(ОН)7;
3) 1 моль NH3 и 0,5 моль Н3РО4;
4) 1 моль Са3(РО4), и 1 моль Н3РО4.
2. Укажите справедливые утверждения:
1) белый фосфор используется в изготовлении спичек;
2) в темноте светится белый фосфор;
3) фосфор входит в состав костей человека;
4) фосфор в природе в основном встречается в сво-
бодном виде.
3. Охарактеризуйте строение молекулы белого фосфо-
ра и связи в ней:
1) плоский треугольник с атомом фосфора в центре;
2)тетраэдр;
3) все связи о-типа;
4) всего в молекуле 6 связей.
4. Прочность связи в ряду молекул PF3, РС13, Р13:
1) последовательно уменьшается;
2) последовательно возрастает;
3) сначала возрастает, затем уменьшается;
4) сначала уменьшается, затем возрастает.
5. В реакции, уравнение которой NH3 + Н7РО“ = NH4 +
+ НР(Д , дигидрофосфат-ион ведет себя как:
1) восстановитель; 2) окислитель;
3) донор протонов; 4) акцептор электронов.
--- 424 ---
6. Основной составной частью фосфорита является
вещество, формула которого:
1) РН3; 2) Са3Р,; 3) Са,(РО4),; 4) СаНРО4.
7. Соль фосфорной кислоты можно получить при вза-
имодействии:
1) СаНРО4 и Ва(ОН), (р-р);
2) Н,РО4 и С,Н5ОН; *
3) ВаНРО4и Н3РО4 (р-р);
4) NH,H,PO, и NH, Н,О.
8. В отличие от дигидрофосфата калия фосфат калия
реагирует с веществом, формула которого:
1) КОН (р-р); 2) Н3РО4; 3) Ва(ОН)2; 4) NH3 • Н2О.
9. Укажите, между веществами в каких парах возмож-
ны обе химические реакции:
1) Са3(РО4)2 и H,SO4 (конц.); Na,SO4 (р-р) и Н3РО4;
2) Р и HNO3 (конц.); AgNO, (р-р) и Н,РО4 (разб.);
3) СаНРО4 и КОН (р-р); КН,РО4 (р-р) и Н3РО4;
4) К2НРО4 (р-р) и Н3РО4; NaHCO3 (р-р) и Н3РО4.
10. При н.у. газами являются:
1)Н3РО4; 2) РН3; 3) Р2О5; 4)NO2.
ТЕСТ 5
1. Укажите формулу двойного суперфосфата:
1) Са(Н,РО4)2 + 2CaSO4 Н,О;- 2) Са3(РОД;
3) Са(Н2РО4)2; 4) СаНРО4 • 2Н,О.
2. Осадок, нерастворимый в разбавленных сильных
кислотах, образуется при взаимодействии:
1) КОН (р-р) и Н3РО4; 2) КН,РО4 и КОН (р-р);
3) AgNO3 (р-р) и Н3РО4 (разб.); 4) Р,О. и NaOH (р-р).
3. Комплексными являются удобрения:
1) аммофос; 2) калийная селитра;
--- 425 ---
3) двойной суперфосфат; 4) натриевая селитра.
4. Бинарные соединения фосфора с металлами назы-
ваются:
1) фосфиды; 2) фосфины;
3) фосфаты; 4) суперфосфаты.
5. Укажите схему реакции, отражающей химизм горе-
ния спички при ее трении о боковую поверхность коробка:
1) Р + О, —> Р,О5;
2) Р + Са —> Са3Р,;
3) Р + КС1О3 -> КС1 + Р,О5;
4) Са3(РО4), + SiO2 -> CaSiO3+ Р,О5.
6. Вправо равновесие процесса РО3 + Н.,0 НРО4“ +
+ ОН - Q сместится, если:
1) подогреть раствор; 2) подкислить раствор;
3) подщелочить раствор; 4) разбавить раствор водой.
7. Средняя соль фосфорной кислоты образуется при
взаимодействии:
1) СаО и РЭО5;
2) СаС12 (р-р) и Na3PO4 (р-р);
3) 1 моль Р2О5 и 6 моль КОН (р-р);
4) 1 моль Р,О5 и 2 моль КОН (р-р).
8. Совместно в водном растворе в значительных ко-
личествах НЕ могут существовать ионы:
1) РО3 и К+; 2) Н,РО~ и ОН;
3) РО3- и Ag+; 4) РО3- и Н+.
9. Укажите формулы веществ, с которыми в водном
растворе реагируют как фосфорная кислота, так и гидро-
ксид кальция:
1) Са(Н2РО4)2; 2) NaCl; 3) К,НРО4; 4) NaHCO3.
10. Укажите схему качественной реакции на фосфат-ион:
1) РО3 + Н+ -> Н3РО4; 2) РО3 + Ag+ -> Ag3PO4;
3) РО3" + К+ -> К РО4) РО3- + Na+ -> Na,P04.
7 4 3 4’ 7 4 34
--- 426 ---
ТЕСТ 6
1. Наибольшее число о- связей содержится в молекуле:
1) пирофосфорной (дифосфорной) кислоты;
2) метафосфорной кислоты;
3) Р4О|0;
4) ортофосфорной кислоты.
2. Ортофосфорная кислота НЕ реагирует с:
1) преципитатом; 2) двойным суперфосфатом,
3) фосфоритной мукой; 4) калийной селитрой.
3. Дигидрофосфат кальция может образоваться при
взаимодействии:
1) Сач(РО4)2 и H2SO4 (конц ); 2) Са,(РОД и Н3РО4;
3) СаНРО4 и Са(ОН)2; 4) СаНРО4 и НЧРО4. •
4. Оксид фосфора (V) образуется, когда между собой
реагируют:
1) Р.О, и О,; 2) Р и КС1О3 (/°);
3) Са,(РО4)2 и SiO, (/°); 4) Са3Р; и Н,О.
5. Аммофос можно получить взаимодействием:
1) фосфорита с серной кислотой;
2) аммиака с водой;
3) аммиака с фосфорной кислотой;
4) аммиачной воды с соляной кислотой.
6. Оксид фосфора (V) может реагировать с вещества-
ми, формулы которых:
1) HNO3; 2) SiO2; 3) КОН; 4) Н2О.
7. Учитывая, что P,OS жадно поглощает воду, укажи-
те продукты реакции между оксидом фосфора (V) и сер-
ной кислотой:
1) SO, и НРО„ 2) SO, и Н3РО4;
3) SO, и ПРО,, 4) SO; и Н,РО3.
--- 427 ---
8. Укажите ряд, в котором формулы ионов, находящихся
в растворе Ва(Н2РО4),, записаны в порядке увеличения их
химического количества (гидролиз не учитывайте):
1) РО3-, НРО;-, Н,РО;, Ва2+, Н+;
2) РО3-, НРО2’, Н’РО;, Н', Ва2+;
3) РО3’, НРО;-, Н:, Н,РО;, Ва2+;
4) РО;, НРО2’, Н+, Ва2+, Н.РО;.
9. Укажите пары, в водных растворах которых pH для
первого вещества больше, чем для второго (молярные
концентрации одинаковы):
1) К,РО4 и Na ,HPO (; 2) PH, и NH,;
3) К2НРО4 и КН,РО4; 4) NaH2PO4 и NaNO,.
10. Укажите число молекул белого фосфора в его пор-
ции массой 24,8 г:
1) 1,204 • 1023; 2) 1,204 • 1022; 3) 1,204 • 1024; 4) 6,02 • 1023.
ТЕСТ 7
1. В несколько стадий в водном растворе диссоциируют.
1) Н,РО4; 2) К,РО4; 3) К,НРО4; 4) КНПРО4.
2. Раствор, содержащий 0,1 моль Н,РО4 и гидроксид
натрия массой 6,0 г, выпарили и получили:
1) ортофосфат натрия;
2) дигидроортофосфат натрия;
3) смесь равных химических количеств дигидроорто-
фосфата натрия и гидрофосфата натрия;
4) смесь равных химических количеств ортофосфата
натрия и гидроортофосфата натрия.
3. Совместно в водном растворе НЕ могут находиться
ионы:
1) Н РО. и НРО;-; 2) РО3 и НРО;-;
3) Н>04 и РО3-; 4) Н,РО( и ОН .
--- 428 ---
4. Наибольшее химическое количество ионов РО’ мож-
но обнаружить в водном растворе, содержащем 0,05 моль:
1) Н,РО4; 2) NaH2PO4; 3) Na,HPO4; 4) К,РО4.
5. В фосфорных удобрениях принято массовую долю
атомов фосфора приводить в перерасчете на оксид фос-
фора (V). Укажите массовую долю (%) оксида фосфора
(V) в составе двойного суперфосфата:
1) 60,7; 2) 57,5; 3) 43,4; 4) 31,2.
6. Прочность связи последовательно возрастает в ряду
соединений, формулы которых:
1)NH3,PH„H2S; 2) РН3, NH3, HnS;
3) РН3, H.S, NH3; 4) H2S, РН3, NH3.
7. Температура кипения веществ последовательно
возрастает в ряду:
1) Р4, NH3, РН3; 2) Р4, РН3, NH3;
3) РН3, NH3, Р4; 4) NH3, РН3, Р4.
8. Водные растворы NaCl и Na3PO4 можно различить
с помощью:
1) AgNO3; 2)HNO3; 3) КОН; 4) КС1.
9. Ортофосфорная кислота реагирует с:
1) К, НРО,; 2) Са(Н,Р0(),,
3) Na3PO4; 4) Na2SO4.
10. Водные растворы КС1, KNO3 и К3РО4 можно раз-
личить с помощью:
1) H„SO4 (разб.); 2)CH3COOAg;
3)BaI2; 4)Са(ОН)2.
ТЕСТ 8
1. В кристаллогидрате Na,HPO4 • хН,0 массовая доля
атомов фосфора равна 11,56%. Укажите значение х.
1)5; 2) 7; 3) 11; 4) 15.
--- 429 ---
2. Энергия химической связи минимальна в веществе:
1) азот; 2) черный фосфор;
3) белый фосфор; 4) красный фосфор.
3. На нейтрализацию фосфорноватистой кислоты
Н.РО, массой 6,6 г требуется гидроксид калия химичес-
ким количеством 0,1 моль. На основании этих данных
укажите графическую формулу кислоты:
Н —О\ /О
Н— СК \ / ।
1) /Р-Н; 2) Н —О —Р | ;
Н~° Н—OZ
Н —О. /Н
3) /Р^
Н ХО
Н
I /О
4) Н —Р^
1^0
н
4. Какая масса (кг) фосфорита с массовой долей фос-
фата кальция 90% потребуется для получения фосфора
массой 62 кг при выходе продукта 80%?
1) 430,6; 2) 382,7; 3) 344,4; 4) 310,0.
5. На нейтрализацию фосфористой кислоты Н3РО3 хи-
мическим количеством 0,05 моль потребовался гидро-
ксид натрия массой 4,0 г. На основании этих данных ука-
жите графическую формулу кислоты:
Н —
1) о=Р=О;
н
Н—О—Р—о—н
2> i
I
н
Н— О /О—н
4)
н
430 ---
6. При взаимодействии некоторого металла с порцией
красного фосфора, содержащей 3,01 1022 атомов фосфора,
образовался фосфид массой 4,55 г Укажите символ металла:
l)Mg; 2) Ca;3)Sr; 4) Ba.
7. К раствору, содержащему 0,03 моль Ва(ОН),, по кап-
лям добавляют раствор, содержащий 0,028 моль НЧРО4
При этом образуются:
1) только Ва,(РОД;
2) только ВаНРО4;
3) смесь Ва3(РОД и ВаНРО4 с преобладанием хими-
ческого количества Ва3(РОД;
4) смесь Ва3(РОД и ВаНРО4 с преобладанием хими-
ческого количества ВаНРО4.
8. Порция белого фосфора, содержащая 6,02 • 1021 моле-
кул, с образованием фосфида без остатка реагирует с образ-
цом металла массой 8,22 г. Укажите символ металла:
l)Mg; 2) Ва;3)Са; 4) Sr.
9. Порция белого фосфора, содержащая 3,612 • 1023 элек-
тронов в атомах, без остатка взаимодействует с метал-
лом и образует фосфид массой 6,52 г. Укажите символ
металла.
1) Sr; 2) Ва;3)Са; 4) Mg.
10. Смешали растворы, содержащие равные химичес-
кие количества К3РО4 и КН,РО4 Укажите сумму коэф-
фициентов в сокращенном ионном уравнении протека-
ющей при этом реакции:
1)4, 2)3; 3)2; 4) 1.
--- 431
ТЕМА 32
Общая характеристика элементов IVA группы.
Углерод. Оксиды углерода.
Угольная кислота и ее соли
ТЕСТ1
1. Укажите справедливые утверждения:
1) все элементы IVA группы — элементы неметаллы;
2) электронная конфигурация внешнего электронно-
го слоя атомов элементов IVA группы — ns~np- (п — но-
мер периода);
3) все оксиды состава ЭОэ для элементов IVA группы
являются кислотными;
4) в ряду СО„ SiO„ GeO„ SnO.,, РЬО, кислотные свой-
ства оксидов постепенно ослабевают.
2. Охарактеризуйте физические свойства оксида уг-
лерода (II):
1) бесцветный газ (н.у.);
2) ядовит;
3) обладает характерным запахом;
4) хорошо растворим в воде.
3. Отметьте формулы кислых солей угольной кислоты:
1) (СиОН),СО3; 2) NH4HCO3;
3) Ва(НСО3)2; 4) CO(NH2)2.
4. Карбонат натрия может реагировать с:
1) водным раствором СОП; 2) KNO3 (р-р);
3)ВаС12(р-р); ‘ 4)SiO2(z°).
5. Степень окисления атома углерода наименьшая в
веществе, формула которого:
1) НСНО; 2) СО; 3) СО2; 4) SiC.
--- 432 ---
6. Аллотропными модификациями углерода являются:
1) графит и кокс;
2) фуллерен и алмаз;
3) карбин и алмаз;
4) алмаз и активированный уголь.
7. Кальцинированную соду можно получить при на-
гревании:
1) известняка;
2) питьевой соды;
3) кристаллической соды;
4) малахита.
8. Соль угольной кислоты может образоваться при
взаимодействии:
1) K,SiO3 (р-р) и СО,;
2) Са(НСО3), и NaCl (разб. р-ры);
3) NaHCO3 и СаС1,;
4) NH3 • Н,0 и СО,.
9. Реактивом на углекислый газ является:
1) Mg; 2) КОН (р-р); 3) Н,О; 4) Са(ОН), (р-р).
10. Углекислый газ проявляет свойства кислотного
оксида, реагируя с:
1) углеродом;
2) оксидом кальция;
3) магнием;
4) гидроксидом бария.
ТЕСТ 2
1. Укажите справедливые утверждения:
1) в отличие от алмаза графит проводит электричес-
кий ток;
2) в химических реакциях углерод всегда восстановитель;
— 433
3) графит нельзя превратить в алмаз ни при каких ус-
ловиях;
4) алмаз имеет атомное строение, а фуллерен — мо-
лекулярное.
2. Формулы карбидов — это:
1) СаСО3; 2) SiC; 3) СаС2; 4) А14Су
3. Газ (20 °C) выделяется, когда в воду вносят:
1) карборунд; 2) карбид кальция;
3) карбид алюминия; 4) кокс.
4. Сместить вправо равновесие процесса СО~ + Н2О
НСО3 + ОН - Q можно:
1) повышением температуры;
2) подкислением раствора;
3) подщелачиванием раствора;
4) добавлением воды.
5. В процессе фотосинтеза участвуют оксиды:
l)SiO, иН,О; 2)СО,иН,О;
3)СОиН2О; 4) СО2 и SiO,.
6. Углекислый газ образуется в результате:
1) спиртового брожения глюкозы;
2) фотосинтеза;
3) нагревания гидрокарбоната калия;
4) взаимодействия мела с азотной кислотой.
7. Оксид углерода (IV) и оксид углерода (II) между со-
бой различаются:
1) числом л-связей в молекуле;
2) степенью окисления атома углерода;
3) валентностью атома углерода;
4) окислительно-восстановительными свойствами.
8. Углерод — окислитель, реагируя с:
1)Н2; 2) O2;3)Si; 4) Са.
— 434 —
9. Углерод в составе кокса — только восстановитель,
реагируя с:
1) HNO, (конц ); 2) СО,,
3) оксидом кальция; 4) водой.
10. Углекислый газ может реагировать с:
1) известковым молоком; 2) коксом;
3) магнием, 4) оксидом фосфора (V).
ТЕСТЗ
1. Укажите справедливые утверждения.
1) с увеличением атомного номера радиус атомов эле-
ментов IVA группы последовательно возрастает,
2) в ряду атомов элементов С, Si, Ge, Sn энергия иони-
зации постепенно возрастает;
3) в ряду атомов элементов С, Si, Pb электроотрица-
тельность атомов последовательно уменьшается;
4) энергия связи в соединениях СН4, SiH4, GeH4 пос-
ледовательно уменьшается.
2. Углекислый газ — окислитель, реагируя с:
1) коксом, 2) оксидом кальция, 3) магнием; 4) водой.
3. Атомы кремния и углерода между собой различаются:
1) протонным числом,
2) числом валентных электронов;
3) числом вакантных орбиталей на внешнем элект-
ронном слое,
4) числом электронов в атоме.
4. Водный раствор кальцинированной соды реагиру-
ет с веществами, формулы которых:
1) ВаС1,; 2) СО,; 3) Са(НСО,),; 4) KNO,.
5. Водные растворы КНСО3 и К,СО4 можно разли-
чить с помощью:
1) HCI; 2) СаС12; 3) NaNO3; 4) NaOH.
--- 435 ---
6. Гидрокарбонаты в карбонаты в водном растворе
полностью можно перевести с помощью:
1) сильной кислоты; 2) щелочи;
3) воды; 4) углекислого газа.
7. Карбонаты в гидрокарбонаты можно полностью
перевести с помощью:
1) СО, (р-р); 2)Н,О;
3) КОН (р-р); 4) NaOH (р-р).
8. Валентность и степень окисления атома углерода
численно совпадают в составе соединения, формула ко-
торого:
1) СН,О; 2) Н,С,О4; 3) СО; 4) SiC.
9. Укажите схемы окислительно-восстановительных
реакций:
1)CO+JC12-»COC1,;
2) СО2 + Са(ОН), —>Са(НСО3),;
3) СО., + Mg -> MgO + С;
4) СаС, + Н,0 -> Са(ОН), + С,Н,.
10. Кислая соль угольной кислоты в качестве конеч-
ного продукта образуется при взаимодействии:
1) СаСО3 и СО, (р-р);
2) СО, (2 моль) и Ва(ОН), (1 моль);
3) СО, и NaOH (р-р, изб.);
4) NaHCO3 (р-р) и СаС1, (р-р).
ТЕСТ 4
1. Водный раствор карбоната калия реагирует с:
1) СО,; 2) SiO,; 3) НС1; 4) KNO,.
2. В водном растворе карбонат натрия реагирует, а
гидрокарбонат натрия — нет с веществами, формулы
которых:
1) Н3РО4; 2) СО,; 3) HCI; 4) СаС1,.
— 436 —
3. Углерод — восстановитель, реагируя с:
1) Н,; 2) О,; 3) Са; 4) CuO.
4. Для полного превращения гидрокарбоната бария в
карбонат бария можно использовать:
1)воду;
2) гидроксид бария;
3) раствор углекислого газа в воде;
4) гидроксид натрия.
5. Углекислый газ выделяется при:
1) нагревании гидрокарбоната натрия;
2) нагревании смеси песка и кальцинированной соды;
3) нагревании малахита;
4) сливании водных растворов питьевой соды и гид-
роксида натрия.
6. В лаборатории углекислый газ в основном получают:
1) обжигом известняка;
2) взаимодействием мрамора (мела) с сильной кис-
лотой;
3) сжиганием кокса в избытке кислорода;
4) нагреванием питьевой соды.
7. «Сухой лед» — это:
1) твердый сернистый газ;
2) замерзшая вода;
3) твердый оксид углерода (IV);
4) твердый оксид серы (VI).
8. Укажите координационное число атома углерода в
составе фуллерена С :
1)2; 2)3; 3)4; 4) 6.
9. Чему равно число л-связей, посредством которых
в карбине каждый атом С связан с соседними атомами?
1) 1; 2) 2; 3)3; 4) 4.
— 437 —
10. Оксид углерода (II) можно получить:
1) разложением щавелевой кислоты Н,С,О4;
2) сжиганием кокса в избытке кислорода;
3) пропусканием воды над раскаленным коксом;
4) взаимодействием кислорода с избытком кокса.
ТЕСТ 5
1. С увеличением заряда ядра для элементов IVA груп-
пы возрастают:
1) энергия связи в водородных соединениях соста-
ва ЭН4;
2) число электронных слоев в атоме;
3) металлические свойства атомов элементов;
4) число валентных электронов в атоме.
2. В водном растворе питьевая сода реагирует с ве-
ществами, формулы которых:
1) СН3СООН; 2) СО,; 3) КС1; 4) Ва(ОН)2.
3. Степень окисления атома углерода равна +2, а ва-
лентность — III в соединении, формула которого:
1) СО2; 2) СаС,; 3) СО; 4) Н,С2О4.
4. Энергия связи постепенно увеличивается в рядах
соединений, формулы которых:
1) СН4, PbH4, GeH4; 2) PbH4, SiH4, СН4;
3) СН4, GeH4, РЬН4; 4) GeH4, SiH4, СН4.
5. Пропуская через гранулы щелочи, можно осушать
газы, формулы которых:
1)NH3;2)CH4; 3) СО; 4) СО,.
6. В водном растворе как MgCl,, так и Mg(HCO3), мо-
гут реагировать с:
1) гидроксидом натрия; 2) серной кислотой;
3) углекислым газом; 4) питьевой содой.
— 438 -----
7. При одинаковых массах и условиях наибольший
объем СОП выделяется, когда с избытком соляной кис-
лоты реагирует:
1) малахит; 2) доломит;
3) поташ; 4) питьевая сода.
8. Укажите физические свойства графита:
1) мягок,
2) бесцветен;
3) прозрачен;
4) проводит электрический ток.
9. Твердый остаток реакции обжига известняка обра-
ботали водой. Полученный при этом продукт использу-
ется в качестве:
1) антисептика,
2) вяжущего строительного материала;
3) материала для изготовления стекла;
4) основы гипсовых повязок.
10. Охарактеризуйте свойства алмаза
1) атомная кристаллическая решетка,
2) тугоплавок;
3) твердый;
4) хорошо проводит электрический ток
ТЕСТ 6
1. В водном растворе гидро карбонат-ион можно об-
наружить с помощью:
1) гидроксида калия, 2) соляной кислоты;
3) хлорида натрия; 4) нитрата бария
2. Повысить выход угарного газа в реакции С(т) +
+ СОЭ,. Is 2СО. — 119,8 кДж можно:
1) повышением давления;
2) повышением температуры;
--- 439 —
3) понижением давления;
4) увеличением массы угля
3. Соль угольной кислоты можно получить при взаи-
модействии:
1) кальция и кокса;
2) карбида кальция и воды;
3) известковой воды и избытка углекислого газа;
4) водного раствора аммиака и углекислого газа.
4. Основным компонентом мела, мрамора, известня-
ка является:
1) карбонат кальция; 2) карбид кальция;
3) кристаллическая сода; 4) кальцинированная сода.
5. Увеличение давления смещает равновесие в сто-
рону исходных веществ для реакций:
1)СаСО t^CaO +СО ;
7 3(т) 7 (т) 2(г)’
2) СО.. + С(, 2СО
' 2(г) (т) “* (г)’
3) Fe.O,. + ЗСО„ tz 2Fe., + ЗСО 7
' 2 3(т) (г) 7 (Т) 2(Г)’
4) СО2(г) + Н2О(ж) Н2СО, (р-р)
6, При равных химических количествах основного
вещества наибольший объем (н. у) СО , выделяется, ког-
да с избытком соляной кислоты реагирует:
1) кальцинированная сода; 2) известняк;
3) малахит; 4) доломит.
7. Карбонат натрия в качестве конечного продукта НЕ
ОБРАЗУЕТСЯ при взаимодействии:
1) СО., и NaOH (р-р, избыток),
2) NaHCO, и NaOH (р-р);
3) СО., (избыток) и NaOH (р-р),
4) СН,СОО№(т) и NaOH(r) (/°).
8. Укажите уравнение реакции «гашения» извести:
l)MgO + H2o£°Mg(OH)2,
2) Са(ОН)2 + СО2 = СаСО^ + Н2О;
— 440 —
3) Са(ОН),£°СаО + Н,0;
4) СаО + Н,0 = Са(ОН),.
9. В свежеоштукатуренных помещениях гашеная из-
весть затвердевает и превращается в вещество, формула
которого:
1) Са(ОН),; 2) СаО; 3) СаСО3; 4) СаС,.
10. Углерод — окислитель, реагируя с:
1)водой; 2)водородом;
3) алюминием; 4) азотной кислотой.
ТЕСТ 7
1. Укажите справедливые утверждения для водород-
ных соединений состава СН4 — GeH4 — РЬН4:
1) слева направо длина связи возрастает;
2) с ростом атомного номера энергия связи возрастает;
3) наиболее термически устойчив метан;
4) наименее термически устойчив плюмбан (РЬН4).
2. Под действием содержащихся в глубине водоемов
бактерий СО, и Н, реагируют между собой с образова-
нием:
1) С и Н,О; 2) СН4 и Н,О; 3) СО и Н,О; 4) СО и СП,.
3. Разрушение горных пород под действием углекис-
лого газа и воды отражает уравнение реакции:
1) Са(НСО3),+ Са(ОН), = 2СаСО3 + 2Н,О;
2) Са(ОН), + СО, = СаСО3 + Н,О;
3) СаСО + Н,0 + СО, = Са(НСО,),;
4) СаО + СО, = СаСО,.
4. Негашеную известь в промышленности получают
из природного сырья:
1) апатита; 2) известняка;
3) криолита; 4) гипса.
— 441
5. HE являются аллотропными модификациями уг-
лерода:
1) сажа; 2) фуллерен;
3) активированный уголь; 4) карбин.
6. Для оксида углерода (II) НЕВЕРНЫ утверждения:
1) связь в молекуле непрочная;
2) ядовит;
3) обладает выраженными окислительными свойствами;
4) плотность (н.у.) равна 1,25 г/дм3.
7. Укажите уравнение качественной реакции на угле-
кислый газ:
1) СО, + С = 2СО; 2) СО, + 2К0Н = К,СО3 + Н,О;
3) СО,+ Са(ОН), = СаСО3+Н,О; 4) СО, + СаО = СаСО3.
8. С известковой водой реагируют:
1) хлор; 2) карбонат натрия;
3) гидрокарбонат кальция; 4) хлорид калия.
9. К неизвестному раствору добавили раствор, содер-
жащий гидрокарбонат-ионы; при этом выделился газ. В
растворе содержался ион, формула которого:
I) К+; 2) NH;; 3) ОН-; 4) Н+.
10. Карбонат кальция образуется, когда с водным ра-
створом хлорида кальция реагирует:
1) NaHCO3; 2) Na,CO3; 3) СО,; 4) КНСО3.
ТЕСТ 8
1. Углерод может реагировать с веществами, форму-
лы которых:
1) Н,О; 2) HCI(p-p); 3) HNO3 (конц.); 4) Са.
2. При соответствующих условиях оксид углерода (IV)
может реагировать с:
1) питьевой содой (р-р);
— 442 —
2)коксом;
3) магнием;
4) суспензией карбоната кальция.
3. При нагревании щавелевой кислоты в основном
образуются:
1)СО; 2) С; 3) СО,; 4) Н,О.
4. Кальцинированную соду НЕЛЬЗЯ получить нагре-
ванием:
1) известняка; 2) питьевой соды;
3) карбида кальция; 4) силикагеля.
5. Процесс отвердения гашеной извести на воздухе
описывает уравнение реакции:
1) СаО + СО, = СаСО3;
2) Са(ОН), + 2СО, = Са(НСО3),;
3) Са(ОН)‘ + СО, = СаСО, + И,О;
4) СаО + Н,0 = Са(ОН),. '
6. Отметьте формулу оксида с наиболее выраженны-
ми кислотными свойствами:
1) SnO,; 2) СО,; 3) РЬО,; 4) SiO,.
7. Немолекулярное строение (н.у.) имеют:
1) углекислый газ; 2) карборунд;
3) фуллерен; 4) оксид кремния (IV).
8. Только окислительные свойства в реакциях с дру-
гими веществами атом углерода проявляет в составе:
1) угарного газа; 2) углекислого газа;
3) кокса; 4) карборунда.
9. Для того чтобы отделить угарный газ от примеси
углекислого газа, нужно смесь газов:
1) окислить кислородом;
2) пропустить через гранулы щелочи;
3) пропустить над нагретым коксом;
4) пропустить через воду.
— 443 —
10. Угольная кислота -— это:
I) электролит, существующий при температуре 20 °C
только в водном растворе;
2) слабый электролит;
3) электролит, образующий как средние, так и кислые
соли;
4) термически устойчивое вещество.
ТЕСТ 9
1. Человек за сутки выдыхает СО, объемом (н.у.) 0,662 м3.
Это соответствует массе (кг) углекислого газа, равной:
1) 0,650; 2) 1,30; 3) 1,95; 4) 2,60.
2. Одинаковый объем (н. у.) СО, образуется при сжи-
гании равных масс:
I) алмаза и фуллерена; 2) карбина и графита;
3) сажи и алмаза; 4) угля и графита.
3. Превращение СаСО3 -э СО, можно осуществить с
помощью:
1) НС1; 2) SiO,; 3) Н,СО3; 4) нагревания.
4. Доказать наличие в растворе ионов СО~, содер-
жащих также ионы SO3, можно с помощью:
1) BaCl,; 2) НС1; 3) Mg(NO,),; 4) KNO3.
5. Карбонат кальция в качестве конечного продукта
можно получить при взаимодействии (гидроксид взят
в виде водного раствора):
I) СО, и Са(ОН), (избыток);
2) Са(ОН), и СО, (избыток);
3) СаО и СО,;
4) СаС, и Н,О.
6. Водный раствор питьевой соды НЕ реагирует с:
1) Ca(NO3),; 2) НС1; 3) NaOH; 4) Н3РО4.
--- 444 ---
7. Из одного сосуда в другой можно «перелить» газы,
формулы которых:
l)CO2;2)SiH4;3)CH4;4)C3H8.
8. При взаимодействии СО, объемом 1,12 дм3 (н.у.) с
избытком КО, выделяется газ объемом (н.у., дм3):
1) 1,12; 2) 1,68; 3)2,24; 4) 3,36.
9. Оксид углерода (IV) реагирует с пероксидом калия.
При этом образуются вещества, формулы которых:
1) СО и О,; 2) К,СО, и О,;
3) СО и К,СО,; 4) К’СО3, СО и О,.
10. Массовая доля атомов углерода наибольшая в ве-
ществе, название которого:
1) малахит; 2) кальцит;
3) доломит; 4) питьевая сода.
ТЕСТЮ
1. Рассчитайте число атомов углерода в навеске фул-
лерена Cg0 массой 9,6 г:
1) 2,816 • 1023; - 2) 3,816-1023;
3)4,816-1023; 4) 5,816-1023.
2. Температура плавления веществ сначала возраста-
ет, а затем уменьшается в ряду соединений, названия ко-
торых:
1) алмаз, фуллерен, карборунд;
2) фуллерен, карборунд, белый фосфор;
3) фуллерен, белый фосфор, графит;
4) карборунд, фуллерен, алмаз.
3. В пределах одного слоя в графите атом углерода
связан с соседними атомами углерода, число которых
равно:
1) 1; 2) 2; 3)3; 4) 4.
— 445 —
4. Сожгли по 1 г алмаза, графита, фуллерена С60 и фул-
лерена Сда. Объем полученного при этом углекислого газа:
1) больше в случае С60;
2) больше в случае Cg0;
3) наименьший в случае Cg0;
4) во всех случаях одинаков.
5. Валентность атома С изменяется в ходе реакции,
схема которой:
1) СН, + О, СО, + Н,О; 2) НСНО + Н, -э СН .ОН;
3) СО + О, -> СО,; " 4) С,Н, + Вг, С,Н,Вг4.
6. Укажите уравнение реакции промышленного по-
лучения углекислого газа:
1) СаСО,= СаО + СО,?;
2) СаСО3 + 2НС1 = СаС1, + Н,0 + СО,?;
3) 2NaHCO, = Na,CO3 +'Н,0 + СО,?;
4) С6Н12О6 + 60, = 6С0,? + 6Н,0. ~
7. Карбид кальция можно получить при взаимодей-
ствии:
1) гашеной извести и углекислого газа;
2) негашеной извести и углекислого газа;
3) кальция и кокса;
4) оксида кальция и кокса.
8. Осадок образуется, если известковую воду по от-
дельности добавлять к водным растворам:
1) Na,SO4, К,СО3, NaCI;
2) NaHCO3, К,СО3, КВг;
3) NaHSO4, КНСО,, К,СО,;
4) Na,SiO3, Са(НСО,),, K,SO3.
9. Укажите плотность (г/дм3) газовой смеси (н.у.), об-
разующейся при окислении углерода азотной кислотой
(кислота восстанавливается до оксида азота (II)):
1) 1,61; 2) 1,51; 3) 1,41; 4) 1,31.
— 446 —
10. Очистить раствор питьевой соды от примесей по-
таша можно с помощью:
1) НС1; 2) ВаС12; 3) H,SO4 (разб ); 4) KNO,
ТЕМА 33
Кремний. Оксид кремния (IV).
Кремниевая кислота и ее соли.
Строительные материалы на основе
соединений кремния и углерода
ТЕСТ1
1. В ряду олово — кремний — восстановительные
свойства атомов элементов:
1) уменьшаются;
2) возрастают,
3) сначала возрастают, затем уменьшаются;
4) сначала уменьшаются, затем возрастают.
2. В реакциях с азотом, углеродом и серой кремний
проявляет свойства:
1) окислителя;
2) восстановителя;
3) восстановителя в реакции с азотом, окислителя в
реакциях с серой и углеродом;
4) восстановителя в реакциях с азотом и серой, окис-
лителя в реакции с углеродом.
3. По химическим свойствам кремний наиболее по-
хож на:
1) углерод, 2) фосфор; 3) алюминий; 4) свинец.
— 447 —
4. Соль кремниевой кислоты может образоваться при:
1) нагревании смеси песка и кристаллической соды;
2) взаимодействии кремниевой кислоты и поташа (р-р);
3) взаимодействии кремния с горячим концентриро-
ванным раствором щелочи;
4) сливании водных растворов силиката натрия и хло-
рида бария.
5. Окислительно-восстановительными являются ре-
акции, схемы которых:
1) Ca,Si + Н,0 -» Са(ОН), + SiH4;
2) SiH4 + О, -» SiO, + Н,б;
3) SiO, + Si —» SiO;
4) SiO' + CaO -> CaSiO,.
6. Какой объем газа (дм3, н.у.) выделится при полном
растворении кремния массой 2,8 г в горячем концент-
рированном растворе КОН?
1) 1,12; 2) 2,24; 3)3,36; 4) 4,48.
7. Температура плавления веществ последовательно
возрастает в ряду соединений:
1) песок, карборунд, силан;
2) силан, песок, белый фосфор;
3) фуллерен, песок, белый фосфор;
4) оксид углерода (II), белый фосфор, карборунд.
8. Жидкое (растворимое) стекло может реагировать с
каждым из веществ в ряду:
1) СО,, СаС1„ НС1; 2) H,SO4, Ba(NO3)„ КС1;
3) SO,', CO,, (NH4),SO4; 4) HNO3, BaCl,, K£Or
9. Аморфный оксид кремния (IV) называется:
I) горный хрусталь; ' 2) кремень;
3) силикагель; 4) растворимое стекло.
10. Кремень, горный хрусталь, силикагель, песок,
кварц, кремнезем имеют химическую формулу основно-
го вещества:
1) CaSiO3; 2) SiO,; 3) K,SiO3; 4) AI,O3 • 2SiO, • 2H,O.
--- 448 ---
ТЕСТ 2
1. Степень окисления атома кремния равна -4 в со-
ставе соединения, формула которого:
1) Si3N4; 2) SiS2; 3) Ca,Si; 4) SiH4.
2. Оксид кремния (IV) может реагировать с:
1) коксом (/°);2) Mg (t°); 3) Р,О5; 4) Na,СО, (t°).
3. Кислотный характер оксида кремния (IV) иллюст-
рируют уравнения реакций:
l)SiO,+ 4HF = SiF4 + 2H,O;
2) SiO’ + К,О = K2SiO_;
3) SiO," + 2Mg = 2MgO + Si;
4) SiO2 + 2KOH = K2SiO3 + H2O.
4. В отличие от углерода кремний НЕ реагирует с:
1) Н2; 2) HNO3; 3) Fe2O3; 4) SiO2.
5. Кремниевая кислота может образоваться при взаи-
модействии:
1) SiO2 и Н,О; 2) K2SiO3 (р-р) и СО2;
3) Na2SiO3 и НС1 (р-р); 4) SiO, и HF(p-p).
6. Для пропитки изделий с целью придания им огне-
упорных свойств используется водный раствор:
1) Na2SiO3; 2) Na,CO3; 3) H2SiO3; 4) SiC.
7. Для получения обычного оконного стекла используют:
1) песок; 2) кальцинированную соду;
3) жидкое стекло; 4) известняк.
8. Как оксид кремния (IV), так и оксид углерода (IV)
реагируют с веществами, формулы которых:
1) Н,О; 2) Mg; 3) С(кокс); 4) КОН(р-р).
9. Как силикат натрия, так и карбонат натрия в вод-
ном растворе могут реагировать с:
1) СО2; 2) НС1; 3) Ba(NO3)2; 4) KNO3.
15 Зак. 1530
--- 449 ---
10. Формулы соответственно ортоклаза (полевого
шпата) и каолина (основная составная часть белой гли-
ны) — это:
1) А!,О3 • 2SiO, • 2Н,О; SiO,;
2) А1,О3 • 2SiO, • 2Н,О; Na,О • СаО • 6SiO,;
3) К,О • А1,О3 • 6SiO,; А1,О3 • 2SiO, - 2Н,О;
4) К,О • А Г, О. 6SiO,; К,О А1,О,: 6SiO, • Н,О.
7 2 2 э 2 2 2 э 2 2
ТЕСТЗ
1. Степень окисления атома кремния равна +4 в составе:
1) SiCl4; 2) SiC; 3) Ca,Si; 4) SiH4.
2. Атомы кремния и углерода между собой различаются:
1) размерами;
2) числом вакантных орбиталей на внешнем элект-
ронном слое;
3) числом валентных электронов;
4) энергией ионизации.
3. Оксид кремния (IV) и оксид углерода (IV) между
собой различаются:
1) типом кристаллической решетки в твердом состоянии;
2) степенью окисления атомов углерода и кремния;
3) валентностью атомов углерода и кремния;
4) растворимостью в воде.
4. Оксид кремния (IV) может образоваться в результате:
1) взаимодействия SiO и О,;
2) взаимодействия SiH4 и О,;
3) взаимодействия Si и Н,0 (20 °C);
4) нагревания H,SiO3.
5. Кремний может реагировать с веществами, форму-
лы которых:
1) Fe,O3; 2) Н2; 3) HF(r); 4) С(кокс).
— 450 —
6. Силан можно получить при взаимодействии:
!)Mg,SiKHCl(p-p); 2) Ca,Si и Н,О;
3) Si и Н,О; 4) SiO, и HF(p-p).
7. Кремниевая кислота НЕ может образоваться при
взаимодействии:
1) SiO, и Н,О; 2) K,SiO3 (р-р) и СО,;
3) Na,SiO? (р-р) и Н3РО4; 4) Si*и HNO,.
8. Кремний можно получить при взаимодействии:
l)SiCl4nH,; 2) 1 моль SiO, и 3 моль С;
3) SiH4H О,; 4) 1 моль SiO, и 2 моль Mg.
9. Атомы кремния — окислители в реакциях, схемы
которых:
1) Mg,Si + Н,О -> SiH4 + Mg(OH),;
2) SiO, 4- С 4 Si + CO;
3) SiBr4 + H, —> Si + HBr;
4) SiC + O, SiO, + CO,.
10. В водном растворе как K,SiO3, так и КНСО3 реа-
гируют с:
L) Ва(ОН),; 2) HNO3; 3) КС!; 4) СО,.
ТЕСТ 4
1. Сущность действия доломитной муки как раскис-
лителя почвы отражает схема реакции:
1) СаСО3 MgCO3 + СО2 + Н,0 -> Mg(HCO3), +
+ Са(НСО3),;
2) СаСО3 • MgCO3 + Н+ -> Са2+ + Mg2+ + СО, + Н,О;
3) СаСО3 • MgCO3 Л СаО + MgO + СО ;
4) СаСО3 MgCO, + SiO, Л CaSiO3 + MgSiO3 + СО,.
2. Оксид кремния (IV) реагирует, а оксид углерода (FV)—
нет с веществом, формула которого:
1) Н,О; 2) HF(p-p); 3) КОН(р-р); 4) Mg.
--- 451
3. Силикат НЕ образуется при взаимодействии:
1) силикагеля и оксида бария;
2) кремнезема и плавиковой кислоты;
3) силицида кальция и воды;
4) кальцинированной соды и кремнезема.
4. Силикатный клей — это:
1) водный раствор силикатов натрия и калия;
2) водный раствор карбоната и гидрокарбоната натрия;
3) расплав оксида кремния (IV);
4) взвесь кремниевой кислоты.
5. При производстве различных сортов стекла НЕ ис-
пользуют:
1) песок; 2) оксид свинца (II);
3) оксид серы (VI); 4) поташ.
6. Кварцевое стекло получают из:
1) карборунда; 2) оксида кремния (IV);
3) поташа; 4) хрусталя.
7. Оконное стекло неустойчиво к действию:
1) воды; 2) плавиковой кислоты;
3) соляной кислоты; 4) щелочей.
8. Для оксида кремния (IV) НЕВЕРНО утверждение:
1) атомная кристаллическая решетка;
2) наиболее распространенная модификация — кварц;
3) реагирует со щелочами;
4) НЕ реагирует с плавиковой кислотой.
9. Кремниевую кислоту можно получить при взаимо-
действии:
1) SiO, и Н,О; 2) К,SiO, (р-р) и Н,;
3) Na,SiO3 (р-р) и СО,; 4) Si* О, и Н,О.
10. «Плавление» стекла — это взаимодействие стек-
ла с водным раствором:
1) НС1; 2) NaOH; 3) HF; 4) HNOr
--- 452 ---
ТЕСТ 5
1. При «плавлении» стекла между собой взаимодей-
ствуют:
l)Na,OnHF, 2) SiO, и HF;
3) СаО и НС1; 4) SiO, и NaOH.
2. Кремний НЕ входит в состав:
1) керамики; 2) цемента, 3) стекла; 4) криолита.
3. Для производства цемента используют:
1) известняк и глину; 2) кварц и глину;
3) известняк и кварц, 4) глину и алебастр.
4. В качестве вяжущего строительного материала НЕ
используют:
1) гашеную известь; 2) алебастр; 3) цемент, 4) гипс.
5. Хрусталь получают добавлением при варке стекла
вещества, формула которого:
1) К,СО3; 2) МпО; 3) РЬО; 4) СоО.
6. Укажите формулу силицида:
1) SiH4; 2) Ca,Si; 3) SiF4; 4) SiO2.
7. Для полного растворения смеси кремния и цинка
можно использовать водный раствор:
1) НС1; 2) NaOH; 3) H2SO4; 4) Cl2.
8. Какую массу (г) СО, можно получить из фуллерена
Сб() массой 2,4 г?
1)2,2; 2) 4,4; 3) 6,6; 4) 8,8.
9. Водные растворы K,SiOt и Na,CO3 можно разли-
чить с помощью:
1) ВаС1,; 2) Ва(ОН)2; 3) СО,; 4) HCI
10. Из мельчайших частичек графита состоят
1) сажа; 2) силикагель;
3) древесный уголь; 4) кокс.
--- 453 ----
ТЕСТ 6
1. Укажите справедливые утверждения:
1) при определенных условиях алмаз и графит взаи-
мопревращаемы;
2) при нагревании электрическая проводимость крем-
ния, как и металлов, уменьшается;
3) при сгорании в кислороде алмаза, фуллерена и гра-
фита образуются одни и те же вещества;
4) уголь и сажа— отдельные модификации углерода.
2. Алмаз и графит между собой отличаются:
1) твердостью;
2) электрической проводимостью;
3) качественным составом;
4) окраской.
3. Охарактеризуйте строение и физические свойства
карборунда:
1)тугоплавок;
2) кристаллическая решетка атомного типа;
3) хорошо растворим в воде;
4) степень окисления атома кремния равна +4.
4. Укажите схему реакций, в которой степень окисле-
ния атома кремния изменяется от -4 до + 4:
1) Ca,Si + Н,0 -> Са(ОИ), + SiH4;
2) SiH4 + О2-> SiO, + Н26;
3) SiC + О, -» SiO, + CO;
4) SiO, + HF —> SiF4 + Н2О.
5. Из предыдущего задания выберите схемы реакций,
в которых степень окисления атома кремния НЕ изме-
няется:
1)1, 2,3; 2) 1,3,4;
3)2, 3,4; 4) 1,2, 3,4.
— 454 —
6. Атомы кремния — окислители в реакциях, схемы
которых:
1) SiO, + F, -> SiF4 + О,;
2) SiO’ + С -> SiC + СО;
3) S114 + К -> Si + KF;
4) SiCl4 + Н2 —» Si + НС1.
7. Кремний входит в состав всех веществ (материа-
лов, минералов), названия которых перечислены в ряду:
1) железобетон, керамика, хрусталь, жидкое стекло;
2) стекловата, черепица, кирпич, гашеная известь;
3) цемент, бетон, полевой шпат, алебастр;
4) стеклотекстолит, каолин, эмали, кальцит.
8. Для цепочки одностадийных химических превра-
щений: Si -U Mg,Si Л. SiH4 Л- SiO, Л. Si укажите, какие
стадии будут окислительно-восстановительными:
1) 1,2,3; 2) 1,2,4;
3)2, 3,4; 4) 1,2, 3,4.
9. При взаимодействии кремния массой 2,80 г с ме-
таллом образовался силицид массой 30,2 г. Укажите сим-
вол металла:
l)Mg; 2) Са; 3) Sr; 4) Ва.
10. Укажите формулу силиката, в составе которого
массовые доли (%) оксидов SiO2, А12О3 и Na,0 соответ-
ственно равны 68,7; 19,5 и 11,8:
1) Na,О 2А12О3 • 6SiO,;
2) 2Na,O А1,О3 • 6SiO~;
3)Na,O • A1,O3 • 6SiO,;
4) Na,О • Al‘O, • 4SiO,.
--- 455 ---
ТЕМА 34
Металлы: строение электронных оболочек,
общая характеристика физических
и химических свойств, способы получения.
Качественное обнаружение ионов металлов.
Электрохимический ряд напряжений металлов.
Коррозия металлов. Электролиз.
Сплавы металлов
ТЕСТ1
1. Укажите справедливые утверждения:
1) все элементы s-семейства являются металлами;
2) среди элементов р-семейства есть как металлы, так
и неметаллы;
3) все элементы d-семейства являются металлами;
4) не все элементы f-семейства являются металлами.
2. Только при нагревании с водой реагируют металлы:
1) железо; 2) калий; 3) барий; 4) цинк.
3. В земной коре наиболее распространен металл:
1) железо; 2) алюминий; 3) кальций; 4) магний.
4. Символы только элементов металлов приведены в
рядах:
1) Са, Zn, Cd; 2) Ga, In, Tl; 3) Те, As, В; 4) W, Bi, Sb.
5. Радиус атома постепенно возрастает в ряду элемен-
тов металлов:
1) К, Na, Mg; 2) Mg, Na, К; 3) Mg, К, Na; 4) Na, Mg, Al.
6. С водой при комнатной температуре (20 °C) реаги-
руют металлы:
1) Сг; 2) Li; 3) К; 4) Ag.
--- 456 ---
7. Для получения металла из сульфидной руды обыч-
но используют:
1) электролиз расплава руды;
2) восстановление сульфида водородом;
3) метод алюмотермии;
4) обжиг руды в кислороде и последующее восстанов-
ление полученного оксида металла.
8. Лучше всех металлов электрический ток проводит:
1) серебро; 2) железо; 3) медь; 4) алюминий.
9. Коррозия железа усилится при его контакте с ме-
таллами, символы которых:
1) Zn; 2) Au; 3) Си; 4) Mg.
10. При электролизе водного раствора хлорида калия
на аноде выделяется:
1)водород; 2)хлор; 3)калий; 4)кислород.
ТЕСТ 2
1. Укажите справедливые утверждения:
1) кристаллическая решетка металлов ионного типа;
2) в химических реакциях простые вещества металлы
проявляют главным образом восстановительные свойства;
3) электрическая проводимость металлов обусловле-
на наличием в их кристаллической решетке свободных
электронов;
4) в периодической системе элементы металлы нахо-
дятся как в А- так и В-группах.
2. Даже при нагревании с водой не реагируют металлы:
1) железо; 2) золото; 3) серебро; 4) цинк.
3. Процесс Fe2+ + 2е = Fe° протекает при внесении в
раствор сульфата железа (II):
1) натрия; 2) цинка; 3) меди; 4) магния.
--- 457 ---
4. Самым тугоплавким металлом является:
1) золото; 2) хром; 3) титан; 4) вольфрам.
5. Процесс 2Н+ + 2е = Н2 протекает при внесении в
разбавленный раствор хлороводорода металлов, симво-
лы которых:
l)Zn;2)Cu;3)Hg; 4) Fe.
6. Как в свободном (самородном) виде, так и в соста-
ве соединений в природе находятся металлы:
I) натрий; 2) платина; 3) алюминий; 4) медь.
7. Образец латуни можно полностью растворить в:
1) разбавленной соляной кислоте;
2) водном растворе щелочи;
3) концентрированной азотной кислоте;
4) разбавленной серной кислоте.
8. Кислотные свойства наиболее выражены у оксида
металла, формула которого:
I) МпО; 2) Сг2О3; 3) ZnO; 4) Мп2О7.
9. Пять электронов на внешнем электронном слое в
основном состоянии содержит атом металла:
1) марганца; 2) висмута; 3) мышьяка; 4) свинца.
10. С разбавленной серной кислотой реагируют все
металлы, символы которых приведены в ряду:
1) Zn, Со, Ag; 2) Fe, Al, Zn; 3) Ni, Cr, Au; 4) Sn, Mg, Hg.
TECT3
1. Укажите справедливые утверждения:
1) элементы металлы составляют большинство эле-
ментов периодической системы;
2) на внешнем электронном слое атомов металлов в
основном состоянии не может находиться более четы-
рех электронов;
--- 458 ---
3) в каждом периоде атом щелочного металла имеет
наибольший радиус;
4) вплоть до середины XVIII века человеку было из-
вестно семь металлов.
2. Самый легкоплавкий металл — это:
1) натрий; 2) галлий; 3) ртуть; 4) хром
3. Явление пассивации металлов при их взаимодей-
ствии с HNO3 (конц.) состоит в образовании на поверх-
ности металла защитной пленки:
1) гидроксида, 2) оксида, 3) нитрата, 4) нитрида.
4. В водном растворе из числа перечисленных наи-
более сильными окислительными свойствами обладает
ион, символ которого:
1) Си2+; 2) Hg2+; 3) Au3+; 4) Fe2+.
5. Три /^-электрона на внешнем электронном слое в
основном состоянии содержит атом металла:
1) мышьяка; 2) висмута; 3) свинца, 4) таллия.
6. Наименее выраженными основными свойствами
обладает гидроксид, формула которого:
1) Mg(OH)2; 2) КОН, 3) Ве(ОН)2, 4) RbOH.
7. Первый металл вытесняет второй из водного ра-
створа соли в случаях:
1) кальций и цинк; 2) цинк и серебро;
3) никель и медь; 4) железо и магний.
8. Пробирки с сухими солями NaCI и К,РО4 можно
различить:
1) по окраске пламени,
2) водным раствором AgNO3;
3) водным раствором HNO3;
4) водным раствором NaNO3.
9. Коррозия железа ослабится при его контакте с:
1) магнием; 2) цинком; 3) медью, 4) серебром.
--- 459 ---
10. Оксид образуется, когда с водой при нагревании
реагируют:
1) натрий; 2) цинк; 3) железо; 4) медь.
ТЕСТ 4
1. Укажите справедливые утверждения:
1) любой металл можно получить электролизом вод-
ного раствора соли;
2) в ряду Fe, Zn, Na восстановительные свойства ме-
таллов в водном растворе возрастают;
3) в ряду катионов Fe2+, Cu2+, Ag+ их окислительные
свойства в водном растворе увеличиваются;
4) все металлы хорошо отражают своей поверхнос-
тью световые лучи.
2. Катионы металла обязательно входят в состав:
1) хлорофилла и гемоглобина;
2) витамина Вр и солей;
3) микроудобрений и гидроксидов;
4) морской воды и оксидов.
3. Газ выделяется, когда с водой взаимодействуют:
1) карбид кальция; 2) нитрид магния;
3) хлорид натрия; 4) фосфид кальция.
4. Как с H,SO4 (разб.), так и с НС1 (разб.) НЕ реагиру-
ют металлы:
1) цинк; 2) медь; 3) железо; 4) золото.
5. В ряду галогенидов натрия NaF — Nal—NaCl тем-
пература плавления:
1) возрастает;
2) уменьшается;
3) сначала уменьшается, затем возрастает;
4) сначала возрастает, затем уменьшается.
— 460 —
6. С кислородом при комнатной температуре с наи-
большей скоростью реагирует металл:
1) железо; 2) медь;
3) барий; 4) серебро.
7. Какой из компонентов загрязненного воздуха явля-
ется наиболее коррозионно-активным по отношению к
металлам во влажном воздухе?
1) азот; 2) углекислый газ;
3) угарный газ; 4) сернистый газ.
8. Химическая реакция будет протекать при смешивании:
1) Zn и HCl(p-p); 2) Си и S (?°);
3) Fe и ZnSO4 (р-р); 4) Fe и HNO3 (конц.) (20 °C).
9. Укажите последовательность восстановления на
катоде катионов металлов Fe2+, Sn2+, Au3+ и Ag' (моляр-
ная концентрация катионов одинаковая):
1) Au3+, Ag+, Fe2+, Sn2+; 2) Fe2+, Sn2+, Ag+, Au3+;
3) Au3+, Ag+, Sn2+, Fe2"; 4) Ag+, Au3", Sn2+, Fe2+.
10. Водород HE может использоваться для восстанов-
ления из их оксидов металлов, символы которых:
1) Са; 2)W; 3)Fe; 4) Al.
ТЕСТ 5
1. Укажите справедливые утверждения:
I) металлы могут образовывать оксиды только с ос-
новными и амфотерными свойствами;
2) гидроксиды металлов могут обладать как основны-
ми, так и кислотными и амфотерными свойствами;
3) чем выше степень окисления атома металла в ок-
сиде, тем слабее выражены у оксида основные свойства;
4) в атомах большинства металлов на внешнем элект-
ронном слое находится от одного до трех электронов.
— 461 —
2. Среди перечисленных металлов самым твердым яв-
ляется:
1) цинк; 2) хром; 3) железо; 4) медь.
3. Химическая реакция произойдет между попарно
взятыми веществами (электролиты взяты в виде водных
растворов):
1) Zn и СаС12; 2) Си и AgNO3;
3) Pb и Zn(NO3),; 4) Fe и CuSO4.
4. Металл можно получить при взаимодействии ве-
ществ в обеих реакциях:
1) СиО и СО (/°); CuSO4 (р-р) и Zn;
2) CuCL, (р-р) и Ag; Сг,О3 и Al (Z°);
3) СиО и H, (r°); Fe,O.и Si (/°);
4) Fe2O3 и CO (C); WO3 и H2 (z°).
5. Укажите число сплавов из приведенных (латунь,
бронза, мельхиор, чугун, дуралюмин), в состав которых
входит медь:
1)5; 2) 4; 3)3; 4)2.
6. Оксид металла НЕЛЬЗЯ получить при обжиге в
избытке кислорода соединений, формулы которых:
1) A12S3; 2) HgS; 3) Ag2S; 4) ZnS.
7. Кислотные свойства наиболее выражены у оксида
металла, формула которого:
1) ВеО; 2) Na^; 3) Сг2О3; 4) МпО3.
8. В бледно-зеленый цвет окрашивают пламя горел-
ки соединения:
1)бария; 2)натрия; 3)калия; 4)кальция.
9. Оба металла — цинк и ртуть — реагируют с:
1) НС1(р-р); 2) H2SO4 (разб.); 3) S (С); 4) AgNO3 (р-р).
10. Сколько полностью свободных Зс/-орбиталей со-
держит в основном состоянии атом металла с зарядом
ядра +21?
1)2; 2) 5; 3) 4; 4)3.
— 462 —
ТЕСТ 6
1. Укажите справедливые утверждения:
1) оксиды всех металлов 5-семейства являются ос-
новными;
2) в каждом периоде элементов металлов больше, чем
элементов неметаллов;
3) элементы металлы третьего периода образуют ос-
новные и амфотерные оксиды;
4) в шестом периоде присутствуют элементы метал-
лы s-, р-, d- и f-семейств.
2. Высшая степень окисления правильно указана для
атомов металлов:
1) СС6; 2) Мп+7; 3) Сн+|; 4) Аи+|.
3. Для получения меди из оксида меди (II) можно ис-
пользовать:
1) СО,; 2) С; 3) SO,; 4) СО.
4. Масса железной пластинки не изменится при ее
выдерживании в водном растворе соли (кислород в ра-
створе отсутствует):
1) AgNO3; 2) CuSO4; 3) HgCl,; 4) KNOr
5. В каких парах ионов, формулы которых приведены
ниже, первый ион в водном растворе более сильный
окислитель, чем второй?
l)H+nMg2+; 2)Ag+HFe2+;
3) Cu2+ и Au3+; 4) Н+ и Hg2+.
6. При нагревании сравнительно легко разлагаются
соединения металлов, формулы которых:
1) Ag,O; 2) CuOH; 3) NaOH; 4) КС1.
7. Шесть электронов на 5-орбиталях содержится в ато-
мах металлов, символы которых:
1) А1; 2) Na; 3) Sc; 4) Mg.
--- 463 ---
8. В водные растворы солей, формулы которых указа-
ны ниже, опущены пластинки из железа. В растворах
каких солей масса пластинки увеличится?
1) CuSO4; 2) ZnCl,; 3) AgNO,; 4) MgBr?.
9. Проявление нескольких степеней окисления в со-
единениях характерно для металлов:
1) кальция; 2) железа; 3) хрома; 4) алюминия.
10. Катионами водорода (гидроксония) в разбавлен-
ных водных растворах сильных кислот могут окислять-
ся металлы:
1) серебро; 2) цинк; 3) железо; 4) медь.
ТЕСТ 7
1. Укажите справедливые утверждения:
1) в малых периодах изменение свойств атомов эле-
ментов от металлических к неметаллическим происхо-
дит более резко, чем в больших периодах;
2) для атомов металлов третьего периода высшая сте-
пень окисления равна +6;
3) если при нагревании нитрата металла выделяются
NO., и О2, то в электрохимическом ряду металл обяза-
тельно расположен до водорода,
4) в атомах элементов металлов d- семейства четвер-
того периода на внешнем энергетическом уровне нахо-
дится не более двух электронов.
2. Для получения хрома методом алюмотермии сле-
дует взять:
1) Сг(ОН), и А1(ОН)Ч; 2) Сг,О4 и А1,ОЧ;
3)Сг2О,иА1; 4)Сг‘О3иА1(ОН)?.
3. Все три металла — железо, медь, цинк — могут
реагировать с:
1)хлором, 2)серой;
— 464 —
3) водой; 4) разбавленной соляной кислотой.
4. Укажите справедливые утверждения:
1) не любой металл можно растворить в азотной кис-
лоте при обычных условиях или нагревании;
2) редкий элемент не обязательно является рассеян-
ным;
3) образцы всех металлов тонут в воде;
4) амфотерные свойства Fe(OH)3 выражены сильнее,
чем у А1(ОН)Г
5. Какая группа веществ из перечисленных ниже мо-
жет быть использована в качестве восстановителей при
получении металлов?
1) алюминий, углерод (кокс), кремний, кальций;
2) оксид углерода (II), магний, водород, сера;
3) углерод (кокс), алюминий, водород, хлор;
4) магний, кальций, алюминий, оксид серы (IV).
6. Металлы проводят электрический ток за счет:
1) ионов; 2) протонов и нейтронов;
3) полярных молекул; 4) электронов.
7. Для получения железа из карбонатной руды необ-
ходимо:
I) восстановить металл из карбоната водородом;
2) окислить соль, а затем восстановить продукт;
3) провести электролиз расплава соли;
4) нагреть соль, затем восстановить оксид металла.
8. Постоянную степень окисления в своих устойчи-
вых соединениях проявляют металлы, символы которых:
1) Ва; 2) А1; 3) Сг; 4) Мп.
9. Четыре электрона на внешнем электронном слое
находится в основном состоянии атома металла:
1) алюминия; 2) свинца;
3) железа; 4) висмута.
--- 465 ---
10. В ряду атомов металлов натрий — цезий — алю-
миний энергия ионизации:
1) растет;
2) уменьшается;
3) сначала растет, затем уменьшается;
4) сначала уменьшается, затем растет
ТЕСТ 8
1. Укажите справедливые утверждения для атомов
металлов ЗбЛсемейства и их соединений:
1) характерна постоянная степень окисления;
2) многие обладают каталитическими свойствами;
3) на внешнем электронном слое уровне в основном
состоянии атома находится не более двух электронов;
4) их оксиды и гидроксиды могут обладать как основ-
ными, так амфотерными и кислотными свойствами.
2. Символы металлов в порядке последовательного
возрастания радиуса атома приведены в ряду:
1) Li, Be, Na, Mg, 2) Li, Na, Be, Mg;
3) Mg, Be, Li, Na; 4) Mg, Na, K, Rb.
3. В растворах с pH > 7 в значительных количествах
могут существовать катионы:
1)Си2+;2) Ва2+;3)К+; 4)А1’+
4. Осадить катионы Ва2+ в присутствии катионов Mg24
и АР+ можно с помощью реактива, содержащего анионы:
1) РО’ ; 2) SO2; 3) СО2; 4) F .
5. НЕТ естественных семейств металлов, называемых:
1) черными; 2) щелочными;
3) щелочноземельными; 4) редкими.
6. Образец бронзы можно полностью растворить в.
1) разбавленном растворе щелочи;
— 466 —
2) разбавленной соляной кислоте;
3) разбавленной серной кислоте;
4) концентрированной азотной кисдоте.
7. При коррозии в водной среде окислителем обычно
является(ются):
1) кислород; 2) ионы Н3О+;
3) азот; 4) анионы ОН .
8. Электрохимическая коррозия наблюдается при:
1) почернении серебряных изделий на воздухе;
2) контакте железа с оловом в водной среде;
3) взаимодействии меди с парами воды и углекислым
газом на воздухе;
4) окислении стальных турбин самолетов выхлопны-
ми газами.
9. Для удаления примеси CuSO4 из раствора ZnSO4
следует использовать:
1) КОН; 2) K,S; 3) Ba(NO3)2; 4) Fe.
10. Для лужения с целью получения белой жести ис-
пользуют:
1) хром; 2) никель; 3) олово; 4) цинк.
ТЕСТ 9
1. Укажите справедливые утверждения:
1) понятия «руда» и «минерал» — синонимы;
2) валентные электроны в атомах всех J-элементов рас-
положены только на внешнем энергетическом уровне;
3) в атомах «/-элементов валентные электроны могут
располагаться как на внешнем, так и предвнешнем энер-
гетических уровнях;
4) ряду Na+ — Mg2+ — А13+ радиус ионов металлов
уменьшается.
--- 467 ---
2. Для полного растворения образца цинка массой
0,65 г необходимо взять раствор H2SO4 с молярной кон-
центрацией ее 0,1 моль/дм3 объемом (см3):
1) 10; 2) 100; 3)500; 4) 1000.
3. Прочность металлической связи в ряду простых
веществ металлов вольфрам — калий — железо:
1) увеличивается;
2) сначала увеличивается, затем ослабевает;
3) уменьшается;
4) сначала уменьшается, затем увеличивается.
4. В каких парах первый металл быстрее корродирует
на воздухе, чем второй?
1) натрий и железо; 2) медь и алюминий;
3) золото и железо; 4) магний и кальций.
5. При повреждении цинкового покрытия железного
изделия на поверхности цинка появляется вещество бе-
лого цвета, формула которого:
1) Fe2O3 • иН2О; 2) Zn(OH)2; 3) Fe3O4; 4) FeO • иН2О.
6. Полностью в раствор сплав золота и серебра пере-
водится с помошью:
1) царской водки;
2) концентрированной азотной кислоты;
3) раствора щелочи;
4) концентрированной серной кислоты.
7. Коррозия железа на воздухе ослабевает:
1) в присутствии влаги;
2) при контакте с медью;
3) в отсутствие влаги;
4) если поверхность железа тщательно отполировать.
8. Укажите схемы реакций получения металлов мето-
дом пирометаллургии:
1)СаС1,->Са + С1,;
--- 468 —
2) СаО + Al -> Са + Са(А1О,)э;
3) Na3CO3 + С —> Na + СО;
4)А1,Ь3->А1 + О2.
9. Плотность золота равна 19,32 г/см3. Укажите объем
(см3), который займет образец золота, содержащий
6,02 10" атомов:
1) 1,00; 2) 1,01; 3) 1,02; 4) 1,03.
10. На основании положения металла в электрохи-
мическом ряду можно предсказывать (судить):
1) число изотопов элемента металла;
2) природу продуктов термического разложения нит-
ратов;
3) относительную окислительную способность кати-
онов металлов в водных растворах;
4) об относительной величине энергии ионизации:
чем левее расположен металл в электрохимическом ряду,
тем меньше для него энергия ионизации атома.
ТЕСТЮ
1. Укажите НЕВЕРНЫЕ утверждения:
1) электрической проводимостью обладают только
простые вещества металлы (но не неметаллы);
2) поскольку в контакте с оловом коррозия железа уси-
ливается, олово не используют для защиты железа от кор-
розии;
3) дуралюминий прочнее, чем алюминий;
4) наиболее коррозийно-неустойчивые металлы на-
ходятся в VIIIB группе.
2. Химическая коррозия наблюдается при:
1) разрушении металлов оксидами азота;
2) окислении металлов выхлопными газами автомо-
билей;
— 469 —
3) окислении металлов оксидами серы;
4) разрушении металлов в среде электролита с одно-
временным возникновением электрического тока.
3. При прохождении 3,01 • 1023 электронов через рас-
плав кальций хлорида на катоде выделяется кальций
массой (г):
1) 10; 2)20; 3)30; 4) 40.
4. Железо в контакте с медью корродирует сильнее,
так как:
1) медь—катализатор реакции образования ржавчины;
2) ионы Fe2+ приобретают электроны эффективнее,
чем ионы Си2+;
3) атомы железа отдают электроны легче, чем атомы меди;
4) атомы меди отдают электроны легче, чем атомы
железа.
5. Степень окисления атома металла повышается при
взаимодействии:
a) Cu2S и О,; б) FeS и НС1;
в) FeO и HNO3 (конц.); г) Fe3O4 и О,;
д) FeS, и О,; е) Fe3O4 и СО.
1) а, в, г, д; 2) а, б, в, г; 3) а, в, д, е; 4) а, б, д, е.
6. С помощью ионов Ag+ НЕЛЬЗЯ определить ани-
он, формула которого:
1)F~; 2) СП; 3)Вг; 4)1.
7. Массовая доля металла выше, чем неметалла в лю-
бом (любой):
1) оксиде; 2) гидроксиде; 3) соли; 4) образце чугуна.
8. Металлическая связь наиболее прочна в простом
веществе, металле, атомы которого имеют электронную
конфигурацию:
l)[Ar]3d,04s';
2) [Ar] 3t/l(l4.s24/265.sl;
— 470 -----
3) [Kr] 4Jl04fl‘’5№5/?65i/")6№;
4) [Kr] 4r7’°4f 45s25p65dA6s2.
9. В реакциях с различными кислотами водород ни-
когда не выделяется в случае металла, символ которого:
l)Fe;2)Zn;3)Al;4)Hg.
10. Укажите необязательные признаки элемента ме-
талла или простого вещества металла:
1) характерный металлический блеск;
2) сравнительно низкие значения энергии ионизации;
3) высокая температура плавления;
4) плотность, превышающая плотность воды.
ТЕМА 35
Щелочные и щелочноземельные металлы.
Магний. Жесткость воды и способы ее
устранения. Калийные удобрения
ТЕСТ1
1. Укажите характеристики, одинаковые для всех ще-
лочных металлов:
1) число электронов на внешнем электронном слое;
2) основный характер оксидов;
3) число электронных слоев в атоме;
4) степень окисления атомов в соединениях.
2. Сумма электронов на внешнем и предвнешнем
электронных слоях в атоме натрия для основного состо-
яния равна:
1)3; 2)9; 3) 11; 4) 19.
--- 471
3. Даны вещества, формулы которых SO2, Р2О5, А12О3,
N2O5, CuSO4, А1(ОН)3. Укажите число веществ, с кото-
рыми КОН (р-р) может реагировать по типу реакции
соединения:
1) шесть; 2) четыре; 3) пять; 4) три.
4. Оксид кальция реагирует с:
1) Н2О; 2) NaOH (р-р); 3) НС1 (р-р); 4) NaCl (р-р).
5. В промышленности гидроксид натрия получают:
1) взаимодействием натрия и воды;
2) электролизом водного раствора хлорида натрия;
3) взаимодействием оксида натрия и воды;
4) взаимодействием гидрида натрия и воды.
6. В водном растворе натрий гидроксид может реаги-
ровать с:
1) А1 и KNO3; 2) АЦО3 и С1,;
3) CuSO4 и MgSO4; 4) СО2 и СгО3.
7. Отметьте электронную схему атома натрия:
1) 2, 8, 1; 2) 2, 1; 3) 2, 8, 2; 4) 2, 8, 8, 1.
8. Пропусканием через гранулы NaOH можно осушать
газы:
1)водород; 2) хлороводород;
3) углекислый газ; 4) метан.
9. Атомы калия и натрия между собой различаются:
1) размерами;
2) энергией ионизации;
3) числом валентных электронов;
4) числом электронных слоев.
10. Активным компонентом белильной извести яв-
ляется:
1) хлорид кальция; 2) хлорат кальция;
3) гипохлорит кальция; 4) бертолетова соль.
--- 472 ---
ТЕСТ 2
1. Укажите справедливые утверждения:
1) общая формула гидридов щелочных металлов ЭН;
2) в каждом периоде атомы щелочных металлов име-
ют наибольший радиус;
3) атомы всех щелочных металлов содержат два ва-
лентных электрона;
4) для атомов всех металлов ПА группы одинаковая
энергия ионизации.
2. Кальций можно получить:
1) восстановлением оксида кальция водородом;
2) восстановлением оксида кальция алюминием;
3) электролизом водного раствора хлорида кальция;
4) электролизом расплава хлорида кальция.
3. Гидроксид натрия можно получить:
1) электролизом водного раствора NaCl;
2) взаимодействием NaCl(p-p) и КОН(р-р);
3) взаимодействием Na2SO4 (р-р) и Ва(ОН)2 (р-р);
4) взаимодействием NaH и Н,О.
4. Наибольший радиус имеет атом:
1) калия; 2) стронция; 3) цинка; 4) рубидия.
5. В водном растворе мирабилит реагирует с:
1) Ba(NO3),; 2) НС1; 3) КОН; 4) HNO3.
6. Известковая вода может реагировать с:
1) СО2; 2) Са(НСО3)2; 3) С1,; 4) NaOH.
7. Карбоназ кальция в качестве конечного продукта
образуется при взаимодействии:
1) СаС1, и Na,CO3 (р-р);
2) 0,01 моль Са(ОН)2 и 0,01 моль СО.,;
3) Са(ОН)2 (р-р) и СО, (изб.);
4) Са(НСО3), и КОН (р-р, изб).
--- 473 ---
8. При сгорании лития на воздухе образуются два ве-
щества, формулы которых:
1) Li3N; 2) Li2O; 3) LiO2; 4) Li,O,.
9. Укажите, какое химическое количество (моль) ионов
натрия выделится при связывании с помощью катио-
нита ионов кальция химическим количеством 10 моль:
1)5; 2) 10; 3)20; 4) 30.
10. Известковая вода — это:
1) водная взвесь гашеной извести;
2) водный раствор белильной извести;
3) водная взвесь мела;
4) водный раствор гашеной извести.
ТЕСТЗ
1. Укажите справедливые утверждения:
1) щелочные и щелочноземельные металлы в приро-
де находятся только в составе соединений;
2) в ряду Li — К — Ва восстановительная способ-
ность металлов в водном растворе уменьшается;
3) оксиды всех металлов ПА группы — основные;
4) ни один из оксидов металлов ПА группы не может
реагировать со щелочами.
2. Укажите массовую долю атомов хлора (%) в актив-
ном компоненте хлорной извести:
1) 63,96; 2) 49,65; 3) 55,91; 4) 38,05.
3. Для обнаружения углекислого газа используют:
1) хлорную известь; 2) оксид кальция;
3) известковую воду; 4) известковое молоко.
4. Основная составная часть мрамора может реаги-
ровать с:
1) НС1 (р-р); 2) KNO3 (р-р); 3) СО, (р-р); 4) SiO, (t°).
--- 474 ---
5. Атомы калия и кальция между собой различаются:
1) энергией ионизации;
2) числом валентных электронов;
3) размерами;
4) числом электронных слоев.
6. При взаимодействии К с водным раствором ZnCln
НЕ может образоваться вещество состава:
1) (ZnOH)Cl; 2) КОН; 3) K2ZnO2; 4) КС1
7. Масссовая доля атомов Са наибольшая в составе его:
1) карбида; 2) фосфида; 3) нитрида; 4) силицида.
8. Укажите формулы солей, присутствие которых обус-
ловливает временную жесткость воды:
1) MgCl2, 2) Са(НСО3)2; 3) Mg(HCO3)2; 4) MgSO4.
9. Постоянную жесткость воды можно устранить:
1) кипячением;
2) действием известкового молока,
3) с помощью кристаллической соды;
4) с помощью ортофосфата натрия.
10. При насыщении известковой воды оксидом угле-
рода (IV) в качестве конечного продукта образуется:
1) оксид кальция; 2) карбонат кальция;
3) белильная известь, 4) гидрокарбонат кальция
ТЕСТ 4
1. Укажите справедливые утверждения
1) щелочноземельные металлы — это все металлы IIА
группы, кроме бериллия;
2) все щелочные и щелочноземельные металлы реа-
гируют с водой при температуре 20 °C;
3) твердость простых веществ щелочных металлов
меньше, чем простых веществ металлов 3<7-семейства,
--- 475 ----
4) химическая связь в простом веществе калий сла-
бее, чем в простом веществе железо.
2. Постоянная жесткость воды обусловлена содержа-
нием в ней:
1) MgSO4; 2) Са(НСО,),: 3) СаСЦ 4) CaSO4.
3. Как временную, так и постоянную жесткость воды
можно устранить:
1) кипячением;
2) с помощью катионитов;
3) добавлением питьевой соды;
4) добавлением кристаллической соды.
4. Временную жесткость воды можно устранить:
1) кипячением;
2) добавлением известкового молока;
3) с помощью кристаллической соды;
4) добавлением дигидрофосфата натрия.
5. Даны вещества, формулы которых: NaH, Н2О,
Na2SO4, Ва(ОН).,, Na, Na,CO3. Укажите число способов
получения NaOH только из этих веществ с помощью
одностадийных реакций:
1) шесть; 2) пять; 3) четыре; 4) три.
6. Основная составная часть гашеной извести — это:
1) СаО; 2) Са(ОН)2; 3) СаСО3; 4) Са(НСО3)2.
7. Сильвинит может реагировать с:
1) H2SO4 (конц.); 2) AgNO3 (р-р);
3) HNO3 (разб.); 4) Ba(NO3)2 (р-р).
8. Укажите формулу вещества, при взаимодействии
которого с водой выделяется самый тяжелый газ:
I) СаС2; 2) Ca,Si; 3) Ca3N,; 4) Са3Р,.
9. Водные растворы каких веществ при стоянии на
воздухе в открытых сосудах со временем мутнеют:
1) гидроксид калия; 2) гидроксид кальция;
--- 476 ---
3) аммиак, 4) гидроксид бария.
10. Магний в отличие от серы реагирует с:
1) хлором;
2) водородом;
3) соляной кислотой,
4) гидроксидом натрия (р-р).
ТЕСТ 5
1. Укажите формулы веществ, образующих накипь при
устранении временной жесткости воды кипячением:
I) CaSO4; 2) СаСО3, 3) MgCO,; 4) Са(НСОД.
2. В отличие от меди магний может реагировать с:
1) С12; 2) SiO2; 3) СО2; 4) HNO, (конц )
3. Водный раствор КС1 в отличие от водного раство-
ра KNO3 реагирует с:
1)Н,8О4(разб); 2)AgNO,;
3) CuSO4; 4) Pb(CH,COO)2.
4. В реакции HSO, (конц.) с соответствующими твер-
дыми калиевыми солями можно получить вещества Вг2,
Cl?, KHSO4, S, H2S, SO2, НС1, F, (укажите их число):
1) восемь, 2) семь; 3) шесть; 4) пять.
5. Щелочные металлы получают из их галогенидов:
1) восстановлением углеродом;
2) сначала окислением до оксидов, затем восстанов-
лением;
3) электролизом водных растворов;
4) электролизом расплавов.
6. Негашеную известь в промышленности получают из:
1) гипса, 2) апатита;
3) известняка; 4) криолита
--- 477 ---
7. Атомы кальция — восстановители при взаимо-
действии:
1) СаО и СО,; 2) Са и N,;
3) Са(ОИ), и H,SO4; 4) СаО и Al.
8. Натрий можно хранить в растворителях:
1) вода; 2) этанол; 3) керосин; 4) диэтиловый эфир.
9. С NaOH в водном растворе реагируют:
1) КС1; 2)Zn; 3) MgCl,; 4) А1С13.
10. Конечным продуктом будет осадок, когда между
собой реагируют:
1)NH3 и НС1 (р-р);
2) известковая вода и избыток углекислого газа;
3) углекислый газ и избыток гидроксида бария (р-р);
4) разбавленные водные растворы NaOH и CuSO4.
ТЕСТ 6
1. Укажите справедливые утверждения:
1) кальций НЕ вытесняет магний из водных раство-
ров солей магния;
2) в ряду Са — Mg — Be восстановительные свой-
ства металлов в водном растворе увеличиваются;
3) щелочные и щелочноземельные металлы относят-
ся к элементам 5-семейства;
4) с водой щелочные и щелочноземельные металлы
взаимодействуют при температуре 20 °C.
2. Даны вещества, формулы которых: Н,, А1,О3, Н,О, А1,
С, SiO,, СО,, ВеО. Сколько из них может реагировать с СаО?
1) 8; 2) 7; 3) 6; 4)5.
3. Даны вещества, формулы которых: A1,(SO4)3, ZnO,
KNO3, СН3СООН, Cl„ BaBr,, H,SO4. Сколько из них ре-
агирует с NaOH в водном растворе?
1)7; 2) 6; 3)5; 4) 4.
— 478 —
4. Протекает реакция при смешивании NaHCO3 (р-р) и:
1) водного раствора СО,; 2) известковой воды;
3) хлорной воды; 4) гидрида калия.
5. Укажите сумму коэффициентов в молекулярном
уравнении реакции Ba(HS), + Ba(OI{)2 = BaS + ...:
1) 10; 2) 9; 3) 8; 4) 7.
6. Из водного раствора Ва(НСО3), выпадает осадок
при добавлении к нему:
1) СО,; 2) Ва(ОН),; 3) Р,О5; 4) СаС1,.
7. Для уравнения реакции X + СО2 = СаСО3 + Н,0
подходит реагент X:
1) СаС1,; 2) Са(НСО3),; 3) Са(ОН),; 4) СаО.
8. С водой щелочные металлы реагируют:
1) с образованием оксидов и водорода;
2) с образованием гидроксидов и водорода;
3) очень медленно при температуре 20 °C;
4) только при нагревании.
9. При нагревании гидроксиды натрия и калия:
1) не разлагаются;
2) возгоняются;
3) разлагаются с образованием воды и оксидов металлов;
4) разлагаются с образованием металлов и воды.
10. Укажите формулу нитрида бария:
1) Ba3N2; 2) Ba(NO3)2; 3) Ba(NH2)2; 4) Ba,N3.
ТЕСТ 7
1. Кислород выделяется, когда с углекислым газом
реагируют:
1) КОН; 2) К,О; 3) К,О2; 4) КО,.
2. В водный раствор Ва(ОН), пропускают углекислый
газ. Укажите зависимость электрической проводимости X
--- 479 ---
раствора от объема V углекислого газа:
3. Укажите сумму коэффициентов в уравнении реак-
ции КО, с углекислым газом:
1)9; 2) 10; 3) 11; 4) 12.
4. Какой объем (дм3, н.у.) кислорода выделится при
взаимодействии 0,5 моль К2О2 с избытком СО,?
1)2,8; 2) 5,6; 3)8,4; 4) 11,2.
5. Укажите справедливое утверждение для реакции
СаС12 + 2Н,£°СаН2 + 2НС1Т:
1) водород — только окислитель;
2) водород — только восстановитель;
3) водород — и окислитель, и восстановитель;
4) водород — ни окислитель, ни восстановитель.
6. Укажите справедливые утверждения для реакции,
схема которой СаН2 + НС1 (р-р) —> CaCl, + Н,:
1) гидрид-ион — окислитель;
2) гидрид-ион — восстановитель;
3) соляная кислота является окислителем и участвует
в солеобразовании;
4) соляная кислота участвует в восстановлении и со-
леобразовании.
— 480 —
7. В состав костей и зубов кальций входит в виде со-
единения, формула которого:
1) Са3(РО4),; 2) СаСО3; 3) CaSO4; 4) СаНРО4.
8. Согласно термохимическому уравнению реакции
СаС12(т) + 6Н2О(ж) = СаО, 6Н2О(т) + 1967 кДж рассчитай-
те теплоту (кДж) обезвоживания кристаллогидрата мас-
сой 10,0 г:
1) +89,8; 2) +196,7; 3) -89,8; 4) -196,7.
9. При хранении щелочи КОН на воздухе она «рас-
плывается» от влаги и частично переходит в вещество,
формула которого:
1) К2О2; 2) K3N; 3) К,СО3; 4) КНСО3.
10. Концентрация гидроксид-ионов повысится пос-
ле растворения в воде:
1) K>SO4; 2) КН; 3) К^СОз; 4) КОН.
ТЕСТ 8
1. Устранение временной жесткости воды проводят с
помощью реакций, уравнения которых:
1) Са(НСО3)2 + H,SO4 - CaSO4 + 2Н,0 + 2СОД;
2) Са(НСО3)э + Са(ОН), = 2СаСО3>1 + 2Н,О;
3) Mg(HCO3)\ + Na,CO*= MgCO.X + 2NaHCO3;
4) MgSO4 + Na2CO3 = MgCO3i + Na,SO4.
2. При нагревании природного гипса образуется але-
бастр, формула которого:
l)CaSO4 -2Н.О; 2) СаО;
3) CaSO4 • 0,5Н,О; 4) CaSO4.
3. Укажите формулу вещества X в уравнении реакции
Ва(НСО3), = X + СО, + Н,О:
1) Ва; 2) ВаО; 3) Ba(OH),f4) ВаСО3.
16 Зак 1530
--- 481
4. Соль только одного состава независимо от моль-
ных соотношений реагентов может образоваться при вза-
имодействии:
1) КОН(р-р) и СО,; 2) NaOH (р-р) и N,O„
3) Са(ОН), (р-р) и Р,О5; 4) А1(ОН)3 и НС1 (р-р).
5. Тонко размолотый известняк от гашеной извести
можно различить с помощью водных растворов:
1) HNO3; 2) КОН; 3) лакмуса; 4) КС1.
6. Ионное уравнение НСО3 + ОН = СО; + Н,0 отве-
чает взаимодействию растворов, содержащих:
1) 0,1 моль КНСО3 и 0,1 моль КОН;
2) 0,2 моль КНСО3 и 0,2 моль Ва(ОН),;
3) 0,30 моль КНСО3 и 0,15 моль Ва(ОН),;
4) 0,05 моль К2СО3 и 0,05 моль Ва(НСО3),
7. Прозрачные растворы КОН и Ва(ОН), между со-
бой можно различить с помощью.
1) SO2; 2) HNO3; 3) Na2CO3; 4) КНСО,.
8. Жесткую воду, содержащую ионы Са2+ и Mg2', умяг-
чают добавлением:
1) питьевой соды; 2) кальцинированной соды,
3) нитрата калия, 4) соляной кислоты
9. В раствор Ва(ОН), небольшими порциями добав-
ляют избыток фосфорной кислоты. Укажите график за-
висимости электрической проводимости раствора X от
химического количества п добавленной кислоты:
— 482 —
10. Для графика 4) предыдущего задания минимум на
кривой отвечает мольному соотношению л?[Ва(ОН),]/
//(Н ,РО4), равному:
1) 1 : 1; 2) 2 : 1; 3) 1,5 : l;4) I : 1,5.
ТЕСТ 9
1. Из данных по растворимости соединений щелоч-
ных металлов (г на 100 г воды) при различных темпера-
турах следует, что выделением теплоты сопровождает-
ся растворение вещества (веществ), указанного (указан-
ных) в таблице под номером:
№ Соль Растворимость
20 °C 80 °C
1 KNO3 32 169
2 Ы2СОз 0,3 0,1
3 NaOH 109 314
4 IJ2SO4 35 32
2. Массовая доля атомов калия наибольшая в удобрегши:
1) поташ; 2) сильвинит;
3) калийная селитра; 4) сульфат калия.
3. В золе ботвы томатов в значительных количествах
содержится удобрение:
1) поташ; 2) калийная селитра;
3) двойной суперфосфат; 4) мочевина.
--- 483 —
4. Из водного раствора СаС12 осадок выпадает при
добавлении к нему:
1) КНСО3; 2) Na,CO3; 3) HF; 4) NaHSO4.
5. Для разделения ионов Mg2+ и Ва2+ можно исполь-
зовать реактивы, содержащие ионы:
1) ОН’; 2) F-; 3) SO2 ; 4) РО3~.
6. Ионное уравнение реакции Ва2+ + НРО2 = ВаНРО4>1
отвечает взаимодействию водных растворов:
1) BaCl, и Na,HPO4; 2) BaCl, и КН,РО4;
3) Ba(NO3), и Н3РО4; 4) Ba(NO3), и Na3PO4.
7. Из раствора Ba(NO3), осадок выпадает при добав-
лении к раствору:
1) СО2; 2) КНСО3;
3) К,СО3; 4) H2SO4 (разб.).
8. Прозрачные растворы образуются при сливании
растворов:
1) Ba(NO3)2 и К2СО3;
2) СаС12 и NH4NO3;
3) MgSO4 и KF;
4) NaHCO3 и СаС12.
9. Для полного взаимодействия с раствором Ba(NO3)2
объемом 20 см3 с молярной концентрацией соли
0,2 моль/дм3 потребуется раствор К2СО3 с молярной
концентрацией соли 0,05 моль/дм3 минимальным объе-
мом (см3):
1)20; 2) 40; 3)60; 4) 80.
10. В природной воде объемом 5 дм3 находятся
Са(НСО3), массой 0,2400 г и Mg(HCO3), массой 0,6000 г.
Укажите суммарную молярную концентрацию (ммоль/дм3)
ионов Са2+ и Mg2+ в воде:
1) 1,12; 2) 1,00; 3)0,918; 4) 0,848.
--- 484 ---
ТЕМА 36
Алюминий. Оксид и гидроксид алюминия
ТЕСТ1
1. При температуре 20 °C алюминий реагирует с:
1) КОН (р-р); 2) HNO3 (конц.);
3) H,SO4 (конц.); 4) H,SO4 (разб.).
2. Оксид алюминия можно получить при нагревании:
1)А1(ОН)3; 2)A1(NO3)3;
3) смеси А1(ОН)3 и КОН(т); 4) смеси Fe3O4 и А1.
3. Амальгамированный алюминий в отличие от сво-
его оксида может реагировать с:
1)Н2О; 2) NaOH (р-р);
3) H2SO4 (разб.); 4) AgNO3 (р-р).
4. Укажите формулы солей, в которые алюминий вхо-
дит в состав аниона:
1)A12(SO4)3; 2)К3[А1(ОН)6];
3)Са(А1О2)2; 4) [A1(OH)2]2SO4.
5. При взаимодействии 2,0 моль метаалюмината ка-
лия и 3,0 моль серной кислоты образуется:
1) А1(ОН)3; 2) A12(SO4)3; 3) [A1(OH)J2SO4; 4) (A1OH)SO4.
6. Укажите формулу защитной пленки на поверхнос-
ти алюминия:
1) A1N; 2) А1(ОН)3; 3) А12О3; 4) А14С3.
7. Число протонов в ядре атома алюминия равно:
1) 13; 2) 14; 3)27; 4) 40.
8. В алюмотермических процессах алюминий играет роль:
1) восстановителя; 2) окислителя;
3) катализатора; 4) ингибитора.
--- 485 ---
9. Гидроксид алюминия может реагировать с веще-
ствами, формулы которых:
1) КС1 (р-р); 2) NaOH (р-р);
3)КОН(т)(П; 4) K2SO4 (р-р).
10. Металлические свойства атомов элементов в ряду
К —А1 Са:
1) уменьшаются;
2) усиливаются;
3) сначала уменьшаются, затем усиливаются;
4) сначала усиливаются, затем уменьшаются.
ТЕСТ 2
1. Для получения гидроксида алюминия осаждением
из раствора сульфата алюминия можно использовать:
1) NH3; 2) ВаС12; 3) КОН (изб.); 4) NaNOy
2. Алюминиевая проволока реагирует с водой при
следующих условиях:
1) только при нагревании;
2) будучи очищенной от оксидной пленки и только
при нагревании;
3) будучи очищенной от оксидной пленки и при ком-
натной температуре (=20 °C);
4) комнатная температура.
3. От оксидной пленки на поверхности алюминия
можно освободиться с помощью:
1)ртути;
2) водного раствора щелочи;
3) водного раствора нитрата калия;
4) соляной кислоты.
4. Оксид алюминия может реагировать с:
1) Н,О; 2) H2SO4 (разб.); 3) СаО (t°); 4) КОН(т) (20 °C).
--- 486 ---
5. Гидроксид алюминия в качестве конечного продукта
может образоваться при взаимодействии:
I) 1 моль А1С13 (р-р) и 3 мольИаОН;
2) 0,5 моль A1(NO3)3 и 3,0 моль КОН (р-р);
3) А1,О, и Н,О;
4) К3[А1(ОН)6] и 3 моль НС1 (р-р).
6. Алюминий в промышленности получают:
1) электролизом расплава А1,О3 в криолите;
2) взаимодействием К и А1С1, (р-р);
3) электролизом водного раствора А1С13;
4) взаимодействием А1,О3 и Н,.
7. При взаимодействии в различных условиях КОН и
А1(ОН)3 можно получить:
1) КАЮ,; 2) К, О; 3) К3[А1(ОН)6]; 4) Н,О.
8. Амфотерный характер А1(ОН)3 можно доказать с
помощью реакций, схемы которых
1) А1(ОН)3 + НС1 (р-р) -> А1С13 + Н,О;
2)А1(ОН)3ЛА1,О3 + Н?О;
3) А1(ОН)3 + Ва(ОН), (р-р) -4 Ва3[А1(ОН)6]?;
4) А1С13 + КОН (р-р) -> А1(ОН),С1 + КС1.
9. При сплавлении оксидов алюминия и кальция об-
разуется:
1) СаАЮ,; 2) Са(А1О2)2; 3) Са3(А1О2)2; 4) Са2(А1О2)3.
10. При взаимодействии сплава Al(Hg) с водой при
температуре 20 °C образуются:
1)А1,О, иН,; 2) А1(ОН)3 и Н,;
3)А1Н иН2;' 4) А1(ОН)3 и А1,О3.
ТЕСТЗ
1. Под амальгамированием понимается:
1) получение сплавов на основе алюминия;
--- 487 ---
2) снятие защитной оксидной пленки с поверхности
алюминия с помощью раствора щелочи;
3) получение металлов из их оксидов с помощью алю-
миния;
4) снятие защитной оксидной пленки с поверхности
алюминия с помощью ртути.
2. Оксид алюминия проявляет свойства кислотного
оксида, реагируя с:
1) кислотными оксидами,
2) кислотами;
3) щелочами; г
4) основными оксидами.
3. В реакциях с какими веществами гидроксид алю-
миния проявляет основные свойства?
l)HCl(p-p); 2) КОН (р-р);
3) NaOH(T) (/°); 4) H2SO4 (разб).
4. Между собой могут реагировать:
1) А1,О3 и КС1; 2) А17О3 и КОН(т),
3) СаО и А1; 4) A12(SO4)3 и NH3 • Н2О.
5. Гидроксид алюминия можно получить при взаи-
модействии:
1)А12О, и КОН (р-р);
2) Na3[Al(OH)6] и НС1 (р-р);
3) A12(SO4)3 (р-р) иЫН3(изб.),
4) Alp, и NH3 • Н2О (изб.).
6. Укажите формулы солей, в составе которых алю-
миний находится в катионной части соли:
1)KA1(SO4)2; 2)Na3[Al(OH)6];
3)КА1О2; 4)А1(ОН)С1п.
7. При взаимодействии А1 и СаО (изб.) образуется:
1) Са и А1,О3; 2) Са и СаА1Оп;
3) Са(А1О2)2 и А12О3; 4) Са(А1ОД и Са.
--- 488 ---
8. При комнатной температуре (20 °C) протекают ре-
акции между:
1) А1 и HNO3 (конц.); 2) А1,О3 и NaOH (р-р);
3) А1(ОН)3 и КОН (р-р); 4) А1Д и КОН(т).
9. Только при нагревании протекают реакции, схемы
которых:
1) А1,О3 + КОН -> КАЮ, + Н,О;
2) А1(ОН)3 +NaOH -> Na3[Al(OH)6];
3) Al(Hg) + Н,О -> А1(ОН)3 + Н,;
4) A1(NO3)3 -» А1,О3 + NO, + 62.
10. Укажите массовую долю (%) атомов алюминия в
криолите:
1) 12,9; 2) 11,9; 3) 10,9; 4) 9,90.
ТЕСТ 4
1. Конечным продуктом будет осадок, когда между со-
бой взаимодействуют:
1)А1(Нё)иН,О;
2) А1С13 (р-р) и NH/изб.);
3) A1,(SO4)3 (1 моль) и КОН (р-р) (12 моль);
4) A1(NO3)3 (р-р) (0,5 моль) и NaOH (1,5 моль).
2. Сульфат алюминия образуется при взаимодействии:
1)A1hS;
2) Al и FeSO4 (р-р);
3) Al и H,SO4 (конц.) (20 °C);
4) А 1,0, и H,SO4 (разб.).
3. При взаимодействии алюминия с серной кислотой
или водным раствором гидроксида натрия НЕЛЬЗЯ по-
лучить:
1)водород;
2) гексагидроксоалюминат натрия;
— 489 —
3) метаалюминат натрия;
4) гидроксид алюминия.
4. Алюминий НЕ входит в состав минерала, назва-
ние которого:
1) каолин; 2) боксит; 3) корунд; 4) халькопирит.
5. Какое свойство алюминия используется при изго-
товлении электропроводов?
1) легкость;
2) высокую теплопроводность;
3) прочность;
4) высокую электрическую проводимость.
6. Водород выделяется при смешивании:
1) Al(Hg) иН,О; 2) А1 и H,SO4 (конц.) (С);
3) Al и НС1 (р-р); 4) А1 и HNO3 (конц.) (f°).
7. Серебро можно очистить от примеси алюминия с
помощью:
1) HNO3 (разб.); 2) HNO3 (конц.);
3) H2SO4 (конц.); 4) НС1 (разб.).
8. Ионное уравнение А1(0Н)3 + ЗН+ = А13+ + ЗН,О со-
ответствует реакции между А1(ОН)3 и:
1) NH3 • Н2О; 2) КОН (р-р); 3) Н,РО4; 4) НС1 (конц.).
9. Ионное уравнение А1(ОН), + ЗОН = А1(ОН)3 соот-
ветствует взаимодействию:
1)А1(0Н)3 иКОН(т);
2)A1(OH)3hNH3H,O;
3)А1(ОН)3иН,8О4(разб.);
4) А1(ОН)3 и NaOH (р-р).
10. Ионное уравнение Al3+ +ЗОН = А1(ОН)3Х соответ-
ствует взаимодействию:
1) A1(NO3), и КОН (р-р, изб.);
2) А1С13(р-р) и NH3 Н2О(изб.);
3) A1,(SO4)3 (0,2 моль) и NaOH (р-р) (1,2 моль);
4) А1,О3 и NaOH (р-р).
--- 490 ---
ТЕСТ 5
1. Выделяется газ и образуется комплексное соедине-
ние, когда между собой реагируют:
1) А14С3 и Н,О; 2) А1 и КОН (р-р);
3) А1 и NaOH(T); 4) А1ЭО3 и Ва(ОН), (р-р).
2. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении реакции между К,[А1(0Н)6] и избытком
H,SO4 (разб.):
1) 11; 2) 12; 3) 13; 4) 14.
3. Укажите сумму коэффициентов в ионном уравне-
нии реакции между водными растворами, содержащи-
ми 0,5 моль Na3[Al(OH)6] и 1,5 моль HNO3:
1)6; 2) 7; 3)8; 4) 9.
4. Отметьте формулу вещества X в уравнении реак-
ции K2Cr,O7 + 4А1 = 2Сг + 2Х + А1,О3:
1) Сг2б3; 2) КА1О2; 3) КСгО2; 4)‘К3АЮ3.
5. С раствором, содержащим A12(SO4)3 массой 3,420 г,
может максимально прореагировать Ва(ОН)2 массой (г):
1) 2,565; 2) 20,52; 3) 7,695; 4) 10,26.
6. Реакция замещения протекает при взаимодействии:
1) Al(Hg) и Н2О; 2) А12О3 и КОН (р-р);
3) А1 и CuSO4 (р-р); 4) А1 и H2SO4 (разб.).
7. Водород выделяется, когда между собой реагируют:
1) А1 и КОН (р-р); 2) А1 и H,SO4 (разб.);
3) А12О3 и NaOH (р-р); 4) А1(ОН)3 и КОН(т).
8. Образец сплава дюралюминия можно полностью
растворить с помощью:
1)НС1(разб.);
2) Н,SO/разб.);
3) HNO3 (конц.) (20 °C);
4)NaOH (р-р) и HNO3 (разб.).
— 491 —
9. Соль состава ЭЛЮ, образуется при взаимодействии:
1) А1 и КОН (р-р); ‘ 2) А1,О3 и КОН(т);
3) А12О3 и Ва(ОН)2(т(; 4) А1(ОН)3 и NaOH(i).
10. Соль состава Э3[А1(ОН)6] образуется при взаимо-
действии:
I) NaOH(T) и А1(ОН)3; 2) КОН (р-р) и А1Д;
3) Ва(ОН)2 (р-р) и AI; 4) NaOH (р-р) и А1(ОН)3.
ТЕСТ 6
1. При постепенном добавлении серной кислоты к
раствору К3[А1(ОН)6] последовательно образуются:
1)A1(OH)3,K2SO4,A1,(SO4)3;
2)K2SO4,A1(OH)3,A1,(SO4)3;
3) A1,(SO4)3, K2SO4, А1(ОН)3;
4)Af2(SO4)3,Al(OH)3,K2SO4.
2. НЕЛЬЗЯ кипятить в алюминиевом сосуде раство-
ры (учтите диссоциацию или взаимодействие ионов
электролита с водой):
1) KHSO4; 2) К2СО3; 3) КОН; 4) NaNO3.
3. Ионы Ва2+ в присутствии ионов А13+ можно обна-
ружить с помощью реактивов, содержащих анионы:
1) РО3’; 2) Н+; 3) ОН ; 4) SO2-.
4. В реакции, схема которой Al+S —> A12S3+509 кДж/моль,
с участием алюминия химическим количеством 0,5 моль
образуется масса продукта и выделяется теплота:
I) 37,5 г; 2) 75,0 г; 3) 127 кДж; 4) 254 кДж.
5. Соль состава ЭА1О, образуется при сплавлении:
1) 4 моль СаО и 2 моль А1; 2)А1,О,иКОН;
3) А1Д и Са(ОН),; 4)А12О3иВаО.
6. Анионы состава А1О; образуются при взаимодей-
ствии:
1) Al(Hg) и Н,О; 2) А1,О3 и КОН (р-р);
3) СаО и А12О3; 4) КОН(т) и А1(ОН)3.
— 492 —
7. Анионы состава [А1(ОН)6]3 образуются, когда меж-
ду собой реагируют:
1) Al(Hg) иН7О;
2) КАЮ, и НС1 (р-р);
3) КОН (р-р) и А1(ОН)3;
4) А1 и Ва(ОН)2 (р-р).
8. Оксид алюминия НЕЛЬЗЯ получить:
1) взаимодействием А1(ОН)3 и NaOH(i,
2) при нагревании A1(NO ,)3;
3) взаимодействием NaAIO, и H2SO4 (р-р);
4) при нагревании А1(0Н)3.
9. При взаимодействии карбида алюминия с водой
образуются:
1) А17О3 и сн4; 2) А1(ОН)3 и С,Н„
3) А1~О3 и С,н2; 4) А1(ОН)3 и СН4"
10. В уравнении реакции 2А1 + 6NaOH + 6Н,О - 2х +
+ ЗН, вместо х следует записать формулу:
1) Na[Al(OH)J; 2) Na,[Al(OH)fl; 3) NaAlO,; 4) Al(OH),.
ТЕСТ 7
1. В уравнении реакции А12О3 + Ва(ОН),(т) = х+у вме-
сто х и у следует соответственно записать:
1) А1(ОН)3 и Н,О; 2) ВаАЮ, и Н,О;
3) Ba(A10Q2 и Н2О; 4) Ва3[А1(ОН)'], и Н2.
2. Согласно сокращенному ионному уравнению
[А1(ОН)6]3“ + ЗН+ = А1(ОН)3J- + ЗН7О между собой реа-
гируют:
1) Na3[Al(OH)6] и избыток НС1 (р-р),
2)К3[А1(ОН)6]’иСО2(р-р);
3) К3[А1(ОН)6] (1 моль) и HNO3 (разб.) (3 моль);
4) К3[А1(ОН)6] (1 моль) и Н,Р04 (1 моль)
--- 493 ----
3. Укажите сумму коэффициентов в сокращенном ион-
ном уравнении между КАЮ, (1 моль) и НС1 (р-р, 1 моль):
1)4; 2) 5; 3)6; 4) 7.
4. В сокращенном ионном уравнении реакции между
Ва(А1О,), и избытком H,SO4 (разб.) сумма коэффициен-
тов равна:
1) 17; 2) 19; 3)21; 4) 23.
5. Сокращенному ионному уравнению
[A1(OH)J + 6Н+ = А13+ + 6Н,О отвечает взаимодей-
ствие водных растворов, содержащих:
1) 0,5 моль Na3[Al(OH)J и 1,5 моль НС1;
2) 0,2 моль КДА1(ОН)6] и 1,2 моль HNO3 (разб.);
3) Na3[Al(OH)6] и СО, (р-р, изб.);
4) K3[A1(OH)J и Н3РО4(изб.).
6. Водные растворы A12(SO4)3 и CuSO4 можно разли-
чить с помощью:
1) НС1; 2) ВаС12; 3) КОН; 4) Fe.
7. Конечным продуктом будет осадок, когда между
собой реагируют:
1)А1С13иКОН (р-р, изб.);
2) A12(SO4)3 и ВаС1, (р-р);
3) A12(SO4)3 (р-р) и NH3 (изб.);
4) 0,1 моль A1(NO3)3 (р-р) и 0,3 моль КОН.
8. НЕПРАВИЛЬНО составлены формулы солей алю-
миния:
1) Ва[А1(ОН)6]; 2) Ва3[А1(ОН)6],; 3) СаАЮ,; 4) КА1РО4.
9. Как А1,О3, так и А1(ОН)3 могут реагировать с:
1) NaOH (р-р); 2)КОН(г);
3) Ba(NO3), (р-р); 4) H,SO4 (разб.).
10. Гидроксид алюминия реагирует, а гексагидроксо-
алюминат калия — нет с веществом, формула которого:
l)HCl(p-p); 2) КОН (р-р);
3) Na2SO4 (р-р); 4) HNO3 (разб.).
--- 494 ---
ТЕСТ 8
1. При взаимодействии 0,1 моль А1(ОН), и водного
раствора, содержащего 0,05 моль H,SO4, образуется ве-
щество, формула которого:
1) А1,(8ОД; 2) [A1(OH)2]2SO4; 3) (A1OH)SO4; 4) A12S3.
2. Сольсостава (A1OH)SO4 образуется, когда между со-
бой реагируюз А1(ОИ)3 химическим количеством 0,2 моль
и серная кислота химическим количеством (моль):
1)0,1; 2) 0,2; 3)0,3; 4) 0,6.
3. Комплексное соединение образуется при взаимо-
действии:
I) 1 моль A1(NO3)3 и 3 моль NaOH (р-р);
2) 0,1 моль A1(NO3)3 и 0,3 моль NH3 (р-р);
3) 0,2 моль A12(SO4)3 и 2,4 моль КОН;
4) A1(NO3)3 (р-р) и избытка Ва(ОН)2.
4. В водном растворе К3[А1(ОН)6] наибольшей будет
концентрация ионов:
1)К+; 2) А13+; 3)ОН";4) Н+.
5. Нагревание обязательно требуется, чтобы между
собой прореагировали:
1) Al(Hg) и Н2О; 2) А12О3 и КОН{т);
3) А1(ОН)3 и КОН (р-р); 4) А1(ОН)3 и Ва(ОН)2(т).
6. Укажите объемную долю (%) более тяжелого газа в
смеси газов, образовавшихся при нагревании A1(NO3)3:
1)20; 2) 40; 3)60; 4) 80.
7. Укажите заряд катиона, образующегося при диссо-
циации А1(ОН)3 по второй стадии:
1)+1;2) +2; 3)+3;4)+4.
8. Сколько веществ, формулы которых Fe3O4, С, КОН
(р-р), CuSO4 (р-р), HNO3 (конц., 20 °C), могут реагиро-
вать с алюминием:
1)5; 2) 4; 3)3; 4) 2.
--- 495 ---
9. Оксид алюминия может реагировать, а оксид ка-
лия — нет с веществами, формулы которых:
1) Н2О; 2) СаО; 3) PnOs; 4) NaOH(T).
10. Сходство гидроксидов алюминия и калия состоит
в том, что оба соединения:
1) легко разлагаются при нагревании;
2) сильные электролиты;
3) реагируют с сильными кислотами;
4) реагируют с водными растворами щелочей.
ТЕМА 37
Металлы Б групп. Берилий
ТЕСТ1
1. Масса цинковой пластинки уменьшится при вы-
держивании ее в растворах:
1) CuSO4; 2) НО; 3) Fe(NO3)2; 4) HgSO4.
2. Железо можно получить взаимодействием:
1) магнетита с избытком оксида углерода (II);
2) натрия с водным раствором сульфата железа (II);
3) цинка с водным раствором Fe(NO3)n;
4) пирита с избытком кислорода.
3. Укажите символ иона с сокращенной электронной
конфигурацией ... 3<734л0:
1) Fe3+; 2) Мп+б; 3) Мп+4; 4) Zn‘2.
4. Для получения Zn из раствора его соли можно ис-
пользовать металлы:
1)А1; 2)Ca;3)Mg; 4) Fe.
--- 496 ---
5. Пять электронов на ЗсУ-подуровне содержится в
атомах или ионах:
1)Си; 2) Мп; 3) Fe3+; 4) Со.
6. Основные свойства наиболее выражены у оксида,
формула которого:
1)МпО,; 2) СгО;
3) Сг,О3; 4) ВеО.
7. В электротехнике используют свойство меди:
1)ковкость;
2) высокую электрическую проводимость;
3) твердость;
4) высокую теплопроводность.
8. Коррозия железа в воде может быть обусловлена:
1) растворенным кислородом;
2) азотом;
3) наличием в железе примесей других металлов;
4) ионами водорода.
9. Про золото НЕЛЬЗЯ сказать, что этот металл:
1) обладает наименьшей электрической проводимос-
тью среди других металлов;
2) наиболее пластичен из всех металлов;
3) химически активен;
4) в природе встречается только в виде соединений.
10. Укажите последовательность восстановления ок-
сидов железа в доменной печи:
1) FeO -н ► Fe3O4 -i ► Fe,O3 - -> Fe;
2) Fe3O4 - -> Fe,O, -> FeO - -» Fe;
3) Fe^O, - -> Fe3O4 - -» FeO- -> Fe;
4) Fe3O4 - -» Feb > Fe\O, - 2 э -> Fe.
--- 497 ---
ТЕСТ 2
1. Основные свойства гидроксидов усиливаются в ряду:
1) Fe(OH)3, Fe(OH)2, Ba(0H)7;
2) Fe(0H)7, Fe(OH)~, Ва(ОН)7;
3) Ва(ОН),, Fe(OH)„ Fe(OH)3;
4) Ba(OH)2, Fe(OH)3, Fe(OH),.
2. Укажите электронную конфигурацию иона Fe2+:
1) [Ar] 3t75; 2) [Ar] 3d*4s2\ 3) [Ar] 3t76; 4) [Ar] 3d54s'.
3. При взаимодействии 1 моль магнетита с избытком
соляной кислоты кроме воды образуется(ются):
1) 3 моль FeCl7;
2) 3 моль FeQ3;
3) 2 моль FeCI, и 1 моль FeCl3;
4) 1 моль FeCL, и 2 моль FeCl3.
4. Оксид железа (III) может реагировать с веществами:
1) Н2О (20 °C); 2) Н, (С); 3) НС1 (р-р); 4) NaOH(T|(f°).
5. Комплексное соединение образуется при взаимо-
действии:
1) Мп(ОН)4 и КОН (р-р); 2) Сг(ОН)3 и NaOH (р-р);
3) Be и NaOH (р-р); 4) ВеО и К2О (С).
6. Гидроксид железа (II) может реагировать с:
1) H7SO4 (разб.);
2) Na2SO4 (р-р);
3) КОН (разб. р-р);
4) кислородом во влажном воздухе.
7. Примерный состав ржавчины отражает формула:
1) FeO; 2) Fe2O3; 3) Fe2O, • /?Н2О; 4) Fe,O4.
8. Соль железа (III) образуется при взаимодействии:
1) Fe и HCl(p-p); 2) Fe и С12 (изб.);
3) Fe2O3 и Н2 (С); 4) Fe2O3 и H2SO4 (разб.).
9. Как с кислотами, так и со щелочами могут реагировать:
1) Сг2О3; 2) СгО; 3) Fe7O3; 4) Ве(ОН)2.
--- 498 ---
10. Соединение состава Na.,[3(OH)4] образуется при
взаимодействии:
1) Мп(ОН)4 и NaOH (р-р); 2) ZnO и NaOH (р-р);
3) Ве(ОН)2 и NaOH(p-p); 4) ZnO и NaOH(T).
ТЕСТЗ
1. К элементам (/-семейства относятся:
1)Ве; 2) Fe; 3)Сг; 4) Zn.
2. В отличие от гидроксида железа (II) гидроксид же-
леза (III) может реагировать с:
1) НС1 (р-р); 2) КОН (конц. р-р);
3) Na2SO4 (р-р); 4) H2SO4 (разб.).
3. Для превращения магнетита в оксид железа (III)
нужно, чтобы магнетит прореагировал с:
1) Н2; 2) С(кокс); 3) СО; 4) О2.
4. Атомы железа в степени окисления +3 входят в состав:
1) K2FeO4; 2) Fe,O4; 3) KFeO2; 4) K3[Fe(OH)6].
5. В растворе, содержащем ZnCL, массой 1,36 г, пол-
ностью растворили натрий массой 0,92 г и получили:
1) 0,01 моль Zn(OH), 2) 0,01 моль Na,ZnO.,;
3) 0,01 моль Na,[Zn(OH)4; 4) 0,02 моль Na'[Zn(OH)4],
6. Железо — восстановитель, когда между собой реа-
гируют:
1) FeO и НС1 (р-р); 2) FeS и О2 (изб.);
3) FeO и HNO3 (конц.) (С); 4) Fe и CuSO4 (р-р).
7. Оба гидроксида—Fe(OH), и Fe(OH), — реагируют с:
1) КОН (разб.); 2) Na,SO. (р-р);
3) H2SO4 (разб.); 4) КС1 (р-р).
8. Соединение состава КМеО, образуется при взаи-
модействии:
1) Fe2O3 и КОН (р-р); 2) ZnO и К,0 (С);
3) Сг2О3 и КОН (р-р); 4) Сг2О3 и КОН(т) (С).
— 499 —
9. Даны вещества, формулы которых: Н,О, К,О, NaOH,
H,SO4. Сколько из них может реагировать с оксидом бе-
риллия?
1)4; 2)3; 3)2; 4) 1.
10. Комплексное соединение состава К[Ме(ОН)4] об-
разуется при взаимодействии:
1) Fe,O, и КОН (/°); 2) СгДХ и КОН (/°);
3) Zn(OH)2 и КОН (р-р); 4) Сг(ОН)3 и КОН (р-р).
ТЕСТ 4
1. Укажите число неспаренных электронов в основ-
ном состоянии атома железа:
1)4; 2)3; 3)2; 4) 1.
2. При температуре 20 °C железо реагирует с:
1) HNO3 (конц ); 2) НС1 (р-р);
3) Cu(NO3)2 (р-р); 4) H,SO4 (конц ).
3. Сульфат железа (II) в водном растворе может реа-
гировать с:
1) НС1; 2) ВаС1п; 3) КОН; 4) Zn.
4. Водные растворы K,S04, (NH4)2SO4 MgS04 и
A1,(SO4)3 можно различить с помощью одного реактива,
формула которого:
1) ВаС12; 2) КОН; 3) НС1; 4) KNO4.
5. Ниже указаны формулы солей, в водных растворах
которых некоторое время выдерживались пластинки из
кадмия Укажите формулу соли, при выдерживании в
растворе которой масса пластинки уменьшилась:
1) FeSO4, 2) NiSO4; 3) AgNO,; 4) ZnSO4.
6. Для превращения магнетита в оксид железа (II) не-
обходимо, чтобы магнетит прореагировал с:
1) Н2; 2) О2; 3) СО; 4) С (кокс)
--- 500 ---
7. В составе перманганата калия степень окисления
атома марганца равна:
1)+2; 2)+4; 3)+7; 4) +8.
8. При взаимодействии гидроксида хрома (III) с вод-
ным раствором гидроксида калия образуется вещество,
формула которого:
1) Сг,О3; 2) КСгО,; 3) К[Сг(ОН)4]; 4) К,[Сг(ОН)4].
9. Даны вещества, формулы которых: Н,О, КОН, H,SO4,
Na,O. Сколько из них может реагировать с Zn(OH),?
1)4; 2)3; 3)2; 4) 1.
10. Укажите сумму коэффициентов в сокращенном
ионном уравнении реакции между растворами, содер-
жащими 0,1 моль Na,[Be(OH)4] и 0,2 моль НС1:
1) 6; 2) 5; 3) 4; 4) 3*.
ТЕСТ 5
1. В раствор, содержащий 0,01 моль FeCl2, внесли Са
химическим количеством тоже 0,01 моль. После завер-
шения реакции получили вещества, формулы которых:
1) Fe; 2) Fe(OH),; 3) СаС12; 4) Са(ОН)2.
2. Процесс ржавления железа может быть описан урав-
нением реакции, схема которой Fe + О, + Н2О —> Fe(OH)3.
Какие утверждения справедливы для этого процесса?
1) атомы кислорода восстанавливаются;
2) атомы железа окисляются;
3) степень окисления атомов железа уменьшается;
4) степень окисления атомов кислорода увеличивается.
3. Укажите формулы продуктов восстановления ок-
сида железа (III) оксидом углерода (II) на первой стадии:
1) FeO и СО,; 2) Fe3O4 и СО,;
3) FeO и СО; 4) Fe3O4 и СО?
--- 501
4. Железо реагирует с водными растворами:
1) KCI; 2) НС1; 3) AgNO,; 4) H2SO4 (разб.).
5. Химическое воздействие возможно между:
1) Мп(ОН)4 и КОН (р-р); 2) Fe,O4 и H„SO4 (разб.);
3) Си и FeSO4 (р-р); 4) Fe3O4 и О,.
6. По типу реакции замещения железо реагирует с:
1) НС1 (р-р); 2) С1,; 3) ZnSO4 (р-р); 4) AgNO3 (р-р).
7. Основный характер оксида железа (III) показыва-
ют реакции, схемы которых-
1) Fe,O, + СО -> Fe3O4 + СО,;
2) Fe Д + КОН -> KFeO, + Н,О;
3) Fe,O3 + НС1 -> FeCl3 + Н Д
4) Fe,O3 + Р,О5 Л FePO4 + Н2О.
8. Кислотный характер оксида хрома (III) показыва-
ют реакции, схемы которых:
1) Cr2O3 + А1 -> Сг+ А12О3;
2) Сг,О3 + КОН + Н2О -> К[Сг(ОН)4];
3) Сг2О3 + КОН -» КСгО2 + Н2О;
4) Cr2O3 + SO3 -> Cr2(SO4)3.
9. Как с кислотами, так и со щелочами могут реагиро-
вать вещества, формулы которых:
1) K,[Zn(OH)4]; 2) Zn(OH)2; 3) Mn(OH)4; 4) ВеО.
10. Укажите сумму коэффициентов в сокращенном
ионном уравнении реакции между растворами, содер-
жащими 0,05 моль Na,[Zn(OH)4] и 0,10 моль H,SO4:
1)9; 2)10; 3)11; 4) 12.
ТЕСТ 6
1. Укажите справедливые утверждения для железа и
его соединений:
1) в контакте с цинком корродирует медленнее;
--- 502 ----
2) основные свойства Fe(OH), выражены сильнее, чем
yFe(OH)2;
3) при нагревании Fe(NO3), на воздухе образуются
Ке.Д, NO, и О,;
4) в природе железо в основном встречается в сво-
бодном виде.
2. Железо можно получить при взаимодействии:
1) Fe,O4 и СО; 2) FeO и О,;
3) Zn и FeSO4 (р-р); 4) FeSO4 (р-р) и KMnO4/H,SO4.
3. При обжиге FeS в избытке О, конечными продук-
тами будут:
1) Fe3O4 и SO,; 2) Fe,O, и SO,;
3) FeO и SO2; 4)Fen SO,.
4. Для превращения оксида железа (III) в магнетит
необходимо, чтобы оксид железа (III) прореагировал с:
1)О2; 2) Н2; 3) СО; 4) SO,.
5. Железо сильнее всего подвергается коррозии в:
1) дистиллированной воде;.
2) воде, насыщенной кислородом;
3) воде, насыщенной азотом;
4) воде, насыщенной смесью кислорода и углекисло-
го газа.
6. Какое химическое количество (моль) H,SO4 (разб.)
потребуется для полного растворения магнетита хими-
ческим количеством 1 моль?
1) 1; 2) 2; 3) 3; 4) 4.
7. Укажите число электронов на предпоследнем элект-
ронном слое в основном состоянии атома марганца:
1) II; 2) 12; 3) 13; 4) 14.
8. Гидроксид железа (II) можно получить взаимодей-
ствием:
1) FeO и Н,О; 2) FeCl, и КОН (р-р);
--- 503 ----
3) Fe(OH)3 и О, (влажный); 4) Fe2O3 и Н,.
9. Соединение состава К,МеО, образуется при взаи-
модействии:
1) СцО, и КОН, 2) ZnO и КОН(т);
3) Сг(ОН)3 и КОН (р-р); 4) Ве(ОН)2 и КОН(т).
10. Укажите сумму коэффициентов в сокращенном
ионном уравнении реакции между ZnSO4 и избытком
раствора NaOH:
1)8; 2) 5; 3)4; 4)6.
ТЕСТ 7
1. Сульфат железа (II) можно получить при взаимо-
действии:
1) Fe и H3SO4 (конц.) (г°);
2) Fe и CuSO4 (р-р);
3) Fe и H,SO4 (разб.);
4) Fe(OH), и Na2SO4 (р-р).
2. Железо НЕЛЬЗЯ получить взаимодействием:
1) магнетита и кислорода;
2) магнетита и оксида углерода (II);
3) оксида железа (III) и алюминия;
4) калия с водным раствором сульфата железа (II).
3. При взаимодействии калия с водным раствором
хлорида цинка могут образоваться:
1)водород;
2) цинкат калия;
3) тетрагидроксоцинкат калия;
4) гидроксид цинка.
4. Взаимодействием натрия с водным раствором суль-
фата цинка НЕЛЬЗЯ получить:
1) Zn; 2) Na,SO4; 3) Н2; 4) Na3[Zn(OH)6].
--- 504 ---
5. Для оксида хрома (III) справедливо утверждение:
1) кислотный оксид;
2) амфотерный оксид;
3) основный оксид;
4) реагирует с кислотами, но не со щелочами.
6. С водными растворами щелочей реагируют все ве-
щества, формулы которых приведены в рядах:
1) Cr2O3, Zn(OH)2, K[Cr(OH)J;
2) ВеО, Ве(ОН)2, K2[Zn(OH)J;
3) ZnO, Cr,O3, Cr(OH)3;
4) Mn(OH)4, Zn, Zn(OH)2.
7. Водный раствор FeSO4 реагирует с:
1) HC1; 2) NaOH; 3) AgNO3; 4) NaNO3.
8. Укажите схемы НЕВОЗМОЖНЫХ реакций:
1) Zn + HCl(p-p) -> ZnCl, + H2;
2) Zn + HNO. (конц.) —> Zn(NO3), + NH4NO, + H2O;
3) Zn + H SO4 (конц.) —> ZnSO4 + H2;
4) Zn + MgSO4(p-p) -> ZnSO4+ Mg?
9. Гидроксид цинка может реагировать с водными
растворами веществ, формулы которых:
1) НС1; 2) KCI; 3) HNO3; 4) KOI 1.
10. Постоянную степень окисления в соединениях
проявляют атомы элементов, символы которых:
1) Fe и Zn; 2) Be и Zn; 3) Сг и Zn; 4) К и Мп.
ТЕСТ 8
1. Справедливы утверждения:
1) железо реагирует с водой только при нагревании;
2) железо в соединениях проявляет переменную сте-
пень окисления;
3) железо вытесняет медь из водного раствора суль-
фата меди (II);
— 505 —
4) железо реагирует с концентрированной азотной
кислотой при комнатной температуре.
2. Магнетит может образоваться при взаимодействии:
l)FenH,O; 2) Fe и О,;
3) Fe,O3 и Н,; 4) FeO и СО.
3. Для ряда оксидов хрома СгО — Сг,О3 — СгО3 спра-
ведливы утверждения:
1) свойства окидов изменяются от основных через
амфотерные к кислотным;
2) степень окисления атома хрома изменяется в пос-
ледовательности: +2, +3, +6;
3) со щелочами реагируют только два последних оксида;
4) со щелочами реагирует только СгО3.
4. Амфотерные свойства ZnO иллюстрируют схемы
реакций:
I) ZnO + NaOH -э Na,ZnO, + Н,О;
2) ZnO + CO —> Zn + CO,; '
3) ZnO + HNO3 -> Zn(NO3)2 + H,O;
4) ZnO + SO3 -> ZnSO4.
5. Взаимодействие Cr(OH)3 с KOH (р-р) можно отне-
сти к типу реакций:
1) соединения; 2) обмена;
3) окислительно-восстановительной; 4) замещения.
6. Каков заряд иона железа с электронной конфигура-
цией [Ar] 3t/54.v(l?
1)+2; 2) +3;3)+6; 4) +8.
7. Для получения железа из его оксидов можно ис-
пользовать:
1)0,; 2) H2;3)AI;4)Si.
8. Магнетит может реагировать с веществами, фор-
мулы которых:
1) Н2; 2) 02; 3) НС1 (р-р); 4) KN03 (р-р).
/
--- 506 ---
9. Сходство химических свойств алюминия и железа
состоит в том, что оба металла:
1) энергично реагируют с водой при комнатной тем-
пературе (20 °C);
2) при комнатной температуре (20 °C) не реагируют с
концентрированной азотной кислотой;
3) реагируют с соляной кислотой с выделением во-
дорода;
4) реагируя с соляной кислотой!, образуют соли, в ко-
торых степень окисления атома металла равна +3.
10. Железную стружку можно отделить от алюмини-
евой с помощью:
1) NaOH(p-p); 2) HNO, (конц.) (20 °C);
3) H?SO4 (конц.) (20 °C); 4) НО (конц.).
ТЕСТ 9
1. При взаимодействии магнетита с избытком концен-
трированной азотной кислоты в основном образуются:
1) Fe(NO3), и NO; 2) Fe(NO3), и NH4NO,;
3) Fe(NO3)3 и NO,; 4) Fe(NO3), и NO,.
2. Водород образуется при взаимодействии:
1) Fe и HNO, (конц.) (/°); 2) Fe и NH, • Н,0 (конц.);
3) Fe и H,SO4 (разб.); 4) Fe и NaOH (разб.).
3. Сокращенному ионному уравнению сульфид-ион +
+ 2Н+ = H,S отвечает взаимодействие:
1) FeS, и HNO, (конц.); 2) H,S и HNO, (конц.);
3) FeS и H,SO4 (разб.); 4) K2S и HCI(p-p).
4. Сталь в промышленности получают:
1) выплавкой в доменной печи;
2) методом алюмотермии;
3) электролизом расплава оксида железа (III) в криолите;
— 507 —
4) из чугуна в конвертерах.
5. В доменных печах чугун в основном получают при
взаимодействии:
1) Fe,O3 и А1; 2) Fe,O3 и СО, 3) FeS, и О2; 4) Fe2O3 и Н,
6. Укажите формулу продукта реакции между СгС13 и
NaOH (р-р, изб ):
1) Сг(ОН)3; 2) NaCrO2; 3) Сг(ОН);С1, 4) Na[Cr(OH)4].
7. Какова степень окисления атома хрома в дихрома-
те калия?
1)+2; 2)+3,3)+5, 4)+6.
8. НЕ протекает реакция между:
1) СиО и Н,О, 2) 1ССг,О7 и H,S (р-р);
3) Мп2О7 и КОН (р-р); 4) CrO/и КОН (р-р).
9. В растворе медного купороса выдерживали пластин-
ки из железа, серебра и цинка. Красный налет появится.
I) на железной и серебряной пластинках;
2) только на железной пластинке;
3) на железной и цинковой пластинках;
4) на цинковой и серебряной пластинках ?
10. Соль состава Me2ZnO2 образуется при взаимодействии:
1) Zn и Са(ОН)7(т) (7°); 2) ZnO и КОН(т) (/°);
3) Zn(OH), и КОН(т) (/°); 4) Zn(OH)2 и NaOH(p-p).
ТЕСТ 10
1. Сокращенному ионному уравнению Zn2+ + S2” =
= ZnSJ? отвечает взаимодействие:
1) Zn и S, 2) Zn(OH) , и H,S (р-р),
3) Zn(OH); и K2S (р-р), 4) ZnSO4 и Na/S (р-р)
2. Укажите формулу дихромата бария:
1) ВаСгО4, 2) ВаСг2О7; 3) Ва[Сг(ОН)4],; 4) Ва(СгО2)7.
--- 508 ----
3. Схема разложения перманганата калия при нагре-
вании — это:
1) КМпО4 —> К,МпО4 + МпО., + О,;
2) КМпО4 -> К,0 + МпО, + 6,;
3) КМпО4 -> К^О, + МпО, + О„
4) КМпО4 -> К,МпО4 + МпО + О,.
4. При взаимодействии NaOH(p-p, изб.) и СгО, обра-
зуется:
1) Na,CrO,, 2) Na,CrO3; 3) Na,CrO4; 4) NaCrO,.
5. Формула продукта реакции между NaOH(p-p) и
Мп,О7 — это:
1) NaMnO4; 2) Na[Mn(OH)J; 3) Na,MnO4; 4) Na4MnO4.
6. Какой объем газа (дм3, н.у.) выделится при взаимо-
действии золота массой! 1,97 г с избытком царской водки?
1) 0,224; 2) 0,336; 3) 0,448; 4) 0,672
7. В уравнении реакции, описывающем взаимодей-
ствие между FeS и О2 (изб), на окисление соли хими-
ческим количеством 0,1 моль расходуется кислород объе-
мом (дм3, н.у):
1) 3,92; 2) 3,72; 3) 1,96; 4) 5,88.
8. Основная соль образуется при взаимодействии ра-
створов, содержащих:
1) 15,85 г СгС13 и 16,8 г КОН,
2) 15,85 г СгО, и 11,2 г КОН;
3) 1,36 г ZnCl, и 2,24 г КОН;
4) 4,00 г Fe2(SO4)3 и 2,24 г КОН
9. Атомы элементов «7-семейства входят в состав:
1) хлорофилла и гемоглобина;
2) гемоглобина и витамина В|2,
3) хлорофилла и витамина Вг;
4) ферментов и латуни.
— 509 —
10. Укажите сумму коэффициентов в молекулярном
уравнении реакции между BeCI, массой 0,80 г (раствор)
и КОН массой 2,24 г (раствор):
1)6; 2) 7; 3)8; 4) 9.
ТЕМА 38
Обобщение знаний
о химических свойствах элементов
1. Укажите сумму молярных масс (г/моль) азотсодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
АёЯО3ЛА^^Б(оченьразб.)т^ В^^Г
2. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ Б и Г для цепочки химических превра-
щений, протекающих по схеме:
y'lqg + О, (изб ), i; д + КОН (р-р, изб.^ g + СаС1д (р-р, избД g + SO, (изб,)? р
3. Укажите сумму молярных масс (г/моль) фосфорсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
Са (РО ) tC + s'°" С А +0-(иэ6>-с g + кон (р-р- изб1. з +н,ро4(тб.)
-> г.3
4. Укажите сумму молярных масс (г/моль) азотсодер-
жащих веществ А, В и Г для цепочки химических пре-
вращений, протекающих по схеме:
NH С1 +кон(р-р-из6-)-/ A +HNOs Б -Л В +Са’ Г.
--- 510 ---
5. Укажите сумму молярных масс (г/моль) железосо-
держащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
магнетит (1 моль) +4мольС-^ д j-cUm6-)-g Б
—>влг
6. Укажите сумму молярных масс (г/моль) алюминий-
содержащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
Д] (NO ) ri А +к»°- г б + нс1 (р-р, изб.)^ в + кон (р-р, изб.} р
7. Укажите сумму молярных масс (г/моль) цинксодер-
жащих веществ Б и Г для цепочки химических превра-
щений, протекающих по схеме:
Zn(NO ) А +№он(р-р-из6Р б +нко><избХ в + кон (р-р, изб.^ г
8. Укажите сумму молярных масс (г/моль) углеродсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 моль СО +2мольМВ’^ д + °-5 моль Са. г б +н2°(изб1 в +°д(т6 )-с
9. Укажите сумму молярных масс (г/моль) кремний-
содержащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
pj SiQ С А + КОН (Р~Р. изб.^ g +СО, ; в + NaOH (р-р, избр р
10. Укажите сумму молярных масс (г/моль) хлорсодер-
жащих веществ Б и Г для цепочки химических превра-
щений, протекающих по схеме:
NaCl А + КОН (р-р), (° £ Г, кат В +AgNO,(p-p\ р
11. Укажите сумму молярных масс (г/моль) медьсодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
Cu(NO ) ri А + HaS0, Б + NaOH <РазВ -из(з) в + HNO1 <из61 с
--- 511
12. Укажите сумму молярных масс (г/моль) кальций-
содержащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
ра —А +Н;О- Б + СОг (из6/ В ’ Са^он^1 (иА) р
13. Укажите сумму молярных масс (г/моль) азотсодер-
жащих веществ Б, В и Г для цепочки химических пре-
вращений, протекающих по схеме:
Са + N, (изб.), Г Д + Н О (изб.^ g + О,, е, кат g + О,, р
14. Укажите сумму молярных масс (г/моль) кремний-
содержащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 моль Mg2Si 2Ж А Б + 2мольМ&£ в *4MOllbHF> Г.
15. Укажите сумму молярных масс (г/моль) хромсо-
держащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
Cr(NO ) А +кон(р~р-изб1 б +НС1<ИЗЧ В +Mg Г
16. Укажите сумму молярных масс (г/моль) цинксо-
держащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 моль ZnO + 2 молъ ко11"” ~ А + 2 моль на Б + NaOH (р~р’из6j
17. Укажите сумму молярных масс (г/моль) железосо-
держащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
магнетит+ С°-("3б)-£ 1 МОЛЬА 1 Нд5О.(раз6„Изб^) Б+ 1 мольКОЩр-р^
__jg + 1 моль NaOH (р р)^ р
18. Укажите сумму молярных масс (г/моль) барийсо-
держащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
0,21 моль Ва +^(избЧ A Б "0-42моль1Ь-ро^в ->
1- 0,21 моль Ва(ОН)2^ р
--- 512 ----
19. Укажите сумму молярных масс (г/моль) медьсо-
держащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 моль Cu,S А —NO'(ro6)> Б + 2мольК°н(р-р^ в ->
+ 2 моль HNO3 (разб.)^ р
20. Укажите сумму молярных масс (г/моль) кремний-
содержащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 моль SiO +2мольС< д + С1= (из6 ) f б +Hi (изб)' > В + 4 моль Н1- Г.
21. Укажите сумму молярных масс (г/моль) кремний-
содержащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 моль SiO +3мольС,с а о, (изб.), с g + к,о (изб.), f в +с°лр-р), р
22. Укажите сумму молярных масс (г/моль) алюминий-
содержащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 моль ALS, ±SO(»»4 А -А Б +к°н(рр.“3Ч в t6 моль НС1 (р-р)^
2 3
->г.
23. Укажите сумму молярных масс (г/моль) калийсо-
держащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
J{ 4 Н,О д + СО, (изб.) g С в + SiO, (изб.), Г р
24. Укажите сумму молярных масс (г/моль) хлорсодер-
жащих веществ Б, Г, Д для цепочки химических превра-
щений, протекающих по схеме:
КЛЦ fry Г>\ + Q, ** „ A +P, Г Г электролиз q + NaOH (p-p), 5 °C
\P Р/ _ H2O, - KC1 k водного раствора q ~
->г + д.
25. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ Б и Г для цепочки химических превра-
щений, протекающих по схеме:
H2SO4 (конц.) A Б В Ж Г.
17 Зак 1530
--- 513 ----
26. Укажите сумму молярных масс (г/моль) фосфорсо-
держащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
HNO3(конц., изб.)+0-5моль?-Л AБ +н,ро4(и-^
jg 4- 1 моль Са(ОН)2^ р
27. Укажите сумму молярных масс (г/моль) азотсодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме
Ду + царская водка, избыток, Г д + О2 (изб.)^ g + НаО, + О2 jg Г р
28. Укажите сумму молярных масс (г/моль) калийсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
+ 0,5 моль Р2О,^ р
29. Укажите сумму молярных масс (г/моль) натрийсо-
держащих веществ В, Г и Д для цепочки химических
превращений, протекающих по схеме:
1 моль Na7O2+С(Мтб) A Б +2мольВа(он)^ в —>
+ С1, (изб.), (° р + Д
30. Укажите сумму молярных масс (г/моль) азотсодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме.
HNO3(очень разб.) А ^он^изб.^ Б
31. Укажите сумму молярных масс (г/моль) железосо-
держащих веществ Б, В и Г для цепочки химических пре-
вращений, протекающих по схеме:
0,6 моль FeS +о»(избЧ А -|‘0-1м°иьСО<^ б В —>
+ HNO) (конц., изб.), Г р
— 514 —
32. Укажите сумму молярных масс (г/моль) углерод-
содержащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
2 моль KNO3 +..!_м°”ьСЛ А +2мольМ&£ Б -^4 В -Ж Г.
33. Укажите сумму молярных масс (г/моль) ртутьсо-
держащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
Hg +S>? А + °г (а Б k H;S°4 <конц )’ С В ВаС1, (р-р) р
34. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ Б и Г для цепочки химических превра-
щений, протекающих по схеме:
£ + HNO, (конц.), Г д + P,Oi? g । ИД g + NH, (избу p
35. Укажите сумму молярных масс (г/моль) хромсо-
держащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 МОЛЬ Cr2O3 д + НС1 (р-р, изб.)^ Б + КОН (р-р, изб.В
+ 2 моль HNO3 (р-р)^ г-1
36. Укажите сумму молярных масс (г/моль) железосо-
держащих веществ А, В и Г для цепочки химических пре-
вращений, протекающих по схеме:
магнетит (1 моль) +1мольСО-г; A ^мольн^о^у» б
+ 3 моль КОН (р-рД в + 3 моль NaOH (р-ру р
37. Укажите сумму молярных масс (г/моль) медьсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
малахит (1 моль) -4 А +на(р-р,изб^ Б + 2 моль кон в
-I- СН,СНО, Г р
38. Укажите сумму молярных масс (г/моль) ртутьсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
gg + HNO, (концу
д г б +s, г в + о, (изб.), g р
--- 515 ----
39. Укажите сумму молярных масс (г/моль) серебро-
содержащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
Ag + HNO, (конц-) д г g + S, г в + О, (изб ), I» р
<
40. Укажите сумму молярных масс (г/моль) железосо-
держащих веществ Б, В и Г для цепочки химических пре-
вращений, протекающих по схеме:
FeS (1 МОЛЬ) +HNO,(K0HU.,H36j А +1 моль КОН (р-р)^ g Д В
+ 1/6 моль Н2, Г р
41. Укажите сумму молярных масс (г/моль) алюминий-
содержащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
СаО (1 моль) +А5м-°^л|А A Б —>
+ 1 моль КОН (р-р^ в -F 0,25 моль H2SO4 j-
42. Укажите сумму молярных масс (г/моль) натрийсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
С (1 моль) + N^c°.(°.SM°Jb)-£ А + Н,(изб.), Г g + Н,О(изб.)^ в->
+ ВеО (0,5 моль) р
43. Укажите сумму молярных масс (г/моль) марганец-
содержащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
Мп О А +к°н(рг.из6^ g (т) г в ->
2 7 v 7 - О2, - К^МпО^
+нс1(р-р)? в
44. Укажите сумму молярных масс (г/моль) углерод-
содержащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
ДОЛОМИТ Л А + Нг(изб.), бактерии, g + НгО, Ni, 850 °С^, g ±2!^ f.
--- 516 ---
45. Укажите сумму молярных масс (г/моль) хлорсодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
Р-ГСЮ Д + КОН (р-р) Г +Р,г Г) электролиз р
> /А U > -О водного раствора *
46. Укажите сумму молярных масс (г/моль) фосфорсо-
держащих веществ В и Г для цепочки химических пре-
вращений, протекающих по схеме:
1 МОЛЬ Р +О^0'75моль)’Г Д + о. (изб.), г g + КОН (р-р, изб.в
+ HZSO4 (разб., изСх) р
47. Укажите сумму молярных масс (г/моль) хлорсодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
КС1 (т) +H;so.(KoHakr д tao Б (КОНЦ ) + в —>
+ Са(ОН), (р-р), 5 °C .
— СаС1, '
48. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ В и Г для цепочки химических превра-
щений, протекающих по схеме:
Ag + H;SO, (конц.), д (газ) + Ва(ОН), (р-р, изб.), g +А jg + H,SO, (разб.)
49. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ В и Г для цепочки химических превра-
щений, протекающих по схеме:
CuS (1 МОЛЬ) -+-°,<и?бК Д +НЫО,(кОНц.),^ g + ЕГ в + 2мольНДг
50. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
KNO, (2 МОЛЬ) + 3 моль С,+ 1 мольбе» Д 4-НСЦр-р.изб.)^ g ->
+ О,(изб.), в + 0.5 МОЛЬ Ва(ОН), (p-g) р
--- 517 ---
51. Укажите сумму молярных масс (г/моль) азотсодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
(NH ) СО +н2о(изб-1 А + кон ^р~р^ Б —Н;О> В + Ni°"5 °с? Г
52. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
r СООН + soc4 А + HN0, *ко"ц-)’ Б + Сц(°н>- (из6), jg
4- КОН (р-р, изб.^ р
53. Укажите сумму молярных масс (г/моль) медьсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
юга navuT г А +НС|(Р-Р), К + КОН (р-р, изб.) р +СН,ОН —СН;6н г
MdJldXni —» /Л-----*• D---------О -------------1 .
54. Укажите сумму молярных масс (г/моль) медьсо-
держащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме
малахит Л А +.а1-о1Ч Б 2»^ В +CH>CHP--+NaO^. Г.
55. Укажите сумму молярных масс (г/моль) фосфорсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
Са,(РО4),(1 моль)+2мольНЖ(конЧ А Б —>
+ H2SO4 (конц., изб.)^ в + I моль Ва(ОН), (р-р^ р
56. Укажите сумму молярных масс (г/моль) углерод-
содержащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме
Na2CO, (1 моль) +2мольС’г> А .^.(мол-Аг Б —>
+ 4 моль Н2, бактерии g + Н2О (1 моль), Ni, 850 °C р
--- 518 ---
57. Укажите сумму молярных масс (г/моль) сложных
кальцийсодержащих веществ А и Г для цепочки хими-
ческих превращений, протекающих по схеме:
СаО (I моль) + 0-5м°льА1< А + 2мм1-иа(р-р)> Б в —>
+ 0,5 моль CsCl, t° р
58. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
+ 1 моль H,S, г g + HNO, (конц., изб.), Г
D + 0,75 моль Са(ОН)2 |-
---> Ь------------1 -
59. Укажите сумму молярных масс (г/моль) натрийсо-
держащих веществ А и Г для цепочки химических пре-
вращений, протекающих по схеме:
Na,О (1 моль) А Б в —>
+ КОН (р-р, ичб.^ р
KNO3 (1 моль)+|)-5моль5-С А
60. Укажите сумму молярных масс (г/моль) азотсодер-
жащих веществ Б и Г для цепочки химических превра-
щений, протекающих по схеме:
KNO +s,<> А +нч5О<(Разб Б б + Рг°‘1 В + CsOH (р~р). 5 °с., р
61. Укажите сумму молярных масс (г/моль) галоген-
содержащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
кон+ НВг ^~р >
д + H2SO4 (конц.)^
Б±аы;в
+ NaOH (р-р, изб.)
62. Укажите сумму молярных масс (г/моль) медьсо-
держащих веществ А, Б и Г для цепочки химических пре-
вращений, протекающих по схеме
CuSO4 (1 МОЛЬ) + 2 моль Д +С1,(изб.) g 1 моль NaOH (p-j)
___В + 1 моль КОЦ р
--- 519 ---
63. Укажите сумму молярных масс (г/моль) углерод-
содержащих веществ В и Д для цепочки химических пре-
вращений, протекающих по схеме
| | £ Q + H,SO, (конц.), g (Д + Б) + °* ; В + С (И36 )' - Г _>
д.
64. Укажите сумму молярных масс (г/моль) бериллий-
содержащих веществ В и Д для цепочки химических пре-
вращений, протекающих по схеме.
ВеС12 (1 моль) +2 мыл, кон (р-р)» А д Б ^кон^г в —>
+ 2 моль НС1 (р-рЦ р + NaOH (р-р, изб А д
65. Укажите сумму молярных масс (г/моль) .хромсо-
держащих веществ А и Д для цепочки химических пре-
вращений, протекающих по схеме:
К2СГ2О7 (р-р в H2SO4) ^.нсцконц.)» д + ВаС1,(р.р,и3б.)> Б —>
+ КОН (р-р, изб.^ в + HNO, (разб., изб.)^ р г д
66. Укажите сумму молярных масс (г/моль) фосфорсо-
держащих веществ Б и Г для цепочки химических пре-
вращений, протекающих по схеме:
Са3(РО4)2 (0,5 моль) +e-+sio^ A Б —>
+ 1 моль Са(ОН)2^ в +Н3РО4* р
67. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме.
KNO3 (2 моль) +3MOJbC-.t-l-MomS-C> А +нс1<р-р-”16-1> Б —>
+ КОН (р-р, изб.^ в + Б (изб.)^ р
68. Укажите сумму молярных масс (г/моль) серосодер-
жащих веществ А и Г для цепочки химических превра-
щений, протекающих по схеме:
К S (р-р)+с1г (изб\ А + **2S°4 (ко||ц-* изб-)д- 5 + кон (р-р* изб-1 в_>
+ СаС12 р
--- 520 ---
69. Укажите молярную массу (г/моль) бромсодержа-
щего конечного продукта для цепочки химических пре-
вращений, протекающих по схеме:
| | S (р-р) +ВГ;1 +СЦ + и (Р~Р), + Н .SO, (концу
70. Укажите молярную массу (г/моль) иодсодержаще-
го конечного продукта для цепочки химических превра-
щений, протекающих по схеме:
Т£Т ' KMnO,/H,SOs + Al, кат. I NaOH (р р, изб )^ + С1,
--- 521
ОРГАНИЧЕСКАЯ ХИМИЯ
ТЕМА 39
Общие положения органической химии
ТЕСТ1
1. Природные органические вещества — это:
1) крахмал и полиэтилен; 2) целлюлоза и жиры;
3) белки и карбонат кальция; 4) сахароза и метан.
2. В состав углеводородов входят элементы:
1) углерод и кислород; 2) углерод и азот;
3) углерод и водород; 4) кислород и азот.
3. Для определения воды, образующейся при окисле-
нии органических веществ, обычно используют:
1) СаС12; 2) Р,О5; 3) CuSO4; 4) SiO,.
4. Укажите сумму коэффициентов в уравнении реак-
ции окисления этана оксидом меди (II):
1) 16; 2) 18; 3)20; 4) 22.
5. Какой вид связей наиболее характерен для органи-
ческих веществ?
1) ковалентные; 2) ионные;
3) водородные; 4) металлические.
6. При отрыве атома водорода от молекулы метана
образуется частица, электронная формула которой:
НН НН
1)Н:С:Н 2) Н : С : Н 3)Н:С- 4) Н : С Н
Н НН
--- 522 ----
7. Сколько веществ изображено с помощью формул:
СН, (СН3),СНСН(СН3)2
Н,С —СН —СН —СН,
I J СНз
СН, I
3 Н3С сн
Н3С. /СН3 \/\ ?
СН — СН СИ СН’
HjC^ ^сн3 сн3
1) одно; 2) два; 3) три; 4) четыре.
8. По структурам углеродного скелета углеводородов
укажите одинаковые вещества:
С С
9. Укажите формулу ациклического органического ве-
щества:
10. Отметьте схемы реакций присоединения:
1) снз - СН = сн2 + В г, -» СН3 - СНВг — СН2Вг;
2) лСН, = CHCI -> 4- СН2 — СН 4-;
t Cl In
3) снз - СН,ОН -» СН, = СН,+ Н,О;
4) /?СЛН1ЛОГ (С Н О j + 77Н О. '
' 6 12 6 х 6 10 э7/» 2
--- 523 ----
ТЕСТ 2
1. В число положений теории химического строения
органических веществ НЕ входит утверждение:
1) атомы и группы атомов в молекулах взаимно влия-
ют друг на друга;
2) атомы в молекулах связаны в определенной после-
довательности согласно их валентности;
3) органические вещества НЕ могут быть получены
из неорганических;
4) одной и той же молекулярной формулой может опи-
сываться состав различных веществ.
2. В органических веществах валентность атома угле-
рода, как правило, равна:
1) IV; 2) III; 3) II; 4) I.
3. Для определения углекислого газа, образующегося
при окислении органических веществ, используют:
l)CuSO4; 2) СаО;
3) Са(ОН)2; 4) CaSO4 • 0,5Н2О.
4. При отрыве атома водорода от молекулы углеводо-
рода образуются:
1) радикал и катион;
2) катион и анион;
3) два радикала;
4) две электронейтральные частицы.
5. Сколько углеводородов изображено с помощью сле-
дующих структур углеродного скелета?
С\ /С
С —С
хс
1) один; 2) два; 3) три; 4) четыре.
--- 524 ---
6. В карбоциклических соединениях циклы построе-
ны из атомов:
1) углерода;
2) углерода и азота;
3) углерода и кислорода;
4) углерода, азота и кислорода.
7. Среди названных, укажите число свойств, харак-
терных для типичных органических веществ: горючи,
тугоплавки, при нагревании разлагаются, химические
связи ионного типа:
1) одно; 2) два; 3) три; 4) четыре.
8. Укажите формулу гомолога вещества состава С6Н6:
1) ОД2; 2) ОД4; 3) ОД6; 4) ОД.
9. Выберите формулы изомеров:
1)СН, — СН, — С — ОН; 2)СН,—С —О —СН3;
II J II
О о
3) Н — С — О — С,Н ; 4) СН (СНДОН.
II
° ?
10. При указанном разрыве ковалентной связи Н3С 2 : С1
образуются: '
1) два свободных радикала; 2) катион и анион;
3) катион и радикал; 4) анион и радикал.
ТЕСТЗ
1. Изомеры отличаются между собой:
1) строением молекул;
2) физическими свойствами;
3) молярными массами;
4) химическими свойствами.
--- 525 ----
2. Типичные органические вещества легкоплавки, так
как имеют кристаллическую решетку:
1) молекулярную; 2) атомную;
3) ионную; 4) металлическую.
3. Укажите формулу гомолога вещества следующего
строения СН3— СН(СН3) — СН, — СН3:
1) СН3 — СНВг — СН, — СН3;
2) СН, — СН, — CH, — СН, — СН3;
3)СН3 —С(СН3Х-СН3;
4) СН3 — (СН2)2 — СН3.
4. Число электронов в радикале, полученном при от-
рыве атома водорода от молекулы пропана, равно:
1)26; 2) 25; 3)44; 4)43.
5. Укажите число электронов в группировке атомов,
называемой гомологической разностью'.
1) шесть; 2) двенадцать; 3) восемь; 4) четырнадцать.
6. Укажите заряд этильного радикала • С2Н5:
1)0; 2)+1; 3)-1; 4)+2.
7. Для изомеров одинаковы:
1) молярные массы;
2) физические свойства;
3) строение молекул;
4) качественный и количественный состав.
8. Выберите формулу гетероциклического соединения:
9. Укажите схемы реакций отщепления:
1) СН3 — СН2 — СН2ОН -> СН3 — СН = СН2 + Н2О;
--- 526 ---
2) С,Н6 + Cl, -> С,Н5С1 + НС1;
3) С'Н5 — CHBr — СН3 -> С6Н. CH - CH, + НВг;
4) и[ВДЧ-(СН,),-СООН] [HN—(СН,)5—С—], +
+ 7?Н,О.
10. Сколько веществ изображено с помощью формул:
С1 С1 Н Н 1 1 1
Н —с —F 1 1 1 Н —с —Н F— С — С1 н —С —F? 1 1 1
Н 1) одно; 3) три; 1 1 F Н С1 2) два; 4) четыре. ТЕСТ 4
1. К одному классу функциональных производных
углеводородов относятся:
о СТ ^0 -nh2 2) kJ н
3) Н—С' 4) HZN—СН2—С ''Н
2. Для гомологов справедливы утверждения:
1) различаются молярными массами;
2) имеют одинаковую общую формулу;
3) могут различаться химическими свойствами;
4) всегда имеют одинаковую массовую долю атомов
углерода.
3. Гомологами по отношению друг к другу являются:
1) СН3 - ОН и СН3 - О - СН3;
--- 527 ---
2) CH, — О — СН, и СН, - СН2 - ОН;
3) Н — С — ОН и СН, -С - ОН;
II II
о о
4) СН, — О — СН, и СН, — О — CJL.
4. Отметьте электронную формулу частицы, которая
образовалась при указанном разрыве связи в молекуле
):С2Н5 : Н Н Н н
1)Н:С:С 2) Н : С : с
ii н Н ii
н н Н н
3) Н : С : С 4) Н : С с
н ii Н н
5. Изомерами по отношению друг к другу являются
углеводороды со строением углеродной цепи:
С С
1)^ и
2)С —С —С —С
С
С —С —С
I
С
и с—С—С
I I
С с
3)С —С —С —С И
I
с
с
I
с —с —с
I
с
--- 528 ----
с\ /с
4) С — С и С — С — С
cz Хс ХС
6. Какая группа атомов НЕ относится к функциональ-
ной группе:
1) — ОН; 2) — С — Н; 3) - СН,; 4) - С1.
II
О
7. Укажите правильную последовательность степеней
окисления атомов углерода начиная с левого крайнего в
соединении НО — С — СН, — С — СН — С — Н:
II II I II
О О С1 О
1)+3,+2,+2,-1,0; 2)+3,-2,+2, 0,-1;
3) +3, -2, +2, +1, 0; 4) +3, -2, +2, 0, +1.
8. Число атомов водорода в этане С,Н6 объемом 2,00 дм3
(н.у.) равно:
1) 3,22 1023; 2) 3,22 1024; 3) 5,37 • 1022; 4) 5,37 • 1023.
9. Укажите справедливые утверждения. В углеводо-
роде со структурной формулой
СН,
I
Н2С —СН —СН —С —СН,:
1111
н2с —сн2 сн, сн,
1) число первичных атомов С в два раза больше чис-
ла третичных;
2) число третичных атомов С в два раза больше числа
четвертичных;
3) число вторичных атомов С равно числу третичных;
4) число первичных атомов С равно сумме числа вто-
ричных и четвертичных.
--- 529 ---
10. Укажите формулу углеводорода с массовой долей
атомов углерода 80%:
1) С,Н ; 2) С.Н • 3) С,Н ’ 4) СДНГ
7 3 6’ 7 (з 6’ 7 2 6’ 7 46
ТЕСТ 5
1. При взаимодействии с Na в первую очередь будет
замещаться атом Н, номер которого в молекуле
н2 н3
I I
Н —О —С —С —С —С —Н4 :
II I I II
ОКНО
1)4; 2)3; 3)2; 4) 1.
2. Укажите формулы одинаковых веществ:
СН3
нзсх | 3
1) СНСН(СН3)2 2) Н3С — СН — С(СН3)3
3)(СН3)3ССН(СН3)2 4)уЛ
3. В состав молекулы, скелет которой имеет строение
N —С
I I
С — С , дополнительно входят только атомы водорода.
Укажите их число:
1)8; 2) 7; 3)6; 4) 5.
4. Два различных способа написания структуры од-
ного и того же вещества приведены в примерах:
1) Н3С — СН = СН — СН3, Н2С = СН—СН2 — СН3;
--- 530 ---
3) Нзс — СН = СН„ СН, = СН — СН3;
5. Укажите число атомов водорода в соединении,
строение которого
1)21; 2) 20; 3) 19; 4) 18.
6. Все атомы водорода одинаковы по своим химичес-
ким свойствам в составе молекул, формулы которых:
1)С(СН3)4 2)СН2 —СН2
I I
ОН он
Н2С —СН2
3) I I
Н2С — сн2
Н3С^
4) СН —СН3
НзС^
7. Атом углерода в нулевой степени окисления вхо-
дит в состав молекул, строение которых:
Н
I
1)Н —О —С —С —С —О
II I I
О Вг Н
^о
3)Н3С —
"NH2
2)н —С = 0
I
н
4)С(СН3)Г
--- 531
8. Укажите формулы гетероциклических соединений:
9. Выберите формулы ароматических веществ:
10. Укажите число третичных атомов С в молекуле уг-
леводорода со следующим строением углеродного скелета:
ТЕСТ 6
1. Структурными изомерами по отношению друг к
дру1у являются вещества в парах:
--- 532 ----
4)
и
2. Строением углеродной цепи отличаются изомеры
в парах:
3. Изомерия по отношению друг к другу соединений
и | обусловлена изомерией:
ОН ОН
1) углеродного скелета;
2) межклассовой;
3) положения функциональной группы;
4) пространственной.
4. Энантиомеры возможны для соединений:
1)НС —СН —СН; 2) НОН,С — СНОН — С — Н;
I “ II
сн3 о
3) Н С—СН—СН — CHO; 4) / \— СН(ОН)СН3.
I I
СН, он
--- 533 ----
5. Геометрическими (цис-, транс-) изомерами по от-
ношению друг к другу являются:
6. Укажите формулы соединений, для которых воз-
можно существование энантиомеров:
7. Укажите формулы энантиомеров:
СНО сно
ХС.
'’h^TVoh 11 ноне*” | н
он он
--- 534 ---
8. Одним и тем же веществом являются:
--- 535 ----
10. Изомерами по отношению друг к другу являются:
ТЕМА 40
Алканы
ТЕСТ1
1. Назовите по систематической номенклатуре алкан
строения СН, — СН — СН — СН3:
I I
СН, с2н5
1) 1-метил-2-этилбутан;
— 536 —
2) 2-метил-З-этилбутан;
3) 2-этил-З-метилбутан;
4) 2,3-диметилпентан.
2. Относительная молекулярная масса алкана равна
142. Укажите число атомов углерода в молекуле алкана:
1)8; 2) 6; 3) 10; 4) 12.
3. Число изомеров для алкана с относительной моле-
кулярной массой, равной 86, составляет:
1)5; 2) 4; 3) 2; 4)3.
4. Укажите НЕПРАВИЛЬНЫЕ названия алканов:
1) 2-метилпентан; 2) 2-этилбутан;
3) 1-метилпентан; 4) диметилбутан.
5. Наибольшую температуру кипения имеет:
1) бутан; 2) пропан; 3) 2-метилбутан; 4) пентан.
6. Укажите формулы гомологов метана:
1) ОД; 2)С4Н8;3)С4Н,0; 4) ОД.
7. Изомерами являются вещества, названия которых:
1) 2,2,3,3-тетраметилбутан; 2) З-метил-З-этилпентан;
3) 2-метилоктан; 4) 2,2-диметилпентан.
8. Укажите формулу изопропильной группы:
1) СН, —; 2) СН, — СН — СН,;
I
3)СН3 —СН, —; 4)СН3 —СН, —сн2—.
9. Для алканов НЕВОЗМОЖНЫ реакции:
1) замещения; 2) полимеризации;
3) присоединения; 4) изомеризации.
10. Число изомерных соединений состава С4НдС1 рав-
но (с учетом пространственной изомерии):
1)5; 2) 4; 3) 3; 4) 2.
--- 537 ----
ТЕСТ 2
1. Укажите название алкана строения
СН3 — СН — СН, — СН — СН3:
I ‘ I
сн3 с2н.
1) 2-метил-4-этилпентан; 2) 2-этил-4-метилпентан;
3) 2,4-диметилгексан; 4) 3,5-диметилгексан.
2. Самую длинную цепь атомов углерода имеет алкан:
1) 2-метилпентан; 2) 2,2-диметилпентан;
3) 3,3-ДИметилпентан; 4) гексан.
3. Сколько изомеров отвечает формуле С3Н6Вг2?
1) два; 2) три; 3) четыре; 4) пять.
4. Укажите формулу 2,3,3-триметилоктана:
1) СН, — (СН2)4 — СН — СН — СН,
I I
СН, СН,
СН, СН,
I I
2) СН, —СН2 —СН2 —СН2 —С —С —СН,
СН, С2Н,
СН, 325
3) СН, — С — (СН2)4 — СН,
I
С2Н5
СН,
I
4) СН, — С — (СН2)4 — СН,
I
СН, — СН
I
СН,
--- 53S ----
5. Число изомерных монохлорпроизводных пропана
равно:
1) два; 2) три; 3) четыре; 4) пять.
6. Число атомов водорода в молекуле алкана с отно-
сительной молекулярной массой 100 составляет:
1) 12; 2) 14; 3) 16; 4) 18.
7. Массовая доля атомов углерода в алканах с возрас-
танием их молярной массы:
1) не изменяется; 2) уменьшается;
3) возрастает; 4) изменяется немонотонно.
8. В отличие от пропана бутан вступает в реакцию:
1) горения в кислороде;
2) хлорирования при освещении;
3) разложения на простые вещества при сильном на-
гревании;
4) изомеризации.
9. Из числа названных ниже веществ гомологами 2-
метилпентана являются:
1) пропан; 2) 2,2-диметилпропан; 3) бутан; 4) гексан.
10. Синтез-газ - это смесь:
1) метана и угарного газа;
2) угарного газа и водорода;
3) метана и воды;
4) углекислого газа и метана.
ТЕСТЗ
1. Укажите формулы углеводородов, которые являют-
ся изомерами 2,3-диметилбутана:
1) СН, — СН — СН — СН,;
z 3 1 3
I
сн3
--- 539 ----
2) СН3 — СН, — СН, — СН,;
3) СН,— СН — СН, — СН,;’
сн,
I
сн3
4) СН,
СН,— С — сн, — сн,
сн3
2. Укажите число асимметричных (связанных с четырь-
мя различными заместителями) атомов С в молекуле
H2N — СН — СН — СООН:
I
сн3
1)4; 2)3; 3)2; 4)1.
3. По отношению друг к другу 2-метилпропан и 2,2-
диметилпропан являются:
1) изомерами;
2) гомологами;
3) аллотропными модификациями;
4) изомерами и гомологами.
4. Углеводородным группам (радикалам) могут соот-
ветствовать формулы:
1)СН4; 2)С5Нп;3)С4Н10; 4)С2Н5.
5. Укажите названия веществ, которые могут вступать
в реакцию Вюрца:
1) метан; 2) хлорэтан;
3) метилциклопропан; 4) бромциклогексан.
--- 540 ---
6. Укажите название вещества, которое эффективнее
других из перечисленных реагирует с бромом:
1) пропан; 2) бутан;
3)2-бромбутан; 4) пентан.
7. Выберите название вещества, которое получается
при нагревании 2-бромбутана с избытком натрия:
1) 2,3-диметилгексан; 2) 2,4-диэтилбутан;
3) 3,4-диметилгексан; 4) З-метил-4-этилпентан.
8. Сколько различных органических продуктов полу-
чится при взаимодействии смеси хлорметана и хлорэ-
тана с избытком натрия?
1) 1; 2) 2; 3)3; 4) 4.
9. При хлорировании метана можно получить:
1) хлороформ; 2) дихлорметан; 3) тефлон; 4) этан
10. В лаборатории для получения метана использу-
ются:
1) пропионат натрия; 2) ацетат натрия;
3) природный газ; 4) гидроксид натрия.
ТЕСТ 4
1. Применение метана в качестве источника энергии
отражает схема реакции:
1)СН4—»С + Н2;
2) СН4 + С12 -> СН3С1 + НС1;
3) СН4 + О,-> СО, + Н2О;
4) СН4 + О' -» СН‘ОН.
2. В ряду пентан, гексан, гептан температуры кипе-
ния алканов соответственно равны (°C) +36, + 69, +98.
Укажите температуру кипения октана (°C):
1)85; 2) 115; 3) 126; 4) 138.
— 541
3. В результате какой реакции разрывается связь С га-
логен и образуется связь С — С?
1)хлорирования;
2) дегидрирования;
3) Вюрца;
4)горения в кислороде.
4. В результате реакции Вюрца с участием гало, л;ая
канов цепь углеродных атомов
1) укорачивается;
2) удлиняется;
3) остается без изменения;
4) может как укорачиваться, так и удлиняться.
5. Гомологами по отношению друг к другу являются:
1) пропан; 2) 1-хлорпропан;
3) хлорциклопентан; 4) 2-хлорбутан.
6. Укажите названия веществ, которые между собой
являются изомерами:
1) 2-хлорпропан; 2) 2-хлорбутан;
3) 1-хлорбутан; 4) 2,2-дихлорпропан.
7. Температура кипения алканов последовательно воз-
растает в ряду:
1) этан — пентан — 2-метилбутан;
2) этан — 2-метилбутан — пентан;
3) пентан — 2-метилбутан — этан;
4) 2-метилбутан — этан — пентан.
8. С гексаном взаимодействуют реагенты:
1) водный раствор перманганата калия;
2) бромная вода;
3) кислород (/°);
4) хлор при освещении.
— 542 —
9. Укажите название хлорпроизводного алкана
СН3 — СН, — СН — СС1,:
сн3
1) 2-трихлорметилбутан;
2) 2-метил-1-трихлорбутан;
3) 1-трихлор-2-метилбутан;
4) 2-метил-1,1,1 -трихлорбутан.
10. Число третичных атомов углерода в молекуле 4-
изопропил-2,3,3 -триметилгептана равно:
1) 1; 2) 2; 3)3; 4) 4.
ТЕСТ 5
1. Существование энантиомеров возможно для соеди-
нений строения:
Н у СН3
1) H,N — СН, — СООН ; 2) ^С —С^ ;
/Н Н3С СН2 С1
3) f - f \ ; 4) (CH3),CHCH(F)CHO.
с—с Вг
2. Цепь углеродных атомов в молекуле алкана укора-
чивается в результате реакции:
1) дегидрирования; 2) бромирования;
3) Вюрца; 4) крекинга.
3. Укажите число изомерных хлорпроизводных этана
состава С,Н,С13:
1) 1;2)2;3)3;4)4.
4. Простейший алкан, содержащий неэквивалентные
(не одинаковые) в химическом отношении атомы водо-
рода— это:
1) метан; 2) этан; 3) пропан; 4) бутан.
— 543 —
5. Укажите название алкана, в молекуле которого со-
держится 7 связей о-типа:
1) пентан; 2) пропан; 3) бутан; 4) этан.
6. Энантиомеры возможны для:
1) 1,1,2,2-тетрабромпропана;
2) 1,1,2,3-тетрабромпропана;
3) 1,1,1,2-тетрабромпропана;
4) 1,1,3,3-тетрабромпропана.
7. В молекуле алкана содержится 8 атомов водорода.
Молярная масса алкана (г/моль) равна:
1)42; 2)44; 3) 40; 4)38.
8. Укажите формулу галогенпроизводного этана, НЕ
имеющего изомеров:
1) С2Н4С12; 2) С,Н3С13; 3) С Н2С14; 4) С2НС15.
9. Число различных по строению монохлорпроиз-
водных, которые можно получить при хлорировании
2,2-диметилпропана, равно:
1)1; 2) 2; 3)3; 4) 4.
10. В реакцию Вюрца с образованием в качестве орга-
нического вещества только бутана вступает:
1) хлорметан; 2) смесь хлорметана и 1 -хлорпропана;
3) хлорэтан; 4) смесь хлорметана и 2-хлорпропана.
ТЕСТ 6
1. Укажите формулу алкана с относительной плотно-
стью паров по водороду, равной 29:
1)С3Н8; 2)С4Н,0; 3) С2Н6; 4) С7Н16.
2. Укажите число изомеров соединения состава С3Н5С13:
1)6; 2) 5; 3)4; 4)3.
3. Этан в чистом виде можно получить полным гид-
рированием смеси:
1) пропана и этилена; 2)этилена и ацетилена;
— 544 —
3) пропана и ацетилена; 4) пропана и пропена.
4. Охарактеризуйте вещество строения
СН3 —СН —СН3:
С1
I) углеводород;
2) называется хлорпропан;
3) вступает в реакцию Вюрца с образованием 2,3-ди-
метилбутана;
4) содержит 2 первичных атома углерода.
5. Назовите алкан, в молекуле которого имеются только
первичные и третичные атомы углерода, причем пер-
вичных атомов в два раза больше, чем третичных:
1) 2-метилбутан; 2) 2,3-диметилбутан;
3) 2,3-диметилпентан; 4) 2-метилпентан.
6. Два и не более асимметричных атома углерода со-
держится в молекуле:
н3сх zc6H5
1) С — ;
Н3С сн2 Вг
н н он н
1111
2) Н — С— С — С — С — СНО;
1111
ОН он н он
Вт F
I I
3)Н3С —С— С —СООН;
I I
н он
18 Зак 1530
--- 545 ----
— Br.
7. Укажите схемы НЕВОЗМОЖНЫХ реакций с уча-
стием алканов:
1) С,Н6 + Вг, -> С,Н6Вг,;
2) СН4 + НС1 —> СН3С1 + Н,;
3) СН, — СН, — СН, — СН3 А1С1„ нагревание^
->СН, — СН — снз;
сн3
4) СН4 Л С + 2Н2.
8. Всем алканам присущи свойства:
1) при температуре 20 °C являются жидкостями;
2) вступают в реакции замещения;
3) изомеризуются в присутствии катализатора и при
нагревании;
4) сгорают в кислороде.
9. Основную часть природного газа составляет:
1) бутан; 2) пропан;
3) этан; 4) метан.
10. Охарактеризуйте свойства метана:
1) газ (н.у.) без цвета;
2) имеет резкий запах;
3) взрывоопасен в смеси с воздухом в объемном от-
ношении 1 : 2 соответственно;
4) легче воздуха.
ТЕСТ 7
1. Алканы, строение углеродного скелета которых при-
ведено ниже, являются:
--- 546 ---
С с
с т
1) структурными изомерами пентана;
2) молекулами пентана с различной ориентацией уг-
леродной цепи в пространстве;
3) гомологами пентана;
4) различными энтаптиомерами пентана.
2. Укажите число изомеров состава С3Н4Вг4:
1) 10; 2)9; 3) 8; 4) 7.
3. Относительная плотность паров хлороформа по
воздуху равна:
1)5,310; 2) 4,121; 3)2,931; 4) 1,741.
4. Метан можно получить при взаимодействии:
1) С и Н,;
2)А14С3иН,О;
3) СаС2 и Н,О;
4) CH3CH2COONa и NaOH.
5. Изомерами по отношению друг к другу являются:
1) 1,1-дихлорбутани 1,2-дихлорбутан;
2) хлороформ и дихлорметан;
3) 2,2-диметилпентан и гептан;
4) 2-бромпропан и бромциклопропан.
6. Скорость реакций замещения с участием алканов и
галогенов последовательно возрастает в ряду:
1)1, —Вг, —С1,; 2)Вг, —С1, —I,;
3) Вг, - ij — C1J; 4) C1J - BrJ — Г2.
7. Ближайшие гомологи гептана - это:
1) пентан; 2) гексан; 3) декан; 4) октан.
--- 547 ---
8. Только два (и не более) разных моногалогенпроиз-
водных (без учета стереоизомерии) могут образоваться
при хлорировании:
1) пентана; 2) 2-метилпропана;
3) бутана; 4) 2,2-диметилпропана.
9. Бутан можно получить:
1) сплавлением CH3CH9CH2CH,COONa с NaOH;
2) действием воды на 1-бутилмагнийбромид;
3) крекингом октана;
4) из смеси 2-хлорпропана и 1-хлорпропана в усло-
виях реакции Вюрца.
10. При полном сжигании алкана в избытке кислорода
получили углекислый газ и воду, объемы которых (120 °C)
относятся соответственно как 4:5. Молярная масса (г/моль)
алкана равна:
1)58; 2) 44; 3) 30; 4) 72.
ТЕСТ 8
1. Укажите название по систематической номенкла-
туре вещества строения
1) З-этил-2-бромгексан; 2) 2-бром-З-этилгексан;
3) 5-бром-4-этилгексан; 4) 4-этил-5-бромгексан.
2. В схеме превращений СН.С1 С,Н6 Д С,Н5С1 ре-
агентами А и Б являются:
l)HCl;2)Na;3)NaCl;4)Cl2.
--- 548 ----
3. Отметьте формулу газообразного алкана, при сжи-
гании 1,4 дм3 (н.у.) которого в избытке кислорода полу-
чили воду массой 4,5 г:
1) СН4; 2) С2Н6; 3) С3Н8; 4) С4Н10.
4. При полном взаимодействии 1 моль этана и 2 моль
хлора образуются:
1) 1 моль C,HSC1 и 1 моль НО;
2) 1 моль С,Н4С1, и 2 моль НО;
3) 2 моль С?Н4О2 и 1 моль НО;
4) 2 моль С,Н4ОЭ и 2 моль НО.
5. При окислении метана в различных условиях мож-
но получить:
1) НСНО; 2) СН3ОН; 3) НСООН; 4) СН3СООН.
6. В результате изомеризации какого алкана можно
получить 2-метилбутан?
1) бутан; 2) пентан; 3) гексан; 4) 2,2-диметилбутан.
7. Укажите формулу алкана с самой длинной цепью
углеродных атомов:
1)(С2Н5)2С(СН3)2; 2)\^^/;
3) | |; 4) СН3(СН2)3СН — (СН2)2СН(СН3)2.
> ।
I СН2СН(СН3)2
8. Для того чтобы в качестве органического продукта
получить только 2,3-диметилбутан, в реакцию Вюрца сле-
дует ввести:
1) 1-хлорпропан;
2) смесь хлорметана и 2-метил-З-хлорбутана;
3) смесь хлорметана и 2-метил-2-хлорбутана;
4) 2-хлорпропан.
— 549 —
9. Для получения в качестве одного из продуктов
2,2-диметилпропана в реакцию Вюрца следует ввести:
1) CHJ и (СНДС(Т);
2) (СНДСВг и СН3СН,СН,Вг;
3) С„Н,Вг и (СНДСВг;
4) C’HsBr и СН,Вг
10. Назовите по систематической номенклатуре ал-
кан, который образуется при сплавлении NaOH и (СНДС
— СН? — НС(СН,) — COONa:
1) 2-метилпентан; 2) 2,2-диметилпентан;
3) 4,4-диметилпентан; 4) 2,2,4-триметилпентан.
ТЕСТ 9
1. Назовите по систематической номенклатуре соеди-
нение, формула которого q
1) 5-бром-З-метил-З-хлоргептан;
2) 3-бром-5-метил-4-хлоргексан;
3) 3-бром-5-метил-4-хлоргептан;
4) 3-бром-4-хлор-5-этилгексан.
2. Укажите последовательно число первичных, вто-
ричных, третичных и четвертичных атомов С в соеди-
нении, молекула которого имеет строение:
1) 8, 3, 4, 1; 2) 8, 3, 3, 2; 3) 7, 4, 3, 2; 4) 8, 4, 2, 2.
--- 550 ---
3. Наибольшее число монохлорпроизводных образу-
ется при хлорировании:
1) 2,3-диметилбутана; 2) 2-метилбутана;
3) 2,2-диметилпропана; 4) 2,4-Диметилпентана.
4. Существование энантиомеров возможно для:
1) 2-хлорбутана; 2) 1-хлорбутана;
3) 2-метил-1-хлорпропана; 4) 2-метил-2-хлорпропана.
5. Укажите число структурных изомеров состава С4Н8С12:
1) 7; 2) 9; 3) 5; 4) 4.
6. НЕ имеют структурных изомеров:
1) 1,2-дихлорэтан; 2) хлорэтан;
3) 1,1-дихлорпропан; 4) пентахлорэтан.
7. Назовите по систематической номенклатуре алкан
строения: СН3 СН3
I I
Н3С —С —СН —СН — сн2
III
СН3 СН2 —СН3 НС —сн3
Н3С —сн2
1) 2,2,4,6-тетраметил-З-этилоктан;
2 ) 3,5,7,7-тетрамети л-6-эт и л о ктан;
3) 2,2,4-триметил-3,6-диэтилгептан;
4) 3,6-диэтил-2,2,4-триметилгептан.
8. Укажите число изомеров состава CnH4(F)(Cl):
1)2; 2)3; 3)4; 4)5.
9. Метан от примесей углекислого газа можно очис-
тить с помощью:
1) известковой воды; 2) оксида фосфора (V);
3) хлорида кальция; 4) твердой щелочи.
--- 551
10. Осуществите превращения согласно схемам реакций:
СН, - СН, - СН, - СН, - Вг А Ж Б В.
3 2 2 2 эфир
Укажите сумму молярных масс (г/моль) органических
веществ А и В:
1) 195; 2) 219; 3) 139; 4) 243.
ТЕСТЮ
1. Сколько изомерных алкильных групп содержат в
составе 33 электрона?
1)2; 2)3; 3)4; 4)5.
2. Число электронов N и число атомов углерода п в
алкильной группе связывает формула:
Г) N= + 2; 2) N= 8п + 1; 3) N = 14и + 2; 4) N= 1+ 1.
3. При хлорировании смеси двух изомерных алканов
состава С5Нр получено семь различных монохлорпро-
изводных (без учета стереоизомерии). Хлорированию
подвергалась смесь:
1) 2,2-диметилиропана и пентана;
2) 2-метилбутана и пентана;
3) 2-метилбутана и 2,2-диметилпентана;
4) 2-метилбутана и 2,2-диметилпропана.
4. Молекула алкана содержит х первичных атомов С и
у — третичных (вторичные и четвертичные атомы С от-
сутствуют). Укажите число /V атомов Н в молекуле алкана:
l)7V = x + у; 2)N=2x + у; 3)А = х + Зу; 4)/V=3x+y.
5. Назовите по систематической номенклатуре вещество,
молекулы которого имеют строение (СН3СН,),СНСН(СН3),:
1) диэтил изопропил метан:
2) 4-метил-З-этилпентан;
3) 3-изопропилпентан;
4) 2-метил-З-этилпентан.
--- 552 ---
6. Из пяти структурных изомеров состава С,Н ВгТ (по-
стройте их формулы) в виде энантиомеров существуют:
1) один, 2) два; 3) три; 4) четыре.
7. При нагревании соли (CH3)3CCH(CH3)COONa с
избытком NaOH образуется
1) бутан; 2) пентан, 3) 2,2-диметилбутан; 4) гексан.
8. В качестве основных продуктов при крекинге алкана
получены бутан и смесь бутенов. Крекингу подвергался:
1) октан; 2) 2-метилгексан, 3) гептан, 4) декан.
9. Чтобы в реакции Вюрца в качестве органического
продукта получить только 3,4-диметилгексан, необходи-
мо использовать:
1) 1-хлорбутан, 2) 2-метил-1-хлорпропан;
3) 2-хлорбутан; 4) 2-метил-2-хлорпропан.
10. При полном сгорании алкана объемы полученных
воды и углекислого газа (110 °C, давление нормальное)
относятся к объему алкана и затраченного кислорода
соответственно как 7 : 6 Укажите название алкана.
1) метан; 2) этан; 3) пропан; 4) бутан.
ТЕСТ 11
1. Укажите формулу 2,3,7-триметил-6-этнлоктана:
2. Назовите по систематической номенклатуре алкан
строения CH3CH(CnHs)CH,CH(CH3)n:
1) 2,4-диметилгексан,
— 553 —
2) 3,5-диметилгексан;
3) 2-метил-4-этилпентан;
4) 2-этил-4-метилпентан.
3. Укажите правильно составленное название вещества:
1) 2-бром-3,4-диэтилпентан,
2) 2,3-диэтил-4-бромпентан;
3) 2-бром-4-метил-3-этилгексан,
4) 1-метил-2,3-диэтил-3-бромбутан.
4. Изомером вещества состава CSH( (Вг НЕ является:
1) 1-бром-2-этилбутан,
2) 1-бром-2,2-диметилпропан;
3) 2-бромпентан,
4) 2-бром-3-метилбутан.
5. Осуществите превращения согласно схемам реакций:
СН3
I
Н с — с — СН3 А 4Ж Б
J । -* эфир
СН2Вг
g + Na (изб.)^ р
Укажите число первичных атомов углерода в молеку-
ле органического вещества Г:
1)2; 2) 4; 3)6; 4)8
6. При бромировании одного из изомеров состава CsHp
получено только одно монобромпроизводное алкана. На-
зовите алкан по систематической номенклатуре:
1) тетраметилметан; 2) 2,2-диметилпропан,
3) 2-метилбутан; 4) ментан.
7. Подвергли хлорированию 2-метилбутан, а смесь мо-
нохлорпроизводных обработали избытком натрия. При
этом НЕ получили:
1) 2,3,4,5-тетраметилгексан;
2) 3,3,4,4-тетраметилгексан;
--- 554 ---
3) 3,6-диметилоктан;
4) 4,5-диметилоктан.
8. Диполями являются молекулы, формулы которых:
1) СНС13; 2) СН3 — СНС1,; 3) СН2С12; 4) СС14.
9. Укажите мольную долю 1-хлорпропана в смеси
монохлорпроизводных, полученных при хлорировании
пропана (вероятность замещения атомов Н у первично-
го и вторичного атомов С считайте одинаковой):
1)25; 2) 50; 3)75; 4) 95.
10. В реакции каталитической изомеризации алкана
может образоваться единственный продукт. Укажите
название этого продукта:
1) пропан; 2) 2-метилпропан;
3) 2,2-диметилпропан; 4) 2,2,4-триметилпентан.
ТЕМА 41
Циклоалканы
ТЕСТ1
1. Как называется по систематической номенклатуре
циклоалкан строения
СН3
сн3
1) 1,4-диметил-5-этилциклогексан;
2) 1,4-диметил-З-этилциклогексан;
--- 555 ----
3) 1,4-диметил-2-этилциклогексан,
4) пара-диметилэтилциклогексан.
2. При нагревании хлорциклопентана с натрием ко-
нечным продуктом будет вещество строения:
3. Укажите название соединения, которое нужно вве-
сти в реакцию с цинком, чтобы получить 1,2-диметил-
циклопропан:
1) 1,3-дибромпентан, 2) 2,4-дибромпентан;
3) 1,4-дибромпентан, 4) 1,5-дибромпентан.
4. Изомерами циклогексана являются:
1) гексан; 2) 2-метилпентан,
3) метилциклопентан; 4) 1,2,3-триметилциклопропан.
5. Учитывая возможность хлорирования метилцик-
логексана в метильную группу и кольцо, укажите число
возможных изомерных монохлорпроизводных метил-
циклогексана (без учета стереоизомерии):
1)6, 2)5, 3)4; 4)3.
6. Какой циклоалкан из названных получится в реак-
ции Вюрца с участием хлорметана и 1-метил-2-хлорцик-
лопентана?
1) 1,1 -диметилциклопентан;
2) 1,2-диметилциклопентан;
3) 1,3-диметилциклопентан;
4) 1 -метил-2-этилциклопентан.
7. Для каких циклоалканов относительная плотность
паров по водороду равна 28?
1) метилциклопропан; 2)этилциклопропан;
--- 556 ---
3) циклобутан; 4) метил циклобутан.
8. НЕПРАВИЛЬНО составлено название циклоал-
кана:
1) этилциклобутан; 2) диметилциклопропан;
3) метилциклопентан; 4) пропилциклогексан.
9. Укажите названия веществ, которые между собой
являются гомологами:
1)этилциклопропан; 2) циклопропан;
3) циклобутан; 4) пропан.
10. По структурным формулам выберите изомерные
вещества:
1) СН3 2)СН —СН2
Г ||
СН СН —сн2
Н2С^СН2
3)СН —СН —C2HS
I I
СН — сн2
ТЕСТ 2
1. Укажите формулу 1,1-диметилциклогексана:
СН2 СН2
2) I I
СН2 СН — сн3
сн2
--- 557 —
сн2 сн —сн3
4)1 |
сн2 сн —сн3
сн2
2. Охарактеризуйте углеводород строения
СН,—СН —СН3
I ~ I :
сн, — сн — сн3
1)циклоалкан;
2) называется диметилциклобутан;
3) изомерен пропилциклопропану;
4) может вступать в реакции замещения.
3. Существование стереоизомеров возможно для:
1)1,2-диметилциклопропана;
2) 1,1-диметилциклобутана;
3)1 -бром-2,2-диметилциклобутана;
4) 1,3-дибромциклобутана.
4. При действии магния на 1,3-дибромпентан получа-
ется карбоциклическое соединение, название которого:
1) пентан; 2) метилциклопентан;
3) метилциклобутан; 4) этилциклопропан.
5. Укажите число структурных изомеров циклоалка-
нов состава С5Н]0:
1) 4; 2) 5; 3) 6; 4) 3.
6. Укажите названия веществ, НЕ имеющих структур-
ных изомеров:
1) бутан; 2) пропан: 3) этан; 4) циклопентан.
7. Выберите названия изомеров 1,2-диметилцикло-
пропана:
--- 558 ----
1) пентан; 2) циклопентан;
3) метилциклобутан; 4) 1,1-диметилциклопропан.
8. Число изомерных дихлорпроизводных циклоалка-
нов состава СЯГС1, с четырьмя атомами углерода в цикле
равно (без учета энантиомерии):
1)4; 2) 5; 3) 6; 4) 7.
9. Какие углеводороды имеют относительную плот-
ность паров по воздуху, равную 2,414?
1) циклогексан;
2) метилциклобутан;
3) циклопентан;
4) 1,2-д иметилцикл опропан.
10. Одновременно существование цис-, транс-изоме-
ров и энантиомеров возможно для:
1) 1,1-дихлорциклопентана;
2) 1 -бром-1,2-диметилциклопропана;
3) 1-фтор-2-хлорциклобутана;
4) 1,3-дибромциклобутана.
ТЕСТЗ
1. На какое вещество нужно подействовать цинком,
чтобы получить 1,3-диметилциклобутан?
1) 2,5-дихлоргексан;
2) 2-метил-2,4-дихлорбутан;
3) 2-метил-1,4-дихлорпентан;
4) 3,4-диметил-1,4-дихлорпентан.
2. Взаимодействие низших циклоалканов с Н, сопро-
вождается разрывом связей С — С в цикле. С учетом
этого укажите названия продуктов реакции гидрирова-
ния метилциклобутана:
1) гексан; 2) пентан;
--- 559 ---
3) 2-метилбутан; 4) 3-метилпентан.
3. Укажите число изомерных циклоалканов состава
С7Н14 с четырьмя атомами углерода в цикле (без учета
стереоизомерии):
1)9; 2) 8; 3)7; 4) 6.
4. Отметьте справедливые утверждения для 1,3,5-три-
изопропилциклогексана:
I) число первичных атомов С равно числу вторичных;
2) число первичных атомов С равно числу третичных;
3) число третичных атомов С в два раза больше числа
вторичных;
4) число первичных атомов С больше числа третичных.
5. В случае циклоалканов число атомов углерода п и
число электронов N в молекуле связывает формула:
l)7V=8n + 2; 2)У=8н;3)У = 14/z; 4) N= 14/7 + 2.
6. Гомологический ряд алициклических углеводоро-
дов, молекулы которых содержат две двойные связи и
два цикла, описывается общей формулой:
1)СН,;2)СН, ,;3)СН, d;4)CH,
7 л 2л’ 7 л 2л-2’ 7 п 2л-4’ 7 л 2л-6
7. Какова общая формула алициклических насыщен-
ных углеводородов, содержащих т циклов в молекуле?
1)СН; 2) С Н, •
3) с Н2га+2; 4) С Н2т.
8. При взаимодействии метилциклопропана с бромом
образуются (учтите, что реакция протекает с разрывом
связи С — С в цикле):
1) 1,3-дибромбутан;
2) 1,2-дибромбутан;
3) 1,3-дибром-2-метилпропан;
4) 1,4-дибромбутан.
9. При взаимодействии метилциклопропана с НВ г
преимущественно образуется (учтите, что реакция про-
— 560 —
тскает по правилу Марковникова и сопровождается раз-
рывом связи С — Св цикле):
1) 1-бромбутан;
2) 2-бромбутан;
3) 2,3-дибромбутан;
4) 1,1-дибромбутан.
10. Сколько изомерных монохлорпроизводных (без
учета стереоизомеров) можно получить для цикличес-
кого вещества, образованного взаимодейс гвием избыт-
ка цинка с 2-метил-1,5-дихлорпентаном?
1)6; 2) 5; 3)4; 4)3.
ТЕМА 42
Алкены. Циклоалкены
ТЕСТ1
1. Назовите по систематической номенклатуре алкен
строения СЛ
I
СН2 = СН —С — СН3:
I
сн3
1) 3,3-Диметилбутен-2; 2) 2-диметилбутен-З;
3) 2,2-диметилбутен-З; 4) 3,3-диметилбутен-1.
2. С ростом молярной массы массовая доля атомов
углерода в алкенах:
1) возрастает;
2) уменьшается;
— 561
3) не изменяется;
4) изменяется немонотонно.
3. При одинаковом числе атомов углерода в молекуле
как соотносятся между собой массовые доли углерода в
алканах, алкенах и циклоалканах?
1) массовые доли одинаковы во всех случаях;
2) наибольшая в алканах,
3) наименьшая в алканах;
4) одинакова в алкенах и циклоалканах.
4. Алкены по составу изомерны:
1) алканам; 2) циклоалканам; 3) алкинам; 4) алкадиенам.
5. Качественные реакции на алкены - это их взаимо-
действие с водными растворами:
1) NaOH; 2) НС1; 3) Вг2; 4) КМпО4.
6. Укажите формулу 5-метилгексена-2:
1) снз — СН — СН, — СН = сн2;
I
сн3
2) снз— СН — СН, — СН = СН — снз;
сн3
3) СН3 — СН — СН = СН,;
сн3
4) СН3 — С = СН — СН, — СН3.
I
сн3
7. Бромэтан может быть превращен в этилен:
1) взаимодействием с натрием;
2) взаимодействием со спиртовым раствором щелочи;
3) нагреванием с серной кислотой;
4) отщеплением бромоводорода.
— 562 —
8. Относительная молекулярная масса алкена с шес-
тью атомами углерода в молекуле равна:
1)86; 2) 84; 3) 82; 4) 80.
9. С этиленом взаимодействуют реагенты:
1) бромная вода;
2) водный раствор перманганата калия;
3) метан;
4) вода в присутствии концентрированной серной
кислоты.
10. Реакция присоединения воды к ненасыщенным
углеводородам называется реакцией:
1) гидрирования; 2) дегидратации;
3) гидратации; 4) дегидрирования.
ТЕСТ 2
1. Назовите по систематической номенклатуре алкен
строения од
СН3 —С —СН = СН2:
С2Н5
1) 2-метил-2-этилбутен-3;
2) З-метил-З-этилбутен-1;
3) 3,3-диметилпентен-3;
4) 3,3-Диметилпентен-1.
2. НЕПРАВИЛЬНО названы алкены:
1) СН(С1) = СН(С1) дихлорэтен;
2) СН, = СН(С1) хлорэтен;
3) СП. — С — СН — СН3 З-хлор-2-метилбутен-1;
II I
сн2 С1
— 563
СН2
2) СН — СН(С1)
СН
СН3
4) С = С
С1
СНз ZCH3
4) с = С /и/мшс-2-метил-3-хлорпентен-2.
сн3 44(31
3. Укажите формулы веществ, которые между собой
являются изомерами:
1)(С1)СН,— сн, — сн3
СНз ZCH3
3) с = с
/ XcI
4. Какие вещества, названия которых приведены
ниже, являются между собой гомологами?
1) этен; 2) 2-метилпропен;
3) 1,2-дихлорпропен; 4) 1-хлорпропен
5. Сколько изомерных алкенов можно получить при
дегидрировании 2-метилбутана?
1)2; 2)1; 3)3; 4) 4.
6. Укажите названия алкенов, для которых возможна
цис-, /и/хшс-изомерия: ,
1) 1,1-дихлорэтен; 2) 1,2-дихлорэтен;
3) винилхлорид; 4) бутен-2.
7. Сколько изомерных алкенов отвечает эмпиричес-
кой формуле C4HS?
1)4; 2)2; 3)3; 4)1.
8. Пропен можно получить:
1) дегидрированием пропана;
2) взаимодействием 2-хлорпропана и спиртового ра-
створа щелочи;
--- 564 ---
3) взаимодействием 1-хлорпропана и спиртового ра-
створа щелочи;
4) взаимодействием 1,3-Дибромпропана с избытком
цинка.
9. Какими свойствами обладают и пропан, и пропилен?
1) реагируют с бромной водой;
2) обесцвечивают водный раствор КМпО4;
3) газы при комнатной температуре (20 °C);
4) сгорают в кислороде.
10. При взаимодействии цинка с 1,2-дибромпропа-
ном преимущественно получается:
1) бутен-2; 2) пропен;
3) циклопропан; 4) 1,4-дибромбутан.
ТЕСТЗ
1. Пропен может вступать в реакции:
а) полимеризации; б) гидратации;
в) гидрирования; г) окисления.
1) а, б, г; 2) б, в, г; 3) а, б, в, г; 4) а, в, г.
2. Укажите число изомерных алкенов состава С3Н2Вг4:
1) пять; 2) шесть; 3) семь; 4) восемь.
3. В каких схемах правильно показаны частичные за-
ряды на атомах углерода?
5+ 8-
1)СН3 —СН = СН?;
8+ 8-~
2) СН — СН = СН — СН
z 3 э
8- 8 +
3) CF3 — СН = СН2;
--- 565 ----
сн3
I 5+ 3-
4) СН3 — С — СН = СН2
С2Н5
4. Отметьте правильные утверждения:
1) энергия двойной связи углерод — углерод равна
удвоенной энергии a-связи углерод — углерод;
2) двойная связь между атомами углерода короче, чем
одинарная связь между атомами углерода;
3) реакция гидратации для алкенов протекает по ион-
ному механизму;
4) при взаимодействии алкенов с бромоводородом
первой стадией реакции является взаимодействие ани-
она брома с электронами л-связи.
5. Укажите название вещества, обладающего цис-,
/лр«//с-изо мерией:
1) 2-метилпентен-2; 2)2,3-дихлорбутен-1;
3) 2-метилбутен-2; 4) 1-бром-2-хлорэтен.
6. Алкен может образоваться при взаимодействии:
1)СН3 —СН —CH2nZn;
Br Br
2) СН, — СН2 — СН, — СН2 и Mg; -
Г I
С1 С1
3) снз — СН — СН, — снз и КОН (спирт.р-р);
а
4) снз — СН, — СН — снз и H,SO4 (конц.), 170 °C.
ОН
--- 566 ---
7. Изомерами пентена-2 являются:
1) метилциклобутан; 2) циклопентен;
3) З-метилбутен-1; 4) 1,2-диметилциклобутан.
8. Укажите названия соединений, которые могут всту-
пать в реакцию полимеризации:
1) этен; 2) винилхлорид; 3) пропен; 4) хлорэтан.
9. Укажите число связей a-типа в молекуле пропена:
1)7; 2)6; 3)9; 4) 8.
10. В отличие от пропана пропен реагирует с:
1) бромом (/°, /?г); 2) бромной водой;
3) водой (в присутствий H2SO4); 4) водородом (кат.).
ТЕСТ 4
1. Укажите название по систематической номенкла-
туре алкена строения gr
1 . /СН2С1
Н3СУ у :
сн3
1) 1 -хлор-5-бром-2-метилгексен-3;
2) 2-бром-5-метил-6-хлоргексен-3;
3) 5-бром-2-метил-1-хлоргексен-3;
4) 5-бром-1 -хлор-2-метилгексен-З.
2. Отметьте названия веществ, молекулы которых об-
ладают пространственной изомерией:
1) 1,2,3-трихлорпропен;
2) 1,1,2-трихлорпропен;
3) 1,2,3,3-тетрахлорпропен;
4) 1,3,3-трихлорпропен.
3. В каких парах названные вещества изомерны друг
другу?
1) винилхлорид и 1-хлорпропен;
--- 567 ----
2) циклопропан и пропен;
3) г/пс-бутен-2 и 2-метилпропен;
4) бутан и трлнс-бутен-2.
4. Укажите название вещества, которое преимуще-
ственно получается при взаимодействии бромоводоро-
да с З-метилбутеном-1:
1) 2-бром-З-метилбутан;
2) 1-бром-3-метилбутан;
3) 2-метилбутан;
4) 1,2-дибром-З-метилбутан.
5. Каким реактивом надо подействовать на 2-хлорбутан,
чтобы с наибольшим выходом превратить его в бутен-2?
1) цинком;
2) H2SO4 (конц.), 170 °C;
3) водным раствором КОН;
4) спиртовым раствором КОН.
6. Какие соединения названы НЕВЕРНО?
1) бутен-1; 2) /тфш/с-пентен-1;
3) пентен-4; 4) 2-этилпропен.
7. По ионному механизму протекают реакции между:
1) СН3 — СН = СН2 и НС1;
2) С2Н6 и С12 (освещение);
3) СН, = СН, и Вг, (водный раствор);
4) СН, = СН — СН — СН3 и Н,О (в присутствии
катализатора).
сн3
8. Укажите число изомерных алкенов со.става С3Н5Вг:
1)4; 2) 5; 3)3; 4) 2.
9. Какая структура углеродного скелета пропена наи-
более правильная?
1)С — С = С; 2)С = С;
I
С
--- 568 ----
сх
4) S'.
(X
10. При гидрировании пропена
сн3 — сн = сн2
изменяются (цифрами помечены номера атомов С):
1) геометрия молекулы;
2) порядок расположения атомов углерода в молекуле;
3) длина связи между атомами углерода С(1) и С(2);
4) химическая активность молекулы.
ТЕСТ 5
1. Укажите названия изомеров ш/с-бутена-2:
1) ш/х///с-бутен-2; 2) бутен-1;
3) этилен; 4) 2-метилпропен
2. При взаимодействии бутена-1 с хлороводородом
преимущественно образуется:
1) 1-хлорбутан; 2)2-хлорбутан;
3) 1,2-дихлорбутан; 4) 2-хлорбутен-1
3. Гомологами трстс-пентена-2 являются:
1) ш/с-пентен-2; 2) /шс-бутен-2; 3) пентен-1; 4) пропен.
4. Цис- и /7//?г///с-изомеры бутена-2 между собой раз-
личаются:
1) порядком соединения атомов углерода,
2) физическими свойствами;
3) взаимной ориентацией атомов (групп атомов) в
пространстве;
4) положением двойной связи в молекуле
— 569 —
5. Что изменяется при взаимодействии бромоводо-
рода с пропеном t
СН3 — СН = сн2
(цифрами помечены номера атомов углерода)?
1) порядок соединения атомов углерода;
2) длина'связи между атомами С(1) и С(2);
3) пространственное строение молекулы;
4) способность вращения групп атомов относитель-
но связи С(1) — С(2).
6. С помощью правила Марковникова объясняется
присоединение к алкенам:
1) водорода; 2) хлороводорода; 3) воды; 4) брома.
7. При полном гидрировании щ/с-бутена-2 образуется:
1)транс-буген-2; 2) гд/с-буган; 3) бутан; 4) транс-бугая.
8. В реакциях каких веществ со спиртовым раствором
КОН образуется алкен?
1) хлорметан; 2) бромэтан;
3) циклопропан; 4) 2-иодпропан.
9. Очистить этан от примесей этена можно:
1) бромной водой;
2) водным раствором КМпО4;
3) иодоводородом;
4) спиртовым раствором КОН.
10. Бромную воду обесцвечивают:
1) полиэтилен; 2) дпс-бутен-2;
3) транс-яеягея-2; 4) 2-хлорбутен-2.
ТЕСТ 6
1. Укажите число изомеров состава ЦНС1:
1)6; 2) 5; 3)4; 4)3.
--- 570 ---
2. При взаимодействии бутена-2 с холодным водным
раствором перманганата калия образуется:
1) бутандиол-1,2; 2) бутандиол-2,3;
3) бутановая кислота; 4) бутаналь.
3. Число алкенов, которые можно получить при де-
гидрировании 2,2,4-триметилпентана, равно:
1)5; 2) 4; 3)3; 4) 2.
4. При взаимодействии 2-метилбутена-2 с бромово-
дородом преимущественно образуется:
1) 2-бром-З-метилбутан; 2) 2-бром-2-метилбутан;
3) 1-бром-2-метилбутан; 4) 1-бром-З-метилбутан.
5. При дегалогенировании вещества строения
(СН3)3С — CHCI — СН2С1
образуется:
1) 2,2-диметилпентен-З; 2) 3,3-диметилпентен-1;
3) 2,2-диметилбутен-З; 4) 3,3-диметилбутен-1.
6. Дегидрированием 2-метилбутана можно получить
алкены:
1) 2-метилбутен-1; 2) 2-метилбутен-2;
3) пентен-1; 4) 3-метилбутен-1.
7. Отметьте особенности строения и химических
свойств алкенов:
1) возможна пространственная изомерия;
2) реакции присоединения галогеноводородов про-
текают по ионному механизму;
3) насыщенные соединения;
4) л-электронная плотность кратной связи легко по-
ляризуется под действием заместителей.
8. Укажите формулу 2,3,4,4-тетраметилпентена-2:
1)(СН3),С = С(СН3)С(СН3)3;
2) (СН3),С = С — СН(СН3),;
с2н5
--- 571
3) CH, — С = С — (СН,)2 — СН,;
СД СД
4) СН, = С(СН,)С(СН,),СН(СН,),
9. Назовите по систематической номенклатуре алкен
строения (ВДСН н
С = С
/ ХСН(СН3)2
1) транс-!,5-диметилгексен-3;
2) иис-2,5-диметилгексен-З;
3) /шс-диизопропилпентан;
4) /7?/¥Шс-2,5-диметилгексен-4.
10. Свободное вращение вокруг двойной связи НЕ-
ВОЗМОЖНО, так как это требует:
1) разрыва а-связи;
2) разрыва л-связи;
3) разрыва ст- и л-связи;
4) разрыва одной л-связи и двух о-связей.
ТЕСТ 7
1. С пропеном с наибольшей скоростью реагирует:
1)HF; 2)НС1;3)НВг; 4) HI.
2. С наибольшей скоростью бромоводород реагирует с:
1) этеном; 2) пропеном;
3) бутеном-1; 4) 3,3-диметилбутеном-1.
3. Укажите электронную формулу пропена:
Н
1)Н:С:С::С:Н
ii н н
н н
2) Н : С : : С : С : Н
Н Н Н
--- 572 ----
н н н н
3)Н:С:С:С:Н 4) Н : С : :: С :С : Н
НН Н
4. Назовите по систематической номенклатуре алкен
строения: щ
I II
СН —С —СН3
СН2 — СН(СН3)г
1) 2,3,5-триметилгексен-1;
2) 2,4,5-триметилгексен-5;
3) 4-изопропил-2,3-диметилбутен-1;
4) 2,3-диметил-4-изопропилбутен-1.
5. Укажите общую формулу циклоалкенов:
1) С Н,; 2) С И, _9; 3) С К _л; 4) С Н
6. Чему равен угол СЭС3С4 в молекуле пентена-1?
1) 109°; 2) 120°; 3) 90°; 4) 180°
7. Сколько изомерных алкенов (без учета энантиоме-
ров) можно образовать из алкана, углеродный скелет ко-
торого имеет строение
С — С — С — С — С?
С
1)5; 2) 4; 3)3; 4) 2.
8. Назовите по систематической номенклатуре алкен
строения СН2Вг^
1) 3,4-диметил-1-бромгексен-5;
2) 3,4-диметил-6-бромгексен-1;
3) 1-бром-3,4-диметилгексен-5;
--- 573 ----
9. Учитывая, что при отщеплении галогеноводоро-
дов от галогеналканов водород преимущественно отщеп-
ляется от менее гидрированного атома углерода, назо-
вите основной продукт реакции дегидрогалогенирова-
ния галогеналкана строения
(СН3)2СН — СНВг — СН2— СН(СН3)2:
1) 2,5-диметилгексен-1; 2) 2,5-диметилгексен-2;
3) 2,5-диметилгексен-З; 4) 2,4-диметилгексен-З.
10. Назовите по систематической номенклатуре со-
единение, при обработке которого спиртовым раство-
ром гидроксида калия образуется 2,3-диметилбутен-2:
1) 2-бром-2,3-диметилбутан;
2) 1 -бром-2,3 -д иметилбутан;
3) 3-бром-2,3-диметилбутан; -
4) 2,3-дибром-2,3-диметилбутан.
ТЕСТ 8
1. При действии КОН(спирт) на вещество строения
ВгСН2 — СНВг—СН2Вг при условии отщепления толь-
ко одной молекулы НВг могут образоваться:
1) 1,3-дибромпропен; 2) 1,2-дибромпропен;
3) 1,1-дибромпропен; 4) 2,3-дибромпропен.
2. При дегидратации спирта строения
СН3 — СН2 — С(ОН)(СН3) — СН(СН3)2 в основном
образуется (учтите, что атом Н отщепляется от менее
гидрированного атома С):
1) 2,3-диметилпентен-1; 2) 2,3-диметилпентен-2;
3) 3,4-диметилпентен-2; 4) 2,3-диметилпентен-3.
3. В результате реакции между хлоридом иода IC1 и 2-
метилбутеном-2 преимущественно образуется:
1) 3-иод-3-метил-2-хлорбутан;
--- 574 ---
2) 2-иод-З-метил-З-хлорбутан;
3) 3-иод-2-метил-2-хлорбутан;
4) 2-иод-2-метил-3-хлорбутан.
4. В одну стадию 2-метилбутен-2 можно получить из:
1) 1-бром-3-метилбутана; 2) 2-бром-2-метилбутана;
3) 3-метилбутанола-1; 4) З-метилбутанола-2.
5. Укажите число вторичных атомов С в молекуле
соединения Б, которое преимущественно образуется в
результате химических превращений, протекающих по
схеме:
2-метилбутен-1 ±2Я А + Na (из6)> Б:
1)5; 2) 4; 3) 3; 4) 2.
6. В отличие от раствора Вг2 в СС14 раствор Вг, в Н,0
при взаимодействии с этиленом может образовать:
1) 1^2-дибромэтан; 2) 1,1-дибромэтан;
3) 2-бромэтанол; 4) этан.
7. Получить 2-бром-2-метилбутан можно при взаи-
модействии:
1) 2-метилбутана с бромной водой;
2) 2-метилбутана с бромом;
3) 2-метилбутена-2 с бромоводородом;
4) 2-метилбутана с бромоводородом.
8. Преимущественно 2-бром-2-метилбутан образует-
ся, когда с НВг реагируют:
1) 2-метилбутен-1; 2) пентен-1;
3) 3-метилбутен-1; 4) 2-метилбутен-2.
9. Вопреки правилу Марковникова HI присоединяет-
ся к веществам, формулы которых:
1) СН3 — СН = СН — СН3;
2) CF3 —СН = СН2;
--- 575 ----
^/СНз
3)Н2С —с
I II
Н2С — сн
4) СН, = СН —СООН.
10. Двойная связь наиболее полярна в соединении
строения:
1) СН3 — СН = СН,; 2) СН3 — СН = СН — СН3;
снзХ
3) (CF3),C = СН,; 4) С = СН(СН3).
сн,/
ТЕСТ 9
1. Для молекулы Н,С = СН — СН, — СН, — СН3 в
одной плоскости постоянно лежат атомы углерода, но-
мера которых:
1) только 1 и 2; 2) 1, 2, 3, 4; 3) 1, 2, 3; 4) 1, 2, 3, 4, 5.
2. Этиленоксид можно получить при взаимодействии
этена и:
1) КМпО4 (5 °C, водный раствор);
2) О, (на серебряном катализаторе);
3) СН3СОООН;
4) О, (избыток, /°).
3. Назовите по систематической номенклатуре веще-
ство строения Вг — СН, — СН, — СН — СН,:
1) 1-бромбутен-З; 2) 1-бромбутен-1,
3) 4-бромбутен-1; 4) 4-бромбутен-2.
4. Сколько атомов углерода в молекуле 1,2-диметил-
гексена постоянно лежат в одной плоскости^
1)6; 2) 5; 3) 7; 4)4.
--- 576 —
5. Назовите по систематической номенклатуре алкен
строения
Вг
1) 2-бром-4-изопропилгексен-2;
2) 2-бром-5-метил-3,4-диэтилгексен-2;
3) 5-бром-2-метилгексен-4;
4) 5-бром-З-изопропилгексен-4.
6. Укажите число изомеров состава С ,Н4С12 (без учета
энантиомеров):
1)10; 2) 9; 3) 8; 4) 7.
7. Выберите формулу основного продукта реакции
между бромоводородом и 1-этилциклогексеном:
С2Н5
Вг
2)
8. При взаимодействии 1-метилциклогексена с водным
раствором КМпО4 (5 °C) образуется вещество строения:
19 Зак. 1530
--- 577 ----
9. Укажите формулу основного продукта реакции меж-
ду иодоводородом и веществом, формула которого
10. Отметьте формулу продукта реакции полимериза-
ции 2-метилбутена-2:
СН3
1) СН2 — СН — СН2 — СН2 2) СН — СН -j-
СН3 СН3
сн3
3)-4с —снД- 4)Хсн2 — сн—сн—сн2Д-
V | | 'П ' || 'п
сн3 сн3 сн3 сн3
ТЕСТЮ
1. Назовите по систематической номенклатуре алкен
строения: q
1) 2 -бр ом- 3 -метил- 5 -хлор-4-этилгексен- 5;
--- 578 ----
2) 3-метил-2-бром-5-хлор-4-этилгексен-5;
3) 4-метил-5-бром-3-этил-2-хлоргексен-1;
4) 5-бром-4-метил-2-хлор-3 этилгексен-1.
2. Укажите формулу мономерного звена продукта ре-
акции полимеризации пентена-2:
1) —СН —СН —СН2— 2) —СН —СН —
СН3 СН3 СН3 С2Н5
СН3
3) —СН —С— 4)—СН —СН2 —СН —
сн3 сн3 сн3 сн3
3. При взаимодействии водного раствора КМпО4 (5 °C)
с З-метилпентеном-2 образуется:
1) 2-метилпентандиол-2,3;
2) З-метилпентандиол-1,2;
3) 3-мети лпентандио л-2,3;
4) З-метилпентанол-З.
4. Укажите число изомерных алкенов состава С5Н10:
1)7; 2) 6; 3)5; 4) 4.
5. Число изомерных веществ состава С4Н7С1 равно (без
учета стереоизомеров):
1) 13; 2) 12; 3) 11; 4) 10.
6. Пропен НЕЛЬЗЯ в одну стадию получить из веще-
ства, формула которого:
1) СН3СН2СН2ОН; 2) СНВг2СНэСН3;
3) СН3(СН2)4СН3; 4) СН3СНВгСН3.
7. При дегидрогалогенировании всех изомерных алка-
нов состава С4Н9Вг можно получить алкенов состава C4Hg:
1) два; 2) три; 3) четыре; 4) пять.
--- 579 ---
2) пропиленоксид;
4) 1-бромпропан.
8. Из пропена в одну стадию с большим выходом мож-
но получить:
1) пропандиол-1,3;
3) пропанол-2;
9. Укажите формулу продукта реакции между HI и ве-
ществом строения
СН2:
1)
CH2I
СН3
3)
I
2)
4)
CHI
СН3
7 8 9
сн2 —сн2—сн3
10. В случае соединения 4
2) 1,2, 3,4;
4) только 1, 2, 3.
постоянно в одной плоскости лежат атомы углерода,
номера которых:
1) только 1,2, 7;
3)1, 2, 3,6, 7;
ТЕСТИ
1. Назовите по систематической номенклатуре алкен
строения Вг
1) 6-бром-5-метил-4-этилгептен-1;
2) 2-бром-3-метил-4-этилгептен-6;
--- 580 —
3) 5-метил-6-бром-4-этилгептен-1;
4) 3-метил-2-бром-4-этилгептен-6.
2. Укажите название по систематической номенклатуре
основного продукта реакции между
СН3иВгС1:
1) 1 -бром-1 -метил-2-хлорцикло гексан;
2) 2-бром-2-метил-1-хлорциклогексан;
3) 2-бром-1-метил-1-хлорциклогексан;
4) 1 -бром-2-метил-2-хлорцикло гексан.
3. Смесь веществ образуется при взаимодействии:
1) 3-бромгексана и КОН (спиртовой р-р);
2) этена и HI;
3) бутена-1 и НЭО (в присутствии H,SO4);
4) бутена-2 и НВг.
4. Укажите число изомерных алкенов неразветвлен-
ного строения состава С4НбС12 с кратной связью у перв-
го атома углерода (без учета энантиомеров):
1) 14; 2) 13; 3) 12; 4) 11.
5. Какая формула связывает число электронов N и
число атомов углерода п в молекулах алкенов?
1)2У=8л; 2)7V= 14»;
3)W=8w + 2; 4)/V- 14// + 2.
6. Назовите по систематической номенклатуре алкен
1) 7/г/с-2-бром-6-фтор-5-хлоргексен-3;
2) /77/*77/с-2-бром-6-фтор-5-хлоргексен-3;
3) 7/г/с-5-бром-1-фтор-2-хлоргексен-3;
4) 77?/л7нс-5-бром-1 -фтор-2-хлоргексен-З.
— 581
7. Для проведения одностадийной реакции, схема
которой СиН2„ СиН2и(ОН)2, используют реагент.
1) КОН (спирт, р-р);
2) КОН (водн. р-р);
3) H2SO4(kohh., /° > 140 °C);
4) КМпО4 (водн. р-р, 5 °C).
8. На 2-метилпентен-2 вначале действуют иодоводо-
родом, а затем избытком натрия При этом в основном
образуется:
1) 2,5-диметил-3,4-диэтилгексан;
2) 4,4,5,5-тетраметилоктан;
3) 2,3,4,5-тетраметилоктан;
4) 2,3,4,5,6-пентаметилгептан.
9. Осуществите превращения согласно схемам реакций:
Вг — СН, — (СНД — СН2 — Вг А
+кон (спирт), избы^ £ +c;h5coooh> р Укажите молярную массу
(г/моль) алициклического продукта Г:
1) 102; 2) 84; 3)86; 4) 116.
10. Мономерное звено полимера имеет состав СН^.
Такие полимеры могут образоваться при полимеризации:
1) тефлона; 2) пропена;
3) винилхлорида; 4) бутена-2.
--- 582 ----
ТЕМА 43
Алкадиены. Природный и синтетический
каучуки
ТЕСТ1
1. Охарактеризуйте вещество строения:
СН —С = СН —СН:
I II
сн3 сн2
1) называется 2-метилпентадиен-2,4;
' 2) реагирует с бромной водой;
3) изомер бутадиена-1,3;
4) гомолог изопрена.
2. Укажите число о-связей в молекуле бутадиена-1,3:
1)8; 2) 9; 3)7; 4) 5.
3. Молярная масса алкадиена равна 82 г/моль. Сколь-
ко атомов водорода содержится в молекуле алкадиена?
1) 10; 2) 14; 3) 12; 4) 8.
4. В каких парах вещества по отношению друг к другу
являются изомерами?
1) изопрен и бутадиен-1,3;
2) винилхлорид и поливинилхлорид;
3) изопрен и пентадиен-1,3;
4) циклобутен и бутадиен-1,2.
5. При взаимодействии брома (1 моль) и гептадие-
на- 1,3 могут образоваться:
1) 1,2-дибромгептен-З; 2) 1,3-дибромгептен-2;
3) 3,4-дибромгептен-1; 4) 1,4-дибромгептен-2.
--- 583 ----
6. При взаимодействии 1 моль бутадиена-1,3 с 1 моль
брома могут образоваться:
1) 1,4-дибромбутен-2; 2) 1,2-дибромбутен-1;
3) 3,4-дибромбутен-1; 4) 1,2,3,4-тетрабромбутан.
7. Простейший алкадиен называется:
1) аллил; 2) аллен; 3) пропадиен; 4) циклобутадиен-1,3.
8. Бутадиен-1,3 может реагировать с:
I) бромной водой; 2) водородом;
3) метаном; 4)хлороводородом.
9. Укажите правильную структуру углеродного скеле-
та бутадиена-1,3:
С С
II II
1)С = С —С = С; 2) С — С
С
II
3) с —С
с
4) С = С
^С = С
10. Реакцией Лебедева называется получение бутади-
ена-1,3 из:
1) этилена; 2) винилхлорида; 3) бутана; 4) этанола.
ТЕСТ2
1. Изопрен можно получить дегидрированием:
1) метана; 2) бутана; 3) 2-метилбутана; 4) бутадиена-1,3.
2. При взаимодействии избытка раствора брома в СС14
с бутадиеном-1,3 конечным продуктом будет:
1) 1,4-дибромбутен-2; 2) 1,2,3,4-бромбутан;
3) 1,2,3,4-тетрабромбутан; 4) 1,2-дибромбутен-2.
3. Натуральный каучук представляет собой:
1) /ираис-форму полибутадиена;
--- 584 ---
2) щ/с-форму полиизопрена;
3) г/ис-форму полибутадиена;
4) ш/с-форму продукта реакции полимеризации 2-ме-
тилбутадиена-1,3.
4. При полном бромировании изопрена раствором
брома в СС14 образуется:
1) 3,4-дибром-3-метилбутен-1;
2) тетрабромбутан;
3) 1,2,3,4-тетрабром-2-метилбутан;
4) 2,3-дибром-3-метилбутен-1.
5. Укажите названия диенов с сопряженными двой-
ными связями:
1) бутадиен-1,3; 2) аллен;
3) изопрен; 4) пентадиен-1,4.
6. Бутадиен-1,3 можно получить:
1) дегидрированием бутана;
2) дегидрированием 2-метилбутана;
3) дегидратацией и дегидрированием этанола;
4) дегидрированием бутена-1.
7. Бутадиеновый каучук образуется в результате реакции:
1) дегидрирования бутана;
2) полимеризации бутена-1;
3) дегидратации и дегидрирования этанола;
4) полимеризации бутадиена-1,3.
8. Геометрическую (цис-, транс-) изомерию проявляют:
1) полибутадиен; 2) полихлоропрен;
3) 2-метил-3-хлорбутен-2; 4) полиизопрен.
9. Укажите число изомерных алкадиенов состава С.Н8,
отличающихся положением двойных связей и строени-
ем углеродного скелета (без учета стереоизомерии):
1)8; 2) 7; 3) 6; 4)5.
--- 585 ----
10. При взаимодействии изопрена с НВг (мольное
отношение реагентов 1:1) в основном образуется:
1) З-бром-З-метилбутен-1;
2) 3-бром-2-метилбутен-1;
3) 1,4-дибром-2-метилбутен-2;
4) 3,4-дибром-2-метилбутен-1.
ТЕСТЗ
1. Укажите название тетрахлоралкана, который под
действием цинковой пыли превращается в пентадиен-2,3:
1) 1,2,2,3-тетрахлорпентан;
2) 2,3,3,4-тетрахлорпентан;
3) 1,2,3,4-тетрахлорпентан;
4) 1,2,3,3-тетрахлорпентан.
2. При взаимодействии равных химических количеств
бутадиена-1,3 и бромоводорода (20 °C) образуется(ются):
1) только 3-бромбутен-1;
2) только 1-бромбутен-2;
3) смесь З-бромбутена-1 и 1-бромбутена-2;
4) смесь 1-бромбутена-2 и 2-бромбутена-2.
3. Укажите структуру продукта реакции 1,4-присое-
динения хлороводорода к 2,3-диметилбутадиену-1,3
(мольное соотношение реагентов 1:1):
СН3
1) Н3С —С —С —СН2 2) Н3С —- СН — СН — СН3
С1 сн3 С1 сн3
3) Н3С — С = С — СН2С1 4) нзс — СН — СН — СН2С1
сн3 сн3 сн3 СН3
--- 586 ----
4. Назовите продукт реакции 1,2-присоединения брома
к 2,3-диметилбутадиену-1,3 (мольное соотношение реаген-
тов 1:1):
1) 3,4-дибром-2,3-диметилбутен-1;
2) 1,2-дибром-2,3-диметилбутен-3;
3) 1,4-дибром-2,3-диметилбутен-2;
4) 2,3-диметил-1,4-дибромбутен-2.
5. В результате действия брома (20°С) на диеновый
углеводород образовался 2,5-дибромгексен-З. Диеновый
углеводород называется:
1) гексадиен-1,3; 2) гексадиен-1,2;
3) гексадиен-2,3; 4) гексадиен-2,4.
6. Отметьте название конечного органического про-
дукта превращений, протекающих по схеме
2,3-диметилбутадиен-1,3 -гт—-(ИВг-*- A +Na<lp6A Б:
1) 2,3,3,4,4,5-гексаметилгексадиен-1,5;
2) 2,3,6,7-метилоктадиен-2,6;
3) 2,3,6,7-тетраметилоктадиен-2,6;
4) 2,3,3,4,4,5-метилгексадиен-1,5.
7. Сколько алкадиенов состава С5Н8 обладают про-
странственной (цис-, транс-) изомерией?
1)4; 2)3; 3)2; 4)1.
8. Пространственная (цис-, транс-)изомерпя. возмож-
на для:
1) 1,4-дибромбутадиена-1,3; 2) 2-метилбутадиена-1,3;
3) 4-метилпентадиена-1,3; 4) пентадиена-1,3.
12 3 4
9. Для бутадиена Н,С = СН — СН = СН, справедли-
вы утверждения:
1) длина связи С“ — С меньше, чем в этане;
2) длина связи С — С такая же, как и связи С — С3;
3) длина связи С — С больше, чем в этене;
4) длина связи С — С такая же, как в этене.
--- 587 ---
10. Конечными продуктами одностадийных превраще-
ний, протекающих по схеме С,Н4 —> C J I O —> С4Н6 (1 моль)
+ 1мольВг2> , ле могут быть вещества, формулы которых:
1) СН3 — СНВг — СНВг — СНЧ;
2) СН, = СН — СНВг — СН,Вг;
3) СНДЗг — СН — СН — СНДЗг;
4) СН‘ — СН — СН — СНВг..
ТЕСТ 4
1. Укажите число изомерных диенов состава C5HS (с
учетом цис-, транс- изомерии):
1)8; 2) 7; 3)6; 4) 5.
2. Назовите преимущественный продукт реакции 1,2-
присоединения бромоводорода к бутадиену-1,3 (мольное
соотношение реагентов 1 : 1):
1) З-бромбутен-1; 2) 1-бромбутен-2;
3) 2-бромбутен-1; 4) 2-бромбутен-2.
3. При полимеризации 2-бромбутадиена-1,3 могут
образоваться полимеры строения:
4. При взаимодействии 1,4-дибромбутана с избытком
спиртового раствора КОН образуется:
1) бутадиен-1,2; 2) аллен;
3) бутадиен-1,3; 4) 4-бромбутен-1.
--- 588 ----
5. Назовите по систематической номенклатуре диен
строения
1)1 -хлор-3-метилпентадиен-1,4;
2) 3-метил-1 -хлор-пентадиен-1,4;
3) 3-метил-1 -хлорпентадиен-1,3;
_ 4) 1 -хлор-3-метилпентадиен-1,3.
6. Пространственная (цис-, транс-) изомерия возмож-
на для:
1)1,1,4,4-тетрахлорбутадиена-1,3;
2) 1 -бром-2-метилбутадиена-1,3;
3) 1,2-дибром-З-метилбутадиена-1,3;
4) 2-метил-3-хлорбутадиена-1,3.
7. Укажите формулу мономерного звена продукта ре-
акции полимеризации гексадиена-2,4:
1) —СН —СН —СН —СН —;
СН3 сн3
2) — С = СН — СН = С —;
сн3 сн3
3) — СН, — СН, — СН — СН — СН, — СН, —;
4) — CR, — С = С — СН, —.
СН3 СН3
8. Назовите по систематической номенклатуре диен
строения
1) 2-метил-5-бром-3,4-диэтилгексадиен-2,4;
— 589 -----
2) 2-бром-5-метил-3,4-диэтцдгексадиен-2,4;
3) 2-бром-5-метил-3,4-диэтилгексадиен-2,3;
4) 2-метил-5-бром-3,4-диэтидгексадиен-2,3.
9. Укажите формулу мономерного звена продукта ре-
акции полимеризации 2,3-диметилпентадиена-1,3:
Н сн3
1) —СН2 —С —С—;
снз СНз
2) — СН2 — С = С — СН —;
СН3 СН3 СН3
3) — СН2 — СН — СН — СН —;
СН3 СН3 СН3
4) — СН2 — С = С — СН2 —.
СН3 С2Н5
10. Укажите число изомерных алкенов, которые можно
получить при частичном гидрировании гептадиена-2,4:
1)2; 2)3; 3)4; 4) 5.
— 590 —
ТЕМА 44
Алкины
ТЕСТ1
1. Охарактеризуйте вещество строения
си3
СН — С = С — С — СН:
I
сн3
1) называется 2,2-диметилпентин-З;
2) гомолог бутина-2;
3) изомер гептадиена-1,3;
4) реагирует с бромоводородом.
2. При взаимодействии между собой трех молекул
ацетилена в присутствии катализатора и при нагрева-
нии получается:
1) бензол; 2) винилацетилен;
3) винилхлорид; 4) изопрен.
3. В результате димеризации ацетилена в присутствии
катализатора образуется:
1) ацетальдегид; 2) бутадиен-1,3;
3) винилацетилен; 4) бензол.
4. По реакции Кучерова получают из:
1) этанола бутадиен-1,3;
2) ацетилена винилацетилен;
3) ацетилена ацетальдегид;
4) хлорэтана этан.
5. Укажите формулу вещества, которое преимуще-
ственно образуется при взаимодействии 1 моль пропи-
— 591
на с 2 моль бромоводорода (протекание всех стадий под-
чиняется правилу Марковникова):
Вг
1) СН3 — С — СН3; 2) СН3 — СН — СН2;
В г Вг Вг
3) СН3 —С = СН2; 4) СН3 — СН — СН3.
Вг Вг
6. Укажите число изомерных углеводородов состава С,Н4:
1)3; 2) 4; 3)2; 4) 5.
7. Длина связи между атомами углерода наименьшая в
молекуле:
1) циклобутана; 2) этена;
3) этина; 4) этана.
8. В молекуле алкина 8 атомов углерода. Укажите мо-
лярную массу алкина (г/моль):
1) 110; 2) 112; 3) 114; 4) 108.
9. Какие виды изомерии возможны для углеводоро-
дов класса алкинов?
1) углеродного скелета;
2) положения тройной связи;
3) пространственная (цис-, транс-) изомерия;
4) межклассовая.
10. Укажите наиболее правильную структуру углерод-
ного скелета бутина-2:
С
1) с=с 2) с=с
У20. Хс .2»" Хс
--- 592 ----
3)С — С = С — С 4) С = С
С С
ТЕСТ 2
1. Охарактеризуйте алкин строения
СН, — СН — СН, — С = СН:
э | ~
с2н5
1) называется 2-этилпентин-4;
2) называется 4-этилпентин-1;
3) изомер гептина-2;
4) гомолог гексина-3.
2. В молекуле пентина-1 на одной прямой лежат ато-
мы углерода, номера которых:
1) 1, 2, 3; 2) 2, 3, 4; 3) 1, 2, 3, 4; 4) 2, 3, 4, 5.
3. Пропин можно получить:
1) гидрированием пропена;
2) дегидрированием пропена;
3) дегидрированием пропана;
4) гидрированием одной двойной связи пропадиена.
4. Охарактеризуйте тройную связь между атомами
углерода (в сравнении с одинарной и двойной связями
углерод - углерод):
1) короче одинарной, но длиннее двойной;
2) короче и одинарной, и двойной связей;
3) прочнее и одинарной, и двойной связей;
4) энергия равна утроенной энергии одинарной связи
5. По составу алкины изомерны:
1) диенам; 2) циклоалканам;
3) циклоалкенам; 4) алканам.
— 593 —
6. В отличие от этена ацетилен:
1) обесцвечивает бромную воду;
2) обесцвечивает подкисленный раствор КМпО4;
3) может реагировать с водой;
4) при одинаковых химических количествах требует
для полного гидрирования в 2 раза большее химическое
количество водорода.
7. Соединение, которое преимущественно образуется
при взаимодействии эквимолярных химических коли-
честв пропина и бромоводорода, называется:
1) 1-бромпропен; 2) 2-бромпропен;
3) 1,2-дибромпропен; 4) 2-бромпропан.
8. Конечным продуктом реакции пропина с водой в
присутствии солей Hg2+ в кислой среде является:
1) пропаналь; 2) кетон; 3) пропанон; 4) альдегид.
9. Относительная молекулярная масса алкина равна 82.
Число атомов водорода в молекуле алкина составляет:
1)6; 2) 10; 3) 16; 4) 12.
10. При отщеплении молекулы хлороводорода от мо-
лекулы 1,1,2,2-тетрахлорэтана образуется:
1) винилхлорид; 2)хлорэтен;
3) 1,1,2-трихлорэтен; 4) хлороформ.
ТЕСГЗ
1. Назовите по систематической номенклатуре алкин,
молекула которого имеет строение:
СН = С —СН —СН —СН2:
сн3 сн3 СН3
1) 3,4,5-триметилпентин-1; 2) 3,4-диметилгексин-1;
3) 3,4-диметилгексин-5; 4) 1,2,3-триметилпентин-4.
— 594 —
2. Укажите число изомерных углеводородов состава
С Н *
1)8 2) 7; 3)6; 4) 5.
3. Как пропан, так и пропин реагируют с:
1) водородом; 2) бромной водой;
3) кислородом; 4) водой.
4. Ацетилен можно получить:
1) взаимодействием этилена с водородом;
2) взаимодействием карбида кальция с водой;
3) дегидрированием этана;
4) каталитическим окислением метана кислородом при
температуре 1500°.
5. На воздухе наиболее коптящим пламенем сгорает:
1) метан; 2) этилен; 3) ацетилен; 4) этан.
6. Укажите число изомерных алкинов состава C5Hg:
1) 2;2) 3; 3) 4; 4) 5.
7. Энергия связи между атомами углерода в ряду
этан — этен — этин:
1) уменьшается;
2)возрастает;
3) не изменяется;
4) сначала увеличивается, затем уменьшается.
8. Охарактеризуйте свойства и строение ацетилена:
1)газ (н.у.);
2) хорошо растворим в воде;
3) легче воздуха;
4) все атомы в молекуле лежат на одной прямой.
9. Промежуточным и конечным продуктами реакции
гидратации ацетилена в кислой среде в присутствии
солей ртути (II) являются соответственно:
1) виниловый спирт и ацетон;
* Учтите углеводород бициклического строения.
--- 595 ----
2) аллиловый спирт и этаналь;
3) виниловый спирт и этаналь;
4) аллиловый спирт и ацетон.
10. В молекуле пентина-2 на одной прямой лежат ато-
мы углерода:
1) только Ср С„ С3; 2) все;
3) только Ср С2, С3, С4; 4) только С2, С3, С4.
ТЕСТ 4
1. Назовите по систематической номенклатуре алкин
строения ।
1) 3-бром-2,6-диметилгептин-З;
2) 1-бром-1-изопропилпентин-2;
3) 1-изопропил-1-бромпентин-2;
4) 5-бром-2,6-диметилгептин-З. || ।
2. Укажите число атомов Н в молекуле :
1) 14; 2) 13; 3) 12; 4) 11. Т Х
3. При взаимодействии равных химических количеств
З-метилбутина-1 и бромоводорода преимущественно
образуется:
1)1 -бром-3 -метилбутен-1;
2) 2-бром-З-метилбутен-1;
3) 4-бром-2-метилбутен-3;
4) 3-бром-2-метилбутен-3. ;
4. Бутин-1 в отличие от бутина-2 реагирует с:
1) Н2 (кат); 2) AgNO3 (амм. р-р);
3) Вг2/СС14; 4) КМпО4/Н\ Н2О.
— 596 —
5. Число структурных изомеров состава С,Н3С1 равно:
1)6; 2) 5; 3)4; 4)3.
6. Укажите электронную формулу пропина.
И Н
1) Н : С : С :: С : Н 2) Н : С : С ::: С : Н
Н Н
И Н
3) Н : С ::: С : С : Н 4)Н:С:С:::С:Н
Н НН
7. Назовите алкин строения 1
Н3С — НС — СН2 СН3
I I I
С = С СН2 —С —СН3:
Н3С —С —СН3 СН3
СН3
1.) 2,2,5,8,8-пентаметилнонин-6;
2) 1,5-дитретбутилпентин-1;
3) 1,5-дитретбутилпентин-4;
4) 2,2,5,8,8-пентаметилнонин-З.
8. При взаимодействии гексина-3 с избытком раство-
ра Bi\ в СС14 конечным продуктом будет:
I) 3,3,4,4-тетрабромгексан,
2) 3,4-дибромгексен-3;
3) 2,3,4,4-тетрабромгексан;
4) 2,3,4,5-тетрабромгексан.
9. Пропин без примеси других углеводородов можно по-
лучить при взаимодействии избытка КОН (спирт, р-р) с:
1) 1,3-дибромпропаном; 2) 1,1-дибромпропаном;
3) 1-бромпропеном; 4) 1,2-дибромпропаном.
--- 597 ----
10.4-метилпентин-2 можно получить при взаимодей-
ствии:
1) 2,2,3,3-тетрабром-4-метилпентана с избытком цинка;
2) 2,3-дибром-4-метилпентана с избытком КОН (спирт,
р-р);
3) 1,1 -дибром-4-метилпентана с избытком КОН (спирт,
р-р);
4) 1,3-дибром-4-метилпентана с избытком КОН (спирт.
Р-Р).
ТЕСТ 5
1. Действием одного реагента из 1,1-дибромбутана
можно получить вещества строения:
1) СНВг = СН — СН, — СН,;
2) СН, = СН — СН = СН,;'
3) СН == С — СН, — СН3; ‘
4) СН3 — СН = СН — СН3.
2. Изомерами 4-метилпентина-1 будут:
1) пентин-2; 2) гексадиен-1,3;
3) 3-метилбутин-1; 4) циклогексен.
3. Веществом X в двухстадийном синтезе
СН — СН — СН^ —> X —» СН3 — С = СН могут быть:
1) СН3 — СН(ОН)СН3; 2) СН3 — СН(Вг) — СН3;
3) СН3 — СН(Вг) — СН,(Вг); 4) СН3 — СН — СН,.
ОН ОН
4. Назовите вещество X для превращения
СНз /СН3
х+Н£(Н2Н§Х н с_ с _ с _ СН _ СН
I II \СН
СН3 о 3
--- 598 ----
1) 2,5,5-триметилгексин-З; 2) 2,5,5,-триметилгексен-З;
3) 2,2,5-триметилгексин-З; 4) 2,2,5-триметилгексен-З.
5. Назовите вещество X для превращения
(основной продукт):
1)бутин-1; 2)бутин-2;
3) 2-бром-3-метилбутен-1; 4) 2-бром-3-метилбутен-2.
6. Назовите вещество X для превращения
Х + Вг2(изб.)
20°С '
Вг
1) 4-метилгексин-2;
3) 4-метилгексин-1;
Вг
Вг
2) 3-метилгексин-3;
4) 5-метилгексин-2.
7. Для осуществления одностадийных превращений
СН3 — СН2 — С = СН X СН3 — СВг2 — СН2 — СН3
—> СН3 — С = С — СН на стадиях 1 и 2 соответствен-
но следует воспользоваться реагентами:
1) НВг и Zn; 2) НВг и КОН (спирт);
3) Вгэ и КОН (спирт); 4) НВг и H2SO4 (конц.).
8. Для осуществления с наибольшим выходом одно-
стадийных превращений СН3 — СН2 — СНЭ — СН,С1 -С
А 4 Б Л СН3 — СН2 — С = СН на стадиях 1,2,3 соот-
ветственно следует воспользоваться реагентами:
1) КОН (спирт.), НВг, КОН (спирт.);
2) КОН (спирт.), Вг2, КОН (спирт.);
3) КОН (спирт.), Вг2, КОН (водн.);
4) КОН (водн.), Вг2, КОН (спирт.).
— 599 —
л тт V + H2O(H/Hg2l
9. Для превращения X------------»
веществом
X может быть:
1) бутин-2; 2) пропин;
3) бутин-1; 4) пентин-2.
10. В молекуле алкина число атомов углерода и водо-
рода различается на три. Изомерами этого алкина будут:
1). аллен; 2) изопрен;
3) циклопентен; 4) дивинил
ТЕСТ 6
1. Назовите по систематической номенклатуре алкин
строения (СН3)3С — С = С — СН(СН3)2:
1) 2,5,5-триметилгексин-З;
2) 2,2,5-триметилгексин-3;
3) 4-изопропил-2,2-диметилбутин-4;
4) изопропилтретбутилацетилен.
2. При действии различных количеств КОН (спирт р-р)
на вещество строения СН,Вг — СНВг — СН, — СН(СН3)2
можно получить:
1) 2-бром-4-метилпентен-1; 2) 1 -бром-4-метилпентен-1;
3) 1-бром-4-метилпентен-2; 4) 4-метилпентен-1.
3. В молекуле алкина число электронов в три раза
больше числа атомов. Сколько существует таких изомер-
ных алкинов?
1) один; 2) два; 3) три; 4) четыре.
4. Гомолог З-метилбутина-1— это:
1) гексадиен-1,3; 2) пентин-2;
3) 2-метилгептин-З; 4) циклопентен
--- 600 ---
5. При действии различных количеств КОН (спирт,
р-р) на вещество строения (СН,).СН — СВг2 — СН(СН3)2
можно получить:
1) 4,4-диметилпентадиен-1,2;
2) 3-бром-2,4-диметилпентен-2;
3) 2,4-диметилпентадиен-2,3;
4) 2-бром-2,4-диметилпентен-2.
6. На 1 -бром-3,3-диметилбутан последовательно по-
действовали спиртовым раствором КОН, раствором
брома в СС14, затем снова избытком спиртового раство-
ра КОН. В результате получилось вещество:
1) 3,3-диметилбутин-1; 2)3-метилбутин-1;
3) бутин-1; 4)3 -метилбутадиен-1,2.
7. Укажите формулы возможных конечных органичес-
ких веществ соответственно В и Г для цепочки превра-
щений, протекающих по схеме
СН3 — СН2 — СН2С1 ^Qh^-p-pU а +Вг-(ССЧ Б -»
+ КОН (спирт, р-р, из(х) в +H2O(H*/Hg2^ р.
1) снз — С = СН, снз — С — снз;
О
2) СН. = С = СН., СН — С — СН,;
у 2 27 3 д’
О
3) снз — С = СН, снз — СН. — СНО;
4) СН. = С = СН., СН. — СН — СН,.
у 2 2’3 з
ОН
8. Осуществить с наибольшим выходом превращение
СН — СНС1 — СН.С1 -» СН, — CI. — СН. можно по-
3 2 з 2 3
следовательным действием реактивов:
1) КОН(спирт.), HI; 2) КОН(спирт.), I.;
— 601
3) КОН(водн.), HI; 4) КОН(водн.), I,.
9. Осуществить с наибольшим выходом превращение
CHj—(СН,),—СНВг—сн3 ^сн3—СН,—с= с—сн3
можно последовательным действием реагентов:
1) КОН(водн.), НВг, КОН (спирт.);
2) КОН(спирт.), НВг, КОН(спирт.);
3) КОН(спирт.), Вг,, КОН(спирт.);
4) КОН(водн.), Вг„ КОН(спирт).
10. Смесь СО,, С,Н4и С,Н, вначале пропускают через
склянку с известковой водой, а затем через склянку с из-
бытком раствора брома в СС14. В последней склянке кроме
брома и СС14 будет находиться:
1) СО, и тетрабромэтан;
2) СО, и дибромэтан;
3) смесь этилена и ацетилена;
4) смесь 1,2-дибромэтана и 1,1,2,2-тетрабромэтана.
ТЕМА 45
Арены
ТЕСТ1
1. Для строения молекулы бензола справедливы ут-
верждения:
1) молекула плоская;
2) л-связь включает 6 электронов;
3) длина связи между атомами углерода в бензоле
меньше, чем в этене, но больше, чем в этине;
4) двойные связи находятся в сопряжении друг с другом.
— 602 —
2. Охарактеризуйте вещество строения
1) гомолог бензола;
2) изомер кумола;
3) называется 1,4-диметилбензол;
4) в молекуле 18 связей с-типа.
3. Гомологи бензола — это:
1) винилбензол; 2) бромбензол;
3) изопропилбензол; 4) 1,2-диметилбензол.
4. Укажите справедливые заключения относительно
химических свойств бензола:
1) возможны как реакции замещения, так и реакции
присоединения;
2) легко вступает в реакции присоединения при ком-
натной температуре;
3) с хлором может реагировать по типу реакций как
замещения, так и присоединения;
4) в реакции с нитрующей смесью в качестве основ-
ного продукта образует 1,2-динитробензол.
5. Получить нитробензол можно при взаимодействии
бензола и:
1) NaNO3; 2) HNO/H?SO4;
3) HNO2; 4) H2SO4/NaNO2.
6. Число изомерных диметилпроизводных бензола
равно:
1)5; 2) 2; 3)4; 4)3.
7. Укажите формулы веществ, которые могут относить-
ся к гомологам бензола:
1)С7Н8; 2)С,Н,2; 3) С8Н,,; 4)С10Н|4.
— 603 —
8. В каких парах оба вещества по отношению друг к
другу являются гомологами?
1) стирол и бензол;
2)толуол и бензол;
3)толуол и этилбензол;
4) бутилбензол и 1,2,3,4-тетраметилбензол.
9. При взаимодействии бензола со смесью концентри-
рованных HNO3 и H2SO4 преимущественно образуется:
1) 1,2-динитробензол;
2) нитробензол;
3) 1,2,3-тринитробензол;
4) 1,4-динитробензол.
10. Толуол отличается от бензола:
1) числом электронов в тг-системе;
2) химической активностью в реакциях замещения в
бензольном кольце;
3) числом G-связей в молекуле;
4) молярной массой.
ТЕСТ 2
1. Охарактеризуйте вещество
— СН = СН2:
1) называется винилбензол;
2) гомолог бензола;
3) обесцвечивает бромную воду;
4) вступает в реакцию полимеризации.
2. Сколько изомерных гомологов бензола отвечает
формуле С8Н10?
1)3; 2) 4; 3)5; 4) 6.
--- 604 ---
3. Укажите молярную массу гомолога бензола (г/моль),
в молекуле которого содержится 7 атомов углерода:
1) 98; 2) 96; 3) 100; 4) 92.
4. Вещество строения ci —(( ))— СН3 можно на-
звать: V—V
1) хлортолуол; 2) метилхлорбензол,
3) 1-метил-4-хлорбензол; 4) 1-хлор-4-метилбензол.
5. Бензол можно получить:
1) тримеризацией ацетилена;
2) дегидрированием циклогексана;
3) ароматизацией нефтепродуктов;
4) по реакции Лебедева из этанола.
6. По типу реакции замещения бензол может реаги-
ровать с:
1) галогенами; 2) кислородом,
3) азотной кислотой; 4) водородом.
7. Чтобы получить кумол, в реакцию с хлорбензолом
в присутствии натрия следует ввести:
1)С9Н5С1; 2)СН3С1;
3) СН3СН(С1)СН3; 4) СН3С(СН3)(С1)СН3.
8. В молекуле бензола сформированы:
1) три к-связи;
2) шесть о-связей;
3) одна шестиэлектронная л-система,
4) двенадцать а-связей
9. В реакциях бензола с какими веществами сохраня-
ется ти-система бензольного кольца?
1)водородом;
2) хлором в присутствии FeCl3;
3) хлором при освещении;
4) азотной кислотой в присутствии серной
— 605 —
10. В присутствии FeCl3 при взаимодействии бензо-
ла с хлором в основном образуется:
1) хлорбензол; 2) 1,2-дихлорбензол:
3) хлорциклогексан; 4) гексахлорбензол.
ТЕСТЗ
I. Охарактеризуйте вещество строения:
1) относится к классу аренов;
2) гомолог бензола;
3) называется 1-метил-4-этилбензол;
4) изомер стирола.
2. В каких парах оба вещества являются изомерами
по отношению друк к другу?
1) 1,2-диметилбензол и 1,4-диметилбензол;
2) 1-метил-3-этилбензол и пропилбензол;
3) винилбензол и этилбензол;
4) кумол и пропилбензол.
3. Укажите число изомерных трихлорбензолов:
1)2; 2)3; 3)4; 4)5.
4. Отметьте формулу фенильной группы:
1) СН, = СН —; 2) С6Н5СН, — ;
3)С6Н5-; 4)Н3С- С6Н4-.
5. Наибольшее химическое количество Н, может при-
соединить 1 моль:
1) пропина; 2) бензола; 3) бутадиена-1,3; 4) стирола.
6. Сколько различных изомеров имеет вещество, со-
держащее в бензольном ядре одну метильную группу и
один атом хлора?
— 606 —
1)2; 2)3; 3)4; 4)5.
7. Укажите схемы реакций присоединения:
8. Массовая доля углерода наименьшая в:
1) ацетилене; 2) бензоле; 3) этилене; 4) толуоле.
9. Арен может образоваться при:
1) тримеризации бутина-2;
2) дегидрировании метилциклогексана;
3) взаимодействии СН, — (СН,)4 — СН, и Zn;
Cl Cl
4) взаимодействии [T^J] и Ц-
10. С разрушением тс-системы бензола протекают про-
цессы:
1) хлорирование на свету;
2) бромирование в присутствии FeBr3;
3) гидрирование;
4) нитрование.
— 607 —
ТЕСТ 4
1. Укажите число изомерных тетрахлорбензолов:
1)2; 2)3; 3)4; 4)5.
2. Сколько различных монохлорпроизводных можно
получить при хлорировании 1,3,5-триметилбензола в
кольцо или метильные группы?
1)2; 2)3; 3)4; 4) 5.
3. В отличие от /тфанс-бутена-2 бензол НЕ может ре-
агировать с:
1)Н2; 2) НВг; 3)Вг2/СС14; 4)0,
4. Укажите число изомерных аренов состава С7Н7С1:
1)2; 2)3; 3)4; 4) 5.
5. Получая толуол, в реакцию Вюрца следует ввести:
1) бензол и метан; 2) хлорбензол и метан;
3) бензол и хлорметан; 4) хлорбензол и хлорметан.
6. Длина связи углерод — углерод последовательно
уменьшается в ряду соединений:
1) этин — этен — этан — бензол;
2) этан — бензол — этен — этин;
3) этен — этин — этан — бензол;
4) этан — этен — бензол — этин.
7. При гидрировании толуола образуется:
1) циклогексан; 2) метил циклогексан;
3) стирол; 4) кумол.
8. Гомологам бензола могут отвечать формулы:
1) С6Н5С1; 2) С7Н8; 3) С8Н№ 4) СДО.
9. Укажите формулы ароматических веществ:
10. Число G-связей в молекуле стирола равно:
1)12; 2)14; 3)15; 4) 16.
--- 608 ---
ТЕСТ 5
1. Назовите по систематической номенклатуре соеди-
нение ОД
Cl
1) 1-метил-3-нитро-4-хлорбензол;
2) 4-метил-2-нитро-1 -хлорбензол;
3) 1-нитро-5-метил-2-хлорбензол;
4) 1 -хлор-2-нитро-4-метилбензол.
2. Соединение
можно назвать как:
1) 6-бром-4-фенилоктан;
2) 4-фенил-6-бромоктан;
3) З-бром-5-фенилоктан;
4) 5-фенил-З-бромоктан.
3. Назовите соединение СН = СН? как про-
изводное стирола: /
СН3
1) 3-винилтолуол; 2) 4-метилстирол;
3) 1-винил-З-метилбензол; 4) 3-метилстирол.
4. Укажите формулу дифенилацетилена:
20 Зак. 1530
--- 609 ---
5. Выберите формулу 2-бром-4-метил-1 -фенилпента-
диена- 1,3:
6. Соединение, имеющее структуру |] , назы-
вается:
1) 4-бутил-2-метил-1 -этилбензол;
2) 1 -бутил-3-метил-4-этилбензол;
3) 2-метил-4-бутил-1-этилбензол;
4) 3-метил-1 -бутил-4-этилбензол.
7. При взаимодействии 1 моль стирола и 4 моль во-
дорода образуется:
1) этилбензол; 2) 1-этилциклогексен;
3) этилциклогексан; 4) 1-этилциклогексадиен-1,3.
8. При частичном гидрировании стирола могут обра-
зоваться вещества строения:
pQC з>СГ 4)СХ
9. Ароматическое соединение состава С8Н10, образу-
ющее три изомерных монохлорпроизводных при хло-
рировании в бензольное кольцо, может называться:
1) 1,3-диметилбензол; 2) 1,4-диметилбензол;
3) этилбензол; 4) 1,2-диметилбензол.
10. Укажите число изомерных аренов состава СдН]7:
1)10; 2)9; 3) 8; 4) 7.
— 610 —
ТЕСТ 6
1. При взаимодействии равных химических количеств
этилбензола и брома при УФ-освещении преимуще-
ственно образуется:
1) 2-бромэтилбензол; 2) 4-бромэтилбензол;
3) 1-бром-1-фенилэтан; 4) 1-бром-2-фенилэтан.
2. Подобно алканам бензол может вступать в реакции:
1) присоединения; 2) гидратации;
3) замещения; 4) окисления кислородом.
3. Получение бензола из циклогексана является ре-
акцией:
1) замещения; 2) дегидратации;
3) гидрирования; 4) дегидрирования.
4. Укажите число атомов Н в молекуле кумола:
1) 11; 2) 12; 3) 10; 4) 13.
5. Ближайший низший гомолог кумола — это:
1) пропилбензол; 2) толуол; 3) стирол; 4) этилбензол.
6. Укажите формулы гомологов бензола:
7. В молекуле бензола атомы водорода:
1) все неравноценны;
2) все равноценны;
3) равноценны в двух группах по три атома Н;
4) равноценны в трех группах по два атома II.
8. Чтобы превратить бензол в циклогексан нужно бен-
зол ввести в реакцию:
1)гидрирования;
3) дегидрирования;
2)окисления;
4) гидратации.
— 611
9. Стирол можно получить при взаимодействии:
1) 1-фенилэтанола и КОН (спирт, р-р);
2) 2-фенилэтанола и НВг;
3) 1-фенилэтанола и HoS04 (/ >140 С);
4) 1-бром-2-фенилэтана и КОН (спиртр-р).
10. Изомер бензилхлорида — это:
1)толуол; 2)хлорбензол;
3) 1-метил-4-хлорбензол; 4) стирол.
ТЕСТ 7
1. Укажите число электронов в л-системе антрацена:
ООО 1)6; 2) 14; 3) 18; 4) 20.
2. При взаимодействии толуола с хлором в зависи-
мости от условий можно получить вещества строения:
3. При взаимодействии бензола с 2-метилпропеном
в присутствии сильной кислоты преимущественно об-
разуется:
СН(СН3)2
— 612 —
СИ
ГН
4. Назовите промежуточное вещество Y в трехстадий-
ном синтезе по схеме 1-бромпропан X —> Y —> бен-
зол:
1) пропен; 2) пропин;
3) ацетилен; 4) циклогексан.
5. Бензол в одну стадию НЕЛЬЗЯ получить из:
1) ацетилена; 2) бензоата натрия (C6H.COONa);
3) циклогексана; 4) 1-бромпропана.
6. Какова общая формула гомологического ряда аро-
матических углеводородов, содержащих два бензольных
кольца, но не имеющих общих вершин?
ОСН, • 2)СН, ;
• ' п 2n-6, 7 п 2/1-14’
3)СН_2; 4) С Н2П(С6Н5)2-
7. Труднее (с меньшей скоростью), чем бензол, в реак-
ции замещения в бензольном ядре вступают соедине-
ния, формулы которых:
8. С избытком брома (раствор в СС14) соединение со-
става С Нэ (,Вг образуют вещества, один из представи-
телей гомологического ряда которых имеет формулу:
С^СН
2) нс = с — сн = сн — сн = сн2
--- 613 —
CH = сн2
4) нс = с —сн — сн—с=сн
9. Молекула гомолога бензола содержит 58 электро-
нов. Ближайший высший гомолог этого соединения на-
зывается:
1) этилбензол; 2) пропилбензол;
3) бутилбензол; 4) пентилбензол.
10. В молекуле углеводорода ряда аренов с одним бен-
зольным кольцом и одной двойной связью в боковой
цепи число атомов С равно числу атомов Н. Укажите
молярную массу (г/моль) этого арена:
1)110; 2) 104; 3) 108; 4) 106.
ТЕСТ 8
1. Газ, полученный в реакции толуола с хлором, про-
реагировал с 2-метилбутеном-1. При этом получили:
1) только 2-метил-2-хлорбутан;
2) только 2-метил- 1-хлорбутан;
3) смесь 2-метил-2-хлорбутана и 2-метил-1-хлорбу-
тана с преобладанием первого из указанных веществ;
4) смесь 2-метил-2-хлорбутана и 2-метил-1-хлорбу-
тана с преобладанием второго из указанных веществ.
2. Отметьте формулы гомологов бензола:
— 614 —
3. Укажите промежуточное вещество X в двухстадий-
ном синтезе по схеме 1,1-дибромэтан —> X —> бензол:
1) этан; 2) этен; 3) этин; 4) хлорэтен.
4. Отметьте промежуточные вещества соответствен-
но X и Y в трехстадийном синтезе, протекающем по схе-
ме С6Н6 —> X Y —> С6Н.СН,ОН (бензиловый спирт):
1) С6Н5С1, С6Н5ОН;
2) С ’Н5С1, С6Н5СН3;
3) С6Н.СН3, С6Н5СН,С1;
4) C,H.NO„ C,H,NH,.
5. Сколько электронов содержит л-система нафталина
1)6; 2) 8; 3) 10; 4) 12.
6. Сколько монобромпроизводных существует у наф-
талина (см. выше приведенную формулу)?
1) одно; 2) два; 3) три; 4) четыре.
7. Терефталевую кислоту можно получить окислением:
1) стирола; 2) толуола;
3) 1,2-диметилбензола; 4) 1,4-диметилбензола.
8. При сплавлении бензоата натрия (C6H.COONa) с
NaOH образуется:
1)стирол; 2)толуол;
3) бензол; 4) кумол.
9. Гексахлоран образуется при взаимодействии:
1) С6Н6 и Cl, (FeCl3); 2) С6Н6 и С1, (освещение);
3) C6HSCH3 и Cl2 (FeCl3); 4) СДСН, и Cl, (освещение)
10. При гидрировании бензола НЕЛЬЗЯ получить:
1) циклогексен; 2) циклогексан;
3) циклогексадиен-1,3; 4) циклогексадиен-1,2.
— 615 —
ТЕСТ 9
1. Укажите соединения, в молекулах которых все двой-
ные связи находятся в сопряжении:
2. Укажите формулу гомолога этилбензола:
4. В реакции между 1 моль бензола и 2 моль водорода
образуется:
1) гексан; 2) циклогексен;
3) циклогексадиен-1,3; 4) циклогексан.
5. Бензол в указанных условиях может взаимодейство-
вать с реагентами:
1) Вгэ(СС14), 20°С; 2) Вг, (FeBr3), 20 °C;
3) С12 (освещение); 4) СН3СН = СН2 (Н+, t°).
6. Стирол В ОТЛИЧИЕ от бензола может реагировать с:
1) О2; 2) Вг2(СС14); 3) НВг; 4) Н2 (кат., С).
---616 —
сн3
J^/F
7. Укажите название арена строения Г |Г :
Вг
1) 5-бром-1 -метил-2-фторбензол;
2) 4-бром-2-метил-1-фторбензол;
3) 1-бром-3-метил-4-фторбензол;
4) 3-бром-1-метил-6-фторбензол.
8. Бензол НЕ взаимодействует с реагентами:
1) КОН (Н,О); 2) КМпО4 (Н,О, 20 °C);
3) Н, (Kat, ?); 4) Вг2 (Н,О, 20 °C).
9. Сколько атомов углерода в молекуле — С = СН
находятся в одной плоскости?
1)8; 2) 7; 3)6; 4) 4.
10. При взаимодействии этилена с бензолом в при-
сутствии сильной кислоты образуется:
1) стирол; 2) смесь диметилбензолов;
3) этилбензол; 4) толуол.
ТЕСТЮ
1. Относительная плотность паров гомолога бензола
по аргону равна 3,00. Укажите формулу арена:
1)С7Н8; 2)С8Н,„; 3) С„Н,,; 4) С10Н14.
2. В реакцию присоединения бензол может вступать
с обоими реагентами:
1) Н, (Г°, Kat); Н,О; 2) Н, (Z°, Kat); Cl, (/?v);
3) Br, (Av); Cl, (FeCL); 4) HNO3 (H,SO4,>); Br2 (FeCL).
--- 617 ---
3. Сколько веществ изображено с помощью формул?
1) одно; 2) два; 3) три; 4) четыре.
4. Укажите число изомерных монобромпроизводных
1,3-диметилбензола, содержащих атом галогена в бен-
зольном кольце:
1)4; 2)3; 3)2; 4)1.
5. Все двойные связи находятся в сопряжении Друг с
другом в случае обеих молекул, формулы которых:
6. Укажите число изомерных монохлорпроизводных
1-гидрокси-4-метилбензола, содержащих галоген в бен-
зольном кольце:
1) один; 2) два; 3) три; 4) четыре.
7. Число атомов углерода п в молекуле гомолога бен-
зола и суммарное число электронов и протонов в ней 7V
связывает формула:
l)N = 8/?-6; 2) N = 8/7 + 6;
3)N= 16/7- 12; 4) N = 16/7 + 12.
8. Укажите число изомерных монобромпроизводных
1-гидрокси-З-этилбензола, содержащих галоген в бен-
зольном кольце:
1) четыре; 2) три; 3) два; 4) один.
— 618 —
9. С наименьшей скоростью с водой в присутствии
щелочи взаимодействует арен, формула которого:
— СН2С1;
10. При взаимодействии между собой трех молекул
пропина могут образоваться арены:
1) 1,2,3-триметилбензол; 2) стирол;
3) 1,2,4-триметилбензол; 4) 1,3,5-триметилбензол.
ТЕМА 46
Комбинированные задания
по теме «Углеводороды.
Природные источники углеводородов.
Связь между углеводородами»
ТЕСТ1
1. При гидратации пропена в присутствии серной
кислоты в основном образуется:
1) пропанол-1; 2) пропаналь;
3) виниловый спирт; 4) пропанол-2.
2. При окислении этена в различных условиях можно
получить:
1) этандиол-1,2; 2) оксид этилена;
3) этаналь; 4) глицерин.
— 619 —
3. В реакцию полимеризации вступают:
1)стирол; 2) винилхлорид;
3) пентадиен-1,3; 4) полиизопрен.
4. Бромэтан НЕЛЬЗЯ получить при взаимодействии:
1) этана с бромоводородом;
2) этилена с раствором брома в четыреххлористом
углероде;
3) этана с бромом (7°, освещение);
4) этилена с бромоводородом.
5. Какая формула связывает общее число связей /V в
молекулах алканов и число атомов углерода п в молеку-
ле?
1) N = 4и; 2) /V = Зп + 2; 3) N = Зп + 1; 4) N = Зп - 1.
6. Назовите по систематической номенклатуре веще-
ство строения (С2Н5)2СН(С2Н5):
Вг
1) диэтилбромметан; 2) 3-бромпентан;
3) 3-бромбутан; 4) 2-бромпентан.
7. При действии спиртового раствора щелочи на мо-
ногалогенпроизводные алканов преимущественно об-
разуются:
1)алкины; 2) спирты;
3) алкены; 4) алканы.
8. По типу реакции присоединения хлор может реа-
гировать с:
1) бензолом; 2) гексаном;
3) пропеном; 4) циклогексеном.
9. Все атомы углерода являются вторичными в мо-
лекуле:
1) 2-метилпентана;
2) 2,2-диметилциклобутана;
— 620 —
3) циклобутана;
4) 2,2-диметилпропана.
10. Укажите название по систематической номенкла-
туре арена строения
СН3
Хф-
СН3
1) 1,4-диметил-5-этилбензол;
2) 2-этил-1,4-диметилбензол;
3) 1,4-диметил-З -этилбензол;
4) 1,4-лиметил-2-этилбензол.
ТЕСТ 2
1. Метил бен зо л может взаимодействовать с реагентами:
1) KMnO4 (H9SO4, t°); 2) Нэ (t°, Kat);
3)Cl,(hv); ~ 4)HBr(H2O).
2. Массовая доля атомов углерода одинаковая в угле-
водородах:
1) метан; 2) этен; 3) этин; 4) бензол.
3. С бромной водой НЕ реагируют:
1) пропен; 2) бутан;
3) пропин; 4) метилциклогексан.
4. Пространственную (цис-, транс-) изомерию про-
являют:
1) 1,1-дихлорэтен; 2) 2-метилбутен-2;
3) пентен-2; 4) 1-хлор-2-метилбутен-1.
5. НЕПРАВИЛЬНО названы алканы:
1) метилпентан; 2) 4-бутилпентан;
3) 4-метилпентан; 4) 4-изопропилгептан.
— 621 —
6. Какие вещества химическим количеством 1 моль
максимально присоединяют бром химическим количе-
ством 2 моль?
1) изопрен; 2) бутен-2; 3) бутин-1; 4) стирол.
7. Циклогексен можно превратить в бромциклогек-
сан действием:
1) водорода; 2) брома;
3) бромоводорода; 4) водного раствора КМпО4.
8. Энантиомеры возможны для:
1) пропана; 2) 3-метилгексана;
3)2-бром-2-хлорбутана; 4) циклопропана.
9. Назовите алкин строения
СН3
НС&-:
СН2С1
1) 6-хлор-5-метилгексин-1; 2) 2-метил-1-хлоргексин-2;
3) 5-метил-6-хлоргексин-1; 4) 1-хлор-2-метилгексин-2.
10. С раствором брома в СС14 реагируют:
1) 3-метилциклопентен; 2) толуол; 3) бензол; 4) стирол.
ТЕСТЗ
1. При окислении пропена холодным водным раство-
ром КМпО4 образуется:
1) кислота; 2) спирт; 3) альдегид; 4) простой эфир.
2. Дихлорметан образуется при взаимодействии С12 и:
1) • СН3; 2) • СНС13; 3) • СС13; 4) • СН,С1.
3. НЕ проявляют ине-, транс-изомерию соединения:
1) пентен-2; 2) бутен-1;
3) 1,1-диметилциклопропан; 4) 2-метилпропен.
4. Окраска бромной воды усилится, если через нее
пропускать:
1) метан; 2) этен; 3) хлор; 4) ацетилен.
— 622 —
5. НЕ могут полимеризоваться:
1) 2-хлорбутан; 2) пропилен; 3) пропан; 4) стирол.
6. Укажите алкан, 1 моль которого содержит в сумме
8,428 • 1024 атомов С и Н:
1) бутан; 2) пропан; 3) этан; 4) метан.
7. Укажите число структурных изомеров состава С7Н16:
1)9; 2)8; 3)7; 4) 6.
8. Дцетилен в лаборатории в основном получают:
1) крекингом этана;
2) дегидрированием этилена;
3) взаимодействием карбида кальция с водой;
4) прямым синтезом из углерода и водорода.
9. Этилен в лаборатории получают-
1) гидрированием этана;
2) дегидрированием бутана;
3) нагреванием этанола с концентрированной серной
кислотой;
4) крекингом нефтепродуктов.
10. Для описания нефти подходят утверждения:
1) не имеет определенной температуры кипения;
2) смесь различных веществ;
3) хорошо смешивается с водой;
4) путем фильтрования разделяется на отдельные
фракции.
ТЕСТ 4
1. Простейший углеводород с двумя двойными связя-
ми называется:
1) этин; 2) этен; 3) аллен; 4) бутадиен-1,3.
2. Укажите формулу радикала винила:
1) СН3СН7—; 2) СН = С —;
--- 623 ----
3) сн2 = СН — 4) снз —
3. При термическом крекинге нефтепродуктов проте-
кает реакция:
1) гидратации;
2)хлорирования;
3) разрыва связей углерод — углерод;
4) дегидрогалогенирования.
4. Укажите число л-связей в молекуле винилацетилена:
1) четыре; 2) три; 3) две; 4) одна.
5. Общей формулой С Н выражается состав:
1) гомологов стирола; 2) циклоалкенов;
3)алкинов, 4)алкадиенов.
6. Как изменяется длина связи углерод — углерод в
ряду этан — этин — этен?
1) увеличивается;
2) сначала увеличивается, затем уменьшается;
3) уменьшается;
4) сначала уменьшается, а затем увеличивается.
7. При каталитической изомеризации алкана может
максимально образоваться три различных (не считая
исходный алкан) продукта. Назовите алкан:
1) бутан; 2) пентан, 3) гексан; 4) гептан.
8. При хлорировании смеси двух алканов получили
всего четыре различных монохлорироизводных. Хлори-
рованнию подвергалась смесь:
1)2-метилбутана и пентана,
2) 2-метилбутана и 2,2-диметилпропана;
3) пентана и 2,2-диметилпропана;
4) пропана и 2,2-диметилпропана.
9. При взаимодействии бензола с хлором на свету
образуется:
1) хлорбензол;
2) 1,2,3,4,5,6-гексахлорциклогексан;
--- 624 ---
3) 1,2,3,4,5,6-гексахлорбензол;
4) гексахлоран.
10. К одному классу органических веществ относятся
все изомеры состава:
1)С4Н8; 2)С4Н,о; 3) СД 4) СД
ТЕСТ 5
1. По отношению друг к другу изомерами являются:
1) 1,2-диметилциклогексан и 1,2-диметилбензол;
2) 1,3,5-триметилбензол и пропилбензол;
3) 2-бромгексан и 1,2-дибромгексан;
4) бутадиен-1,3 и бутин-2.
2. Гомологический ряд углеводородов, представите-
лем которых является аллен, называется:
1) арены; 2) циклоалкены; 3) диены; 4) алкины.
3. Укажите молекулярную формулу углеводорода ряда
циклоалкенов, содержащего 5 атомов углерода:
1)СД 2) С5Н,О;3)С5Н|2; 4) СД
4. Способ получения мономера для синтетического
каучука по методу С. В. Лебедева отражает уравнение:
1) 2СДОН -> С4Н6 + Н7 + 2Н7О;
2) С4Н,„ СД СД
3) С4Н|0 —> СД + 2Н,;
4) 2СН, = СНС1 + 2Na -> СД + 2NaCl.
5. Метан может реагировать с:
1) соляной кислотой;
2) водным раствором гидроксида натрия;
3) хлором при освещении ультрафиолетовым светом;
4) водным раствором КМпО4.
6. В одной плоскости все атомы С и Н лежат в молекулах:
1) этина; 2) бензола; 3) этена; 4) пропина.
--- 625 ----
7. Бромную воду обесцвечивают:
1) полиэтилен; 2) циклогексен;
3) пропин; 4) гщс-бутен-2.
8. При действии водного раствора КМпО4 окислению
подвергаются:
1) этан; 2) стирол; 3) полиэтилен; 4) бутадиен-1,3.
9. Какое вещество (вещества) нужно ввести в реак-
цию Вюрца, чтобы органическим продуктом был толь-
ко 2,2,3,3-тетраметилбутан?
1) хлорметан и 2,2,3-триметил-3-хлорбутан;
2) изопропилхлорид;
3) 2-метил-2-хлорпропан;
4) хлорэтан и 2-метил-2-хлорпропан.
10. Некоторое органическое вещество обесцвечивает
раствор КМпО4 (при нагревании), вступает в реакцию с
хлором, но не реагирует с хлороводородом. Укажите
название вещества:
1) пентан; 2) толуол; 3) стирол; 4) октадиен-1,3.
ТЕСТ 6
1. Для сжигания порции алкана, содержащей 1 • 1023
молекул, требуется порция кислорода, содержащая 1,6 •
1024 атомов. Укажите число изомерных алканов, удов-
летворяющих условию задачи:
1) два; 2) три; 3) пять; 4) семь.
2. Как изменяется температура кипения алканов в ряду
пропан пентан —-> октан?
1)возрастает;
2) уменьшается;
3) сначала возрастает, затем уменьшается;
4) сначала уменьшается, затем возрастает.
— 626 —
3. Укажите формулу несуществующего углеводорода:
1)С,ОНМ; 2)С10Н20; 3) С,ОН24; 4) C,0H,g.
4. Изопрен является представителем гомологическо-
го ряда:
1) диенов; 2) алкенов; 3) циклоалкенов; 4) алкинов.
5. Отметьте уравнение реакции Кучерова:
1)ЗСН = СН^С6Н6;
2) СН == СН + НЭО -н>неХ СНОСНО;
3) СНЭ = СНЭ + Н?О Ж СДОН;
4) СН = СН + 2Н, С Д’
6. Наименьшей устойчивостью к детонации обладают:
1) арены; 2) циклоалканы;
3) алканы неразветвленного строения;
4) алканы разветвленного строения.
7. На сгорание 0,10 моль циклоалкана затрачен кис-
лород химическим количеством 0,45 моль (образуются
СО2 и НЭО). Укажите формулу углеводорода:
1) С4Н8; 2) СН,,,; 3) С,Д; 4) С6Н|2.
8. При окислении этилена холодным водным раство-
ром КМпО4 образуется:
1) уксусная кислота; 2) этиленгликоль;
3) глицерин; 4) ацетальдегид.
9. Пространственно упорядоченные полимеры на-
зываются:
1) резиной; 2) стереорегулярными;
3) стереоизомерами; 4) этантиомерами.
10. Аллен можно получить при взаимодействии
КОН(спирт. р-р) и:
1) 1,1-дибромпропана; 2) 1,3-дибромпропана;
3) 1-бромпропана; 4) 2-бромпропана.
--- 627 ---
ТЕСТ 7
1. Укажите название по систематической номенкла-
туре вещества следующего строения
СИ3
снз — С — СН, — СН3:
С = СН
1)3 -метил-3 -этилбутин-1;
2) диметилэтилацетилен,
3) 3,3-Диметилпентин-4;
4)3,3 - диметилпентин-1.
2. При крекинге бутана НЕ может образоваться:
1)этен; 2) изобутан; 3)2-метилпентан; 4)этан.
3. Средняя степень полимеризации полиэтилена со
средней относительной молекулярной массой 1400
равна:
1) 25; 2) 50; 3) 75; 4) 100.
4. Укажите сумму коэффициентов в окислительно вос-
становительной реакции между циклогексеном и вод-
ным раствором КМпО4:
1)7; 2) 9; 3) 16; 4)24.
5. В виде цис-, транс- изомеров могут существовать
диены строения:
1) СО, = СН — СН = СН,;
С1
2) СНС1 = С — СН = СН,
3)Н,С = С —С = СНВг;“
СН3 Вг
4) Н2С = СН — СН = СН — СН3
--- 628 ----
6. Относительно строения молекулы бензола справед-
ливы утверждения:
1) все связи между атомами углерода имеют одинако-
вую длину;
2) длина связи между атомами углерода больше, чем в
молекуле ацетилена, но меньше, чем в молекуле этилена;
3) ядра всех атомов углерода и водорода лежат в од-
ной плоскости;
4) энергия связи между атомами углерода больше, чем
в молекуле этана, но меньше, чем в молекуле этена.
7. Бензин, имеющий октановое число 72, допускает
такое же сжатие в цилиндре, как:
1)изооктан;
2) смесь из 72% изооктана и 28% гептана;
3) смесь из 72% 2,2,4-триметилпентана и 28% гептана;
4) гептан.
8. Какие углеводороды преимущественно входят в
состав нефти различных месторождений?
1) алкины; 2) циклоалканы; 3) арены; 4) алканы.
9. Укажите химические процессы:
1) перегонка нефти;
2) термический крекинг фракций нефти;
3) каталитический крекинг фракций нефти;
4) разделение природного газа на отдельные фракции
повышением давления.
10. Укажите число изомерных диенов состава С Н5Вг
(без учета энантиомеров):
1)7; 2) 6, 3)5; 4) 4.
--- 629 ---
ТЕСТ 8
1. Сколько веществ представлено формулами?
СН сн, —сн3 сн3 сн2 —сн3
ill Г II
С —СН2 —СН2 С^С-СН,
сн=с—сн,—сн2—сн2—сн3
с—сн,
I
СН3 —С сн2 —сн3
1)1; 2) 2; 3)3; 4) 4.
2. С бромом при комнатной температуре в отсутствие
катализатора реагируют:
1) изопрен; 2) бензол; 3) стирол; 4) бутадиен-1,3.
З.НЕ имеет структурных изомеров:
1) пропин; 2) бутадиен-1,3; 3) пропан; 4) пропен.
4. Укажите справедливые утверждения:
1) бензин каталитического крекинга более устойчив к
детонации, чем бензин прямой перегонки;
2) при каталитическом крекинге нефтепродуктов про-
исходит изомеризация углеводородов;
3) октановое число бензина при каталитическом кре-
кинге нефтепродуктов понижается;
4) перегонка нефтепродуктов сопровождается их аро-
матизацией.
5. Укажите названия веществ, проявляющих цис-,
/ирянс-изомерию:
1) 1,1-диметилциклопропан;
2) 1,2-дихлорпропен;
3) 1,1-дихлорпентен-2;
4) 1,4-дихлорбутадиен-1,3.
— 630 —
6. Алкен можно получить:
1) крекингом пентана;
2) взаимодействием 1-хлорпропана со спиртовым
раствором КОН;
3) дегалогенированием 1,2-дихлорэтана;
4) взаимодействием 1 моль пропина с 2 моль водорода.
7. Понижением давления из природного газа выделяют:
1) бензин; 2) смесь пропана и бутана;
3) лигроин; 4) керосин.
8. Укажите верные утверждения. В ходе реакции меж-
ду пропеном и бромоводородом:
1) образуется карбкатион;
2) разрывается су-связь;
3) образуются насыщенные соединения;
4) изменяются валентные углы.
9. При изомеризации октана НЕ могут быть получе-
ны вещества:
1) декан; 2) 2,3 -диметил гекс ан;
3) 2-метилнонан; 4) 2,3,4-триметилпентан.
10. Для получения 2,2,3-триметилпентана в реакцию
с NaOH следует ввести:
1) C(CH3)3CH(CH3)COONa;
2) C(CH3)3CH(CH3)CH9CH,COONa;
3) C(CH3)3CH9CH,CO6Naf
4) C(CH3)3C(CH3)2CH9COONa.
ТЕСТ 9
1. Массовая доля какого вещества наибольшая в сме-
си, полученной при монобромировании 2-метилбутана?
1) 1-бром-2-метилбутана;
2) 2-бром-2-метилбутана;
— 631 —
3) 1-бром-3-метилбутана;
4) 2-бром-З-метилбутана.
2. Укажите число изомеров состава С4Н8:
1)6; 2) 5; 3)4; 4)3.
3. Укажите правильные утверждения:
1) все алканы при н.у. являются жидкостями;
2) для алканов невозможны реакции присоединения;
3) алканы плохо растворимы в воде, хорошо — в гексане;
4) алканы нормального строения имеют более высо-
кие температуры кипения, чем изомерные им алканы раз-
ветвленного строения.
4. Пропан может образоваться при гидрировании:
1) бензола; 2) циклопропана;
3) пропина; 4) аллена.
5. Для получения циклогексана в одну стадию можно
использовать:
1) гексан; 2) бензол;
3) 1,5-дибромгексан; 4) 1,6-дихлоргексан.
6. Устойчивость бензина к детонации можно повы-
сить добавлением к нему:
1) гексана; 2) толуола;
3) тетраэтилсвинца; 4) изооктана.
7. Укажите пары, в которых углеводороды по отно-
шению друг к другу являются изомерами:
1) гексан и 2-метилпентан;
2) бутан и циклобутан;
3) 1-хлорпропан и 2-хлорпропан;
4) пентен-1 и метилциклобутан.
8. Какие из изомерных алкенов при взаимодействии
с хлороводородом образуют 2-хлор-2-метилбутан?
1) 2-метилбутен-2; 2) пентен-1;
3)3 -метилбутен-1; 4) 2-метилбутен-1.
— 632 —
9. Укажите число структурных изомеров состава С5Ы (Вг:
1) 11; 2) 10; 3)9; 4) 8. ”
10. 2-метилпропен может реагировать с:
1) метаном; 2) водой;
3) раствором брома с СС14; 4) этеном.
ТЕСТ 10
1. Углеводород состава С4Н6, который после реакции с
Вг/СС14 образует 1,4-дибромбутен-2, относится к классу:
1)алкенов; 2)алкинов;
3) диенов; 4) аренов.
2. Укажите сумму коэффициентов в окислительно-
восстановительной реакции, протекающей по схеме
CrHs — СН + КМпО -> СИ — COOK + МпО. +
+ КОН + НЭО:
1)8;2)7;3) 6; 4)5.
3. К реакциям присоединения относятся:
1) бромирование бензола в присутствии FeBr3;
2) хлорирование бензола при освещении;
3) хлорирование пропана при нагревании;
4) гидратация этилена.
4. Укажите число диенов состава С.Н8, при полиме-
ризации которых образуется каучук:
1) четыре; 2) три; 3) два; 4) один.
5. Кратная связь неполярна в молекулах:
— 633 —
6. Средняя степень полимеризации поливинилхло-
рида со средней относительной молекулярной массой
12 500 равна:
1)20; 2) 50; 3) 100; 4)200.
7. Ароматическая структура гомологов бензола может
сохраняться в реакциях:
1) отщепления; 2) замещения;
3) окисления; 4) присоединения.
8. Методом электронного баланса расставьте коэффи-
циенты и укажите их сумму для окислительно-восста-
новительной реакции, протекающей по схеме
толуол + KMnO4 + H2SO4 -» бензойная кислота +
+ MnSO4 + K,SO4 + НЭО: ‘
1)20; 2) 28; 3)38; 4) 48.
9. Промежуточными продуктами реакции бутадиена-1,3
с раствором брома в СС14 НЕ могут быть:
1) 1,4-дибромбутен-2; 2) 2,3-дибромбутен-1;
3) 3,4-дибромбутен-1; 4) 2,4-дибромбутен-1.
10. Дегидрирование — это:
1) присоединение водорода;
2) присоединение воды;
3) отщепление галогеноводорода;
4) отщепление водорода.
ТЕСТИ
1. Бромную воду обесцвечивают:
1)стирол; 2) поливинилхлорид;
3) циклобутен; 4) 2-метилгептин-З.
2. В состав природного газа НЕ входит:
1) пропан; 2) метан;
3) циклогексан; 4) этан.
— 634 —
3. Укажите формулу гомолога бутадиена, содержаще-
го 8 атомов водорода:
1)С3Н8;2)С4Н8,3)С5Н8;4)С6Н,
4. Одинаковую массовую долю атомов углерода имеют:
1) этан; 2) этилен; 3) ацетилен; 4) бензол.
5. Укажите формулу газа, при добавлении которого к
смеси равных объемов СН4 и С0о плотность получен-
ной смеси возрастает:
1)NO; 2)N2; 3) С4Н10; 4) С2Н4
6. Укажите вещество, на сжигание 1 моль которого
требуется 7,5 моль кислорода:
1)толуол; 2)бензол; 3)ацетилен; 4)этан.
7. Пропан может образоваться при:
1) взаимодействии CH3CH?COONa и NaOH (/°);
2) взаимодействии CH3CH7CH?COONa и NaOH (/°);
3) крекинге СбН14;
4) взаимодействии 1 моль пропина и 1 моль Н?.
8. В реакцию гидратации могут вступать:
1) бутен-1; 2) толуол;
3) пропан; 4) ацетилен
9. С какими углеводородами реагирует бромоводород?
1) бутен-1; 2) бутан; 3) стирол; 4) циклогексен.
10. Укажите число изомерных соединений состава
C?H,(F)(C1):
1)2; 2)3; 3)4; 4)5.
ТЕСТ 12
1. Для осуществления превращения
С Н , , Вг -э CFL используют реагент:
1) КМпО4 (Н76, 5°С); 2) КОН (НПО);
3) КОН (спирт); 4) H2SO4 (конц ), t >140 °C.
— 635 —
2. В молекулах каких веществ все химические связи
о-типа?
1) этан; 2) бензол; 3) циклогексен; 4) циклопентан.
3. Укажите число о-связей в молекуле толуола:
1) 13; 2) 15; 3)28; 4) 10.
4. Для какого из веществ, описываемых приведенны-
ми формулами, НЕ МОЖЕТ быть цис-, транс-нзом&рии’.
АН АН
1) С = С 2)
НА В А
АН АВ
3) С = С 4) С = С^
АВ В Г
5. Укажите формулу, которая связывает число элект-
ронов Л'(с) в молекулах гомологов стирола с числом ато-
мов углерода п в молекуле гомолога:
1) А(е) = 8л - 4; 2) А(е) = 8/7 - 6;
3) А(е) = 8л - 8; 4) А(е) = 8/7-10.
6. Отметьте названия изомеров пентина-1:
1) 2-метилбутадиен-1,3; 2) циклопентен;
3) 4-метилпентин-2; 4) З-метилбутин-1.
7. Какой углеводород имеет шесть изомеров нецик-
лического строения?
1) С4Н8; 2) С5Н,„; 3) С6Н|2; 4) С5Н8.
8. Укажите структурные формулы одного и того же
вещества:
— 636 —
3) С(СН3),СН,С(СН3)3 и
9. Учитывая, что реакция присоединения к алкенам
протекает тем легче, чем большая электронная плотность
сосредоточена между атомами С, связанными двойной
связью, укажите формулу алкена, которой реагирует с НВг
с наибольшей скоростью:
1) СН2= СН2; 2) CF3 — СН = СН2;
СН сн
3)СН3-СН = СН2; 4) зХС = С< -
СН3Х хсн3
10. Полимер с мономерным звеном С Н получают
из мономеров, названия которых:
1) 3,3-диметилбутен-1; 2) 2,3-диметилбутадиен-1,3;
3) 2,2-диметилбутан; 4) 2-метилпентадиен-1,3.
ТЕСТ 13
1. Состав мономерного звена полимера C5Hg. Такой
полимер при полимеризации могут дать углеводороды:
1) 3-метилбутен-1; 2) 2-метилбутен-2;
3) пентадиен-1,3; 4) 2-метилбутадиен-1,3.
2. С какими веществами при определенных условиях
реагируют и толуол, и пропен?
1)вода; 2) водород;
3) бромоводород; 4) бром.
— 637 —
3. При полном гидрировании смеси цис-бутена-2 и
бутена-1 избытком водорода образуется:
1) смесь щ/с-бутена-2 и бутана;
2) бутан;
3) смесь транс-бутена-2 и бутена-1;
4) смесь иис-бутена-2 и транс-бутена-2.
4. При полном гидрировании смеси циклопропана и
циклобутана избытком водорода образуется:
1) только циклобутан; 2) только бутан;
3) только пропан; 4) смесь бутана и пропана.
5. Из каких веществ в одну стадию можно получить
изопрен?
1)этанол; 2)2-метилбутан;
3) 2-метилбутен-1; 4) 3 -метил-4-хлорбутен-1.
6. Только одно моногалогенпроизводное образуется
при хлорировании:
1)2-метилбутана;
2) 2,2-диметилпропана;
3 ) 1,2,3,4,5,6-гексамети лбензола;
4) метилциклогексана.
7. Вещество состава С Н Вг образуется, когда с из-
бытком НВг реагируют:
1) алкены; 2) алкины;
3) диены; 4) гомологи стирола.
8. В каком ряду приведены названия веществ, все из
которых обладают цис-, -ш/?янс-изомерией?
1) пентен-1, пентен-2, гексен-3;
2) 1,1-дихлорэтен, 1,2-дихлорэтен, винилхлорид;
3) 1,2-дихлорпропен, 1,3-дихлорпропен, 2,3-дихлор-
бутен-2;
4) 1-хлор-2-метилбутен-1, 3-хлор-2-метилбутен-2,
гексен-2.
--- 638 ---
9. Все вещества являются гомологами по отношению
друг к другу в ряду:
1) 2,3-Диметилбутен-2, 2-метилбутен-2, 2-метилбутен-1;
2) пропан, бутан, метилциклогексан;
3) пропен, циклопропан, 2-метилпентен-1;
4) 2,3-диметилбутен-2,2-метилбутен-З, /я/ганс-бутен-2.
10. Все вещества являются структурными изомерами
по отношению друг к другу в рядах:
1) 1,2-дихлорэтен, 1,1-дихлорэтен, 1,1,2-трихлорэтен;
2) пентен-2, этилциклопропан, метилциклобутан;
3) 1-метил-2-хлорциклопропан, 2-хлорбутен-1, 3-
хлорбутен-1;
4) гексен-1,2-метилпентен-2,1,2-диметилциклопропан.
ТЕСТ 14
1. Кратные связи могут отсутствовать в соединении
состава:
1) С3Н4; 2) С3Н6; 3) С6Н6; 4) С7Н,„.
2. Мономерное звено полимера С Д£1. Такой поли-
мер может образоваться при полимеризации:
1)1 -хлорбутена-1; 2)1 -хлорбутадиена-1,3;
3)1,2-дихлорбутадиена-1,3; 4) 2-хлорбутадиена-1,3.
3. Водный раствор КМпО4 обесцвечивают:
1) стирол; 2) пропин; 3) циклогексан; 4) бутен-2.
4. Углеводород состава С8Н[0 в реакции с азотной кис-
лотой в мольном отношении 1 : 1 в присутствии H2SO4
образует единственный продукт, а при окислении пер-
манганатом калия — соединение состава С8Н О . Ука-
жите название исходного углеводорода:
1) этилбензол; 2) 1,2-диметилбензол;
3) 1,4-диметилбензол; 4) кумол.
— 639 —
5. Укажите наиболее правильную структуру углерод-
ного скелета бутена-1:
1)С = С —С —С
2)С = С —С
120°^ £
3) С = С -109° С
-120°^
С ~120°
-120° С _С
6. При взаимодействии циклопропана с бромом по
типу реакции присоединения образуется:
1) 1,2-дибромпропан; 2) 1,3-дибромпропан;
3) 1,2-дибромциклопропан; 4) 1,3-дибромциклопропан.
7. Укажите формулу газа, при добавлении которого к
смеси равных объемов метана и пропина плотность сме-
си не изменится:
1)СО2; 2)N2; 3) О2; 4) Н2.
8. Циклобутан можно получить:
1) гидрированием бензола;
2) дегидрированием гексана;
3) взаимодействием 1,4-дибромбутана с цинком;
4) одновременным дегидрированием и циклизацией
бутана.
9. При взаимодействии цинка с 1,3-дибромбутаном
образуется:
1) циклобутан; 2) метилциклопропан;
3) циклопропан; 4) циклопентан.
10. Тетраэтилсвинец добавляют к моторному топли-
ву с целью:
1) понижения его устойчивости к детонации;
2) повышения детонационной стойкости;
3) понижения температуры замерзания топлива в
странах с холодным климатом;
4) очистки продуктов сгорания топлива от вредных
веществ.
— 640 —
ТЕСТ 15
1. Укажите число а—связей в молекуле винилацетилена:
1)5; 2) 6, 3) 7; 4)8.
2. При взаимодействии смеси хлорэтана и 1-хлор-
пропана с избытком натрия образуются:
1) пентан; 2) гексан; 3) бутан; 4) гептан.
3. Укажите названия веществ, которые реагируют с
водородом, но не реагируют с бромоводородом:
1) этилен; 2) бензол, 3) пропин, 4) толуол.
4. Какая фракция перегонки нефти имеет самую низ-
кую температуру кипения?
1) петролейный эфир; 2) лигроин;
3) керосин; 4) газоль.
5. Сколько изомерных диенов содержат в молекуле 38
электронов (без учета энантиомеров):
1) восемь, 2) семь; 3) шесть; 4) пять.
6. Для осуществления превращения СиН9и ( [ОН —>
—> С Н следует воспользоваться реагентом:
1)КМпО4(Н2О),
2) H9SO4 (конц.),/> 140 °C;
3) КОН (Н2О),
4) КОН (спирт, р-р).
7. Укажите число структурных изомеров состава CJ LCL,:
1)2; 2)3; 3)4; 4)5.
8. Укажите общую формулу углеводорода нециклическо-
го строения, содержащего х двойных связей и у—тройных:
1)СН,(, , 2)СН
3) с H2w+2_2vi4r, 4) с н2и+2_2г_б;
9. При взаимодействии 1 моль винилацетилена и
I моль хлороводорода можно получить:
1) хлоропрен; 2) изопрен;
3) хлоропреновый каучук; 4) 2-хлорбутадиен-1,3.
21 Зак 1530
----- 641
10. Детонацией называется:
1) смесь жидких и твердых углеводородов;
2) взрывное сгорание моторного топлива;
3) одна из фракций прямой перегонки нефти;
4) один из компонентов моторного топлива.
ТЕСТ 16
1. При взаимодействии вещества X с избытком НС1 в
основном образуется 3-метил-2,2-дихлорбутан. Вещество
X — это:
1) 3-метил-1 -хлорбутен-1; 2) 3-метил-3-хлорбутен-1;
3) З-метилбутин-1; 4) 2-метилбутен-2.
2. Число о-связей в молекуле циклогексадиена-1,3:
1) 11; 2) 12; 3) 13; 4) 14.
3. Для осуществления с наибольшим выходом превра-
щения СН3 — СН2 — СНВг2 -> СН3 — СС12 — СНС12
следует воспользоваться:
1) КОН(спирт.р-р), С12; 2) КОН(спирт.р-р), НС1;
3) H2SO4(kohh., Z°), СЦ 4) Н28О4(конц., Z°), НС1.
4. В качестве катализатора при получении алкенов из
спиртов в лаборатории используют:
1) никель;
2) спиртовой раствор щелочи;
3) водный раствор щелочи;
4) концентрированную серную кислоту.
5. Массовая доля атомов углерода в циклоалкене рав-
на 0,889. Укажите формулу углеводорода:
1) С3Н4; 2) С4Н6; 3) С5Н8; 4) С6Н,„.
6. Переход С Н Вг2 С Н2 (ОН)2 можно осуществить
с помощью реагента:
1) КМпО4 (Н,О); 2) КОН(спирт. р-р);
--- 642 ---
3) KOH (Н2О); 4) H2SO4(kohu., t > 140 °C).
7. Молекула алкена содержит 24 электрона. Укажите
название алкена:
1) этен; 2) пропен; 3) бутен-1; 4) пентен-2.
8. Охарактеризуйте нефть:
1) легче воды;
2) хорошо растворима в воде;
3) имеет определенную температуру кипения;
4) представляет смесь различных веществ.
9. Укажите наиболее правильные структуры углерод-
ного скелета бутена-2:
1)С —С = С —С 2)С = С
С С
7/с
3) С = С 4) Сг=С
/ /f^20°
С с с
10. При полимеризации пентадиена-1,3 могут обра-
зоваться полимеры строения:
--- 643 ----
ТЕСТ 17
1. В реакции вещества состава С Н2п с хлором выде-
лился хлороводород. Укажите возможный класс углево-
дорода и тип реакции:
1) алкан, замещения; 2) алкен, замещения;
3) цикло алкан, замещения; 4) алкен, присоединение.
2. Каучук образуется при полимеризации:
1) этена; 2) дивинила; 3) пропена; 4) пентадиена-1,3.
3. Пространственная цис-, транс-изомерия возмож-
на для:
1) 1,2-дифенилэтена; 2) 1,1,2-трихлорэтена;
3) 1-фтор-2-хлорэтена; 4) 1,2-дибромциклопропана.
4. Какие вещества можно использовать для получения
изомерных бутенов в одну стадию (прямым синтезом)?
1) октан; 2) бензол; 3) бутин-2; 4) 1,2-дихлорэтан.
5. Этен можно получить:
1) крекингом бутана;
2) взаимодействием хлорэтана со спиртовым раство-
ром КОН;
3) взаимодействием 1 моль этина с 2 моль водорода;
4) дегидрированием этана.
6. Нефтепродукты подвергают вторичной переработ-
ке для:
1) увеличения выхода бензина;
2) получения этилена и его гомологов;
3) получения ароматических углеводородов;
4) получения углеводородов неразветвленного строения.
7. Охарактеризуйте процесс термического крекинга
нефтепродуктов:
1) протекает по ионному механизму;
2) протекает по радикальному механизму;
— 644 —
3) сопровождается разрывом связей углерод—углерод;
4) приводит к образованию ненасыщенных соеди-
нений.
8. Керосин — это:
1) огнеопасная жидкость;
2) одна из фракций первичной переработки нефтепро-
дуктов;
3) горючее для тракторов;
4) смесь углеводородов ряда метана с примерным
числом атомов углерода от 5 до 11.
9. Изомер 2-метилпропана—это углеводород строения:
С1
1)/\ 3)/%/ 4)|3
10. При крекинге октана могут образоваться:
1) этен; 2) бутан; 3) бутен-1, 4) декан.
ТЕСТ 18
1. Все атомы углерода равноценны (эквивалентны) в
химическом отношении в молекулах:
1) бензола; 2)толуола;
3) циклобутана; 4) метилциклопропана.
2. Ядра всех атомов С лежат на одной прямой в мо-
лекулах:
1) пропилена; 2) пропина; 3) бутина-2; 4) бутина-1.
3. Укажите справедливые утверждения:
1) реакции замещения для бензола протекают легче,
чем для алканов;
2) реакции присоединения для бензола протекают
труднее, чем для алкенов;
3) бензол нитруется легче, чем толуол;
4) бензол обесцвечивает бромную воду.
— 645 —
4. Укажите число изомерных алкенов состава С?НЭС1?:
1)2; 2)3; 3)4; 4)5.
5. Молярная масса продукта реакции диена с избыт-
ком НВг равна 230 г/моль. Укажите формулу диена:
1)С,Н4; 2)СД;3)СД4) СД,,.
6. Изомерами бензилхлорида будут:
1)толуол; 2) хлорбензол;
3) 2-хлортолуол; 4) 1-метил-4-хлорбензол.
7. Какие хлорпроизводные этана имеют изомеры?
1) С2Н5С1; 2) С2Н4С12; 3) С2Н3С13; 4) С2Н2С14.
8. Укажите формулы веществ, к которым присоедине-
ние хлороводорода объясняется с позиций правила Мар-
ковникова:
1)СН3 —С = СН;
2) CF3 —СН = СН,;
3) СН3 — СН2 — СН = СН2;
4) СН3 — СН = СН — СН3.
9. При одинаковом числе атомов углерода массовая
доля атомов углерода наибольшая в молекуле:
1) алкана; 2) алкена; 3) алкина; 4) гомолога бензола.
10. Алкин максимально присоединяет бром массой
8 г. Какой максимальный объем (дм3, н.у) водорода мо-
жет поглотить этот алкин?
1) 1,12;) 1,22; 3) 5,60; 4) 0,561.
ТЕСТ 19
1. Какие виды изомерии могут быть у соединения
состава С4Н8 (выберите один ответ):
а) углеродного скелета; б) положения кратной связи;
в) пространственная; г) межклассовая
1) а, б, в; 2) б, в, г; 3) а, б, в, г; 4) а, в, г.
— 646 —
2. Каким видом изомерии объясняется различие в
строении 2-метилбутана и 2,2-диметилпропана?
1) углеродного скелета;
2) положения кратной связи;
3) положения функциональной группы;
4) межклассовая.
3. С какими реагентами взаимодействует 1-фенил-1-
хлорэтан (выберите один ответ):
а) КОН (спирт, р-р);
б) КОН (Н/Э);
в)С12 (hv);
г) СН3С1 (в присутствии натрия).
1) а, б, в, г; 2) а, в, г; 3) а, б, в; 4) б, в, г.
4. Гомолог бензола образуется, когда между собой ре-
агируют:
1) бензол и хлорметан (в присутствии кат, /°);
2) стирол и бромоводород;
3) бензол и пропен (в присутствии кат);
4) бромбензол'и бромэтан (в присутствии натрия).
5. Укажите формулу продукта реакции 1,4- присоеди-
нения НВг к циклогексадиену-1,3:
6. При дегидрировании бутана можно получить:
1) 2-метилпропан; 2) гшс-бутен-2;
3) бутен-1; 4) бутин-2.
7. Для описания свойств как пропина, так и пропена
справедливы утверждения:
1) ненасыщенные соединения;
— 647 —
2) конечный устойчивый продукт гидратации —
спирт;
3) обесцвечивают бромную воду;
4) при полном гидрировании образуется одно и то
же вещество.
8. Процесс первичной переработки нефти основан на
различии в:
1) химических свойствах отдельных фракций;
2) температурах кипения различных фракций;
3) отношении фракций к окислителям;
4) стойкости фракций к детонации.
9. Укажите название алкана, молекула которого содер-
жит 1 четвертичный, 1 третичный, 1 вторичный и 5
первичных атомов углерода:
1) 2,2-диметилпропан; 2) 2,2,3,3-тетраметилбутан;
3) 2,2,3-триметилбутан; 4) 2,2,4-триметилпентан.
10. Укажите формулу наиболее устойчивого карбка-
тиона:
1) СН3СН2; 2) СН3— СН — СД;
3) СН3 — СН2 — С — СД; 4) СН3 — СН — СД5.
сд
ТЕСТ 20
1. Смесь метана с воздухом взрывоопасна при объем-
ном соотношении метан : воздух, равном:
1) 1 :2;2) 1 : 10; 3) 1 : 15; 4) 1 : 20.
2. Для описания каталитического крекинга подходят
утверждения:
1) физический процесс;
2) сопровождается образованием углеводородов с
— 648 —
меньшим значением молярной массы;
3) приводит к изомеризации углеводородов;
4) химический процесс.
3. Укажите число электронов, участвующих в образо-
вании л-связей в молекуле 1,2-дифенилацетилена:
1) 12; 2) 14; 3) 16; 4) 18.
4. Назовите по систематической номенклатуре веще-
ство строения Вг — СН, — СН = СН — С1:
1) 1-хлор-3-бромпропен-1;
2) 3-хлор-1-бромпропен-2;
3) 1-бром-3-хлорпропен-2;
4) З-бром-1-хлорпропен.
5. Укажите формулу продукта реакции 1,4-присоеди-
нения бромоводорода к циклопентадиену-1,3:
6. Отметьте формулу продукта реакции 1,2-присое-
динения Вг, к циклогексадиену-1,3:
Вг
Вг
7. В результате прямой перегонки нефти получают:
1) лигроин; 2) бензин; 3) каучук; 4) газойль;
8. Укажите процессы вторичной переработки нефти:
1) перегонка; 2) термический крекинг;
3) ферментация; 4) каталитический крекинг.
9. 1-бромгексадиен-2,4 может существовать в виде
цис-, транс- изомеров, число которых равно:
1) три; 2) четыре; 3) пять; 4) шесть.
— 649 —
10. Сколько алкенов, содержащих в молекуле 6 ато-
мов углерода, могут существовать в виде цис-, транс-
изомеров?
1) четыре; 2) пять, 3) шесть; 4) семь.
ТЕСТ 21
1. Алкены превращают в алканы реакцией:
1) дегидрирования; 2) изомеризации;
3) гидрирования; 4) гидратации.
2. Сколько веществ изображено формулами:
С1
С1
Н Н
\ /
с=с .
/ \
С1 С1
1)2; 3)4; 3)3; 4) 1.
3. Назовите по систематической номенклатуре алкен
строения
1) 6-бром-5-изопропил-2-этилоктен-1;
2) 5-изопропил-6-бром-2-этилоктен-1;
3)3 -бром-4-изопропил-7-этилоктен-7;
4) 4-изопропил-3-бром-7-этилоктен-7.
4. Укажите формулы изомеров гептана:
--- 650 ---
5. Отметьте формулы одинаковых веществ:
6. Сколько веществ изображено с помощью формул?
1)одно; 2) два;
3)три; 4) четыре
7. Молярная масса продукта реакции диена с избыт-
ком раствора Вгп в СС14 равна 402 г/моль. Укажите фор-
мулу диена:
1)СД; 2) СД; 3) СД0; 4) СД2.
8. Насыщенный углеводород образуется при взаимо-
действии:
1) пропилмагнийиодида с водой;
2) 1,6-дибромгексана с магнием;
3) 1-бром-1-фенилэтана с КОН (спирт р-р);
4) ацетата натрия с NaOH (С).
9. Укажите формулы реагентов соответственно X, Y,
Z и К, позволяющих с наибольшим выходом указанных
продуктов осуществить превращения по схеме:
снз — СН2 — СНВг — СН2Вг -2U А
-> СЦСН^СВ^СН, Б СН3СНВг — СНВг—СН3
1) КОН (спирт), Вг2 (СС14), КОН (спирт), Вг2(СНС13);
2) КОН (спирт), НВг, КОН (спирт), НВг;
3) КОН (спирт), Вг2 (СНС13), КОН (спирт), НВг;
4) КОН (спирт ), НВг, КОН (спирт), Вгэ(СС14)
10. Для описания бензина применимы утверждения:
а) горюч;
б) смесь жидких углеводородов;
— 651
в) малорастворим в воде;
г) не имеет определенной температуры кипения.
1) только а, б, в; 2) а, б, в, г;
3) только б, в, г; 4) только а, б, г
ТЕСТ 22
1. Спиртовой раствор КОН обычно используется для
проведения реакции:
1) дегидрирования; 2) дегидратации;
3) дегидрогалогенирования; 4) изомеризации.
2. Укажите формулу вещества, для которого возможна
геометрическая изомерия (X, Y, Z — заместители):
1) Х2С = СУ2; 2) XYC = CZO;
3) Х2С = CXY; 4) XYC = CXZ
3. Жидкие углеводороды переводят в газообразные
посредством реакции:
1) гидролиза; 2) окисления;
3) крекинга; 4) гидрирования.
4. Конечными продуктами реакции полного окисле-
ния углеводородов избытком кислорода являются:
1) карбоновые кислоты; 2) альдегиды;
3) вода; 4) углекислый газ.
5. При нагревании 1,2-дибромэтана с избытком спир-
тового раствора КОН образуется:
1) этан; 2) этилен; 3) ацетилен; 4) этиленгликоль.
6. Сколько веществ представлено формулами?
СН3
СН3 —С —СН
II \
СН2 СН3
сн3 —с = сн2
I
СН3 — СН — сн3
— 652 —
CH, — CH — CH, CH, CH2
I I II
CH, — C — CH, CH — C — CH,
1) 1,2) 2; 3)3; 4) 4. снз
7. Гексахлоран можно получить:
1) замещением всех атомов водорода в бензоле на хлор;
2) хлорированием бензола на свету;
3) замещением всех атомов водорода в циклогексане
на хлор;
4) замещением всех атомов водорода в этане на хлор.
8. В результате реакции Вюрца в качестве органичес-
кого вещества получили только 1,2-дифенилэтан. Исход-
ные вещества (вещество) — это:
1) хлорбензол;
2) бензилхлорид;
3) смесь хлорбензола и 1-фенил-2-хлорэтана;
4) смесь бензилхлорида и 1-фенил-2-хлорэтана.
9. При сгорании одного объема углеводорода образу-
ется пять объемов углекислого газа, а при хлорировании
углеводорода образуется четыре различных монохлор-
производных. Этот углеводород может называться:
1) пентан; 2) 2-метилбутан
3) метилциклобутан; 4) 2,2-диметилпропан.
10. Какое химическое количество Н, (моль) требуется
на полное гидрирование одного моля винилацетилена?
1)4; 2)3; 3)2; 4) 1.
ТЕСТ 23
Г •
1. Толуол и кумол между собой отличаются:
1) числом электронов в тг-системе;
--- 653 ----
2) числом атомов С, лежащих в одной плоскости;
3) числом о-связей;
' 4) температурой плавления.
2. Укажите формулу структурного изомера вещества
строения (Н3С)2СН(СН2)2СН3:
си3
1) Н3С — СН — СН3 2) н3с — сн — сн2 — сн3
сн0 — сн,
3) (Н3С)2СНСН(СН3)2 4) Нзс — СН = СН(С2Н5)
3. Число электронов N и число атомов углерода п в
молекулах гомологов бензола связывает формула:
1) N= 127/ - 6; 2) N= 8/z - 6; 3)N= 8//- 8; 4)N= 1277- 8.
4. Укажите формулу мономерного звена природного
каучука:
— Н2С сн2 —
\ /
1) с = с
н н
— н2с н
\ /
3) С = С
н3с сн2 —
— н2с сн2 —
\ /
с = с
2) /с \
Н3с н
— Н2С н
\ /
4) С = С
н сн2 —
5. При каталитической дегидроциклизации (аромати-
зации) 4-этилгептана могут образоваться арены:
1) пропилбензол, 2) 1-метил-2-этилбензол;
3) 1-метил-З-этилбензол; 4) 1-метил-4-этилбензол.
6. Число циклоалканов, имеющих в молекуле 40 элек-
тронов, равно (учтите цис-, транс- изомерию):
1) шесть; 2) пять; 3) четыре; 4) три.
— 654 —
7. В молекуле циклоалкена число атомов Н на два
больше числа атомов С. Укажите число структурных
изомеров циклоалкенов, удовлетворяющих этому ус-
ловию:
1) пять; 2) четыре; 3) три; 4) два.
8. Укажите число возможных монобромпроизводных
для толуола:
1) пять; 2) четыре; 3) три; 4) шесть.
9. Укажите число изомерных гептадиенов-2,4:
1) четыре; 2) три; 3) два; 4) пять.
10. Отметьте число изомерных циклоалканов состава
СДр, имеющих четыре атома С в цикле (учтите простран-
ственную цис-, транс-\\?>оие^\\\^, но не энантиомерию):
1) семь; 2) шесть; 3) пять; 4) четыре.
ТЕСТ 24
1. Укажите молярную массу (г/моль) арена Г для це-
почки превращений, протекающих по схеме:
1, 6-дибромгептан --^4 А +- мольС1;’В —>
+ Na р
2. Укажите сумму молярных масс (г/моль) аренов В и
Г для цепочки превращений, протекающих по схеме:
толуол +1 моль °* 1 2 3’ h\ А ДЯ Б +Нг°; в +2моль C|i.*v р
3. Укажите формулы реагентов соответственно X, Y,
Z и К для цепочки превращений
НС == СН винилацетилен —С. бутадиен-1,3
1,4-дибромбутен-2 —бутатриен:
1) СД,, Д, НВг, КОН (спирт);
2) СД, Д, Вг2, КОН (ДО);
3) СД2, Д, НВг, КОН (спирт);
--- 655 ----
4. Укажите молярную массу (г/моль) ароматического
вещества Г для цепочки превращений, протекающих по
схеме:
бензол +c^cl/Alck А +1 мольС1»h\ Б + кон(спирЧ в —>
+ КМпО, (5 °C, Н2О^ р
5. Укажите молярную массу (г/моль) ароматического веще-
ства Д для цепочки превращений, протекающих по схеме:
Pt, 450 °С^ а + 1 моль СН2 = СН/Н* g + 1 моль Br2, hy*
__g + КОН (спирт)* р + 1 моль Вг2 (СНС13)^ д
6. Укажите сумму молярных масс (г/моль) цикличес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
1,5- дихлорпентан А +1 моль ВГ;’А > Б +кон<спирт)> в
+ КМпО4 (5 °с, н2о^ р
7. Укажите сумму молярных масс (г/моль) аромати-
ческих веществ В и Е для цепочки превращений, проте-
Н3С(СН2)4СН3
кающих по схеме:
/° кат л +1 моль Вг hv 1' + 1 моль C,I LBr, + Из (изб)
метилциклогексан А + 1|^оль-2’..х> Б -—_(сДсн)2-
__g + 1 моль Cl2, hy? р + КОН (спирт)* д + Н2О/Н* р
8. Укажите сумму молярных масс (г/моль) органичес-
ких веществ А и Г для цепочки превращений, протека-
ющих по схеме:
Qg +0Z,1500°C Д + Вг2 (СС14, изб)* g 4- Zn (изб), g + Н2О (Hg^/НД р
4
9. Укажите число первичных атомов углерода в мо-
лекуле основного органического вещества Д для цепоч-
ки превращений, протекающих по схеме:
Q g + 1 моль Cl2, hy* + 2 моль Na* g А1С1„ t° g кат- ? р
2 6 — 1 моль Н2
+ H2O(iq д
--- 656 ---
10. Укажите молярную массу (г/моль) органического ве-
щества Г для цепочки превращений, протекающих по схеме:
(2аС + А + 1 МОЛЬ НВг? Б + 11? кат-)? g + C,HsBr, + Na^ р
ТЕСТ 25
1. Укажите сумму молярных масс (г/моль) цикличес-
ких веществ В и Е для цепочки превращений, протекаю-
щих по схеме:
СаС + Н2°> А +С активиР-'450—SOO^C g + 2 моль Н, (Г°, кат.) g _
+ НВг р + КОН (спирт) д + КМпО4 (5 °C, Н2Оу р
2. Укажите сумму молярных масс (г/моль) цикличес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
этен (1 моль) +Вг?сс^изЧ A + KOH<c"»pT) изб. Б
+ 2 моль С2Н2 (Сактив., С) g + С12 (изб., h\!)? р
3. Укажите число вторичных атомов углерода в моле-
куле основного органического вещества Г для цепочки
превращений, протекающих по схеме:
1,4-дибром-2-метилбутан +к9н(спирАиз6ы^. д —>
+1 моль HI g + Н2 /Г, кат g + Na (избу р
(1,4-присоединение)
4. Укажите сумму молярных масс (г/моль) цикличес-
ких веществ Г и Д для цепочки превращений, протека-
ющих по схеме:
+НВг Л + 1 моль бромбепзола, + Na г + 1 моль Cl2, Av р ч
пропен ------> а -------—ь ------------------2 * 4 5-—>- о —>
+ КОН (спирту р + Вг2 (СС14, избу д
5. Укажите молярную массу (г/моль) основного конеч-
ного циклического продукта Г для цепочки превраще-
ний, протекающих по схеме:
4-метил-2,6-дихлороктан +Mg-(--i А + 2“°?ьс1д/|> Б —>
+ 2 моль КОЦ g + Вг2/СС14 (изб.) р
(спирт, р-р)
--- 657 ---
6. Укажите молярную массу (г/моль) ароматического
вещества Г для цепочки превращений, протекающих по
схеме:
CH3CH9CH9COONa +NaOtW> A + 1r***^ Б
—> в +®,н*? г
7. Укажите октановое число вещества Д для цепочки
превращений, протекающих по схеме:
СН А Аг2* Б iSSi В г tas. д.
14 30 -С,Н,4 -Н2 эфир
8. Укажите молярную массу циклического вещества Г
для цепочки превращений, протекающих по схеме:
бутан A + н2о/ю Б h2so4(<= i7o°q В + сн3сооон^ Г.
9. Укажите молекулярную массу (г/моль) циклическо-
го вещества Г для цепочки превращений, протекающих
по схеме:
циклопропан A Б ТААн* В ->
+ 1 моль (СН3)эСВг, АКТ р
10. Укажите молярную массу (г/моль) циклического
вещества Д для цепочки превращений, протекающих по
схеме:
хлорэтан t кон (спирту А ^о^сщ^ Б
+ Н2804(конц., t > 140 °C) g + 1 моль Н2 (кап) р +O2(Ag, гу д
--- 658 ---
ТЕМА 47
Одноатомные и многоатомные спирты.
Простые эфиры
ТЕСТ1
1. Назовите по систематической номенклатуре спирт
строения СН3 — СН — ОН:
сн,
1) 1-метилэтанол-1; 2) 2-метилэтанол-1;
3) пропанол-1; 4) пропанол-2.
2. Гомологами метанола являются:
1) пропанол-1; 2) этандиол-1,2;
3) бензиловый спирт; 4) З-метилбутанол-1.
3. Алкоголятами называются продукты взаимодействия:
1) фенолов с активными металлами;
2) спиртов с галогеноводородами;
3) спиртов с карбоновыми кислотами;
4) спиртов с активными металлами.
4. Укажите названия первичных спиртов:
1) этанол; 2) изопропиловый;
3) пропанол-1; 4) 2-метилбутанол-1.
5. Для насыщенного одноатомного спирта с тремя
атомами углерода в молекуле возможна изомерия:
1) углеродного скелета;
2) положения гидроксильной группы;
3) межклассовая;
4) пространственная.
6. Изомерами диэтилового эфира являются:
1) пропанол-2; 2) бутанол-1;
— 659 —
3) 2-метилпропанол-2; 4) бутанол-2.
7. Отметьте названия гомологов диметилового эфира:
1) метилэтиловый эфир; 2) фенол;
3) диэтиловый эфир; 4) этандиол-1,2.
8. Укажите названия реагентов, с которыми взаимо-
действует этанол:
1) бромоводород;
2) уксусная кислота (в присутствии H7SO4);
3) метанол (в присутствии H,SO4);
4) раствор брома в четыреххлористом углероде.
9. При взаимодействии этиленгликоля с избытком НВг
в качестве конечного продукта образуется:
1) СН2 — СН7Вг; 2) СН7ОВг — СН2ОВг;
Вг
3)СН2 — СН7ОВг; 4)СН7 —СН —Вг.
I ' 1'1
ОН он он
10. Укажите название вещества с самой высокой тем-
пературой кипения:
1) хлорэтан; 2) этан; 3) этанол; 4) диметиловый эфир.
ТЕСТ 2
1. Охарактеризуйте спирт строения
СН3 —СН —СН7ОН:
I
ОД
1) вторичный спирт;
2) называется 2-этилпропанол-1;
3) гомолог бутанола-1;
4) называется 2-метилбутанол-1.
— 660 —
2. Укажите названия вторичных спиртов:
1) бензиловый спирт; 2) бутанол-2;
3) З-метилбутанол-2; 4) циклогексанол.
3. Назовите по систематической номенклатуре соеди-
нение, которое преимущественно получается при взаи-
модействии водного раствора щелочи с 2-хлорбутаном:
I) бутен-1; 2) бутен-2;
3) бутанол-2; 4) 1-метилпропанол-1.
4. При дегидратации пропанола-1 в различных усло-
виях могут образоваться:
1) пропен;
2) метилпропнловый эфир;
3) дипропиловый эфир;
4) пропанол-2.
5. Бензиловый спирт может реагировать с:
1) водным раствором КОН;
2)калием;
3) бромоводородом;
4) уксусной кислотой (в присутствии H2SO4).
6. Этиленгликоль можно получить взаимодействием:
1) ацетилена с водой;
2) этилена с холодным водным раствором КМпО4;
3) 1,2-дихлорэтана с водным раствором щелочи;
4)этилена с водой.
7. Глицерин может реагировать с:
1) бромоводородом;
2) азотной кислотой (в присутствии H,SO4(i.oiiu ();
3)этаном;
4) свежеприготовленным гидроксидом меди (II).
8. При окислении первичного спирта можно получить:
1) карбоновую кислоту; 2) альдегид;
3) углекислый газ; 4) алкан.
— 661 —
9. Водородные связи образуются между молекулами:
1) метанола;
2) метана;
3) диэтилового эфира;
4)этиленгликоля.
10. Сколько изомерных спиртов отвечает формуле
С4Н9ОН (учтите пространственную изомерию)?
1) два; 2) три; 3) четыре; 4) пять.
ТЕСГЗ
1. Как по систематической номенклатуре называется
спирт строения
Н
сн3 — сн — с - сн3?
I I
С7Н. он
1) 2-метил-3-этилбутанол-2;
2) 2,3-диметилпентанол-2;
3) 2,3-Диметилбутанол-2;
4) 4,4-диметилпентанол-2.
2. Укажите справедливые утверждения:
I) в ряду этанол —> бутанол-1 —э гексанол-2 раство-
римость спиртов в воде уменьшается;
2) спирты с двумя гидроксильными группами при
одном атоме углерода неустойчивы;
3) бутантетраол-1,2,3,4 является гомологом пропан-
триола-1,2,3;
4) кислотные свойства 2,2-дихлорэтанола выражены
сильнее, чем у этанола.
— 662 —
3. При взаимодействии каких из перечисленных ве-
ществ между собой можно получить вещество строения
СН, — СН — СН,?
1'1 I
ОК ок ок
1) пропан и калий; 2) глицерин и калий;
3) глицерин и хлорид калия; 4) глицерин и нитрат калия.
4. Сколько изомерных простых эфиров отвечает со-
ставу с4н10о?
I) два; 2) три; 3) четыре; 4) пять.
5. Укажите число изомерных веществ состава С3Н8О:
1) два; 2) три; 3) четыре; 4) пять.
6. При взаимодействии с избытком натрия наиболь-
ший объем водорода выделяется в случае спирта (хими-
ческое количество спиртов одинаково):
1) этиленгликоля; 2) глицерина;
3) бутантетраола-1,2,3,4; 4) 2-метилпропанола-2.
7. Для получения глицерина в промышленности ис-
пользуют вещества:
1) этанол; 2) жиры; 3) этиленгликоль; 4) пропен.
8. Гомологом винилового спирта является спирт:
I) аллиловый; 2) этандиол-1,2;
3) пропанол-1; 4) бутин-З-ол-1.
9. В порядке возрастания температуры кипения ве-
щества перечислены в ряду:
1) метан — метанол — хлорметан;
2) метанол — хлорметан — метан;
3) метан — хлорметан — метанол;
4) хлорметан — метан — метанол.
10. В ряду пропанол-1 -» этиленгликоль —> глицерин
температура кипения спиртов:
1) уменьшается;
— 663 —
2) возрастает;
3) практически не изменяется;
4) сначала возрастает, затем уменьшается.
ТЕСТ4
1. Назовите по систематической номенклатуре спирт
строения
СН3 —СН, —СН, сн3
I ~ I
СН — С — С — снз:
I I
он сн3
1) 2,2-диметил-4-пропилбутанол-1;
2) 3,3-диметил-2-пропилбутанол-2;
3) 4,5,5-триметилгексанол-4;
4) 2,2,3-триметилгексанол-3.
2. С натрием с наибольшей скоростью реагирует спирт:
1) 2-метилпропанол-2;
2)этанол;
3) метанол;
4) 2,2-дихлорэтанол.
3. При взаимодействии глицерина с избытком бро-
моводорода в присутствии катализатора образуется:
1) 2,3-дибромпропанол-1;
2) 1,3-дибромпропанол-2;
3) 1,2,3-трибромпропан;
4) 1,2-дибромпропанол-1.
4. Сколько органических веществ можно получить,
нагревая смесь метанола и этанола в присутствии ката-
лизатора при различных температурах?
1) два; 2) пять; 3) три; 4) четыре.
— 664 —
5. Укажите формулы веществ, которые являются изо-
мерами бензилового спирта:
6. С какими веществами реагирует 2-метилпропа-
нол-2?
1) уксусной кислотой (в присутствии серной кислоты);
2)калием;
3) гидроксидом меди (II);
4) бромоводородом,
7. Изомерами по отношению друг к другу являются:
1) З-хлорпропанол-1;
2) 2-хлорпропанол-2;
3) пропанол-1;
4) 2-метилпропанол-1.
8. Укажите промышленные способы получения этанола:
1) гидратация этилена;
2) гидратация ацетилена;
3) гидролиз клетчатки и сбраживание полученной
глюкозы;
4) взаимодействие хлорэтана с водным раствором
Са(ОН),.
9. Состав насыщенных одноатомных спиртов можно
представить как:
1)С Н, + ,ОН; 2) С Н, О; 3) С Н, +7О; 4) С Н7 ОН.
7 п 2п + 1 ’ 7 п 2« 7 и 2п + 2 ’ 7 п 2п+2
--- 665 ----
10. При нагревании насыщенных одноатомных спир-
тов с концентрированной серной кислотой в зависимо-
сти от температуры образуются:
I) карбоновые кислоты;
2) простые эфиры;
3) алкены;
4)альдегиды.
ТЕСТ 5
1. Одинаковые спирты изображают формулы:
сн3
I
I) сн — сн — с — сн2он
I I
сн3 н
н
2)СН3 —С —СН3
I
сн3 — сн — сн2он
3) СН3С(СН3)2СН2СН2ОН
4) (СН3)2СНСН(СН3)СН2ОН.
2. Группа ОН отщепляется от спиртов, когда спирты
реагируют с:
1) натрием; 2) бромоводородом;
3) уксусной кислотой; 4) калием.
3. Укажите название вещества, при внутримолекуляр-
ной дегидратации которого может образоваться пентен-2:
1) пентанол-1; 2) пентанол-2;
3) гексанол-2; 4) 2-метилбутанол-1.
— 666 —
4. При взаимодействии циклопентанола с оксидом
меди (II) при нагревании образуется вещество строения:
5. С помощью свежеприготовленного гидроксида
меди (II) можно распознать:
1) метанол; 2) бензол;
3) глицерин; 4) этилен.
6. Какой атом в молекуле спирта
Н Н
'е п> н‘
н — с — с — и — н
н н
с наибольшей скоростью взаимодействует с протоном?
1)атом1; 2) атом 2;
3) атом 3; 4) атом 4.
7. Спирт с хорошим выходом можно получить при вза-
имодействии:
1) 1,2-дихлорэтана и КОН (изб.) (спирт, р-р);
2) 1,3-дибромпропана и №ОН(изб.) (водн. р-р);
3) СО и Н, (Z°, Р, Kat);
4) СН3 — СН = СН2 и Н2О (Kat).
8. Укажите формулы неустойчивых спиртов:
1) СН3СН7ОН; 2) СН, = СН(ОН);
ОН
I
3)Н3С —С = СН2; 4)СН3—СН.
ОН ОН
--- 667 ---
9. З-метилбутен-З-ол-2 взаимодействует с избытком
НВг. Укажите число неподеленных пар электронов в
молекуле конечного органического продукта:
1)3; 2) 4; 3)5; 4) 6.
10. Отметьте справедливые утверждения:
1) межмолекулярное взаимодействие в глицерине
сильнее, чем в этаноле;
2) в отличие от этанола глицерин имеет сладковатый вкус;
3) в отличие от этанола этиленгликоль реагирует со
свежеприготовленным гидроксидом меди (II);
4) глицерин реагирует с галогеноводородами, а эта-
нол — нет.
ТЕСТ 6
1. Укажите формулу 2-метилпентанола-З:
1) СН3 — СН — СН — ОН;
сн3 сн2 —сн3
2) СН3 — СН — СН — СН3;
I I
сн3 он
он
3) СН3 — сн2 — СН2 — С — СН3;
I
сн3
он
I
4) СН3 — С — сн2 — СН, — СН3.
сн3
— 668 —
2. Отметьте формулу вторичного спирта:
/Н
ОН
2) СН3— СН7 — СН — ОН;
I
сн3
сн3
3)снз —сн2 —С —ОН;
СН3
4) сн3 — СН2 — СН — СН2 — ОН.
сн3
3. При взаимодействии пропена с водой в присут-
ствии серной кислоты преимущественно образуется:
1) пропанол-1; 2) пропаналь;
3) пропанол-2; 4) пропионовая кислота.
4. Состав С.Н12О имеют соединения:
1) циклопентанол; 2) амиловый спирт;
3) 2-метилбутанол-2; 4) бензиловый спирт.
5. Этиленгликоль может реагировать с:
I)кислородом;
2) метанолом (в присутствии катализатора);
3) раствором брома в четыреххлористом углероде;
4) бромоводородом.
6. При действии водного раствора щелочи на 2-бром-
2-метилпропан преимущественно образуется:
1) 2-метилпропен; 2) 2-метилпропанол-1;
3) 2-метилпропанол-2; 4) пропанол-2.
— 669 —
7. Какое соединение преимущественно образуется при
нагревании смеси пропанола с серной концентрирован-
ной кислотой при температуре ~ 170 °C?
1) дипропиловый эфир; 2) пропен;
3) этилен; 4) аллиловый спор;.
8. В порядке возрастания вязкости спирть сречис-
лены в ряду:
1) этанол — глицерин — этиленгликоль;
2) глицерин — этиленгликоль — этанол;
3) этанол — этиленгликоль — глицерин;
4) этиленгликоль — этанол — глицерин.
9. Укажите название изомера этанола:
1) этиленгликоль; 2) метанол;
3) диэтиловый эфир; 4) диметиловый эфир.
10. Для алканолов с каким минимальным числом ато-
мов углерода возможна изомерия углеродной цепи?
1) двумя; 2) тремя;
3) четырьмя; 4) пятью.
ТЕСТ 7
1. По систематической номенклатуре спирт строения
СН3СН(Вг)СН2ОН называется:
1) 1-гидрокси-2-бромпропан;
2) 2-бром-2-гидроксипропан;
3) 2-бромпропанол-1;
4) 2-бромпропанол-З.
2. Этанол нагревают с концентрированной H2SO4
выше 140 °C и полученный продукт пропускают в сосуд
с избытком брома. При этом образуется:
I) СН7(Вг)СН,ОН; 2) СНэ(Вг)СН7(Вг);
3)СН(Вг)2СН(Вг2); 4)С2Н.Вг.
--- 670 ---
3. Укажите общую формулу гомологов циклогекса-
нола:
I) С Н2п+2О; 2) СДО; 3) С Н2я+ ,О; 4) СД. ,0.
4. Дегидратация устойчивых спиртов может приво-
дить к образованию:
1)альдегидов; 2)алкенов;
3) простых эфиров; 4) карбоновых кислот.
5. Изомеры диэтилового эфира — это:
1) фенол; 2) бензиловый эфир;
3) бутанол-1; 4) метилпропиловый эфир.
6. Укажите класс веществ, к которому относится нит-
роглицерин:
1) соль; 2) простой эфир;
3) сложный эфир; 4) нитроалкан.
7. Отметьте название алкена, который может быть
получен в одну стадию из спирта строения
С\3 /Н
С :
сн3 Х°н
1) пропен; 2) этен; 3) 2-метилпропен; 4) бутен-1.
8. Выберите название спирта, который преимуще-
ственно получается при гидратации алкена строения
СН3
СН — СН - СН2:
СН3
1) 2-метилбутанол-2; 2) 3-метилбутаиол-1,
3) 2-метилбутанол-З; 4) З-метилбутанол-2.
9. Сколько устойчивых изомерных двухатомных спир-
тов существует у ближайшего гомолога этандиола-1,2?
I) два; 2) три; 3) четыре; 4) пять.
— 671 —
10. При дегидратации различных изомерных бутило-
вых спиртов можно получить:
I) бутен-1; 2) т/?анс-бутен-2;
3) бутановую кислоту; 4) 2-метилпропен.
ТЕСТ 8
1. Назовите по систематической номенклатуре* спирт
строения
Н3С. ,СН2ОН
Н,С/ Ч^ СН,
1) 2-изопропилбутанол-1;
2) 2-метил-3-этилбутанол-4;
3) 3-метил-2-этилбутанол-1;
4) 3,3-диметил-2-этилэтанол-1.
2. Из этанола в одну стадию можно получить веще-
ства строения:
1)С2Н5 —О —С2н5; 2)Н —С —О —СН3;
О
3) СН3 — СНО; 4) Н2С = СН2.
3. В этилате натрия присутствуют связи:
1) металлические; 2) ионные;
3) водородные; 4) ковалентные полярные.
4. Гомологи метанола — это:
1)этиленгликоль; 2)этанол;
* При наличии нескольких углеродных цепей одинаковой!
длины в качестве основной выбирается та, которая содер-
жит большее число заместителей.
--- 672 ---
3) диметиловый эфир; 4) пропанол-1.
5. Укажите формулу винилового спирта:
1)НС = С — СН7ОН; 2)СН, —СН —ОН;
3) СН3 — СН = СН — ОН; 4) СН, — СН, — ОН.
6. Пропанол-1 можно с хорошим выходом превратить
в пропанол-2 последовательным действием реагентов:
1) НВг; КОН (Н,О); 2) H,SO4 (конц., /°); Н2О;
3) НС1; КОН (спирт.); 4) К; Н,О.
7. Укажите изомеры бутанола-1:
1)бутанол-2;
2) 2-метилпропанол-1;
3) диэтиловый эфир;
4) метиловый эфир пропановой кислоты.
8. Ближайший гомолог этиленгликоля — это:
1) метанол; 2)глицерин;
3) пропандиол-1,2; 4) бутандиол-1,3.
9. Многоатомный спирт с хорошим выходом можно
получить:
1) кислотным гидролизом жира;
2) окислением пропена холодным водным раствором
перманганата калия;
3) взаимодействием 1,3-дихлорпропана с водным ра-
створом щелочи;
”4) взаимодействием 1,2-дибромэтана со спиртовым
раствором щелочи.
10. Соединение, молекулы которого имеют строение
Н7С = СН — СН7ОН, обладает свойствами:
1) только спиртов;
2) спиртов и ненасыщенных соединений;
3) только ненасыщенных соединений;
4) альдегидов и ненасыщенных соединений.
22 Зак 1530
--- 673 ----
ТЕСТ 9
1. Назовите по систематической номенклатуре спирт
строения
Н2С = С —СН3:
I
ОН
1) пропен-2-ол-1; 2) пропен-1-ол-2;
3) пропанол-1-ен-1; 4) пропанол-2-ен-1.
2. Укажите название третичного спирта:
1) циклопентанол; 2) бензиловый;
3) 2,3,3-триметилбутанол-2; 4) аллиловый.
3. Отметьте название спирта, который образуется при
взаимодействии водного раствора щелочи с галогенал-
каном строения ц g сн
h3c>^ch2ci
1) 2,2-диметилпропанол-З;
2) 2,2-диметилпропанол-1;
3) 2-метилпропанол-1;
4) 2-метилпропанол-2.
4. Веществом А в цепочке одностадийных превраще-
ний метан А —> метанол может быть:
1) хлорметан; 2) дихлорметан;
3) трихлорметан; • 4) тетрахлорметан.
5. Продолжит гомологический ряд, начинающийся
этандиолом-1,2, вещество состава:
1) С3Н6О2; 2) С3Н8О2; 3) C3HgO; 4) C3HgO3-
6. Растворимость спиртов в воде возрастает в ряду:
1) СН3 — СН, — СН, — ОН, СН3(СН,)3СН,ОН,
СН3(СН,).СН,ОН;
2) СН3 — СН, — СН, — ОН, СН3(СН,).СН2ОН,
СН3(СН,)3СН,ОН;
--- 674 ---
3) СН3(СН7)5СН2ОН, СН3(СН7)3СН,ОН,
снз — СН, — СН, — ОН;
4) СН3(СН,)3СН,ОН, СН3(СН2)5СН,ОН,
сн3 — сн2 — сн2 — ОН.
7. Образованием межмолекулярных водородных свя-
зей можно объяснить:
1) взаимодействие этанола с натрием;
2) сравнительно высокую температуру кипения этанола;
3) вязкость глицерина;
4) взаимодействие многоатомных спиртов с Си(ОН)2.
8. Кетоны образуются при окислении каждого из
спиртов в паре:
1) пропанол-2; метанол;
2) бутанол-2; пентанол-1;
3) 3-метилбутанол-2; циклопентанол;
4) З-метилбутанол-1; бензиловый.
9. При окислении пропанола-1 НЕЛЬЗЯ получить:
1) пропаналь; 2) ацетон;
3) углекислый газ; 4) пропановую кислоту.
10. Соединение СП,Вг— СНОН — 011,011 называется:
1) 1-бромпропандиол-2,3; 2) З-бромпропандиол-1,2;
3) 1-бромэтандиол-2,3; 4) З-бромэтандиол-1,2.
ТЕСТЮ
1. Назовите по систематической номенклатуре спирт
строения Вг /
ОН / \
1) 5,6-диметил-2-бром-4-этилгептанол-3;
— 675 —
2) 2-бром-5,6-диметил-4-этилгептанол-3;
3) 6-бром-2,3-диметил-4-этилгептанол-5;
4) 2,3-диметил-6-бром-4-этилгептанол-5.
2. Этиленгликоль с хорошим выходом можно полу-
чить при взаимодействии:
1)СН7 = СН7иН70 (Н+);
2) СН7 = СН7 и КМпО4 (5 °C, Н7О);
3) СН7Вг — СН7Вг и КОН (Н7О)'
4) СН7Вг — СН7Вг и КОН (спирт.).
3. Глицерин может по отдельности реагировать со
всеми веществами, формулы которых приведены в ряду:
1) HNO3, К, Си(ОН)2, НВг;
2) Na, Cu(OH)7, СН3СООН, KNO3;
3) Cu(OH)2, HBr, HNO3, NaNO7;
4) HC1, HNO3, CH3OH, NaCl.
4. Укажите степень окисления центрального атома
углерода в молекуле глицерина:
1)-1;2)+1;3) 0; 4)+2.
5. Для получения триглицерата натрия в реакцию не-
обходимо ввести:
1) 1 моль Na и 1 моль глицерина;
2) 2 моль Na и 1 моль глицерина;
3) 3 моль Na и 1 моль глицерина;
4) 3,45 г Na и 4,50 г глицерина.
6. Альдегид можно получить взаимодействием СиО и:
1) бензилового спирта; 2) циклогексанола;
3) пропанола-2; 4) 3-метилбутанола-1.
7. Этанол можно получить:
1) брожением глюкозы;
2) взаимодействием этилена с КМпО4 (5 °C, Н7О);
3) взаимодействием воды и этилата натрия;
4) гидратацией этена.
— 676 —
8. Насыщенные одноатомные спирты могут вступать
в реакции:
1) присоединения; 2) дегидратации;
3) этерификации; ' 4) замещения.
9. Насыщенные одноатомные спирты НЕ могут всту-
пать в реакции:
1) окисления; 2) гидратации;
3) полимеризации; 4) дегидратации.
10. Укажите формулу спирта, название которого бу-
тин-З-ол-1:
1) Н,С = СН — СН, — СН, — ОН;
2) Н'С —С = С —СН, —ОН;
3) НС = С — СН, — СН, — ОН;
4) Н3С — СН, — С = С ОН.
ТЕСТИ
1. Укажите название по систематической номенкла-
туре спирта строения
Вг
ОН
1) 4-бромгептин-6-ол-3;
2) 4-бромгептанол-3-ин-6;
3) гептанол-3 -ин-6-бром-4;
4) гептин-6-ол-3-бром-4.
2. Как по систематической номенклатуре называется
спирт строения
Si СН2ОН
К 9
Н3СХХСН3
--- 677 ---
1) 2-метилоктен-2-ол-8;
2) 7-метилоктен-6-ол-1;
3) 2-метил-ол-8-октен-2;
4) 7-метил-ол-1-октен-6.
3. При взаимодействии с Н,0 спирта, указанного в
предыдущем задании, образуется (образуются):
1) только 7-метилоктандиол-1,7;
2) только 7-метилоктандиол-1,6;
3) смесь 7-метилоктандиола-1,7 и 7-метилоктаНдиола-1,6;
4) только октандиол-1,6.
4. Назовите по систематической номенклатуре спирт
гераниол
CzHj
1) 3,7-диметилоктанол-8-диен-2,6;
2) 2,6-диметилоктадиен-2,6-ол-8;
3) 3,7-диметилоктадиен-2,6-ол-1;
4) октадиен-2,6-ол-1.
5. Укажите формулу спирта, название которого 2-бу-
тил-4-хлорбутен-2-ол-1:
678 —
6. Назовите по систематической номенклатуре двуха-
томный спирт строения
^ХН2ОН
НОСН2
1) 2-пропилбутандиол-1,4;
2) З-пропилбутандиол-1,4;
3) 3-гидроксиметилгексанол-1;
4) 4-гидроксиметилгексанол-6.
7. Назовите по систематической номенклатуре спирт
строения НО — СН2 — С — С — СН, — ОН:
Вг СН3
1) 3-метил-2-бромбутен-2-диол-1,4;
2) 2-бром-З-метилбутандиол-1,4-ен-2;
3) 2-бром-3-метилбутен-2-диол-1,4;
4) З-метил-2-бромбутандиол-1,4-ен-2.
8. Укажите структурную формулу основного продукта
реакции между избытком НВг и спиртом, указанным в
вопросе 2 данного тестового задания:
Вг
1)Н3С—СН—СН—СН,—СН2—СН,—сн2—СН,Вг;
сн3
сн3
2)Н3С—С—СН,—СН,—СН,—СН2—СН,—СН,Вг;
Вг
--- 679 ---
Вг
I
3)Н,С—С—СЦ—СН,—СК—СН2—СН,— CH.Br;
' А ‘ “ . '
Вг
4)Ц,С—CHLj—С—СЦ—CHj—СЦ—СН,—СН,Вг.
}Ь 'J/; 4 Вг ‘
9. Назовите по систематической номенклатуре спирт
строения ОН
, СН?ОН
1) 3 -этил-3 -пропилпропандиол-1,3;
2) 2-этилпентандиол-1,2;
3) 2-про пил-2-этилпропандиол-1,2;
4) 1-этил-1-пропилэтандиол-1,2.
10. Назовите по систематической номенклатуре спирт
строения СН,Вг — СН — СН — СН — СН — C2HS:
NO. ОН
1) 1-бром-4-нитрогептен-2-ол-5;
2) 4-нитро-1-бромгептен-2-ол-5;
3) 4-нитро-7-бромгептен-5-ол-3;
4) 7-бром-4-нитрогептен-5-ол-3.
ТЕСТ 12
1. Сколько изомерных спиртов отвечает составу С5Н] j ОН
(без учета пространственной изомерии)?
1) 10; 2) 9; 3) 8, 4) 7.
— 680 —
2. При гидратации алкена массой 2,52 г образуется
спирт массой 3,60 г Укажите формулу спирта:
1) СН3СН(ОН)СН3; 2)СН3СН,ОН;
3) СН3СН,СН(ОН)СН3; 4)С5Н12О'
3. При взаимодействии алканола массой 3,2 г с окси-
дом меди (II) получена медь массой 6,4 г. Укажите фор-
мулуспирта:
1) С4Н9ОН; 2) ОДОН; 3) СДОН; 4) СН3ОН.
4. Назовите по систематической номенклатуре спирт
строения
ОД Вг !-
C2HS ОН
1) ?/7/с-2-бром-4-этилгептен-4-ол-1;
2) /пр7нс-2-бром-4-этилгептен-4-ол-1;
3) ?/?/с-2-бром-4-этил-5-этилпентен-4-ол-1;
4) /пранс-2-бром-4-этил-5-этилпентен-4-ол-1.
5. Массовая доля атомов кислорода в насыщенном
одноатомном спирте равна 18,18 %. Сколько вторичных
спиртов удовлетворяет этому условию?
1) один; 2) два; 3) три; 4) четыре.
6. Укажите формулу спирта с наиболее выраженны-
ми кислотными свойствами:
1) Н3С — СН, — СН, — СН2 — ОН;
сн;
I
2)Н3С —С —СН3;
I
Вг
3) CF3 — СН2 — СН2 — СН, — ОН;
--- 681 ----
ст3
4) F3C — С — CF3.
I
ОН
7. Отметьте формулу спирта с наименее выраженны-
ми кислотными свойствами:
ОН
8. Укажите общую формулу гомологов бензилового
спирта:
1) С Н, О; 2) С Н, О; 3) С Н7 6О; 4) С Н. 60Н.
9. Глицерин НЕ реагирует с каждым из веществ в паре:
1) HBr; HNO3; 2) КС1; Na2CO3;
3) Na; СН3СООН; 4) Cu(OH)2; KNOr
10. При взаимодействии избытка этанола с H2SO4 при
0 °C образуется:
1) простой эфир; 2) алкен;
3) сложный эфир; 4) диэтилсульфат.
ТЕСТ 13
1. Образование водородных связей между молекула-
ми спиртов и водой объясняет такое свойство спиртов,
каких:
1) химическую активность;
2) плохую растворимость в воде (высших спиртов);
3) хорошую растворимость в воде (низших спиртов);
4) химическую инертность.
— 682 —
2. В результате реакции СН2СН2СН2ОН
может образоваться:
1) пропановая кислота; 2) пропаналь;
3) дипропиловый эфир; 4) пропанон.
3. Этиленгликоль используется для получения:
1) лавсана; 2) антифризов;
3) этанола; 4) пластификаторов.
4. Укажите формулу продукта реакции 2 моль метано-
ла с 1 моль Н3РО4 при О °C:
снзХ сн,х
1) Р —ОН 2) О—Р —ОН
СН/ сн/
СН3О
3) О = Р—ОН
СН3О
ОН
4)СН3О —Р==О
ОН
5. При взаимодействии равных химических количеств
этанола и H2SO4 при О °C образуется продукт, формула
которого:
1) C2H5OSO3H; 2) (C2H5)2SO2;
3) (C2H5O)2SO2; 4) C2H5SO3H.
6. Бензиловый спирт реагирует с:
1) К; 2) КОН(Н2О); 3) НВг; 4) СН3ОН/Н+.
7. При взаимодействии 4-метилпентена-1 с холодным
водным раствором перманганата калия образуется:
1) 2-метилпентадиол-3,4; 2) 4-метилпентанол-2;
3) 4-метилпентанол-1; 4) 4-метилпентадиол-1,2.
8. Укажите формулу гомолога этиленгликоля:
1) СН2ОН — СНОН — СН2ОН;
2) СН2ОН — СНОН — СН3;
' /J Г/(1.
— 683 —
3) СН2ОН —СН2ОН;
4)(Q>-CH2OH.
9. При полном сгорании спирта химическим количе-
ством 0,100 моль получили 6,72 дм3 (н. у.) углекислого
газа и воду массой 7,20 г. Укажите возможные формулы
спиртов:
1) С2Н6О; 2) СДО,; 3) С,Н,О2; 4) С,Н,О.
10. При взаимодействии КОН(Н,О) с веществом стро-
ения (Н3С)3ССН,С1 образуется:
1) 2,2-диметилпропанол-З;
2) 2,2-диметилпропанол-1;
3) 2-метилпропанол-1;
4) 2-метилпропанол-2.
ТЕСТ 14
1. Аллиловый спирт может реагировать с:
1) Вг2(СС14); 2) Н2О/Н+; 3) НВг; 4) К2СО3.
2. Ненасыщенные спирты — это:
1) виниловый; 2) глицерин;
3) древесный спирт; 4) аллиловый.
3. Укажите общие формулы двухатомных насыщенных
спиртов (гликолей):
DCIVP; 2)СН2я(ОН)2;
3)CH2n_,(OH)3; 4)СН2л+2°г
4. При дегидратации этиленгликоля в различных ус-
ловиях могут образоваться вещества, формулы которых:
1)СН3 —С=О 2) СН3 —С —ОН
I «
н о
--- 684 ---
о
Н2С сн2
3)н2с сн2 4)н2с—сн2
ХОХ '(/
5. При взаимодействии аллилового спирта с избыт-
ком НВг конечными продуктами могут быть:
1) 1,3-Дибромпропан;
2) 1,2-дибромпропан;
3) 3-бромпропен;
4) 2-бромпропанол-1.
6. При взаимодействии пропен-2 -ола-1 с бромово-
дородом промежуточным продуктом является:
1) 3-бромпропан;
2) 3-бромпропен;
3) 2-бромпропанол-2;
4) 1,2-дибромпропан.
7. Назовите по систематической номенклатуре спирт
1) 1 -бром-3-метил-2-этилциклогексанол-4;
2)2 -метил-4-бром-З -этилциклогексанол;
3) 4-бром-2-метил-3-этилциклогексанол;
4) 4-бром-6-метил-5-этилциклогексанол.
8. Укажите формулу 1,3-Дифенилпропанола-2:
— 685 —
9. Температура кипения первого спирта выше, чем
второго в парах:
1) СН2ОН — СНОН — СН,ОН; СНЭОН — СН,ОН;
2) СН3(СН2)3ОН; (СН3)3СОН;
3) СН3СНЭСН2ОН; СН3СН(ОН)СН3;
4) СН3СН2СН2ОН; СН3(СН2)3СН2()Н.
10. Укажите названия алкенов, гидратацией которых
можно с хорошим выходом получить З-метилгексанол-З:
1) З-метилгексен-2;
2) 4-метилгексен-2;
3) З-метилгексен-1;
4) З-метилгексен-З.
ТЕСТ 15
1. Чтобы получить в реакции с NaOH(H2O) 3,3-диме-
тилбутанол-2, нужно взять галогенпроизводное, назва-
ние которого:
1) 3-бром-2,2-диметилбутан;
2) 2-бром-3,3-диметилбутан;
3) 3,3-дибром-2,2-диметилбутан;
4) 2,2-дибром-3,3-диметилбутан.
2. При взаимодействии с NaOH(H2O) 1-хлорбутена-2
образуется спирт, название которого:
1) бутен-2-ол-1; 2) бутен-2-ол-2;
3) бутен-2-ол-4; 4) бутанол-2.
— 686 —
3. Вещество строения {_j может образоваться при
внутримолекулярной дегидратации:
1) пентандиола-1,4;
2) бутандиола-1,4;
3) бутандиола-1,3;
4) пентандиола-1,5.
4. При дегидратации пентандиола-1,3 может образо-
ваться вещество строения:
1) н3с — сн = сн — сн = сн.,,
2) Н2с = СН — сн2 — СН = СН2;
3) СН3 — СН2 — СН — СН — СН3;
4) Н3С — СН2 — СН2 — СН2 — С = О.
Н
5. Гомологический ряд насыщенных ациклических
трехатомных спиртов описывается формулами:
1)СН2„_,(ОН)3; ^CHJOH),;
3) С IVA; 4) с н2А
6. Укажите число изомерных ароматических одно-
атомных спиртов, содержащих 8 атомов углерода в мо-
лекуле:
1) три; 2) четыре; 3) пять; 4) шесть.
7. Сколько ближайших (отличающихся на один атом С)
устойчивых структурных изомерных спиртов есть у гли-
церина?
1) один; 2) два; 3) три; 4) четыре.
8. Гидратацией соответствующего алкена НЕ могут
быть получены спирты:
ОСН^СН, ОН; 2)СН3ОН;
--- 687 ---
С(СН3)3
3) СН3СН(ОН)СН3; 4) (Н3С)3С — С — С(СН3)3.
ОН
9. В реакцию внутримолекулярной дегидратации НЕ
могут вступать спирты:
1) бензиловый; 2) метиловый;
3) циклогексанол; 4) 2-метилпропанол-2.
10. НЕПРАВИЛЬНО химические свойства пропано-
ла-2 описывают уравнения реакций, схемы которых:
1) (СН3)2СНОН + Na (СН3)2СН — ONa + Н2;
2) (СН3)2СНОН + СиО СН3СН2СНО + Си + Н2О;
3) (СНДСНОН+Си(ОН)2 -> СН3С(О)СН3+Си2От Н2О;
4) (СНДСНОН (СН3)2СН —- О — СН(СН3)2.
ТЕСТ 16
1. Назовите по систематической номенклатуре спирт
строения
с2н5
СН — С — СН = СН, —СН, — СН,:
I I
он сн3 он
1) 5-метил-5-этилгексен-3-диол-1,6;
2) 2-метил-2-этилгексен-3-диол-1,6;
3) 5-метил-5-этилгексен-4-диол-1,6;
4) 2-метил-2-этилгексен-4-диол-1,6.
2. Энантиомеры возможны для:
1) бутанола-1;
2) бутанола-2;
— 688 —
3) 2-метилпропанола-2;
4) 2-метилпропанола-1.
3. Структурный изомер (изомеры) может (могут) быть у:
1) винилового спирта; 2) этанола;
3) бутандиола-1,4; 4) метанола.
4. При горении спирта образовались равные химичес-
кие количества СО2 и Н2О. Укажите название спирта:
1) бензиловый; 2) этиленгликоль;
3) глицерин; 4) циклогексанол.
5. Для химических превращений, протекающих по
схеме С Н, ,Вг-ЛС Д -Y^C Н, ,,О^> С, Н +Д
укажите формулы реагентов соответственно X, Y, Z:
1) КОН (спирт), Н28О4(конц„ 180 °C), Н,О (Н+);
2) КОН (водн.), 1ЦО (Н+), НДОДконц., 140 °C);
3) КОН (спирт), Н2О (Н+), Н,8О4(конц., 140 °C);
4) КОН (спирт), Н2О (Н+), Н28О4(конц., 180 °C).
6. Назовите по систематической номенклатуре спирт
строения
сн2 —сн2 —сн3
Н3С — СН2 — С — СН — СН — СН3:
ОН СН2 — СН3
1) 6-метил-4-этилоктанол-4;
2) 4-этилнонанол-5;
3) 3-метил-1 -пропил-1 -этилпентанол-1;
4) 5-метил-З-пропилгептанол-З.
7. Для химических превращений, протекающих по
схеме С Н,я + ,ONa СН,л + 3О —С Н,в + ,Вг
—» ДН4л+2, укажите формулы реагентов соответствен-
но X‘Y,Z:
1) Н2О, Br2(CCl4), Na; 2) НД HBr, Na;
— 689 —
3) НВг, Н2о, Na; 4) Н20, НВг, Н28О4(конц., 140 °).
8. При нагревании 1-метилциклопентанола
с H2SO4 (конц.) можно получить:
1) 1-метилциклопентен;
2) 1-метилциклогексен;
3) дициклопентиловый эфир;
4) 1 -метилциклопентандиол-1,3.
9. При нагревании 1-метилциклогексанола
с H2SO4 (конц.) НЕЛЬЗЯ получить вещества строения:
10. Число изомерных алкенов, которые можно полу-
чить при нагревании гексанола-2 с H2SO4 (конц.), рав-
но:
1) один; 2) два; 3) три; 4) четыре.
ТЕСТ 17
1. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
+1 МО*1Ь Вг, №у) д + NaOH (Н,О)^ g Н,5О.(конц), 1 > 140 °g g
+ КМпО, (5 °C, Н,О^ р
2. Укажите число первичных атомов углерода в мо-
лекуле основного органического вещества Г для цепоч-
ки превращений, протекающих по схеме:
— 690 —
Н3С.
СН — CH2Br +KOH<<wr^ д + ндо/н'^ Б +нвг в
Н3С^
+ Na (изб.)^ р
3. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
+ 1 моль Вг2(Ау)^ а + NaOH (спирт) g + КМпО4 (5 °C, Н2О^ g _
+ НВг (изб.)^ р
4. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
+ 1 моль С1Д, Лу д -I- КОН (Нд(Д g + CuO, t° g + LiAlH,^ p
5. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
Срр + Н О Ni'850 °с~ А + Б е,р' KaT,j В + H;SO< ^оиц1 г
6. Укажите молярную массу (г/моль) органического
вещества Д для цепочки превращений, протекающих по
схеме:
CJ-J 1500 °с, + О, д + 1 моль Нд, Ni^ g +Н,О/1Г g + Na, р + Н,0 д
7. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
С[ [ (-J + Na (изб.) Д + 1 моль Вгд, Лу g + КОН (спирту g + НДО/Н’^ р
8. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
СН Вг + Na А + 1 мояьСЬ |, + NaOH (Н,О) g + H;SO, р
n3D * Г <140’0’
--- 691 ----
9. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Д и Ж для цепочки превращений, протека-
ющих по схеме:
Q | ] + 1 моль Cl„ A + Na(H]6), g кат. ? g С (актив ), г°
14 -2 мольН,
> Г СН, СН/1Г Д + 1 МОЛЬ силу J? + NaOH(H,O)^
10. Укажите сумму молярных масс (г/моль) органи-
ческих веществ В и Г для цепочки превращений, проте-
кающих по схеме:
2-бромпропан +.n*oh(W А Б +-НС1(и-збг В Г.
ТЕМА 48
Фенолы
ТЕСТ1
1. Укажите формулы фенолов:
2. В каких парах первое вещество обладает более силь-
ными кислотными свойствами, чем второе?
1) фенол и метанол; 2) метанол и диметиловый эфир;
3) вода и фенол; 4) угольная кислота и фенол.
3. Влияние гидроксильной группы на свойства фено-
ла состоит в том, что:
1) кислотные свойства фенола выше, чем у метанола;
2) повышается электронная плотность в положениях
2,4,6 бензольного кольца;
— 692 —
3) реакции замещения в бензольном кольце для фено-
ла протекают легче, чем для бензола;
4) фенол, в отличие от метанола, реагирует с водны-
ми растворами щелочей.
4. Охарактеризуйте свойства фенола:
1) ядовит;
2) кристаллическое вещество (20 °C);
3) неограниченно растворим в воде (20 °C);
4) без запаха.
5. Как фенол, так и бензол реагируют с:
1) бромной водой;
2) натрием;
3) нитрующей смесью;
4) водным раствором гидроксида натрия.
6. Укажите число G-связей в молекуле фенола:
1)11; 2) 12; 3)13; 4) 15.
7. Для обнаружения фенола используются:
1)хлороводород;
2) свежеприготовленный гидроксид Cu(II);
3) хлорид железа (III);
4) бромная вода.
8. Укажите число изомерных бензолдиолов:
1)2; 2) 4; 3) 3; 4) 5.
9. Для дезинфекции помещений используется раствор:
1) бензола; 2)толуола;
3) диметилового эфира; 4) фенола.
10. Как фенол, так и бензиловый спирт реагируют с:
1)хлороводородом;
2)калием;
3) водным раствором гидроксида калия;
4) гидрокарбонатом натрия.
— 693 —
ТЕСЛ
1. Сколько веществ изображено с помощью формул:
1) 1; 2) 2; 3)3; 4) 4.
2. Различить пробирки с бензольными растворами
фенола и этанола можно с помощью:
1) натрия; 2) гидроксида калия;
3) бромной воды; 4) хлороводорода.
3. Чему равен угол связи ОСС в молекуле фенола?
1) 90°; 2) 109°; 3) 120°; 4) 107°.
4. Укажите формулу продукта реакции между избыт-
ком калия и веществом строения
5. Соединение, формула которого НО—
реагирует с:
а) натрием; б) гидроксидом калия (Н2О);
в) бромоводородом; г) метанолом (Н+).
— 694 —
1)а, б, в; 2)6, в, г;
3) а, б, в, г; 4) а, в, г.
6. Фенол образуется при взаимодействии:
1) фенолята калия и соляной кислоты;
2) хлорбензола и NaOH (t°, Р),
3) фенолята натрия и водного раствора СО,;
4) фенолята натрия и этанола
7. Укажите число различных веществ в перечне: древес-
ный спирт, метанол, карболовая кислота, кумол, изопропил-
бензол, фенол, пикриновая кислота, 2,4,6-тринитрофенол:
1) восемь; 2) семь; 3) пять, 4) четыре.
8. В отличие от этанола фенол реагирует с:
1) калием; 2) водным раствором КОН;
3) хлороводородом; 4) сульфатом калия.
9. НЕ является ароматическим веществом:
1) фенол; 2) кумол;
3) пикриновая кислота; 4) 1,3-циклогексадиен.
10. Укажите формулу продукта реакции между фено-
лом и метаналем:
ОН Л/СН3 ' он JL/CHO о он Л/СН2ОН он „ JL/СООН
— 695 —
ТЕСТЗ
1. Укажите формулу соединения, которое является
2. Охарактеризуйте реакцию фенола с бромной водой:
1) реакция замещения;
2) сопровождается образованием белого осадка;
3) продуктами являются соль и 2,4,6-трибромфенол;
4) качественная реакция на фенол.
3. В водном растворе фенола лакмус фиолетовый:
1) синий; 2) красный;
3) фиолетовый; 4) желтый.
4. Бензольные растворы толуола, фенола и стирола
можно различить с помощью:
1) натрия; 2) карбоната натрия;
3) бромной воды; 4) гидроксида натрия.
— 696 —
5. Укажите формулы изомеров 2-мстилфснола:
6. Фенолят натрия образуется при взаимодействии
фенола с:
1) натрием; 2) гидроксидом натрия;
3) нитратом натрия; 4) хлоридом натрия.
7. При взаимодействии фенола с какими веществами
замещению подвергаются атомы водорода в бензольном
кольце?
1) азотная кислота;
2) бромная вода;
3) гидроксид натрия;
4) метаналь (на первой стадии).
8. Для приготовления динамита используется:
1)толуол; 2)тринитротолуол;
3) пикриновая кислота; 4) тринитроглицерин.
9. Какое вещество наиболее энергично (с наибольшей
скоростью) взаимодействует с натрием?
1) фенол; 2) 2,4,6-тринитрофенол;
3) глицерин; 4) метанол.
— 697 —
10. В водных растворах каких веществ среда щелочная?
I) метилат калия; 2) фенолят натрия;
3) 2,4,6-тринитрофенол; 4) глицерин.
ТЕСТ 4
1. Укажите число изомерных фенолов состава CgH|0O:
1) шесть; 2) семь; 3) восемь; 4) девять.
2. В чем проявляется влияние бензольного кольца на
свойства фенола?
1) повышается электронная плотность в положениях
2,4,6 ароматического кольца;
2) атом водорода гидроксильной группы фенола бо-
лее подвижен, чем атом водорода гидроксильной груп-
пы ₽ ддканолах;
3) фенол в отличие от насыщенных одноатомных
спиртов реагирует с водными растворами щелочей;
4) фенол в отличие от бензола реагирует с бромной
водой.
3. Укажите формулы изомеров 2-этилфенола:
— 698 —
4. Связь С — Cl наиболее прочная в:
1) хлорметане; 2) хлорбензоле;
3) хлорэтане; 4) 2-хлорпропане.
5. Какие два органических вещества используются для
получения фенола в промышленности?
1)толуол; 2) бензол;
3) этилен; 4) пропилен.
6. Помутнение холодного водного раствора наблюда-
ется при взаимодействии:
1) водного раствора фенолята натрия и НС1;
2) фенола и бромной воды;
3) водного раствора фенолята калия и СО,;
4) глицерина и свежеприготовленного гидроксида
меди (II).
7. Атомы водорода гидроксильных групп равноцен-
ны в химическом отношении в молекулах:
1) глицерина;
2)этиленгликоля;
3) бензол диол а-1,4;
4) пропандиола-1,2.
8. Фенол в промышленности используют для полу-
чения:
1) пластмасс;
2) лекарственных препаратов;
3) красителей;
4) этанола.
9. Фенолят калия можно получить при взаимодей-
ствии:
1) фенола и калия;
2) фенола и гидроксида калия (водный раствор);
3) ацетата калия и фенола;
4) фенола и хлорида калия.
— 699 —
10. Фенол образуется при взаимодействии:
1) С,Н —ОК и СН ОН;
' О J J
2) и NaOH (t°, р);
3) С6Н—СН3 и KMnO4(f°);
4) С6Н5—СН(СН3)2 и О2 (Г°, кат.).
ТЕСТ 5
1. Укажите формулу продукта реакции между избыт-
ком водного раствора КОН и веществом строения
ОН
700 ---
2. То, что фенол слабая кислота, показывает реакция,
схема которой:
3. Охарактеризуйте вещество строения
1) двухатомный ароматический спирт;
2) реагирует с водным раствором КОН;
3) ароматическое вещество;
4) гомолог фенола.
4. Фенол реагирует, а этанол — нет с:
1) калием;
2)хлороводородом;
3) азотной кислотой;
— 701
4) водным раствором гидроксида калия.
5. Фенолам могут отвечать формулы:
1) СД.О; 2) СбНбО3; 3) С7Н8О; 4) СДО,.
6. Связь О — Н наиболее полярная в молекуле:
1) воды, 2) метанола,
3) фенола; 4) пропанола-2.
7. Фенол НЕ проявляет кислотных свойств, реагируя с:
1)Вг2(Н2О), 2) HNO,;
3) NaOH; 4) К.
8. Водородные связи НЕ могут образоваться между
молекулами:
1) фенола и воды;
2) диметилового эфира и диэтилового эфира,
3) бензилового спирта и воды;
4) этиленгликоля и метанола.
9. К одному классу относятся вещества строения
ОН ОН
А Б
НО —(О)— СН.; Н,С — СН— С = О:
। ।
ОН ОН н
в
1) А и Б; 2) А и Г; 3) Б и В; 4) Б и Г.
10. Окислительно-восстановительными будут реак-
ции фенола с:
1)Вг2(Н,О); 2)КОН(Н,О);
3) HNO '; 4) К
--- 702 ----
ТЕСТ 6
1. Атомы Н в группе ОН фенола замещаются, когда
фенол реагирует с: <
1) КОН(Н2О); 2) Вг2(Н2О); 3) К; 4) НС1.
2. В порядке усиления кислотных свойств (т. е., уси-
ления подвижности атома Н гидроксильной группы) ве-
щества перечислены в рядах:
1) бутанол-1, фенол, 2-метилпропанол-2, 2,4,6-три-
нитрофенол;
2) 2-метилпропанол-2, бутанол-1, фенол, 2,4,6-три-
нитрофенол;
3) этанол, глицерин, фенол, пикриновая кислота;
4) этанол, вода, фенол, бензиловый спирт.
3. Укажите формулу продукта, который образуется при
взаимодействии избытка НВг с веществом строения
Н°—(Q>— СН2ОН:
1)вг~СЭ—сн20Вг; 2)но~<О>~сн2вг;
3)Br — <Q> —сн2Вг; 4)ВгО —<Q> —СН2Вг.
4. Скорость реакции замещения атомов Н в бензольном
ядре последовательно возрастает в ряду соединений:
1) бензол, толуол, фенол, 2,4,6-тринитрофенол;
2) толуол, бензол, фенол, 2,4,6-тринитрофенол;
3) нитробензол, бензол, толуол, фенол;
4) нитробензол, бензол, фенол, толуол.
5. Укажите общую формулу гомологов фенола: > >
1)СН, fiO;2)CH, 7О;3)СН, „О; 4) С Н ,0.
7 п 2л - 6 ’ 7 п 2л - 7 ’ 7 п 2л - 8 ’ 7 п п-6
6. В молекуле гомолога фенола содержится 66 электро-
нов. Укажите число изомерных фенолов такого состава:
1) 10; 2) 9; 3) 8; 4) 7.
— 703 —
7. Укажите электронную формулу молекулы фенола:
:О:Н :О:Н
I) Н С С С Н 2) Н С С С Н
нЯс^'н н ’ ё с -^ н
ii н
:О:Н О:Н
3) Н сЛс- Н -*) н- с;?-с -н
и-ё’^-ё и н ^н
ii ii
8. Укажите число изомерных фенолов состава С6Н6О3:
1)4; 2)3; 3)2; 4)5.
9. Назовите по систематической номенклатуре как
производное фенола вещество строения
ОН
Вг
1) 4-бром-2-метил-5-нитрофенол;
2) 4-бром-6-метил-3-нитрофенол;
3) 4-бром-5-нитро-2-метилфенол;
4) 4-бром-3-нитро-6-метилфенол.
10. Химические свойства фенола НЕПРАВИЛЬНО
описывают реакции, схемы которых:
а) С6Н5ОН + НВг -> С6Н5Вг + Н2О;
б) С JLOH + CuO -> C.ILCHO + Си + НО;
z О 3 0 3 £
--- 704 ----
в) С6Н5ОН + NaOH -> C6H5Na + Н2О;
г) С6Н5ОН + Вг2(Н2О) изб. -> С6Н4ВгОН + НВг.
1) а, б, в; 2) а, б, в, г; 3) б, в, г; 4) а, в, г.
ТЕСТ 7
1. Вещество состава СкН10О реагирует с Na и NaOH(H,O),
а под действием Вг2(Н,О) превращается в вещество со-
става С8Н7Вг3О. Исходное вещество может иметь
структуру:
2. С FeCl3 дают фиолетовое окрашивание, реагируют
с КОН (Н2О) и НВг вещества, формулы которых:
1)<Q^CH —СН3;
ОН
2) НО
СН2 —СН —СН3;
ОН
23 Зак 1530
--- 705 ----
НО
4)
— СН, —СН, — ОН.
3. Укажите число всех изомерных ароматических ве-
ществ состава C7HgO:
1) 6; 2) 5; 3) 4; 4) 3.
4. Вещество состава C7HgO не дает характерной реак-
ции с FeCl3, в реакции с НВг образует вещество состава
С7Н7Вг, окисляется раствором КМпО4 в вещество соста-
ва С7Н6О2. Формула исходного вещества — это:
ОН
5. Дана цепочка превращений C6H5ONa + HiO> + со’> А —>
+.™°»(конц -из6^ Б +КНСО1> в. Укажите молярную массу (г/моль)
органического вещества В:
1)267; 2) 228; 3) 207; 4) 160.
6. Для цепочки превращений X + КОН(Н’О)> А X ве-
ществом X может быть:
— 706 —
он
СН2ОН
сн3
он
3)[ф 4) СН3СН,ОН
СН2СН2ОН
7. Сколько веществ из нижеперечисленных в водном
растворе реагируют с 2,4,6-тринитрофенолом: КОН, NH3,
NaHCO3, Na?
1) одно; 2) два; 3) три; 4) четыре.
8. Сколько ароматических веществ состава С?Н8О ре-
агируют как с К, так и с КОН(Н2О)?
1) 5; 2) 4; 3) 3; 4) 2.
9. Сильнее, чем у фенола, кислотные свойства выра-
жены у соединений:
ОН
сн3
сн3
— 707 —
он он
no2 cf3
10. Вещество состава С7Н8О НЕ реагирует ни с К, ни
с КОН(Н,О). Укажите его формулу:
ОН
ОН
СН3
--- 708 ---
ТЕМА 49
Альдегиды
ТЕСТ1
1. Назовите по систематической номенклатуре альде-
гид строения
СН,— СН, СН — СН,:
I
с = о
I
н
1) бутаналь-2; 2) З-метилбутаналь-4;
3)2-метилбутаналь, 4) 2-этилпропаналь.
2. Укажите формулу функциональной группы альде-
гидов:
1) — С = О; 2) — с ;
| ОН
3) —С , 4) —ОН.
хн
3. Состав насыщенных ациклических альдегидов вы-
ражается формулой:
1)СН, ,О;2)СН,+,О;3)СН,О;4)СН О.
4. Для насыщенных ациклических альдегидов возмож-
на изомерия:
1) положения альдегидной группы;
2) углеродного скелета;
3) пространственная {цис-, транс-)',
4) функциональных групп.
--- 709 ---
5. Число альдегидов с общей формулой C4HgO равно:
1)3; 2) 2; 3) 5; 4) 4.
6. Охарактеризуйте физические свойства метаналя:
1) жидкость (н.у);
2)ядовит;
3) обладает резким запахом;
4) хорошо растворим в воде.
7. Укажите формулу альдегида с наиболее активной
альдегидной группой в реакциях присоединения:
.О
1)Н —С ; 2)СН—С ;
ХН ХН
3)CCL— С ; 4)СНС1— С .
ХН ХН
8. Пентаналь подвергли монобромированию в мяг-
ких условиях. При этом преимущественно образуется:
1) 3-бромпентаналь; 2) 4-бромпентаналь;
3) 5-бромпентаналь; 4) 2-бромпентаналь.
9. Укажите формулу спирта, при дегидрировании ко-
торого получается 3,3-диметилбутаналь:
1) (СН3)3ССН2 СН2ОН;
2) СН3СН2С(СН3)2СН2ОН;
3) СН3СН(СН3)СН(СН3)СН2ОН;
4) СН3СН2СН2ОН.
10. Формалином называется:
1) 35—40%-ный раствор этанола в воде;
2) 35—40%-ный раствор метаналя в воде;
3) 35—40%-ный раствор муравьиного альдегида в
воде;
4) 35—40%-ный раствор формальдегида в воде.
— 710 —
ТЕСТ 2
1. Назовите по систематической номенклатуре альде-
гид строения
СН3—СН —СНО:
СН
Н3С СН3
1) 2-изопропилпропаналь;
2) 2-изопропилпропионовый;
3) 2,3-диметилбутаналь;
4) 2,3-диметилвалериановый.
2. Число изомерных альдегидов состава С5Н10О равно:
1)3; 2) 4; 3)2; 4) 5.
3. При восстановлении бензальдегида С6Н5—СНО
образуется:
1) фенол; 2) бензол;
3) бензойная кислота; 4) бензиловый спирт.
4. Этаналь можно получить:
1) дегидрированием этанола;
2) каталитическим окислением этанола кислородом;
3) взаимодействием этилена с водой;
4) взаимодействием ацетилена с водой.
5. При восстановлении 3-метилбутаналя образуется
спирт:
1) третичный бутиловый; 2) 2-метилбутанол-1;
3) 3-метилбутанол-1; 4) 2-метилбутанол-4,
6. Хуже других из перечисленных в воде растворяет-
ся альдегид:
1) пентаналь; 2) пропаналь; 3) метаналь; 4) бутаналь.
7. Гомологи метаналя — это:
1) этаналь; 2) формалин; 3) бутаналь; 4) этанол.
— 711
8. Изомером 2-метилпропаналя является:
1) 1 -бутанол; 2)бутаналь;
3) валериановый альдегид; 4) пентаналь.
9. Охарактеризуйте строение карбонильной группы:
1) связь ковалентная полярная;
2) электронная плотность смещена к атому углерода;
3) связь двойная, состоит из о- и 71-связей;
4) электронная плотность смещена к атому кислорода.
10. При взаимодействии насыщенных альдегидов с
водородом образуются:
1) карбоновые кислоты; 2) вторичные спирты;
3) первичные спирты; 4) простые эфиры.
ТЕСГЗ
1. Охарактеризуйте альдегид строения
/°
сн3— сн2 сн3
1) называется 2,2,3-триметилпентаналь;
2) изомер октаналя;
3) гомолог октанола-1;
4) при восстановлении водородом образует 2,2,3-три-
метилпентанол-1. . ,
2. При окислении этаналя в различных условиях мо-
гут образоваться:
1) этанол; 2) этановая кислота;
3) углекислый газ; 4) вода.
— 712 —
3. При окислении этилена кислородом в присутствии
хлоридов палладия и меди преимущественно образуется:
1) этанол; 2) уксусная кислота;
3) ацетальдегид; 4) этаналь.
4. При окислении спирта строения
сн3 а
I I
сн3 — с — с — сн,он
I I
сн3 сн3
образуется альдегид:
1) З-метил-2-хлорбутаналь;
2) 2-хлор-2,3,3-триметилбутаналь;
3) 2,3,3-триметил-2-хлорбутаналь;
4) 1,2,2-триметил-1-хлорбутаналь.
5. Укажите название конечного продукта реакций,
протекающих по схеме СН3—СНО A ±52^. В С:
1) этановая кислота; 2) этанол; 3) бутан; 4) этилбромид.
1
6. В молекуле формальдегида Н—
2^°
С 4 В ОДНОЙ ПЛОС-
КИ
кости лежат атомы, номера которых:
1) только 1,2,4; 2) только 3,2,4;
3) только 1,2,3; 4) 1,2, 3,4.
7. Укажите электронную формулу муравьиного аль-
дегида: --
.О: <О: ...0: -О-
1)Н:С*. 2)Н:С': 3)Н:С.' 4)Н:сТ
Н Н Н Н
8. Укажите формулу соединения, которое с наимень-
шей скоростью вступает в реакции присоединения:
— 713 —
✓°
1)СН,— С — СИ,; 2)Н— С ;
II Н
<V° ^0
3)СН — С ; 4)СС1,— С
ХН ХН
9. При взаимодействии с какими реагентами при со-
ответствующих условиях этаналь превращается в уксус-
ную кислоту?
1) K2Cr2O7/H2SO4; 2) KMnO4/H2SO4;
3) Н2; 4) аммиачный раствор Ag2O.
10. В порядке возрастания температуры кипения ве-
щества перечислены в ряду:
1) этанол — этаналь — этан;
2) этан — этаналь — этанол;
3) этаналь — этан — этанол;
4) этанол — этан — этаналь.
ТЕСТ 4
1. Укажите название альдегида, который образуется
при окислении спирта строения
СН3 —СН —СН2ОН:
I
с2н5
1) 2-этилггропаналь; 2) 2-метилбутаналь;
3) пентаналь; 4) масляный.
2. Охарактеризуйте связи в молекуле этаналя:
1)7 а; 2)5ои2л;
3) 6 о и 1 л; 4) все связи ковалентные.
3. Альдегид может образоваться при взаимодействии:
1) СН, = СН, и КМпО4 (5 °C, Н20);
2) CHJ — СН = СН, и СО + Н, (7°, Kat);
--- 714 ----
3) СН3 — С = СН и Н,0 (Hg27H+);
4) СН3ОН и CuO (/°). - *
4. С какими веществами может реагировать пропе-
наль СН2 — СН — СНО?
а) бромной водой;
б) бромоводородом;
в) гидроксидом меди (II) при нагревании;
г) водородом (t°, кат.).
1) а, б, в; 2) а, в, г;
3) б, в, г; 4) а, б, в, г.
5. При полном гидрировании пропеналя образуется:
1) пропановая кислота; 2) пропен;
3) пропаналь; 4) пропанол-1.
6. При взаимодействии какого вещества с фенолом об-
разуется продукт, используемый для получения пластмасс?
1) гидроксид натрия; 2) этанол;
3) азотная кислота; 4) метаналь.
7. Укажите формулу вещества, которое получается при
взаимодействии формальдегида с водой:
Н
Л)
1)Н —С 2)Н —С —Н
^ОН |
Н
сн3 н
3) С 4)н —С —О —Н
|\он I
он о —н
8. Укажите число изомерных альдегидов состава С6Н12О
(без учета стереоизомерии):
1)5; 2) 7; 3)8; 4) 6.
--- 715 —
9. Между собой гомологами являются:
1) масляный альдегид; 2) бутанол-2;
3) 2-хлорбутанол-2; 4) пентаналь.
10. Муравьиный альдегид может реагировать с:
а) фенолом; б) водой; в) кислородом; г) водородом.
1) а, б, в; 2)6, в, г;
3) а, б, в, г; 4) а, в, г.
ТЕСТ 5
1. Как по систематической номенклатуре называется
альдегид, который образуется при окислении спирта
строения
СН3
I
сн3 —с —сн2он?
с2н5
1) 2-метил-2-этилпропаналь; 2) 2-метилбутаналь;
3) 2,2-диметилбутаналь; 4) 2-диметилбутаналь.
2. Укажите число атомов С в молекуле альдегида, при
окислении которого образуется бензойная кислота:
1) 5; 2) 6; 3) 7; 4) 8.
3. Бензальдегид образуется при окислении:
1) фенола; 2) бензилового спирта;
3) бензойной кислоты; 4) бензолдиола-1,4.
4. Сколько альдегидов изображено с помощью формул:
С2Н5
хн
сн—сн3
сн3 —сн2—сн —с
сн3
--- 716 ---
сн3
сн3
I
с —с
I Хн
сн3
1) 1;2) 2; 3)3; 4) 4.
5. Укажите название по систематической номенкла-
туре альдегида строения
СН3
I
СН3 —С —СН2 —С ?
I
сн2 —сн2 —сн3
1) 3-изопропил-3-метилбутаналь;
2) З-пропил-З-метилбутаналь;
3) 3,3-диметилгексаналь;
4) 3-диметилгексаналь.
6. Какие последовательности реактивов позволяют
осуществить превращения по схеме
С2НЛ -> С,Н Br -> CJLOH -> СН, — С ?
2 о 2 j 2 Э 3 's.
н
1) бром — водород — гидроксид натрия;
2) бром — гидроксид натрия — водород;
3) бром — гидроксид натрия — оксид меди (II);
4) бром — гидроксид калия — кислород (в присут-
ствии катализатора).
7. В каком ряду альдегиды перечислены в порядке
возрастания активности альдегидной группы в реакци-
ях присоединения?
1) этаналь — метаналь -— трихлорэтаналь;
2) метаналь -— трихлорэтаналь — этаналь;
--- 717 ----
3) трихлорэтаналь — метаналь — этаналь;
4) этаналь — трихлорэтаналь — метаналь.
8. Чтобы получить 2,2-диметилпропаналь необходи-
мо окислить спирт:
1) 2-метилпропанол-1;
2) 2-метилпропанол-1,
3) 2,2-диметилпропанол-1;
4) 2,2-диметилбутанол-1.
9. Укажите формулу продукта реакции метаналя с ме-
танолом (мольное отношение 1:1):
осн3 1
i)H—С —осн3; II О 1 2) Н — СН ; 1 ОН
3)CH3 —С —ОН; II О 10. Отметьте формулу ацеталя: 4) СН,СН,ОН
ОСН3
1) СН3 —С —О —С —СН3; 2)СН3 — СН ;
II II I
о о он
ос2н5
I
3)Н —СН , 4) СН, — О — С,Н,.
ОС2Н5
— 718 —
ТЕСТ 6
1. При восстановлении альдегида образуется 2,2-ди-
метилбутанол-1. Укажите число атомов всех элементов
в молекуле альдегида:
1) 19; 2) 18; 3) 17; 4) 16.
2. Назовите по систематической номенклатуре про-
дукт X для реакции (СНДС — СНО -+-'А1Д, X:
1) 2-метилпропанол-1; 2) 2-метилбутанол-1,
3) 2,2-диметилпропанол-1, 4) 3,3-диметилбутанол-1.
3. Назовите по систематической номенклатуре гало-
генпроизводное А для цепочки химических превраще-
ний, протекающих по схеме А + К9Н№О)> + K,cr,o/H,sos
—> 2,3-диметилбутаналь:
1) 2,3-диметил-1-хлорбутан;
2) 3,3-диметил-1-хлорбутан;
3) 2,2-диметил-1-хлорбутан,
4) 2-метил-1-хлорбутан.
4. Укажите номер связи, по которой окисление альде-
гидов протекает наиболее легко
Н Н
I । >°
R—С—С—С4 :
I I хн
1)4;2)3;3)2;4) 1,Н Н
5. В раствор пропанола-2 погружают раскаленную
медную проволоку и получают: - ,
1) пропаналь;
3) пропановую кислоту;
6. Продукт реакции (на первом этапе) между фено-
лом и метаналем может взаимодействовать с:
а) фенолом; б) водным раствором щелочи;
2) пропанон,
4) пропен.
719 —
в) калием; г) бромоводородом.
1) а, б, в, г; 2) а, в, г;
3) б, в, г; 4) а, б, в.
7. С фенолом может реагировать вещество, формула
которого:
1)НВг;
ОН
СН2ОН
2) KNO3(p-p, 20°С)
4) КНСО/р-р).
8. Укажите формулу вещества X для цепочки превра-
щений, протекающих по схеме
СН3- СВг2 - СН
+ NaBH, у.
+ КОН (спирт, р-р, из(х) д 4- Н2О (Hg*7H^ g ______________
1) СН3СН2СН2ОН; 2) СН3СН,СООН;
3) СН3СН2СНО; 4) СН3СН(ОН)СН3.
9. К одному классу функциональных производных
углеводородов относятся вещества, формулы которых:
10. Укажите формулу вещества X для цепочки превра-
щений, протекающих по схеме (учтите, что соединения
с двумя и более группами -ОН при одном и том же ато-
ме С неустойчивы)
СаС +н'°> А +НВг(изЦ Б + кон (н,о) из^.
1) СН3СНО; 2) СН3 - СНВг,;
3) СН3СН2ОН; 4) СН3СООН.'
--- 720 ---
ТЕСТ 7
1. Укажите число атомов Н в молекуле альдегида, при
окислении которого образуется метакриловая кислота:
1) 6; 2) 7; 3) 8; 4) 5.
2. Назовите по систематической номенклатуре альде-
гид строения qjj
I ’
Н3С —СН
\
сн—с
I хн
н3с—сн2
1) этилизопропилметаналь; 2) 2-изопропилбутаналь;
3) З-метил-2-этилбутаналь; 4) изопропилэтилэтаналь.
3. Укажите формулы веществ, относящихся к одному
классу функциональных производных углеводородов:
1)Н3С —О —СН3;
3) H3C —С —СН3;
О
О
4. Изомеры ацетальдегида — это:
1) ацетон; 2) виниловый спирт;
3) этиленоксид; 4) диметиловый эфир.
5. Укажите число изомеров состава С2Н4О (включая
неустойчивые):
1) 2; 2) 3; 3) 4; 4) 5.
6. Для цепочки превращений, протекающих по схеме
С И ют, Д +0>(МС11)
НП6 -ц А ’
g -t-LiAlH., g 4-CiH,OH(140°C,H;SO<)j
X, ука-
--- 721
жите молярную массу (г/моль) основного органического
вещества X:
1)46; 2) 74; 3) 44; 4) 108.
7. Назовите по систематической номенклатуре веще-
ство, при восстановлении которого образуется 2,3,3-три-
метилбутанол-1, а при окислении — 2,3,3-триметилбу-
тановая кислота:
1) 2,3,3-триметилбутаналь,
2) 2,2,3-триметилбутаналь,
3) 2,3,3-триметилпентаналь;
4) 2,2,3-триметилпентаналь.
8. Для цепочки превращений, протекающих по схеме
СН, - СНО А Ж Б в .сио,^ кажи-
те молярную массу (г/моль) органического вещества X:
1) 60; 2) 46; 3) 44; 4) 30.
9. Метаналь можно получить:
1) окислением метанола;
2) окислением метановой кислоты;
3) гидратацией этина;
4) окислением метана.
10. Укажите суммарное число атомов всех элементов
в молекуле спирта, при окислении которого образуется
2-метил-2-фенилбутаналь:
1)30, 2) 29; 3)27; 4)28.
ТЕСТ 8
1. Назовите по систематической номенклатуре альде-
гид строения
Вг О
--- 722 ----
1) 2-бром-З-метилбутаналь;
2) З-бром-4-метилпентаналь;
3) 4-метил-З-бромпентаналь;
4) З-метил-2-бромбутаналь.
2. Укажите формулу вещества, которое в основном об-
разуется при гидратации бутина-1 в условиях реакции
Кучерова:
1) СН3СН,СН2СООН;
2) СН — СН, — С — СН,;
II
О
3) СН3 — С'Н, — СН2 — СНО;
4) СН3 — СН2 — СН — СН3.
I
ОН
3. При взаимодействии 1,1-дибром-З-метилпентана
с избытком водного раствора щелочи образуется соеди-
нение, формула которого:
1) СН3 — СН2 — СН — СН, — СН2Вг;
СН3
2) СН3 — СН2 — СН — СН2 — СООН;
СН3
3) СН3 — СН2 — СН — СН2 — СНО;
СН3 f
’ 4) СН3 — СН,— СН — СН2 — СН,ОН.
I
сн3
— 723 —
4. Укажите формулу вещества, которое образуется при
взаимодействии 4-метил-2,2-дихлорпентана с избытком
водного раствора щелочи:
1) СН( — СН — СН, — СН, — СНО;
I
сн3
2) СН — СН — СН, — С — СН3;
I ' II
снз О г.
3) СН3 — СН — сн2 — СН, — СООН;
СН3
4) сн3 — СН — сн, — сн2 — сн2он.
сн3
5. Назовите по систематической номенклатуре вещество,
которое образуется при восстановлении соединения:
1) 2-фенилбутанол-2; 2)1 -фенилбутанол-2;
3)1 -фенилбутанол-1; 4) 2-фенилбутанол-1.
6. Сколько ненасыщенных ациклических альдегидов
имеют состав С4Н6О?
1)5; 2) 4; 3)3; 4) 2.
7. Укажите молярную массу (г/моль) органического веще-
ства Г для цепочки превращений, протекающих по схеме
(СН3),СН - С(О) - СН2 — снз » А /В Б 5
Г:
1) 86; 2) 84; 3) 80; 4) 78.
— 724 ------
8. Отметьте формулу продукта реакции между 1 моль
метаналя и 1 моль метанола:
ОН осн3
1)Н —СН 2)Н —СН
осн3 осн3
он сн3
I I
3)Н —СН 4)Н —СН
сн3 сн3
9. Укажите число изомерных веществ состава С3Н6О
(включая неустойчивые):
1)9; 2)8;3) 7; 4) 6.
10. При сгорании альдегида массой 3,480 г получили
СО2 объемом (н.у) 4,032 дм3. Укажите формулу альдегида:
1)НСНО; 2)СН3СНО;
3) С2Н5СНО; 4) С3Н7СНО.
ТЕСТ 9
1. Укажите название по систематической номенкла-
туре альдегида строения
Вг
1) 4-бром-3,6-диметилгептаналь-5-ен;
2) 4-бром-3,6-диметилгептен-5-аль;
3) 4-бром-2,5-диметилгептен-2-аль-7;
4) 4-бром-2,5-диметилгептаналь-2-ен-2.
— 725 —
2. Такую же степень окисления, как и атом углерода
карбонильной группы в молекуле ацетона, атом углеро-
да имеет в молекуле:
1)этиленгликоля; 2)этаналя;
3) уксусной кислоты; 4) угарного газа.
3. Укажите справедливые утверждения:
1) любой альдегид имеет изомерный ему кетон;
2) насыщенные ациклические альдегиды по составу
изомерны циклоалканолам;
3) температура кипения этанола выше, чем у этаналя;
4) эпоксиды и кетоны — межклассовые изомеры.
4. Для получения альдегидов из первичных спиртов
можно использовать реагенты:
1) NaBH4; 2) CuO;3) К2Сг2О7; 4) НВг
5. Из соответствующего алкина по реакции Кучерова
НЕЛЬЗЯ получить альдегиды:
1)НСНО, 2) СН,СНО,
3) СН3СН2СН;СНО; 4) СбН5СНО.
6. Укажите формулу продукта реакции между ацеталь-
дегидом и цианистоводородной кислотой HCN:
ОН
I
1) СН3 —СН
CN
ОН
I
3)СН3 —С—CN
CN
2)СН3 —СН2
CN
CN
I
4) СН3 —С—CN
CN
--- 726 ----
7. Выберите формулу З-бром-4-гпдроксибутаналя:
8. Кислотные свойства соединений последователь-
но возрастают в ряду:
1) вода, этанол, этаналь, фенол,
2) этанол, вода, этаналь, фенол,
3) этаналь, этанол, вода, фенол;
4) этаналь, этанол, фенол, вода.
9. Для цепочки превращений
д+ NaBH4 g + НВг + КОН / спирт, jp_
СН
веществом А может быть:
1) 2,2,3-триметилбутаналь;
2) 2,3,3-триметилпентаналь;
3) 2,2,3-триметилпентаналь;
4) 2,3,3-триметилбутаналь.
10. Пространственные изомеры могут быть у альде-
гидов, названия которых:
1) бензальдегид,
2)2-метилбутаналь;
3) пропеналь,
4) бутен-2-аль.
— 727 —
ТЕСТЮ
1. Укажите формулу продукта реакции между трихлор-
этаналем и избытком метанола в кислой среде:
ОСН, он
1)СС13 —СН 2)СС13 —СН
осн3 осн3
сн3
I
3) СС13 — С(ОСН3)3 4) СС13 — сн
! I
СН3
2. Отметьте формулу мономерного звена продукта
полимеризации формальдегида:
О Н
II I
1)— С — Н — 2) —С —О —
Н
3) —Н —С —Н— 4)Н —С —О —Н —
О
3. Назовите по систематической номенклатуре альде-
гид строения q
•, II • ' ??
/М^АН-
1) 2-метил-2-этилгептин-4-аль;
2) 2,2-диэтилгексин-З-аль;
3) 2,2-диэтилгексин-З-аль;
4) 5-метил-5-этилгептин-3-аль.
— 728 —
4. Соединения, которые реагируют при нагревании с
Си(ОН)2 с образованием красного осадка, образуются
при взаимодействии:
1) СН3СН2ОН и СиО (/°);
2) СН, = СН2 и О2 (/°, CuCl2, PdCl,);
3) СН2 = СН, и КМпО4 (5 °C, Н2О);
4) СН3СНО и Ag2O (аммиачн. р-р).
5. Чтобы альдегид превратить в спирт, нужно альде-
гид ввести в реакцию:
1)окисления; 2)гидрирования;
3) гидратации; 4) дегидрирования.
6. Бромэтан из уксусного альдегида можно получить:
1) бромированием СН3СНО;
2) взаимодействием СН3СНО и НВг;
3) по схеме: СН3СНО ±4^ ... Ж,..
4) по схеме: СН3СНО ...
7. Карбонильные соединения с тем же числом ато-
мов С, что и в молекуле окисляемого вещества, можно
получить при окислении:
1) метанола; 2) 2-метилпропанола-2;
3) пропанола-1; 4) пропанола-2.
8. Второй представитель гомологического ряда кето-
нов имеет формулу:
1) С2Н4О; 2) СДО; 3) C4HgO; 4) С5Н]0О.
9. Укажите число изомерных кетонов состава С6Н12О
(без учета стереоизомерии):
1) 8; 2) 7; 3) 6; 4) 5.
10. В схеме органического синтеза X ?Р”соедине™
СН3 — С — СН2 — СН3 вещество X — это:
II
О
1) бутановая кислота; 2) бутин-1;
3) бутен-2; 4) бутен-1.
— 729 —
ТЕМА 50
Карбоновые кислоты
ТЕСТ1
1. Назовите по систематической номенклатуре карбо-
новую кислоту строения
СН3 —СН —СООН:
с2н5
1) 2-этилпропионовая; 2) 2-этилпропановая;
3) 2-метилпропионовая; 4) 2-метилбутановая.
2. Общую формулу насыщенных одноосновных ацик-
лических карбоновых кислот можно представить в виде:
1) С Н, - СООН; 2)С Н, +1 - СООН;
3) С H, О; 4) С Н, О,.
' п 2г ’ 7 п 2п 2
3. Укажите формулу функциональной группы карбо-
новых кислот:
^О
1)—С ; 2) —ОН; 3) —С—; 4) —С
ХН || \)-Н
О
4. Какая запись правильно отражает распределение
электронной плотности в молекулах карбоновых кислот?
Н 5- Н 5-
I I
!)-С— С 8- 2)-С— С б
| £о—н | Ъэ—н
н н
--- 730 ---
н S Н 6
I S-/0 I 6До
3) — С—>С. s 9j4)f7—С—*С 5
| уо*— н | ур—*н
н н
5. Для насыщенных ациклических одноосновных кар-
боновых кислот возможна изомерия:
1) пространственная (энантиомерия);
2) положения карбоксильной группы,
3) углеродного скелета;
4) межклассовая.
6. Укажите название изомера масляной кислоты:
1) валериановая кислота;
2) пентановая кислота;
3) 2-метил про пановая кислота;
4) бензойная кислота.
7. Более сильными, чем уксусная, будут кислоты:
1) хлоруксусная;
2)соляная;
3) угольная;
4) муравьиная.
8. Укажите название вещества с самой высокой тем-
пературой кипения:
1) метаналь,
2) хлорметан;
3) метанол;
4) муравьиная кислота
9. Уксусная кислота может реагировать с:
1) медью;
2) аммиачным раствором оксида серебра (I),
3) гидрокарбонатом калия;
4) метанолом (в присутствии сильной кислоты)
— 731
10. Укажите формулы веществ, которые дают реакцию
«серебряного зеркала»:
с ; 2)Н — С ;
v \н ^ОН
3)СН, — ОН; 4)СН3 —С .
хн
ТЕСТ 2
1. Укажите формулу самой сильной кислоты:
1) СНС12 — СООН; 2) СН,Вг —СООН;
3) CHJ — СООН; 4) СН* — СООН.
2. Наиболее подвижный атом водорода содержится в
молекуле:
I) воды; 2) этаналя;
3) метанола; 4) метановой кислоты.
3. Метановая кислота может реагировать с:
1) сульфатом натрия (водный раствор);
2) алюминием;
3) питьевой содой;
4) аммиачным раствором оксида серебра (I) с образо-
ванием серебра.
4. В отличие от других насыщенных одноосновных
карбоновых кислот муравьиная кислота:
1) реагирует с натрием;
2) вступает в реакцию этерификации;
3) дает качественную реакцию с Ag,O (аммиачн. р-р);
4) представляет собой по строению альдегидокислоту.
5. При растворении в воде уксусного ангидрида хи-
мическим количеством 1 моль образуется:
1) 2 моль этаналя; 2) 2 моль этанола;
— 732 —
3) 2 моль уксусной кислоты; 4) 1 моль метилацетата.
6. Укажите формулу уксусного ангидрида:
1) СН3 — С ;
ХО- СП,
2) сн3 — с — о — с — с2н5;
II II
о о
3) СН3 — С — О — С снз;
II II
о о
4) снз — СН2 — О — сн2 — снз.
7. В результате превращений, описываемых схемой
СН3 — СНО А * ИВг> В,
получаются вещества А и В:
1) бромэтен; 2) уксусная кислота;
3) этанол; 4) бромэтан.
8. С какими веществами может реагировать ацетат
натрия?
1) соляной кислотой; 2) гидроксидом натрия;
3) водой; 4) этаном.
9. При взаимодействии метанола и оксида углерода
(II) в соответствующих условиях получается:
1) этаналь; 2) этановая кислота;
3) диметиловый эфир; 4) метилформиат.
10. Кислота образуется при взаимодействии:
ОЦН^иО, (С,/?, кат.);
2) НСООК и (разб.);
3) СН3СНО и Н, (t°, кат );
4) СО и Н2 (/°, кат., р).
— т —
ТЕСТЗ
1. Укажите число изомерных карбоновых кислот со-
става С5Н[0О2 (без учета стереоизомерии):
1) 2; 2) 3; 3) 4; 4)5.
2. По систематической номенклатуре капроновая кис-
лота называется:
1)бутановая; 2) пентановая;
3) гексановая; 4) 2-метилбутановая.
3. Карбоновая кислота строения
СИ3
сн3 — с — соон
СН3
по систематической номенклатуре называется:
1) изовалериановая; 2)валериановая;
3) 1,1-диметилпропановая; 4) 2,2-димстилпропановая.
4. Охарактеризуйте физические свойства уксусной
кислоты:
1) жидкость при комнатной температуре;
2) обладает острым запахом;
3) плохо смешивается с водой;
4) газ при комнатной температуре.
5. Водородные связи могут образоваться между мо-
лекулами:
1)ацетальдегида;
2) воды и формальдегида;
3) уксусной кислоты;
4) воды и муравьиной кислоты.
6. Кислые соли могут образовывать кислоты:
1) масляная; 2) щавелевая;
3) адипиновая; 4) терефталевая.
— 734 —
7. Метакриловая кислота может реагировать с:
а) бромной водой; в) аммиаком; 1) а, б, в; 2) а, б, в, г; б) бромоводородом; г) водородом. 3) а, в, г; 4) б, в, г.
8. Реакцию «серебряного зеркала» дает кислота:
1) бензойная; 2)трихлоруксусная;
3) терефталевая; 4) муравьиная.
9. Простейшая ненасыщенная одноосновная ацикли-
ческая кислота называется:
1)бензойная; 2) пропеновая;
3) метакриловая; 4) сорбиновая.
10. Ненасыщенные карбоновые кислоты могут всту-
пать в реакции:
а) окисления; б) полимеризации;
в) присоединения; 1) а, б, в, г; 2) а, б, в; г) этерификации. 3) а, в, г; 4) б, в, г.
ТЕСТ 4
1. В порядке возрастания температур кипения веще-
ства перечислены в ряду:
1) пропан — пропанол-1 — пропаналь — пропано-
вая кислота;
2) пропан — пропаналь — пропанол-1 — пропано-
вая кислота;
3) пропаналь —- пропан — пропанол-1 пропано-
вая кил ота; . , , : :
4) пропаналь — пропанол-1 — пропан —7 пропано-
вая кислота.
•ф-
—735 -
2. Отметьте формулу соединения, которое преимуще-
ственно образуется при взаимодействии пропеновой
кислоты с бромоводородом:
Н
1)СН2=СН —С ; 2) СН3 — С — СООН;
^Вг |
Вг
3) СН2 — СН2 — СООН; 4) СН = СН — СООН;
Вг Вг
3. Укажите число двойных связей углерод — углерод
в молекуле ациклической кислоты состава C6HgO2:
1) 1;2) 2; 3)3; 4) 4.
4. Выберите общую формулу ненасыщенных одноос-
новных ациклических карбоновых кислот с тремя двой-
ными связями в алкильной группе:
1) С Н, О,; 2) С Н, ,О,;3)СН, О ; 4) С Н .О7.
5. Учитывая электронодонорный характер алкиль-
ных групп, укажите, какая из изомерных кислот самая
слабая:
1) пентановая; 2) 2-метилбутановая;
3) 2,2-диметилпропановая; 4) 3-метилбутановая.
6. В отличие от стеариновой кислоты олеиновая кислота:
1) жидкая при комнатной температуре;
2) растворима в воде;
3) обесцвечивает бромную воду;
4) реагирует со щелочами.
7. Из перечисленных кислот самая высокая темпера-
тура плавления у кислоты:
1) этановой; 2) пропановой;
3) бутановой; 4) пентановой.
--- 736 ---
8. С водородом могут реагировать
1) линолевая кислота; 2) сорбиновая кислота;
3) пропаналь; 4) пропан.
9. Укажите формулы ненасыщенных ациклических
карбоновых кислот:
1) С4Н8О2; 2) С18Н30О2; 3) СДСООН; 4) С,НдСООН.
10. Охарактеризуйте щавелевую кислоту:
1) гомолог муравьиной;
2) образует средние и кислые соли;
3) изомер уксусной кислоты,
4) простейшая двухосновная карбоновая кислота.
ТЕСТ 5
1. Какое вещество химическим количеством 1 моль
может присоединить наибольшее химическое количество
водорода?
1) ацетальдегид; 2) этен;
3) линоленовая кислота; 4) сорбиновая кислота.
2. При полном восстановлении кратных связей угле-
род —углерод сорбиновая кислота превращается в кислоту:
1) бутановую; 2) пентановую;
3) гексановую; 4) гептановую.
3. Гомологами пропеновой кислоты являются кислоты:
1) пропановая; 2) метакриловая;
3) стеариновая, 4) олеиновая.
4. Какова степень окисления атомов углерода в моле-
куле щавелевой кислоты?
1)+2; 2)0; 3)+3;4) +4.
5. С какими веществами реагирует молочная кислота?
1) этанолом (в присут. кат), 2) бромоводородом;
3) аммиаком; 4) сульфатом натрия.
24 Зак, 1530
--- 737 ---
6. Бромную воду обесцвечивают кислоты:
1) линолевая; 2) стеариновая;
3) олеиновая; 4) метакриловая.
7. Водные растворы глицерина, пропаналя и этано-
вой кислоты можно различить с помощью одного реак-
тива. Укажите этот реактив:
1) бромной воды; 2) карбоната калия;
3) гидроксида меди (II); 4) азотной кислоты.
8. В реакциях с какими веществами с участием уксус-
ной кислоты от ее молекулы отщепляется гидроксиль-
ная группа?
1) металлами, 2) щелочами;
3) спиртами; 4) карбонатами металлов
9. Пробирки с пропаналем и уксусной кислотой мож-
но различить с помощью:
1) лакмуса;
2)гидрокарбоната натрия;
3) аммиачного раствора оксида серебра (I);
4) медных стружек.
10. Пропионовая кислота может реагировать с:
1) раствором брома в СС14;
2) хлором (в присутствии красного фосфора);
3) этанолом (в присутствии H2SO4),
4) гидроксидом калия.
ТЕСТ 6
1. Водные растворы уксусной и муравьиной кислот
можно различить с помощью:
1) лакмуса; 2) поташа,
3) гидроксида меди (II); 4) железных стружек.
--- 738 ----
2. Пространственная (цис-, транс-) изомерия возмож-
на для кислот:
1) стеариновой; 2) олеиновой;
3)сорбиновой; 4) бензойной.
3. Наибольшее число цис-, транс-изомеров существует
у кислоты:
1) линоленовой; 2) сорбиновой;
3) линолевой; 4) олеиновой.
4. Уксусную кислоту можно получить:
1) взимодействием ацетата натрия с водным раство-
ром СО,;
2) взаимодействием метанола и угарного газа (в при-
сутствии катализатора);
3) ферментативным окислением этанола;
4) восстановлением ацетальдегида.
5. При окислении изобутилового спирта образуется
кислота:
1) бутановая; 2) масляная;
3) валериановая; 4) 2-метилпропановая.
6. Отметьте формулу амида пропановой кислоты:
О
II
1)СН3 —С —NH2;
2) СН3 — СН2 — COONH4;
3) СН — СН2 — С — NH2;
II
О
4) nh2 — сн2 — СН, — СООН.
7. Укажите формулы веществ, для которых возможна
цис-, транс-изомерия:
1) снз — СН = СН — СНО;
2) НООС — СН = СН — СООН;
--- 739 ---
3) СН2 = CH — СООН;
4) СН' — (СН2)7 — СН = СН — (СН,)7 — СООН.
8. Хлорангидрид карбоновой кислоты образуется, ког-
да карбоновая кислота реагирует с:
1) С12; 2) НС1; 3) SOC1,; 4) КС1.
9. Двойственной химической функцией обладают кис-
лоты:
1) метакриловая; 2) молочная;
3) муравьиная; 4) уксусная.
10. Относительная молекулярная масса насыщенной
двухосновной ациклической карбоновой кислоты равна
104. Укажите число метиленовых групп СН, в молекуле
кислоты:
1)2; 2) 1; 3) 3; 4) 4.
ТЕСТ 7
1. Соль образуется, когда уксусная кислота реагирует с:
1) SOC12; 2) С12; 3) KNO3; 4) NH3 • Н2О (20°С) .
2. Карбоновую кислоту можно получить:
1) окислением 1,4-диметилбензола;
2) окислением бутана;
3) восстановлением бензальдегида;
4) гидратацией этилена.
3. Укажите формулы соединений, которые реагируют как
с натрием, так и с водным раствором гидроксида натрия:
1) НО —(Q>— ОН; 2) СООН;
3)<Q>-CH,OH; 4)Н3С —СН —СООН.
ОН
4. Как с бромоводородом, так и с водным раствором
--- 740 ---
щелочи реагируют кислоты
1) бензойная; 2) 2-гидроксипропановая;
3) метакриловая; 4) терефталевая.
5. Изомасляная кислота образуется при окислении
спирта, название которого:
1) бутанол-1; 2) 2-метилпропанол-1;
3) 2-метилпропанол-2; 4) бутанол-2.
6. Кислоту с тем же числом атомов С, что и в молеку-
ле окисляемого спирта, НЕЛЬЗЯ получить при окисле-
нии спиртов, формулы которых:
1) СН,ОН, 2) СН, — СН — СН,;
I
ОН
сн3
3)СН3 —С —СН3; 4)<О>— СН2ОН.
ОН
7. Изомером р-хлормасляной кислоты является:
1) масляная кислота;
2) 2-хлорбутановая кислота;
3) Р-хлорвалериановая кислота,
4) 3-хлорбутановая кислота.
8. Доказать, что уксусная кислота загрязнена муравь-
иной, можно с помощью:
1) NaHCO,; 2) Ag ,0 (аммиачн. р-р);
3) КОН; 4) Си(ОН)э (свежеприготовл).
9. Гомологи уксусной кислоты являются электроли-
тами:
1) все слабыми;
2) все сильными;
3) все амфотерными,
— 741
4) сильными (муравьиная кислота) и слабыми (осталь-
ные кислоты).
10. Укажите формулу изомера бензойной кислоты:
ТЕСТ 8
1. С возрастанием длины алкильной группы раство-
римость карбоновых кислот в воде:
1) уменьшается;
2) возрастает;
3) не изменяется;
4) изменяется немонотонно.
2. НЕ является карбоновой кислотой вещество строения:
1) ^2)— СООН; 2) ^2)— ОН;
3)<Q>—СООН; 4) Н3С — СН — СООН.
ОН
3. Голубой раствор образуется при взаимодействии:
1) НСООН и Ag2O(aMMHaHH.p-p);
2) Cu(OH), и СН3СООН;
3) СН3СООН и NaHCO3;
4) СН3СНО и Cu(OH),(r°).
4. Укажите формулу фенилуксусной кислоты:
--- 742 ----
1) ОСООН; 2) НгС — соон;
©
3) (^3)— СООН; 4)Н2С —СООН.
он 6
5. Отметьте формулу формиата алюминия:
1) (СН3СОО)3А1; 2) (НСО)3А1;
3) (НСОО),А1; 4) (СН3СО)3 А1
6. Из числа перечисленных веществ. Ag,0 (аммиачн.
р-р), NaHCO3, СН3ОН, BaO, Al, KNO3, Н, муравьиная кис-
лота может при определенных условиях реагировать с:
1) пятью; 2) шестью, 3) семью, 4) четырьмя.
7. Укажите формулу пропионового ангидрида:
1) (СН3СО)?О; 2) (СН3СН,СОО),О;
3) (СН3СН;СО)2О, 4) (СН3СОО),О
8. Отметьте формулу вещества X для цепочки превра-
щений, протекающих по схеме:
СаС 1 В + (Hg'VH*). + Ag,O (аммианн. р р).
1) С,Н2; 2) СН3СНО; 3) СНСООН; 4) СН3С(О)СН3
9. Укажите формулу вещества X для цепочки превра-
щений, протекающих по схеме
Q pj + 1 моль С12, hv^ + NaOH (Н2О)^ + КМпОДГ (избыток)^
1) с’н/)Н, 2) СЦСООН; 3) (СН3СО),О; 4) СН3СНО.
10. Укажите формулу основного вещества X для це-
почки превращений, протекающих по схеме:
СаС + 11,0 + 2 моль НВг~ + NaOH +Cu(OH),, г х-
1) C,HSOH; 2) (СН3СО)2О; 3) СН3СООН; 4) СН.СНО
--- 743 ----
ТЕСТ 9
1. Назовите по систематической номенклатуре карбо-
новую кислоту строения
Вг
СООН:
1) 5-бром-7-метилоктен-4-овая;
2) 2-метил-4-бром-5-этилоктен-4-овая;
3) 4-бром-2-метил-5-этилоктен-4-овая;
4) 4-бром-5,5-диэтилпентен-4-овая.
2. Карбоновая кислота строения НО —V ~Ч—СООН
реагирует с избытком водного раствора питьевой соды.
Укажите формулу продукта реакции:
1) NaO — COONa; 2) НО — ^>— CONa;
3) НО — COONa; 4) Na— COONa.
3. Карбоновая кислота строения НО—(( "V-COOH
реагирует с избытком водного раствора гидроксида ка-
лия. Укажите формулу продукта реакции:
1) НО —COOK; 2) К — COOK;
3) КО — COOK; 4) КО - ЛЛ— СООН.
4. Кислотные свойства соединений последователь-
но нарастают в рядах:
1) этанол, фенол, угольная кислота, уксусная кислота;
2) фенол, этанол, угольная кислота, уксусная кислота;
--- 744 ---
3) муравьиная кислота, вода, фенол, уксусная кислота;
4) вода, фенол, уксусная кислота, муравьиная кислота.
5. Укажите число атомов водорода в молекуле аль-
дегида, окислением которого получают метакриловую
кислоту:
1) три; 2) четыре; 3) пять; 4) шесть.
6. Кислотные свойства соединений последователь-
но возрастают в рядах:
1) этанол, этиленгликоль, глицерин, фенол, уксусная
кислота;
2) этиленгликоль, фенол, хлоруксусная кислота, уксус-
ная кислота, глицерин;
3) бензальдегид, фенол, бензиловый спирт, бензой-
ная кислота;
4) бензальдегид, бензиловый спирт, фенол, терефта-
левая кислота.
7. Укажите формулы соединений, относящихся к одно-
му классу функциональных производных углеводородов:
8. Внутримолекулярная водородная связь образуется
в кислоте:
1) муравьиной; 2) бензойной;
3) салициловой; 4) терефталевой.
--- 745 ----
9. Сильнее, чем бензойная, будут кислоты, формулы
которых:
1) Н3С СООН; 2) O2N ’ СООН;
3) Н3С V- СООН; 4) НООС — СООН.
^'СН1
10. Карбонильная группа входит в состав:
1) ацетона; 2) пропанола-2;
3) метановой кислоты; 4) этаналя.
ТЕСТЮ
1. Назовите по систематической номенклатуре кис-
лоту строения
ВгСН2 — СН — СН — СН — СООН:
сн3 ОН ОН
1) 5-бром-4-метил-2,3-дигидроксипентановая;
2) 5-бром-2,3-дигидрокси-4-метилпентановая;
3) 1-бром-2-метил-3,4-дигидроксипентановая;
4) 1 -бром-3,4-дигидрокси-2-метилпентановая.
2. Укажите формулу 2-гидроксибензойной (салицило-
вой) кислоты:
^/СООН
^^^СН.ОН
^.СООН
^ХСНО
--- 746 ----
3. Простейшую двухосновную кислоту (щавелевую)
можно получить окислением альдегида строения:
1)НСНО; 2)Н — С — С — Н;
II II
О О
4. Укажите формулу продукта реакции между водой и
СООН.
СООН
ОН
5. Укажите название продукта реакции между мета-
криловой кислотой и раствором брома в СС14:
1) 2,3-Дибром-2-метилпропанол-1;
2) 2-метил-2,3-Дибромпропановая кислота;
3) 2,3-Дибром-2-метилпропаналь;
4) 2,3-дибром-2-метилпропановая .кислота.
6. С бромоводородом реагируют:
1) салициловая кислота;
--- 747 ----
2) молочная кислота;
3) метакриловая кислота;
4) терефталевая кислота.
7. Качественную реакцию с КМпО4 дают:
1) метаналь; 2) метакриловая кислота,
3) этановая кислота; 4) олеиновая кислота.
8. Укажите формулы веществ, с которыми НЕ реаги-
рует уксусная кислота.
1) С12; 2) SOC12; 3) Си; 4) CCl^COONa
9. Соль образуется, когда пропановая кислота реаги-
рует с:
1) СН,ОН; 2) NH,, 3) С12; 4) КОН.
10. Бензоат натрия может реагировать с веществами,
формулы которых:
1) NaOH; 2) Н2СО,; 3) H,SO4; 4) Н2О.
ТЕСТИ
1. При взаимодействии с избытком водного раствора
С1
I
щелочи вещества строения Н,С — С — С — О образу-
ем С1
ется соединение, название которого:
1) 2-метилпропаналь;
2) 2-метилпропановая кислота;
3) 2-метилпропанол-1;
4) 2-метилпропанол-2.
2. Укажите число изомерных кислот состава С6Н)?О,
(без учета стереоизомерии):
1)9; 2) 8, 3) 7; 4)6.
--- 748 ----
3. С учетом стереоизомерии число карбоновых кис-
лот состава С5Н|0О2 равно:
1)7; 2)6; 3)5; 4)4.
4. Укажите электронную формулу муравьиной кислоты:
1)Н:С::О; 2)Н:С:О:; 3)Н:С::О:; 4)Н:С::О:.
Р- -Q: .д’:
Н Н н Н
5. Число неподеленных пар электронов наибольшее
в молекуле кислоты:
1) муравьиной; 2) молочной;
3) терефталевой; 4) бензойной.
6. Укажите формулу вещества X для цепочки превра-
щений, протекающих по схеме С2Н5ОН +HaSC>4 (К0|Щ)-170 °£
__+ О2, PdCI2, + Na^Cr^O/H^ + Вг2/фосфор^ + NaOH/H2O, g уг.
1) CH,ONa — COONa;
2) CH'OHCOONa;
3) СН.ОНСООН;
4) CH’BrCOONa.
7. При взаимодействии пропанола-2 и ангидрида ук-
сусной кислоты образуется вещество строения:
НзС>СН —О —С —СН3;
,1)Н3СХ ||
О
2)Н3С —С —СН(СН3)2;
О
3) (Н3С),СН — О — С,Н_;
4) НС — СН, — СН, — О — С — СН
II
О
--- 749 ---
8. Укажите сумму коэффициентов в уравнении реак-
ции пропанового ангидрида с метанолом:
1) 2; 2) 3; 3) 4; 4)5.
9. Укажите число изомерных ненасыщенных кислот
состава С4Н6О2:
1)2; 2)3; 3)4; 4)5.
10. В молекулах гомологов муравьиной кислоты чис-
ло электронов N(e) и число атомов п углерода связывает
формула:
1) 7V(e) = 6п + 16; 2) 7V(e) = би + 32;
3) Me) = 8и + 16; 4) Me) = 8и + 32.
ТЕСТ 12
1. При взаимодействии пропановой кислоты с избыт-
ком аммиака при различных температурах* образуются
вещества строения:
1)СН—С —NH,; 2) СН — СН — С — NH,;
II ’ II
О О
3) снз — СН, — COONH4; 4) H2N — СН, — С — NH2;
О
2. Укажите формулу органического вещества X для
цепочки превращений, протекающих по схеме
С —NH2;
* При нагревании аммиак и амины реагируют с карбок-
сильной группой карбоновых кислот по типу реакции заме-
щения.
--- 750 ---
3. К карбоновым кислотам могут относиться вещества
состава:
1)С4Н8О; 2)С4Н6О2;
3) С6Н6О6; 4) С3Н6О2.
4. Укажите общую формулу гомологического ряда аро-
матических одноосновных карбоновых кислот:
1)СН, СООН; 2)СН, О;
3)СН2я_8О2; 4)СН2п_7О2.
5. Этановую кислоту в одну стадию НЕЛЬЗЯ полу-
чить из вещества, формула которого:
1) СН3СНО; 2) (СН3СО)2О; 3) СН4; 4) С4Н,0.
6. Укажите формулу основного вещества X для пре-
вращения Н2С = СН — СООН X:
1) СН3СН(ОН)СООН; 2) НОСН2СН(ОН)СООН;
3) НОСН2СН2СООН; 4) Н — С — СН2 — С — Н.
7. Укажите формулу вещества X для цепочки превра-
щений, протекающих по схеме С2Н5ОН
+ H;SO4 (конц ), 170 °C
+ КМпО, (5 “С, H;Oji + СчО (изб,), g
1) СН3СН2ОН; 2) СН3СООН;
3)НО —С —С —ОН; 4)Н — С — С — Н.
II II II II
0 0 0 0
8. Отметьте формулы функциональных производных
карбоновых кислот:
О О
--- 751
2)ЛЛ-С — Cl;
II
О
О
4) С — О — СН2 —
О
9. Этил ацетат можно получить при взаимодействии:
1) СН3СНО и С,Н5ОН; 2) (СН3С0),0 и С2Н5ОН;
3) СН3СООН и 'С2Н5ОН; 4) (СН3СО)2О и Н20.
10. В концентрированном водном растворе уксусной
кислоты содержатся частицы:
а) (СН3СООН)2; б) Н+; в) СН3СОО ; г) СН3СООН.
1)а, б, в; 2)6, в, г;
3) а, б, в, г; 4) а, в, г.
ТЕСТ 13
1. При нагревании с H2SO4 (конц.) вещества строения
НО — (СН2)5 — СООН образуется продукт, имеющий
формулу:
2. Укажите формулу вещества, при нагревании которо-
го с H,SO4 (конц.) образуется продую, имеющий формулу
--- 752 ----
1) СН,ОНСН2СООН; 2) СН2ОНСН2СН2СООН;
3) СН‘ОНСН(СН3)СООН; 4) СН'ОНСН.СН'СНО.
3. Чему равна молярная масса (г/моль) органического
вещества X в цепочке превращений, протекающих по
схеме С(СН3)3СНО +А&О(аМмиаЧн.р-р),^ +NaOH(p-P)>
+ NaOH(T), X-
1)58; 2) 56; 3) 46; 4) 44.
4. Степень окисления атома (атомов) углерода, непос-
редственно связанного (связанных) с атомами кислоро-
да, последовательно возрастает в рядах соединений:
1) этанол, этаналь, этановая кислота;
2) этиленгликоль, фенол, этановая кислота;
3) этаналь, ацетон, этановая кислота;
4) пропанон, фенол, этанол.
5. Число электронов N и число атомов углерода п в
молекулах гомологов бензойной кислоты связывает
формула:
l)N=8rt + 24; 2)ДГ=8и + 32;
3)W=8w + 8; 4)У=8н+16.
6. Только реакции окисления включает схема превра-
щений:
1) СН2СНО -+ СН3СН2ОН -> СН3СООН;
2) СН3СН2ОН -> СН3СНО -> СН3СООН;
3) СН3СНО -> СН3СООН -> СН3СН2ОН;
4) СН3СН2ОН -> СН3СООН -> СН3СНО.
7. Только реакции восстановления включает схема
превращений:
1) С6Н5СООН -> С6Н5СНО -> С6Н5СН,ОН;
2) С6Н5СООН -> С6НГН,ОН -> С6Н5СНО;
3) С6Н5СНО -+ С6Н.СН2ОН -> С6Н.СООН;
4) С.Н.СНО -> CJLCOOH -+ С Н СН,ОН.
7 6 э 6 э 652
--- 753 ----
8. Сколько ароматических двухосновных карбоновых
кислот, содержащих карбоксильные группы непосред-
ственно в бензольном кольце, имеют состав С9Н8О4?
1)6, 2) 7; 3)8; 4)9.
9. Укажите число изомерных ароматических кислот
состава С9Н|0О2:
1)8;2)7;3) 11; 4) 10
10. Назовите кислоту строения O2N —& \— СООН:
1) 6-метил-2-бром-4-нитробензойная; ^Вг
2) 1 -бром-З-метил-5-нитробензойная;
3) 2-бром-6-метил-4-нитробензойная;
4) 1 -метил-3-бром-5-нитробензойная.
ТЕСТ 14
1. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Б и В для цепочки превращений, протекаю-
щих по схеме:
С J-J Q+ 3 моль С12, Д + КОН (Н;О),изб^ g + SOCl^ g
6 5 3
2. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
(С Н СО) О Ч Н‘°- А +№ОН<Н»°)Т в + NaOH <т). i° в + ci, (изб.), яу
3. Укажите формулу вещества X для цепочки превра-
щений, протекающих по схеме
изомасляная кислота укощспир^ х
1) СН3 — СН — СООН, 2) Н2с = С — СООН;
сн3
СН
--- 754 ---
3)Н2С = С —СНО; 4)Н,С = С — СН,ОН.
I ' I
сн3 сн3
4. Щавелевую кислоту (НООС — СООН) можно по-
лучить окислением:
1) этандиола-1,2; 2) метанола;
3) метаналя; 4) метановой кислоты.
а СООН
с
СООН
H2SO4 (конц.) образуется вещество строения:
6.2-метилбутан образуется, когда с NaOH сплавляют
натриевые соли кислот:
1) 2,2-диметилбутановой; 2) 2,3-диметилбутановой;
3) 3-метилпентановой; 4) 2-метилпентановой.
7. Бензойная кислота образуется, когда с избытком
водного раствора щелочи реагирует вещество строения:
СН2С1
--- 755 ----
8. Как с уксусной, так и фосфорной кислотами могут
реагировать:
1) СН3ОН/Ш; 2) NaH,PO4 (р-р);
3) NaOH(p-p); 4) KNO3 (р-р).
9. Молекула гомолога бензойной кислоты содержит
72 электрона. Укажите молярную массу (г/моль) гомолога:
1)116; 2)126; 3)136; 4)146.
10. Укажите химическое количество (моль) атомов
водорода в порции бензоата кальция химическим коли-
чеством 1,5 моль:
1)5; 2) 10; 3) 15; 4) 20.
ТЕМА 51
Сложные эфиры. Жиры. Мыла
ТЕСТ1
1. В основе получения сложных эфиров лежит реакция:
1) нейтрализации; 2) полимеризации;
3) этерификации; 4) гидрирования.
2. Общую формулу сложных эфиров, образованных
насыщенными одноатомными спиртами и насыщенны-
ми одноосновными карбоновыми кислотами, можно
представить как:
1)сн2п+2о2; 2)сн2о2;
3)С„Н2„+1-С
ХО —
(л = к', и Ф к)
; 4) С Н, О.
QH,+ I
--- 756 ----
3. Укажите относительную молекулярную массу слож-
ного эфира, содержащего в молекуле 6 атомов углерода:
1) 118; 2) 116; 3) 120; 4) 100.
4. Укажите формулу винилацетата:
1) СН3 —С —О —С7Н5;
II
О
2) СН2 = СН — О — С — СН3;
II
О
3) СН — с — о — сн
II
о
4) Н —С — О — СН = СН .
II
о
5. Число изомерных сложных эфиров состава C4HgO2
равно:
1)2; 2)4; 3) 3; 4) 5.
6. В состав жиров могут входить кислоты:
1) только высшие карбоновые;
2) в основном высшие насыщенные и ненасыщенные;
3)бутановая;
4) неорганические кислородсодержащие.
7. В состав твердых при комнатной температуре жи-
ров главным образом входят остатки:
1) высших ненасыщенных карбоновых кислот;
2) высших насыщенных карбоновых кислот;
3) пальмитиновой и стеариновой кислот;
4) олеиновой и линолевой кислот.
8. В промышленности кислотный или щелочной гид-
ролиз жиров проводят с целью получения:
1) этиленгликоля; 2) глицерина;
--- 757 ---
3) высших карбоновых кислот; 4) мыла.
9. В промышленности жидкие жиры переводят в твер-
дые с целью получения:
1) мыла; 2) глицерина; 3) маргарина; 4) олифы.
10. Жир, в состав которого входят остатки олеиновой
кислоты, реагирует с:
1) водородом (в присутствии катализатора);
2) бромной водой;
3) гидроксидом калия (водный раствор);
4) глицерином.
ТЕСТ 2
1. Укажите названия изомеров этил ацетата:
1) изопропилформиат; 2) бутановая кислота;
3) бутаналь; 4) метилпропионат.
2. С какими реагентами взаимодействует метилфор-
миат?
1) кислородом;
2) водой (в присутствии сильной кислоты);
3) водным раствором щелочи;
4) калием.
3. Гомологами бутил ацетата являются:
1) пропилпропионат; 2) гексановая кислота;
3) этилформиат; 4) метилацетат.
4. При кислотном гидролизе этилформиата образуются:
1) уксусная кислота; 2) муравьиная кислота;
3) метанол; 4) этанол.
5. Сложные эфиры образуются, когда с глицерином
реагируют кислоты:
1) азотная; 2)соляная;
3) серная; 4) пальмитиновая.
--- 758 ----
6. НЕ являются сложными эфирами:
1) гликолят меди (II); 2) триацетил глицерин;
3) тристеарин; 4) пентен-2-диол-1,5.
7. В состав жидких жиров входят остатки спирта:
1) этандиола; 2) пропантриола-1,2,3;
3) глицерина; 4) этанола.
8. Какие из перечисленных веществ по отношению
друг к другу являются изомерами?
1) фенил ацетат; 2) метил ацетат;
3) пропановая кислота; 4) этилформиат.
9. Укажите формулы твердого мыла:
1) C|7H35COONa; 2) C6H]3COONa;
3) С15Н3|СООК; 4) C|5H3|COONa.
10. Мыло можно получить взаимодействием:
1) пальмитиновой кислоты и поташа; > тя
2) стеариновой кислоты и гидроксида натрия;
3) гексановой кислоты и гидроксида калия;
4) стеариновой кислоты и гидроксида кальция.
ТЕСТЗ
1. При щелочном гидролизе фенилацетата (щелочь в
избытке) образуются:
1) фенол; 2) фенолят;
3) уксусная кислота; 4) соль уксусной кислоты.
2. Изомерами пропилформиата являются:
1) масляная кислота; 2) этилацетат;
3) бутановая кислота; 4) диэтиловый эфир.
3. Укажите формулу жидкого мыла:
1) С17Н35 — COONa; 2) C,.H3I — COOK;
3) (С|7Н35СОО)2Са; 4) С,5Н31 — COONa.
--- 759 ---
4. Мыло можно получить непосредственно при вза-
имодействии:
1) жира и Н2О (H2SO4, t°);
2) С|7Н35СООН и NaHCO3 (водн.р-р);
3) жира и NaOH (р-р, t°);
4) С|5Н3|СООН и КОН (водн. р-р).
5. Какой реагент переводит жидкие жиры в твердые
жиры?
1) бром;
2)водород;
3) водный раствор КМпО4;
4) водный раствор КОН.
6. Сложный эфир образуется при взаимодействии:
1)1 моль глицерина и 3 моль HNO3;
2) 1 моль глицерина и 3 моль С|7Н35СООН;
3) 1 моль глицерина и 3 моль НВг;
4) 1 моль этиленгликоля и 2 моль С|5Н3|СООН.
7. Укажите формулу метилметакрилата:
1)СН2 = С —СООН;
I
сн3
2) СН2 = СН — СООН;
3)СН2=С—С ;
| ХО —СН3
СН3
4)СН = С—С
I I хо —сн3
сн3 сн3
8. Валериановой кислоте изомерен:
1) пропил формиат; 2) этилацетат;
— 760 —
3) бутилформиат; 4) бутил ацетат
9. Синтетические моющие средства представляют
собой:
1) калиевые соли высших спиртов;
2) натриевые соли высших спиртов;
3) натриевые соли кислых сложных эфиров высших
спиртов и серной кислоты;
4) калиевые соли высших карбоновых кислот.
10. Укажите формулу растворимого в воде соединения
кальция:
1) (С|7Н„СОО)2Са;
2) СаСО3;
3) (ClsH3ICOO)2Ca;
4) (С15Н31 — СН, — О — SO2 - О)2Са.
ТЕСТ 4
1. Какое максимальное химическое количество КОН
(моль) может прореагировать с 1 моль фенилацетата с
учетом образования фенолята?
I) 1;2)2; 3) 3; 4) 4
2. Укажите формулы веществ, при кислотном гидро-
лизе которых образуется спирт (спирты):
— 761
о
з)сн3—с. .
хо — сн2—<О> ’
о
II
4) СН2 —О—С —СН3-
о
II
СН2 —О—С —С2Н5
. 3. При гидролизе фенилформиата водным раствором
КОН (щелочь в избытке) образуются:
1) фенолят калия; 2) фенол;
3) муравьиная кислота; 4) формиат калия.
4. Соль карбоновой кислоты образуется при взаимо-
действии:
1) жира и Н2О (H2SO4, С);
2) жира и КОН (р-р, /°);
3) СН3СООН и KNO3;
4) фенилацетата и КОН (р-р, С).
5. Если на водный раствор мыла подействовать сер-
ной кислотой, то на поверхность всплывает твердое не-
растворимое в воде вещество. Этим веществом является:
1) глицерин;
2) сульфат натрия или калия;
3) эфир глицерина с серной кислотой;
4) пальмитиновая или стеариновая кислоты.
6. Отметьте формулы сложных эфиров:
1) С2Н5 — ONO,; 2) C3H7NO2;
— 762 ------
3) СН2 — О—С — С2Н5; 4)СН2 —О—СН3.
О
СН2 —О—С —СН3 сн2 —о—сн3
о
7. Молярная масса сложного эфира равна 74 г/моль, и
эфир образован алканолом и насыщенной однооснов-
ной карбоновой кислотой. Сколько изомерных сложных
эфиров удовлетворяет такой молярной массе?
1)2; 2)3; 3)4; 4) 5.
8. При взаимодействии глицерина и нитрующей сме-
си получается вещество, относящееся к классу:
1) простых эфиров; 2) сложных эфиров;
3) нитросоединений; 4) солей.
9. Натриевое мыло реагирует с:
1) серной кислотой;
2) гидрокарбонатом кальция;
3)водой;
4) гидроксидом калия (раствор).
10. Вправо равновесие экзотермической реакции эте-
рификации можно сместить:
1) добавлением катализатора;
2) удалением эфира из равновесной смеси;
3) увеличением концентрации спирта;
4) повышением температуры.
ТЕСТ 5
1. Наиболее низкую температуру плавления имеет
жир, содержащий:
1) три остатка стеариновой кислоты;
2) три остатка пальмитиновой кислоты;
— 763 —
3) два остатка стеариновой кислоты и один остаток
олеиновой кислоты;
4) три остатка олеиновой кислоты.
2. Сложные эфиры — это:
1) фенолят калия; 2) фенилацетат;
3) бензилформиат; 4) мыло.
3. Этанол образует сложные эфиры, реагируя с:
1) метанолом; 2) пропановой кислотой;
3) соляной кислотой; 4) азотной кислотой.
4. Сложный эфир образуется при взаимодействии:
1) этиленгликоля и нитрующей смеси;
2) глицерина и линолевой кислоты;
3) метанола и этанола;
4) глицерина и хлороводорода.
5. Укажите формулы сложных эфиров:
1) СН3 — С — О — С — СН3;
II II
О О
2)СН3—-С ;
ХО —С6Н5
3) СН3 — О — С2н5;
4) СН2 —О —SO3H.
I
СН, — О — SO3H
6. Жидкие жиры могут вступать в реакции:
а) окисления; б) гидрирования;
в) гидролиза; г) присоединения галогенов.
1)а, б, в, г; 2) а, б, в;
3 ) а, в, г; 4) б, в, г.
7. Мыло непосредственно (в одну стадию) из жиров
получают с помощью реакции:
— 764 —
1) дегидрирования; 2) гидрирования;
3) щелочного гидролиза; 4) окисления.
8. Сложный эфир, получаемый при взаимодействии
бензойной кислоты и этанола, называется:
1) фенилацетат; 2) этилацетат;
3) этилбензоат; 4) этилфенолят.
9. Какие кислоты в основном входят в состав при-
родных жиров?
1) имеющие, как правило, четное число атомов углерода;
2) с неразветвленной в большинстве случаев углерод-
ной цепью;
3) азотная и муравьиная;
4) с числом атомов углерода от 4 до 26.
10. Какие вещества вступают в реакцию этерифика-
ции для образования бензилацетата?
1) фенол; 2) уксусная кислота;
3) бензиловый спирт; 4) бензойная кислота.
ТЕСТ 6
1. К одному классу функциональных производных уг-
леводородов относятся:
--- 765 ----
4) СН2 — О — С
\=/ II
О
2. В качестве моющих средств можно использовать
вещества, формулы которых.
1) СН2 — О — СО — С17Н35, 2) C15H31CH2OSO,Na;
СН — О — СО — С|7Н33 3) C17H33COONa,
I
СН2 — О — СО — С|7Н3| 4) С5Н,,ONa.
3. Для образования вещества строения
СН2 — О — СО — C,HS
I
СН — О — СО — с„н,
I
сн2 — о — со — с2н5
нужно, чтобы между собой прореагировали:
1) этиленгликоль и пропанол-1;
2) глицерин и пропанол-1;
3) глицерин и уксусная кислота;
4) глицерин и пропановая кислота
4. Укажите формулу изопропилметаноата:
1)Н — С — О — СН2 — СН2 — СН3;
II
О
2) Н3С — С — О — СН2 — СН2 — СН3;
II
О
3) Н’С>СН — О — С — СН3;
Н3С^ II
о
— 766 —
4) (Н3С)2СН — О — С — Н.
II
О
5. Основу искусственных эссенций составляют:
I) высшие спирты; 2) простые эфиры;
3) сложные эфиры; 4) высшие карбоновые кислоты.
6. Функциональная группа сложных эфиров — это:
1) — С — Н;2) — С — ОН; 3) -ОН;4) —С —О—.
II
О О о
7. При полном гидрировании кратных связей в ал-
кильных группах триолеина образуется:
1) трипальмитин; 2) тристеарин; 3) глицерин; 4) мыло.
8. Слезоточивым действием обладает:
1) винилацетат; 2) бутилбутаноат;
3) изоамилэтаноат; 4) пентилбутаноат.
9. При щелочном гидролизе говяжьего жира больше
всего (в % по массе) образуется:
1) солей пальмитиновой и стеариновой кислот;
2) пальмитиновой и стеариновой кислот;
3) солей линолевой кислоты;
4) линолевой кислоты.
10. Вещество строения
Н С — СН = СН — С — ОСН.
II
О
может взаимодействовать с реагентами:
1) KMnO4 (Н.О); 2) Вг, (СС14);
3) KNO3 (води. р-р); 4) Н.О (Н+).
--- 767 ----
ТЕСТ 7
1. Укажите число изомерных сложных эфиров соста-
ва С5Н|0О2:
1) 11; 2) 10; 3)9; 4)8.
2. Для производства клея ПВА используется соедине-
ние, формула которого:
О
3. Полимер, мономерное звено которого имеет строение
си,
—сн2—с—,
соосн3
получают полимеризацией:
1) метилметакрилата;
2) метилового эфира пропеновой кислоты;
3) винилацетата;
4) винилметакрилата.
4. Укажите формулу мономерного звена полимера,
образующегося при полимеризации вещества строения
н,с = сн—с—осн •
II
о
— 768 —
н н
I I
1) —СН —С —; 2) —СН—С —;
I I
о — с — сн3 о = с —сн3
II
о
н н
I I
3) —СН, —С —; 4) —СН—С—.
I ’ I
осн3 о = с — осн3
5. Изомерами между собой являются:
1) фенилацетат и бензилбензоат;
2) бензилформиат и фенилацетат;
3) аллилацетат и винилпропаноат;
4) метилбензоат и бензилформиат.
6. Укажите формулу метилбензоата:
7. Выберите формулу фенилацетата:
1)0 = С — О — СН3; 2) О —С —СН3;
25 Зак. 1530
--- 769 ---
9 ?
3)О = С —СН3; 4) СН3 — С — О —СН2.
8. Укажите формулы функциональных производных
углеводородов одного класса:
9. Формула метилметакрилата—это:
10. Сколько различных изомерных триглицеридов
можно получить, имея три различные кислоты (без уче-
та стереоизомерии)?
1) два; 2) три; 3) четыре; 4) пять.
— 770 —
ТЕСТ 8
1. По систематической номенклатуре эфир строения
О
Н
можно назвать как:
1) изопропилформиат; 2) пропилформиат;
3) изопропилметаноат; 4) пропилметаноат.
2. При гидролизе в присутствии H2SO4 сложного эфи-
ра строения Н,С = С — С — ОСН( образуются:
I II
сн3 О
1) акриловая кислота и метанол;
2) метакриловая кислота и метанол,
3) З-гидрокси-2-метилпропановая кислота и метанол;
4) метакриловая кислота и виниловый спирт.
3. Укажите формулу продукта реакции между этано-
лом и ангидридом уксусной кислоты:
4. Формула продукта реакции между 2-метилпропа-
нолом-2 и пропановым ангидридом — это:
— 771 —
5. Один из продуктов гидролиза сложного эфира —
третичный спирт Сколько эфиров состава С(Н|2О, удов-
летворяет этому требованию?
1) один; 2) четыре; 3) три; 4) два.
6. Укажите сумму коэффициентов в уравнении реак-
ции этилолеата с водным раствором КМпО4 (5 °C):
1) 16; 2) 15; 3) 14; 4) 13.
7. Энантиомеры возможны для сложных эфиров (эфи-
ра) состава:
1) С2Н4О2; 2) С3НбО2; 3) СДО,; 4) С5НИ)О2.
8. Сложный эфир дает качественную реакцию с Ag2O
(аммиачн. р-р), а при окислении одного из продуктов
кислотного гидролиза эфира образуется кетон Укажите
формулу сложного эфира:
Р О
9. Отметьте число изомерных триглицеридов, обра-
зованных остатками метановой и этановой кислот (без
учета стереоизомеров):
1)2; 2)3; 3)4; 4)5.
10. Для производства органического стекла (плексиг-
ласа) используется:
1) тристеарин; 2) метилметакрилат;
3) триолеин; 4) метилметаноат
--- 772 ---
ТЕСТ 9
1. Соль (соли) карбоновой кислоты образуется (ются)
при взаимодействии:
1) фенола и КОН (Н2О);
2) жира и Н2О (Н+);
3) жира и КОН (Н2О);
4) фенилбензоата и NaOH(H2O).
2. Натриевое мыло реагирует с:
1) H,SO. (разб ); 2) Са(НСОД (р-р);
3) Na2CO3 (р-р); 4) КНСО3 (р'-р).
3. Для образования бензилбензоата между собой дол-
жны прореагировать:
1) бензойная кислота и фенол;
2) бензойная кислота и бензиловый спирт;
3) фенол и бензиловый спирт;
4) бензойная кислота и бензол.
4. Фенилбензоат образуется, когда между собой реа-
гируют вещества, формулы которых:
1) <Q>— СН2ОН и СООН,
2) СООН и ОН;
3) СН2ОН и 0Н’
4) СООН и
5. Двухатомный спирт образуется при кислотном гид-
ролизе:
1) триолеина,
2) метилакрилата;
3) винилсалицилата;
4) аллилацетата.
--- 773
6. При кислотном гидролизе жиров никогда не обра-
зуются:
1) этиленгликоль; 2) мыло;
3) масляная кислота; 4) этан диол-1,2.
7. При щелочном гидролизе сложного эфира НЕЛЬЗЯ
получить:
1) этиленгликоль; 2) соль карбоновой кислоты;
3) карбоновую кислоту; 4) алканол.
8. При нагревании маслянопропилового эфира в при-
сутствии водного раствора КОН образуются:
1) С3Н7СООН и С3Н7ОН; 2) С3Н7СООН и С3Н7ОК;
3) С3Н7СООК и С3Н7ОК; 4) С3Н7СООК и С3Н7ОН.
9. Сложный эфир образуется, когда HNO3 реагирует с:
1) этанолом (0 °); 2) этаном;
3) глицерином; 4) бензолом.
10. Метилметакрилат может вступать в реакции:
1) полимеризации; 2) этерификации;
3) гидролиза; 4) окисления.
ТЕСТЮ
1. Ацетат калия образуется при гидролизе в присут-
ствии КОН веществ строения:
О
||
1)Н— С ; 2) СН3— С ;
ХО —С2Н5 ХОСН3
--- 774 ---
4)/у—С —О —СН3.
W II
О
2. В реакцию щелочного гидролиза с КОН (Н,О) всту-
пают вещества, формулы которых.
1) С17Н35СООН;
2) СН3 — СН = СН — СООСН3;
3) СН = С — СООН
' ' I
сн3
4) СН, = С — СООС,Н,.
" I
сн3
3. Спирт и кислота (кислоты) образуются при кислот-
ном гидролизе-
1) фенилацетата; 2) бензилацетата;
3) бензилбензоата; 4) жира.
4. К сложным эфирам НЕ относятся вещества состава:
1) (СН3СО)2О; 2) (СН3О)3Р = О;
3) С3Н7СООСН2С6Н5; 4) СН3СОС6Н5.
5. В отличие от кислотного гидролиза жиров при их
щелочном гидролизе образуются:
1) глицерин;
2) высшие карбоновые кислоты;
3) соли высших карбоновых кислот;
4) этиленгликоль.
6. Укажите формулы производных углеводородов од-
ного класса:
--- 775 ----
сн2 —о—no2
7. Кислотные свойства соединений последователь-
но возрастают в ряду:
1) метанол, метилацетат, уксусная кислота, фенол;
2) метилацетат, метанол, фенол, уксусная кислота;
3) метанол, уксусная кислота, метилацетат, фенол;
4) метилацетат, фенол, метанол, уксусная кислота.
8. Для получения мыла непосредственно (в одну ста-
дию) из жиров используется процесс:
1) гидратации;
2) этерификации;
3) щелочного гидролиза;
4) гидрогенизации.
9. Триолеин может вступать в реакции:
1) окисления;
2) гидролиза;
3) гидрогенизации (гидрирования);
4) этерификации.
10. Укажите сумму молярных масс (г/моль) органи-
ческих веществ В и Д для цепочки превращений, проте-
кающих по схеме:
___ СН + *моль А 4 (н2о>^ Б * В
+ Ag;O (аммиачн. р-р), р + С6Н5СН2ОН/ЬГ д
ТЕСТИ
1. Относительная плотность паров сложного эфира
по водороду равна 30. Укажите название эфира, если он
— 776 —
образован алканолом и насыщенной одноосновной кар-
боновой кислотой:
1) метилацетат; 2) метилметаноат;
3) этилэтаноат; 4) этил формиат.
2. Винилацетат образуется, когда между собой реаги-
руют:
1 )уксусная кислота и этанол;
2 ) этилен и этановая кислота;
3 )этилен и этанол;
4) ацетилен и уксусная кислота.
3. Укажите формулу этилпропаноата:
1) СН3СООС,Н5; 2) СН3СООСН3;
3) СН3СН2СООС2Н5; 4) СН3СН2СОС2Н5.
4. Альдегид образуется, когда кислотному гидролизу
подвергается:
1) винил салицилат; 2) аллилацетат;
3) аспирин; 4) бутилметаноат.
5. Укажите сумму молярных масс (г/моль) карбоцик-
лических органических веществ Г, Д, Е для цепочки пре-
вращений, протекающих по схеме:
СН3(СН2)4СН3 А +3 молвило, Б +1мольС1,.АУа g
+ КОН (спирт)' р + КМпО, (5 °C, НО) д + СН,СООН /Н~ (избито^) р
6. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
+ н;о * Ч-НАН/ТН’)
СаС2
g + Cu(OHj„ g + С,Н,СН,ОН/Н^ р
7. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
+1 моль СН3С1/Н^
д 4-1 моль Br2 g + КОН (Н2О)^ g ______________________
+ НСООН/1Г р
--- 777 ----
8. В схеме превращений СНОСНО +х’-^ СН.СООН -+ --->
—> СН7СООСН,С.Н5 вещества X и Y — это соответственно:
l)LiA!H4,cXcH2OH:
2) Ag^O(aMMna4H. р-р), С6Н$ОН;
3) Си(ОН)„ С6Н5СН,ОН; ’
4) КМпО4, С6Н5СООН.
9, В схеме превращений А + Cu(OHb< Б - е^енонш бен-
зилметаноат вещества А и Б — это соответственно:
1) метаналь и метановая кислота;
2) метанол и метановая кислота;
3) метанол и метаналь;
4) метан и метановая кислота.
10. Молекула сложного эфира, образованного первич-
ным алканолом и насыщенной одноосновной карбоно-
вой кислотой, содержит 48 электронов. Этому эфиру изо-
мерны вещества:
1) масляная кислота; 2) валериановая кислота;
3) изопропилметаноат; 4) пропилэтаноаз.
ТЕСТ 12
1. Укажите окраску лакмуса в водном растворе твер-
дого мыла:
1) красная; 2) синяя; 3) желтая; 4) малиновая.
2. Какая формула связывает число электронов N(e) и
число атомов углерода и в молекуле сложного эфира,
образованного алканолом и насыщенной одноосновной
карбоновой кислотой?
1)Ме)= 14//+ 16; 2) Me) = 14/7 + 32;
3) ЛГ(е) = 8л+ 16; 4) Me) = 8/7 + 32.
3. Отметьте справедливые утверждения:
1) жиры плохо растворимы в воде, по хорошо — в
--- 778 ----
бензине;
2) олифу в основном получают из подсолнечного масла;
3) при гидрировании жидких жиров образуется саломас;
4) в реакции между СН3 — С — ОН и Н18О — СН3
II
О
образуется вода, в состав которой входит нуклид 18О.
4. Осадок образуется, когда к водному раствору жид-
кого мыла добавить:
1) НС1; 2) КОН; 3) СаС12; 4) NaNO,.
5. Укажите формулу синтетического моющего средства:
4)
ОН.
6. Качественную реакцию с аммиачным раствором
Ag2O дают:
1) метилметаноат;
2) этилацетат;
3)бензилбензоат;
4) этилформиат.
7. При взаимодействии уксусной кислоты и этилена
образуется:
1) винилацетат; 2) уксусный ангидрид;
3) аллилацетат; 4) этилацетат.
— 779 —
8. Укажите структурную формулу пропил-2-бромбу-
тен-3-оата:
О
II
1) Н2с = СН — С — сн2 — СН, — снз;
Вг
О
II
Н2С = СН — СН — С — ОСН2 — СН2 — СН3;
Вг
з)н,с—с = с—с—о—сн,—сн, —сн-
I I II ‘
Вг Н О
о
II
4)Н2С = С —сн2 —с —о —сн2 —сн2 —сн3.
Вг
9. Гидролиз метилбензоата проводят водой, меченой
нуклидом 18О. Укажите формулу продукта, в составе ко-
торого будет находиться нуклид 18О: 18
,8 'I
1) С,Н, — С — ОН; 2) СН, — С — ОН;
7 6 5 7 б э
“о
3) СН, — С — ,8ОН; 4) СН/ОН.
7 б J 7 э
II
о
10. Укажите число изомерных триглицеридов, содер-
жащих один остаток стеариновой кислоты и два остатка
олеиновой кислоты (без учета стереоизомеров):
1) два; 2) три; 3) четыре; 4) пять.
— 780 —
ТЕСТ 13
1. Укажите верные утверждения:
1) при окислении жиров энергии выделяется больше,
чем при окислении такой же массы углеводов;
2) жиры — поставщики кислот, не синтезируемых в
организме человека;
3) на воздухе легче окисляются твердые, а не жидкие
жиры;
4) все без исключения жиры животного происхожде-
ния — твердые (t = 20°С).
2. Отметьте формулы веществ, которые образуются при
гидролизе в присутствии сильной кислоты вещества
строения
Н О
I II
Нзс —С —С —ОСН3:
НС—С—О
II
О
1) СН3СООН; 2)СН3ОН;
3) СН3СН — СООН; 4) СН3СН2СООН.
ОН
3. Укажите формулы веществ, которые образуются при
гидролизе в присутствии КОН вещества строения
Н О
I II
н с —с—с —ос,н •
I
о —с —сн3
II
о
--- 781 ----
1) Н С — CH — COOK; 2) Н,С — СН — COOK;
I I
ОК он
3) С2Н5ОК; 4) Н3ССООК.
4. Отметьте формулу вещества А для цепочки превра-
щений, протекающих по схеме:
+ А&О(амм.р-р), ^ С02 + н о
* ♦Н.О/Н'
А—!—>Б
+ СН,СООН/1Г
СН3СООСН3
1) НСООС2Н5; 2) НСООСН3;
3) СН3СООСН3; 4) СН3СООС2Н5.
5. Меченый нуклидом |8О этилацстат Н3ССО — |8ОС2Н5
подвергали гидролизу в кислой среде. Укажите формулу
продукта, в состав которого входит нуклид 18О:
1) Н3ССО|8ОН; 2) CJH/OH;
3)Н,С —С —ОН; 4) Н,С — С — ,8ОН.
II II
I8Q 180
6. В наибольшей степени при хранении на воздухе
окислению будет подвергаться масло:
1) дипальмитоолеин; 2) пальмитодиолеин;
3) трилинолеин; 4) пальмитоолеолинолеин.
7. Какие вещества образуются при гидролизе в кис-
лой среде соединения строения
1)Н00С
Н
СН2ОН?
--- 782 ---
2) НООС — СООН;
3) НО — СН2ОН;
4) НОСН, ~СН2°Н.
8. В соединении, формула которого
, 2
Н3С —сн2 —С 5 6
хо — сн2—сн3
постоянно в одной плоскости находятся атомы СиО,
номера которых:
1) 3, 4, 5, 6; 2) 2, 3,4, 5; 3) 1, 2, 3,4; 4) 4, 5, 6, 7.
9. Укажите формулу продукта реакции между глице-
рином и избытком фосфорной кислоты:
1)СН2 —О —Н
СН —О —Н
I /0Н
СН2 —О^Р = О
4 он
2) СН2 —О —Н
I /ОН
СН — О — Р О
хон
/ОН
СН2 — О — Р = О
ХОН
/ОН
3) СН2 —О —Р = О
хон
/ОН
СН —О —Р = О
хон
/ОН
СН2 —О —Р = О
ХОН
4)СН2 —О
СН —О--Р-О-Н
СН2-0
783 ---
10. Отметьте формулу продукта реакции между сали-
циловой кислотой и уксусным ангидридом:
ТЕСТ 14
1. Винилацетат может реагировать с:
1)КОН(Н,О); 2)Н,О(1Г);
3) н2 (Kat, ?); 4) KNO, (Н7О).
2. Укажите химическое количество (моль) Н2, которое
потребуется для полного гидрирования кратных связей
в алкильных группах трилинолеина химическим коли-
чеством 2 моль:
1)6; 2) 8; 3) 10; 4) 12.
3. Сколько реагентов из перечисленных (аммиачный
раствор Ag2O, Н, (Kat), NaOH (Н7О), Н70 (Н+), СаСО3,
KNO,) могут взаимодействовать с этилметаноатом?
1) шесть; 2) пять; 3) четыре; 4) три.
4. Водородные связи могут образовываться между
молекулами, формулы которых:
1) СН3СООСН3; 2) НСООС7Н5;
3) С2Н5СООН; 4) НОСН7СН7СНО.
--- 784 ---
5. Пропилэтаноат можно получить при взаимодей-
ствии:
1) СД и СН3СООН;
2) СН3СН2СНЭОН и СН3СООН;
з) сн3снэаСон и (сн,сдсо) о,
4) СН3СН2СН2ОН и (СН3СО)2О. ‘
6. В одну стадию в вещество состава СДД можно
перевести:
1) уксусный ангидрид;
2) этилформиат;
3)этаналь;
4) бутен-2-диол-1,4.
7. Чем отличаются сложные эфиры от простых?
1) простые эфиры могут иметь симметричное строе-
ние, а сложные — нет;
2) молекулы сложных эфиров могут содержать карбо-
нильную группу, а простых — нет;
3) простые эфиры реагируют с кислородом, а слож-
ные — нет;
4) сложные эфиры могут быть изомерны карбоновым
кислотам, а простые -— нет.
8. Этилметаноат реагирует, а метилацетат — нет с:
1) Н,0 (Н+); 2) АоэО(аммиачн р-р), /°;
3) КОН ДО); 4) СаСО3.
9. При щелочном гидролизе бензилбензоата в при-
сутствии избытка водного раствора NaOH образуются
вещества, формулы которых:
1) <Q>~ ONa; 2) <Q>- СДОН;
3) СООН; 4) <Q- COONa
--- 785 ----
10. Молекула сложного эфира образована этиленгли-
колем и остатками только одной монокарбоновой кис-
лоты и имеет формулу С|0Н14О4. Сколько молекул Вг, мо-
жет присоединить одна молекула такого эфира?
1) одну; 2) две; 3) три; 4) четыре.
ТЕСТ 15
1. Укажите формулу воска:
1) СН, — О — С17Н35; 2) С17Н35СООСН3;
сн —о —с17н35
сн, — о — с17н35
3) С17Н35СООС14Н29; 4) СН3СООС,4Н29.
2. При кислотном гидролизе лаврового масла образу-
ются:
1) этиленгликоль и лауриновая кислота (С|(Н23СООН);
2) глицерин и этиленгликоль;
3) этиленгликоль и линолевая кислота;
4) глицерин и лауриновая кислота.
3. Укажите возможные продукты кислотного гидро-
лиза воска:
I) С|5Н31СООН и С,Н5ОН;
2) СН3СООН и С31Н63ОН;
3) С, .Н..СООН и СП ОН;
4) C6H5COOH и CH3OH.
4. При гидролизе аспирина в присутствии избытка
NaOH образуются вещества, формулы которых:
aCOONa ../C()ONa
• 2>С 1 ;
ONa ^^ОН
--- 786 ---
СООН
3) СН COONa; 4) [ |Т
^\ONa
5. На полное взаимодействие с салициловой кисло-
той массой 6,90 г потребуется КОН массой (г):
1)2,8; 2) 5,6; 3) 8,4; 4) 11,2.
6. Аспирин массой 2,7 г может в водном растворе мак-
симально прореагировать с NaOH массой (г):
1) 0,6; 2) 1,2; 3) 1,8; 4) 2,4.
7. При гидролизе аспирина в присутствии сильной
кислоты образуются вещества, формулы которых:
СООН
осн3
3) СН3 — СООН;
8. Аспирин образуется при взаимодействии:
1) С6Н5СООН и С6Н5ОН;
2) С6Н5СООН и (СН3СО)2О;
3) ЛЛ— СООН и (СН3СО)2О;
^^ОН
4) СООН и (СН3СО)2О.
^\()Н
9. Сколько молекул брома может присоединить пор-
ция жира состава С57Ну2О6 массой 43,6 г (в состав жира
входят остатки только одной кислоты)?
1) 2,709 -1023; 2) 9,03 • 1022; 3) 1,806 • 1023; 4) 3,612 • Ю23.
--- 787 ---
10. Сколько молекул иода могут присоединить 2 мо-
лекулы жира состава С57Н98О6 (в состав жира входят ос-
татки только одной кислоты)?
1)6; 2) 8; 3) 10; 4) 12.
ТЕМА 52
Моносахариды
ТЕСТ1
1. Укажите справедливые утверждения:
1) в растворе а- и p-формы глюкозы находятся в рав-
новесии;
2) кристаллическая глюкоза существует в цикличес-
кой, а не линейной форме;
3) ОС-форма глюкозы переходит в P-форму, минуя аль-
дегидную форму;
4) циклическая форма глюкозы более устойчива, чем
линейная.
2. Реакция с каким веществом может использоваться для
доказательства того, что глюкоза — пятиатомный сцирт?
1) гидроксидом меди (II) при комнатной температуре;
2) аммиачным раствором оксида серебра (I) при на-
гревании;
3) уксусным ангидридом;
4) бромной водой.
3. Каким одним реактивом можно распознать разные
пробирки, содержащие водные растворы глицерина,
ацетальдегида, глюкозы и уксусной кислоты?
1) лакмусом;
— 788 —
2) аммиачным раствором Ag,O;
3) гидроксидом меди (II);
4) карбонатом натрия.
4. При окислении бромной водой глюкоза превраща-
ется в:
1) шестиатомный спирт; 2) глюконовую кислоту;
3) молочную кислоту; 4) сахарозу.
5. Пентозы —’ это:
1) глюкоза; 2) рибоза; 3) дезоксирибоза; 4) фруктоза.
6. Глюкоза может образоваться в результате:
1) гидролиза крахмала;
2) изомеризации фруктозы в щелочной среде;
3) фотосинтеза;
4) окисления рибозы.
7. Химические свойства глюкозы, характерные для
альдегидов, проявляются в реакциях:
1) брожения; 2) с Ag2O(aMMna4Hbifi р-р), /°;
3) с Сп(ОН),, 20 °C; 4) с Cu(OH),,t°.
8. Дезоксирибоза может реагировать с:
1) водным раствором нитрата калия;
2) гидроксидом меди (II) при комнатной температуре;
3) бромоводородом;
4) уксусной кислотой.
9. Рибоза и дезоксирибоза различаются между собой:
1) молярной массой;
2) числом атомов кислорода в молекуле;
3) числом атомов водорода в молекуле;
4) числом гидроксильных групп.
10. При восстановлении альдегидной группы глюко-
за превращается в:
1) пятиатомный спирт; 2) альдегидокислоту;
3) шестиатомный спирт; 4) кетоноспирт.
— 789
ТЕСТ 2
1. Соединение, полученное при восстановлении аль-
дегидной группы глюкозы, реагирует с:
1) уксусной кислотой (в присутствии сильной кис-
лоты);
2) аммиачным раствором оксида серебра (I) с образо-
ванием серебра;
3) гидроксидом меди (II);
4) бромоводородом.
2. Охарактеризуйте строение и свойства фруктозы:
I) изомер глюкозы;
2) в нейтральной среде дает реакцию «серебряного
зеркала»;
3) с гидроксидом меди при комнатной температуре
образует ярко-синий раствор;
4) по строению является кетоноспиртом.
3. Глюкоза может реагировать с:
I) кислородом;
2) гидроксидом меди (II) при комнатной температуре;
3) хлоридом натрия (в водном растворе);
4) бромной водой.
4. а- и P-формы глюкозы различаются между собой:
1) молярной массой;
2) числом гидроксильных групп в молекуле;
3) взаимным расположением гидроксильных групп у
первого и четвертого атомов углерода;
4) числом атомов углерода и цикле.
5. Для полной этерификации глюкозы химическим
количеством 1 моль необходима уксусная кислота хими-
ческим количеством (моль):
1)2; 2)3; 3)4; 4) 5.
— 790 —
6. В какой группе все перечисленные вещества дают
реакцию «серебряного зеркала»?
1) метаналь, глюкоза, уксусная кислота;
2) метановая кислота, рибоза, глицерин;
3) дезоксирибоза, глюкоза, формальдегид;
4) этанол, этаналь, муравьиная кислота.
7. Укажите справедливые утверждения:
1) состав не всех углеводов можно выразить форму-
лой С ;(Н,О\;
2) при образовании циклической формы глюкозы из
линейной изменяется степень окисления первого атома
углерода;
3) массовая доля линейной формы глюкозы в водном
растворе значительно меньше, чем циклических;
4) больные сахарным диабетом должны вместо фрук-
тозы употреблять глюкозу.
8. Химические свойства глюкозы, характерные для
многоатомных насыщенных спиртов, проявляются в ре-
акции:
1) спиртового брожения; 2) гидрирования;
3) с бромной водой; 4) с Си(ОН)2, 20 °C.
9. Продукт, полученный при молочнокислом броже-
нии глюкозы, может при определенных условиях реаги-
ровать с:
1) бромоводородом; 2) уксусной кислотой;
3) нитратом калия; 4) этанолом.
10. Отметьте области практического использования
глюкозы:
1) в пищевой промышленности;
2) как укрепляющее лечебное средство;
3) для получения витамина С;
4) для получения ацетатного волокна.
— 791
ТЕСТЗ
1. В циклической форме глюкозы присутствует функ-
циональная группа:
1) гидроксильная; 2) альдегидная;
3) карбоксильная; 4) карбонильная.
2. В линейной форме молекулы фруктозы присутству-
ют функциональные группы:
1) карбонильная; 2) альдегидная;
3) гидроксильная; 4)карбоксильная.
3. Наличие в молекуле глюкозы альдегидной группы
доказывают ее реакции с:
1) Си(ОН), (комнатная температура);
2) уксусным ангидридом;
3) Ag,0 (аммиачный р-р, А);
4) Cu(OH)2, 1°.
4. Глюкоза образует сложные эфиры, реагируя с:
1) спиртами;
2) гидроксидом меди (II) при комнатной температуре;
3) уксусным ангидридом;
4) водородом.
5. Глюконовую кислоту из глюкозы получают посред-
ством реакции:
1) брожения; 2) этерификации;
3) окисления; 4) восстановления.
6. В состав всех четырех молекул моносахаридов (глю-
козы, фруктозы, рибозы и дезоксирибозы), находящихся
в циклической форме, входит функциональная группа:
1) карбонильная; 2) альдегидная;
3)карбоксильная; 4) гидроксильная.
7. В линейной форме молекулы глюкозы присутству-
ют функциональные группы:
1) альдегидная; 2) сложноэфирная;
— 792 —
3)гидроксильная; 4)карбоксильная.
8. За счет гидроксильных групп глюкоза реагирует с:
1)Си(он),(О;
2) СН3СООН;
3) Си(ОН)2(комнатная температура);
4) Ag,0 (аммиачный р-р), (t°).
9. Чтобы превратить глюкозу в шестиатомный спирт,
ее нужно ввести в реакцию с:
1) уксусной кислотой;
2) аммиачным раствором оксида серебра (I);
3) этанолом;
4)водородом.
10. Глюкозу в промышленности получают:
1) синтезом из формальдегида;
2) крекингом нефтепродуктов;
3) синтезом из углекислого газа и воды;
4) гидролизом крахмала.
ТЕСТ 4
1. Состав каких веществ, относящихся к классу угле-
водов, может быть выражен общей формулой Сп(Н2О)п?
1) рибоза;
2) дезоксирибоза;
3) глюкоза;
4) уксусная кислота.
2. В состав молекулы фруктозы в линейной форме вхо-
дят функциональные группы:
1) — С—; 2)-С ; 3) —ОН; 4) —С
II хн хо —н
о
--- 793 ----
3. В молекулах глюкозы как в линейной, так и цикли-
ческой формах присутствует функциональная группа:
1)альдегидная; 2)гидроксильная;
3) карбонильная; 4)карбоксильная.
4. Укажите справедливые утверждения. При переходе
молекулы глюкозы из линейной формы в циклическую:
1) изменяется число гидроксильных групп в молекуле;
2) исчезает альдегидная группа;
3) изменяется относительная молекулярная масса глю-
козы;
4) появляется возможность существования двух форм
глюкозы.
5. Какая масса (г) уксусного ангидрида расходуется на
полную этерификацию глюкозы массой 1,8 г?
1)5,1; 2) 4,1; 3)3,1; 4) 2,1.
6. Укажите сумму коэффициентов в уравнении реак-
ции 1 моль глюкозы и 3 моль уксусного ангидрида:
1)6; 2) 7; 3) 8; 4) 9.
7. Глюкоза НЕ реагирует с:
1) водородом (Z°, Kat);
2) бромной водой;
3) этилпропаноатом;
4) метанолом (в присутствии сильной кислоты).
8. При образовании 1 моль глюкозы поглощается
2920 кДж теплоты. Сколько теплоты (кДж) выделяется
при окислении глюкозы массой 1 г?
1)8,1; 2) 16,2; 3)24,3; 4) 32,4.
9. Воспользуйтесь данными предыдущего теста и оп-
ределите, какой объем (дм3, н.у.) О, выделяется в про-
цессе фотосинтеза, если поглотилось 730 кДж теплоты:
1) 11,2; 2) 22,4; 3)33,6; 4) 44,8.
— 794 —
10. При восстановлении альдегидной группы дезок-
сирибозы образуется:
1) альдегидоспирт; 2) спиртокислота;
3) четырехатомный спирт; 4) пятиатомный спирт.
ТЕСТ 5
1. Укажите циклическую форму рибозы*:
2. Согласно циклической форме альдогексозы (ман-
укажите формулу ее линейной формы:
* При образовании циклической формы рибозы взаимодей-
ствуют альдегидная группа и гидроксил у четвертого атома
углерода.
--- 795 ---
сно
сно
1) Н но н н 3)НО но н н пи Н — он
Un L± и Н он
и хх — н
UH он
с ( — ин :н2он < :но с ЗН2ОН :но TJ
11 ни и И 11 ОН
г! ОН НО н
пи и он
( VJJL1 -П ЗН2ОН ( 2Н2ОН
3. Простой эфир образуется при взаимодействии глю-
козы с:
1) (СН3СО)2О, 2) СН.ОН (Н+),
3)Н2; 4)Вг2(Н2О)
4. Укажите формулу триметилглюкозы:
I) с,н„о(; 2) с,н,Д; 3) С9Н„Ов; 4) СД.,0,.
5. Отметьте формулу пентаацетилглюкозы:
1) С|2НнО,; 2) С|6Н„О„; 3) С.ДД; 4) С1сО!9Н,„.
--- 796 ----
6. Укажите формулу конечного органического продукта
реакций, протекающих по схеме:
глюкоза ДРОЖЖИ? +H2SO4, 170°С^ + О» (PdCl2), г _____
+ Na2Cr2O/H2SO^ + С12 (фосфор) + 2-мстилпропанол-2/Н
1) ан2с—\qZx/; 2) cih2c —о
о о
3)С1Н2С—/; 4)С1Н2С— { ,
0-х х°—V
7. Сколько типов реакций из перечисленных (окисле-
ние, восстановление, этерификация, гидролиз, броже-
ние) возможны для глюкозы?
1) пять; 2) четыре;
3) три; 4) два.
8. Двойственной химической функцией обладают:
1) сорбит;
2) глюконовая кислота;
3) глюкоза в линейной форме;
4) фруктоза в циклической форме.
9. Формулой Сп(Н2О)п НЕ может быть выражен состав:
1) глюкозы;
2) дезоксирибозы;
3) фруктозы;
4) рибозы.
10. В водном растворе глюкозы в равновесии находятся
формы:
1) только линейная и а;
2) только линейная и Р;
3) только а- и Р;
4) линейная, а- и р.
— 797 —
ТЕСТ 6
1. Укажите формулу пентаацетилглюкозы (для а-формы):
— 798 —
2. Доказать наличие в молекуле глюкозы двух различ-
ных функциональных групп можно с помощью одного
реактива, формула которого:
1) Ag,0 (р-р в NH3); 2) Cu(OH),;
3)Вг?(Н2О); 4) (СН3СО)2О.
3. Сложные эфиры образуются, когда глюкоза реаги-
рует с:
1) Си(ОН)2; 2) СН3СООН; 3) Н3РО4; 4) (СН3СО)2О.
4. При образовании циклической формы глюкозы меж-
ду собой реагируют функциональные группы:
1) —ОНи —С —ОН; 2) —ОНи —С —Н;
II II
О О
3) — С — и — С — О; 4) —С —ОНи —С—.
II I II II
ОН о о
5. Механизм образования циклической формы ман-
нозы (изомер глюкозы) такой же, как и для глюкозы. Ис-
ходя из линейной формы маннозы
^О
С^Н
НО —с —н
I
но —с —н
I
н—с —он
I
н—с —он
СН2ОН
укажите строение одной из ее циклических форм:
— 799 —
он он он н
6. Для описания реакции фотосинтеза подходят ха-
рактеристики:
1) окислительно-восстановительная;
2) соединения;
3) эндотермическая;
4) гетерогенная.
7. Бромной водой окисляется:
1) только a-форма глюкозы;
2) только P-форма глюкозы;
3) а- и P-формы глюкозы;
4) только линейная форма глюкозы.
8. Фруктоза дает реакцию «серебряного зеркала» в
среде:
1) только кислой;
2) только нейтральной;
3) только щелочной;
4) во всех средах, перечисленных выше.
— 800 —
9. Качественную реакцию с Си(ОН), с образованием
красного осадка дает:
1) a-форма глюкозы при 20 °C;
2) [3-форма глюкозы при нагревании;
3) линейная форма глюкозы при 20°С;
4) линейная форма глюкозы при нагревании.
10. Ярко-синее окрашивание наблюдается, когда све-
жеосажденный Си(ОН), добавить к раствору:
1) глюкозы; 2) сорбита; 3) фруктозы; 4) ацетальдегида.
ТЕСТ 7
1. НЕ является углеводом вещество, формула которого:
1) С5Н10О2; 2) С5Н10О5; 3) С12Н22О1Р 4) СбН12Об.
2. Укажите формулу глюконата кальция:
1) (С5НрОбСОО)2Са; 2) (С5Н]0ОбСОО),Са;
3) (С5Н„ОбСО)2Са; 4) (С5НиОбСОО)2Са.
3. Сколько характеристик из указанных подходят для
описания рибозы, пентоза, кетоноспирт, моносахарид,
не подвергается гидролизу?
1) четыре; 2) три; 3) две, 4) одна.
4. Для описания как фруктозы, так и глюкозы подхо-
дят утверждения:
1) моносахариды;
2) существуют только в циклических формах;
3) не подвергаются гидролизу,
4) в реакции с уксусным ангидридом образуют слож-
ные эфиры.
5. В процессе фотосинтеза поглотился СО2 объемом
(н.у.) 11,2 дм3. При этом образовалась глюкоза массой (г):
1) 7,50;2) 15,0; 3) 22,5; 4) 30,0.
26 Зак 1530
--- 801
6. Укажите минимальную массу (г) уксусного ангид-
рида, которая потребуется для этерификации половины
гидроксильных групп в сорбите массой 9,10 г (выход
реакции 100%):
1) 12,3; 2) 13,3; 3) 14,3; 4) 15,3.
7. В молекуле сорбита массовая доля (%) атомов кис-
лорода равна:
1) 52,75, 2) 51,75; 3) 50,75, 4) 49,75.
8. Какая масса (г) 2-гидроксипропановой кислоты
образуется при соответствующем брожении глюкозы
химическим количеством 0,250 моль?
1)45,2) 90,3) 180; 4)360.
9. Качественную реакцию с Ag2O(aMMiia4H.p-p) НЕ
дают:
1) сорбит; 2) дезоксирибоза;
3) фруктоза; 4) глюконовая кислота.
10. Содержание глюкозы в крови регулирует гормон:
1) пепсин; 2) инсулин;
3) эстрадиол; 4) тестостерон.
ТЕМА 53
Дисахариды. Полисахариды
ТЕСТ1
1. Дисахариды — это:
1) гликоген; 2) лактоза, 3) мальтоза; 4) сахароза. •
2. Гидролизу могут подвергаться углеводы:
1) мальтоза; 2) лактоза, 3) фруктоза; 4) крахмал.
3. К числу полисахаридов относятся:
1) гликоген; 2) мальтоза; 3) крахмал; 4) целлюлоза.
— 802 —
4. Конечным продуктом гидролиза целлюлозы яв-
ляется:
1) фруктоза; 2) а-глюкоза; 3) ^-глюкоза; 4) мальтоза.
5. В природных веществах макромолекулы крахмала
и целлюлозы образуются из отдельных молекул глюко-
зы за счет реакции:
1) этерификации; 2) полимеризации;
3) поликонденсации; 4) гидролиза.
6. Синее окрашивание появляется в случае, когда иод
реагируете:
1) глюкозой; 2) крахмалом; 3) фруктозой; 4) сахарозой.
7. При нагревании сахарозы с H2SO4 (разб.) образуются:
1) глюкоза и мальтоза; 2) лактоза и фруктоза;
3) а-глюкоза и фруктоза; 4) Р-гпюкоза и фруктоза.
8. Взаимодействие целлюлозы с азотной кислотой
приводит к образованию:
1) сложного эфира; 2) нитросоединения;
3) простого эфира; 4) амина.
9. Конечным продуктом гидролиза крахмала является:
1) декстрины; 2) карамель; 3) а-глюкоза; 4) мальтоза.
10. Избыток глюкозы в организме человека накапли-
вается в:
1) легких в виде гликогена;
2) мышцах в виде гликогена;
3) печени в виде крахмала;
4) печени в виде гликогена.
ГЕСТ 2
1. Общей формулой Cn(H,O)m (пит могут быть оди-
наковыми или разными) может быть выражен состав:
1) гликогена; 2)сахарозы;
3) целлюлозы; 4) дезоксирибозы.
— 803 —
2. Целлюлоза может реагировать с:
1)кислородом;
2) водным раствором нитрата калия;
3) азотной кислотой;
4) уксусным ангидридом.
3. Укажите названия веществ, которые могут подвер-
гаться гидролизу:
1) гликоген; 2) целлюлоза; 3) рибоза; 4) сахароза.
4. Отметьте верные утверждения:
1) целлюлоза является полисахаридом, а крахмал—нет;
2) макромолекулы целлюлозы имеют только линей-
ное строение, а крахмала — как линейное, так и развет-
вленное;
3) макромолекулы целлюлозы построены из остатков
Р-глюкозы, а крахмала -— из остатков а-глюкозы;
4) средняя степень полимеризации целлюлозы боль-
ше, чем крахмала.
5. Укажите число гидроксильных групп в мономер-
ном звене целлюлозы и крахмала:
1) пять; 2) четыре; 3) три; 4) две.
6. При нагревании древесины без доступа воздуха
получают:
1) уксусную кислоту; 2) ацетон;
3) пироксилин; 4) метанол.
7. Молекула сахарозы образуется из молекул глюкозы
и фруктозы за счет реакции:
1) полимеризации; 2) этерификации;
3) дегидратации; 4) поликонденсации.
8. Атомы азота содержатся в составе природного по-
лимера, название которого:
1) тринитроцеллюлоза; 2) пироксилин;
3) хитин; 4) триацетилцеллюлоза.
— 804 —
9. Сложные эфиры образуются, когда целлюлоза реа-
гирует с:
1) азотной кислотой (в присутствии H2SO4);
2)водой;
3) уксусным ангидридом (в присутствии H,SO4);
4)кислородом.
10. При гидролизе крахмала могут образоваться:
1) фруктоза; 2) глюкоза; 3) декстрины; 4) мальтоза.
ТЕСТЗ
1. Для сахарозы возможны реакции:
1) гидролиза; 2) этерификации;
3) окисления; 4) гидратации.
2. В организме человека гидролизу подвергаются:
1) крахмал; 2) целлюлоза; 3) мальтоза; 4) сахароза.
3. В отличие от глюкозы сахароза НЕ реагирует с:
1) гидроксидом меди (II) при нагревании с образова-
нием красного осадка;
2) аммиачным раствором оксида серебра (I) при на-
гревании с образованием серебра;
3) гидроксидом меди (II) при комнатной температуре
с образованием синего раствора;
4)кислородом.
4. Красный осадок образуется, когда с Си(ОН)2 при
нагревании реагируют:
1) клейстер крахмала; 2) рибоза
3) сахароза; 4) глюкоза.
5. Средняя относительная молекулярная масса макромо-
лекул хлопкового волокна равна 753508. Сколько в сред-
нем мономерных звеньев содержится в макромолекуле?
1)4551; 2) 4651; 3) 4751; 4) 4951.
— 805 —
6. Наибольшее химическое количество уксусного ан-
гидрида потребуется на этерификацию одного моля:
1) рибозы; 2) фруктозы; 3) глюкозы; 4) сахарозы.
7. Ацетатное волокно изготавливается из продуктов
этерификации:
1) глюкозы уксусным ангидридом;
2) крахмала уксусным ангидридом;
3) целлюлозы азотной кислотой;
4) целлюлозы уксусным ангидридом.
8. К числу природных полимеров относятся:
1) крахмал; 2) гликоген; 3) хитин; 4) лактоза.
9. Изомерами по отношению друг к другу являются:
1) крахмал и хитин;
2) глюкоза и фруктоза;
3) ос-глюкоза и ^-глюкоза;
4) рибоза и дезоксирибоза.
10. При гидролизе одной молекулы сахарозы обра-
зуются:
1) две молекулы ос-глюкозы;
2) две молекулы Р-глюкозы;
3) одна молекула фруктозы и одна молекула а-глюкозы;
4) одна молекула фруктозы и одна молекула Р-глюкозы.
ТЕСТ 4
1. Укажите строение мономерного звена продукта ре-
акции целлюлозы с избытком уксусного ангидрида:
ОСОСНЭ ОСОСНз
-- 806 --
2. Отметьте число молекул воды, которые потребуют-
ся для полного гидролиза молекулы углевода линейного
строения, состоящей из пяти остатков глюкозы:
1) шесть; 2) пять; 3) четыре; 4) три.
3. На полный гидролиз молекулы углевода линейно-
го строения затрачено 6 молекул воды. Укажите моляр-
ную массу углевода (г/моль), если он состоит только из
остатков глюкозы:
1) 1260; 2) 1206; 3) 1170; 4) 1152.
4. Укажите молярную массу (г/моль) пентасахарида
линейного строения, состоящего из остатков глюкозы:
1)900; 2) 828; 3)864; 4) 810.
5. Чему равна сумма коэффициентов в уравнении ре-
акции мономерного звена целлюлозы с уксусным ангид-
ридом при мольном соотношении 1 : 2 соответственно?
1)3; 2) 4; 3)5; 4) 6.
6. Формулой (С6Н|0О5)п может быть выражен состав:
1) гликогена;
2) сахарозы;
3) крахмала;
4) целлюлозы.
7. Сахароза в водном растворе может реагировать с:
1) раствором брома в СС14;
2) гидроксидом кальция;
— 807 —
3) гидроксидом меди (II);
4) аммиачным раствором Ag2O с образованием серебра.
8. Для производства бездымного пороха используют:
1) триацетилцеллюлозу;
2) тринитроцеллюлозу;
3) пентаацетилглюкозу;
4) пентанитроглюкозу.
9. К описанию пироксилина подходят утверждения:
1) взрывчатое вещество;
2) сложный эфир;
3) образуется при обработке целлюлозы избытком
азотной кислоты;
4) продукт реакции этерификации целлюлозы уксус-
ным ангидридом.
10. Укажите сумму коэффициентов в уравнении реак-
ции мономерного звена целлюлозы с азотной кислотой
(мольное отношение равно 1 : 3 соответственно):
1) 6; 2) 7; 3) 8; 4) 9.
ТЕСТ 5
1. Укажите структурную формулу фрагмента целлюлозы:
— 808 —
2. К типу гексоз относятся:
1) глюкоза;
2) мальтоза;
3)крахмал;
4) фруктоза.
3. В отличие от целлюлозы крахмал:
1) углевод;
2) дает качественную реакцию с иодом;
3) природный полимер;
4) не используется для изготовления волокон.
— 809 —
4. Что общего в строении целлюлозы и крахмала?
1) конфигурация макромолекул в пространстве;
2) средняя степень полимеризации;
3) формула мономерного звена;
4) строение остатков моносахарида, из которых пост-
роены эти полимеры.
5. Для получения искусственного волокна целлюлозу:
1) обрабатывают азотной кислотой;
2) обрабатывают уксусным ангидридом;
3) подвергают гидролизу;
4) восстанавливают.
6. Пироксилин — это:
1) простой эфир;
2) продукт гидролиза целлюлозы;
3) сложный эфир;
4) азотсодержащее органическое вещество.
7. Получение нитроцеллюлозы относится к типу ре-
акций:
1) гидролиза; 2) гидрирования;
3) полимеризации; 4) этерификации.
8. Для получения бездымного пороха используется
вещество, формула которого:
1) [С6Н7О2(ОН),ОСН3]п;
2) [С6Н7О,(ОН)(ОСН3),]п;
3){С6Н7О,(ОН)э(ОСОСН3)]п;
4) [C6H7O2(ONO2)3]n.
9. Какое число нитрогрупп содержится в мономер-
ном звене нитроцеллюлозы с массовой долей атомов
азота, равной 14,1%?
1) одна; 2) две; 3) три; 4) четыре.
10. При добавлении гашеной извести к водному ра-
створу сахарозы происходит:
1) димеризация сахарозы;
— 810 —
2) дегидратация сахарозы;
3) гидрирование сахарозы;
4) образование молекулярного комплекса с гидрокси-
дом кальция.
ТЕСТ 6
1. В процессе фотосинтеза поглотился углекислый газ
массой 4,4 г. Укажите массу (г) полученного крахмала:
1)2,7; 2) 3,1; 3)4,8; 4)5,4.
2. Уголь образуется, когда целлюлозу обрабатывают:
1) HNO3 (конц.); 2) H2SO4 (конц.);
3) (СН3СО)2О; 4) СН3СООН.
3. Укажите молярную массу (г/моль) конечного орга-
нического продукта для цепочки превращений, проте-
кающих по схеме:
целлюлоза +Н2°/Н>> ... ... Ж ... 4Na(1”4 ...
1)58; 2) 46; 3)56; 4)44.
4. Сколько соединений из перечисленных (рибоза,
муравьиная кислота, пропановая кислота, уксусная кис-
лота) образуются при полном кислотном гидролизе ве-
щества строения
1) одно; 2) два; 3) три; 4) четыре.
5. В состав углеводов НЕ входит функциональная группа:
— 811 —
1) альдегидная; 2) карбонильная;
3)гидроксильная; 4)карбоксильная.
6. Пентасахарид линейного строения, образованный
остатками глюкозы, имеет формулу:
1) С»НЮОИ; 2) С20Н52О26; 3) СМНИО27; 4) С„НМО24.
7. Сколько гидроксильных групп содержится в моле-
куле сахарозы?
1) 10; 2)9; 3) 8; 4) 7.
8. Укажите число гидроксильных групп в молекуле
пентасахарида линейного строения, образованного ос-
татками глюкозы:
1) 17; 2) 16; 3) 15; 4) 14.
9. Сахароза в водном растворе может реагировать с:
1) СН3ОН (в присутствии катализатора);
2)Са(ОН)2;
3) (СН3СО)2О (в присутствии 1 L,SO4);
4) Ag2O(aMMna4Hbifi р-р), t°.
10. Тот факт, что сахароза в стакане сладкого чая не
подвергается гидролизу, можно доказать с помощью:
1) индикатора; 2) Си(ОН)2,20 °C;
3) Ag2O (аммиачн.р-р), С; 4) Cu(OH)2, t°.
ТЕСТ 7
1. Назовите продукты, которые образуются при пол
ном кислотном гидролизе трисахарида строения
Н ОН Н ОН ОН Н
1) а-глюкоза; 2) [3-глюкоза; 3) фруктоза; 4) рибоза.
— 812 —
2. При полном кислотном гидролизе салицина
н ОН
образуются:
1) а-глюкоза; 2) р-глюкоза;
3) бензиловый спирт; 4) 2-гидроксиметилфенол.
3. Даны равные массы нижеперечисленных углево-
дов. Наибольшую массу этанола (все реакции протека-
ют с выходом 100 %) можно получить из:
1) глюкозы; 2) фруктозы* , 3) крахмала, 4) сахарозы.
4. Какая минимальная масса (г) уксусного ангидрида
потребуется для этерификации сахарозы массой 3,42 г,
если в реакции этерификации участвует половина гид-
роксильных групп сахарозы, а реакция протекает с вы-
ходом 80 %?
1) 5,10; 2) 4,08; 3) 8,16; 4) 10,20.
5. Укажите формулу продукта этерификации сахаро-
зы уксусным ангидридом, если в реакции приняли уча-
стие 87,5% гидроксильных групп сахарозы:
1) С2Д8О19; 2)С2Л4О17,
3) ед8о19; 4) с2ЛЛ-
6. Укажите молярную массу (г/моль) гептасахарида
линейного строения, образованного остатками глюкозы:
1) 1260; 2) 1152; 3) 1134; 4) 990.
7. Укажите формулу диацетилцеллюлозы:
1) [С6Н7О2ОН(ОСОСНД]п; 2) [С6Н7(ОСОСНД], п;
3) [СбН7О2(ОН)2ОСОСН,]п; 4) [СбН7О9ОН(ОСН3)2]п.
* Спиртовое брожение фруктозы такое же. как и глюкозы.
--- 813 ----
8. Массовая доля атомов углерода наибольшая в со-
ставе:
I) крахмала; 2) глюкозы;
3) сахарозы; 4) рибозы.
9. На полный гидролиз крахмала затратили воду мас-
сой 3,60 г. Укажите массу (г) крахмала:
1) 32,0; 2) 7,2; 3) 32,4,4) 14,4.
10. Массовая доля атомов углерода одинаковая в составе:
1) рибозы и дезоксирибозы;
2) глюкозы и фруктозы,
3) декстринов и сахарозы;
4) декстринов и целлюлозы.
ТЕМА 54
Комбинированные задания по теме:
«Кислородсодержащие производные
углеводородов»
ТЕСЛ
1. Водный раствор гидроксида калия практически ре-
агирует с:
1) метилацетатом; 2) фенолом,
3) пропанолом-1; 4) триолеином.
2. Газ выделяется, когда с раствором гидрокарбоната
калия взаимодействуют:
1) глюкоза; 2) фенол;
3) хлоруксусная кислота; 4) пикриновая кислота.
3. Соли образуются, когда пропановая кислота взаи-
модействует с:
1) сульфатом натрия, 2) калием;
— 814 -----
3) гидроксидом натрия; 4) этанолом.
4. Лакмус имеет красный цвет в водном растворе:
1) фенола; 2) фенолята натрия;
3) хлоруксусной кислоты; 4) глицерина.
5. Лакмус окрашивается в синий цвет в водных ра-
створах:
1) ацетата натрия; 2) метилформиата;
3) фенолята калия; 4) глюкозы.
6. Карбонильная группа входит в состав:
1) простых эфиров;
2) сложных эфиров;
3) циклической формы фруктозы;
4) линейной формы глюкозы.
7. Укажите названия веществ, которые являются изо-
мерами капроновой кислоты:
1) глюконовая кислота;
2) пропилпропионат;
3) 2,2-диметилбутановая кислота; <-
4)гексаналь.
8. С уксусной кислотой при определенных условиях
могут реагировать:
1) хлор; 2) глюкоза; 3) глицерин; 4) нитрат калия.
9. Укажите названия веществ, состав которых можно
выразить формулой C4HgO:
1) 2-метилпропанол-1; 2) бутаналь;
3) 2-метилпропаналь; 4) этилацетат.
10. Молекула гомолога бензилового спирта содержит
74 электрона. Укажите молярную массу (г/моль) гомо-
лога:
1) 136; 2) 122; 3) 108; 4) 94.
— 815 —
ТЕСТ 2
1. Формула гомологов линолевой кислоты:
1) С 11, .СООН; 2) С Н, + ,СООН;
3) _ jCOOH; 4) СД, 3СООН.
2. Остатки Р-глюкозы входят в состав:
1) гликогена; 2) мальтозы; 3) целлюлозы; 4) крахмала.
3. Укажите общую формулу гомологов молочной кис-
лоты:
1) С 11, О,; 2) С Н, О ; 3) С II, О ; 4) С 11, ,0,.
4. Сложные эфиры — это:
1) изоамилнитрат; 2) диметилсульфат;
3) триэтилфосфат; 4) нитропропан.
5. В основе получения тристеарина из глицерина и
стеариновой кислоты лежит реакция:
1) гидратации; 2) гидрогенизации (гидрирования);
3) этерификации; 4) изомеризации.
6. Глюконовую кислоту можно получить:
1) окислением глюкозы бромной водой;
2) восстановлением глюкозы;
3) взаимодействием глюкозы с Си(ОН), при 20 °C;
4) взаимодействием рибозы с аммиачным раствором
Ag2O при нагревании.
7. При неполном гидролизе крахмала образуются:
1) декстрины, 2) мальтоза; 3) лактоза; 4) сахароза.
8. При нагревании с Си(ОН), красный осадок выпа-
дает в случае водных растворов:
1) ацетона; 2) сахарозы;
3) метилформиата; 4) муравьиной кислоты.
9. Каким одним реактивом можно различить пробир-
ки с олеиновой кислотой, муравьиной кислотой и глю-
козой (водные растворы)?
1) бромная вода; 2) лакмус;
— 816 —
3) гидроксид меди (II); 4) гидрокарбонат калия.
10. Укажите формулу соединения, которое образуется
при восстановлении пропаналя:
1) СН3СН2СООН; 2) СН3СН2СН3;
3) СН3СН2СН2ОН; 4) СН3 — СН — СН3.
ОН
ТЕСТЗ
1. При нагревании вторичных спиртов с концентри-
рованной серной кислотой при температуре -140 °C
преимущественно образуются:
1) сложные эфиры; 2) алкены;
3) простые эфиры; 4) кетоны.
2. Наиболее подвижные атомы водорода содержатся
в составе:
1)этанола; 2)этаналя;
3) диметилового эфира; 4) ацетона.
3. Двойственной химической функцией обладают:
1) пропеновая кислота; 2) аллиловый спирт;
3) глюкоза; 4) этилацетат.
4. Водородные связи образуются между молекулами:
1) целлюлозы; 2) этиленгликоля;
3) сорбита; 4) диэтилового эфира.
5. Укажите название вещества, которое образуется при
взаимодействии избытка раствора брома в СС14 с про-
пеновой кислотой:
1) 3,3-дибромпропановая кислота;
2) 2,2-дибромпропановая кислота;
3) 2,3-дибромпропановая кислота;
4) 2,3-дибромпропеновая кислота.
— 817 —
6. При определенных условиях глицерин может реа-
гировать с:
1) Си(ОН)2; 2) С17Н33СООН; 3) КС1; 4) HNO3.
7. Сложные эфиры образуются, когда этанол реаги-
рует с:
1) глицерином;
2) глюкозой;
3) метакриловой кислотой;
4) фосфорной кислотой (0°С).
8. Изомерами по отношению друг к другу являются:
1) глюкоза и мальтоза;
2) фенол и бензиловый спирт;
3) ацетон и аллиловый спирт;
4) мальтоза и сахароза.
9. Остатки а-глюкозы входят в состав полимеров, на-
звания которых:
1) сахароза; 2) крахмал; 3) клетчатка; 4) гликоген.
10. Укажите название самой сильной кислоты из пе-
речисленных:
1) уксусная; 2) хлоруксусная;
3) дихлоруксусная; 4) трифторуксусная.
ТЕСТ 4
1. В порядке возрастания кислотных свойств соеди-
нения перечислены в ряду:
1) фенол — этанол—уксусная кислота—хлоруксус-
ная кислота;
2) этанол — фенол — уксусная кислота — хлоруксус-
ная кислота;
3) фенол—уксусная кислота — этанол — хлоруксус-
ная кислота;
— 818 —
4) этанол — фенол — хлоруксусная кислота — уксус-
ная кислота.
2. Какие соединения дают качественную реакцию с
раствором КМпО4?
1) пропеновая кислота; 2) олеиновая кислота;
3) пропаналь; 4) пальмитиновая кислота.
3. Укажите общую формулу насыщенных ацикличес-
ких кислот, содержащих одну карбоксильную и одну аль-
дегидную группы:
1)СН, О-2)СН, ,О-3)СН, ,О-4)СНП о.
4. Качественную реакцию с аммиачным раствором
оксида серебра (I) дают все вещества групп:
1) пропаналь, глюкоза, этилметаноат;
2) сахароза, этаналь, глюкоза;
3) метаналь, фенол, метановая кислота;
4) муравьиная кислота, рибоза, этаналь.
5. Укажите названия соединений, при гидролизе ко-
торых можно получить а-глюкозу:
1) крахмал; 2) целлюлоза; 3) гликоген; 4) мальтоза.
6. Укажите молярную массу (г/моль) простейшей мо-
нокарбоновой насыщенной ациклической кислоты, име-
ющей энантиомеры:
1) 102; 2)88; 3)74; 4) 60.
7. При растворении в воде вещества строения
образуются:
1) этанол и пропановая кислота;
2) уксусная кислота и пропановая кислота;
3) уксусная кислота и 2-метилпропановая кислота;
4) этаналь и 2-метилпропановая кислота.
— 819 —
8. Укажите названия изомеров изопропилового спирта:
1) пропанол-1; 2) бутанол-2;
3) метилацетат; 4) метилэтиловый эфир.
9. При взаимодействии натрия с избытком водного
раствора этанола конечными продуктами будут:
1) Н, и C,H5ONa;
2) Н’ и C~HsNa;
3) Н'; NaOH и C7H5ONa;
4) Н, и NaOH.
10. Муравьиную кислоту можно получить:
1) каталитическим окислением метана;
2) кислотным гидролизом этилэтаноата;
3) взаимодействием формиатов с серной кислотой;
4) действием на хлорметан водным раствором КОН.
ТЕСТ 5
1. Охарактеризуйте реакцию этерификации:
1) катализируется кислотами;
2) приводит к образованию сложных эфиров;
3) при образовании продукта от молекулы кислоты
отщепляется водород;
4) обратима.
2. В порядке возрастания кислотных свойств соеди-
нения перечислены в ряду:
1) вода — фенол — метаналь — метановая кислота;
2) метаналь — вода — фенол — метановая кислота;
3) фенол — вода — метаналь -— метановая кислота;
4) метаналь —- фенол — вода — метановая кислота.
3. Качественную реакцию с бромной водой дают:
1) глицерин; 2) фенол;
3) метакриловая кислота; 4) диметиловый эфир.
— 820 —
4. Наиболее подвижные атомы водорода содержатся
в составе:
1)этанола; 2)этаналя;
3) глицерина; 4) пропанола-2.
5. При щелочном гидролизе сложных эфиров алканов
НЕ образуются:
1) глицерин; 2) алкоголяты;
3) карбоновые кислоты; 4) мыло.
6. Сложные эфиры образуются, когда азотная кислота
реагирует с:
1) фенолом; 2) этиленгликолем,
3) целлюлозой; 4) 2-метилпропаном.
7. Какие из перечисленных ниже соединений реаги-
руют с бромоводородом?
1) этанол; 2) молочная кислота;
3) уксусная кислота, 4) метакриловая кислота.
8. При кислотном гидролизе сложного эфира НЕЛЬЗЯ
получить:
1) гидроксикислоту; 2) салициловую кислоту,
3) аспирин, 4) метилметакрилат
9. Гидролизу могут подвергаться:
1) алкоголяты; 2) мальтоза;
3) пропилацетат; 4) глюкоза.
10. В состав всех перечисленных классов веществ —
спиртов, фенолов, углеводов — входит функциональная
группа:
1)альдегидная; 2)карбоксильная;
3) сложноэфирная; 4) гидроксильная.
— 821 —
ТЕСТ 6
1. Тривиальное название 2, 3,4, 5-тетрагидроксипен-
таналя — это:
1) глюкоза; 2) фруктоза; 3) дезоксирибоза; 4) рибоза.
2. Ярко-синий раствор со свежеприготовленным
Си(ОН)2 образуют вещества:
1) этанол; 2) мальтоза;
3) пропандиол-1,2; 4) сорбит.
3. С натрием могут реагировать:
1) глицерин; 2) метил ацетат;
3) диметиловый эфир; 4) фенол.
4. С водным раствором щелочи практически взаимо-
действуют:
1) триолеин; 2) 2,4,6-тринитрофенол;
3) бензиловый спирт; 4) метилметакрилат.
5. Альдегидная группа входит в состав:
1) метановой кислоты; 2) ацетона;
3) сахарозы/ 4) дезоксирибозы.
6. Спирт можно получить, вводя в реакцию с водо-
родом:
1) бензол; 2)альдегид;
3) кетон; 4) оксид углерода (II).
7. В реакцию этерификацию могут вступать:
1) тристеарин; 2) диацетилцеллюлоза;
3) тринитроцеллюлоза; 4) глицерин.
8. Спирт образуется при взаимодействии:
1) глюкозы и LiAlH4;
2) СОиН2 Kat);
3) СН, — С — СН, и NaBH ;
II
О
4) рибозы и Вг2(Н,О).
--- 822 ----
9. С водой в присутствии H,SO4 могут реагировать:
1) сорбит; 2) лактоза; 3) декстрины; 4) гликоген.
10. С водным раствором КОН практически взаимо-
действуют вещества, формулы которых:
1) С3Н7ОН; 2) С3Н7СООН; 3) С6Н5ОН; 4) С,Н7С1.
ТЕСТ7
1. С бромной водой реагируют:
1) фенол; 2) глюкоза;
3) метакриловая кислота; 4) уксусная кислота.
2. Укажите молярную массу (г/моль) вещества X для
цепочки одностадийных превращений
метанол —> X —> метановая кислота:
1)30; 2) 32; 3)44; 4) 46.
3. Смешали этанол и уксусную кислоту. Для того что-
бы между ними произошло химическое взаимодействие,
в смесь надо добавить:
1) КС1; 2) Na2CO3; 3) 11,0; 4) H,SO4.
4. Укажите номер стадии реакции дегидратации для
цепочки химических превращений
этан -U хлорэтан А. этен Л. этанол А» диэтиловый эфир:
1)4; 2)3; 3)2; 4) 1.
5. Отметьте справедливые утверждения. Атом водо-
рода группы -ОН в алканолах:
1) более подвижен, чем атом Н группы -СНО;
2) менее подвижен, чем атом Н группы -СООН;
3) более подвижен, чем атом Н в гидроксильной груп-
пе фенола;
4) может замещаться на металл в реакции с натрием.
6. Изомер бензилового спирта —- это:
1) фенол; 2) 2-феш шэтанол;
3) 2-метилфенол; 4) 4-метилбензальдегид.
--- 823 ----
7. Кислота и спирт образуются при кислотном гид-
ролизе:
1) фенилацетата; 2) триолеина;
3) крахмала; 4) этилметаноата.
8. Укажите формулы сложных эфиров:
1)С3Н7 —О —СН3; 2)С3Н7 —OSO3H;
ОН
3) O2NxJyNO2; 4) С12Н25СООСН3.
NO2
9. Степень полярности связи Н — О возрастает в ряду
соединений:
1) фенол, этанол, уксусная кислота, пикриновая кислота;
2) этанол, фенол, уксусная кислота, пикриновая кислота;
3) этанол, фенол, пикриновая кислота, уксусная кислота;
4) фенол, этанол, пикриновая кислота, уксусная кислота.
10. Степень окисления атома углерода, связанного с
гидроксильной группой, равна 0 в составе спиртов:
2)аллилового;
4) пропанола-2.
1) этанола;
3) винилового;
ТЕСТ 8
1. Наиболее высокую температуру кипения имеет:
1) фенол; 2)глицерин;
3) олеиновая кислота; 4) гексанол-1.
2. Один и тот же спирт можно получить в одну ста-
дию из каждого соединения по отдельности в парах:
1) С6Н12О6 и СН3СН7СООСН3;
2) СН3СН = СН2 и СН3— С(О) — СН3;
3) (СН3)3СС1 и (СН3)7С = СН2;
4) СО и С3Н7СООСН3.
--- 824 -—
3. Фенолы — более сильные кислоты, чем алканолы,
так как:
1) между молекулами алканолов образуется более
прочная водородная связь;
2) в фенолах электроны ^-системы смещены к атому
кислорода, из-за чего возрастает подвижность атомов Н
групп О — Н;
3) в фенолах прочность связи О — Н уменьшается за
счет взаимодействия неподеленной пары электронов
атома кислорода с л-системой кольца;
4) в молекуле фенола больше массовая доля атомов Н.
4. Какая из структурных формул описывает тетрозу?
ОН СН2ОН
5. Существование энантиомеров возможно для:
1) молочной кислоты; 2) пропандиола-1,2;
3) глицерина; 4) бутанола-2.
6. Какова общая молекулярная формула соединений го-
мологического ряда, в который входит вещество строения
Н7С = СН —С —ОСН?
II
О
1)СН, О ; 2) С Н О ; 3) С Н О ; 4) С Н О.
' п 2л-2 2’ ' п 2п 2’ 7 п 2п + 2 2’ 7 п 2/?-4 2
--- 825 ----
7. Вещество состава С3Н6О может относиться к классу:
1) циклических эфиров; 2) кетонов;
3) циклических спиртов; 4) карбоновых кислот.
8. Из какого органического вещества в результате двух
последовательно протекающих реакций дегидратации и
присоединения можно получить 2,3-дибром-2,4-диме-
тилпентан?
1) 2,4-диметилпентанол-1;
2) 2,4-диметилпентанол-2;
3) 2,4-диметилпентанол-З;
4) 2,3-диметилпентанол-3.
9. Целлюлоза химическим количеством Ю4 моль имеет
массу 324 г. Найдите среднюю степень полимеризации цел-
люлозы:
1) 20; 2) 200; 3) 2000; 4) 20000.
10. Масса глюкозы, полученной при гидролизе крах-
мала, на 9,000 г больше массы крахмала. Какая масса (г)
крахмала подверглась гидролизу?
1) 40,50; 2) 81,00; 3) 121,5; 4) 162,0.
ТЕСТ 9
1. Сколько ненасыщенных альдегидов имеют форму
С5Н8О?
1)8; 2)9; 3) 10; 4) 11.
2. Укажите число изомерных ациклических карбоно-
вых кислот и сложных эфиров состава С4Н6О2:
1) 10; 2) 9; 3)8; 4) 7.
3. Отметьте общую формулу членов гомологического
ряда, представителем которого является соединение
Н,С = СН — СН, — О — СН3:
|)СН, + ,О; - 2) С Н, О;
3)СН, О; 4)СН, О.
--- 826 ---
4. Моносахарид состава Cv(H2O) массой 0,600 г окис-
лили и получили одноосновную карбоновую кислоту
химическим количеством 0,004 моль с тем же числом
атомов углерода в молекуле. Укажите формулу моноса-
харида:
О ОДА;2) ОД<А; з) ОДА; 4) с7н14о7.
5. Сколько соединений изображено с помощью формул:
Н
(СН3)3ССН2СНО
сн3
он I
Н3С — С — СН2 — СООН
сн3
1) одно; 2) два; 3) три; 4) четыре.
6. Энергия связи углерод — кислород возрастает в ряду
соединений:
1)этанол, фенол, оксид углерода (IV), оксид углерода (II);
2) фенол, этанол, оксид углерода (IV), оксид углерода (П);
3) этанол, фенол, оксид углерода (П), оксид углерода (IV);
4) оксид углерода (IV), фенол, этанол, оксид углерода (II).
7. Мыло НЕ может образоваться при взаимодействии
водного раствора NaOH с:
1) С|7Н35СООН; 2) С|5Н31ОН;
3) СН3(СН2)14СООСН3; 4) С4Н9СООН.
8. Укажите формулы углеводов:
--- 827 ---
ОН ОСН3
4) НОСН2 — (СНОН)3 — с — СН2ОН
о
9. Моносахарид имеет формулу Ся(Н2О)я. Укажите
общую формулу продукта его реакции с избытком уксус-
ного ангидрида:
DC^./Hp).,,; 2)Сп_,(Нр)п_|;
ЗК^./Нр)^; 4)С„./Нр)Л.,.
10. Укажите число изомерных простых ароматичес-
ких эфиров состава СоН.,,О:
1) 5; 2) 4; 3) 3; 4) 2.
ТЕСТЮ
1. К действию окислителей наиболее устойчив спирт
строения:
СН,
I
1)СН3 —СН —СН2ОН;
2) СН3 — СН2 — СН, — СН, — ОН;
СИз
3) СН3 —С —снз;
ОН
4) о- сн^он-
2. Укажите название по систематической номенкла-
туре вещества строения
--- 828 ----
сн2—он
н3с СНз
1) 3-этилбутен-2-ол-4;
2) 2-этилбутен-2-ол-1;
3) З-гидроксиметилпентен-З;
4) З-гидроксиметилпентен-2.
3. Отметьте формулу основного продукта реакции
между фенолом (1 моль) и этаналем (1 моль):
ОН
4. Винилэтиловый эфир получается при взаимодей-
ствии:
1) СН2 = СН2 и СН3СООН;
2) СН2 = СН2 и С7Н5ОН;
3) СН = СН и СН'СООН;
4) СН = СН и С2Н5ОН.
5. Сколько циклических спиртов можно получить при
гидрировании фенола?
1) 12; 2) 11; 3) 10; 4) 9.
6. Длина связи углерод — кислород возрастает в ряду
соединений:
1) оксид углерода (II), оксид углерода (IV), этанол, фенол;
2) оксид углерода (II), оксид углерода (IV), фенол, этанол;
— 829 —
3) оксид углерода (IV), оксид углерода (П), фенол, этанол;
4) оксид углерода (IV), оксид углерода (II), этанол, фенол.
7. Укажите формулу диаллилтерефталата:
пен=сн—о—с—°—Сн =
II II
О О
4)CH2 = CH-CH2-O-<Q)-O-CH2- сн=сн2.
8. Вещество X, полученное в результате превращения
Н2С = СН, +со’+нЛСг-,Ка!и х, может реагировать с:
‘ 1) Вг2(СС14); 2) СиО, /°; 3) NaBH4; 4) Ag,O (амм. р-р), /°.
9. Пространственной {цис-, транс-)мзом&рие1л обла-
дают:
1) пропеналь; 2) бутен-2-аль;
3) бутен-2-овая кислота; 4) бутен-2-ол-1.
10. Сколько веществ из перечисленных являются изо-
мерами винилэтилового эфира?
бутин-2-овая кислота, аллилформиат,
бутен-З-диол-1,2, циклобутанол.
1)4; 2)3, 3)2; 4) 1.
ТЕСТ 11
1. Укажите название по систематической номенкла-
туре соединения следующей структуры
ОН
-- 830 --
1) бутен-2-ол-1; 2) аллиловый спирт;
3) бутен-1-ол-З; 4) бутен-З-ол-2.
2. Среди приведенных формул C,H5ONO2,
— СН2 — О — СН3, — СН2ОН, отсутствуют
формулы соединений класса:
1) сложных эфиров; 2) простых эфиров;
3) фенолов; 4) спиртов.
3. Кислотные свойства соединений последователь-
но нарастают в ряду:
1) муравьиная кислота, уксусная кислота, фенол, бен-
зиловый спирт;
2) бензиловый спирт, фенол, уксусная кислота, мура-
вьиная кислота;
3) фенол, бензиловый спирт, муравьиная кислота, ук-
сусная кислота;
4) бензиловый спирт, фенол, муравьиная кислота, ук-
сусная кислота.
4. Укажите общую формулу членов гомологического
ряда, представителем которого является соединение
1)СН, Д;2)СН, О;3)СН, 7О,;4)СН, О.
5. Молекула вещества содержит атомы С, Н и О (в
составе карбонильной группы). В образовании л- свя-
зей в молекуле участвуют 4 электрона, а в образовании
о- связей — 20 электронов. Укажите число ацикличес-
ких изомеров, удовлетворяющих перечисленным усло-
виям:
1) пять; 2) четыре; 3) три; 4) две.
— 831
6. Скорость реакции замещения гидроксильной груп-
пы в молекуле бутанола-1 в реакции с галогеноводоро-
дами возрастает в ряду:
1) НС1, HI, НВг; 2) НС1, НВг, HI;
3) HI, НВг, НС1; 4) HI, НС1, HBr.
7. Укажите справедливые утверждения:
1) энергия связи С — О в феноле больше, чем в мета-
ноле;
2) энергия связи О — Н в метаноле больше, чем в му-
равьиной кислоте;
3) длина связи С — О в феноле больше, чем в мета-
ноле;
4) энергия связи О — Н в феноле меньше, чем в мета-
ноле.
8. Укажите схемы реакций замещения:
1) СН3 — СН2ОН + НВг -> СН3СН2Вг + Н2О;
2) СН3СНО СН3СН2ОН;
3) "С6Н12О6 -> (С6Н10О5)„ + «Н2О;
4) [С6Н7О2(ОН)3] в + Зп (СН3СО)2О ->
-> [С6Н7О2(ОСОСН3)3] И + ЗиСН3СООН.
9. Средняя степень полимеризации крахмала равна
2000. Чему равна масса крахмала (г) химическим коли-
чеством 0,001 моль?
1)324; 2) 162; 3) 81,0; 4) 40,5.
10. Средняя степень полимеризации целлюлозы равна
2000. Какая минимальная масса (г) воды нужна для полного
гидролиза целлюлозы химическим количеством 1 • 10 3 моль?
1)4,5; 2) 9,0; 3) 18; 4) 36.
ТЕСТ 12
1. Без ошибок составлена формула:
--- 832 ----
о —н
I
1)Н —С —NH2 —Cl; 2)Н3С —сн2 —сн2 —Cl;
Н Вг
Н2С = СН н Н\
3) с = С—N ; 4) C = N .
он
2. Укажите число атомов водорода в молекуле трип-
тофана: тт
1) 12; 2) 11; 3) 10; 4) 9.
3. Отметьте формулу с правильной нумерацией ато-
мов углерода:
F F F F
п’Ц’ = ; 3)'^ •
Вт Вг Вг Вг
4. Сложным эфиром и амидом одновременно являет-
ся вещество:
1)H,N —СН, —С —Н;
’ II
О
2) H,N — СН2 — СН, — О — СН3;
3) H*N — СН, — С — О — СН
- II
О
4) Н С — С — О — СН, — С — NH,.
II ‘ II
О о
27 Зак, 1530
--- 833 ----
5. Назовите по систематической номенклатуре веще-
ство строения
1) 4-этилнонанол-5;
2) 6-метил-4-этилоктанол-4;
3)3 -метил-1 -пропил-1 -этил пентанол-1;
4) 5-метил-З-пропилгептанол-З.
6. При растворении в воде значение pH будет наи-
меньшим в случае вещества строения:
1) С12СН — СН2 — СООН;
2)СН3 — СС12 — СООН;
3) СН3 — СС12 — СНО;
4) С1СН2 — СНС1 — СООН.
7. Укажите формулу продукта реакции ацетальдегида
(1 моль) и этиленгликоля (1 моль):
/°\
1)Н3С —С СН2;
I ХОХ
Н
/СН2
2)Н3С — С | ;
I ЧСН2
Н
ОН
I '
3) Н3С — С — О — СН2 — СН3;
Н
Н3СХ /О —СН2
4) /Ск 1 •
Hz чо — сн2
--- 834 ----
8. Сколько веществ, формулы которых приведены
ниже, обладают стереоизомерией?
НОН2С — СН(ОН) — СНО;
СН, = СН —СН,ОН;
Н Н Н Н
1111
Н — С — С — С — С — СНО;
1111
ОН он он он
н2с = СН — СН — сн,
он
1)одно; 2) два, 3)три; 4) четыре.
9. Сложный эфир образуется, когда хлорангидрид ук-
сусной кислоты реагирует с:
1) этанолом; 2) алкоголятами;
3) аммиаком; 4) водой.
10. При кислотном гидролизе какого эфира образуется
вещество, окислением которого можно получить кетон?
ТЕСТ 13
1. Укажите число первичных атомов углерода в ве-
ществе Г для цепочки превращений, протекающих по
схеме:
бутанол-1 А Б в А1С1- > Г
--- 835 ----
2. Укажите молярную массу (г/моль) органического
вещества Д для цепочки превращений, протекающих по
схеме:
СО I н О Фотосинте3у Д дрожжи^ g + ферменты g __________
4- I МОЛЬ Cl^ (фосфор)^ g + 2 МОЛЬ КОН (ВОД1ь) д
3. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
(2а '*'Г, Г Д +HjO, g +СН,СООН g 4- Вг,(ССЦ р
4. Укажите сумму молярных масс органических ве-
ществ А и Г для цепочки превращений, протекающих
по схеме:
ацетон 1 NaBll\. A 4HBt; Б + р~р(, в 1 KMnO) (5 °с' Ha°j- г
5. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Б и Г для цепочки превращений, протекаю-
щих по схеме:
метан (1 моль) + 2моль.с'»h\. А Б +L1A1H<> В —>
+ СО (Л Kat) р
6. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Б и Г для цепочки превращений, протекаю-
щих по схеме:
СН^ + КМпО4 (5 °C, Н2О^ д 4- СиО (изб.), g 4- Ag2 О (амм. р-р), изб^
_g + СНрН/Н* (избыток)^ g
7. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
2,3- дибромбутен-2 A +H*°<Hg,/H\ б + NaBH<> В —»
+ H;SO., 170 °C р
8. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
— 836 —
q g (21 + Na <из6), д +aici„ г g <°.№ в + о, (гаец р
2 5 — Н2
9. Укажите сумму молярных масс (г/моль) органичес-
ких веществ А и Г для цепочки превращений, протека-
ющих по схеме:
(С6Н,0О5)я (2 МОЛЬ) +(« моль) Н.О/1Г д + H;O/lT(H36j Б
) g +Са(ОН),а р
10. Укажите сумму молярных масс (г/моль) органи-
ческих веществ В и Е для цепочки превращений, проте-
кающих по схеме:
(СН СО) О +Н;°1 A +Na0H(p~P)? g +NaOH„,(r), g + O„ 1500 °C
_p +c(«nw).C д +а,(изб.,*у1 p
ТЕСТ 14
1. Укажите молярную массу (г/моль) органического веще-
ства Е для цепочки превращений, протекающих по схеме:
С Н + * моль А + О136-)*, g С кэт-у В +НС1* р + КОН (Н2О)^
2 6 — Н3
-> д .+СиО'?; е.
2. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
пропанол-1 Ж A Б в В +CuO'f°> Г.
3. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
пропен A Б В 1М№<ДЧ. г
4. Укажите сумму молярных масс (г/моль) аромати-
ческих веществ Б и В для цепочки превращений, проте-
кающих по схеме:
салициловая кислота А /С-111О11ДГ> Б —>
4~ КОН (Н2О) изб^ в
--- 837 ---
5. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
1,2-дибромэтанвЖ А ЖЖ Б +N-^> В ->
+ 1 моль HNO2 (О °С)^ р
6. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
гексан A Б .tH^W-170_£. В Г.
— Lzjflg Прилежаева
7. Укажите молярную массу (г/моль) органического веще-
ства Г для цепочки превращений, протекающих по схеме:
бензол Ж А Б В Г.
эфир
8. Укажите название ароматического вещества Г для
цепочки превращений, протекающих по схеме:
бензол + С1дЖ А + 2 моль NaOH’'°'А Б +НС|? В 4 <сн^с°)1°- р
1) бензилацетат; 2) фенилацетат;
3) бензилбензоат; 4) фенилбензоат.
9. Укажите молярную массу (г/моль) ароматического
вещества Г для цепочки превращений, протекающих по
схеме:
бензилхлорид « А Б+soci^ в
+ NH„^ р
10. Укажите молярную массу (г/моль) ароматического ве-
щества Е для цепочки превращений, протекающих по схеме:
бензол +1 моль сНдС!’ кату А +1 моль Б + (н2о)^ в +
__р + Ag2O(aMMHa4H. р-р), пЖЖЕ.
--- 838 ---
ТЕМА 55
Азотсодержащие органические соединения:
амины, нитросоединения, эфиры азотной
кислоты
ТЕСТ1
1. Укажите формулы аминов:
1)СН3 —NO,; 2)С6Н5 — NH,;
3) CJLONO,; 4) СН3 — NH — С2Н5.
2. Отметьте справедливые утверждения:
1) основные свойства аммиака выражены сильнее,
чем у анилина, но слабее, чем у диметиламина;
2) метиламин окрашивает водный раствор лакмуса в
синий цвет, а аммиак — нет;
3) и аммиак, и анилин реагируют с хлороводородом;
4) при сгорании диметиламина на воздухе в основ-
ном образуются вода, углекислый газ и азот.
3. Метиламин может реагировать с:
1)кислородом;
2) раствором брома в СС14;
3)хлороводородом;
4) бромметаном.
4. Укажите число <7-связей в молекуле метиламина:
1) 6; 2) 7; 3) 5; 4) 4.
5. Гомологами между собой являются:
1) анилин; 2) метиламин;
3) 4-метиланилин; 4) 2-этиланилин.
6. Укажите изомеры пропанамина-2:
1) пропиламин; 2) метилэтиламин;
3) триметиламин; 4) диэтиламин.
— 839 —
7. Каким реагентом надо подействовать на нитросо-
единение, чтобы превратить его в амин?
1) кислородом; 2) бромной водой;
3)водородом; 4)хлороводородом.
8. Какие свойства анилина объясняются влиянием
аминогруппы на бензольное кольцо?
I) электронная плотность повышена в положениях 2,
4 ,6 бензольного кольца;
2) анилин в отличие от бензола реагирует с бромной
водой;
3) как основание анилин слабее, чем аммиак;
4) электронная плотность повышена в положениях
3,5 бензольного ядра.
9. В реакции с триметиламином хлороводород игра-
ет роль:
1) донора электронов; 2) донора протонов;
3) акцептора электронов; 4) основания.
10. Лакмус в синий цвет окрашивают водные растворы:
1) бромида этиламмония; 2) нитробензола;
3) триэтиламина; 4) диметиламина.
ТЕСТ 2
1. В порядке возрастания основных свойств амины
перечислены в ряду:
1) анилин — диэтиламин — этиламин;
2) этиламин — анилин — диэтиламин;
3) анилин — этиламин — диэтиламин;
4) диэтиламин — этиламин — анилин.
2. Сильнее, чем у аммиака, основные свойства выра-
жены у:
1) фениламина; 2) метиламина;
— 840 —
3) N-метилэтиламина; 4) гидроксиламина.
3. Изомерами метилпропиламина являются:
1) диэтиламин, 2) бутанамин-2;
3) бензиламин; 4) диметилэтиламин
4. Охарактеризуйте свойства и строение анилина:
1) электронная плотность повышена в положениях 2,
4, 6 бензольного ядра;
2) плохо растворим в воде при комнатной температуре;
3) водный раствор окрашивает лакмус в красный цвет;
4) как основание слабее, чем бензиламин.
5. Охарактеризуйте реакцию бромной воды с ани-
лином:
1) одна из качественных реакций на анилин;
2) приводит к образованию белого осадка;
3) бром замещает атомы водорода в основном в по-
ложениях 3, 5 бензольного ядра;
4) продуктом является 2,4,6-триброманилин.
6. Состав гомологов анилина можно выразить общей
формулой:
1)СН, N; 2) С I I, .N;
3)CHw 6N; 4) СН _SN.
7. Укажите число изомерных аминов состава C,H9N:
1)2; 2)3;
3)4; 4)5.
8. Сколько первичных аминов отвечает составу C,H9N?
1)2; 2)3,3) 1,4)4.
9. Укажите формулы аминов:
1) CH,COONH4, 2)(C6HJ3N;
3) СН, — С — NH2; 4) СбН5 — CH .NH,.
II
О
--- 841
10. Соль образуется, когда анилин реагирует с:
1) водой,
2) бромоводородом;
3) разбавленной серной кислотой;
4) кислородом.
ТЕСТЗ
1)(CH3)3N;
1. Укажите формулы третичных аминов:
/СН3
2)С6Н5 — N
хс2н5
сн3
4)СН3 — С — С2Н5
NH2
2. Выберите формулу хлорида фениламмония:
NH2
3. Амин получается при взаимодействии:
1) аммиака с хлороводородом;
2) этанола и водорода;
3) бромида диметилэтиламмония с водным раство-
ром щелочи,
--- 842 ----
4) хлорангидрида уксусной кислоты и метиламина.
4. При взаимодействии этиламина химическим коли-
чеством 1 моль с 1 моль H2SO4 (разб.) образуется:
1) сульфат диэтиламмония;
2) сульфат этиламмония;
3)соль;
4) гидросульфат этиламмония.
5. Укажите название амина, который образуется при
взаимодействии 2-метилпропанола-2 с аммиаком:
1) пропанамин-2; 2) пропанамин-1;
3) 2-метилпропанамин-1; 4) 2-метилпропанамин-2.
6. Состав насыщенных ациклических аминов можно
выразить общей формулой:
1)CH9+1NO- 2)CH,+,N;
3) С Н NH ; 4) С Н ,N.
7 л 2л 2’ 7 л 2л-1
7. Учитывая электронодородные или электроноакцеп-
торные свойства заместителей, укажите формулу амина
с наиболее сильными основными свойствами:
8. Укажите формулу соединения, при восстановлении
которого получается пропанамин-2:
1) СН, — СН — СН NO • 2) CJL — NO •
, J 2 2 2' z о 3 27
/СД
3) СН3 — СН — СН3; 4) СН3 — СН
1 ~ xno2
no2 2
9. Выберите название амина с самыми слабыми ос-
новными свойствами:
1) фениламин; 2) метиламин;
3) дифениламин; 4) N-метиланилин.
— 843 —
10. Анилин проявляет основные свойства, реагируя с:
1) бромом; 2) кислородом;
3) хлороводородом; 4) разб. серной кислотой.
ТЕСТ 4
1. Укажите формулы аминов:
О
3)|^J; 4)N2H — СН2 — С .
он
2. Бутанамин-2 проявляет основные свойства, реаги-
руя с:
1) уксусной кислотой; 2) водой;
3) кислородом; 4) иодоводородом.
3. В реакции с хлороводородом метиламин играет роль:
1) донора электронов; 2) донора протонов;
3)акцептора электронов; 4) основания.
4. Продукт взаимодействия толуола с нитрующей сме-
сью относится к классу:
1) сложных эфиров; 2) простых эфиров;
3) нитросоединений; 4) аминов.
5. В порядке возрастания основных свойств вещества
перечислены в ряду:
1) аммиак — метиламин — гидроксиламин;
2) гидроксиламин — метиламин — аммиак;
3) метиламин — аммиак — гидроксиламин;
4) гидроксиламин — аммиак — метиламин.
6. Основные свойства возрастают, если атомы Н в NH3
замещаются на:
1) фенил; 2) этил; 3) гидроксил; 4) метил.
— 844 —
7. Укажите электронную формулу метиламина:
н н н н
1)Н:С ::N 2)H:C:N
ii ii ii ii
и н н H
3)H:C::N: 4)H:C:N
ii ii ii ii
8. Какое свойство анилина объясняется влиянием фе-
нильного радикала на аминогруппу?
1) анилин вступает в реакции замещения легче, чем
бензол;
2) электронная плотность в ароматическом кольце
распределена неравномерно;
3) как основание анилин сильнее, чем метиламин;
4) как основание анилин слабее, чем аммиак.
9. Электронная плотность на атоме азота понижает-
ся, если в молекуле NH3 атом Н заместить га:
1) пропил; 2) гидроксил; 3) фенил; 4) фтор.
10. Самым сильным основанием из перечисленных
является:
1) бензиламин; 2) фениламин;
3) анилин; 4) дифениламин.
ТЕСТ 5
1. Укажите формулы аминов:
--- 845 ----
2. Выберите формулы первичных аминов:
РСДС^-ИН^
2)<Q>-NH2;
3)C6HsN(CH3)2;
4) СН3 —СН —СН(СН3)2,
NH2
3. Укажите формулы нитросоединений:
1)Q-NO2;
xono2
(С6Н7О2) —он
XONO
3) СН2 — О — NO2; 4) C2H5NO2.
СН, — О — NO2
4. В каких парах первое соединение обладает более
основными свойствами по сравнению со вторым?
и °=n
2)CH,-<Q^NH, и Q-nh,;
3) NH3 и СН3 — NH,,
4)(CH3)2NH и CH3NH,.
5. Сильнее, чем у аммиака основные свойства выра-
жены у:
1) анилина; 2) метиламина;
3) ацетамида; 4) бензиламина.
6. Сильнее, чем у анилина, основные свойства выра-
жены у:
1) дифениламина; 2) N-метиланилина;
— 846 —
3) аммиака; 4) бензиламина.
7. Охарактеризуйте свойства и строение метиламина:
1) газ (н.у.);
2) имеет запах аммиака;
3) хорошо растворим в воде;
4) водный раствор имеет кислую реакцию.
8. Укажите названия изомеров пентанамина-1:
1) пентанамин-2;
2) 2-метилпропанамин-2;
3) 2,2-диметилпропанамин-1;
4) диметилпропиламин.
9. Как по систематической номенклатуре называется
амин, который получается при восстановлении нитро-
соединения
СН,
I
СН, —- С — СН(СН,),?
I
no2
1) 2,3-диметилбутанамин-3;
2) 2,3-диметилбутанамин-2;
3) триметилэтиламин;
4) диметилпропиламин.
10. Укажите формулу N-метилпропиламина:
1) СН3СН2 — NH — СН3;
2) СН, — СН — NH — СН,;
I
сн3
3) CH3CH,CH, — NH — снз;
4) СН3СН2СН2 — N - СН3.
сн3
--- 847 ---
ТЕСТ6
1. Основные свойства анилина можно повысить:
1) замещая атомы Н в аминогруппе на фенильные
группы;
2) вводя в положение 4 бензольного кольца нитро-
группу;
3) замещая атом Н в аминогруппе на метильную группу;
4) вводя в бензольное кольцо в положение 4 метиль-
ную группу.
2. Фиолетовую окраску лакмуса на синюю изменяют
водные растворы:
1) фенола;
2) этиламина;
3) бромида метил аммония;
4) N-метил этил амина.
3- Аммиак при определенных условиях может реаги-
ровать с:
1) хлорэтаном; 2) этанолом;
3) хлорбензолом; 4) диметиламином.
4. Укажите число первичных аминов состава C4HhN
(с учетом стереоизомерии):
1)2; 2)3; 3)4; 4) 5.
5. В составе формульной единицы хлорида метилам-
мония отсутствуют связи:
1) ковалентные полярные;
2) ковалентные неполярные;
3) ионные;
4) водородные.
6. Укажите число вторичных аминов состава C4HhN:
1)2; 2)3; 3)4; 4)5.
7. В составе формульной единицы бромида фенилам-
--- 848 ----
мония присутствуют связи:
1) ковалентные полярные;
2) ковалентные неполярные;
3) ионные;
4) водородные.
8. С наименьшей скоростью в^реакции замещения в
бензольном кольце вступает:
1) фенол; 2) нитробензол;
3) бензол; 4) анилин.
9. Укажите число изомерных соединений состава
C7H9N, содержащих бензольное ядро:
1)3; 2) 4; 3)5; 4) 6.
10. НЕ являются аминами вещества, формулы которых:
1)Н —С —ONH4; 2)4 |Г У
II
° Н
3) NH ; 4) Нзс — СН2 — С — NH2.
О
ТЕСТ 7
1. Укажите формулу 2-метилпропанамина-2:
2. Амин строения можно назвать:
I
Н
1) N-метилэтиламин; 2) N-метилпропиламин;
3) метилэтанамин; 4) метилизопропиламин.
— 849 —
3. В отличие от бензола анилин:
1) реагирует с кислородом;
2) взаимодействует с бромоводородом;
3) не является гомологом толуола;
4) хорошо растворим в воде (20°С).
4. Вторичные амины НЕ реагируют с веществом, фор-
мула которого:
1) НВг (р-р); 2) СН,С1; 3) Н,; 4) Н,О.
5. С раствором Вг, в СС14 может реагировать:
1) пропиламин; 2) аллиламин;
3) метиламин; 4) N-метилэтиламин.
6. Гетероциклические амины — это:
1) анилин; 2) пиридин;
3)циклогексиламин; 4) пиримидин.
7. В водном растворе метиламина присутствуют час-
тицы:
1) CH3NH(; 2) ОН ; 3) CH3NH,; 4) NH;.
8. Соединение состава НО — СН, — СН, — NH, про-
являет свойства:
1) только спиртов;
2) только оснований;
3) спиртов и оснований;
4) альдегидов и оснований.
9. Укажите формулу продукта реакции между этила-
мином и муравьиной кислотой:
1) [C J LNirjHCOO ; 2) [C2H5NH;]HCOO ;
3) [C2H5NH;]HCOO+; 4) [C,HSNH,]HCOO+.
10. При взаимодействии метиламина (1 моль) и сер-
ной кислоты (разб., 1 моль) образуется вещество, фор-
мула которого:
1) [CH3NIi;]2SO42-; 2) [CH3NH;]HSO4;
3) [CH3NH,]HSO4+; 4) [CH3NH;],SO42+.
— 850 —
ТЕСТ 8
1. Укажите формулу Ы-метилпропанамина-2:
2. Соединение строения Н3СХ можно на-
звать: сн3
1) ГУТЧ-диметилэтиламин;
2) диметилпропиламин;
3) диметилизопропиламин;
4) N-метил пропил амин-2.
3. Укажите сумму коэффициентов в реакции горения
анилина в избытке кислорода:
1) 35; 2) 59; 3) 73; 4) 75.
4. Из солей замещенного аммония амины получают с
помощью:
1) щелочь (спирт); 2) щелочь (вода);
3)Вг2(Н2О); 4) Н2О.
5. Укажите формулы веществ, относящихся к одному
классу функциональных производных углеводородов:
2) H2N - СН2 - СООН;
3) СН3 — СН — СН3;
nh2
851
6. Изомером N-метилэтиламина является:
1) диметиламин; 2) диэтиламин;
3) анилин; 4) пропанамин-1.
7. При взаимодействии метанола и этиламина обра-
зуется:
1) пропиламин; 2) пропанамин-2;
3) N-метилэтиламин; 4) триметиламин.
8. Амин можно получить при взаимодействии:
1) С2Н5ОН и NH3;
2) CH3BrnNH3;
3)[(С2Н5)2НН2]ВгиКОН(Н2О);
4) СН — С — ClnNH .
II
О
9. Укажите число ковалентных связей в формульной
единице бромида этиламмония:
1) 11;2) 10; 3) 9; 4) 8.
10. В составе гидроксида метиламмония валентность
атома азота равна:
1)5; 2) 4; 3)3; 4) 2.
ТЕСТ 9
1. Назовите по систематической номенклатуре амин
строения
1) 4-метил-6-этилгептанамин-2;
2) 3,5-диметилоктанамин-7;
3) 4,6-диметилоктанамин-2;
4) 4-метил-2-этилгептанамин-2.
— 852 —
2. При обработке нитробензола избытком смеси же-
лезных стружек и соляной кислоты образуется вещество,
формула которого:
3. В цепочке превращений C ITOI1 CJI^NH, 2>
-э (COH.),NH Л- (C?H5)3N добавление С JLBr требуется
на этапах:
1) 1, 2, 3; 2) 1, 3; 3) только 1; 4) 2, 3.
4. При взаимодействии метиламина и этанола обра-
зуется:
1) N-метилпропиламин;
2) N-метилэтиламин;
3) N, N-диметилпропиламин;
4) N, N-диметилэтиламин.
5. Сколько веществ из перечисленных (водород, вода,
кислород, хлорэтан, бромоводород, метан, метанол, хло-
рангидрид уксусной кислоты) могут реагировать с этил-
амином?
1)8; 2) 7; 3)6; 4)5.
6. Как анилин, так и фенол могут реагировать с:
1) О2; 2) НВг (р-р); 3) Вг2 (Н2О); 4) HNO3.
7. Оба вещества — метанол и фениламин — могут
реагировать с:
1) НВг; 2) Н,; 3) О ; 4) HNO,.’
8. Метиламин можно получить при взаимодействии:
1) СН3ОН и NH3; 2) (CH,),NH и СН3Вг;
3) CHjBr и Nh/ 4) [CH,NH3 ]Вг и КОН (Н,О).
9. Водородные связи образуются между молекулами:
1) (CH3)3N и (C2H5)3N; 2) CH3NH? и (C2H.)2NH;
--- 853 ----
3) CH3NH2 и H2O; 4) C2H5NH2 и C2H6.
10. В водном растворе возможна реакция между хло-
ридом метил аммония и:
1) AgNO3; 2) НС1; 3) NaNO3; 4) КОН.
ТЕСТЮ
1. К одному классу производных углеводородов от-
носятся вещества, формулы которых:
О
2) СН2 —СООН;
nh2
^о
3) СН3 — С ;
xnh2
2. Валентность атома азота равна III в составе:
1) анилина; 2) бромида фениламмония;
3) метиламина; 4) гидросульфата этиламмония.
3. Для получения диметиламина к метиламину добав-
ляют:
1) аммиак; 2) водный раствор щелочи;
3) хлорметан; 4) воду.
4. Укажите формулу продукта реакции между анили-
ном и хлорангидридом уксусной кислоты:
--- 854 ---
5. С наименьшей скоростью в реакцию с аммиаком
вступает:
1)бромметан; 2) хлорметан;
3) хлорбензол; 4) бензилхлорид.
6. Укажите формулу 1-фенилпропанамина-2:
NH2
4) <Q>- СН2 — СН2 — СН2 — NH2.
7. С хлорангидридом уксусной кислоты НЕ реагирует:
1) аммиак; 2) метиламин; 3) анилин; 4) триэтиламин.
8. Укажите формулу вещества, при нагревании кото-
рого образуется соединение строения
— Н;
— (СН,),— NH2;
3) H2N — (СН2)4 — СООН;
2) H„N — (CH2)S — ОН
4)Н> —(СН2)4 —ОН
9. В порядке возрастания основных свойств формулы
веществ приведены в рядах:
1) [(CH,)4N]Br, СН, — С — NH,, NH„ CH,NH„
II
О
2) [CH,)4N]Br, NH,, СН, — С — NH2, CH,NH,;
--- 855 ----
з) nh2> Q- nh2, nh—с—снз;
о
4) NH — С — СН3, <Q>-NH,, Q-NH2.
О
10. В порядке возрастания температуры кипения изо-
мерные амины перечислены в ряду:
1) бутиламин, диэтиламин, диметилэтиламин;
2) диэтиламин, бутиламин, диметилэтиламин;
3) диметилэтиламин, диэтиламин, бутиламин;
4) диметилэтиламин, бутиламин, диэтиламин.
ТЕСТИ
1. Укажите число изомерных ароматических веществ
состава C6H6NBr:
1)6; 2) 5; 3)4; 4)3.
2. Энергия связи С — N наибольшая в молекуле:
1) метиламина; 2) анилина;
3) этиламина; 4) диметиламина.
3. Четыре вещества (пентанамин-1, гексан, пентанол-1,
масляная кислота) имеют примерно одинаковую моляр-
ную массу. Укажите ряд, в котором они перечислены в
порядке возрастания температуры кипения:
1) гексан, пентанамин-1, пентанол-1, масляная кислота;
2) пентанамин-1, гексан, пентанол-1, масляная кислота;
3) гексан, пентанамин-1, масляная кислота, пентанол-1;
4) пентанамин-1, гексан, масляная кислота, пентанол-1.
4. Укажите число неподеленных пар электронов в
молекуле пиримидина:
1)4; 2)3; 3)2; 4) 1.
— 856 —
5. Гомологами являются:
1) аммиак, метиламин и этиламин;
2) этиламин, триметиламин, диэтиламин;
3) анилин, 2-метиланилин, бензиламин;
4) циклопропиламин, циклобутиламин, циклогексил-
амин.
6. Связь N — Н наименее прочная в молекуле:
1) анилина; 2) метиламина;
3) этиламина; 4) диэтиламина.
7. Температура кипения веществ последовательно
возрастает в ряду:
1) диметиловый эфир, этанол, этиламин, этановая
кислота;
2) диметиловый эфир, этиламин, этанол, этановая
кислота;
3) этанол, диметиловый эфир, этиламин, этановая
кислота;
4) этанол, этиламин, диметиловый эфир, этановая
кислота.
8. Формулой CnH2n+3N можно выразить состав:
1) бензиламина; 2) триэтиламина;
3) циклогексиламина; 4) анилина.
9. Укажите число первичных аминов состава C5H]3N
(учтите стереоизомерию):
1) 12; 2) 11; 3) 10; 4) 9.
10. Основные свойства соединений последователь-
но возрастают в рядах:
1) ал лил амин, метиламин, диметиламин;
2) метиламин, аллиламин, диметиламин;
3) амид уксусной кислоты, аммиак, метиламин, диэ-
тиламин;
4) дифениламин, анилин, бензиламин.
— 857 —
ТЕСТ 12
1. Укажите сумму молярных масс (г/моль) аромати-
ческих веществ В и Г для цепочки превращений, проте-
кающих по схеме:
q____(СН ) — СН 450°- Ftr A +HNC№SO«^. б ре/НС1<из6)г
В +КОН(Н20) р
2. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Г и Д для цепочки превращений, протека-
ющих по схеме:
CH3COONa +Na°HW-C A Б + В Г ->
+ NH3, Г°, кат д
3. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Б и Г для цепочки превращений, протекаю-
щих по схеме:
pg + 1 моль С1„ ЙУ Д + NaOH (Н,О)у g + NH„ f, кат, g + CH,Br р
4. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
(2 а С Д + 2 моль актив, уголь^ g + HNO3/H2SO4>
+ 3 моль H2, Ni, g p
5. Укажите сумму молярных масс (г/моль) органичес- ,
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
СН +1 модь с>2> h\ A +Na ^изб‘Хг Б +1 моль Вг^г> hv\r В + 2 моль NHs Г
4
6. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Г и Д для цепочки превращений, протека-
ющих по схеме:
+ НгО д + 1 моль H2/Ni~ в + НаО/Л в + NH„ кат, р _
-ь НСООН/Н: 20°С Д.
--- 858 ----
7. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
2-бромбутан А Б Ж В г
8. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Г и Д для цепочки превращений, протека-
ющих по схеме:
С Н ОН *70 °C. Д + О; (РДСЦ g +Ag,O(aMMHa4H. р-р), £ р ___
+ NHs г Д
1 -Н,О
9. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
С Н С1 + j А + О*»соли и Qg g + SOC12^ g + CHjNH^ p
10. Укажите сумму молярных масс (г/моль) органи-
ческих веществ Г и Д для цепочки превращений, проте-
кающих по схеме:
глюкоза -дрожжи> А Б > Си(онЧ В +CHw, г Д.
ТЕСТ 13
1. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
пропанол-1 А +Ае.О(аммиачн.р-р),^ g ySOCl^ р
+ (CH,)NH(CaH^ р
2. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
бензол А +^аОН.ЛАкаг^
+ сн,сн,—с;
хсг р
g + NH3, кат
в ->
--- 859 ----
3. Укажите молярную массу (г/моль) ароматического
вещества Г для цепочки превращений, протекающих по
схеме:
бензилацетат в А Б в
+ CH,NH„ р
-Н,О * 1
4. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме. +сн,с—а
толуол + 1м<У!ь-а-*Х> А +кон <»?>> Б t-NI4°’_K.S В-£—* Г.
5. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
бензиловый спирт А р-р). С. Б
g +QH,NH, р
6. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
пропаналь »£ АБ В Г.
7. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
бензол + HN°/H.SO-. А +Ге/нс|(изб.ь g + кон (no), g +с,н,а р
— НС1
8. Укажите сумму молярных масс (г/моль) органичес-
ких веществ Б и Г для цепочки превращений, протекаю-
щих по схеме:
толуол +3мольС|»*\ А + Н,О(ОН)изб.' g + SOCI,? g -I CH,NH< p
9. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
щих по схеме:
3-хлорпропен ^К»А±^БВГ.
-н,о
--- 860 ----
10. Укажите сумму молярных масс (г/моль) органи-
ческих веществ В и Г для цепочки превращений, проте-
кающих по схеме:
С Н ONa Щ А Б В г.
6 5 -HI -HI
ТЕМА 56
Аминокислоты. Белки
ТЕСТ1
1. Укажите формулу глицилаланина:
1) HN — СН, — С — N — СН — СООН;
• II I I
о н сн3
2)H,N —СН —С- Н —СН —СООН;
I II I I
сн3 о н сн3
3) H,N — СН, — С — N — СН — СООН;
' II I I
о н с2н5
4)HN —СН —С —N —СН —СООН.
Л 11 1 1
О ° н СНз
2. Сколько различных дипептидов линейного строе-
ния можно получить, используя только глицин и фенил-
аланин (без учета стереоизомерии)?
1) 1;2) 2; 3)3; 4) 4.
3. Назовите по систематической номенклатуре ами-
нокислоту строения
— 861
СНз
СН, — СН — С — СН — СООН?
I I I
nh2 сн3 с2н5
1) Р,Р-диметил-ос-этил-у-аминовалериаиовая;
2) а.а-диметил-Р-этил-у-аминопентановс1я;
3) 4-амино-3,3-диметил-2-этилпентановая;
4) 4-амино-3,3-диметил-2-этилвалериановая.
4. Водный раствор глутаминовой кислоты изменит
окраску лакмуса фиолетового на:
1) синюю; 2) желтую; 3) красную; 4) оранжевую.
5. Водный раствор диаминомонокарбоновой кисло-
ты изменит окраску фенолфталеина на:
1) малиновую; 2) синюю; 3) зеленую; 4) желтую.
6. Соль образуется, когда глицин реагирует с:
1) хлороводородом; 2)этанолом;
3) гидроксидом натрия; 4) водой.
7. В реакцию этерификации могут вступать:
1) глицин; 2) пропиламин;
3) метиловый эфир глицина; 4) глицилаланин.
8. Как аммиак, так и аминокислоты могут реагиро-
вать с:
1) кислотами; 2) щелочами; 3) спиртами; 4) метаном.
9. Амфотерность аланина можно доказать с помощью:
1) НВг и СН3ОН; 2) НС1 и КОН;
3) КОН и СН3ОН; 4) КОН и KNO3.
10. Фенолфталеин остается бесцветным в водных ра-
створах:
1) фенола; 2) метиламина;
3) аланина; 4) глицилаланина.
— 862 —
ТЕСТ 2
1. Сколько различных трипептидов линейного строе-
ния (содержащих по одному остатку каждой кислоты)
можно получить из глицина, аланина и фенилаланина
(без учета стереоизомерии)?
1) 5; 2) 6; 3) 7; 4) 8.
2. Укажите формулу аммонийной соли р-аминопро-
пионовой кислоты:
1)СН3 —СН —СООН;
nh2
2) СН3 — СН — COONH4;
nh2
3)СН3 —СН —COO";
NH3+
4) (NH2)CH2 — СН2 — coonh4.
3. Пептидная связь образуется, когда глицин реагирует с:
1) хлороводородом; 2) гидроксидом калия;
3) аланином; 4) метанолом.
4. Аминокислота строения
СН3 — СН — СН — СООН
6
реагирует с:
а) бутанолом-1 в кислой среде;
б) разбавленной серной кислотой;
в) гидроксидом калия;
г) концентрированной азотной кислотой.
1)а, б, в; 2)6, в, г;
3) а, б, в, г; 4) а, в, г.
— 863 —
5. Укажите формулу а-фенил-Р-аминопропионовой
кислоты:
4) NH2 — CI 12 — СН — СООН.
ед
6. Аминокислоту (аминокислоты) можно получить
при кислотном гидролизе:
1) гл ицилфенилаланина; 2) метилового эфира глицина;
3) белка; 4) этилбензоата.
7. Аминокислота образуется при взаимодействии ам-
миака с:
1) хлорангидридом уксусной кислоты;
2) этилбромидом;
3) пропанолом-2;
4) Р-хлорпропионовой кислотой.
8. Укажите формулу продукта реакции между глици-
ном и бромоводородом:
1)H2N — CI 12 СООН;
2) H3N— СН2— СОО“;
3) Br’fHjN — СН2 — СООН];
4) Br+[H3N — СН2 — СООН].
9. Укажите формулу продукта реакции замещения
— 864 —
между аланином и уксусной кислотой:
1) СН —С —N —СН —СООН;
II I I
о н сн3
2) H,N —СН —С —О —СН •
I II
сн3 о
3) H,N — СН — С — О — С — СН
I II II
сн3 о о
4) СН — С — N — СН — С — СИ,.
II I I II
о н сн3 О
10. В молекуле белка содержится один атом серы, а
массовая доля атомов серы в белке равна 0,32%. Укажи-
те молярную массу (г/моль) белка:
1) 1 - 103; 2) 1 - 104;
3) 1 • 105; 4) 1 • 106.
ТЕСГЗ
1. Аминокислотам отвечают формулы:
1) HS — СЙ, — СН — СОО;
' I
+NH3
2)NH2 — СН2 — С ;
xNH2
4) НО — СН, — СН — СООЛ
+NH3
28 Зак. 1530
--- 865 ----
2. Охарактеризуйте строение и свойства вещества
HLN — СН — С — N — СН, — СООН:
II I ‘ н
О Н
1 \ ' М ' 3 ’ i
1) трипептид;
2) взаимодействует с водным раствором щелочи;
3) при кислотном гидролизе образуется соль гли-
цина;
4) реагирует с хлороводородом.
3. Укажите названия веществ, которые реагируют с
КОН в водном растворе:
1) анилин, 2) хлорид фениламмония;
3) глицин; 4) глицилаланин.
4. Кислотные свойства аминокислот иллюстрирует
реакция, схема которой:
1) H2N — СН, — СООН + СН3ОН
—> H?N — СН2 — СООСН,;
2) H2N — СН2 — СООН + КОН -щг
-» H?N — СН2 — COOK;
3) H2N — СН2 — СООН + НС1 ->
-» Cf[H3N — сн2 — СООН];
4) H2N — СН, — СООН + О2 -> N2 — СО2 + Н2О
5. Сколько веществ образуется при полном кислотном
гидролизе вещества строения
H.N—СН —С—NH—СН —С—NH—СН—С —ОСН ;
II I II 1 II
о сн3 о с,н5 о
1) два; 2) три; 3) четыре; 4) пять.
6. При равных молярных концентрациях pH наиболь-
шее в водном растворе вещества, формула которого:
1) H?N — СН, — СООН; , 2) (СНДЫН;
3) CH,CONHj, 4) NH2OH.
— 866 —
7. Укажите формулу глицина в кислой среде:
1)NH, — СН2 — СООН;
2) NH~— СН2 — СОО;
3) NH3 — СН2 — СООН;
4)NH2 — СН, — СОО’.
8. Первичная структура белка формируется за счет
связей:
1) водородных; 2) сложноэфирных;
3) пептидных; 4) ионных.
9. Какие утверждения в отношении строения и
свойств белка справедливы?
1) первичная структура—последовательность «-ами-
нокислотных звеньев в линейной полипецтидной цепи;
2) продукт реакции поликонденсации ^-аминокислот;
3) при гидролизе образуется смесь различных ос-ами-
нокислот;
4) гемоглобин — белок с четвертичной структурой.
10. Амфотерными свойствами обладают:
1) белок; ' ' •
2) анилин;
3) аминоуксусная кислота;
4) аланин.
II; II ТЕСТ4
1. Сколько веществ из перечисленных: азотная кисло-
та, хлороводород, гидроксид калия (р-р), этанол (кислая
среда) реагируют с соединением строения:
h,n—сн — С—NH — СН — СООН?
- • ; 2 ii м-
1 1 о с6н5
1)4; 2)3; 3)2; 4) 1.
—'867 —
2. Биполярный ион образуется в результате:
1) взаимодействия аминокислот со щелочами;
2) взаимодействия аминокислот с галогеноводородами,
3) образования полипептидов;
4) внутренней нейтрализации аминокислот
3. При равных молярных концентрациях pH наимень-
шее в водном растворе вещества, формула которого:
1) CH3CH(NH2)COOH;
2)(CH3)2NH;
3) HOOCCH(NH2)CH,CH,COOH;
4) HOOCCH(NH2)CH2CH2CONH2:
4. Гомологами между собой являются:
1) глицин, 2) глицилглицин;
3) аланин; 4) 3-аминобутановая кислота.
5. С какими веществами реагирует 3-амино-2-метил-
пропановая кислота?
1) гидроксидом калия; 2) сульфатом натрия;
3) метанолом (в кислой среде); 4) аланином.
6. Укажите формулы веществ, относящихся к одному
классу производных углеводородов:
О О
1)С —ОН, 2)С —NH„;
I I
сн2—nh2 сн2—nh2
о
II
3)H2N —СН —С —ОН; 4)CH> —NH,
СН2 - О CH2-NH2
7. Сколько изомерных аминокислот и нитросоединений
отвечает составу C3H7NO2 (с учетом стереоизомерии)?
— 868 —
8. В формировании третичной структуры белков уча-
ствуют связи:
1) амидные; 2) дисульфидные;
3) сложноэфирные; 4) водородные.
9. Сколько пептидных связей входит в состав молеку-
лы тетрапептида линейного строения:
1) 1;2)3;3) 2; 4)4.
10. Общей формулой C3H7NO2 можно выразить состав:
1) пропилового эфира азотной кислоты;
2) 2-нитропропана;
3) аланина;
4) глицилглицина.
ТЕСТ5
1. В состав всех аминокислот входят функциональные
группы:
1) сульфгидрильная (-SH); 2) аминогруппа;
3) карбоксильная; 4)гидроксильная.
2. Сложныйэфир образуется, когда глицин реагирует с:
1) гидроксидом натрия; 2) этанолом (кислая среда);
3) бромоводородом; 4) аминоуксусной кислотой.
3. Соль образуется, когда хлороводород реагирует с:
1) фенолом; 2) аланином; 3) анилином; 4) аммиаком.
4. Укажите формулы Р-аминокислот:
1) H3N — СН — СН2 — СОО ;
2) H3N — СН — СОО';
СН2ОН
--- 869 ---
3)СН> —COO-;
СН, —NH3
4) СН — С(СН Л — СН — СОО’.
I + -a-h
с2н5 —с —nh3 ,;w
сн3
5. Изомерами по отношению друг к другу являются:
1) нитроэтан и глицин;
2) глицин и аланин;
3) 2-нитропропан и аланин;
4) глицилаланин и аланилглицин.
6. Каким реактивом надо подействовать на а-хлор-
пропионовую кислоту, чтобы получить а-аминопропи-
оновую кислоту?
1) водным раствором КОН; 3) метиламином;
2) спиртовым раствором КОН; 4) аммиаком.
7. Число изомерных аминокислот состава C4H9NO2
составляет (учтите стереоизомерию):
1)5; 2) 6; 3) 7; 4) 8.
8. Появление сине-фиолетового окрашивания в реак-
ции белка с солью меди (II) в щелочной среде указывает
на наличие в белках групп:
1) - SH; 2) - С6Н5; 3) - NH — СО -; 4) - ОН.
9. Укажите формулы веществ, которые могут образо-
ваться при полном кислотном гидролизе белка:
1) СН — СН — СООН;
I
nh2
2) НООС — (СН2)2 — СН — СООН;
nh2
--- 870 —
3) HS — сн2 — CH — СООН;
nh2
4) (C2H5)3N. Ж
10. Ближайшими гомологами аланина являются:
1) Р-аминопропионовая кислота;
2) глицин;
3) а-аминомасляная кислота;
4)1-нитробутан.
ТЕСТ 6
1. Появление желтой (переходящей в оранжевую) ок-
раски в реакции белка с HNO3 (конц.) указывает на на-
личие в остатках аминокислот групп атомов:
1) - С6Н5; 2) - NH — СО -; 3) - ОН; 4) - HS.
2. Устойчивость вторичной структуры белка обеспе-
чивается связями:
1) сульфидными; 2) водородными;
3) сложноэфирными; 4) металлическими.
3. Аминокислоту НЕЛЬЗЯ получить при гидролизе:
1) белка; 2) жира; 3) крахмала; 4) аланилглицина.
4. Укажите формулы веществ, реагирующих с гидро-
ксидом натрия в водном растворе:
1) О-NHr 2) Вг[Нз™—СНг—СООН];
3) H,N — СН — С — ОС,Н ; 4)
II
О
5. Как этанол, так и аланин при определенных усло-
виях могут реагировать с:
1) НВг; 2) NaOH (водный р-р); 3)'С11,011; 4) СН3СООН.
--- 871 ----
6. Укажите формулу глицина в водном растворе NaOH:
1) H3N — СН2 — COONa; 2) H,N — СН2 — COONa;
3) H,N — CH2 — COO-; 4) H~N — CH2 — COO".
7. Укажите формулу соединения, которое образуется при
взаимодействии метанола и аланина в присутствии НС1:
1) Н3С — СН — СООСН3; 2)Н3С—СН—СООСН ;
I I
nh2 nh3 • сг
3)нзс —СН —СООН; 4) Н С — СН — СООН.
I I
NH —О —СН3 СГШ2—О —СН3
8. Отметьте формулу Р-аминопропионовой кислоты:
1) СН3 — CH(NH3) — СОО";
2) СН3 — CH(NH3) — СН2 — СОО";
3) СН3 — СН2 — CH(NH3j — СОО";
4) NH3 — (СН,), — СОО".
9. В водном растворе аланин имеет строение:
1) СН3 — СН — СООН; 2) СН3 —- СН — СОО";
nh2 nh3
3)СН3 —СН —СООН; 4) СН3 — СН — СОО".
I I
NH3 NH2
10. В холодный раствор хлоруксусной кислоты про-
пустили трехкратный избыток аммиака. Укажите фор-
мулу продукта реакции:
1)H2N —СН, — СООН;
2) Н N — СН~ — С — NH,;
‘ .11 - ь
О
3) H,N — СН, — COONH4;
4) H^N — СН2 — СН2 — NH,.
— 872 —
ТЕСТ 7
1. В раствор аланина в изопропиловом спирте пропу-
стили бромоводород. Укажите формулу продукта реакции:
i)h,n—сн—с—о—сн,—сн,—сн •
I II 2.3
сн3 о
2) Bf~[H N — СН — С — О — СН, — СН, — CHJ;
I II - 2 3
сн3 о
3) Br“[H N — СН — с — О — СН(СНЛ];
I II
сн3 о
4) Н N — СН — С — О — СН(СНД.
I II
сн3 о
2. Вещество, полученное в предыдущем задании, об-
работали избытком водного раствора КОН. Укажите
формулу одного из продуктов реакции:
1) H,N — СН — COOK;
I
сн3
2) H,N — СН — СООН;
I
сн3
3) H,N — СН — С — О — СН(СНЛ;
I II
сн3 о
о
II
4) СН3 —СН —С —ОК.
NH3 Вг ,
3. Продукт реакции глицина с бромоводородом обра-
ботали избытком водного раствора NaOH. Укажите фор-
— 873 —
мулу продукта реакции:
1) СН, — COONa; 2) СН2 -г- CONa;
I ’ I
HjN • ВС H3N • Br“
3) СН, — COONa; » 4) CH, — CONa.
I 1 ‘
NH, NH,
4. Отметьте формулу продукта реакции замещения меж-
ду аланином и метиламином:
1)H,N — СН — С — О— NH,;
I II
сн3 о
2) СН — N — С — СН — NH,;
I ’ II
н О
сн3
' I
3) [СН — NHJO — С — СН — NH,;
II
О
4) H,N — СН — С — N — С,Н,.
I II I
сн3 о н
5. Какова формула продукта реакции замещения гли-
цина и уксусной кислоты?
1) СН3 — СОО [NH — СН, — С — ОН];
II
О
2) NH, — СН, — С — О — СН, — СН ;
II Е
О
--- 874 ----
3) CH — С— N — СН — С — ОСН;
II I ' "
О } н
4)СН —С —N
II I
ОН о
6. Какое химическое количество (моль) КОН может
максимально прореагировать с 1 моль вещества строения
H.N —СН, —С —N —СН —С —N —СН —С —ОСН?
II I I II I I II
о н сн3 о н сн2 о
1) два; 2) три; 3) четыре; 4) пять.
7. С 1 моль вещества, формула которого
Н3С — СН — СООС2Н5,
H3N • ВС
может максимально прореагировать КОН (водный р-р)
химическим количеством (моль);
1) один; 2) два; 3) три; 4) четыре.
8. При гидролизе некоторого полипептида линейно-
го строения образовалось 5 молекул фенилаланина,
20 молекул цистеина и 25 молекул глицина. Укажите
число пептидных связей в полипептиде:
1)48; 2) 49; 3) 50; 4)51.
9. Имеются водные растворы глицина, глутаминовой
кислоты, метиламина и аммиака. Число растворов, в
которых pH > 7, равно:
1) 1; 2) 2; 3)3; 4) 4.
10. Молекула полипептида линейного строения со-
стоит из 25 остатков молекул фенилаланина и 35 остат-
ков молекул цистеина. Укажите массу (в г) воды, кото-
— 875 —
рая потребуется для полного гидролиза такого полипеп-
тида массой 72,98 г:
1) 10,44; 2) 10,62; 3) 10,80; 4) 10,98.
ТЕСТ 8
1. Укажите молярную массу (г/моль) полипептида
линейного строения, состоящего из 20 остатков молекул
аланина и 22 остатков молекул фенилаланина:
1) 4690; 2) 4672; 3) 4654; 4) 4636.
2. Молекула полипептида линейного строения состо-
ит из 15 остатков молекул глицина, 20 остатков молекул
аланина и 20 остатков молекул фенилаланина. Укажите
приблизительную массу (г) образца такого полипептида
химическим количеством 0,005 моль:
1) 26,17; 2) 26,85; 3) 27,15; 4) 28,43.
3. В состав молекулы некоторого полипептида линей-
ного строения входят 25 остатков молекул аланина и 30
остатков молекул другой аминокислоты. Молярная мас-
са полипептида равна 4883 г/моль. Укажите молярную
массу (г/моль) другой аминокислоты:
1) 75; 2) 165; 3) 121; 4) 164.
4. Наибольшее число неподеленных пар электронов
содержится в молекуле:
1) пиридина; 2) пиримидина;
3) цистеина; 4) глутаминовой кислоты.
5. pH > 7 будет в водном растворе:
1) а-аминопропионовой кислоты;
2) аминоуксусной кислоты;
3) глутаминовой кислоты;
4) лизина (H2N — (СН2)4 — CH(NH2) — СООН).
— 876 —
6. Укажите формулы ос-аминокислот:
ly^N^COOH;
Н
3) H2N(CH2)5COOH;
7. В виде катиона глицин существует в среде:
1) нейтральной; 2) кислой;
3) щелочной; 4) во всех перечисленных средах.
8. В щелочной среде в виде аниона с. зарядом -2 су-
ществует:
1) глутаминовая кислота; 2) глицин;
3) аланин; 4) фенилаланин.
9. Главным образом в виде биполярного иона аланин
существует в среде:
1) кислой; 2) щелочной;
3) нейтральной; 4) во всех перечисленных средах.
10. Укажите формулу соединения, при нагревании ко-
торого образуется вещество строения
1) H,N(CH,)3COOH; 2) H2N(CH,)4COOH;
3) HOOC(CH2)2CH(NH2)COOH; 4) H2N(CH2)3CHO.
--- 877 ---
ТЕСТ 9
1. В сильнокислом растворе в виде катиона с зарядом
+2 существует аминокислота, формула которой:
1) HOOCCH(NH2)CH2COOH;
2)
CH2CH(NH2)COOH
3) HS — СН, — CH(NH,) — СООН;
4) CH3CH(NH2)COOH. *
2. При гидролизе дипептида состава С( IH]4N,O3 по-
лучили аминокислоту состава C2HSNO,. Укажите фор-
мулу второй аминокислоты:
1) C9H12NO; 2) C9H12NO2; 3) C9H„NO; 4) C9HUNO2.
3. Дипептид линейного строения образован остатка-
ми только одной аминокислоты и имеет молекулярную
формулу C]gH20N2O3. Укажите формулу вещества, кото-
рое образуется при кипячении этого дипептида с избыт-
ком НС1 (конц):
1) С.ДДОД 2) СДДОД 3) СД, 2С1; 4)СД ,NOr
4. Укажите формулу соединения, которое образуется
при действии избытка водного раствора КОН на веще-
ство строения ,
—“ 878
н
н
5. Наибольшее химическое количество КОН(р-р) про-
реагирует с веществом, формула которого:
1)Н3С —СН —СН2 —С1;
ОН
2) Н3С —СН —СООН;
NH3 • Вг"
3) Нзс — СН — СООСН3;
NH3 • Вг’
— 879 —
о
II
4) ЦС — СН — С — О — С6Н5.
NH3 • Вг’
6. Из предыдущего задания выберите вещества, кото-
рые максимально взаимодействуют с одинаковым хими-
ческим количеством щелочи (водный раствор):
1) 1 и 2; 2) 2 и 3; 3) 3 и 4; 4) 2 и 4.
7. Наименьшее химическое количество щелочи (водн.
р-р) требуется на полное взаимодействие с веществом
строения:
1) НС — СН — СН, — СН, — С1;
I
ОН
2) нс — сн — соос,н •
z 3 । Z J
NH3 • СГ
3) Н3С —СН —СООН;
NH3 • Вг"
4) НС — СН — СН, — СООС Н..
z 3 । 2 о Э
NH3 • Вг-
S. Вещество строения
Н3С — СН, — О — СН — СН, — СООН
NH,
имеет свойства:
1) сложных эфиров, аминов, карбоновых кислот;
2) простых эфиров, аминов, карбоновых кислот;
3) спиртов, аминов, карбоновых кислот;
4) простых эфиров, аминов, сложных эфиров.
9. Укажите сумму молярных масс (г/моль) органичес-
ких веществ В и Г для цепочки превращений, протекаю-
— 880 —
щих по схеме:
СН, - СН — СН, — СООН Д + 3 моль NH,(20°C)-
СН,
—> Б +НВг; в +кон(нго)изб5 г
10. Укажите молярную массу (г/моль) органического ве-
щества Г для цепочки превращений, протекающих по схеме:
СН СН,ОН ФСРМСНТЬ|? Д + 1 МОЛЬ Cl,, hv_ g + 2 моль NH,(20°C) g _
+ СН,МнД° ]-~
-Н2О
ТЕСТЮ
1. Даны две различные моноаминомонокарбоновые
кислоты. Сколько можно образовать тетрапептидов ли-
нейного строения, содержащих по два остатка каждой
из аминокислот (без учета стереоизомерии)?
1)2; 2) 4; 3)6; 4)8.
2. Какое максимальное химическое количество (моль)
NaOH может прореагировать с одним молем дипептида
линейного строения, образованного аланином и глута-
миновой кислотой?
1) 1;2) 2; 3)3; 4) 4.
3. Дипептид состава ChH14N,O, образован остатка-
ми глицина и еще одной аминокислоты. При длитель-
ном кипячении с избытком НС1(конц.) получили веще-
ства, формулы которых
1) C2H5NO2; 2) C,H6NO2C1; 3) СД ,NO2; 4) C9HpNO,Cl.
4. Какое максимальное химическое количество (моль)
НВг может прореагировать с аминокислотой серином
H.N — СН — СООН?
СН,ОН
1) 1; 2) 2; 3)3; 4) 4.
--- 881
5. Назовите по систематической номенклатуре ами-
нокислоту строения
H2N — СН —СООН:
СН2С1
1) З-хлор-2-аминопропановая;
2) 2-амино-З-хлорпропановая;
3) а-амино-3-хлорпропановая;
4) 3-хлор-а-аминопропановая.
6. При взаимодействии глицина и ос-аминопропио-
новой кислоты могут образоваться дипептиды, имею-
щие формулы:
1) H2NCH2CONHCH2CH2COOH;
2) H,NCH2CONHCH(CH3)COOH;
3) H2NCH(CH3)CONHCH2COOH;
4) h2nch2ch2conhch2cooh.
7. Укажите формулу продукта X для реакции
H,N — СН — СООН X:
I
сн3
1) Н N — СН — С — О — СН
I II
сн3 о
си5
2)HN —С —СООН;
I
сн3
сн
I >
3) Н N — С — С — ОСН,;
I II
сн3 о
— 882 —
4) ’ /N —СН —СООН.
HX I
CH
8. Денатурацию белка вызывают водные растворы
веществ, формулы которых:
1) NaOH; 2) Hg(NO.),; 3) NaCI; 4) НС1 (конц ).
9. Укажите незаменимые аминокислоты:
1) фенилаланин, 2) глицин, 3) аланин; 4) лизин.
10. Какая масса (г) глицина была сожжена, если газо-
образные продукты полного сгорания заняли объем, рав-
ный 28 дм3 (н.у)?
1)75,0; 2) 37,5,3) .1.50; 4) 112,5.
ТЕСТИ
1. НЕ имеют энантиомеров аминокислоты:
1) глицин;
2) сс-аминопропионовая,
3) Р-аминопропионовая;
4) 2-аминобутановая.
2. С бромом (20°С) легко реагирует аминокислота
строения:
1) H,N — СН, — СООН,
2) НО —(TV- СН, — С
СН.
3) HOOCCH(NH,)CH,CH.COOH;
^•N^COOH
883 —
3. Для полного гидролиза трипептида химическим
количеством 3 моль потребуется вода массой (г):
1) 162; 2) 108; 3) 54; 4) 36.
4. Укажите число изомерных ароматических амино-
кислот состава С7Н?МОЭ:
1)2; 2) 3; 3)4; 4) 5.
5. Число аминогрупп (~NH2) в составе тетрапептида
линейного строения, образованного моноаминомоно-
карбоновыми кислотами, равно:
1) 4, 2)3; 3)2, 4) 1.
6. С 2-бромпропановой кислотой химическим коли-
чеством 1 моль может максимально прореагировать ам-
миак массой (г):
1) 17,2) 34; 3)51; 4) 68.
7. Укажите молекулярную формулу трипептида, линей-
ного строения, состоящего из двух остатков глицина и од-
ного остатка аланина:
1) CgH19N3O6; 2) C8H17N3O5;
3) C7H17N3O6; 4) C7H1?N3O4.
8. Аминокислота превращается в изомер своего бли-
жайшего гомолога, реагируя с:
1) СН3СОС1; 2) СН3ОН; 3) НВг; 4) С,Н.ОН
9. Сколько оптических изомеров (энантиомеров) име-
ет аминокислота строения
H2N — СН — СООН?
СН —ОН
сн3
1)2; 2) 4; 3)6, 4)8.
10. Укажите объемную долю (%) азота в смеси газов
(н. у), полученных после полного сгорания глицина в
избытке кислорода:
1) 10; 2) 20; 3) 30; 4) 50.
— 884 —
ТЕСТ 12
1. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
0,5 моль (С^СО^О А Б +2wojlbNHs В ->
«РЙцмдМмЧ!
2. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
СН3
Н3С С СООН +1мольВг,(г,Лу)^ д + 2moju.NH,^ g + НВг
сн3
В +с,н,он/н* г
3. Укажите молярную массу (г/моль) азотсодержаще-
го органического вещества Г для цепочки превращений,
протекающих по схеме:
(СН3)2СНСН2СООН Ai?MonbNHs Б ±™-он/н>
__В + КОН (р-р, изб.^ р
4. Укажите сумму молярных масс (г/моль) азотсодер-
жащих органических веществ Г и Д для цепочки пре-
вращений, протекающих по схеме:
СН СНО4 Ае‘° (амм~р~р^ ~ А +1 б + 2 ыоль в >
+ СН,ОН/НВг г + КОН (Н,О),изб-, д
5. Укажите молярную массу (г/моль) органического
вещества Г для цепочки превращений, протекающих по
схеме:
--- 885 ----
СУ ОН * CQ Kat)r А *1 моль Б + 2 моль В _______>
декарбоксилаза р-.
-СО2 *
6. Самым сладким из известных р .настоящее время
веществ является пептид строения
О
Н3С сн3
nh2
о
НО —С —СН2 —СН —С —NH —СН —СОО—( I)
- I V/
соосн, >
Сг13
Сколько веществ образуется при полном кислотном
гидролизе этого соединения?
1)2; 2)3; 3)4; 4)5.
7. При полном гидролизе трипептида образовались
две аминокислоты — глицин и аланин. Сколько суще-
ствует различных вариантов строения трипептида (без
учета стереоизомерии)?
1)8; 2) 7; 3) 6; 4)5.
8. Какое химическое количество (моль) КОН потребует-
ся для полного гидролиза одного моля пептида строения
(СНДС - CO - NH - СН(СН,) - СО - NH -Qf COOC.IL?
1) 4; 2)3; 3)2; 4) 1.
9. Укажите общую формулу гомологического ряда ами-
нобензойных кислот:
1)СН, 7N0,; 2)СН, rNO,,
7 л 2л-7 2’ 7 п 2л -6 2’
3)CHNO„ 4) С Н, NO,.
7 л л 2’ 7 л 2л -8 2
10. Укажите формулу гомолога глутаминовой кислоты:
1) HOOCCH(NH,)CHnCONH,;
2) HOOCCH(NH jCHXOOH;
3) HOOCCH(NH jCH'CH,CONH,;
4) H,N(CHJ4CH(NHjCOOH.
— 886 —
ТЕМА 57
Высокомолекулярные соединения
(полимеры)
ТЕСТ1
1. Укажите названия полимеров природного проис-
хождения:
1) крахмал; 2) полиэтилен; 3) целлюлоза; 4) лавсан.
2. Амидная связь содержится в волдкнах:
1) лавсан; 2) капрон;
3) найлон; 4)кевлар.
3. Натуральный (природный) каучук—-это:
1) ф/ополибутадйен; 2) пгранс-полизопрен;
3) транс-полибутадиен; 4) i/wc-полиизопрен.
4. Гуттаперча — это /иранс-форма макроцепи нату-
рального каучука. Укажите формулу мономерного звена
гуттаперчи:
— СН2Х / сн2—
1) = ;
нх хн
— СН2Х /Н
2) /С==С. ;
Н3СХ хсн2—
— СН2\ /Сн2—
3) /С = С^
Н3СХ
— СН2\
4) /С - С
IIх
с=с
н
сн2—
— 887 —
5. Чему равна средняя степень полимеризации полипро-
пилена со средней молярной массой, равной 100 000 г/моль?
1) 2300; 2) 2375; 3) 2381; 4) 2392.
6. Средняя молярная масса целлюлозы льняного во-
локна равна 586 602. Укажите среднюю степень поли-
меризации целлюлозы:
1) 1) 3550; 2) 3601; 3) 3621; 4) 36553.
7. К химическим волокнам относятся:
1) хлопковое; 2) вискозное; 3) лавсан; 4) шерстяное.
8. Мономер, используемый для получения волокна
лавсан, образуется при взаимодействии:
1) глицерина и терефталевой кислоты;
2) этиленгликоля и бензойной кислоты;
3) этиленгликоля и бензилового спирта;
4) терефталевой кислоты и этиленгликоля.
9. К синтетическим волокнам относятся:
1) льняное; 2) найлон; 3) капрон; 4) ацетатное.
10. Укажите массовую долю (%) атомов хлора в по-
ливинилхлориде :
1) 55,8; 2) 56,8; 3) 57,8; 4) 58,8.
ТЕСТ 2
1. Искусственные волокна — это:
1) лавсан; 2) вискозное; 3) ацетатное; 4) капрон.
2. При образовании волокна лавсан между собой вза-
имодействуют функциональные группы:
1) —ОНи —СНО; 2) — ОН и — NH,;
3) — СООН и — NH2; 4) — СООН и — ОН.
3. Укажите формулу мономерного звена целлюлозы:
0-С6Н12О6-; 2)-Cf2H22O„-;
з)-с6н10о5-; 4) -- с6н10о4 -.
--- 888-----
4. Какие полимеры имеют одинаковую формулу мо-
номерного звена?
1) лавсан и капрон; 2) капрон и найлон;
3) лавсан и найлон; 4) крахмал и гликоген.
5. К природным полимерам относятся:
1) сахароза; 2) белок;
3) триацетилцеллюлоза; 4) натуральный каучук.
6. Формулу мономерного звена целлюлозы можно
записать как:
1) С6Н7О,(ОН)7; 2) С6Н7ОЭ(ОН)3;
3) С6Н7О2(ОН)4; 4) С6Н7О2(ОН)5.
7. Волокно капрон представляет собой продукт реакции:
1) поликонденсации е-аминокапроновой кислоты;
2) поликонденсации 6-аминогексановой кислоты;
3) поликонденсации у-аминокапроновой кислоты;
4) совместной полимеризации этиленгликоля и тереф-
талевой кислоты.
8. Реакция этерификации лежит в основе образова-
ния мономеров, используемых для получения:
1) капрона; 2) лавсана;
3) ацетатного волокна; 4) найлона.
9. Укажите примерное среднее число мономерных
звеньев в макромолекуле природного каучука, если его
средняя молярная масса равна 1 000 000:
1)16706; 2) 15706;
3) 14706; ~ 4) 14806.
10. Винилхлорид можно получить взаимодействием
ацетилена с:
1)хлором;
2)хлороводородом;
3) Н2(изб.), азатем НС1;
4) ацетиленом (димеризация), а затем с НС1.
— 889 —
ТЕСТЗ
• . i.
1. Для получения искусственного волокна целлюлозу:
1) подвергают гидролизу;. ,. f -
2) обрабатывают азотной кислотой;
3) обрабатывают оксидом азота (IV);
4) обрабатывают уксусным ангидридом.
2. Синтетическое волокно найлон получают посред-
ством реакции:
I) полимеризации; 2) поликонденсации;
3) гидратации; 4) изомеризации.
3. Гидролизу подвергаются:
1) полипептиды; 2) гликоген; 3) рибоза; 4) белок.
4. Сколько веществ из перечисленных ниже могут
вступить в реакцию полимеризации или поликонден-
сации: глюкоза, метилметакрилат, дивинил, е-аминокап-
роновая кислота?
1) одно; 2) два; 3) три; 4) четыре.
5. НЕ вступают в реакцию полимеризации:
1) винилацетат; 2) диметиловый эфир;
3) винилхлорид; 4) тристеарин.
6. Бутадиеновый каучук образуется в результате реакции:
1) дегидрирования бутана;
2) полимеризации бутена-2;
3) дегидратации и дегидрирования этанола;
4) полимеризации дивинила.
7. К полиэфирным волокнам относятся:
1) ацетатное; 2) лавсан; 3) капрон; 4) шелк.
8. Укажите полиамидные волокна:
1) хлопковое; 2) найлон; 3) кевлар; 4) капрон.
9. Капрон получают из:
1) глицина; 2) терефталевой кислоты;
3) капролактама; 4) этиленгликоля. 4
— 890 —
10. К числу синтетических полимеров относятся:
1) тефлон; 2) крахмал; 3) кевлар; 4) полипропилен.
ТЕСТ 4
1. В состав волокна капрон входят атомы элементов:
1)С, Н, О, Р; 2) С, Н, О, N;
3) С, Н, О, Si; 4) С, Н, О, Е
2. Укажите формулы мономерного звена возможных
продуктов реакции полимеризаци 2,3-диметилбутадие-
на-1,3*:
1) —СН, —С = С —СН2 —;
сн3
си,
2) — СН2 — С = С —;
с2н5
си,
3) —СН2 —С —;
I
н3с — с = сн2
си,
4) —СН, —СН —СН —СН, —;
I
сн3
* Рассмотрите полимеризацию по типу 1,2- и 1,4- присое-
динения.
— 891 —
3. Отметьте формулу мономерного звена продукта ре-
акции полимеризации по типу 1,4- присоединения 2-ме-
тил-1,3 -пентадиена ,
1) —НС —С = СН —;
I I
сн3 с2н5
2) —Н,С —С = СН —СН —;
I I
сн3 сн3
сн, сн,
I I
3) —С —С —;
I I
сн3 сн3
4) — нс — с = с — сн,—.
I I
сн3 сн3
4. Полимер имеет строение
Мономер — это:
1) гексадиен-1,3;
3) гексадиен-2,4;
2) гексен-2;
4) 2,3-диметилбутен-2,4.
5. Укажите формулу мономерного звена продукта ре-
акции полимеризации 2,3-диметилбутена-2:
1) — СН, — СН — СН — СН, —;
*11
сн3 сн3
2) — СН, — СН — СН, — СН, —;
I
с,н5
--- 892 ---
сн, сн,
I I
3) —С —С —;
I I
сн3 сн3
4) —СН —СН —.
' I I
с2н5 с2н5
6. При полимеризации 2-метилпентадиена-1,3 по типу
1,4- присоединения образуется каучук, строения:
7. Мономерное звено каучука имеет формулу
— СН —СН = СН —СН —.
I I
сн3 сн3
Мономер — это:
1) гексадиен-1,3;
3) гексадиен-2,4;
2) 2,3-диметилбутадиен-1,3;
4) изопрен.
8. Укажите формулу мономерного звена волокна найлон:
1) — NH — (СН2)5 — С —;
О
--- 893 —
3) — NH — (CH2)6 — NHCO — (CH2)4 — С
Ml О '
4) - С6Н7О2(ОСОСН3)3
9. К полимерам относятся:
1) парацетамол; 2) лигнин;
3)диоксин; 4) хитин.
10. Укажите формулу мономерного звена полимера
кевлара, образующегося при сополимеризации хлоран-
гидрида терефталевой кислоты и л-фенилендиамина:
О
3) — NH —NH — С —С—;
W || ||
о о
ТЕСТ 5
1. Средняя молярная масса полиэтилентерефталата
равна 384000 г/моль. Укажите среднюю степень поли-
меризации полимера:
;; 1) 1 000, 2) 2000; 3) 3000; 4) 4000.
2. Каучуками могут быть продукты полимеризации:
1) пентадиена-1,4; 2) изопрена; v
3) гексадиена-1,3; 4) 2,3-диметилбутддиена-1.,3.
--- 894 —
3. Средняя молярная масса полиметилметакрилата
равна 1 106 г/моль. Укажите среднюю степень полиме-
ризации полимера:
1) 1 • 104; 2) 1 10s; 3) 1 106; 4) 1 • Ю7.
4. Средняя молярная масса поливинилацетата равна
1,29 105 г/моль. Укажите среднюю степень полимери-
зации полимера:
1) 750; 2) 1000; 3) 1500; 4) 2250.
5. Мономерное звено полимера имеет формулу
— СН — СН —
I
ОСОСН3 !
Назовите полимер:
I) полиметилметакрилат; 2) поливинилацетат;
3) лавсан; 4) кевлар.
6. Укажите формулу мономерного звена полимера,
полученного при полимеризации метилового эфира про-
пеновой кислоты:
СД
1) —СН, —СН —; 2) —СН, —С —;
I ' I
ососн3 соосн3
3) —СН, —СН—; 4) —СН, —СН —.
I I
соосн3 сосн3
7. Укажите формулу мономерного звена пироксилина:
1) - C6H7O,(NO,)3-; 2) - С6Н7О,(ОСН3)3 —;
3) - С6Н7О2(ОСОСН3)3 -; 4) - С(Н7О2(ОН)3.
8. Средняя молярная масса продукта сополимериза-
ции стирола и бутадиена-1,3 равна 395000 г/моль. Ука-
жите число мономерных звеньев в макромолекуле по-
лимера (мольное отношение реагентов 1:1):
1) 2000; 2) 2500; 3) 3000; 4) 3500. > U - *
--- 895 —
9. Средняя степень полимеризации крахмала равна
2000. Какую массу (г) глюкозы можно получить из крах-
мала химическим количеством 0,5 • 10-3 моль:
1)90; 2) 180; 3)360; 4) 450.
10. Из крахмала с выходом 100% получили глюкозу
массой 4,5 г. Укажите число молекул воды, затраченных
на гидролиз крахмала:
1) 1,505 - 1022; 2) 3,010 1022;
3) 1,505-1023; 4)3,010-1023.
ТЕСТ 6
1. Укажите схемы реакций поликонденсации:
1) «сн,=сн2 —> 4- сн,—сн,э-„;
2) n[H,N—(СН,) -СООН] -><NH - (СНТ - С )- + «И, О;
II " '
о
3) иСН2 = СН(С1) ->сн2 — СН-}-,.
С1
4) «CfH„Ofi -> -СС.Н. о 4- + «но.
2. К действию окислителей наименее устойчив по-
лимер:
1) поливинилхлорид;
2) тефлон;
3) полиизопрен;
4) полиэтилен.
3. Бутадиен-1,3 со стиролом реагирует только в поло-
жении 1,4 и в мольном соотношении 1:1. Укажите фор-
мулу мономерного звена полученного полимера:
1) —СН —СН, — СН — СН = СН СН, —;
6
--- 896 ----
2) — CH — СН2 — СН2 — СН2 — ;
3) — СН —СН2 —СН2 —СН —;
4) — сн — СН, — (СН2 — СН = СН — сн2)2
4. Для оценки соотношения стирольных и бутадие-
новых звеньев в бутадиен-стирольном каучуке можно
использовать реакцию с бромом. Определите отноше-
ние соответственно бутадиеновых и стирольных зве-
ньев в образце каучука, 0,284 г которого присоединяют
0,173 г брома:
1)1:1; 2) 1:2; 3)1 : 3; 4) 1 : 4.
5. Укажите формулу мономерного звена полимера,
полученного сополимеризацией стирола с акрилонит-
рилом (СН2 = СН — CN), считая, что образуется поли-
мер с регулярным чередованием мономерных звеньев
(мольное соотношение мономеров 1:1):
1) — СН — СН2 — СН2 — СН — CN — ;
2) — СН — СН, — СН — ;
CN
сн3
3) — СН — СН — С -;
A CN
29 Зак. 1530
— 897 —
4) — CH — СН2 — СН, — СН —.
6 ™
6. Полимер, называемый «органическим стеклом» или
«плексигласом», получается при полимеризации:
1) тефлона; 2) винилацетата;
3) метилметакрилата; 4) этилентерефталата.
7. Полимер строения
получают совместной полимеризацией:
1) бутадиена-1,2 и бутена-2;
2) изопрена и бутена-1;
3) изопрена и 2-метилпропена;
4) бутадиена-1,2 и 2-метилпропена.
8. К полиамидным полимерам относятся:
1) лексан; 2) кевлар;
3) найлон; 4) полиэтилентерефталат.
9. Число диенов состава С6Н|0, образующих при по-
лимеризации продукты, которые можно отнести к кау-
чукам, равно:
1) 12; 2) 10; 3)8; 4) 5.
10. Укажите формулу мономерного звена продукта
совместной полимеризации изопрена и винилхлорида
(мольное соотношение реагентов 1:1):
1) — СН — СН = СН — СН, — СН, — СН — ;
I
С1
СН
I
2) — СН, — С = С — СН, — СН, — СН — ;
I * I
сн3 С1
— 898 —
3) — сн2 — С -СН--сн2 — сн2 — СН —;
СН3 С1
4) — СН — С = СН — СИ, — СН — .
I ~ I
СН, С1
ТЕСТ 7
1. В реакцию полимеризации или поликонденсации
могут вступать:
1) триолеин; 2) формальдегид;
3) е-аминокапроновая кислота; 4) кевлар.
2. Молярная масса (г/моль) мономерного звена волок-
на лавсан равна:
1) 192; 2) 182; 3) 100; 4) 86.
3. Укажите название полимера, для которого моляр-
ная масса мономерного звена равна 86 г/моль:
1) полиэтилентерефталат; 2) поливинилацетат;
3) полиметилметакрилат; 4) тефлон.
4. Укажите молярную массу (г/моль) мономерного зве-
на продукта совместной полимеризации бутадиена-1,3
и бутена-2 (мольное соотношение реагентов 1:1):
1) 108; 2) НО; 3) 112; 4) 114.
5. Средняя молярная масса полимера, полученного
при совместной полимеризации стирола и акрилонит-
рила (СН2 — СН — CN) равна 392500 г/моль (мольное
отношение реагентов равно 1:1). Укажите среднее чис-
ло мономерных звеньев в макромолекуле полимера:
1) 2500; 2) 2300; 3) 2100; 4) 1900..
6. Средняя молярная масса ПВА равна 129000 г/моль.
Укажите среднюю степень полимеризации ПВА:
1) 1700; 2) 1500; 3) 1300; 4) 1100.
— 899 —
7. Укажите формулу мономерного звена продукта со-
вместной полимеризации винилацетата и метилмета-
крилата (мольное отношение 1:1):
1) —СН, —СН— СН — СН —;
~ I ' ~ I
о-с-сн с-о-сн.
II II
о о
сн,
2) — СН, — С — СН, — СН — ;
' I ' I
о=с-осн3 осн3
3) —СН, —СН — СН, — СН —;
I ~ I
О = С-ОСН, о-с-сн.
II
о
сн3
4) —СН, —СН — СН, — С—.
I I
о-с-сн, с-о-сн,
II II
о о
8. Формула мономерного звена полимера имеет вид
СН
I
— СН, — С — СН, — О — .
I
сн3
Полимер получен совместной полимеризацией:
1) формальдегида и 2-метилпропена;
2) формальдегида и пропена;
3) этена и 2-метилпропена;
— 900 —
4) этаналя и пропена.
9. Полимер, формула мономерного звена которого
О О
получают совместной полимеризацией веществ, фор-
мулы которых:
10. Средняя молярная масса полимера, полученного со-
вместной полимеризацией метаналя и бутена-2, равна
154800 г/моль (мольное соотношение реагентов 1:1).
Укажите среднее число мономерных звеньев в макромо-
лекуле полимера:
1) 1600; 2) 1800; 3) 200; 4) 2200.
— 901
ТЕМА 58
Идентификация веществ: качественные
реакции
ТЕСТ1
1. Различить пробирки с бензольными растворами
фенола и этанола можно с помощью:
l)Na; 2) KOH;3)Br,;4) НС1.
2. Тлеющая лучинка погаснет при внесении ее в со-
суд, заполненный:
1) кислородом; 2) смесью озона и кислорода;
3) азотом; 4) углекислым газом.
3. Бензольные растворы толуола, фенола и стирола
можно различить с помощью одного реактива, формула
которого:
1) К; 2) К,СО3; 3) КОН; 4) Вг,.
4. Различить разбавленные водные растворы KI, КС1,
КВт и KF можно с помощью одного реактива, формула
которого:
1) С12; 2) AgNO3; 3) Ca(NO3)2; 4) H2SO4 (разб.).
5. Укажите формулу реактива, с помощью которого
можно различить водные растворы глицерина, этаналя
и этановой кислоты:
1) Вг2; 2) Na,CO3; 3) Cu(OH)2; 4) HNO3.
6. Водные растворы солей Na,CO3, Na2S, Na,SO3 и
AgNO3 можно различить с помощью реактива:
1) ВаС12; 2) НС1; 3) КОН; 4) KI.
7. Пробирки с водными растворами этаналя и уксус-
ной кислоты можно различить с помощью:
1) индикатора; 2) Си(ОН),; 3) NaHCO3; 4) Си.
— 902 —
8. Пробирки с бесцветными водными растворами суль-
фатов алюминия, магния, калия и аммония можно разли-
чить с помощью одного реактива, формула которого:
1) ВаС12; 2) КОН; 3) HNO3; 4) Na3PO4
9. Различить пробирки с водными растворами мура-
вьиной кислоты и уксусной кислоты можно с помощью:
1) лакмуса; 2) питьевой соды; 3) магния; 4) аммиач-
ного раствора оксида серебра (I).
10. Водные растворы K2S, K,SO3, К2СО3 и K2SO4
можно различить с помощью:
1) NaOH; 2) ВаС12; 3) НС1; 4) NH3 • Н2О.
ТЕСТ 2
1. С помощью индикатора можно различить водные
растворы:
1) КС1 и NaNO3; 2) Na2S и Na2SO4;
3) A12(SO4)3 и Na2CO3; 4) NH4C1 и (NH4)2SO4.
2. С помощью какого одного реактива можно разли-
чить пробирки с водными растворами глицерина, эта-
наля, глюкозы и уксусной кислоты?
1) Н2; 2) Ag2O(aMMHa4H.p-p); 3) Cu(OH),; 4) NaHCO3.
3. Водные растворы КС1 и К3РО4 можно различить с
помощью:
1) Н2БО4(разб.); 2) лакмуса; 3) AgNO3; 4) MgSO4.
4. Пробирки с водными растворами глюкозы и мура-
вьиной кислоты можно различить с помощью:
1) Вг2; 2) Ag2O(aMMHa4H. р-р);
3)Cu(OH)2; 4)NaHCO3.
5. Пробирки с разбавленными растворами НС1 и HNO3
можно различить с помощью:
1) медных опилок; 2) питьевой соды;
— 903 —
3) нитрата серебра (I); 4) сульфата натрия.
6. Машинное масло (получается при перегонке нефти)
от растительного можно различить с помощью:
1)Вг2; 2)КМпО4;
3) Ag,0 (аммиачн.р-р); 4) Н,О.
7. Пробирки с разбавленными растворами HNO3 и
H2SO4 можно различить с помощью:
1) медных опилок; 2) поташа;
3) хлорида бария; 4) фосфата калия.
8. Пробирки с гексаном, гексеном-2 и бензолом мож-
но различить с помощью растворов:
1) КМпО4 и КОН; 2) Вг, и HNO3/H,SO4;
3) КМпО4 и Вг,; 4) Вг2 и КОН.
9. Реактив на пептидную связь — это:
1) HNO3 (конц.); 2) Cu(OH)2 + NaOH;
3)НС1(р-р); 4)Вг, (Н,О).
10. Пробирки с НС1(конц.) и Н,5О4(конц.) можно раз-
личить с помощью:
1) Си; 2) Н2О; 3) K2SO3; 4) КМпО4.
ТЕСТЗ
1. Циклогексанол и циклогексен можно различить с
помощью:
1) Вг2; 2) КМпО4; 3) Na; 4) NaHCO3.
2. Пробирки с разбавленными растворами HCI, HNO3
и H,SO4 можно различить с помощью:
1) BaCl, и AgNO3; 2) BaCl, и КНСО3;
3) ВаС12 и Na,SO3; 4) (NH4),CO3 и MgBr,.
3. Для различения пропанола-1 и метилэтилового
эфира можно воспользоваться:
1) питьевой содой; 2) натрием;
— 904 —
3) щелочью (р-р); 4) соляной кислотой.
4. Пробирки с разбавленными водными растворами
HCI и Н3РО4 можно различить с помощью:
1) AgNO3; 2) ВаС1э; 3) KNO3; 4) лакмуса.
5. Стирол и этилбензол можно различить с помощью:
1) Вг2; 2) КОН; 3) НС1; 4) NaHCO3.
6. Вещество состава С3Н6О2 дает качественную реак-
цию с Ag2O (аммиачн. р-р) и реагирует с Na. Укажите
его формулу:
1)Н—сГ ;
XOC2HS
^О
2)Н3С — СН — СС ;
I хн
ОН
3) Н3С — С — СН2ОН;
о
4) Н3С — С—СН2ОН.
о
7. С помощью НСЦразб.) можно обнаружить наличие
в растворе:
1) ионов Ag+ 2) сульфат-ионов;
3) гидрокарбонат-иона; 4) сульфид-ионов.
8. Сухие соли КС1 и Ba(NO3), можно различить с по-
мощью:
1) воды и нитрата серебра;
2) окраски пламени;
3) воды и лакмуса;
4) воды и сульфата натрия.
--- 905 ---
9. Бесцветный газ А с резким запахом взаимодейству-
ет с газом Б, имеющим запах тухлых яиц. При этом об-
разуется простое твердое вещество желтого цвета. Ука-
жите формулы газов А и Б соответственно:
1) О, и 11,8; 2) SO, и H,S; 3) NH3 и H,S; 4) СО2 и H,S.
10. Соединение А состава С4Н10О реагирует с Na, а
при его окислении образуется кетон с четырьмя атома-
ми углерода в молекуле. Укажите формулу вещества А:
1) Нзс — СН — СН,ОН; 2) (СН3)3СОН;
СН3
3) (СН3)2СНСН2ОН; 4) СН3СН(ОН)С2Н5.
ТЕСТ 4
1. Укажите формулу вещества, водный раствор которо-
го имеет кислую реакцию и обесцвечивает бромную воду:
1) СН3СН,СООН; 2) СН, = СН — СООН;
3) СН, = СН — СНО; 4) СН2 = СН — СН2ОН.
2. Твердое вещество А серого цвета нагревали в токе
кислорода и получили бесцветное кристаллическое ве-
щество Б, которое сплавили с магнием. Полученное ве-
щество В обработали кислотой и получили газ Г, при
сгорании которого в качестве одного из продуктов обра-
зуется вещество А. Вещество А — это:
1) кремний; 2) кремнезем;
3) силан; 4) силицид магния.
3. Пробирки с бензолом, гексаном и гексеном-2 мож-
но различить с помощью:
1) брома и железа;
2)хлороводорода;
3) брома и водного раствора КМпО4;
— 906 —
4) водного раствора перманганата калия.
4. Доказать наличие в растворе ионов СО.; в при-
сутствии сульфат-ионов можно с помощью:
1) НС1; 2) Ba(NO3)2; 3) MgBr,; 4) КОН.
5. Изопрен и 2-метилбутан можно распознать с по-
мощью:
1) КОН(спирт); 2) Ag2O (аммиачн. р-р);
3) КМпО4 (Н,О); 4)Вг2(СС14).
6. С помощью соляной кислоты можно распознать
пробирки с водными растворами:
1) Na,S и K,SO3; 2) КС1 и КДО4;
3) NaHCO3 и NaNO3; 4) AgNO3 и Ba(NO3)2.
7. С помощью бромной воды можно различить:
1) пропан от этана;
2) бензол от фенола;
3) пропин от пропана;
4) анилин от циклопентена.
8. Распознать водные растворы NH4C1 и КС1 можно с
помощью:
1) H?SO4 (разб.); 2) NaOH; 3) AgNO3; 4) лакмуса.
9. По цвету пламени можно различить:
1) KNO3 и NaCI; 2) бензол и гексан;
3) этин и этан; 4) этен и циклопропан.
10. Водные растворы (NH4)2CO3 и КНСО3 можно раз-
личить с помощью:
1) НС1; 2) СаС12; 3) NaOH; 4) NaNO3.
ТЕСТ5
1. Сухие соли К2СО3 и K2SO4 можно различить с по-
мощью водного раствора:
1) Ca(NO3)2; 2) ВаС12; 3) NaNO3; 4) НС1.
— 907 —
2. Водным раствором перманганата калия можно вос-
пользоваться для различения:
1) бензола от циклогексана;
2) этена от циклогексена;
3) бутана от пропина;
4) бутадиена-1,3 от бутана.
3. Водные растворы K,SiO3 и К,СО3 можно разли-
чить с помощью:
1) СаС12; 2) H,SO4 (разб.); 3) NaOH; 4) NaCl.
4. Некоторое соединение А при взаимодействии с НВг
образует монобромпроизводное, которое в реакции с Na
переходит в 2,3-диметилбутан. Соединение А называется:
1) пропин; 2) этен; 3) пропен; 4) гексен-1.
5. Гашеную известь от известняка можно различить с
помощью водного раствора:
1) НС1; 2) КОН; 3) NaNO3; 4) NaCl.
6. Фенол и бензол (растворы в гексане) можно разли-
чить с помощью:
1) Вг2; 2) НС1; 3) Na; 4) Na,CO3.
7. Бесцветное пламя горелки станет желтым при вне-
сении в него соединений:
1) калия; 2) бария; 3) натрия; 4) кальция.
8. Водные растворы фенола и глицерина можно раз-
личить с помощью:
1) индикатора; 2) натрия;
3) питьевой соды; 4) хлорида железа (III).
9. Питьевая сода может использоваться для различе-
ния между собой водных растворов веществ:
1) этанол и 2,4,6-тринитрофенол;
2) этанол и этановая кислота;
3) глюкоза и сорбит;
4) фенол и аспирин.
— 908 —
10. Выделение газа, окрашивающего влажную лакму-
совую бумажку в красный цвет, наблюдается при взаи-
модействии:
1) СаН2 и Н2О; 2) Си и HNO3 (конц.);
3) K2SO3 и НС1 (р-р); 4) NH4C1 (р-р) и КОН.
ТЕСТ 6
1. Жидкость А в реакции с Na выделяет газ, а при де-
гидратации вещества А образуется только пентен-1. Ука-
жите название вещества А:
1) пентанол-2; 2) пентанол-1;
3) 2-метилбутанол-1; 4) 2-метилбутанол-2.
2. Выделение газа (н.у.), окрашивающего влажную лак-
мусовую бумажку в синий цвет, наблюдается при взаи-
модействии:
1) хлорида фениламмония и щелочи (р-р);
2) нитрата аммония и щелочи (р-р);
3) бромида метиламмония и щелочи (р-р);
4) сульфита натрия и соляной кислоты.
3. Известковая вода может использоваться для обна-
ружения газов:
1) НС1; 2) NO2; 3) СО2; 4) SO2.
4. Вещество А дает реакцию «серебряного зеркала»,
восстанавливается водородом и образуется при дегид-
рировании этанола. Вещество А — это:
1) НСНО; 2) СН3СНО;
3) СН3С(О)СН3; 4) С6Н5ОН.
5. В четырех пробирках нагревают соли NaNO3,
NH4NO3, К3РО4 и СаСО3. Тлеющая лучинка вспыхнет,
если ее внести в пробирки, содержащие:
1) К3РО4; 2) NaNO3; 3) СаСО3; 4) NH4NO,.
— 909 —
6. Некоторое вещество А при окислении переходит в
соединение, которое реагирует с питьевой содой, а по-
лученный при этом продукт в реакции с NaOH(T) можно
использовать для получения этана. Укажите название ве-
ществ А:
1) бутаналь; 2) пропаналь; 3) этаналь; 4) метаналь.
7. Водные растворы ZnCl„ MgC'l,, КС1 и NH4C1 можно
различить с помощью одного реактива, формула которого:
1) NaNO3; 2) AgNO3; 3) NaOH; 4) H,SO4.
8. Вещество А изменяет окраску лакмуса, выделяет газ
в реакции с содой и дает реакцию «серебряного зерка-
ла». Вещество А — это:
1) этаналь; 2) этановая кислота;
3) метановая кислота; 4) 2,4,6-тринитрофенол.
9. Концентрированные растворы H2SO4, НС1 и HNO3
можно различить с помощью:
1) ВаС12; 2) Ag; 3) ВаО; 4) Ва(ОН)2.
10. Вещество А при гидролизе образует два соедине-
ния с равным числом атомов углерода. Одно из этих
соединений при дегидратации переходит в простейший
алкен. Название вещества А:
1) этилацетат; 2) пропилпропаноат;
3)этилформиат; 4) метилпропаноат.
ТЕСТ7
1. Некоторый сплав частично растворяется в разбав-
ленном растворе щелочи и полностью — в разбавленной
серной кислоте. Укажите возможный состав сплава:
1) Al, Zn; 2) Zn, Си; 3) Al, Be; 4) Zn, Fe.
2. Некоторое вещество А при окислении аммиачным
раствором Ag2O образует соединение, взаимодействую-
щее с КОН, а при восстановлении — одноатомный
— 910 —
спирт, при дегидратации переходящий в 2-метилпропен.
Назовите вещество А:
1) бутаналь; 2) 2-метилпропаналь;
3) пропаналь; 4) метилпропаноат.
3. Различить водные растворы NU4NO(, K,S и CuSO4
можно с помощью:
1) Н,8О4(разб.); 2) КОН; 3) NaCl; 4) MgCl2.
4. Некоторое вещество А подвергается гидролизу и
дает реакцию «серебряного зеркала». Один из продук-
тов гидролиза при окислении образует кетон. Вещество
А —это:
I) изопропил ацетат; 2) пропилформиат;
3) изопропилформиат; 4) бутилформиат.
5. Некоторый сплав частично растворяется в H2SO4
(конц., 20°С) и полностью — в разбавленном растворе
щелочи. Укажите возможный состав сплава:
1) Си и Zn; 2) Al и Zn; 3) Си и А1; 4) Fe и Be.
6. Вещество А в щелочной среде реагирует с Си(ОН),
с образованием сине-фиолетового раствора, при нагре-
вании которого выпадает осадок красного цвета. Ука-
жите название вещества А:
1) фенол; 2) уксусная кислота;
3) фруктоза; 4) этаналь.
7. Вещество А при растворении в воде образует смесь
двух кислот, одна из которых в реакции с AgNO3 образу-
ет белый осадок. Вещество А — это:
1)NO2; 2) Вг2; 3) С12; 4) СО2.
8. Вещество А состава С5Н10 при гидрировании обра-
зует 2-метилбутан, а в реакции с НС1 — в основном со-
единение, при щелочном гидролизе которого можно по-
лучить вторичный спирт. Укажите возможное название
вещества А:
1) 3-метилбутен-1; 2) 2-метилбутен-2;
— 911 —
3) 2-метилбутен-1; 4) пентен-1.
9. С помощью тлеющей лучинки можно различить
вещества в парах:
1) H2SO4 (разб.) и H2SO4 (конц.); 2) О, и СО2;
3) NaNO3 и КС1 (при нагревании); 4) СО, и N,.
10. Гидроксид меди (II) может использоваться для
обнаружения веществ:
1) целлюлозы; 2) мальтозы;
3) 1,2,3,4-бутантетраола; 4) этилформиата.
ТЕСТ 8
1. Укажите название газа, который обесцвечивает
бромную воду, при гидратации образует вещество, из
которого получают сырье для производства синтетичес-
кого каучука:
1) бутадиен-1,3; 2) изопрен; 3) этен; 4) этин.
2. Для разделения ионов Mg2+ и Ва2+ в водном раство-
ре можно воспользоваться:
1) K2SO4; 2) NaNO3; 3) К3РО4; 4) NaOH.
3. При действии H2SO4 (разб.) на водный раствор соли
А выделяется газ, при взаимодействии которого с хлор-
ной водой образуется осадок простого вещества. Веще-
ство А— это:
1) Na2SO4; 2) Na2CO3; 3) Na2SO3; 4) Na2S.
4. Назовите соединение состава С5НрО, если извест-
но, что при его дегидрировании образуется альдегид, а
при дегидратации - 2-метилбутен-1:
1) 2-метилбутанол-2; 2) этилпропиловый эфир;
3) 2-метилбутанол-1; 4) 3-метилбутанол-1.
5. Пробирки с твердыми веществами белого цвета —
сахарозой, сульфатом натрия и сульфитом калия можно
— 912 —
различить с помощью одного реактива. Укажите форму-
лу этого реактива:
1) КОН (р-р); 2) H,SO4 (конц.);
3) NaCI (р-р); 4) KNO3 (р-р).
6. Назовите вещество состава С4Н]0О, если оно взаимо-
действует с Na, а при окислении избытком Na,Cr2O7/H2SO4
образует продукт с тем же числом атомов С в молекуле,
не обладающий кислотными свойствами:
1) бутанол-1; 2) 2-метилпропанол-1;
3) бутанол-2; 4) 2-метилпропанол-2.
7. Укажите формулу газа, который реагирует со щело-
чами и бромной водой, горюч:
1) С2Н4; 2)H2S;3) С12; 4) СО2.
8. Вещество состава C3HgO взаимодействует с Na, а при
окислении образует альдегид. Это вещество называется:
1) пропанол-1; 2) пропанол-2;
3) метилэтиловый эфир; 4) пропановая кислота.
9. Укажите формулу газа, который растворим в воде,
реагирует со щелочами и H2SO4 (конц.):
1) NH3; 2) SO2; 3) СО2; 4) H2S.
10. Гомолог бензола состава С9Н]2 при хлорировании
на свету или в присутствии катализатора образует толь-
ко два моногалогенпроизводных. Назовите гомолог:
1) пропилбензол; 2) 1-метил-2-этилбензол;
3) 1,3,5-триметилбензол; 4) кумол.
ТЕСТ 9
1. В пробирках находятся четыре разных вещества
одинакового цвета. Одно из них выделяет газ при обра-
ботке как сильной кислотой, так и щелочью. Укажите
формулу этого вещества:
1) Na2SO3; 2) NH4HCO3; 3) (NH4)2SO4; 4) K2S.
30 Зак 1530
--- 913 ----
2. Полимер с мономерным звеном С4Н6 получен при
полимеризации:
1) бутена-1; 2) изопрена; 3) дивинила; 4) бутена-2.
3. Имеются два органических вещества, оба из кото-
рых реагируют с КОЙ (Н2О) и раствором Вг2(СС14). Од-
нако одно из них вступает в реакцию этерификации, а
другое — нет. Этими веществами могут быть:
1) уксусная кислота и метакриловая кислота;
2) метакриловая кислота и метилацетат;
3) метакриловая кислота и метилметакрилат;
4) фенол и бензиловый спирт.
4. Два органических вещества реагируют с этанолом и
метиламином. Однако одно из них взаимодействует с пить-
евой содой, а другое — нет. Этими веществами могут быть:
1) уксусная кислота и хлорангидрид уксусной кислоты;
2) уксусная кислота и метановая кислота;
3) пропеновая кислота и пропановая кислота;
4) бензойная кислота и бензиловый спирт.
5. Вещество А состава C7HgO окисляется в вещество
Б состава С7Н6О, которое само легко окисляется в веще-
ство В состава С7Н6О2. Вещество В реагирует с этано-
лом с образованием соединения Г состава С9Н10О2. Ука-
жите название вещества А:
1)2-метилфенол; 2) бензиловый спирт;
3) 4-метилфенол; 4) бензальдегид.
6. Укажите названия веществ, которые могут реаги-
ровать со всеми перечисленными соединениями — КОН
(Н2О), К2СО3, К:
1) пикриновая кислота; 2) фенол;
3) уксусная кислота; 4) бензиловый спирт.
7. Два органических вещества реагируют с NaOH
(Н2О), но не дают качественную реакцию с Си(ОН)2 при
— 914 —
нагревании. Одно из веществ реагирует с натрием, а дру-
гое — нет. Этими веществами могут быть:
1) этановая кислота и муравьиная кислота;
2) этилацетат и муравьиная кислота;
3) пропановая кислота и метилпропаноат;
4) пикриновая кислота и бензилацетат.
8. Качественную реакцию с Ag,O(aMMHa4H.p-p) дают
все вещества, перечисленные под номером:
1) муравьиная кислота, глюкоза, этилформиат;
2) рибоза, дезоксирибоза, сахароза;
3) метаналь, этаналь, глицерин;
4) этаналь, этилформиат, фенол.
9. С помощью индикатора можно отличить водные
растворы:
1) фенола и глицерина;
2) фенола и 2,4,6-тринитрофенола;
3) этановой кислоты и этаналя;
4) этанола и этилацетата.
10. Водный раствор питьевой соды можно использо-
вать для различения водных растворов:
1) хлоруксусной кислоты и уксусной кислоты;
2) пикриновой кислоты и фенола;
3) метановой кислоты и глюкозы;
4) анилина и фенола.
ТЕСТЮ
1. Пробирки с водными растворами глицерина и эта-
нола можно различить с помощью:
1) лакмуса; 2) бромной воды;
3) гидроксида меди (II); 4) питьевой соды.
— 915 —
2. Бензол и бензольные растворы глицерина и этано-
ла можно различить с помощью пары реактивов:
1) Си(ОН)2 и Ag2O (аммиачн.р-р);
2) NaHCO3 и Вг2;
3) Си(ОН)2и Na;
4) Си(ОН)э и лакмус.
3. Водные растворы глюкозы и глицерина можно раз-
личить с помощью:
1) Ag2O (аммиачн. р-р); 2) лакмуса;
3) NaHCO3; 4) Cu(OH)2.
4. Водные растворы белка и глицерина можно разли-
чить с помощью:
1) Си(ОН)2 (в присутствии щелочи);
2) HNO3 (конц.);
3) Ag2O(aMMHa4H.p-p);
4) NaHCO3.
5. Укажите название вещества, которое с Си(ОН), вна-
чале дает сине-фиолетовое окрашивание, а после нагре-
вания — осадок красного цвета:
1) пропаналь; 2) глицерин;
3) глюкоза; 4) этановая кислота.
6. Вещество А состава С4Н]0О реагирует с Na, а при
дегидратации образует смесь трех алкенов. Укажите на-
звание вещества А:
1) бутанол-1; 2) диэтиловый эфир;
3) бутанол-2; 4) 2-метилпропанол-1.
7. Органическое вещество А состава С5Н10О вступает
в реакцию «серебряного зеркала». При хлорировании
этого вещества образуется единственный монохлорид.
Укажите название вещества А:
1) пентаналь; 2) 2-метилпентаналь;
3) 3-метилпентаналь; 4) 2,2-диметилпропаналь.
— 916 —
8. Вещества А и Б имеют один и тот же состав C4HgO2.
Одно из них (А) реагирует с Na2CO3 с выделением СО2.
Второе вещество с Na,CO3 не реагирует, но при нагре-
вании с КОН (Н,О) образует этанол. Веществами А и Б
могут быть соответственно:
1) бутановая кислота и этилформиат;
2) 2-метилпропановая кислота и диэтиловый эфир;
3) изомасляная кислота и этилацетат;
4) бутановая кислота и пропилметаноат.
9. Вещество А состава C7HgO не дает цветной реак-
ции с FeCl3, при взаимодействии с НВг образует веще-
ство состава С7Н7Вг, сильными окислителями окисля-
ется в вещество состава С7Н6О2. Вещество А — это:
1) метилфениловый эфир; 2) 2-метилфенол;
3) бензойная кислота; 4) бензиловый спирт.
10. При внутримолекулярной дегидратации спирта со-
става С7Н16О образуется только один алкен. Дегидриро-
вание этого спирта по функциональной группе невоз-
можно. Назовите спирт:
1) гептанол-2;
2) 2,3-диметилпентанол-2;
3) 3,4-диметилпентанол-2;
4) 2,3,3-триметилбутанол-2.
ТЕСТ 11
1. При внутримолекулярной дегидратации спирта со-
става С7Н]6О образуется смесь трех изомерных алкенов.
Это могут быть спирты:
1) гептанол-1;
2) гепганол-2;
3) 2,3-диметилпентанол-3;
4) 2,3,3-триметилбутанол-2.
— 917 —
2. Соединение А имеет молекулярную формулу C7HgO,
в реакции с Na образует вещество состава C_H7ONa. С
этанолом вещество А дает соединение состава С9Н12О,
а при действии НВг превращается в соединение состава
С7Н7Вг. Вещество А -— это:
1) метилфениловый эфир; 2) 2-метилфенол;
3) бензиловый спирт; 4) бензойная кислота.
3. Учитывая, что абсолютная ошибка при определении
массовой доли атомов углерода в веществе равна ± 0,3%,
определите, вещества в каких парах можно различить
на основании анализа массовой доли атомов углерода:
1) пропан и пропен;
2) спирты состава С30Н61ОН и С30Н59ОН;
3) стеариновая и линолевая кислоты;
4) бензиловый спирт и фенол.
4. Бромалкан А при нагревании с КОН(спирт) может
образовать алкен состава С5Н10, существующий в виде
цис-, нгранс-изомеров. Это могут быть бромалканы:
1) 1-бромпентан; 2) 2-бромпентан;
3) 3-бромпентан; 4) 1-бром-3-метилбутан.
5. Некоторый спирт в реакции с НВг образует веще-
ство, которое при взаимодействии с Na в качестве орга-
нического продукта образует только 2,2,3,3-триметилбу-
тан. Исходный спирт - это:
1)бутанол-1; 2) бутанол-2;
3) 2-метилпропанол-1; 4) 2-метилпропанол-2.
6. Два органических вещества реагируют с калием и
терефталевой кислотой. Одно из них взаимодействует с
Си(ОН),, а другое — нет. Этими веществами могут быть:
1) глицерин и метанол;
2) этиленгликоль и этаналь;
3) 1,2-пропандиол и этанол;
4) глицерин и уксусная кислота.
— 918 —
7. Два органических вещества вступают в реакцию с
натрием, а одно из них реагирует с питьевой содой. Оба
реагируют с бромной водой. Этими веществами могут быть:
1) фенол и уксусная кислота;
2) фенол и глицерин;
3) фенол и пропеновая кислота;
4) фенол и метилметакрилат.
8. Некоторое вещество А при взаимодействии с
Н28О4(конц.) может образовывать продукты состава С3Н6
или С6Н14О. При окислении оксидом меди (II) вещество
А превращается в соединение, дающее красный осадок
при нагревании с Си(ОН)2. Вещество А — это:
1) метилэтиловый эфир; 2) пропанол-1;
3) пропанол-2; 4) ацетон.
9. Некоторое вещество А дает сине-фиолетовое окраши-
вание с Си(ОН)2, а с избытком уксусного ангидрида обра-
зует вещество состава С5НрО4. Веществом А может быть:
1) этиленгликоль; 2) глицерин;
3) пропандиол-1,3; 4) бутандиол-1,3.
10. Соединение А состава С5НрО окисляется в веще-
ство состава С7Н[2О4. При нагревании вещества А с
Н28О4(конц.) образуется единственный продукт состава
С10Н22О. Вещество А — это:
1) 2,2-диметилпропанол-1; 2) З-метилбутанол-1;
3) пентанол-1; 4) 2-метилбутанол-1.
ТЕСТ 12
1. Соединение А — кристаллическое вещество слад-
кого вкуса, вступающее в реакцию с Са(ОН)э с образова-
нием растворимого вещества В. При пропускании СОЭ
через раствор вещества В образуется осадок и вновь ве-
— 919 —
щество А. Вещество А — это:
1) крахмал; 2) фенол;
3) сахароза; 4) пикриновая кислота.
2. Водные растворы средних натриевых солей фос-
форной, серной, кремниевой и угольной кислот можно
различить с помощью:
1) соляной кислоты и хлорида калия;
2) азотной кислоты и хлорида магния;
3) углекислого газа и соляной кислоты;
4) серной кислоты и нитрата натрия.
3. Глицерин, анилин и этаналь можно различить с
помощью:
1) Н2О и Сп(ОН)2;
2) Na и Вг2 (Н2О);
3) NaHCO3 и Ag2O(aMMna4H.p-p);
4) Ag2O(aMMna4H.p-p) и Вг2 (Н2О).
4. В четырех колбах находятся кислород, воздух, азот
и углекислый газ. Содержимое каждой колбы можно
определить с помощью:
1) тлеющей лучинки и раствора гидроксида натрия;
2) тлеющей лучинки и известковой воды;
3) тлеющей лучинки и водного раствора силиката
калия;
4) известковой воды и водного раствора силиката
калия.
5. Для различения водных растворов глицерина, му-
равьиной кислоты и фенола можно воспользоваться:
1) FeCl3 и Сп(ОН)2;
2) содой и бромом;
3) натрием и Ag2O(aMMna4H.p-p);
4) лакмусом и содой.
— 920 —
6. Соединение А химическим количеством 1 моль
вступает в реакцию максимально с тремя молями Na, но
с двумя молями NaOH(p-p). При действии на вещество
А хлорида железа (III) возникает фиолетовое окрашива-
ние. Укажите возможную формулу вещества А:
1) НОСН2 —(О)— ОН ; 2) НО —/Q\— ОН;
^СН2ОН ^Ч)Н
СН2СООН
3)НО —С —СООН. 4) НО—ОН
СН2СООН ^сн.он
7. Соединение А химическим количеством 1 моль всту-
пает в реакцию максимально с 2 моль Na, но с 1 моль
NaOH (р-р), реагирует с бромной водой и вступает в ре-
акцию гидрирования на никелевом катализаторе. Ука-
жите возможные формулы вещества А:
.ОН
1) Н3С — СН — СООН; 2) <0^“ СН2ОН;
ОН
8. Даны четыре пронумерованные пробирки с разбав-
ленными водными растворами HNO3, ВаС12, Na2SO4,
Na3PO4. При приливании раствора II к раствору I ника-
ких изменений не наблюдалось. Нет признаков реакции
и при сливании полученной смеси с раствором III. Ра-
створ IV не дает осадка с раствором AgNO3. Укажите
номер пробирки с раствором Na2SO4:
1) I; 2) II; 3) III; 4) IV.
— 921
9. Некоторое вещество А используется в качестве жа-
ропонижающего средства, взаимодействует с NaOH (Н2О)
и водным раствором соды. Укажите формулу вещества А:
10. Проба некоторого минерала окрашивает пламя в фио-
летовый цвет. Обработка минерала H2SO4 (конц.) приводит
к выделению хорошо растворимого в воде газа, не вызыва-
ющего помутнения известковой воды. Раствор минерала в
воде образует белые осадки при его обработке как хлоридом
бария, так и нитратом серебра. Укажите формулу минерала:
1) КС1 • MgCl2 6Н2О; 2) КС1 • MgSO4 • ЗН2О;
3) КС1 NaCl; 4) MgCO3 • СаСО3.
ТЕМА 59
Вещества в природе.
Применение и получение веществ
ТЕСТ1
1. Укажите вещества природного происхождения:
1) лавсан; 2) кварц; 3) цемент; 4) крахмал.
--- 922 ---
2. Для изготовления зеркал и елочных украшений ис-
пользуется:
1) сахароза; 2) глюкоза; 3) целлюлоза; 4) фруктоза.
3. Для понижения кислотности в почву вносят:
1) мирабилит; 2) сильвинит; 3) известняк; 4) малахит.
4. В холодильных установках используется газ, фор-
мула которого:
1)NH3; 2) СО2; 3) Н2; 4) Аг.
5. Количество кислорода в атмосфере остается прак-
тически постоянным благодаря процессу, схема которого:
1) СО2 + Н2о -> С6Н12О6 + о2;
2) Н2О —> Н2 + О2;
3) КС1О3 КС1 + О2;
4) СН4 + О2 -> СО2 + Н2О.
6. Под парниковым эффектом понимается:
1) таяние айсбергов;
2) повышение температуры Земли;
3) понижение температуры Земли;
4) разрушение озонового слоя.
7. Роль озонового слоя Земли состоит в:
1) участии озона в фотосинтезе;
2) поглощении ультрафиолетовых лучей;
3) обеззараживании воздуха;
4) обеззараживании воды.
8. Сплавлением соды, известняка и кремнезема по-
лучают:
1) алебастр; 2) керамику; 3) стекло; 4) цемент.
9. В промышленности гидрирование жиров исполь-
зуется для получения:
1) аминокислот; 2) маргарина;
3) глицерина; 4) углеводов.
--- 923 ----
10. Промежуточными продуктами в промышленном
производстве азотной кислоты из аммиака НЕ являются:
1) NO; 2) N2O; 3) N2O5; 4) NO2.
ТЕСТ 2
1. Парниковый эффект могут вызывать:
1) вода; 2) углекислый газ; 3) озон; 4) галогеналканы.
2. Сущность парникового эффекта состоит в том, что
СО2 и некоторые другие вещества:
1) участвуют в процессе фотосинтеза;
2) поглощают ультрафиолетовое излучение Земли,
превращая его в тепло;
3) поглощают инфракрасное излучение Земли, пре-
вращая его в тепло;
4) разрушают озоновый слой.
3. Из воздуха в промышленности получают газы:
1) Аг; 2) СО2; 3) О2; 4) SO2.
4. Озоновый слой Земли разрушается под действием:
1) углекислого газа; 2) водяных паров;
3) фреонов; 4) азота.
5. В качестве отбеливающего средства используются:
1) хлорная известь; 2) гашеная известь;
3) озон; 4) негашеная известь.
6. Для профилактики заболеваний щитовидной же-
лезы рекомендуется применять:
1) флюорит; 2) иодированную соль;
3) криолит; 4) сильвинит.
7. Атомы элемента фтора НЕ входят в качестве основ-
ной части в состав минералов, названия которых:
1) криолит; 2) карналлит;
3) флюорит; 4) глауберова соль.
--- 924 ---
8. В качестве растворителей для сухой химчистки ис-
пользуются:
1)этиленгликоль; 2)тетрахлорэтен;
3) 1,1,1 -трихлорэтан; 4) кевлар.
9. Метанол в промышленности НЕ используется для
получения:
1) формальдегида; 2) метана;
3) уксусной кислоты; 4) высокооктановых бензинов.
10. Заменитель аспирина — парацетамол — можно
получить взаимодействием:
1) анилина и хлорангидрида уксусной кислоты;
2) 4-гидроксианилина и салициловой кислоты;
3) гидрохлорида 4-гидроксианилина и водного ра-
створа щелочи;
4) 4-гидроксианилина и хлорангидрида уксусной кис-
лоты.
ТЕСТЗ
1. Для получения пироксилина используют:
1) крахмал; 2) жиры; 3) белки; 4) целлюлозу.
2. Укажите схему уравнения реакции второй стадии
получения серной кислоты из пирита:
l)FeS2 + O2^Fe2O3 + SO2; 2) S + О2-> SO2;
3) SO2 + О2 SO3; 4)SO3 + H2O^H2SO4.
3. При получении азотной кислоты из аммиака на
второй стадии происходит:
1) окисление NH3 до NO;
2) окисление NO до N2O3;
3) окисление NO до NO2;
4) поглощение NO2 водой в присутствии О2.
— 925 —
4. Резина — это продукт:
1) вулканизации каучука;
2) вулканизации триацетилцеллюлозы;
3) реакции сополимеризации бутадиена-1,3 и винил-
хлорида;
4) реакции совместной поликонденсации этиленгли-
коля и терефталевой кислоты.
5. В свободном виде в природе находятся вещества:
1) сера и фтор; 2) кислород и аргон;
3) золото и натрий; 4) медь и серебро.
6. Укажите схему реакции получения аммиака в про-
мышленности:
1)NH4C1-^NH3 + HC1;
2) NH4C1 + Са(ОН)2 -£ NH3T + СаС12 + Н2О;
3) N2 + Н2 —> NH3;
4) Zn + HNO3 -> Zn(NO3)2 + NH3? + H2O.
7. Удобрения бывают:
1) комплексные; 2) органические;
3) зеленые; 4) кислородные.
8. В число стадий получения H2SO4 из пирита НЕ
входит:
1) обжиг серного колчедана;
2) окисление SO2 в SO3;
3) поглощение SO3 водой;
4) поглощение SO3 концентрированной серной кислотой.
9. Сколько стадий при получении HNO3 из NH3 в про-
мышленности являются окислительно-восстановитель-
ными?
1) одна; 2) две; 3) три; 4) ни одной.
10. При получении фосфора в промышленности вос-
становителем является вещество, формула которого:
1) SiO2; 2) С; 3) СО; 4) Са3(РОД.
— 926 —
ТЕСТ 4
1. При поглощении «лисьего хвоста» водой образует-
ся кислота:
1) Н3РО4; 2) HNO3;
3) Н2СО3; 4) H2SO4.
2. Углекислый газ в промышленности НЕ получают:
1) обжигом известняка;
2) гашением извести;
3) взаимодействием известняка с соляной кислотой;
4) сжиганием синтез-газа.
3. Синтез-газ образуется при взаимодействии:
1) С и Н2; 2) СН4и Н2О; 3) СН4 и Вг2; 4) N2 и Н2.
4. Под влиянием микроорганизмов в почве мочевина
превращается в:
1)(NH2)2CO; 2) (NH4)2CO3;
3)NH3; 4) NH4NO3.
5. Меланж — это промышленное название смеси
концентрированных кислот:
1) НС1 и H2SO4; 2) НС1 и HNO3;
3) H2SO4 и HNO3; 4) Н3РО4 и HNO3.
6. В промышленности этен используется для полу-
чения:
1)этиленоксида; 2)этаналя;
3) метана; 4) бензола.
7. Способ промышленного производства синтетичес-
кого каучука из этанола разработал:
1) Н. А. Прилежаев; 2) Н. Н. Зинин;
3) С. В. Лебедев; 4) А. М. Бутлеров.
8. Для получения тугоплавкого стекла используют:
1) К^О,, СаСО3, SiO2; 2) Na2CO3, СаСО3, SiO2;
3) NaHCO3, СаСО3, SiO2; 4) ДЕД, К2СО3, SiO2.
— 927 ------
9. Накипь на стенках чайника можно удалить с помощью:
1) водного раствора питьевой соды;
2) уксусной кислоты;
3) водного раствора нитрата калия;
4) бензина.
10. Химиз реакции горения спички отражает схема:
1) КС1О3 -> КС1 + О2;
2) Р + О2 —> Р2О5;
3) КС1О3 + Р —» КС1 + Р2о5;
4) Са3(РО4)2 + SiO2 -> CaSiO3 + Р2О5.
ТЕСТ 5
1. Вспышка на раскаленном угольке используется для
распознавания:
1) силикатов; 2) фосфатов;
3)селитр; 4)карбонатов.
2. В число основных компонентов цемента НЕ входит:
1) СаО; 2) MgO; 3) А12О3; 4) SiO2.
3. Внесение известняка в почву способствует:
1) повышению кислотности;
2) понижению кислотности;
3) обогащению питательными элементами;
4) удалению из почвы фосфора.
4. В организме человека кальций концентрируется в кос-
тях преимущественно в виде различных солей кислоты:
1) угольной; 2) серной;
3) соляной; 4) фосфорной.
5. К ядовитым веществам НЕ относится:
1) фенол; 2) бензол; 3) метанол; 4) крахмал.
6. В состав черного пороха входят:
1) KNO3; 2) SiO2; 3) С; 4) S.
--- 928 ---
7. Явление, называемое «кислотным дождем», обус-
ловлено повышением содержания в атмосфере оксида,
формула которого:
1) СО2; 2) SiO2; 3) NO2; 4) СО.
8. Для нейтрализации болезненного действия избы-
точной кислоты желудочного сока необходимо прини-
мать вовнутрь:
1) медный купорос; 2) питьевую соду;
3) натриевую селитру; 4) нашатырь.
9. Картофель в промышленности используется для
получения:
1) жиров; 2) белка; 3) целлюлозы; 4) крахмала.
10. В жизненных процессах животных и человека
глюкоза:
1) является источником энергии;
2) выполняет роль катализатора;
3) участвует в синтезе жиров;
4) участвует в синтезе белков.
ТЕСТ 6
1. В организме человека центральную роль в энерге-
тическом обмене играет:
1) крахмал; 2) глюкоза; 3) сахароза; 4) фруктоза.
2. Для получения кислорода в лаборатории НЕ ис-
пользуют:
I) Н2О2; 2) КМпО4; 3) КС1О3; 4) СиО.
3. Сырьем для промышленного производства ацетат-
ного волокна является:
1) крахмал; 2) гликоген; 3) целлюлоза; 4) сахароза.
4. Какой углевод является резервным в организме че-
ловека?
1) целлюлоза; 2) крахмал; 3) гликоген; 4) лактоза.
— 929 —
5. При заболевании сахарным диабетом в крови че-
ловека повьциается содержание: (
1) глюкозы; 2) фруктозы; 3) мальтозы; 4) лактозы.
6. Для дезинфекции ран и порезов НЕ используются:
1) иодная настойка; 2) пероксид водорода;
3) нашатырный спирт; 4) питьевая сода.
7. В процессах пищеварения в организме человека
важную роль играет кислота:
1) уксусная; 2) соляная; 3) бензойная; 4) фосфорная.
8. Для получения различных удобрений используют
кислоты:
1) Н3РО4; 2) Н2СО3; 3) HNO3; 4) H2SO4.
9. В жесткой воде моющие свойства исчезают у ве-
ществ, формулы которых:
1) C|7H35COONa; 2) CH3(CH2)uOSO3ONa;
3) С17Н33СООК; 4) C|5H3,COONa.
10. В алюминиевой посуде НЕ рекомендуется:
1) готовить маринады; 2) готовить кислые щи;
3) кипятить раствор соды; 4) кипятить молоко.
ТЕСТ 7
1. В процессе фотосинтеза зеленое растение усваива-
ет углекислый газ и образует:
1) глюкозу; 2) азот; 3) кислород; 4) уксусную кислоту.
2. С помощью хлорофилла в зеленом растении обра-
зуется:
1) азот; 2) вода; 3) глюкоза; 4) углекислый газ.
3. Мономер для производства полистирола получа-
ют дегидрированием:
1) циклогексана; 2) метилциклогексана;
3) толуола; 4) этилбензола.
— 930 —
4. Аденозинтрифосфат (АТФ) можно рассматривать как:
I) сложный эфир на основе серной кислоты;
2) сложный эфир на основе фосфорной кислоты;
3) производное глицина;
4) триглицерид.
5. Катализатор обязательно используется в промыш-
ленных процессах:
1) синтез аммиака из простых веществ;
2) обжиг пирита;
3) окисление SO2 в SO3 при производстве H2SO4;
4) получение метанола из синтез-газа.
6. Какой спирт называют «древесным»?
1) этанол; 2) метанол; 3) этиленгликоль; 4) глицерин.
7. Изделия из железа покрывают масляной краской,
потому что она:
1) препятствует соприкосновению железа с азотом;
2) делает поверхность более гладкой;
3) предохраняет железо от контакта с кислородом и
влагой;
4) отражает солнечные лучи.
8. Металл, который легко испаряется при комнатной
температуре и вызывает тяжелые отравления, — это:
1) железо; 2) цинк; 3) алюминий; 4) ртуть.
9. Натрий можно хранить под слоем:
1) керосина; 2) воды;
3) 1-хлорпропана; 4) этанола.
10. Водород в промышленности используется для
получения:
1) аммиака; 2) воды; 3) метанола; 4) маргарина.
— 931
ОТВЕТЫ
ТЕМА№1
Вещество и его свойства
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3 4 3 2 2 2,4 3,4 2,4 2,4 2,3
2 1,2,3 4 1 2 1,2,3 2 2,3 3 1,3 2,4
3 1,2,4 1,2,3 2,4 2,4 3,4 2 3,4 1,3,4 3,4 2,4
4 4 | 1,3 1,4 1 3 1,3 2 4 1,4 3
5 4 2 1,3 2,3,4 2 2,4 1,2,3 3,4 1,2,4 1,3
ТЕМА №2
Атом. Химический элемент
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3,4 1,2,3 2,4 2 1,2,4 1,2,3 2 1,3,4 1,4 2,3,4
2 1,2 2 1,3,4 2,3 3 1,2,3 2,4 1,2 1,2,3 3
3 4 1,3 2 1,3 1,3 1,2,4 2,3,4 2,4 2 2,4
4 1,4 1,4 1,2,4 2,4 4 1,4 1,4 2,4 4 2,3
5 4 2 1 3 1 2 1,3 2,4 4 2,4
6 4 1 2,3 1,3 1,3 1,2 4 3 2 2,4
7 1 4 4 3 1,4 3 2 2,3,4 2 4
8 2,3 1 1,2,4 2 1 2,3 2,3 4 4 1,3
9 2 1 4 3 2,3 1,3 4 3 4 3,4
ТЕМА№3
Моль. Закон Авогадро
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2 3 4 2,3,4 2,3,4 1,3 4 1,2,4 2,3,4 1,3
2 1 2 2 1 3 2 3 2 2 1,3
3 3 4 4 3 4 3 2 2,3,4 2,4 1,4
4 1,2 1,2,4 2 2,4 2 2 1,3,4 2,4 2,4 3
--- 932 ---
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
5 4 2,3,4 2,3,4 2,3,4 1,2,4 1,2,4 4 1,3,4 3 1,2,3
6 1 2 2 2 2,4 2,3 1,3.4 4 2 2,3,4
7 4 3 3 2 1 2 3 3 4 3
8 4 1 4 2 1 1,4 1 2 4 3
ТЕМА №4
Типовые расчетные задачи
1 14,55 г 20 1,10 39 7,31 • 10 33 г
2 6,02 10“ 21 12 40 Fe
3 17,0г 22 55% 41 4 дм3 N2
4 2 23 73,8% 42 17,5г
5 32 24 66,7% 43 2,69 10|у
6 28 г/моль 25 1,435 44 7,0 г
7 44 г/моль 26 17,1г 45 16 г/моль
8 14,5 27 8 46 2,625 г
9 43,7% 28 108 см3 47 В 5 раз больше в порции метана
10 12,8 29 0,5 г 48 В 2 раза больше в порции аммиака
11 2 г 30 0,3 моль 49 303 г
12 1,806 10“ 31 7,1г 50 16,3 г
13 0,279 моль 32 С12О5 51 3,1г
14 2,78 г 33 57,1% 52 14
15 2,93 г 34 С12О3 53 5,0 г
16 10,65 г 35 КС1О2 54 6,17
17 9,7 г 36 1,806- 1033 55 0,967 г/дм?
18 1,12 дм3 37 Р4 56 129 г
19 1,204- 1034 38 11,0 57 26,9 дм3
58 75 % 66 13,95 74 35,48 %
59 24,7 % 67 44 г/моль 75 3,45 г
60 6,79 г 68 0,713 дм3 76 0,668
61 0,914 г 69 57,1% 77 11,38%
62 С2Н2 70 8% 78 C2H7N
63 0,729 г/см3 71 59,2 г 79 8/7
64 0,287 72 34,2 дм3 80 8/7
65 0,633 73 14,29 %
--- 933 ----
ТЕМА №5
Строение
ядер атомов.
Изотопы
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3,4 2 3 2,4 2 1,3 4 2,4 1,3 1,3,4
2 4 4 2,4 4 4 1,3 1,2 2,3 4 3
3 3 3 2 1 2 2 4 1 2 3
4 2 2,3 2 2,3,4 2 3 2 4 4 2
5 3 3,4 2,4 2,3 2,3,4 1,2,4 4 4 3 4
6 1 4 1,3 2,4 4 1,4 1,2 1 3 2
7 3, 4 3 2 3 1 4 2 4 3
8 2 3 3 2 3 2 2 2 2 2
9 2 2 2,3 1 2 1,3,4 2 4 3 1
10 2 3 3 2 3 4 4 2 1 2
И 3 4 2 3 1 2 3 4 2 4
ТЕМА №6
Электронные
оболочки атомов
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3 4. 4 3 2,3,4 1 2,4 2 1 3
2 4 3 1 3 3 3 I 3 ] 3
3 2 1,3 3,4 3 3 1,3 1,2,4 2 1 4
4 3 2 4 3 3 2 3 1 2,3,4 4
5 1,2,3 2 1 3,4 1,2,4 2 4 2 3 1
6 2,3 2 1 4 3 2 2,3 3 3 2,3
7 2,3 3 3 2 2 2,3,4 1 3 4 4
8 3,4 1,3,4 1 2 2 2,4 2,3,4 4 4 3
9 2 2,4 2 2,4 2 1,2,3 3 3 2 3
10 1,2,3 1 2 1,4 2,4 1,2 2,3,4 4 3 1,2
И 1,2,3 1 4 2 3,4 1,4 2,4 3,4 2 3
--- 934 ---
ТЕМА №7
Периодическая система
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3 3 1,3,4 2,3 1 2,3,4 3 2 1,3 2,4
2 2,3 2,3 3 3 4 2 3 4 2,3 2,4
3 4 4 1,3,4 1,3 1,3,4 3 4 2 3 1,2,3
4 3 4 2 3 1 1 4 1 2 1
5 2 2 1 3 1 1,3 1,3,4 1,4 2,3 1,2
6 1,3,4 4 3 3 4 2,3 2,4 2,4 2,4 2
7 1 1,4 2 1,2,3 3 3 1 1,3,4 4 3
8 2,4 1,3 2 2,3 1,3,4 1,4 2,3 4 2 2
9 4 3 3 2 2 3,4 2 1,3,4 2 2
10 2,4 1,3 4 4 1,2,4 2 2 4 3,4 1,4
11 3 2 3 1,2,4 2,3 3 3 3 4 ' 3
12 3 1 3 4 4 2 2 2 1,2,3 1,2,3
ТЕМА №8
Ковалентная связь
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,3 1,2,3 1 1,3 4 1,4 3 2 3 3
2 2 3 1 3 1 1 3 2 2 3
3 2 2 1 3 2 3 3 4 4 1
4 3 3 3 2 3 2,3 2 3,4 2 1
5 2 2 2 4 3 3 2 2,3,4 3 1
6 3 1,2,4 2 1,3 2,3 2,4 2 3,4 1,2,3 1,3,4
7 2,3 2 2,3,4 2 3 2,4 2,3,4 2,3 2,3 1,4
8 1,3 1,2 2 3 2,3 3 3 2,4 2,3 1,4
9 1,2 2 4 1,3,4 3 1,2 1,4 1,3 1,4 1,4
10 4 3 1,3,4 1 2,4 4 3 3 2 2,3,4
11 1,3 2 1,3 2,3 1 2 1,3,4 1 4 4
12 1,3 2 3 1,4 3 2,4 2,3 2,3,4 4 2
13 1,4 3 1,2,3 1,3,4 2 2,4 2 2,4 3 2
14 4 1,2,3 1,2,3 2 2 2 2,3 3,4 1,3,4 2,3
15 2,3,4 2,3,4 2,3 2,4 2,3 4 1,4 2,3,4 2,3 1
--- 935 ----
№ _________________Номер тестового задания
теста 1 2 3 4 5 6 7 8 9 10
16 4 2 1,2 2,3 3 2,3 1,3,4 2,4 1,2,4 1,4
17 2 1 2,3 2,4 4 2 1,2,3 1 3 2
18 1,4 2,3 4 3 1 2,4 3 4 1,2 1,3
ТЕМА №9
Ионная, металлическая, водородная связи
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,4 2,3 1,4 1,4 2,3 1,2,4 3 2 4 1,2,4
2 1,2,4 2 2 1,3 1,3 1,4 2,3 2,3,4 1,2,3 1,2,4
3 3 2,4 4 3 3 3 2,4 2,3,4 1 2
4 2,4 2 2,4 2,3 4 2 2 2,3 4 2
5 1,3,4 2 1,3,4 4 3 2,3 1,4 2 4 1,2
6 2,3 2,3 1,3 1,3 4 2 2 2 2 1,3
7 4 1,3,4 3 2,3,4 1,2 3 3 3 2 4
8 2 3 3 2 2 1,3 1,2,3 2 2 3
9 3 1 4 4 2 2,3 4 3,4 1,2,4 3
ТЕМА №10
Валентность. Степень окисления
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2 1 3,4 3 3 2,4 1,2 1,3,4 3 2,3
2 2 2,4 1,2 2,3 2 2 2,3 2,3 2 2,3
3 3 2 3 4 4 2,3 1,3 2,4 2,3 2
4 4 1 3 1 3 2,4 1 2 2 2
5 1,2,3 1,4 3,4 2 3 2 4 4 2 1,3
6 2 1 3 1 1,2 2,3 4 1,4 2,3,4 2,3
7 2,3,4 2,4 1,3,4 2 2,3 3,4 1 2 3,4 2
8 1 3 3 1,4 1 1,2 2,3,4 4 3,4 2,3,4
9 4 1,4 4 4 2 2,3 2 1,3,4 1,2 2,4
10 2,3 1,2,3 2,3,4 1,4 3,4 1 2 1,2,4 1,2,4 2
11 2,3 1 2,4 2 3,4 2 4 2,4 1,3 1,4
12 3 3 1,2,4 1,2,3 3 1 2,3,4 2,3 2 1
13 2 3 4 4 1,2 2,3 3,4 2 1,2,3 1,2,4
14 1,4 1 3 1,4 3,4 3 4 4 3 3
--- 936 ---
ТЕМА №11
Оксиды
№ _________________Номер тестового задания
теста 1 2 3 4 5 6 7 8 9 10
1 1,2,4 3 2 1 1 2 4 1 2 1
2 1 1 3 2 2 2 1 1 4 3
3 1,2,4 1,3,4 2,3 1,2 1,4 4 2,4 2 1,2,3 1,2
4 1,2,4 4 2 3 4 2 1 2 2 2,4
5 2 3 3 4 3 2 1,4 3 2 3
6 4 2,4 1,3 2,4 2,3 2,3 2,4 1 2,3 2,3
7 3 1 2,3 2,3,4 2,4 3 2,3,4 3,4 1 3,4
8 2,3,4 1,3 2 2,3 1 1,3,4 1,4 2 1,2 2,3
9 1 1 1,4 1,4 2 3 3 4 1,3 3
10 2,4 3,4 1,3,4 2 4 1,2,4 2 2 2,3,4 3,4
11 3,4 2 2,4 2 2,4 4 1,3,4 3 2 4
12 3 1 2 2,3,4 1 4 2,3 2 2 2
13 2,4 2,3 1,2 2,3,4 2 3,4 1,4 1,2,3 2 1,2,4
ТЕМА № 12
Основания
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1 2 4 2 1 4 1 1 4 2
2 1,4 1,3 1,2 4 2,4 1,4 4 2,4 2,3 2
3 2 2,4 1,2,4 2,3 2,4 2 2 2,4 2,3 2,3
4 1,3 1,4 1 2,3,4 1,2,3 3 1,2,3 2,3 2,3,4 2
5 3 1,2,4 2,3,4 2,4 2,4 1,2 2,3 2,3,4 3,4 2
6 3 1,3 3 3 1,2,4 2 3,4 1,3 2,4 1,2,4
7 2 4 3 1,3 2,4 4 2 2,4 3,4 2
ТЕМА №13
Кислоты
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,3 1,4 1,4 1,3,4 2,4 2 2,4 2,3,4 1 2,4
2 1,2,4 1,3,4 1,3 1,3 3,4 1,2 2,3 1 1,3,4 1,2
3 2,3 1,3 1,2,3 3 1,2,3 2,3,4 2,4 4 1,3 2,3
--- 937 ---
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
4 3 2 3 3 2 3 2 1 2 3
5 3 2 2 1,3,4 2,4 1,2,4 2 1,2 2 1,2,3
6 2,4 4 1 2,3 2,4 4 1,2,3 1,2,4 2 2,3,4
7 2 4 3 3 2,3 2,4 1,3 2 2 1,3
ТЕМА №14
Соли
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,3 4 2,4 1 1,4 3 2,3 2,3,4 2,3 4
2 1 2 4 3 2 3 3 3 1 1
3 1,3 2,4 2,4 3,4 2,3 2 1,2,4 2,3 1,4 4
4 3 1,4 3 2,3 1,4 2 2,3 3,4 2 2,4
5 2,4 1 1 1,4 1,2 2,3 2,4 1,2 3 2,3,4
6 2,4 1,2,3 4 3 2,3 1,3 1,2,3 1,2,4 2,4 2,3
7 2,3,4 2,4 1 2,4 1,3 4 2,3,4 2,3,4 3 3,4
8 2,3,4 1 1,3 1,4 2,3 1,3 1,2 2,4 3 1,2,3
9 1,2 1,2,3 2,4 3 2,3 2,4 2,3 2,3,4 1,2,4 2,3
10 1,4 1,3 2,3,4 1,4 1 1,2 3 2,4 3 1,2,3
11 3 2 3 2 2 4 1 3,4 1,2 2
12 3 1 2 1,2 2 4 2 2,4 1,2 1,3,4
13 4 3 2,3,4 2 1,3,4 1,2 2 1,3 3,4 3
14 4 1,4 3 1,2 4 2 2 4 3,4 1,3,4
ТЕМА №15
Связь между классами неорганических веществ
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,3,4 1,3,4 3 2,3,4 1,4 1,2,3 1,2,3 1,3 2,4 3,4
2 1,4 2,4 2,3 2,3,4 2,3,4 2,3 1,3 1,3,4 1,3 2,3,4
3 3,4 1,3,4 2 3 1,3,4 3 3 1,2,3 1,3 2,3
4 4 3 1,3,4 1,2,4 2,4 3 2,3 1,2,4 1,2,4 2,3
5 1,3 1,2,4 2 3 1,4 3,4 3 2 3 3,4
6 2 2 1 3 3 2,4 4 2,3 1,2,3 2
7 2,4 3 4 2 4 1 3 4 4 3
--- 938 ---
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
8 3 2 2,3 4 3,4 2,4 2,4 3 3 1
9 Na:CO, К,[Л|(ОН). ] FcCh FcCh Fc(OH)x Fc(OH>2 NaHCO? Ca(HCO02 BaCOx CaCOx
10 1,23 2,3,4 4 3 2 1 2,3 2 1,2,4 1,4
ТЕМА № 16
Классификация
химических
реакций
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3,4 2,3 1,2,3 1,4 2,4 1,2 1,2,3 1,2,4 1,3,4 2,3
2 1 2 3 3 1,3,4 1 3 3,4 3,4 3,4
3 2 1,3 1,3,4 1 4 3 2,4 2,4 1,2 2
4 4 2 4 2,4 2,3,4 3 3 3 2 1,2
ТЕМА № 17
Окислительно-восстановительные
реакции
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3 1,3,4 2,4 2,4 2 2,3 2,3 1,2,3 2 2
2 3 3 1,4 2,3,4 1,3,4 2,3,4 2 3 2 1
3 4 2 3 2,4 4 1 3 2 4 3
4 2 2,4 2,3 1,2,3 2,4 3,4 3,4 2 1,4 2,4
5 1 3 1,2,3 2,3 1,3 3 1,3 2 1,2 3
6 1,4 1,3,4 1,2,3 3,4 2,3,4 2 1,3 2,3,4 1,3,4 1,2
7 4 1 4 2,4 2 1 3 1 3 2
8 2,3 2,3 3 1,4 2 2 1,3 3 1,3 2
9 2 2,4 2 4 1 3 1 4 2 1
10 4 3 2 4 1 1 3 3 1 3
--- 939 ---
ТЕМА №18
Тепловой эффект
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3 2,3 3 1 2 3 2 2 3 2
2 1,3 2,3,4 1,2,3 1 3 1,4 1,2,3 1 3 4
ТЕМА №19
Скорость. Равновесие
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,4 3 1 3 2 2,4 1 4 2,3,4 1,2
2 2 3,4 4 1 1,2 1 1,2,3 2 1,2,3 1,2,4
3 1,2,4 1,3,4 1,2,4 1,2 2,3 2,3 3,4 1,2 2,4 4
4 1,3 4 1,2,4 1,3,4 2,3 1,2,3 1 1,3 3 1,2,3
5 2,3 2,3 3 4 2 3,4 3 2,3 1,2,4 3
6 1,2 1 1,3,4 2,4 1,3 2,3,4 2,4 3 1,4 2,4
7 1 2 4 4 1 4 4 4 1 1
8 2,4 1 1,4 3 3 4 2 2 4 1,4
9 2,3,4 4 3 2 4 3 2 3 3 3
10 1 4 1 3 3 2 3 2 3 3
ТЕМА № 20
Растворы
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,3 3,4 2,3 1,2 1,3 3 3 3 2 3,4
2 4 1,2,4 1,2,4 3 1,2,3 3 1,2,3 1 1,2,3 1
3 3 1,3 3,4 2,3 1,3 1,3 1 4 2 1,2
4 1,3,4 1,3 1 1,3,4 2,3,4 3 2,3,4 2,4 2 1
5 1,3,4 2,4 1,3 1,2,3 2,3,4 3 4 1,3 3 1,2
6 1,4 1,2,3 1,3,4 1,2 1,2,4 1,4 3 3 2 4
7 1,2,3 3 1,2,3 1,4,2 4 1,3,4 1,2,3 3 1,3 3
8 2,3 3,4 1,3,4 1,2,4 4 3 1,2 1,3 2 2
9 3 1,2,3 1,3 3 1 1,2 1 1,2 2 1
10 1 3 1 2 1 4 3 3 2 2
11 3 4 3 4 2 3 1 1 3 3
--- 940 ---
ТЕМА №21
Электролитическая диссоциация
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3 2 2,3 2,3 2 2 1 1,2 1,3 2,3
2 3,4 1,4 4 3 3,4 1,2,3 2,4 2,3 2 2
3 3 1 2,4 2 2 2 4 1,3,4 1 3
4 1,2,3 1 4 3 3 3 2 3 3 4
5 4 4 3,4 1,2,3 2,3 1 3,4 4 1,2,4 1,3,4
6 3 2 4 4 3,4 2 3 2 2 3
7 3 2 4 4 4 4 4 . 2 2 1,4
8 2,3 2 4 2 1 4 3,4 1,2 4 3
9 4 2,4 2,4 1,3 4 3,4 2,3 4 3 1,2
10 2,3,4 3 3 1,3,4 3,4 2,4 3 2 3 1,2
И 3 3 4 1 1,3,4 3 4 2 3 1,2
12 2,3 1,2 4 2,3,4 2,3,4 2,3 1,2 2 3 3
13 4 1,2 3,4 3 2 4 1 3 2 3
14 3 3 4 4 2,4 1 1 1,3 2,3 1,2
15 3 3 1,2,4 1 3 2 1 1 2 1
16 2,3 2 4 2 3 3 2 3 3 1
17 2 4 1 2 4 2 3 4 4 2
18 4 2 3 1 2 3 1 3 3 3
ТЕМА № 22
Ионные уравнения
№ теста Номер тестового задания
1 2 3 4 5 6 7 . 8 9 10
1 1,4 2,4 3 3 1,4 1,3 2 4 4 3
2 1,3,4 4 3 3 1,3 1,2 1 2 3,4 3,4
3 2 4 2,3 3 1,3 1 3 3 3 3
4 2,3 2,3,4 1,4 1,3 2,3 3 1,3 1,2,3 1,3 3,4
5 1,2,4 2,3 2,3,4 1 2 1,2,3 1,4 2,3 4 1,4
6 4 4 1,4 2,4 2,4 1,3,4 2 2,4 3 3
7 3 2 3,4 2,3,4 2,4 2 2,3 3,4 2,4 3
8 2 2 3 2,3 2 1,4 1,3 1,2,3 3 3
9 2 2,4 2,3 1 2 2 3 2 3 2
10 3 4 3 1 3 1 3 2 4 2
11 1,2 2,4 3 1 3 2 1 1,2 2 2,4
--- 941
ТЕМА № 23
Неметаллы ’
' № теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 4 1 3 3,4 1,4 2,4 2,4 2,3 2,3
2 2,4 2,4 2,4 3,4 1,2,4 1,3 2 2 '2.4 3
3 3 1 2,3 3 2,3 1,3 2,4 2,3 п 3
4 2 1,3,4 1,3,4 2 1 3 1,2,4 1 1 1,4
5 3 3,4 3 1,3 1 2,3,4 3,4 1,2 4 2
6 4 4 1,4 2 2,3,4 2,3,4 2,3,4 2,3 2,3,4 4
ТЕМА №24
Водород. Вода
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3 2,3,4 3 1,3,4 2 2 2 3,4 4 Г
2 1,2,4 1,4 1,2,3 2,4 1,2,3 1 1,3 2 2 4
3 3,4 1,2 4 2,4 1,2 2,3 3 3 1,2,4 2,3,4
4 1,3,4 2,3,4 4 2 2 1,2,3 1,3 1,3,4 2,3,4 2,4
5 2,4 1,3,4 2,3,4 1,3,4 4 1 2 3 1,3 2
6 3 3 2,3 4 2,3 2 4 1,3,4 1,3,4 1,2,3
7 2,3,4 1 1 3 4 1 2 3 4 1,2
8 4 1,4 3 1,3 1 3,4 2,3 1 4 1,4
ТЕМА №25
Галогены. Хлор
№ тепа Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,4 1,4 4 2 1 1,3 3 2,4 1 3,4
2 1,2 2,3,4 4 2,3 4 2,4 4 2 2,3 2
3 1,4 1,2,3 1,2,3 2,4 3 2,4 3 2,3,4 2,3 2,3
4 1,3,4 1,2 1,3 2,4 4 4 3 4 2 4
5 1,4 4 2,3 4 2 3 3,4 1 2,3 2,3,4
6 3 1,2,4 3 2,4 1,4 3 2 1 2,3 1,2
7 2,4 1 1,3,4 1,2,4 2 4 1 4 4 4
8 1,3 2 1,4 1,4 2 2 3 2,4 3 4
9 1 2 3 2,4 1,2,3 4 1,3,4 3 2 3,4
10 3 2 4 2,3,4 3 2 4 3 2,3,4 3,4
--- 942 ---
ТЕМА № 26
Халькогены. Кислород
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3,4 1 3 3 3 1,3 4 2 3,4 2,3,4
2 1,2 2 1 1,2,4 4 3 1,4 4 1,2 2
3 1,4 2,3,4 2,3 2,4 1 2 3 4 1,4 3
4 2 3,4 2,4 3,4 3 3 2 4 3,4 1
5 2,4 1,3 3 4 2,4 1,3 3 3 2 1
ТЕМА №27
Сера. Оксиды серы. Сероводород
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3,4 3 1,4 1,3,4 2,3 2 1,3 2,4 1,2 2
2 2,3,4 2,3 1,3 1,3,4 3,4 2,4 3 3 1,2 1,4
3 1,2,4 2 2 1,2,3 1,4 2 3 1,3 1,3,4 1
4 2 2 1 2,3,4 1,2 1,2 4 1,3,4 1,2 1
5 2,4 1 1,2,4 1,3 1,4 3 1,2 4 1,3,4 1,2
6 2,3 1,3 1,4 2,3 4 1,3 2,3 2,4 3 3
7 2,3 2 3 2 1,2,3 4 1,2,4 1,3 2,4 2
8 1 4 3 2 1 3 2 3 1 3
ТЕМА №28
Серная кислота
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3 1,3,4 1,2,4 1 2,3 2,3 2,3,4 3 1,4 1,2,3
2 2,4 2,3 1,2,3 1,2,3 1,3 2,3 1,3,4 3 2 1,2,4
3 1,2,3 1,2 3 2,3,4 1,2 1 1,2,4 2,3 2 1,2,3
4 2,4 1,4 2,3,4 1,3 2,3 3 2,3,4 2,4 2,4 2,3
5 1,2 1,4 1,2,3 2 2,3 3,4 3 3 3 4
6 1 1,2 2 1 3 3 4 3 3,4 1
7 1 2 2 1,4 2 1 4 2 1 3
--- 943 —_
ТЕМА № 29
Элементы VA группы.
Азот и его оксиды.
Аммиак
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3,4 4 2 2,3,4 4 1,3,4 3 4 1,2,3 1,3,4
2 2,3 2,3,4 2 2,3 4 1,2,4 3,4 1,3 2 1
3 1,3,4 4 1 2,4 2,4 1,4 1,2,3 3 2,3,4 2
4 2,4 1,2,3 1,3 1,2,3 1,4 2,3,4 1 2,4 1,3,4 2,3
5 1,4 2,3,4 2 2,3 2 1,3,4 1,2 1,2,3 1,2,4 1,3
6 2 2,3 2,3,4 1,4 3,4 1,2 1,3 1,2,3 2 2
7 1,3 1 3 2,3,4 2,3 1,2,3 2,3,4 2,3,4 1 1,3
8 1,2,3 1,3,4 3 1,2,4 1,2,3 1,2,4 3,4 1,3 2,3,4 2
9 2 2 1 4 2,3 3 1 2,4 4 4
10 1,4 1,3 3 4 1,4 3,4 1,3,4 2 1.3 2
11 2,3 1,2 3 2 2,3,4 2,3 3 3,4 1,2,4 1,4
12 3 4 1,4 2 3 1 3 2 3 1,2,3
ТЕМА № 30
Азотная кислота
и ее соли
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,2,4 1,2,4 1,4 3,4 1,2,4 1,3,4 2 2,3 1 1,4
2 3,4 1 4 1,3 2 4 2 2,4 1,3 3
3 2,4 2 2,3 3 1 1 2,3 1,3 2,3 1,2,4
4 2,3 1 2,4 1,4 2 2 2 2 2,3 4
5 1,3 1,4 3 4 4 1,2 2 3 1 3
6 3 3 4 1,2 4 2 3 2 3 1
7 1,3 3 3 1 2,3 1 1 2 2 3
8 2 2 4 2,3,4 2 1,3,4 2 4 4 1,3
9 2 2 3 . 3 1,4 1,2,4 2 2,3 1 3
--- 944 ---
ТЕМА №31
Фосфор и его соединения
№ теста Номер тестового задания
1 2 3 1 4 5 6 7 8 9 10
1 2,3,4 2,3 1,2,4 3,4 1,2,3 1,2,4 1,3,4 1,2,4 2,3,4 3
2 2 2 2,3,4 2,3,4 3 2 3,4 2,3,4 3 1
3 3 1,4 4 1,3,4 3 2 2,3,4 1,2,4 3,4 1,3
4 1,2 2,3 2,3,4 1 3,4 3 1,3,4 2 2,4 2,4
5 3 3 1,2 1 3 1,2,4 1,2,3 2,3,4 3,4 2
6 3 2,4 1,2,4 1,2,3 3 1,3,4 3 4 1,3 1
7 1,3,4 3 3,4 4 1 3 3 1 1,4 2
8 2 3 3 1 4 2 4 2 1 1
ТЕМА №32
Элементы IVА группы. Углерод и его соединения
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,4 1,2 2,3 1,3,4 4 2,3 2,3 1,4 4 2,4
2 1,4 2,3,4 2,3 1,2,4 2 1,3,4 2,3,4 1,3,4 1,2,4 1,2,3
3 1,3,4 1,3 1,3,4 1,2,3 2 2 1 4 1,3 1,2
4 1,3 2,4 2,4 2,4 1,2,3 2 3 2 2 1,3,4
5 2,3 1,4 3 2,4 1,2,3 1 4 1,4 2 1,2,3
6 2 2,3 3,4 1 1,2 4 3 4 3 2,3
7 1,3,4 2 3 2 1,3 1,3 3 1,2,3 4 2
8 1,3,4 2,3,4 1,3,4 1,3,4 3 2 2,4 2 2,4 1,2,3
9 2 1,2 1,2,4 2,3 1,3 1 1,2,4 2 2 4
10 3 2 3 4 3 1 3,4 3,4 1 2
ТЕМА №33
Кремний и его соединения
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 4 2 1 1,3,4 1,2,3 4 4 1 3 2
2 3 1,2,4 2,4 1,2 2,3 1 1,2,4 2,3,4 1,2,3 3
3 1,2,4 1,2,4 1,4 1,2,4 1,3,4 1,2 1,4 1,4 2,3 1,2
31 Зак 1530
— 945 —
№ _________________Номер тестового задания
теста 1 2 3 4 5; 6 7 8 9 10
4 2 2 2,3 1 3 . 2 2,4 4 3 3
5 2 4 1 4 3 2 2 4 3,4 1,3,4
6 1,3 1,2,4 1,2,4 1 3 3,4 1 4 4 3
ТЕМА №34
Металлы: общая характеристика
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3 1,4 2 1,2,4 2 2,3 4 1 2,3 2
2 2,3,4 2,3 2,4 4 1,4 2,4 3 4 2 2
3 1,3,4 3 2 3 2 3 2,3 1,2 1,2 2,3
4 2,3,4 1 1,2,4 2,4 3 3 4 1,2 3 1,4
5 2,3,4 2 2,4 1,3,4 2 „ 2,3 4 1 3,4 3
6 3,4 1,2 2,4 4 1,2 1,2 1,4 1,3 2,3 2,3
7 1,4 3 1,2 1,2 1 4 4 1,2 2 4
8 2,3,4 4 2,3 2 1,4 4 1 2 4 3
9 3,4 2 4 1,2 2 1 3,4 2,3 3 2,3
10 1,2,4 1,2,3 1 3 1 1 4 4 4 3,4
ТЕМА №35
Щелочные и щелочноземельные металлы.
Жесткость воды
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,2,4 2 2 1,3 2 2,3,4 1 1,4 1,2,4 3
2 1,2 2,4 1,3,4 4 1 1,2,3 1,2,4 1,2 3 4
3 1,2 2 3 1,3,4 1,2,3 3 3 2,3 3,4 4
4 2,3,4 1,3,4 2,4 1,2,3 3 2 1,2 4 2,4 3
' 5 2,3 2,3 2,4 4 4 3 2 3,4 2,3,4 3,4
6 1,3,4 2 3 2,3,4 1 2,3 3 2 1 1
7 3,4 3 3 2 3 2,3 1 3 3 2,3,4
8 2,3 3 4 2 1,3 1 1,3,4 2 4 3
9 2,4 1 1 2,3,4 1,3 1 3,4 2,4 4 1
--- 946 ---
ТЕМА №36
Алюминий
и его соединения
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,4 1,2,4 1,4 2,3 4 3 1 1 2.3 3
2 1 3 1,2,4 2,3 1,4 1 1,3,4 1,3 2 2
3 4 3,4 1,4 2,3,4 2,3 1,4 4 2,3 1,4 1
4 1,2,4 2,4 3,4 4 4 1,3 4 4 4 3
5 2 4 3 2 4 1,3,4 1,2 4 2,4 2,4
6 2 1,2,3 4 1,3 2 3,4 3,4 1,3 4 2
7 3 3 1 2 2 3,4 2,3,4 1,3,4 1,2,4 2
8 2 2 3,4 1 2,4 4 2 2 2,4 3
ТЕМА №37
Металлы Б группы.
Бериллий
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,2,3 1,3 3 1,3 2,3 2 2 1,3,4 1,3,4 3
2 1 3 4 2,3,4 1,2,3 1,4 3 2,4 1,3,4 2,3
3 2,3,4 2 4 2,3,4 3 2,3,4 3 4 2 4
4 1 2,3 2,3,4 2 2 1,3,4 3 3 2 1
5 2,3 1,2 2 2,3,4 1,2,4 1,4 3,4 2,3 2,3,4 2
6 1,3 1,3 2 2,3 4 4 3 2 2,4 4
7 2,3 1,4 1,3,4 1,4 2 3,4 2,3 2,3,4 1,3,4 2
8 1,2,3 1,2,3 1,2,3 1,3,4 1 2 2,3,4 1,2,3 2,3 ]
9 3 3 4 1,4 2 4 4 1. 3 2,3
10 4 2 1 3 1 1. 1 2,4 2,4 3
--- 947 ---
ТЕМА №38
Обобщение
химии элементов
1 63 19 331 37 224 55 565
2 360 20 274 38 526 56 72
3 167 21 118 39 356 57 269
4 193 22 324 40 589 58 298
5 322,5 23 292 41 298 59 242
6 344 24 207,5 42 146 60 226
7 390 25 66 43 213 61 263
8 56 26 446 44 115 62 424
9 182 27 76 45 222 63 143
10 266 28 ' 274 46 310 64 242
11 268 29 205 47 179,5 65 544
12 174 30 108 48 532 66 332
13 93 31 546 49 96 67 182
14 136 32 70 . 50 409 68 310
15 211 33 473 51 160 69 160
16 288 34 212' 52 238 70 254
17 332 35 262 53 266
18 564 36 404 54 208
ТЕМА №39
Общие положения
органической химии
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,4 3 3 3 1 3 1 1,2,4 2 1,2
2 3 1 3 3,4 2 1 2 4 1,2,3 2
3 1,2,4 1 4 2 3 1 1,4 3 1,3 1
4 2,3 1,2,3 3,4 2 3 3 4 1 1,2,4 3
5 4 3,4,2 2 2,3 2 1,3 1,2,4 2,4 1,4 3
6 2,4 2,4 3 2,3,4 2,3 1,2,4 1,3 1,2,3 4 2,3,4
--- 948 ---
ТЕМА №40
Алканы
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 4 3 1 2,3,4 4 1,3 1,2 2 2,3 1
2 3 4 4 4 1 3 3 4 1,2,3 2
3 3,4 3 2 4,2 2,4 3 3 3 1,2,4 2,4
4 3 3 3 2 2,4 2,3 2 3,4 4 3
5 2,4 4 2 3 4 2,3 2 4 ] 3
6 2 1 3,4 2 3 1,2 2,4 4 1,4
7 2 3 2 1,2 1,3 1 2,4 2,3 1,2,3 1
8 2 2,4 3 2 1,2,3 2 4 4 1 2
9 3 1 2 1 2 2,4 1 2 1,4 2
10 3 2 2 V 4 3 3 1 3 3
11 2 1 3 1 3 2 4 1,2,3 3 2
ТЕМА №41
Циклоалканы
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3 1 2 3,4 2 2 1,3 2 1,2,3 1,2
2 3 1,3,4 1,3,4 4 2 2,3 2,3,4 2 2,3,4 2,3
3 3 2,3 5“ 2,3 2 4 2 1,3 2 3
ТЕМА №42
Алкены
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 4 3 3,4 2 3,4 2 2,4 2 1,2,4 3
2 4 1,3,4 2,3,4 1,2 3 2,4 1 1,2,3 3,4 2
3 3 3 1,3,4 2,3 4 1,3,4 1,3 1,2,3 4 2,3,4
4 3 1,3,4 2,3 1 4 2,3,4 1,3,4 1 3 1,3,4
5 1,2,4 2 2,4 2,3 2,3,4 2,3 3 2,4 1,2,3 2,3,4
6 2 2 4 2 4 1,2,4 1,2,4 1 1 2
7 4 4 1 1 2 1 2 4 2 1
--- 949 ---
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
8 1,4 2 3 2,4 4 3 2,3 1,4 2,4 3
9 3 2,3 3 1 2 1 2 14 1 3
10 4 2 3 2 3 2 3 2,3 2 3
11 1 3 1,3 3 1 4 4 2 2 2,4
ТЕМА № 43
Алкадиены. Каучуки
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,4 2 1 3,4 1,3,4 1,3 2,3 1,2,4 4 4
2 3 3 2,4 3 1,3 1,3,4 4 1,2,4 3 1
3 2 3 3 1 3 4 1,4 1,3 1,4
4 2 1 1,2,3 3 2 2,3 1 2 2 3
ТЕМА №44
Алкины
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3,4 1 3 3 1 1 3 1 1,2,4 3
2 3,4 1 2,3 2,3 1,3 4 2 2,3 2 3
3 2 1 3 2,3,4 3 2 2 1,3,4 3 3
4 4 1 2 2 2 2 4 .1 2,3 1,2
5 1,3 2,4 3,4 3 3 1 2 2 1,3 2,3
6 2 1,2,3 2 3 2,3 1 1,2 1 3 4
ТЕМА №45
Арены
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,2,4 1,3,4 3,4 1,3 2 4 1,2,4 2,3 2 2,3,4
2 1,3,4 2 4 3 1,2,3 1,3 3 3,4 2,4 1
3 1,2,3 1,2,4 2 3 4 2 1,3 3 1,2 1,3
--- 950 ---
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
4 2 1 2,3 3 4 2 2 2,3 1,4 4
5 2 3 4 1 1 1 3 1,2,3 1,3 3
6 3 3,4 4 2 4 3,4 2 1 3,4 3
7 2 2,3,4 2 4 4 2,4 2,3 2 2 2
8 3 3,4 3 3 3 2 4 3 2 4
9 1,2 3 1,3 2 2,3,4 2,3 2 1,2,4 1 3
10 3 2 1 2 2,4 2 3 1 1 3,4
ТЕМА №46
Углеводороды: комбинированные задания
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 4 1,2,3 1,2,3 1,2 3 2 3 1,3,4 3 4
2 1,2,3 3,4 2,4 3,4 1,2,3 1,3 3 2,3 3 1,4
3 2 4 2,3,4 3 1,3 1 1 3 3 1,2
4 3 3 3 2 2,3,4 4 3 3 2,4 2
5 2,4 3 1 1 3 1,2,3 2,3,4 2,4 3 2
6 2 1 3 1 2 3 3 2 2 2
7 4 3 2 3 2,3,4 1,3,4 2,3 2,3,4 2,3 2
8 2 1,3,4 3 1,2 2,3,4 1,2,3 2 1,3,4 1,3 2
9 2 1 2,3,4 2,3,4 1,2,4 2,3,4 1,3,4 1,4 4 2,3,4
10 3 1 2,4 2 2,3 4 1,2,3 4 2,4 4
11 1,3,4 3 3 3,4 3 2 2,3 1,4 1,3,4 2
12 3 1,4 2 3 3 1,2,4 2 2,3,4 4 2,4
13 3,4 2,4 2 4 2,3,4 2,3 2,3 3 4 2,3
14 2 2,4 1,2,4 3 3 2 2 3,4 2 2
15 3 1,2,3 2,4 1 2 2 1 3 1,4 2
16 3 4 1 4 2 3 2 1,4 3,4 1,2,3
17 2,3 2,4 1,3,4 1,3 1,2,4 1,2,3 2,3,4 1,2,3 3 1,2,3
18 1,3 2,3 1,2 2 3 3,4 2,3,4 1,3 4 1
19 3 1 1 1,3,4 1 2,3,4 1,3,4 2 4 3
20 2 2,3,4 3 4 4 4 1,2,4 2,4 2 1
21 3 3 1 1,4 1,4 4 3 1,2,4 4 2
22 3 4 3 3,4 3 1 2 2 2,3 2
23 2,3,4 3 2 2 L3_ 1 3 2 ] 2
24 182 253 4 138 264 170 256 70 3 58
25 198 369 4 396 442 120 0 44 134 44
--- 951
ТЕМА № 47
Одноатомные спирты.
Простые эфиры
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 4 1,4 4 1,3,4 2,3 2,3,4 1,3 1,2,3 1 3
2 3,4 2,3,4 3 1,3 2,3,4 2,3 1,2,4 1,2,3 1,4 4
3 2 1,2,4 2 2 2 3 2,4 1 3 2
4 4 4 3 4 3,4 1,2,4 1,2 1,3 1,3 2,3
5 1,2,4 2 2 2 3 3 2,3,4 2,3,4 4 1,2,3
6 1 2 3 2,3 1,2,4 3 2 3 4 3
7 3 2 2 2,3 3,4 3 1 4 2 1,2,4
8 3 1,3,4 2,4 2,4 2 2 1,2,3 3 1,2,3 2
9 2 3 2 1 2 3 2,3 3 2 2
10 2 2,3 1 3 3,4 1,4 1,3,4 2,3,4 2,3 3
11 1 2 3 3 2 1 3 2 2 4
12 3 1 4 2 3 4 4 ‘ 3 2 3,4
13 3 1,2 1,2,4 3 1 1,3,4 4 2 2,3 2
14 1,2,3 1,4 2,4 1,3,4 1,2 2 3 3 1,2,3 1,4
15 1 1 2 1 1,3 4 2 2,4 1,2 2,3
16 2 2 1,2,3 4 3 1 2 1 2,4 3
17 170 6 242 170 46 46 74 120 228 164,5
ТЕМА №48
Фенолы
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3 1,2,4 2,3 1,2 3 3 3,4 3 4 2
2 3 3 3 3 3 1,2,3 4 2 4 2
3 3 1,2,4 3 3 1,3 1,2 1,2,4 4 2 1,2
4 4 2,3 1,4 2 2,4 1,2,3 2,3 1,2,3 1,2 2,4
5 3 4 2,3 4 1,2,3 3 1,2 2 3 1,4
6 1,3 2,3 2 3 1 2 3 2 1 2
7 2,3 2,4 2 3 1 2 4 3 3,4 2
— 952 —
ТЕМА №49
Альдегиды
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3 3 3 2,4 2 2,3,4 3 4 1 2,3,4
2 3 4 4 1,2,4 3 1 1,3 2 1,3,4 3
3 1,2,4 2,3,4 3,4 3 3 4 3 1 1,2,4 2
4 2 3,4 2,4 4 4 4 4 3 1.4 3
5 3 3 2 2 3 3,4 1 3 2 3
6 1 3 1 1 2 1 3 1,3 1
7 1 3 2,3 2,3 2 2 1 3 1,4 4
8 2 2 3 2 2 2 1 1 1 3
9 2 4 2,3,4 2,3 1,3,4 1 4 3 4 2,4
10 1 2 4 1,2 2 3 1,3,4 3 3 2
ТЕМА №50
Карбоновые
кислоты
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 4 2,4 4 3 1,3,4 3 1,2,4 4 2,3,4 1,2,4
2 1 4 2,3,4 3,4 3 3 3,4 1,2,3 2 1,2
3 3 3 4 1,2 2,3,4 2,3,4 2 4 2 1
4 2 3 2 4 3 1,3 1 1,2,3 2,4 2,4
5 3 3 2,4 3 1,2,3 1,3,4 3 3 1,2,3 2,3,4
6 3 2,3 1 2,3 4 3 1,2,4 3 1,2,3 2
7 4 1,2 1,2,4 2,3 2 2,3 2 2,4 1 4
8 1 2 2 2 3 2 3 3 2 3
9 3 3 3 1,4 4 1,4 1,3 3 2,4 1,3,4
10 2 3 2 3 4 2,3 1,2,4 3,4 2,4 1,3,4
11 2 2 3 3 3 2 1 3 3 3
12 2,3 2 2,4 В 3 3 4 1,2,4 2,3 3
13 2 2 1 1,2,3 3 2 1 1 3 3
14 262,5 369 2 1 3 1,2,3 2 1,3 3 3
--- 953 ----
ТЕМА №51
Сложные эфиры.
Жиры. Мыла
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3 2,3 2 2 2 2,3 2,3 2,3,4 1,2,3 1,2,3
2 1,2,4 1,2,3 3,4 2,4 1,3,4 1,4 2,3 2,3,4 1,4 1,2
3 2,4 1,2,3 2 2,3,4 2 1,2,4 3 3 3 4
4 2 1,3,4 1,4 2,4 4 1,3 1 2 1,2,3 2,3
5 4 2,3 2,4 1,2 2,4 1 3 3 1,2,4 2,3
6 1,4 2,3 4 4 3 4 2 1 1 1,2,4
7 2 4 1 4 2,3,4 3 2 1,3,4 3 2
8 1,3 3 2 3 4 1 4 3 1 2
9 3,4 1,2 2 2 4 1,2,4 3 4 1,3 1,3,4
10 2,3 2,4 2,3,4 1,4 3 3,4 2 3 1,2,3 318
11 2 4 3 1 398 210 244 3 1 1,3
12 2 3 1,3 1,3 2 1,4 4 2 3 1
13 1,2 1,2,3 2,4 2 2 3 2,4 2 3 3
14 1,2,3 4 3 3,4 2,4 1,3 1,2,4 2 2,4 2
15 3 4 3 1,3 2 3 2,3 4 1 4
ТЕМА №52
Моносахариды
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,2,4 3 3 2 2,3 1,2,3 2,4 2,3,4 1,2,4 3
2 1,3,4 1,3,4 1,2,4 3 4 3 1,3 4 1,2,4 1,2,3
3 1 1,3 3,4 3 3 4 1,3 2,3 4 4
4 1,3 1,3 2 2,4 1 3 3 2 3 3
5 2 3 2 3 2 3 2 2,3 2 4
6 3 2 2,3,4 2 3 1,3,4 4 3 4 1,2,3
7 1 4 2 1,3,4 2 4 1 1 1,4 2
--- 954 ---
ТЕМА №53
Ди- и полисахариды
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,3,4 1,2,4 1,3,4 3 3 2 3 1 3 2,4
2 1,2,3 1,3,4 1,2,4 2,3,4 3 1,2,4 3 3 1,3 2,3,4
3 1,2,3 1,3,4 1,2 2,4 2 4 4 1,2,3 2,3 3
4 2 3 4 2 4 1,3,4 2,3 . 2 1,2,3 3
5 : 1 1,4 2,4 3 2 3,4 4 4 3 4
6 1 2 1 4 4 2 3 1 1,2,3 3,4
7 1,2,3 2,4 3 1 4 2 1 1 3 2,4
ТЕМА №54
Обобщение знаний
по кислородсодержащим
производным углеводородов
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,2,4 3,4 2,3 3 1,3 2,4 2,3 1,2,3 2,3 1
2 1 3 2 1,2,3 3 1 1,2 3,4 3 3
3 3 1 1,2,3 1,2,3 3 1,2,4 3,4 3,4 2,4 4
4 2 1,2,3 3 1,4 1,3,4 1 3 1,4 4 1,3
5 1,2,4 2 2,3 3 2,3 2,3 1,2,4 3,4 1,2,3 4
6 4 2,3,4 1,4 1,2,4 1,4 2,3,4 2,4 1,2,3 2,3,4 2,3,4
7 1,2,3 1 4 1 1,2,4 3 2,4 2,4 2 3,4
8 1 2,3,4 3 1 1,2,4 1 1,2,3 3 4 2
9 3 2 2 2 2 1 2,4 2,4 4 1
10 3 2 1 4 3 2 3 3,4 2,3,4 4
11 4 3 2 4 1 2 1,2,4 1,3,4 1 4
12 4 1 4 4 4 2 4 3 1,2 3
13 3 114 246 136 90 176 130 72 772 307
14 72 58 86 408 107 58 106 2 121 226
--- 955 ----
ТЕМА № 55
Амины. Нитросоединения.
Эфиры азотной кислоты
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,4 1,3,4 1,3,4 1 1,3,4 1,2,3 3 1,2 2,3 3,4
2 3 2,3 1,2,4 1,2,4 1,2,4 2 3 1 2,4 2,3
3 1,2 3 2,3 3,4 4 2 3 3 3 3,4
4 1,2,3 1,2,4 1,4 3 4 2,4 2 4 2,3,4 1
5 1,3,4 1,2,4 1,4 1,2,4 2,4 2.3,4 1,2,3 1,3,4 2 3
6 3,4 2,4 1,2,3 4 2,4 2 1,2,3 2 3 1.4
7 4 2 2,3 3 2 2,4 1,2.3 3 2 2
8 3 1 4 2 3,4 4 3 1,2,3 2 2
9 3 4 4 2 3 1,3,4 1,3,4 1.3,4 2,3 1,4
10 1,3 1,3 3 7 3 3 4 2 1,4 3
11 3 2 1 3 2,4 Т~ 2 2 2 1,3,4
12 222,5 63 76 216 154 136 283 136 151,5 164
13 207,5 242 135 149 149 202 121 257 171 202
ТЕМА №56
Аминокислоты. Белки
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1 4 3 3 1 1,3 1,4 1.3 2 1,3,4
2 2 4 3 3 4 1,2,3 4 3 1 2
3 1,4 2,3,4 2,3,4 2 3 2 3 3 1,3,4 1.3,4
4 1 4 3 1,3,4 1,3,4 1,3 4 2,3,4 2 2,3
5 2,3 2 2,3,4 1,3,4 1,3,4 4 4 2,3 2,3
6 2 2,3 2,3,4 1,3,4 3 2 4 2 3
7 3 1 3 2 4 2 2 2 2 2
8 2 1 3 4 4 1.4 2 1 3 1
9 2 4 2 3 4 2 1 2 370 88
10 3 3 2,4 2 2 2,3 4 1,2,4 1,4 2
11 1,3 2 23 2 4 3 4 2 2 2
12 117 226 155 283 31 Т~ 3 2 1 2
--- 956 —
ТЕМА №57
Полимеры
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 1,3 2,3.4 4 3 3 2,3 4 2,3 2
2 2,3 4 3 4 2,4 2 1,2 2,3 3 2
3 4 2 1,2,4 4 2,4 4 1,2 2,3,4 3 1,3,4
4 2 1,3 2 3 3 4 Т- 3 2,4 з.
5 2 2,3,4 1 3 2 3 1 2 2 1
6 2,4 3 1 2 4 3 3 2,3 2 □
7 2,3,1 1 2 2 1 2 4 1 3 ' 2
ТЕМА №58
Идентификация веществ
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 3 3,4 4 2 3 2 1,2,3 2 4 3
2 2,3 3 2,3,4 3,4 1,3 1,2 1,3 2 2 1,2,4
3 1,2,3 1 2 1,2 1 2 1,3,4 1,2,4 2 4
4 2 1 1 1,3 3,4 1,3,4 2,3,4 2,4 1,2,3 2,3
5 4 3,4 2 3 1 1,3 3 4 1,2,4 2,3
6 2. 2,3 3,4 2 2,4 2 3 3 2 1
7 4 2 2 3 2 3 3 1 1,2,3 2,3,4
8 3 1,4 4 3 2 3 2 1 4 3
9 2 3 3 1,4 2 1,3 3,4 1 2,3 2,3
10 3 3 4,1 2 3 3 4 1,3 4 4
11 2,3 3 1,3,4 2,3 4 1,3 3 2 3 1
12 3 2 1,2,4 2,3 1,2 4 2,3 4 3 2
— 957 —
ТЕМА № 59
Применение веществ
№ теста Номер тестового задания
1 2 3 4 5 6 7 8 9 10
1 2,4 2 3 1 1 2 2 3 2 2,3
2 2,4 3 1,3 3 1,3 2 2,4 2,3 2 4
3 4 3 3 1 2,4 3 1,2,3 3 3 2
4 2 2,3,4 2 2 3 1,2 3 1 2 3
5 3 2 2 4 4 1,3,4 3 2 4 1
6 2 4 3 3 1 3,4 2 1,3,4 1,3,4 1,2,3
7 1,3 3 4 2 1,3,4 2 3 4 1 1,3,4
— 958 —
ЛИТЕРАТУРА
1. Врублевский А. И., Барковский Е. В. Тесты по химии.
Теоретические основы химии. — М.: Рольф: Айрис-пресс,
1999. —288 с.
2. Врублевский А. И., Барковский Е. В. Тесты по химии.
Химия элементов. — М.: Рольф: Айрис-пресс, 1999. — 256 с.
3. Барковский Е. В., Врублевский А. И. Тесты по химии.
Органическая химия. — М.: Рольф: Айрис-пресс, 1999. —
288 с.
4. Барковский Е. В., Врублевский А. И. Тесты по химии
для школьников и абитуриентов. — Мн.: ООО «Юнипресс»,
2002, — 192 с.
5. Врублевский А. И. Учебно-тренировочные материалы
для подготовки к централизованному тестированию по хи-
мии. — Мн.: ООО «Юнипресс», 2003. — 368 с.
6. Аванесов В. С. Форма тестовых заданий. — М.: «Центр
тестирования», 2005. — 156 с.
--- 959 ---
Содержание
ОТ АВТОРА.......................................3
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
ТЕМА 1. Вещество. Вещества простые и сложные. Физические
и химические явления. Закон сохранения массы.
Физические и химические свойства веществ. Смеси.5
ТЕСТ 1..........................................5
ТЕСТ2...........................................7
ТЕСТЗ...........................................8
ТЕСТ4..........................................10
ТЕСТ5..........................................12
ТЕМА 2. Атом. Химический элемент. Аллотропия.
Химические формулы. Химические уравнения.
Закон постоянства состава. Молекула. Ион. Вещества
молекулярного и немолекулярного строения.
Относительные атомная и молекулярная масса......14
ТЕСТ1..........................'...............14
ТЕСТ2........................................ 16
ТЕСТЗ..........................................17
ТЕСТ4..........................................19
ТЕСТ 5....................................... 20
ТЕСГ6..........................................22
ТЕСТ7..........................................24
ТЕСТ 8.........................................25
ТЕСТ9..........................................27
ТЕМА 3. Моль. Молярная масса. Закон Авогадро. Молярная
концентрация газа..............................28
ТЕСТ1..........................................28
ТЕСТ2..........................................30
ТЕСТЗ..........................................31
ТЕСТ 4.........................................32
--- 960 ---
ТЕСТ5..............................................34
ТЕСТ б.............................................36
ТЕСТ7..............................................37
ТЕСТ 8........................................... 39
ТЕМА 4. Типовые расчетные задачи ..................40
ТЕМА 5. Строение ядер атомов. Изотопы. Нуклиды. Явление
радиоактивности...............................48
ТЕСТ1..............................................48
ТЕСТ2..............................................49
ТЕСТЗ..............................................51
ТЕСТ 4.............................................52
ТЕСТ 5.............................................53
ТЕСТ 6.............................................54
ТЕСТ 7.............................................55
ТЕСТ 8.............................................56
ТЕСТ9..............................................58
ТЕСТЮ............................................ 59
ТЕСТИ............................................ 60
ТЕМА 6. Строение электронных оболочек атомов.......61
ТЕСТ 1.............................................61
ТЕСТ2..............................................62
ТЕСТЗ..............................................63
ТЕСТ 4.............................................65
ТЕСТ5..............................................66
ТЕСТ6..............................................67
ТЕСТ 7.............................................68
ТЕСТ8..............................................69
ТЕСГ9..............................................70
ТЕСТ 10............................................72
ТЕСТИ..............................................73
ТЕМА 7. Периодическая система химических элементов.74
ТЕСТ 1.............................................74
ТЕСТ 2.............................................76
ТЕСТЗ..............................................78
ТЕСТ 4............................................ 79
ТЕСТ 5.............................................81
ТЕСТ б............................................ 82
ТЕСГ7..............................................83
ТЕСТ 8........................................... 85
ТЕСТ9..............................................86
ТЕСТ 10............................................88
ТЕСТИ .............................................89
ТЕСТ 12............................................91
--- 961
ТЕМА 8. Природа и типы химических связей.
Ковалентная связь..............................92
ТЕСЛ...........................................92
ТЕСТ 2.........................................9+
ТЕСТЗ..........................................95
ТЕСТ 4.........................................96
ТЕСТ5..........................................97
ТЕСТ6..........................................99
ТЕСГ7..........................................100
ТЕСТ 8.........................................101
ТЕСТ9..........................................102
ТЕСЛО.......................................... 103
ТЕСТИ .........................................104
ТЕСТ 12..................................... 105
ТЕСТ 13.......................................107
ТЕСТ 14.......................................108
ТЕСГ15 ........................................109
ТЕСТ 16........................................ПО
ТЕСТ 17.......................................112
ТЕСТ 18.......................................113
ТЕМА 9. Ионная связь. Металлическая связь.
Типы кристаллических решеток. Межмолекулярное
взаимодействие.
Водородная связь..............................115
ТЕСЛ..........................................115
ТЕСТ2.........................................116
ТЕСТЗ.....................................t....117
ТЕСТ 4........................................119
ТЕСТ5.........................................120
ТЕСТ6.........................................122
ТЕСТ 7........................................123
ТЕСТ 8........................................125
ТЕСТ 9........................................127
ТВМЛ 10. Валентность. Степень окисления.
Координационное число.........................129
ТЕСТ 1........................................129
ТЕСТ 2........................................130
ТЕСТЗ ...:....................................131
ТЕСТ4........................................ 133
ТЕСТ5........................................ 134
ТЕСТ6........................................ 136
ТЕСТ 7....................................... 137
ТЕСТ 8........................................138
--- 962 ---
ТЕСТ 9......................................140
ТЕСТЮ.......................................141
ТЕСТИ.......................................143
ТЕСТ 12.....................................144
ТЕСТ 13.....................................145
ТЕСТ 14.....................................147
ТЕМА 11. Оксиды.............................148
ТЕСТ 1......................................148
ТЕСТ 2..................................... 149
ТЕСТЗ...................................... 150
ТЕСТ4.......................................151
ТЕСТ 5..................................... 153
ТЕСТ 6......................................154
ТЕСТ 7......................................155
ТЕСТ 8......................................157
ТЕСТ 9......................................158
ТЕСТЮ...................................... 159
ТЕСТИ ......................................160
ТЕСТ 12.....................................161
ТЕСТ 13.....................................162
ТЕМА 12. Основания..........................164
ТЕСЛ........................................164
ТЕСТ 2......................................165
ТЕСТЗ.......................................166
ТЕСТ 4..................................... 167
ТЕСТ 5......................................169
ТЕСТ6.......................................170
ТЕСТ 7......................................171
ТЕМА 13. Кислоты............................173
ТЕСТ 1......................................173
ТЕСТ2..................................... 174
ТЕСТЗ.......................................176
ТЕСТ 4..................................... 177
ТЕСТ5...................................... 178
ТЕСТ6..................................... 179
ТЕСТ 7......................................181
ТЕМА 14. Соли.............................. 182
ТЕСТ 1..................................... 182
ТЕСТ 2......................................183
ТЕСТЗ...................................... 184
ТЕСТ 4..................................... 186
ТЕСТ 5......................................187
ТЕСТ6.......................................188
--- 963 ----
ТЕСТ 7.......................................................... 190
ТЕСТ 8...........................................................191
ТЕСТ 9.......................................................... 192
ТЕСТ 10......................................................... 194
ТЕСТИ ...........................................................195
ТЕСТ 12........................................................ 197
ТЕСТ 13.................:........................................198
ТЕСТ 14..........................................................200
ТЕМА 15. Связь между классами неорганических веществ.............201
ТЕСЛ...................'..................................................................... 201
ТЕСТ 2...........................................................203
ТЕСТЗ......................................................... 204
ТЕСГ4 ........ ....... .......................................................................... 206
ТЕСТ 5...........................................................207
ТЕСТ6............................................................209
ТЕСТ 7...........................................................210
ТЕСГ8............................................................212
ТЕСТ 9...........................................................214
ТЕСТЮ.......................................................... 215
ТЕМА 16. Классификация химических реакций........................217
ТЕСТ 1 ...............................................^........д_....ь"217
ТЕСТ 2.................................................... ...:. 219
ТЕСТЗ..........................:.................................220
ТЕСТ 4...........................................................222
ТЕМА 17. Окислительно-восстановительные реакции .................224
ТЕСТ 1...........................................................224
ТЕСТ 2...........................................................226
ТЕСТЗ............................................................227
ТЕСТ 4...........................................................229
ТЕСТ 5...........................................................231
ТЕСТ 6...........................................................233
ТЕСТ 7...........................................................234
ТЕСТ8........................................................... 236
ТЕСТ 9...........................................................238
ТЕСТЮ............................................................239
ТЕМА 18. Тепловой эффект химической реакции......................241
ТЕСТ1 ....................................... 241
ТЕСТ 2...........................................................243
ТЕМА 19. Скорость химической реакции
и химическое равновесие..........................................245
ТЕСТ 1...........................................................245
ТЕСТ2............................................................247
--- 964 ---
ТЕСТЗ........................................249
ТЕСТ4........................................251
ТЕСТ 5.......................................253
ТЕСТ6........................................255
ТЕСТ7........................................257
ТЕСТ 8.......................................259
ТЕСТ9........................................262
ТЕСТЮ........................................265
ТЕМА 20. Растворы............................267
ТЕСТ1........................................267
ТЕСТ2........................................268
ТЕСТЗ........................................270
ТЕСГ4........................................271
ТЕСТ 5.......................................273
ТЕСТ 6.......................................274
ТЕСТ7........................................275
ТЕСТ 8.......................................277
ТЕСТ 9.......................................279
ТЕСТЮ....................................... 281
ТЕСТИ........................................282
ТЕМА 21. Электролитическая диссоциация.......284
ТЕСТ!........................................284
ТЕСТ 2.......................................285
ТЕСТЗ........................................287
ТЕСТ 4.......................................288
ТЕСТ 5.......................................290
ТЕСТ 6.......................................291
ТЕСТ7........................................292
ТЕСТ 8.......................................294
ТЕСТ 9...................................... 295
ТЕСТЮ........................................296
ТЕСТИ........................................298
ТЕСТ 12..................................... 299
ТЕСТ 13......................................300
ТЕСТ 14......................................302
ТЕСТ 15......................................303
ТЕСТ 16......................................305
ТЕСТ 17......................................307
ТЕСТ 18......................................308
ТЕМА 22. Ионные уравнения реакций............310
ТЕСТ1................................. '.....310
ТЕСТ 2.......................................312
ТЕСТЗ........................................313
--- 965 ----
ТЕСТ 4........................................315
ТЕСТ5.........................................316
ТЕСТ6.........................................317.
ТЕСТ7.........................................319
ТЕСТ8.........................................320
ТЕСТ 9........................................322
ТЕСТЮ.........................................324
ТЕСТИ ........................................325
ХИМИЯ ЭЛЕМЕНТОВ
ТЕМА 23. Неметаллы: общая характеристика электронного
строения атомов, физических и химических свойств
простых веществ и соединений.................328
ТЕСТ1........................................328
ТЕСТ 2.......................................329
ТЕСТЗ........................................330
ТЕСТ 4.......................................332
ТЕСТ 5.......................................333
ТЕСТ 6.......................................334
ТЕМА 24. Водород. Вода.......................336
ТЕСТ!...................................... 336
ТЕСТ 2.......................................338
ТЕСТЗ........................................339
ТЕСТ4........................................340
ТЕСТ 5.......................................341
ТЕСТ6........................................342
ТЕСТ7........................................344
ТЕСТ 8.......................................345
ТЕМА 25. Галогены. Хлор и его соединения.....347
ТЕСЛ.........................................347
ТЕСТ2........................................348
ТЕСТЗ........................................350
ТЕСТ4........................................351
ТЕСТ 5.......................................353
ТЕСТ6........................................354
ТЕСТ 7.......................................355
ТЕСТ 8.......................................357
ТЕСТ 9.......................................358
ТЕСТЮ........................................359
ТЕМА 26. Общая характеристика элементов VIA группы.
Кислород.............................361
ТЕСТ1........................................361
--- 966 ---
ТЕСТ 2........................................362
ТЕСТЗ.........................................364
ТЕСТ4.........................................365
ТЕСТ5.........................................366
ТЕМА 27. Сера и ее оксиды. Сероводород. Сульфиды......368
ТЕСТ1........................................ 368
ТЕСТ 2........................................369
ТЕСТЗ.........................................370
ТЕСТ 4........................................372
ТЕСТ 5.........../............................373
ТЕСТ 6........................................374
ТЕСТ 7........................................375
ТЕСТ 8........................................377
ТЕМА 28. Серная кислота и ее соли.............378
ТЕСТ 1.......................................378
ТЕСТ 2........................................380
ТЕСТЗ.........................................381
ТЕСТ 4........................................383
ТЕСТ 5........................................384
ТЕСТ6........................:................386
ТЕСТ 7....................................... 387
ТЕМА 29. Общая характеристика элементов VA группы. Азот.
Оксиды азота. Аммиак. Соли аммония...389
ТЕСТ 1........................................389
ТЕСТ 2........................................391
ТЕСТЗ.........................................392
ТЕСТ4.........................................394
ТЕСТ 5........................................396
ТЕСТ6.........................................397
ТЕСТ7.........................................398
ТЕСТ 8....................................... 400
ТЕСТ 9........................................401
ТЕСТ 10.......................................402
ТЕСТИ.........................................404
ТЕСТ 12.......................................405
ТЕМА 30. Азотная кислота и ее соли. Азотные удобрения.407
ТЕСТ!.............................’...........407
ТЕСТ 2........................................408
ТЕСТЗ.........................................410
ТЕСТ4.........................................411
ТЕСТ 5........................................412
ТЕСТ 6........................................414
ТЕСТ 7........................................415
--- 967 ---
ТЕСТ 8.....................................41(j
ТЕСТ 9......................................418
ТЕМА 31. Фосфор. Оксиды фосфора. Фосфорная кислота
и ее соли. Фосфорные удобрения..............420
ТЕСЛ...................................... 420
ТЕСТ2.......................................421
ТЕСТЗ.......................................422
ТЕСТ 4......................................424
ТЕСТ 5..................................... 425
ТЕСТ 6......................................427
ТЕСТ 7..................................... 428
ТЕСТ 8......................................429
ТЕМА 32. Общая характеристика элементов 1VA группы.
Углерод. Оксиды углерода. Угольная кислота
и ее соли...........................432
ТЕСТ 1 ................... 432
ТЕСТ 2......................................433
ТЕСТЗ.......................................435
ТЕСТ 4...........?........................ 436
ТЕСТ 5......................................438
ТЕСТ6.......................................439
ТЕСТ7.......................................441
ТЕСГ8.......................................442
ТЕСТ 9......................................444
ТЕСТЮ.......................................445
ТЕМА 33. Кремний. Оксид кремния (IV). Кремниевая
кислота и ее соли. Строительные материалы на
основе соединений кремния и углерода........447
ТЕСТ1.........................'.............447
ТЕСТ 2......................................449
ТЕСТЗ.......................................450
ТЕСТ 4......................................451
ТЕСТ 5......................................453
ТЕСТ 6......................................454
ТЕМА 34. Металлы: строение электронных оболочек,
общая характеристика физических и химических
свойств, способы получения. Качественное
обнаружение ионов металлов. Электрохимический
ряд напряжений металлов. Коррозия металлов.
Электролиз. Сплавы металлов.........456
ТЕСТТ.......................................456
ТЕСТ2.......................................457
--- 968 ----
ТЕСТЗ.........................................458
ТЕСГ4.........................................460
ТЕСТ5.........................................461
ТЕСТ6.........................................463
ТЕСТ7.........................................464
ТЕСТ8.........................................466
ТЕСТ 9........................................467
ТЕСТЮ.........................................469
ТЕМА 35. Щелочные и щелочноземельные металлы. Магний.
Жесткость воды и способы ее устранения. Калийные
удобрения.............................471
ТЕСТ 1........................................471
ТЕСТ 2........................................473
ТЕСТЗ.........................................474
ТЕСТ 4........................................475
ТЕСТ 5........................................477
ТЕСТ6.........................................478
ТЕСТ 7........................................479
ТЕСТТ.........................................481
ТЕСТТ.........................................483
ТЕМА 36. Алюминий. Оксид и гидроксид алюминия.485
ТЕСТ1.........................................485
ТЕСТ2.........................................486
ТЕСТЗ.........................................487
ТЕСГ4.........................................489
ТЕСТ 5........................................491
ТЕСТ6.........................................492
ТЕСТ7.........................................493
ТЕСТ 8........................................495
ТЕМА 37. Металлы Б групп. Берилий.............496
ТЕСТ1.............'...........................496
ТЕСТ 2........................................498
ТЕСТЗ.........................................499
ТЕСТ 4........................................500
ТЕСТ 5........................................501
ТЕСТ6.........................................502
ТЕСТ 7........................................504
ТЕСТ 8........................................505
ТЕСТТ........................................ 507
ТЕСТ 10.......................................508
ТЕМА 38. Обобщение знаний о химических свойствах
элементов...........................................510
--- 969 ---
ОРГАНИЧЕСКАЯ ХИМИЯ
ТЕМА 39. Общие положения органической химии.522
ТЕСЛ........................................522
ТЕСТ 2.................................... 524
ТЕСТЗ.......................................525
ТЕСТ 4......................................527
ТЕСТ5.......................................530
ТЕСГ6.......................................532
ТЕМА 40. Алканы.............................536
ТЕСТ 1 .....................................536
ТЕСТ 2......................................538
ТЕСТЗ.......................................539
ТЕСТ 4......................................541
ТЕСТ 5......................................543
ТЕСТ 6......................................544
ТЕСТ 7......................................546
ТЕСТ 8......................................548
ТЕСТ 9......................................550
ТЕСТЮ.......................................552
ТЕСТИ ................................... ... 553
ТЕМА 41. Циклоалканы........................555
ТЕСЛ....................................... 555
ТЕСТ2.......................................557
ТЕСТЗ.......................................559
ТЕМА 42. Алкены. Циклоалкены................561
ТЕСТ1.......................................561
ТЕСТ 2...'..................................563
ТЕСТЗ.......................................565
ТЕСТ 4......................................567
ТЕСТ 5......................................569
ТЕСТ 6......................................570
ТЕСТ7.......................................572
ТЕСТ 8......................................574
ТЕСТ 9......................................576
ТЕСТ 10.....................................578
ТЕСТИ ..................................... 580
ТЕМА 43. Алкадиены.
Природный и синтетический каучуки...........583
ТЕСЛ....................................... 583
ТЕСГ2.......................................584
ТЕСТЗ.......................................586
ТЕСТ 4......................................588
--- 970 ---
ТЕМА 44. Алкины.............................591
ТЕСТ 1......................................591
ТЕСТ 2......................................593
ТЕСТЗ.......................................594
ТЕСТ 4......................................596
ТЕСТ 5......................................598
ТЕСТ6.......................................600
ТЕМА 45. Арены..............................602
ТЕСЛ........................................602
ТЕСТ 2..................................... 604
ТЕСТЗ.......................................606
ТЕСТ 4......................................608
ТЕСТ 5......................................609
ТЕСТ6.......................................611
ТЕСГ7.......................................612
ТЕСГ8.......................................614
ТЕСТ 9......................................616
ТЕСТЮ.......................................617
ТЕМА 46. Комбинированные задания по теме «Углеводороды.
Природные источники углеводородов.
Связь между углеводородами» ........619
ТЕСТ1...................................... 619
ТЕСТ 2..,...................................621
ТЕСТЗ.......................................622
ТЕСГ4...................................... 623
ТЕСГ5.......................................625
ТЕСТ6.......................................626
ТЕСГ7.......................................628
ТЕСТ 8......................................630
ТЕСТ 9......................................631
ТЕСТЮ.......................................633
ТЕСТИ ......................................634
ТЕСТ 12.....................................635
ТЕСТ 13.................................... 637
ТЕСТ 14.....................................639
ТЕСТИ.......................................641
ТЕСТ 16.....................................642
ТЕСТ 17.....................................644
ТЕСТЮ.......................................645
ТЕСТЮ.......................................646
ТЕСЛО.......................................648
ТЕСТ 21 ....................................650
ТЕСТ22 .................................... 652
--- 971
ТЕСТ23 ..................................... 653
ТЕСТ 24......................................655
ТЕСТ25.......................................657
ТЕМА 47. Одноатомные и многоатомные спирты.
Простые эфиры............................... 659
ТЕСТ 1.......................................659
ТЕСТ 2.......................................660
ТЕСТЗ........................................662
ТЕСТ4........................................664
ТЕСТ 5.......................................666
ТЕСТ 6.......................................668
ТЕСТ 7.......................................670
ТЕСТ8........................................672
ТЕСТ 9.......................................674
ТЕСТЮ........................................675
ТЕСТИ .......................................677
ТЕСТ 12......................................680
ТЕСТ 13......................................682
ТЕСТ14.......................................684
ТЕСТ15.......................................686
ТЕСТ 16......................................688
ТЕСТ 17......................................690
ТЕМА 48. Фенолы..............................692
ТЕСТ1........................................692
ТЕСТ 2.......................................694
ТЕСТЗ........................................696
ТЕСТ 4.......................................698
ТЕСТ 5.......................................700
ТЕСТ 6..................................... 703
ТЕСТ 7..................................... 705
ТЕМА 49. Альдегиды...........................709
ТЕСЛ.........................................709
ТЕСТ 2.......................................711
ТЕСТЗ........................................712
ТЕСТ 4..................................... 714
ТЕСТ 5.......................................716
ТЕСТ 6.......................................719
ТЕСТ7........................................721
ТЕСТ 8...................................... 722
ТЕСТ 9.......................................725
ТЕСТЮ........................................728
ТЕМА 50. Карбоновые кислоты..................730
ТЕСТ1........................................730
--- 972 ---
ТЕСТ 2..................................732
ТЕСТЗ...................................734
ТЕСТ 4..................................735
ТЕСТ 5..................................737
ТЕСТ6...................................738
ТЕСТ7...................................740
ТЕСТ 8..................................742
ТЕСТ 9..................................744
ТЕСТ 10.................................746
ТЕСТИ ..................................748
ТЕСТ 12.................................750
ТЕСТ 13.................................752
ТЕСТ 14.................................754
ТЕМА 51. Сложные эфиры. Жиры. Мыла......756
ТЕСЛ.................................. 756
ТЕСТ 2..................................758
ТЕСТЗ .................. 759
ТЕСТ 4..................................761
ТЕСТ 5..................................763
ТЕСТ6................................. 765
ТЕСТ7...................................768
ТЕСТ 8..................................771
ТЕСТ 9..................................773
ТЕСТ 10.................................774
ТЕСТИ ................... 776
ТЕСТ 12 778
ТЕСТ 13.................................781
ТЕСТ 14.................................784
ТЕСТ 15.................................786
ТЕМА 52. Моносахариды...................788
ТЕСТ 1..................................788
ТЕСТ 2 .................................790
ТЕСТЗ................................. 792
ТЕСТ4...................................793
ТЕСТ 5..................................795
ТЕСТ6...................................798
ТЁСТ7...................................801
ТЕМА 53. Дисахариды. Полисахариды.......802
ТЕСТ 1 ............................... 802
ТЕСТ 2..................................803
ТЕСТЗ...................................805
ТЕСТ 4..................................806
ТЕСТ 5..................................808
--- 973
ТЕСТ6.........................................811
ТЕСТ7..........................................812
ТЕМА 54. Комбинированные задания по теме:
«Кислородсодержащие производные
углеводородов».......................814
ТЕСТ 1 .......................................814
ТЕСТ 2........................................816
ТЕСТЗ.........................................817
ТЕСТ4........................................ 818
ТЕСТ5........................................ 820
ТЕСТ6.........................................822
ТЕСТ 7........................................823
ТЕСТ 8........................................824
ТЕСТ 9........................................826
ТЕСТЮ.........................................828
ТЕСТИ ........................................830
ТЕСТ 12...................................... 832
ТЕСТ 13 ......................................835
ТЕСТ 14..................................... 837
ТЕМА 55. Азотсодержащие органические соединения:
амины, нитросоединения, эфиры азотной кислоты .. 839
ТЕСТ 1 .......................................839
ТЕСТ 2........................................840
ТЕСТЗ.........................................842
ТЕСТ4.........................................844
ТЕСТ 5........................................845
ТЕСТ 6...................................... 848
ТЕСТ 7........................................849
ТЕСТ8.........................................851
ТЕСТ9.........................................852
ТЕСТ 10.......................................854
ТЕСТ 11 ......................................856
ТЕСТ 12 ......................................858
ТЕСТ 13.......................................859
ТЕМ А 56. Аминокислоты. Белки.................861
ТЕСТ 1........................................861
ТЕСТ 2........................................863
ТЕСТЗ.........................................865
ТЕСТ4.........................................867
ТЕСТ 5........................................869
ТЕСТ 6........................................871
ТЕСТ 7........................................873
ТЕСТ 8........................................876
--- 974 ---
ТЕСТ 9............................................878
ТЕСТЮ.............................................881
ТЕСТИ ............................................883
ТЕСТ 12...........................................885
ТЕМА 57. Высокомолекулярные соединения (полимеры).887
ТЕСТ1.............................................887
ТЕСТ 2............................................888
ТЕСТЗ.............................................890
ТЕСТ4.............................................891
ТЕСТ 5............................................894
ТЕСТ 6............................................896
ТЕСТ7.............................................899
ТЕМА 58. Идентификация веществ: качественные реакции.902
ТЕСТ 1 ...........................................902
ТЕСТ 2............................................903
ТЕСТЗ.............................................904
ТЕСТ4.............................................906
ТЕСТ 5............................................907
ТЕСТ 6............................................909
ТЕСТ7................................................; 910
ТЕСТ 8............................................912
ТЕСТ9........................................... 913
ТЕСТ 10...........................................915
ТЕСТ 11 ..........................................917
ТЕСТ 12...........................................919
ТЕМА 59. Вещества в природе.
Применение и получение веществ...............922
ТЕСТ 1............................................922
ТЕСТ 2............................................924
ТЕСТЗ.............................................925
ТЕСТ 4............................................927
ТЕСТ 5............................................928
ТЕСТ 6.........’..................................929
ТЕСТ 7............................................930
ОТВЕТЫ............................................932
--- 975 ---