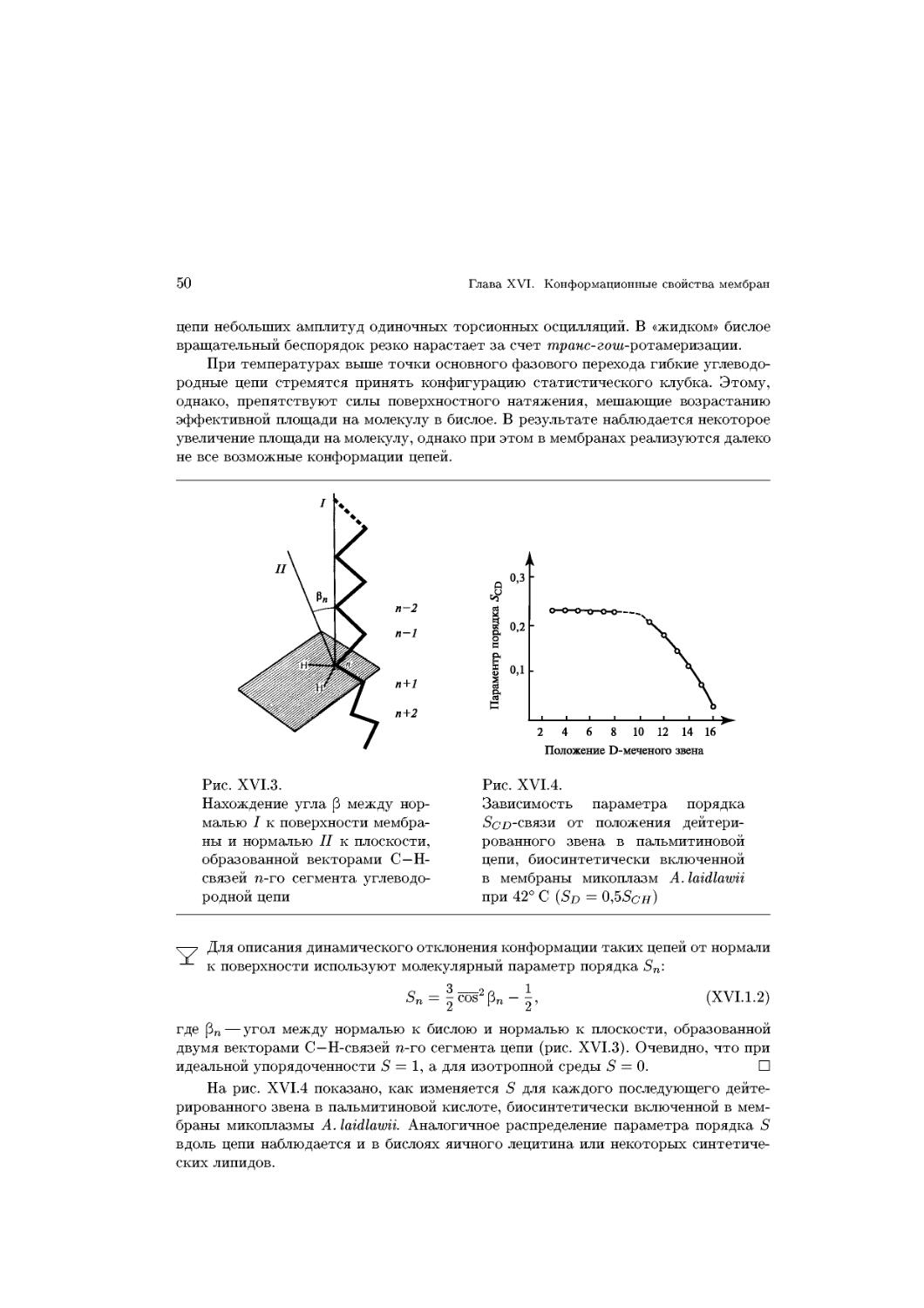
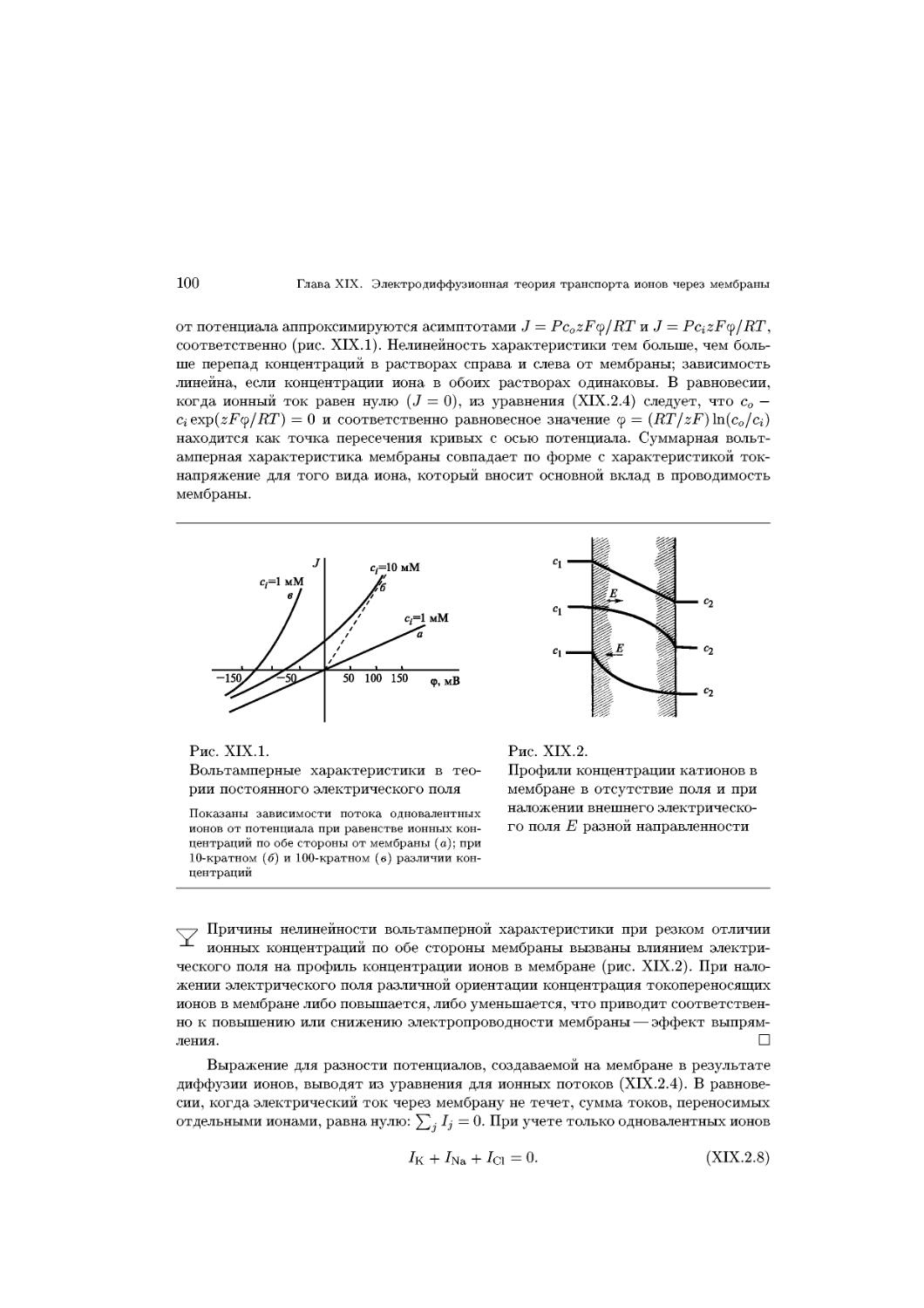
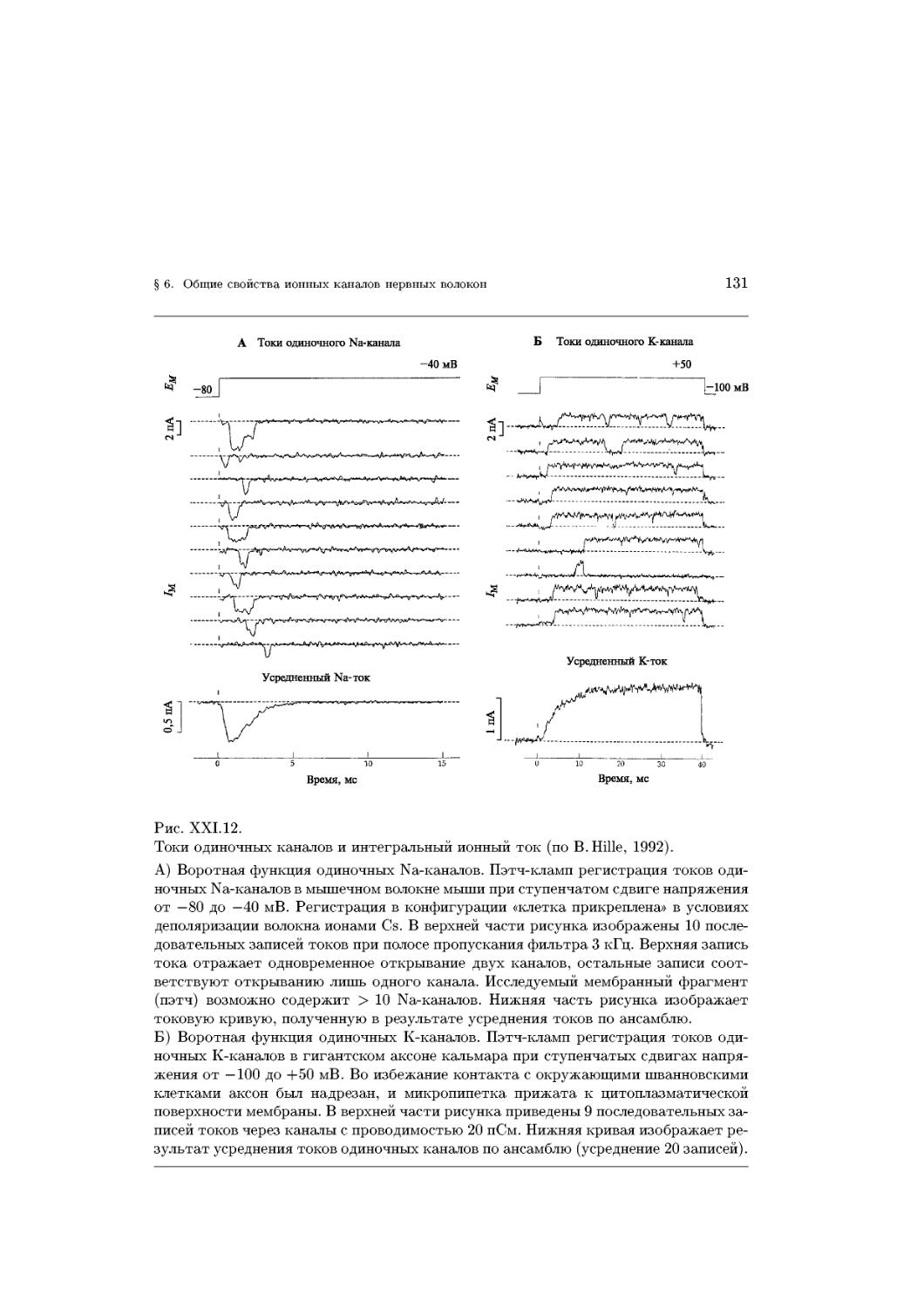
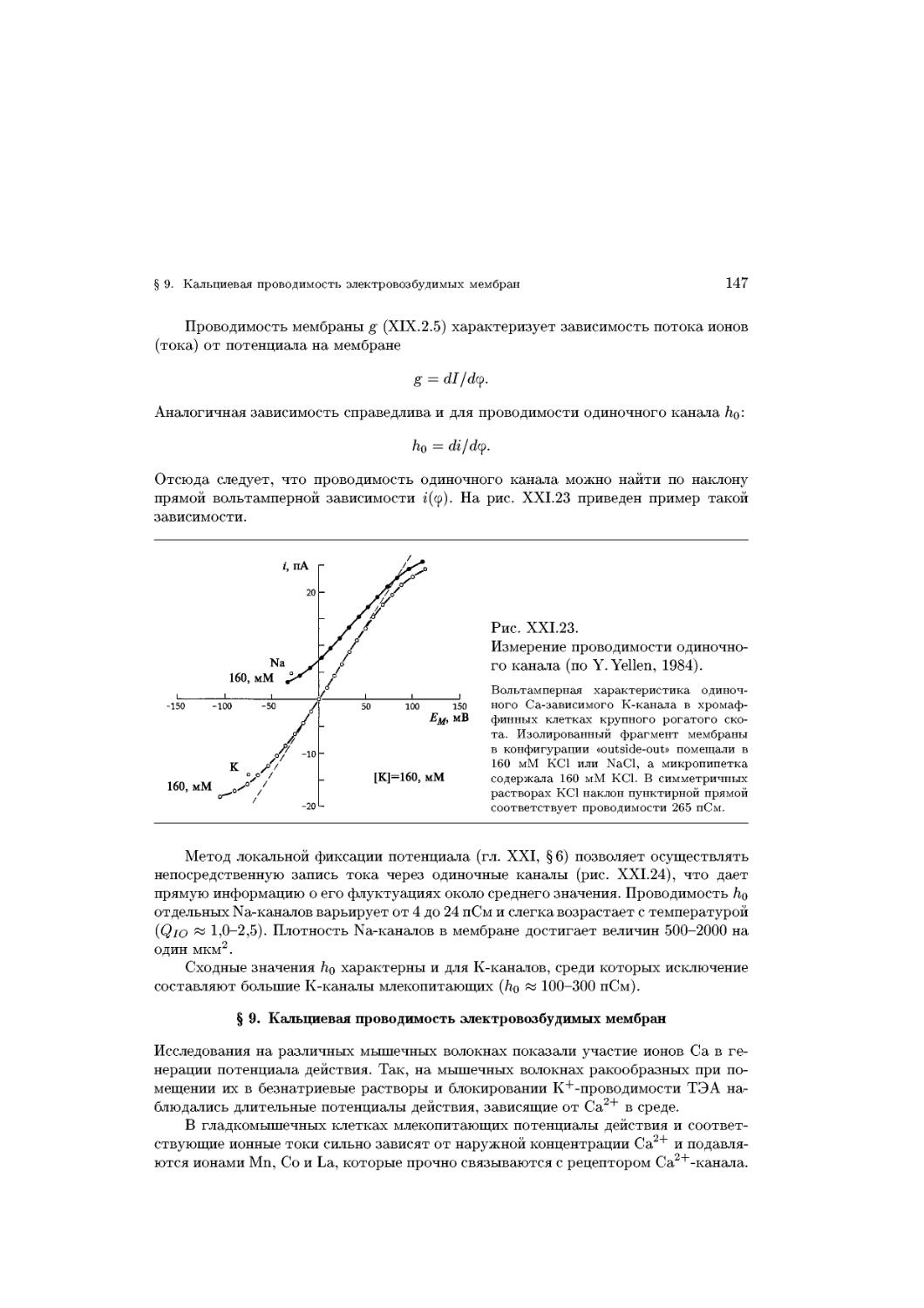
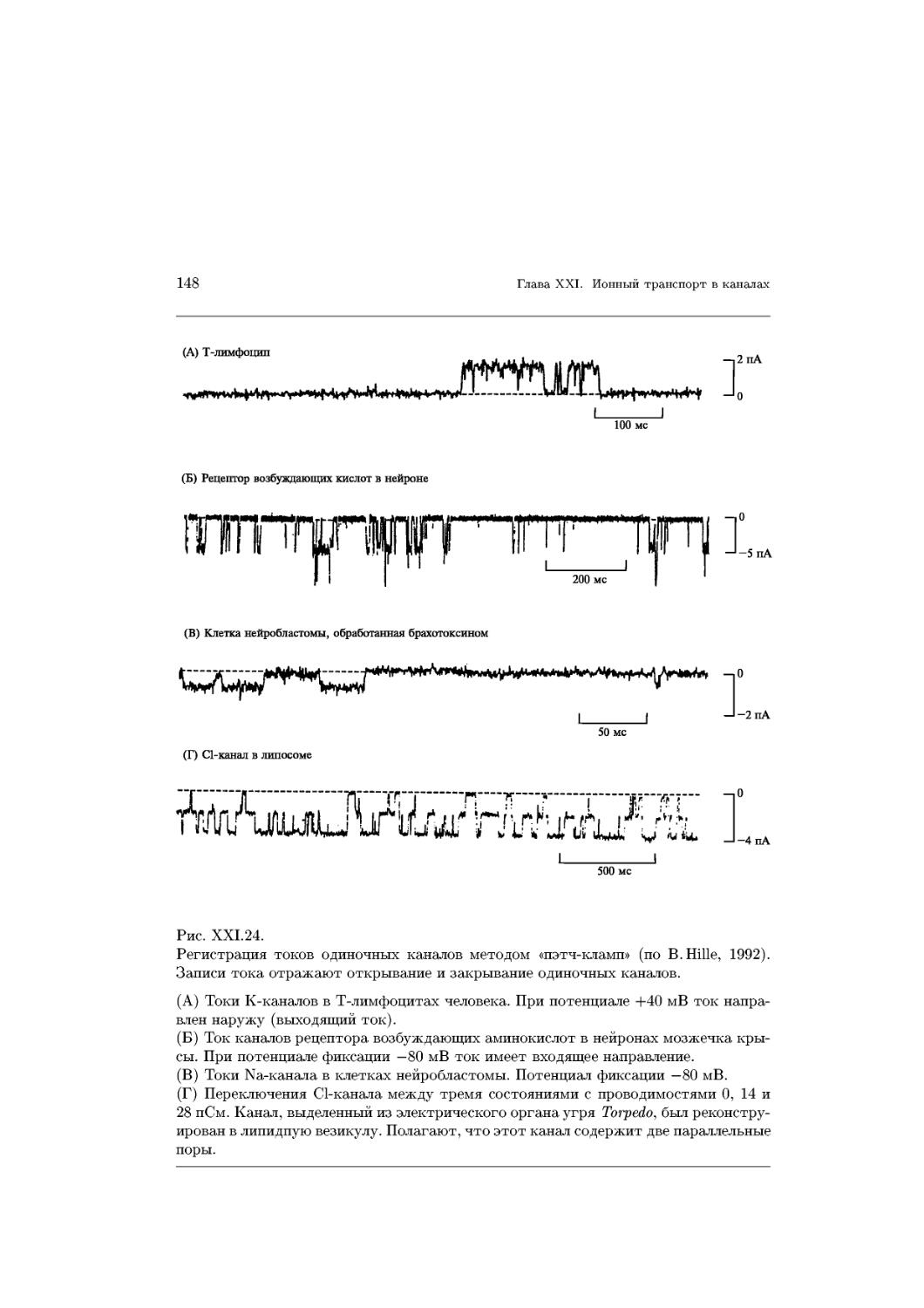
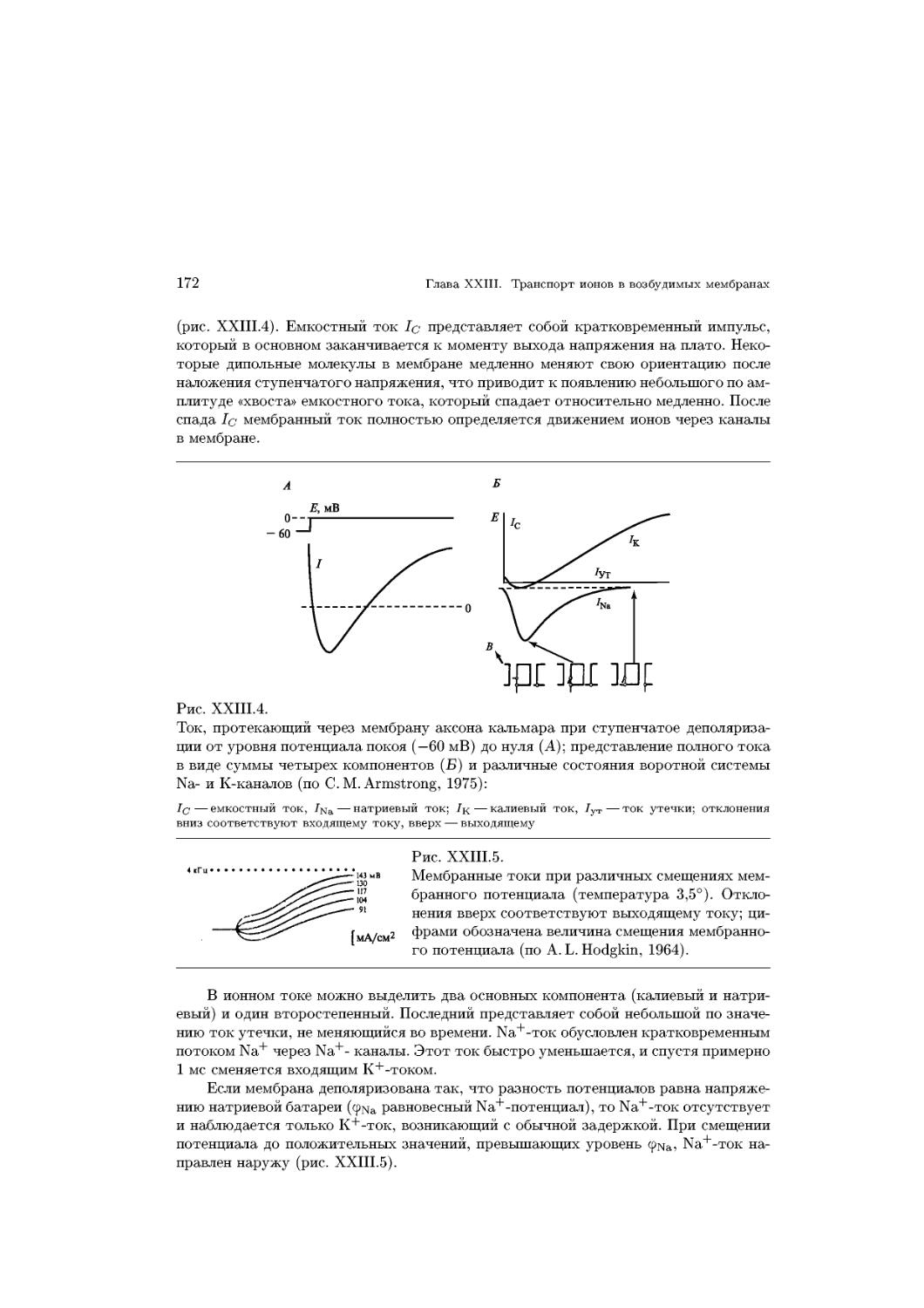
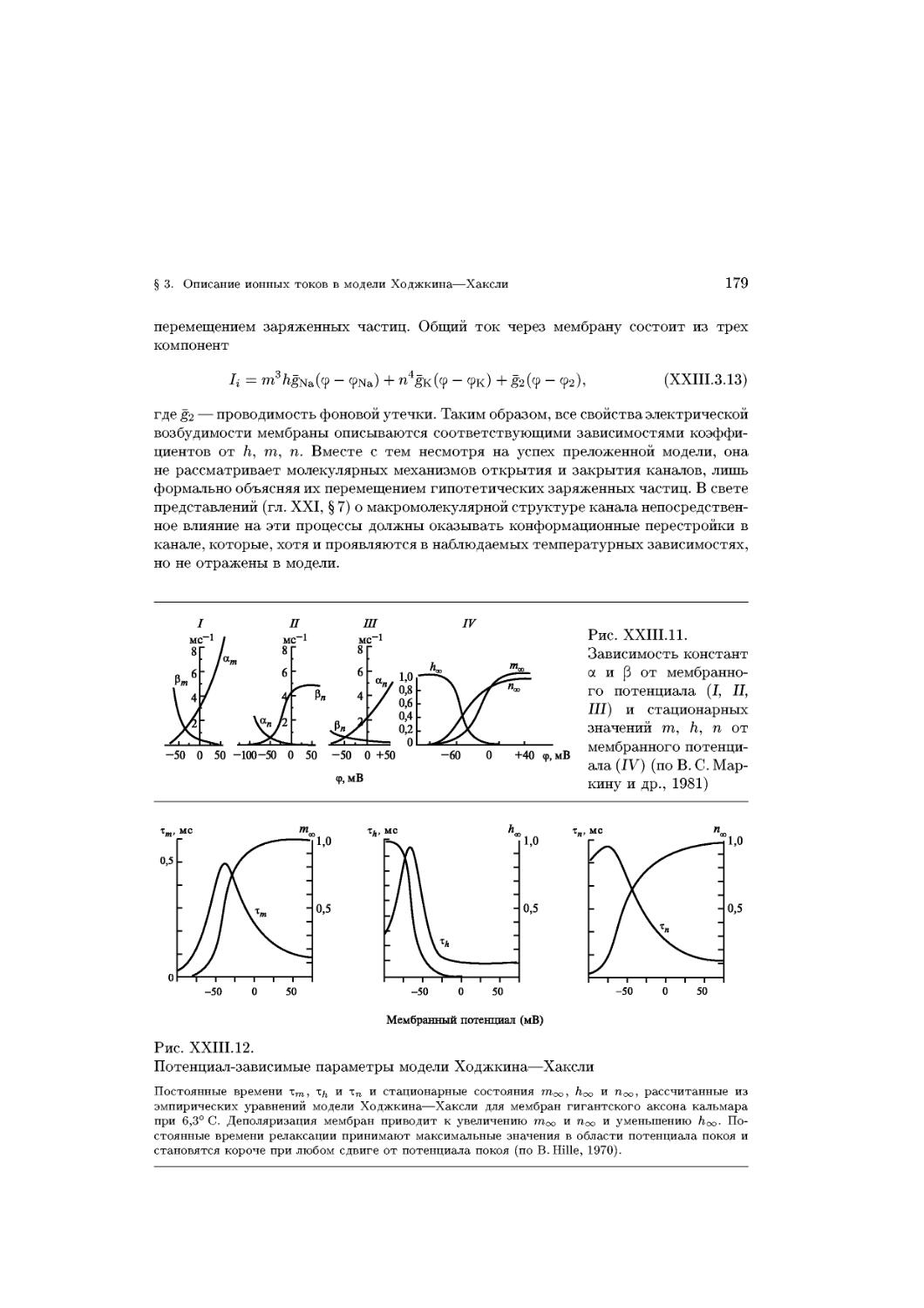
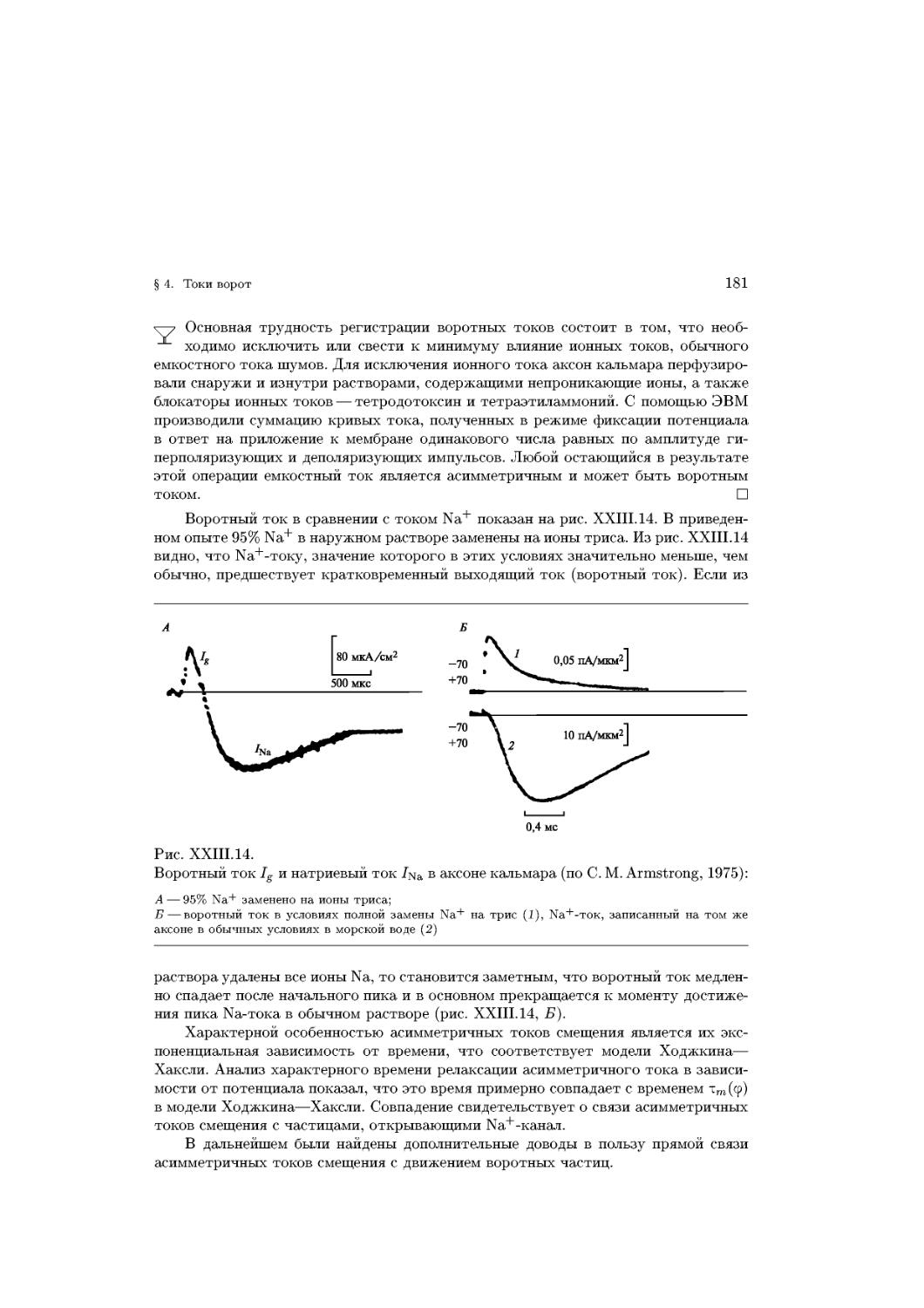
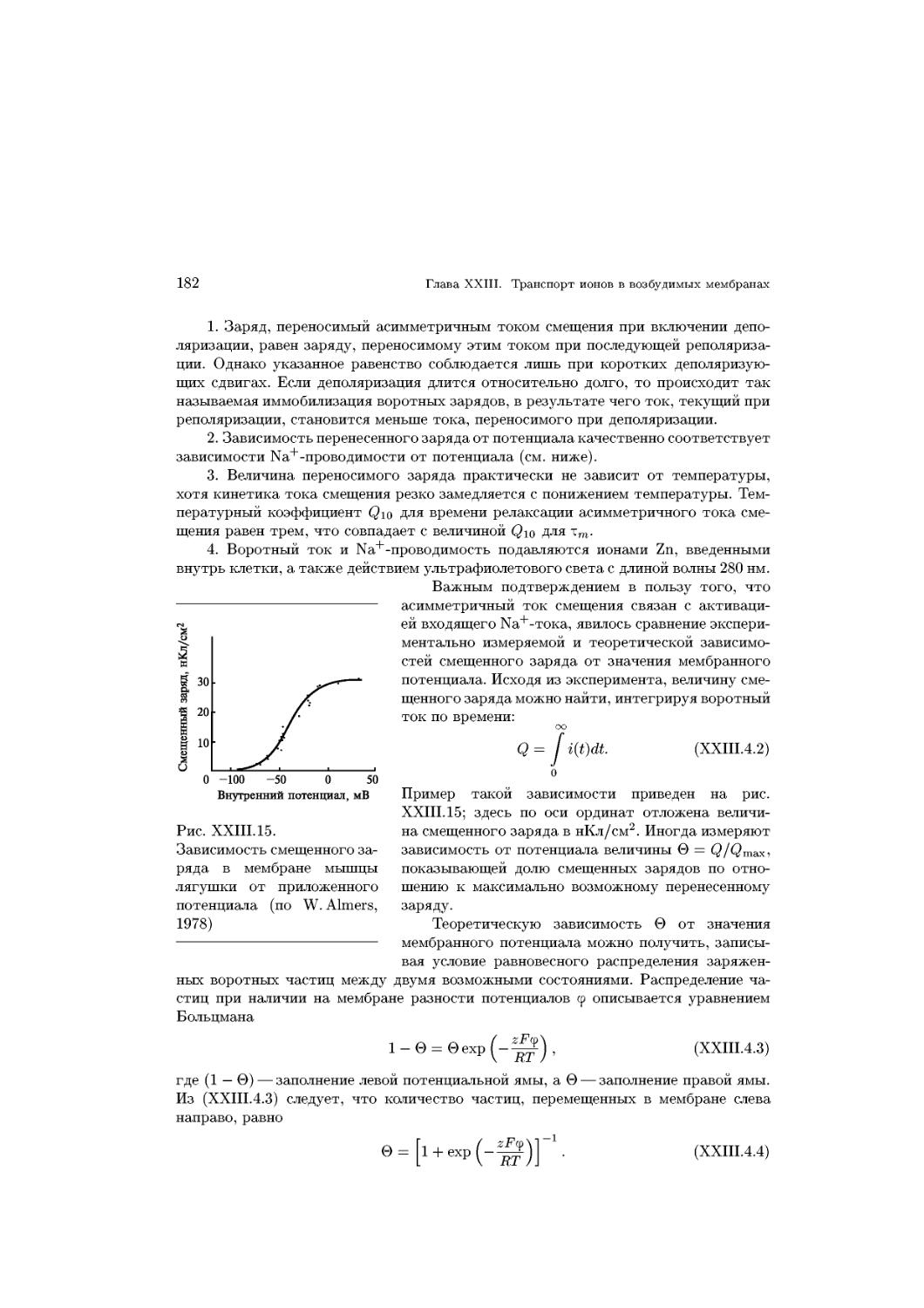
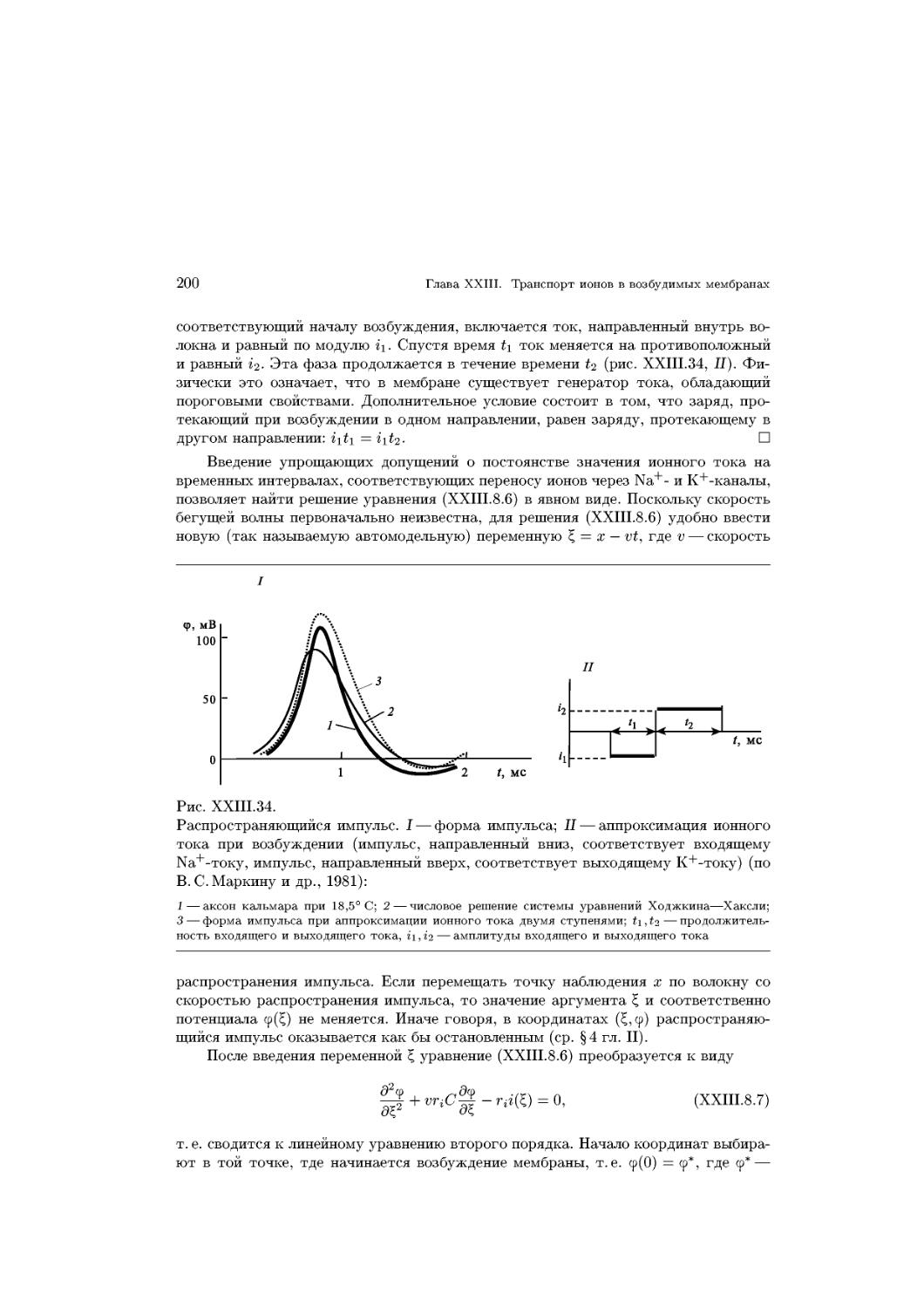
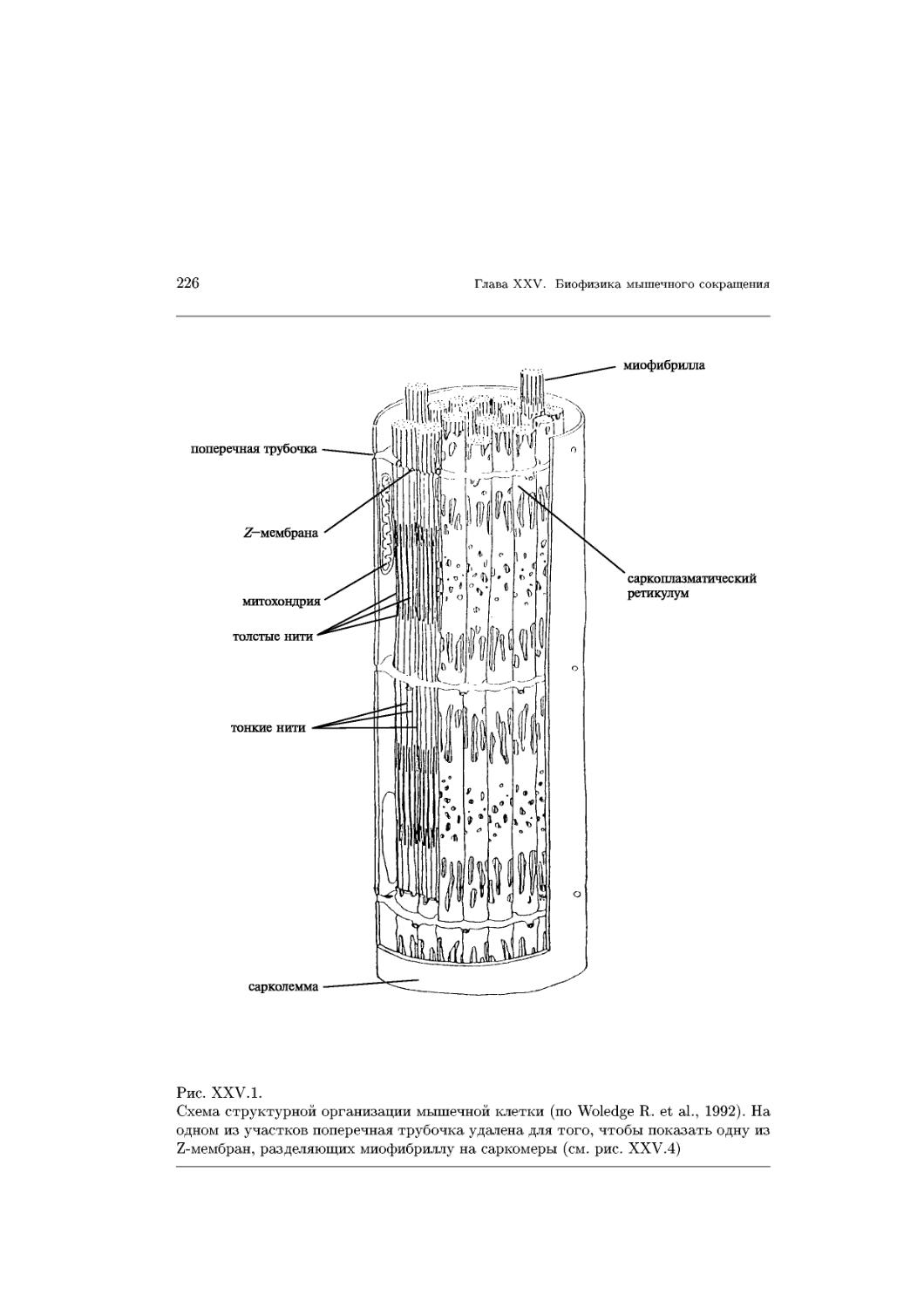
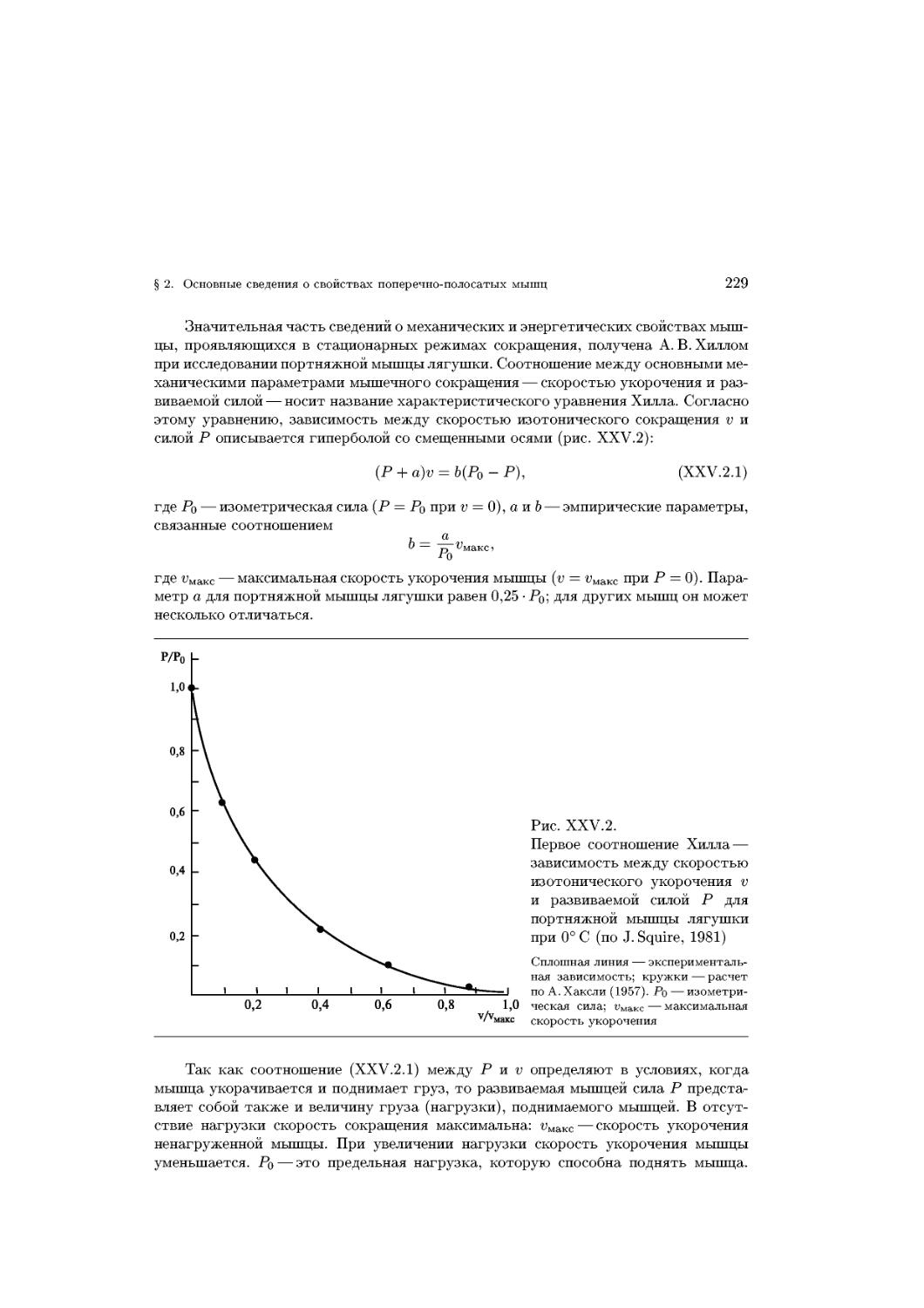
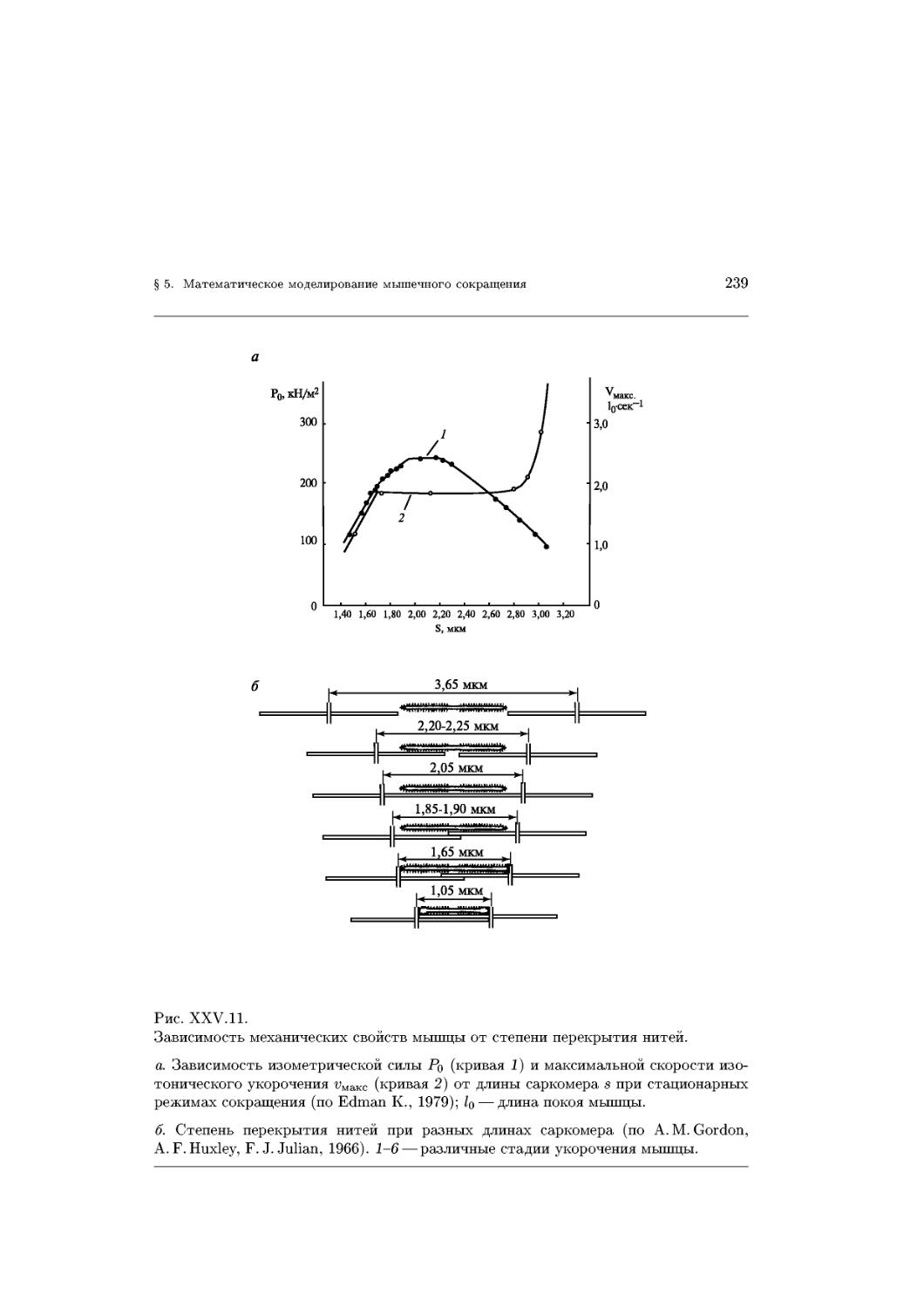
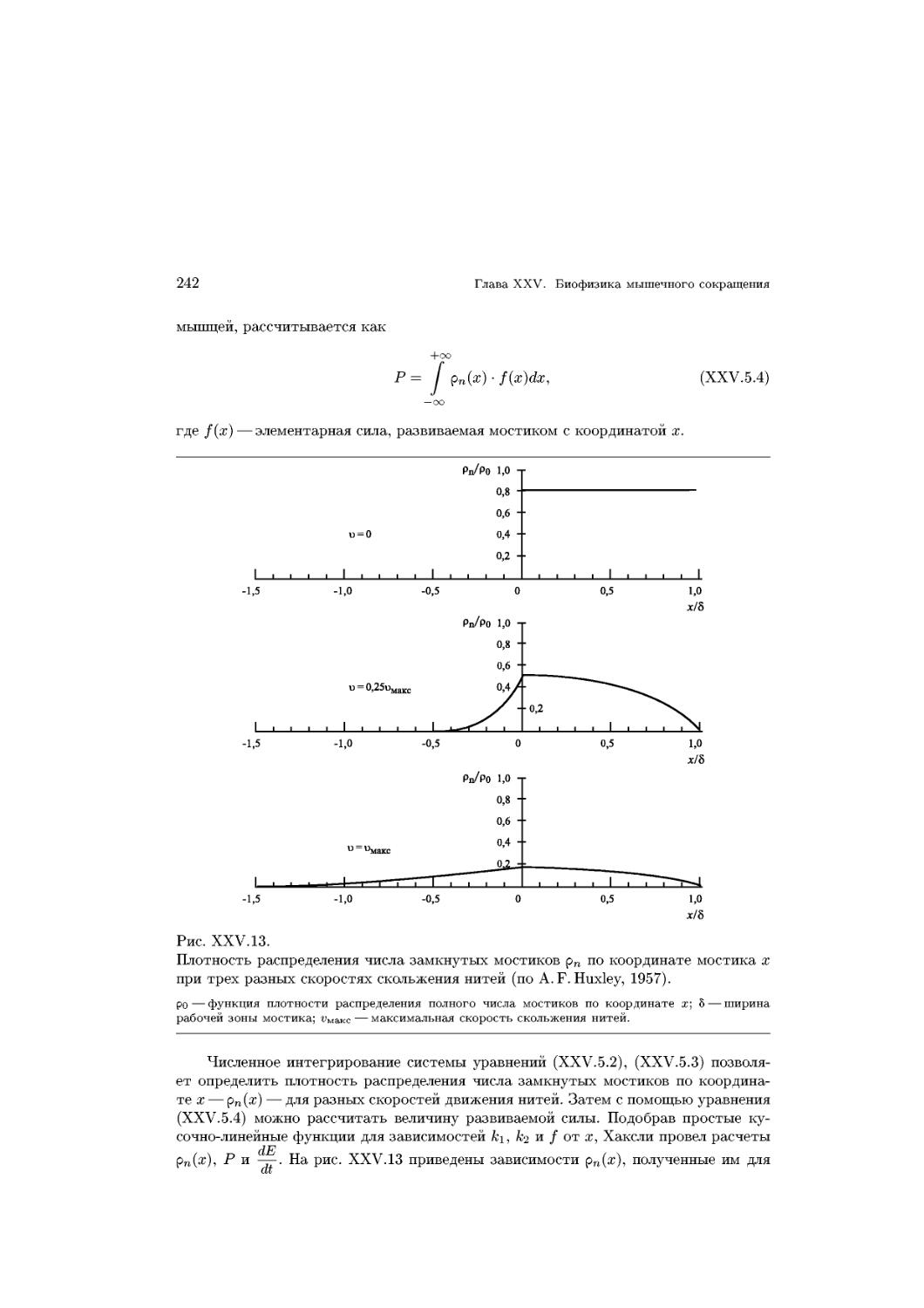
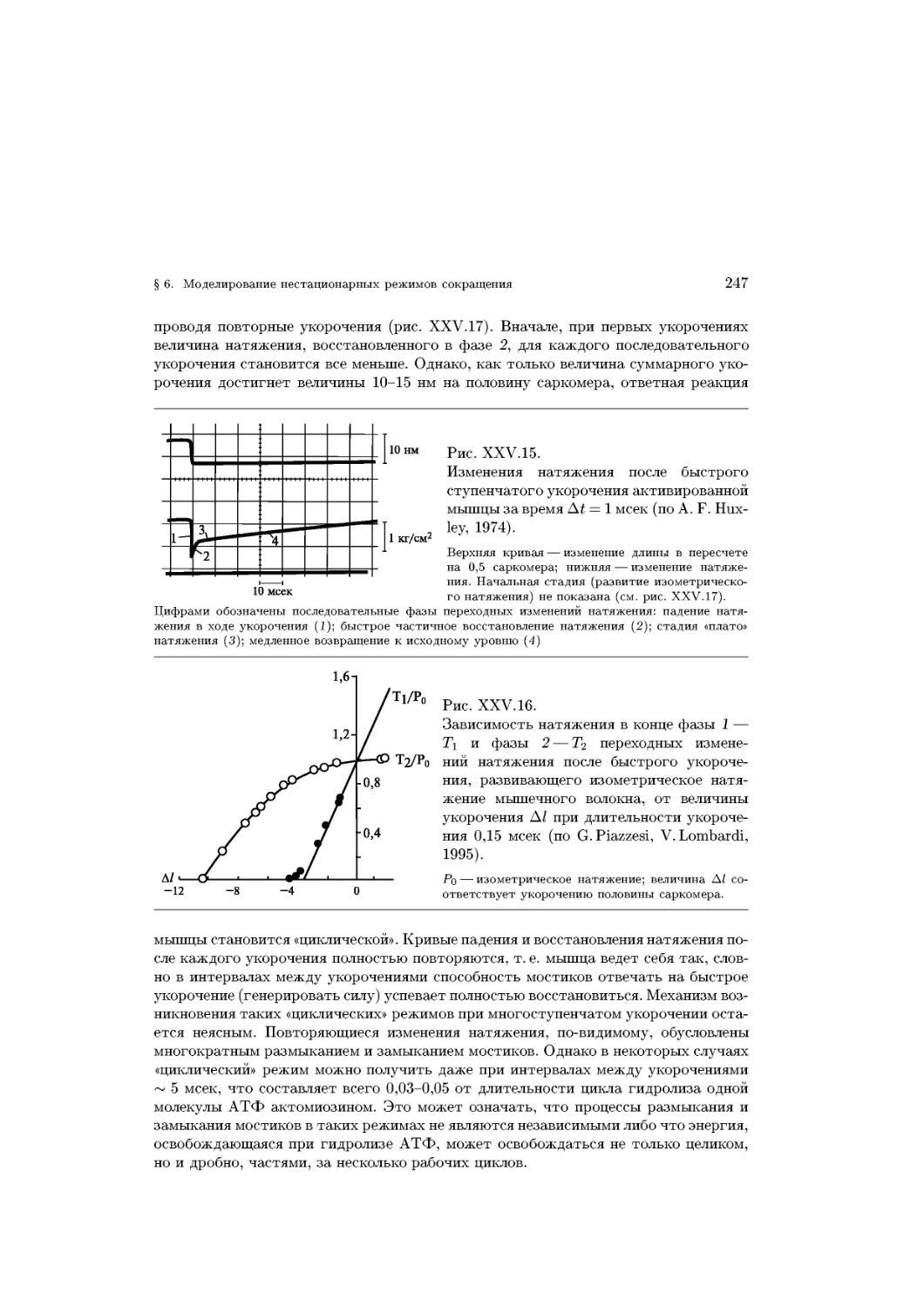
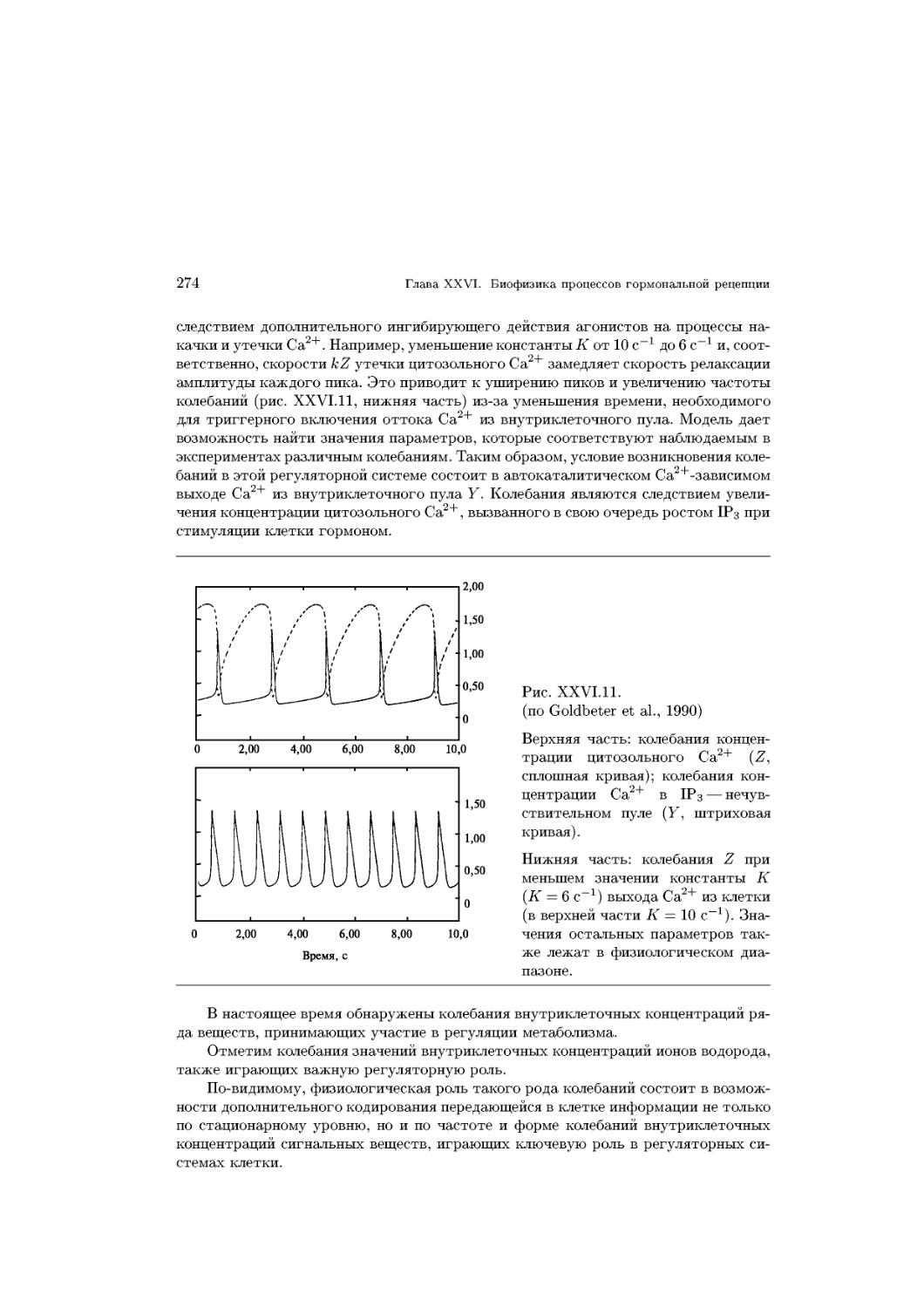
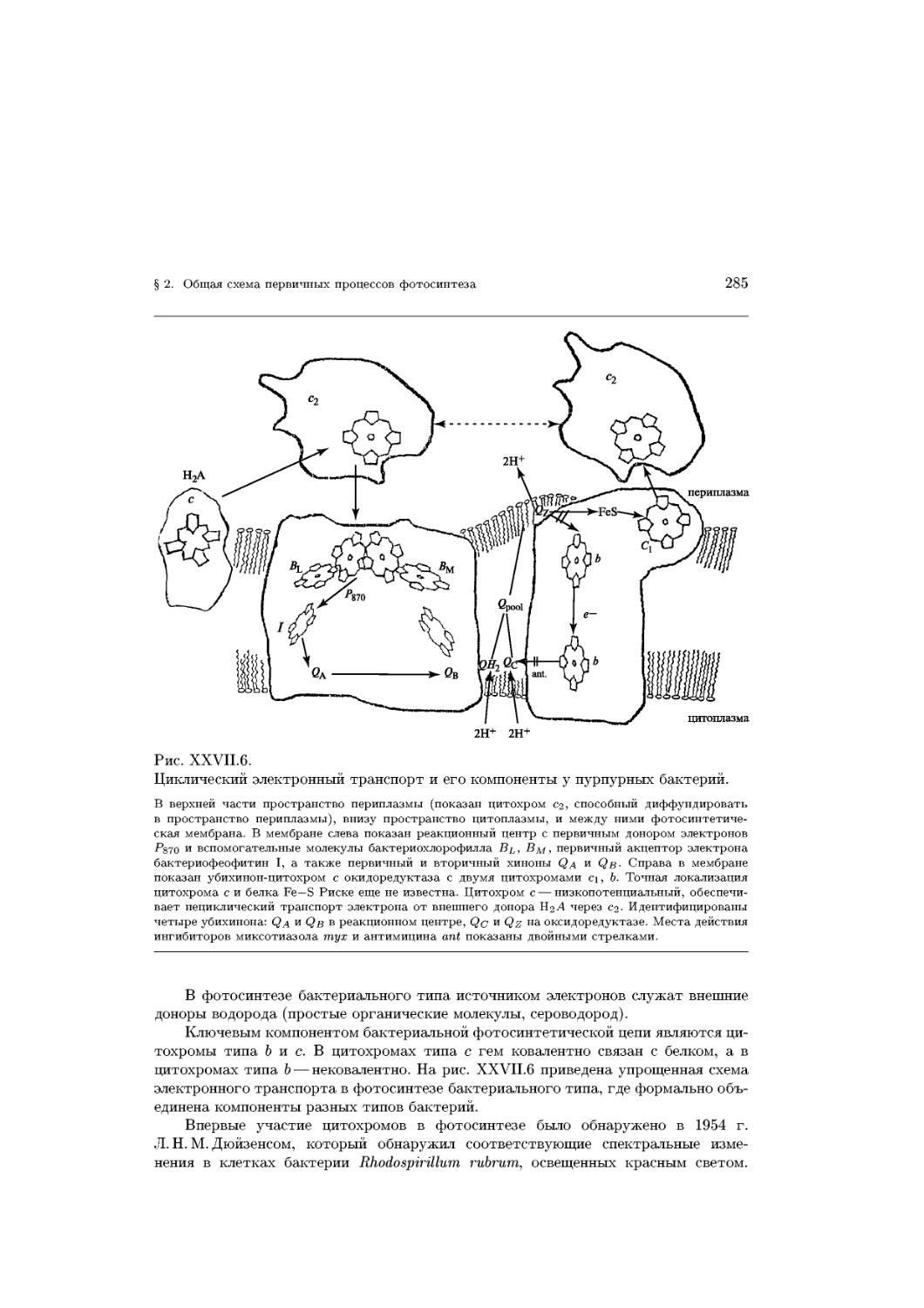
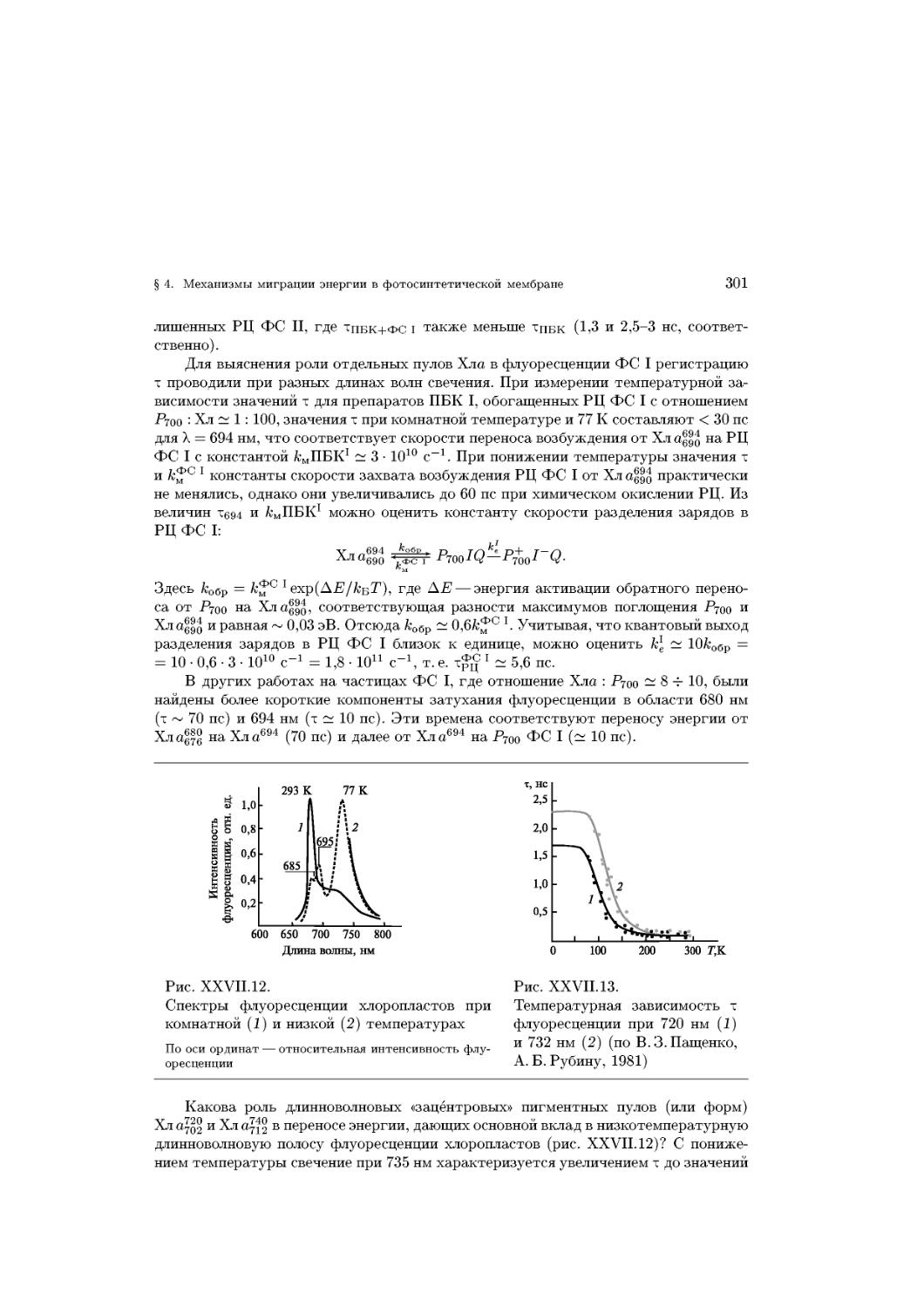
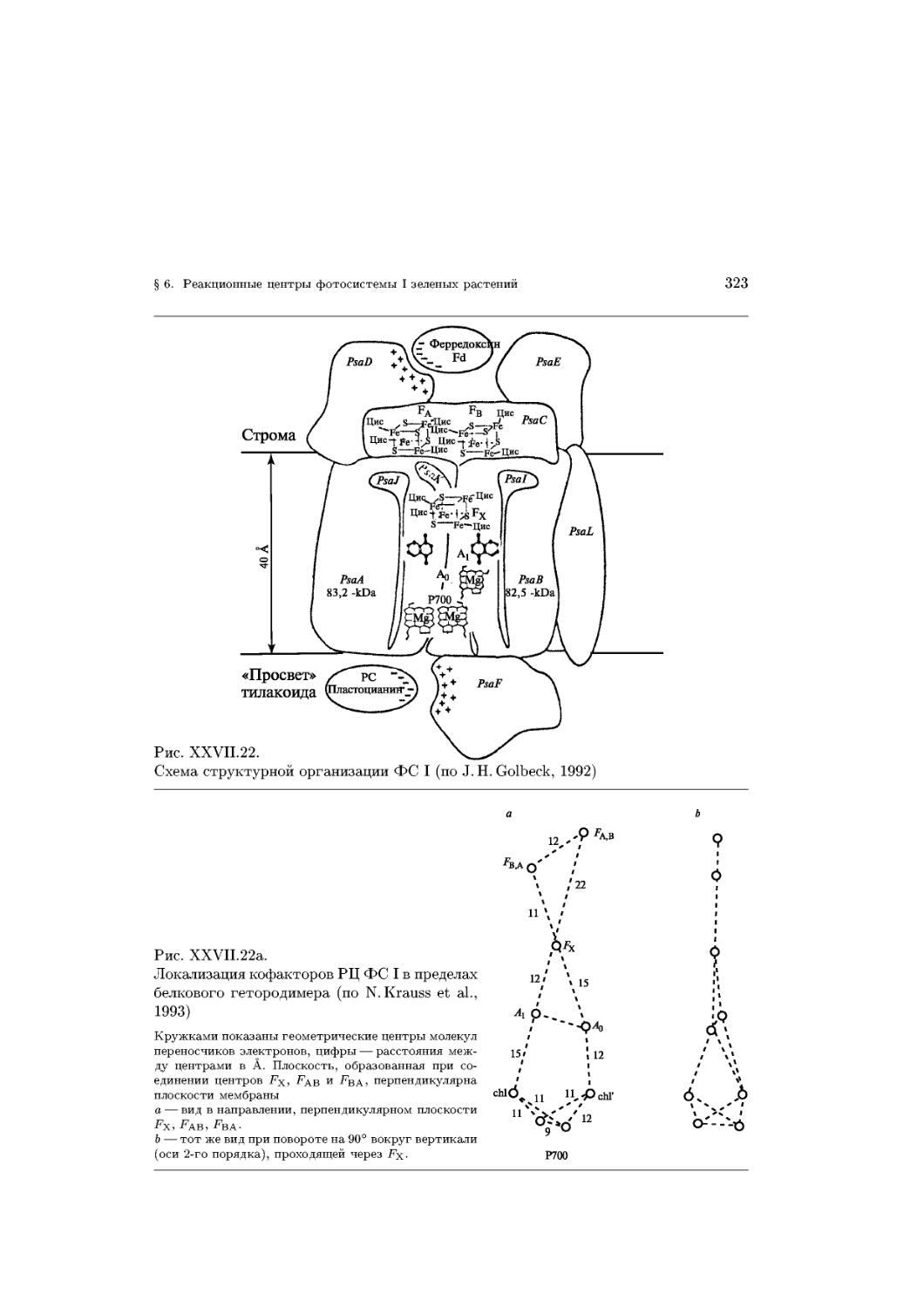
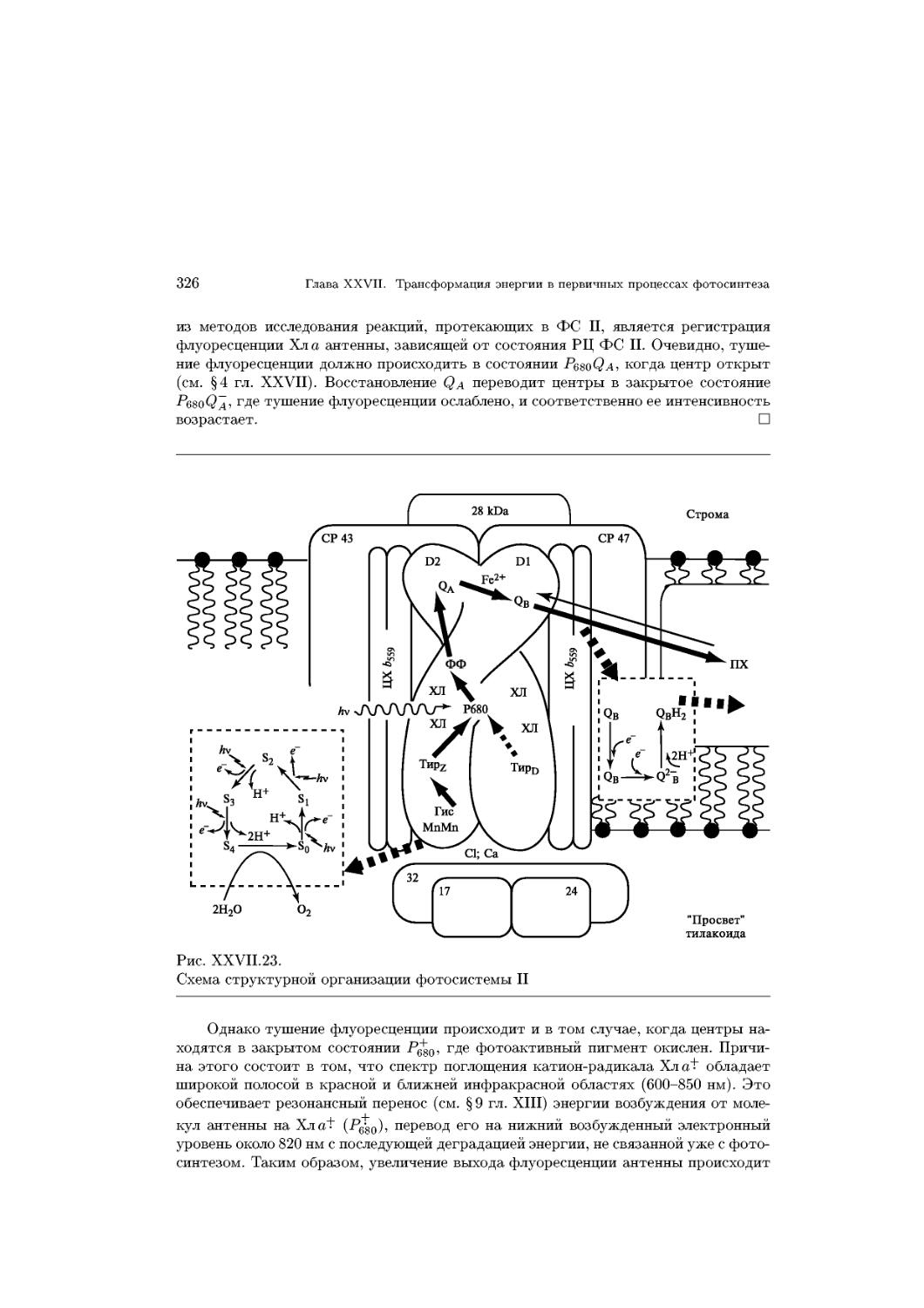
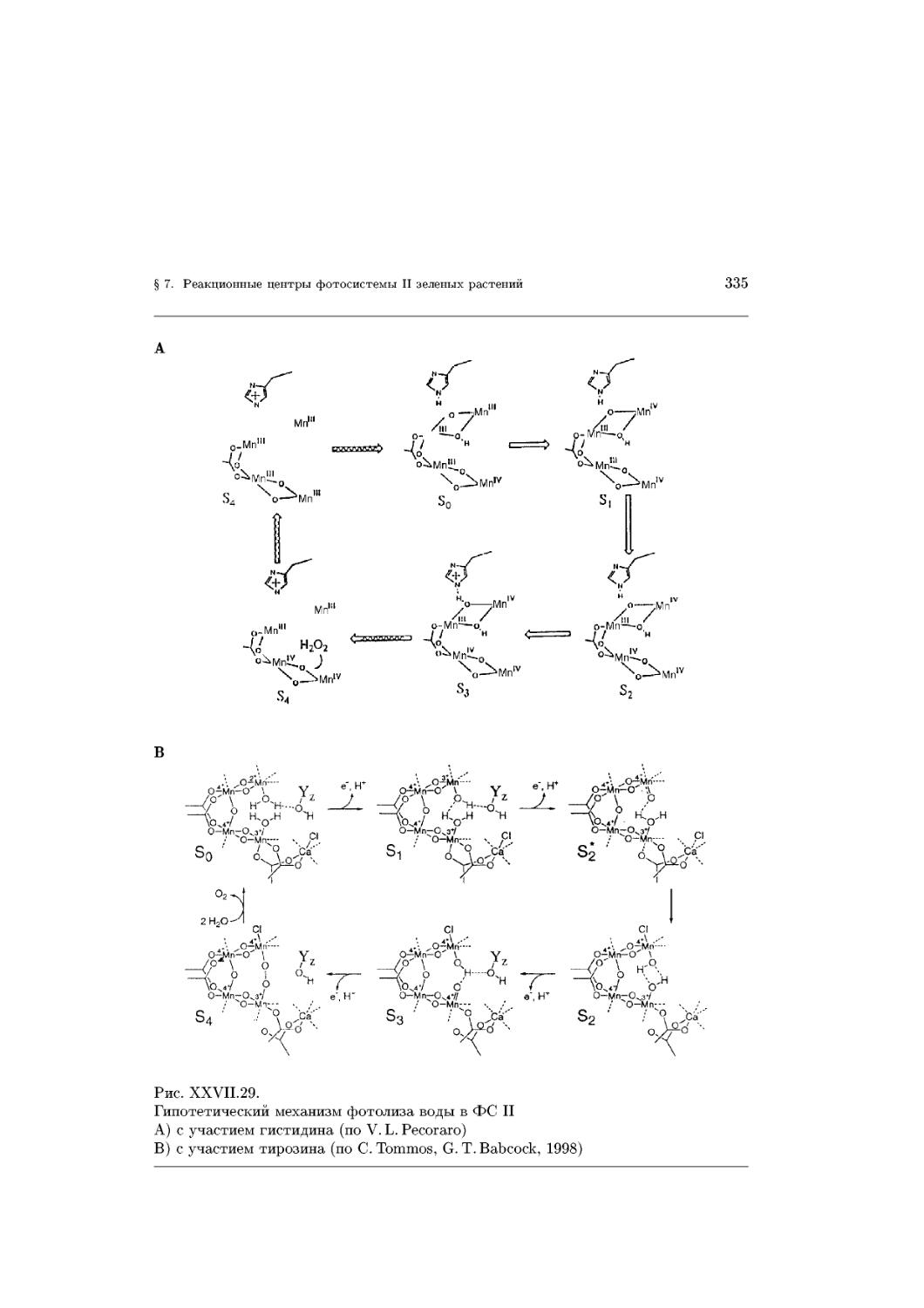
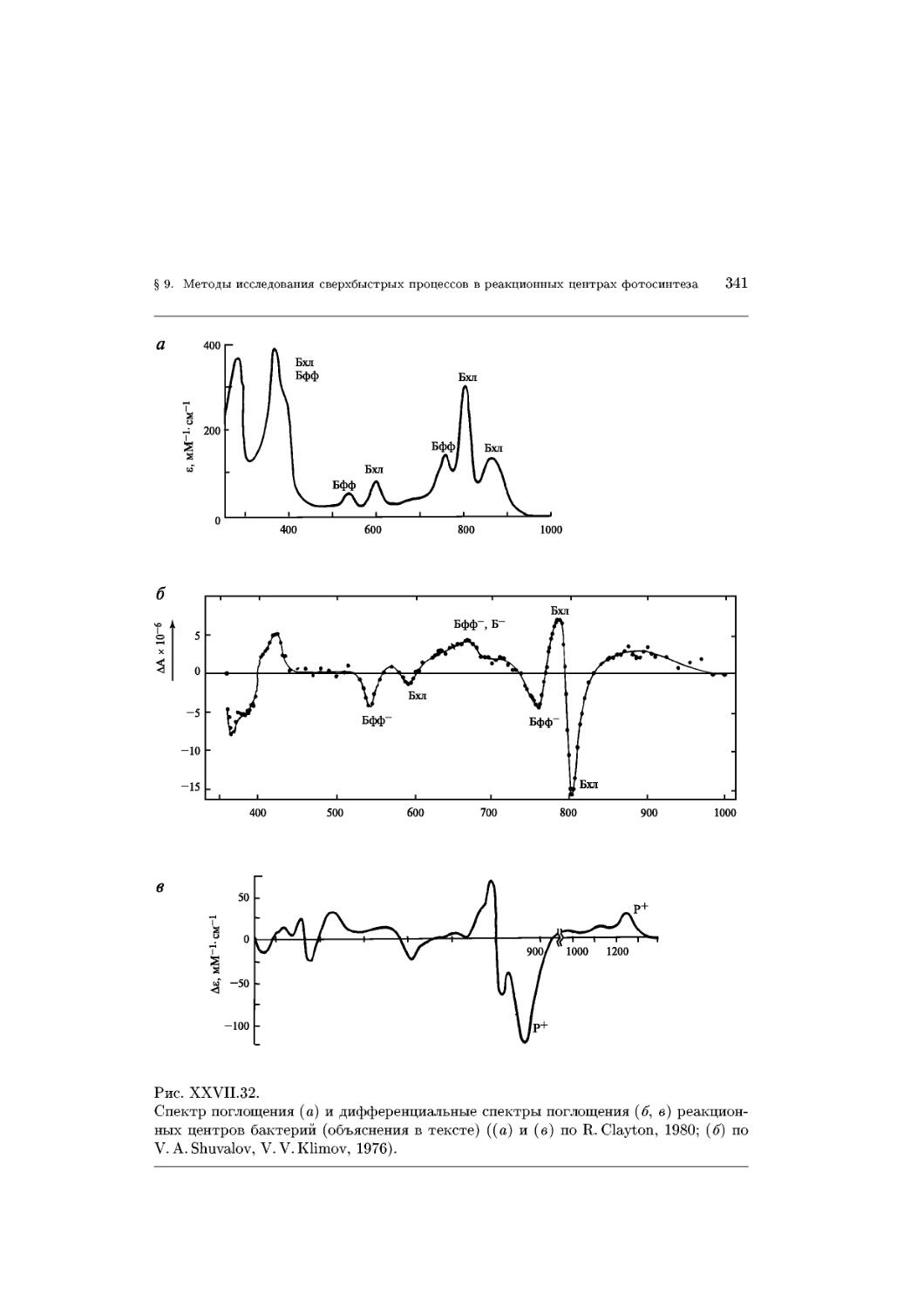
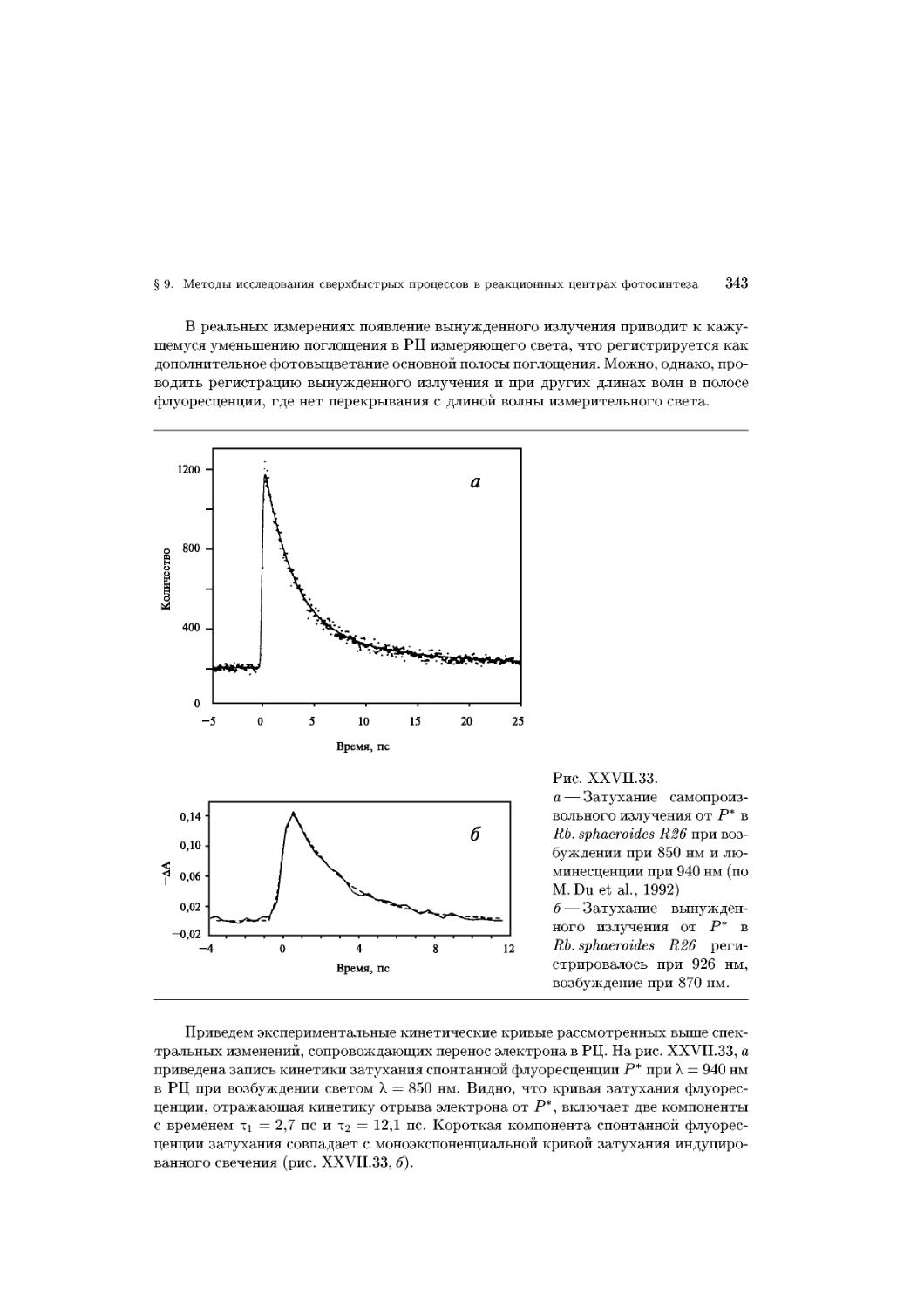
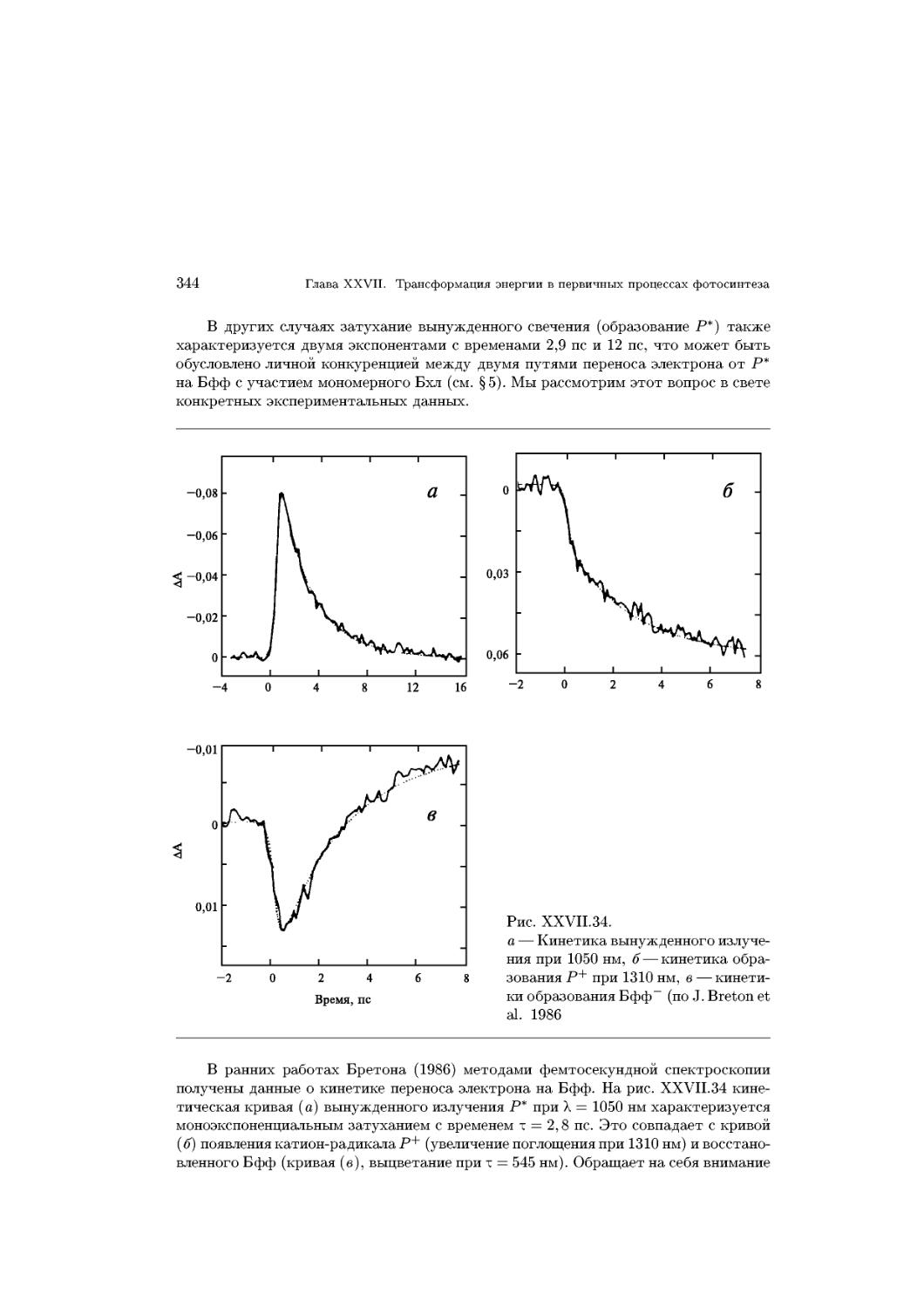
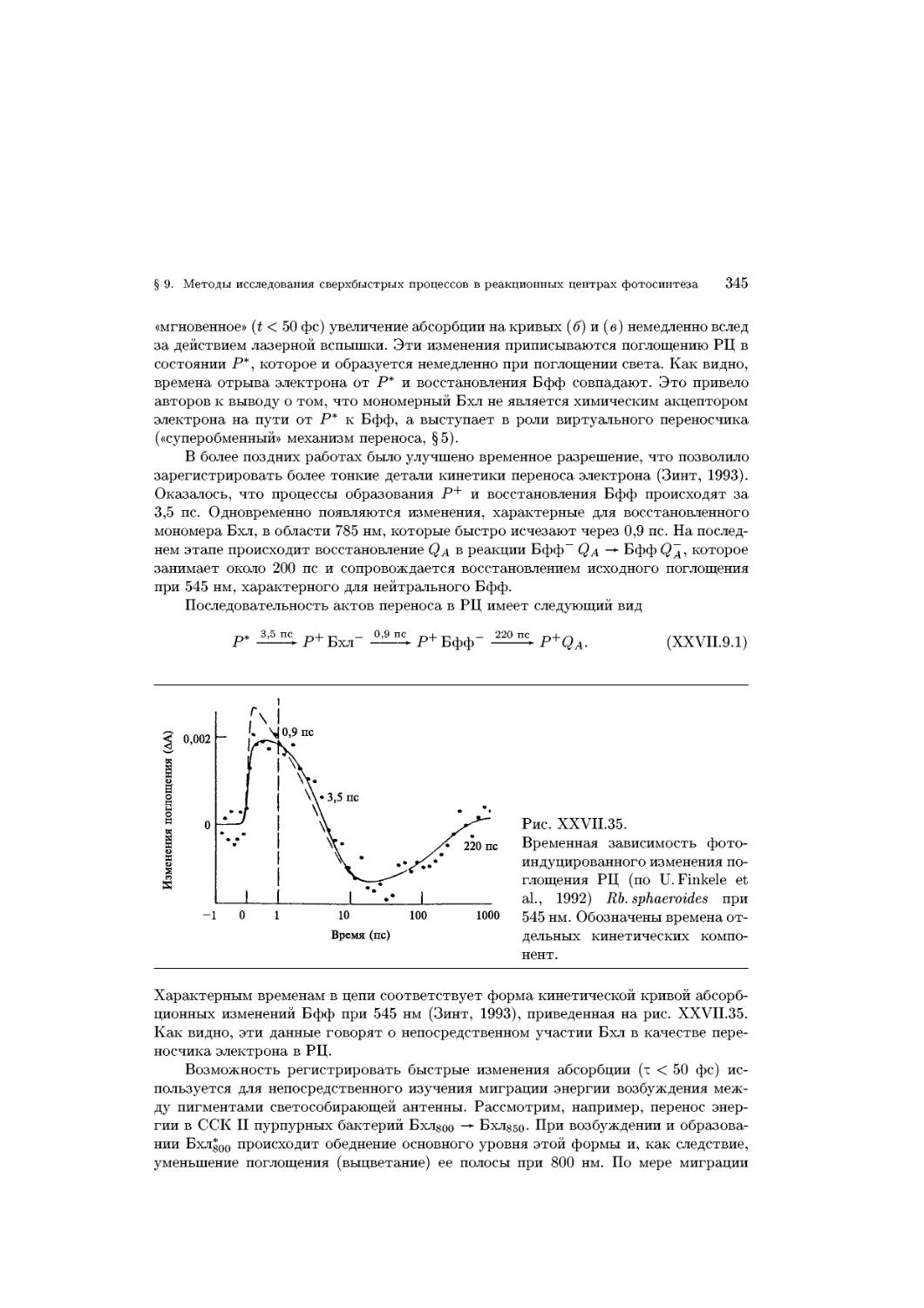
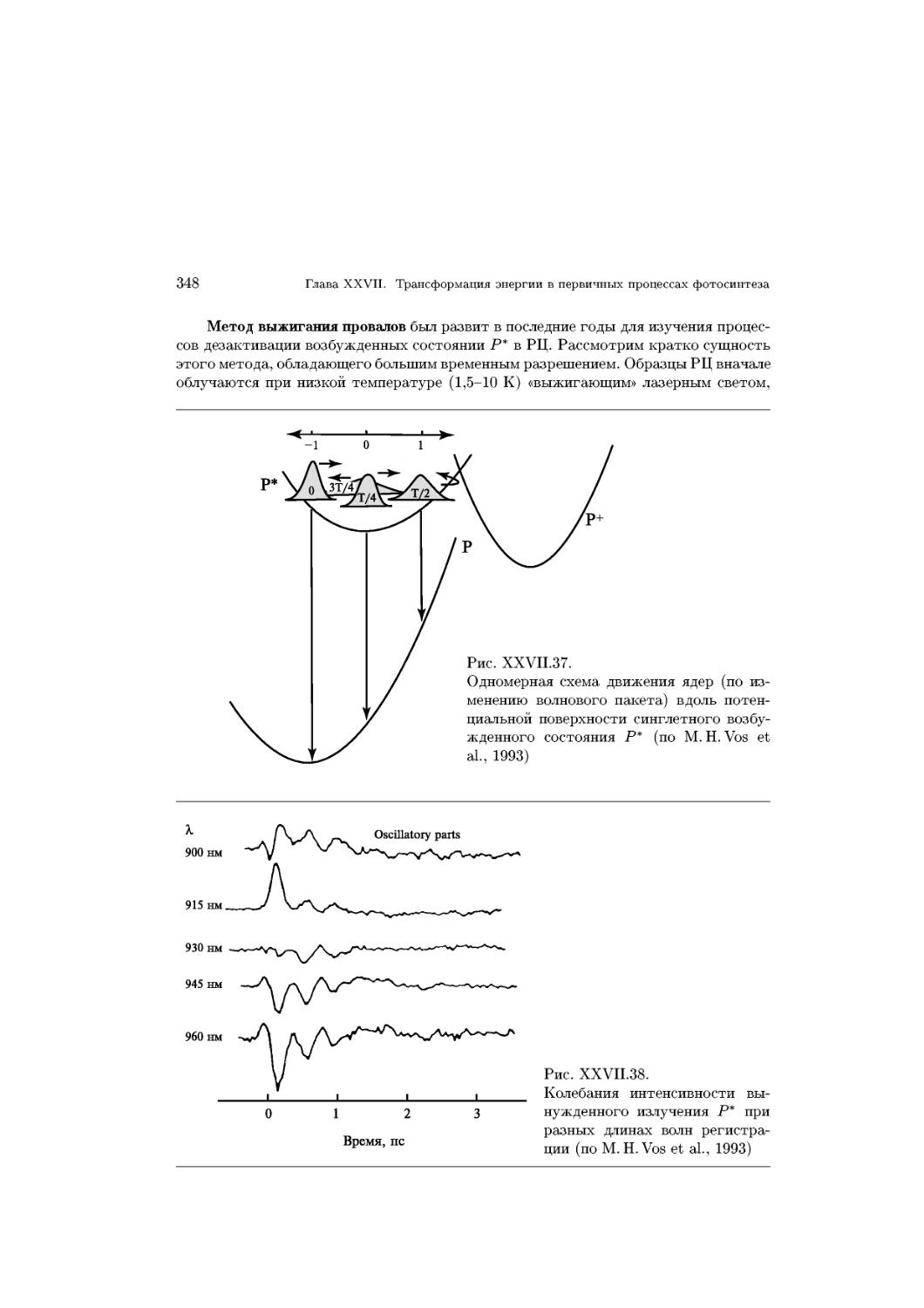
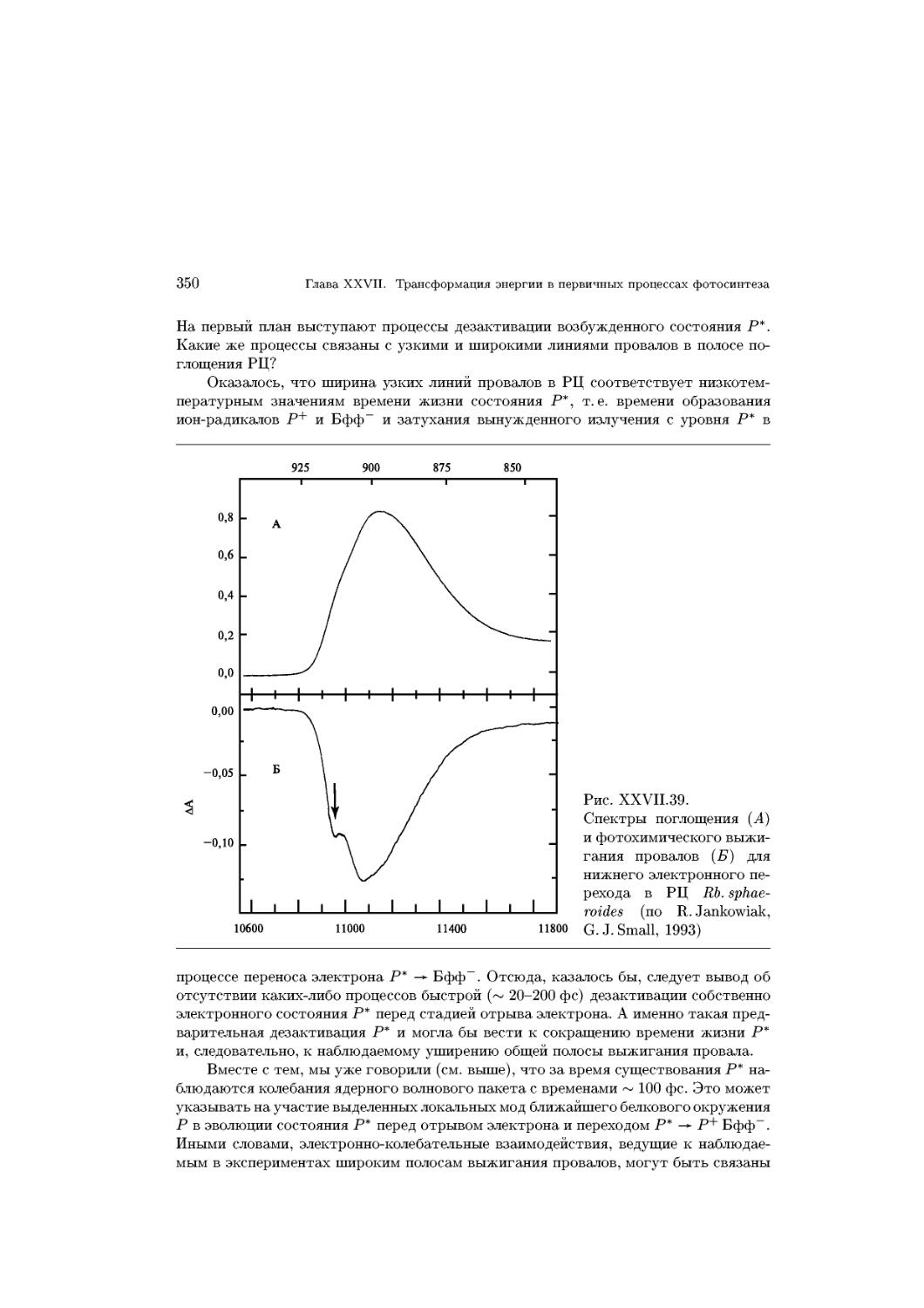
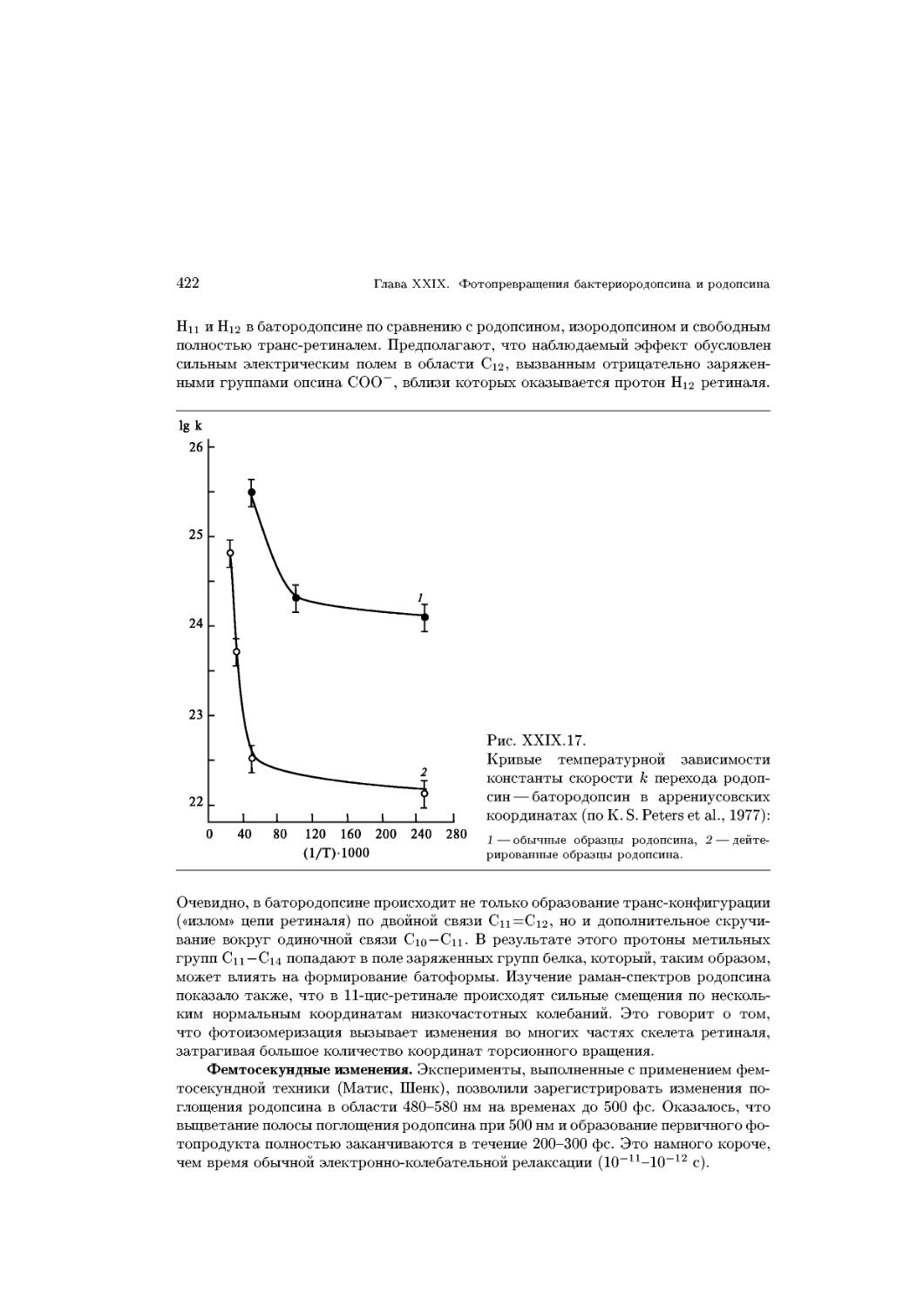
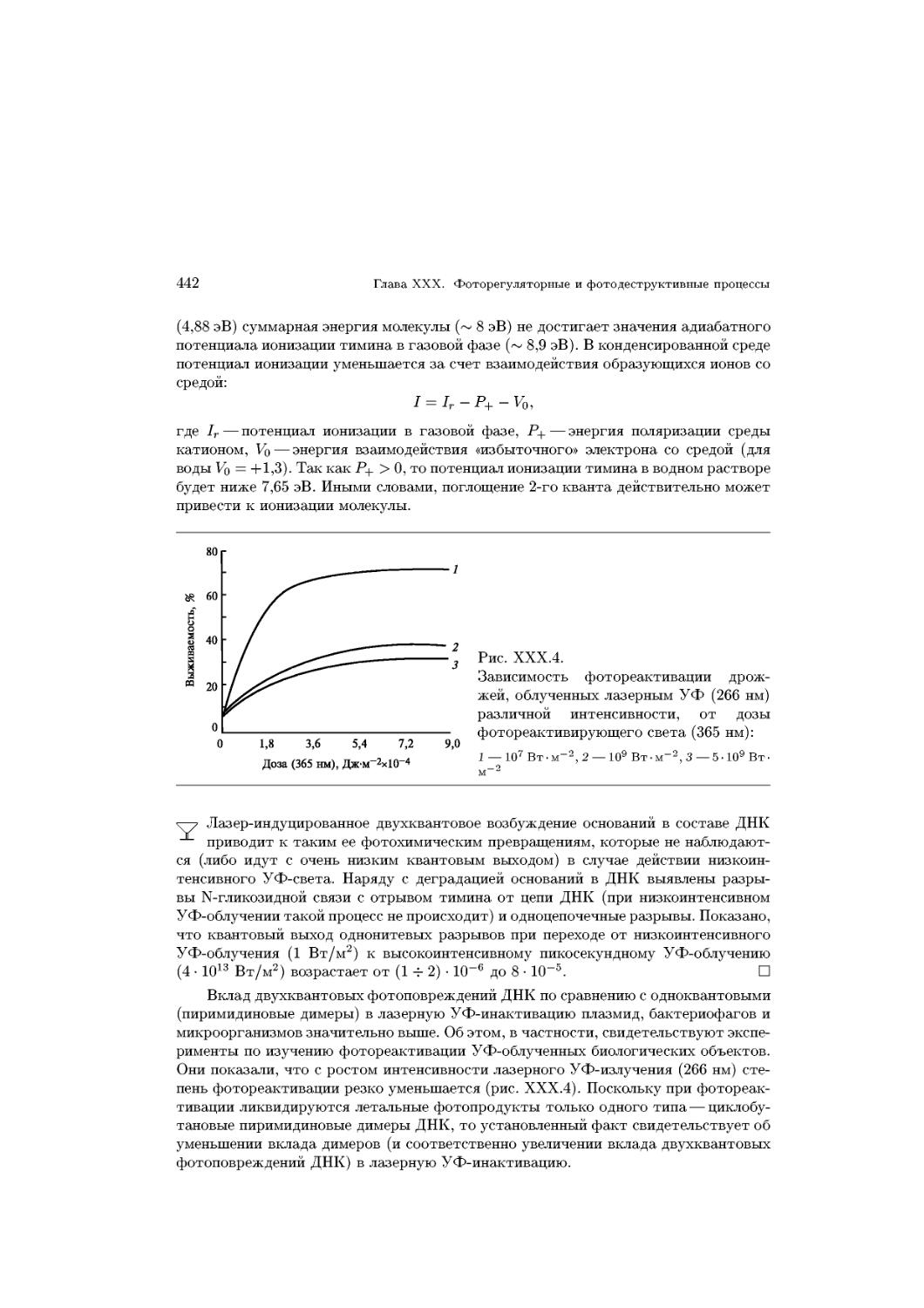
Text
Предисловие
В основу учебника положена программа общего курса биофизики для студентов
биологических факультетов государственных университетов. Широкое развитие
биофизики и проникновение ее в различные смежные области биологии и меди-
медицины стало возможным главным образом благодаря формированию в биофизике
собственной теоретической базы. Именно на этой единой основе читаются общие
курсы биофизики в различных биологических, медицинских, физических и сельско-
сельскохозяйственных вузах.
Настоящий учебник ориентирован главным образом на подготовку специали-
специалистов-биологов экспериментального профиля. Поэтому основное внимание уделяется
результатам, полученным биофизикой в решении соответствующих биологических
проблем. Однако изложение общих теоретических положений носит достаточно
универсальный характер и может быть полезно широкому кругу различных спе-
специалистов.
В учебнике при изложении основ биофизики использованы необходимые сведе-
сведения из общих курсов смежных биологических дисциплин и общих курсов физики, хи-
химии, физической химии и математического анализа для студентов-биологов. Кроме
того, введены и разъяснены некоторые физико-математические понятия, которые
применяются в современной биофизике, но не входят в программы университетских
дисциплин физико-математического цикла при подготовке студентов биологиче-
биологических специальностей.
Учебник состоит из двух книг. В первой — изложены теоретические положения
кинетики и термодинамики биологических процессов и основы молекулярной био-
биофизики; проанализированы физические модели и представления, лежащие в основе
понимания молекулярно-кинетических механизмов биологических процессов.
Изложенный материал служит в биофизике теоретической базой для анализа
биологических явлений на разных уровнях организации при выяснении элементар-
элементарных молекулярных взаимодействий и путей регуляции в биологических системах.
Как было показано выше, этот подход связан с современной идеей об электрон-
но-конформационных взаимодействиях в макромолекулярных комплексах, функци-
функциональные свойства которых определяют как молекулярные особенности метаболи-
метаболических процессов, так и конкретные механизмы их регуляции.
Биофизика внесла достойный вклад в исследование ряда процессов в клетке,
и удалось понять особенности биологических явлений путем раскрытия их молеку-
молекулярных механизмов.
Во второй книге рассмотрены основы биофизики клеточных процессов, про-
протекающих в клетках организма. В ней представлены данные о структурно-функ-
структурно-функциональной организации биологических мембран: описаны молекулярная органи-
организация и конформационные свойства биологических мембран. Специальный раздел
учебника посвящен биофизике процессов транспорта веществ через биомембраны
4 Предисловие
и биоэлектрогенезу; он содержит данные о транспорте неэлектролитов, о ионных
равновесиях, ионном транспорте в каналах и индуцированном ионном транспор-
транспорте. Рассмотрена электродиффузионная теория транспорта ионов через мембраны,
активный транспорт и транспорт ионов в возбудимых мембранах.
В книге изложены представления о переносе электронов и трансформации энер-
энергии в биомембранах, биофизике сократительных систем и процессах рецепции. По-
Подробно представлен материал о биофизике фотобиологических процессов. Описаны
первичные процессы фотосинтеза и другие биологические процессы в биологиче-
биологических системах: трансформация энергии и электронно-конформационные взаимодей-
взаимодействия в первичных процессах фотосинтеза; фотохимические реакции бактериоро-
допсина и родопсина; фоторегуляторные и фотодеструктивные процессы.
Автор
27 апреля 1998
Биофизика
мембранных процессов
VI
Структурно-функциональная
организация
биологических мембран
XV
Молекулярная организация
биологических мембран
XVI
Конформационные свойства мембран
Глава XV
Молекулярная организация биологических мембран
§ 1. Состав и строение биологических мембран
Биологическими мембранами (от лат. тетЪгапа — перепонка) называют функци-
функциональные структуры клеток толщиной в несколько молекулярных слоев, ограни-
ограничивающие цитоплазму и большинство внутриклеточных структур, а также обра-
образующие единую внутриклеточную систему канальцев, складок и замкнутых поло-
полостей. Толщина биологических мембран редко превышает 10,0 нм, однако вследствие
сравнительно плотной упаковки в них основных молекулярных компонентов (белки
и липиды), а также большой общей площади клеточных мембран они составляют
обычно более половины массы сухих клеток.
\—? Биологические мембраны построены в основном из белков, липидов и углево-
дов. Белки и липиды составляют основную часть сухой массы мембран. Доля
углеводов обычно не превышает 10-15%, причем они связаны либо с молекулами
белка (гликопротеины), либо с молекулами липидов (гликолипиды). В мембранах
различного происхождения содержание липидов колеблется от 25 до 75% по массе
по отношению к белку (табл. XV.1). П
В состав биологических мембран: входят липиды, относящиеся главным обра-
образом к трем основным классам: глицерофосфатиды (фосфолипиды), сфинго- и гли-
гликолипиды, а также стероиды.
Мембранные липиды имеют сравнительно небольшую полярную (заряженную)
головку и длинные незаряженные (неполярные) углеводородные цепи. Полярные
головки глицерофосфатидов — фосфатидилхолин, фосфатидилэтаноламин и сфин-
гомиелин — несут положительный и отрицательный заряд и при нейтральных рН в
целом электронейтральны (цвиттерионные липиды). Фосфатидилсерин и фосфати-
дилинозит имеют по одному, а кардиолипин — два некомпенсированных отрица-
отрицательных заряда.
Жирные кислоты, входящие в состав липидов биологических мембран, обычно
имеют от 14 до 22 углеродных атомов. Углеводородные цепи могут быть полностью
насыщенными либо содержать 1-6 ненасыщенных двойных связей. Двойные связи
практически всех жирных кислот находятся в цис-конформации. В природных фос-
фолипидах жирные кислоты, имеющие ненасыщенные связи, обнаруживаются, как
правило, во 2-м положении глицеринового остатка. Многочисленные эксперимен-
экспериментальные данные указывают, что в природных мембранах липидный состав внутрен-
внутреннего и наружного слоев может различаться по качественному и жирнокислотному
составу.
§ 1. Состав и строение биологических мембран
Таблица XV. 1.
Липидный состав мембран клеток млекопитающих, % от массы всех липидов
Липиды
Фосфатидилхолин
Сфингомиелин
Фосфатидилэтаноламин
Фосфатидилсерин
Фосфатидилинозитол
Лизофосфатидилхолин
Дифосфатидилглицерин
Другие фосфолипиды
Холестерин
Эфиры холестерина
Свободные жирные кислоты
Другие липиды
Плазма-
Плазматические
мембраны
18,5
12,0
11,5
7,0
3,0
2,5
0
2,5
19,5
2,5
6,0
15,0
Мито-
Митохондрии
37,5
0
28,5
0
2,5
0
14,0
-
2,5
-
15,0
Лизосомы
23,0
23,0
12,5
6,0
6,0
0
5,0
-
14,0
8,0
-
2,5
Ядра
44,0
3,0
16,5
3,5
6,0
1,0
1,0
-
10,0
1,0
9,0
5,5
Эндо-
плазмати-
ческий
ретику-
лум
48,0
5,0
19,0
4,0
7,5
1,5
0
-
5,5
1,0
3,5
5,0
Аппарат
Гольджи
24,5
6,5
9,0
2,5
5,0
3,0
0
-
7,5
4,5
18,0
16,0
Белковый состав мембран также исключительно многообразен. Большинство
мембран, за редким исключением, содержит большое число различных белков, мо-
молекулярная масса которых колеблется от 10 000 до 240000.
В зависимости от степени гидрофобности, числа и локализации гидрофобных
аминокислотных остатков в полипептидной цепи белки либо частично, либо цели-
целиком погружены в липидный слой мембран или пронизывают его насквозь. Наиболее
слабо связаны с мембраной так называемые периферические белки, которые удер-
удерживаются в мембране за счет слабых, в основном неэлектростатических, взаимо-
взаимодействий. Белки, сильно связанные с липидами мембран и глубоко погруженные в
липидный слой мембран, так называемые интегральные белки, составляют основ-
основную массу мембранных белков. Обычно полипептидные цепи этих белков включают
большое число неполярных аминокислотных остатков.
^—р В функциональном отношении мембранные белки подразделяются на фермен-
тативные, транспортные и регуляторные. Выделяют также структурные белки,
которые выполняют в основном «опорно-строительные» функции. ?
Важным структурным компонентом мембран является вода (см. § 4 гл. IX).
Особенности взаимодействия основных молекулярных компонентов мембран с во-
водой определяют не только многие структурно-функциональные свойства мембран,
но и являются решающими в процессе формирования самих мембран и стабилизации
мембранных систем. Воду, входящую в состав мембран, подразделяют на связан-
связанную, свободную и захваченную. Наименьшей подвижностью отличается так назы-
называемая внутренняя связанная вода, присутствующая в виде одиночных молекул в
углеводородной зоне мембран. Эта фракция воды, по данным ЯМР-спектроскопии,
характеризуется временем корреляции тс ~ 10~7 с. Основная часть связанной во-
воды— вода гидратных оболочек. Подвижность этой воды в мембранах выше, что
приводит к меньшим значениям: тс sj (8 4-10) ~10 с. Гидратные оболочки образуются
главным образом вокруг полярных частей молекул липидов и белков. Гидратные
8 Глава XV. Молекулярная организация биологических мембран
оболочки основных структурообразующих липидов состоят обычно из 10-12 моле-
молекул воды. Эта вода осмотически неактивна, она не способна растворять какие-либо
вещества.
Слабосвязанная вода по подвижности и некоторым другим свойствам занимает
промежуточное положение между водой гидратных оболочек и жидкой свободной
водой.
Свободная вода входит в состав мембран в виде самостоятельной фазы и обла-
обладает изотропным движением, характерным для жидкой воды. Захваченная вода,
обнаруживаемая иногда в центральной части мембран между липидными бислоями,
по параметрам подвижности соответствует жидкой свободной воде, но медленно
обменивается с внешней водой из-за физической разобщенности.
Изучение строения мембран необходимо для понимания их функционирования.
В 1935 г. Ф. Даниэлли и Г. Давсон выдвинули первую гипотезу о строении биологи-
биологических мембран, согласно которой мембрана состоит из двойного липидного слоя,
покрытого с двух сторон слоями глобулярных белков.
В 50-х годах XX в. методом электронной микроскопии были получены снимки
мембран в виде трехслойных структур толщиной около 10 нм для плазматических
и несколько меньшей — для субклеточных мембран. В 1964 г. Дж.Робертсон пред-
предложил унитарную схему асимметричного строения мембраны. В соответствии с
этой схемой белки могут разворачиваться на поверхности двойного липидного слоя
под действием сил электростатического взаимодействия с заряженными головками
фосфолипидов мембран; на наружной поверхности мембраны располагаются еще и
молекулы гликопротеинов. Однако под влиянием новых фактов, и в первую очередь
обнаружения зернистой структуры мембран, которая просматривалась на снимках,
полученных при большом увеличении, первоначальные представления о трехслойно-
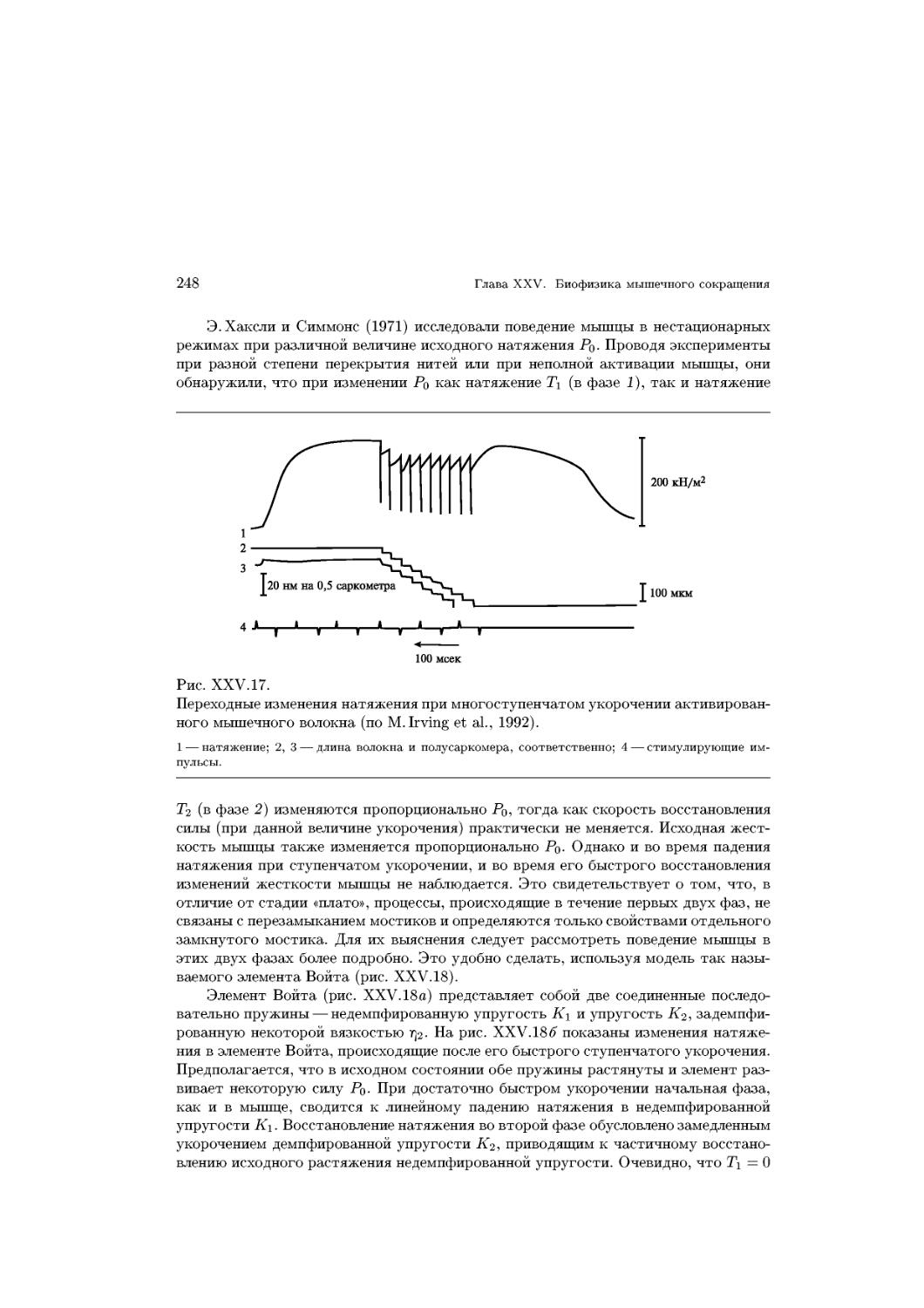
сти мембран были пересмотрены. На рис. XV. 1 отражены изменения представлений
о строении мембран.
^—р В настоящее время считают, что белки не выстилают поверхность липидно-
го слоя, мембран, а «плавают» на поверхности в виде отдельных глобулярных
молекул или частиц, в большей, или меньшей степени погруженных в мембрану.
Эта жидкомозаичная модель, предложенная Дж. Ленардом и С. Сингером A966), по-
позволяет удовлетворительно объяснить целый ряд фактов, в частности зависимость
многих физиологических функций мембран и активности отдельных мембранных
ферментов от фазового состояния липидов в мембране, ее текучести (вязкость).
Более поздняя белково-кристаллическая модель (G. Vanderkooi, D. Green, 1970) от-
отличается от жидкомозаичной модели фактически лишь постулированием существо-
существовании в мембране жесткой белковой структуры, возникающей в результате дально-
действуюших белок-белковых связей.
В настоящее время получили наибольшее распространение различные варианты
жидкомозаичной модели. ?
Характер взаимодействия полярных и неполярных групп белка и липидного би-
слоя приводит к тому, что пептид должен быть расположен так, чтобы максималь-
максимально возможное количество неполярных аминокислотных остатков было погружено
в бислой. Это очевидное требование определяет характер трех основных типов
белок-мембранных комплексов, которые включают 6-складчатые и а-спиральные
1. Состав и строение биологических мембран
авповпопошшою
J.F. Danielli and H.J.Dayson A935)
W.D. Stein and J.F. Danielli A956)
J.B. Finean1 A962)
HMlllllilllll!
IW1IIIMIIHIII
J.D. Robertson A964)
J.B. Finean A972)
P.H. Zahler A969)
F. Sjosrand A968)
(впервые предложено в 1965 г.)
J.A. Lucy A964)
G. Vanderkooi and D.E. Green A970)
I I, , I Krf V» II
'у'!?;';;
J.Lenard and S.J. Singer A966)
A.Berson A968) "
D.E. Green and J. Perdue A966)
Рис. XV.l.
Развитие представлений о молекулярной организации биологических мембран (по
Ю.А.Владимирову, 1975)
10 Глава XV. Молекулярная организация биологических мембран
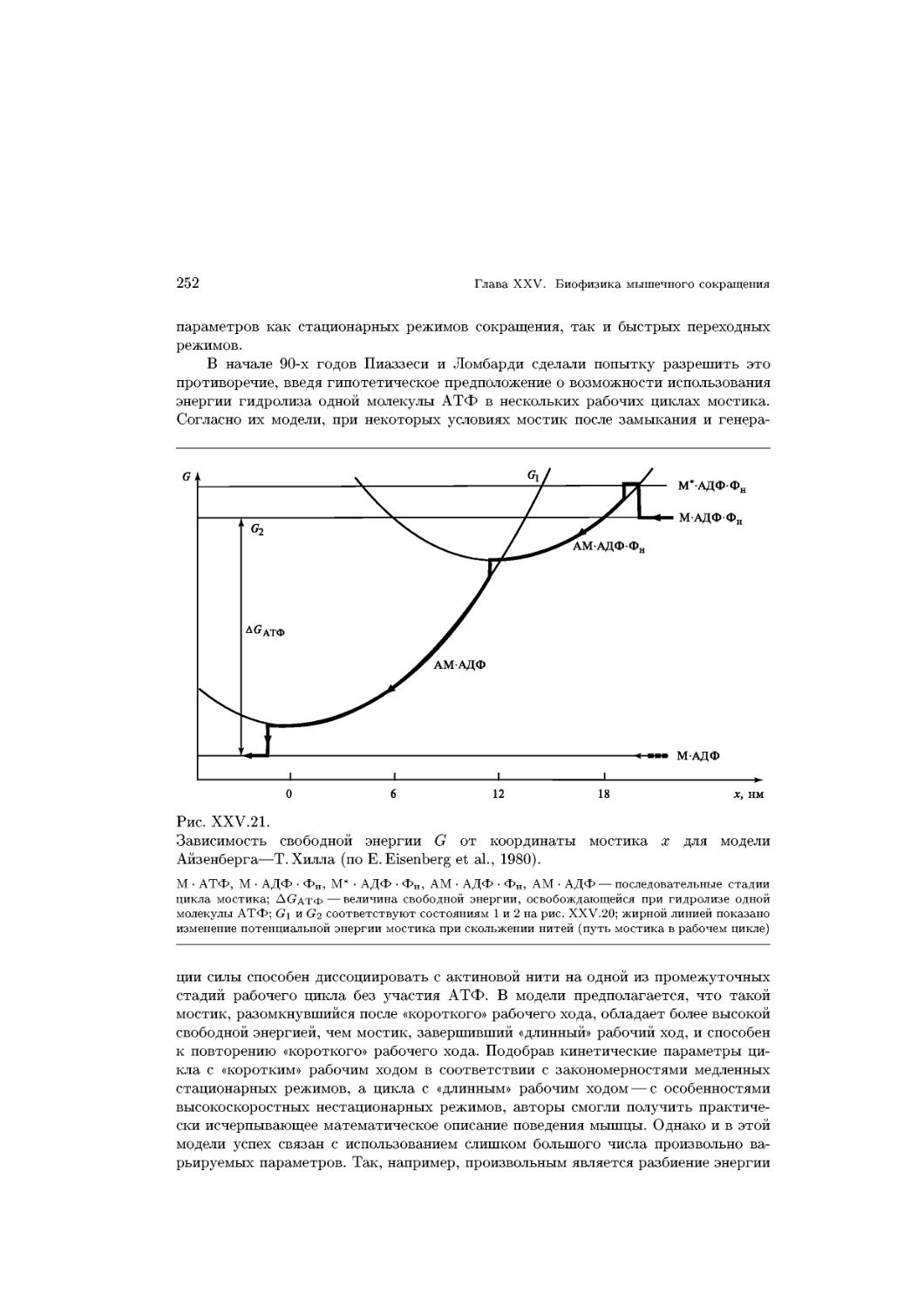
структуры с различным соотношением полярных и неполярных групп (рис. XV. 2).
Предполагается, что амфифильные C-складчатые структуры (тип 1) свора-
сворачиваются с образованием пор для пассивной диффузии веществ через мембраны
(см. гл. XVII). Внутри такой поры расположены полярные, а наружи в контакте с
биолоем — неполярные группы.
-ш
- структура а- спираль
ч
Рис. XV.2.
Три типа белок-мембранных взаимодействий
1 — амфифильная C-структура; 2 — а-спираль амфифильная; 3 — а-спираль равномерногидрофоб-
ная; черные кружки соответствуют заряженным боковым цепям; квадраты — полярным, но неза-
незаряженным, белые кружки — неполярным боковым цепям.
Пептидные гормоны (гл. XXVI) могут образовывать комплексы (тип 2) с мем-
мембранами. Структуры типа 3 характерны для интегральных мембранных белков,
пронизывающих мембраны своими а-спиралями (бактериородопсины, гл. XXIX).
§ 2. Образование мембранных структур
Монослои. Жидкие кристаллы
\—? Основные мембранообразующие липиды представляют собой соединения с иде-
альным сочетанием гидрофобных и гидрофильных свойств. Они сравнительно
плохо растворимы в воде в мономерном виде, а стремление их полярных головок
максимально контактировать с водой придает им уникальные способности обра-
образовывать многообразные сравнительно устойчивые структуры при агрегации этих
молекул. ?
Нерастворимые монослои на границе раздела вода-воздух. Большинство мем-
бранообразующих липидов при нанесении их на поверхность воды практически
не растворяется в объемной фазе, а быстро растекается по поверхности, обра-
образуя мономолекулярный слой (И. Ленгмюр, 1933). При сжатии монослоя начинают
проявляться межмолекулярные взаимодействия, нарушающие состояние идеального
двумерного газа (рис. XV.3, А).
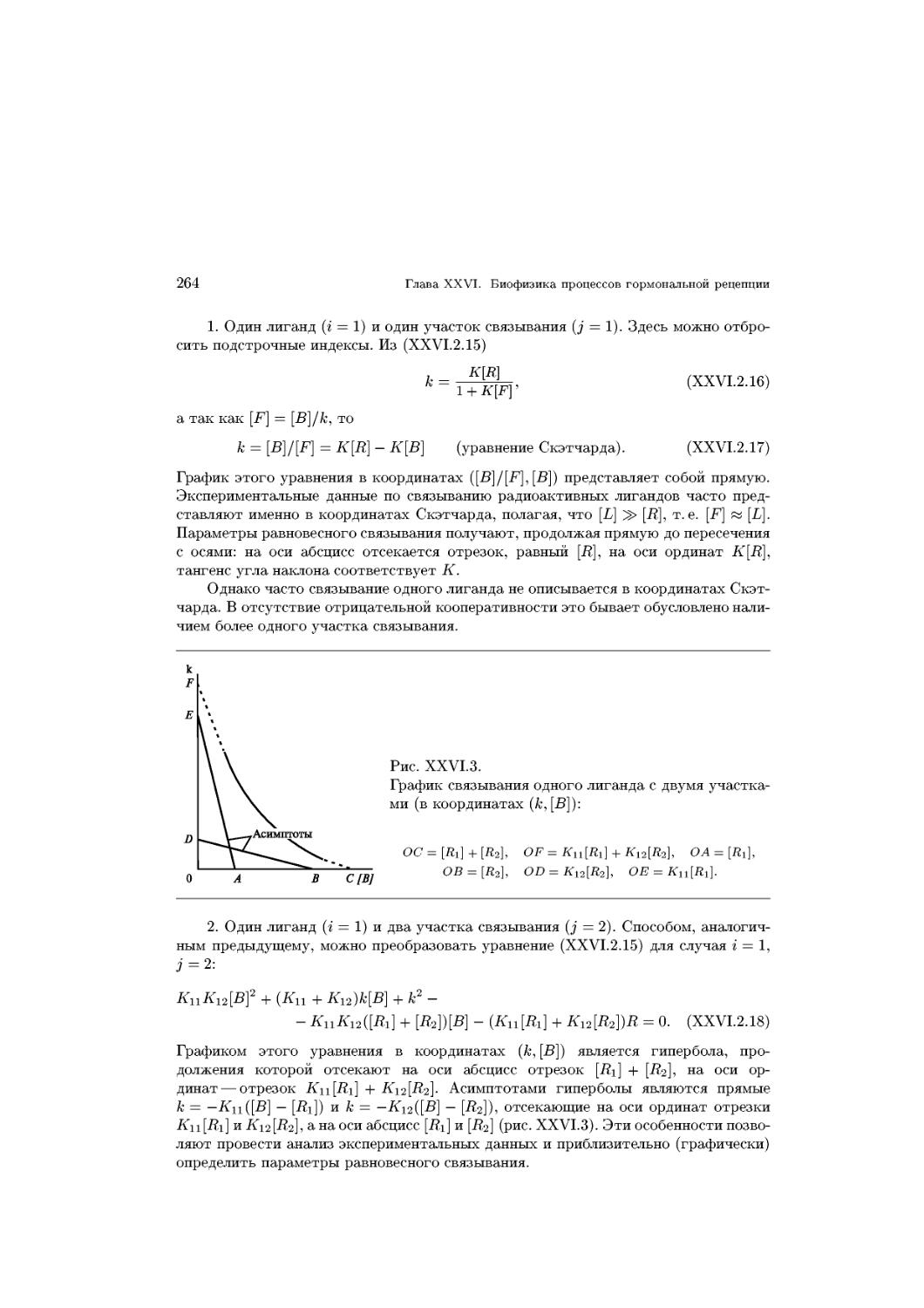
Дальнейшее возрастание давления приводит к формированию так называемой
растянутой жидкой пленки. Молекулы в этом состоянии обладают всеми степенями
свободы, как и в обычной жидкости, однако их полярные головки фиксированы
на поверхности раздела фаз (рис. XV.3, В). Углеводородные цепи молекул в этом
состоянии склонны к агрегации и взаимопроникновению.
i 2. Образование мембранных структур
11
При дальнейшем возрастании давления в монослое будет реализовываться наи-
наиболее плотная упаковка молекул, т. е. их вертикальная ориентация. Вначале по-
подвижность углеводородных цепей будет выше, чем у полярных головок, так как
последние сильно гидратированы. В этом состоянии сохраняется возможность дви-
движения молекул в плоскости поверхности (латеральная подвижность) и его можно
рассматривать как конденсированную жидкую пленку (рис. XV.3, С). Дальнейшее
мН-м
40
30
20
10
Е
D
V
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
нм2/молекулу
II
С
В
Рис. XV.3.
Кривая (изотерма) площадь-дав-
площадь-давление для монослоя длинноцепоч-
ных липидов (/) и схема располо-
расположения липидных молекул на гра-
границе раздела фаз вода-воздух (II):
А — состояние двумерного газа, В —
растянутая жидкая пленка, С — конден-
конденсированная жидкая пленка, D — твер-
доконденсированное состояние, Е — со-
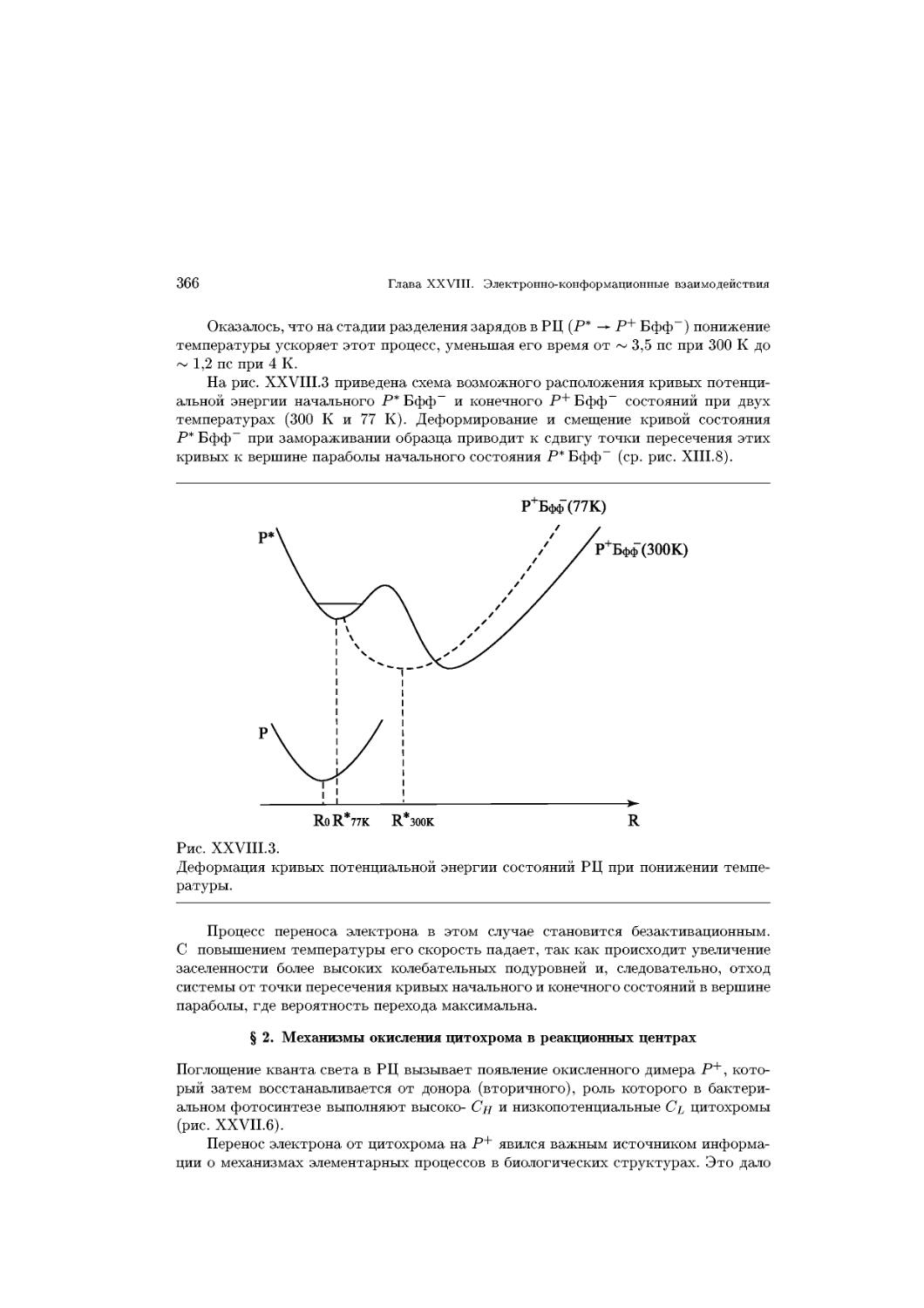
состояние коллапса
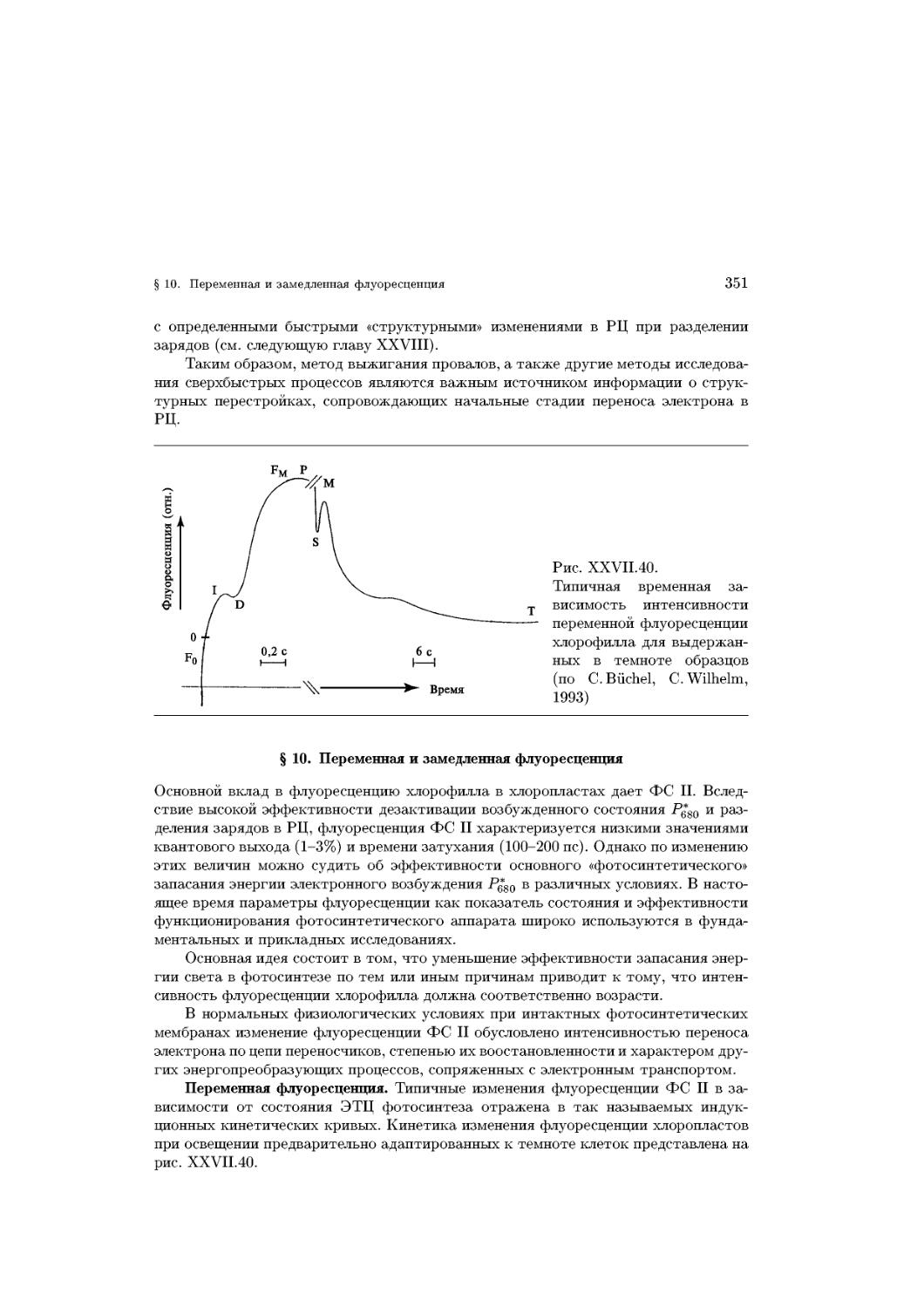
уплотнение слоя при возрастании давления может произойти лишь за счет разруше-
разрушения гидратных оболочек полярных головок, после чего слой становится практически
несжимаемым и находится в твердоконденсированном состоянии (рис. XV.3, D),
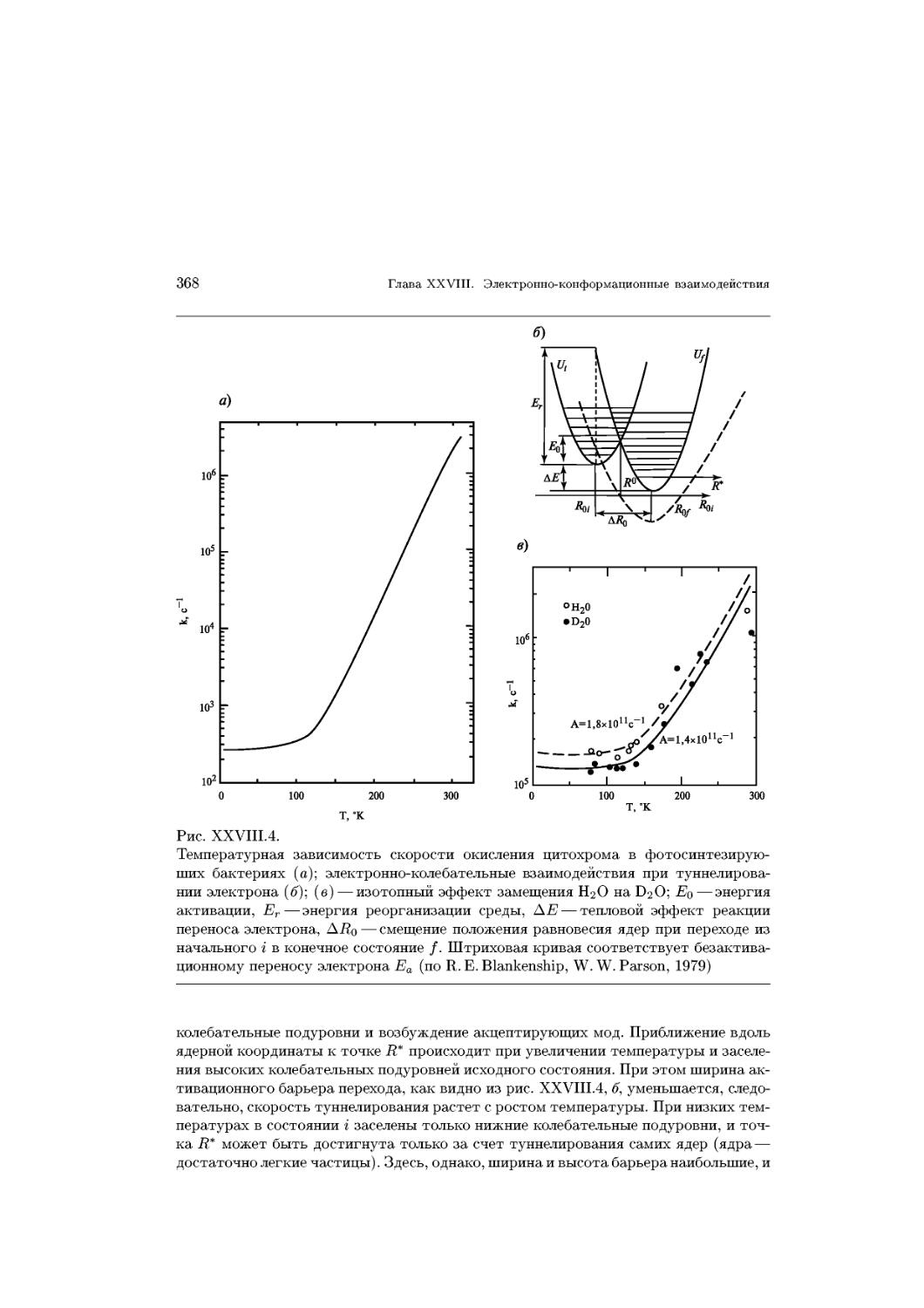
где площадь поперечного сечения молекул не зависит от длины углеводородной
цепи. Площадь поперечного сечения углеводородной цепи составляет ~ 0,2 нм2,
предельная площадь молекул насыщенного фосфатидилхолина — 0,44 нм2, а фосфа-
тидилэтаноламина ~ 0,4 нм2. После превышения некоторого предельного давления
монослой начинает разрушаться — состояние коллапса (рис. XV.3, Е).
\—? Поверхностные монослои широко используют в качестве модельных мембран-
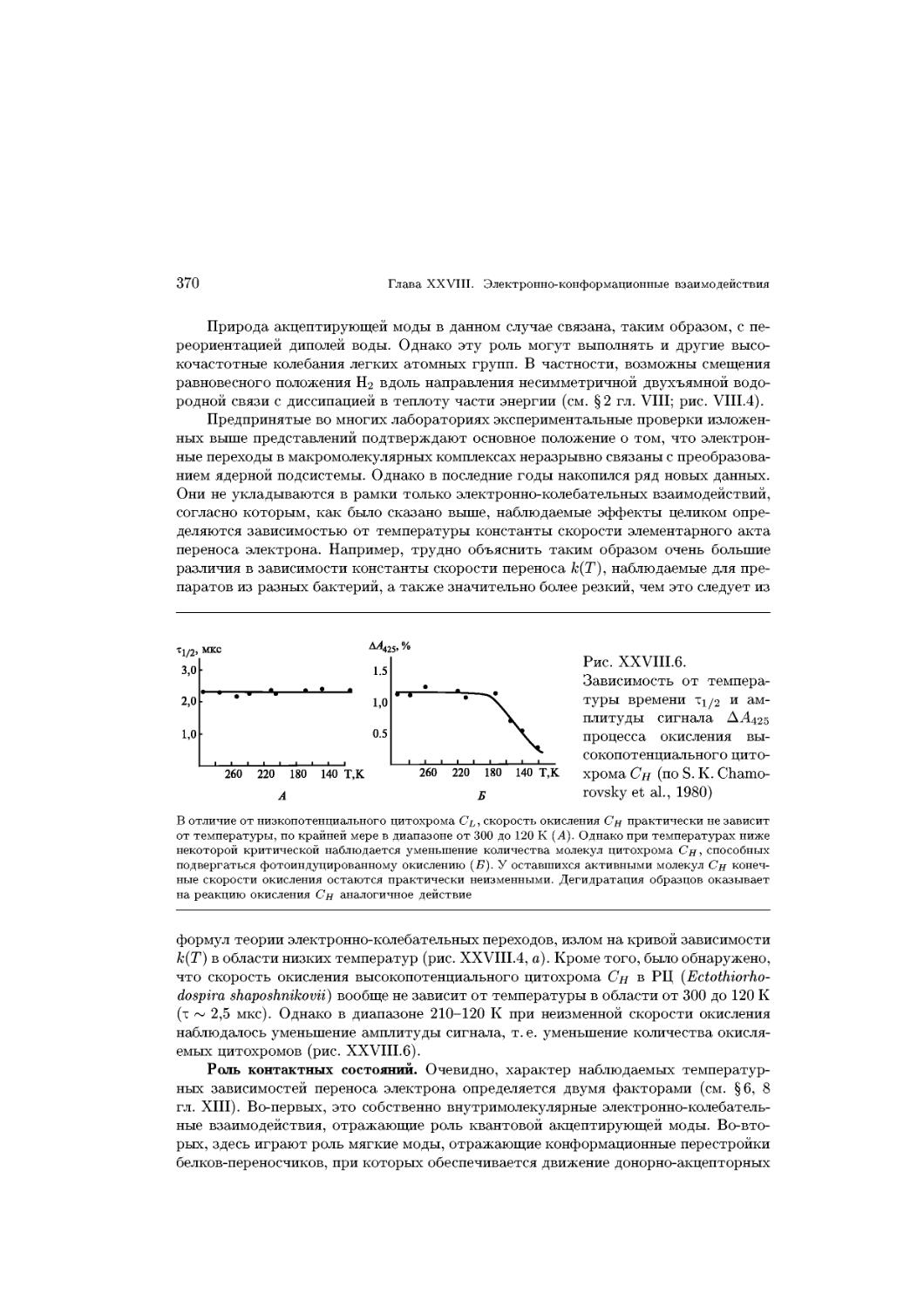
ных систем. С их помощью изучают подвижность и типы упаковки молеку-
молекулярных компонентов в мембранах, межмолекулярные взаимодействия в мембранах,
механические свойства мембран; исследуют кинетику и механизмы ферментатив-
ферментативных процессов, протекающих на границе раздела фаз; изучают процессы переноса
ионов и электронов через границу раздела фаз, инжекцию заряда в липидный слой
(диэлектрик) и т. д. Однако этот метод имеет ряд ограничений, в значительной
степени обусловленных тем, что монослой — это лишь половина липидного слоя мем-
мембран, обращенного в газовую фазу. Последнего ограничения удается избежать при
использовании в качестве мембраны мономолекулярного слоя, образующегося на
границе двух несмешивающихся жидкостей (углеводород-вода). Более адекватные
модели, представляющие собой липидные бислои, удается получить в виде полимо-
полимолекулярных структур, которые образуются липидами в объеме водной фазы. ?
Лиотропный и термотропный полиморфизм липидов. Как было показано, по-
полярные части мембранообразующих липидов сильно взаимодействуют с водой, по-
поэтому эти соединения могут смешиваться с водой в любых соотношениях. Однако
возникающие смеси не представляют собой истинных растворов, а образуют мно-
многообразные упорядоченные фазы с периодической структурой. В зависимости от
12
Глава XV. Молекулярная организация биологических мембран
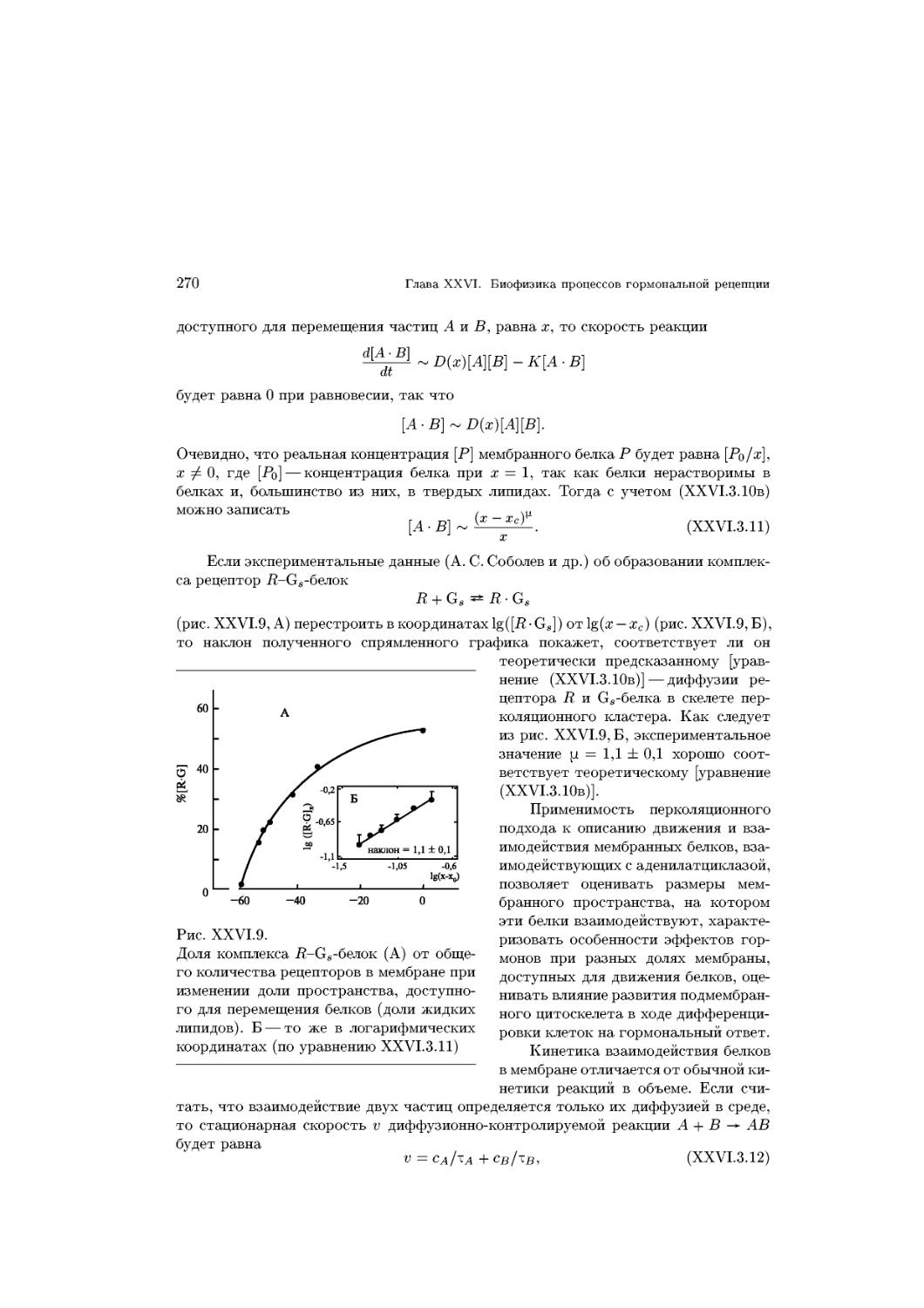
количества присутствующей в системе воды эти фазы закономерно (для конкретных
липидов) переходят друг в друга (рис. XV.4; лиотропный полиморфизм). Изменение
структурной организации системы липид — вода в зависимости от температуры
получило название термотропного полиморфизма.
Устойчивость того или иного типа мезофаз и диапазон их существования опре-
определяются гидрофобным эффектом, а также эффективной геометрической формой
липидных молекул.
100
0 10 20 30 40 50
Вода, %
100
Рис. XV.4.
Бинарная фазовая диаграмма смеси яично-
яичного фосфатидилхолина с водой как функция
температуры (по В.Ф.Антонову, 1982):
I — жидкокристаллическое состояние липида, ла-
меллярный бислой; II — двухфазная система вода-
жидкие кристаллы, ламеллярный бислой; III —
область, где жидкокристаллические ламеллярные
бислойные структуры сосуществуют с гексаго-
гексагональными; IV — твердая (гелеобразная) ламелляр-
ная фаза; Тп — кривая температуры фазового пе-
перехода
La
^bD
\
/
HI
НИ
Рис. XV.5.
Строение (поперечный раз-
разрез) мезофаз:
L — ламеллярная фаза; а — жид-
коподобная фаза, C и C' — кри-
кристаллические фазы с различным
углом наклона цепей к поверхно-
поверхности раздела фаз, HI — гексагон-
гексагональная; НII — инвертированная
гексагональная (вода в липиде).
Ламеллярный тип организации
бислойных структур наиболее со-
соответствует характеру молеку-
молекулярной организации липидов в
биологических мембранах
Наличие нескомпенсированного заряда на полярной головке молекул липида,
например фосфатидилсерина, затрудняет формирование плоских структур этими
молекулами вследствие эффекта электростатического отталкивания. Такие молеку-
молекулы проявляют повышенную склонность образовывать радиально ориентированные
структуры с большой кривизной поверхности.
Сложные протяженные и чередующиеся структуры характеризуются анизотро-
анизотропией механических, электрических, магнитных и оптических свойств. Эти струк-
структуры обладают промежуточными свойствами между жидкостями и твердыми кри-
кристаллами и представляют собой типичные жидкокристаллические (мезоморфные)
состояния липидов.
§ 2. Образование мембранных структур 13
Как правило, состояние клеточных мембран, обеспечивающее их оптимальную
функциональную активность, относится к жидкокристаллическому типу. Внутрен-
Внутреннее строение липидного бислоя в жидких кристаллах отличается от состояния угле-
углеводородов в растворе, хотя в обоих случаях эти структуры гидрофобны. Большая
часть анизотропного бислоя в жидком кристалле высокоупорядочена и только от-
относительно небольшие участки в середине биолоя жидкоподобны.
Из всего разнообразия зарегистрированных мезофаз с биологической точки
зрения наиболее интересны однопространственная ламеллярная и двухпростран-
ственная цилиндрическая, или гексагональная (рис. XV.5).
Повышенный интерес к небислойным, в частности гексагональным (или мицел-
лярным), структурам обусловлен способностью этих структур формировать сквоз-
сквозные поры, резко увеличивающие проницаемость мембран для воды и растворенных
веществ.
Искусственные бислойные мембраны
Мультиламеллярные липосомы. Плоские ламеллярные структуры проявляют
склонность (при энергичном встряхивании) образовывать замкнутые сферические
частицы. Этот процесс энергетически выгоден, так как в этом случае достигает-
достигается минимум площади контакта гидрофобных поверхностей с водой. При простых
механических воздействиях образуются в основном многослойные частицы (диаме-
(диаметром в несколько микрометров) с концентрической организацией слоев — мульти-
мультиламеллярные липосомы или везикулы (мешочки). В этих частицах липидные бислои
отделяют внутреннюю водную фазу от внешнего раствора. Такая организация по-
позволяет использовать мультиламеллярные липосомы для исследования барьерных
свойств липидного бислоя и некоторых других специальных задач. Мультиламел-
Мультиламеллярные липосомы осмотически активны: они изменяются в объеме при изменении
осмотических свойств внешней среды.
Моноламеллярные липосомы. Более энергичное воздействие на грубые фосфо-
липидные дисперсии, например с помощью ультразвукового излучения, вызыва-
вызывает образование моноламеллярных (однослойных) везикул (диаметр 20,0-40,0 нм).
В зависимости от эффективной конфигурации липидных молекул (критический
параметр упаковки и заряд) размеры моноламеллярных липосом могут несколько
варьировать (рис. XV.6; табл. XV.2).
Моноламеллярные липосомы широко и эффективно используют в разнообраз-
разнообразных исследованиях биологического и медико-биологического характера. Тем не ме-
менее, малый внутренний объем и осмотическая неактивность липосом существенно
сужают круг этих исследований. В последнее время разработаны методики полу-
получения больших A00 нм в диаметре и более) моноламеллярных липосом, которые
лишены этих недостатков.
Протеолипосомы. Многие мембранные белки и мелкие фрагменты биологиче-
биологических мембран сравнительно легко могут быть включены в состав искусственных
везикулярных мембран. Такие комбинированные системы называются протеоли-
посомами. Эффективность встраивания большинства белков компонентов в искус-
искусственные мембранные системы резко зависит от липидного состава мембран, рН,
солевого состава, температуры и т. д. Как правило, эффективность встраивания
14
Глава XV. Молекулярная организация биологических мембран
белковых молекул или липопротеиновых фрагментов мембраны возрастает в при-
присутствии небольших количеств детергентов. Полагают, что сравнительно мелкие
молекулы детергентов заполняют дефекты на границе белковой молекулы в мем-
мембране, экранируя гидрофобные участки мембраны от воды.
Фосфолипиды
Мультиламеллярные
липосомы
I
Мультиламеллярные
липосомы
Ультразвук
Рис. XV.6.
Образование замкнутых
фосфолипидных везикул
(липосомы)
Таблица XV.2.
Параметры мембран моноламеллярных липосом из яичного фосфатидилхолина и
дипальмитоилфосфатидилхолина (бислой в «жидком» состоянии)
Параметр
Радиусы (гв,гс,Гн), нм1)
Толщина наружного монослоя (гс — гн), нм
Толщина внутреннего монослоя (гс — гв), нм
Число молекул пн
Число молекул пъ
Объем на молекулу липида, нм3
Поверхностная площадь на молекулу, нм2:
в наружном монослое
во внутреннем монослое
Яичный
лецитин
6,2; 7,8; 9,9;
3,7
2Д
1,6
1658
790
2Д
1,25
0,74
0,61
Дипальмито-
иллецитин
7,4; 8,9; 10,9;
3,5
1,98
1,52
1970
1030
1,9
1,20
0,76
0,69
*) Индексы «н», «в» и «с» обозначают наружный, внутренний монослои и середину углеводородной
зоны мембран, соответственно.
\—? Исключительная ценность протеолипосом как искусственных мембранных си-
стем в первую очередь определяется широкими возможностями, которые эти
системы предоставляют для исследования функционирования многих важных ком-
i 2. Образование мембранных структур
15
понентов биологических мембран. По существу, получение протеолипосом можно
рассматривать как последний этап перед полной реконструкцией функционирую-
функционирующих мембранных систем из составляющих их компонентов. ?
Рис. XV.7.
Образование бислойной липидной
мембраны (БЛМ). А — ячейка для
получения БЛМ и изучения ее
электрических свойств; Б — этапы
форимирования БЛМ (/ — толстая
мембрана, II — выпуклая линзопо-
добная мембрана, III — БЛМ):
1—тефлоновый стакан, 2 — электроды,
3 — круглое отверстие в стенке тефлоно-
вого стакана
Следует отметить, что способность образовывать замкнутые везикулярные
частицы свойственна не только искусственным липидным системам. Она широко
проявляется при различных способах фрагментации биологических мембран (ульт-
(ультразвук, детергенты, механическое диспергирование и пр.). Замкнутые мембранные
пузырьки образуют фрагменты мембран саркоплазматического и эндоплазматиче-
ского ретикулума, внутренней мембраны митохондрий. В некоторых случаях удает-
удается получить везикулы с вывернутой ориентацией мембран, что чрезвычайно важно
для изучения структурно-функциональной организации этих мембран.
Плоские бислойные лшшдные мембраны. Липиды, спонтанно образующие ла-
меллярные слои, обычно способны формировать бислойные структуры (БЛМ или
«черные» пленки) на небольших отверстиях в тонких гидрофобных материалах. Это
явление впервые было описано О. Мюллером и соавторами A962), которые получили
БЛМ из фосфолипидов мозга на небольших отверстиях @,5-5,0мм2) в тефлоновой
перегородке, разделяющей две водные фазы. Доказав бислойность сформированных
мембран, авторы с помощью простой электроизмерительной техники охарактеризо-
охарактеризовали важнейшие электрические параметры этих мембран. Относительная простота
получения БЛМ, широкий спектр применения разнообразных электроизмеритель-
электроизмерительных методов исследования, возможность изменять в широких пределах липидный
состав БЛМ и состав омывающих растворов, включать в БЛМ разнообразные мо-
модификаторы барьерных свойств мембран, функционально активные элементы био-
биологических мембран — все это быстро обеспечило этим искусственным мембранным
системам центральное место в современной экспериментальной мембранологии.
Общая схема ячейки для формирования БЛМ и несколько последовательных
этапов формирования бислойной структуры приведены на рис. XV. 7. Процесс обра-
образования БЛМ начинается с нанесения небольшого количества подходящего липида,
растворенного обычно в жидких углеводородах (гексан, октан, декан и др.), на от-
отверстие в тефлоновом стаканчике (рис. XV. 7, /). Далее эта толстая пленка самопро-
самопроизвольно утонынается вплоть до образования бислойной структуры (рис. XV.7, III).
16 Глава XV. Молекулярная организация биологических мембран
\—? Главными силами, определяющими поведение пленки, являются межфазное (по-
(поверхностное) натяжение а и ван-дер-ваальсовы силы притяжения водных фаз
по обе стороны пленки, сжимающие пленку в поперечном направлении,— расклини-
расклинивающее давление (см. XV.3.7 и XV.3.9). ?
Первоначально толщина липидной плёнки превышает 100 нм. При такой тол-
толщине расклинивающее давление близко к нулю и поведение липидной массы опреде-
определяется различием гидростатического давления в ее периферической искривленной
части — торе — и центральной сравнительно плоской части. В соответствии с зако-
законом Лапласа различие гидродинамического давления Ар между фазой, находящейся
под вогнутой поверхностью раздела (в торе), и фазой над этой поверхностью опре-
определяется выражением
Ар = a(l/i?i + 1/Д2),
где R\ и i?2 — внутренний и наружный радиусы кривизны поверхности.
Очевидно, что в центральной части пленки, где радиус кривизны близок к бес-
бесконечности (i?i = i?2 -* 00), Ар = 0. Это означает, что в торе гидродинамическое
давление ниже, чем в плоской части мембраны, и вследствие этого жидкая мем-
бранообразующая фаза будет выдавливаться из центральной части в радиальном
направлении. Скорость возникающего потока будет максимальной на периферии
пленки в областях, прилегающих к тору, где линейный градиент гидродинамиче-
гидродинамического давления максимален. В соответствии с этим плоская часть пленки быстрее
утонынается по периферии, формируя линзообразную структуру (см. рис. XV.7, II).
В участках, где толщина пленки становится тоньше ~ 100 нм, вмешиваются
силы взаимодействия поверхностных слоев и водных фаз по обе стороны пленки.
Совокупность этих сил либо ускоряет процесс утонынения пленки — отрицательное
расклинивающее давление, либо препятствует этому процессу — пояснительное рас-
расклинивающее давление. Дальнейшее утонынение пленки приводит или к ее разрыву,
или к скачкообразному формированию устойчивой, чаще всего бислойной, структу-
структуры. Формирование бислойной структуры заканчивается, когда она распространит-
распространится на всю площадь, непосредственно контактируя с тором. Обычно формирование
бислойной структуры протекает в течение 5-20 мин, однако продолжительность
этого процесса резко зависит от многих параметров (липидный состав, темпе-
температура, рН, ионная сила и состав растворов и другие, часто неконтролируемые,
параметры).
\—? Процесс утонынения пленки и формирования БЛМ можно наблюдать визуально
в отраженном свете. Пока плёнка толстая, она выглядит как обычное макроте-
макротело. Когда толщина пленки становится соизмеримой с длиной волны падающего све-
света, начинает проявляться интерференция лучей, отраженных от передней и задней
поверхностей пленки; на поверхности мембраны возникают цветные узоры, извест-
известные в оптике под названием колец Ньютона. Такие небислойные пленки, содержащие
линзоподобные утолщения, получили название цветных пленок. Бислойные липид-
ные структуры в отраженном свете выглядят черными на светлом фоне, в связи
с чем и называются «черными». Низкая отражающая способность таких пленок
обусловлена тем, что разность фаз между лучами, отраженными от передней и
задней поверхностей пленки, близка к л, т. е. эти лучи находятся в противофазе и
гасят друг друга. ?
i 2. Образование мембранных структур
17
Формирование черной бислойной мембраны не означает полного завершения
всех процессов формирования БЛМ. Параллельно с почернением идут более медлен-
медленные и продолжительные процессы: растекание липидного раствора по поверхности
перегородки, на которой сформирована мембрана, выход растворителя из мембра-
мембраны в объем тора и водную фазу, а также уплотнение упаковки молекул липида
в монослое и на поверхности тора. Все эти процессы приводят к постепенному
(в течение 10-20 мин после почернения) снижению поверхностного натяжения и
увеличению электрической емкости БЛМ вплоть до некоторых стационарных зна-
значений.
^—р В целом по своим электрическим характеристикам и ряду других физико- хи-
мических свойств бислойные липидные пленки, приготовленные из природных
липидов, близки к биологическим мембранам (табл. XV.3). Немодифицированные
искусственные БЛМ отличаются низкой проводимостью. Они лишены метаболиче-
метаболической активности и не обладают столь высокой селективностью, как биологические
мембраны. Однако многие из этих свойств могут быть приданы искусственным
мембранам путем введения в их состав разнообразных мембранно-активных со-
соединений и отдельных функционально важных элементов биологических мембран.
В присутствии всех этих модификаторов проводимость бислойных мембран обыч-
обычно возрастает. Все это свидетельствует о том, что бислойная липидная структура
выполняет роль естественной матрицы для многих молекулярных компонентов био-
биологических мембран и что липидный бислой в той или иной мере свойственен при-
природным мембранам. Поэтому теория липидного бислоя, рассматривающая основные
термодинамические закономерности его формирования, межмолекулярные взаимо-
взаимодействия в бислое, его физические свойства, устойчивость, играет важную роль
в понимании общей структурной организации и функционирования биологических
мембран. ?
Проблема формирования в клетках организмов замкнутых везикул, состоящих
из липидного бислоя, заслуживает особого внимания. По-видимому этот процесс
в клетках, также как и в модельных системах, носит характер спонтанной само-
самоорганизации. Он очевидно не связан непосредственно с транспортом липидов из
Таблица XV.3.
Сравнение свойств искусственных липидных и биологических мембран
Свойство
Электронно-микроскопический снимок
поперечного среза
Толщина, нм
Межфазное натяжение, Н/см
Сопротивление, Ом/см2
Электрическая емкость, мкф/см2
Напряжение пробоя, мВ
Показатель преломления
Проницаемость для воды, мкм/с
Энергия активации водной проницаемости,
кДж/моль
Ионная избирательность PK+/PN&+
Биомембраны
Трехслойная
структура
6,0-10,0
@,03-3,0) х 10
102-105
0,5-1,3
100
1,6
0,5-400
40,3
1-25
Бислойные липидные
мембраны
Трехслойная
структура
2,5-8,0
0,2-6,0
10б-109
0,2-1,0
150-300
1,56-1,66
31,7
53,3
5,4-9,0
18 Глава XV. Молекулярная организация биологических мембран
места их биосинтеза и направленным внедрением в формирующуюся мембрану. Во
всяком случае, самоорганизация бислоя продолжается в клетке, где были подавлены
процессы биосинтеза белка. Однако до конца не ясно, насколько сходны механизмы
самоорганизации бислоя в клетке и в модельных системах. Предполагается, что в
обоих случаях общим этапом является самоорганизация монослоя и формирование
на этой основе больших моноламеллярных везикул, которые затем превращаются в
мультиламеллярные липосомы.
Существует критическая температура (для раствора димиристоилфосфатидил-
холина Т*р = 23°), при которой из раствора липидов образуются моноламиллярные
везикулы. При дальнейшем повышении Г > Т*р начинается формирование мицелл.
В самой критической точке Г* плотность монослоя приближается к плотности
бислоя, хотя фазового перехода с образованием типичной бислойной структуры еще
не происходит (Гершфельд Н., 1989).
Речь идет, таким образом, об особом критическом состоянии поверхностного
бислоя с повышенным поверхностным давлением л (л = тгтах при Г = Т*р), образу-
образующимся на границе поверхностного и дисперсионного состояний.
Оказалось, что в растущих клетках критические температуры Т*р образования
моноламеллярных везикул экстрагированными липидами совпадают с температу-
температурой роста исходных клеток. Следовательно, в клетках это промежуточное монола-
меллярное критическое состояние достигается при температурах роста организма
(Т*р = Гроста), которые, таким образом, определяют условия спонтанного форми-
формирования биомембраны из пула свободных клеточных липидов.
Заметим, что достижение равновесия в системе бислой — раствор и самоорга-
самоорганизация бислоя достигаются за времена в 100-1000 раз короче характерных времен
сопряженных процессов биосинтеза фосфолипидов (~ 20 мин) в клетках.
§ 3. Термодинамика процессов формирования и устойчивости мембран
^—р Формирование мембран, их стабилизация во многом определяются поверхност-
ными явлениями и межмолекулярными взаимодействиями. Теоретическое изу-
изучение свойств высокоорганизованных биологических мембран проводят на примере
углеводородных пленок и структур, образуемых липидами в водных средах. ?
Поверхностная активность, работа адсорбции. Поведение различных соедине-
соединений в растворах подчиняется адсорбционному уравнению Гиббса:
m
-da =^Г;ф;, (XV.3.1)
г=1
где а — межфазное (поверхностное) натяжение, Fj — степень адсорбции г-го ком-
компонента в поверхностном слое, [ij — химический потенциал г-го компонента.
Для бинарной системы (например, липид-вода) адсорбционное уравнение Гибб-
Гиббса записывается в виде
-da = Г1Ф1 + r2d[i2- (XV.3.2)
При низкой концентрации растворенного вещества, сильно адсорбирующегося на
поверхности раздела (весьма реальная ситуация для системы липид-вода), адсорб-
3. Термодинамика процессов формирования и устойчивости мембран
19
цию самого растворителя можно приравнять к нулю (Г2 = 0). Тогда
Так как для разбавленных растворов
4*1 ~ RT In 01 ~ RT In Cl,
(XV.3.3)
(XV.3.4)
где а\ и С\ — активность и концентрация растворенного вещества, то адсорбцион-
адсорбционное уравнение принимает вид
„ _ aido cida ,„,. „ _,
Rl da\ Rl dc\
Величина —(da/dc)c^o называется поверхностной активностью. Поверхностно-
активными называются вещества, понижающие поверхностное натяжение. Для та-
таких веществ da/dc < 0 и Г > 0. К этим соединениям, хорошо адсорбирующимся в
поверхностном слое и снижающим поверхностное натяжение, относятся органиче-
органические амфифильные соединения, в частности, липиды.
^—? Гидрофобные взаимодействия в мембранах. Стремление амфифильных молекул
объединяться в водных растворах в поверхностные или объемные структуры,
в которых углеводородные (гидрофобные) участки молекул тесно контактируют
друг с другом, рассматривают обычно как результат гидрофобных взаимодействий
(см. § 4 гл. IX).
Энергию гидрофобного взаимодействия обычно оценивают, исходя из энергии
переноса данного соединения (углеводород, липид) из воды в органическую фазу.
?
Оценка изменения свободной энергии, энтальпии и энтропии при переносе из
воды в неполярный органический растворитель неразветвленных углеводородов по-
показывает, что эти изменения возрастают с ростом длины углеводородной цепи.
Причем для не очень длинных цепей наблюдается постоянство инкремента этих тер-
термодинамических параметров в пересчете на каждую добавочную СНг-группу. Ниже
приведены абсолютные значения этих инкрементов, полученные в ряду метан-этан-
пропан-бутан при переносе углеводородов из неполярного растворителя в воду не-
непосредственно или через газовую фазу:
Газовая фаза
-СН2-
Неполярный
растворитель
- СН2-
'AG = + 4,2 кДж/моль
\Н= + 2,52 кДж/моль
AS=- 1,4 э.е.
Вода
— СН2 —
20 Глава XV. Молекулярная организация биологических мембран
Описанные закономерности усложняются в эффектах гидратации полярных
головок липидов и электростатических взаимодействий. Для цвиттерионов, поляр-
полярные головки которых располагаются приблизительно параллельно границе раздела
фаз, энергию электростатического взаимодействия между положительно заряжен-
заряженными NH - или М+(СНз)з- группами и отрицательно заряженными фосфатными
группировками соседних молекул можно оценить по скорости вращения полярной
головки. Считая, что барьер для вращения головки создается только за счет элек-
электростатического взаимодействия, а время корреляции вращения головки составляет
тс ~ 1,5 • 10~9 с, можно вычислить, что свободная энергия электростатического вза-
взаимодействия не превышает ~ 21 кДж/моль. Энергия же гидратации обычно суще-
существенно выше и для одиночных ионов составляет 210-840 кДж/моль. Это означает,
что в полностью гидратированных структурах энергия гидратации выше, чем элек-
электростатическая, так что вклад электростатических сил в стабилизацию структур
может оказаться существенным только в условиях ограниченной гидратации.
\—? В целом гидратация полярных и заряженных головок липидов существенно вли-
яет на энергетику гидрофобного взаимодействия, увеличивая растворимость
липидов в водной фазе. Однако наличие длинных углеводородных цепей в молекулах
природных структурообразующих липидов обуславливает их достаточно низкую
растворимость в воде. Так, например, критическая концентрация мицеллообразо-
зования для дигексаноиллецитина F углеродных атомов) ~ 10 мМ, в то время как
для дипальмитоиллецитина A6 углеродных атомов) ~ 5 • 10~10 М.
Межмолекулярные взаимодействия в тонких пленках и мембранах. Уже про-
простой анализ действия факторов, приводящих к дезинтеграции тонких углеводо-
углеводородных пленок и биологических мембран, позволяет получить определенное пред-
представление об особенностях различных межмолекулярных взаимодействий (электро-
(электростатические и ван-дер-ваальсовы), формирующих эти структуры (см. гл. VIII).
В мембранных системах электростатические взаимодействия осуществляются меж-
между анионными липидами, амино- и SH-группами аминокислотных остатков белков
(положительный заряд), а-карбоксильными группами сиаловой кислоты (отрица-
(отрицательный заряд) и т. д. Условно выделяют три типа электростатических взаимодей-
взаимодействий в мембранных системах: латеральное, или тангенциальное взаимодействие
заряженных групп молекул, которые расположены в одном полуслое мембран; транс-
трансмембранное взаимодействие заряженных групп, расположенных по разные стороны
мембраны; межмембранное взаимодействие заряженных групп, расположенных на
поверхности двух соседних мембран. ?
Теоретическое описание первого типа взаимодействий в мембранах осложнено
трудностями определения точной топографии (размещения) зарядов в мембранах
и нахождения диэлектрической проницаемости среды, разделяющей заряды в мем-
мембране.
К настоящему времени глубже разработана теория межмембранных электро-
электростатических взаимодействий. Однако формальное описание установленных законо-
закономерностей достаточно сложно. Не вдаваясь в детали расчетов, укажем, что энергия
отталкивания, например, эритроцитов на расстояниях, больших 10 нм, обращается
в нуль, а уже при ~ 2 нм она более чем на три порядка превышает энергию теплового
движения.
§ 3. Термодинамика процессов формирования и устойчивости мембран 21
Трансмембранные ионно-электростатические взаимодействия обычно рассма-
рассматривают по аналогии с плоским конденсатором. Однако теория этого взаимодей-
взаимодействия применительно к мембранным системам разработана недостаточно.
В ван-дер-ваальсовых взаимодействиях в мембранах наибольшее значение име-
имеют дисперсионные силы [см. (VIII. 1.14)]. Эти силы являются преобладающими во
взаимодействии фаз, разделенных мембраной. Расчет этих взаимодействий прово-
проводят путем суммирования парных взаимодействий по всему объему. Для двух фаз,
разделенных узким зазором толщиной /, вначале находят энергию парных взаимо-
взаимодействий одной молекулы фазы со всеми остальными молекулами противоположной
фазы. Затем интегрируют эти взаимодействия для всех молекул, находящихся в
объеме первой фазы. В результате можно определить силы притяжения F, или
расклинивающее давление Пдисп, приходящееся на единицу площади:
Пдисп = -F = -Vp/F/3) = -S/Fti/3), (XV.3.6)
где q — число молекул в единице объема, / — толщина зазора между фазами, C —
константа дисперсионных взаимодействий Лондона [см. (VIII.1.15)].
\—? Величина
В = тгУр (XV.3.7)
называется константой Гамакера. ?
Суммирование парных взаимодействий приводит к резкому возрастанию даль-
дальнодействия дисперсионных взаимодействий между телами. Это приводит к то-
тому, что, дисперсионные взаимодействия тел обнаруживаются на расстояниях, су-
существенно превышающих толщину липидных и биологических мембран вплоть до
100 нм. Отметим также, что для простоты выражение (XV.3.6) получено для взаи-
взаимодействия двух аналогичных тел через вакуум. Когда тела взаимодействуют через
слой, представляющий собой мембранную систему, в приведенных выражениях кон-
константа Гамакера должна быть заменена на сложную константу Гамакера, которая
учитывает взаимодействие между молекулами разных типов в такой системе.
В отсутствие неоднородностей расклинивающее давление П в БЛМ можно пред-
представить как сумму составляющих:
П = Пдисп+Пэл.стат. (XV.3.8)
\—? При взаимодействии в растворе однородных клеток, имеющих не слишком боль-
большой поверхностный потенциал, дисперсионная составляющая энергии ван-дер-
ваальсова взаимодействия проявляется на больших расстояниях, чем электроста-
электростатическая (отталкивание). Это означает, что суммарный эффект таких сил может
приводить к появлению минимума энергии взаимодействия клеток при расстояниях
между ними 3-8 нм. Отсюда следует, что в определенных условиях во взвеси кле-
клеток могут находиться клетки, объединенные взаимным притяжением. Они должны
отличаться от других клеток рядом свойств, в том числе подвижностью. Суще-
Существование таких клеток подтверждается экспериментально, например по оседанию
эритроцитов, или при движении клеток под действием электрического поля. Есте-
Естественно, что глубина и ширина энергетической «ямы» определяются целым рядом
22 Глава XV. Молекулярная организация биологических мембран
факторов, в том числе плотностью поверхностных зарядов, рН среды, ионной силой
и др. ?
Термодинамика равновесия двусторонних пленок (мембран). Для термодина-
термодинамического описания мембранных систем используют подход Гиббса, в котором не
рассматриваются реальные свойства системы вблизи границы раздела фаз, обусло-
обусловленные особенностями молекулярных взаимодействий у поверхности (см. гл. XVII-
XVIII).
Пользуясь методом Гиббса, можно схематически представить реальную систе-
систему, ограничив мембрану с двух сторон разделяющими поверхностями и полагая,
что фаза C однородна вплоть до этой поверхности (рис. XV.8). В методе Гибб-
Гиббса определяется толщина мембраны как расстояние между двумя разделяющими
поверхностями. Если внутри мембраны сохраняет-
сохраняется слой со свойствами объемной фазы, то такую
мембрану называют толстой. Для толстых пленок
характерно свойство аддитивности, когда значение
энергии складывается из ее значений для объемной
фазы и поверхностных слоев. При отсутствии слоя
со свойствами объемной фазы в пленках наблюда-
наблюдается взаимодействие между поверхностными слоя-
слоями и условия аддитивности энергии не выполняют-
' ' ся. Такие пленки называют тонкими. Подавляющая
Пленка а и часть жидкой фа- часть прирОдНЫХ мембран удовлетворяет термоди-
Р намическим критериям тонких пленок. Важная осо-
особенность тонких пленок состоит в том, что давление
в фазе, из которой сформирована пленка (мембрана), и давление в окружающей
среде не одинаковы. Эту разницу давлений
/ - ра = П (XV.3.9)
Б.В.Дерягин назвал расклинивающим давлением. Расклинивающее давление, по
сути, обусловлено обобщенным эффектом всех молекулярно-поверхностных сил
[см. (XV.3.6)] в тонком слое. В соответствии с определением Дерягина знак да-
давления выбран положительным при наличии отталкивания поверхностных слоев и
отрицательным — при притяжении.
^—р Таким образом, тонкие мембраны (плёнки) могут быть охарактеризованы не
только межфазным натяжением, но и расклинивающим давлением и полным
натяжением пленки. Межфазное натяжение [см. (XV.3.1)] представляют как работу
изотермического изменения площади А пленки при неизменной толщине
о = ±(dF/dA)Tth,n, (XV.3.10)
где F — свободная энергия, Г — температура, h — толщина пленки, п — число мо-
молекул пленки. ?
Полное натяжение v пленки характеризуют как работу изотермического изме-
изменения площади пленки при постоянном объеме V:
v = (dF/dA)T,v,n.
i 4. Механические свойства мембран
23
Очевидно, что в последнем случае изменяется толщина пленки и приведенное вы-
выражение включает составляющую работы за счет изменения расклинивающего да-
давления. В наиболее простом виде взаимосвязь всех этих параметров пленки опреде-
определяется уравнением
v = 2a + II/i (XV.3.12)
В этом уравнении коэффициент 2 введен для учета межфазного натяжения обеих
поверхностей пленки.
§ 4. Механические свойства мембран
^—р Подвижность молекулярных компонентов в мембранах. Гидрофобный эффект,
объединяющий молекулярные компоненты в мембранах, препятствует их вы-
выходу в водную фазу за пределы мембраны. В то же время силы межмолекулярного
взаимодействия обычно не мешают молекулам в мембранах обмениваться друг с
другом местами, поскольку площадь контакта между водой и гидрофобными участ-
участками молекул при этом практически не изменяется. Вследствие этого молекулярные
компоненты в мембранных системах сохраняют индивидуалную подвижность и мо-
могут диффузионным путем передвигаться в пределах мембран. ?
Молекулы липидов легче всего совершают вращательное движение вокруг своей
длинной оси. Время корреляции вращательного движения тс молекул (время пово-
поворота на угол, равный 1 рад) спин-меченых фосфолипидных молекул, стеринов и
жирных кислот в различных модельных и природных мембранах, находящихся в
жидком состоянии, составляет ~ 10~9 с. Вращательная подвижность сохраняется
сравнительно высокой (тс ~ 10 ~8 с) и при температуре ниже точки плавления жир-
нокислотных цепей липидов в мембранах.
Диффузионное перемещение молекул липидов вдоль слоя, обычно называемое
латеральной диффузией, также совершается достаточно быстро. Коэффициент ла-
латеральной диффузии D спин-меченых и флуоресцентных фосфолипидных зондов
во многих искусственных и биологических мембранах составляет 10~7-10~8 см2/с
(табл. XV.4). Среднеквадратичное расстояние, которое молекула проходит вдоль
Таблица XV.4.
Константы латеральной диффузии липидов в искусственных и природных мем-
мембранах
Мембраны
Яичный лецитин (везикулы)
Яичный лецитин + холестерин (везикулы), 4 : 1
Е. coli
Седалищный нерв
Липиды мембран седалищного нерва
Саркоплазматический ретикулум
Липиды саркоплазматического ретикулума
Микросомы печени
D, см2 -с • 108
1,8
1,8
5
10
1,8
0,5
0,8
1,8
0,4
11
Температура,
°С
30
25
25
40
31
31
31
25
31
30
Метод
ЯМР
ЭПР
ЭПР
ЭПР
ЯМР
ЯМР
ЯМР
ЯМР
ЯМР
ЭПР
24 Глава XV. Молекулярная организация биологических мембран
мембраны за время t, равно
[=л/4Ш. (XV.4.1)
Легко вычислить, что при D = 6 х 10~8 см2/с молекула липида за 1 с пере-
перемещается по мембране на расстояние порядка 5000 нм, т. е. может «обежать» всю
плазматическую мембрану таких клеток, как эритроцит, Е. coli и др. Скорость ла-
латеральной диффузии существенно зависит от липидного состава мембран и темпе-
температуры. Так, холестерин, добавленный к яичному лецитину в количестве 30-50 моль,
снижает скорость латеральной диффузии более чем в два раза. Энергия активации
латеральной диффузии в липосомах из яичного лецитина и мембранах саркоплазма-
тического ретикулума при комнатных температурах составляет 29-46 кДж/моль.
При температурах ниже точки плавления углеводородных цепей липида константа
латеральной диффузии снижается примерно на порядок и более.
Другой тип движения молекул липидов в мембранных системах — это трансби-
слойное движение (флип-флоп-переход). Оно осуществляется в мембранах с относи-
относительно малой скоростью вследствие высокого барьера для пересечения полярной
головкой молекулы липида углеводородной зоны мембран. В модельных везику-
везикулярных мембранах скорость флип-флоп-перехода, оцененная по времени перено-
переноса половины количества молекул-меток из одного полуслоя в другой, составляет
10-20 ч и более. В природных мембранах этот процесс может идти существенно
быстрее. В мембранах электрических органов угря это время составляет 3-7 мин, в
мембранах эритроцитов — 20-30 мин. Отмечено, что при добавлении к мембранам
клиновидных молекул, индуцирующих появление искривленных структур, а также
при нарушении равновесного распределения молекул между слоями (например, при
действии фосфолипаз) скорость флип-флоп-перехода резко возрастает. Очевидно,
что сохранение ассиметричного распределения молекулярных компонентов в искус-
искусственных и природных мембранах возможно только при относительно медленной
скорости флип-флоп переходов в этих системах.
Молекулы белков в мембранах также проявляют диффузную подвижность. Од-
Однако вследствие большей массы они движутся существенно медленнее. Так, время
корреляции вращения родопсина в фоторецепторных мембранах ~ 10~6 с; для ци-
тохромоксидазы это время ~ 10 с.
Латеральная подвижность белков также существенно ниже, чем липидов. Ко-
Коэффициенты латеральной диффузии белков в природных мембранах при комнатных
температурах обычно находятся в пределах 10~10-10~12 см2/с (табл. XV.5).
Приведенные выше константы латеральной и вращательной диффузии ли-
пидных и белковых молекул в мембранах свидетельствуют, что при физиологи-
физиологических условиях мембранные системы проявляют свойства двумерной жидкости.
Вязкость т) этих сред формально можно определить, исходя из уравнения Стокса—
Эйнштейна:
1 =!"§:' (XV.4.2)
где г — радиус диффундирующей молекулы. Однако, поскольку мембраны неод-
неоднородны и асимметричны, скорость вращения или латеральной диффузии зондов
в мембранах определяется микроструктурой их непосредственного окружения.
§ 4. Механические свойства мембран
Таблица XV.5.
Константы латеральной диффузии мембранных белков
25
Клетки
Гетерокарионты
(мышь — человек)
Мышечное волокно
«Тени» эритроцитов
Мышца эмбрионов
Наружные сегменты
палочек сетчатки
Миобласты
Фибробласты
Белки
Поверхностные антигены
Поверхностные антигены
Интегральные белки
Рецепторы конканавали-
на А
Родопсин
Ацетилхолиновые рецеп-
рецепторы
Рецепторы гормонов
D, см2-с-1
2-10-1°
A4-3) • 10"9
4- Ю-"
D 4-7) • 10-1°
Bч-6)-10"9
D 4-5) • Ю-"
C 4-5)-10-1°
Темпе-
рату-
ратура, °С
37
25
37
22
20
22
23
Метод
Слияние мембран
Флуоресцентная
метка
Слияние
Электрофорез
ЭПР
ЭПР
ЭПР
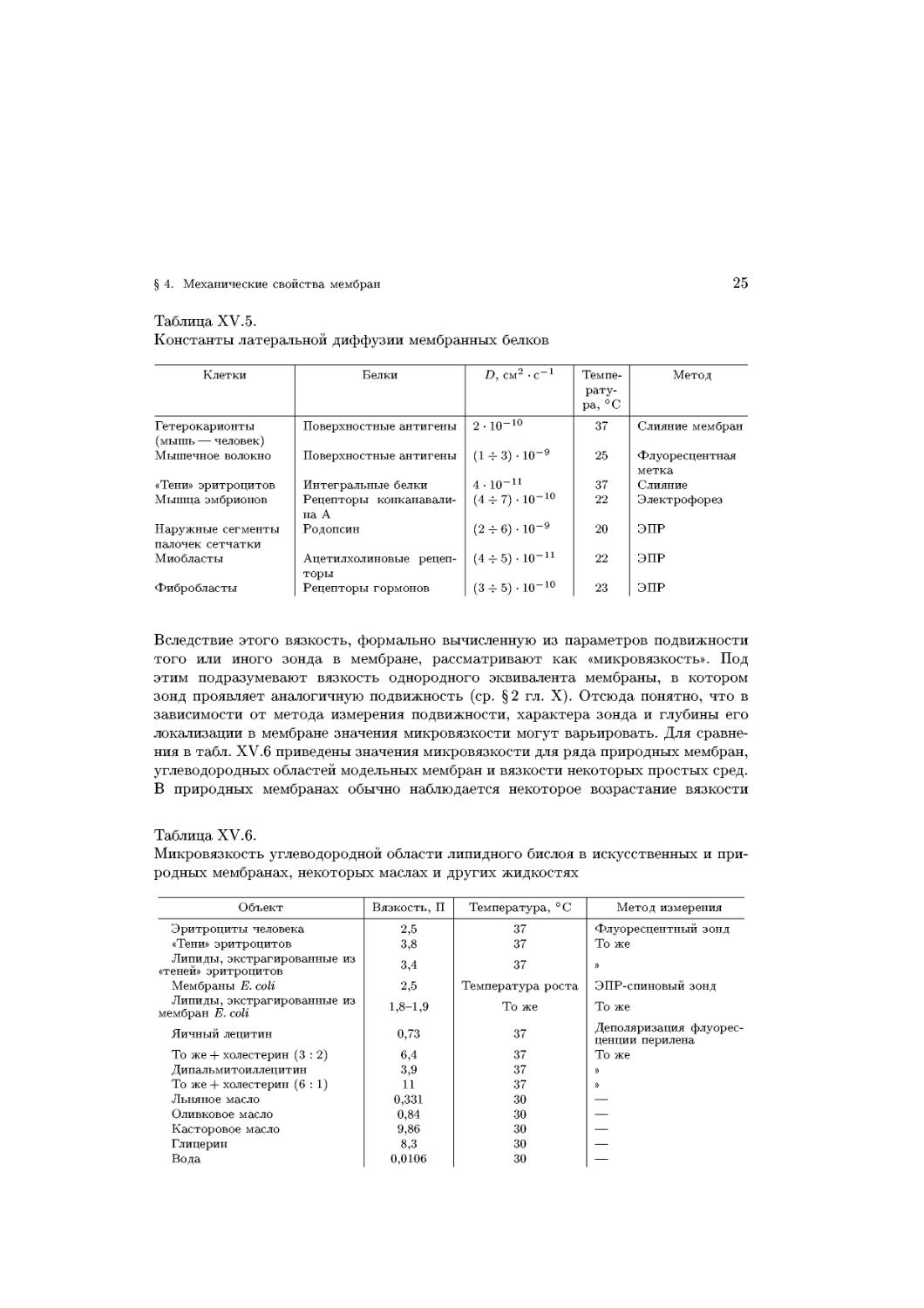
Вследствие этого вязкость, формально вычисленную из параметров подвижности
того или иного зонда в мембране, рассматривают как «микровязкость». Под
этим подразумевают вязкость однородного эквивалента мембраны, в котором
зонд проявляет аналогичную подвижность (ср. §2 гл. X). Отсюда понятно, что в
зависимости от метода измерения подвижности, характера зонда и глубины его
локализации в мембране значения микровязкости могут варьировать. Для сравне-
сравнения в табл. XV.6 приведены значения микровязкости для ряда природных мембран,
углеводородных областей модельных мембран и вязкости некоторых простых сред.
В природных мембранах обычно наблюдается некоторое возрастание вязкости
Таблица XV.6.
Микровязкость углеводородной области липидного бислоя в искусственных и при-
природных мембранах, некоторых маслах и других жидкостях
Объект
Эритроциты человека
«Тени» эритроцитов
Липиды, экстрагированные из
«теней» эритроцитов
Мембраны Е. coli
Липиды, экстрагированные из
мембран Е. coli
Яичный лецитин
То же + холестерин C : 2)
Дипальмитоиллецитин
То же + холестерин F : 1)
Льняное масло
Оливковое масло
Касторовое масло
Глицерин
Вода
Вязкость, П
2,5
3,8
3 4
2,5
1,8-1,9
0,73
6,4
3,9
11
0,331
0,84
9,86
8,3
0,0106
Температура, °С
37
37
37
Температура роста
То же
37
37
37
37
30
30
30
30
30
Метод измерения
Флуоресцентный зонд
То же
ЭПР-спиновый зонд
То же
Деполяризация флуорес-
флуоресценции перилена
То же
»
»
—
—
—
—
—
26 Глава XV. Молекулярная организация биологических мембран
липидов, образующих ближайшее окружение мембранных белков, обусловленное
ограничением подвижности липидов за счет так называемых белок-липидных
взаимодействий и некоторых других эффектов.
\—? Совокупность всех полученных к настоящему времени результатов по оценке
вязкости мембран позволяет сделать вывод, что для нормального функциони-
функционирования большинства природных мембран углеводородная зона должна находиться
в жидком состоянии, причем ее вязкость должна быть примерно равна вязкости
оливкового масла. ?
Упругие свойства мембран. Под упругостью мембран (пленки) понимают их
способность изменять свое натяжение при растяжении (сжатии). В общем случае
реакция мембран на внешние воздействия оказывается сложной и описывается лишь
эмпирическими уравнениями. Однако при малых амплитудах и низких скоростях
деформации мембран под действием внешних сил процесс с достаточной степенью
точности можно рассматривать как термодинамически обратимый.
В равновесных условиях при постоянной температуре упругая потенциальная
энергия мембран совпадает со свободной энергией Гельмгольца [см. (V.1.5)]: F =
= U -TS.
Упругий потенциал F при постоянной температуре равен работе W, совершен-
совершенной над системой:
(dF)T = dU- TdS = dW. (XV.4.3)
Допущение, что мембрана изотропна вдоль поверхности, позволяет предста-
представить плотность потенциальной энергии упругости как функцию двух независимых
переменных, характеризующих два типа деформации: относительного изменения
площади поверхности а за счет изотропного растяжения (сжатия) и параметра
C, отражающего деформационное растяжение (сдвиг) поверхности при постоянной
площади (например, растяжение круглой области в эллипсоидную). Отсюда упру-
упругий потенциал можно представить через частные производные по каждому из этих
параметров:
(?f) (ЩЛ ф. (XV.4.4)
т
Противодействие изотропному растяжению (сжатию) является свойством, ха-
характерным для твердого и жидкого состояний. В мембранах изотропное растяже-
растяжение (сжатие) площади поверхности происходит относительно равновесного состоя-
состояния. Это начальное изотропное натяжение Го в мембране можно определить через
частную производную свободной энергии в исходном состоянии (а = 0):
dF\
да J $tT
(XV.4.5)
а=0
\—? Связь изменения изотропного натяжения с малыми относительными измене-
изменениями площади (по сравнению с начальным состоянием) задается модулем по-
поверхностного изотермического сжатия (модуль Юнга):
| =(^)| . (XV,,,
М а=0 \ аа / 1а=0
§ 4. Механические свойства мембран 27
При деформационном растяжении (при постоянстве площади) накопление энер-
энергии и сопротивление деформации характеризуется поверхностным модулем упру-
упругости мембран при сдвиге [i. Этот модуль определяется как частная производная
упругой энергии по параметру деформации C при постоянной площади и темпера-
температуре:
?
Эти два модуля — важнейшие характеристики мембран при механических воз-
воздействиях. Можно оценить модуль изотермического поверхностного сжатия бислоя
в водной фазе, сравнивая площадь, занимаемую молекулой в естественном нена-
тяженном состоянии, и собственную площадь молекулы, или исключенную пло-
площадь. Например, модуль поверхностного упругого сжатия лецитинового бислоя
Е» — 1,5 • 10~3 Н/см. В природных мембранах упругие свойства могут существенно
изменяться за счет структурных белков. Так, в мембране эритроцитов липидный
бислой поддерживается сетью гибких молекул структурного белка спектрина. Мо-
Модельные расчеты и непосредственные механические измерения на мембранах эри-
эритроцитов указывают, что поверхностный модуль упругого сжатия этих мембран
равен C Ч- 4) • 10~3 Н/см, а поверхностный модуль сдвига ~ 10~5 Н/см. Отсюда сле-
следует, что значение модуля сдвига примерно на четыре порядка ниже по сравнению
с поверхностным модулем упругого сжатия природных мембран. Это означает, что
клеточные мембраны сильно сопротивляются изменению поверхностной плотности
или площади, но легко деформируются без изменения площади мембраны.
При нагревании мембран эритроцитов до 50 °С, когда спектриновая сетка раз-
разрушается, поверхностный модуль упругого сжатия снижается примерно в 2-3 раза.
Отсюда вклад липидного бислоя в общий модуль поверхностного упругого сжатия
мембран эритроцитов оценивают величиной порядка 10~3 Н/см, а вклад спектри-
новой сетки ~ 2 • 10~3 Н/см.
Измерение механических характеристик природных мембран — сложная экспе-
экспериментальная задача, требующая тонких, подчас ювелирных методик (всасывание
мембран в микропипетку, одностороннее растяжение мембран, вибрационные ме-
методики и др.).
\—? Упругость БЛМ. Ввиду сложности строения и малых геометрических размеров
природных мембран исключительно важная роль в изучении упругих свойств
мембранных систем принадлежит искусственным мембранным системам и главным
образом БЛМ. Эти мембраны, сформированные на отверстиях в перегородках,
имеют сравнительно большие площади. Кроме того, экспериментальное изучение
механических свойсв этих систем возможно при использовании в качестве сжимаю-
сжимающей мембрану механической силы давления, создаваемого электрической разностью
потенциалов,— являение электрострикции. ?
В простейшем приближении БЛМ рассматривают как однородное изотропное
двумерное жидкое тело с осью симметрии упругих свойств, перпендикулярной его
поверхности (рис. XV.9). Для таких систем модуль поперечной упругости (модуль
Юнга) можно представить в виде
Е'± = (-h/Ah)Ap, (XV.4.8)
28
Глава XV. Молекулярная организация биологических мембран
модуль продольного изотропного растяжения
Щ = (S/AS)Af,
(XV.4.9)
где р— сила, сдавливающая мембрану в направлении, нормальном к поверхности S;
f — сила изотропного сжатия. Модули
упругости мембран рассчитываются с
учетом или без учета ее толщины; связь
этих модулей задается выражением Е =
= E'h, где h — толщина мембраны.
При создании разности электриче-
электрических потенциалов на мембране сжимаю-
сжимающая механическая сила равна
= Дг, (XV.4.10)
р
/ р
/
7
h
f
>
f
>
/ / i/
Рис. XV.9.
Действующие на мембрану силы р, f
р — сжимающие, / — растягивающие; h —
толщина мембраны
где См — емкость мембраны, ср — раз-
разность потенциалов, he — диэлектрическая
(емкостная) толщина мембраны, е — ди-
диэлектрическая постоянная.
Для оценки реально достигаемых зна-
значений давления рассмотрим БЛМ из мо-
нолауроилглицерида с холестерином. Для этой мембраны См = 0,64 мкФ/см2
(е = 2,1), а максимальное напряжение ~ 0,86 В. Отсюда находим предельное зна-
значение Fe = 81,6 Н/см2, т. е. на мембрану действует давление ~ 8 • 105 Па. Обычно
См ~ 0,38 мкФ/см2; ср ~ 0,1 В; FE ~ 0,04 Н/см2.
Таким образом, сдавливающую силу Fe можно легко изменять в широких пре-
пределах с помощью приложенной разности потенциалов. Приравнивая найденное зна-
значение Fe к величине Ар из (XV.4.8), получим выражение
\E'±Ah/h\ =
(XV.4.11)
из которого на основании экспериментальных оценок изменения толщины мембра-
мембраны А/г под действием приложенной разности потенциалов вычисляют модуль E'j_
упругой деформации БЛМ. Эти методы, однако, не учитывают важных свойств
мембран.
Основная сложность вычисления Ah/h по величине АС /С обусловлена непосто-
непостоянством s и площади S бислойной части БЛМ при наложении разности потенциалов.
При этом форма тора и микролинз меняется (см. рис. XV.7), что приводит к измене-
изменению общей площади бислойных участков мембраны и изменению при сжатии бислоя.
Кроме того, упругость БЛМ, содержащих растворитель, изменяется со временем,
так как растворитель вытесняется из бислоя в тор или микролинзы. Поэтому БЛМ,
вообще говоря, следует охарактеризовывать модулем Юнга, зависящим от времени.
Результаты измерений на «сухих», бездефектных БЛМ показали, что эти мембра-
мембраны характеризуются Е'± ~ 5 • 104 Н/см2, что близко к значениям модуля упругой
деформации винипласта D • 104) и целлулоида A,1 • 105).
§ 4. Механические свойства мембран 29
Столь высокая устойчивость липидных бислоев в отношении упругой дефор-
деформации означает, что электрострикционные изменения толщины природных ембран
в физиологическом диапазоне трансмембранных потенциалов (~ 0,1 В) не превы-
превышают сотых долей нанометра. Следовательно, геометрические изменения толщины
природных мембран вряд ли могут играть сколько-нибудь существенную роль при
их функционировании.
Для мембран как однородного изотропного тела значения модулей Юнга Е'±
(XV.4.8) и El (XV.4.9) должны совпадать. В действительности БЛМ оказались
более упругими при их поперечном сжатии, т. е. упругие свойства мембран ани-
анизотропны.
ч—? Механизмы разрушения лшшдного бислоя. Приведенные выше характеристики
упругих свойств мембранных систем свидетельствуют, что липидный бислой
мембран представляет достаточно жесткое структурное образование. Это имеет
большое значение для поддержания формы разнообразных клеточных структур и
выполнения барьерных функций природными и искусственными мембранами. Од-
Однако известно, что время жизни БЛМ ограничено и зависит от состава мембран и
внешних условий. В природных мембранах также в ряде случаев возникают меха-
механические нарушения и дефекты, причем эти явления сопряжены с такими важными
биологическими процессами, как слияние клеток, лизис, секреция, гемолиз. ?
Исходя из общей теории устойчивости, условия устойчивости мембран (пленок)
записываются в виде следующих простых неравенств:
(dv/dA)s,v,n > 0, (dv/dh)s<v,n < 0, (du/dh)s,A,n <0. (XV.4.12)
\—? Эти неравенства означают, что мембраны устойчивы, когда изменения рас-
клинивающего давления П [см. (XV.3.9)] или полного натяжения мембран v
[см. (XV.3.11)] препятствуют изменениям ее геометрии [ср. (V.1.9a) гл. V]. ?
Обычно процесс разрушения мембран связывают с достижением параметрами
системы некоторых критических значений, после чего процесс отклонения стано-
становится необратимым и наступает разрушение мембран. Липидные бислой устойчивы
лишь при малых изменениях параметров, т. е. представляют собой метастабильные
системы.
Отклонение мембран от равновесия можно связать с возникновением дефек-
дефектов в структуре мембран за счет случайного локального сжатия в продольном или
поперечном направлении. Случайное уменьшение толщины мембраны носит резко
выраженный локальный характер, что следует рассматривать как начальный этап
формирования локального углубления.
^—р Наиболее признанным в настоящее время является механизм разрушения мем-
бран, обусловленный дефектами типа сквозной поры. Предполагают, что в этом
случае формирование дефекта сопровождается переориентацией молекул липида,
расположенных вблизи границы дефекта с образованием так называемой инверти-
инвертированной поры. Для приближенного описания охарактеризуем пору радиусом экви-
эквивалентного цилиндрического дефекта г. Энергия Е дефекта равна работе образова-
образования такого дефекта за вычетом энергии соответствующего бездефектного участка
30 Глава XV. Молекулярная организация биологических мембран
мембраны, т. е.
Е = 2ъог - тшг2, (XV.4.13)
где а — линейное натяжение единицы длины периметра дефекта (а = han); а—
натяжение мембраны; h — толщина мембраны; ап — межфазное натяжение «вну-
«внутренней» поверхности дефекта (поры). ?
Эта функция имеет форму кривой с максимумом в точке гкр = а/а. Очевидно,
что случайные дефекты при г < гкр будут «захлопываться» под действием сил, воз-
возникающих при их образовании. В то же время для разрушения БЛМ достаточно
появления всего одного дефекта с надкритической величиной радиуса г > гкр.
Многие природные мембраны функционируют в условиях, когда к ним прило-
приложена высокая B50-300 мВ) разность электрических потенциалов (см. гл. XXIV), что
резко сокращает время жизни БЛМ, хотя кратковременное воздействие электриче-
электрического поля на БЛМ приводит к увеличению фоновой проводимости и появлению
флуктуации проводимости (см. §5 гл. XXI). Это указывает на возможность фор-
формирования простейших каналов под действием поля, тем более что их появление
на БЛМ удается регистрировать и при других модификациях липидов (фазовые
переходы при нагревании, введение продуктов перекисного окисления; см. § 1-2
гл. XVI). Поэтому механизмы электрического пробоя БЛМ представляют несомнен-
несомненный интерес для понимания их функционирования.
Один из первых механизмов разрыва мембран в электрическом поле был пред-
предложен Дж. Кроули A973). Согласно этой электромеханической модели мембрану
рассматривают как конденсатор с упругим диэлектриком между обкладками. При
наложении разности потенциалов электрическая сила Fe, сдавливающая обкладки
такого конденсатора, уравновешивается силой упругости Fynp, описываемой зако-
законом Гука [ср. (XV.4.11)]:
/е^ (XV.4.14)
=
h 2/г2
Это уравнение не имеет корней при ср > сркр, где сркр = y^0,376Eh^/s. Исчезнове-
Исчезновение решения объясняется разной зависимостью Fe и Fynp от толщины мембраны
(Fe ~ h~2; Fynp ~ ln(l//i)). Отсутствие решения означает возникновение электро-
электромеханического коллапса, приводящего к деструкции мембраны при потенциалах,
превышающих (ркр — потенциал пробоя.
Электромеханическая модель позволяет дать простое объяснение сильной не-
нелинейности вольтамперных характеристик мембран (см. гл. XIX). Однако в модели
рассматривают поведение мембраны как единого однородного тела без учета воз-
возможных локальных изменений молекулярной организации липидного бислоя. Кро-
Кроме того, экспериментальные данные дают существенно более низкое критическое
уменьшение (до 20%) толщины мембраны при коллапсе по сравнению с моделью.
В настоящее время интенсивно развиваются представления, согласно которым про-
пробой мембран под действием электрического поля обусловлен особенностями поведе-
поведения локальных дефектов типа сквозной поры в липидном бислое.
Пробой как следствие локальных дефектов. Наиболее полное эксперименталь-
экспериментальное и теоретическое исследование электрического пробоя БЛМ проведено в работах
i 4. Механические свойства мембран
31
lg t,MKC
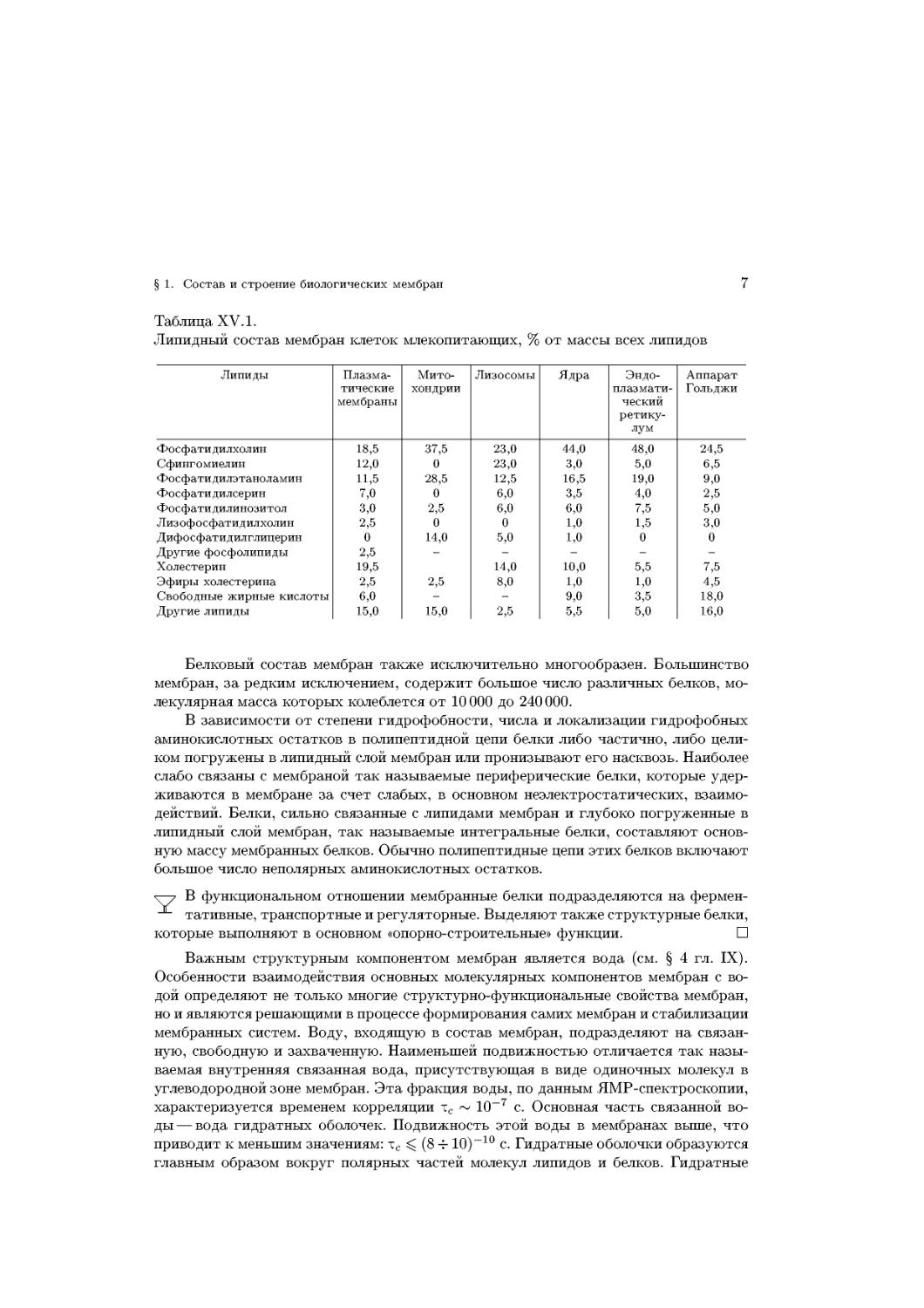
Ю. А. Чизмаджева. Установлено, что среднее время жизни t БЛМ в электрическом
поле падает при увеличении разности потенциалов на мембране (рис. XV.10). Этот
факт свидетельствует о том, что термин «потенциал пробоя» <ркр, используемый в
электромеханической модели, лишен четкого смысла и не может быть использован
в качестве параметра устойчивости мембран в электрическом поле.
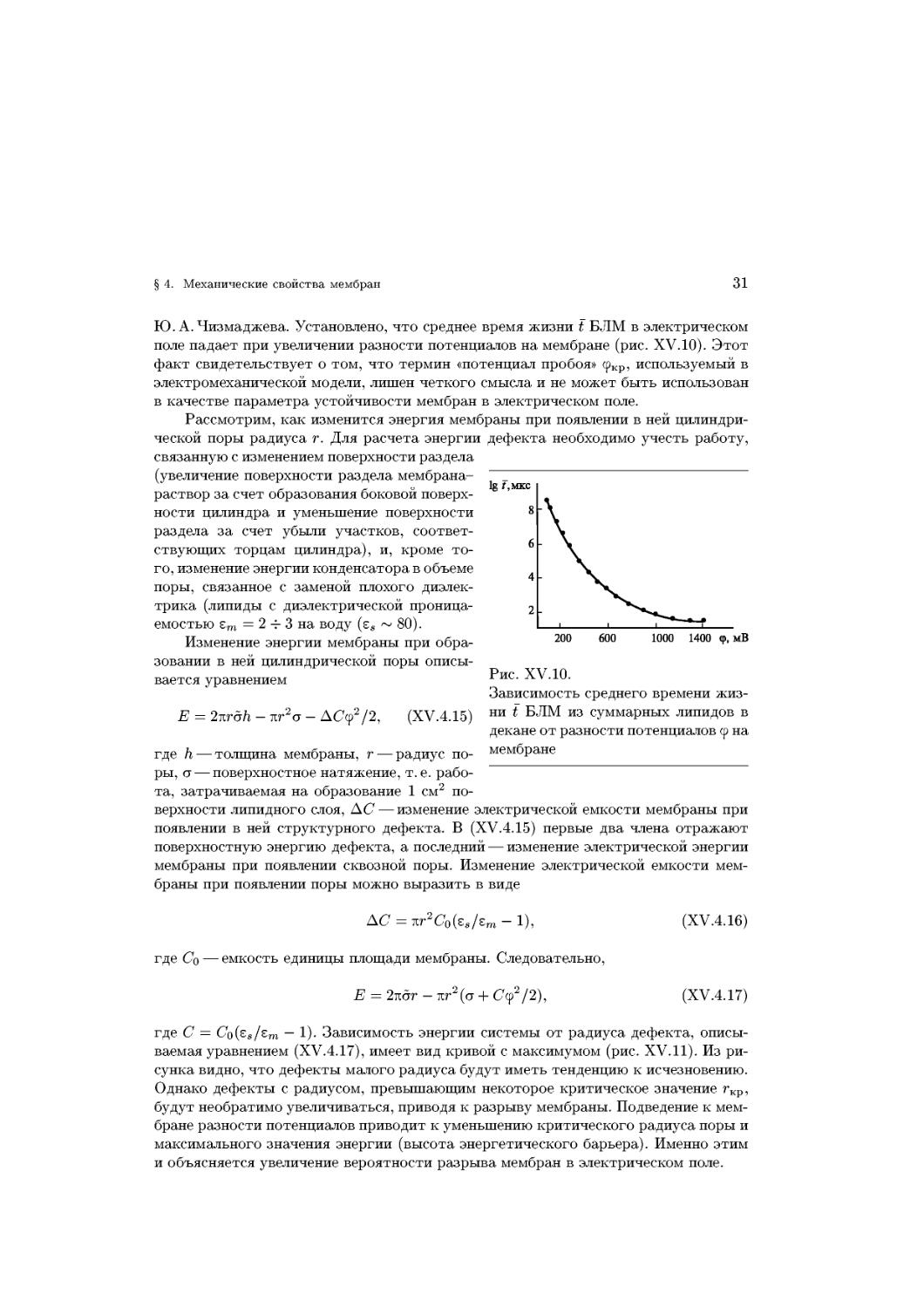
Рассмотрим, как изменится энергия мембраны при появлении в ней цилиндри-
цилиндрической поры радиуса г. Для расчета энергии дефекта необходимо учесть работу,
связанную с изменением поверхности раздела
(увеличение поверхности раздела мембрана-
раствор за счет образования боковой поверх-
поверхности цилиндра и уменьшение поверхности
раздела за счет убыли участков, соответ-
соответствующих торцам цилиндра), и, кроме то-
того, изменение энергии конденсатора в объеме
поры, связанное с заменой плохого диэлек-
диэлектрика (липиды с диэлектрической проница-
проницаемостью ет = 2 ч- 3 на воду (ss ~ 80).
Изменение энергии мембраны при обра-
образовании в ней цилиндрической поры описы-
описывается уравнением
200
600
1000 1400 <р, мВ
= 2Tzrah-Tir2a-AC(f2/2, (XV.4.15)
- толщина мембраны, г -
-радиус по-
Рис. XV.10.
Зависимость среднего времени жиз-
жизни i БЛМ из суммарных липидов в
декане от разности потенциалов ср на
мембране
где h —
ры, а — поверхностное натяжение, т.е. рабо-
работа, затрачиваемая на образование 1 см2 по-
поверхности липидного слоя, АС — изменение электрической емкости мембраны при
появлении в ней структурного дефекта. В (XV.4.15) первые два члена отражают
поверхностную энергию дефекта, а последний — изменение электрической энергии
мембраны при появлении сквозной поры. Изменение электрической емкости мем-
мембраны при появлении поры можно выразить в виде
AC=nr2C0(es/em-l),
где Со — емкость единицы площади мембраны. Следовательно,
Е = 2тшг - ш2 (а + Сер2/2),
(XV.4.16)
(XV.4.17)
где С = Co(ss/sm — 1). Зависимость энергии системы от радиуса дефекта, описы-
описываемая уравнением (XV.4.17), имеет вид кривой с максимумом (рис. XV.11). Из ри-
рисунка видно, что дефекты малого радиуса будут иметь тенденцию к исчезновению.
Однако дефекты с радиусом, превышающим некоторое критическое значение гкр,
будут необратимо увеличиваться, приводя к разрыву мембраны. Подведение к мем-
мембране разности потенциалов приводит к уменьшению критического радиуса поры и
максимального значения энергии (высота энергетического барьера). Именно этим
и объясняется увеличение вероятности разрыва мембран в электрическом поле.
32
Глава XV. Молекулярная организация биологических мембран
Зависимость критического радиуса дефекта, соответствующего точке макси-
максимума на кривой Е(г), определяется из условия dE/dr = 0 и описывается соотноше-
соотношением
го =
(XV.4.18)
Подстановкой (XV.4.18) в (XV.4.17) находим зависимость максимального значения
энергии Е* от потенциала:
Е(г)
Е,
кр
'кр
Е* =
(XV.4.19)
кр
'кр
Таким образом, под действием элек-
электрического поля уменьшается энергия
образования критического барьера Е*,
в результате чего вероятность образо-
образования надкритического дефекта возра-
возрастает. При возникновении такого де-
дефекта мембрана разрывается самопро-
самопроизвольно, так как увеличение размера
дефекта сопровождается понижением
свободной энергии системы.
Согласно теории электрического
пробоя, среднее время жизни i мем-
мембран в электрическом поле есть вели-
величина, обратная стационарной скорости
потока дефектов через энергетический
барьер Е*:
t = l/j. (XV.4.20)
Скорость процесса, энергия активации которого равна Е*, можно в первом
приближении описать уравнением
Рис. XV. 11.
Зависимость энергии дефекта в мембра-
мембране Е(г) от его радиуса г в отсутствие
электрического поля и при наложении раз-
разности потенциалов ср (по В. Ф. Антонову,
1982)
1 — при ф = 0; 2 — при ф > 0; вверху справа —
изображение поры в бислое
j = к0 ехр
-Е*
(XV.4.21)
Из уравнений (XV.4.20) и (XV.4.21) с учетом (XV.4.19) находим зависимость сред-
среднего времени жизни мембран от потенциала:
- . Е .
t = А ехр -—— = А ехр
квТ
(XV.4.22)
где А — константа. Соотношение (XV.4.22) описывает в первом приближении зави-
зависимость среднего времени жизни мембран от приложенного потенциала.
Анализ показывает, что форма зависимости ?((р) гораздо более чувствительна к
изменению параметра а, чем к изменению а. Оказалось, что минимальные значения
а характерны для мембран из лизолецитина, молекулу которого можно представить
4. Механические свойства мембран
33
1с
п
104
а)
110-12А
1,6
J, Ю-12 А
1,6
J, Ю-12 А
в) 1с
П
104
1-Ю-12 А
1,6
J, Ю-12 А
Рис. XV.12.
Флуктуации тока через бислоиную липидную мембрану. Справа — частотное рас-
распределение токов, построенное с помощью анализатора сигналов. Напряжение на
мембране—100 мВ.
а) мембрана сформирована из 0,2% раствора дистеалоилфосфотидилхолина при
температуре 59 °С; б) флуктуации тока в грамицидиновом канале; в) бислойная
мембрана из яичного лецитина в н-декане при температуре 22° С в присутствии
10~9 М грамицидина А (по В.Ф.Антонову, 1980).
34 Глава XV. Молекулярная организация биологических мембран
в виде конуса: основанием его служит большая полярная часть молекулы, верши-
вершиной — гидрофобный жирнокислотный остаток. Для мембран из лецитина, молекулы
которого имеют цилиндрическую форму, характерны промежуточные значения а.
Максимальные значения а свойственны мембранам из фосфолипидов типа фосфати-
дилэтаноламина, молекулы которых имеют форму конуса с малой полярной головой
и большим гидрофобным основанием.
По-видимому, вероятность локальных искажений бислоя с образованием дефек-
дефектов типа сквозных пор зависит от геометрии липидных молекул. Молекулы кониче-
конической формы типа лизолецитина, находясь в бислое, проявляют большую склонность
к образованию водных пор по сравнению с молекулами, имеющими форму цилиндра
или перевернутого конуса. Таким образом, значения а, вероятно, характеризуют
спонтанную кривизну мембран из различных фосфолипидов.
Дефекты типа сквозных пор при фазовом переходе липидов. Появление гидро-
гидрофильных пор в бислойных липидных мембранах при фазовом переходе из жидко-
жидкокристаллического состояния в гель было обнаружено в лаборатории В. Ф. Антонова.
Стрессовое состояние липидного бислоя может быть достигнуто изменением темпе-
температуры в области основного фазового перехода липида, образующего бислой. Осо-
Особенность этого процесса заключалась прежде всего в том, что рождение трансмем-
трансмембранных пор происходило при электрическом напряжении на мембране, не превыша-
превышающем 100 мВ, что весьма далеко от напряжения электрического пробоя и соответ-
соответствует физиологическим значениям мембранных потенциалов (XXIII, §1). «Замо-
«Замораживание» липидного бислоя при физиологических температурах (ДМФХ 23 °С,
ДПФХ 42 °С) сопровождается значительным снижением константы латеральной
диффузии молекул липида и микровязкости липидного бислоя (табл. XV.6), что
позволяет резко замедлить процесс затекания пор и уверенно регистрировать этапы
рождения пор по флуктуациям тока. На рис. XV. 12 показаны флуктуации тока,
соответствующие проводимости гидрофильных пор в бислойной мембране из ди-
стеароилфосфатидилхолина (ДСФХ) при температуре фазового перехода (а). Для
сравнения ниже представлены флуктуации тока в грамицидиновом канале (б). Мож-
Можно видеть, что липидные поры в отличие от пептидных сильно варьируют по разме-
размерам — гистограмма выявляет по крайней мере 4 вида пор. В жидкокристаллическом
состоянии флуктуации тока не регистрируются (в). Значительная вариабельность
липидных каналов согласуется с концепцией о случайном блуждании пор.
Рождение пор в липидном бислое обусловлено уменьшением упругой энергии
бислоя в результате замораживания, появлением локальных пустот, эволюциониру-
эволюционирующих в гидрофильную пору. Причиной образования пустот может служить измене-
изменение площади, приходящейся на головку молекулы липида, в результате гош-транс
перехода (для дипальмитоилфосфатидилхолина (ДПФК) от 58 А2 до 48 А2. Если
принять, что размеры липидного домена, в котором рождается пора, сопостави-
сопоставимы с размерами кооперативной единицы, выявляемой методом дифференциальной
сканирующей калориметрии в области основного фазового перехода (XVI, § 1), то
можно оценить изменение упругой энергии (первое слагаемое) и краевой энергии
поры:
Е = r(JVAa-;r) + 2жд*, (XV.4.23)
Naf
i 4. Механические свойства мембран
35
где Е — изменение энергии Гиббса при рождении поры,
Г — коэффициент упругости бислоя, равный 5 • 10~2 Н/м;
N — число молекул в кооперативной единице,
Аа — разность площадей на молекулу липида в двух состояниях,
а' — площадь, приходящаяся на молекулу липида в жидкокристаллическом со-
состоянии,
г — радиус поры,
а* — линейное натяжение поры (а — натяжение мембраны).
Физический смысл уравнения состоит в том, что убыль упругой энергии бислоя
в результате рождения поры компенсируется ростом краевой энергии поры, про-
пропорциональной периметру поры. С ростом радиуса поры можно ожидать появления
Е, Дж-1(Г19
2,0 -
1,0
#=190
1,0
Рис. XV.13.
N — Зависимость изменений энергии
Гиббса от радиуса поры число мо-
молекул
Аа = af - as = 0,1
нм
по
2,0
3,0 г, нм В. Ф. Антонову, 1992)
локального минимума энергии, что будет свидетельствовать об энергетически вы-
выгодной структуре мембраны с порой. Семейство кривых, соответствующих различ-
различным размерам кооперативной единицы, представлено на рис. XV. 13. Можно видеть,
что первый локальный минимум, соответствующий устойчивой поре, появляется
при радиусе равном 1,2 нм. С ростом кооперативной единицы радиус поры растет.
Интересно отметить, что поры такого радиуса, по-видимому, достаточны для вы-
выхода крупных молекул лекарства из липосом и молекул гемоглобина из эритроцитов
при осмотическом гемолизе.
Стабильность липидного бислоя определяется критическим радиусом поры
(рис. XV.11). Большему критическому радиусу поры соответствует большая вели-
величина энергетического барьера. Дестабилизация мембраны в результате фазового
перехода липидов или электрического пробоя сопровождается снижением барьера.
В этом случае снижение критического радиуса может привести к тому, что
существующие поры окажутся на нисходящей ветви кривой (рис. XV.11), что
приведет к неограниченному росту поры и в конечном счете к разрыву мембраны.
Большую роль в стабилизации мембран играет величина линейного натяжения
периметра поры. Рост линейного натяжения поры (от 5 • 10~n H до 6 • 10~n H)
36 Глава XV. Молекулярная организация биологических мембран
сопровождается резким ростом среднего времени жизни мембран (от 0,1 с до
4 • 106 с), что вполне согласуется со средним временем жизни липидного бислоя
биологических мембран.
В отличие от белковых и пептидных пор, липидные поры в биологических мем-
мембранах возникают в результате упругих деформаций липидного матрикса, причины
которых весьма разнообразны. Это — фазовые переходы в липидном бислое, инду-
индуцируемые действием температуры или химических веществ (ионами двухвалентных
металлов), а также электрических и магнитных полей. Рожденные таким образом
поры определяют, в свою очередь, стабильность мембран.
Изучение критического состояния липидного бислоя раскрывает биологический
смысл этого явления. Считается, что на начальных этапах эволюции клеточных
структур формировались липидные везикулы, мембраны которых, как это следу-
следует из рассмотренного выше, способны были обеспечивать такие важные функции
клетки, как проницаемость и генерацию мембранных потенциалов ионной природы.
Однако чистые липидные пленки хрупки, и их стабильность в сильной степени
зависит от внешних условий. Для предотвращения разрушения липидного бислоя
в состоянии стресса в клетке и выработалась система стабилизации. Во-первых,
жирнокислотные радикалы, входящие в соотав молекулы природного фосфолипида,
как правило, различаются по насыщенности: один радикал представлен насыщенной
жирной кислотой, второй — ненасыщенной. Это обеспечивает жидкостное состоя-
состояние липидного бислоя во всем диапазоне физиологических температур, поскольку
область фазового перехода таких липидов находится ниже 0 °С. Во-вторых, в боль-
большинстве мембран содержится холестерин, который, как известно, резко расширяет
температурный диапазон фазового перехода, а при его эквимолярном содержании
в количестве по отношению к фосфолипидам — даже исключает такой переход.
В-третьих, образованию насыщенных продуктов в результате перекисного оки-
окисления препятствует набор мембранных антиоксидантов. И, наконец, специальные
ферменты — фосфолипазы — способны полностью изменить фосфолипидный пор-
портрет мембраны, модифицируя как жирнокиолотные радикалы (фосфолипаза А),
так и полярные головки (фосфолипаза Д). Совершенно очевидно, что нарушение
какого-либо из указанных элементов этой системы стабилизации может разрушить
биологическую мембрану, что может привести клетку в состояние патологии.
§ 5. Влияние электрических полей на клетки
Электрические поля являются нормальным фактором функционирования большин-
большинства биологических мембран. Вместе с тем, электрические поля высокой напряжен-
напряженности вызывают появление качественно новых явлений. В ранних работах с клет-
клетками харовых водорослей было найдно, что гиперполяризация клеточной мембра-
мембраны до некоторого критического значения потенциала вызывает резкое увеличение
трансмембранного тока — явление, аналогичное электрическому пробою диэлектри-
диэлектриков. Однако в случае клеточных мембран пробой был полностью обратимым: при
реполяризации клетки низкая проводимость мембраны восстанавливалась, а само
явление электрического пробоя можно было наблюдать неоднократно. Нарушение
стабильности мембран в сильных электрических полях подробно изучено на модель-
модельных системах — бислойных липидных мембранах (см. главу XV, §4).
§ 5. Влияние электрических полей на клетки 37
При действии на суспензии клеток импульсных электрических полей высокой
напряженности (импульсы длительностью от нескольких микросекунд до несколь-
нескольких миллисекунд при напряженности поля в несколько кВ/см) отмечены нарушения
проницаемости клеточных мембран и гибель клеток. Электростимулируемый лизис
клеток был продемонстрирован для бактерий, дрожжей, эритроцитов и протопла-
протопластов. Нарушение барьерных свойств мембраны обусловлено индукцией в электриче-
электрическом поле трансмембранного потенциала величиной до 1 В. Тщательный контроль
параметров электрической обработки клеток позволяет вызывать обратимое по-
повышение проницаемости клеточных мембран (электропорация) с целью введения в
клетки биологически активных веществ и чужеродных генов, что открывает широ-
широкие возможности для применения электрических полей в молекулярно-генетических
и биотехнологических исследованиях. Наряду с порацией мембран, электрические
поля способны индуцировать слияние клеток, что может быть использовано для
получения гетеркарионов и гибридов. Кроме того, воздействие электрических полей
может активировать функцию мембранных белков, стимулировать протекание кле-
клеточных процессов, вызывать морфологические изменения, такие как формирование
клеточных отростков или локальных сферических вздутий мембраны (блебы) на
поверхности клеток. В связи с этим влияние электрических полей на живый клетки
явилось предметом многочисленных исследований.
Эффекты, вызываемые действием электрических полей на клеточные мембраны
могут быть классифицированы следующим образом: 1) электропорация, 2) элек-
электрослияние, 3) движения в электрическом поле (электрофорез, диэлектрофорез и
электровращение), 4) деформации мембран, 5) электротрансфекция, 6) электроак-
электроактивация мембранных белков.
Электропорация. При исследовании электропорации обычно используют корот-
короткие импульсы прямоугольной формы. Для расчета трансмембранного электрическо-
электрического потенциала, индуцируемого внешним электрическим полем в сферической клетке
используют уравнение Максвелла
A(f = l,5REcos@, (XV.5.1)
где R — радиус клетки, Е — напряженность внешнего электрического поля, 0 —
угол между ориентацией электрического поля и радиус-вектором. Неравномерное
распределение индуцируемого потенциала по поверхности клетки было подверждено
в опытах с применением потенциалочувствительных красителей.
Если клетка находится в высокочастотном переменном электрическом поле,
индуцируемый мембранный потенциал окажется меньше, чем рассчитываемый по
формуле (XV.5.1). В этом случае индуцируемый потенциал рассчитывают по фор-
формуле
д МДЕсове^ (XV52)
1 + (сот)
где т = RCm(pi + ро/2). В этом соотношении со, Ст, р* и ро обозначают угловую
частоту переменного поля, емкость клеточной мембраны, а также сопротивления
внутренней среды клетки и внешнего раствора, соответственно. Величина т назы-
называется постоянной времени, иои временем релаксации, и измеряется в секундах.
Повышение проницаемости мембраны под действием переменногоэлектрического
38 Глава XV. Молекулярная организация биологических мембран
поля удается, в частности, наблюдать по возрастанию флуоресценции непроникаю-
непроникающего зонда пропидия бромида; интенсивность свечения возрастает при связывании
зонда с внутриклеточной ДНК. С помощью электропорации удавалось «нагружать»
эритроциты меченой сахарозой, которая сохранялась внутри клеток в течение 15-20
суток.
Индукция мембранного потенциала в сферических везикулах под действием
внешнегоэлектрического поля используется также в качестве метода исследования
процессов переноса заряда в фотосинтетических мембранах. Воздействие внешне-
внешнего электрического поля на набухшие «хлоропласты» вызывает сильное возрастание
замедленной флуоресценции фотосистем I и II в связи с изменением вероятности
рекомбинации разделенных зарядов при изменении напряженности поля в мембране
(см. XXVIII). Воздействие импульсного электрического поля на хлоропласты, набух-
набухшие в гипотонической среде, вызывает также изменения быстрой флуоресценции
фотосистемы II, амплитуда которых зависит от состояния реакционного центра.
После воздействия электрического импульса, приводящего к образованию в
мембране пор, проницаемых для ионов и сахарозы, клетки, как правило, набухают
за время от нескольких секунд до нескольких минут. После электропорации в связи
с появлением в мембране сквозных пор, концентрации солей и сахарозы в клетке
и в среде быстро выравниваются. Однако мембрана клетки остается непроницае-
непроницаемой для макромолекул цитоплазмы, которые поддерживают в клетке избыточное
осмотическое давление. Благодаря этому происходит движение воды в клетку, со-
сопровождаемое набуханием. Таким образом, набухание клеток после электропорации
имеет коллоидно-осмотическую природу.
Электрослияние мембран. Явления электрослияния клеток по-видимому тесно
связаны с электропорацией мембран. Существуют гипотезы, основанные на срав-
сравнительно простых физико-химических моделях и теории устойчивости коллоидов.
Действительно, слияние мембран контактирующих клеток можно уподобить коагу-
коагуляции гидрофобных коллоидных частиц. Современная теории устойчивости, разви-
развитая Дерягиным совместное Ландау и независимо — Фервеем и Овербеком, рассма-
рассматривает процесс слипания как результат совместного действия ван-дер-ваальсовых
сил притяжения и электростатических сил отталкивания между частицами, несущи-
несущими поверхностный заряд (ср. §2, 3). В зависимости от баланса сил в разделяющей
частицы тонкой водной пленке возникает либо положительное давление, препят-
препятствующее соединению частиц, либо же отрицательное, приводящее к утонынению
водной прослойки и образованию контакта между частицами.
В случае плоскопараллельных мембран, разделенных водной пленкой с тол-
толщиной 2/г, электростатическое взаимодействие поверхностных зарядов создает в
межмембранном зазоре избыточное давление, равное
Tz=(zF(fhJ ~, (XV.5.3)
где (pft — значение электрического потенциала посередине толщины водной пленки,
а С — концентрация электролита в окружащих мембраны водных растворах. По-
Потенциал (ph связан с поверхностным потенциалом ср8 соотношением
,п. - Ф*
5. Влияние электрических полей на клетки
39
где х — обратная толщина двойного слоя. Формула (XV.5.4) применима, если потен-
RT „
пиал <os невелик по сравнению с —^-- энергия электростатического отталкивания
F
мембран численно равна работе, необходимой для перенесения двух заряженных
поверхностей из бесконечности на расстояние h от плоскости симметрии:
= 2 iidh.
(XV.5.5)
Силы молекулярного притяжения (силы Лондона—Ван-дер-Ваальса) действуют
между молекулами, которые не имеют ни электрического заряда, ни постоянного
дипольного момента (см. гл. VIII). В результате внутреннего движения нейтраль-
F, отн. ед.
[10
Рис. XV.14.
Зависимость результирующей силы
взаимодействия мембраны от рассто-
расстояния между мембранами при различ-
различных плотностях поверхностного заря-
да G; 7,6; 10)
ная молекула может на короткое время образовать диполь, который индуцирует
появление диполя в другой молекуле. Энергия ван-дер-ваальсова взаимодействия
для двух одинаковых пластин бесконечной толщины определяется выражением
U = --
В
12%R
.2 '
(XV.5.6)
где R — расстояние между пластинами (мембранами), а В — постоянная Гамаке-
ра (XV.3.7), имеющая порядок 10~21-10~20 Дж. Помимо баланса сил электроста-
электростатического отталкивания и молекулярного притяжения, необходимо учитывать на-
наличие на поверхности мембран слоя воды с измененными свойствами. Ориентация
молекул в гидратных слоях создает дополнительные препятствия для установления
контакта между близкорасположенными мембранами. Гидратные силы проявляются
на расстояниях порядка 2-3 ангстрема и экспоненциально возрастают с уменьше-
уменьшением расстояния между поверхностями.
40
Глава XV. Молекулярная организация биологических мембран
Для межмембранных расстояний порядка 1-10 нм можно учитывать только
электростатическое отталкивание и ван-дер-ваальсовы силы притяжения. Резуль-
Результирующая сила взаимодействия мембран представлена на рис. XV. 14.
Из рис. XV. 14 видно, что на больших расстояниях и на очень малых расстояниях
преобладает притяжение. Однако, если мембраны несут большой поверхностный
заряд, для соединения мембран потребуется преодолеть очень значительную силу
электростатического отталкивания. В случае умеренного поверхностного заряда
энергетический барьер слияния мембран оказывается преодолимым.
Одна из схем механизма слияния представлена на рис. XV. 15. На первой стадии
происходит сближение мембран и уменьшается толщина водной прослойки; затем в
силу тепловых флуктуации мембран преодолевается барьер, препятствующий соеди-
соединению мембран, и образуется мембранная перегородка. В дальнейшем в перегородке
клетка 1
б)
зона контакта
в)
г)
Рис. XV.15.
Стадии слияния мембран: а) исход-
исходное состояние, б) сближение мем-
мембран, в) образование бислойной пе-
перегородки, г) полное слияние
в результате тепловых флуктуации возникает пора сравнительно большого радиуса,
приводящая к разрыву мембранной перегородки и полному слиянию клеток.
Опыты, проведенные на бислойных липидных мембранах, показали, что про-
процесс слияния в данной модельной системе происходит через стадию образования
бислойной мембранной перегородки и так называемой триламинарнои структуры
(рис. XV.16). Первичный контакт между мембранами возникает за счет существо-
существования дефектов — локальных вспучиваний. Вероятность появления вспучиваний за-
зависит от молекулярной геометрии фосфолипидов и наиболее высока для фосфо-
фосфолипидов, у которых размеры гидрофобного хвоста молекулы превышают размеры
полярной головы. Плоский бислой, сформированный из молекул конусной формы на-
находится в напряженном состоянии и содержит дефекты, имеющие вид вспучиваний.
В зоне случайного контакта дефектов возникает перемычка (рис. XV.16, б). После
этого внутренние монослои уходят из области контакта, а внешние монослои обра-
образуют бислойную перегородку (рис. XV.16, в). Полное слияние мембран возникает
после образования в липидном бислое сквозной поры. Вероятность образования пор
наиболее высока для фосфолипидов, имеющих форму обращенного конуса (большая
полярная голова и узкий гидрофобный хвост).
i 5. Влияние электрических полей на клетки
41
При исследовании слияния целых клеток установлено, что вероятность слияния
возрастает в присутствии некоторых липидов (насыщенные карбоновые кислоты
с 10-14 углеродными атомами), индуцирующих коллоидно-осмотическое набухание
клеток. Набухание, сопровождаемое слиянием, наблюдали также при прогреве эри-
эритроцитов до 50°. В процессе слияния клеток отмечено разрушение мембранных бел-
белков, в связи с активацией Са2+ активируемых протеаз и разрушением цитоскелета.
Процедура элекстрослияния обычно включает предварительную стадию приве-
приведения клеток в контакт. Такой контакт может быть достигнут путем воздействия
на суспензию клеток переменного электрического поля: в результате диэлектро-
фореза клетки выстраиваются в цепочки. Для приведения клеток в контакт исполь-
используют также центрифугирование, сближение культивируемых клеточных монослоев
под давлением и другие методы. После приведения клеток в контакт их обраба-
а)
б)
в)
г)
Д)
Рис. XV.16.
Предполагаемый механизм слияния фосфолипидных мембран: а) плоскопаралель-
ный контакт, б) образование перемычки между локальными вспучиваниями близ-
близкорасположенных (внутренних) монослоев, в) триламинарная структура, г) обра-
образование сквозной поры в бислойной перегородке; д) образование трубки (полное
слияние)
тывают коротким импульсом электрического поля, которое вызывает образование
пор и индукцию слияния. На следующей стадии происходит набухание клеток и
увнличение сечения мембранной трубки, соединяющей клетки.
Механизм электрослияния представляют следующим образом. Под действием
внешнего электрического поля в зоне контакта клеточных мембран происходит
образование коаксиальных пор, через которые проходит ток. Силовые линии элек-
электрического поля распределены таким образом, что возникает давление, сближающее
мембраны и замыкающее кромки пор. При замыкании кромок пор контактных мем-
мембран образуется мембранная трубка, соединяющая цитоплазму сливающихся кле-
клеток. Вызванное электропорацией набухание клеток вызывает натяжение мембран,
благодаря которому происходит увеличение периметра межклеточной перемычки
и полное перемешивание цитоплазмы клеток.
42 Глава XV. Молекулярная организация биологических мембран
Движение клеток. Известны два типа движения клеток в электрических полях.
Постоянное поле вызывает перемещение клеток, имеющих поверхностный заряд,—
явление электрофореза. При воздействии на клеточные суспензии переменного не-
неоднородного поля наблюдается движение клеток, называемое диэлектрофорезом.
При диэлектрофорезе поверхностный заряд клеток не играет существенной роли;
механизм движения состоит во взаимодействии наведенного дипольного момента с
внешним полем.
В теории диэлектрофореза клетку обычно рассматривают в виде сферы, имею-
имеющей диэлектрическую оболочку. Частотно-зависимая составляющая индуцируемого
дипольного момента для такой сферической частицы записывается в виде:
К = ->2/f
о> е0А
где j = \[—T, со = 2ti/ — круговая частота. Параметры Ai, A2, Bi, B2, C\ и C2 опре-
определяются независящими от частоты значениями проводимости и диэлектрической
проницаемости наружной и внутренней сред и разделяющей оболочки:
Ах = ?e?i/r + С(ее -
А2 = -2seSi/r - СBее
d = g(<3i - Ue) - OiUe/r,
С2 = g(oi + 2ае) + 2аое/г,
где г, С, g, se, Si, ae, Oi, и So обозначают радиус клетки, емкость мембраны, удель-
удельную проводимость мембраны, диэлектрические проницаемости наружной и вну-
внутренней среды, проводимости наружной и внутренней среды и абсолютную диэлек-
диэлектрическую проницаемость вакуума, соответственно.
Из приведенных соотношений рассчитаны частотные зависимости диэлектро-
форетической силы, действующей на клетки в неоднородном электрическом поле,
а также усилия, определяющего вращение клеток во вращающемся электрическом
поле. Согласно теории, диэлектрофоретическая сила пропорциональна действитель-
действительной части безразмерного параметра К и градиенту квадрата напряженности поля:
F= l-Re(K)-\7E2. (XV.5.9)
Вращающий момент пропорционален мнимой части параметра К и квадрату на-
напряженности вращающегося поля:
Fc=Im(K)-E2. (XV.5.10)
Спектры диэлектрофореза и электровращения клеток представлены на рис. XV.17.
Различие направлений диэлектрофоретической силы на низких (килогерцы) и
высоких (мегагерцы) частотах обусловлено различной ориентацией индуцирован-
индуцированного дипольного момента по отношению к внешнему электрическому полю. Из
i 5. Влияние электрических полей на клетки
43
курсов по электричеству известно, как ориентируются дипольные моменты плохо
проводящих диэлектрических частиц в проводящей среде, и хорошо проводящих ча-
частиц, окруженных малопроводящей средой. В случае воздействия низкочастотного
поля мембрана представляет собой хороший изолятор, и ток идет в обход клет-
клетки по проводящей среде. Индуцированные заряды распределяются, как показано
на рис. XV. 18, А, и усиливают напряженность поля внутри частицы. Такое рас-
распределение индуцированных зарядов соответствует антипараллельной ориентации
дипольного момента частицы относительно внешнего поля.
t
1,0
0,5
1
-
-JL-
103
/l
f
/
105
Частота,
Л
\
10'
Гц
\ F,
10»
-0,8
103 105 107 109
Частота, Гц
Рис. XV.17.
Типичные спектры диэлектрофореза (А) и электровращения (Б) для сферических
частиц с однослойной оболочкой.
Рис. XV.18.
Распределение индуцированных зарядов на поверхности частицы и ориентация ин-
индуцированного дипольного момента. А — непроводящая частица в проводящей сре-
среде (клетка в низкочастотном поле); Б — проводящая частица в плохо проводящей
среде. Вектор Е показывает ориентацию внешнего эл. поля.
44 Глава XV. Молекулярная организация биологических мембран
При воздействии высокочастотного поля проводимость мембраны высока; и
так как электропроводность внутриклеточной среды выше электропроводности
бессолевой внеклеточной среды, ток протекает преимущественно через клетку
(рис. XV. 18). В этих условиях распределение индуцированных зарядов на поверх-
поверхности частиц соответствует параллельной ориентации дипольного момента по
отношению к внешнему полю.
Критическая частота Д (см. рис. XV. 17), при которой происходит смена на-
направления диэлектрофоретического движения, соответствует условию равенства
электропроводностей среды и клетки. При повышении частоты в диапазоне десят-
десятков и сотен мегагерц диэлектрофоретическая сила уменьшается от максимального
уровня Fi до нуля, а затем вновь меняет направление. Этот переход обусловлен дис-
дисперсией поляризации цитоплазмы, аналогично тому как изменение силы от уровня
F\ до Fi связано с дисперсией поляризации мембран.
Зависимость скорости и направления вращения клеток от частоты враща-
вращающегося поля определяется формулами (XV.5.7), (XV.5.10), и представлена на
рис. XV. 17, Б. Максимумы в спектре электровращения соответствуют критическим
частотам /i и /г в спектре диэлектрофореза.
Деформация мембран. Явления диэлектрофореза и электровращения клеток
тесно связаны с действием на поверхность клетки сил, называемых максвеллов-
скими напряжениями. Величина и направление силы, действующей на клеточные
мембраны в электрическом поле определяется соотношением
Т = ss0 Е[Еп] - =^-п\ , (XV.5.11)
где Т — сила, Е — напряженность поля, п — вектор нормали к поверхности, е —
относительная диэлектрическая проницаемость диэлектрика, So — абсолютная ди-
диэлектрическая проницаемость вакуума к, 8,85 • 10~12 Ф/м.
В случае воздействия на клетку низкочастотного поля силовые линии обхо-
обходят клетку (рис. XV. 18, А), т.е. поле направлено тангенциально к поверхности. По
определению векторного произведения, [En] = .Encoscp, где ср — угол между векто-
вектором поля и радиус-вектором п. Так как векторы Е и п взаимно перпендикулярны,
произведение векторов [En] равно нулю. Поэтому
^_ (XV.5.12)
Из (XV.5.12) видно, что на клетку в области экватора действует направленное
внутрь давление, которое заставляет клетку вытягиваться вдоль силовых линий
поля.
В случае воздействия высокочастотного поля силовые линии проходят через
клетку (рис. XV.18,-Б1), т.е. поле направлено перпендикулярно мембране на обоих
концах клетки, обращенных к электродам. При совпадении направлений векторов
поля и нормали к поверхности произведение En равно Еп и [Е[Еп]] = Е2п. Поэтому
Т = ^^-п. (XV.5.13)
i 5. Влияние электрических полей на клетки
45
Из (XV.5.13) видно, что высокочастотное поле создает усилие, которое растягивает
концы клеток в направлении к электродам. Деформация клеток в переменных элек-
электрических полях наблюдается экспериментально и содержит информацию о вязко-
упругих характеристиках клетки. Помимо обратимых деформаций, исчезающих
после выключения поля, обнаружены и необратимые изменения клеточной морфо-
морфологии, обусловленные воздействием переменных полей. Показано, что наложение
электрического доля приводит к формированию у фибробастов отростков, которые
по своей морфологии сходны с отростками, формирующимися в физиологических
условиях, например, при распластывании клеток на субстрате.
Рис. XV.19.
Механизм электрослияния клеток. А) расположение силовых линий; Б) силы, дей-
действующие на мембраны в области кромки пор, длина стрелок соответствует ве-
величине действующей силы; В) поле, направленное тангенциально к поверхности
мембраны в кромке поры, растягивает пору и приводит к полному слиянию клеток
Силы, действующие на клеточные мембраны в электрическом поле, играют
важную роль в сближении мембран при электроиндуцированном слиянии клеток.
Механизм электроиндуцированного слияния, вероятно, несколько отличается от
механизма слияния плоских БЛМ (см. выше). Согласно одной из гипотез, электро-
электрослияние начинается со стадии образования соосных пор в контактных мембранах
сближенных клеток (рис. XV. 19). В области образования соосных пор линии поля
располагаются тангенциально к поверхности мембраны и создают силу, которая
заставляет сближаться участки мембраны вблизи поры. В результате действия этих
сил повышается вероятность смыкания кромок пор (рис. XV. 19, Б1). После образо-
образования сквозной поры поле, направленное тангенциально к кромке поры, стремится
растянуть пору (рис. XV.19, В), что приводит к полному слиянию клеток.
Электротрансфекция. Под электротрансфекцией и электротрансформацией по-
понимают введение в клетки чужеродной ДНК. Для проникновения через мембрану
ДНК важное значение имеют два фактора: образование в мембране пор под действи-
действием поля (электропорация), а также наличие у молекулы ДНК заряда, обеспечиваю-
обеспечивающего электрофоретическое движение ДНК в момент приложения импульса. Элек-
Электрообработка клеток в присутствии ДНК приводит к более сильному повышению
мембранной проницаемости, по сравнению с аналогичной обработкой без ДНК. На
основании этих данных выдвинуто предположение о том, что взаимодействие ДНК
с мембраной при электропорации приводит к повышению эффективного диаметра
пор или увеличению их времени жизни.
46 Глава XV. Молекулярная организация биологических мембран
Электроактивация белков. В качестве примера электроактивации мембранных
ферментов можно назвать активацию Na, К-АТФазы в эритроцитах человека при
действии переменного поля с амплитудой 20 В/см и частотой 1 кГц. Существенно,
что электрические поля такой слабой напряженности не оказывают повреждающе-
повреждающего действия на функции клеток и их морфологию. Слабые поля низкой частоты
F0 В/см, 10 Гц) оказывают также стимулирующее влияние на синтез АТФ ми-
тохондриальной АТФазой. Предполагают, что электроактивация обусловлена вли-
влиянием поля на конформацию белков. Теоретический анализ модели облегченного
мембранного транспорта с участием переносчика (модель с четырьмя состояния-
состояниями транспортной системы) указывает на взаимодействие транспортной системы с
переменным полем. В результате такого взаимодействия энергия поля может ис-
использоваться транспортной системой и преобразовываться в энергию химической
связи АТФ.
Слабые постоянные поля могут вызывать движение свободных клеток (элек-
(электрофорез), а также вызывать латеральное перемещение заряженных рецепторов
по поверхности клеточной мембраны у иммобилизованных клеток. Явления элек-
электрофреза мембранных рецепторов используется как инструмент для изучения по-
подвижности белков в плазматической мембране.
Взаимодействие клеточных мембран. В обычных физиологических условиях
слияние клеточных мембран является важным биологическим процессом, лежащим
в основе таких явлений как экзоцитоз гормонов, ферментов, нейротрансмедиато-
ров, а также при образовании гигантских клеток в воспалительных процессах,
при внедрении вирусов, обладающих оболочкой, в клетки хозяев (вирус СПИД).
Рассмотренные выше механизмы действия электрических полей на бислойные мем-
мембраны и клетки дают представление о физико-химических факторах, влияющих
на взаимодействие клеточных мембран, которые приводят к их слиянию. Однако,
конкретные молекулярные механизмы этого биологического явления намного слож-
сложнее. Основная особенность состоит в активном участии специальных мембранных
белков в процессе слияния. В качестве примера рассмотрим роль гемоагглютинина
(ГА) вируса простудных заболеваний (Уайт, 1992). Молекула этого белка состоит
из трех субъединиц, каждая из которых содержит пептид с большим количеством
гидрофобных аминокислот. ГА играет важную роль в первичном связывании вируса
и атакуемой им клетки. Вследствие изменения третичной структуры ГА вируса про-
происходит освобождение его глобулярных пептидов и их присоединение к мембране
атакуемой клетки.
Эта стадия предшествует появлению поры в мембране, в образовании кото-
которой принимают активное участие несколько тримеров ГА. Именно пептиды ГА
взаимодействуют о мембранными липидами вируса и клетки, обеспечивая их «пе-
«перемешивание». Таким образом, как белки, так и липиды входят в состав элементов
конструкции поры.
Большое значение имеют здесь гидрофобные участки а-спиралей пептидов, ко-
которые непосредственно обеспечивают взаимодействие с липидами. По-видимому,
модель действия ГА несет в себе достаточно общие черты, которые отражают ак-
активную роль интегральных мембранных белков в слиянии двух липидных бислойных
мембран и в других случаях.
Глава XVI
Конформационные свойства мембран
§ 1. Фазовые переходы в мембранных системах
Природные и искусственные мембранные системы могут находиться в двух основ-
основных фазовых состояниях: в виде твердого двумерного кристалла (гель) или в жид-
жидкокристаллическом (расплавленном) состоянии.
Температурная точка основного фазового перехода, или параметр Гфп систем,
образованных из индивидуальных липидов, в сильной степени зависит от длины
и степени ненасыщенности углеводородных цепей липидов. Температура фазового
перехода увеличивается с увеличением длины цепей и уменьшается с увеличением
степени ненасыщенности жирнокислотных остатков.
Жирнокислотные цепи природных липидов обычно содержат ненасыщенные
связи. Вследствие этого у большинства природных мембран ГфП лежит в области
отрицательных температур, т. е. в естественных условиях они находятся в «жидком»
состоянии. Основной фазовый переход в этих мембранах происходит лишь после
того, как они окажутся «вморожены» в водную фазу.
В искусственных и реконструированных мембранных системах, построенных
из индивидуальных синтетических, как правило насыщенных, липидов, точки фазо-
фазовых переходов лежат в области положительных температур. Аналогичная картина
наблюдается у некоторых ауксотрофных микроорганизмов, которые не способны
синтезировать жирные кислоты и используют для построения собственных мембран
только липиды, присутствующие в питательной среде. В отношении структурных
перестроек переход гель — жидкокристаллическое состояние представляет собой
переход углеводородных цепей из полностью тракс-состояния в разупорядоченное
состояние (жидкоподобная а-фаза). При таких переходах площадь, приходящаяся
на молекулу липида, меняется. Например, для мембран из дипальмитоиллецитина
она меняется от 0,48 до 0,58 нм2, среднее расстояние между цепями увеличивается
от ~ 0,49 до 0,53 нм, а толщина углеводородного слоя уменьшается почти на 0,5 нм.
Относительное изменение объема при фазовом переходе невелико: AV/V ~ 1,5%.
Это означает, что латеральное расширение компенсируется утонынением слоя.
Гипотеза петли (кинка). Плавление жирнокислотных цепей при фазовом перехо-
переходе обусловлено вращательной изомеризацией (см. § 3 гл. VIII). Наименьшей энергией
обладает транс-, а наибольшей— цмс-конфигурация.
-Гош-конформации (гош (+) и гош (—), поворот на ±120° относительно транс-
конформации) сравнительно мало превышают по энергии тракс-конформацию
(на 2-3 кДж/моль), но эти состояния разделяет энергетический барьер высотой
48
Глава XVI. Конформационные свойства мембран
~ 12-17 кДж/моль. Если углеводородные цепи в полностью траке-конфигурации
представляют собой линейные структуры, то появление одиночной гош-конфор-
мации в цепи приводит к искривлению пространственной конфигурации цепи на
угол ~ 120° (см. рис. VIII.6-VIII.8). В плотно упакованных мембранных системах с
полностью тракс-конформацией углеводородных цепей это искривление порождает
серьезные стерические затруднения, делающие невозможным появление одиночных
гош-конформаций.
0,127 нм
гош ?
0,15 нм
77
III
Рис. XVI. 1.
Углеводородные цепи в полностью
траке-конфигурации (/), гош-транс-
гош-конфигурации (Л), цис-транс-
гош-конфигурации (III)
о о о о
.о о о о
в о.
Рис. XVI.2.
Кинк-блоки в углеводородных
цепях мембран:
7 — в одном полуслое, 77 — в двух мо-
монослоях липидного бислоя
\—? Уменьшение стерических затруднений при плавлении углеводородных цепей в
мембранах достигается при синхронном появлении в цепи сразу двух гош-кон-
фигураций (гош (+) и гош (—)), разделенных С—С-связью в тракс-конформации.
Хотя энергия такого состояния вдвое выше одиночной гош-конформации, возни-
возникающее ротационное состояние цепи не вызывает сильного расширения решетки,
так как при последовательном повороте цепи на +120 и —120° пространственная
конфигурация цепи в целом сохраняется прямолинейной (рис. XVI. 1). Участок цепи,
находящийся в гош (+)-транс-гош (—)-конформации, формирует уступ или петлю в
углеводородной цепи, которую часто называют кинком (от англ. kink —петля). ?
Образование кинка сопровождается уменьшением эффективной длины цепи на
~ 0,127 нм. При этом часть цепи отодвигается на ~ 0,15 нм, образуя свободный объ-
объем, а занимаемый молекулой липида общий объем увеличивается на 0,025-0,050 нм3
(рис. XVI. 1).
Хотя появления одного кинка в углеводородной цепи недостаточно для ее пла-
плавления, однако одиночные кинки облегчают возникновение кинков в соседних угле-
углеводородных цепях, формируя чередующиеся кинк-блоки (рис. XVI.2). Такие блоки
могут возникать либо в одном полуслое мембраны, либо в двух противоположно
расположенных углеводородных цепях. При увеличении числа кинков в углеводо-
углеводородных цепях разупорядоченность углеводородной зоны мембран резко нарастает.
§ 1. Фазовые переходы в мембранных системах 49
Двойные (цис-) связи в жирнокислотных ненасыщенных цепях мембран мо-
могут играть роль зародышей образования кинков в соседних насыщенных цепях.
В этом случае для образования кинка в ненасыщенной цепи необходимо появление
лишь одной гош-конформации при искривлении цепи на 80°. При этом устраня-
устраняются стерические затруднения, возникающие при размещении ненасыщенной цепи
в углеводородной зоне мембран из насыщенных липидов [см. (XVI.1)], что хоро-
хорошо согласуется с экспериментально наблюдаемым резким снижением Гфп мембран
из насыщенных липидов при добавлении к ним небольших количеств ненасыщен-
ненасыщенных жирнокислотных цепей. Поворот вокруг С—С-связи с образованием транс-
конформации практически исключен (см. §3 гл. VIII; §3 гл. IX).
\—? Таким образом, низкую вязкость (высокая текучесть) углеводородной зоны
мембран в жидкокристаллическом состоянии (при Г > ГфП) связывают с возра-
возрастанием амплитуды крутильных осцилляции вокруг С—С-связей, появлением гош-
конформаций (кинки) и их быстрой изомеризацией в соседние положения. ?
Для оценки эффективности этих процессов полезно сопоставить частоту кру-
крутильных колебаний вокруг С—С-связей F 4- 8) • 1012 с с частотой возникнове-
возникновения гош-конформаций при комнатных температурах. Полагая, что величина ба-
барьера, отделяющего транс- от гош-конформаций, равна ~ 12 кДж/моль, находим
v = (квТ/h) exp[-AE/RT] и 1010 с [см. (XIV.1.1)]. Отсюда следует, что гош-
конформации при комнатных температурах возникают с высокой частотой вслед-
вследствие крутильных осцилляции.
В условиях высокой текучести гидрофобной зоны мембран кинк может изоме-
ризоваться, смещаясь вдоль углеводородной цепи за счет синхронного поворота на
120° соответствующей последовательности С—С-связей. При смещении в соседнее
положение кинк передвигается на ~ 0,13 нм. Такое перемещение кинка вдоль угле-
углеводородной цепи можно рассматривать как своеобразную одномерную диффузию,
которую можно охарактеризовать коэффициентом диффузии Т>к'-
DK = 0,5vK(ALf, (XVI.1.1)
где Vk — частота скачка кинка, AL — шаг одного скачка. Полагая, что часто-
частота скачка кинка по порядку величины соответствует частоте появления гош-
конформаций (~ 1010 с), находим Dji ~ 10~5 см2/с. Полученное значение практи-
практически совпадает с известными коэффициентами проницаемости липидных мембран
для кислорода, воды и небольших молекул неэлектролитов. Это совпадение, а
также геометрическое соответствие размеров таких молекул и свободного объема,
возникающего при образовании кинка, послужило основанием для утверждения,
что трансмембранный перенос малых молекул осуществляется внутри свободного
объема, образуемого кинком.
Молекулярный параметр порядка. Высокая подвижность углеводородных це-
цепей в мембранах позволяет судить лишь о динамической конформации этих струк-
структур или о наиболее вероятной (средняя) форме цепей. Даже в твердом бислое при
полностью тракс-конформации обнаруживается подвижность звеньев углеводород-
углеводородных цепей, которая заметно возрастает к концу цепи по мере удаления от карбо-
карбонильного атома. При этом нарушения траке-конфигурации не происходит, а по-
подвижность звеньев возрастает за счет последовательного суммирования к концу
50
Глава XVI. Конформационные свойства мембран
цепи небольших амплитуд одиночных торсионных осцилляции. В «жидком» бислое
вращательный беспорядок резко нарастает за счет тракс-гош-ротамеризации.
При температурах выше точки основного фазового перехода гибкие углеводо-
углеводородные цепи стремятся принять конфигурацию статистического клубка. Этому,
однако, препятствуют силы поверхностного натяжения, мешающие возрастанию
эффективной площади на молекулу в бислое. В результате наблюдается некоторое
увеличение площади на молекулу, однако при этом в мембранах реализуются далеко
не все возможные конформации цепей.
п-2
п-1
п+1
п+2
Рис. XVI.3.
Нахождение угла C между нор-
нормалью / к поверхности мембра-
мембраны и нормалью II к плоскости,
образованной векторами С—Н-
связей n-го сегмента углеводо-
углеводородной цепи
2 4 6 8 10 12 14 16
Положение D-меченого звена
Рис. XVI.4.
Зависимость параметра порядка
5сг>-связи °т положения дейтери-
рованного звена в пальмитиновой
цепи, биосинтетически включенной
в мембраны микоплазм A. laidlawii
при 42° С (SD = 0,5SCh)
^—р Для описания динамического отклонения конформации таких цепей от нормали
к поверхности используют молекулярный параметр порядка Sn:
Sn = - cos21
1
2'
(XVI. 1.2)
где (Зга — угол между нормалью к бислою и нормалью к плоскости, образованной
двумя векторами С—Н-связей n-го сегмента цепи (рис. XVI.3). Очевидно, что при
идеальной упорядоченности S = 1, а для изотропной среды 5 = 0. ?
На рис. XVI.4 показано, как изменяется S для каждого последующего дейте-
рированного звена в пальмитиновой кислоте, биосинтетически включенной в мем-
мембраны микоплазмы A. laidlawii Аналогичное распределение параметра порядка S
вдоль цепи наблюдается и в бислоях яичного лецитина или некоторых синтетиче-
синтетических липидов.
1. Фазовые переходы в мембранных системах
51
Как видно, после 8-9-го метиленового звена разупорядоченность резко возра-
возрастает, приближаясь к изотропному движению у концевых метильных групп. Воз-
Возможно, что начальные плотноупакованные участки углеводородной зоны обеспе-
обеспечивают когезионные взаимодействия между цепями, необходимые наряду с гидро-
гидрофобными эффектами для поддержания целостности бислоя. В то же время «жидкая»
углеводородная середина обеспечивает заполнение возможных дефектов в гетеро-
гетерогенных системах и поддерживает вязкость системы на необходимом низком уров-
уровне. Примечательно в связи с этим, что в большинстве природных ненасыщенных
жирных кислот двойные связи разме-
размещаются после 9-го углеродного атома
и таким образом прямо не снижают
плотность упаковки начальных участ-
участков углеводородных цепей.
Для экспериментального опреде-
определения параметра порядка применяют
ЯМР-метки, которыми являются липи-
ды, дейтерированные в разных метиле-
новых положениях углеводородной це-
цепи или меченные ядрами 13С. Исполь-
Используют также спин-меченые липиды, в
которых парамагнитные группы свя-
связаны с разными углеродными атома-
атомами углеводородной цепи. В последнее
время благодаря усовершенствованию
30 40 7фп
Температура, "С
50
Рис. XVI.5.
Зависимость приращения энтальпии и
избыточной удельной теплоемкости дис-
дисперсии дипальмитоилфосфатидилхолина
от температуры
техники метода ЯМР стало возможным
определять S по параметрам релакса-
релаксации ядер 13С, присутствующих в угле-
углеводородах мембран за счет естествен-
естественного содержания изотопа.
Термодинамические параметры фазовых переходов. С термодинамической точ-
точки зрения фазовые переходы в мембранных системах можно рассматривать как
превращения агрегатных состоянии A -Н- 2).
\—? При фазовом переходе в мембранах изменяются скачком упорядоченность си-
системы (энтропия) и ее объем, т. е. объем и энтропия системы, являющиеся
первыми производными свободной энергии (dG/дТ) = —S и (dG/др) = V, претер-
претерпевают разрыв в точке фазового перехода. Это означает, что фазовые переходы в
мембранах относятся к переходам первого рода (см. §3 гл. VII). ?
Типичные экспериментальные кривые изменения теплоты и теплоемкости при
фазовом переходе приведены на рис. XVI.5. Измерив поглощение теплоты при фазо-
фазовом переходе AQ и зная количество образца в пробе т (в молях), можно рассчитать
молярную энтальпию перехода АН = AQ/m и затем молярную энтропию перехода
AS = АН/Т.
При плавлении кристаллов общее изменение энтропии обусловлено увеличени-
увеличением конформационной, позиционной и ориентационной разупорядоченности. В мем-
мембранах при плавлении углеводородных цепей, находящихся полностью в транс-
52 Глава XVI. Конформационные свойства мембран
конформации, основной вклад в изменение энтропии обусловлен возможностью по-
появления новых конфигураций за счет тракс-гош-изомеризации. Отсюда фазовый
переход в мембранах можно рассматривать как конфигурационное плавление.
Для фосфатидилхолинов наблюдается линейная зависимость приращения эн-
энтропии при фазовом переходе от длины углеводородных цепей п при 14 sj п sj
Sj 22. Инкремент приращения энтропии на одну СН-группу составляет AS и 5,25
Дж • град • моль. Это позволяет, исходя из больцмановского определения энтро-
энтропии, оценить вероятность тракс-состояний pt при температурах, несколько превы-
превышающих точку фазового перехода. Пользуясь уравнением
AS = R
Pt v ' 1-pt
можно показать, что для фосфатидилхолинов вероятность нахождения СНг-
группы в тракс-конформации pt ~ 0,8. Поскольку pt + 2pg = 1, вероятность
гош-конформации pg ~ 0,1. Из полученных значений вероятности следует, что
при температурах выше точки фазового перехода в углеводородных цепях из
16 углеродных атомов в среднем возникает ~ 2,8 гош-конформаций.
Фазовые переходы в липидных бислоях происходят в сравнительно широком
температурном интервале (At ~ 0,2 -j- 1,0° С). Это обусловлено тем, что в бислое
одна фаза обязательно возникает в матриксе другой фазы («жидкий» и «твердый»
бислои) с образованием большого числа доменов новой фазы микроскопических
размеров, но с большой удельной площадью поверхностей.
По границе домена молекулы находятся в необычной упаковке, что отражается
на внутреннем поверхностном натяжении а. Вследствие изменения объема систе-
системы при фазовых переходах на границе раздела фаз (доменов) будут действовать
механические силы )(. В результате жидкокристаллические фазы доменов будут
находиться под влиянием сил сжатия, а гель-объемы будут испытывать растяжение.
Следовательно, для двух сосуществующих фаз A и 2) в лидидном бислое появляется
дополнительная зависимость их энергий (Gi и G?) от внутреннего поверхностного
натяжения и механических сил:
1,2) и Gi =
В результате сложное равновесие между фазами устанавливается в сравнитель-
сравнительно широком температурном интервале, и крутизна фазового перехода уменьшается,
что указывает на снижение степени кооперативности перехода (см. §5 гл. IX).
Резкий переход возможен только в случае бесконечной кооперативной единицы,
образованной взаимодействующими молекулами, что соответствует плавлению со-
совершенного кристалла. В липидах мембранных структур число молекул N, объеди-
объединяющихся в кооперативные единицы, не превышает нескольких сотен. Это означает,
что в мембранах макроскопических размеров возникает огромное число мозаично
разбросанных кооперативных единиц, которые по закону «все или ничего» находят-
находятся в виде одной (А) либо другой (В) фазы:
А Ф* В.
§ 1. Фазовые переходы в мембранных системах 53
Если долю молекул (или кооперативных единиц) в состояниях Атл В обозначить
С а и Св, то степень перехода 0 можно охарактеризовать как
Кажущаяся константа равновесия этого процесса равна
К = fa/k2 = 0/A-0). (XVI.1.4)
Подход к фазовому превращению как к химической реакции позволяет описать
зависимость К от температуры с помощью уравнения Вант-Гоффа:
din К ЛЯВГ 1 d& ,YVT ,
~^~ ~ ~Wr ~ 6A- в) dT> (XVI.1.5)
где АНвг — теоретическая теплота реакции или энтальпия Вант-Гоффа.
Так как в средней точке перехода 0 = 0,5 (при Г = Гфп), то
АЯвг _
4ЛГ2П "
что совпадает с уравнением (IX.5.3).
Зависимость 0 от температуры может быть найдена экспериментальным путем
с помощью калориметрических, радиоспектральных и флуоресцентных методов.
Предложено несколько приближенных методов оценки энтальпии Вант-Гоффа, на-
например по полуширине перехода ATi/2:
АНВГ~ 7Т'
\—? Для оценки степени кооперативности процесса сравнивают вычисленную ДДвг
и измеряемую калориметрическую теплоту перехода AQ. При отсутствии ко-
кооперативности Д0/ДДвг = 1, а для кооперативного процесса эта величина много
меньше единицы. В общем виде степень кооперативности задается соотношением
[ср. (IX.5.3)] Д-Нвг = NAQ, где N — число молекул в кооперативной единице. Для
характеристики степени кооперативности процесса часто используют также пара-
параметр кооперативности а [см. (IX.5.6)] а = (AQ/АНвгJ¦ Очевидно, что чем мень-
меньше а, тем больше кооперативность процесса. Связь параметра кооперативности с
размером кооперативной единицы определяется выражением
N = 1/л/Б. (XVI.1.7)
?
Вычисленные из экспериментальных данных (при фазовых переходах) размеры
кооперативных единиц в мембранах липосом, состоящих из различных фосфолипи-
дов, представлены ниже.
54
Глава XVI. Конформационные свойства мембран
Фосфолипид
Димиристоилфосфатидилхолтин (ДМФХ)
Дипальмитоилфосфатидилхолин (ДПФХ)
Дистеарилфосфатидилхолин (ДСФХ)
Димиристоилфосфатидилэтаноламин (Д МФЭ)
Дипальмитоилфосфатидилэтаноламин (ДЛФЭ)
Дилаурилфосфатидилэтаноламин (ДЛФЭ)
Количество
молекул в
кооперативной
единице N
200 ± 40
70 ±10
80 ±10
70 A00)
260
440
Следует, однако, с осторожностью использовать уравнение Вант-Гоффа и ка-
калориметрические данные, которые могут зависеть не только от изменения тепло-
теплоемкости, но и от внутримолекулярных перестроек в биомембранах (ср. §3 гл. VII).
Стабильное Термодинамический
состояние равновесный переход
"V / Метастабильное
Переход
Метастабильное _¦
состояние стаоильное
состояние
ХВА
ХАВ х
Рис. XVI.6.
Фазовый переход через метастабильное состо-
состояние (гистерезис)
Переход в направлении А -> В при изменении независи-
независимой переменной х (например, температуры) происходит
через метастабильное состояние при изменении незави-
независимой переменной от жравн до хав- Собственно переход
от А к В происходит при хав ¦ В случае обратного пере-
перехода от В к А система вновь попадает в метастабильное
состояние при изменении независимой переменной от
Жравн до хва, и переход от В к А осуществляется в
точке
Особенности протекания фазовых переходов в мембранных системах могут
быть связаны с появлением у них гистерезиса, т. е. смещения точки фазового пере-
перехода, регистрируемой при нагревании или охлаждении системы. Появление гисте-
гистерезиса возможно, когда кинетические барьеры для фазового перехода достаточно
высоки, так что затрудняется установление термодинамического равновесия между
фазами при температуре равновесного перехода. В результате процесс перехода
совершается через метастабильное состояние (рис. XVI.6).
Экспериментально гистерезис обнаружен в искусственных мембранных систе-
системах из синтетических и природных липидов. Например, для ДПФХ и ДМФХ ги-
стерезисное смещение Гфп в определенных условиях может достигать 3-5° С. Ги-
стерезисная петля обнаружена и в ряде природных мембран, причем гистерезисное
смещение Гфп в мембранах Е. coli оказалось существенно больше, чем в искусствен-
искусственных мембранах, построенных из липидов, которые были выделены из мембран этих
микроорганизмов. Примечательно, что гистерезис проявляется и на функциональ-
функциональных характеристиках биологических мембран. Так, широкая гистерезисная петля
(~ 10° С) наблюдается при регистрации потенциала действия на гигантском аксоне
кальмара.
§ 1. Фазовые переходы в мембранных системах 55
Теории фазового перехода. Попытки теоретически описать фазовые переходы
липидов в мембранах предпринимались неоднократно. В общих теориях стремятся
дать полное описание процесса и вычислить температуру фазового перехода и его
тепловой эффект. Возможные конфигурации липидов, определяющие фазовый пе-
переход, находят, исходя из анализа энергии системы, представляющей собой сумму
энергий внутримолекулярных и межмолекулярных взаимодействий. Наиболее про-
простая модель, предложенная Дж. Ф. Найглом A973), рассматривает фазовый переход
бислоя в рамках поворотно-изомерной теории (см. § 3 гл. VIII) как переход порядок-
беспорядок с допущением произвольного сочетания транс- и гош-конформаций в
каждой цепи. При подсчете числа возможных конфигураций предполагают, что
соседние цепи находятся в одной плоскости и их углеродные атомы могут зани-
занимать ячейки плоской гексагональной решетки. Стерические ограничения учиты-
учитывают путем допущения, что в одной ячейке решетки не может находиться более
одного С-атома. Вычисленная на основе такого грубого двумерного приближения
теплота перехода оказалась достаточно близкой к экспериментально измеренным
величинам.
Модели фазового перехода, учитывающие большее число факторов, построены
на основе теории молекулярного поля с использованием понятия «параметра по-
порядка». В этих моделях полагают, что конфигурация системы липидных молекул,
подобно нематическим жидким кристаллам, определяется взаимной ориентацией
соседних молекул.
В модели, предложенной С. Марчельи A974), энергию углеводородной цепи с
конфигурацией г в бислое определяют следующим образом:
Первый член ??*н представляет собой внутримолекулярную энергию цепи, ко-
которую находят с помощью поворотно-изомерной теории.
Третий член рА% введен для учета бокового давления на цепь в бислое, возника-
возникающего за счет стерического отталкивания, электростатических взаимодействий и
гидрофобного эффекта. Обычно в расчетах принимают, что значения р составляют
~ 2 • 10~4 Н/см; А — эффективная площадь продольного сечения цепи ~ 0,2 нм2.
Второй член -БдИСП введен для учета межмолекулярных дисперсионных взаимо-
взаимодействий.
Модель Марчельи позволяет рассчитать температуру и тепловой эффект пе-
перехода, а также основные геометрические параметры цепей, которые находятся в
хорошем соответствии с экспериментом.
Фазовые переходы в липидах мембран удается описать в более общем виде с
помощью феноменологической теории Ландау. Она позволяет представить термо-
термодинамический потенциал (свободная энергия) вблизи точки фазового перехода в
виде степенного разложения по параметру порядка v:
Gv = oiv + |a2v2 - |a3v3 + \a^\ (XVI.1.9)
Здесь a\ = p(Sf — Ss), p — латеральное давление, Sf и Ss — поверхностные площади
на молекулу в жидкокристаллическом и твердом состояниях, а?, аз, а^ — коэффи-
56 Глава XVI. Конформационные свойства мембран
циенты, которые могут быть найдены по зависимости ГфП и v от латерального
давления р.
Параметры фазового перехода находят, минимизируя зависимость Gy от Г и v.
В теории Ландау параметр порядка определен несколько иным образом — через
изменение поверхностной площади молекул при фазовом переходе:
v = ^^г, (XVI.1.10)
где S — реальная поверхностная площадь на одну молекулу.
С помощью этого подхода рассмотрено влияние холестерина и белков на фазо-
фазовые переходы и исследована зависимость параметра порядка липидов в ближайшем
окружении молекул белков и холестерина в мембранах. Результаты этих работ в
целом согласуются с результатами, полученными из модели Марчельи, в частности
они указывают, что липиды могут образовывать несколько молекулярных слоев с
постепенно меняющейся упорядоченностью вокруг белковых молекул.
Частные теории посвящены описанию зависимости фазовых переходов в бислое
от параметров системы. В модели Трейбла и Эйбла A974) в качестве такого па-
параметра рассматривают свойства полярных групп липидов. В противоположность
электронейтральным (цвиттерионные) липидам у заряженных липидов обычно на-
наблюдается четкая зависимость температуры перехода от многих факторов, опре-
определяющих заряд липидов (рН, ионная сила, адсорбция ионов и т.д.). Если бы вза-
взаимодействие заряженных групп сводилось к простому отталкиванию одноименных
зарядов, то фазовые переходы в заряженных липидах должны были бы происходить
при более низких температурах, чем в электронейтральных. Фактически наблю-
наблюдается обратная картина. В модели вклад электростатического взаимодействия
в изменение энтальпии при фазовом переходе определялся в предположении, что
свободная энергия заряженной поверхности зависит от плотности поверхностного
заряда. В том случае, если заряды на поверхности липидного бислоя распределены
равномерно, свободная энергия двойного электрического слоя ср может быть рас-
рассчитана по уравнению Гуи—Чэпмена (см. § 5 гл. XVIII).
Поскольку площадь, занимаемая молекулой липида в «твердом» бислое, мень-
меньше, чем в «жидком», плотность поверхностного заряда и, следовательно, свободная
электростатическая энергия должны уменьшаться при фазовом переходе геля в
жидкокристаллическое состояние.
Считай, что энтальпия фазового перехода состоит из неэлектростатического
компонента АН и электростатического члена АЕЭЛ, температуру фазового перехо-
перехода Г* для заряженных липидов можно записать в виде
г* =
Смещение точки фазового перехода АГ для заряженных липидов определяется вы-
выражением
ДГ = Г*_Г=Д^=_2ДГГДА_ (АЛЛ
AS AS [ А1 А1А2 \ у '
где А\, А2 — площади, занимаемые молекулой в «твердом» и «жидком» бислоях; а —
степень диссоциации соответствующей группы; А А = А2 — А\.
§ 2. Особенности межмолекулярных взаимодействий в мембранах 57
В предположении, что AS не зависит от рН, по этому уравнению можно
предсказать, что температура фазового перехода, например фосфатидной кислоты,
должна уменьшаться на ~ 20° С при переходе от протонированной к полностью
ионизованной форме молекулы липида. Экспериментальная проверка показала
достаточно хорошее совпадение реальных значений с теоретическим расчетом.
В целом термодинамические теории хорошо описывают влияние одновалентных
катионов на Гфп.
§ 2. Особенности межмолекулярных взаимодействий в мембранах
В реальных условиях не только природные, но часто и искусственные мембраны
существенно неоднородны по липидному или белковому составу. В структурной
организации стабилизации таких систем наряду с обычными гидрофобными эф-
эффектами важное место занимают так называемые липид-белковые и белок-белковые
взаимодействия. Эти термины используют для обозначения широкого круга разно-
разнообразных, отличающихся по механизмам явлений, которые приводят к неравномер-
неравномерному распределению молекулярных компонентов в мембранах — микрогетерогенно-
микрогетерогенности мембран.
Липид-лшшдные взаимодействия. Этот термин обычно используют, чтобы вы-
выделить специфические взаимодействия, возникающие в мембранных системах вслед-
вследствие неоднородности липидного состава.
Среди различных факторов, определяющих соотояние липидов в мембранах,
наибольшее значение имеют электростатические силы притяжения и отталкивания
между заряженными полярными головками, стерические факторы, учитывающие
форму молекул липидов и характер расположения их головок и гидрофобных угле-
углеводородных хвостов, «сила гидратации», а также водородные связи между головка-
головками липидов. Гидратационные силы играют важную роль при взаимодействии фос-
фолипидных мембран между собой. Сохранение слоя воды 10-30 А около наружной
полярной поверхности препятствует сближению мембран и их непосредственному
контакту. Для удаления такого слоя воды необходимо нарушить его состояние и
затратить энергию, что собственно и лежит в основе проявления гидратационнах
сил.
Природа гидратационных сил отталкивания носит неэлектростатический ха-
характер, а проявляется на фоне кулоновских взаимодействий, резко не экспоненци-
экспоненциально возрастая на коротких расстояниях. Так, при сближении бислоев дигекса-
децилдиметиламиноацетата это происходит на расстоянии ~ 11 А между поверх-
поверхностями (Парседжан В., 1989). Однако добавление ионов Са в систему может
привести к их взаимодействиям с полярными группами, нарушению из-за этого
гидратационного отталкивания и, как следствие, слипанию бислоев в структуру, не
содержащую воды.
Гидратация липидов зависит от их природы и во многом определяет их физи-
физические свойства. Обычно меньшая гидратация наблюдается у липидов с донорны-
ми и акцепторннми группами, принимающими участие в образовании водородных
связей. Их пониженная гидратация вызывается участием групп полярных головок
липидов в образовании водородных связей между собой, а не с окружающими мо-
молекулами воды (Боггс, 1987). Для того, чтобы это было возможно, необходимо
58 Глава XVI. Конформационные свойства мембран
разрушить водородные связи с водой липидных групп и образовать «свою» водо-
водородную связь:
Л-Н...ОН2 + Б...НОН — А-Я...В + НОН...ОН2, (XVI.2.1)
где А—И — водород-донорная, а Б — водород-акцепторная группа двух липидных
молекул. В качестве Л-Н-групп выступают NH+, NH2, РОН, СОН, СООН, HNC-O,
а Б-группы включают РО", СОО", ОС-О, СОС.
Очевидно, реакция (XVI.2.1) будет осуществляться, если при этом суммарная
стабильность водородных образованных связей в правой части уравнения будет
больше, чем у водородных связей с водой групп А—И и Б. Сопровождающее этот
процесс освобождение молекул воды с поверхности бислоя вызовет увеличение
энтропии системы, что внесет вклад в компенсацию энергетических затрат для
разрыва водородных связей между липидами и водой. Такого рода водородные
связи легко разрываются и вновь возникают между другими липидами за времена
~ 10-11-10~12 с. Единая система лабильных водородных связей способствует
проявлению кооперативных свойств и, в частности, повышает температуру Г
фазовых переходов гель — жидкий кристалл, блокируя дестабилизирующее дей-
действие электростатических сил отталкивания полярных головок, которое, наоборот,
снижает Т.
¦\У Энергию взаимодействия системы, состоящей из двух липидных компрнентов
А и Б, можно представить в виде парных потенциалов Фаа, Фвв и Фав- Если
разность Фав — 1/2(Флл + Фвв) мала, то в системе будет наблюдаться равномерное
распределение компонентов А и Б. Когда же потенциалы взаимодействия силь-
сильно различаются, становится возможным скомпенсировать уменьшение энтропии за
счет возрастания упорядоченности системы. В этом случае следует ожидать не-
неравномерного распределения липидов и расслоения системы. Поскольку основной
вклад в энергию взаимодействия липидов в мембранах обусловлен дисперсионным
взаимодействием углеводородных цепей, эти эффекты наиболее явно проявляются
в мембранах, сформированных из липидов, резко различающихся длиной углеводо-
углеводородных цепей. ?
Так, в мембранах из ДМФХ A4 углеродных атомов) и ДСФХ A8 углеродных
атомов) при любом объемном соотношении компонентов (до 75% ДСФХ) наблюда-
наблюдаются два раздельных фазовых перехода (при 23 и 58° С соответственно), амплитуда
которых пропорциональна мольной доле компонентов в мембране. Это означает
отсутствие смешивания компонентов в твердой фазе. При 23° С < Г < 58° С си-
система представляет собой двумерный раствор кристаллических доменов ДСФХ в
жидкокристаллической матрице из ДМФХ. Ненасыщенные липиды обычно также
плохо смешиваются в твердой фазе с насыщенными липидами.
Иную картину можно наблюдать, когда мембраны сформированы целиком из
насыщенных липидов, слабо различающихся длиной углеводородных цепей. В таком
случае при любом соотношении компонентов равномерное распределение обнару-
обнаруживается как в «твердом», так и в «жидком» состоянии. Например, в мембранах из
ДПФХ A6 углеродных атомов) и ДСФХ регистрируется один фазовый переход,
который постепенно смещается от 41 до 58° С при изменении доли ДСФХ в смеси
от 0 до 100% соответственно.
§ 2. Особенности межмолекулярных взаимодействий в мембранах 59
В природных мембранах, содержащих большое число различных компонентов,
весьма вероятно гетерогенное распределение липидов. Накоплен значительный экс-
экспериментальный материал, подтверждающий эту возможность, однако функцио-
функциональное значение гетерогенного распределения липидов в мембранах является пред-
предметом дискуссий.
Лшшд-белковые взаимодействия. В основе данных взаимодействий лежат меж-
межмолекулярные дисперсионные и электростатические силы, водородные связи или
другие эффекты связывания. Липид-белковые взаимодействия и обусловленные ими
явления условно классифицируют следующим образом: взаимодействия белок — ли-
пидный монослой; взаимодействия белок — липидный бислой; липид-белковые взаи-
взаимодействия в мембранах, включающие липид-зависимые ферменты.
Взаимодействие белков с липидными монослоями обнаруживается при включе-
включении в монослои радиоактивно меченных белков (альбумин, цитохром с). Электро-
Электростатические взаимодействия между белками и монослоем проявляются в виде рез-
резкого изменения сорбции белков на заряженных монослоях при отклонении от изо-
электрической точки белков. В опытах с фосфолипазами показано, что электроста-
электростатические взаимодействия определяют начальные этапы взаимодействия фермент —
липидный монослой. Начальные этапы существенно облегчают последующую пра-
правильную стереохимическую ориентацию компонентов фермент-субстратного ком-
комплекса.
Взаимодействие белок — липидный бислой—высокоспецифичный и многоста-
многостадийный процесс, характеризующийся наряду с поверхностной сорбцией внутримем-
бранным встраиванием белков. Экспериментальным критерием встраивания белков
в липидный бислой обычно служит изменение ионной проницаемости мембран. В мо-
модельных экспериментах встраивание мембранных белков в искусственные бислой-
ные системы играет решающую роль в их успешной функциональной реконструк-
реконструкции.
Липид-белковое взаимодействие в мембранах проявляется при образовании
внутри мембран специфичного липидного окружения вокруг белковых молекул.
Такие липиды называются связанными или аннулярными (от англ. annular —
кольцеобразный). В настоящее время, однако, окончательно не решен вопрос о воз-
возможности формирования вокруг белков в жидкокристаллических мембранах (при
Г > ГфП) специфического липидного окружения, характеризующегося сравнительно
медленным обменом с остальными липидами. Тем не менее с помощью метода ЭПР
доказано изменение подвижности и характера упаковки углеводородных цепей под
влиянием белков. Более того, методами ЭПР, ЯМР, флуоресценции и другими
показано, что пертурбирующее действие различных интегральных и перифериче-
периферических белков (цитохром-с-оксидаза, цитохром с, полилизин, миелин, родопсин, белки
тилакоидных мембран и др.) распространяется вплоть до четвертого слоя липидов,
окружающих молекулу белка.
Функциональное значение аннулярных липидов обычно интерпретируют, ис-
исходя из экспериментальных наблюдений, согласно которым большая активность
белков проявляется в менее вязком липидном окружении. Это показано, напри-
например, для цитохром-с-оксидазы, встроенной в искусственные липидные мембраны
разного состава, или в случае АТФаз в мембранах ауксотрофных микроорганиз-
микроорганизмов.
60 Глава XVI. Конформационные свойства мембран
В настоящее время описано несколько десятков мембранных ферментов, актив-
активность которых зависит от присутствия липидов, ниже перечислены некоторые из
них.
Ферментативная активность (функция) Необходимые липиды
Митохондриальный электронный транс- Общие липиды митохондрий
порт
Na+, К+-АТФаза Фосфатидилсерин, фосфатидилглицерол
Гликозо-6-фосфатаза Са2+-АТФаза Фосфатидилэтаноламин
Лизофосфатидилхолин, фосфатидилхо-
лин, нейтральные детергенты
Комплекс переносчиков НАД-цитохром- Фосфатидилхолин: лизофосфатидилхо-
с-редуктазы лин A:1)
Стеарил-коэнзим-А-десатураза Фосфолипиды, триглицериды, жирные
кислоты
Р-Гидроксибутиратдегидрогеназа Фосфатидилхолин
Некоторые из них, например митохондриальные электрон-транспортные белки,
слабо чувствительны к липидному составу, но эффективно активируются суммар-
суммарной липидной фракцией, содержащей некоторое количество ненасыщенных липидов.
Для достижения максимальной активности других ферментов требуются липиды
строго определенного состава. Эти ферменты проявляют специфичность по отно-
отношению к полярным головкам липидов и слабо зависят от жирнокислотного состава.
В противоположность этому функциональная активность, например, родопсина за-
зависит от длины углеводородных цепей липидов.
Липидная зависимость активности мембранных ферментов может отчетливо
проявляться в условиях селективной экстракции мембранных липидов и при после-
последующем добавлении определенных липидов к делипидизированным мембранам. Так,
мягкая эфир-бутанольная экстракция плазматических мембран печени приводит
к снижению базальной аденилатциклазной активности и гормон-стимулируемых
ответов. Базальная активность полностью восстанавливается при добавлении к
мембранам фосфатидилинозитола. Почти полное восстановление гормон-стимули-
руемой активности наблюдается при добавлении к мембранам фосфатидилсерина.
Предполагают, что взаимодействие аденилатциклазы с определенными липидами
мембран необходимо для проявления активности каталитического центра и обра-
образования активного гормон-рецепторного комплекса (см. гл. XXVI).
Белок-белковые взаимодействия. Эти взаимодействия проявляются в мембра-
мембранах в виде обратимой внутримембранной агрегации мембранных белков, часто со-
сопровождающейся изменением функциональной и ферментативной активности си-
системы. Так, в мембранах эритроцитов равномерно распределены белковые внутри-
мембранные частицы, обратимо агрегирующие при значениях рН ниже 5,5. Агре-
Агрегация чувствительна к составу водной фазы; при возрастании концентрации элек-
электролитов и низких значениях рН агрегация приостанавливается. Эта внутримем-
бранная агрегация белковых частиц в эритроцитах коррелирует с изменением рас-
распределения поверхностных рецепторов.
К настоящему времени выявлено, что циклы агрегации-дезагрегации белков
в клеточных мембранах — широко распространенное явление, проявляющееся при
§ 3. Перекисное окисление липидов биомембран 61
пиноцитозе, на ряде стадий клеточного цикла, при взаимодействии и слиянии мем-
мембран и т. д. Полагают, что в основе агрегационных взаимодействий могут лежать
силы электростатического характера или более сложные взаимодействия, опосре-
опосредованные особенностями липидного окружения белков, а также локальная кристал-
кристаллизация липидов в мембранах.
§ 3. Перекисное окисление липидов биомембран
Перекисное окисление липидов — процесс, наблюдаемый при нормальном функци-
функционировании биомембран, обычно возрастает при патологических состояниях орга-
организма.
В изучении механизма этого явления важную роль сыграли теории пе-
рекисного окисления Баха—Энглера A897) и цепных разветвленных реакций
Н.Н.Семенова A934), а также работы школ Н.М.Эмануэля о жидкофазном
окислении углеводородов и Б.Н. Тарусова о роли цепного свободнорадикального
окисления липидов в действии повреждающих факторов на клетку.
Процесс перекисного окисления липидов начинается с образования свободно-
радикальных продуктов за счет разрыва в молекуле углеводорода С—Н или С—С-
связей. Легче он протекает в углеводородах, содержащих ненасыщенные двойные
связи. Наименьшей энергией разрыва обладает СН-связь, находящаяся рядом с двой-
двойной связью в а-положении. Но и в этом случае для ее разрыва необходимо затратить
более 300 кДж/моль. Поэтому общая скорость перекисного окисления липидов опре-
определяется прежде всего стадией инициирования свободнорадикального процесса.
Перекись липида ROOH возникает в реакции свободнорадикального интер-
медиата — алкильного радикала R' с кислородом; сначала образуется перекисный
радикал ROO , а затем после его взаимодействия с молекулой субстрата RH появля-
появляется перекись: R' + О2 -* ROO' + RH -* ROOH + R\
Реакции, в ходе которых исходный углеводородный радикал R затем регене-
регенерируется вновь из неокисленной молекулы субстракта RH, называются цепными.
Число циклов, которое успевает совершить свободнорадикальный центр до момента
гибели, определяет длину цепи.
В интактных биомембранах обнаружены ферментные и неферментные систе-
системы, способные инициировать перекисное окисление липидов. Инициатором свобод-
свободнорадикального окисления является активированный кислород в форме суперок-
супероксидного анион-радикала OJ, пергидроксильного радикала НО2, гидроксильного
радикала НО и синглетного кислорода 1Ог. Важную роль в инициировании оки-
окислительных реакций играет перекись водорода.
Активированные формы кислорода. В молекуле кислорода два электрона из 12
неспарены. Поэтому молекула кислорода обладает суммарным спином 1 и свойства-
свойствами бирадикала. Она парамагнитна, и ее основное состояние триплетное 3Ог (tt)-
В триплетном состоянии 3Sg кислород легко реагирует с ионами железа, другими
парамагнитными радикалами. Вместе с тем молекулярный кислород относительно
мало активен при взаимодействии с органическими молекулами, находящимися в
основном (синглетном) состоянии. Последовательное одноэлектронное восстановле-
восстановление кислорода до воды приводит к образованию активных промежуточных продук-
продуктов (рис. XVI.7).
62
Глава XVI. Конформационные свойства мембран
На первом этапе восстановления кислорода образуется супероксидный ани-
анион-радикал OJ. Он имеет окислительно-восстановительный потенциал, равный
—0,32 В, что близко к потенциалам восстановленных пиридиннуклеотидов. В про-
протонных растворителях OJ протонируется до пергидроксильного радикала НО2.
Константа диссоциации реакции равна 4,8, и потому процессы с участием НО2
протекают преимущественно в кислой среде. Дальнейшее восстановление суперок-
супероксидного анион-радикала приводит к образованию перекиси водорода. Это соедине-
соединение в присутствии ионов переменной валентности распадается до гидроксильных
радикалов НО' (см. ниже). Диссоциация перекиси водорода на ионы возможна
только в щелочной среде (рК = 11,8).
Синглетно
возбужденный
кислород
НО/
Н++НО-,
Н++От
pk=4,8
рк=11,9
\(О2)-
2Н+
Н2О2
2 2
Н2О + НО*
2
Н2О
Кислород Суперо- Перекись Гидроксильный
в основном ксидный водорода радикал
триплетном анион-
состоянии радикал
Рис. XVI. 7.
Образование форм активированного кислорода в процессах его одноэлектронного
восстановления и возбуждения
На следующем этапе одноэлектронного восстановления перекиси водорода про-
происходит разрыв связи между атомами кислорода и образование молекулы воды и
гидроксильного радикала НО'. Завершается восстановление кислорода образовани-
образованием второй молекулы воды.
Гидроксильный радикал обладает чрезвычайно высокой реакционной способ-
способностью. Константа скорости реакции отрыва водорода от углеводородной цепи
молекулы радикалом НО' близка к константе диффузии —109-1010 м~1с~1. Вза-
Взаимодействие гидроксильного радикала с субстратами окисления практически неиз-
неизбирательное.
Из исходного триплетного состояния кислород может переходить в одно из
двух возбужденных состояний, отличающихся локализацией внешних электронов
(рис. XVI.7). Такой переход осуществляется в случае получения кислородом энер-
энергии как в фотохимических, так и темновых реакциях. Нижнее возбужденное со-
3. Перекисное окисление липидов биомембран
63
стояние Ag обладает избыточной энергией 94,5 кДж • моль , что соответствует
энергии инфракрасного излучения с длиной волны 1270 нм. Состояние с большей
энергией *I]g A56,7 кДж • моль) обладает очень малым временем жизни в водных
системах (порядка 10~10 с) и его участие в биологических процессах маловероятно.
Синглетный кислород в воде имеет время жизни около 2 мкс. Он активно вступает
в реакции с многими ненасыщенными соединениями, образуя специфические про-
продукты, например, диокситаны и трансаннулярные внутренние перекиси. Константа
скорости взаимодействия синглетного кислорода с полиненасыщенными жирными
кислотами около 104-105 м~1с~1. На рис. XVI.8 показаны основные реакции пре-
преобразования активных форм кислорода.
донор т
энергии L
(хлорофилл*)
1О2] Димоль
О,' спонтанная
2 дисмутация
люминисценция
в видимой области
Fe _
3О2 + Fe2+ -4 О2
3О2 + Fe2
О7 реакция
Хабера-Вайса
НО" + Fe3+
$™ io2 + ho"+ho-
Рис. XVI.8.
Основные реакции преобразования форм активированного кислорода
В представленной схеме центральное место занимает супероксидный анион-
радикал ОJ. Его спонтанная дисмутация приводит к появлению перекиси водорода
и, по некоторым данным, синглетного кислорода. При взаимодействии перекиси
водорода с супероксидным анион-радикалом (реакция Хабера—Вайса) образует-
образуется гидроксильный радикал НО и, возможно, синглетный кислород. Трехвалентное
железо или другой окисленный ион переменной валентности могут быть восстано-
восстановлены перекисью водорода или супероксидным анион-радикалом. Гомолитический
распад перекиси водорода при ее взаимодействии с двухвалентным железом (реак-
(реакция Фентон) дает гидроксильный радикал НО'.
Активированный кислород в биологических системах. Образование активиро-
активированного кислорода в клетке происходит в ходе аэробного дыхания и фотосинте-
фотосинтеза. Существует некоторая вероятность того, что первичный продукт восстановле-
восстановления кислорода — супероксидный анион-радикал покинет пределы дыхательной или
фотосинтетической цепи и окажется в цитозоле. Эффективность этого события
обычно возрастает при «перегрузке» электронтранспортной цепи, когда возрастает
восстановленность ее переносчиков. В дыхательной цепи донором электрона для
кислорода может служить семихинонная форма убихинона. В фотосинтетической
64
Глава XVI. Конформационные свойства мембран
электронтранспортной цепи (см. гл. XXVII) значительная часть О2 возникает на
уровне акцепторов электронов фотосистемы 1 и ферредоксина. В фотосистеме 2
одноэлектронное восстановление кислорода могут осуществлять пластохинон и пла-
стоцианин.
Кроме того, активация кислорода возможна в системе мембран эндоплазма-
тического ретикулума, где в ходе транспорта электронов от восстановленных пи-
ридиннуклеотидов и при участии переносчика электронов цитохрома Р-450 проис-
происходит гидроксилирование стероидных гормонов, холестерина, желчных кислот, а
также ксенобиотиков (липофильных чужеродных молекул) по типу монооксигеназ-
ных реакций:
S + DH2 + О2 — SOH + D + Н2О2,
где S — субстрат окисления, DH2— донор электронов НАДФН. Важно отметить,
что система монооксигеназного окисления в отсутствие субстратов гидроксилиро-
вания переключается на перекисное окисление полиненасыщенных жирных кислот
мембранных липидов. В результате возможно изменение химического состава, фи-
физических параметров, ультраструктурной организации и функциональных харак-
характеристик биологических мембран.
Цитоплазматическая
мембрана фагоцита
Глюкозо-
монофосфатный
шунт
Стимулятор
фагоцитоза
Глюкоза
О2Т, Н2О2;НО',1О2
н2о2 + а-
миелопероксидаза
*- ос1- + н2о
Н2О2 + ОС1--
-*¦ ю2 + а- + н2о
Рис. XVI.9.
Кислородзависимые реакции, сопровождающие фагоцитоз
Особая система генерации активированного кислорода функционирует у фа-
фагоцитирующих клеток. Она представлена на рис. XVI.9. Появление чужеродной
§ 3. Перекисное окисление липидов биомембран 65
частицы на пути фагоцита приводит к активации в клетке гексозомонофосфатного
шунта восстановления НАДФН. Затем НАДФН с помощью мембранносвязанно-
го цитохрома &-245 восстанавливает кислород до супероксидного анион-радакала.
Дальнейшая судьба радикала представлена на схеме рисунка XVI.8. Одновременно
при участии миелопероксидазы в клетке генерируются ионы ОС1~. Указанные на
схеме рисунка XVI.9 кислородсодержащие свободнорадикальные продукты, явля-
являясь мощными бактерицидными агентами, участвуют в уничтожении чужеродных
клеток.
Растительный организм не имеет специализированных клеток, использующих
«кислородное» оружие для борьбы с внешней инфекцией. Но принцип защиты у
растений весьма похож на тот, к которому прибегают животные клетки. Контакт
паразита с растительной клеткой вызывает выход из нее во внеклеточное простран-
пространство фенольных соединений и окисление последних пероксидазой клеточной стенки.
Генерируемые при этом свободнорадикальные продукты являются токсичными для
паразита. Это один из механизмов фитоиммунитета. Активные формы кислорода,
по-видимому, играют определенную роль и в так называемой реакции сверхчув-
сверхчувствительности растения.
Активированный кислород участвует в биосинтетических процессах, напри-
например, при образовании простогландинов у животных или фитогормона этилена у
растений.
В фотосинтетических реакциях возможна также миграция энергии с возбу-
возбужденной молекулы пигмента (хлорофилла) на кислород и перевод его в активи-
активированное синглетное состояние 1О% (рис. XVI.8). Этот процесс может привести к
деструкции фотосинтетических мембран, богатых ненасыщенными липидами. На
этом основано также фотодинамическое действие света, когда донором энергии
для молекулы Ог служат молекулы красителей. Генерируемый в фотохимических
реакциях синглетный кислород ответственен в большой степени за бактерицидное
действие солнечного света.
Предполагают, что активные формы кислорода как в физиологических усло-
условиях, так и при окислительном стрессе, вызванном различным факторами, могут
выполнять роль инициаторов эндонуклеазной фрагментации ДНК (апоптозис, за-
запрограммированная гибель клетки) или даже непосредственно атаковать ДНК (ги-
дроксильный радикал). Биологическое значение клеточного апоптозиса заключает-
заключается в защите организма от злокачественного перерождения клеток.
\—? Итак, в аэробных условиях в организмах появляется активированный кислород,
как побочный продукт ряда биохимических реакций, так и в связи с целенапра-
целенаправленной активацией кислорода в целях защиты от инфекции, удаления ксенобиоти-
ксенобиотиков, а возможно и самоликвидации переродившихся клеток. Формы активирован-
активированного кислорода в высокой концентрации обладают токсическим и, в частности,
бактерицидным действием. Высказаны предположения о роли форм активного ки-
кислорода как мессенджера в регуляции гомеостаза клетки. Ненасыщенные липиды
биологических мембран представляют собой одну из наиболее уязвимых мишеней
активированного кислорода. ?
Перекисное окисление липидов является фактором, способным изменять
химический состав и физические параметры, ультраструктурную организацию
66 Глава XVI. Конформационные свойства мембран
и функциональные характеристики биологических мембран. Процесс перекисного
окисления охватывает главным образом непредельные фосфолипиды биологических
мембран, в основном полиненасыщенный фосфатидилэтаноламин. Перекисное
окисление приводит к увеличению вязкости мембран за счет уменьшения количе-
количества жидких гидрофобных липидов в бислойных участках, появления поперечных
межмолекулярных сшивок и возрастания количества упорядоченных липидов,
обладающих ограниченной подвижностью в бислое. Происходит также увеличение
отрицательного заряда на поверхности мембран, обусловленное появлением вто-
вторичных продуктов перекисного окисления липидов, содержащих карбонильные и
карбоксильные группы.
В биологических мембранах (мембраны эритроцитов, митохондрий, саркоплаз-
матического и эндоплазматического ретикулума, лизосом) вследствие перекисного
окисления липидов индуцируется проницаемость для различных ионов, неэлектро-
неэлектролитов и макромолекул. Этот эффект потери мембранами барьерных функций лежит
в основе патогенеза многих заболеваний.
В результате перекисного окисления липидов происходят изменения свойств та-
таких мембранных белков, как транспортные Са2+-АТФаза, Na+/K+-ATOa3a, цито-
хромы Р-450, &5> с, глюкозо-6-фосфатаза, моноаминоксидаза, фосфолипаза, родоп-
родопсин. В основе модифицирующего действия лежит обеднение микроокружения бел-
белков полиеновыми фосфолипидами, образование межмолекулярных сшивок за счет
взаимодействия со вторичными продуктами перекисного окисления, окисление SH-
групп, снижение термоустойчивости белков.
Обычно схема процесса перекисного окисления липидов мембран строится по
типу реакций жидкофазного окисления углеводородов:
О RH -* R' ко Зарождение цепи
2 RH + ROi - R- + ROOH jfej Продолжение цепи
3 ROOH -* RO' + 'ОН k3 Вырожденное разветвление (XVI.3.1)
4 R' +K -* ^ , fen
5 R-+RO-+ Молекулярные Обрыв цепей
6 ROi+RO^JnP°flyKTbI kj
Здесь RH — молекула углеводорода (жирнокислотный остаток), R' и RO2 — ал-
кильный и перекисный свободные радикалы, ROOH — гидроперекись, к$,к\,... —
константы соответствующих реакций.
Поскольку реакция 1 протекает с высокой скоростью (к\ ~ 107 Ч-108 М~1с~1),
а концентрация кислорода в жидкофазных системах обычно достаточно велика,
полагают, что в жидкофазных системах выполняется условие [R] <C [RO2]. Значит,
в жидкофазных системах важнейшим радикалом является радикал RO2, только он
участвует в процессе продолжения цепи (реакция 2) и вступает в реакции обрыва
цепи (реакция 6).
Защитные механизмы. Биологические системы адаптированы к аэробным усло-
условиям. Они защищены от токсического действия активных форм кислорода фермент-
ферментными системами, антиоксидантами и тушителями синглетного кислорода.
Концентрация перекиси водорода в клетке контролируется каталазой, разлага-
разлагающей перекись без образования активных продуктов, и пероксидазами, использу-
§ 3. Перекисное окисление липидов биомембран 67
ющими перекись водорода для окисления всевозможных субстратов. Фермент глу-
татионпероксидаза восстанавливает перекиси липидов и, таким образом, предот-
предотвращает их распад до радикальных продуктов и тормозит развитие окислительной
реакции (реакция 3 на схеме XVI.3.1). Важную роль в удалении перекиси водорода
из хлоропласта играет аскорбат-пероксидаза.
Антиоксиданты — вещества, защищающие биологические системы от окисле-
окисления за счет взаимодействия со свободными радикалами. Наиболее типичными ан-
тиоксидантами являются соединения фенольного типа, способные эффективно вза-
взаимодействовать с активными свободными радикалами липидов с образованием ма-
малоактивных радикалов ингибитора. В различных природных мембранах это токо-
токоферолы и ряд гидрохинонов.
Другую группу антиоксидантов образуют соединения, эффективно взаимодей-
взаимодействующие с активными формами кислорода. Они резко снижают концентрацию
супероксидных радикалов в системе, катализируя реакцию дисмутации (суперок-
сиддисмутаза (СОД)), с образованием перекиси водорода и кислорода в триплетном
состоянии:
2OJ + 2H+ ^Н2О2+О2.
Константа скорости этой реакции B • 109 М~1с~1) очень велика.
\-у Антиокислительное действие в системах, где генерируется *О2, оказыва-
ют тушители синглетного кислорода. В этом отношении наиболее эффек-
эффективен C-каротин, скорость тушения которым 1О2 контролируется диффузи-
диффузией (к ~ 1010 М~1с~1). а-Токоферол также достаточно эффективно тушит 1О2
(к ~ 108 М~1с~1). Этот процесс преимущественно протекает по механизму фи-
физического тушения, в котором дезактивируется синглетное состояние кислорода.
Процесс химического тушения 1О% сопровождается окислением ингибитора и,
как правило, идет с меньшей скоростью (для токоферола к ~ 106 4- Ю7 М^с).
Суммарная константа физического и химического взаимодействия с 1О% для
гистидина, триптофана порядка C 4- 5) • 107 М^с. В фотосинтетических мем-
мембранах синглетный кислород образуется в реакции кислорода 3О2 с мономерными
молекулами хлорофилла или бактериохлорофилла Р (см. гл. XXVII, XXVIII),
находящимися в триплетном состоянии (см. рис. XVI.8):
В результате последующих реакций пигмент окисляется, а в системе возникает
хемилюминесценция (см. ниже):
за счет рекомбинации радикалов при разложении лабильных перекисей пигментов.
Защитные функции каротиноидов (см. гл. XXVII) осуществляются по механиз-
механизму физического тушения. ?
В целом, в адаптированных к аэробным условиям биологических системах ток-
токсическое действие активных форм кислорода в большей или меньшей степени бло-
блокировано ферментными системами, антиоксидантами и тушителями синглетного
68 Глава XVI. Конформационные свойства мембран
кислорода. Содержание супероксидных радикалов в клетках контролируется су-
пероксиддиомутазой, которая является основным фактором, приводящим к элими-
элиминированию супероксидного аниона.
Концентрация перекиси водорода в клетке контролируется каталазой, разлага-
разлагающей перекись без образования активных продуктов, и пероксидазами, использу-
использующими перекись водорода для окисления некоторых субстратов, например глута-
тиона в случае глутатионпероксидазы. Кроме того, глутатионпероксидаза может
восстанавливать перекиси липидов и, таким образом, предотвращать распад пере-
перекисей до радикальных продуктов и продолжения цепи (реакция 3 на схеме XVI.3.1
на с. 66). Важнейшую роль в удалении перекиси водорода в хлоропластах играет
аскорбат-пероксидаза.
Таким образом, аэробные организмы обладают многоуровневой защитой от
развития неуправляемых свободнорадикальных процессов. Однако в ряде случаев
эти средства защиты оказываются недостаточными, что и приводит к патологиче-
патологическим состояниям организма.
Хемилюминесценция. Хемилюминесценцией ХЛ называют свечение, генериру-
генерируемое в ходе химической реакции. В механизме ХЛ реакции выделяют две стадии:
химическую и физическую. На химической стадии возникают электронно-возбу-
электронно-возбужденные продукты. Вероятность их образования, равная отношению числа возбу-
возбужденных молекул к числу прореагировавших молекул, определяет квантовый выход
возбуждения Вв. На следующей физической стадии ХЛ происходит переход возбу-
возбужденной молекулы продукта из синглетного или триплетного состояния в основное
с испусканием кванта света. Вероятность испускания кванта света, т. е. отноше-
отношение числа излученных квантов к числу возбужденных молекул продукта, называют
квантовым выходом люминесценции Вл. Квантовые выходы возбуждения и люми-
люминесценции всегда меньше единицы.
Таким образом, интенсивность излучения в химической реакции пропорцио-
пропорциональна скорости химической реакции W и произведению квантовых выходов воз-
возбуждения и излучения продуктов реакции:
/хл = ВВВЛЖ (XVI.3.2)
На интенсивность световой реакции влияют физические тушители — вещества, ко-
которые перехватывают энергию возбужденного продукта и диссипируют ее в тепло.
Зависимость уровня ХЛ от концентрации тушителя передает уравнение
Штерна—Фольмера:
^ (XVL3-3)
где /о — интенсивность ХЛ в отсутствие тушителя, /т — под действием тушителя,
т — время жизни возбужденного состояния продукта реакции, [Г] — концентрация
тушителя и к — константа взаимодействия тушителя с возбужденным продуктом.
Добавление в реагирущую систему соединений, обладающих более высоким
квантовым выходом люминесценции (активаторов, А), чем излучающий продукт
ХЛ реакции, может усилить излучение системы. Происходит это потому, что с
продукта реакции энергия возбуждения может мигрировать на молекулу актива-
§ 3. Перекисное окисление липидов биомембран 69
тора:
Р* + А -* Р + А* + /iv,
где Р* и Р — молекула продукта в возбужденном и основном состояниях, А* и
А — молекула активатора в возбужденном и основном состояниях. Активатор не
должен участвовать в химическом процессе и влиять на скорость реакции, а только
изменять уровень свечения.
Спектр излучения ХЛ реакции обычно соответствует люминесцентным харак-
характеристикам конечного продукта реакции или вещества активатора. Спектр излуче-
излучения активатора сдвинут в более длинноволновую область по сравнению со спектром
излучения продукта. Возбужденная молекула излучает свет либо с синглетного
(флуоресценция), либо с триплетного (фосфоресценция) уровня. Коротковолновую
границу спектра ХЛ определяют следующим условием:
/iv ^ Еа + АН,
где /iv — величина коротковолнового кванта на границе спектра ХЛ, Еа — энергия
активация химической реакции, АН — изменение энтальпии.
Для излучения кванта света в видимой части спектра в единичном химическом
акте должна освобождаться энергия от 1,8 до 3,1 электрон-вольт D1-71 ккал/моль
или 171-298 кДж/моль). Наиболее экзотермичными реакциями являются рекомби-
рекомбинация свободных радикалов или ионных пар, а также перенос электрона от анион-
радикала на окислитель. Эти реакции могут сопровождаться ХЛ при соответству-
соответствующих условиях.
Другим темновым химическим процессом, в результате которого возникают
электронно-возбужденные продукты, является распад органических эндоперекисей.
Последние наиболее вероятно образуются в биологических системах при взаимодей-
взаимодействии различных субстратов с активированным кислородом. Образующиеся пере-
кисные соединения класса диокситанов при распаде дают электронно-возбужденное
состояние одного из карбонильных продуктов (кетонов):
= с-
1
= с-
0
1
О
= с = о
—>- 1 1
= с = о
Испускание кванта в акте перехода карбонильного соединения из возбужден-
возбужденного состояния в основное приводит к ХЛ.
Генерация синглетного возбужденного кислорода с последующим переходом его
в основное состояние также может дать начало ХЛ. Наибольшее значение имеет
переход из синглетного состояния 1Ag в основное с испусканием квантов инфра-
инфракрасного излучения X = 1270 нм с очень низким квантовым выходом. Время жизни
1А^-состояния в водных растворах не превышает нескольких микросекунд. Кроме
того возможно образование димерной формы возбужденного кислорода, которое
сопровождается изменением в видимой области спектра
О^ + О^ [О^О?] -* /iv (Х = 633,5 нм).
Хемилюминесценция синглетного кислорода может наблюдаться в химических си-
системах, где он активно генерируется. Так, в химической реакции взаимодействия
70 Глава XVI. Конформационные свойства мембран
гипохлорита Na с перекисью водорода в видимой области спектра излучают диме-
ры синглетного кислорода. Однако в целом такого типа реакции в биологических
системах вряд ли возможны, поскольку синглетно возбужденный кислород быстро
реагирует с различными ненасыщенными соединениями, а время жизни его в во-
воде соответственно всего около 2 мкс. Кроме того в клетках синглетный кислород
эффективно тушат каротиноиды, токоферолы и другие молекулы.
По-видимому, наблюдаемая в биологических системах ХЛ происходит с участи-
участием активированных молекул кислорода в основном в результате распада продуктов
окисления органических соединений, а не за счет непосредственного испускания
кванта синглетно возбужденным кислородом.
Как правило, спонтанная ХЛ животных и растительных тканей сопровождает
их нормальную жизнедеятельность. Это свечение обычно возрастает при стрессо-
стрессовых воздействиях, что указывает на активацию окислительных процессов в этих
условиях. Большой вклад в исследование природы свечения живых организмов вне-
внесла отечественная школа Б. Н. Тарусова.
Хемилюминесценция является одним из наиболее чувствительных методов об-
обнаружения и оценки уровня протекания реакций с участием форм активированного
кислорода в биологических системах. Часто для обнаружения и измерения кон-
концентрации активированного кислорода в исследуемую систему добавляют хемилю-
минесцентный индикатор—люминол или люцигенин. Эти соединения окисляются
формами активированного кислорода и при этом хемилюминесцируют с высоким
квантовым выходом.
VII
Транспорт веществ и биоэлектрогенез
XVII
Транспорт неэлектролитов
XVIII
Транспорт ионов. Ионные равновесия
XIX
Электродиффузионная теория
транспорта ионов через мембраны
XX
Ионный транспорт в каналах
XXI
Индуцированный ионный транспорт
XXII
Активный транспорт
XXIII
Транспорт ионов в возбудимых мембранах
Глава XVII
Транспорт неэлектролитов
§ 1. Диффузия
Прохождение многих незаряженных веществ через мембраны подчиняется законам
диффузии. Процесс диффузии был впервые количественно описан Фиком. Первый
закон Фика отражает тот простой факт, что поток вещества J в направлении оси х
пропорционален движущей силе, т. е. градиенту концентрации dc/dx:
J = -Ddc/dx, (XVII.1.1)
где D — коэффициент диффузии, см2 • с; размерность потока — моль • см~2с-1.
Уравнение диффузии (XVII.1.1) представляет собой частный случай более об-
общего электродиффузионного уравнения Нернста—Планка (см. § 1 гл. XIX) при усло-
условии, что транспортируемые частицы не заряжены. Из сопоставления (XVII.1.1)
и (XIX.1.2) видно, что D = RTu, где R — газовая постоянная, Г — абсолютная тем-
температура, U — подвижность вещества в рассматриваемой среде. В случае стацио-
стационарной диффузии через тонкие мембраны dc/dx = const. Если на краях мембраны
толщиной h поддерживаются постоянные концентрации (с[ и с'2), связанные с кон-
концентрациями в омывающих растворах (ci исг) соотношениями с[ = yci и с'2 = усг,
где у — коэффициент распределения, то поток равен
J = -D dc/dx = D(c2 - cifr/Л = р(с2 - ci). (XVII.1.2)
Здесь р = Dy/h = uRTy/h — проницаемость мембраны для данного вещества, см •
с; коэффициент у отражает липофильность вещества; и — подвижность вещества
в мембране.
В общем случае нестационарной диффузии концентрация вещества в любой
точке по оси х изменяется во времени. Рассмотрим подробнее одномерную диффу-
диффузию вещества в направлении оси х (рис. XVII.1). Представим элементарный объем
с площадью 5 = 1 см2 и толщиной dx. Предположим, что в точке х поток равен J, a
в точке (х + dx) поток равен J + (dJ/dx)dx, где dJ/dx — градиент потока в напра-
направлении оси х. Количество вещества, накапливающегося в рассматриваемом объеме
за единицу времени, равно —{dJ/dx)dx. Количество вещества, накапливающегося
в элементарном объеме, можно выразить как результат изменения концентрации
во времени dc/dt, умноженной на объем V = S dx. Приравнивая эти два разных
выражения, описывающие накопление вещества в объеме, получаем так называемое
уравнение непрерывности
-dJ/дх = dc/dt. (XVII. 1.3)
1. Диффузия
73
Подставляя (XVII.1.1) в (XVII.1.3), получаем выражение для второго закона Фика:
дс/dt = Dd2c/dx2. (XVII. 1.4)
Уравнение (XVII.1.4) описывает изменение концентрации растворенного вещества
в зависимости от координаты х и времени. Методом подстановки можно убедиться
в том, что решение дифференциального уравнения (XVII.1.4) имеет вид
с =
2(%Dt)
1/2
exp(-x2/4Dt).
(XVII.1.5)
В этом уравнении Cq — общее количество вещества, нанесенного в начальный мо-
момент времени t = 0 в точке х = 0, а с — концентрация в точке х в любой момент
J+(dJ/dx)dx
х' х' + dx
Рис. XVII.1.
Градиент потока J в случае од-
одномерной диффузии через эле-
элементарный объем с площадью S
и толщиной dx
х=0 хх х х=0
Рис. XVII.2.
Профили концентрации диффундирующе-
диффундирующего вещества для двух моментов времени t
времени t. Профили концентрации вещества по координате х для двух различных
моментов времени, описываемые уравнением (XVII.1.5), приведены на рис. XVII.2.
Для выпуклых участков кривой д2с/дх2 < 0 и, по уравнению (XVII.1.4), дс/dt < О,
т. е. концентрация вещества уменьшается во времени. На удаленных от центра
участках кривой д2с/дх2 > 0. Следовательно, дс/dt > 0, т. е. концентрация вещества
в этих участках во времени повышается. Полученный результат отражает извест-
известный факт, что диффузия всегда направлена на выравнивание концентрационных
градиентов.
Профиль концентрации, достигаемый к моменту времени t (см. рис. XVII. 2),
характеризуется параметром х. Концентрация вещества на расстоянии х умень-
уменьшается в е раз по сравнению с концентрацией в начальной точке, если показатель
экспоненты в уравнении (XVII.1.5) равен единице: х2/4Dt = 1.
¦\У Следовательно,
x2 = ADt.
(XVII. 1.6)
74 Глава XVII. Транспорт неэлектролитов
Формула (XVII. 1.6) характеризует важное свойство процесса диффузии: время,
необходимое для диффузии, увеличивается пропорционально квадрату расстояния.
?
Коэффициент диффузии определяется размером и формой молекул. Для малых
молекул в воде D ~ 10~5 см2 • с. Для сферических частиц, диффундирующих в
жидкости, применимо уравнение Стокса—Эйнштейна, связывающее коэффициент
диффузии с радиусом частиц г и вязкостью среды т):
D = —. (XVII.1.7)
671ГГ)
Предполагая, что молекулярная масса вещества М пропорциональна объему сфери-
ческих молекул (М ~ |ттх3), при постоянных т) и Г получаем соотношение
DM1/3 = const или lg D + \ lg M = const. (XVII. 1.8)
о
Графически зависимость (XVII.1.8) между lgD и lgM изображается прямой с угло-
угловым коэффициентом коэффициентом —0,33, что было получено в случае диффузии в
воде крупных белковых молекул, обладающих почти сферической формой (молеку-
(молекулы рибоонуклеазы). Для малых молекул, от водорода до трисахаридов, эксперимент
дает более крутую прямую
DM1/2 = const. (XVII.1.9)
Это отклонение обусловлено тем, что молекулы малых размеров нельзя рассма-
рассматривать как сферические. Кроме того, уравнение (XVII.1.7) относится к частицам,
диффундирующим в идеальной гомогенной жидкости. Для малых молекул, сравни-
сравнимых по размерам с молекулами воды, это условие, очевидно, не соблюдается.
^—р Многочисленные исследования диффузии веществ через биологические мем-
браны выявили корреляцию между проникающей способностью веществ и их
растворимостью в липидах. В связи с этим долгое время полагали, что молекулы
проникают через липидную часть мембраны благодаря своей способности раство-
растворяться в липидах. Однако малые гидрофильные молекулы могут проникать через
поры в мембране (см. § 1 гл. XVI).
Для проникновения неэлектролитов из воды в гидрофобную часть мембраны
или узкую мембранную пору необходима частичная или полная дегидратация мо-
молекул, т. е. затраты энергии на преодоление взаимодействий полярных групп моле-
молекулы (—СООН, —ОН, —NH2) с диполями воды. Например, значения энергии акти-
активации, полученные для проникновения этиленгликоля, глицерина и эритрита через
искусственные фосфолипидные мембраны, а также через мембраны изолированных
клеток, близки к значениям энергии дегидратации этих соединений. Необходимость
дегидратации молекул является причиной сильной температурной зависимости ко-
коэффициента проницаемости мембран для ряда неэлектролитов. Хотя через биоло-
биологические мембраны диффундируют самые разные соединения, в то же время даже
сравнительно небольшие молекулы аминокислот и моносахаридов практически не
проникают через мембраны большинства клеток за счет простой диффузии. ?
§ 2. Облегченная диффузия 75
§ 2. Облегченная диффузия
Пассивный транспорт веществ при участии переносчиков характеризуется некото-
некоторыми чертами, отличающими его от простой диффузии.
1. Высокая специфичность, которая связана со способностью переносчиков раз-
различать близкие по структуре соединения (например, L- и D-изомеры Сахаров и
аминокислот).
2. С ростом концентрации субстраста скорость транспорта увеличивается толь-
только до некоторой предельной величины (насыщение).
3. Наблюдается чувствительность к низким концентрациям ингибиторов, вза-
взаимодействующих с переносчиками.
Механизм транспорта с участием переносчика можно представить в виде сле-
следующей кинетической схемы:
*CSi
kiS,
где С и S — молекулы переносчика и субстрата.
Обозначим: с0 и с; — концентрации переносчиков в свободном состоянии на
наружной и внутренней сторонах мембраны, a cs0 и csi — переносчики, связанные с
субстратом; s0 и Sj —концентрации субстрата в наружном и внутреннем растворах
соответственно, a ki~kg —константы скоростей отдельных стадий. Выражение для
скорости потока субстрата можно получить, решая систему уравнений, описываю-
описывающих стационарное состояние, при dco/dt = d[csi]/dt = dco/dt = 0. Отсюда следует,
что поток субстрата J равен
J = k\coso — fecso = k^cs0 — k^csi = k^csi — k^CiSi = ктс^ — к$с0. (XVII.2.1)
Поскольку суммарная концентрация переносчика Ct неизменна, можно записать
ct = c0+ cs0 +Ci + csi. (XVII.2.2)
Решение приведенной системы уравнений (XVII.2.1); (XVII.2.2) в общем виде
включает различные комбинации констант от к\ до к$, а также концентрации
субстрата по обеим сторонам мембраны s0 и s,. Начальная скорость перено-
переноса вещества, когда s, = 0, описывается выражением, аналогичным уравнению
Михаэлиса—Ментен
J= lmaxSo . (XVII.2.3)
При очень низкой концентрации субстрата s0 уравнение (XVII.2.3) сводится к
формуле для случая простой диффузии (линейная зависимость от концентрации s0).
Константа Кт численно равна концентрации субстрата, при которой J = Jmax/2,
и является важным параметром, характеризующим скорость всего процесса.
В реальной системе общий поток через мембрану всегда включает компонент,
76
Глава XVII. Транспорт неэлектролитов
Рис. XVII.3.
Зависимость начальной скоро-
скорости J поступления вещества
внутрь клеток от концентра-
концентрации в наружной среде So'-
1 — транспорт с участием перенос-
переносчика, 2 — простая диффузия, 3 —
суммарная скорость переноса
обусловленный простой диффузией (рис. XVII.3).
Специфические ингибиторы транспортных
систем имеют структурное сходство с транс-
транспортируемыми молекулами. Например, флорид-
зин конкурентно ингибирует транспорт глюкозы
в некоторые клетки, не проникая при этом через
клеточную мембрану. В роли конкурентных инги-
ингибиторов транспорта Сахаров, например D-глюко-
зы, могут выступать близкие по структуре саха-
сахара, например D-галактоза, способные транспор-
транспортироваться через мембрану.
Существуют переносчики, обладающие дву-
двумя центрами связывания субстрата. В этом слу-
случае транспорт одного вещества через мембра-
мембрану часто зависит от присутствия другого веще-
вещества. Примером такой системы транспорта слу-
служит совместный перенос в одном направлении
(симпорт) некоторых аминокислот и Na+ в эри-
эритроцитах и в эпителиальных клетках кишечника.
^—р Движущей силой, транспорта с участием переносчика является градиент хи-
мического или электрохимического потенциала вещества. Функционирование
систем с облегченной диффузией, так же как и простой диффузии, направлено на
выравнивание градиентов и установление равновесия в системе. Однако градиенты
вещества могут поддерживаться длительное время за счет того, что проникающие
молекулы потребляются или образуются в ходе биохимических реакций по одну из
сторон мембраны. ?
Ткани животных обладают системами облегченной диффузии для ряда метабо-
метаболитов, которые они получает из плазмы крови, например для Сахаров, аминокислот,
пуринов и глицерина.
Некоторые транспортные процессы, имеющие решающее значение для орга-
организма, протекают не только при участии переносчиков, но и с затратами энер-
энергии метаболизма, поддерживающими градиенты. Это позволяет транспортировать
вещества против градиентов концентрации или электрохимического потенциала.
Такие процессы называют активным транспортом (см. § 3, гл. V). Основное отличие
активного транспорта от облегченной диффузии заключается в том, что одна из
стадий активного транспорта является энергозависимой. Когда для переноса ве-
вещества используется энергия АТФ или окислительно-восстановительных реакций,
транспорт называют первично-активным. Если же в качестве источника энергии
используется градиент концентрации ионов, то транспорт называют вторично-ак-
вторично-активным. В отличие от предыдущего вида транспорта энергозависимая стадия этого
процесса представляет собой антипорт или симпорт веществ с ионами. Более по-
подробно системы активного транспорта рассмотрены в гл. XXVI.
Глава XVIII
Транспорт ионов. Ионные равновесия
^—р Существует несколько возможных механизмов прохождения ионов через мем-
брану: 1) растворение иона в липидной фазе мембраны, диффузия и последую-
последующий переход из мембраны в раствор; 2) движение по ионным каналам, являющим-
являющимся структурными компонентами мембран; 3) транспорт с участием переносчиков.
Эти механизмы переноса установлены как для биологических мембран, так и для
бислойных липидных мембран. Отдельную категорию составляет транспорт через
мембранные барьеры клетки по механизму пиноцитоза. П
Скорость проникновения ионов через мембрану определяется такими ее свой-
свойствами, как толщина, значение диэлектрической проницаемости, наличие фиксиро-
фиксированных электрических зарядов на ее поверхности, знак и плотность расположения
этих фиксированных зарядов на мембране, размеры и число пор в мембране, на-
наличие фиксированных зарядов в порах, и некоторыми другими. В данном разделе
рассмотрены движущие силы пассивного транспорта ионов и ионные равновесия в
мембранных системах.
§ 1. Электрохимический потенциал
Движущей силой диффузии служит разность химических потенциалов данного ве-
вещества в двух областях, между которыми происходит диффузия. Химический по-
потенциал растворенного вещества [i для условий, при которых вкладом гидростати-
гидростатического давления можно пренебречь, равен [см. (V.2.13)]
где [io — стандартный химический потенциал, зависящий от природы растворителя,
а с — концентрация. При больших значениях концентраций с в (XVIII.1.1) заме-
заменяется активностью. Для ионов, движение которых зависит не только от концен-
концентрации, но и от электрического потенциала, соответствующим понятием является
электрохимический потенциал [см. (V.3.12)]. Электрохимический потенциал у. иона
типа г для условий, при которых активность иона равна его концентрации, а вклад
гидростатического давления пренебрежимо мал, равен
\х = цо + RT'In с + zF(f, (XVIII.1.2)
где ер — электрический потенциал; z — валентность; Г — абсолютная температу-
температура, К; R — газовая постоянная, равная примерно 8,31 Дж • моль • К;
78 Глава XVIII. Транспорт ионов. Ионные равновесия
F— число Фарадея (~ 9,65 • 104 Кл/моль). Электрохимический потенциал — мера
работы, необходимой для переноса 1 моля A грамм-эквивалент) ионов из раствора
с данной концентрацией и данным электрическим потенциалом в бесконечно
удаленную точку в вакууме. Эта работа складывается из затрат на преодоление
сил химического взаимодействия Цо + ЙГ1пс и работы по переносу зарядов в
электрическом поле zF(p. Иногда работу по переносу ионов относят не к грамм-
эквиваленту, а к одному иону. В этом случае в правую часть уравнения (XVIII.1.2)
вместо констант R и F, относящихся к 1 молю ионов, входят постоянная Больцмана
(А;Б ~ 1,38 • 103 Дж • К) и заряд электрона (е и 1,6 • КГ19 Кл)
\х = \хо + къТ\пс + гец. (XVIII. 1.3)
Независимо от выбора определений (XVIII. 1.2) или (XVIII. 1.3) формулы, описыва-
описывающие распределение потенциала и концентраций в равновесных и неравновесных
системах, получаются эквивалентными, так как отношения RT/F и квТ/е равны и
составляют при температуре 20° С примерно 25 мВ.
Пассивное движение ионов происходит из области с высоким электрохимиче-
электрохимическим потенциалом в область с более низким электрохимическим потенциалом. Дви-
Движущей силой переноса ионов является градиент электрохимического потенциала
d\x/dx.
§ 2. Гидратация ионов
Взаимодействие иона с молекулами растворителя определяет значение стандартно-
стандартного химического потенциала \1q. В воде гидратация ионов приводит к изменению
их эффективного радиуса. Радиус гидратированных ионов обычно оценивают с
помощью соотношения Стокса—Эйнштейна [см. (XVII.1.7)]:
г = |^. (XVIII.2.1)
При температуре 25° С радиус в нанометрах равен 0,245 • 10~5/D, где D выражается
в см2 • с. Рассчитанный таким способом радиус Na+ равен 0,184 нм. Это значе-
значение в два раза больше ван-дер-ваальсова радиуса (см. § 1 гл. VIII), измеренного по
дифракции рентгеновских лучей на кристаллах, и вызвано наличием вокруг иона
молекул воды.
Применение соотношения (XVIII.2.1) к частицам атомных размеров ограниче-
ограничено, поскольку при размере диффундирующих частиц, близком к размеру воды, сре-
среду нельзя рассматривать как гомогенную. Кроме того, диффундирующая частица
влияет на локальную структуру воды, в результате чего эффективная локальная
вязкость может отличаться от макроскопической вязкости.
Зависимость от радиуса коэффициентов диффузии различных неэлектролитов
(Нг, О3, He, Ne, Ar, H2S), мало изменяющих структуру воды, согласуется с уравне-
уравнением Стокса—Эйнштейна. В соответствии с теорией малые частицы оказываются
подвижнее больших. Однако зависимость подвижности ионов в воде от радиуса мак-
максимальна при 0,15 нм для одновалентных катионов и при 0,2 нм для одновалентных
анионов (рис. XVIII. 1).
2. Гидратация ионов
79
Все ионы щелочных металлов располагаются слева от максимума. Это отража-
отражает известную аномалию — ионы металлов с большим порядковым номером диффун-
диффундируют быстрее, чем ионы с меньшим порядковым номером. Обратную пропорци-
пропорциональность между радиусом иона и трением при диффузии можно объяснить, не
привлекая представления об увеличении радиуса при гидратации малых ионов.
">2 "
Радиус, нм
ТЭА
0,4
Рис. XVIII.1.
Зависимость коэффициентов свободной
диффузиии D одновалентных катионов и
анионов от кристаллографического ради-
уса иона A, 2); кривая 3 изображает те-
оретическую зависимость, описываемую
уравнением Стокса—Эйнштейна:
МА — метиламмоний, ДМА — диметиламмоний,
ТМА — триметиламмоний, ТЭА — тетраэтилам-
монии
Согласно современной теории, на движущийся ион действует не только ги-
гидродинамическая сила трения, пропорциональная радиусу, но и так называемая
диэлектрическая сила трения. Гидродинамическая сила трения F, действующая
на сферические частицы, движущиеся в жидкости со скоростью v, описывается
законом Стокса:
F = бщгь. (XVIII.2.2)
Эта сила пропорциональна радиусу частицы и не зависит от заряда. В отличие от
нее диэлектрическая сила трения пропорциональна квадрату заряда и обратно про-
норциональна кубу ионного радиуса. Результирующая этих двух сил имеет минимум
при радиусе порядка 0,2 нм. Наличие диэлектрической силы трения объясняет и
малую подвижность многовалентных ионов.
^—р Происхождение диэлектрического трения можно представить, рассмотрев од-
нородный диэлектрик, обтекающий заряженную сферу. Диэлектрик поляризу-
поляризуется при приближении к заряду и теряет поляризацию при удалений от него. Если
бы изменение поляризаций происходило так же быстро, как изменение электриче-
электрического поля при приближении или удалении заряда, то поляризация была бы сфери-
сферически симметричной н не создавала суммарной силы, действующей на ион. Однако
в реальных диэлектриках одна из составляющих вектора поляризации релаксирует
достаточно медленно (для воды время релаксации ~ 101 с). Из-за этого запаз-
запаздывания поляризация среды, приближающейся к заряженной сфере, оказывается
меньше, чем поляризация удаляющейся среды, где поляризация уже завершилась.
Поляризация не является сферически симметричной, и движение иона тормозится
тем больше, чем быстрее он движется. ?
Энергия гидратации щелочных ионов Cs, К, Na лежит в пределах от —280
до —400 кДж/моль, т. е. приближается к энергии СН-связи в углеводородах. По срав-
сравнению с энергией тепловых колебаний (RT ~ 2,5 кДж/моль) энергия гидратации
80 Глава XVIII. Транспорт ионов. Ионные равновесия
громадна. Поэтому дегидратация любого иона щелочных металлов является энерге-
энергетически невыгодной. Энергия гидратации равна энергии поляризации диэлектрика
сильным локальным полем иона. Чем выше значение диэлектрической проницаемо-
проницаемости среды, тем сильнее поляризация и более стабилен ион.
Согласно электростатической теории Борна, энергия иона радиусом г в среде
с диэлектрической проницаемостью е определяется формулой
2 2
W = -^—, (XVIII.2.3)
8iireeo
где So — абсолютная диэлектрическая проницаемость вакуума, равная примерно
8,85 • 10~12 Ф/м. Формула (XVIII.2.3) для энергии электрического поля иона по-
получена путем интегрирования по объему так называемого максвеллова напряжения
W = I ^j-E2dV. (XVIII.2.4)
Напряженность поля на произвольном расстоянии R от центрального иона с заря-
зарядом Ze численно равна силе, действующей на единичный заряд:
Е=~е = тАл- (XVIII.2.5)
При интегрировании рассматривают объем тонкого сферического слоя диэлек-
диэлектрической среды радиусом R и толщиной dR: dV = 4nR2dR. При подстановке
в (XVIII.2.4) выражений для Е2 и dV и последующем интегрировании в пределах
от R = г до R = оо получают (XVIII.2.3).
Изменение свободной энергии при переходе иона из воды в мембрану можно
приближенно оценить по формуле
AW = ^— (—-—), (XVIII.2.6)
8теог \е2 ei/
где Si и ?2 — относительные диэлектрические проницаемости воды и неполярного
растворителя (si и 80, a s2 « 2-3).
В расчете на 1 моль ионов изменение свободной энергии составит
AW =
Z2e2N
(—-—), (XVIII.2.7)
\е2 ei/
где N — число Авогадро.
Рассчитанные по теории значения свободной энергии для перехода ионов Cs,
К и Na из вакуума в воду составляют примерно —412, —517 и —727 кДж/моль
соответственно, что превышает экспериментальные значения. Электрические поля
вблизи ионов настолько велики A0е—107 В/см), что ближайшие к иону молекулы
воды ориентированы практически полностью. Такое состояние называют диэлек-
диэлектрическим насыщением. Упорядоченность воды в гидратной оболочке является бо-
более полной вблизи меньших по размеру ионов, которые создают наиболее интен-
интенсивные локальные электрические поля. Как только упорядоченность становится
§ 3. Ионное равновесие на границе раздела фаз 81
полной, дальнейшая поляризация делается невозможной. Это эквивалентно пониже-
понижению эффективной диэлектрической проницаемости, и общая энергия поляризации
в реальных системах оказывается меньше, чем в случае идеально поляризуемого
диэлектрика.
§ 3. Ионное равновесие на границе раздела фаз
Ионное равновесие между двумя водными растворами, разделенными мембраной,
описывается наиболее просто. В случае равновесия по ионам одного типа электро-
электрохимические потенциалы иона в обоих растворах одинаковы:
? = RT\nc2
откуда [см. (V.3.13)]
Уравнение Нернста (XVIII.3.1) показывает, что в условиях электрохимиче-
электрохимического равновесия разность потенциалов на мембране определяется соотношением
концентраций данного иона в двух соприкасающихся растворах. После перехода
в (XVIII.3.1) к десятичным логарифмам и подстановке 2,3RT/F и 58 мВ (при
температуре 20° С) уравнение Нернста для одновалентных ионов принимает вид:
Аср = 58 lg(ci/c2). (XVIII.3.2)
В биологических системах распределение К+ между цитоплазмой животных клеток
и средой достаточно хорошо соответствует уравнению Нернста. Однако распреде-
распределение Na+ в большинстве клеток резко отличается от равновесного.
Рассмотрим ионное равновесие на границе вода-неполярный растворитель. Та-
Такая система может рассматриваться как модель границы раздела вода-липидная
мембрана с диэлектрической проницаемостью 2-3.
Представим систему из двух несмешивающихся жидкостей, например масло-
вода, в которой растворен электролит А+В~. Вследствие неодинаковой липофиль-
ности ионов А+ и В~ между объемами фаз возникает так называемая межфазная
разность потенциалов.
На рис. XVIII. 2 схематично показаны профили равновесного распределения
концентраций А+ и В~ и профиль электрического потенциала вблизи поверхности
раздела двух фаз с различными диэлектрическими проницаемостями (si > ?2) для
случая, когда растворимость анионов в неполярной среде выше, чем растворимость
катионов. Плоскость х = 0 соответствует границе раздела фаз, слева от которой
находится среда с диэлектрической постоянной Si, а справа — с диэлектрической
постоянной S2- Если анионы обладают большей липофильностью, то общее их со-
содержание в органической фазе несколько превышает содержание катионов, вслед-
вследствие чего неполярная органическая фаза несет избыточный отрицательный заряд
и имеет более низкий потенциал, чем водная фаза. Избыток ионов одного знака
в каждой из соприкасающихся фаз настолько мал, что не может быть обнару-
обнаружен современными аналитическими методами. В областях, далёких от поверхности
82
Глава XVIII. Транспорт ионов. Ионные равновесия
Рис. XVIII.2.
Профили распределения потенциала и концен-
концентрации ионов (А+ и В~) на границе раздела фаз
(I и Я):
I— водный раствор (si = 80), II— масло (ег = 2 -f- 3);
а — распределение потенциала (ф), б — распределение
концентраций (с) катионов и анионов; ci, сг —концен-
—концентрации электролитов в объеме фаз I и Л; графики от-
относятся к случаю, когда анионы лучше растворимы в
неполярной фазе, чем катионы
раздела, концентрации катионов и анионов одинаковы, т. е. соблюдается условие
электронейтральности объемов фаз сд = Св- Электрический потенциал в объеме
фаз постоянен и принимает значения (pi и ср2 в водной фазе и органическом рас-
растворителе соответственно. Концентрация ионов в фазе с низкой диэлектрической
проницаемостью c<i ниже, чем концентрация в водной фазе с\, поскольку переход
заряженных частиц из фазы с высоким е в фазу с низким значением диэлектриче-
диэлектрической проницаемости связан с повышением электростатической энергии заряженной
частицы.
Вблизи поверхности раздела, справа и слева от границы, расположены диф-
диффузные слои (см. рис. XVIII.2), в каждом из которых концентрации катионов и
анионов неодинаковы. Условие электронейтральности для этих областей не выпол-
выполняется: в одной из фаз содержится небольшой избыток отрицательных зарядов, а
в другой — положительных. В этой области потенциал не постоянен, а зависит от
пространственной координаты х. Таким образом, потенциал на границе раздела
двух фаз меняется не скачком, а постепенно на некотором расстоянии от границы.
^—р Формулы, описывающие разность электрических потенциалов и распределение
концентраций между объемами фаз, могут быть получены из условия электро-
электрохимического равновесия в системе. При равновесии электрохимический потенциал
для каждого из ионов одинаков в любой точке системы (не зависит от координа-
^ г> -A) -B) -A) -B)
ты х). В связи с этим fiA' = [^д и № = № > т- е-
RT In <? + Fcp! =
RT In cf - F9l =
+ RT In 4 + F<?2 (z = +1),
+ RT In (f - Fcp2 (z =-1),
(XVIII.3.3)
где индексы 1 и 2 относятся к первой и второй фазе, а индексы А и В — к катио-
катиону А+ и аниону В~. ?
3. Ионное равновесие на границе раздела фаз 83
Уравнения (XVIII.3.3) после перегруппировки имеют вид
-FAcp = -Ацов + RT^f
FAcp = -Ацоа + ЯГ1п(сА/сА),
(XVIII.3.4)
где Аср = (pi — ср2; A[ioA = ^оа ~~ f-'oA • В объеме фаз концентрации катионов и анионов
одинаковы: с* = cf = С\ и сА = df = с2. Решая уравнения относительно c2/ci или
Аф, получаем формулы, отражающие зависимости разности потенциалов между
объемами фаз и распределения ионов между объемами фаз от стандартных хими-
химических потенциалов ионов А+ и В~ в водной и органической средах:
(XVIII.3.5)
Соотношения (XV111.3.5) становятся более наглядными, если выразить разность
стандартных химических потенциалов для каждого иона Afio через межфазный
коэффициент распределения \, который, по определению, равен отношению концен-
концентраций иона в соприкасающихся фазах у самой границы раздела:
Y = 42)/41). (XVIII.3.6)
В этой формуле с0 и с0 обозначают концентрации иона у самой границы раздела
(плоскость х = 0) слева и справа от границы соответственно.
Для того чтобы выразить Afio через коэффициенты распределения, запишем
условие равновесия для границы раздела фаз:
« + RT In с« = $1 + RT In c$. (XVIII.3.7)
Члены ^ф в левой и правой частях этого уравнения отсутствуют, поскольку элек-
трический потенциал на границе фаз непрерывен и значения (р0 и срц вблизи
плоскости х = 0 одинаковы. Учитывая, что Cq /% = \, получим из (XVIII.3.7)
^ ^ (XVIII.3.8)
Возвращаясь к уравнениям (XVIII.3.5), можно выразить межфазную разность по-
потенциалов и соотношение концентраций электролита в двух фазах в виде:
In(c2/ci) =-Aпул+Ьув) или c2/ci = л/улУв] (XVIII.3.9)
Аф = ^1п(ув/1пул). (XVIII.3.10)
\—? Как следует из уравнения (XVIII.3.10), межфазный скачок потенциала возника-
ет только в том случае, когда коэффициенты распределения катионов и анионов
различны. При одинаковых коэффициентах межфазная разность потенциалов равна
нулю. ?
Коэффициент распределения иона можно в первом приближении оценить из
уравнения (XVIII.3.8), показывающего, что коэффициент связан экспоненциальной
84
Глава XVIII. Транспорт ионов. Ионные равновесия
зависимостью с работой по переносу иона из водной фазы 1 в неполярную фазу 2.
Эта работа равна энергии дегидратации иона и может быть оценена по формуле
Борна [см. (XVIII.2.3)]. Если принять, что радиус иона равен 0,2 нм, а диэлек-
диэлектрическая постоянная мембраны s = 3, то коэффициент распределения окажется
равным 10 ~20. В таком случае проводимость бислойных липидных мембран была
бы существенно ниже реально измеряемых значений (~ 10~8 Ом • см~2 для немоди-
фицированных мембран).
Рис. XVIII.3.
Профили свободной энергии иона на
границе несмешивающих жидкостей и
в мембранах:
I — без учета краевых эффектов; II — на
малых расстояниях вблизи границы разде-
раздела; III — в тонкой незаряженной мембране;
IV — в мембране с фиксированными заряда-
зарядаw =
E2dV,
где W — энергия иона, Е — напряженность
поля, dV — элементарный объем, s — диэлек-
диэлектрическая проницаемость среды, so — абсо-
абсолютная диэлектрическая проницаемость ва-
вакуума, ) радиус иона.
Расхождение расчетных и экспериментальных значений мембранной проводи-
проводимости указывает, что энергия ионов в тонких липидных и биологических мембранах
должна быть несколько ниже, чем следует из формулы Борна. Такое понижение
электростатической энергии иона в мембране может быть обусловлено рядом при-
причин. Прежде всего электростатическая энергия иона при переходе его из водной
фазы в органический растворитель меняется не скачком, а постепенно на неко-
некотором расстоянии справа и слева от границы раздела (рис. XVIII.3). Расчеты по
приведенной в подписи к рис. XVIII.3 формуле показывают, что основное изменение
свободной энергии иона по координате х происходит на расстоянии порядка ион-
ионного радиуса от границы раздела. В связи с этим энергия иона в тонкой мембране,
сравнимой по толщине с размерами ионов, несколько ниже, чем энергия иона в
сплошной среде (рис. XVIII.3, III), т.е. энергетический барьер для прохождения
ионов через мембрану понижен. Однако для клеточных и бислойных липидных
мембран, имеющих толщину 7,0-10,0 нм, понижение энергетического барьера (AW,
см. рис. XVIII.3, III) составляет не более 5% и такой небольшой сдвиг можно не
учитывать при оценке коэффициентов распределения.
Существенное снижение энергии иона в мембране может быть обусловлено дру-
другими факторами: 1. Ионы могут образовывать ионные пары внутри мембраны;
2. Мембрана может содержать поры с высокой диэлектрической постоянной, проход
через которые требует более низкой энергии активации, чем переход иона из рас-
раствора в липид; 3. Ион может быть «завернут» в нейтральную молекулу «переносчика»
§ 4. Профили потенциала и концентраций у границы раздела фаз 85
с высокой поляризуемостью, которая сольватирует его (увеличивает эффективный
радиус г), чем способствует растворению его в мембране.
Следует отметить приближенный характер оценок коэффициентов распределе-
распределения по формуле Борна. Такие оценки неприменимы в отношении жирорастворимых
ионов, высокое сродство которых к липидной фазе обусловлено спецификой их хими-
химической структуры. Кроме того, при использовании формулы Борна не учитывается
наличие на поверхности мембран заряженных групп полярных головок фосфолипи-
дов (см. § 1 гл. XV). Наличие фиксированных отрицательных зарядов способствует
адсорбции катионов и существенно сказывается на концентрации ионов в мембране.
Взаимодействие ионов с фиксированными зарядами мембраны приводит также
к изменению профиля энергии иона в мембране. Для гомогенной незаряженной мем-
мембраны (см. рис. XVIII.3, III) существует один барьер, величина которого отражает
работу по переносу заряженной частицы внутрь слоя с низкой диэлектрической
проницаемостью. Для фосфолипидных мембран, имеющих на поверхностях фикси-
фиксированные заряды, в энергетическом профиле возникают дополнительные барьеры
на краях мембраны, соответствующие энергии активации адсорбции-десорбции ио-
иона в участках с фиксированными зарядами (см. рис. XVIII.3, IV).
§ 4. Профили потенциала и концентрации у границы раздела фаз
Уравнения (XVIII.3.9) и (XVIII.3.10) относятся к скачку потенциала и соотношению
концентраций между объемами фаз. Распределение концентраций ионов в двойном
слое вблизи границы раздела определяется статистическим уравнением Больцмана,
которое может быть получено из условия равенства электрохимического потенци-
потенциала в любой точке по оси х (см. рис. XVIII.2). Для произвольно взятой плоскости х
в фазе 1 имеем (полагая \хх = yto)'-
RT In сх + zF(fx = RT In со + zFq0,
где cx, (fx—концентрация иона и электрический потенциал на расстоянии х; Со,
фо — концентрация и потенциал в объеме фазы 1; Отсюда следует, что
сх = со exp(-zFy/RT), (XVIII.4.1)
где ер = фж — фо—потенциал в плоскости х, отсчитанный от уровня потенциала
в объеме раствора. Уравнение (XVIII.4.1) показывает, что по мере приближения к
отрицательно заряженной фазе (см. рис. XVIII.2) локальная концентрация катионов
возрастает, а локальная концентрация анионов снижается. Десятикратное изме-
изменение концентрации одновалентного иона достигается на участке, где потенциал
изменяется на 58 мВ.
^—р Возникновение межфазной разности потенциалов, определяемой уравнени-
ем (XVIII.3.10), связано с разделением зарядов в окрестностях границы
раздела и с образованием двойного электрического слоя. Вопрос о характере
распределения электрического потенциала в двойном слое, в частности вблизи
границы раздела вода-неполярный растворитель, решается на основании одного из
основных уравнений электростатики — уравнения Пуассона. Для рассматриваемого
одномерного случая (одна пространственная координата — х) это уравнение имеет
86 Глава XVIII. Транспорт ионов. Ионные равновесия
вид
^В = _?(?), (XVIII.4.2)
dx2 ее0 у '
где р(х) —плотность электрических зарядов в плоскости х:
cx, (XVIII.4.3)
е — абсолютная диэлектрическая постоянная, принимающая значения Si при х < О
и ?2 при х > 0. Уравнение Пуассона связывает вторую производную потенциала в
плоскости х с плотностью зарядов в этой плоскости. Если концентрацию электроли-
электролита в объеме фазы принять равной с, то, учитывая уравнение Больцмана (XVIII.4.1),
плотность зарядов может быть записана в виде
р = zF(cA+ -cB-)=zFc (ехр =g* - exp ^) , (XVIII.4.4)
где ф = ф(ж) — ф(оо) — потенциал в плоскости х относительно потенциала в объеме
фазы ф(оо), a z = z+ = —Z-. Для случая, когда значение потенциала на границе
раздела ф@) относительно потенциала в объеме фазы невелико, экспоненциальные
члены в уравнении (XVIII.4.4) могут быть разложены в ряд. ?
После введения подобных упрощений уравнение Пуассона—Больцмана прини-
принимает вид
^|=х2ф, (XVIII.4.5)
ах
где
х2 = gg. (XVIII.4.6)
Решение уравнения (XVIII.4.5) имеет вид (приближение Дебая, или модель Гуи)
Ф = фОехр(-х|а;|), (XVIII.4.7)
где фо и ф — значения электрического потенциала на границе раздела и в плос-
плоскости х, измеряемые относительно потенциала в объеме фазы: |ж|—абсолютное
значение координаты х. Уравнение (XVIII.4.7) показывает, что электрический по-
потенциал изменяется экспоненциально с изменением расстояния от границы раздела
(рис. XVIII.4). Двойной электрический слой распространяется в глубь обеих фаз,
по обе стороны от поверхности раздела. Крутизна изменения потенциала в зависи-
зависимости от расстояния определяется величиной х, которая зависит от концентрации
ионов в данной фазе и диэлектрической проницаемости. Величина х принимает
значение Xi и Х2 для фаз 1 и 2 соответственно. Основное изменение потенциала
вблизи границы раздела происходит на расстоянии, равном 1/х. Величина X = 1/х
характеризует толщину каждой обкладки диффузного двойного слоя и называется
длиной экранирования или дебаевской длиной.
i 4. Профили потенциала и концентраций у границы раздела фаз
87
Из формулы (XVIII.4.7) видно, что при х = 1/х потенциал ср принимает значе-
значение (ро/е, т. е. примерно на 63% меньше, чем разность потенциалов между границей
раздела и объемом фазы. Области с длиной Xi и Хг справа и слева от поверхности
раздела несут избыток ионов разного знака.
Длина экранирования существенно зависит от концентрации электролита в
данной фазе:
1/2
\2cz2F2J
(XVIII.4.8)
\—? В разбавленных водных растворах длина экранирования, т. е. область диффуз-
ного двойного слоя, достигает десятков нанометров, а в концентрированных
растворах — десятых долей нанометра. В присутствии в растворе двухвалентных
ионов двойной электрический слой становится более плотным, т. е. длина экраниро-
экранирования уменьшается.
Длина экранирования зависит главным образом от числа носителей зарядов в
данной фазе. Так как концентрация неорганических ионов в неполярном раствори-
растворителе на несколько порядков меньше, чем в водном растворе, то длина экранирования
в неполярной органической фазе намного превосходит длину экранирования в вод-
водном растворе. ?
Рис. XVIII.4.
Профили распределение по-
потенциала на границе раздела
фаз (I), в мембранах разной
толщины (II), в тонкой мем-
мембране в отсутствие внешнего
поля (III, 1) и при наложе-
наложении разности электрических
потенциалов (III, 2):
п
ш
Ф1 > Ф2 — электрические потенциалы в объеме фаз; фо — электрический потенциал на границе раз-
раздела, si, ?2 — диэлектрическая проницаемость двух фаз, Xi, Хг — длина экранирования для первой
и второй фаз
Важно представлять, в какой пропорции делится полный скачок межфазной
разности потенциалов между фазами, т. е. какая часть от суммарной разности
потенциалов приходится на водный раствор и какая — на неполярную фазу
(рис. XVIII.4). Избыток зарядов, содержащийся в диффузном слое по одну сторону
границы раздела, уравновешивается избытком зарядов другого знака во второй
фазе. Это условие записывается в виде
и оо
— / pdx = pdx.
(XVIII.4.9)
88 Глава XVIII. Транспорт ионов. Ионные равновесия
Выразив р по формуле (XVIII.4.2), получим
о оо
/d ф , Г d ф ,
—iax = — z<i I —^dx,
dx2 J dx2
—оо О
или
si (d(f/dx)(^l0 = s2 (d(f/dx)(^l0. (XVIII.4.10)
Угол наклона кривой потенциала при переходе через границу раздела изменяется
пропорционально отношению диэлектрических проницаемостей фаз (рис. XVIII.4).
Физический смысл соотношения (XVIII.4.10) состоит в том, что напряженность
электрического поля является непрерывной функцией и не претерпевает разрыва
на границе раздела фаз. Так как
)^20 = (ф1 - фо) Ai и
)х=о = (фо — фг)А2>
то из соотношения (XVIII.4.10) можно получить выражение, показывающее, в какой
пропорции делится межфазная разность потенциалов:
ф! -'
фО-ф2
где С\ и С2 — концентрации электролита в объемах фаз. Поскольку для неполярной
фазы (фаза 2) характерны низкие значения диэлектрической постоянной и низкая
Ф1 — Фо 1
концентрация носителей заряда, очевидно, что — <С 1, т. е. основной скачок
фО - ф2
потенциала локализован в гидрофобной фазе, а не в водном растворе.
Профиль электрического потенциала в мембранах, омываемых электролитом,
существенно зависит от толщины мембраны. Если толщина намного превышает
длину экранирования, то ситуация не отличается от случая бесконечно про-
протяженных фаз. Профиль потенциала в такой мембране показан на кривой 1
(рис. XVIII.4, II). Основная часть межфазной разности потенциалов падает в
мембране, причем длина экранирования в мембране намного больше длины экрани-
экранирования в растворе электролита. Так как значения диэлектрической проницаемости
в водном растворе и мембране резко отличаются, то из условия (XVIII.4.10) следует,
что кривая изменений потенциала претерпевает излом на границе раздела.
\—? В другом предельном случае размер мембраны по толщине намного меньше
длины экранирования. Именно такая ситуация возникает в клеточных и би-
слойных липидных мембранах, толщина которых составляет 7-10 нм. В этом слу-
случае скачок потенциала внутри мембраны практически отсутствует (кривая 3 на
рис. XVIII.4, II). Можно считать, что в отсутствие внешне приложенного поля по-
потенциал внутри мембраны постоянен по всей ее толщине. Распределение потенциала
в такой тонкой мембране при наложении внешнего поля показано на рис. XVIII.4, III.
Потенциал внутри тонкой мембраны меняется линейно, а градиент потенциала по-
постоянен по всей ее толщине: dcp/dx = const. Предположение о постоянстве электри-
электрического поля в биомембранах лежит в основе уравнений, используемых для описания
транспорта ионов через биомембраны и для оценки значения мембранного потен-
потенциала [уравнения Гольдмана; см. (XIX.2.4)]. ?
§ 5. Двойной электрический слой 89
§ 5. Двойной электрический слой
В § 4 отмечалось, что значения потенциала в мембранах малой толщины, сформиро-
сформированных из неполярного растворителя, при отсутствии внешнего поля не отличаются
от уровня потенциала в окружающих растворах. На рис. XVIII.4 схематично пока-
показано, что для таких незаряженных мембран электрический потенциал одинаков на
любом удалении от мембраны. Этот вывод не распространяется на мембраны, в
структуре которых находятся фиксированные заряды.
Наличие фиксированных поверхностных зарядов клеточных мембран приводит
к образованию около мембраны двойного электрического слоя, который является
важным фактором в протекании многих биоэлектрохимических процессов.
\—? Согласно представлениям, развитым в работах Г. Гуи и Д. Л. Чэпмена A910)
распределение ионов в области заряженной поверхности определяется двумя
факторами: электростатическим притяжением, удерживающим противоионы у по-
поверхности, и тепловым движением этих ионов, стремящимся, наоборот, к вырав-
выравниванию их концентраций в поверхностном слое и объеме. В устанавливающемся
равновесии плотность распределения ионов около заряженной поверхности убывает
с увеличением расстояния от поверхности. Равновесные концентрации катионов с+
и анионов с~ в поверхностном слое и в объеме раствора представлены схематически
на рис. XVIII.5. Слой раствора с измененными концентрациями вблизи поверхности
называется диффузным. В зависимости от условий его толщина изменяется на не-
несколько порядков — от десятых нанометра до микрометров. ?
со
со
Рис. XVIII.5.
Распределение ионов в двойном электриче-
электрическом слое:
I — избыточные катионы; II — концентрация ионов
на разных расстояниях от поверхности; со — кон-
концентрация электролита в объеме, С+ и с_ —концен-
—концентрации катионов и анионов; по оси абсцисс отложено
расстояние от границы раздела, по оси ординат —
концентрация электролита
Концентрация ионов вблизи заряженной поверхности определяется зако-
законом Больцмана [см. (XVIII.4.1)]. Профиль потенциала в области двойного слоя
(рис. XVIII.6) определяется уравнением Пуассона—Больцмана, которое получается
при объединении уравнения Пуассона [см. (XVIII.4.2)] с учетом определения плотно-
плотности зарядов в плоскости х [см. (XVIII.4.3)] и уравнения Больцмана [см. (XVIII.4.1)].
Уравнение Пуассона—Больцмана имеет вид
dx2
(XVIII.5.1)
90
Глава XVIII. Транспорт ионов. Ионные равновесия
В § 4 приведено решение уравнения Пуассона—Больцмана для случая малых
потенциалов. Если ограничиться случаем бинарного симметричного электролита,
для которого Со+ = Со- = с и z+ = —Z-, то уравнение (XVIII.5.1) после некоторых
преобразований упрощается и преобретает следующий вид:
dx
(exp(zF<?/2RT) - exp(-zF<?/2RT)).
Потенциал часто выражают через безразмерные величины:
ф = zFy/RT.
В этом случае
Жр _ j2RTc,
dx
(ехр(ф/2)-ехр(-ф/2)).
(XVIII.5.2)
(XVIII.5.3)
(XVIII.5.4)
Условие электронейтральности двойного электрического слоя выражается ра-
равенством поверхностного заряда а и суммарного заряда диффузного слоя:
оо
о = — pdx.
(XVIII.5.5)
Рис. XVIII.6.
Распределение потенциала ср в двойном электри-
электрическом слое:
d — толщина плотного слоя, X — длина экранирования;
Расстояние от Ф1—потенциал в плоскости максимального приближе-
границы раздела ния свободных катионов
Выразив р из (XVIII.4.2) и подставляя в (XVIII.5.5), находим
= [
J
№) dx = -еео (?)
dxz) \dxjx=o
(XVIII.5.6)
Подставляя значение d(f/dx из (XVIII.5.4), получаем уравнение Гуи—Чэпмена
а = л/2??0ЛГс(ехр(ф/2) - ехр(-ф/2)) или а = (8е?0ЛГсI/2 sh(<|V2). (XVIII.5.7)
Формула (XVIII.5.7) выражает соотношение между плотностью поверхностно-
поверхностного заряда а, поверхностным потенциалом ф и равновесной концентрацией электро-
электролита в растворе с.
§ 5. Двойной электрический слой 91
Согласно теории Гуи—Чэпмена, потенциал убывает с увеличением расстояния
от мембраны в соответствии с уравнением:
l+«exp(-x,) = ехр2ДГ \ (XVIII.5.8
l-aexp(-x,)' ехр §| + 1
где х — расстояние от границы раздела, х — обратная дебаевская длина [см.
(XVIII.4.6)], a (fs—поверхностный потенциал, т.е. потенциал на границе раздела
мембраны с раствором. В случае малых поверхностных потенциалов уравне-
уравнение (XVIII.5.8) упрощается и принимает вид (XVIII.4.7).
Уравнение (XVIII.5.7) учитывает лишь кулоновские взаимодействия противоио-
нов с фиксированными зарядами и не учитывает специфической адсорбции проти-
воионов под действием некулоновских (ван-дер-ваальсовых) сил. Это специфическое
взаимодействие, характерное для адсорбции многовалентных ионов, заряженных
красителей, алкалоидов, поверхностно-активных веществ, рассматривается в тео-
теории Штерна A924).
Измеряя с помощью различных методов поверхностный потенциал, удается
определить плотность поверхностных зарядов в мембранах. Учет поверхностного
потенциала и электростатических взаимодействий ионов с фиксированными заряда-
зарядами позволил, например, объяснить влияние солей на интенсивность флуоресценции
хлорофилла (см. § 3, 4 гл. XXVII), взаимодействие заряженных красителей и редокс-
медиаторов с фотосинтетической мембраной.
\—? Катионы щелочных металлов и двухвалентные катионы оказывают влияние на
поверхностный потенциал в основном посредством экранирования фиксирован-
фиксированных зарядов мембраны. В отличие от этого ионы Н+ оказывают свое действие пре-
имущетвенно путем связывания — протонирования соответствующих группировок,
т. е. путем влияния на плотность фиксированных зарядов а. По этой причине Н+ и
другие ионы, способные к специфической адсорбции на мембранах, называют по-
тенциалопределяющими ионами в отличие от индифферентных, которые участвуют
лишь в экранировании фиксированных зарядов. ?
Поверхностный потенциал мембраны не может быть экспериментально измерен
прямыми методами. Можно, однако, изменить другую, близкую к (р величи-
величину— электрокинетический потенциал ?, называемый дзета-потенциалом. Дзета-
потенциал определяют как потенциал границы скольжения, также отсчитываемый
от уровня потенциала в объеме раствора. Граница скольжения определяется
первым слоем ионов с их гидратными оболочками и первым слоем молекул воды,
смачивающих твердую фазу. Этот слой не перемещается относительно заряжен-
заряженной поверхности и увлекается вместе с мембранной частицей при ее движении
относительно жидкости. Поэтому обычно полагают, что С ^ ф1 (рис. XVIII.6).
Различие между Z, и ср должно быть тем менее заметным, чем меньше d(p/dx, т.е.,
согласно (XVIII.5.2), уменьшаться в области разбавленных растворов.
Величину дзета-потенциала можно рассчитать, измеряя скорость движения за-
заряженных мембранных частиц в электрическом поле по формуле Смолуховского:
(XVIII.5.9)
92 Глава XVIII. Транспорт ионов. Ионные равновесия
где т) — вязкость среды, v — скорость перемещения частиц, Е — градиент потенци-
потенциала внешнего электрического поля. Отношение v/E называют электрофоретической
подвижностью.
Наличие на поверхности фиксированных электрических зарядов лежит в основе
электрокинетических явлений, открытых в 1808 г. профессором Московского уни-
университета Ф. Ф. Рейсом. Он обнаружил явление переноса жидкости под действием
внешнего электрического поля, возникающее как в капиллярно-пористых телах,
так и в одиночных капиллярах. Это явление получило название электроосмоса;
перемещение частиц дисперсной фазы в электрическом поле названо электрофоре-
электрофорезом. Позже, во второй половине XIX в., было обнаружено возникновение разно-
разности потенциалов на пористой мембране при фильтрации через нее воды: разность
потенциалов была пропорциональна давлению, под которым протекала жидкость.
Это явление, обратное электроосмосу, называется потенциалом течения. Явление,
обратное электрофорезу, называется потенциалом оседания и состоит в том, что
при оседании заряженных частиц регистрируется разность потенциалов между дву-
двумя электродами, расположенными на разной высоте.
На основе кинетических представлений о механизме электрокинетических явле-
явлений удается установить между ними количественные связи. Величина объёма жид-
жидкости, переносимого электроосмосом через капилляр в единицу времени, или вели-
величина объемного электроосмотического потока J, определяется следующим выраже-
выражением:
Jap=o = ^y~, (XVIII.5.10)
где I — сила тока, проходящего через капилляр, X— удельная электропроводность
жидкости, s — диэлектрическая постоянная, т) — коэффициент вязкости, ? — элек-
трекинетический потенциал. Можно показать, что отношение потенциала тече-
течения Аф к разности давлений Ар в состоянии, когда 1 = 0, задается выражением
(Аф/Ар)/=0 =
Сравнивая два последних выражения, можно найти количественную связь между
явлениями электроосмоса и потенциала течения:
(J/I)ap=o = (Аф/Ар)/=0 = ^f. (XVIII.5.12)
Соотношение (XVIII.5.12) может быть получено на основе представлений Онзаге-
ра без привлечения данных о молекулярно-кинетических механизмах наблюдаемых
явлений.
Действительно, используя (V.3.4) и (V.3.5), можно записать общие феномено-
феноменологические уравнения переноса через мембрану при постоянной температуре веще-
вещества J под действием разности давлений и электрического тока I, обусловленного
разностью потенциалов Аф:
J = Ln Ар + Li2 Аф,
г л L21=L12. (XVIII.5.13)
?Аф;
§ 6. Доннановское равновесие 93
Из этих соотношений в соответствии с данными выше определениями каждого элек-
электрокинетического явления можно легко найти следующие выражения.
В случае электроосмоса (Ар = 0) имеем
(J/I)ap=o = L12/L22.
Для тока переноса (Дер = 0)
(//^)дФ=о = Win- (XVIII.5.15)
Потенциал течения (I = 0) описывается как
(Аф/Ар)/=0 = -L21/L22.
Для электроосмотического давления
(Ap/Acp)J=o = -Li2/Lii.
Сравнивая между собой выражения (XVIII.5.14)-(XVIII.5.16), находим два связыва-
связывающих уравнения:
(Аф/Ар)/=0 = -(J/I) ар=о, (XVIII.5.18)
(Ap/A(p)J=0 = -(//7)дФ=о. (XVIII.5.19)
Как видно, уравнение (XVIII.5.18) совпадает с (XVIII.5.12). Однако преимущество
термодинамического вывода состоит в том, что он справедлив независимо от ха-
характера конкретной молекулярно-кинетическои модели движения жидкости через
капилляр, которая лежит в основе формулы (XVIII.5.12).
§ 6. Доннановское равновесие
Рассмотрим еще один вид ионного равновесия между двумя фазами, которое воз-
возникает, если одна из фаз несет заряды, не способные перейти в другую фазу. Такое
ограничение подвижности ионов может быть обусловлено либо тем, что ионы фик-
фиксированы в объеме фазы, как, например, в ионообменных смолах, либо наличием
между растворами мембраны, проницаемой для растворителя и малых ионов, но
непроницаемой для ионов с размерами коллоидных частиц.
Пусть в системе из двух водных фаз растворен бинарный электролит А+В~.
Предположим, что одна из фаз несет фиксированные положительные заряды и что
значения стандартных химических потенциалов для обеих фаз одинаковы. Из усло-
условия равновесия (XVIII.3.1) получаем
RT , СА2 ЯГ , СВ2 f-v\ гттт r> -I \
ф1 - Ф2 = — In — = -— In —, (XVIII.6.1)
где слг и са2 — концентрации подвижных катионов, свг и св2 — концентрации по-
подвижных анионов в двух фазах. Из уравнения (XVIII.6.1) непосредственно следует
соотношение
са2св2 = cAlcBl (XVIII.6.2)
94 Глава XVIII. Транспорт ионов. Ионные равновесия
В фазе 1, не содержащей фиксированных зарядов, концентрация электролита рав-
равна с, а концентрации катионов и анионов одинаковы: САг = Свг = с. Следовательно,
cAlcBl=c2, са2св2=с2. (XVIII.6.3)
Если плотность положительных фиксированных зарядов в фазе 2 равна Q, то усло-
условие электронейтральности для этой фазы имеет вид
сВ2 = сА2 + Q. (XVIII.6.4)
Комбинируя уравнения (XVIII.6.3) и (XVIII.6.4), получим
ca2(ca2+Q) = c2. (XVIII.6.5)
Решая это квадратное уравнение, находим концентрацию свободно диффундирую-
диффундирующих ионов в фазе 2:
сА2 = -Q/2 + (<22/4 + с2I/2. (XVIII.6.6)
Из полученного решения видно, что распределение свободных ионов в системе су-
существенно зависит от концентрации фиксированных зарядов и от концентрации
ионов во внешней среде (фаза 1).
В том случае, когда плотность фиксированных зарядов мала (Q <S с), концен-
концентрации свободных катионов и анионов в заряженной фазе равны
са2 = -Q/2 + с, св2 = Q/2 + с. (XVIII.6.7)
Это означает, что заряд недиффундирующих катионов в фазе 2 компенсируется
повышенным содержанием в ней анионов и более низким содержанием катионов.
Доннановская разность потенциалов в этом случае равна
_ RT са2 _ RT с _ RT
ф1-ф2-^гП— _ — П с_д/2 - —р-
или после разложения In f 1 — — 1 в ряд по формуле [1пA — х) и —х]
ф2 - ф1 = ^ - Я- (XVIII.6.8)
Если, например, Q = 0,2с, то ф2 — ф1 ~ 2,5 мВ.
В другом предельном случае, когда объемная плотность фиксированных заря-
зарядов велика по сравнению с концентрацией электролита во внешней среде (Q > с),
получаем из уравнения (XVIII.6.6)
4с2 ^1/2
Разлагая в ряд ( 1 + —j I по формуле A + х)т и 1 + тх получаем
Q J
сА2 = ?[-!+ Щ^1 = ^. (XVIII.6.9)
§ 6. Доннановское равновесие 95
Таким образом, концентрация 2са свободных катионов в фазе в этом случае
низка, т. е. катионы вытесняются из этой фазы. Заряд недиффундирующих катио-
катионов в этом случае полностью компенсируется анионами, которые аккумулируются
в фазе 2 до концентрации св2 = Q + с2 /Q, намного превышающей концентрацию
электролита в водном растворе. Скачок потенциала между фазами для этого случая
равен
Из уравнения (XVIII.6.10) видно, что в разбавленных растворах (с <С Q) рав-
равновесная разность потенциалов в доннановской системе может быть достаточно
высокой.
Глава XIX
Электродиффузионная теория
транспорта ионов через мембраны
В условиях электрохимического равновесия суммарные ионные потоки в системе от-
отсутствуют, в противном случае возникает пассивное движение ионов по градиенту
электрохимического потенциала. При неодинаковых подвижностях ионов разного
вида в жидкости (или в мембране) возникает диффузионная разность потенциалов,
которая в отличие от разностей потенциалов в равновесных системах зависит не
только от ионных концентраций в соприкасающихся растворах, но и от кинетиче-
кинетического параметра — подвижности ионов.
Теории пассивного мембранного транспорта ионов были разработаны приме-
применительно к физико-химическим мембранам. Существует два основных подхода к
описанию прямого прохождения заряженных частиц: дискретный и непрерывный.
В дискретном подходе, основанном на эйринговской теории абсолютных скоростей
реакций, предполагают, что частица преодолевает мембрану с помощью несколь-
нескольких дискретных перескоков через активационные барьеры. Непрерывный подход
основан на представлении об электродиффузии частиц в однородной мембране.
Непрерывный подход, основанный на электродиффузионной модели, наиболее
оправдан для описания транспорта ионов через искусственные липидные мембра-
мембраны. Для описания транспорта ионов через селективные ионные каналы клеточных
мембран логичнее использовать дискретный подход (см. гл. XXI).
§ 1. Уравнение электродиффузии Нернста—Планка
\—? В электродиффузионной модели мембрану рассматривают как непрерывную
гомогенную среду, в которой происходит диффузия точечных невзаимодей-
невзаимодействующих частиц. Суммарный поток произвольного вида ионов j, движущихся
пассивно и независимо в такой гомогенной среде в направлении оси х, пропорци-
пропорционален концентрации ионов, их подвижности и действующей на ион силе. Общее
транспортное уравнение имеет вид:
поток = концентрация х действующая сила х подвижность.
?
Таким образом, поток J ионов j, концентрация которых в плоскости х равна с,
а подвижность и, равен [ср. (V.3.2)]
J = cu(-d\x/dx). (XIX.1.1)
§ 1. Уравнение электродиффузии Нернста—Планка 97
Учитывая определение электрохимического потенциала [см. (XVIII.1.2)] и подста-
подставляя в уравнение (XIX.1.1) значение производной d\i/dx, получим
J = -uRT^ - uczFp-, (XIX.1.2)
dx dx
где z — валентность иона, Г — абсолютная температура, R — газовая постоянная,
F— число Фарадея. Уравнение (XIX.1.2) называется уравнением электродиффузии
или уравнением Нернста—Планка: и описывает диффузию ионов в растворе или в
гомогенной незаряженной мембране. Первый член в правой части уравнения опи-
описывает свободную диффузию (диффузионная компонента общего потока), второй
выражает миграцию ионов в электрическом поле (миграционная компонента). Раз-
Размерность потока — моль • см~2 • с.
Задача описания диффузии заряженных частиц предполагает решение системы
двух уравнений, одно из которых — уравнение Нернста—Планка (XIX.1.2), вто-
второе— уравнение Пуассона (XVIII.4.2). Для упрощения электро-диффузионной за-
задачи вводят дополнительные условия, например допущение о постоянстве одного
из градиентов в мембране (dc/dx = const или dy/dx = const) или допущение об
электронейтральности мембраны.
В подходе Планка—Гендерсона к решению электродиффузионного уравнения
(XIX.1.2) предполагают, что условие электронейтральности выполняется не только
для объема фаз, разделенных мембраной, но и для самой мембраны. Иначе говоря,
предполагают, что концентрации катионов и анионов в любой плоскости по оси х
одинаковы (с+ = с_). В стационарном состоянии при условии разомкнутой цепи
суммарный электрический ток через мембрану не течет, т. е. сумма переносимых
катионов равна сумме переносимых анионов. Для бинарного электролита, содер-
содержащего одновалентный катион и одновалентный анион, условие равенства потоков
имеет вид
dC 7-1 ^Ф rkmdC 7-1 ^Ф /-IT-TIT- I П\
u+RT— + u+cF-*- = u-RT- u-cF-^-, (XIX.1.3)
где и+ и U— — подвижности катиона и аниона в мембране. Отсюда
Ар _ и+ - и- RT 1 dc (XIX 1 4^
dx u+ +u- F cdxJ
Учитывая, что A/с)(dc/dx) = d\nc/dx и интегрируя уравнение (XIX.1.4), получаем
т и+ + и- F c\
где Аср = ср2 — ф1- Соотношение (XIX. 1.5) называется уравнением Гендерсона. Оно
позволяет рассчитать диффузионный потенциал, возникающий между двумя рас-
растворами электролита разной концентрации. Например, при соприкосновении двух
растворов NaCl начинается диффузия ионов через границу раздела. Так как по-
подвижность С1~ в водном растворе примерно в 1,5 раза выше подвижности Na+
(uq\ Pi l,5uNa)> то ион С1 продвигается по градиенту концентрации быстрее, чем Na,
в результате чего разбавленный раствор приобретает отрицательный потенциал по
отношению к концентрированному раствору. Возникающая разность потенциалов
98 Глава XIX. Электродиффузионная теория транспорта ионов через мембраны
между растворами замедляет движение анионов и ускоряет движение катионов,
т. е. приводит к выравниванию скоростей диффузии катионов и анионов. В том
случае, если соприкасающиеся растворы NaCl отличаются по концентрации в 10
раз, разность потенциалов между ними составляет примерно 12 мВ.
Уравнение Гендерсона (XIX.1.5) пригодно для мембран макроскопической тол-
толщины (порядка микрометров и более), но несправедливо в случае тонких липидных
и клеточных мембран, где условия локальной электронейтральности по всей толщи-
толщине мембраны не соблюдаются. Это связано с тем, что вследствие неодинаковой ли-
пофильности катионов и анионов их концентрации в мембране неодинаковы (см. § 3
гл. XVIII). Существенно также, что толщина биомембран меньше дебаевского ра-
радиуса экранирования (см. выше). Следовательно, уравнение Гендерсона непригодно
для описания мембранного потенциала клетки.
§ 2. Приближение постоянного поля
¦\У Второй подход к решению уравнения Нернста—Планка, известный как прибли-
жение постоянного поля, основан на предположении о линейности изменения
электрического потенциала или постоянства напряженности поля по всей толщине
мембраны (dcp/dx = const). Это условие выполняется для тонких мембран, в которых
концентрация носителей зарядов мала, а толщина двойного электрического слоя
очень велика (см. §4 гл. XVIII), т.е. в случае диффузии ионов через липидные
бислои и клеточные мембраны. ?
Если профиль электрического потенциала в мембране с толщиной h линеен
(dy/dx = cp/ft = const), то уравнение Нернста—Планка (XIX.1.2) приобретает вид
неоднородного линейного дифференциального уравнения
dc/dx + Ac= -В, (XIX.2.1)
где А = zFy/RTh, В = J/uRT, ср— трансмембранная разность потенциалов. Реше-
Решение уравнения (XIX.2.1) показывает зависимость суммарного пассивного потока Jj
ионов j от разности потенциалов на мембране (р и концентраций ионов на краях
мембраны:
с' - с" expQ-Fcp/ДГ)
т _ zFyu с - с expQ-Fcp/ДГ) , ,
Jj ~ ~h l-exp(zFv/BT) ' (XIX.2.2)
где с' и с" — концентрации иона j на краях в фазе мембраны в плоскостях х = 0 и
х = h. Для практического использования уравнения (XIX.2.2) необходимо произве-
произвести замену концентраций с' и с", относящихся к фазе мембраны, на концентрации
ионов в растворах по обе стороны мембраны. А. Ходжкин и Б. Катц предположили,
что концентрации ионов на краях мембраны (с' и с") пропорциональны соответ-
соответственно концентрациям в наружном и внутреннем омывающих растворах с0 и cf.
с' = Хс0; с" = Ха, (XIX.2.3)
где у — коэффициент распределения, зависящий от липофильности иона. Тогда
уравнение (XIX.2.2) для пассивного потока ионов через мембрану примет вид
т zFyP Co - Cj exp(zFy/RT) , ,
3 ~ ~КГ " 1ехр(^Ф/ДГ) (XIX.2.4)
§ 2. Приближение постоянного поля 99
\—? Величина Р (Р = uRT\/h), называемая коэффициентом проницаемости, имеет
размерность см/с [см. (XVII.1.2)]. Она прямо пропорциональна подвижности
иона в мембране и коэффициенту распределения и обратно пропорциональна тол-
толщине мембраны. Значение тока I, переносимого данным ионом, равно I = zFJ. ?
Уравнение (XIX.2.4), выведенное Д. Е. Гольдманом A943) и дополненное
А. Ходжкиным и Б.Катцем A949), позволяет рассчитать пассивный поток иона,
если известны его концентрация в растворах по обе стороны мембраны, разность
потенциалов на мембране и проницаемость мембраны для данного иона. Для оценки
коэффициента проницаемости мембраны необходимо с помощью радиоактивной
метки определить односторонние потоки и суммарный поток иона, и также
убедиться в том, что в транспорте иона не принимают участия системы ак-
активного транспорта. На мембранах растительных клеток значения коэффициентов
проницаемости для К+ варьируют в пределах от 10~8 до 10~6 см/с; значения Р^а
обычно на порядок ниже значений Рк, а значения Рс\ не превышают 10~8 см/с.
Проницаемость и проводимость. Понятие ионной проницаемости следует от-
отличать от ионной проводимости. Эти два свойства тесно связаны между собой, и
фактически изменения проницаемости всегда сопровождаются изменениями прово-
проводимости. Проницаемость Pj является свойством мембраны и в первом приближении
не зависит от содержания ионов в окружающих растворах. Проводимость мембра-
мембраны gj характеризует изменение потока ионов j при небольших сдвигах мембранного
потенциала:
gj = zFdJj/dc? = dIj/<?, (XIX.2.5)
где zF dJj = dlj — изменение тока, переносимого ионами j в ответ на небольшое
смещение разности потенциалов на мембране dcp. Так как количество переносимых
ионов j зависит от их концентрации в растворах, то и проводимость по иону j в
отличие от проницаемости Pj зависит от содержания ионов данного вида в наруж-
наружном и внутреннем растворах. Если концентрации ионов по обе стороны мембраны
одинаковы, то проводимость мембраны по одновалентному иону j определяется
простым уравнением
gj = F2PjC/RT. (XIX.2.6)
Суммарная проводимость мембраны (величина, обратная электрическому со-
сопротивлению мембраны) равна сумме проводимостей мембраны для отдельных ио-
ионов и определяется как изменение суммарного электрического тока I через мем-
мембрану в ответ на небольшое смещение мембранного потенциала:
(XIX.2.7)
Вольтамперные характеристики. Уравнение Гольдмана (XIX.2.4) предсказыва-
предсказывает нелинейную зависимость трансмембранного потока ионов от разности потен-
потенциалов на мембране. При больших положительных и больших отрицательных по-
потенциалах поток линейно зависит от разности потенциалов, однако коэффициенты
пропорциональности различны. При ср —> — оо и (р —> +оо зависимости ионного тока
100
Глава XIX. Электродиффузионная теория транспорта ионов через мембраны
от потенциала аппроксимируются асимптотами J = PcozFy/RT и J = P
соответственно (рис. XIX. 1). Нелинейность характеристики тем больше, чем боль-
больше перепад концентраций в растворах справа и слева от мембраны; зависимость
линейна, если концентрации иона в обоих растворах одинаковы. В равновесии,
когда ионный ток равен нулю (J = 0), из уравнения (XIX.2.4) следует, что с0 —
Ciexp(zF(f/RT) = 0 и соответственно равновесное значение ср = (RT/zF)\n(co/ci)
находится как точка пересечения кривых с осью потенциала. Суммарная вольт-
амперная характеристика мембраны совпадает по форме с характеристикой ток-
напряжение для того вида иона, который вносит основной вклад в проводимость
мембраны.
с,=1 мМ
с,=10 мМ
c,=l мМ
50 100 150 ,р,мв
Рис. XIX. 1.
Вольтамперные характеристики в тео-
теории постоянного электрического поля
Показаны зависимости потока одновалентных
ионов от потенциала при равенстве ионных кон-
концентраций по обе стороны от мембраны (а); при
10-кратном (б) и 100-кратном (в) различии кон-
концентраций
С2
Рис. XIX.2.
Профили концентрации катионов в
мембране в отсутствие поля и при
наложении внешнего электрическо-
электрического поля Е разной направленности
\—? Причины нелинейности вольтамперной характеристики при резком отличии
ионных концентраций по обе стороны мембраны вызваны влиянием электри-
электрического поля на профиль концентрации ионов в мембране (рис. XIX.2). При нало-
наложении электрического поля различной ориентации концентрация токопереносящих
ионов в мембране либо повышается, либо уменьшается, что приводит соответствен-
соответственно к повышению или снижению электропроводности мембраны — эффект выпрям-
выпрямления. ?
Выражение для разности потенциалов, создаваемой на мембране в результате
диффузии ионов, выводят из уравнения для ионных потоков (XIX.2.4). В равнове-
равновесии, когда электрический ток через мембрану не течет, сумма токов, переносимых
отдельными ионами, равна нулю: J3 • Ij = 0. При учете только одновалентных ионов
= 0.
(XIX.2.S
§ 2. Приближение постоянного поля 101
После подстановки и сокращения всех членов на общие множители, получим
Рк[К0] - PK[Ki] ехр(РФ/ДТ) + PNa[Na0] - PNa[Na;] ехр(Рср/ДТ) +
+ PCi[Cl0] - PciPi] ехр(Рф/ДГ) = 0. (XIX.2.9)
Решая полученное уравнение относительно (р, находим выражение для мембранного
потенциала:
т RT, PK[K0]+PNa[Na0] + Pcl[Cl0]
* " Т Ь РК[К;] + РЫ^] + РС1[С1;] (XIX.2.10)
где ф — разность потенциалов на мембране, Pj — проницаемости соответствующих
ионов; индексы о и г относятся к концентрациям ионов в наружной и внутренней
фазах. Выражение (XIX.2.10) называется уравнением Гольдмана для мембранного
потенциала. Оно показывает, что электрический потенциал на мембране определя-
определяется различием в стационарных концентрациях ионов по обе стороны мембраны и
разными коэффициентами их проницаемости. Соответственно наибольшее влияние
на мембранный потенциал оказывает тот ион, который обладает самым высоким
коэффициентом проницаемости, что и наблюдается в экспериментах. Соотношение
(XIX.2.10) удовлетворительно описывает экпериментальные зависимости потенци-
потенциала от ионного состава среды при условии, что интервал концентраций не слишком
широк. Это указывает на серьезные ограничения электродиффузионной теории для
описания электрических характеристик живой клетки.
Соотношение Уссинга. Суммарный поток ионов, определяемый уравнением
(XIX.2.4), равен алгебраической сумме двух односторонних потоков: J = Ji — Jo,
где Ji — поток во внутреннюю фазу, отделенную мембраной, а Jo — поток в на-
наружный раствор. Очевидно, что в выражении (XIX.2.4), описывающем суммарный
ионный поток, слагающие члены соответствуют входящему и выходящему потоку.
Выражения для односторонних потоков имеют вид
_ _
~ г~ f i^WBV (Х1Х2Л1)
~ ° ~ RT '
где j и j —потоки ионов, направленные во внутренний и наружный раство-
растворы. Как видно из приведенных уравнений, входящий поток линейно зависит от
концентраций иона в наружном растворе и не зависит от концентрации во вну-
внутренней среде. В свою очередь, выходящий поток зависит только от концентрации
во внутреннем растворе. Это и означает, что входящий и выходящий потоки в
приближении постоянного поля являются независимыми.
Из уравнения (XIX.2.11) следует, что односторонние потоки связаны между
собой соотношением Уссинга—Теорелла:
(XIX.2.12)
Jo Ci exp(zFcp/.RT)
\—? Выполнение уравнения Уссинга—Теорелла является критерием пассивного
транспорта, при котором поток иона обусловлен только градиентом концен-
концентраций и действием электрического поля. Отклонение от равенства (XIX.2.12)
102 Глава XIX. Электродиффузионная теория транспорта ионов через мембраны
может указывать на участие системы активного транспорта в переносе ионов
через мембрану или быть следствием нарушения независимости ионных потоков,
например при диффузии через узкие каналы в мембране, (см. гл. XX). В этом случае
обычное электродиффузионное описание [см. (XIX.1.2); (XIX.2.4); (XIX.2.12)],
основанное на представлении о диффузии точечных невзаимодействующих частиц,
теряет силу. ?
Односторонние потоки определяют с помощью радиоактивных изотопов, до-
добавляя их в один из растворов и измеряя скорость поступления изотопа в другой
раствор, отделенный мембраной.
Глава XX
Индуцированный ионный транспорт
§ 1. Бислойные липидные мембраны
Основные закономерности транспорта ионов через мембраны изучены в опытах с
различными моделями, из которых самой близкой к биомембранам оказалась би-
слойная липидная мембрана (БЛМ) (см. §2 гл. XV).
Затраты энергии, необходимые для проникновения иона в неполярную фазу,
можно оценить по формуле Борна [см. (XVIII.2.3)], согласно которой энергия, за-
затрачиваемая на перемещение иона из воды в мембрану, зависит от его радиуса г и
диэлектрических проницаемостей воды sB и мембраны ем.
В системе СГС эта формула имеет наиболее простую и наглядную запись:
W = ^-A/?м - 1/ев),
где z — валентность иона, е — элементарный заряд. Рассчитанные по данному урав-
уравнению значения свободной энергии для перехода К+ и К+ из воды в неполярный
растворитель с sM = 2 составляют большую величину B50-350 кДж/моль). Именно
это создает барьер, препятствующий прохождению ионов щелочных металлов через
гидрофобную часть липидного бислоя в негидратированной форме.
Как видно из (ХХ.1.1), энергия перехода иона в мембрану снижается с уве-
увеличением радиуса иона. Поэтому крупные органические ионы проникают через
БЛМ легче, чем катионы щелочных металлов. Для таких крупных липофильных
ионов, как дипикриламин и тетрафенилбор, возможно прямое прохождение через
мембрану. При изменении градиента концентрации в случае одного проникающего
иона разность электрических потенциалов на БЛМ изменяется в соответствии с
уравнением Нернста. Этим методом было продемонстрировано пассивное движение
проникающих ионов через мембраны митохондий, субмитохондриальных частиц,
бактериальных хроматофоров при энергозависимой генерации мембранного потен-
потенциала (см. гл. XXIV).
^—р Как видно из (ХХ.1.1), величина энергетического барьера в мембране уменына-
ется, а следовательно, проницаемость мембраны для иона возрастает не только
при увеличении его радиуса, но и при приближении значений sM к ев. На этих
физических принципах и основан перенос ионов ионофорами. Ионофоры могут
образовывать с ионом комплекс большого размера — переносчики — либо формиро-
формировать пору в мембране, заполненную водой, — каналы. Это механизмы переноса —
с участием переносчиков и через ионные каналы — изучены наиболее подробно в
опытах с БЛМ. ?
104
Глава XX. Индуцированный ионный транспорт
§ 2. Подвижные переносчики
Перенос иона через мембрану с участием переносчика включает стадии образования
комплекса иона с ионофором на одной стороне мембраны, перемещения комплекса
через мембрану, освобождения иона на другой стороне и возвращения ионофора.
Возможны две схемы работы переносчика: малая «карусель», когда ионофор не
выходит из мембраны, и большая «карусель», когда ионофор проходит мембрану
насквозь, а образование и распад комплексов протекает в неперемешиваемых слоях
около мембраны. По механизму малой карусели
осуществляется, например, перенос К+ в при-
присутствии валиномицина.
Энергию комплекса иона радиусом г с пере-
переносчиком радиусом Ь в мембране с диэлектри-
диэлектрической проницаемостью sM можно записать на
основании формулы Борна (рис. XX. 1):
(XX.2.1)
Рис. XX. 1.
К расчету электростатической
энергии комплекса ион-перенос-
ион-переносчик:
?м — диэлектрическая постоянная
мембраны, sK — эффективная диэлек-
диэлектрическая постоянная внутренней
полости комплексона, ) радиус
иона, Ь — радиус комплекса ион-
переносчик
где ?к — эффективная диэлектрическая прони-
проницаемость внутренней сферы комплексона. Энер-
Энергия комплекса ион-переносчик оказывается зна-
значительно меньше энергии дегидратированного
иона. Так, для заряженного комплекса радиусом
1 нм свободная энергия перехода из воды в мем-
мембрану составляет около 15 кДж/моль в отличие
от значений 250-350 кДж/моль, соответствую-
соответствующих энергии дегидратации свободных ионов с
радиусом 0,1-0,15 нм.
Среди соединений, относящихся к ионным
переносчикам, центральное место занимают ма-
кроциклические антибиотики, выделенные из
микроорганизмов, и ряд синтетических макро-
циклических комплексонов (Ю. А. Овчинников, А. М. Шкроб, В. Т. Иванов). Некото-
Некоторые соединения из этой группы — нейтральные ионофоры — не содержат ионизиру-
ионизируемых групп. Это циклические полипептиды, циклические молекулы, состоящие из
чередующихся аминокислот и а-оксикислот (так называемые депсипептиды, при-
примером которых являются валиномицин и его аналоги), макроциклические струк-
структуры, включающие четыре лактоновых кольца, — макротетролиды (нонактин) —
и некоторые синтетические циклические полиэфиры. Комплексы, образуемые ней-
нейтральными макроциклическими соединениями с ионами щелочных металлов, несут
положительный заряд. Перенос иона через мембрану происходит в виде заряженно-
заряженного комплекса.
¦\У Рентгеноструктурный анализ таких комплексов показывает, что катион вхо-
дит во внутреннюю полость молекулы ионофора, причем образовавшаяся струк-
структура стабилизируется за счет взаимодействия иона с 6-8 полярными группировками
(эфирные, амидные или сложноэфирные). В таких комплексах ион металла экрани-
§ 2. Подвижные переносчики 105
рован от взаимодействия с растворителем. Химическое строение молекулы вали-
номицина показано на рис. XX.2. Высокая избирательность валиномицина к обра-
образованию комплексов с К+ достигается хорошим стерическим соответствием К+ и
внутренней полости валиномицина, которую образуют СО-группы. Валиномицин,
комплексуясь с К+, полностью его дегидратирует, а карбонильные (СО—) диполи
заменяют гидратную оболочку. Ион Na может поместиться в полости валиноми-
валиномицина, однако вследствие меньшего (по сравнению с К+) радиуса он оказывается
не в состоянии взаимодействовать с кислородом карбонильных групп. Поэтому
П
Рис. ХХ.2.
Химическое строение некоторых ионофоров. I — молекула валиномицина, II — си-
система металл-кислородных и водородных связей в серебряной соли нигерицина
энергия связывания иона Na с водой гидратнои оболочки оказывается больше энер-
энергии его связывания с молекулой валиномицина. Если бы молекула валиномицина
была достаточно гибкой и размер полости можно было бы «подстроить» под Na+,
то валиномицин не обладал бы хорошей селективностью. Молекула валиномицина
переносит через БЛМ не более 104 ионов/с. ?
Некоторые ионофоры, такие, как нигерицин и гризориксин, формально имеют
нециклическое строение, но они также способны связывать ионы металлов, образуя
комплексы, в которых молекула находится в свернутой, псевдоциклической конфор-
мации. В нигерицине и его аналогах присутствует СООН-группа, ионизированная
при нейтральных значениях рН. Предполагаемое строение комплекса катиона с ни-
герицином также показано на рис. ХХ.2.
106
Глава XX. Индуцированный ионный транспорт
Будучи слабыми кислотами и одновременно обладая способностью образовы-
образовывать комплексы с ионами металлов, нигерицин и его аналоги переносят через мем-
мембрану сразу два типа ионов, а при наличии градиента ионов индуцируют обменный
транспорт (см. §3 гл. XXIV). Так, нигерицин индуцирует в БЛМ и биологиче-
биологических мембранах обмен Н+ на К+. В растворе с высоким содержанием протонов
нигерицин протонируется и в форме нейтральной недиссоциированной молекулы
пересекает мембрану. На другой стороне мембраны происходит депротонирование
к
-••IF
/ // III
Рис. ХХ.З.
Индуцированный транспорт ионов при участии различных переносчиков, I—ней-
I—нейтральные ионофоры (валиномицин), II — нигерицин (обменный транспорт Н+ и
К+); III — липофильные разобщители фосфорилирования (перенос протонов):
А~ — диссоциированная форма переносчика, АН — протонированная форма переносчика, V —
валиномицин
СООН-группы нигерицина; при этом молекула свертывается в кольцо вокруг К+.
Стабильная конфигурация образуемого комплекса поддерживается взаимодействи-
взаимодействием катиона с дипольными частями ионофора и водородными связями между его
противоположными концами (рис. XX.2). Переносчики двухвалентных катионов
Х537 и А23187 индуцируют электронейтральный обмен Са2+ и Mg2+ на протоны.
Рассмотренные варианты работы переносчиков показаны на рис. ХХ.З, здесь
же изображен механизм переноса Н+ липофильными проводниками протонов. Пе-
Перенос протонов через мембрану осуществляется в основном слабыми кислотами,
диссоциированная форма которых присоединяет Н+ с образованием нейтральной
молекулы. Недиссоциированная форма протонофора пересекает мембрану, двигаясь
по градиенту концентрации; перенос отрицательно заряженной анионной формы в
обратном направлении происходит под действием электрического поля. По тако-
такому механизму работают разобщители окислительного и фотосинтетического фос-
фосфорилирования, повышающие проницаемость БЛМ и энергосопрягающих мембран
для Н+, такие, как 2,4-динитрофенол, карбонилцианидхлорфенилгидразон, тетра-
хлортрифторметилбензимидазол и др. (рис. XX.4).
§ 3. Каналообразующие агенты
¦\У Движение иона значительно облегчается, если молекулы ионофора образуют
комплекс, имеющий водную пору — канал. Наиболее известными каналообразу-
ющими соединениями являются грамицидин А, аламетицин, амфотерицин, моназо-
мицин и полиеновые антибиотики. ?
3. Каналообразующие агенты
107
Все эти молекулы обладают сродством к водной и органической фазам, что,
с одной стороны, позволяет им образовывать водную пору, а с другой — приво-
приводит к сильной сорбции антибиотика на мембрану. Внешняя часть молекул в поре
гидрофобна, а внутрь канала обращены хорошо поляризуемые группы.
Заряженные или сильно полярные группы могут находиться на одном конце
молекулы. Такие группы служат «якорем», удерживая полярный конец на одной из
сторон мембраны, позволяя молекуле пронизать гидрофобную часть мембраны.
¦NO,
NC'
NC
NC
:c=n—n H-
III
¦;C«=N—N№
II
-O—CF,
CI
W
Рис. ХХ.4.
Химическое строение некоторых
липофильных переносчиков про-
протонов
I — 2,4-динитрофенол; II — карбо-
нилцианидхлорфенилгидразон; III —
карбонилцианидтрифторметоксифенил-
гидразон; IV — тетрахлортрифторме-
тилбензимидазол (TTFB)
СНО — L-вал — гли — L-ana — D-лей
L-ana — D-вал — L-вал — D-вал — L-mpu — D-лей
L-mpu — D-лей — L-mpu — D-лей — L-mpu — NHC2H4OH
Рис. ХХ.5.
Структура грамицидина А. Каждый горизонтальный ряд аминокислот соответ-
соответствует примерно одному повороту л^ о-спирали, диагональные линии — пептидным
связям, соединяющим отдельные витки спирали
Ионные каналы в БЛМ экспериментально можно обнаружить по характерно-
характерному шуму проводимости, возникающему вследствие их открывания и закрывания
(см. §5 гл. XX). Эта черта функционирования каналов позволяет отличить данный
механизм проводимости от транспорта с участием переносчиков.
Каналы, образованные грамицидином А. Пептидная цепь молекулы грамициди-
грамицидина А сформирована пятнадцатью гидрофобными аминокислотами (рис. ХХ.5), при-
причем характерной чертой является чередование L- и D-конфигураций аминокислот, а
также наличие формильной группы на N-конце молекулы (голова) и этаноламина на
С-конце (хвост). Молекула полностью гидрофобна, за исключением карбонильных
и иминогрупп пептидной цепи и концевых полярных групп.
Находясь в мембране, молекула грамицидина А сворачивается в спиралевид-
спиралевидную структуру — полупору, стабилизированную гидрофобными связями, и форми-
формирует полый цилиндр длиной около 3 нм и диаметром поры около 0,5-0,8 нм. Такая
108
Глава XX. Индуцированный ионный транспорт
структура называется л^ о-спиралью. Название определяется тем, что каждый ви-
виток спирали образован шестью аминокислотными остатками, причем СО-группы
L-аминокислотных остатков ориентированы вдоль оси спирали по направлению к
С-концу, а соответствующие группы D-остатков и глицина — к N-концу.
При добавлении небольших количеств грамицидина А к БЛМ наблюдаются
скачкообразные изменения тока через мембрану. При фиксированном значении на-
напряжения на БЛМ происходят дискретные изменения проводимости мембран при-
¦]JLhw
Юс
Рис. ХХ.6.
Записи тока через одиночные ка-
каналы, образованные в БЛМ грами-
грамицидином А
Рис. ХХ.7.
Равновесие анти-р!]- (I) и п^ Q-спиралей (II)
грамицидина А; штриховыми линиями обозна-
обозначены водородные связи (по D. W.Urry, 1972)
Предполагают, что %\ D-спираль может находиться
/ II в равновесии с другой структурой — так называемой
анти-Р^-спиралью. В анти-Р^-спирали нет внутренней
полости, и поэтому она не может вмещать ионы металлов. Так как анти-Р^-спираль имеет меньший
дипольный момент, чем п^ о-спираль, то равновесие между этими формами может смещаться в
ту или другую сторону под влиянием внешнего электрического поля
мерно равной величины (рис. ХХ.6). Они могут быть вызваны, например, образова-
образованием и распадом одиночных каналов при ассоциации двух мономеров и диссоциации
димера грамицидина. Димерная структура образует сквозной трансмембранный
канал с проводимостью около 40 пСм в 0,1 М растворе КС1. По такому каналу
может переноситься около 107-108 ионов/с.
Причины переходов между проводящим и непроводящим состояниями канала
могут быть различны. Альтернативный механизм открывания грамицидиновых ка-
каналов показан на рис. ХХ.7.
Относительно низкая селективность грамицидинового канала может быть след-
следствием эластичности спиральной структуры. При входе иона в канал вода гидрат-
ной оболочки частично замещается на карбонильные группы, обращенные внутрь
поры. При этом происходит некоторое смещение карбонильных групп по направле-
направлению к оси спирали, в результате чего диаметр поры сужается примерно до размера
иона. Таким образом обеспечивается наиболее сильное взаимодействие катиона с
лигандной системой канала.
Грамицидин — крайне эффективный модификатор БЛМ. В субмикромолярных
концентрациях он повышает проводимость в 106-108 раз по отношению к уровню
проводимости немодифицированных мембран.
3. Каналообразующие агенты
109
Аламетицин. Это пептидный антибиотик, состоящий из 20 преимущественно
гидрофобных аминокислот, объединенных в линейную цепь. Проводимость БЛМ,
находящихся в водном растворе, в присутствии аламетицина резко зависит от
концентраций антибиотика и электролита и от значения мембранного потенциала
(рис. XXI.8).
Установлено, что каждый канал, образуемый аламетицином, может иметь не-
несколько (до семи) состояний проводимости. Предполагают, что канал представляет
i, мкАсм2
20 .
10
-200
-10
100 q>, мВ
Рис. ХХ.8.
Зависимость проводимости БЛМ (в
присутствии аламетицина) от значения
мембранного потенциала (ср):
г — ток через мембрану
Рис. ХХ.9.
Сборка аламетицинового канала. Пока-
Показаны различные состояния канала, соот-
соответствующие тримеру, тетрамеру и пен-
тамеру из молекул аламетицина
100
10
собой водную пору переменного диаметра. Добавление одной молекулы аламетици-
аламетицина в кольцо молекул, образующих водную пору, приводит к увеличению эффектив-
эффективного сечения поры, а каждому состоянию канала соответствует определенное ко-
количество мономеров в кольце. Первое проводящее состояние обусловлено тримером
из молекул аламетицина, второе — тетраме-
ром и т.д. (рис. ХХ.9).
\-у Состояние канала характеризуется не
только величиной проводимости, но и
средним временем жизни. Если переходы меж-
между открытым и закрытым состояниями кана-
канала являются случайными, т. е. представляют
собой марковский процесс, то зависимость чи-
числа каналов, время жизни которых превыша-
превышает заданное время t, N(t), от значения пара-
параметра t в полулогарифмических координатах
спрямляется (рис. XX. 10). ?
Среднее время жизни канала то определя-
определяется уравнением
(-*/т0). (ХХ.3.1)
10
15
20 t, с
Рис. ХХ.10.
Распределение времен жизни ам-
фотерициновых каналов:
N(t) — число каналов, находящихся в
открытом состоянии в течение большего
времени, чем заданное значение t
110 Глава XX. Индуцированный ионный транспорт
\—? Величина то связана с константой скорости перехода канала из открытого в
закрытое состояние а соотношением а = 1/то- П
Дискретные изменения проводимости регистрируются лишь в том случае, ко-
когда проводимость мембраны сопоставима с проводимостью одиночного канала, т. е.
при крайне малых концентрациях антибиотика. При высокой степени модификации
мембраны антибиотиками ее проводимость на несколько порядков превышает про-
проводимость одиночного канала и дискретные изменения проводимости неизмеримы.
Тем не менее существует возможность отличить механизмы переноса с участием
подвижных переносчиков и по ионным каналам по измерениям интегральной про-
проводимости.
Рис. ХХ.11.
Концентрационные зависимости
проводимости БЛМ на постоян-
постоянном (I) и переменном (II) токе в
случае транспорта по канально-
е е му механизму A) и с участием
/ // подвижных переносчиков B).
Два механизма ионного транспорта (каналы и переносчики) можно различать по концентраци-
концентрационным зависимостям проводимости на переменном токе, более информативным, чем измерения
на постоянном токе. Например, зависимость проводимости на постоянном токе от концентрации
переносимого иона как для транспорта с переносчиком, так и по канальному механизму носит
немонотонный куполообразный характер. Это объясняется блокировкой каналов при высоких
концентрациях транспортируемого иона. В случае подвижных переносчиков снижение скорости
переноса при высоких концентрациях обусловлено отсутствием свободной формы ионофора, так
как весь ионофор находится в виде комплекса с катионом. На переменном токе зависимости про-
проводимости БЛМ для двух разных механизмов переноса отличаются. При высоких концентрациях
электролита входные участки каналов заполнены, перескоки через центральный барьер невоз-
невозможны и проводимость канала на переменном токе остается низкой. В то же время заряженные
комплексы переносчика с катионом и на высокой частоте могут переносить ток через мембрану,
благодаря чему проводимость БЛМ с переносчиком остается высокой
Один из подходов состоит в том, что мембрану охлаждают до температуры
ниже точки фазового перехода липида (см. §1 гл. XVI). При этом проводимость
БЛМ, индуцированная подвижными переносчиками — валиномицином или нонакти-
ном, —значительно уменьшается, а проводимость, индуцированная грамицидином,
почти не изменяется. Увеличение вязкости мембраны при понижении температуры
препятствует движению подвижных переносчиков, но оказывает относительно сла-
слабое влияние на транспорт ионов через канал, пронизывающий мембрану насквозь.
Другой подход состоит в сравнении проводимости мембран на переменном токе
(рис. ХХ.11).
§ 4. Влияние поверхностного и дипольного потенциалов
на скорость ионного транспорта
Проводимость мембран, индуцированная нейтральными ионофорами-переносчика-
ми, существенно изменяется при введении в водные растворы заряженных поверх-
поверхностно-активных веществ и дипольных модификаторов. Это объясняется тем, что
i 4. Влияние поверхностного и дипольного потенциалов на скорость ионного транспорта 111
движение заряженных комплексов ион-переносчик через БЛМ и клеточные мембра-
мембраны существенным образом зависит от скачков потенциала на границе мембраны с
электролитом, называемых граничными потенциалами.
\—? Граничный потенциал cpj (рис. XX.12) складывается из двух компонентов —
поверностного потенциала cps и дипольного потенциала
фь =
(ХХ.4.1)
?
Рис. ХХ.12.
Граничный потенциал (ерь) как
сумма поверхностного (ср8) и ди-
дипольного (фй) потенциалов
Мембрана находится в симметричном
ионном окружении при отсутствии
внешне приложенной разности потенци-
потенциалов
Поверхностный потенциал обусловлен фиксированными зарядами мембраны,
образованными диссоциируемыми группами в полярных головках липидов, а также
ионизируемыми группами аминокислот, входящих в состав структурных белков
мембраны. Фиксированные на поверхности мембраны заряды и притягивающиеся
к ним противоионы образуют двойной электрический слой (см. §5 гл. XVIII).
Плотность фиксированных зарядов мембраны а обычно находится в пределах
от 0 до 5 мкКл/см2 и зависит от состава липидов и рН среды (см. §1, 2 гл. XV).
Отрицательный заряд мембран возрастает с увеличением рН среды.
Плотность зарядов мембраны изменяется также в результате адсорбции на
мембране катионных и анионных детергентов, например цетилтриметиламмония
или додецилсульфата, а также многовалентных ионов (Са, La, A1, многовалентные
анионы).
\—? Дипольный скачок потенциала образован ориентированными диполями воды и
полярных групп липидных молекул. На оснований измерений граничного потен-
потенциала монослоев различных липидов был сделан вывод, что гидрофобная область
БЛМ заряжена положительно на несколько сот милливольт по отношению к потен-
потенциалу водных растворов у границы с мембраной. Принято считать, что в отличие
от поверхностного потенциала дипольный потенциал не зависит от рН и ионной
силы водного раствора.
Дипольный потенциал можно менять, вводя в БЛМ различные вещества — ди-
польные модификаторы, электронейтральные молекулы которых обладают значи-
значительным дипольным моментом. К таким веществам относятся, например, холесте-
холестерин, салициламид и флоретин. Поверхностный и дипольный потенциалы относятся
112 Глава XX. Индуцированный ионный транспорт
к одним из основных факторов, определяющих проницаемость липидных бислоев
для проникающих ионов и заряженных комплексов ион-переносчик. Значение по-
поверхностного потенциала определяет равновесную концентрацию ионов в мембране
на границе с раствором:
(^) (ХХ.4.2)
где у — коэффициент распределения иона или заряженного комплекса между мем-
мембраной и водой. Если поверхностный потенциал отрицателен, что характерно для
большинства клеточных мембран и многих БЛМ, то примембранная концентрация
катионов повышена, а соответственно повышена и концентрация катионов в мем-
мембране на границе с раствором. ?
Значение дипольного потенциала определяет в качестве одной из составляю-
составляющих высоту потенциального барьера для перехода заряженных частиц в мембрану.
Так как проводимость мембраны g пропорциональна произведению равновесной
концентрации заряженных частиц в мембране у границы с раствором на константу
скорости их перемещения через мембрану v, то с учетом (ХХ.4.2) получаем простую
формулу, описывающую зависимость проводимости от граничного потенциала:
. (XX.4.3)
Валентность z в (XX.4.3) относится к заряду транспортируемого иона в случае
прямого прохождения иона и к заряду комплекса ион-переносчик в случае индуци-
индуцированного ионного транспорта.
Из уравнения (XX.4.3) видно, что увеличение отрицательного поверхностного
потенциала (при неизменном значении дипольного потенциала) должно сопрово-
сопровождаться увеличением проводимости БЛМ, индуцируемой положительно заряжен-
заряженными комплексами ион-переносчик. Экспериментальное исследование зависимости
проводимости БЛМ, индуцированной положительно заряженным ионофорным ком-
комплексом нонактин-калий, полностью подтверждает это предположение. Так как
заряд БЛМ образуется в результате диссоциации кислотных и основных групп
головок фосфолипидов, то он меняется в зависимости от рН, что приводит к росту
проводимости с увеличением рН в присутствии нонактина. В соответствии с фор-
формулой (XX.4.3) проводимость заряженных БЛМ, индуцируемая нонактином, при
нейтральных и щелочных значениях рН снижается с увеличением ионной силы, что
вызвано экранированием поверхностного заряда, уменьшением значения ср8 и со-
соответствующим снижением равновесной концентрации положительно заряженных
носителей тока в мембране (рис. XX. 13).
Дипольный модификатор салициламид в концентрации 10 мМ повышает в
20 раз проводимость БЛМ для катионов и во столько же раз снижает проводимость
для анионов, но не оказывает влияния на электрокинетический (дзета) потенциал
везикул. Указанные изменения обусловлены сдвигом дипольного потенциала на
величину около 75 мВ. Флоретин в концентрации 10 ~4 М повышает проводимость
БЛМ для катионов в 1000 раз, что соответствует сдвигу дипольного потенциала
на 180 мВ.
Если известна плотность п расположения дипольных групп, ориентированных
перпендикулярно плоскости мембраны, и известна величина дипольного момента [i,
i 4. Влияние поверхностного и дипольного потенциалов на скорость ионного транспорта 113
ft См
ю-2 h
10-5
10
ю~6
Ю-8
*J
23456789 10 рН
Ю-3 Ю-2 Ю-1 cLiCl, мМ
Рис. ХХ.13.
Влияние поверхностного заряда на индуцированную нонактином проводимость
БЛМ (g):
I — влияние рН на проводимость БЛМ из амфотерного фосфатидилэтаноламина, II — влияние
ионной силы на проводимость БЛМ из фосфатидилэтаноламина при различных рН A — 10,9; 2 —
5,5; 3 — 2,4)
можно оценить дипольныи потенциал:
Фд =
пу.
so '
(ХХ.4.4)
Значения дипольных моментов некоторых химических связей и молекулярных
групп приведены в таблице XX. 1.
При расчетах по (ХХ.4.4) необходимо учитывать, что дипольныи момент вели-
величиной один дебай соответствует A/3) • 10~29 Кл • м в системе СИ.
Изменение проводимости БЛМ при адсорбции на ней заряженных детергентов
и ионов многовалентных металлов также объясняется изменением повехностного
потенциала БЛМ.
Таблица XX. 1.
Дипольные моменты молекулярных групп и химических связей (по S. Ohki, 1985)
Дипольные моменты связей в миллидебаях
СН2
ц = 0 -*Ч
СН2 ц = 360 (мД)
I /
с+ = о
ц = 170 -*-/° \ = о
+СН2
ц = 0 -М
сн3
Дипольные моменты групп в дебаях
Группа
СНз-С
С-С1
С-Вг
NH3-C
C-CN
C-NC-2
С-ОН
С-ОСНз
С-СООН
Алифатические
соединения
0
2,1
2,0
0,8
3,8
3,5
1,7
1,3
1,7
Ароматические
соединения
0,4
1,6
1,5
1,5
3,9
3,9
1,6
1,3
1,6
Глава XXI
Ионный транспорт в каналах
§ 1. Дискретное описание транспорта
Классическое описание транспорта ионов через биологические мембраны основано
на представлении о диффузии не взаимодействующих между собой заряженных ча-
частиц в сплошной однородной среде. Электродиффузионные уравнения, полученные
в приближении постоянного поля (приближение Гольдмана), составляют теоретиче-
теоретическую основу электрофизиологии. Это уравнения [см. (XIX.2.4); (XIX.2.10)], описы-
описывающие поток одного вида ионов через мембрану, а также мембранный потенциал
в условиях нулевого электрического тока:
т — zFyP со ~ с% ехр(гРср/ДГ) . ,
3 ~ RT l-expizFcf/BT) ' (XXI.1.1)
¦\У Уравнения (XXI.1.1) и (XXI.1.2), выведенные в приближении постоянного поля,
основываются на следующих постулатах: 1) мембрана представляет собой го-
гомогенную фазу; 2) профиль электрического потенциала в мембране линеен (d(p/dx =
= const); 3) концентрация иона в мембране на границе с раствором пропорциональна
концентрации этого иона в среде с коэффициентом пропорциональности у; 4) ионы
движутся через мембрану независимо, не взаимодействуя между собой.
Если представление о линейной зависимости потенциала от расстоягия в первом
приближении оправдвно по отношению к тонким мембранам с толщиной sj 10 нм,
то другие предпосылки электродиффузионной теории в случае ионного транспорта
нарушаются. ?
Мембрана не является однородной фазой для движения ионов, поскольку пе-
перенос ионов через мембраны осуществляется через специализированные участки —
ионные каналы, представляющие собой липопротеиновые комплексы сложной струк-
структуры.
В узких каналах (натриевый — 0,31 х 0,51 нм, калиевый — 0,45 х 0,45 нм) не-
невозможна независимая диффузия, а допустимо только однорядное движение ионов.
Вследствие узости поры в канале могут происходить сильные ион-ионные взаимо-
взаимодействия.
Различия в поверхностных потенциалах на концах поры могут привести и к раз-
различным значениям коэффициента распределения. Возможно также существование
локальных неоднородностей электрического поля, связанных с зарядами белковой
1. Дискретное описание транспорта
115
молекулы, образующей канал. Наконец, экспериментальные данные показывают,
что в натриевом канале входящий и выходящий потоки подчиняются принципу
независимости [см. (XIX.2.12.)] в том случае, когда через канал идет Na+, но не
другие ионы; калиевый канал в гигантском аксоне кальмара вовсе не подчиняется
принципу независимости.
Таким образом, существуют явления, которые нельзя объяснить в рамках пред-
представлений о свободной диффузии, — это взаимодействие потоков, а также блокиров-
блокировка канала при высоких концентрациях электролита.
^—р В последнее время сформировалась новая теория, в основе которой лежат общие
физические принципы.
1. Поступление иона в канал сопровождается замещением воды гидратной обо-
оболочки на полярные группы, выстилающие полость канала.
2. Особенности взаимодействия иона с молекулярными группами канала учи-
учитываются соответствующими профилями потенциальной энергии иона в канале,
который представляется рядом последовательных потенциальных ям и барьеров.
3. Ион достаточно долго (по сравнению со временем тепловых колебаний) за-
задерживается в каждой потенциальной яме. Перескок возможен только в пустую
яму. Второй ион не может попасть в занятую потенциальную яму из-за электроста-
электростатического взаимодействия с уже находящимся там ионом.
4. Перескоки между ямами совершаются под действием тепловых флуктуации.
Вероятность перескока зависит от приложенного электрического поля. ?
Рис. XXI. 1.
Энергетический профиль в трехбарьерной модели ка-
канала (I) в отсутствие поля A) и при наложении на
мембрану разности электрических потенциалов B),
и профиль электрического потенциала ср на мембра-
мембране (II):
Со, Ci — концентрации электролита в окружающем мембрану
растворе, Е — высота основного центрального барьера, z —
валентность иона, F — число Фарадея, ~] и j~—односторон-
j~—односторонние потоки иона через канал
Исходя из этих предположений уравнение для потока ионов можно вывести на
основе теории абсолютных скоростей реакций Эйринга, если рассматривать транс-
транспорт ионов как серию последовательных перескоков через энергетические барьеры
в канале. Наиболее простым и достаточно общим оказывается случай, когда в мем-
мембране существует всего три кинетических барьера. Боковые барьеры соответству-
соответствуют входным участкам канала, где происходит первичный процесс дегидратации,
центральный барьер — селективной области (селективный фильтр). Если скорость
переноса ионов через канал лимитируется центральным энергетическим барьером,
который расположен посередине толщины мембраны (рис. XXI.1), то односторонние
116
Глава XXI. Ионный транспорт в каналах
ионные потоки определяются уравнениями [см. (XIV.1.1
— + J^)j = covexp (-
= с^ехр [- (— - |^jj = Civexp
(XXI.1.3)
где А — константа, Е — высота барьера в отсутствие электрического поля, v —
константа скорости перехода через основной барьер в отсутствие электрического
поля.
Величину F(f/RT часто называют безразмерным потенциалом. Вводя ф =
= F(f/RT в уравнения (XXI.1.3), получим выражение для тока, переносимого
ионами данного вида:
= zF(J - 7) = zFv(a
- с0
(XXI.1.4)
В условиях симметричного ионного окружения (с0 = С{ = с) вольтамперная харак-
характеристика канала описывается формулой
(XXI. 1.5)
- ехр(-,гф/2)) =
sh x = - (exp x — ехр(—ж)).
Рис. XXI.2.
Профили энергии в каналах с внутрен-
внутренней лимитирующей стадией (I, 1) и гра-
граничной лимитирующей стадией (I, 2)
и соответствующие вольтамперные ха-
характеристики каналов (II):
I — ток, ф — электрический потенциал; фх, фг,
Фз — падение напряжения на участках мембра-
мембраны, соответствующих трем энергетическим ба-
барьерам
^—р Таким образом, если ток через канал определяется скоростью переноса ионов
через основной энергетический барьер, расположенный в центре мембраны, то
вольтамперная характеристика имеет форму гиперболического синуса: с ростом
напряжения на мембране проводимость возрастает (согласно приближению посто-
постоянного поля, мембрана, находящаяся в симметричном ионном окружении, обладает
линейной вольтамперной характеристикой (т.е. проводимость постоянна). ?
По форме вольтамперной характеристики ионного канала можно выявить,
какая стадия, граничная или внутренняя, определяет перенос иона через канал.
Рис. XXI.2 иллюстрирует соотношение между профилем энергии (I) и формой
вольтамперной характеристики канала (II)- Если ток через канал определяется
§ 2. Блокировка и насыщение канала 117
переносом через центральный барьер, то, как видно из (XXI.1.5), вольтамперная
характеристика будет наклоняться к оси токов (кривые 1). Если же ток опре-
определяется скоростью входа в канал, то при больших напряжениях на мембране
все ионы, входящие в канал, будут переноситься через него, а ток стремится
к насыщению (кривые 2). Константы скорости переноса ионов через боковые
барьеры слабо зависят от электрического поля, поскольку приложенная к мембране
разность потенциалов практически вся падает на внутренней части мембраны
(падение напряжения срг), а падение потенциала на границе незначительно (падение
напряжения cpi и срз)- На Рис XXI. 2 показано, что суммарный скачок потенциала на
мембране складывается из небольших по величине скачков потенциала на границах
({pi и (рз) и основного падения потенциала на внутренней части мембраны.
Как видно из уравнений (XXI.1.3), отношение односторонних потоков равно
что совпадает с формулой Уссинга [см. (XIX.2.12)], выведенной на основе элек-
электродиффузной модели. Это является следствием того, что выражения (XXI.1.3)-
(XXI. 1.6) были получены для случая разбавленных растворов ионов, когда канал
большую часть времени остается пустым и ионы «не мешают» друг другу. Однако
и в этом случае симметрия вольтамперной характеристики существенным образом
зависит от положения основного барьера относительно середины мембраны. При
расположении основного энергетического барьера у одной из сторон мембраны об-
обнаруживается эффект выпрямления: поток ионов в одном направлении существенно
зависит от потенциала, а встречный поток слабо чувствителен к изменениям мем-
мембранного потенциала.
§ 2. Блокировка и насыщение канала
В теории постоянного поля проводимость мембраны (для иона г), находящейся
в симметричном ионном окружении [см. (XIX.2.6)], должна линейно возрастать с
повышением концентрации электролита
\—? Теория однорядного транспорта в канале учитывает нелинейные и немонотон-
немонотонные зависимости проводимости каналов от концентрации. Приведенные форму-
формулы (ХХ1.1.3)-(ХХ1.1.5) справедливы лишь при низких концентрациях электролита,
когда канал большую часть времени остается пустым. При высоких концентрациях
ионов оба участка связывания на «входе» и «выходе» меняют свои состояния не
только в процессе самого транспорта через канал, но и за счет взаимодействия с
омывающими растворами. Иными словами, скорость транспорта в канале должна
зависеть от вероятности заполнения ионами участков связывания на границах мем-
мембраны, что может приводить к заполнению обоих мест связывания и блокировке ка-
канала при высоких концентрациях электролита. Рассмотрим модель канала с двумя
центрами связывания и одним основным энергетическим барьером (рис. XXI.3). ?
118
Глава XXI. Ионный транспорт в каналах
Каждый участок связывания может находиться в одном из двух состояний: за-
заполненном или незаполненном. Вероятность заполнения входного участка канала 0
ионами зависит от их концентрации и может быть найдена из условия равновесия
потоков, направленных из раствора в канал и обратно. Так, для левого участка
связывания условие равенства потоков имеет вид
- 0) = к2@,
(XXI.2.2)
где с — концентрация иона в среде, A — 0) — вероятность того, что участок свя-
связывания свободен, a fci и &2 — константы. Отсюда следует
0 =
к\с
(ki/k2)c
где у = к\/к2 —коэффициент распределения иона. Соответственно
1-0 = A + ус).
(XXI.2.3)
(XXI.2.4)
Уравнение (XXI.2.3) показывает, что 0 = ус/A + ус) линейно возрастает с увели-
увеличением с в области низких концентраций и выходит на плато при высоких концен-
концентрациях.
Рис. XXI.3.
Симметричный энергетический профиль модели
канала:
с — концентрация электролита в окружающем растворе;
ki,k2 —константы сорбции и десорбции в участках связы-
связывания А и В, v — константа преодоления основного энерге-
энергетического барьера
Односторонний поток слева направо в канале можно выразить в виде произве-
произведения ©лA ~~ 0вM которое отражает вероятность нахождения канала в состоянии
1 0 (левая яма занята ионом, правая — пустая), умноженного на потенциалзависи-
мую константу скорости перехода иона через центральный барьер в состояние 0 1
(левая яма пуста, правая занята ионом):
3 =«
(XXI.2.5)
¦\У Так как ®а и A — ®в) определяются концентрациями электролита по разные
стороны мембраны, то, согласно (XXI.2.5), односторонний поток зависит от
концентраций иона в обоих омывающих мембрану растворах. Следовательно, прин-
принцип независимости ионных потоков в применении к каналам при высоких концен-
концентрациях ионов не соблюдается [см. (XIX.2.12); (XXI.1.6)]. ?
3. Функции состояния канала
119
Если концентрации транспортируемого иона в обоих омывающих растворах
одинаковы и равны с, то односторонний поток равен
= 0(l-0)vexp(
ф-F1 \ _ ус
2RTJ
rcl + rc
(-
1 / cpF \
vexp I —x— I =
2RTJ
При малых концентрациях, когда ус <С 1, поток иона через канал возрастает
пропорционально концентрации, однако с дальнейшим ростом концентрации
знаменатель в предэкспоненциальном множителе усA + Yc)~2 растет быстрее,
чем числитель, и поток иона через канал тормозится (рис. XXI.4). Таким образом,
для канала с двумя участками связывания («двухместный канал») характерно
снижение проводимости при высоких концентрациях иона в окружающих раство-
растворах, когда оба центра связывания заполнены (канал находится в состоянии 1 1).
Это наблюдается, например, для грамицидиновых каналов, формируемых в БЛМ,
в присутствии повышающихся концентраций Cs+.
В экспериментах зависимость проводимости
канала от концентрации ионов часто характеризу-
характеризуется насыщением, которое обусловлено нахождени-
нахождением в канале только одного иона. Второй ион не мо-
может войти в канал из-за электростатического взаи-
взаимодействия с ионом, уже находящимся в канале. С
ростом концентрации электролита односторонний
поток через такой «одноместный» канал стремится
к насыщению. Аналогичным образом меняется и
проводимость. Такие насыщающиеся зависимости
проводимости характерны, например, для каналов,
образуемых в БЛМ грамицидином в присутствии
5 мМ-5 М растворов NaCl, а также для амфотери-
циновых каналов при физиологических концентра-
концентрациях электролита.
Рис. XXI.4.
Эффект блокировки потока
ионов через канал:
с — концентрация электролита,
~] — односторонний поток через
канал
§ 3. Функции состояния канала
^—р Ионный канал с одним участком связывания может находиться только в двух
состояниях: в свободном или заполненном. Канал с двумя участками связыва-
связывания может находиться в четырех состояниях, между которыми возможны переходы,
изображенные на схеме (рис. XXI.5). ?
Под функциями состояния канала понимают вероятности нахождения канала
в отдельных состояниях (т.е. в состояниях 1 0; 0 1; 1 1; 0 0). Проводимость кана-
канала (g) зависит от вероятности нахождения канала в состояниях 1 0 и 0 1, поскольку
суммарный поток определяется выражением
J = l'F(l 0) - l"F@ 1), (XXI.3.1)
где F(l 0) и F{0 1) — вероятности состояний 1 0 и 0 1 соответственно, а /' и
I" — потенциалзависимые константы скорости перехода ионов через центральный
120
Глава XXI. Ионный транспорт в каналах
барьер:
(XXI.3.2)
В модели однорядного транспорта функции состояния F@ 0), F(l 0) и другие
находят, решая систему дифференциальных уравнений, составленных на основе
приведенной кинетической схемы (см. рис. XXI.5, IT и §2 гл. IV). Например, ба-
балансное уравнение для функции состояния F(l 0) записывается в виде
0)
= F@
Dvexp (-
t_2 exp
-, «P (-
(XXI.3.3)
где (pi, cp2 и фз — падение потенциала на боковых и центральном барьерах ((pi + (р2 +
+ (рз = ф)- Аналогичным образом записывают уравнения для dF@ Q)/dt; dF(l l)/dt
II
j j о»/ w
О 1
о о
Рис. ХХ1.5.
Кинетическая схема переходов между отдельными состояниями для трехбарьерного
канала. I — профили энергии и потенциала (р; II — модель переходов:
с — концентрация электролита в водных растворах, fei, k—i, Лг, А—2—константы преодоления
боковых барьеров, /',/"—потенциалзависимые константы скорости перехода ионов через цен-
центральный барьер, 0 — пустые участки связывания, 1 — заполненные участки связывания (связь
между константами In v дается уравнением (XXI.3.2)
и dF{0 l)/dt. Поскольку сумма вероятностей всех состояний канала равна единице,
условие нормировки имеет вид
F(l 1) + F(l 0) + F@ 1) + F@ 0) = 1. (XXI.3.4)
Для решения системы в стационарном случае используют метод диаграмм.
i 4. Ионный канал как динамическая структура
121
§ 4. Ионный канал как динамическая структура
Если один из участков связывания в канале заполнен, то поступление в свободный
участок второго иона будет затруднено в связи с необходимостью дополнительных
затрат на преодоление энергии кулоновского взаимодействия с уже находящимся в
канале ионом. Иначе говоря, попадание иона в левую потенциальную яму приведет к
повышению энергетического барьера, соответствующего переходу иона из раствора
в правую потенциальную яму (рис. XXI.6).
Таким образом, при учете кулоновских взаимодействий вид энергетического
профиля зависит от положения и числа ионов в канале. В связи с изменением высоты
барьеров изменяются и константы скорости перехода через отдельные барьеры. На-
Например, константа скорости, соответствующая поступлению второго иона в канал,
будет равна
к\° = к^° exp(-W/2RT), (XXI.4.1)
где W — энергия кулоновского взаимодействия: W = e2/sr; r — расстояние между
потенциальными ямами.
Рис. XXI.6.
Зависимость энергетического профиля от заполнения ка-
канала при учете кулоновских взаимодействий
к\ —константы поступления иона в раствор, ki — константы вы-
выхода иона из раствора. Верхние индексы соответствуют разным
состояниям канала с разным заполнением участков связывания
\—? При изменении числа частиц в канале энергетические профили изменяются
таким образом, что вход второго иона в канал по сравнению с входом пер-
первого затрудняется, а выход второго иона из канала, напротив, идет очень легко.
Подробный анализ модели показывает, что кулоновское ион-ионное взаимодействие
значительно ускоряет общий ионный транспорт через канал.
Высота барьеров может претерпевать динамические изменения не только за
счет кулоновских взаимодействий ионов в канале, но и в результате конформа-
ционных перестроек белка, формирующего ионный канал, которые могут иници-
инициироваться перескоками иона между отдельными участками связывания. Сильное
электрическое поле иона, попадающего в канал, вызывает поляризацию и перео-
переориентацию близлежащих полярных групп. В результате появления такого крнфор-
мационно неравновесного состояния смещается уровень потенциальной энергии в
участке связывания и изменяется высота ближайших барьеров. ?
122 Глава XXI. Ионный транспорт в каналах
Особенно важное значение могут иметь циклические изменения конформации
мембранных белков, обусловленные биоэнергетическими процессами. Такие перио-
периодические конформационные перестройки протекают, по-видимому, в АТФазе энер-
госопрягающих мембран в процессе ее функционирования, в цитохромах при изме-
изменении их окислительно-восстановительного состояния, в бактериородопсине гало-
фильных бактерий при возбуждении хромофорной группы (см. гл. XXIV; XXX).
Это обстоятельство послужило основой для гипотезы о том, что системы активно-
активного транспорта ионов, использующие энергию света, АТФ или разности редокс-по-
тенциалов, представляют собой трансмембранный ионный канал с регулируемой
высотой энергетических барьеров (см. §4 гл. XXII).
§ 5. Транспорт в открытом канале. Теория селективности
Исследования ионной проницаемости возбудимых мембран нервных волокон каль-
кальмара привели к выводу о существовании в этих мембранах двух основных типов
каналов: селективно пропускающих Na+ и селективных для К+. Следует отметить,
что представления о наличии у биологических мембран ионной селективности сло-
сложились задолго до работ А. Ходжкина и А. Хаксли. Избирательная проницаемость
клеточной мембраны нервов для К+ и возрастание проницаемости при возбуждении
для других ионов предполагались Дж. Бернштейном A902). В теории пор (теория
молекулярного сита) П. Бойля и Е. Конвея A941) проницаемость мембранных пор
для ионов определялась прежде всего гидратационным радиусом ионов. Предпола-
Предполагали, что меньший по размеру гидратированный ион К+ свободнее, чем гидрати-
рованный ион Na+, проникает через клеточные мембраны.
Современный взгляд на селективность биомембран основан главным образом
на теории ионообменной селективности, созданной Дж. Эйзенманом применительно
к ионоселективным стеклянным электродам. Сродство иона к участкам связывания
в ионных каналах определяется значением свободной энергии перехода иона из
раствора в канал, которое зависит от следующих факторов.
¦\У Проникновение иона в пору облегчается тем, что возрастание свободной энер-
гии, обусловленное потерей гидратной оболочки E00-700 кДж/моль), компен-
компенсируется понижением энергии при взаимодействии с дипольными группами канала.
Другим важным фактором, облегчающим проникновение иона в канал, явля-
является кулоновское взаимодействие транспортируемого катиона с фиксированным
анионным центром в просвете канала. Наличие дипольных групп в канале и фикси-
фиксированных зарядов приводит к тому, что энергия перехода иона из раствора в канал
не превышает ~ 30,5 кДж/моль. ?
Переход иона из раствора в полость канала можно формально рассматривать
как перенос иона из среды с диэлектрической проницаемостью ss в среду с ди-
диэлектрической проницаемостью sp и последующее приведение иона в контакт с
фиксированным отрицательным зарядом. Поэтому изменение свободной энергии
при переходе одновалентного иона из среды в полость канала записывается в виде
). f. , (XXI.5.1)
(a + c)zp
§ 5. Транспорт в открытом канале. Теория селективности 123
е2
где -. ч энергия кулоновского взаимодействия иона радиуса а с фиксирован-
(а + с)ер
ным в стенке канала анионом радиуса с. В целях более компактной записи энергии
дегидратации проникающего иона [см. (XVIII.2.6)] и энергии кулоновского взаимо-
взаимодействия, формула (XXI.5.1) приведена в системе СГС. Как видно из (XXI.5.1) и
показано на рис. XXI.7, зависимость AW от ионного радиуса немонотонна и весь-
весьма чувствительна к размеру фиксированного аниона. Соответственно лучше всего
связываются в канале ионы, для которых изменение свободной энергии минимально.
Порядок расположения катионов щелочных металлов в рядах селективности
меняется в зависимости от предполагаемого радиуса анионного центра. Для самых
больших анионных радиусов энергия кулоновского взаимодействия мала и опреде-
определяющим фактором является взаимодействие катиона с водой. В этом случае срод-
сродство катиона к участкам связывания в мембране возрастает с увеличением ионного
радиуса в ряду связывания: Cs > Rb > К > Na > Li.
Для самых малых анионных радиусов, наоборот, преобладает притяжение ка-
катиона к фиксированному отрицательному заряду аниона и тогда образуется ряд
6.W
Рис. XXI.7.
( ^>ч-«^___ Изменение свободной энергии AW иона радиуса а при
а переходе из раствора в мембранную пору с фиксиро-
фиксированным анионом:
1 и 2 — кривые зависимости энергии дегидратации и энергии
кулоновского взаимодействия от ионного радиуса;
3 — сумма кривых 1 и 2
связывания, в котором катионы меньшего радиуса связываются прочнее, чем круп-
крупные: Li > Na > К > Rb > Cs. Существуют другие переходные ряды для промежу-
промежуточных значений радиуса фиксированного отрицательного заряда.
^—р В случае проникновения через канал органических катионов важен не только
их размер, но и способность образовывать водородные связи. Так, из трех
изостерических молекул — гидроксиламина, гидразина и метиламина — метиламин
практически не проходит через Ма+-канал, так как не образует водородных связей
с атомами кислорода в выстилающих группировках канала. ?
Наблюдаемая в опытах резкая зависимость проницаемости ионов от их геоме-
геометрии и размеров говорит о том, что она определяется топографией селективного
фильтра, соответствующего наиболее узкому месту. Когда размер иона достигает
критического значения, его проницаемость падает до нуля. В целом, однако, струк-
структурные факторы, определяющие проницаемость, не сводятся лишь к геометрии иона
и селективного фильтра, а должны включать детали химического строения макро-
макромолекул канала, а также сопряженных с перемещением ионов движений молекул
воды в поре. Метод динамического моделирования внутримолекулярной подвижно-
подвижности (гл. XI, § 3) позволяет изучать динамику движения ионов на коротких временах
10~8-10~9 с, которые близки к разрешающей способности метода.
124
Глава XXI. Ионный транспорт в каналах
Моделировались движения молекул воды в узкой части поры канала К+
(~ 0,3 нм-0,5 нм), через которую проходят ионы (Грин, 1991). Оказалось, что
наличие в стенках каналов заряженных групп белка (СОО~, NH^") так изменяет
характер движения воды внутри поры, переводя воду в связанное состояние,
что молекулы воды закрывают узкое место канала и блокируют тем самым
прохождение ионов. Подобные механизмы могут лежать в основе управления
ионной проницаемостью канала (см. Воротные токи, гл. XXIII).
§ 6. Общие свойства ионных каналов нервных волокон
Среди различных ионных каналов биологических мембран наиболее полно охарак-
охарактеризованы два основных типа каналов, содержащихся в нервных волокнах: Na+-
каналы и К+-каналы.
Соответствующие данные получены главным образом на основании кинетики
прохождения ионных потоков через каналы при различных воздействиях. В ре-
результате удалось установить общую схему функционирования каналов, структура
№+-канал
Рис. XXI.8.
Энергетические профили натриевого и
калиевого каналов возбудимых мембран:
1 и 2 — альтернативные модели Na^-канала
которых представляет собой сложный макромолекулярный комплекс, активно вза-
взаимодействующий с проходящим ионом. Однако прямые экспериментальные данные
о молекулярном строении каналов были получены сравнительно недавно, а именно
они позволяют по-новому осмысливать предлагаемые модели работы каналов. Мы
рассмотрим эти вопросы в последующих разделах.
Экспериментальные данные по транспорту ионов в Ма+-канале адекватно опи-
описываются на основе двух различных моделей с отличающимися профилями энергии
(рис. XXI.8) (кривые 1 и 2). Входящий и выходящий потоки Na+ в Ма+-канале
независимы; этот факт соответствует энергетическому профилю с высоким цен-
центральным барьером (кривая 1). Однако такая форма энергетического профиля не
согласуется с данными о существовании в селективном центре Na -канала фик-
фиксированной анионной группы, которое доказывается зависимостью проводимости
Ма+-каналов от рН среды. Протонирование кислотной группы (рК 5,2) приводит к
блокированию Ма+-канала. При физиологических значениях рН состоянию канала
с депротонированной кислотной группой больше соответствует профиль, в кото-
котором центральный энергетический барьер расщеплен на два (рис. XXI.8; кривая 2).
В таком канале фиксированный анионный центр, притягивая катионы, облегчает
их вход в канал. Однако тем самым одновременно затрудняется выход из основной
потенциальной ямы, который может облегчиться, когда в боковом участке связы-
связывания появляется второй катион. Электростатическое отталкивание способствует
выходу первого иона, и второй ион может заполнить центральную яму.
§ 6. Общие свойства ионных каналов нервных волокон 125
Согласно данным Б. Хилле, через Ма+-канал могут проходить различные орга-
органические катионы, размеры которых не превышают 0,3 х 0,5 нм, что соответствует
минимальному сечению поры. Размеры многих из проникающих ионов такие же,
как у частично гидратированного иона Na (рис. XXI.9). Очевидно, ион Na может
проходить через селективный фильтр, сохраняя в гидратной оболочке 1-3 молекулы
воды. На рис. XXI.9, Б приведен энергетический профиль Na-канала.
Органические катионы, способные к проникновению через Ма+-канал, не содер-
содержат метильнои (—СНз) или метиленовой (—СЕЬ— )-групп. Например, ионы гидрок-
силаммония (H3N"—ОН) и метиламмония (H3N"—СНз) обладают одинаковыми раз-
размерами порядка 0,45 х 0,38 х 0,38 нм. Однако Ма+-канал оказывается проницаемым
для гидроксиламмония и непроницаемым для метиламмония, в молекуле которого
содержится СНз-группа. Возможно, что вдоль стенок поры расположены атомы
кислорода, с которыми атом водорода ОН-группы гидроксиламмония может обра-
образовывать сильную водородную связь, уменьшая тем самым эффективный размер
иона. В результате обеспечивается прохождение иона через пору шириной всего
0,3 нм. Водородные атомы метильнои группы метиламмония не могут образовывать
водородные связи, поэтому данная группа остается слишком большой по размеру и
не проходит через пору.
Величины относительной проницаемости в Na- и К-каналах для ионов составля-
составляют соответственно: литий — 0,93; 0,02, таллий — 0,33; 2,3, метиламмоний — 0,007;
0,02.
Предполагаемый энергетический профиль для калиевого канала показан на
рис. XXI.8. Такой профиль соответствует условиям, когда наиболее медленной ста-
стадией транспорта является переход частиц через границу мембраны. Форма энер-
энергетического профиля предполагает также, что десорбция ионов замедлена отно-
относительно адсорбции из раствора. Подробный анализ модели с учетом указанных
предположений показывает, что канал все время находится в заполненном двухча-
двухчастичном состоянии. Поэтому выход частицы из канала в раствор сопровождается
последовательным сдвигом ионов по всему каналу. А так как число ям в канале
равно двум, то «порядок» реакции увеличивается вдвое. В этих условиях формула
Уссинга [см. (XIX.2.12)] не соблюдается:
У = ^ехр V—КГ ) = 6ХР 1 RT ) = ехР[2(Ф° ~Ф)]> (XXI.6.1)
где фо — равновесный нернстовский потенциал. Появление е2 в отношении односто-
односторонних потоков соответствует удвоению порядка реакции при переносе иона через
канал.
Эмпирический коэффициент п, появляющийся в так называемой обобщенной
формуле Уссинга (для К+-канала п = 2)
^^) (XXI.6.2)
по данным разных исследователей, варьирует в пределах 1,5-2,5, что хорошо со-
согласуется с теоретической моделью. Теория показывает, что число п в обобщенной
формуле Уссинга имеет смысл среднего числа ионов в канале.
126
Глава XXI. Ионный транспорт в каналах
А)
9,5
Вн
0-
Б)
В)
Рис. XXI.9.
Гипотетическая структура селективных фильтров Na- и К-каналов с находящимися
внутри ионами (по В. НШе, 1992).
A) Фронтальная проекция селективного фильтра; 1,1' — СОО группа; 2—6 — атомы
кислорода; масштабная сетка нанесена в десятых долях нанометра; в Na-канале
находится молекула воды.
Б) Энергетический профиль Na-канала. Обозначения А, В, С, D и Е соответству-
соответствуют энергиям иона на разных стадиях его перехода через канал. Уровни энергии
потенциальных барьеров для иона Na приведены в единицах RT. Для ионов с мень-
меньшей проникающей способностью пик С должен быть более высоким; ионам с более
сильным связыванием в канале соответствует более глубокая потенциальная яма В.
B) Вид селективного фильтра Na-канала в направлении, параллельном плоскости
мембраны. А, В, С', D и Е обозначают различные положения ионов в канале. В поло-
положении С ион проходит через наибольшее сужение канала—селективный фильтр, в
котором присутствует заряженная СОО~ группа (снизу) и атом кислорода (сверху),
а также молекула воды. Темные зоны сверху и снизу изображают устье канала.
i 6. Общие свойства ионных каналов нервных волокон
127
0 5 4
0,5 нм
Рис. XXI.10.
Калиевые каналы аксона (I) и сарко-
плазматического ретикулума (II):
1—широкое устье диаметром около 1 нм,
2 — узкая часть поры, 3 — критическое су-
сужение (селективный фильтр), штриховыми
линиями показан возможный внешний уча-
участок связывания тетраэтиламмония, 4 —
белковый компонент, 5—липидный бислой,
о, г — соответственно внешняя и внутренняя
стороны мембран
Калиевые каналы содержат широкое устье со стороны цитоплазмы. Это устье
может блокироваться тетраэтиламмонием и более крупными его производными,
такими как пентилтриэтиламмоний и нонилтриэтиламмоний (рис. XXI. 10). Эф-
Эффективность блокаторов возрастает с ростом длины гидрофобной углеводородной
цепи. Если повысить наружную концентрацию К+, входящий поток К+ как бы
выталкивает крупные катионы блокаторов во внутренний раствор, в результате
чего ускоряется выход каналов из блокированного состояния. Высокая эффектив-
эффективность ионов-блокаторов с длинной гидрофобной цепью свидетельствует о наличии
в устье канала гидрофобных участков. Для того чтобы ионы тетраэтиламмония и
нонилтриэтиламмония могли входить в пору, диаметр устья должен быть не менее
0,8 нм. Узкая часть поры проницаема для ионов с размерами от 0,26 до 0,3 нм и
непроницаема как для меньших, так и для больших ионов. Ионы, размер которых
больше 0,3 нм, не могут проходить через пору по стерическим причинам. Ионы,
размер которых меньше 0,26 нм, недостаточно эффективно взаимодействуют с
атомами О, которые расположены в стенках поры (см. рис. XXI.9). Ион К эффек-
эффективно взаимодействует со всеми атомами О, расположенными в стенках поры, и его
энергия в поре незначительно больше, чем в воде. Ион Na эффективно связывается
только с двумя атомами О в селективном фильтре, другие атомы не могут подойти
к Na+ из-за жесткости стенок поры. По этой причине потенциальная энергия Na+
значительно выше, чем в воде, и ион не проходит через селективный фильтр К+-
канала. В целом К+-каналы лучше различают ионы, чем Na-каналы.
Проводимость одиночного К+-канала в аксонах кальмара составляет около
10 пСм. В мембранах саркоплазматического ретикулума обнаружены высокоспе-
высокоспецифичные К+-каналы, проводимость которых почти на порядок выше и составляет
130 пСм. Предполагаемое строение таких каналов показано на рис. XXI. 10, П. Диа-
Диаметр широкого устья каналов составляет не менее 1 нм. Узкая часть поры имеет
диаметр около 0,7 нм и длину 1 нм. В узкой части канала находится селективный
фильтр с диаметром пропускного отверстия 0,4-0,5 нм. Представляется вероятным,
что К+-каналы с низкой и высокой проводимостью построены по общей схеме, т. е.
имеют широкое устье, в котором происходит свободная диффузия ионов, узкую
цилиндрическую часть поры, на которой в основном падает трансмембранная раз-
разность потенциалов, и селективный фильтр. Различие в проводимостях К+-каналов
двух типов может быть обусловлено лишь различной длиной узкой части канала.
128 Глава XXI. Ионный транспорт в каналах
Метод локальной фиксации напряжения (пэтч-кламп). Ионные каналы биоло-
биологических мембран исследуют главным образом с помощью метода локальной фик-
фиксации напряжения, называемого также методом пэтч-кламп. В этом методе на-
напряжение фиксируют на микроучастке клеточной поверхности, что позволяет ре-
регистрировать токи одиночных ионных каналов. Первые такие измерения, были
осуществлены Э. Неером и Б. Сакманом в 1976 г. В качестве измерительного элек-
электрода используют стеклянную микропипетку с диаметром отверстия 0,5-1 мкм и
электрическим сопротивлением около 5 МОм. С помощью специального устрой-
устройства в пипетке можно создать пониженное давление и втянуть фрагмент клеточ-
клеточной мембраны в кончик микроприсоски. Клеточная мембрана образует плотный
и механически прочный контакт о торцом микропипетки, благодаря чему обеспе-
обеспечивается надежная электрическая изоляция мембранного фрагмента от остальной
поверхности клетки и внеклеточного раствора. Сопротивление изоляции достига-
достигает 100 ГОм (гигаомный контакт), что обусловливает низкие значения тока утеч-
утечки и низкий уровень шумов тока. В этих условиях могут быть зарегистрирова-
зарегистрированы изменения тока, связанные с открыванием и закрыванием отдельных ионных
каналов.
Благодаря механической прочности контакта между стеклом в торце микро-
микропипетки и клеточной мембраной мембранный фрагмент можно отделить от клет-
клетки, получив доступ к его внутренний поверхности, либо разрушить мембранную
перегородку в кончике пипетки и получить сравнительно низкоомный контакт с
внутриклеточной средой. В зависимости от условий различают несколько вари-
вариантов измерений: 1) на микроучастке мембраны с прикрепленной клеткой, 2) на
изолированном участке мембраны с внешней поверхностью, обращенной внутрь пи-
пипетки, 3) на изолированном фрагменте, внешняя поверхность которого обращена
наружу, 4) измерение интегральных токов на целой клетке (метод внутренного
диализа). Каждый из вариантов отведения токов имеет свои преимущества. Реги-
Регистрация в режиме «клетка прикреплена» обеспечивает условия, наиболее близкие к
физиологическим для работы ионных каналов. При этом сохраняются механизмы
внутриклеточной регуляции канальной активности и связи канала с перифериче-
периферическими слоями цитоплазмы. Опыты на изолированных фрагментах обеспечивают
возможность полного контроля ионного состава растворов с обеих сторон мембра-
мембраны. Метод внутриклеточного диализа позволяет измерять ионные токи через всю
клеточную поверхность на клетках малого размера (диаметр 10-20 мкм) в условиях
постепенного вымывания компонентов цитоплазмы и их замещения на раствор,
заполняющий микроприсоску.
Измерения токов одиночных каналов при различных напряжениях и разном
ионном составе окружающих растворов дают сведения о проводимости каналов,
среднем времени открытого и закрытого состояний, несут информацию о потенци-
алозависимости и селективности каналов, и дают основу для построения кинетиче-
кинетических моделей функционирования ионных каналов. Этот метод позволяет также ис-
исследовать модификации структурно-функциональных характеристик каналов при
воздействии различных фармакологических препаратов.
Общая схема Na+-, K+-канала. В главе XXIII мы рассмотрим подробно моле-
молекулярные механизма проводимости Na - и К+-каналов и ее изменения в процессе
генерации нервного импульса. Сейчас заметим лишь, что открывание каналов обес-
i 6. Общие свойства ионных каналов нервных волокон
129
Лшгадный бислой
Наружная сторона (+:
мембраны
Сенсор напряжения
Цитоплазматическая
сторона
Сужение поры
Селективный филь'
Остатки
Сахаров
Белки, фиксирующие канал
на структурных элементах
цитоплазмы
Рис. XXI. 11.
Схематическое изображение ионного канала (по В.НШе, 1992).
Канал изображен в виде расположенной в мембране макромолекулы со сквозной
полостью посередине. Часть молекулы, обращенная в наружный раствор, несет
гликозидные группы. Представления о функциональных участках канала—селек-
канала—селективном фильтре, воротах и сенсоре напряжения — основаны преимущественно на
методе фиксации напряжения и дополнены данными структурных исследований
печивается специальным молекулярным «воротным» устройством, которое откры-
открывает пору при изменении внешнего электрического потенциала.
На рис. XXI.11 (Хилле, 1993) приведена структурно-функциональная схема ка-
канала, где воротное устройство открывается о помощью управляющего сенсора,
чувствительного к внешнему электрическому полю. «Тело» канала состоит из транс-
трансмембранного белка, погруженного в липидный бислой. Как будет показано ниже,
макромолекула включает 1900-4000 аминокислотных остатков, уложенных в од-
одну или несколько полипептидных цепей, а также несколько сот сахарных остат-
остатков, ковалентно связанных с аминокислотами во внешнем пространстве. Внутрен-
Внутренняя поверхность поры включает в основном гидрофильные аминокислоты. Для от-
открытия и закрытия ворот канала требуется обратимое изменение конформации
130 Глава XXI. Ионный транспорт в каналах
белка, который тем самым переводит ворота в соответствующую позицию. Веро-
Вероятность открытия и закрытия канала в свою очередь определяется состоянием сен-
сенсора, который в канале электровозбудимых мембран содержит несколько заряжен-
заряженных групп, двигающихся под влиянием приложенного мембранного электрического
поля.
Эти индуцированные электрическим полем движения зарядов и вызывают необ-
необходимую для работы конформационную перестройку белка канала. Важная особен-
особенность работы Na+- и К+-каналов состоит в том, что при их открытии и закрытии
нарастание и исчезновение ионного тока в каждом из них в отдельности происходит
скачком и носит пороговый характер (рис. XXI.12).
Однако суммарные изменения тока в совокупности каналов, каждый из кото-
которых с определенной вероятностью скачком изменяет свое состояние, усредняются
статистически и в целом имеют плавный характер (рис. XXI. 12).
Общим свойством Na -каналов является их способность быстро активировать-
активироваться и открываться под действием деполяризующего импульса. После прекращения
короткого деполяризующего импульса канал быстро закрывается и происходит
его выход из активного состояния. Таким образом проводимость канала быстро
меняется, увеличиваясь или уменьшаясь в зависимости от приложенного импульса.
Наряду с этим существуют и более медленные процессы инактивации ^+-каналов,
которые лишают каналы способности открываться при активации. Инактивация
^+-каналов является причиной потери их возбудимости в условиях продолжитель-
продолжительной аноксии или ингибирования метаболических процессов.
Восстановление Na -канала после инактивации может наблюдаться в экспери-
экспериментах с двумя последовательными деполяризующими (—15 мВ) импульсами. После
первого импульса каналы активируются и открываются, а затем закрываются и
инактивируются. В течение времени перед приходом второго импульса часть ка-
каналов успевает восстановиться после инактивации. Поэтому амплитуда ответа на
действие второго импульса зависит от временного интервала, прошедшего после
прекращения действия первого импульса. Полное восстановление происходит по
экспоненциальному закону (т ~ 4-5 мс) и в свою очередь зависит от потенциала
покоя.
На К+-каналах многих клеток наблюдается быстрое увеличение калиевого то-
тока /к при возбуждении деполяризующим импульсом и открытии (активации) кана-
каналов, которое одновременно сопровождается более медленной их инактивацией.
Процесс инактивации К+-каналов включает быструю E00 мс) и медленную
A0-20 с) фазы. В обычных условиях состояние инактивации исчезает под влиянием
потенциала покоя на мембране.
Схему перехода между закрытым R, открытым О и инактивированным I со-
состояниями канала можно представить в виде
Как видно, канал может обратимо инактивироваться I, находясь как в открытом О,
так и в закрытом R состояниях. Вопрос о механизмах взаимного влияния этих
состояний мы рассмотрим позднее.
i 6. Общие свойства ионных каналов нервных волокон
131
А Токи одиночного Na-канала
-40 мВ
Б Токи одиночного К-канала
+50
-80
kioo мв
^^^f^^
Усредненный К-ток
Усредненный Na-ток
Г*
Время, мс
0 10 20
Время, мс
Рис. XXI. 12.
Токи одиночных каналов и интегральный ионный ток (по В.НШе, 1992).
А) Воротная функция одиночных Na-каналов. Пэтч-кламп регистрация токов оди-
одиночных Na-каналов в мышечном волокне мыши при ступенчатом сдвиге напряжения
от —80 до —40 мВ. Регистрация в конфигурации «клетка прикреплена» в условиях
деполяризации волокна ионами Cs. В верхней части рисунка изображены 10 после-
последовательных записей токов при полосе пропускания фильтра 3 кГц. Верхняя запись
тока отражает одновременное открывание двух каналов, остальные записи соот-
соответствуют открыванию лишь одного канала. Исследуемый мембранный фрагмент
(пэтч) возможно содержит > 10 Na-каналов. Нижняя часть рисунка изображает
токовую кривую, полученную в результате усреднения токов по ансамблю.
Б) Воротная функция одиночных К-каналов. Пэтч-кламп регистрация токов оди-
одиночных К-каналов в гигантском аксоне кальмара при ступенчатых сдвигах напря-
напряжения от —100 до +50 мВ. Во избежание контакта с окружающими шванновскими
клетками аксон был надрезан, и микропипетка прижата к цитоплазматической
поверхности мембраны. В верхней части рисунка приведены 9 последовательных за-
записей токов через каналы с проводимостью 20 пСм. Нижняя кривая изображает ре-
результат усреднения токов одиночных каналов по ансамблю (усреднение 20 записей).
132 Глава XXI. Ионный транспорт в каналах
§ 7. Молекулярное строение каналов
Интенсивное изучение химического строения каналов началось в биофизике в конце
1960-х годов. К этому времени стало ясно, что для выяснения механизмов активации
и инактивации каналов, их селективности, блокировки, прохождения ионов через
пору и других функциональных свойств необходимо знание структуры макромо-
макромолекул, входящих в состав канала. В середине 70-х годов было установлено, что
Ма+-канал представляет собой трансмембранный белок, погруженный в липидный
бислой. Этот же вывод был получен и в отношении другого типа каналов, изменение
проводимости которых достигается не за счет изменения электрического потенци-
потенциала на мембране, а в результате действия химических нейромедиаторов.
Ацетилхолиновый рецептор. Наиболее изученными являются активируемые
ацетилхолином каналы нервномышечных соединений позвоночных (двигательная
концевая пластинка). Пришедший к синапсу нервный импульс вызывает освобо-
освобождение в синаптическую щель нейротрансмиттера ацетилхолина:
СН3-СО-ОСН2СН-]М+-(СНз)з.
Последующая диффузия молекул ацетилхолина приводит к их связыванию в постси-
наптической мембране с рецепторными молекулами. Вследствие этого происходит
деполяризация постсинаптической мембраны (до 0 мВ), открытие в результате
этого Ма+-каналов и возникновение в мышечном волокне распространяющегося
потенциала действия.
Обратное восстановление поляризованного состояния достигается под действи-
действием фермента ацетилхолинэстеразы, который гидролизует ацетилхолин до ацетата
и холина. Ацетилхолиновый рецептор (электрического органа ската) представляет
собой комплекс, состоящий из четырех типов субъединиц (а, C, у и 8) с молекулярной
массой соответственно 40, 50, 60 и 65 кДа, которые входят в комплекс в соотноше-
соотношении а2$уЪ. Две а-субъединицы несут на себе два места связывания ацетилхолина.
Интактный ацетилхолиновый рецептор может быть встроен в липидную мембра-
мембрану, где он проявляет все основные свойства ионного канала: ион-селективность и
проводимость, чувствительность к действию ингибиторов.
Аминокислотная последовательность первых 54 остатков ацетилхолинового ре-
рецептора была определена химическим путем. Она оказалась сходной для всех че-
четырех типов субъединиц белка, которые, очевидно, кодируются гомологичными
генами. Полная структура белка была определена известными методами генной
инженерии. Так, знание частичной аминокислотной последовательности позволило
вначале провести клонирование и секвенирование копий ДНК, соответствующих
информационной РНК (мРНК) субъединиц белка ацетилхолинового рецептора. Та-
Такая комплементарная ДНК (кДНК) получалась, как известно, на основе мРНК с
помощью обратной транскриптазы. Затем транскрипты ДНК включались в ДНК
плазмид для последующего введения в клетки Escherichia coli и получения банка
кДНК, содержащего в качестве случайных отдельные участки исходной мессен-
джер-последовательности. Дополнительно синтезировались искусственные молеку-
молекулы ДНК, которые кодировали небольшую часть уже известной аминокислотной
последовательности белка-рецептора. Отбор нужных плазмид из всего исходного
набора проводили путем гибридизации ДНК плазмид с этими искусственно синте-
§ 7. Молекулярное строение каналов 133
зированными молекулами ДНК. Тем самым отбирались способные к гибридизации
молекулы ДНК плазмид и определялась последовательность их оснований, которая
уже включала и дополнительные, новые, кодирующие белок участки.
Повторяя эту процедуру, удалось в конце концов правильно расшифровать весь
кодирующий участок и на основе триплетного кода определить первичную амино-
аминокислотную последовательность субъединиц белка ацетилхолинового рецептора.
На рис. XXI. 13 приведена гипотетическая схема топографической организа-
организации отдельной субъединицы ацетилхолинового рецептора, содержащей сегменты
М4-М4. Как видно, полипептидная цепь пересекает мембрану четыре раза. Сегмен-
Сегменты Mi, M2, М3, М4 соответствуют участкам первичной аминокислотной последова-
последовательности, уложенным в а-спиральные структуры. Каждый из сегментов содержит
20-30 аминокислот при общем числе их 430-500 в каждой из четырех субъединиц а,
C, у, 8, входящих в состав всего рецептора.
Наибольшая функциональная роль принадлежит сегменту М2 и его ближайше-
ближайшему гидрофобному окружению. В нижней части рис. XXI.13 показаны участки субъ-
субъединиц а, C, \, 8, несущие отрицательно заряженные аминокислоты (Асп~, Глю~,
Глн~). Изменение (уменьшение) заряда этих участков путем замены аминокислот
методами генной инженерии приводило к уменьшению потока катионов через ка-
канал. По-видимому два внутренних и один наружный отрицательно заряженных
участка влияют на проводимость поры канала. Сама пора образована сегментом Мг
каждой из отдельных субъединиц. Отметим, что модификация отрицательных за-
зарядов вблизи других сегментов М3, M4 не приводит к подобным результатам по
изменению проводимости канала.
Na-, K-, Са-каналы. Методы генной инженерии позволили расшифровать струк-
структуру белков других каналов. Оказалось, что основным носителем функциональных
свойств в Na- и Са-каналах являются большие а (в Na-канале) и ai (в Са-канале)
субъединицы, состоящие из четырех повторов (рис. XXI. 14) по 300-400 аминокислот
в каждом. В свою очередь, каждый из этих повторов включает в себя 6 трансмем-
трансмембранных а-спиральных сегментов (Si, S2, S3, S4, S5, Sq)
Особая роль среди них в обеспечении функциональных свойств канала принад-
принадлежит сегменту S4, который несет положительные заряды от 4 до 8 на каждом тре-
третьем остатке аргенина или лизина. Этот сегмент S^, возможно, играет роль сенсора
в воротном механизме канала. В Na- и Са-каналах одна большая субъединица доста-
достаточна для обеспечения работы канала. По-видимому в этих каналах пора образуется
между трансмембранными сегментами Si-Sg, принадлежащими четырем различ-
различным внутренним повторам одной субъединицы. В отличие от Na- и Са-каналов,
в белковой субъединице К-канала повтор встречается не 4 раза, а только один раз
(рис. XXI.14) (Дрозофила Shaker А). Этот повтор представляет собой единственный
кластер трансмембранных сегментов, аналогичных сегменту S4 с положительными
зарядами. В основе структуры К-канала типа Shaker лежит тетрамер, образован-
образованный четырьмя аналогичными субъединицами. Пора К-канала расположена не в а-
спиральных участках, а в пептидной петле между S5 и S6 сегментами.
Имеется большое количество разных К-каналов, в том числе и полученных
клонированием генов К-канала Shaker. Они отличаются друг от друга разными
типами субъединиц, кодирующихся гомологичными генами (для млекопитающих
около 10). Различные комбинации этих субъединиц в составе тетрамеров К-канала
fc> И-
внешняя сторона
Иле-264
Лей
а(М2)
внутренняя сторона
Тр-237
Вал-270
Лис"
Вал-273
Лис"
р(М2)
у(М2)
Про-243
Лей-278
Арг+
8(М2)
Лис+
Глю"
1
Гпю
Сер
Асп"
Лис4"
Глю"
1
Глю
Ала
Асп"
Лис"
Глн
Глю
Глю
Ала
Глн
Лис"
Глю"
1
Глю
Сер
Глю"
Промежуточное
кольцо
Цитоплазматическое
кольцо
Рис. XXI. 13.
Предполагаемая топология отдельной субъединицы ацетилхолинового рецептора (по В. НШе, 1992).
Полипептидная цепь, формирующая субъединицу рецептора, пересекает мембрану четыре раза, причем N- и С-концы
этой цепи расположены с внешней стороны мембраны. Внутримембранные участки соответствуют фрагментам цепи;
обозначенным Mi, М2, М3 и М4. Ацетилхолиновый рецептор составлен из пяти таких субъединиц.
8>
S
о
а
а
Е
В'
в
"О
8>
а
о
Я
О
¦о
7. Молекулярное строение каналов
135
(Si-s6)
+H3N
ScTx
К-канал
+H,N
'СО,
Са-канал
+H3N'
Г\
СО,
\J
Рис. XXI. 14.
Предсказание топологии мембранных белков (по В.НШе, 1992).
Предполагаемое внутримембранное расположение пептидных цепей главных субъ-
субъединиц потенциалзависимых ионных каналов. Мембранные фрагменты обозначены
индексами I, II, III и IV. Показаны также участки, в которых располагаются гли-
козидные группы (ф), участки фосфорилирования Р, а также зоны взаимодействия
с токсинами скорпиона (ScTX), харибдотоксином (СЬТХ), сенсор напряжения (+)
и функциональный блок (п), ответственный за инактивацию проводимости.
136
Глава XXI. Ионный транспорт в каналах
НО
H2N
н>
ОН
но
н н он
Сз№ С2Н5
р\/
NH
'э
Прокаин
С2Н,
© I ¦
С2Н5—N—С2Н5
С2Н5
TEA
NH2
Рис. XXI.15.
Химическая структура бло-
каторов ионных каналов (по
В.НШе, 1992).
Тетродотоксин (ТТХ) и сакси-
токсин (STX) относятся к при-
природным токсинам, специфически
блокирующим Na-каналы. Ион те-
траэтиламмония (TEA) являет-
является простым четвертичным произ-
производным аммония, блокирующим
К-каналы. Действие всех перечи-
перечисленных агентов является обрати-
обратимым.
обеспечивают их структурное разнообразие.
Механизмы блокирования каналов. Блокировка каналов различными фармако-
фармакологическими агентами применяется для изучения структуры канала и механизма
его функционирования. Существуют два типа блокировки: 1) связывание непосред-
непосредственно в поре канала, предшествующее прохождению через нее иона; 2) аллосте-
рическое связывание агента макромолекулярными структурами в канале, которое
стабилизирует конформацию поры в закрытом состоянии и препятствует тем са-
самым открыванию канала. Оба вида блокирования могут одновременно иметь место
при действии химических веществ.
Обратим внимание на очевидную аналогию с конкурентным (за место в актив-
активном центре) и аллостерическим типами ингибирования ферментативного процесса
(гл. XIV).
Наибольшую роль в исследовании селективного иигибирования определенных
видов ионной проводимости сыграли вещества: тетродотоксин ТТХ, сакситоксин
STX, тетраэтиламмоний TEA (рис. XXI.15)
ТТХ содержится в органах рыб семейства Tetraodontidae. Он воздействует на
наружную поверхность мембраны, подавляя возникновение потенциалов действия
в нервах и мышцах (см. гл. XXIII, §3) и блокируя селективно натриевый ток.
Аналогичное действие оказывает и STX, содержащийся в жгутиковых. Ион TEA
селективно подавляет калиевый ток, удлиняя фазу падения потенциала действия
(см. XXIII, § 3). Блокирование канала инициируется связыванием агента с рецепто-
рецептором, который представляет собой определенный элемент молекулярной структуры
канала. Считается, что молекула блокатора Т связывается обратимо с рецептором
в реакции
fci
T + Rec
TRec,
^равн
(XXI.7.1)
К-каналы блокируются миллимолярными концентрациями TEA, введенными во вну-
внутриклеточное пространство. Было показано, что рецептор находится в поре, но
становится доступным для молекул со стороны аксоплазмы только тогда, когда
канал (ворота) открывается под действием деполяризующего импульса. При этом
§ 7. Молекулярное строение каналов 137
ингибирование выходящего К-тока (%к) выражено гораздо сильнее, чем входяще-
входящего. В закрытом состоянии канала ионы аммония не могут достичь рецептора со
стороны аксоплазмы. Восстановление проводимости происходит в результате дис-
диссоциации комплекса (TRec) под действием входящих снаружи ионов К+, которые
вытесняют ингибитор из поры и выталкивают его в аксоплазму. Если канал, где
ингибитор предварительно связался с рецептором в поре, закроется, то вытал-
выталкивания ингибитора в аксоплазму не произойдет. В этом случае восстановление
проводимости задерживается (медленная фаза) до тех пор, пока ворота канала не
откроются вновь.
Молекулы веществ ТТХ и STX содержат гуанидиновые части, ионы гуанидина
проникают в клетку через Na-каналы. Возможно, что рецептор находится в селек-
селективном фильтре и содержит одну или две отрицательно заряженных групп (СОО~),
заряды которых изменяются при разных рН.
Действие ТТХ на Na-каналы имеет общие черты с влиянием TEA на К-каналы,
поскольку в обоих случаях эффект зависит от взаимодействия с аминокислотными
остатками рецептора вблизи устья канала. Местные анестетики (третичные амины)
используются в клинике и их действие основано на блокировке Na-каналов. Они
оказывают это действие при протонировании аминогруппы и переходу молекулы в
заряженное состояние
NHt —
Для большинства местных анестетиков рКа находится в пределах 7-9. Бло-
Блокировка осуществляется только заряженными молекулами, проникающими во вну-
внутреннее устье открытого Na-канала. Рецептор находится между воротами и се-
селективным фильтром канала. В нейтральной форме местные анестетики могут
проникать внутрь нервного волокна, растворяясь в липидном матриксе мембраны с
последующим протонированием внутри волокна. В этом случае они могут взаимо-
взаимодействовать и с закрытыми каналами. На рис. XXI. 16 изображена схема действия
анестетиков, которые вытесняются из комплекса с рецептором ионами Na+ и Н+,
проникающими в канал снаружи. Образование комплекса в свою очередь влияет
на эффективность воротного механизма, оставляя ворота открытыми и сильно
замедляя процесс инактивации канала. Так, блокатор TV-метилстрихнин, введенный
в открытые каналы, блокирует их и фиксирует ворота в открытом положении, так
что они не могут закрыться до тех пор, пока блокатор не покинет канал. Таким
образом, доступ блокаторак рецептору возможен лишь при открытых воротах. При
закрытии ворот после образования TRec-комплекса анестетик оказывается запер-
запертым в канале. Влияние анестетиков ТТХ, STX на воротный механизм не прямое, а
обусловлено их связью о другими молекулами, способствующими закрытию ворот
(аллостерический механизм).
Ингибирование воротного механизма. Процесс инактивации легко ингибиру-
ется при действии химических агентов, проникающих в каналы со стороны аксо-
аксоплазмы. Замедление инактивации может привести к тому, что продолжительность
потенциала действия (открытый Na-канал) продлится до нескольких минут. Эф-
Эффект наблюдается при введении проназы (смесь протеолитических эндопептидаз),
138
Глава XXI. Ионный транспорт в каналах
(А) Заряженный анестетик (Б) На
R
(В) Рецептор местных анестетиков
Анестетик в мембране
Анестетик в мембране
Анестетик в мембране
Наружн.
Анестетик в мембране
Внутр.
Рис. XXI. 16.
Гипотетическая схема блокирования ионного канала местными анестетиками (по
В.НШе, 1992).
(A) Состояния Na-канала и переходы, вызванные взаимодействием с заряженными
молекулами анестетика: R — состояние покоя (resting state), О — открытое состо-
состояние (open state), I — инактивированное состояние (inactivated state). Заряженные
(гидрофильные) молекулы анестетика способны проникать через канал лишь при
открытых воротах.
(Б) Молекулы незаряженного анестетика могут связываться и освобождаться даже
при закрытых водотах.
(B) Два пути по которым анестетики могут проникнуть к рецептору в просвете
канала. Гидрофильный путь блокируется закрыванием ворот. Внеклеточные Na и
Н+ могут взаимодействовать со связанными молекулами анестетика через область
селективного фильтра.
когда Na-каналы остаются открытыми при действии продолжительного деполяри-
деполяризующего импульса, теряя способность к инактивации и закрытию.
По-видимому местом действия ингибиторов инактивации воротного механизма
Na-каналов являются пептидные петли между повторами III и IV (рис. XXI.14) с
доступными аминокислотными остатками — аргинином, тирозином, триптофаном,
гистидином. Рецептор для их связывания отличен от такового для ТТХ или STX.
Местные анестетики конкурируют с ними за место связывания.
§ 8. Флуктуации проводимости мембран 139
Другой ингибитор а-токсин скорпиона (пептид) обратимо связывается с рецеп-
рецептором в наружной части канала, удлиняя продолжительность потенциала действия.
Его связывание возможно в открытом и закрытом, но не в инактивированном, со-
состояниях. Отсюда следует, что в нормальных условиях инактивация Na-каналов не
только вызывает закрытие ворот, но сопровождается изменениями наружной части
структуры канала, где расположен рецептор.
Таким образом, существуют различные вещества, модифицирующие воротный
механизм закрытия — открытия каналов. Так, ферменты (проназа) необратимо
действуют со стороны цитоплазмы и необратимо повреждают структуры, от-
ответственные за инактивацию канала. Другие ингибиторы (пептидные токсины)
действуют снаружи, замедляя инактивацию каналов. Растворимые в липидах
токсины угнетают активацию (открытие) каналов, замедляют инактивацию и
уменьшают ионную селективность канала. Наконец, изменения рН, внутриклеточ-
внутриклеточной концентрации двухвалентных ионов, ионной силы влияют на работу воротного
механизма. Таким образом, в процесс инактивации вовлекаются структурные
элементы, расположенные снаружи канала и в области ворот. Активация же зависит
от структур, глубоко погруженных в липидную часть мембраны и недоступных
внешним химическим агентам. На рис. XXI.17 показаны места действия различных
ингибиторов на Na-каналы.
§ 8. Флуктуации проводимости мембран
\—? Электрические флуктуации в мембранах обусловлены изменением числа от-
крытых каналов вследствие случайных процессов их формирования и распада.
Анализ флуктуации проводимости позволяет оценить две основные характеристики
канала: среднее время жизни канала в открытом состоянии и проводимость оди-
одиночного канала. ?
Суммарная проводимость мембрана определяется статистическим наложением
проводимости отдельных каналов, каждый из которые может находиться с опре-
определенной вероятностью в закрытом или открытом состояниях. В 70-х годах были
развиты методы регистрации и статистического анализа флуктуации проводимо-
проводимости мембран, позволяющие оценить вклад в этот процесс и получить характери-
характеристики проводимости одиночных каналов. Переход канала между открытым О и
закрытым R состояниями представляет собой в кинетическом отношении реакцию
первого порядка с вероятностями закрытия q и открытия р в единицу времени.
Среднее статистическое время пребывания одиночного канала в открытом состоя-
состоянии то обратно пропорционально вероятности его перехода в закрытое состояние q,
Достижение равновесного распределения между открытыми по и закрытыми пц
каналами в макроскопической системе с большим числом каналов происходит со-
согласно уравнению кинетики
по + nR = N
nR = -pnR + qno,
140
Глава XXI. Ионный транспорт в каналах
Проназа, иодат,
N-бромоацетамид
внеклеточная
сторона
й.. мембранные 2
липиды
внутриклеточная
сторона
Рис. XXI. 17.
Рецепторы токсинов в натриевом канале (по В.НШе, 1992).
Гипотетическая схема организации Na-канала:
1 — участок связывания тетродотоксина и сакситоксина; 2 — участок связывания липофильных
модификаторов воротной функции (батрахотоксин ВТХ); 3 — место связывания пептидных ток-
токсинов скорпиона ScX и актинии АТХ (модификаторы инактивации); 4 — участок связывания C-
токсинов скорпиона ((З-ScTx) (модификаторы активации). Кроме того показаны внутренние участ-
участки мембраны, подвергающиеся воздействию химических модификаторов инактивации (проназа,
иодат), участок связывания местных анестетиков (LA) внутри гидрофильной поры и отрицатель-
отрицательные поверхностные заряды, притягивающие двухвалентные катионы и ионы Na в устье канала.
по экспоненциальному закону
no(t) =по- (по - по) ехр[-(р
q)t],
где по—равновесное, по— начальное значения величины по', среднее время до-
достижения равновесных значений по и пд в макроскопической системе составляет
1
p + q
При обычных температурах происходят флуктуации числа открытых и за-
закрытых каналов около их равновесных значений, соответствующие флуктуациям
проводимости мембраны. Можно показать (флуктуационно-диссипативная теоре-
теорема Кубо), что небольшие спонтанные флуктуации будут затухать с характерным
§ 8. Флуктуации проводимости мембран 141
временем т = 1/(р + q). Таким образом, информация о кинетике микроскопических
переходов между состояниями одиночного канала может быть получена при наблю-
наблюдении флуктуации значений равновесных параметров макроскопической системы.
Соответствующий математический анализ флуктуации проводимости мембра-
мембраны проводится с целью определения ряда параметров, характеризующих свойства
одиночного канала: время открытого состояния (то = 1/р) и скорости переходов
между разными состояниями; проводимость одиночного канала. Напомним, что
проводимость мембраны (XIX. 25) характеризует зависимость потока ионов (ток)
от потенциала на мембране g = dl/dcp. В случае линейных вольтамперных зависи-
зависимостей тока от потенциала на мембране проводимость равна tg а, где а — угол
наклона прямой /(ср). При фиксированных потенциалах флуктуации тока и его
среднее значение соответствуют флуктуациям и среднему значению проводимости
на мембране.
Рис. XXI.18.
Изменение проводимости мембраны как функция
времени
Если значение проводимости мембраны в момент t рав-
равно g(t), то через небольшой промежуток времени значение
проводимости g(t + x) будет иметь близкую величину; иначе
говоря, величина в момент времени (? + т) будет «коррелировать» с величиной в момент време-
времени t. Однако через достаточно большой промежуток времени уже невозможно предсказать ве-
величину g(t + т), основываясь на ее первоначальной величине g(t), т.е. g(t + т) и g(t) становятся
полностью независимыми
Причина флуктуации состоит в том, что макроскопический ток через мембра-
мембрану есть результат наложения микроскопических токов, идущих через одиночные
каналы, которые ведут себя стохастически и открываются и закрываются с опре-
определенной вероятностью.
Если каналы в мембране открываются и закрываются независимо, то изменения
проводимости мембраны представляют собой стохастический процесс. Значения
проводимости g колеблются около некоторого среднего значения g с дисперсией а2
или среднеквадратичным отклонением а:
(рис. XXI.18). Анализ этого процесса проводят с помощью функций корреляции
[см. (Х1.1.9)-(Х1.1.15)].
Величина временного интервала, через который g(t + т) перестает коррели-
коррелировать с g(t), является мерой скорости, характеризующей затухание корреляции.
Временная зависимости случайных флуктуации может быть охарактеризована так
называемой автокорреляционной функцией, которая определяется как среднее от
произведения флуктуирующей величины g(t) в момент времени t на ее значение
через промежуток времени т [см. (XI.1.9)]:
T)>. (XXI.8.2)
142
Глава XXI. Ионный транспорт в каналах
Для простоты обычно полагают, что значение проводимости флуктуирует
вокруг нуля (т.е. проведено вычитание среднего значения). Значение авто-
автокорреляционной функции при т — 0, по определению, равно дисперсии флуктуиру-
флуктуирующего сигнала а2 [см. (XI.1.11)]. Оно всегда больше нуля, поскольку для т = 0 все
усредняемые произведения являются квадратами и, следовательно, положительны.
Однако при увеличении т часть усредняемых произведений будет положительна, а
часть — отрицательна. Поэтому при достаточной величине т суммирование таких
произведений приведет к их компенсации. Следовательно, функция С(т) уменьша-
уменьшается и приближается к нулю, если т становится очень большим по сравнению со
средним временем флуктуации.
Шумы процессов открывания-закрывания каналов. Предположим, что в мем-
мембране существует большое число статистически независимых каналов, которые от-
открываются и закрываются по принципу «все или ничего» и остаются открытыми
в течение промежутков времени, малых по срав-
нению с временами их жизни в закрытом состо-
состоянии. Если времена их открытого состояния рас-
распределены экспоненциально со средним временем то
(N = 7Voexp(—t/то)), то автокорреляционная функ-
функция оказывается простой экспоненциальной функци-
функцией [см. (XI.1.13)] с постоянной времени то и началь-
начальной амплитудой а2 (рис. XXI.19) среднеквадратич-
среднеквадратичного смещения проводимости
С(т) = а2 ехр(-т/т0). (XXI.8.3)
Фурье-образ, или энергетический спектр, свя-
связан с автокорреляционной функцией соотношением
(XI.1.15):
Рис. XXI. 19.
Автокорреляционные функ-
функции, соответствующие мед-
медленным A) и быстрым B)
флуктуациям:
то — характерное время экспо-
экспоненты, совпадающее со средним
временем жизни канала в откры-
открытом состоянии
Р(<л) = B/л) Г С(т) cos(ut)*:. (XXI.8.4)
Энергетический спектр характеризует распределе-
распределение энергии флуктуации как функцию частоты и может быть измерен в экспери-
эксперименте с помощью частотных анализаторов (рис. XXI. 20). Если автокорреляционная
функция имеет вид, даваемый уравнением
С(т) = Со ехр(-т/т0), (XXI.8.5)
то можно вычислить энергетический спектр:
Р(со) = -Со /exp(-T/T0)cos(coT)dT;
к J
=-Со
1 +
(XXI.8.6)
В экспериментах на БЛМ результаты измерений интенсивности шума на дан-
данной частоте / (/ = 2лсо) выражают обычно в форме безразмерных единиц е(/):
sVn(f)-SvAf)
</¦) =
(XXI.8.7)
§ 8. Флуктуации проводимости мембран 143
где Syn (/) — интенсивность флуктуации напряжения V на частоте / при пропуска-
пропускании через мембрану постоянного электрического тока (неравновесное состояние —
n), a Sye (/) — интенсивность флуктуации напряжения в отсутствие тока (равновес-
(равновесное состояние — е). Величина s(/) не зависит ни от степени модификации мембраны
антибиотиком, ни от площади мембраны, и поэтому удобна для сравнения резуль-
результатов, полученных на разных мембранах с разным электрическим сопротивлением.
Тепловой шум. Для систем, находящихся в термодинамическом равнове-
равновесии, флуктуации напряжения связаны с импедансом системы теоремой Найкви-
ста A928):
SVe(f) = 4:kBTReZ(f). (XXI.8.8)
В этом выражении Z(f)— импеданс, т.е. комплексное сопротивление системы для
переменного тока, включающее действительную и мнимую части:
Z = Rs + iXs = Re Z + i Im Z,
где Rs = Re Z — активное сопротивление (действительная часть импеданса), a Xs =
= ImZ — реактивное сопротивление (мнимая часть импеданса).
Рис. XXI.20.
Зависимость спектральной плотности флуктуации
Л»)
от частоты беспорядочного процесса
1
Энергетический спектр (распределение спектральной плот-
плотности флуктуации) Р(со) имеет вид кривой Лоренца [ср.
' l~~ ^ (XIII.3.16)]. Спектральная плотность флуктуации представле-
представлена как функция логарифма частоты. Спектр флуктуации —
_ . . прямая линия на частотах от нуля до частоты порядка 1/то,
0 линия резко идет вниз в области частот ~ 1/то- Видно, что
беспорядочный процесс является эффективным широкополос-
широкополосным источником частот вплоть до частоты 1/то
Теорема Наиквиста описывает спектральную плотность теплового шума в про-
проводниках, обусловленного тепловым движением заряженных частиц. Для мембран,
эквивалентная схема которых обычно изображается в виде параллельного соеди-
соединения сопротивления R и емкости С, зависимость реальной части импеданса от
частоты описывается соотношением
(XXI.8.9)
o2C2R2
Cz Rz l+4m.z{fCRY
Соотношение (XXI.8.9) выводится из условия, что суммарная проводимость для
параллельной цепи 1/Z равна сумме проводимости активного сопротивления 1/R и
проводимости конденсатора:
1/Z = 1/R + г—[— = 1/R + шС.
I/coo
Отсюда следует, что
R _ ДA - моСД) _ R
¦ ¦ _| » f^i т^ О О О О О О О О О *
144 Глава XXI. Ионный транспорт в каналах
В полученном выражении импеданс представлен в виде суммы его действительной
(активная) и мнимой (реактивная) составляющих. Учитывая (XXI.8.9), формулу
(XXI.8.8) можно записать в виде
(XXI.8.10)
В режиме фиксации потенциала, когда измеряются флуктуации тока I, соответ-
соответствующая спектральная плотность будет иметь вид
?/(/) = 4kBT/R. (XXI.8.11)
¦\У Таким образом, флуктуации тока, обусловленные тепловым шумом, не зависят
от частоты. По этой причине тепловой шум часто называют «белым» шумом.
?
Тепловые флуктуации напряжения на БЛМ, находящейся в симметричных рас-
растворах электролита, при отсутствии тока достаточно хорошо описываются соот-
соотношениями (XXI.8.8) и (XXI.8.10).
Если ионные каналы проводимостью ho имеют только два состояния, соответ-
соответствующие открытому и закрытому каналу, со средними временами состояний то
и т3 соответственно, то для линейного участка вольтамперной характеристики
мембраны справедливо соотношение
(XXI.8.12)
е(/) =
UJ квТт0 (/)
где V — среднее падение напряжения на БЛМ, а т = тот3(то -Ьтз).
При условии, что среднее время закрытого состояния канала намного больше
характерного времени открытого состояния т3 3> то, формула (XX.8.12) упроща-
упрощается:
t?^ (XXL813>
Именно эту формулу используют обычно для расчета параметров каналов,
спектры шума которых можно описать лоренцевскои кривой.
Запись флуктуации проводимости мембраны концевой пластинки мышцы ля-
лягушки приведена на рис. XXI.21. В покоящемся состоянии при фиксированном на-
напряжении —100 мВ флуктуации невелики. Однако при возбуждении мембраны пу-
путем введения в нее ацетилхолина ток и флуктуации резко возрастают. Частотно-
энергетический спектр этих флуктуации (рис. XXI.20) приведен на рис. XXI.22.
Форма лоренцовой кривой спектральной плотности флуктуации S(f) описывается
как
=
1
где / — частота флуктуации, 5@) и /с — константы, соответствующие спектраль-
спектральной плотности при нулевой частоте, /с — значение частоты, при которой ампли-
амплитуда уменьшается в 2 раза, то = 1/2ti/c — время релаксации флуктуации. Из кри-
кривых рис. XXI.22 можно найти значение то, которое, как видно, увеличивается при
i 8. Флуктуации проводимости мембран
145
100 мс
без ацетилхолина
+ ацетилхолин
+ ацетилхолин
Рис. XXI.21.
без ацетилхолина флуктуации ТОКа В СИ-
наптической мембране
(поВ.НШе, 1992)
Токи, измеряемые на мышечном волокне лягушки в условиях фиксации напряжения. Верхние кри-
кривые — измерения тока при малом коэффициенте усиления; нижние кривые — измерения при высо-
высоком коэффициенте усиления. В покоящемся нервно-мышечном окончании ток, регистрируемый при
слабом усилении, равен нулю. Запись, сделанная при высоком коэффициенте усиления, отображает
низкий уровень шума и одиночный импульс входящего тока, вызванный спонтанным выделе-
выделением нейротрансмиттера из одиночного пресинаптического пузырька. При аппликации низкой
концентрации ацетилхолина на малом усилении регистрируется большой постоянный входящий
ток. Записи, сделанные при высоком усилении выявляют флуктуации, вызванные стохастическим
открыванием большого числа каналов. Температура 8° С.
10-20
10-22
Рис. XXI.22.
Спектр флуктуации то-
тока, вызванных действием
ю-23 "~ ¦ i ¦ i.iiin л, , .ill ацетилхолина на мышеч-
j j 102 ное волокно лягушки (по
Частота, Гц С. R. Anderson, C.F.Ste-
C.F.Stevens, 1973)
Спектральная плотность флуктуации S(f) представлена как функция частоты в двойном логариф-
логарифмическом масштабе. Стрелками отмечена частота среза лоренцовых кривых (сплошные линии).
Деполяризация волокна и повышение температуры приводят к повышению частоты среза.
146 Глава XXI. Ионный транспорт в каналах
охлаждении объекта и гиперполяризации. При —50 мВ и 20° С оно составляет то =
= ~ 1 мкс. Поскольку в опытах использовались низкие концентрации ацетил-
p + q
холина, когда вероятность открытия канала р очень мала (р <С q), то в этих условиях
время то соответствует времени нахождения канала в открытом состоянии
1 1
P + q Р
Время жизни разных каналов может варьировать в широких пределах от миллисе-
миллисекунд до секунд.
Из этих опытов также следует, что доля открытых каналов зависит от потен-
потенциала на мембране и уменьшается при деполяризации.
Проводимость одиночного канала. Если в равновесных условиях количество
открытых каналов флуктуирует во времени, то это вызывает соответствующие
флуктуации макроскопической проводимости мембраны. В экспериментах измеря-
измеряются импульсы тока через мембрану, которые характеризуют среднее квадратич-
квадратичное отклонение а2 от среднего значения I:
+ I2 = -> It-I2, (XXI.8.14)
к=1 к
где 2^/Ik/n = I.
Рассмотрим одиночный канал, который открывается с вероятностью р, и про-
пропускает ток г. Средний ток, проходящий через такой канал, равен ip, а величина
квадрата тока i2p. Из (XXI.8.14) следует, что
а2 = i2p - i2p2 = г2рA -р) = i2pq, (XXI.8.15)
где q — вероятность того, что канал закрыт. Для N независимых каналов макро-
макроскопическая флуктуация тока I равна
aj = N(i2p - i2p2) = Ni2pq, (XXI.8.16)
а средний ток на мембране
I = Nip. (XXI.8.17)
Из последних двух выражений следует, что а2 = Iiq. Отсюда ток г через одиночный
канал можно найти как
* = Т- = ТГГ—V (XXI.8.18)
Iq 7A —р)
т. е. г зависит от флуктуации а2 тока I на мембране. Если р <С q, что часто соот-
соответствует реальным условиям, то
Таким образом можно найти величину тока г, проходящего через одиночный канал,
измеряя среднее значение и флуктуации тока I через мембрану.
i 9. Кальциевая проводимость электровозбудимых мембран
147
Проводимость мембраны g (XIX.2.5) характеризует зависимость потока ионов
(тока) от потенциала на мембране
g = dl/dy.
Аналогичная зависимость справедлива и для проводимости одиночного канала ho'-
h0 = di/dy.
Отсюда следует, что проводимость одиночного канала можно найти по наклону
прямой вольтамперной зависимости г(ср). На рис. XXI.23 приведен пример такой
зависимости.
160,
1 1
-150 -100
К
/, пА
20
Na у
мМ „J^
1
-50
//
° о'/
160, мМ о- /
/
/ -10
-20
-
-
7
/
-
-
-
/
i
50
7
i
100
[К]=160,
»
о
Ем,
мМ
i
150
мВ
Рис. XXI.23.
Измерение проводимости одиночно-
одиночного канала (по Y. Yellen, 1984).
Вольтамперная характеристика одиноч-
одиночного Са-зависимого К-канала в хромаф-
финных клетках крупного рогатого ско-
скота. Изолированный фрагмент мембраны
в конфигурации «outside-out» помещали в
160 мМ КС1 или NaCl, а микропипетка
содержала 160 мМ КС1. В симметричных
растворах КС1 наклон пунктирной прямой
соответствует проводимости 265 пСм.
Метод локальной фиксации потенциала (гл. XXI, § 6) позволяет осуществлять
непосредственную запись тока через одиночные каналы (рис. XXI.24), что дает
прямую информацию о его флуктуациях около среднего значения. Проводимость ho
отдельных Na-каналов варьирует от 4 до 24 пСм и слегка возрастает с температурой
(Qio ~ 1,0-2,5). Плотность Na-каналов в мембране достигает величин 500-2000 на
один мкм2.
Сходные значения ho характерны и для К-каналов, среди которых исключение
составляют большие К-каналы млекопитающих (ho ~ 100-300 пСм).
§ 9. Кальциевая проводимость электровозбудимых мембран
Исследования на различных мышечных волокнах показали участие ионов Са в ге-
генерации потенциала действия. Так, на мышечных волокнах ракообразных при по-
помещении их в безнатриевые растворы и блокировании К+-проводимости ТЭА на-
наблюдались длительные потенциалы действия, зависящие от Са2+ в среде.
В гладкомышечных клетках млекопитающих потенциалы действия и соответ-
соответствующие ионные токи сильно зависят от наружной концентрации Са и подавля-
подавляются ионами Мп, Со и La, которые прочно связываются с рецептором Са -канала.
148
Глава XXI. Ионный транспорт в каналах
(А) Т-лимфоцип
-,2пА
100 мс
(Б) Рецептор возбуждающих кислот в нейроне
I
200 мс
(В) Клетка нейробластомы, обработанная брахотоксином
Г" ТГ *М<Н№~ f*V"^V^r»^))^^iv/^^ О
L
(Г) С1-канал в липосоме
-.о
-I-2 пА
50 мс
.р,—^—, . ч,.„7.„. „ _, о
'ПУТ;
—4 nA
500 мс
Рис. XXI. 24.
Регистрация токов одиночных каналов методом «пэтч-кламп» (по В.НШе, 1992).
Записи тока отражают открывание и закрывание одиночных каналов.
(A) Токи К-каналов в Т-лимфоцитах человека. При потенциале +40 мВ ток напра-
направлен наружу (выходящий ток).
(Б) Ток каналов рецептора возбуждающих аминокислот в нейронах мозжечка кры-
крысы. При потенциале фиксации —80 мВ ток имеет входящее направление.
(B) Токи Na-канала в клетках нейробластомы. Потенциал фиксации —80 мВ.
(Г) Переключения С1-канала между тремя состояниями с проводимостями 0, 14 и
28 пСм. Канал, выделенный из электрического органа угря Torpedo, был реконстру-
реконструирован в липидпую везикулу. Полагают, что этот канал содержит две параллельные
поры.
§ 9. Кальциевая проводимость электровозбудимых мембран 149
Потенциалы действия гладкомышечных клеток не подавляются ТТХ и сохраняются
при полном удалении из среды Na .
С использованием белка экворина, светящегося в присутствии следовых ко-
количеств Са , удалось показать, что поступление Са в аксон при возбуждении
происходит в две фазы. Первая фаза совпадает по времени с входящим Na -током и
блокируется ТТХ. Вторая фаза, длительностью несколько секунд, нечувствительна
к ТТХ и ТЭА, но подавляется при введении в среду Мп, а также, верапамила и инги-
ингибитора Са2+-канала—D-600. Очевидно, быстрый Са2+-ток обусловлен переносом
Са2+ по ^+-каналам, а медленный — активацией небольшого числа специфических
Са2+-каналов. Са2+-каналы обнаружены также в пресинаптических мембранах от-
отростков нейронов.
Механизмы электрической возбудимости изолированных нейронов моллюсков
имеют существенные особенности в сравнении с механизмом потенциала действия в
мембране аксона. Развитие методов внутриклеточного диализа изолированных ней-
нейронов позволило охарактеризовать систему ионных каналов сомы нервной клетки
(П. Т. Костюк, О. А. Крышталь). В нейронах, диализируемых трисфосфатом, вы-
выходящие токи подавлены и наблюдается только входящий ток, включающий два
кинетических компонента. Быстрый входящий ток обусловлен активацией Na+-Ka-
налов, а медленный входящий ток — активацией Са2+-каналов. Входящий Са2+-ток
нечувствителен к действию ТТХ и ТЭА, но подавляется ионами Cd, Mn, Co, Ni, La,
а также верапамилом и D-600. Кроме того, входящий Са2+-ток подавляется при
внутриклеточном диализе нейрона раствором, содержащим анионы F в концентра-
концентрации около 20 мМ.
Выходящие токи в мембране нейронов моллюсков также включают два компо-
компонента. Быстрый выходящий ток переносится К+; этот ток подавляется при вну-
внутриклеточном введении ТЭА, а также при добавлении в среду 4-аминопиридина
в концентрации около нескольких миллимоль. Переносчиком задержанного выходя-
выходящего тока, видимо, также являются ионы К+, транспортируемые по другой системе
ионных каналов.
В нейронах позвоночных, как и в нейронах моллюсков, существуют входящий
Na+-TOK и медленный входящий Са2+-ток, а также быстрый и задержанный выхо-
выходящие К+-токи.
С работой Са +-зависимых ион-транспортных систем тесно связана электри-
электрическая возбудимость эмбриональных клеток. Так, потенциалы действия яйцеклеток
морского червя Chaetopterus до начала деления являются Са -зависимыми, а на
стадии реснитчатого эмбриона становятся Na -зависимыми. В опытах с фиксацией
мембранного потенциала на ооцитах оболочников, морских ежей и мышей показано,
что во всех случаях имеются быстрый входящий ток Na+ и медленный входящий
ток Са2+, причем Са2+-ток блокируется при внутриклеточном введении F~.
\—? Роль Са2+ в электрической возбудимости клеток не исчерпывается переносом
тока по Na+- и Са2+-каналам. Сорбируясь на мембране в области входного
участка канала, ионы Са могут затруднять доступ в канал другим ионам за счет
изменения поверхностного заряда.
Кальций регулирует активность ряда ферментов, обеспечивающих поддержа-
поддержание функционально активного состояния канала. Так как внутриклеточная концен-
150 Глава XXI. Ионный транспорт в каналах
трация Са + очень низка A0~8 М), она может измениться даже за счет небольших
потоков, связанных с генерацией потенциала действия.
Механизм регуляторного действия Са на внутриклеточном уровне в настоя-
настоящее время активно изучается. Взаимодействуя с кальмодулином, Са может дей-
действовать на систему циклических нуклеотидов, активируя фосфодиэстеразу и по-
понижая концентрацию цАМФ. Тем самым Са2+ влияет на цАМФ-зависимое фосфо-
рилирование канальных белков и функциональное состояние канала. Существуют
данные, что Са2+-зависимая активация аденилатциклазы, другого основного фер-
фермента системы циклических нуклеотидов, представляет важное звено в механизме
мембранной рецепции: рецепторы, взаимодействуя с соответствующим медиатором,
вызывают поступление Са + в цитоплазму и, как следствие, повышение внутрикле-
внутриклеточного уровня цАМФ. ?
В возбудимых клетках харовых водорослей Са2+ выступает в качестве акти-
активатора хлорных каналов. При деполяризации плазмалеммы ионы Са поступают по
Са — Na -каналам из среды в цитоплазму и активируют С1~-каналы плазмалем-
плазмалеммы и тонопласта, в результате чего С1~ начинает выходить из клетки в среду.
Поступление в клетку Са и выход из нее С1~ определяют появление быстрого
и медленного компонентов входящего тока, которые разделяются по потенциалам
реверсии, а также по чувствительности к ряду ингибиторов.
Повышение внутриклеточной концентрации Са2+ может быть обусловлено не
только поступлением его из среды, но и выбросом из внутриклеточных органелл.
Так, предполагают, что цАМФ может вызывать выброс Са2+ из митохондрий,
которые служат депо кальция.
Ионы Са не принимают непосредственного участия в воротном процессе. Мы-
Мышечные волокна продолжают генерировать потенциалы действия и сокращаться
даже после понижения наружной концентрации Са до ~ 10 ~9 М.
Глава XXII
Активный транспорт
§ 1. Натрий-калиевый насос
Существование градиентов концентрации Na, К и Са между внутри- и внеклеточной
средой — основное условие поддержания потенциала покоя [см. (XIX.2.10)] и элек-
электрической возбудимости нервных и мышечных клеток. Ионы, способные проникать
через мембрану, могут накапливаться в клетке или вытесняться из нее в соответ-
соответствии с градиентом мембранного электрохимического потенциала. Так, несмотря
на существование значительного градиента концентрации К+ между клетками и
средой, эти ионы находятся почти в равновесии. Градиент концентрации и градиент
потенциала направлены в противоположные стороны.
^—р Распределение Na значительно отличается от равновесного: оба компонента
пассивного потока — по градиенту концентрации и в направлении электриче-
электрического поля — направлены внутрь клетки. Для поддержания низкого неравновесного
уровня концентрации Na+ в клетке необходим механизм активного выведения в
среду. Такого рода системы активного транпорта обеспечивают перенос ионов про-
против градиента электрохимического потенциала за счет энергии АТФ (Na -насос
плазматических мембран, Са -насос мембран саркоплазматического ретикулума;
см. гл. XXV) или энергии окислительно-восстановительных реакций (Н+-насос ми-
митохондрий, хлоропластов и других энергосопрягающих мембран; см. гл. XXIV).
Активный транспорт Na+ в нервных клетках осуществляется Na+, К+-АТФазой,
локализованной в плазматических мембранах. ?
Первые успехи в исследовании Na+, К+-АТФазы принадлежат Дж. С.Скоу
A957). Он изучал расщепление АТФ в препаратах мембран из нервов краба и
показал, что гидролиз значительной части АТФ зависит от совместного действия
ионов Na и К. Стимулируемая ионами Na и К+-АТФазная активность подавляется
уабаином. Повышение концентрации уабаина оказывало одинаковое подавляющее
действие как на транспорт Na+, так и на активность АТФазы. Результаты количе-
количественных измерений показали, что при гидролизе одной молекулы АТФ происходит
транспорт двух ионов К внутрь клетки и выведение трех (иногда двух) ионов Na
из клетки. Таким образом, сложилось представление, что Na+-Hacoc представляет
собой локализованную в плазматической мембране клетки ферментную систему,
осуществляющую перенос Na+ из клетки во внеклеточную среду, а К+ — в обратном
направлении. Насос транспортирует ионы Na против градиентов электрохимиче-
электрохимических потенциалов за счет сопряжения ионообменных процессов с гидролитическим
расщеплением АТФ Mg2+-зависимой Na+, К+-стимулируемой АТФазой.
152 Глава XXII. Активный транспорт
Na+, К+-АТФаза-фермент состоит из ДВУХ полипептидных цепей с молеку-
молекулярной массой 84000 и 5700, которые формируют большую и малую субъединицы
фермента. Белок прочно связан с фосфолипидами, полное удаление которых из
мембран приводит к исчезновению АТФазной активности.
Схема работы насоса предполагает последовательное протекание нескольких
реакций в средах разного ионного состава в присутствии Mg2+ и АТФ с участием
белка—фермента в двух состояниях Е\ и Е2.
?i~P -* Е2-Р + Nae,
Ке + Е2-Р -* KtE2-P — Е2 + Р + К;. (XXII.1.1)
На внутренней стороне мембраны в присутствии Na+ и Mg-АТФ происходит фос-
форилирование белка. В ходе реакции освобождается АДФ. В результате фосфо-
рилирования конформация белка изменяется таким образом, что обеспечивается
переход Na на внешнюю поверхность мембраны Nae, а белок переходит в состояние
Е2—Р. На следующей стадии изменяется сродство фермента к ионам К и Na, так что
связывается К^~. Затем К+ переносится внутрь, а белок Е2—Р дефосфорилирует-
ся и возвращается к исходному конформационному состоянию. Конформационные
изменения АТФазы сопровождаются переносом К+ и Na+ в разных направлениях.
Ионофорные центры связывания К+ и Na+ удалены в белке от каталитического
центра фермента. В этом центре за счет энергии гидролиза АТФ индуцируются
конформационные переходы между состояниями Е\ и Е2 всего белка, в которых
АТФаза обладает разным сродством к К+ и Na+. Таким образом все компоненты
функционируют в согласованном кооперативном режиме.
На рис. XXII. 1 показана схема организации активного центра Na+, K+-
АТФазы. Как видно, молекула АТФ (Ad—R—Ра—Рр—Рт) расположена оптимально
для переноса Рт фосфатного остатка на белковый домен и фосфорилирование
аспартат-369. Перенос Рт на аспартат-369 обеспечивается лизином, который
образует дополнительные стабилизирующие контакты с кислородом остатка Рт.
Конформационный переход Е\ -* Е2 связан с взаимодействием в области катали-
каталитического центра пептидных участков 145-285 и 342-779.
Отличительной особенностью Na+, К+-АТФазы по сравнению с независимой
АТФ-синтетазой (гл. XXIV) является наличие в ней промежуточных фосфорили-
рованных форм фермента Е\ — Р, Е2—Р.
Помимо гидролиза АТФ в Na+, К+-АТФазе происходит также гидролиз
связи между карбоксильной группой аспартат-369 и Рт-фосфатным остатком
(асп369-СО-О-Н2РОз).
Конкретный механизм трансформации энергии, необходимой для транспорта
ионов и конформационных перестроек Е\ ** Е2 в белке, основан на представлениях
о перегруппировке атомов, которые образуют эфирные связи соответственно между
атомами фосфора Рт и кислорода в АТФ и в аспартат +C-карбоксил-фосфатном
производном белка.
Различные модели должны учитывать электростатические взаимодействия по-
положительно заряженных атомов фосфора, а также зависимость энергии связей от
их углов и длин в разных атомных конфигурациях. Так, при длине связи между
кислородом и Рт-атомом в АТФ 0,168 нм энергия связи составляет 400 кДж/моль.
1. Натрий-калиевый насос
153
Рис. XXII. 1.
Схематическое изображение струк-
структуры каталитического центра Na+,
К+-АТФазы. Показано расположение
молекулы АТФ (Ad-R-Pa-P^-PY)
между нуклеотдид-связывающим до-
доменом (а-спирали изображены в ви-
виде цилиндров, а C-структуры — в ви-
виде изогнутых стрелок) и фосфорли-
рующим доменом. Перенос фосфата
на аспартат фосфорилирующего до-
домена предположительно сопровожда-
сопровождается смещением шарнирного домена
(по W. R. Taylor, N. М. Green, 1989).
При увеличении длины связи ее энергия связи уменьшается, что облегчает ее разрыв
при гидролизе. Предполагается (Репке, 1992), что в карбоксил-фосфорилированном
производном происходит изменение числа и перегруппировка кислородных лиган-
дов из пленарной конфигурации в пирамидальную. В пирамидальной конфигурации
атом фосфора находится в центре треугольника (рис. XXII.2), образованного на
плоскости тремя атомами кислорода (штриховые линии). Два других атома кисло-
кислорода находятся вне плоскости и образуют более слабые связи, которые легко раз-
разрываются, что необходимо для реакций фосфорилирование/дефосфорилирование.
На рис. XXII.2 приведена гипотетическая схема гидролиза АТФ Na+, K+-
АТФазой, соотнесенного с переносом ионов. Вначале происходит фосфорилирова-
ние C-аспарагинкарбоксилата в белке Е\ фосфорным остатком Рт молекулы АТФ.
Координационные связи Mg (стадия 2) изменяют углы связи О—Р—О до 90°, так
что одна из Р—О связей выходит из плоскости, удлиняется и становится слабее.
Перегруппировка кислородных лигандов на стадии 2^-3 облегчает отрыв
АДФ и образование макроэргической связи (стадия 4). Образованный комплекс
Nae— i?i~P выносит Na наружу.
Аналогичное образование внеплоскостной слабой Р—О связи с карбоксилом
происходит и на стадии 5 -* 6 в белке в состоянии E<i- Тем самым облегчается
последующее дефосфорилирование E<i -* Р на стадиях 6, 7, сопряженное с транс-
трансмембранным переносом К+ -* К^~ и возвращением белка в исходное состояние Е\.
Выброс трех моль Na+ требует энергии около 19 кДж при нормальных физио-
физиологических условиях, а энергия, освобождающаяся при гидролизе макроэргической
связи в комплексе Nai-Ea АТФ составляет 24 кДж/моль. Транспорт двух моль К+
©
ОЦ----Л /° NQ
V---Mg"-.
Mg-
©
,0 0.
ор\ :
HO
Рис. XXII. 2.
Гипотетическая схема процесса гидролиза АТФ Na+, К+-АТФазой (объяснения в тексте) (по K.R. Repke,
R. Schon, 1993).
Перенос фосфатной группы с АТФ на карбоксильную группу аспартата в молекуле фермента (стадии 1—4) а также
дефосфорилирование фермента (стадии 5—7) включает перегруппировку кислородных лигандов (стадии 2—3 и 5—6),
в результате которой изменяются геометрия и свойства ионофорных центров. При этом фермент переходит из кон-
формации Ei к конформации Е-i- Ионы Mg2+ и положительно заряженные боковые группы аминокислот (обозначены
на схеме в виде ф), взаимодействуя с атомами кислорода, понижают энергию активации перегруппировки лигандов
и способствуют последующему отщеплению АДФ. Расщеплению О—Р связи на стадии 3-4 предшествует образование
комплекса, включающего АТФ, фермент Е и два иона Mg2+.
s>
S
а
а
Е
В'
в
¦о
8>
а
о
а
о
"О
в
1. Натрий-калиевый насос
155
АДф
АДФ
Е + АТФ
- Р->(Na+ *¦ К+) -^Е2-Р
+ Р^ Е
Рис. ХХП.З.
Рабочий цикл димера Na+-Hacoca в режиме Na+/K+-o6MeHa
а) связывание Na~*~ и К+ в полостях субьединиц, б) Na-зависимое фосфорилирование большой субъ-
субъединицы, в), г) обмен катионами между субъединицами, д) К+-зависимое дефосфорилирование и
выброс ионов;
1 —большая субъединица, 2 — малая субъединица; полыми кружками изображены Na~*~, зачернен-
зачерненными — К+; Pj — фосфат, Е — фермент
внутрь клетки требует ~ 16 кДж, а энергия, освобождающаяся при разрыве связи
Ке—Е-2— Р -* Ке + Е-2 + Р, порядка 18 кДж/моль. Освобождающаяся энергия ис-
используется для переноса Na и К+ от ионофорных центров в соответствующее
примембранное пространство.
Рассмотрим теперь гипотетические схемы обмена ионами. На рис. ХХП.З
изображена последовательность превращений функционального димера Na , К+-
АТФазы, основанная на конформационных превращениях и обмене ионов Na и К
в полости белка. Ионообменная полость открывается с внутренней поверхности
мембраны, а внешний вход в эту полость (канал) закрыт гидрофобным контактом
липидов и белков. Гидролитический центр расположен на большой субъединице с
внутренней стороны мембраны. Большой а-полипептид пронизывает мембрану,
а гликопротеин (малая C-субъединица) расположен на ее наружной стороне.
В исходном состоянии ионообменные полости субъединиц могут заполняться
катионами только из примембранных слоев. Эти полости, как предполагается,
из-за стерических затруднений могут вмещать три иона Na и лишь два иона К.
Присоединение АТФ индуцирует конформационные изменения, в результате
которых сродство большой субъединицы к Na значительно возрастает. Одновре-
Одновременно увеличивается и эффективный отрицательный заряд ионообменной полости
за счет близко расположенной отрицательно заряженной фосфатной группы АТФ.
¦\У В результате последующих конформационных перестроек три иона Na оказы-
ваются замкнутыми в ионнообменной полости большой субъединицы. На этой
стадии сродство большой субъединицы к Na+ понижается, а к К+ повышается.
Состояние ??~Р энергетически невыгодно, и фермент переходит из «напряженного»
состояния в стабильное состояние Е—Р. ?
156
Глава XXII. Активный транспорт
Дальнейшее протекание реакции и обмен ионов связаны с участием малой субъ-
субъединицы. Предполагается, что субъединицы димера могут незначительно смещать-
смещаться друг относительно друга в результате тепловых флуктуации. Когда полость
малой субъединицы совмещается с полостью большой субъединицы, между ними
может происходить обмен катионами. За время жизни стабильного фосфорилиро-
ванного состояния возможность для обмена ионами между субъединицами реализу-
реализуется неоднократно. Если в каком-либо из этих случаев в полости малой субъединицы
оказывается два иона К, то возникает состояние, изображенное на рис. XXII.3, в.
В этом состоянии обмен ионами между полостями энергетически выгоден.
\—? Замена трех ионов Na на два иона К в большой субъединице (стадия в-г) вновь
приводит к возникновению конформационно-неравновесного состояния систе-
системы. Уменьшение числа положительных зарядов в полости большой субъединицы со-
сопровождается исчезновением большого активационного барьера, препятствующего
дефосфорилированию фермента и отщеплению отрицательно заряженной фосфат-
фосфатной группы. При этом происходит открывание полости большой субъединицы во
внутриклеточную среду. После диссоциации АДФ и Pj фермент возвращается в
исходное состояние. ?
Изменение сродства ион-связывающих центров может быть обусловлено изме-
изменением их геометрии при связывании АТФ, а также при фосфорилировании и
дефосфорилировании фермента. Катионы, находясь в ион- связывающих полостях,
образуют координационные связи с кислородсодержащими группами полипептид-
полипептидных цепей. При перестройке анионного окружения катионов происходит замещение
ионов одного вида на другие катионы.
Рис. ХХП.4.
Две конформации Na-поло-
сти Na+, К+-АТФазы
Согласно теоретическим расчетам, четыре атома О, расположенные в одной
плоскости на определенных расстояниях, могут образовать Na+-специфичную ячей-
ячейку, а шесть атомов О — К+-специфичную ячейку. Исходя из этого можно предпола-
предполагать, что ион-связывающая полость большой субъединицы содержит 12 атомов О,
которые попеременно могут образовывать координационную сферу для трех ио-
ионов Na+ или двух ионов К+ (рис. ХХП.4). Переход между этими состояниями, соот-
соответствующими связыванию трех ионов Na или двух ионов К, т. е. перегруппировка
лигандов, может являться основным энергозависимым процессом, обеспечивающим
Na+/K+-o6MeH в Na+-Hacoce (В. А. Твердислов).
§ 2. Активный транспорт кальция 157
При заполнении Ма+-полости катионами из примембранных областей первый
катион, попавший в полость, определяет тип симметрии лигандов и повышает ве-
вероятность попадания в полость катионов того же вида. Энергизованное состояние
фермента возникает тогда, когда в результате фосфорилирования конфигурация
лигандов перейдет в состояние, изображенное в правой части рис. XXII.4, когда в
полости еще осталось три иона Na. Это «напряженное» состояние фермента снима-
снимается при замене трех ионов Na на два иона К. Таким образом, энергия АТФ рас-
расходуется вероятнее всего на упорядоченное изменение сродства ион-связывающих
центров к катионам, а само перемещение субъединиц осуществляется уже за счет
тепловых колебаний.
§ 2. Активный транспорт кальция
Са -зависимая АТФаза, сопряженная с мощным Са -насосом, локализована в
мембранах саркоплазматической сети и имеет некоторые сходные черты с Na ,
К+- АТФазой. Са -АТФаза состоит из одной полипептидной цепи с молекулярной
массой около 100 000 и относительно высоким содержанием гидрофобных аминоки-
аминокислот (аминокислоты с неполярными боковыми цепями). Для работы Са2+-зависимой
АТФазы также необходимо присутствие фосфолипидов.
Работу Са2+-АТФазы изучают на фрагментах саркоплазматическото ретику-
лума, выделяемых из мышечной ткани, а также на мембранных пузырьках, которые
образуются в определенных условиях в смеси очищенного препарата Са +-АТФазы
с фосфолипидами (реконструированная система — протеолипосомы; см. § 2 гл. XV).
Схема работы Са2+-АТФазы может быть представлена следующим образом. На
первом этапе происходит связывание Са и АТФ. Эти соединения связываются
с разными центрами на внешней поверхности мембранного пузырька. Константа
связывания Са2+ составляет порядка 107 М. На втором этапе АТФ гидролизуется
с образованием фосфорилированного фермента. Образование фермент-фосфатного
комплекса можно обнаружить по включению в белок радиоактивного изотопа 32Р из
АТФ, меченной по фосфату. Образующаяся фосфорилированная форма фермента
.Е~Р конформационно неустойчива и претерпевает изменение пространственной
структуры так, что ион-связывающие участки оказываются отделенными от внеш-
внешней среды. Изменение конформации Са +-АТФазы проявляется в изменении сигна-
сигнала ЭПР спиновой метки, присоединенной к белку, в связи с изменением подвижности
метки.
На следующем этапе цикла происходит изменение сродства Са -связывающих
центров к ионам Са одновременно с изменением характера связи фосфатной груп-
группы с ферментом. Энергия, ранее сосредоточенная в макроэргической фосфатной
связи комплекса ??~Р, расходуется на изменение константы связывания ионов Са
с ферментом. Как и в случае Na+, К+-АТФазы, изменение сродства обусловлено,
по-видимому, изменением расположения полярных групп, образующих координаци-
координационные связи с Са2+. Вследствие происшедшего изменения пространственной струк-
структуры фермента ионы Са получают доступ во внутреннее пространство мембранных
пузырьков и выбрасываются во внутренний объем. Константа связывания Са + при
образовании стабильной фосфорилированной формы фермента уменьшается от 107
до 103 М-1.
158
Глава XXII. Активный транспорт
На основании соотношения (V.1.12), связывающего константу химического рав-
равновесия с изменением свободной энергии в ходе реакции AGq, т. е. A Go = —RTlnK,
можно найти, что изменение свободной энергии при уменьшении константы связы-
связывания от 107 до 104 М составляет 17,8 кДж/моль. Таким образом, суммарные
затраты энергии на перенос Са через мембрану примерно вдвое меньше энергии
гидролиза АТФ (около 40 кДж/моль при рН 9), которой хватает на перенос двух
ионов Са. Вследствие десорбции Са2+ с фермента суммарный положительный заряд
в ион-связывающей полости уменьшается, что значительно облегчает десорбцию
фосфата. В результате этих превращений фермент вновь приходит в исходное
состояние.
§ 3. Электрогенный транспорт ионов
^—р Активный транспорт ионов может быть электронейтральным или электроген-
ным. Транспортная система электронейтральна в том случае, если ее функци-
функционирование сопровождается обменом внутриклеточных ионов на внеклеточные в
соотношении «заряд на заряд». В такой ситуации система активного транспорта
является лишь средством поддержания концентрационных градиентов и не учав-
ствует непосредственно в создании разности потенциалов на клеточной мембране.
Потенциал на мембране создается тогда только за счет диффузии ионов по гради-
градиентам концентрации.
Рис. ХХП.5.
Принципиальная схема измерения тока короткого
замыкания на коже лягушки:
1 — измерительные электроды, 2 — тоновые электроды, 3 —
кожа лягушки
В том случае, если количество зарядов, переносимых в одном направлении в
единицу времени, не компенсируется суммой зарядов, переносимых в противопо-
противоположном направлении, транспортный механизм непосредственно участвует в созда-
создании даполнительной разности потенциалов на мембране. Например, в электроген-
электрогенном режиме работает Na+-Hacoc, обменивая три иона Na на два иона К. ?
Системы электрогенного активного транспорта были впервые выявлены и наи-
наиболее подробно изучены на коже лягушки, а впоследствии и на других эпителиаль-
эпителиальных тканях. Если разделить две камеры, содержащие раствор Рингера, участком
кожи лягушки, то между наружной и внутренней поверхностями кожи возникает
разность потенциалов, достигающая 100 мВ (внутренняя поверхность кожи положи-
положительна по отношению к внешней). Подавая от внешнего источника ЭДС противопо-
противоположного направления (рис. ХХП.5), можно скомпенсировать разность потенциалов
3. Электрогенный транспорт ионов
159
на коже до нуля (так называемый режим короткого замыкания кожи). В этих
условиях пассивный перенос ионов должен прекратиться (так как нет ни гради-
градиентов концентрации, ни разности потенциалов) и односторонние потоки пассивно
транспортируемых ионов — выравняться. Однако в действительности поток мече-
меченого Na , направленный от наружной поверхности кожи к внутренней, намного
превышает поток Na+ в противоположном направлении. Суммарный поток Na+ че-
через кожу лягушки пропорционален значению электрического тока. Таким образом,
значение тока короткого замыкания пропорционально скорости активного транс-
транспорта Na+, направленного от наружной к внутренней поверхности кожи.
Процесс активного транспорта Na+ в коже лягушки со стороны слизистой
оболочки (наружная поверхность кожи) в сторону серозной оболочки (внутренняя
поверхность кожи) близок по механизму к переносу ионов через эпителий в кишеч-
кишечнике и почечных канальцах. Общая схема переноса Na через слой клеток эпителия
представлена на рис. XXII.6.
Во многих эпителиальных тканях обнаружена система активного электроген-
электрогенного транспорта С1~. Вклад этих систем в ток короткого замыкания обычно на-
намного меньше тока активного транспорта Na+.
У растительных клеток вклад электрогенных транспортных систем в мембран-
мембранный потенциал в целом значительно выше, чем в клетках животных. Это про-
проявляется в том, что значение мембранного потенциала клетки намного превышает
Внешний
раствор
Апикальная
мембрана
Na-канал .
(блокируется
амилоридом)
Слизистая
оболочка
(наружная
поверхность
кожи)
Na+
Внутренний
раствор
Базальная
мембрана
Na-насос
(подавляется
уабаином)
Серозная
оболочка
(внутренняя
поверхность
кожи)
Рис. ХХП.6.
Активный транспорт натрия в эпите-
эпителиальных тканях
максимально возможный уровень потенциала, создаваемого за счет пассивной диф-
диффузии ионов, в частности уровень равновесного калиевого потенциала. Так, мем-
мембранный потенциал в гифах грибоз Neurospora составляет —200 мВ, а значение
нернстовского потенциала для К+ равно —133 мВ. В клетках листа элодеи, ряски,
харовых водорослей мембранный потенциал достигает значений 250-270 мВ (ци-
(цитоплазма отрицательна), что превышает уровень равновесного К+-потенциала на
100-120 мВ. Добавление в среду ингибиторов дыхания приводит к деполяризации
клеток до уровня равновесного К+-потенциала. Предполагают, что высокий уро-
уровень мембранного потенциала в клетках растений поддерживается АТФ-зависимой
системой активного электрогенного транспорта Н+ из цитоплазмы в наружную
среду. В качестве альтернативной гипотезы существует предположение о наличии
в плазмалемме растительных клеток цепи переноса электронов, функционирование
которой сопряжено с поглощением Н+ из цитоплазмы и выделением Н+ в наружную
среду (редокс-помпа, см. §3 гл. XXIV).
160 Глава XXII. Активный транспорт
Выражение для мембранного потенциала можно получить, используя аппарат
кинетики химических реакций. Так, если в клеточной мембране существует система
активного транспорта Na наружу, а пассивно переносятся ионы К, Na и С1, то
стационарные потоки К+, Na и С1~, направленные внутрь клетки и в наружную
среду, с учетом влияния мембранного потенциала (р можно записать в таком виде:
Входящий поток Выходящий поток
[K0]kKexp(9F/RT) [Ki]kK
[Nao]fcNa exp(-cpF/i?T) [Nai]A;Na + [Nai]A;a
[Clo]fcciexp((pF/i?T) [Ck}kCi
Здесь кк, &Na> &ci — константы скорости, характеризующие пассивное проникнове-
проникновение ионов К, Na и С1 через мембрану; ка — константа скорости активного транспор-
транспорта; индексы о и г относятся к концентрациям ионов в наружной среде и цитоплазме
клеток.
В стационарном состоянии сумма всех входящих потоков равна сумме выхо-
выходящих потоков (потоки С1~ в противоположных направлениях обычно равны друг
другу). Условие равенства входящих и выходящих потоков имеет вид
[K0]fcKexp (-||) + [Nao]fcNaexp (-||) = [Кг}кК + [Na;]fcNa + [Na;]fca
Решая уравнение (XXII.3.1) относительно потенциала, получим
Y F fcK[K0] + fcNa[Na0] v ;
Первый член в числителе подлогарифмического выражения отражает активность
электрогенного ионного насоса. Если активный транспорт неэлектрогенен, то этот
член отсутствует и выражение (XXII.3.2) становится идентичным уравнению Гольд-
мана [см. (XXI.1.2)] для мембранного потенциала, обусловленного пассивными ион-
ионными потоками.
I
Рис. ХХП.7.
Упрощенная эквивалентная электрическая схема мембра-
ны, содержащей параллельно функционирующие элек-
трогенный насос и каналы пассивной диффузии ионов:
gn и ga — проводимости каналов пассивной диффузии и системы
активного транспорта, ЕП и Е& — соответствующие им ЭДС.
Другой подход к описанию мембранного потенциала, создаваемого за счет пас-
пассивной диффузии и электрогенного транспорта ионов, основан на анализе экви-
эквивалентной электрической схемы мембраны. Простейшим электрическим аналогом
является схема, состоящая из двух параллельно соединенных цепей (рис. ХХП.7).
§ 3. Электрогенный транспорт ионов 161
Это так называемая модель электрогенного насоса с утечкой. Левая ветвь цепи
соответствует путям пассивной диффузии, причем gu — суммарная проводимость
мембраны по диффузионным каналам, а электродвижущая сила Еи представляет
собой диффузионный потенциал, рассчитываемый по (XXI.1.2). Правая ветвь цепи
соответствует электрогенному насосу, проводимость которого равна ga, а ЭДС Е&.
Если ЭДС насоса отличается от диффузионной ЭДС, то в рассматриваемой
цепи течет круговой ток г, который создает дополнительное падение напряжения на
сопротивлении l/gn- Таким образом, суммарную разность потенциалов на мембране
можно записать в виде
Ф = Еп + i/gn. (XXII.3.3)
Уравнение (XXII.3.3) показывает, что мембранный потенциал в этом случае можно
рассматривать как сумму диффузионной составляющей и электрогенной компонен-
компоненты. Силу тока в цепи г можно выразить по закону Ома:
г = .fa~f7 ¦ (ХХП.3.4)
1/ga + 1/gn
После преобразований и подстановки (ХХП.3.4) в (XXII.3.3) получаем формулу,
описывающую мембранный потенциал в рамках рассматриваемой эквивалентной
схемы:
(ХХП.3.5)
Ф ^ЕП + ^Ей.
gn+ga, gn+ ga,
Вопрос о том, какой вклад вносит проводимость насоса ga в суммарную про-
проводимость мембраны, в настоящее время окончательно не выяснен. Это в первую
очередь относится к мембранам растительных клеток. Электрогенный насос обыч-
обычно уподобляют генератору тока, т. е. считают, что его внутреннее сопротивление
намного больше сопротивления мембран для пассивного потока ионов (ga <C gn); a
иногда — источнику ЭДС (ga > gn).
Выражение для ЭДС насоса можно получить, рассматривая условие термоди-
термодинамического равновесия для сопряженных реакций гидролиза АТФ и активного
переноса ионов через мембрану. В случае Н+-насоса получим
„ Ац RT, [Hj\ rvYTT ч а\
Е--^-^Ы[Щ> (ХХП.3.6)
где A[i — изменение свободной энергии в ходе химической реакции (гидролиз
АТФ); v — стехиометрический коэффициент, отражающий количество транспорти-
транспортируемых протонов при гидролизе одной молекулы АТФ; [Hj] и [Но] — концентрации
протонов в цитоплазме и внешней среде. Уравнение (ХХП.3.6) предсказывает
зависимость ЭДС насоса как от рН среды, так и от рН цитоплазмы.
Функциональная роль электрогенного Н+-насоса растительной клетки состоит
в регуляции рН цитоплазмы. Кроме того, градиент рН, создаваемый на мембране,
способствует процессам накопления Сахаров и аминокислот при сопряжении этих
процессов с пассивным потоком Н+.
162 Глава XXII. Активный транспорт
§ 4. Транспорт протонов
В функционировании биоэнергетических систем важное место принадлежит транс-
транспорту протонов. Перенос электронов в энергосопрягающих мембранах митохон-
митохондрий, хлоропластов и бактерий сопровождается трансмембранным переносом Н+ и
образованием градиента электрохимического потенциала этого иона Дрн+> кото-
который включает электрический (мембранный потенциал) и концентрационный (гра-
(градиент рН) компоненты:
Арн+ = RT Hci/co) + zF((fi - ф0) = zFA<? - 2,ЗЛГАрН. (ХХП.4.1)
В приведенном выражении индексы г и о относятся к растворам, находящимся вну-
внутри и снаружи замкнутой мембранной системы. В сопрягающих мембранах локали-
локализованы также АТФ-синтетазные системы, через каналы которых осуществляется
пассивное движение Н+ по градиенту электрохимического потенциала (подробнее
см. гл. XXIV). В последнее время возрастает интерес к латеральному транспор-
транспорту Н+ по поверхности мембран, а также по микроструктурам цитозоля.
¦\У Перенос Н+ через мембраны может осуществляться механизмами трех типов.
В некоторых мембранах существуют подвижные переносчики протонов (пла-
стохинон в фотосинтетической мембране хлоропластов). Возможны также конфор-
мационные переходы мембранного белка при связывании протона на одной стороне
мембраны и депротонировании белка с другой стороны мембраны, сопряженные с
поворотом макромолекулы в мембране, при котором присоединенный протон пере-
пересекает мембрану. Наконец, протоны могут транспортироваться через мембрану по
специализированным структурам — Н+-каналам. Протонный канал представляет
собой узкую полость, образованную полярными группами белка. ?
Протонный канал — важный компонент всех Н+-АТФаз. Он образован гидро-
гидрофобной частью субъединицы сопрягающего фактора — комплексом CFq. По Н+-
каналу протоны поступают к каталитическому участку транспортной системы, в
котором осуществляется сопряжение переноса Н+ с реакциями синтеза-гидролиза
АТФ. Таким образом, основными узлами Н+-насосов являются протонный канал и
активный центр.
Транспорт протонов по Н+-каналам обычно сравнивают с переносом Н+ по
регулярной решетке, образованной системой водородных связей, аналогичной та-
таковой во льду. В структуре льда возможны переходы протона от одной молекулы
воды к соседней (см. § 4 гл. IX). В результате возникает ионная пара, состоящая из
положительно заряженного иона гидроксония Нд О и гидроксила ОН~. В отсутствие
электрического поля обмен протонами происходит хаотично, однако при создании
разности потенциалов возникает направленная миграция дефектов. В итоге дости-
достигается быстрое смещение протонов вдоль упорядоченной цепи водородных связей.
В некоторых кристаллах (например, имидазол), которые содержат систему
водородных связей, ориентированных в определенном направлении, подвижность
протона в направлении цепи Н+-связей в 103 раз выше, чем в перпендикулярном
направлении. В биологических мембранах системы водородных связей, по которым
транспортируются протоны, образованы полярными группами, не участвующими в
формировании Н-связей а-спирали полипептидной цепи. Для формирования сквоз-
§ 4. Транспорт протонов 163
ной трансмембранной структуры, транспортирующей Н+, необходимо около 20 ами-
аминокислотных остатков.
Эстафетная передача протонов возможна лишь при чередовании стадий пере-
перескока протона и поворотов химических связей в области образовавшегося дефекта
(рис. XXII.8). Как видно из рисунка, транслокация одного протона по цепи про-
протекает в две стадии. Сначала происходит перескок протона от группы к группе
(рис. XXII.8, I), а затем поворот группы (на рис. XXII.8, II поворот вокруг свя-
связи С—О), в результате которого происходит дополнительное смещение заряда, и
система связей возвращается в исходное состояние. В результате поворота химиче-
химической группы или молекул воды образуется конфигурация, не допускающая возврата
протона в начальное положение. В жесткой структуре а-спирали повороты групп
крайне затруднены; поэтому система Н-связей а-спирали не способна проводить
протоны.
/с
°
wo -
с
45
0
4 ? Рис.ХХП.8.
и*-*0'• s-° Проведение протона по цепи Н-связей:
йЪ> нр I — стадия перескока протона, II — стадия поворо-
с с та групп (миграция поворотного дефекта)
На стадии миграции ионного дефекта лишь некоторая часть от полного заряда
протона смещается за счет перескока Н+ от группы к группе. Остальная часть
заряда смещается за счет поворота полярной группы. Во льду, например, доля
ионного дефекта в переносе заряда составляет 0,62 от полного заряда протона.
Благодаря разделению заряда протона при переносе между ионным и поворотным
дефектами, существенно снижается энергетический барьер переноса Н+ через мем-
мембрану. Высота барьера определяется уровнем электростатической энергии заряда
в ионном канале и оценивается по формуле Борна [см. (XX.1.1)]. Как следует из
этой формулы, уменьшение транспортируемого заряда в два раза по сравнению с
зарядом протона приводит к 4-кратному уменьшению энергии активации перено-
переноса Н+ через мембрану. Характерные подвижности ионного и поворотного дефектов
составляют 10~3 и 10~4 см/В • с соответственно. Согласно расчетам, время мигра-
миграции ионного и поворотного дефекта через мембрану толщиной 5 нм не превышает
0,25 мкс и 2,5 мкс соответственно.
Величина активационного барьера переноса протона сильно зависят от рас-
расстояния между донорно-акцепторными парами. В большинстве случаев в системе
водородных связей расстояние между ядрами атомов составляет 0,23-0,27 нм. Уве-
Увеличение расстояния на 0,1 нм приводит к пропорциональному росту барьера на
величину 125-250 Дж/моль. Это значит, что изменение расстояний между ориен-
ориентированными парами в белке всего на 0,1-0,2 нм может служить затвором протон-
протонной проводимости белка. Фактором, влияющим на протонную проводимость белка
164
Глава XXII. Активный транспорт
могут быть внешние электрические поля (трансмембранные) и наличие заряженных
групп. Время элементарного акта переноса протона сравнимо с временами вибра-
вибраций и флуктуации длин связей вследствие атомных колебаний, т. е. лежит в преде-
пределах A0-50) • 10~15 с. Методы моделирования молекулярной динамики (гл. XI, § 3)
позволяют вычислить траектории движения протона, преодолевающего барьер при
переходе между двумя группами. Так была вычислена траектория перехода прото-
протона от глутамата-35 лизозима к атому кислорода молекулы субстрата (Воршелл).
В результате случайных флуктуации зарядов и диполей взаимодействующих групп
за время ~ 16 пс создается переходная конфигурация с пониженным барьером,
благоприятная для перехода протона. Поскольку последующий перескок протона
происходит за несколько фемтосекунд A0~15 с), то лимитирующей стадией пере-
переноса протона является образование активной конфигурации атомов при случайных
флуктуациях (~ пс).
Рис. ХХП.9.
Энергозависимые изменения
структуры барьеров в ион-
ионном канале активной транс-
портной системы:
г — потенциальный минимум
¦\У В общем виде систему активного транспорта рассматривают как трансмем-
бранный канал с большим числом участков связывания Н+, в котором трансло-
транслокация протонов происходит за счет последовательных перескоков Н+ между участ-
участками связывания. Такой ионный канал может работать как ионный насос, если
структура энергетических барьеров претерпевает динамические изменения за счет
энергообеспечивающей реакции, например изменяются константа диссоциации про-
тон-связывающих участков канала и высота соседних барьеров. В этом случае про-
протон будет освобождаться преимущественно с одной стороны мембраны, а погло-
поглощаться— с другой. ?
На рис. ХХП.9 показаны профили потенциальной энергии Н+ для основного
и энергизованного состояния канала, формируемого бактериородопсином в мем-
мембранах галофильных бактерий (см. гл. XXIX). В основном состоянии протон зани-
занимает наиболее глубокую потенциальную яму, соответствующую главному участку
связывания. Этот участок доступен с цитоплазматической стороны мембраны, но
отделен от внешней среды высоким энергетическим барьером. При поглощении
бактериородопсином кванта света энергетический уровень участка связывания и
высота барьеров изменяются таким образом, что протон высвобождается во внеш-
внешний раствор. Изменение высоты активационных барьеров, обусловленное небольши-
небольшими изменениями конформации Н+ канала, может быть связано с изменением рКа
сродства к протону аминокислотных остатков переносчиков Н+ (гл. XXIX).
§ 4. Транспорт протонов 165
Рассмотренная схема может быть распространена на Н+-насосы, использующие
в качестве источника энергии разность окислительно-восстановительных потенци-
потенциалов. В этом случае разные конформационные состояния канала соответствуют
окисленной и восстановленной форме ферментов — переносчиков электрона. Ана-
Аналогичным образом можно описать АТФ-зависимый транспорт протонов.
Глава XXIII
Транспорт ионов в возбудимых мембранах
§ 1. Потенциал действия
Нервные импульсы, возникающие в отдельных волокнах, имеют постоянную ам-
амплитуду и форму. Одиночный нервный импульс — потенциал действия — длится
примерно 1 мс и распространяется со скоростью от 1 до 100 м/с.
В основе представлений о процессе генерации нервного импульса лежат иссле-
исследования, выполненные на гигантских нервных волокнах кальмара А. Ходжкиным,
А.Хаксли и Б.Катцем. Для измерения потенциала действия внутри аксона вводят
тонкий стеклянный капилляр с диаметром кончика менее 0,5 мкм, заполненный
концентрированным раствором КС1, что не оказывает заметного влияния на ак-
активность аксона.
Толчок тока, 2 мс
Мембранный
потенциал
Рис. XXIII. 1.
Возникновение импульса в результате
местной деполяризации (по Б. Катцу,
1968)
При действии толчка тока фиксированной дли-
длительности B мс), но различной силы и напра-
направления, возникают изменения мембранного по-
потенциала, представленные семейством кривых
на графике
При пропускании гиперполяризующих или подпороговых деполяризующих им-
импульсов тока мембрана ведет себя подобно пассивной ЛС-цепи, заряжаясь экспо-
экспоненциально от исходного до нового уровня с характерным временем т, равным
произведению сопротивления на емкость мембраны (рис. XXIII.1). При действии
надпороговых деполяризующих импульсов наблюдается быстрое смещение значе-
значений потенциала внутренней части волокна до уровня +D0-50) мВ и последующий
§ 1. Потенциал действия 167
их возврат с кратковременной стадией следовой гиперполяризации. Амплитуда по-
потенциала действия составляет 100-120 мВ.
Потенциал покоя. Как и протоплазма многих других клеток, аксоплазма содер-
содержит в высокой концентрации К+ и в относительно низкой концентрации Na и С1~.
Ионы К внутри волокна свободны и не связаны с белками или другими крупными
молекулами.
В состоянии покоя мембрана более проницаема для К+, чем для Na+. Вследствие
диффузии К+ наружу из аксоплазмы внутреннее содержимое нервного волокна в
состоянии покоя заряжено отрицательно по отношению к наружному раствору. Эта
постоянная разность потенциалов — потенциал покоя — равна 50-70 мВ. Какими
факторами определяется это значение? Если бы мембрана была проницаема только
для К+, равновесная разность потенциалов достигла бы значения, определяемого
уравнением Нернста [см. (XVIII.3.1)] для калиевого электрода
где срк — равновесный потенциал для К+. При концентрациях К+ в крови 20 мМ
и аксоплазме 400 мМ кальмара рассчитанное значение срк равно —75 мВ. Действи-
Действительно, в интактных аксонах регистрируют потенциалы покоя около —70 мВ. Сле-
Следовательно, в этих условиях мембрана ведет себя подобно К+-электроду. Однако
при более низких концентрациях К+ в среде потенциал покоя уже существенно
отличается от расчетных значений равновесного потенциала срк-
Как оказалось, зависимость потенциала покоя от концентрации К+ в среде
значительно лучше описывается уравнением Гольдмана (см. (XIX.2.10)], которое
выведено в рамках электродиффузионной теории в приближении постоянного поля.
В состоянии покоя распределение С1~ близко к равновесному, т. е. потоки С1~
из клетки и внутрь ее одинаковы. В этом случае условие нулевого тока через мем-
мембрану [см. (XIX.2.8)] /к + -?Na + ^ci = 0 упрощается до /к + /Na = 0 и потенциал
покоя вычисляется по формуле
И!
Y F
\—? Потенциал на мембране в состоянии покоя (XXIII. 1.2) приближается к равно-
весному потенциалу для К+, так как проницаемости для К+ в этих условиях
намного больше коэффициента проницаемости для Na (Рк : PNa = I : 0,04). ?
Генерация импульса. Реверсия мембранного потенциала во время развития им-
импульса вызвана тем, что на гребне спайка потенциала действия мембрана избира-
избирательно проницаема для Na+, так что отношение ионных проницаемостей становит-
становится равным Рк : PNa = 1 : 20. Как видно из формулы (XXIII.1.2), в этих условиях
(PNa 3> -Рк) потенциал на мембране приближается к равновесному натриевому по-
потенциалу cpNa- Разность потенциалов на мембране, проницаемой только для Na+,
выражается формулой Нернста
^gj (ХХШ.1.3)
168
Глава XXIII. Транспорт ионов в возбудимых мембранах
Предельное значение потенциала, вычисленное по (XXIII.1.3), равно +55 мВ, что
лишь немного превышает экспериментально наблюдаемые значения обращенного
потенциала. Эти выводы сохраняются, если воспользоваться для выражения мем-
мембранного потенциала более полной формулой, где учтены потоки С1~:
,
PK[Ki] + PNa[Nai]
(XXIII. 1.4)
\—? В состоянии покоя Рк : -PNa : -F*ci = 1 : 0,04 : 0,45, а в состоянии возбуждения
на пике потенциала действия, когда вновь соблюдается условие нулевого тока
через мембрану, Рк
Наружная среда
Цитоплазма
Рис. ХХШ.2.
Эквивалентная схема мембра-
мембраны нервной или мышечной
клетки (по Б. Катцу, 1968).
Фк, Фсь ФКа — равновесные по-
потенциалы для К+, Cl~, Na~*~; gK,
gCb gNa— проводимость для К+,
Cl~, Na+; См — емкость мембра-
мембраны; ф — мембранный потенциал
: Ра = 1 : 20 : 0,45. ?
Для описания изменений мембранного потен-
циала при возбуждении помимо приближения по-
постоянного поля [см. (XXIII.1.4)] часто используют
и другой подход, основанный на представлении
ионных проводимостей мембраны в виде эквива-
Ф лентной электрической цепи (рис. ХХШ.2).
Мембранный потенциал, измеряемый на схеме
между точками г и о (внутренняя и наружная сре-
среда клетки), создается электродвижущими силами,
равными равновесным потенциалам отдельных ви-
видов ионов, последовательно соединенными с соот-
соответствующими сопротивлениями. Ток в каждой из
ветвей равен
h = gi(<? ~ ф»),
(ХХШ.1.5)
где gi — проводимость мембраны для данного вида
ионов, (pj — равновесный потенциал данного вида
ионов, а ф — общий потенциал на мембране. Ис-
Используя условие, что в разомкнутой цепи при по-
постоянном напряжении на мембране сумма токов
равна нулю, можно получить следующее выражение для мембранного потенциала:
_
gNa9Na + gCl9Cl
(ХХШ.1.6)
где gM — суммарная проводимость мембраны: gM = gK + gNa + gci.
Из (ХХШ.1.6) видно, что значение мембранного потенциала определяется теми
ионами, для которых проводимость мембраны максимальна. Уравнение (ХХШ.1.6)
во многих случаях лучше описывает зависимости мембранного потенциала от кон-
концентрации ионов в среде, чем уравнение (XXIII.1.4).
Эквивалентная схема ионных проводимостей мембраны и основанное на ней
уравнение (ХХШ.1.6) предполагают, что разные виды ионов проникают через кле-
клеточную мембрану по пространственно разделенным путям. Это соответствует со-
современным представлениям о существовании отдельных типов ионных каналов, се-
селективно проницаемых для Na и К+.
§ 1. Потенциал действия 169
\—? Процесс возбуждения развивается вследствие зависимости проницаемости мем-
мембраны для ионов от мембранного потенциала. При достижении критической де-
деполяризации, когда возрастает проницаемость мембраны для Na , эти ионы устрем-
устремляются внутрь и вызывают дальнейшую деполяризацию мембраны. Процесс про-
продолжается до тех пор, пока потенциал не сместится до равновесного натриевого
потенциала. В этих условиях потоки Na+ наружу и внутрь сравниваются. Затем
происходит увеличение проницаемости для К+ и ионы К начинают выходить из
клетки по градиенту своего электрохимического потенциала. В этом процессе мем-
мембрана реполяризуется. Выход К+ прекращается, когда потенциал на мембране при-
приблизится к равновесному калиевому потенциалу. ?
Важным подтверждением мембранной теории возбуждения явились экспери-
эксперименты по регистрации потенциала действия на перфузируемых аксонах, у которых
аксоплазма заменена на подходящий солевой раствор (например, K^SC^)- Заполнен-
Заполненные искусственным раствором аксоны проводят импульсы в течение нескольких ча-
часов, хотя в результате перфузии удаляется около 95% аксоплазмы. Опыты с перфу-
перфузией аксона подтвердили идею о том, что потенциал покоя регулируется ионом К+.
Так, при перфузии аксона бескалиевым раствором потенциал покоя был близок к
нулю. Повышение концентрации К+ внутри аксона в интервале до 150 мМ сопро-
сопровождалось повышением потенциала покоя в соответствии с уравнением Нернста.
Аналогичные опыты с изменением концентрации Na+ в перфузируемом раство-
растворе выявили зависимость пикового значения потенциала действия от внутриклеточ-
внутриклеточной концентрации Na . При повышении концентрации Na величина спайка умень-
уменьшалась, а при замене 50% калия на натрий в перфузируемом растворе проведение
возбуждения прекращалось.
Одно из веских доказательств мембранной теории состоит в том, что прове-
проведение импульса связано с заметным возрастанием скорости движения Na+ и К+
по градиентам концентрации. Количество входящего Na+ и выходящего К+ можно
определить с помощью изотопов или методом пламенной фотометрии после много-
многократной стимуляции аксона. Результаты измерений показывают, что в гигантском
аксоне каракатицы каждый импульс связан не только с входящим потоком Na+
A0,3 пмоль/см2), но и с выходящим потоком этого же иона F,6 пмоль/см2). Та-
Таким образом, суммарный вход Na+ составляет 3,7 пмоль/см2, что приблизительно
соответствует потере К+ на один импульс.
Количество входящего Na вполне достаточно для переполяризации мембраны
в период потенциала действия. Действительно, чтобы изменить напряжение кон-
конденсатора емкостью 1 мкФ на 120 мВ, необходим заряд, равный 0,12 • 10~6 Кл.
Это эквивалентно 1,2 • 10~12 моль одновалентного катиона, что составляет лишь
1/3 от наблюдаемого входа Na+. Таким образом, общее количество входящего Na+
значительно превышает минимум, необходимый для изменения потенциала на мем-
мембране при возбуждении. Превышение минимума объясняется тем, что Na+ входит
не только во время восходящей фазы спайка. Вход Na+ продолжается и во время
ранней фазы спада, когда высока проницаемость и для Na+, и для К+. В этот период
заряд, переносимый входящим Na+, с избытком компенсируется выходящим К+.
После прохождения по аксону одного спайка система возвращается в исход-
исходное состояние, за исключением того, что в клетке появился некоторый избыток
170 Глава XXIII. Транспорт ионов в возбудимых мембранах
ионов Na, вошедших в период деполяризации, и некоторый недостаток ионов К,
вышедших на фазе реполяризации. Изменения внутриклеточной концентрации Na
и К+, вызванные одиночным потенциалом действия, крайне малы, но могли бы
оказаться значительными при многократном прохождении нервных импульсов. Для
поддержания постоянного уровня внутриклеточных концентраций К+ и Na в кле-
клеточной мембране и существует система Na+, К+-насоса (см. § 1 гл. XXII), обеспечи-
обеспечивающая активное выведение Na+ в обмен на поступление в клетку К+, работающая
за счет энергии АТФ.
§ 2. Ионные токи в мембране аксона
Механизмы возбудимости были расшифрованы благодаря измерениям мембранного
тока методом фиксации потенциала (К.Коул, 1949). В обычных измерениях потен-
потенциала действия проницаемости для Na и К+ являются функцией двух переменных:
значения мембранного потенциала и времени. В методе фиксации потенциала сме-
смещения мембранного потенциала находятся под контролем, что дает возможность
четко разграничить влияние этих двух факторов за счет подавления автоматиче-
автоматического взрывоподобного развития потенциала действия.
п Рис. ХХШ.З.
Принципиальная (I) и эквивалент-
эквивалентная (II) схемы установки для фикса-
фиксации мембранного потенциала
Основу установки составляет дифферен-
дифференциальный усилитель Уг с высоким коэф-
коэффициентом усиления, на один вход кото-
которого подается разность потенциалов меж-
между измерительным микроэлектродом Эн и
наружным электродом сравнения Эс, т.е.
мембранный потенциал (измеряется уси-
усилителем Ух). На другой вход поступает
командный потенциал Е. Если командный потенциал Е равен потенциалу покоя ф, то напряжение
на выходе дифференциального усилителя равно нулю, и в цепи, включающей токовый электрод Эт,
клеточную мембрану и электрод сравнения, ток не течет. Если же командный потенциал отлича-
отличается от потенциала покоя, то на выходе дифференциального усилителя возникает напряжение,
пропорциональное разности потенциалов (Е — ф) с коэффициентом пропорциональности Kq ~ 10е
(Ко — коэффициент усиления операционного усилителя). При этом в цепи обратной связи через
токовый микроэлектрод с сопротивлением R3, клеточную мембрану и электрод сравнения потечет
ток, который смещает потенциал на мембране, приближая его к заданному уровню потенциала Е
^—р В методе фиксации потенциала используют электронную управляющую систе-
систему с обратной связью, которая обеспечивает поддержание мембранного потен-
потенциала на заданном уровне. При этом регистрируется ток, текущий через мембрану.
На рис. ХХШ.З представлен способ измерения тока при фиксации потенциала.
При ступенчатом смещении командного потенциала от уровня потенциала по-
покоя напряжение на мембране практическим мгновенно устанавливается на новом
заданном уровне, равном командному сигналу. Ток, текущий при этом через мем-
§ 2. Ионные токи в мембране аксона 171
брану, измеряется с помощью включенного в цепь усилителя тока, показанного на
схеме в виде микроамперметра. ?
Данные, получаемые методом фиксации потенциала, интепретируют обычно
на основе эквивалентной схемы возбудимой мембраны (см. рис. XXIII.2). Каждый
элемент мембраны нервного волокна содержит мембранную емкость См, калиевую
батарею срк и сопротивление 1/gK, а также натриевую батарею cpNa и сопротивле-
сопротивление 1/gNa- Сопротивление утечки ~ 1/gi, и батарея (р; введены для учета движения
ионов, проходящих по каналам, которые не меняются во время активности. Во-
Волокно в целом следует рассматривать в виде большого числа подобных элементов,
связанных между собой и образующих непрерывный кабель.
В состоянии покоя ток через мембрану не течет. Если потенциал на мембране
сместить от уровня потенциала покоя в сторону деполяризации, то проницаемости
Na+- и К+-каналов изменяются определенным образом от одного стационарного
состояния к другому. В этом случае в каждом из параллельно соединенных участков
текут токи, пропорциональные разности между равновесным потенциалом иона cpj
и поддерживаемым на мембране потенциалом:
Ii=gi((f-(fi), (XXIII.2.1)
где gi — проводимость мембраны для данного вида ионов. Общий ток через мем-
мембрану /Общ равен сумме емкостного тока и ионного тока, обусловленного движением
ионов по отдельным путям:
/общ = См dcf/dt + /, (ХХШ.2.2)
где См — мембранная емкость, dcp/dt — скорость изменения мембранного потенци-
потенциала, / = ^2 Ii — трансмембранный ионный ток.
Если потенциал на клеточной мембране не поддерживается на фиксирован-
фиксированном уровне, то в период потенциала действия d(p/dt /0 и через мембрану течет
значительный емкостной ток. Важное преимущество метода фиксации потенциала
состоит в том, что емкостный ток протекает только в течение очень короткого
периода после сдвига мембранного потенциала на заданный уровень. После кратко-
кратковременного выброса емкостный ток прекращается, так как потенциал на мембране
не изменяется (dcp/dt = 0). Поскольку длительность потенциала действия составляет
несколько миллисекунд, важно, чтобы установление потенциала на новом уровне и
спад емкостного тока происходили значительно быстрее, например за время поряд-
порядка десятка микросекунд. Тогда ток, развивающийся после прекращения емкостного
тока, будет обусловлен уже только переносом ионов через мембрану.
Физический анализ процесса электрического возбуждения в мембране нервно-
нервного волокна осложняется распространением нервного импульса по волокну. Чтобы
устранить эту трудность и заставить всю мембрану аксона возбуждаться синхрон-
синхронно, внутрь аксона вводят металлический осевой электрод. Введение осевого элек-
электрода внутрь аксона позволяет не учитывать кабельные свойства волокна и заме-
заменить эквивалентную схему с распределенными емкостью и ионной проводимостью
(см. §8 гл. XXIII) на простую эквивалентную схему (см. рис. XXIII.2).
В ответ на ступенчатую деполяризацию аксона кальмара от потенциала по-
покоя до 0 мВ регистрируется мембранный ток, состоящий из четырех компонентов
172
Глава XXIII. Транспорт ионов в возбудимых мембранах
(рис. XXIII.4). Емкостный ток 1с представляет собой кратковременный импульс,
который в основном заканчивается к моменту выхода напряжения на плато. Неко-
Некоторые дипольные молекулы в мембране медленно меняют свою ориентацию после
наложения ступенчатого напряжения, что приводит к появлению небольшого по ам-
амплитуде «хвоста» емкостного тока, который спадает относительно медленно. После
спада 1с мембранный ток полностью определяется движением ионов через каналы
в мембране.
о--
Е, мВ
-60
Рис. ХХШ.4.
Ток, протекающий через мембрану аксона кальмара при ступенчатое деполяриза-
деполяризации от уровня потенциала покоя (—60 мВ) до нуля (А); представление полного тока
в виде суммы четырех компонентов (Б) и различные состояния воротной системы
Na- и К-каналов (по C.M.Armstrong, 1975):
Iq — емкостный ток, 7^а — натриевый ток; 7к — калиевый ток, 7ут — ток утечки; отклонения
вниз соответствуют входящему току, вверх — выходящему
Рис. ХХШ.5.
Мембранные токи при различных смещениях мем-
мембранного потенциала (температура 3,5°). Откло-
Отклонения вверх соответствуют выходящему току; ци-
цифрами обозначена величина смещения мембранно-
мембранного потенциала (по A. L. Hodgkin, 1964).
[мА/см2
В ионном токе можно выделить два основных компонента (калиевый и натри-
натриевый) и один второстепенный. Последний представляет собой небольшой по значе-
значению ток утечки, не меняющийся во времени. Na+-TOK обусловлен кратковременным
потоком Na+ через Na+- каналы. Этот ток быстро уменьшается, и спустя примерно
1 мс сменяется входящим К+-током.
Если мембрана деполяризована так, что разность потенциалов равна напряже-
напряжению натриевой батареи (cpNa равновесный Ма+-потенциал), то Na+-TOK отсутствует
и наблюдается только К+-ток, возникающий с обычной задержкой. При смещении
потенциала до положительных значений, превышающих уровень cpNa> Na -ток на-
направлен наружу (рис. ХХШ.5).
i 2. Ионные токи в мембране аксона
173
Ионный ток удается разделить на отдельные компоненты путем замены Na+
в среде на непроникающие катионы холина. В этом случае кинетическая кривая
включает только К+-компонент (рис. XXIII.6).
\-у Разделение тока на компоненты наглядно иллюстрируют опыты с использова-
использованием ряда фармакологических агентов. Добавление к аксону малых количеств
тетродотоксина ТТХ полностью подавляет Na+-TOK (рис. XXIII.7). Если в аксон
Внутренний потенциал
1imA/cm2 Рис. XXIII.6.
Экспериментальное разделение мембранного то-
тока I на калиевый и натриевый компоненты (по
A. L. Hodgkin, 1964):
1 —аксон находится в морской воде, I = 7Na + 7К; 2 —
большая часть натрия заменена холином, I = 1К; 3 — раз-
разность между 1 и 2, I = 1^л, температура 8,5° С; отклонение
вверх соответствует выходящему току
+ 80
2 мс
III
Рис. XXIII. 7.
Влияние тетродотоксина ТТХ, тетраэтиламмония
ТЭА и проназы на ионные токи в мембране аксона,
вызываемые смещением мембранного потенциала до
¦ + 80 0 и до +80 мВ:
I— калиевый ток в аксонах, обработанных ТТХ; II — натри-
натриевый ток в аксонах, перфузируемых раствором с добавлением
15 мМ ТЭА; III — то же, что и II, после введения в перфузиру-
емый раствор проназы B мг/мл); цифрами у кривых отмечены
значения потенциала внутреннего раствора
кальмара инъецирован или введен с помощью перфузии тетраэтиламмоний ТЭА
до концентрации 15 мМ, то практически полностью подавляется К+-ток. Опыты
с использованием ТТХ и ТЭА свидетельствуют о том, что Na - и К+-каналы —
раздельные структуры, как и предполагается эквивалентной схемой, предложенной
в работах А. Ходжкина и А. Хаксли. ?
Дальнейшее подтверждение существования двух типов каналов получено в опы-
опытах с применением проназы. Оказалось, что перфузия аксона раствором с проназой
174
Глава XXIII. Транспорт ионов в возбудимых мембранах
не оказывает влияния на кинетические кривые К+-тока, но существенно изменяет
кинетику Na -тока. Обработка проназой приводит к подавлению стадии инактива-
инактивации Na -тока (рис. XXIII.7, III), т.е. к исчезновению стадии быстрого уменьшения
Na -тока после достижения пикового значения. Значение тока остается большим
на протяжении всего импульса напряжения. Эквивалентная схема, используемая
при интерпретации данных в опытах по фиксации потенциала (см. рис. XXIII.2),
предполагает, что токи, текущие по Na+- и К+-каналам, подчиняются уравнениям
JNa = ?рч[а(ф — cpNa); 1к = ,§к(ф ~ фк)- (ХХШ.2.3)
Если во время развития ионного тока скачком сместить мембранный потенциал
на новый уровень, то ток также изменится скачком. Построенные таким способом
мгновенные вольт-амперные характеристики мембраны аксона оказались линейны-
линейными: мгновенный сдвиг ионного тока был пропорционален величине смещения потен-
потенциала, что соответствует уравнению (ХХШ.2.3). Из соотношений (ХХШ.2.3) видно,
Внутренний потенциал
20
10
20
10
-/
-1
\
i Ч
lvSNa
- %Му
J
56 мВ
у?Ыа
1
1
1
s
0 2 4 6 8
Время, мс
Рис. ХХШ.8.
Изменение натриевой и калиевой проводи-
проводимости во времени при деполяризации мем-
мембраны на 56 мВ (по A. L. Hodgkin, 1964)
Сплошными линиями показана проводимость при
длительной деполяризации, штриховыми — про-
проводимость при реполяризации мембраны через
0,6 и 6,3 мс
Рис. ХХШ.9.
Изменение натриевой (А) и калиевой
(Б) проводимости мембраны аксона
при различных смещениях мембранно-
мембранного потенциала от уровня потенциала
покоя
Цифрами обозначена величина деполяриза-
деполяризации (мВ)
что изменение тока Na+ и К+ во времени в режиме фиксации напряжения обусло-
обусловлено изменением проводимостей gNa и ёк, поскольку величина (ср — (pi) остается
постоянной в течение всего импульса.
Разделив суммарный ионный ток на отдельные компоненты, нетрудно найти
кинетические кривые изменений проводимости для каждого иона:
(ХХШ.2.4)
§ 3. Описание ионных токов в модели Ходжкина—Хаксли 175
На рис. XXIII.8 показаны вычисленные по (XXIII.2.4) изменения проводимости,
вызванные быстрым смещением потенциала внутри волокна от уровня потенциала
покоя (—56 мВ) до нуля в экспериментах, приведенных на рис. XXIII.6. Как видно,
при ступенчатой деполяризации мембраны Na -проводимость начинает изменяться
от чрезвычайно малой величины, быстро нарастает до 25 мСм/см2, а затем экспо-
экспоненциально уменьшается. Проводимость для К+ нарастает по S-образной кривой и
выходит на постоянный уровень через 5-6 мс. Изменения проницаемости для К+
и Na+ градуальны и обратимы. Натриевая проводимость восстанавливается при-
примерно в 10 раз быстрее, чем калиевая.
Ма+-проводимость может быть уменьшена двумя разными способами. Если
мембранный потенциал возвратить на исходный уровень через короткий промежу-
промежуток времени, то система, регулирующая Na+- проницаемость, быстро возвращается
к состоянию покоя. Второй импульс, нанесенный сразу же после первого, вызывает
в этом случае повторное увеличение Na -проводимости. Если же деполяризация
продолжительна, Na -проводимость уменьшается более медленно вследствие про-
процесса, называемого инактивацией. Для того чтобы второй импульс после инакти-
инактивации ^+-каналов мог снова вызвать изменение проницаемости для Na+, мембра-
мембрана в течение нескольких миллисекунд до начала второго импульса должна быть
реполяризована. Этот период необходим для выхода из состояния инактивации
(см. XXI, §7).
На рис. XXIII.9 представлено семейство кривых, показывающих зависимость
проводимости от амплитуды сдвига потенциала и времени после ступенчатого из-
изменения напряжения на мембране. В области порога возбуждения увеличение депо-
деполяризации мембраны на 4-6 мВ вызывает быстрое возрастание проводимости.
§ 3. Описание ионных токов в модели Ходжкина—Хаксли
\—? На основе опытов по фиксации напряжения в аксоне кальмара А. Ходжкин
и А. Хаксли сформулировали ряд важных принципов. 1. Перенос Na и К+
осуществляется различными невзаимодействующими структурами. 2. Изменение
токов являются следствием изменения проницаемости мембран (для Na и К+).
3. Пропускная способность мембраны управляется электрическим полем. ?
А. Ходжкин и А. Хаксли предложили удовлетворительное математическое опи-
описание экспериментально наблюдаемой кинетики изменений натриевой и калиевой
проводимости при различных смещениях мембранного потенциала (рис. XXIII.9).
Модель предполагает, что проводимость мембраны для ионов Na и К регулируется
некоторыми управляющими частицами, перемещающимися в мембране при измене-
изменениях электрического поля.
Такое перемещение можно представить в виде перескоков положительно заря-
заряженных частиц между двумя потенциальными ямами через энергетический барьер
с константами скоростей а и C (рис. XXIII. 10), которые зависят от высоты энерге-
энергетического барьера и, следовательно, являются потенциалозависимыми. Повышение
электрического потенциала с левой стороны мембраны приводит к увеличению кон-
константы а и уменьшению константы C.
При ступенчатом изменении разности потенциалов на мембране происходит пе-
перераспределение частиц между двумя состояниями. При этом изменяются до новых
176
Глава XXIII. Транспорт ионов в возбудимых мембранах
равновесных значении вероятности заполнения правой и левой потенциальных ям: х
и A — х) соответственно.
Процесс изменения вероятности (ж) заполнения правой ямы после ступенчатого
сдвига потенциала может быть описан дифференциальным уравнением
dx/dt = аA — х) — (Зж.
(ХХШ.3.1)
Задаваясь граничными условиями: х = Хо при t = 0 и х = Жоо при t = оо, получим
х = ж,» -
-жо)ехр[-г(а + Р)].
(ХХШ.3.2)
Уравнение показывает, что накопление частиц в правой части мембраны происхо-
происходит по экспоненциальному закону с постоянной времени т, где т = 1/(а + C).
Изменения калиевой проводимости. Если бы
канал открывался в результате перехода слева на-
направо только одной активирующей частицы, то
проводимость ионных каналов менялась бы во вре-
времени также по экспоненте, т. е. можно было бы
записать gi = xgi, где gi —максимальная проводи-
проводимость для ионов типа г. Однако наилучшее соответ-
соответствие кинетической кривой калиевой проводимо-
проводимости в аксоне кальмара достигается при допущении,
что для открывания калиевых каналов необходим
приход к определенному участку мембраны четы-
четырех активирующих частиц.
Пусть п обозначает вероятность того, что од-
одна частица, управляющая К+-проницаемостью, на-
находится в правой части мембраны. Тогда вероят-
вероятность р того, что там находится одновременно
четыре частицы, равна п4. Поэтому К+-проводи-
мость мембраны в любой момент времени равна
Рис. XXIII. 10.
Модель, демонстрирующая
перемещение заряженных
частиц в мембране при
изменениях электрического
поля:
х — вероятность нахождения ча-
частицы в правой стороне мембра-
мембраны; A — х)—вероятность нахо-
нахождения частицы а левой стороне
мембраны; а и C — потенциалзави-
симые константы перехода заря-
заряженных частиц через мембрану
(ХХШ.3.3)
где п определяется уравнением типа (ХХШ.3.1) и
может варьировать в пределах от 0 до 1:
dn/dt = апA — п) — р„п.
(ХХШ.3.4)
Частицы, управляющие проницаемостью К+-каналов, называют п-частицами.
Рассмотрим простой случай, когда в исходном состоянии все n-частицы нахо-
находятся с левой стороны мембраны (п = 0) и К+-каналы закрыты. После наложения
большой разности потенциалов со знаком плюс по левую сторону мембраны все п-
частицы перетекают в правую яму. Кинетика накопления n-частиц в правой части
мембраны описывается экспонентой [см. (ХХШ.3.2)]
n(t) =
- п0) ехр(-*/т„),
(ХХШ.3.5)
§ 3. Описание ионных токов в модели Ходжкина—Хаксли 177
где тп = 1/(ага + (Зп). Так как в рассматриваемом случае щ = О, а п^ = 1, то
n(t) = 1 - exp(-i/xn).
Величина К+-проводимости, пропорциональная четвертой степени п, растет уже не
по экспоненте, а с большим периодом задержки. Быстрое изменение величины п4
начинается лишь после того, как значения п превысят 0,7.
Приведенный пример поясняет и способ определения кинетических параме-
параметров активации К+-проводимости. Для определения постоянной времени актива-
активации тп необходимо произвести нормировку кинетических кривых проводимости,
т.е. построить зависимости gK.{t)/gK = п^- Затем, извлекая корень четвертой сте-
степени, построить зависимость n(t) и определить постоянную времени экспоненты
тп = 1/(ап + (Зп) для данного уровня мембранного потенциала.
Если приложенная к мембране разность потенциалов недостаточно велика, то
не все управляющие частицы переместятся с левой стороны мембраны; это означает,
что параметр п не достигнет предельного значения (п = 1) и К+-проводимость
установится на уровне меньше максимальной g. Величину Поо определяют из экспе-
эксперимента по формуле
«ос = teoo/gI/4, (ххш.з.6)
где g^ — стационарный уровень К+-проводимости при данном потенциале, g —
максимальная К+-проводимость. Из уравнения (XXIII.3.4) следует, что в равно-
равновесии (dn/dt)
Поо = а„/(ап + р„).
Таким образом, из семейства кинетических кривых К+-проводимости (см.
рис. XXIII.9, Б) можно отыскать значения констант скоростей а и C при разных
потенциалах, используя систему уравнений
т = 1/(а + р); п0О=а/(а + р). (ХХШ.3.7)
Как видно из (ХХШ.3.7), а = Поо/т.
Изменения натриевой проводимости. Кинетические кривые Ма+-проводимости
имеют более сложную форму (см. рис. XXIII.9, А): проводимость нарастает до
максимума — активация, а затем снижается — инактивация. Изменение Na -про-
-проводимости удалось описать на основе предположения о наличии активирующих тп-
частиц и инактивирующих /г-частиц. Предполагают, что для открывания канала
необходимо поступление в определенный участок мембраны трех m-частиц. Пере-
Переход через мембрану одной инактивирующеи частицы вызывает блокировку канала.
Таким образом, изменения Ма+-проводимости описывают уравнением
gNa = gNam3ft, (XXIII.3.8)
где gNa — максимальная Ма+-проводимость, m — вероятность нахождения в задан-
заданном участке мембраны одной m-частицы, h — вероятность того, что инактивиру-
ющая частица в этом участке отсутствует. При наложении поля, перемещающего
заряженные частицы с левой стороны мембраны (рис. XXIII.10) на правую, тп воз-
возрастает в пределах от 0 до 1, a h снижается (в пределе до 0).
178 Глава XXIII. Транспорт ионов в возбудимых мембранах
Кинетика перераспределения частиц через мембрану при наложении электри-
электрического поля описывается однотипными уравнениями
= am(l-m)-fimm, dh/dt = ah(l-h)-^hh, (XXIII.3.9)
где аир — константы скорости, зависящие только от мембранного потенциала (при
постоянной температуре и концентрации Са ). Решение этих уравнений имеет вид
m(t) = moo - (moo - то) ехр(-*/тто), где тга = 1/(ато + рто); /ххттт
h(t) = Лоо - (hoo ~ h0) exp(-t/xft), где Th = l/(a + p)
Значения moo и /loo определяются из граничных условий
moo = am/(am + pm); h^ = aft/(aft + pft). (XXIII.3.11)
В результате анализа кинетических кривых активации и инактивации Na+-npo-
водимости А. Ходжкин и А. Хаксли построили графические зависимости параме-
параметров ат, (Зто, а^, Cft, otn, (Зп, а также moo, поо и ^оо от мембранного потенциала
(рис. XXIII.11, 12) и подобрали эмпирические соотношения, описывающие ход
указанных зависимостей.
Исходя из эмпирических зависимостей, представленных на рис. XXIII.11, можно
показать, что отношение констант скоростей переходов m-частиц через мембрану
зависит от потенциала в соответствии с формулой
Из приведенных на рис. XXIII.11, 12 кривых видно, что стационарный К+-ток
имеет место в широкой области потенциалов, тогда как стационарный Na+-TOK
ограничен узкой областью, где т3 и h одновременно отличны от нуля. На основе
рассмотренной математической модели А. Ходжкину и А. Хаксли удалось с высо-
высокой точностью воспроизвести нервный импульс, генерируемый мембраной аксо-
аксона в различных экспериментальных условиях. После незначительной модификации
модели был имитирован процесс электрического возбуждения в миелинизирован-
ных нервных волокнах (Б. Франкенхаузер) и в соме нервных клеток (П. Г. Костюк,
О. А. Крышталь).
\—? Разделение трансмембранных токов на отдельные компоненты сыграло чрезвы-
чайно важную роль для понимания механизмов электровозбудимости мембран:
охарактеризованы селективность, потенциалзависимость, кинетика включения и
выключения внутримембранных путей — ионных каналов. В основном в результа-
результате этих работ были созданы общие представления о структурно-функциональной
организации Na+- и К+-каналов, управляемых изменениями электрического поля
(рис. XXI.11); выделены функциональные элементы ионных каналов, ответствен-
ответственные за механизмы селекции, — селективный фильтр, активации—«активационные
ворота» и инактивации—«инактивационные ворота» (гл. XXI, §§6, 7). ?
Модель Ходжкина—Хаксли рассматривает активацию и инактивацию каналов
как полностью независимые друг от друга процессы, которые определяются лишь
3. Описание ионных токов в модели Ходжкина—Хаксли
179
перемещением заряженных частиц. Общий ток через мембрану состоит из трех
компонент
h = m3hgNa,(y - cpNa) + "-4?к(ф - фк) + Ыф -
ф2),
(ХХШ.3.13)
где g2 — проводимость фоновой утечки. Таким образом, все свойства электрической
возбудимости мембраны описываются соответствующими зависимостями коэффи-
коэффициентов от h, m, п. Вместе с тем несмотря на успех преложенной модели, она
не рассматривает молекулярных механизмов открытия и закрытия каналов, лишь
формально объясняя их перемещением гипотетических заряженных частиц. В свете
представлений (гл. XXI, § 7) о макромолекулярной структуре канала непосредствен-
непосредственное влияние на эти процессы должны оказывать конформационные перестройки в
канале, которые, хотя и проявляются в наблюдаемых температурных зависимостях,
но не отражены в модели.
и
ш
-50 0 50 -100-50 0 50 -50 0 +50
<р,мВ
-60
+40 <р,мВ
Рис. ХХШ.11.
Зависимость констант
а и C от мембранно-
мембранного потенциала (I, II,
III) и стационарных
значений т, h, n от
мембранного потенци-
потенциала (IV) (по В. С. Мар-
Маркину и др., 1981)
-50
50
-50
50
-50
50
Мембранный потенциал (мВ)
Рис. XXIII. 12.
Потенциал-зависимые параметры модели Ходжкина—Хаксли
Постоянные времени тт, т/, и хп и стационарные состояния me», /loo и Поо, рассчитанные из
эмпирических уравнений модели Ходжкина—Хаксли для мембран гигантского аксона кальмара
при 6,3° С. Деполяризация мембран приводит к увеличению тсс и Псо и уменьшению hco- По-
Постоянные времени релаксации принимают максимальные значения в области потенциала покоя и
становятся короче при любом сдвиге от потенциала покоя (по В.НШе, 1970).
180
Глава XXIII. Транспорт ионов в возбудимых мембранах
§ 4. Токи ворот
Простейшая физическая интерпретация уравнений Ходжкина—Хаксли, описываю-
описывающих зависимость проводимости возбудимых мембран от потенциала, предполагает
наличие в мембране подвижных заряженных частиц т, п и h, которые перерас-
перераспределяются в мембране под действием электрического поля и переводят канал в
проводящее или непроводящее состояние.
¦\У Если в мембране действительно находятся заряженные частицы, способные пе-
ремещаться в электрическом поле, то, очевидно, можно зарегестрировать ток,
обусловленный перемещением этих воротных частиц. Недавно удалось эксперимен-
экспериментально обнаружить движение воротного заряда, или воротный ток. ?
Суть эксперимента состоит в следующем. Если мембрана представляет собой
идеальный диэлектрик, то при наложении ступенчатого импульса напряжения че-
через нее в первые моменты времени протекает емкостный ток, или ток смещения,
i
-\
i +
' " Рис. XXIII. 13.
Асимметричный ток смещения в
мембране, содержащей подвижные
заряженные частицы.
А — асимметричное распределение частиц в мембране в исходном состоянии; Б—
кинетика емкостного тока при наложении гиперполяризующих A) и деполяризую-
деполяризующих B) импульсов напряжения
Штриховая линия — изменения емкостного тока при отсутствии в мембране подвижных зарядов;
г, о — внутренняя и наружная стороны мембраны
значение и кинетика которого не зависят от полярности приложенного импульса.
Иная ситуация возникает в том случае, если в мембране содержатся заряженные
частицы, способные перемещаться в электрическом поле, причем в исходном со-
состоянии распределение подвижных частиц асимметрично. Предположим для опре-
определенности, что в исходном состоянии все воротные частицы находятся на левой
(внутренней) стороне мембраны, имеющей более низкий потенциал (рис. XXIII. 13).
Если мембрану гиперполяризовать, наложив ступенчатый импульс напряжения той
же полярности, что и существующий потенциал, то через нее потечет емкостный
ток точно такой же, как и в отсутствие воротных частиц. Однако при наложении на-
напряжения противоположной полярности помимо основного компонента емкостного
тока возникает дополнительный ток, обусловленный смещением воротных частиц
слева направо. Значение этого тока может оказаться весьма малым по сравнению с
основным компонентом тока.
Комбинируя методы внутриклеточной перфузии, фиксации потенциала и син-
синхронного накопления сигнала, К. Армстронг и Ф. Безанилла обнаружили на гигант-
гигантском аксоне кальмара малый асимметричный ток смещения, связанный предполо-
предположительно с активацией Na -каналов.
i 4. Токи ворот
181
\-у Основная трудность регистрации воротных токов состоит в том, что необ-
необходимо исключить или свести к минимуму влияние ионных токов, обычного
емкостного тока шумов. Для исключения ионного тока аксон кальмара перфузиро-
вали снаружи и изнутри растворами, содержащими непроникающие ионы, а также
блокаторы ионных токов — тетродотоксин и тетраэтиламмоний. С помощью ЭВМ
производили суммацию кривых тока, полученных в режиме фиксации потенциала
в ответ на приложение к мембране одинакового числа равных по амплитуде ги-
перполяризующих и деполяризующих импульсов. Любой остающийся в результате
этой операции емкостный ток является асимметричным и может быть воротным
током. ?
Воротный ток в сравнении с током Na+ показан на рис. XXIII. 14. В приведен-
приведенном опыте 95% Na+ в наружном растворе заменены на ионы триса. Из рис. XXIII.14
видно, что Na -току, значение которого в этих условиях значительно меньше, чем
обычно, предшествует кратковременный выходящий ток (воротный ток). Если из
80 мкА/см2
I i
500 мкс
0,05 пА/мкм2]
10 пА/мкм2!
Рис. XXIII. 14.
Воротный ток Ig и натриевый ток
0,4 мс
в аксоне кальмара (по С. М. Armstrong, 1975):
А — 95% Na+ заменено на ионы триса;
Б — воротный ток в условиях полной замены Na+ на трис A), Na+-TOK, записанный на том же
аксоне в обычных условиях в морской воде B)
раствора удалены все ионы Na, то становится заметным, что воротный ток медлен-
медленно спадает после начального пика и в основном прекращается к моменту достиже-
достижения пика Na-тока в обычном растворе (рис. XXIII.14, Б).
Характерной особенностью асимметричных токов смещения является их экс-
экспоненциальная зависимость от времени, что соответствует модели Ходжкина—
Хаксли. Анализ характерного времени релаксации асимметричного тока в зависи-
зависимости от потенциала показал, что это время примерно совпадает с временем тга (ср)
в модели Ходжкина—Хаксли. Совпадение свидетельствует о связи асимметричных
токов смещения с частицами, открывающими ^+-канал.
В дальнейшем были найдены дополнительные доводы в пользу прямой связи
асимметричных токов смещения с движением воротных частиц.
182
Глава XXIII. Транспорт ионов в возбудимых мембранах
1. Заряд, переносимый асимметричным током смещения при включении депо-
деполяризации, равен заряду, переносимому этим током при последующей реполяриза-
ции. Однако указанное равенство соблюдается лишь при коротких деполяризую-
деполяризующих сдвигах. Если деполяризация длится относительно долго, то происходит так
называемая иммобилизация воротных зарядов, в результате чего ток, текущий при
реполяризации, становится меньше тока, переносимого при деполяризации.
2. Зависимость перенесенного заряда от потенциала качественно соответствует
зависимости Na+-проводимости от потенциала (см. ниже).
3. Величина переносимого заряда практически не зависит от температуры,
хотя кинетика тока смещения резко замедляется с понижением температуры. Тем-
Температурный коэффициент <5ю Лля времени релаксации асимметричного тока сме-
смещения равен трем, что совпадает с величиной <5ю Лля тт-
4. Воротный ток и Na -проводимость подавляются ионами Zn, введенными
внутрь клетки, а также действием ультрафиолетового света с длиной волны 280 нм.
Важным подтверждением в пользу того, что
асимметричный ток смещения связан с активаци-
с^ ей входящего Na+-TOKa, явилось сравнение экспери-
экспериментально измеряемой и теоретической зависимо-
зависимостей смещенного заряда от значения мембранного
потенциала. Исходя из эксперимента, величину сме-
смещенного заряда можно найти, интегрируя воротный
ток по времени:
9 зо
20
10
Q= i(t)dt.
(ХХШ.4.2)
0 -100 -50 0 50
Внутренний потенциал, мВ
Рис. XXIII. 15.
Зависимость смещенного за-
заряда в мембране мышцы
лягушки от приложенного
потенциала (по W. Aimers,
1978)
Пример такой зависимости приведен на рис.
XXIII. 15; здесь по оси ординат отложена величи-
величина смещенного заряда в нКл/см2. Иногда измеряют
зависимость от потенциала величины О = Q/QmBx,
показывающей долю смещенных зарядов по отно-
отношению к максимально возможному перенесенному
заряду.
Теоретическую зависимость О от значения
мембранного потенциала можно получить, записы-
записывая условие равновесного распределения заряжен-
заряженных воротных частиц между двумя возможными состояниями. Распределение ча-
частиц при наличии на мембране разности потенциалов ср описывается уравнением
Больцмана
(ХХШ.4.3)
где A — О) —заполнение левой потенциальной ямы, а О — заполнение правой ямы.
Из (ХХШ.4.3) следует, что количество частиц, перемещенных в мембране слева
направо, равно
(ХХШ.4.4)
4. Токи ворот
183
Эта же величина определяет и долю открытых каналов в зависимости от прило-
приложенного потенциала ср и валентности z переносимой частицы. На рис. XXIII. 16
приведена кривые О(ср) разных значениях z.
Совпадение теоретической (рис. XXIII.16) и экспериментальной (рис. XXIII.15)
кривых такого рода зависимостей для г'к и i^& наблюдается при значениях z = 4, 5
для gK и z = 6 для gNa- Отсюда следует, что открывание Na-канала происходит при
перемещении воротного заряда, эквивалентного 6 элементарным зарядам. Зная ве-
величину смещенного заряда 0g в единицах элементарного заряда е, можно, разделив
ее на z = 6, найти и плотность Na-каналов.
Для Na-каналов величина Og колеблется в разных объектах в широких пределах
от 260 е/мкм2 (сердечная мышца крысы) до 1500-2200 е/мкм2 (гигантский аксон),
а плотность Na-каналов соответственно меняется от 40 до 250-350 мкм2. Для К-
каналов 0g ~ 500 е/мкм2, а для Са-канала 0g ~ 1500-2000 е/мкм2.
1,0 г
Мембранный потенциал, мВ
Рис. XXIII. 16.
Больцмановское описание потенциалозависимости канала. При описании потенциа-
лозависимости каналов, имеющих два (открытое и зактрытое) состояния, предпо-
предполагают, что открывание канала контролируется движением частиц с суммарным
зарядом z между противоположными сторонами мембраны. Для частиц с более
высоким зарядом z теоретическая зависимость вероятности открытого состояния
характеризуется большей крутизной (по В.НШе, 1992).
184 Глава XXIII. Транспорт ионов в возбудимых мембранах
Воротные токи в простейшей интерпретации рассматривают как следствие
перескока m-частиц в процессе активации Na -каналов мембраны. Однако пере-
перескок нескольких заряженных групп через всю толщу мембраны выглядит мало-
маловероятным. Скорее всего, токи смещения обусловлены относительно небольшими
смещениями заряженных групп в воротном устройстве канала. Тем не менее если
предположить, что m-частицы испытывают только небольшие смещения (порядка
нескольких десятых нанометра), то окажется, что перепад энергии между двумя
устойчивыми состояниями для воротных частиц крайне мал и составляет (pzFb/h,
где h — толщина мембраны, 8 — расстояние, на которое могут перемещаться ворот-
воротные частицы. Однако в этом случае величина смещенного заряда, определяемая по
формуле
становится слабо чувствительной к изменению мембранного потенциала, что про-
противоречит регуляторной функции частиц. Это противоречие может указывать на
то, что в действительности заряженные воротные группы обладают исключитель-
исключительно высокой величиной валентности. Другая возможность, устраняющая указанное
противоречие, состоит в том, что мембрана в области локализации канала обла-
обладает настолько небольшой толщиной, что перепад потенциала (p/h в (XXIII.4.5) на
единицу длины в этой области значительно выше, чем в области липидного бислоя.
Особенности воротных токов. Расшифровка полной макромолекулярной струк-
структуры дает возможность понять механизмы, лежащие в основе кинетических законо-
закономерностей открытия, закрытия и инактивации ионных каналов. Основная проблема
здесь состоит в идентификации конкретных молекулярных групп, выполняющих
роль воротных зарядов, которые соответственно изменяют свое состояние, переме-
перемещаясь под действием внешнего электрического поля. Мы уже видели роль зарядов
в этих процессах в канале (гл. XXI, §7). Отметим, что цикл открытие-закрытие
не связан с разрывом или образованием каких-либо ковалентных химических
связей, а по-видимому включает каскад конформационных изменений белка канала.
Пороговый характер и высокая скорость открытия отдельных закрытых каналов
указывает также на согласованный кооперативный характер этих процессов.
Сложная кинетика ионных токов, изменение чувствительности каналов к раз-
различным химическим веществам в процессе их работы указывают на роль переходов
между отдельными конформационными состояниями белка, по своим общим мас-
масштабам явно превышающие перемещение отдельных гипотетических атомов (во-
(воротных зарядов).
Сопоставим такой «конформационный» подход и формальную модель Ходжки-
на—Хаксли (гл. XXIII, §3). Процесс открытие-закрытие канала можно описать в
виде диаграммы переходов между его состояниями (ср. гл. III, §4). Например, мы
можем рассматривать К-канал, где, как известно, имеются 4 открывающие п-ча-
стицы, как структуру, которая включает соответственно четверо n-ворот. Каждые
из этих ворот могут быть либо в открытом A), либо в закрытом @) состояниях.
Из общего числа 16 различных состояний канала @,0,0,0), A,0,0,0), @,1,0,0) ...
A,1,0,0), A,0,1,0) ... A,1,1,0), A,1,0,1) ... открытому будет соответствовать
только одно состояние A,1,1,1), а все остальные являются закрытыми. Точно так
i 4. Токи ворот
185
Инактивированные состояния
За„
2а„
2Р„
ЗР„
V
Закрытые состояния без инактивации
Открытые
состояния
Рис. XXIII. 17.
Кинетическое состояние Na-канала по Ходжкину—Хаксли (по В. НШе, 1978)
Существуют восемь основных состояний воротной системы. Только в состоянии m^hi все ворота
открыты и канал может пропускать ионы.
же в Na-канале диаграмма из восьми состояний (рис. XXIII.17) включает только
одно открытое состояние тз/ii, где присутствуют все 3 активирущие т-частицы,
и отсутствует hi инактивирующая /г-частица.
Закрытому состоянию канала соответствует не одно, а несколько (семь) состо-
состояний, в свою очередь связанных друг с другом переходами. Закрытые состояния
TJiohi, rriihi, mih\ не имеют инактивирующей /г-частицы, а инактивированные со-
состояния nioho, niiho, ni2ho, тф^ наоборот, ее содержат.
Формально такого рода диаграммы переходов между состояниями канала соот-
соответствуют как модели Ходжкина—Хаксли, так и представлениям о конформацион-
ных перестройках в канале. Однако принципиальным отличием является взаимное
влияние (кооперативная связь) таких состояний в конформационном описании в
отличие от уравнений Ходжкина—Хаксли, где эти состояния предполагаются пол-
полностью независимыми. Можно предложить эквивалентную схему, включающую три
закрытых состояния R и одно открытое О,
R " R 2a- R За- О
с положительной кооперативной взаимосвязью между ними, при которой обеспечи-
обеспечивается переход между состояниями R по мере приближения к открытому состоянию
(а -*¦ 2а -*¦ За). Действительно, экспериментальные данные подтвердили вывод о
186
Глава XXIII. Транспорт ионов в возбудимых мембранах
кооперативном характере переходов и, в частности, показали, что инактивация
закрытых состояний зависит от количества уже имеющихся m-частиц (mi, тп?),
т. е. от глубины прошедшей конформационной перестройки в процессе активации
канала. На это же указывает и многокомпонентный характер кинетики и задержка
начала инактавации Na-канала, которые зависят от степени и времени существо-
существования предшествующего активированного состояния. По-видимому, инактивация
канала связана с иммобилизацией около 70% воротного заряда в процессе акти-
активации. В результате этого воротный ток, возникающий в ответ на прекращение
деполяризующего импульса, намного меньше, чем при активации канала. А следова-
следовательно, состояние активации не является быстро обратимым состоянием, поскольку
воротный заряд остается в «активированном» положении некоторое время после
прекращения возбуждения.
В К-канале (Shaker) также возможно существование трех состояний
R
О
I,
закрытое R, открытое О и инактивированное I.
Увеличение отрицательного мембранного потенциала на внутренней стороне
мембраны стабилизирует Л-состояние, не влияя на остальные состояния О и I.
При наложении положительного потенциала канал открывается R —> О, а затем
инактивируется. Время открытия канала тд^о сильно зависит от величина по-
положительного возбуждающего импульса и варьирует от нескольких миллисекунд
(+0,1 мВ) до долей миллисекунды при +50 мВ.
Сильная зависимость величины тд^о °т потен-
потенциала говорит о том, что движение зарядов на
белке канала сопряжено с конформационными пе-
перестройками, ведущими к открытию канала. Со-
Состояние инактивации определяется участком по-
полипептидной цепи в ]МН2-терминальной области
(рис. XXI. 14). Удаление этого участка приводит
к тому, что после открытия канала состояние
инактивации вообще не наступает. По-видимому
роль воротного заряда, ответственного за инак-
инактивацию канала, выполняет МНз-терминальная
группа (рис. XXIII. 18), которая попадает в пору
между S$ и 5б сегментами после открытия (ак-
(активации канала).
Все это указывает на ограниченность фор-
формальной модели, где открытие-закрытие канала
связывается с перемещением независимых друг
от друга управляющих частиц. По-видимому,
понимание механизма работы канала лежит на пути расшифровки конформа-
конформационных перестроек белка, индуцированных деполяризующим импульсом. Мож-
Можно провести аналогию с функционированием фермента, где каскад электронно-
конформационных перестроек индуцируется изменением электронного состояния
активного центра вследствие прихода в него молекулы субстрата (гл. XIV). С
Out
In
Рис. XXIII. 18.
Активация и инактивация
единичного шейкер-канала.
Инактивационная модель —
«мяч на цепи». Канал имеет
три состояния: R — покоя,
О — открытое и I — инакти-
инактивированное (по С. Miller, 1991).
i 5. Дипольная модель канала
187
этой точки зрения подобную роль играют локальные изменения состояния сенсо-
сенсора (рис. XXI.11) (сегмент 54, рис. XXI.14), вызывающие конформационные пере-
перестройки белка, которые и лежат в основе воротного механизма. Наблюдаемые в
экспериментах сложные зависимости параметров (проводимость, времена актива-
активации и инактивации, вольт-амперные характеристики) могут отражать особенности
конформационных перестроек в сложной структуре канала, в ходе которых изменя-
изменяется положение многих, в том числе заряженных, белковых групп. Аллостерический
(«тело» канала) и конкурентный (вход в канал) характер действия различных ин-
ингибиторов соответствует этой картине.
§ 5. Дипольная модель канала
Природа, воротных токов может состоять в том, что асимметричный ток смещения
обусловлен не перемещением заряженных групп через мембрану, а кооперативным
изменением ориентации диполей, выстилающих внутреннюю полость канала. Про-
Прохождение иона через канал зависит от его взаимодействия с дипольными группи-
группировками, которое определяет электростатическую энергию иона (см. §5 гл. XX).
Переориентация диполей может существенно изменить энергию взаимодействия
иона с окружением в канале и тем самым вероятность попадания иона в канал.
Кроме того, изменение ориентации диполей может сопровождаться конформацион-
ной перестройкой, изменяющей геометрию канала, что может также сказаться на
концентрации ионов в канале и их подвижности, т. е. на пропускной способности
канала.
Рис. ХХШ.19.
Диполь в электрическом поле
Равные по величине и противоположные по
знаку электрические заряды +е и —е рас-
расположены на расстоянии I друг от друга.
Электрический момент диполя представля-
представляет собой вектор с модулем el. Проекция ди-
польного момента на вектор напряженности
поля равна El cos C = е5. Энергия W дипо-
диполя в электрическом поле равна произведению
проекции дипольного момента на напряженность поля Е: W = —еЬЕ = —еЬц/fh, где ф — разность
электрических потенциалов на мембране, имеющей толщину h. Знак минус показывает, что устой-
устойчивым положением диполя является расположение его вектора по направлению электрическо-
электрического поля. Изменение энергии при повороте одиночного диполя в электрическом поле составляет
AW = (еф//1)Eг — 5i) = — ?ф, где s — коэффициент s = еEг — 5i)//i.
Известны свойства одиночного жесткого диполя, находящегося во внешнем
электрическом поле (рис. ХХШ.19).
Рассмотрим систему взаимодействующих диполей канала, каждый из которых
может находиться в двух ориентациях, отличающихся по проекции дипольного мо-
момента на ось канала (рис. XXIII.20). Энергия диполя в рассматриваемой системе
складывается из нескольких компонентов: стандартной химической энергии Uq,
энергии взаимодействия диполя с внешним электрическим полем (см. рис. ХХШ.19)
188
Глава XXIII. Транспорт ионов в возбудимых мембранах
и энергии взаимодействия диполя с другими диполями системы. Если липопротеино-
вый комплекс, содержащий рассматриваемую систему диполей, является достаточно
жестким, то процесс переориентации отдельных диполей будет кооперативным. Это
означает, что энергия, необходимая для переориентации каждого элементарного
диполя в системе, зависит не только от его собственной энергии, но и от доли
диполей, уже изменивших свою ориентацию. Тогда изменение энергии элементар-
элементарного диполя при его переориентации будет зависеть от доли переориентированных
диполей 0 и составлять величину —©(И^ — W\) = QW, где W\ и W<i — параметры
взаимодействия диполя в двух его ориентациях с си-
стемой окружающих диполей.
Ы| I Если стандартные свободные энергии дипо-
\\\\ \ \\\ тj ля для обеих ориентации одинаковы, то разность
энергетических уровней между двумя состояниями,
складывающаяся из изменения энергии взаимодей-
взаимодействий с внешним полем еср (см. рис. XXIII.19) и
другими диполями системы, составит —scp — QW. В
условиях равновесия доли диполей, находящихся в
переориентированном состоянии 0 и в исходном со-
состоянии A — 0), связаны между собой соотношением
Больцмана. Отсюда следует, что отношение заселен-
ностей энергетических уровней двух ориентации 0
и A — 0) экспоненциально зависит от разности энер-
энергий между этими уровнями —scp — QW:
Рис. ХХШ.20.
Дипольная модель регуля-
регуляции приводимости ионного
канала:
I, II — все диполи, выстилающие
внутреннюю полость канала, за-
занимают одну из возможных ори-
ориентации; III — смешанное состо-
состояние
в
1-е
(ХХШ.5.1)
где ко — константа. Таким образом, доля диполей, находящихся в каждом из состо-
состояний, зависит от мембранного потенциала, и эта зависимость описывается соотно-
соотношением
в
¦ ехр(-со@) = к0 exp(ei<Ji),
(ХХШ.5.2)
где со = W/квТ — параметр кооперативности, ф = еср/квТ — безразмерный потен-
потенциал, si = s/e. Полученное уравнение при подборе параметров со и si позволяет
описать экспериментально наблюдаемую зависимость смещенного заряда от мем-
мембранного потенциала. Действительно, поворот диполя сопровождается некоторым
эффективным смещением заряда вдоль оси канала, поэтому величина 0, означаю-
означающая долю диполей, которые находятся в одном из состояний, может рассматривать-
рассматриваться как показатель перенесенного в мембране заряда. При со = 3,5 зависимость 0 от
мембранного потенциала, рассчитанная по уравнению (ХХШ.5.2), хорошо согласу-
согласуется с экспериментом (см. рис. XXIII. 16).
¦\У Рассмотренный электростатический механизм регуляции проводимости канала
за счет поворота мембранных диполей может в принципе обеспечить наблюда-
наблюдаемую зависимость проводимости от потенциала. Однако в этом случае проводи-
проводимость одиночного канала также должна непрерывно зависеть от поля, а не пре-
претерпевать скачкообразные переходы между открытым и закрытым состояниями
i 5. Дипольная модель канала
189
(см. §8 гл. XXI). Вместе с тем, если поворот диполей в мембране сопровождается
конформационным изменением канала, то скачкообразные изменения проводимости
в одиночном канале также вполне возможны. ?
Предполагают, что дипольный механизм регуляции лежит в основе потенциа-
лозависимости проводимости БЛМ, модифицированных грамицидином А. Согласно
предположению Д. Урри, существует равновесие между проводящей и непроводящей
конформациями молекулы грамицидина, причем проводящая л^ о-спираль имеет
больший дипольный момент (см. § 3 гл. XX). Различие дипольных моментов для двух
конформаций, создаваемое одним витком спирали (шаг спирали 0,45 нм), составляет
15 • 10~18 ед. СГСЭ • см, или 15D (ID = | • 10~29 Кл • м). Различие дипольных момен-
моментов для трансмембранной структуры длиной 3 нм, способной образовать ионный
канал, составит 100 • 10~18 ед. СГСЭ • см, или 100D. Разность энергии диполей, соот-
соответствующих двум конформациям, во внешнем электрическом поле рассчитывают
по формуле (см. рис. XXIII. 19):
AW = y.FE/e, (XXIII.5.3)
где у.— дипольный момент, е — заряд электрона и 1,6 • 10~19 Кл, F — число Фа-
радея (и 96 500 Кл/моль = 96,5 кДж • В • моль), Е — напряженность электриче-
электрического поля, В/см. При толщине мембраны 3 нм и разности потенциалов 0,1 В, Е =
= 0,1/C • 10~7) В/см, разность энергии AW в (XXIII.5.3) составляет 6,7 кДж/моль.
Если предполагать, что в отсутствие электрического поля вероятности каждой из
двух конформаций одинаковы, то при наложении на БЛМ разности потенциалов в
100 мВ соотношение числа непроводящих и проводящих структур изменится при-
примерно на порядок в соответствии с формулой Больцмана N1/N2 = exp(—AW/RT),
где RT ~ 2,5 кДж/моль.
Рис. ХХШ.21.
Модель формирования
канала из параллельно
соединенных субъединиц:
а и б — полипептидная цепь
в разных ориентациях; стрел-
стрелками показана ориентация ди-
диполей; под влиянием поля
полипептидные цепи занима-
занимают преимущественно положе-
положение б
Согласно другой модели, молекулы грамицидина находятся в конфигура-
конфигурации а-спирали и могут располагаться на поверхности мембраны или поперек
нее (рис. ХХШ.21). Погружению мономеров в толщу мембраны препятствуют
полярные группы, которые в случае конфигурации л^ о-спирали образуют вну-
внутримолекулярные водородные связи между отдельными витками. Однако внешнее
электрическое поле, взаимодействующее с дипольным моментом а-спирали поли-
полипептидной цепи, стремится ориентировать молекулы перпендикулярно плоскости
190 Глава XXIII. Транспорт ионов в возбудимых мембранах
мембраны. Расчеты показывают, что разность энергий для ДВУХ ориентации
диполя мономерной формы грамицидина составляет примерно 4,2 кДж/моль.
Выигрыш в энергии, создаваемый поворотом диполя в электрическом поле,
недостаточен для того, чтобы «затащить» полярные группы мономера в мем-
мембрану. Однако если образуется тример или комплекс из шести мономеров, в
котором параллельные цепи грамицидина связываются поперечными межцепо-
межцепочечными водородными связями и образуют структуры типа складчатого слоя
(C-структуры), то разность электрической энергии таких диполей при различной
ориентации во внешнем поле будет составлять 12,6 и 25,2 кДж/моль соответ-
соответственно. Поскольку в таких комплексах большинство полярных групп объединено
водородными связями и молекулы могут свободно погружаться в липидный
бислой, электрическое поле оказывается эффективным регулятором ориентации
комплексов. В случае формирования сквозной поры комплексом из шести моно-
мономеров наложение разности потенциалов в 0,1 В должно изменять соотношение
молекул, ориентарованных параллельно и перпендикулярно плоскости мембраны, в
103 раз.
§ 6. Физико-химические модели возбуждения. Осциллятор Теорелла
Среди различных моделей электрической возбудимости клеток особый интерес
представляет предложенная в конце 50-х годов Т. Теореллом физико-химическая
модельная система, названная мембранным осциллятором. Модель представляет
собой две ячейки, заполненные электролитом разной концентрации и разделенные
мембраной из пористого стекла с фиксированными отрицательными зарядами.
При пропускании через мембрану тока в ячейках возникает отчетливый сдвиг
уровней жидкости, т. е. создается перепад гидростатических давлений. Пока
ток не превышает некоторого критического значения, разность потенциалов на
мембране и перепад давлений остаются постоянными. Однако после превышения
критического значения тока система переходит в автоколебательный режим,
при котором разность потенциалов на мембране и разность давлений начинают
совершать релаксационные колебания.
В основе работы мембранного осциллятора лежат электрокинетические явления
(см. §5 гл. XVIII). Суммарный поток жидкости по капиллярам пористой мембра-
мембраны представляет собой разность электроосмотического потока (его направление
совпадает с направлением электрического поля) и встречно направленного гидро-
гидродинамического потока.
Если поток направлен так, что мембрана заполняется концентрированным рас-
раствором электролита, то сопротивление мембраны резко снижается, и наоборот, если
мембрана заполняется малопроводящим разбавленным раствором, ее сопротивление
возрастает. В зависимости от направления движения жидкости профиль концентра-
концентрации внутри мембраны приобретает вогнутую или выпуклую форму, соответствую-
соответствующую низкой и высокой концентрации носителей заряда в мембране (рис. XXIII. 22).
С увеличением скорости течения профиль концентрации в мембране приближается
к прямоугольному. При высоких скоростях течения сопротивление мембраны при-
принимает одно из двух предельных значений в зависимости от направления потока
раствора (рис. ХХШ.23).
i 6. Физико-химические модели возбуждения. Осциллятор Теорелла
191
Скорость течения жидкости v через мембрану зависит от разности давлений р
и разности потенциалов ср следующим образом:
v = ар — (Зср,
(ХХШ.6.1)
где аир — коэффициенты пропорциональности. Первый член описывает фильтра-
фильтрационное течение через пористую среду, второй — соответствует электроосмотиче-
электроосмотическому потоку.
Мембрана
Рис. ХХШ.22.
Распределение концентрации ионов внутри
мембраны в зависимости от направления и
скорости протекания жидкости:
с\, а — концентрации электролита в водных рас-
растворах, г> — скорость движения иона через мембра-
мембрану, vi, V2, v—i, V—2 —скорости при разных значе-
значениях потоков
Рис. ХХШ.23.
Зависимость сопротивления мем-
мембраны Rm от скорости потока
жидкости v
Рис. XXIII. 24.
Вольтамперная характеристика мембранного ос-
осциллятора (по В. С. Маркину и др., 1981):
I — электрический ток, ф — потенциал, ф* — критический
потенциал, соответствующий нулевой скорости течения
В теории мембранного осциллятора доказывается, что при достаточно высоких
скоростях |г>| 3> D/h (D — коэффициент диффузии токопереносящих ионов внутри
мембраны, h — толщина мембраны) большая часть мембраны заполнена электроли-
электролитом одной и той же концентрации С\ или Ci зависимости от направления потока.
Лишь при малых значениях скорости концентрация плавно изменяется от одного
значения к другому. В связи с этим можно считать, что концентрация в мембране
равна ci, если v > 0, и с2, если v < 0.
¦\У Отсюда следует, что вольтамперная характеристика мембраны состоит из двух
линейных участков с резким переходом между ними (рис. XXIII.24). Наклоны
участков определяются сопротивлением электролита в мембране при С\ и с?, а пере-
переход между участками происходит при потенциале (р, соответствующем нулевой ско-
скорости течения. Реальная вольтамперная характеристика, полученная методом фик-
192
Глава XXIII. Транспорт ионов в возбудимых мембранах
сации потенциала (штриховая на том же рисунке), отличается лишь тем, что вместо
резкого перехода имеется довольно крутой участок с отрицательным наклоном. ?
Существование этого участка создает предпосылки для возникновения колеба-
колебаний в системе. В некоторых пределах каждому значению тока соответствуют три
значения потенциала. Промежуточное значение относится к неустойчивому состоя-
состоянию, крайние — к устойчивому, т. е. такая система является триггерной (см. гл. II).
В том случае, когда в рассматриваемой модели перепад давлений поддержива-
поддерживается на постоянном уровне, с помощью импульсов тока можно переводить систему
из одного устойчивого состояния в другое (рис. XXIII.25).
Рис. ХХШ.25.
Переход между двумя устойчивыми состояниями в
модели Теорелла (по В. С.Маркину и др., 1981):
1,2 — устойчивые состояния, 3 — неустойчивое При возраста-
возрастании тока го до г' потенциал на мембране ф скачком возра-
возрастает от ioiJi до i'Ri, где i?i—сопротивление мембраны в
состоянии 1. Увеличение потенциала приводит к уменьшению
скорости движения раствора через мембрану в соответствии с
формулой (XXIII.7.1); мембрана задолняется обедневшим рас-
раствором, и ее сопротивление возрастает. По завершении им-
импульса ток мгновенно уменьшается от г' до г'о, одновременно
происходит падение потенциала от г'Дг до г'ойг- Здесь Яг —
максимальное значение сопротивления, достигнутое за время
приложения импульса тока. Дальнейшее поведение потенциала
на мембране зависит от соотношения г'о Дг и ф*. Если г'о Дг > ф*,
потенциал продолжает расти и система переходит в состоя-
состояние 2 (Б). Если же г'оДг < ф*, система возвращается в исходное
состояние 1 (А)
В условиях, когда разность давлений не зафиксирована, изменения потенциала
на мембране, вызываемые импульсами тока, имеют выраженное сходство с потен-
потенциалом действия в аксоне. Амплитуда потенциала в модельной системе составля-
составляет около 2 В, а продолжительность достигает нескольких минут. Как следует из
уравнения (XXIII.6.1), изменение перепада на мембране не оказывает влияния на
крутизну устойчивых участков вольтамперной кривой, а влияет только на значение
потенциала ср*, при котором происходит изменение направления движения жид-
жидкости, т. е. на положение вертикального участка вольтамперной характеристики.
На рис. ХХШ.26 приведены стационарные вольтамперные характеристики системы
для разных перепадов давления.
Электрохимическая модель, предложенная Теореллом, способна воспроизво-
воспроизводить многие свойства нервного волокна, включая проведение возбуждения.
§ 7. Математические модели возбудимых мембран
Математическая модель Ходжкина—Хаксли (см. §§ 2, 3 гл. XXIII) является одним
из наиболее точных описаний процесса электрического возбуждения в мембране.
Однако эта модель слишком сложна для качественного анализа.
§ 7. Математические модели возбудимых мембран 193
\—? Один из подходов к упрощению этой модели состоит в разделении быстрых
и медленных переменных (см. §3 гл. II). Действительно, переменная Na -ак-
-активации т изменяется на порядок быстрее, чем переменные п и h. Постоянная
времени тга составляет ~ 10~4 с, а т„ и т/, ~ 2 ¦ 10~3 с. Поэтому основное изменетие
параметров пиЛ происходит при установившемся значении т (т = т^). ?
Рассмотрим, как упрощаются уравнения Ходжкина—Хаксли при замене пере-
переменной т на ее стационарное значение moo. Учтем также экспериментально уста-
установленный факт, что значения п и h связаны между собой соотношением
h + п = G = const (и 0,85). (ХХШ.7.1)
о
Рис. ХХШ.26.
Вольтамперные характеристики мембранной систе-
системы при двух перепадах давления р\ и %>i на мембране
(остальные обозначения те же, что на рис. XXIII.25)
(по В. С.Маркину и др., 1981).
Предположим, что вначале система находится в стационарном
состоянии 1, в котором поддерживаются ток г'о и давление pi.
Если подействовать на систему электрическим стимулом, изме-
изменив ток до значения г', то система перейдет в новое устойчивое
состояние 2 при давлении pi, поскольку на левой ветви нет стационарного состояния, отвечающего
давлению pi и току V. По окончании раздражения, когда ток возвращается от V до г'о, система
перейдет в состояние 3. Если давление в системе не фиксировано, то оно постепенно изменяется,
и соответственно меняется положение падающего участка вольтамперной кривой. Когда давление
достигает значения рг, система не может более оставаться в состоянии, описываемом правой
ветвью N-образной вольтамперной кривой, и переходит в первоначальное состояние
С учетом (ХХШ.2.2), (ХХШ.2.3), (ХХШ.3.3) и (ХХШ.3.8), полное уравнение
Ходжкина—Хаксли записывается в виде
Cdcf/dt = - [gNa,m3h((f - cpNa) + №"-4(ф - срк) + gi(<? - фО] + /общ, (ХХШ.7.2)
где т, п и h — функции потенциала и времени. Левая часть этого равенства пред-
представляет собой емкостный ток, а правая — разность между полным током /Общ,
текущим во внешней цепи, и ионным током, складывающимся из трансмеморанного
тока Na , К+ и тока утечки gi((f — ф;).
Заменив переменную т на ее стационарное значение и выразив h через п из
соотношения (ХХШ.7.1), получим
С dcp/dt = -[gNaTO^o(G -П)(ф -CpNa) +№"-4(ф - Срк) + gl(<? -фО] +/общ-
(ХХШ.7.3)
Поведение переменной п во времени описывается экспонентой (см. §§ 3, 5 гл. XXIII).
dn/dt = (noo - п)/т. (ХХШ.7.4)
\—? Полученная редуцированная система уравнений (ХХШ.7.3) и (ХХШ.7.4) со-
держит только две переменные (п и ср) вместо четырех в исходной системе
194
Глава XXIII. Транспорт ионов в возбудимых мембранах
(XXIII.7.2). Числовые расчеты показали, что упрощенная система достаточно
хорошо описывает форму потенциала действия; отмечается совпадение и дру-
других электрофизических характеристик редуцированной модели и полной модели
Ходжкина—Хаксли (с точностью 10-15%). ?
Для оценки свойств решений упрощенной системы строят графики главных
изоклин уравнений (XXIII.7.3) и (XXIII.7.4), т. е. изоклины dy/dt = 0 и dn/dt = 0. Из
уравнения (XXIII.7.4) следует, что изоклина dn/dt = 0 описывается соотношением
п = пг
где Поо —функция потенциала ср (см. рис. XXIII.11).
Изоклину d(f/dt = 0 находят из уравнения (XXIII. 7.3):
- фк)
- п)(ф -
(ХХШ.7.5)
= 0. (ХХШ.7.6)
л
1
0,5
-
1
...•••¦
\/
\
dn/dt=0
50
100 <р,мВ
Рассчитанные на ЭВМ нуль-изоклины приведе-
приведены на рис. XXIII.27. Изоклина d(p/dt = 0 име-
имеет N-образную форму, что обеспечивает гене-
генерацию импульса. Особая точка расположена на
левой ветви изоклины d(p/dt = 0 и устойчива.
Это соответствует отсутствию спонтанной ак-
активности в исходных уравнениях Ходжкина—
Хаксли.
Изоклины dn/dt = 0 и dy/dt = 0 предста-
представляют собой фазовый портрет редуцированной
математический модели. На основе фазовых
портретов упрощенной модели Ходжкина—
Хаксли удается объяснить самые различные
электрофизиологические явления.
Спонтанная активность. Известно, что в
клетках, не обладающих спонтанной активно-
активностью, последняя может быть вызвана увеличе-
увеличением Na+- или уменьшением К+-проводимости.
Однако при этом рассматриваемая модель по-
позволяет определить, когда в системе реализуются автоколебания.
Спонтанная активность в модели возникает, когда система теряет устойчи-
устойчивость, в ней появляется предельный цикл и возникают автоколебания (см. § 2 гл. II).
Особые точки, расположенные на средней ветви изоклины d(p/dt = 0, неустойчивы,
а расположенные на левой или правой ветви — устойчивы, причем одна из перемен-
переменных (ф) оказывается более быстрой, чем п (тф/тга ~ 10).
Изоклины системы при параметрах, соответствующих мембране аксона, пока-
показаны на рис. XXIII.27. Особая точка устойчива (расположена на левой ветви), и
мембрана не обладает спонтанной активностью. Уровень потенциала покоя при-
принят условно за нуль. При изменении параметров изоклины деформируются. Если
при этом особая точка станет неустойчивой (сместится с левой ветви изоклины
d(f/dt = 0 на среднюю), то возникнет спонтанная активность (рис. XXIII.28,1). Если
Рис. ХХШ.27.
Главные изоклины упрощенной
модели Ходжкина—Хаксли (по
Г. Р. Иваницкому и др., 1978):
S — стационарная точка лежит на ле-
левой ветви; устойчива; п — параметр
активации К+-проводимости
7. Математические модели возбудимых мембран
195
устойчивая точка перемещается на правую ветвь изоклины d(f/dt = О, то возникает
устойчивая деполяризация мембраны (рис. XXIII.28, II).
Так, в гигантском аксоне кальмара автоколебания в мембранах могут возни-
возникать под действием внешнего тока. Рассматривая семейство главных изоклин, рас-
рассчитанных для разных значений тока, можно определить, в каких условиях (т. е. при
каких значениях токов) возникают повторные потенциалы действия. Внешний ток
входит только в выражение для изоклины d(p/dt = 0 и поэтому при увеличении тока
изменяется лишь ее характер (рис. XXIII.29). Повторные ответы возникают, когда
особая точка, смещаясь с левой ветви изоклины d(p/dt = 0 на среднюю, становится
неустойчивой. При дальнейшем увеличении тока особая точка смещается со средней
ветви на правую и вновь становится устойчивой. Повторные ответы прекращаются,
и возникает устойчивая деполяризация под током.
Скачкообразная деполяризация. При плавном повышении концентрации КС1 во
внешней среде потенциал покоя возбудимых мембран может изменяться скачком.
0,5
dn/dt=O
0,5
d<?/dt=O
0
50
100 ф, мВ
о
50
100 ф, мВ
Рис. ХХШ.28.
Главные изоклины, соответствующие различным состояниям мембраны:
I— спонтанная активность (особая точка S неустойчива, лежит на средней ветви); пунктиром
показана проекция предельного цикла системы на плоскость;
II — устойчивая деполяризация мембраны (особая точка S устойчива, расположена на правой
ветви); п — параметр активации К+-проводимости (по Г. Р. Иваницкому и др., 1978)
dn/dt=Q
750
>/dt=O
50
100 <Р, мВ
Рис. ХХШ.29.
Главные изоклины упрощенной модели Ходж-
кина—Хаксли при изменениях внешнего тока
(цифрами на кривых показаны значения тока в
мкА/см2, остальные обозначения те же, что на
рис. ХХШ.28) (по Г. Р. Иваницкому и др., 1978)
196
Глава XXIII. Транспорт ионов в возбудимых мембранах
Долгое время считали, что классическая теория Ходжкина—Хаксли не объясняет
скачкообразную деполяризацию (И. Тасаки). Однако фазовый портрет редуциро-
редуцированной системы позволяет подобрать параметры, при которых этот эффект воспро-
воспроизводится и на полной модели Ходжкина—Хаксли. Для наблюдения скачкообраз-
скачкообразной деполяризации необходимо, чтобы при изменении параметра срк в уравнении
(XXIII. 7.6) особая точка, определяющая потенциал покоя, скачком переходила с ле-
левой ветви изоклины d(p/dt = 0 на правую, минуя неустойчивую ветвь (рис. XXIII.30).
Триггерные свойства мембраны. Аксон кальмара при некоторых эксперимен-
экспериментальных условиях, например, при внутриклеточной перфузии раствором CsF, может
вести себя как триггер с двумя устойчивыми состояниями: раздражение током,
направленным попеременно наружу и внутрь, приводит к перебросу потенциала
из одного устойчивого состояния в другое (рис. XXIII.31). Однако и здесь можно
найти параметры в редуцированной модели, при которых этот необычный эффект
воспроизводится в модели Ходжкина—Хаксли. Как видно из рис. XXIII.31, для
dn/dt=0
Рис. ХХШ.ЗО.
Скачкообразная деполяризация в
модели при увеличении внекле-
внеклеточной концентрации К+ (по
¦d<?/dt=O г_ р_ Иваницкому и др., 1978):
5 50 500 [Kq], мМ 5
50
I — зависимость потенциала покоя;
II — нуль-изоклины; точки пересе-
100 Ф мВ чения соответствуют стационарным
состояниям; обозначения те же, что
на рис. ХХШ.28
<р,мВ
1б0мВ1 1
V-P-
'jo
dn/dt=0
df/dt=0
0 50 100 <р,мВ
Рис. XXIII.31.
Триггерные свойства в упрощен-
упрощенной модели Ходжкина—Хаксли
(по Г. Р. Иваницкому и др., 1978):
I — изменения потенциала, вызванные
кратковременными толчками тока (по-
(показаны стрелками): II — главные изо-
изоклины при тех же значениях параме-
параметров; точками обозначены два устой-
устойчивых стационарных состояния
возникновения триггерных свойств необходимо существование двух устойчивых
состояний: нормально поляризованного и деполяризованного. Толчки тока проти-
противоположной полярности вызывают в этом случае переходы из одного стабильного
состояния в другое.
Таким образом, с помощью качественных методов удается определить основ-
основные характеристики математических моделей мембраны и проанализировать их
поведение при различных изменениях параметров.
§ 8. Распространение импульса 197
§ 8. Распространение импульса
\—? Важнейшим свойством нервного импульса является его способность распро-
страняться вдоль волокна без затухания с постоянной скоростью. Распростра-
Распространение возбуждения связано с протеканием локальных токов между покоящимися и
активными (возбужденные) участками (рис. XXIII.32). Для простоты рассуждений
примем, что внешняя поверхность аксона эквипотенциальна, т. е. внешняя среда хо-
хорошо проводит электрический ток. В области возникновения потенциала действия
внутренняя часть волокна заряжена положительно, а в соседних невозбужденных
участках — отрицательно. В результате возникает локальный ток между возбу-
возбужденным и покоящимся участками нерва, который деполяризует мембрану непо-
непосредственно перед активным участком. При достижении критической деполяриза-
деполяризации эта область также возбуждается. Подобным образом возбуждение передается
дальше. Одностороннее проведение импульса по нервному волокну связано с тем,
что участки, в которых потенциал действия завершен, теряют на некоторое время
способность к возбуждению (рефрактерность). ?
В волокнах позвоночных большая часть поверхности покрыта миелином, кото-
который действует как изолятор, поэтому локальный ток проходит между перехватами
Ранвье (рис. XXIII.32, II). В результате возбуждение передается скачками от одно-
одного перехвата Ранвье к другому, причем с большей скоростью и с меньшими затра-
4 \
I ^гУ УУ
и
I ~l-\
Рис. ХХШ.32.
Иллюстрация теории локальных токов (по A. L. Hodgkin, 1964):
I — немиелинизированное нервное волокно, II — миелинизированное нервное волокно
тами энергии, чем в немиелинизированных волокнах сравнимого диаметра. Малые
энергетические потери объясняются тем, что электрическая емкость миелиновой
оболочки очень мала и на ее зарядку требуется значительно меньше энергии, чем
на зарядку мембраны аксона беспозвоночных, имеющей высокую электрическую
емкость. В дальнейшем будет рассмотрен лишь процесс передачи импульсов по
немиелинизированным (безмякотные) волокнам.
Волокна, по которым распространяется нервный импульс, обычно сравнивают
с кабелем, имеющим несовершенные электрические свойства, (низкая электропро-
198
Глава XXIII. Транспорт ионов в возбудимых мембранах
водность аксоплазмы, недостаточные изолирующие свойства мембраны, большая
мембранная емкость). Эквивалентная электрическая схема аксона, отражающая его
кабельные свойства волокон, представлена на рис. XXIII.33. В случае аксона, по-
погруженного в большой объем проводящей среды, наружным сопротивлением можно
пренебречь и наружный потенциал считать постоянным. Внутреннее сопротивле-
сопротивление на единицу длины обозначим г, (Ом/см), а сопротивление мембраны на единицу
длины — гм (Ом • см). Пусть в одной точке аксона приложена разность потенциалов
фо по отношению к уровню потенциала покоя. Распределение потенциала вдоль
аксона в условиях, когда мембрана не возбуждена, определяется силой продоль-
продольного тока в аксоплазме. Согласно закону Ома, продольный ток ц пропорционален
проводимости участка аксоплазмы и падению напряжения на данном участке:
_ ф
г,- dx
(ХХШ.8.1)
С увеличением расстояния х продольный ток уменьшается из-за утечки в наружную
среду; эта часть составляет мембранный ток. Так как ток через мембрану гм равен
убыли продольного тока на участке dx, можно записать
i
/1 == L ==
d
i
L ==
I d
dx г» dx
.2 "
(ХХШ.8.2)
П
Аксоплазма
х=0
Среда
о
Рис. ХХШ.ЗЗ.
Эквивалентная электрическая схема волокна, отражающая его кабельные свой-
свойства (I) и распределение потенциала по длине волокна х при «инъекции» тока в
точке х = О (II):
X — постоянная длины волокна, Сш — емкость мембраны, RM — сопротивление мембраны, Щ —
сопротивление аксоплазмы, ц —продольный ток, гш — мембранный ток
С другой стороны, по закону Ома мембранный ток равен гм = ф/гм, где ф — раз-
разность потенциалов на удалении х от точки приложения потенциала фо- В итоге
получим
р, (ХХШ.8.3)
dx'
¦\ 9 d ф ,о
или kz—-\ = ср, где kz = rM
dx
§ 8. Распространение импульса 199
Решение уравнения (XXIII.8.3) имеет вид
ср = фо ехр(-ж/Х). (ХХШ.8.4)
Сигнал экспоненциально затухает с увеличением расстояния, ослабляясь до фо/е
при х = X. Величина X = \/rM/ri называется постоянной длины волокна. Зависи-
Зависимость гм и Tj от удельных сопротивлений 1 см2 мембраны RM и 1 см3 аксоплазмы
Ri выражается следующим образом:
% ^ (ХХШ.8.5)
где D — диаметр волокна. Следовательно, константа длины пассивного волокна рав-
равна (DBm/^jI/2, т. е. пропорциональна корню квадратному из толщины волокна.
У безмякотного аксона диаметром 30 мкм с RM = 5 кОм • см2 и i?j = 50 Ом • см3
константа длины равна 2,7 мм. У клеток харовых водорослей, достигающих в диа-
диаметре 1 мм, при сопротивлении RM = 10 кОм • см2 постоянная длины составляет
несколько сантиметров. При возбуждении RM резко снижается, и соответственно
уменьшается константа длины.
^—р Хотя кабельные свойства аксона несовершенны, непрерывная кабельная связь
между соседними участками волокна—необходимый фактор в процессе пере-
передачи электрических изменений от одной точки к другой. Отсутствие затухания при
распространении импульса объясняется тем, что аксон не обычный кабель: вдоль
его волокна в мембране размещены молекулярные «генераторы», подпитывающие
бегущий импульс. ?
Распределение мембранного потенциала по волокну ф(ж, t) в общем случае опре-
определяется кабельным уравнением, которое вытекает из условия равенства полно-
полного тока через мембрану гм [см. (XXIII.8.2)] сумме емкостного и ионного токов
[см. (XXIII. 2.2)]:
1^1 + С^, (ХХШ.8.6)
1 + С^,
П дх2 dt
где С — емкость мембраны, приходящаяся на единицу длины волокна, г% — сопро-
сопротивление аксоплазмы на единицу длины, I — ионный ток, протекающий через мем-
мембрану; значение потенциала ф отсчитывается от уровня потенциала покоя. Ток I
слагается из парциальных ионных токов: натриевого, калиевого и тока утечки
(см. § 2 гл. XXIII). Динамика изменения каждого из парциальных токов описывается
эмпирическим уравнением Ходжкина—Хаксли.
Таким образом, задача об отыскании скорости распространения импульса и
его формы сводится к решению уравнения (ХХШ.8.6) в системе с уравнениями
Ходжкина—Хаксли. В результате числовых решений с помощью ЭВМ удается рас-
рассчитать форму и скорость распространения потенциала действия (рис. XXIII.34).
¦\У Задача о распространении нервного возбуждения по волокну существенно упро-
щается, если ионный ток, входящий в соотношение (XXIII.8.6), описывать не
системой уравнений Ходжкина—Хаксли, а аппроксимировать его двумя ступенями
разной направленности. Иными словами, предполагают, что в некоторый момент,
200
Глава XXIII. Транспорт ионов в возбудимых мембранах
соответствующий началу возбуждения, включается ток, направленный внутрь во-
волокна и равный по модулю i±. Спустя время t\ ток меняется на противоположный
и равный %2- Эта фаза продолжается в течение времени ti (рис. XXIII.34, II). Фи-
Физически это означает, что в мембране существует генератор тока, обладающий
пороговыми свойствами. Дополнительное условие состоит в том, что заряд, про-
протекающий при возбуждении в одном направлении, равен заряду, протекающему в
другом направлении: iiti = i\t2- ?
Введение упрощающих допущений о постоянстве значения ионного тока на
временных интервалах, соответствующих переносу ионов через Na+- и К+-каналы,
позволяет найти решение уравнения (XXIII.8.6) в явном виде. Поскольку скорость
бегущей волны первоначально неизвестна, для решения (XXIII.8.6) удобно ввести
новую (так называемую автомодельную) переменную \ = х — vt, где v — скорость
h
h
t,
мс
Ф, мВ
100
50
t, мс
Рис. ХХШ.34.
Распространяющийся импульс. I — форма импульса; II — аппроксимация ионного
тока при возбуждении (импульс, направленный вниз, соответствует входящему
Na -току, импульс, направленный вверх, соответствует выходящему К+-току) (по
В.С.Маркину и др., 1981):
1—аксон кальмара при 18,5° С; 2— числовое решение системы уравнений Ходжкина—Хаксли;
3 — форма импульса при аппроксимации ионного тока двумя ступенями; t\, ?г — продолжитель-
продолжительность входящего и выходящего тока, ii,i2 —амплитуды входящего и выходящего тока
распространения импульса. Если перемещать точку наблюдения х по волокну со
скоростью распространения импульса, то значение аргумента \ и соответственно
потенциала cp($) не меняется. Иначе говоря, в координатах ($,ср) распространяю-
распространяющийся импульс оказывается как бы остановленным (ср. §4 гл. II).
После введения переменной \ уравнение (XXIII.8.6) преобразуется к виду
= 0,
(ХХШ.8.7)
т. е. сводится к линейному уравнению второго порядка. Начало координат выбира-
выбирают в той точке, тде начинается возбуждение мембраны, т.е. ср(О) = ср*, где (р* —
i 8. Распространение импульса
201
пороговый потенциал. При подборе параметров i\ = 63 мкА/см2, ii = 40 мкА/см2,
t\ = 0,35 мс и ti = 0,55 мс удается получить хорошее соответствие между расчет-
расчетной формой импульса и формой потенциала действия, наблюдаемой в эксперименте
(рис. XXIII.34, I). Решение показывает, что существует два допустимых значения
скорости, каждому из которых соответствует бегущий импульс определенной фор-
формы, причем один оказывается устойчивым, а другой — неустойчивым.
Скорость устойчивого импульса описывается простой формулой, если прене-
пренебречь проводимостью мембраны в состоянии покоя:
«1 =
(ХХШ.8.8
В выражение входят только параметры первой фазы тока возбуждения, т. е. ско-
скорость распространения определяется передним фронтом бегущего импульса.
п
Рис. ХХШ.35.
Прохождение импульса по расширен-
расширенному волокну. I — изменение скорости
импульса v в зависимости от его на-
направления; II — схема расширяющего-
расширяющегося волокна:
1, 2 — импульсы проходят, 3 — импульсы
блокируются; штриховая линия показывает
скорость распространения импульса вдали
от места изменения диаметра волокна
\—? Изучение зависимости скорости распространения импульса от диаметра нерв-
ного волокна в экспериментах на безмякотных волокнах показало, что скорость
приблизительно пропорциональна квадратному корню из диаметра волокна. Такой
же результат дает и приведенная формула. Для гигантского волокна кальмара по-
получается скорость около 21 м/с. ?
На основе модели порогового мембранного генератора ионного тока можно
изучать распространение импульсов по неоднородным и ветвящимся волокнам, а
также рассмотреть взаимодействие импульсов в параллельных волокнах. Так, ана-
анализ прохождения импульса по расширяющемуся волокну (рис. ХХШ.35) показывает,
что по мере приближения к месту расширения скорость импульса уменьшается, а
после расширения начинает расти, пока не достигнет нового стационарного значе-
значения, которое превышает первоначальное. Таким образом, переход к более высоким
значениям скорости происходит не монотонно, а с периодом замедления, который
тем больше, чем больше разница в сечениях волокна. При достаточно большом
расширении импульс может остановиться совсем. Расчет, проделанный в описанной
выше модели, показывает, что при критическом расширении волокна, которое уже
не пропускает импульс, условие блокирования имеет вид
уK/2 > х + 1Д1Х1/2 - 1,69 = К(х),
(ХХШ.8.9)
202
Глава XXIII. Транспорт ионов в возбудимых мембранах
где Г\ и г2 — радиусы двух частей волокна, х — фактор безопасности, равный от-
отношению амплитуды потенциала действия к порогу возбуждения. Для гигантского
аксона кальмара оценки показывают, что критическим является расширение, не-
несколько больше четырехкратного.
При обратном движении импульса блокирования не происходит. Импульс все-
всегда может перейти из широкого волокна в узкое. Но изменение скорости при неод-
неоднородности носит противоположный .характер. При подходе к сужению скорость
импульса увеличивается, а затем начинает спадать до нового стационарного значе-
значения. Таким образом, на графике скорости наблюдается своеобразная петля гистере-
гистерезиса, происхождение которого физически вполне понятно. Расположенное впереди
широкое волокно с большой емкостью представляет собой мощный сток для заряда,
поэтому значение потенциала медленнее поднимается до порогового. Наоборот, в
суженной части не может поглотиться большой за-
ряд, и эта часть волокна представляет собой отра-
отражающий экран, вблизи которого потенциал увели-
увеличивается скорее, а следовательно, скорость распро-
распространения импульса увеличивается.
Другим видом неоднородности является ве-
ветвление волокон, где возможны различные способы
прохождения и блокирования импульса. Если им-
импульс подходит к узлу ветвления по одному волок-
волокну (рис. XXIII.36), то условие блокирования имеет
вид
Рис. ХХШ.36.
Прохождение импульсов че-
через узел ветвления.
I — импульс подходит по одно-
одному волокну; II — импульс подхо-
подходит сразу по двум волокнам
3/2 3/2
> К(х).
(ХХШ.8.10)
Если импульсы подходят к узлу ветвления сразу по двум волокнам, то условие
блокирования при синхронном движении импульсов имеет вид
„3/2
3/2 , 3/2
г/ +г'
> К(х).
(ХХШ.8.11)
При разновременном подходе импульсов к узлу ветвления условие блокирования
зависит от временного сдвига 0 между ними. Если временной сдвиг между им-
импульсами мал, то импульсы «помогают» друг другу проникнуть в третье волокно.
Однако если сдвиг достаточно велик, то импульсы начинают мешать друг другу,
поскольку импульс, подошедший первым, но не сумевший возбудить третье волокно,
частично переводит узел в рефракторное состояние.
В организме нервные волокна обычно объединены в пучки или нервные стволы,
где каждое волокно представляет собой самостоятельную линию связи. Однако,
когда по одному из волокон движется нервный импульс, он создает электрическое
поле в окружающей межклеточной жидкости, которое может повлиять на мембран-
мембранный потенциал соседних волокон. Действительно, при обработке нервных стволов
специальными химическими веществами удается наблюдать не только взаимные
помехи, но и передачу возбуждения между соседними волокнами.
§ 8. Распространение импульса 203
Исследование одновременного прохождения импульсов по разным волокнам по-
показало, что взаимодействие импульсов может приводить к их синхронизации. В
результате при одновременном возбуждении волокон может возникнуть коллектив-
коллективный импульс. Однако синхронизоваться могут лишь импульсы, скорости которых
отличаются не более чем на 10%, причем их взаимодействие очень сильно увеличи-
увеличивается с ростом сопротивления внешней среды. При возбуждении одного волокна
в соседнем наводится знакопеременный мембранный потенциал: вначале волокно
гиперполяризуется (пониженная возбудимость), затем деполяризуется (повышенная
возбудимость) и наконец еще раз гиперполяризуется. Непосредственная передача
возбуждения на соседнее волокно увеличивается при повышении его радиуса.
Для решения задачи об одновременном возбуждении двух соседних волокон не-
необходимо искать автомодельное решение, когда два импульса движутся с одинако-
одинаковой скоростью на постоянном расстоянии друг от друга. В этом случае существует
два неизвестных параметра: скорость и расстояние между импульсами. Так как
импульсы влияют друг на друга, то формально скорость каждого из них является
функцией расстояния между ними.
Основные результаты, изложенные выше, были получены с помощью простой
модели мембранного генератора тока. В таком подходе остается неясным, как
влияет истинная динамика развития возбуждения на распространение импульса.
Рассмотрим в связи с этим соотношение (XXIII.8.6), где ток I описывается уравне-
уравнениями Ходжкина—Хаксли. Для вычисления скорости импульса можно учитывать
лишь процессы, протекающие в области его фронта. Напомним, что переменные
тп, n и h характеризуются существенными различиями в скоростях их изменений,
а именно
где тп, Tft, тга — характерные времена релаксации переменных: К+-проводимости,
инактивации и активации Na -проводимости, соответственно. Пользуясь указан-
указанной иерархией времен (XXIII.8.12) и учитывая лишь переменную тп, можно упро-
упростить систему (XXIII.8.6) и уравнения Ходжкина—Хаксли до приближенной систе-
системы двух уравнений:
-^ = ^—f+m°, -оо < I < оо;
^ u dl (XXIII.8.13)
dm 1 г
[тт
где введены автомодельная координата \ = t + x/v и следующие обозначения: и =
= v(RC2(p*/iI/2, ф = ф/ф*. Здесь т(ф) и т^ф) —известные функции. В случае бы-
быстрой релаксации Ма+-переменной т скорость распространения возбуждения имеет
вид
и = 1, т.е. v = ( —^ при т -* 0. (ХХШ.8.14)
\RC ф /
Этот результат совпадает с выражением (XXIII.8.8) для скорости распростране-
распространения импульса в модели мембранного генератора, рассмотренной выше. Очевидно,
204 Глава XXIII. Транспорт ионов в возбудимых мембранах
эта модель отвечает случаю быстрой релаксации Na+-TOKa. В другом предельном
случае — медленной релаксации — получаем выражение
( г \1/8
„-1,25-3-^—4 • (ХХШ.8.15)
Сопоставление с экспериментом показывает, что предельный случай медленной ре-
релаксации (ХХШ.8.15) Na+-TOKa является наилучшим приближением для описания
скорости распространения нервного импульса.
VIII
Трансформация энергии
в биомембранах
XXIV
Перенос электронов
и трансформация энергии
в биомембранах
XXV
Биофизика сократительных систем
XXVI
Биофизика процессов рецепции
Глава XXIV
Перенос электронов и трансформация
энергии в биомембранах
§ 1. Общая характеристика преобразования энергии в биомембранах
Процессы трансформации энергии при электронном транспорте в мембранах не-
некоторых бактерий, митохондрий, хлоропластов и хроматофоров обладают фунда-
фундаментальным сходством. Во всех этих системах происходит использование энергии
электронного потока для синтеза молекул АТФ. Механизмы этого процесса, однако,
во многом непонятны.
Существует большое количество различных гипотез относительно механизма
мембранного фосфорилирования, которые отличаются друг от друга включением
в схемы синтеза АТФ различных окислительно-восстановительных реакций и ком-
компонентов сопряжения при трансформации энергии. На ранних этапах обсуждался
возможный механизм химического сопряжения переноса электронов в ЭТЦ с синте-
синтезом АТФ. В этих гипотезах сопряжения предполагали образование высокоэнерге-
высокоэнергетического соединения переносчика электрона А и интермедиата X, участвующего
в процессе переноса энергии на стадии переноса электрона от А к В:
На следующей стадии энергия от А ~ X переносится к!~7, где Y также как
и X является интермедиатом только в процессах переноса энергии и не содержит
компонентов ЭТЦ:
A~X + Y**X~Y + A. (XXIV.1.2)
Наконец, на третьем этапе происходит фосфоролиз нефосфорилированного макро-
макроэрга 1~7и трансфосфорилирование до химически стабильной молекулы АТФ:
Х~У + ФН + АДФ^ АТФ + X + Y. (XXIV.1.3)
Как видно из реакций (XXIV.1.1)-(XXIV.1.3), перенос энергии от пары (АВ.2,В)
на АТФ осуществляется путем сдвига вправо химического равновесия, ведущего к
появлению избытка АТФ.
¦\У Возможно ли осуществление этого принципа в чистом виде в биологических
мембранах? Согласно расчетам, макроэргический характер фосфатной связи
в АТФ обусловлен энергией отталкивания атомов вследствие избыточной отри-
отрицательной электронной плотности на атомах кислорода в фосфорных остатках.
§ 1. Общая характеристика преобразования энергии в биомембранах 207
Поэтому сама макроэргическая связь ~ Р может образовываться за счет напра-
направленного индукционного перемещения электронной плотности в промежуточных
соединениях, при котором избыток электронной энергии не диссипирует в теплоту
за время гидролиза. Следовательно, для осуществления эффективного энергетиче-
энергетического сопряжения способом смещения электрохимического равновесия необходимо,
чтобы избыток электронной энергии, сосредоточенный на химических связях про-
промежуточных нестабильных соединений, за время реакции не диссипировал в тепло-
теплоту, а сохранялся, трансформируясь без потерь в энергию конечного стабильного
макроэргического соединения (АТФ). ?
Известно (см. гл. Х-ХП), что рассеяние избытка энергии в процессах электрон-
электронно-колебательной релаксации в конденсированной фазе (мембранные белки) проте-
протекает за 10~11-10~12 с. Это означает, что бездиссипативная передача энергии по хи-
химическому пути возможна, если весь процесс трансформации энергии произойдет в
один элементарный акт за 10~11-10~12 с. Только в этом случае избыток электронной
энергии, сосредоточенный на определенных связях атомных групп нестабильных
промежуточных соединений, не успеет диссипировать в теплоту в ходе электрон-
электронно-колебательной релаксации. Ясно, насколько трудно осуществить последователь-
последовательно все превращения (XXIV. 1.1)-(XXIV. 1.3) за столь короткое время. Это тем более
очевидно, что в процессе должны принимать участие несколько низкомолекулярных
соединений, которые, согласно предположению, исходно пространственно разделе-
разделены в мембране, а затем диффундируют к месту реакции. Отсюда следует важный
вывод, что высокоэффективное энергетическое сопряжение, основанное на сдвиге
химического равновесия в цепи реакций, включающих нестабильные соединения,
не может осуществляться в конденсированной фазе. Для этого необходим единый
комплекс молекул, где трансформация энергии происходит в один акт без тепловых
потерь. Именно таким комплексом и является фермент АТФ-синтетаза. Неудачи в
поисках химических соединений между компонентами электрон-транспортной цепи
и переносчиков энергии привели к необходимости рассмотрения других принципов
сопряжения. Наибольшее признание получила хемиосмотическая теория Митчела,
согласно которой перенос электронов по электрон-транспортной цепи приводит к
переносу протонов через гидрофобный барьер мембраны. Сформулированный в
общей форме хемиосмотический принцип сопряжения Митчела предполагает, что
перенос электронов связан с синтезом АТФ через образование трансмембранной
разности электрохимических потенциалов [см. (V.3.12)] ионов водорода АрН+:
АрН+ = FAcp + 2,3 ЛГАрН, (XXIV. 1.4)
где Дер — разность электрических потенциалов, АрН — разность концентраций во-
водородных ионов по обе стороны мембраны, F — число Фарадея, R — газовая по-
постоянная, Г — температура. Считают, что энергия АрН+ используется для синтеза
АТФ из АДФ и Фн с помощью особого фермента — мембранной АТФ-синтетазы
(Н+-АТФаза). Однако молекулярные механизмы, посредством которых при перено-
переносе электронов происходит трансмембранный перенос протонов, а также механизм
образования АТФ с помощью АТФазы остаются предметом дискуссий.
208
Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
§ 2. Электрон-транспортные цепи
В митохондриях образование доноров электронов (НАДН, сукцината и др.) дает
начало переносу электронов во внутренней мембране от НАДН и сукцината к кис-
кислороду, сопряженному с транслокацией протонов.
Известно около 20 переносчиков электронов, составляющих ЭТЦ митохондрий;
это основные элементы структуры митохондрий, на которые приходится около
25% белка митохондриальных мембран. Среди переносчиков только НАД, флавины
и убихинон является двухэлектронными, в то время как остальные компоненты
ЭТЦ — одноэлектронные.
Белковые компоненты переносчиков влияют на окислительно-восстановитель-
окислительно-восстановительные превращения переходных металлов, входящих в их состав, а также создают
специфическое диэлектрическое и химическое окружение при переносе электронов
(ср. §4 гл. XIV).
НАДН-
/
ФМН
(FeS)!_4
Y
Ill
Цит*562
Цит*566
FeSR
¦-Цит с-»-
IW
Цит а
Си*
Си«з
Рис. XXIV.1.
Мультиферментные комп-
комплексы, составляющие ды-
дыхательную цепь митохон-
митохондрий
Как правило, в ЭТЦ переносчики электронов расположены в последовательно-
последовательности, при которой их среднеточечные окислительно-восстановительные потенциалы
Ei/2 возрастают от отрицательных значений, приблизительно соответствующих
водородному электроду, до значения, приближающегося к потенциалу, при кото-
котором происходит восстановление СЬ до Н2О. Окисление НАДН (Ei/2 = —320 мВ)
молекулярным кислородом влечет за собой общее изменение потенциала приблизи-
приблизительно на 1,1-1,2 В. Эта разность окислительно-восстановительных потенциалов,
включающая ряд более мелких перепадов, и есть та движущая сила, которая в
обычных условиях приводит к синтезу АТФ. Переносчики электронов расположены
асимметрично в мембране, что приводит к зависимости кажущихся среднеточечных
окислительно-восстановительных потенциалов отдельных переносчиков от значе-
значений трансмембранного и поверхностного потенциалов.
Фракционирование препаратов внутренней мембраны митохондрий из сердца
быка привело к разделению митохондриальной электрон-транспортной системы на
четыре белково-липидных комплекса:
I. НАДН: убихинон-оксидоредуктаза.
П. Сукцинат: убихинон-оксидоредуктаза.
III. Убихинол: феррицитохром с-оксидоредуктаза.
IV. Цитохром с: кислород-оксидоредуктаза.
i 2. Электрон-транспортные цепи
209
Таблица XXIV. 1.
Свойства комплексов цепи переноса электронов митохондрий (по I. Hatefi,
I. M. Galante, 1978)
Комплекс
I. НАДН: KoQ-оксидоредук-
таза
П. Сукцинат: KoQ-оксидоре-
дуктаза
III. K0QH2: цитохром с-окси-
доредуктаза
IV. Цитохром с: Ог-оксидо-
редуктаза
Соотношение
в мембране
1
2
3
7
Молекулярная
масса
комплекса
< 700
200
250
150-200
Количество
полипептидов
в комплексе
16-18
4
8-9
7
Компоненты
комплексов
ФМН
Негемовое железо
Убихинон
ФАД
Негемовое железо
Цитохром Ь
Цитохром Ь
Цитохром с\
Негемовое железо
Убихинон
Цитохром а
Цитохром аз
Медь
Молекулярное
соотношение
компонентов
в комплексе
1
16-18
4
1
7-8
1
2
1
2
^ 1
1
1
2
Специфические
ингибиторы
Ротенон
Амитал
Пирицидин
а-Теноилтри-
фторацетон
Антимицин А
Цианид
Азид
СО
Полная ЭТЦ состоит из четырех отдельных мультиферментных комплексов
(рис. XXIV. 1), которые принято обозначать цифрами I, II, III, IV. Некоторые свой-
свойства этих комплексов приведены в табл. XXIV.1. Каждый комплекс состоит, как
правило, не менее чем из пяти субъединиц; часть из них несет на себе кофакто-
кофакторы, между которыми возможен перенос электронов. Комплексы входят в ЭТЦ в
различных соотношениях.
На рис. XXIV.2 показана предполагаемая организация электрон-транспортных
комплексов I-IV и АТФазы (Fo.Fi) во внутренней мембране митохондрий.
Комплекс III занимает важное место в энергетическом обмене не только в ЭТЦ
митохондрий, но и в хлоропластах, хроматофорах, а также в некоторых бактериях.
Поэтому ниже более детально рассмотрен перенос электронов в этом комплексе.
Наиболее простой является линейная последовательность переноса электронов
в дыхательной цепи, в частности в комплексе III:
НАДН
KoQ
Антимицин
¦ О2 (XXIV.2.1)
Сукцинат
Эта схема хорошо согласуется с наблюдением, что ингибирование электронного
переноса в митохондриях антимицином приводит к увеличению восстановленности
210
Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
убихинона и цитохромов Ь и уменьшению восстановленности цитохромов с и с±.
Однако оказалось, что в присутствии сукцината и антимицина А добавка кисло-
кислорода или феррицианида приводит к восстановлению цитохромов Ь, в то время как
согласно линейной схеме (XXIV.2.1) должно было бы наблюдаться его окисление.
Существует еще целый ряд кинетических особенностей, которые наряду с эффек-
эффектом «сверхвосстановления» цитохромов Ь заставляют отказаться от линейной схемы
(XXIV.2.1). П. Митчелом A975) для объяснения сложного поведения цитохромов Ь
в комплексе III была предложена схема так называемого (^-цикла (рис. XXIV.3).
В отличие от линейной схемы здесь предполагается отсутствие непосредствен-
непосредственного окислительно-восстановительного контакта между цитохромами & и с (ci); их
взаимодействие друг с другом осуществляется через убихинон.
г Фумарат' | ^
'АТФ ^укцинат НАДН, + НАД+
АДФ+Фн
Рис. XXIV.2.
Электрон-транспортная цепь дыхания и сопрягающий комплекс во внутренней мем-
мембране митохондрий:
I-IV — электрон-транспортные комплексы, Fo,Fi —сопрягающий комплекс (Н+-АТФаза)
Электроны между комплексами переносятся с помощью мобильных переносчиков — убихинона
(не показан) и цитохрома (цит) с. Двигаясь диффузно через липидный слой мембраны, убихинон
связывает между собой комплексы I и III, а также комплексы II и III. Цитохром с также выполняет
аналогичную «челночную» функцию на участке между комплексами III и IV, диффундируя вдоль
поверхности мембраны. Не исключена возможность непосредственного переноса электронов от
одного комплекса к другому
^—р Детальное рассмотрение строения фотосинтетической цепи электронного
транспорта будет проведено в гл. XXVII. Здесь лишь необходимо отметить,
что фотосинтетические ЭТЦ, подобно митохондриальной, построены по блочному
принципу (см. рис. XXIV.2). Для всех этих цепей характерна асимметричная
организация переносчиков электронов в мембране, согласованная с ориентацией
АТФазы. Сходство простирается также и на АТФазы, которые, имеют практи-
практически идентичный субъединичный состав. Сравнительный анализ электрон-транс-
электрон-транспортных комплексов, участвующих в преобразовании энергии, приводит к выводу
что они составляют структурно-функциональную основу электрон-транспортных
i 2. Электрон-транспортные цепи
211
биоэнергетических процессов. Электрон-транспортные комплексы можно рассма-
рассматривать как необходимую для этого минимальную функциональную единицу.
При этом отдельные подвижные переносчики электронов играют подчиненную
роль, обеспечивая перенос электрона между комплексами. Очевидно, созданные
природой и отобранные в результате эволюции комплексы переносчиков оказались
достаточно универсальными, чтобы удовлетворить энергетические потребности
различных организмов. ?
На рис. XXIV.4 приведены в единой энергетической шкале все три энергопре-
образующих комплекса митохондрий, а также фотосинтетические РЦ фотосинте-
зирующих бактерий и хлоропластов.
Сукцинат Фумарат 2Н+
,¦' Центр i
.№-,— - QH2
/s
1+
'562
-¦-, \
&-/¦*¦«
566
Мембрана
V
\o2
I
2H+
Рис. XXIV.3.
E-цикл Митчела
Предполагают наличие двух мест реак-
реакций, в которых участвует убихинон, —
так называемые центры г и о, локализо-
локализованные, по-видимому, на противополож-
противоположных сторонах мембраны. В центре о уби-
хинол окисляется до убихинона с осво-
освобождением двух протонов, причем один
электрон от убихинола поступает к же-
лезосерному белку Риске, а затем к ци-
тохрому ci, в то время как другой по-
поступает к цитохрому &5бб- Восстановлен-
Восстановленный семихиноном цитохром 6566) B свою
очередь, восстанавливает цитохром &5б2-
Электрон от цитохрома 6562 использует-
используется для восстановления убихинона в цен-
центре г
В ЭТЦ пурпурных фотосинтезирующих бактерий (см. гл. XXVII, XXVIII), по-
поглощающих свет в дальней красной области, энергии кванта света хватает только
на то, чтобы для организации потока электронов использовать лишь комплекс III.
Использовать цитохром-оксидазу (комплекс IV) им удается только в аэробных усло-
условиях (несерные пурпурные бактерии). Восстановить НАД бактерии могут лишь за
счет обратного транспорта электронов, который начинается на уровне хинонов и
захватывает комплекс I.
В фотосинтезе высших растений для переноса электронов от фотосистемы II
(ФС II) к фотосистеме I (ФС I) может быть использован комплекс III b^-J'-ком-
b^-J'-комплекс). Поэтому представляется естественным сходство акцепторных сторон фо-
фотосинтетических реакционных центров (РЦ) бактерий и ФС II зеленых растений,
когда в том и другом случаях происходит сопряжение РЦ с комплексом III. Су-
Существует также определенное сходство донорнои части РЦ пурпурных бактерий и
ФС I высших растений в значениях окислительно-восстановительных потенциалов
переносчиков, находящихся в донорнои стороне РЦ. В обоих случаях происходит
сопряжение комплекса III с фотосинтетическими РЦ.
212
Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
§ 3. Механизмы транслокации протонов и генерации Д^.Н+ в дыхательной
и фотосинтетической цепях электронного транспорта
Механизмы сопряжения. Асимметрично локализованные комплексы переносчиков
функционируют так, что перенос электрона сопровождается транслокацией про-
протона через мембрану. Возможны различные механизмы этого сопряжения (см. §4
гл. XXII). Во-первых, предполагают существование асимметрично расположенных
специальных мембранных белков, переносящих протон. Их сродство к протону и
протонсвязывающие свойства меняются при переносе электрона, что и приводит
к соответствующим изменениям концентрации протонов на обеих сторонах мем-
ДмВ
-400
-300
-200
-100
0
100
200
300
400
500
600
700
Av700
ФС/
ФМН
Шг
ш
2Циг*
FeSR
Цитс
-(РОЦиг с-
IV
Цит а
Сиа
Цит а
Av
870
РЦ
^
680
ФСП
>н,о-
Рис. XXIV.4.
Сопряжение различных электрон-транспорт-
электрон-транспортных комплексов в ЭТЦ митохондрий, хлоро-
пластов и хроматофоров
Дыхательная цепь митохондрий представлена тремя
комплексами (I, III, IV), способными окислять НАДН
до воды. Фотосинтетические ЭТЦ представлены со-
соответствующими РЦ. В центре рисунка находится
комплекс III, содержащий цитохром типа Ь, цитохром
типа с\ и железосерный белок Риске (FeS«). Донором
электронов для него является убихинон Q или пласто-
хинон PQ, акцептором — цитохром с (цит с) или пла-
стоцианин PC. Среди комплексов, способных гене-
генерировать Д(Ш+, комплекс III, по-видимому, являет-
является наиболее универсальным, поскольку присутствует
в ЭТЦ митохондрий, хлоропластов и хроматофоров.
Остальные комплексы молекул переносчиков, участ-
участвующие в преобразовании энергии, являются более
специфическими и присутствуют лишь у определен-
определенных групп организмов
браны. Во-вторых, возможно образование редокс-зависимого протонного канала
в белковой части переносчика электронов. В этом случае переносчик электронов
должен одновременно выполнять функции и протонного насоса. Предполагают,
что транслокация протонов при окислительно-восстановительных превращениях
переносчиков происходит либо за счет конформационных изменений самих пере-
переносчиков (или специального протонофорного белка), либо за счет редокс-зависимо-
редокс-зависимого протонирования — депротонирования. Пока неясно, каким образом происходит
транспорт протонов против поля. Так, в случае цитохромоксидазы предполагают,
что наиболее гидрофобная третья субъединица цитохромоксидазы формирует ре-
докс-зависимый протонный канал. Важную роль в транслокации протона, види-
видимо, играют окислительно-восстановительные превращения тема цитохрома а. Об
этом свидетельствуют чувствительность этого цитохрома к протонам матрикса
3. Механизмы транслокации протонов и генерации Д(лН+
213
и зависящий от наличия третьей субъединицы окислительно-восстановительный
потенциал цитохрома а (рис. XXIV.5).
В-третьих, перенос протона может быть обусловлен работой подвижных пе-
переносчиков, которые, восстанавливаясь на одной стороне мембраны, одновременно
с электроном присоединяют протон, а затем диффундируют на другую сторону
мембраны, где происходит окисление переносчика и выброс протона за счет диссо-
диссоциации в примембранную область. В соответствии с этим П. Митчел предположил,
что в каждом протонпереносящем сегменте ЭТЦ переносчики водорода BН+ +2е~)
чередуются с переносчиками электронов Bе~) (рис. XXIV.6), образуя редокс-петлю.
Согласно схеме редокс-петли, переносчик водорода D передает водород переносчи-
н+ н+
Рис. XXIV.5.
Цитохромоксидаза как редокс-зависимая про-
протонная помпа
Функция цитохромоксидазы заключается не только в
поглощении протонов, необходимых для восстановления
кислорода до воды, но и в переносе протонов из внутрен-
внутренней фазы наружу
ку А, находящемуся на противоположной стороне мембраны. При окислении D и
восстановлении А происходит освобождение двух протонов в среду. Электроны от А
трансмембранно переносятся на другой переносчик электронов В. Можно предста-
представить, что переносчик водорода, будучи незаряженным, подобно хинону, диффун-
диффундирует по градиенту концентрации к А. В то же время перенос электронов от А
к В происходит против электрического поля, образующегося при трансмембранном
переносе протонов. При такой организации электронного транспорта окисление
донора электронов DH конечным акцептором В, находящимся на той же стороне
мембраны, сопряжено с трансмембранным переносом протонов и, следовательно,
генерирует на мембране Д[ХН+. Перенос двух электронов в редокс-петле сопрово-
сопровождается транслокацией двух протонов.
^—р Три комплекса ЭТЦ в дыхательной цепи I, III и IV играют роль генерато-
ров АрН+, сопрягающих перенос электронов с трансмембранным переносом
протонов. Действительно, для изолированных комплексов доказана способность ге-
генерировать АрН+ при встраивании их в липосомы из фосфолипидов. Таким обра-
образом, эти комплексы являются не только структурной единицей переноса электронов,
но и функциональной единицей сопряжения переноса электронов с образованием
АТФ. ?
214
Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
Перенос протонов в фотосинтезе. На рис. XXIV.7 изображена схема функцио-
функционирования фотосинтетической цепи высших растений, где последовательно взаимо-
взаимодействуют две фотосистемы I и II (подробнее см. гл. XXVII-XXVIII). Каждая фо-
фотосистема переносит один электрон с внутренней на наружную сторону мембраны
тилакоида за время короче 20 не. Полярность мембраны тилакоида обратна поляр-
полярности митохондрий (плюс на внутренней и минует на наружной стороне мембраны).
Взаимосвязь фотосистем осуществляется электрон-транспортной цепью, включаю-
включающей цитохромный комплекс и подвижные переносчики. Так, ФС II и цитохромный
комплекс взаимодействуют через подвижный переносчик — пластохинон, который
одновременно передает электроны и протоны с наружной на внутреннюю сторону
Мембрана
С
^ш
le
y Л
Н+-
-2Н+
Мембрана
С
Субстрат Н2
субстрат
2Н+
2Н+
н,о
III
Мембрана
-2Н+
-2Н+
Н+
Рис. XXIV.6.
Перенос зарядов через мембрану:
I, II — отдельная редокс-петля, III — ды-
дыхательная цепь митохондрий
мембраны за 20 мс. Как окисление воды, так и окисление пластогидрохинона други-
другими переносчиками, которые сами не связывают протоны при своем восстановлении,
освобождает по одному протону во внутреннее пространство тилакоида. Наоборот,
при восстановлении пластохинона и НАДФ на наружной стороне потребляются
протоны из наружной фазы. Таким образом, перенос электрона через ФС I и ФС II
эквивалентен транслокации двух протонов из наружной во внутреннюю фазу ти-
тилакоида. Освобождение протона при окислении води занимает около 300 мке, а
захват протона из наружного пространства при восстановлении пластохинона и
НАДФ происходит намного медленнее F0 мс) вследствие диффузионных барьеров
3. Механизмы транслокации протонов и генерации Д(лН+
215
в наружной поверхности мембраны. Не исключено также и дополнительное участие
протонпереносящих белков, которое может вызывать наблюдаемые в эксперимен-
экспериментах отклонения величины Н+/е~ от 2.
В первые моменты освещения появление электрического поля происходит за
счет локальных потенциалов, созданных в результате фотохимического переноса
электрона ФС I и ФС П. Затем транслокация Н+ пластохиноном также дает свой
вклад в разность электрических потенциалов, увеличивая положительный заряд
внутри тилакоида. По направлению образованного поля происходит электрогенное
движение хорошо проникающих через мембрану ионов, которые своими зарядами
компенсируют мембранный электрический потенциал Дер, тем самым облегчая пере-
hv
ФСП
Флюоресценция
hv
Тилакоидная мембрана
Утечка протонов
Рис. XXIV. 7.
Схема трансмембранного переноса протонов в фотосинтетической мембране
нос протонов и одновременно способствуя увеличению АрН. В хлоропластах такими
компенсирующими ионами являются К+, Mg2+ и С1~.
Возможна и противоположная ситуация, когда индуцируется стехиометри-
ческий обмен с протоном катионов — антипорт, и анионов — симпорт (см. §2,
гл. XXI). Если скорость антипорта и симпорта ионов близка к скорости транслока-
216 Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
ции протона ЭТЦ, химический потенциал протонов с каждой стороны мембраны
будет возвращаться к исходному и значение АрН, создаваемое электронным
транспортом, будет минимальным, а электрическая составляющая трансмембран-
трансмембранного потенциала—максимально высокой. Наоборот, электрогенное движение
заряженных ионов по направлению поля максимально увеличит АрН и уменьшит
мембранный потенциал. В определенных условиях взаимодействие этих процессов
может обратить в нуль сумму обоих компонентов, что фактически и происходит
в присутствии разобщителей (см. §2 гл. XXI). Таким образом, действительная
величина электрохимического градиента в стационарных условиях будет зависеть
от соотношения скоростей всех указанных процессов ионного транспорта.
Рассмотрим возможность использования самого понятия АрН внутри частиц
малого размера, какими являются клеточные органеллы: хлоропласты, хромато-
форы и митохондрии. При переносе протонов происходит подкисление внутренней
фазы тилакоида и сдвиг рН до значений рН 5, что соответствует концентрации Н+,
равной 10~5 М во внутритилакоидном пространстве. Учитывая, что осмотический
объем одного тилакоида составляет A -j- 6) • 106 нм3, нетрудно подсчитать, что в
водной фазе внутритилакоидного пространства одного тилакоида находится всего
лишь от 6 до 36 протонов. Это более чем на порядок ниже числа ЭТЦ в тилакоиде,
которое приближается к ~ 300. Между тем общее число протонов, перенесенных
в тех же условиях стационарного освещения в отсутствие фосфорилирования во
внутреннюю фазу тилакоида, составляет около 100 протонов на одну ЭТЦ. Это
означает, что не менее 99% всех протонов связано во внутренней фазе с буферными
группами, природа которых до конца неизвестна.
Следует учесть также функциональную и структурную неоднородность ти-
тилакоида, связанную с латеральной гетерогенностью мембран. Комплексы ФС II
локализованы в местах контакта тилакоидов гран, ФС I и АТФ-синтетазный ком-
комплексы— в зонах свободного контакта со стромой в ламелярных тилакоидах и
маргинальных торцовых участках тилакоидов гран. Цитохромный комплекс и пла-
стохинон равномерно распределены в латеральном плане мембраны. Диффундирую-
Диффундирующий внутри тилакоида пластоцианин имеет разную долю восстановленных молекул
в центре тилакоида и на краях. Скорость транспорта электронов по ЭТЦ зави-
зависит от рН внутри тилакоида и рН стромы. Для тилакоидов, собранных в граны,
может иметь значение нехватка протонов в тонком водном слое между дисками
для образования PQH2 из-за медленной диффузии ионов из стромы через узкую
межгранную щель. Реалистичное описание зависимости внутритилакоидного рН и
числа поглощенных на свету протонов от рН стромы дает математическая модель,
описывающая диффузный перенос протонов через мембрану тилакоида путем об-
обмена Н+ с внутримембранными кислотными группами (Тихонов). Таким образом,
все процессы электронного и протонного транспорта и их сопряжения необходимо
рассматривать в распределенной гетерогенной системе.
При столь малых, объемах тилакоида поверхностные заряды мембраны также
могут влиять на поведение ионов в прилегающем к мембране диффузном электриче-
электрическом слое (см. § 5 гл. XVIII). Размеры данного слоя сравнимы с расстояниями между
близкими поверхностями тилакоидных мембран, обращенных в сторону матрикса.
Очевидно, значительная часть протонов не выходит внутрь тилакоида, а остается
связанной внутри мембраны в метастабильных протонных пулах. Распределение Н+
§ 4. АТФазный комплекс 217
внутри тилакоида носит не равномерный, а локальный характер, соответствующий
протонсвязывающим свойствам участков мембраны. Вследствие такого рода ла-
латеральной гетерогенности тилакоидных мембран внутреннее пространство может
разделяться на отдельные сравнительно изолированные друг от друга компартмен-
ты, между которыми протонное равновесие устанавливается медленно. В частно-
частности, известны данные, когда в ответ на короткие вспышки света происходит синтез
АТФ, а значение рН внутри тилакоида практически не меняется, оставаясь около
7,5-8,0. Возможно, что протоны, выделяющиеся при разложении воды и окислении
пластогидрохинона, попадают к АТФ-синтетазным центрам, мигрируя вдоль по-
поверхности мембраны и не выходя в водную фазу внутритилакоидного пространства.
Основой для недиффузионного латерального переноса протона по примембранно-
му слою могут быть ионогенные группы белков (в первую очередь карбоксильные
группы), образующие системы кооперативных Н-связей, обеспечивающих возмож-
возможность переноса протона по эстафете Н-связей. Есть основания предполагать, что
латеральный поток протонов к АТФазе в определенных условиях имеет место в
ФС П.
\—? Таким образом, смысл параметра АрН компонента АрН" как движущей силы
синтеза АТФ носит в значительной степени общий термодинамический харак-
характер. Действительная проблема состоит здесь не в значении АрН+ и сопоставлении
его с количеством образованных молекул АТФ, а в механизмах внутримолекуляр-
внутримолекулярных превращений в АТФ-синтетазном комплексе. П
§ 4. АТФазный комплекс
В настоящее время протонные АТФазы выделены практически из всех типов сопря-
сопрягающих мембран: митохондрий, хлоропластов, хроматофоров. АТФазный комплекс,
или Н+-АТФаза, — обратимый фермент, обладающий как АТФ-синтетазной, так и
АТФазной функциями. Синтез АТФ осуществляется за счет АрН+, а гидролиз
АТФ приводит к тому, что протонная АТФаза сопряженно генерирует транс-
трансмембранную разность электрохимического потенциала Н+. Таким образом, в Н+-
АТФазе происходят процессы по общей схеме
АТФ-синтетаза
АРН+ АТФаза АТФ (XXIV.4.1)
АТФазный комплекс (FoFi-АТФаза) состоит из растворимой АТФазы (фактор F{)
и мембранных компонентов (комплекс Fq). Общая топография АТФазного комплек-
комплекса приведена на рис. XXIV.8.
Считают, что Fo формирует канал, по которому протоны поступают к актив-
активному центру АТФазы. Проводимость протонов носит специфический характер и
подавляется антибиотиком олигомицином и ДЦКД (N, N'-дициклогексилкарбодии-
мид) — ингибиторами Н+-АТФазы. Особым образом организованный канал обес-
обеспечивает прохождение протона через всю мембрану из водной фазы в гидрофобную
область мембраны, а затем из нее в воду по другую сторону липопротеиново-
го барьера. Основную роль в переносе играет ДЦКД-связывающий протеолипид.
Предполагают, что он располагается поперек мембраны, так что полярная часть
оказывается на внешней поверхности мембраны митохондрий и служит входом в
218
Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
канал. Наиболее вероятным механизмом переноса протона представляется эстафет-
эстафетная передача по протон-донорным и протон-акцепторным группам аминокислот,
включая остатки арг, тир и глу.
Предполагая, что индивидуальный перенос Н+ (либо вдоль водородных связей,
либо путем туннелирования между центрами) происходит на величину, не превос-
превосходящую 0,2-0,3 нм, легко подсчитать, что для того, чтобы пересечь всю мембрану
D-5 нм), число групп должно быть не менее 15-20.
Рис. XXIV.8.
Строение Н+-АТФазного комплекса
(по J.K.Lanyi, 1995)
Для выяснения функции отдельных субъединиц был успешно использован им-
мунохимический анализ, а также различные препаративные методы, позволившие
получать молекулы F\ без тех или иных субъединиц. Основные каталитические
свойства фактора F\ обеспечиваются а- и C-субъединицами, где расположены ме-
места связывания нуклеотидов с разным сродством, а-субъединица фермента содер-
содержит некаталитические центры, обладающие высоким сродством к АДФ и высокой
специфичностью ее связывания. На C-субъединице локализованы активные центры
АТФазной реакции, субстратом для которой служит комплекс Mg2+-AT<t> (свобод-
§ 5. Механизм энергетического сопряжения 219
ные Mg + и АТФ — конкурентные ингибиторы фермента). Минорные субъединицы
(у,§, s), в отсутствие которых сохраняется АТФазная активность, обеспечивают
процессы пассивной утечки Н+ через АТФазу, регуляцию АТФазной активности,
а также связывание каталитического сектора с мембраной. Работа АТФазы сопро-
сопровождается кооперативными конформационными перестройками, затрагивающими
четвертичную структуру фермента, для чего требуется приток энергии. Так, в
мембранах хлоропластов АТФаза находится в латентной форме, которая может
активироваться с изменением четвертичной структуры при освещении в присут-
присутствии ионов Mg2+ и SH-групп, при создании на мембране протонного градиента или
действии внешнего электрического поля. Схема строения Н+-АТФазы приведена на
рис. XXIV.8.
Переходы между различными состояниями можно представить в виде:
(FiFo-АДФ)*
fc+з k^
(FiF0) + АТФ, (XXIV.4.2)
где (FiFo-АДФ)* и (FiFo-АДФH — активная и неактивная формы Н+-АТФазы
в комплексе с АДФ, индекс Е в символах h,2 , k_s означает, что соответ-
соответствующие процессы требуют притока энергии. Характерные времена переходов
(l/fc+з ~ l/fc-з) между состояниями * и 0 должны составлять несколько секунд,
что намного медленнее, чем непосредственные реакции синтеза и гидролиза АТФ
A0~3-10~2 с). Отсюда следует, что энергизация Н+-АТФазы происходит не во
время ее функционирования, а предшествует ему.
§ 5. Механизм энергетического сопряжения
Согласно хемиосмотическому механизму захват энергии, выделяющейся в процес-
процессах электронного транспорта, осуществляется за счет создания трансмембранной
разности АрН+, а перенос энергии к АТФ-синтазе обеспечивается потоком прото-
протонов через ее протонный канал.
Синтез АТФ из АДФ и Фн может происходить в мембранных везикулах и в
отсутствие переносчиков электронов. Для этого необходимо лишь тем или иным
образом создать трансмембранную разность электрохимических потенциалов Н+
на мембране, в которой находится АТФ-синтетаза. Такого рода процессы синтеза
АТФ наблюдаются в липосомах из фосфолипидов, в состав которых помимо АТФ-
синтетазы входит бактериородопсин (см. гл. XXIX), способный под действием света
переносить Н+ через мембраны. Аналогично, синтез АТФ можно осуществить,
создав разность АрН+ с помощью «кислотно-щелочного удара» или прикладывая
разность электрических потенциалов. В действительности проблема состоит в том,
чтобы понять, каким образом компоненты АрН+ взаимодействуют с Н+-АТФазой,
не вовлекая непосредственно перенос электрона в ЭТЦ.
Хемиосмотический принцип трансформации энергии не может объяснить непо-
непосредственного молекулярного механизма синтеза АТФ. Согласно одному из первых
вариантов хемиосмотической гипотезы, образование АТФ сопряжено с распадом
220 Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
высокоэнергетического предшественника X~Y. Считали, что существуют некие
компоненты (подвижные в липидах ионы) X и Y, находящиеся в мембране в виде
ХН+ и YOH+, которые могут диссоциировать: ХН =г* Х~ + Н+; YOH =г* YO~ + Н+.
В митохондриальной мембране у внешней стороны происходит реакция конден-
конденсации [см. (XXIV.1.1)-(XXIV.1.3)]
2H++X-+YO" ^H2O + X~Y. (XXIV.5.1)
Эта реакция сильно сдвинута вправо за счет повышения трансмембранного АрН и
движения анионов Х~ и YO к внешней поверхности под действием сил трансмем-
трансмембранного электрического поля. На схеме (XXIV.5.1) природа X и Y по-прежнему
остается неизвестной. Однако главный недостаток хемиосмотического принципа
сопряжения состоит в том, что роль АрН+ здесь сводится лишь к пассивному
фактору, сдвигающему химические равновесия в системе реакций. В самом деле,
величина АрН+ в соответствии с представлениями классической термодинамики и
кинетики определяет среднестатистическую вероятность, или среднее число актов
переноса протонов между поверхностями мембраны, разделенными энергетическим
барьером АрН+ [ср. (XIV.1.1)]. Однако само по себе значение АрН+ не раскрывает
молекулярных механизмов процесса прохождения единичного протона через Н+-
АТФ-синтетазу и синтеза АТФ в активном центре. Иными словами, несмотря на
успех хемиосмотической теории, доказавшей роль АрН+ в качестве движущей силы
синтеза АТФ, одного лишь концентрационного градиента протонов недостаточно
для понимания молекулярного механизма сопряжения. Необходимо принимать во
внимание активную роль протонов, непосредственно взаимодействующих с макро-
молекулярным комплексом Н+-АТФазы.
Согласно представлениям Митчела, в активный центр АТФазы нагнетаются
протоны, которые непосредственно восстанавливают фосфорильный кислород не-
неорганического фосфата в активном центре, образуя соединения типа
но-""'
Преодоление энергетического барьера элементарного акта синтеза АТФ дости-
достигается за счет «горячих» протонов, которые разгоняются электрическим полем в
протонном канале Н+-АТФазы. Таким образом, передача энергии АрН+ должна
была бы осуществляться здесь путем трансформации кинетической энергии прото-
протонов. Но в конденсированной фазе, где релаксация возбужденных степеней свободы
происходит быстро A0~12-10~11 с), такой механизм также невозможен. Не спасает
положение и представление о некоем аккумуляторе, в котором должны накапли-
накапливаться протоны, движущиеся внутри АТФ-синтетазы до тех пор, пока не наберется
энергия, достаточная для синтеза одной молекулы АТФ.
Можно было бы попытаться использовать только электрическую составляю-
составляющую Аср в качестве движущей силы, смещающей полярные группы в ходе элемен-
элементарного акта. Однако тогда необходимо сделать предположение, что все падение
напряжения на мембране реализуется в активном центре на расстояниях действия
химических или, в крайнем случае, межмолекулярных сил, т. е. на 0,3-0,4 нм. Это
представляется нереальным (Л. А. Блюменфельд).
§ 5. Механизм энергетического сопряжения 221
\—? В действительности проблему синтеза АТФ в Н+-АТФ-синтетазе следует рас-
рассматривать исходя из общих представлений о роли электронно-конформацион-
ных взаимодействий в механизмах ферментативного катализа (гл. XIV).
Как известно, элементарный акт катализа осуществляется в активном центре
фермента спонтанно, когда в нем достигается реакционноспособная конфигурация
между реагирующими группами субстрата и фермента, расположенными на рас-
расстояниях порядка длин химических связей. На стадиях взаимодействия субстрата
и фермента при образовании активной конфигурации и затем при отщеплении обра-
образовавшегося продукта в ферменте происходят конформационные изменения. Такие
внешние факторы, как температура, ионная сила раствора, вязкость, могут влиять
на эти релаксационные стадии. Однако непосредственный акт катализа в сформи-
сформированной активной конфигурации уже не требует тепловой энергии активации. ?
Именно с этими представлениями согласуются результаты Дж. Бойера. Элемен-
Элементарный акт образования АТФ может происходить в активном центре Н+-АТФазы
в условиях деэнергизации мембраны, когда А[аН+ = 0, и даже в активном центре
изолированного фактора F\, находящегося в растворе. Однако валовой синтез АТФ
при деэнергизации практически не происходит. Изучение реакций изотопного об-
обмена 18О (АТФ ч± Н218О) показало, что стадией, определяющей крайне низкую ско-
скорость валового синтеза АТФ в отсутствие АрН+, является освобождение синтези-
синтезированного АТФ из активного центра (Boyer P. D.). Именно этот процесс ускоряется
(в 1000 раз) при энергизации мембраны. Таким образом, энергия АрН+ использует-
используется в основном для вытеснения прочносвязанного АТФ из каталитического центра
фермента. Энергия также расходуется и при связывании ферментом фосфата и
АДФ, причем каталитические центры функционируют, чередуясь в определенном
порядке. Все это означает, что энергия АрН+ расходуется не на стадии элементар-
элементарного акта образования ковалентной связи АДФ ~ Ф в активном центре фермента,
а влияет на процессы связывания ферментом субстрата и освобождения продукта
реакции из активного центра.
Согласно одной из схем, в комплексе существуют два активных центра, которые
могут находиться либо в открытом, либо в закрытом состоянии. Связывание АДФ
и Ф в одном центре вызывает такое изменение конформации, которое способствует
высвобождению АТФ из другого центра. Аналогично этому, в процессе гидролиза
АТФ связывание и гидролиз АТФ приводят к быстрой диссоциации АДФ и Фн
из альтернативного центра. Роль компонентов АрН+ состоит в протонировании
определенных молекулярных групп АрН или изменении положения полярных групп
под действием электрического поля Дер. При этом (см. § 3 гл. XIV) изменяется
характер движения отдельных групп белка в конформационном потенциале. Это и
может непосредственно влиять на формирование фермент-субстратного комплекса
при связывании субстрата и на отщепление продукта реакции, т. е. на процессы,
происходящие в ходе конформационной релаксации.
Так, считается, что энергия Дер используется для движения комплекса предсин-
тезированной АТФ4~ с лигандами некаталитического центра [АТФМ^ЗД№Нз]2+ к
внутренней поверхности мембраны, где и происходит диссоциация АТФ в матрикс.
Когда движущей силой синтеза АТФ является ДрН, а не Дер, то транслокация
положительно заряженного комплекса АТФ с лигандами осуществляется под дей-
222 Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
ствием локальных электрических полей, которые возникают при протонировании
аминокислотных остатков вблизи активного центра и депротонировании остатков
вблизи некаталитического центра. В целом процессы связывания АТФ и субстрата
АДФ + Фн в активном и неактивном центрах должны быть строго сбалансированы
по зарядам, что может достигаться фиксированной системой положительно (NHg ,
Mg2+) и отрицательно (СОО~) заряженных групп.
Схема синтеза АТФ в активном центре. Рассмотрим теперь модели работы
Н+-АТФ-синтетазы, где используются новые данные о структурных перестройках,
приводящих к изменению состояния каталитических центров (см. рис. XXIV.8)
(Boyer P.D., Walker J., Skou J, 1997).
Сопрягающий фактор АТФазы (фактор F\ для митохондрий или CF± для хло-
ропластов) представляет собой полифункциональный белок, имеющий сложную че-
четвертичную структуру. Он построен из трех типов крупных субъединиц (а, C, у с
молекулярной массой 30000-60000) и двух типов минорных субъединиц 8, s с моле-
молекулярной массой 11000-20000). Стехиометрия комплекса (аз(ЗзУ^8- Разложение его
на отдельные субъединицы ведет к потере ферментативной активности. «Шляпка»
высотой 80 А и шириной 100 A (Walker J., 1994) грибовидного выроста Н+-АТФазы
соответствует фактору F\, частично погруженному в мембрану, а основание —
гидрофобным белкам комплекса Fo, который включает три типа полипептидов
(а, Ь, с) с молекулярными массами от 6500 до 30 000 и обеспечивает связывание
фактора F\ с мембраной и перенос протонов при работе фермента. На каждую
пару а-C-субъединиц приходится по одному полипептиду а, по два белка & и по 9-
12 копий с-белка водорастворимого комплекса. Субъединицы а и C гомологичны,
они уложены в белковые глобулы, которые образуют единый ансамбль, в котором
а- и C-субъединицы расположены поочередно вокруг у-субъединицы, имеющей вид
слегка изогнутого стержня длиной 90 А. Существуют кинетические и структурные
доказательства наличия 3-х взаимодействующих гидролитических мест, по одному
на каждой C-субъединице, отделенных друг от друга на 120 градусов, у-субъединица
как бы выступает из глобулы CF\, играя роль связующего звена между мембранами
F\ и водорастворимыми Fo фрагментами АТФазы.
Было показано, что комплекс F\ может поворачиваться вокруг оси, совпада-
совпадающей по направлению с субъединицей у. При повороте на 120° каждая из а- и
C-субъединиц переместится на место другой такой же а- и C-субъединицы, а при
повороте на 60° соседние а- и C-субъединицы поменяются местами (см. рис. XXIV.8).
Недавно появились прямые доказательства такого рода вращения субъедини-
субъединицы у относительно «сидящего» на ней фактора сопряжения F± (Noji et al, 1997).
Японские ученые наблюдали с помощью флуоресцентного микроскопа движение
у-субъединицы при гидролизе АТФ молекулой F\. Три C-субъединицы комплекса
F\ были иммобилизованы на неподвижной подложке, а к концу у-субъединицы был
химически «пришит» флуоресцирующий фрагмент нити актина длиной ~ 1 микрон.
В ходе функционирования фермента и гидролиза АТФ происходило вращение нити
актина, которое прекращалось в отсутствие АТФ. Движущей силой вращения этого
молекулярного мотора является попеременное протонирование и депротонирование
функционально важных аминокислотных остатков в ферменте. В результате ин-
индуцируются направленные электростатические взаимодействия, «толкающие» всю
структуру комплекса по направлению вращения. Таким образом кооперативные
i 5. Механизм энергетического сопряжения
223
структурные перестройки активных центров, необходимые для работы Н+-АТФа-
зы, находят свое выражение в реальном вращении субъединиц относительно друг
друга.
В силу некоторой асимметричности вращение F± -комплекса переводит его
C-субъединицы при каждом повороте в новое положение, где они попадают в другое
микроокружение. Это и приводит к изменению состояния и конформационной
перестройке активных центров, при вращении молекулы F\.
ADP
ATP
Рис. XXIV.9.
Схема, иллюстрирующая энергозависимые изменения состояния каталитических
центров
Каждый из трех активных центров в результате вращения F± -комплекса может
поочередно находиться в одном из трех конформационных состояний, которые раз-
различаются по степени сродства молекул ATP, ADP и Р к каталитическому центру.
На рис. XXIV.9 схематически показана смена состояний центра при вращении
C-субъединиц. В состоянии 1 центр C-субъединицы открыт и в нем связываются
молекулы ADP и Р, которые сравнительно слабо удерживаются центром. Вращение
и конформационные перестройки комплекса F\ переводят этот центр в состояние 2,
где происходит непосредственно синтез АТР.
Здесь ADP и Р прочно фиксируются в каталитическом центре, находясь в
активной конфигурации, необходимой для образования ковалентнои связи между
фосфатными группами ADP и Р. Поэтому на этой стадии, как уже говорилось
выше, не требуется притока энергии извне (Boyer P. D.). В этом состоянии 2 в ката-
каталитическом центре самопроизвольно идут акты образования и разрыва ковалентнои
224 Глава XXIV. Перенос электронов и трансформация энергии в биомембранах
связи ADP—Р, поскольку константа равновесия реакции
ATP ** ADP + Р
близка к единице.
На следующем этапе центр переходит в состояние 3, где за счет энергозави-
энергозависимой структурной перестройки происходит ослабление прочной связи молекулы
АТР с центром и выход ее наружу. На освободившееся место приходят из рас-
раствора новые молекулы ADP и Р. Описанные перестройки носят кооперативный
характер и затрагивают состояние всех трех каталитических центров C-субъединиц
комплекса F\. Поскольку весь цикл включает три этапа, а в Н+-АТРазе имеется
3 субъединицы, то после каждого структурного перехода в растворе появляется
новая молекула АТР.
Комплекс Fq может рассматриваться как вращающийся ансамбль субъединиц с
9-12 остановками, позволяющий прерывать поток протонов. Временное связывание
протонов может осуществляться остатком Acn-6L на каждой субъединице. Каждый
поворот у-субъединицы внутри комплекса (или ансамбля азРз-субъединиц вокруг
субъединицы у) происходит в соответствии с тем, заполнено ли гидролитическое
место АТР или ADP и Р. Эти конформационные изменения (механические изме-
изменения структуры) обеспечивают перенос 3-х или 4-х протонов через мембрану на
каждый третий этап цикла. Связывание, гидролиз и освобождение АТФ и АДФ в
Fq—Fi АТФазе зависит от величин и геометрии расположения заряда в активном
месте.
Пока еще не ясна природа и расположение заряженных молекулярных групп,
ответственных за непосредственное вращение молекулярного мотора Н+-АТРазы.
В целом кооперативная перестройка структуры Н+-АТРазы связана с направлен-
направленным характером электронно-конформационных взаимодействий. Движущая сила —
компоненты A[iH+ — изменяет электронное состояние в локальной области актив-
активного центра. В результате развиваются конформационно-релаксационные процес-
процессы, происходит изменение четвертичной структуры (вращение F±-комплекса), что
необходимо как для связывания субстрата, так и для отщепления продуктов реак-
реакции, образовавшихся в активном центре.
Глава XXV
Биофизика мышечного сокращения
Ш
§ 1. Общая характеристика преобразования энергии в системах биологической
подвижности
Способность к движению — одно из характерных свойств всех живых организмов,
начиная от простейших и кончая самыми сложными. Сокращение разных мышц и
движение листьев растений, биение ресничек и движение жгутиков, деление клеток
и движение протоплазмы — все эти разнообразные формы проявления двигатель-
двигательной активности имеют общую черту — превращение химической энергии, освобо-
освобождающейся при гидролизе АТФ, в механическую. Белковые структуры, участвую-
участвующие в гидролизе АТФ и генерации силы, — это либо миозин и актин, либо кинезин
(или динеин) и тубулин. При мышечном сокращении механическая работа осуще-
осуществляется организованными в надмолекулярные структуры ферментом — АТФазой
миозина — и актином. Регулятором двигательной активности в мышцах является
кальций. В немышечных клетках, наряду с кальциевой, по-видимому, существуют
и другие способы регуляции. Выяснение молекулярных механизмов генерации си-
силы, трансформации химической энергии гидролиза АТФ в механическую работу, а
также механизмов регуляции этих процессов является основной задачей биофизики
биологической подвижности. Наибольшие успехи в этом направлении достигнуты
при исследовании наиболее организованных поперечно-полосатых мышц позвоноч-
позвоночных.
§ 2. Основные сведения о свойствах поперечно-полосатых мышц
Система электромеханического сопряжения мышцы. Поперечно-полосатая скелет-
скелетная мышца состоит из продольных пучков мышечных волокон с характерным
угловатым поперечным сечением. Ширина мышечных волокон варьирует от 10
до 100 мкм, а длина часто соответствует длине мышцы, достигая в некоторых
волокнах 12 см. Всю мышцу окружает тонкий чехол соединительной ткани, которая
отделяет пучки мышечных волокон друг от друга и участвует в присоединении их
концов к сухожилиям. Мышечное волокно (рис. XXV.1) представляет собой сложную
многоядерную клетку, содержащую одну-две тысячи более тонких вытянутых
волоконец (миофибрилл) диаметром 1-2 мкм, состоящих из элементарных сокра-
сократительных единиц — саркомеров. Толстые и тонкие нити саркомеров образованы
из сократительных (миозин и актин) и Са +-чувствительных регуляторных белков
(см. §3 этой главы). Функциональная активность белков сократительной системы
зависит от концентрации ионов Са внутри саркомера. Быстрое и эффективное
226
Глава XXV. Биофизика мышечного сокращения
поперечная трубочка
Z— мембрана
митохондрия
толстые нити
тонкие нити
сарколемма
миофибрилла
саркоплазматический
ретикулум
Рис. XXV. 1.
Схема структурной организации мышечной клетки (по Woledge R. et al., 1992). На
одном из участков поперечная трубочка удалена для того, чтобы показать одну из
Z-мембран, разделяющих миофибриллу на саркомеры (см. рис. XXV.4)
§ 2. Основные сведения о свойствах поперечно-полосатых мышц 227
управление концентрацией ионов Са + в мышечном волокне осуществляется с
помощью специального аппарата — так называемой системы электромеханического
сопряжения.
Каждое мышечное волокно имеет отдельную мембранную оболочку — сарко-
сарколемму — и электрически изолировано от других мышечных клеток. Внутри волок-
волокна, помимо миофибрилл, имеются две специализированные мембранные системы —
система поперечных трубочек (Т-система) и саркоплазматический ретикулум (сар-
коплазматическая сеть). Т-трубочками названы своеобразные впячивания поверх-
поверхностной мембраны, которые образуют разветвленную систему поперечных трубо-
трубочек диаметром 0,04 мкм, повторяющихся в соответствии с повторяемостью сарко-
меров. Саркоплазматический ретикулум представляет собой систему сплюснутых
вытянутых соединяющихся друг с другом пузырьков, которая охватывает каждый
саркомер миофибриллы, подобно муфте. Части саркоплазматического ретикулума,
прилегающие к поперечным трубочкам (терминальные цистерны), образуют с окон-
окончаниями поперечных трубочек специализированные контакты — триады.
Управление сократительной активностью мышцы осуществляется с помощью
большого числа мотонейронов, аксоны которых в составе двигательного нерва под-
подходят к мышце. Войдя в мышцу, аксон разветвляется на множество веточек, рас-
расходящихся к разным волокнам. Таким образом, один мотонейрон иннервирует це-
целую группу мышечных волокон (так называемая нейромоторная функциональная
единица), которая работает как единое целое. Мышца состоит из множества функ-
функциональных единиц и способна работать не всей своей массой, а по частям, что
постоянно используется при регулировке силы и скорости сокращения.
Веточка аксона, подойдя к волокну, образует несколько нервных окончаний
(терминалей), которые размещаются на поверхности волокна в специальных вы-
вытянутых углублениях (бороздках) таким образом, что между мембраной терми-
нали аксона и мембраной волокна вдоль всей длины терминали остается зазор в
40-50 нм — синаптическая щель. Терминаль аксона и углубление сарколеммы по-
покрыты шванновской клеткой. Вся эта структура называется концевой двигательной
пластинкой, нервно-мышечным синапсом или нервно-мышечным соединением.
В расслабленной мышце (состояние покоя) мембрана волокна электрически по-
поляризована. В фазном мышечном волокне в состоянии покоя разность потенциалов
между внешней и внутренней сторонами мембраны составляет 70-90 мв (со знаком
минус на внутренней стороне). При этом концентрация ионов Са в саркоплазме
не превышает 10~7 М. Приход нервного импульса вызывает сброс ацетилхолина из
нервного окончания в синаптическую щель, что приводит к изменению проницаемо-
проницаемости мембраны. В фазных волокнах это дает начало волне деполяризации (так назы-
называемый потенциал действия), распространяющейся по сарколемме вдоль мышечного
волокна. В области триад возбуждение передается на мембрану саркоплазматиче-
саркоплазматического ретикулума и вызывает повышение ее проницаемости, что приводит к выходу
из пузырьков ретикулума (главным образом, из терминальных цистерн) содержа-
содержащихся в них ионов кальция. При этом концентрация кальция в цитоплазме мышеч-
мышечной клетки (саркоплазме) возрастает приблизительно до 10~5 М. Вышедший каль-
кальций диффундирует в миофибриллы, где, присоединяясь к регуляторным белкам ак-
томиозиновой системы, «включает» взаимодействие актина и миозина и, тем самым,
процесс сокращения. Наряду с процессом выброса кальция, представляющим собой
228 Глава XXV. Биофизика мышечного сокращения
кратковременное событие, в волокне происходит непрерывный активный обратный
транспорт кальция (так называемая секвестрация), осуществляющаяся преимуще-
преимущественно продольным ретикулумом. Понижение концентрации кальция до величин
ниже порогового значения приводит к расслаблению мышцы и возвращению ее в
состояние покоя.
Нейромоторные функциональные единицы подразделяются на две основные
группы — фазные и тонические нейромоторные единицы. Мышечные волокна фаз-
фазных единиц — так называемые фазные мышечные волокна — имеют одиночную ин-
иннервацию и мембрану, способную к распространению потенциала действия (и волны
сокращения) вдоль волокна. Работа фазных единиц представляет собой чередова-
чередование фаз — волна сокращения быстро сменяется фазой расслабления. К этому типу
относится большинство волокон скелетных (поперечно-полосатых) мышц. В мышеч-
мышечных волокнах тонических нейромоторных единиц — так называемых тонических
мышечных волокнах, мембрана которых неспособна к проведению потенциала, —
по всей длине волокна разбросаны десятки нервно-мышечных окончаний (множе-
(множественная иннервация). Сокращение этих волокон начинается лишь после целого ряда
нервных импульсов, идущих с таким интервалом, чтобы обеспечить суммирование
локального потенциала и достаточное его возрастание. Сокращение такого типа,
медленно развивающееся, слитное, которое мышца способна поддерживать длитель-
длительно, без видимого утомления, носит название тонического сокращения. Нейромотор-
Нейромоторные единицы тонического типа обычно участвуют в поддержании мышечного то-
тонуса. Существуют и нейромоторные единицы переходного типа, мышечные волокна
которых способны в зависимости от частоты приходящих импульсов сокращаться
либо по фазному, либо по тоническому типу.
Основные результаты по механике и энергетике мышечного сокращения полу-
получены на портняжной мышце лягушки и на поясничной мышце кролика, содержащих,
в основном, быстрые фазные волокна.
Механика и энергетика мышечного сокращения. В экспериментах по иссле-
исследованию мышечного сокращения мышца (или мышечное волокно) обычно стиму-
стимулируется не через нерв, а путем подачи прямоугольных импульсов электрического
тока непосредственно на саркоплазматическую мембрану. Характер механического
ответа мышцы на электрическое раздражение зависит как от формы стимулиру-
стимулирующего сигнала, так и от наложенных на мышцу механических ограничений. При
активации мышца развивает силу и укорачивается, либо только развивает силу,
если ее концы фиксированы. В наиболее простом типе механических экспериментов
исследуют изменения развиваемой мышцей силы (натяжения) при фиксированной
длине всей мышцы либо некоторой ее части. Это — так называемое изометрическое
сокращение. Иногда постоянной (стационарной) поддерживают величину внешней
нагрузки на мышцу и наблюдают за изменениями ее длины. Это — изотоническое
сокращение. Очень информативными являются так называемые нестационарные
режимы сокращения, в которых исследуются переходные процессы, возникающие
в мышце в ответ на быстрые контролируемые изменения одного из механических
параметров либо какого-нибудь из внешних условий. Результаты таких исследова-
исследований будут рассмотрены ниже, в § 6 этой главы. Вначале следует остановиться на
экспериментальных данных, полученных для стационарных режимов сокращения
мышцы.
i 2. Основные сведения о свойствах поперечно-полосатых мышц
229
Значительная часть сведений о механических и энергетических свойствах мыш-
мышцы, проявляющихся в стационарных режимах сокращения, получена А. В. Хиллом
при исследовании портняжной мышцы лягушки. Соотношение между основными ме-
механическими параметрами мышечного сокращения — скоростью укорочения и раз-
развиваемой силой — носит название характеристического уравнения Хилла. Согласно
этому уравнению, зависимость между скоростью изотонического сокращения v и
силой Р описывается гиперболой со смещенными осями (рис. XXV.2):
a)v = b(P0-P),
(XXV.2.1)
где Ро — изометрическая сила (Р = Ро при v = 0), а и Ь — эмпирические параметры,
связанные соотношением
h — —
•П)
где г>макс — максимальная скорость укорочения мышцы (у = г>макс при Р = 0). Пара-
Параметр а для портняжной мышцы лягушки равен 0,25 • Ро; для других мышц он может
несколько отличаться.
0,2 -
Рис. XXV.2.
Первое соотношение Хилла —
зависимость между скоростью
изотонического укорочения v
и развиваемой силой Р для
портняжной мышцы лягушки
при 0° С (по J. Squire, 1981)
Сплошная линия — эксперименталь-
экспериментальная зависимость; кружки — расчет
по А. Хаксли A957). Ро — изометри-
изометрическая сила; г>макс — максимальная
скорость укорочения
Так как соотношение (XXV.2.1) между Р и v определяют в условиях, когда
мышца укорачивается и поднимает груз, то развиваемая мышцей сила Р предста-
представляет собой также и величину груза (нагрузки), поднимаемого мышцей. В отсут-
отсутствие нагрузки скорость сокращения максимальна: г>макс — скорость укорочения
ненагруженной мышцы. При увеличении нагрузки скорость укорочения мышцы
уменьшается. Ро — это предельная нагрузка, которую способна поднять мышца.
230 Глава XXV. Биофизика мышечного сокращения
При Р > Pq скорость укорочения становится отрицательной (мышца растягива-
растягивается).
Рассмотрим теперь «энергетику» сокращения мышцы. При сокращении мышца
обычно не только совершает работу, но и выделяет тепло (нагревается). Живая
мышца даже в состоянии покоя постоянно выделяет небольшое количество тепла,
связанное с обменом веществ (теплота покоя). При возбуждении мышцы теплопро-
теплопродукция увеличивается. В ходе изометрического сокращения выделяется так назы-
называемое изометрическое тепло со скоростью примерно 0,0625 • Ро ¦ г>макс = 0,25 • Ь ¦ Ро-
Если активированная мышца укорачивается и совершает работу, тепла выделяет-
выделяется больше, чем при изометрическом сокращении. Этот эффект (эффект Фенна)
противоречит вязкоупругим теориям мышечного сокращения, включая и широко
признанную в 20-е годы полиэлектролитную теорию Хилла и Мейергофа. В таких
теориях обычно предполагается, что вся энергия, используемая мышцей при со-
сокращении, запасается до начала сокращения. В этом случае следовало бы ожидать,
что при увеличении количества энергии, затрачиваемой на работу, будет умень-
уменьшаться ее количество, освобождающееся в виде тепла. Как показал Фенн, этого
не происходит. Чем большую работу совершает мышца, тем большим оказывается
суммарное количество освобожденной энергии (теплота плюс работа). Это озна-
означает, что энергообеспечение мышцы тесно связано с работой ее сократительного
аппарата. Открытие Энгельгардтом и Любимовой АТФазной активности у основ-
основного комплекса мышечных белков — актомиозина — привело к выводу о том, что
для сокращения мышцы используется энергия, освобождающаяся при гидролизе
АТФ актомиозином, причем процесс гидролиза тесно сопряжен с сократительным
процессом.
Подробные исследования теплопродукции мышцы при изотонических укоро-
укорочениях были проведены А. В.Хиллом. Измеряя количество тепла, выделяющееся в
сокращающейся мышце дополнительно к изометрическому теплу — так называемое
избыточное тепло или теплота укорочения AQ, — Хилл вначале установил, что при
сокращениях с постоянной нагрузкой величина AQ зависит только от величины
укорочения А/:
AQ = A ¦ А/,
где А — коэффициент пропорциональности. При этом, соответственно, скорость
dQ dl
теплопродукции —— пропорциональна скорости укорочения v = —:
dt dt
§=A-v.
dt
Если величина нагрузки Р ф 0, и при укорочении мышца совершает работу AW =
= Р • А/, то скорость суммарной избыточной энергопродукции будет равна
dE dQ dW . , D ,. , m
l + A+p (A+p)
Проводя затем укорочения одинаковой величины при различных нагрузках, Хилл
показал, что в таких сокращениях скорость избыточной энергопродукции пропор-
пропорциональна отклонению от максимально развиваемой мышцей силы (Pq ~~ P)- Таким
i 2. Основные сведения о свойствах поперечно-полосатых мышц
231
образом, он получил, что
dE_
dt
= b(P0-P).
(XXV.2.2)
При А = 0,25Ро уравнение (XXV.2.2) точно совпадает с характеристическим урав-
уравнением Хилла (XXV.2.1). Однако более точные эксперименты показали, что коэф-
коэффициент А зависит от нагрузки:
А = 0,16Р0 + 0,18Р.
(XXV.2.3)
Это означает, что соотношение (XXV.2.2) выполняется точно лишь для Р =
= 0,5Р0. При Р > 0,5Р0 ^р « 1,072 • Ъ ¦ (Ро - Р); при малых нагрузках (Р -* 0)
(Хь
dE
зависимость —— от (Pq ~~ Р) становится нелинейной (рис. XXV.3).
(Хь
dE/
1,0 -
0,8 -
0,6
0,4 ¦
0,2 ¦
0
0,2 0,4 0,6
0,8 1,0
Р/Ро
Рис. XXV.3.
Второе соотношение Хилла — зависимость скорости
dE
энергопродукции — в ходе изотонического сокра-
сокращения от нагрузки Р для портняжной мышцы ля-
лягушки при 0° С.
Зависимость построена без учета изометрического тепла, ко-
которое производится в изометрически сокращающейся мышце
со скоростью
— =О,25-6-Ро,
(it ИЗОМ
Ь — параметр уравнения Хилла (XXV.2.1); Ро—изометриче-
Ро—изометрическая сила. Пунктиром показана прямая у = 1,072 • Ь ¦ (Ро — Р)
По количеству выделяемого мышцей тепла можно оценить эффективность
преобразования энергии при сокращении. При изотоническом режиме сокра-
сокращения коэффициент полезного действия мышцы, определяемый как отноше-
работа
ние , мало изменяется в широком диапазоне нагрузок, и при
работа+теплота
Р = @,2 Ч- 0,8)Ро составляет около 40%. Эффективность работы самого сократи-
сократительного аппарата значительно выше: если оценивать полную энергопродукцию
при учете только теплоты укорочения, то КПД, например, портняжной мышцы
лягушки может достигать величины 70% и более.
Как отмечалось выше, основным источником энергии для мышечного сокра-
сокращения является энергия гидролиза АТФ. В изометрическом режиме сокращения
скорость гидролиза невелика. При укорочении мышцы скорость гидролиза повы-
повышается в соответствии с ростом производимой работы. Установлено, однако, что
освобождаемой при гидролизе энергии достаточно для обеспечения только совер-
совершаемой работы, но не полной энергопродукции мышцы. Источники энергии для
теплоты укорочения до сих пор остаются неясными.
232
Глава XXV. Биофизика мышечного сокращения
Установленные А. В. Хиллом соотношения (XXV.2.1), (XXV.2.2), (XXV.2.3)
являются важным критерием для проверки справедливости любой теории мы-
мышечного сокращения. Ниже в § 5, будут рассмотрены две теории мышечного
сокращения, позволяющие получить соотношения Хилла теоретически.
§ 3. Структура сократительного аппарата
Прежде чем перейти к рассмотрению современных представлений о механизме со-
сокращения мышцы, следует остановиться на структурной организации ее основных
сократительных элементов — миофибрилл и саркомеров.
Миофибриллы скелетных мышц (см. рис. XXV.1, рис. XXV.4) представляют
собой нитевидные образования диаметром 1-2 мкм, располагающиеся параллельно
I—полоса
z
А—полоса
Н-зона
I—полоса
Z
a ,
• • •
б • в г
Рис. XXV.4.
Схема расположения толстых и тонких нитей в саркомере поперечно-полосатой
мышцы (по J. Squire, 1981).
Показан только небольшой фрагмент миофибриллы, включающий часть одного из саркомеров.
Вверху (а) саркомер показан в продольном сечении, внизу — поперечные срезы через различные
участки саркомера: вблизи Z-мембраны {б), в области перекрытия толстых и тонких нитей (в),
в Н-зоне (г). А — тонкая (актиновая) нить; М — толстая (миозиновая) нить. Z-мембрана на этом
рисунке изображена условной прямой линией. На толстых нитях поперечной штриховкой выделена
область, содержащая миозиновые выступы (мостики).
друг другу и идущие от одного конца мышечного волокна до другого. Каждая мио-
фибрилла разделена узкими поперечными пластинками — Z-мембранами на множе-
множество коротких повторяющихся единиц — саркомеров, длиной обычно 2-3 мкм. Под
световым микроскопом они имеют вид повторяющихся темных и светлых полос,
границы которых в соседних миофибриллах обычно совпадают, что и придает всей
мышце характерную поперечную исчерченность. Темные полосы, находящиеся в
§ 3. Структура сократительного аппарата 233
середине саркомера, принято называть анизотропными полосами (А-полосами или
А-дисками). Светлые полосы, не проявляющие анизотропных свойств, называют
изотропными полосами (I-полосами или I-дисками). В середине А-полосы имеется
светлый участок — Н-полоса.
Структура саркомера образована двумя типами нитей, которые упакованы в
гексагональные решетки, взаимно проникающие друг в друга. Более толстые ни-
нити, диаметром около 15 нм и длиной ~ 1,5 мкм, состоят, в основном, из миозина.
Молекула миозина (рис. XXV. 5) с молекулярной массой ~ 500fcDa состоит из двух
тяжелых и четырех легких цепей с молекулярными массами ~ 200kDa и ~ 20kDa,
соответственно. Тяжелые цепи асимметричны. Их тонкие a-спиральные стержни,
скручиваясь вместе в coiled-coil структуру, образуют вытянутый изогнутый стер-
1
\
100 нм
Рис. XXV.5.
Схематическое изображение молекулы миозина (по Rayment I., Holden H. 1994).
1 — легкий меромиозин; 2 — субфрагмент 2; 3 — глобулярный участок тяжелой цепи (субфраг-
(субфрагмент 1); 4—существенная легкая цепь; 5 — регуляторная легкая цепь.
жень диаметром ~ 2 нм и длиной ~ 150 нм. На одном из концов молекулы тяжелые
цепи расходятся, образуя две массивные грушевидные глобулярные головки (суб-
(субфрагменты 1) размерами ~ 19 х 4 нм, соединенные с coiled-coil стержнем и друг с
другом шарнирным соединением. Вблизи шарнирного соединения на субфрагмен-
субфрагментах 1 попарно располагаются так называемые существенная и регуляторная легкие
цепи. Второй шарнирный участок, расположенный на расстоянии примерно 50 нм от
места присоединения головок, разделяет миозиновыи стержень на две функциональ-
функционально различные части: легкий меромиозин, длиной около 100 нм, и субфрагмент 2, ко-
который вместе с глобулярными головками входит в состав так называемого тяжелого
меромиозина. В толстых нитях стержни легкого меромиозина плотно упакованы,
образуя стволы нитей, тогда как субфрагменты 2 и глобулярные головки распола-
располагаются на их поверхности и участвуют во взаимодействии с актиновыми нитями.
Структура толстой нити биполярна: молекулы миозина в каждой половине толстой
234
Глава XXV. Биофизика мышечного сокращения
нити уложены головками в сторону Z-мембран, так что в средней части нити обра-
образуется небольшая «голая зона», целиком состоящая из антипараллельно уложенных
стержней легкого меромиозина и не содержащая мостиков (см. рис. XXV.4). В по-
покоящейся мышце субфрагменты 2 прижаты к стволу толстой нити таким образом,
что глобулярные головки миозина, расположенные на поверхности толстой нити,
42,9 нм
?
ссэ (
0D
Ф
14,3 нм
do
Рис. XXV.6.
Трехтяжевая модель толстой
Сквайра (по J. Offer, 1974).
нити — модель
Модель построена в предположении, что субфрагменты 2
миозина прижаты к стволу нити; миозиновые головки
условно изображены в виде цилиндрических выступов. По-
Показан фрагмент одного из боковых участков нити, содер-
содержащий головки. Центральная часть нити, не содержащая
головок («голая зона»), в рисунок не включена. Пункти-
Пунктиром показан один из трех тяжей спирали, образованной
миозиновыми головками.
Рис. XXV.7.
Схема строения тонкой ни-
нити (по S.Ebashi, 1975).
1 — глобула актина;
2 — комплекс тропонинов;
3 — тропомиозиновый тяж
образуют своеобразную трехтяжевую спираль (модель Сквайра) с субъединичным
и осевым шагом спирали 14,3 нм и 42,9 нм, соответственно (рис. XXV.6). При акти-
активации мышцы субфрагменты 2 могут отходить от ствола толстой нити, обеспечивая
головкам, каждая из которых содержит актин-связывающий и АТФазный центры,
возможность приближаться к актиновым нитям и взаимодействовать с ними.
Более тонкие нити (рис. XXV.7), диаметром 8-10 нм и длиной около 1 мкм,
состоят из актина и Са -чувствительных регуляторных белков — тропомиозина
§ 3. Структура сократительного аппарата 235
и тропонинов. Полярные глобулы актина размером ~ 4 нмх5, 5 нм агрегируют
полярно, образуя двухтяжевую спираль актиновой нити с периодом повторения
~ 36 нм. Тропомиозин располагается в канавках актиновой спирали в виде двух
тяжей, каждый из которых образован агрегацией полярных молекул тропомиозина
по типу «голова к хвосту». На тяжах тропомиозина с регулярными интервалами
36-38 нм располагаются комплексы тропонина. Так формируется полярная струк-
структура актиновой нити, в которой каждая молекула тропомиозина взаимодействует
с 7 мономерами актина и одним тропониновым комплексом. Полярность структу-
структуры тонкой нити выявляется при ее декорации тяжелым меромиозином или миози-
миозином: присоединение этих молекул к глобулам актина в нитях создает своеобразную
структуру вдвинутых друг в друга «наконечников стрел», направленных в одну
сторону. Тонкие нити, отходящие от Z-мембран на противоположных концах сарко-
мера, имеют разную полярность: при их декорации тяжелым меромиозином острия
образующихся при декорации «наконечников стрел» направлены с обеих сторон к
центру саркомера, т. е. навстречу друг другу.
В А-полосе расположены, в основном, миозин-содержащие толстые нити. Тон-
Тонкие, актин-содержащие нити, начинаясь от Z-мембран по обеим сторонам сарко-
саркомера, тянутся через I-диски, входят в А-диск, располагаясь в промежутках между
толстыми нитями, и заканчиваются на границах Н-зоны. При сокращении мышцы
длина А-диска остается неизменной. Укорочение происходит лишь за счет одновре-
одновременного уменьшения ширины I-дисков и Н-зоны. Эти данные легли в основу модели
«скользящих нитей», согласно которой сокращение мышцы происходит в результате
относительного перемещения (скольжения) толстых и тонких нитей в саркомере
навстречу друг другу без изменения их длины.
Строгая упорядоченность расположения белков в структуре саркомера позво-
позволила исследовать динамику молекулярной структуры мышцы с помощью метода
малоугловой (ограниченной углами рассеяния порядка 2°) дифракции рентгенов-
рентгеновских лучей. Пионерская роль в развитии этого направления исследований принад-
принадлежит Хью Хаксли. На рис. XXV.8 представлена схема установки для регистрации
малоугловой дифракции. На рис. XXV.9 (см. также рис. XXV.4, в) приведена схема
гексагональной упаковки толстых и тонких нитей в саркомере, в результате ко-
которой возникают две системы отражающих рентгеновские лучи плоскостей: A,0)
и A,1). Дифракционная картина мышцы состоит из дифракционных максимумов
(рефлексов), возникающих в результате дифракции как на этих системах плоско-
плоскостей (экваториальные рефлексы 1,0 и 1,1), так и на повторяющихся структурах ак-
тиновых и миозиновых нитей (меридиональные рефлексы и так называемые слоевые
линии рефлексов). При изменении функционального состояния мышцы местополо-
местоположение рефлексов значительно не изменяется, происходит лишь перераспределение
их интенсивностей.
Активация мышцы сопровождается значительными изменениями интенсивно-
интенсивности экваториальных рефлексов: интенсивность рефлекса A,0), возникающего в ре-
результате дифракции на решетке миозиновых нитей, заметно падает параллельно
с усилением рефлекса A,1), что свидетельствует о значительном переносе элек-
электронной плотной массы из областей вблизи миозиновых нитей к актиновым нитям.
Этот эффект принято интерпретировать как перемещение глобулярных головок
миозина к актиновым нитям с образованием поперечных мостиков между толстыми
236
Глава XXV. Биофизика мышечного сокращения
и тонкими нитями — так называемое замыкание мостиков. «Миозиновые» рефлек-
рефлексы, возникающие в результате дифракции на спиралях, образованных массивными
миозиновыми головками, наиболее сильны в покоящейся мышце. В активированной
мышце интенсивность меридионального рефлекса, соответствующего расстоянию
Рис. XXV.8.
Малоугловая дифракция рент-
рентгеновских лучей мышцей (по
К.Бэгшоу, 1985).
1 — источник рентгеновского излу-
излучения; 2 — мышца; 3, 4 — экватор
и меридиан дифракционной карти-
картины, соответственно. Положение ди-
дифракционных пятен на дифракци-
дифракционной картине очень условно; ме-
меридиональные и экваториальные ре-
рефлексы, а также слоевые линии, со-
состоящие из рефлексов, расположен-
расположенных параллельно линии экватора на
верхней и нижней половинах ди-
дифракционной картины, выполнены
без соблюдения масштаба и интен-
сивностей дифракционных пятен.
LO-^^-ж-н
<f a m m
mr w * •
Рис. XXV.9.
Схема упаковки нитей в саркомере поперечно-
поперечнополосатой мышцы (поперечное сечение).
Штриховые прямые показывают отражающие плоско-
плоскости A,0), проходящие через длинные оси миозиновых
нитей и A,1), проходящие через длинные оси актиновых
и миозиновых нитей.
14,3 нм между соседними ярусами миозиновых головок на толстой нити, почти не
отличается от его интенсивности в покоящейся мышце, однако, рефлексы слоевой
линии, соответствующие периоду повторения миозиновои спирали 42,9 нм, заметно
ослабевают. В состоянии ригора, когда в мышце исчерпан АТФ и она становится
нерастяжимой, что принято считать результатом замыкания максимального числа
мостиков, происходит дальнейшее усиление экваториального рефлекса A,1), осла-
ослабление «миозиновых» рефлексов, и появляются очень сильные «актиновые» рефлек-
рефлексы. Все эти изменения хорошо согласуются с мостиковои гипотезой генерации силы.
§ 4. Мостиковая гипотеза генерации силы
При формулировке модели скольжения предполагалось, что скольжение нитей в со-
сокращающейся мышце происходит в результате действия независимых генераторов
силы, равномерно распределенных в саркомере между актиновыми и миозиновыми
нитями и действующими циклически. В мостиковои модели такими генераторами
i 4. Мостиковая гипотеза генерации силы
237
силы принято считать выступающие из ствола толстой нити мостики тяжелого
меромиозина (миозиновые головки и субфрагмент 2). В покоящейся мышце мости-
мостики не взаимодействуют с актином, поэтому такая мышца легко растяжима. При
активации ионы кальция связываются с регуляторным комплексом тонких нитей,
в котором происходят структурные изменения, интерпретируемые как смещение
тропомиозиновых тяжей относительно актиновои нити. В результате этого центры
взаимодействия на глобулах актина становятся доступными для замыкания мио-
зиновых мостиков. Структура толстых нитей при активации также изменяется;
происходит разупорядочивание мостиков и их отход от ствола толстой нити по
направлению к тонким нитям.
I
М С
II
АТФ
м с
III
М[
\
IV
м с
М[
Рис. XXV. 10.
Схема рабочего цикла мостика (по R. R. Schroeder et al., 1992).
А — актиновая нить (глобулы актина не показаны); М — миозиновая нить; I-VI — последователь-
последовательные стадии рабочего цикла. Состояние I соответствует ригорному состоянию мостика; переход
V -> VI сопровождается генерацией силы («рабочий ход» мостика); двойными стрелками показано
направление сил, действующих на толстую и тонкую нити. Конформационные изменения миози-
новой головки условно показаны как изменения ее геометрической формы.
Рабочий цикл мостика сопряжен с гидролизом АТФ. Основные сведения о
гидролитическом цикле мостика получены из исследований, проведенных на рас-
растворах мышечных белков. При условиях, близких к физиологическим, скорость
гидролиза АТФ на чистом миозине очень мала и составляет 0,05-0,1 с. Актин
может ускорять этот процесс в сотни раз. Согласно современным представлени-
представлениям, цикл гидролиза АТФ актомиозином в мышце (рабочий цикл мостика) можно
условно разделить на 6 стадий (рис. XXV. 10), отличающихся по структуре мостика
и по характеру связанного нуклеотида. Расщепление АТФ на АДФ и неоргани-
238 Глава XXV. Биофизика мышечного сокращения
ческий фосфат (стадии III—IV цикла) происходит на свободном (не связанном с
актином) миозине (схема Лимна—Тейлора). Образовавшийся при этом долгожи-
вущий миозин-продуктный комплекс может соединяться с актином: содержащая
продукты реакции миозиновая головка подходит к актиновой нити и замыкается
на одной из глобул в положении, перпендикулярном оси нити (стадии IV-V). Затем
она поворачивается, наклоняясь на угод примерно 45° (модель поворачивающегося
мостика) и проталкивает актиновую нить в направлении от Z-мембраны (рабочий
ход мостика, стадии V-VI). Для совершения рабочего хода используется свободная
энергия, освобождающаяся при диссоциации продуктов реакции гидролиза АТФ,
которая составляет более 50% от всей свободной энергии реакции. Согласно совре-
современным данным, основная доля свободной энергии освобождается при десорбции
фосфата. После сбрасывания АДФ (стадии VI-I) происходит связывание новой мо-
молекулы АТФ (стадии I—II), вызывающее новую диссоциацию мостика (стадии II—III)
и начало нового рабочего цикла.
Таким образом, разомкнутый мостик представляет собой смесь различных ми-
миозин-субстратных и миозин-продуктных, а замкнутый — различных миозин-про-
дуктных комплексов, причем генерация силы сопряжена со сбрасыванием продук-
продуктов гидролиза АТФ, в основном, фосфата.
Силы, развиваемые отдельными мостиками, суммируются. При сокращении
мышцы с закрепленными концами (изометрическом сокращении) величина гене-
генерируемой мышцей силы Ро зависит от длины саркомера. Как видно из рис. XXV.11,
при изменении длины саркомера Ро изменяется в соответствии с изменением степе-
степени перекрытия актиновых и миозиновых нитей, т. е. оно пропорционально числу ра-
работающих мостиков. Известно также, что при сокращении ненагруженной мышцы
скорость сокращения — максимальная скорость изотонического укорочения г>макс —
в значительном диапазоне длин саркомеров остается постоянной. Это означает, что
мостики работают независимо друг от друга, т. е. и сила, развиваемая отдельным
мостиком, и кинетические параметры цикла мостика не зависят от числа работа-
работающих мостиков и полностью определяются свойствами самого мостика. Как будет
показано в следующем параграфе, это свойство мышцы оказывается очень суще-
существенным при теоретическом моделировании стационарных режимов мышечного
сокращения.
§ 5. Математическое моделирование мышечного сокращения
Для понимания молекулярных механизмов мышечного сокращения математическое
моделирование составляет существенную часть исследований. Современный уро-
уровень техники не позволяет проследить за динамикой молекулярного мотора не-
непосредственно в мышце, однако, его работу можно смоделировать на основании
знаний о молекулярной конструкции саркомера и его физико-химических свойств.
Критерием адекватности модели служит степень совпадения описания макроско-
макроскопических свойств мышцы (например, механики и энергетики) в модели с экспери-
экспериментальными результатами. Основной прогресс в этой области связан с именами
Э. Хаксли, В. И. Дещеревского, Т. Хилла.
Основы математического моделирования мышечного сокращения. Математи-
Математическое моделирование мышечного сокращения основывается на ряде постулатов.
5. Математическое моделирование мышечного сокращения
239
300
200
100
0 '—'
V
'макс.
10сек-1
3,0
2,0
1,0
1,40 1,60 1,80 2,00 2,20 2,40 2,60 2,80 3,00 3,20
S, мкм
3,65 мкм
Рис. XXV. 11.
Зависимость механических свойств мышцы от степени перекрытия нитей.
а. Зависимость изометрической силы Ро (кривая 1) и максимальной скорости изо-
изотонического укорочения г>макс (кривая 2) от длины саркомера s при стационарных
режимах сокращения (по Edman К., 1979); /о — длина покоя мышцы.
б. Степень перекрытия нитей при разных длинах саркомера (по А. М. Gordon,
A.F.Huxley, F.J.Julian, 1966). 1-6 — различные стадии укорочения мышцы.
240
Глава XXV. Биофизика мышечного сокращения
A) Силы, развиваемые каждым саркомером, равны, так как эти элементы со-
соединены последовательно, а распределенной массой волокна в большинстве режимов
сокращения можно пренебречь. B) Развиваемая волокном сила равна сумме сил
мостиков в слое толщиной 0,5 саркомера, поскольку в этом слое мостики соединены
последовательно, а правая и левая части саркомера зеркально симметричны. C) Ско-
Скорость изменения длины волокна составляет V = 2Nv, где N — число саркомеров в
волокне, a v — относительная скорость скольжения нитей. D) Эквивалентно ори-
ориентированные мостики находятся на расстоянии 42,9 нм, а диапазон перемещения
замкнутого мостика не превышает 10-20 нм, так что возле свободного мостика
может находиться только свободный актиновый центр. Следовательно, процессы
образования и диссоциации мостиков можно описывать уравнениями мономолеку-
мономолекулярной кинетики. E) Сила, приходящаяся на один мостик в зоне перекрытия нитей,
не зависит от степени перекрытия нитей, несмотря на изменение расстояния между
нитями (см. рис. XXV.9). Из этого следует, что мостики функционируют незави-
независимо, а мышца может рассматриваться как одномерная система, т. е. свойства мо-
мостика могут описываться только одной механической координатой. Механическая
координата мостика может изменяться только при скольжении нитей.
к Z-мембране
Рис. XXV. 12.
Модель миозинового мостика (по A. F. Huxley, 1957)
МН — миозиновая нить; АН — актиновая нить; М — актин-связываюший сегмент миозинового мо-
мостика; А — актиновый центр; х — координата мостика; 5 — координата актинового центра; 0 —
равновесное положение миозинового мостика. Стрелками показаны направления относительного
скольжения нитей при сокращении мышцы
Теории Э. Хаксли и В. И. Дещеревского. Основные подходы к теоретическо-
теоретическому моделированию процесса мышечного сокращения в рамках модели скольже-
скольжения и мостиковои гипотезы независимых генераторов силы были сформулированы
Э.Хаксли A957). На рис. XXV.12 показана схема мостика, предложенная Хаксли.
Хотя она является очень упрощенной и не соответствует современным данным о
молекулярной структуре мостика, на ее примере удобно ввести основные понятия,
используемые при математическом моделировании мышечного сокращения.
Буквой М на рисунке обозначен миозиновый мостик, способный осциллиро-
осциллировать возле равновесного положения 0 под действием тепловых флуктуации. А —
актиновый центр, вошедший в зону замыкания мостика М. Обозначим расстояние
§ 5. Математическое моделирование мышечного сокращения 241
ОА буквой 8. Введем координату мостика х, равную величине его отклонения от
равновесного положения 0. При достаточной величине тепловой флуктуации мо-
мостик достигнет координаты 8 и замкнется на актиновой нити. Развиваемая при
этом сила, обусловленная упругой деформацией пружин, будет стремиться вызвать
относительное движение нитей в направлениях, указанных стрелками. Такое дви-
движение нитей соответствует уменьшению координаты мостика (движению мостика
влево вдоль оси координат х). При этом развиваемая мостиком сила, в соответ-
соответствии с законом Гука, линейно уменьшается, становясь отрицательной при х < 0
(см. рис. XXV. 14, а). Цикл мостика в такой схеме включает только два состояния —
свободное а и замкнутое п:
а ===* п, (XXV.5.1)
где константы скоростей замыкания к\ и размыкания к? являются функциями коор-
координаты мостика. Хаксли постулировал, что константа скорости замыкания к\ > 0
лишь в некотором диапазоне координат [0,8] («зона замыкания») справа от поло-
положения х = 0, т. е. в области положительных сил. Константа скорости размыкания
мостика &2 в этом же диапазоне координат невелика, но значительно возраста-
возрастает при х < 0, т. е. в области отрицательных сил. В каждом цикле «замыкание—
размыкание»гидролизуется одна молекула АТФ.
Вследствие несоизмеримости периода повторения мостиков на миозиновой ни-
нити D2,9 нм) и осевого периода актиновой спирали C6 нм), разные мостики в мыш-
мышце будут находиться на разных расстояниях до ближайшего актинового центра
(т.е. иметь разные координаты х). В результате этого при активации в мыш-
мышце образуется почти непрерывный набор замкнутых мостиков, различающихся по
координате х. Это дает возможность ввести функцию плотности распределения
числа замкнутых мостиков по координате мостика х — pn(x,i)—таким образом,
что рп (х, i) ¦ Ах соответствует числу мостиков в момент времени t с координатами
в диапазоне [х, х + Ах], а полное число замкнутых мостиков определяется как
+ ОО
П =
= / pn(x)dx.
На основании цикла (XXV.5.1) для рп(х) можно записать кинетическое дифферен-
дифференциальное уравнение в частных производных:
^^ = (ро - Рп) • h - рпк2, (XXV.5.2)
где ро (х) = const — плотность распределения полного числа мостиков по коорди-
координате х. Учет движения мостиков вдоль оси х при скольжении нитей дает второе
дифференциальное уравнение в частных производных:
^'^t'^ =fci-Po~(fci+fc2)-Pn, (XXV.5.3)
где v — скорость относительного скольжения нитей. Суммарная сила, развиваемая
242
Глава XXV. Биофизика мышечного сокращения
мышцей, рассчитывается как
+ ОО
Р= Г рп(х) • f(x)dx,
(XXV.5.4)
где f(x) —элементарная сила, развиваемая мостиком с координатой х.
Рп/РО 1,0 -¦
0,8
0,6 -¦
и = 0 0,4 - ¦
0,2 -¦
|_
-1,5
-1,0
-0,5
0
0,5
, L
1,0
х/8
Рис. XXV. 13.
Плотность распределения числа замкнутых мостиков рп по координате мостика х
при трех разных скоростях скольжения нитей (по A.F.Huxley, 1957).
ро—функция плотности распределения полного числа мостиков по координате х; 5 — ширина
рабочей зоны мостика; г>Макс — максимальная скорость скольжения нитей.
Численное интегрирование системы уравнений (XXV.5.2), (XXV.5.3) позволя-
позволяет определить плотность распределения числа замкнутых мостиков по координа-
координате ж — рп (х) — для разных скоростей движения нитей. Затем с помощью уравнения
(XXV.5.4) можно рассчитать величину развиваемой силы. Подобрав простые ку-
кусочно-линейные функции для зависимостей к\, к? и / от х, Хаксли провел расчеты
рга(ж), Р и —. На рис. XXV.13 приведены зависимости рп(х), полученные им для
§ 5. Математическое моделирование мышечного сокращения 243
трех разных скоростей скольжения нитей. При изометрическом сокращении, когда
v = О, функция рп{х) не равна нулю лишь для х > О, где ее величина не зависит от х
и определяется соотношением констант скоростей замыкания и размыкания мости-
мостиков. Если v > О, число замкнутых мостиков становится зависимым от координаты
мостика. При скольжении нитей часть замкнутых мостиков переходит в область
х < О, где, прежде чем разомкнуться, они развивают отрицательную силу.
Как видно из рис. XXV.2, Хаксли смог получить соотношение между нагрузкой
Р и скоростью скольжения нитей v, совпадающее с соотношением Хилла (XXV.2.1).
Кроме того, при расчете скорости энергопродукции мышцы он получил линейную
зависимость — от (Ро — Р), соответствующую уравнению (XXV.2.2), которое счи-
считалось верным по представлениям тех лет.
Теория Хаксли была упрощена и усовершенствована В. И. Дещеревским. В его
кинетической теории рассмотрена модель работы мостика с трехстадииным кине-
кинетическим циклом:
fci
а э- п
\ / (XXV.5.5)
к2 \ / v/b
т
включающим одно свободное состояние а мостика и два замкнутых — тянущее п
при х > 0 («тянущая» зона) и тормозящее т при х < 0 («тормозящая» зона). Та-
Таким образом, одно замкнутое состояние, постулированное Хаксли, разбивается на
два состояния в зависимости от знака развиваемой силы. Кроме того, вводится
ряд упрощений. Рассмотрен только предельный случай, когда константы скоро-
скоростей обратных переходов в цикле мостика пренебрежимо малы, и их можно не
учитывать. Постулируется, что и развиваемая сила (рис. XXV. 14, б), и константы
скоростей переходов между стадиями цикла (fei, к%, v/b) не зависят от координаты
мостика. Рабочий цикл мостика в такой схеме можно описать следующим образом.
Мостик замыкается в начале тянущей зоны при координате мостика х = 8 и
начинает развивать тянущую силу F = +/. Рабочий ход мостика жестко связан
со скольжением нитей. На рис. XXV. 14 ему соответствует уменьшение координаты
мостика (движение влево по оси х). По достижении координаты х = 0 мостик закан-
заканчивает рабочий ход и переходит в тормозящее состояние, в котором он развивает
тормозящую силу F = —/, и получает возможность разомкнуться. После размыка-
размыкания мостик снова возвращается в исходное состояние. В тянущей зоне размыкание
мостика запрещено.
В соответствии с циклом (XXV.5.5) для числа тянущих (п) и тормозящих (т)
мостиков можно написать систему обыкновенных дифференциальных уравнений:
% = k1(a0-n-m)-v%, (XXV.5.6)
at о
^ = v J - к2т, (XXV.5.7)
где ссо — полное число доступных для замыкания мостиков.
При стационарном режиме сокращения, когда v = const, производные по вре-
dn dm „
мени от числа тянущих и тормозящих мостиков — = —т— = (J, а сумма сил, раз-
развиваемых тянущими и тормозящими мостиками, равна нагрузке, приложенной к
244
Глава XXV. Биофизика мышечного сокращения
мышце:
= f-(n-m).
(XXV.5i
В этом случае решение системы (XXV.5.6)-(XXV.5.7) может быть получено анали-
аналитически, т. е. в виде формулы:
v = k2b-^-(f-a0-P). (XXV.5.9)
Ах), пН
6-1
4-
2-
10 х, нм
Ах), пН
6-1
4-
2-
-2-
-4-
10 х, нм
Рис. XXV.14.
Сила /, развиваемая замкну-
замкнутым мостиком, в зависимо-
зависимости от координаты мости-
мостика х.
а. Зависимость, постулируемая в
теории Хаксли 1957 г. (по White,
Thorson, 1973);
б. Зависимость, постулируемая в
кинетической теории мышечного
сокращения В. И. Дещеревского
(по В. И. Дещеревский, 1977).
х = 5 — начало «тянущей» зоны
Полученное соотношение между скоростью укорочения мышцы и развиваемой си-
силой полностью совпадает с характеристическим уравнением Хилла (XXV.2.1). Ко-
Коэффициенту а уравнения Хилла соответствует выражение а = — / • ао, тогда
как коэффициент Ь = к2 ¦ Ь-
-, так что при / • ссо и к2 ¦ 8 = г>макс соотношение
также выполняется.
П)
§ 5. Математическое моделирование мышечного сокращения 245
Сопоставление соотношений (XXV.2.1) и (XXV.5.9) позволило провести оценку
параметров цикла мостика /, 8, к\, к?. Для портняжной мышцы лягушки Pq =
= 3 • 106 дин/см2, а/Р0 = 0,25; vM3bKC = 1,5 • 10~4 см/сек при 0°С. Считая, что в
мышечном слое толщиной в половину саркомера с поперечным сечением 1 см2 число
мостиков ссо = 1013, энергия гидролиза одной молекулы АТФ при физиологической
ионной силе s = 3-10~13 эрг и полагая, что значение положительной работы в цикле
/•8 = s, получим / = 3 • 10~7 дин, 8 = 10~6 см, к\ = 50 сек, k<i = 150 сек.
Стационарные количества тянущих п и тормозящих т мостиков, соответствен-
соответственно, в кинетической теории равны:
= i(/0 + )+2 = fci(/«o-P)
/B*i+*2) ' /B*i+*2)'
так что полное число замкнутых мостиков
+k2
(XXV.5.10)
При подстановке в это уравнение полученных выше значений параметров цикла
мостика получаем (п + т)/а.о = 0,4 • A + 1,5Р/Ро), что хорошо согласуется с экс-
экспериментальными данными: при увеличении нагрузки относительная жесткость
мышцы, которую принято связывать с числом замкнутых мостиков, линейно растет
от 0,3-0,4 при Р = 0 до 1 при Р = Ро.
Стационарная скорость энергопродукции в кинетической теории пропорцио-
пропорциональна скорости размыкания тормозящих мостиков:
где s — энергия, освобождающаяся при гидролизе одной молекулы АТФ.
Итак, в кинетической теории, благодаря введенным упрощениям, система диф-
дифференциальных уравнений в частных производных (XXV.5.2), (XXV.5.3), предло-
предложенная Э. Хаксли, заменяется системой обыкновенных дифференциальных уравне-
уравнений (XXV.5.6), (XXV.5.7). Это позволило, в отличие от теории Хаксли, получить оба
уравнения Хилла (XXV.2.1) и (XXV.2.2), а также зависимость жесткости мышцы
от нагрузки аналитически, т. е. в виде формул. Это означает, что совпадение тео-
теоретических кривых с экспериментальными зависимостями в кинетической теории
не связано с подгонкой произвольно постулируемых параметров цикла мостика от
его координаты, как в теории Хаксли, а полностью обеспечивается особенностями
кинетического цикла мостика. Однако кинетическая теория, как и теория Хаксли,
позволяет получить только линейное соотношение между скоростью энергопродук-
энергопродукции и нагрузкой, что, согласно современным данным, справедливо лишь для Р > Ро-
По-видимому, это связано с тем, что при высоких скоростях скольжения нитей
какие-то из упрощений кинетической теории перестают выполняться.
Несмотря на простоту математического аппарата кинетической теории, Де-
щеревский, используя один и тот же набор параметров цикла мостика, провел
успешные расчеты основных закономерностей не только стационарных режимов со-
сокращения скелетных мышц, но и колебательных режимов сокращения летательных
мышц насекомых, а также кинетики гидролиза АТФ в растворах мышечных белков
246 Глава XXV. Биофизика мышечного сокращения
как при наличии, так и в отсутствие тропонин-тропомиозинового регуляторного
комплекса.
Таким образом, и теория Хаксли, и теория Дещеревского удовлетворительно
описывали основные экспериментальные данные по механике и энергетике стаци-
стационарных и медленных (с временным разрешением > 5 мсек) нестационарных ре-
режимов сокращения. Позже, при исследовании быстрых нестационарных режимов с
временным разрешением и 1 мсек было обнаружено, что для объяснения поведения
мышцы в этих режимах необходимо рассматривать цикл мостика, включающий не-
несколько последовательных состояний с / > 0. Наличие нескольких промежуточных
состояний в рабочем цикле мостика следует и из биохимических данных (см. § 4). Не-
Необходимо отметить, что в обеих рассмотренных выше теориях имелась принципи-
принципиальная возможность введения нескольких дополнительных промежуточных состоя-
состояний замкнутого мостика в зависимости от его координаты. Однако распределение
мостиков между этими состояниями считалось равновесным. Это предположение
было оправданным и позволяло получать правильное описание поведения мышцы в
стационарных и медленных нестационарных режимах с помощью одного усреднен-
усредненного состояния мостика. В быстрых нестационарных режимах, когда распределение
мостиков между состояниями становится неравновесным, процесс перераспределе-
перераспределения мостиков между состояниями начинает играть решающую роль, что требует
правильного моделирования свойств замкнутого мостика. В следующем параграфе
нестационарные режимы сокращения будут рассмотрены более подробно.
§ 6. Моделирование нестационарных режимов сокращения
Экспериментальные результаты. Исследования нестационарных режимов сокраще-
сокращения мышцы с высоким временным разрешением ведутся, начиная с 60-70-х годов
и связаны с именами Подольского, Э.Хаксли, Симмонса, Ломбарди. Наиболее ин-
информативными являются экспериментальные исследования, связанные с быстрым
ступенчатым изменением длины мышцы. В таких режимах мышцу стимулируют,
давая возможность развить максимальное изометрическое натяжение Ро, а затем
на некоторый промежуток времени At освобождают один из ее концов, позволяя
укоротиться на величину А/ (рис. XXV.15). Развиваемая сила вначале падает почти
пропорционально укорочению (фаза 1), а затем восстанавливается до исходного
уровня. При очень быстрых укорочениях (At < 1 мсек) процесс восстановления
силы становится нелинейным и включает несколько стадий (фаз), сильно различа-
различающихся по временным параметрам. Сразу по окончании укорочения сила быстро,
за 1-2 мсек, восстанавливается до некоторого промежуточного уровня (фаза 2).
Скорости восстановления силы в этой фазе может быть различной и увеличива-
увеличивается с ростом величины укорочения. Затем некоторое время — 5 Ч- 20 мсек — сила
держится почти на постоянном уровне (фаза 3, так называемое «плато» натяже-
натяжения), после чего медленно восстанавливается до исходной изометрической силы.
Величины сил в конце фазы 1 — (Ti) и в конце фазы 2— (Гг) зависят от величины
укорочения (рис. XXV. 16), достигая нулевого значения при А/ = 4-5 нм для Т\ и
при А/ = 10-12 нм для Гг.
В фазе «плато» (см. рис. XXV. 15) натяжение почти не изменяется, но в мыш-
мышце происходят активные восстановительные процессы, которые можно выявить,
i 6. Моделирование нестационарных режимов сокращения
247
проводя повторные укорочения (рис. XXV.17). Вначале, при первых укорочениях
величина натяжения, восстановленного в фазе 2, для каждого последовательного
укорочения становится все меньше. Однако, как только величина суммарного уко-
укорочения достигнет величины 10-15 нм на половину саркомера, ответная реакция
1-
3,
^2
"?
¦¦•¦
»м ¦
10 нм
Рис. XXV.15.
Изменения натяжения после быстрого
ступенчатого укорочения активированной
мышцы за время At = 1 мсек (по A. F. Них-
ley, 1974).
Верхняя кривая — изменение длины в пересчете
на 0,5 саркомера; нижняя — изменение натяже-
натяжения. Начальная стадия (развитие изометрическо-
изометрического натяжения) не показана (см. рис. XXV.17).
Цифрами обозначены последовательные фазы переходных изменений натяжения: падение натя-
натяжения в ходе укорочения A); быстрое частичное восстановление натяжения B); стадия «плато»
натяжения C); медленное возвращение к исходному уровню D)
1 кг/см2
10 мсек
Tl/P° Рис. XXV. 16.
Зависимость натяжения в конце фазы 1 —
Т\ и фазы 2 — T<i переходных измене-
Т2/Р0 ний натяжения после быстрого укороче-
.0,8 ния, развивающего изометрическое натя-
натяжение мышечного волокна, от величины
укорочения А/ при длительности укороче-
0,4 ния 0,15 мсек (по G. Piazzesi, V. Lombardi,
1995).
-12
-8
-4
Pq — изометрическое натяжение; величина А1 со-
соответствует укорочению половины саркомера.
мышцы становится «циклической». Кривые падения и восстановления натяжения по-
после каждого укорочения полностью повторяются, т. е. мышца ведет себя так, слов-
словно в интервалах между укорочениями способность мостиков отвечать на быстрое
укорочение (генерировать силу) успевает полностью восстановиться. Механизм воз-
возникновения таких «циклических» режимов при многоступенчатом укорочении оста-
остается неясным. Повторяющиеся изменения натяжения, по-видимому, обусловлены
многократным размыканием и замыканием мостиков. Однако в некоторых случаях
«циклический» режим можно получить даже при интервалах между укорочениями
~ 5 мсек, что составляет всего 0,03-0,05 от длительности цикла гидролиза одной
молекулы АТФ актомиозином. Это может означать, что процессы размыкания и
замыкания мостиков в таких режимах не являются независимыми либо что энергия,
освобождающаяся при гидролизе АТФ, может освобождаться не только целиком,
но и дробно, частями, за несколько рабочих циклов.
248
Глава XXV. Биофизика мышечного сокращения
Э.Хаксли и Симмонс A971) исследовали поведение мышцы в нестационарных
режимах при различной величине исходного натяжения Pq. Проводя эксперименты
при разной степени перекрытия нитей или при неполной активации мышцы, они
обнаружили, что при изменении Pq как натяжение Т± (в фазе 1), так и натяжение
200 кН/м2
20 нм на 0,5 саркометра
100 мкм
4 J-
100 мсек
Рис. XXV. 17.
Переходные изменения натяжения при многоступенчатом укорочении активирован-
активированного мышечного волокна (по M.Irving et al., 1992).
1 — натяжение; 2, 3 — длина волокна и полусаркомера, соответственно; 4 — стимулирующие им-
импульсы.
T<i (в фазе 2) изменяются пропорционально Ро, тогда как скорость восстановления
силы (при данной величине укорочения) практически не меняется. Исходная жест-
жесткость мышцы также изменяется пропорционально Ро- Однако и во время падения
натяжения при ступенчатом укорочении, и во время его быстрого восстановления
изменений жесткости мышцы не наблюдается. Это свидетельствует о том, что, в
отличие от стадии «плато», процессы, происходящие в течение первых двух фаз, не
связаны с перезамыканием мостиков и определяются только свойствами отдельного
замкнутого мостика. Для их выяснения следует рассмотреть поведение мышцы в
этих двух фазах более подробно. Это удобно сделать, используя модель так назы-
называемого элемента Войта (рис. XXV. 18).
Элемент Войта (рис. XXV.18а) представляет собой две соединенные последо-
последовательно пружины — недемпфированную упругость К\ и упругость К2, задемпфи-
рованную некоторой вязкостью тJ. На рис. XXV. 186 показаны изменения натяже-
натяжения в элементе Войта, происходящие после его быстрого ступенчатого укорочения.
Предполагается, что в исходном состоянии обе пружины растянуты и элемент раз-
развивает некоторую силу Ро- При достаточно быстром укорочении начальная фаза,
как и в мышце, сводится к линейному падению натяжения в недемпфированной
упругости К\. Восстановление натяжения во второй фазе обусловлено замедленным
укорочением демпфированной упругости К?, приводящим к частичному восстано-
восстановлению исходного растяжения недемпфированной упругости. Очевидно, что Т± = 0
i 6. Моделирование нестационарных режимов сокращения
249
при величине укорочения А/, равной исходному растяжению пружины К±, т. е. на-
наклон прямой Ti(A/) сразу дает жесткость пружины К±, тогда как Т? = 0 при А/,
равном сумме исходных растяжений обеих пружин, так что наклон прямой
определяется соотношением их жесткостей.
к.
б
Lo 1
Po-
4
Д1
Рис. XXV. 18.
Изменения натяжения при сту-
ступенчатом укорочении элемента
Войта (по J. Squire, 1981).
а. Схема элемента Войта. К\, К^ —
упругие элементы; тJ — элемент с
вязкостью.
б. Переходы натяжения после быст-
быстрого ступенчатого укорочения эле-
элемента Войта. Верхняя кривая — дли-
длина, нижняя — натяжение; Lq — ис-
исходная длина элемента Войта; Pq —
сила, развиваемая элементом до на-
начала укорочения; Т\ — натяжение в
конце фазы 1; Тг — натяжение в кон-
конце фазы 2.
е. Зависимость 7\ и Тг от величины
укорочения А1 для элемента Войта.
Итак, и в мышце, и в элементе Войта временной ход изменений натяжения в
первых двух фазах одинаков — падение натяжения и последующее быстрое частич-
частичное восстановление. При этом зависимость Ti(AZ) в обоих случаях линейна. Это
свидетельствует о наличии у замкнутого мостика упругих свойств, аналогичных
свойствам недемпфированной упругости К\ элемента Войта (так называемая после-
последовательная упругость). Зависимость T<i (А/) в мышце, в отличие от элемента Войта,
нелинейна. Это означает, что модель мостика — генератора силы не может быть
сведена к пассивному вязкоупругому элементу, как в модели Войта. При скольжении
нитей мостик проходит через несколько активных состояний, в каждом из которых
он способен генерировать силу. Было предложено несколько моделей замкнутого
мостика для объяснения поведения мышцы в нестационарных режимах. Некоторые
из них будут рассмотрены в следующем разделе.
Модели мостика, генерирующего силу. Существуют различные модели мо-
мостика, генерирующего силу. Э.Хаксли и Симмонс предложили модель мостика
(рис. XXV. 19), в которой, по аналогии с элементом Войта, имеется последо-
последовательный упругий элемент, дополнительный к генерирующему силу элементу.
Упругий элемент может быть локализован в субфрагменте 2 миозина, как показано
на рисунке, либо в любом другом участке мостика, включая актин. Генерация
натяжения в модели сопряжена с активными переходами между несколькими про-
промежуточными состояниями замкнутого мостика, которые на схеме соответствуют
контактам с разными парами точек актинового центра (на схеме для простоты
показаны четыре точки контакта). Первоначальное замыкание — с контактом по
250 Глава XXV. Биофизика мышечного сокращения
точкам 1, 2 — не связано с генерацией силы; мостик генерирует силу и растягивает
последовательный упругий элемент при переходе из этого состояния в состояние с
контактами по точкам 2 и 3, а затем, после относительного скольжения нитей, —
по точкам 3 и 4, и т. д.
Г МН
к Z-мембране
Рис. XXV. 19.
Модель мостика Э.Хаксли—Симмонса A971) (по Woledge R., 1992).
МН — миозиновая нить; АН — актиновая нить; 1, 2, 3, 4 — последовательные точки контакта ми-
озиновой головки с актиновым центром. На рисунке показано состояние мостика с контактами в
точках 2 и 3 (стрелками указано направление сил, действующих со стороны мостика на актиновую
и миозиновую нити)
В рамках новой модели мостика получает простое объяснение ускорение ста-
стадии быстрого восстановления натяжения в фазе 2 с ростом амплитуды укороче-
укорочения (см. стр. 246). При продвижении нитей навстречу друг другу в результате
скачка длины в последовательном упругом элементе замкнутого мостика возни-
возникает упругая деформация (сжатие), пропорциональная амплитуде скачка. Потен-
Потенциальная энергия этой деформации будет понижать активационный барьер для
переходов слева направо (от контактов по точкам 1-2 к контактам по точкам 2-3
и т.д.). Так как восстановление натяжения в фазе 2, согласно модели Хаксли—
Симмонса, обусловлено этими переходами, то понижение активационного барьера
будет приводить к значительному ускорению процесса восстановления натяжения,
что и наблюдается в эксперименте.
Другой способ объяснения упругих свойств замкнутого мостика предложен
Айзенбергом и Т.Хиллом (рис. XXV.20). Согласно их модели, линейная зависи-
зависимость между натяжением и координатой мостика в фазе 1 возникает вследствие
его движения в потенциальной яме параболического типа, т. е. с квадратичной за-
зависимостью между потенциальной энергией и координатой мостика. Разным биохи-
биохимическим состояниям и разным механическим состояниям в модели соответствуют
разные участки потенциальной поверхности.
На рис. XXV.20 показана поверхность потенциальной энергии для двух раз-
различных состояний 1 и 2 замкнутого мостика, постулируемая в модели Айзенберга
и Хилла. Свойства мостика в состоянии 1 определяются формой потенциальной
6. Моделирование нестационарных режимов сокращения
251
ямы G\ с минимумом потенциальной энергии 10 ккал/моль, соответствующим углу
наклона мостика 90° (и координате х = 12 нм). Состояние 2 соответствует потен-
потенциальной яме Gi с минимумом потенциальной энергии при угле наклона мостика
45° (и координате х = 0). Изменение угла наклона мостика, на схеме соответству-
соответствующее движению по горизонтали, возможно лишь при скольжении нитей; измене-
изменение биохимического состояния, на схеме соответствующее движению по вертикали,
90°
12 нм
Рис. XXV.20.
Двумерная схема поверхности потенци-
потенциальной энергии для модели замкнутого
мостика с двумя устойчивыми состояни-
состояниями 1 и 2 (по E.Eisenberg, T. Hill, 1978).
Показаны проекции на плоскость рисунка ли-
линий, соединяющих точки с одинаковой величи-
величиной потенциальной энергии; для некоторых из
них указана величина потенциальной энергии в
ккал/моль. Движение по оси у соответствует
изменению биохимического состояния; движе-
движение по оси х — изменению механической коор-
координаты х или угла наклона мостика ф. G\, G2 —
потенциальные ямы, соответствующие состоя-
состояниям 1 и 2 замкнутого мостика.
возможно и без изменения утла наклона мостика. На рис. XXV.21 представлена
проекция потенциальных ям G\ и Gi на плоскость, перпендикулярную плоскости
рис. XXV.20. Ось у на рис. XXV.21 соответствует величине свободной энергии
замкнутого мостика G. Айзенберг и Хилл предположили, что потенциальная яма G\
(рис. XXV.21) соответствует комплексу AM • АДФ • Фн, тогда как потенциальная
яма Gi — комплексу AM • АДФ, т. е. переход между эквипотенциальными участками
потенциальных ям Gi и G\, указанный на рис. XXV.20 вертикальной пунктирной
линией, сопряжен со связыванием или с освобождением фосфата и, соответствен-
соответственно, с генерацией силы. Затем, если скольжение нитей разрешено, мостик получает
возможность движения к минимуму потенциальной энергии ямы G-2 (рабочий ход
мостика).
В модели Айзенберга и Хилла генерируемая мостиком сила при его движе-
движении в параболической потенциальной яме является линейной функцией координаты
мостика независимо от наличия гуковского упругого элемента. Кроме того, мо-
модель предоставляет возможность проведения хотя бы качественного сопоставления
биохимических состояний мостика в цикле гидролиза АТФ с его структурными и
механическими состояниями. Однако, к сожалению, и в модели Айзенберга—Хилла,
и в модели Хаксли—Симмонса параметры цикла мостика недостаточно конкре-
конкретизированы для адекватного математического моделирования сокращения мышцы
и требуют введения большого количества произвольно постулируемых функций.
Кроме того, в обеих моделях возникают принципиальные трудности при попыт-
попытке совместить требования, необходимые для описания в рамках единого набора
252
Глава XXV. Биофизика мышечного сокращения
параметров как стационарных режимов сокращения, так и быстрых переходных
режимов.
В начале 90-х годов Пиаззеси и Ломбарди сделали попытку разрешить это
противоречие, введя гипотетическое предположение о возможности использования
энергии гидролиза одной молекулы АТФ в нескольких рабочих циклах мостика.
Согласно их модели, при некоторых условиях мостик после замыкания и генера-
G k
ч
\
G2
М'АДФФН
МАДФ Фн
Д(?АТФ
адф
МАДФ
12
18
X, НМ
Рис. XXV.21.
Зависимость свободной энергии G от координаты мостика х для модели
Айзенберга—Т.Хилла (по E.Eisenberg et al., 1980).
М • АТФ, М • АДФ • Фн, М* • АДФ • Фн, AM • АДФ • Фн, AM • АДФ — последовательные стадии
цикла мостика; AGato—величина свободной энергии, освобождающейся при гидролизе одной
молекулы АТФ; G\ и Gi соответствуют состояниям 1 и 2 на рис. XXV.20; жирной линией показано
изменение потенциальной энергии мостика при скольжении нитей (путь мостика в рабочем цикле)
ции силы способен диссоциировать с актиновои нити на одной из промежуточных
стадий рабочего цикла без участия АТФ. В модели предполагается, что такой
мостик, разомкнувшийся после «короткого» рабочего хода, обладает более высокой
свободной энергией, чем мостик, завершивший «длинный» рабочий ход, и способен
к повторению «короткого» рабочего хода. Подобрав кинетические параметры ци-
цикла с «коротким» рабочим ходом в соответствии с закономерностями медленных
стационарных режимов, а цикла с «длинным» рабочим ходом — с особенностями
высокоскоростных нестационарных режимов, авторы смогли получить практиче-
практически исчерпывающее математическое описание поведения мышцы. Однако и в этой
модели успех связан с использованием слишком большого числа произвольно ва-
варьируемых параметров. Так, например, произвольным является разбиение энергии
§ 7. Молекулярный мотор мышцы 253
гидролиза АТФ между «длинным» и «коротким» рабочим ходом, которое авторы ни-
никак не связывают с биохимическими состояниями мостика. Не получают достаточ-
достаточного обоснования ни постулируемые в модели сложные линейно-экспоненциальные
зависимости большого набора констант скоростей переходов между различными
стадиями рабочих циклов мостика, ни физиологические механизмы, необходимые
для выполнения этих сложных зависимостей в мышце. В связи с этим, несмотря на
исключительно высокую степень совпадения теоретических кривых с эксперимен-
экспериментальными данными, вопросы о молекулярных механизмах работы мостика, включая
механизм, обусловливающий нелинейное поведение мышцы в нестационарных режи-
режимах, остаются открытыми.
Возможно, что путь к их пониманию лежит в ином направлении и связан с
новыми подходами к исследованию мышцы, разработанными в последние годы, та-
такими, как искусственные подвижные системы (in vitro motility assays), молекулярная
генетика мышечных белков, расшифровка их молекулярных структур и т. д. Рас-
Рассмотрению некоторых результатов этих исследований будет посвящен следующий
параграф.
§ 7. Молекулярный мотор мышцы
Типы молекулярных моторов. Мостиковая гипотеза генерации силы была сформу-
сформулирована более 40 лет тому назад. За истекшие годы была расшифрована структура
саркомера и составляющих его белков, с высоким временным разрешением иссле-
исследована механика и энергетика мышечного сокращения, изучена биохимия реакции
гидролиза АТФ актомиозином. Однако молекулярный механизм трансформации
химической энергии АТФ в механическую работу продолжает оставаться неясным.
Со времени открытия Энгельгардтом и Любимовой АТФазной активности актоми-
озина и последующей локализации АТфазного центра в глобулярном субфрагменте
миозина, субфрагмент 1 начинает претендовать на роль основного элемента мышеч-
мышечного «двигателя». В последнее время эти притязания получают все большее обосно-
обоснование. Исследования, проведенные с помощью так называемых искусственных по-
подвижных систем показали, что субфрагмент 1 способен осуществлять движение по
иммобилизованным актиновым нитям без участия не только миозиновых нитей, но
и субфрагмента 2. Обнаружен целый ряд других миозиноподобных «молекулярных
моторов», включая многочисленное семейство «одноголовых»миозинов, а также ки-
незин и цитоплазматический динеин. Предполагают, что в каждой клетке имеется
не менее 50 различных молекул, использующих энергию гидролиза АТФ для осуще-
осуществления движения по актиновым филаментам или по микротрубочкам. В связи с
этим вопрос о механизме трансформации энергии с помощью миозина приобретает
все большее значение. Недавние успехи в расшифровке структуры глобулярного
фрагмента миозина — субфрагмента 1 — позволили прояснить некоторые детали
этого механизма.
Трехмерная структура субфрагмента 1. Необходимым условием для расши-
расшифровки трехмерной структуры белка является наличие высококачественных мо-
монокристаллов, пригодных для проведения рентгеноструктурного анализа. Мето-
Методики получения миозина и его фрагментов известны уже более 30 лет и хорошо
разработаны, однако, все попытки кристаллизации длительное время оставались
254
Глава XXV. Биофизика мышечного сокращения
безуспешными. Лишь в начале 90-х годов для субфрагмента 1 проблема была ре-
решена Реимонтом с соавторами благодаря использованию методики метилирования
лизиновых аминокислотных остатков, входящих в состав белка.
На рис. 22 показана стереопара молекулярной модели субфрагмента 1 в ленточ-
ленточном представлении, полученная в результате рентгеноструктурного анализа мо-
монокристаллов субфрагмента 1 миозина из мышцы цыпленка, с метилированным
j
371
4
я
324
2
214W
2162
828,
\
h
2073
if^6
fffi\6O5
681CS
[3° ^й
с
4
312
3^
\)го90
^2019
r
РЛЦ
5
L
43
^562
?^
«л
371
J
324 (
213
2141>tL
2163 3'
2073
ЙГ406 543 *
?&-
3128 ^E^ "Й
^2090
К 2019
РЛЦ
Рис. XXV.22.
Модель молекулярной структуры субфрагмента 1 в «ленточном» представлении (по
Rayment I. et al., 1993).
1 — актин-связывающий участок; 2 — АТФазный центр; РЛЦ, СЛЦ — регуляторная и существен-
существенная легкие цепи, соответственно
лизином. Указанная на рисунке нумерация аминокислотных остатков начинается с
N-конца; для легких цепей к номеру остатка прибавлено 2000 в случае регуляторнои
РЛЦ и 3000 в случае существенной СЛЦ легкой цепи.
В модели имеется несколько пропусков, соответствующих неупорядоченным
участкам первичной последовательности, положение которых в молекуле белка
осталось нерасшифрованным. Два таких участка — между Glu204 и Gly216, а также
между Туг626 и Gin647 тяжелой цепи расположены вблизи АТФазного и актин-
связывающего центров и, по некоторым данным, могут играть важную роль в
организации взаимодействия между этими центрами.
§ 7. Молекулярный мотор мышцы 255
Как видно из рисунка, субфрагмент 1 представляет собой массивный «мотор-
«моторный» домен, содержащий центры связывания актина и АТФ, от которого отхо-
отходит вытянутая, слегка изогнутая «рукоятка» мотора. Основу «рукоятки»составляет
длинная (и 8,5 нм) а-спираль, идущая к С-концу субфрагмента 1, стабилизируемая
охватывающими ее последовательно существенной и регуляторной легкими цепями.
Центр связывания с актином и нуклеотид-связывающий центр представляют со-
собой глубокие вытянутые «карманы», расположенные на противоположных сторонах
«моторного» домена на расстоянии ~ 4 нм друг от друга. Обширный нуклеотид-
связывающий карман глубиной ~ 1,3 нм, стенки которого сходятся под утлом ~ 40°
друг к другу, в модели имеет размеры и 1,5 х 1,3 нм2 и, по-видимому, соответствует
«открытой» конформации активного центра в отсутствие нуклеотида. Связывание
АТФ должно приводить к «захлопыванию» кармана, что в случае фиксированного
положения актин-связывающего участка на актине может вызывать перемещение
С-конца миозиновой головки на расстояние не менее 5 нм.
Верхняя часть «моторного» домена состоит из двух неравных, не имеющих кон-
контактов, независимых субдоменов, отделенных друг от друга протяженной узкой ще-
щелью, которая начинается непосредственно под нуклеотид-связывающим карманом
и проходит сквозь всю головку вплоть до актин-связывающего участка на другой
стороне субфрагмента 1. Как показало сопоставление молекулярных структур ак-
актина (Холмс и др., 1990) и субфрагмента 1, в образовании прочного контакта между
двумя белками могут принимать участие как электростатические взаимодействия
комплементарно заряженных групп обоих белков, так и стереоспецифические вза-
взаимодействия гидрофобных остатков, расположенных на обоих субдоменах «мотор-
ного»домена и на двух соседних глобулах актиновой нити. При этом обеспечение
строгого стереоспецифического соответствия контактных участков возможно лишь
при закрытой щели в «моторном» домене. Как будет показано ниже, конформацион-
ные перестройки, связанные с открыванием и закрыванием этой щели, могут играть
важную роль в сопряжении биохимического и механического циклов мостика.
Молекулярная модель рабочего цикла мостика. На рис. XXV. 23 представлена
модель работы мостика, предложенная Реймонтом и др. A993) на основании прове-
проведенной ими расшифровки молекулярной структуры субфрагмента 1 и его комплекса
с актином. Исходное состояние — стадия I — соответствует ригорному комплексу
в отсутствие нуклеотида. В этом состоянии щель в «моторном» домене закрыта, а
АТФазный центр находится в «открытой» конформации. II стадия — связывание
АТФ — сопровождается открытием щели в «моторном» домене, что приводит к
нарушению стереоспецифического соответствия между контактными участками
актина и миозина и диссоциации миозиновой головки. III стадия — на свободной
головке происходит захлопывание нуклеотид-связывающего кармана и гидролиз
АТФ, сопровождающийся переходом миозиновой головки в неравновесную напря-
напряженную конформацию, которая на рисунке отражена в изогнутой форме головки.
IV стадия — поиск нового актинового центра, первоначальное нестереоспецифиче-
ское связывание миозин-продуктного комплекса на одной из глобул актина. V ста-
стадия — образование прочной стереоспецифической связи с двумя глобулами актина,
сопровождающееся закрытием щели и диссоциацией фосфата. Уход фосфата, в
свою очередь, вызывает обратную конформационную перестройку в «моторном»
домене, сопровождающуюся движением С-конца миозиновой головки относительно
256
Глава XXV. Биофизика мышечного сокращения
актиновой нити — происходит рабочий ход мостика. VI стадия — в результате этих
преобразований вновь открывается нуклеотид-связывающии карман, освобождает-
освобождается АДФ, после чего головка возвращается в ригорное состояние.
Важной особенностью модели является предположение о конформационной
перестройке в диссоциированной головке, происходящей в результате гидролиза
АТФ. Как предполагают авторы, при этом «химическая» свободная энергия,
II
III
Рис. XXV.23.
Схема сопряжения биохимического и механического циклов мостика (по Rayment I.,
Holden H., 1994).
I — мостик, замкнутый в отсутствие АТФ; II—IV — последовательные стадии гидролиза АТФ;
V, VI — диссоциация фосфата и АДФ, соответственно
освобождающаяся в результате гидролиза, запасается в виде «механической»
потенциальной энергии деформации «моторного» домена, которая затем может
использоваться для генерации силы и совершения рабочего хода.
Многие положения модели находят подтверждение в результатах других иссле-
исследований. Так, например, согласно модели, уменьшение длины а-спиральной «руко-
«рукоятки» моторного домена должно уменьшать амплитуду рабочего хода. «Укорочен-
«Укороченный» субфрагмент 1 можно получить либо путем удаления легких цепей, приводя-
приводящим к свертыванию а-спирали, либо от мутантных молекул миозина. Как показали
проведенные исследования, такие «укороченные» субфрагменты 1 сохраняют свою
§ 7. Молекулярный мотор мышцы 257
актин-активируемую АТФазную активность, однако скорость их движения в ис-
искусственных подвижных системах значительно уменьшена.
Авторы модели на данном этапе не конкретизируют последовательность меж-
и, возможно, внутридоменных движении, приводящих к открыванию и закрыванию
нуклеотидного кармана и щели в моторном домене. Это — предмет дальнейших
исследований. Не является окончательной и сама предложенная модель. Остается
открытым вопрос о возможных искажениях, вносимых в структуру в результате
метилирования остатков лизина. Однако не вызывает сомнений, что работа Рей-
монта с соавторами — это огромный успех исследователей мышечного сокращения,
предоставляющий широкие возможности для объединения усилий молекулярных
биологов, биофизиков и биохимиков на пути окончательного решения стоящих в
этой области проблем.
Глава XXVI
Биофизика процессов гормональной рецепции
§ 1. Передача сигнала от гормонов и медиаторов внутрь клетки
Существование высокоорганизованного многоклеточного организма животного и
человека невозможно без постоянного обмена информацией, командами и сигна-
сигналами между клетками. Эта стройная, тонко отлаженная система обусловливает
взаимодействие множества клеточных ансамблей, позволяющее многоклеточному
организму функционировать как единому целому.
Известно 3 варианта химической коммуникации клеток внутри животного ор-
организма, различающиеся по расстояниям, на которых они действуют: 1) эндокрин-
эндокринная и 2) паракринная сигнализация, а также 3) синаптическая передача. В первом
случае выделяемые эндокринными клетками сигнальные молекулы-гормоны раз-
разносятся током крови по всему организму и достигают самых удаленных клеток-
мишеней; во втором случае из-за быстрой инактивации и/или связывания клетками-
мишенями сигнальные молекулы-медиаторы диффундируют на расстояния порядка
миллиметра; наконец, при синаптической передаче диффузия ограничивается рас-
расстояниями около 0,05 м. Во всех случаях диффузия сигнальной молекулы должна
завершаться ее связыванием с особым белком клетки-мишени — рецептором.
Если рассматривать понятие химической коммуникации (сигнализации) шире,
включая и сигналы, которые воспринимаются животным организмом из внешней
среды, то сюда войдет также обонятельная и вкусовая рецепция, обеспечивающая
восприятие сигнальных молекул, «обладающих» запахом или вкусом. Как показа-
показали исследования последнего десятилетия, молекулярные механизмы обонятельной и
вкусовой рецепции имеют много общего с таковыми во внутриклеточной химиче-
химической коммуникации. Поскольку последняя изучена значительно более подробно, то
мы остановимся именно на этом наиболее наглядном примере.
Известно, что эндокринной регуляции свойственна высокая степень иерархич-
иерархичности. Так, стимул, поступивший от нервной клетки головного мозга к нейросекре-
торные клеткам гипоталамуса (или подбугорья — участка головного мозга), вызы-
вызывает выход в кровь пептидных гормонов двух классов: 1) либеринов, или рилизинг-
факторов, и 2) статинов. Оба этих класса веществ воздействуют на расположенный
рядом гипофиз, однако, если либерины стимулируют секрецию гормонов гипофиза,
то статины подавляют ее. Причем секреция большинства гипофизарных гормонов
предназначена для стимуляции других, периферических эндокринных желез, выде-
выделяющих третьи гормоны. Эта цепочка может быть прослежена на следующем при-
примере: первый гормон — кортиколиберин (гипоталамус) вызывает секрецию в кровь
§ 1. Передача сигнала от гормонов и медиаторов внутрь клетки 259
второго гормона — кортикотропина, или адренокортикотропного гормона (АКТГ,
передняя доля гипофиза), а тот в свою очередь стимулирует в коре надпочечников
синтез и выход кортизола (третий гормон). Видно, что гипоталамус, находясь на
вершине этой «иерархической пирамиды», регулирует эндокринную систему.
Во всех случаях сигнальная молекула—гормон, локальный медиатор, нейроме-
диатор — для того чтобы вызвать эффект у клетки-мишени, должна связаться со
специфическим рецептором этой клетки. Рецепторы для большинства сигнальных
молекул находятся на плазматической мембране; стероидные гормоны (гидрофоб-
(гидрофобные молекулы) имеют внутриклеточные рецепторы.
Мембранные рецепторы подразделяются на 3 класса:
1) рецепторы факторов роста,
2) рецепторы, сопряженные с G-белками, и
3) каналообразующие рецепторы (например, рецепторы нейромедиаторов аце-
тилхолина, ГАМК), являющиеся ионными каналами, открывающимися в результате
связывания нейромедиатора (об ионных каналах см. главу XXI).
Рецепторы факторов роста (например, фактора роста эпидермиса, тромбоци-
тарного фактора роста) участвуют в регуляции клеточного деления и роста. На
своем внеклеточном N-конце они содержат участок связывания фактора роста, за-
затем следует трансмембранный домен, а цитоплазматический С-конец имеет домен
с ферментативной, обычно протеинкиназной активностью, т. е. способностью ка-
катализировать перенос g-фосфатной группы от АТФ к белку-субстрату. Эти транс-
трансмембранные пептиды диффундируют в плазматической мембране. Связывание фак-
фактора роста со своим рецептором способствует димеризации рецепторов (R + R — 2R)
в плазматическоймембране, фосфорилированию киназного домена одной рецептор-
ной молекулы протеинкиназои другой молекулы и активации фосфорилированного
домена. В результате фосфорилированными и активированными оказываются оба
домена у димера, что обеспечивает интенсивное фосфорилирование соответствую-
соответствующих внутриклеточных белковых субстратов — передачу сигнала вовнутрь клетки.
Рецепторы, сопряженные с G-белками, опосредовано, через эти мембранные
белки стимулируют или ингибируют особые эффекторные ферменты плазматиче-
плазматической мембраны (например, аденилатциклазу) или ионные каналы плазматической
мембраны. Из нескольких классов G-белков следует выделить два: стимулирую-
стимулирующие Gs и ингибирующие Gj. Такие гормоны как, например, тиреотропный, лютеи-
низирующий, глюкагон, связавшись со своими рецепторами, способствуют их вза-
взаимодействию с G^-белками, которые, активировавшись после этого, стимулируют
аденилатциклазу. Адреналин, например, может взаимодействовать с несколькими
адренорецепторами — а и Ь, причем &-адренорецепторы активируют Gs-белки и,
тем самым, стимулируют аденилатциклазу, тогда как аг-адренорецепторы (подтип
а-адренорецепторов) активируют Gj-белки и поэтому подавляют ее активность.
Процесс протекает следующим образом. После связывания лиганда (гормона)
конформация рецептора изменяется так, что открывается его участок для взаи-
взаимодействия с G-белком (рис. XXVI.1); за счет латеральной диффузии в липидном
бислое плазматической мембраны происходит образование комплекса рецептор-
G-белок, что позволяет заменить GDP на GTP. В результате этого а-субъединица
G-белка диссоциирует, у нее появляется участок для взаимодействия с аденилатци-
клазой, и она образует с ней комплекс, активируя ее. Аденилатциклаза синтезирует
260 Глава XXVI. Биофизика процессов гормональной рецепции
цАМФ; а в результате гидролиза субъединиц возвращается в исходное неактивное
состояние: комплекс с (Зу~субъединицами.
Во всех перечисленных случаях действие гормонов сводится к усилению
или ослаблению производства аденилатциклазой внутриклеточного посредника
этих гормонов — циклического АМФ (цАМФ). Последний служит активатором
протеинкиназ А.
Аденилатциклаза
G-белок Рис. XXVI.1.
Схема активации адени-
латциклазы (по Албертсу
и др., 1994)
Сходная цепь событий происходит при активации соответствующих рецепто-
рецепторов такими гормонами и медиаторами, как вазопрессин и ацетилхолин, только эф-
фекторным ферментом является фосфоинозитид —специфическая фосфолипаза С.
Ею начинается фосфоинозитидный каскад, так как она образует из мембранного
фосфолипида фосфатидилинозит-1,4-бифосфата два продукта: 1) диацилглицерин,
активирующий протеинкиназу С, и 2) инозит 1,4,5-трифосфат, освобождающий
еще один внутриклеточный посредник Са из внутриклеточных депо, который
активирует Са -зависимые протеинкиназы.
Таким образом, переработка сигнала в процессах гормональной рецепции про-
происходит по общей схеме: доставка сигнальной молекулы -* связывание-узнавание -*
преобразование сигнала -* функциональные изменения.
§ 2. Общие закономерности рецепции гормонов и медиаторов
Расстояния, преодолеваемые сигнальными молекулами в организме, могут изме-
измеряться метрами; перемещения на такие большие расстояния обусловлены не диф-
диффузией, а различными видами конвекции, например, движением крови. Однако
вблизи клетки, на расстояниях порядка микрометра от ее поверхности, молекулы
достигают рецепторных мембранных структур уже путем диффузии. Г. Адам и
М. Дельбрюк A968) показали, что существование рецепторных структур на мембра-
мембране клетки при определенных условиях резко ускоряет взаимодействие сигнальной
молекулы с рецептором. Было рассчитано среднее время диффузии т молекулы к
мишени радиуса а в области пространства радиуса Ь и размерности г, если коэффи-
коэффициент диффузии молекулы D^'. Оказалось, что т* есть функция от отношения Ь/а,
зависящая от размерности пространства:
(b/a). (XXVI.2.1)
i 2. Общие закономерности рецепции гормонов и медиаторов
261
Так, в одномерном пространстве (г = 1)
При Ъ 3> а
В двумерном пространстве при Ъ^> а
а в трехмерном при Ъ 3> а
(XXVI.2.2)
(XXVI.2.3)
(XXVI.2.4)
(XXVI.2.5)
III
КГ1
10-2
N
\
\
4
4
lO = 1
\
C,2) дC)
\
\
101 102 103 104 Ъ/а
Рис. XXVI.2.
К выводу формулы
(XXVI.2.6). Пояснение
см. в тексте
Расположение рецепторов на мембране, куда вначале попадают сигнальные
молекулы, диффундирующие затем непосредственно к рецептору, может способ-
способствовать ускорению взаимодействия этих молекул с рецепторами. На рис. XXVI.2,1
показан случай обычной трехмерной диффузии в большой сфере радиуса Ь к «рецеп-
«рецептору» — малой концентрической сфере радиуса а, которая захватывает попавшие
в нее диффундирующие молекулы. На рис. XXVI.2, IT дана иллюстрация другого
262 Глава XXVI. Биофизика процессов гормональной рецепции
случая, когда частица, двигаясь в цилиндре высоты Ь и радиуса Ь, попадает в эква-
экваториальную «рецепторную» мембранную плоскость, и уже по ней диффунидирует
к «рецептору» — диску радиуса а. В этом случае трехмерная диффузия заменяется
комбинированной двухстадийной диффузией: вначале сигнальная молекула за счет
диффузии в цилиндре попадает на его основание, а затем, диффундируя по нему, —
на диск-«рецептор». Расчеты показывают, что соотношение времен трехмерной
диффузии т*-3) [см. (XXVI.2.5)] и такой комбинированной т*-3'2-1 диффузии зависит
от отношения b/а и ?)B)/?)C). Для многих реальных для клетки ситуаций, можно
использовать приближенную формулу
C,2
2)/тC) и (o/b)(?>C)/?,B)) . 10. (XXVI.2.6)
т
Графики зависимостей тC,2)/т^ от b/а и D^ /D^ даны на рис. XXVI.2, III. На нем
незакрашенная область соответствует тC,2)/тC-) < 1. Вполне очевидны преимуще-
преимущества двустадийной диффузии перед одностадийной трехмерной в случае больших
Ъ/а и малых D^ /D^3\ Таким образом, существование рецепторных областей на
мембране способствует ускорению взаимодействия сигнальных молекул с рецепто-
рецепторами.
Следующим этапом рецепции является связывание молекулы лиганда—гормо-
лиганда—гормона, нейромедиатора — с рецептором, ведущее к восприятию сигнала. В результате
взаимодействия лиганда с рецептором образуется лиганд-рецепторный комплекс,
формально аналогичный фермент-субстратному комплексу (см. гл. XIV):
L + rJ^ (L/R). (XXVI.2.7)
Здесь L—лиганд, R — рецептор, К — константа сродства (К = 1/Кдисс, где
-Кдисс — равновесная константа диссоциации).
Константы сродства гормон-рецепторных комплексов лежат в интервале
108-1011 М, что намного больше сродства фермент-субстратных комплексов.
Собственно «узнавание» соответствующего лиганда заключается в связывании его
специфическим рецептором; чуждое для этого рецептора вещество, не имеющее к
нему сродства, не связывается и тем самым остается «неузнаваемым».
Рассмотрим наиболее общую ситуацию, когда п лигандов взаимодействуют с
т классами участков связывания (рецепторы), причем в рассматриваемой систе-
системе отсутствуют какие-либо другие вещества, способные взаимодействовать как
с этими лигандами, так и с участками связывания. Помимо этого примем, что:
1) между лигандом и связывающим участком возможна только одна обоатимая
реакция; 2) все реагирующие компоненты системы одновалентны, а образующийся
комплекс не выходит из реакции и не включается в другие реакции; 3) каждая
реакция связывания независимо от остальных приходит к равновесию в соответ-
соответствии с кинетикой реакции второго порядка; 4) нет кооперативных эффектов и
аллостерического связывания.
Поскольку г-й лиганд может существовать в состоянии, связанном с j-м участ-
участком Bij (от англ. bound — связанный), и в свободной форме F^ (от англ. free —
§ 2. Общие закономерности рецепции гормонов и медиаторов 263
свободный), то общая концентрация г-го лиганда [Li] будет равна:
i = l,...,n. (XXVI.2.8)
Аналогично, общая концентрация j-x участков связывания Rj складывается из
концентрации незанятых участков rj и участков, связавших лиганды:
[Rj] = Ы + ?[ВД i = 1, • • •, m. (XXVI.2.9)
Константа сродства Kij при равновесии (Fi + rj ч± Bij) равна
^^ г = 1,...,п; j = l,...,m. (XXVI.2.10)
Подставляя значения для .By из этого уравнения в уравнения (XXVI.2.8) и
(XXVI.2.9), получим
г=1
Найдем из уравнения (XXVI.2.12)
(XXVI.2.11)
(XXVI.2.12)
= l,...,m. (XXVI.2.13)
j
%=\
и, подставив в (XXVI.2.11), получаем
1 + E Kai[Fa]
0=1
(XXVI.2.14)
Это уравнение с учетом (XXVI.2.8) можно преобразовать так, чтобы охарак-
охарактеризовать отношение fe, концентраций связанного и свободного г-го лиганда
(Н. A. Feldman, 1972):
(XXVI.2.15)
о=1
Рассмотрим ряд характерных случаев.
264 Глава XXVI. Биофизика процессов гормональной рецепции
1. Один лиганд (г = 1) и один участок связывания (j = 1). Здесь можно отбро-
отбросить подстрочные индексы. Из (XXVI.2.15)
к = ТТВД' (XXVI.2.16)
а так как [F] = [В]/к, то
к = [B]/[F] = K[R] - К[В] (уравнение Скэтчарда). (XXVI.2.17)
График этого уравнения в координатах ([B]/[F], [В]) представляет собой прямую.
Экспериментальные данные по связыванию радиоактивных лигандов часто пред-
представляют именно в координатах Скэтчарда, полагая, что [L] 3> [R], т.е. [F] ~ [L].
Параметры равновесного связывания получают, продолжая прямую до пересечения
с осями: на оси абсцисс отсекается отрезок, равный [R], на оси ординат АГ[Л],
тангенс угла наклона соответствует К.
Однако часто связывание одного лиганда не описывается в координатах Скэт-
Скэтчарда. В отсутствие отрицательной кооперативности это бывает обусловлено нали-
наличием более одного участка связывания.
Рис. XXVI.3.
График связывания одного лиганда с двумя участка-
участками (в координатах (к, [В]):
ОС =[Ri] + [R2], OF = Kn[Ri] + K12[R2], OA = [Ri],
'-^j OB = [R2], OD = K12[R2], OE = Kn[Ri]-
2. Один лиганд (г = 1) и два участка связывания (j = 2). Способом, аналогич-
аналогичным предыдущему, можно преобразовать уравнение (XXVI.2.15) для случая г = 1,
j = 2:
КцК^В? + (Кц + К12)к[В] + к2 -
- (ATn[i?i] + K12[R2])R = 0. (XXVI.2.18)
Графиком этого уравнения в координатах (к, [В]) является гипербола, про-
продолжения которой отсекают на оси абсцисс отрезок [Ri] + [R2], на оси ор-
ординат— отрезок ifn[i?i] + ATi2[i?2]- Асимптотами гиперболы являются прямые
к = — Кц([В] — [i?i]) и к = —К 12([В] — [R2]), отсекающие на оси ординат отрезки
-Kii[i2i] и Ki2[R2], а на оси абсцисс [Ri] и [R2] (рис. XXVI.3). Эти особенности позво-
позволяют провести анализ экспериментальных данных и приблизительно (графически)
определить параметры равновесного связывания.
3. Особенности внутримембранных процессов рецепции
265
3. Два лиганда (г = 2) и один участок связывания (j = 1). Случай, часто встре-
встречающийся на практике, когда есть один меченый лиганд, специфически связываю-
связывающийся с одним типом рецепторов, и возникает необходимость определить характе-
характеристики связывания другого, но уже немеченого лиганда.
Из (XXVI.2.14) и (XXVI.2.8) получаем
m
3=1
о=1
г = 1,... ,п.
(XXVI.2.19)
При г = 1 и j; = 1 для лиганда 1 (обычно радиоак-
радиоактивного; помечен звездочкой) из (XXVI.2.19) сле-
следует
L lJ ц-
(XXVI.2.20)
18 [LJ
Рис. XXVI.4.
«Вытеснение» лигандом 2 (?2)
меченого лиганда 1: [Х2] 3> [-R]
(пояснение см. в тексте)
Если концентрацию меченого лиганда 1 под-
поддерживать постоянной и изменять концентрацию
немеченого лиганда 2 , то с увеличением [.F2] будет уменьшаться [В±] из-за «вы-
«вытеснения» его немеченым конкурентом. Рассмотрим условия, когда [Х2] 3> [R]
(рис. XXVI.4). В отсутствие лиганда 2, т.е. когда [.F2] ~ [Х2] = 0, связывание мече-
меченого лиганда 1 максимально:
" ГГТП*П (XXVI.2.21)
Можно найти такую эффективную концентрацию лиганда 2 (ЕС^о = [-Р2]' ~ [-^2]')>
которая на 50% «вытесняет» меченый лиганд (рис. XXVI.3), т.е. становится рав-
равной 1/2[Б*]0. Легко рассчитать из (XXVI.2.20) и (XXVI.2.21), что в этом случае
(XXVI.2.22)
4. Число лигандов и участков связывания больше 1 (г > 1, j > 1).
Этот случай требует числового решения уравнений (XXVI.2.15), (XXVI.2.16)
или (XXVI.2.20), позволяющего найти оптимальные значения j, формы теоретиче-
теоретических кривых, а также многие параметры связывания, в том числе и вклад данных
j-x участков в общем связывании лиганда. Этим методом была получена подробная
информация о рецепторах катехоламинов (адреналин, норадреналин и их аналоги)
и других гормонов, о взаимодействии этих рецепторов с регуляторными мембран-
мембранными белками на начальных стадиях преобразования гормонального сигнала.
§ 3. Особенности внутримембранных процессов рецепции
Рецепторы, G-белки и эффекторные ферменты существуют в плазматической
мембране как отдельные и часто независимые интегральные белки. Поэтому их
взаимодействие (например, димеризация рецепторов факторов роста, функциони-
266
Глава XXVI. Биофизика процессов гормональной рецепции
1
2 3 4 5 6 7 8
Время, отн. ед.
рование рецепторов, сопряженных с G-белками) связано о характером и скоростью
их перемещения, на что существенное влияние будет оказывать структура мембра-
мембраны и, в частности, ее липидного бислоя (см. главы XV, XVI). Неслучайно скорость
аденилатциклазной реакции, активируемой гормоном, существенно зависит от
физического состояния липидов мембраны — сре-
ды, где происходит взаимодействие белков адени-
латциклазного комплекса.
Движение рецепторов в плазматической мем-
мембране живой клетки может быть эксперименталь-
экспериментально обнаружено. Так, рецептор можно метить,
присоединяя к нему флуоресцирующее соедине-
соединение (см. § 2 гл. X). Вспышка лазера вызывает фо-
фотоокисление и «отбеливание» флуорофора (поте-
(потеря способности флуоресцировать) на небольшом
участке клетки (радиусом 1-2 мкм). Затем проис-
происходит восстановление флуоресценции «отбеленно-
«отбеленного» участка. Процесс восстановления флуоресцен-
флуоресценции отражает «наплывание» в этот участок «неот-
«неотбеленных» рецепторов, т. е. свидетельствует об их
движении (рис. XXVI. 5). По параметрам восста-
восстановления флуоресценции можно рассчитывать ко-
коэффициенты латеральной диффузии рецепторов.
Связь коэффициента диффузии рецептора с восстановлением флуоресценции
можно пояснить следующим образом. В одномерном случае пространственно-
временные изменения концентрации с диффундирующего вещества определяются
по второму закону Фика:
Л = ^_?, (XXVI.3.1)
о* ох
где D — коэффициент диффузии, t — время, х — единственная координата диффу-
диффузии.
Решение этого уравнения для начальных условий, когда при t = 0 все веще-
вещество Со сконцентрировано в начале координаты, будет
Рис. XXVI.5.
Кинетика восстановления флу-
флуоресценции после «фотоотбе-
«фотоотбеливания» участка клеточной
мембраны
с/со = DnDty1/2 ехр(-ж2/4Dt).
(XXVI.3.2)
Так как среднее значение пробега (х) диффундирующих частиц для любого t будет
(х) = 0, то найдем дисперсию (ж2). Выражение (XXVI.3.2) можно рассматривать как
плотность распределения вероятности обнаружения диффундирующего вещества в
точке х. Тогда
оо
= f
(XXVI.3.3)
Интеграл разбивается на два табличных, и для одномерного случая получаем
(х2) = 2Dt или D = (x2)/2t. (XXVI.3.4)
§ 3. Особенности внутримембранных процессов рецепции 267
Для двумерного случая (движение в плоскости мембраны)
D = (x2)/4t, (XXVI.3.5)
а для трехмерного
D = (x2)/6t. (XXVI.3.6)
Используя формулу (XXVI.3.5) в несколько преобразованном виде (D.Axelrod
et al, 1976), можно рассчитать D по данным «фотоотбеливания»:
D = [w2/4^i/2]Y, (XXVI.3.7)
где w — радиус лазерного луча; т^—время полувосстановления флуоресценции;
у — величина, характерная для используемого лазерного луча и получаемая при точ-
точном решении уравнения двумерной диффузии (обычно около 1,3). Величины D для
рецепторов, полученные методом восстановления флуоресценции после фотоотбели-
фотоотбеливания (методом ВФФ), оказываются около 10~10 см2/с и менее. Полного восстано-
восстановления флуоресценции меченых белков (в т. ч. рецепторов) на «отбеленном»участке
обычно не происходит (рис. XXVI.4), поэтому методом ВФФ по кривым восста-
восстановления флуоресценции можно определить фракции мобильных и «неподвижных»
белков.
Существенным фактором, определяющим подвижность рецепторов и взаимо-
взаимодействующих с ними белков (а тем самым и передачу гормонального сигнала в
клетку), служит макроструктура мембраны. Мембранные белки образуют агрега-
агрегаты, которые могут удерживаться цитоскелетом и подмембранными структурами, в
состав последних входят белки: фодрин, спектрин или ГИ^260/240. Таким образом,
движение рецепторов осуществляется не в открытом липидном «море» мембраны, а
между «островами» из неподвижных агрегатов белков. Движение белков в мембране
осложняется также наличием липидов в фазе геля («твердые» липиды). Следователь-
Следовательно, на скорость передвижения будет оказывать существенное влияние доля площади
мембраны т), доступной для движения белков.
Диффузия в среде с препятствиями может быть описана теорией перколяции
(от лат. percolatio — просачивание)—одним из разделов теоретической физики.
Основные понятия этой теории можно проиллюстрировать на примере решеточной
перколяции. Представим себе решетку, состоящую из узлов и связей, в которой
каждый узел может существовать с вероятностью р (рис. XXVI.6; р можно рассма-
рассматривать и как концентрацию узлов). Совокупность узлов, связанных друг с другом
расстоянием ближайшего соседства, образует кластер. Существует критическая
концентрация узлов ро (перколяционный порог), выше которой в системе возника-
возникает впервые перколяционный кластер, пронизывающий всю решетку (рис. XXVI.7).
Основная часть перколяционного кластера без тупиковых ветвей получила название
скелета перколяционного кластера.
Перемещение в решетке возможно от узла к узлу по связям, их соединяющим.
Таким образом, наличие перколяционного кластера обуславливает возможность пе-
перемещения по всей решетке. Отсутствующие узлы (или связи) представляют собой
препятствие для перемещения.
268
Глава XXVI. Биофизика процессов гормональной рецепции
Согласно теории перколяции (А. Л. Эфрос, 1982; D. Stauffer, 1985) свойства пер-
перколяционного кластера, в том числе диффузия в нем, описываются функциями вида
(XXVI.3.5
где и — критический показатель, который определяется функцией f(x) и зависит
лишь от размерности пространства. Например, для двумерного пространства (к ко-
которому можно отнести мембрану),
Р = 0,14,
рв = 0,5,
ц = 1,16,
(XXVI.3.9)
где Р(р)—вероятность того, что точка принадлежит перколяционному кластеру,
Рв (р) — вероятность того, что точка принадлежит скелету перколяционного кла-
кластера, D(p) — коэффициент диффузии вдоль скелета перколяционного кластера.
—t
i—
—(
—<
—i
\—
>—
—<>
Рис. XXVI.6.
Решетка с узлами и связями. Два узла
в сплошном овале образуют кластер, в
пунктирном — кластера не образуют
Рис. XXVI.7.
Решетка с перколяционным
кластером (жирные линии)
Перемещение в реальных системах, в том числе мембранах, которое часто не
имеет ярко выраженного дискретного характера, удобнее рассматривать как не-
непрерывную перколяцию. В этом случае вместо величины р обычно используют
величину х — долю пространства, доступного для перемещения. Было показано,
что для непрерывной перколяции критические показатели остаются теми же, что и
для решеточной, если, конечно, размерность пространства неизменна. Следователь-
Следовательно, какая бы модель ни была избрана — решеточная или непрерывная, — величина
критических показателей для данной размерности пространства сохранится. Тогда
3. Особенности внутримембранных процессов рецепции
269
выражения (XXVI.3.9) записываются так:
Р(х) ~ (х - xcf, p = 0,14,
Рв(х) ~ (х - xcfB, рв=0,5,
?>(ж) ~ (х - Xcf, [1 = 1,16.
(XXVI.3.10a)
(XXVI.3.106)
(XXVI.3.10b)
Очевидно, что в логарифмических координатах кривые, описываемые этими выра-
выражениями, спрямляются, и по наклону их можно определять значения критических
показателей.
В приложении понятий теории перколяции к описанию биологических мембран
перколяционный кластер может представлять собой непрерывный путь для диф-
диффузии мембранных белков. В таком случае при уменьшении доли пространства,
доступного для перемещения белков, ниже порогового, хс, перколяционный кла-
кластер разбивается на мелкие кластеры, не связанные между собой, и, как следствие,
диффузия на большие расстояния (в скелете перколяционного кластера) становится
невозможной.
Методом ВФФ (А. С. Соболев, 1994, 1995) были определены коэффициенты
диффузии и мобильная фракция белков в нативных плазматических мембранах с
измененными долями жидких липидов и им-
иммобилизованных конгломератов белков —
т. е. с измененными значениями х.
Оказалось, что с уменьшением х сни-
снижались как коэффициент латеральной диф-
диффузии белков, так и доля мобильной их
фракции; это изменение соответствовало
предсказаниям теории перколяции — име-
имело порог. Экспериментально определенные
критические показатели хорошо совпада-
совпадали с теоретическими. Рассмотрим это на
следующих примерах. Известно, что бел-
белки способны к латеральной диффузии лишь
в областях мембраны, занятых жидкими
(жидкокристаллическими) липидами, сле-
следовательно, перколяционный кластер дол-
должен представлять собой кластер жидких
липидов. Предположим, что в освещаемом
участке клетки радиусом со [см. уравнение
(XXVI.3.8)] находится перколяцяонный кла-
кластер. Восстановление флуоресценции после
отбеливания на этом участке осуществляется за счет диффузии белков в скеле-
скелете этого перколяционного кластера. Следовательно, величина мобильной фракции,
определяемая методом ВФФ, должна соответствовать Рв(х). Экспериментальные
данные (см. рис. XXVI.8) оказались в хорошем соответствии с теоретическими (ср. с
уравнением (XXVI.3.106)).
Если рассматривать обратимую диффузионно-контролируемую реакцию А +
+ В ** А ¦ В, протекающую в среде с препятствиями, причем доля пространства,
-0,4 -
-0,8 -
-1Д
-0,4
Рис. XXVI.8.
Зависимость lg(мобильной фрак-
фракции) белков плазматической мембра-
мембраны, определенной методом ВФФ, от
lg(a; - хс).
270
Глава XXVI. Биофизика процессов гормональной рецепции
доступного для перемещения частиц А и В, равна х, то скорость реакции
d[A ¦ В]
dt
¦D(x)[A][B]-K[A-B]
будет равна 0 при равновесии, так что
[A-B]~D{x)[A][B].
Очевидно, что реальная концентрация [Р] мембранного белка Р будет равна [Ро/х],
х ф 0, где [Ро] — концентрация белка при х = 1, так как белки нерастворимы в
белках и, большинство из них, в твердых липидах. Тогда с учетом (XXVI.З.Юв)
можно записать
[А-В]
-T-W
(x-xc)
(XXVI.3.11)
Если экспериментальные данные (А. С. Соболев и др.) об образовании комплек-
комплекса рецептор i?-Gs-6anoK
60
О 40
20
(рис. XXVI.9, А) перестроить в координатах lg([R -Gs]) OTlg(a; — хс) (рис. XXVI.9, Б),
то наклон полученного спрямленного графика покажет, соответствует ли он
теоретически предсказанному [урав-
[уравнение (XXVI.З.Юв)]—диффузии ре-
рецептора R и Gs-белка в скелете пер-
коляционного кластера. Как следует
из рис. XXVI.9, Б, экспериментальное
значение \1 = 1,1 ± 0,1 хорошо соот-
соответствует теоретическому [уравнение
(XXVI.3.10b)].
Применимость перколяционного
подхода к описанию движения и вза-
взаимодействия мембранных белков, вза-
взаимодействующих с аденилатциклазой,
позволяет оценивать размеры мем-
мембранного пространства, на котором
эти белки взаимодействуют, характе-
характеризовать особенности эффектов гор-
гормонов при разных долях мембраны,
доступных для движения белков, оце-
оценивать влияние развития подмембран-
ного цитоскелета в ходе дифференци-
ровки клеток на гормональный ответ.
Кинетика взаимодействия белков
в мембране отличается от обычной ки-
кинетики реакций в объеме. Если счи-
считать, что взаимодействие двух частиц определяется только их диффузией в среде,
то стационарная скорость v диффузионно-контролируемой реакции А + В —> АВ
будет равна
/ + св/тв, (XXVI.3.12)
-60
-40
-20
Рис. XXVI.9.
Доля комплекса i?-Gs-6aroK (А) от обще-
общего количества рецепторов в мембране при
изменении доли пространства, доступно-
доступного для перемещения белков (доли жидких
липидов). Б — то же в логарифмических
координатах (по уравнению XXVI.3.11)
v =
§ 3. Особенности внутримембранных процессов рецепции 271
где са и св — концентрации частиц А и В в молях на единицу объема или единицу
площади; та — среднее время диффузии, за которое частица А достигает неподвиж-
неподвижной частицы В; тв — то же для подвижной частицы В.
Все пространство, где происходит реакция, можно разбить на ячейки радиуса Ь,
в центре которого находятся «ловушка» радиуса а. Частицы (допустим, типа А)
свободно диффундируют в ячейки, пока не попадут в ловушку радиуса а, где они
взаимодействуют с частицей типа В. Размер ячейки радиуса Ь можно определить,
исходя из числа реагирующих частиц в единице объема или единице площади: Nc,
где N — число Авогадро. Тогда в трехмерном случае
14
—о —величина ячейки с «ловушкой» в виде частицы В;
NcB c
14
= —о- — величина ячейки с «ловушкой» в виде частицы А.
NcA
Отсюда, подставляя в (XXVI.2.5) величины ЬА и Ьв, найдем
т43) = DTi7VacjBD^), т^ = DжМ acAD в)'1, (XXVI.3.13)
а подставляя (XXVI.3.13) в (XXVI.3.12), получаем
v = 4:TiNa(DA + DB)cAcB- (XXVI.3.14)
В двумерном случае, соответственно, имеем размеры «ловушек»
1 =nbA, -^—=-кЬв. (XXVI.3.15)
NcB A' NcA
Решая (XXVI.3.15) относительно Ь, находим величины т в выражении (XXVI.2.4),
а затем и -у в (XXVI.3.12) (Sh.Hardt, 1979):
v = 2tzN ( Da — + ^——) саСв. (XXVI.3.16)
Выражение (XXVI.3.14)—известная формула Смолуховского. Величина
4nNa(DA + Db), стоящая перед произведением саСв, представляет собой константу
скорости реакции второго порядка в объеме. Очевидно, зависимость скорости
реакции от концентраций са и св соответствует здесь зависимости, характерной
для реакций второго порядка.
В двумерном случае (XXVI.3.16) оказывается, что скорость реакции более
сложным образом зависит от концентраций реагентов. С увеличением концентра-
концентраций са и св будет увеличиваться значение множителя, стоящего перед саСв в
(XXVI.3.16), а с уменьшением концентраций, наоборот, снижаться.
Следовательно, в двумерном случае скорость реакции может дополнительно
регулироваться концентрациями реагирующих частиц.
Такая регуляция осуществляется в клетке in vivo, в частности, за счет умень-
уменьшения или увеличения числа рецепторов, реагирующих с лигандами, это так назы-
называемая down- и up-регуляция. В результате значительно изменяется интенсивность
внутриклеточной реакции на соответствующий гормон, взаимодействующий с ре-
рецептором данного типа.
272
Глава XXVI. Биофизика процессов гормональной рецепции
§ 4. Кинетические особенности системы регуляции внутриклеточными
посредниками
После преобразования сигнала гормона в плазматической мембране — в случае ре-
рецепторов, сопряженных с G-белками, — в клетке изменяются концентрации внутри-
внутриклеточных посредников, таких как цАМФ или Са2+, которые в свою очередь влияют
на активность соответствующих протеинкиназ. В результате этой цепи процессов
происходит каскадное усиление сигнала от гормона: число молекул на каждом этапе
возрастает, так что общее число молекул внутриклеточных посредников значитель-
значительно превышает число молекул гормона, связавшихся с рецепторами, а число молекул
ферментов, фосфорилированных протеинкиназами. на порядки превосходит число
молекул посредников.
Образование Р3
Ро- индуцированный Са2+ - индуцированный
выход Са2+ выход Са2+
Гормон
L±z—
Z = Са^ (запуск) + Са^" (пик)
Рис. XXVI. 10.
Схема регуляции внутрикле-
внутриклеточной концентрации ионов
Са2+.
ФФЛС — фосфатидилинозит-спе-
фосфатидилинозит-специфическая фосфолипаза С, 1Рз —
инозит-1,4,5-трифосфат, Р1Рг —
фосфатидилинозит- 1,4-бифосфат,
ДГ — диацилглицерин
Эта сложная система может обладать своеобразным динамическим поведением.
Действительно, оказалось, что для концентрации внутриклеточного посредника, —
ионов Са2+, характерно колебательное изменение в ответ на сигналы гормонов и ме-
медиаторов. В клетке наблюдаются осцилляции внутриклеточной концентрации Са2+
с периодами от < 1 до почти 30 мин. Рассмотрим одну из моделей этого явления
(Голдбетер). Под влиянием гормона и, соответственно, рецептора R с G-белком ак-
активируется фосфатидилинозитспецифическая фосфолипаза С, которая гидролизует
фосфатидилинозит-1,4-бисфосфат с образованием инозит-1,4,5-трифосфата ГРз и
диацилглицерина ДГ (рис. XXVI.10). ГРз воздействует на ГРз-зависимый внутрикле-
внутриклеточный пул Са2+ через свои рецепторы, заполняемые им со степенью C. Скорость
индуцированного выхода Са2+ из 1Рз-чувствительного пула, i>iC, пропорциональна
насыщению C рецептора 1Рз- Таким образом, 1Рз регулирует выход в цитозоль
ионов Са2+, которые в свою очередь запускают осцилляторные циклы выброса
§ 4. Кинетические особенности системы регуляции внутриклеточными посредниками 273
Са + другим, нечувствительным к 1Рз, пулом Са +. В модели рассматриваются две
переменные: Z— концентрация свободного Са в цитозоле и Y — концентрация
ионов Са в 1Рз-нечувствительном пуле, кинетика изменений этих концентраций
может быть записана так:
— = v0 + uiP - v2 + v3 + kfY - kZ,
— =V2-V3-kfY,
(XXVI.4.1)
где Vo и kZ — скорости входа и выхода Са2+ из клетки, соответственно, без гор-
гормональной стимуляции; v2 — скорость АТФ-зависимой накачки Са2+ из цитозоля в
1Рз-нечувствительный пул; г>з —скорость выхода из этого пула в цитозоль; kfY —
скорость пассивной утечки из Y в Z; kZ — скорость выхода цитозольного Са2+ из
клетки. Процессы накачки Са2+ в 1Рз-нечувствительный пул и выхода Са2+ из него
в цитозоль имеют кооперативную природу, а цитозольный Са2+ сам активирует
(автокатализ) выход Са + из 1Рз-нечувствительного пула.
С учетом этого выражение для скорости г>2 входа Са и v$ выхода Са в
цитозоль из 1Рз-нечувствительного пула примут вид:
zn
V2 = VM2
= VM3-
\m ZP (XXVI.4.2)
R
В этих уравнениях Vmi и Умз означают максимальные скорости накачки и утечки
Са , соответственно; сами эти процессы описаны уравнениями Хилла, и коэф-
коэффициенты коопераривности равны п и m; p — степень кооперативности процесса
активирования, а К2, Кц и К а — пороговые константы дня накачки, утечки и
активации. Уравнения (XXVI.4.1) и (XXVI.4.2) имеют единственное стационарное
решение, которое однако не всегда устойчиво. Известно (см. главу II), что когда
неравновесное стационарное состояние становится неустойчивым, могут возникать
незатухающие колебания на траектории предельного цикла. В рассматриваемой
системе они возникают при 29,1% < C < 77,5%, если остальным параметрам, vo, k,
kf, Vi, K2, Кд, VM2, умз придать физиологические значения. Вне этого диапазона
значений параметров стационарное состояние стабильно и колебания не происходят.
Дальнейший теоретический анализ показал, что эффективность фосфорицирования
субстратов Са -зависимой протеинкиназой зависит от осцилляции концентрации
ионов Са и растет с ростом их частоты.
На рис. XXVI. 11 показаны колебания концентрации цитозольного Са2+ (Z)
при увеличении параметра C до 30%, индуцированные увеличением 1Рз в ответ на
внешний сигнал (верхняя часть, сплошная кривая). Одновременно происходят пило-
пилообразные колебания Са2+ во внутриклеточном пуле Y. Колебания концентрации Z
цитозольного Са2+ с периодом около 1 с на рисунке соответствуют наблюдаемым в
некоторых экспериментах, так же, как и с периодом 1 мин в разных типах клеток.
Форма пиков на колебательных кривых может зависеть от природы агонистов.
Так, на клетках печени узкие пики наблюдаются с норэпинафрином, а при
использовании вазопрессина они намного шире. Изменение формы пиков являются
274
Глава XXVI. Биофизика процессов гормональной рецепции
следствием дополнительного ингибирующего действия агонистов на процессы на-
накачки и утечки Са . Например, уменьшение константы К от 10 с до 6 с и, соот-
соответственно, скорости kZ утечки цитозольного Са замедляет скорость релаксации
амплитуды каждого пика. Это приводит к уширению пиков и увеличению частоты
колебаний (рис. XXVI.11, нижняя часть) из-за уменьшения времени, необходимого
для триггерного включения оттока Са2+ из внутриклеточного пула. Модель дает
возможность найти значения параметров, которые соответствуют наблюдаемым в
экспериментах различным колебаниям. Таким образом, условие возникновения коле-
колебаний в этой регуляторной системе состоит в автокаталитическом Са2+-зависимом
выходе Са2+ из внутриклеточного пула Y. Колебания являются следствием увели-
увеличения концентрации цитозольного Са +, вызванного в свою очередь ростом 1Рз при
стимуляции клетки гормоном.
YY\
¦
0 2,00 4,00
1111
JuUuu
1
u\
) 2,00 4,00
Время,
/
/
6,00
1 1
w
6,00
с
2,00
1,50
1,00
0,50
0
8,00 10,0
1 1 1
\W\:
1,50
1,00
0,50
0
8,00 10,0
Рис. XXVI.11.
(по Goldbeter et al., 1990)
Верхняя часть: колебания концен-
концентрации цитозольного Са2+ (Z,
сплошная кривая); колебания кон-
концентрации Са2+ в 1Рз — нечув-
нечувствительном пуле (У, штриховая
кривая).
Нижняя часть: колебания Z при
меньшем значении константы К
(К = 6 с) выхода Са2+ из клетки
(в верхней части К = 10 с). Зна-
Значения остальных параметров так-
также лежат в физиологическом диа-
диапазоне.
В настоящее время обнаружены колебания внутриклеточных концентраций ря-
ряда веществ, принимающих участие в регуляции метаболизма.
Отметим колебания значений внутриклеточных концентраций ионов водорода,
также играющих важную регуляторную роль.
По-видимому, физиологическая роль такого рода колебаний состоит в возмож-
возможности дополнительного кодирования передающейся в клетке информации не только
по стационарному уровню, но и по частоте и форме колебаний внутриклеточных
концентраций сигнальных веществ, играющих ключевую роль в регуляторных си-
системах клетки.
Биофизика
фотобиологических процессов
IX
Первичные процессы
фотосинтеза
XXVII
Трансформация энергии
в первичных процессах
фотосинтеза
XXVIII
Электронно-конформационные
взаимодействия
в первичных процессах
фотосинтеза
276
Фотобиология изучает действие света на различные биологические системы.
Современный этап развития этой области биологии характеризуется глубоким про-
проникновением в молекулярные механизмы первичных реакций, выяснением внутрен-
внутренней организации фотоэнергетических и фоторецепторных систем. Проблемы фо-
фотобиологии оказались в центре внимания серьезных биофизических исследований,
а их результаты во многом обогатили современную молекулярную биофизику и, в
частности, способствовали раскрытию механизмов электронно-конформационных
взаимодействий. Существуют разнообразные фотобиологические процессы, к важ-
важнейшим из которых относятся фотосинтез, зрение, фоторецепторные реакции, де-
деструктивное действие ультрафиолетового света.
¦\У Во всех фотобиологических процессах энергия света необходима для преодоле-
ния активационных барьеров химических превращений. Однако в фотосинтезе
при этом происходит непосредственное запасание световой энергии и виде энергии
химических связей, конечных продуктов (глюкоза), поскольку последние облада-
обладают большим запасом свободной энергии по сравнению с исходными веществами
(СОг и Н2О). В остальных фотобиологических процессах свет также индуцирует
фотохимические реакции, но в их продуктах не содержится избытка свободной
энергии по сравнению с исходными веществами. Тем не менее и в этих случаях в
последующих за фотохимической стадиях темновых процесах могут инициировать-
инициироваться сложные физиолого-биохимические превращения, в ходе которых мобилизуются
большие количества свободной энергии, ранее запасенной в биоструктурах. Ко-
Конечные результаты такого рода превращений (например, стимулирующее действие
света на морфогенез, биосинтез пигментов, фотостимуляция дыхания) по общему
энергетическому эффекту могут быть весьма велики, хотя непосредственного запа-
запасания энергии света при этом и не происходит. Последовательность превращений
в фотобиологических процессах может включать следующие стадии: поглощение
света хромофорной группой и образование электронно-возбужденных состояний —>
миграция энергии электронного возбуждения —> первичный фотофизический акт и
появление первичных фотопродуктов —> промежуточные стадии, включая перенос
заряда, -* образование первичных стабильных химических продуктов -* физиолого-
биохимические процессы -* конечный фотобиологический эффект. ?
Выяснение механизмов и путей регуляции начальных этапов трансформации
энергии электронного возбуждения и сопровождающих ее молекулярных превраще-
превращений, включая изменения в хромофорных группах, их белковых носителях и окру-
окружающей мембране, представляет собой одну из основных задач биофизики. Эта
проблема связана с выяснением роли и механизмов участия электронно-возбужден-
электронно-возбужденных состояний в биологических процессах. Специфическая особенность фотобиоло-
фотобиологических процессов, отличающая их от других темновых биохимических реакций,
состоит в том, что источником электронного возбуждения здесь являются кванты
света. Однако, несмотря на это отличие, биофизические исследования в области
фотобиологии привели к установлению ряда закономерностей, имеющих общебио-
общебиологическое значение.
Глава XXVII
Трансформация энергии в первичных процессах
фотосинтеза
л . - i
. I I,
t ¦ I •
§ 1. Общая характеристика начальных стадий фотобиологических процессов
В гл. X, XII было показано, что при поглощении кванта света один из электро-
электронов, находящийся на нижнем энергетическом уровне на связывающей орбитали,
переходит на верхний энергетический уровень, заполняя нижнюю разрыхляющую
орбиталь и переводя тем самым молекулу в возбужденное электронное состояние
(синглетное Si или триплетное Г, см. рис. Х.5). Существуют различные пути транс-
трансформации энергии возбуждения, включающие внутримолекулярную конверсию, бе-
зызлучательную передачу энергии возбуждения другой молекуле (миграция энер-
энергии) и использование энергии возбуждения в каких-либо фотохимических реакциях:
А*
Внутримолекулярная
Миграция конверсия
энергии
где кф, км, к — константы скоростей соответствующих процессов, причем к пред-
представляет собой суммарную вероятность внутримолекулярной дезактивации возбу-
возбужденного состояния [см. (Х.2.8)]: к = р + q + г где р, q, r — частоты переходов
в единицу времени с синглетного возбужденного уровня «Si на основной с испус-
испусканием света флуоресценции р, тепловой дезактивации состояния Si(q), конвер-
конверсии Si -+T(r).
Согласно (Х.2.10), выход флуоресценции без учета миграции энергии км равен
B=p/(p+q + r)=p/k, (XXVII.1.1)
а при учете фотохимического процесса
В1=р/(к + кф). (XXVII.1.2)
Так как, согласно (Х.2.8),
T = l/(p + q + r) = l/k, (XXVII. 1.3)
то
В=рт. (XXVII. 1.4)
278
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
При фотохимической дезактивации возбужденного состояния
Ti = 1/(к + кф).
Аналогично получим, что
В! = 1/Т1
ИЛИ
= A/р)В = т0В,
(XXVII.1.5)
(XXVII. 1.6)
(XXVII.1.7)
где р = 1/то —вероятность флуоресценции.
Таким образом, время жизни ii пропорциональ-
но величине выхода флуоресценции В. Квантовая
эффективность Ф фотохимического процесса свя-
связана с выходом флуоресценции В. Очевидно,
л*+в
АЕ,
дя,
Ф = кф/(к + кф).
(XXVII. li
Комбинируя уравнения (XXVII.1.1)-(XXVII.1.7),
найдем
Ф = 1 - В1/В или Ф = 1 - ti/t. (XXVII. 1.9)
Реакционная способность возбужденной светом
молекулы определяется рядом факторов. Она зави-
зависит от положения возбужденного энергетического
электронного уровня, что обеспечивает преодоле-
преодоление энергетического барьера (рис. XXVII. 1). Боль-
Большое значение имеет время жизни т возбужденного
состояния, в течение которого сохраняется избы-
избыток энергии в молекуле. Во многих фотохимиче-
фотохимических процессах реализуется высокая реакционная
способность триплетного состояния. Она обусло-
обусловлена его относительно большим временем жизни
(тт 3> fsi), а также бирадикальными свойствами.
В триплетном состоянии молекула обладает двумя
неспаренными электронами, приобретая тем самым свойства анион-радикала на
время существования возбуждения. Известно, что в реакционноспособных анион-
радикалах, полученных путем восстановления нейтральных молекул, присоединен-
присоединенный электрон занимает нижнюю вакантную разрыхляющую орбиталь, но не может
понизить свой энергетический уровень и перейти в систему связывающих орбита-
лей, поскольку последние полностью заполнены в нейтральной молекуле.
Собственно фотохимические превращения проходят, как правило, в виде одно-
квантовых фотохимических процессов. Исключение представляют условия мощного
светового лазерного возбуждения, когда за время возбужденного состояния молеку-
молекула успевает поглотить второй квант, так что становится возможным двухфотонное
hv
А+В
Рис. XXVII. 1.
Энергетическая схема фото-
фотохимического процесса А* +
+ В ^Р
АЕ\ — энергия активации темно-
вой реакции А + В -> Р; АЕ2 —
энергия активации фотохимиче-
фотохимической реакции А* + В -> Р (АЕ\ >
> АЕ2)
§ 1. Общая характеристика начальных стадий фотобиологических процессов 279
возбуждение одной молекулы и переход ее на верхние возбужденные уровни:
So
Механизмы одноквантовых фотохимических процессов весьма различны. Очевид-
Очевидно, что бимолекулярная фотореакция произойдет, когда второй реагент успеет
достичь возбужденной молекулы до того, как она дезактивировалась.
При этом должно выполняться соотношение 1/кф < т, где т — время жизни
соответствующего состояния Si или Т.
Как правило, диффузионные процессы в конденсированных средах, которы-
которыми являются биологические мембраны, не успевают обеспечить высокую частоту
встреч реагентов за время жизни Si состояния. Это затруднение, однако, несуще-
несущественно для триплетного состояния. Оно также облегчается, если молекула обра-
образует комплекс со вторым реагентом в основном или возбужденном состоянии —
эксиплекс. В этом случае возможна реакция присоединения, например образование
димеров: А + hv -* А* + А -* (А*...А) -* А—А + /п>фл.
Возбужденные молекулы обычно реагируют мономолекулярно, т. е. диссоции-
диссоциируют с образованием ионов, радикалов:
(А-В) -^ (А-В)*
А + В
или изомеризуются (фотоперегруппировка):
Фотохимическим путем может происходить перенос протона: его присоединение
А* + ВЯ -* АН+ + В~ или отдача (АН)* + В — А~ + Н+Б, а также фотоперенос
электрона по типу окислительно-восстановительных реакций: А* + В -* А+ + В~;
А* + С -* А- + С+.
^—р В биологических системах диффузионные процессы, как правило, ограничены
по сравнению с растворами; константы скоростей обычных ферментативных
процессов не превышают 102-103 с. Это делает наиболее вероятным осуществле-
осуществление начальных стадий фотобиологических процессов по типу внутрикомплексных
превращений. Иными словами, реакционный комплекс, включающий поглощающую
свет молекулу-сенсибилизатор и молекулы других реагентов, исходно уже образо-
образован. Эта принципиальная особенность биологических систем накладывает глубокий
отпечаток на механизмы трансформации и использования в них энергии электрон-
электронного возбуждения. ?
280 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
§ 2. Общая схема первичных процессов фотосинтеза
Сущность фотосинтеза составляет происходящее в клетках фототрофных организ-
организмов превращение световой энергии в биохимически доступную форму энергии, за
счет чего в конечном итоге в клетках синтезируются органические соединения.
Уникальность фотосинтеза как физико-химического процесса связана с ин-
индуцируемым светом переносом электрона против градиента термодинамического
потенциала от соединений с высоким окислительным потенциалом к соединениям с
высокой восстановительной силой. Результатом этих — первичных — процессов фо-
фотосинтеза, определяющих в основном его специфику, является фотосинтетическое
фосфорилирование и фотосинтетическое восстановление пиридиннуклеотидов.
Обобщенное уравнение фотосинтеза можно представить следующим образом:
СО2 + 2Е2А -* (СН2О) + Н2О + 2А,
где Н2А— донор электронов, (СН2О)—элементарное звено углевода.
Различные организмы отличаются природой донора электронов, необходимого
для функционирования фотосинтетической электрон-транспортной цепи.
Эволюция фотосинтеза включала переход от анаэробных бактериальных ор-
организмов, утилизирующих в качестве донора различные соединения серы, азота,
простейшие органические соединения, к цианобактериям, водорослям и высшим
растениям, перешедшим к использованию Н2О в качестве источника электронов
водоросли и высшие
цианобактерии э- растения
зеленые пурпурные серные пурпурные несерные
фотосинтезирующие >- фотосинтезирующие >- фотосинтезирующие
бактерии бактерии бактерии
В основе первичных процессов фотосинтеза ППФ лежит сложная совокупность
окислительно-восстановительных реакций переноса электрона между компонента-
компонентами электрон-транспортной цепи ЭТЦ. Наибольший интерес представляют меха-
механизмы трех основных стадий трансформации энергии в ППФ: поглощение света
фотосинтетическими пигментами и миграция энергии электронного возбуждения
на РЦ фотосинтеза; первичное разделение зарядов и трансформация энергии в
РЦ; перенос электрона по ЭТЦ и сопряженные с ним процессы, приводящие к
образованию первичных стабильных продуктов (НАДФ и АТФ), используемых в
дальнейших темновых реакциях фиксации СО2 и образования конечных продуктов
фотосинтеза.
Рассмотрим общие особенности функционирования и организации ППФ.
В фотосинтезе высших растений перенос электрона от воды (окислительно-
восстановительный потенциал полувосстановления, ?а/2, при рН 7 равен +0,82 В)
к НАДФ (Ei/2 ~ —0,32 В) осуществляется при затрате энергии двух квантов
света с участием соответственно двух функционально сопряженных и работающих
последовательно фотосистем (ФС II и ФС I). Схема взаимодействия фотосистем и
промежуточных переносчиков в ЭТЦ фотосинтеза высших растений показана на
рис. XXVII.2; там же даны соответствующие значения i?i/2 компонентов ЭТЦ.
i 2. Общая схема первичных процессов фотосинтеза
281
Некоторые общие особенности функционирования этой системы были устано-
установлены еще до расшифровки деталей ее организации.
В 30-е годы известными опытами Р. Эмерсона и В. Арнольда с прерывистым
освещением было измерено количество кислорода, выделяемого клетками хлореллы
-0,9
-0,6
04
-0,3
0,3
0,6
/
ФС II
Av,
Н,0
Диурон
А/В
Ферредоксин
НАДФ
Цитохром 6563
Пул
пластохинонов
Цитохром/
Пласто- р
цианин^ ^/00
/*
ФС\
0,9 ¦
Рис. XXVII.2.
Первичные процессы фотосинтеза высших растений:
J — первичный акцептор ФСП; Aq, Ai,Fx,Fj^,Fg — акцепторы ФС I
В соответствии с представлениями о последовательном взаимодействии двух фотосистем (ФС I и
ФС II) в так называемой Z-схеме фотосинтеза восстановленные продукты ФС II служат донорами
электронов для ФС I. Возбуждение светом, который в основном поглощается ФС II, приводит к
восстановлению промежуточных переносчиков, а возбуждение ФС I, наоборот, к их окислению
под действием вспышек света длительностью 10 5 с. Величина темнового интервала
(~ 0,02 с) между вспышками, необходимого для использования поглощенной свето-
световой энергии и выделения СЬ, ясно указывала на участие ферментов, лимитирующих
общую скорость ППФ. При относительно большом числе промежуточных стадий
переноса (рис. XXVII. 2) это, очевидно, свидетельствует о больших скоростях от-
отдельных этапов транспорта электрона. Было также показано, что ферментативная
282
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
система, ответственная за выделение одной молекулы Ог, обслуживается одновре-
одновременно несколькими сотнями молекул хлорофилла. Комплекс светособирающих пиг-
пигментных молекул, передающих энергию на один фотоактивный центр (ФС I и
ФС II), получил название фотосинтетической единицы (ФСЕ).
Оставалось, однако, неясным, от-
отражает ли понятие ФСЕ реальную мо-
молекулярную организацию фотосинте-
фотосинтетических мембран, когда каждый све-
тособирающий пигментный комплекс
обслуживает «свой» РЦ (уницентраль-
ная модель). Другая возможность со-
состоит в том, что РЦ как бы вкраплены
в светособирающую антенну, а перенос
энергии возбуждения носит статисти-
статистический характер и не имеет никаких
топографических ограничений (муль-
тицентральная модель).
Пигментные системы, входящие в
При добавлении диурона Ц^/не восстанавливается
Рис. XXVII.3.
Окисление и восстановление цитохро-
цитохрома /: при действии дальнего красного
X > 680 нм и красного X ~ 562 нм света,
соответственно
состав ФС I и ФС II, отличаются по
своим спектральным свойствам, а хло-
хлорофилл ФС I поглощает в более длинно-
длинноволновой области по сравнению с хло-
хлорофиллом ФС П. Это позволяет селек-
селективно возбуждать фотосистемы: отдельно ФС I (X > 680 нм) и вместе ФС 1+ФС II
(X < 680 нм).
Опытами Л. Н. М. Дюйзенса A961) на водорослях методами абсорбционной
дифференциальной спектрометрии показано, что длинноволновый свет (X > 680 нм)
вызывает окисление цитохрома / (регистрировалось по уменьшению поглощения
при 420 нм). Использование коротковолнового освещения (X ~ 562 нм) приводило к
частичному восстановлению цитохрома / (рис. XXVII.3). Ингибитор фотосинтеза
ДХММ C-C,4-дихлорфенил)-1,1-диметилмочевина), или диурон, снимал восстана-
восстанавливающее действие коротковолнового света. Согласно Z-схеме (см. рис. XXVII.2),
дальний красный свет окисляет цитохром, отбирая от него электроны для вос-
восстановления первичного окислителя, образуемого ФС I. Коротковолновый свет
восполняет убыль электронов на цитохроме за счет восстановления его ФС П.
Диурон блокирует этот процесс, что приводит к ингибированию выделения Ог.
Объект можно освещать двумя последовательными вспышками света: вначале крас-
красного (X < 680 нм), затем дальнего красного света (X > 680 нм). Тогда электроны,
освобожденные в ФС II в ответ на первую вспышку, достигнут через определенное
время цитохрома /, который затем окислится фотосистемой ФС I под действием
второй вспышки. Варьирование интервала времени между вспышками позволяет
определить время, необходимое для переноса электрона на цитохром от ФС II; оно
составляет ~ 5 • 10 ~3 с.
Роль донора электронов для ФС I, видимо, играет пластоцианин — медь-со-
держащий белок (?4/2 ~ +0,37 В). Электроны от первичных акцепторов ФС II
принимают на себя пластохиноны (E\ji ~ +0,06 В), единственные двухэлек-
§ 2. Общая схема первичных процессов фотосинтеза 283
тронные переносчики в ЭТЦ, которые при восстановлении одновременно при-
присоединяют протоны. Помимо цитохрома /, существуют цитохромы Ь (цит. Ъ§,
Ei/2 ~ —0,03 В), которые контактируют с ФС I и участвуют в циклическом
электронном транспорте. Цитохром Ьд связан с ФС II, так что на каждый РЦ
приходится 1-2 молекулы этого цитохрома. Такова последовательность донор-
но-акцепторных актов, сопровождающих перенос электрона по ЭТЦ в хлоропластах
(см. рис. XXVII.2).
\—? Важнейшая особенность топографической организации ППФ состоит в том,
что отдельные переносчики ЭТЦ в хлоропластах объединены в единые элек-
электронно-транспортные макромолекулярные комплексы, локализованные в фотосин-
фотосинтетических мембранах. Наибольшее значение имеют следующие из них: светособи-
рающий пигмент-белковый комплекс (ССПБК), от которого энергия возбуждения
направляется на РЦ; комплексы фотосистем ФС II (ПБК II) и ФС I (ПБК I),
включающие помимо светособирающего, или антенного, хлорофилла а фотохими-
фотохимически активные пигменты Pqso и -Ргоо соответственно, а также непосредственные
доноры и акцепторы электронов для РЦ фотосистем; цитохромный комплекс b^—f,
который состоит из пяти белковых субъединиц и включает цитохром /, два цито-
цитохрома &б, а также железосерный белок Риске. Цитохромный комплекс ответствен за
последовательный перенос электрона между фотосистемами и циклический транс-
транспорт электронов вокруг ФС I. АТФазный сопрягающий комплекс CFq — CFi был
рассмотрен в гл. XXIV. ?
На рис. XXVII.4 схематически показано расположение этих комплексов в фо-
фотосинтетической мембране тилакоида. Как видно, электрон на своей пути пересе-
пересекает мембрану, проходя через комплекс b$-f от ее внутренней стороны, где рас-
расположена донорная часть ФС II, на наружную сторону к акцепторному участку
ФС I. Взаимодействие между макромолекулярными комплексами ФС I, b^-f и ФС II
осуществляется при посредстве подвижных переносчиков — пластоцианина Пц и
пластохинона Пх, причем молекулы последнего образуют пул, содержащий не ме-
менее 10 молекул Пх на один Пц. Другой подвижный переносчик — ферредоксин —
акцептирует электроны у ФС I, осуществляя связь ППФ с темновыми процессами.
Своеобразное сочетание обычных диффузионных и внутрикомплексных реакций в
ЭТЦ накладывает свой глубокий отпечаток на кинетику и физические механизмы
переноса электрона.
Приведенная на рис. XXVII.4 схема показывает асимметричный характер по-
поперечного расположения донорных и акцепторных компонентов ФС I и ФС II в
мембране тилакоида. В последние годы стало ясно (Дж. Андерсон, Дж. Барбер),
что и латеральное расположение комплексов в плоскости мембраны носит явно вы-
выраженный гетерогенный характер (рис. XXVII. 5). Как видно из рисунка, пигмент-
пигментные системы ФС II и ФС I пространственно разобщены, что затрудняет миграцию
энергии электронного возбуждения между ними.
Важным фактором, регулирующим этот процесс, становится конформационное
состояние мембраны тилакоида и белковой части ССПБК, а также движения ком-
комплексов, от которых зависят расстояния между молекулами пигментов, входящих
в состав ФС II и ФС I. Одновременно возрастает и роль подвижных переносчиков,
обеспечивающих перенос электрона между этими комплексами.
284
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Наружная
сторона
АТФ
1/2О2
Рис. XXVII.4.
Электрон-транспортная цепь фотосинтеза и сопрягающий комплекс в мембране ти-
тилакоида:
I — комплекс ФС I, II — комплекс ФС II, III — цитохромный b§-f, CFi + C-Fo-сопрягающий ком-
комплекс, Фд — ферредоксин, Фдвосст — ферредоксин-НАДФ-редуктаза; пути электронного транс-
транспорта обозначены стрелками (остальные объяснения в тексте)
H ~ ФС II и светособирающая антенна
? -ФС1
О - CF1 + CF0
Рис. XXVII.5.
Гетерогенное распределение комплексов
фотосистем и сопрягающего фактора в
латеральном плане мембран: 1 — мем-
мембраны гран, 2 — мембраны стромы
Гранальная часть, включающая мембраны контактирующих тилакоидов, содержит комплексы
ФСП ФС II и светособирающий пигмент-белковый комплекс (ПБК). В то же время стромальная
часть тилакоида (ламеллы, соединяющие граны тилакоида) содержит в основном комплексы ФС I и
только 10-20% общего количества комплексов, содержащих РЦ ФСП и светособирающего комплек-
комплекса ССПКБ. Здесь же одновременно присутствуют ферредоксин-НАДФ-редуктаза и сопрягающий
фактор CFq
i 2. Общая схема первичных процессов фотосинтеза
285
периплазма
цитоплазма
2Н+ 2Н+
Рис. XXVII.6.
Циклический электронный транспорт и его компоненты у пурпурных бактерий.
В верхней части пространство периплазмы (показан цитохром сг, способный диффундировать
в пространство периплазмы), внизу пространство цитоплазмы, и между ними фотосинтетиче-
фотосинтетическая мембрана. В мембране слева показан реакционный центр с первичным донором электронов
Р%70 и вспомогательные молекулы бактериохлорофилла В^, Вм, первичный акцептор электрона
бактериофеофитин I, а также первичный и вторичный хиноны Qa и Qb- Справа в мембране
показан убихинон-цитохром с окидоредуктаза с двумя цитохромами ci, b. Точная локализация
цитохрома с и белка Fe—S Риске еще не известна. Цитохром с — низкопотенциальный, обеспечи-
обеспечивает нециклический транспорт электрона от внешнего донора НгА через сг- Идентифицированы
четыре убихинона: Qa и Qb в реакционном центре, Qc и Qz на оксидоредуктазе. Места действия
ингибиторов миксотиазола тух и антимицина ant показаны двойными стрелками.
В фотосинтезе бактериального типа источником электронов служат внешние
доноры водорода (простые органические молекулы, сероводород).
Ключевым компонентом бактериальной фотосинтетической цепи являются ци-
тохромы типа & и с. В цитохромах типа с гем ковалентно связан с белком, а в
цитохромах типа Ь — нековалентно. На рис. XXVII.6 приведена упрощенная схема
электронного транспорта в фотосинтезе бактериального типа, где формально объ-
объединена компоненты разных типов бактерий.
Впервые участие цитохромов в фотосинтезе было обнаружено в 1954 г.
Л. Н. М. Дюйзенсом, который обнаружил соответствующие спектральные изме-
изменения в клетках бактерии Rhodospirillum rubrum, освещенных красным светом.
286 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
С тех пор было показано, что цитохромы & и с участвуют в циклическом и
нециклическом фотосинтетическом электронном транспорте. У пурпурных бак-
бактерий было обнаружено два функционально и структурно отличающихся класса
цитохромов с: водорастворимые подвижные высокопотенциальные цитохромы
(E\j2 ~ +300 мВ), структура и функции которых аналогичны митохондриальным
цитохромам с; мультигемовые низкопотенциальные {Е1/2 ~ +10 мВ) цитохромы с,
прочно связанные с мембраной и фотосинтетическим реакционным центром. Через
них осуществляется медленный нециклический транспорт от внешнего донора для
восполнения убыли электронов в циклической цепи переноса.
В ходе циклического транспорта растворимый цитохром с переносит элек-
электрон от убихинолащитохром с оксидоредуктазы на фотоокисленный фотосинтети-
фотосинтетический реакционный центр. Можно выделить 3 стадии этого процесса: 1) диффузия
вдоль внутриплазматической мембраны или в периплазматическом пространстве
(на рис. XXVII.6 показана пунктирной стрелкой); 2) электростатическое связы-
связывание с реакционным центром; 3) собственно электронный перенос. В настоящее
время считается, что этот перенос происходит по туннельному механизму с участи-
участием некоторых ароматических аминокислотных остатков полипептидной цепи белка
реакционного центра (подробнее см. главу XXVIII).
Перенос электрона с участием мультигемового мембранно-связанного цито-
хрома включает в себя лишь третью стадию, поскольку цитохромная субъединица
находится в устойчивом связанном состоянии в мембране.
В состав фотосинтетической цепи переноса электронов включены также
цитохромы с третьего типа [с\), которые служат хромофорной группой убихи-
нолщитохром с оксидоредуктазы.
Биохимические реакции, контролируемые диффузией, характеризуются време-
временами порядка 100 мкс и более. Собственно акт переноса электрона от связанного
цитохрома на окисленный реакционный центр занимает несколько микросекунд,
причем реакция может протекать не только при комнатной, но и при криогенных
температурах. Исследование температурных зависимостей фотоиндуцированного
окисления мембранно-связанных цитохромов позволяет исследовать физические ме-
механизмы переноса электронов в биологических системах (см. гл. XXVIII).
§ 3. Строение фотосинтетического пигментного аппарата и миграция энергии
Структурная организация пигмент-белковых комплексов антенны. Структурная
организация светособирающих пигмент-белковых комплексов (ССПБК) определяет
их функционирование в фотосинтетической мембране. Эти комплексы являются
основными компонентами, обеспечивающими перенос энергии к РЦ фотосинтеза и
ее перераспределение между фотосистемами.
В последние годы удалось расшифровать детали структурной организации
некоторых светособирающих комплексов (ССК), а также обнаружить ряд новых
ССК и высказать предположение об их функциональной роли.
В фотосинтетических мембранах основным ССПБК служит комплекс, в со-
состав которого входят субъединицы с М.м. 28, 27 и 25 кДа. Наиболее тяжелые
субъединицы формируют периферическую (внешнюю) антенну ФС II и предста-
представлены тримерами. Эти белки могут фосфорилироваться с помощью протеинки-
§ 3. Строение фотосинтетического пигментного аппарата и миграция энергии 287
назы, активируемой восстановлением пластохинона, и мигрировать в стромаль-
ную область, перераспределяя энергию в пользу ФС I (см. далее). Белки с М.м.
25 кДа более прочно связаны с кор-комплексом ФС II (ПБК II) и, по-видимому,
представлены мономерами. Кроме основного ССПБК существуют специфические
для каждой из фотосистем антенные белки, непосредственно взаимодействующие с
кор-комплексом ФС II (ПБК II) и ФС I (ПБК I). В случае ФС II это белки с М.м.
24, 26 и 29 кДа (СР24, СР26, СР29). Эти антенные комплексы связывают основную
массу ССПБК с ядром (или кор-комплексом) ФС II и непосредственно передают
энергию на ПБК II, а также могут участвовать в процессе нефотохимического
тушения энергии возбуждения. Специфическими светособирающими комплексами,
связанными с кор-комплексом ФС I, служат белки с М.м. от 20 до 25 кДа четырех
типов.
Все перечисленные выше светособирающие комплексы несут в своем составе
хл. а и хл. Ь различных соотношениях, а также каротиноиды, и являются полипе-
полипептидами, кодируемыми ядерными генами.
Светособирающие комплексы отличаются своими спектральными свойствами
и содержат различные пулы определенным образом организованных молекул пиг-
пигментов, имеющие характерные спектральные компоненты (полосы) поглощения и
флуоресценции и называемые ранее формами пигментов. В ряде случаев опреде-
определенный ансамбль одинаковых молекул пигмента может иметь несколько полос по-
поглощения, как, например, в случае кластеров с экситонным взаимодействием между
молекулами.
Наиболее хорошо изученным в структурном отношении является основной
ССПБК, субъединицы которого формируют тримеры, образующие внешнюю
антенну ФС П. Каждый мономер представлен тремя трансмембранными а-спи-
ралями А, В и С, длина которых составляет 43 А, 51 А и 32 А, соответственно.
Центральные А- и В-спирали расположены под углами 25° и 31° относительно
нормали к плоскости мембраны и слегка переплетены, а С-спираль — под углом 9°
и локализована со стороны В-спирали. В составе мономера была обнаружена также
короткая спираль D, расположенная на границе мембраны в люменальной области.
В пределах трансмембранных спиралей локализованы 12 молекул хлорофилла G хл. а
и 5 хл. Ь) и 2 молекулы лютеина. Все порфириновые кольца ориентированы почти
перпендикулярно к плоскости мембраны и расположены на двух уровнях у наружной
и внутренней поверхности тилакоидной мембраны. Расстояния между молекулами
пигментов составляют 9-14 А, что приводит к экситонным взаимодействиям между
ними. В таких системах делокализация экситона происходит за 10~13-10~14 с.
«Функциональное ядро» или кор-комплекс ФС II (ПБК II) включает два ан-
антенных белка с М.м. 40-45 и 45-51 кДа (СР 43 и СР 47) и комплекс РЦ ФС II
(?>1-1J-Цит. &559 комплекс РЦ ФС II). Антенные белки связывают 13-15 молекул
хл. а и по две молекулы C-каротина, Пигменты здесь так же, как и в субъединице
ССПБК, по-видимому, организованы в кластеры с экситонным взаимодействием
между молекулами (энергия взаимодействия около 100 см, см. XIII, §3). Если
перенос энергии в пределах кластера осуществляется по экситонному механизму, то
перенос энергии между кластерами на разных мономерах или между кластерами на
разных тримерах во внешней антенне происходит по индуктивно-резонансному ме-
механизму Фёрстера (XIII, § 8) вследствие больших расстояний между хромофорами.
288
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Антенные комплексы ядра ФС II контактируют с комплексом РЦ, причем СР 47
взаимодействует с ним более сильно. В последнее время получены данные о том,
что кор-комплекс ФС II в фотосинтетических мембранах формирует димеры.
На рис. XXVII. 7 приведена модель структурной организации ФС П. Тримеры
основного светособирающего комплекса формируют периферическую и внутрен-
внутреннюю антенну; более плотно связанная с кором антенна образована мономерами
СР 24, СР 26 и СР 29; кор-комплекс содержит комплексы СР 43, СР 47 и комплекс РЦ
ФС II, в состав которого входят D\, D<i белки и цит. &559- На рисунке обозначены
также М.м. не содержащих пигментов белковых субъединиц, входящих в состав
ФС П. Функции некоторых из этих субъединиц пока не выяснены.
ЦИТ А559
Рис. XXVII. 7.
Модель структурной организации белковых компонентов ФС II (по Н.-Е. Akerlund,
1993)
pLHC II и LHC II — внешний и внутренний основной ССПБК, образующий тримеры. Мономерные
ССК: СР24, СР26, СР29. Антенные белки кор-комплекса: СР43 и СР47. Di-D2-4ht. 6559 — белки
комплекса РЦ ФС П. Показаны не содержащие пигментов белки с определенными значениями М.м.
и белки — продукты соответствующих генов.
На рис. XXVII.8 представлена схема организации ФС II с учетом димерной
структуры кор-комплекса. Димер окружен мономерными ССК (СР 24, СР 25, СР 26
и СР 29), которые в свою очередь контактируют с тримерами основного ССПБК.
Кор-комплекс ФС I представляет собой гетеродимер, образованный большими
белковыми субъединицами с М.м. 82,5 и 83,2 кДа, в состав которых входят как
компоненты РЦ ФС I, так и антенные пигменты (около 100 молекул хл. а и 12-16
молекул C-каротина). Антенные пигменты кор-комплекса ФС I формируют по край-
крайней мере два кластера — коротковолновый (Хпогл < 700 нм) и длинноволновый (так
3. Строение фотосинтетического пигментного аппарата и миграция энергии
289
ССПБК
Рис. XXVII.8.
Схема организаций ФС II
с димерной структурой
кор-комплекса (по
S. Jansson, 1994)
Показан тример ССПБК и
мономеры Lhcb3, Lhcb4,
Lhcb5, Lhcb6 (ССПБК 25,
CP29, CP26 и СР24). Каждый
кор-комплекс содержит
антенные СР43 и СР47 и
Di-D2~hht. 6559 комплекс РЦ
ФС П.
= Trimers of Lhcbl/Lhcb2
(ССПБК)
PS I
COPE
я 90
chl a
J
'*$' Г
1 ry
IX
fl
\j
1
0
Л ^^
HM
5
У
10
Рис. XXVII.9.
Схема организации ФС I (по
S. Jansson, 1994)
Показан тример ССПБК и светособираю-
щие мономеры Lhcal, Lhca2, Lhca3, Lhca4,
которые представляют 4 разных типа ССК
ФС I (LHCI' 730, LHCI' 680, LHCI" 730,
LHCI" 680). Кор-комплекс (CORE) содер-
содержит 90-100 молекул хлорофилла а.
290 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
называемые «зацентровые» формы, Хпогл > 700 нм), которые участвуют в переносе
энергии на РЦ ФС I.
На рис. XXVII.9 представлена схема организации ФС I. Кор-комплекс окружен
мономерами светособирающих комплексов четырех типов, с которыми контакти-
контактируют тримеры основного ССПКБ.
В хроматофорах пурпурных фотосинтезирующих бактерий имеется два типа
антенных комплексов, связанных с мембранными белками. Они также образуют
внешнюю и внутреннюю антенны. Внутренняя антенна представляет собой ан-
ансамбль светособиращих комплексов, в которые включены молекулы бактериохлоро-
филла, поглощающие свет при 890 нм. В некоторых видах бактерий в ССК I могут
присутствовать формы Бхл 870, Бхл 875. Они окружают РЦ, образуя кор-комплекс
CCKi Бхл 870-РЦ, в котором энергия возбуждения передается непосредственно
фотоактивному пигменту Р890.
Внешняя антенна образована светособирающими комплексами ССК2 — Бхл 800-
850, куда входят молекулы бактериохлорофилла, поглощающие свет при 800
и 850 нм. По данным кругового дихроизма Бхл 800 находится в мономерном
состоянии, а Бхл 850 представлен формой тесно взаимодействующих молекул.
Недавно была расшифрована кристаллическая структура антенного комплекса
Бхл 800-850 (Macdermot, 1995). Белковый носитель ССК2—Б 800-850 состоит из
трансмембранных 9 спиралей а-апобелков, упакованных в цилиндр радиусом 1,8 нм.
Другие 9 спиралей C-апобелка образуют вокруг него внешний цилиндр радиусом
3,4 нм. Между внешней и внутренней стенками этих цилиндров расположено
18 молекул Бхл 850, тесно упакованных и взаимодействующих друг с другом
(рис. XXVII. 10, А).
Плоскости порфириновых колец расположены перпендикулярно к плоскости
мембраны. Остальные 9 мономерных отдельных молекул Бхл 800 упакованы между
спиралями C-апобелка внешнего цилиндра с плоскостями порфириновых колец
параллельно плоскости мембраны (рис. XXVII. 10,Б). Молекулы каротиноидов
геометрически тесно «сплетены» с фитольными хвостами Бхл.
а- и C-апобелки связаны друг с другом гидрофобными силами и водородными
связями, которые образуются ароматическими остатками триптофана и тиразина.
Молекулы Бхл 850 находятся в гидрофобной среде и образуют Ван-дер-Вааль-
совские связи с аминокислотами а-апобелка. В противоположность этому Бхл 800
образует сильные водородные связи в полярной среде со своим окружением в C-апо-
белке.
Отметим, что молекулы каротиноидов помимо светособирающей и защитной
функции выполняют роль стабилизаторов структуры пигмент-белковых комплексов
фотосинтезирующих бактерий, высших растений и водорослей.
Пути миграции энергии возбуждения. Доставка энергии электронного возбу-
возбуждения к РЦ фотосистем I и II высших растений и РЦ бактериального фотосинтеза
осуществляется за счет миграции энергии в светособирающей антенне. Мигра-
Миграция энергии в фотосинтезе — наиболее изученный тип безизлучательного переноса
энергии электронного возбуждения в биологических системах (см. §9-11, гл. XIII).
Ее функциональное биологическое значение состоит в повышении эффективности
использования поглощенных световых квантов. Действительно, среднее время, не-
необходимое для утилизации энергии кванта света (выделение молекулы О2), соста-
3. Строение фотосинтетического пигментного аппарата и миграция энергии
291
вляет всего 0,01-0,02 с. Время регенерации фотоактивного пигмента РЦ намного
меньше этой величины (^ 10~6 с). Интенсивность дневного солнечного света дости-
достигает 1015-1016 квант • см2 • с. Сечение поглощения молекулы пигмента составля-
составляет 10~15-10~16 см2. Следовательно, каждая отдельная молекула хлорофилла будет
поглощать не более 1-10 квант • с, а при обычных интенсивностях света — еще
36 А
68 А
Рис. XXVII. 10.
(по G. McDermont et al., 1995)
А — Кольцо молекул бакте-
риохлорофилла а Б 850;
Б — Положение молекул бак-
териохлорофилла а Б 800 меж-
между спиралями C-апопротеи-
нов, образующих наружную
цилиндрическую стенку ком-
комплекса
меньше. В этом случае РЦ, практически лишенный собственной светособирающеи
антенны и включающий в свой состав фотоактивный пигмент, будет значительную
часть времени «простаивать». Объединение многих десятков молекул пигментов в
так называемую фотосинтетическую единицу (ФСЕ), обслуживающую фотоактив-
фотоактивный пигмент, предотвращает такого рода потери.
292 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Эффективность и направленность миграции энергии по фотосинтетической
пигментной матрице зависит как от характера локализации молекул пигмента в
пределах данного пигмент-белкового комплекса (ПБК) (т. е. от расстояния между
молекулами и их ориентации), так и от взаиморасположения различных ПБК в
фотосинтетической мембране. Эти факторы в сочетании с различными условиями
светового возбуждения могут привести к тому, что перенос энергии между раз-
разными группами пигментов будет происходить по разным физическим механизмам
(см. § 9-11 гл. XIII) в пределах одной ФСБ. Физические механизмы и пути миграции
энергии связаны с особенностями молекулярной организации ПБК в фотосинтети-
фотосинтетических мембранах. Прогресс в изучении этих механизмов был достигнут на пути
совершенствования препаративных методов выделения таких комплексов.
Исследования динамики переноса энергии возбуждения в наиболее изученном в
структурном отношении ССПБК методами абсорбционной и флуоресцентной спек-
спектроскопии позволили выявить различные кинетические компоненты и интерпре-
интерпретировать характерные времена миграции. Так, перенос энергии между соседними
молекулами хлорофилла, находящимися на расстояниях около 10 А в субъединице,
происходит в субпикосекундном диапазоне A50-300 фс). Обнаружены и другие ком-
компоненты с временами 2-6 пс и 14-36 пс, которые приписываются переносу энергии
между отдельными пигментными кластерами и мономерами в тримере ССПБК,
соответственно. Эти данные коррелируют с предположением об экситонном взаи-
взаимодействии между молекулами в субъединице комплекса и быстрой делокализации
возбуждения в пигментном кластере. Перенос энергии между мономерами в триме-
тримере или между соседними тримерами, когда расстояния между ближайшими молеку-
молекулами хлорофилла превышает 10-15 А, требует уже единиц и десятков пикосекунд
и может осуществляться по механизму Фёрстера.
Перенос энергии между ССПБК и другими ССК наружной антенны ФС II еще
мало изучен вследствие недостаточной информации о структуре и свойствах таких
комплексов. Имеются данные о том, что ССПБК может непосредственно передавать
энергию как на субъединицу кор-комплекса СР 43, так и на СР 47.
Динамика переноса энергии в кор-комплексе ФС II непосредственно связана
с процессами захвата энергии возбуждения реакционным центром ФС II (см. §4
гл. XXVII). Было установлено, что в случае «открытых» РЦ кинетика релаксации
возбужденных состояний в антенне кор-комплекса характеризуется компонентами
с временами 30-60 пс и 150-250 пс, а для «закрытых» центров времена возрастают
и составляют 200-250 пс и 1300 пс (по другим данным, 100 пс, 500 пс и 1500 пс).
В настоящее время нет общепринятых представлений о том, с какими именно кон-
конкретными процессами переноса энергии в кор-комплексе ФС II связаны эти компо-
компоненты.
Исследование кинетики дезактивации возбужденных состояний в кор-комплексе
ФС I позволило обнаружить характерные компоненты в диапазоне 20-40 пс. Впо-
Впоследствии было установлено, что в течение этого времени энергия возбуждения
достигает РЦ ФС I и захватывается им, а за 5-20 пс успевает перераспределиться
между коротковолновым и длинноволновым антенными пулами пигментов. В ли-
литературе имеются данные о том, что время, необходимое для попадания энергии
возбуждения из антенны в РЦ ФС I с последующим «захватом», составляет около
70-80 пс. В кинетике затухания флуоресценции препаратов ФС I, содержащих кор-
§ 3. Строение фотосинтетического пигментного аппарата и миграция энергии 293
комплекс совместно с хл. а/хл. &-светособирающим комплексом ФС I, был обнаружен
компонент с характерным временем 80-120 пс. Этот компонент, по-видимому, свя-
связан с наличием дополнительной антенны и увеличением пути миграции энергии со
светособирающего на кор-комплекс ФС I.
Совокупность полученных экспериментальных данных показывает, что во всех
случаях свет поглощается большой массой антенных пигментов и энергия возбу-
возбуждения быстро передается на реакционные центры. Перенос энергии возбуждения
между ближайшими молекулами пигментов антенны происходит за 0,2-5 пс. Про-
Процесс несколько замедляется при переносе энергии между различными ПБК, отли-
отличающимися взаиморасположением. Время между поглощением фотонов антенной и
фотохимическим захватом энергии составляет для фотосистемы I и бактериальных
комплексов 50-100 пс, в то время как для ФС II — около 300 пс. Такая разница
во времени связана со структурной организацией фотосистем, благодаря которой
ФС II обладает более «мелкой» энергетической ловушкой по сравнению с ФС I. Это
означает, что первичный донор ФС II Р 680 (см. §4, гл. XXVII) энергетически
ближе к антенным компонентам, донирующим энергию непосредственно на РЦ,
чем первичный донор ФС I P 700. Расчеты показывают, что энергетический зазор
между Р 680 и максимумом поглощения антенных компонентов ФС II составляет
около 0,5 кТ, в то время как для ФС I — около 2,5 кТ. Кроме того, процесс захвата
энергии РЦ ФС II в отличии от РЦ ФС I обратим и таким образом необходимое для
такого захвата время 300 пс оказывается больше, чем время для первого попадания
энергии возбуждения в РЦ ФС II и больше, чем требуется для захвата возбуждения
РЦ ФС I. Это может означать, что энергия возбуждения достигает первичного
донора обеих фотосистем примерно с одинаковой скоростью (за 50-100 пс).
Перераспределение энергии возбуждения. Известно, что при одновременном
возбуждении объекта (хлорелла) коротковолновым и длинноволновым красным све-
светом скорость фотосинтеза выше, чем суммарная скорость, складывающаяся из ско-
скоростей раздельного возбуждения двумя длинами волн (эффект Эмерсона). Отсюда
следует вывод о необходимости одновременного функционирования в фотосинтезе
обеих фотосистем. Очевидно, между пигментными системами ФС II и ФС I про-
происходит непосредственное перераспределение поглощенной энергии в зависимости
от интенсивности и спектрального состава освещения. Показано, что освещение
дальним красным светом ФС I вызывает такое изменение фотосинтетического
аппарата, при котором большая часть квантов передается в фотосистему П. Это
приводит к повышению флуоресценции, выход которой у ФС II больше, чем у
ФС I. Свет с меньшей длиной волны дает обратный эффект. Состояние с более
высоким выходом флуоресценции, индуцированное освещением дальним красным
светом, называется состоянием 1, а состояние с низким выходом флуоресценции —
состоянием 2. Перераспределение квантов между двумя фотосистемами может быть
обусловлено как увеличением миграции на ПБК I из ССПБК, так и перераспределе-
перераспределением квантов, уже попавших на ФС II, и их миграцией на ФС I. Последнее явление
получило название спилловер (от англ. spillover — переливание через край).
Комплексы ФС I и ФС II латерально разделены в тилакоидной мембране вслед-
вследствие разной плотности их поверхностных зарядов. Большая плотность поверхност-
поверхностного заряда в комплексе ФС I обусловливает выталкивание их в стромальную часть
из области контакта тилакоидов, которая имеет малую плотность поверхностных
294 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
зарядов. Слипание соседних мембран тилакоидов в граны за счет ван-дер-Вааль-
совых сил притяжения гидрофобных участков происходит в присутствии менее
заряженных комплексов ФС II и ССПБК. Изменение зарядового состояния ком-
комплексов ФС I, ФС II и ССПБК влияет на их взаимное расположение вследствие
электростатических взаимодействий и тем самым может оказывать регуляторное
воздействие на распределение энергии между ними. На этом и основан механизм
«спилловера».
Он носит сложный характер и в основном связан с конформационным состоя-
состоянием фотосинтетических мембран, от которого зависят как взаимные расстояния
и ориентации пигментных комплексов ФС I и ФС II, так и их связь с ССПБК.
В свою очередь, это определяется присутствием ионов, рН среды и в особенности
степенью фосфорилирования белков светособирающего ПБК. Фосфорилирование
белков ССПБК приводит к увеличению миграции энергии к ФС I, т. е. перево-
переводит систему в состояние 2. Аналогичные результаты получают и при инкубации
мембран тилакоидов с АТФ на свету. При низкой концентрации катионов (Mg )
обеспечивается максимальный перенос энергии от ФС II к ФС I. В то же время
высокая концентрация Mg2+ снижает эффективность спилловера. Если мембран-
мембранные белки тилакоидов фосфорилированы и в среде отсутствуют ионы Mg, то 75%
общего числа поглощенных квантов направляется к ФС I. Переходы 1 ** 2 сопро-
сопровождаются структурными изменениями в мембранах, в частности, уменьшением
степени слипания мембран тилакоидов в состоянии 2.
\—? Основной причиной конформационных изменений в мембранах тилакоидов и
перераспределения энергии возбуждения между ФС II и ФС I является измене-
изменение заряда ССПБК. Даже в отсутствие фосфорилирования светособирающего ком-
комплекса, но при низкой концентрации положительных ионов, отрицательные заряды,
находящиеся на поверхности мембранных белков, создают высокий поверхностный
электрический потенциал на тилакоидных мембранах и препятствуют слипанию
тилакоидов. В этих условиях ФС I и ССПБК равномерно распределены в плоско-
плоскости мембраны, благодаря чему возможна эффективная миграция энергии от ФС II
к ФС I. Фосфорилирование ССПБК приводит к появлению на нем дополнитель-
дополнительного отрицательного заряда, что вызывает переход ССПБК в стромальный уча-
участок мембраны и возрастание переноса энергии от него к ФС I. Фофорилирование
ССПБК осуществляется с помощью протеинкиназы, находящейся в гранальных
участках мембраны. Добавление в среду 100 мМ одновалентных катионов или 1 мМ
двухвалентных катионов частично экранирует отрицательные заряды белка, пре-
препятствуя выталкиванию ССПБК в строму, и снижает эффективность «спилловера».
Обратная реакция дефосфорилирования ССПБК, оказавшегося в стромальной ча-
части вблизи ФС I, осуществляется другим ферментом — протеинфосфатазой, кото-
которая находится в стромальном участке мембраны.
Протеинфосфатаза, которая дефосфорилирует ССПБК, вызывает тем самым
возвращение его в гранальную мембрану. Протеинкиназа активируется при восста-
восстановлении пластохинона, переносящего электроны между ФС I и ФС II, и переходит
в неактивное состояние при его окислении. Активность протеинфосфатазы сохра-
сохраняется постоянной. Таким образом, пластохинон служит «датчиком» для сохране-
сохранения баланса энергии возбуждения между фотосистемами. Избыточное возбуждение
§ 4. Механизмы миграции энергии в фотосинтетической мембране 295
ФС II вызывает перевосстановление пластохинона и активацию протеинкиназы. То-
Тогда при фосфорилировании переход части ССПБК из гран в стромальные мембраны
уменьшает поток возбуждений в ФС II и увеличивает его в ФС I. В результате
выравниваются скорости возбуждения ФС I и ФС II, а степень восстановления
пластохинона опять уменьшается. Напротив, избыточное окисление пластохинона
при преимущественном возбуждении ФС I вызывает инактивацию протеинкиназы
и возвращение ССПБК в граны вследствие дефосфорилирования его протеинфос-
фатазой. ?
Перераспределение энергии между фотосистемами отражает большую роль
факторов физиолого-биохимической регуляции в тилакоидной мембране, которые
имеют важное значение наряду с обычными физическими факторами, определяю-
определяющими миграцию энергии (см. § 9-10 гл. XIII). Значение этой регуляции заключается
в возможности изменять соотношение между нециклическим и циклическим элек-
электронными потоками, преимущественно ускоряя последний при фосфорилировании
ССПБК. Было установлено также, что в хлоропластах присутствуют два типа
ФС II, которые различаются по местам локализации и размерам их антенных
комплексов: ФС Па и ФС Пр. Из них ФС Па обладает большой антенной и поэтому
насыщается при более высокой интенсивности света, проявляя и более высокую фо-
фотосинтетическую активность. ФС Пр соответственно обладает меньшей антенной
и раньше насыщается при увеличении интенсивности света.
Локализация большей части ФС II (ФС Па) в гранальной области обеспечивает
основной нециклический поток электронов, восстанавливающий молекулы пласто-
пластохинона, которые затем диффундируют в стромальную область, отдавая электроны
ФС I. Меньшая часть ФС II (ФС Пр), обладающая и меньшей частью ССПБК II
в стромальной области, обеспечивает более слабый поток, взаимодействующий с
интенсивным циклическим потоком ФС I — источником энергии для синтеза АТФ.
\—? Итак, характер расположения и взаимодействия главных макромолекулярных
комплексов меняется в зависимости от конформационного состояния тилако-
тилакоидной мембраны. Организация фотосинтетической единицы (см. §2 гл. XXVII),
видимо, также тесно связана с состоянием мембран тилакоидов, которое определяет
степень обособленности отдельных частей ССПБК и контактирующих с ними РЦ
фотосистем. В зависимости от степени слипания отдельных участков мембраны
возможны и различные переходы от уницентральной до мультицентральной органи-
организации ФСЕ. Такие факторы, как температура, ионный состав, рН среды, состояние
липидной фазы, определяют архитектонику и вязкость мембран, а следовательно
и латеральную подвижность комплексов. С этой точки зрения ясно, что приве-
приведенная на рис. XXVII.2 iT-схема фотосинтеза отражает основную направленность
процессов переноса электрона. В пределах этой схемы скорости и соотношения меж-
между потоками электронов на отдельных участках цепи меняются в зависимости от
физиолого-биохимического состояния клеток фотосинтезирующего организма. ?
§ 4. Механизмы миграции энергии в фотосинтетической мембране
Захват энергии возбуждения в РЦ. Первичная трансформация энергии в фото-
фотосинтезе осуществляется, когда энергия электронного возбуждения, мигрируя по
светособирающей матрице, захватывается фотоактивным пигментом реакционного
296 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
центра. Первые измерения длительности и выхода флуоресценции (см. § 2 гл. X)
пигментов (хлорофилл, бактериохлорофилл) в растворе (т и В) и в клетках фото-
синтезирующих организмов (xi и В\) показали (С. Броди, А.Н. Теренин), что эти
величины составляют: т ~ 5 не, В ~ 0,3, ii ~ 0,3 не, В\ ~ 0,02.
Квантовый выход первичных процессов фотосинтеза достаточно высок. Поэто-
Поэтому указанное сокращение длительности и выхода флуоресценции пигментов в жи-
живых системах должно быть главным образом обусловлено не тепловыми потерями, а
процессом «фотохимической» дезактивации синглетного возбуждения состояния S\
в реакционных центрах фотосинтеза. Независимо от механизма этого процесса РЦ
следует рассматривать как естественные фотохимические тушители флуоресцен-
флуоресценции молекул пигментов светособирающеи матрицы. Можно оценить эффективность
этого тушения, считая, что в фотосинтетической мембране значения констант р, q,
г (см. § 1 гл. XXVII) сохраняются неизменными, а процесс тушения флуоресценции
при захвате энергии реакционными центрами эквивалентен фотохимической дез-
дезактивации кф состояния Si молекул антенны. Тогда, подставляя величины т, В, ii,
В\ в формулы (XXVII. 1.1)—(XXVII. 1.9), найдем, что эффективность использования
возбуждения реакционными центрами составляет Ф ~ 0,93 Ч- 0,95 (Борисов А. Ю.).
\—? Сами РЦ обладают высокой фотохимической активностью, величина кванто-
квантовой эффективности первичного фотохимического процесса в них близка к еди-
единице. Отсюда и из (XXVII.1.9) следует, что в самом РЦ длительность возбужден-
возбужденного состояния молекулы фотоактивного пигмента, в течение которого должен
произойти первичный акт фотосинтеза, не превышает ii ~ 10~п с.
Таким образом, после поглощения света в фотосинтетической мембране на
первом этапе происходит миграция энергии электронного возбуждения по свето-
светособирающеи матрице и захват ее реакционными центрами за времена порядка 0,2-
0,3 не. На втором этапе уже непосредственно в реакционных центрах энергия элек-
электронного возбуждения используется в первичном фотохимическом акте за вре-
время ~ 10~п с. ?
Какие факторы влияют на длительность и выход флуоресценции пигментов в
фотосинтетической мембране? Организация фотосинтетической мембраны носит
явно выраженный гетерогенный характер, где группы пигментов объединены в со-
соответствующие ПБК. Отдельные ПБК, передающие энергию возбуждения по общей
схеме
ПБК II ^ РЦ ФС II
ССПБК (XXVII.4.1)
ПБК I > РЦ ФС I
могут характеризоваться и различными временами жизни флуоресценции в зави-
зависимости от характера их взаимодействия и расстояния между белковыми носи-
носителями и фиксированными на них молекулами пигментов. Соответственно могут
различаться механизмы миграции энергии между молекулами пигментов в случае
§ 4. Механизмы миграции энергии в фотосинтетической мембране 297
переноса между разными ПБК или при миграции в пределах одного и того же
ПБК. Эти особенности должны проявляться в наличии нескольких компонентов
затухания флуоресценции разных групп пигментов, передающих друг другу энер-
энергию и отличающихся по спектральному составу флуоресценции. Можно ожидать
также и проявления зависимости длительности флуоресценции от температуры,
например, при миграции энергии по механизму некогерентного экситона, которая
носит активационный характер (см. §11 гл. XIII).
\—? Длительность флуоресценции групп ПБК, обслуживающих непосредственно ре-
акционные центры, должна также зависеть и от эффективности самого про-
процесса захвата энергии возбуждения в РЦ, т. е. от процесса «фотосинтетического»
тушения флуоресценции. Последнее обстоятельство определяется не только взаи-
взаимодействием между РЦ и принадлежащим ему ПБК, но и состоянием самого РЦ.
Очевидно, активные РЦ, эффективно трансформирующие энергию электронного
возбуждения, дают начало электронному потоку в ЭТЦ фотосинтеза и одновремен-
одновременно являются активными тушителями флуоресценции ПБК. Наоборот, РЦ, которые
по каким-либо причинам не могут передавать электроны в цепь фотосинтеза, не
в состоянии утилизировать энергию электронного возбуждения, которая, следова-
следовательно, остается в ПБК неиспользованной и может высвечиваться в виде флуорес-
флуоресценции с большим временем жизни. ?
Указанные выше закономерности относятся не только к длительности, но и
выходу флуоресценции, величины которых связаны между собой соотношением
(XXVII.1.4). Однако экспериментальное определение длительности флуоресценции
имеет определенные преимущества, так как оно дает непосредственную инфор-
информацию о кинетике процессов дезактивации электронных возбужденных состояний
[см. (Х.2.9)]. В то же время определение выхода флуоресценции сопряжено с необ-
необходимостью учитывать энергию, поглощенную именно данной группой пигментов,
что весьма затруднительно в гетерогенной фотосинтетической мембране.
^—р Фотосинтетические реакционные центры. Основной принцип работы РЦ со-
состоит в том, что возбуждение фотоактивного пигмента приводит к отрыву от
него электрона и восстановлению первичного акцептора, который затем передает
электрон следующему акцептору и далее в ЭТЦ. Общая схема работы РЦ имеет вид
PIQ + hv^ P*IQ -* P+I-Q -* P+IQ-. (XXVII.4.2)
?
Последующее восстановление Р+ происходит от доноров электрона в ЭТЦ в
соответствии с рис. XXVII.2 и XXVII.6. В схеме (XXVII.4.2) символом PIQ обо-
обозначены компоненты РЦ: Р — фотоактивный пигмент, I — первичный акцептор,
Q — следующий за ним акцептор. Роль I в РЦ выполняют порфириновые молекулы
пигментов (хлорофилл в РЦ ФС I, феофитин в РЦ ФС II, бактериофеофитин в РЦ
пурпурных бактерий). В качестве вторичного акцептора выступают молекулы хи-
нона (РЦ пурпурных бактерий), пластохинона (РЦ ФС II) или железосерные белки
(РЦ ФС I). Эффективность отрыва электрона от Р* и перенос его на/и далее на Q
зависят от состояния компонентов РЦ. Так, если I исходно восстановить в темноте,
например за счет создания достаточно низкого окислительно-восстановительного
298 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
потенциала Е^ в среде, то на свету отрыв электрона от Р уже не может произойти.
Точно так же химическое окисление фотоактивного пигмента отнимает у него элек-
электрон и тем самым мешает его способности отдавать электрон на свету первичному
акцептору I. Реакционные центры, находящиеся в активном состоянии PIQ, где пе-
перенос электрона от Р* совершается нормально, называются открытыми центрами.
РЦ не может отдавать электроны в фотосинтетическую ЭТЦ, если он находится в
закрытом состоянии (P+I~Q, P+IQ~, P+IQ, PIQ~ или PI~Q).
Очевидно, в тех закрытых соотояниях, где Р исходно окислен в темноте (Р+),
в ЭТЦ отсутствует первичный донор электрона. В случае, когда в темноте исходно
восстановлены переносчики в акцепторной части, вакантные места для переноса
электрона заняты и Р* также не может дать начало электронному потоку. Оче-
Очевидно, в этих условиях возрастает выход C и длительность т флуоресценции хло-
хлорофилла, энергия электронного возбуждения которого не может использоваться в
первичных процессах фотосинтеза. Однако значения т и C при закрытых РЦ не до-
достигают величин, характерных для разбавленных растворов пигментов, где отсут-
отсутствует фотосинтез. Дело в том, что ион-радикал Р+, образованный в окисленных
РЦ, обладает собственным спектром поглощения, который частично перекрывается
со спектром флуоресценции пигментов ПБК. В результате этого происходит ми-
миграция энергии возбуждения от молекул ПБК на Р+ или диссипация в тепло на Р+.
В РЦ в состоянии PIQ~ появление отрицательного заряда на Q~ препятствует
первичному разделению зарядов и появлению электрона на I (PIQ~ -* P+I~Q~) в
силу электростатического отталкивания.
Поэтому восстановление Q уменьшает тушение флуоресценции антенны реак-
реакционными центрами и увеличивает ее выход и длительность. Кроме того, электро-
электроны, даже появившиеся в этих условиях на I, не в состоянии переходить дальше на
Q~ и возвращаются назад на -Р+, давая начало замедленному рекомбинационному
свечению РЦ:
PIQ- -* P+I-Q- -* P*IQ- -* PIQ + hv.
Длительность флуоресценции пигментов. Значения длительности флуоресцен-
флуоресценции пигментов в клетке были впервые получены методом фазовой флуорометрии.
Метод основан на измерениях сдвига фазы между синусоидально модулированным
возбуждающим световым потоком и возникающим под его действием потоком флу-
флуоресценции в образце. Сдвиг фазы появляется вследствие задержки поглощенных
квантов перед высвечиванием их флуоресцирующими молекулами. Метод дает хо-
хорошие результаты, когда в системе имеется лишь один вид молекул с одним общим
средним временем экспоненциального затухания флуоресценции. В случае несколь-
нескольких компонентов флуоресценции, количество, времена и законы затухания которых
заранее не известны, возможности метода фазовой флуорометрии становятся огра-
ограниченными.
В последние годы благодаря развитию лазерной техники и, в частности, получе-
получению пикосекундных A0~12 с) и субпикосекундных (~ 10~13 с) световых импульсов,
появились методы импульсной пикосекундной спектрофлуорометрии. Флуоресцен-
Флуоресценция образца здесь возбуждается импульсом света, длительность которого намного
меньше времени жизни флуоресцентного состояния исследуемых молекул. Кинетика
затухания флуоресценции регистрируется при разных длинах волн в спектре испус-
4. Механизмы миграции энергии в фотосинтетической мембране
299
кания, а также при различных длинах волн возбуждающего лазерного импульса.
В результате исследований A975-1982) удалось доказать, что кинетика затухания
флуоресценции включает несколько компонентов с различными временами жизни
и спектральным составом, которые соответствуют гетерогенному характеру орга-
организации пигментного аппарата и характеризуют свечение его отдельных частей.
10° и
Ю-3
500
1000
1500
2000
2500
Время, пс
Рис. XXVII. 11.
Кинетика затухания флуоресценции хлоропластов гороха
• — экспериментальные точки; модельная кривая, приближающая кинетику флуоресценции
по методу наименьших нелинейных квадратов Марквардта согласно выражению:
оо
= J K(t - t')
-t' /ti)
-t' /т2) + A3exp(-t/ /x3))dt',
где K(t) —аппаратная функция системы регистрации. Для параметров Ах, ti, Аъ, тг, Аз, тз были
получены следующие значения: Ах = 0,15, ti = 41 пс; А^ = 0,8, тг = 310 пс; Аз = 0,05, тз = 4,6 не.
Предэкспоненциальные коэффициенты Ах, Ai, A3 пропорциональны вкладу соответствующего
компонента в кинетику затухания флуоресценции (аппроксимирующая кривая и компоненты по-
показаны на рисунке сплошными линиями).
Как правило, при комнатной температуре обнаруживаются несколько компонент
свечения с временами жизни, варьирующими в широких пределах в зависимости от
состояния и природы объекта.
На рис. XXVII.11 приведена в качестве примера запись кинетики затухания
флуоресценции хлоропластов, содержащая три компоненты с временами -ц ~ 40 пс,
300 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Т2 — 300 пс, тз — 4500 пс. В других опытах значения т компонентов затухания соста-
составляли 100, 400 и 1100 или 180, 500,1400 пс. В настоящее время существует общепри-
общепринятое представление о том, что кинетику затухания флуоресценции в интактных
системах (хлоропласты высших растений, целые клетки зеленых водорослей) при-
присутствуют по крайней мере три компоненты ii = 80 4 300 пс, Т2 = 400 4 1500 пс и
т3 = 1500 4 4000 пс.
Природа долгоживущих компонент флуоресценции довольно сложна. Во-
первых, молекулы хлорофилла, по тем или иным причинам не связанные с ФСБ,
обладают флуоресценцией с временем жизни тз, близким к т флуоресценции рас-
растворов пигментов E не). Во-вторых, попадание энергии возбуждения в закрытый
реакционный центр PIQ~ вызывает восстановление первичного акцептора и
переход РЦ в состояние Р+1~ Q~. Поскольку дальнейший перенос электрона от /~
на Q~ невозможен, будет происходить рекомбинация зарядов между Р+ и /~ с
переводом Р в возбужденное состояние Р*. Возникающая замедленная флуоресцен-
флуоресценция с S\ -уровня характеризуется увеличенным временем жизни, соответствующим
времени рекомбинации разделенных зарядов в РЦ в состоянии Р+ I~Q~ (Климов).
Остается однако открытым вопрос, насколько велик вклад этого рекомбинаци-
онного свечения в общий выход флуоресценции при закрытых центрах. Поскольку
квантовый выход разделения зарядов в состоянии PIQ~ мал из-за электростати-
электростатического отталкивания электронов на /~ и Q^, возможен также обратный перенос
энергия от Р* в антенну с испусканием флуоресценции. В целом считается, что
затухание флуоресценции антенны ФС I характеризуется временем т ~ 100 пс, а
для ФС II это составляет т ~ 300 пс. Обнаруживаемая короткоживущая компо-
компонента т ~ 10 пс отражает процесс миграции экситона в пределах одного пигмент-
белкового комплекса.
Выделение препаратов ПБК в нативном состоянии делает возможным непо-
непосредственное измерение величин т и соответствующих констант миграции энергии.
Выделенные в чистом виде препараты ССПБК с основным максимумом низкотем-
низкотемпературной флуоресценции при 680-681 нм, не содержащие ФС I и ФС II, характе-
характеризуются значением tlh ~ 2,5 не, которое близко к значению т для разбавленных
растворов пигментов. Следовательно можно полагать, что сокращение т флуорес-
флуоресценции пигментов в фотосинтезирующих организмах до 0,3 не вызвано фотохими-
фотохимической дезактивацией в РЦ, а не бесполезным для фотосинтеза концентрационным
тушением флуоресценции с переводом энергии в теплоту. Для выделенных частиц
ФС II, включающих ССПБК + ПБК II РЦ ФС II, значения тфс п составляли 450 пс,
что отражает миграцию энергии от ССПБК на ФС П. Для целых хлоропластов
(ССПБК + ПБК II РЦ ФС II + ПБК I РЦ ФС I) величина т была еще меньше
(toe п+ФС i — 350 пс вследствие одновременного тушения флуоресценции ССПБК
обоими типами тушащих центров ФС II и ФС I. Легко показать, что
1/тфс п - 1/тпвк = fc"; 1/тфс п+фс i - 1/тпвк - /? = /?, (XXVII.4.3)
где к1ы и к1^ — константы скорости миграции энергии от ССПБК на ПБК ФС I
и ПБК ФС II соответственно. Оценки по формуле (XXVII.4.3) показывают, что
для хлоропластов с активными РЦ к]} и к1ы составляют величины порядка A 4- 2) •
109 с. Такие же значения к1ы получены на хлоропластах из мутантов гороха,
i 4. Механизмы миграции энергии в фотосинтетической мембране
301
лишенных РЦ ФС II, где тпбк+фс i также меньше тпвк A,3 и 2,5-3 не, соответ-
соответственно) .
Для выяснения роли отдельных пулов Хла в флуоресценции ФС I регистрацию
т проводили при разных длинах волн свечения. При измерении температурной за-
зависимости значений т для препаратов ПБК I, обогащенных РЦ ФС I с отношением
Р700 : Хл ~ 1: 100, значения т при комнатной температуре и 77 К составляют < 30 пс
для X = 694 нм, что соответствует скорости переноса возбуждения от Хл а^9,4, на РЦ
ФС I с константой км11БК1 ~ 3 • 1010 с. При понижении температуры значения т
и fc*c ! константы скорости захвата возбуждения РЦ ФС I от Хл а^д4, практически
не менялись, однако они увеличивались до 60 пс при химическом окислении РЦ. Из
величин Тб94 и ^мПБК1 можно оценить константу скорости разделения зарядов в
РЦ ФС I:
-Л.Л Qa(\{\ ( (Ы1 т -* 700-**й -* 700-* ^ь •
1 ехр(АЕ/квТ), где АЕ — энергия активации обратного перено-
д, соответствующая разности максимумов поглощения Р700 и
и равная ~ 0,03 эВ. Отсюда koo-p ~ 0,6fc*c !. Учитывая, что квантовый выход
разделения зарядов в РЦ ФС I близок к единице, можно оценить к\ ~ 10fcO6P =
= 10 • 0,6 • 3 • 1010 с = 1,8 • 1011 с, т. е. т^ l ~ 5,6 пс.
В других работах на частицах ФС I, где отношение Хла : Р700 — 8 Ч- 10, были
найдены более короткие компоненты затухания флуоресценции в области 680 нм
(т ~ 70 пс) и 694 нм (т ~ 10 пс). Эти времена соответствуют переносу энергии от
на Хла694 G0 пс) и далее от Хла694 на Р7Оо ФС I (~ 10 пс).
Здесь ко6р =
са от Р700 на
0,2
77 К
\2
600 650 700 750 800
Длина волны, нм
т, не
2,5
2,0
1,5
1,0
0,5
100
200 300 Г,К
Рис. XXVII.12.
Рис. XXVII. 13.
Спектры флуоресценции хлоропластов при Температурная зависимость т
комнатной A) и низкой B) температурах
По оси ординат — относительная интенсивность флу-
флуоресценции
флуоресценции при 720 нм A)
и 732 нм B) (по В.З.Пащенко,
А. Б. Рубину, 1981)
Хл 0
Какова роль длинноволновых «зацёнтровых» пигментных пулов (или форм)
^02
B переносе энергии, дающих основной вклад в низкотемпературную
длинноволновую полосу флуоресценции хлоропластов (рис. XXVII.12)? С пониже-
понижением температуры свечение при 735 нм характеризуется увеличением т до значений
302
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
2,0-2,5 не при 77 К. Возможно, что увеличение происходит в основном за счет долго-
живущего компонента флуоресценции, вклад которого возрастает при понижении
температуры.
Температурная зависимость т флоуресценции при 720 и 732 нм приведена на
рис. XXVII.13. Роль этих «зацентровых» форм (Хла^ и Хла™)) видимо, состоит
в передаче возбуждения на РЦ ФС I с энергией активации переноса ~ 0,05 Ч- 0,07 эВ.
При температуре ниже 180 К обнаруживается разгорание флуоресценции длинно-
длинноволновых полос (тразг ~ 50 Ч- 150 пс), которое отражает перенос энергии возбужде-
возбуждения от ПБК I на зацёнтровые формы. На основании приведенных выше данных
Хлй,Хла
ССПБК
120 пс
ПБК1
Хл694
/fc> 3-10Ю с-1
< 30 пс
Хл
,720
702
Хл
/740
712
Хл695 ПБК II
Рис. XXVII.14.
Миграция энергии возбуждения в фотосинтетиче-
фотосинтетической мембране (на отдельных этапах миграции ука-
указаны времена (т, пс) и константы (к, с)) переноса
РтооА и Рбво-^ — компоненты реакционных центров
фотосистем I и II
можно составить общую схему миграции энергии без учета всех типов ССК внеш-
внешней антенны, где указаны времена отдельных стадий переноса электронного воз-
возбуждения по пигментному аппарату в фотосинтетической мембране высших расте-
растений (рис. XXVII. 14). При поглощении света энергия возбуждения, попадающая в
ССПБК, направляется двумя потоками к ПБК I и ПБК П.
§ 4. Механизмы миграции энергии в фотосинтетической мембране 303
Как видно из значений констант переноса, миграция энергии между ССПБК и
кор-комплексами обеих фотосистем осуществляется по механизму индуктивного ре-
резонанса (см. §9 гл. XIII). В пределах пигментных кластеров ПБК миграция энергии
происходит по экситонному типу.
Флуоресценция пигментов и захват возбуждения в РЦ. Времена жизни и ки-
кинетика затухания флуоресценции дают важную информацию о функционировании
фотосинтетического аппарата и, в частности, о тушении флуоресценции антенны
реакционными центрами.
Прежде всего необходимо еще раз подчеркнуть, что сокращение длительности
и выхода флуоресценции пигментов в фотосинтетической мембране происходит в
результате захвата энергии электронного возбуждения антенны в реакционных цен-
центрах. Измерение времени затухания флуоресценции выделенных светособиращих
комплексов или в мутантах, лишенных РЦ, дало значения т, в общем близкие к
значениям, характерным для разбавленных растворов пигментов. Это справедливо
как для высших растений (т ~ 2,5-4 не), так и для фотосинтезирующих бактерий
(т ~ 1 не).
Отсюда ясно, что в нормальной фотосинтетической мембране отсутствуют эф-
эффективные виды бесполезного для организма тушения возбуждения. Рассмотрим
соотношение между различными процессами, определяющими эффективность за-
захвата энергии электронного возбуждения антенны в реакционных центрах.
В первоначальных моделях захвата возбуждения РЦ предполагалось, что про-
процесс захвата возбуждения в ловушке РЦ намного эффективнее, чем обратная реак-
реакция возврата возбуждения в антенну (Батлер, 1977). РЦ в этих моделях играли роль
«воронки», куда необратимо стекалась энергия возбуждения. Однако в последние
годы накопились сведения о том, что «узким местом» в утилизации возбуждения
является процесс его захвата и разделения зарядов, который протекает обратимо.
Как было показано выше, для РЦ ФС I
К = ко6рещ>(-АЕ/квТ),
где АЕ ~ 0,03 эВ—энергия активации обратного переноса от Р700 на Хл^, т.е.
км ~ l,6fcO6P. Как видно, константы км и k0QP одного порядка, и, следовательно,
процесс захвата действительно обратим. В захвате возбуждения ловушкой важную
роль играет число N молекул, непосредственно окружающих Р. С увеличением чи-
числа N растет время существования экситона в антенне до его захвата ловушкой РЦ.
Так, время затухания флуоресценции антенны частиц ФС II увеличивалось от 80 пс
до 200 пс при соответствующем увеличении в препаратах ФС II количества молекул
Хл в антенне от 80 до 250, приходящихся на одну молекулу Рбво-
Из анализа модели случайных блужданий возбуждения следует, что для того,
чтобы в процессе случайного блуждания экситон попал в ловушку РЦ, окружен-
окруженную антенной из N = 80 молекул Хл, необходимо около 120 прыжков возбуждения.
Считая, что энергия взаимодействия между молекулами хлорофилла в антенне со-
составляет Евз ~ 100 см (~ 0,01 эВ ~ 4,6 • 10~21 Дж), можно оценить время тм
одного прыжка (ХШ.11.4) как тм ~ h/EB3 ~ 1(Г13-1(Г14 ~ 50 фс (~ 0,05 пс). Сле-
Следовательно, время, необходимое для однократного попадания в ловушку, составляет
120 • 50 фс = 6 пс, а общее число попаданий, которые экситон успевает совершить
за время 80 пс до эффективного захвата ловушкой, будет равно 80 пс/6 пс ~ 13.
304 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Следовательно, «узким местом» является не миграция возбуждения в антенне, а его
захват ловушкой РЦ.
Именно поэтому может произойти возврат энергии возбуждения обратно мо-
молекулам антенны, непосредственно окружающим РЦ. Иными словами, РЦ предста-
представляют собой неглубокую ловушку для возбуждения, откуда оно может «выбраться»
назад в антенну. Заметим, что в силу этого для эффективного захвата необходимо
несколько попаданий в РЦ экситона за время жизни возбуждения в антенне.
В процессе миграции распространение возбуждения по антенне происходит на-
намного скорее (на порядок), чем достигается окончательное разделение и стабилиза-
стабилизация зарядов в РЦ (Холцварт, 1990). Прямым экспериментальным доказательством
этого явилась обнаруженная Холцвартом компонента разгорания флуоресценции
длинноволновой формы (ХфЛ ~ 720 нм) ФС I со временем 10-15 пс. Это соответ-
соответствует времени распространения экситонного возбуждения от антенны до молекул
пигмента, непосредственно принадлежащих РЦ ФС I. Как говорилось выше, общее
время затухания флуоресценции или время жизни экситона в антенна ФС I намно-
намного больше (т Jj 80 пс). Это значит, что оно определяется не быстрым процессом
миграции энергии и диффузией экситона в антенне, а более медленным процессом
захвата возбуждения и разделения зарядов в ловушке реакционного центра. Это
будет справедливо только если возбуждение, попавшее в Р700} может вернуться
назад в антенну РЦ:
где км и &обр — константы захвата ловушкой и возвращения возбуждения в ан-
антенну.
После локализации возбуждения на Р* происходит акт элементарного разделе-
разделения зарядов в РЦ с константой ке
Хл*Р1 5=* ХлР*1 -Ь- ХлР+J".
Кобр
Вычисленные на основе данных по кинетике затухания флуоресценции значения
константы разделения зарядов ке зависят от быстрого обратимого обмена возбу-
возбуждения между Хл антенны и Р.
В опытах Холцварта полученная таким образом кажущаяся константа разде-
разделения зарядов, включающая процесс обратимого захвата возбуждения (км и k0QP),
составляла ке ~ 10 пс.
Очевидно, когда количество окружающих молекул антенны сведено к миниму-
минимуму, возрастает вероятность прямого попадания возбуждения на Р. В этих условиях
вычисленная по затуханию флуоресценции константа ке элементарного разделения
зарядов приближается к значениям ке, непосредственно измеренным методами аб-
абсорбционной фемтосекундной спектроскопии (см. ниже) на изолированных РЦ, где
она составляет те ~ 1/ке ~ 2-4 пс.
Таким образом короткоживущая компонента разгорания флуоресценции ii
(ti ~ 10-15 пс) соответствует распространению и тушению экситона антенны
пигментами РЦ, а долгоживущая (т2 ~ 100-200 пс) компонента затухания флуо-
флуоресценции отражает дезактивацию возбуждения антенны в процессе обратимого
разделения зарядов в РЦ. Кроме того, более медленному этапу стабилизации
§ 4. Механизмы миграции энергии в фотосинтетической мембране 305
зарядов и восстановления Qa
P+I-Qa -^ P+IQ-A
также соответствует отдельная более длительная компонента затухания флуорес-
флуоресценции антенны тз ~ 500 пс. Восстановление Qa и закрытие РЦ (PIQa) вызывает
вследствие электростатического отталкивания уменьшение константы ке первич-
первичного разделения зарядов и увеличение длительности флуоресценции. Величины Т2
и тз возрастают в 1,5-3 раза, а короткоживущая компонента ii тушения экситона
остается неизменной. Возникающее при этом долгоживущее свечение в принципе
может частично носить рекомбинационный характер Р+1~ —*¦ Р*1 —*¦ PI+hv. Одна-
Однако в основном оно связано с увеличением флуоресценции антенны и уменьшением, а
не увеличением, скорости образования ион-радикальной пары Р+1~. В то же время
сама по себе миграция экситона в антенне мало изменяется при восстановлении Qa-
Заметим также, что два типа комплексов фотосистемы ФС Па и ФС Пр отли-
отличаются друг от друга по значению т компонент затухания флуоресценции, которые
остаются, однако, в пределах -ц ~ 10-20 пс и Т2 ~ 100-200 пс. Детальные измерения
длительности флуоресценции в зависимости от состояния РЦ были проведены на
фотосинтетических мембранах бактерий и выделенных из них препаратах РЦ.
В интактных хроматофорах, где присутствуют оба светособирающих комплек-
комплекса ССПБК II и ССПБК I с активными реакционными центрами, обнаруживаются
две основные компоненты затухания флуоресценции с временами ii ~ 50-70 пс и
Т2 ~ 250 пс. В отсутствие РЦ собственное время флуоресценции антенны составляет
700-1000 пс. Вместе с тем время одного акта переноса возбуждения между соседни-
соседними молекулами в антенне здесь, как и в хлоропластах, также невелико (~ 10~13 с).
Это значит, что общее время, необходимое для распространения экситона в антенне
и достижения РЦ должно быть намного меньше измеренного экспериментально
времени жизни флуоресценции в хроматофорах. Так же, как и в хлоропластах, это
означает, что возбуждение, попавшее в РЦ, может вернуться назад в антенну. Схема
процессов представляется здесь в виде
А* =<==* Р* -Ь. Р+ Бфф- -^ P+Qa-
Здесь км = 1/ti —константа тушения флуоресценции антенны (А* -* Р), k0QP соот-
соответствует возвращению возбуждения в антенну, ке — константа реакций разделения
зарядов в РЦ и перенос электрона от Р на Бфф (к~г ~ 3 пс), kpQ — константа
переноса электрона на первичный хинон.
Проведенный анализ (Фрейберг, 1996) показал, что при изменении константы
ке соблюдается линейная зависимость
где те = к~х — время разделения зарядов в РЦ, а величины км и k0QP оказались
одного порядка: км ~ fcO6p-
Поведение второй компоненты Т2 отражает в основном реакцию стабилизации
зарядов в переносе электрона на первичный хинон:
— 1 , ^обр ' «е
fee "г ^обр
306
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Следовательно, в хроматофорах, как и в хлоропластах, происходит быстрое распро-
распространение возбуждения (~ 10-20 пс) по антенне в каждом из комплексов ССПБК II
Б800-850, ССПБК I Б890, причем время «прыжка» возбуждения между соседними
молекулами не превышает 1-2 пс, а миграция энергии между комплексами занимает
30-40 пс. Узким местом является тушение флуоресценции в РЦ, которое носит
обратимый характер (k\ ~ fc_i).
Следует обратить внимание на возможное влияние белка на процессы флуорес-
флуоресценции пигментов. Наличие различных форм пигментов с разными максимумами
флуоресценции может быть связано с участием белковых компонент в релаксацион-
релаксационных электронно-колебательных взаимодействиях, сопровождающих флуоресценцию
(гл. X). В этом случае модификация белка в фотосинтетических мембранах может
оказывать регуляторное воздействие на миграцию энергии как за счет изменения
межпигментных расстояний и взаимной ориентации, так и за счет более тонко-
тонкого влияния на внутримолекулярные релаксационные процессы, и тем самым на
соотношение полос флуоресценции и поглощения пигментов в пигмент-белковых
комплексах.
Структура ФСЕ и захват возбуждения в РЦ. Большое значение для эффектив-
эффективного затрата возбуждения в РЦ имеют топографические особенности организации
молекул пигментов в антенне. Мы видели, что при больших размерах антенны
и, соответственно, увеличении количества случайных прыжков, необходимых для
попадания возбуждения в РЦ, эффективность захвата падает.
Рис. XXVII.15.
Модель светособирающей антенны (по
V. I. Novoderezhkin, A. P. Razjivin, 1995)
Общее число молекул бактериохлорофилла — N;
d — диполный момент перехода n-ой молекулы;
X, Y, Z — едничные векторы системы коорди-
координат.
Максимальные величины эффективности ср достигаются при небольшом числе
молекул N в антенне N < 50. Между тем экспериментальные значения ср приближа-
приближаются к 90% для таких по размерам антенн, где число молекул пигментов намного
больше C00 < N sj 1000). Это сопоставление показывает, что для достижения вы-
высоких квантовых выходов передачи возбуждения от антенны к РЦ структура ФСЕ
должна быть на самом деле жестко оптимизирована и тем самым отличаться от
расположения молекул в растворе или изотропном кристалле.
§ 4. Механизмы миграции энергии в фотосинтетической мембране 307
Среди структурных факторов, которые могут влиять на эффективность пе-
передачи возбуждения, наибольшее значение имеют кластерный характер решетки
ФСЕ, избирательная анизотропия межмолекулярных расстояний для обеспечения
выбранного направления миграции и определения ориентации векторов дипольных
моментов переходов молекул ФСЕ. Эти предположения подтвердились в результа-
результате исследований передачи энергии электронного возбуждения на зеленых серных
бактериях (Фетисова). Оказалось, что в клетках этих бактерий существуют спе-
специальные хлоросомы (большие природные антенны), где критерии оптимизации
находят свое выражение в олигомеризации (кластеризации) молекул пигментов при
сильных взаимодействиях между ними. Причем максимальное ускорение передачи
энергии к РЦ достигается при образовании кластеров — цепочек, расположенных
поперек длинной оси вытянутой ФСЕ. Векторы дипольных моментов Qy — перехо-
перехода антенных молекул — параллельны друг другу и направлены вдоль длинной оси
хлоросомы.
Другой характерный пример специальной структурной организации светоооби-
рающей антенны пурпурных бактерий был представлен на рис. XXVII. 10, а, б). Эта
структура кристаллизованных препаратов ССПБК полностью подтверждает тео-
теоретические расчеты, проведенные независимо ранее (Новодережкин, Разживин) на
основе модели делокализованных экситонов.
Известно, что поглощение кванта света молекулами светособирающей антенны
приводит к тому, что за время существования возбуждения и перехода на первый
синглетный возбужденный уровень (рис. Х.5) Sq —> «Si происходит обеднение основ-
основного уровня Sq. Вследствие этого наблюдается уменьшение поглощения в основной
полосе и появление отрицательного максимума в длинноволновой области диффе-
дифференциального спектра поглощения при световом возбуждении (выцветание основной
полосы поглощения). Однако, кроме этого, при возбуждении появляются также
положительные максимумы в коротковолновой области спектра. Затухание этих
индуцированных абсорбционных изменений происходит, во-первых, в изолирован-
изолированных комплексах Бхл 875 за времена ii ~ 15 пс вследствие ухода возбуждения к
другим группам пигментов (Бхл 875 -* Бхл 896) и, во-вторых, при дезактивации
состояния Si всего комплекса и перехода его на основной уровень Si -* So за время
Т2 ~ 600 пс. Как видно, эти времена ii и Т2 соответствуют компонентам затухания
флуоресценции в ССПБК пурпурных бактерий. Большие величины абсорбционных
изменений показывают, что в них должны участвовать несколько молекул Бхл,
выцветающих на время существования возбуждения.
Для объяснения этих эффектов была предложена и проанализирована модель
теоретического циркулярного расположения N молекул в антенне, изображенная
на рис. XXVII. 15. Такой агрегат при сильном экситонном взаимодействии ведет
себя как единая супермолекула. Дипольный момент перехода в такой коллектив-
коллективной системе увеличивается, как показывают расчеты, в \/~N раз по сравнению с
мономерной формой.
Это приводит к 3-4-кратному увеличению фотоиндуцированных абсорбцион-
абсорбционных изменений (выцветанию полосы) в длинноволновой области. Однако в коротко-
коротковолновой области также возникают новые положительные изменения поглощения.
Они вызваны дипольным моментом перехода на новый высокий экситонныи уровень
возбуждения, появившийся в супермолекуле.
308 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Эффективность взаимодействий с РЦ и передача на него энергии повышается,
поскольку такой агрегат ведет себя как единая супермолекула с делокализованным
на ней экситоном. В других экспериментах на хроматофорах и хлоропластах при
высокой интенсивности лазерного импульса возбуждения (до 1015~17 фотон/см2)
было обнаружено такого рода дополнительное поглощение, нелинейно зависящее
от интенсивности возбуждающего света (Пащенко, Фогель). Нелинейные эффекты
возникают в агрегате молекул антенны (N > 5) и отражают электронные перехо-
переходы между экситонными уровнями коллективного возбуждения, возникающего при
сильном межпигментном взаимодействии в светособирающей антенне.
§ 5. Реакционные центры пурпурных фотосинтезирующих бактерий
Первичный акт фотосинтеза, приводящий к разделению зарядов и восстановлению
первичного акцептора, осуществляется в реакционных центрах. В настоящее вре-
время благодаря развитию методов препаративной биохимии удалось выделить в на-
тивном состоянии РЦ фотосинтезирующих бактерий, который представляет собой
отдельный пигмент-белковый комплекс.
Компоненты РЦ. РЦ пурпурных бактерий можно рассмотреть на примере хо-
хорошо изученных препаратов из Rhodopseudomonas sphaeroides, штамм Л-26, содер-
содержащих три белковые субъединицы с молекулярной массой 19 • 103, 22 • 103 и 28 • 103.
Их обозначают как L, М, Н (легкая, средняя и тяжелая соответственно). Белок РЦ
гидрофобен и нерастворим в воде в отсутствие детергента. Детергент переводит
РЦ в водный раствор, делая гидрофильной поверхность белка, которую он покры-
покрывает. В состав РЦ входят четыре молекулы бактериохлорофилла Бхл, две молекулы
бактериофеофитина Бфф, одна или две молекулы убихинона Q, атом железа Fe,
а также цитохромный комплекс. Последний присутствует не у всех видов бакте-
бактерий, в частности, он обнаружен у Rps. viridis, но его нет у Rb. sphaeroides. В каче-
качестве простатических групп, на которых локализуется электрон, либо необходимых
для обеспечения его высокоэффективного переноса, в состав реакционного центра
входят 6 порфириновых центров D бактериохлорофилла и 2 бактериофеофитина),
2 хинона и 1 атом негемового железа. С комплексом реакционного центра может
быть также ассоциирована 1 молекула каротиноида, но с белками, выделенными из
бескаротиноидных штаммов бактерий, каротиноиды не ассоциированы. Поскольку
квантовая эффективность первичных реакций фотосинтеза и константы скоростей
этих реакций в реакционных центрах, выделенных из бескаротиноидных мутантов
или штаммов дикого типа, практически идентичны, можно заключить, что кароти-
каротиноиды реакционного центра не принимают непосредственного участия в процессах
электронного транспорта.
Природа первичного фотохимического акта была выяснена в работах
Л. Н. М. Дюйзенса, который обнаружил небольшие обратимые изменения погло-
поглощения АА при освещении хроматофоров Rhodospirillum rubrum. Эти изменения
характеризовались выцветанием полосы поглощения при 870 нм и сдвигом в синюю
область полосы при 800 нм. Подобные небольшие (около 2%) изменения поглощения
были получены и при химическом окислении РЦ. Это указывает на окисление под
действием света небольшой части активного Бхл а, принадлежащего РЦ, которая
составляет лишь около 2% от общего содержания Бхл а и представляет собой
§ 5. Реакционные центры пурпурных фотосинтезирующих бактерий 309
реакционноспособный пигмент Ps7o- Фотоокисление Ps7o происходит с квантовой
эффективностью, достигающей 100%, и осуществляется также с большой квантовой
эффективностью при 1 К. На рис. XXVII. 16, А приведен спектр поглощения
препаратов РЦ бескаротиноидного штамма бактерий R. sphaeroides, R-26, на
котором обозначены максимумы поглощения, принадлежащие пигментам Бхл и
Бфф. При поглощении света происходит выцветание полос при 870, 600 нм и сдвиг
в синюю область полосы 800 нм, принадлежащих Р$70у с одновременным появлением
новой полосы поглощения около 1250 нм.
На рис. XXVII. 16,-Б1 приведены дифференциальные спектры поглощения (свет
минус темнота) при образовании Р+ с положительными максимумами 435,1250 нм и
отрицательными максимумами, соответствующими выцветанию полос поглощения
при 600, 870 нм, а также сдвигу и выцветанию полосы при 800 нм. Все эти изме-
изменения характерны для образования катион-радикала димера фотоактивного Бхл+.
Выцветание полос при 545 и 760 нм свидетельствует о превращении Бфф, а поло-
положительный максимум при 670 нм — о появлении при этом анион-радикала Бфф~.
Кроме того, увеличение поглощения при 670 нм характерно также и для анион-
радикала Бхл. Выцветание полосы при 275 нм обусловлено образованием восстано-
восстановленного убихинона и образованием убисемихинона. После выключения света эти
спектральные изменения исчезают, что вызвано рекомбинацией между Р+ и Q~.
При использовании спектральных эффектов установили последовательность
прямых реакций переноса электрона между указанными компонентами РЦ:
РБфф QaQb -^- Р+ Бфф- QaQb -* Р+ Бфф Q\QB -*
UQh> (XXVII.5.1)
где Р — димер бактериохлорофилла, Qa, Qb — первичный и вторичный акцепторы
хинонной природы (убихиноны).
Поскольку переносчики обладают различными окислительно-восстановитель-
окислительно-восстановительными потенциалами, то, меняя окислительно-восстановительный потенциал среды,
можно восстановить хинонные акцепторы химическим путем в темноте, т. е. приго-
приготовить РЦ в исходном состоянии РБфф Q^Q^. Тогда освещение РЦ в присутствии
соответствующих доноров электрона, которые восстанавливают Р, будет приво-
приводить к накоплению состояния РБфф" QaQb- Измеряя дифференциальные спектры
«свет минус темнота» для таких образцов, т. е. разницу в поглощении между состо-
состояниями РБфф" QaQb и -РБфф QaQbj можно регистрировать спектральные изме-
изменения, сопровождающие фотовосстановление бактериофеофитина. Именно таким
путем были получены экспериментальные доказательства участия Бфф в качестве
промежуточного переносчика электрона между Р и Qa (рис. XXVII. 16).
Первичный фотоактивный донор электрона Р представляет собой димер
(БхлJ, в котором в состоянии Р+ оставшийся неспаренный электрон обобществлен.
Одноэлектронное окисление Р приводит к появлению сигнала ЭПР, у которого g-
фактор равен 2,0026, так же как и для катион-радикала Бхл+. Однако для Р+
ширина сигнала составляет АН = 0,94 мТл, что в у2 уже, чем для мономерного
катиона Бхл (АН = 1,2 мТл). Напомним, что сужение линии ЭПР пропорциональ-
пропорционально \/п, где п — число молекул, обобществляющих неспаренный электрон (в данном
310
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
А 1,0 г
0,4 "
0,2 -
300 400
500
700 800 900 1000 1100 1200 1300
Длина волны, нм
Б 0,04
1245
-0,02
-0,04
300 400 500 600 700 800 900 1000 1100 1200 1300
Длина волны, нм
Рис. XXVII. 16.
Спектр поглощения (А) реакционных центров РЦ и дифференциальный спектр по-
поглощения (свет минус темнота) (Б):
а — спектр РЦ в темноте, б— спектр освещенных РЦ, в —разность между а и б
Полосы спектра поглощения (А) в диапазоне длин волн короче 450 нм имеют очень большую
амплитуду, поэтому на рисунке показаны в шестикратном уменьшении
§ 5. Реакционные центры пурпурных фотосинтезирующих бактерий 311
случае п = 2). Величина Ei/2 пары Р/Р+ составляет около +450 мВ и не зависит
от рН среды, т. е. отрыв электрона от Р не сопровождается протонированием.
Димерная структура фотоактивного Бхл в бактериальных РЦ вызывает инте-
интерес исследователей, тем более, что есть указания на подобное «устройство» первич-
первичного донора электрона и у высших растений. Возможно, что такое строение фото-
фотоактивного пигмента обеспечивает какие-то определенные преимущества в первич-
первичном акте фотосинтеза. Так, высказываются предположения, что димерная струк-
структура Р способствует эффективному первичному захвату фотовозбуждения до от-
отрыва электрона и переноса его в цепь переносчиков. Это происходит благодаря
сверхбыстрому разделению зарядов в самом димерном комплексе с быстрой (за
сотни фемтосекунд) сопутствующей поляризацией ближайшего белкового окруже-
окружения. Имеются и доводы в пользу прочной стабилизации во времени положительного
заряда на Р, образованного при его фотоокислении, в результата делокализации
«дырки» по структуре димера. Это способствует замедлению бесполезных обрат-
обратных рекомбинационных процессов. Последнему благоприятствует в димере наличие
большого числа степеней свободы для небольших структурных изменений, которые
сопровождают фоторазделение зарядов (см. гл. XXVIII).
Первичный хинон Qa — одноэлектронный переносчик, хотя в определенных
условиях он присоединяет два электрона. Вторичный хинон Qb в отличие от Qa
в обычных условиях может функционировать как двухэлектронный переносчик.
Fe входит в состав комплекса QaQb, который можно схематически представить
как QaFgQb- Измерение спектров эффекта Мессбауэра показало, что Fe не меняют
свою валентность и остается в высокоспиновом Fe -состоянии независимо от пере-
переноса электрона в акцепторном хинонном комплексе. Однако удаление Fe нарушает
перенос электрона между Qa и Qb- Очевидно, сам атом железа не является акцеп-
акцептором электрона, а только облегчает его перенос между первичным и вторичным
хинонами.
В последнее время благодаря успехам в получении кристаллических препаратов
белков фотосинтетических РЦ пурпурных бактерий удалось расшифровать трех-
трехмерную структуру расположения компонентов РЦ (рис. XXVII. 17, А).
Одним из наиболее выдающихся достижений молекулярной биофизики послед-
последних лет явилась расшифровка трехмерной пространственной структуры белка ре-
реакционного центра методом рентгеноструктурного анализа.
В отличие от водорастворимых белков, таких как цитохром с, миоглобин и
другие, легко образующих крупные кристаллы, дающие четкие рентгеновские ди-
фрактограммы, гидрофобные мембранные белки до последнего времени кристалли-
кристаллизовать не удавалось, вследствие чего их пространственную структуру можно было
изучать лишь на основании косвенных данных.
Первым белком подобного рода, который удалось кристаллизовать и подверг-
подвергнуть рентгеноструктурному анализу, явился четырехсубъединичный комплекс соб-
собственно РЦ и цитохрома с (физиологического донора электронов для фотоокислен-
ного Р) из бактерии Rhodopseudomonas viridis. Рентгеноструктурный анализ кри-
кристаллических препаратов этих комплексов позволил установить пространственную
картину взаимного расположения 4-х гемов цитохромной субъединицы и просте-
тических групп РЦ, представленную на рис. XXVII.17, А. Данный комплекс явился
по существу одним из первых сложных гидрофобных мембрано-связанных белков,
312
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Гем4
ГемЗ
Гем2
13 А
Гем!
21 А
10 А
<ЯБзш
7 А ТирМ208
М
Fe+2
Рис. XXVII. 17.
A — Схема расположения простетических групп и расстояния между ними в
цитохром-РЦ комплексе Rps. viridis; Б — модель строения РЦ Rps. sphaeroides no
данным рентгеноструктурного анализа (по J. Deisenhofer, H. Michel, 1989; J. P. Allen
et al., 1987)
На рисунке Б цилиндрами изображены спиральные тяжи, простетические группы
зачернены, точка с кружком указывает локализацию негемового железа, место свя-
связывания Qa закрыто белком. Ароматические аминокислоты ТирМгов и
служат мостиками для переноса на участках Р -* БФФ и БФФ ->• Qa
§ 5. Реакционные центры пурпурных фотосинтезирующих бактерий 313
для которых установлена детальная пространственная структура. За эту фунда-
фундаментальную работу группа немецких исследователей (Михель, Дейзенхофер, Ху-
бер) получила в 1988 г. Нобелевскую премию. В настоящее время уже детально
расшифрована пространственная структура также для собственно РЦ из бакте-
бактерий Rb. sphaeroides Д-26, на которых выполнено подавляющее большинство кине-
кинетических и других функциональных измерений первичных процессов фотосинтеза.
Строение фотосинтетического РЦ из бактерий Rb. sphaeroides, согласно данным
рентгеноструктурного анализа, показано на рис. XXVII.17, Б.
Основные черты последней структуры таковы. Она содержит 11 а-спиральных
гидрофобных участков (по 22-31 аминокислот), организованных в близкие к парал-
параллельные тяжи, имеющие в хроматофорах трансмембранную направленность. В до-
дополнение к трансмембранным а-спиралям белок РЦ содержит и более короткие
а-спиральные участки, которые образуют, в частности, «карманы» вокруг мест ло-
локализации молекул хинонов. В целом структура белка РЦ образует жесткий каркас,
с которым связаны две симметричные цепи молекул пигментов с общим для обеих
цепей димером Бхл Р: Р-Бхл-Бфф-<5. Локализация пигментов на рис. XXVII.17, Б
зачернена. Кружком показано положение иона Fe2+. Структура белка РЦ доста-
достаточно плотно прикрывает место связывания Qa, но в области связывания Qb в
этих структурах имеется полость, через которую Qb может диффундировать в
пул мембранных хинонов, связывая электрон-транспортную цепь РЦ с другими
мембранными переносчиками электрона. Несмотря на наличие в структуре бак-
бактериальных РЦ двух «ветвей» (X и М) переносчиков, образующих две электронные
тропы, индуцируемый светом транспорт электрона идет преимущественно толь-
только по одной из них — по цепи L. Это связано, по-видимому, в первую очередь с
асимметрией белкового окружения и особенно распределения ароматических ами-
аминокислот, играющих роль электронных мостиков (XIII, § 7) в двух цепях. Опре-
Определенное значение здесь, вероятно, принадлежит и водородным связям, формируе-
формируемым кофакторами электронного переноса с белковым окружением, которые играют
роль в стабилизации электрона при туннелировании (XIII, §6). Показана неэкви-
неэквивалентность водородных связей и ароматических остатков для двух ветвей. Так,
образованная ветвь L отличается от ветви М наличием водородных связей между
пирольным кольцом Бфф и Глю 104, а также присутствием остатков тирозина в
белковом окружении кофакторов переноса. Ниже мы увидим, что белковая среда
в соответствии с современной концепцией электронно-конформационных взаимо-
взаимодействий (гл. XIII) играет решающую роль в регуляции электронного переноса в
РЦ. Роль неактивной цепи пока не совсем ясна. Возможно, что компоненты этой
цепи обеспечивают перенос и диссипацию триплетного состояния молекулы бакте-
риохлорофилла Р на молекулу входящего в структуру РЦ специфического кароти-
ноида.
Перенос электрона в РЦ. Кинетика электроннного транспорта в РЦ пурпур-
пурпурных бактерий была детально расшифрована с помощью методов абсорбционной и
флуоресцентной спектроскопии высокого временного разрешения вплоть до 10~13 с.
Возбуждение РЦ лазерным импульсом индуцирует характерные изменения погло-
поглощения редокс-кофакторов (см. рис. XXVII. 16), времена нарастания и исчезновения
которых соотвествуют переносу электрона между отдельными редокс-компонента-
ми РЦ.
314 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Поглощение света фотохимически-активным пигментом Р переводит его в син-
глетное возбужденное состояние Р* с последующим отрывом электрона. Этот про-
процесс завершается за время короче 10 пс и сопровождается выцветанием полосы
Р при 870 нм, выцветанием полос Бфф при 545, 760 нм и появлением полосы по-
поглощения Бфф при 670 нм. Таким образом, в результате возбуждения световым
импульсом в РЦ образуется ион-радикальная пара с разделенными между Р и Бфф
зарядами и локализацией электрона на БФФ: (Л+Бфф~). Применение методов
фемтосекундной спектроскопии показало, что время нарастания изменений погло-
поглощения Бфф при 545 и 670 нм, отвечающее переносу на Бфф, составляет около 4 пс.
Регистрация спектров с временным разрешением < 30 пс обнаруживает также
отличающийся от описанного выше спектр, с изменениями поглощения при 800 нм.
На основании этого высказано предположение об участии промежуточного пере-
переносчика электронов между Р и Бфф — молекулы Бхл, поглощающей при 800 нм
(Шувалов В. А.).
Оказалось, однако, что далеко не всегда удается изменение при 800 нм надежно
характеризовать даже при более высотам временном разрешении (до 10~13 с). Тем
не менее, вопрос об участии Бхл в переносе электрона остается в центре внимания
и в настоящее время, поскольку он тесно связан с фундаментальными механизмами
транспорта электрона в биомакромолекулярных системах. Мы обсудим эту про-
проблему подробно в гл. XXVIII, а сейчас отметим два возможных механизма этого
процесса.
Считается, что мономерная молекула Бхл принимает участие в переносе элек-
электрона между Р и Бфф. Эта роль может быть связана с прямым восстановлением
Бхл и образованием Бхл~. Однако при большой общей скорости потока электронов
(т < 3 пс) образующаяся популяция Бхл~ очень мала и в обычных условиях не
может быть достаточно точно детектирована спектроскопически даже с помощью
фемтосекундной техники.
Другой — обменный — механизм предполагает, что молекула Бхл играет роль
посредника, который усиливает взаимодействие между Р и Бфф, но не претер-
претерпевает истинного окислительно-восстановительного превращения. В гл. XIII, § 7
мы видели, что перенос электрона по белковой цепи зависит от перекрывания мо-
молекулярных орбиталей донора и акцептора с молекулярными орбиталями звеньев
полипептидной цепи — медиатора переноса электрона (XIII.7.7).
Аналогичную роль медиатора переноса электрона между Р и Бфф выполняет
Бхл. В простейшем случае скорость переноса между Р и Бфф зависит от попар-
попарного перекрывания орбиталей (Р и Бхл) и (Бхл и Бфф), или соответственно от
матричных элементов (XIII.4.2) их попарных взаимодействий Урвхл и ^Бхл-бфф-
Константа скорости переноса Р -* Бфф соответственно зависит от:
2ti \Vp Вхл • ^Бхл • Бфф |
&РБфф~т {Key '
где АЕ — разница энергетических уровней состоянии Р* и Р+ Бхл~. При больших
АЕ и низких температурах, когда обычный активационныи процесс восстановления
Бхл практически невозможен, обменный механизм обеспечивает транспорт элек-
электрона с участием виртуального уровня Бхл. Химическое восстановление Бхл ста-
§ 5. Реакционные центры пурпурных фотосинтезирующих бактерий 315
новится эффективным при нормальных температурах и при небольших (или отри-
отрицательных) АЕ. Обычно АЕ лежит в области значений —300 см < АЕ < 600 см.
Однако эти пределы могут варьировать в мутантных образцах с модифицирован-
модифицированным аминокислотным составом белка, входящего в структуру РЦ.
Наиболее вероятная схема участия Бхл включает два параллельных пути:
обменный перенос A) и двухступенчатый окислительно-восстановительный пере-
перенос B):
Р+ Бхл" Бфф
B) ^* "\ B)
Р* Бхл Бфф — ^ Р+ Бхл Бфф"
В двустороннем механизме на первой стадии (за 3,5 пс) происходит восстановление
Бхл, а его окисление на второй стадии (Бхл^Бфф) осуществляется гораздо быстрее
(за 0,9 пс), что и предотвращает его накопление в РЦ. Вопрос о соотношения двух
механизмов участия Бхл решается в настоящее время путем изучения кинетики
переноса электрона методами фемтосекундной спектроскопии.
\—? В настоящее время принято считать, что образующееся за 4-7 пс первичное
состояние РЦ с разделенными зарядами (Р~^1~) представляет собой смесь со-
состояний РБхл и РБфф, находящихся в равновесии, причем не менее ~ 60% элек-
электронной плотности неспаренного электрона локализуется на Бфф. Через 150-200 пс
после образования Бфф~ восстанавливается первичный хинон Qa, который далее
отдает электрон на Qb уже за время ~ 10~4 с. Таким образом, прямые реакции
переноса электрона и их времена в РЦ можно представить как
РБхлБфф<ЭА<Эв ^ Р*БхлБфф<ЭА<Эв ^^* Р+(БхлБффУ<ЭА<Эв 150~200 пс-
—»PfБxлБффQA'Qв 1ООмкс, р+БхлБффQaQ^. (XXVII.5.3)
?
Если перед возбуждением восстановить Qa химическим путем, т. е. перевести
РЦ в состояние [Р(БхлБфф)<5^], то образующееся под действием света состояние
[Pf (БхлБфф)~ QJ] живет намного дольше (до ~ 10 не). Очевидно, в этих условиях
Бфф~ не может отдать электрон на Q~A и распад состояния [Р~!" Бхл Бфф ~ Q~a\
должен осуществляться другими путями. Действительно, в спектре фотоиндуци-
рованных изменений состояния [Р~!"(БхлБфф)~<5^] с течением времени возникают
спектральные полосы нового типа, свойственные триплетному состоянию фотоак-
фотоактивного димера бактериохлорофиллатР (или 3Р). Анализ показывает, что в данном
случае триплетное состояние 3Р образуется не в результате непосредственного пе-
перехода из синглетного возбужденного состояния 1Р*. Оно появляется вследствие
конверсии спинов за время существования радикальной пары [Р~!~(БхлБфф)~] при
переходе спинов неспаренных электронов на Р~ и Бфф~ в параллельную триплет-
ную ориентацию:
1[Р+(БхлБфф)^] ^3[Р+(БхлБфф)^]. (XXVII.5.4)
316 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Если в темноте исходно восстановить Бфф и химически перевести РЦ в состояние
[Р(БхлБфф)~<5^], то при освещении триплетное состояние уже не образуется. Это
также доказывает, что триплеты появляются в ходе рекомбинации Р"!" и Бфф~ в
радикальной паре. Таким образом, в состоянии [Р"!"(БхлБфф)~] возможны два пути
рекомбинации радикалов Р~!~ и Бфф":
-* 1[Р*БхлБфф1;
, , (XXVII.5.5)
3[Р1"(БхлБфф)^] -* 3[РБхлБфф].
Появление Р* в ходе реакций в состоянии [Р"!"(БхлБфф)~] является причиной уве-
увеличения флуоресценции, когда перенос электрона от Бфф на Q^ блокирован.
Выход триплетных молекул ТР увеличивается от 10-20% при комнатной тем-
температуре до 90-100% при 20 К, причем при комнатной температуре он понижается
в 1,5-2 раза при действии внешнего магнитного поля (Н ~ 0,1-0,2 мТл). Суще-
Существуют различные механизмы, вызывающие переориентацию спинов в радикальной
паре и переход ее в триплетное состояние. Основную роль играют здесь дипольные
магнитные взаимодействия между электронами (спин-спиновый обмен). Значение
обменного спин-спинового интеграла (J) определяет расщепление синглетного и
триплетного уровней радикальной пары [Р~!~(Бхл Бфф)~] на величину энергети-
энергетического зазора между синглетным и триплетным состояниями ^Р^Бхл Бфф)"!"] и
3[р+(БхлБфф)+].
Величина I задается выражением
I = 2s2Iint/(AEJ, (XXVII.5.6)
где АЕ — разница энергетических уровней состояний [Р*БхлБфф] и
[Р"!"(БхлБфф)~]; Jint—величина энергетического расщепления синглетного и
триплетного уровней, димера бактериохлорофилла Р; s2—интерал перекрывания
волновых функций состояний [Р*БхлБфф] и [Р"!"(БхлБфф)~], определяющий
эффективность туннельного переноса электрона с образованием радикальной пары
(см. § 3, гл. XIII). Таким образом, величина I связана с константой скорости к тун-
туннельного переноса электрона от Р* на Бфф. Значение константы скорости переноса
электрона между Р* и Бфф равно величине, обратной времени разделения зарядов
к = 1/т (т ~ 5 • 10~12 с), и составляет к ~ 2 • 1011 с. Отсюда можно приближенно
оценить s2 ~ 2000 см~2. Принимая, что 7int ~ 2500 см, АЕ ~ 3000 см, находим из
(XXVII.5.5) величину обменного спин-спинового взаимодействия, которая должна
составить I = 1 см. Однако на расстояниях 0,9-1,0 нм между молекулами Р
и Бфф значения I, определенные экспериментально, в действительности на три
порядка меньше и не превышают 10~3 см.
Очевидно, большая величина обменного взаимодействия, необходимая для обес-
обеспечения высокой константы скорости переноса электрона, характеризует обменное
взаимодействие на меньших расстояниях в промежуточном положении между Р+
и (БхлБфф)". Это положение электрон занимает в комплексе [Р"!"(БхлБфф)~], ча-
частично локализуясь на Бхл.
Эффективное смешение синглетных и триплетных состояний обеспечивается
малой величиной энергетического зазора между ними. Если за время существова-
существования радикальной пары произойдет обращение спина электрона, то осуществляется
i 5. Реакционные центры пурпурных фотосинтезирующих бактерий
317
переход S —> Г на один из подуровней триплетного состояния. В нулевом магнит-
магнитном поле энергетическое расщепление между подуровнями радикальных пар весьма
мало и переход происходит на любой из трех подуровней Г+i, To, T_i. Однако во
внешнем магнитном поле триплетные уровни радикальной пары расщепляются на
три подуровня 7+1, Tq, Г_1 в соответствии со значением спинового квантового
Р*1
Р*1
И
Рис. XXVII. 18.
Энергетические уровни радикальной пары в отсутствие внешнего магнитного поля
(А) и во внешнем магнитном поле (Б)
Расстояние между подуровнями определяется величиной энергии Зеемана gCi?, где C — магнетон
Бора [см. (Х.2.15)]. При достаточно больших значениях Н подуровни Т + 1 настолько расходятся,
что только один уровень То остается близким к синглетному уровню для обеспечения S -* Т-
перехода. В этом случае заселенность состояний 3[Р • (Бхл Бфф)<3л] падает, что проявляется в
уменьшении выхода образования триплетных молекул 3Р при действии внешнего магнитного поля
числа ms = 0, ±/ (см. § 1, гл. XII), определяющего величины проекций суммарного
магнитного момента электронов на направление внешнего поля Н (рис. XXVII. 18).
Рекомбинация зарядов в радикальной паре, находящейся в синглетном состоя-
состоянии [Р~!~(БхлБфф)~], приводит к переходу ее в основное [РБхлБфф] либо возбу-
возбужденное 1[Р*БхлБфф] состояние. В последнем случае рекомбинация сопровожда-
сопровождается появлением замедленной флуоресценции с временем жизни в несколько нано-
наносекунд (в обычных условиях, когда Qa не восстановлен, квантовый выход флуорес-
флуоресценции РЦ составляет всего 0,03-0,04%). Восстановление Qa b темноте приводит
к повышению выхода свечения до 0,12-0,15% в основном за счет увеличения за-
замедленной флуоресценции. Понижение температуры уменьшает выход рекомбина-
ционного свечения. Наоборот, действие внешнего магнитного поля, замедляющего
переход S-^Ги тем самым увеличивающего заселенность синглетного состояния
радикальной пары, увеличивает выход рекомбинационного свечения до 3-5% при
напряженностях Н от 10 до 50 мТл.
¦\У На рис. XXVII. 19 представлена схема переноса электрона в РЦ пурпурных
бактерий. Как видно, прямые реакции переноса электрона по направлению
Р -* (Бхл, Бфф) -* Qb происходят за времена намного короче, чем времена обрат-
обратных реакций рекомбинаций или диссипаций соответствующих промежуточных
318
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
состояний. В этом состоит принцип кинетической организации переноса электрона,
согласно которому высокая эффективность функционирования РЦ обеспечивается
тем, что на каждом участке цепи прямые реакции идут на 2-3 порядка скорее,
чем обратные, ведущие к снижению общего квантового выхода первичных стадий
электронного транспорта. ?
Следует еще раз подчеркнуть, что триплетные состояния бактериохлорофилла
в РЦ выявляются лишь когда Qa исходно восстановлен в темноте, а прямой перенос
электрона затруднен. В том случае, когда Ps90 исходно окислен химически, возбу-
возбуждение не тушится в РЦ и остается в антенне. В результате триплетные состояния
Бхл в РЦ отсутствуют, но вместо них появляются триплетные состояния Бхл в
антенне.
Е, эВ
1,5
1,0
0,5
IP* Бхл Бфф QAQB
2-4 пс
Г20 не 2 мкс
3Р Бхл Бфф QAQB
10"
150-200 пс
Р ¦ Бхл Бфф QA ¦ QB
7-10 не
5x10"
100 мкс
Бхл Бфф QAQB~
2-5 с
Рис. XXVII. 19.
Перенос электрона в РЦ пурпурных бактерий
В присутствии каротионидов (Кар) происходит миграция энергии триплетного
состояния за 20 не на 1 молекулу Кар:
3Бхл + Кар -* Бхл +3Кар.
(XXVII.5.7)
Этот процесс идет намного быстрее, чем реакция триплетных молекул Бхл с ки-
кислородом A0~4 с), которая может приводить к деструкции фотосинтетической
мембраны на свету за счет образования при этом активного окислителя — синглет-
ного кислорода (см. §3 гл. XVI). Тем самым каротиноиды выполняют защитную
2
0
-2
-4
-6
-g
-10
-12
¦\t
• •
I*
1 1
i i i
.•••"¦""*"•¦—-.
i i /' i i i*
.*• /
•* * /
§ 6. Реакционные центры фотосистемы I зеленых растений 319
функцию, предохраняя компоненты мембраны от фотоокисления. Миграция энер-
энергии синглетного состояния, которое в отличие от триплетного у Кар лежит выше,
чем у Бхл, происходит от Кар к молекулам Бхл антенны:
*Кар + Бхл -* Кар +1Бхл. (XXVII.5.8)
§ 6. Реакционные центры фотосистемы I зеленых растений
Все фотосинтезирующие организмы, способные под действие света выделять ки-
кислород — от цианобактерий до высших растений — содержат реакционные центры
фотосистемы ФС I и фотосистемы П. Характерно, что, несмотря на большие так-
таксономические и экологические различия между растениями этих групп, структура
реакционных центров ФС I или ФС II
у них весьма сходна.
Первичный донор Р700 электронов
в ФС I был открыт в одном из первых
экспериментов по применению диффе-
дифференциальной оптической спектроско-
спектроскопии для исследования фотосинтетиче-
фотосинтетических мембран. 400 450 500 550 600 650 700 750 800 850
Б. Кок A956) обратил внимание дшшавошш,нм
на небольшие изменения поглощения
при 700 нм, возникающие при дей- рИс. XXVII.20.
ствии света на суспензию хлоропла- Дифференциальный спектр (свет минус
стов (рис. XXVII.20). Химические оки- темнота) для субхлоропластных, частиц,
слители вызывают аналогичный спек- содержащих фотосистему I
тральный эффект, на основании чего
было высказано предположение об оки-
окислении светом небольшой фракции молекул хлорофилла в мембране. Б. Кок назвал
эту фракцию Р700 (Р — от англ. pigment, 700 нм — экстремум в дифференциальном
спектре) и это обозначение прочно закрепилось в научной литературе. По аналогии
с Р700 называют и фотохимически активные компоненты реакционных центров
других фотосистем: Pqso в фотосистеме II, Ps7o или Рд^о — У фотосинтезирующих
бактерий, Рв4о —У зеленых фотосинтезирующих бактерий и т. д.
До настоящего времени не удалось препаративно выделить Р700 B чистом ви-
виде из фотосинтезирующей мембраны. В связи с этим абсолютный спектр Р700 не
зарегистрирован. В то же время хорошо изучен дифференциальный спектр Р700
(«свет минус темнота»), который может быть измерен и при наличии в среде дру-
других пигментов (при условии, что они не изменяют своих спектральных свойств
под действием света). Этот спектр включает интенсивную «отрицательную» полосу
выцветания при 700 нм (±3 нм) и при 430 нм, а также небольшие «положительные»
полосы при 810 нм и 450 нм (рис. XXVII.20).
В хлоропластах растений 1 моль Р700 приходится на ~ 400 молей светособи-
рающего хлорофилла антенны. Разработаны препаративные методы, позволяющие
получать мембранные фракции, существенно более обогащенные фотосистемой I.
В таких фракциях, сохраняющих основные фотохимические реакции ФС I, 1 моль
Р700 приходится на ~ 50-100 молей хлорофилла. Природа первичного донора ФС I
320 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
интенсивно исследовалась спектроскопическими методами. Положение полос диф-
дифференциального спектра Р700 характерно для хлорофилла а, который в обогащен-
обогащенных ФС I мембранных фракциях является практически единственным тетрапирро-
льным пигментом.
При окислении Р700 образуется катион-радикал, сигнал ЭПР которого харак-
характеризуется g-фактором 2,0026, а полуширина приблизительно в л/2 раз меньше,
чем полуширина сигнала ЭПР катион-радикала мономера Хла в растворе. Это
свидетельствует в пользу того, что Р700 может представлять собой димер Хла,
в котором электронная плотность делокализуется между двумя молекулами хлоро-
хлорофилла а, образующими Р7оо-
В соответствии с димерной структурой Pjoo, были искусственно синтезированы
модельные соединения, некоторые из которых обладали спектральными свойствами,
весьма сходными с Р700 •
Поглощение кванта света реакционным центром ФС I переводит Р700 B нижнее
синглетное возбужденное состояние. Структурная и функциональная организация
реакционного центра такова, что вероятность переноса электрона с возбужден-
возбужденного уровня на так называемый первичный фотохимический акцептор намного
превышает вероятность излучательнои или безизлучательнои диссипации энергии
этого возбужденного состояния. Локализовавшись на первичном акцепторе, элек-
электрон затем проходит по цепи переносчиков (вторичных акцепторов), окислительно-
восстановительные потенциалы которых образуют нисходящую «лестницу» (соот-
(соответствующую увеличению Е, т.е. снижению восстановительной способности).
Наиболее подробно изучены конечные акцепторы электронов ФС I. Такими
акцепторами у всех кислород-выделяющих фотосинтезирующих организмов (от ци-
анобактерий и одноклеточных водорослей до высших растений) являются водо-
водорастворимые ферредоксины. Эти сравнительно небольшие белки с молекулярной
массой около 10 кДа содержат железо-серные кластеры (типа 2Fe-2S) и имеют до-
довольно низкий окислительно-восстановительный потенциал (Ет ~ 400 мв). Водорас-
Водорастворимый ферредоксин сорбируется тилакоиднои мембраной в локусе локализации
ФС I, а после восстановления электронами, поступающими от ФС I, включается в
нециклический электронный поток на НАДФ+ (реакция катализируется ферментом
ферредоксин/НАДФ-редуктазой), либо в циклический электронный поток в ФС I.
Этот растворимый 2Fe, 28-ферредоксин получает электроды от связанных с
мембраной железо-серных белков А (Ра) и В (Рв), являющихся терминальными
акцепторами электрона в составе реакционного центра ФС I. Эти белки не уда-
удается выделить из фотосинтетической мембраны, не денатурируя их. Поэтому их
точная структура и молекулярные характеристики подробно не изучены. Однако,
поскольку эти белки обладают характерными спектрами ЭПР, многие особенно-
особенности их строения и функционирования удалось изучить непосредственно в составе
фотосинтетической мембраны.
Было показано, что активным центром этих белков является 4Fe, 48-кластер.
Величины окислительно-восстановительных потенциалов Рд и Рв у шпината со-
составляют —540 мВ и —590 мВ. Для других видов растений эти величины могут
несколько отличаться, причем центры Рв могут быть более восстановительными,
как у шпината, или менее восстановительными, как у ячменя, чем центры Рд.
При освещении фотосинтетических мембран малоинтенсивным светом сначала вое-
§ 6. Реакционные центры фотосистемы I зеленых растений 321
станавливается центр Fa, а затем центр Fb- При низких температурах перенос
электронов между Fb и Fa блокирован, однако при комнатной температуре возмож-
возможность такого переноса не исключена. Можно предположить как последовательное,
так и параллельное включение центров Fa, Fb в электронный перенос. В случае
параллельного включения на уровне этих центров может происходить разветвление
циклического и нециклического электронного транспорта.
Центры Fa, Fb не являются первичными акцепторами электрона в ФС I. Если
эти центры предварительно восстановить в темноте химическим путем, то после-
последующее освещение вызывает обратимое окисление Р700} наблюдаемой и при низ-
низких температурах. Наряду с окислением Р700 ПРИ этом возникает новый сигнал
ЭПР, характерный для железосерных белков с центрами 2Fe,2S. Этот сигнал со-
соответствует фотовосстановлению акцептора Fx (или А?), величина окислительно-
восстановительного потенциала которого составляет —705 мВ. Сигнал от этого
акцептора можно наблюдать лишь в условиях, когда центры Fa и Fb восстановлены.
Если же хотя бы один из этих центров окислен, то электроны с Fx быстро пере-
переносятся на окисленный центр Fa или Fb, и фотостационарная концентрация вос-
восстановленного Fx становится пренебрежимо малой. Однако и центр Fx не является
первичным акцептором, получающим электроны непосредственно с возбужденного
уровня Р7Оо-
Считается, что между Р700 и Fx располагается еще как минимум 2 акцептора,
называемых А$ и А\. Указания на существование этих акцепторов были получены из
данных сверхбыстрой пикосекундной спектроскопии комплексов ФС I с химически
восстановленными или инактивированными центрами Fx.
Наиболее близким к Р700 непосредственным акцептором электронов от пер-
первичного донора служит, по-видимому, мономер хлорофилла а, полоса поглощения
которого находится при 693-695 нм (Хл 695). Перенос электрона от Р7Оо на Ао
осуществляется быстрее чем за 10 пс и сопровождается выцветанием полосы Хл 695.
После этого электрон за 20-50 пс переходит на акцептор А\, который, по-видимому,
представляет собой филлохинон (витамин Ki). С каждым реакционным центром
ФС I ассоциированы две молекулы филлохинона,одна из которых связана более
прочно, чем другая.
Время переноса электрона с А\ на Fx по разным оценкам находится в пределах
от 200 пс до 20-50 не, а время переноса с Fx на Fa и далее на FB составляет
170 не. В кинетике переноса электрона от пластоцианина на Р700 различают две
фазы — быструю и медленную с временами 12-14 мке и 200 мке, которые связывают
с существованием, соответственно, двух популяций молекул пластоцианина вблизи
первичного донора ФС I.
Кинетика переноса электрона на ферредоксин, согласно современным данным,
может быть представлена тремя компонентами с характерными временами 500 не,
13-20 мке и 100-123 мке, что связано с возможным образованием трех типов
комплексов ФС I с ферредоксином (см. схему переноса электрона в ФС I на
рис. XXVII.21).
Данные биофизических методов, методов молекулярной генетики и биохимии
белков в сочетании с последними результатами рентгеноструктурного анализа с
разрешением 4,5 А (группа Крауса и Витта) позволили получить информацию о
структуре РЦ ФС I.
322
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Субъединицы PsaA и PsaB формируют гетеродимер и содержат по 11 транс-
трансмембранных а-спиралей и еще четыре спирали, параллельные плоскости мембра-
мембраны. Эти субъединицы связывают около 100 молекул хлорофилла а, 12-16 молекул
C-каротина, две молекулы филлохинона и один 4Fe, 4S кластер Fx, расположен-
расположенный в месте контакта субъединиц. Периферическая небольшая субъединица PsaC
(М.м. 8,9 кДа), расположенная со стромальной стороны, несет в своем составе два
терминальных 4Fe, 4S кластера (Fa и Fb). Функции всех других белков, не несущих
в своем составе пигментов, еще полностью не расшифрованы, однако известно, что
белки PsaD и PsaF необходимы для взаимодействия с ферредоксином и пласто-
цианином, соответственно, PsaL играет важную роль при образовании тримеров
ФС I (см. рис. XXVII.22).
Ет, мВ
-1,4
-1,2
-1,0
-0,8
-0,6
-0,4
-0,2
0,0
0,2
0,4
0,6
-
-
-
-
-
-
-
-
-
Г рс ^
-V °—>
12,200 мкс
/>700
170 нс
Р700
500 не - 100 мкс
[О Fd
Рис. XXVII.21.
Перенос электрона в РЦ ФС I (по P. R. Chitnis, 1996)
Представлены среднеточечные потенциалы и времена переноса. Вариации в оценках определяются
данными, полученными в различных лабораториях. PC — пластоцианин, Fd— ферредоксин.
Около люменальнои поверхности в пределах субъединиц PsaA и PsaB локали-
локализуются две молекулы хлорофилла а, расстояние между центрами которых составля-
составляет 7-9 А. Такому димеру приписывается роль первичного донора электронов (Р700)
i 6. Реакционные центры фотосистемы I зеленых растений
323
«Просвет» /" рс ^^
тилакоида
Рис. XXVII.22.
Схема структурной организации ФС I (no J.H. Golbeck, 1992)
12
'BAQ
/22
9
О
Рис. XXVII. 22а.
Локализация кофакторов РЦ ФС I в пределах
белкового гетородимера (по N.Krauss et al.,
1993)
Кружками показаны геометрические центры молекул
переносчиков электронов, цифры — расстояния меж-
между центрами в А. Плоскость, образованная при со-
соединении центров Fx, ^*ав и ^*ва> перпендикулярна
плоскости мембраны
а — вид в направлении, перпендикулярном плоскости
Fx, FAB, FBA.
b — тот же вид при повороте на 90° вокруг вертикали
(оси 2-го порядка), проходящей через -Fx-
121
15
I 12
12
Р700
6.
О-'--4
324 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
в ФС I. На расстоянии 12 А от димера обнаружены еще две молекулы хлорофилла а,
которые спектрально не выявляются. Далее следует еще пара молекул хлорофилла а,
одна из которых, по-видимому, служит в качестве переносчика электронов Aq.
Молекула филлохинона даже при разрешении 4,5 А не идентифицируется. Fx лока-
локализован в центре гетеродимера таким образом, что служит точкой, через которую
можно провести ось симметрии второго порядка C<i- Локализация кофакторов РЦ
ФС I показана на рис. XXVII.22a.
Таким образом, последовательность переноса электрона в ФС I имеет вид
)
(XXVII.6.1)
Восстановление Р700 происходит в цепи цит / -* пластоцианин -* Р^о за время
и 200 мкс, а также частично непосредственно от цит / (цит / -* -Рттю) за 15 мкс
(см. рис. XXVII.2).
Аналогично РЦ пурпурных бактерий, в РЦ ФС I происходит образование три-
плетных и синглетных состояний радикальной пары [Р7'00А{~]. После восстановления
в темноте железосерного белкового комплекса (Fx-Fa-Pb) последующее освещение
вызывает появление замедленной люминесценции @,1-0,2 мкс) в результате реком-
рекомбинации зарядов в радикальной паре:
[PLAI] - [Я?оИ] - РгооАг + /iv. (XXVII.6.2)
При действии магнитного поля переходы S->-Tb радикальной паре затрудня-
затрудняются, и в результате возрастает заселенность синглетного состояния 1 [Р7'00 А{~]. Как
следствие, происходит усиление замедленной рекомбинационной люминесценции в
РЦ и увеличение флуоресценции ближайших к РЦ молекул хлорофилла антенны.
§ 7. Реакционные центры фотосистемы II зеленых растений
Основная функция РЦ ФС II состоит в акцептировании электронов от кислородвы-
деляющего комплекса КВК и дальнейшей передаче их в цепь переносчиков по на-
направлению в ФС I. Первичным донором электрона в ФС II является фотоактивный
пигмент Рбвсъ названный так по аналогии с Ргоо- Освещение вызывает выцветание
полосы при 680-690 нм и некоторое увеличение поглощения при 820 нм, характерное
для катион-радикала хлорофилла. Характер возникающего сигнала ЭПР указывает
на то, что Р^о может представлять собой димер хлорофилла. Однако существуют
и другие соображения о природе Рбво, в которых учитывается, что красный сдвиг в
спектре поглощения Рбво по сравнению с мономерной формой хлорофилла намного
меньше, чем соответствующий сдвиг в случае Psgo специальной пары димер Бхл2 в
РЦ пурпурных бактерий. Спектральные свойства Рбво связаны с экситонным взаи-
взаимодействием фотоактивного хлорофилла с другими шестью молекулами хлорофил-
хлорофилла, расположенными в РЦ на расстояниях больших, чем в димере. По-видимому, Рбво
представляет собой своего рода «мультимер», состоящий из нескольких слабо вза-
взаимодействующих пигментов (Тетенькин, Гуляев). Любое воздействие, нарушающее
их экситонные взаимодействия, приводит к резкому уменьшению длинноволнового
сдвига полосы поглощения Рбво •
§ 7. Реакционные центры фотосистемы II зеленых растений 325
Поскольку Рб80 окисляет молекулу воды, его окислительно-восстановительный
потенциал Е-^м должен превышать +810 мВ. Это означает, что Pggo—сильный
окислитель, который может окислять соседние молекулы пигментов, если восстана-
восстанавливающий его «нормальный» донор в цепи не имеет электронов. Именно поэтому
исследования -Pggo затруднены, так как накопить Pgg0 B достаточном количестве
можно только в сильно окислительных условиях и при ингибировании КВК.
Большое внимание уделяют изучению природы первичного акцептора, рас-
расположенного между Pggo и первичным пластохиноном. Оказалось, что дифферен-
дифференциальные спектры фотоиндуцированных изменений поглощения субхлоропластных
фрагментов, обогащенных ФС II и измеренных в восстановительных условиях,
соответствуют спектру фотовосстановления феофитина (Фф). Выцветание полос
поглощения при 408-410, 422-428, 685 нм, а также полос при 518 и 545 нм, появле-
появление широких полос при 450 и 650 нм, узкой полосы при 675 нм, характерны для
появления Фф в реакции:
Р6*80Фф - Р+0Фф-. (XXVII.7.1)
Общая схема переноса имеет вид
Низкие Ph Диурон.
КВК -U- Тир -> P6S0 -> Фф -> QA -f Qb -> пул хинонов. (XXVII.7.2)
V У
Как видно, восстановление Р^о обеспечивается вторичным донором тирозином, ко-
который получает электроны от КВК. Роль первичного акцептора играет феофитин
(Климов).
Состав реакционного центра. Кроме 6 молекул хлорофилла, в РЦ ФС II содер-
содержатся по 2 молекулы Фф и C-каротина и одна молекула цит &559- Две из шести
молекул хлорофилла непосредственно связаны с субъединицей кор-комплекса СР 47
и служат «воротами» для приема энергии возбуждения в РЦ из внутренней антенны
ФС П. Структурной основой РЦ являются интегральные белки Д1 и Дг, несколь-
несколько периферических полипептидов меньшей молекулярной массы (около 10 кДа), а
также цит Р»559-
Белок Д1 несет на себе первичный акцептор Фф и вторичный донор для РЦ
ФС II YZ (или Z) —молекулу Тир 161, а также молекулу Гис, берущего электроны
от КВК. На белке Дг расположены неактивный Тир 160 (Тир Д) и первичный хи-
нон Фа, берущий электрон от Фф и передающий на Фв, который локализован на
белке Дь
На рис. XXVII. 23 приведена схема структурной организации РЦ ФС II, где
показан путь переноса электрона от Н2О на хиноны, Mn-содержащий комплекс раз-
разложения воды и выделения кислорода (см. ниже), а также обозначены молекулярные
веса субединиц белков, связанных с РЦ ФС П.
Цитохром &559 играет важную роль, обеспечивая защиту реакционного центра
от фотоингибирования.
¦\У В акцепторной части молекулы хинонов Qa, Qb представляют собой пласто-
хиноны. Перенос электрона между первичным и вторичным пластохинонами
Qa и Qb блокируется диуроном, действием низкой температуры. При низких зна-
значениях рН и пониженных температурах прерывается восстановление Pggo- Одним
326
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
из методов исследования реакций, протекающих в ФС II, является регистрация
флуоресценции Хла антенны, зависящей от состояния РЦ ФС П. Очевидно, туше-
тушение флуоресценции должно происходить в состоянии PqsqQa, когда центр открыт
(см. §4 гл. XXVII). Восстановление Qa переводит центры в закрытое состояние
P&%oQ~A, гЛе тушение флуоресценции ослаблено, и соответственно ее интенсивность
возрастает. ?
Строма
Ay
Vs4t
2Н2О
Рис. XXVII.23.
Схема структурной организации фотосистемы II
"Просвет"
тилакоида
Однако тушение флуоресценции происходит и в том случае, когда центры на-
находятся в закрытом состоянии Р$$о, где фотоактивный пигмент окислен. Причи-
Причина этого состоит в том, что спектр поглощения катион-радикала Хла"!" обладает
широкой полосой в красной и ближней инфракрасной областях F00-850 нм). Это
обеспечивает резонансный перенос (см. § 9 гл. XIII) энергии возбуждения от моле-
молекул антенны на Хла"!" (.Pggo), перевод его на нижний возбужденный электронный
уровень около 820 нм с последующей деградацией энергии, не связанной уже с фото-
фотосинтезом. Таким образом, увеличение выхода флуоресценции антенны происходит
7. Реакционные центры фотосистемы II зеленых растений 327
только в состоянии PqsoQ^¦ Если затем Q~^ отдает электрон на Qb, а Рб80 остается в
восстановленной форме (PesoQ^Q в -* PqsoQaQ~b), to флуоресценция уменьшается.
¦\У Кинетику переноса электрона в ФС II исследовали с помощью флуоресцент-
ных методов в условиях действия ингибиторов (диурон, низкий рН среды) и
с помощью измерения флуоресценции после каждой вспышки света при действии
серии последовательных вспышек. Так, давая последовательные вспышки света и
варьируя темновой интервал между ними, можно измерить время, необходимое для
переноса электрона от Qa на Qb- Кинетику появления и исчезновения -Pggo измеряли
непосредственно в максимуме поглощения при 680 или 820 нм. ?
Восстановление первичного пластохинона Qa в опытах с двумя последователь-
последовательными вспышками регистрировали по изменению поглощения при 320 нм. Было
установлено, что понижение температуры или действие диурона приводит к за-
замедлению переноса электрона на пластохинон. Как и в пурпурных бактериях, эта
реакция сопровождается другими изменениями поглощения, в частности при 550 нм
(эффект С-550). Этот эффект представляет собой электрохромный сдвиг полосы
поглощения C-каротина и является индикатором восстановления Qa, подобно тому,
как в РЦ пурпурных бактерий восстановление Qa сопровождается электрохромным
сдвигом полосы поглощения бактериофеофитина.
В последнее время появились данные о гетерогенном характере первичного
акцептора Qa- В присутствии диурона, когда не происходит повторного окисления
Qa за счет дальнейшего переноса электрона на Qb, выход флуоресценции является
мерой общего количества фотовосстанавливающихся молекул Qa- Обычно кинети-
кинетика фотовосстановления носит двухфазный характер: быстрая а и медленная C экс-
экспоненциальные фазы, регистрируемые по индукционной кривой нарастания флуо-
флуоресценции. Если перед освещением препараты инкубировать при определенном зна-
значении окислительно-восстановительного потенциала среды, то последующее фото-
индуцированное увеличение флуоресценции будет тем меньше, чем больше молекул
Qa химически восстановлено в темноте. Кривая окислительно-восстановительного
титрования флуоресценции хлоропластов в присутствии диурона имеет явно вы-
выраженный двухфазный характер с двумя компонентами: Е\/2 ~ —250 мВ (Qa) и
Е\/2 ~ 0 мВ (Qa)- Быстрая а-фаза восстановления Qa соответствует высокопо-
высокопотенциальному Qa, а более медленнаяC-фаза — низкопотенциальному Q\ в соответ-
соответствии с наличием двух типов фотосистем: ФС Па и ФС Пр, возможно, локализован-
локализованных в разных частях тилакоида.
С помощью метода ЭПР при температуре жидкого Не был обнаружен сиг-
сигнал, соответствующий триплетному состоянию 3Рб80- Так же как и в препаратах
бактериальных РЦ, триплетный сигнал появляется только при освещении РЦ, у
которых в темноте исходно восстановлен первичный пластохинон. Если в исходном
состоянии перед освещением Фф находился в восстановленном состоянии, то ампли-
амплитуда триплетного сигнала резко уменьшалась. Происходящие в РЦ ФС II процессы
образования радикальной пары и триплетных состояний можно суммировать на
схеме:
DP680 Фф Q~A —^ ?>ptQ фф^ q- > ?Зр680 фф q- (XXVII.7.3)
328
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Общая последовательность процессов переноса электрона в РЦ ФС II приведена
на рис. XXVII. 24. Как видно, за время 3 пс происходит образование радикальной па-
пары Р~!~ Фф. Наряду с прямым переносом электрона на Qa и далее на Qb, возможны
Fe
200 мс
200 мс
200 пс
ФФ
hv
hv
200 пс
H+
O2+2H+
Рис. XXVII. 24.
Схема переноса электрона в РЦ ФС П.
Fv—переменная флуоресценция, Fo—исходная флуоресценция, FM = Fo + Fv—максимальная
флуоресценция, возникающая при ингибировании потока электронов. КВК — кислородвыделяю-
щий (Mn-содержащий) комплекс. So,Si,S2,S3,Si — состояния КВК. Гис, Тир, Qa, Qs, ^680, Фф>
Пх — остальные переносчики. Обозначены времена переноса и длительность флуоресценции _Fo
и Fx
и обратные реакции при восстановлении Qa, ведущие к замедленной флуоресцен-
флуоресценции Fy (~ 2 нм) или образованию триплетного состояния. Восполнение дефицита
электронов происходит за ~ 30 не от донора тирозина, берущего электроны за
^ 1 мс от КВК.
Хинонный акцепторный комплекс. Здесь будут рассмотрены закономерности,
которым подчиняется перенос электрона в акцепторном комплексе РЦ, включа-
7. Реакционные центры фотосистемы II зеленых растений
329
ющем первичный и вторичный хинонные акцепторы Qa и Qb- Изучение этого
процесса дает важную информацию о физических механизмах переноса электрона
в ЭТЦ (см. гл. XXVIII).
Большая часть экспериментальных данных по кинетике переноса электронов
в хинонном комплексе была получена с помощью освещения короткими световыми
вспышками хлоропластов или изолированных РЦ, хроматофоров и целых клеток
пурпурных бактерий.
В хлоропластах в ответ на первую вспышку индуцируется перенос
QaQb Пх
Пх - QAQl Пх .
В ответ на вторую
QlQl
QaQI Пх
+2Н
QAQBIlxE2,
(XXVII. 7.4)
(XXVII.7.5)
где Пх — пул пластохинонов. Здесь не отображены фотохимические реакции Pqso >
который окисляется на каждую вспышку Рб80 ~* -^Vso' отдавая электрон на Qaj и
быстро восстанавливается от D±. Известно, что семихиноны Q~ характеризуются
поглощением в спектральной области 320-450 нм (появление такого поглощения
ясно указывает на образование семихинона). Поэтому если осветить РЦ одиночной
вспышкой света, то возникает поглощение при
320-450 нм, которое не изменяется при переходе
/~. — /~. 200-500 мкс х-. гл —
Qa^b *¦ QaQb> так как число семихино-
нов при этом остается тем же. Состояние может
сохраняться в темноте в течение нескольких секунд.
Однако после второй вспышки света происходит уже
образование дважды восстановленного хинона QB~ и
исчезновение полосы поглощения семихинона. Моле-
Молекула QB~ протонируется из внешнего окружения и
обменивается с одной молекулой хинона из пула Пх,
занимая ее место. Система возвращается в исходное
состояние с той лишь разницей, что одна молекула
пула теперь протонирована: Пх Н2. Третья вспышка
опять приводит к образованию семихинонных ради-
радикалов и соответствующему увеличению поглощения.
Колебания оптического поглощения в области 320-
450 нм соответствуют образованию и распаду семи-
хинонного радикала, что сопровождается аналогич-
аналогичными колебаниями сигнала ЭПР (g = 1,82).
В препаратах хроматофоров и РЦ пурпурных
бактерий перенос электронов в пул убихинонов происходит аналогичным образом
и также приводит к появлению осцилляции (рис. XXVII.25). Двухтактные колебания
наблюдаются, как правило, в хроматофорах, к которым добавляется медиатор М,
быстро восстанавливающий фотоокисленныи пигмент перед очередной вспышкой
света.
Рис. XXVII.25.
Изменение поглощения АА
семихинонной формы вто-
вторичного хинонного акцеп-
акцептора под действием после-
последовательных вспышек света
330 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Общая схема процесса имеет вид
1-я вспышка pqaqb _^U- PfQlQB > P^QaQI
2H+
2-я вспышка PQaQb —^U- P+QJQJ —^ P+QaQbH2 ^^ P^QaQb ^^ PQaQb
2H+
Образованный дважды восстановленный вторичный хинон Qb^-2 быстро окисляет-
окисляется при достаточно высоких окислительно-восстановительных потенциалах среды.
Наоборот, семихинонный вторичный акцептор Q~j^ более стабилен и медленно оки-
окисляется за счет реакции с окисленной формой медиатора. Стабильность связи се-
михинонной формы <ЗЦ с белком РЦ по сравнению с Qb^-2 может быть обусловлена
сильным электростатическим взаимодействием положительно заряженной имида-
зольной группы гистидинового остатка или Fe + белка с отрицательно заряжен-
заряженным Qb- Ингибитор переноса электрона офенантролин обратимо вытесняет Qb с
места специфического связывания на белке, однако не оказывает ингибирующего
действия на перенос электрона от Qa к семихинонной форме Q^, прочно связанной
с белком РЦ.
Упрощенная схема взаимодействия в акцепторной части РЦ пурпурных бакте-
бактерий с медиатором имеет вид
На рис. XXVII.26 (Feher G.) показаны наиболее вероятные протон-транспортные
пути из цитоплазматического пространства в интерьер Qb с аминокислотными
остатками серии L 223 и глутамат L 212 в качестве конечных звеньев проведения со-
соответственно первого и второго протонов путем эстафетной передачи по цепочкам
водородных связей по механизму Гротгуса (XXII, § 4). Данная схема была построена
на основе анализа рентгеноструктурных данных и результатов по влиянию на
протонный транспорт замены конкретных аминокислотных остатков в окружении
Qb методами направленного точечного мутагенеза (см. §8). При замене полярного
остатка аспартат L 213 с группой СОО~ на неполярный аспаратин L 213 перенос
протона блокируется, что указывает на роль электростатических взаимодействий
в стабилизации протона. Интересно, что функциональную активность можно
вновь восстановить путем замены аспарагин М 44 на аспартат М 44 в другой
М-субъединице. Очевидно, влияние электростатических взаимодействий может
передаваться по белковой глобуле в силу кооперативных свойств.
Выделение кислорода. Окисление воды катализируется КВК, представляющим
собой один из главных компонентов ФС2. Вода является источником электронов
и протонов для синтеза фотосинтетическим аппаратом высокоэнергетических со-
соединений (НАДФ и АТФ), используемых затем в темновых реакциях. В результате
фотолиза воды образуется также побочный продукт — молекулярный кислород,
выделяющийся в наружную среду. Поскольку эта реакция является практически
единственным источником кислорода на нашей планете, важность ее трудно пере-
переоценить.
7. Реакционные центры фотосистемы II зеленых растений
331
Каталитическим центром КВК является четырехъядерныи кластер марганца,
осуществляющий окисление в каждом каталитическом акте 2-х молекул воды и
синтез одной молекулы кислорода, при этом во внутритилакоидное пространство
Гис L190
Рис. XXVII.26.
Вероятные пути переноса первого Н+ A) и второго Н+ B) протонов к восстана-
восстанавливаемому вторичному хинону в РЦ пурпурных бактерий. Штриховкой указана
область локализации пула связанных в структуре РЦ вблизи Qb молекул воды (по
М. Y. Okamura, G. Feher, 1992)
выделяются четыре протона, а по фотосинтетической электрон-транспортной цепи
на восстановление НАДФ+ уходят четыре электрона. Для обеспечения этой реакции
необходимо последовательное поглощение 4-х квантов света. Поглощение реакцион-
реакционным центром кванта света сопровождается разделением зарядов — восстановлением
феофитина и окислением первичного донора -Рбво- Окисленный первичный донор
Р^о обладает уникально высоким для биологических соединений окислительно-
восстановительным потенциалом (около 1,2 В), достаточным для окисления воды, и
окисляет вторичный донор электронов, которым является редокс-активный остаток
тирозина Yz, расположенный в позиции 161 в аминокислотной последовательности
интегрального полипептида D1 C3 кДа). Полипептид D1 совместно с полипептидом
D2 C3 кДа) формируют реакционный центр ФС П. В свою очередь окисленный
переносчик электронов Yz (редокс-потенциал пары Yz/Y^« около 1 в) окисляет
марганцевый кластер. Последовательное поглощение 4-х квантов света сопровожда-
сопровождается последовательным удалением из марганцевого кластера 4-х электронов, после
332
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
чего окисленный марганцевый кластер окисляет две молекулы воды и восстанавли-
восстанавливается до исходного редокс-состояния, завершая тем самым каталитический цикл.
Этот каталитический цикл носит название «S-цикла и показан на рис. XXVII.27, А.
Мп(П) Мп(Ш)
Mn(IV) Mn(IV)
Mn(IV) Mn(IV)
Mn(IV) Mn(IV)
H++e
Mn(III) Mn(IV)
Mn(IV) Mn(IV)
g
12
20
24
Рис. XXVII. 27.
А) Цикл 5-состояний марганцевого кластера КВК. В рамках показан состав кла-
кластера для каждого из 5-состояний. Б) Выделение СЬ в зависимости от номера N
вспышки
5-цикл состоит из 5-ти 5-состояний S0S4. Каждому 5-состоянию соответствует
определенная степень окисленности катионов, образующих марганцевый кластер
(показано в рамках на рис. XXVII.27). Поглощение реакционным центром каждого
из 4-х квантов света сопровождается одноэлектронным окислением катионов мар-
марганца и последовательным переходом кластера от низшего состояния Sq к высшему
§ 7. Реакционные центры фотосистемы II зеленых растений 333
состоянию «S4. По-видимому, в этом процессе имеется одно исключение, а именно,
при переходе из состояния S2—S3 имеет место окисление не катиона марганца, а
остатка гистидина, входящего в состав координационной сферы марганцевого кла-
кластера. После последовательной экстракции из марганцевого кластера 4-х электронов
кластер переходит в нестабильное состояние 54, из которого без влияния света кла-
кластер возвращается в интервале 1 мс в исходное состояние «So за счет восстановления
электронами из воды; при этом выделяется молекула кислорода. Окисление воды
и, по-видимому, ее связывание с марганцевым кластером имеют место только в
состоянии 54- Выделение протонов в процессе «S-цикла происходит при переходе
So-Si (один протон), S2-S3 (один протон) и S4-S0 (два протона).
Функционирование КВК успешно изучают по кинетике выделения Ог на оди-
одиночные световые вспышки A-10 мкс). Выход Ог на отдельную вспышку зависит
от номера вспышки в серии из нескольких последовательных вспышек. Эта зави-
зависимость проявляется в виде затухающих колебаний в выделении Ог на каждую
вспышку с периодом в четыре вспышки: максимальный выход наблюдается на 3, 7,
11 и т. д. вспышку (рис. XXVII.27, Б).
Темновая дезактивация более окисленных состояний в менее окисленные про-
происходит по одноступенчатому механизму (S3-S2S1). После длительного освещения
постоянным светом устанавливается равномерное распределение по состояниям So,
Si, S2, S3 B5% в каждом из состояний). В результате последующей темновой ада-
адаптации и перехода S$-Si и S2-S1 устанавливается такое распределение: 25% So,
75% Si и 0% «S2 и <?з, поскольку состояния S2 и 5з в темноте нестабильны и в
интервале от нескольких секунд до нескольких минут переходят в состояние Si.
Для активации КВК, адаптированного к темноте, и перевода его в состояние «S3
необходимо дать две вспышки, которые переведут 75% из состояния Si в «S3. Тре-
Третья по счету вспышка вызовет переход S3—S4 и интенсивное выделение Ог, что и
наблюдается в опытах. Характерные времена переходов между состояниями So~Si,
S1-S2, S2-S3 находятся в пределах 200-500 мкс, что близко к временам преноса
Qa~Qb, тогда как переход S$-So занимает несколько мс.
Помимо марганца необходимым компонентом КВК являются катион кальция
и один или несколько анионов хлора. Роль этих кофакторов в механизме окисления
воды неясна, однако в их отсутствии кислород не выделяется. Кальций расположен
в непосредственной близости от марганцевого кластера и связан с ним мостиком,
роль которого играет карбоксильная группа аспарагиновой или глутаминовой ами-
аминокислоты. По видимому, этот катион обеспечивает либо доступ воды к марганце-
марганцевому кластеру, либо отток протонов, образующихся при депротонировании воды, от
марганцевого кластера в наружную среду. Анион хлора, возможно, связан с одним
из катионов марганца.
В последнее время с привлечением современных методов рентгеновской аб-
абсорбционной спектроскопии (EXAFS, extended X-ray absorption spectroscopy fine
structure) удалось достичь больших успехов в изучении структуры марганцевого
кластера. Согласно предложенной на основании этих данных модели, марганцевый
кластер состоит (рис. XXVII.28) из двух димеров, в каждом из которых катионы
марганца расположены относительно друг друга на расстоянии 2,7 А и соединены
между собой двумя кислородными мостиками. В свою очередь димеры располо-
расположены относительно друг друга на расстоянии 3,3 А и соединены между собой
334
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
кислородным мостиком и одной или двумя карбоксильными группами. В состав
лигандов катионов марганца входят остатки гистидина и карбоксильные группы
аспарагиновой и/или глутаминовой аминокислот. Результаты точечного мутагене-
мутагенеза указывают на то, что эти аминокислотные остатки принадлежат полипептидам
D1 и D2, образующим реакционный центр ФС II, и расположены с внутренней
стороны тилакоидной мембраны.
Рис. XXVII.28.
Модель марганцевого кластера КВК, предложенная на основании данных рентге-
рентгеновской спектроскопии (по Yachandra et al., 1993)
На основе этой модели был предложен механизм окисления воды, схематически
показанный на рис. XXVII.29. Согласно предложенной схеме в одном из димеров
в процессе окисления марганцевого кластера происходит образование молекулы
перекиси водорода, которая выделяется и разлагается с образованием молекулы
кислорода с участием второго димера марганца. Образование перекиси водоро-
водорода происходит следующим образом. В фотолизе воды принимает участие редокс-
активный остаток гистидина, который окисляется при переходе из состояния $2 в
состояние 5з- Окисление гистидина сопровождается изменением его рК, в результа-
результате чего образуется водородная связь между гистидином и кислородом, формирую-
формирующим мостик в одном из димеров марганца. Дальнейшее одноэлектронное окисление
марганцевого кластера (S3-S4) сопровождается образованием связи между двумя
протонированными атомами кислорода— мостиками в димере — и формированием
молекулы перекиси водорода. Перекись водорода высвобождается и разлагается с
участием второго димера марганца.
7. Реакционные центры фотосистемы II зеленых растений
335
о-Мп»
Мп1"
аМп
<+>
rr
Мп"
/
/ш
о- —о.
ЧУ
;
о-Мп~— о
Ч(
н
~0v
*Mn"
/
чо^М„№
о—-,Мп
о-Мп—о
Ч' "
В
.'. ^O^Mn'-'—
о^мп-о \ у
У о Н' ~!]--oN
S
o2
2H,O
У O-Mn;.- -, P.
CI
4Д ^04*Mrr—
¦/ о i
е, Н"
О Са"
о" \ Y
в'. Н* nf,
o.
CI
4.\ ^о4ип"-"-'-
о-мп-о \
Са
s, ¦'
a^o' --
O-Mn-O'-'i
'"' \ p
О u-' ,
. " -O-^Mn-- ... PI
02 6.
CI
±л .¦¦¦
O-Mn-O' \
/c \ о
—(/ * н ч.
O—Mn—0^3*/
¦ O-Mn;-- -, / .
S? ' / °\ ^<?a'
Рис. XXVII.29.
Гипотетический механизм фотолиза воды в ФС II
A) с участием гистидина (по V. L. Ресогаго)
B) с участием тирозина (по C.Tommos, G. T.Babcock, 1998)
336 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Как уже отмечалось выше, окисление марганцевого кластера осуществляется
окисленным вторичным донором Yz- Однако, роль этого компонента в функциони-
функционировании донорного участка может быть более сложной. По-видимому, он не только
участвует в переносе электронов от марганцевого кластера к Pqsq, но и является,
наряду с ионами марганца, кальция и хлора, составным элементом КВК, участвуя
в депротонировании воды в процессе ее окисления.
Таким образом, согласно современным представлениям КВК, осуществляющий
фотолиз воды, состоит (рис. XXVII.30) из четырехъядерного кластера марганца,
образованного двумя димерами, катиона кальция, связанного с марганцевым кла-
кластером карбоксильной группой глутаминовой и аспарагиновой аминокислот, аниона
хлора, входящего в координационную сферу марганцевого кластера, редокс-актив-
ного остатка гистидина, связанного с одним из катионов Мп, и редокс-активного
остатка тирозина (TyrZ), участвующего не только в переносе электрона от марган-
марганцевого кластера к первичному донору Р$$о, но и, по-видимому, в депротонировании
воды в процессе ее окисления.
§ 8. Использование направленного мутагенеза для изучения
первичных процессов фотосинтеза
Мы видели, что активность фотосинтетических систем существенно зависит от
сбалансированного взаимодействия между белками и редокс-активными простети-
ческими группами, входящими в состав этих комплексов.
Первичная аминокислотная последовательность большинства структурных бел-
белков хорошо изучена. Для ряда белков реакционных центров определена и трехмер-
трехмерная пространственная структура. Однако структурно-функциональные соотноше-
соотношения в таких сложных системах не всегда очевидны. Именно поэтому направленная
модификация структуры белка с параллельным контролем фотосинтетической ак-
активности является одним из наиболее мощных инструментов исследования механиз-
механизмов процесса фотосинтеза.
Модификация структуры белка может быть достигнута, например, путем му-
мутации гена, кодирующего его биосинтез.
Условно можно выделить 2 типа мутагенеза:
а) случайные мутации,
б) направленный, или специфический мутагенез.
Самопроизвольные или индуцированные случайные мутации — явление доста-
достаточно широко известное. Среди наиболее распространенных мутагенных факторов
можно отметить ионизирующее излучение, ультрафиолет, некоторые химические
мутагены и др. С помощью мутагенных воздействий были получены и выделены
мутанты фотосинтезирующих организмов, дефицитные по тем или иным комплек-
комплексам (реакционный центр, фотосистемы I или II, светособирающая антенна и др.)
или отдельным компонентам комплексов (каротиноиды, некоторые полипептиды).
При изучении подобных мутантов были получены очень интересные и показа-
показательные результаты. Однако, случайный характер возникновения мутаций, плей-
отропный, а в некоторых случаях скрытый, характер их проявления существенно
ограничивает возможности использования классического мутагенеза.
i 8. Использование направленного мутагенеза для изучения первичных процессов
337
В последнее время в молекулярной генетике все большее применение начинают
получать методы сайт-специфического или направленного мутагенеза. Уже первые
опыты их применения для исследования первичных процессов фотосинтеза дали
очень интересные и многообещающие результаты. Остановимся кратко на этих
данных и на особенностях направленного мутагенеза фотосинтезирующих орга-
организмов.
Dl
Рис. XXVII.30.
Схема организации КВК в ФС II
Обычно направленный мутагенез включает стадии выделения гена, интересу-
интересующего экспериментатора, модификации (in vitro) с последующим повторным вве-
введением модифицированного гена в исходный организм.
Гомологичная рекомбинация ДНК, необходимая для введения генов в клетку,
эффективно протекает, как правило, только у прокариотов. Именно поэтому круг
фотосинтезирующих организмов, подвергнутых направленному мутагенезу, в на-
настоящее время ограничен бактериями и некоторыми одноклеточными водорослями.
Выделяют 3 основных методических подхода к направленному мутагенезу:
1. Делеция или инактивация гена.
2. Замена нативного гена на гомологичный ген из другого организма.
3. Сайт-специфичный мутагенез, при котором происходит точечная замена
только одного из оснований в молекуле ДНК.
Наиболее мощным и направленным методом воздействия на структуру белка
является сайт-специфичный мутагенез, успешно применявшийся для изучения био-
биосинтеза белков синтетического аппарата цианобактерии Synechocystis.
338 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Благодаря точечным мутациям оснований в молекуле ДНК происходит напра-
направленная замена одних аминокислот в структуре белка на другие.
Направленным мутагенезом гена psbA, кодирующего биосинтез белка D1 фо-
фотосистемы II цианобактерии Synechocystis, замещали остаток Тир 169 этого белка
на Фен. Фототрофный рост бактерий при этом подавляется, а по характеристикам
электрон-транспортных реакций (сигналы ЭПР, спектры поглощения) можно за-
заключить, что остаток Тир 161 служит непосредственным донором электронов для
Pg^0 в фотосистеме П. Аналогичные исследования, выполненные на фотосинтези-
рующих бактериях Rb. sphaeroides, показали, что остаток Тир 162 субъединицы L
белка реакционного центра участвует в переносе электрона от цитохрома с на Р$7о-
С несколько иной целью метод направленного мутагенеза был применен при
исследовании структуры первичного донора в бактериальном фотосинтетическом
реакционном центре. Известно, что аксиальными лигандами атомов Mg в димере
бактериохлорофилла служат остатки Гис 173 и Гис 200. При замене Гис 200 на
Phe или Leu происходит выпадение Mg и феофитинизация одной из молекул бакте-
бактериохлорофилла в димере. Такая модификация реакционного центра и образование
гетеродимера не ингибирует фотохимической активности, но изменяет кинетиче-
кинетические и спектральные характеристики процессов переноса электрона. Так, величина
квантового выхода первичного разделения зарядов у мутанта уменьшена в 2 раза по
сравнению с контролем, а константа скорости этой реакции упала до к = 1/30 пс
по сравнению с к = 1/4 пс у интактных центров.
Аналогичные исследования проводятся по изучению роли аминокислотных
остатков белков в других сайтах, фотосинтетической электрон-транспортной
цепи.
Увеличение числа водородных связей при замене Фен или Лей на Гис, наоборот,
замедляет процесс разделения зарядов за счет уменьшения скорости релаксацион-
релаксационных процессов в РЦ (см. гл. XXVIII).
Следует особо подчеркнуть, что само по себе изменение эффективности процес-
процесса переноса электрона при замене путем точечной мутации одной аминокислоты на
другую не всегда говорит о непосредственном участии данного аминокислотного
остатка в механизме изучаемой реакции. Обнаруживаемая при этом корреляция
может иметь и опосредованный характер в силу изменения общих структурных
особенностей белков РЦ при их модификации. Уместно провести в этих случаях
аналогию с аллостерическим эффектом ингибирования ферментов, который дости-
достигается вследствие взаимодействия ингибитора с белковой глобулой в месте, удален-
удаленном от активного центра. Причина этого состоит в кооперативных свойствах белка,
в результате чего локальные структурные изменения могут распространяться по
всей глобуле, влияя на функциональные свойства белка.
§ 9. Методы исследования сверхбыстрых процессов
в реакционных центрах фотосинтеза
В предыдущих разделах мы рассматривали процессы переноса электрона в реакци-
реакционных центрах фотосинтеза.
На рис. XXVII.31 представлена обобщенная схема транспорта электрона в РЦ
бактериального фотосинтеза и фотосистем I и П. Как видно, между тремя типа-
§ 9. Методы исследования сверхбыстрых процессов в реакционных центрах фотосинтеза 339
ми РЦ существует определенное сходство в отношении кинетики основных стадий
переноса электрона. Быстрое начальное разделение заряда (т < 3 пс) и восстано-
восстановление первичным фотоактивным донором (Pg-jQ, Р700, Peso) первичного акцептора
порфириновой природы (Бфф, Хл, Фф) сопровождается последующим более мед-
медленным (т ~ 150 пс) переносом заряда на вторичные акцепторы хинонной природы
Qa (убихинон, филлохинон, пластохинон), а затем далее за т ~ 100 мкс — на Qb
(убихинон, пластохинон) или железо-серные центры (ФС I).
Окисленный фотоактивный донор Р восстанавливается (за ~ 2 мкс) от вто-
вторичного донора D, роль которого выполняет цитохром с, пластохинон или тиро-
тирозин. Обратные реакции переноса электрона происходят намного медленнее прямых
(т ~ 1-10 не), что обеспечивает высокую эффективность общего потока электронов.
Расшифровка деталей этой кинетической картины стала возможной благодаря
применению новых методов лазерной пикосекундной и фемтосекундной спектро-
спектроскопии. Ниже на конкретных примерах мы рассмотрим характер эксперименталь-
экспериментальных данных, анализ которых лежит в основе модели первичных процессов в РЦ.
Этот материал полезен также в качестве иллюстрации принципиальной роли био-
биофизических методов как источника новой информации о молекулярных механизмах
сверхбыстрых (т sj 10~12 с) процессов в интактных биологических объектах.
Напомним, что применение спектральных абсорбционных методов в фотосин-
фотосинтезе основано на том, что возникающее при приеме и отдаче электрона редокс-
состояние промежуточных переносчиков отличаются друг от друга спектрами
10 нс
1 мкс Av
D *- PIQa )
3 пс 150 пс
*- P+I"Qa *~ P+rQ a
100 мкс
P+I"QaQb *~ PIQaQ"b
2 мкс
CP+IQaQb > C+PIQaQb
р —*~
I —»-
Qa »-
Qb »-
D »~
Pg70 БХЛ
Вфф
убихинон
убихинон
ЦхС
P7OOXn2(PSI)
СЫ696 (PS I)
филлохинон
Fe-S центры
Пц (пластоцианин)
P68OXn(PSII)
Pheo (PS II)
пластохинон
пластохинон
Z (тирозин)
Рис. XXVII.31.
Обобщенная схема транспорта электрона в РЦ бактериального фотосинтеза и фо-
фотосистем I и II
340 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
поглощения, которые обладают характерными максимумами. Поэтому кинетика
изменения поглощения при определенных длинах волн соответствует кинетике
окислительно-восстановительных превращений того или иного переносчика, т. е.
отражает реакции прихода и ухода электрона.
На рис. XXVII.32, а, приведен спектр поглощения РЦ пурпурных бактерии
(Rb. sphaeroides), на котором обозначены максимумы поглощения отдельных форм
пигментов. Как видно, Бфф имеет максимум при 545 нм и 750 нм, мономерный
Бхл — при 600 нм, 800 нм, а димер Бхл2 фотоактивного пигмента — при 890 нм
(Рвэо). На рис. XXVII.32, б показан абсорбционный дифференциальный спектр,
получающийся в результате образования восстановленного Бфф при освещении.
Он представляет собой разность спектров поглощения на свету и в темноте
(«свет минус темнота») (ср. рис. XXVII. 16). На спектре обозначены отрицательные
E45 нм, 750 нм) максимумы, соответствующие появлению анион-радикала Бфф в
результате исчезновения нейтрального Бфф (Бфф —> Бфф~). Видно также, что
Бфф~ характеризуется и появлением положительного максимума в районе 665-
675 нм. Кроме того, появление отрицательного заряда на Бфф приводит вследствие
электрохромного эффекта к сдвигу в коротковолновую область полосы поглощения
мономерного Бхл, что проявляется в характерных полосах в дифференциальном
спектре при 600 нм и 800 нм.
Образование катион-радикала Р^о видно на рис. XXVII.32, в, где обозначены
полоса выцветания при 890 нм и положительные изменения в области 1100-1300 нм,
характерные для окисленного димера Бхл^. Положения этих максимумов сильно
зависит от вида бактерий и от условий эксперимента: интенсивности освещения,
температуры, редокс-потенциала среды, наличия экзогенных доноров и акцепторов
электронов в среде, содержащей РЦ. Это подчас представляет определенные труд-
трудности для правильной интерпретации формы дифференциальных спектров. Тем не
менее по изменению во времени амплитуды максимумов при определенных длинах
волн под действием коротких вспышек света можно судить о кинетике и о после-
последовательности актов переноса электрона на отдельных участках цепи в РЦ. Мы
рассмотрим сущность этого подхода на примере изучения транспорта электрона в
РЦ пурпурных бактерий на акцепторном участке Р$9о Бхл Бфф Qa (§ 5).
Посмотрим, каким образом изучается перенос электрона между Р* и Бфф.
Поскольку Р* теряет оптический возбужденный электрон, отдавая его Бфф, он не
поглощает больше в основной длинноволновой полосе Qy перехода.
Кинетика выцветания поглощения основного максимума Р будет соответство-
соответствовать образованию катион-радикала Р+. Одновременно надо знать и изменение во
времени образования катион-радикала Бфф~. Для этого измеряют поглощение при
длинах волн E45 нм, 675 нм) максимумов в спектре поглощения анион-радика-
анион-радикала Бфф~. Затем проводят сравнение двух кинетических кривых: выцветание длин-
длинноволновой полосы поглощения Р+ и изменение поглощения в спектре анион-ради-
анион-радикала Бфф~. Совпадение характерных времен обоих спектральных изменений, т.е.
совпадение во времени появления Р+ с образованием Бфф~ и будет основой для
заключения о непосредственном взаимодействии переносчиков Р и Бфф в переносе
электрона Р* Бфф -* Р+ Бфф~.
Как мы увидим ниже, в ряде случаев удается зарегистрировать также измене-
изменение в области спектра, характерной для образования анион-радикала мономерного
9. Методы исследования сверхбыстрых процессов в реакционных центрах фотосинтеза 341
а 4оо
400
600
Бхл
Бхл
800
1000
400
500
1000
Рис. XXVII.32.
Спектр поглощения (а) и дифференциальные спектры поглощения (б, в) реакцион-
реакционных центров бактерий (объяснения в тексте) ((а) и (в) по R.Clayton, 1980; (б) по
V. A. Shuvalov, V. V. Klimov, 1976).
342 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Бхл. Это указывает на возможное участие Бхл в качестве промежуточного пере-
переносчика в транспорте электрона (§ 5)
Р*(Бхл)Бфф -* |Р+(Бхл^)Бфф| ^Р+(Бхл)Бфф^.
Понятно, что такой же подход может применяться и для изучения кинетики пере-
переноса электрона на других этапах, где спектральные эффекты определяются только
образованием и исчезновением анион-катион-радикалов переносчиков.
Однако на участке РБхлБфф<Зл начальное возникновение электронного воз-
возбуждения состояния Р* является причиной того, что на коротких временах (т ~
~ 10~12-10~13 с) в спектральные изменения дают свой вклад и другие процессы.
Объединение основного уровня поглощения за счет перехода So -* Si и обра-
образования Pggo сопряжено с появлением новых полос поглощения, характерных для
возбужденного состояния и переходов Si —> 52 на высшие возбужденные синглет-
ные уровни. Это новое фотоиндуцированное поглощение возникает одновременно с
исчезновением (фотовыцветанием) основной полосы поглощения Р. Оно существу-
существует только в течение времени сохранения возбужденного состояния Si в Р*. Оно
исчезает со временем, равным времени дезактивации синглетного возбужденного
состояния или тушения флуоресценции фотоактивного димера Р*.
Поскольку основной вклад в тушение возбуждения Р* дают процессы ухода
элактрона от Р на следующий акцептор, то время затухания флуоресценции Р*
должно совпадать со временем отрыва электрона от димера Бхл в РЦ. Помимо
фотовыцветания основной полосы поглощения, которое наблюдается одновременно
с переходом «So —> Si в Р, дальнейший уход электрона от Р* приводит к образованию
вследствие этого катион-радикала Р~!~ и соответственно к появлению новых поло-
положительных изменений поглощения в спектре при 1200-1350 нм. Время нарастания
этих изменений равно времени переноса электрона от Р* на соседний акцептор.
Восстановление поглощения основной полосы происходит позднее (т ~ 2 мкс) от
вторичного донора электрона D.
Очевидно, наибольшие спектральные эффекты достигаются, когда возбужде-
возбуждение РЦ осуществляется в области основной полосы поглощения Р. Однако это
создает экспериментальные трудности в регистрации эффекта фотовыцветания
максимума Р$9о из-за перекрывания длин волн действующей лазерной вспышки и
сканирующего измеряющего луча света.
Поэтому в ряде случаев применяется метод так называемого стимулированно-
стимулированного, или вынужденного свечения. Если освещать возбужденные молекулы в состоянии
Si светом, который обычно поглощается этой молекулой на основном уровне Sq, to
в результате резонансного взаимодействия будут индуцироваться переходы возбу-
возбужденного уровня Si на основной уровень So, которые сопровождаются испусканием
света флуоресценции (ср. гл. X, §2, (Х.2.16)). Интенсивность этого индуцирован-
индуцированного свечения очевидно зависит от заселения возбужденного уровня Si в момент
действия измерительного света. По мере уменьшения количества возбужденных
молекул в состоянии Si вследствие их дезактивации в РЦ интенсивность индуци-
индуцированного свечения падает. Таким образом, регистрируя после лазерной вспышки
изменение во времени интенсивности индуцированного зондирующим светом све-
свечения с длиной волны в основной полосе поглощения Р, можно судить о кинетике
дезактивации возбуждения Р* в РЦ, связанной с отрывом электрона от Р.
§ 9. Методы исследования сверхбыстрых процессов в реакционных центрах фотосинтеза 343
В реальных измерениях появление вынужденного излучения приводит к кажу-
кажущемуся уменьшению поглощения в РЦ измеряющего света, что регистрируется как
дополнительное фотовыцветание основной полосы поглощения. Можно, однако, про-
проводить регистрацию вынужденного излучения и при других длинах волн в полосе
флуоресценции, где нет перекрывания с длиной волны измерительного света.
1200 -
800 -
400 -
-0,02
Рис. XXVII.33.
а — Затухание самопроиз-
самопроизвольного излучения от Р* в
Rb. sphaeroides R26 при воз-
возбуждении при 850 нм и лю-
люминесценции при 940 нм (по
M.Duet al., 1992)
б—Затухание вынужден-
вынужденного излучения от Р* в
Rb. sphaeroides R26 реги-
регистрировалось при 926 нм,
возбуждение при 870 нм.
Приведем экспериментальные кинетические кривые рассмотренных выше спек-
спектральных изменений, сопровождающих перенос электрона в РЦ. На рис. XXVII.33, а
приведена запись кинетики затухания спонтанной флуоресценции Р* при X = 940 нм
в РЦ при возбуждении светом X = 850 нм. Видно, что кривая затухания флуорес-
флуоресценции, отражающая кинетику отрыва электрона от Р*, включает две компоненты
с временем ii = 2,7 пс и Т2 = 12,1 пс. Короткая компонента спонтанной флуорес-
флуоресценции затухания совпадает с моноэкспоненциальной кривой затухания индуциро-
индуцированного свечения (рис. XXVII.33, б).
344
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
В других случаях затухание вынужденного свечения (образование Р*) также
характеризуется двумя экспонентами с временами 2,9 пс и 12 пс, что может быть
обусловлено личной конкуренцией между двумя путями переноса электрона от Р*
на Бфф с участием мономерного Бхл (см. § 5). Мы рассмотрим этот вопрос в свете
конкретных экспериментальных данных.
-0,08
12 16 -2 0 2 4 6
-0,01
Рис. XXVII.34.
а — Кинетика вынужденного излуче-
излучения при 1050 нм, б — кинетика обра-
образования Р+ при 1310 нм, в — кинети-
кинетики образования Бфф~ (по J. Breton et
al. 1986
В ранних работах Бретона A986) методами фемтосекундной спектроскопии
получены данные о кинетике переноса электрона на Бфф. На рис. XXVII.34 кине-
кинетическая кривая (а) вынужденного излучения Р* при X = 1050 нм характеризуется
моноэкспоненциальным затуханием с временем т = 2,8 пс. Это совпадает с кривой
(б) появления катион-радикала Р+ (увеличение поглощения при 1310 нм) и восстано-
восстановленного Бфф (кривая (в), выцветание при т = 545 нм). Обращает на себя внимание
§ 9. Методы исследования сверхбыстрых процессов в реакционных центрах фотосинтеза 345
«мгновенное» (t < 50 фс) увеличение абсорбции на кривых (б) и (в) немедленно вслед
за действием лазерной вспышки. Эти изменения приписываются поглощению РЦ в
состоянии Р*, которое и образуется немедленно при поглощении света. Как видно,
времена отрыва электрона от Р* и восстановления Бфф совпадают. Это привело
авторов к выводу о том, что мономерный Бхл не является химическим акцептором
электрона на пути от Р* к Бфф, а выступает в роли виртуального переносчика
(«суперобменный» механизм переноса, §5).
В более поздних работах было улучшено временное разрешение, что позволило
зарегистрировать более тонкие детали кинетики переноса электрона (Зинт, 1993).
Оказалось, что процессы образования Р+ и восстановления Бфф происходят за
3,5 пс. Одновременно появляются изменения, характерные для восстановленного
мономера Бхл, в области 785 нм, которые быстро исчезают через 0,9 пс. На послед-
последнем этапе происходит восстановление Qa в реакции Бфф~ Qa -*¦ Бфф Q^, которое
занимает около 200 пс и сопровождается восстановлением исходного поглощения
при 545 нм, характерного для нейтрального Бфф.
Последовательность актов переноса в РЦ имеет следующий вид
Р+ Бхл
Р+ Бфф
_ 220 пс
(XXVII.9.1)
В
о
0,002
0
,Г\
1. \) 0,9 пс
{
1
\
4*
\\« 3,5 nc
\\
\ *
*
уЛ 220 пс
¦
1
-1
10
Время (пс)
100
1000
Рис. XXVII.35.
Временная зависимость фото-
индуцированного изменения по-
поглощения РЦ (по U. Finkele et
al., 1992) Rb. sphaeroides при
545 нм. Обозначены времена от-
отдельных кинетических компо-
компонент.
Характерным временам в цепи соответствует форма кинетической кривой абсорб-
абсорбционных изменений Бфф при 545 нм (Зинт, 1993), приведенная на рис. XXVII.35.
Как видно, эти данные говорят о непосредственном участии Бхл в качестве пере-
переносчика электрона в РЦ.
Возможность регистрировать быстрые изменения абсорбции (т < 50 фс) ис-
используется для непосредственного изучения миграции энергии возбуждения меж-
между пигментами светособирающей антенны. Рассмотрим, например, перенос энер-
энергии в ССК II пурпурных бактерий Бхлзоо -*¦ Bxjigso- При возбуждении и образова-
образовании Bxjig00 происходит обеднение основного уровня этой формы и, как следствие,
уменьшение поглощения (выцветание) ее полосы при 800 нм. По мере миграции
346 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
возбуждения на Бхл85о молекулы Бхл8оо возвращаются на основной уровень и погло-
поглощение при 800 нм вновь увеличивается. Следовательно, кинетика изменения погло-
поглощения основной полосы 800 нм отражает распространение экситона между этими
формами. Отсюда, в частности, было найдено время миграции Bxjig00 -* Bxjigso,
равное т ~ 1-2 пс.
В ССК I на этапе Bxjig7o -* Ps90 возбуждение Бхл§70 вызывает появление отри-
отрицательного максимума при 870 нм в дифференциальном спектре свет-темнота. Эти
изменения нарастают и достигают насыщения за ~ 300 фс (Ван-Грондель, 1995),
что соответствует времени распространения возбуждения в антенне (Bxjig7o).
Одновременно нарастает степень фотовыцветания полосы 890 нм за счет процесса
|.Fggo ""•¦ -^8901- Кинетика восстановления Бфф и появление -Р§д0 измеряются по
вынужденному излучению Р+ или появлению положительных изменений при
1200-1300 нм. Подобные измерения были сделаны и для РЦ ФС II высших растений
и фокусирующей кор-антенны (Барбер, Портер, 1993):
670 ~%ZT 680-
Авторы регистрировали эффекты увеличения поглощения при 680 нм и 670 нм при
уходе возбуждения от этих форм. На это накладываются эффекты выцветания
полосы при 680 нм вследствие образования Р^о и исчезновения при этом выну-
вынужденного излучения -Р6*8о- Основной результат состоял в том, что между Хлб7о и
Рбво происходит обратимая миграция энергии при к\ ~ fc_i ~ B00 фс).
Принципиально новые возможности открывает применение методов фемто-
секундной спектроскопии для изучения движения ядер в молекулах, находящих-
находящихся в электронном возбужденном состоянии. В Т. I, гл. X (рис. Х.2) мы видели,
что электронные переходы при поглощении и испускании кванта света молекулой
сопровождаются изменением кинетической энергии ядер. Избыток колебательной
энергии, образующейся при электронном переходе, быстро диссипатирует в тепло
при переходе ядер на нижние колебательные уровни за время 1-5 пс).
В стационарных условиях ядра совершают колебания, амплитуда которых со-
соответствует положению ядерного колебательного уровня на диаграмме рис. Х.2.
Большую часть временя ядра проводят в крайних точках поворота, координаты
которых соответствуют пересечению линии колебательного уровня с кривой элек-
электронной энергии молекулы U* (R)- За время (т ~ 10~12-5 • 10~12 с) нахождения в этих
точках ядер происходит быстрое A0~15-10~16 с) испускание света при практиче-
практически неподвижных ядрах, согласно принципу Франка-Кондона. Время сохранения
самого электронного возбуждения в молекуле «Si перед испусканием кванта света
намного больше (т ~ 5-10 не) времени ядерной релаксации A-5 пс).
Возбуждая молекулу фемтосекундными (т < 50 фс) вспышками, можно изучать
кинетику последующего испускания света флуоресценции в субпикосекундном диа-
диапазоне. Кинетика затухания флуоресценции должна очевидно зависть от характера
колебаний ядер. Это можно наблюдать, используя явление вынужденного излучения
при соответствующем временном разрешении. Для этого, дополнительно освещая
возбужденные лазерной вспышкой молекулы измерительным светом в полосе по-
поглощения, индуцируют вынужденное резонансное испускание света. Интенсивность
этого вынужденного излучения будет изменяться во времени в соответствии с ча-
§ 9. Методы исследования сверхбыстрых процессов в реакционных центрах фотосинтеза 347
стотой колебаний ядер, которые периодически меняют свое положение между край-
крайними точками поворота. Действительно, в работах Мартена A993) были обнаруже-
обнаружены колебания интенсивности вынужденного излучения, которые регистрировались
при различных длинах волн в спектре флуоресценции (рис. XXVII.36).
о
1
О
850
900
950
Рис. XXVII.36.
Спектр поглощения РЦ A) и вынужденного излучения B). Регистрация происходит
при длинах волн, указанных стрелками (по М. Н. Vos et al., 1993)
На рис. XXVII.37 показана диаграмма движения волнового ядерного пакета
между крайними точками на потенциальной кривой синглетного возбужденного
состояния Р*. В крайних точках поворота происходит испускание света флуорес-
флуоресценции. Оно имеет место также и при прохождении ядер над дном потенциальной
ямы, но с меньшей интенсивностью и удвоенной частотой.
На рис. XXVII.38 приведена запись колебаний интенсивности вынужденного
излучения при разных длинах волн. Фурье-анализ показал, что две основные ком-
компоненты вынужденного излучения имеют модуляцию 15 и 77 см (~ 2 пс и ~ 0,4 пс).
На рис. XXVII.37 показано также пересечение потенциальных кривых состоя-
состояний Р* и Р+. Точка пересечения соответствует ядерной координате, где происходит
отрыв электрона от Р и образование Р+. Характерное время ядерных колебаний в Р
реакционного центра совпадает по величине с характерными временами первичного
акта переноса электрона Р*1 -* Р+1~ (т ~ 1-3 пс).
Таким образом, движение ядер неразрывно связано с электронными переходами
в РЦ-фотооинтезе, что накладывает свой глубокий отпечаток на сверхбыстрые
механизмы транспорта электронов (см. гл. XIII и ниже гл. XXVIII). Как мы увидим
ниже, здесь уже несправедливо обычное приближение, используемое для разделения
электронных и релаксационных процессов (трел <С тэл) (гл. XIII, §4, 5).
348
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Метод выжигания провалов был развит в последние годы для изучения процес-
процессов дезактивации возбужденных состоянии Р* в РЦ. Рассмотрим кратко сущность
этого метода, обладающего большим временным разрешением. Образцы РЦ вначале
облучаются при низкой температуре A,5-10 К) «выжигающим» лазерным светом,
Рис. XXVII.37.
Одномерная схема движения ядер (по из-
изменению волнового пакета) вдоль потен-
потенциальной поверхности синглетного возбу-
возбужденного состояния Р* (по М. Н. Vos et
al., 1993)
960 нм
Oscillatory parts
1 2
Время, пс
Рис. XXVII.38.
Колебания интенсивности вы-
вынужденного излучения Р* при
разных длинах волн регистра-
регистрации (по М. Н. Vos et al., 1993)
§ 9. Методы исследования сверхбыстрых процессов в реакционных центрах фотосинтеза 349
который возбуждает Р: Р -*¦ Р* с последующей за этим быстрой дезактивацией
Р* и разделением зарядов: Р* -* Р+Бфф~. При низких температурах радикаль-
радикальная пара Р+ Бфф~ стабилизируется в этом состоянии. Это позволяет исследовать
спектр выцветания основной полосы поглощения Р, являющийся результатом обед-
обеднения основного уровня Sq молекул Р. Очевидно, свой вклад в спектр «выжже-
ного» спектрального провала дадут молекулы Р, находящиеся в соответствующих
электронно-колебательных (вибронных) состояниях, которые принимают участие в
первичном разделении зарядов в РЦ.
Рассмотрим характер информации, которую при этом можно получить о про-
процессах дезактивации возбужденных молекул Р*. Форма и ширина спектра погло-
поглощения сложных молекул зависят от спектра их колебательных подуровней и веро-
вероятности перераспределения энергии между нормальными колебаниями (рис. Х.4).
За время существования электронного возбуждения т достигается полное тепло-
тепловое равновесие вследствие релаксационных процессов в колебательной подсистеме,
отвечающее температуре опыта. В сложных молекулах идет эффективный обмен
колебательной энергией, и тепловое равновесие быстро устанавливается при возбу-
возбуждении в области частоты 0-0-перехода voo (рис. X.4).
Выяснение природы релаксационных процессов связано с определением часто-
частоты поглощения и ширины уровня нулевого вибрационного перехода Voo-
Для обычных молекул, помещенных в кристаллическую и стеклообразную ма-
матрицу при криогенных температурах, наблюдается, по крайней мере, одна узкая
линия выжигания провала в области 0-0-перехода. Действительно, для порфиринов
в стеклах или для хлорофилла, введеного в структуру миоглобина, наблюдается
узкий провал шириной 1 см. Однако, в противоположность этому, в РЦ в полосе
поглощения Р узкие провалы в области 0-0-перехода наблюдаются не всегда. Вме-
Вместо этого появляются широкие провалы с шириной, почти равной ширине полной
полосы поглощения Р. В последнее время в ряде работ удалось наблюдать на фоне
широкой полосы также слабые и узкие линии провалов в длинноволновой части
полосы поглощения Р в РЦ (рис. XXVII.39).
Напомним, что однородная ширина полосы поглощения, или ширина энерге-
энергетического уровня Г состояния Р, возникающего при поглощении света, связана с
временем т существования данного состояния соотношением неопределенностей для
энергии (Х.2.20)
Г • т ~ П. (XXVII.9.2)
Как было показано в (Х.2.21), ширина уровня зависит от двух процессов: дез-
дезактивации электронного возбужденного состояния Р* (тушение флуоресценции Р*
за время т ~ Xi), и колебательной релаксации (время Гг), ведущей к потере коге-
когерентности фазы исходных колебательных соотояний, возникших при поглощении
света:
Г = 1/2т + 1/Г2. (XXVII.9.3)
Величина T<i определяется взаимодействием электронно-возбужденного состояния
Р* с тепловыми фононами и сильно зависит от температуры. Так, при комнатной
температуре ширина Г = \jT-i равна ~ кТ ~ 200см. Однако при низких темпе-
температурах влияние процессов сбоя фазы на ширину линии становится минимальным.
350
Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
На первый план выступают процессы дезактивации возбужденного состояния Р*.
Какие же процессы связаны с узкими и широкими линиями провалов в полосе по-
поглощения РЦ?
Оказалось, что ширина узких линий провалов в РЦ соответствует низкотем-
низкотемпературным значениям времени жизни состояния Р*, т. е. времени образования
ион-радикалов Р+ и Бфф~ и затухания вынужденного излучения с уровня Р* в
-0,05 -
-0,10 -
925
900
875
I I I I I I I I I I I I I
10600
11000
11400
11800
Рис. XXVII.39.
Спектры поглощения (А)
и фотохимического выжи-
выжигания провалов (Б) для
нижнего электронного пе-
перехода в РЦ Rb. sphae-
roides (no R. Jankowiak,
G. J. Small, 1993)
процессе переноса электрона Р* -* Бфф . Отсюда, казалось бы, следует вывод об
отсутствии каких-либо процессов быстрой (~ 20-200 фс) дезактивации собственно
электронного состояния Р* перед стадией отрыва электрона. А именно такая пред-
предварительная дезактивация Р* и могла бы вести к сокращению времени жизни Р*
и, следовательно, к наблюдаемому уширению общей полосы выжигания провала.
Вместе с тем, мы уже говорили (см. выше), что за время существования Р* на-
наблюдаются колебания ядерного волнового пакета с временами ~ 100 фс. Это может
указывать на участие выделенных локальных мод ближайшего белкового окружения
Р в эволюции состояния Р* перед отрывом электрона и переходом Р* -*¦ Р+ Бфф~.
Иными словами, электронно-колебательные взаимодействия, ведущие к наблюдае-
наблюдаемым в экспериментах широким полосам выжигания провалов, могут быть связаны
10. Переменная и замедленная флуоресценция
351
с определенными быстрыми «структурными» изменениями в РЦ при разделении
зарядов (см. следующую главу XXVIII).
Таким образом, метод выжигания провалов, а также другие методы исследова-
исследования сверхбыстрых процессов являются важным источником информации о струк-
структурных перестройках, сопровождающих начальные стадии переноса электрона в
РЦ.
Рис. XXVII.40.
Типичная временная за-
зависимость интенсивности
переменной флуоресценции
хлорофилла для выдержан-
выдержанных в темноте образцов
(по C.Buchel, C.Wilhelm,
1993)
§ 10. Переменная и замедленная флуоресценция
Основной вклад в флуоресценцию хлорофилла в хлоропластах дает ФС П. Вслед-
Вследствие высокой эффективности дезактивации возбужденного состояния Р6*80 и раз-
разделения зарядов в РЦ, флуоресценция ФС II характеризуется низкими значениями
квантового выхода A-3%) и времени затухания A00-200 пс). Однако по изменению
этих величин можно судить об эффективности основного «фотосинтетического»
запасания энергии электронного возбуждения Р6*80 в различных условиях. В насто-
настоящее время параметры флуоресценции как показатель состояния и эффективности
функционирования фотосинтетического аппарата широко используются в фунда-
фундаментальных и прикладных исследованиях.
Основная идея состоит в том, что уменьшение эффективности запасания энер-
энергии света в фотосинтезе по тем или иным причинам приводит к тому, что интен-
интенсивность флуоресценции хлорофилла должна соответственно возрасти.
В нормальных физиологических условиях при интактных фотосинтетических
мембранах изменение флуоресценции ФС II обусловлено интенсивностью переноса
электрона по цепи переносчиков, степенью их воостановленности и характером дру-
других энергопреобразующих процессов, сопряженных с электронным транспортом.
Переменная флуоресценция. Типичные изменения флуоресценции ФС II в за-
зависимости от состояния ЭТЦ фотосинтеза отражена в так называемых индук-
индукционных кинетических кривых. Кинетика изменения флуоресценции хлоропластов
при освещении предварительно адаптированных к темноте клеток представлена на
рис. XXVII.40.
352 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
Начальные стадии миграции энергии возбуждения в антенне и ее захват в РЦ,
происходящие в наносекундном временном диапазоне (§ 3, 4) не отражены на этой
кривой в силу малого временного разрешения. Основная информация связана с мед-
медленными изменениями флуоресценции, начиная с ее исходного низкого уровня Fq
(точка 0 на кривой). Величина Fq определяется флуоресценцией хлорофилла, когда
все РЦ находятся в «открытом» рабочем состоянии и способны тушить флуоресцен-
флуоресценцию антенны. Все молекулы переносчика первичного хинона Qa в открытых РЦ
окислены и готовы к принятию электрона от Р6*80:
Р6*80 Фф QA - Р6+80 ФФ" Qa - PL ФФ Qa-
При этом происходит так называемое фотохимическое туннелирование qp флуорес-
флуоресценции открытыми РЦ. В закрытых РЦ Qa восстановлен и поэтому в силу элек-
электростатического отталкивания перенос электрона от Рб80 на Фф~ в присутствии
Q~^ не может произойти. Поэтому энергия электронного возбуждения состояния
Pggo в основном возвращается в антенну, а уровень флуоресценции становится
максимальным Fm- На кривой (рис. XXVII.40) видно, что после достижения уров-
уровня Fq флуоресценция растет в миллисекундном диапазоне, и после прохождения
промежуточного максимума ID достигает величины Fm- Очевидно, участок 01 со-
соответствует начальному восстановлению Qa фотосистемы II после включения света
с последующим его частичным окислением фотосистемой I на участке ID. Затем в
процессе освещения и «работы» ЭТЦ (ФС II) накапливаются молекулы Qa, а на
кривой достигается точка Р. Разница между Fm и Fq, равная Fm — Fq, называется
переменной флуоресценцией
Fv = FM - Fq.
Заметим, что истинную величину Fm (XXVII.7.2) можно определить, освещая образ-
образцы в присутствии диурона, блокирующего перенос электрона в цепи между фотоси-
фотосистемами после места расположения Qa- После достижения пика в точке Р наступает
более медленное изменение и постепенное снижение уровня флуоресценции, вызван-
вызванные в основном физическими причинами.
На участке PS уровень флуоресценции падает от Fm до более низких значений.
Здесь происходит так называемое нефотохимическое тушение флуоресценции фу,
которое включает следующие процессы: энергизационное рН-зависимое нефотохи-
нефотохимическое тушение q&; тушение флуоресценции по механизму «спилловер» qx вслед-
вследствие фосфорилирования ССПБК и его перехода за несколько минут в мембране от
ФС II к ФС I (§3), тушение флуоресценции qj из-за фотоингибирования компонен-
компонентов ФС II под действием света (XXVI, §3) — qs, qi, qj-
Все эти виды тушения приводят к уменьшению Fm в условиях, когда Qa оста-
остается в восстановленном состоянии, и именно поэтому называются нефотохимиче-
нефотохимическими фч[-
При этом падение Fm происходит за счет уменьшения Fy, а уровень исходной
флуоресценции Fq меняется очень мало. На более поздних стадиях (участок SMT)
свою роль играют соотношения между реакциями восстановления конечных продук-
продуктов световой стадии и их потреблением в темновом цикле фиксации СОг- Нефото-
Нефотохимическое тушение q^ имеет важное регуляторное значение, изменяя активность
ФС II в различных физиологических условиях. Однако молекулярные механизмы
§ 10. Переменная и замедленная флуоресценция 353
этого явления остаются во многом неясны, особенно в случае рН-зависимого умень-
уменьшения флуоресценции qs.
Изменение флуоресценции q$ зависит от энергизации мембран тилакоидов и
образования трансмембранной разности концентраций ионов водорода APh (XXIV,
§3). Степень Aph независимого тушения линейно растет с увеличением концентра-
концентрации Н+ внутри тилакоида. Это происходит из-за увеличения вероятности тепловой
дезактивации возбужденного состояния ХЛ в присутствии ионов водорода. Такого
рода эффекты известны в фотохимии красителей, квантовый выход флуоресценции
зависит от Ph среды.
Наряду с этим в энергизационном тушении флуоресценции антенны может
участвовать каротиноид зеаксантин, который образуется из виолоксантина и, как
показали опыты, дезактивирует возбужденный Хл антенны. Предполагается также
(Хортон), что протонирование остатков глютамата и аспартата белковых субъеди-
субъединиц СР29 и СР24 светособирающего комплекса ФС II вызывает такие конформа-
ционные перестройки пептидной части, которые переводят в нефлуоресцирующее
состояние расположенные на них плотно упакованные слои хлорофилла антенны.
При этом, в основном, усиливается безызлучательное тушение возбуждения в ре-
реакционном центре ФС II и тушится только переменная флуоресценция, а выход
флуоресценции открытых центров (Fo) не изменяется. Соответственно снижается
отношение Fv/Fm и эффективность разделения зарядов в РЦ. После выключения
действующего света выход переменной флуоресценции возвращается к исходному
значению за время порядка десятков секунд, необходимое для релаксации протон-
протонного градиента. Считается, что этот механизм обеспечивает тушение избыточной
энергии возбуждения, приходящей в ФС II при насыщающей интенсивности света.
Тушение qj при фотоингибировании реакционных центров ФС II происходит
при длительное воздействии света, интенсивность которого значительно выше той,
при которой происходит световой насыщение фотосинтеза. При этом, так же как
и в случае qE, подавляется, в основном, переменная флуоресценция Fy = Fm — Fo,
и уменьшается квантовая эффективность реакций фотосистемы П. В отличие от
энергизационного тушения, увеличение выхода переменной флуоресценции в тем-
темноте после прекращения действия интенсивного света происходит за время порядка
часа. Установлено, что фотоингибирование связано с необратимой инактивцией по-
полипептида D1 в реакционном центре фотосистемы II, являющегося местом посадки
пластохинона. Длительное восстановление фотоингибированных центров обусловле-
обусловлено необходимостью ресинтеза этого полипептида. Предполагают, что подобный
механизм, вызывающий безизлучательное тушение возбуждения, уменьшает веро-
вероятность перехода молекул хлорофилла в триплетное состояние, энергия которого
может передаваться молекулам кислорода (образование синглетного кислорода) с
последующей деструкцией клеточных структур (XVI, §3).
Измерение значений Fm, -Fo и Fy = Fm — Fo особенно важно, поскольку дает воз-
возможность определить абсолютную квантовую эффективность разделения зарядов
в РЦ. Напомним (XXVII, §1), что судьба энергии возбуждения в РЦ определяет-
определяется соотношением констант скорости трех конкурирующих процессов реактивации
возбужденных молекул хлорофилла в антенне реакционного центра:
Р* kf+kd+k'h, p, (XXVII.10.1)
354 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
где Р и Р* —основное и возбужденное состояния молекулы хлорофилла a; kf, kd и
kph — константы скорости излучательной (флуоресценция), безизлучатальной (те-
(тепловая диссипация) и фотохимической (в реакционном центре) дезактивации воз-
возбуждения.
Квантовые выходы первичного разделения зарядов q<& в фотосинтезе и флуо-
флуоресценции qFo равны, соответственно,
Ф= h *"* и qF0 = kf . (XXVII.10.2)
kf + kd + kph kf + kd + kph
Константа кри отражает скорость захвата возбуждения реакционным центром
ФС II в реакции первичного разделения зарядов и переноса электрона от воз-
возбужденной молекулы пигмента реакционного центра на молекулу феофетина.
Затем следует серия вторичных процессов переноса электрона, обеспечивающих
стабилизацию разделенных зарядов (§ 7):
Qz. (XXVII.10.3)
(!) B) C) D) E)
При окисленном первичном хинонном акцепторе Qa (состояние 1), когда реак-
реакционный центр находится в так называемом открытом состоянии, константа кри
является наибольшей из этих трех констант. Поэтому здесь энергия возбуждения
используется в реакциях фотосинтеза с квантовым выходом дФ, близким к единице,
и только небольшая часть возбуждений (около 0,3%) теряется в виде флуоресценции
за время переноса возбуждения к реакционному центру.
Процесс преобразования энергии в реакционном центре (переход из состояния 1
в состояние 5) занимает около 1 мс. В течение этого времени (так называемое время
оборота реакционного центра) первичные продукты фотохимической реакции еще
не использованы в дальнейших реакциях и реакционный центр находится в закры-
закрытом состоянии, в котором он не способен использовать следующие порции энергии.
Поскольку состояние 4 является наиболее долгоживущим, то в стационарном
состоянии и на временах более 10 мкс именно оно определяет изменения выхода
флуоресценции под действием света. Через 10 мкс после короткой насыщающей
вспышки света или при насыщающей интенсивности постоянного света все ре-
реакционные центры фотосистемы II оказываются в состоянии 4 и флуоресценция
постигает максимального значения Fm'-
дФ = 0, kph = 0, qFM = kf/(kf+kd). (XXVII.10.4)
Таким образом, увеличение выхода флуоресценции при полном закрывании реакци-
реакционных центров (Fy = Fm — -Pb) обусловлено той частью световой энергии, которая
использовалась в первичных реакциях фотосинтеза при открытых реакционных
центрах. Легко найти, что отношение выходов переменной и максимальной флуорес-
флуоресценции равно квантовому выходу первичной фотохимической реакций разделения
зарядов в фотосинтетических реакционных центрах:
1FM-iF0 = kph = ф (XXVII.10.5)
qFM kf + kd + kph
10. Переменная и замедленная флуоресценция
355
Таким образом, измерение интенсивностеи флуоресценции хлорофилла Fo и Fm
в относительных единицах позволяет получить абсолютную величину квантовой
эффективности разделения зарядов, в фотосинтетических реакционных центрах.
Измерение параметров индукционных кривых проводятся не только в лабо-
лабораторных, но и в природных условиях, где с их помощью определяют состояние
фотосинтетического аппарата листьев и фитопланктона. Один из способов изме-
измерения величин Fq, Fm, а также параметров тушения qp, (?n состоит в освещении
FV~FM~FO
qN-Fv
\J
-F
60 c
-Fn
-»- Время
0
Рис. XXVII.41.
Кинетика индукции флуоресценции, измеренная под действием возбуждающих
вспышек света па фоне постоянного освещения (по C.Biichel, С. Wilhelm, 1993)
Открытые стрелки — включение и выключение измеряющего света, короткие стрелки — соответ-
соответственно начало и конец непрерывного освещения, длиная стрелка — соответствует первой корот-
короткой вспышке света насыщающей интенсивности.
объектов постоянным светом, на фоне которого после прохождения максимального
уровня Fm в процессе индукции даются короткие вспышки насыщающего света
(рис. XXVII.41). При этом каждая вспышка переводит <5а в полностью восстано-
восстановленное состояние. Однако эти вспышки не возвращают флуоресценцию к исход-
исходному уровню Fm, поскольку в ФС II уже развились процессы нефотохимического
тушения (?n- Величины FM после каждой насыщающей вспышки соответствуют сте-
степени восстановленности <5а в данный момент или фотохимическому тушению др.
Разность между величинами Fm начального пика на индукционной кривой и FM
говорит о степени развития нефотохимического тушения q^ в системе. При этом
356 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
происходит уменьшение -Fy — исходной переменной флуоресценции:
Fy = FM — Fo = Fy —
Определяя исходные величины Fy = Fm ~~ Fq и q^ в разные моменты времени, а
также величину Fy = F"M — Fq, можно соответственно найти и коэффициенты ту-
тушения
qp = -^ и qN = —-—*-. (XXVII.10.6)
Замедленная флуоресценция. Быстрая флуоресценция обусловлена потерями
энергии возбуждения в процессе захвата ее фотосинтетическими реакционными
центрами. Однако, стабилизация первичных разделенных зарядов в реакционных
центрах также не является абсолютно совершенной, т. е. разделенные заряды
могут рекомбинировать. Это приводит к регенерации синглетного возбужденного
состояния реакционного центра, а следовательно, и к возможности излучательной
потери энергии этого вторичного возбуждения в виде так называемой замедленной
флуоресценции хлорофилла. Время затухания этого свечения может на много
порядков превосходить собственное время жизни синглетного возбужденного
состояния молекулы хлорофилла.
Несмотря на столь большую разницу во времени жизни, различие между бы-
быстрой и замедленной флуоресценцией является в какой-то мере условным, поскольку
в обоих случаях излучение происходит при переходе из синглетного возбужденного
в основное состояние хлорофилла, и эти процессы отражают динамику возбужден-
возбужденного состояния в одном и том же пуле пигментов фотооистемы П. Замедленная
флуоресценция ЗФ дает важную информацию о механизмах переноса электрона
в ППФ. Она была открыта Б. Л. Стрелером и В. Арнольдом A951) при изучении
фотофосфорилирования и впоследствии обнаружена практически у всех фотосин-
тезирующих организмов. Существует строгая корреляция между ЗФ и функциони-
функционированием РЦ, выражающаяся в подавлении ЗФ при ингибировании РЦ. У мутант-
ных штаммов, лишенных РЦ, полностью отсутствует и замедленная флуоресценция.
ЗФ полностью отсутствует в препарате ССПБК и отчетливо выражена у частиц
ФС II (ССПБК + ПБК II) с активными РЦ. Совпадение спектра ЗФ со спектром
флуоресценции хлорофилла и бактериохлорофилла доказывает, что ЗФ обусловле-
обусловлена излучательной активацией первого синглетного возбужденного состояния этих
пигментов. Спектры возбуждения флуоресценции и ЗФ также совпадают между
собой и сходны со спектром действия фотосинтеза. Очевидно, что ЗФ возникает
в процессах обратной рекомбинации первичных фотоокисленных и фотовосстано-
вленных продуктов начальных стадий фотосинтеза в РЦ:
DiP* Фф ** DiP+ Фф" . (XXVII.10.7)
В схеме (XXVII.10.7) восстановление Р+ вторичными донорами D\ и окисление
Фф~ последующими акцепторами должно уменьшать концентрацию Р+ и Фф~,
а следовательно, ингибировать свечение. В реальных условиях количество компо-
компонентов ЗФ и их длительность определяются временами жизни восстановленных и
окисленных фотопродуктов, которые сложным образом зависят от кинетики реак-
реакций прямого и обратного переноса электрона в ближайшем донорно-акцепторном
§ 10. Переменная и замедленная флуоресценция 357
окружении ФС П. Так, обработка хлоропластов при низких значениях рН = 4, за-
замедляющая восстановление Pqsq, одновременно способствует и возникновению более
долгоживуших компонентов послесвечения. Аналогично, в пурпурных бактериях
ЗФ не возникает в области низких окислительно-восстановительных потенциалов
среды, при которых вторичный донор (цитохром с) находится в восстановленном
состоянии, поскольку в этих условиях происходит быстрое (~ 1 мкс) восстановле-
восстановление P^so- Повышение окислительно-восстановительного потенциала среды приводит
к окислению цитохрома и возникновению миллисекундного послесвечения в присут-
присутствии о-фенантролина, который блокирует реакцию переноса Q~\ -* Qb-
\—? Согласно рекомбинационной гипотезе, интенсивность послесвечения L пропор-
циональна количеству РЦ, находящихся в состоянии [P+Q^]. Величина L зави-
зависит также от константы скорости излучательной рекомбинации зарядов, ведущей
к образованию Р* и вероятности излучательной дезактивации синглетного возбу-
возбужденного состояния Р*, образованного в результате рекомбинации. ?
Интенсивность послесвечения пропорциональна вероятности нахождения цен-
центров в состоянии P+Q~a
L = Nk*(f[P+Q^\, (XXVII. 10.8)
где TV — концентрация РЦ, ср — квантовый выход излучательной дезактивации со-
состояния Р*, квадратные скобки обозначают вероятность данного состояния. При
низкой интенсивности возбуждающего света все РЦ находятся в открытом состоя-
состоянии, когда эффективно происходит отток электронов от Q~. Однако в присутствии
диурона даже при низкой интенсивности возбуждающего света центры переходят
в закрытое состояние и, поскольку отток электронов от Q~ уже прекращен, интен-
интенсивность ЗФ становится пропорциональной общему количеству РЦ.
Как и в случае переменной флуоресценции, процесс, влияющий на выход ЗФ, —
энергизация фотосинтетической мембраны и образование протонного градиента.
Однако механизм влияния здесь другой. Разница между уровнями возбужденно-
возбужденного хлорофилла Р* и первичных восстановленных фотопродуктов составляет около
0,6 эВ, что соответствует энергии активации обратных процессов рекомбинации
и объясняет, почему квантовый выход ЗФ очень мал и не превышает 10~5-10~7.
Однако энергия активации может быть снижена за счет электростатического поля,
направленного параллельно образующемуся дипольному моменту [Р+<3~]. Так как
рекомбинирующие заряды Р+ и Q~ расположены на противоположных сторонах
мембраны, то разница электрических потенциалов Фм сторон мембраны изменя-
изменяет величину энергетического барьера для послесвечения. В этом случае уравнение
(XXVII. 10.8) для скорости рекомбинации, ведущей к ЗФ, имеет вид
L = Nk^P+Q-] ехр (-АД~уФм) , (XXVII.10.9)
где АЕ — энергия активации в отсутствие поля, F — число Фарадея.
Согласно (XXVII. 10.9) с увеличением Фм растет интенсивность ЗФ. Это дей-
действительно наблюдается в опытах при создании диффузионной разности электри-
электрических потенциалов на мембране путем добавления солей или в присутствии, на-
например, валиномицина, избирательно увеличивающего проницаемость мембраны
358 Глава XXVII. Трансформация энергии в первичных процессах фотосинтеза
для К+. Замечено, что искусственно созданный трансмембранный градиент про-
протонов АрН индуцирует всплеск люминесценции. Стимулирующий эффект АрН на
ЗФ определяется изменением поверхностного электрического потенциала наруж-
наружной поверхности тилакоида при закислении среды. Аналогично электрической со-
составляющей Фм электрохимического потенциала, значения градиента рН можно
включить в уравнение (XXVII.10.9), учитывая, что рекомбинирующие донор и ак-
акцептор участвуют в протонном равновесии, изменяя энергию активации процесса
рекомбинации:
L = NkMP+Q-A] exp f-^*M-'g[imAPH)])\ _ (XXVII.10.10)
^—р Выражение в квадратных скобках в (XXVII.10.10) пропорционально протон-
движущей силе, поэтому можно после калибровки использовать интенсивность
ЗФ для определения значения этой силы, составляющего около 100 мВ. ?
Понижение температуры до —30...—40° С ингибирует выделение Ог и прямые
электрон-транспортные реакции, в результате чего обратная рекомбинация стано-
становится преобладающей. Однако долгоживущие компоненты, указывающие на уча-
участие в рекомбинации отдаленных от РЦ восстановленных продуктов, исчезают при
охлаждении. При достаточно низких температурах наблюдаются только два ком-
компонента свечения: 1-2 и 30 мс, причем первый может соответствовать обратной
реакции между -Pg§0 и Q~¦ Повышение температуры активирует ЗФ. Это позво-
позволяет оценить энергию активации для различных компонентов свечения (от 0,15 до
0,9 эВ). Образующиеся на свету продукты — предшественники ЗФ — могут быть
стабилизированы, если образец охладить до низкой температуры. Последующее
нагревание образца в темноте приводит к появлению свечения, которое было назва-
названо термолюминесценцией. Очевидно, образованные на свету и стабилизированные
при охлаждении образца фотопродукты активируются затем и рекомбинируют с
хлорофиллом, приводя к свечению. Кривая зависимости интенсивности термовы-
термовысвечивания от температуры объекта в процессе нагревания содержит несколько
пиков, наблюдаемых при определенных характеристических температурах. Число
и положение пиков термолюминесценции отражает различные стадии стабилизации
энергии в ФС II и зависит от функционирования кислородвыделяющего комплекса.
Глава XXVIII
Электронно-конформационные
взаимодействия в первичных
процессах фотосинтеза
Одной из центральных проблем биофизики является выяснение механизмов началь-
начального разделения зарядов в РП и транспорта электронов между переносчиками в пер-
первичных процессах фотосинтеза. Эта проблема по своей важности выходит за рамки
фотосинтеза, а ее решение приобретает принципиальное значение для понимания
глубоких механизмов функционирования биологических макромолекул. В много-
многокомпонентных макромолекулярных комплексах переносчиков, объединенных в еди-
единый РЦ, начиная о самых первых этапов (т < 1 пс) происходит высокоэффектив-
высокоэффективный и направленный транспорт электронов. Добавим, что в пределах РЦ перенос
электрона может происходить с высокой эффективностью и при сверхнизких тем-
температурах A00 К-4 К). Очевидно, обычные диффузионные механизмы химических
реакций в растворах по типу сталкивающихся частиц не в состоянии обеспечить та-
такого рода перенос электрона в плотной белковой среде. Мы видели (гл. XXVII), что
в основе этого лежит туннелирование электрона, сопряженное с колебательными и
конформационными изменениями в белковой матрице (гл. XIII).
Можно сравнить РЦ фотосинтеза с особым фотоактивным ферментом, в кото-
котором простетические группы переносчиков РЦ играют роль компонентов активного
центра. Вместо обычного низкомолекулярного ферментного субстрата здесь вы-
выступают кванты света, поглощение которых «запускает» и работу РЦ фотосинтеза.
В обычных ферментах (гл. XIV) начальные изменения электронного состояния
активного центра происходят за очень короткие времена. Они дают «толчок» раз-
разным по масштабу и времени конформационным перестройкам в белковой глобуле
фермента. Накопленный в последнее время экспериментальный материал со всей
очевидностью показывает, что подобный принцип тесного сопряжения электрон-
электронных переходов с конформационными перестройками в белке справедлив и для РЦ
фотосинтеза.
В настоящей главе мы рассмотрим механизмы электронных переходов, сопря-
сопряженные с колебательными и конформационными степенями свободы, которые от-
ответственны за высокие скорости и эффективность начального разделения зарядов
и переноса электрона в РЦ фотосинтеза высших растений и бактериального типа.
Мы будем опираться на схемы первичных процессов, которые были приведены в
предыдущей главе (XXVII), а также на экспериментальные данные по кинетике
переноса электрона в РЦ.
360 Глава XXVIII. Электронно-конформационные взаимодействия
§ 1. Начальное разделение зарядов в РЦ
Первичные стадии транспорта электронов в РЦ бактериального типа включают
отрыв электрона от электронно-возбужденного димера Бхл2 и перенос его на БФФ
3,5 пс
Р+ БхлБфф". (XXVIII.1.1)
Мономерный Бхл выступает здесь либо как непосредственный переносчик в двух-
_„ 3,5 пс „ 0,9 пс „
ступенчатом механизме Р > Ьхл > Ьфф, либо играет роль виртуального
переносчика в суперобменном механизме Р* —^-» Бфф~ (см. XXVII, §9). В обоих
3,5 пс
случаях вначале происходит эффективная дезактивация Р* и образование окислен-
окисленного димера Р+. Совпадение диапазонов времен переноса электрона и колебаний
ядерного скелета РЦ (~ 3,5 пс) говорит о тесном электронно-колебательном вза-
взаимодействии, лежащем в основе процесса разделения зарядов. Это значит, что в
перенос электрона могут вовлекаться выделенные колебательные подсостояния в
сложном пигмент-белковом комплексе РЦ, которые взаимодействуют с переносом
электрона. В этом отношении высказываются разные гипотезы.
Мы видели (§9, XXVII), что имеются свидетельства о совпадении времен
A-3 пс) переноса электрона Р* -* Бфф~, затухания флуоресценции Р* и ве-
величины 71, полученной из ширины узкой линии провала. Отсюда следует, что
первоначально возникшее состояние Р* должно совпадать с излучающим флуорес-
флуоресценцию состоянием димера Бхл2. Но, с другой стороны, одновременное наличие
также широкой полосы провала указывает на быстрые релаксационные процессы
(~ 20-200 фс), предшествующие излучению спонтанной флуоресценции с уровня Р*.
Это может указывать на то, что состояние Р* имеет примесь других состоя-
состояний, например, состояния с разделенными зарядами Р+Бфф~, которое характе-
характеризуется большими смещениями ядерной конфигурации относительно основного
состояния Р. Это эквивалентно сильному электронно-колебательному взаимодей-
взаимодействию с определенными степенями свободы (см. XIII, §5). В перенос электрона,
таким образом, вовлекаются выделенные колебательные степени свободы в сложном
пигмент-белковом комплексе РЦ, которые взаимодействуют с переносом электрона
в состоянии Р*.
Релаксационный переход в состояние с переносом заряда происходит вдоль
поверхности потенциальной энергии возбужденного состояния Р* (рис. XXVIII.1)
и носит квазиадиабатический характер. Он сопряжен с большими смещениями рав-
равновесной ядерной конфигурации ооновного состояния. Именно в силу этого узкие
провалы 0-0-переходов плохо наблюдаются (ср. рис. X.4) на фоне широкого про-
провала. В самом деле, целый ряд экспериментальных данных, полученных в разных
лабораториях методами фемтосекундной спектроскопии, указывает на быстрые ре-
релаксационные процессы в возбужденном состоянии Р*. Так, максимум выцветания
основной полосы поглощения Р сдвигается в течение первых 100-500 фс после обра-
образования Р*. Этот сдвиг происходит значительно быстрее, чем последующий за ним
перенос электрона.
В инфракрасной области спектра удалось также зарегистрировать абсорбци-
абсорбционные изменения при 1000-1300 см, которые нарастают в течение первых 200 фс
после вспышки. Они обладают большой амплитудой и не могут быть отнесены к
1. Начальное разделение зарядов в РЦ
361
простой тепловой колебательной релаксации. Они отражают колебания длин и углов
С=С, С—С, С—N и С—Н связей тетрапирольных колец специальной пары Бхл2.
Имеются указания о быстрых (т ~ 600 фс) изменениях колебаний карбонильных
групп 9-кето С=О групп A70 см) нейтрального Р и возбужденного Р*, а также о
быстрых временных изменениях длин связей карбонильных групп (поглощение при
1665 см), совпадающих с кинетикой образования Бхл~ (т ~ 0,9 пс). По-видимому
начальные стадии эволюции возбужденного состояния Р* связаны с определенными
локальными модами и «микроструктурными» быстрыми изменениями ядерной кон-
конфигурации пигмент-белкового комплекса РЦ. Детальная картина этих процессов
еще далека от завершения. Однако мы можем сопоставить имеющиеся данные с
известными принципами молекулярной спектроскопии.
Р+Бфф"
->- R
Рис. XXVIII. 1.
Схема расположения кривых
потенциальной энергии состо-
состояния РЦ: Р — Р* — Р+ Бфф~,
R — ядерная координата.
Напомним, что в спектроскопии сложных молекул различают релаксационные
процессы с тепловой диссипацией энергии и электронную релаксацию, связанную с
определенными колебательными модами и изменением возбужденного состояния за
время его существования (Непорент).
В первом случае тепловая релаксация сопряжена с быстрым рассеянием избыт-
избытка колебательной энергии, образованного на колебаниях, которые принимали уча-
участие в переходе Р -* Р*, и с достижением равновесного распределения всех частот и
амплитуд нормальных колебаний. В случае же электронной релаксации происходит
изменение молекулярного скелета по определенным степеням свободы с дальней-
дальнейшей эволюцией Франк-Кондоновского электронного состояния, которое первона-
первоначально было достигнуто при оптическом переходе Р -* Р*. Эволюция завершается
образованием нового стационарного электронного состояния, самосогласованного с
новой конфигурацией молекулы. Электронная релаксация происходит одновремен-
одновременно с выделенной колебательной, которая включает изменения координат положе-
положения уровней за счет излома кручения скелета молекулы. В результате возможны
362 Глава XXVIII. Электронно-конформационные взаимодействия
изменения симметрии, степени переноса заряда, степени сопряжения л-электрон-
ных цепей двух частей молекулы, мультиплетности вследствие усиления спин-орби-
спин-орбитальных взаимодействий. Электронные релаксации могут привести к размыванию
вибронной структуры и появлению сплошных спектров.
Отметим, что максимальная скорость электронной релаксации может быть зна-
значительно больше, чем скорость тепловой колебательной релаксации и проходить на
временах, не превышающих 10~15-10~13 с.
Очевидно, рассмотренные выше особенности сопряжения электронных и коле-
колебательных процессов на разных стадиях разделения зарядов в РЦ соответствуют
этим закономерностям. Аналогична и роль структурных факторов в обеспечении
эффективности и направленности первичного разделения зарядов.
Мы уже говорили о существовании в РЦ пурпурных бактерий двух ветвей:
активной L и неактивной М. Квантовохимические расчеты показали, что в фото-
фотоактивном димере Бхл2 наблюдается асссиметричное распределение возникающего
положительного заряда Р+ между входящими в состав димера молекулами Бхл^
и Бхлм с преимущественной локализацией заряда на Бхл^. Поэтому в активной
L-ветви РЦ и происходит соответственно преимущественное образование состояния
с переносом заряда. Переносу электрона от Р* в L-ветви также способствует вра-
вращение ацетильной группы Бхлм, не связанной водородными связями, которое при-
приводит к снижению здесь энергетических уровней состояний Р+ Бфф^ и Р+ Бхл^.
Наряду с другими факторами это определяет перенос электрона по активной L-ве-
тви.
Влияние водородных связей и низкой температуры. В структуре димера Бхл2
важную роль играют водородные связи между аминокислотой гистидином и карбо-
карбонильными группами молекул Бхл в димере. В диком штамме Kb. sphaeroides обра-
образуется одна Н-связь между Гис-?168 и 2-ацетильной группой 1-го кольца Бхл^.
Методы генной инженерии (точечные мутации, XXVII, § 8) позволяют получать
мутации с измененным количеством и локализацией водородных связей. Имеется
мутант, где гистидин L168 заменен на фенилаланин: HF(X168), и где тем самым
удалена Н-связь с 2-ацетильной группой Бхл^. Наоборот, в других мутантах по-
появляются дополнительные водородные связи с 2-ацетильной группой Бхлм за счет
замены фенилаланина на гистидин в мутанте FH(M197).
Замена на гистидин лейцина в положении L131 дала мутант LH(X131), а лей-
лейцина в положении М160 — мутант LH(.M160). В обоих случаях в структуре РЦ
мутантов добавлены водородные связи с 9-кето группой молекул соответственно
Бхл? и Бхлм- В этом мутанте с увеличением числа водородных связей увели-
увеличивается величина Ем среднеточечного окислительного потенциала пары Р/Р+.
Окислительный потенциал определяли методом электрохимического титрования по
выцветанию максимума А полосы поглощения при 865 нм (Р -* Р+):
Р/Р+ = Л ~ Локисл- = ехр[0,03894(?м - Щ,
^4-восст. А
где Л-окисл. — поглощение полностью окисленного Р+, а Авосст — поглощение пол-
полностью восстановленного Р образца РЦ.
Результаты (Парсон, Аллен) можно представить в виде ряда мутантов, где
каждому из них соответствует значение Ем (мВ) (Таблица XXVIII.1):
§ 1. Начальное разделение зарядов в РЦ
Таблица XXVIII. 1.
363
штамм
HF(L168)
Дикий штамм
LH(M160)
LH(L131)/LH(M160)
LH(L131)/LH(M160)/FH(M197)
число
Н-связей
В ВХЛ2
0
1
2
3
4
Ем, мВ
410
505
565
635
765
"Греком 1 МС
220
100
75
60
40
"Сразд. зар? ПС
3,6
3,4
5,7
24
52
Рост Ем с увеличением числа водородных связей димера Р связан с электро-
электростатическими взаимодействиями Р+ с гистидином. Качественно это приводит к
повышению сродства Р+ к электрону.
Как видно из таблицы (XXVIII.1), в результате этого ускоряется процесс вос-
восстановления Р+ в ходе рекомбинации P+Q^ -* PQa- Одновременно замедляется
и скорость начального разделения зарядов Р* -* Р+, что видно по увеличению
времени тразд. Зар в этих объектах.
Однако увеличение прочности и числа водородных связей может проявиться в
еще большей степени в их влиянии на скорость релаксационных процессов в белках
РЦ и сопряженного с ними переноса электрона. Данный эффект будет обусловлен
снижением внутримолекулярной подвижности белковой матрицы по выделенным
колебательным степеням свободы и замедлением транспорта электрона вследствие
участия «неотрелаксированных» состояний переносчиков.
Для изучения природы релаксационных процессов в высокоупорядоченном ком-
комплексе переносчиков используются различные воздействия, модифицирующие си-
систему водородных связей в РЦ: изотопное замещение ЕЬО на D2O, модифика-
модификация водородных связей в образцах криопротекторами, многоатомными спирта-
спиртами (этиленгликоль, пропиленгликоль), апротонными растворителями (диметилсуль-
фоксид). Эти воздействия, делая водородные связи менее лабильными, замедляют
релаксационные процессы, уменьшают подвижность и увеличивают жесткость ма-
макромолекул. Как оказалось, они замедляют в 2-2,5 раза перенос электрона в РЦ.
На рис. XXVIII.2 представлены изменения поглощения при 665 нм, соответствую-
соответствующие появлению и исчезновению восстановленного бактериофеофитина под влиянием
изотопного замещения D2O на Н2О и действия диметилсульфоксида. Видно, что
указанная модификация системы водородных связей приводит к замедлению пере-
переноса электрона на этапах Р -* Бфф и Бфф -* Qa- Степень эффекта, вызванного
действием криопротектора, увеличивается в зависимости от его гидрофобности и
коррелирует с глубиной его проникновения во внутренние области фотосинтетиче-
фотосинтетических мембран. Одновременно с замедлением прямого переноса Р -* Бфф появляется
компонента восстановления Р+ в ходе рекомбинации Р+ +- Бфф~ (рис. XXVIII.2, в,
кривая 2) со временем ~ 0, 7-1 не, что сопровождается возникновением замедленной
люминесценции с тем же характерным временем.
Наблюдаемые кинетические эффекты говорят о том, что перенос электрона
на бактериофеофитин сопровождается молекулярной релаксацией с участием
364
Глава XXVIII. Электронно-конформационные взаимодействия
ДА, отн. ед.
0 10
50 t, пс
0,8 -
-
0,4 -
0
V, ДАб65, отн. ед.
W
W \
Г dsP ~ 500 пс
б
0 0,5
1,0 1,5 t,Hc
0
-0,4-
-0,8-
-1 П
д^
1
L870, отн. ед.
в
2
2.—& 5 " о
0,7
1,4 2,1 t,HC
Рис. XXVIII.2.
Изменение скорости переноса
электрона в РЦ (Р* -* Бфф ->•
-* Qa) в нормальных образ-
образцах (кривые 1), при модифика-
модификации системы водородных свя-
связей (кривые 2) (по А. В. Rubin
et al., 1994).
§ 1. Начальное разделение зарядов в РЦ 365
внутрибелковых водородных связей. Появление Р* дает начало переносу электрона
Р* -*¦ Бфф и изменяет зарядовое состояние в донорно-акцепторном комплексе по
сравнению с исходным. При этом изменяется баланс сил, определяющий равно-
равновесную конформацию системы, адаптированной к темноте. В ходе последующей
релаксации с участием системы водородных связей и достигается новое равновесное
состояние ион-радикальной пары. Затем происходит дальнейший перенос электрона
на Qa-
Схема событий в цепи переноса имеет вид:
Р* Бфф Д- (Р* Бфф)релакс. -^ Р* Бфф" -^ Р+ Бфф Q~A,
где (Р* Бфф)релакс.—промежуточное состояние, которое достигается в процессе
электронной релаксации Р*, кт — константа релаксации, ке — константа переноса
электрона на Бфф из «отрелаксированного» состояния, Uqa — константа переноса
от Бфф- на Qa-
В нормальных условиях кт < A00 фс), дальнейший перенос электрона проис-
происходит из этого полностью «отрелаксированного» состояния (Р* Бфф)рел.
Решающим фактором является соотношение между характерными временами
электронных переходов тэл и релаксационных процессов трел. Напомним, что со-
соотношение трел <С тэл, необходимое для необратимого переноса электрона, обычно
выполняется в нормальных условиях, поскольку процессы колебательной релакса-
релаксации происходят достаточно быстро (< 1 пс) по сравнению с электронными пере-
переводами и не оказывают влияния на их характер. Однако на этапах начального
переноса электрона в комплексе Р Бфф времена электронных переходов составляют
несколько пикосекунд и сравнимы с временами колебательной релаксации трел — тэл-
Модификация водородных связей в еще большей степени замедляет релаксацию
первоначального состояния комплекса. В результате электрон не успевает стабили-
стабилизироваться в достаточной степени на бактериофеофитине до того, как произойдет
его дальнейший перенос из еще не отрелаксированного состояния [Р+Бфф~]. Из
этого состояния [Р+ Бфф~] электрон теперь успевает вернуться обратно, реком-
бинируя с Р+ за время ~ 1 не, что сопровождается замедленной люминесценцией.
Может произойти и дальнейший перенос электрона из состояния [Р+ Бфф~] на
Qaj но с меньшей скоростью. Таким образом, в процессах релаксации при условии
трел — тэл в донорно-акцепторном комплексе достигаются микроконформационные
подсостояния, которые отличаются друг от друга по своей функциональной актив-
активности (скоростям и направленности переноса электрона). Состояние водородных
связей влияет здесь на динамику фотоиндуцированных релаксационных процессов
в системе.
Особый интерес в биофизике фотосинтеза представляет изучение переноса
электрона при сверхнизких температурах. Мы уже рассматривали (Т. I, гл. XIII)
теоретические модели влияния низкой температуры на туннелирование электрона,
сопряженное с тепловой диссипацией энергии по колебательным степеням свободы.
Температура может влиять и на динамику релаксационных процессов в белке в
ходе электронно-конформационных переходов, особенно тех, в которые вовлечены
мягкие моды (XIII, § 11).
366
Глава XXVIII. Электронно-конформационные взаимодействия
Оказалось, что на стадии разделения зарядов в РЦ (Р* -* Р+ Бфф ) понижение
температуры ускоряет этот процесс, уменьшая его время от ~ 3,5 пс при 300 К до
~ 1,2 пс при 4 К.
На рис. XXVIII.3 приведена схема возможного расположения кривых потенци-
потенциальной энергии начального Р* Бфф~ и конечного Р+ Бфф~ состояний при двух
температурах C00 К и 77 К). Деформирование и смещение кривой состояния
Р* Бфф~ при замораживании образца приводит к сдвигу точки пересечения этих
кривых к вершине параболы начального состояния Р* Бфф~ (ср. рис. XIII.8).
Р+БффG7К)
Р+БффC00К)
RoR*77K R*300K
R
Рис. XXVIII.3.
Деформация кривых потенциальной энергии состояний РЦ при понижении темпе-
температуры.
Процесс переноса электрона в этом случае становится безактивационным.
С повышением температуры его скорость падает, так как происходит увеличение
заселенности более высоких колебательных подуровней и, следовательно, отход
системы от точки пересечения кривых начального и конечного состояний в вершине
параболы, где вероятность перехода максимальна.
§ 2. Механизмы окисления цитохрома в реакционных центрах
Поглощение кванта света в РЦ вызывает появление окисленного димера -Р+, кото-
который затем восстанавливается от донора (вторичного), роль которого в бактери-
бактериальном фотосинтезе выполняют высоко- Сн и низкопотенциальные Cl цитохромы
(рис. XXVII.6).
Перенос электрона от цитохрома на Р+ явился важным источником информа-
информации о механизмах элементарных процессов в биологических структурах. Это дало
§ 2. Механизмы окисления цитохрома в реакционных центрах 367
толчок новому направлению в биофизике фотосинтеза — исследованию транспорта
электронов в биологических мембранах в условиях, исключающих обычную диффу-
диффузию молекул переносчиков.
В работе Де Во и Чанса понижение температуры клеток пурпурных бактерий
(Chromatium) позволило впервые выявить и измерить температурную зависимость
скорости такого рода реакции окисления цитохромов фотоокисленным димером
бактериохлорофилла С -* Р+ (см. рис. XIII.1). Оказалось, что при понижении тем-
температуры от 300 до 120 К характерное время реакции увеличивается от 1 мкс до
2,5 мкс, оставаясь практически неизменным при дальнейшем понижении темпера-
температуры. Принципиальный вывод, следующий из этих экспериментов, состоял в том,
что окисление цитохромов в фотосинтетических мембранах не требует обычных
активационных механизмов, подобных окислительно- восстановительным реакциям
в растворах, а протекает по другим законам. Основополагающая концепция, вы-
выдвинутая в результате обнаруженного эффекта, базируется на физическом явлении
туннельного переноса электрона, который может происходить между молекулами
донора D и акцептора А в условиях, когда энергия электрона меньше высоты
разделяющего их активационного барьера. Напомним основные положения теории
туннельного переноса (гл. XIII).
Согласно квантово-механическим представлениям существует определенная ве-
вероятность перекрывания электронных волновых функций начального и конечного
состоянии, зависящая от высоты и ширины барьера. За время пребывания электрона
на молекуле акцептора происходит потеря части электронной энергии и, как след-
следствие, нарушение резонансного совпадения положения уровней А и D. В результате
этого обратное туннелирование практически невозможно, и перенос электрона ста-
становится необратимым. Диссипация электронной энергии за счет электроколебатель-
электроколебательных взаимодействий происходит за 10~12-10~13 с с возбуждением колебательных
акцептирующих мод в донорно-акцепторном комплексе в состоянии DA*.
Таким образом, условием необратимости в конечном состоянии туннельного
переноса является соотношение между временем электронного перехода тэл, зави-
зависящим от перекрывания волновых функций начального и конечного состояний, и
временем колебательной релаксации трел в конечном состоянии: тэл 3> трел (золотое
правило Ферми).
В литературе имеется большой материал по низкотемпературному окислению
низкопотенциальных Cl и высокопотенциальных Сн цитохромов фотоактивным
бактериохлорофиллом Р.
На рис. XXVIII.4 приведены типичные двухфазные температурные кривые оки-
окисления Сх цитохрома, диаграмма потенциальных поверхностей электронной энер-
энергии Ui и Uf начального г и конечного / состояний донорно-акцепторной пары DA
и экспериментальные данные о влиянии замещения Н2О на D2O.
Туннелирование электрона происходит, когда энергии состояний г и / стано-
становятся равными, что имеет место в точке R* ядерной координаты, где кривые Ui (R)
и Uf(R) пересекаются (рис. XXVIII.4, б):
(D*A)i - (DA*)f.
В состоянии (DA*)f система оказывается на одном из высших колебательных под-
подуровней, с которого происходит сброс избытка энергии с переводом на нижние
368
Глава XXVIII. Электронно-конформационные взаимодействия
а)
ю6 ¦
100
200
300
ю5
1
°н2о
• D20
A=l,
ш
1
8x10
°~'с
1
/
1
/
4x10
1
i
/
'/
100
200
300
Т, "К
Т, "К
Рис. XXVIII.4.
Температурная зависимость скорости окисления цитохрома в фотосинтезирую-
ших бактериях (а); электронно-колебательные взаимодействия при туннелирова-
нии электрона (#); (в) — изотопный эффект замещения Н2О на D2O; Eq —энергия
активации, Ег — энергия реорганизации среды, АЕ — тепловой эффект реакции
переноса электрона, Ai?o — смещение положения равновесия ядер при переходе из
начального г в конечное состояние /. Штриховая кривая соответствует безактива-
ционному переносу электрона Еа (по R. E. Blankenship, W. W. Parson, 1979)
колебательные подуровни и возбуждение акцептирующих мод. Приближение вдоль
ядерной координаты к точке R* происходит при увеличении температуры и заселе-
заселения высоких колебательных подуровней исходного состояния. При этом ширина ак-
тивационного барьера перехода, как видно из рис. XXVIII.4, б, уменьшается, следо-
следовательно, скорость туннелирования растет с ростом температуры. При низких тем-
температурах в состоянии г заселены только нижние колебательные подуровни, и точ-
точка R* может быть достигнута только за счет туннелирования самих ядер (ядра —
достаточно легкие частицы). Здесь, однако, ширина и высота барьера наибольшие, и
§ 2. Механизмы окисления цитохрома в реакционных центрах 369
поэтому скорость туннелирования минимальная, но от температуры уже не зависит.
Таким образом, двухфазный характер температурной зависимости окисления цито-
цитохрома объясняется влиянием температуры на процесс перестройки ядерной конфи-
конфигурации, который характеризуется величиной смещения АЛ = Ло/ — Ло» исходной
равновесной ядерной конфигурации Ло» к новому равновесному значению Ло/ при
переносе электрона. Разработанная количественная теория туннельного переноса в
белковой среде дает выражения для константы скорости туннелирования в случае
сильной и слабой электронно-колебательной связи (XIII, §6), которые позволяют
найти параметры процесса переноса электрона и, в частности, частоты колебаний
акцептирующей моды. Эти частоты характеризуются значениями ~ 300-400 с.
В качестве акцептирующей моды могут выступать колебания молекул воды в ги-
дратных оболочках порфириновых молекул, в других случаях — также колебания
атомов водорода в химических группах С—Н, О—Н, N—H2. Низкотемпературный
предел скорости реакции определяется туннелированием молекул Н2О как целого
на расстояния АЛ и 0,15-0,2 А.
sf Sj- Рис. XXVIII.5.
Л Порфирин —Mg С = О • ¦ ¦ Н Н Участие молекул воды в
; \ / диссипации энергии по
О О акцептирующей моде в
/ \ ; реакции окисления цито-
Н Н • • • О = С • • • —Mg— Порфирин хрома в РЦ пурпурных
бактерий
1 * При изменении зарядового со-
¦*-'»¦ /—\ стояния димера (А) изменя-
+ е ^ \ \ ются эффективные заряды Ь\
и 5г на атомах Mg и кислорода
С=О-группы. Это должно вы-
вызвать изменение равновесного
положения диполя воды (Б)
Изотопный эффект. Замена Н2О на D2O в бактериальных хроматофорах при-
приводит при низких температурах к уменьшению константы скорости окисления Cl
реакционным центром в ~ 1,4 раза, причем этот эффект несколько уменьшается
при переходе к комнатным температурам. Частота колебаний акцептирующей мо-
моды, найденная по температуре точки излома кривой температурной зависимости
рассматриваемой реакции, составляет 330-350 с. Это очень близко к частоте
колебаний Н2О в гидратных оболочках Mg и Fe. Замена Н2О на D2O уменьшает
частоту колебаний со до 314 с и несколько увеличивает константу электронно-
колебательной связи, которая отражает величину относительной деформации мо-
молекулы вдоль координаты акцептирующей моды со при изменении электронного
состояния [см. (XIII.5.14)].
Характерные изменения равновесных расстояний между Mg2+ и Н2О в ко-
координационной сфере при изменении заряда иона на единицу составляют АЛ ~
~ 0,01 Ч- 0,12 нм. Сопоставляя это со значением параметра связи 5н2о = 6,6, можно
заключить, что в процессе участвуют две-три молекулы воды (рис. XXVIII.5).
370 Глава XXVIII. Электронно-конформационные взаимодействия
Природа акцептирующей моды в данном случае связана, таким образом, с пе-
переориентацией диполей воды. Однако эту роль могут выполнять и другие высо-
высокочастотные колебания легких атомных групп. В частности, возможны смещения
равновесного положения Н2 вдоль направления несимметричной двухъямной водо-
водородной связи с диссипацией в теплоту части энергии (см. §2 гл. VIII; рис. VIII.4).
Предпринятые во многих лабораториях экспериментальные проверки изложен-
изложенных выше представлений подтверждают основное положение о том, что электрон-
электронные переходы в макромолекулярных комплексах неразрывно связаны с преобразова-
преобразованием ядерной подсистемы. Однако в последние годы накопился ряд новых данных.
Они не укладываются в рамки только электронно-колебательных взаимодействий,
согласно которым, как было сказано выше, наблюдаемые эффекты целиком опре-
определяются зависимостью от температуры константы скорости элементарного акта
переноса электрона. Например, трудно объяснить таким образом очень большие
различия в зависимости константы скорости переноса к{Т), наблюдаемые для пре-
препаратов из разных бактерий, а также значительно более резкий, чем это следует из
Рис. XXVIII.6.
Зависимость от темпера-
температуры времени ii/2 и ам~
плитуды сигнала АА425
процесса окисления вы-
высокопотенциального цито-
140 т,к хрома Сн (по S. К. Chamo-
rovsky et al., 1980)
В отличие от низкопотенциального цитохрома Сх, скорость окисления Сн практически не зависит
от температуры, по крайней мере в диапазоне от 300 до 120 К (А). Однако при температурах ниже
некоторой критической наблюдается уменьшение количества молекул цитохрома Сн, способных
подвергаться фотоиндуцированному окислению (Б). У оставшихся активными молекул Сн конеч-
конечные скорости окисления остаются практически неизменными. Дегидратация образцов оказывает
на реакцию окисления Сн аналогичное действие
формул теории электронно-колебательных переходов, излом на кривой зависимости
к(Т) в области низких температур (рис. XXVIII.4, а). Кроме того, было обнаружено,
что скорость окисления высокопотенциального цитохрома Сн в РЦ (Ectothiorho-
dospira shaposhnikovii) вообще не зависит от температуры в области от 300 до 120 К
(т ~ 2,5 мкс). Однако в диапазоне 210-120 К при неизменной скорости окисления
наблюдалось уменьшение амплитуды сигнала, т. е. уменьшение количества окисля-
окисляемых цитохромов (рис. XXVIII.6).
Роль контактных состояний. Очевидно, характер наблюдаемых температур-
температурных зависимостей переноса электрона определяется двумя факторами (см. §6, 8
гл. XIII). Во-первых, это собственно внутримолекулярные электронно-колебатель-
электронно-колебательные взаимодействия, отражающие роль квантовой акцептирующей моды. Во-вто-
Во-вторых, здесь играют роль мягкие моды, отражающие конформационные перестройки
белков-переносчиков, при которых обеспечивается движение донорно-акцепторных
§ 2. Механизмы окисления цитохрома в реакционных центрах 371
групп в процессе формирования контактных состояний между ними. Именно спон-
спонтанное движение донорно-акцепторных групп в комплексе Сн — Ps70 определяет
возможность формирования такого контактного состояния, в пределах которого
происходит туннелирование электрона, характеризующееся слабой электронно-ко-
электронно-колебательной связью.
\—? Для реализации контактного состояния необходима определенная конформаци-
онная свобода или набор внутримолекулярных степеней свободы молекулы ци-
цитохрома. Таким образом, речь идет о структурном туннелировании между донорно-
акцепторными группами (см. § 7 гл. XIII), где белковая цепь, видимо, выступает как
медиатор электронного переноса. ?
В последнее время существование специфической электронной тропы с участи-
участием аминокислотных остатков было показано для цитохрома Сн между донорной
группой гема и поверхностью глобулы. В белке РЦ такая менее специфическая тро-
тропа идет от поверхности глобулы к фотоактивному димеру Р (Онучек) (гл. XIII, § 7).
Результаты говорят о множественности путей структурного туннелирования элек-
электрона между белками цитохрома и РЦ.
\—? В такой системе нарушение структурной целостности сказывается на возмож-
ности образования электронной «тропы» в макромолекулярном комплексе, где
донорно-акцепторные группы занимают соответствующие места. В контактной по-
позиции существует перекрытие волновых функций групп D и А, и поэтому рассто-
расстояние между ними составляет около 0,1 нм. В неконтактной позиции расстояние
между группами D и А увеличивается до 0,3-0,5 нм (такова амплитуда сегмен-
сегментального движения отдельных а-спиральных участков белка, возможных носителей
групп D и А). Поскольку на расстояниях 0,3-0,5 нм перекрытие волновых функций
практически равно нулю, между группами возникает барьер АЕ ^ 10 эВ, соответ-
соответствующий потенциалу ионизации нейтральных групп. Это сразу же снижает ско-
скорость туннелирования в неконтактной позиции в 106 раз, т. е. делает практически
невозможным перенос электрона. П
Очевидно, в ЭТЦ роль релаксационных процессов в белке не сводится только
к акцептированию избытка электронной энергии, а может быть связана с более
глубокой реорганизацией донорно-акцепторного комплекса по выделенным степе-
степеням свободы. К этому заключению приводят результаты по влиянию дегидратации
на фотоиндуцированное окисление высокопотенциальных цитохромов. При деги-
дегидратации пленочных образцов РЦ от уровня нормальной относительной влажности
до 0,1-0,3 P/Ps @,15-0,25 г воды на 1 грамм сухого веса препарата, т. е. гН2О/г)
так же, как и при понижении температуры в оводненных образцах, происходит
уменьшение количества окисляемых молекул высокопотенциального цитохрома при
относительно неизменной скорости окисления тех молекул Сн, которые оставались
в активном состоянии. При гидратации обезвоженных препаратов наблюдалось
резкое увеличение подвижности протонов воды и неводных молокул, регистриру-
регистрируемое по появлению медленных компонент спада спинового эха T<i ~ 1 мс (X, §2).
Это увеличение подвижности в мембране коррелирует с ростом функциональной
активности процесса фотоокисления Сн при влажностях от 0,5 до 0,8 P/Ps @,25-
0,47 гНгО/г), где появляются подвижные молекулы слабо связанной воды. Если
оставаться в рамках изложенной выше теории туннельного переноса, то согласно
372
Глава XXVIII. Электронно-конформационные взаимодействия
расчетам, в условиях обезвоживания расстояние между Сн и Р должно было бы
возрасти до 20 А, что явно нереально. Очевидно, влияние гидратации связано не
с изменениями параметров барьера какого-то одного элементарного акта тунне-
лирования (Сн —* Р)- При изменении состояния воды изменяется структура всего
комплекса вследствие модификации взаимного расположения донорно-акцепторных
пар в белковой матрице. Это обстоятельство влияет на образование контактного
состояния между ними, в пределах которого возможен межбелковый перенос элек-
электрона от цитохрома к бактериохлорофиллу. Роль воды в этом процессе перестрой-
перестройки мембран велика, поскольку нативная конформация комплекса цитохрома с РЦ
зависит от гидрофобных взаимодействий. Характер и направленность структур-
структурных перестроек в мембранах определяется соотношением фактов упорядоченности
водного окружения (энтропийный фактор) и образованием водородных связей меж-
между молекулами воды и гидрофобных связей между молекулярными группами (эн-
тальпийный фактор). Перестройка мембран, сопровождающая эти переходы, носит
сложный характер и по-разному проходит в липиднои и белковой фазах у разных
организмов. Во всех случаях, однако, при P/Ps = 0,80 резко увеличивается подвиж-
подвижность всех мембранных компонентов, растет количество сорбированных молекул
воды и становится возможной их латеральная подвижность. Функциональная ак-
активность на всех участках ЭТЦ достигает при этом нормальных значений.
Рис. XXVIII.7.
Поведение молекулярных
групп в области контак-
контакта между макромолекула-
макромолекулами высокопотенциального
цитохрома (донор) и ре-
реакционного центра (ак-
(акцептор) в фотосинтетиче-
фотосинтетических мембранах пурпур-
пурпурных бактерий при пони-
понижении степени гидрата-
гидратации и температуры.
А — контактная позиция;
Б, В — неконтактные позиции
На рис. XXVIII.7 приведена в качестве примера схема, иллюстрирующая воз-
возможность образования контактного и неконтактного состояний по этому механиз-
механизму. Баланс сил, обусловливающий стабилизацию контактного состояния, опреде-
определяется полярным взаимодействием контактирующих групп и гидрофобными си-
силами, которые зависят от наличия молекул воды в системе. В присутствии воды
§ 3. Конформационная динамика и перенос электрона в реакционных центрах 373
при низких температурах неконтактная позиция (В) сохраняется вследствие сла-
слабой подвижности структурных групп и молекул воды в области контакта. Од-
Однако при повышении температуры подвижность отдельных молекулярных групп
и, главное, молекул воды растет. Следовательно, возрастает и энтропия системы.
Именно это обстоятельство делает энергетически более выгодной и устойчивой при
комнатной температуре позицию А, несмотря на то, что энтальпия в этом состо-
состоянии увеличивается. В пределах позиции А происходит формирование собственно
контактного состояния между подвижными группами 1 и 2. Снижение энтропии,
сопровождающее образование комплекса, не может существенно уменьшить общую
величину энтропии конформационно «расторможенной» позиции А. Таким образом,
роль воды здесь заключается в одновременном обеспечении конформационной по-
подвижности и «энтропийной» устойчивости контактного состояния. Аналогичную
роль может играть вода и в акте первичного разделения зарядов. Как оказалось,
удаление воды ингибирует процесс разделения зарядов в РЦ пурпурных фотосин-
тезирующих бактерий, нарушая образование контактных состояний, либо препят-
препятствует стабилизации электрона на Бфф за счет изменения характера водородных
связей.
\—? Таким образом, действие температуры и влажности в случае слабой электронно-
колебательной связи осуществляется через мягкие моды путем влияния на
формирование контактного состояния между функционально активными группами.
Однако и при сильной электронно-колебательной связи процессы формирования
контактных состояний дают свой вклад в наблюдаемую температурную зависи-
зависимость туннелирования. ?
Итак, процесс окисления Сн является конформационно контролируемым. Это
значит, что он может происходить, например, за счет образования л-мостика при
движении одного из ароматических аминокислотных остатков (тирозина). Если
положение этого мостика зависит от значения обобщенной конформационной ко-
координаты, то существует наиболее благоприятная ситуация для его порогового
образования и, следовательно, для переноса электрона на Р+. Анализ уравнений
типа Фоккера—Планка (XIII, § 11) показал, что это происходит при нерегулярном,
случайном характере зависимостей коэффициентов диффузии от конформации си-
системы или при достаточно широком распределении высот потенциальных барьеров,
преодолеваемых конкретной белковой группой при конформационной релаксации.
Причина этой нерегулярности в конечном счете заключается в очень сложном ха-
характере гиперповерхности конформационной энергии биополимеров.
§ 3. Конформационная динамика и перенос электрона в реакционных центрах
Электронные переходы должны быть сопряжены с внутримолекулярной подвиж-
подвижностью белка РЦ, которая обеспечивает, во-первых, процессы электронно-колеба-
электронно-колебательной релаксации по акцептирующей моде и фиксации электрона в акте тун-
туннельного переноса, и во-вторых, индуцированные вследствие изменения зарядового
состояния акцептора последующие конформационные перестройки в макромолеку-
лярном комплексе. Для изучения этой проблемы были проведены исследования вну-
внутримолекулярной подвижности белка РЦ и эффективности переноса электрона при
соответствующих параметрах температуры и влажности препаратов. Показатели
374
Глава XXVIII. Электронно-конформационные взаимодействия
электронно-транспортной активности РЦ сопоставляли с параметрами введенных в
препараты спиновых зондов и меток (нитроксильные радикалы), гамма-резонанс-
гамма-резонансных зондов 657Fe, люминесцентных меток (индикаторы локальных внутримоле-
внутримолекулярных движений с частотами 107-109 с), а также фосфоресцентных меток
(регистрируемые частоты движения 103-101 с).
250
210
170
Т,К
0,8 0,6 0,4 0,2
Относительная влажность, P/Ps
Рис. XXVIII.8.
Функциональная активность A) и конформационная динамика B,3) реакционных
центров в спин-меченых хроматофорах R. rubrum в зависимости от температу-
температуры (А) и влажности (Б) (по А.И.Берг и др., 1979):
N — эффективность фотоиндуцированного переноса электрона от Qa на Qb (кривые 1); т' —
эффективный параметр времени корреляции вращательной диффузии гидрофобного зонда B) и
и спинной метки на SH-группы (З)
Влияние температуры и гидратации. На рис. XXVIII.8 показаны температур-
температурные зависимости эффективности фотоиндуцированного прямого переноса электро-
электрона N в системе хинонных акцепторов, а также времен корреляции вращательной
диффузии спиновой метки, ковалентно присоединенной к SH-группам белка и ги-
гидрофобного спинового зонда в мембранах хроматофоров (см. § 2,гл. X). В интервале
140-180 К величина т' (эффективный параметр времени корреляции) изменяет-
изменяется мало, что указывает на отсутствие быстрых движений в системе. Однако при
повышении температуры происходит резкое уменьшение т' до значений sj 10~7 с,
что свидетельствует о «размораживании» движений в белково-липидном локальном
окружении нитроксильных фрагментов. В том же температурном диапазоне, где
возрастает внутримолекулярная подвижность белка РЦ, увеличивается и функцио-
функциональная активность. При Г < 180 К сильному торможению подвижности соответ-
соответствует и низкий (близкий к нулевому) уровень электрон-транспортной активности.
На рис. XXVIII.8, Б видно, что согласованность в изменении эффективности
переноса электрона от Qa на Qb и динамических параметров фотосинтетической
мембраны отчетливо проявляется и при изменении степени гидратации препаратов.
При использовании методики ЭПР с насыщением сигнала удалось показать,
3. Конформационная динамика и перенос электрона в реакционных центрах
375
что нитроксильный радикал участвует также в более медленных движениях с ча-
частотами vc = 103 с, возможно, связанных с липидной фазой РЦ.
ч—? Типичная температурная зависимость вероятности поглощения у-кванта без
отдачи или фактора /'(—In/') [см. (Х.2.26)] для хроматофоров показана на
рис. XXVIII.9. Видно, что при повы-
повышении температуры Г > 170 К ве-
величина /' падает; это свидетельству-
свидетельствует о появлении движений мессбауэ-
ровского атома 57Fe с амплитудами
(ха) 3> 0,03 нм и временами, превы-
превышающими 10~7 с. Следовательно, при "
Г > 170 К растормаживается движение
белковой макромолекулы по конформа-
ционным подсостояниям. ?
Однако в обезвоженных препара-
препаратах, когда содержание воды не превы-
превышает 3%, кривая /'(Г) монотонна и не
имеет точки перегиба (сплошная кри-
кривая). Амплитуда смещений мессбауэ-
ровских ядер лишь несколько увели-
увеличивается при нагревании, но зависи-
зависимость от температуры остается линей-
линейной, т. е. типичной для кристалличе-
кристаллических твердых тел (см. гл. X). В увлаж-
увлажненных образцах зависимость /'(Г) в
области температур ниже 180-200 К
совпадает с аналогичной зависимостью
для максимально высушенных препаратов; при дальнейшем нагревании наблюдает-
наблюдается аномальное уменьшение /' и соответствующее возрастание амплитуды смещений.
Оказалось, что границы излома для гидрофобных мессбауэровских меток лежат в
целом при более низких температурах, чем для меток, локализованных в полярных
областях. Эти данные свидетельствуют о более высокой подвижности внутренних
областей мембран по сравнению с поверхностными участками, по крайней мере, при
низких температурах. Очевидно, в процессе нагревания образца начинает растор-
растормаживаться подвижность внутренних гидрофобных областей. В дальнейшем акти-
активируются и движения поверхностных гидрофильных участков мембраны, а также
собственно молекулярные движения мембранных белков.
Определение параметров подвижности. В соответствии с моделью ограничен-
ограниченной диффузии (см. §1 гл. XI), основным фактором, вызывающим увеличение по-
подвижности мессбауэровского атома при росте температуры, является уменьшение
времени корреляции движения тс вследствие уменьшения коэффициента трения у.
Согласно (Х1.1.27)-(Х1.1.29),
250 Т, К
Рис. XXVIII.9.
Температурная зависимость фактора /
A) и константы скорости Uqaqb B) фо-
тоиндуцированного переноса электрона
от первичного хинонного акцептора ко
вторичному для хроматофоров (величина
фактора / является мерой вероятности
эффекта Мессбауэра) (по A.B.Rubin et
al., 1994)
(XXVIII.3.1)
376 Глава XXVIII. Электронно-конформационные взаимодействия
где т) = т)о exp(s/i?T) — микровязкость в локальной окрестности мессбауэровского
ядра; соо — частота колебаний в отсутствие активации вязкого течения внутри бел-
белковой глобулы;
тс ~ г] ~ ехр(е/ДТ). (XXVIII.3.2)
Путем обработки экспериментальных кривых /'(Г) были найдены значения
энергии активации вязкого течения, микровязкости при комнатной температуре
и их зависимости от степени гидратации хроматофоров. Значение s ~ 8 кДж/моль
для гидрофобных областей мембраны близко к энергии активации заторможенного
вращения вокруг С—С-связи. Это означает, что флуктуации плотности в гидро-
гидрофобной среде, делающие возможным смещения метки, определяются конформаци-
онными движениями липидной цепи. Значение е ~ 25 кДж/моль для поверхностных
участков мембраны близко к энергии водородных связей и энергии активации вяз-
вязкости воды. Абсолютные значения микровязкости в случае размеров движущегося
участка в ~ 0,5 нм составляют примерно 60 и 40 Па • с для гидрофобных и по-
полярных областей, и возрастают в несколько раз при обезвоживании препаратов.
Большие абсолютные значения микровязкости (г) ~ 10 Па • с) по сравнению с обыч-
обычно измеряемыми величинами вязкости липидов @,1-1,0 Па • с) свидетельствуют о
специфическом микроокружении в окрестности введенной метки (см. §4, гл. XV).
\—? Корреляция эффективности транспорта электрона и величины /'(Г) не озна-
чает непосредственной связи переноса электрона именно с теми конформаци-
онными степенями свободы, которые дают вклад в движение мессбауэровского
атома. Резкое уменьшение фактора /' указывает лишь на то, что в рассматри-
рассматриваемой области температур происходит быстрое уменьшение времен корреляции
конформационных движений с амплитудой Jj 0,1 нм ниже значений 10~7 с. Тем
самым создаются предпосылки для растормаживания других, более масштабных
конформационных степеней свободы. Это, в свою очередь, создает условия для
формирования контактных донорно-акцепторных состояний, в пределах которых
происходит туннелирование электрона в системе хинонных цепторов. ?
Метод у-резонансной спектроскопии позволяет регистрировать высокочастот-
высокочастотные движения (т < 10~7 с) с амплитудами Jj 0,02 нм в фотосинтетических мем-
мембранах и РЦ. Измерение параметров флуоресценции и фосфоресценции хромофор-
хромофорных меток (см. § 2 гл. X) в тех же температурных областях позволило оценить
подвижность молекул среды в диапазоне времен тс от 1 до 10~9 с. Оказалось, что,
как и в случае применения методов ЯГР и ЭПР, температурная зависимость для
эффективности прямого переноса электрона в системе Qa~Qb — звена электрон-
транспортной цепи, локализованного вблизи поверхности трансмембранного белка
РЦ — лучше коррелирует с быстрыми движениями в поверхностных слоях препа-
препаратов с характерными временами тс ~ 10~8 с. В то же время изменения скорости
обратной реакции — рекомбинация Р+ и Q^ {P+Q~A -* PQa) процесса, протекаю-
протекающего во внутренних структурах РЦ, лучше коррелирует с появлением в образцах
при размораживании низкочастотных движений схс» 10~8 с. В температурном
интервале 130-190 К во внутренних частях мембранных белков также наблюдают-
наблюдаются движения с временами тс ~ 1 с, которые регистрируются по сдвигу спектров
собственной фосфоресценции ароматических аминокислот.
§ 4. Формирование контактных состояний в системе хинонных акцепторов (PQaQb) 377
\—? Таким образом, наблюдаемая конформационная подвижность характеризуется
широким набором времен релаксации (от 1 до 10~8 с в зависимости от темпе-
температуры). Это и составляет основу для формирования контактных состояний между
компонентами цепи.
Проявление при данной температуре того или иного вида движения с опреде-
определенным значением времени корреляции тс не означает, что смещения соответству-
соответствующих молекулярных групп полностью отсутствовали при других температурах.
Наблюдаемые температурные эффекты могут быть связаны с такими изменениями
уже существующих движений молекулярных групп, когда их времена корреляции
попадают в пределы временного разрешения данного метода и становятся тем са-
самым доступными для наблюдения. ?
§ 4. Перенос электронов и формирование контактных состояний в системе
хинонных акцепторов (PQaQв)
Система хинонных акцепторов представляет собой характерный пример, где влия-
влияние температуры на перенос электрона может осуществляться не только путем из-
изменения константы скорости (см. § 5-7 гл. XIII), но и через образование выделенных
или контактных конформационных состояний между переносчиками в комплексе
PQaQb- При этом сами константы скорости собственно электронного переноса в
конкретных выделенных состояниях могут и не зависеть от температурного фак-
фактора, поскольку температура влияет на переходы между этими состояниями.
Рекомбинационные процессы в PQaQb- В гл. XXVII было показано, что под
действием света фотоактивный пигмент окисляется, а электрон сначала переходит
на Qa, а затем на Qb- Поэтому на свету вначале образуется состояние P+Q~aQb,
которое распадается по двум каналам:
P+QaQb - PQaQb, P+Q~aQb - P+QAQi- (XXVIII.4.1)
После выключения света наблюдается темновое восстановление фотоокисленного
пигмента Р, которое носит обычно двухкомпонентный характер (рис. XXVIII. 10).
Быстрый компонент восстановления соответствует возвращению электронов на Р+
от Q~A из состояния P+Q~aQb {P+Q~aQb —¦ PQaQb), а медленный — от Qg из
состояния P+QaQ^ {P+QaQ^ - PQaQb).
Таким образом, эффективность N переноса электрона от Qa к Qb можно
оценить по соотношению медленного и быстрого компонентов темнового восста-
восстановления Р+. Уменьшение величины N при понижении температуры и влажности
свидетельствует о падении эффективности переноса электрона между Qa и Qb
(см. рис. XXVIII.8).
Однако основная причина состоит не в уменьшении константы скорости соб-
собственно переноса электрона Qa -* Qb ¦ Такое заключение следует из сопоставления
результатов, полученных при охлаждении исследуемых препаратов в темноте или
при одновременном активирующем освещении. Оказывается, что при охлаждении
в темноте при некоторых достаточно низких температурах (Г < 200 К) перенос
электрона от Qa к Qb почти полностью блокируется — об этом свидетельствует
доминирование быстрого компонента в кинетике восстановления Р+ после фото-
фотовозбуждения РЦ (рис. XXVIII.10,/). Однако картина выглядит совсем по-другому
378
Глава XXVIII. Электронно-конформационные взаимодействия
при охлаждении тех же препаратов, но на свету. В этом случае в некоторой ча-
части реакционных центров фотомобилизованный электрон вообще фиксируется в
акцепторном комплексе на неопределенное время. В результате в кинетической кри-
кривой появляется большая доля «необратимой» компоненты регистрируемого сигнала
при выключении света после замораживания препарата (см. рис. XXVIII. 10, III).
Она соответствует невосстанавливаемой доле Р+. В оставшейся же обратимой до-
доле сигнала кинетика восстановления Р+ по существу не отличается от таковой
при комнатной температуре (XXVIII. 10, /). Она характеризуется лишь медленными
компонентами восстановления Р+.
II
III
20°С
-140°С
t t I
P/Ps: 0,9 0,23 0,12
11 1 I
Юс
2о°с;
140°С
Рис. XXVIII. 10.
Кинетика темнового восстановления Р+ в реакционном центре хроматофоров в
зависимости от температуры /, влажности Л и при охлаждении препаратов на
свету III (по П. П. Нокс и др., 1979; Э.Г.Петров и др., 1983) (стрелками вверх и
вниз обозначено включение и выключение освещения)
Следовательно, при охлаждении на свету формируется такое структурное со-
состояние пигмент-белкового комплекса РЦ, в котором перенос Qa ~~*" Qb происходит
быстро даже при низких температурах и является поэтому безактивационным. По
существу, этому соответствует формирование контактного состояния в паре QaQb
в этих условиях.
Фотоконформационный переход в системе хинонных акцепторов. Характер
движений Qa и Qb можно выяснить по влиянию температуры на реакцию тем-
темнового восстановления Р+ от Qa- Результаты экспериментов показывают, что с
понижением температуры скорость рекомбинации Р+ и Q~^ может возрастать в
2-3 раза (т^ снижается от 80 до 25-30 мс), если образец охлаждается в темноте.
Для изучения рекомбинации Р+ +- Q^ в «чистом» виде обычно используют РЦ
с искусственно блокированным в результате различных химических воздействий
переносом электрона от Q^ к Qb- При этом кинетика рекомбинации в области
промежуточных температур характеризуется существенной немоноэкспоненциаль-
ностью. Если же охлаждение идет на активирующем свету, то время рекомбина-
рекомбинации практически не зависит от температуры и сохраняется близким к таковому
§ 4. Формирование контактных состояний в системе хинонных акцепторов (PQaQb) 379
при 20° С. Очевидно, присоединение электрона к Qa и образование Q~\ в исходно-
равновесной конфигурации PQa изменяет ее электронное состояние (Qa —*¦ Qa)-
Последующая конформационная релаксация включает переполяризацию бли-
ближайших к <3j[ групп белка и более медленное смещение аниона Q^ в направлении к
положительно заряженному иону железа Fe в комплексе с Qb ¦
^—р С понижением температуры эффект увеличения расстояния между Р~!" и Q~A
при движении Q~\~ снижается, что и объясняет аномальное увеличение при
этом скорости рекомбинации Р~!" и Q~\. Если же охлаждение происходит посте-
постепенно и на свету, то в этих условиях образованный Q~\ успевает сместиться от Р~!"
к Qb- В этом случае скорость рекомбинации Р~!" и Q~\ уменьшается. Наблюдаемое
в опытах небольшое (на 20%) увеличение скорости реакции рекомбинации Р~!~ и Q~^
при дейтерировании и замещении Н2О на D2O связано с увеличением микровязко-
микровязкости и замедлением движения Qa, при котором затрагиваются гидратные оболочки
белка. ?
Таким образом, изменение зарядового состояния комплекса при освещении
PQa -* P+Q^ вызывает переход системы в напряженно-конформационное состоя-
состояние, которое далее релаксирует к новому равновесию. В процессе этого движения
понижение температуры фиксирует систему в той или иной точке конформационнои
координаты. Иными словами, в этом случае мы имеем дело с так называемым
фотоконформационным переходом. С первых же моментов освещения начинается
каскад конформационных изменений. Если на этом фоне понижается температура
исследуемого образца, то в зависимости от скорости охлаждения и интенсивности
освещения можно зафиксировать объект (при низкой температуре) на той или
иной глубине конформационного перехода. В итоге можно получить наборы
различных кинетик рекомбинации Р+ и Q~^ — от характерной для выраженного
«светового» состояния системы до таковой, присущей адаптированному к темноте
препарату. Оказалось, например, что кинетические кривые рекомбинации образцов
при комнатных температурах и охлажденных на слабом свету до 80 К сильно
отличаются друг от друга. Однако если охлаждение проводилось под сильным
фоновым освещением B • 103 Вт • м~2), то эти различия практически исчезали.
Иными словами, при комнатной температуре в ответ на насыщающую вспышку
и восстановление Qa успевает произойти соответствующий конформационный
переход. При охлаждении в темноте различие в кинетике есть следствие того, что
конформационная подвижность заторможена. Однако при охлаждении на сильном
свету система вновь конформационно «оживает» и фиксируется в положении,
близком к равновесному положению при комнатной температуре (Р+<Э^)релакс-
Таким образом, изменяя интенсивность освещения и режим охлаждения образцов
РЦ, мы можем фиксировать при замораживании определенные конформационные
состояния, которые система последовательно достигает в процессе релаксации.
Можно в различное время после начала освещения при различных температурах
(т. е. при различной глубине конформационного перехода) измерять скорость воз-
возвращения электрона от хинонного акцептора на Р+ (рис. XXVIII.11). Оказывается,
что она зависит от времени, прошедшего после возбуждающей вспышки. Чем
больше времени прошло после этой вспышки A, 40, 80, 120 мс), тем больше времени
требуется электрону, чтобы вернуться на окисленный пигмент от первичного
380
Глава XXVIII. Электронно-конформационные взаимодействия
хинона. В свою очередь это время зависит от температуры. Если проводить опыты
при температуре выше, чем 230 К, то практически через 1 мс после действия
возбуждающей вспышки время возврата электрона увеличивается до 100 мс. Это
означает, что после возбуждения при температуре выше 230 К успевает пройти
весь конформационный переход в первичном акцепторе.
кг.
тг~20 мс
0,05
0,04
0,03
0,02
тг~100 мс
0,01
п
и
&с—^
О
- §
&
ъ f
о
в
?
г
100
О
о
о
¦ о
¦
В|
? п
? ¦
* в
150
О
О
¦ и О С
п ? ¦/¦
200
V—>
9
в) о о
2 п"
• 8 g
250
О
в
D
О
В
8
т _
t
i i
t h
1/krOc
t
i
'2
hv вспышка
'1=1
i2=40
f,=80
8 "
300
T, К
t
1
'3
P
t
i > *
4
knW
<-» A
Рис. XXVIII. 11.
Зависимость скорости конформационного перехода от времени и температуры по-
после вспышки (объяснения в тексте) (по А. В. Rubin et al., 1994)
Если провести такого же рода опыты при температуре ниже 200 К, то видно,
что при этом скорость конформационного перехода замедляется. Если ждать после
возбуждающей вспышки те же промежутки времени: 1, 40, 80, 120 мс, то, посколь-
поскольку конформационный переход при этих температурах замедлен, скорость возврата
электрона не так сильно падает, как при температурах выше 230 К.
На рисунке можно видеть, что если мы производим охлаждение на свету, то
сразу меняется конформационный потенциал и происходит движение системы вдоль
новой конформационной координаты, появление которой индуцировано приходом
электрона. При разных температурах мы фиксируем объект в разных состояниях и,
следовательно, имеем набор процессов, связанных с возвратом электрона из разных
точек на пути конформационного перехода. Интересно, что при температуре 100 К
и ниже, когда скорость конформационного перехода сильно уменьшается, он тем
не менее все равно происходит, хотя и требует значительно большего времени.
Это означает, что путь, по которому происходит конформационный переход в РЦ,
становится более длинным.
Таким образом, полученные результаты показывают, что константы скоростей
реакций переноса электрона зависят от того, в каком конформационном состоянии
находится соответствующий переносчик.
§ 5. Математические модели первичных процессов переноса электрона в фотосинтезе 381
Движение системы вдоль конформационной координаты описываются уравне-
уравнением Фоккера—Планка для внутримолекулярной динамики в плотно структуриро-
структурированной среде, которую представляет собой белок РЦ. Результаты (Шултен) числен-
численного моделирования внутримолекулярной динамики РЦ показали, что длины и углы
связей атомных групп меняются на величины до 0,4-1 А при переносе электрона по
цепи Р -* Бхл -* Бфф -* Qa-
Мы отсылаем читателя к теоретическому рассмотрению динамики фотокон-
формационного перехода, приведенному в Т. I, гл. XIII, § 11.
Движение Qb- Возвращаясь к общему описанию «контактного» и «неконтакт-
«неконтактного» состояний, регулирующих скорости и эффективность переноса электрона,
продолжим это рассмотрение применительно ко вторичному хинону. Движение Qb
при образовании контактного состояния можно рассмотреть на основании моде-
модели электронно-конформационных взаимодействий, где учитывается изменение кон-
формационного потенциала при изменении зарядового состояния подвижной груп-
группы (см. §8 гл. XIII; рис. XIII.13). Будем считать, что образование контактного со-
состояния QaQb связано в основном с конформационной подвижностью Qbj который,
двигаясь в конформационном потенциале, приближается к Q~^, принимает от него
электрон и переходит в анион-радикальное состояние Qj^. В отличие от схемы на
рис. XIII. 13 <Эд из-за сильной электростатической стабилизации не может покинуть
места посадки и практически прекращает свое диффузное движение, оставаясь в
комплексе с Qa • Только после принятия второго электрона, захвата 2Н+ и восста-
восстановления до Qb^-2 вторичный хинон начинает диффундировать в мембране.
Нейтральная дважды восстановленная форма хинона Qb^-2, так же как и фор-
форма Qb, обладает значительной подвижностью, и вследствие этого может быстро
обмениваться на окисленный хинон мембранного пула. Возможность значительной
латеральной диффузии хинона подтверждается данными о том, что коэффициенты
диффузии для фосфолипидов составляют 10~8-10~9 см2 • с. Это означает, что
при двумерной диффузии хинон за 1 мкс смог бы пройти расстояние 0,5-2 нм.
В последних работах Феера A997) было показано, что после восстановления Qb
меняет свою позицию, сдвигаясь на 0,45 нм в сторону цитоплазмы и одновременно
поворачиваясь на 180° относительно изопренового молекулярного хвоста. Резуль-
Результаты были получены при замораживании «световых» и «темновых» образцов РЦ и
изучении их рентгенограмм в кристаллизированном состоянии.
§ 5. Математические модели первичных процессов
переноса электрона в фотосинтезе
^—р Из изложенного в гл. XXVII материала видно, что в фотосинтетических РЦ
перенос электрона осуществляется как подвижными переносчиками, так и пе-
переносчиками, организованными в молекулярные комплексы. В первом случае про-
процессы транспорта описываются бимолекулярными уравнениями второго порядка,
основанными на применении закона действующих масс. Во втором случае матема-
математическое описание основывается на уравнениях для вероятностей переходов между
разными состояниями молекулярного комплекса; эти состояния включают перенос-
переносчики в соответствующих окислительно-восстановительных состояниях. ?
382 Глава XXVIII. Электронно-конформационные взаимодействия
Общий вид уравнений переноса. Математический аппарат, используемый в
этих двух типах моделей, был подробно описан в гл. I-IV. Например, реакция
переноса электрона между двумя подвижными переносчиками С± и С2, взаимодей-
взаимодействующими в открытой цепи с внешними донором D и акцептором А,
D -^ d -^ С2 -^ A. (XXVIII.5.1)
Кинетические уравнения имеют вид
dCl/dt = hD1^ - k2C\C%; dCl/dt = k2C\C% - к3С^А°, (XXVIII.5.2)
где D1, C\, C\ —концентрации восстановленных, a D°, С®, C2 — окисленных форм
компонентов цепи, к\, к2, &з — бимолекулярные константы скоростей соответству-
соответствующих реакций.
Как правило, в цепи (XXVIII.5.1) общая концентрация переносчиков остает-
остается неизменной, т.е. С\ + С\ = Сю', С\ + С2 = С2о- Основное условие применения
закона действующих масс заключается в том, что редокс-состояния отдельных пе-
переносчиков в ЭТЦ независимы. Они определяются лишь окислительно-восстанови-
окислительно-восстановительным состоянием среды, с которой переносчики находятся в равновесии. Это
означает, что в условиях равновесия в темноте исходные концентрации окисленных
и восстановленных форм переносчиков задаются окислительно-восстановительным
потенциалом среды Е^. А именно, согласно уравнению Нернста,
Eh = Е1/2 + (RT/F) ln(Ci/C?) (XXVIII.5.3)
или отсюда
&° <xxvra 5-4)
где -Ei/2—нормальный потенциал полувосстановления переносчика, Е^—равно-
Е^—равновесный окислительно-восстановительный потенциал среды, F — число Фарадея.
Включение света вызывает перенос электрона в соответствии с уравнения-
уравнениями (XXVIII.5.2) при начальных условиях (XXVIII.5.4). Однако независимость ре-
докс-состояний переносчиков нарушается при отсутствии равновесия со средой, на-
например на свету, когда редокс-состояние переносчиков определяется фотоиндуци-
рованным потоком электронов. При наличии кооперативности в переносе электрона
в комплексах, когда переносчики влияют друг на друга, их окислительно-восстано-
окислительно-восстановительные состояния также становятся взаимозависимыми. В этих случаях приме-
применяют описание «в комплексе», которое позволяет учитывать также состояния, от-
отличные от окисленных и восстановленных: протонированные, депротонированные,
конформационные. Если перенос электрона по схеме (XXVIII.5.1) осуществляется в
комплексе из двух переносчиков, то размеченный граф состояний этого комплекса
(Ci, C2) будет иметь следующий вид:
A) t.xL2 ^LXL2 C)
А /А
к3\ / ЪЫ (XXVIII.5.5)
I # к2
B) О?Ск^С\С1 D)
§ 5. Математические модели первичных процессов переноса электрона в фотосинтезе 383
Здесь цифры в скобках указывают номер состояния комплекса (С1С2), к%— кон-
константы скоростей соответствующих переходов, указанных на схеме (XXVIII.5.1).
Кооперативность в переносе может проявляться в том, что константы скоростей
переходов между состояниями комплекса зависят от состояний переносчиков, не
принимающих непосредственного участия в реакции. В (XXVIII.5.5) степень ко-
оперативности для переходов
A) ѰѰ -Ь. С\С1 C); B) С\С\ -^ С\С1 A);
^ С\С\ D); D) С\С\ -^ С{С° C)
характеризуется параметрами аир, которые показывают, как зависит процесс
восстановления С\ или окисления Сг от редокс-состояний переносчиков С\ или Сг
соответственно. При а = C = 1 кооперативность отсутствует; система дифферен-
дифференциальных уравнений в этом случае для вероятностей состояний комплекса (С1С2)
в схеме (XXVIII.5.5) имеет вид
(xxviii.5.6)
ФЗ 7 1 7 7 Ф4 , , ^
— = fclPl +&3P4-K2P3, -jj- = KlP2 - K3P4, г=1
Решив систему уравнений (XXVIII.5.6) относительно вероятностей р^ состояний
комплекса (С1С2), можно найти вероятности состояний отдельных переносчиков.
Для этого надо просуммировать вероятности всех тех состояний комплекса, в кото-
которых рассматриваемый переносчик находится в интересующем нас состоянии. Так,
вероятность того, что первый переносчик находится в окисленном состоянии С®,
равна сумме вероятностей состояний A) и B) комплекса в схеме (XXVIII.4.5):
р(С?) = р(С?С%) + р{С%С\) =р1+р2 = 1- р(С\). (XXVIII.5.7)
\-у Суммарная скорость v переноса электрона между С\ и Ci в комплексе
пропорциональна концентрации комплексов, находящихся в состоянии С\С\
(v = k,2[C\C%\). Здесь в едином акте происходит как окисление С\, так и восстано-
восстановление С2 ¦ Поэтому если оба переносчика, входящие в комплекс, либо окислены, либо
восстановлены, переноса электрона между ними нет. Следовательно, компоненты
одного и того же комплекса взаимодействуют между собой, а отдельные комплексы
изолированы друг от друга. В фотосинтезе это соответствует параллельным
изолированным цепям переноса электронов. ?
В бимолекулярных реакциях, протекающих в растворах для восстановленного
переносчика С\, всегда найдется окисленный С®, между которыми и произойдет
перенос электрона.
В фотосинтетической цепи переноса электронный поток запускается при по-
поглощении кванта света фотоактивным пигментом Р, чему соответствует «световая»
константа скорости ко генерации возбуждаемых молекул Р*.
В схеме функционирования РЦ [см. (XXVII.5.1)] для перехода
р ^°, р*
384 Глава XXVIII. Электронно-конформационные взаимодействия
ко равна произведению интенсивности / падающего света на сечение поглощения а:
ко = 1а (с). На прямом солнечном свету /тах составляет ~ 1016 квант • см~2с-1 и
а ~ 10~16 см2. В этом случае значение ко близко к единице (см. §3 гл. XXVII).
Следовательно, на постоянном свету значение ко лимитируется интенсивностью
света или частотой попадания квантов в РЦ. Истинные времена и константы пе-
переноса электрона в ЭТЦ можно определить в условиях, когда интенсивность света
не является лимитирующим фактором. Это достигается (см. гл. XXVII) при воз-
возбуждении короткими лазерными импульсами длительностью 10~п с мощностью
1022-1025 квант • с (или 1011-1014 квант в импульсе).
¦\У Модель переноса в комплексе PQaQb- На основании данных о функциониро-
вании ЭТЦ составляются математические модели, описывающие окислитель-
окислительно-восстановительные превращения переносчиков. Результаты теоретического ис-
исследования свойств математической модели позволяют описать зависимость стацио-
стационарных концентраций и переходных кривых редокс-превращений переносчиков при
включении и выключении возбуждающего света от значений констант переноса, и в
частности, от величины ко- Сопоставление этих результатов с экспериментальными
данными дает возможность не только проверить справедливость исходных предпо-
предположений о характере функциональной организации ЭТЦ, но и определить значения
констант переноса и соотношение между ними на отдельных участках цепи. ?
Идентификация моделей включает выбор структуры модели и определение ее
параметров, наилучшим образом соответствующих экспериментальным данным по
кинетике переноса электрона. Для этого необходимо построение моделей фрагмен-
фрагментов ЭТЦ, ее отдельных участков, для которых имеются достоверные кинетические
данные.
Для идентификации параметров используются кинетические (рис. XXVIII.10)
кривые фотоиндуцированных изменений поглощения, отражающие редокс-превра-
щения Р и хинонных акцепторов. Условия однозначности идентификации параме-
параметров сформулированы лишь для линейных систем, к которым относятся изолиро-
изолированные бактериальные РЦ, комплексы ФС I. В случае более сложных нелинейных
систем привлекаются дополнительные критерии зависимости кинетических харак-
характеристик от режима освещения, действия ингибиторов. Идентификация проводится
путем минимизации суммы взвешенных квадратов отклонений теоретических зна-
значений переменных от экспериментальных.
Идентификация модели показала, что значения констант скорости переноса
электрона в реакции рекомбинации Р+ ¦*— Q~^ в темноте или на свету не одина-
одинаковы, а отличаются друг от друга по крайней мере на порядок. Этот результат
соответствует изложенным выше представлениям о различных конформационных
состояниях РЦ, формирующихся в темноте или на свету при функционировании
ЭТЦ. Причина столь большого различия в значения «темновых» и «световых» кон-
констант не может быть вызвана только изменением кулоновских взаимодействий и
перекрыванием электронных волновых функций при изменении редокс-состояний
переносчиков, а связана с процессом реорганизации белка РЦ. Анализ этого факто-
фактора проводили по зависимости константы рекомбинации Р+ ¦*- Q~^ от коэффициента
конформационнои диффузии D и разницы в расстояниях АЛ между компонентами
§ 5. Математические модели первичных процессов переноса электрона в фотосинтезе 385
донорно-акцепторной пары в темновой и световой конформациях
D
к =
aARex.p(-E/kT)}
где а — ширина энергетической ямы, Е — энергия активации. В результате удалось
получить значение характерного времени завершения полных конформационных
перестроек в белке РЦ (т < 102 с) (Ризниченко, Шайтан). Этот результат интересен
также в том отношении, что показывает возможности современных методов мате-
математического моделирования по теоретическому определению параметров объекта,
которые используются в уравнениях, но не могут быть найдены непосредственно в
экспериментах. Для железосерных центров в фотовосстанавливающейся части ФС I
также оказалось, что константы возврата электрона на Р^о изменяются на свету и
в темноте, что соответствует представлениям об изменении их конформационного
состояния в процессе переноса электрона. Таким образом, идентификация параме-
параметров математических моделей может стать серьезным инструментом в изучении
реальных свойств фотосинтетического электронного транспорта.
X
Первичные фотопроцессы
в биологических системах
mm::-
XXIX
Фотопревращения
бактериородопсина
и родопсина
XXX
Фоторегуляторные
и фотодеструктивные
процессы
Глава XXIX
Фотопревращения
бактериородопсина
и родопсина
и V -. г. -
Исследования молекулярных механизмов фотопревращений родопсина и бактерио-
бактериородопсина представляют собой важную область биофизики фотобиологических
процессов, которая особенно бурно развивается в последние годы. Бактерио-
родопсин Бр был обнаружен в пурпурной мембране галофильных бактерий
(В. Стокениус, 1971), которая оказалась новым типом биологической мембраны,
способной преобразовывать энергию света. Эта система, видимо, является наи-
наиболее простой из всех изученных систем запасания световой энергии в форме
разности электрохимических потенциалов Н+. Каждая молекула Бр содержит
один хромофор-ретиналь (полиеновый альдегид) в комплексе с белком — опси-
ном — единственным белком, который содержится в пурпурной мембране. Опсин
использует энергию света для активного перемещения протонов через мембрану,
в результате чего происходит синтез АТФ и обеспечивается выполнение других
физиологических функций. В основе этого биоэнергетического процесса лежит
фотохимический цикл превращений Бр.
Зрительный пигмент родопсин, так же как и бактериородопсин, — практиче-
практически единственный белок в фоторецепторной мембране зрительной клетки сетчат-
сетчатки глаза (на его долю приходится до 80% всего белка в мембране). Хромофором
родопсина также служит ретиналь, находящийся в комплексе с опсином. Фотопре-
Фотопревращения родопсина тесно сопряжены с ионными и ферментативными процессами,
лежащими в основе зрительной рецепции, а также с возникновением трансмембран-
трансмембранной разности потенциалов на фоторецепторной мембране за счет сдвига протона в
мембране.
^—р По целому ряду свойств родопсин и бактериородопсин схожи (аминокислотный
состав, молекулярная масса, химическая природа хромофора). Общие черты
присущи и процессам фотохимических превращений, особенно на первых стадиях.
Как будет показано в настоящей главе, первичные механизмы фотопревращений
бактериородопсина и родопсина сходны во многом также и с механизмами про-
процессов, проходящих в РЦ фотосинтеза (см. гл. XXVIII). Эти механизмы включа-
включают фотоиндуцированные конформационные изменения в белковой части фоточув-
фоточувствительного хромопротеина, осуществляющиеся согласно принципу электронно-
конформационных взаимодействий. ?
1. Структура и функции пурпурных мембран
389
§ 1. Структура и функции пурпурных мембран
Пурпурные мембраны ПМ, локализованные в цитоплазме клеток некоторых экс-
экстремально галофильных бактерий, например Halobacterium salinarium, содержат
единственный гидрофобный пигмент-белковый комплекс ПБК бактериородопсин
(молекулярная масса ~ 26 000), молекулы которого располагаются в ПМ строго
упорядоченно.
Согласно электронно-микроскопическим данным, ПМ в интактных клетках и
в изолированных препаратах представляют собой дискообразные образования диа-
диаметром около 0,5 мкм и толщиной 5-6 нм. Бр расположен в ПМ симметричными
группами по три молекулы, причем каждый такой тример стабилизирован 12-14 мо-
молекулами структурных липидов. Размер ячейки составляет около 0,6 нм. Тримеры,
в свою очередь, образуют двумерную гексагональную «кристаллическую» решетку
в плоскости ПМ с периодом 6,3 нм.
Данные спектров кругового дихроизма в УФ-области свидетельствуют о высо-
высокой степени а-спирализации белковой цепи Бр G5-80% а-спирализации). Хромофор
белка—ретиналь — содержится в белке в молярном соотношении 1 : 1, т.е. на ка-
каждую белковую цепь приходится один ретиналь.
Тщательный биохимический анализ молекулы Бр позволил расшифровать
первичную последовательность аминокислот в белковой цепи (Ю. А. Овчинников,
Корана, 1979), а также определить расположение молекулы Бр в ПМ. Концевая
СООН-группа белковой молекулы находится на цитоплазматической стороне
мембраны, a NH2-rpynna — на внешней стороне.
1ЧН2-лиз
L-H1-A
Рис. XXIX.1.
Образование альдиминовой связи меж-
между ретиналем и лизином в белковой це-
цепи (шиффово основание)
Ретиналь ковалентно связан с опсином и образует альдиминную связь с
одним из остатков лизина в белковой цепи (так называемое шиффово осно-
основание (рис. XXIX.1), которое может быть протонировано). Одна молекула Бр
содержит 7 а-спиральных участков, пронизывающих ПМ. Три из этих «столбов»
расположены почти перпендикулярно плоскости мембраны, остальные четыре
образуют небольшие углы с нормалью к плоскости мембраны. На рис. XXIX.2
приведена трехмерная модель строения Бр, построенная на оснований данных по
390 Глава XXIX. Фотопревращения бактериородопсина и родопсина
диффракции электронов в опытах с использованием низкотемпературной микро-
микроскопии образцов (Хендерсон). Ретиналь в Бр прикреплен к диз-216, находящемуся
в конце Ga-спирального столба (рис. XXIX.2). Место прикрепления ретиналя к
белку расположено ближе к цитоплазматической стороне ПМ — на расстоянии
0,6-1,0 нм от поверхности, в то время как иононовое кольцо ретиналя находится
внутри мембраны, почти в ее центре. Эксперименты по дифракции нейтронов
на препаратах ПМ с дейтерированным ретиналем показали, что величина угла
между переходным дипольным моментом ретиналя, практически совпадающим с
его длинной осью, и плоскостью ПМ лежит в диапазоне 19°-25°.
Как видно из рис. XXIX.2, в состав ближайшего белкового окружения ретина-
ретиналя помимо диз-216 входят и другие аминокислоты, которые играют важную роль
в структурной стабилизации и функционировании Бр (подробнее см. ниже). Они
расположены от ретиналя на разных расстояниях D-10 А) и могут играть роль
сложного противоиона А~ для протона шиффова основания (см. рис. XXIX. 1).
Макромолекулы Бр гораздо менее подвижны, чем другие мембранные белки.
Из температурной зависимости спектров кругового дихроизма ПМ видно, что при
температурах выше 30° С взаимодействие молекул Бр внутри тримеров практиче-
практически исчезает и в ПМ существует только мономерная форма Бр.
Следует отметить, что термостабильность Бр зависит от степени гидратиро-
ванности препаратов ПМ. Так, методом синхротронного рассеяния рентгеновских
лучей было показано, что в водной суспензии двумерная гексагональная структура
ПМ имеет точку фазового перехода из твердого в жидкое состояние при температу-
температуре 69° С, а необратимая денатурация белка происходит при 90° С. Однако в обезво-
обезвоженных мембранах многочасовой нагрев даже до 140° С не вызывает структурных и
функциональных повреждений Бр. Такая высокая термоустойчивость, по существу,
является рекордной для всех известных белков и ферментов и, очевидно, является
результатом природной самосборки пигмент-белковых комплексов с липидами в
двумерный квазикристалл.
В спектре поглощения ПМ один из максимумов, расположенный около 280 нм,
соответствует поглощению ароматических аминокислот в белке. В модельных си-
системах максимум поглощения шиффова основания в протонированнои форме нахо-
находится около 440 нм, в непротонированной — около 360 нм. Однако в Бр максимумы,
соответствующие протонированнои форме шиффова основания, расположены около
560-570 нм, а непротонированной — около 412 нм.
Различие в положении максимума поглощения ретиналя с протонированным
шиффовым основанием в белке Бр E70 нм) по сравнению с положением его мак-
максимума в полярных растворителях D40 нм) называется «опсиновым» спектральным
сдвигом D40 -* 570 нм). В обоих случаях в протонированном шиффовом основании
происходит смещение максимума в спектре поглощения ретиналя в длинноволновую
область по сравнению с непротонированной формой. Это обусловлено электроста-
электростатическим влиянием положительного заряда протона, образующего одновременно
и водородную связь с отрицательно заряженным противоионом А~ в ближайшем
окружении шиффова основания (рис. XXIX.2). Чем сильнее эта водородная связь,
тем слабее влияние протона, и тем меньше длинноволновый сдвиг в положении
максимума ретиналя с протонированным шиффовым основанием по сравнению с
непротонированной формой.
1. Структура и функции пурпурных мембран
391
Цитоплазма
О ,
с\- A
-<8.О ~.: С
N-конец
внешн.
Рис. XXIX.2.
Трехмерная структура молекулы бактериородопсина (по R.Henderson et al., 1990).
392 Глава XXIX. Фотопревращения бактериородопсина и родопсина
Очевидно, влияние отрицательного заряда противоиона А~, образующего водо-
водородную связь с протоном шиффова основания, одновременно уменьшает величину
этого длинноволнового сдвига. В растворе роль такого отрицательного противо-
противоиона выполняют, например, ионы С1~. Однако в белке роль отрицательных проти-
воионов принадлежит уже ионизированным аминокислотным остаткам с меньший
зарядами вблизи ретиналя (рис. XXIX.2).
— С = N+ — лиз
I
Н
Вследствие этого водородная связь ослабляется, а влияние положительного заря-
заряда протона шиффова основания в Бр возрастает. Это и приводит к «опсиновому»
спектральному сдвигу D40 -* 570 нм) Бр по сравнению с модельными системами.
Помимо основных противоионов Асп 212, Асп 85, свое влияние могут оказывать и
заряды других остатков (Apr 82), а также триптофан (Трп 189) в гидрофобном
кармане опсина, где находится ретиналь.
Так, было показано, что в мутантах, где отрицательно заряженный аспарат
Асп 85 замещен на нейтральный аспарагин Асн, максимум поглощения Бр сдвига-
сдвигается еще дальше в красную область до 590 нм. Отрицательный заряд на Асп 85
исчезает и при протонировании этого остатка с соответствующим длинноволно-
длинноволновым смещением положения Хмакс. Этот эффект можно также вызвать и заменой
положительно заряженного Apr 82 на другой нейтральный остаток (Ала, Глю), в
результате чего Асп 85 может протонироваться. Таким образом, положительный
ион Apr 82 стабилизирует Асп 85 в его депротонированном состоянии.
Таким образом, при оценке состояния протонированного шиффова основания в
Бр надо учитывать эффект не одного противоиона, а аминокислотного окружения
ретиналя в целом с участием нескольких остатков.
Другой причиной длинноволнового сдвига является дополнительная делокали-
зация л-электронов в полиеновой цепи ретиналя (см. гл. XII, §1). Это происходит
при 6 цис -*¦ 6 транс (Сб~С7-связь) изомеризации свободной полиеновой цепи рети-
ретиналя при ее связывании с иононовым кольцом и включением из-за этого двойной
связи кольца в общую систему л-электронов (рис. XXIX.1).
\—? Бр в ПМ может находиться в двух различных состояниях: после адаптации к
темноте или к свету. Эти состояния отличаются по спектрам поглощения Бр.
Максимум полосы поглощения Бр в образцах, адаптированных к темноте, распо-
расположен около 560 нм. После освещения максимум сдвигается до 570 нм. По данным
химических анализов, ПМ, адаптированные к темноте, содержат эквимолярные
количества молекул БР, имеющих ретиналь в 13-цис и полностью транс-формах.
Светоадаптированные ПМ содержат Бр только с полностью транс-ретиналем
(рис. XXIX.3). ?
Изомеры Бр A3-цис- + транс-) при возбуждении светом вовлекаются в различ-
различные циклы превращений. В темноте наблюдается медленный процесс релаксации
части Бр (транс-) в Бр A3-цис) до достижения темноадаптированного состояния.
i 2. Фотоцикл бактериородопсина
393
Скорость изомеризации обладает сильной температурной зависимостью
Бр56оA3-Чис- + транс-) 'те^та' Бр570(транс-). (XXIX.1.1)
14
Рис. XXIX.3.
Структурные формулы полностью транс-ретиналя (/) и 13-цис-ретиналя (II).
§ 2. Фотоцикл бактериородопсина
Общие свойства. В основе функционирования Бр как протонной помпы лежит его
способность за счет энергии света переносить протоны с цитоплазматической на
внешнюю сторону клеточной мембраны.
¦\У Эксперименты с применением рН-индикаторных красителей на модельных си-
стемах (замкнутые везикулы, содержащие ПМ в такой же ориентации, как и
в нативной клетке) показали, что выброс протона происходит на внешней стороне
ПМ, а захват — на цитоплазматической. Следовательно, наблюдающееся закисление
среды, суспендирования клеток галобактерий при их освещении обусловлено выхо-
выходом протонов при функционировании протонной помпы, роль которой выполня-
выполняет Бр. Кроме того, при освещении суспензии галобактерий наблюдается увеличение
содержания АТФ в клетках и торможение дыхания. Процессы фотоиндуцирован-
ного переноса протонов через ПМ включают электрогенные стадии, протекание
которых сопровождается образованием на мембране фотопотенциала. ?
Поглощение света ретиналем дает начало фотохимическому циклу превраще-
превращений Бр, в ходе которого он претерпевает переходы между разными формами на
пути возвращения в исходное состояние. Отдельные стадии фотоцикла сопрово-
сопровождаются характерными спектральными изменениями Бр, что позволяет экспери-
экспериментально изучать кинетику переходов между формами в фотоцикле. Каждая из
стадий соответствует определенному этапу трансмембранного транспорта протона.
Особенно плодотворным подходом к изучению функционирования Бр оказался
направленный точечный мутагенез, в результате которого отдельные аминокисло-
аминокислоты в молекуле Бр можно заменить на другие. Сопоставление функциональной ак-
активности мутагенного белка с белком дикого типа позволяет сделать обоснованный
вывод об участии определенных аминокислотных остатков в конкретных фотохи-
фотохимических реакциях Бр и этапах переноса протона. Исследованиями, выполненными
на точечных мутантах галобактерий, было показано, что первичным донором и
акцептором протона в молекуле Бр являются остатки аспартата Асп 96 и Асп 85
394
Глава XXIX. Фотопревращения бактериородопсина и родопсина
соответственно. После поглощения кванта света ретиналь изомеризуется и перехо-
переходит из полностью-транс в 13-цис форму (рис. XXIX.3). При этом протон с шиффова
основания переносится на Асп 85, после чего образовавшаяся вакансия заполняется
протоном, перешедшим с Асп 96.
Н+
Рис. XXIX.4.
Схематическое изображение бактериородопсина. Путь протона показан прямыми
стрелками. Изогнутая стрелка показывает направление изгиба спирали F в ходе
фотохимического цикла (по J.K.Lanyi, 1995)
Такой внутримолекулярный перенос протона инициирует эстафетную цепочку
транспортных реакций, в результате которых происходит высвобождение протона
на внешней стороне мембраны и поглощение протона из внутриклеточного про-
пространства. В схематическом виде это показано на рис. XXIX.4.
В ходе цикла фотохимических превращений Бр испытывает конформацион-
ные переходы, которые по сути сходны с таковыми у большинства ферментов
(см. гл. XIV). Эти конформационные переходы инициируются кулоновским вза-
взаимодействием в донорно-акцепторных парах аминокислот: между положительно
заряженным внутримолекулярным донором и отрицательно заряженным акцеп-
акцептором протона. До поглощения кванта света структура белка стабилизирована
энергией связи комплекса, образованного протонированным шиффовым основани-
основанием, заряженными группами в локусе ретиналя и связанной водой (рис. XXIX.2).
i 2. Фотоцикл бактериородопсина
395
В этом конформационном состоянии (конформация Е) протон шиффова основания
координационно связан с Асп 85 и находится в контакте с наружной стороной
мембраны. Фотоизомеризация ретиналя смещает шиффово основание относитель-
относительно Асп 85, но возникающие в молекуле Бр напряжения способствуют переносу
(адаптированный к темноте)
БР570
(транс)
< 10 пс
2 мкс
40 мкс
Н
Рис. XXIX.5.
Фотохимический цикл бактерио-
бактериородопсина: цифрами указаны по-
положения максимумов поглощения,
времена жизни и нижние темпе-
температурные пределы соответствую-
соответствующих переходов; остальные поясне-
пояснения см. в тексте
протона с шиффова основания на аспарат 85. Данные структурных исследований
показывают, что Бр при этом переходит в новую конформацию (конформация С),
отличающуюся сдвигом спирали G от цитоплазматической стороны мембраны к
центру молекулы (см. рис. XXIX.4). В конформации С шиффово основание уже
находится в контакте с цитоплазматической стороной мембраны, а его контакт с
Асп 85 и, следовательно, с наружной стороной мембраны нарушен.
Таким образом, Бр представляет собой ионный насос с переменным доступом
активного центра к противоположным сторонам мембраны. В терминах конформа-
ционной динамики Бр представляет собой систему с двумя устойчивыми состояни-
состояниями, причем избыточная конформационная энергия запасается в ходе фотоцикла в
виде трансмембранного градиента электрохимического потенциала ионов водорода.
Первые исследования цикла фотоиндуцированных превращений Бр в суспензии
ПМ при комнатной температуре, выполненные методом импульсной абсорбцион-
абсорбционной спетроскопии, показали наличие шести промежуточных состояний. Каждое из
этих состояний, обозначаемых буквами латинского алфавита от if до О в порядке
возрастания длительности жизни, характеризуется определенными спектральными
свойствами. Упрощенная последовательность переходов между обнаруженными со-
состояниями активированного Бр представлена на рис. XXIX.5. Образующаяся вслед
396
Глава XXIX. Фотопревращения бактериородопсина и родопсина
за поглощением света форма К ею при температурах ниже 140 К является стабиль-
стабильной (Литвин, Балашов, 1975). Однако она фотоактивна и может быть переведена
обратно в исходное состояние Бр570 (транс-) воздействием красного света с длиной
волны > 630 нм. Установлена независимость от температуры (в интервале от 77
до 9 К) фотоиндуцированного перехода Бр57о транс- ~* -К^ю и обратной реакции,
квантовые выходы которых равны соответственно 0,64 и 0,67. Показано, что форме
-К"бю предшествует образование продукта Jq25 (см. ниже). Исходная форма Бр570
содержит ретиналь только в транс-конфигурации, а уже на стадии интермедиата
J^25 ретиналь находится в полностью 13-цис-состоянии.
^—р Образование промежуточной формы М412 в фотоцикле Бр, по многочисленным
данным, связано с переносом протона через мембрану. Процесс образования
М412 сопряжен с освобождением протона и выходом его во внешнюю среду. Распад
формы М412 сопровождается связыванием протона на другой стороне мембраны
(В. Стокениус, 1978). ?
Цитоплазма
Бр
Лиз216
Асп212
Наружная поверхность
Рис. XXIX.6.
Схема переноса протона в
Бр по цитоплазматическо-
му A) и периплазматиче-
скому B) каналам. Показа-
Показано расположение основных
участников переноса про-
протона. ХН — терминальный
донор протона во внешнюю
среду
Механизмы переноса протона. Современные модели переноса протона в цикле
Бр основаны на представлениях о двух протонных каналах, связывающих рети-
ретиналь с внутренней и наружной сторонами мембраны. Ретиналь служит своего рода
молекулярным переключателем, регулирующим общий трансмембранный перенос
протонов по цитоплазматическому и периплазматическому каналам (рис. XXIX.6).
Первичным акцептором протона от шиффова основания является Асп 85. Груп-
§ 2. Фотоцикл бактериородопсина 397
па X, определенная как Глю-204, непосредственно отдает протон в наружную среду.
Остаток Асп 96 репротонирует шиффово основание, восполняя дефицит протонов
за счет цитоплазматического источника.
Основным фактором, определяющим направление и скорость движения про-
протона между участками транспортной системы, является степень их сродства к
протону, или, как известно из биохимии, величина рКа. Поскольку аминокислотные
остатки находятся друг от друга на коротких расстояниях, то рКа каждого из них
определяется также и влиянием электрических зарядов соседних групп. Величина
рКа остатка, или сродство к протону, увеличивается или уменьшается, если в не-
непосредственной близости от него на соседних молекулярных группах появляются
соответственно отрицательный или положительный заряды. Именно это обстоя-
обстоятельство определяет движущую силу и механизм регуляции транспорта протона
вБр.
Первичный акт фотопроцесса Бр, природу которого мы более детально рас-
рассмотрим ниже, включает фотоизомеризацию транс-13-цис ретиналя. В результате
изменения конфигурации ретиналя шиффово основание смещается в гидрофобную
область белка с более низким значением диэлектрической постоянной. Это приводит
к увеличению взаимодействия между положительным протоном основания и отри-
отрицательным зарядом противоиона Асп 85, в результате чего рКа шиффова основания
уменьшается. Теперь протон может перейти на отрицательно заряженный остаток
Асп 85 и протонировать его. Изменения электростатических взаимодействий, ин-
индуцированные актом транс-13-цис-фотоизомеризации ретиналя тесно сопряжены с
поляризацией и соответствующими конформационными изменениями белка Бр.
Переход протона на Асп 85 происходит в несколько стадий, соответству-
соответствующих последовательному появлению форм Jq25, -Кбкь -^550 и М412 в фотоцикле
(см. рис. XXIX.5).
Транс-13-цис-фотоизомеризация ретиналя в исходном Бр570 сопряжена с изме-
изменениями плоскостного расположения и небольшими изгибами полиеновой цепи и по
другим связям. Наблюдаемый красный сдвиг спектра 570 -* 610 нм в состоянии -К"бю
вызван отмеченным выше ослаблением взаимодействия шиффова основания с отри-
отрицательным противоионом (Асп 85 ) и увеличенной делокализацией л-электронов.
В состоянии -К"бю 13-цис-ретиналь и его ближайшее белковое окружение нахо-
находятся в напряженном состоянии, которое постепенно релаксирует к плоскостному
расположению 13-цис-ретиналя в L-форме.
В состоянии ?550 шиффово основание еще протонировано, однако сдвиг положе-
положения максимума в коротковолновую сторону F10 —> 550 нм) указывает на усиление
влияния акцепторного отрицательного противоиона Асп 85. Принципиальный этап
в транспорте протона связан с распадом формы ?550» вызванным депротонирова-
нием шиффова основания, переносом протона на Асп 85 и образованием в резуль-
результате формы М412- Положительный заряд при этом смещается к внешней стороне
мембраны за ~ 25 мкс, что соответствует движению протона к Асп 85 и появлению
Асп-СООН. В состоянии М412 ретиналь находится в полностью отрелаксированном
13-цис положении (рис. XXIX.7). Протонирование Асп 85 и нейтрализация отрица-
отрицательного заряда его группы СОО~ понижает рКа протонированной терминальной
аминогруппы ХН от 9,4 до 4,7, что способствует ее депротонированию и выбросу
протона во внешнюю среду (ХН —> Х~ + Н+). При этом Асп 85 остается все еще в
398
Глава XXIX. Фотопревращения бактериородопсина и родопсина
БР568
6-s-TpaHC
БР555
6-8-транс
м412
Рис. XXIX. 7.
Конфигурация ретиналя в формах Бр570, L, М по данным ЯМР (по М. Engelhard,
В. Bechinger, 1995)
§ 2. Фотоцикл бактериородопсина 399
протонированном состоянии, причем ее рКа повышается с 3 до 7 единиц. Очевидно,
существуют два состояния формы М412, в каждом из которых остаток Асп 85
протонирован. В первом состоянии формы М412 приход протона на Асп 85 застает
терминальный акцептор ХН исходно протонированным, а во втором состоянии ХН
уже отдает протон во внешнюю среду. Таким образом, выброс протонов на пе-
риплазматической стороне мембраны в первые 1-2 мс происходит при сохранении
остатка Асп в протонированной форме Асп-СООН.
Переходы между формами L -* М можно представить в виде:
Асп 96 COOH(C=NH) Асп 85 СОСГХН -*
-* Асп 96 COOH(C=N) Асп 85 СООН ХН -*
МAL12
-* Асп 96 COOH(C=N) Асп 85 СООН X".
МBL12
Вторая часть фотоцикла Бр связана с репротонированием шиффова основания
и распадом M^yi- Вначале происходит перенос протона по цитоплазматическому
каналу от Асп 96 СООН через «посредников» (Трионин, Н2О) с образованием формы
Асп 96 COOH(C=N) Асп 85 СООНХ" -*
Mai
-* Асп 96 COO"(C=NH) Асп 85 СООНХ" -* .
В мутантах, где Асп 96 замещен на другие остатки (аспарагин), резко замед-
замедляется транспорт протонов и исчезновение формы М±\2-
Состояние -/V520 распадается далее за 1 мс с репротонированием Асп 96 СОО~ за
счет цитоплазматического источника протонов. Одновременно хромофор реизоме-
ризуется из 13-цис в исходную форму полностью транс-ретиналь, что соответствует
форме О64о
Асп 96 COO"(C=NH+) Асп 85 СООНХ" -*
N520
-* Асп 96 COOH(C=NH+) Асп 85 СООНХ".
транс Об4о
Сдвиг 520 —> 640 нм при переходе -/V520 ~* Об4о вызван ослабленным влиянием ней-
нейтрализованного протонированного противоиона Асп 85 СООН на положительный
заряд протона шиффова основания.
Как показали опыты по тепловой изомеризации ретиналя Бр, в темноте барьер
для цис ->• транс переходов снижается, если Асп 85 протонирован (см. XXIX.1.1).
Это происходит за счет ослабления водородной связи шиффова основания с про-
тивоионным окружением и большей делокализациеи л-электронов хромофора. Эту
роль в ускорении темновой реизомеризации ретиналя и возвращении в исходное
состояние на этапе Об4о ~* Бр570 и выполняет Асп 85 СООН.
Асп 96 COOH(C=NH+) Асп 85 СООНХ" -*
транс Об4о
-* Асп 96 COOH(C=NH+) Асп 85 СОО"ХН.
транс Бр570
400 Глава XXIX. Фотопревращения бактериородопсина и родопсина
Таким образом, помимо своего значения как противоиона и акцептора протона
от шиффова основания Асп 85 играет также регуляторную роль. В депротони-
рованном состоянии Асп СОО~ препятствует превращению в темноте активного
транс-Бр в неактивную 13-цис-форму до начала освещения. Наоборот, в протониро-
ванном состоянии Асп СООН облегчает темновую реизомеризацию хромофора на
последней стадии фотоцикла. В этой связи особое значение имеет и положительно
заряженный Apr 82, который одновременно стабилизирует отрицательный заряд
на Асп СОО".
§ 3. Первичный акт фотопревращений бактериородопсина
Начальные стадии фотопревращений Бр включают образование промежуточной
формы J625 и первого относительно стабильного продукта, который по своим спек-
спектральным свойствам идентичен форме К ею (батоформа Бр)
Бр57о -* Бр570 -* J625 -* -Кбю-
Именно на этом этапе фотоцикла происходит запасание энергии поглощенного
кванта, которая потом используется в процессах транслокации протона.
Фотоцикл Бр не включает каких-либо окислительно-восстановительных реак-
реакций, где подобно фотосинтезу, происходил бы отрыв и перенос электрона между
разными молекулами. Под действием поглощенного кванта света в Бр лишь сме-
смещается электронная плотность вдоль полиеновой цепи при возбуждении аромати-
ароматического кольца ретиналя. Происходящая в результате транс-цис фотоизомеризация
ретиналя является триггером, «запускающим» всю дальнейшую цепь последователь-
последовательных превращений фотоцикла Бр.
Это аналогично событиям в первичных реакциях фотосинтеза, где начальная
стадия разделения зарядов в РЦ дает «толчок» всей цепи переноса электрона. Как
мы увидим ниже, в фотоцикле Бр, как и в фотосинтезе, фотоиндуцированные
электронные переходы тесно сопряжены с колебательными и конформационными
изменениями ближайшего белкового окружения хромофора.
Основные экспериментальные подходы и методы исследований первичных ре-
реакций фотоцикла Бр, а также характер получаемой с их помощью информации во
многом сходны с таковыми в случае фотосинтеза, и были уже подробно описаны
выше (гл. XXVII-XXVIII).
Здесь также применяются методы резонансной раман- и инфракрасной диффе-
дифференциальной спектроскопии, которые позволяют наблюдать колебания атомов в от-
отдельных химических связях и определять частоты этих колебаний. На рис. XXIX.8
представлен раман-спектр Бр, где обозначены пики колебаний одинарных С—С и
двойных С=С, C=N связей, а также внеплоскостных колебаний протона.
Оказалось, что переход Бр570 -* -К"бю сопровождается уменьшением частоты
A640 см) колебаний связи C=N в протонированном шиффовом основании
C=+NH на 15-30 см. Это свидетельствует об увеличении расстояния между
группой СОО~ белка и протоном в шиффовом основании, в результате которого
происходит делокализация положительного заряда протона с уменьшением частоты
колебаний связи C=N. Происходящее при образовании К^ю некоторое удаление
3. Первичный акт фотопревращений бактериородопсина
401
протона шиффового основания может быть первым этапом на пути его дальнейшей
транслокации.
\—? В форме .Кбю шиффово основание еще частично протонировано, хотя состоя-
ние протона уже успевает существенно измениться. Об этом также свидетель-
свидетельствуют изменения полосы колебаний при 1646 см связи C=+NH, происходящие
в пикосекундном временном диапазоне. В форме М412 группа СОО" белка уже
протонирована (пик при 1760 см). ?
200
400
600
800 1000
Частота, см
1200
1400
1600
Рис. XXIX.8.
Раман-спектр бактериородопсина в диапазоне 100-1700 см
R. A. Mathies, 1995)
по G. G. Kochenderfer,
HOOP — внеплоскостные колебания протона, С—С, С=С — колебания связей. Торсионные колеба-
колебания в полиеновой цепи наблюдаются при 187 см.
С помощью метода рамановской спектроскопии при низкой температуре, а
также динамической спектроскопии в наносекундном и пикосекундном временном
диапазонах показано, что уже на стадии существования -К"бю хромофор облада-
обладает характеристиками, свидетельствующими о наличии в нем 13-цис-конформации
(область 1100-1400 см в раман-спектре. Раман-спектр ретиналя в 13-цис-кон-
фигурации в форме -К"бю характеризуется появлением новых линий (при 811 и
957 см) по сравнению с модельным 13-цис-ретиналем, что указывает на усиление
внеплоскостных колебаний протонов, принадлежащих винильным группам полие-
полиеновой цепи. Очевидно, в этих условиях 13-цис-конфигурация хромофора находится
в возмущенном состоянии вследствие влияния белкового окружения, вызывающе-
вызывающего, по всей видимости, торсионную деформацию («скручивание») полиеновой цепи
ретиналя (рис. XXIX.7).
402 Глава XXIX. Фотопревращения бактериородопсина и родопсина
Процесс изомеризации ретиналя сопровождается также и изменениями погло-
поглощения в области 260-450 нм. Совокупность этих данных позволяет сделать за-
заключение, что процесс транс-цис-изомеризации ретиналя растянут во времени. Он
начинается раньше образования -К"бю-
На протяжении всего времени жизни интермедиата К^ю хромофор существует
в некоем переходном состоянии, которое, строго говоря, не является ни транс-, ни
13-цис-конфигурацией. Полностью завершается процесс изомеризации к моменту
образования формы L550 и -^412-
Применение методов фемтосекундной и пикосекундной лазерной спектроско-
спектроскопии позволило детально изучить кинетику быстрых начальных процессов в фото-
фотоцикле Бр. Нарастание фотоиндуцированных абсорбционных изменений при 625 нм
происходит за время ~ 500 фс, что соответствует появлению формы 3§2Ь-
Колебательная релаксация первичного фотопродукта J^25 сопровождается дис-
диссипацией избытка колебательной энергии, дальнейшей структурной перестройкой
скелета молекулы в ходе изомеризации ретиналя и образования за 3 пс формы К ею
* 500 фс 3 пс „
ЬРб70 " ^625 * Лею-
Однако эта последовательность событий включает и другие сверхбыстрые
структурные изменения, сопровождающие фотоизомеризацию ретиналя. Они
затрагивают молекулы ретиналя и аминокислотные остатки ближайшего белкового
окружения, взаимодействие с которыми играет важную роль в обеспечении высокой
скорости и эффективности фотоизомеризации. Оказалось, что динамика начальных
спектральных изменений поглощения Бр в диапазоне до 100 фс носит колебательный
характер, связанный с когерентными колебаниями ядерного волнового пакета при
движении вдоль потенциальной поверхности возбужденного состояния в первые
100-200 фс (ср. рис. XXVIII.37, 38). Моделирование такого рода движений ядер
на частоте торсионных колебаний при 187 см показало, что поворот на 90°
действительно может завершиться за 100-200 фс (Воршел).
Очевидно, начальный этап фотоизомеризации ретиналя происходит за время
100-200 фс при адиабатическом переходе вдоль поверхности потенциальной энергии
возбужденного состояния.
Транс-13-цис-поворот представляет собой электронную релаксацию Бр* по
выделенной степени свободы торсионного вращения (ср. § 1 гл. XXVIII). Он носит
направленный микроструктурный характер. Высокая скорость сопряженных
с ним движений ядер приводит к наблюдаемому в экспериментах уширению
полос поглощения Бр в первые 100-200 фс после светового возбуждения. После
транс-13-цис-поворота происходит безизлучательный переход за 500 фс на по-
потенциальную поверхность фотопродукта Jq25 с его последующей колебательной
релаксацией и переходом в -К"бю за 3 пс. Это сопряжено с дальнейшими структур-
структурными перестройками в других частях скелета ретиналя. Время образования Jq25
в несколько раз (~ 5 раз) меньше, чем время затухания флуоресценции Бр* или
время существования электронного возбуждения Бр*, которое составляет 2,5 пс
(> 500 фс). Следовательно, возбуждение в Бр* сохраняется некоторое время после
образования Jq25, что говорит о сложном характере адиабатического перехода
Бр* -* J625-
3. Первичный акт фотопревращений бактериородопсина
403
Об этом же свидетельствует и слабая температурная зависимость скоростей
начальных процессов Бр* -* J625 -* -Кбю в области B95-77 К), с небольшой энергией
активации (~ 0,5 кДж/моль).
На рис. XXIX.9 изображена гипотетическая схема расположения кривых по-
потенциальных энергий состояний Бр* —> 3§ъь -*¦ К ею- Кривая состояния Бр* име-
имеет небольшой промежуточный барьер транс-цис-изомеризации, разделяющий флу-
флуоресцирующее состояние Бр* и область перехода J^25- Видно, что часть молекул
Бр* возвращается на основной уровень с испусканием кванта флуоресценции, и не
участвует в реакции. Другая часть претерпевает фотоизомеризацию, находясь в
возбужденном состоянии.
БР570
Рис. XXIX.9.
Схема расположения кривых потенциальных энергий состояний Бр*
R — ядерная координата.
¦J,
625
Скорость фотоизомеризации ретиналя (т ~ 200 фс) в плотном белке Бр намно-
намного выше, чем изолированного ретиналя в растворе (~ 10~п с). Эта особенность
определяется, очевидно, своеобразием белкового окружения и взаимодействием ре-
ретиналя с аминокислотными остатками, которое ответственно за форму кривой по-
потенциальной энергии состояния Бр*.
В прямых экспериментах измерялась скорость фотоизомеризации Бр в мутан-
мутантах, где с помощью точечного метагенеза были замечены функционально-активные
аминокислотные остатки, входящие в состав сложного противоиона шиффова осно-
основания. Оказалось, что замена заряженных остатков Асп 85, Асп 212 и Apr 82 на
нейтральные Асн и Глн снижала скорость фотоизомеризации в несколько раз (Эль-
Саид). По-видимому, наличие отрицательно заряженных компонентов противоиона
способствует снижению активационного барьера фотоизомеризации за счет ку-
лоновского отталкивания между ними и отрицательным зарядом ароматического
кольца ретиналя, куда смещается электронная плотность при световом возбуждении
хромофора.
Роль белка в фотоцикле Бр. Процесс транслокации протона связан не толь-
только с локальными изменениями значений рК компонентов протонных каналов
(рис. XXIX.6), но и сопряжен с изменениями конформации белка.
404 Глава XXIX. Фотопревращения бактериородопсина и родопсина
На начальном этапе образования iif-формы из ~ 210 кДж/моль энергии по-
поглощенного кванта света запасается около 40 кДж/моль вследствие структурных
перестроек и электростатических взаимодействий в окружении ретиналя. Эти про-
процессы могут включать и поляризацию белка, сопровождающуюся его конформаци-
онными изменениями не только на начальных этапах фотоцикла. Так, образование
формы М412 сопровождается увеличением энтальпии за счет уменьшения энтропии
@,3 кДж/моль) с соответствующими конформационными перестройками белка. На
следующем этапе перехода N520 ~* 0^40 происходит вновь увеличение энтропии
(~ 0,2 кДж/моль), и конформация белка возвращается к исходному состоянию.
Очевидно, свободная энергия, запасенная за счет уменьшения энтропии на этапе
образования М412, затем используется для обратной 13-цис-транс-изомеризации ре-
ретиналя.
В целом можно представить себе, что в результате первичного фотоакта про-
происходит стабилизация системы на новом основном уровне, более высокоэнергетиче-
высокоэнергетическом по сравнению с исходным Бр570, который достигается в результате внутримо-
внутримолекулярных перестроек и поляризации ближайшего окружения ретиналя. При этом
происходит запасание энергии электронного возбуждения в форме -К"бю-
Обратный спонтанный переход в исходное состояние отсюда уже затруднен,
так как он потребовал бы перестройки молекулярных групп в Бр, которая в этом
случае уже не обеспечена внешней энергией. Регенерация -К"бю ~* Бр570 может осу-
осуществляться здесь под действием света (X > 630 нм). По существу, весь каскад пре-
превращений Бр происходит вдоль кривой потенциальной энергии основного состояния
Бр570, которое в конформационном отношении неравновесно.
^—р Поглощение света обеспечивает исходный сдвиг электронной плотности в Бр570
и поляризацию белкового окружения ретиналя. За счет соответствующих вну-
внутримолекулярных перестроек на кривой появляются новые минимумы, попадая в
которые, система стабилизируется. На стадии К^ю перестройки включают транс-
цис-изомеризацию ретиналя, частичный сдвиг протона шиффова основания и из-
изменения в ближайшем белковом окружении. Постепенное снижение энергетических
минимумов вдоль кривой основного состояния и изменение барьера между ними
каждый раз приводит к соответствующему увеличению времени жизни промежу-
промежуточного продукта в фотоцикле Бр. В результате не только достигается общая ста-
стабилизация энергии возбуждения, за счет которого протекает весь цикл, но и обес-
обеспечиваются функционально направленные конформационные перестройки в макро-
молекулярном комплексе ретиналь-опсин. Такой молекулярный механизм возможен
лишь вследствие вполне определенного «устройства» составных частей макромоле-
кулярного комплекса. ?
Переходы между конформационными оостояниями белка регулируются куло-
новскими взаимодействиями в активном центре Бр, включающем шиффово основа-
основание и его ближайшее окружение. Напомним, что в конформации Е протон шиффова
основания связан с Асп 85 и, соответственно, с периплазматическим каналом. В ре-
результате фотоизомеризации происходит перестройка активного центра и переход
белка в конформацию С. Здесь уже шиффово основание связано с цитоплазмати-
ческим каналом и готово к приему протона от Асп 96. Интересно, что переходы
между Е- и С-конформациями могут происходить и без освещения в мутантах,
§ 3. Первичный акт фотопревращений бактериородопсина 405
где Асп 85 заменен на нейтральный аспарагин (Асн 85), и где депротонирование
шиффова основания осуществляется в темноте при увеличении рН.
Очевидно, фотоизомеризация ретиналя является тем триггером, который ис-
исходно вызывает соответствующие электростатические взаимодействия в активном
центре Бр. Последние уже непосредственно регулируют каскад конформационных
изменений белка, необходимых для переноса протона. Таким образом принцип
электронно-конформационных взаимодействий справедлив и в случае Бр.
Молекулярная динамика фотоцикла. В литераторе накоплен большой экспери-
экспериментальный материал, частично рассмотренный выше, который показывает, какие
изменения в расположении отдельных молекулярных групп белкового окружения
ретиналя сопровождают фотопревращения Бр.
Результаты по численному моделированию молекулярной динамики (гл. XI, § 3)
иллюстрируют кооперативный характер конформационных движений белка в фо-
фотоцикле Бр (Шултен). Оказалось, что спектральный сдвиг 570 —> 625 нм, сопрово-
сопровождающий образование фотопродукта 3§ъь > вызван поляризацией белковой матрицы
за 500 фс под действием измененного дипольного момента возбужденного ретиналя.
Сама по себе изомеризация по Сц—Сц связи ретиналя не дает вклада в спек-
спектральный сдвиг, а служит только триггерным механизмом для его осуществления.
Это аналогично действию электрического поля в темноте на модельные пленки Бр,
вызывающему спектральные эффекты за счет поляризационных перестроек макро-
молекулярных компонентов Бр (§4).
В исходном состоянии в Бр происходит образование водородной связи между
шиффовым основанием и молекулой воды, которая служит мостиком для протона
на Асп 85. После переноса протона к Асп 85 нарушается связь шиффова основания
с водой, что дает возможность ретиналю завершить транс-13-цис-изомеризацию.
Одновременно изменяется и ориентация атома азота основания, так что он стано-
становится направленным в сторону остатка Асп 96 для принятия от него протона при
последующем репротонировании.
Динамическое моделирование подтвердило также, что превращения интерме-
диата М412 сопряжены с последовательными изменениями конформаций белка и
скелета ретиналя. Оказалось, что здесь также участвуют молекулы воды (три),
связывающие гидроксильные группы Тир 57 и Тир 89, но не Асп 85. Это препят-
препятствует обратному переносу протона от Асп 85 к ретиналю на стадии М412 • На этом
же этапе происходит увеличение наклона G спирали до 60° в сторону от центра Бр,
которое открывает цитоплазматический канал Бр и обеспечивает в него доступ
молекул воды с образованием ее водородной связи с азотом шиффова основания.
Дополнительные молекулы воды, входящие затем в канал, формируют теперь сетку
водородных связей для переноса по ним протона от Асп 96 к ретиналю.
Таким образом, шиффово основание действует как активный переключатель
потока протонов, который за счет транс-цис-поворота разъединяет проводящую
сетку водородных связей между ретиналем и Асп 85 и формирует новую сетку
между ретиналем и Асп 96.
Изменение взаимосвязи внутримолекулярных степеней свободы, определяющих
релаксацию белка, изомеризацию ретиналя, смещение и перенос протона, может
приводить к появлению других фотопродуктов. Так, предполагают, что наблюда-
наблюдаемое при низких температурах преимущественное образование псевдобактериоро-
406
Глава XXIX. Фотопревращения бактериородопсина и родопсина
допсина вместо формы -К"бю происходит, когда этот переход не сопровождается
одновременной релаксацией «замороженной» белковой части Бр. Остается неясным,
насколько полно в этих условиях может осуществляться изомеризация самого ре-
тиналя, которая и при комнатной температуре проходит быстрее, чем в растворах,
вследствие влияния специфического белкового микроокружения.
§ 4. Модельные системы, содержащие бактериородопсин
В экспериментальных исследованиях принципов функционирования Бр широкое
применение нашли разнообразные модельные системы и особенно пленки ПМ. На
этих объектах изучают преобразование световой энергии в электростатическую
энергию разделенных зарядов и энергию поляризации макромолекулярных компо-
компонентов Бр. Найдено, что внешнее электрическое поле напряженностью 107 В • м,
0,025 -
-0,025 -
Рис. XXIX. 10.
Дифференциальный спектр изменений
поглощения бактериородопсина, инду-
индуцированных электрическими полями A)
и светом при —190° С B) (Borisevitch G.
et al., 1977).
приложенное в темноте при комнатной температуре к пленке ПМ, вызывает обра-
обратимые изменения спектра поглощения Бр. Соответствующий дифференциальный
спектр указывает на длинноволновый сдвиг полосы поглощения Бр под влияни-
влиянием электрического поля и характеризуется отрицательной полосой в области 430-
580 нм со слабо выраженной структурой и интенсивной широкой положительной
полосой с максимумом около 630 нм (рис. XXIX. 10). Полученное электроиндуциро-
ванное состояние Бр спектрально подобно первому продукту (батоформа) нормаль-
нормального цикла фотопревращений Бр, обнаруженному при низких температурах.
Кинетика нарастания и релаксации электроиндуцированных спектральных из-
изменений носит двухкомпонентный характер — начальные быстрые фазы сменяются
медленными изменениями в секундном диапазоне. Вместе с тем, в отличие от фото-
индуцированной батоформы электроиндуцированныи батопродукт не дает начало
§ 4. Модельные системы, содержащие бактериородопсин 407
циклу дальнейших темновых превращений Бр. Возможно, что электрическое поле
изменяет распределение электронной плотности в молекуле Бр аналогично тому,
как это происходит при световой активации, что и проявляется в длинноволновом
сдвиге полосы поглощения.
\—? Существование медленных компонентов в кинетике электроиндуцированных
сигналов свидетельствует об одновременном протекании процессов диэлектри-
диэлектрической поляризации, в которые вовлекаются относительно малоподвижные элемен-
элементы структуры макромолекулярного комплекса Бр. Электроиндуцированный бато-
хромный сдвиг в Бр существенно ингибируется при понижении температуры уже
до —20° С. Это и означает, что внешнее электрическое поле действует на ретиналь,
главным образом возбуждая в опсине конформационные перестройки, формирую-
формирующие эффективное реакционное поле в микроокружении ретиналя. ?
Трансмембранное электрическое поле способно, по-видимому, и изменять вели-
величину рК аминокислотных остатков, участвующих в транспорте Н+, и, возможно,
самого шиффова основания. Однако в Бр дикого типа основание Шиффа имеет
очень высокое сродство к протону (рК ~ 13), и изменение рК во внешнем элек-
электрическом поле порядка 107 В/м не приводит к его депротонированию. Поэтому
эффект появления максимума при 630 нм вызван в основном поляризационными
перестройками белка, а также, возможно, протонированием остатка Асп 85 от
протонов, находящихся в периплазматическом канале и не связанных с шиффовым
основанием. Однако в некоторых мутантах, где Асп 85 заменен на нейтральный
Асн, основание Шиффа имеет гораздо меньшую аффинность к протону (рК ~ 8-9)
вследствие нарушения баланса зарядов в акцепторном сегменте. В таких мутантах
электрическое поле индуцирует в темноте переход в форму с депротонированным
основанием Шиффа. Причем эффект имеет выраженный векторный характер и про-
проявляется при отрицательном потенциале на периплазматическои стороне мембраны
мутантного штамма, т. е. в условиях, когда поле стимулирует перенос протона от
основания Шиффа в акцепторный участок канала к Асп 212 (рис. XXIX.6).
Эксперименты по импульсному фотовозбуждению пленки ПМ в присутствии
внешнего электрического поля показывают, что количество молекул Бр, вовлечен-
вовлеченных в этих условиях в цикл фотопревращений, уменьшается примерно на 30%.
Таким образом, если в нормальных условиях в клетке произойдет повышение транс-
трансмембранной разности потенциалов до определенной величины, то это приведет к
снижению количества молекул Бр, вовлекающихся в фотоцикл. В результате созда-
создается препятствие для дальнейшего увеличения фотоиндуцированного потенциала
на мембране, что может быть важно с точки зрения сохранения ее целостности.
Внешнее электрическое поле способно влиять на фотоиндуцированные процес-
процессы в пленке ПМ не только на начальных стадиях фотоцикла. Важным проявлением
этого является электростимуляция образования ключевого промежуточного про-
продукта фотоцикла Бр — формы М±\2-
В темноте электрическое поле не вызывает изменений в полосе поглоще-
поглощения М412- Однако включение электрического поля на фоне сине-зеленого света,
вызывающего переход Бр570 —> М412, приводит к существенному увеличению
стационарной концентрации формы М412 (рис. XXIX.11). Проявление эффекта
электростимуляции не зависит от последовательности включения света и поля.
408
Глава XXIX. Фотопревращения бактериородопсина и родопсина
Приложение электрического поля не вызывает изменения кинетики фотоин-
дуцированного образования формы М, однако наблюдается заметное торможение
распада этой формы, ведущего к регенерации исходного Бр. Этим, видимо, и опре-
определяется сдвиг равновесия в сторону накопления промежуточного продукта на све-
свету в присутствии поля.
420 нм
630 нм
Рис. XXIX. 11.
Кинетика электро- и фотоиндуцированных изменений поглощения Бр при 420, 570
и 630 нм в воздушно-сухих пленках ПМ. Зигзагообразными стрелками отмечено
включение (вверх) и выключение (вниз) электрического поля B х 107 В • м),
прямыми стрелками — включение и выключение постоянного действующего света
C80 нм < X < 580 нм; 80 Вт • м~2); 1 —темновые изменения под влиянием поля, 2 —
электроиндуцированные изменения на фоне действующего света, 3 — фотоиндуци-
рованные изменения на фоне приложенного поля (Lukashev E. et al., 1980).
Следует отметить, что электроиндуцированные изменения поглощения Бр в
темноте (при 630 нм) и на свету (при 420 нм; рис. XXIX.11) характеризуются
практически одной и той же кинетикой нарастания и спада сигнала с медленными
компонентами в секундном диапазоне.
Торможение распада формы М412 и увеличение ее концентрации, по-видимому,
обусловлено необходимостью преодолеть дополнительный энергетический барьер
при перемещении протона на этой стадии фотоцикла от первичного донора Асп 96
к депротонированному основанию Шиффа (рис. XXIX.6). Эффект носит векторный
§ 4. Модельные системы, содержащие бактериородопсин 409
характер и наблюдается в том случае, если к цитоплазматической стороне ПМ при-
приложен отрицательный потенциал, препятствующий движению протона от Асп 96 к
ретиналю. В поле противоположного знака, ускоряющего движение протона, следу-
следует ожидать уменьшение стационарной концентрации продукта М412 на свету из-за
ускорения его распада. Экспериментальное подтверждение этого было получено на
пленках пурпурных мембран с высокой степенью ориентации.
^—р Можно предположить существование молекулярного механизма регуляции фо-
топревращений Бр, который зависит от электрического поля и действует по
принципу отрицательной обратной связи. На стадии -К"взо регуляция осуществля-
осуществляется посредством управления фондом потенциально активных макромолекул Бр.
Далее на этапе образования М412 регулируется скорость превращений тех моле-
молекул Бр, которые уже вовлечены в фотоцикл. В физиологических условиях такой
механизм может поддерживать протонный градиент в ПМ на уровне, соответству-
соответствующем энергетическим потребностям клетки. Это обеспечивается за счет уменьше-
уменьшения скорости превращения Бр на завершающей стадии (переход формы М в исход-
исходное состояние) в случае нежелательного возрастания напряженности мембранного
электрического поля, не компенсированного другими факторами.
Торможение перехода М -* Бр в электрическом поле следует, вероятно, свя-
связывать с уменьшением эффективности (увеличение энергии активации) взаимодей-
взаимодействия депротонированного шиффова основания с протон-донорными группами ами-
аминокислотных остатков, формирующих протонный канал в макромолекуле Бр. ?
Диэлектрическая поляризация и конформационные перегруппировки в место-
местоположении ретиналя проявляются в возникновении электрического потенциала меж-
между поверхностями пленки ПМ при ее освещении.
На искусственных лецитиновых мембранах, содержащих ориентированные ПМ,
при возбуждении коротким лазерным импульсом A0 не) зарегистрирован фото-
фотопотенциал значением около 100 мВ (В. П. Скулачев). Первая быстрая фаза нара-
нарастания потенциала (т < 200 не) отрицательна по знаку и обусловлена изменением
дипольного момента возбужденного ретиналя. Остальные стадии с временами от
десятков микросекунд и больше положительны по знаку и отражают уже процесс
транслокации протона через мембрану.
На сухих пленках ПМ, обладающих высокой степенью ориентации мембран, по-
получены фотопотенциалы до нескольких вольт. Кинетика медленных стадий генера-
генерации и разрядки фотопотенциала и кинетика образования и распада промежуточной
формы М фотоцикла Бр имеют близкий характер. Этот результат подтверждает
представление о том, что прохождение стадии М в фотоцикле Бр, контролируемое
электрическим полем, отражает конформационные поляризационные перестройки
макромолекулярного ПБК в процессе его фотопревращений.
Применение в биотехнологии. Своеобразное сочетание фотохромных и фото-
фотоэлектрических свойств пленок ПМ, содержащих Бр, делает этот белок перспек-
перспективным материалом в биотехнических быстродействующих устройствах записи,
хранения и считывания информации. Развитие этой области, получившей назва-
название нанобиология, основано на использовании механизмов быстрого преобразова-
преобразования энергии света в макромолекулярных фоточувствительных комплексах белок-
хромофор (белок-хлорофилл, белок-ретиналь).
410 Глава XXIX. Фотопревращения бактериородопсина и родопсина
В перспективе намечается создание нанобиомолекулярных компьютеров, эле-
элементы которых будут отличаться чрезвычайно малыми габаритами (нанометры) и
высокими скоростями обработки информации.
Посмотрим, каким образом можно использовать Бр для этих целей. Фотоцикл
Бр сопровождается возникновением и сменой хорошо разрешаемых спектральных
максимумов поглощения (рис. XXIX. 5), причем продукты фотоцикла (формы Бр)
сами обладают светочувствительностью и способны изменять свое состояние и
спектральные свойства при дополнительном освещении. Например, образованная
под действием желтого E70 нм) света форма М412 может под действием синего
света регенерировать в исходное состояние Бр570.
Кроме того, при переходе Бр570 -* М412 под действием желтого света в су-
сухих пленках ориентированных ПМ может возникать фотопотенциал до нескольких
вольт в результате смещения протона от шиффова основания к первичному акцеп-
акцептору Асп 85. Этот фотоэлектрический сигнал может быстро уменьшаться при осве-
освещении синим светом, индуцирующим обратное движение протона и регенерацию
М412 к исходному состоянию Бр570 как при комнатной, так и при низких темпера-
температурах. Такой эффект связан с обратимостью перехода Бр из исходного состояния
в относительно стабильный интермедиат фотоцикла М^п- Имеется возможность
увеличения времени жизни данного продукта различными способами: путем пони-
понижения температуры и степени гидратации, химической модификации, замены рети-
наля синтетическими аналогами, а также в результате направленного мутагенеза.
Все это и является основой для использования пленок ПМ в качестве перспективного
материала для записи, хранения и обработки оптической информации. Информация
будет записана при воздействии на Бр желтым светом, и может считываться путем
регистрации соответствующего электрического сигнала на ПМ, т. е. способом, не
разрушающим сделанную запись. Стирание этой записи осуществляется при облу-
облучении пленок синим светом и возвращении в исходное состояние Бр570.
На тонких пленках ориентированных ПМ (толщиной менее 50 нм) можно до-
достичь разрешения между активными элементами памяти в 60 А (расстояние между
центрами тримеров Бр в структуре ПМ), а возможно, и 30 А (расстояние между
отдельными молекулами Бр в тримере). Техническая проблема состоит в том, как
электрическим путем считывать информацию, записанную оптическим способом,
с таким же высоким разрешением.
§ 5. Молекулярные основы зрительной рецепции. Зрительные клетки (палочки)
Способность рецепторных клеток сетчатки глаза реагировать на изменение свето-
светового потока лежит в основе зрительного восприятия позвоночных и беспозвоночных
животных. Процесс трансформации энергии света в фоторецепторный сигнал у
позвоночных происходит в светочувствительных клетках сетчатки — палочках и
колбочках. Палочки обеспечивают сумеречное зрение. Наиболее подробно молеку-
молекулярные и мембранные механизмы зрительной рецепции изучены в палочках позво-
позвоночных. Палочка способна генерировать зрительный сигнал в ответ на поглощение
одного кванта. На рис. XXIX. 12 приведена схема палочки.
Наружный сегмент палочки состоит из стопки многочисленных дисков, рас-
расположенных перпендикулярно длинной оси клетки. Например, палочка лягушки
5. Молекулярные основы зрительной рецепции. Зрительные клетки (папочки)
411
н
о
:диски
плазматическая мембрана
- цитоплазматическое
пространство
пространство
между дисками
реснички
митохондрия
- аппарат Гольджи
эндоплазматический
ретикулум
ядро
. синаптическое
окончание
Рис. XXIX.12.
Строение зрительной клетки позвоночных
(по L. Stryer, 1987). Подробные объяснения
в тексте
412
Глава XXIX. Фотопревращения бактериородопсина и родопсина
достигает 60 мкм в длину, 6-8 мкм в диаметре, а ее наружный сегмент содержит
1000-1500 дисков. Диск толщиной 15-16 нм образован двумя соединенными по краям
мембранами толщиной около 7 нм. Внутреннее расстояние между почти прилегаю-
прилегающими друг к другу мембранами не более 1,5-2,0 нм. Основной молекулярной фото-
фоточувствительной структурой зрительной клетки является фоторецепторная мембра-
мембрана дисков. В ее фосфолипидном бислое встроены молекулы зрительного пигмента
родопсина, который по своей структуре во многом сходен с бактериородопсином.
Ниже мы подробно рассмотрим фотохимические свойства и превращения родопси-
родопсина, а сейчас остановимся на основных процессах, ведущих к появлению зрительного
сигнала в палочке позвоночных.
Рис. XXIX. 13.
Структурные формулы полностью транс-ретиналя (/) и 11-цис-ретиналя
В темноте ретиналь-хромофор родопсина находится в 11-цис-положении. По-
Поглощение кванта света переводит его в транс-состояние (рис. XXIX. 13). Фотоизоме-
Фотоизомеризация ретиналя и дает начало последовательности событий, ведущих к появлению
зрительного пигмента. Мембрана палочки обладает селективной проницаемостью
для разных ионов. В состоянии покоя это приводит к поляризации мембраны и
созданию разности потенциалов между протоплазмой палочки и наружной средой
(—40 мВ). Освещение палочки вызывает увеличение исходного отрицательного по-
потенциала внутри клетки, т.е. гиперполяризацию клеточной мембраны (до —80 мВ).
Это происходит вследствие того, что под действием света резко уменьшается про-
проницаемость клеточной мембраны для ионов натрия, несущих положительный заряд.
Поглощение только одного кванта приводит к закрытию 100-300 натриевых каналов
в наружной мембране. Возникающий светоиндуцированный электрический сигнал
гиперполяризации передается от наружного сегмента к синаптическому окончанию
на внутреннем сегменте палочки и приводит к появлению нервного импульса. Таким
образом, в основе нейрофизиологического зрительного сигнала лежит индуцирован-
индуцированное фотоизомеризацией ретиналя изменение проницаемости наружной мембраны
палочки для ионов натрия.
Очевидно, фотоизомеризация ретиналя в мембране дисков может приводить к
закрытию натриевых каналов во внешней мембране палочки лишь при участии боль-
большого числа (более 100) молекул особого внутриклеточного медиатора (посредника),
находящихся в цитоплазме наружного сегмента.
Первоначальная гипотеза относительно природы этого посредника отводила
его роль ионам Са. Согласно «кальциевой гипотезе», в ответ на действие света ионы
Са выбрасываются изнутри фоторецепторных дисков в цитоплазму наружного сег-
сегмента, диффундируют к плазматической мембране и блокируют в ней Na -каналы.
§ 5. Молекулярные основы зрительной рецепции. Зрительные клетки (папочки) 413
В темноте же Са + активно «закачивается» из цитоплазмы снова внутрь дисков.
Однако опыты Фесенко A985) показали, что проводимость наружной мембраны
" /~i 24- "
палочки не изменяется под действием Са , который, следовательно, не является
клеточным медиатором в процессе зрительной рецепции. В то же время оказалось,
что циклический нуклеотид цГМФ C', 5'-циклический гуанозин-монофосфат ) спо-
способен непосредственно открывать натриевые каналы мембраны палочек. В темно-
адаптированном рецепторе концентрация цГМФ в цитоплазме наружного сегмента
весьма велика, поэтому очевидно, что циклический нуклеотид цГМФ в темноте под-
поддерживает Ма+-каналы в открытом состоянии. Если происходит гидролиз цГМФ
(под действием фермента фосфодиэстеразы ФДЕ), то концентрация цГМФ резко
падает, а натриевые каналы переходят в закрытое состояние.
Именно на этом основана роль цГМФ как клеточного медиатора. Изменение
его концентрации в наружном сегменте регулирует состояние Na -каналов внеш-
внешней мембраны и, как следствие, величину трансмембранного электрического по-
потенциала палочки. Между световым возбуждением родопсина и гидролизом цГМФ
фосфодиэстеразой существует сложная многоступенчатая функциональная связь,
природа которой установлена в конце 30-х годов благодаря работам целого ряда
лабораторий. Было показано, что на свету в наружном сегменте действительно
резко уменьшается уровень цГМФ при одновременной активации нескольких сот
молекул фермента ФДЕ. Для этого требуется присутствие также ГТФ, как источ-
источника энергии. Фактором, связывающим ГТФ в клетке, является особый G-белок
трансдуцин Т, ответственный за активацию ФДЕ. Молекула трансдуцина состоит
из трех субъединиц а,р,у (Та,|3,т)-
Трансдуцин может также связывать ГДФ, но в этом состоянии он не способен
активировать ФДЕ. Переход трансдуцина в активное состояние из неактивного
происходит при обмене ГДФ на ГТФ
Т - ГДФ + ГТФ -* Т - ГТФ + ГДФ.
В образованном комплексе Та>|з>т-ГТФ отщепляется активная а-субъединица транс-
трансдуцина Та и связанная с ней молекула ГТФ. Отделенный от Та>|з>т комплекс Т-ГТФ
в свою очередь активирует фермент ФДЕ. Активация ФДЕ также основана на
разной функциональной роли субъединиц а,C,у5 входящих в состав молекулы фер-
фермента, из которых у-субъединица подавляет активность ФДЕ. Именно отщепление
у-субъединицы, ингибирующей фермент, приводит его в активное состояние.
Сложная последовательность реакций запускается при фотоизомеризации ре-
тиналя в родопсине и переводе родопсина R в активированное состояние R*. Акти-
Активированный родопсин мигрирует латерально в фоторецепторной мембране, обла-
обладающей крайне низкой вязкостью, и образует комплекс с трансдуцином
R* + Т-ГДФ -* 1Г-Т-ГДФ,
в которой затем ГДФ замещается на ГТФ
1Г-Та>|з,т-ГДФ + ГТФ -* 11*-Та>|з,т-ГТФ + ГДФ,
с последующей его диссоциацией
1Г-Та,р,т-ГТФ - R* + Тр>т + Та-ГТФ.
414
Глава XXIX. Фотопревращения бактериородопсина и родопсина
Фрагмент Т-ГТФ и активирует непосредственно ФДЕ, «отбирая» у нее усубъеди-
ницу
Та-ГДФ + ФДЕ(а,р,у) - ФДЕ(а,р) +Та-ГДФ-ФДЕт.
Последовательность этих событий представлена на рис. XXIX. 14.
II
ФДЕ
фотон
ФДЕ
i l : i~ , т
IV 5ТМФ
- цГМФ
ъ
• ¦
ft Т<х-ГТФ-<!
PDEap'L
ВДЕу
гидролиз ГТФ
инактивация родопсина
регенерация родопсина
{ родопсин* | ~
1
'/
>
III
I, \ ,-,
':' \ i
Рис. XXIX. 14.
Каскад реакций, лежащих в основе зрительной рецепции (по L. Stryer, 1987)
I — поглощение кванта света активирует родопсин R*, который затем реагирует с белком-
трансдуцином Т; II — происходит замена ГДФ на ГТФ в a-субъединице Та трансдуцина; III — от-
отщепленная Та—ГТФ активирует фосфодиэстеразу ФДЕ, отщепляя ее у-субъединицу, IV — активи-
активированная ФДЕ гидролизует тысячи молекул цГМФ. Через некоторое время ГТФ в а-субъединице
Та расщепляется и превращается в ГДФ, Та—ГДФ присоединяется к Трт. Трансдуцин и ФДЕ
восстанавливаются. Родопсин R* инактивируется и регенерирует в исходное состояние.
Центральное место в этом каскаде реакций занимает стадия IV (рис. XXIX.14),
где возникает эффект многократного усиления действия кванта света за счет того,
что одна активная молекула ФДЕ(а,C) гидролизует тысячи молекул цГМФ.
Регенерация активированного родопсина R* осуществляется в ходе последо-
последовательных реакций его фосфорилирования родопсин-киназой РК с образованием
R—пФ, где п — число фосфатных групп (n ~ 9). R*— пФ связывается с белком S,
§ 6. Фотохимический цикл родопсина 415
образуя комплекс R* —пФ ¦ S. В этом состоянии уже не происходит дальнейшая акти-
активация G-белка трансдуцина родопсином, который релаксирует из активированного
состояния R*— пФБ -*¦ В° — пФБ. Окончательная репарация родопсина осуществля-
осуществляется через ~ 30 минут после его дефосфорилирования (фосфатазой) и присоедине-
присоединения новой молекулы 11-цис-ретиналя взамен покинувшего родопсин транс-ретиналя:
11 цис
д* Z5- Д*-пФ -Д- Л*-пФ5 —> Л°-пФ —> В0 —> R
\
транс
Обращает на себя внимание сходство приведенной последовательности событий
с общей схемой гормональной рецепции (гл. XXVI), протекающей с участием сиг-
сигнальных G-белков, к классу которых принадлежит и трансдуцин. Этапу связывания
гормона с мембранным рецептором и активации G-белка с появлением фрагмента
С?а-ГТФ соответствует возбуждение родопсина и перевод трансдуцина в активное
состояние Га-ГТФ.
В обоях случаях активные а-субъединицы G-белков (С?а-ГТФ и Га-ГДФ) в свою
очередь активируют соответствующие ферменты (аденилатциклаза и фосфодиэсте-
раза), которые уже модифицируют молекулы клеточных медиаторов сигнала рецеп-
рецепции. Роль последних выполняют циклические нуклеотиды: цАМФ в гормональной
рецепции, цГМФ в зрительной рецепции.
Такова основная схема биохимических превращений, лежащих в основе зри-
зрительной рецепции. С точки зрения биофизики, центральное место здесь занимает
механизм активации родопсина при поглощении кванта света и фотоизомеризации.
В основе этого процесса лежат фотохимические превращения, или фотохимический
цикл родопсина.
§ 6. Фотохимический цикл родопсина
Родопсин. Фоторецепторная мембрана образована фосфолипидным бислоем, в ко-
который встроены молекулы зрительного пигмента родопсина. Вследствие крайне
низкой вязкости фоторецепторной мембраны молекула родопсина испытывает в ней
быструю вращательную и более медленную латеральную диффузию. Родопсин —
хромопротеин с молекулярной массой порядка 40000. Больший гидрофобный фраг-
фрагмент молекулы (около 26 000) находится внутри рецепторной мембраны. В этом от-
отношении родопсин напоминает Бр, однако в отличие от последнего он еще содержит
меньший гидрофильный фрагмент A2000) с С-концевым участком в гидрофильной
области и на поверхности мембраны. Как и в случае Бр, хромофором родопсина
служит ретиналь, представляющий собой половину молекулы C-каротина. Из всех
изомеров этой сопряженной полиеновой структуры только 11-цис-форма является
хромофором всех известных зрительных пигментов (рис. XXIX.11). В некоторых
условиях может образовываться так называемый изородопсин, хромофор которо-
которого представляет собой не 11-цис-, а 9-цис-ретиналь. Полипептидная цепь опсина
содержит около 400 аминокислот, половина из которых — гидрофобные. Ковалент-
ная связь ретиналя с опсином осуществляется при образовании альдиминнои связи
416
Глава XXIX. Фотопревращения бактериородопсина и родопсина
между s-аминогруппой лизина (Лиз-296) и альдегидной группой ретиналя. Эта аль-
диминная связь протонирована и представляет собой протонированное шиффово
основание
Ретиналь — С = N+ — опсин (лиз 296),
I I
Н Н
находящееся в опсине в гидрофобном окружении.
Рис. XXIX.15.
Схема расположения ре-
ретиналя в зрительном бел-
белке опсине (по Li Tang et
al., 1995). Латинские бу-
буквы соответствуют при-
принятым в биохимии на-
названиям аминокислот. На
светлом поле обозначены
аминокислоты, обращен-
обращенные к плоскости рисунка.
На рис. XXIX. 15 показана схема строения зрительного белка опсина, состоя-
состоящего из семи а-спиралей. Спирали II, III и IV близко расположены друг к другу.
Гли 90 (G-90) в спирали II и Глю 113 (Е 113) в спирали III находятся близко к
шиффову основанию и эффективно взаимодействуют с ним. Спирали IV, V и VI
расположены близко к C-иононовому кольцу хромофора. Отрицательно заряженный
остаток Глю 113 является противоионом положительно заряженного протониро-
ванного шиффова основания в зрительных пигментах различных позвоночных жи-
животных. Он расположен близко (~ 3 А) к атому Ci2 ретиналя. Однако, в отличие
i 6. Фотохимический цикл родопсина
417
от Бр (см. §1), водородная связь между протонированым шиффовым основанием
и противоионом в родопсине не является слабой. Она близка по своим свойствам к
водородный связям в модельных системах, содержащих ионы С1~ в качестве про-
тивоионов. По-видимому, величина батохромного сдвига в родопсине определяется
взаимодействием с отрицательным противоионом, которое стабилизирует положи-
положительный заряд около атома азота, а также влиянием иононового кольца, связанного
с полиеновой цепью в области 6-5-цис-связи ретиналя.
Гипсородопсин D30)
Изородопсин D85)
(9 цис) >
~~Метародопсин / D78)
(транс)
1 мкс J-H" | | -Н+ 100-Ю0 о
-15°С
^Метародопсин // C80)
Метародопсин /// D65)
N -Ретинилиденопсин D40)
(кислый)
(Ретиналь-изомераэа)
- Транс-ретиналь C87) + О псин
Рис. XXIX.16.
Фотолиз родопсина
Е^М-Ретинилиденопси„(Зб5) Волнистыми стрелками обо-
+н (щелочной) ^
значены фотореакции, сплош-
сплошными — темновые переходы,
остальные объяснения см. в
тексте.
Фотолиз родопсина. Фотопревращения родопсина запускаются в результате
поглощения видимого света. При этом происходит обесцвечивание родопсина и
сдвиг максимума в спектре поглощения хромофора с 500 нм в коротковолновую
область. В то же время положение полосы поглощения при 278 нм, принадлежащей
опсину, и ее интенсивность остаются практически неизменными.
В исходном состоянии в родопсине ретиналь находится в 11-цис, 12-в-цис-кон-
фигурации. В результате фотолиза происходит цис-транс-изомеризация хромофора
и депротонирование шиффова основания. Эти процессы сопровождаются измене-
изменением взаимодействия ретиналя с опсином и конформации последнего. На конечной
стадии разрывается альдиминная связь и высвобождается свободный ретиналь в
транс-конфигурации. На рис. XXIX. 16 приведена схема фотолиза родопсина, где
отмечены максимумы спектров поглощения промежуточных продуктов, темпера-
температуры, выше которых начинается переход к следующему продукту фотолиза, харак-
характерные времена отдельных стадий при комнатной температуре.
418 Глава XXIX. Фотопревращения бактериородопсина и родопсина
Изородопсин, содержащий 9-цис-ретиналь, легко получается в качестве побоч-
побочного продукта процесса фотолиза: родопсин ** батородопсин ** изородопсин, но
в рецепторах позвоночных или беспозвоночных он не обнаружен. Как видно, ста-
стадии фотолиза до метародопсина II при комнатной температуре протекают суще-
существенно быстрее, чем последующие превращения. Именно быстрые стадии вплоть
до метародопсина Л относятся непосредственно к фоторецепторному акту — акту
трансдукции.
\—? Наибольший физиологический интерес представляет переход метародопсина /
D78 нм) в метародопсин II C80 нм). «Синий» сдвиг максимума поглощения
метародопсина Л до 380 нм означает, что на этой стадии шиффово основание уже
полностью депротонировано. На стадии образования метародопсина II фосфолипи-
ды, ранее тесно связанные с опсином, могут быть экстрагированы, а опсин частично
фосфорилируется, пептидные и SH-группы белка становятся доступными действию
внешних агентов; появляются дополнительно титруемые SH-группы; увеличивается
объем, занимаемый липидным окружением опсина. Все это указывает на некоторое
разрыхление третичной структуры белка при сохранении его вторичной структу-
структуры. В самой фоторецепторной мембране вследствие изменения белок-липидных вза-
взаимодействий увеличивается микровязкость гидрофобного окружения спин-зонда,
погруженного в фоторецепторную мембрану. ?
Огромное количество ненасыщенных жирных кислот в наружном сегменте и
высокий уровень потребления кислорода создают опасность фотоокисления липи-
дов (см. гл. XVI) при поглощении света родопсином. Защита осуществляется систе-
системой антиоксидантов (а-токоферол), препятствующих развитию процессов перекис-
ного окисления в сетчатке глаза.
Распад образовавшегося в ходе фотолиза метародопсина II может идти либо
через образование метародопсина III с его последующей деградацией, либо бла-
благодаря прямому гидролизу с появлением конечного продукта — свободного транс-
ретиналя.
Восстановление родопсина может происходить на свету (фотореактивация)
практически из любого промежуточного продукта фотолиза, включая метародоп-
метародопсин Л (рис. XXIX.16). Однако физиологическое значение имеет темновая реизо-
меризация свободного полностью транс-ретиналя в 11-цис-конфигурацию и, как
следствие, биохимическая регенерация родопсина.
Структурные перестройки родопсина. Фотоцикл родопсина сопровождается
структурными перестройками как в скелете ретиналя, так и в его ближайшем бел-
белковом окружении. В последние годы получены данные, позволяющие связать эти пе-
перестройки с функциональной активностью промежуточных продуктов фотоцикла.
Первый батоинтермедиат фотоцикла содержит ретиналь в скрученной 11-транс-15-
анти-конформации, образование которой сопровождается тесным взаимодействием
с белком, включая противоион Глю 113 вблизи Ci2-
Спектральные измерения высокого временного разрешения показали, что про-
процесс превращения бато- в люмиродопсин включает промежуточный продукт, ко-
который поглощает в более синей области около 477 нм и, соответственно, поэтому
получил свое название BSI (blue-shifted):
„ 74 не. г,г,т 105 не
-* Ъато <1П_ ' ВЫ > люми -* .
543 нм 1ит нс 497 нм
§ 6. Фотохимический цикл родопсина 419
Изучая изменение линейного дихроизма главной полосы поглощения при фотолизе
родопсина, удалось определить характер движения хромофора на этих этапах фо-
фотоцикла. Угол, образованный хромофором с плоскостью мембраны, увеличивается
от 16° до 24° с появлением бато-продукта.
Однако при образовании BSI этот угол опять уменьшается до 5°, а хромо-
хромофор возвращается к плоскостному расположению в родопсине. В люми-продукте
хромофор вновь выходит из плоскости мембраны A6°).
Барьер превращения бато- в В5/-продукт связан с необходимостью движения
атома водорода 8—Н мимо метильной группы 5—СНз. Особое значение имеет также
движение метильной группы в положении С13.
В отличие от продукта мета /, который фиксируется при низких температурах
(рис. XXIX.16), BSI проявляет свое присутствие при физиологических темпера-
температурах.
В состоянии люми происходит релаксация скрученных частей скелета хромо-
хромофора. Группа C=N попадает в среду, где водородные связи становятся очень сла-
слабыми, что предшествует последующему депротонированию шиффова основания.
В мета / продукте водородная связь протона шиффова основания становится еще
слабее, так что противоион Глю 113 протонируется. В то же время аминокислота
Глю 122 депротонируется, образуя тем самым новый противоион.
Физиологически активное состояние родопсина представлено продуктом ме-
мета Л, который активирует трансдуцин. В этом состоянии шиффово основание де-
протонировано. Поскольку депротонирование шиффова основания в мета // не со-
сопровождается выбросом протонов, в родопсине должен существовать внутренний
акцептор протона (противоион Глю 113). Вместе с тем из внешней среды фоторе-
цепторным диском в мета // поглощаются дополнительно два протона.
После замены Глю 134 на Глн в мутантах поглощение протонов извне прекра-
прекращается, что делает Глю 134 их вероятным акцептором. Остаток Глю 134 находится
в спирали III на границе с цитоплазмой.
Наиболее интересные данные, касающиеся природы активированного состоя-
состояния мета Л, связаны с существованием мутантов родопсина, не содержащих рети-
наль, которые могут активировать трансдуцин в темноте.
В этих мутантах отрицательно заряженный противоион Глю 113 был заменен
на нейтральный Глн или неполярный Ала. Способность активировать в темноте
трансдуцин проявлялась в них в отсутствии ретиналя. Однако в таких мутантах
присоединение 11-цис ретиналя к родопсину мешало их активности в темноте и
вновь делало их светочувствительными. Напомним, что в состоянии мета II депро-
тонированное шиффово основание и протонированный противоион Глю 113 стано-
становятся одновременно электронейтральными. Отсюда было сделано предположение,
что в нормальных физиологических условиях активность родопсина непосредствен-
непосредственно обусловлена нейтрализацией противоиона Глю 113 при протонировании его бо-
боковой цепи и, как следствие, разрывом солевого мостика между Глю 113 и Лиз 296.
С этой точки зрения можно было бы ожидать также и спонтанного темново-
го восстановления Глю 113 от внутренних источников протонов помимо шиффова
основания. Это привело бы к непредусмотренной активации трансдуцина в темно-
темноте. Предотвращение этого эффекта и достигается присутствием ретиналя, кото-
который в состоянии 11-цис является, кроме того, стерическим антогонистом темновой
420 Глава XXIX. Фотопревращения бактериородопсина и родопсина
активации родопсина. На свету полностью транс-ретиналь включает электриче-
электрический механизм активации родопсина, что сопровождается соответствующими кон-
формационными перестройками белка. Однако в темноте 11-цис-ретиналь за счет
стерических ограничений препятствует конформационным перестройкам белка, не-
необходимым для активирования родопсина.
Таким образом, само по себе депротонирование шиффова основания не является
необходимым для процесса активации родопсина, а служит лишь механизмом его
электростатического включения.
Основным фактором здесь является нейтрализация заряда боковой цепи
Глю 113. Ретиналь, переходя в состояние полностью-транс, запускает этот процесс,
а в темноте в 11-цис форма препятствует «стерически» любым конформационным
перестройкам белка, ведущим к активации родопсина. Существуют однако и
другие факторы, определяющие характер связывания активного родопсина с
трансдуцином. Они включают положения спиралей III и IV в состоянии мета II,
стабилизированное дисульфидными связями между ними на внешней поверхности
фоторецептора.
Большую роль в образовании связи с трансдуцином играет и взаимодействие
C-иононового кольца и метильной группы 9—СНз полностью транс-ретиналя с ами-
аминокислотными остатками на поверхности спиралей III, IV. Так, освещение зри-
зрительного пигмента, содержащего ретиналь без метильной группы 9—СНз (цис-9-
деметилированный ретиналь), приводило к падению активирования им G-белка на
80%. Движение метильной группы 13—СНз влияет на скорость перехода
бато —> BSI -*¦ люми,
которое резко возрастает при удалении этой метильной группы, очевидно, вслед-
вследствие появления свободного объема вблизи ретиналя.
Взаимодействия белок-хромофор около С-13 также важны для достижения не-
необходимой конформации белка на стадии регенерации родопсина и его фосфорили-
рования родопсинкиназой.
§ 7. Первичный акт фотопревращения родопсина
В настоящее время можно считать полностью доказанным, что начальный этап
фотоцикла и образование бато-продукта происходит в результате цис-транс-фото-
изомеризации ретиналя. Однако доказательство этого факта потребовало не только
больших экспериментальных исследований. Необходимо было также достичь теоре-
теоретического понимания механизмов быстрой фотоизомеризации ретиналя в плотной
белковой среде при участии и других молекулярных групп, со скоростями, превыша-
превышающими таковые в модельных растворах с малой вязкостью. Мы остановимся кратко
на развитии этого направления, где имеется много общего с соответствующими
работами в области фотосинтеза и фотопревращений бактериородопсина.
¦\У Цис-транс-фотоизомеризация. Простое сравнение химических конфигураций
родопсина A1-цис) и изородопсина (9-цис) показывает, что их взаимопревра-
взаимопревращение через единственный общий интермедиат батородопсин возможно, если этот
процесс включает цис-транс-фотоизомеризацию. Иными словами, в батородопсине
ретиналь должен находиться в транс-конфигурации, что подтверждено в настоящее
§ 7. Первичный акт фотопревращения родопсина 421
время большим количеством работ. Если исходить из 11-цис-, 12-в-цис-исходной
формы ретиналя, то начальная стадия фотолиза родопсина включает следующие из-
изменения конформации ретиналя: 11-цис, 12-в-цис —> 11-транс, 12-в-цис —> 11-транс,
12-в-транс. П
Цис-транс-изомеризация на стадии образования батородопсина была подтвер-
подтверждена структурными исследованиями, а также данными по круговому дихроиз-
дихроизму, резонансной раман-спектроскопии. Так исследованы фотохимические реакции
синтетических аналогов родопсина, где атомы углерода Сю и С13 в полиеновой
цепи 11-цис-ретиналя были соединены трехуглеродным алкильным мостиком. Такая
модификация не мешала изменениям электронной плотности или смещениям прото-
протона в ретинале, но предотвращала возможность цис-транс-фотоизомеризации около
двойной связи Cn=Ci2. Фотопревращения этого химически модифицированного
родопсина носили уже совсем другой характер по сравнению с нативным родо-
родопсином. Продукты фотохимических реакций резко отличались по своим свойствам
от батородопсина. Они не содержали транс-изомер ретиналя, но образовывались
также в пикосекундном временном диапазоне.
Показано также, что при комнатной температуре батородопсин образуется за
время порядка 3 пс не только из родопсина A1-цис), но и из изородопсина (9-цис)
(Альфано). Это может происходить, только если ретиналь батородопсина нахо-
находится в транс-состоянии, поскольку такая конфигурация является единственной
общей для обоих 9-цис- и 11-цис-изомеров. Аналогичный вывод следует и из транс-
трансформации метародопсина /, который, находясь в полностью транс-конфигурации,
претерпевает фотопревращения в те же самые 11-цис- и 9-цис-изомеры.
Роль протона. Поглощение света и изменение электронного состояния долж-
должно привести к соответствующим молекулярным перестройкам в хромофоре и его
ближайшем белковом окружении. Цис-транс-изомеризация ретиналя может быть
не единственной из таких фотоиндуцированных перестроек. Эти вопросы изучали
методами низкотемпературной спектроскопии, с помощью которых исследовали фо-
фотопереход родопсин -* батородопсин. Применение абсорбционного флеш-фотолиза с
пикосекундным лазерным возбуждением позволило измерить скорость этой реакции
в широкой области температур. Оказалось, что при комнатной температуре время
образования батородопсина < 6 пс, а при 4 К оно составляет 36 пс (Рентцепис). Кри-
Кривая зависимости константы скорости от температуры носит двухфазный характер
и, кроме того, обнаруживает явно выраженный изотопный эффект уменьшения
(в 7 раз) скорости реакции при дейтерировании (рис. XXIX. 17).
Очевидно, изменение состояния протона осуществляется на ранней стадии
фотолиза, которая, таким образом, не может быть сведена лишь к обычной
цис-транс-изомеризации ретиналя. Действительно, методами резонансной раман-
спектроскопии удалось показать, что образование батородопсина сопровождается
появлением трех сильных линий при 853, 875 и 921 см, которые соответствуют
высокочастотным (~ 10~12 с) колебаниям протонов. Замена водорода на дейтерий в
батородопсине у атомов углерода Сю, Сц, Ci2 вызывает сдвиг этих линий. Данные
результаты указывают на появление в батородопсине сильных внеплоскостных
колебаний атомов Н, связанных с СНз-группами ретиналя.
Особенностью наблюдаемого эффекта является уменьшение частоты (на
60 см) колебаний протона Hi2 около Ci2 и внеплоскостных колебаний протонов
422
Глава XXIX. Фотопревращения бактериородопсина и родопсина
Нц и Hi2 в батородопсине по сравнению с родопсином, изородопсином и свободным
полностью транс-ретиналем. Предполагают, что наблюдаемый эффект обусловлен
сильным электрическим полем в области Ci2, вызванным отрицательно заряжен-
заряженными группами опсина СОО~, вблизи которых оказывается протон Hi2 ретиналя.
lgk
26 Ь
25
24
23
22
О 40 80
120 160 200
A/ТI000
240 280
Рис. XXIX. 17.
Кривые температурной зависимости
константы скорости к перехода родоп-
родопсин — батородопсин в аррениусовских
координатах (по К. S. Peters et al., 1977):
1 — обычные образцы родопсина, 2 — дейте-
рированные образцы родопсина.
Очевидно, в батородопсине происходит не только образование транс-конфигурации
(«излом» цепи ретиналя) по двойной связи Cn=Ci2, но и дополнительное скручи-
скручивание вокруг одиночной связи Сю—Сц. В результате этого протоны метильных
групп Сц—С14 попадают в поле заряженных групп белка, который, таким образом,
может влиять на формирование батоформы. Изучение раман-спектров родопсина
показало также, что в 11-цис-ретинале происходят сильные смещения по несколь-
нескольким нормальным координатам низкочастотных колебаний. Это говорит о том,
что фотоизомеризация вызывает изменения во многих частях скелета ретиналя,
затрагивая большое количество координат торсионного вращения.
Фемтосекундные изменения. Эксперименты, выполненные с применением фем-
тосекундной техники (Матис, Шенк), позволили зарегистрировать изменения по-
поглощения родопсина в области 480-580 нм на временах до 500 фс. Оказалось, что
выцветание полосы поглощения родопсина при 500 нм и образование первичного фо-
фотопродукта полностью заканчиваются в течение 200-300 фс. Это намного короче,
чем время обычной электронно-колебательной релаксации A0-11-10~12 с).
7. Первичный акт фотопревращения родопсина
423
100
50
0
¦
¦Si
\ A
¦
530 нм/
550 нм/
_ 580 нм /
к—*д^_ А
—» ¦—, 'дмм
;
-
500 нм z' ^4^^^^^?^~
Д» 200 It L !L»
v полностью-транс
11-цис родопсин фотопродукт
Были обнаружены также когерентные колебания абсорбции в области полосы
поглощения бато-продукта E30-580 нм) с периодом 0,1 пс. Авторы приписали эту
колебательную моду торсионным осцилляциям скелета ретиналя. На рис. XXIX. 18
приведена схема возникновения этих колебаний. Как видно, при движении вдоль
торсионной координаты по поверхности по-
потенциальной энергии S\ синглетного воз-
возбужденного состояния родопсина в тече-
течение 200 фс происходит переход на кри-
кривую основного состояния So батопродук-
та. Этот быстрый переход в области пе-
пересечения кривых Si и So совершается без
потери когерентности колебаний волнового
ядерного пакета и не сопровождается коле-
колебательной релаксацией в возбужденном со-
состоянии родопсина (см. рис. XXIX.9). Вы-
Высокая скорость достижения области пере-
пересечения и большая вероятность перехода
на поверхность So бато-продукта опреде-
определяют высокий квантовый выход образова-
образования бато-продукта. Согласно эксперимен-
экспериментальным данным, соотношение квантовых
выходов переходов из возбужденного состо-
состояния «Si в исходную форму и бато-продукт
составляет 0,33 : 0,67.
В модельных системах скорость фото-
фотоизомеризации ретиналя намного ниже, чем
в опсине. Так, в метаноле время образова-
образования фотопродукта 11-цис-ретиналя в ком-
комплексе с протонированным шиффовым осно-
основанием составляло ~ 8 пс, а квантовый вы-
выход 0,15. Очевидно, опсин ускоряет фото-
фотоизомеризацию ретиналя. Это определяет-
определяется особенностями белок-хромофорного вза-
имодействия. Среди факторов, способству-
способствующих этому, можно назвать электростатическое отталкивание между 13—СНз-
группой и 10—Н в родопсине, которое ускоряет скручивание скелета ретиналя и
переход
Si -* So (бато).
В целом, слабая температурная зависимость (до 4 К) и высокая скорость фотоизо-
фотоизомеризации в родопсине являются следствием специфического белкового окружения
ретиналя.
¦\У В растворах, где полярные молекулы растворителя создают плотную сольват-
ную оболочку, изомеризация затруднена вследствие причин стерического ха-
характера. При учете свободной энергии сольватации в растворе изменяется потен-
потенциальная кривая, так что на ней уже появляется барьер, затрудняющий цис-транс-
координаты изомеризации
Рис. XXIX. 18.
Поверхности потенциальной энер-
энергии состояний So и Si при фото-
фотоизомеризации ретиналя в фемтосе-
кундном диапазоне (по G.G.Koch-
enderfer, R. A.Mathies, 1995). Пока-
Показаны колебательные изменения по-
поглощения при 530, 550, 580 нм.
424
Глава XXIX. Фотопревращения бактериородопсина и родопсина
переход в возбужденном состоянии. В этом состоит причина того, что в родопсине
время фотоизомеризации F пс) намного меньше, чем в растворах (~ 1 -j- 5 не). ?
Из рис. XXIX. 19 видно, что свободная энергия (AF = AU — TAS) батородопси-
батородопсина больше (на ~ 55 кДж) энергии исходного родопсина. Поскольку цис-транс-изоме-
Батородопсин
1?4>50 кДж
Рис. XXIX. 19.
Кривые потенциальной энергии основ-
основного и возбужденного состояний в родо-
родопсине по торсионной координате Сц_12
7 — возбужденное состояние родопсина и бато-
батородопсина, 77 — основное состояние родопси-
родопсина и батородопсина; 777 — основное состояние
изолированного хромофора; Фьфг—эффек-
Фьфг—эффективности достижения потенциального миниму-
минимума родопсином и батородопсином по Cn_i2;
Yi, Y2 — эффективности перехода с этого ми-
минимума в конфигурации полностью транс- и
11-цис-основного состояния.
ризация при 77 К не сопровождается большими изменениями энтропии, эта разница
отражает непосредственное запасание энергии света за счет повышения внутренней
энергии в конформации батородопсина. Свободный ретиналь не обладает способ-
способностью запасать энергию при цис-транс-переходе (см. рис. XXIX.19, 77Т). Поэтому
этот эффект обусловлен особым микроокружением ретиналя в белке и, в частности,
его электростатическими воздействиями с противоионом. Например, увеличение
внутренней энергии и напряженности конформации произойдет, если в результате
поворота ретиналя при цис-транс-переходе протонированный атом азота (+NH)
закрепится в новом положении, при котором увеличится расстояние между ним и
противоионом белка СОО~.
\—? Безбарьерный характер кривой общего возбужденного состояния родопсина и
батородопсина является следствием специфического белкового окружения ре-
ретиналя и обеспечивает его быструю изомеризацию. ?
Глава XXX
Фоторегуляторные и фотодеструктивные процессы
§ 1. Механизмы фоторегуляторных реакций фитохрома
Действие света на растительные и микробные организмы не ограничивается фо-
фотосинтезом. Существует большое количество других, прямо не связанных с фото-
фотосинтезом фотобиологических процессов, среди которых в первую очередь следует
выделить процессы фоторегуляции. В отличие от фотосинтеза они не участвуют
непосредственно в запасании энергии квантов света. Однако фоторегуляторные
системы выполняют весьма важную функцию, регулируя многие стороны жизнеде-
жизнедеятельности организмов.
¦\У Особенностью фоторегуляторных систем является их высокая квантовая чув-
ствительность, сочетающаяся с большой эффективностью биологического дей-
действия. Это обусловлено триггерным принципом действия систем фоторегуляции:
здесь свет служит только сигналом, запускающим сложную цепь последовательных
биохимических изменений, приводящих в конечном результате к определенному
фотобиологическому эффекту. Триггерный механизм действия света лежит в осно-
основе таких известных фоторегуляторных процессов, как фотоморфогенез, фототро-
фототропизм, фотопериодизм, фототаксис, фотоиндуцированный биосинтез пигментов и
ряд других.
Любой фоторегуляторный процесс включает несколько последовательных ста-
стадий: поглощение кванта света и образование электронно-возбужденного состояния
фоторецептора; фотофизическую реализацию энергии возбуждения и сенсибили-
сенсибилизацию фотохимической реакции; образование промежуточных фотопродуктов и
конечное проявление фотобиологического эффекта. ?
Идентификация природы пигментов-сенсибилизаторов — первоочередная зада-
задача при изучении механизмов фоторегуляторных реакций. Однако пигменты-сенси-
пигменты-сенсибилизаторы большинства фоторегуляторных процессов до сих пор не идентифи-
идентифицированы и о природе их судят только по спектрам действия фотобиологических
эффектов. Исключение составляет фитохром — пигмент, характеризующийся уни-
универсальностью распространения среди растительных организмов. Именно благода-
благодаря открытию этого пигмента в изучении механизмов фоторегуляторных реакций
достигнут значительный прогресс. Закономерности функционирования фитохром-
ной системы имеют во многом общий характер с другими фоторегуляторными
системами.
Фитохром — хромопротеин. Его оптические свойства и способность выпол-
выполнять функцию фоторецептора обусловлены хромофором — линейным тетрапирро-
426 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
лом (или билитриеном). Взаимодействие между хромофором и белковой частью
пигмента имеет важное значение, поскольку от этого зависит характерное свой-
свойство фитохрома — его фотообратимость и наличие двух взаимопревращающихся
форм. Одна форма обладает длинноволновым максимумом поглощения при 660 нм
(Фббо)> а ЛРУгая — при 730 нм (Фтзо)- Переход одной формы фитохрома в другую
индуцируется красным F60 нм) и дальним красным G30 нм) светом:
., 660 нм ._ х________ ч
фббо Щ^? Фтзо- (ХХХ.1.1)
Спектры действия прямой и обратной фотоконверсии фитохрома близко совпадают
со спектрами поглощения Фббо и Ф7зо> соответственно. При этом квантовый выход
реакции Фббо ~* Ф730 примерно в 1,5 раза выше, чем реакции Ф730 ~* Фббо-
Молекула фитохрома является димером, в котором каждый из мономеров с
молекулярной массой около 124 кДа содержит хромофор, присоединенный к цисте-
ину апобелка тиоэфирной связью. К настоящему времени выявлено несколько типов
фитохромов (А—Е), различающихся по структуре апобелка, но содержащих один и
тот же хромофор — фитохромобилин. Предполагается, что хромофор формы Фббо
расположен в гидрофобном белковом кармане.
Между ароматическими аминокислотными остатками белкового носителя
и билитриеновой группировкой фитохрома протекают процессы индуктивно-
резонансной миграции энергии. Эффективность переноса энергии электронного
возбуждения составляет 30-35%, причем ультрафиолетовый свет, поглощаемый
белком, активен как для протекания прямой (Фббо ~* Ф7зо)> так и обратной
(ф730 -* Ф660) реакции. Установлено, что энергия электронного возбуждения
переносится с триплетного уровня триптофановых остатков в белке на синглет-
ный возбужденный уровень билитриена, о чем свидетельствует появление его
замедленной флуоресценции.
Прямая и обратная фотоконверсия фитохрома — многоступенчатые процессы,
включающие в себя образование и распад ряда спектрально различимых интермеди-
атов, которые зарегистрированы методом флеш-фотолиза при низких температу-
температурах. Индуцированные красным светом изменения в хромофор-белковом взаимодей-
взаимодействии приводят к длинноволновому смещению максимумов в спектрах поглощения
интермедиатов в направлении от 660 к 730 нм. Обратное фотопревращение также
протекает через промежуточные формы, однако, спектрально отличающиеся от
таковых при прямом фотопревращении.
Фототрансформацию фитохрома можно разделить на две фазы. Первичная
фотохимическая реакция происходит в наносекундном временном диапазоне и за-
заключается в фотоиндуцированной Z—E изомеризации фитохромобилина относи-
относительно двойной связи при С15 между С и D кольцами и, вероятно, повороте хро-
хромофора вокруг тиоэфирной связи. В работах В. А. Синещекова зарегистрирована
флуоресценция нативной красной формы фитохрома с максимумом излучения в
области 682-687 нм. Квантовый выход флуоресценции фитохрома при комнатной
температуре очень низок (и 5 • 10 ~3), что указывает на преимущественную дез-
дезактивацию его синглетного возбужденного состояния не по излучательному, а по
фотохимическому пути в фотореакции изомеризации.
Последующие темновые перегруппировки занимают миллисекунды и приводят
белковую часть фитохрома в соответствие с новой конформацией хромофора. В ре-
1. Механизмы фоторегуляторных реакций фитохрома
427
зультате такой фотоиндуцированнои перестройки образуется дальнекрасная форма
фитохрома (Ф730) с гидрофобной белковой зоной, которая может взаимодейство-
взаимодействовать с регуляторными и сигнальными молекулами (Рис. XXX.1).
ФббО A5Z)
Ф730 A5Е)
Рис. XXX. 1.
Модель фотопреврашений и регуляторно-
го действия фитохрома. Черным кружком
обозначен С15 между С и D кольцами фито-
хромобилина. X — регуляторная или сиг-
сигнальная молекула.
гидрофобная зона
^—р Конформационные перестройки белка при фотоконверсии фитохрома подтвер-
ждаются данными иммунохимического анализа, изменениями в спектрах кру-
кругового дихроизма в интервале 200-300 нм и появлением разностных спектров по-
поглощения между формами Фббо и Ф730 B области 210-300 нм. Вместе с тем конфор-
конформационные перестройки белка отличаются от денатурационных, поскольку энтро-
энтропия активации промежуточных стадий фотоконверсии фитохрома невелика (AS* ~
~25э.е.). ?
С фотоиндуцированным образованием физиологически активной формы фи-
фитохрома связаны многообразные изменения в метаболизме, активности фермен-
ферментов, движениях, росте и дифференциации растений. Доказательствами зависимо-
зависимости физиологической реакции от фитохрома могут служить спектр действия этой
реакции с максимумом при 660 нм и обратимость эффекта при последовательном
428 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
чередовании периодов освещения красным и дальним красным светом. Некоторые
из фитохром-индуцированных процессов протекают быстро, другие обладают лаг-
фазой после фотоконверсии Фббо ~* Ф7зо-
Использование ^ (
ацетилхолина
1
Уменьшение
проницаемости
Н+
1
Деполяризация
1
Отлипание корней
ft
р660
600 нм
730 нм
Образование
ф730 *~ ацетилхолина
1
Увеличение
проницаемости
Н+
1
Генерация
положительного
биопотенциала
\
Адгезия к отрицательно
заряженному стеклу
Рис. ХХХ.2.
Участие ацетилхолина в реакции адгезии, индуцируемой фитохромом (Ф)
Совокупность полученных к настоящему времени экспериментальных данных
свидетельствует о том, что «быстрые» процессы обусловлены индуцированными
Ф730 структурными перестройками мембран. Косвенно на это указывают опыты, в
которых при активации фитохромнои системы выявлены изменения проницаемости
клеточных мембран для ионов, электрического потенциала и адгезивных свойств
поверхности растительных клеток. Так, в экспериментах с изолированными кореш-
корешками проростков фасоли показано, что облучение корней красным светом приводит
к развитию положительного биоэлектрического потенциала, тогда как при последу-
последующем воздействии дальним красным светом возникает отрицательный биопотенци-
биопотенциал. Фотоиндуцированное образование биоэлектрических потенциалов сопровожда-
сопровождалось обратимой адгезией корней к отрицательно заряженному стеклу. При этом
кинетические характеристики обоих процессов близко совпадали, а сами процессы
характеризовались достаточно высокой скоростью протекания.
На основании полученных данных сделан вывод о том, что реакции адгезии
связаны с фотоиндуцированным изменением проницаемости мембраны и образо-
образованием в ней электрохимического градиента в результате изменений ионных по-
потоков в клетках корней. Поскольку оказалось, что этим процессам предшествует
изменение в клетках концентрации ацетилхолина, было выдвинуто предположение
о медиаторной функции данного гормона. Подтверждением такой точки зрения
явились результаты экспериментов, в которых были обнаружены фотомиметиче-
фотомиметические свойства ацетилхолина: экзогенный ацетилхолин заменял действие красного
света, усиливая поток Н+ и вызывая реакцию адгезии корней. Представления о
роли ацетилхолина в индукции «быстрых» фитохромзависимых реакций отражены
на рис. ХХХ.2.
§ 1. Механизмы фоторегуляторных реакций фитохрома 429
\—? Индуцируемые фитохромом изменения свойств мембран растительной клетки
объясняют, исходя из данных о его ассоциации с определенными участками
поверхности мембраны. Таким образом, фитохром можно рассматривать в качестве
специфического фоторегуляторного лиганда, а участок поверхности мембраны, с
которым он связывается, — в качестве ее рецептора. ?
Наряду с индукцией «быстрых» реакций фитохромная система регулирует боль-
большое количество биохимических и физиологических процессов, для реализации кото-
которых требуются несколько часов и более длительные промежутки времени. Устано-
Установлено, что в основе механизма участия фитохромной системы в этих так называе-
называемых «медленных» процессах лежит индуцированное пигментом Ф730 активирование
генов. Считают, что каждая дифференцированная клетка содержит полный набор
генов, которые по отношению к свету подразделяются по крайней мере на три
функциональных типа: активные гены, транскрибирующиеся одинаково в темноте
и на свету; неактивные гены, не транскрибирующиеся ни в темноте, ни на свету;
«потенциально активные» гены, активирующиеся фитохромом. Форма Ф730 через
определенные медиаторы гормональной природы включает «потенциально актив-
активные» гены, что приводит к синтезу молекул РНК и ферментов, определяющих
направленность той или иной морфогенетической реакции.
Анализ закономерностей проявления «быстрых» и «медленных» процессов, ре-
регулируемых фитохромной системой, позволяет предположить, что на первичных
стадиях они реализуются по общему механизму, в основе которого лежат индуци-
индуцированные Ф730 конформационные перестройки мембран. Действительно, изменение
проницаемости мембран в результате их конформационных перестроек может об-
облегчить доступ фитогормонов и других важных метаболитов к ДНК, и тем самым
вызвать дерепрессию генов.
Одним из возможных путей реализации регуляторной функции фитохрома мо-
может быть взаимодействие хромофора формы Ф730 со специфическими протеинки-
назами и ингибирование их активности. Известно, что последовательные реакции
дефосфорилирования и фосфорилирования белков играют важную роль в усилении
и передаче внутриклеточных сигналов.
Интересной особенностью фитохрома является его способность к образованию
димеров. С использованием моноклональных антител показано существование как
Фббо : Фббо и Ф730 : Ф730 гомодимеров, так и Фббо : Ф730 гетеродимеров фитохрома.
Предполагается, что именно образование менее стабильных гетеродимеров и их
быстрая обратная темновая конверсия лежат в основе опосредуемых фитохромом
ответов на низкие интенсивности света.
Выше было показано, чти первичная фотохимическая реакция фитохрома со-
сопровождается конформационными изменениями белковой части пигмента. Очевид-
Очевидно, именно это свойство фитохрома является определяющим в механизме его ре-
гуляторного действия на структурное состояние мембран и активность фермен-
ферментов. Аналогичным свойством обладает и ряд других фоторецепторных систем, на-
например зрительный пигмент родопсин и светочувствительная система голохром —
протохлорфиллид. Последняя участвует в контроле за формированием хлоропла-
стов высших растений и некоторых зеленых водорослей. Поглощение красного све-
света вызывает гидрирование протохлорофиллида, разрушение комплекса голохром —
430 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
протохлорофиллид, высвобождение белка голохрома с последующим изменением его
конформации и кооперативной перестройкой проламеллярной структуры пластиды.
Эти реакции сопровождаются индуцированным биосинтезом белка, различных пиг-
пигментов и компонентов ЭТЦ фотосинтеза.
§ 2. Другие фоторегуляторные реакции
В настоящее время первичные механизмы действия некоторых фоторецепторов
фоторегуляторных реакций подтверждены модельными экспериментами, в кото-
которых установлена способность ряда простых органических молекул (фотохромы)
при поглощении квантов света эффективно изменять активность ферментов и про-
проницаемость мембран. Видимо, молекула фотохрома образует комплекс с фермен-
ферментом, что позволяет рассматривать его как фотохром-протеин. Поглощая квант све-
света, молекула фотохрома претерпевает фотохимическую реакцию (например, цис-
транс-изомеризации), приводящую к изменению пространственной конфигурации
фотохрома, что отражается на характере взаимодействия фотохрома с ферментом.
Таким образом, общим свойством фотохромных молекул является их способность
изменять активность фермента за счет непосредственного пространственно-струк-
пространственно-структурного взаимодействия с его активным или аллостерическим центром. При встра-
встраивании фотохромных молекул в искусственную мембрану удается наблюдать фо-
тоиндуцированные изменения таких ее свойств, как проницаемость и мембранный
потенциал. Существенно меняется и строение мембраны. Так, одна молекула кра-
красителя хризофинина, встроенного в искусственную мембрану из полигидроксиэтил-
метакрилата, при поглощении кванта света индуцирует структурные перестройки,
захватывающие несколько сотен молекул мономеров.
В клетках функцию фотохромов могут выполнять различные соединения, ка-
каждое из которых характеризуется строго индивидуальным спектром поглощения,
поэтому наблюдается большое разнообразие спектров действия фоторегуляторных
реакций. Максимумы в спектрах действия фоторегуляторных процессов, рассмо-
рассмотренных выше, расположены в красной области спектра. Вместе с тем существует
ряд процессов, в проявлении которых наибольшей эффективностью обладает свет
синей области спектра.
Характерным примером такого рода процессов является фототропизм, опре-
определяемый как индуцированное односторонним освещением искривление верхушки
надземных частей растений. Фототропические реакции характеризуются исключи-
исключительно высокой квантовой чувствительностью: заметные изгибы наблюдаются уже
при дозах синего света, составляющих ~ 10~3 Дж/м2. Фототропические изгибы
обусловлены различиями в скоростях деления клеток на освещенной и затемненной
сторонах растения, что, в свою очередь, связано с фотоиндуцированным созда-
созданием бокового градиента гормона роста — ауксина. Спектры действия фототро-
фототропических реакций позволяют предполагать, что основными рецепторами биологи-
биологически активного света являются флавиновые хромофоры, способные сенсибилизи-
сенсибилизировать фотоокисление ауксина. Действительно, в модельных опытах обнаружено
фотосенсибилизированное рибофлавином окисление молекул ауксина с квантовым
выходом ~ 0,7. В то же время показано, что само фоторазрушение ауксинов не
может создать необходимый градиент гормона. Предполагают, что такой градиент
§ 2. Другие фоторегуляторные реакции 431
возникает, в основном, за счет изменения проницаемости мембран при их струк-
структурной модификации продуктами фотолиза ауксина. В пользу такой точки зрения
косвенно свидетельствуют данные о способности одного из фотопродуктов ауксина
C-метилоксииндол) имитировать фототропный эффект.
¦\У В соответствии с описанными данными предложена такая последовательность
реакций, приводящих к фототропическому эффекту:
поглощение кванта света флавином
фотосенсибилизированное окислительное
декарбоксилирование индолилуксусной
кислоты
J
образование 3-метилоксииндола
взаимодействие этого фотопродукта с
мембранами
структурная модификация мембран
транспорт ауксинов с появлением
бокового градиента
асимметричный рост клеток
изгиб проростка.
?
Другим типичным «ответом на синий свет», который может сенсибилизиро-
сенсибилизироваться флавиновыми фоторецепторами, является фотоиндуцированный каротино-
генез. Согласно имеющимся данным, фоторецептор (флавопротеин) при поглоще-
поглощении кванта света переходит из окисленного состояния (Фок) в восстановленное
(Фвосст), что сопровождается окислением какого-то соединения, служащего доно-
донором электрона (X). В темноте фотовосстановленныи флавопротеин может быстро
реагировать с акцепторами электрона (наиболее вероятно — цитохромами) и пере-
переходить в исходное окисленное состояние:
hv
\
Цитохромвосст
Цитохромок
432 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
Фотохимическая активность флавиновых хромофоров обусловлена их перехо-
переходом под действием света из основного в возбужденное синглетное, а затем три-
плетное состояние, отличающееся высокой каталитической активностью. Посколь-
Поскольку время жизни флавина в триплетном состоянии при комнатной температуре со-
составляет ~ 20 мкс, а в синглетном — лишь 2,3 не, предполагают, что именно три-
плетный флавин участвует в реакции молекулярной фотосенсибилизации на пер-
первичной стадии фотоиндуцированного каротиногенеза.
Еще один тип фотобиологических процессов, также индуцируемых синим све-
светом, составляет большая группа реакций фоторегуляции движения микроорганиз-
микроорганизмов, называемых фототаксисом.
Фототаксис определяется как способность микроорганизмов регулировать
уровень своей освещенности путем перемещения и аккумуляции в области про-
пространства с оптимальными световыми условиями, где обеспечивается максимальная
скорость фотосинтеза при минимальном повреждающем действии света. Различают
несколько типов фоторегуляции движения микроорганизмов (например, фотоки-
нез, фотофобная реакция), из которых наиболее эффективным и совершенным
является истинный фототаксис, обеспечивающий перемещение клетки параллельно
световым лучам. В этом случае для детектирования направления распростра-
распространения света движущиеся водоросли (например, двужгутиковые хламидомонады)
используют анизотропию поглощения света фоторецептором, локализованным
в плазматической мембране клетки. Под фоторецептором внутри хлоропласта
расположена стигма, состоящая из группы липофильных гранул, функция которой,
как предполагается, и сводится к обеспечению анизотропии поглощения света
фоторецептором.
С использованием специально разработанной методики экстраклеточной реги-
регистрации потенциалов удалось обнаружить и исследовать фотоэлектрические реак-
реакции, связанные с рецепцией и преобразованием светового стимула при фототаксисе
(О. Синещеков, Ф. Литвин). Последовательность таких реакций на плазматической
мембране включает первичный, градуально зависящий от интенсивности света элек-
электрический ответ — фоторецепторный потенциал фототаксиса, пороговую регене-
регенеративную реакцию и последующие медленные изменения разности потенциалов.
На основании анализа результатов фотоэлектрических измерений и регистрации
двигательной активности жгутиков водоросли предполагается, что градуальный
фоторецепторный потенциал непосредственно контролирует движение жгутиков
при фотоориентации, тогда как регенеративная электрическая реакция вовлека-
вовлекается в пороговый фотофобный ответ клетки при резком изменении освещенно-
освещенности. Что касается медленных изменений трансмембранного потенциала, то они, по-
видимому, отражают адаптацию фоторецепторной системы к измененному уровню
освещенности.
Полученные спектры действия фототаксиса позволяют рассматривать в каче-
качестве наиболее вероятных кандидатов на роль первичных фоторецепторов флави-
новые пигменты. Вместе с тем имеются данные, указывающие на возможную пиг-
пигментную гетерогенность фоторецептора фототаксиса. Предполагается, что функ-
функционирование такого фоторецептора включает процесс миграции энергии с его ан-
антенной части на «реакционный центр», концентрация которого относительно мала.
Судя по спектру действия фотоиндукции рецепторного потенциала фототаксиса
§ 3. Общая характеристика фотодеструктивных процессов 433
у жгутиковой водоросли Н. pluvialis, имеющего отчетливо выраженную структуру
с 6 максимумами в диапазоне 400-600 нм, «реакционный центр» фоторецептора
может представлять собой молекулы типа бактериальных родопсинов.
§ 3. Общая характеристика фотодеструктивных процессов
К фотодеструктивным процессам относятся инициируемые светом в молекулах
биосубстрата реакции, приводящие к образованию таких химических изменений
молекул, которые сопровождаются нарушением или даже полной потерей их функ-
функциональных свойств и в конечном счете обусловливают проявление повреждающих
эффектов на клеточном и организменном уровнях.
Фотодеструктивные реакции наиболее эффективно индуцируются в биологиче-
биологических системах коротковолновым ультрафиолетовым (УФ) излучением (< 290 нм),
что связано с прямым поглощением этого излучения нуклеиновыми кислотами, бел-
белками и некоторыми другими биологически важными внутриклеточными компо-
компонентами. Вместе с тем при определенных условиях фотодеструктивные процессы
могут протекать и под действием света более длинноволнового диапазона оптиче-
оптического спектра, который подразделяется на три области: средневолновую УФ B90-
320 нм), длинноволновую УФ C20-400 нм) и видимую D00-700 нм). В отличие
от коротковолнового УФ-излучения, поглощаемого озоном атмосферы, эти виды
оптического излучения достигают поверхности Земли и, следовательно, являются
экологическими компонентами солнечной радиации.
Длинноволновое УФ-излучение и видимый свет практически не поглощаются
нуклеиновыми кислотами и белками. Поэтому инициация в них деструктивных ре-
реакций при действии этих видов оптического излучения осуществляется преиму-
преимущественно с участием других молекул, выступающих в качестве первичных фо-
фоторецепторов. Такие вещества называются фотосенсибилизаторами, а процессы, в
которых они участвуют, — фотосенсибилизированными.
Известно несколько типов первичных фотохимических превращений молекул,
ответственных за деструктивное действие оптического излучения. К ним относятся
реакции фотоокисления, фотоионизации, фотодиссоциации и фотоприсоединения.
Реакции фотоионизации, фотодиссоциации и фотоприсоединения наиболее ча-
часто протекают в белках и нуклеиновых кислотах при их облучении коротковол-
коротковолновым УФ-светом. Основной первичной фотореакцией при УФ-фотолизе остатков
триптофана (АН) в белках является его фотоионизация с образованием катион-
радикала (АН+) и сольватированного электрона (е~):
В цистиновых остатках белков первичная фотохимическая реакция заключается в
фотодиссоциации S—S-связей:
R-S-S-R -^* 2(i?-SH),
+2Н
т. е. фотолиз цистина идет через стадию свободных радикалов с локализацией не-
спаренного электрона на атоме серы.
434 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
В отличие от белков, в нуклеиновых кислотах фотоионизация азотистых осно-
оснований происходит только при поглощении двух квантов УФ-света. Такие двух-
квантовые реакции удается наблюдать при использовании высокоинтенсивного им-
импульсного лазерного УФ-излучения. При относительно низких же интенсивностях
УФ-света основными фотохимическими реакциями, в которые вступают основания
нуклеиновых кислот, являются реакции фотоприсоединения — димеризация, гидра-
гидратация и образование F-4) пиримидиновых аддуктов.
Фотосенсибилизированные деструктивные реакции в большинстве случаев про-
протекают с участием кислорода. Эти процессы, получившие название фотодинамиче-
фотодинамических, по своему механизму разделяют на два типа в зависимости от того, каким
способом энергия светового возбуждения передается от сенсибилизатора к биологи-
биологическому субстрату. Они могут быть представлены в виде следующей общей схемы:
радикалы R 2 > окисленные
или ион-радикалы продукты тип I
окисленные ТИП II
продукты
где S* — возбужденный фотосенсибилизатор, подвергающийся первичным измене-
изменениям, «S+ — окисленная форма сенсибилизатора, А — молекула биосубстрата, участ-
участвующая в реакции на последующей стадии.
В реакциях типа I фотовозбужденный сенсибилизатор может вступать в оки-
окислительно-восстановительные реакции с различными биологически важными моле-
молекулами, участвуя в переносе электрона либо атома водорода. В результате обра-
образуются реакционноспособные радикалы (и/или ион-радикалы) сенсибилизатора и
молекул биологического субстрата, вступающие в дальнейшие химические реакции
с кислородом.
В фотодинамических реакциях типа II происходит перенос энергии от возбу-
возбужденной в триплетное состояние молекулы сенсибилизатора к кислороду с образо-
образованием его электронно-возбужденной формы 1Ог; образовавшийся синглетный ки-
кислород затем окисляет молекулы биологического субстрата. С меньшей эффектив-
эффективностью некоторые триплетные сенсибилизаторы способны осуществлять одноэлек-
тронное восстановление молекулярного кислорода с образованием супероксидного
анион-радикала О^~.
Наряду с фотодинамическими деструктивными процессами известны механиз-
механизмы фотосенсибилизации, не требующие участия кислорода. Такие фотосенсибили-
фотосенсибилизированные реакции, протекающие, в частности, в ДНК, реализуются с участием
молекул-сенсибилизаторов, которые либо передают энергию возбуждения на азо-
азотистые основания, обеспечивая тем самым их последующую димеризацию, либо в
возбужденном состоянии реагируют с мононуклеотидами, образуя аддукты. К пер-
первой группе фотосенсибилизаторов относятся некоторые кетоны; вторую группу
составляют производные фурокумаринов (псоралены). При фотосенсибилизации с
помощью псораленов в ДНК образуются два типа фотопродуктов: A) моноаддукты
§ 4. Фотохимические реакции в ДНК и ее компонентах 435
(молекула псоралена ковалентно связана с одним пиримидином) и B) диаддукты,
или межнитевые ковалентные сшивки (молекула псоралена ковалентно связана с
двумя пиримидинами).
В последующих разделах рассматриваются первичные механизмы основных
типов фотохимических реакций, которые индуцируются в биологически важных
макромолекулах и мембранах светом различных длин волн и обусловливают повре-
повреждающее действие оптического излучения на клетки.
§ 4. Фотохимические реакции в ДНК и ее компонентах
\—? Согласно общепринятому мнению, ДНК — основная внутриклеточная мишень
при летальном и мутагенном действии коротковолнового УФ-излучения. Это, в
частности, подтверждается совпадением максимума в спектрах действии фотобио-
фотобиологических эффектов B60-265 нм) с максимумом в спектре поглощения ДНК. ?
Основными хромофорами ДНК являются азотистые основания нуклеотидов,
причем квантовые выходы фотопревращений пиримидиновых компонентов при-
примерно на порядок выше, чем пуриновых. Поглощение азотистыми основаниями
квантов УФ-света (максимум поглощения при 260 нм) приводит к образованию их
электронно-возбужденных синглетных и триплетных состояний, которые возника-
возникают преимущественно в результате л —> т!*-переходов.
При относительно низких интенсивностях УФ-излучения обычных источников
возбуждаются низколежащие синглетные (Si) и триплетные Gi) электронные уров-
уровни молекул за счет поглощения ими одного кванта. В S±- и ^-состояниях основания
ДНК вступают в различные фотохимические реакции, из которых с наибольшим
квантовым выходом идут три реакции фотоприсоединения: димеризация, гидрата-
гидратация и образование F-4) пиримидиновых аддуктов.
Помимо одноквантовых реакций основания ДНК могут вступать в фотохими-
фотохимические реакции и при поглощении двух квантов УФ-света. Такие двухквантовые ре-
реакции удается наблюдать либо в «жестких» средах (замороженные до стеклообраз-
стеклообразного состояния органические растворители) при облучении уже низкоинтенсивным
УФ-светом ртутных ламп, либо при импульсном высокоинтенсивном УФ-излучении
лазерных источников. В последнем случае двухквантовое возбуждение оснований
происходит и в жидких средах при комнатной температуре.
В «жесткой» среде вследствие ограниченности движения молекул время их жиз-
жизни в 1-м возбужденном триплетном состоянии G1) достигает теоретических вели-
величин (~ 1Ч-10 с), что обусловливает высокую концентрацию молекул в ^-состоянии.
Это, в свою очередь, увеличивает вероятность поглощения 2-го кванта света даже
при низких интенсивностях УФ-излучения от обычных источников. В результате
происходит заселение высшего триплетного уровня Тп G1 -* Тп = поглощение).
В высоковозбужденном триплетном состоянии молекула приобретает способность
вступать в такие фотохимические реакции, которые не наблюдаются в условиях
одноквантовой фотохимии. Так, при облучении тимина (ТН) в кислых и щелоч-
щелочных стеклах при 225 К происходит его двухквантовая ионизация с образованием
радикала Т по схеме
ТН -^ ТН* -* ТН** ^* ТН+ -^5- т. (ХХХ.4.1)
436 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
Гидратированные электроны и радикалы тимина обнаружены методом ЭПР.
Особенность такой двухквантовой реакции связана с тем, что молекула после по-
поглощения кванта в низшем возбужденном Ti-состоянии переходит в одно из высо-
высоковозбужденных состояний, энергия которых превышает энергию ионизации мо-
молекулы. Это и обусловливает необычные с точки зрения классической фотохимии
химические превращения молекул.
В жидких средах при комнатной температуре двухквантовые процессы в осно-
основаниях ДНК реализуются при использовании УФ-излучения лазерных источников.
При высоких интенсивностях лазерного УФ-излучения (> 108 Вт/м) увеличивается
как заселенность Si и Ti-уровней оснований, так и скорость их опустошения в
результате переходов наверх. Это приводит к двухквантовому возбуждению вы-
соколежащих электронных уровней (Sn и Тп) через промежуточные уровни «Si и
Ti с последующей ионизацией молекул и эффективным протеканием химических
реакций, не наблюдающихся (либо идущих с очень низким квартовым выходом)
при одноквантовом возбуждении.
Реакция фотодимеризации. Эта реакция впервые была обнаружена при УФ-
облучении замороженных растворов тимина. Она состоит в соединении двух основа-
оснований по 5,6-двойной углеродной связи с образованием кольца циклобутанового типа:
Считают, что димеры пиримидиновых оснований (прежде всего тимина), образу-
образующиеся в одной цепи ДНК, составляют 70-80% от всех летальных повреждений,
индуцируемых коротковолновым УФ-светом. Характерная черта реакции димери-
димеризации — ее фотообратимость. Пиримидиновые основания поглощают свет в области
200-300 нм, их димеры — примерно в том же диапазоне УФ-спектра B00-285 нм).
Поэтому при УФ-облучении оснований или ДНК для каждой длины волны возбу-
возбуждающего света между димерами и основаниями устанавливается динамическое
равновесие, определяемое соотношением поперечных сечений димеризации основа-
оснований и мономеризации димеров. Так, в случае облучения тимина при 280 нм диме-
ризуется около 65% оснований, а при 280 нм — около 15%.
^—р Вследствие бимолекулярного характера реакции фотодимеризации ее кванто-
вый выход существенно зависит от степени взаимоориентации мономеров при
возбуждении одного из них. Например, квантовый выход димеризации тимина в
водном растворе при комнатной температуре ~ 4,7 • 10~4, а в замороженном рас-
растворе ~ 1. Квантовый выход димеризации тимина в ДНК ~ 2 • 10~2. В соответ-
соответствии с проведенными расчетами, условия для димеризации тимина в ДНК являются
оптимальными, если соседние мономеры ориентированы друг к другу под углом
в 36°. ?
§ 4. Фотохимические реакции в ДНК и ее компонентах 437
Вопрос о том, через какое электронно-возбужденное состояние пиримидино-
вых оснований (первое синглетное или триплетное) осуществляется димеризация,
подробно исследовали на растворах тимина и ДНК с использованием тушителей
триплетных состояний и метода фотосенсибилизации. Данные об уменьшении вы-
выхода циклобутановых димеров при облучении тимина в присутствии триплетных
тушителей (кислород и парамагнитные ионы) свидетельствуют о том, что в этом
случае димеры тимина возникают через триплетное состояние основания. Однако
те же триплетные тушители не оказывают никакого влияния на эффективность
образования тиминовых димеров в ДНК. Поэтому можно было бы считать, что в
ДНК димеризация тимина идет через синглетное возбужденное состояние осно-
основания. Однако отсутствие влияния триплетных тушителей на выход димеров в
ДНК может быть связано и с тем, что константа скорости димеризации на три-
плетном уровне за счет близкого и благоприятного расположения молекул тимина
намного больше константы скорости тушения триплетного состояния. Если такое
предположение верно, то димеризация тимина в ДНК возможна и через триплетное
состояние. Образование тиминовых димеров в ДНК через триплетное состояние
продемонстрировано в опытах по селективному заселению триплетного уровня с
помощью фотосенсибилизатора ацетофенона, у которого синглетный возбужден-
возбужденный и триплетный уровни расположены по отношению к соответствующим уровням
тимина в соответствии со схемой
260 нм *
ST
* 350 нм
-^Миграция Димеризация
^Ч 440 нм )
Ацетофенон Тимин ДНК
На схеме значения энергий уровней даны в длинах волн квантов соответству-
соответствующей энергии. При облучении раствора ДНК в ацетофеноне светом длиной волны
350 нм кванты поглощаются только сенсибилизатором. В дальнейшем происходит
перенос энергии с триплетного уровня сенсибилизатора (ацетофенон характеризу-
характеризуется весьма высокой степенью интерконверсии) на триплетный (но не синглетный)
уровень тимина, который взаимодействует с соседней молекулой тимина с образо-
образованием димера циклобутанового типа.
Результаты опытов с ацетофеноном подтверждают принципиальную возмож-
возможность димеризации через триплетное состояние тимина. Однако они не дают ответа
на вопрос о механизме образования димеров в том случае, когда имеет место пря-
прямое возбуждение тиминовых оснований в ДНК. Недавно этот вопрос исследован
путем двухступенчатого возбуждения молекул тимина в полинуклеотиде с исполь-
использованием пикосекундных и наносекундных импульсов высокоинтенсивного лазер-
438 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
ного УФ-излучения B66 нм). Установлено, что при переходе от низкоинтенсивного
(~ 1 Вт/м2) к высокоинтенсивному E • 1013 Вт/м2) пикосекундному УФ-облучению
квантовый выход образования димеров в полинуклеотиде падает в ~ 10 раз. При на-
носекундном же лазерном УФ-облучении (^ 1011 Вт/м2) выход тиминовых димеров
оказался таким же, как и в случае низкоинтенсивного УФ-облучения. Уменьшение
квантового выхода димеризации при пикосекундном УФ-облучении объясняется
эффективным опустошением Si-уровня за счет двухступенчатого возбуждения вы-
соколежащих синглетных уровней. В то же время при наносекундном УФ-облу-
УФ-облучении, когда происходит опустошение Xi-уровня, уменьшения квантового выхода
димеризации тимина не наблюдается. На основании этих данных делается вывод
о том, что в полимерах нуклеиновых кислот пиримидиновые димеры образуются в
основном через «Si-состояние оснований.
Существует мнение, что димер тимина образуется непосредственно из экси-
мера, минуя стадию лабильного химического фотопродукта. Как видно из струк-
структурной формулы димера, замыкание углеродных связей между двумя молекулами
тимина происходит в 5-м и 6-м положениях, между которыми в соответствии с
квантово-механическими расчетами в 1-м возбужденном состоянии наиболее высока
концентрация неспаренных электронов. Это и способствует «разрыву» 5,6-двойной
связи и замыканию межтиминовых связей.
Некоторые красители акридинового ряда могут эффективно уменьшать выход
УФ-индуцированных димеров в ДНК. Защитное свойство акридинов основано на
их способности интеркалировать между парами оснований в молекуле ДНК. Ха-
Характерная черта взаимодействия акридинов (например, акридиновый оранжевый)
с ДНК заключается в том, что при образовании комплекса резко увеличивается ин-
интенсивность флуоресценции красителя в максимуме спектра при 530 нм. По мнению
некоторых авторов, это может быть обусловлено синглет-синглетной миграцией
энергии возбуждения с оснований ДНК на краситель. Расчеты показывают, что
максимальный квантовый выход такой миграции энергии достигается при соотно-
соотношении 1 молекула красителя/~ 5 оснований, и составляет 32%.
Помимо увеличения интенсивности флуоресценции тестом на связывание акри-
акридинов с ДНК может служить также изменение степени поляризации люминесцен-
люминесценции, зависящей от подвижности молекул красителей. С помощью этого метода пока-
показано, в частности, что плоскость кольца акридинового оранжевого перпендикулярна
длинной оси спирали ДНК и параллельна плоскостям оснований.
Обсуждают два возможных механизма защитного действия акридиновых кра-
красителей. Одни авторы считают, что уменьшение выхода пиримидиновых димеров в
присутствии акридинов происходит в результате дезактивации ими возбужденных
состояний оснований ДНК. При этом одна молекула красителя за счет синглет-
синглетной или триплет-триплетной миграции может принимать энергию от 10-20
оснований. По мнению других авторов, предотвращение формирования димеров
происходит за счет изменения структуры молекулы ДНК при интеркалировании
красителя, что в силу бимолекулярного характера реакции фотодимеризации при-
приводит к уменьшению ее квантового выхода.
Реакция фотогидратации. Этот процесс — вторая важная фотохимическая ре-
реакция пиримидиновых оснований ДНК, которая заключается в присоединении воды
к пиримидиновому кольцу у С5 (H) и Сб (ОН) углеродных атомов с разрывом двойной
§ 4. Фотохимические реакции в ДНК и ее компонентах 439
связи между ними и образованием 6-окси-5-гидропроизводных оснований:
н н
Н2О
-^ н -^ н
В отличие от димеризации реакция гидратации не является фотообратимой. Од-
Однако гидраты могут разрушаться при повышении температуры (> 30° С) и ионной
силы раствора, а также при сдвигах рН. Скорость фотогидратации уменьшается
при замене Н2О на D2O. Предшественниками гидратов пиримидинов являются, ви-
видимо, их синглетные возбужденные состояния. В пользу этого свидетельствуют сле-
следующие данные: триплетные тушители не влияют на фотогидратацию; квантовый
выход реакции не зависит от длины волны УФ-света, хотя вероятность конверсии
в триплетное состояние зависит от нее; избирательное фотосенсибилизированное
заселение триплетных уровней оснований (например, с помощью ацетофенона) не
приводит к их гидратации.
\—? Особенность реакции фотогидратации заключается в том, что она протекает
только в одноцепочечной ДНК. Поэтому гидраты пиримидинов могут вносить
вклад в летальный или мутагенный эффект лишь у клеток с активными процессами
репликации и транскрипции, в ходе которых появляются короткие одноцепочные
участки ДНК. ?
Образование F-4) пиримидиновых аддуктов. Эти фотопродукты, характери-
характеризующиеся абсорбцией при 315-320 нм и флуоресценцией в области 405-440 нм, были
выделены из кислотного гидролизата УФ-облученной ДНК. Структура аддуктов
была установлена с помощью УФ-, ИК-, ЯМР-спектроскопии и масс-спектрометрии.
Квантовый выход F-4)-аддуктов порядка 10~3, т.е. в ~ 10 раз меньше, чем цикло-
бутановых димеров, и следовательно, в летальный эффект УФ-излучения B54 нм)
они вносят незначительный вклад. Однако в УФ-мутагенезе они могут играть
важную роль. В отличие от летальных повреждений ДНК, мутационные дефекты
возникают намного реже, и поэтому для них требование максимального квантового
выхода не имеет принципиального значения. Полагают, что реакция образования
F-4) пиримидиновых аддуктов идет по схеме:
н
тимин-цитозиновый F-4)-аддукт
440 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
Сшивки с белками. Это пример межмолекулярных взаимодействий, относящих-
относящихся к третьему типу фотохимических реакций, в которые вступают пиримидиновые
основания ДНК. Акцепторами УФ-света являются оба компонента, поскольку об-
облучение как белка, так и ДНК перед смешиванием сопровождается образованием
сшивок. Механизм данного процесса, вероятно, заключается в прикреплении ами-
аминокислотных остатков белка через SH- или ОН-группы к С5 или Сб цитозина или
тимина ДНК. В модельной системе наблюдали образование по такому механизму
5-8-цистеин-6-гидроурацила:
s — сн2 — сн — соон
I
NH,
н
Рассмотренные выше фотохимические реакции ДНК протекают с участием
низших возбужденных (синглетное и триплетное) состояний пиримидиновых осно-
оснований, которые возникают в результате поглощения одного кванта УФ-света. Вме-
Вместе с тем при определенных условиях, которые будут описаны ниже, основания ДНК
могут вступать в фотохимические реакции и при поглощении двух квантов УФ-
света.
§ 5. Особенности действия высокоинтенсивного лазерного УФ-излучения
на ДНК (двухквантовые реакции)
До создания лазерных источников УФ-излучения классическая УФ-фотобиология
рассматривала в основном процессы, линейные по интенсивности УФ-света, т. е.
изучались биологические эффекты одноквантовых фотохимических реакций. В от-
отличие от света, испускаемого обычными некогерентными источниками, лазерное
излучение обладает такими замечательными свойствами, как пространственная ко-
когерентность, монохроматичность, высокая интенсивность и концентрация энергии
в коротком импульсе наносекундной или пикосекундной длительности. В частности,
большая мощность и ультракороткое время действия делают лазерное УФ-излуче-
ние потенциально новым инструментом для исследования процессов двухквантово-
го возбуждения электронных уровней оснований ДНК, особенностей протекающих
при этом фотохимических реакций и их проявления на биологическом уровне.
Двухквантовое возбуждение азотистых оснований ДНК в водном растворе при
комнатной температуре осуществляется с помощью наносекундных (т = 10 не) и пи-
косекундных (т = 30 пс) импульсов лазерного УФ-излучения с длиной волны 266 нм,
близкой к максимуму первой электронной полосы поглощения So -* Si оснований.
Это достигается при интенсивностях излучения выше 108 Вт/м2, когда возрастает
заселенность уровней Si и Г] и скорость их опустошения в результате перехо-
переходов наверх, вследствие чего реализуется возбуждение высоколежащих электронных
уровней (Sn и Тп) оснований через промежуточную ступень — уровни S\ тл.Т\. Такое
i 5. Особенности действия высокоинтенсивного лазерного УФ-излучения на ДНК
441
двухквантовое возбуждение через реальное промежуточное состояние называется
двухступенчатым.
Экспериментальные исследования, в которых водные растворы азотистых осно-
оснований облучали пикосекундными или наносекундными импульсами УФ-излучения
B66 нм), показали, что при интенсивностях выше 1010 Вт/м2 происходят необра-
необратимые фотохимические изменения молекул, причем образующиеся продукты каче-
качественно отличаются от фотопродуктов одноквантовых реакций, таких, как пири-
мидиновые димеры и гидраты.
Степень деградации оснований квадратично зависит от интенсивности излу-
излучения, что свидетельствует о двухквантовом механизме лазер-индуцированных фо-
фотохимических превращений.
Рис. ХХХ.З.
Синглетный (/) и триплетный (II) каналы
двухступенчатого возбуждения:
So — невозбужденный сннглетный уровень, Si —
первый синглетный возбужденный уровень,
Sn — высоколежащий возбужденный синглетный
уровень, Т\ — первый возбужденный триплетный
уровень, Тп — высоколежаший возбужденный
триплетный уровень
Теоретический анализ процессов, происходящих при ступенчатом поглощении
молекулой двух квантов света, показал, что при пикосекундных импульсах засе-
заселение высоколежащих электронных состояний происходит по синглетному кана-
каналу (So —> Si —> Sn), тогда как при наносекундных импульсах — по триплетному
(So —<¦ Si -* Ti —> Тп) (рис. ХХХ.З). Однако независимо от того, по какому каналу
(S — S или Г — Г) поглощается 2-й квант излучения, в реакциях участвуют, веро-
вероятно, фотоионизированные состояния молекул. В пользу такой точки зрения мо-
могут свидетельствовать экспериментальные данные о сходстве конечных продуктов
лазерного фотолиза и продуктов гамма-радиолиза оснований ДНК, при котором
процессы идут, как известно, через стадию ионизации молекул. На основе этих
данных предложена схема первичных стадий превращений молекулы тимина при
лазерном фотолизе:
ГН
ftv
ГН*
[ГН]+
Возможность фотоионизации оснований при лазерном УФ-облучении можно
показать также, оценивая значение энергии, которую приобретает молекула в ре-
результате поглощения двух квантов излучения. При поглощении тимином, находя-
находящимся в нижнем триплетном состоянии (Е = 3,2 эВ), кванта с длиной волны 266 нм
442
Глава XXX. Фоторегуляторные и фотодеструктивные процессы
D,88 эВ) суммарная энергия молекулы (~ 8 эВ) не достигает значения адиабатного
потенциала ионизации тимина в газовой фазе (~ 8,9 эВ). В конденсированной среде
потенциал ионизации уменьшается за счет взаимодействия образующихся ионов со
средой:
I = Ir-P+-V0,
где 1Г — потенциал ионизации в газовой фазе, Р+ — энергия поляризации среды
катионом, Vq—энергия взаимодействия «избыточного» электрона со средой (для
воды Vq = +1,3). Так как Р+ > 0, то потенциал ионизации тимина в водном растворе
будет ниже 7,65 эВ. Иными словами, поглощение 2-го кванта действительно может
привести к ионизации молекулы.
80
60
40
20
1,8 3,6 5,4 7,2
Доза C65 нм), Дж-м-МО
9,0
Рис. ХХХ.4.
Зависимость фотореактивации дрож-
дрожжей, облученных лазерным УФ B66 нм)
различной интенсивности, от дозы
фотореактивирующего света C65 нм):
1 — 107 Вт ¦ м, 2 — 109 Вт ¦ м, 3 — 5 ¦ 109 Вт ¦
\—? Лазер-индуцированное двухквантовое возбуждение оснований в составе ДНК
приводит к таким ее фотохимическим превращениям, которые не наблюдают-
наблюдаются (либо идут с очень низким квантовым выходом) в случае действии низкоин-
низкоинтенсивного УФ-света. Наряду с деградацией оснований в ДНК выявлены разры-
разрывы N-гликозидной связи с отрывом тимина от цепи ДНК (при низкоинтенсивном
УФ-облучении такой процесс не происходит) и одноцепочечные разрывы. Показано,
что квантовый выход однонитевых разрывов при переходе от низкоинтенсивного
УФ-облучения A Вт/м2) к высокоинтенсивному пикосекундному УФ-облучению
D • 1013 Вт/м2) возрастает от A Ч- 2) • 10~6 до 8 • 10~5. ?
Вклад двухквантовых фотоповреждений ДНК по сравнению с одноквантовыми
(пиримидиновые димеры) в лазерную УФ-инактивацию плазмид, бактериофагов и
микроорганизмов значительно выше. Об этом, в частности, свидетельствуют экспе-
эксперименты по изучению фотореактивации УФ-облученных биологических объектов.
Они показали, что с ростом интенсивности лазерного УФ-излучения B66 нм) сте-
степень фотореактивации резко уменьшается (рис. ХХХ.4). Поскольку при фотореак-
фотореактивации ликвидируются летальные фотопродукты только одного типа — циклобу-
тановые пиримидиновые димеры ДНК, то установленный факт свидетельствует об
уменьшении вклада димеров (и соответственно увеличении вклада двухквантовых
фотоповреждений ДНК) в лазерную УФ-инактивацию.
§ 6. Фотореактивация и фотозащита 443
§ 6. Фотореактивация и фотозащита
Фотореактивация. Это фотобиологический процесс, направленный на устранение
УФ-индуцированных летальных фотопродуктов ДНК. Механизм этого процесса
предполагает участие специального фоточувствительного фермента фотолиазы,
субстратом которого являются только пиримидиновые димеры. Фотореактивация
приводит к распаду димеров пиримидина. Кинетические закономерности реакции
фотоферментативного расщепления димеров соответствуют кинетике классиче-
классических ферментативных процессов, описываемых по схеме Михаэлиса—Ментен:
IP I Q Ч TPQ ^v Z71 | ТУ i"VW d 1\
Л/ -г о t, • Л/О —*• Л/ -\- г. ^Л-Л-Л-.D.IJ
¦\У В случае реакции фотомономеризации димеров каталитический акт в фер-
мент-субстратном комплексе протекает только под действием света C20-
500 нм): фотолиаза работает в электронно-возбужденном состоянии. При этом,
видимо, происходит перенос электрона от фермента к субстрату — димеру. Такую
точку зрения подтверждают данные об ингибировании процесса ферментативного
фоторасщепления димеров активными акцепторами электронов (KNO3 и КС1),
а также результаты модельных экспериментов по фотосенсибилизированному
расщеплению димеров в ДНК некоторыми индольными производными, которое, как
показано, включает стадию переноса электрона от сенсибилизатора к димеру. ?
К настоящему времени фермент, ответственный за фотореактивацию, выделен
из многих биологических объектов, однако его хромофорную группировку уда-
удалось идентифицировать пока только у двух фотолиаз: бактериальной и дрожжевой.
Анализ спектральных свойств этих ферментов позволил отнести их хромофорные
группы к соединениям флавиновой природы: у дрожжевой фотолиазы это восстано-
восстановленный ФАД (ФАДВОС) с максимумом поглощения при 380 нм; а у бактериальной —
производное диазофлавина с максимумом поглощения, зависящим от рН в области
от 375 до 420 нм. Представляют интерес данные о том, что флавиновыи хромофор
в модельной системе обладает способностью к фоторасщеплению пиримидиновых
димеров в ДНК, что может свидетельствовать о его роли как кофактора фотолиазы.
Недавно показано, что, образуя комплекс с димером, фотолиаза связывается с
участком цепи ДНК в ~ 4 пары оснований. При поглощении кванта света фотовоз-
фотовозбужденный флавиновыи хромофор фотолиазы донирует электрон димеру с образо-
образованием аниона пиримидинового димера. Эта форма нестабильна и спонтанно распа-
распадается на два свободных пиримидина плюс электрон. Восстановление флавинового
хромофора может затем происходить путем захвата электрона от распавшегося
аниона димера.
^—р Фотозащита. Помимо фотоферментативного расщепления димеров ДНК (про-
цесс фотореактивации), уменьшить выход этих фотопродуктов в клетках мож-
можно с помощью другого фотобиологического процесса — фотозащиты. Фотозащит-
Фотозащитный эффект заключается в том, что предварительное облучение меток длинновол-
длинноволновым УФ-светом приводит к значительному уменьшению их чувствительности
к летальному действию коротковолнового УФ-излучения. Недавно такой эффект
обнаружен у ряда представителей дрожжевых организмов. ?
444 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
Характерная особенность фотозащитного эффекта заключается в том, что
для его проявления необходим температурно-зависимый интервал времени между
последовательными воздействиями на клетки длинноволнового и коротковолнового
УФ-света. В этот интервал времени в клетках происходит фотоиндуцированное
образование определенного соединения, идентифицированного как 5-окситрипта-
мин, или серотонин. Роль данного соединения в качестве основного интермедиата в
процессе фотозащиты подтверждается следующими результатами. 1. Фотозащита
практически не наблюдается у клеток, дефицитных по предшественникам синте-
синтеза серотонина (триптофан и 5-окситриптофан), однако эффект вновь проявляется
при их экзогенном введении в клетки. 2. Специфический ингибитор цепи синтеза
серотонина полностью снимает эффект фотозащиты. 3. Экзогенно добавленный к
клеткам серотонин вызывает эффект зашиты от УФ-инактивации, аналогичный
фотозащите, т. е. серотонин обладает фотомиметическим действием.
Согласно данным, полученным в опытах in vivo и в модельных экспериментах
(Г. Я. Фрайкин), защитное действие серотонина в процессе фотозащиты осуще-
осуществляется в результате его связывания с ДНК и уменьшения выхода в ней УФ-инду-
УФ-индуцированных пиримидиновых димеров. Спектрофлуориметрический анализ показал,
что серотонин связывается с ДНК интеркаляционным путем. При этом каждая ин-
теркалированная молекула серотонина может уменьшать выход димеров в ДНК на
участке цепи, включающем ~ 4 пары оснований.
§ 7. Действие длинноволнового ультрафиолетового света
на ДНК (фотодинамические реакции)
До сих пор рассматривались только те фотохимические реакции ДНК, которые
индуцируются коротковолновым УФ-светом. Вместе с тем проведенные в последние
годы исследования позволили установить, что фотодеструктивные реакции в ДНК
как in vivo, так и in vitro могут протекать при действии длинноволнового УФ-
света C20-400 нм). Однако для того чтобы наблюдать такие реакции, необходимо
использовать весьма высокие интенсивности и дозы излучения, на 2-3 порядка (по
интенсивности) и 5-6 порядков (по дозе) превышающие значения соответствующих
параметров коротковолнового УФ-излучения.
^—р Длинноволновый УФ-свет индуцирует в ДНК образование двух основных фо-
топродуктов: пиримидиновых димеров и одноцепочечных разрывов. Выход ди-
димеров не зависит от того, в каких условиях производят облучение ДНК — аэробных
или анаэробных, т. е. процесс образовании димеров не является кислродзависимым.
В то же время разрывы наблюдаются только при облучении ДНК в присутствии Ог.
Эти данные свидетельствуют о различных механизмах образования двух типов фо-
фотопродуктов. С другой стороны, очевидно, что в обоих случаях молекула ДНК не
может служить первичным хромофором при действии УФ-излучения длин волн
больше 320 нм, поскольку длинноволновая граница ее поглощения лежит при 300-
310 нм. Следовательно, и димеры, и разрывы должны образовываться не за счет
прямого поглощения квантов молекулой ДНК, а косвенным путем с участием опре-
определенных молекул — хромофоров, тесно связанных с ДНК. ?
Очевидно, что как сами хромофоры, так и механизмы сенсибилизируемых ими
фотохимических реакций, приводящих к образованию димеров и разрывов, должны
§ 7. Действие длинноволнового ультрафиолетового света на ДНК 445
быть различными. Зависимость от Ог выхода разрывов позволяет считать, что
образование этих фотопродуктов идет по фотодинамическому механизму. Такой
механизм, как известно, осуществляется при наличии следующей комбинации фак-
факторов: свет + хромофор + О2.
Молекула возбужденного хромофора (сенсибилизатора) на первичной стации
может либо непосредственно взаимодействовать с субстратом, либо, альтернатив-
альтернативно, с кислородом в реакционной смеси, приводя к образованию активных интер-
медиатов, которые в свою очередь способны реагировать с субстратом. Таким
образом, как и любая фотохимическая реакция, фотосенсибилизированный процесс
имеет начальную «световую стадию», за которой следуют «темновые стадии». Боль-
Большинство фотосенсибилизированных реакций протекает по весьма сложному меха-
механизму, включающему несколько конкурентных процессов. Наиболее характерные
типы первичных реакций, в которые вступают возбужденные (главным образом
триплетные) сенсибилизаторы с молекулами биосубстрата, заключаются либо в пе-
переносе электрона (или атома водорода) (реакции типа I), либо в переносе энергии
(или электрона) на кислород (реакции типа II).
Известно, что молекула в триплетном состоянии способна легче как отнимать
электроны (атомы водорода) от других молекул, так и донировать эти частицы мо-
молекулам субстрата. Эффективность таких реакций зависит от химической структу-
структуры сенсибилизатора и субстрата, а также от условий протекания реакции. Так, фо-
тосенсибилизированные реакции типа I с наибольшей эффективностью протекают
при высокой концентрации субстрата и низкой концентрации кислорода, поскольку
кислород является сильным конкурентом молекулы субстрата за взаимодействие с
триплетным сенсибилизатором. Можно ожидать, что образование нековалентных
комплексов между сенсибилизатором и субстратом до облучения увеличит вероят-
вероятность реакций типа I из-за близости сенсибилизатора к молекулам субстрата. Во-
вторых, наиболее эффективно фотодеградируют по механизму типа I те субстраты,
которые легко окисляются или восстанавливаются.
Главный механизм фотосенсибилизированных реакций типа II заключается в
переносе энергии от триплетного сенсибилизатора на основное состояние кислорода
с образованием электронно-возбужденного синглетного состояния кислорода AО2)
и основного состояния сенсибилизатора:
Синглетный кислород может существовать в двух возбужденных состояниях: од-
одно— 1S+—с более высокой энергией (~ 1,6 эВ), другое — 1Ag—с более низкой
энергией (~ 1 эВ). Время жизни 1Х+-состояния в растворе составляет 0,01-0,1 не,
тогда как 1 Ag-состояние обладает намного более длительным временем жизни (от
2-4 мке в воде до нескольких десятков мке в липидах). Поэтому 1 Ag-состояние явля-
является основной формой синглетного кислорода, участвующей в фотодинамических
реакциях.
Наличие переноса энергии от триплетных сенсибилизаторов на кислород с пе-
переводом его в 1 Ag-состояние показано прямым методом измерения флуоресценции
с максимумом при 1272 нм. Эффективный перенос энергии от 3S на 3О2 возмо-
возможен лишь в том случае, если энергия ^-состояния больше энергии синглетного
уровня кислорода. Поскольку для молекулы кислорода величина энергии перехода в
446 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
1 Ag-состояние весьма мала, практически любая органическая молекула, находяща-
находящаяся в триплетном состоянии, способна сенсибилизировать образование синглетного
кислорода.
Выше отмечалось, что к механизму фотосенсибилизации типа II можно отне-
отнести и реакции, в которых происходит перенос электрона от молекулы триплетного
сенсибилизатора на кислород:
Образующийся супероксидный радикал (О^~) является относительно долгоживущей
формой кислорода (~ 2 мс при физиологических рН), и в принципе способен вызы-
вызывать депротонирование некоторых молекул:
6^ -ЬАН^НО^ +А~,
где НО^~ — гидропероксид.
Однако, поскольку он характеризуется относительно низкой реакционной
способностью, его повреждающее действие на биоструктуры реализуется главным
образом за счет образования других реакционноспособных частиц (НО^~, Н2О2, ОН),
и в первую очередь гидроксильного радикала ОН, который может образовываться
из О^~ в катализируемых ионами железа реакциях Хабера-Вайса:
Н2О2 + Fe2+ -* ОН + ОН" + Fe3+.
где Н2О2 (перекись водорода) является продуктом либо дисмутации
6^- + н+ + но2 -* н2о2 + о2,
либо его одноэлектронного восстановления:
Наиболее реакционноспособный радикал ОН легко (с константами скорости, близ-
близкими к диффузионно-контролируемым) взаимодействует с большинством биомоле-
биомолекул, отрывая ияи присоединяя атом водорода. В воде время жизни ОН < lfi с, вслед-
вследствие чего он, как и синглетный кислород, реагирует с молекулами биосубстрата в
ближайшем микроокружении.
При фотосенсибилизированном образовании кислородо-зависимых одноцепо-
чечных разрывов в ДНК в качестве эндогенных сенсибилизаторов могут выступать
такие распространенные биохимические компоненты, как НАД • Н, 4-тиоуридин и 2-
тиоурацил, которые имеют максимумы поглощения в длинноволновой УФ-области
спектра (при ~ 340 нм). Установлено, что фотосенсибилизированная этими соеди-
соединениями инициация разрывов в ДНК осуществляется по фотодинамическому меха-
механизму с участием активированных форм кислорода. При этом первичной фотогене-
рируемой формой кислорода является супероксидный анион-радикал (О^~). Однако
0^ обладает сравнительно малой реакционной способностью. Поэтому в качестве
непосредственного инициатора разрывов в ДНК выступает его значительно бо-
более реакционноспособный продукт — радикал ОН. В соответствии с полученными
§ 8. Действие ультрафиолетового света на белки 447
данными, фотосенсибилизированные реакции образования кислородных радикалов,
приводящие к одноцепочечным разрывам в ДНК, можно представить в виде следу-
следующей схемы:
s J^ s* % s+ + 62- -*> н2о2 —*> он
{
ДНК
I
Одноцепочечные
разрывы
Отсутствие зависимости от О2 выхода пиримидиновых димеров при облуче-
облучении ДНК длинноволновым УФ-светом свидительствует о том, что их образование
осуществляется не по фотодинамическому механизму, а путем молекулярной фото-
фотосенсибилизации, при которой энергия возбуждения с молекулы хромофора, погло-
поглотившей квант света, переносится на пиримидиновое основание ДНК. (Выше был
рассмотрен пример образования димеров по такому механизму, когда в качестве
первичного хромофора-сенсибилизатора выступала молекула ацетофенона).
\—? Индуцируемые длинноволновым УФ-светом повреждения ДНК обусловливают
инактивирующий, летальный и мутагенный эффекты при действии этого из-
излучения на трансформирующую ДНК, бактериофаги и микроорганизмы. Сильная
зависимость фотобиологических эффектов от О2, а также отсутствие фотореакти-
фотореактивации позволяют считать, что основными летальными фотопродуктами являются
одноцепочечные разрывы ДНК, а не пиримидиновые димеры, как это имеет место
в случае действия коротковолнового УФ-излучения. Роль разрывов в инактивирую-
щих эффектах длинноволнового УФ-света подтверждается данными о совпадении
спектров действия фотоинактивации биологических объектов со спектром действия
образования разрывов в ДНК. ?
Рассмотренный выше материал свидетельствует о том, что фотодеструктив-
фотодеструктивные реакции в ДНК индуцируются не только коротковолновым, но и длинновол-
длинноволновым УФ-излучением. Поскольку большинство биологических систем подверга-
подвергается действию солнечного света, необходимо детально исследовать молекулярные
механизмы биологических эффектов длинноволнового УФ. Это тем более важно,
что длинноволновое УФ-излучение является эффективным в индукции эритемы и
рака кожи человека и животных, особенно при его комбинированном действии со
средневолновым УФ B90-320 нм), приводящем к синергическим эффектам.
Такого рода синергические фотодеструктивные реакции обнаружены также
при комбинированном действии различных длин волн УФ-спектра на ДНК, бак-
бактериофаги, микроорганизмы и некоторые другие биологические системы. Однако
механизмы, лежащие в основе этих реакций, в настоящее время исследованы мало.
§ 8. Действие ультрафиолетового света на белки
¦\У Второй внутриклеточной мишенью при действии УФ-излучения на биологиче-
ские системы являются белки. УФ-свет инактивирует белки по однокванто-
вому, одноударному механизму с квантовым выходом для разных белков от 10~2
до 103. Чтобы идентифицировать природу белковых хромофоров, взаимодействие
448 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
света с которыми приводит к инактивации белков, нужно наряду со спектром дей-
действия процесса измерять степень фотоповреждения различных аминокислот при
разных длинах волн и дозах УФ-излучения. Использование такого подхода позволя-
позволяет выявить роль определенных аминокислотных остатков в поддержании нативной
структуры белков или ферментов. ?
Если принять, что из щ остатков какой-то аминокислоты в белковой молекуле
т,{ остатков существенны для сохранения ее интактности и «поперечное сечение»
разрушения этих остатков (а,) — величина постоянная, то сумма поперечных сече-
сечений фотолиза всех остатков данной аминокислоты будет равна
<3\ГП\ + О2ГП2 + ¦ ¦ ¦ + ОпШп = ^2 aimi- (ХХХ.8.1)
%
Так как при УФ-облучении белков фотолизу подвергаются главным образом три-
триптофан и цистин, то выражение для поперечного сечения инактивации белка (о^)
можно записать в следующем виде:
<*б = <Зтри1Птри + Оцис™цис- (XXX.8.2)
Величину аб можно определить из дозовой кривой инактивации белка, а значе-
значения отри и оцис — из дозовых кривых фотолиза триптофанового и цистинового
остатков в данном белке. Однако остается невыясненным, какие именно остатки
триптофана и цистина являются «существенными» для инактивации белка. Решение
этого вопроса возможно при использовании монохроматического облучения белка
УФ-светом различных длин волн, которые по-разному поглощаются триптофаном
и цистином (например, 254 нм и 280 нм). В данном случае значения oq определяют
для обеих длин волн УФ-света:
°б54 = <$%v.mmpu + °2ц5иСгпцис; (ХХХ.8.3)
°Г = о^°риттри + <°cm4UC;. (ХХХ.8.4)
Из этих уравнений можно найти значения двух искомых величин: ттри и тцис.
С помощью этого подхода показано, например, что в тринсине разрушение одного
остатка триптофана (из четырех) и одного остатка цистина (из шести) приводит к
фотоинактивации фермента. В пепсине существенным для фотоинактивации ока-
оказалось разрушение только одного остатка триптофана.
^—р Итак, именно фотолиз триптофана и цистина имеет первостепенное значение
в фотоинактивации белков. Учитывая это, рассмотрим механизмы первичных
УФ-индуцированных процессов в этих аминокислотах. ?
В настоящее время доказано, что основной первичной фотореакцией трипто-
триптофана (АН) в белке является его фотоионизация с образованием катион-радикала и
сольватированного электрона:
АН + /iv -* АН* -* АН+ + е~. (ХХХ.8.5)
При комнатной температуре эта реакция протекает за 5-20 мкс и может быть
исследована только с использованием метода флеш-фотолиза. Показано, что через
§ 8. Действие ультрафиолетового света на белки 449
5 мкс после УФ-облучения в растворе триптофана появляются характерные мак-
максимумы поглощения в красной и дальней красной области спектра, которые при-
принадлежат сольватированному электрону, т. е. электрону, «выбитому» из молекулы
аминокислоты и захваченному дипольными молекулами растворителя. Сольватиро-
ванный электрон быстро реагирует с другими молекулами, в частности, с молеку-
молекулами растворителя и Ог, вследствие чего полоса его поглощения исчезает. Однако
если облучать замороженные образцы триптофана при температуре жидкого азота
(в этих условиях сольватированные электроны не рекомбинируют), то поглощение
сольватированного электрона (максимум при 600 нм) можно зарегистрировать и на
обычном спектрофотомере. Кроме того, наличие некомпенсированного магнитного
момента (спин) у сольватированного электрона позволяет обнаружить его мето-
методом ЭПР.
При облучении реакционной смеси из сольватированного электрона и катион-
радикала триптофана красным светом, поглощаемым сольватированным электро-
электроном, происходит обратная фотохимическая реакция с образованием исходной ами-
аминокислоты:
es + АН+ + hv^e*s + АН+ -+¦ АН* -+¦ АН. (ХХХ.8.6)
При этом часть молекул аминокислоты оказывается в возбужденном состоянии,
о чем свидетельствуют ее УФ-флуоресценция и синяя фосфоресценция (процесс
фотоиндуцированной люминесценции):
АН + ftvi (Флуоресценция)
У"
АН* (ХХХ.8.7)
AHV ->¦ АН + /п»2 (Фосфоресценция)
Рекомбинация сольватированного электрона и катион-радикала триптофана
происходит и спонтанно за счет термической активации выхода электрона из ло-
ловушки. В результате наблюдается рекомбинационное свечение, активируемое при
нагревании (термолюминесценция):
АН+ + es >80K- AW -* АН + /iv. (XXX.8.8)
Исследование рассмотренных выше процессов позволило получить данные о
механизме образования катион-радикала триптофана АН+. Линейная зависимость
от интенсивности УФ-света интенсивности термолюминесценции и фотоиндуциро-
фотоиндуцированной люминесценции триптофана в замороженных водных растворах свидетель-
свидетельствовала о том, что его фотоионизация в этих условиях осуществляется по одно-
квантовому механизму, причем предшественником катион-радикала является, веро-
вероятно, синглетное возбужденное состояние триптофана. Последнее подтверждается
опытом, в котором показано, что увеличение темнового интервала между УФ-облу-
чением замороженного водного раствора триптофана и действием красного света
в пределах времени жизни триплетных состояний триптофана F мкс) не приводит
450 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
к возрастанию интенсивности фотоиндуцированной люминесценции, отражающей
концентрацию АН+. Однако в сильнощелочных замороженных растворах трипто-
триптофана интенсивность термолюминесценции и поглощение сольватированного элек-
электрона при 600 нм квадратично зависит от интенсивности УФ-света, что указывает
на возможность фотоионизации молекулы по двухквантовому механизму. В этом
случае поглощение 2-го кванта происходит, видимо, на триплетном уровне:
So + hv vSi ^Тг+hv ^Тп ^AE++es. (XXX.8.9)
Кроме того, в водно-солевых (NaCl) замороженных растворах триптофана скорость
образования АН+ нелинейно зависела от интенсивности УФ-света со степенным
показателем в пределах от 1 до 2, что указывает как на одноквантовые, так и
двухквантовые реакции. Следовательно, при ионизирующем действии УФ-света на
замороженные растворы триптофана электрон может отрываться как от синглет-
но-, так и от триплетно-возбужденной молекулы.
Что касается фотоионизации триптофановых остатков в белке при физиоло-
физиологических условиях, то она осуществляется, вероятно, только по одноквантовому
механизму с участием синглетных возбужденных состояний молекул. В пользу этого
свидетельствуют, в частности, экспоненциальные зависимости от дозы УФ-света
как фотолиза триптофановых остатков, так и фотоинактивации белков. Предпола-
Предполагают, что возникающий в белках под действием УФ-света катион-радикал трипто-
триптофана диссоциирует на протон и нейтральный радикал, который, взаимодействуя с
соседними группами полипептидной цепи, образует межмолекулярную ковалентную
«сшивку» — стабильный фотопродукт:
АЕ+ -* Н+ + А Д- А-В. (ХХХ.8.10)
Если фотолизу подвергается триптофан, входящий в состав активного центра
фермента, то этого, очевидно, достаточно, чтобы вызвать потерю его фермента-
ферментативной активности. В том случае, когда происходит фотиразрушение триптофана
вне активного центра, такая сшивка может изменить водородные, гидрофобные и
другие слабые связи, поддерживающие нативную конформацию белковой макромо-
макромолекулы, что также приведет к потере ее ферментативной активности.
Рассмотренный механизм прямого фотолиза триптофана — не единственная
причина повреждающего действия УФ-излучения на белки. Второй механизм фо-
фотоинактивации белков связан с фотосенсибилизированными реакциями при уча-
участии сольватированного электрона. Последний, будучи сильным восстановителем,
активно реагирует с различными соединениями, обладающими высоким сродством
к электрону, и прежде всего — с растворенным Ог, образуя СЬ и гидроперекисный
радикал НО2: +
ё3 + 0=0 -* 0-0^ -±2-~ НО-6. (ХХХ.8.11)
Однако реакции с участием молекулярного кислорода вносят незначительный вклад
в процесс УФ-инактивации белков. Так, фотоинактивация трипсина проходит при-
примерно с одинаковым квантовым выходом в присутствии кислорода @,026) и в вакуу-
мированных растворах @,028). Наибольшее значение имеет взаимодействие сольва-
сольватированного электрона непосредственно с аминокислотными остатками белковой
i 8. Действие ультрафиолетового света на белки
451
макромолекулы. При этом вероятность такого взаимодействия в зависимости от
сродства той или иной аминокислоты к сольватированному электрону может быть
различной. Поскольку наибольшим сродством к сольватированному электрону обла-
обладает цистин, можно ожидать, что именно эта аминокислота будет в первую очередь
разрушаться в результате взаимодействия с сольватированным электроном.
Av B80 нм)
Av B54 нм)
АН
АН+
А + Н+
¦ АН+ + eg
S-S-связь цистина
Радикалы цистина
Разрыв S-S-связи
Разрушение активного
центра или изменение
конфирмации белка
Инактивация
Рис. ХХХ.5.
УФ-инактивация белков: АН-триптофан
Использование методов флеш-фотолиза и ЭПР позволило изучить механизм
взаимодействия сольватированного электрона с цистином, который включает обра-
образование свободных радикалов по схеме
i?-CH2-S-S-CH2-i?
(i?-CH2-S-S-CH2-i?)-
радикал цистина
-* i?-CH2-S" +
цистеин
S-CH2-i? (XXX.8.12)
радикал цистеина
Дисульфидные группы белка могут разрушаться не только за счет фотосенси-
билизированных реакций, но и вследствие прямого фотолиза. Наиболее эффектив-
эффективной в этом процессе является спектральная область, где максимально поглощает
свет цистин, т. е. короче 260 нм. УФ-свет этих длин волн (например, 254 нм) осо-
особенно активен в инактивации белков, поскольку квантовый выход фотолиза цистина
на порядок превышает таковой для триптофана. В соответствии с приведенными
выше данными процесс фотоинактивации белков можно представить в виде общей
схемы (рис. ХХХ.5).
452 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
§ 9. Действие оптического излучения на биологические мембраны
Согласно полученным в последнее время данным, мембранные структуры клеток
служат важной критической мишенью при действии оптического излучения — как
УФ-, так и видимого диапазонов. Мембраны выполняют в клетке в первую очередь
барьерную функцию, основанную на их низкой проницаемости для полярных моле-
молекул и ионов. Оптическое излучение при определенных дозах вызывает увеличение
проницаемости мембран для различных веществ, и прежде всего для ионов. Фото-
индуцированное изменение ионной проницаемости клеточных мембран обнаружено
у самых разнообразных биологических объектов — от микроорганизмов до клеток
растительных и животных организмов.
Действие УФ-излучения. Вызываемые УФ-излучением процессы изменения
ионной проницаемости мембран наиболее подробно исследованы на животных
клетках. Полученные результаты свидетельствуют о связи нарушения барьерной
функции мембран главным образом с фотолизом липидов. Так, на эритроцитарных
мембранах показано, что при дозе УФ-облучения B54 нм, 20 кДж/м2) ~ 90%
каналов К+- и Ма+-проницаемости в них возникает за счет фотолиза липидов;
остальная часть таких каналов может быть отнесена к прямой фотомодификации
мембранных белков.
Основной путь фотолиза мембранных липидов заключается в перекисном фо-
фотоокислении цепей полиненасыщенных жирных кислот фосфолипидов. Результатом
такого фотоокисления является образование гидроперекисей и продуктов их даль-
дальнейшего превращения. При этом протекают две фотохимические реакции: кислоро-
дзависимая цепная реакция перекисного окисления, заканчивающаяся образованием
гидроперекисной, и реакция разложения гидроперекисей, при которой накаплива-
накапливаются самые разнообразные продукты, в частности альдегиды и кетоны. Гидропе-
Гидроперекиси поглощают при 233 нм и после добавления к ним солей Fe2+ дают вспыш-
вспышку хемилюминесценции; продукты 2-й реакции обладают поглощением в области
260-280 нм и характеризуются способностью давать окраску с 2-тиобарбитуровой
кислотой — реагентом на диальдегидную группу —СО—СО— (ТБК-активные про-
продукты).
Процесс перекисного окисления липидов является фотосенсибилизированным,
так как ненасыщенные жирные кислоты, не обладая способностью поглощать свет
в средневолновой и длинноволновой области УФ-спектра, подвергаются перекис-
ному фотоокислению при облучении в данной области спектра. Наиболее вероят-
вероятными фотосенсибилизаторами могут быть продукты собственного окисления ли-
липидов (прежде всего гидроперекиси), которые практически всегда присутствуют в
мембранах животных клеток и их органелл. Механизм сенсибилизации липидов к
УФ-излучению собственными продуктами окисления состоит в фотоинциировании
цепей окисления ненасыщенных жирных кислот свободными радикалами, генери-
генерируемыми из гидроперекисей (см. §4 гл. XVI).
Важной особенностью перекисного фотоокисленин липидов в мембранах жи-
животных клеток является ингибирование процесса антиоксидантами (например, а-
токоферолом) и зависимость скорости его протекания от структурного состояния
мембран, контролируемого, в частности, температурой. Показано, что возрастание
степени перекисного окисления липидов при температурах выше 20-25° С, харак-
§ 9. Действие оптического излучения на биологические мембраны 453
терное для мембран микросом, митохондрий и эритроцитов, связано не с измене-
изменением конформации белков, а со структурной перестройкой липидной зоны мембра-
мембраны, поскольку аналогичный эффект наблюдается и на липосомах, сформированных
только из липидов.
При изучении влияния температуры на скорость перекисного фотоокисления
липидов и УФ-индуцированное изменение ионной проницаемости эритроцитов,
определяемой по скорости их гемолиза, выявлена близкая корреляция в зависи-
зависимости этих процессов от температуры. Такая же закономерность обнаружена
и при изучении влияния кислорода и экзогенных антиоксидантов: удаление Ог
прекращает перекисное фотоокисление липидов в мембранах эритроцитов и резко
снижает скорость их гемолиза; а-токоферол тормозит перекисное фотоокисление
липидов и заметно уменьшает степень гемолиза эритроцитов.
При обсуждении возможных путей реализации повреждающего действия пе-
перекисного фотоокисления липидов на биомембраны выдвигают предположение о
существовании двух различных механизмов. Один из них заключается, вероятно, в
нарушении свойств самой липидной зоны мембраны. В пользу этого свидетельству-
свидетельствует тот факт, что возрастание ионной проницаемости наблюдается на искусственных
липидных мембранах при протекании в них перекисного фотоокисления липидов.
Второй механизм, видимо, связан с разрушением белковых SH-групп, необходимых
для сохранения барьерных свойств мембран. Косвенно на это указывают данные о
более высоком квантовом выходе разрушения тиолов мембран @,18) по сравнению
с таковым в случае УФ-облучения тиолов белков в растворе @,03).
В отличие от мембран животных клеток, мембраны растительных клеток по
критерию изменения их ионной проницаемости обнаруживают значительно более
высокую квантовую чувствительность при действии УФ-излучения. Так, увеличе-
увеличение проницаемости плазматической мембраны растительных клеток для различных
ионов (К+, Na+, Cl~, НСО^~) и ее деполяризация наблюдаются уже при таких дозах
УФ света B54 нм, 500-2000 Дж/м2), которые на порядок ниже доз УФ-излучения,
приводящих к изменению барьерных свойств мембран животных клеток.
На культивируемых in vitro растительных клетках показано, что УФ-индуци-
рованный выход К+ во внеклеточную среду идет со скоростью 5 • 10~10 мкмоль/мин
на клетку и сопровождается выходом в среду НСО^~, образующегося в ходе реакции
гидратации СО2:
н2о + со2 -* н+ + нсо^.
Это, в свою очередь, вызывает уменьшение цитоплазматического рН, зарегистри-
зарегистрированного методом 31Р-ЯМР.
Природа отмеченных изменений исследована в экспериментах с изолирован-
изолированными плазматическими мембранами. Оказалось, что наиболее чувствительным к
УФ-облучению компонентом является АТФаза, связанная с трансмембранным ион-
ионным транспортом, причем ее фотоинактивация происходит в результате прямо-
прямого поглощения квантов УФ-света. В пользу этого свидетельствует тот факт, что
чувствительность АТФазы к УФ была одинаковой при облучении как мембран,
так и раствора очищенного фермента. На основании снятого спектра действия
УФ-инактивации мембранной АТФазы предполагают, что ее хромофором является
триптофан.
454
Глава XXX. Фоторегуляторные и фотодеструктивные процессы
Таблица XXX. 1.
Основные фотодеструктивные реакции и типы повреждений в биологических ма-
макромолекулах и мембранах, индуцируемые излучением различных областей УФ-
спектра
Вид УФ
Коротковол-
Коротковолновый УФ
(< 290 нм)
Длинновол-
Длинноволновый УФ
C20-400 нм)
Биологические структуры
ДНК
Фотодимеризация ос-
оснований (пиримиди-
новые димерыI'2-*
Одноцепочечные раз-
разрывы
белки
Фотолиз триптофа-
новых и цистиновых
остатков (радикалы
триптофана и цисти-
на, межмолекулярные
ковалентные сшивки)
мембраны
животных клеток
Перекисное фотооки-
фотоокисление липидов (гид-
(гидроперекиси, ТБК-ак-
тивные продукты)
Перекисное фотооки-
фотоокисление липидов (гид-
(гидроперекиси)
растительных
клеток
Фотоинак-
Фотоинактивация
АТФазы
) Реакция фотообратима, димеры мономеризуются фотолиазой в процессе фотореактивации
(см. §6 этой главы).
2) Выход димеров может быть уменьшен при связывании серотонина с ДНК в процессе фотоза-
фотозащиты (см. §6 этой главы).
Изложенные выше данные об основных фотодеструктивных процессах, проте-
протекающих в биологических структурах под действием УФ излучения, суммированы
в табл. XXX. 1.
Действие видимого света. Индуцируемые видимым светом деструктивные ре-
реакции в биологических мембранах наиболее эффективно протекают при облучении
биологических систем в присутствии экзогенных сенсибилизаторов и кислорода.
Фотодинамические эффекты такого рода оказываются столь сильными, что их
можно использовать для фототерапии опухолей — метода, в основе которого ле-
лежит разрушение опухолевых клеток видимым светом в присутствии порфириновых
молекул, способных достаточно избирательно накапливаться в опухолевой ткани.
Эффективность фотосенсибилизируемых порфиринами процессов в мембранах
определяется в первую очередь чувствительностью к фотоповреждению их главных
компонентов — липидов и белков. В липидах высокую чувствительность к сенсиби-
сенсибилизированному фотоокислению проявляют ненасыщенные жирные кислоты и хо-
холестерин. Процессы сенсибилизированного фотоокисления ненасыщенных жирных
кислот фосфолипидов протекают по механизму свободнорадикального перекисного
фотоокисления липидов. Так, при облучении видимым светом эритроцитов боль-
больных эритропоэтической протопорфирией, содержащих повышенные концентрации
эндогенного протопорфирина, а также теней нормальных эритроцитов в сочета-
сочетании с экзогенным сенсибилизатором тетрасульфофенилпорфином (ТСФП), в них
выявлены характерные продукты перекисного окисления липидов — гидроперекиси
и малоновый диальдегид. Как показано в экспериментах с использованием ТСФП,
накопление ТБК-активных продуктов продолжается и после помещения облученных
образцов в темноту, что отражает инициацию аутоокисления липидов первичными
фотопродуктами.
§ 9. Действие оптического излучения на биологические мембраны 455
Для выяснения механизма инициации фотосенсибилизируемого ТСФП пере-
кисного окисления липидов исследовано влияние супероксиддисмутазы, каталазы и
азида натрия на этот процесс. Оказалось, что ферменты, катализирующие реакции
разложения 0^ и Н2О2, не изменяют кинетику накопления ТБК-активных продук-
продуктов, тогда как тушитель синглетного кислорода (азид) резко ингибирует процесс.
Эти данные можно рассматривать как указание на участие 'Ог в фотосенсиби-
лизированном ТСФП образовании продуктов перекисного окисления липидов, т. е.
о реализации в данном случае фотодинамической реакции типа П. Вместе с тем,
как показано в модельных экспериментах по облучению липосом в присутствии ге-
матопорфирина, тип фотосенсибилнзированной реакции окисления липидов может
зависеть от соотношения концентраций сенсибилизатора и липидов. Когда оно мало,
сенсибилизатор находится в липидной фазе в мономерной форме, и процесс идет в
основном по механизму типа П. При относительно больших концентрациях гема-
топорфирина в липосомах образуются агрегаты сенсибилизатора, и преобладает
реакция типа I.
Сенсибилизированное фотоокисление липидов вызывает увеличение вязкости
липидной фазы мембран, а также их структурные изменения, что приводит к рез-
резкому снижению барьерных свойств липидных бислоев.
В мембранных белках фотосенсибилизированные изменения проявляется в пер-
первую очередь в образовании ковалентных сшивок между различными полипептидны-
полипептидными цепями, о чем свидетельствует появление на гель-электрофореграммах высоко-
высокомолекулярных агрегатов белков. Ряд данных показывает, что эти сшивки не зависят
от фотосенсибилизированного окисления липидов в мембранах. Так, фотосенсиби-
лизированное сшивание перефирического белка спектрина происходит примерно
с одинаковой скоростью при облучении его раствора и мембран. При помещении
облученных образцов в темноту процесс сшивания мембранных белков прекраща-
прекращается, несмотря на продолжающееся аутоокисление липидов. Выход фотосенсибили-
зированных сшивок белков не зависит от добавок антиоксидантов, ингибирующих
фотоокисление липидов. Заметное сшивание мембранных полипептидов наблюдает-
наблюдается уже при дозах облучения, при которых образование ТБК-активных продуктов
обнаружить еще не удается.
В основе сшивания полипептидов лежат фотодинамические процессы, иници-
инициируемые главным образом синглетным кислородом. Константы скорости реакции
1Ог с белками весьма велики A09-1010 М~1с~1), на несколько порядков выше,
чем с другими биологически важными молекулами. Эти и обусловливает высо-
высокую эффективность повреждения мембранных белков при фотосенсибилизации.
Особенно сильно фотоокисля-
ются такие остатки белков, н
как цистеин, гистидин и три-
триптофан. Именно с окислением R—^ Jl^ + О2
этих аминокислотных остатков
главным образом связано фо-
тосенсибилизированное сшива-
сшивание белков. В качестве примера гистидин
приведена схема фотоокисления эндопероксид
гистидина.
456 Глава XXX. Фоторегуляторные и фотодеструктивные процессы
Фотосенсибилизированные сшивки полипептидов в мембранах являются, по-
видимому, причиной нарушения их транспортных свойств.
Рассмотренные процессы фотосенсибилизированного окисления белков и липи-
дов мембран, приводящие к потере их важнейших функциональных свойств, могут
обусловливать гибель клеток при фотодинамическом действии видимого света.
Фотодинамические эффекты наблюдаются и при облучении биологических
систем видимым светом без добавленных сенсибилизаторов. Недавно такой эффект
подробно исследован на дрожжевых клетках. На основании изучения спектра
действия фотоинактивации клеток, обнаружившего близкое сходство со спектром
поглощения порфирина, выделенного из плазматических мембран дрожжей, сделано
заключение, что этот пигмент выполняет роль эндогенного фотосенсибилизато-
фотосенсибилизатора. Показано также, что основным инициатором фотодеструктивных реакций,
приводящих к нарушению барьерной функции плазматических мембран, является
1Ог, фотогенерируемый порфирином. Как установлено в экспериментах с изоли-
изолированными плазматическими мембранами, фотосенсибилизированное изменение
их проницаемости обусловлено главным образом процессом перекисного фотооки-
фотоокисления липидов. На основании зарегистрированного методом ЭПР ограничения
подвижности спинового зонда E-доксилпальмитат) сделан вывод о том, что пере-
кисное фотоокисление липидов сопровождается увеличением вязкости мембраны.
Выше уже отмечалось, что фотодинамические реакции с участием экзогенных
сенсибилизаторов порфириновой природы лежат в основе фототерапии опухолей.
В последнее время разрабатываются основы нового модифицированного метода
фотодинамической терапии, в котором в роли фотосенсибилизатора выступает
эндогенный протопорфирин IX.
Свободные фотодинамически активные эндогенные порфирины являются пред-
предшественниками на путях синтеза функционально активных металлопорфиринов.
Так, протопорфирин IX служит непосредственным предшественником при образо-
образовании гемов. Скорость синтеза гемов и, соответственно, интермедиатов порфирино-
порфириновой природы, определяется уровнем активности фермента синтазы 5-аминолевули-
новой кислоты. Эта стадия, являющаяся узким местом синтеза тема и находящаяся
под контролем со стороны конечного продукта, может быть преодолена при вве-
введении в организм экзогенной 5-аминолевулиновой кислоты. Это соединение само
по себе не обладает фотодинамической активностью, однако в его присутствии
происходит избыточный синтез и внутриклеточное накопление (преимущественно
в раковых клетках) достаточных для эффективной фотосенсибилизации количеств
протопорфирина IX. Индуцированный биосинтез порфиринов и последующие фото-
фотодеструктивные реакции делают также возможным использование 5-аминолевулино-
5-аминолевулиновой кислоты в качестве гербицида и инсектицида.
Рекомендуемая литература
К разделу VI
Антонов В. Ф., Смирнова Е. Ю., Шевченко Е. И. Липидные мембраны при фазовых превращени-
превращениях. М., Наука, 1992
Болдырев А. А., Курелла Е.Г., Павлова Т.Н., Стволинский С. Л., Федосова Н. У. Биологические
мембраны. М., 1992
Геннис Р. Биомембраны. Молекулярная структура и функция. М.: Мир, 1997
Ивков В. Г., Берестовский Г.Н. Липидный бислой биологических мембран. М., 1982
Кагава Я. Биомембраны. М.: Высшая школа, 1985
К разделу VII
Албертс В., Брей Д., Льюис Док., Рэфф М., Роберте К., Уотсон Дж. Молекулярная биология
клетки. Т. 1-3. М.: Мир, 1994.
Иваницкий Г. Р., Кринский В. И., Сельков Е.Е. Математическая биофизика клетки. М., 1978
Колье О.Р, Максимов Г. В, Раденович Ч.Н. Биофизика ритмического возбуждения. М.: МГУ,
1993
Максимов Г. В., Орлов С. Н. Транспорт ионов кальция при функционировании нервного волокна:
Механизмы и регуляция. М.: МГУ, 1994
Маркин В. С, Пастушенко В. Ф., Чизмаджев Ю.А. Теория возбудимых сред. М.: Наука, 1974
Овчинников Ю. А., Иванов В. Т., Шкроб А. М. Мембранно-активные комплексоны. М.: Наука, 1974
Ходжкин А. Нервный импульс. М.: Наука, 1965
НШе В. Ionic Channels of Excitable Membranes. Sinauer Associates Inc., 1992
Huguenard J., McCormik D.A. Electrophysiology of the Neuron. Interactive Tutorial. Oxford, New
York, 1994
К разделу VIII
Бэгшоу Л. Мышечное сокращение. М., 1985
Блюменфельд Л. А. Проблемы биологической физики. М., 1977
Волькенштейн М.В. Биофизика. М.: Наука, 1988
Николе Д. Д. Биоэнергетика: Введение в хемиосмотичекую теорию. М.: Мир, 1967
Рекер Э. Биоэнергетические механизмы: новые взгляды. М., 1979
Рубин А. Б., Шинкарев В. П. Транспорт электронов в биологических системах. М., 1984
Скулачев В. П. Энергетика биологических мембран. М., Наука, 1989
Хилл А. Механика мышечного сокращения. М., 1985.
Lehninger A., Nelson D., Cox M. Principles of Biochemistry. New York, Worth Publishers, 1997
Molecular Mechanisms in Bioenergetics. (Ed. Ernster, Ed.) Amsterdam, Elsevier, 1992
Nelson N. Structure, Function and Evolution of Proton-ATPase // Plant Physiol. 86 A988), № 1
К разделу IX
Говинжди А. Фотосинтез. Кн. I, П. М., 1987
Клейтон Р. Фотосинтез. Физические механизмы и химические модели. М., 1984
Холл Д., Рао К. Фотосинтез. М., 1983
The Photosynthetic Reaction Center. Vol. I, II. Acad. Press, 1993
The Reaction Center of Photosynthetic Bacteria—Structure and Dynamics. (M.-E. Michel-Beyerle, Ed.)
Berlin, Springer-Verlag, 1996
458 Рекомендуемая литература
К разделу X
Балашов СП., Литвин Ф. Ф. Фотохимические превращения бактериородопсина. М., 1985
Молекулярные механизмы биологического действия оптического излучения. (Под ред. А. Б. Рубина).
М., 1987
Синещеков В. А. Система фитохромов: фотобиофизика и фотобиохимия in vivo // Биологические
мембраны 15 A998), №5, с. 549-572
Kohen E., Santus R., Hirschberg J. S. Photobiology. Acad. Press, 1995
Lanyi J. K. Understating Structure and Function in the light-driven Proton pump bacteriorhodopsin //
Journal of Structural Biology 124 A998), p. 164-178
Photophysics and Photochemistry of Retinal Proteins. (M. Ottolenghi & M. Sheves, Ed.) // Israel Journal
of Chemistry 34 A995), p. 3-4
Stryer L. Molecules of Visual Excitation // Scientific American A987) July
Предметный указатель
1)
Автоколебания 195
Автокорреляционная функция 141
Автомодельная переменная 200
Адсорбция 18
Аденилатциклаза 259
АДФ 218
Активация и инактивация каналов 178
Активированные формы кислорода 61
Активный транспорт кальция 157
Актин 225
Акцепторы электронов 320
Аламетицин 109
Амфифильные молекулы 19
Анестетики местные 137
Антиоксиданты 67
Апоптозис 65
Аскорбат-пероксидаза 68
АТФ 217
АТФ-синтетаза 207
АТФаза 210
Ауксин 430
Ацетилхолин, фотомиметические свойства
428
Вактериородопсин 164, 388
— начальные стадии фотопревращений
400
— первичный акт фотоцикла 393
— сверхбыстрые структурные изменения
402
— термостабильность 390
— фотохимический цикл превращений 388
— фотоцикл 393
Вактериофеофитин 285*
Вактериохлорофилл 285*, 296
Вато-продукт, образование 420
Ватородопсин 421
Белок-белковые взаимодействия 57
Вислойные липидные мембраны (ВЛМ) 15,
103
Блокировка и насыщение канала 117
— каналов фармакологическими агентами
136
Валиномицин 104
Ван-дер-ваальсовы силы 16
Везикулы, образование 14*
Взаимодействие латеральное (тангенци-
(тангенциальное) 20
— межмембранное 20
— трансмембранное 20
— клеточных мембран 46
Внутримолекулярная энергия цепи 55
Вода свободная 8
— связанная, свободная и захваченная 7
— слабосвязанная 8
Водородные связи 313, 362, 390
Возбужденное электронное состояние 277
Вольтамперные характеристики канала 99
Воротный ток 180
Время корреляции вращательного движе-
движения 23
Вязкость 24, 49
Гидратационные силы 57
Гидратация липидов 57
— ионов 78
Гидроксильный радикал 62, 446
Гидрофобные взаимодействия в мембранах
19
Гидрофобный эффект 12
Гипотеза петли 47
Гистерезис 54
Глутатионпероксидаза 67
Гормоны 258
Гош-конформация 47
Гош-транс переход 34
Грамицидин А 106
Граница раздела фаз 81
Граны 294
1'Звездочкой отмечены те страницы, на которых помещены рисунки или таблицы
460
Предметный указатель
Давление гидродинамическое 16
— расклинивающее 22
Движение клеток 42
Двойной электрический слой 85, 89
Двумерный кристалл (гель) 47
Двухфотонное возбуждение 278
Деформация мембран 37, 44
Дзета-потенциал 91
Димер бактериохлорофилла 309
— хлорофилла 324
Димеры синглетного кислорода 70
Динамическое моделирование 405
Диокситаны 69
Диффузия 72, 286
— латеральная 23
— облегченная 75
— одномерная 49, 72
— простая 75
Диэлектрическая толщина мембраны 28
Диэлектрофорез 37, 42
Диэлектрофоретическая сила 42
Длина экранирования 86
Донор электрона 297, 298
Емкость мембраны 28
Железосерные белки (белок Риске) 283,
297, 321
Жидкие кристаллы 10
Жидкокристаллическое (расплавленное)
состояние 47
Жидкоподобная а-фаза 47
Жидкофазное окисление углеводородов 66
Са2+-3ависимая АТФаза 157
Закон Гука 30
— Лапласа 16
— Фика второй 73
— Фика первый 72
Защитное действие акридиновых красите-
красителей 438
Инактивация Na -каналов 130, 175
Ионный насос 395
Ионофоры 103
Ионы липофильные 103
Кабельное уравнение 199
Кабельные свойства нервных волокон 198
Канал протонный 162
Каналы натриевые 413
— натриевый и калиевый 124
Р-каротин 67
Каротиногенез 431
Каротиноиды 290
Каталаза 66
Квантовый выход возбуждения 68
флуоресценции 278
Кинезин 225
Кинк, см. Гипотеза петли
Кислородвыделяющий комплекс 324
Константа Гамакера 21
— Лондона 21
Константы латеральной диффузии 23*
Конформационная динамика 373
Конформационные изменения 388
— переходы 394
Кооперативная единица 35, 52
Кортизол 259
Кортиколиберин 258
Кортикотропин 259
Коэффициент диффузии 49, 74
— проницаемости 99
— распределения 98
— распределения межфазный 83
Критический радиус дефекта 32
Латеральная подвижность белков 24
Липид-белковые взаимодействия 57, 59
Липид-липидные взаимодействия 57
Липиды аннулярные 59
— мембранные 6
Липосомы 14*
— моноламеллярные 13
— мультиламеллярные 13
Локальные вспучивания 40
Макроэргическая связь 207
Максвелловские напряжения 44
Математическое моделирование 238
Медиаторы 260
Межмолекулярные взаимодействия мем-
мембран 20
Мезофазы 12
Мембрана фоторецепторная 415
Мембранная трубка 41
Мембранное фосфорилирование 206
Мембраны биологические 6
состав 6
— эквивалентная схема 168
Метод выжигания провалов 348
— дифференциальной сканирующей кало-
калориметрии 34
Предметный указатель
461
Метод пэтч-кламп 128
— стимулированного свечения 342
— фиксации потенциала 170
Механизм Гротгуса 330
— Фёрстера 287
Механизмы фотохимических процессов 279
Миграция энергии 65, 277, 294
Миелопероксидаза 65
Миозин 225
Миофибриллы 232
Модели фазового перехода 55
Модель жидкомозаичная 8
— канала дипольная 187
— Ходжкина—Хаксли 175
Модельные системы 406
Модуль Юнга 26
Молярная энтальпия перехода 51
— энтропия перехода 51
Монослои 10
Мотонейрон 227
Мультиферментные комплексы 209
Направленный мутагенез 337
Натрий-калиевый насос 151
Натяжение межфазное 22
— межфазное (поверхностное) 16
— полное 22
Нециклический транспорт 286
Нигерицин 105
Опсин 388
Осциллятор мембранный 190
Палочки 410
Параметр кооперативности 53
— порядка молекулярный 49, 55
Перекисное окисление липидов 61, 452
Перекись водорода 67
— липида 61
Перенос электрона 280
Переносчики подвижные 104
Перколяция, теория 267
Пероксидазы 66
Пикосекундная спектрофлуорометрия 298
F-4) Пиримидиновые аддукты 439
Плавление кристаллов 51
Пластохинон 214, 283, 339
Пластоцианин 216, 282, 283
Пленки черные, см. Вислойные липидные
мембраны
Площадь углеводородной цепи 11
Поверхностная активность 18
Поверхностный заряд 89
Подвижность электрофоретическая 92
Порфирины 454
Поры коаксиальные 41
— сквозные 40
Потенциал безразмерный 116
— граничный 111
— действия 166
— дипольный 111
— диффузионный 97
— межфазная разность 81
— окислительно-восстановительный 280
— оседания 92
— поверностный 111
— поверхностный 90, 91
— покоя 167
— пробоя 31
— течения 92
— упругий 26
— электрокинетический 91
— электрохимический 77
Приближение Дебая 86
— постоянного поля 98, 168
Проводимость кальциевая 147
— мембраны 99
— одиночного канала 146
Проназа 173
Простогландины 65
Протеинкиназа 294
Протеинфосфатаза 294
Протеолипосомы 13
Противоион 392
Протон, механизмы переноса 396
Профиль энергии иона в мембране 85
Пурпурные мембраны 389
— адаптированные к темноте 392
— пленки 406
— фотосинтезирующие бактерии 290
Равновесие Доннана 93
Раман-спектр 401
Распад органических эндоперекисей 69
Распространение импульса 197
Растяжение деформационное 26
— изотропное 26
Реакции двухквантовые 435, 440
— фотодинамические 444
типа I 434, 445
типа II 434, 445
462
Предметный указатель
Реакции фотохимические 277
Реакционный центр 292
Реакция Фентон 63
— Хабера—Вайса 63
Рекомбинационное свечение 298
Релаксационные процессы 349
Релаксация колебательная 361
— электронная 361
Репарация родопсина 415
Ретиналь 389
Рецептор 258
— ацетилхолиновый 132
Родопсин, фотопревращения 388
Сарколемма 227
Саркомеры 225
Саркоплазматический ретикулум 227
Светособирающая антенна 282
Светособирающий пигмент-белковый ком-
комплекс 283
Свободная энергия Гельмгольца 26
Селективность 122
Селективный фильтр 178
Синглетные и триплетные состояния 435
Синглетный кислород 63, 445
Скорость распространения импульса 201
— перекисного окисления липидов 61
Сокращение мышечное 225
Соотношение Уссинга 101
— Хилла 231
Сопрягающий комплекс 284*
Спилловер 293
Спонтанная активность 194
— кривизна мембран 34
Сродство к протону 397
Степень кооперативности 53
Структура а-спиральная 10
— Р-складчатая 10
Супероксиддисмутаза 67, 68
Супероксидный анион-радикал 62
Температурная точка основного фазового
перехода 47
Теории фазового перехода 55
Теория молекулярного поля 55
— перекисного окисления Баха—Энглера
61
— электрического пробоя 32
Термодинамические параметры фазовых
переходов 51
Тетраэтиламмоний 136, 173
Тетродотоксин 136, 173
Тилакоид 283
Токи ворот 180
— ионные в мембране аксона 170
— локальные 197
— одиночных каналов 131*
а-токоферол 67
Токоферолы 67
Точечный мутагенез 393
Транс-13-цис-фотоизомеризация ретиналя
397
Транс-конформация 47
Трансдуцин 413
Транслокация протонов 212
Транспорт Н+ электрогенный 159
— активный 76
— ионов электрогенный 158
— протонов 162
Транспорт в открытом канале 122
Трансформация энергии 206
Триггерные свойства мембраны 196
Триплетное состояние 278
Триплетное состояние кислорода 61
Триптофан 433
Тропомиозин 234
Тропонины 235
Тубулин 225
Туннелирование 352, 367
Туннельный механизм 286
Тушители синглетного кислорода 67
Убихинон 339
Убихинон-цитохром с окидоредуктаза 285*
Упругость мембран 26
Уравнение Вольцмана 85, 182
— Ген дер сон а 97
— Гиббса 18
— Гольдмана 167
для мембранного потенциала 101
— Гуи—Чэпмена 56, 90
— Максвелла 37
— Михаэлиса—Ментен 75
— непрерывности 72
— Нернста 81
— Нернста—Планка 96, 97
— Пуассона 85
— Пуассона—Вольцмана 86
— Стокса—Эйнштейна 24, 74
— Штерна—Фольмера 68
Условия устойчивости мембран 29
Предметный указатель
463
Фагоцитоз 64*
Фазовая флуорометрия 298
Фазовый переход основной 34
Фемтосекундная спектроскопия 344
Фемтосекундные изменения 422
Ферменты мембранные 60
Ферредоксин 283, 320
Физическое тушение 67
Филлохинон 321
Фитоиммунитет 65
Фитохром 425
— фотоконверсия 426
Флеш-фотолиз 426
Флип-флоп-переход (трансбислойное дви-
движение) 24
Флуоресценция 69, 278
— замедленная 317, 356
— переменная 328, 351
— тушение 326
— квантовый выход 278
Форма М412, два состояния 399
Формирование ВЛМ 15
Формула Ворна 84
— Смолуховского 91
Фосфолипаза А 36
— Д36
Фосфоресценция 69
Фотобиология 276
Фотогидратация 438
Фотодеструктивные реакции 433
Фотодимеризация 436
Фотозащита 443
Фотоизомеризация ретиналя 412
Фотоинактивация 451
Фотоингибирование 352
Фотоионизация 433
Фотоконформационный переход 378
Фотолиазы 443
Фотолиз воды 335
— липидов 452
— триптофана и цистина 448
Фотопревращения родопсина 417
Фотореактивация 442
Фоторегуляция 425
Фоторецепторная мембрана дисков 412
Фотосенсибилизированные процессы 433
Фотосинтез 280
— первичные процессы 280, 281*
— ?-схема 281*, 295
Фотосинтетическая единица 282
Фотосистемы I и II 211, 280
Фототаксис 432
Фототерапия опухолей 454
Фототропизм 430
Фотохимические реакции в ДНК 435
Хемилюминесценция 67, 68
— синглетного кислорода 69
Хинон вторичный 311
— первичный 311
Хлоропласты 299, 300
Хлорофилл 283, 296
Хромофоры флавиновые 430
Цвиттерионы 20
Q-Цикл Митчела 211
Циклический электронный транспорт 285*
Цис-транс-изомеризация 421
Цитохром 282
— Р-450 64
— Ь 283, 285
— 6559 325
— с 285, 285*
— с2 285*
— / 282, 283
Цитохромный комплекс 216
be-f 283
Цитохромоксидаза 213
Частотные зависимости диэлектрофорети-
ческой силы 42
Шиффово основание 389, 395
Экзогенные сенсибилизаторы порфирино-
вой природы 456
Экситон 297, 303
Экситонные взаимодействия 287
Электрический пробой ВЛМ 30
Электрическое поле 407
Электроактивация белков 46
Электроактивация мембранных белков 37
Электровращение 37
Электронно-возбужденные продукты 68
Электронно-конформационные взаимодей-
взаимодействия 359
Электрон-транспортные цепи 208, 280,
284*
Электроосмос 92
Электроосмотический поток 190
Электропорация 37
Электрослияние мембран 37, 38, 41
464
Предметный указатель
Электротрансфекция 37, 45
Электрофорез 37, 42, 92
Эндогенные порфирины 456
Энергетический профиль 115
— спектр 142
Энергетическое сопряжение 207
Энергизация мембран 353
Энергия 39
— гидратации ионов 79
— гидрофобного взаимодействия 19
— дефекта 29
Энтальпия Вант-Гоффа 53
— фазового перехода 56
Эффект Мессбауэра 311
— Эмерсона 293
Явление электрострикции 27
ЯМР-метки 51