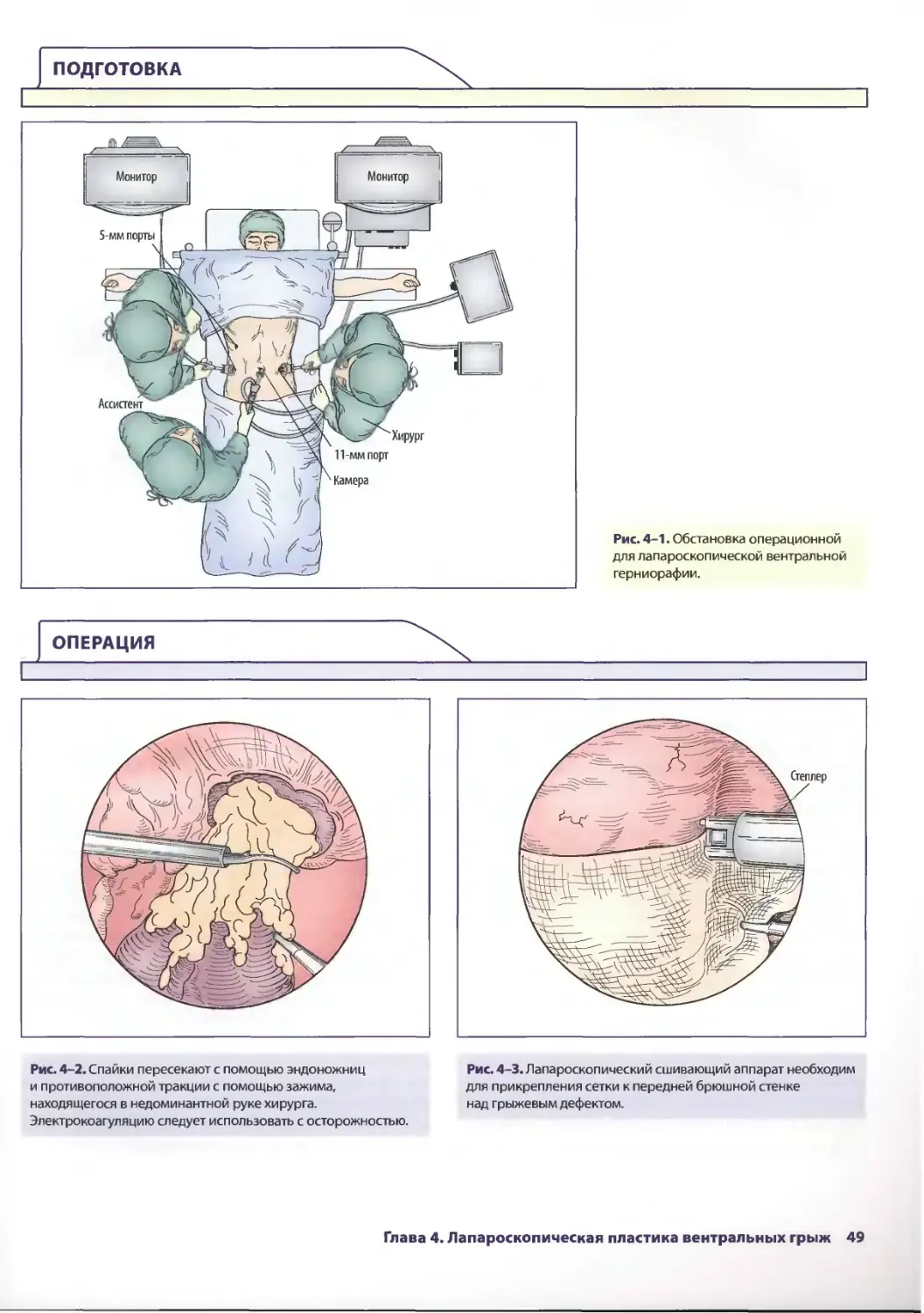
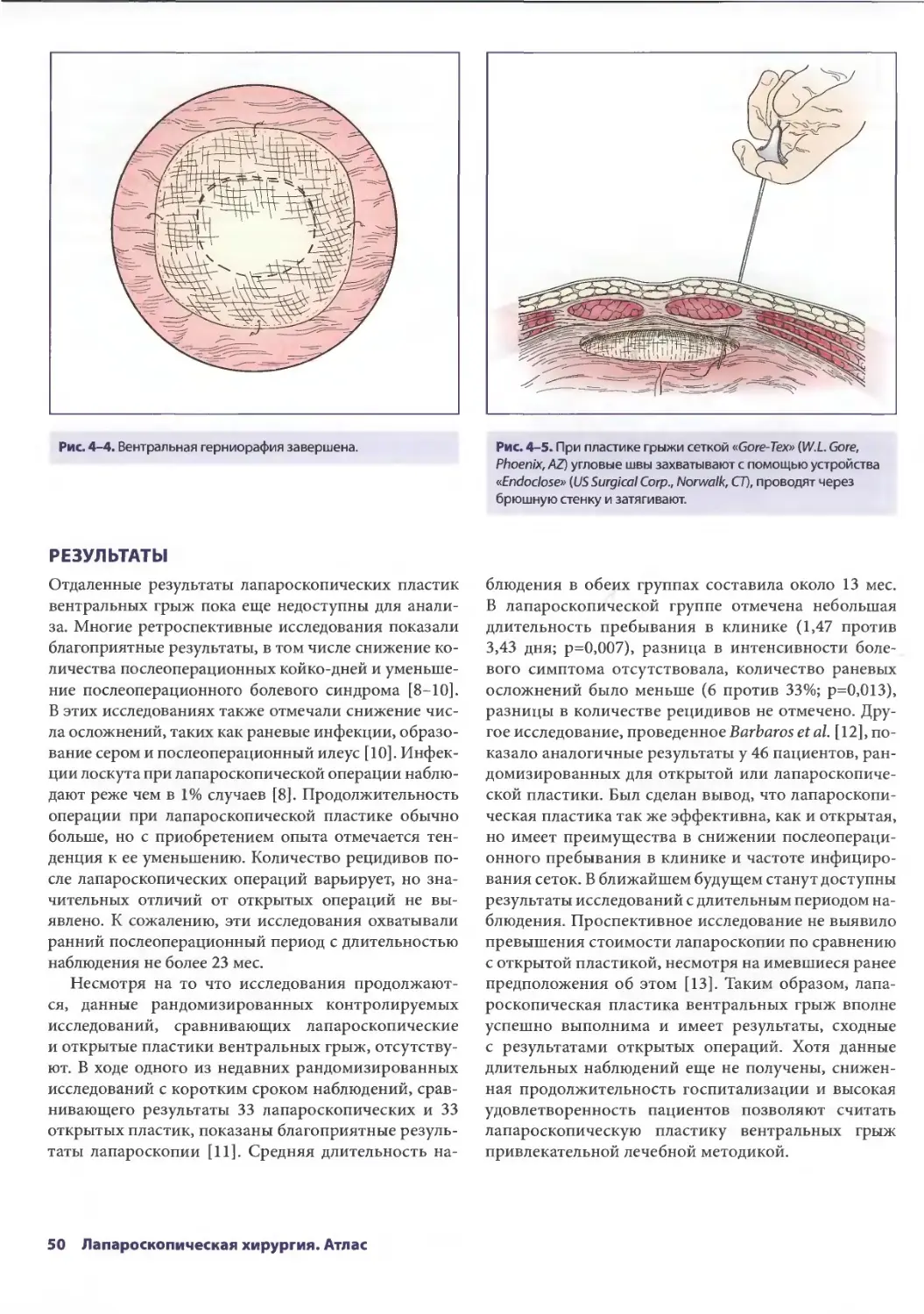
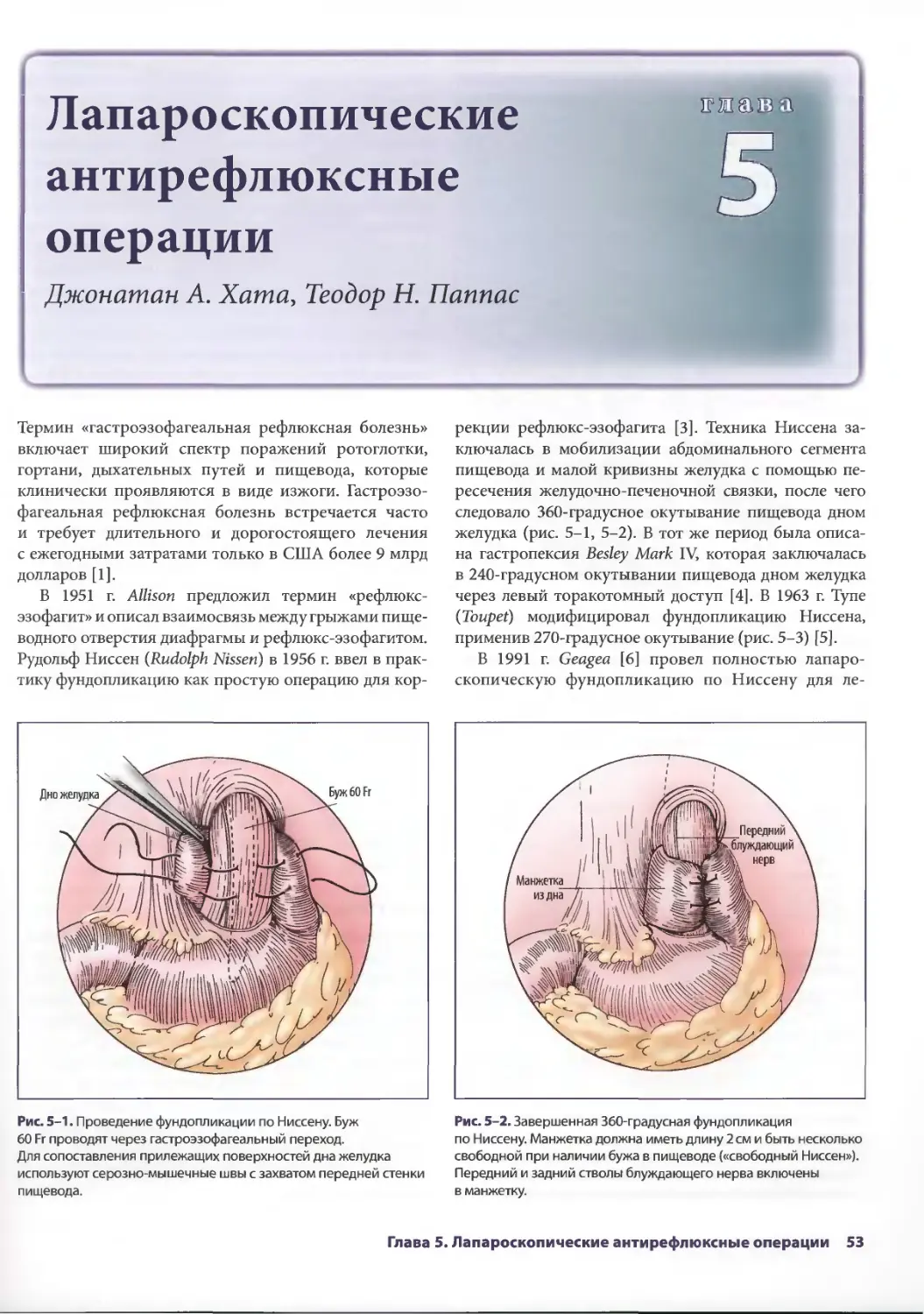
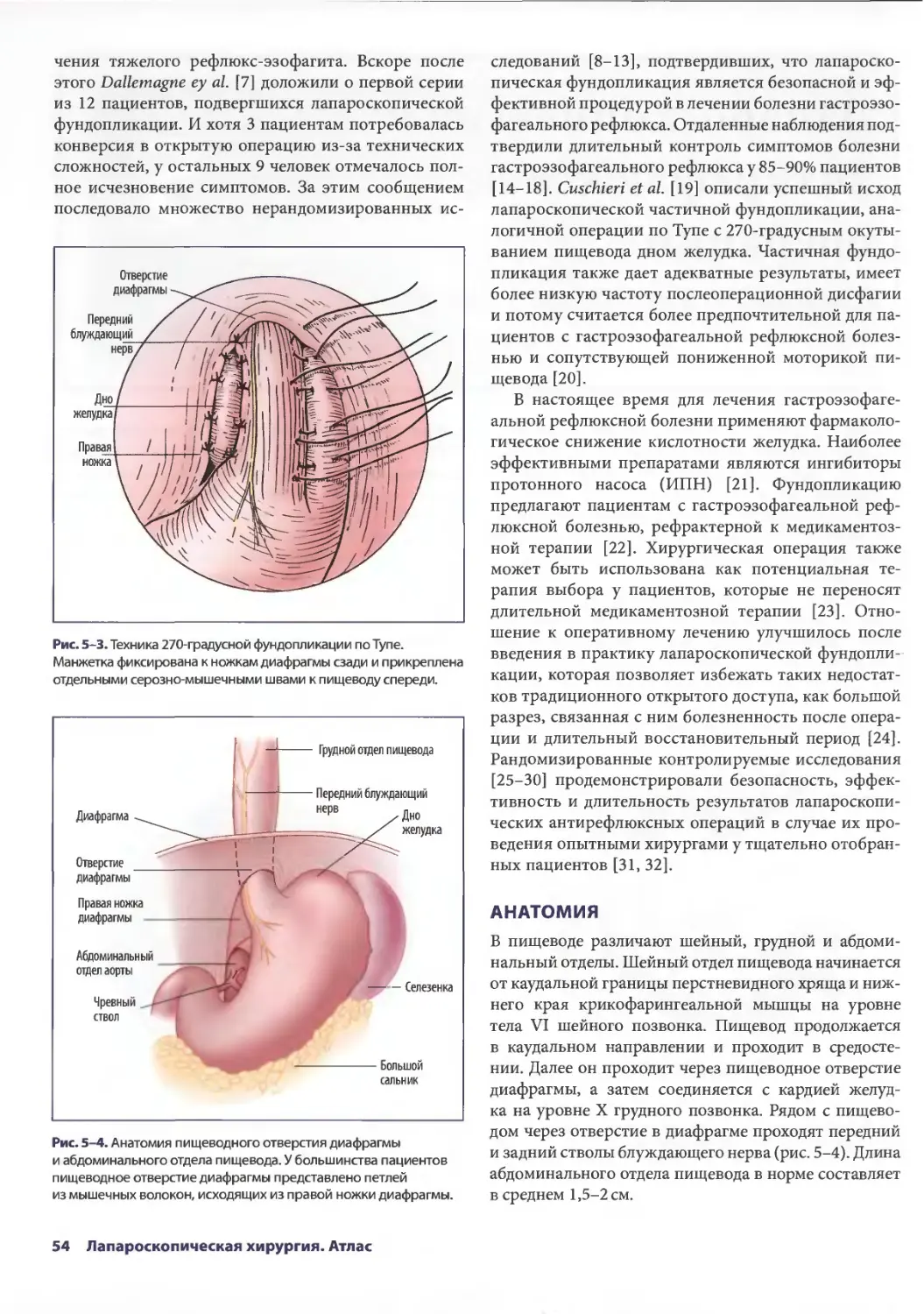
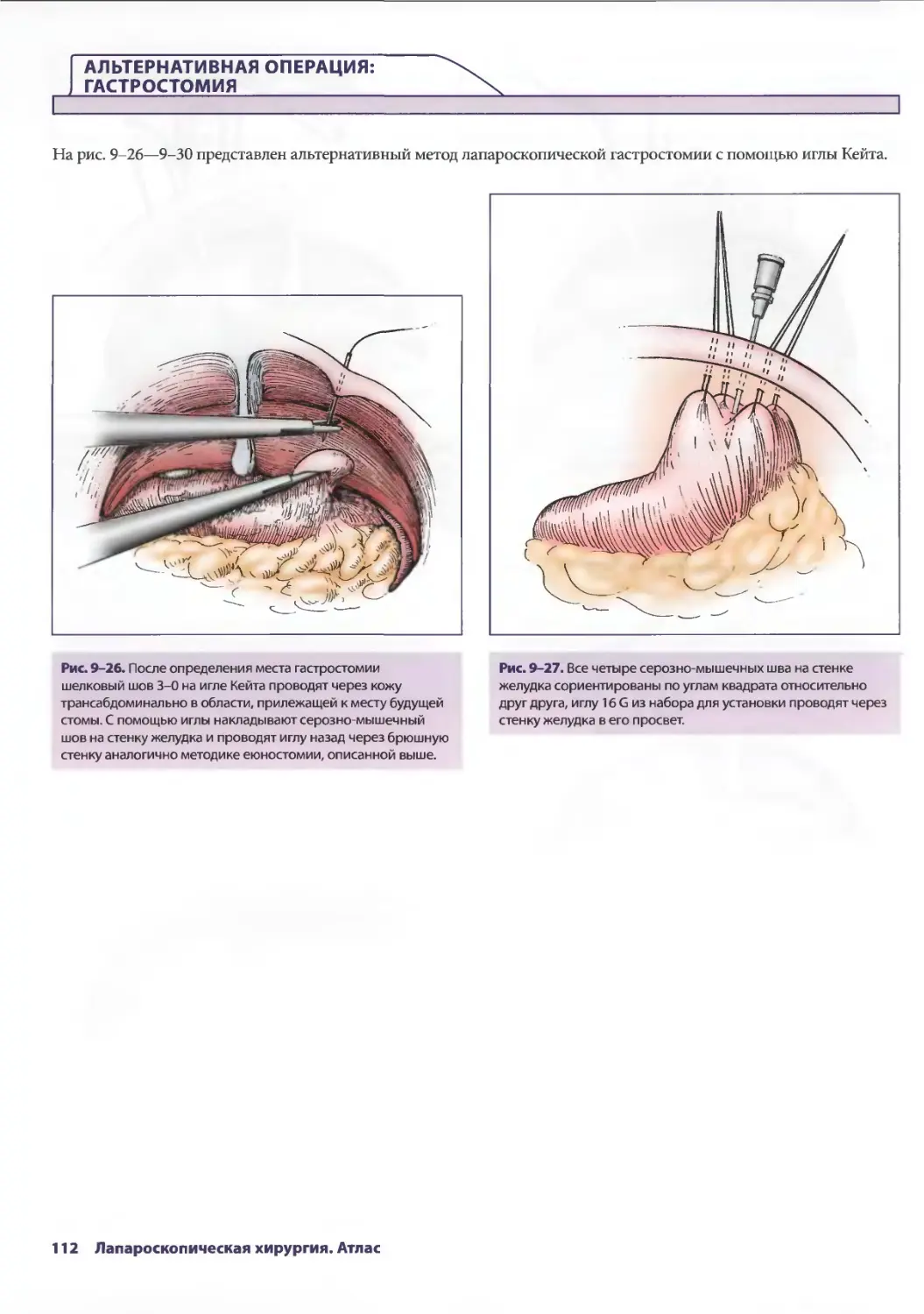
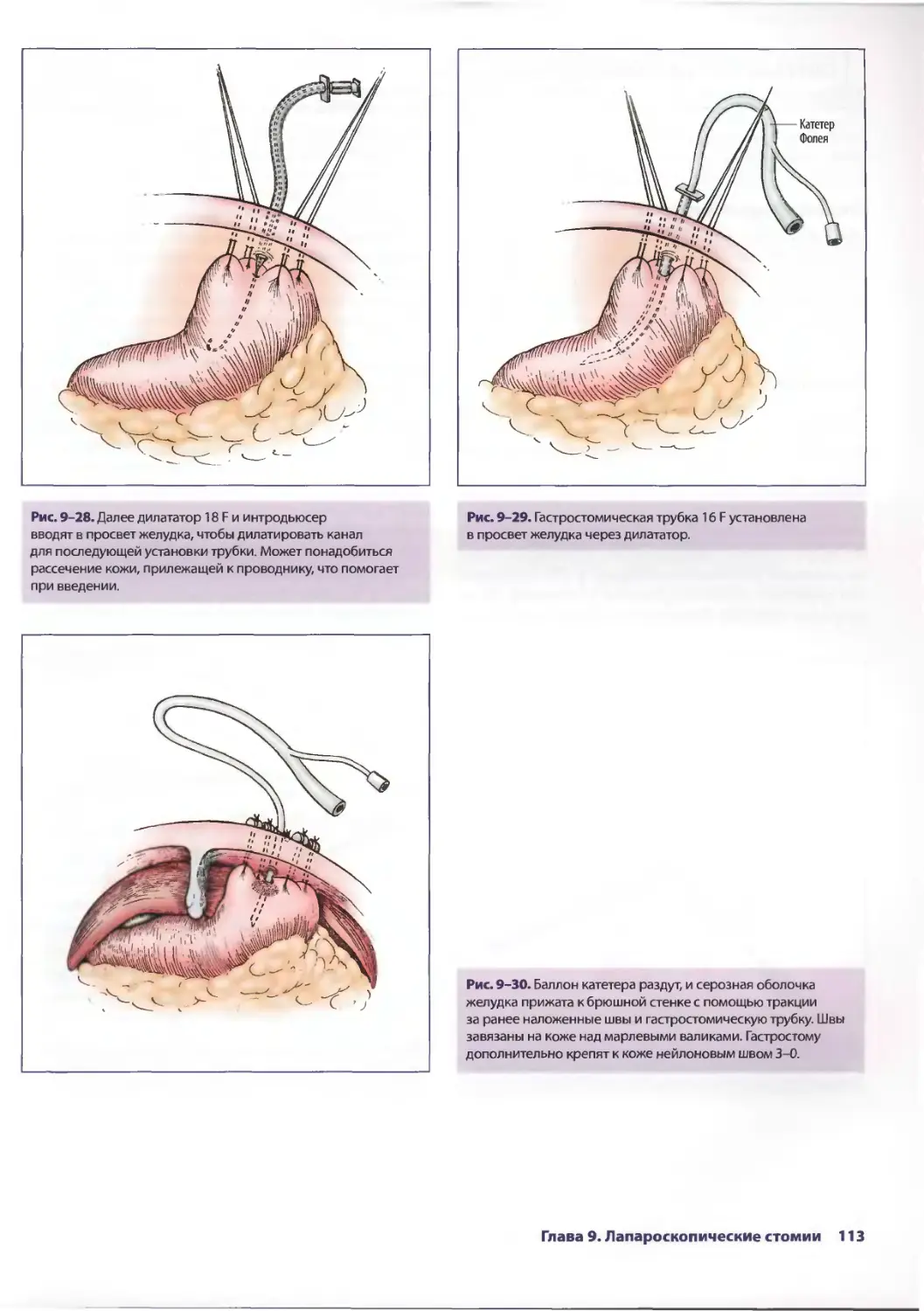
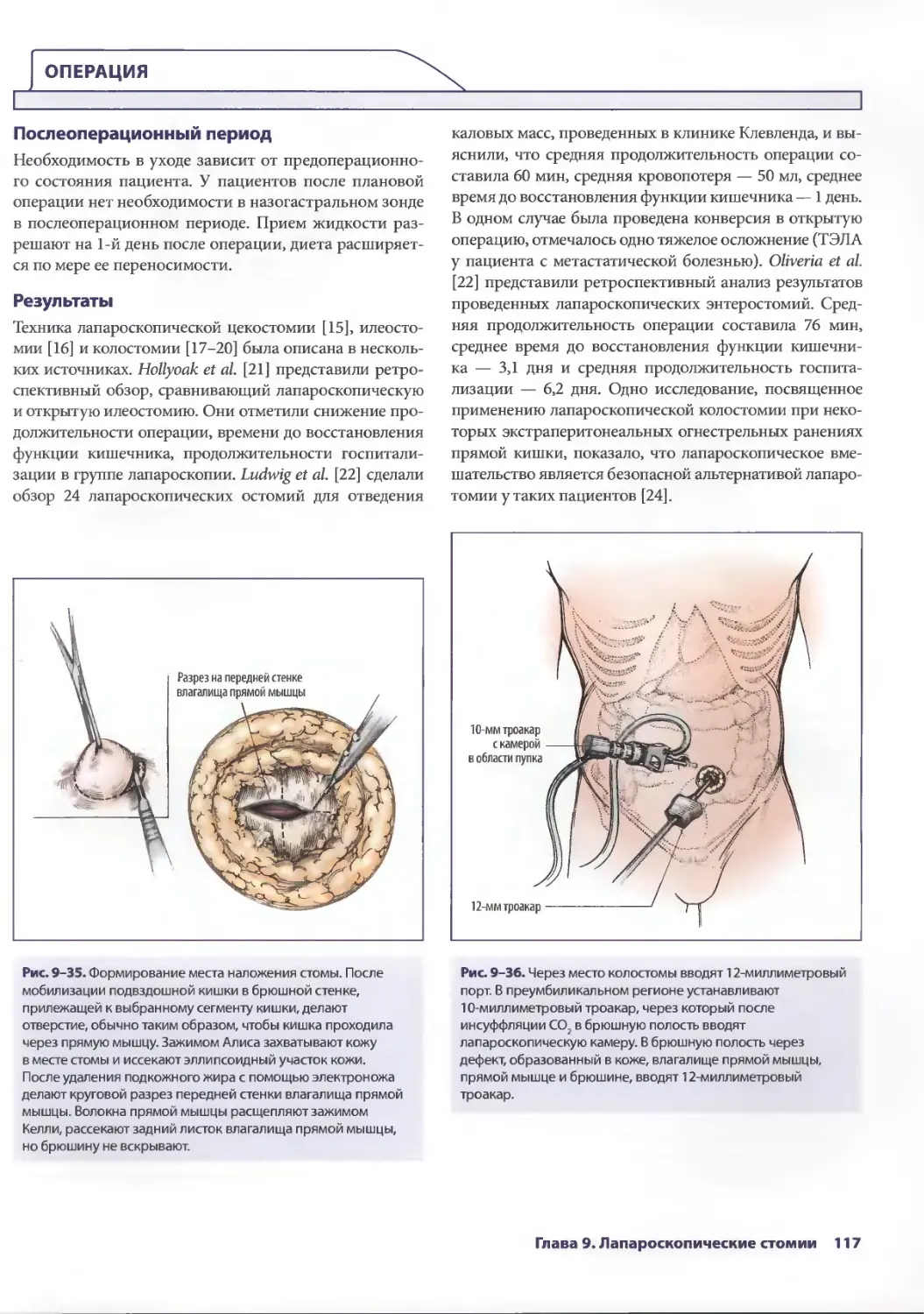
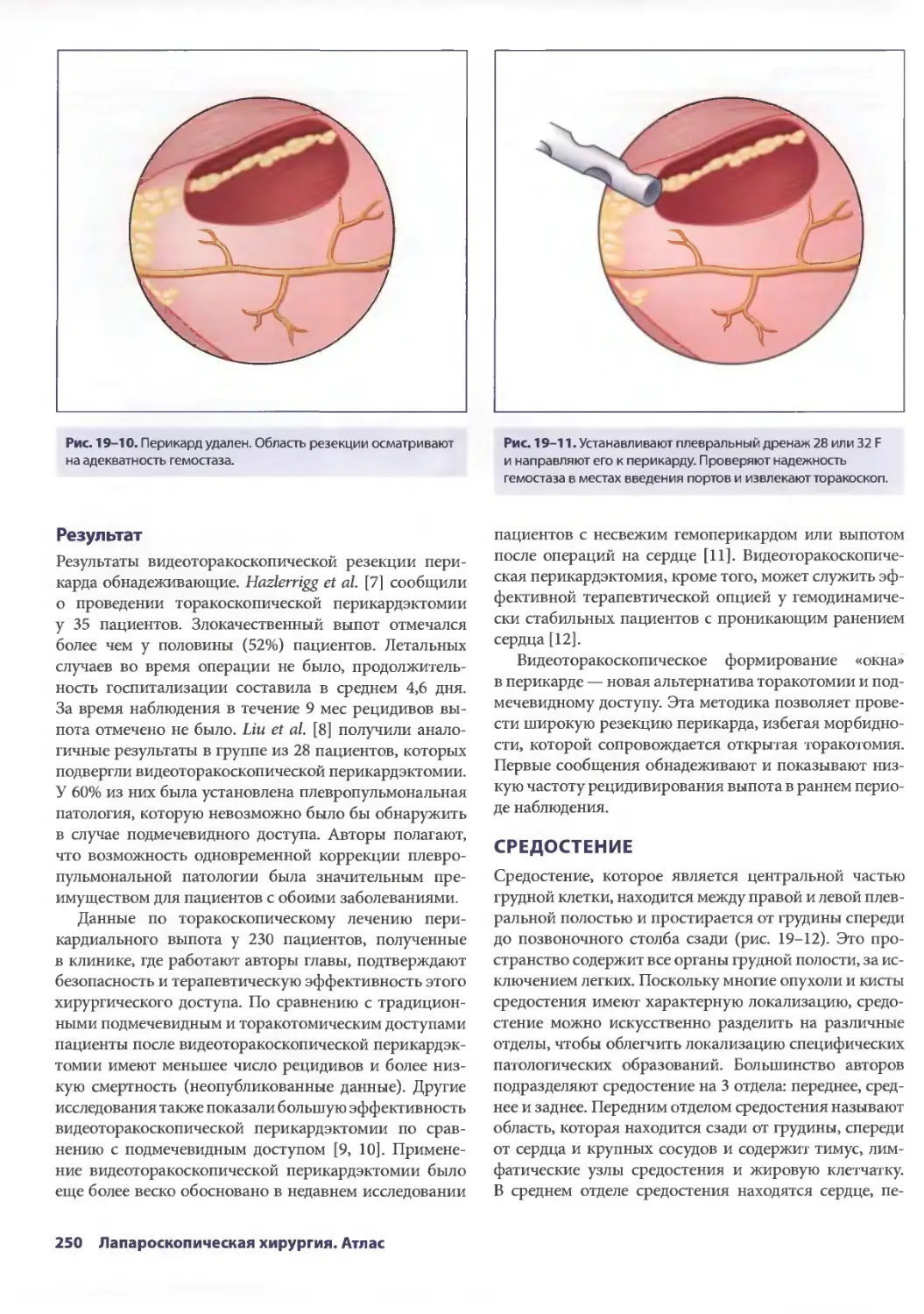
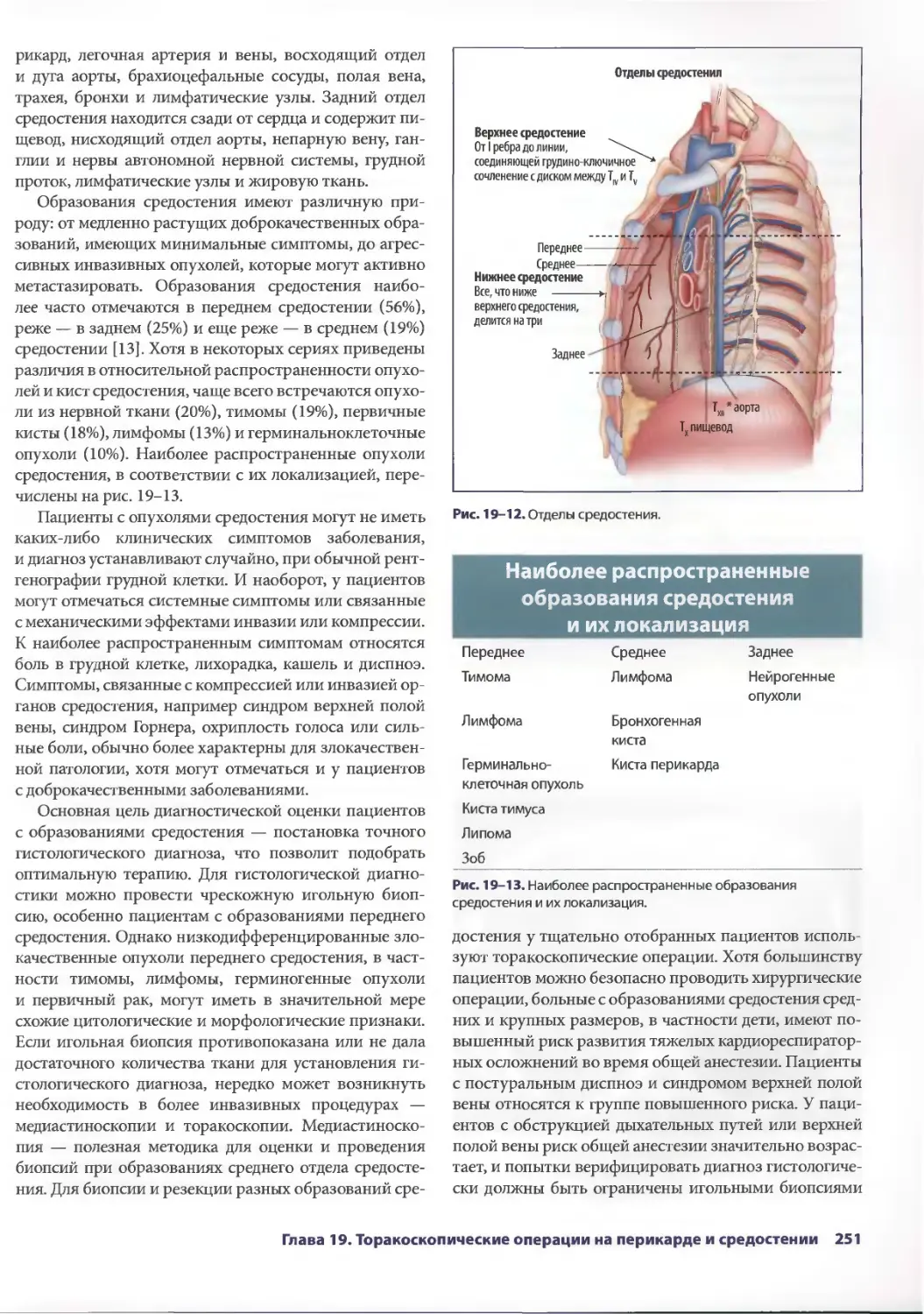
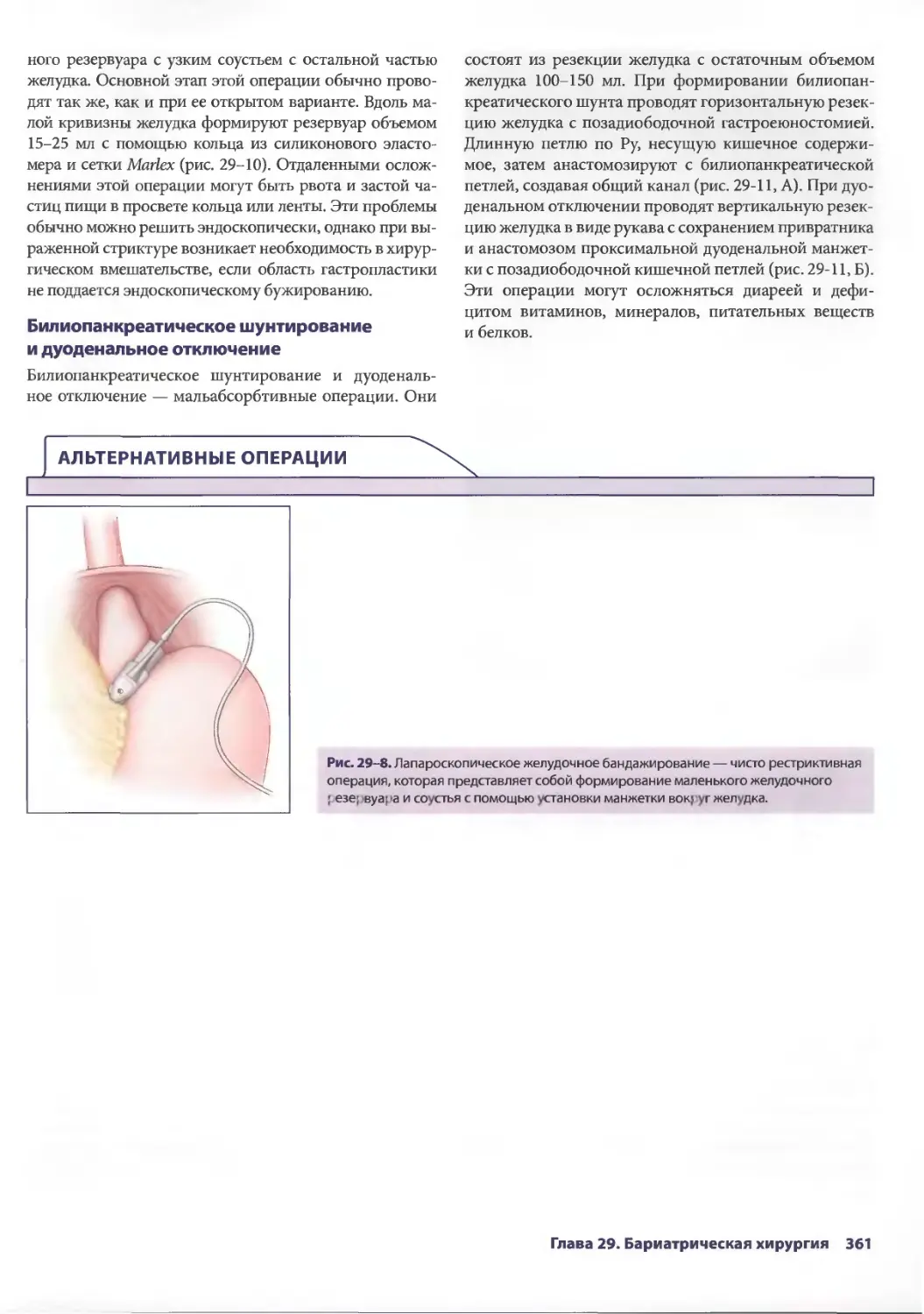
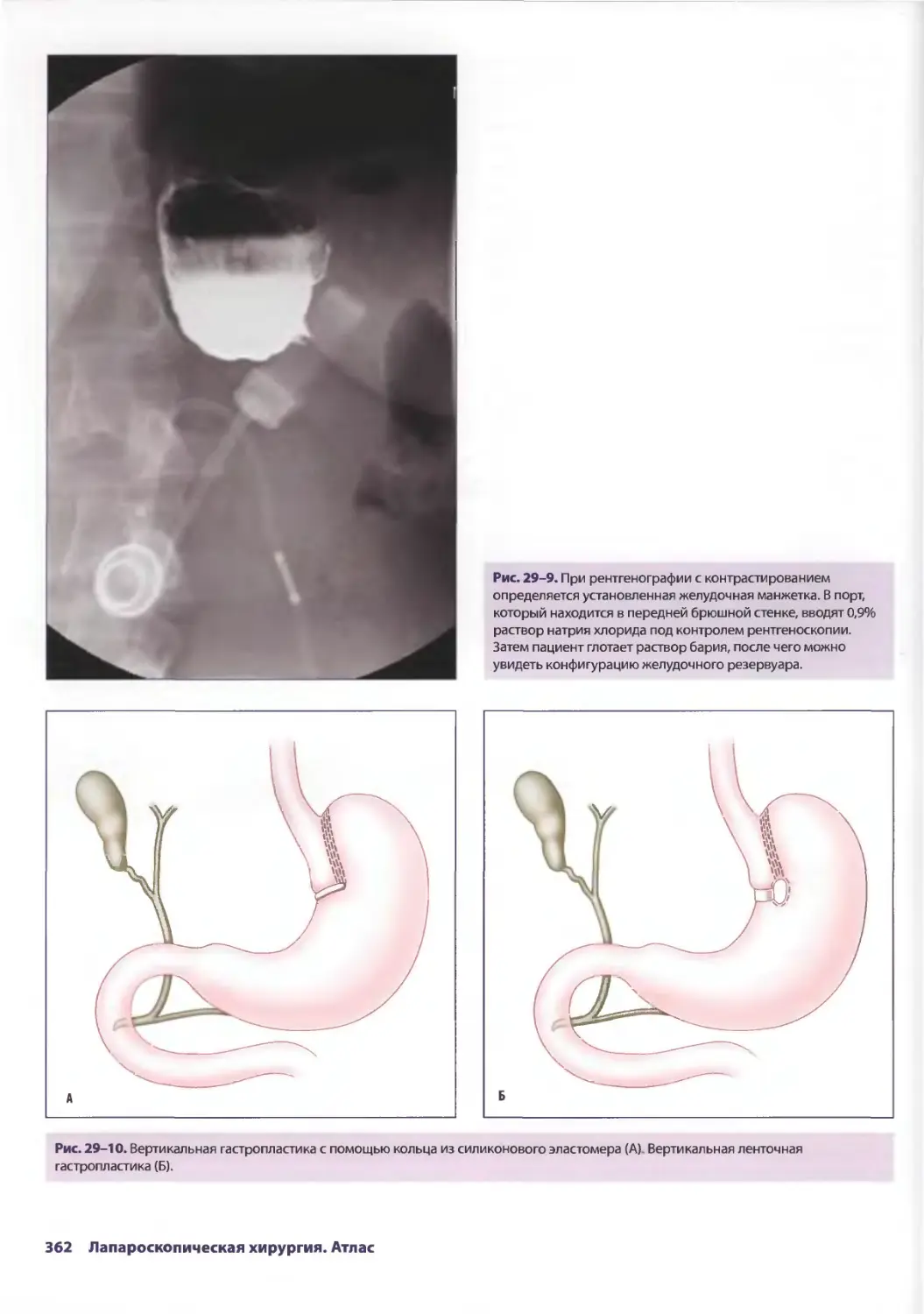
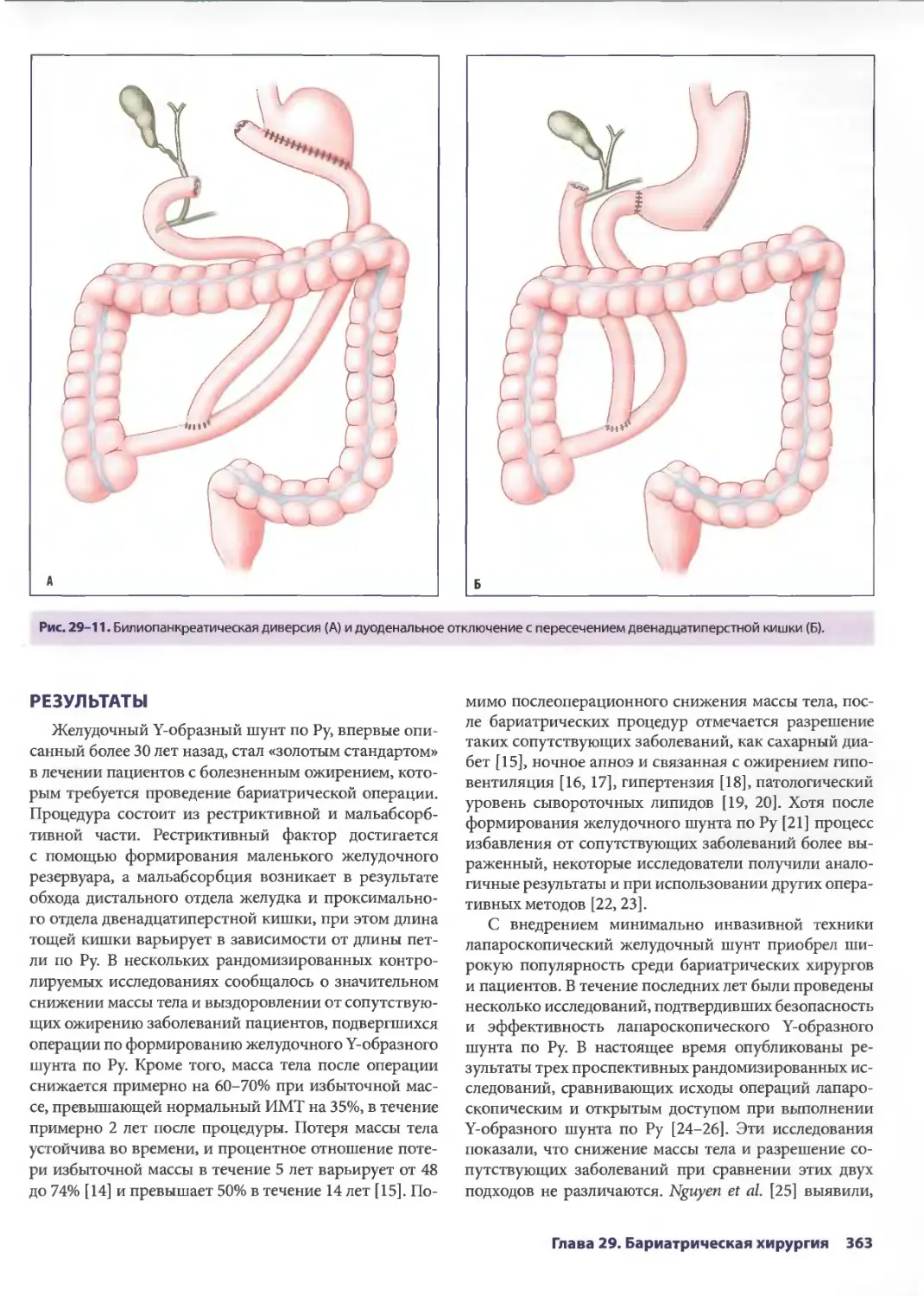
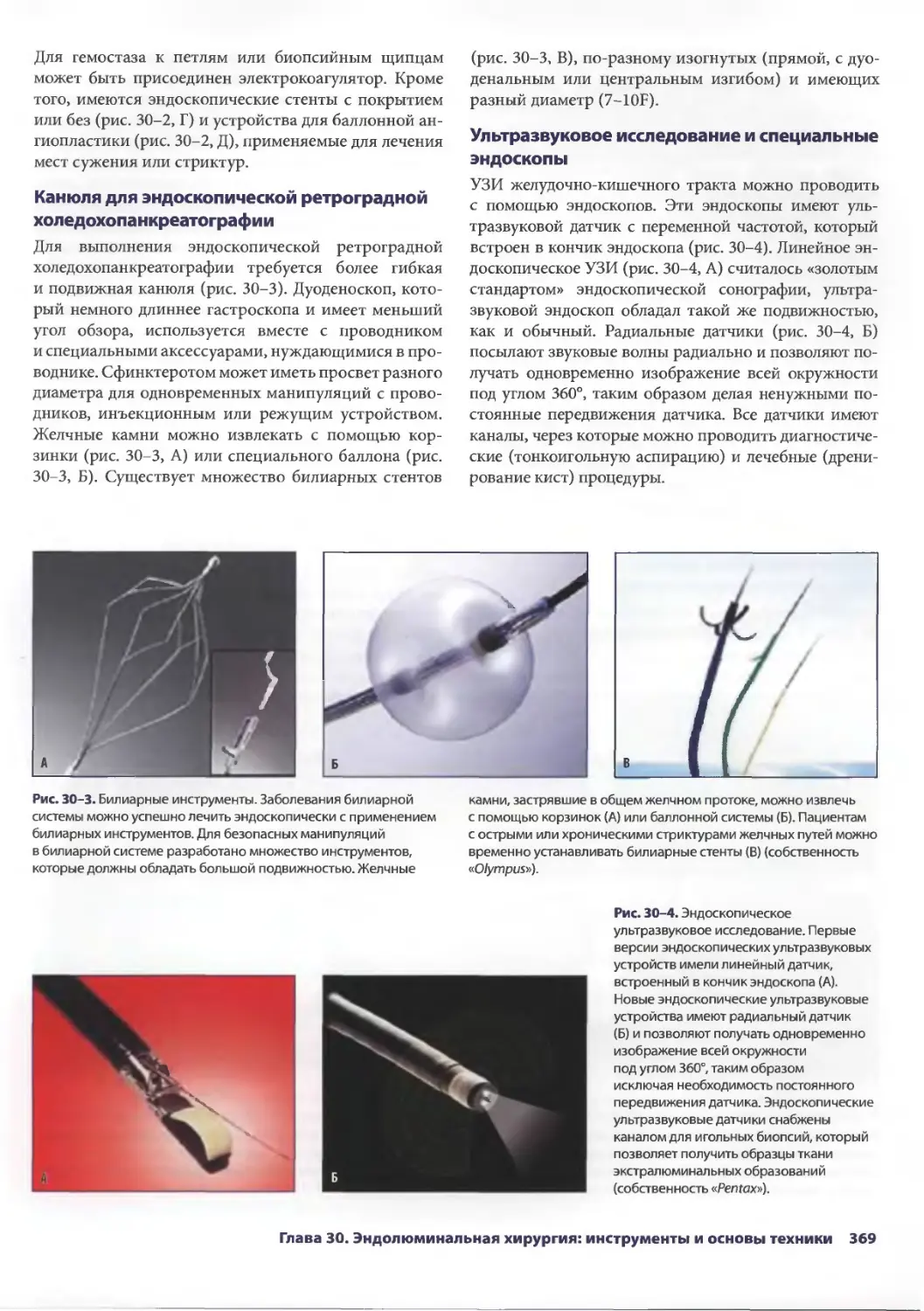
Author: Паппас Т.Н. Приор А.Д. Харниша М.С.
Tags: хирургия ортопедия офтальмология медицина
ISBN: 978-5-9704-2234-2
Year: 2012
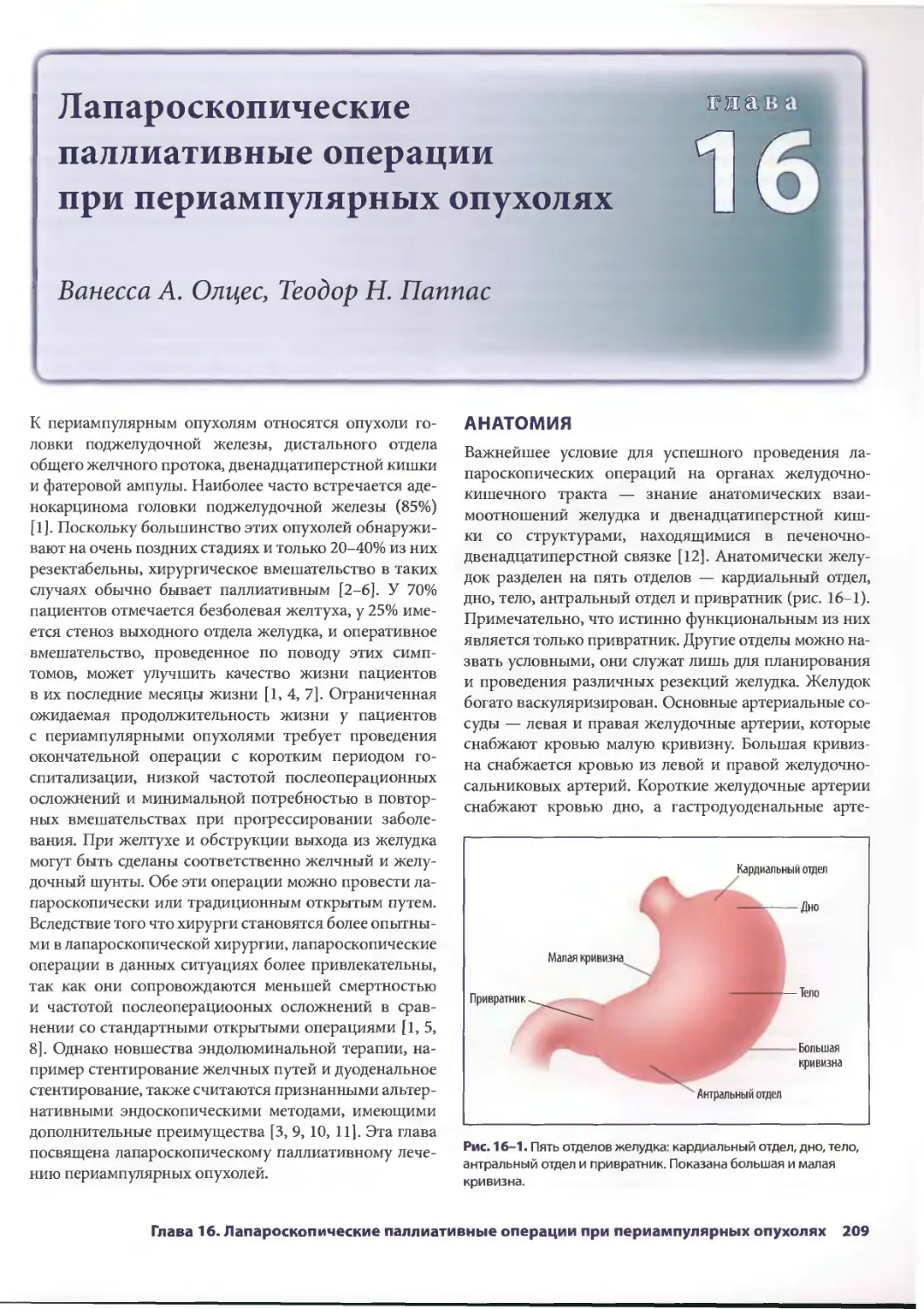
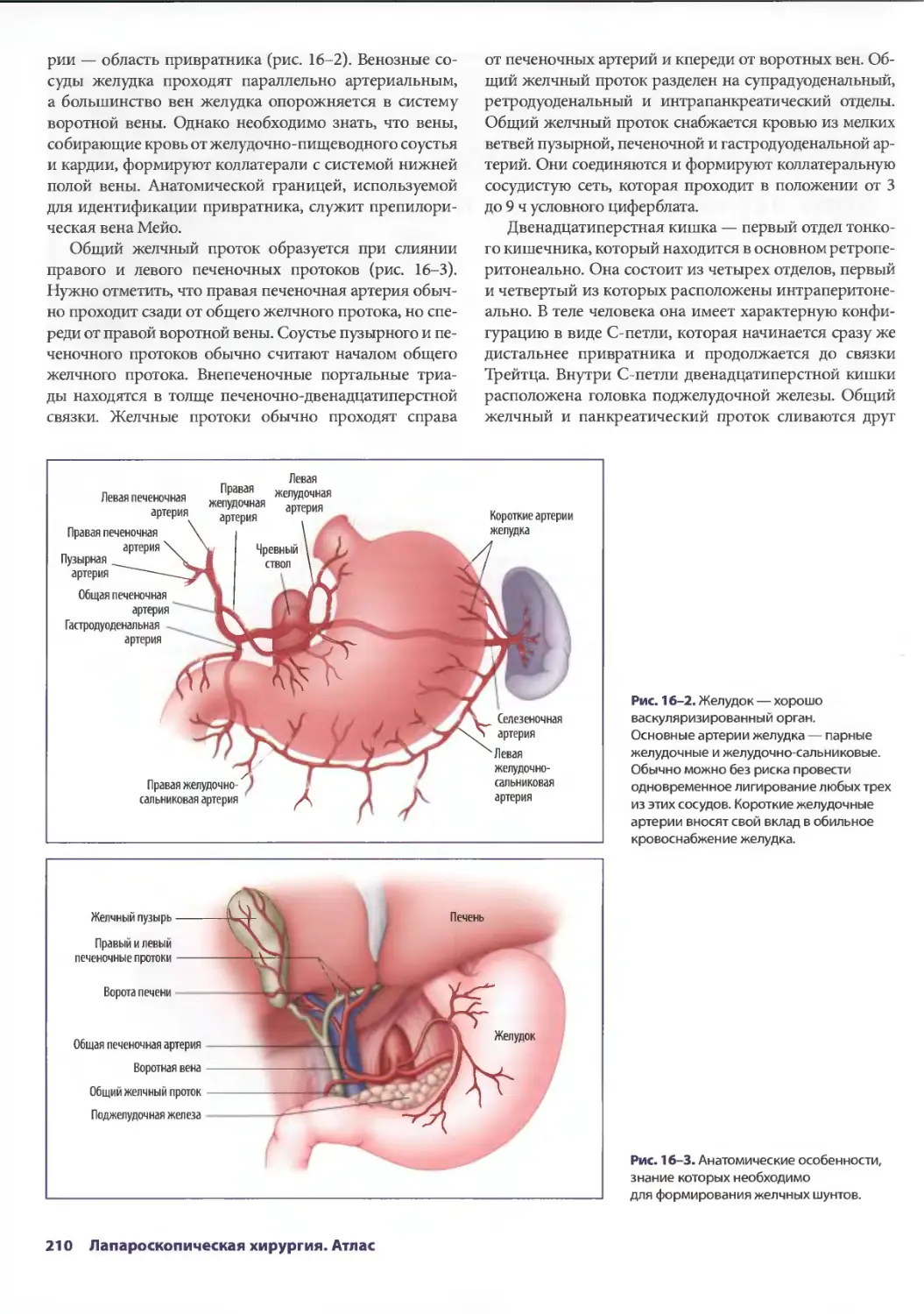
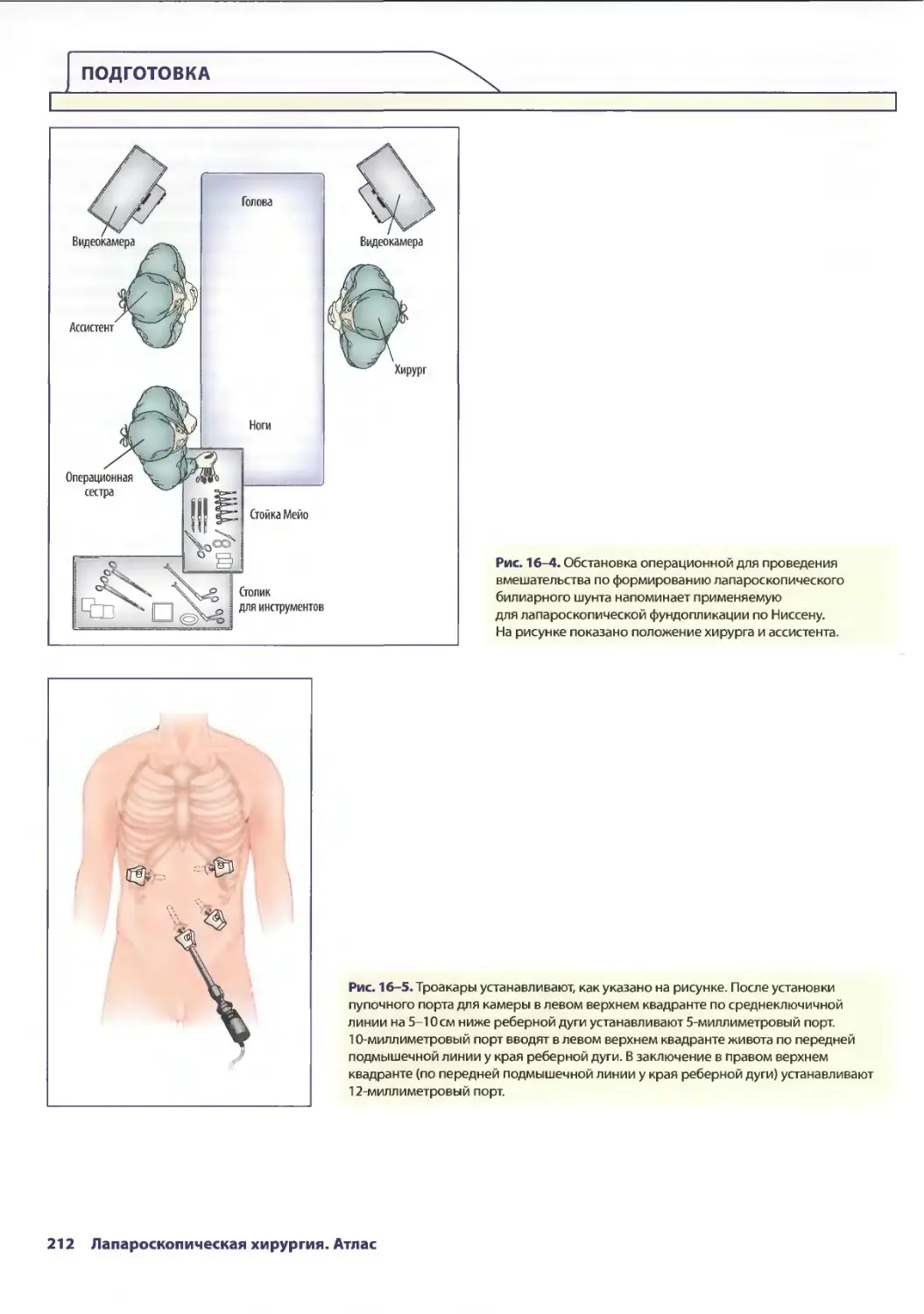
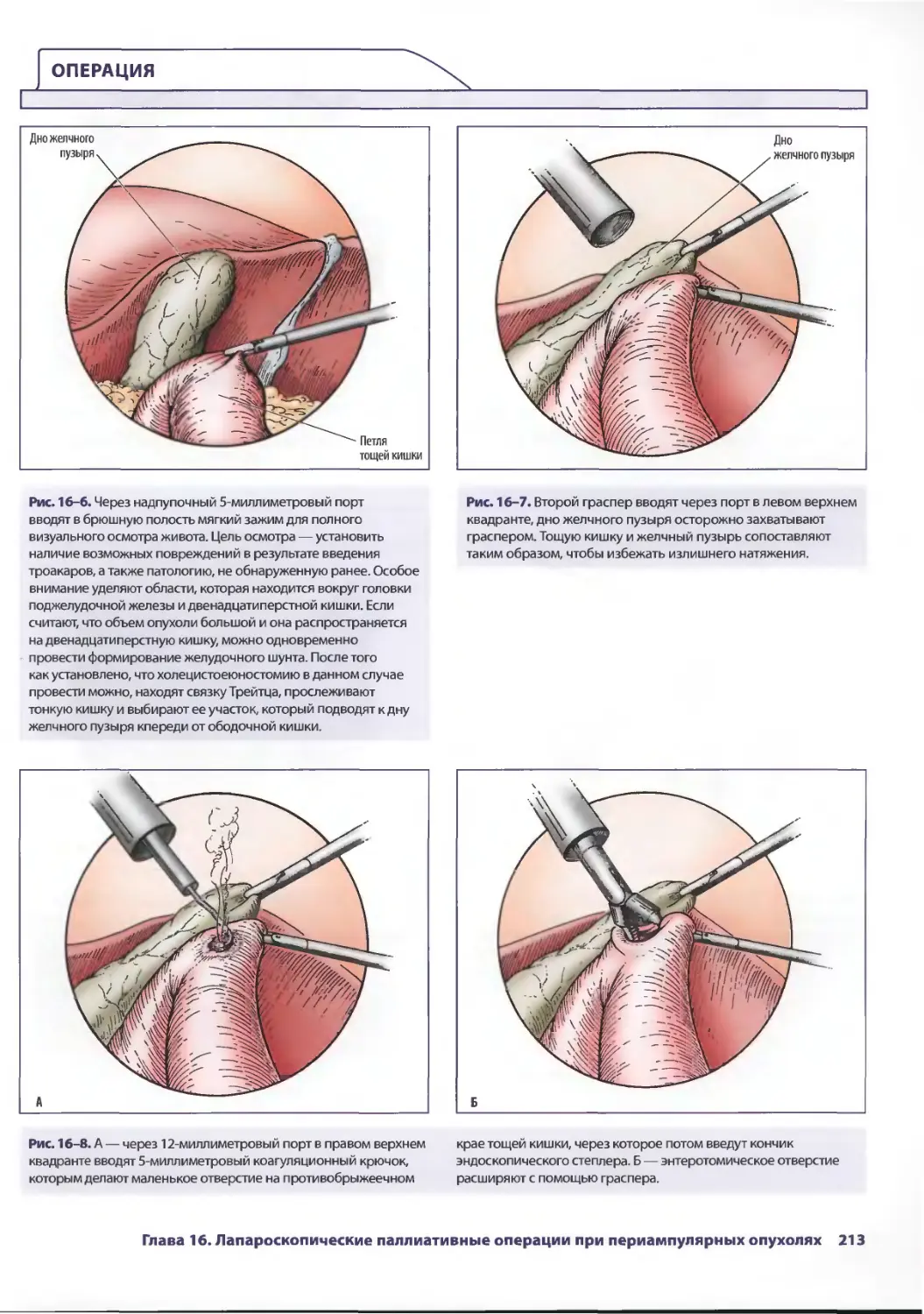
Text
АТЛАС
Пол редакцией
Теодора Н. Паппаса
Авроры Д. Приор
Михаэля С. Харниша
Перевод
с английского
пол редакцией
профессора С.С. Харнаса
л I
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
ATLAS OF
LAPAROSCOPIC
SURGERY
Third Edition
Editors
Theodore N. Pappas, MD
Professor and Vice Chairman,
Administration Department of Surgery
Duke University School of Medicine
Durham, North Carolina
Aurora D. Pryor, MD, FACS
Assistant Professor
Department of Surgery
Duke University Medical Center
Director
Duke Minimally Invasive Surgery
Durham Regional Hospital
Durham, North Carolina
Michael C. Harnisch, MD
Chief, Advanced Laparoscopic Surgery
Department of Surgery
Brooke Army Medical Center
San Antonio, Texas
With 63 contributors
Developed by Current Medicine Group LLC
Philadelphia
£)Sp
ringer
[^
Current Medicine Group LLC
a division of
Current Medicine Group Springer Science+Business Media LLC
АТЛАС
Под редакцией
Теодора Н. Паппаса
Авроры Д. Приор
Михаэля С. Харниша
Перевод
с английского
под редакцией
профессора С.С. Харнаса
Москва
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
2012
УДК 617-089-072.1(084.4)
ББК 54.546.5я61
Л76
Л76 Лапароскопическая хирургия. Атлас / Теодор Н. Паппас, Аврора Д. Приор,
Михаэль С. Харниш; пер. с англ. под ред. проф. С.С. Харнаса. — М.: ГЭОТАР-
Медиа,2012. — 388 с.
ISBN 978-5-9704-2234-2
Издание содержит главы, где описаны технические основы и инструменты,
лапароскопическое лечение травм живота, паховая и вентральная герниорафия, антирефлюксные операции,
лапароскопическая миотомия Геллера при ахалазии пищевода, лапароскопическая пластика
диафрагмальных грыж, лапароскопическая биопсия печени, торакоскопическая перикард-
эктомия, торакоскопическая редукция объема легких, лапароскопический доступ к
поясничному отделу позвоночника для дискэктомии и спондилодеза, а также педиатрическая эндохирур-
гия.
Атлас содержит детальные иллюстрации, фотографии, таблицы и схемы с подробными
объяснениями, которые сопровождаются научными статьями, обзорами и руководствами, поэтому
может рассматриваться и как исчерпывающее руководство, посвященное хирургическим
методам лапароскопии и торакоскопии.
УДК 617-089-072.1(084.4)
ББК54.546.5я61
Данное издание представляет собой перевод оригинального англоязычного издания «Atlas
of Laparoscopic Surgery, Third Edition». Editor: Theodore Pappas, ISBN: 978-1-57340-287-3.
© 2007 Published in arrangement with Current Medicine Group LLC, part of Springer
Science+Business Media LLC; 400 Market Street; Suite 700; Philadelphia, PA 19106; USA. All rights
reserved. No part of this publication may be reproduced, stored in a retrieval system, or transmitted in
an electronic or other form without prior permission of the copyright owner.
Опубликовано с согласия Current Medicine Group LLC, part of Springer Science+Business Media
LLC; 400 Market Street; Suite 700; Philadelphia, PA 19106; USA.
Все права защищены. Никакая часть материала данного издания не может быть
использована без согласия правообладателя.
© 2008 Current Medicine Group LLC a division of
Springer Science+Business Media LLC
© OOO Издательская группа «ГЭОТАР-Медиа», пере-
ISBN 978-5-9704-2234-2 Вод на русский язык, 2012
• -
ОГЛАВЛЕНИЕ
■
Предисловие к изданию на русском языке 7
Предисловие 8
Авторский коллектив 9
Список сокращений 12
Глава 1. Лапароскопический инструментарий и базовые методики 13
Мани А. Данешманд, Геворг А. Мутафьян
Глава 2. Лапароскопическая хирургия при травме живота 23
Марк Л. Шапиро, Майур Б. Пател, Стивен Н. Вэслеф
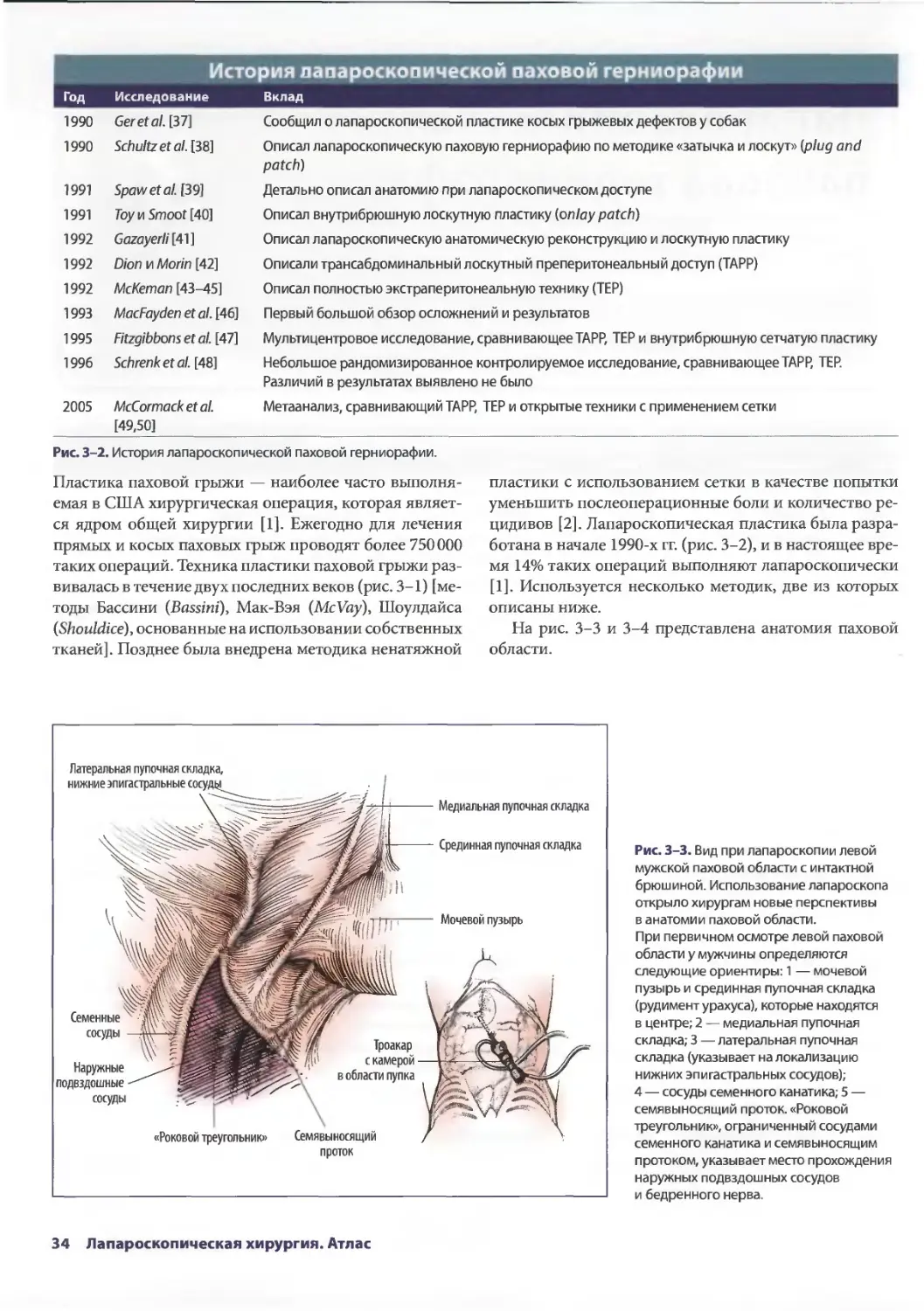
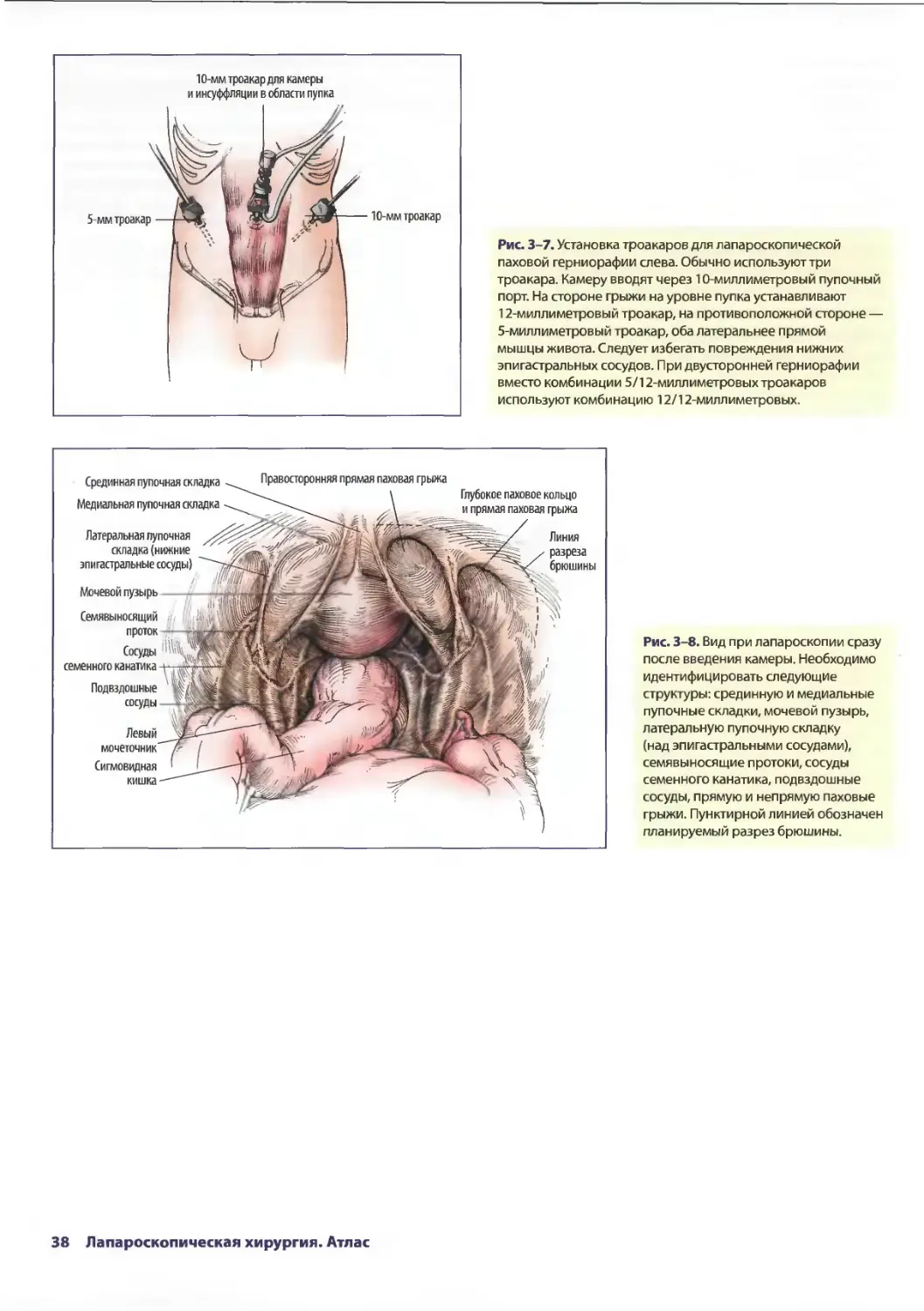
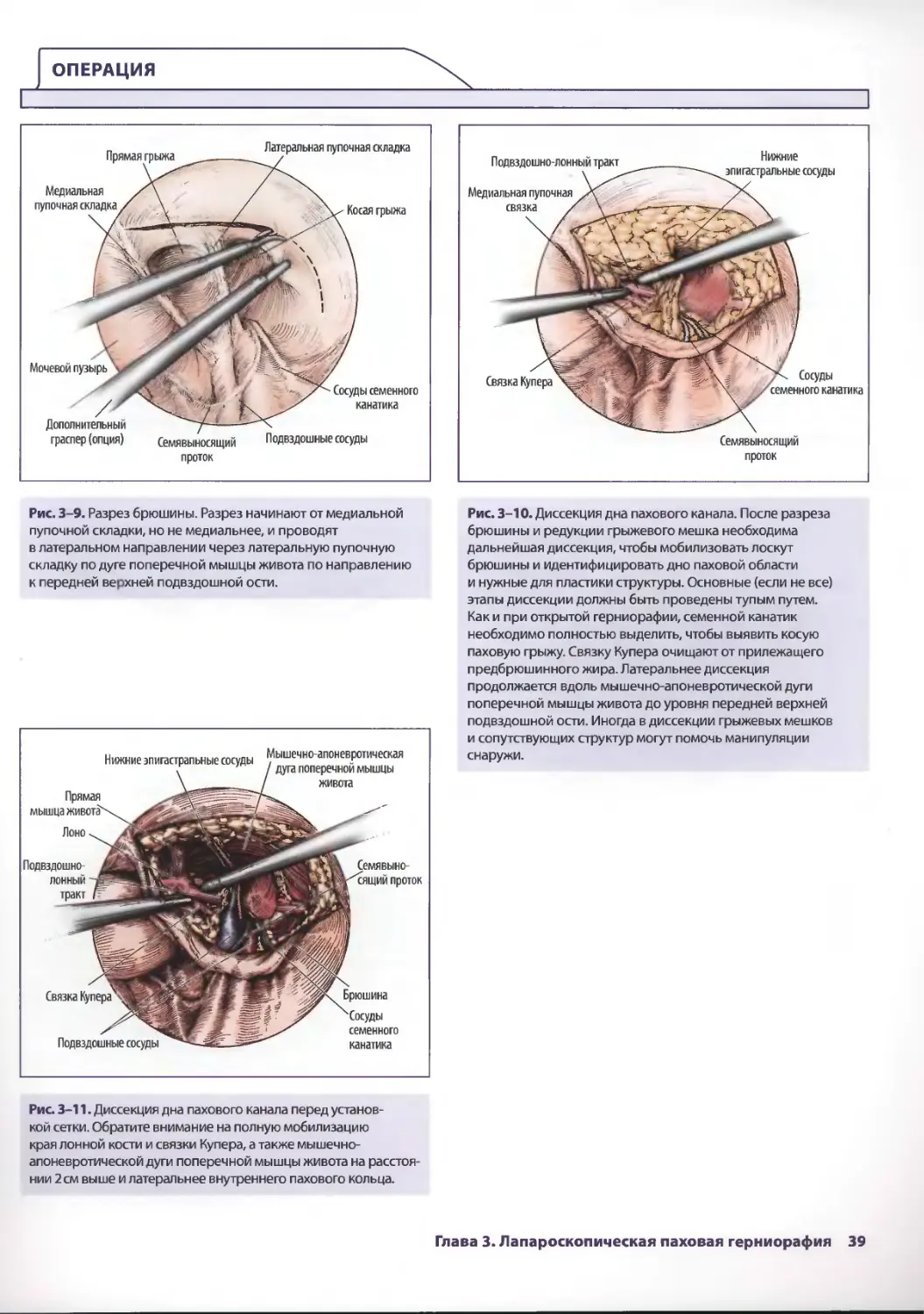
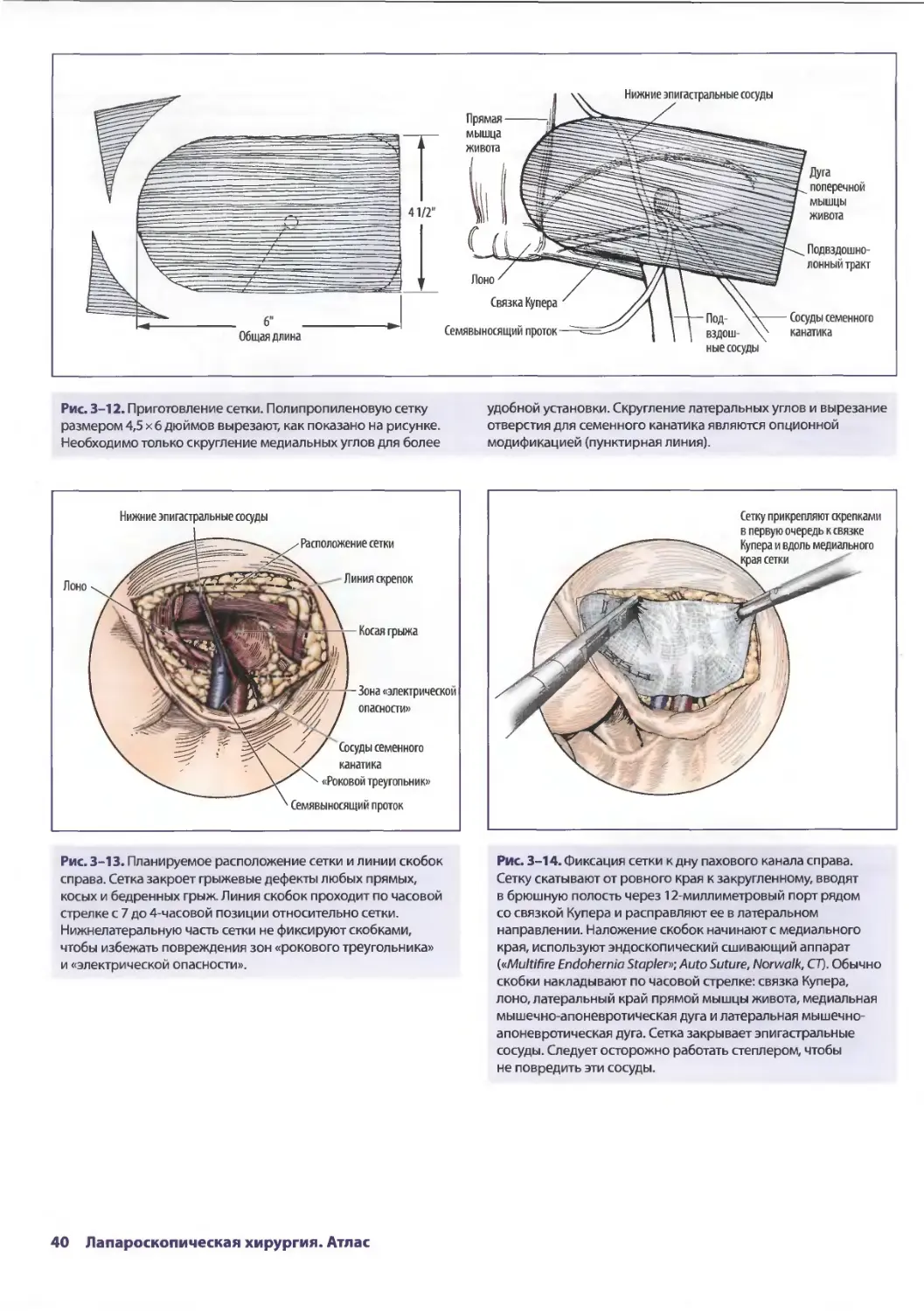
Глава 3. Лапароскопическая паховая герниорафия 33
Лоретта Эрунмвунсе, Лиза Кларк-Пикетт
ШахабА. Акхтер, Стив Эбэнкс
Глава 4. Лапароскопическая пластика вентральных грыж 47
Сэндия А. Лагу-Динэдэялэн, Якоб Н. Шродер
ПаулДж. Чай, Эдвард Ж. Чекан
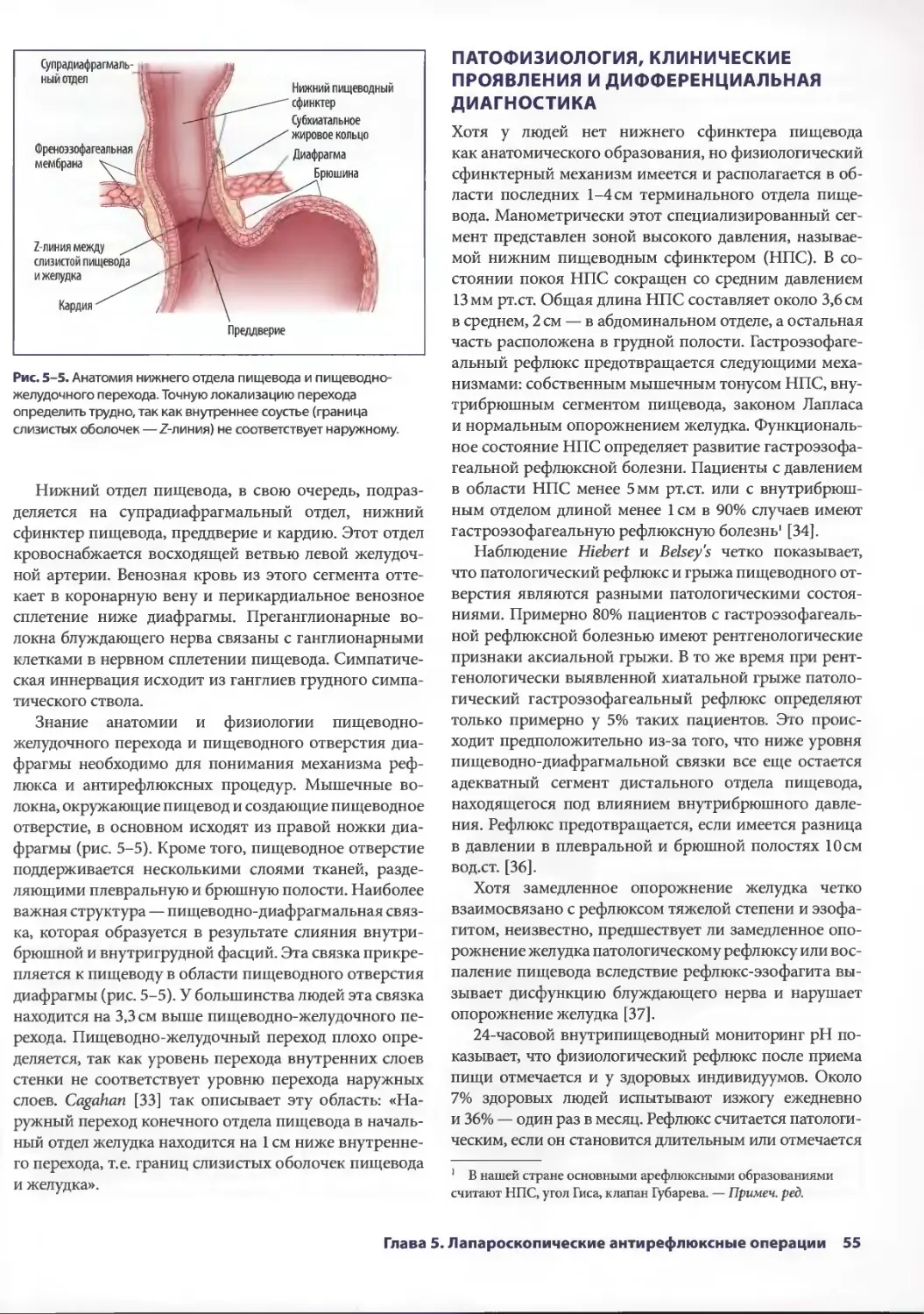
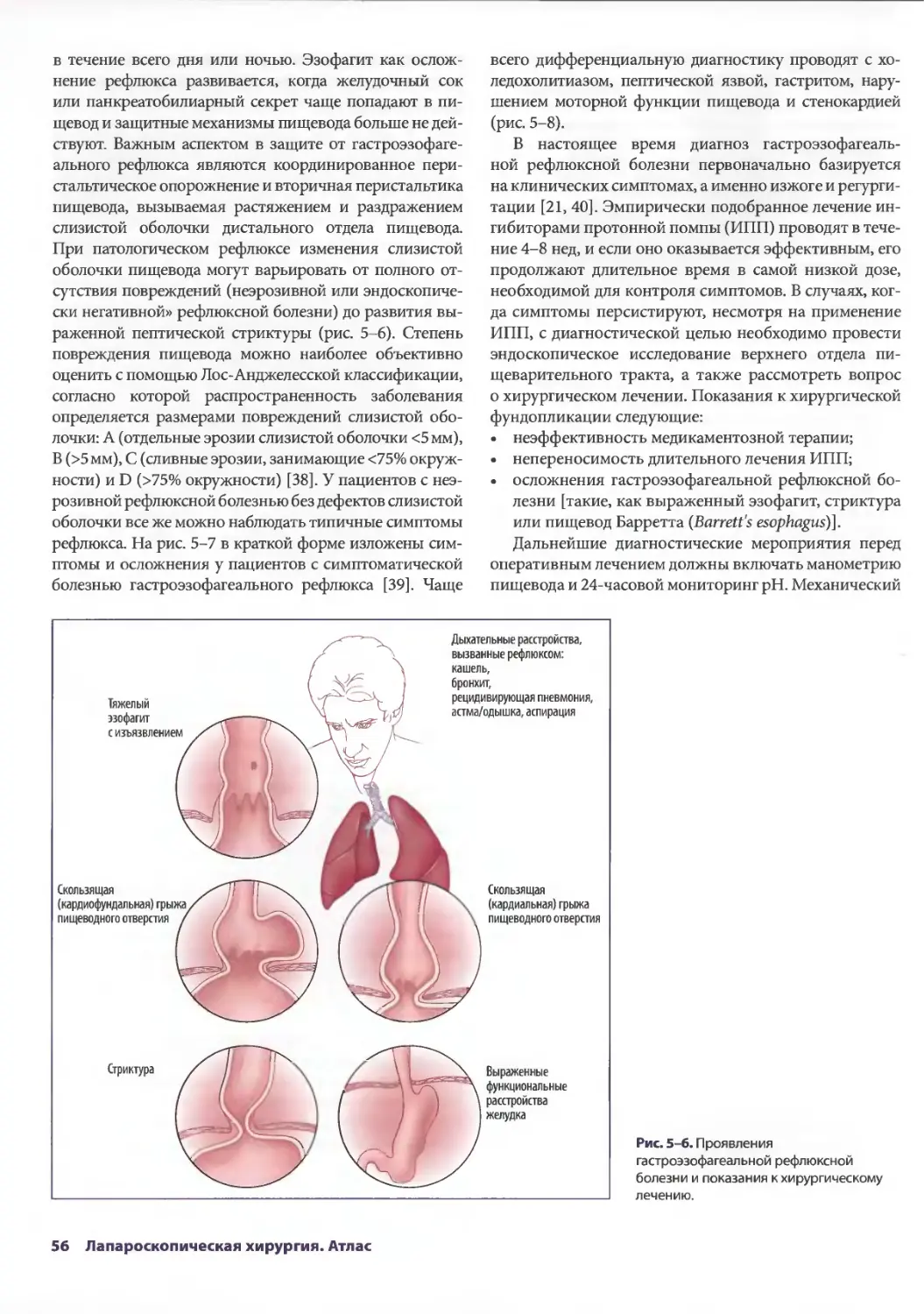
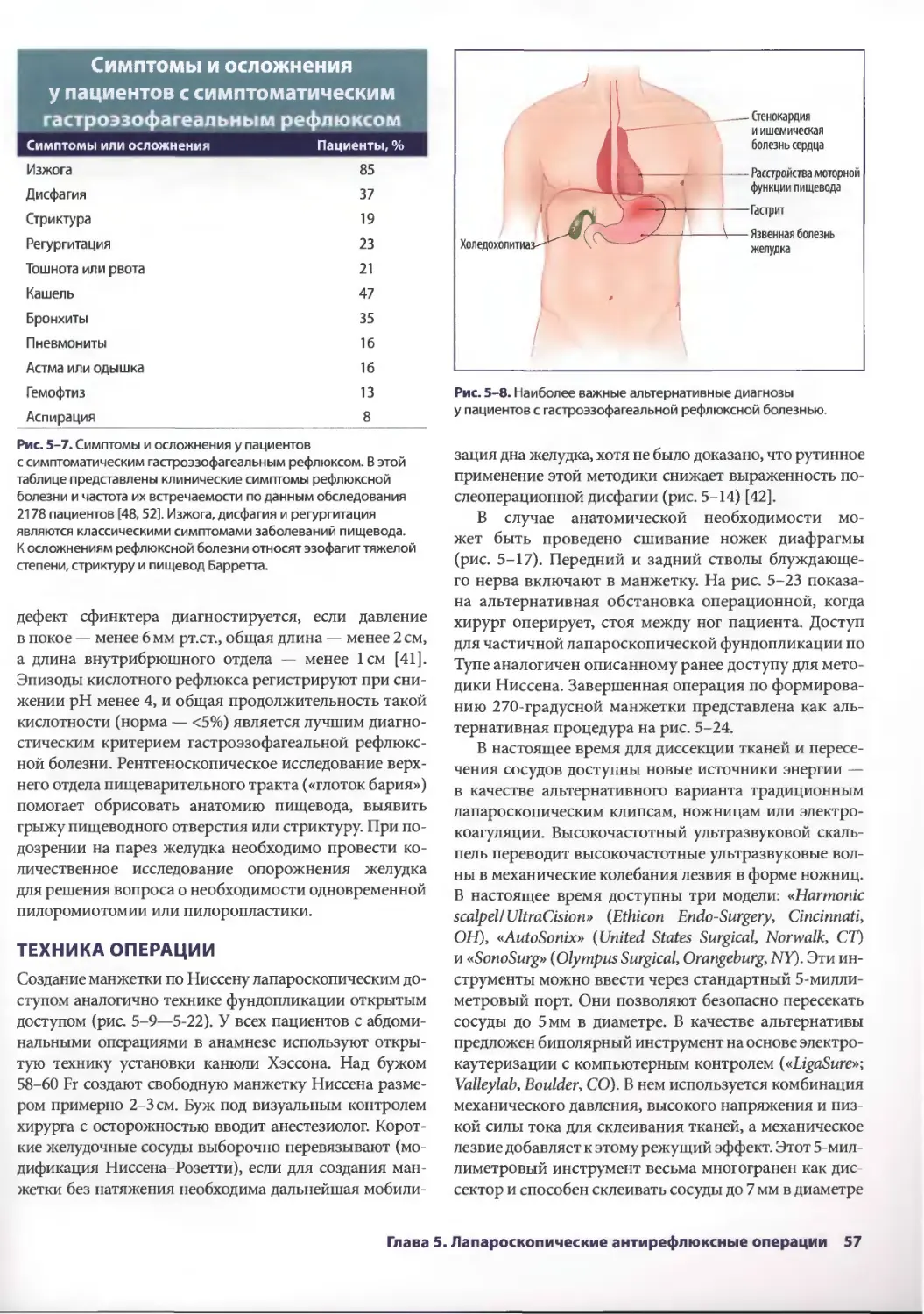
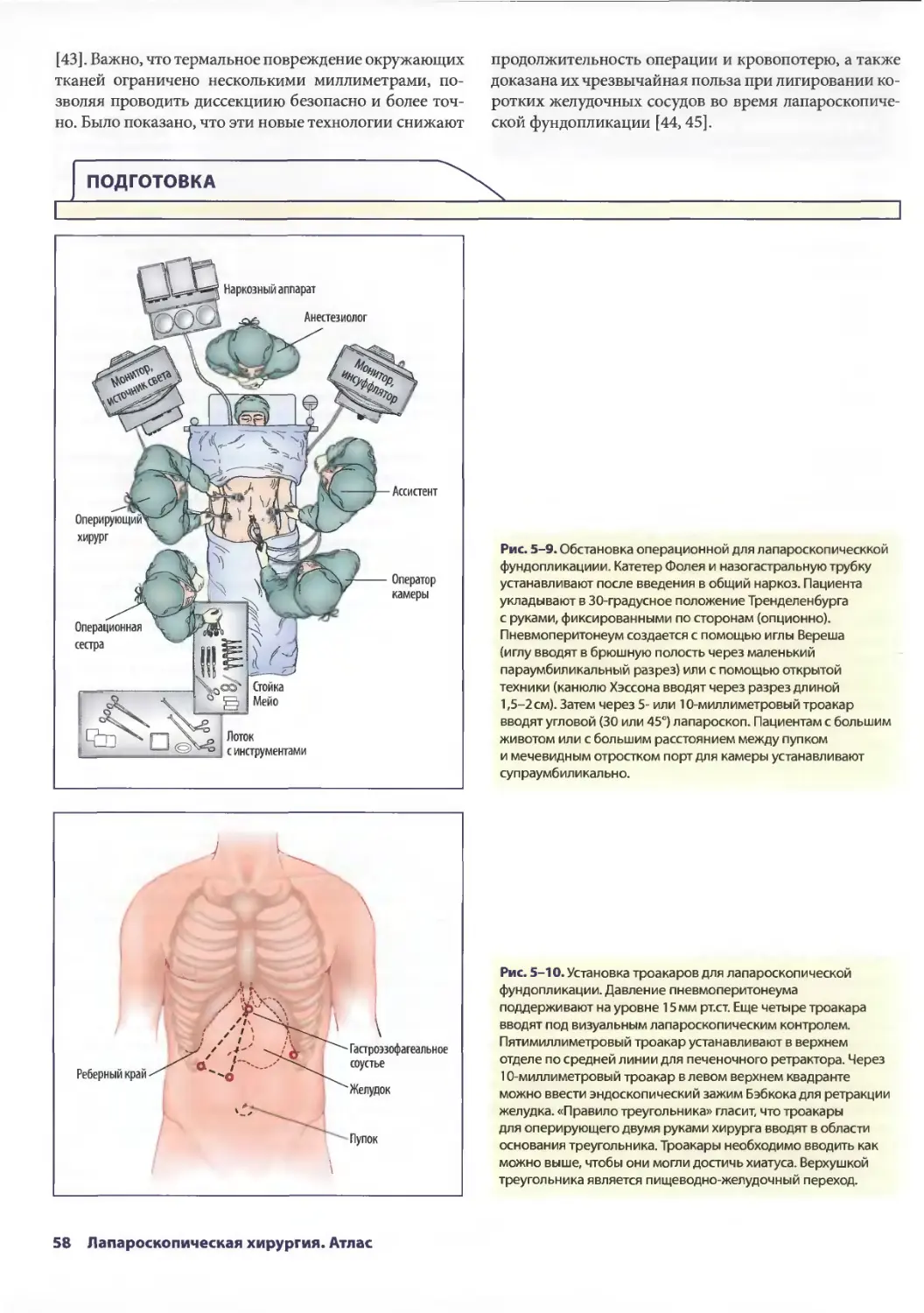
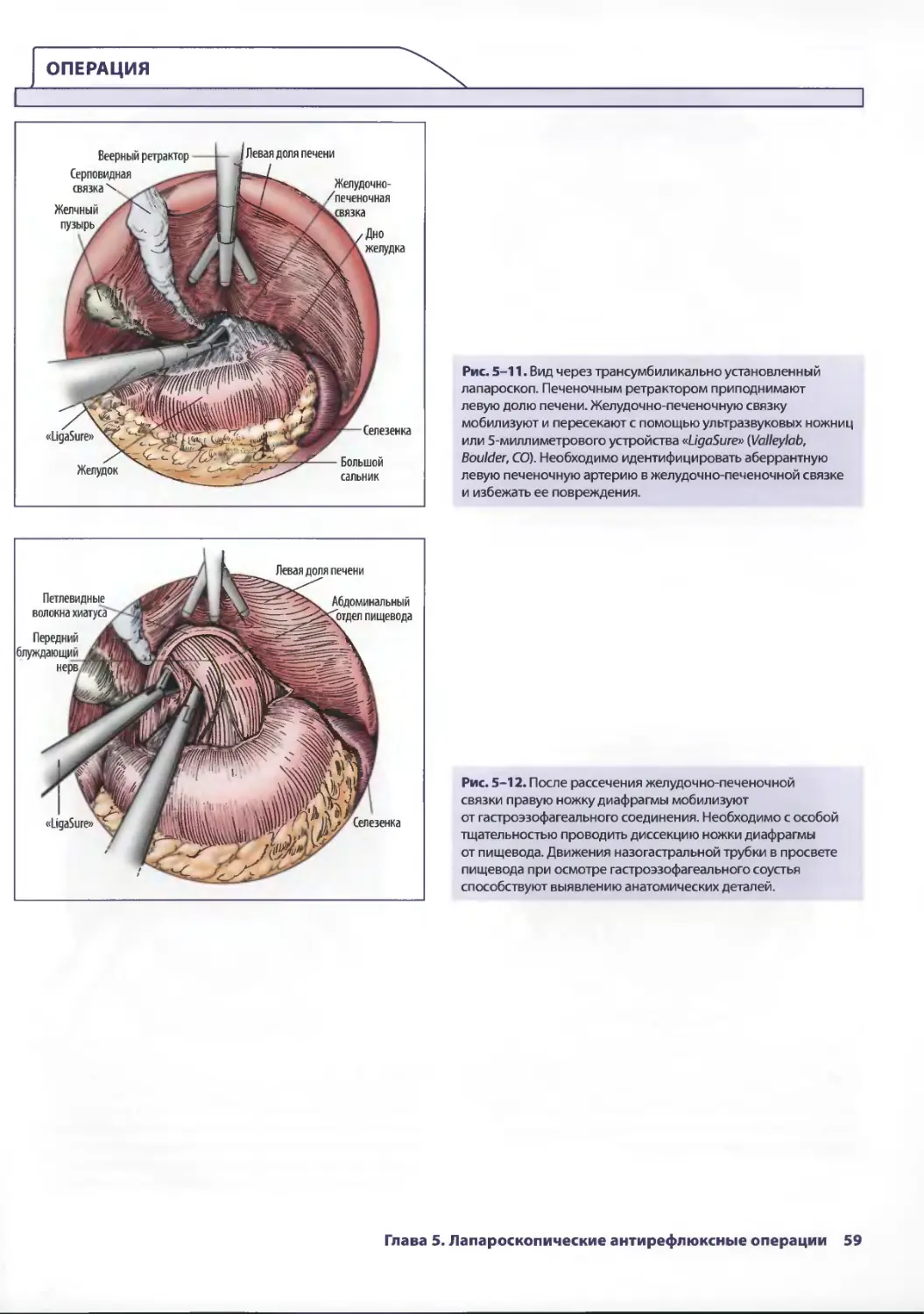
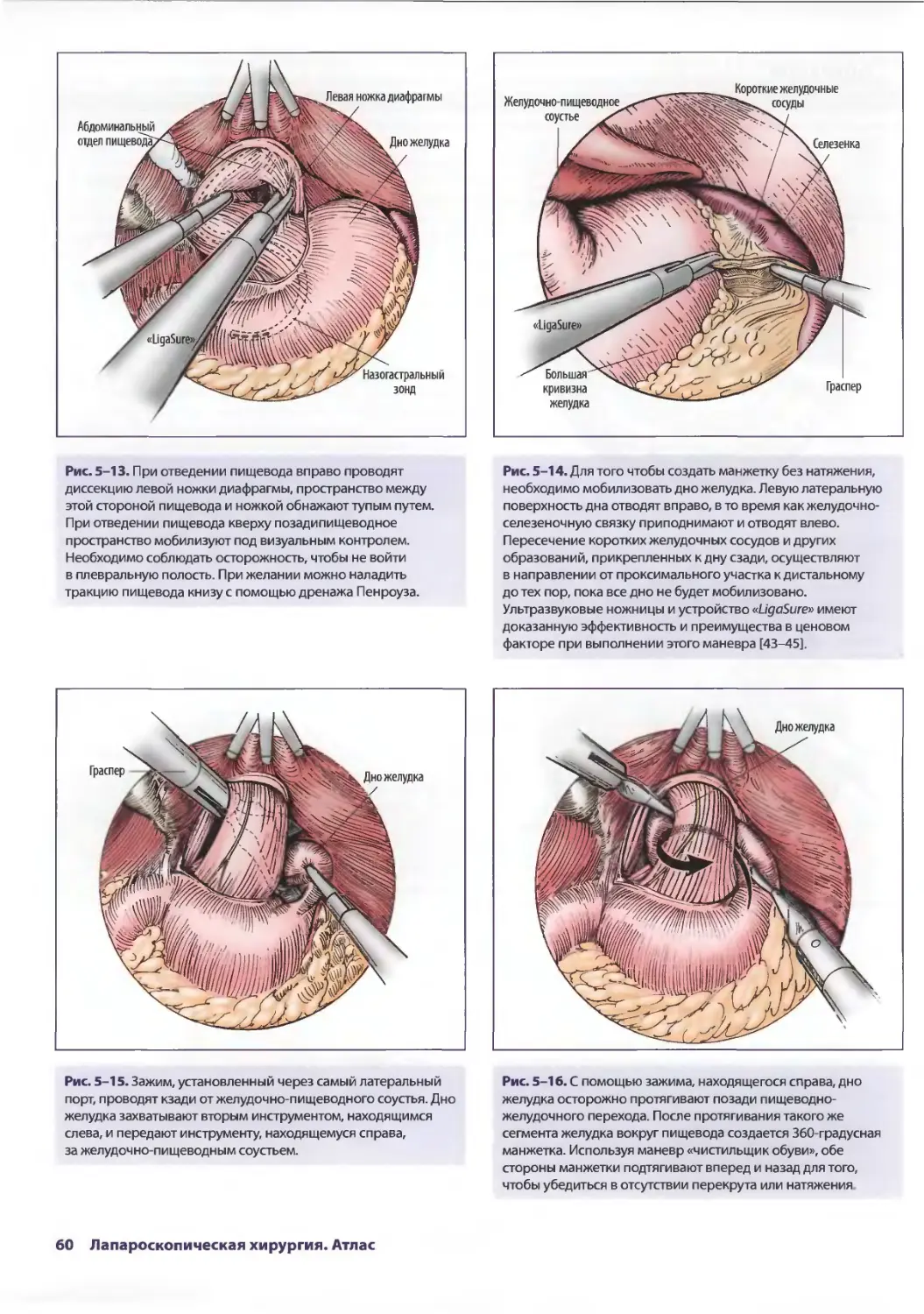
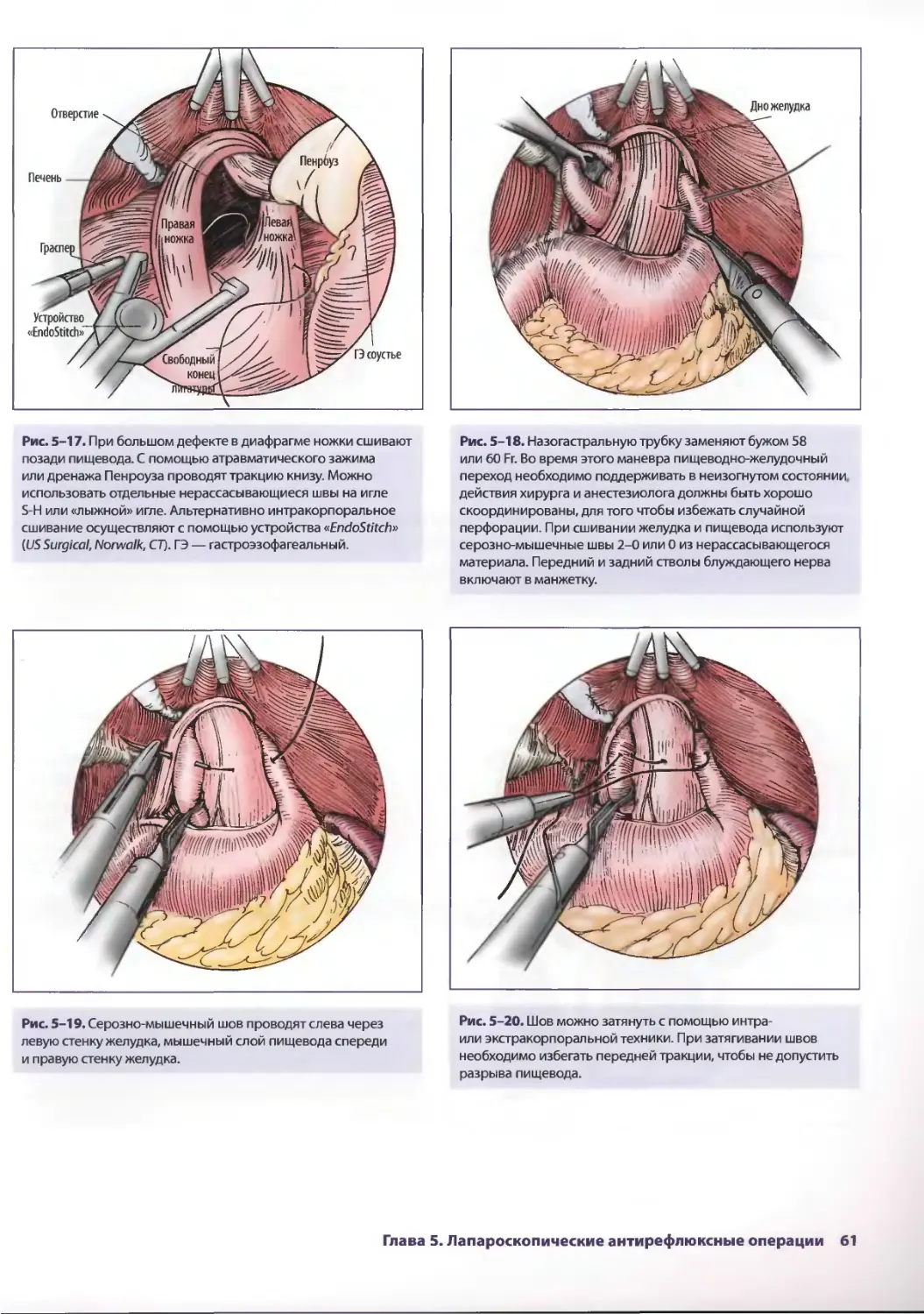
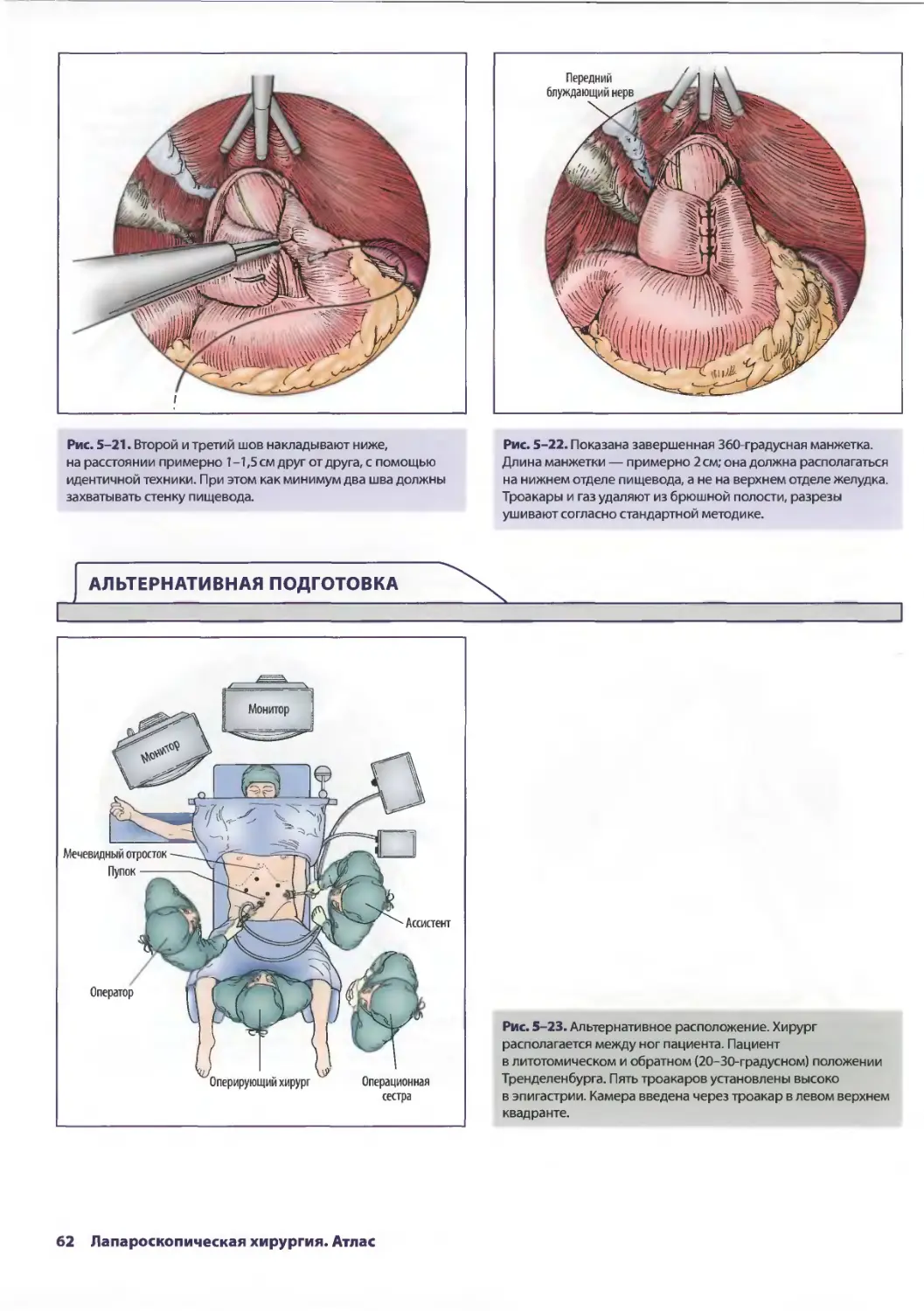
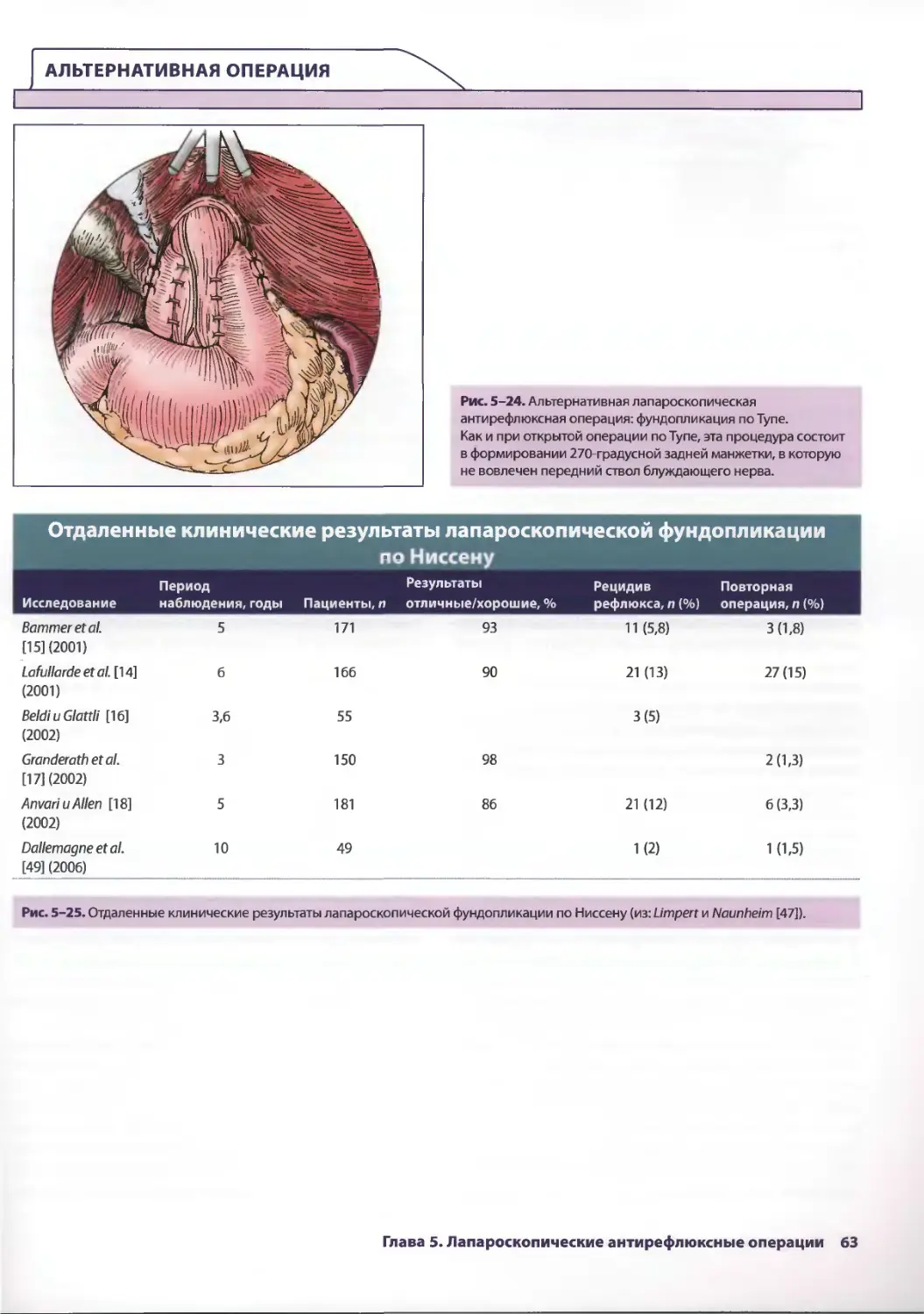
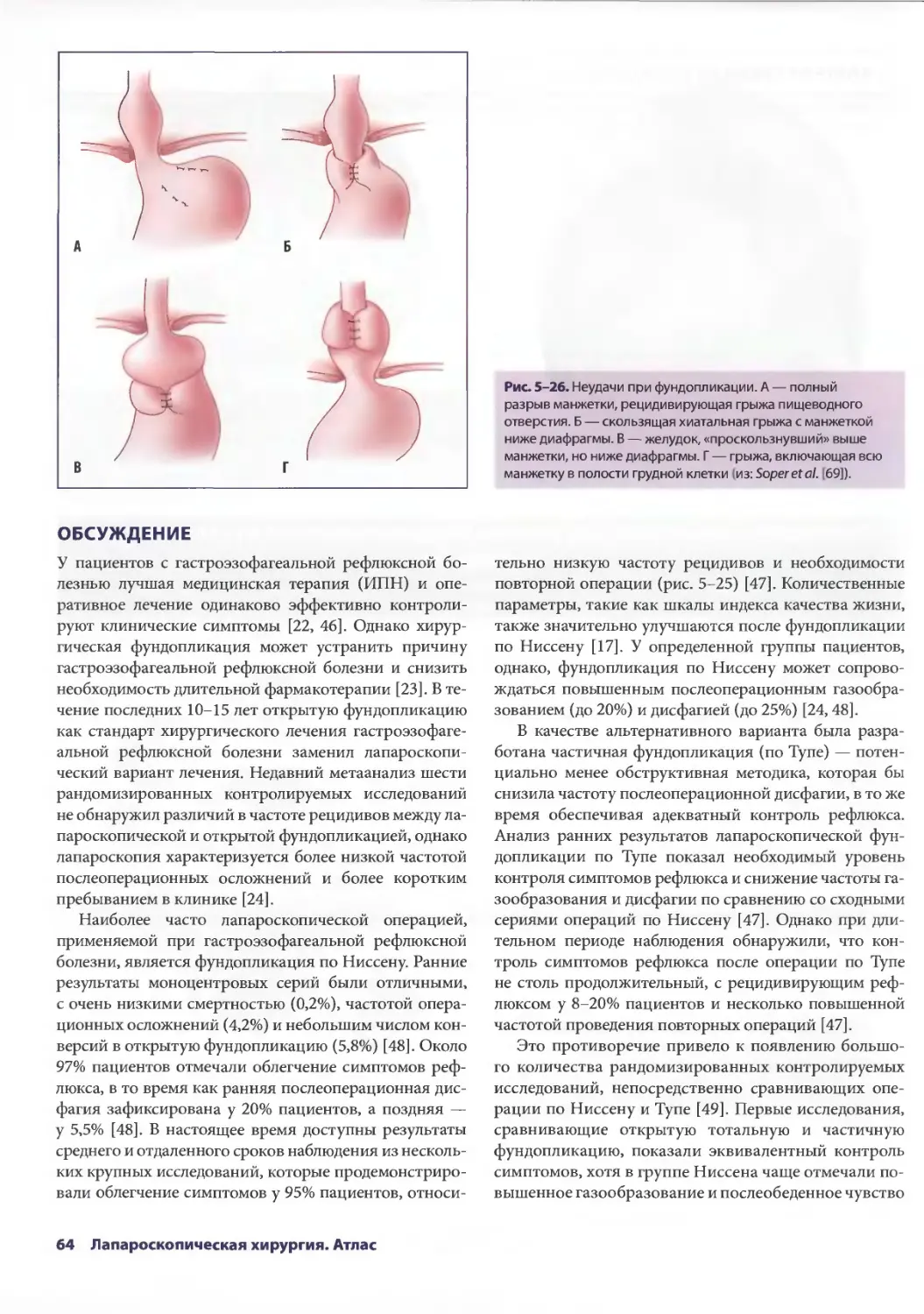
Глава 5. Лапароскопические антирефлюксные операции 53
Джонатан А. Хата, Теодор Н. Паппас
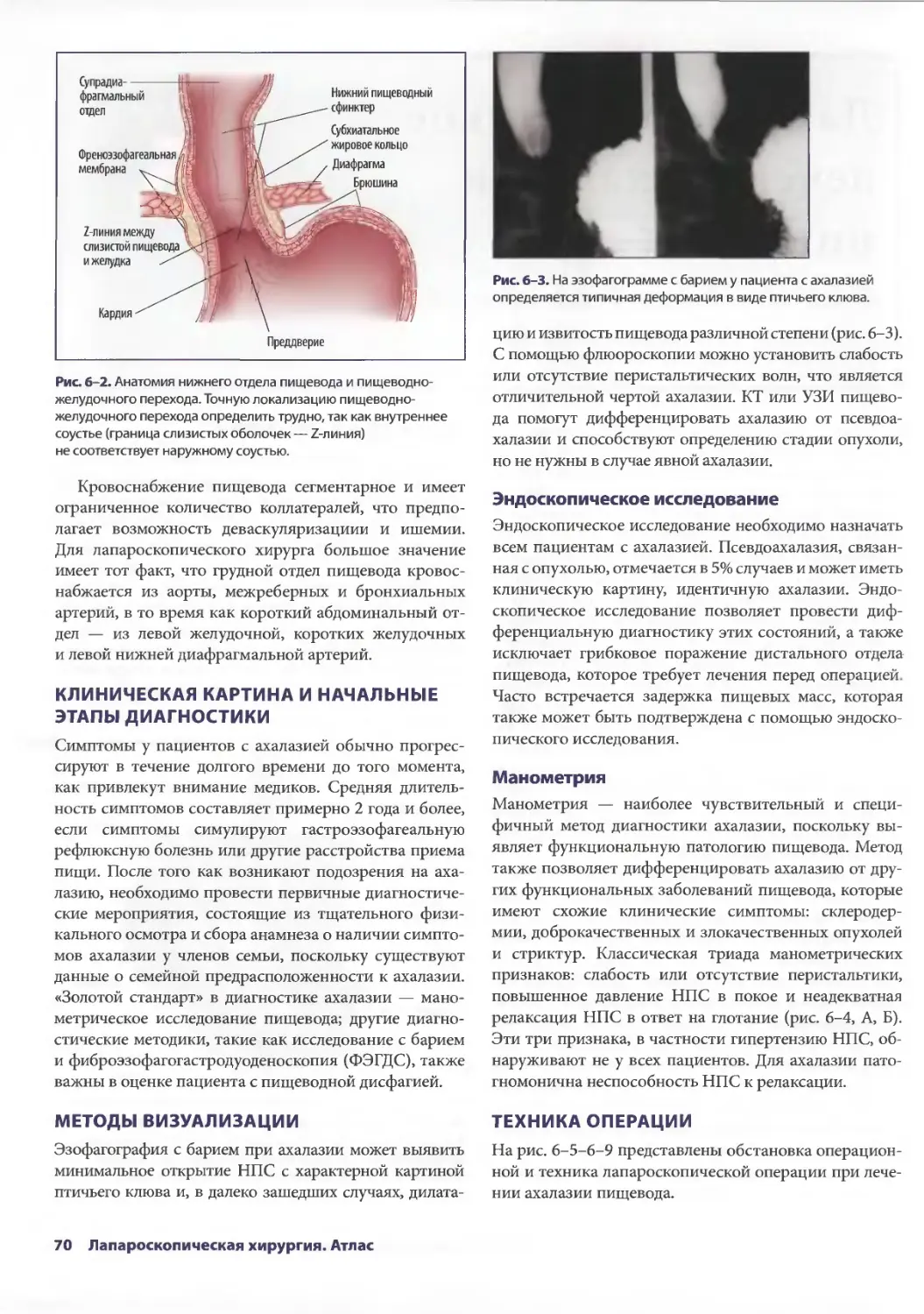
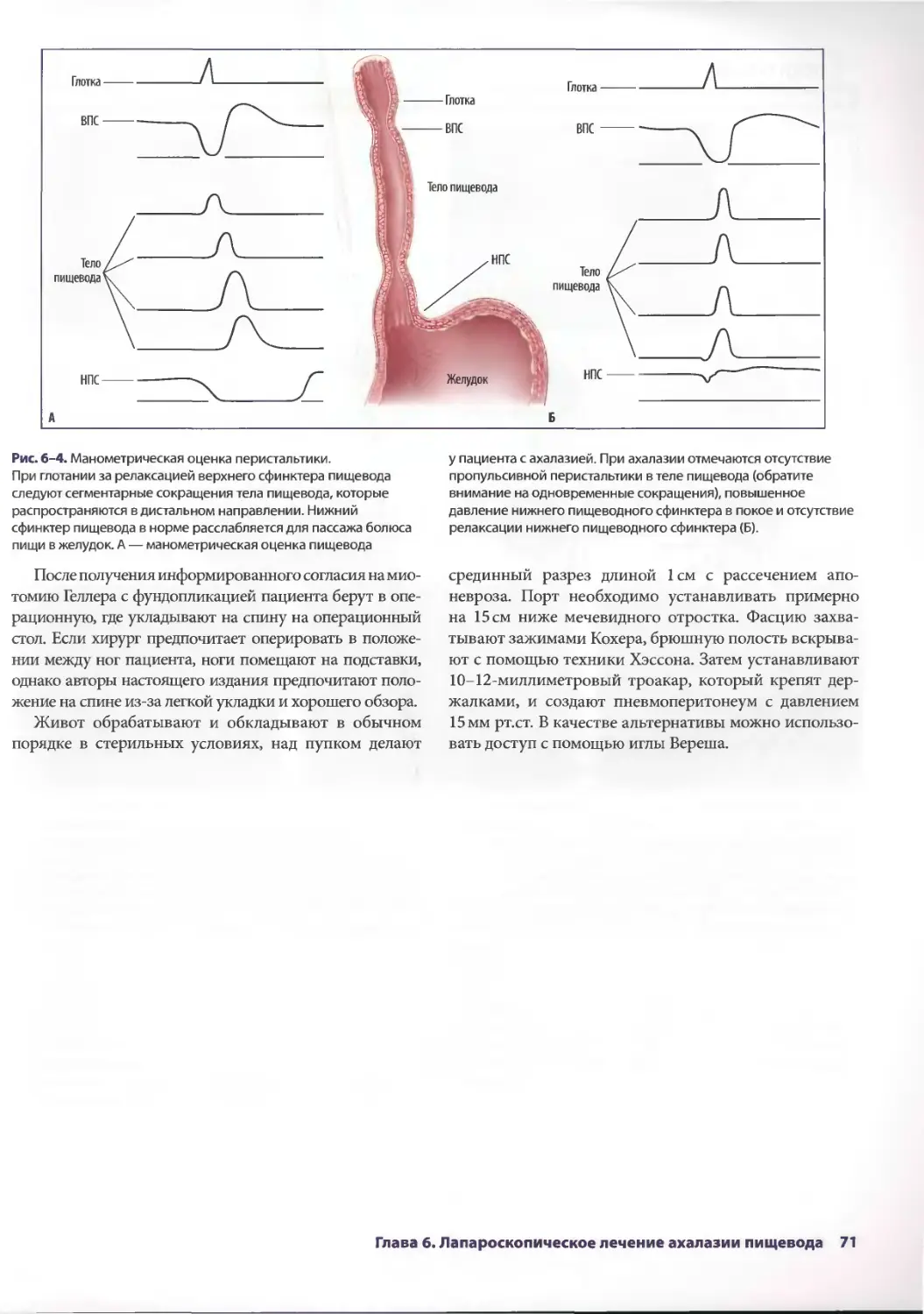
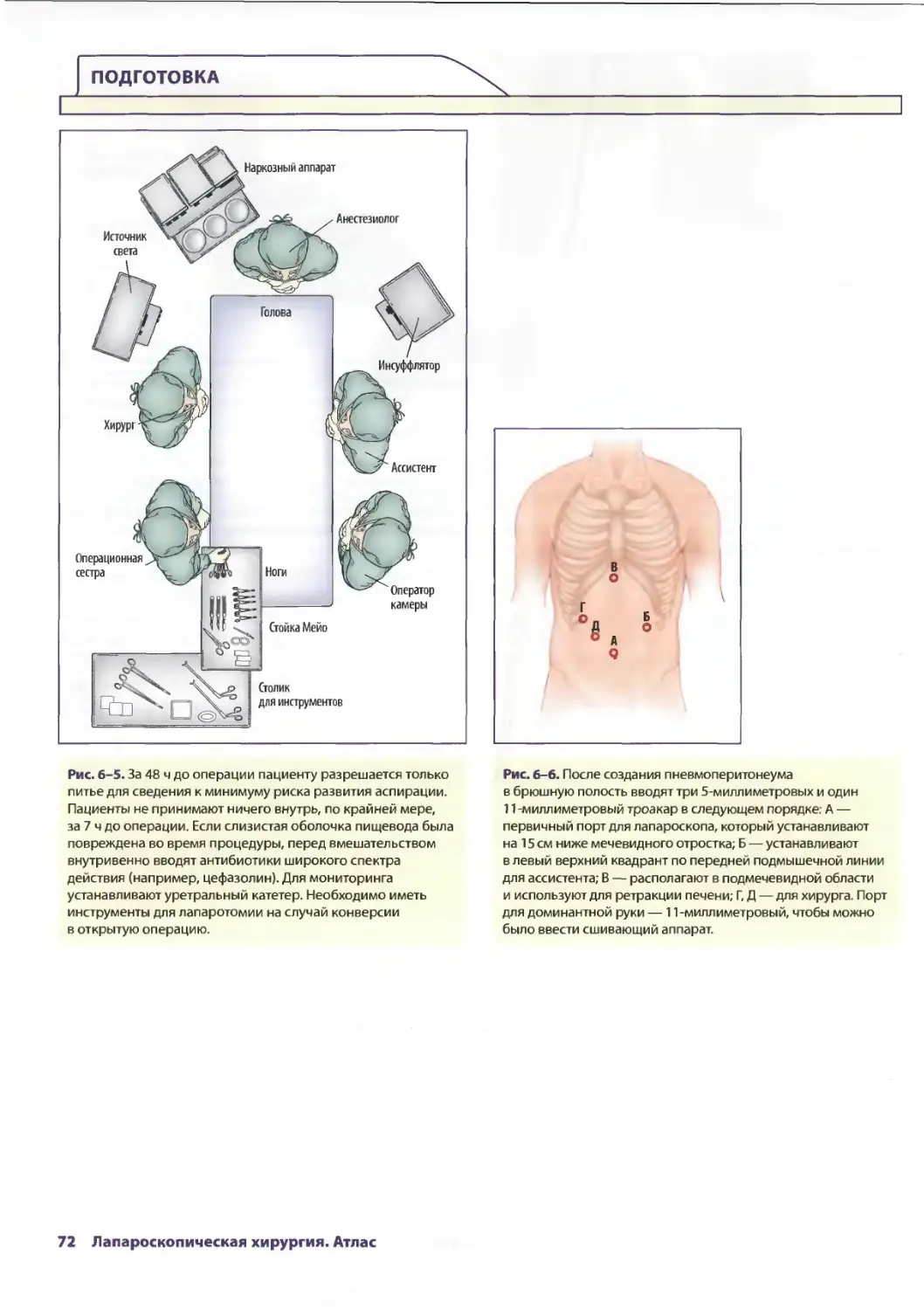
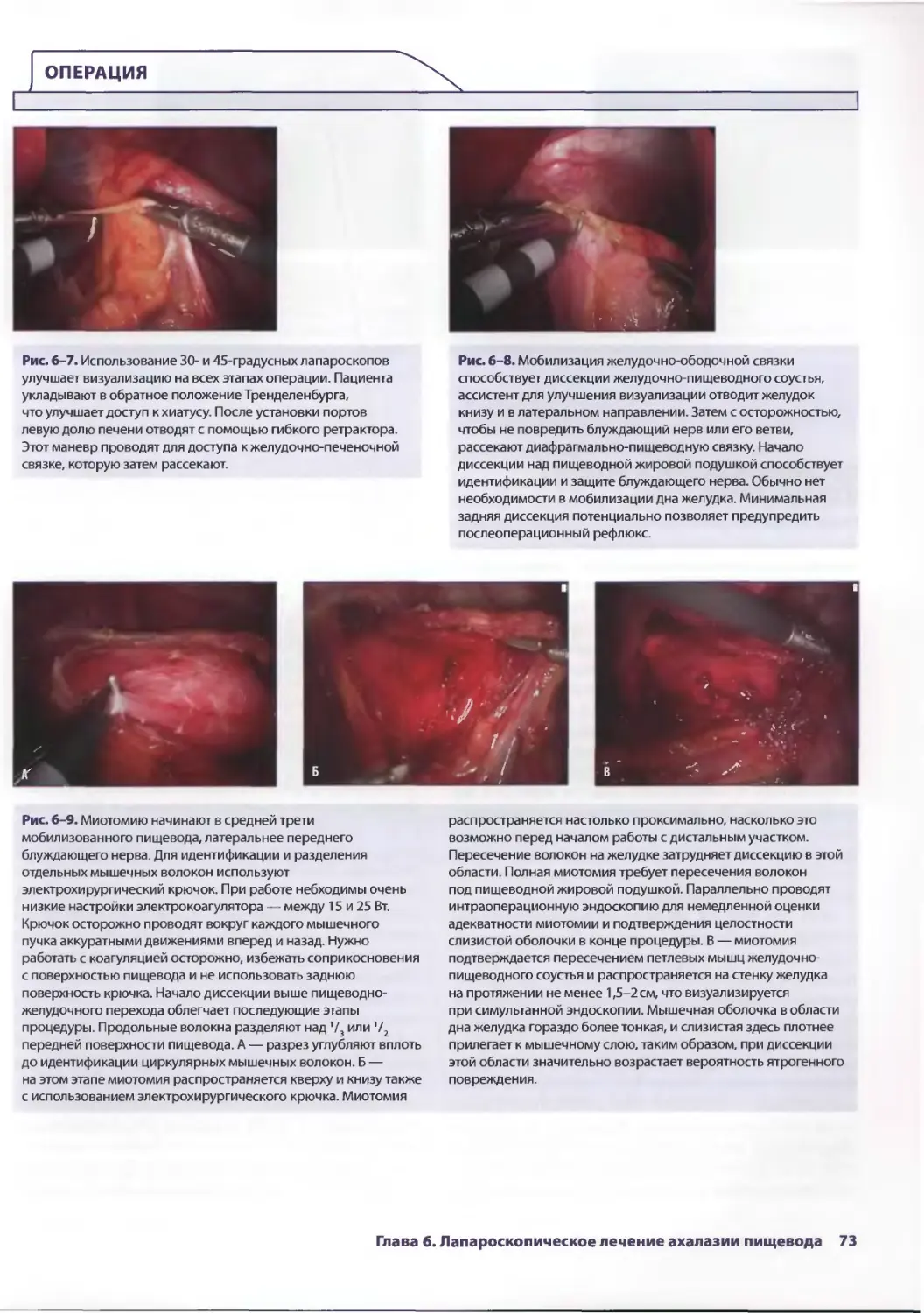
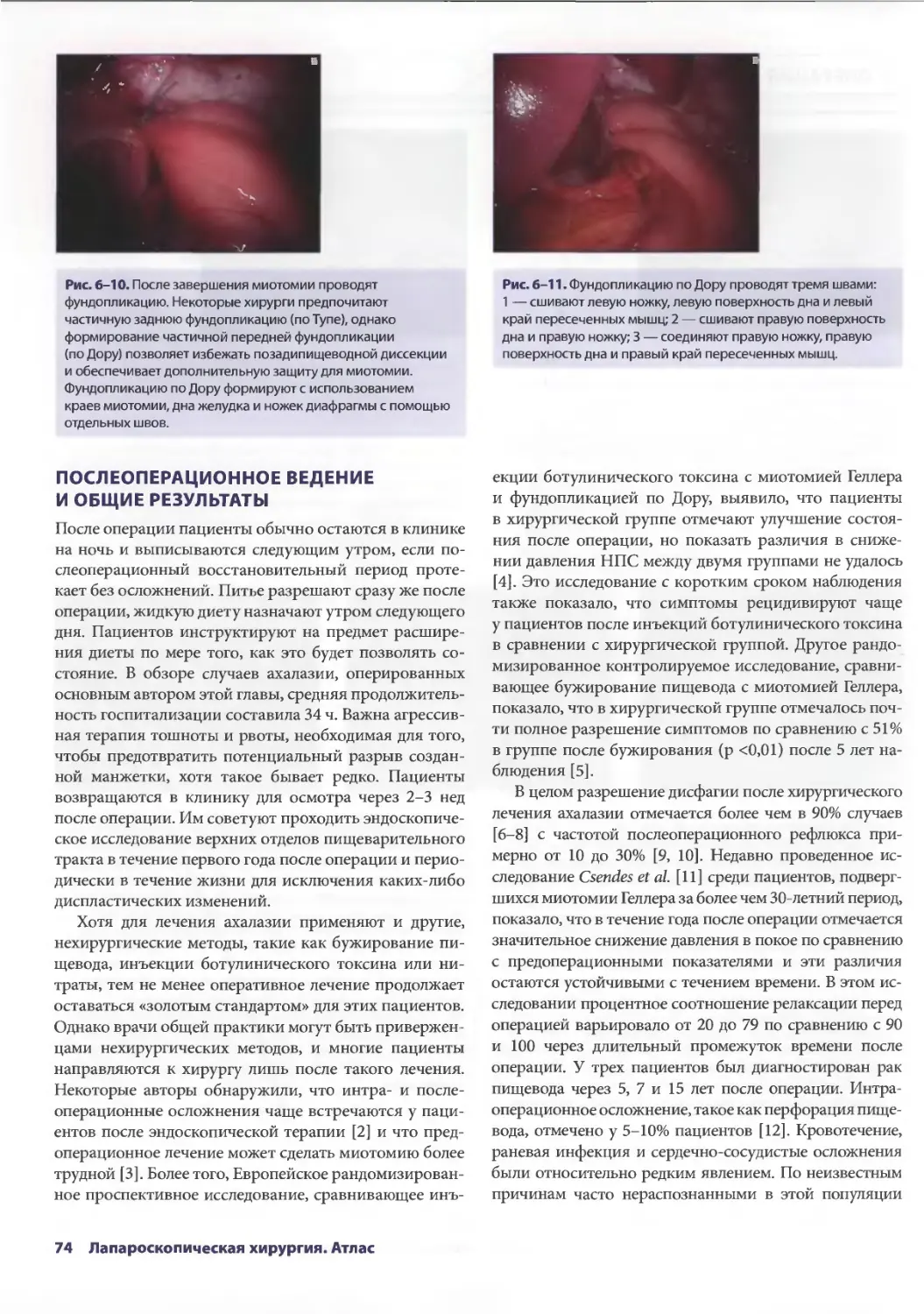
Глава 6. Лапароскопическое лечение ахалазии пищевода 69
Себастьян Ж. дела Фуенте, Аврора Д. Приор
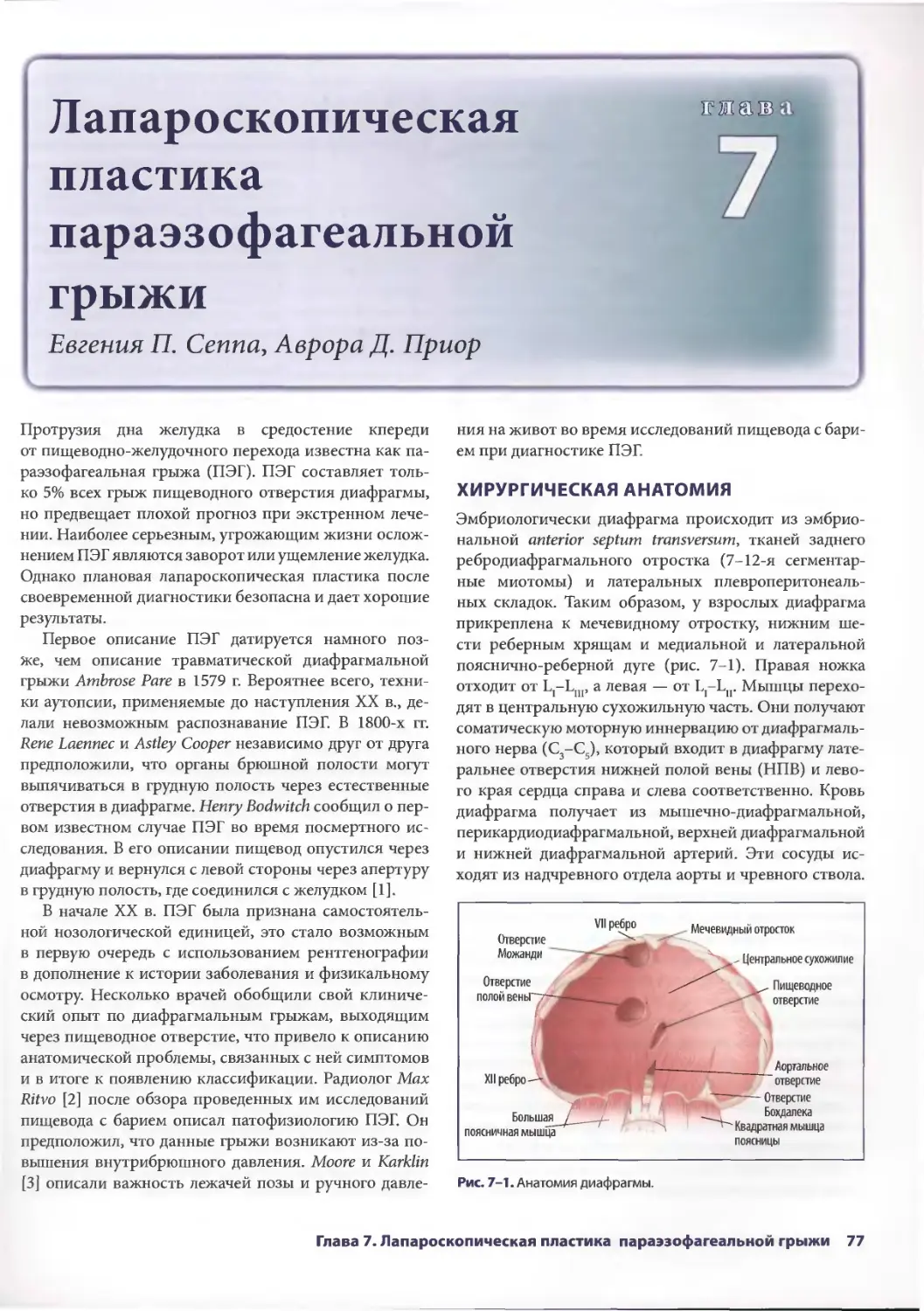
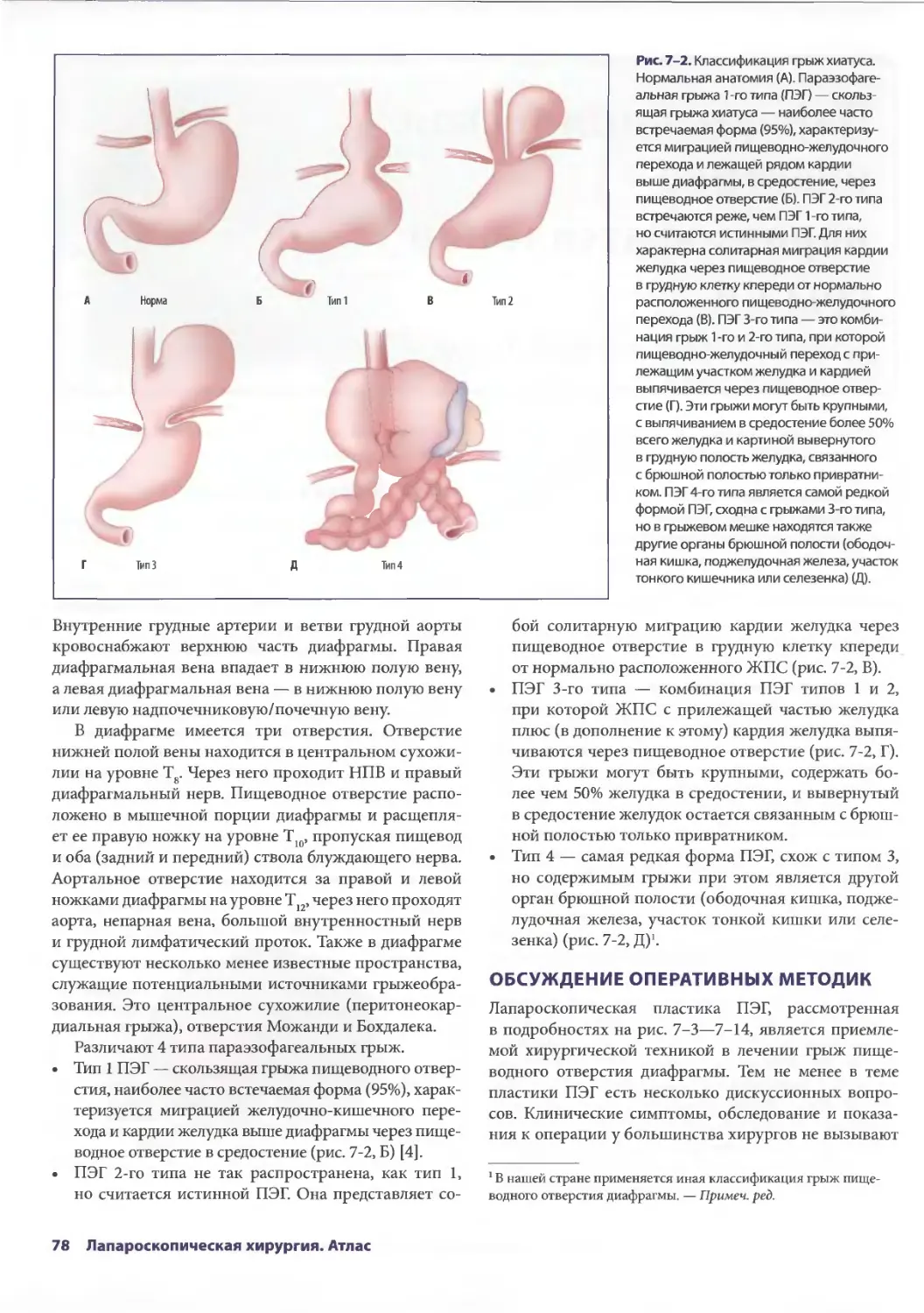
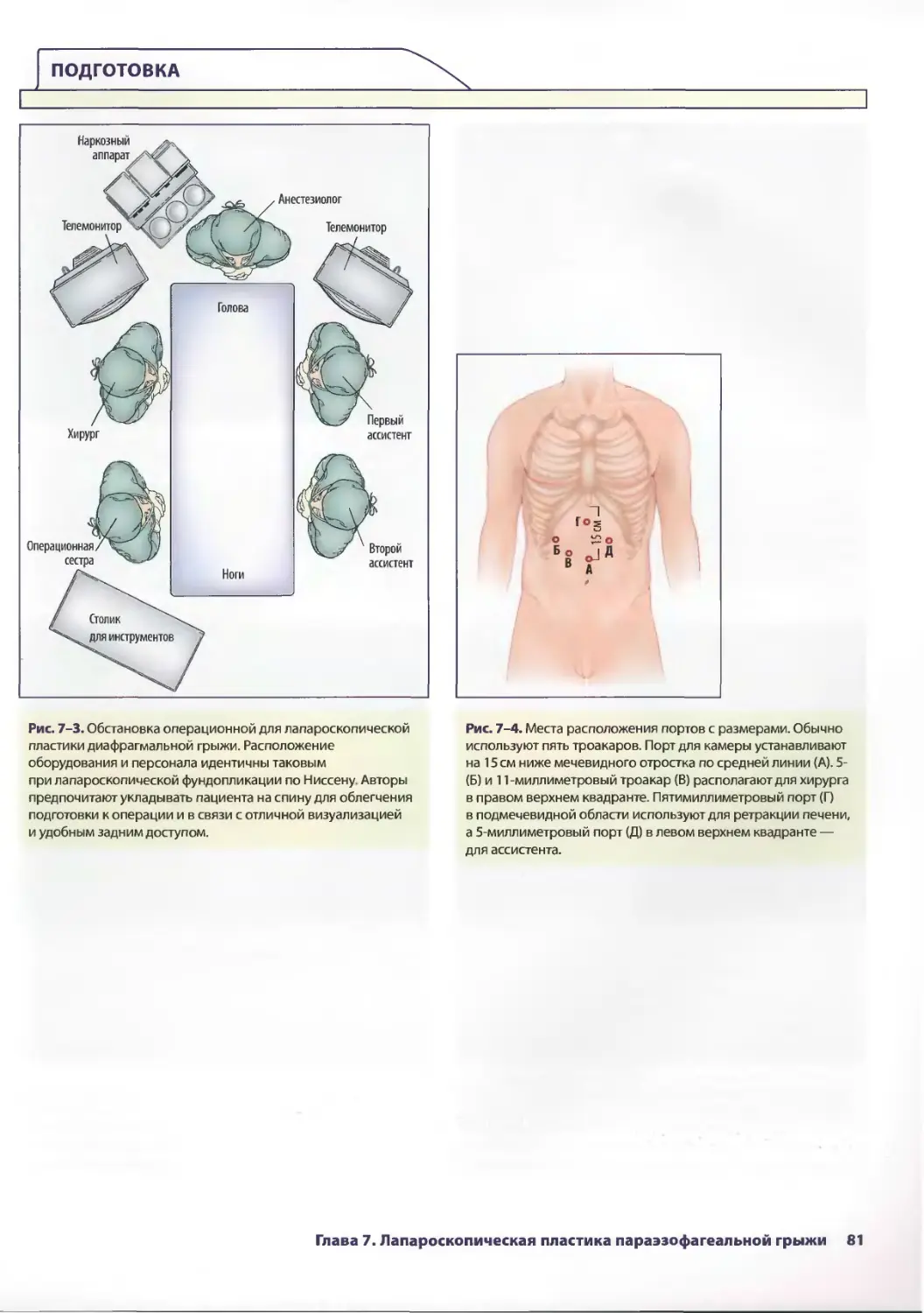
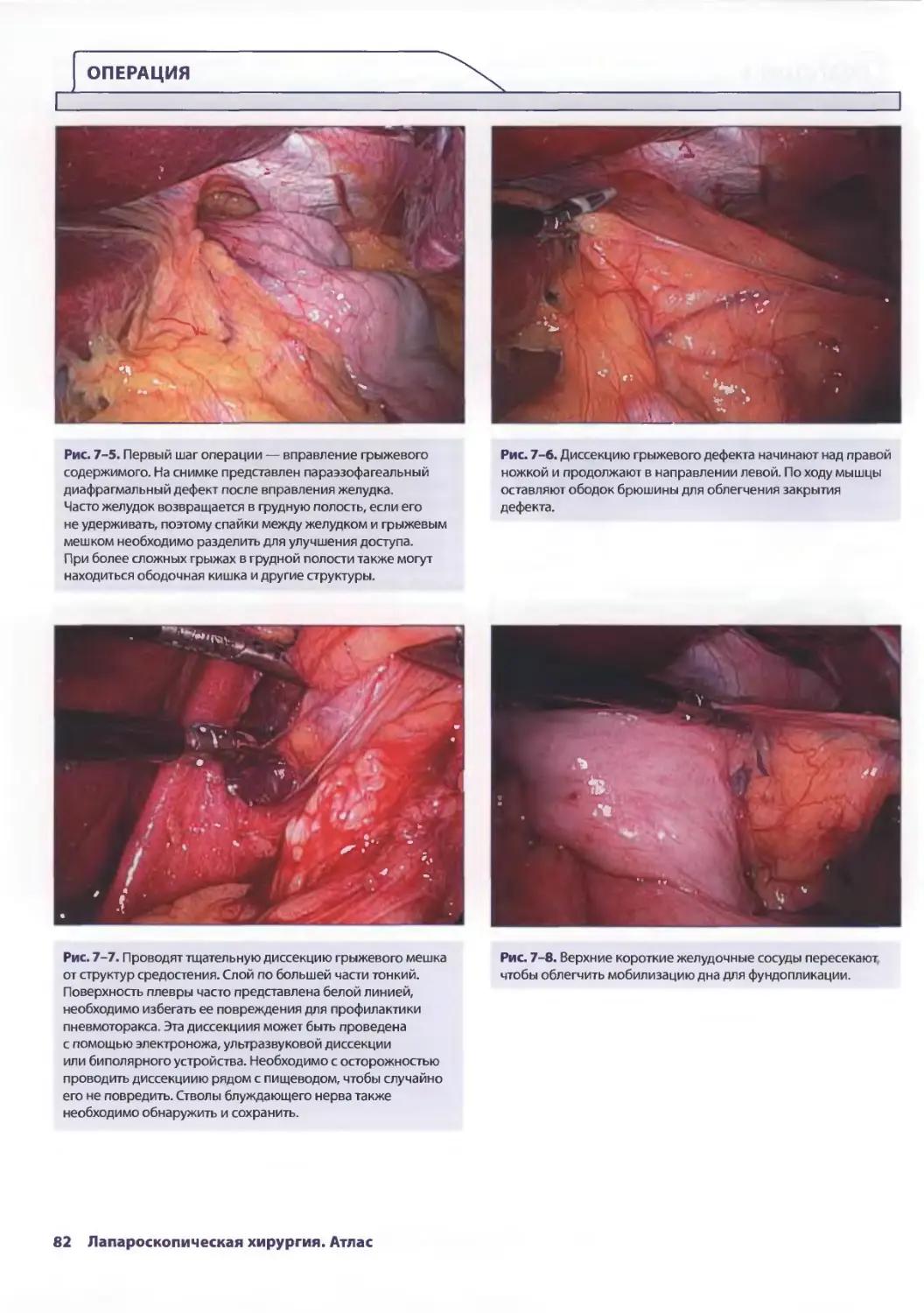
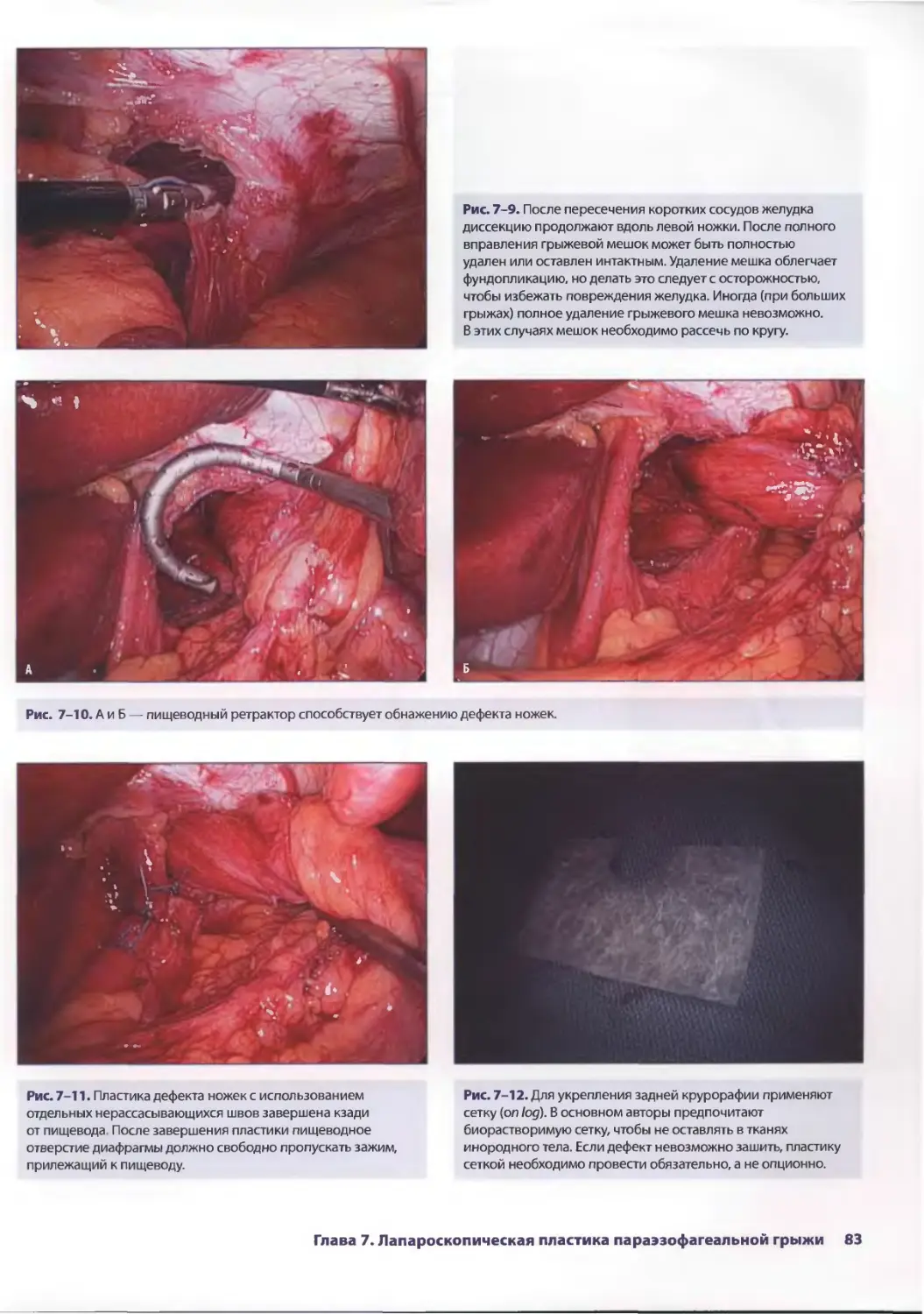
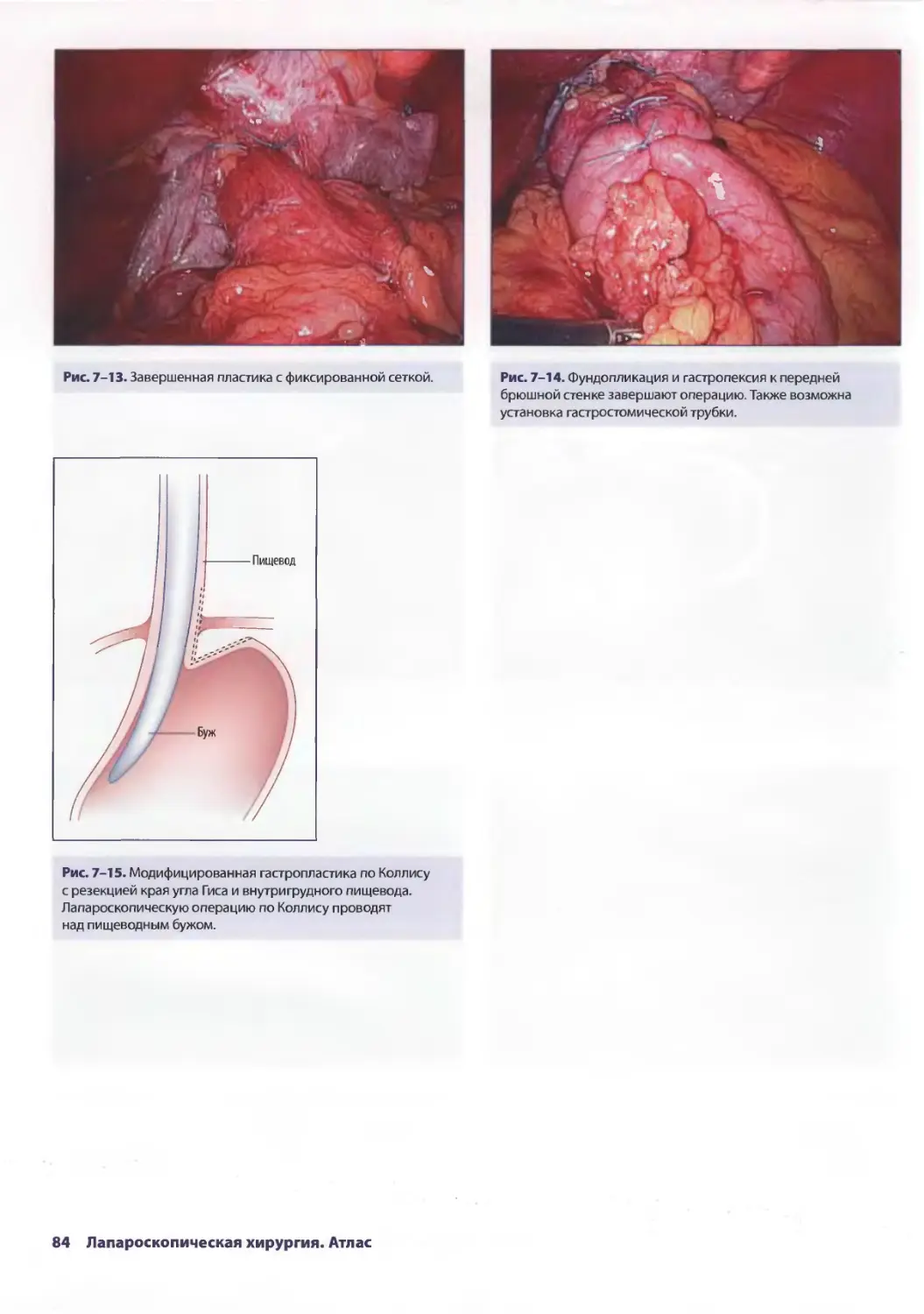
Глава 7. Лапароскопическая пластика параэзофагеальной грыжи 77
Евгения П. Сеппа, Аврора Д. Приор
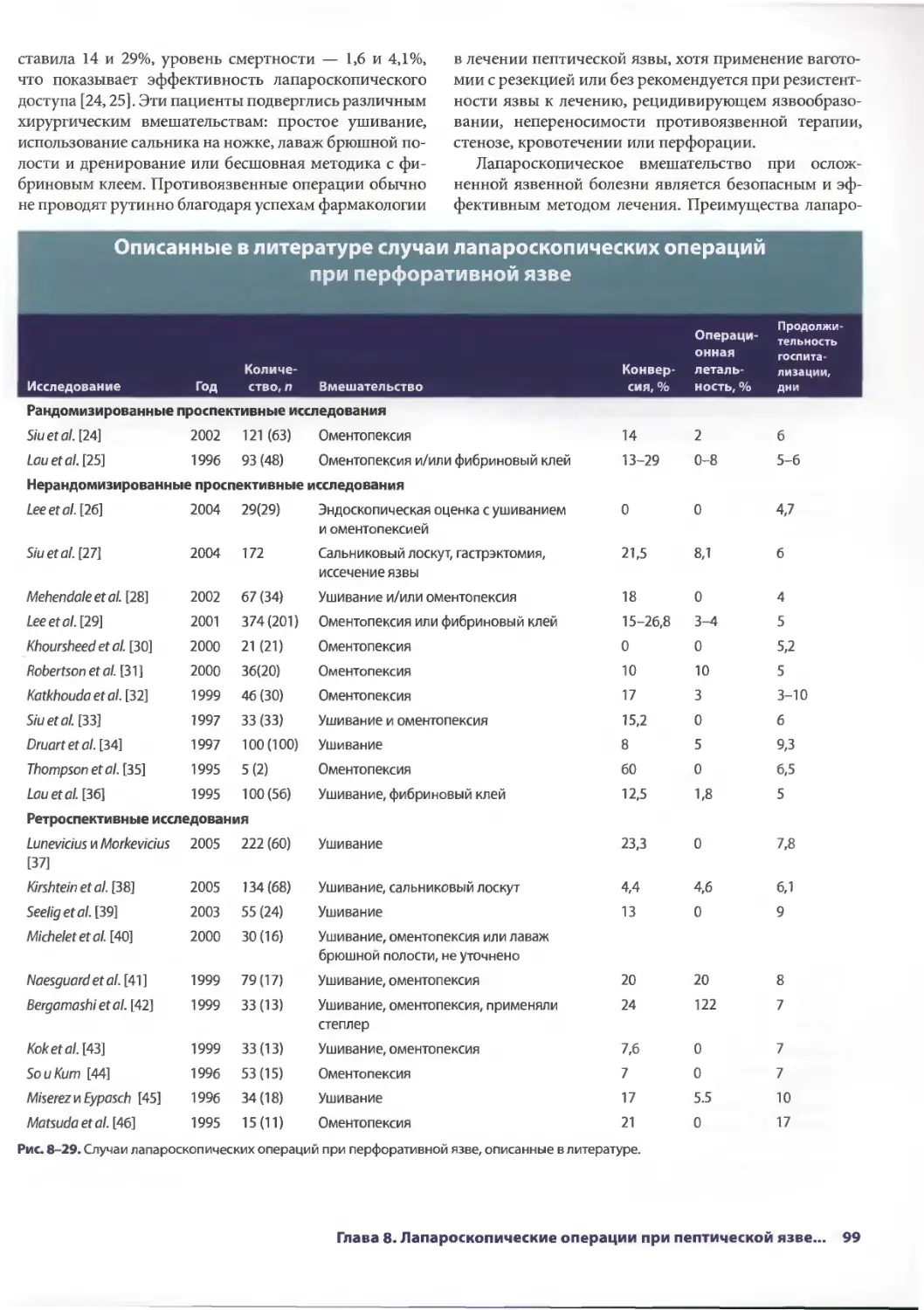
Глава 8. Лапароскопические операции при пептическои язве:
ваготомия и ушивание перфоративной язвы 87
Диана Л. Дисен, Джон С. Хани, Теодор Н. Паппас
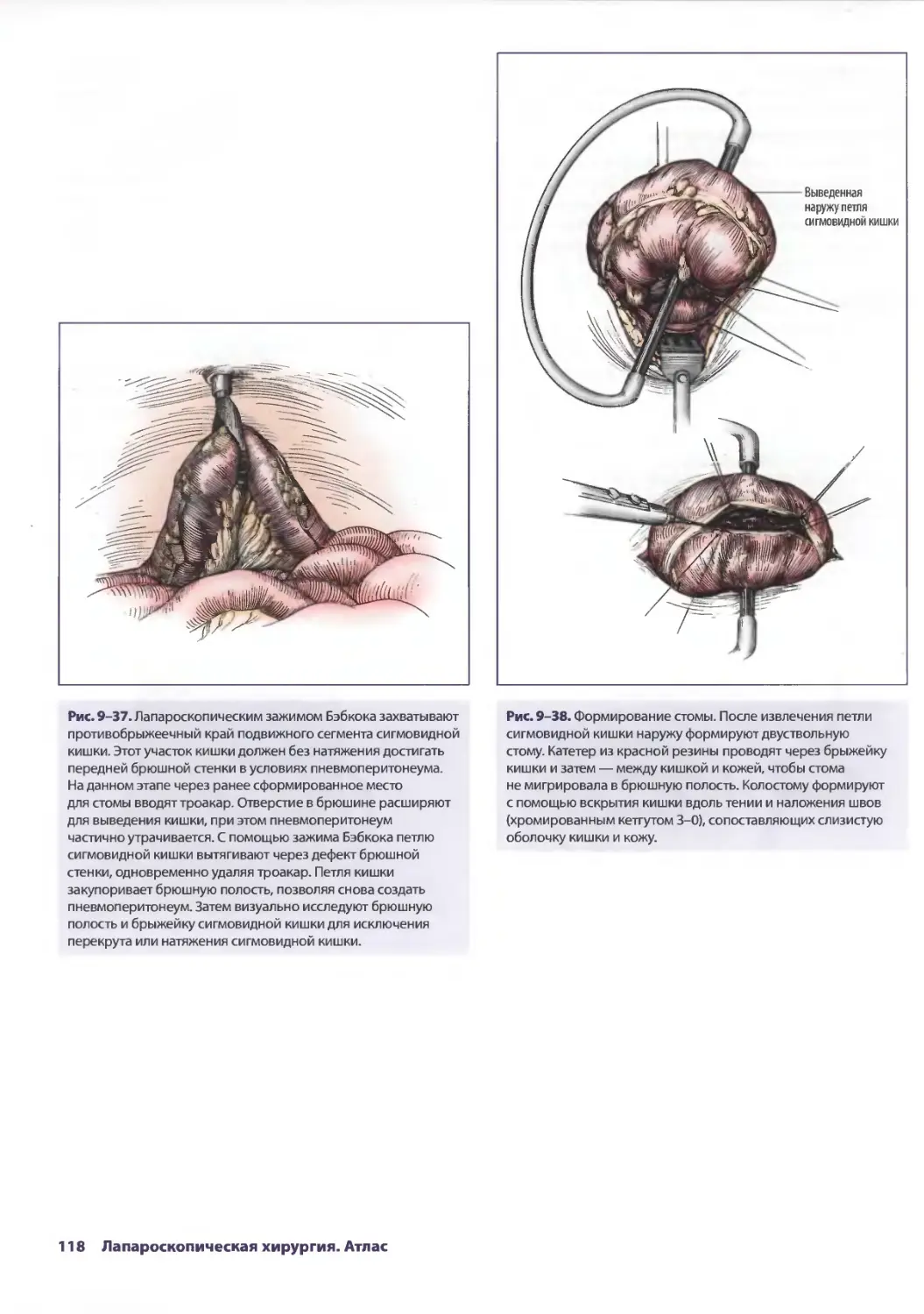
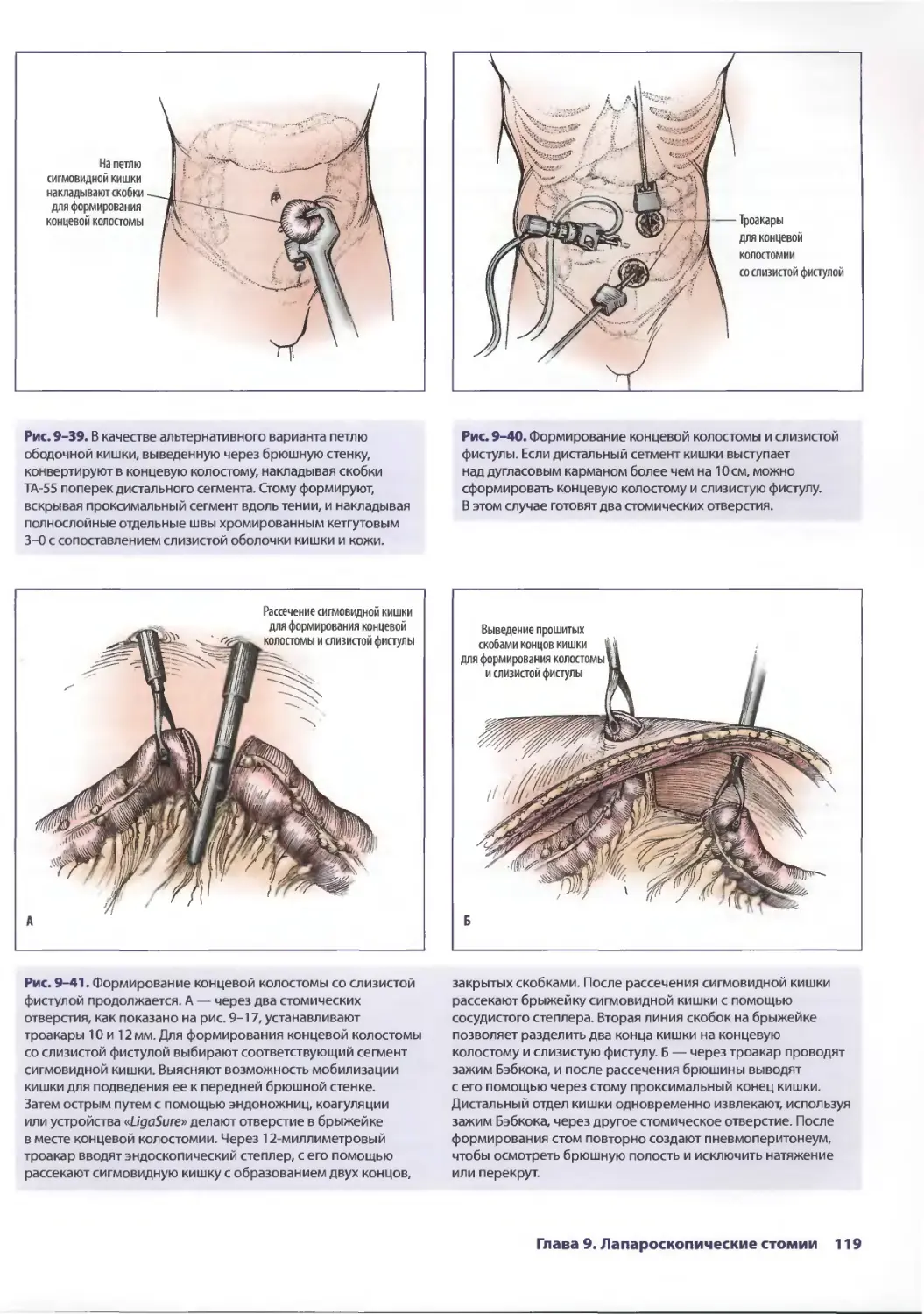
Глава 9. Лапароскопические стомии 103
Дженнифер X. Олдринк, Сэндия А. Лагу-Динэдэялэн
Лиза А. Кларк, Джон П. Грант
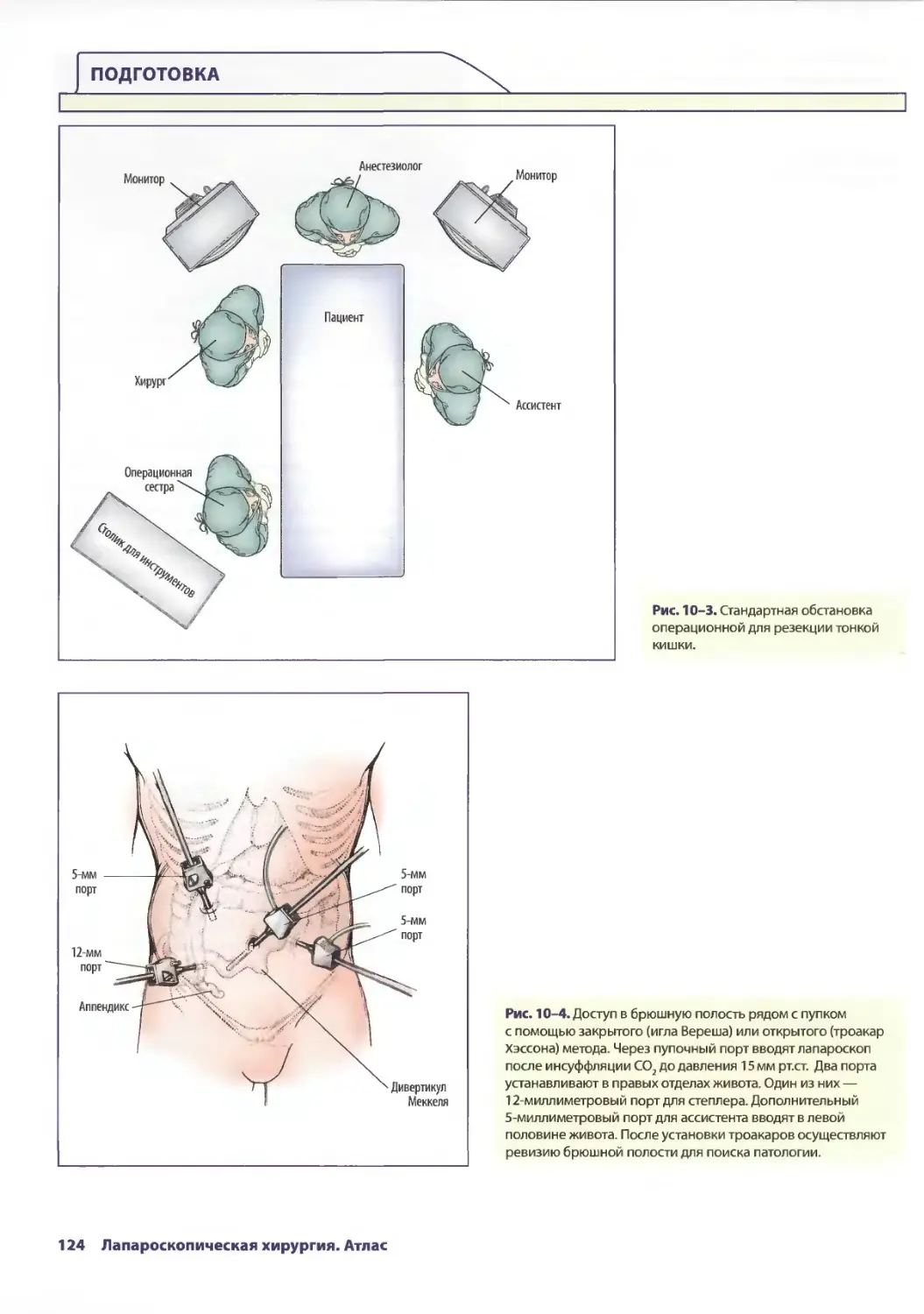
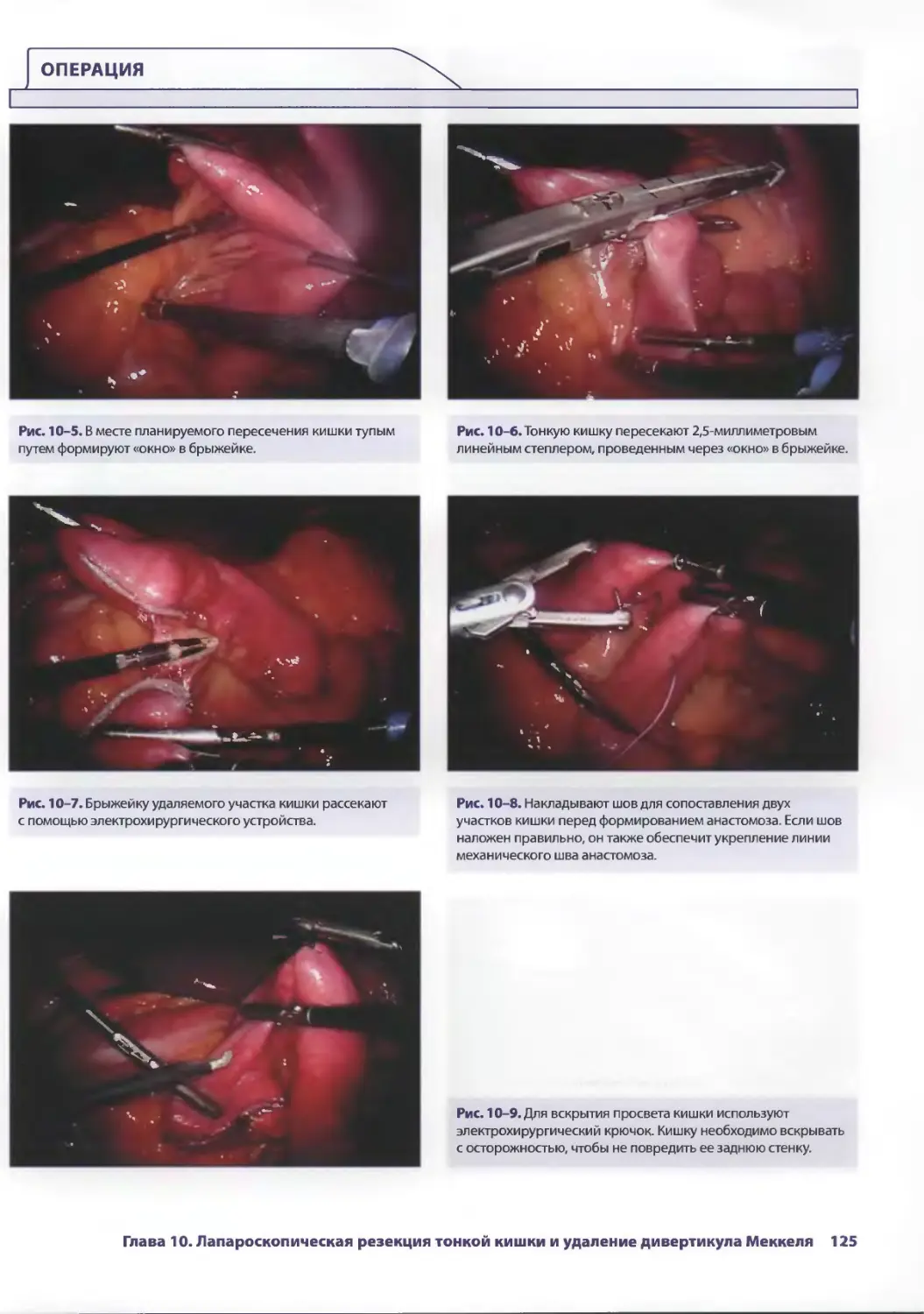
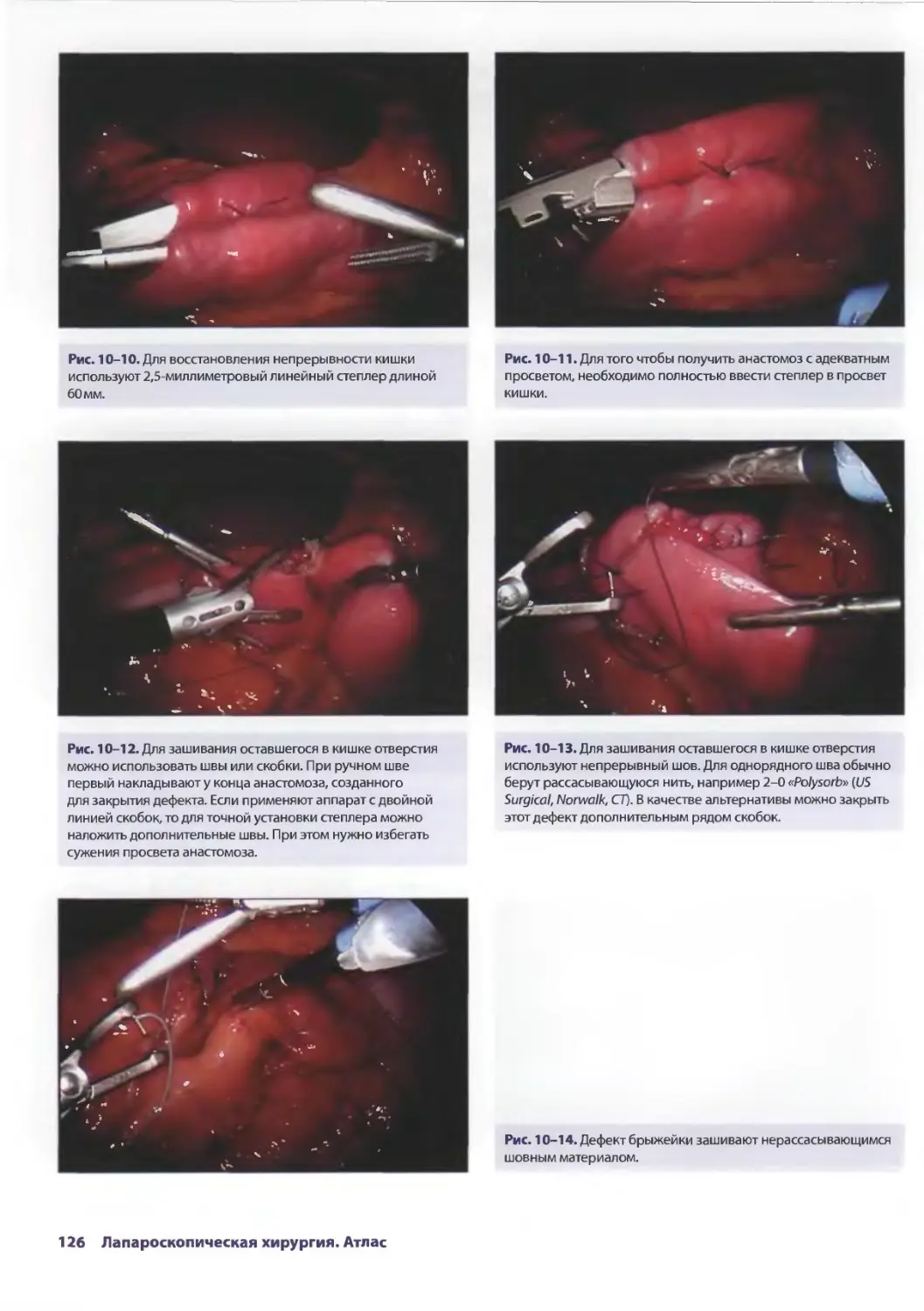
Глава 10. Лапароскопическая резекция тонкой кишки
и удаление дивертикула Меккеля 121
СДениз Чинг, Аврора Д. Приор
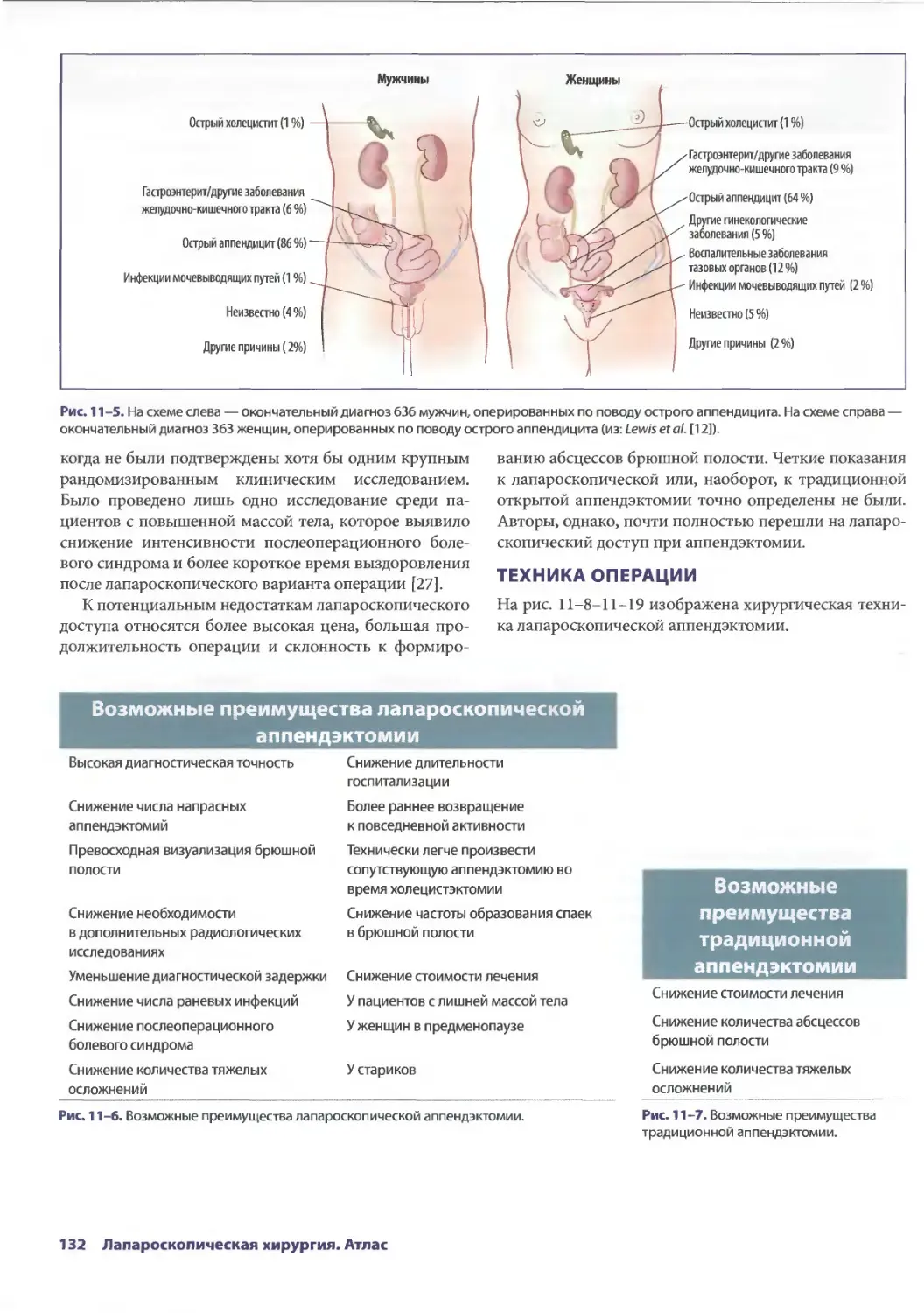
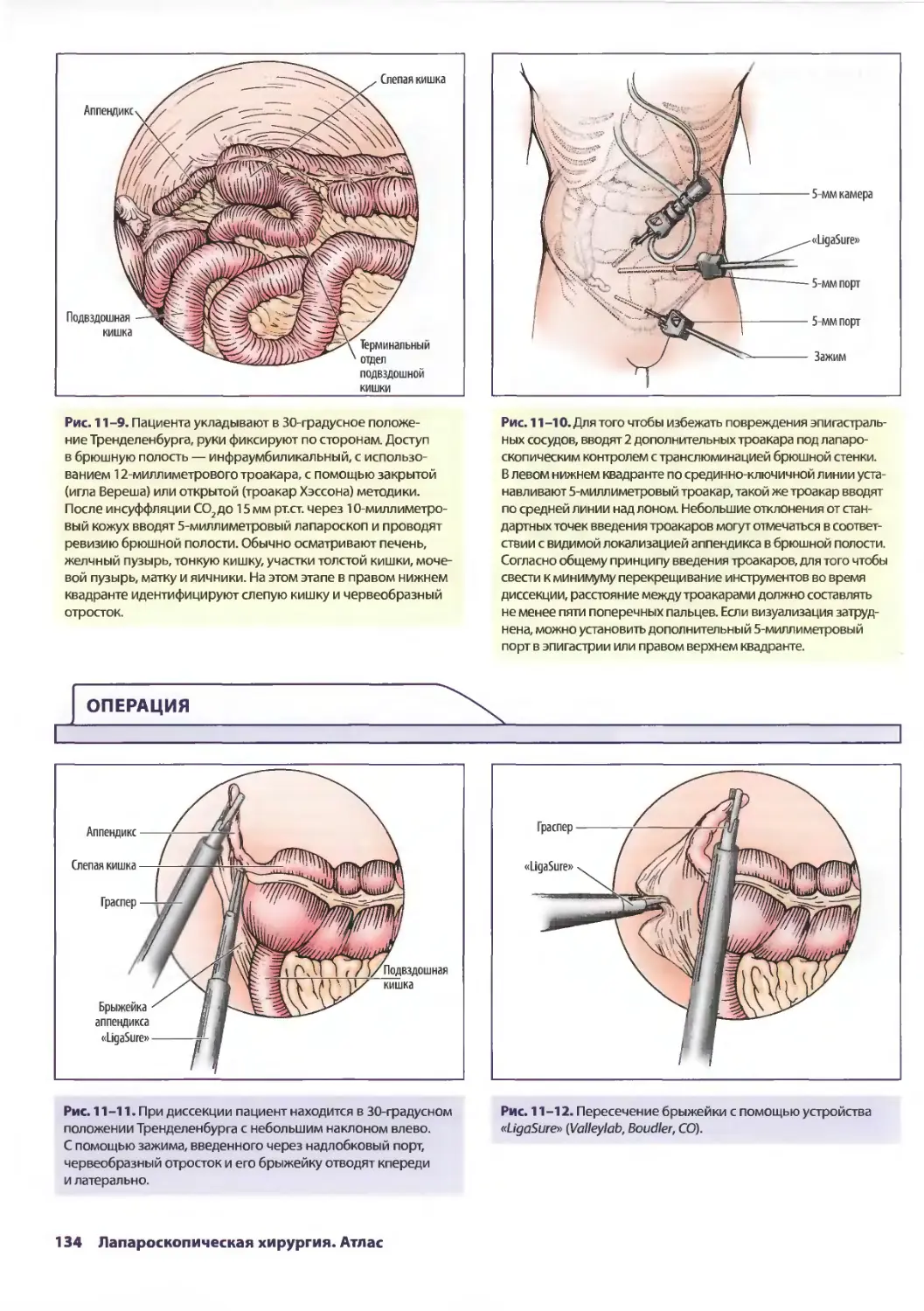
Глава 11. Лапароскопическая аппендэктомия 129
РобертоДж. Мэнсон, КеркА. Людвиг
Глава 12. Лапароскопическая колэктомия 141
Джонатан А. Хата, КеркА. Людвиг
Глава 13. Лапароскопическая холецистэктомия 161
Дэвид Синдрэм, Кфер Бэн-Дэвид
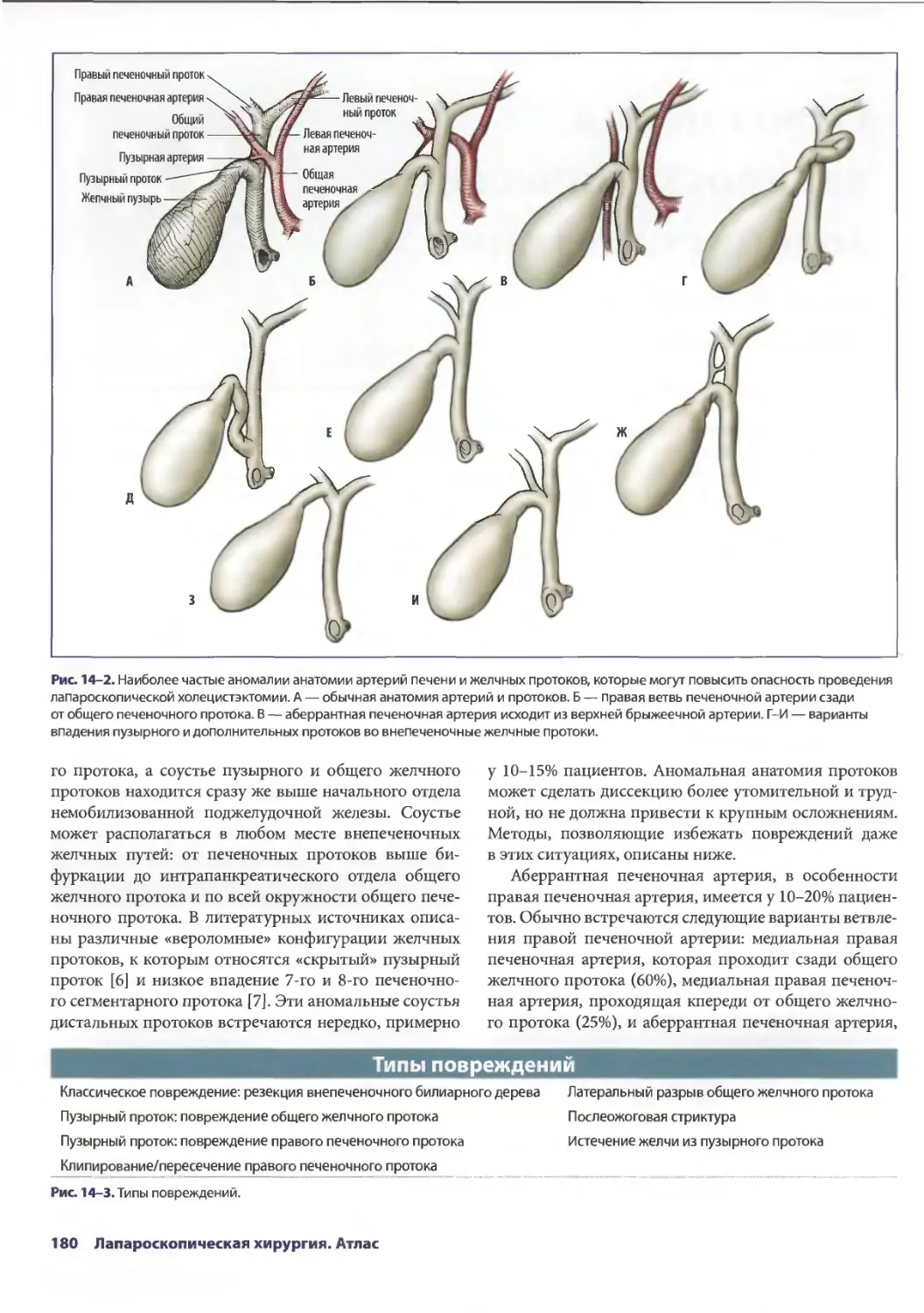
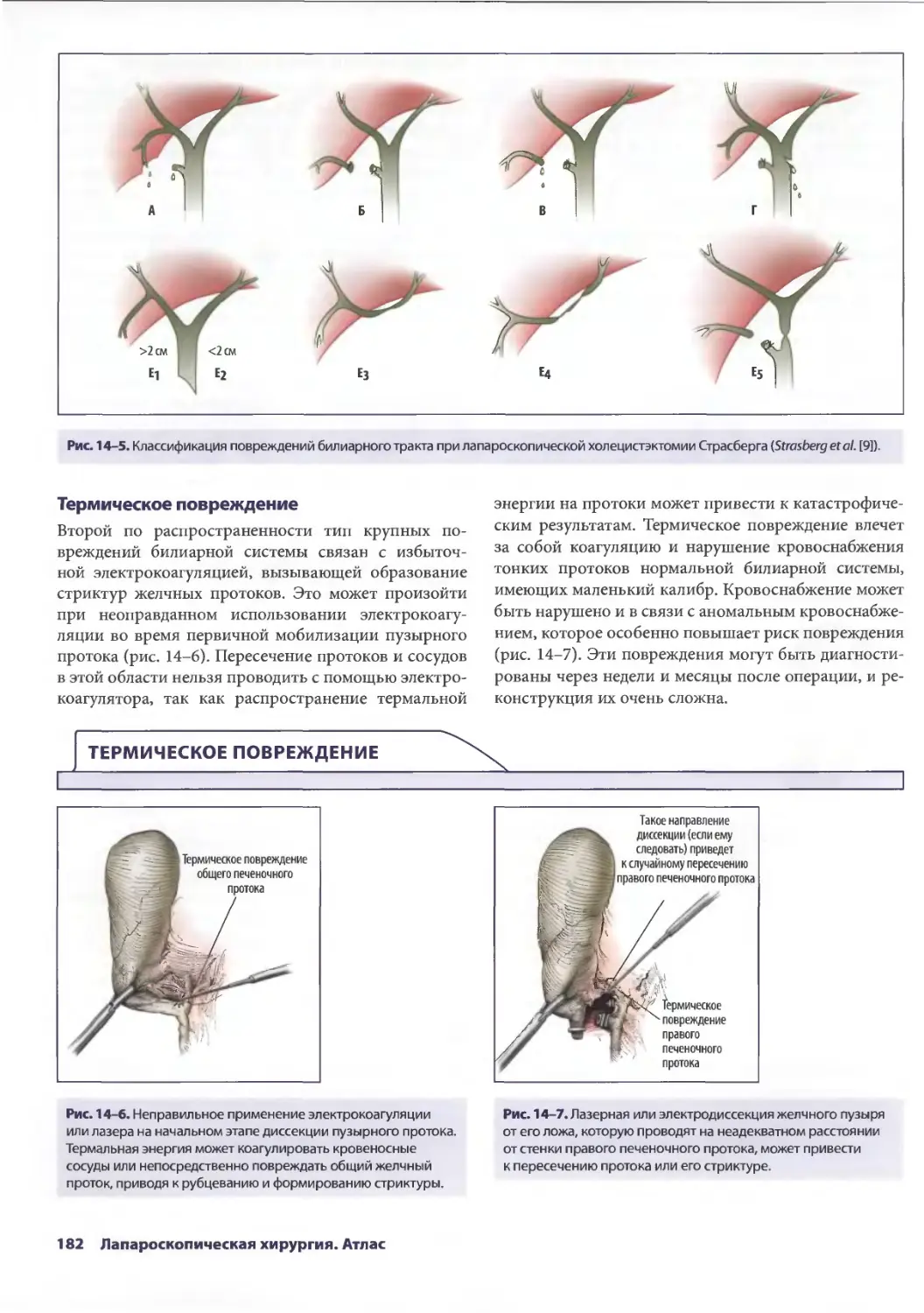
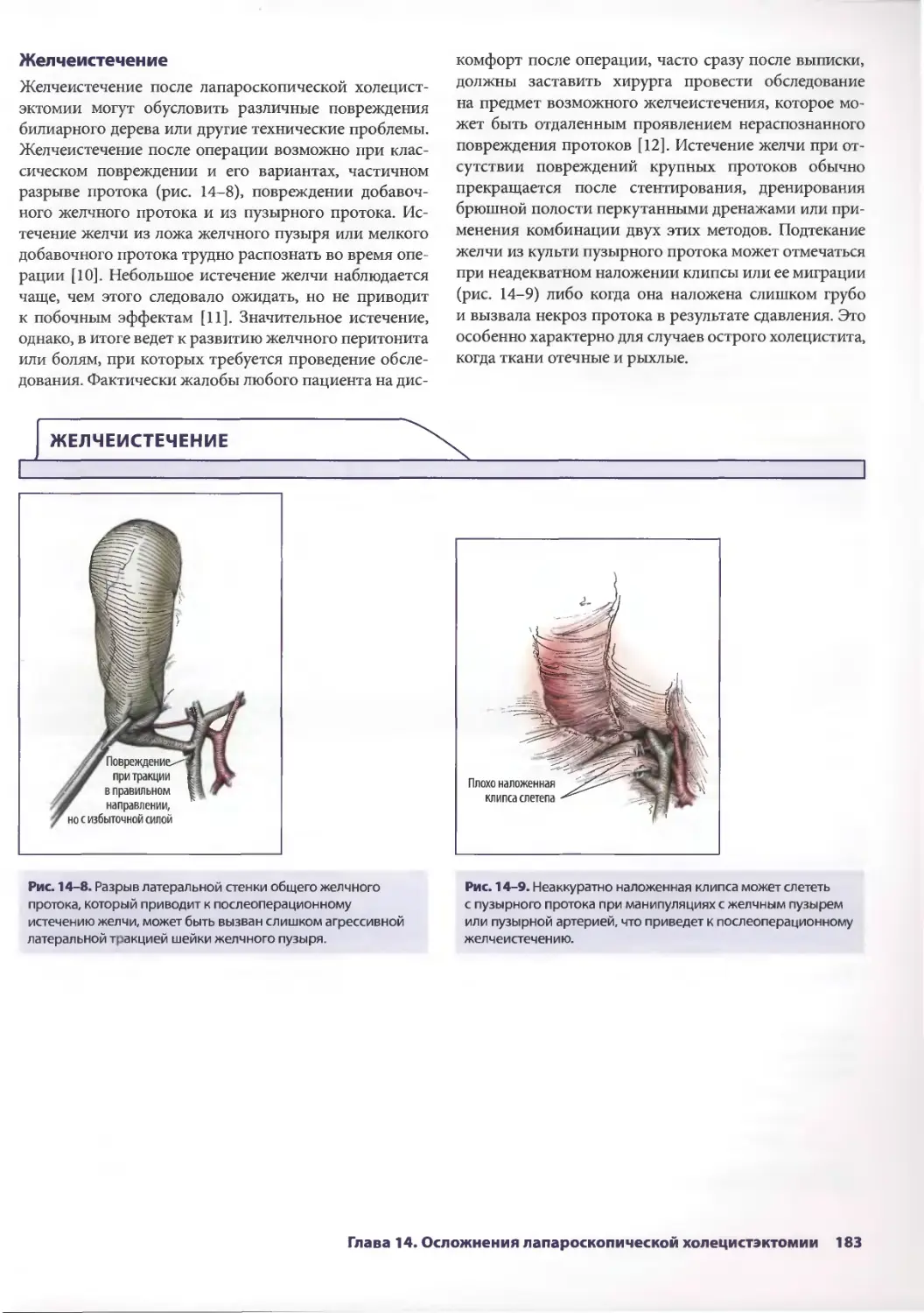
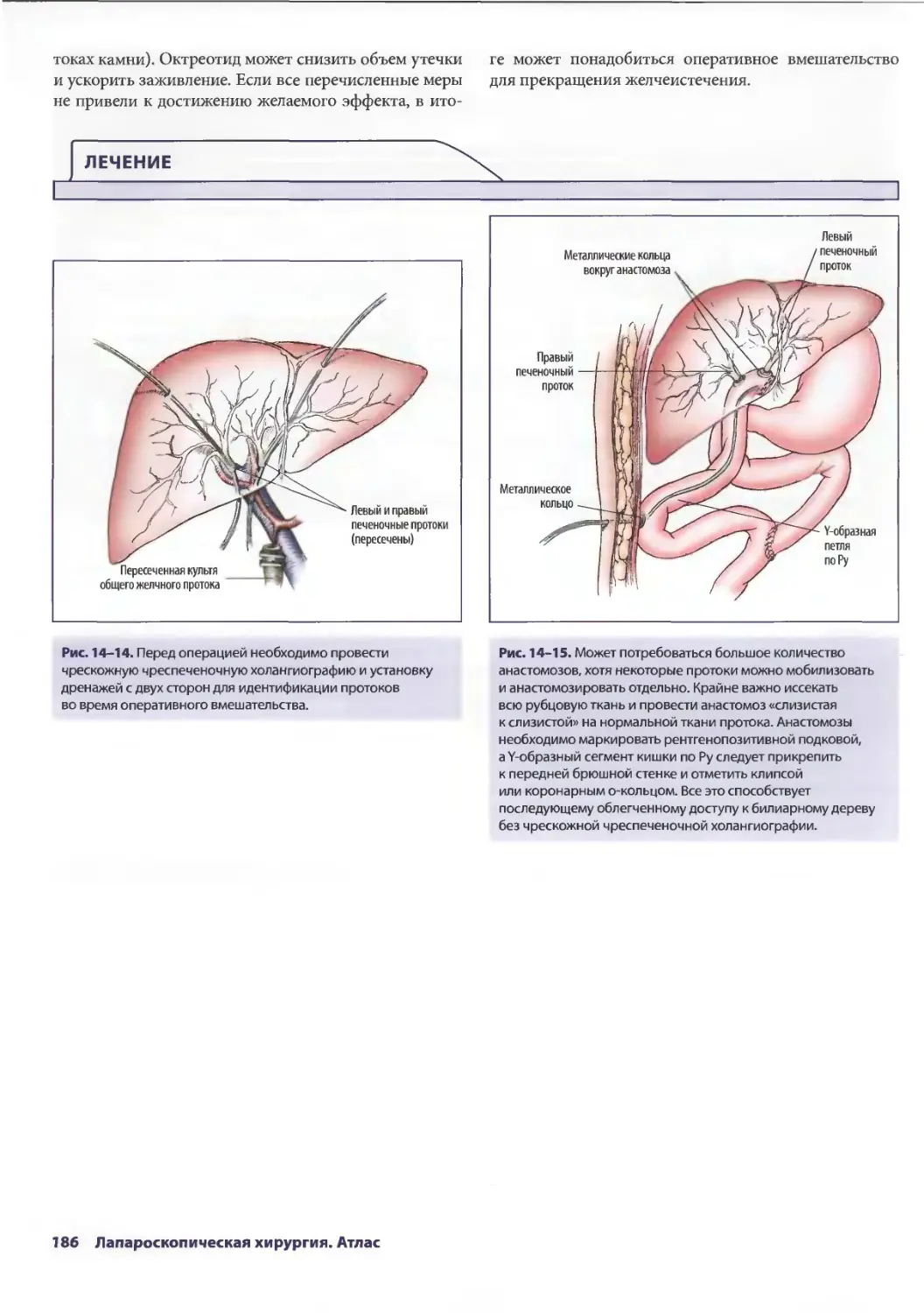
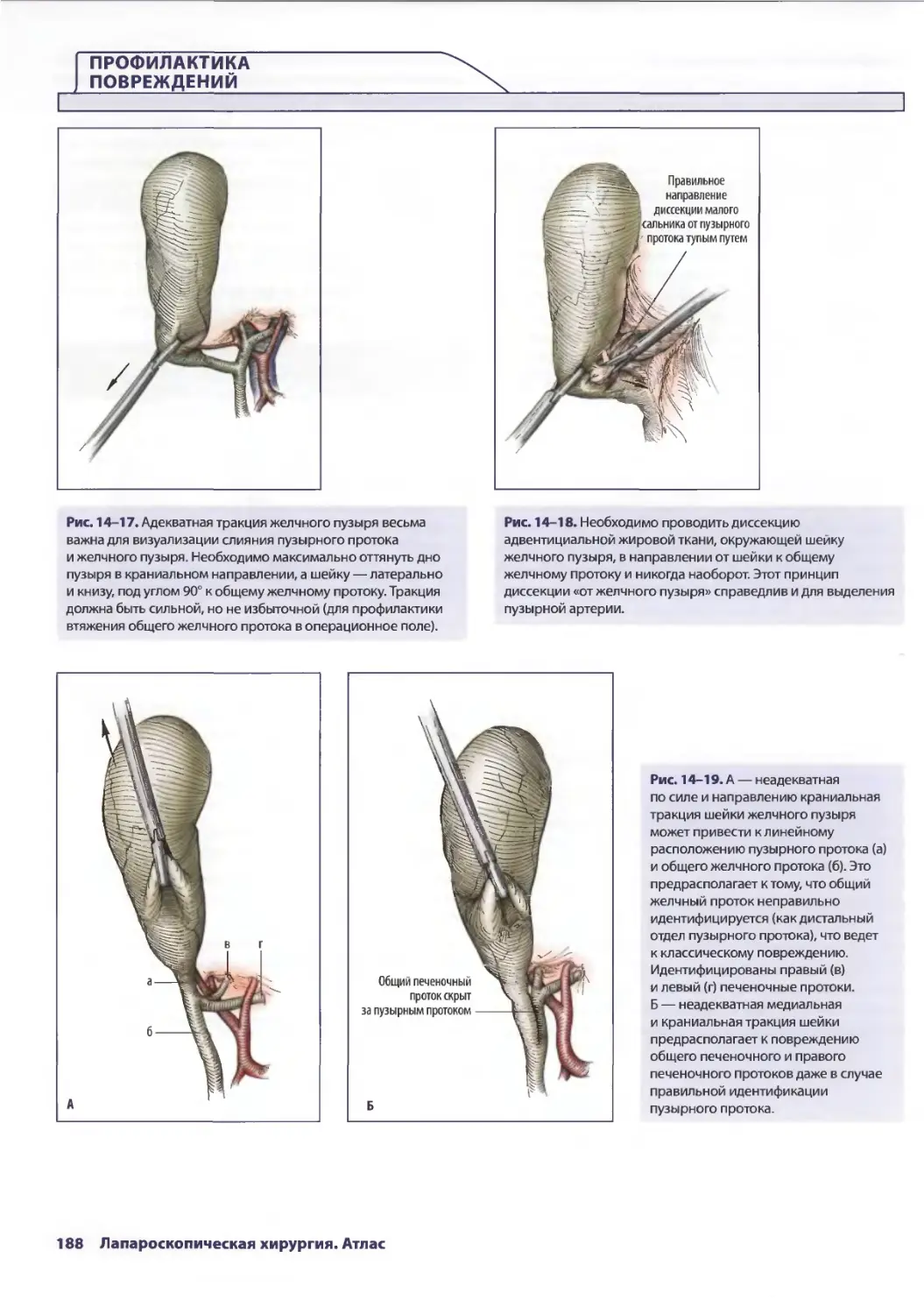
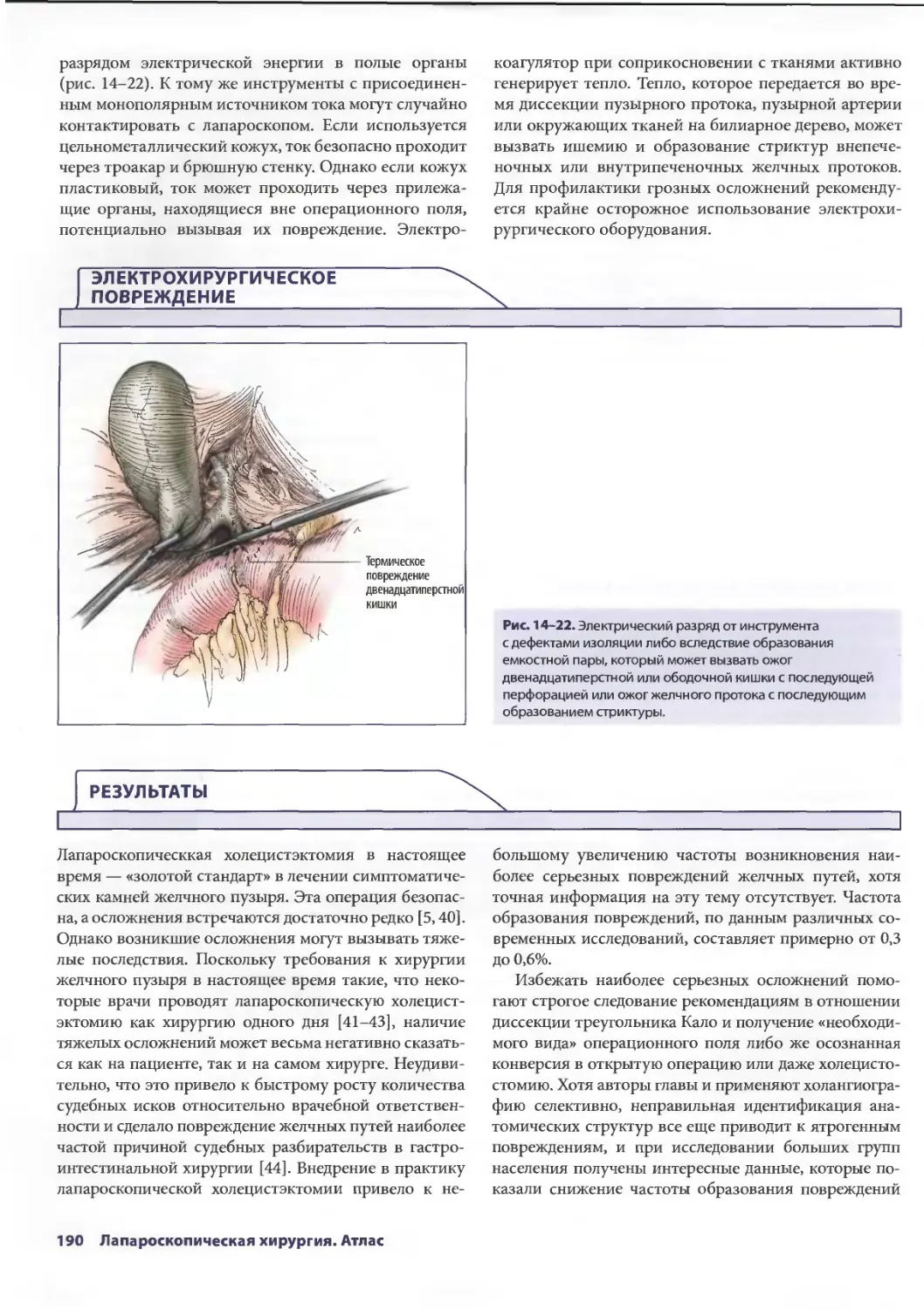
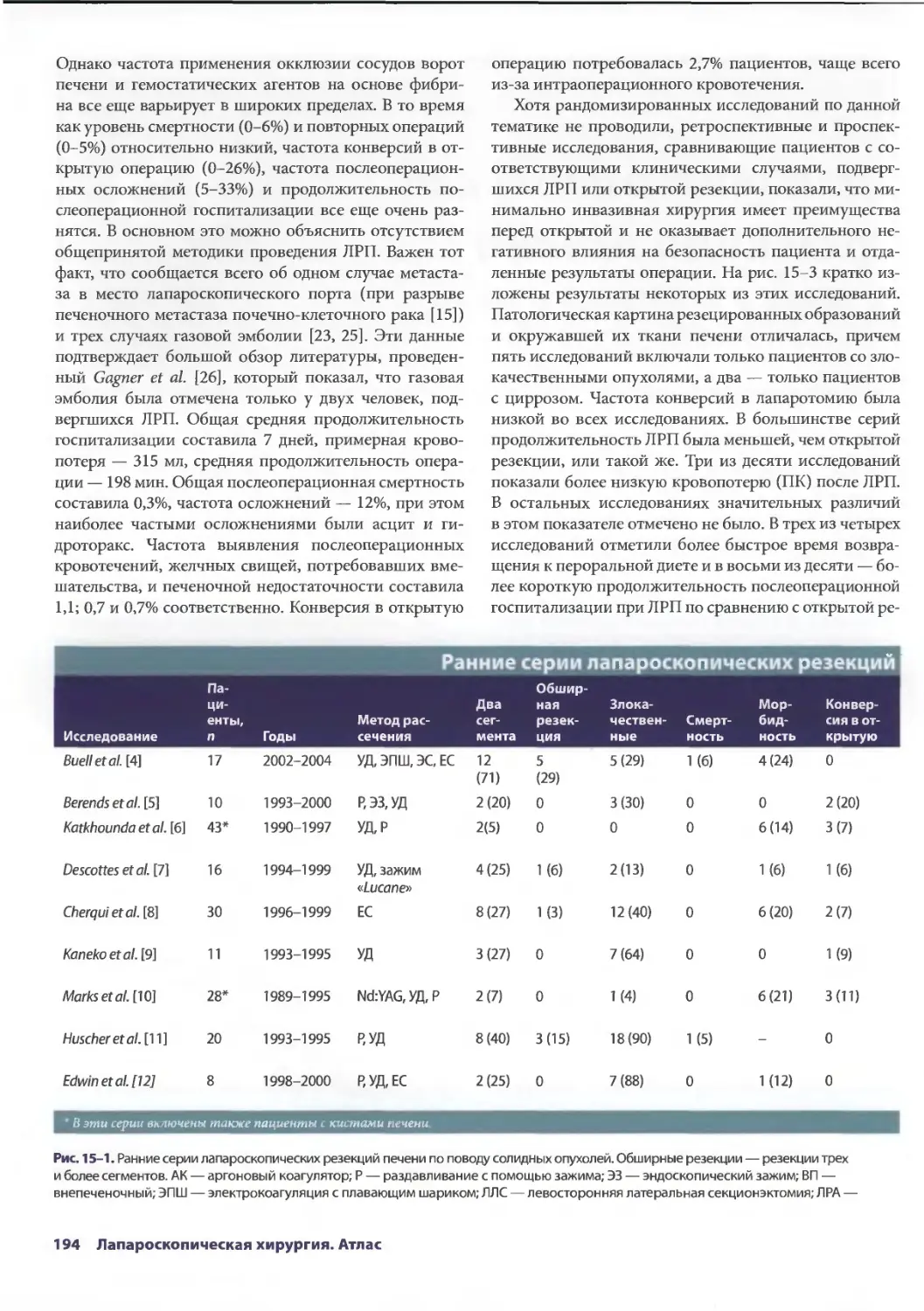
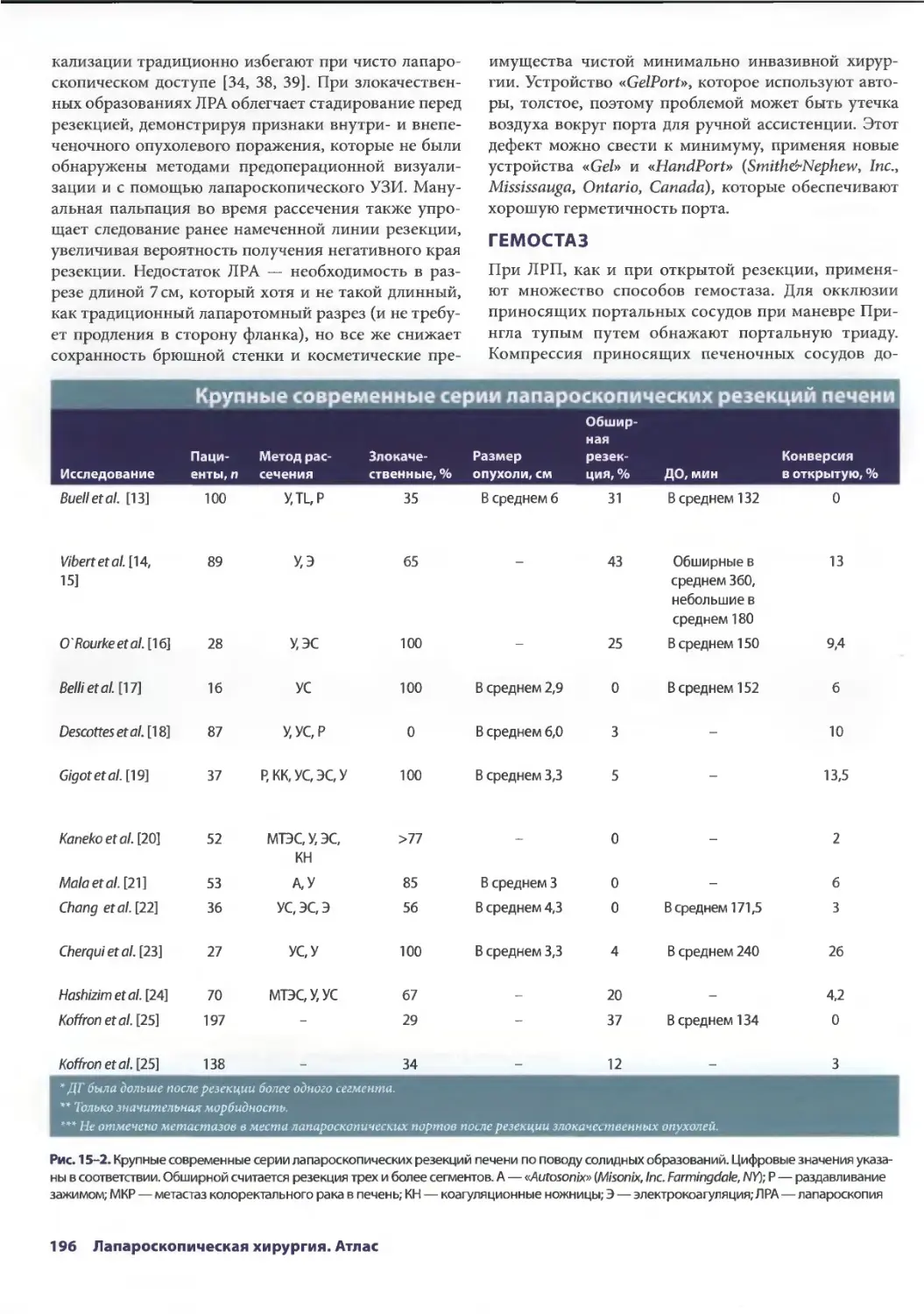
Глава 14. Осложнения лапароскопической холецистэктомии 179
Дана Д. Портенер, Дэвид Синдрэм
Марк В. Онаитис, Эдвард Ж. Чекан
Оглавление 5
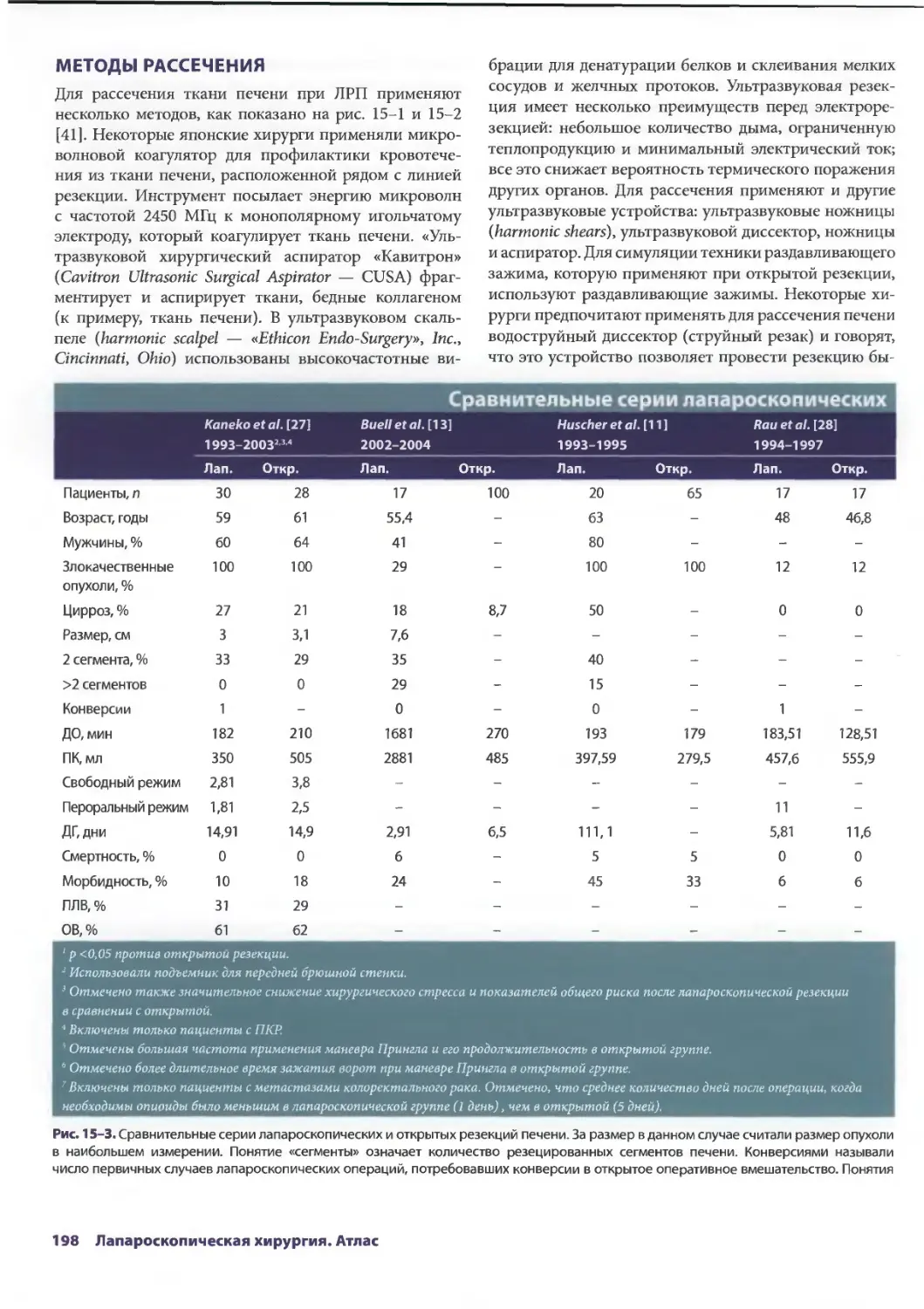
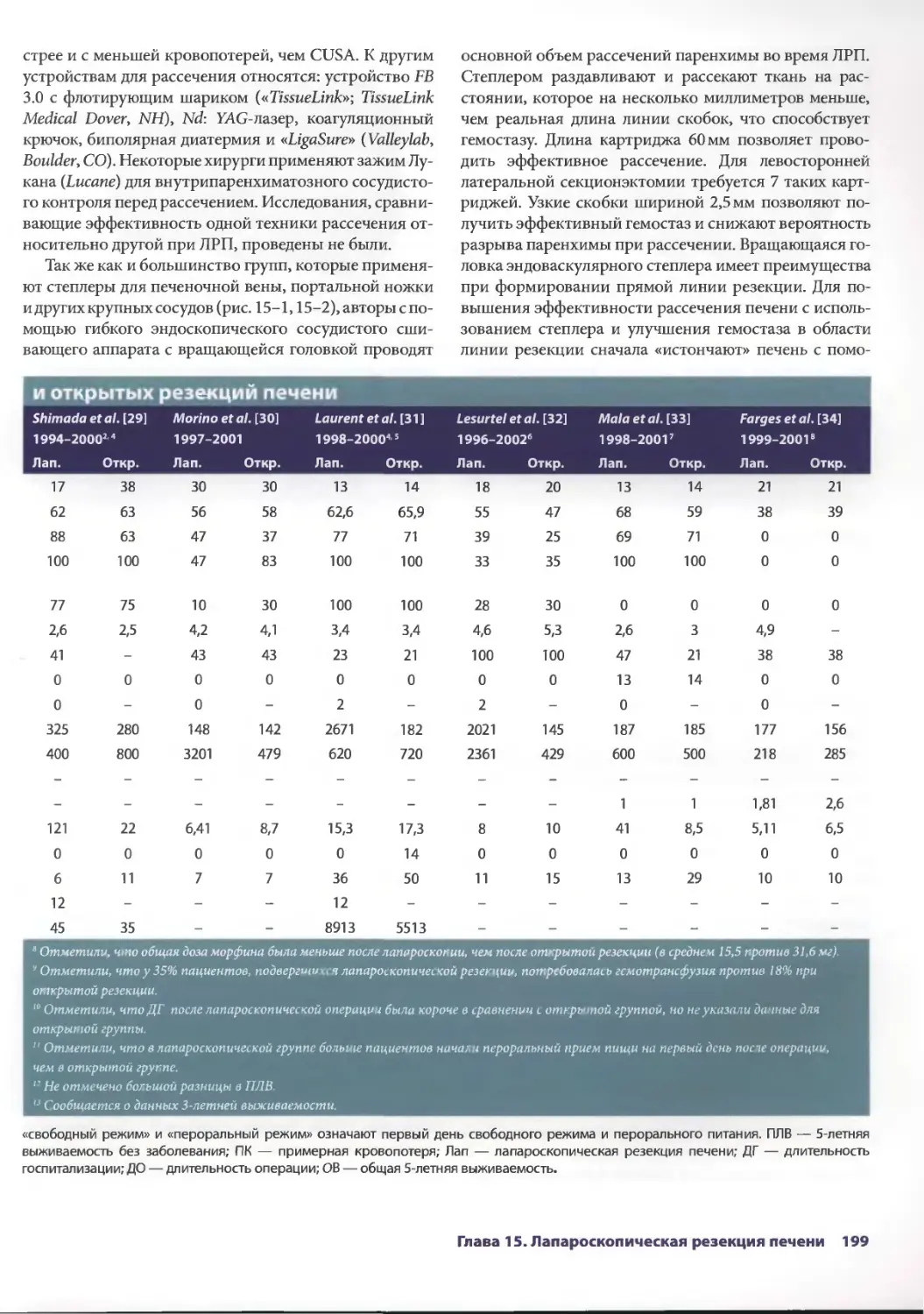
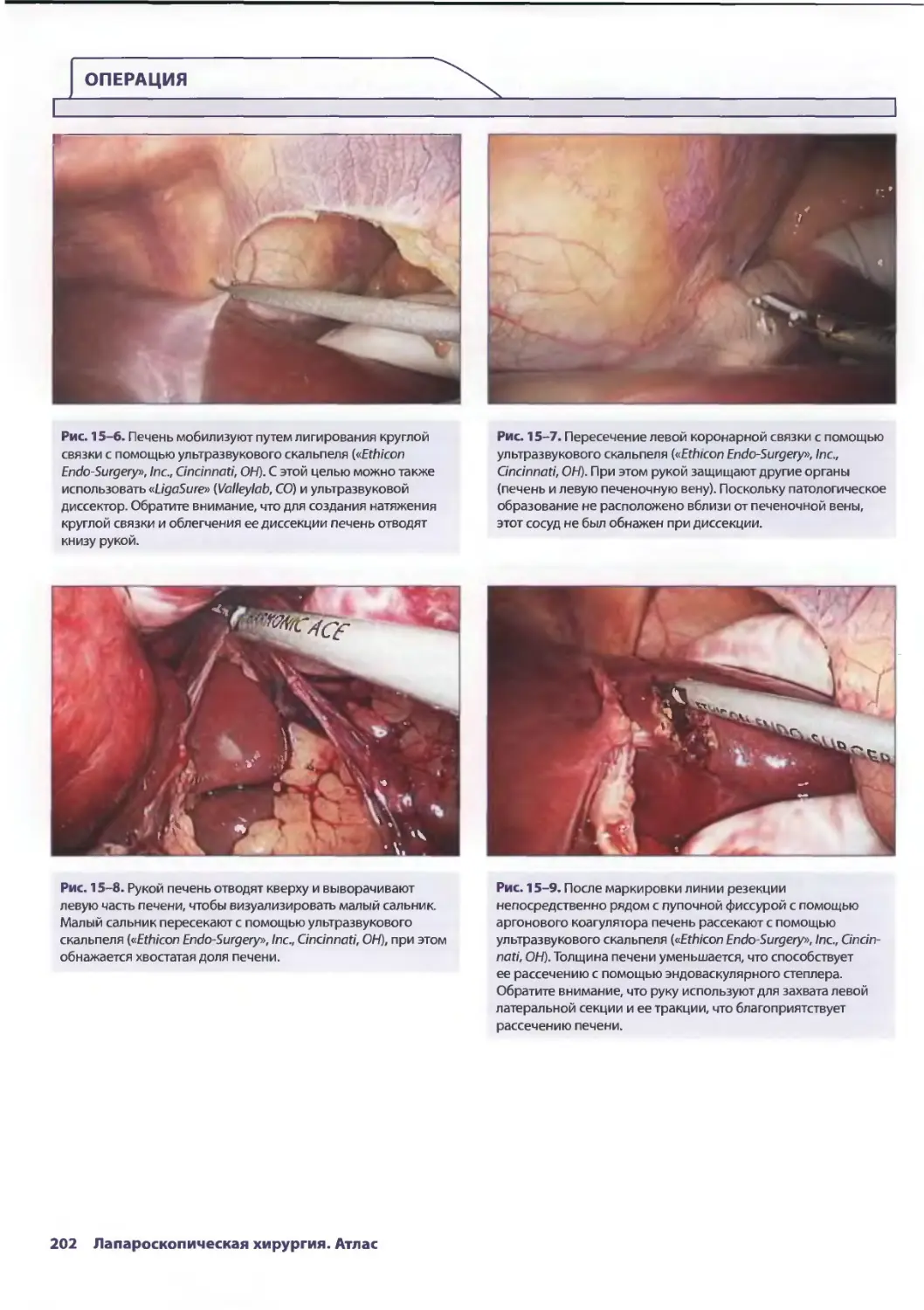
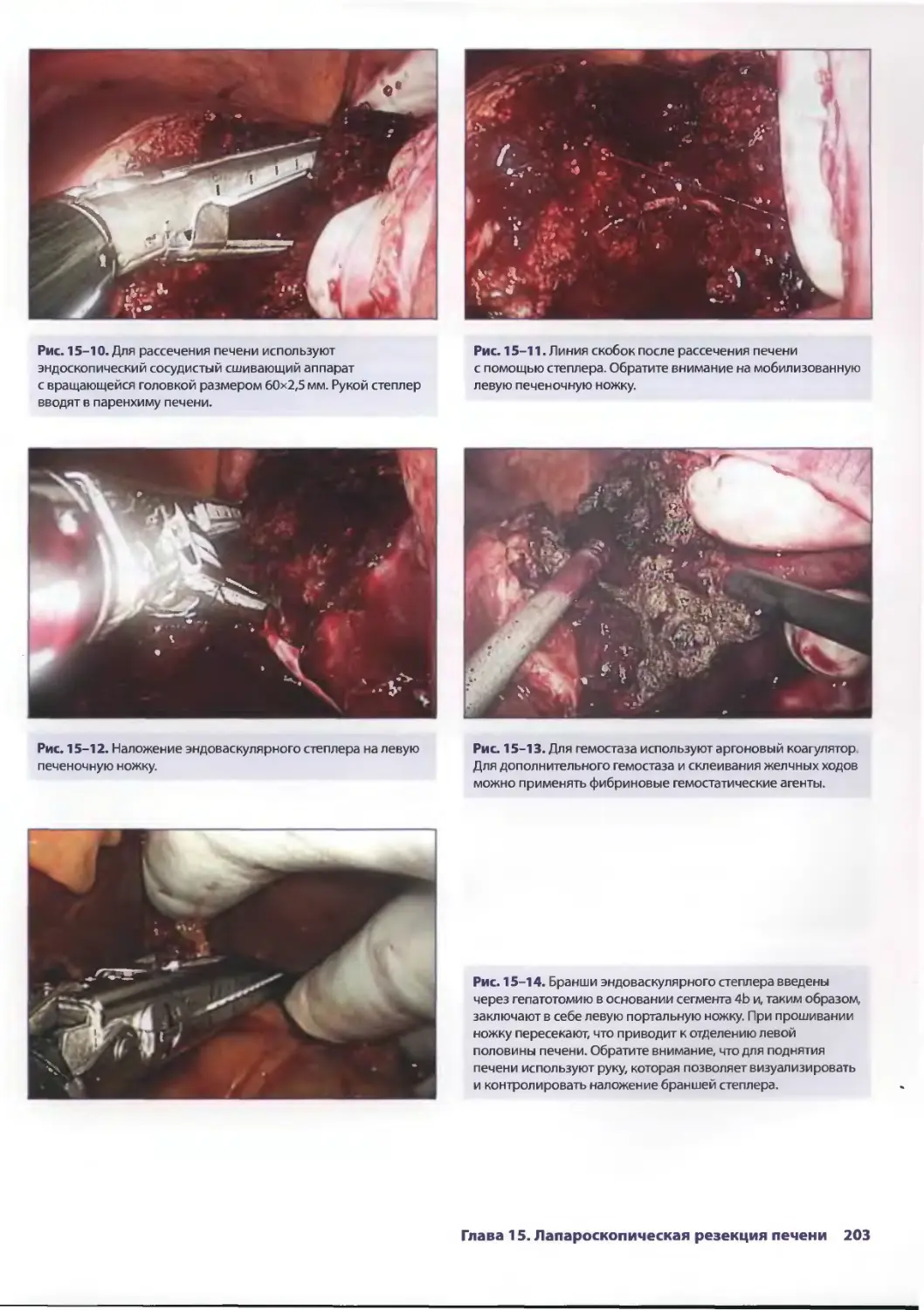
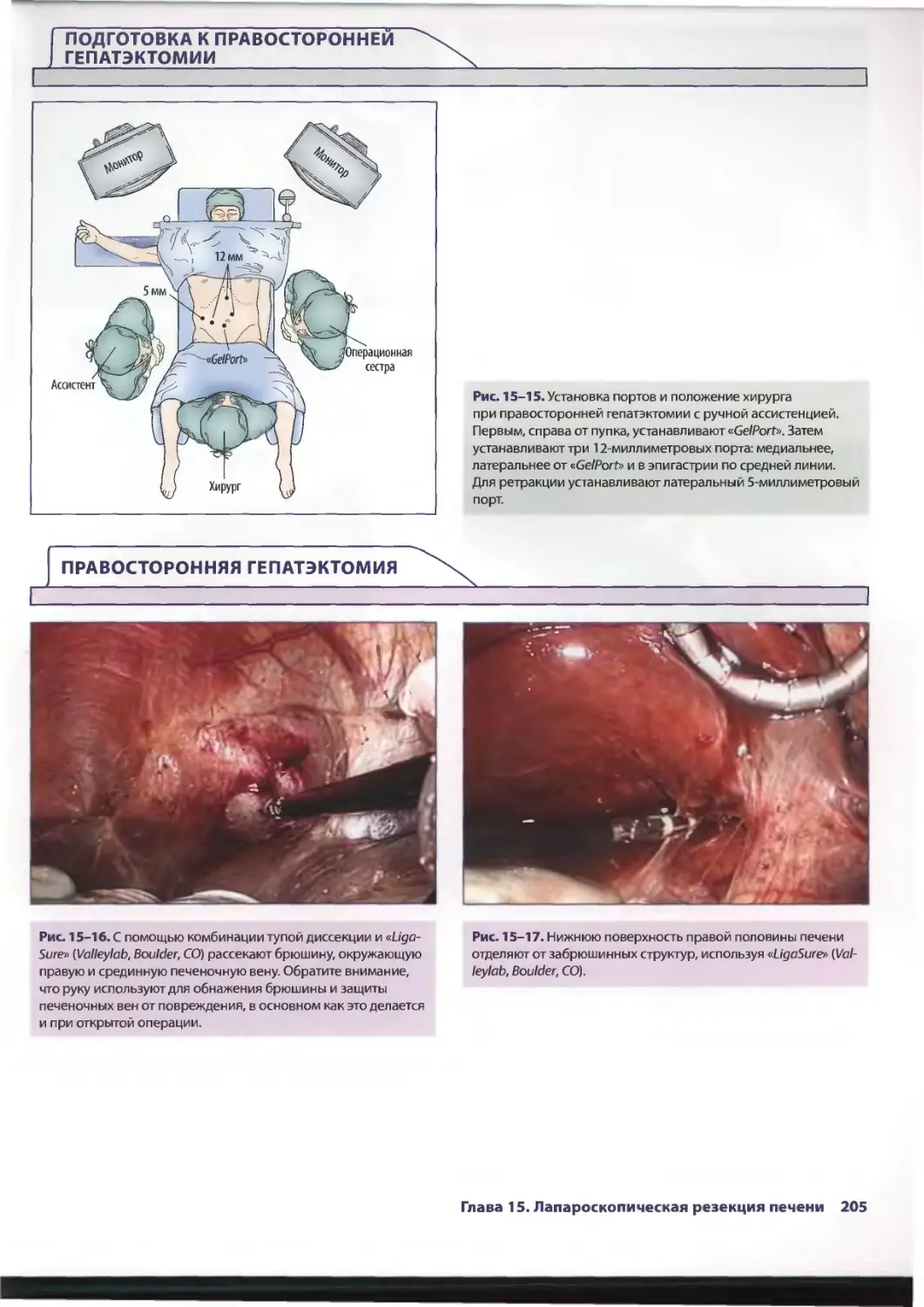
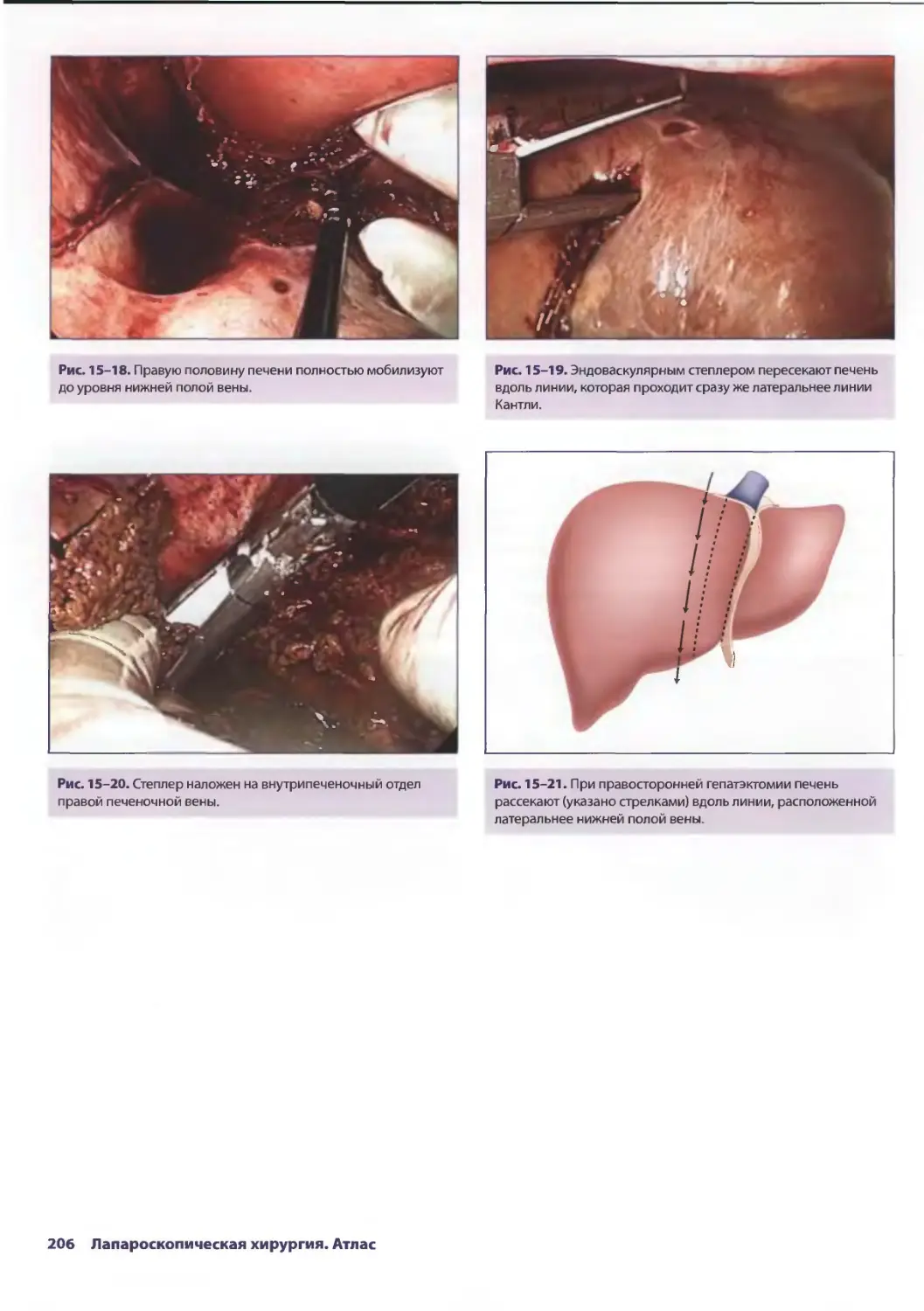
Глава 15. Лапароскопическая резекция печени 193
Сриневас К. Редди, Брайн М. Клэри
Глава 16. Лапароскопические паллиативные операции
при периампулярных опухолях 209
Ванесса А. Олцес, Теодор Н. Паппас
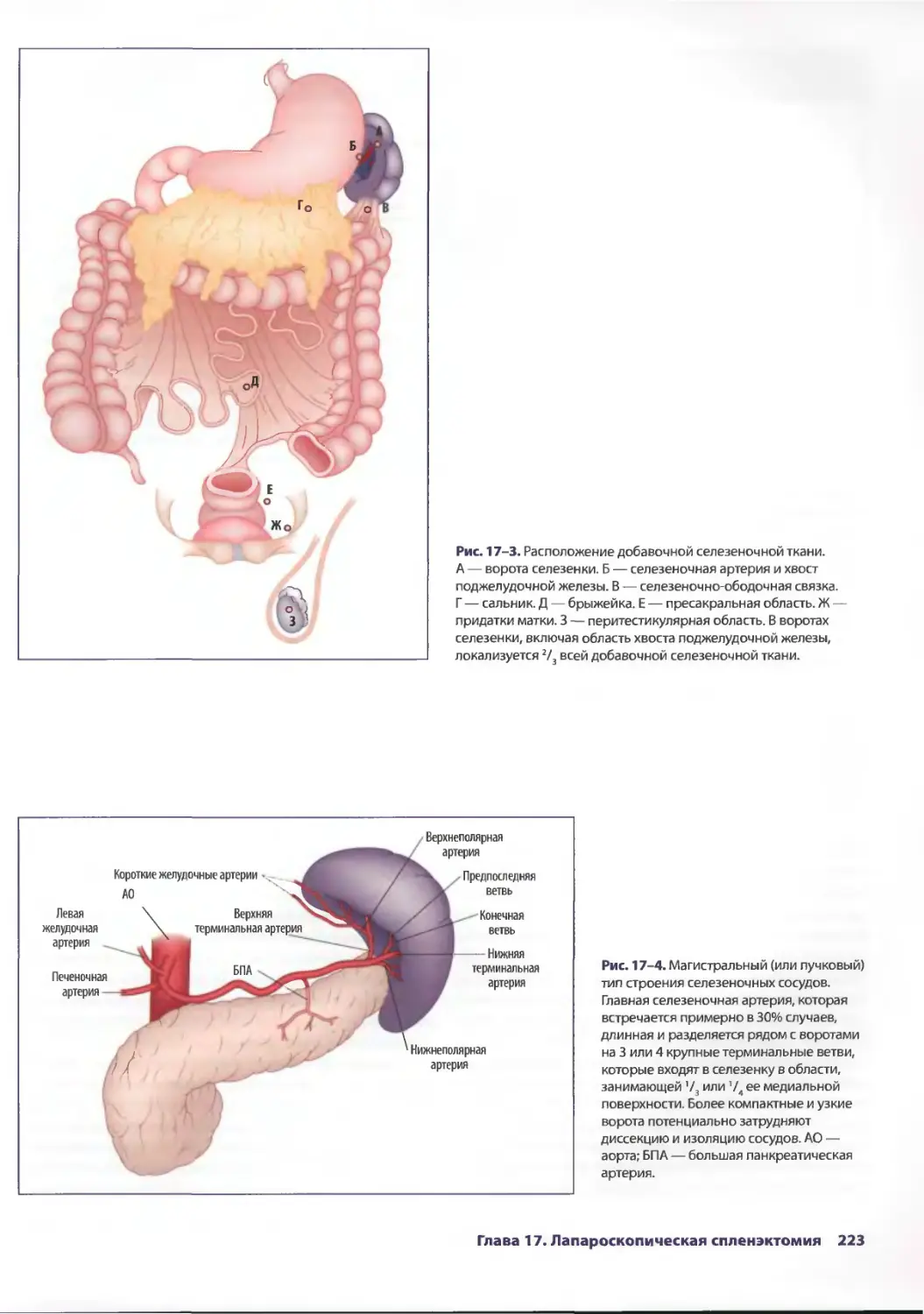
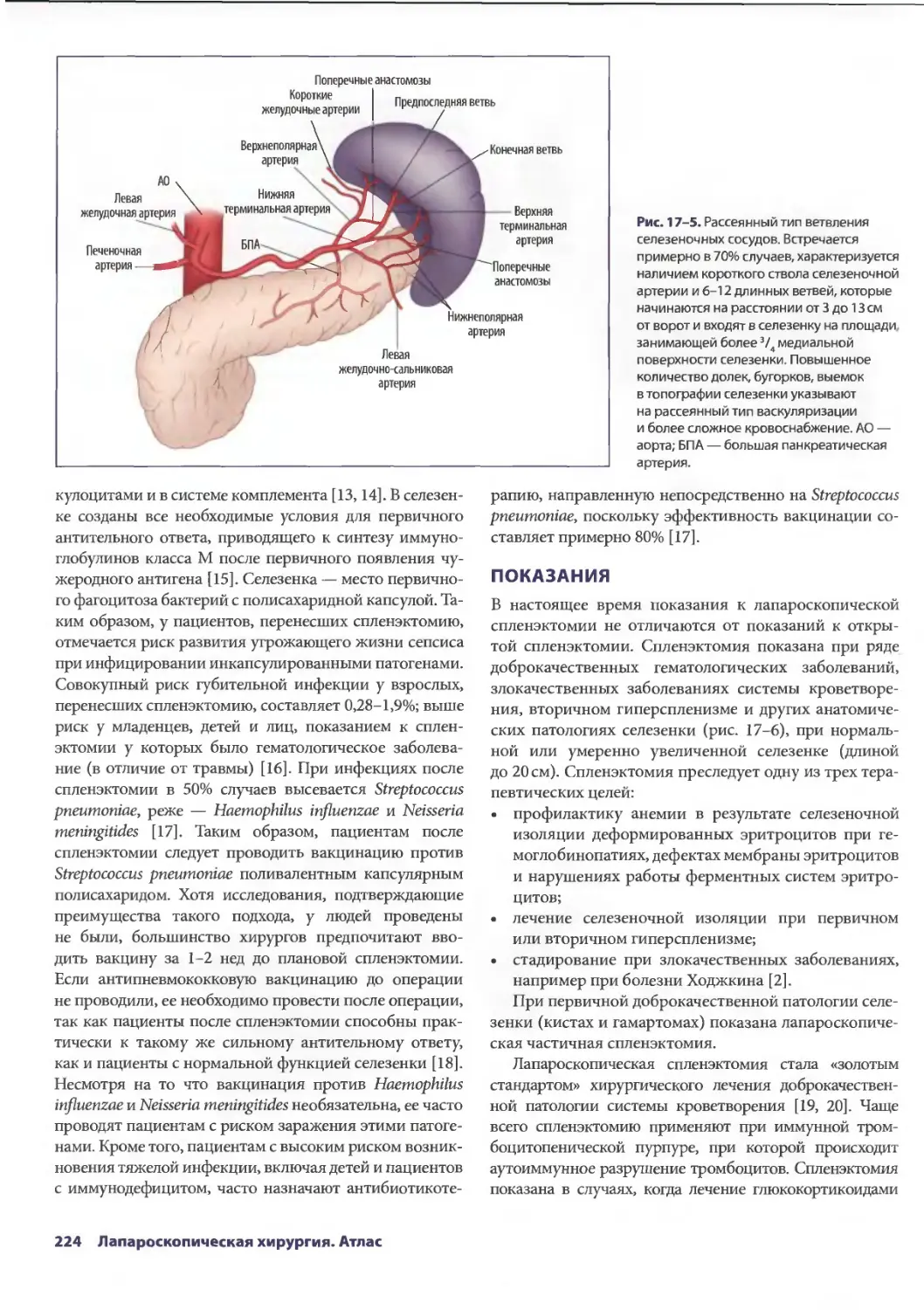
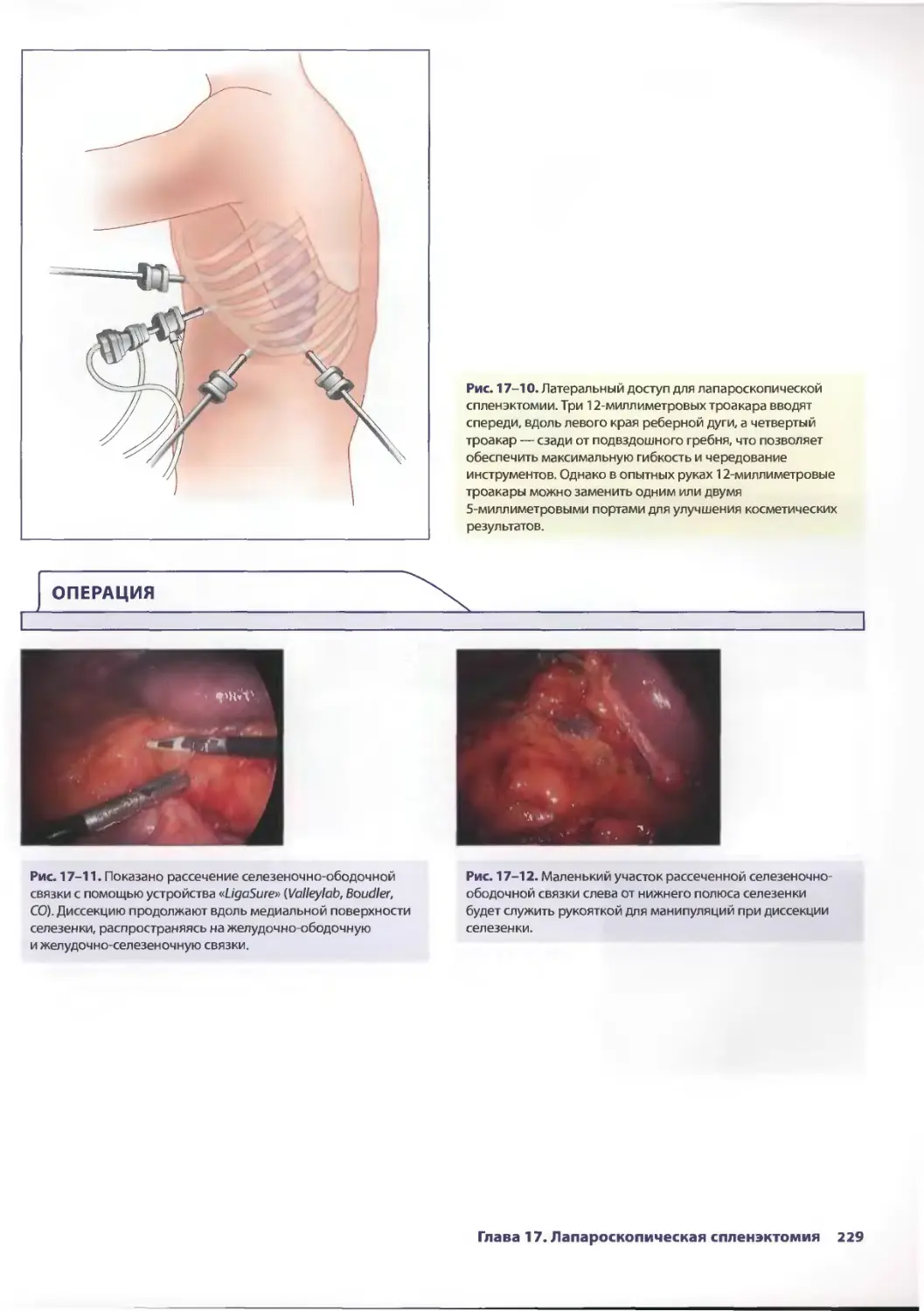
Глава 17. Лапароскопическая спленэктомия 221
Элизабет Т. Трайси, Михаэль С. Харниш
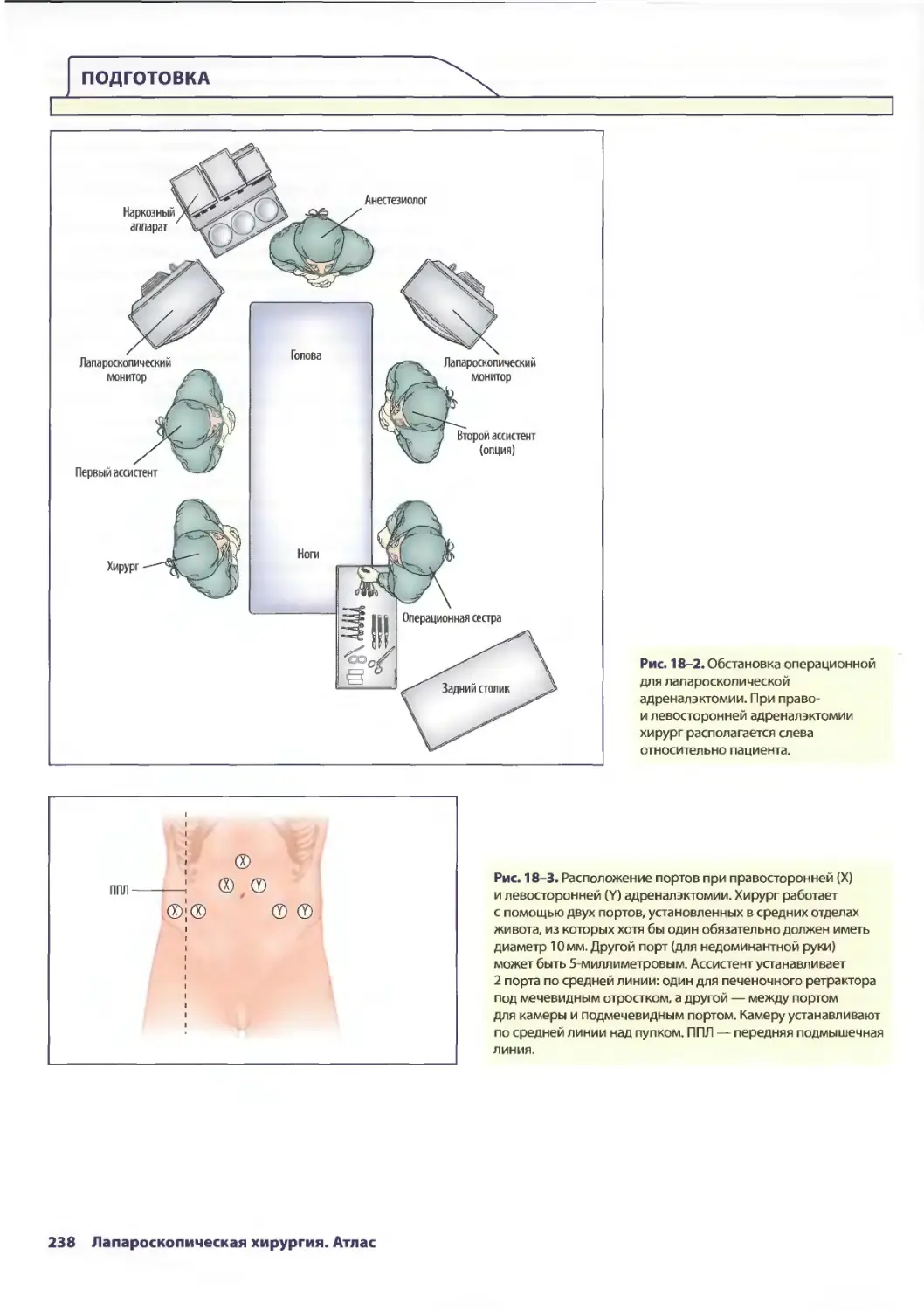
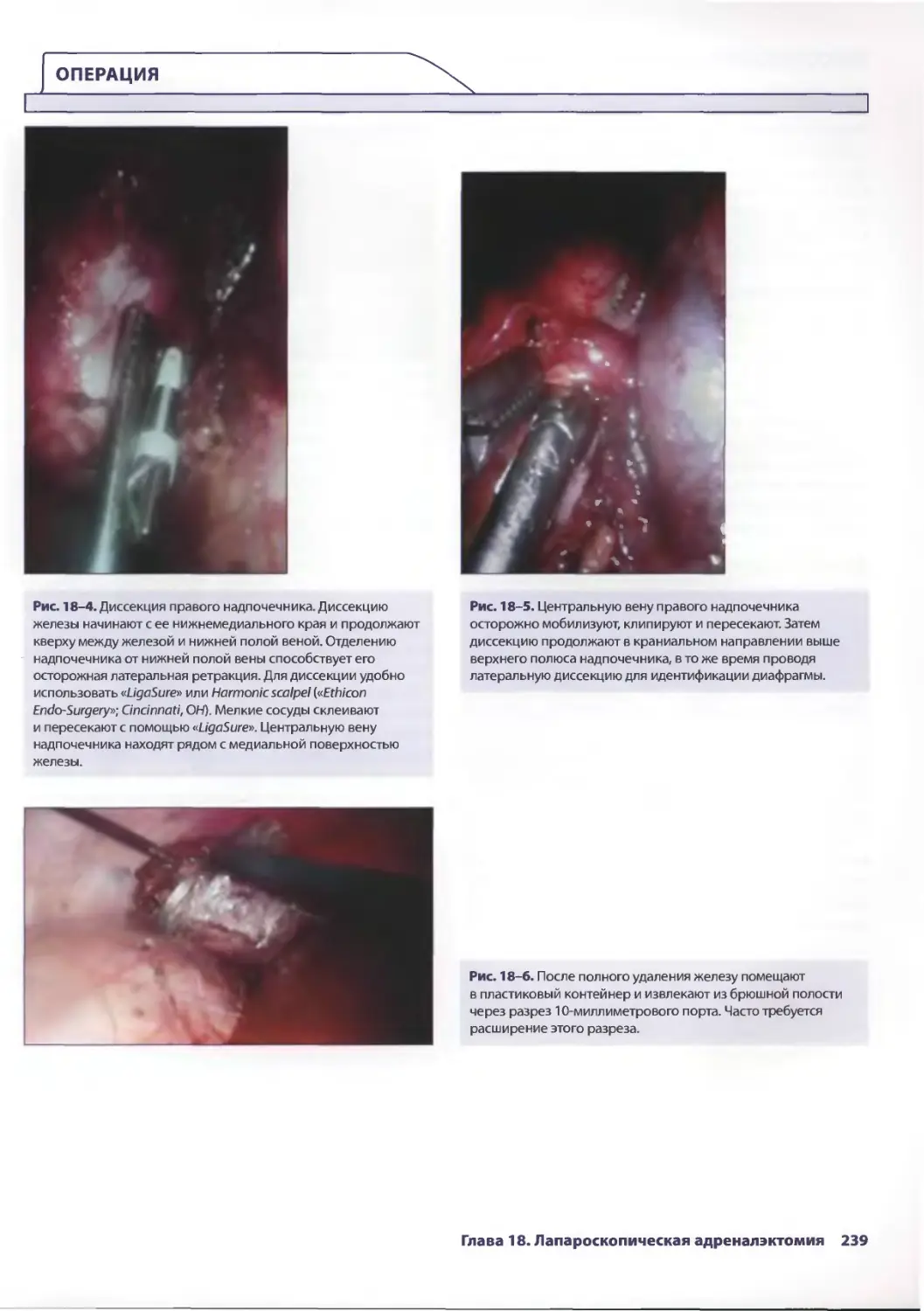
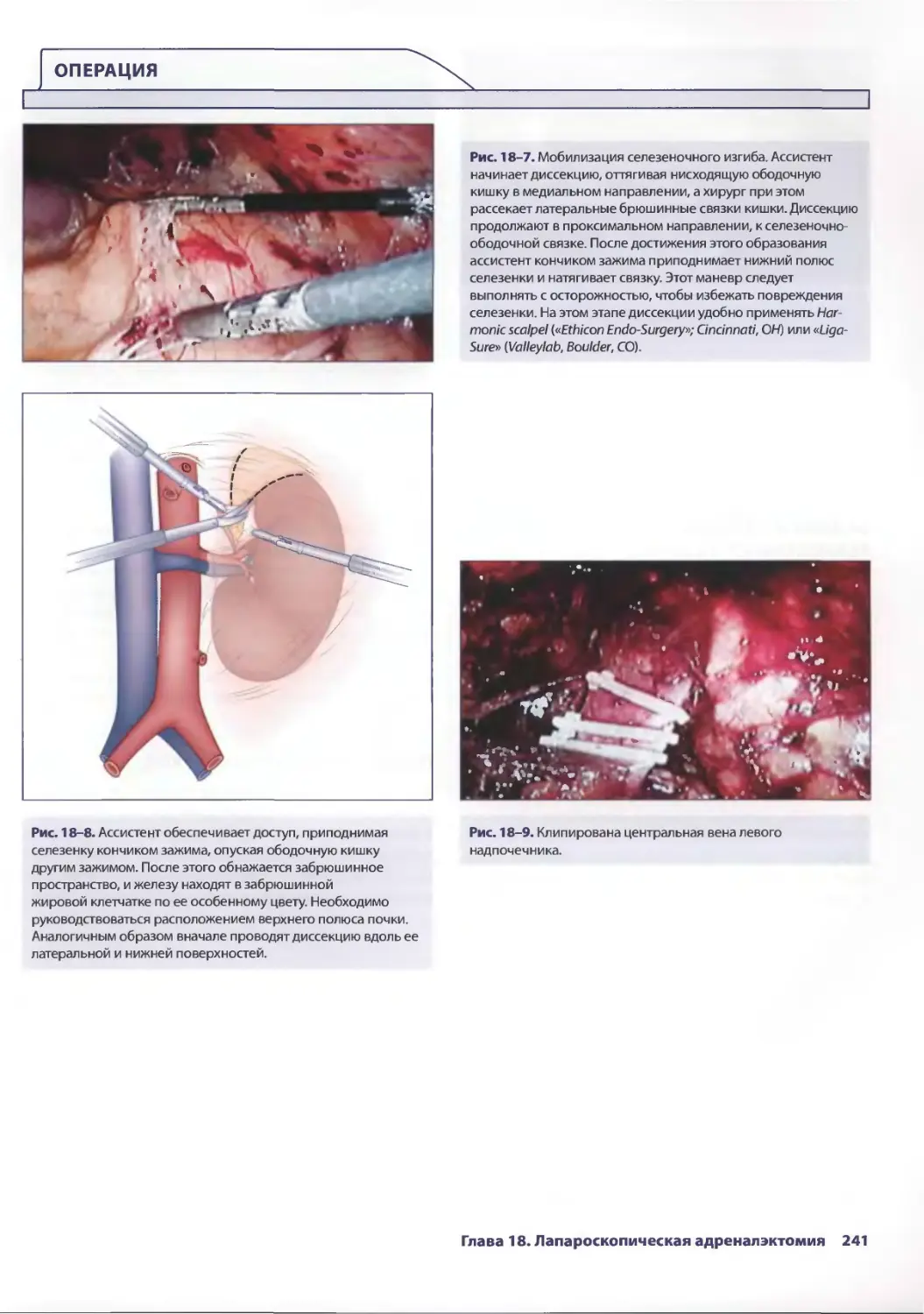
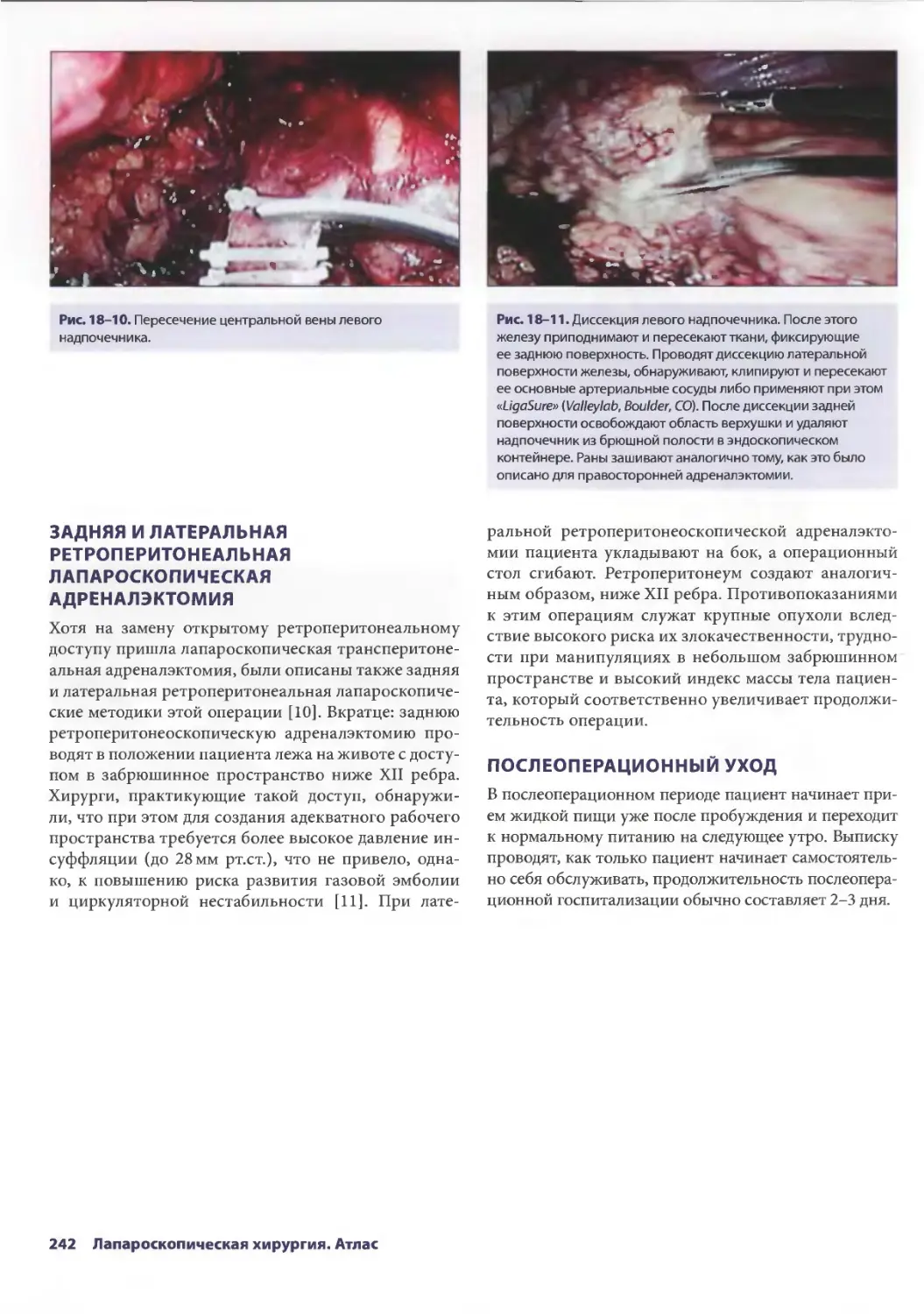
Глава 18. Лапароскопическая адреналэктомия 235
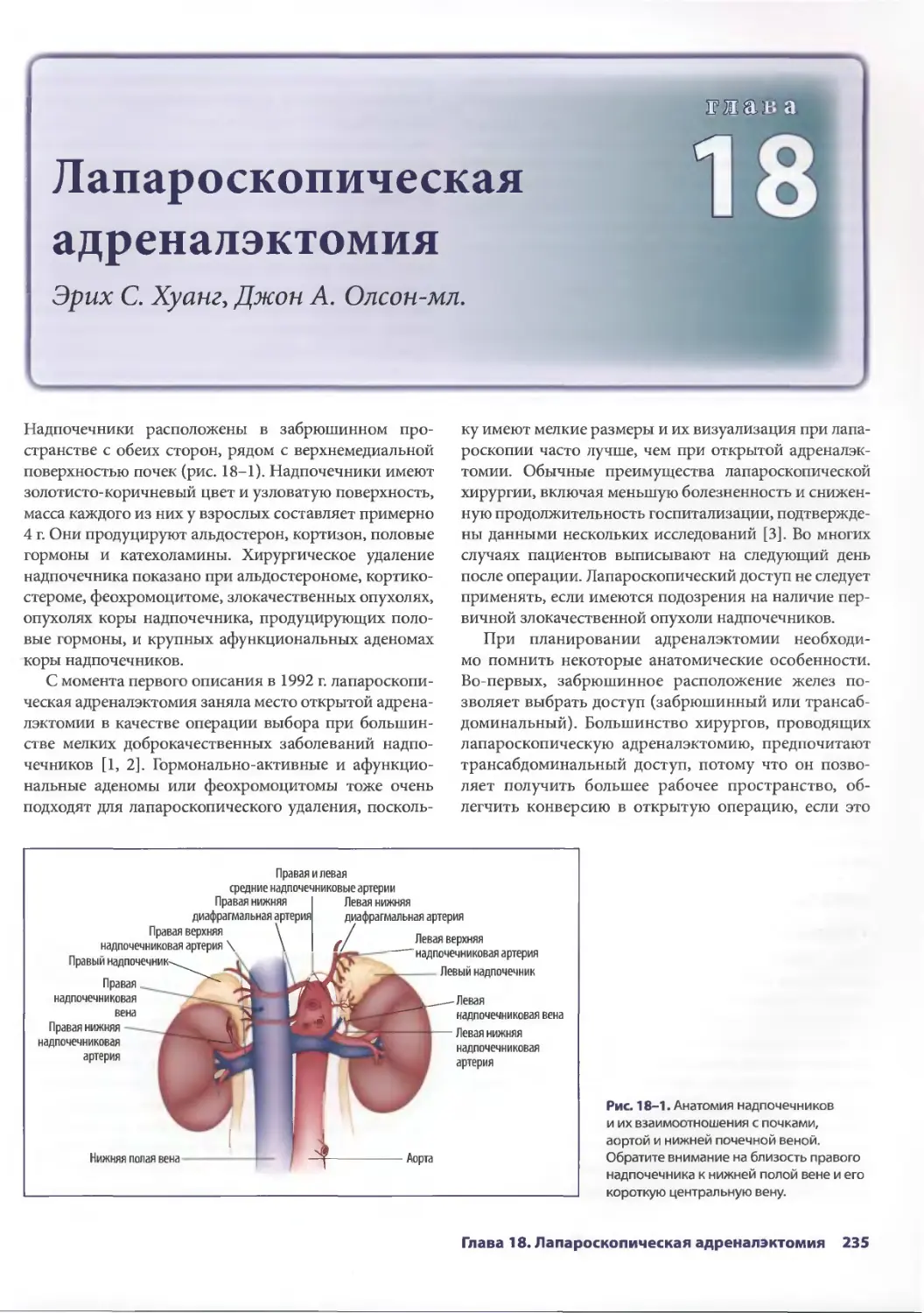
Эрик С. Хуанг, Джон А. Олсон-мл.
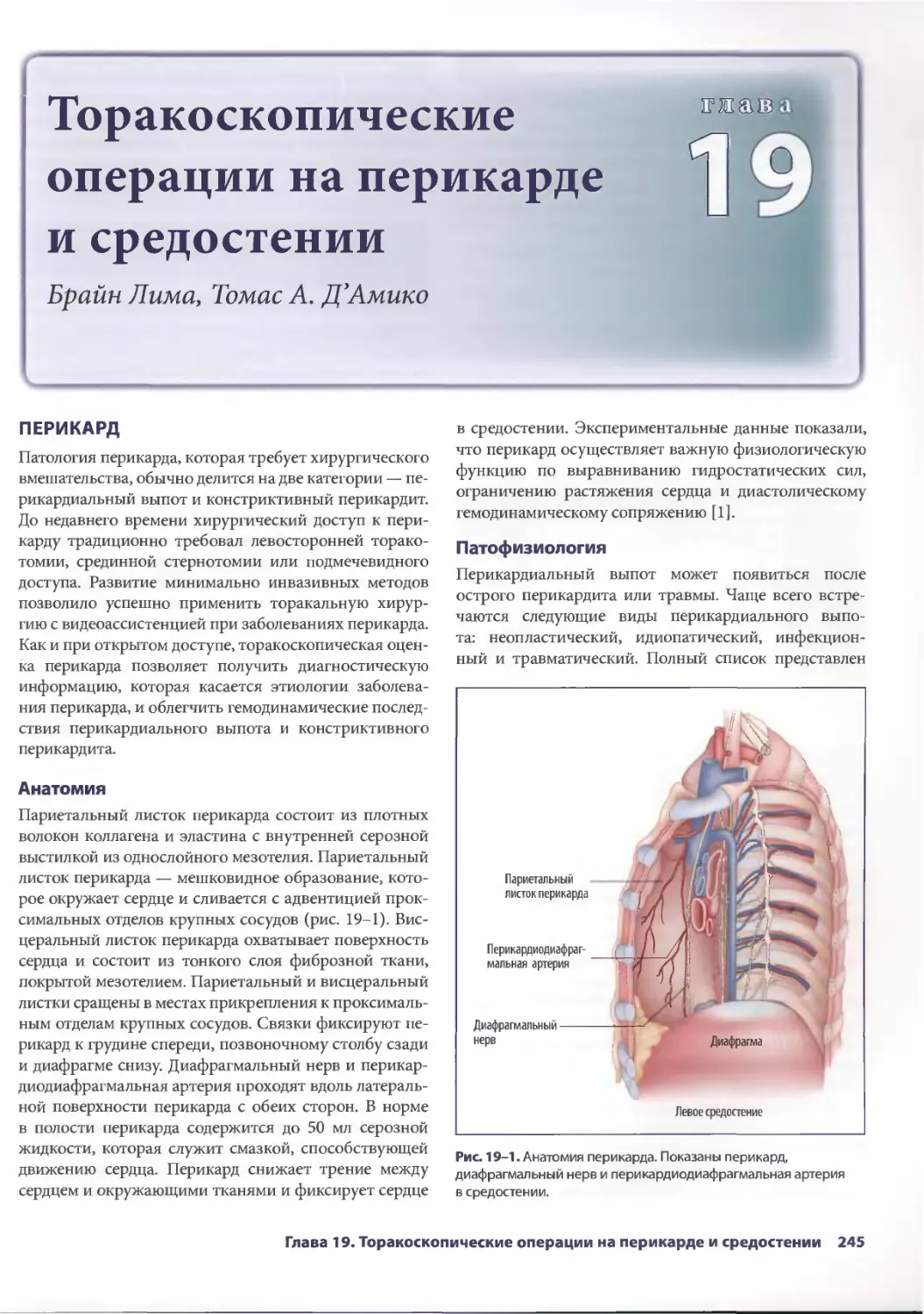
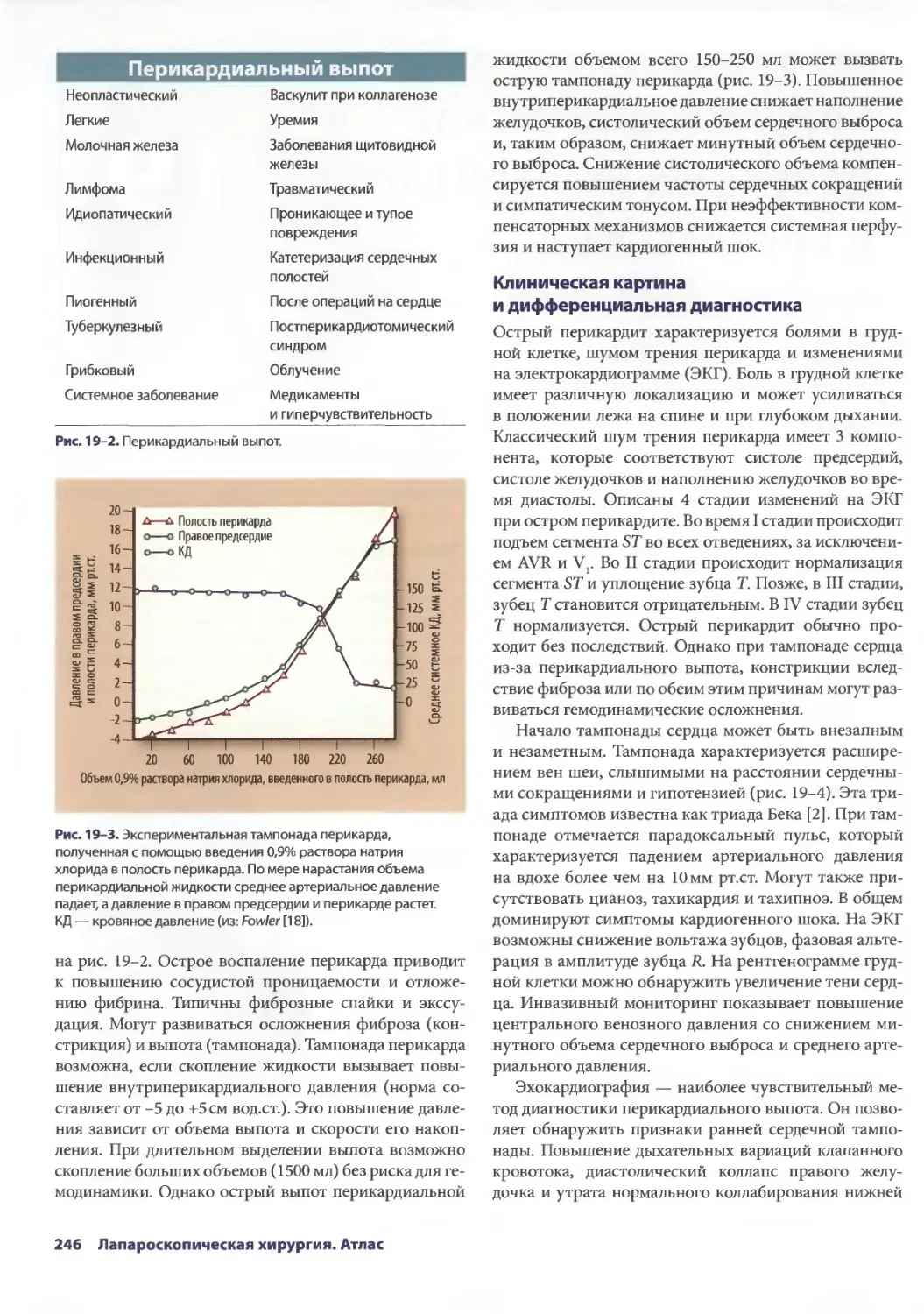
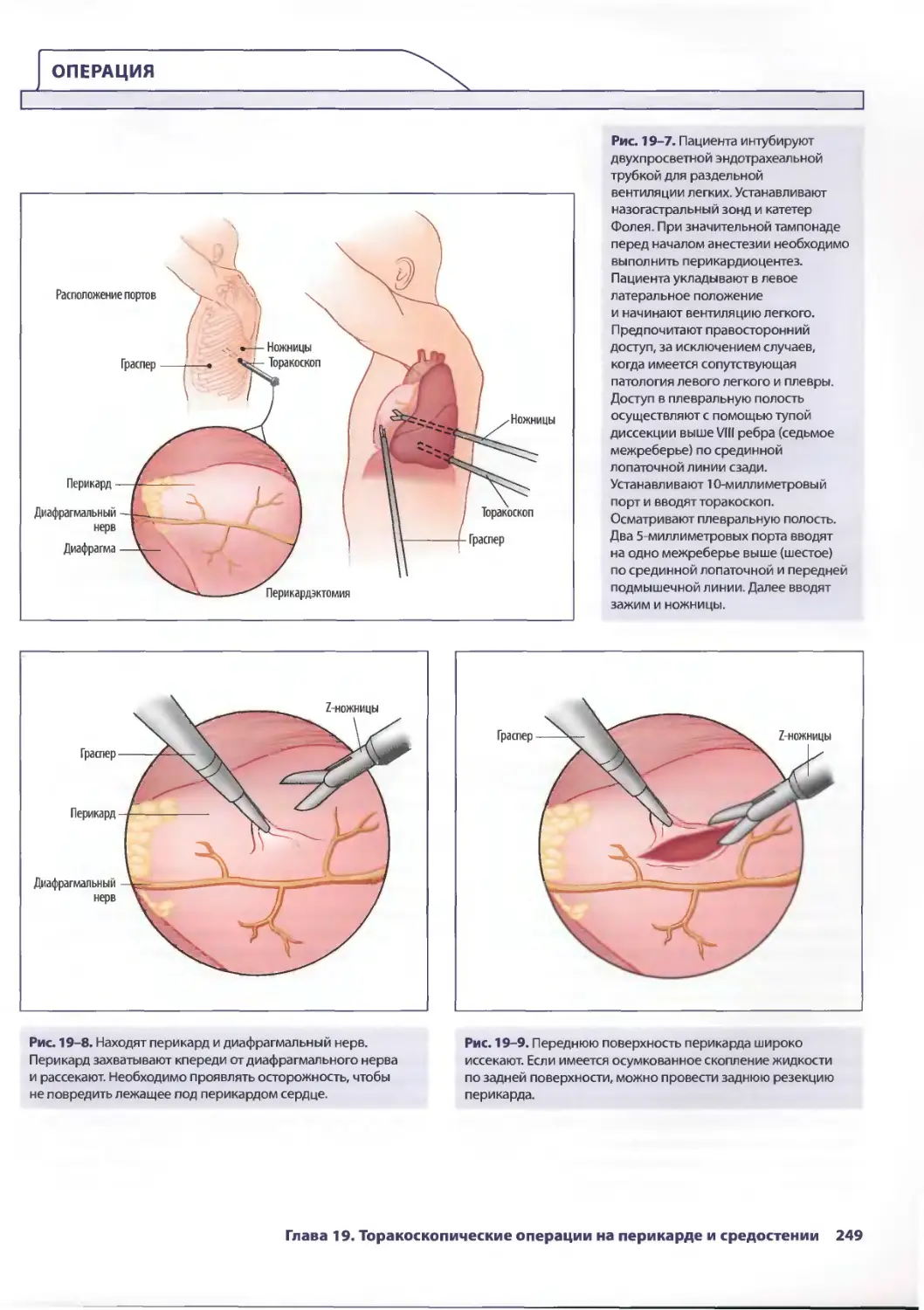
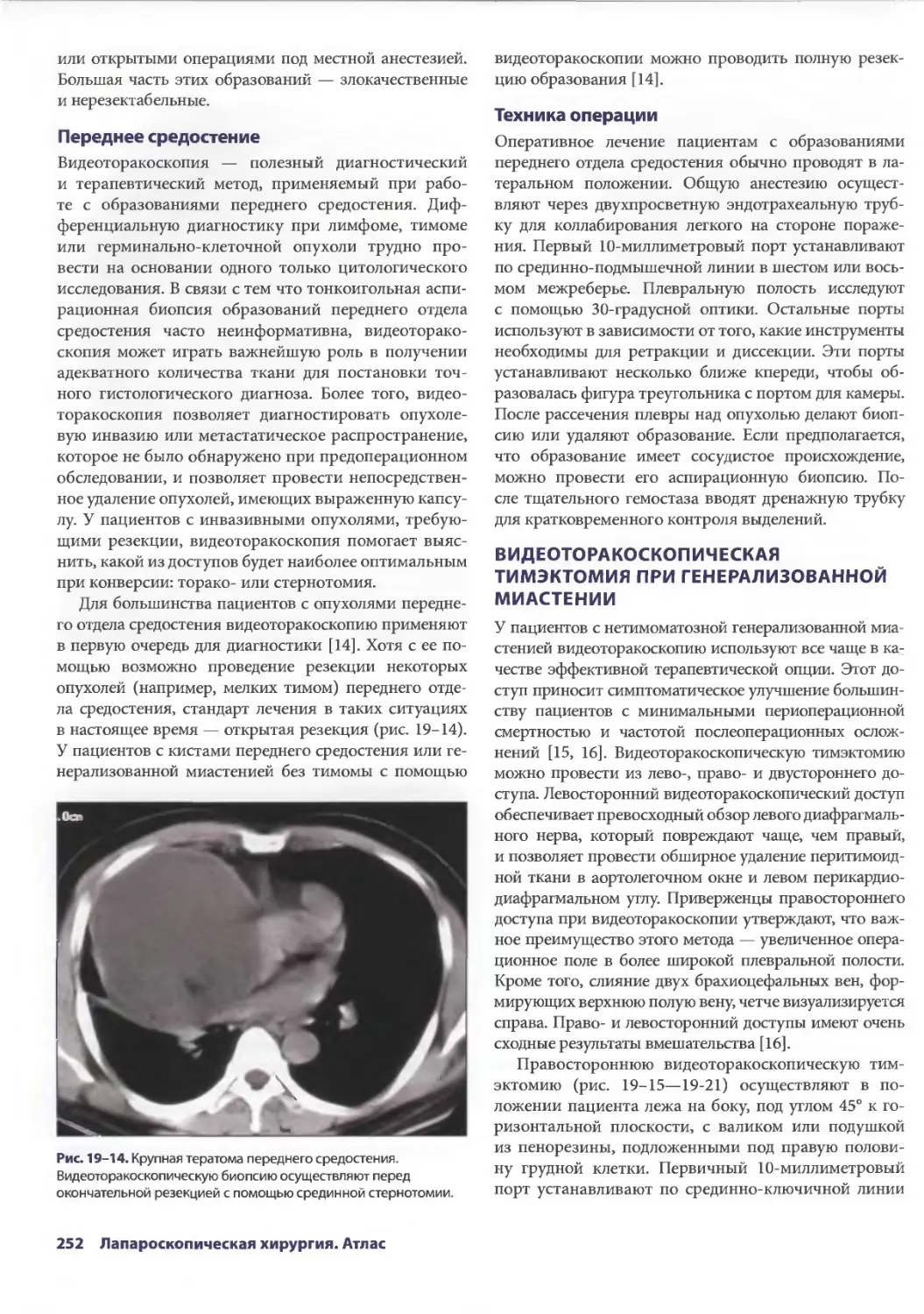
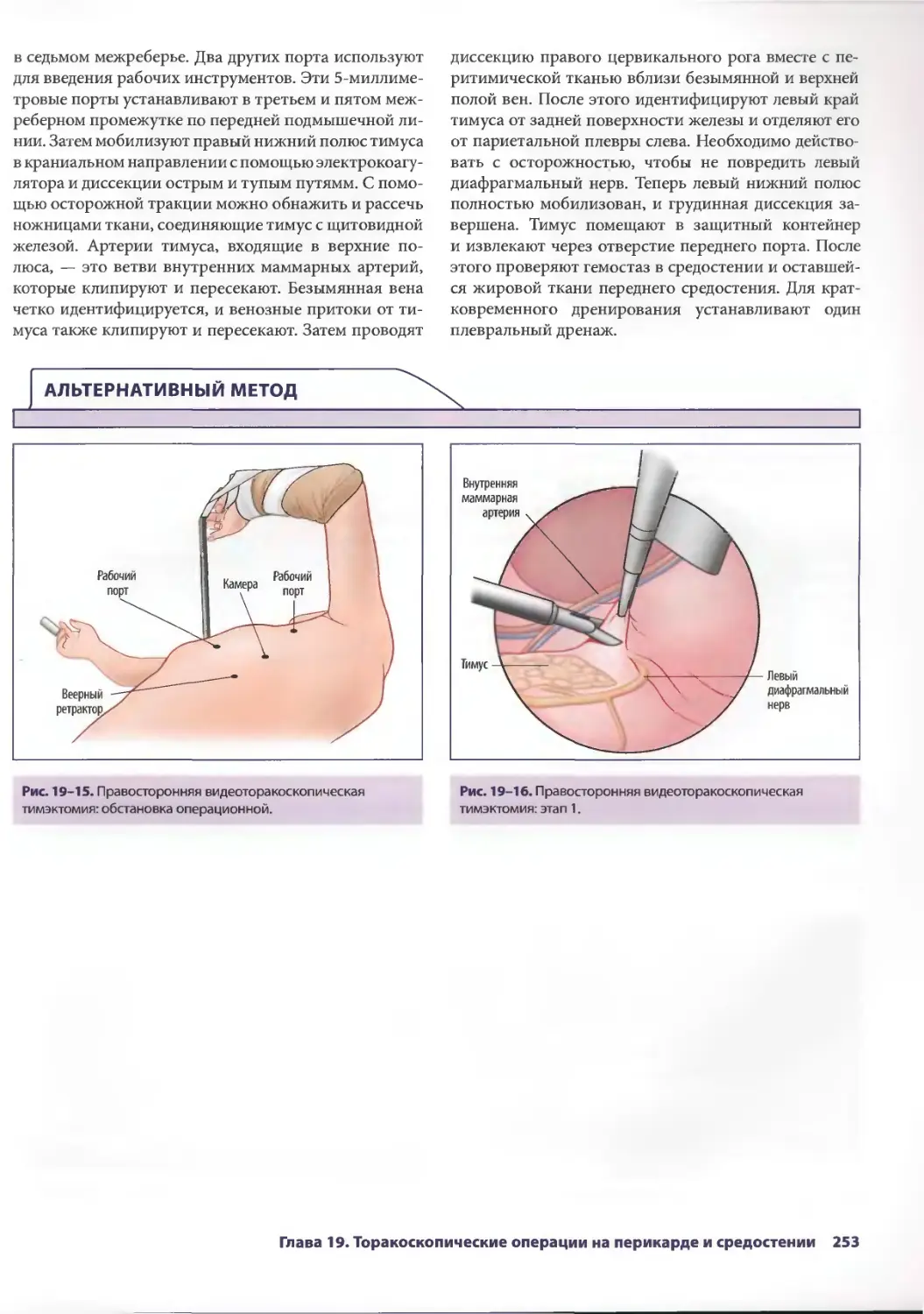
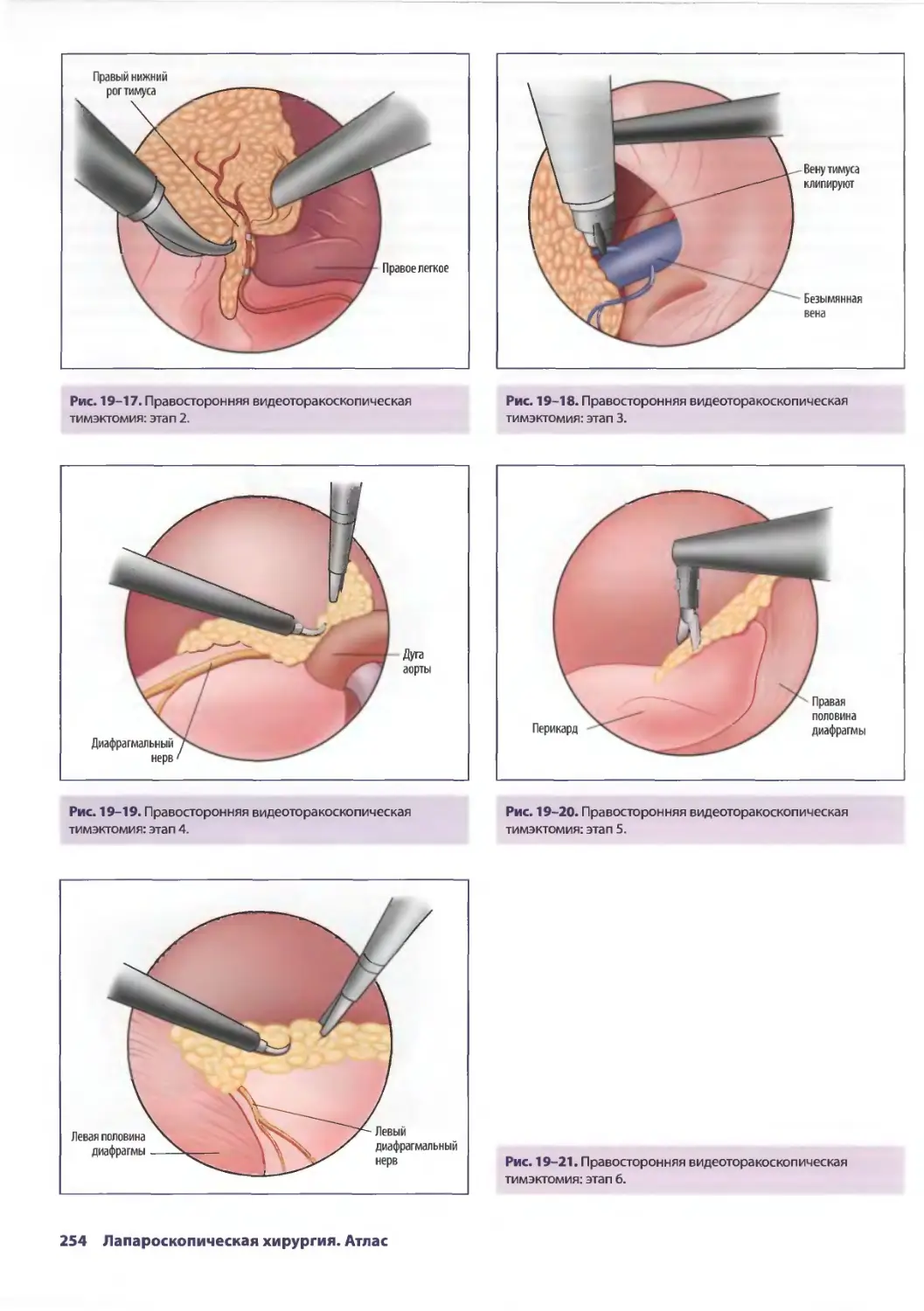
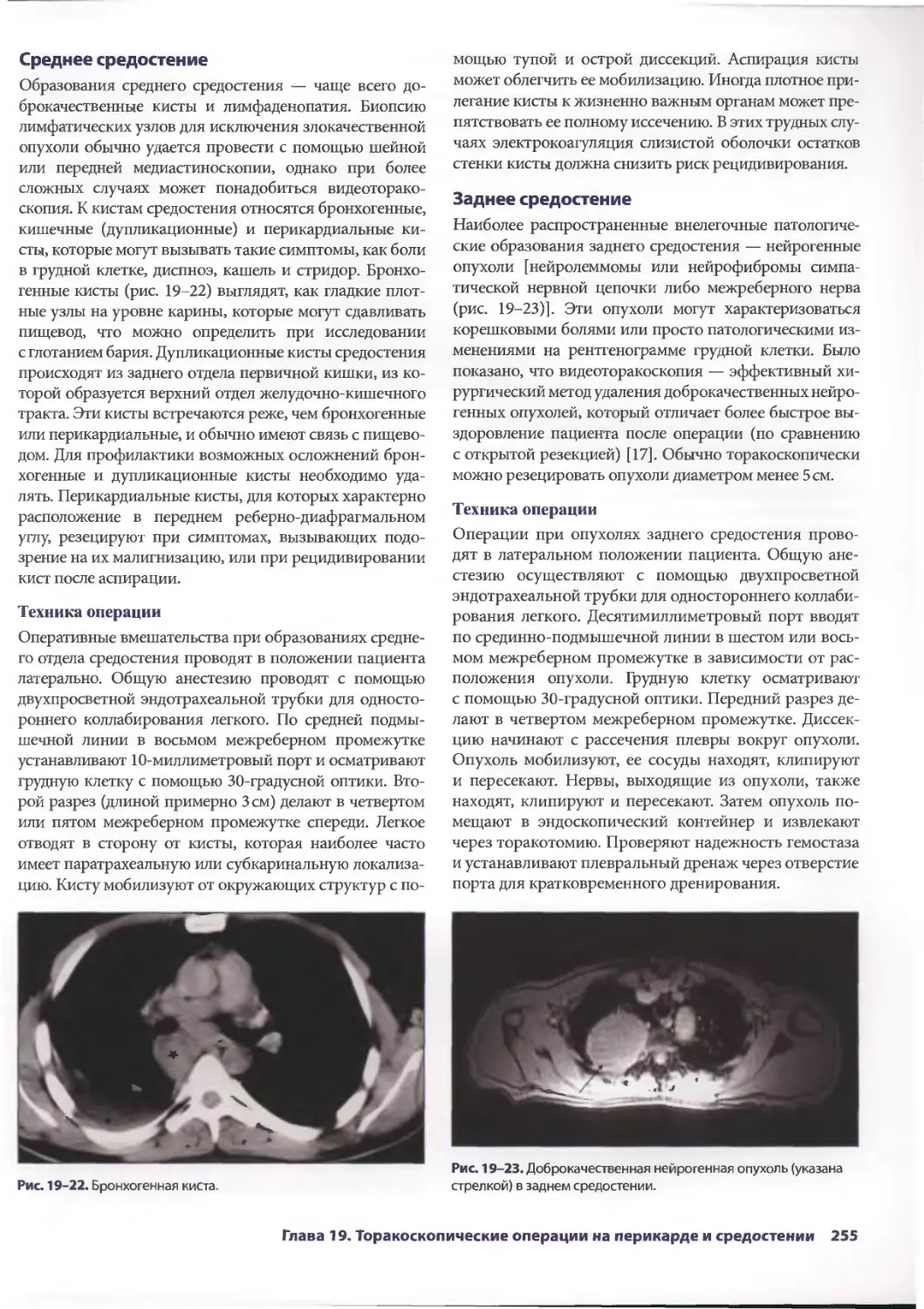
Глава 19. Торакоскопические операции на перикарде и средостении 245
Брайн Лима, ТомасА.Д'Амико
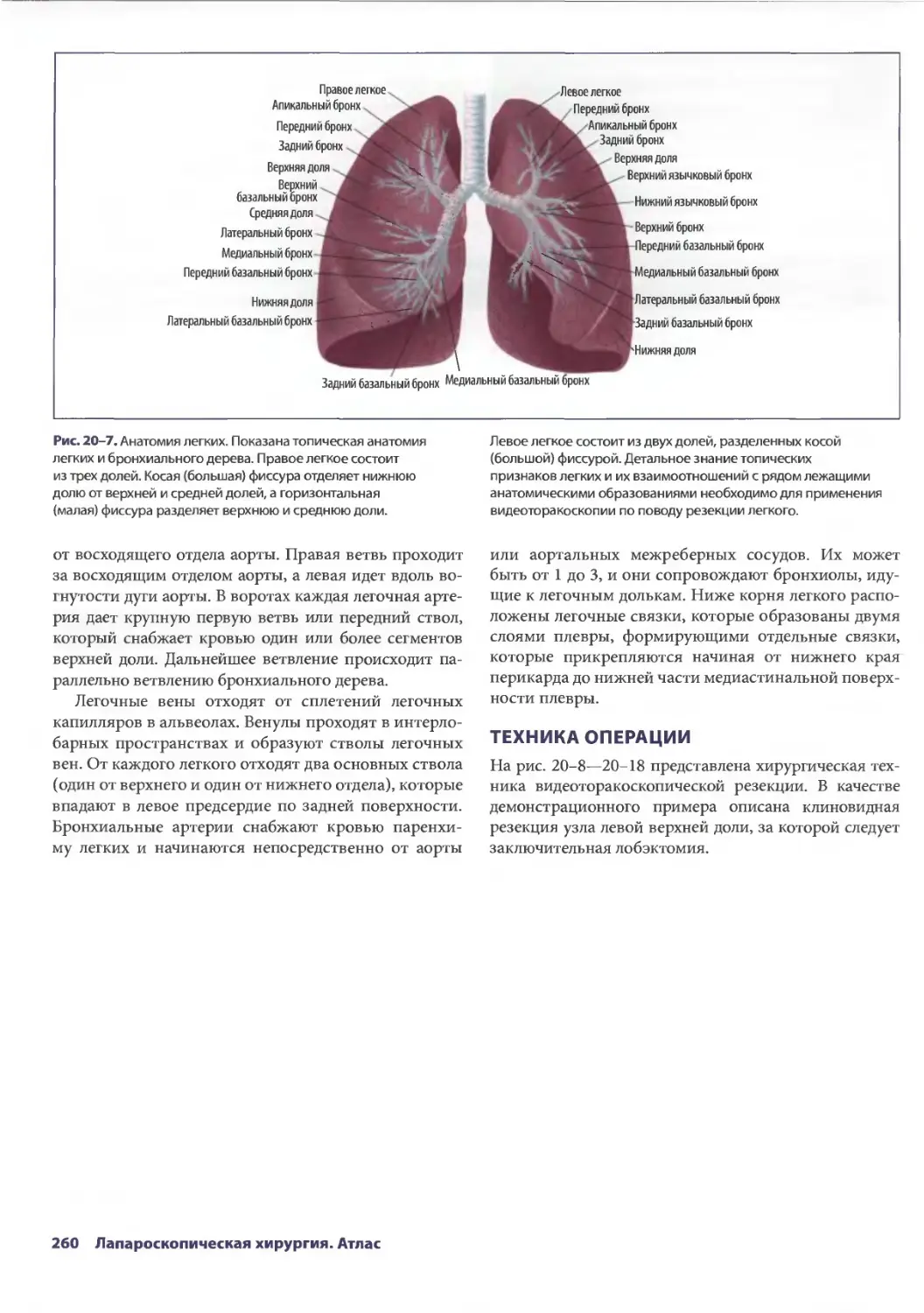
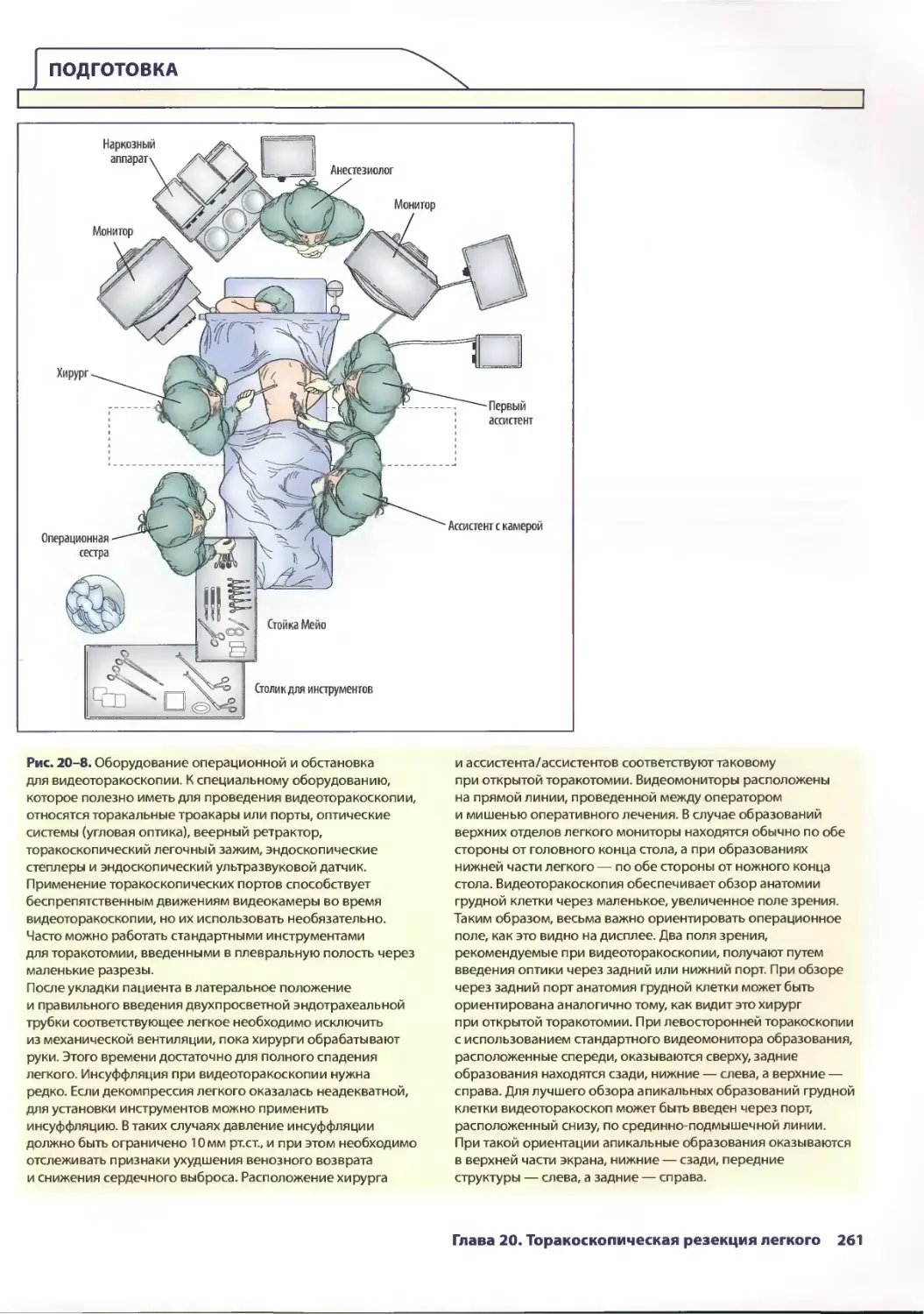
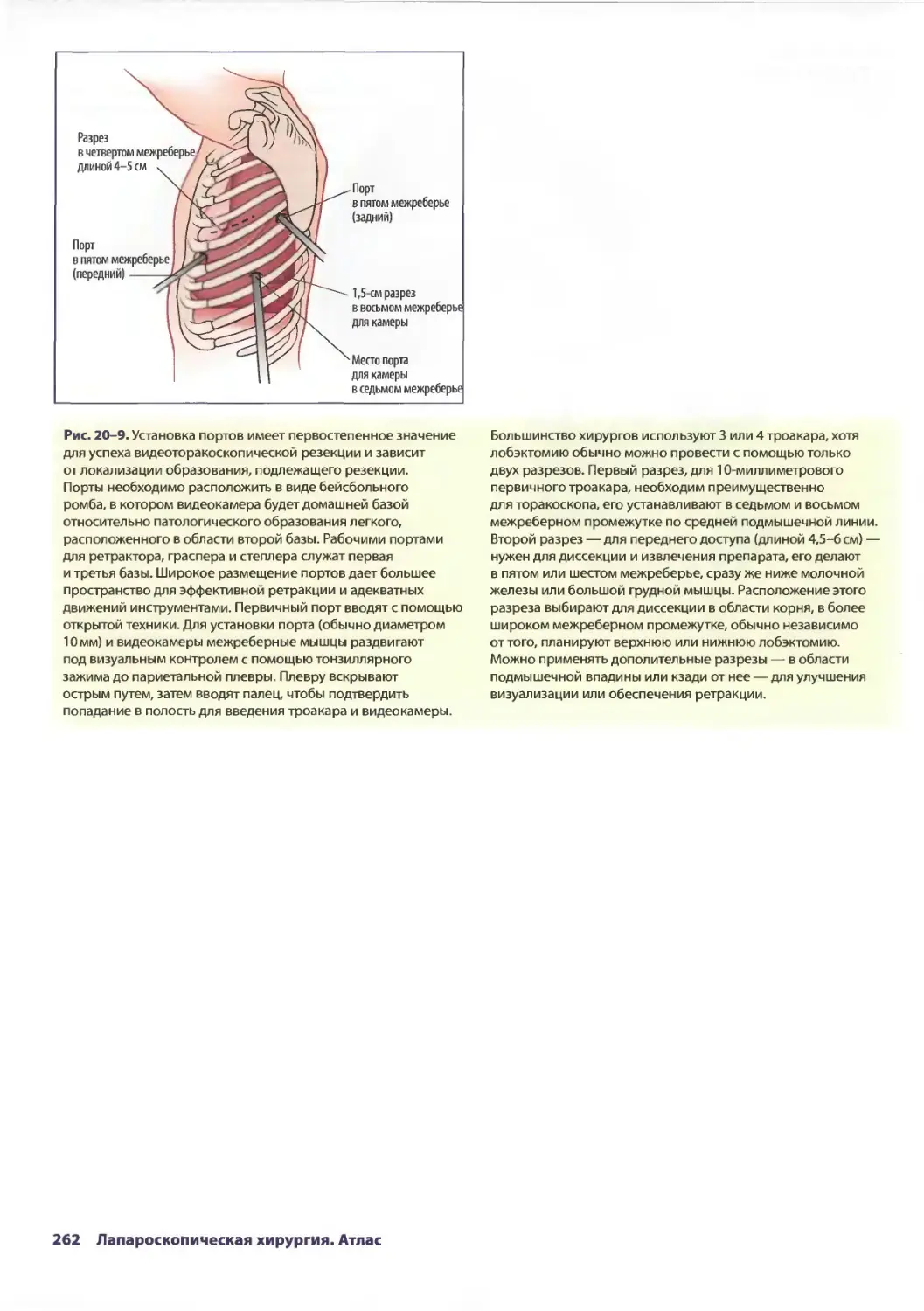
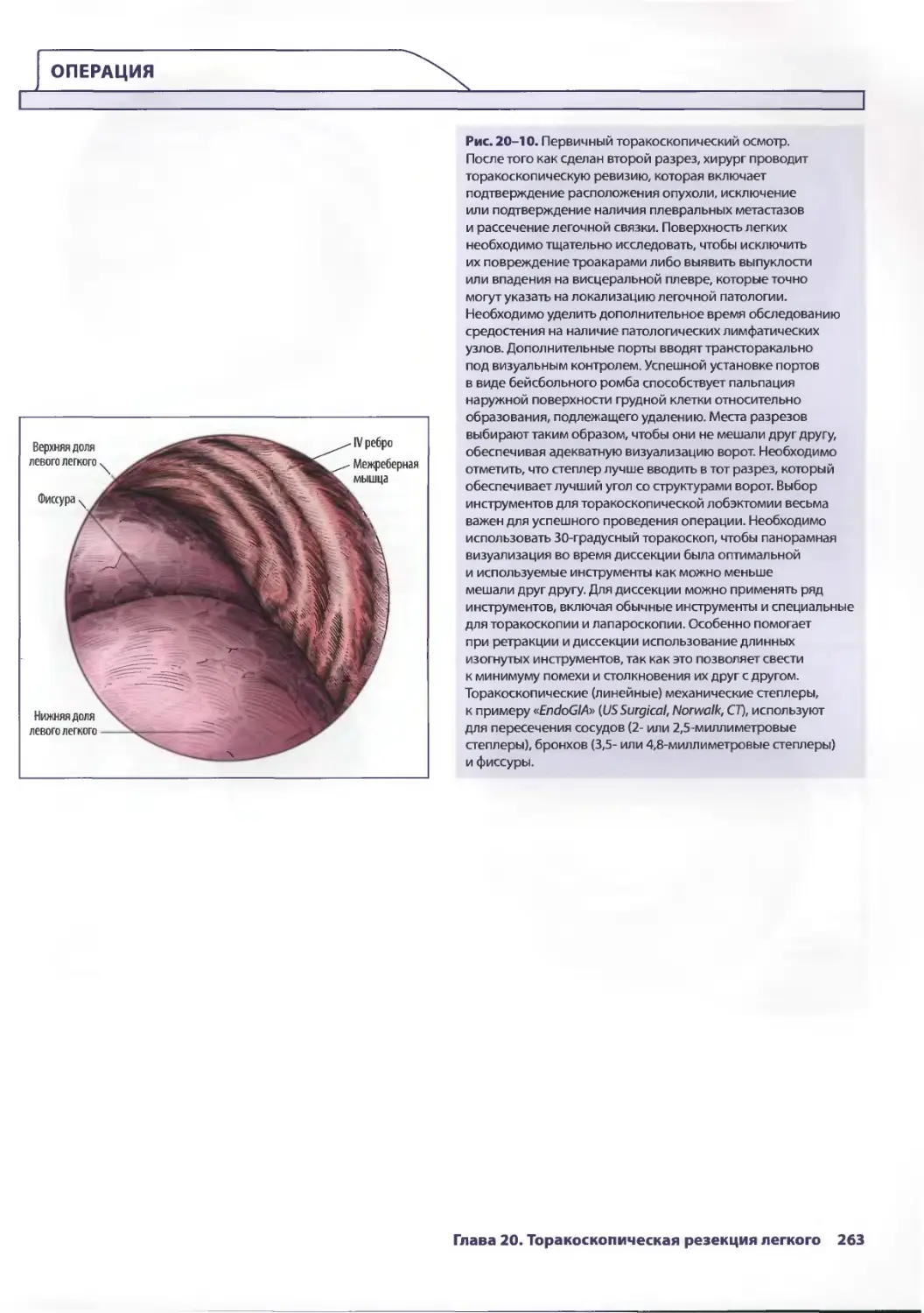
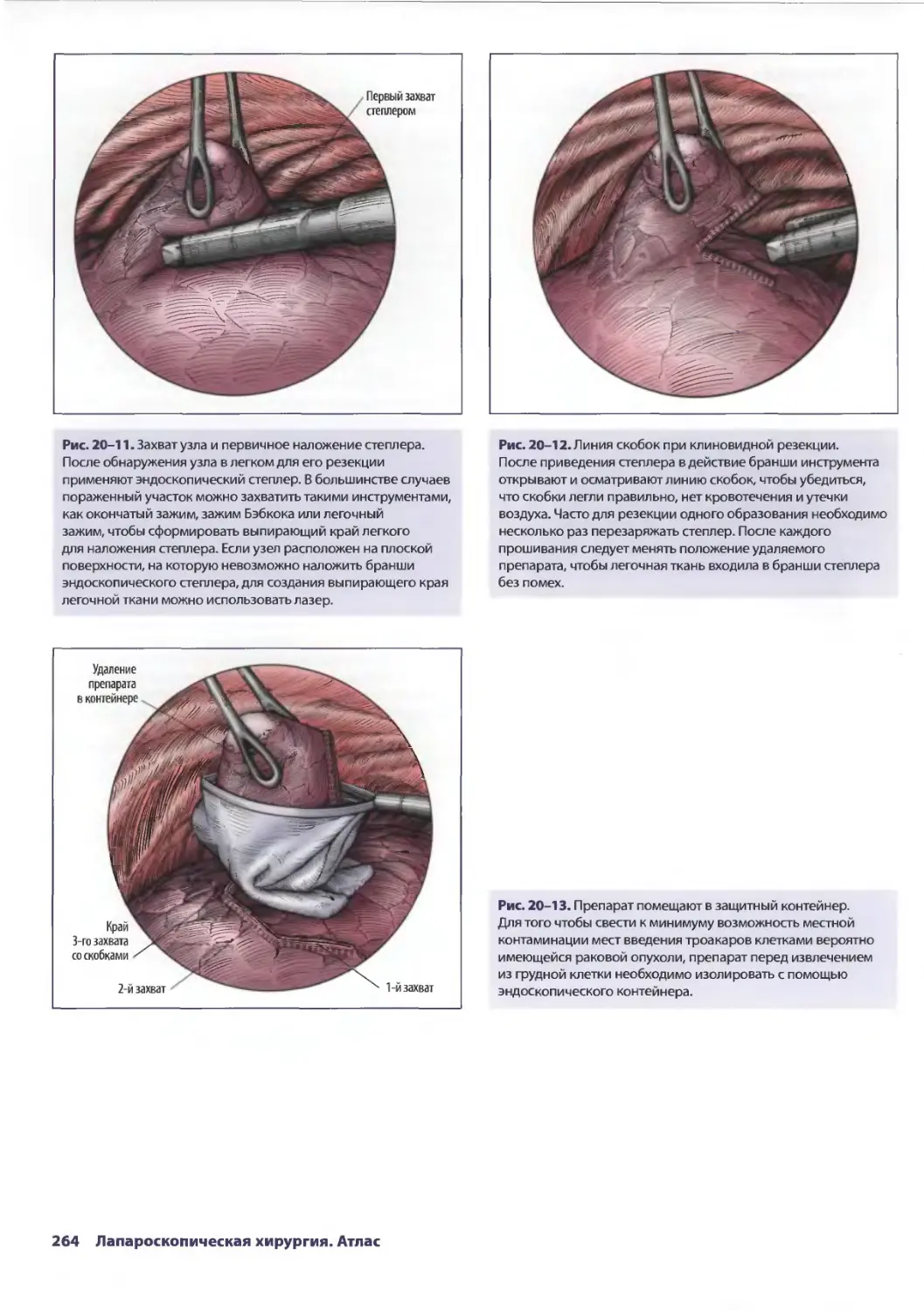
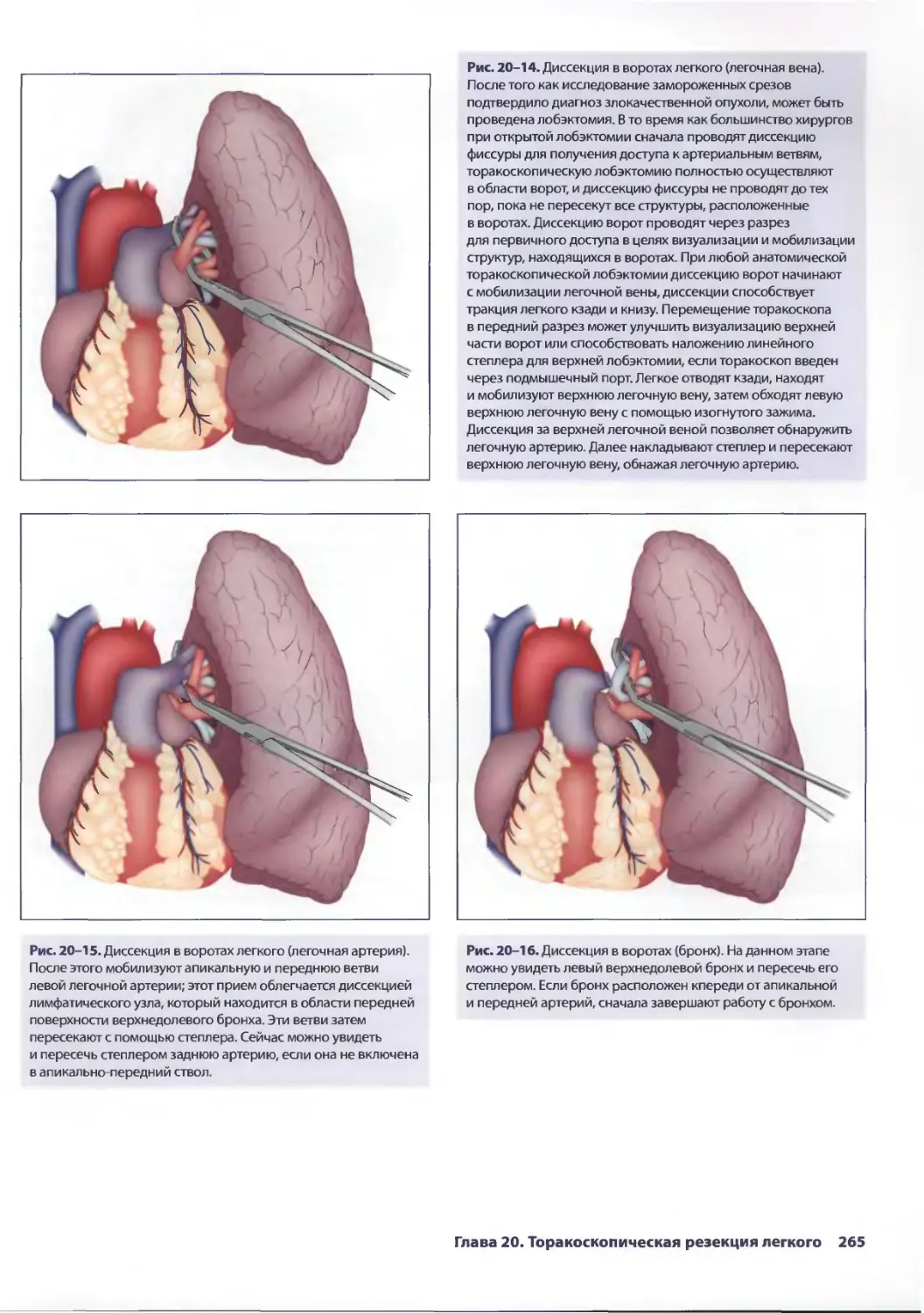
Глава 20. Торакоскопическая резекция легкого 257
Эдвард Канту III, ТомасА.Д'Амико
Ж. Чад Хьюес, Дэвид X. Харполе-мл.
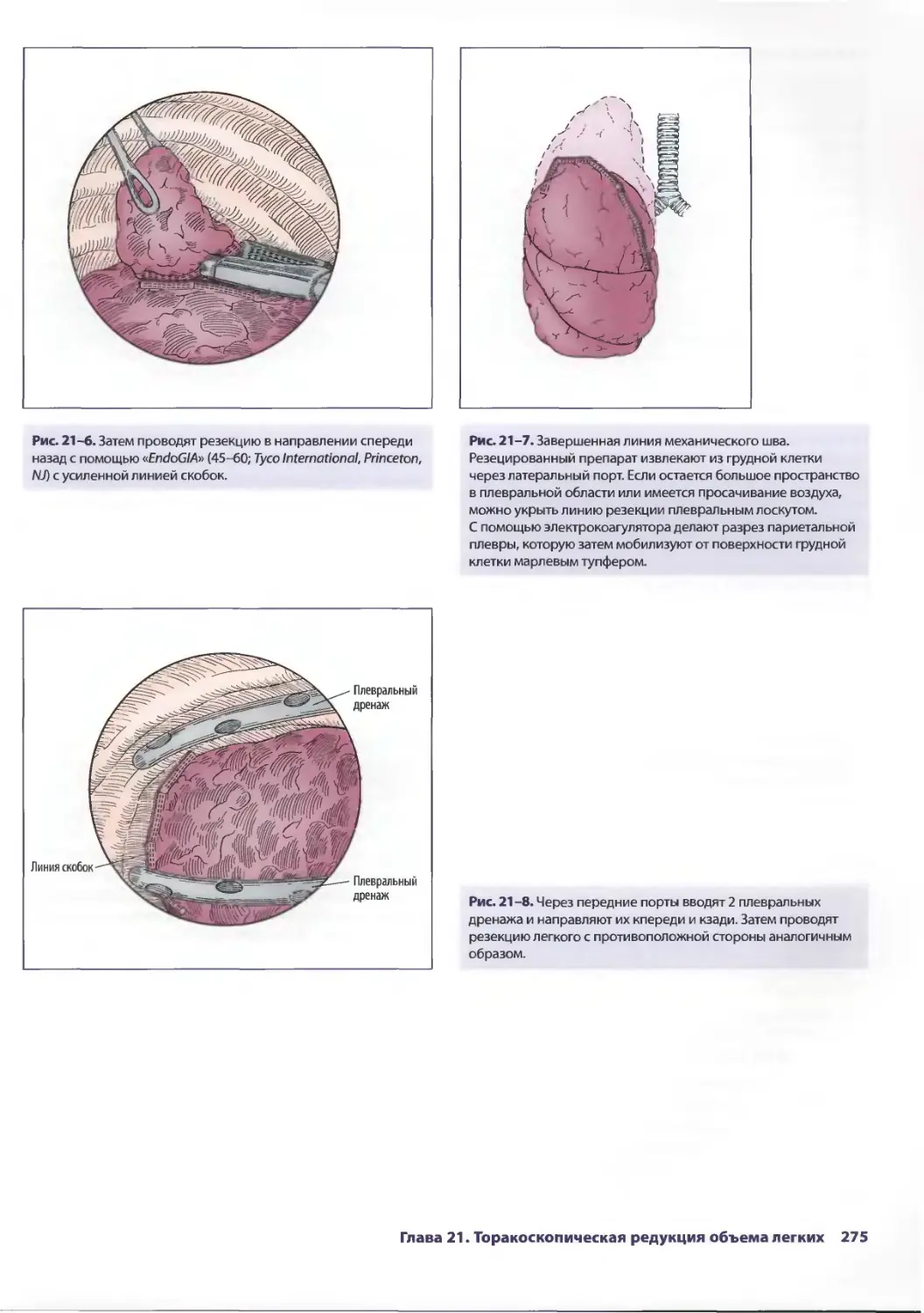
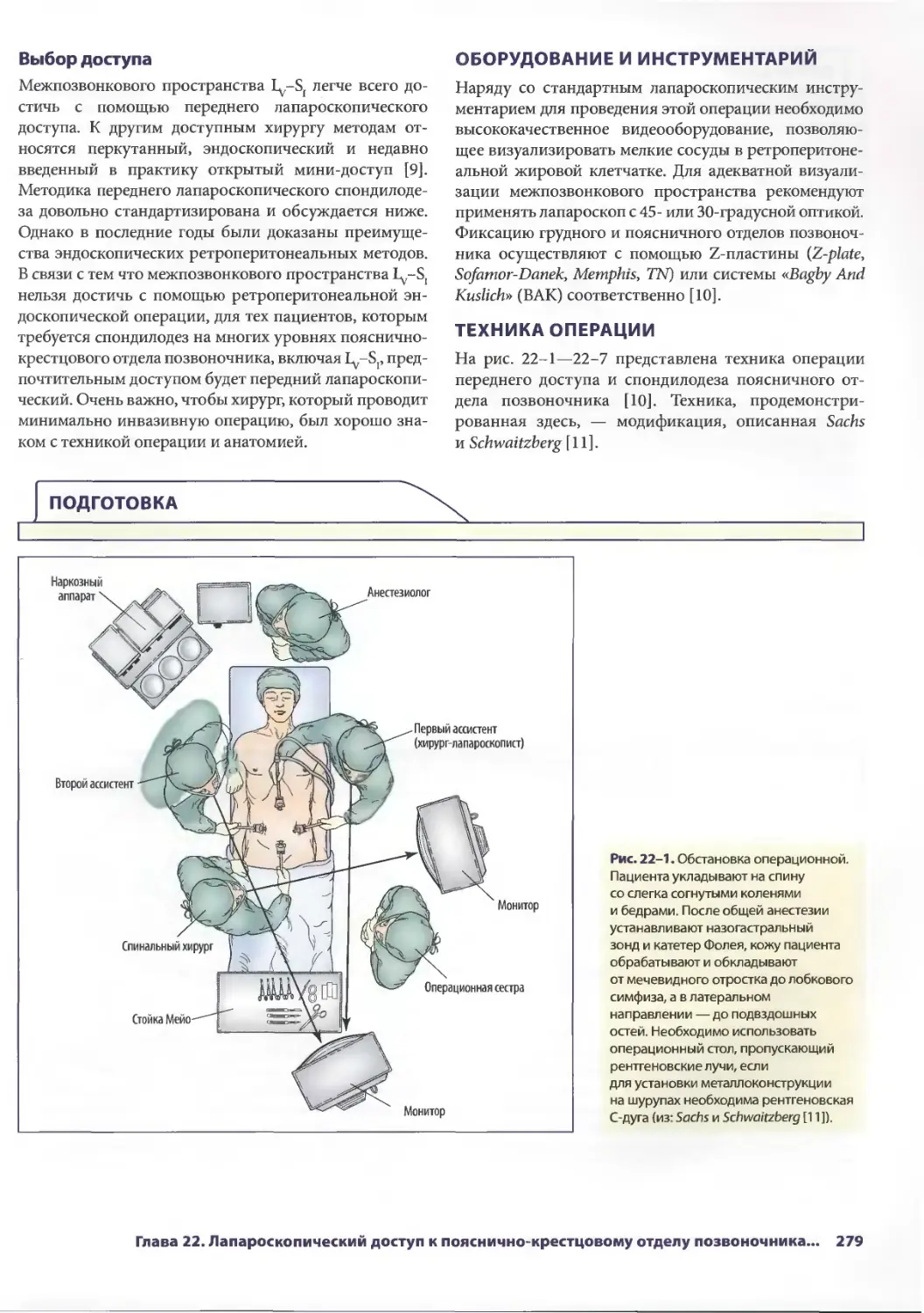
Глава 21. Торакоскопическая редукция объема легких 271
ТомасА.Д'Амико
Ашиш С. Шах, Р. ДуэйнДэвис-мл., Дэвид X. Харполе-мл.
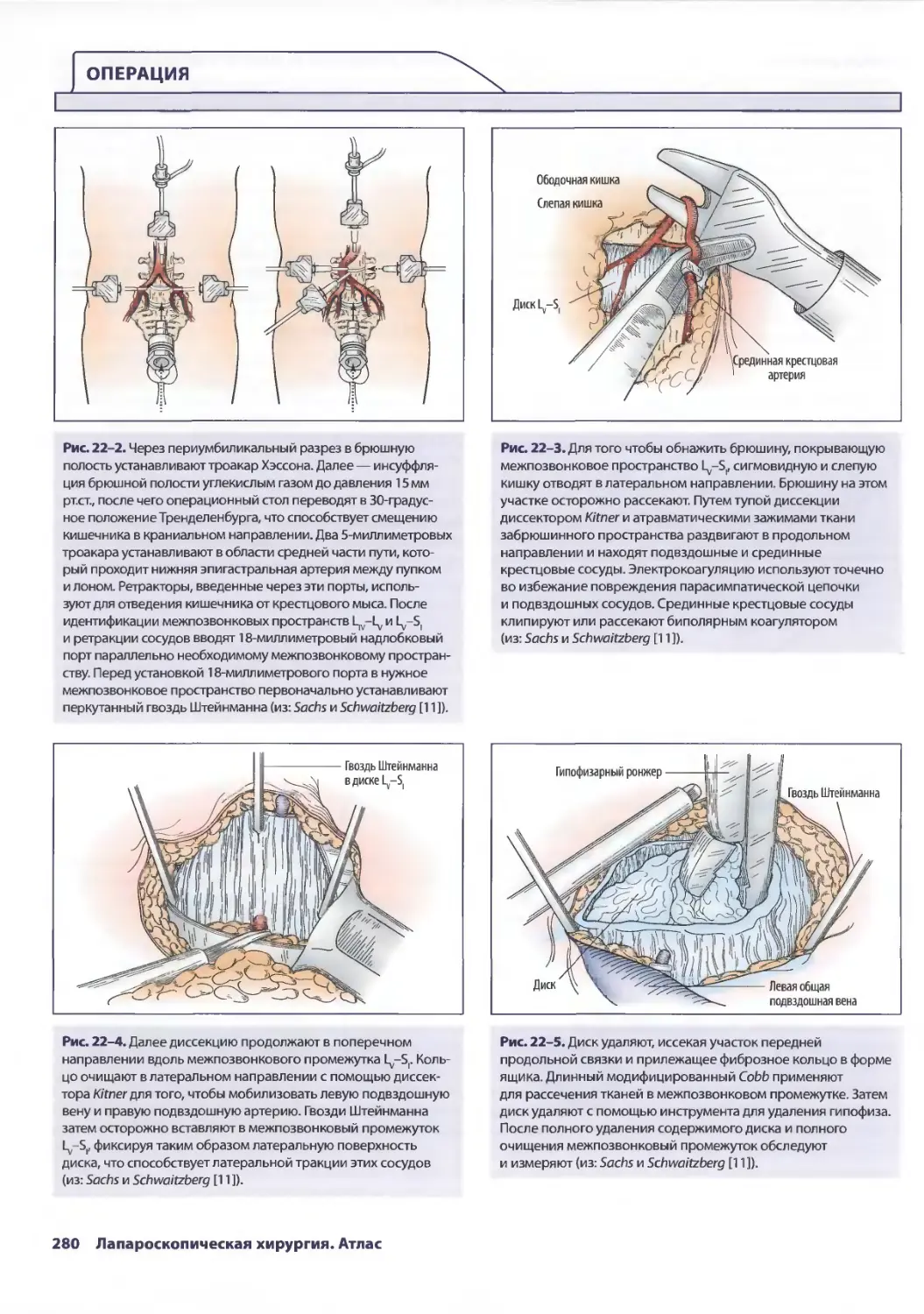
Глава 22. Лапароскопический доступ к пояснично-крестцовому отделу
позвоночника для дискэктомии и спондилодеза 277
Дана Д. Портенер, Кеки Р. Балсара
Ж. Роберт Стефенсон-мл., Джеффри X. Лаусон, Фредрик Броди
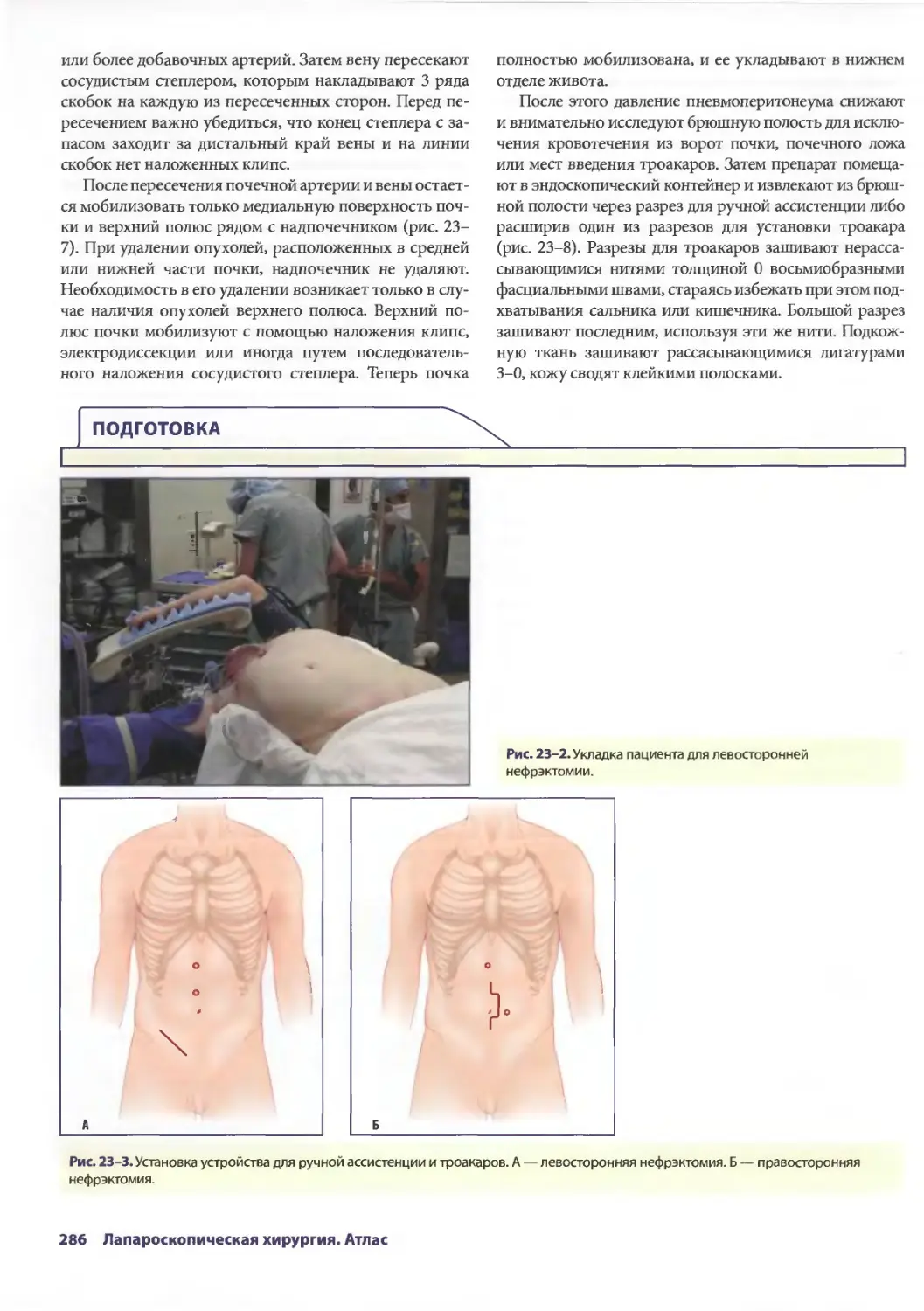
Глава 23. Лапароскопические операции в урологии 283
B. Купер Бушемейр III, Дэвид М. Албала
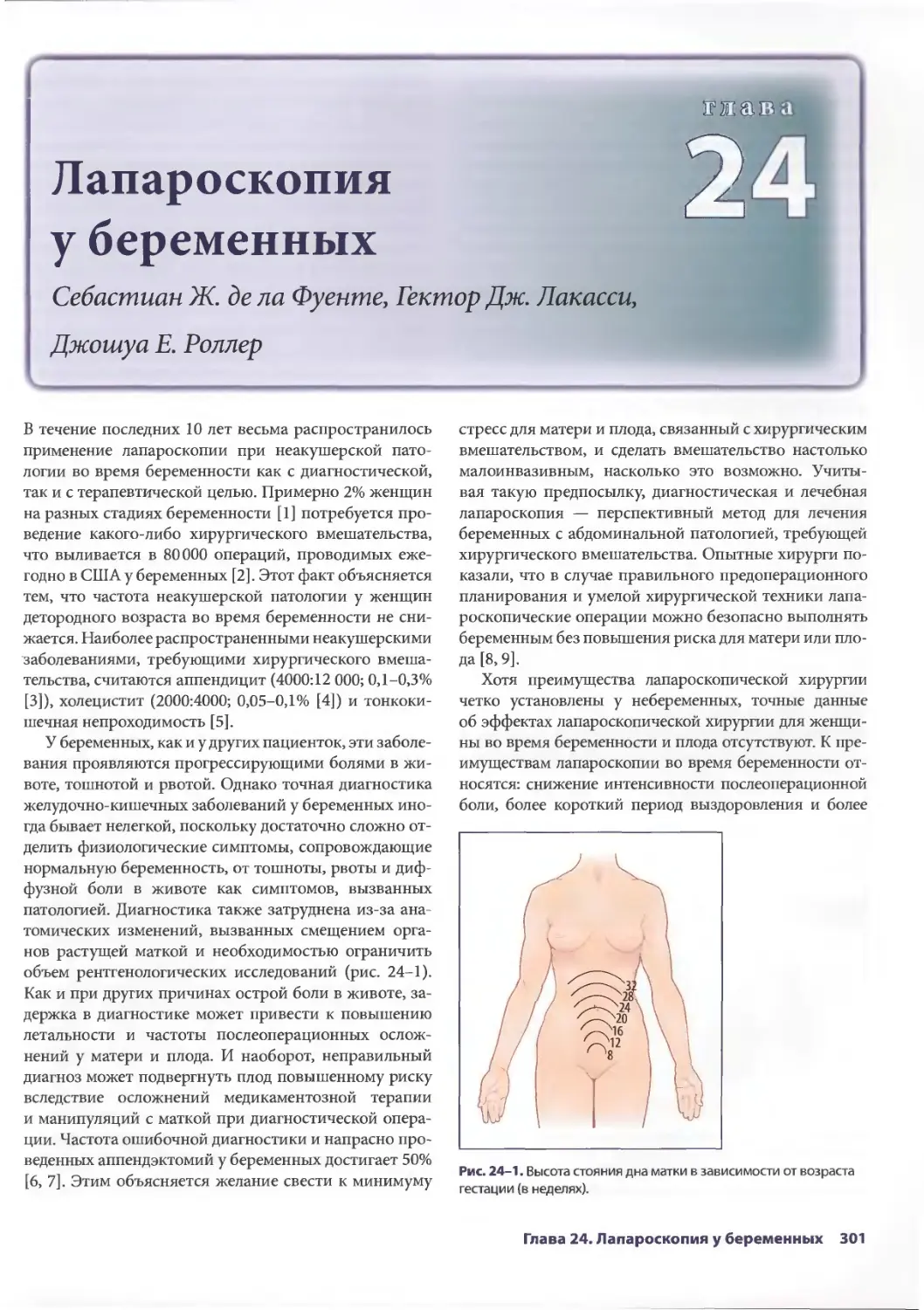
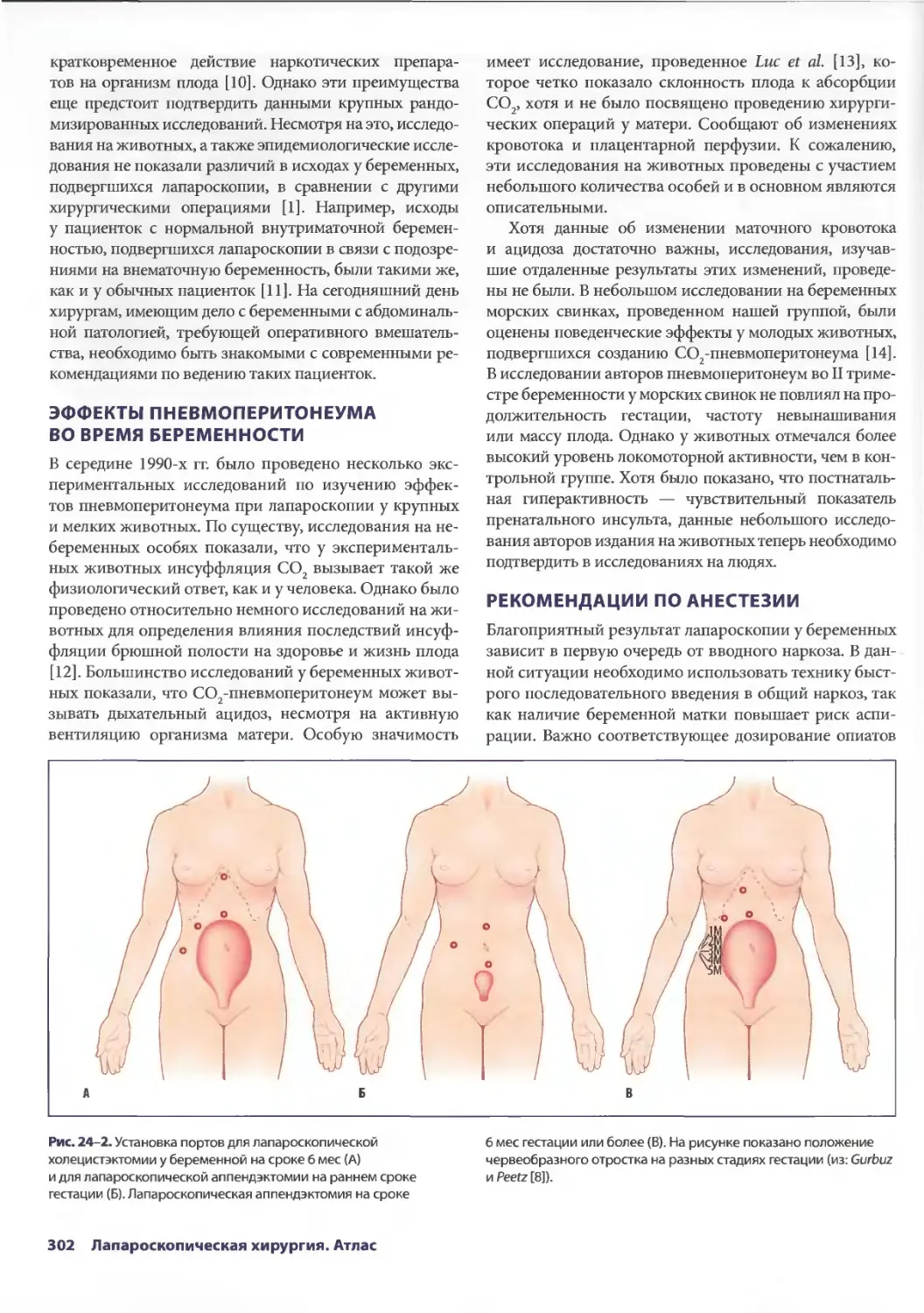
Глава 24. Лапароскопия у беременных 301
Себастиан Ж. дела Фуенте, Гектор Дж. Лакасси, Джошуа Е. Роллер
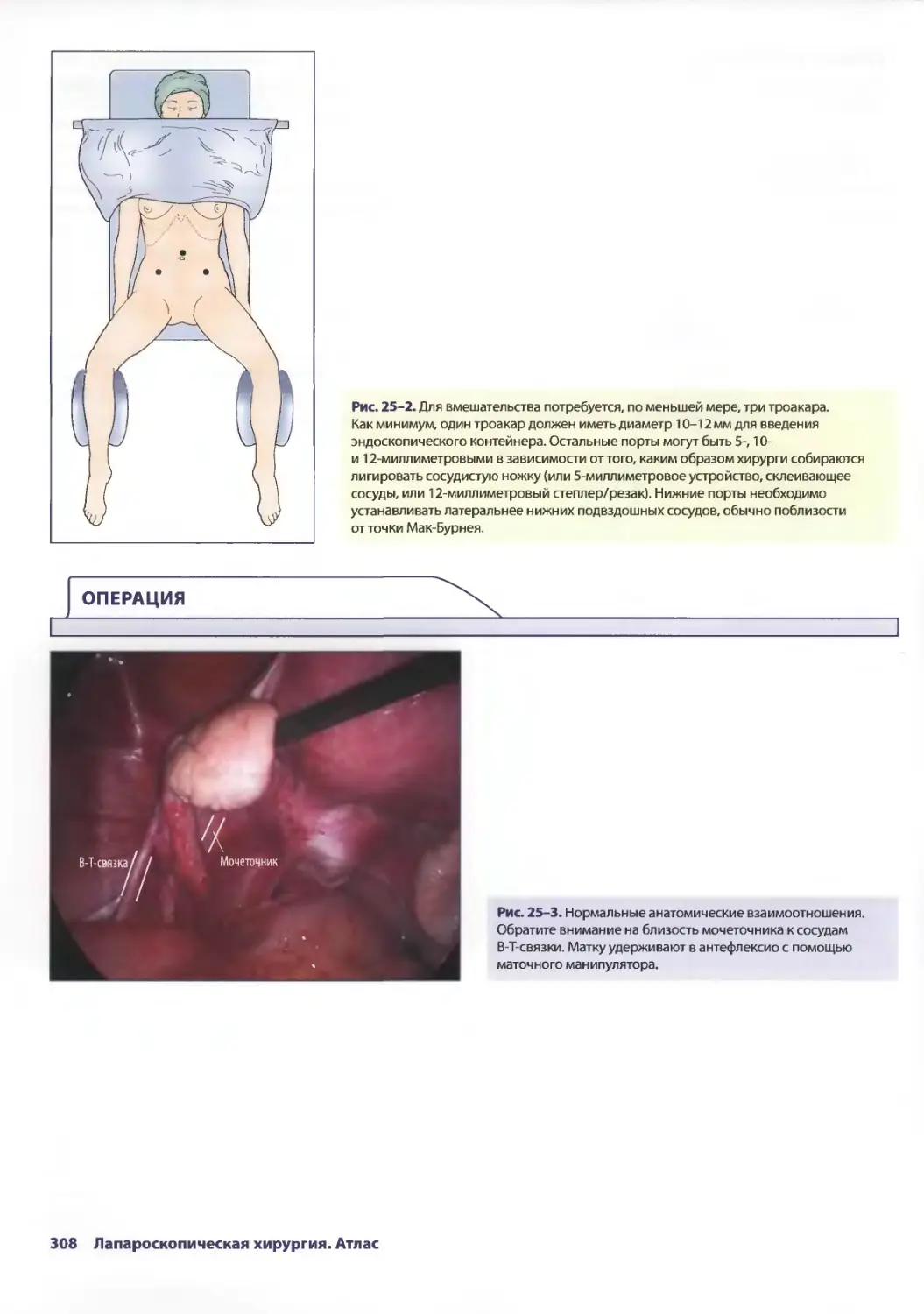
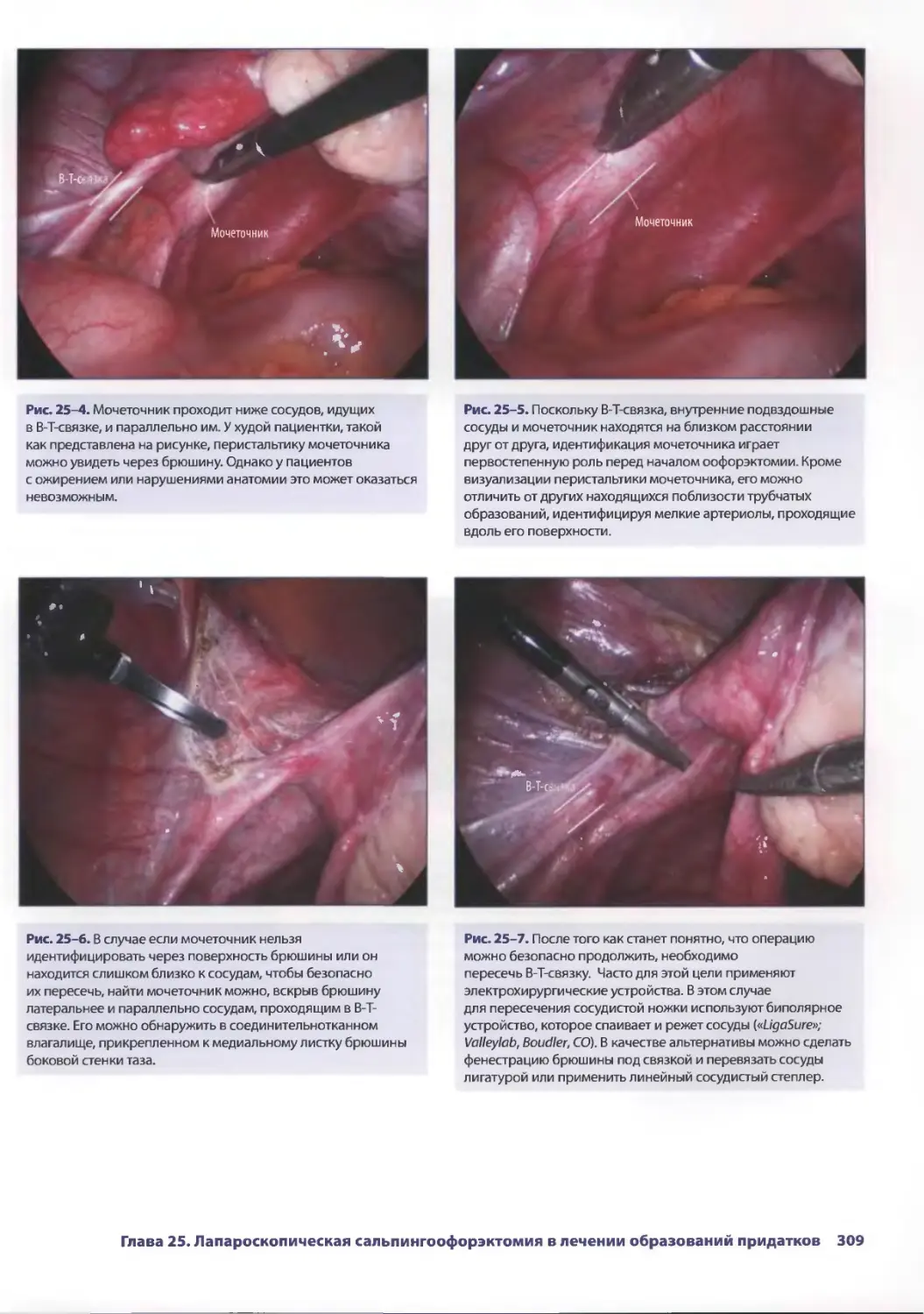
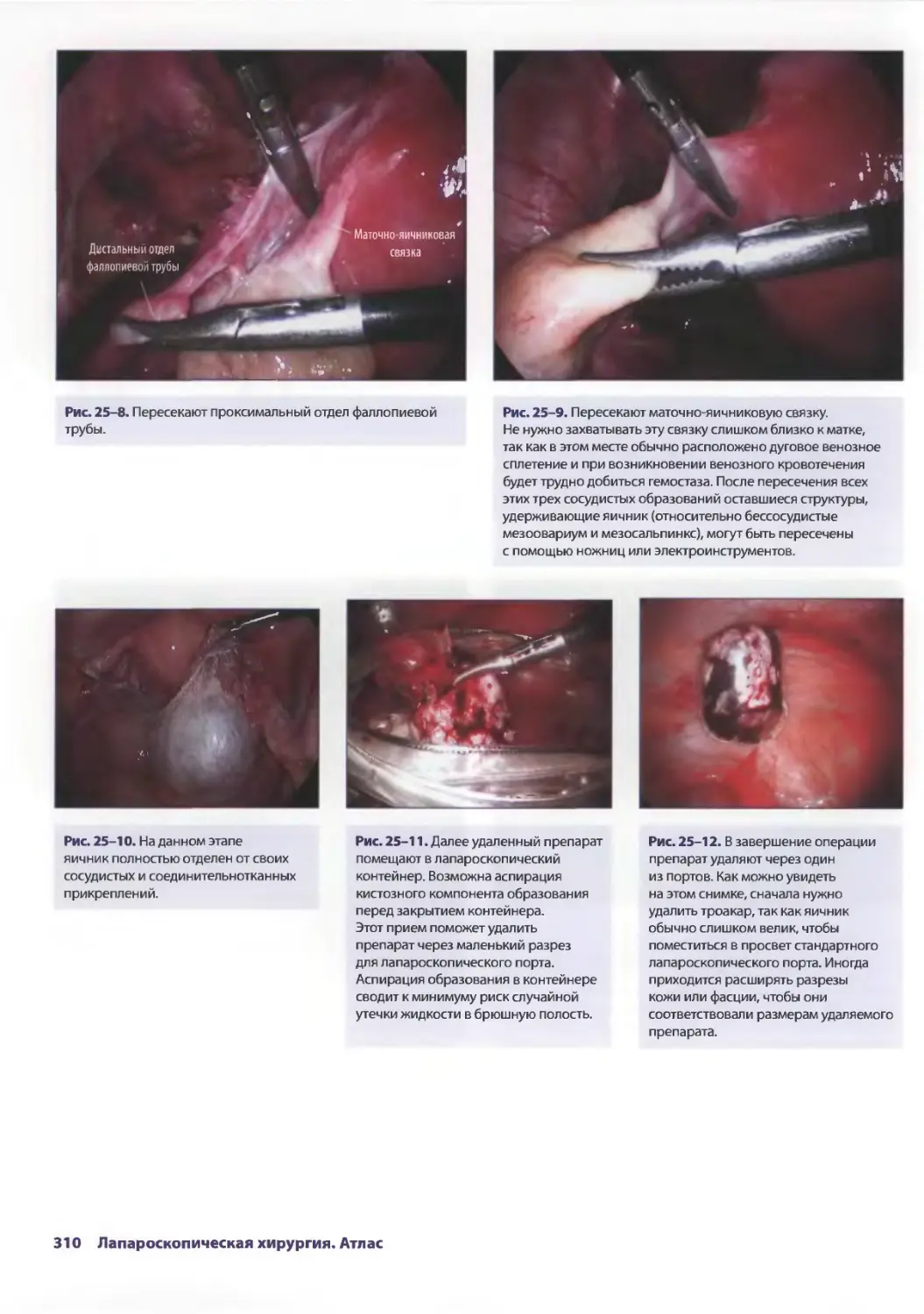
Глава 25. Лапароскопическая сальпингоофорэктомия
влечении образований придатков 305
КрэгДж. Соболевски
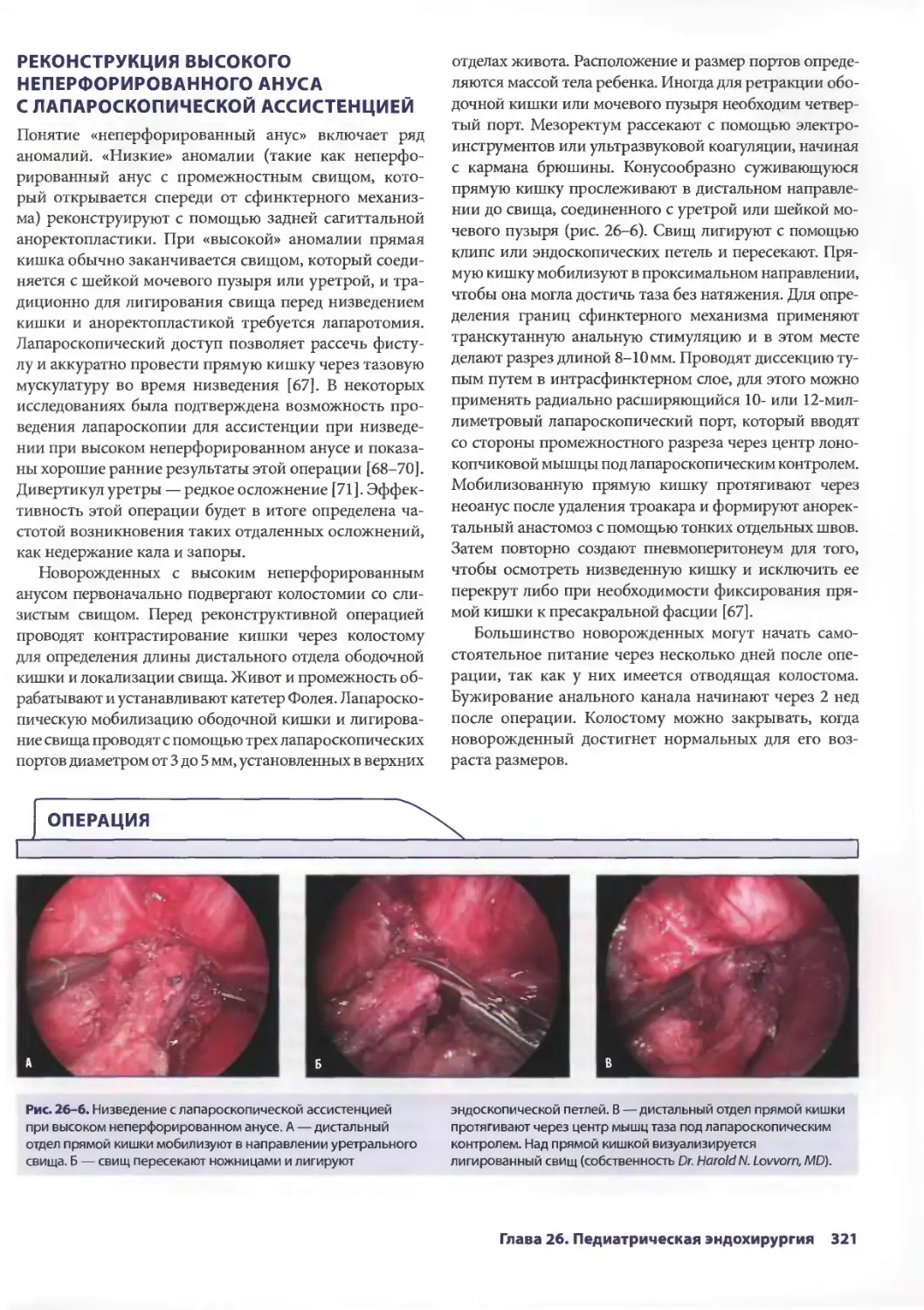
Глава 26. Педиатрическая эндохирургия 313
Мэри Т. Остин, Гретхен П. Пурселл
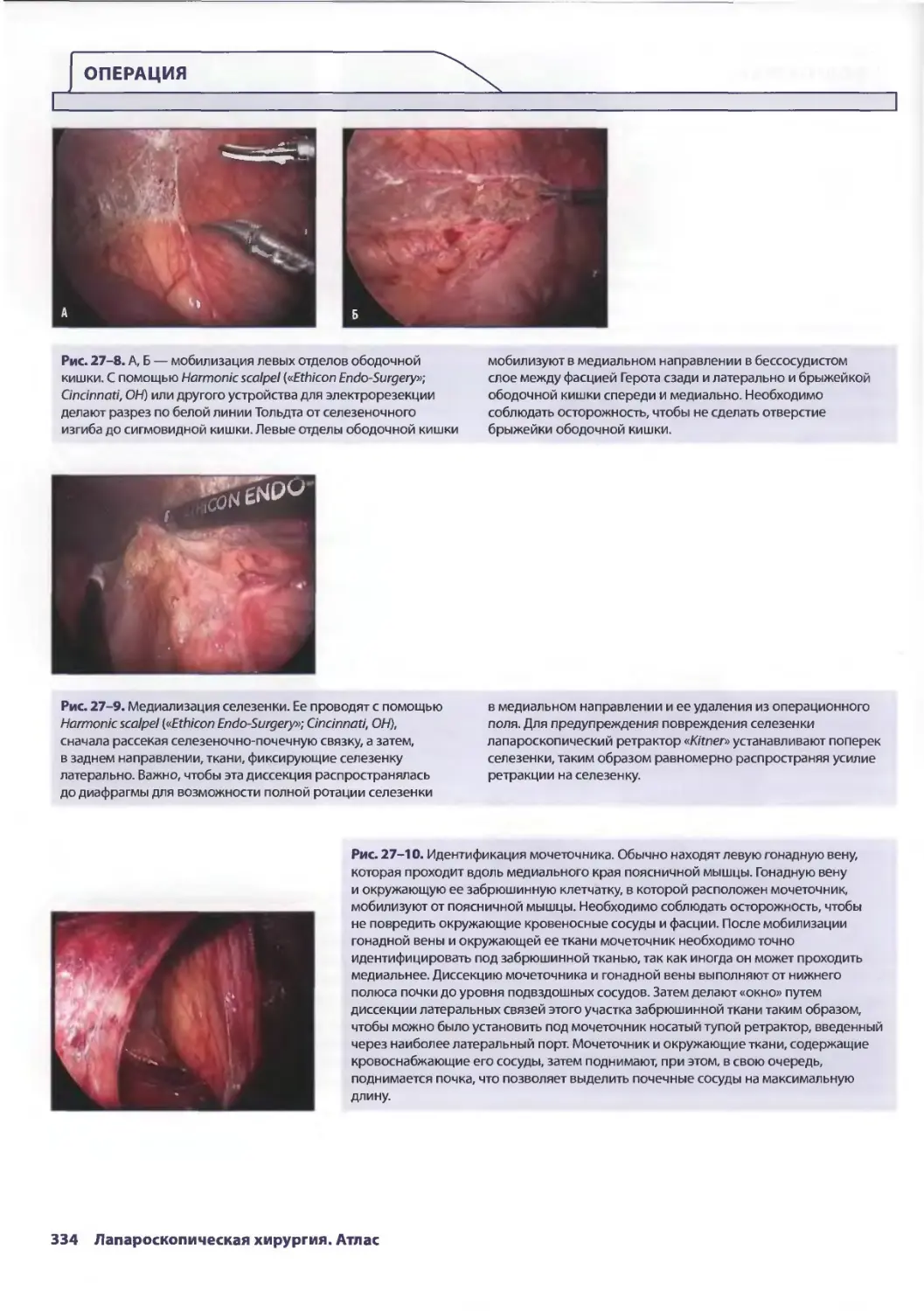
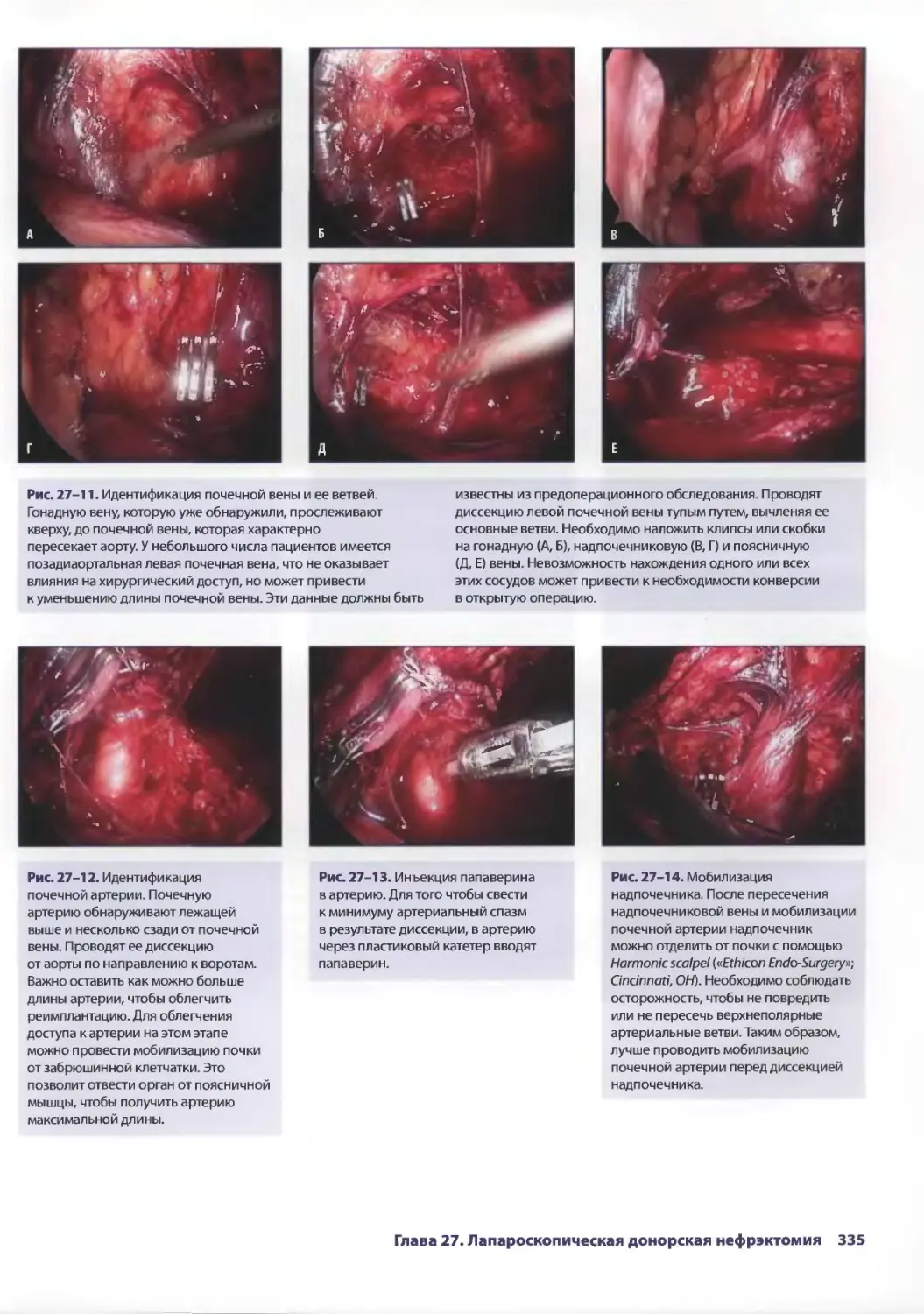
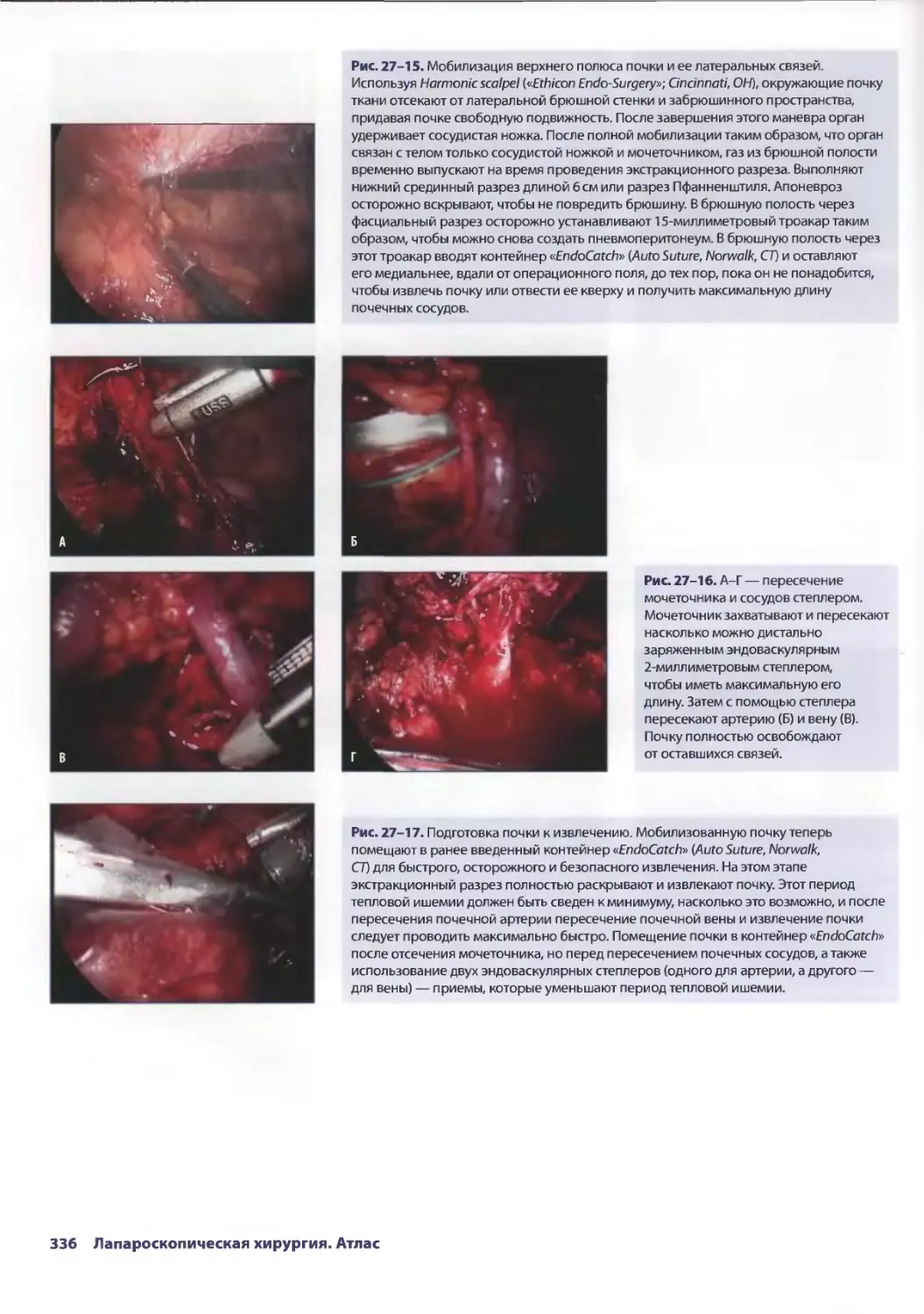
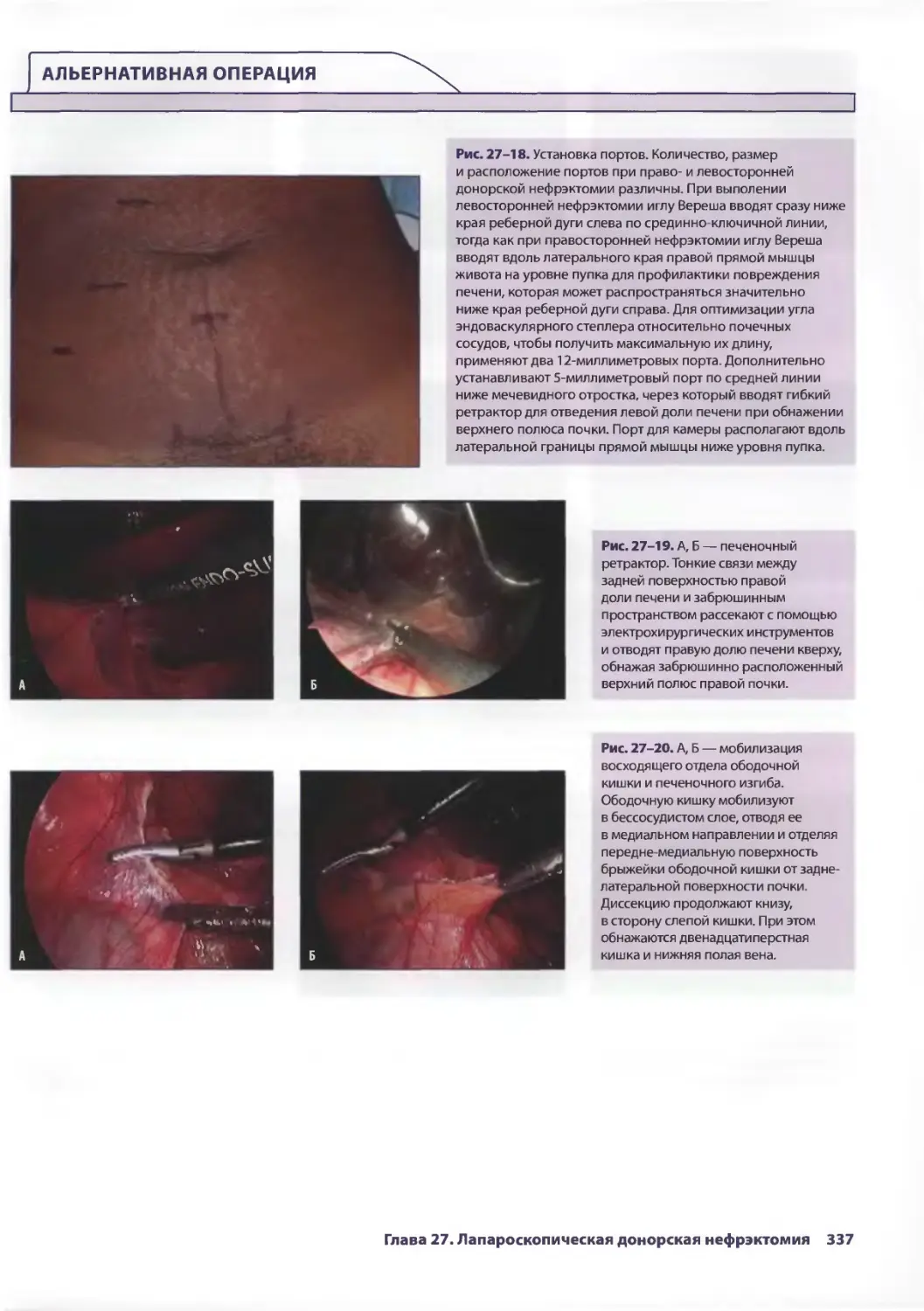
Глава 27. Лапароскопическая донорская нефрэктомия 329
Стивен И. Ханиш, Карлос И. Марроквин, Пол К. Куо, Дев М. Десай
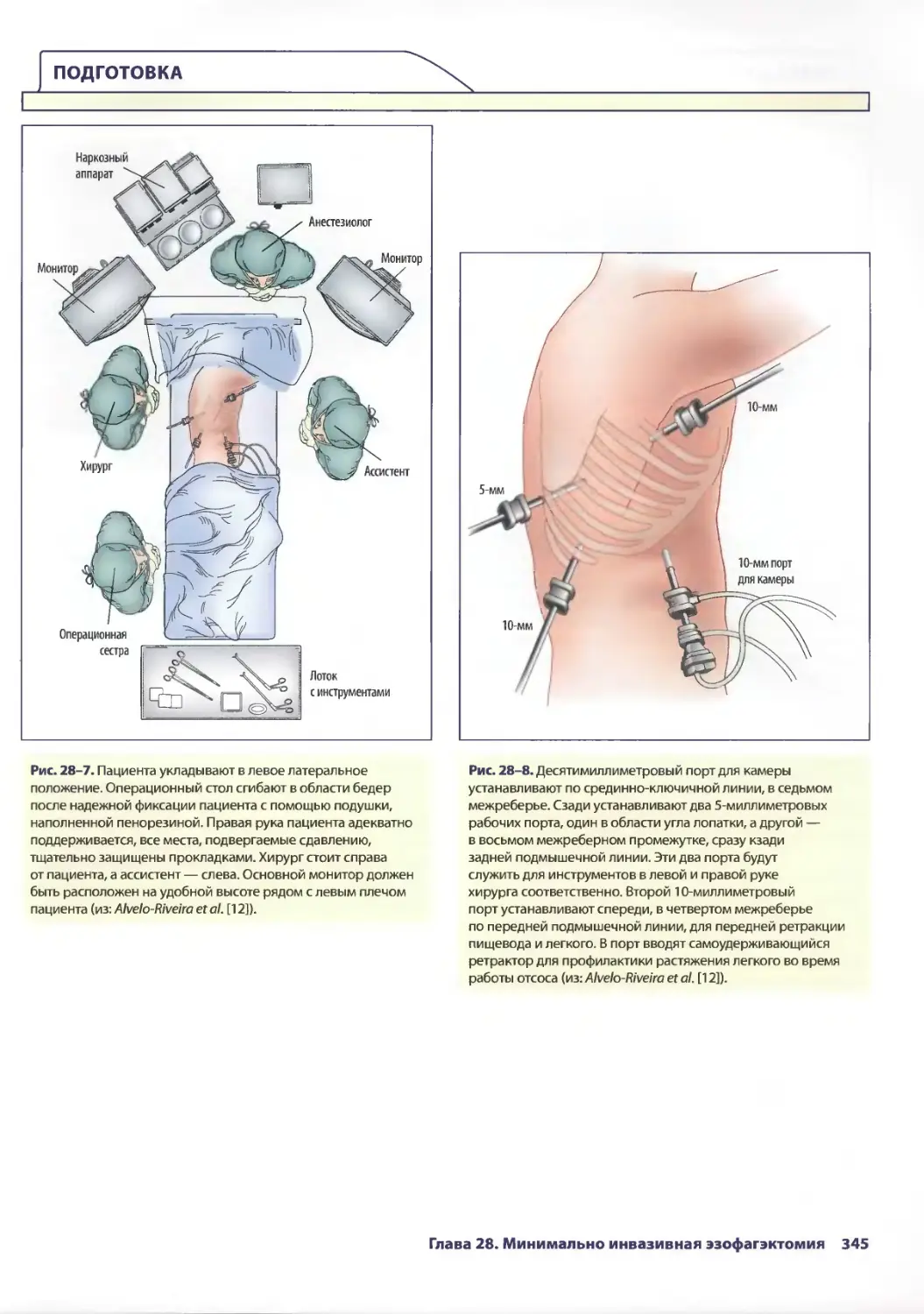
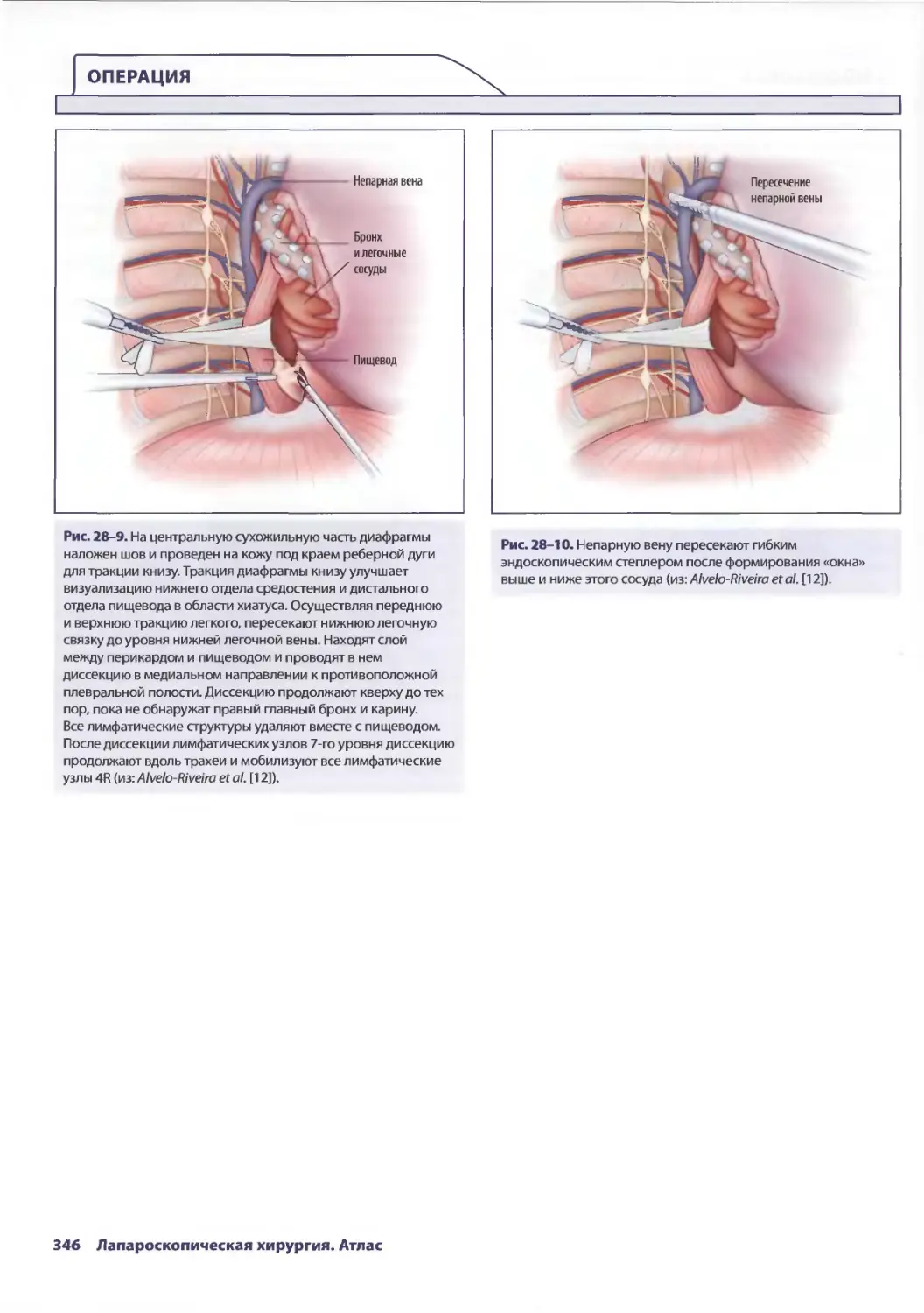
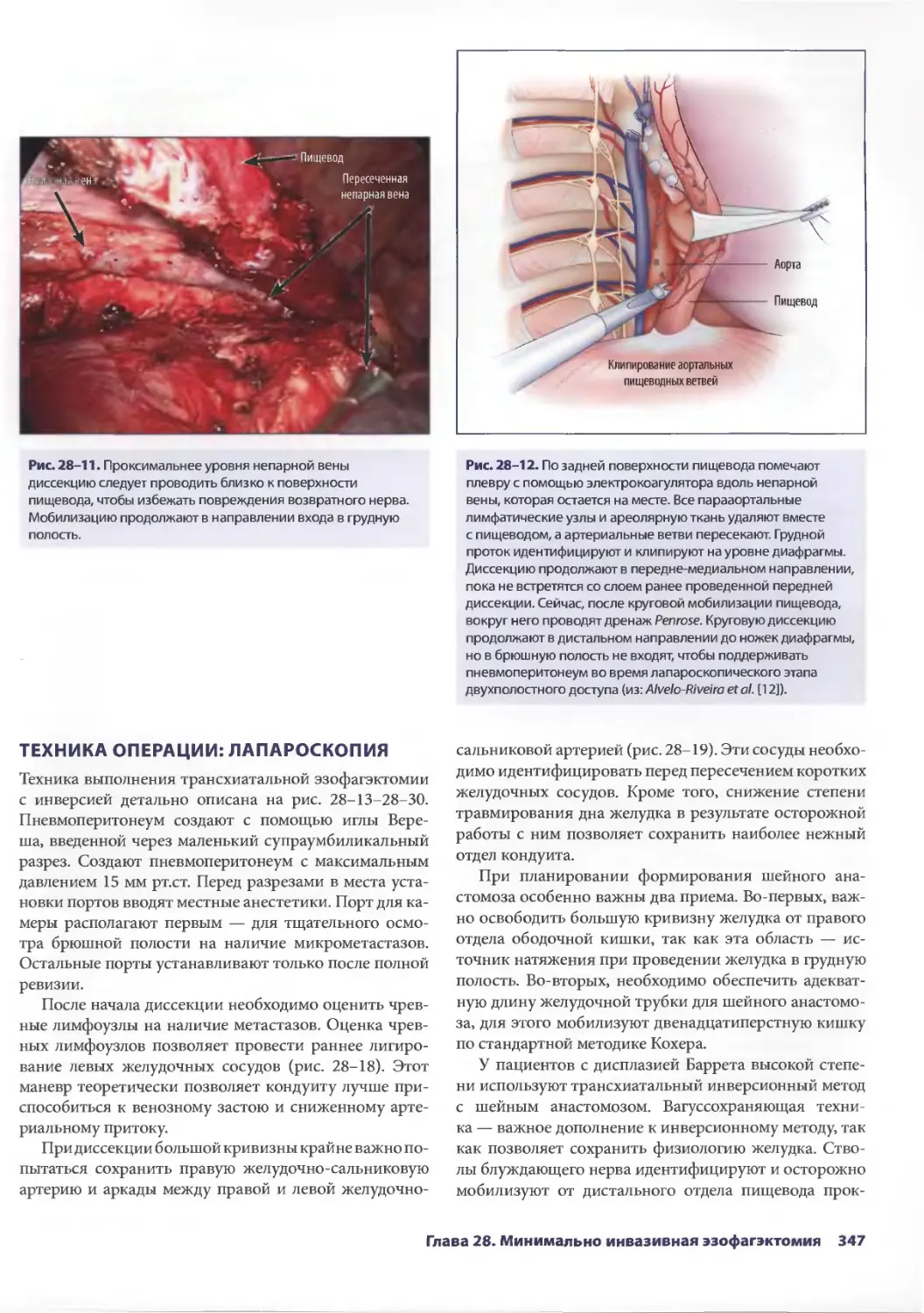
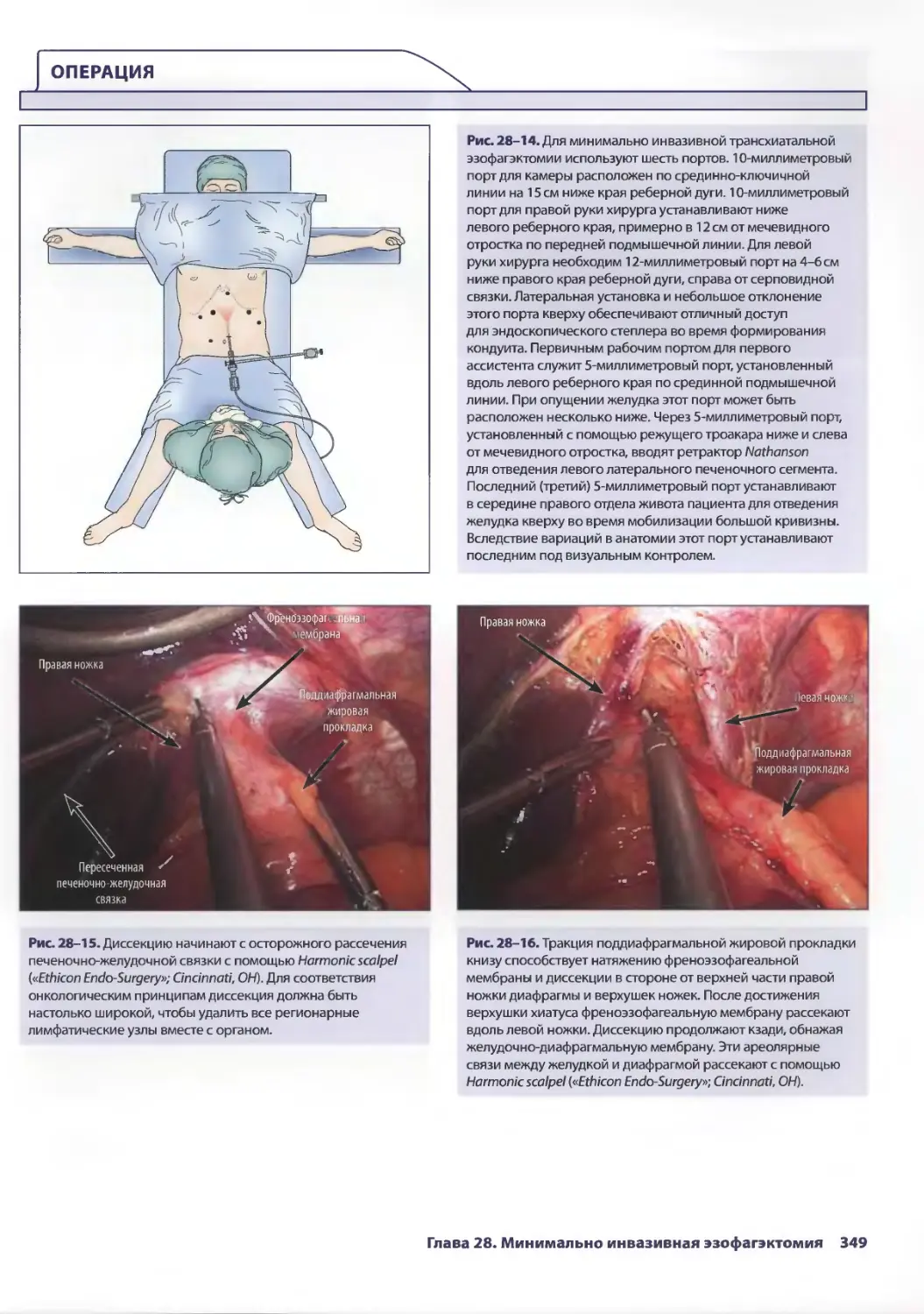
Глава 28. Минимально инвазивная эзофагэктомия 341
C. Кристиан Энестведт, Блэйр А. Жобе
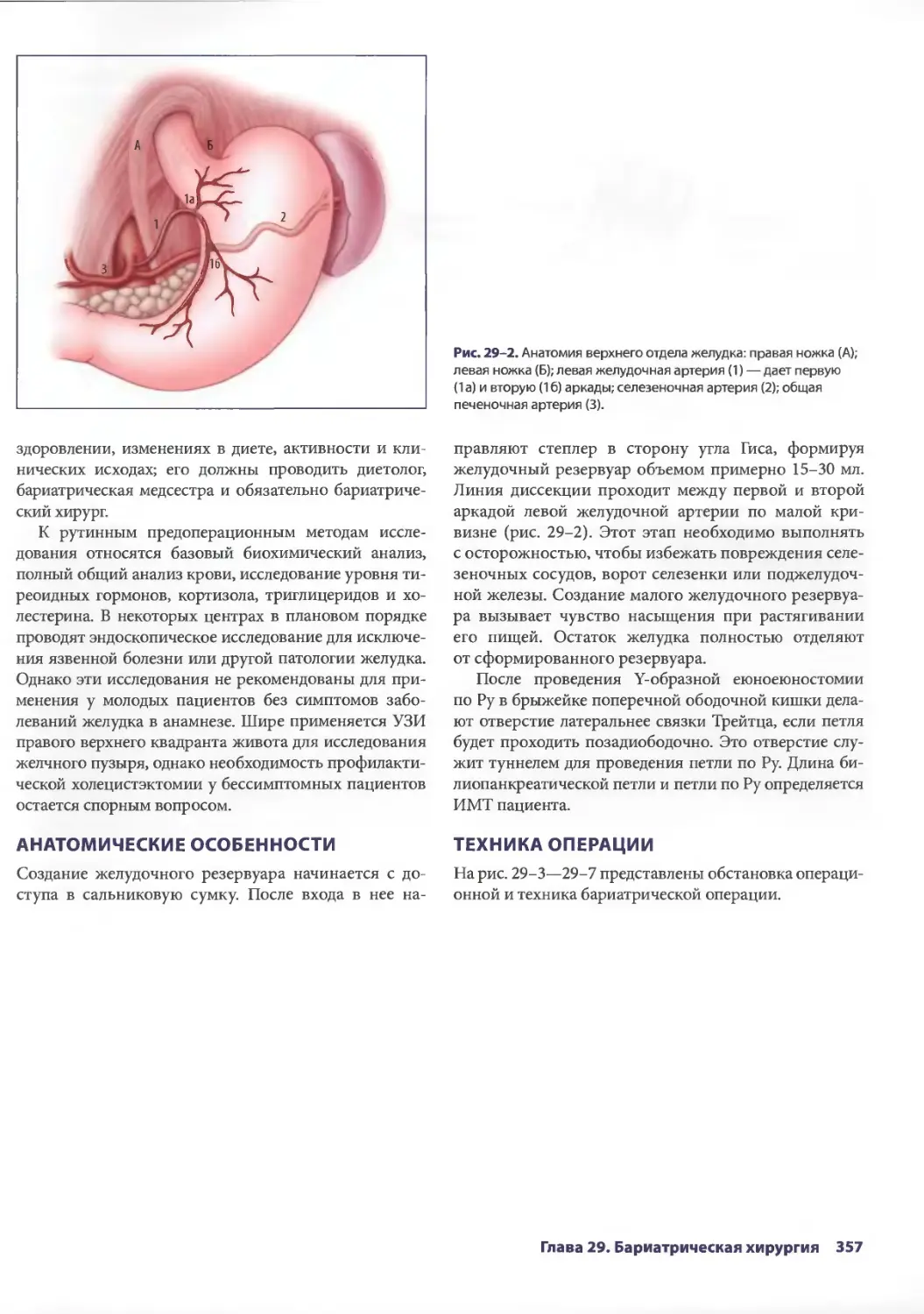
Глава 29. Бариатрическая хирургия 355
Себастиан Ж. де ла Фуенте, ЭрикДж. Де Мария
Глава 30. Эндолюминальная хирургия: инструменты и основы техники 367
ДьюиКан Фом, Аврора Д. Приор
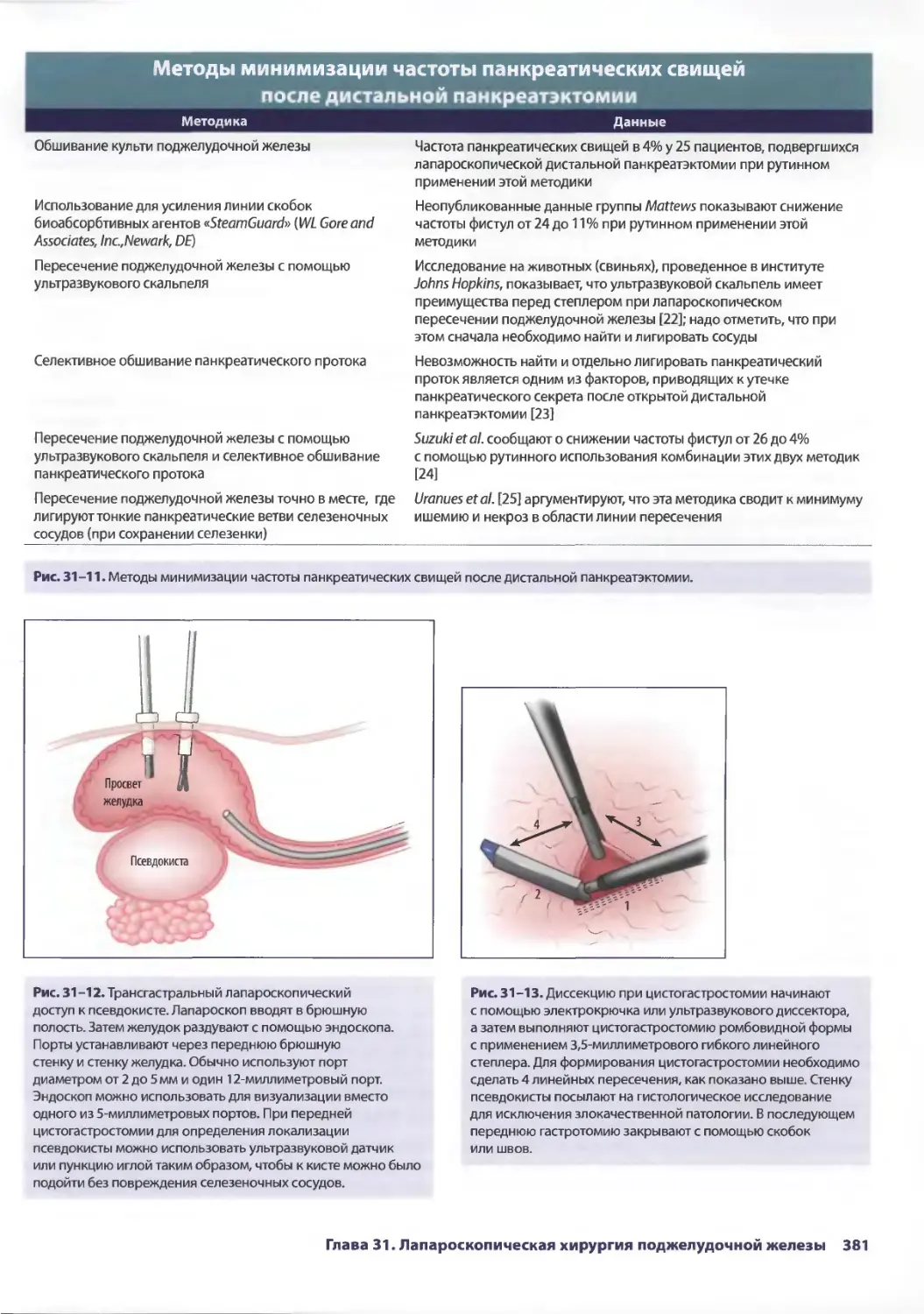
Глава 31. Лапароскопическая хирургия поджелудочной железы 375
Джин С. Йо, Аврора Д. Приор
б Лапароскопическая хирургия. Атлас
ПРЕДИСЛОВИЕ К ИЗДАНИЮ НА РУССКОМ ЯЗЫКЕ
■
В настоящее время хирургические лапароскопические
методы, будучи менее травматичными, удобными для
выполнения и сопровождающимися меньшим
процентов осложнений, а в ряде случаев более эффективными
для конкретного больного, выходят на передний план
среди всех лечебно-диагностических вмешательств.
Вниманию российских врачей всех хирургических
профилей — абдоминальных, торакальных и пластических
хирургов, травматологов, гинекологов, урологов —
представляется возможность ознакомиться с третьим
изданием атласа лапароскопической хирургии,
освещающим теоретические и практические аспекты
выполнения лапароскопических вмешательств. Учитывая
разработку и внедрение в практическую деятельность
все новых методик, инструментов, изменения взглядов
на ряд подходов к хирургическому лечению тех или
иных заболеваний и в то же время сохраняя
преемственность в отношении большого объема материала,
изложенного в предыдущих изданиях атласа, третье
издание переработано и дополнено новыми
медицинскими данными и рекомендациями.
В атласе приводится описание хирургического
инструментария, в первую очередь лапароскопического,
технических основ выполнения хирургических
манипуляций, а также подробные иллюстрации, в том числе
наглядные и четкие интраоперационные снимки,
варианты доступов и последующих манипуляций на
различных органах и в анатомических областях. Помимо
описания лечения «классических» хирургических
заболеваний, таких как острый аппендицит, холецистит,
заболеваний органов малого таза, в том числе
объемных образований, выполнения резекций тонкой и
толстой кишки, легкого, печени, поджелудочной железы,
спленэктомии, читатели могут ознакомиться с
аспектами выполнения пластических операций на
пищеводе, кишечнике, внутренних половых органах и др.
Особое внимание уделено формированию стом
различных локализаций, возможным осложнениям
лапароскопического вмешательства, малоинвазив-
ным методам, а также вопросам эндолюминальнои и
бариатрической хирургии, а также операциям у
беременных и детей. Настоящее издание будет
полезно для врачей всех специальностей: как начинающих
докторов, так и состоявшихся специалистов, а также
научных сотрудников и студентов-медиков, позволит
обладать современной информацией о последних
достижениях лапароскопической хирургии и открыть
новый взгляд на те или иные аспекты в этой
перспективной области.
Д-р мед. наук, проф. кафедры
факультетской хирургии № 1
Первого МГМУ им. И.М. Сеченова
С.С. Харнас
Предисловие к изланию на dvcckom языке
7
ПРЕДИСЛОВИЕ
Первое издание атласа лапароскопической хирургии
вышло в свет, когда минимально инвазивная
хирургия еще была новой концепцией для общих хирургов.
Издание было задумано как познавательное
руководство для хирургов, которые стараются научиться
чему-то новому. Однако минимально инвазивная
хирургия — это быстроразвивающаяся отрасль
медицины, и скоро новые методики и инструменты стали
доступными для большинства хирургов. Со временем
атлас также был усовершенствован. Для того чтобы
отразить прогресс в этой области, произошедший со
времени последней публикации, третье издание атласа
лапароскопической хирургии подверглось основательной
переработке. Во всех главах описаны
усовершенствованные оперативные методики с множеством новых
технологий, которые детализированы в первой главе
данного издания («Лапароскопический
инструментарий и базовые методики»). В атлас также включено
достаточное количество интраоперационных снимков,
дополняющих отличные, как уже исторически
сложилось, иллюстрации.
В издание были добавлены главы по бариатриче-
ской хирургии, минимально инвазивной резекции
пищевода, донорской нефрэктомии, резекции печени
и хирургии поджелудочной железы. Последними
нововведениями в оперативной технике и в области
минимально инвазивной хирургии являются эндолюми-
нальные хирургические техники (endoluminal surgical
techniques) и операции, проводимые через
естественные отверстия (natural orifice surgery), которым авторы
также посвятили одну из глав издания. В книге
охвачены не только минимально инвазивные операции в га-
строинтестинальной хирургии, но также в
гинекологии, урологии, торакальной хирургии, для того чтобы
расширить багаж знаний хорошо обученного общего
хирурга.
Эта книга написана для всех врачей,
интересующихся минимально инвазивной хирургией, независимо
от уровня мастерства. Она также будет служить
источником новых знаний как для сестринского персонала,
студентов-медиков, так и для практикующих хирургов.
Публикуем третье издание атласа с большой надеждой,
что нам удалось рассказать о лучших техниках
минимально инвазивной хирургии 2007 г. Надеемся, что
читатели получат удовольствие от прочтения этого атласа
и смогут с его помощью улучшить свою хирургическую
технику.
Теодор Н. Паппас,
Аврора Д. Приор,
Михаэль С. Харниш
8 Лапароскопическая хирургия. Атлас
»""""""" " lllllllllllllllllll ..11Г11Г11.1П1Г1Т11. 1.1 HI ИНИН 'ИГ
АВТОРСКИЙ КОЛЛЕКТИВ
■
Шахаб А. Акхтер
(Shahab A. Akhter, MD)
Assistant Professor of Surgery Division
of Cardiothoracic Surgery University of
Chicago
Chicago, Illinois
Дэвид М. Апбала
(David M. Albala, MD)
Professor of Urology
Department of Surgery, Division of
Urology Duke University Medical School
Durham, North Carolina
Дженнифер Х. Олдринк
(Jennifer H. Aldrink, MD)
Chief Resident
Department of General Surgery Duke
University Medical Center Durham,
North Carolina
Мэри Т. Остин
(Mary Т. Austin, MD, MPH)
Fellow, Pediatric Surgical Critical
Care Department of Pediatric Surgery
Children's Hospital of Los Angeles
Los Angeles, California
Кеки Р. Балсара
Keki R. Balsara, MD)
Resident
Department of Surgery Duke University
Medical Center
Durham, North Carolina
Кфер Бэн-Дэвид
(Kfir Ben-David, MD)
Assistant Professor
Department of Surgery
University of Florida College of Medicine
Gainesville, Florida
Фредрик Броди
(Fredrick Brody, MD, MBA)
Associate Professor Department of
Surgery George Washington University
Medical Center
Washington, DC
В. Купер Бушемейр III
(W. Cooper Buschemeyer III, MD)
Resident
Department of Surgery, Division of
Urology
Duke University
Durham, North Carolina
Эдвард Канту III
(Edward Cantu III, MD)
Cardiothoracic Fellow Department of
General and Thoracic Surgery Duke
University Medical Center
Durham, North Carolina
Евгения П. Сеппа
(Eugene R Ceppa, MD)
Resident
Department of Surgery Duke University
Medical Center
Durham, North Carolina
Паул Дж. Чай
(Paul J. Chai, MD)
Pediatric Cardiovascular Surgeon
St. Joseph's Children's Hospital
Tampa, Florida
Эдвард Ж. Чекан
(Edward G. Chekan, MD)
Associate Medical Director
Ethicon Endosurgery
Cincinnati, Ohio
С. Дениз Чинг
(С. Denise Ching, MD)
Fellow
Surgical Oncology
MD Anderson Cancer Center
Houston, Texas
Лиза Кларк-Пикетт
(Lisa Clark-Pickett, MD,
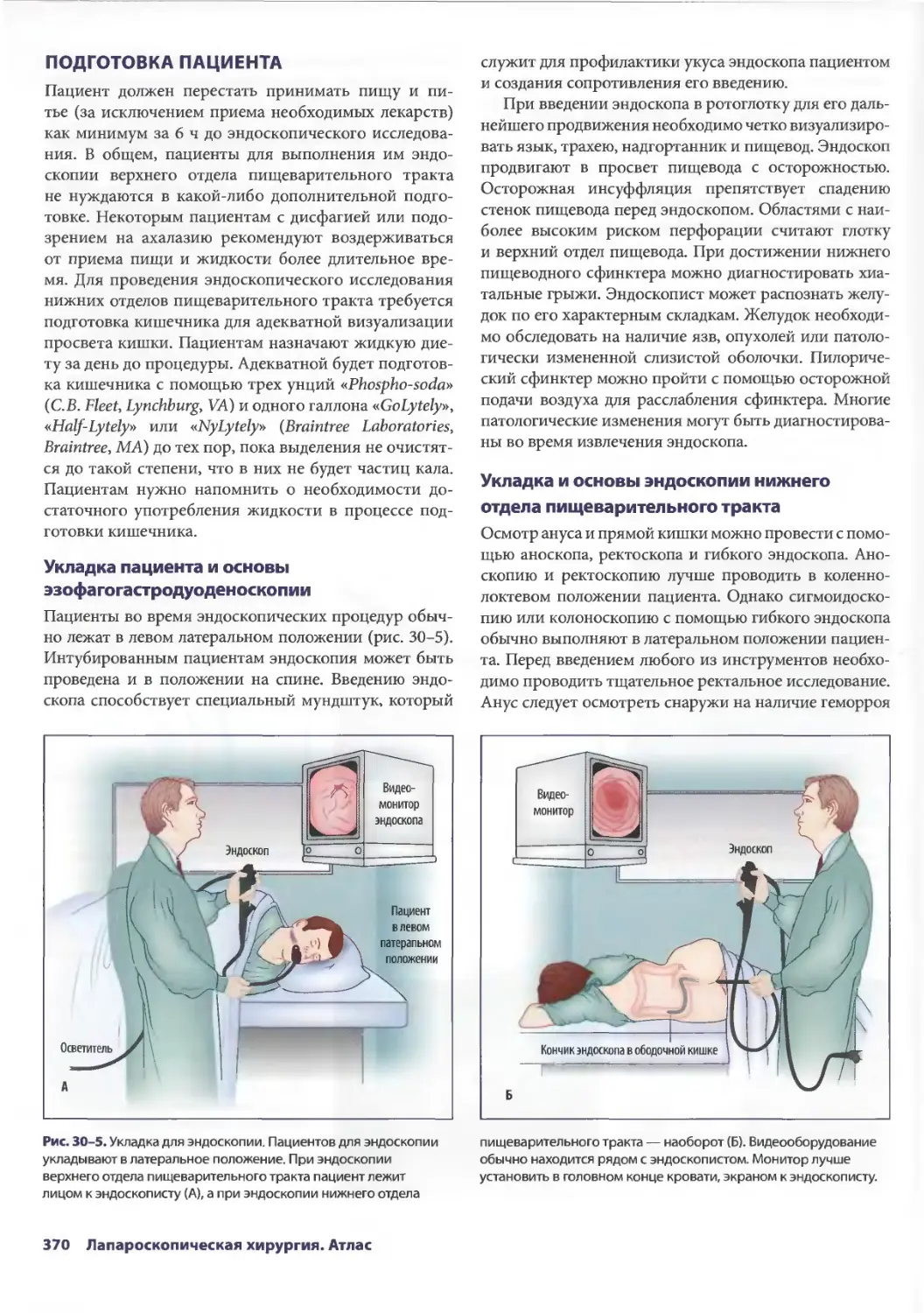
FACS)
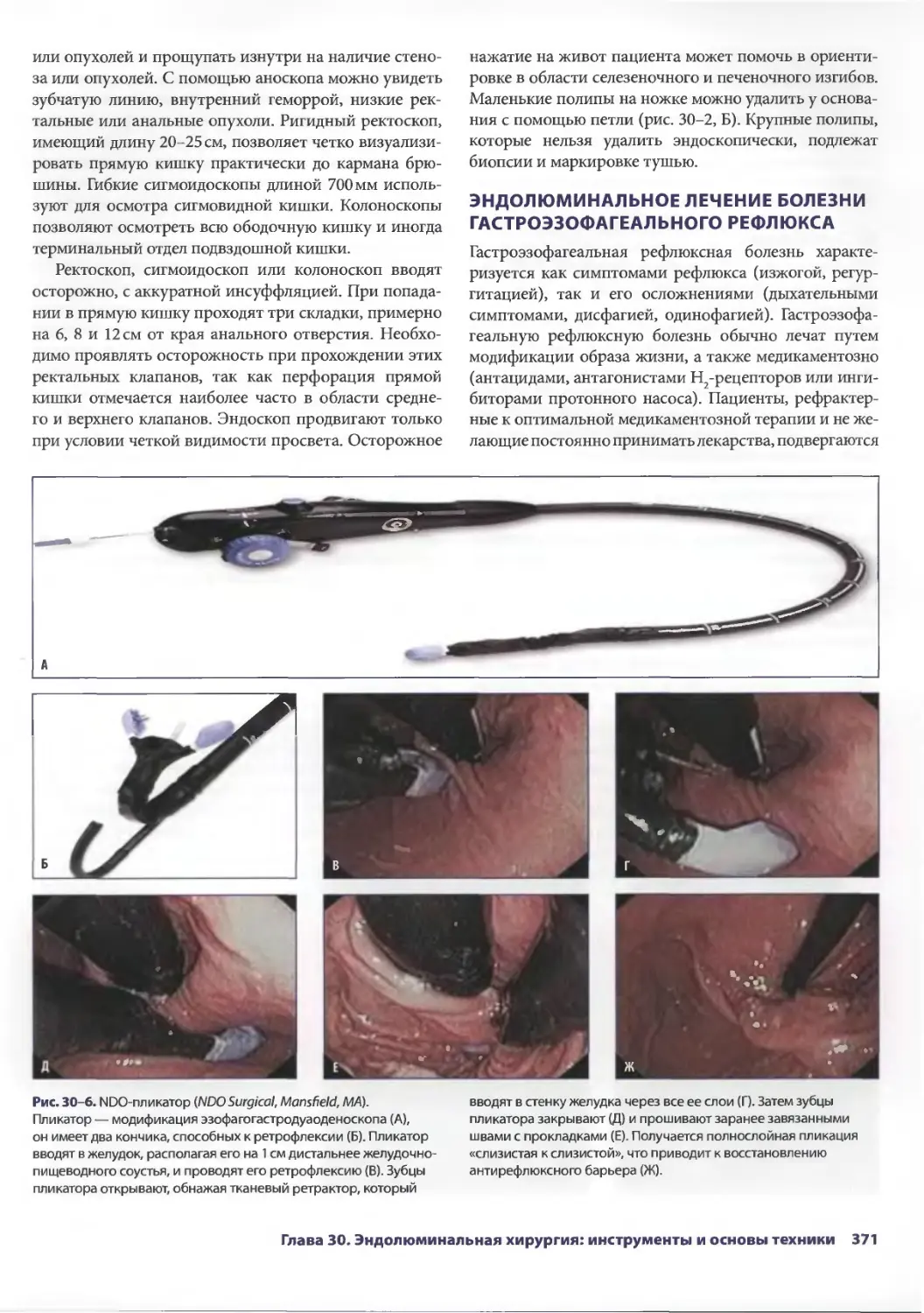
Assistant Professor of Surgery Assistant
Professor of Medicine Department
of Surgery Duke Health Center Duke
University
Durham, North Carolina
Брайн М. Клэри
(Bryan M. Clary, MD, FACS)
Assistant Professor of Surgery Chief of
Hepatobiliary Surgery Duke University
Medical Center
Durham, North Carolina
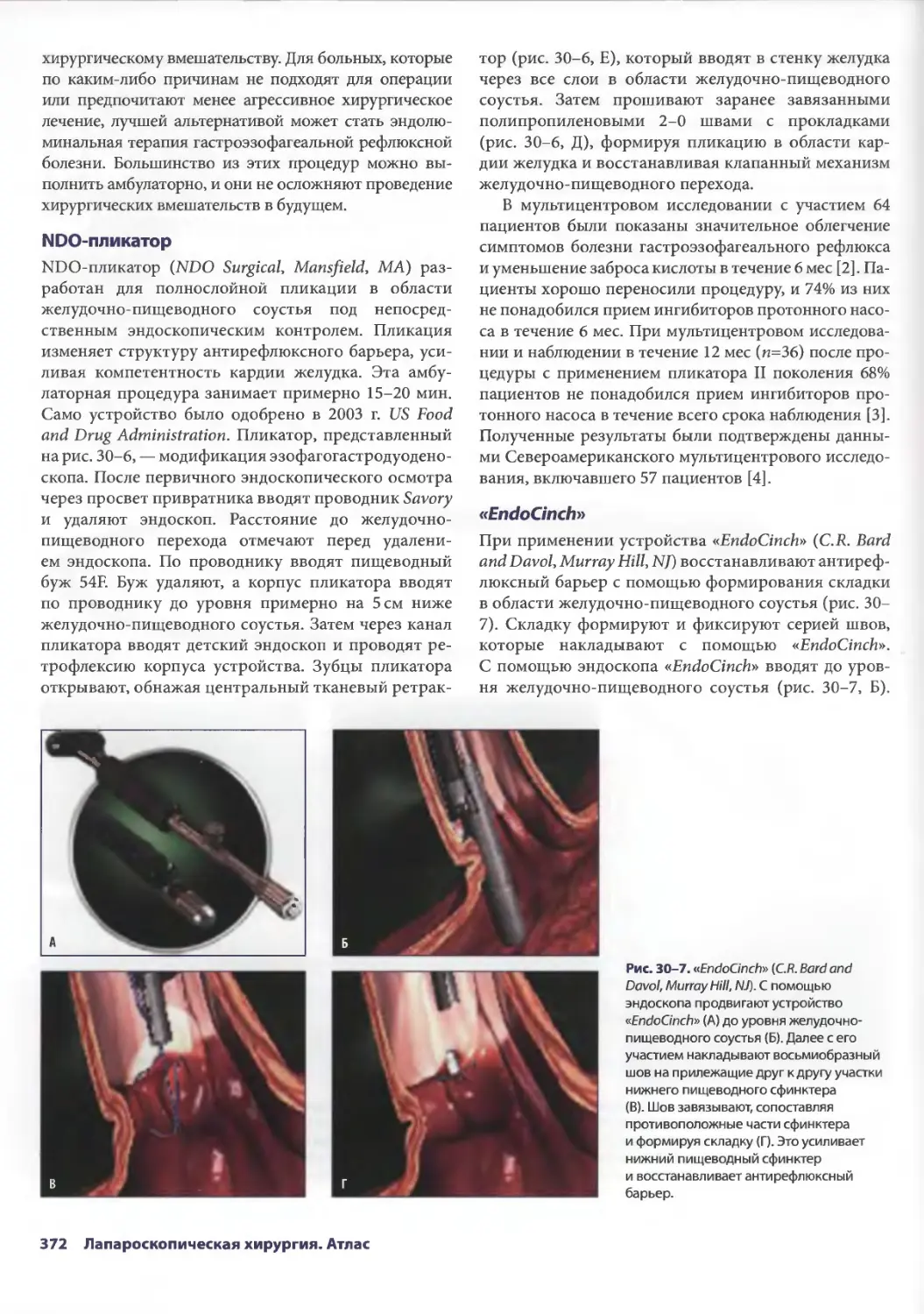
Томас А. Д'Амико
(Thomas A. DAmico, MD)
Professor of Surgery Department of
Thoracic Surgery Duke University
Medical Center
Durham, North Carolina
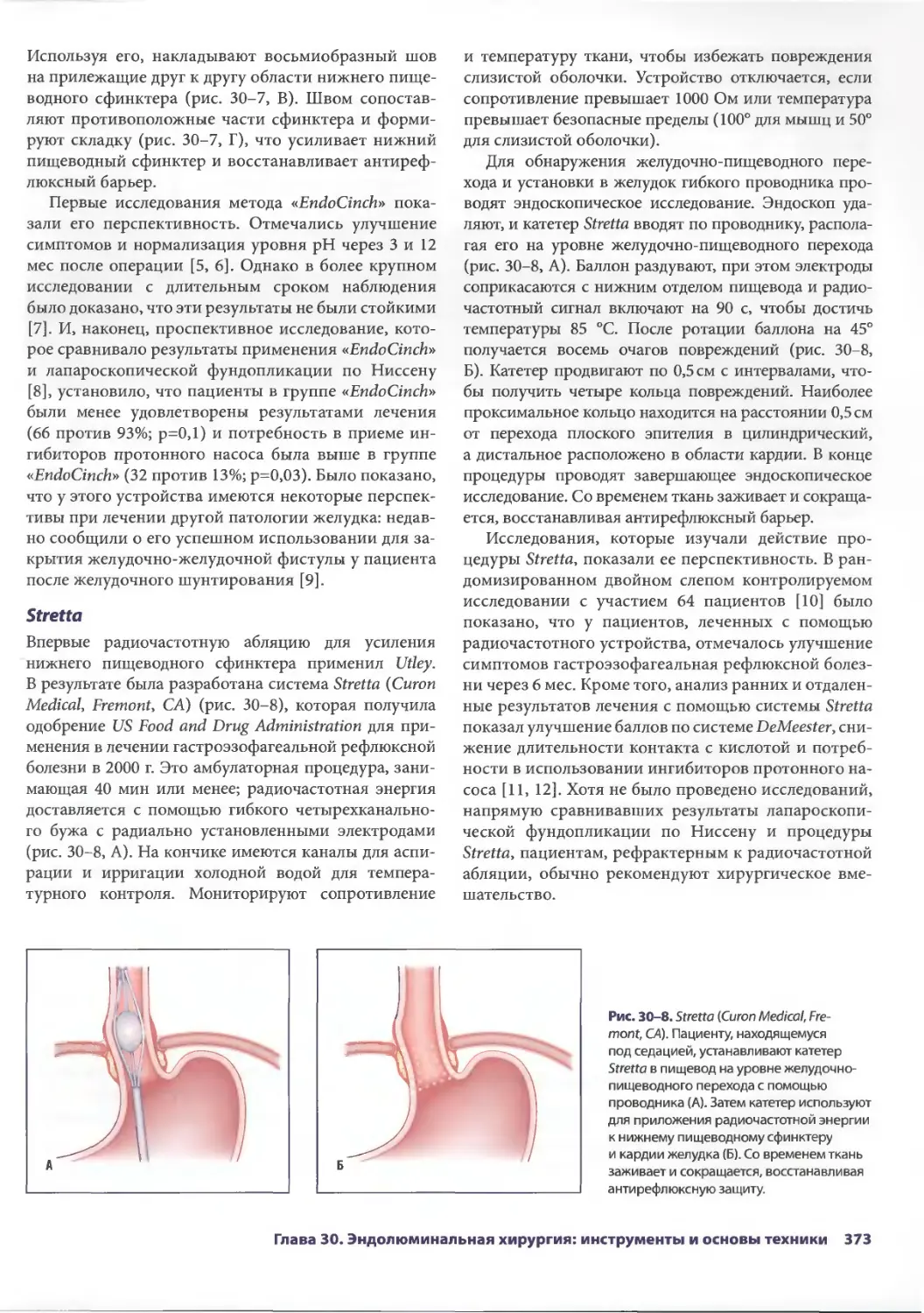
1
Мани А. Данешманд
(Mani A. Daneshmand, MD)
Research Fellow Department of Surgery
Duke University
Durham, North Carolina
P. Дуэйн Дэвис-мл.
(R. Duane Davis, Jr., MD)
Department of Surgery Division of
Cardiovascular and Thoracic Surgery
Duke University Medical Center
Durham, North Carolina
Себастьян Ж. де ла Фуенте
(Sebastian G. de la Fuente, MD)
Resident, General Surgery Department
of Surgery Duke University Medical
Center
Durham, North Carolina
Эрик Дж. Де Мария
(Eric J. De Maria, MD)
Professor of Surgery Department of
Surgery Duke University Medical
School
Durham, North Carolina
Дев М. Десай
(Dev M. Desai, MD, PhD)
Assistant Professor of Transplant
Surgery Director, Pediatric Solid Organ
Transplantation
Duke University Medical Center
Durham, North Carolina
Диана Л. Дисен
(Diana L. Diesen, MD)
Resident, General Surgery Department
of General Surgery Duke University
Medical Center
Durham, North Carolina
С. Кристиан Энестведт
(С. Kristian Enestvedt, MD)
Resident, Department of General
Surgery Oregon Health and Science
University
Portland, Oregon
Лоретта Эрунмвунсе
(Loretta Erhunmwunsee, MD)
Resident
Department of General Surgery
Duke University Medical Center
Durham, North Carolina
Авторский коллектив 9
Стив Эбэнкс (Steve Eubanks, MD)
Hugh E. Stephenson, Jr.
Chair of Surgery
W. Alton Jones Distinguished Professor
in Surgery
University of Missouri
Columbia, Missouri
Джон П. Грант (John P. Grant, MD)
Director
Weight Loss Surgery Clinic Duke
University Medical Center
Durham, North Carolina
Джон С. Хани
(John С. Haney, MD, MPH)
Resident, General Surgery Department of
Surgery Duke University Medical Center
Durham, North Carolina
Стивен И. Ханиш
(Steven I. Hanish, MD)
Clinical Instructor Fellow, Transplant
Surgery Department of Surgery,
Division of Transplant Surgery
University of Wisconsin
Madison, Wisconsin
Михаэль С. Харниш
(Michael С. Harnisch, MD)
Chief, Advanced Laparoscopic Surgery
Department of Surgery Brooke Army
Medical Center
San Antonio, Texas
Дэвид X. Харполе-мл.
(David H. Harpole, Jr., MD)
Associate Professor
Department of Thoracic Surgery
Chief
General Thoracic Surgery
Duke University Medical Center
Durham, North Carolina
Джонатан А. Хата
(Jonathan A. Hata, MD)
Chief Resident Department of Surgery
Duke University Medical Center
Durham, North Carolina
Эрик С. Хуанг
(Erich S. Huang, MD, PhD)
Chief Resident
Department of General Surgery Duke
University Medical Center
Durham, North Carolina
Ж. Чад Хьюес
(G. Chad Hughes, MD)
Research Fellow Department of Surgery
Duke University Medical Center
Durham, North Carolina
Блэйр А. Жобе
(Blair A. Jobe, MD)
Associate Professor Department of
General Surgery Oregon Health and
Science University
Portland, Oregon
Пол К. Куо
(Paul С Kuo, MD, MBA)
Professor
Department of Surgery Duke University
Medical School
Durham, North Carolina
Гектор Дж. Лакасси
(Hector J. Lacassie, MD)
Associate Professor of Anesthesiology
Department of Anesthesiology
Universidad Catolica
Santiago, Chile
Сэндия А. Лангу-Динэдэялэн
(Sandhya A. Lagoo-Deenadayalan,
MD, PhD)
Assistant Professor Department of
Surgery Duke University Medical Center
Durham, North Carolina
Джеффри X. Лаусон
(Jeffrey H. Lawson, MD, PhD)
Assistant Professor Department of
Surgery Duke University Medical Center
Durham, North Carolina
Брайн Лима (Brian Lima, MD)
Senior Assistant Resident Department of
Surgery Duke University Medical Center
Durham, North Carolina
Керк А. Людвиг
(KirkA.Ludwig,MD)
Assistant Professor Department of
Surgery Duke University Medical Center
Durham, North Carolina
Роберто Дж. Мэнсон
(Roberto J. Manson, MD)
Research Fellow Department of Surgery
Duke University Medical Center
Durham, North Carolina
Карлос И. Марроквин
(Carlos E. Marroquin, MD)
Department of Surgery Duke University
Durham, North Carolina
Геворг А. Мутафьян
(Gevorg A. Mutafyan, MD)
Research Fellow, Minimally Invasive
Surgery Department of Surgery Duke
University
Durham, North Carolina
Ванесса А. Олцес
(Vanessa A. Olcese, MD, PhD)
Senior Resident Department of Surgery
Duke University Medical Center
Durham, North Carolina
Джон А. Олсон-мл.
(John A. Olson, Jr., MD, PhD)
Associate Professor of Surgery Chief of
Endocrine Surgery Surgical Oncology
Duke University Medical Center
Durham, North Carolina
Марк В. Онаитис
(Mark W. Onaitis, MD)
Assistant Professor of Surgery
Department of General Surgery Duke
University Medical Center
Durham, North Carolina
Теодор Н. Паппас
(Theodore N. Pappas, MD)
Professor and Vice Chairman,
Administration Department of Surgery
Duke University School of Medicine
Durham, North Carolina
Майур Б. Пател
(Mayur В. Patel, MD)
Senior Assistant Resident Department
of General Surgery Duke University
Medical Center
Durham, North Carolina
ДьюиКан Фам
(DuyKhanh Pham, MD)
Chief Resident Department of Surgery
Duke University Medical Center
Durham, North Carolina
Дана Д. Портенер
(Dana D. Portenier, MD)
Department of Surgery
Duke University Medical Center
Durham, North Carolina
Аврора Д. Приор
(Aurora D. Pryor, MD, FACS)
Assistant Professor
Department of Surgery
Duke University Medical Center
Director
Duke Minimally Invasive Surgery
Durham Regional Hospital
Durham, North Carolina
Гретхен П. Пурселл
(Gretchen P. Purcell, MD, PhD)
Assistant Professor of Surgery and
Biomedical Informatics Department of Pediatric
Surgery Vanderbilt Children's Hospital and
Vanderbilt University Medical Center
Nashville, Tennessee
10 Лапароскопическая хирургия. Атлас
Сриневас К. Редди
(Srinevas К. Reddy, MD)
Resident
Department of Surgery Duke University
Medical School
Durham, North Carolina
Джошуа Е. Роллер
(Joshua E. Roller, MD)
Instructor
Department of Surgery Duke University
Medical Center
Durham, North Carolina
Якоб Н. Шродер
(Jacob N. Schroder, MD)
Senior Surgical Resident Department of
Surgery Duke University
Durham, North Carolina
Ашиш С. Шах
(Ashish S. Shah, MD)
Resident
Department of General and Thoracic
Surgery Duke University Medical
Center
Durham, North Carolina
Марк Л. Шапиро
(Mark L. Shapiro, MD, FACS)
Associate Professor of Surgery Associate
Director, Trauma Services Trauma,
Critical Care and General Surgery Duke
University Medical Center
Durham, North Carolina
Дэвид Синдрэм
(David Sindram, MD, PhD)
Chief Resident Department of Surgery
Duke University Medical Center
Durham, North Carolina
Крэг Дж. Соболевски
(Craig J. Sobolewski, MD)
Assistant Professor Department of
Obstetrics and Gynecology Duke
University
Durham, North Carolina
Ж. Роберт Стефенсон-мл.
(G. Robert Stephenson, Jr., MD)
Resident
Department of Surgery Duke University
Medical Center
Durham, North Carolina
Элизабет Т. Трайси
(Elisabeth Т. Tracy, MD)
Resident
Department of General Surgery Duke
University Medical Center
Durham, North Carolina
Стивен Н. Вэслеф
(Steven N. Vaslef, MD, PhD)
Assistant Professor Department of
Surgery Duke University Medical Center
Durham, North Carolina
Джин С. Йо (Jin S. Yoo, MD)
Resident, General Surgery Department of
Surgery Duke University Medical Center
Durham, North Carolina
Авторский коллектив 11
СПИСОК СОКРАЩЕНИЙ
]
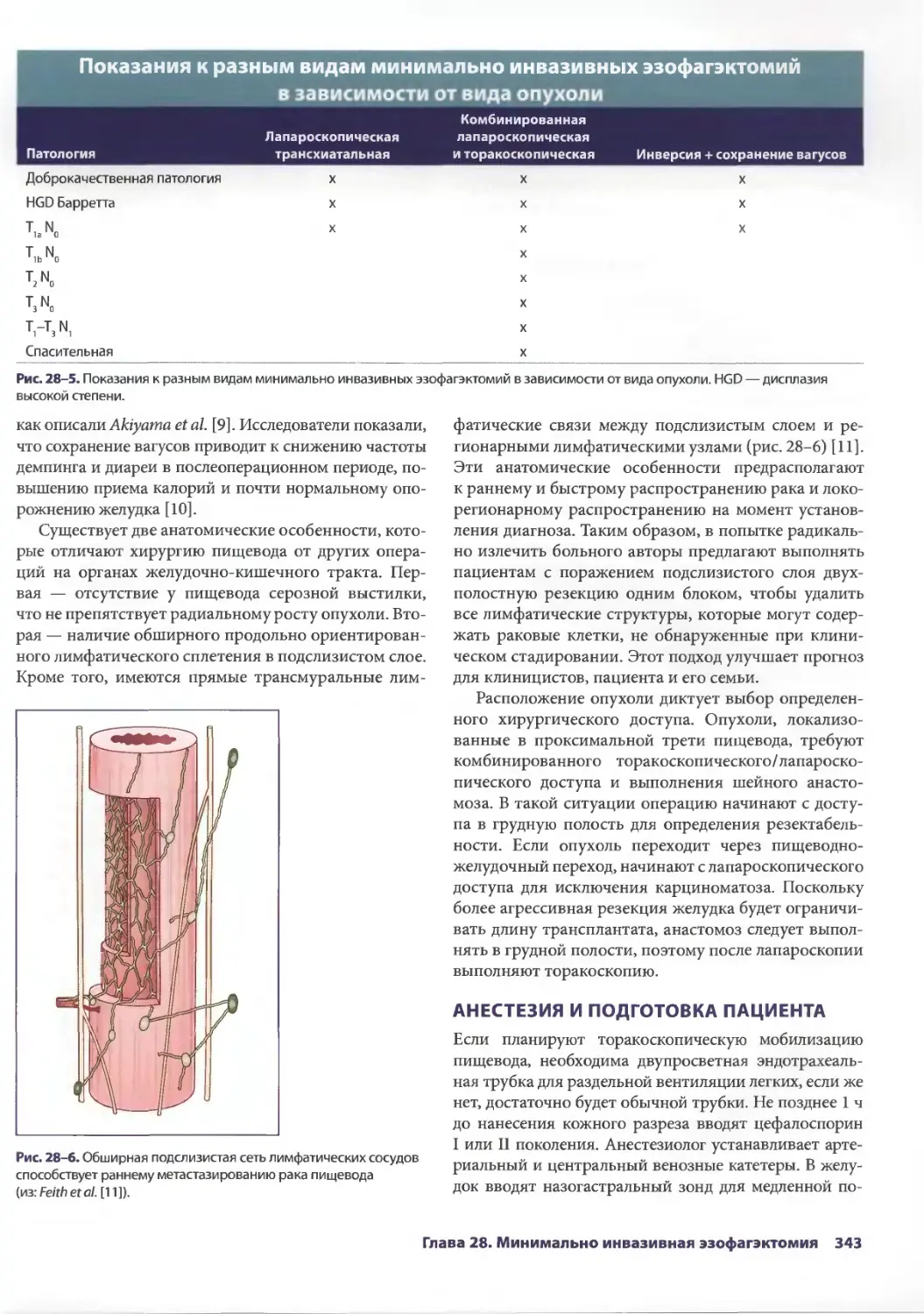
В-Т — воронко-тазовая (связка) ФЭГДС
ИМТ — индекс массы тела ХДД
ИПН — ингибитор протонного насоса ХДЕ
КТ — компьютерная томография ХОБЛ
ЛРА — лапароскопия с ручной ассистенцией ХРОЛ
ЛРП — лапароскопическая резекция печени ХЕС
МРТ — магнитно-резонансная томография ЧЧХ
НПВ — нижняя полая вена
НПВП — нестероидные противовоспалительные ЭКГ
препараты ЭРХПГ
НПС — нижний пищеводный сфинктер
ОФВ1 — объем форсированного выдоха за 1 с ЯБЖ
ПЭГ — параэзофагеальная грыжа ТАРР
ПЭТ — позитронно-эмиссионная томография
РХПГ — ретроградная холангиопанкреатография ТЕР
ТЭЛА — тромбоэмболия легочной артерии
УЗИ — ультразвуковое исследование
фиброэзофагогастродуоденоскопия
холедоходуоденостомия
холедохоеюностомия
хроническая обструктивная болезнь легких
хирургическая редукция объема легких
холецистоеюностомия
чрескожная чреспеченочная холангиогра-
фия
электрокардиограмма
эндоскопическая ретроградная
холангиопанкреатография
язвенная болезнь желудка
трансабдоминальная предбрюшинная гер-
ниопластика
полностью экстраперитонеальная гернио-
пластика
12 Лапароскопическая хирургия. Атлас
Лапароскопический
инструментарий
и базовые методики
Мани А. Данешманд, Геворг А. Мутафьян
Гш;
сП
Первоначальный успех лапароскопической холецист-
эктомии побудил хирургов и инженеров к
изобретению новых инструментов и разработке новых
хирургических операций все возрастающей сложности.
Лапароскоп, который первоначально применяли только
для удаления желчного пузыря, теперь используется
при операциях на почти всех органах живота, грудной
клетки и средостения. Разработка и внедрение
нового инструментария растут экспоненциально. Хирурги
должны хорошо освоить новую технику, а также знать
ее потенциальные недостатки, для того чтобы
безопасно и эффективно проводить операции. В этой главе
представлены общие рекомендации по применению
лапароскопического и торакоскопического
инструментария, а также последние разработки в области ви-
деоскопической хирургии.
ОПЕРАЦИОННАЯ
Возможно, ни один фактор в видеоскопической
хирургии не имеет такой важности, как правильное
обучение персонала операционной подготовке к работе и
использованию видеооборудования, а также освоение
необходимых мер, принимаемых при возникновении
неполадок. Авторы предпочитают содержать в
штате обученного специалиста, в обязанности которого
входят подбор оборудования и его содержание в
исправном состоянии. Такой подход сводит к минимуму
проблемы, зачастую возникающие при использовании
нового или испорченного оборудования, а также
экономит много операционного времени.
Точные детали дизайна лапароскопической
операционной зависят от вида проводимых операций.
Тем не менее основные направления можно проследить
в большинстве операционных. Успех любой
лапароскопической операции зависит от пространственного
расположения хирурга, первого ассистента и
видеомониторов. Основной монитор должен быть установлен так,
чтобы хирург находился лицом к нему и
оперируемому органу. Монитор нельзя заслонять электрическими
проводами, шлангами, оборудованием анестезиолога
и тому подобным. Необходимо в то же время
постараться расположить пациента и оборудование таким
образом, чтобы обеспечить удобство и отсутствие
помех для хирурга при работе с видеомонитором.
Монитор для первого ассистента нужно установить исходя
из таких же принципов. Другие мониторы (для
операционной сестры и наблюдателей) следует располагать
на удалении от операционного стола. Если это
возможно, ассистент и хирург стоят лицом в одном
направлении таким образом, чтобы они могли работать
на одной линии ориентации.
В большинстве клиник для видеоскопических
процедур модифицируют уже имеющиеся операционные.
Однако дизайн помещения должен позволять
устанавливать видеоскопические хирургические системы
с прикрепленными к потолку видеокамерами и другим
специализированным оборудованием. Используют
также прикрепленные к потолку консоли для
монитора, видеомагнитофона, инсуффляторов (рис. 1-1). Эти
специализированные консоли снижают износ
оборудования, минимизируют вероятность его повреждения,
сокращают время между операциями, а также
уменьшают длительность операции в сравнении со
стационарно расположенным оборудованием.
СИСТЕМЫ ВИЗУАЛИЗАЦИИ
Развитие эндоскопии начиналось почти 200 лет
назад — со свечки и оловянной трубки. Однако движение
в направлении современных видеосистем стало
происходить только с созданием системы линз Хопкинса
(Hopkins Rod-Lens) в 1966 г. Первый совместный осмотр
брюшной полости всей операционной бригадой
благодаря телекамере с компьютерным чипом,
присоединенной к лапароскопу, проведен в 1986 г. Этот момент
Глава 1. Лапароскопический инструментарий и базовые методики 13
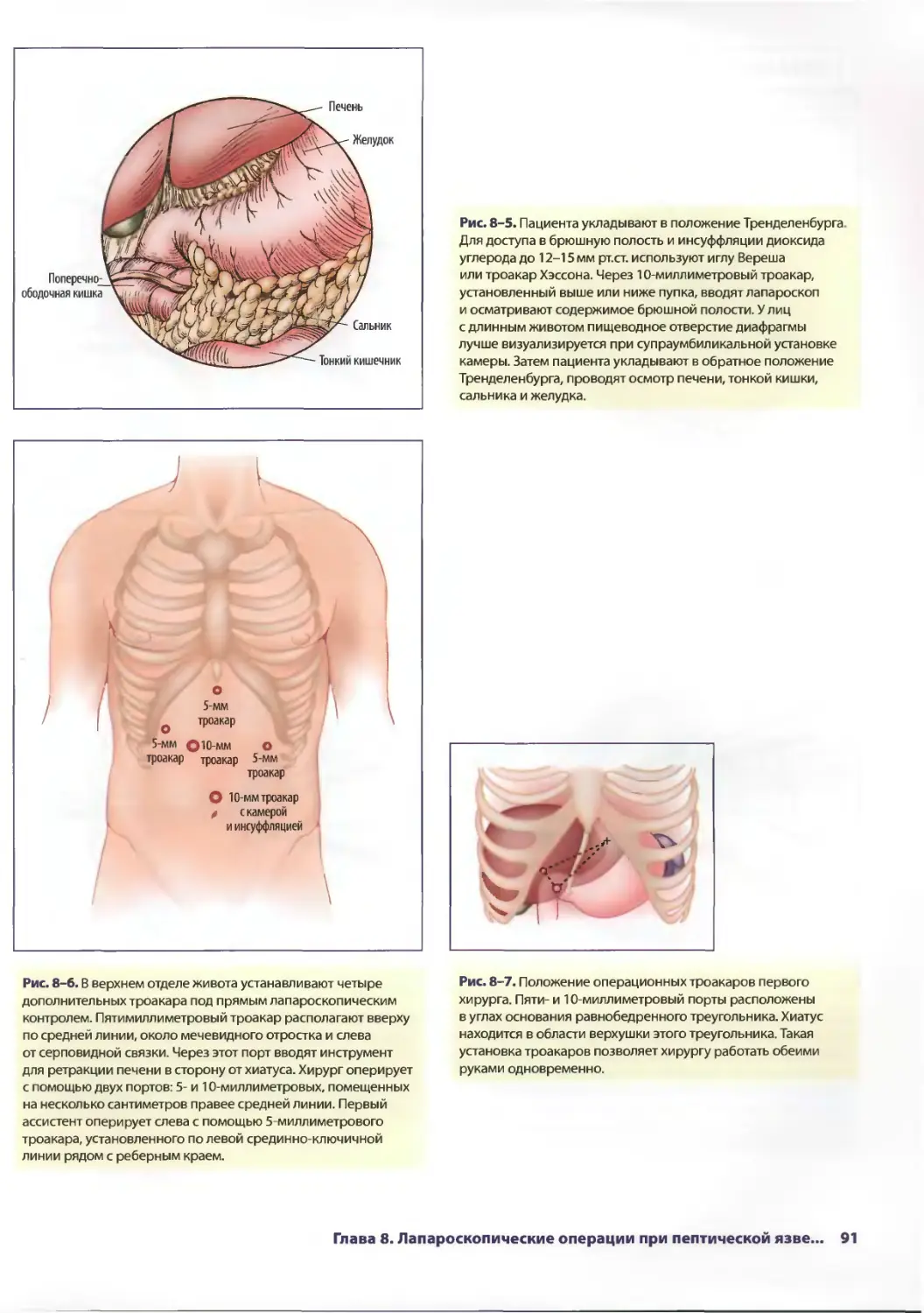
Рис. 1-1. Оборудование педиатрической лапароскопической
операционной в медицинском центре Университета Дюка (Duke
University Medical Center).
Рис. 1-2. фотография 5-миллиметрового микроэндоскопа (Styker
Corp., Kalamazoo, Ml).
стал отправной точкой развития современной
лапароскопии.
ЛАПАРОСКОПЫ
На сегодняшний день при лапароскопических
операциях применяются «потомки» оригинальной
системы линз Хопкинса (Hopkins Rod-Lens). Большинство
хирургов используют лапароскопы
непосредственного обзора с линзами 0, 30 и 45°. Лапароскопы
диаметром 10 мм остаются наиболее
востребованными, однако 5-миллиметровые лапароскопы и мини-
эндоскопы меньшего диаметра применяют все чаще
(рис. 1-2).
Для проведения большинства сложных
оперативных вмешательств авторы предпочитают
30-градусный лапароскоп, с помощью которого можно
манипулировать углом обзора и получать расширенное поле
зрения с использованием одного порта. Это свойство
позволяет проводить такие потенциально опасные
манипуляции, как выделение задней стенки пищевода
в ходе фундопликации по Ниссену, что безопаснее
выполнять под непосредственным визуальным
контролем. Лапароскопическое наложение швов также легче
проводить с использованием угловой системы линз,
которая позволяет уменьшить затруднения при
проведении иглы. Однако использование лапароскопа
с угловыми линзами требует большего навыка и
опыта, чем применение торцевой оптики.
ИСТОЧНИК СВЕТА
Для адекватного освещения брюшной или
плевральной полости необходим источник света высокой
интенсивности. Современные системы
располагают волоконно-оптическим способом передачи света
от источника света через лапароскоп к
операционному полю с минимальной потерей интенсивности.
Четкость видеоизображения зависит от качества
передачи света. Осторожное обращение с волоконно-
оптическим кабелем, своевременная его замена в
случае повреждения волокон необходимы для
безопасного проведения операций.
Несмотря на отделение источника света от
световода с помощью теплового экрана, энергия светового
пучка может приводить к нагреву кончика
лапароскопа. Необходимо принять меры по
предотвращению термического повреждения при контакте конца
волоконно-оптического кабеля или лапароскопа с
персоналом или объектами, находящимися в
операционном поле.
ВИДЕОКАМЕРА
Камера — электронно-оптическое устройство,
прикрепляемое к лапароскопу. Камера и лапароскоп
соединены с микропроцессором, который получает
и передает изображение. Одночиповые камеры
(разрешающая способность — 560 горизонтальных линий
на дюйм) обеспечивают необходимую визуализацию
при большинстве лапароскопических операций.
Однако для сложных лапароскопических операций
оптимальными считаются трехчиповые камеры, имеющие
значительно лучшую разрешающую способность (900
горизонтальных линий на дюйм).
ВИДЕОМОНИТОРЫ
Качество монитора должно соответствовать качеству
камеры, так как разрешающая способность зависит
от качества применяемого элемента. В настоящее время
плоскими дисплеями высокого разрешения заменены
традиционные мониторы на основе катодных трубок.
Большинство мониторов связано с кассетным
видеомагнитофоном или фотопринтером. Копирование
лапароскопических изображений нужно для
документации и позволяет сохранять ценные записи при
наличии выраженных патологических изменений.
Однако в вопросе о необходимости видеозаписи операций
и создании архива существуют разночтения. Многие
хирурги отказываются от записи лапароскопических
процедур в связи с судебными проблемами, которые
могут возникнуть при огласке интраоперационных
осложнений. Четкие юридические документы,
оговаривающие необходимость записи операции или
включение видеофильма в медицинскую документацию,
отсутствуют.
14 Лапароскопическая хирургия. Атлас
ТРЕХМЕРНОЕ ТЕЛЕВИДЕНИЕ
И ТЕЛЕВИДЕНИЕ С ВЫСОКОЙ ЧЕТКОСТЬЮ
ИЗОБРАЖЕНИЯ
Трехмерные (3D) лапароскопические системы были
предложены в целях обеспечения «чувства
глубины» традиционному двухмерному изображению.
Хотя благодаря последним достижениям качество
изображений значительно улучшилось, а
эксплуатация упростилась, ЗБ-телевидение имеет недостатки,
такие как необходимость работы в защитных очках,
сниженные цветность и разрешающая способность.
К тому же отсутствие доказательств в пользу четких
преимуществ использования этих систем привело
к слабому восприятию этого оборудования на рынке
и ослаблению интереса к нему [4].
Телевидение высокой четкости (HDTV)
обеспечивает изображение с прекрасным разрешением и
«чувством глубины». Однако, как и в случае с ЗО-системами,
нет достаточных преимуществ HDTV-систем над трех-
чиповыми камерами. Этот факт наряду с высокими
ценами конверсии традиционных систем в HDTV привел
к ограниченному применению HDTV-систем в
лапароскопической хирургии [4].
ОБОРУДОВАНИЕ
Инсуффляция
Визуализация брюшной полости требует растяжения
или ретракции передней брюшной стенки, чтобы
создать операционное поле для инструментов и
манипуляций. Хотя для получения операционного поля
традиционно использовали инсуффляцию газа,
необходимая полость для работы может быть получена с
использованием механической ретракции стенки живота
(лапароскопия без газа). Безгазовая лапароскопия
оказывает меньшее отрицательное влияние на
сердечнососудистую и дыхательную системы, характеризуется
меньшими периферическим венозным стазом и нейро-
эндокринным ответом [5, 6]. В настоящее время
стандартом остается инсуффляция газа. Наиболее часто
применяют автоматический инсуффлятор, созданный
доктором Куртом Земмом почти 40 лет назад и
обеспечивающий постоянный приток газа и регуляцию вну-
трибрюшного давления.
Для инсуффляции использовали разные газы,
включая воздух, кислород, азот, оксид азота, гелий,
аргон и диоксид углерода. Наиболее популярным газом
для инсуффляции вследствие непособности к
возгоранию, высокой растворимости, доступности и низкой
цены является диоксид углерода. Недостаток диоксида
углерода — потенциальная возможность развития
метаболического ацидоза при его абсорбции из брюшной
полости. У пациентов с нарушениями функций
легких может отмечаться неприемлемый уровень
диоксида углерода во время лапароскопических операций.
Для пациентов с сердечно-легочными заболеваниями
рекомендуют интра- и послеоперационный
мониторинг газового состава артериальной крови.
Последние исследования показали, что пневмопери-
тонеум с диоксидом углерода приводит к интраопераци-
онной иммуносупрессии, вероятно, в результате того,
что он ингибирует продукцию фактора некроза опухо-
ли-а макрофагами [7]. Кроме того, еще недавно с ин-
суффляцией диоксида углерода связывали
предположения об отсеве раковых клеток в троакарных разрезах
при лапароскопии [8], а в исследованиях in vivo и in vitro
диоксид углерода усиливал рост раковых клеток [9].
Инсуффляторы обеспечивают доставку диоксида
углерода через регулятор с различной скоростью
потока и поддерживают постоянное внутрибрюшное
давление. Исторически считалось, что оптимальное
внутрибрюшное давление у взрослого человека во
время лапароскопии должно составлять от 12 до 15 мм
рт.ст. Повышенное внутрибрюшное давление может
вызвать нестабильную гемодинамику в ответ на
компрессию вен. В таком случае необходимо немедленно
удалить пневмоперитонеум и решить вопрос о
конверсии в открытую операцию. Таким образом,
рекомендуется поддерживать наименьшее внутрибрюшное
давление, позволяющее получить адекватную
визуализацию операционного поля, а не стандартные значения.
У пациентов с нарушениями функций легких, сердца
или почек альтернативным подходом является
комбинация подъемников брюшной стенки и низкого вну-
трибрюшинного давления, хотя применение устройств
для подъема передней брюшной стенки у среднего
пациента не имеет клинически значимых преимуществ
перед использованием пневмоперитонеума с низким
давлением (5-7 мм рт.ст.) [10].
Ранние модели инсуффляторов подавали газ со
скоростью до 3 л/мин, в то время как устройства
второго поколения работают со скоростью до 8-10л/мин.
Системы ускоренной подачи, созданные в последние
годы, способны подавать газ со скоростью 15-20 л/мин,
что позволяет поддерживать адекватный
пневмоперитонеум даже в условиях постоянной утечки газа
из троакаров. Инсуффлятор должен быть оборудован
ограничительным клапаном и сигнализатором
избыточного давления в брюшной полости1.
Все члены операционной бригады должны уметь
обращаться с инсуффлятором. Давление газа и скорость
его подачи необходимо отслеживать во время
первичной инсуффляции брюшной полости и периодически
контролировать по ходу операции. Высокую скорость
подачи и низкое первоначальное давление (менее 5 мм
рт.ст.) отмечают в случае правильного положения
канюли Хэссона. Повышенное давление при низкой скорости
1 Современные инсуффляторы обеспечивают подачу газа
до 40 л/мин, что необходимо в некоторых сложных ситуациях.
Глава 1. Лапароскопический инструментарий и базовые методики 15
подачи могут говорить о неверном положении троакара,
закрытом клапане, перегибе инсуффляционных трубок
или неадекватной анестезии, вызвавшей реакцию Валь-
сальвы. При повышенном первоначальном давлении
следует немедленно прекратить подачу газа для
предотвращения инфузии газа в экстраперитонеальное
пространство или просвет сосуда. Оптимальные значения
абдоминального давления в необычных ситуациях,
например при беременности, точно не выяснены.
Клинические выгоды подачи подогретого,
увлажненного газа минимальны и противоречивы. При
длительных лапароскопических операциях с использованием
пневмоперитонеума необходимо применять
прерывистую пневматическую компрессию нижних
конечностей для снижения риска тромбоза глубоких вен [10].
Иглы для инсуффляции
Большинство игл для инсуффляции созданы на основе
иглы Вереша, которая имеет подвижный тупоконечный
Рис. 1-3. Троакар Хэссона {USSurgical, Norwalk, CT).
Рис. 1-5. Троакар Хэссона прикреплен к животу с помощью
апоневротических швов. К канюле присоединена трубка
для инсуффляции.
обтуратор с пружинным механизмом, выдвигающийся
из острого кончика иглы при попадании ее в брюшную
полость. Преимущество пружинного механизма в том,
что сразу же после проникновения в брюшную полость
он позволяет обезопасить острый кончик иглы.
Большим преимуществом одноразовых игл служит всегда
острый кончик, благодаря которому оператор
прилагает стандартное усилие при введении иглы. Техника
установки иглы Вереша предполагает подъем передней
брюшной стенки с помощью бельевых цапок и
введение иглы в брюшную полость с приложением
дозированного усилия.
Техника Хэссона показана на рис. 1-3-1-5. Хотя
исследования показали, что применение и открытой,
и закрытой методики сопровождается одинаковым
количеством осложнений, виды этих осложнений
значительно различаются. Например, при проведении
техники Хэссона отмечают повреждения кишечника,
а повреждения крупных сосудов для нее нехарактерны.
Рис. 1-4. В области пупка сделали вертикальный разрез кожи
длиной 10 мм. После разведения тканей на апоневроз наложили
швы-держалки. Затем апоневроз приподняли за держалки
для введения троакара Хэссона в брюшную полость.
Рис. 1-6. Различные троакары, используемые
в лапароскопической хирургии. Слева направо: кожух троакара
для поэтапного доступа, безопасная игла кожуха поэтапного
доступа, 5-миллиметровый троакар для поэтапного доступа,
интродьюсер для 5-миллиметрового троакара для поэтапного
доступа, 10-миллиметровый троакар для поэтапного доступа,
интродьюсер для 10-миллиметрового троакара для поэтапного
доступа (US Surgical, Norwalk, CT).
1 б Лапароскопическая хирургия. Атлас
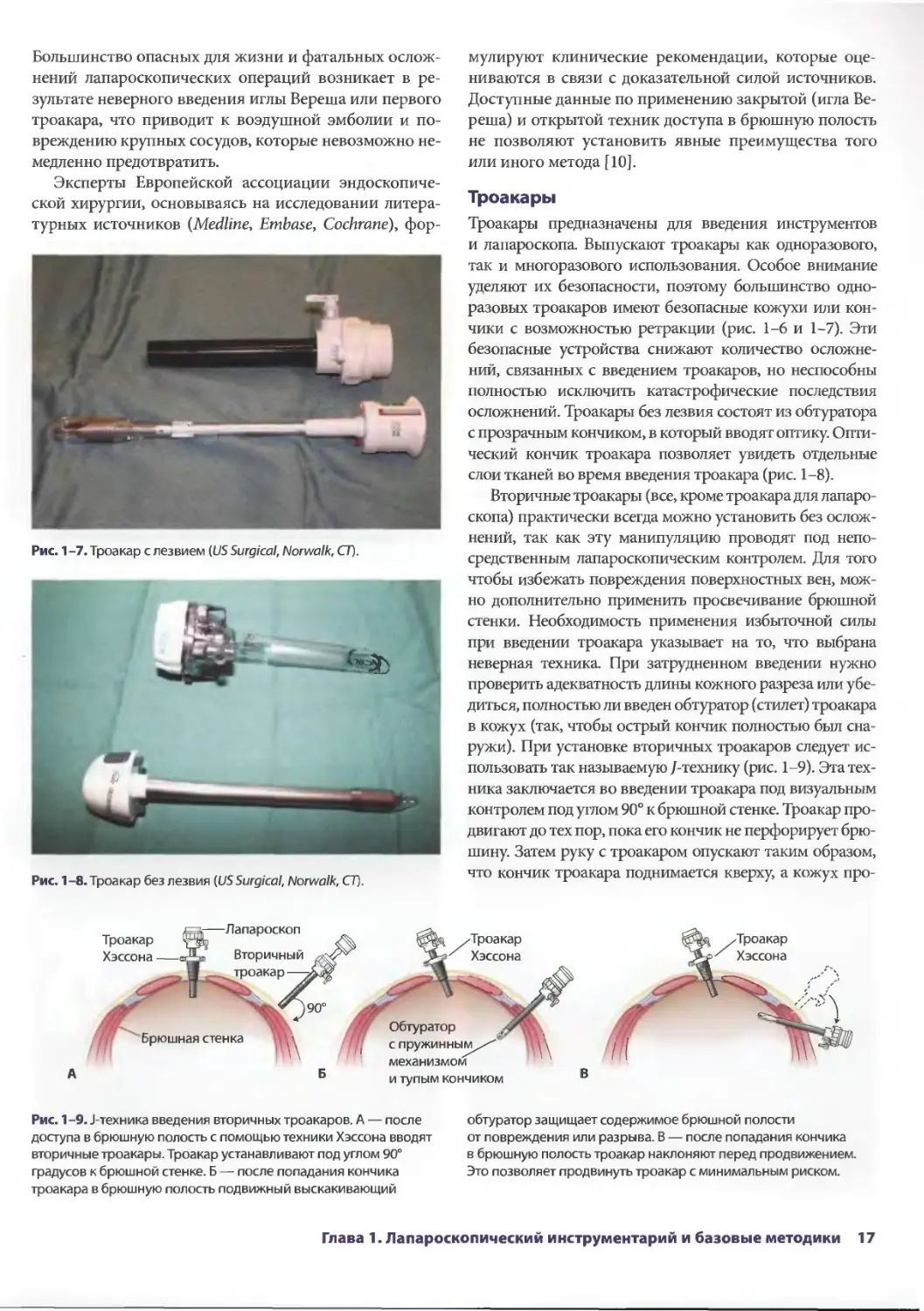
Большинство опасных для жизни и фатальных
осложнений лапароскопических операций возникает в
результате неверного введения иглы Вереша или первого
троакара, что приводит к воздушной эмболии и
повреждению крупных сосудов, которые невозможно
немедленно предотвратить.
Эксперты Европейской ассоциации
эндоскопической хирургии, основываясь на исследовании
литературных источников (Medline, Embase, Cochrane), фор-
Рис. 1 -7. Троакар с лезвием {US Surgical, Norwalk, CT).
Рис. 1-8. Троакар без лезвия (US Surgical, Norwalk, CT).
Рис. 1-9. J-техника введения вторичных троакаров. А — после
доступа в брюшную полость с помощью техники Хэссона вводят
вторичные троакары. Троакар устанавливают под углом 90°
градусов к брюшной стенке. Б — после попадания кончика
троакара в брюшную полость подвижный выскакивающий
мулируют клинические рекомендации, которые
оцениваются в связи с доказательной силой источников.
Доступные данные по применению закрытой (игла
Вереша) и открытой техник доступа в брюшную полость
не позволяют установить явные преимущества того
или иного метода [10].
Троакары
Троакары предназначены для введения инструментов
и лапароскопа. Выпускают троакары как одноразового,
так и многоразового использования. Особое внимание
уделяют их безопасности, поэтому большинство
одноразовых троакаров имеют безопасные кожухи или
кончики с возможностью ретракции (рис. 1-6 и 1-7). Эти
безопасные устройства снижают количество
осложнений, связанных с введением троакаров, но неспособны
полностью исключить катастрофические последствия
осложнений. Троакары без лезвия состоят из обтуратора
с прозрачным кончиком, в который вводят оптику.
Оптический кончик троакара позволяет увидеть отдельные
слои тканей во время введения троакара (рис. 1-8).
Вторичные троакары (все, кроме троакара для
лапароскопа) практически всегда можно установить без
осложнений, так как эту манипуляцию проводят под
непосредственным лапароскопическим контролем. Для того
чтобы избежать повреждения поверхностных вен,
можно дополнительно применить просвечивание брюшной
стенки. Необходимость применения избыточной силы
при введении троакара указывает на то, что выбрана
неверная техника. При затрудненном введении нужно
проверить адекватность длины кожного разреза или
убедиться, полностью ли введен обтуратор (стилет) троакара
в кожух (так, чтобы острый кончик полностью был
снаружи). При установке вторичных троакаров следует
использовать так называемую /-технику (рис. 1-9). Эта
техника заключается во введении троакара под визуальным
контролем под углом 90° к брюшной стенке. Троакар
продвигают до тех пор, пока его кончик не перфорирует
брюшину. Затем руку с троакаром опускают таким образом,
что кончик троакара поднимается кверху, а кожух про-
обтуратор защищает содержимое брюшной полости
от повреждения или разрыва. В — после попадания кончика
в брюшную полость троакар наклоняют перед продвижением.
Это позволяет продвинуть троакар с минимальным риском.
Глава 1. Лапароскопический инструментарий и базовые методики 17
двигается в направлении, параллельном перитонеальной
поверхности брюшной стенки. Применение этой техники
сводит к минимуму повреждение органов брюшной
полости и забрюшинного пространства.
Оптимальное пространственное положение
троакаров важно для успешного проведения
лапароскопических операций. Они должны находиться на
расстоянии 7-10 см друг от друга (или на расстоянии ширины
ладони). Троакары необходимо располагать в форме
треугольника, направленного вершиной к органу-
мишени. Это позволяет хирургу работать двумя
руками вдоль оси лапароскопа. Необходимо избегать
такого расположения троакаров, при котором хирург
и ассистенты будут вынуждены работать против
визуальной оси лапароскопа. Применение
2-5-миллиметровых троакаров вместо 5-10-миллиметровых
значительно улучшает косметические результаты и снижает
послеоперационный болевой синдром [10].
Орошение и аспирация
Предложен широкий спектр систем для ирригации —
от ручного насоса до систем, обеспечивающих
высокую интенсивность орошения и аспирации.
Устройства для аспирации высокой мощности применяют
при сложных лапароскопических процедурах, когда
необходимо быстрое удаление крови, затрудняющей
осмотр операционного поля. Скорость потока
жидкости зависит от нескольких факторов: давления в
емкости с жидкостью, сопротивления системы трубок
и диаметра устройства для ирригации и аспирации
(рис. 1-10). При использовании мощных устройств
для ирригации и аспирации необходимо иметь высо-
копроводительный инсуффлятор (15-20 мл/мин),
поскольку при отсасывании происходит быстрая потеря
давления пневмоперитонеума.
Некоторые устройства оснащены подогревателем
жидкости для поддержания температуры тела пациен-
Рис. 1-10. Канюля для ирригации и аспирации (вверху).
Устройство для аспирации и ирригации (внизу) (USSurgical,
Norwalk, CT).
та. К другим новациям в устройстве приборов для
аспирации относится возможность введения через
ирригационный порт таких инструментов, как коагулятор,
зажимы и ножницы. Это важно, поскольку позволяет
быстро останавливать кровотечение во время
лапароскопической операции. Небольшое количество крови
в брюшной полости может поглощать значительную
часть света, ухудшая видимость. Кровь также
затрудняет дифференциацию тканей. Авторы вводят по 8000
единиц гепарина в каждую емкость для орошения, чтобы
предотвратить образование сгустков крови. Кроме того,
изменение положения операционного стола позволяет
собрать скопившуюся жидкость и оценить промывные
воды на предмет продолжающегося кровотечения.
В устройстве «Ligasure» (Valleylab, Boudler, СО)
используется комбинация электротермальной энергии
и плотного сжатия, что позволяет надежно
коагулировать сосуды диаметром до 7мм (рис. 1-11) [11].
Прибор позволяет достичь гемостаза без диссекции
кровеносных сосудов. Было показано, что эффективность
гемостаза сохраняется даже при воздействии на сосуд
давления до 900 мм рт.ст. Устройство «Ligasure»
характеризуется распространением термальной энергии
на 1-2 мм и, таким образом, имеет безопасные коагу-
ляционные характеристики для использования в
лапароскопической хирургии [11].
Гармонический скальпель
Принцип работы гармонического скальпеля
(Harmonic scalpel, Ethicon Endo-Surgery, Cincinnati, OH)
основан на использовании ультразвука для
денатурации белков и формирования сгустка, который обтури-
рует мелкие сосуды (рис. 1-12). Бранши инструмента
вибрируют с частотой 55500 Гц, генерируя
температуру примерно 50-100 °С. Ультразвуковой скальпель
безопасно коагулирует сосуды диаметром до Змм
[12]. Бранши инструмента не проводят электричества,
Рис. 1-11. Устройство для гемостаза «Ligasure» {Valleylab, Boudler,
СО). Бранши устройства «Ligasure» (вкладка).
18 Лапароскопическая хирургия. Атлас
поэтому рассеивание коагулирующей энергии и,
соответственно, риск повреждения окружающих структур
минимальны [13].
Интраоперационное ультразвуковое
исследование
После усовершенствования лапароскопические
ультразвуковые датчики очень часто можно встретить
в операционных. В настоящее время интраоперацион-
ная сонография применяется для исследования печени
и поджелудочной железы. Лапароскопическое
ультразвуковое исследование используют для уточнения ге-
патобилиарной анатомии во время холецистэктомии,
оно особенно полезно для выявления гепатобилиар-
ных, гастроэзофагеальных и панкреатических
образований [14, 15].
ИНСТРУМЕНТЫ
Для захвата тканей используют разные инструменты,
многие из которых сделаны на основе стандартных
хирургических инструментов. Зажимы (грасперы)
бывают атравматическими и имеющими зубья на
поверхностях для захвата тканей (рис. 1-13). Авторы
предпочитают пользоваться атравматическими зажимами
практически при любых обстоятельствах, за исключением
процесса удаления препарата из брюшной полости.
Эндоскопические ножницы также выпускают с
разными кончиками. Чаще всего используют ножницы
с изогнутыми кончиками, аналогичными ножницам
Метценбаума. Другие виды ножниц созданы для
особых ситуаций (к примеру, крючковидные или
микроножницы, необходимые при работе с пузырным
протоком). Большинство эндоскопических ножниц можно
присоединить к коагулятору для одновременной резки
и коагуляции.
Некоторые виды инструментов созданы
специально для эндоскопической хирургии. Эндоскопический
крючок часто необходим для рассечения брюшины
между желчным пузырем и печенью. Как и при
открытых операциях, важнейшую роль для
безопасного проведения процедуры играет экспозиция. Этой
цели служат такие эндоскопические ретракторы,
как «Endo Paddle», «Endo Retract» (US Surgical, Norwalk,
CT), которые могут иметь различные форму и размеры.
Для экстракорпорального затягивания узлов
необходим эндоскопический толкатель (пушер).
Предложены одноразовые эндоскопические петли с входящим
в комплект толкателем. Устройство «Endo Stitch» (US
Surgical, Norwalk, CT) является инновацией в
лапароскопическом инструментарии, которая в значительной
мере облегчает наложение швов (рис. 1-14). С
помощью эндоскопического иглодержателя можно интра-
корпорально накладывать обычные швы.
Эндоскопические сшивающие аппараты (степле-
ры) — дорогие инструменты, позволяющие снижать
время проведения лапароскопических операций.
Большинство лапароскопичееских хирургов
считают, что для фиксации сетки при эндоскопических
грыжесечениях необходимы эндоскопические
грыжевые степлеры. Эндоскопический клипатор — один
из наиболее часто используемых лапароскопических
инструментов (рис. 1-15). Данный инструмент
сыграл большую роль в быстром распространении
лапароскопической холецистэктомии, так как позволял
с легкостью лигировать пузырный проток и
пузырную артерию с помощью клипс. Такие эндоскопиче-
Рис. 1-12. Гармонический скальпель {Harmonicscalpel, Ethicon
Endo-Surgery, Cincinnati, ОН). Бранши ультразвукового скальпеля
(вкладка).
Рис. 1-13. Атравматический и зубатый лапароскопические
зажимы.
Рис. 1-14. Устройство «Endo Stitch» {US Surgical, Norwalk, CT).
Глава 1. Лапароскопический инструментарий и базовые методики 19
ские сшивающие аппараты, как «Endo GIA» и «Endo
ТА» (US Surgical, Norwalk, CT) используют в тех же
ситуациях, что и их обычные аналоги (рис. 1-16). «Endo
Catch» (US Surgical, Norwalk, CT) служит для захвата
удаленного препарата и его изоляции, пока он
находится в брюшной полости (рис. 1-17).
МИНИ-ЛАПАРОСКОПИЯ
Мини-лапароскопия — новая грань лапароскопической
хирургии. По сравнению с обычными
лапароскопическими инструментами, диаметр которых составляет
5-10 мм, инструменты для мини-лапароскопии имеют
диаметр 1,7-3,0 мм. Однако несмотря на применение
волоконно-оптических технологий, качество
изображения все еще остается ниже, чем при стандартной
Рис. 1-15. Устройство «Endo Clip» (US Surgical, Norwalk, CT).
Рис. 1-16. Степлер «Endo GIA» (US Surgical, Norwalk, CT).
Рис. 1-17. Устройство «Endo Catch» (US Surgical, Norwalk, CT).
лапароскопии [16]. Мини-лапароскопию, как правило,
используют с диагностической целью, а также для
проведения аппендэктомии, холецистэктомии и адренал-
эктомии [17, 18]. Ее можно проводить под местной
анестезией с внутривенной седацией [19]. Для успеха
минимально инвазивного доступа необходим
соответствующий подбор пациентов и инструментария. С
помощью мини-лапароскопии возможно провести также
многие сложные процедуры. Используя данный вид
доступа, хирург на первых порах сочетает
инструменты для мини-лапароскопии и стандартные
лапароскопические инструменты. То, какие инструменты
применяет хирург, зависит от его опыта и навыка.
Хотя рандомизированные исследования показали,
что мини-лапароскопия так же безопасна, как и
обычная лапароскопия, тем не менее устранение таких
осложнений, как кровотечения или повреждения
органов брюшной полости, является более трудной
задачей при применении маленьких инструментов [20, 21].
Клипаторы таких маленьких размеров еще не
появились на рынке, поэтому кровотечения останавливают
с помощью петель или прошивания. Кроме того,
предельно тонкие канюли для аспирации неспособны
очищать операционное поле от крови так же эффективно,
как стандартная 5-миллиметровая канюля.
ОБУЧЕНИЕ И ЛИЦЕНЗИРОВАНИЕ
В дополнение к общехирургическому обучению
лапароскопическая хирургия требует специфических
базовых знаний и навыков. Лапароскопические операции
должны проводить только те хирурги, которые
способны осуществлять их открытым доступом. Однако
хирурга, имеющего технические навыки в открытых
операциях, нельзя автоматически считать компетентным
в лапароскопии. Многие хирурги после завершения
резидентуры по общей хирургии выбирают
специализацию и дальнейшее обучение технике лапароскопии,
хотя лапароскопическая хирургия стала обязательным
компонентом при обучении резидентов. Таким
образом, возникает огромная необходимость в
лапароскопическом обучении практикующих хирургов, а также
во внедрении новых методик и технологий.
Не существует национальных стандартов по
лицензированию хирургов, занимающихся
лапароскопической хирургией. Американское общество гастроинте-
стинальных и эндоскопических хирургов (SAGES)
опубликовало рекомендации по обучению и
лицензированию лапароскопическиих хирургов. Кроме того, SAGES
проводит сертификационные курсы по основам
лапароскопической хирургии. Однако медицинская и
юридическая ответственность за лицензирование лапаро-
скопистов лежит на плечах отдельных клиник.
Необходимый компонент обучения,
соответствующего сертификационным стандартам, — прохожде-
20 Лапароскопическая хирургия. Атлас
ние хирургом курсов лапароскопического тренинга,
включающих получение теоретических и
практических навыков. Хирург должен участвовать в качестве
наблюдателя или ассистента на определенном
количестве операций. Он также должен самостоятельно
провести определенное количество операций в
присутствии сертифицированного хирурга-лапароскописта,
который, со своей стороны, выступает в качестве
учителя или инструктора. Обучающийся хирург затем
должен провести определенное количество операций
в присутствии специально назначенного инспектора.
Инспектор — незаинтересованное лицо, которое
наблюдает за проведением лапароскопических операций,
но не вмешивается в ход операции и не дает
инструкций. Затем инспектор в рекомендательной форме
делает заключение для руководителей клиники о
компетентности данного хирурга в проведении
определенного типа операций. Заключительная стадия
сертификации — рецензия и одобрение, полученные от
сертификационного комитета клиники. Количество операций,
необходимое для сертифицирования на каждой
стадии, в разных клиниках значительно варьирует. SAGES
по требованию обеспечит материалами по
подготовке и лицензированию лапароскопических хирургов,
адрес: Suite 600, ИЗО West Olympic Boulevard, Los Angeles,
California, 90064.
СПИСОК ЛИТЕРАТУРЫ
1. Berci С. History of endoscopy // Endoscopy / Ed. C. Berci. — New
York: Appleton-Century-Crofts, 1976. — xix — xxiii.
2. Knyrim K., Seidlitz H., Vakil N., Classes M. Perspectives in
«electronic endoscopy»: past, present, and future of fibers and
CCDs in medical endoscopes // Endoscopy. — 1990. — Vol. 22
(Suppl. 1). - P. 2-8.
3. Minimally Invasive Surgery / Eds J. C. Hunter, J. M. Sackier. — New
York: McGraw-Hill, Inc. — 1993.
4. Szold A. Seeing is believing: visualization systems in endoscopic
surgery (video, HDTV, stereoscopy, and beyond) // Surg.
Endosc. — 2005. — Vol. 19. — P. 730-733.
5. Koivusalo A.M., Kellokumpu I., Scheinin M. et al. Randomized
comparison of the neuroendocrine response to laparoscopic
cholecystectomy using either conventional or abdominal wall lift
techniques // Br. J. Surg. — 1996. — Vol. 83. — P. 1532-1536.
6. Neuhaus S.J., Gupta A., Watson D.I. Helium and other alternative
insufflation gases for laparoscopy // Surg. Endosc. — 2001. —
Vol. 15. — P. 553-560.
7. Neuhaus S.J., Watson D.I., Ellis T. et al. The influence of different
gases on intraperitoneal immunity in tumour bearing rats //
World J. Surg. — 2000. — Vol. 24. — P. 1227-1231.
8. Matthew G., Watson D.I., Rofe A.M. et al. Wound metastases
following laparoscopy // Br. J. Surg. — 1996. — Vol. 83. — P. 1087-
1089.
9. Jacobi C.A., Sabat R., Bohm B. et al. Pneumoperitoneum with
carbon dioxide stimulates growth of malignant colonic cells //
Surgery. — 1997. — Vol. 121. — P. 72-78.
10. Neudecker J., Sauerland S., Neugebauer E. et al. The European
Association for Endoscopic Surgery clinical practice guideline on
the pneumoperitoneum for laparoscopic surgery // Surg. Endosc. —
2002. — Vol. 16. — P. 1121-1143.
11. Kennedy J.S., Stranahan PL., Taylor K.D. et al. High-burst-strength,
feedback-controlled bipolar vessel sealing // Surg. Endosc. —
1998. — Vol. 12. — P. 876-878.
12. Bellows C.E, Sweeney J.E Laparoscopic splenectomy: present status
and future perspective // Expert Rev. Med. Devices. — 2006. —
Vol. 3. — P. 95-104.
13. Sietses C, Eijsbouts Q.A., von Blomberg B.M. et al. Ultrasonic
energy vs monopolar electrosurgery in laparoscopic
cholecystectomy // Surg. Endosc. — 2001. — Vol. 15. — P. 69-71.
14. Bezzi M., Silecchia G., De Leo A. et al. Laparoscopic and
intraoperative ultrasound // Eur. J. Radiol. — 1998. — Vol. 27
(Suppl. 2). — P. 207-214.
15. Machi J. Intraoperative and laparoscopic ultrasound // Surg. Oncol.
Clin. North. Am. — 1999. — Vol. 8. — P. 205-226.
16. Kolios E., Moran M.E. Microlaparoscopy// J. Endourol.
Vol. 18.— P. 811-817.
2004. —
17. Liao C.H., Chueh S.C., Wu K.D. et al. Laparoscopic partial
adrenalectomy for aldosterone-producing adenomas with
needlescopic instruments // Urology. — 2006. — Vol. 68. — P. 663-
667.
18. Sato N., Kojika M., Yaegashi Y et al. Minilaparoscopic
appendectomy using a needle loop retractor offers optimal cosmetic
results // Surg. Endosc. — 2004. — Vol. 18. — P. 1578-1581.
19. Bruhat M.A., Goldchmit R. Minilaparoscopy in gynecology // Eur.
J. Obstet. Gynecol. Reprod. Biol. — 1998. — Vol. 76. — P. 207-210.
20. Novitsky YW, Kercher K.W, Czerniach D.R. et al. Advantages of
minilaparoscopic vs conventional laparoscopic cholecystectomy //
Arch. Surg. — 2005. — Vol. 140. — P. 1178-1183.
21. Sarli L., Lusco D., Gobbi S. et al. Randomized clinical trial of
laparoscopic cholecystectomy performed with mini-instruments //
Br. J. Surg. — 2003. — Vol. 90. — P. 1345-1348.
Глава 1. Лапароскопический инструментарий и базовые методики 21
Лапароскопическая
хирургия при травме
живота
Марк Л. Шапиро, Майур Б. Пател, Стивен Н. Вэслеф
В США травмы остаются основной причиной
смерти людей в возрасте от 1 до 44 лет и лидируют среди
причин потери потенциальных лет жизни в возрасте
до 65 лет [19]. Травма — это мультисистемное
поражение, для лечения которого необходимы передовые
достижения как медицины в целом, так и хирургии,
включая лапароскопию и минимально инвазивную
хирургию.
Самое раннее сообщение о применении
лапароскопии при травме относится к 1920-м гг. и связано
с диагностикой гемоперитонеума [2, 3]. В конце XX в.,
после того как лапароскопия доказала свою
практическую пользу и получила всеобщее признание,
возникла потребность ее использования для
диагностики при закрытых и проникающих ранениях живота
[4-6]. Однако при закрытой травме лапароскопия
не имеет четких преимуществ перед другими, менее
инвазивными методиками, такими как лапароцен-
тез или КТ [7-10], которые до сих пор используются
во многих клиниках.
Хотя в некоторых литературных источниках
применяют термин «диагностическая лапароскопия»,
лапароскопию при травмах можно разделить на скринин-
говую, диагностическую и лечебную. Скрининговая
лапароскопия предназначена для выявления или
исключения повреждений, требующих диагностической
лапаротомии. Цель диагностической лапароскопии —
обнаружить все повреждения, она часто противостоит
«золотому стандарту» — лапаротомии — в точности
ее данных. Целью лечебной лапароскопии является
устранение повреждений после исключения травм,
требующих открытой операции [11].
Лапароскопию можно с успехом использовать в
лечении проникающих травм живота для снижения числа
эксплоративных лапаротомии, но для ее широкого
применения имеются определенные препятствия. В 1997 г.
Zantut et al. [12] провели ретроспективное мультицен-
тровое исследование по оценке скрининговой
лапароскопии при проникающей травме живота. Оказалось,
что более чем у 50% пострадавших не было
перфорации брюшины или значительных повреждений.
Однако у остальных пациентов, подвергшихся лапаротомии
по результатам скрининговой лапароскопии, были
дополнительно обнаружены повреждения кишечника
или забрюшинных органов [12]. Villavicencio и Аисаг
[11] провели обзор 37 исследований, охватывающих
более 1900 пациентов с тупыми и проникающими
травмами. Оказалось, что при скрининговой
лапароскопии было пропущено около 1% повреждений и 67%
пациентов были спасены от ненужной лапаротомии,
но при диагностической лапароскопии было
пропущено от 41 до 77% повреждений. Проспективное
рандомизированное исследование Leppaniemi и Haapiainen
[13] пациентов с резаными ранами показало, что у
пациентов с повреждением органов брюшной полости
скрининговая лапароскопия имеет мало преимуществ
перед лапаротомией по показателям смертности,
частоты осложнений, стоимости и пропущенной патологии,
однако 55% лапаротомии удалось избежать благодаря
лапароскопии. В 2005 г. была проспективно
исследована группа пациентов из 52 человек с проникающими
ранениями живота. У 77% пациентов с
проникающими повреждениями и стабильными витальными
функциями удалось избежать эксплоративной лапаротомии
благодаря скрининговой лапароскопии [14]. Сходные
данные были получены Мс Quay и Britt [15] в их
недавно проведенном исследовании, включавшем 80
пациентов с проникающими торакоабдоминальными
травмами, подвергшимися скрининговой лапароскопии,
72,5% которых избежали лапаротомии.
Признана важная роль лапароскопии в
специфической ситуации — при подозрении на повреждение
диафрагмы у пациентов с левосторонней
проникающей торакоабдоминальной травмой, затрагиваю-
Глава 2. Лапароскопическая хирургия при травме живота 23
щей область, ограниченную соском и верхушкой
лопатки сверху и краем реберной дуги снизу. Известно,
что радиологические исследования, такие как
рентгенография грудной клетки, КТ, контрастные
исследования, ненадежны в диагностике небольших нео-
сложненных повреждений диафрагмы [ 16]. У этой
категории пациентов при невыраженных клинических
симптомах и нормальных данных
рентгенологических исследований частота повреждений диафрагмы
составляет примерно 42% [17]. Ivatury et al. [18, 19]
закрепили позиции лапароскопии как прекрасной
методики для ревизии верхней части брюшной
полости и диафрагмы. Murray et al. [20] проспективно
оценили ПО пациентов с левосторонними
проникающими торакоабдоминальными повреждениями
(без абдоминальных симптомов). Частота скрытых
повреждений диафрагмы, выявленных с помощью
лапароскопии, составила 24%. В проспективной
серии исследований Parkland Memorial Hospital (2005)
чувствительность, специфичность и частота
отрицательных результатов лапароскопии в диагностике
проникающих торакоабдоминальных повреждений
составили 100, 87,5 и 96,8% соответственно [21]
что подтвердило данные, полученные Ortega et al
в 1996 г. [22].
Противопоказания к лапароскопии у
пациента с травмой такие же, как и у нетравмированного
за исключением одного — повреждений головы.
Повышенное давление в брюшной полости, т.е. пневмо-
перитонеум, вызывает значительное повышение
внутричерепного давления у пациентов с травмой головы
Этот эффект вероятнее всего является результатом
повышенного внутригрудного давления, которое
препятствует оттоку крови из головного мозга [23, 24]
Повышенное парциальное давление диоксида
углерода в крови может повысить внутричерепное давление
вследствие вазодилатирующего рефлекса [25]. Таким
образом, травмы головного мозга являются
противопоказанием к лапароскопии.
ХИРУРГИЧЕСКАЯ ТЕХНИКА
На рис. 2-1—2-25 показана техника лапароскопии
при травме живота.
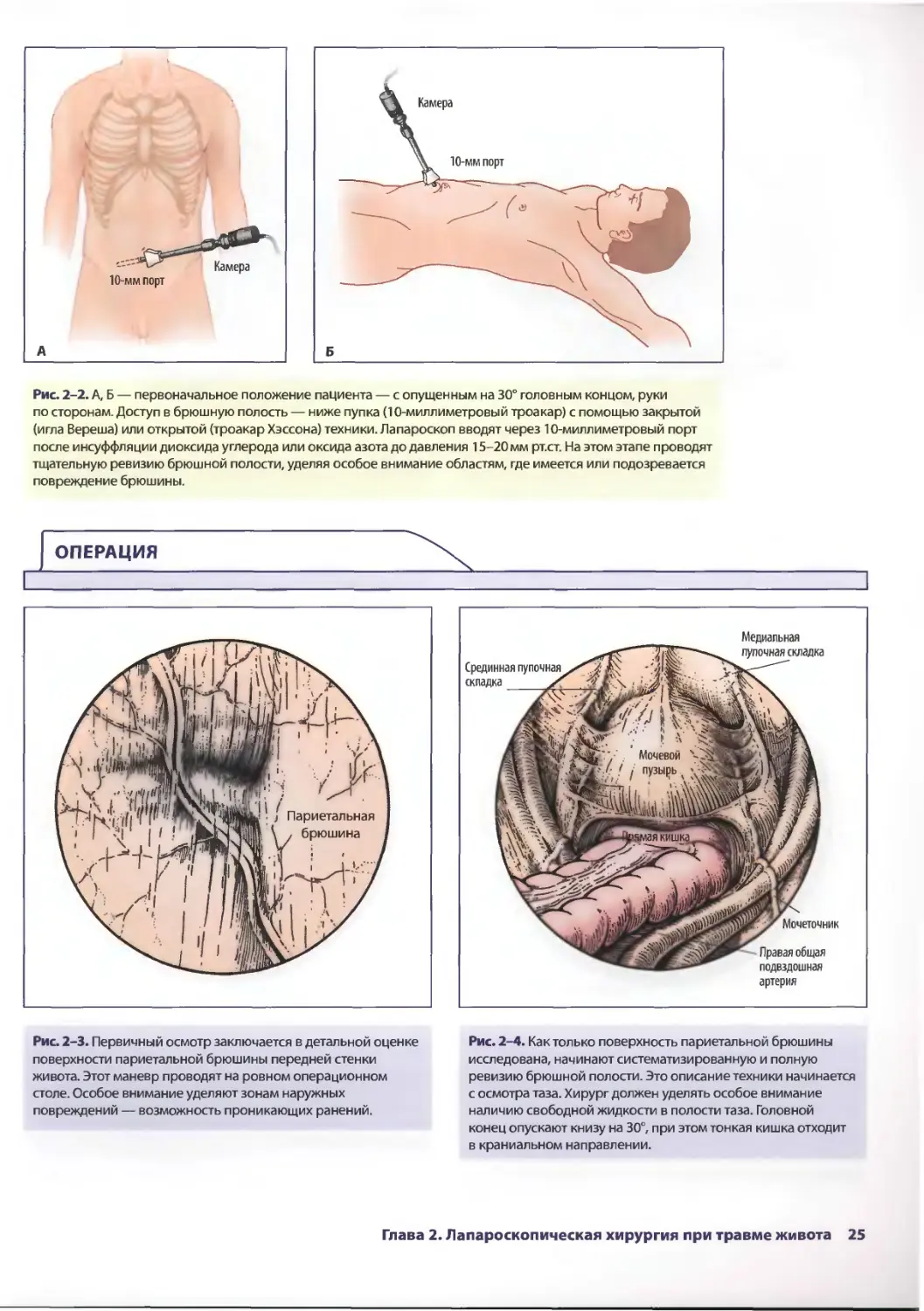
Рис. 2-1. Обстановка операционной для лапароскопического
вмешательства при травме живота. Перед операцией
в отделении экстренной помощи пациенту вводят
антибиотики и устанавливают назогастральный зонд
и катетер Фолея. Первоначальное положение пациента —
как для лапароскопической холецистэктомии. Хирург должен
убедиться в том, что анестезиолог сможет с легкостью
двигать пациента. Ассистент должен приготовиться
к работе с камерой в процессе операции. Персоналу
операционной и оперирующему хирургу следует иметь
в виду, что возможность перемены положения пациента
и перемещения оборудования очень важна во время такой
операции.
ПОДГОТОВКА
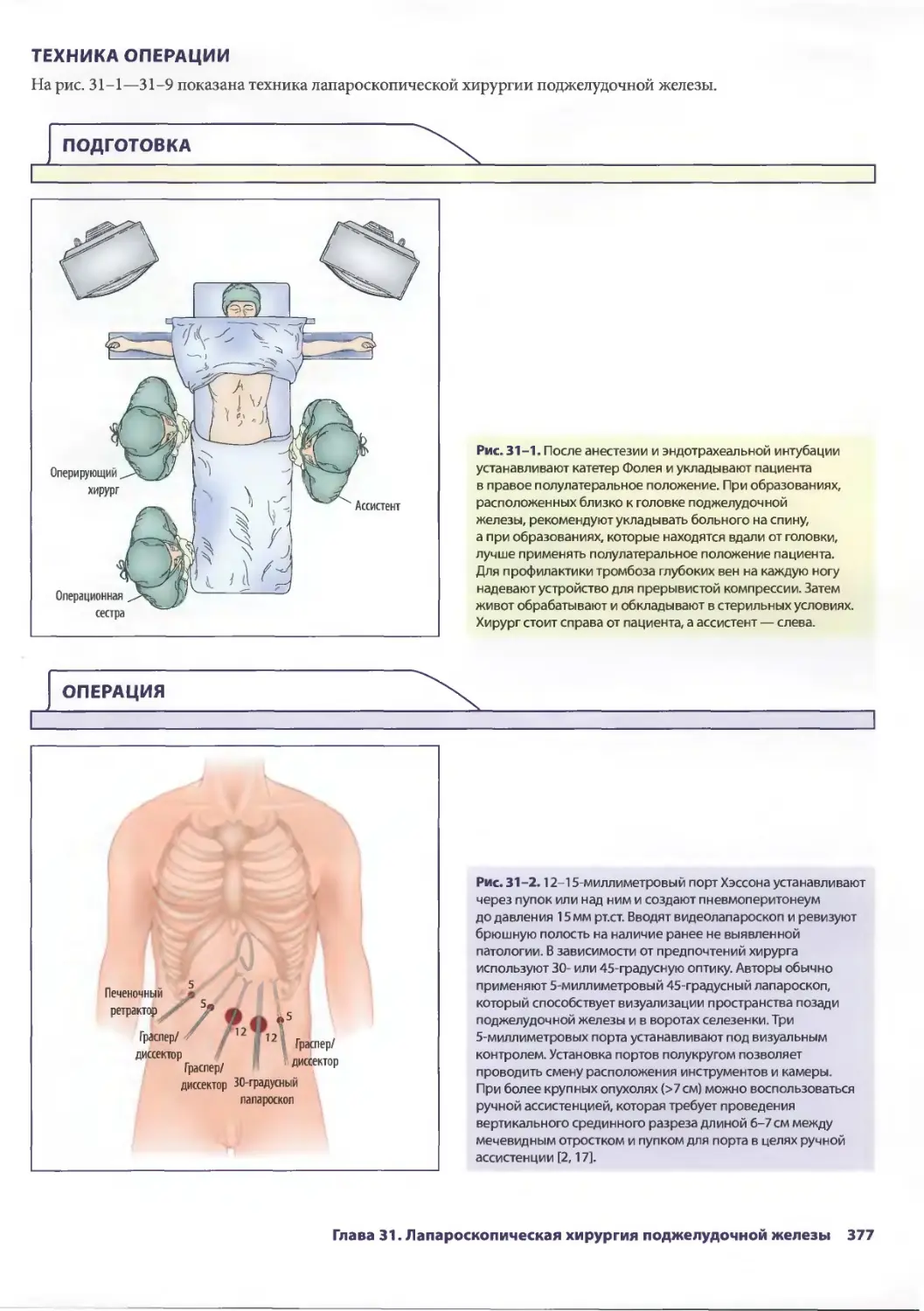
24 Лапароскопическая хирургия. Атлас
\
4
I
-.г- ^\^ Камера
10-ммпорт
\
А
Рис. 2-2. А, Б — первоначальное положение пациента — с опущенным на 30° головным концом, руки
по сторонам. Доступ в брюшную полость — ниже пупка (10-миллиметровый троакар) с помощью закрытой
(игла Вереша) или открытой (троакар Хэссона) техники. Лапароскоп вводят через 10-миллиметровый порт
после инсуффляции диоксида углерода или оксида азота до давления 15-20 мм рт.ст. На этом этапе проводят
тщательную ревизию брюшной полости, уделяя особое внимание областям, где имеется или подозревается
повреждение брюшины.
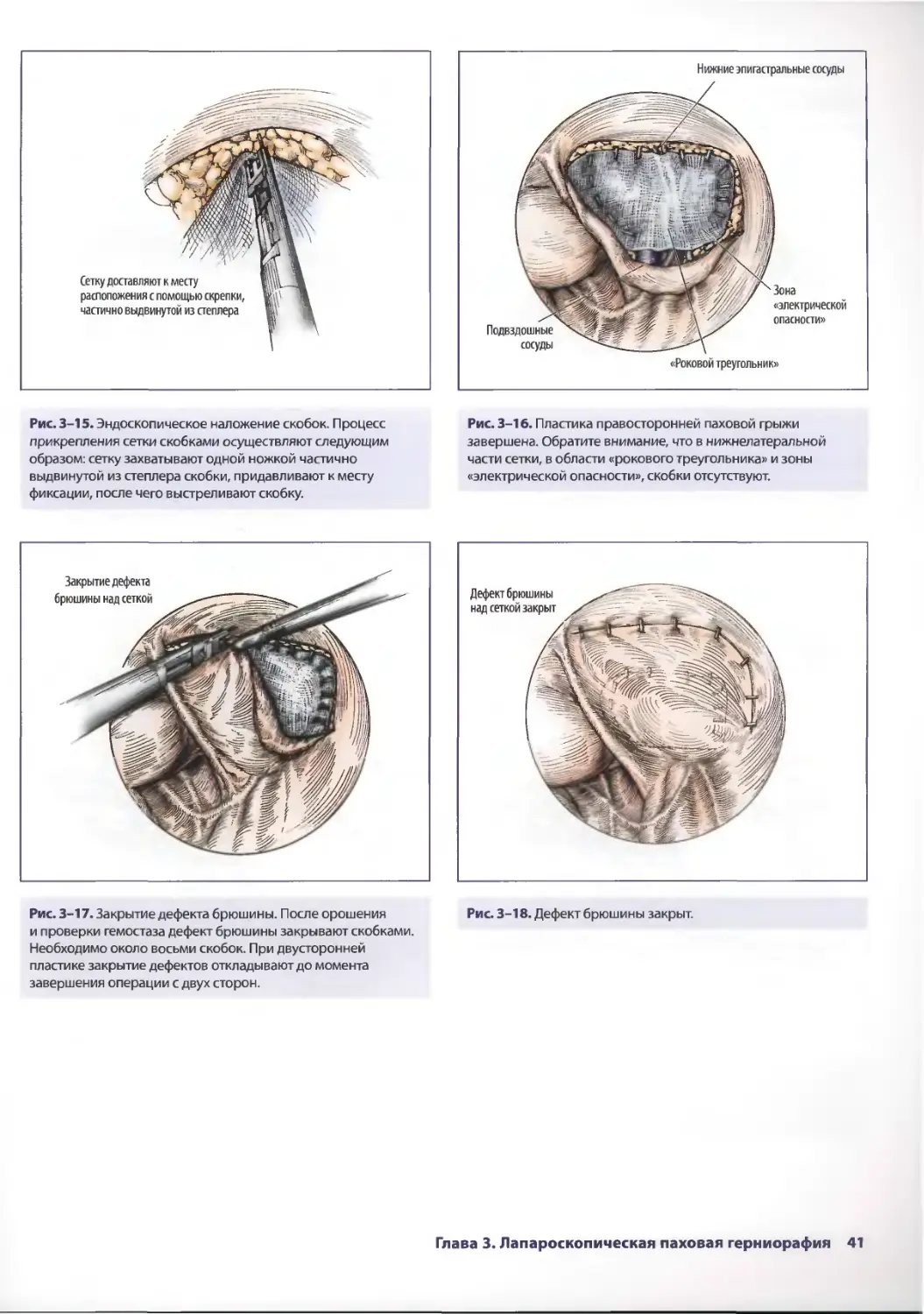
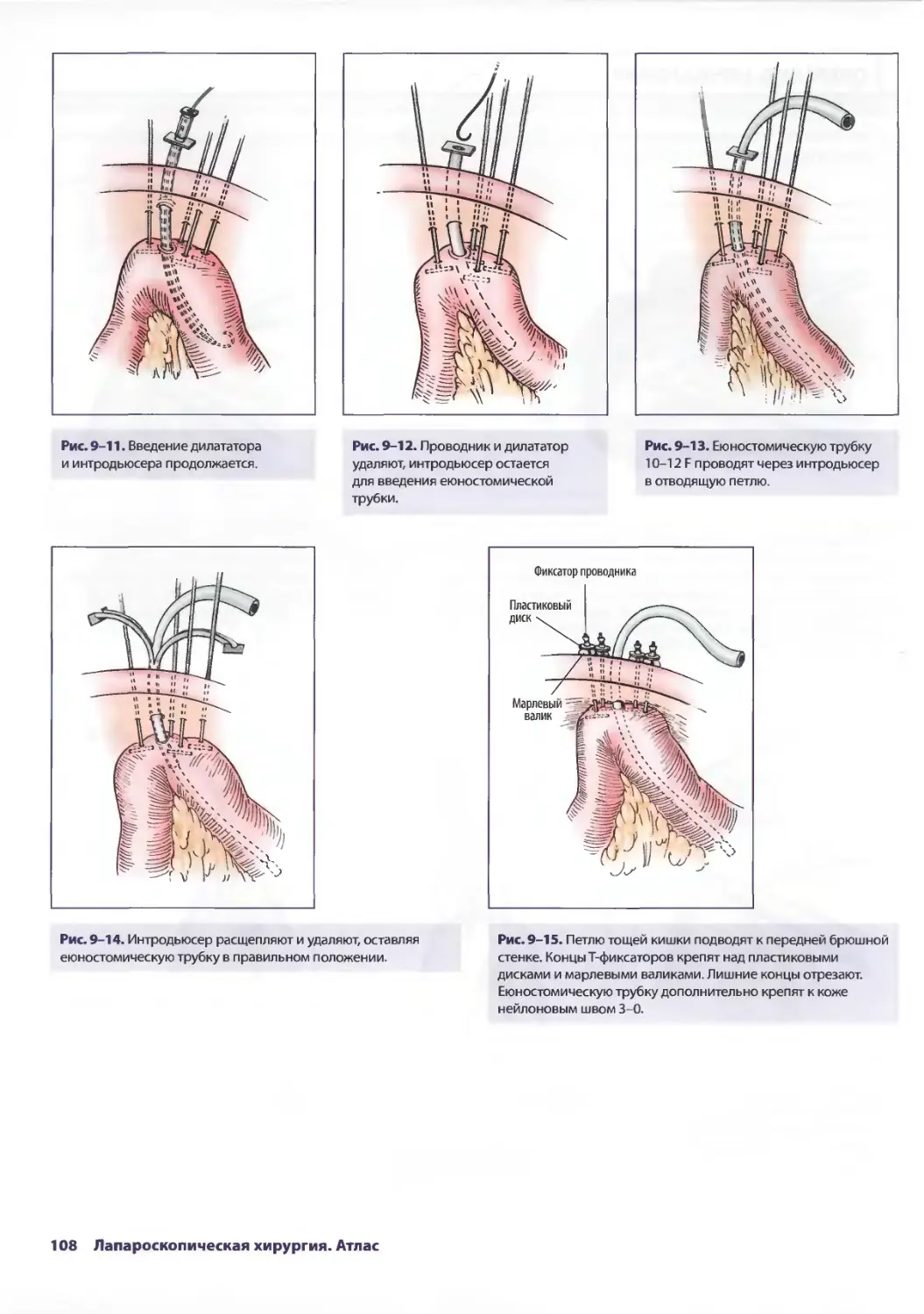
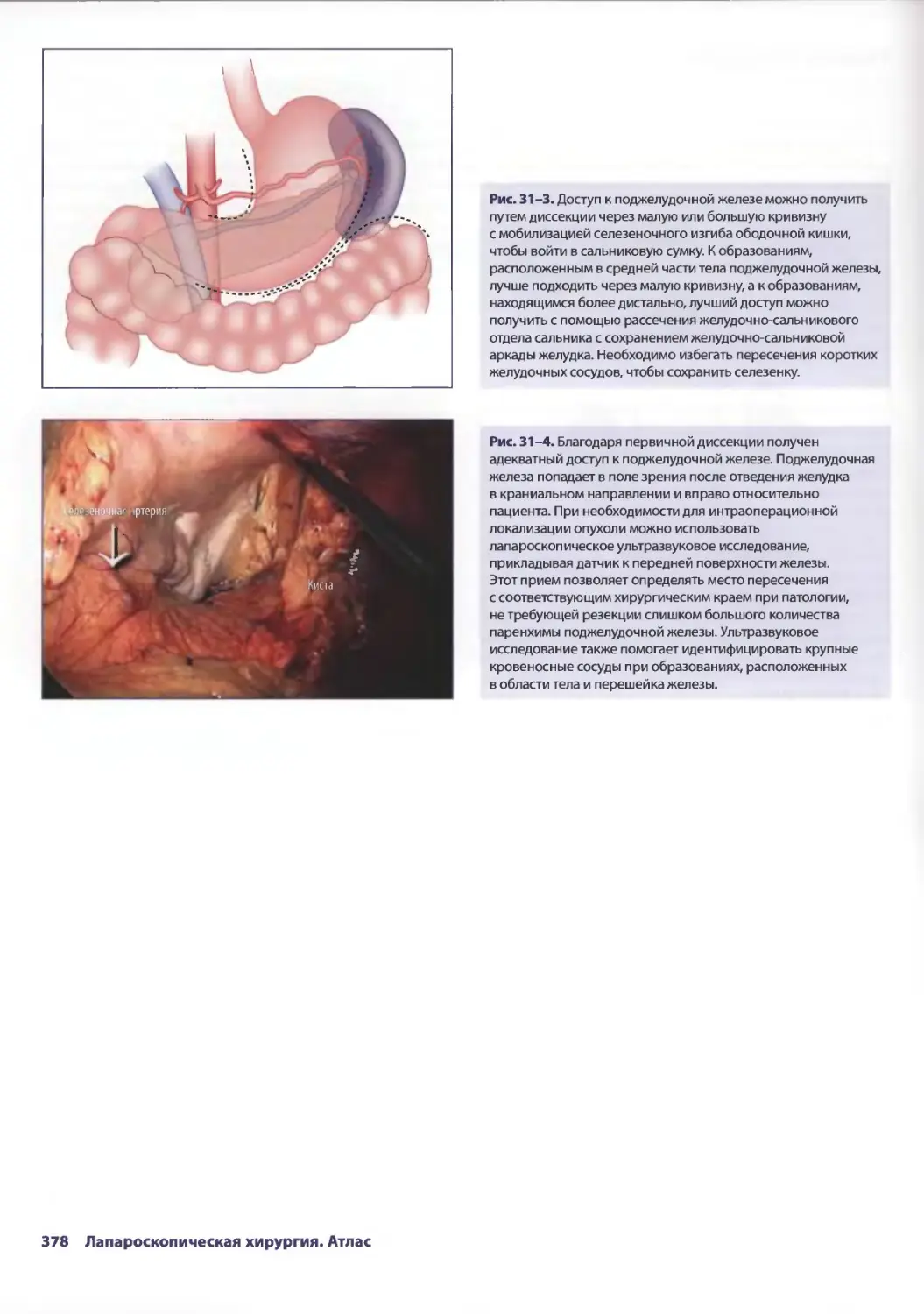
ОПЕРАЦИЯ
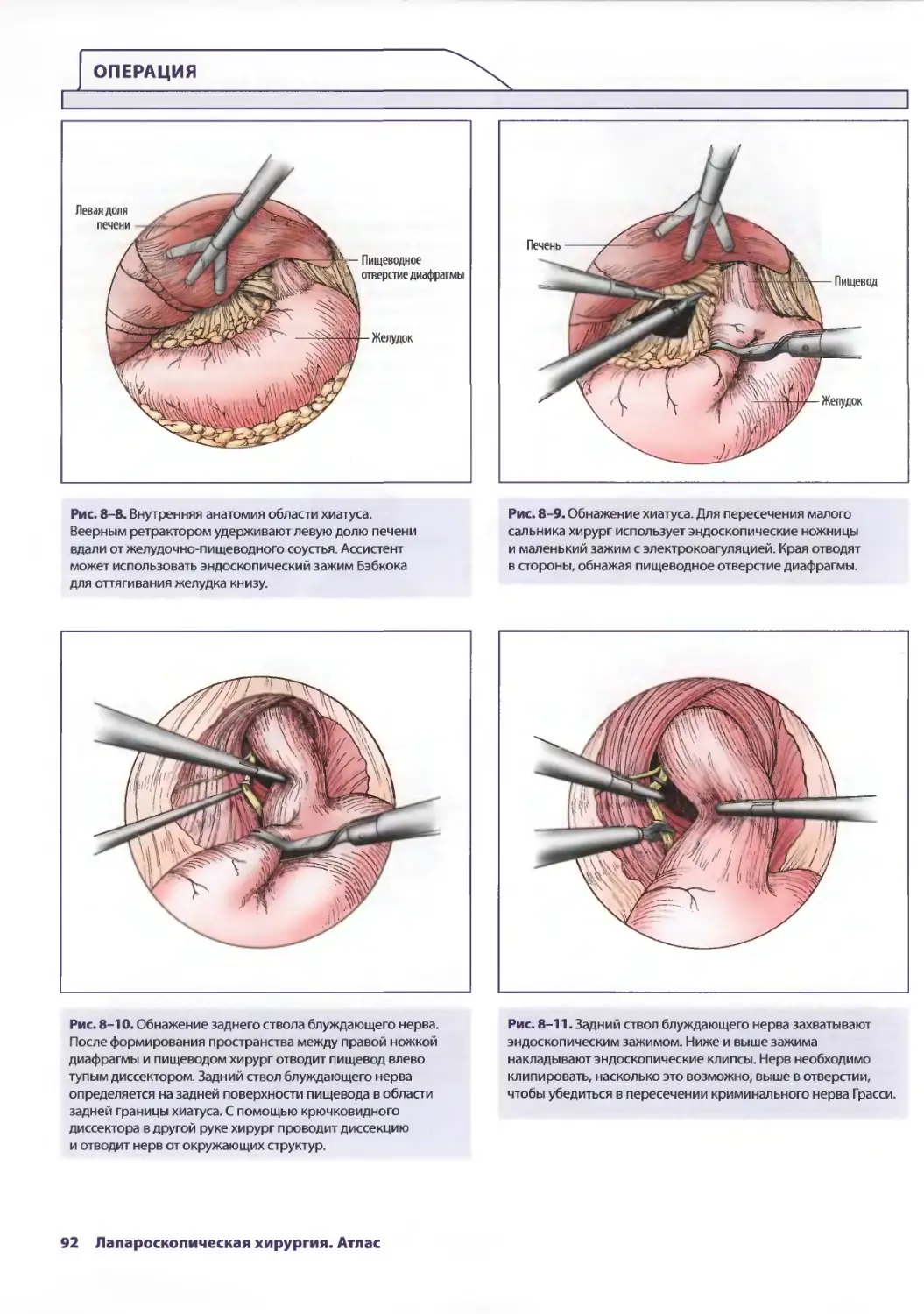
Рис. 2-3. Первичный осмотр заключается в детальной оценке Рис. 2-4. Как только поверхность париетальной брюшины
поверхности париетальной брюшины передней стенки исследована, начинают систематизированную и полную
живота. Этот маневр проводят на ровном операционном ревизию брюшной полости. Это описание техники начинается
столе. Особое внимание уделяют зонам наружных с осмотра таза. Хирург должен уделять особое внимание
повреждений — возможность проникающих ранений. наличию свободной жидкости в полости таза. Головной
конец опускают книзу на 30°, при этом тонкая кишка отходит
в краниальном направлении.
Глава 2. Лапароскопическая хирургия при травме живота 25
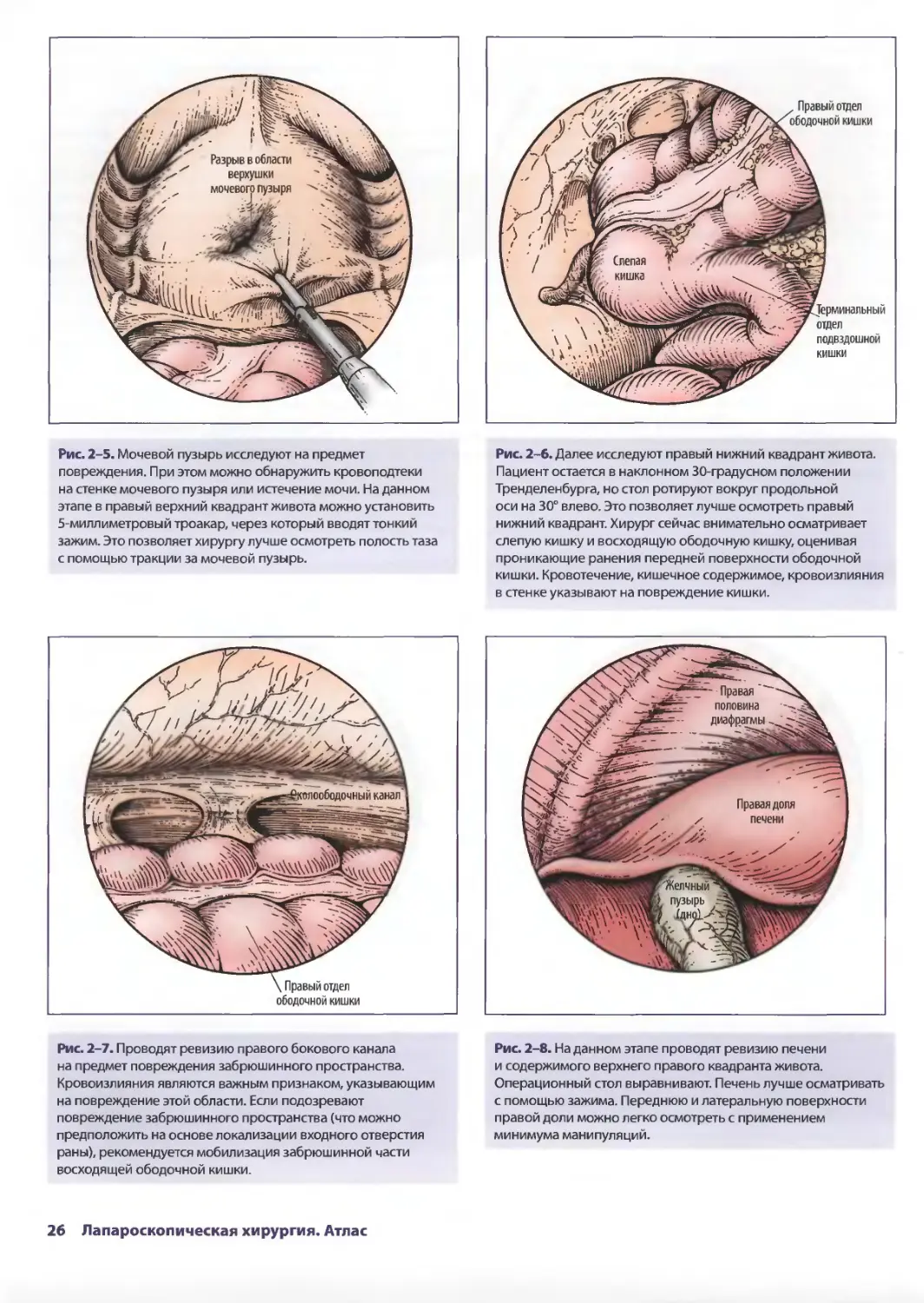
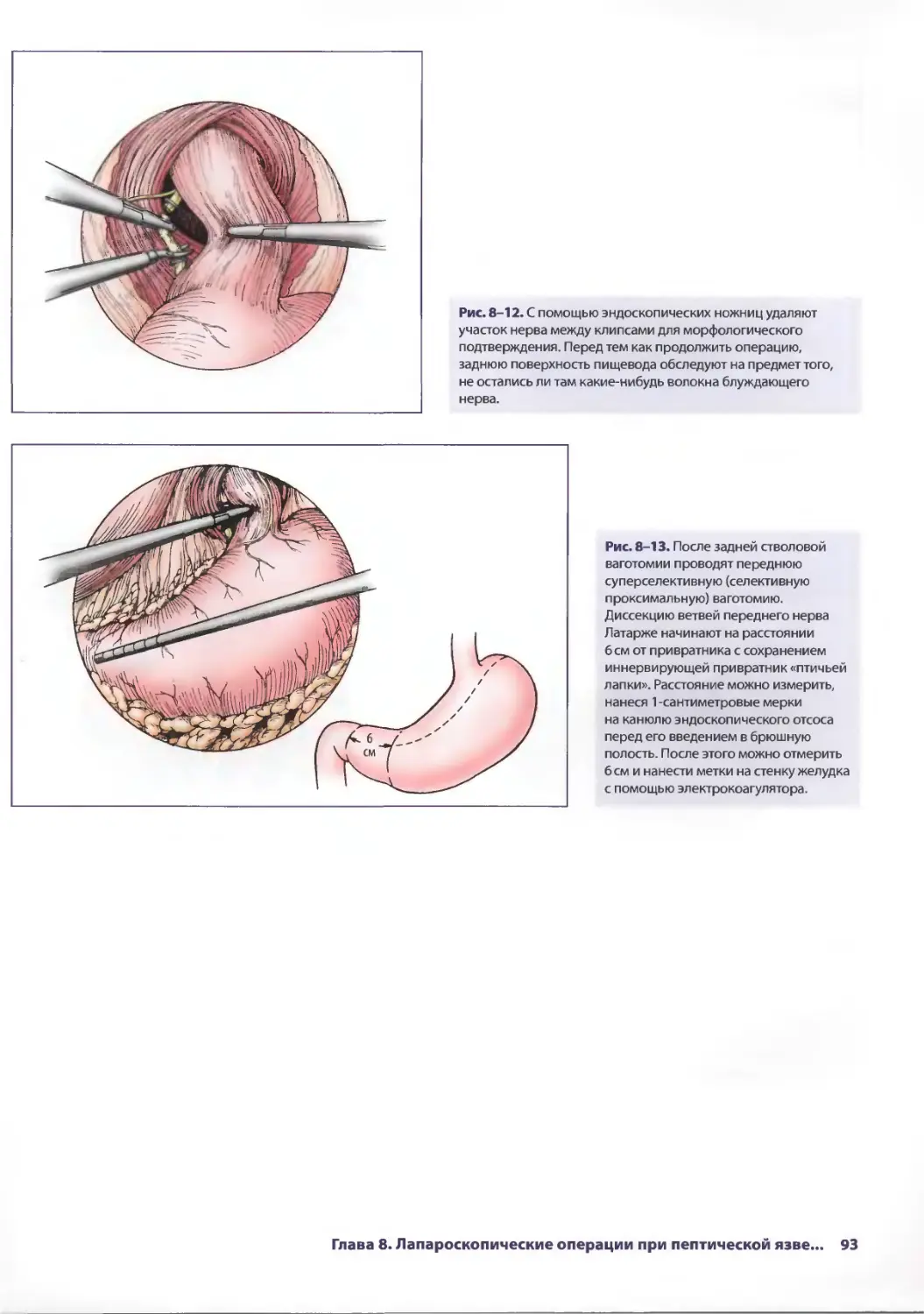
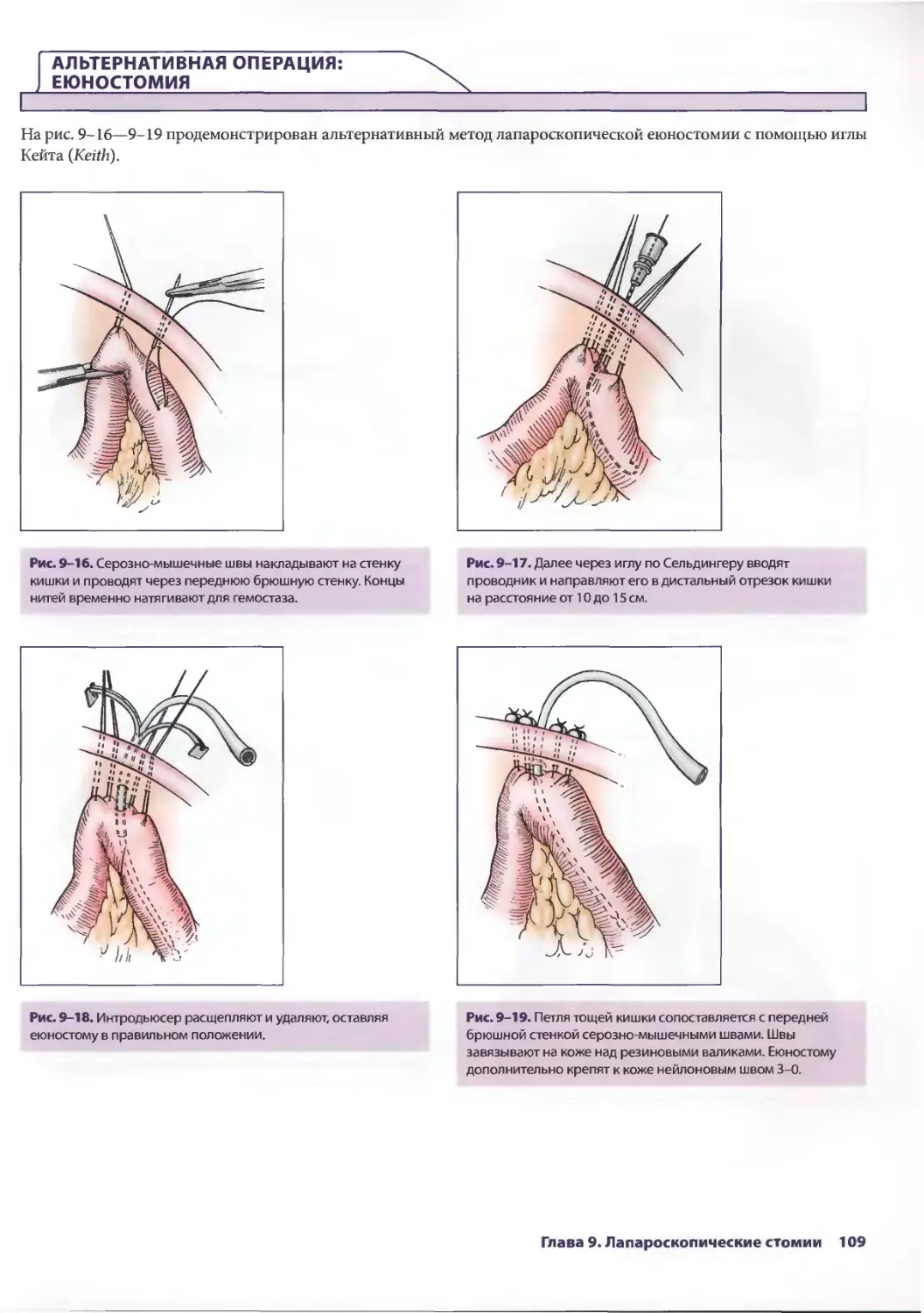
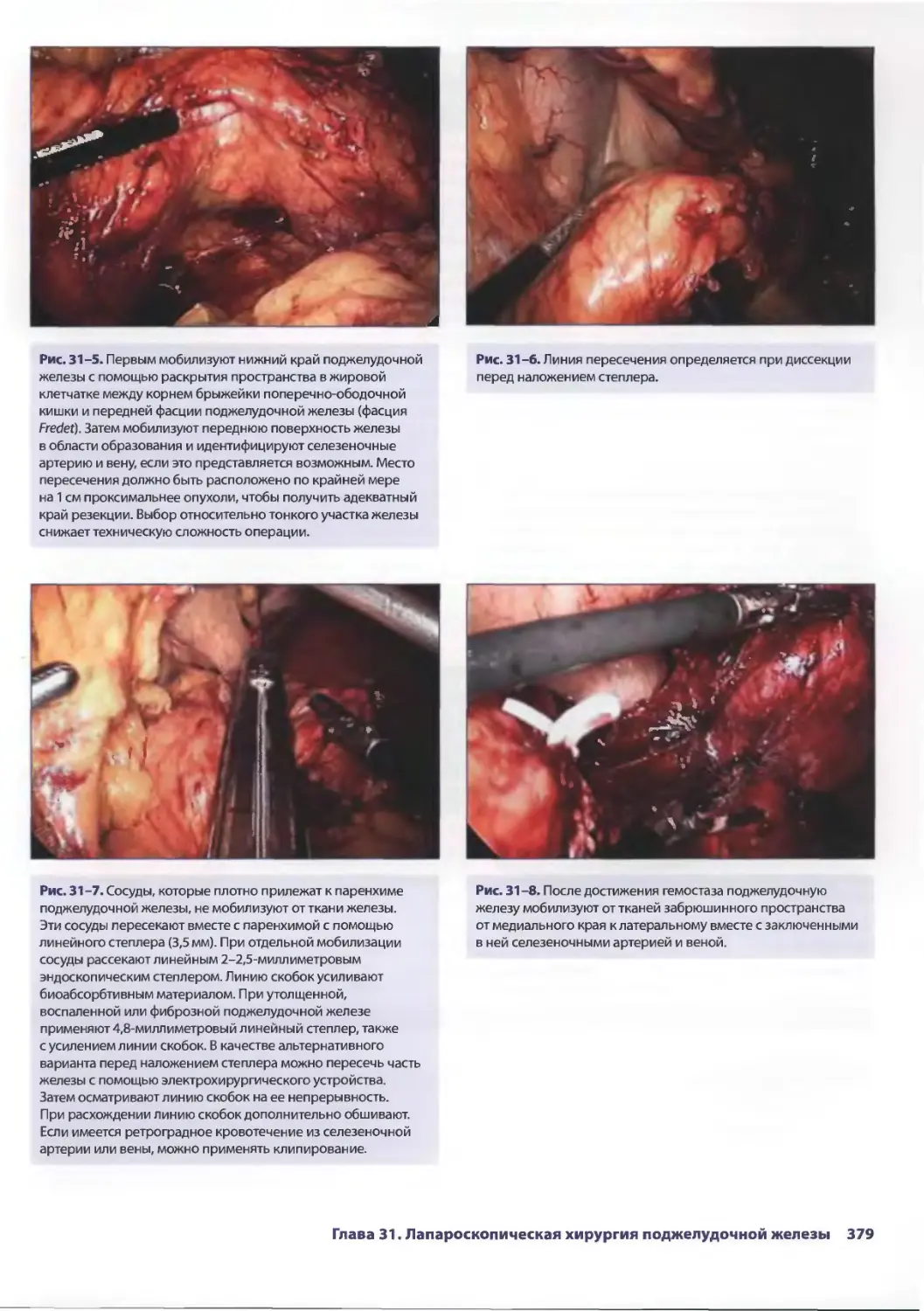
Рис. 2-5. Мочевой пузырь исследуют на предмет
повреждения. При этом можно обнаружить кровоподтеки
на стенке мочевого пузыря или истечение мочи. На данном
этапе в правый верхний квадрант живота можно установить
5-миллиметровый троакар, через который вводят тонкий
зажим. Это позволяет хирургу лучше осмотреть полость таза
с помощью тракции за мочевой пузырь.
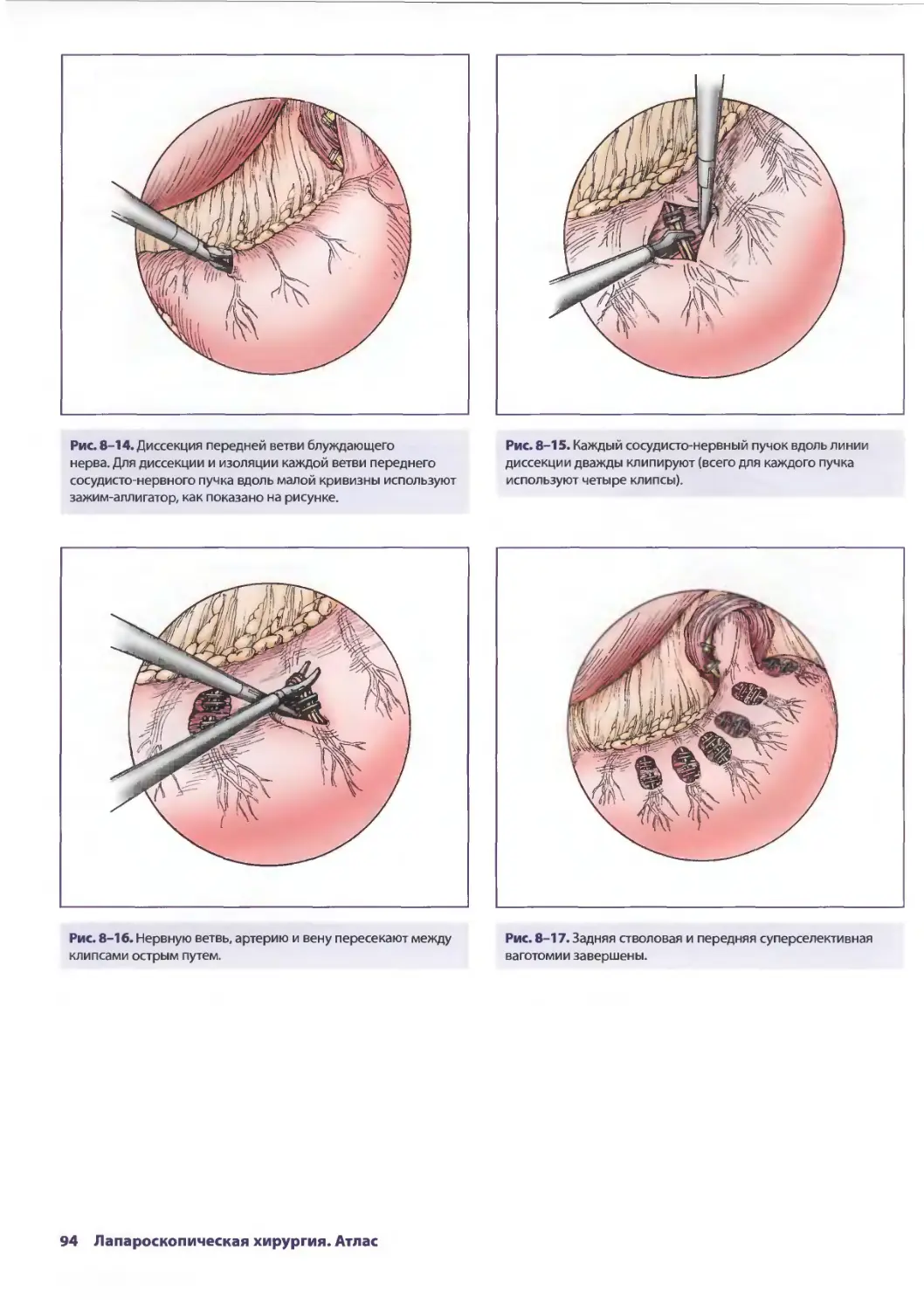
Рис. 2-7. Проводят ревизию правого бокового канала
на предмет повреждения забрюшинного пространства.
Кровоизлияния являются важным признаком, указывающим
на повреждение этой области. Если подозревают
повреждение забрюшинного пространства (что можно
предположить на основе локализации входного отверстия
раны), рекомендуется мобилизация забрюшинной части
восходящей ободочной кишки.
Рис. 2-6. Далее исследуют правый нижний квадрант живота.
Пациент остается в наклонном 30-градусном положении
Тренделенбурга, но стол ротируют вокруг продольной
оси на 30° влево. Это позволяет лучше осмотреть правый
нижний квадрант. Хирург сейчас внимательно осматривает
слепую кишку и восходящую ободочную кишку, оценивая
проникающие ранения передней поверхности ободочной
кишки. Кровотечение, кишечное содержимое, кровоизлияния
в стенке указывают на повреждение кишки.
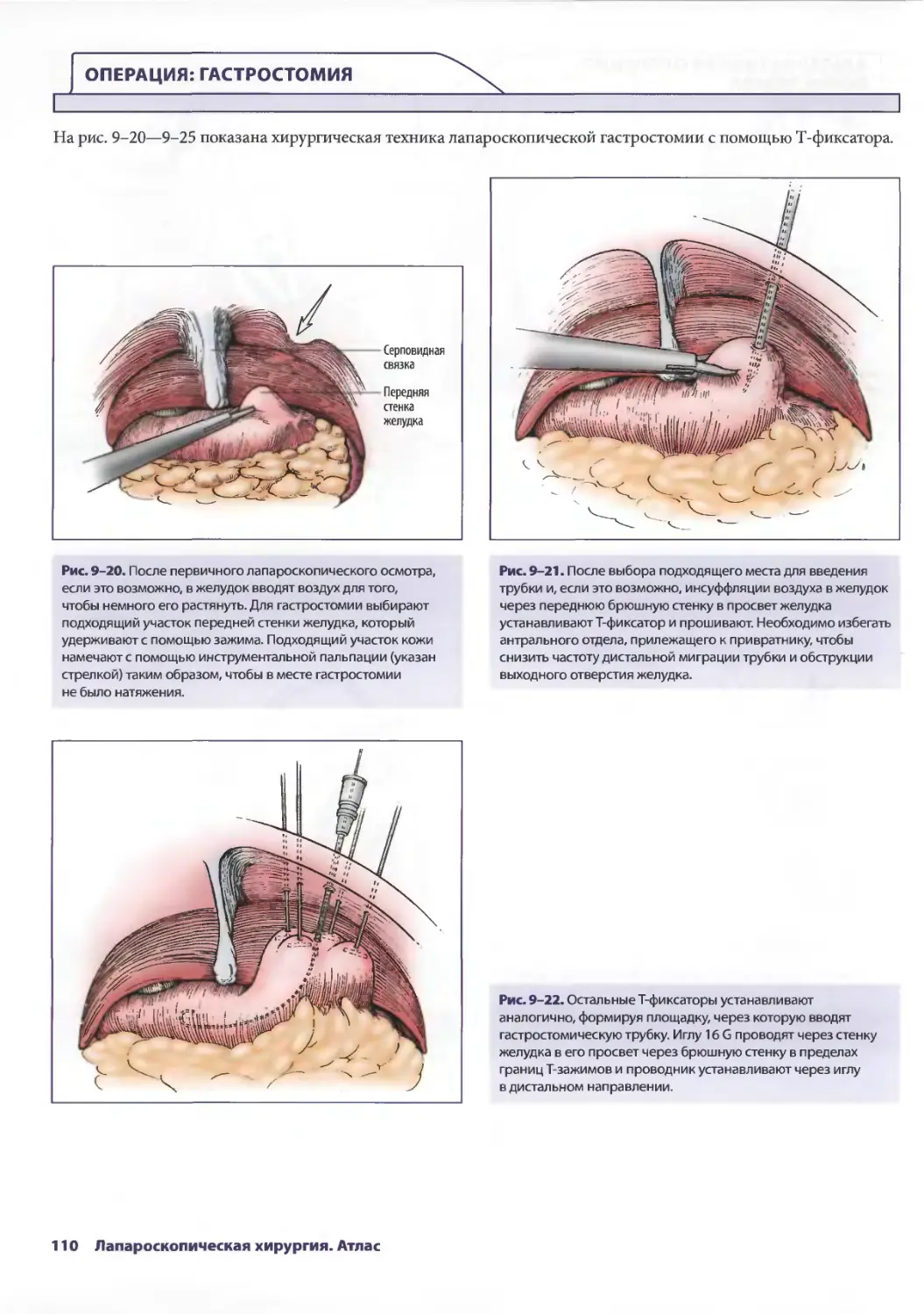
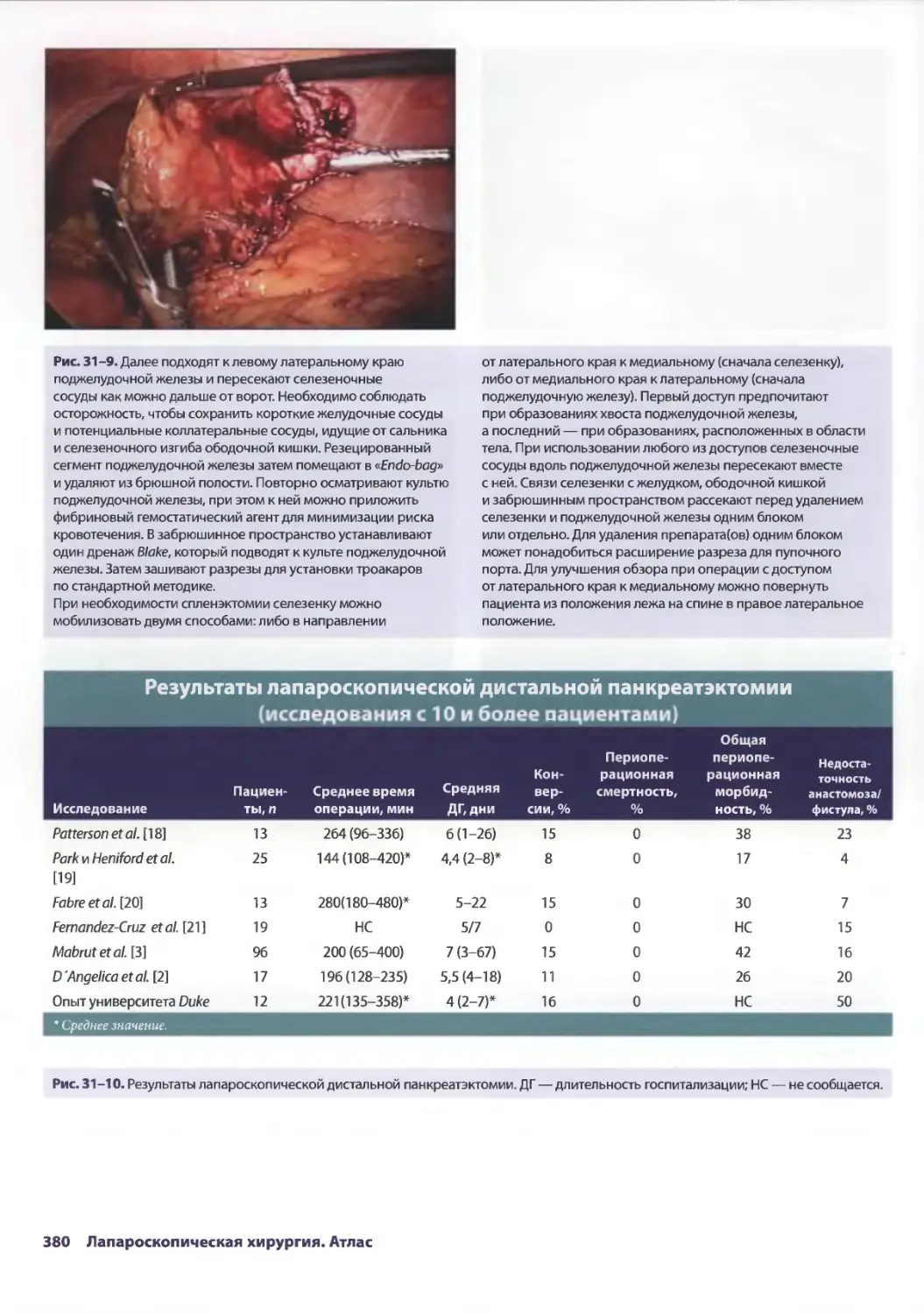
Рис. 2-8. На данном этапе проводят ревизию печени
и содержимого верхнего правого квадранта живота.
Операционный стол выравнивают. Печень лучше осматривать
с помощью зажима. Переднюю и латеральную поверхности
правой доли можно легко осмотреть с применением
минимума манипуляций.
26 Лапароскопическая хирургия. Атлас
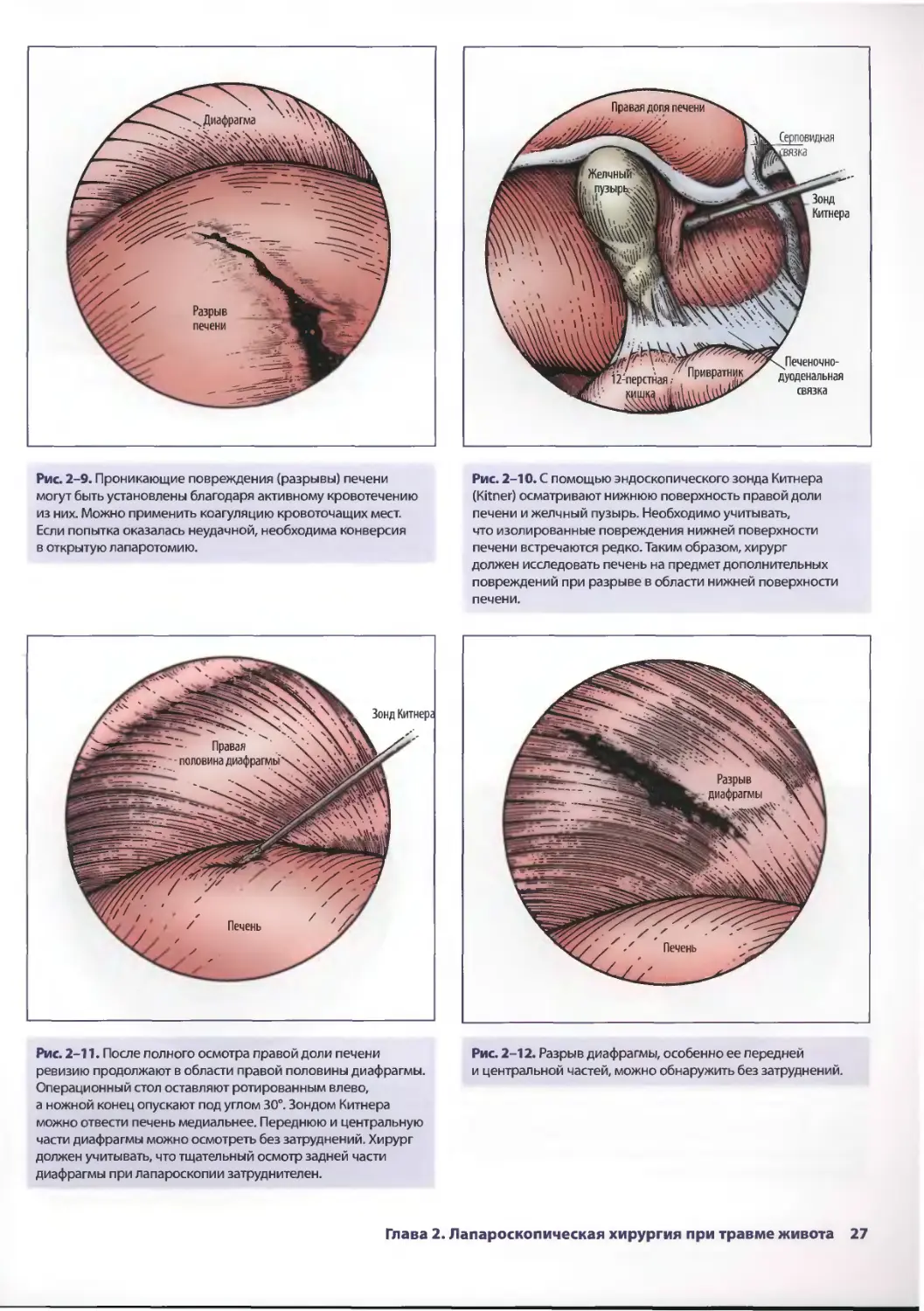
Рис. 2-9. Проникающие повреждения (разрывы) печени
могут быть установлены благодаря активному кровотечению
из них. Можно применить коагуляцию кровоточащих мест.
Если попытка оказалась неудачной, необходима конверсия
в открытую лапаротомию.
Рис. 2-11. После полного осмотра правой доли печени
ревизию продолжают в области правой половины диафрагмы.
Операционный стол оставляют ротированным влево,
а ножной конец опускают под углом 30°. Зондом Китнера
можно отвести печень медиальнее. Переднюю и центральную
части диафрагмы можно осмотреть без затруднений. Хирург
должен учитывать, что тщательный осмотр задней части
диафрагмы при лапароскопии затруднителен.
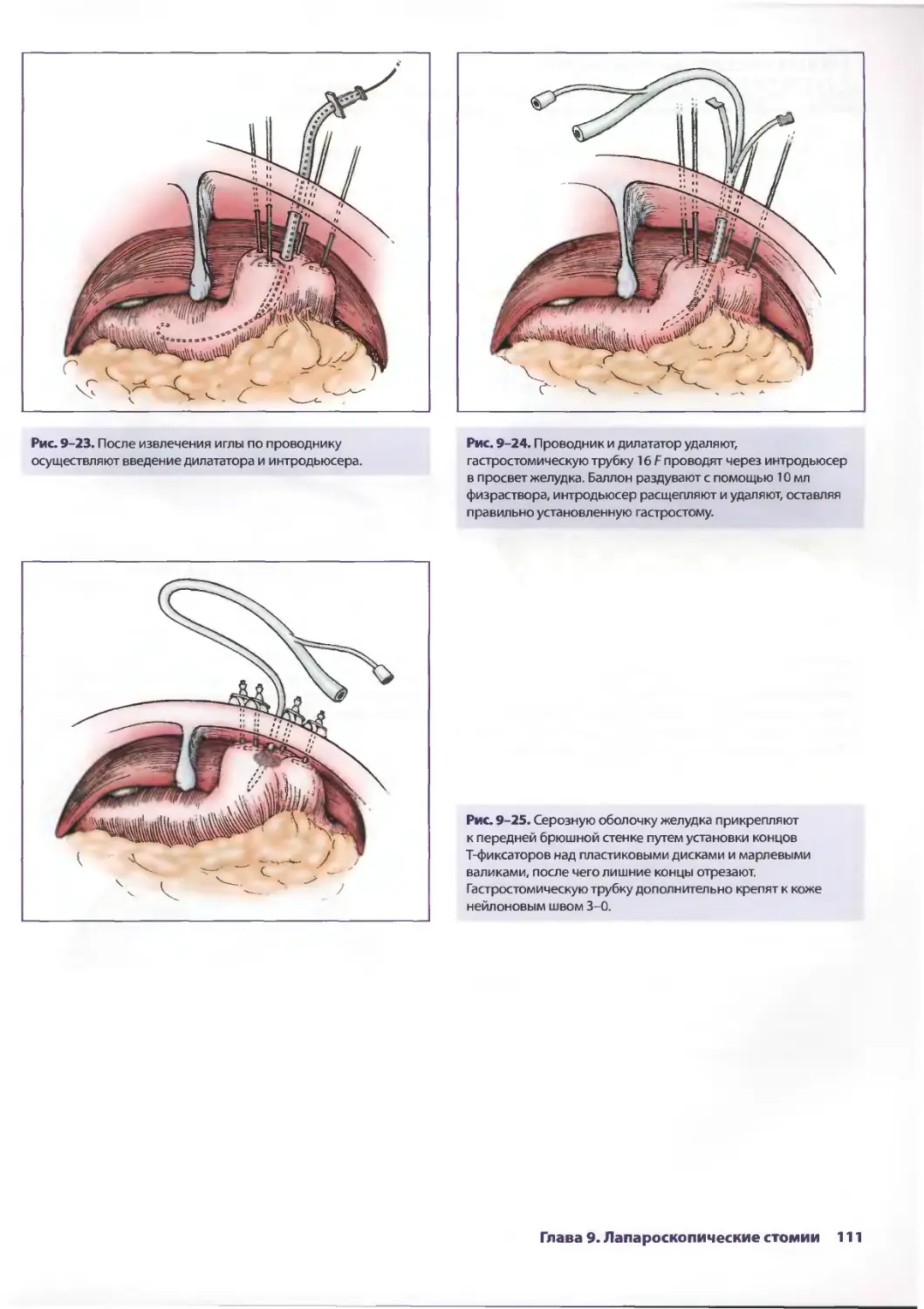
Рис. 2-10. С помощью эндоскопического зонда Китнера
(Kitner) осматривают нижнюю поверхность правой доли
печени и желчный пузырь. Необходимо учитывать,
что изолированные повреждения нижней поверхности
печени встречаются редко. Таким образом, хирург
должен исследовать печень на предмет дополнительных
повреждений при разрыве в области нижней поверхности
печени.
Рис. 2-12. Разрыв диафрагмы, особенно ее передней
и центральной частей, можно обнаружить без затруднений.
Глава 2. Лапароскопическая хирургия при травме живота 27
Рис. 2-13. Отрыв центральной части диафрагмы,
обнаруженный при лапароскопии.
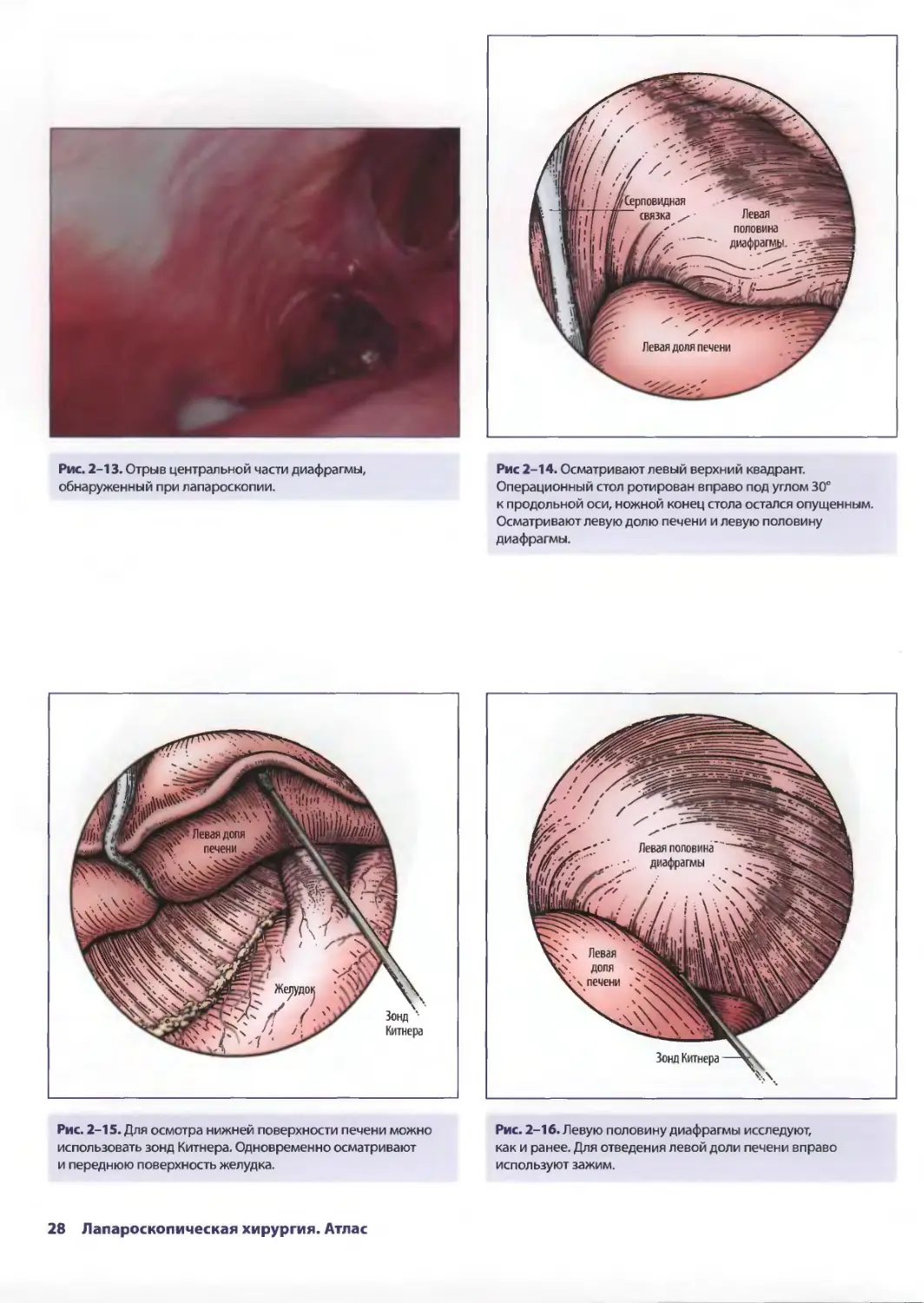
Рис. 2-15. Для осмотра нижней поверхности печени можно
использовать зонд Китнера. Одновременно осматривают
и переднюю поверхность желудка.
Рис 2-14. Осматривают левый верхний квадрант.
Операционный стол ротирован вправо под углом 30°
к продольной оси, ножной конец стола остался опущенным.
Осматривают левую долю печени и левую половину
диафрагмы.
Рис. 2-16. Левую половину диафрагмы исследуют,
как и ранее. Для отведения левой доли печени вправо
используют зажим.
28 Лапароскопическая хирургия. Атлас
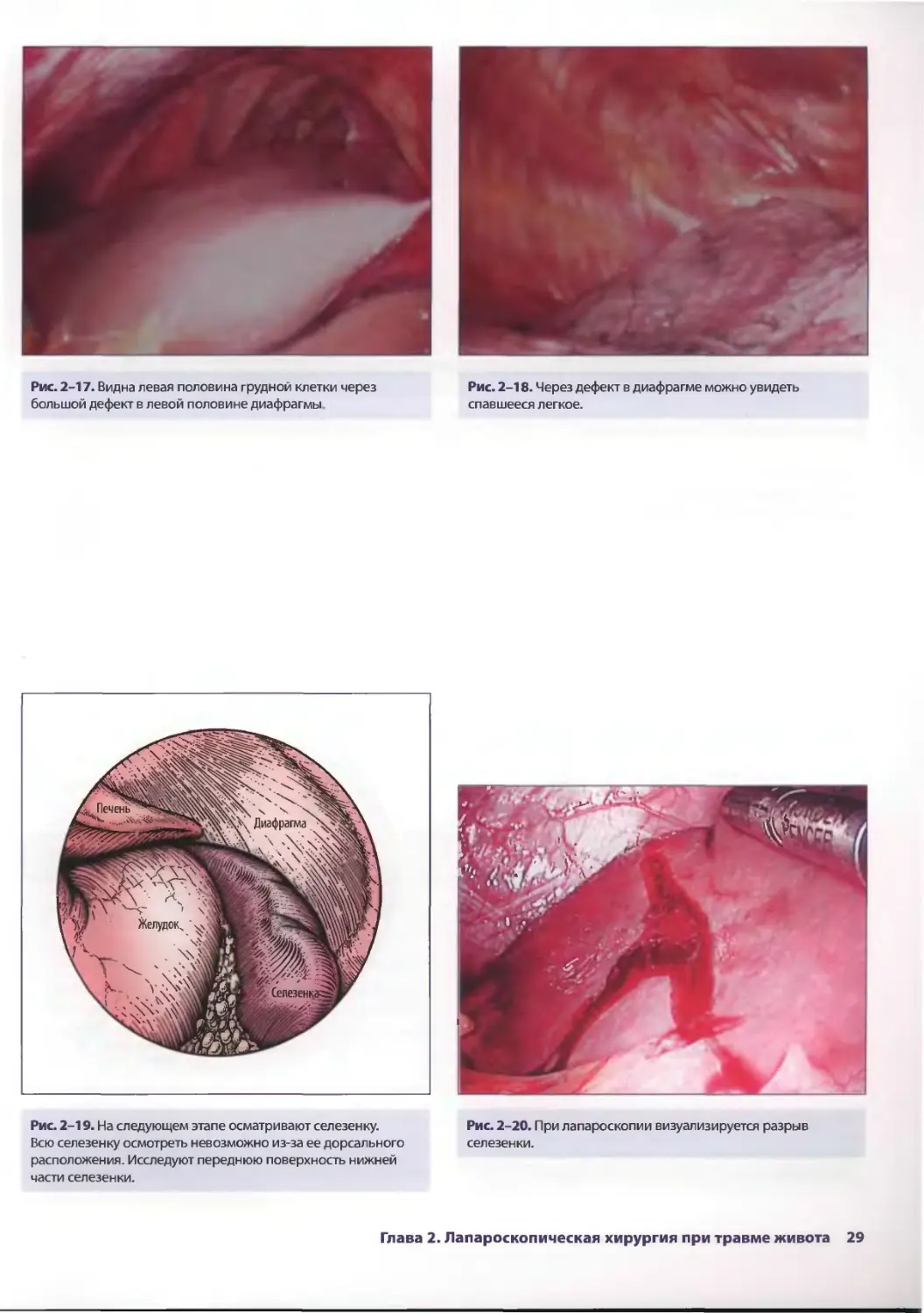
Рис. 2-17. Видна левая половина грудной клетки через
большой дефект в левой половине диафрагмы.
Рис. 2-18. Через дефект в диафрагме можно увидеть
спавшееся легкое.
Рис. 2-19. На следующем этапе осматривают селезенку.
Всю селезенку осмотреть невозможно из-за ее дорсального
расположения. Исследуют переднюю поверхность нижней
части селезенки.
Рис. 2-20. При лапароскопии визуализируется разрыв
селезенки.
Глава 2. Лапароскопическая хирургия при травме живота 29
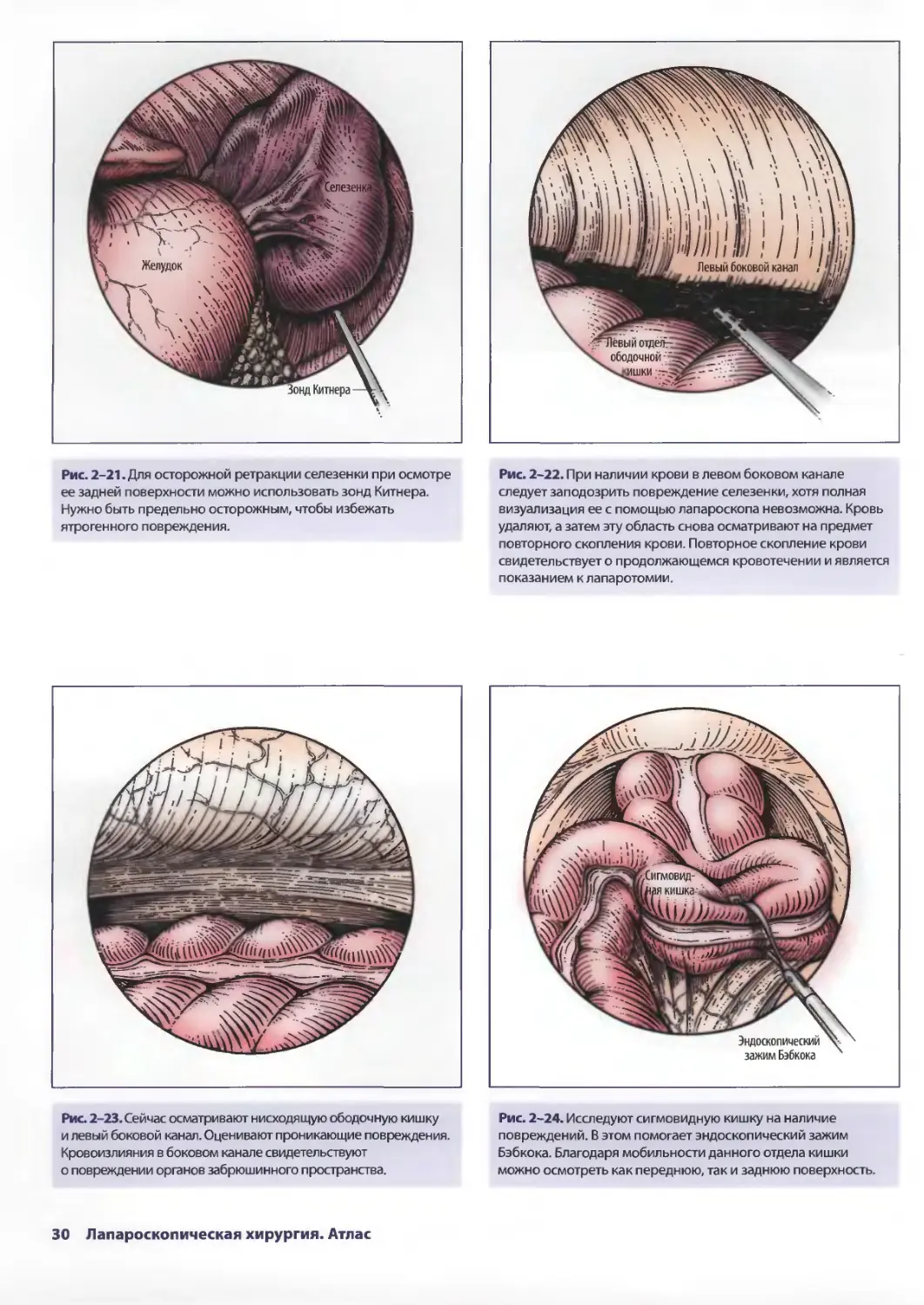
Рис. 2-21. Для осторожной ретракции селезенки при осмотре
ее задней поверхности можно использовать зонд Китнера.
Нужно быть предельно осторожным, чтобы избежать
ятрогенного повреждения.
Рис. 2-23. Сейчас осматривают нисходящую ободочную кишку
и левый боковой канал. Оценивают проникающие повреждения.
Кровоизлияния в боковом канале свидетельствуют
о повреждении органов забрюшинного пространства.
Рис. 2-22. При наличии крови в левом боковом канале
следует заподозрить повреждение селезенки, хотя полная
визуализация ее с помощью лапароскопа невозможна. Кровь
удаляют, а затем эту область снова осматривают на предмет
повторного скопления крови. Повторное скопление крови
свидетельствует о продолжающемся кровотечении и является
показанием к лапаротомии.
Рис. 2-24. Исследуют сигмовидную кишку на наличие
повреждений. В этом помогает эндоскопический зажим
Бэбкока. Благодаря мобильности данного отдела кишки
можно осмотреть как переднюю, так и заднюю поверхность.
30 Лапароскопическая хирургия. Атлас
Рис. 2-25. Эвентрация через резаную рану передней
брюшной стенки. Хирург имеет два варианта действий:
зашить дефект для создания пневмоперитонеума
и проведения диагностической лапароскопии или сделать
экстренную лапаротомию.
Показания
Относительные показания и противопоказания к лапароскопии
ри тупой и проникающей травме
Противопоказания
ПРОНИКАЮЩАЯ
Скрининг при проникающей травме брюшной полости,
нанесенной по тангенциальной траектории.
Скрининг при торакоабдоминальных травмах слева на
наличие повреждения диафрагмы.
Лечение резаных ран передней брюшной стенки.
При сомнениях в постановке диагноза после осмотра живота
ТУПАЯ
При сомнениях в постановке диагноза после осмотра живота
ТУПАЯ и ПРОНИКАЮЩАЯ
Гемодинамическая нестабильность.
Очевидный перитонит.
Повреждение кишечника с попаданием содержимого
в брюшную полость.
Травма головного мозга
ЗАКЛЮЧЕНИЕ
Лапароскопия при травмах живота наиболее
необходима для скрининга, особенно при проникающих
повреждениях брюшной полости, но противопоказана
при травмах головного мозга. Лапароскопия позволяет
снизить количество диагностических (нелечебных) ла-
паротомий и выявить повреждения диафрагмы при
левосторонних торакоабдоминальных травмах.
СПИСОК ЛИТЕРАТУРЫ
Short A.R. The uses of celioscopy // Br. Med. J.
P. 254-255.
1925. — Vol. 2.
2. Stone W.E. Intra-abdominal examination by the aid of the
peritoneoscope // J. Kans. Med. Soc. — 1924. — Vol. 24. — P. 63-65.
3. Wood D., Berci G., Morgenstern L. et al. Mini-laparoscopy in blunt
abdominal trauma // Surg. Endosc. — 1988. — Vol. 2. — P. 184-189.
4. Ivatury R.R., Simon R.J., Stahl W.M. Selective celiotomy for missile
wounds of the abdomen based on laparoscopy // Surg. Endosc. —
1994. — Vol. 8. — P. 366-370.
5. Fabian T.C., Croce M.A., Stewart R. M. et al. A prospective analysis
of diagnostic laparoscopy in trauma // Ann. Surg. — 1993. —
Vol. 217. — P. 557-565.
6. Elliot D.C., Rodriguez A., Moncure M. et al. The accuracy of
diagnostic laparoscopy in trauma patients: a prospective controlled
study // Int. Surg. — 1998. — Vol. 83. — P. 294-298.
7. Livingston D.H., Tortella B.J., Blackwood J. et al. The role of
laparoscopy in abdominal trauma // J. Trauma. — 1992. —
Vol. 33. — P. 471-475.
8. Leppaniemi A.K., Elliot D.C. The role of laparoscopy in blunt
abdominal trauma // Ann. Med. — 1996. — Vol. 28. — P. 483-489.
9. Root H.O., Hauser C.W., Mc Kinley C.R. et al. Diagnostic peritoneal
lavage // Surgery. — 1965. — Vol. 57. — P. 633-637.
10. Villavicencio R.T., Aucar J.A. Analysis of laparoscopy in trauma // J.
Am. Coll. Surg. — 1999. — Vol. 189. — P. 11-20.
11. Zantut L.E, Ivatury R.R., Smith R.S. et al. Diagnostic and
therapeutic laparoscopy for penetrating abdominal trauma: a multi-
center experience // J. Trauma. — 1997. — Vol. 42. — P. 825-831.
12. Leppaniemi A., Haapiainen R. Diagnostic laparoscopy in
abdominal stab wounds: a prospective, randomized study //
J. Trauma. — 2003. — Vol. 55. — P. 636-645.
Глава 2. Лапароскопическая хирургия при травме живота 31
13. Ahmed N., Whelan J., Brownlee J. et al. The contribution of
laparoscopy in evaluation of penetrating abdominal wounds //
J. Am. Coll. Surg. — 2005. — Vol. 201. — P. 213-216.
14. Mc Quay N., Britt L.D. Laparoscopy in the evaluation of penetrating
thoracoabdominal trauma // Am. Surg. — 2003. — Vol. 69. —
P. 788-791.
15. Demetriades D., Velmahos G. Technology-driven triage
of abdominal trauma: the emerging era of nonoperative
management // Annu. Rev. Med. — 2003. — Vol. 54. — P. 1-15.
16. Murray J.A., Demetriades D., Cornwell E.E. et al. Penetrating left
thoracoabdominal trauma: the incidence and clinical presentation of
diaphragm injuries // J. Trauma. — 1997. — Vol. 43. — P. 624-626.
17. Ivatury R.R., Simon R.J., Weksler B. et al. Laparoscopy in the
evaluation of the intrathoracic abdomen after penetrating injury //
J. Trauma. — 1992. — Vol. 33. — P. 101-109.
18. Ivatury R.R., Simon R.J., Stahl W.M. A critical evaluation of
laparoscopy in penetrating abdominal trauma // J. Trauma. —
1993. — Vol. 34. — P. 822-828.
19. Murray J.A., Demetriades D., Asensio J. et al. Occult injuries to the
diaphragm: prospective evaluation of laparoscopy in penetrating
injuries to the left lower chest // J. Am. Coll. Surg. — 1998. —
Vol. 107. — P. 626-630.
20. Friese R.S., Coin C.E., Gentilello L.M. Laparoscopy is sufficient
to exclude occult diaphragm injury after penetrating abdominal
trauma // J. Trauma. — 2005. — Vol. 58. — P. 789-792.
21. Ortega A.E., Tang E., Froes E.T. et al. Laparoscopic evaluation
of penetrating thoracoabdominal traumatic injuries // Surg.
Endosc. — 1996. — Vol. 10. — P. 19-22.
22. Citerio G., Vascotto E., Villa F. et al. Induced abdominal
compartment syndrome increases intracranial pressure in
neurotrauma patients: a prospective study // Crit. Care. Med. —
2001. — Vol. 29. — P. 1466-1471.
23. Poole G.V, Thomae K.R., Hauser C.J. Laparoscopy in trauma //
Surg. Clin. North Am. — 1996. — Vol. 76. — P. 547-556.
24. Holthausen U.H., Nagelschmidt M., Troidl H. C02
pneumoperitoneum: what we know and what we need to know //
World. J. Surg. — 1999. — Vol. 23. — P. 794-800.
32 Лапароскопическая хирургия. Атлас
1
Лапароскопическая
паховая герниорафия
Лоретта Эрунмвунсе, Лиза Кларк-Пикетт
Шахаб А. Акхтер, Стив Эбэнкс
шша®
Год Исследование
ткая история хирургии гр
Страна Вклад
1556
1756
1778
1793
1804
1806
1809
1871
1884
Pierre Franco [11]
PervicalPottlU]
August Gottlieb Richter
[13]
Arbos Gimbernat [11]
SirAstley Paston Cooper
[15,16]
Franz Casper Hesselbach
[17,18]
Antonio Scarpa [15,16]
Henry 0. Marcy [21,22]
Edoardo Bassini [23]
Франция
Англия
Германия
Испания
Англия
Германия
Италия
Бостон
Италия
1889 William S. Hoisted [24]
Балтимор
1898 Georg Lothaissen [25] Австрия
1942 Chester В. McVay [26,27] Южная Дакота
1920 Sir George Lenthal Cheatle Англия
[28]
1936 Arnold Kirkpatrick Henry Чикаго
[29]
1960-e LloydNyhus [30,31 ] Сиэтл, Чикаго
1975 ReneE.Stoppa [32,33] Дублин, Каир
1969 Edwin W. Shearburn Канада
Richard N. Myers [34]
1970 Irving L. Lichtenstein [35] Лос-Анджелес
1989 Irving L Lichtenstein [36] Лос-Анджелес
Анатомическая эра
Первое описание операции при ущемленной грыже
Опубликовал научный трактат о грыжах, содержавший первое
упоминание о врожденной природе косых грыж
Описал лакунарную (жимбернатову) связку
Описал верхнюю лонную связку, поперечную фасцию и замыкательный
механизм внутренней косой и поперечной мышц
Описал подвздошно-лонный тракт и треугольник Хессельбаха
Опубликовал классический трактат о кремастерной фасции (фасции
Скарпа) и скользящих грыжах
Ранние сообщения о хирургическом лечении грыж
Описал реконструкцию дна пахового канала с помощью сопоставления
поперечной фасции и паховой связки (способ Бассини)
Описал реконструкцию дна пахового канала с транспозицией семенного
канатика (операцию Халстеда 1)
Описал пластику с использованием связки Купера
Повторно ввел в практику и популяризировал пластику с использованием
связки Купера (способ Мак-Вэя)
Ввел в практику преперитонеальную пластику
Повторно открыл способ преперитонеальной пластики
Популяризировал преперитонеальную пластику с использованием
подвздошно-лонного тракта
Сообщение о пластике гигантской грыжи с применением протеза;
современные методы пластики
Описали многослойную пластику дна паховой области (способ
Шоулдаиса)
Популяризировал амбулаторную хирургию грыж
Ввел в практику ненатяжную первичную пластику с применением сетки
Рис. 3-1. Краткая история хирургии грыж.
Глава 3. Лапароскопическая паховая герниорафия 33
История
Год Исследование
1990
1990
1991
1991
1992
1992
1992
1993
1995
1996
2005
Geretal. [37]
Schultzetal. [38]
Spawetal. [39]
Toy и Smoot [40]
Gazayerli [41 ]
Dion и Mow? [42]
McKeman [43-45]
MacFayden etal. [46]
Fitzgibbons et al. [47]
Schrenketal. [48]
McCormack et al.
[49,50]
Сообщил о лапароскопической пластике косых грыжевых дефектов у собак
Описал лапароскопическую паховую герниорафию по методике «затычка и лоскут» (plug and
patch)
Детально описал анатомию при лапароскопическом доступе
Описал внутрибрюшную лоскутную пластику {onlay patch)
Описал лапароскопическую анатомическую реконструкцию и лоскутную пластику
Описали трансабдоминальный лоскутный преперитонеальный доступ (ТАРР)
Описал полностью экстраперитонеальную технику (ТЕР)
Первый большой обзор осложнений и результатов
Мультицентровое исследование, сравнивающее ТАРР, ТЕР и внутрибрюшную сетчатую пластику
Небольшое рандомизированное контролируемое исследование, сравнивающее ТАРР, ТЕР.
Различий в результатах выявлено не было
Метаанализ, сравнивающий ТАРР, ТЕР и открытые техники с применением сетки
Рис. 3-2. История лапароскопической паховой герниорафии.
Пластика паховой грыжи — наиболее часто
выполняемая в США хирургическая операция, которая
является ядром общей хирургии [1]. Ежегодно для лечения
прямых и косых паховых грыж проводят более 750 000
таких операций. Техника пластики паховой грыжи
развивалась в течение двух последних веков (рис. 3-1)
[методы Бассини (Bassini), Мак-Вэя (McVay), Шоулдайса
(Shouldice), основанные на использовании собственных
тканей]. Позднее была внедрена методика ненатяжной
пластики с использованием сетки в качестве попытки
уменьшить послеоперационные боли и количество
рецидивов [2]. Лапароскопическая пластика была
разработана в начале 1990-х гг. (рис. 3-2), и в настоящее
время 14% таких операций выполняют лапароскопически
[1]. Используется несколько методик, две из которых
описаны ниже.
На рис. 3-3 и 3-4 представлена анатомия паховой
области.
Латеральная пупочная складка
нижние эпигастральные сосуду
Медиальная пупочная складка
Срединная пупочная складка
Семенные
сосуды -
Наружные
подвздошные
сосуды
«Роковой треугольник»
Семявыносящий
проток
Рис. 3-3. Вид при лапароскопии левой
мужской паховой области с интактной
брюшиной. Использование лапароскопа
открыло хирургам новые перспективы
в анатомии паховой области.
При первичном осмотре левой паховой
области у мужчины определяются
следующие ориентиры: 1 — мочевой
пузырь и срединная пупочная складка
(рудимент урахуса), которые находятся
в центре; 2 — медиальная пупочная
складка; 3 — латеральная пупочная
складка (указывает на локализацию
нижних эпигастральных сосудов);
4 — сосуды семенного канатика; 5 —
семявыносящий проток. «Роковой
треугольник», ограниченный сосудами
семенного канатика и семявыносящим
протоком, указывает место прохождения
наружных подвздошных сосудов
и бедренного нерва.
34 Лапароскопическая хирургия. Атлас
Нижние
эпигастральные
сосуды
Внутреннее
паховое кольцо
Латеральный
бедренно-
кожный нерв
Зона
«электрической
опасности
Бедренно-
половой нерв
Мышечно-
апоневротическая дуга
поперечной мышцы
живота
Латеральная граница
прямой мышцы живота
— Подвздошно-лонный тракт
Лоно
Связка Купера
Семявыносящий
проток
Рис. 3-4. Вид при лапароскопии левой
мужской паховой области с удаленной
брюшиной. После удаления брюшины
топографическая анатомия этой области
становится более понятной. Важно
отметить следующие структуры: 1 —
образования, к которым крепят сетку
во время пластики паховой грыжи (связка
Купера, лонная кость, латеральная
граница прямой мышцы живота);
2 — подвздошно-лонный тракт —
утолщение апоневроза поперечной
мышцы живота, расположенное сразу
кзади от паховой связки; 3 — нижние
эпигастральные сосуды, конечные
ветви наружной подвздошной артерии
и вены перед их входом под паховую
связку; 4 — сосуды семенного канатика
и семявыносящий проток; 5 — зона
«электрической опасности», которая
содержит латеральный бедренный нерв,
генитальные ветви бедренного нерва
и бедренно-половой нерв. Сейчас можно
легко определить локализацию разных
видов грыж. Различают косую (К), прямую
(П) и бедренную (Б) грыжи.
ПАТОФИЗИОЛОГИЯ, КЛИНИЧЕСКИЕ
ПРОЯВЛЕНИЯ И ДИФФЕРЕНЦИАЛЬНАЯ
ДИАГНОСТИКА
Прямая грыжа возникает вследствие первичного
дефекта в задней стенке пахового канала, которая
представлена апоневрозом поперечной мышцы живота
и поперечной фасцией. В большинстве случаев
паховая грыжа развивается в процессе старения, а
предрасполагающими факторами являются подъемы внутри-
брюшного давления при кашле, запорах, гиперплазии
простаты и ожирении. Биохимические исследования
показали, что причиной образования паховых грыж
является снижение синтеза коллагена у взрослых [3].
Косая паховая грыжа выходит через внутреннее
паховое кольцо, по ходу гонадных сосудов и семявыно-
сящего протока (или круглой связки матки у женщин).
Яички (после их опускания в процессе
внутриутробного развития) в норме покрыты участком брюшины
(белочной оболочкой) и связаны с брюшной полостью
влагалищным отростком брюшины. В норме
происходят инволюция влагалищного отростка и отделение
брюшной полости от полости мошонки. Косые грыжи
являются результатом необлитерированного отростка,
когда грыжевое содержимое проникает через
внутреннее паховое кольцо и входит в мошонку. Таким
образом, большинство косых грыж имеют врожденный
характер развития1.
Бедренная грыжа выходит через дефект в дне
пахового канала кзади от паховой связки вдоль бедренных
1 Это утверждение спорно.
сосудов и поэтому в классификации стоит отдельно
от прямых и непрямых грыж. Патогенез бедренных
грыж, возможно, сходен с патогенезом прямых
паховых грыж и считается результатом слабости волокон
подвздошно-лонного тракта, где бедренные сосуды пе-
нетрируют фасцию.
Паховая грыжа обычно проявляется постоянным
или периодическим, болезненным или
безболезненным выпячиванием. Жалобы на наличие этого
выпячивания часто возникают или усиливаются в
положении стоя или при физической нагрузке. При сборе
анамнеза необходимо выяснить возможные
предрасполагающие факторы, такие как хроническая об-
структивная болезнь легких, запоры, цирроз печени
с асцитом. Для того чтобы результаты операции были
надежными, необходимо лечить эти сопутствующие
заболевания.
Диагноз обычно можно поставить уже при
объективном осмотре. Необходимо сначала осмотреть
пациента в положении стоя, затем — лежа. Паховые области
осматривают на наличие выпячиваний. Яички и
семенной канатик пальпируют, чтобы выявить содержимое
брюшной полости в грыжевом мешке или
болезненность. Для диагностики прямой грыжи дно пахового
канала пальпируют во время пробы Вальсальвы.
Возникновение боли при натуживании позволяет
предположить наличие грыжи, но не установить
окончательный диагноз. Многие заболевания вызывают
болезненность или увеличение в размерах паховой области,
поэтому в случае атипичной симптоматики следует
провести дифференциальную диагностику (рис. 3-5).
Глава 3. Лапароскопическая паховая герниорафия 35
Дифференциальная диагностика
при паховой грыже
Гидроцеле (сообщающееся и несообщающееся)
Варикоцеле
Липома семенного канатика
Боли в скелетных мышцах (тяжесть в паху)
Пубалгия у атлетов
Инфекции мочевыводящих путей
Простатит
Аневризма или псевдоаневризма бедренной артерии
Паховая аденопатия
Гематома (серома) после ранее проведенной операции
Аппендицит
Рак яичка
Эпидидимит
Эпидермальная киста
Гнойный гидроаденит
Периректальный абсцесс
Гастроэнтерит
Дивертикулит
Абсцесс брюшной полости
Колоректальный рак
Трубная беременность
Воспалительное заболевание органов таза
Абсцесс в области поясничной мышцы
Гематома влагалища прямой мышцы живота
Перекрутяичника
Неопущение яичка
Сперматоцеле
Рис. 3-5. Дифференциальная диагностика при паховой грыже.
В отдельных случаях оперативное лечение может быть
проведено и при отсутствии признаков заболевания
при осмотре, если данные анамнеза с большой
вероятностью позволяют предположить диагноз грыжи.
ЭКСКУРС В ЛАПАРОСКОПИЧЕСКУЮ
ГЕРНИОПЛАСТИКУ
В конце 1980-х гг. была предложена методика ненатяжной
открытой герниопластики с использованием сетки.
Целью этой методики было снизить количество рецидивов
и частоту хронического болевого синдрома, которые были
характерны для открытых пластик грыжи на основе
собственных тканей по Бассини (Bassini), Мак-Вэю (McVay)
и Шоулдайсу (Shouldice) [2]. В результате использования
сетки частота развития рецидивов снизилась с 15 до 5%
[4]. Лапароскопическая герниопластика была
предложена для дальнейшего улучшения результатов.
Лапароскопическая герниорафия завоевала
популярность, так как, по данным многих исследований,
пациенты после лапароскопии отмечают менее выраженный
болевой синдром, более быстрое выздоровление,
лучшие косметические результаты и более короткий
восстановительный период [1, 4, 5]. Однако исследования
также показали, что лапароскопическая герниопластика
имеет более высокую стоимость, большую длительность
операции и большее количество серьезных осложнений,
связанных с лапароскопией [1]. В результате проведения
проспективного исследования в госпитале
администрации ветеранов (VA), включившего 1700 пациентов, было
обнаружено, что лапароскопические пластики
сопровождались меньшей послеоперационной болезненностью
и более быстрым выздоровлением. Исследование также
выявило более высокий уровень рецидивов (10
против 5% через два года после операции) и более
высокий уровень послеоперационных осложнений (39
против 33% для открытого доступа) после лапароскопии,
чем при открытом доступе [7].
Приверженцы лапароскопической герниорафии
отмечают, что многие ранние сравнительные
исследования были проведены в тот период, когда эта методика
еще находилась на стадии разработки и использовались
сетки меньшего размера. Именно поэтому, как они
полагают, количество осложнений было таким высоким.
Arregui et al. [7] также напоминают о том, что
количество рецидивов в госпитале ветеранов было намного
ниже у наиболее опытных хирургов, и предполагают,
что высокий уровень рецидивов в этом исследовании
объяснялся тем, что сложные операции проводили
неопытные резиденты. Кроме того, многие исследования,
подтвердившие преимущества лапароскопического
грыжесечения, проводили в специализированных
центрах по лечению грыж, и их результаты трудно
сопоставить с результатами среднего хирурга, занимающегося
пластиками грыж.
В то же время лапароскопическое грыжесечение
абсолютно показано при рецидивирующих и
двусторонних грыжах, так как в этом случае пластику проводят
на ранее не поврежденных тканях предбрюшинного
слоя, и ее возможно осуществить сразу с обеих
сторон, что не требует двух паховых разрезов [8].
Лапароскопия противопоказана при инфекциях брюшной
полости, некорригируемой коагулопатии и
невозможности общей анестезии. Относительным
противопоказанием являются перенесенные ранее операции, такие
как простатэктомия или открытая гистерэктомия.
ТРАНСАБДОМИНАЛЬНЫЙ
ПРЕДБРЮШИННЫЙ ИЛИ ПОЛНОСТЬЮ
ВНЕБРЮШИННЫЙ ДОСТУПЫ
В настоящее время широко распространены два
варианта лапароскопической герниопластики:
трансабдоминальная предбрюшинная (ТАРР) и полностью
экстраперитонеальная (ТЕР). Обе методики —
варианты одного и того же вмешательства, каждая из них
преследует одну цель — проведение пластики
дефекта через предбрюшинное пространство. При
использовании ТАРР-методики хирург создает доступ через
брюшную полость, но укладывает сетку между
брюшиной и брюшной стенкой, закрывая грыжевой дефект.
При применении ТЕР-методики доступ — внебрю-
36 Лапароскопическая хирургия. Атлас
шинный, и для того чтобы войти в преперитонеальное
пространство, где будет установлена сетка, проводят
диссекцию между прямой мышцей живота и задним
листком влагалища прямой мышцы живота.
The Cochrane Collaboration Review провело метаана-
лиз для сравнения вариантов ТАРР и ТЕР. Для анализа
использовали только одно рандомизированное
контролируемое исследование и восемь —
нерандомизированных. Анализ рандомизированного
контролируемого исследования, охватившего 52 пациента, показал,
что между ТАРР- и ТЕР-методикой нет статистически
значимых отличий в длительности операции,
образовании гематом, продолжительности госпитализации,
времени возврата к повседневной активности и реци-
дивировании. По данным восьми
нерандомизированных исследований, для ТАРР-методики характерны
повышенный риск грыжеобразования через троакарные
отверстия (0-3,7 против 0-0,1% для ТЕР) и большее
количество висцеральных повреждений (0-0,9
против 0-0,23% для ТЕР), хотя при применении ТЕР чаще
отмечали необходимость конверсии в открытую
операцию (0-7 против 0-5% для ТАРР) [8]. Период
обучения ТЕР также был длиннее (100 случаев против 50
для ТАРР) [9].
Хотя для точного сравнения методик ТАРР и ТЕР
нужно провести еще много рандомизированных
исследований, имеющиеся данные свидетельствуют
о том, что обе методики надежны. На рис. 3-6—3-26
представлена хирургическая техника
лапароскопической герниорафии.
ПОДГОТОВКА
Наркозный
аппарат
Анестезиолог
Ассистент
Операционная
сестра
^ъ1а
Столик
для инструментов
Монитор,
источник света,
инсуффлятор
Рис. 3-6. Обстановка операционной
для проведения левосторонней
лапароскопической герниорафии.
Перед операцией однократно
вводят антибиотик. Общая анестезия
предпочтительнее, так как позволяет
создать комфортные условия во время
пневмоперитонеума, хотя можно
использовать спинальную анестезию
вместе с подъемником для передней
брюшной стенки (Laprplift; Origin Med-
systems, Menlo Pare, CA). Устанавливают
мочевой катетер и желудочный
зонд. Оператор камеры и хирург
стоят со стороны грыжи, а ассистент
(его присутствие необязательно) —
на противоположной. Камерой
также может управлять ассистент.
Выбор стороны зависит
от персональных предпочтений,
однако при двусторонних грыжах
необходимости в обмене местами
при пластике с другой стороны
не возникает. Требуется только
один видеомонитор, который
устанавливают у ножного конца стола.
Глава 3. Лапароскопическая паховая герниорафия 37
10-мм троакар для камеры
и инсуффляции в области пупка
5-мм троакар
10-мм троакар
Рис. 3-7. Установка троакаров для лапароскопической
паховой герниорафии слева. Обычно используют три
троакара. Камеру вводят через 10-миллиметровый пупочный
порт. На стороне грыжи на уровне пупка устанавливают
12-миллиметровый троакар, на противоположной стороне —
5-миллиметровый троакар, оба латеральнее прямой
мышцы живота. Следует избегать повреждения нижних
эпигастральных сосудов. При двусторонней герниорафии
вместо комбинации 5/12-миллиметровых троакаров
используют комбинацию 12/12-миллиметровых.
Срединная пупочная складка
Медиальная пупочная складка
Латеральная пупочная
складка (нижние
эпигастральные сосуды)
Правосторонняя прямая паховая грыжа
Глубокое паховое кольцо
и прямая паховая грыжа
Мочевой пузырь
Семявыносящий ,
проток
Сосуды ■'•'■
семенного канатика
Подвздошные
сосуды —ШШ
Левый
мочеточник
Сигмовидная
кишка
Линия
разреза
брюшины
Рис. 3-8. Вид при лапароскопии сразу
после введения камеры. Необходимо
идентифицировать следующие
структуры: срединную и медиальные
пупочные складки, мочевой пузырь,
латеральную пупочную складку
(над эпигастральными сосудами),
семявыносящие протоки, сосуды
семенного канатика, подвздошные
сосуды, прямую и непрямую паховые
грыжи. Пунктирной линией обозначен
планируемый разрез брюшины.
38 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Прямая грыжа
Медиальная
пупочная складка
Мочевой пузырь
Дополнительный
граспер(опция)
Латеральная пупочная складка
Косая грыжа
Сосуды семенного
канатика
Семявыносящий
проток
Подвздошные сосуды
Подвздошно-лонный тракт
Медиальная пупочная
связка
Нижние
эпигастральные сосуды
Связка Купера
Сосуды
семенного канатика
Семявыносящий
проток
Рис. 3-9. Разрез брюшины. Разрез начинают от медиальной
пупочной складки, но не медиальнее, и проводят
в латеральном направлении через латеральную пупочную
складку по дуге поперечной мышцы живота по направлению
к передней верхней подвздошной ости.
Нижние эпигастральные сосуды
Прямая
мышца живота
Лоно
Подвздошно-
лонный
тракт
Мышечно-апоневротическая
дуга поперечной мышцы
живота
Семявыносящий проток
Связка Купера
Подвздошные сосуды
Рис. 3-10. Диссекция дна пахового канала. После разреза
брюшины и редукции грыжевого мешка необходима
дальнейшая диссекция, чтобы мобилизовать лоскут
брюшины и идентифицировать дно паховой области
и нужные для пластики структуры. Основные (если не все)
этапы диссекции должны быть проведены тупым путем.
Как и при открытой герниорафии, семенной канатик
необходимо полностью выделить, чтобы выявить косую
паховую грыжу. Связку Купера очищают от прилежащего
предбрюшинного жира. Латеральнее диссекция
продолжается вдоль мышечно-апоневротической дуги
поперечной мышцы живота до уровня передней верхней
подвздошной ости. Иногда в диссекции грыжевых мешков
и сопутствующих структур могут помочь манипуляции
снаружи.
Рис. 3-11. Диссекция дна пахового канала перед
установкой сетки. Обратите внимание на полную мобилизацию
края лонной кости и связки Купера, а также мышечно-
апоневротической дуги поперечной мышцы живота на
расстоянии 2 см выше и латеральнее внутреннего пахового кольца.
Глава 3. Лапароскопическая паховая герниорафия 39
Нижние эпигастральные сосуды
Прямая
мышца
живота
Общая длина
Лоно
Связка Купера
Семявыносящий проток
ные сосуды
Дуга
поперечной
мышцы
живота
Подвздошно-
лонный тракт
Сосуды семенного
канатика
Рис. 3-12. Приготовление сетки. Полипропиленовую сетку
размером 4,5 х б дюймов вырезают, как показано на рисунке.
Необходимо только скругление медиальных углов для более
удобной установки. Скругление латеральных углов и вырезание
отверстия для семенного канатика являются опционной
модификацией (пунктирная линия).
Нижние эпигастральные сосуды
Лоно
Расположение сетки
Линия скрепок
Косая грыжа
Зона «электрической
опасности»
\. / / Сосуды семенного
\/ канатика
\/ \ «Роковой треугольник»
Семявыносящий проток
Рис. 3-13. Планируемое расположение сетки и линии скобок
справа. Сетка закроет грыжевые дефекты любых прямых,
косых и бедренных грыж. Линия скобок проходит по часовой
стрелке с 7 до 4-часовой позиции относительно сетки.
Нижнелатеральную часть сетки не фиксируют скобками,
чтобы избежать повреждения зон «рокового треугольника»
и «электрической опасности».
11^Шк
\^г:л
4$^ А
\\
у^^Ящ^.:'':
\Щ**. ■
\%*
^^ [.
Сетку прикрепляют скрепками
в первую очередь к связке
>5_ Купера и вдоль медиального
^\края сетки ^*^
"wk %
щ 1
1 J3 1
У
/
4 ■': У'УуУУ
Рис. 3-14. Фиксация сетки к дну пахового канала справа.
Сетку скатывают от ровного края к закругленному, вводят
в брюшную полость через 12-миллиметровый порт рядом
со связкой Купера и расправляют ее в латеральном
направлении. Наложение скобок начинают с медиального
края, используют эндоскопический сшивающий аппарат
(«Multifire Endohernia Stapler»; Auto Suture, Norwalk, CT). Обычно
скобки накладывают по часовой стрелке: связка Купера,
лоно, латеральный край прямой мышцы живота, медиальная
мышечно-апоневротическая дуга и латеральная мышечно-
апоневротическая дуга. Сетка закрывает эпигастральные
сосуды. Следует осторожно работать степлером, чтобы
не повредить эти сосуды.
40 Лапароскопическая хирургия. Атлас
Рис. 3-15. Эндоскопическое наложение скобок. Процесс
прикрепления сетки скобками осуществляют следующим
образом: сетку захватывают одной ножкой частично
выдвинутой из степлера скобки, придавливают к месту
фиксации, после чего выстреливают скобку.
Рис. 3-17. Закрытие дефекта брюшины. После орошения
и проверки гемостаза дефект брюшины закрывают скобками.
Необходимо около восьми скобок. При двусторонней
пластике закрытие дефектов откладывают до момента
завершения операции с двух сторон.
Рис. 3-16. Пластика правосторонней паховой грыжи
завершена. Обратите внимание, что в нижнелатеральной
части сетки, в области «рокового треугольника» и зоны
«электрической опасности», скобки отсутствуют.
Рис. 3-18. Дефект брюшины закрыт.
Глава 3. Лапароскопическая паховая герниорафия 41
АЛЬТЕРНАТИВНАЯ ОПЕРАЦИЯ
Эндоскоп с баллоном
в преперитонеальном пространстве
Брюшина
Мочевой пузырь Кишечник
Эндоскоп с баллоном продвигают книзу
в преперитонеальном пространстве
Брюшина
Лоно
Рис. 3-19. Альтернативная методика: полностью
экстраперитонеальная установка сетки. Некоторые хирурги
предпочитают проводить лапароскопическую паховую
герниорафию полностью в предбрюшинном пространстве,
без вскрытия брюшины. По средней линии, на уровне пупка
(как показано на сагиттальном срезе), предбрюшинно вводят
специально разработанный лапароскопический троакар
с тупым кончиком и раздуваемым баллоном {Origin Medsys-
tems, Inc., Menlo Park, CA; and General Surgical Innovations, Portola
Valley, CA).
Рис. 3-20. Продвижение тупого кончика к лону. Троакар
с тупым кончиком продвигают в предбрюшинном
пространстве до уровня лонной кости.
Баллон раздувают
в преперитонеальном пространстве
Мочевой пузырь
Объем расширенного
преперитонеального рабочего пространства
поддерживается с помощью инсуффляции
Рис. 3-21. Раздувание баллона предбрюшинно.
Под лапароскопическим контролем баллон раздувают
воздухом, формируя операционное поле в потенциальном
предбрюшинном пространстве.
Рис. 3-22. Предбрюшинное операционное поле. Баллон
сдувают и заменяют рабочим троакаром.
42 Лапароскопическая хирургия. Атлас
/
/
А
j^-
%
1 1.
г
1
,J
L
010
012
o5
I 1
-^
1 1
fe^n '
\
j '..
\
\
\
I
\
Б
/'
/
1
|
i
J
/
^
012 010
V/
L^
©12
\
н
i
(I
\
Рис. 3-23. Установка троакаров. А, Б — две конфигурации
установки остальных троакаров. Авторы по возможности
предпочитают конфигурацию Б, хотя этого можно достичь
только при благоприятной анатомии и создании большого
предбрюшинного рабочего пространства.
Нижние эпигастральные сосуды
Прямая
мышца
живота
Связка
Купера
Семявыносящий
проток
■ Подвздошно-
лонный тракт
Сосуды
семенного
канатика
Рис. 3-24. Операционное поле. После введения
дополнительных троакаров и диссекции тупым путем вид
операционного поля должен быть идентичен таковому
при трансабдоминальном доступе.
Рис. 3-25. Подготовка сетки. Сетку выкраивают, как показано
на рисунке. При этом доступе лучше вырезать отверстие
для семенного канатика, так как рабочее пространство снизу
ограничено. Часто аналогичным образом устанавливают
участок сетки размером бхб дюймов.
Глава 3. Лапароскопическая паховая герниорафия 43
ЗАКЛЮЧЕНИЕ
При лапароскопической пластике грыжи отмечаются
скорейшее выздоровление и меньшая
послеоперационная болезненность. Однако эта операция дороже,
занимает больше времени, имеет более длительный срок
обучения и сопровождается хотя и редкими, но тяже-
- ■«■■вшшиишшишшшии
СПИСОК ЛИТЕРАТУРЫ
*■
1. Fitzgibbons R.J., Puri V. Laparoscopic inguinal hernia repair // Am.
Surg. — 2006. — Vol. 72. — P. 197-206.
2. Nathan J.D., Pappas T.N. Inguinal hernia: an old condition with
new solutions // Ann. Surg. — 2003. — Vol. 238. — P. 148-151.
3. Wagh P.V. Read RC: Defective collagen synthesis in inguinal
herniation // Am. J. Surg. — 1972. — Vol. 124. — P. 819.
4. Arregui M.E., Young S.B. Groin hernia repair by laparoscopic
techniques: current status and controversies // World J. Surg. —
2005. — Vol. 29. — P. 1052-1057.
5. Eklund A., Rudberg C, Leijonmarck C.E. et al. Recurrent inguinal
hernia: randomized multicenter trial comparing laparoscopic and
Lichtenstein repair // Surg. Endosc — 2007. — Vol. 21. — ?. 634-640.
6. Kuhry E., van Veen R.N., Langeveld H.R. et al. Open or endoscopic
total extraperitoneal inguinal hernia repair: a systematic review //
Surg. Endosc. — 2007. — Vol. 21. — P. 161-166.
7. Neumayer L., Giobbie-Hurder A., Jonasson O. et al. Open mesh
versus laparoscopic mesh repair of inguinal hernia // N. Engl.
J. Med. — 2004. — Vol. 350. — P. 1819-1827.
8. Bencini L., Lulli R., Mazzetti M.P. Experience of laparoscopic hernia
repair in a laparoscopically oriented unit of a large community
hospital // J. Laparoendosc. Adv. Surg. Tech. A. — 2007. —
Vol. 17. — P. 200-204.
9. Wake B.L., Mc Cormack K., Fraser C. et al. Transabdominal
preperitoneal (TAPP) vs total extraperitoneal (ТЕР) laparoscopic
techniques for inguinal hernia repair // Cochrane Database Syst.
Rev. — 2005. — 1:CD004703.
10. Liebl B.J., Jager C., Kraft B. et al. Laparoscopic hernia repair: TAPP
or / and ТЕР? // Langenbecks Arch. Surg. — 2005. — Vol. 390. —
P. 77-82.
44 Лапароскопическая хирургия. Атлас
Рис. 3-26. Пластика завершена. Положение сетки такое же,
как и при трансабдоминальной ее установке.
лыми осложнениями. Тем не менее в руках опытного
хирурга лапароскопическая пластика имеет
преимущества для отдельных пациентов. ТАРР и ТЕР —
надежные методики, которые могут проводить опытные
хирурги.
11. Petit Traitee Contenant une des Parties Principalles de Chirurgie,
Laquelle les Chirugiens Hernieeres Excerent (French) / Ed.
P. Franco. — Lyon: Antione Vincent. — P. 1556.
12. A Treatise on Ruptures / Ed. P. A. Pott. — London: C. Hitch and
L. Hawes. — P. 1756.
13. Abhandlung von den Bruuchen (German) / Ed. A. G. Richter. —
Gottingen: J. C. Dieterich. — P. 1778.
14. Nuevo Meetodo de Operar en la Hernia Crural (Spanish) / Ed.
A. Gimbernat. — Madrid: vda. Ibarra. — P. 1793.
15. The Anatomy and Surgical Treatment of Inguinal and Congenital
Hernia / Ed. A.P. Cooper. — London: Cox. — P. 1804.
16. The Anatomy and Surgical Treatment of Crural and Umbilical
Hernia / Ed. A.P. Cooper. — London: Longman. — P. 1807.
17. Nueste anatomisch-pathologische Untersuchungen uber den Ursprung
und das Fortschreiten der Leisten-und Schenkel-bruche (German) /
Ed. F. K. Hesselbach. — Wurzburg: Baumgartner. — P. 1806.
18. Anatomisch-Chirugische Abhandlung uber den Ursprung de
Leistenbruche (German) / Ed. F. K. Hesselback. — Wurzburg:
Baumgartner. — P. 1806.
19. Sull'ernia del revinea / Ed. A. Scarpa. — Pavia: P. Bizzoni. —
P. 1821.
20. A Treatise on Hernia / Ed. A. Scarpa; Translated by John Henry
Wishart. — Edinburgh: Longman, Hurst, and Rees. — P. 1814.
21. Marcy H. O. A new use of carbolized catgut ligatures //
Boston Med. Surg. J. — 1871. — Vol. 85. — P. 315.
22. Marcy H. O. The radical cure of hernia by the antiseptic use of the
carbolized catgut ligature // Trans. Am. Med. Assoc. — 1878. —
Vol. 29. — P. 295-305.
23. Bassini E. Nuovo metodo per la cura radicale dell'ernia // Atti.
Cong. Assoc. Med. Ital. — 1889. — Vol. 2. — P. 179.
24. Halsted W.S. The radical cure of hernia // Bull Johns Hopkins
Hosp. — 1889. — Vol. 1. — P. 12.
25. Lothaissen G. Zur radikaloperation der schenkelhernien
(German) // Zentralbl. Chir. — 1898. — Vol. 25. — P. 548.
26. Anson B.J., Mc Vay C.B. The anatomy of the inguinal and
hypogastric regions of the abdominal wall // Anat. Rec. — 1938. —
Vol. 70.— P. 211-225.
27. McVay C.B. Inguinal and femoral hernioplasty: anatomic repair //
Arch. Surg. — 1948. — Vol. 57. — P. 524-530.
28. Cheatle G. I. An operation for the radical cure of inguinal and
femoral hernia // BMJ. — 1920. — Vol. 2. — P. 68-69.
29. Henry A.K. Operation for femoral hernia by a midline
extraperitoneal approach: with a preliminary note on the use of this
route for reducible inguinal hernia // Lancet. — 1936. — Vol. 1. —
P. 531-533.
30. Nyhus L. M., Couden R.E., Harkins H.N. Clinical experiences with
preperi toneal hernial repair for all types of hernia of the groin //
Am. J. Surg. — 1960. — Vol. 100. — P. 234.
31. Nyhus L.M. An anatomical reappraisal of the posterior inguinal
wall: special consideration of the iliopubic tract and its relation
to groin hernia // Surg. Clin. North Am. — 1964. — Vol. 44. —
P. 1305-1312.
32. Stoppa R.E., Warlaumont C.R. The preperitoneal approach and
prosthetic repair of groin hernia // Hernia. — 3rd ed. / Eds L.
M. Nyhus, R. E. Condon. — Philadelphia: J. B. Lippincott, 1989. —
P. 199.
33. Stoppa R., Petit J., Henry X. Unsutured Dacron prosthesis in groin
hernias // Int. Surg. — 1975. — Vol. 60. — P. 411-412.
34. Shearburn E.W., Myers R.N. Shouldice repair for inguinal hernia //
Surgery. — 1969. — Vol. 66. — P. 450-459.
35. Hernia Repair Without Disability / Ed. I.L. Lichtenstein. — St.
Louis: С V Mosby, 1970.
36. Lichtenstein I.L., Shulman A.G., Amid P.K., Montllor M.M. The
tension-free hernioplasty // Am. J. Surg. — 1989. — Vol. 157. —
P. 188-193.
37. Cer R., Monroe K., Duvuvier R., Mishrick A. Management of
indirect inguinal hernias by laparoscopic closure of the neck of the
sac // Am. J. Surg. — 1990. — Vol. 159. — P. 370-373.
38. Schultz L., Graber J., Pietrafitta J., Hickok D. Laser laparoscopic
herniorrha-phy: a clinical trial preliminary results //
J. Laparoendosc. Surg. — 1990. — Vol. 1. — P. 41-45.
39. Spaw A.T., Ennis B.W., Spaw L.P. Laparoscopic hernia repair: the
anatomic basis // J. Laparoendosc. Surg. — 1991. — Vol. 1. —
P. 269-277.
40. Toy F.K., Smoot R.T., Jr. Toy-Smoot laparoscopic hernioplasty //
Surg. Laparosc. Endosc. — 1991. — Vol. 1. — P. 151-155.
41. Gazayerli M.M. Anatomical laparoscopic hernia repair of direct or
indirect inguinal hernias using the transversalis fascia and iliopubic
tract // Surg. Laparosc. Endosc. — 1992. — Vol. 2. — P. 49-52.
42. Dion Y.M., Morin J. Laparoscopic inguinal herniorrhaphy // Can.
J. Surg. — 1992. — Vol. 35. — P. 209-212.
43. McKernan J.B., Laws H.L. Laparoscopic preperitoneal prosthetic
repair of inguinal hernias // Surg. Rounds. — 1992. — P. 597-607.
44. McKernan J.B. Laparoscopic extraperitoneal repair of
inguinofemoral herniation // Endosc. Surg. Allied. Technol. —
1993. — Vol. 1. — P. 198-203.
45. McKernan J.B. Laparoscopic extraperitoneal inguinal hernia
repair // Curr. Tech. Cen. Surg. — 1994. — Vol. 3. — P. 1-7.
46. MacFayden B.V., Jr., Arregui M.E., Corbitt J.D. Jr. et al.
Complications of laparoscopic herniorrhaphy // Surg. Endosc. —
1993.— Vol. 7.— P. 155-158.
47. Fitzgibbons R.J., Camps J., Coronet D.A. et al. Laparoscopic inguinal
herniorrhaphy: results of a multicenter trial // Ann. Surg. —
1995.— Vol. 221. —P. 3-31.
48. Schrenk P., Woisetschlager R., Rieger R., Wayand W. Prospective
randomized trial comparing postoperative pain and return
to physical activity after transabdominal preperitoneal, total
preperitoneal or Shouldice technique for inguinal hernia repair //
Br. J. Surg. — 1996. — Vol. 83. — P. 1563-1566.
49. McCormack K, Scott N.W., Go P.M. et al. Laparoscopic techniques
versus open techniques for inguinal hernia repair (Cochrane
review) // Cochrane Database Syst. Rev. — 2003. — Is. LCD001
785.
50. McCormack K., Wake В., Perez J. et al. Laparoscopic surgery
for inguinal hernia repair: systemic review of effectiveness and
economic evaluation // Health Technol. Assess. — 2005. —
Vol. 9. — P. 1-203.
Глава З. Лапароскопическая паховая герниорафия 45
Лапароскопическая
пластика вентральных
грыж
Сэндия А. Лагу-Динэдэялэн, Якоб Н. Шродер
Паул Дж. Чай, Эдвард Ж. Чекан
Вентральной грыжей называется любой дефект
передней брюшной стенки. Существует три основных типа
вентральных грыж: диастаз прямых мышц, эпига-
стральные грыжи и послеоперационные грыжи.
Диастаз прямых мышц — безвредное состояние,
вызванное расхождением в стороны медиальных мышц
живота с течением времени. Проявляется диффузным
выпячиванием истонченной белой линии между краями
прямых мышц. Этот вид грыж обычно не имеет
симптомов и не требует хирургического вмешательства.
Эпигастральные грыжи обычно встречаются
у людей с ожирением или беременных, но могут
возникать и спонтанно. Как правило, это мелкие дефекты
в фасции, часто содержащие небольшое количество
ущемленной жировой клетчатки, что вызывает боли.
Послеоперационные грыжи являются результатом
неадекватного зашивания раны после лапаротомии.
Сообщают о частоте операционных вентральных грыж
после лапаротомии от 3 до 13%, что приводит к
необходимости проведения 90 000 пластик вентральных грыж
в год в США [1, 2]. Пациенты с ожирением, раневыми
инфекциями, сниженным питанием, а также лица,
длительно принимающие стероиды, имеют повышенный
риск возникновения послеоперационных грыж.
Открытая первичная пластика вентральных грыж
сопровождается рецидивами в 31-54% случаев [3, 4].
Применение сетчатых протезов позволило снизить частоту
рецидивов до 10% и менее [5]. Лапароскопическая
пластика вентральных грыж была предложена как
попытка снизить количество рецидивов и осложнений, таких
как серомы, инфекции и послеоперационная кишечная
непроходимость.
АНАТОМИЯ
Брюшная стенка состоит из 9 слоев: кожи, подкожной
клетчатки, фасции Скарпа, наружной косой мышцы,
внутренней косой мышцы, поперечной мышцы
живота, поперечной фасции, предбрюшинной жировой
ткани и брюшины. Белая линия, которую образует
апоневроз всех групп мышц брюшной стенки, расположена
по средней линии живота. Влагалище прямой мышцы
в верхней части живота имеет крепкую заднюю стенку,
состоящую из фасции внутренней косой мышцы, а
передняя стенка влагалища в этом отделе живота состоит
из апоневрозов наружной и внутренней косой мышцы
живота. В нижней части живота задняя стенка
влагалища прямой мышцы отсутствует, фасции наружной
и внутренней косой мышцы лежат кпереди от прямой
мышцы, а задняя стенка влагалища прямой мышцы
состоит из тонкого слоя поперечной фасции.
ПАТОФИЗИОЛОГИЯ
Частота первичного расхождения ран возрастает
вследствие раневой инфекции, ожирения пациента, плохого
питания или лекарственной терапии (например,
длительного приема стероидов), что ухудшает процесс
заживления ран. При ретроспективном
литературном обзоре более 320000 случаев за 34-летний период
Poole [6] обнаружил, что механические факторы, такие
как раневая инфекция, растяжение живота и кашель,
оказывают большее влияние на расхождение раны,
чем системные факторы (плохое питание или
длительный прием стероидов) [6].
Раневые инфекции — наиболее частая причина
развития послеоперационных грыж. Инфекция
препятствует нормальному процессу заживления, что
выражается в снижении синтеза коллагена и меньшем
формировании перекрестных связей коллагена в ране.
Антибиотикопрофилактика и тщательная
хирургическая техника (аккуратная работа с тканями, гемостаз)
могут снизить частоту развития послеоперационных
раневых инфекций.
Важность техники зашивания живота
(непрерывными или одиночными швами) как фактора риска
Глава 4. Лапароскопическая пластика вентральных грыж 47
формирования грыжи давно является предметом
споров. В рандомизированном исследовании с участием
571 пациента Richards и Balch [7] сравнили обе
методики и не обнаружили значительной разницы в частоте
возникновения вентральных грыж.
КЛИНИЧЕСКАЯ КАРТИНА
У пациентов обычно имеется болезненное образование
в области рубца после лапаротомии. Образование часто
увеличивается при повышении внутрибрюшного
давления (при кашле или пробе Вальсальвы) и уменьшается
при легком надавливании. Для установления диагноза
пациентам с ожирением или при неясных
абдоминальных симптомах иногда необходимо провести КТ.
У пациентов с симптоматическими грыжами (с
болями или признаками кишечной непроходимости)
может иметься ущемление грыжи. Большинство
пациентов с ущемлением могут сообщить, что ранее грыжа
вправлялась в брюшную полость. У пациентов
возникают симптомы ишемии кишки или кишечной
непроходимости (тошнота, рвота или сильная боль в
животе). В области ущемления могут отмечаться
покраснение и болезненность. Пациенты с ущемленной грыжей
подлежат экстренному оперативному лечению.
ТЕХНИКА ОПЕРАЦИИ
На рис. 4-1-4-5 продемонстрирована хирургическая
техника лапароскопической пластики вентральной грыжи.
Данную операцию лучше проводить под общим
наркозом. В мочевой пузырь устанавливают катетер, а в
желудок — назогастральный зонд. Пациента укладывают
на спину (рис. 4-1), с помощью открытой техники в
нижней части живота по средней линии вводят троакар Хэс-
сона. Затем проводят инсуффляцию С02 и в брюшную
полость вводят 30-градусный лапароскоп, после чего
проводят ревизию брюшной полости. Особое внимание
уделяют области грыжевого дефекта, оценке степени
выраженности спаек и потенциальным местам ввода
дополнительных троакаров. Затем устанавливают
дополнительные троакары, насколько возможно латеральнее,
обычно один 11-миллиметровый троакар располагают
в левом нижнем квадранте и два 5-миллиметровых —
справа. Абдоминальные спайки разделяют эндозажимом
и эндоножницами (рис. 4-2), в результате висцеральное
содержимое выходит из грыжевого мешка. Грыжевой
мешок сохраняют интактным, если это возможно.
Размер сетки примеряют к грыжевому дефекту
экстракорпорально. Сетка должна укрывать
грыжевой дефект с захватом еще по крайней мере 3 см
здоровых тканей. Разметка краев грыжевого
дефекта на коже живота может помочь в приготовлении
сетки. Необходимо отметить ориентацию сетки
перед введением в брюшную полость. Сетку вводят
через 11-миллиметровый троакар и разворачивают
в брюшной полости.
При применении для пластики полипропиленовую
сетку прикрепляют над грыжевым дефектом к
передней брюшной стенке (рис. 4-3), используя только
лапароскопический степлер или многозарядное
спиральное крепящее устройство, такое как аппарат «Таскег»
(US Surgical Corp., Norwalk, CT). После завершения
пластики необходимо убедиться, что между сеткой и
кишечником расположен сальник (рис. 4-4).
При использовании политетрафторэтиленовой
сетки («Gore-Tex»; W.L. Gore, Phoenix, AZ), помимо
фиксации степлером, необходимо применить транс-
фасциальное наложение швов, так как этот материал
медленно прорастает тканями. Сначала
трансабдоминальными швами фиксируют все четыре утла сетки.
На каждый из углов сетки перед ее введением в
брюшную полость накладывают лигатуры из
нерастворимого материала. С помощью скальпеля с лезвием № 11
делают маленькие разрезы кожи (длиной примерно
2 мм) для проведения эндоскопического проводника
для швов через брюшную стенку. Затем угловые швы
захватывают проводником для швов, проводят через
брюшную стенку и затягивают (рис. 4-5). Несколько
дополнительных швов накладывают по периферии
сетки, а между швами края сетки крепят с помощью
спирального крепящего устройства.
После завершения пластики троакары и газ удаляют
из брюшной полости. Отверстия от троакаров
диаметром более 10 мм требуют зашивания фасции. Кожные
раны закрывают с помощью швов и «Steri-Strips» (ЗМ
Health Care, St. Paul, MN), накладывают стерильные
повязки. В последнее время приобрели популярность
композитные сетки, такие как «Dualmesh» (W.L. Gore
and Assoc, Flagstaff, AZ), «Sepramesh» (Genzyme Corp.,
Cambridge, MA), «Parietex» (Sofradim Corp., Wrentham,
MA). Теоретически эти двухкомпонентные сетки
способствуют лучшему прорастанию тканей
брюшной стенки и сводят к минимуму образованию спаек
в брюшной полости. Хотя не существует данных
рандомизированных контролируемых исследований по
применению композитных сеток, их используют все чаще
с сообщениями об отличных результатах.
48 Лапароскопическая хирургия. Атлас
ПОДГОТОВКА
Рис. 4-1. Обстановка операционной
для лапароскопической вентральной
герниорафии.
ОПЕРАЦИЯ
Рис. 4-2. Спайки пересекают с помощью эндоножниц
и противоположной тракции с помощью зажима,
находящегося в недоминантной руке хирурга.
Электрокоагуляцию следует использовать с осторожностью.
Рис. 4-3. Лапароскопический сшивающий аппарат необходим
для прикрепления сетки к передней брюшной стенке
над грыжевым дефектом.
Глава 4. Лапароскопическая пластика вентральных грыж 49
Рис. 4-4. Вентральная герниорафия завершена.
РЕЗУЛЬТАТЫ
Отдаленные результаты лапароскопических пластик
вентральных грыж пока еще недоступны для
анализа. Многие ретроспективные исследования показали
благоприятные результаты, в том числе снижение
количества послеоперационных койко-дней и
уменьшение послеоперационного болевого синдрома [8-10].
В этих исследованиях также отмечали снижение
числа осложнений, таких как раневые инфекции,
образование сером и послеоперационный илеус [10].
Инфекции лоскута при лапароскопической операции
наблюдают реже чем в 1% случаев [8]. Продолжительность
операции при лапароскопической пластике обычно
больше, но с приобретением опыта отмечается
тенденция к ее уменьшению. Количество рецидивов
после лапароскопических операций варьирует, но
значительных отличий от открытых операций не
выявлено. К сожалению, эти исследования охватывали
ранний послеоперационный период с длительностью
наблюдения не более 23 мес.
Несмотря на то что исследования
продолжаются, данные рандомизированных контролируемых
исследований, сравнивающих лапароскопические
и открытые пластики вентральных грыж,
отсутствуют. В ходе одного из недавних рандомизированных
исследований с коротким сроком наблюдений,
сравнивающего результаты 33 лапароскопических и 33
открытых пластик, показаны благоприятные
результаты лапароскопии [11]. Средняя длительность на-
Рис. 4-5. При пластике грыжи сеткой «Gore-Tex» {W.L Gore,
Phoenix, AZ) угловые швы захватывают с помощью устройства
«Endodose» (US Surgical Corp., Norwalk, CT), проводят через
брюшную стенку и затягивают.
блюдения в обеих группах составила около 13 мес.
В лапароскопической группе отмечена небольшая
длительность пребывания в клинике (1,47 против
3,43 дня; р=0,007), разница в интенсивности
болевого симптома отсутствовала, количество раневых
осложнений было меньше (6 против 33%; р=0,013),
разницы в количестве рецидивов не отмечено.
Другое исследование, проведенноеBarbaros etal. [12],
показало аналогичные результаты у 46 пациентов,
рандомизированных для открытой или
лапароскопической пластики. Был сделан вывод, что
лапароскопическая пластика так же эффективна, как и открытая,
но имеет преимущества в снижении
послеоперационного пребывания в клинике и частоте
инфицирования сеток. В ближайшем будущем станут доступны
результаты исследований с длительным периодом
наблюдения. Проспективное исследование не выявило
превышения стоимости лапароскопии по сравнению
с открытой пластикой, несмотря на имевшиеся ранее
предположения об этом [13]. Таким образом,
лапароскопическая пластика вентральных грыж вполне
успешно выполнима и имеет результаты, сходные
с результатами открытых операций. Хотя данные
длительных наблюдений еще не получены,
сниженная продолжительность госпитализации и высокая
удовлетворенность пациентов позволяют считать
лапароскопическую пластику вентральных грыж
привлекательной лечебной методикой.
50 Лапароскопическая хирургия. Атлас
СПИСОК ЛИТЕРАТУРЫ
1. Mudge M., Heghes L. Incisional hernia: a 10-year prospective study of
incidence and attitudes // Br. J. Surg. — 1985. — Vol. 72. — P. 70-71.
2. Condon R. Incisional Hernia. — Philadelphia: J. B. Lippincott,
1995.
3. Anthony Т., Bergen PC, Kim L.T. et al. Factors affecting recurrence
following incisional herniorrhaphy // World J. Surg. — 2000. —
Vol. 24.— P. 95-100.
4. Luijendijk R.W., Lemmen M.H., Hop W.C. et al. Incisional hernia
recurrence following «vest-over-pants» or vertical Mayo repair
of primary hernias of the midline // World J. Surg. — 1997. —
Vol. 21. — P. 62-65.
5. Liakakos Т., Karanikas I., Panagiotidis H. et al. The use of Marlex
mesh in the repair of recurrent incisional hernia // Br. J. Surg. —
1994. — Vol. 81. — P. 248-249.
6. Poole C. Mechanical factors in abdominal wound closure: the
prevention of fascial dehiscence // Surgery. — 1985. — Vol. 97. —
P. 631-640.
7. Richards P., Balch C. Abdominal wound closure: a randomized
prospective study of 571 patients comparing continuous versus
interrupted suture techniques // Ann. Surg. — 1983. — Vol. 197. —
P. 238-243.
8. Heniford В. Т., Park A., Ramshaw B.J. et al. Laparoscopic ventral
and incisionaj hernia repair in 407 patients // J. Am. Coll. Surg. —
2000. — Vol. 190. — P. 645-650.
9. Lomanto D., Iyer S.G., Shabbir A. et al. Laparoscopic versus open
ventral hernia mesh repair: a prospective study // Surg. Endosc. —
2006. — Vol. 20. — P. 1030-1035.
10. Mc Greevy J.M., Goodney P.P., Birkmeyer CM. et al. A prospective
study comparing the complication rates between laparoscopic and
open ventral hernia repairs // Surg. Endosc. — 2003. — Vol. 17. —
P. 1778-1780.
11. Misra M.C., Bansal V.K., Kulkarni M.P. et al. Comparison of
laparoscopic and open repair of incisional and primary ventral
hernia: results of a prospective randomized study // Surg.
Endosc. — 2006. — 26: (epub).
12. Barbaras U„ Asoglu O., Seven R. et al. The comparison of
laparoscopic and open ventral hernia repairs: a prospective
randomized study // Hernia. — 2006. — 28: (epub).
13. Earle D., Seymour N., Fellinger E. et al. Laparoscopic versus open
incisional hernia repair: a single-institution analysis of hospital
resource utilization for 884 consecutive cases // Surg. Endosc. —
2006. — Vol. 20. — P. 71-75.
Глава 4. Лапароскопическая пластика вентральных грыж 51
Лапароскопические
антирефлюксные
операции
Джонатан А. Хата, Теодор Н. Паппас
■ ■■... ■ ;
S
,
Термин «гастроэзофагеальная рефлюксная болезнь»
включает широкий спектр поражений ротоглотки,
гортани, дыхательных путей и пищевода, которые
клинически проявляются в виде изжоги.
Гастроэзофагеальная рефлюксная болезнь встречается часто
и требует длительного и дорогостоящего лечения
с ежегодными затратами только в США более 9 млрд
долларов [1].
В 1951 г. Allison предложил термин «рефлюкс-
эзофагит» и описал взаимосвязь между грыжами
пищеводного отверстия диафрагмы и рефлюкс-эзофагитом.
Рудольф Ниссен (Rudolph Nissen) в 1956 г. ввел в
практику фундопликацию как простую операцию для
коррекции рефлюкс-эзофагита [3]. Техника Ниссена
заключалась в мобилизации абдоминального сегмента
пищевода и малой кривизны желудка с помощью
пересечения желудочно-печеночной связки, после чего
следовало 360-градусное окутывание пищевода дном
желудка (рис. 5-1, 5-2). В тот же период была
описана гастропексия Besley Mark IV, которая заключалась
в 240-градусном окутывании пищевода дном желудка
через левый торакотомный доступ [4]. В 1963 г. Туле
(Toupet) модифицировал фундопликацию Ниссена,
применив 270-градусное окутывание (рис. 5-3) [5].
В 1991 г. Geagea [6] провел полностью
лапароскопическую фундопликацию по Ниссену для ле-
Рис. 5-1. Проведение фундопликации по Ниссену. Буж
60 Fr проводят через гастроэзофагеальный переход.
Для сопоставления прилежащих поверхностей дна желудка
используют серозно-мышечные швы с захватом передней стенки
пищевода.
Рис. 5-2. Завершенная 360-градусная фундопликация
по Ниссену. Манжетка должна иметь длину 2 см и быть несколько
свободной при наличии бужа в пищеводе («свободный Ниссен»).
Передний и задний стволы блуждающего нерва включены
в манжетку.
Глава 5. Лапароскопические антирефлюксные операции 53
чения тяжелого рефлюкс-эзофагита. Вскоре после
этого Dallemagne ey al. [7] доложили о первой серии
из 12 пациентов, подвергшихся лапароскопической
фундопликации. И хотя 3 пациентам потребовалась
конверсия в открытую операцию из-за технических
сложностей, у остальных 9 человек отмечалось
полное исчезновение симптомов. За этим сообщением
последовало множество нерандомизированных ис-
Отверстие
диафрагмы
Передний
блуждающий
желудка
Правая^
ножка
Рис. 5-3. Техника 270-градусной фундопликации по Тупе.
Манжетка фиксирована к ножкам диафрагмы сзади и прикреплена
отдельными серозно-мышечными швами к пищеводу спереди.
Диафрагма
Отверстие
диафрагмы
Правая ножка
диафрагмы
Грудной отдел пищевода
Передний блуждающий
неРв -Дно
желудка
Абдоминальный
отдел аорты
Чревный
ствол
Селезенка
Рис. 5-4. Анатомия пищеводного отверстия диафрагмы
и абдоминального отдела пищевода. У большинства пациентов
пищеводное отверстие диафрагмы представлено петлей
из мышечных волокон, исходящих из правой ножки диафрагмы.
следований [8-13], подтвердивших, что
лапароскопическая фундопликация является безопасной и
эффективной процедурой в лечении болезни гастроэзо-
фагеального рефлюкса. Отдаленные наблюдения
подтвердили длительный контроль симптомов болезни
гастроэзофагеального рефлюкса у 85-90% пациентов
[14-18]. Cuschieri et al. [19] описали успешный исход
лапароскопической частичной фундопликации,
аналогичной операции по Тупе с 270-градусным
окутыванием пищевода дном желудка. Частичная
фундопликация также дает адекватные результаты, имеет
более низкую частоту послеоперационной дисфагии
и потому считается более предпочтительной для
пациентов с гастроэзофагеальной рефлюксной
болезнью и сопутствующей пониженной моторикой
пищевода [20].
В настоящее время для лечения
гастроэзофагеальной рефлюксной болезни применяют
фармакологическое снижение кислотности желудка. Наиболее
эффективными препаратами являются ингибиторы
протонного насоса (ИПН) [21]. Фундопликацию
предлагают пациентам с гастроэзофагеальной
рефлюксной болезнью, рефрактерной к
медикаментозной терапии [22]. Хирургическая операция также
может быть использована как потенциальная
терапия выбора у пациентов, которые не переносят
длительной медикаментозной терапии [23].
Отношение к оперативному лечению улучшилось после
введения в практику лапароскопической
фундопликации, которая позволяет избежать таких
недостатков традиционного открытого доступа, как большой
разрез, связанная с ним болезненность после
операции и длительный восстановительный период [24].
Рандомизированные контролируемые исследования
[25-30] продемонстрировали безопасность,
эффективность и длительность результатов
лапароскопических антирефлюксных операций в случае их
проведения опытными хирургами у тщательно
отобранных пациентов [31, 32].
АНАТОМИЯ
В пищеводе различают шейный, грудной и
абдоминальный отделы. Шейный отдел пищевода начинается
от каудальной границы перстневидного хряща и
нижнего края крикофарингеальной мышцы на уровне
тела VI шейного позвонка. Пищевод продолжается
в каудальном направлении и проходит в
средостении. Далее он проходит через пищеводное отверстие
диафрагмы, а затем соединяется с кардией
желудка на уровне X грудного позвонка. Рядом с
пищеводом через отверстие в диафрагме проходят передний
и задний стволы блуждающего нерва (рис. 5-4). Длина
абдоминального отдела пищевода в норме составляет
в среднем 1,5-2 см.
54 Лапароскопическая хирургия. Атлас
Рис. 5-5. Анатомия нижнего отдела пищевода и пищеводно-
желудочного перехода. Точную локализацию перехода
определить трудно, так как внутреннее соустье (граница
слизистых оболочек — Z-линия) не соответствует наружному.
Нижний отдел пищевода, в свою очередь,
подразделяется на супрадиафрагмальный отдел, нижний
сфинктер пищевода, преддверие и кардию. Этот отдел
кровоснабжается восходящей ветвью левой
желудочной артерии. Венозная кровь из этого сегмента
оттекает в коронарную вену и перикардиальное венозное
сплетение ниже диафрагмы. Преганглионарные
волокна блуждающего нерва связаны с ганглионарными
клетками в нервном сплетении пищевода.
Симпатическая иннервация исходит из ганглиев грудного
симпатического ствола.
Знание анатомии и физиологии пищеводно-
желудочного перехода и пищеводного отверстия
диафрагмы необходимо для понимания механизма реф-
люкса и антирефлюксных процедур. Мышечные
волокна, окружающие пищевод и создающие пищеводное
отверстие, в основном исходят из правой ножки
диафрагмы (рис. 5-5). Кроме того, пищеводное отверстие
поддерживается несколькими слоями тканей,
разделяющими плевральную и брюшную полости. Наиболее
важная структура — пищеводно-диафрагмальная
связка, которая образуется в результате слияния внутри-
брюшной и внутригрудной фасций. Эта связка
прикрепляется к пищеводу в области пищеводного отверстия
диафрагмы (рис. 5-5). У большинства людей эта связка
находится на 3,3 см выше пищеводно-желудочного
перехода. Пищеводно-желудочный переход плохо
определяется, так как уровень перехода внутренних слоев
стенки не соответствует уровню перехода наружных
слоев. Cagahan [33] так описывает эту область:
«Наружный переход конечного отдела пищевода в
начальный отдел желудка находится на 1 см ниже
внутреннего перехода, т.е. границ слизистых оболочек пищевода
и желудка».
ПАТОФИЗИОЛОГИЯ, КЛИНИЧЕСКИЕ
ПРОЯВЛЕНИЯ И ДИФФЕРЕНЦИАЛЬНАЯ
ДИАГНОСТИКА
Хотя у людей нет нижнего сфинктера пищевода
как анатомического образования, но физиологический
сфинктерный механизм имеется и располагается в
области последних 1-4 см терминального отдела
пищевода. Манометрически этот специализированный
сегмент представлен зоной высокого давления,
называемой нижним пищеводным сфинктером (НПС). В
состоянии покоя НПС сокращен со средним давлением
13 мм рт.ст. Общая длина НПС составляет около 3,6 см
в среднем, 2 см — в абдоминальном отделе, а остальная
часть расположена в грудной полости. Гастроэзофаге-
альный рефлюкс предотвращается следующими
механизмами: собственным мышечным тонусом НПС, вну-
трибрюшным сегментом пищевода, законом Лапласа
и нормальным опорожнением желудка.
Функциональное состояние НПС определяет развитие гастроэзофа-
геальной рефлюксной болезни. Пациенты с давлением
в области НПС менее 5 мм рт.ст. или с внутрибрюш-
ным отделом длиной менее 1 см в 90% случаев имеют
гастроэзофагеальную рефлюксную болезнь1 [34].
Наблюдение Hiebert и Betsey's четко показывает,
что патологический рефлюкс и грыжа пищеводного
отверстия являются разными патологическими
состояниями. Примерно 80% пациентов с гастроэзофагеаль-
ной рефлюксной болезнью имеют рентгенологические
признаки аксиальной грыжи. В то же время при
рентгенологически выявленной хиатальной грыже
патологический гастроэзофагеальный рефлюкс определяют
только примерно у 5% таких пациентов. Это
происходит предположительно из-за того, что ниже уровня
пищеводно-диафрагмальной связки все еще остается
адекватный сегмент дистального отдела пищевода,
находящегося под влиянием внутрибрюшного
давления. Рефлюкс предотвращается, если имеется разница
в давлении в плевральной и брюшной полостях 10 см
вод.ст. [36].
Хотя замедленное опорожнение желудка четко
взаимосвязано с рефлюксом тяжелой степени и эзофа-
гитом, неизвестно, предшествует ли замедленное
опорожнение желудка патологическому рефлюксу или
воспаление пищевода вследствие рефлюкс-эзофагита
вызывает дисфункцию блуждающего нерва и нарушает
опорожнение желудка [37].
24-часовой внутрипищеводный мониторинг рН
показывает, что физиологический рефлюкс после приема
пищи отмечается и у здоровых индивидуумов. Около
7% здоровых людей испытывают изжогу ежедневно
и 36% — один раз в месяц. Рефлюкс считается
патологическим, если он становится длительным или отмечается
1 В нашей стране основными арефлюксными образованиями
считают НПС, угол Гиса, клапан Губарева. — Примеч. ред.
Глава 5. Лапароскопические антирефлюксные операции 55
в течение всего дня или ночью. Эзофагит как
осложнение рефлюкса развивается, когда желудочный сок
или панкреатобилиарный секрет чаще попадают в
пищевод и защитные механизмы пищевода больше не
действуют. Важным аспектом в защите от
гастроэзофагеального рефлюкса являются координированное
перистальтическое опорожнение и вторичная перистальтика
пищевода, вызываемая растяжением и раздражением
слизистой оболочки дистального отдела пищевода.
При патологическом рефлюксе изменения слизистой
оболочки пищевода могут варьировать от полного
отсутствия повреждений (неэрозивной или
эндоскопически негативной» рефлюксной болезни) до развития
выраженной пептической стриктуры (рис. 5-6). Степень
повреждения пищевода можно наиболее объективно
оценить с помощью Лос-Анджелесской классификации,
согласно которой распространенность заболевания
определяется размерами повреждений слизистой
оболочки: А (отдельные эрозии слизистой оболочки <5мм),
В (>5мм), С (сливные эрозии, занимающие <75%
окружности) и D (>75% окружности) [38]. У пациентов с
неэрозивной рефлюксной болезнью без дефектов слизистой
оболочки все же можно наблюдать типичные симптомы
рефлюкса. На рис. 5-7 в краткой форме изложены
симптомы и осложнения у пациентов с симптоматической
болезнью гастроэзофагеального рефлюкса [39]. Чаще
всего дифференциальную диагностику проводят с хо-
ледохолитиазом, пептической язвой, гастритом,
нарушением моторной функции пищевода и стенокардией
(рис. 5-8).
В настоящее время диагноз гастроэзофагеаль-
ной рефлюксной болезни первоначально базируется
на клинических симптомах, а именно изжоге и регурги-
тации [21, 40]. Эмпирически подобранное лечение
ингибиторами протонной помпы (ИПП) проводят в
течение 4-8 нед, и если оно оказывается эффективным, его
продолжают длительное время в самой низкой дозе,
необходимой для контроля симптомов. В случаях,
когда симптомы персистируют, несмотря на применение
ИПП, с диагностической целью необходимо провести
эндоскопическое исследование верхнего отдела
пищеварительного тракта, а также рассмотреть вопрос
о хирургическом лечении. Показания к хирургической
фундопликации следующие:
• неэффективность медикаментозной терапии;
• непереносимость длительного лечения ИПП;
• осложнения гастроэзофагеальной рефлюксной
болезни [такие, как выраженный эзофагит, стриктура
или пищевод Барретта (Barrett's esophagus)].
Дальнейшие диагностические мероприятия перед
оперативным лечением должны включать манометрию
пищевода и 24-часовой мониторинг рН. Механический
Тяжелый
эзофагит
с изъязвлением
Скользящая
(кардиофундальная) грыжа
пищеводного отверстия
Стриктура
Дыхательные расстройства,
вызванные рефлюксом:
кашель,
бронхит,
рецидивирующая пневмония,
астма/одышка, аспирация
Скользящая
(кардиальная) грыжа
пищеводного отверстия
Выраженные
функциональные
расстройства
желудка
Рис. 5-6. Проявления
гастроэзофагеальной рефлюксной
болезни и показания к хирургическому
лечению.
56 Лапароскопическая хирургия. Атлас
Симптомы и осложнения
у пациентов с симптоматическим
гастроэзофагеальным рефлюксом
Симптомы или осложнения
Изжога
Дисфагия
Стриктура
Регургитация
Тошнота или рвота
Кашель
Бронхиты
Пневмониты
Астма или одышка
Гемофтиз
Аспирация
Пациенты, %
85
37
19
23
21
47
35
16
16
13
8
Рис. 5-7. Симптомы и осложнения у пациентов
с симптоматическим гастроэзофагеальным рефлюксом. В этой
таблице представлены клинические симптомы рефлюксной
болезни и частота их встречаемости по данным обследования
2178 пациентов [48,52]. Изжога, дисфагия и регургитация
являются классическими симптомами заболеваний пищевода.
К осложнениям рефлюксной болезни относят эзофагит тяжелой
степени, стриктуру и пищевод Барретта.
дефект сфинктера диагностируется, если давление
в покое — менее 6 мм рт.ст., общая длина — менее 2 см,
а длина внутрибрюшного отдела — менее 1см [41].
Эпизоды кислотного рефлюкса регистрируют при
снижении рН менее 4, и общая продолжительность такой
кислотности (норма — <5%) является лучшим
диагностическим критерием гастроэзофагеальной
рефлюксной болезни. Рентгеноскопическое исследование
верхнего отдела пищеварительного тракта («глоток бария»)
помогает обрисовать анатомию пищевода, выявить
грыжу пищеводного отверстия или стриктуру. При
подозрении на парез желудка необходимо провести
количественное исследование опорожнения желудка
для решения вопроса о необходимости одновременной
пилоромиотомии или пилоропластики.
ТЕХНИКА ОПЕРАЦИИ
Создание манжетки по Ниссену лапароскопическим
доступом аналогично технике фундопликации открытым
доступом (рис. 5-9—5-22). У всех пациентов с
абдоминальными операциями в анамнезе используют
открытую технику установки канюли Хэссона. Над бужом
58-60 Fr создают свободную манжетку Ниссена
размером примерно 2-3 см. Буж под визуальным контролем
хирурга с осторожностью вводит анестезиолог.
Короткие желудочные сосуды выборочно перевязывают
(модификация Ниссена-Розетти), если для создания
манжетки без натяжения необходима дальнейшая мобили-
Холедохолитиа
Стенокардия
и ишемическая
болезнь сердца
- Расстройства моторной
функции пищевода
-Гастрит
■ Язвенная болезнь
желудка
Рис. 5-8. Наиболее важные альтернативные диагнозы
у пациентов с гастроэзофагеальной рефлюксной болезнью.
зация дна желудка, хотя не было доказано, что рутинное
применение этой методики снижает выраженность
послеоперационной дисфагии (рис. 5-14) [42].
В случае анатомической необходимости
может быть проведено сшивание ножек диафрагмы
(рис. 5-17). Передний и задний стволы
блуждающего нерва включают в манжетку. На рис. 5-23
показана альтернативная обстановка операционной, когда
хирург оперирует, стоя между ног пациента. Доступ
для частичной лапароскопической фундопликации по
Тупе аналогичен описанному ранее доступу для
методики Ниссена. Завершенная операция по
формированию 270-градусной манжетки представлена как
альтернативная процедура на рис. 5-24.
В настоящее время для диссекции тканей и
пересечения сосудов доступны новые источники энергии —
в качестве альтернативного варианта традиционным
лапароскопическим клипсам, ножницам или
электрокоагуляции. Высокочастотный ультразвуковой
скальпель переводит высокочастотные ультразвуковые
волны в механические колебания лезвия в форме ножниц.
В настоящее время доступны три модели: «Harmonic
scalpel/UltraCision» (Ethicon Endo-Surgery, Cincinnati,
OH), «AutoSonix» (United States Surgical, Norwalk, CT)
и «SonoSurg» (Olympus Surgical, Orangeburg, NY). Эти
инструменты можно ввести через стандартный
5-миллиметровый порт. Они позволяют безопасно пересекать
сосуды до 5 мм в диаметре. В качестве альтернативы
предложен биполярный инструмент на основе электро-
каутеризации с компьютерным контролем («LigaSure»;
Valleylab, Boulder, СО). В нем используется комбинация
механического давления, высокого напряжения и
низкой силы тока для склеивания тканей, а механическое
лезвие добавляет к этому режущий эффект. Этот
5-миллиметровый инструмент весьма многогранен как
диссектор и способен склеивать сосуды до 7 мм в диаметре
Глава 5. Лапароскопические антирефлюксные операции 57
[43]. Важно, что термальное повреждение окружающих
тканей ограничено несколькими миллиметрами,
позволяя проводить диссекциию безопасно и более
точно. Было показано, что эти новые технологии снижают
продолжительность операции и кровопотерю, а также
доказана их чрезвычайная польза при лигировании
коротких желудочных сосудов во время
лапароскопической фундопликации [44, 45].
Рис. 5-9. Обстановка операционной для лапароскопическкой
фундопликациии. Катетер Фолея и назогастральную трубку
устанавливают после введения в общий наркоз. Пациента
укладывают в 30-градусное положение Тренделенбурга
с руками, фиксированными по сторонам (опционно).
Пневмоперитонеум создается с помощью иглы Вереша
(иглу вводят в брюшную полость через маленький
параумбиликальный разрез) или с помощью открытой
техники (канюлю Хэссона вводят через разрез длиной
1,5-2 см). Затем через 5- или 10-миллиметровый троакар
вводят угловой (30 или 45°) лапароскоп. Пациентам с большим
животом или с большим расстоянием между пупком
и мечевидным отростком порт для камеры устанавливают
супраумбиликально.
Рис. 5-10. Установка троакаров для лапароскопической
фундопликации. Давление пневмоперитонеума
поддерживают на уровне 15 мм рт.ст. Еще четыре троакара
вводят под визуальным лапароскопическим контролем.
Пятимиллиметровый троакар устанавливают в верхнем
отделе по средней линии для печеночного ретрактора. Через
10-миллиметровый троакар в левом верхнем квадранте
можно ввести эндоскопический зажим Бэбкока для ретракции
желудка. «Правило треугольника» гласит, что троакары
для оперирующего двумя руками хирурга вводят в области
основания треугольника. Троакары необходимо вводить как
можно выше, чтобы они могли достичь хиатуса. Верхушкой
треугольника является пищеводно-желудочный переход.
ПОДГОТОВКА
58 Лапароскопическая хирургия. Атлас
Веерный ретрактор -
Серповидная
Желчный
пузырь.
доля печени
Дно
желудка
«LigaSure»
Желудок
Селезенка
Большой
сальник
Рис. 5-11. Вид через трансумбиликально установленный
лапароскоп. Печеночным ретрактором приподнимают
левую долю печени. Желудочно-печеночную связку
мобилизуют и пересекают с помощью ультразвуковых ножниц
или 5-миллиметрового устройства «LigaSure» (Valleylab,
Boulder, СО). Необходимо идентифицировать аберрантную
левую печеночную артерию в желудочно-печеночнои связке
и избежать ее повреждения.
Левая доля печени
Петлевидные
волокна хиатуса
Передний
блуждающи^
Абдоминальный
отдел пищевода
«LigaSure»
Селезенка
Рис. 5-12. После рассечения желудочно-печеночнои
связки правую ножку диафрагмы мобилизуют
от гастроэзофагеального соединения. Необходимо с особой
тщательностью проводить диссекцию ножки диафрагмы
от пищевода. Движения назогастральной трубки в просвете
пищевода при осмотре гастроэзофагеального соустья
способствуют выявлению анатомических деталей.
Глава 5. Лапароскопические антирефлюксные операции 59
Рис. 5-13. При отведении пищевода вправо проводят
диссекцию левой ножки диафрагмы, пространство между
этой стороной пищевода и ножкой обнажают тупым путем.
При отведении пищевода кверху позадипищеводное
пространство мобилизуют под визуальным контролем.
Необходимо соблюдать осторожность, чтобы не войти
в плевральную полость. При желании можно наладить
тракцию пищевода книзу с помощью дренажа Пенроуза.
Рис. 5-15. Зажим, установленный через самый латеральный
порт, проводят кзади от желудочно-пищеводного соустья. Дно
желудка захватывают вторым инструментом, находящимся
слева, и передают инструменту, находящемуся справа,
за желудочно-пищеводным соустьем.
Рис. 5-14. Для того чтобы создать манжетку без натяжения,
необходимо мобилизовать дно желудка. Левую латеральную
поверхность дна отводят вправо, в то время как желудочно-
селезеночную связку приподнимают и отводят влево.
Пересечение коротких желудочных сосудов и других
образований, прикрепленных к дну сзади, осуществляют
в направлении от проксимального участка кдистальному
до тех пор, пока все дно не будет мобилизовано.
Ультразвуковые ножницы и устройство «LigaSure» имеют
доказанную эффективность и преимущества в ценовом
факторе при выполнении этого маневра [43-45].
Рис. 5-1б. С помощью зажима, находящегося справа, дно
желудка осторожно протягивают позади пищеводно-
желудочного перехода. После протягивания такого же
сегмента желудка вокруг пищевода создается ЗбО-градусная
манжетка. Используя маневр «чистильщик обуви», обе
стороны манжетки подтягивают вперед и назад для того,
чтобы убедиться в отсутствии перекрута или натяжения.
60 Лапароскопическая хирургия. Атлас
Рис. 5-17. При большом дефекте в диафрагме ножки сшивают
позади пищевода. С помощью атравматического зажима
или дренажа Пенроуза проводят тракцию книзу. Можно
использовать отдельные нерассасывающиеся швы на игле
S-H или «лыжной» игле. Альтернативно интракорпоральное
сшивание осуществляют с помощью устройства «EndoStitch»
{US Surgical, Norwaik, CT). ГЭ — гастроэзофагеальный.
Рис. 5-19. Серозно-мышечный шов проводят слева через
левую стенку желудка, мышечный слой пищевода спереди
и правую стенку желудка.
Рис. 5-18. Назогастральную трубку заменяют бужом 58
или 60 Fr. Во время этого маневра пищеводно-желудочный
переход необходимо поддерживать в неизогнутом состоянии,
действия хирурга и анестезиолога должны быть хорошо
скоординированы, для того чтобы избежать случайной
перфорации. При сшивании желудка и пищевода используют
серозно-мышечные швы 2-0 или 0 из нерассасывающегося
материала. Передний и задний стволы блуждающего нерва
включают в манжетку.
Рис. 5-20. Шов можно затянуть с помощью интра-
или экстракорпоральной техники. При затягивании швов
необходимо избегать передней тракции, чтобы не допустить
разрыва пищевода.
Глава 5. Лапароскопические антирефлюксные операции 61
Рис. 5-21. Второй и третий шов накладывают ниже,
на расстоянии примерно 1 -1,5 см друг от друга, с помощью
идентичной техники. При этом как минимум два шва должны
захватывать стенку пищевода.
Рис. 5-22. Показана завершенная 360-градусная манжетка.
Длина манжетки — примерно 2 см; она должна располагаться
на нижнем отделе пищевода, а не на верхнем отделе желудка.
Троакары и газ удаляют из брюшной полости, разрезы
ушивают согласно стандартной методике.
АЛЬТЕРНАТИВНАЯ ПОДГОТОВКА
Монитор
Мечевидный отросток -
Пупок -
Оператор
- Ассистент
Оперирующий хирург
Операционная
сестра
Рис. 5-23. Альтернативное расположение. Хирур
располагается между ног пациента. Пациент
в литотомическом и обратном (20-30-градусном) положении
Тренделенбурга. Пять троакаров установлены высоко
в эпигастрии. Камера введена через троакар в левом верхнем
квадранте.
62 Лапароскопическая хирургия. Атлас
АЛЬТЕРНАТИВНАЯ ОПЕРАЦИЯ
Рис. 5-24. Альтернативная лапароскопическая
антирефлюксная операция: фундопликация по Тупе.
Как и при открытой операции по Тупе, эта процедура состоит
в формировании 270-градусной задней манжетки, в которую
не вовлечен передний ствол блуждающего нерва.
Исследование
Период
наблюдения, годы
Bammeretal.
[15] (2001)
Lafullardeetal.lW]
(2001)
Beldi и Glattli [16]
(2002)
Granderath et al.
[17] (2002)
AnvariuAllen [18]
(2002)
Dallemagneetal.
[49] (2006)
5
6
3,6
3
5
10
171
166
55
150
181
49
зультаты лапар<
Нисс
Результаты
Пациенты, п отличные/хорошие, %
93
90
98
86
Рецидив
рефлюкса, п I
Повторная
операция,п(%)
11 (5,8)
21 (13)
3(5)
21 (12)
1(2)
3(1,8)
27(15)
2(1,3)
6 (3,3)
1 (1,5)
Рис. 5-25. Отдаленные клинические результаты лапароскопической фундопликации по Ниссену (из: Limpert и Naunheim [47]).
Глава 5. Лапароскопические антирефлюксные операции 63
в г
ОБСУЖДЕНИЕ
У пациентов с гастроэзофагеальной рефлюксной
болезнью лучшая медицинская терапия (ИПН) и
оперативное лечение одинаково эффективно
контролируют клинические симптомы [22, 46]. Однако
хирургическая фундопликация может устранить причину
гастроэзофагеальной рефлюксной болезни и снизить
необходимость длительной фармакотерапии [23]. В
течение последних 10-15 лет открытую фундопликацию
как стандарт хирургического лечения
гастроэзофагеальной рефлюксной болезни заменил
лапароскопический вариант лечения. Недавний метаанализ шести
рандомизированных контролируемых исследований
не обнаружил различий в частоте рецидивов между
лапароскопической и открытой фундопликацией, однако
лапароскопия характеризуется более низкой частотой
послеоперационных осложнений и более коротким
пребыванием в клинике [24].
Наиболее часто лапароскопической операцией,
применяемой при гастроэзофагеальной рефлюксной
болезни, является фундопликация по Ниссену. Ранние
результаты моноцентровых серий были отличными,
с очень низкими смертностью (0,2%), частотой
операционных осложнений (4,2%) и небольшим числом кон-
версий в открытую фундопликацию (5,8%) [48]. Около
97% пациентов отмечали облегчение симптомов реф-
люкса, в то время как ранняя послеоперационная дис-
фагия зафиксирована у 20% пациентов, а поздняя —
у 5,5% [48]. В настоящее время доступны результаты
среднего и отдаленного сроков наблюдения из
нескольких крупных исследований, которые
продемонстрировали облегчение симптомов у 95% пациентов, относи-
Рис. 5-26. Неудачи при фундопликации. А — полный
разрыв манжетки, рецидивирующая грыжа пищеводного
отверстия. Б — скользящая хиатальная грыжа с манжеткой
ниже диафрагмы. В — желудок, «проскользнувший» выше
манжетки, но ниже диафрагмы. Г — грыжа, включающая всю
манжетку в полости грудной клетки (из: Soperetal. [69]).
тельно низкую частоту рецидивов и необходимости
повторной операции (рис. 5-25) [47]. Количественные
параметры, такие как шкалы индекса качества жизни,
также значительно улучшаются после фундопликации
по Ниссену [17]. У определенной группы пациентов,
однако, фундопликация по Ниссену может
сопровождаться повышенным послеоперационным
газообразованием (до 20%) и дисфагией (до 25%) [24, 48].
В качестве альтернативного варианта была
разработана частичная фундопликация (по Тупе) —
потенциально менее обструктивная методика, которая бы
снизила частоту послеоперационной дисфагии, в то же
время обеспечивая адекватный контроль рефлюкса.
Анализ ранних результатов лапароскопической
фундопликации по Тупе показал необходимый уровень
контроля симптомов рефлюкса и снижение частоты
газообразования и дисфагии по сравнению со сходными
сериями операций по Ниссену [47]. Однако при
длительном периоде наблюдения обнаружили, что
контроль симптомов рефлюкса после операции по Тупе
не столь продолжительный, с рецидивирующим реф-
люксом у 8-20% пациентов и несколько повышенной
частотой проведения повторных операций [47].
Это противоречие привело к появлению
большого количества рандомизированных контролируемых
исследований, непосредственно сравнивающих
операции по Ниссену и Тупе [49]. Первые исследования,
сравнивающие открытую тотальную и частичную
фундопликацию, показали эквивалентный контроль
симптомов, хотя в группе Ниссена чаще отмечали
повышенное газообразование и послеобеденное чувство
64 Лапароскопическая хирургия. Атлас
полноты [50, 51]. Ранние (от 6 нед до 1 года)
результаты исследований, базировавшихся на лапароскопии,
были смешанными, с некоторыми предпосылками,
указывающими на то, что частичная манжетка
позволяет избежать послеоперационного газообразования
и дисфагии [52-54] ценой рецидивирования
симптомов рефлюкса [55, 56]. Kamolz et al. [57] сообщили
ранние (1-летние) и отдаленные (5-летние)
результаты (как клинические, так и по качеству жизни в серии
из 104 операций по Ниссену и 65 операций по Тупе
[58]). После 5 лет наблюдения показатели качества
жизни и частоты дисфагии, рецидивов рефлюкса
и удовлетворенности пациентов для обеих методик
были эквивалентными [58]. Прямо противоположно
этому Fernando et al. [59] сообщили о повышенной
зависимости от ИПН (38 против 20%) и
неудовлетворенности пациентов (21 против 7%), а также
дисфагии (34 против 15%) в группе Тупе через 20 мес после
операции. В этом исследовании, однако, в группе Тупе
перед операцией отмечалась повышенная частота
нарушения двигательной активности пищевода (37
против 8,6%). Эти данные стимулировали других
исследователей к более тщательному изучению связи между
ослабленной перистальтикой пищевода и
результатами лапароскопической фундопликации. Chrysos et al.
проспективно рандомизировали 33 пациентов с
ослабленной двигательной активностью пищевода (<30 мм
рт.ст. амплитуды дистальных сокращений) для
лапароскопических фундопликации по Тупе и Ниссену.
Хотя через 3 мес частота дисфагии (57 против 16%)
и газообразования (50 против 21%) была выше после
операции по Ниссену, уже через 12 мес результаты
были эквивалентными. Другие проспективные
исследования [61, 62] альтернативно
продемонстрировали, что предоперационное нарушение двигательной
функции пищевода существенно не влияет на
клинические результаты и что фундопликация по Ниссену
является надежной опцией даже при наличии
небольшой или умеренно выраженной дисфункции [47].
Неудачная лапароскопическая фундопликация
представлена несколькими формами, каждая из которых
характеризуется персистированием предоперационных
симптомов или появлением новых. Хотя наиболее
частый признак неудачной операции — дисфагия,
имеются и другие симптомы (газообразование, диарея, раннее
насыщение или рецидивирующий рефлюкс). Для
подтверждения диагноза первым тестом, который
необходимо провести, является исследование с барием.
Различают четыре вида анатомических неудач
(рис. 5-26). Технические неудачи могут объясняться
слабой мобилизацией пищевода, неадекватным
сшиванием ножек в условиях грыжи пищеводного
отверстия или созданием манжетки с натяжением после
неудачной попытки пересечения коротких желудочных
сосудов [63]. Другие способствующие факторы —
наличие диафрагматических стрессоров, например
ожирения. Если подозревается неудачный исход операции,
необходимо провести полную диагностическую
оценку, уделяя внимание документации анатомических
и функциональных проблем, включая двигательную
активность пищевода. Опытный хирург может
предпринять повторную операцию лапароскопическим
доступом, она будет заключаться в полной диссекции
и ревизии первичной манжетки [64-66].
В заключение следует сказать, что
лапароскопические фундопликации по Ниссену и Тупе можно
безопасно применять как эффективные антирефлюксные
операции, имеющие такие же хорошие результаты,
как и открытые операции. Лучших результатов можно
достичь у тщательно отобранных пациентов для
выполнения именно этих методик. Для лапароскопических
фундопликации, как и для других лапароскопических
операций, характерны сниженные болевой синдром
и продолжительность госпитализации, а также раннее
возвращение к обычной активности. Общая стоимость
операции может быть ниже, чем при открытом
доступе, из-за снижения сроков госпитализации и раннего
возвращения к труду. Несмотря на неоднозначную
доказательную базу, лапароскопическую фундопликацию
по Тупе часто используют для лечения пациентов с
выраженными нарушениями двигательной активности
пищевода и гастроэзофагеальной рефлюксной
болезнью. Лучшей операцией для пациентов с нормальной
двигательной активностью пищевода является
лапароскопическая фундопликация по Ниссену.
Повторную операцию после неудачной фундопликации
должен проводить опытный лапароскопический хирург.
Для того чтобы определить, какие пациенты являются
оптимальными кандидатурами для проведения
хирургической фундопликации (к примеру, пожилые
или люди с излишней массой тела), необходимо
проведение дальнейших исследований. Следует добавить,
что в настоящее время разрабатывают эндолюминаль-
ные процедуры, которые могут стать следующим
поколением хирургических операций при
гастроэзофагеальной рефлюксной болезни [64-66].
Глава 5. Лапароскопические антирефлюксные операции 65
СПИСОК ЛИТЕРАТУРЫ
1. Sandier R.S., Everhart J.E., Donowitz M. et al. The burden of selected
digestive disease in the United States // Gastroenterology. —
2002. — Vol. 122. — P. 1500-1511.
2. Allison RR. Reflux esophagitis, sliding hiatal hernia and the anatomy
of repair // Surg. Gynecol. Obstet. — 1951. — Vol. 92. — P. 419-
431.
3. Nissen R. Eine einfache Operation zur Beeinflussung der
Refluxoesophagitis // Schweiz. Med. Wochenschr. — 1956. —
Vol. 86. — P. 590-592.
4. Baue A.E., Belsey R.H. R. The treatment of sliding hiatus and reflux
esophagitis by the Mark IV technique // Surgery. — 1967. —
Vol. 62. — P. 396-406.
5. Toupet A.M. Technique dbesophago-gastroplastic avec phreno-
gastropexie applique dans le cure radicale des hernies hiatales et
comme complement de 1-operation de Heller dans les cardiospasmes //
Academie de Chirurgie. — 1963. — Vol. 89. — P. 394-399.
6. Ceagea T. Laparoscopic Nissens fundal plication is feasible // Can.
J. Surg. — 1991. — Vol. 34. — P. 313.
7. Dallemagne В., Weerts J.M., Jehaes C. et al. Laparoscopic Nissen
fundoplication: preliminary report // Surg. Laparosc. Endosc. —
1991. — Vol. 3. — P. 138-143.
8. Bittner H.B., Meyers W.C., Brazer S.R., Pappas T.N. Laparoscopic
Nissen fundoplication: operative results and short-term follow-
up // Am. J. Surg. — 1994. — Vol. 167. — P. 193-198.
9. Hinder R.A., Filipi C.J., Wetscher С et al. Laparoscopic Nissen
fundoplication is an effective treatment for gastroesophageal reflux
disease // Ann. Surg. — 1994. — Vol. 220. — P. 472-483.
10. Jamieson C.C., Watson D.I., Britten-Jones R. et al. Laparoscopic Nissen
fundoplication // Ann. Surg. — 1994. — Vol. 220. — P. 137-145.
11. Cotley D.C., Smithers B.M., Rhodes M., et al. Laparoscopic Nissen
fundoplication: 200 consecutive cases // Gut. — 1996. — Vol. 38. —
P. 487-491.
12. Watson D.I., Hamieson C.G., Baigrie R.J. et al. Laparoscopic
surgery for gastroesophageal reflux: beyond the learning curve //
Br. J. Surg. — 1996. — Vol. 83. — P. 1284-1287.
13. Cattey R.P., Henry L.C., Bielfield M.R. Laparoscopic Nissen
fundoplication for gastroesophageal reflux disease: clinical
experience and outcome in first 100 patients // Surg. Laparosc.
Endosc. — 1996. — Vol. 6. — P. 430-433.
14. LafuUarde T, Watson D.I., Jamieson C.G. et al. Laparoscopic Nissen
fundoplication: five-year results and beyond // Arch. Surg. —
2001. — Vol. 136. — P. 180-184.
15. Bammer Т., Hinder R.A., Klaus A. et al. Five-to eight-year outcome
of the first laparoscopic Nissen fundoplications // J. Gastrointest.
Surg. — 2001. — Vol. 5. — P. 41-48.
16. Beldi G., Glattli A. Long-term gastrointestinal symptoms after
laparoscopic Nissen fundoplication // Surg. Laparosc. Endosc.
Percutan. Tech. — 2002. — Vol. 12. — P. 316-319.
17. Granderath F.A., Kamolz T, Schweiger U.M. et al. Quality of
life, surgical outcome, and patient satisfaction three years after
laparoscopic Nissen fundoplication // World J. Surg. — 2002. —
Vol. 26.— P. 1234-1238.
18. Anvari M /, Allen C. Five-year comprehensive outcomes evaluation
in 181 patients after laparoscopic Nissen fundoplication //
J. Am. Coll. Surg. — 2003. — Vol. 196. — P. 51-57.
66 Лапароскопическая хирургия. Атлас
19. Cuschieri A., Hunter J., Wolfe B. et al. Multicenter prospective
evaluation of laparoscopic antireflux surgery: preliminary report //
Surg. Endosc. — 1993. — Vol. 7. — P. 505-510.
20. Hunter J.H., Trus T.L., Branum G.D. et al. A physiologic approach
to laparoscopic fundoplication for gastroesophageal reflux disease //
Ann. Surg. — 1996. — Vol. 223. — P. 673-687.
21. Moayyedi P., Talley N.J. Gastro-oesophageal reflux disease //
Lancet. — 2006. — Vol. 367. — P. 2086-2100.
22. Allgood P.C., Bachmann M. Medical or surgical treatment
for chronic gastro-oesophageal reflux? A systematic review of
published evidence of effectiveness // Eur. J. Surg. — 2000. —
Vol. 166. — P. 713-721.
23. Spechler S.J., Lee E., Ahnen D. et al. Long-term outcome of medical
and surgical therapies for gastroesophageal reflux disease //
JAMA. — 2001. — Vol. 285. — P. 2331-2338.
24. Catarci M., Gentileschi P., Papi C. et al. Evidence-based appraisal
of antireflux fundoplication // Ann. Surg. — 2004. — Vol. 239. —
P. 325-327.
25. Peters J.H., Heimbucher J., Kauer K.H. et al. Clinical and
physiologic comparison of open and laparoscopic // J. Am. Coll.
Surg. — 1995. — Vol. 180. — P. 385-393.
26. Laine S., Rantala A., Gullichsen R. et al. Laparoscopic versus
conventional Nissen fundoplication: a prospective randomized
study // Surg. Endosc. — 1997. — Vol. 11. — P. 441-444.
27. Wenner J., Nilsson G., Oberg S. et al. Short-term outcome after
laparoscopic and open 360-degree fundoplication: a prospective
randomized clinical trial // Surg. Endosc. — 2001. — Vol. 15. —
P. 1124-1128.
28. Chrysos E., Tsiaoussis J., Athanasakis E. et al. Laparoscopic versus
open approach for Nissen fundoplication: a comparative study //
Surg. Endosc. — 2002. — Vol. 16. — P. 1679-1684.
29. Nilsson G., Wenner J., Larsson S. et al. Randomized clinical trial
of laparoscopic versus open fundoplication for gastroesophageal
reflux // Br. J. Surg. — 2004. — Vol. 91. — P. 552-559.
30. Ackroyd R., Watson D.I., Majeed A.W. et al. Randomized clinical
trial of laparoscopic versus open fundoplication for gastroesophageal
reflux disease // Br. J. Surg. — 2004. — Vol. 91. — P. 975-982.
31. Finlayson S.R., Laycock W.S., Birkmeyer J.D. National trends in
utilization and outcomes of antireflux surgery // Surg. Endosc. —
2003. — Vol. 17. — P. 864-867.
32. Flum D.R., Koepsell Т., Heagerty P., Pellegrini C.A. The nationwide
frequency of major adverse outcomes in antireflux surgery and
the role of surgeon experience: 1992-1997 // J. Am. Coll. Surg. —
2002. — Vol. 195. — P. 611-618.
33. Gahagan T. The function of the musculature of the esophagus and
stomach in the esophagogastric sphincter mechanism // Surg.
Gynecol. Obstet. — 1962. — Vol. 114. — P. 293-303.
34. Stein H.J., De Meester T.R. Who benefits from antireflux surgery? //
World J. Surg. — 1992. — Vol. 16. — P. 313-319.
35. Hiebert C.A., Belsey R.H. R. Incompetency of the gastric cardia
without radio-logic evidence of hiatal hernia // J. Thoracic.
Cardiovasc. — 1961. — Vol. 42. — P. 352-362.
36. De Meester T.R., Wernly J.A., Bryant G.H. et al. Clinical and in vitro
analysis of determinants of gastroesophageal competence // Am.
J. Surg. — 1979. — Vol. 137. — P. 39-46.
37. Skinner D.B. Pathophysiology of gastroesophageal reflux // Ann.
Surg. — 1985. — Vol. 202. — P. 546-556.
38. Lundell L.F., Dent J., Bennett J.R. et al. Endoscopic assessment of
esophagitis: clinical and functional correlates and further validation
of the Los Angeles classification // Gut. — 1999. — Vol. 45. —
P. 172-180.
39. Stein H.J., Barlow A.P., De Meester T.R., Hinder R.A. Complications
of gastroesophageal reflux disease: role of the lower esophageal
sphincter, esophageal acid and acid / alkaline exposure, and
duodenogastric reflux // Ann. Surg. — 1992. — Vol. 216. — P. 35-
43.
40. De Vault K.R., Castell D.O. American College of Gastroenterology
updated guidelines for the diagnosis and treatment of
gastroesophageal reflux disease // Am. J. Gastroenterol. — 2005. —
Vol. 100. — P. 190-200.
41. Stein H.J., De Meester T.R., Naspetti R. The three-dimensional
lower esophageal sphincter pressure profile in gastroesophageal
reflux disease // Ann. Surg. — 1991. — Vol. 214. — P. 374.
42. Watson D.I., Pike C.R., Baigrie R.J. et al. Prospective double-
blind randomized trial of laparoscopic Nissen fundoplication
with division and without division of short gastric vessels // Ann.
Surg. — 1997. — Vol. 173. — P. 242-255.
43. Heniford B.T., Matthews B.D., Sing R.R et al. Initial results with
an electrothermal bipolar vessel sealer // Surg. Endosc. — 2001. —
Vol. 15. — P. 799-801.
44. Swanstrom I.L., Pennings J.L. Laparoscopic control of short gastric
vessels // J. Am. Coll. Surg. — Vol. 181. — P. 347-351.
45. Underwood R.A., Dunnegan D.L., Soper N.J. Prospective,
randomized trial of bipolar electrosurgery vs ultrasonic coagulation
for divison of short gastric vessels during laparoscopic Nissen
fundoplication // Surg. Endosc. — 1999. — Vol. 13. — P. 763-768.
46. Lundell L., Miettinen P., Myrvold H.E. et al. Continued (5-year)
follow-up of a randomized clinical study comparing antireflux
surgery and omeprazole in gastroesophageal reflux disease //
J. Am. Coll. Surg. — 2001. — Vol. 192. — P. 172-181.
47. Limpert P.A., Naunheim K.S. Partial versus complete
fundoplication: is there a correct answer? // Surg. Clin.
North Am. — 2005. — Vol. 85. — P. 399-410.
48. Perdikis C, Hinder R.A., Lund R.L. et al. Laparoscopic Nissen
fundoplication: where do we stand? // Surg. Laparosc. Endosc. —
1997. — Vol. 7. — P. 17-21.
49. Dallemagne В., Weerts J., Markiewicz S. et al. Clinical results
of laparoscopic fundoplication at 10 years after surgery // Surg.
Endosc. — 2006. — Vol. 20. — P. 159-165.
50. Lundell L., Abrahamsson H., Ruth M. et al. Long-term results of a
prospective randomized comparison of total fundic wrap (Nissen-
Rosetti) or semifundo-plication (Toupet) for gastroesophageal
reflux // Br.J. Surg. — 1996. — Vol. 83. — P. 830-835.
51. Hagedorn L., Lonroth H., Rydberg L. et al. Long-term efficacy of
total (Nissen-Rosetti) and posterior partial (Toupet) fundoplication:
results of randomized clinical trial // J. Gastrointest. Surg. —
2002. — Vol. 6. — P. 540-545.
52. Bell R.C. W., Hanna P., Powers B. et al. Clinical manometric results
of laparoscopic partial (Toupet) and complete (Rosetti-Nissen)
fundoplication // Surg. Endosc. — 1996. — Vol. 10. — P. 724-728.
53. Zornig C, Strate U., Emmerman A. et al. Nissen vs Toupet
laparoscopic fundoplication // Surg. Endosc. — 2002. — Vol. 16. —
P. 758-766.
54. Coster D.D., Bower W.H., Wilson V.T. et al. Laparoscopic partial
fundoplication vs. laparoscopic Nissen-Rosetti fundoplication //
Surg. Endosc. — 1997. — Vol. 11. — P. 625-631.
55. Farrell T.M., Archer S.B., Galloway K.D. et al. Heartburn is
more likely to recur after Toupet fundoplication than Nissen
fundoplication // Ann. Surg. — 2000. — Vol. 66. — P. 229-237.
56. Laws H.L., Clements R.H., Swillie CM. A randomized, prospective
comparison of the Nissen fundoplication versus the Toupet
fundoplication for gastroesophageal reflux disease // Ann. Surg. —
1997. — Vol. 225. — P. 647-654.
57. Kamolz Т., Bammer T, Wykypiel H. et al. Quality of life
and surgical outcome after laparoscopic Nissen and Toupet
fundoplication: one-year follow-up // Endoscopy. — 2000. —
Vol. 32. — P. 363-368.
58. Kamolz T, Granderath F.A., Bammer T. et al. «Floppy» Nissen vs
Toupet laparoscopic fundoplication: quality of life assessment in a
5-year follow-up // Endoscopy. — 2002. — Vol. 34. — P. 917-922.
59. Fernando H.C., Luketich J.D., Christie N.A. et al. Outcomes
of laparoscopic Toupet compared to laparoscopic Nissen
fundoplication // Surg. Endosc. — 2002. — Vol. 16. — P. 905-908.
60. Chrysos E., Tsiaoussis J., Zoras O.J. et al. Laparoscopic surgery
for gastroesophageal reflux patients with impaired esophageal
peristalsis: total or partial fundoplication? // J. Am. Coll. Surg. —
2003. — Vol. 197. — P. 8-19.
61. Oleynikov D., Eubanks T.R., Szold A. Total fundoplication is the
operation of choice for patients with gastroesophageal reflux and
defective peristalsis // Surg. Endosc. — 2002. — Vol. 16. — P. 909-
913.
62. Goss В., Shacham Y., Szold A. A complete fundoplication has
similar long-term results in patients with and without esophageal
body dysmotility // Surg. Endosc. — 2003. — Vol. 17. — P. 567-570.
63. Dallemagne В., Weerts J.M., Jahaes C. et al. Causes of failures of
laparoscopic antireflux operations // Surg. Endosc. — 1996. —
Vol. 10.— P. 305-310.
64. Horgan S., Pohl D., Bogetti D. et al. Failed antireflux surgery: what
have we learned from reoperations? // Arch. Surg. — 1999. —
Vol. 134. — P. 809-815.
65. Curet M.J., Josloff R.K., Schoeb O. et al. Laparoscopic reoperation
for failed antireflux procedures // Arch. Surg. — 1999. —
Vol. 134. — P. 559-563.
66. Granderth F.A., Kamolz T, Schwiger U.M. et al. Is laparoscopic
refundoplication feasible in patients with failed primary open
antireflux surgery? // Surg. Endosc. — 2002. — Vol. 16. — P. 381-385.
67. Hoyos A., Fernando H.C Endoscopic therapies for
gastroesophageal reflux disease // Surg. Clin. North Am. — 2005. —
Vol. 85.— P. 465-481.
68. Rothstein R.L, Dukowicz A.C Endoscopic therapy for
gastroesophageal reflux disease // Surg. Clin. North Am. — 2005. —
Vol. 85. — P. 949-965.
69. Mastery of Endoscopic and Laparoscopic Surgery / Eds N.J. Soper,
L.L. Swanstrom, WS. Eubanks. — 2nd ed. — Philadelphia:
Lippincott Williams and Wilkins, 2005. — P. 202.
Глава 5. Лапароскопические антирефлюксные операции 67
Лапароскопическое
лечение ахалазии
пищевода
Себастьян Ж. де ла Фуенте, Аврора Д. Приор
мат®
Ахалазия — расстройство двигательной функции
пищевода, которое характеризуется сочетанием неполного
расслабления нижнего пищеводного сфинктера (НПС)
с отсутствием перистальтики тела пищевода. Это
заболевание одинаково поражает оба пола и встречается
в США с частотой 0,5-1 на 100 000 человек. Проведенные
исследования позволили предположить, что в развитии
ахалазии могут играть роль многие наследственные,
дегенеративные, аутоиммунные и инфекционные
факторы, однако этиология заболевания остается неясной.
Патологическое исследование пациентов с
терминальной стадией ахалазии выявило потерю ингибирующих
неадренергических, нехолинергических ганглионарных
клеток в пищеводном нервном сплетении, фиброз
нервных элементов определенной степени и
воспалительный ответ, состоящий из Т-лимфоцитов, эозинофилов
и тучных клеток [1]. Потеря ингибирующих элементов
и наличие латентного градиента способствуют
возникновению последовательных сокращений, приводящих
к неадекватному расслаблению сфинктера и аперисталь-
тическому состоянию пищевода.
Классическими клиническими признаками
ахалазии пищевода являются дисфагия и боль в грудной
клетке с прогрессирующей непереносимостью
твердой и жидкой пищи. На ранней стадии заболевания
симптомы можно преодолеть с помощью
определенных приемов, таких как запивание пищи жидкостью,
прямая сидячая поза, подъем рук над головой, стояние
или подпрыгивание. У больных также возможна ре-
гургитация непереваренной пищи, особенно после еды
или в лежачем положении. Многие пациенты жалуются
на изжогу, возникающую из-за стаза пищи в пищеводе,
что может еще более отсрочить диагностику ахалазии.
После исключения других причин дисфагии и болей
в грудной клетке лечение ахалазии состоит в
хирургическом устранении обструкции и предотвращении
рефлюкса желудочного содержимого в пищевод.
ОБСУЖДЕНИЕ АНАТОМИИ
Пищевод — мышечная трубка длиной 25 см, которая
лишена серозного слоя и выстлана плоским
эпителием. Верхние 5% мышечной стенки пищевода состоят
из поперечно-полосатых мышц, средние 35-40%
стенки — из сочетания поперечно-полосатых и гладких
мышц и нижние 50-60% — только из гладких мышц.
Внутренний мышечный слой пищевода —
циркулярный, он начинается от верхнего пищеводного
сфинктера с уровня Cy-CVI до НПС. Наружный слой мышц —
продольный, начинается ниже крикофарингеальной
мышцы, от которой он идет в одном направлении
на протяжении всего пищевода (рис. 6-1, 6-2).
Диафрагма
Отверстие
диафрагмы
Правая ножка
диафрагмы
Брюшной отдел
аорты
Чревный ствол
- Грудной отдел пищевода
■ Передний блуждающий нерв
Дно
желудка
Селезенка
Рис. 6-1. Анатомия пищеводного отверстия диафрагмы
и абдоминального сегмента пищевода. Отверстие диафрагмы
представляет собой петлю из мышечных волокон, которые
у большинства индивидуумов исходят из правой ножки
диафрагмы.
Глава 6. Лапароскопическое лечение ахалазии пищевода 69
Рис. 6-2. Анатомия нижнего отдела пищевода и пищеводно-
желудочного перехода. Точную локализацию пищеводно-
желудочного перехода определить трудно, так как внутреннее
соустье (граница слизистых оболочек — Z-линия)
не соответствует наружному соустью.
Кровоснабжение пищевода сегментарное и имеет
ограниченное количество коллатералей, что
предполагает возможность деваскуляризациии и ишемии.
Для лапароскопического хирурга большое значение
имеет тот факт, что грудной отдел пищевода кровос-
набжается из аорты, межреберных и бронхиальных
артерий, в то время как короткий абдоминальный
отдел — из левой желудочной, коротких желудочных
и левой нижней диафрагмальной артерий.
КЛИНИЧЕСКАЯ КАРТИНА И НАЧАЛЬНЫЕ
ЭТАПЫ ДИАГНОСТИКИ
Симптомы у пациентов с ахалазией обычно
прогрессируют в течение долгого времени до того момента,
как привлекут внимание медиков. Средняя
длительность симптомов составляет примерно 2 года и более,
если симптомы симулируют гастроэзофагеальную
рефлюксную болезнь или другие расстройства приема
пищи. После того как возникают подозрения на аха-
лазию, необходимо провести первичные
диагностические мероприятия, состоящие из тщательного физи-
кального осмотра и сбора анамнеза о наличии
симптомов ахалазии у членов семьи, поскольку существуют
данные о семейной предрасположенности к ахалазии.
«Золотой стандарт» в диагностике ахалазии —
манометрическое исследование пищевода; другие
диагностические методики, такие как исследование с барием
и фиброэзофагогастродуоденоскопия (ФЭГДС), также
важны в оценке пациента с пищеводной дисфагией.
МЕТОДЫ ВИЗУАЛИЗАЦИИ
Эзофагография с барием при ахалазии может выявить
минимальное открытие НПС с характерной картиной
птичьего клюва и, в далеко зашедших случаях, дилата-
Рис. 6-3. На эзофагограмме с барием у пациента с ахалазией
определяется типичная деформация в виде птичьего клюва.
цию и извитость пищевода различной степени (рис. 6-3).
С помощью флюороскопии можно установить слабость
или отсутствие перистальтических волн, что является
отличительной чертой ахалазии. КТ или УЗИ
пищевода помогут дифференцировать ахалазию от псевдоа-
халазии и способствуют определению стадии опухоли,
но не нужны в случае явной ахалазии.
Эндоскопическое исследование
Эндоскопическое исследование необходимо назначать
всем пациентам с ахалазией. Псевдоахалазия,
связанная с опухолью, отмечается в 5% случаев и может иметь
клиническую картину, идентичную ахалазии.
Эндоскопическое исследование позволяет провести
дифференциальную диагностику этих состояний, а также
исключает грибковое поражение дистального отдела
пищевода, которое требует лечения перед операцией.
Часто встречается задержка пищевых масс, которая
также может быть подтверждена с помощью
эндоскопического исследования.
Манометрия
Манометрия — наиболее чувствительный и
специфичный метод диагностики ахалазии, поскольку
выявляет функциональную патологию пищевода. Метод
также позволяет дифференцировать ахалазию от
других функциональных заболеваний пищевода, которые
имеют схожие клинические симптомы:
склеродермии, доброкачественных и злокачественных опухолей
и стриктур. Классическая триада манометрических
признаков: слабость или отсутствие перистальтики,
повышенное давление НПС в покое и неадекватная
релаксация НПС в ответ на глотание (рис. 6-4, А, Б).
Эти три признака, в частности гипертензию НПС,
обнаруживают не у всех пациентов. Для ахалазии пато-
гномонична неспособность НПС к релаксации.
ТЕХНИКА ОПЕРАЦИИ
На рис. 6-5-6-9 представлены обстановка
операционной и техника лапароскопической операции при
лечении ахалазии пищевода.
70 Лапароскопическая хирургия. Атлас
Глотка -
ВПС-
А
Глотка
ВПС
yv
Тело .
пищевода'
А.
А
нпс-
Глотка ■
А
ВПС
Тело
пищевода
НПС
А
А
Рис. 6-4. Манометрическая оценка перистальтики.
При глотании за релаксацией верхнего сфинктера пищевода
следуют сегментарные сокращения тела пищевода, которые
распространяются в дистальном направлении. Нижний
сфинктер пищевода в норме расслабляется для пассажа болюса
пищи в желудок. А — манометрическая оценка пищевода
После получения информированного согласия на мио-
томию Геллера с фундопликацией пациента берут в
операционную, где укладывают на спину на операционный
стол. Если хирург предпочитает оперировать в
положении между ног пациента, ноги помещают на подставки,
однако авторы настоящего издания предпочитают
положение на спине из-за легкой укладки и хорошего обзора.
Живот обрабатывают и обкладывают в обычном
порядке в стерильных условиях, над пупком делают
у пациента с ахалазией. При ахалазии отмечаются отсутствие
пропульсивной перистальтики в теле пищевода (обратите
внимание на одновременные сокращения), повышенное
давление нижнего пищеводного сфинктера в покое и отсутствие
релаксации нижнего пищеводного сфинктера (Б).
срединный разрез длиной 1см с рассечением
апоневроза. Порт необходимо устанавливать примерно
на 15 см ниже мечевидного отростка. Фасцию
захватывают зажимами Кохера, брюшную полость
вскрывают с помощью техники Хэссона. Затем устанавливают
10-12-миллиметровый троакар, который крепят
держалками, и создают пневмоперитонеум с давлением
15 мм рт.ст. В качестве альтернативы можно
использовать доступ с помощью иглы Вереша.
Глава б. Лапароскопическое лечение ахалазии пищевода 71
ПОДГОТОВКА
Наркозный аппарат
Анестезиолог
Операционная_
сестра
' Оператор
камеры
Стойка Мейо
^л" пЪ^|дляинструментов
Столик
/
/
1
1
/ 1
/
J
1
г
0
в
о
А
щ
Б
А
-
1
\
\
\
Рис. 6-5. За 48 ч до операции пациенту разрешается только
питье для сведения к минимуму риска развития аспирации.
Пациенты не принимают ничего внутрь, по крайней мере,
за 7 ч до операции. Если слизистая оболочка пищевода была
повреждена во время процедуры, перед вмешательством
внутривенно вводят антибиотики широкого спектра
действия (например, цефазолин). Для мониторинга
устанавливают уретральный катетер. Необходимо иметь
инструменты для лапаротомии на случай конверсии
в открытую операцию.
Рис. 6-6. После создания пневмоперитонеума
в брюшную полость вводят три 5-миллиметровых и один
11-миллиметровый троакар в следующем порядке: А —
первичный порт для лапароскопа, который устанавливают
на 15 см ниже мечевидного отростка; Б — устанавливают
в левый верхний квадрант по передней подмышечной линии
для ассистента; В — располагают в подмечевидной области
и используют для ретракции печени; Г, Д — для хирурга. Порт
для доминантной руки — 11-миллиметровый, чтобы можно
было ввести сшивающий аппарат.
72 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Рис. 6-7. Использование 30- и 45-градусных лапароскопов
улучшает визуализацию на всех этапах операции. Пациента
укладывают в обратное положение Тренделенбурга,
что улучшает доступ к хиатусу. После установки портов
левую долю печени отводят с помощью гибкого ретрактора.
Этот маневр проводят для доступа к желудочно-печеночной
связке, которую затем рассекают.
Рис. 6-8. Мобилизация желудочно-ободочной связки
способствует диссекции желудочно-пищеводного соустья,
ассистент для улучшения визуализации отводит желудок
книзу и в латеральном направлении. Затем с осторожностью,
чтобы не повредить блуждающий нерв или его ветви,
рассекают диафрагмально-пищеводную связку. Начало
диссекции над пищеводной жировой подушкой способствует
идентификации и защите блуждающего нерва. Обычно нет
необходимости в мобилизации дна желудка. Минимальная
задняя диссекция потенциально позволяет предупредить
послеоперационный рефлюкс.
Рис. 6-9. Миотомию начинают в средней трети
мобилизованного пищевода, латеральнее переднего
блуждающего нерва. Для идентификации и разделения
отдельных мышечных волокон используют
электрохирургический крючок. При работе небходимы очень
низкие настройки электрокоагулятора — между 15 и 25 Вт.
Крючок осторожно проводят вокруг каждого мышечного
пучка аккуратными движениями вперед и назад. Нужно
работать с коагуляцией осторожно, избежать соприкосновения
с поверхностью пищевода и не использовать заднюю
поверхность крючка. Начало диссекции выше пищеводно-
желудочного перехода облегчает последующие этапы
процедуры. Продольные волокна разделяют над '/, или 72
передней поверхности пищевода. А — разрез углубляют вплоть
до идентификации циркулярных мышечных волокон. Б —
на этом этапе миотомия распространяется кверху и книзу также
с использованием электрохирургического крючка. Миотомия
распространяется настолько проксимально, насколько это
возможно перед началом работы с дистальным участком.
Пересечение волокон на желудке затрудняет диссекцию в этой
области. Полная миотомия требует пересечения волокон
под пищеводной жировой подушкой. Параллельно проводят
интраоперационную эндоскопию для немедленной оценки
адекватности миотомии и подтверждения целостности
слизистой оболочки в конце процедуры. В — миотомия
подтверждается пересечением петлевых мышц желудочно-
пищеводного соустья и распространяется на стенку желудка
на протяжении не менее 1,5-2 см, что визуализируется
при симультанной эндоскопии. Мышечная оболочка в области
дна желудка гораздо более тонкая, и слизистая здесь плотнее
прилегает к мышечному слою, таким образом, при диссекции
этой области значительно возрастает вероятность ятрогенного
повреждения.
Глава б. Лапароскопическое лечение ахалазии пищевода 73
Рис. 6-10. После завершения миотомии проводят
фундопликацию. Некоторые хирурги предпочитают
частичную заднюю фундопликацию (по Тупе), однако
формирование частичной передней фундопликации
(по Дору) позволяет избежать позадипищеводной диссекции
и обеспечивает дополнительную защиту для миотомии.
Фундопликацию по Дору формируют с использованием
краев миотомии, дна желудка и ножек диафрагмы с помощью
отдельных швов.
ПОСЛЕОПЕРАЦИОННОЕ ВЕДЕНИЕ
И ОБЩИЕ РЕЗУЛЬТАТЫ
После операции пациенты обычно остаются в клинике
на ночь и выписываются следующим утром, если
послеоперационный восстановительный период
протекает без осложнений. Питье разрешают сразу же после
операции, жидкую диету назначают утром следующего
дня. Пациентов инструктируют на предмет
расширения диеты по мере того, как это будет позволять
состояние. В обзоре случаев ахалазии, оперированных
основным автором этой главы, средняя
продолжительность госпитализации составила 34 ч. Важна
агрессивная терапия тошноты и рвоты, необходимая для того,
чтобы предотвратить потенциальный разрыв
созданной манжетки, хотя такое бывает редко. Пациенты
возвращаются в клинику для осмотра через 2-3 нед
после операции. Им советуют проходить
эндоскопическое исследование верхних отделов пищеварительного
тракта в течение первого года после операции и
периодически в течение жизни для исключения каких-либо
диспластических изменений.
Хотя для лечения ахалазии применяют и другие,
нехирургические методы, такие как бужирование
пищевода, инъекции ботулинического токсина или
нитраты, тем не менее оперативное лечение продолжает
оставаться «золотым стандартом» для этих пациентов.
Однако врачи общей практики могут быть
приверженцами нехирургических методов, и многие пациенты
направляются к хирургу лишь после такого лечения.
Некоторые авторы обнаружили, что интра- и
послеоперационные осложнения чаще встречаются у
пациентов после эндоскопической терапии [2] и что
предоперационное лечение может сделать миотомию более
трудной [3]. Более того, Европейское
рандомизированное проспективное исследование, сравнивающее инъ-
Рис. 6-11. Фундопликацию по Дору проводят тремя швами:
1 — сшивают левую ножку, левую поверхность дна и левый
край пересеченных мышц; 2 — сшивают правую поверхность
дна и правую ножку; 3 — соединяют правую ножку, правую
поверхность дна и правый край пересеченных мышц.
екции ботулинического токсина с миотомией Геллера
и фундопликацией по Дору, выявило, что пациенты
в хирургической группе отмечают улучшение
состояния после операции, но показать различия в
снижении давления НПС между двумя группами не удалось
[4]. Это исследование с коротким сроком наблюдения
также показало, что симптомы рецидивируют чаще
у пациентов после инъекций ботулинического токсина
в сравнении с хирургической группой. Другое
рандомизированное контролируемое исследование,
сравнивающее бужирование пищевода с миотомией Геллера,
показало, что в хирургической группе отмечалось
почти полное разрешение симптомов по сравнению с 51%
в группе после бужирования (р <0,01) после 5 лет
наблюдения [5].
В целом разрешение дисфагии после хирургического
лечения ахалазии отмечается более чем в 90% случаев
[6-8] с частотой послеоперационного рефлюкса
примерно от 10 до 30% [9, 10]. Недавно проведенное
исследование Csendes et al. [11] среди пациентов,
подвергшихся миотомии Геллера за более чем 30-летний период,
показало, что в течение года после операции отмечается
значительное снижение давления в покое по сравнению
с предоперационными показателями и эти различия
остаются устойчивыми с течением времени. В этом
исследовании процентное соотношение релаксации перед
операцией варьировало от 20 до 79 по сравнению с 90
и 100 через длительный промежуток времени после
операции. У трех пациентов был диагностирован рак
пищевода через 5, 7 и 15 лет после операции. Интра-
операционное осложнение, такое как перфорация
пищевода, отмечено у 5-10% пациентов [12]. Кровотечение,
раневая инфекция и сердечно-сосудистые осложнения
были относительно редким явлением. По неизвестным
причинам часто нераспознанными в этой популяции
74 Лапароскопическая хирургия. Атлас
послеоперационными осложнениями были
дыхательные расстройства. В клинике автора до 7% пациентов
страдали от некоторых видов дыхательных расстройств
после операции, хотя другие осложнения встречались
редко. Интраоперационные повреждения слизистой
оболочки в серии исследований, проведенных автором,
зафиксированы менее чем в 2% случаев.
Хотя общепризнано, что лапароскопический
доступ обеспечивает отличную визуализацию дисталь-
ного отдела пищевода и желудка, имеются
разночтения, касающиеся протяженности миотомии Геллера
и необходимости антирефлюксной операции у таких
пациентов. По всеобщему соглашению, для лучших
результатов лапароскопической миотомии она должна
захватывать по крайней мере 1,5-3см желудка [13, 14].
Эта расширенная миотомия эффективно разрушает
НПС, улучшая результаты операции [15].
ФУНДОПЛИКАЦИЯ
Поскольку разрушение НПС способствует рефлюксу
желудочного содержимого в пищевод, обычно миото-
мию Геллера дополняют фундопликацией [16].
Приверженцы задней парциальной фундопликации (по Тупе)
соглашаются, что эта методика обеспечивает
превосходный барьер для рефлюкса, сохраняя разделение
краев миотомии [17]. В контрасте с ней передняя
парциальная фундопликация (по Дору) защищает миото-
мию, избегая необходимости позадипищеводной дис-
секции. Техника фундопликации по Дору,
предложенная авторами издания, состоит в прикреплении краев
миотомии к ножкам, таким образом, также сохраняя
разделение краев миотомии (рис. 6-11). Небольшое
рандомизированное исследование показало, что у
пациентов с ахалазией после фундопликации по Тупе
послеоперационный рефлюкс отмечается реже, чем по-
/ "г ' ' '""" " '"""""" """"" ' ■"■""■"" || "'■■-'
СПИСОК ЛИТЕРАТУРЫ
-
1 Coldblum J.R., Whyte R.I., Orringer M.B. et al. Achalasia:
a morphologic study of 42 resected specimens // Am. J. Surg.
Pathol. — 1994. — Vol. 18. — P. 327-337.
2. Smith CD., Stival A., Howell D.L., Swafford V. Endoscopic therapy
for achalasia before Heller myotomy results in worse outcomes than
Heller myotomy alone // Ann. Surg. — 2006. — Vol. 243. — P. 579-
584.
3. Horgan S., Hudda K., Eubanks T. et al. Does botulinum toxin
injection make esophagomyotomy a more difficult operation? //
Surg. Endosc. — 1999. — Vol. 13. — P. 576-579.
4. Zaninotto G., Annese V, Costantini M. et al. Randomized
controlled trial of botulinum toxin versus laparoscopic Heller
myotomy for esophageal achalasia // Ann. Surg. — 2004. —
Vol. 239. — P. 364-370.
5. Csendes A., Braghetto I., Henriquez A. et al. Late results of a
prospective randomized study comparing forceful dilation and
Глава 6.
еле фундопликации по Дору [18]. Однако эти данные
не были подтверждены другими исследователями.
Shulz et al. [19] провели ретроспективный обзор 51
пациента после лапароскопической миотомии Геллера
с фундопликациями по Дору или Тупе. Авторы не
отметили каких-либо различий в послеоперационных
результатах в обеих группах. В более крупном
исследовании, сравнивающем фундопликации по Дору и Тупе,
Arain et al. [20] обследовали 78 пациентов на предмет
послеоперационной дисфагии или симптомов
рефлюкса. Исследование показало, что различий между
группами в оценке послеоперационных симптомов врачом
и разрешении дисфагии, оценке результата пациентом
или послеоперационном использовании ингибиторов
протонного насоса не было. К настоящему времени
в литературных источниках по хирургии не
опубликовано проспективных рандомизированных
контролируемых исследований, сравнивающих эти две техники.
ЗАКЛЮЧЕНИЕ
Миотомия Геллера является терапией выбора для
пациентов с ахалазией. Техника может быть безопасно
проведена лапароскопически с хорошими
отдаленными результатами и относительно небольшим
количеством интра- и послеоперационных осложнений.
В связи с тем что разрыв НПС предрасполагает к реф-
люксной болезни, необходимо дополнить процедуру
частичной фундопликацией. До тех пор пока не
получено более точных данных, выбор методики
фундопликации основывается на освоенности данной
техники хирургом. Для оценки диспластических изменений
пищевода пациенты в послеоперационном периоде
должны подвергаться рутинному эндоскопическому
исследованию, которое начинают через год после
хирургического вмешательства.
esophagomyotomy in patients with achalasia // Gut. — 1989. —
Vol. 30. — P. 299-304.
6. Patti M.C., Pellegrini C.A., Horgan S. et al. Minimally invasive
surgery for achalasia: an 8-year experience with 168 patients //
Ann. Surg. — 1999. — Vol. 230. — P. 587-593.
7. Hunter J.G., Richardson W.S. Surgical management of achalasia //
Surg. Clin. North Am. — 1997. — Vol. 77. — P. 993-1015.
8. Swanstrom L.L., Pennings J. Laparoscopic esophagomyotomy for
achalasia // Surg. Endosc. — 1995. — Vol. 9. — P. 286-292.
9. Holzman M.D., Sharp K.W., Ladipo J.K. et al. Laparoscopic surgical
treatment of achalasia // Am. J. Surg. — 1997. — Vol. 173. —
P. 308-311.
10. Burpee S.E., Mamazza J., Schlachta C.M. et al. Objective analysis of
gastro-esophageal reflux after laparoscopic heller myotomy: an
antireflux procedure is required // Surg. Endosc. — 2005. — Vol. 19. —
P. 9-14.
Лапароскопическое лечение ахалазии пищевода 75
11. Csendes A., Braghetto I., Burdiles P. et al. Very late results of
esophagomyotomy for patients with achalasia: clinical, endoscopic,
histologic, mano-metric, and acid reflux studies in 67 patients
for a mean follow-up of 190 months // Ann. Surg. — 2006. —
Vol. 243. — P. 196-203.
12. Bloomston M., Serafmi E, Rosemurgy A.S. Videoscopic Heller
myotomy as first-line therapy for severe achalasia // Am. Surg. —
2001. — Vol. 67. — P. 1105-1109.
13. Woltman T.A., Pellegrini C.A., Oelschlager B.K. Achalasia // Surg.
Clin. North Am. — 2005. — Vol. 85. — P. 483-493.
14. Patti M.G., Molena D., Fisichella P.M. et al. Laparoscopic Heller
myotomy and Dor fundoplication for achalasia: analysis of
successes and failures // Arch. Surg. — 2001. — Vol. 136. — P. 870-
877.
15. Oelschlager B.K., Chang L., Pellegrini C.A. Improved outcome after
extended gastric myotomy for achalasia // Arch. Surg. — 2003. —
Vol. 138. — P. 490-495.
16. Richards W.O., Torquati A., Holzman M.D. et al. Heller myotomy
versus Heller myotomy with Dor fundoplication for achalasia:
a prospective randomized double-blind clinical trial // Ann.
Surg. — 2004. — Vol. 240. — P. 405-412.
17. Katada N., Sakuramoto S., Kobayashi N. et al. Laparoscopic Heller
myotomy with Toupet fundoplication for achalasia straightens
the esophagus and relieves dysphagia // Am. J. Surg. — 2006. —
Vol. 192. — P. 1-8.
18. Raiser E, Perdikis G., Hinder R.A. et al. Heller myotomy via
minimal-access surgery: an evaluation of antireflux procedures //
Arch. Surg. — 1996. — Vol. 131. — P. 593-597.
19. Schulz H.G., Loick J., Hessling M., Hohlbach G. Laparoscopic
Heller cardio-myotomy either combined with a Dor or Toupet
procedure in the treatment of achalasia // Zentralbl. Chir. —
2004. — Vol. 129. — P. 381-386.
20. Arain M.A., Peters J.H., Tamhankar A.P. et al. Preoperative lower
esophageal sphincter pressure affects outcome of laparoscopic
esophageal myotomy for achalasia // J. Gastrointest. Surg. —
2004. — Vol. 8. — P. 328-334.
76 Лапароскопическая хирургия. Атлас
Лапароскопическая
пластика
параэзофагеальной
грыжи
Евгения П. Сеппа, Аврора Д. Приор
шш©®
Протрузия дна желудка в средостение кпереди
от пищеводно-желудочного перехода известна как па-
раэзофагеальная грыжа (ПЭГ). ПЭГ составляет
только 5% всех грыж пищеводного отверстия диафрагмы,
но предвещает плохой прогноз при экстренном
лечении. Наиболее серьезным, угрожающим жизни
осложнением ПЭГ являются заворот или ущемление желудка.
Однако плановая лапароскопическая пластика после
своевременной диагностики безопасна и дает хорошие
результаты.
Первое описание ПЭГ датируется намного
позже, чем описание травматической диафрагмальной
грыжи Ambrose Pare в 1579 г. Вероятнее всего,
техники аутопсии, применяемые до наступления XX в.,
делали невозможным распознавание ПЭГ. В 1800-х гг.
Rene Laennec и Astley Cooper независимо друг от друга
предположили, что органы брюшной полости могут
выпячиваться в грудную полость через естественные
отверстия в диафрагме. Henry Bodwitch сообщил о
первом известном случае ПЭГ во время посмертного
исследования. В его описании пищевод опустился через
диафрагму и вернулся с левой стороны через апертуру
в грудную полость, где соединился с желудком [1].
В начале XX в. ПЭГ была признана
самостоятельной нозологической единицей, это стало возможным
в первую очередь с использованием рентгенографии
в дополнение к истории заболевания и физикальному
осмотру. Несколько врачей обобщили свой
клинический опыт по диафрагмальным грыжам, выходящим
через пищеводное отверстие, что привело к описанию
анатомической проблемы, связанных с ней симптомов
и в итоге к появлению классификации. Радиолог Мах
Ritvo [2] после обзора проведенных им исследований
пищевода с барием описал патофизиологию ПЭГ. Он
предположил, что данные грыжи возникают из-за
повышения внутрибрюшного давления. Moore и Karklin
[3] описали важность лежачей позы и ручного
давления на живот во время исследований пищевода с
барием при диагностике ПЭГ.
ХИРУРГИЧЕСКАЯ АНАТОМИЯ
Эмбриологически диафрагма происходит из
эмбриональной anterior septum transversum, тканей заднего
ребродиафрагмального отростка (7-12-я
сегментарные миотомы) и латеральных плевроперитонеаль-
ных складок. Таким образом, у взрослых диафрагма
прикреплена к мечевидному отростку, нижним
шести реберным хрящам и медиальной и латеральной
пояснично-реберной дуге (рис. 7-1). Правая ножка
отходит от Lj-Ljj,, а левая — от L.-L.. Мышцы
переходят в центральную сухожильную часть. Они получают
соматическую моторную иннервацию от диафрагмаль-
ного нерва (С,-С5), который входит в диафрагму лате-
ральнее отверстия нижней полой вены (НПВ) и
левого края сердца справа и слева соответственно. Кровь
диафрагма получает из мышечно-диафрагмальной,
перикардиодиафрагмальной, верхней диафрагмальной
и нижней диафрагмальной артерий. Эти сосуды
исходят из надчревного отдела аорты и чревного ствола.
Отверстие
Можанди
Отверстие
полой вены
XII ребро
Большая
поясничная мышца
Мечевидный отросток
Центральное сухожилие
Пищеводное
отверстие
•
Г~~Я
Аортальное
отверстие
Отверстие
Бохдалека
Квадратная мышца
поясницы
Рис. 7-1. Анатомия диафрагмы.
Глава 7. Лапароскопическая пластика параэзофагеальной грыжи 77
А Норма
Г ТипЗ
Тип 4
Рис. 7-2. Классификация грыж хиатуса.
Нормальная анатомия (А). Параэзофаге-
альная грыжа 1-го типа (ПЭГ) —
скользящая грыжа хиатуса — наиболее часто
встречаемая форма (95%),
характеризуется миграцией пищеводно-желудочного
перехода и лежащей рядом кардии
выше диафрагмы, в средостение, через
пищеводное отверстие (Б). ПЭГ 2-го типа
встречаются реже, чем ПЭГ 1 -го типа,
но считаются истинными ПЭГ. Для них
характерна солитарная миграция кардии
желудка через пищеводное отверстие
в грудную клетку кпереди от нормально
расположенного пищеводно-желудочного
перехода (В). ПЭГ 3-го типа — это
комбинация грыж 1 -го и 2-го типа, при которой
пищеводно-желудочный переход с
прилежащим участком желудка и кардией
выпячивается через пищеводное
отверстие (Г). Эти грыжи могут быть крупными,
с выпячиванием в средостение более 50%
всего желудка и картиной вывернутого
в грудную полость желудка, связанного
с брюшной полостью только
привратником. ПЭГ4-го типа является самой редкой
формой ПЭГ, сходна с грыжами 3-го типа,
но в грыжевом мешке находятся также
другие органы брюшной полости
(ободочная кишка, поджелудочная железа, участок
тонкого кишечника или селезенка) (Д).
Внутренние грудные артерии и ветви грудной аорты
кровоснабжают верхнюю часть диафрагмы. Правая
диафрагмальная вена впадает в нижнюю полую вену,
а левая диафрагмальная вена — в нижнюю полую вену
или левую надпочечниковую/почечную вену.
В диафрагме имеется три отверстия. Отверстие
нижней полой вены находится в центральном
сухожилии на уровне Т . Через него проходит НПВ и правый
диафрагмальный нерв. Пищеводное отверстие
расположено в мышечной порции диафрагмы и
расщепляет ее правую ножку на уровне Т , пропуская пищевод
и оба (задний и передний) ствола блуждающего нерва.
Аортальное отверстие находится за правой и левой
ножками диафрагмы на уровне Т,, через него проходят
аорта, непарная вена, большой внутренностный нерв
и грудной лимфатический проток. Также в диафрагме
существуют несколько менее известные пространства,
служащие потенциальными источниками грыжеобра-
зования. Это центральное сухожилие (перитонеокар-
диальная грыжа), отверстия Можанди и Бохдалека.
Различают 4 типа параэзофагеальных грыж.
• Тип 1 ПЭГ — скользящая грыжа пищеводного
отверстия, наиболее часто встечаемая форма (95%),
характеризуется миграцией желудочно-кишечного
перехода и кардии желудка выше диафрагмы через
пищеводное отверстие в средостение (рис. 7-2, Б) [4].
• ПЭГ 2-го типа не так распространена, как тип 1,
но считается истинной ПЭГ. Она представляет
собой солитарную миграцию кардии желудка через
пищеводное отверстие в грудную клетку кпереди
от нормально расположенного ЖПС (рис. 7-2, В).
• ПЭГ 3-го типа — комбинация ПЭГ типов 1 и 2,
при которой ЖПС с прилежащей частью желудка
плюс (в дополнение к этому) кардия желудка
выпячиваются через пищеводное отверстие (рис. 7-2, Г).
Эти грыжи могут быть крупными, содержать
более чем 50% желудка в средостении, и вывернутый
в средостение желудок остается связанным с
брюшной полостью только привратником.
• Тип 4 — самая редкая форма ПЭГ, схож с типом 3,
но содержимым грыжи при этом является другой
орган брюшной полости (ободочная кишка,
поджелудочная железа, участок тонкой кишки или
селезенка) (рис. 7-2, Д)1.
ОБСУЖДЕНИЕ ОПЕРАТИВНЫХ МЕТОДИК
Лапароскопическая пластика ПЭГ, рассмотренная
в подробностях на рис. 7-3—7-14, является
приемлемой хирургической техникой в лечении грыж
пищеводного отверстия диафрагмы. Тем не менее в теме
пластики ПЭГ есть несколько дискуссионных
вопросов. Клинические симптомы, обследование и
показания к операции у большинства хирургов не вызывают
1В нашей стране применяется иная классификация грыж
пищеводного отверстия диафрагмы. — Примеч. ред.
78 Лапароскопическая хирургия. Атлас
разногласий. Однако детали операции остаются
предметом постоянных дебатов и точкой приложения
научного поиска. Важнейшие вопросы дискуссии — доступ
(открытый или лапароскопический), частота
рецидивов, добавление антирефлюксной операции и усиление
ножек диафрагмы с помощью протезов.
ПЭГ проявляются классическими симптомами га-
строэзофагеального рефлюкса, такими как дисфагия,
изжога и регургитация. Часто встречаются рвота, боли
в эпигастральной области живота и под грудиной,
реже отмечаются астма и пневмония. При диагностике
с помощью рентгенографии грудной клетки в боковой
проекции можно установить ретрокардиальную
полноту, уровень жидкости и воздуха ретрокардиально
или воздушный пузырь желудка, находящийся выше
диафрагмы. Кроме того, для определения размера
дефекта хиатуса можно использовать ФЭГДС. КТ
брюшной полости может выявить в грыжевом мешке другие
органы брюшной полости. Однако «золотым
стандартом» диагностики считается исследование с барием.
Другой важный клинический сценарий, о котором
следует помнить, — ущемление желудка или кишечная
непроходимость. При этом отмечают дисфагию,
периодическую рвоту и боли в грудной клетке. Такое
состояние требует немедленной эндоскопической оценки
и, возможно, хирургического вмешательства.
Показания к операции при разных типах ПЭГ
различаются. Показанием к операции при грыжах 1 типа
служит постоянство симптоматики, требующее
медикаментозной терапии, а также непереносимость
лекарственной терапии или любые осложнения гастродуоде-
нальной рефлюксной болезни (пищевод Барретта,
кровотечение, стриктура, перфорация или образование
язвы). Грыжи 2-4-го типа лучше оперировать в
плановом порядке после постановки диагноза из-за
высокого количества осложнений (29%) от медикаментозной
терапии и высокой смертности (50%) после
экстренного оперативного вмешательства [5].
Основные этапы пластики — это низведение
желудка в брюшную полость, иссечение грыжевого
мешка в средостении, сшивание ножек диафрагмы и фун-
допликация. Активное обсуждение возникает вокруг
выбора доступа (открытого или лапароскопического)
[6-8]. Ferri et al. [9] установили, что для
лапароскопической пластики ПЭГ характерны значительно более
низкое количество интраоперационных осложнений
и меньшая кровопотеря. Также в сравнении с
открытой пластикой ПЭГ снижено время до начала
самостоятельного питания, продолжительность пребывания
в клинике и потребность в наркотических средствах.
Между тем в исследуемых группах не было различий
в количестве анатомических рецидивов, качестве
жизни и удовлетворенности пациентов. В свете множества
проведенных исследований, сравнивающих
лапароскопический и открытый доступы, большинство авторов
признали, что лапароскопическая пластика ПЭГ
сопровождается более безопасными исходами операции
и меньшей частотой послеоперационных осложнений.
Рецидив ПЭГ — нежелательный результат, однако
имеется мало различий в количестве рецидивов в
зависимости от того, был ли применен
лапароскопический или открытый доступ. Многие ретроспективные
исследования описывали частоту возникновения
рецидивов, но трудность состоит в том, что ни одно из них
не предлагает четкого опредения понятия «рецидив».
Некоторые авторы понимают под рецидивом
возвращение симптомов, а другие описывают его на основе
данных послеоперационной рентгенографии с барием
независимо от симптоматики. Такое явное
несоответствие делает трудным выявление различий между
исследованиями. Вопрос, является ли бессимптомный
рецидив клинически значимым, остается открытым.
Тем не менее метаанализ 32 коллективных
ретроспективных исследований, проведенный Draaisma et al.
[10], выявил средний уровень рецидивов 9,1% после
открытых операций и 7% — в группе лапароскопии.
Эти данные наводят на мысль, что лапароскопическая
пластика имеет небольшое преимущество над
открытой по частоте рецидивирования.
Применение антирефлюксных методик при ПЭГ
в настоящее время является общепризнанной
практикой. Это связано, в частности, со значительной
частотой возникновения симптомов гастроэзофагеального
рефлюкса, если вмешательство не сопровождалось
фундопликацией. Также улучшение техники и
большой объем антирефлюксных операций, проведенных
хирургом, приводят к лучшей редукции симптомов
заболевания. Несколько авторов поддерживают
необходимость проведения антирефлюксных процедур и
полагают, что предотвращение послеоперационного
рефлюкса с помощью фундопликации несет минимальный
дополнительный хирургический риск [11]. Draaisma
et al. [10] правильно акцентировали внимание на том,
что не было проведено проспективных исследований,
связывающих использование антирефлюксных
процедур и профилактику рецидивирования ПЭГ Фундо-
пликацию проводят в первую очередь для того, чтобы
предотвратить симптомы гастроэзофагеального
рефлюкса после операции, а не в качестве профилактики
рентгенологических рецидивов.
Одним из основных спорных вопросов остается
длина пищевода при пластике ПЭГ. Общепринятым
считается, что гастроэзофагеальный переход при
адекватной пластике должен располагаться интраабдоми-
нально. Этого обычно можно достичь с помощью
адекватной мобилизации внутригрудного отдела пищевода,
часто вплоть до уровня непарной вены. Однако в
некоторых случаях возникает необходимость в процедурах,
удлиняющих пищевод. В условиях лапароскопической
операции этого можно достичь с помощью модифици-
Глава 7. Лапароскопическая пластика параэзофагеальной грыжи 79
рованной гастропластики Коллиса с краевой
резекцией угла Гиса и внутригрудного отдела пищевода.
Лапароскопический вариант операции Коллиса проводят
с помощью бужа. Применение этой методики
сопровождается хорошими результатами (рис. 7-5) [12].
Усиление ножек с помощью протезов приводит
к снижению частоты рецидивов заболевания и
минимуму осложнений. Имплантация синтетической сетки
в области грыжевого дефекта может сопровождаться
послеоперационной дисфагией, разрывом сетки,
образованием стриктур и язв [13]. Во многих
исследованиях ретроспективно сравнивали частоту рецидиви-
рования после обычных и лапароскопических пластик
с применением сетки, но проспективных
рандомизированных исследований было проведено мало. Одно
из них оценивало усиление ножек после пластики ПЭГ
с помощью политетрафторэтиленовой сетки [14].
Авторы обнаружили значительное снижение частоты
развития рецидивов в связи с применением сетки (0%)
в сравнении с простой пластикой (20%) при среднем
сроке наблюдения 40 мес. Granderath et al. [13] рандо-
мизировали 100 пациентов для пластики пищеводного
отверстия диафрагмы полипропиленовой заплаткой
против обычной пластики хиатуса во время
лапароскопической фундопликации по Ниссену. Через 1 год
после обычной пластики зафиксировано 26% случаев
рецидивов, а после пластики сеткой — 8%. Различий
в частоте возникновения симптомов гастроэзофаге-
ального рефлюкса после операции между двумя
группами не было, в то время как пластика сеткой
сопровождалась в 3 раза большей частотой послеоперационной
дисфагии. Недавно в мультицентровом проспективном
рандомизированном исследовании было изучено
применение биологических протезов (SIS, ацелюллярного
ксенолоскута на основе свиного коллагена 1-го типа)
[15]. Авторы установили, что пластика с
биологическим материалом значительно снижает частоту
развития рецидивов в сравнении с обычной пластикой.
Частота осложнений была сходной в обеих группах.
Считается, что преимущество биологических
протезов — минимизация риска разрыва сетки и развитие
дисфагии в связи с мягкостью материала и
интеграцией протеза в ткани тела. Таким образом, применение
сеток в лапароскопической пластике ПЭГ безопасно
и снижает уровень рецидивирования.
Гастростомия была предложена в качестве
необходимого дополнения к пластике ПЭГ в «эру» открытой
хирургии [16]. Она была модифицирована в переднюю
гастропексию и редко применяется при современных
лапароскопических пластиках. Вопрос о
необходимости гастростомии или гастропексии остается спорным,
хотя гастропексия незначительно повышает частоту
послеоперационных осложнений [17].
Лапароскопическая пластика ПЭГ является
безопасным и эффективным хирургическим
вмешательством. Лапароскопическая операция сравнима с
открытой по уровню послеоперационных осложнений,
но имеет более низкий уровень интраоперационных
осложнений, меньшие частоту развития рецидивов
и продолжительность госпитализации.
Использование пластики сеткой и фундопликации желудка
при лапароскопическом доступе дает
дополнительное снижение числа рецидивов и
послеоперационных симптомов. Таким образом, лапароскопическая
пластика ПЭГ является методикой выбора в лечении
этой патологии.
80 Лапароскопическая хирургия. Атлас
ПОДГОТОВКА
Рис. 7-3. Обстановка операционной для лапароскопической
пластики диафрагмальной грыжи. Расположение
оборудования и персонала идентичны таковым
при лапароскопической фундопликации по Ниссену. Авторы
предпочитают укладывать пациента на спину для облегчения
подготовки к операции и в связи с отличной визуализацией
и удобным задним доступом.
/
У?
1
1
1
1
J
о
Бо
В
~1
О
oJfl
А
0
\ ~'\
|
у' И 1
I ^
Рис. 7-4. Места расположения портов с размерами. Обычно
используют пять троакаров. Порт для камеры устанавливают
на 15 см ниже мечевидного отростка по средней линии (А). 5-
(Б) и 11-миллиметровый троакар (В) располагают для хирурга
в правом верхнем квадранте. Пятимиллиметровый порт (Г)
в подмечевидной области используют для ретракции печени,
а 5-миллиметровый порт (Д) в левом верхнем квадранте —
для ассистента.
Глава 7. Лапароскопическая пластика параэзофагеальной грыжи 81
ОПЕРАЦИЯ
Рис. 7-5. Первый шаг операции — вправление грыжевого
содержимого. На снимке представлен параэзофагеальный
диафрагмальный дефект после вправления желудка.
Часто желудок возвращается в грудную полость, если его
не удерживать, поэтому спайки между желудком и грыжевым
мешком необходимо разделить для улучшения доступа.
При более сложных грыжах в грудной полости также могут
находиться ободочная кишка и другие структуры.
Рис. 7-6. Диссекцию грыжевого дефекта начинают над правой
ножкой и продолжают в направлении левой. По ходу мышцы
оставляют ободок брюшины для облегчения закрытия
дефекта.
Рис. 7-7. Проводят тщательную диссекцию грыжевого мешка
от структур средостения. Слой по большей части тонкий.
Поверхность плевры часто представлена белой линией,
необходимо избегать ее повреждения для профилактики
пневмоторакса. Эта диссекциия может быть проведена
с помощью электроножа, ультразвуковой диссекции
или биполярного устройства. Необходимо с осторожностью
проводить диссекциию рядом с пищеводом, чтобы случайно
его не повредить. Стволы блуждающего нерва также
необходимо обнаружить и сохранить.
Рис. 7-8. Верхние короткие желудочные сосуды пересекают,
чтобы облегчить мобилизацию дна для фундопликации.
82 Лапароскопическая хирургия. Атлас
Рис. 7-9. После пересечения коротких сосудов желудка
диссекцию продолжают вдоль левой ножки. После полного
вправления грыжевой мешок может быть полностью
удален или оставлен интактным. Удаление мешка облегчает
фундопликацию, но делать это следует с осторожностью,
чтобы избежать повреждения желудка. Иногда (при больших
грыжах) полное удаление грыжевого мешка невозможно.
В этих случаях мешок необходимо рассечь по кругу.
Рис. 7-10. А и Б — пищеводный ретрактор способствует обнажению дефекта ножек.
Рис. 7-11. Пластика дефекта ножек с использованием
отдельных нерассасывающихся швов завершена кзади
от пищевода. После завершения пластики пищеводное
отверстие диафрагмы должно свободно пропускать зажим,
прилежащий к пищеводу.
Рис. 7-12. Для укрепления задней крурорафии применяют
сетку {on log). В основном авторы предпочитают
биорастворимую сетку, чтобы не оставлять в тканях
инородного тела. Если дефект невозможно зашить, пластику
сеткой необходимо провести обязательно, а не опционно.
Глава 7. Лапароскопическая пластика параэзофагеальнои грыжи 83
Рис. 7-13. Завершенная пластика с фиксированной сеткой.
Рис. 7-14. Фундопликация и гастропексия к передней
брюшной стенке завершают операцию. Также возможна
установка гастростомической трубки.
Рис. 7-15. Модифицированная гастропластика по Коллису
с резекцией края угла Гиса и внутригрудного пищевода.
Лапароскопическую операцию по Коллису проводят
над пищеводным бужом.
84 Лапароскопическая хирургия. Атлас
СПИСОК ЛИТЕРАТУРЫ
-
1. Hochberg L.A. Thoracic Surgery before the 20th Century. — New
York: Vantage Press, 1960.
2. Ritvo M. Hernia of the stomach through the esophageal orifice of
the diaphragm // JAMA. — 1930. — Vol. 94. — P. 15-21.
3. Moore A.B., Kirklin B.R. Progress in the roentgenological diagnosis
of diaphragmatic hernia // JAMA. — 1930. — Vol. 95. — P. 1966-
1969.
4. Athanasakis H., Tzortzinis A., Tsiaoussis J. et al. Laparoscopic repair
of paraesophageal hernia // Endoscopy. — 2001. — Vol. 33. —
P. 590-594.
5. Weiss III C. A., Stevens R.M., Schwartz R.W. Paraesophageal
hernia: current diagnosis and treatment // Curr. Surg. — 2002. —
Vol. 59. — P. 180-182.
6. Terry M., Smith CD., Branum CD. et al. Outcomes of laparoscopic
fundo-plication for gastroesophageal reflux disease and
paraesophageal hernia // Surg. Endosc. — 2001. — Vol. 15. —
P. 691-699.
7. Mattar S.G., Bowers S.P., Galloway K.D. et al. Long-term outcome
of laparoscopic repair of paraesophageal hernia // Surg. Endosc. —
2002. — Vol. 16. — P. 745-749.
8. Pierre A.F., Luketich J.D., Fernando H.C. et al. Results of
laparoscopic repair of giant paraesophageal hernias: 200
consecutive patients // Ann. Thorac. Surg. — 2002. — Vol. 74. —
P. 1909-1915.
9. Ferri L.E., Feldman L.S., Stanbridge D. et al. Should laparoscopic
paraesophageal hernia repair be abandoned in favor of the open
approach? // Surg. Endosc. — 2005. — Vol. 19. — P. 4-8.
10. Draaisma W.A., Gooszen H.G., Tournoij E. et al. Controversies
in paraesophageal hernia repair: a review of literature // Surg.
Endosc. — 2005. — Vol. 19. — P. 1300-1308.
11. Lai D.R., Pelligrini С A., Oelschalger B.K. Laparoscopic repair
of paraesophageal hernia // Surg. Clin. North Am. — 2005. —
Vol. 85.— P. 105-118.
12. Terry M.L., Vernon A., Hunter J.G. Stapled-wedge Collis
gastroplasty for the shortened esophagus // Am. J. Surg. — 2004. —
Vol. 188.— P. 195-199.
13. Granderath F.A., Schweiger U.M., Kamolz T. et al. Laparoscopic
Nissen fundoplication with prosthetic hiatal closure reduces
postoperative intra-thoracic wrap herniation: preliminary results
of a prospective randomized functional and clinical study // Arch.
Surg. — 2005. — Vol. 140. — P. 40-48.
14. Frantzides СТ., Madan A.K., Carlson M.A. et al. A prospective,
randomized trial of laparoscopic polytetrafluoroethylene (PTFE)
patch repair vs. simple cruroplasty for large hiatal hernia // Arch.
Surg. — 2002. — Vol. 137. — P. 649-652.
15. Oelschlager B.K., Pelligrini C.A., Hunter J. et al. Biologic prosthesis
reduces recurrence after laparoscopic paraesophageal hernia
repair: a multicenter, prospective, randomized trial // Ann. Surg. —
2006. — Vol. 244. — P. 481-490.
16. Ellis F.H., Jr., Crozier R.E., Shea J.A. Paraesophageal hiatus hernia //
Arch. Surg. — 1986. — Vol. 121. — P. 416-420.
17. Lai D.R., Pellegrini C.A., Oelschlager B.K. Laparoscopic repair
of paraesophageal hernia // Surg. Clin. North Am. — 2005. —
Vol. 85.— P. 105-118.
Глава 7. Лапароскопическая пластика параэзофагеальной грыжи 85
Лапароскопические операции
при пептической язве:
ваготомия и ушивание
перфоративной язвы
Диана Л. Дисен, Джон С. Хани, Теодор Н. Паппас
Пептическая язва — болезнь XX в., хотя она впервые
была описана в 1799 г. [1] В связи с тем что болезнь
широко распространилась с начала до середины 1900-х
гг., были разработаны и усовершенствованы
противоязвенные операции. Первые из них были направлены
на удаление кислотосекретирующих париетальных
клеток. После того как выяснилась роль вагусной
стимуляции в секреции кислоты, в качестве более
селективной хирургической операции была предложена
стволовая ваготомия. Введенная в практику Dragstedt
и Owens в 1943 г., стволовая ваготомия быстро
вытеснила обширные резекции в качестве хирургической
терапии выбора при пептической язве.
Идентификация Helicobacter pylori (Marshall
и Warren) в 1983 г. и последующее осознание роли
этого возбудителя в этиологии язв произвели революцию
в лечении пептической язвы. С открытием
высокоэффективных медикаментов для снижения продукции
кислоты и уничтожения Helicobacter pylori
медикаментозное лечение вытеснило оперативное как основу
терапии при неосложненной язвенной болезни.
Плановую хирургию язвенной болезни, которая сначала
была одной из самых распространенных операций
в плановой общей хирургии, сейчас проводят
пациентам со сложным или упорным течением болезни [3].
Несмотря на снижение количества плановых
операций, частота госпитализации и поступления в
клинику в экстренном порядке по поводу язвенной болезни
остается относительно постоянной величиной в
течение последних 20 лет. Ежегодно в США отмечается
около 500 000 новых случаев заболевания, и оценочные
затраты на лечение этой патологии составляют около
6 млрд долларов; осложнения пептической язвы
требуют проведения примерно 130000 операций в год [3, 4].
Оперативное вмешательство остается основой
лечения тяжелых осложнений заболевания, а именно:
кровотечения, перфорации и стеноза. В ответ на
сопутствующую смертность, связанную с этими ургентными
операциями, а также всеобщую направленность на
минимально инвазивные техники, в течение последнего
десятилетия «расцвела» лапароскопическая хирургия
ЯБЖ. Лапароскопическая ваготомия (в частности,
высокоселективная) и ушивание перфорации
двенадцатиперстной кишки характеризуются ускоренным
послеоперационным восстановительным периодом
и одинаковыми результатами в сравнении с
открытыми операциями.
АНАТОМИЯ
Правый и левый стволы блуждающего нерва
обеспечивают парасимпатическую иннервацию желудка
и остальных отделов желудочно-кишечного тракта
(рис. 8-1). Находясь в тесной связи с наружной стенкой
пищевода в области диафрагмального отверстия,
правый и левый стволы отражают направление ротации
верхних отделов эмбриональной кишки. Правый ствол
Чревная ветвь ^ i
Печеночная ветвь-. ^х-
Привратникч /Ж
1 \^-^
1 \ \ ^ч^^^
«Птичья лапка»
in a 1
ш\\ 1 Щ/
V4j\.
— Передний ствол вагуса
— Отверстие диафрагмы
Г^ Криминальный
1 нерв Грасси
/ (задний)
^ Передний и задний
нервы Латарже
Рис. 8-1. Анатомия правого и левого ствола блуждающего
нерва, которые обеспечивают парасимпатическую иннервацию
желудка, печени и чревного сплетения.
Глава 8. Лапароскопические операции при пептической язве... 87
вагуса соответственно принимает заднее положение,
а левый ствол изгибается кпереди. Перед тем как
достичь пищеводно-желудочного перехода, задний ствол
раздваивается, посылая ветвь к чревному сплетению.
Передний ствол также разделяется, давая ветвь для
иннервации печени. Задняя и передняя желудочные ветви
(нервы Латарже) следуют затем по ходу малой
кривизны желудка, где более мелкие веточки входят в стенку
желудка. Первичные нервы заканчиваются в «птичьей
лапке», иннервирующей привратник и 6 см желудка
для регуляции его опорожнения.
ПАТОФИЗИОЛОГИЯ
Секреция соляной кислоты париетальными клетками
регулируется сложной серией гормональных и нейро-
нальных сигналов. Нормальная физиология секреции
кислоты представлена на рис. 8-2. Секреция НС1
стимулируется прямой вагусной иннервацией, паракрин-
ным выбросом гистамина энтерохромаффинными
клетками и эндокринным выбросом гастрина антраль-
ными G-клетками. Слизистая оболочка желудка
защищена слоем слизи, богатой бикарбонатами, секрети-
рующеися в ответ на стимуляцию простагландинами.
Развитие пептической язвы наиболее близко связано
с двумя основными факторами риска: инфекцией,
вызванной Helicobacter pylori, и постоянным
применением нестероидных противовоспалительных препаратов
(НПВП) [4]. НПВП препятствуют простагландиновой
стимуляции защитной желудочной слизи, что ведет
к хроническому раздражению и язвообразованию.
Хронический прием НПВП повышает риск развития
клинически значимых гастроинтестинальных
осложнений с частотой от 1 до 4% в год и действует синер-
гически с дополнительными факторами риска,
такими как хеликобактерная инфекция, пожилой возраст,
сопутствующие заболевания и курение [4]. В случаях
рецидивирующих или трудноизлечимых язв всегда
необходимо выяснить, не принимает ли пациент НПВП
тайно, и прием НПВП должен быть прекращен при яз-
вообразовании. Доказательствами роли
«привередливой» грамположительной палочки Helicobacter pylori
в этиологии пептической язвы служат несколько
наблюдений. За исключением НПВП-ассоциированных
язв, Helicobacter pylori была первоначально выявлена
(От вагуса)
Растяжение желудка
Преганглионарные I /"" Интеграция в не
\]ЛуУ кишечника
Просвет тела Постганглионарные
Активирует с—
Ингибирует i—
Движение •*—
Рецептор О
Рис. 8-2. Нормальная физиология
секреции соляной кислоты. Три
отдельных пути, медиаторами
которых являются гистамин, гастрин
и ацетилхолин, стимулируют синтез
протонов Н+, К+-аденозинтрифосфатазой
(АТФазой) париетальными клетками
в просвет желудка.
АХ — ацетилхолин; ХЦК —
холецистокинин; ЭХП —
энтерохромаффиноподобный;
ГПП — гастринпродуцирующий пептид;
ССР — рецептор к соматостатину.
88 Лапароскопическая хирургия. Атлас
у 80-95% пациентов с дуоденальными и 65-95%
пациентов с желудочными язвами [5]. Более поздние данные
продемонстрировали распространенность в 50 и 75%
случаев в США, в то время как в некоторых странах
мира язвенная болезнь остается связанной с
хеликобактерной инфекцией более чем в 90% случаев.
Ежегодная частота пептической язвы варьирует от 0,1 до 0,3%,
что соответствует ежегодному росту хеликобактерной
инфекции на 1%, который увеличивается в 6-10 раз
за счет неинфицированных лиц. Однако еще важнее
то, что роль этой инфекции в этиологии
подтверждается резким снижением частоты рецидивов от 60-100
до 15% при эрадикации Helicobacter pylori [5]. Хотя
точная патофизиология данного заболевания неизвестна,
хеликобактерная инфекция способствует многим
изменениям, стимулирующим язвообразование, включая
усиление секреции кислоты, ослабление дуоденальной
секреции бикарбонатов, что ведет к тяжелым гастритам
и в результате к воспалительному ответу. В
восприимчивости инфицированного лица к язвообразованию
играет роль множество дополнительных генетических
и средовых факторов (рис. 8-3). Как следствие оценки
всех этих данных, эрадикация Helicobacter pylori стала
стандартом лечения ЯБЖ. Серологический анализ
является тестом выбора для постановки диагноза, если
эндоскопия не показана. В случае, когда
эндоскопическое исследование выполняется, широко применяют
быстрый уреазный тест и гистологическое
исследование. В 1994 г. совет, организованный Национальным
институтом здоровья, разработал рекомендации,
согласно которым все пациенты с гастритом или язвой
двенадцатиперстной кишки должны обследоваться
на хеликобактерную инфекцию и подвергаться лечению
в случае получения положительных результатов
исследования. При НПВП-ассоциированных язвах лечение
хеликобактерной инфекции также проводят в случае
ее обнаружения. К тому же, согласно рекомендациям,
любой пациент, подвергающийся оперативному
лечению осложнений пептической язвы, должен иметь
документальное подтверждение об излечении от
хеликобактерной инфекции [7]. Доступно множество режимов
для эрадикации Helicobacter pylori, большинство из
которых представляют собой комбинацию угнетения кис-
лотопродукции с антибиотиками, такими как метрони-
дазол и амоксициллин. Многие режимы терапии имеют
продолжительность 1-2 нед, хотя были также изучены
и более короткие режимы. Эффективность различных
схем эрадикации инфекции составляет 80-95%. Важно,
что успешное лечение зависит от правильного
применения режимов, а замена одних антибиотиков на другие
в пределах одного класса непозволительна [8].
КЛИНИЧЕСКАЯ КАРТИНА
Классически язвенная болезнь проявляется
грызущими болями в эпигастрии, которые часто облегчаются
приемом пищи или антацидов, однако у некоторых
пациентов с язвами луковицы двенадцатиперстной
кишки эти симптомы отсутствуют. Язвы, не поддающиеся
медикаментозной терапии, встречаются редко, точно
они определяются как язвы, неспособные к
заживлению после 8-12 нед лечения или как рецидив после
завершения лечения. При язве, не поддающейся
медикаментозной терапии, показана лапароскопическая
селективная проксимальная ваготомия.
£1
_
?Генетическая
предрасположенность
L
Инфекция антрального
отдела, вызванная Н. pylori
К
Увеличение коли- |
чества клеток вое- I
паления и цитокинов |
Снижение защитных |
механизмов слизи
3L
Снижение уровня
антрального соматостатина
<z
Увеличение количества
или чувствительности
париетальных клеток
Факторы среды
Дуоденит
Рис. 8-3. Язвообразование при инфекции,
вызванной Helicobacter pylori.
Инфекционное поражение антрального
отдела желудка ведет к повышенному
кислотообразованию, усилению
выброса цитокинов воспаления,
снижению защитных механизмов слизи,
что приводит в итоге к изъязвлению.
Такие факторы среды, как курение
и нестероидные противовоспалительные
средства, а также генетическая
предрасположенность влияют на частоту
возникновения язв.
Глава 8. Лапароскопические операции при пептической язве... 89
Свободная перфорация — потенциально грозное
осложнение пептической язвы и наиболее частое
показание к хирургической операции. Перфорацию
диагностируют у 5-10% пациентов, она является
причиной большинства смертей от пептической язвы
[9]. Чаще всего отмечается перфорация стенки
двенадцатиперстной кишки, которая приводит к
химическому перитониту и характеризуется диффузным
напряжением живота вследствие
генерализованного раздражения брюшины. Если вовремя не начать
терапию, состояние прогрессивно ухудшается и
сопровождается гипотензией, тахикардией и ацидозом
с тахипноэ. Важно отметить, что около '/, пациентов
со свободной перфорацией уже находятся в клинике
и более 40% пациентов имеют тяжелую
сопутствующую патологию во время перфорации, что делает
их плохими кандидатами для хирургического
лечения [10].
ТЕХНИКА ОПЕРАЦИИ
Лапароскопическая ваготомия
Рис. 8-4-8-23 отображают хирургическую технику
лапароскопической ваготомии.
ПОДГОТОВКА
Наркозный аппарат
Видеомонитор
и камера;
осветитель
Электрокоагулятор
Операционная^
сестра
Столик для
инструментов
Ассистент
Оператор камеры
Рис. 8-4. Расположение
операционной бригады
для лапароскопической ваготомии.
Перед общей анестезией назначают
антибиотики. Устанавливают катетер
Фолея и назогастральный зонд. Живот
готовят в обычном порядке.
90 Лапароскопическая хирургия. Атлас
Поперечно^
ободочная кишка
Сальник
Тонкий кишечник
Рис. 8-5. Пациента укладывают в положение Тренделенбурга.
Для доступа в брюшную полость и инсуффляции диоксида
углерода до 12-15 мм рт.ст. используют иглу Вереша
или троакар Хэссона. Через 10-миллиметровый троакар,
установленный выше или ниже пупка, вводят лапароскоп
и осматривают содержимое брюшной полости. Улиц
с длинным животом пищеводное отверстие диафрагмы
лучше визуализируется при супраумбиликальной установке
камеры. Затем пациента укладывают в обратное положение
Тренделенбурга, проводят осмотр печени, тонкой кишки,
сальника и желудка.
О
5-мм
троакар
5-мм ©10-мм
троакар троакар
О
5-мм
троакар
О 10-мм троакар
Ф с камерой
и инсуффляцией
Рис. 8-6. В верхнем отделе живота устанавливают четыре
дополнительных троакара под прямым лапароскопическим
контролем. Пятимиллиметровый троакар располагают вверху
по средней линии, около мечевидного отростка и слева
от серповидной связки. Через этот порт вводят инструмент
для ретракции печени в сторону от хиатуса. Хирург оперирует
с помощью двух портов: 5- и 10-миллиметровых, помещенных
на несколько сантиметров правее средней линии. Первый
ассистент оперирует слева с помощью 5-миллиметрового
троакара, установленного по левой срединно-ключичной
линии рядом с реберным краем.
Рис. 8-7. Положение операционных троакаров первого
хирурга. Пяти- и 10-миллиметровый порты расположены
в углах основания равнобедренного треугольника. Хиатус
находится в области верхушки этого треугольника. Такая
установка троакаров позволяет хирургу работать обеими
руками одновременно.
Глава 8. Лапароскопические операции при пептическои язве... 91
ОПЕРАЦИЯ
Левая доля
печени
Пищеводное
к отверстие диафрагмы
• Желудок
Рис. 8-8. Внутренняя анатомия области хиатуса.
Веерным ретрактором удерживают левую долю печени
вдали от желудочно-пищеводного соустья. Ассистент
может использовать эндоскопический зажим Бэбкока
для оттягивания желудка книзу.
Рис. 8-9. Обнажение хиатуса. Для пересечения малого
сальника хирург использует эндоскопические ножницы
и маленький зажим с электрокоагуляцией. Края отводят
в стороны, обнажая пищеводное отверстие диафрагмы.
"W /7//
~^^<^Ул
(ЯШ
^<^n^JlW
IHfev
^Ж^тпк
шХА
7F'tV\Nffi(: й '■f^^^P-^^'
'■■' \Л йуШЩР^^ -г#Л \ i-imMp- —
jWjp
Рис. 8-10. Обнажение заднего ствола блуждающего нерва.
После формирования пространства между правой ножкой
диафрагмы и пищеводом хирург отводит пищевод влево
тупым диссектором. Задний ствол блуждающего нерва
определяется на задней поверхности пищевода в области
задней границы хиатуса. С помощью крючковидного
диссектора в другой руке хирург проводит диссекцию
и отводит нерв от окружающих структур.
Рис. 8-11. Задний ствол блуждающего нерва захватывают
эндоскопическим зажимом. Ниже и выше зажима
накладывают эндоскопические клипсы. Нерв необходимо
клипировать, насколько это возможно, выше в отверстии,
чтобы убедиться в пересечении криминального нерва Грасси.
92 Лапароскопическая хирургия. Атлас
;%Ш^И
Ш^Ш
%Ж\
Я1йл г
'7#| 1ж7""^
Щ/
\vx
Н^ь
Рис. 8-12. С помощью эндоскопических ножниц удаляют
участок нерва между клипсами для морфологического
подтверждения. Перед тем как продолжить операцию,
заднюю поверхность пищевода обследуют на предмет того,
не остались ли там какие-нибудь волокна блуждающего
нерва.
Рис. 8-13. После задней стволовой
ваготомии проводят переднюю
суперселективную (селективную
проксимальную) ваготомию.
Диссекцию ветвей переднего нерва
Латарже начинают на расстоянии
бсм от привратника с сохранением
иннервирующей привратник «птичьей
лапки». Расстояние можно измерить,
нанеся 1-сантиметровые мерки
на канюлю эндоскопического отсоса
перед его введением в брюшную
полость. После этого можно отмерить
6 см и нанести метки на стенку желудка
с помощью электрокоагулятора.
Глава 8. Лапароскопические операции при пептическои язве... 93
Рис. 8-14. Диссекция передней ветви блуждающего
нерва. Для диссекции и изоляции каждой ветви переднего
сосудисто-нервного пучка вдоль малой кривизны используют
зажим-аллигатор, как показано на рисунке.
Рис. 8-16. Нервную ветвь, артерию и вену пересекают между
клипсами острым путем.
Рис. 8-15. Каждый сосудисто-нервный пучок вдоль линии
диссекции дважды клипируют (всего для каждого пучка
используют четыре клипсы).
Рис. 8-17. Задняя стволовая и передняя суперселективная
ваготомии завершены.
94 Лапароскопическая хирургия. Атлас
АЛЬТЕРНАТИВНАЯ ОПЕРАЦИЯ
Рис. 8-18. Передняя и задняя суперселективная ваготомии
являются более предпочтительными, чем задняя стволовая
и передняя суперселективная (если это технически
возможно). При ретракции малой кривизны ассистентом
хирург получает доступ к задней стенке желудка.
Рис. 8-20. Передняя серомиотомия по малой кривизне
желудка является альтернативой передней суперселективной
ваготомии. Для серомиотомии применяют крючковидный
электродиссектор или лазерное волокно. Серомиотомию
начинают от гастроэзофагеального соустья, проводят
на расстоянии 1,5 см от малой кривизны и заканчивают в б см
от привратника. При этом необходима лапароскопическая
визуализация с близкого расстояния.
Рис. 8-19. Как и при передней суперселективной ваготомии,
диссекцию начинают на расстоянии б см от привратника.
Нервную ветвь, артерию и вену изолируют, клипируют
и пересекают.
Рис. 8-21. Гемостаз осуществляют с помощью непрерывного
шва или аппликации фибринового клея или других
прокоагулянтов. При введении в желудок метиленового
синего подтверждается отсутствие перфорации.
Глава 8. Лапароскопические операции при пептическои язве... 95
Рис. 8-22. В качестве альтернативного варианта каждый
сосудисто-нервный пучок можно рассечь с помощью
биполярной диатермии, а не клипировать.
Рис. 8-23. Пациентам со стенозом привратника лучше
проводить переднюю и заднюю стволовые ваготомии
с дренированием. Передний ствол блуждающего нерва
мобилизуют, клипируют сверху и снизу, сегмент между
клипсами удаляют для гистологического исследования. Заднюю
стволовую ваготомию проводят, как было указано выше.
Лапароскопическое ушивание при перфорации двенадцатиперстной кишки
На рис. 8-24—8-27 отражена хирургическая техника лапароскопической операции при перфорации
двенадцатиперстной кишки.
ОПЕРАЦИЯ
Рис. 8-24. Обстановка операционной и доступ
при перфоративной язве такие же. После визуализации
анатомических ориентиров печень отводят кверху
для обнажения места перфорации. Фибрин и кусочки
ткани с передней поверхности двенадцатиперстной кишки
необходимо удалить или смыть.
96 Лапароскопическая хирургия. Атлас
Рис. 8-25. Для предотвращения дальнейшего попадания
содержимого кишки в брюшную полость в первую очередь
уделяют внимание зашиванию перфорации. Три тонких
шелковых или полиглактиновых шва накладывают на место
перфорации в поперечном направлении, оставляя длинные
концы нитей. Затем швы завязывают. Необходимо делать
надежные серозно-мышечные вколы, находящиеся в стороне
от рыхлой ткани вокруг изъязвления.
Рис. 8-26. Поперек места перфорации укладывают участок
большого сальника на ножке, используя зажим, введенный
через порт у мечевидного отростка. Лигатуры завязывают
над лоскутом с помощью интракорпоральной техники.
Лапароскопический «Endoclip» можно использовать
альтернативно — для прикрепления сальника к стенке
двенадцатиперстной кишки. Необходимо быть
внимательными, чтобы не перекрутить сальниковый лоскут.
Рис. 8-27. Язва ушита. После закрытия перфорации брюшную
полость необходимо тщательно промыть. Особое внимание
следует уделять параколическим каналам и пространству
вокруг печени. Брюшную полость не дренируют.
Глава 8. Лапароскопические операции при пептическои язве... 97
РЕЗУЛЬТАТЫ
Успехи медикаментозной терапии в последние годы
снизили частоту пептической язвы и необходимость
в хирургическом вмешательстве, за исключением
осложненных случаев. Показания к оперативному
лечению следующие: желание избежать длительного приема
лекарств, некомплаентность больного, резистентность
к лечению, стеноз, кровотечение и/или перфорация.
Суперселективная ваготомия является традиционной
операцией выбора при неосложненной, не поддающейся
лечению язвенной болезни. На рис. 8-28 показаны
последние исследовательские серии и сообщения по
лапароскопической ваготомии. В общем, операция хорошо
переносится, характеризуется низкой частотой
осложнений, отсутствием смертности и коротким периодом
выздоровления, требующим пребывания в клинике.
По сравнению с другими операциями ваготомия
сопровождается более низкой частотой развития побочных
эффектов, таких как демпинг-синдром. Общепринятая
высокоселективная ваготомия имеет частоту
рецидивов менее 10% у пациентов, оперированных по поводу
неэффективности медикаментозной терапии [13, 23].
Стволовая ваготомия и антрумэктомия
характеризуются значительно меньшей частотой развития рецидивов,
но более высокой частотой диареи и демпинг-синдрома.
Была четко продемонстрирована кислоторедуцирую-
щая эффективность лапароскопической
суперселективной ваготомии, а одинаковая частота рецидивов после
лапароскопии и открытой операции была подтверждена
во многих исследованиях. Конверсия в открытую
операцию встречается редко, осложнения отмечаются у
пациентов с замедленным опорожнением желудка. Многие
из этих пациентов были с успехом подвергнуты
баллонной дилатации или медикаментозной терапии. У таких
пациентов зафиксировано значительное снижение
длительности госпитализации и периода выздоровления
[13,16,17,21].
В течение последних 10 лет лапароскопическая
хирургия распространилась и на лечение осложнений
пептической язвы. На рис. 8-29 в краткой форме
отражены наиболее важные сообщения о
лапароскопических операциях, направленных на лечение перфора-
тивных пептических язв. В двух рандомизированных
проспективных исследованиях частота конверсии со-
Случаи лапароскопической ваготомии, описанные в литератур!
Снижение
секреции
Исследование Год Всего, л ССВ ЗСПСВ ЗСВПСМ СВБДП ТСВ СВГ СВ кислоты, %
г
Продолжительность
госпитализации.
дни
Palaniveluetal.
[11]
Siu etal. [12]
Croceet al. [13]
/Avc/efo/. [14]
Cadiere et al.
[15]
Katkhoudaetal.
[16]
Franzides и Carlson
[17]
Autanz и Ozman
[18]
Nisliet al. [19]
Wyman и Stuart
[20]
Dallemagne et al.
[21]
Mouiel и Katk-
houda [22]
2006
2004
1999
1999
1999
1998
1997
1997
1997
1996
1994
1993
236
15
38
32
33
10
11
32
9
12
35
36
-
-
-
-
33
10
11
-
-
-
35
-
89
23
32
142
15
HC
5,4
20
9
12
32
12
34
HC
HC
70,6
61-89
74
HC
70
73
HC
77
36
12,9
3
4,9
2-7
2
1,7
4,8
9
6
3,6
3-5
Рис. 8-28. Случаи лапароскопической ваготомии, описанные
в литературе. ССВ — суперселективная ваготомия; НС —
не сообщено; ЗСПСВ — задняя стволовая и передняя
суперселективная ваготомии; ЗСВПСМ — задняя стволовая
ваготомия и передняя серомиотомия малой кривизны;
СВ — стволовая ваготомия без дренирования; СВБДП —
стволовая ваготомия с баллонной дилатацией привратника;
СВГ — стволовая ваготомия, гастроеюностомия; ТСВ —
торакоскопическая ваготомия.
98 Лапароскопическая хирургия. Атлас
ставила 14 и 29%, уровень смертности — 1,6 и 4,1%,
что показывает эффективность лапароскопического
доступа [24,25]. Эти пациенты подверглись различным
хирургическим вмешательствам: простое ушивание,
использование сальника на ножке, лаваж брюшной
полости и дренирование или бесшовная методика с фи-
бриновым клеем. Противоязвенные операции обычно
не проводят рутинно благодаря успехам фармакологии
в лечении пептическои язвы, хотя применение вагото-
мии с резекцией или без рекомендуется при
резистентности язвы к лечению, рецидивирующем язвообразо-
вании, непереносимости противоязвенной терапии,
стенозе, кровотечении или перфорации.
Лапароскопическое вмешательство при
осложненной язвенной болезни является безопасным и
эффективным методом лечения. Преимущества лапаро-
Описанные в литературе случаи лапароскопических операций
при перфоративной язве
Операци-
Продолжи-
Количе-
Исследование
Вмешательство
Рандомизированные проспективные исследования
Siuetal. [24] 2002 121(63) Оментопексия
Lauetal. [25] 1996 93(48) Оментопексия и/или фибриновый клей
Нерандомизированные проспективные исследования
Конвер- леталь- Лиза
сия, % ность, % дни
14
13-29
2
0-8
Leeetal. [26]
Siuetal. [27]
Mehendale et al. [28]
Leeetal. [29]
Khoursheed et al. [30]
Robertson et al. [31]
Katkhouda etal. [32]
Siuetal. [33]
Druartetal. [34]
Thompson et al. [35]
Lauetal. [36]
2004
2004
2002
2001
2000
2000
1999
1997
1997
1995
1995
29(29)
172
67 (34)
374(201)
21 (21)
36(20)
46 (30)
33 (33)
100(100)
5(2)
100(56)
Ретроспективные исследования
Lunevicius и Morkevicius
[37]
Kirshtein etal. [38]
Seelig etal. [39]
Micheletetal. [40]
Naesguardetal. [41]
Bergamashi et a/. [42]
/Mefa/.[43]
So и Кит [44]
Miserez и Eypasch [45]
Matsudaetal. [46]
2005
2005
2003
2000
1999
1999
1999
1996
1996
1995
222 (60)
134(68)
55 (24)
30(16)
79(17)
33(13)
33(13)
53(15)
34(18)
15(11)
Эндоскопическая оценка с ушиванием
и оментопексией
Сальниковый лоскут, гастрэктомия,
иссечение язвы
Ушивание и/или оментопексия
Оментопексия или фибриновый клей
Оментопексия
Оментопексия
Оментопексия
Ушивание и оментопексия
Ушивание
Оментопексия
Ушивание, фибриновый клей
Ушивание
Ушивание, сальниковый лоскут
Ушивание
Ушивание, оментопексия или лаваж
брюшной полости, не уточнено
Ушивание, оментопексия
Ушивание, оментопексия, применяли
степлер
Ушивание, оментопексия
Оментопексия
Ушивание
Оментопексия
0
21,5
18
15-26,8
0
10
17
15,2
8
60
12,5
23,3
4,4
13
20
24
7,6
7
17
21
0
8,1
0
3-4
0
10
3
0
5
0
1,8
0
4,6
0
20
122
0
0
5.5
0
6
5-6
4,7
6
4
5
5,2
5
3-10
6
9,3
6,5
5
7,8
6,1
9
8
7
7
7
10
17
Рис. 8-29. Случаи лапароскопических операций при перфоративной язве, описанные в литературе.
Глава 8. Лапароскопические операции при пептическои язве... 99
скопического доступа — повышение комфортности
для пациента, раннее возвращение к повседневной
активности [21, 24, 28, 31, 32]. Установить и уточнить
СПИСОК ЛИТЕРАТУРЫ
1. Wilbur D. L. The history of disease of the stomach and duodenum
with reference also to etiology // The Stomach and Duodenum /
Eds G.B. Eusterman, D.L. Balfour. — Philadelphia: W.B. Saunders,
1935.
2. Dragstedt L.R., Owens R.M., Jr. Supradiaphragmatic section of
vagus nerves in treatment of duodenal ulcer // Proc. Soc. Exp. Biol.
Med. — 1943. — Vol. 53. — P. 152-154.
3. Mercer D.W., Robinson E.K. Stomach: peptic ulcer disease //
Sabiston Textbook of Surgery. — 17th ed. — Philadelphia:
W.B. Saunders, 2004. — P. 1278-1300.
4. Soil A.H. Overview of peptic ulcer: epidemiology and major causes //
UpToDate / Ed.B.D. Rose. — Waltham, MA: UpToDate, 2007.
5. Walsh J.H., Peterson WL. The treatment of Helicobacter pylori
infection in the management of peptic ulcer disease // N. Engl.
J. Med. — 1995. — Vol. 333. — P. 984-991.
6. Peura D.A. Association between Helicobacter pylori infection and
duodenal ulcer // UpToDate / Ed.B. D. Rose. — Waltham, MA:
UpToDate, 2007.
7. NIH Consensus Conference: Helicobacter pylori in peptic ulcer
disease. NIH Consensus Development Panel on Helicobacter pylori
in Peptic Ulcer Disease // JAMA. — 1994. — Vol. 272. — P. 65-69.
8. Abies A.Z., Simon I., Melton E.R. Update on Helicobacter pylori
treatment // Am. Fam. Physician. — 2007. — Vol. 75. — P. 351-358.
9. Svanes C, Salvesen H., Stangeland L. et al. Perforated peptic ulcer
over 56 years: time trends in patients and disease characteristics //
Gut. — 1993. — Vol. 34. — P. 1666-1671.
10. Noquiera C, Silva A.S., Santos J.N. et al. Perforated peptic ulcer:
main factors of morbidity and mortality // World J. Surg. —
2003. — Vol. 27. — P. 782-787.
11. Palanivelu C, Jani K., Rajan P.S. et al. Laparoscopic management
of acid peptic disease // Surg. Laparosc. Endosc. Percutan. Tech. —
2006. — Vol. 16. — P. 312-316.
12. Siu W.T., Tang C.N., Law B.K. et al. Vagotomy and
gastrojejunostomy for benign gastric outlet obstruction //
J. Laparoendosc. Adv. Surg. Tech. — 2004. — Vol. 14. — P. 266-269.
13. Croce E., Olmi S., Russo R. et al. Peptic ulcer disease and
thoracoscopic left truncal vagotomy // SLS. — 1999. — Vol. 3. —
P. 203-207.
14. Avci C, Ozmen V, Avtan L. et al. Vagotomy without
gastric drainage laparoscopic or thoracoscopic approach //
Hepatogastroenterology. — 1999. — Vol. 46. — P. 1494-1499.
15. Cadiere G.B., Bruyns J., Himpens J. et al. Laparoscopic highly
selective vagotomy // Hepatogastroenterology. — 1999. —
Vol. 46. — P. 1500-1506.
16. Katkhouda N., Waldrep D.J. An improved technique for
laparoscopic highly selective vagotomy using harmonic shears //
Surg. Endosc. — 1998. — Vol. 12. — P. 1051-1054.
17. Frantzides СТ., Carlson M.A. Laparoscopic highly selective
vagotomy // J. Laparoendosc. Adv. Surg. Tech. A. — 1997. —
Vol. 7.— P. 143-146.
18. Autanz L., Ozman V. Video endoscopic truncal vagotomy without
gastric drainage // Surg. Lap. Endosc. — 1997. — P. 439-444.
100 Лапароскопическая хирургия. Атлас
роль каждой из данных методик в лечении все более
сложных пациентов помогут дальнейшие
проспективные рандомизированные исследования.
19. Nisii H., Hirai T. Laparoscopic Hill's vagotomy by the abdominal
wall lifting method // Surg. Lap. Endosc. — 1997. — Vol. 7. —
P. 394-398.
20. Wyman A., Stuart R.C. Laparoscopic truncal vagotomy and
gastroenterostomy for pyloric stenosis // Am.I. Surg. — 1996. — 171. —
P. 600-603.
21. Dallemagne В., Weerts J.M. Laparoscopic highly selective
vagotomy// Bry. Surg. — 1994. — Vol. 81. — P. 554-556.
22. Mouiel J., Katkhouda N. Laparoscopic vagotomy for chronic
duodenal ulcer disease // World I. Surg. — 1993. — Vol. 17. —
P. 34-39.
23. Wilkinson J.M., Hosie K.B. et al. Long-term results of highly
selective vagotomy: a prospective study with implication for future
laparoscopic surgery // Brl. Surg. — 1994. — Vol. 81. — P. 1469-
1471.
24. Siu W.T., Leong H.T., Law B.K. et al. Laparoscopic repair for
perforated peptic ulcer: a randomized controlled trial // Ann.
Surg. — 2002. — Vol. 235. — P. 313-319.
25. Lau W.Y., Leung K.L., Kwong K.H. et al. A randomized study
comparing laparoscopic versus open repair of perforated peptic
ulcer using suture or sutureless technique // Ann. Surg. — 1996. —
Vol. 224. — P. 131-138.
26. Lee K.H., Chang H.C., Lo C.J. Endoscope-assisted laparoscopic
repair of perforated peptic ulcers // Am. Surg. — 2004. —
Vol. 70. — P. 352-356.
27. Siu W.T., Chau C.H., Law B.K. et al. Routine use of laparoscopic
repair for perforated peptic ulcer // Br. I. Surg. — 2004. —
Vol. 91. —P. 481-484.
28. MehendaleV C, ShenoyS.N., Joshi A.M. et al. Laparoscopic versus
open surgical closure of perforated duodenal ulcers: a comparative
study // Indian. I. Castroenterol. — 2002. — Vol. 21. — P. 222-224.
29. Lee F.Y., Leung K.L., Lai B.S. et al. Predicting mortality and
morbidity of patients operated on for perforated peptic ulcers //
Arch. Surg. — 2001. — Vol. 136. — P. 90-94.
30. Khoursheed M., Fuad M., Safar H. et al. Laparoscopic closure of
perforated duodenal ulcer // Surg. Endosc. — 2000. — Vol. 14. —
P. 56-58.
31. Robertson C.S., Wemyss-Holden S.A., Maddern G.J. Laparoscopic
repair of perforated duodenal ulcers: the role of laparoscopy in
generalized peritonitis // Ann.R. Coll. Surg. Engl. — 2000. —
Vol. 82.— P. 6-10.
32. Katkhouda N., Mavor E., Mason R.J. et al. Laparoscopic repair
of perforated duodenal ulcers: outcome and efficacy in 30
consecutive patients // Arch. Surg. — 1999. — Vol. 134. — P. 845-
848. — Discussion 849-850.
33. Siu W.T., Leong H.T., Li M.K. Single stitch laparoscopic omental
patch repair of perforated duodenal ulcer // У. R. Coll. Surg.
Edinb. — 1997. — Vol. 42. — P. 92-94.
34. Druart M.L., van Нее R. et al. Laparoscopic repair of perforated
duodenal ulcer: a prospective multicenter clinical trail // Surg.
Endosc — 1997.— Vol. 11. — P. 1017-1020.
35. Thompson A.R., Hall T.J., Anglin B.A. et al. Laparoscopic
placation of perforated ulcer: results of a selective approach //
South. Med. J. — 1995. — Vol. 88. — P. 185-189.
36. Lau W.Y., Leung K.L., Zhu X.L. et al. Laparoscopic repair of
perforated peptic ulcer // Br. I. Surg. — 1995. — Vol. 82. — P. 814-
816.
37. Lunevicius R., Morkevicius M. Comparison of laparoscopic
versus open repair for perforated duodenal ulcers // Surg. Endosc.
2005. — Vol. 19. — P. 1565-1571.
38. Kirshtein В., Bayme M., Mayer T. et al. Laparoscopic treatment
of gastro-duodenal perforations: comparison with conventional
surgery // Surg. Endosc. — 2005. — Vol. 19. — P. 1487-1490.
39. Seelig M.H., Seelig S.K., Behr С et al. Comparison between open
and laparoscopic technique in the management of perforated
gastroduodenal ulcers // J. Clin Castroenterol. — 2003. —
Vol. 37. — P. 226-229.
40. Michelet I., Agresta F: Perforated peptic ulcer: laparoscopic
approach // Eur. J. Surg. — 2000. — Vol. 166. — P. 405-408.
41. Naesgaard J.M., Edwin В., Reiertsen O. et al. Laparoscopic and
open operation in patients with perforated peptic ulcer // Eur.
J. Surg. — 1999. — Vol. 165. — P. 209-214.
42. Bergamaschi R., Marvik R., Johnsen G. et al. Open vs laparoscopic
repair of perforated peptic ulcer // Surg. Endosc. — 1999. —
Vol. 13. — P. 679-682.
43. Kok K.Y., Mathew V.V., Yapp S.K. Laparoscopic omental patch
repair for perforated duodenal ulcers // Am. Surg. — 1999. —
Vol. 65. — P. 27-30.
44. So J.B., Kum C.K. Comparison between laparoscopic and
conventional omental patch repair for perforated duodenal ulcer //
Surg. Endosc. — 1996. — Vol. 10. — P. 1060-1063.
45. Miserez A., Eypasch E: Laparoscopic and conventional closure of
perforated peptic ulcer: a comparison // Surg. Endosc. — 1996. —
Vol. 8.— P. 831-836.
46. Matsuda M., Nishiyama M., Hanai T. et al. Laparoscopic omental
patch repair for perforated peptic ulcer // Ann. Surg. — 1995. —
Vol. 221. — P. 236-240.
Глава 8. Лапароскопические операции при пептическои язве... 101
Лапароскопические
стомии
Дженнифер X. Олдринк,
Лиза А. Кларк, Джон П. Грант
^ , Ш|11 ии,,,Ш1,1Ш1„11Я11,,,,, ,иии _
Сэндия А. Лагу-Динэдэялэн
ч
d
j
Во многих клинических ситуациях желательно иметь
прямой доступ в пищеварительный тракт через
переднюю брюшную стенку. Цель такого доступа —
обеспечение питательной поддержки или отведение
кишечного содержимого. Лапароскопические техники
предлагают минимально инвазивный доступ у
отобранных пациентов. В этой главе обсуждены
лапароскопическая гастростомия, еюностомия, илеостомия
и колостомия.
ЛАПАРОСКОПИЧЕСКАЯ ГАСТРОСТОМИЯ
И ЕЮНОСТОМИЯ
У истощенных пациентов доступ для длительного эн-
терального питания — частая клиническая
необходимость. Хотя пероральное питание считается
оптимальным, нарушения ментального статуса, дисфагия
или обструкция часто требуют искусственного доступа
с помощью гастростомии или еюностомии. Было
показано, что энтеральное питание после создания прямого
доступа является эффективным, недорогим и требует
относительно простого ухода, который может быть
обеспечен в больнице, под наблюдением медицинской
сестры, или дома.
Показания для начала длительного энтерально-
го питания в краткой форме изложены на рис. 9-1.
При выборе анатомической зоны для длительного
питательного доступа необходимо иметь в виду
некоторые особенности. Поскольку желудок служит
резервуаром для пережеванной пищи, разводит
гипертонические жидкости, играет роль в пищеварении (в
начальной переработке пищи) и регулирует выведение
пищи в проксимальный отдел двенадцатиперстной
кишки, кормление через гастростому имеет
преимущества перед кормлением через еюностому. В отличие
от еюностомы, гастростома позволяет проводить
прерывистое болюсное питание, безопасное введение
лекарственных средств и требует меньшего количества
оборудования. Еюностомию проводят только для
длительного энтерального питания, если желудочный
доступ противопоказан (вследствие пареза желудка, если
предполагается использование желудочной трубки
для реконструкции в целях формирования кондуита),
а также у пациентов с маленьким желудком, при вари-
козе или раке желудка и если имеется риск аспирации.
Когда пациенту показано питание через еюностому,
лучше применять постепенное вливание с помощью
насоса, чем болюсное питание. Это делают для
профилактики диареи вследствие демпинга, который
возникает, когда гиперосмолярная, богатая углеводами смесь
слишком быстро вводится в тонкую кишку. Обычно
проводят цикличное питание, в течение 12-14 ч в
сутки. При непосредственном введении медикаментов
в тощую кишку необходимо соблюдать большую
осторожность, чтобы избежать диареи, вызванной гипе-
росмолярностью, и обеспечить всасывание лекарства.
В некоторых случаях требуется гастростомия для
декомпрессии и еюностомия для питания.
Установку гастростомического или еюностоми-
ческого зонда традиционно проводили посредством
Показания
к энтеральному питанию
Нарушения глотания/рецидивирующая асипирация
Опухоли головы и шеи
Доброкачественные и злокачественные обструкции
пищевода
Анорексия
Гастропарез
Ментальные нарушения
Травма пищевода
Рис. 9-1. Показания к энтеральному питанию.
Глава 9. Лапароскопические стомии 103
лапаротомии. В 1980 г. Gauderer et al. [1] сообщили
о новой методике гастростомии — перкутанной
эндоскопической гастростомии. Эта техника приобрела
широкую популярность, поскольку не требует общей
анестезии или лапаротомии и сопровождается
меньшим количеством осложнений (тяжелые осложнения
встречаются в 2,8%, легкие — в 6% случаев) [2]. Если
требуется доступ в тощую кишку, питательную трубку
можно ввести через гастростому или через нос в
качестве назоеюнального дренажа. К сожалению,
пациенты с патологией пищевода, вызывающей обструкцию,
или травмами рта или пищевода — неподходящие
кандидаты для перкутанной эндоскопической
гастростомии. С внедрением лапароскопическкой хирургии
в конце 1980-х гг. установление гастростомы или еюно-
стомы с помощью этого метода является
альтернативным вариантом лапаротомии, если перкутанную
эндоскопическую гастростомию провести невозможно.
Анатомия
Желудок — наиболее широкая часть первичной
кишки, которая локализуется в верхнем левом квадранте
спереди. Он делится на 5 отделов: кардию, дно, тело,
антрум и привратник. Проксимальной границей
желудка является функциональный нижний
пищеводный сфинктер, в то время как анатомический сфинктер
привратника отделяет желудок от двенадцатиперстной
кишки. Оптимальное место для гастростомии —
средняя часть тела желудка. Тонкая кишка продолжается
от привратника до терминального отдела
подвздошной кишки и состоит из двенадцатиперстной (20 см),
тощей (100-ПО см) и подвздошной (150-160 см)
кишки. Проксимальный край тощей кишки расположен
в области связки Трейтца. Оптимальное место для ею-
ностомы находится на расстоянии 15-25 см дистальнее
связки Трейтца.
Техника операции
Лапароскопическую установку гастростомической
или еюностомической трубки обычно проводят
под общей анестезией. Поскольку необходимое
давление инсуффляции составляет всего 8-10 мм рт.ст., у
отдельных пациентов приемлемо использование местной
анестезии с внутривенной седацией. Для установки
гастростомы пациента укладывают на спину на
операционном столе в обратное положение Тренделенбурга.
Для установки еюностомы наиболее
предпочтительным считают умеренное положение Тренделенбурга.
Для введения первичного инфраумбиликального
троакара необходимо применять открытую технику Хэссо-
на у всех пациентов, особенно при наличии у них
абдоминальных операций в анамнезе, для того чтобы
избежать ненамеренной перфорации прилежащих органов
брюшной полости или повреждения крупных сосудов.
Во избежание повреждения мочевого пузыря при
лапароскопической еюностомии, особенно при введении
троакара низко по средней линии, устанавливают
катетер Фолея. Остальные технические аспекты
операции вкратце представлены на рисунках, приведенных
ниже. На рис. 9-2—9-5 отражены анатомические
ориентиры и обстановка операционной при проведении
лапароскопической еюно- и гастростомии.
104 Лапароскопическая хирургия. Атлас
Рис. 9-2. Анатомия, знание которой необходимо Рис. 9-3. Обстановка операционной для лапароскопической
при проведении лапароскопической еюно- и гастростомии. установки питательной трубки. Перед введением первичного
Для установки зонда в тощую кишку обязательна троакара в плановом порядке устанавливают катетер Фолея
идентификация связки Трейтца. При установке зонда и назогастральный зонд. Видеомониторы ориентированы
в желудок нужно избегать той части антрального отдела, прямо перед хирургом и ассистентом, как показано
которая прилежит к привратнику. на рисунке.
Глава 9. Лапароскопические стомии 105
1
А
^^я
К о
/
/
^ )
•...■
Ч"Л
v
1
1* (
■
\
/'''
{ 1
/
\
* Место выхода дренажа
о 5-мм троакар
:.,:10-ммтроакар ^^^ш
§щ\жш\^^ \
троакар
j
0
к.
Щ/
V
=...=
' j4
|
1
\
\
1
Рис. 9-4. Расположение
троакаров для еюностомии (слева)
и гастростомии (справа). Вначале
пациента укладывают в положение
Тренделенбурга, 10-миллиметровый
порт устанавливают ниже пупка
с помощью техники Хэссона,
проводят инсуффляцию до Юммрт.ст.
и эксплоративную лапароскопию
с адгезиолизом, если это необходимо.
Затем под визуальным контролем
в отмеченных точках устанавливают
один или два дополнительных
5-миллиметровых порта. На середине
расстояния между лобком и пупком
устанавливают 10-миллиметровый
троакар для еюностомии и сразу ниже
пупка — для гастростомии.
Серповидная
связка
Рис. 9-5. После введения лапароскопа визуализируются
нижняя часть желудка, большой сальник, желудочно-
ободочная связка и поперечная ободочная кишка. Передняя
стенка желудка становится легкодоступной после ее
ретракции книзу, которую осуществляет ассистент. Доступ
к проксимальному отделу тонкой кишки требует передне-
краниальной ретракции большого сальника, которую также
проводит ассистент.
106 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ: ЕЮНОСТОМИЯ
На рис. 9-6—9-15 изображена хирургическая техника лапароскопической еюностомии с применением
патентованного (коммерческого) Т-фиксатора.
Рис. 9-6. Лапароскопическая установка зонда в тощую кишку начинается
с перемещения кишечника в проксимальном направлении для идентификации
связки Трейтца. Проведению этого этапа содействует укладка пациента в обратное
положение Тренделенбурга. Место установки трубки обычно находится
на расстоянии 15-25 см от связки Трейтца. Петлю тощей кишки необходимо подвести
к передней брюшной стенке без натяжения. Наружная компрессия передней
брюшной стенки в левом верхнем квадранте ассистентом (указана стрелкой)
помогает в выборе места для установки дренажа.
Рис. 9-7. После выбора подходящего
места для установки трубки,
как показано на данном рисунке,
установочное устройство Т-фиксатора
вводят через брюшную стенку
в просвет кишки и прошивают.
Рис. 9-8. Оставшиеся Т-фиксаторы
устанавливают аналогичным образом,
формируя площадку, через которую
будет введена еюностомическая
трубка.
Рис. 9-9. Иглу 1 б G из набора
для еюностомии проводят
в просвет петли тощей кишки через
брюшную стенку в пределах границ
Т-фиксаторов и вводят проводник
через иглу в дистальном направлении.
Рис. 9-10. Установка дилататора
и разделяющегося интродьюсера
по проводнику.
Глава 9. Лапароскопические стомии 107
Рис. 9-11. Введение дилататора
и интродьюсера продолжается.
Рис. 9-12. Проводник и дилататор
удаляют, интродьюсер остается
для введения еюностомической
трубки.
Рис. 9-13. Еюностомическую трубку
10-12 F проводят через интродьюсер
в отводящую петлю.
Рис. 9-14. Интродьюсер расщепляют и удаляют, оставляя
еюностомическую трубку в правильном положении.
Фиксатор проводника
Пластиковый
диск -
Марлевый
валик ;
Рис. 9-15. Петлю тощей кишки подводят к передней брюшной
стенке. Концы Т-фиксаторов крепят над пластиковыми
дисками и марлевыми валиками. Лишние концы отрезают.
Еюностомическую трубку дополнительно крепят к коже
нейлоновым швом 3-0.
108 Лапароскопическая хирургия. Атлас
АЛЬТЕРНАТИВНАЯ ОПЕРАЦИЯ:
ЕЮНОСТОМИЯ
На рис. 9-16—9-19 продемонстрирован альтернативный метод лапароскопической еюностомии с помощью иглы
Кейта (Keith).
Рис. 9-16. Серозно-мышечные швы накладывают на стенку
кишки и проводят через переднюю брюшную стенку. Концы
нитей временно натягивают для гемостаза.
Рис. 9-17. Далее через иглу по Сельдингеру вводят
проводник и направляют его в дистальный отрезок кишки
на расстояние от 10 до 15 см.
Рис. 9-18. Интродьюсер расщепляют и удаляют, оставляя
еюностому в правильном положении.
Рис. 9-19. Петля тощей кишки сопоставляется с передней
брюшной стенкой серозно-мышечными швами. Швы
завязывают на коже над резиновыми валиками. Еюностому
дополнительно крепят к коже нейлоновым швом 3-0.
Глава 9. Лапароскопические стомии 109
ОПЕРАЦИЯ: ГАСТРОСТОМИЯ
На рис. 9-20—9-25 показана хирургическая техника лапароскопической гастростомии с помощью Т-фиксатора.
- Серповидная
связка
- Передняя
стенка
желудка
Рис. 9-20. После первичного лапароскопического осмотра,
если это возможно, в желудок вводят воздух для того,
чтобы немного его растянуть. Для гастростомии выбирают
подходящий участок передней стенки желудка, который
удерживают с помощью зажима. Подходящий участок кожи
намечают с помощью инструментальной пальпации (указан
стрелкой) таким образом, чтобы в месте гастростомии
не было натяжения.
Рис. 9-21. После выбора подходящего места для введения
трубки и, если это возможно, инсуффляции воздуха в желудок
через переднюю брюшную стенку в просвет желудка
устанавливают Т-фиксатор и прошивают. Необходимо избегать
антрального отдела, прилежащего к привратнику, чтобы
снизить частоту дистальной миграции трубки и обструкции
выходного отверстия желудка.
Рис. 9-22. Остальные Т-фиксаторы устанавливают
аналогично, формируя площадку, через которую вводят
гастростомическую трубку. Иглу 16 G проводят через стенку
желудка в его просвет через брюшную стенку в пределах
границ Т-зажимов и проводник устанавливают через иглу
в дистальном направлении.
110 Лапароскопическая хирургия. Атлас
Рис. 9-23. После извлечения иглы по проводнику
осуществляют введение дилататора и интродьюсера.
Рис. 9-24. Проводник и дилататор удаляют,
гастростомическую трубку 1 б F проводят через интродьюсер
в просвет желудка. Баллон раздувают с помощью 10 мл
физраствора, интродьюсер расщепляют и удаляют, оставляя
правильно установленную гастростому.
Рис. 9-25. Серозную оболочку желудка прикрепляют
к передней брюшной стенке путем установки концов
Т-фиксаторов над пластиковыми дисками и марлевыми
валиками, после чего лишние концы отрезают.
Гастростомическую трубку дополнительно крепят к коже
нейлоновым швом 3-0.
Глава 9. Лапароскопические стомии 111
АЛЬТЕРНАТИВНАЯ ОПЕРАЦИЯ:
ГАСТРОСТОМИЯ
На рис. 9-26—9-30 представлен альтернативный метод лапароскопической гастростомии с помощью иглы Кейта.
Рис. 9-26. После определения места гастростомии Рис. 9-27. Все четыре серозно-мышечных шва на стенке
шелковый шов 3-0 на игле Кейта проводят через кожу желудка сориентированы по углам квадрата относительно
трансабдоминально в области, прилежащей к месту будущей друг друга, иглу 1 б G из набора для установки проводят через
стомы. С помощью иглы накладывают серозно-мышечный стенку желудка в его просвет,
шов на стенку желудка и проводят иглу назад через брюшную
стенку аналогично методике еюностомии, описанной выше.
112 Лапароскопическая хирургия. Атлас
Рис. 9-28. Далее дилататор 18 F и интродьюсер
вводят в просвет желудка, чтобы дилатировать канал
для последующей установки трубки. Может понадобиться
рассечение кожи, прилежащей к проводнику, что помогает
при введении.
Рис. 9-29. Гастростомическая трубка 1 б F установлена
в просвет желудка через дилататор.
Рис. 9-30. Баллон катетера раздут, и серозная оболочка
желудка прижата к брюшной стенке с помощью тракции
за ранее наложенные швы и гастростомическую трубку. Швы
завязаны на коже над марлевыми валиками. Гастростому
дополнительно крепят к коже нейлоновым швом 3-0.
Глава 9. Лапароскопические стомии 113
ОПЕРАЦИЯ ПО НАЛОЖЕНИЮ ШВОВ
На рис. 9-31, 9-32 показано наложение кисетных
швов вокруг еюностомического катетера с помощью
устройства «EndoStitch» (Auto Suture Co., Norwalk, CT).
Послеоперационный уход
Для наблюдения пациента забирают в
послеоперационную палату перед его возвращением в отделение.
Назогастральную трубку не оставляют. Необходимые
медикаменты можно сразу же вводить в трубку,
питание начинают через 24 ч и расширяют по мере
переносимости.
Результаты
Со времени первого описания лапароскопической
еюностомии для энтерального питания в 1990 г. было
предложено большое количество методик и оценены
их безопасность и эффективность [4-6]. В метаанализе,
недавно проведенном Hans-Geurts et al. [6], было
проанализировано 23 сообщения, описывающих
лапароскопическую еюностомию, оценивающих хирургическую
технику и катетерассоциированные осложнения. В этом
исследовании осложнения наблюдали у 17% пациентов,
что сравнимо с частотой развития осложнений после
открытых операций. В других источниках сообщается
Рис. 9-31. Кисетный шов вокруг еюностомического катетера
накладывают с помощью устройства «EndoStitch» {Auto Suture,
Norwalk, CT) (адаптировано из: Hans-Geurts etal. [6]).
I
об частоте осложнений от 0 до 26% [7-10]. Наиболее
часто встречались раневые инфекции и миграции
катетера. Тяжелые осложнения, потребовавшие повторного
оперативного вмешательства, зафиксированы в 1,8%
случаев, как и при открытой хирургии [6].
Bankhead et al. [11] сравнили открытую,
лапароскопическую и эндоскопическую установку гастросто-
мы. Было показано, что при минимально инвазивных
методиках длительность операции была ниже: 68, 48
и 30 мин для открытой, лапароскопической и
эндоскопической методики соответственно. Питание в более
ранний срок начинали в лапароскопической (1,5 дня)
и эндоскопической (1,7 дня) группе в сравнении с
открытой группой (2,1 дня). Peitigen et al. [12] описали
42 пациентов, которые подверглись
лапароскопической гастростомии. Средняя продолжительность
операции составила 38 мин; у 4,7% пациентов отмечались
серьезные, у 9,4% — легкие осложнения. Было
отмечено, что лапароскопическая установка питательных
трубок безопасна, частота послеоперационных
осложнений сравнима с открытыми операциями, имеет
одинаковую стоимость, меньшую продолжительность
операции и быстрое послеоперационное выздоровление
с ранним началом питания [13, 14].
Рис. 9-32. Кисетный шов вокруг еюностомического катетера
накладывают с помощью устройства «.EndoStitch» (Auto Suture,
Norwalk, CT) (адаптировано из: Hans-Geurts etal. [6]).
114 Лапароскопическая хирургия. Атлас
ЛАПАРОСКОПИЧЕСКИЕ ИЛЕОСТОМИЯ
И КОЛОСТОМИЯ
Операции по формированию тонкокишечных стом
проводят в различных ситуациях: при перфорации,
обструкции или воспалительных заболеваниях
кишечника (рис. 9-33). Стандартные открытые методики
для формирования илеостомы или колостомы в целях
отведения каловых масс безопасны, эффективны и
часто требуют минимальных разрезов. Однако
некоторые пациенты, которым показаны данные процедуры,
уже подвергались абдоминальной хирургии или имеют
метастатическую болезнь с мезентериальными и
брюшинными имплантатами. Эти обстоятельства
лимитируют возможность проведения минимального разреза
для формирования стомы. Кроме того, открытые
операции часто осложняются послеоперационным
парезом кишечника и длительной госпитализацией.
При временной или перманентной энтеросто-
мии лапароскопия имеет несколько преимуществ.
При лапароскопическом формировании стомы
можно провести тщательную ревизию брюшной полости
для обнаружения дополнительной патологии,
которая, возможно, осталась бы невыявленной в случае
проведения мини-лапаротомии. К тому же при
лапароскопической операции возможно проведение
диагностических биопсий, гастростомии или еюностомии
для питания. Еще одним техническим преимуществом
лапароскопии является возможность исключения
натяжения и перекрута проксимального и дистально-
го участка кишечника после формирования стомы.
Как и при большинстве лапароскопических операций,
манипуляции с кишечником минимальны, что
способствует быстрому восстановлению функции, позволяя
пациенту сразу же начать самостоятельное питание.
Отводная стома функционирует хорошо, если больной
нормально переносит обычную диету. Пациента
можно выписать через 24-48 ч после операции, особенно
если он прошел обучение по уходу за стомой в
предоперационном периоде.
Лапароскопический доступ применяют для
создания отводных колостом и илеостом со
всевозрастающей частотой, хотя существует множество других
минимально инвазивных методик. Стомы бывают
петлевые, концевые или концевые с комбинированной
слизистой фистулой.
Техника операции
При плановой хирургии необходимо начать
подготовку кишечника за день до операции. После проведения
анестезии устанавливают катетер в мочевой пузырь
и назогастральный зонд. У большинства пациентов
оба дренажа удаляют сразу после операции.
На рис. 9-34—9-41 представлена хирургическая
техника лапароскопической энтеростомии.
Показания к энтеростомии
Перфорация
Дивертикулит
Рак
Болезнь Крона
Ишемия
Обструкция
Нерезектабельный рак
Заворот кишок
Инвагинация
Синдром Огилви
Воспалительные заболевания кишечника
Болезнь Крона
Язвенный колит
Токсический мегаколон
Рис. 9-33. Показания к энтеростомии.
Глава 9. Лапароскопические стомии 115
ПОДГОТОВКА
Рис. 9-34. Обстановка операционной
для лапароскопической сигмостомии.
Пациент находится в положении
лежа на спине, живот обрабатывают
и обкладывают широко. Первый
хирург стоит на стороне стомы.
Ассистент с камерой обычно
располагается с другой стороны.
Видеомониторы устанавливают
у ног пациента, по обе стороны
операционного стола, напротив
глаз хирургов. После проведения
анестезии создают пневмоперитонеум
с давлением до 15 мм рт.ст. с помощью
открытой техники (троакар Хэссона
вводят в области пупка). Затем через
10-миллиметровый порт вводят
лапароскоп и проводят ревизию
брюшной полости. При выраженных
спайках, препятствующих
мобилизации сегмента кишки
для стомы, может потребоваться
введение дополнительных троакаров.
На этом этапе можно провести
дополнительные процедуры (биопсии,
трубки для питания и т.п.).
116 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Послеоперационный период
Необходимость в уходе зависит от
предоперационного состояния пациента. У пациентов после плановой
операции нет необходимости в назогастральном зонде
в послеоперационном периоде. Прием жидкости
разрешают на 1-й день после операции, диета
расширяется по мере ее переносимости.
Результаты
Техника лапароскопической цекостомии [15], илеосто-
мии [16] и колостомии [17-20] была описана в
нескольких источниках. Hollyoak et al. [21] представили
ретроспективный обзор, сравнивающий лапароскопическую
и открытую илеостомию. Они отметили снижение
продолжительности операции, времени до восстановления
функции кишечника, продолжительности
госпитализации в группе лапароскопии. Ludwig et al. [22] сделали
обзор 24 лапароскопических остомий для отведения
каловых масс, проведенных в клинике Клевленда, и
выяснили, что средняя продолжительность операции
составила 60 мин, средняя кровопотеря — 50 мл, среднее
время до восстановления функции кишечника — 1 день.
В одном случае была проведена конверсия в открытую
операцию, отмечалось одно тяжелое осложнение (ТЭЛА
у пациента с метастатической болезнью). Oliveria et al.
[22] представили ретроспективный анализ результатов
проведенных лапароскопических энтеростомий.
Средняя продолжительность операции составила 76 мин,
среднее время до восстановления функции
кишечника — 3,1 дня и средняя продолжительность
госпитализации — 6,2 дня. Одно исследование, посвященное
применению лапароскопической колостомии при
некоторых экстраперитонеальных огнестрельных ранениях
прямой кишки, показало, что лапароскопическое
вмешательство является безопасной альтернативой лапаро-
томии у таких пациентов [24].
Разрез на передней стенке
влагалища прямой мышцы
10-мм троакар
с камерой -
в области пупка
12-мм троакар
Рис. 9-35. Формирование места наложения стомы. После
мобилизации подвздошной кишки в брюшной стенке,
прилежащей к выбранному сегменту кишки, делают
отверстие, обычно таким образом, чтобы кишка проходила
через прямую мышцу. Зажимом Алиса захватывают кожу
в месте стомы и иссекают эллипсоидный участок кожи.
После удаления подкожного жира с помощью электроножа
делают круговой разрез передней стенки влагалища прямой
мышцы. Волокна прямой мышцы расщепляют зажимом
Келли, рассекают задний листок влагалища прямой мышцы,
но брюшину не вскрывают.
Рис. 9-36. Через место колостомы вводят 12-миллиметровый
порт. В преумбиликальном регионе устанавливают
10-миллиметровый троакар, через который после
инсуффляции С02 в брюшную полость вводят
лапароскопическую камеру. В брюшную полость через
дефект, образованный в коже, влагалище прямой мышцы,
прямой мышце и брюшине, вводят 12-миллиметровый
троакар.
Глава 9. Лапароскопические стомии 117
Рис. 9-37. Лапароскопическим зажимом Бэбкока захватывают
противобрыжеечный край подвижного сегмента сигмовидной
кишки. Этот участок кишки должен без натяжения достигать
передней брюшной стенки в условиях пневмоперитонеума.
На данном этапе через ранее сформированное место
для стомы вводят троакар. Отверстие в брюшине расширяют
для выведения кишки, при этом пневмоперитонеум
частично утрачивается. С помощью зажима Бэбкока петлю
сигмовидной кишки вытягивают через дефект брюшной
стенки, одновременно удаляя троакар. Петля кишки
закупоривает брюшную полость, позволяя снова создать
пневмоперитонеум. Затем визуально исследуют брюшную
полость и брыжейку сигмовидной кишки для исключения
перекрута или натяжения сигмовидной кишки.
Рис. 9-38. Формирование стомы. После извлечения петли
сигмовидной кишки наружу формируют двуствольную
стому. Катетер из красной резины проводят через брыжейку
кишки и затем — между кишкой и кожей, чтобы стома
не мигрировала в брюшную полость. Колостому формируют
с помощью вскрытия кишки вдоль тении и наложения швов
(хромированным кетгутом 3-0), сопоставляющих слизистую
оболочку кишки и кожу.
118 Лапароскопическая хирургия. Атлас
На петлю
сигмовидной кишки
накладывают скобки
для формирования
концевой колостомы
Троакары
для концевой
колостомии
со слизистой фистулой
Рис. 9-39. В качестве альтернативного варианта петлю
ободочной кишки, выведенную через брюшную стенку,
конвертируют в концевую колостому, накладывая скобки
ТА-55 поперек дистального сегмента. Стому формируют,
вскрывая проксимальный сегмент вдоль тении, и накладывая
полнослойные отдельные швы хромированным кетгутовым
3-0 с сопоставлением слизистой оболочки кишки и кожи.
Рис. 9-40. Формирование концевой колостомы и слизистой
фистулы. Если дистальныи сетмент кишки выступает
над дугласовым карманом более чем на 10см, можно
сформировать концевую колостому и слизистую фистулу.
В этом случае готовят два стомических отверстия.
Рассечение сигмовидной кишки
для формирования концевой
колостомы и слизистой фистулы
Выведение прошитых
скобами концов кишки
для формирования колостомы
и слизистой фистулы
Рис. 9-41. Формирование концевой колостомы со слизистой
фистулой продолжается. А — через два стомических
отверстия, как показано на рис. 9-17, устанавливают
троакары 10 и 12 мм. Для формирования концевой колостомы
со слизистой фистулой выбирают соответствующий сегмент
сигмовидной кишки. Выясняют возможность мобилизации
кишки для подведения ее к передней брюшной стенке.
Затем острым путем с помощью эндоножниц, коагуляции
или устройства «LigaSure» делают отверстие в брыжейке
в месте концевой колостомии. Через 12-миллиметровый
троакар вводят эндоскопический степлер, с его помощью
рассекают сигмовидную кишку с образованием двух концов.
закрытых скобками. После рассечения сигмовидной кишки
рассекают брыжейку сигмовидной кишки с помощью
сосудистого степлера. Вторая линия скобок на брыжейке
позволяет разделить два конца кишки на концевую
колостому и слизистую фистулу. Б — через троакар проводят
зажим Бэбкока, и после рассечения брюшины выводят
с его помощью через стому проксимальный конец кишки.
Дистальныи отдел кишки одновременно извлекают, используя
зажим Бэбкока, через другое стомическое отверстие. После
формирования стом повторно создают пневмоперитонеум,
чтобы осмотреть брюшную полость и исключить натяжение
или перекрут.
Глава 9. Лапароскопические стомии 119
ЗАКЛЮЧЕНИЕ
Лапароскопические методы можно безопасно и эффективно применять для отведения каловых масс в качестве
альтернативы лапаротомии.
СПИСОК ЛИТЕРАТУРЫ
-
1. Cauderer M.W., Ponsky J.L., Izant R.J., Jr. Gastrostomy without
laparotomy: a percutaneous endoscopic technique // J. Pediatr.
Surg. — 1980. — Vol. 15. — P. 872-875.
2. Grant J. P. Percutaneous endoscopic gastrostomy: initial placement
by single endoscopic technique and long-term follow-up // Ann.
Surg. — 1993. — Vol. 217. — P. 168-174.
3. O'Regan P.J., Scarrow CD. Laparoscopic jejunostomy //
Endoscopy. — 1990. — Vol. 22. — P. 39-40.
4. Allen J.W., Ali A., Wo J. et al. Totally laparoscopic feeding
jejunostomy// Surg. Endosc. — 2002. — Vol. 16. — P. 1802-1805.
5. Senkal M., Koch J., Hummel T. Laparoscopic needle catheter
jejunostomy: modification of the technique and outcome results //
Surg. Endosc. — 2004. — Vol, 18. — P. 307-309.
6. Hans-Ceurts I.J. M., Lim A., Stijnen T. et al. Laparoscopic feeding
jejunostomy: a systemic review // Surg. Endosc. — 2005. —
Vol. 19.— P. 951-957.
7. De Cottardi A., Krahenbuhl L., Farhadi J Clinical experience
of feeding through a needle catheter jejunostomy after major
abdominal operations // Eur. J. Surg. — 1999. — Vol. 165. —
P. 1055-1060.
8. Gedaly R., Briceno P., Ravelo R. Laparoscopic jejunostomy with
an 18-mm trocar // Surg. Laparosc. Endosc. — 1997. — Vol. 5. —
P. 420-422.
9. Holmes IV J. H., Brundage S.I., Yuen PC. Complications of surgical
feeding jejunostomy in trauma patients // J. Trauma. — 1999. —
Vol.4.— P. 1009-1012.
10. Myers J.C., Page СР., Stewart R.M. Complications of needle
catheter jejunostomy in 2,022 consecutive applications // Am.
J. Surg. — 1995. — Vol. 170. — P. 547-551.
11. Bankhead R.R., Fisher C.A., Rolandelli R.H. Gastrostomy tube
placement outcomes: comparison of surgical, endoscopic, and
laparoscopic methods // Nutr. Clin. Pract. — 2005. — Vol. 6. —
P. 607-612.
12. Peitgen K., Walz M.K., Krause U. et al. First results of laparoscopic
gastrostomy// Surg. Endosc. — 1997. — Vol. 11. — P. 658-662.
13. Murayama K.M., Johnson T.J., Thompson J.S. Laparoscopic
gastrostomy and jejunostomy are safe and effective for obtaining
enteral access // Am. J. Surg. — 1996. — Vol. 172. — P. 591-594.
14 Nagie A.F., Murayama K.M. Laparoscopic gastrostomy and
jejunostomy // J. Long. Term.Eff. Med. Implants. — 2004. —
Vol. 14.— P. 1-11.
15. Duh Q.Y., Way L.W. Diagnostic laparoscopy and laparoscopic
cecostomy for colonic pseudo-obstruction // Dis. Colon Rectum. —
1993. — Vol. 36. — P. 65-70.
16. Weiss U.L., Jehle E., Becker H.D. et al. Laparoscopic ileostomy // Br.
J. Surg. — 1995. — Vol. 82. — P. 1648.
17. Lyerly H.K., Mault J.R. Laparoscopic ileostomy and colostomy //
Ann. Surg. — 1994. — Vol. 219. — P. 317-322.
18. Jugool S., Mc Kain E.S., Swarnkar K. et al. Laparoscopic or
trephine faecal diversion: is there a preferred approach and why? //
Colorectal Dis. — 2005. — Vol. 7. — P. 156-158.
19. de la Fuente S.G., Levin L.S., Reynolds J.D. et al. Elective stoma
construction improves outcomes in medically intractable pressure
ulcers // Dis. Colon Rectum. — 2003. — Vol. 46. — P. 1525-1530.
20. Liu J., Bruch H.P., Farke S. et al. Stoma formation for fecal
diversion: a plea for the laparoscopic approach. // Tech.
Coloproctol. — 2005. — Vol. 9. — P. 9-14.
21. Hollyoak M. A., Lumley J., Stitz R.W. Laparoscopic stoma formation
for faecal diversion // Br. J. Surg. — 1998. — Vol. 85. — P. 226-228.
22. Ludwig K.A., Milsom J.W, Garcia-Ruiz A. et al. Laparoscopic
techniques for fecal diversion // Dis. Colon Rectum. — 1996. —
Vol. 39. — P. 285-288.
23. Oliveria L., Reissman P., Nogueras J. et al. Laparoscopic creation of
stomas // Surg. Endosc. — 1997. — Vol. 11. — P. 19-23.
24. Navsaria PH., Shaw J.M., Zellweger R. et al. Diagnostic laparoscopy
and diverting sigmoid loop colostomy in the management of
civilian extraperi-toneal rectal gunshot injuries // Br. J. Surg. —
2004. — Vol. 91. — P. 460-464.
120 Лапароскопическая хирургия. Атлас
Лапароскопическая
резекция тонкой кишки
и удаление дивертикула
Меккеля
С. Дениз Чинг, Аврора Д. Приор
ЯШ&1В®,
Лапароскопия, которая была впервые описана Bernheim
в 1911 г. [1] и использовалась ранее преимущественно
в гинекологической хирургии, в настоящее время стала
основной технологией во многих областях хирургии.
В прошедшем десятилетии в связи с технологическим
прогрессом и ростом опыта лапароскопических
хирургов показания к лапароскопии при операциях на
тонкой кишке значительно расширились. Лапароскопия
в настоящее время применяется при различных
заболеваниях тонкой кишки: непроходимости [2-4],
дивертикуле Меккеля [4-6], перфорации [7-9],
инородных телах [10], врожденной мальротации [11] и раке.
Несмотря на различие этих патологических состояний,
основой их лечения является резекция тонкой кишки.
Техника резекции развивалась в течение последних
10 лет. На первых порах тонкую кишку благодаря ее
мобильности извлекали через расширенное троакарное
отверстие и экстракорпорально проводили резекцию
кишки и формировали анастомоз, затем кишку с
анастомозом погружали в брюшную полость. Изобретение
лапароскопических сшивающих аппаратов, а также
электрохирургических систем для коагуляции и
резания на основе термальной энергии привело к
стандартизации интракорпорального анастомоза [11]. В этой
главе описана техника резекции тонкой кишки и
формирования анастомоза, а также ее применение при
таком заболевании, как дивертикул Меккеля.
АНАТОМИЯ
Тонкая кишка состоит из двенадцатиперстной,
тощей и подвздошной кишки, имеет длину около 7 м
(275 дюймов). Двенадцатиперстная кишка имеет
форму С-образной трубки длиной примерно 25 см,
которая простирается от привратника до связки Трейтца.
Она делится на четыре отдела: верхний, включающий
луковицу двенадцатиперстной кишки; нисходящий,
который расположен ретроперитонеально и
принимает протоки поджелудочной железы и желчные
протоки; ретроперитонеальный горизонтальный
отдел, который пересекают верхние брыжеечные
сосуды; и последний — восходящий отдел. Дуоденоею-
нальный переход подвешивается связкой Трейтца,
разделяющей отделы тонкой кишки, расположенные
ретроперитонеально и интраперитонеально. Тощая
и подвздошная кишка прикреплены к задней
брюшной стенке с помощью брыжейки, представляющей
собой складку брюшины в виде веера длиной
примерно 15 см, которая обеспечивает мобильность вну-
трибрюшинно расположенной тонкой кишки. В
брыжейке проходят кровеносные сосуды (ветви верхней
брыжеечной артерии и притоки воротной вены),
лимфатические сосуды, нервы вегетативной и
соматической нервных систем. Парасимпатическую
иннервацию обеспечивает задний ствол блуждающего
нерва, симпатическую — верхний брыжеечный узел.
Соматическая чувствительная иннервация исходит
из внутренностных нервов (Т1Х-ТХ) [12].
ЭМБРИОЛОГИЯ ДИВЕРТИКУЛА МЕККЕЛЯ
Дивертикул Меккеля, названный по имени Иоганна
Фридриха Меккеля, немецкого анатома начала XIX в.,
является остатком омфаломезентериального
протока, который не подвергся облитерации и инволюции
на раннем сроке гестации. Примерно в 90% таких
случаев образуется истинный дивертикул, расположенный
на противобрыжеечном крае тонкой кишки, —
дивертикул Меккеля. Парные желточные артерии следуют рядом
с омфаломезентериальным протоком от аорты к
желточному мешку. Правая желточная артерия становится
верхней брыжеечной артерией, а левая обычно
подвергается инволюции на 7-й неделе гестации. По наружной
поверхности дивертикула Меккеля обычно проходит
крупная артерия, которая является патологическим
рудиментом правой желточной артерии (рис. 10-1).
Глава 10. Лапароскопическая резекция тонкой кишки и удаление дивертикула Меккеля 121
*
Рис. 10-1. Интраоперационная фотография дивертикула
Меккеля.
ПАТОФИЗИОЛОГИЯ
Эпидемиология и строение дивертикула Меккеля
легко запоминаются с помощью «правила двух».
Дивертикулы Меккеля обычно встречаются у 2% популяции,
имеют длину 2 дюйма, чаще расположены на
расстоянии 2 футов от илеоцекального клапана и могут
содержать 2 типа эктопированной слизистой оболочки:
желудочную и панкреатическую. Дивертикул Меккеля —
наиболее частая врожденная аномалия желудочно-
кишечного тракта. Его наличие сопровождается 6%
риском развития в течение жизни таких осложнений,
как кишечная непроходимость, инвагинация,
дивертикулит и кровотечение (рис. 10-2) [13].
КЛИНИЧЕСКАЯ КАРТИНА
Наиболее частыми клиническими признаками
симптоматического дивертикула Меккеля являются
кровотечение, кишечная непроходимость и дивертикулит.
В недавно проведенном обзоре [14] 1476 пациентов
клиники Мейо 38% взрослых имели симптомы крово-
Осложнения, связанные
с дивертикулом Меккеля
Обструкция
Дивертикулит
Кровотечение из нижних отделов желудочно-
кишечного тракта
Омфаломезентериальная фистула
Грыжа Литтре
Инвагинация/заворот
Перфорация
Рис. 10-2. Осложнения, связанные с дивертикулом Меккеля.
течения, 34% — кишечной непроходимости и 28% —
дивертикулита. У детей кишечная непроходимость
отмечалась в 40%, кровотечение — в 31% и
дивертикулит — в 29% случаев.
Кровотечение
Обычно дивертикул Меккеля не имеет четких симптомов
и часто является случайной находкой во время операции
или рентгенологического исследования, которое
проводят по поводу другого заболевания. Клинические
симптомы осложнений дивертикула Меккеля наиболее часто
возникают у детей (в 60% случаев) в возрасте до 10 лет
[14]. Кровотечение — самое частое осложнение
дивертикула Меккеля в детской популяции и наиболее частая
причина желудочно-кишечных кровотечений у детей.
Кровотечение возникает вследствие образования пеп-
тической язвы тощей кишки, вызванной наличием
эктопической слизистой патологии желудка в дивертикуле.
Дифференциальную диагностику проводят с другими
возможными причинами кровотечения из нижних
отделов пищеварительного тракта: инвагинацией, полипами
и воспалительными заболеваниями кишечника.
Кишечная непроходимость
Кишечная непроходимость — второе по частоте
осложнение дивертикула Меккеля, которое обычно
обнаруживают у детей старшего возраста и у взрослых.
Кишечную непроходимость могут вызывать такие состояния,
как инвагинация или заворот вокруг спаек либо
ущемление в паховом или бедренном грыжевом мешке
(грыжа Литтре). У детей кишечная непроходимость также
может быть связана с инвагинацией дивертикула,
которая обычно проявляется интермиттирующей
спастической болью в животе и темно-красным стулом в виде
малинового желе. У взрослых симптомы обструкции,
вызванной дивертикулом Меккеля, неотличимы от
симптомов других заболеваний, вызывающих
тонкокишечную непроходимость, за исключением того, что пациент
может не иметь в анамнезе абдоминальных операций.
Клинически кишечная непроходимость
характеризуется рвотой желчью, вздутием живота и запором.
Диагноз устанавливают на основе физикального
обследования, рентгеноконтрастных исследований тонкой кишки
с контрастом, энтероклизмы. В качестве причины
кровотечения из нижних отделов желудочно-кишечного
тракта у взрослых дивертикул Меккеля опережает рак,
дивертикулез и воспалительные заболевания
кишечника. У взрослых кровотечение чаще проявляется
меленой, а дифференциальную диагностику проводят с
вышеуказанными заболеваниями.
Дивертикулит
Воспаление дивертикула Меккеля вызывает
клинические симптомы, аналогичные симптомам
аппендицита. Дифференциальную диагностику проводят также
122 Лапароскопическая хирургия. Атлас
с холециститом, болезнью Крона и язвенной болезнью.
При дивертикулэктомии отмечается довольно высокая
летальность (6%), что часто связано с поздней
диагностикой этого заболевания.
РАДИОЛОГИЧЕСКИЕ МЕТОДЫ
ДИАГНОСТИКИ
Диагностика дивертикула Меккеля может быть трудной.
Обзорный снимок брюшной полости считается
ненадежным. Что касается исследований с барием, то более
точным, чем традиционный пассаж бария, является эн-
тероклизма, которая позволяет в достаточной степени
растянуть тонкую кишку, что улучшает визуализацию
пораженного сегмента. Роль КТ ограничена, поскольку
с помощью томографии трудно дифференцировать
дивертикул Меккеля от нормальной петли кишечника.
Однако такие осложнения дивертикула Меккеля, как
воспаление или инвагинация, позволяют легко выявить его
на КТ. Диагноз может быть установлен с помощью
радиоизотопного сканирования с 99тТс-пертехненатом,
который преимущественно накапливается и секретируется
клетками желудочного эпителия, имеющегося в
дивертикуле [15, 16]. У таких пациентов ключом к диагнозу
может быть диагностическая лапароскопия.
Помимо дивертикула Меккеля, имеется множество
показаний к лапароскопии при заболеваниях тонкой
кишки. Ее применяют при лечении кишечной
непроходимости, инвагинации, заворота кишок, ишемиче-
ском поражении кишечника, инородных тел,
врожденной мальротации и злокачественных опухолей.
Наложение тонкокишечных анастомозов лапароскопически
позволяет приобрести опыт, необходимый при более
сложных операциях, таких как лапароскопические
желудочные обходные анастомозы.
ТЕХНИКА ОПЕРАЦИИ
Хирургический доступ к тонкой кишке зависит от
места расположения патологического участка, что
влияет на выбор места для введения троакаров.
Существует семь этапов резекции тонкой кишки: доступ
в брюшную полость, осмотр тонкой кишки на всем
протяжении для выявления основной и
сопутствующей патологии, рассечение всех спаек, создание
«окна» в брыжейке, наложение степлера на кишку,
рассечение брыжейки патологического сегмента
кишки, извлечение препарата, формирование
тонкокишечного анастомоза и зашивание дефекта брыжейки.
Первичный троакар вводят в области пупка, а
вторичные (5-миллиметровые троакары) — под
визуальным контролем в разных точках, что придает этому
доступу гибкость. Техника резекции тонкой кишки
представлена на рис. 10-3—10-14.
Глава 10. Лапароскопическая резекция тонкой кишки и удаление дивертикула Меккеля
123
ПОДГОТОВКА
Монитор
Анестезиолог
Монитор
Ассистент
Рис. 10-3. Стандартная обстановка
операционной для резекции тонкой
кишки.
Рис. 10-4. Доступ в брюшную полость рядом с пупком
с помощью закрытого (игла Вереша) или открытого (троакар
Хэссона) метода. Через пупочный порт вводят лапароскоп
после инсуффляции С02 до давления 15 мм рт.ст. Два порта
устанавливают в правых отделах живота. Один из них —
12-миллиметровый порт для степлера. Дополнительный
5-миллиметровый порт для ассистента вводят в левой
половине живота. После установки троакаров осуществляют
ревизию брюшной полости для поиска патологии.
124 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Рис. 10-5. В месте планируемого пересечения кишки тупым
путем формируют «окно» в брыжейке.
Рис. 10-6. Тонкую кишку пересекают 2,5-миллиметровым
линейным степлером, проведенным через «окно» в брыжейке.
Рис. 10-7. Брыжейку удаляемого участка кишки рассекают
с помощью электрохирургического устройства.
Рис. 10-8. Накладывают шов для сопоставления двух
участков кишки перед формированием анастомоза. Если шов
наложен правильно, он также обеспечит укрепление линии
механического шва анастомоза.
Рис. 10-9. Для вскрытия просвета кишки используют
электрохирургический крючок. Кишку необходимо вскрывать
с осторожностью, чтобы не повредить ее заднюю стенку.
Глава 10. Лапароскопическая резекция тонкой кишки и удаление дивертикула Меккеля 125
Рис. 10-10. Для восстановления непрерывности кишки
используют 2,5-миллиметровый линейный степлер длиной
60 мм.
Рис. 10-12. Для зашивания оставшегося в кишке отверстия
можно использовать швы или скобки. При ручном шве
первый накладывают у конца анастомоза, созданного
для закрытия дефекта. Если применяют аппарат с двойной
линией скобок, то для точной установки степлера можно
наложить дополнительные швы. При этом нужно избегать
сужения просвета анастомоза.
126 Лапароскопическая хирургия. Атлас
Рис. 10-11. Для того чтобы получить анастомоз с адекватным
просветом, необходимо полностью ввести степлер в просвет
кишки.
Рис. 10-13. Для зашивания оставшегося в кишке отверстия
используют непрерывный шов. Для однорядного шва обычно
берут рассасывающуюся нить, например 2-0 «Polysorb» (US
Surgical, Norwalk, CT). В качестве альтернативы можно закрыть
этот дефект дополнительным рядом скобок.
Рис. 10-14. Дефект брыжейки зашивают нерассасывающимся
шовным материалом.
СПИСОК ЛИТЕРАТУРЫ
1. Bernheim B.M. Organoscopy: cystoscopy of the abdominal cavity //
Ann. Surg. — 1911. — Vol. 53. — P. 764-767.
2. Bailey I.S., Rhodes M., O'Rourke N. et al. Laparoscopic
management of acute small bowel obstruction // Br. J. Surg. —
1998. — Vol. 85. — P. 84-87.
3. Shalaby R., Desoky A. Laparoscopic approach to small intestinal
obstruction in children: a preliminary experience // Surg. Laparosc.
Enclose. Percutan. Tech. — 2001. — Vol. 11. — P. 301-305.
4. Tashjian D.B., Moriarty K.P. Laparoscopy for treating a small bowel
obstruction due to a Meckel's diverticulum // JSLS. — 2003. —
Vol. 7. — P. 253-255.
5. Shalaby R.Y., Soliman S., Fawy M. et al. Laparoscopic management
of Meckel's diverticulum in children // J. Pediatr. Surg. — 2005. —
Vol. 40. — P. 562-567.
6. Craigie R.J., Forrest N., Nanthakumaran S. et al. Laparoscopy
in diagnosis and management of Meckel's diverticulum //
J. Lapraroendosc. Adv. Surg. Tech. — 2006. — Vol. 16. — P. 70-73.
7. Sinha R., Sharma N., Joshi M. Laparoscopic repair of small bowel
perforation // J.Soc. Laparosc. Surg. — 2005. — Vol. 9. — P. 399-
402.
8. Druart M.L., Van Нее E., Etienne J. et al. Laparoscopic repair of
perforated duodenal ulcer // Surg. Endosc. — 1997. — Vol. 11. —
P. 1017-1020.
I
9. Katkhouda N., Mavor E., Mason R.J. et al. Laparoscopic repair of
perforated duodenal ulcers // Arch. Surg. — 1999. — Vol. 134. —
P. 845-850.
10. Jones M.W., Koper В., Weatherhead W.F. Crohn's disease with
enterolith treated laparoscopically // JSLS. — 2005. — Vol. 9. —
P. 339-341.
11. Seymour N.E., Andersen D.K. Laparoscopic treatment of intestinal
malrotation in adults // JSLS. — 2005. — Vol. 9. — P. 298-301.
12. Cray H. Anatomy of the Human Body. — 20th ed. — Philadelphia:
Lea and Febiger, 1918.
13. Cullen J.J., Kelly K.A., Moir C.R. et al. Surgical management of
Meckel's diverticulum: an epidemiologic, population-based study //
Ann. Surg. — 1994. — Vol. 220. — P. 564-569.
14. Park J. J., Wolff B.C., Toieffson M.K. et al. Meckel diverticulum: the
Mayo Clinic experience with 1476 patients (1950-2002) // Ann.
Surg. — 2005. — Vol. 241. — P. 529-533.
15. Levy A.D., Hobbs C.A. From the archives of the AFIP: Meckel
diverticulum radiologic features with pathologic correlation //
Radiographics. — 2004. — Vol. 24. — P. 565-587.
16. Rossi P., Courtsoyiannis N., Bezzi M. et al. Meckel's diverticulum:
imaging diagnosis // AIR. — 1996. — Vol. 166. — P. 567-573.
Глава 10. Лапароскопическая резекция тонкой кишки и удаление дивертикула Меккеля 127
шша®©
Лапароскопическая
аппендэктомия
Роберто Дж. Мэнсон, Керк А. Людвиг
нет опубликованных сообщений об аппендэктомии,
проведенной с помощью этого нового неоднозначного
и даже захватывающего метода, со временем они,
несомненно, появятся [5].
Аппендэктомия — наиболее частая экстренная
абдоминальная операция, проводимая в США [6, 7];
примерно 12% мужчин и 23% женщин подвергаются
аппендэктомии в течение жизни [8].
Благодаря улучшению качества анестезии,
хирургической помощи в пред- и послеоперационном
периоде и значительному улучшению качества ранней
диагностики смертность среди пациентов с непер-
форативным аппендицитом составляет всего 0,05%,
а пациентов с перфорацией — 0,27% [9]. Несмотря
на такой прогресс, в лечении острого аппендицита все
еще присутствуют нерешенные проблемы. Раневая ин-
В 1894 г. McArthur [1] и МсВитеу [2] описали
стандартный открытый хирургический доступ для
аппендэктомии с раздвижением мышечных волокон (рис. 11-1).
Этот доступ оставался неизменным в течение почти
столетия до тех пор, пока немецкий гинеколог Kurt
Semm в 1980 г. не произвел первую лапароскопическую
аппендэктомию [3]. Когда Semm представил свое
сообщение на съезде хирургов, президент Немецкого
хирургического общества публично пригрозил его за это
повесить [4]. Многое изменилось за 25 лет, и
лапароскопия стала обычным методом лечения
аппендицита. За последние 10 лет разработаны различные новые
устройства для пересечения брыжейки, перевязки
и пересечения аппендикса. В обозримом будущем —
чреспросветная эндоскопическая хирургия с доступом
через естественные отверстия организма. Хотя пока
Основные
исследования Страна Вклад
1735 Claudius Amyand Англия Первое сообщение об аппендэктомии (через мошоночный разрез по поводу грыжи и
калового свища)
Первое описание абсцесса, прилежащего к гангренозному аппендиксу при аутопсии
Описал шесть случаев аутопсии людей с гангреной аппендикса и первым высказался о
необходимости его хирургического удаления
Первое сообщение о дренировании периаппендикулярного абсцесса
Первая аппендэктомия по поводу гангренозного аппендицита
Аппендэктомия по поводу острого воспаления (не сообщалось до 1934 г.)
Впервые использовал термин «аппендицит» и описал клинические симптомы
Удалил перфорированный аппендикс во время операции по поводу ущемленной
паховой грыжи
Произвел аппендэктомию по поводу неперфоративного аппендицита (сообщено в 1889 г.)
Первая лапароскопическая аппендэктомия (сообщил в 1982 г.)
Рис. 11-1. Основные вехи в диагностике и лечении аппендицита.
1711
1827
1848
1880
1883
1886
1886
1887
1980
Lorenz Heister
Francois Melier
Henry Hancock
Lawson Tait
Abraham Groves
Reginald Fitz
R.J. Hall
Edward R. Cutter
Kurt Semm
Германия
Франция
Англия
Англия
Канада
США
США
США
Германия
Глава 11. Лапароскопическая аппендэктомия 129
фекция встречается примерно в 5% случаев рутинной
аппендэктомии по поводу острого аппендицита [10,
11]. В 13-29% случаев острого аппендицита
отмечается перфорация червеобразного отростка, что в
основном можно объяснить поздней диагностикой.
Перфорация ведет к повышению частоты развития раневой
инфекции, формированию внутрибрюшных
абсцессов, системным септическим осложнениям и смерти.
Количество напрасных аппендэктомии (количество
пациентов, оперированных по поводу аппендицита,
у которых червеобразный отросток оказался
гистологически неизмененным) остается постоянным,
достигая, по данным разных клиник, 10-20% [11, 12].
Однако весьма вероятно, что если в отношении пациентов
с болями в животе для диагностики будут более
планомерно применять компьютерную томографию,
количество напрасных аппендэктомии в будущем
значительно снизится [7].
АНАТОМИЯ
Червеобразный отросток — узкое трубчатое
образование, которое исходит из задней поверхности слепой
кишки, места слияния тений ободочной кишки.
Обычно считается, что ширина аппендикса составляет 1 см,
а длина — примерно 10 см, хотя характерны
нормальные вариации размера и расположения аппендикса
[13]. Положение кончика аппендикса особенно
непредсказуемо. «Нормальная» его локализация — в правом
Рис. 11-2. Вариабельность расположения кончика аппендикса.
На нижней части рисунка представлен сагиттальный срез.
В скобках указана распространенность данной анатомической
локализации [14,15].
нижнем квадранте, на крестцовом мысе — отмечается
менее чем в 40% случаев (рис. 11-2) [14, 15]. Наиболее
часто аппендикс расположен сзади от слепой кишки
(ретроцекально), его можно обнаружить также в
полости таза (тазовый аппендикс) или сзади от
терминального отдела подвздошной кишки (ретроилеальный).
Относительная частота встречаемости различных
локализаций червеобразного отростка — широко
обсуждаемый вопрос.
ПАТОФИЗИОЛОГИЯ, КЛИНИЧЕСКАЯ
КАРТИНА И ДИФФЕРЕНЦИАЛЬНАЯ
ДИАГНОСТИКА
Причина острого аппендицита — обтурация
просвета, которая вызывает инфекционный процесс.
Растяжение стенок в результате обтурации просвета
червеобразного отростка каловым камнем, гиперпла-
зированными лимфатическими узлами или опухолью
приводит к стимуляции висцеральных афферентных
нервов отростка и тонкой кишки и возникновению
спастических болей, точную локализацию которых
бывает трудно определить. Боли обычно локализуются
в области пупка, и часто бывает так, что пациент
ощущает не боль в правых отделах живота, а дискомфорт.
Также на этой стадии пациента могут беспокоить ано-
рексия и тошнота.
Обтурация просвета червеобразного отростка
(так же как и других органов тела, выстланных
эпителием) в итоге приводит к застою и инфекции.
Бактерии, находящиеся в просвете отростка, проникают
в его стенку, в результате чего возникает воспаление
серозной оболочки. При контакте воспаленной
серозной оболочки червеобразного отростка с
париетальной брюшиной происходит стимуляция соматических
нервов брюшины, и ранее неспецифические боли
локализуются в правом нижнем квадранте живота. На этой
стадии пациента могут беспокоить рвота, лихорадка,
озноб или диарея.
Болезненность живота при пальпации —
необязательное условие наличия острого аппендицита.
Болезненность при аппендиците обычно определяется
в правом нижнем квадранте, может локализоваться
или не локализоваться в точке Мак-Бурнея (2/3
расстояния от пупка до передней верхней подвздошной
ости). Имеется множество специфических
клинических симптомов, характерных для острого
аппендицита (рис. 11-3), хотя ни один из них нельзя считать
таким надежным, как совокупность всех клинических
данных. Основные показатели жизнедеятельности
и данные лабораторных исследований также могут
помочь при постановке диагноза в случае подозрения
на острый аппендицит. Небольшое учащение пульса
и повышение температуры тела отмечают часто, хотя
повышение температуры выше 38,5 °С в неосложнен-
130 Лапароскопическая хирургия. Атлас
Клинические симптомы
острого аппендиц
Симптом
Боль при осторожной
перкуссии
Боль при кашле
Чувствительность при
отведении руки
Симптом Ровзинга (боль
в правом нижнем квадранте
при пальпации левого
нижнего квадранта)
Непроизвольное
напряжение мышц брюшной
стенки
Повышенная кожная
чувствительность
(повышение тактильной
чувствительности кожи
правого нижнего отдела
живота)
Псоас-симптом (усиление
боли при сгибании бедра)
Запирательный симптом
(усиление боли при ротации
согнутого бедра кнутри)
Боль при ректальном
исследовании
Механизм
Воспаление брюшины
Воспаление брюшины
Воспаление брюшины
Воспаление брюшины
Воспаление брюшины
Воспаление брюшины
Раздражение поясничной
мышцы
Раздражение внутренней
запирательной мышцы
Возможное тазовое
расположение аппендикса
Рис. 11-3. Клинические симптомы острого аппендицита.
ных случаях встречается редко. В опубликованных
данных часто подчеркивается, что хотя чуть меньше
4% пациентов с острым аппендицитом и имеют
абсолютно нормальный уровень лейкоцитов крови и
нормальную лейкоцитарную формулу [16], это не должно
препятствовать дальнейшему наблюдению или
оперативному лечению.
Обширный список заболеваний для
дифференциальной диагностики острого аппендицита представлен
ниже (рис. 11-4). На практике чаще всего приходится
проводить дифференциальную диагностику со
следующими заболеваниями: гастроэнтеритом,
воспалительными заболеваниями тазовых органов,
инфекциями мочевых путей, трубной (внематочной)
беременностью, пиелонефритом, болезненной овуляцией,
дивертикулитом, уретеролитиазом и болезнью Крона.
Поскольку острый аппендицит может симулировать
множество состояний (если в диагностике не
применяют поперечную томографию [7]), нередко во время
операции находят неизмененный аппендикс.
Окончательные, наиболее часто встречаемые диагнозы таких
пациентов представлены на рис. 11-5 [12].
Аппендэктомию можно провести с помощью
открытого или лапароскопического доступа. Преиму-
Дифференциальная диагностика
острого аппендицита
Гастроэнтерит Сахарный диабет
Воспалительные Паранефральный абсцесс
заболевания тазовых
органов
Инфекции мочевыводящих
путей
Трубная (внематочная)
беременность
Пиелонефрит
Срединные боли («m/f-
telschmerz» — боли
Перекрут большого
сальника
Гидронефроз
Yersinia enterocolitis
Псоас-абсцесс
при овуляции, разрыве
фолликулярной кисты)
Дивертикулит
Уретеролитиаз
Болезнь Крона
Острый холецистит
Рак слепой и восходящей
кишки
Дивертикул Меккеля
Перфоративная язва
12-перстной кишки
Пневмония
Остеомиелит
Брюшной тиф
Острая порфирия
Гепатит
Гематома влагалища прямой
мышцы живота
Язва слепой кишки
Обструкция кишечника
Перекрутяичника
Разрыв кисты желтого тела
Эндометриоз
Врожденная обструкция
лоханочно-мочеточникового
сегмента
Амебиаз
Малярия
Мезентериальный тромбоз
Панкреатит
Спонтанный бактериальный
перитонит
Рис. 11-4. Дифференциальная диагностика острого
аппендицита.
ществом традиционной открытой операции служит
доказанная успешность, поэтому, возможно, к ней
необходимо прибегать в случаях, когда диагноз острого
аппендицита очевиден. Приверженцы
лапароскопической аппендэктомии считают, что возможности
лапароскопии для ревизии брюшной полости выше,
чем возможности разреза Мак-Бурнея, и,
следовательно, лапароскопия наиболее полезна в случаях, когда
есть сомнения относительно точности поставленного
диагноза [17-19]. Список других потенциальных
преимуществ лапароскопического доступа представлен
на рис. 11-6. В качестве контраста на рис. 11-7
представлены преимущества традиционной
аппендэктомии. Хотя лапароскопическую аппендэктомию можно
безопасно провести при остром аппендиците [20-25],
перфоративном аппендиците [21, 23, 24], аппендиците
у беременных [26] и детей [25], ее преимущества ни-
Глава 11. Лапароскопическая аппендэктомия 131
Мужчины
Женщины
Острый холецистит (1 %)
Гастроэнтерит/другие заболевания
желудочно-кишечного тракта (6 %)
Острый аппендицит (86 %)
Инфекции мочевыводящих путей (1 %)
Неизвестно (4%)
Другие причины (2%)
Острый холецистит (1 %)
Гастроэнтерит/другие заболевания
желудочно-кишечного тракта (9 %)
Острый аппендицит (64 %)
Другие гинекологические
заболевания(5 %)
Воспалительные заболевания
тазовых органов (12%)
Инфекции мочевыводящих путей (2 %)
Неизвестно(5 %)
Другие причины (2%)
Рис. 11-5. На схеме слева — окончательный диагноз 636 мужчин, оперированных по поводу острого аппендицита. На схеме справа —
окончательный диагноз 363 женщин, оперированных по поводу острого аппендицита (из: Lewis etal. [12]).
когда не были подтверждены хотя бы одним крупным
рандомизированным клиническим исследованием.
Было проведено лишь одно исследование среди
пациентов с повышенной массой тела, которое выявило
снижение интенсивности послеоперационного
болевого синдрома и более короткое время выздоровления
после лапароскопического варианта операции [27].
К потенциальным недостаткам лапароскопического
доступа относятся более высокая цена, большая
продолжительность операции и склонность к
формированию абсцессов брюшной полости. Четкие показания
к лапароскопической или, наоборот, к традиционной
открытой аппендэктомии точно определены не были.
Авторы, однако, почти полностью перешли на
лапароскопический доступ при аппендэктомии.
ТЕХНИКА ОПЕРАЦИИ
На рис. 11-8-11-19 изображена хирургическая
техника лапароскопической аппендэктомии.
Возможные преимущества лапароскопической
аппендэктомии
Высокая диагностическая точность
Снижение числа напрасных
аппендэктомии
Превосходная визуализация брюшной
полости
Снижение необходимости
в дополнительных радиологических
исследованиях
Уменьшение диагностической задержки
Снижение числа раневых инфекций
Снижение послеоперационного
болевого синдрома
Снижение количества тяжелых
осложнений
Снижение длительности
госпитализации
Более раннее возвращение
к повседневной активности
Технически легче произвести
сопутствующую аппендэктомию во
время холецистэктомии
Снижение частоты образования спаек
в брюшной полости
Снижение стоимости лечения
У пациентов с лишней массой тела
У женщин в предменопаузе
У стариков
Рис. 11-6. Возможные преимущества лапароскопической аппендэктомии.
Возможные
преимущества
традиционной
аппендэктомии
Снижение стоимости лечения
Снижение количества абсцессов
брюшной полости
Снижение количества тяжелых
осложнений
Рис. 11-7. Возможные преимущества
традиционной аппендэктомии.
132 Лапароскопическая хирургия. Атлас
ПОДГОТОВКА
Наркозный
аппарат.
. Анестезиолог
Ассистент с камерой
(как опция)
с инструментами Операционная сестра
Рис. 11-8. Обстановка операционной для лапароскопической
аппендэктомии. После принятия решения об оперативном
вмешательстве пациенту вводят антибиотик. После общей
анестезии устанавливают назогастральный зонд и катетер
Фолея. В отличие от лапароскопической холецистэктомии,
более предпочтительным считают расположение мониторов,
указанное на данном рисунке, а не в области головного конца
стола.
Глава 11. Лапароскопическая аппендэктомия 133
Слепая кишка
Аппендикс
Подвздошная
кишка
Терминальный
отдел
подвздошной
кишки
Рис. 11-9. Пациента укладывают в 30-градусное
положение Тренделенбурга, руки фиксируют по сторонам. Доступ
в брюшную полость — инфраумбиликальный, с
использованием 12-миллиметрового троакара, с помощью закрытой
(игла Вереша) или открытой (троакар Хэссона) методики.
После инсуффляции С02до 15 мм рт.ст. через
10-миллиметровый кожух вводят 5-миллиметровый лапароскоп и проводят
ревизию брюшной полости. Обычно осматривают печень,
желчный пузырь, тонкую кишку, участки толстой кишки,
мочевой пузырь, матку и яичники. На этом этапе в правом нижнем
квадранте идентифицируют слепую кишку и червеобразный
отросток.
Рис. 11-10. Для того чтобы избежать повреждения эпигастраль-
ных сосудов, вводят 2 дополнительных троакара под
лапароскопическим контролем с транслюминацией брюшной стенки.
В левом нижнем квадранте по срединно-ключичной линии
устанавливают 5-миллиметровый троакар, такой же троакар вводят
по средней линии над лоном. Небольшие отклонения от
стандартных точек введения троакаров могут отмечаться в
соответствии с видимой локализацией аппендикса в брюшной полости.
Согласно общему принципу введения троакаров, для того чтобы
свести к минимуму перекрещивание инструментов во время
диссекции, расстояние между троакарами должно составлять
не менее пяти поперечных пальцев. Если визуализация
затруднена, можно установить дополнительный 5-миллиметровый
порт в эпигастрии или правом верхнем квадранте.
ОПЕРАЦИЯ
Аппендикс
Слепая кишка
Граспер
Брыжейка
аппендикса
«LigaSure»
Подвздошная
Граспер
«LigaSure» ^
/ Уш
/ /Я$\
1жЩ
Щь
\ 7 III
щ
и
VI' "!Ш
Рис. 11-11. При диссекции пациент находится в 30-градусном
положении Тренделенбурга с небольшим наклоном влево.
С помощью зажима, введенного через надлобковый порт,
червеобразный отросток и его брыжейку отводят кпереди
и латерально.
Рис. 11-12. Пересечение брыжейки с помощью устройства
«LigaSure» [Valleylab, Boudler, CO).
134 Лапароскопическая хирургия. Атлас
Рис. 11-13. Пятимиллиметровую камеру удаляют Рис. 11-14. Степлер «Endo GIA» {US Surgical Corp., Norwalk,
из пупочного порта и устанавливают в порт, находящийся СТ) используют для пересечения червеобразного отростка
в левом нижнем квадранте. в области его основания.
Рис. 11-15. Троакар вместе с зажимом удаляют одним Рис. 11-16. Если аппендикс крупный и рыхлый,
блоком, при этом червеобразный отросток находится внутри для его извлечения можно использовать специальный
троакара. эндоскопический контейнер («EndoCatch»; US Surgical Corp.,
Norwalk, CTj. Контейнер затягивают вокруг аппендикса после
частичного втяжения в 12-миллиметровый троакар. Затем
троакар и контейнер одновременно удаляют.
Глава 11. Лапароскопическая аппендэктомия 135
Рис. 11-18. Лапароскопическое удаление ретроцекального
аппендикса — сложная процедура, но есть сообщения
об успехе подобных операций [20]. А — на первом этапе
брюшину, окружающую аппендикс, рассекают с помощью
эндоскопических ножниц или устройства «LigaSure» {Val-
Рис. 11-17. Ретроградная аппендэктомия. Если верхушка
или тело червеобразного отростка гангренозно изменены,
а основание относительно интактное, сначала лучше
пересечь основание, а затем проводить диссекцию
брыжейки и пораженного сегмента. Этот метод, названный
«ретроградная аппендэктомия», ограничивает попадание
содержимого аппендикса в брюшную полость и облегчает
диссекцию. Ретроградную аппендэктомию можно успешно
провести лапароскопически [18,19]. Основание лигируют
и пересекают с помощью степлера «Endo GIA» (US
Surgical Corp., Norwalk, CT). Также на основание можно накинуть
эндоскопическую петлю и пересечь его острым путем.
Брыжейку аппендикса рассекают аналогичным способом,
аппендикс удаляют. В этой ситуации устройство «LigaSure» (Val-
leylab, Boudler, CO) приносит большую пользу, так как помогает
предотвратить кровотечение из аппендикулярной артерии
и снизить продолжительность операции.
leylab, Boudler, СО). Это делают с осторожностью, чтобы
не повредить восходящую ободочную кишку. Б — после
полного освобождения основания аппендикса осуществляют
ретроградную аппендэктомию, как было описано выше.
Рис. 11-19. Вместо устройства «LigaSure» (Valleylab, Boudler,
СО) можно использовать степлер. С помощью степлера,
введенного через пупочный порт, лигируют и пересекают
основание и брыжейку, в то время как зажимом удерживают
натянутой по направлению к передней брюшной стенке
брыжейку аппендикса.
136 Лапароскопическая хирургия. Атлас
РЕЗУЛЬТАТЫ
В целом лапароскопическая аппендэктомия дает
отличные результаты. Во всей исследованной группе
пациентов конверсия в открытую аппендэктомию
составила только 6%. Тяжелые осложнения и раневая
инфекция были отмечены в 3 и 1,4% случаев
соответственно. Из тяжелых осложнений наиболее часто
отмечались тазовые абсцессы, которые преобладали
при проведении лапароскопическим доступом более
трудных апендэктомий (при гангренозном и перфора-
тивном аппендиците).
Опубликованы ретроспективные обзоры [18,20-26,
28-57], ретроспективные сравнительные
исследования [58-79], проспективные нерандомизированные
[80-88], проспективные рандомизированные [37, 89-
104] исследования и метаанализы [105-108] на данную
тему. Безопасность и эффективность этой операции
четко подтверждены ретроспективными
сравнительными и нерандомизированными исследованиями.
Однако ее превосходство над открытой операцией
остается недоказанным. Некоторые проспективные
исследования показали снижение количества осложнений
[91] и частоты возникновения раневой инфекции [80,
82, 89-92], снижение болезненности и улучшение
контроля боли [89-92, 96, 102, 103, 109], более короткую
длительность госпитализации [80, 81, 83,89, 91,94,103,
109, ПО] и более быстрое возвращение к повседневной
активности [80, 81, 89, 91, 93, 94, 99, ПО, 111]. Однако
другие исследования не выявили преимуществ
лапароскопии в отношении послеоперационных
результатов [37, 79, 83]. Более того, экономия средств
благодаря снижению продолжительности госпитализации
и ускоренному выздоровлению, возможно,
нивелируется повышенными расходами на проведение
операции [64, 76, 80, 83-85, 94, 103, 109, 112].
Первые лапароскопические операции точно
копировали открытые в методике работы с брыжейкой:
аппендикулярную артерию лигировали или клипиро-
вали, брыжейку пересекали с помощью
электрокоагуляции или эндоножниц, вокруг культи аппендикса
накладывали петлю. Внедрение в последующем в
работу эндоскопического степлера позволило сэкономить
время и снизить количество послеоперационных вну-
трибрюшных абсцессов [95]. Был описан
одновременный захват степлером аппендикса вместе с брыжейкой
[ИЗ].
Недавно было введено в практику такое
технологическое новшество, как «LigaSure» (Valleylab, Boudler,
СО). Это биполярное устройство, контролируемое
по принципу обратной связи, которое эффективно
коагулирует сосуды диаметром до 7 мм с минимальным
рассеянием термальной энергии. Доказана
безопасность применения «LigaSure» при разных
хирургических операциях [114-116]. Устройство экономит
время, предотвращая кровотечение из аппендикулярной
артерии. В качестве его основного недостатка можно
назвать высокую цену, даже по сравнению с эндосте-
плером [117]. Успешно применяемые ультразвуковые
ножницы тоже имеют подобный недостаток [118].
Были опубликованы сообщения о
мини-лапароскопических аппендэктомиях (needlescopic). Однако
оказалось, что этот доступ не имеет никаких преимуществ,
кроме лучшего косметического эффекта [119,120].
В заключение следует отметить, что
лапароскопическая аппендэктомия, которую можно провести
безопасно и надежно, — важная технология в арсенале
общего хирурга. Факт, что она стала операцией выбора
во всех случаях при подозрениях на острый
аппендицит, не подтвержден данными, доступными на
сегодняшний день. Несмотря на отсутствие прочной
доказательной базы, эта техника стала
предпочтительной в подавляющем большинстве случаев. Операцию
можно провести быстро и эстетично с
использованием 12-миллиметрового пупочного порта в нижнем
отделе живота, двух 5-миллиметровых портов в
нижнем отделе живота с применением 5-миллиметрового
30-градусного лапароскопа. В неосложненных случаях
пациентов выписывают из больницы через 24-36 ч
после вмешательства и они быстро возвращаются к
повседневной активности. Использование компьютерной
томографии брюшной полости значительно снижает
количество напрасных аппендэктомий в клинике
авторов, но у пациентов с сомнительным диагнозом
лапароскопия, несомненно, обеспечивает более полный
осмотр брюшной полости, чем разрез в правом нижнем
квадранте живота. Отбросив предвзятость и базируясь
на доступных данных, можно сказать, что
лапароскопическую аппендэктомию, так же как и большинство
лапароскопических операций, необходимо проводить
выборочно, исходя из клинических проявлений,
возможностей данной клиники и опыта хирурга.
Глава 11. Лапароскопическая аппендэктомия 137
СПИСОК ЛИТЕРАТУРЫ
1. Strohl E.L., Diffenbaugh W.G. The historical background of the
gridiron or muscle-splitting incision for appendectomy // Med. J. —
1969. — Vol. 135. — P. 287-288.
2. Mc Burney C. The incision made in the abdominal wall in cases of
appendicitis, with a description of a new method of operating //
Ann. Surg. — 1894. — Vol. 20. — P. 38-43.
3. Semm K.I. Advances in pelviscopic surgery // Curr. Probl. Obstet.
Gynecol. — 1982. — Vol. 5. — P. 32-34.
4. Obituary of Kurt Semm // BMJ. — 2003. — Vol. 327. — P. 397.
5. Rattner D., Kaloo A. ASGE/SAGES Working group on natural
orifice transluminal endoscopic surgery // Surg. Endosc. — 2006. —
Vol. 20. — P. 329-333
6. Owings M.F., Kozac L.J. Ambulatory and inpatient procedures in
the United States, 1996. — Vital and Health Statistics. — N 320. —
Hyattsville: National Center for Health Statistics. — November
1998:26. — DHHS publication no. (PHS) 99-1710.
7. Paulson E.K., Kalady M.F., Pappas T.N. Suspected appendicitis //
N. Engl. J. Med. — 2003. — Vol. 348. — P. 236-242.
8. Addiss D.G., Shaffer N., Fowler B.S., Tauxe R. V. The epidemiology
of appendicitis and appendectomy in the United States // Am.
J. Epidemiol. — 1990. — Vol. 132. — P. 910-925.
9. Luckman R. Incidence and case fatality notes for acute appendicitis
in California: a population-based study of the effects of age // Am.
J. Epidemiol. — 1989. — Vol. 129 (Suppl.). — P. 905-918.
10. Berry J., Malt R. A. Appendicitis near its centenary // Ann. Surg. —
1984. — Vol. 200. — P. 567-575.
11. Pappas T.N., Gale E, Ross R.P. Appendicitis can be treated safely
with a negative appendectomy rate of 10% // Dig. Surg. — 1989. —
Vol. 6. — P. 74-77.
12. Lewis F.R., Holcroft J.W., Boey J., Dunphy J.E. Appendicitis: a
critical review of diagnosis and treatment in 1000 cases // Arch.
Surg. — 1975. — Vol. 110. — P. 677-684.
13. Kelley H.A., Hurdon E. The Vermiform Appendix and Its
Disease. — Philadelphia: Saunders, 1905.
14. Wakeley C.P. G. The position of the vermiform appendix as
ascertained by the analysis of 10,00 cases // J. Anat. — 1993. —
Vol. 67. — P. 277.
15. Maisel H. The position of the human vermiform appendix in fetal
and adult age groups // Anat. Rec. — 1960. — Vol. 136. — P. 385.
16. Sasso R.D., Hanna E.A., Moore D.L. Leukocytic and neutrophilic
counts in acute appendicitis // Am. J. Surg. — 1970. — Vol. 120. —
P. 563-566.
17. Engstrom L., Fenyo G. Appendectomy: assessment of stump
invagination versus simple ligation // Br. J. Surg. — 1985. —
Vol. 72.— P. 971-972.
18. Nowzaradan Y., Westmoreland J., Mc Carver СТ.,
Harris R.J. Laparoscopic appendectomy for acute appendicitis:
indications and current use // J. Laparoendosc. Surg. — 1991. —
Vol. 1. — P. 247-257.
19. Schultz L.S., Pietrafitta J.J., Graber J.N., Hickok D.F. Retrograde
laparoscopic appendectomy: report of a case // J. Laparoendosc.
Surg. — 1991. — Vol. 1. — P. 111-114.
20. Geis W.P., Miller C.E., Kokoszka J.S. et al. Laparoscopic
appendectomy for acute appendicitis: rationale and technical
aspects // Contemp. Surg. — 1992. — Vol. 40. — P. 13-19.
21. Klaiber C, Wagner M., Metzger A. Various stapling techniques in
laparoscopic appendectomy: 40 consecutive cases // Surg. Laparosc.
Endosc. — 1994. — Vol. 4. — P. 205-209.
22. Cox M.R., Mc Call J.L., Padbury R.T. et al. Laparoscopic surgery
in women with a clinical diagnosis of acute appendicitis // Med.
J. Aust. — 1995. — Vol. 162. — P. 130-132.
23. Valla J.S., Limonne В., Valla V. et al. Laparoscopic appendectomy in
children: report of 465 cases // Surg. Laparosc. Endosc. — 1991. —
Vol. 1. — P. 166-172.
24. el Choneimi A., Valla J.S., Limonne B. et al. Laparoscopic
appendectomy in children: report of 1379 cases // J. Pediatr.
Surg. — 1994. — Vol. 29. — P. 786-789.
25. Schreiber J.H. Results of outpatient laparoscopic appendectomy in
women // Endoscopy. — 1994. — Vol. 26. — P. 292-298.
26. Meinke A.K., Kossuth T. What is the learning curve for
laparoscopic appendectomy? // Surg. Endosc. — 1994. — Vol. 8. —
P. 371-375.
27. Enochson L., Hellberg A., Rudberg С et al. Laparoscopic vs open
appendectomy in overweight patients // Surg. Endosc. — 2001. —
Vol. 15. — P. 387-392.
28. Mohsen A. A. Endocoagulator control of the mesoappendix for
laparoscopic appendectomy// J. Laparoendosc. Surg. — 1994. —
Vol. 4. — P. 435-440.
29. Corso F.A. Laparoscopic appendectomy // Int. Surg. — 1994. —
Vol. 79. — P. 247-250.
30. Vargas H.I., Tolmos J., Klein S.R. et al. Laparoscopic appendectomy
in the 1990's // Int. Surg. — 1994. — Vol. 79. — P. 242-246.
31. Charoonratana V, Chansawang S., Maipang Т.,
Totemchokchyakarn P. Laparoscopic appendicectomy // Eur.
J. Surg. — 1993. — Vol. 159. — P. 235-237.
32. Cox M.R., Mc Call J.L., Wilson T.G. et al. Laparoscopic
appendicectomy: a prospective analysis // Aust. N. Z. J. Surg. —
1993. — Vol. 63. — P. 840-847.
33. Schiffino L., Mouro J., Karayel M. et al. Laparoscopic
appendectomy: a study of 154 consecutive cases // Int. Surg. —
1993. — Vol. 78. — P. 280-283.
34. Pier A., Gotz E, Backer C. Laparoscopic appendectomy in 625
cases: from innovation to routine // Surg. Laparosc. Endosc. —
1991.— Vol. 1. —P. 8-13.
35. Gotz E, Pier A., Bacher C. Modified laparoscopic appendectomy in
surgery // Surg. Endosc. — 1990. — Vol. 4. — P. 6-9.
36. Pier A., Gotz E, Bacher C, Ibald R. Laparoscopic appendectomy //
World J. Surg. — 1993. — Vol. 17. — P. 29-33.
37. Laparoscopic versus open appendicectomy: prospective
randomised trial // Lancet. — 1993. — Vol. 342. — P. 633-637.
38. Ludwig K.A., Cattey R.P., Henry L.G. Initial experience with
laparoscopic appendectomy // Dis. Colon Rectum. — 1993. —
Vol. 36. — P. 463-467.
39. Paul M.G., Kim D., Tylka B.L. et al. Laparoscopic surgery in a
mobile army surgical hospital deployed to the former Yugoslavia //
Surg. Laparosc. Endosc. — 1994. — Vol. 4. — P. 441-447.
40. Miller J.P. Laparoscopic appendectomy // Pediatr. Ann. — 1993. —
Vol. 22. — P. 663-667.
41. Scott-Conner C.E., Hall T.J., Anglin B.L., Muakkassa F.
Laparoscopic appendectomy: initial experience in a teaching
program // Ann. Surg. — 1992. — Vol. 215. — P. 660-668.
138 Лапароскопическая хирургия. Атлас
42. Goh P., Tekant Y., Kum C.K. et al. Technical modification to
laparoscopic appendectomy // Dis. Colon Rectum. — 1992. —
Vol. 35. — P. 999-1000.
43. Pelosi M.A., Pelosi M.A. 3d: Laparoscopic appendectomy using
a single umbilical puncture (minilaparoscopy) // J. Reprod. Med. —
1992. — Vol. 37. — P. 588-594.
44. Byrne D.S., Bell G., Morrice J.J., Orr G. Technique for laparoscopic
appendicectomy // Br. J. Surg. — 1992. — Vol. 79. — P. 574-575.
45. Richards W., Watson D., Lynch G. et al. A review of the results
of laparoscopic versus open appendectomy // Surg. Cynecol.
Obstet. — 1993. — Vol. 177. — P. 473-80.
46. Daniell J.F., Gurley L.D., Kurtz B.R., Chambers J.E The use of an
automatic stapling device for laparoscopic appendectomy // Obstet.
Cynecol. — 1991. — Vol. 78. — P. 721-723.
47. Cristalli В., Chiche R., Izard V, Levardon M. Douleurs pelviennes
de la femme: evaluation d'une technique d'appendicectomie intra-
peritoneale per-clioscopique // Ann. Chir. — 1991. — Vol. 45. —
P. 529-533.
48. O'Regan P.J. Laparoscopic appendectomy // Can. J. Surg. —
1991. — Vol. 34. — P. 256-258.
49. Bonanni P., Reed J. 3rd, Hartzell G. et al. Laparoscopic versus
conventional appendectomy // J. Am. Coll. Surg. — 1994. —
Vol. 179.— P. 273-278.
50. Saye W.B., Rives D.A., Cochran E.B. Laparoscopic appendectomy:
three years' experience // Surg. Laparosc. Endosc. — 1991. —
Vol. 1. —P. 109-115.
51. Mc Kernan J.B., Saye W.B. Laparoscopic techniques in
appendectomy with argon laser // South. Med. J. — 1990. —
Vol.83.— P. 1019-1020.
52. Schreiber J.H. Early experience with laparoscopic appendectomy in
women // Surg. Endosc. — 1987. — Vol. 1. — P. 211-216.
53. Gangal H.T., Gangal M. H: Laparoscopic appendicectomy //
Endoscopy. — 1987. — Vol. 19. — P. 127-129.
54. Naffis D. Laparoscopic appendectomy in children // Semin. Pediatr.
Surg. — 1993. — Vol. 2. — P. 174-177.
55. Jain A., Mercado P.D., Grafton K.P. et al. Outpatient laparoscopic
appendectomy // Surg. Endosc. — 1995. — Vol. 9. — P. 424-425.
56. Karim S.S., O'Regan P.J. Laparoscopic appendectomy: a review
of 95 consecutive cases of appendicitis // Can. J. Surg. — 1995. —
Vol. 38. — P. 449-453.
57. Hale D.A., Molloy M., Pearl R.H. et al. Appendectomy: a contemporary
appraisal // Ann. Surg. — 1997. — Vol. 225. — P. 252-261.
58. Neal G.E., Mc Clintic E.C., Williams J.S. Experience with
laparoscopic and open appendectomies in a surgical residency
program // Surg. Laparosc. Endosc. — 1994. — Vol. 4. — P. 272-276.
59. Nowzaradan Y., Barnes J.P., Jr., Westmoreland J.,
Hojabri M. Laparoscopic appendectomy: treatment of choice for
suspected appendicitis // Surg. Laparosc. Endosc. — 1993. —
Vol. 3. —P. 411-416.
60. Cohen M.M., Dangleis K. The cost-effectiveness of laparoscopic
appendectomy // Laparoendosc. Surg. — 1993. — Vol. 3. — P. 93-
97.
61. Schirmer B.D., Schmieg R.E., Jr, Dix J. et al. Laparoscopic
versus traditional appendectomy for suspected appendicitis //
Am.J. Surg. — 1993. — Vol. 165. — P. 670-675.
62. Lansdown M., Kraly Z., Milkins R., Royston C. Conventional versus
laparoscopic surgery for acute appendicitis // Br. J. Surg. — 1993. —
Vol. 80. — P. 1349-1350.
63. Tate J. J., Chung S.C., Dawson J. et al. Conventional versus
laparoscopic surgery for acute appendicitis // Br. J. Surg. — 1993. —
Vol. 80. — P. 761-764.
64. Schroder D.M., Lathrop J.C., Lloyd L.R. et al. Laparoscopic
appendectomy for acute appendicitis: is there really any benefit? //
Am. Surg. — 1993. — Vol. 59. — P. 541-548.
65. Fritts L.L., Orlando R. 3d. Laparoscopic appendectomy: a safety and
cost analysis // Arch. Surg. — 1993. — Vol. 128. — P. 521-525.
66. Naver L.P., Kock J. P., Bokmand S. Primary experiences with
laparoscopic appendectomy // Ugeskr. Laeger. — 1994. —
Vol. 156. — P. 3775-3777.
67. Buckley R.C., Hall T.J., Muakkassa F.E et al. Laparoscopic
appendectomy: is it worth it? // Am. Surg. — 1994. — Vol. 60. — P. 30-34.
68. Pruett В., Pruett J. Laparoscopic appendectomy: have we found a better
way? // J. Miss. State. Med. Assoc. — 1994. — Vol. 35. — P. 347-351.
69. Sosa J.L., Sleeman D., McKenney M.G. et al. A comparison of
laparoscopic and traditional appendectomy // J. Laparoendosc.
Surg. — 1993. — Vol. 3. — P. 129-131.
70. Champault G., Belhassen A., Rizk N. et al. Appendicectomie:
McBurney or laparoscopie? // J. Chir. — 1993. — Vol. 130. — P. 5-8.
71. Varlet E, Tardieu D., Limonne B. et al. Laparoscopic versus open
appendectomy in children: comparative study of 403 cases // Eur.
J. Pediatr. Surg. — 1994. — Vol. 4. — P. 333-337.
72. Desgroseilliers S., Fortin M., Lokanathan R. et al. Laparoscopic
appendectomy versus open appendectomy: retrospective
assessment of 200 patients // Can. J. Surg. — 1995. — Vol. 38. —
P. 178-182.
73. Heinzelmann M., Simmen H.P., Cummins A.S. et al. Is laparoscopic
appendectomy the new gold standard? // Arch. Surg. — 1995. —
Vol. 130. — P. 782-785.
74. Tang E., Ortega A.E., Anthone G.J. et al. Intraabdominal abscesses
following laparoscopic and open appendectomies // Surg.
Endosc. — 1996. — Vol. 10. — P. 327-328.
75. Kluiber R.M., Hartsman B. Laparoscopic appendectomy // Dis.
Colon Rectum. — 1996. — Vol. 39. — P. 1008-1011.
76. Richards K.F., Fisher K.S., Flores J.H. et al. Laparoscopic
appendectomy: comparison with open appendectomy in 720
patients // Surg. Laparos. Endosc. — 1996. — Vol. 6. — P. 205-209.
77. Panton O.N., Samson C, Segal J. et al. A four-year experience with
laparos-copy in the management of appendicitis // Am. J. Surg. —
1996. — Vol. 171. — P. 538-541.
78. Moberg A.C., Montgomery A. Appendicitis: laparoscopic versus
conventional operation // Surg. Laparosc. Endosc. — 1997. —
Vol. 7. — P. 459-463.
79. Fallahzadeh H. Should a laparoscopic appendectomy be done? //
Am. Surg. — 1998. — Vol. 64. — P. 231-233.
80. Cilchrist B.F., Lobe Т.Е., Schropp K.P. et al. Is there a role for
laparoscopic appendectomy in pediatric surgery? // J. Pediatr.
Surg. — 1992. — Vol. 27. — P. 209-214.
81. Kollias J., Harries R.H., Otto C. et al. Laparoscopic versus open
appendi-cectomy for suspected appendicitis: a prospective study //
Aust. N. Z. J. Surg. — 1994. — Vol. 64. — P. 830-835.
82. Lujan Mompean J.A., Robles Campos R., Parrilla Paricio P. et
al. Laparoscopic versus open appendicectomy: a prospective
assessment // Br. J. Surg. — 1994. — Vol. 81. — P. 133-135.
83. Reiertsen O., Trondsen E., Bakka A. et al. Prospective
nonrandomized study of conventional versus laparoscopic
appendectomy // World J. Surg. — 1994. — Vol. 18. — P. 411-416.
Глава 11. Лапароскопическая аппендэктомия 139
84. Apelgren K.N., Molnar R.G., Kisala J.M. Laparoscopic is not better
than open appendectomy // Am. Surg. — 1995. — Vol. 61. —
P. 240-243.
85. Apelgren K.N., Molnar R.G., Kisala J.M. Is laparoscopic better
than open appendectomy? // Surg. Endosc. — 1992. — Vol. 6. —
P. 298-301.
86. Bouillot J.L., Salah S., Fernandez F. et al. Laparoscopic procedure
for suspected appendicitis: a prospective study in 283 consecutive
patients // Surg. Endosc. — 1995. — Vol. 9. — P. 957-960.
87. Chao C, Tsai C.T., Wu W.C. Complete two-handed laparoscopic
appendectomy: report of 100 cases // J. Formos. Med. Assoc. —
1995. — Vol. 94. — P. 679-682.
88. Greason K.L., Rappold J.F., Liberman M.A. Incidental laparoscopic
appendectomy for acute right lower quadrant abdominal pain //
Surg. Endosc. — 1998. — Vol. 12. — P. 233-235.
89. Mc Anena O.J., Auston O., Hederman W.P. et al. Laparoscopic
versus open appendicectomy // Lancet. — 1991. — Vol. 338. —
P. 693.
90. Mc Anena O.J., Austin O., O'Connell PR. et al. Laparoscopic
versus open appendicectomy: a prospective evaluation //
Br.J. Surg. — 1992. — Vol. 79. — P. 818-820.
91. Attwood S.E., Hill A.D., Murphy P.G. et al. A prospective
randomized trial of laparoscopic versus open appendectomy //
Surgery. — 1992. — Vol. 112. — P. 497-501.
92. Kum C.K., Ngoi S.S., Goh P.M. et al. Randomized controlled trial
comparing laparoscopic and open appendicectomy // Br. J. Surg. —
1993. — Vol. 80. — P. 1599-1600.
93. Frazee R.C., Roberts J.W., Symmonds R.E. et al. A prospective
randomized trial comparing open versus laparoscopic
appendectomy// Ann. Surg. — 1994. — Vol. 219. — P. 725-731.
94. Martin L.C., Puente I., Sosa J.L. et al. Open versus laparoscopic
appendectomy: a retrospective randomized comparison // Ann.
Surg. — 1995. — Vol. 222. — P. 256-262.
95. Ortega A.E., Hunter J.G., Peters J.H. et al. A prospective,
randomized comparison of laparoscopic appendectomy with open
appendectomy. Laparoscopic Appendectomy Study Group // Am.
J. Surg. — 1995. — Vol. 169. — P. 208-212.
96. Hansen J.B., Smithers B.M., Schache D. et al. Laparoscopic
versus open appendectomy: prospective randomized trial //
World J. Surg. — 1996. — Vol. 20. — P. 17-21.
97. Mutter D., Vix M., Bui A. et al. Laparoscopy not recommended for
routine appendectomy in men: results of a prospective randomized
study// Surgery. — 1996. — Vol. 120. — P. 71-74.
98. Henle K.P., Beller S., Rechner J. et al. Laparoskopische vs
konventionelle Appendektomie: eine prospektive, randomisierte
Studie // Chirurg. — 1996. — Vol. 67. — P. 526-530.
99. Hart R., Rajgopal C, Piewes A. et al. Laparoscopic versus open
appendectomy: a prospective randomized trial of 81 patients //
Can. J. Surg. — 1996. — Vol. 39. — P. 457-462.
100. Chiarugi M., Buccianti P., Celona G. et al. Laparoscopic compared
with open appendicectomy for acute appendicitis: a prospective
study // Eur.J. Surg. — 1996. — Vol. 162. — P. 385-390.
101. Reiertsen O., Larsen S., Trondsen E. et al. Randomized controlled
trial with sequential design of laparoscopic versus open
appendicectomy // Br. J. Surg. — 1997. — Vol. 84. — P. 842-847.
102. Kazemier G., de Zeeuw G.R., Lange J.F. et al. Laparoscopic vs open
appendectomy: a randomized clinical trial // Surg. Endosc. —
1997. — Vol. 11. — P. 336-340.
103. Macarulla E., Vallet J., Abad J.M. et al. Laparoscopic versus open
appendectomy: a prospective randomized trial // Surg. Laparosc.
Endosc. — 1997. — Vol. 7. — P. 335-339.
104. Katkhouda N., Mason R.J., Towfigh S. et al. Laparoscopic versus
open appendectomy: a prospective randomized double-blind
study // Ann. J. Surg. — 2005. — Vol. 242. — P. 439-450.
105. Chung R.S., Rowland D.Y., Li P., Diaz J. A meta-analysis of
randomized controlled trials of laparoscopic versus conventional
appendectomy // Am. J. Surg. — 1999. — Vol. 177. — P. 250-256.
106. Temple L.K. F., Litwin D.E., McLeod R.S. A meta-analysis of
laparoscopic versus open appendectomy in patients suspected of
having acute appendicitis // Can. J. Surg. — 1999. — Vol. 42. —
P. 377.
107. Mc Call J.L., Sharpies K., Jadallah F. Systematic review of
randomized controlled trials comparing laparoscopic with open
appendectomy // Br.J. Surg. — 1997. — Vol. 84. — P. 1045-1050.
108. Golub R., Siddiqui F, Pohl D. Laparoscopic versus open
appendectomy: a meta-analysis // J. Am. Coll. Surg. — 1998. —
Vol. 186. — P. 545-553.
109. Vallina V.L., Velasco J.M., McCulloch C.S. Laparoscopic versus
conventional appendectomy // Ann. Surg. — 1993. — Vol. 218. —
P. 685-692.
110. Cox M.R., Mc Call J.L., Toouli J. et al. Prospective randomized
comparison of open versus laparoscopic appendectomy in men //
World J. Surg. — 1996. — Vol. 20. — P. 263-266.
111. Laine S., Rantala A., Gullichsen R. et al. Laparoscopic
appendectomy: is it worthwhile? // Surg. Endosc. — 1997. —
Vol. 11. —P. 95-97.
112. Minne L., Varner D., Burnell A. et al. Laparoscopic vs open
appendectomy: prospective randomized study of outcomes //
Arch. Surg. — 1997. — Vol. 132. — P. 708-712.
113. Olguner M., Akgiir F.M., Ucan В., Aktug T. Laparoscopic
appendectomy in children performed using single endoscopic GIA
stapler for both mesoap-pendix and base of appendix // J. Pediatr.
Surg. — 1998. — Vol. 33. — P. 1347-1349.
114. Chung Y.C., Wu H.J. Clinical experience of sutureless closed
hemorrhoidectomy with LigaSure // Dis. Colon Rectum. —
2003. — Vol. 46. — P. 87-92.
115. Lee W.J., Chen T.C., Lai I.R. et al. Randomized clinical trial of
LigaSure versus conventional surgery for extended gastric cancer
resection // Br. J. Surg. — 2003. — Vol. 90. — P. 1493-1496.
116. Romano E, Caprotti R., Franciosi С et al. Laparoscopic
splenectomy using LigaSure: preliminary experience // Surg.
Endosc. — 2002. — Vol. 16. — P. 1608-1611.
117. Yang H.R., Wang Y.C., Chung P.K et al. Laparoscopic
appendectomy using the LigaSure vessel sealing system //
Laparoendosc. Adv. Surg. Tech. A. — 2005. — Vol. 15. — P. 353-
356.
118. Martin del Olmo J.C., Blanco Alvarez J.L, Carbajo Caballero M.A.
et al. Laparoscopic appendectomy by ultrasonically activated
scalpel in acute appendicitis: a preliminary report // Laparoendosc.
Adv. Surg. Tech. A. — 2002. — Vol. 12. — P. 111-113.
119. Lau D.H., Yau K.K., Chung C.C. et al. Comparison of needlescopic
appendectomy versus conventional laparoscopic appendectomy: a
randomized controlled trial // Surg. Laparosc. Endosc. Percutan.
Tech. — 2005. — Vol. 15. — P. 75-79.
120. Chock A., Seslar S., Stoopen E. et al. Needlescopic appendectomy:
too much of a good thing? // Surg. Endosc. — 2003. — Vol. 17. —
P. 1451-1453.
140 Лапароскопическая хирургия. Атлас
iFim®©
Лапароскопическая
колэктомия
Джонатан А. Хата, Керк А. Людвиг
Появление и быстрое внедрение лапароскопической
холецистэктомии в конце 1980-х гг. стало началом
новой эры в абдоминальной хирургии и вдохновило
хирургов на внедрение лапароскопческих методик в ко-
лоректальной хирургии. Хотя лапароскопические
операции быстро и успешно стали применять при многих
заболеваниях органов брюшной полости,
лапароскопическая хирургия ободочной кишки развивалась
медленно, по большей части из-за ее сложности,
необходимости соблюдения онкологических принципов
и недостаточных доказательств ее преимуществ перед
открытыми операциями. На начальных этапах
показаниями к лапароскопической колэктомии служили
такие доброкачественные заболевания, как болезнь
Крона и дивертикулит. По мере приобретения
опыта лапароскопию стали применять при заболеваниях
всех отделов ободочной и прямой кишки, в том числе
и при злокачественных опухолях. На первых порах от-
Средняя
ободочная
артерия
Верхняя
брыжеечная
артерия
Правая
ободочная
артерия
Подвздошно-
ободочная
кишка 1
Верхняя
геморроидальная
артерия
Нижняя
брыжеечная
- Нижняя
брыжеечная
артерия
Левая ободочная
артерия
Сигмовидная
I артерия
Леватор
Наружный сфинктер
Рис. 12-1. Анатомия ободочной кишки.
веты на вопросы относительно таких исходов
онкологических процессов, как локорегионарное устранение
опухоли, частота рецидивирования опухоли и
отдаленная выживаемость, были даны после проведенных
проспективных рандомизированных контролируемых
исследований, которые показали эквивалентность
лапароскопических и открытых операций. К тому же
минимально инвазивная хирургия ободочной кишки
имела большое количество краткосрочных
преимуществ: скорейшее выздоровление, меньшая
болезненность, более короткие сроки госпитализации и лучшие
косметические результаты. В последнее время были
разработаны новые инструменты и методики,
которые позволят сделать эти операции более безопасными
и простыми в выполнении для общих хирургов.
Несомненно, что минимально инвазивная колоректальная
хирургия прочно вошла в клиническую практику.
АНАТОМИЯ
Для проведения лапароскопической резекции многие
аспекты анатомии ободочной кишки имеют значение
(рис. 12-1). Ободочная кишка включает в себя интра-
и ретроперитонеальные отделы. Подвздошные,
гонадные сосуды и правый мочеточник особенно близко
расположены к илеоцекальному переходу. Большая
часть правой половины ободочной кишки
расположена ретроперитонеально, восходящая ободочная
кишка достигает печени, прилежит к желчному пузырю,
двенадцатиперстной кишке, поджелудочной железе
и потенциально — к общему желчному протоку.
Поперечная ободочная кишка лежит на теле
поджелудочной железы и прикрепляется к желудку с помощью
желудочно-ободочной связки. Нисходящая ободочная
кишка начинается с левого изгиба ободочной кишки
(селезеночного изгиба) и проходит
ретроперитонеально, пока не переходит в сигмовидную кишку,
расположенную интраперитонеально. Особое внимание
Глава 12. Лапароскопическая колэктомия 141
необходимо уделять правому мочеточнику,
гонадным сосудам, подвздошным сосудам, которые
проходят в подвздошной ямке. Симпатические нервы идут
вдоль аорты и лежат позади нижней брыжеечной
артерии. Симпатический нервный ствол разветвляется
непосредственно над крестцовым мысом, разделяясь
на правый и левый гипогастральные нервы. Этих
нервов необходимо избегать и защищать их во время дис-
секции левых отделов ободочной и прямой кишки.
Большую часть правой половины ободочной
кишки снабжает кровью подвздошно-ободочная
артерия. Правая ободочная артерия обычно ответвляется
от подвздошно-ободочной артерии и кровоснабжает
правый отдел ободочной кишки до печеночного
изгиба [1]. Средняя ободочная артерия снабжает кровью
ободочную кишку от печеночного до селезеночного
изгиба. Артерия разветвляется, ее расположение может
быть разным. Нижняя брыжеечная артерия снабжает
кровью нисходящую, сигмовидную ободочную кишку
и проксимальный отдел прямой кишки. Все крупные
ободочные артерии связаны друг с другом
периферическими ветвями в брыжейке, формируя богатую сеть
анастомозов.
Венозные сосуды сопутствуют артериальным,
кровь от восходящей и поперечной ободочной кишки
впадает в верхнюю брыжеечную вену, а от нисходящей
и сигмовидной ободочной кишки — преимущественно
в нижнюю брыжеечную вену. Аналогично
лимфатические сосуды ободочной кишки сопутствуют крупным
артериям. Лимфатические сосуды начинаются от эпи-
ободочных лимфатических узлов, расположенных
рядом со стенкой кишки. Лимфатические узлы второго
уровня, параободочные, расположены в брыжейке
вдоль артериальных ветвей. Лимфатические узлы
третьего уровня находятся в основании брыжейки
ободочной кишки рядом с нижней или верхней
брыжеечной артерией. Последние (терминальные) узлы в
основании ободочных сосудов имеют анастомозы с параа-
ортальными лимфатическими сосудами.
ИНСТРУМЕНТЫ
Развитие новых технологий существенно
поспособствовало развитию и признанию лапароскопической
колэктомии со времени публикации предыдущего
издания этого атласа. Улучшения произошли во многих
аспектах. Снизилась необходимость в установке
крупных 10- и 12-миллиметровых портов. Что касается
возможностей видеоизображения, то в настоящее время
появились современные 5-миллиметровые
30-градусные лапароскопы с высокой разрешающей
способностью, которые увеличили возможности хирурга
максимально использовать универсальность портов и
оперировать в нескольких квадрантах живота с большей
эффективностью. В настоящее время благодаря
5-миллиметровому лапароскопу можно рассмотреть
анатомию и патологию брюшной полости из множества
ракурсов, так как его можно ввести через любой из
портов. Использование 5-миллиметровых портов снижает
травматизацию брюшной стенки и избавляет от
необходимости наложения фасциальных швов на эти
разрезы. Большим прорывом стало внедрение источников
энергии, сделавших ненужным обычное в таких
случаях использование степлеров для лигирования крупных
сосудов. Эти новые источники энергии позволяют
проводить бескровную диссекцию и рассечение брыжейки
через 5-миллиметровые порты. Высокочастотный
ультразвуковой скальпель трансформирует
высокочастотные ультразвуковые волны в механическую вибрацию
ножницеобразного лезвия. В настоящее время на
рынке доступны три модели: «Harmonic Scalpel/ UltraCision»
(Ethicon Endosurgery, Cincinnati, OH), «AutoSonix» (US
Surgical Norwalk, CT) и «SonoSurg» (Olympus Surgical,
Orangenburg, NY). Каждый из этих инструментов
можно ввести через стандартный 5-миллиметровый порт
и использовать для безопасного рассечения сосудов
диаметром до 5 мм. По сравнению с
традиционными инструментами ультразвуковые скальпели
значительно безопаснее и способны снизить длительность
операции [2, 3]. В качестве альтернативного варианта
создан контролируемый компьютером биполярный
коагулятор «LigaSure» (Valleylab, Boudler, СО), в
котором используется для склеивания тканей комбинация
механического давления, высокой силы тока и низкого
напряжения, механическое лезвие добавляет к этому
режущее действие. Этот 5-миллиметровый инстру-
мет универсален, может быть диссектором, а может
использоваться для пересечения сосудов диаметром
до 7 мм [4]. Важно, что окружающее термическое
повреждение ограничено несколькими миллиметрами,
что делает манипуляции более безопасными и
аккуратными. Хотя эти новые технологии и дороже
традиционных инструментов, было показано, что они снижают
продолжительность операции и кровопотерю, что
демонстрирует их экономическую эффективность [5-7].
КОЛЭКТОМИЯ С РУЧНОЙ АССИСТЕНЦИЕЙ
Другим крупным новшеством в лапароскопической
хирургии ободочной кишки стало применение
ручной ассистенции. Для облегчения осуществления
этих операций были созданы новые, меньшие по
размеру и более эффективные устройства. При
лапароскопии с ручной ассистенцией в брюшную полость
хирург вводит руку, которая обеспечивает
визуализацию в условиях поддержания пневмоперитонеума.
Техника обеспечивает лучшую тактильную
чувствительность и мануальный контроль в условиях
минимально инвазивной хирургии. В настоящее время
активно развивается техника лапароскопической
хирургии ободочной кишки с ручной ассистенцией [8-
10]. В ранних сообщениях были приведены хорошие
142 Лапароскопическая хирургия. Атлас
результаты при простом введении руки через
маленький разрез, когда для поддержания пневмоперитонеу-
ма использовалось запястье. В конце 1990-х гг. были
созданы разные устройства для ручной ассистенции.
В настоящее время для широкого использования
доступны 2 устройства: «GelPort» (Applied Medical, Rancho
Santa Margarita, CA) и «Lap Disc» (Ethicon Endosurgery,
Norwalk, CT). Эти устройства II поколения имеют
систему контурирования раны, служащую и в качестве
защиты раны, и самоклеющееся покрытие, которое
позволяет применить в работе руку хирурга или
лапароскопический порт. «GelPort» имеет уникальное
свойство: он позволяет вводить через самоклеющееся
устройство в брюшную полость инструменты или
лапароскопические порты рядом с рукой хирурга.
По сравнению с открытой хирургией
лапароскопическая хирургия ободочной кишки с ручной
ассистенцией позволяет получить такие же преимущества,
как и полностью лапароскопическая колэктомия:
более короткий период госпитализации, уменьшение
интенсивности болей и ускорение восстановления
функции кишечника [11]. Недавние исследования
показали, что частота интраоперационных осложнений,
длительность периода выздоровления,
онкологические исходы и стоимость лапароскопической
хирургии ободочной кишки с ручной ассистенцией не
отличаются от аналогичных показателей полностью
лапароскопической колэктомии [12-14]. Более того,
приверженцы ручной ассистенции полагают, что
лапароскопическая хирургия ободочной кишки с
ручной ассистенцией в определенных ситуациях обладает
рядом явных преимуществ перед полностью
лапароскопической колэктомией. Пациентам с ожирением,
крупными опухолями, выраженным воспалительным
процессом, которые становятся относительными кан-
дидитами для полностью лапароскопической
колэктомии, можно предложить в качестве более безопасной
альтернативы лапароскопическую операцию с
ручной ассистенцией. Операции с ручной ассистенцией
у пациентов группы высокого риска занимают
меньше времени и имеют более низкую частоту конверсии
в открытое вмешательство [15, 16]. Аналогичные
преимущества можно получить и в случае использования
техники ручной ассистенции при тотальной
абдоминальной колэктомии и проктоколэктомии [17-19].
Другое преимущество ручной ассистенции состоит
в том, что для общего хирурга за пределами
университетской клиники, менее тренированного в
лапароскопии, этот метод может оказаться более знакомым
и выполнимым. Для менее опытных лапароскопистов
операции с ручной ассистенцией — полезная опция,
которая позволяет эффективно и безопасно
проводить минимально ивазивные операции на ободочной
кишке.
Глава 12. Лапароскопическая колэктомия 143
ХИРУРГИЧЕСКИЕ МЕТОДИКИ
Лапароскопическая правосторонняя гемиколэктомия
ПОДГОТОВКА
Монитор, источник света
камера, кассетный
видеомагнитофон,
СО;-инсуффлятор
7\
Монитор,
система орошения у^
Трубка инсуффлятора'
Операционная
сестра
Электрохирургическая
система
Рис. 12-2. Пациент уложен в модифицированное
литотомическое положение с применением подставок «Dan
Allen» {Dan Allen Co., Bedford Heights, ОН). Бедра и колени
немного согнуты — таким образом, что бедра почти
параллельны полу. После создания пневмоперитонеума стол,
который находится в высоком положении Тренделенбурга,
ротируют влево. Хирург стоит между ног пациента,
оперируя в верхнем отделе живота, ассистенты стоят слева
от пациента. Вся операционная бригада фокусирует внимание
на мониторе, который находится в области правого плеча
пациента (из: Milsom и Вопт [20]).
Рис. 12-3. В области пупка с помощью стандартной открытой
техники устанавливают троакар Хэссона. Затем проводят
инсуффляцию и после создания пневмоперитонеума вводят
камеру. Брюшную полость предварительно ревизуют
для того, чтобы выявить патологию, не диагностированную
перед операцией. Затем, в зависимости от предпочтений
хирурга, устанавливают до четырех дополнительных портов:
1) 5-миллиметровый порт в левом нижнем квадранте;
2) 5-миллиметровый порт в надлобковой области;
3) 5-миллиметровый порт в правом нижнем квадранте;
4) опционный 5-миллиметровый порт в левой части средних
отделов живота для помощи при мобилизации печеночного
изгиба. Хирург использует порты в надлобковой области
и правом и левом нижних квадрантах. Дополнительные порты
применяет первый ассистент для ретракции. Полезно иметь
5-миллиметровый 30-градусный лапароскоп для оптимизации
обзора и придания гибкости оперативному вмешательству
(из: Milsom и Вопт [20]).
144 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Терминальный
отдел подвздошно
кишки
Основание
брыжейки
подвздошной
кишки
Правые
подвздошные
сосуды
Слепая кишка
Туннель под брыжейкой
правой ободочной
кишки
Гонадные
сосуды
Правый
мочеточник
Подвздошные
сосуды
Рис. 12-4. Диссекцию начинают после того, как ассистент
обеспечит ретракцию илеоцекальной области в медиальном
и краниальном направлениях вдоль основания
брыжейки подвздошной кишки. Брюшину у основания
брыжейки подвздошной кишки рассекают от слепой
кишки до нижнего края двенадцатиперстной кишки
с помощью 5-миллиметрового ультразвукового скальпеля
или электротермального биполярного устройства LigaSure
{Valleylab, Boudler, СО) (из: Milsom и Bohm [20]).
Рис. 12-5. После рассечения брюшины проводят диссекцию
тупым и острым путем в бессосудистом слое, приподнимая
правую половину ободочной и подвздошную кишку
медиально и формируя туннель под брыжейкой подвздошной
и правой половины ободочной кишки в бессосудистом
участке. После создания туннеля под мезоколоном становятся
видимыми двенадцатиперстная кишка, правый мочеточник,
гонадные сосуды и фасция Герота. По мере продолжения
диссекции краниально, по направлению к основанию
брыжейки поперечной ободочной кишки и печеночному
изгибу, в поле зрения с медиальной стороны попадают
двенадцатиперстная кишка и головка поджелудочной железы
(из: Milsom и Bohm [20]).
Подвздошно-ободочная
сосудистая ножка
Головка
поджелудочной железы
12-перстная кишка
Подвздошно-ободочная
сосудистая ножка
Верхние
брыжеечные
Л, сосуды
Рис. 12-6. На данном этапе дорсальнее, в толще
брыжейки, можно идентифицировать подвздошно-
ободочную артерию и вену и проследить эти сосуды
до места их отхождения. Для того чтобы сформировать
«окна» по обе стороны от сосудов, диссекцию начинают
на безопасном расстоянии от верхней брыжеечной
артерии и вены. Для того чтобы точно дифференцировать
подвздошно-ободочную сосудистую ножку от верхних
брыжеечных сосудов перед ее пересечением, необходимо
проследить за ее ходом дистально, в направлении слепой
кишки. Сосуды одновременно лигируют и пересекают
с помощью эндоскопического сосудистого степлера
или электротермального биполярного устройства
для коагуляции сосудов (из: Milsom и Bohm [20]).
Глава 12. Лапароскопическая колэктомия
145
Рис. 12-7. Диссекцию продолжают
до параободочного канала
от вентральной поверхности корня
брыжейки правых отделов ободочной
кишки, а затем — в медиальном
направлении, до места прохождения
под брюшиной средних ободочных
сосудов. Брюшину рассекают острым
путем, проводят мобилизацию средних
Рис. 12-8. Далее определяют проксимальную границу Рис. 12-9. На этом этапе правый отдел ободочной
резекции и пересекают брыжейку подвздошной кишки, кишки полностью отделяют от забрюшинных структур
начиная от подвздошно-ободочной ножки. Маргинальные с помощью медиальной тракции ободочной кишки, начиная
сосуды рассекают до края подвздошной кишки (из: Milsom и от слепой кишки. Необходимо пересечь только брюшину
Bohm [20]). латерального канала. После достижения печеночного изгиба
для гемостаза лучше использовать электротермальное
биполярное устройство или ультразвуковой скальпель.
Диссекцию продолжают до тех пор, пока ободочная кишка
не будет мобилизована по другую сторону от дистальной
границы резекции. Затем пупочный разрез адекватно
увеличивают (обычно достаточно 4см), после чего
ободочную кишку выводят наружу и проводят резекцию
с анастомозом в обычном порядке. При болезни Крона
с поражением илеоцекального отдела кишечника обычно
нет необходимости в резекции правого отдела ободочной
кишки. Правый отдел ободочной кишки мобилизуют ровно
настолько, чтобы можно было извлечь пораженный отдел.
При болезни Крона разрезы для портов и извлечение кишки
нельзя делать в местах потенциального выведения стом
(из: Milsom и Bohm [20]).
146 Лапароскопическая хирургия. Атлас
Правосторонняя гемиколэктомия с ручной ассистенциеи
ПОДГОТОВКА
Рис. 12-10. Пациента укладывают на спину, как было описано
при традиционной лапароскопической правосторонней
гемиколэктомии. Стол, находящийся в высоком положении
Тренделенбурга, ротируют влево. Хирург стоит слева
от пациента, левая рука хирурга находится в брюшной
полости. Ассистент стоит слева от пациента ближе
к головному концу стола и держит камеру. Операционная
бригада смотрит на монитор, расположенный справа
от пациента.
Рис. 12-11. Делают срединный разрез длиной 6-7 см,
который начинается выше пупка и заканчивается ниже него,
брюшную полость вскрывают с использованием стандартной
методики. Устанавливают устройство ручной ассистенции
(«Ge/Porf», Applied Medical, Rancho Santa Margarita, CA)
и начинают инсуффляцию через троакар Хэссона, введенный
через порт. Затем устанавливают 5-миллиметровый
30-градусный лапароскоп и ревизуют брюшную полость
на предмет ранее не выявленных патологических
изменений. Затем устанавливают два дополнительных
порта: 1) 5-миллиметровый порт под мечевидным отростком
и 2) 5-миллиметровый порт в левой части среднего отдела
живота, немного выше уровня пупка. Лапароскоп и трубки
для инсуффляции затем переставляют в подмечевидный
порт. Хирург вводит в брюшную полость левую руку через
«GelPort» и диссектор или электротермальный биполярный
коагулятор {«.LigaSure», Valleylab, Boudler, CO) — через порт,
расположенный в среднем отделе живота слева. Если
потребуется, в процессе операции можно заменить в этом
порте диссектор на эндостеплер.
Глава 12. Лапароскопическая колэктомия 147
ОПЕРАЦИЯ
[
Рис. 12-12. Диссекцию начинают с приподнимания рукой
печеночного изгиба и создания «окна» в сальниковую сумку
через сальник с помощью «LigaSure» (Valleylab, Boudler, СО).
Печеночный изгиб кишки затем полностью мобилизуют,
обнажая фасцию Герота и двенадцатиперстную кишку (А).
Рис. 12-13. Поперечную ободочную кишку захватывают
граспером и приподнимают, формируют «окно» в брыжейке.
Брыжейку берут в направлении слева направо (она может
включать средние ободочные артерии) (А). Подвздошно-
ободочные сосуды пересекают с помощью «LigaSure»
{Valleylab, Boudler, СО) или эндостеплера (Б). Образец извлекают
Брыжейка правых отделов ободочной кишки мобилизована
от забрюшинного пространства до средней линии. Затем
хирург берет рукой брыжейку подвздошной кишки
и рассекает брюшину от правого нижнего квадранта кверху,
к двенадцатиперстной кишке (Б).
через порт ручной ассистенции. Все оставшиеся связи
удаляемого препарата с брыжейкой разделяют и кишечник
пересекают, используя стандартную технику. После завершения
анастомоза кишечник возвращают в брюшную полость. Разрез
для устройства ручной ассистенции зашивают в обычном
порядке.
148 Лапароскопическая хирургия. Атлас
Лапароскопическая левосторонняя колэктомия
ПОДГОТОВКА
Рис. 12-14. Для операции на левых отделах сигмовидной
кишки пациента укладывают в модифицированное
литотомическое положение с использованием подставок
«Dan Allen» (Dan Allen Co., Bedford Heights, ОН). Бедра
и колени немного сгибают — так, что бедра становятся
почти параллельны полу. Пациента поворачивают вправо
и помещают в положение Тренделенбурга. Для мобилизации
селезеночного изгиба используют обратное положение
Тренделенбурга. Вначале хирург и второй ассистент
(с камерой) находятся справа относительно пациента,
а первый ассистент стоит слева (А). Во время мобилизации
селезеночного изгиба хирург может стоять между ног
пациента, а оба ассистента стоят справа (Б). Показаны
точки введения троакаров: 1) 10-миллиметровый пупочный
троакар; 2) два порта в области латеральной части брюшной
стенки справа, один из котроых — 12-миллиметровый —
для введения степлера при пересечении дистального
отдела ободочной кишки; 3) один или два 5-миллиметровых
порта в области брюшной стенки слева для ретракции
и мобилизации селезеночного изгиба (В) (из: Milsom и Вопт
[20]).
Глава 12. Лапароскопическая колэктомия 149
ОПЕРАЦИЯ
Рис. 12-15. Диссекцию начинают с ретракции брыжейки
сигмовидной кишки в латеральном и краниальном
направлениях, которую обеспечивает первый ассистент
с помощью двух мягких зажимов. Брюшину рассекают
сразу же справа от верхней брыжеечной артерии на уровне
крестцового мыса. Разрез продолжают краниально
в направлении места отхождения нижней брыжеечной
артерии. Для смещения нижних брыжеечных сосудов
вентрально и идентификации левого мочеточника
и гонадных сосудов, которые остаются сзади, используют
диссекцию тупым и острым путем. Диссекцию продолжают
в направлении от середины к периферии в слое между
мезоколоном и забрюшинным пространством (из: Milsom и
Bohm [20]).
Рис. 12-17. Легкая каудальная и медиальная ретракция
с помощью зажима Бэбкока и мягкого зажима способствует
диссекции латеральных связей левой половины ободочной
кишки (из: Milsom и Bohm [20]).
Рис. 12-16. После обнаружения места отхождения
нижней брыжеечной артерии брюшину рассекают
над сосудистой ножкой и слева от нее, по направлению
к нижней брыжеечной вене, которая обычно проходит
рядом с восходящей ветвью левой ободочной артерии.
Латеральнее нижней брыжеечной артерии формируют «окно»
в брюшине. Нижнюю брыжеечную артерию пересекают
с помощью сосудистого степлера или устройства «LigaSure»
{Valleylab, Boudler, СО) с осторожностью, чтобы не повредить
мочеточник. Оставляют культю сосудистой ножки длиной
примерно 1-1,5 см, чтобы в случае необходимости наложить
дополнительную лигатуру (из: Milsom и Bohm [20]).
Рис. 12-18. Далее внимание сосредоточивают на брыжейке
сигмовидной кишки или проксимальной границе резекции.
Применяя принцип треугольника, брыжейку ободочной
кишки пересекают вплоть до края ободочной кишки.
Сосуды обрабатывают с помощью ультразвуковых ножниц
или электротермального биполярного устройства.
150 Лапароскопическая хирургия. Атлас
Рис. 12-19. Затем мобилизуют селезеночный изгиб.
Ассистент обеспечивает тракцию в каудальном направлении
с помощью инструментов, введенных через правосторонние
порты. Если нужно, хирург становится между ног пациента
и работает с помощью портов над лобком и в нижнем левом
квадранте. Для диссекции нисходящей ободочной кишки
от фасции Герота используют ультразвуковые ножницы
или электротермальное биполярное устройство. Слой
диссекции расположен близко к ободочной кишке, и хирург
должен продолжать диссекцию в медиальном направлении
(из: Milsom и Bohm [20]).
(Л) Латеральный сегмент печени
Рис. 12-20. Продолжая каудальную и медиальную ретракцию
ободочной кишки, рассекают ткани, связывающие ободочную
кишку с латеральной стороны. В области селезеночного
изгиба необходимо осторожно отделить большой
сальник от ободочной кишки для того, чтобы обеспечить
адекватную мобилизацию изгиба. После попадания в поле
зрения селезеночного изгиба и поперечной ободочной
кишки хирург может предпочесть работу с помощью
портов в левом верхнем и нижнем квадрантах. Диссекцию
необходимо продолжить вправо настолько, чтобы
нисходящая ободочная кишка могла достичь полости таза.
Дополнительно удлинить нисходящую ободочную кишку
с дистальным отделом поперечной ободочной кишки
можно с помощью пересечения нижней брыжеечной вены
вдоль двенадцатиперстной кишки в области нижнего
края поджелудочной железы. Можно использовать
эндоскопический сосудистый степлер или электротермальное
биполярное устройство (из: Milsom и Bohm [20]).
Рис. 12-21.Теперь мобилизуют прямую кишку по мере
возможности по направлению к дну полости таза,
начиная с мобилизации в заднем направлении сразу же
под собственной фасцией брыжейки прямой кишки. Таким
маневром защищают симпатические нервные стволы. Если
мобилизация ведется в правильном слое, кровотечения быть
не должно. Переднюю диссекцию проводят до уровня ниже
переднего кармана брюшины, насколько это необходимо
(из: Milsom и Bohm [20]).
Глава 12. Лапароскопическая колэктомия 151
Рис. 12-23. После освобождения от брыжейки дистальной
линии резекции прямую кишку пересекают с помощью гибкого
эндоскопического степлера на достаточном расстоянии
от удаляемого участка. Затем соответственно расширяют
разрез для порта в области пупка или нижнем отделе
живота (обычно достаточно 4см), устанавливают устройство
для защиты раны. Препарат и мобилизованный проксимальный
отдел ободочной кишки затем выводят из брюшной полости
наружу, а проксимальный участок кишки пересекают. После
отсечения ряда скобок с проксимального участка кишки
на него накладывают кисетный шов. Далее в просвет кишки
вводят головку циркулярного 31- или 28-миллиметрового
степлера и закрепляют его. После этого кишку возвращают
в брюшную полость, а устройство для защиты раны фиксируют
таким образом, чтобы сделать рану воздухонепроницаемой.
Затем снова проводят инсуффляцию и вводят в анус
циркулярный степлер. Аппарат переводят в открытое
состояние, его острие проходит через линию скобок линейного
степлера или непосредственно рядом с ней. Для подтягивания
острия в брюшной полости используют граспер (из: Milsom и
Bohm [20]).
Рис. 12-22. Затем мезоректум отделяют от прямой кишки
с помощью диссекции тупым путем и электродиссекции.
Мезоректум содержит только два крупных сосуда (верхние
геморроидальные), которые требуют особого внимания.
Эти сосуды проходят сзади и медиальнее через мезоректум.
Их можно пересечь с помощью эндоскопического степлера
или электротермального биполярного устройства (из: Milsom
и Bohm [20]).
Рис. 12-24. Для формирования колоректального анастомоза
используют стандартную технику с двойным рядом скобок.
Зажимом Бэбкока центральный стержень головки вставляют
в центральную стойку степлера, введенного трансанально.
Затем степлер закрывают и прошивают по стандартной
методике. Полость таза наполняют физраствором, через
прямую кишку с помощью ректоскопа вводят воздух,
чтобы убедиться в герметичности анастомоза. В качестве
альтернативного варианта (если кишка была достаточно
мобилизована интракорпорально) препарат можно
полностью вывести наружу без интракорпорального
пересечения дистального конца кишки, и тогда резекцию
и формирование анастомоза осуществляют по стандартной
методике (из: Milsom и Bohm [20]).
152 Лапароскопическая хирургия. Атлас
Левосторонняя гемиколэктомия с ручной ассистенциеи
ПОДГОТОВКА
Монитор
Рис. 12-25. Пациента укладывают в положение на спине
или модифицированное литотомическое положение, как было
описано выше для традиционной лапароскопической
левосторонней гемиколэктомии. Стол, находящийся в низком
положении Тренделенбурга, ротируют вправо. Хирург стоит
справа относительно пациента, его левая рука находится
в брюшной полости. Ассистент (с камерой) стоит ниже
хирурга, справа относительно пациента или между ног
пациента. Бригада смотрит на монитор, расположенный слева
относительно пациента.
Рис. 12-26. Делают срединный разрез длиной 6-7 см,
который начинается выше пупка и заканчивается ниже
него, брюшную полость вскрывают с использованием
стандартной методики. Устанавливают устройство ручной
ассистенции («Ge/Po/t», Applied Medical, Rancho Santa
Margarita, CA) и начинают инсуффляцию через тупой троакар
Хэссона, введенный через порт. Затем устанавливают
5-миллиметровый 30-градусный лапароскоп и ревизуют
брюшную полость на предмет не выявленных ранее
патологических изменений. После этого устанавливают
два дополнительных порта: 1) 5-миллиметровый порт
в надлобковой области и 2) 5-миллиметровый порт
в правой части среднего отдела живота, немного ниже
уровня пупка. Лапароскоп и трубки для инсуффляции
затем переставляют в надлобковый порт. Хирург вводит
в брюшную полость левую руку через «GelPort», а диссектор
или электротермальный биполярный коагулятор {«LigaSure»,
Valleylab, Boudler, CO) — через порт, расположенный в нижнем
правом квадранте живота. Коагулятор в этом порте можно
заменить эндостеплером, если потребуется в процессе
операции. Для ассистенции при мобилизации селезеночного
изгиба в левом нижнем квадранте можно установить
дополнительный 5-миллиметровый порт.
Глава 12. Лапароскопическая колэктомия 153
ОПЕРАЦИЯ
Д Селезеночный изгиб 1
Поперечно-ободочная 1
кишка с брыжейкой
1
* Поджелудочная железа
Г*™
Дфасция Герота и левая почка Щ
Рис. 12-27. Диссекцию начинают с захвата сигмовидной
кишки и ее медиальной тракции. Мобилизуют левую половину
ободочной кишки вдоль линии ее латерального прикрепления
к париетальной брюшине. Брыжейку нисходящей ободочной
кишки мобилизуют от фасции Герота до нижнего края
поджелудочной железы. Селезеночный изгиб мобилизуют,
рассекая сальник и входя в сальниковую сумку (А). Если
пациент крупный или когда визуализация затруднена, хирург
становится между ног пациента и использует в качестве
рабочего порт в левом нижнем квадранте. Селезеночный изгиб
затем мобилизуют вдоль нижнего края поджелудочной железы
у основания брыжейки поперечной ободочной кишки (Б).
Щ Брыжейка прямой кишки Щ
V
•;**?-' <*'
Щ5-мм «Liqasure>m
.
# * - #
Я
■ Сигмовидная ■
кишка
Рис. 12-28. Снова работая справа относительно пациента,
сигмовидную кишку приподнимают кпереди и латерально,
чтобы обнажить нижнюю брыжеечную артерию.
После рассечения брюшины, покрывающей нижнюю
брыжеечную артерию, последнюю лигируют проксимальнее
или дистальнее левой ободочной артерии с помощью
эндостеплера или устройства «LigaSure» {Valleylab, Boudler,
СО). Для дальнейшей мобилизации проксимального отдела
ободочной кишки можно лигировать нижнюю брыжеечную
вену вдоль нижнего края поджелудочной железы.
Рис. 12-29. Как было описано выше, для лапароскопической
левосторонней колэктомии сигмовидную кишку подтягивают
из полости таза. Рассекают брюшину по обе стороны
брыжейки прямой кишки (А). Для перечения дистального
участка ободочной кишки используют ретикулярный
эндостеплер (Б). Участок проксимальной ободочной кишки,
подлежащий удалению, выводят наружу из брюшной
полости, мобилизацию брыжейки завершают, пересекают
проксимальный участок кишки. Устанавливают головку
циркулярного степлера и завершают интракорпоральный
анастомоз, как это было описано ранее. Проводят проверку
герметичности анастомоза, зашивают отверстие для ручной
ассистенции по стандартной методике.
154 Лапароскопическая хирургия. Атлас
Папароскопическая брюшинно-промежностная
Подготовка
вкладка пациента, расположение хирургической
бригады и точек введения троакаров соответствуют тако-
зым для лапароскопической левосторонней колэкто-
У1ии, описание которой представлено выше (см. рис.
L2-14). Троакар в левом нижнем квадранте
необходимо установить в зоне планируемого выведения стомы.
Перед началом диссекциии прямой кишки
видеомониторы сдвигают к коленям пациента.
Операция
Начальная диссекция не отличается от первых
этапов проведения лапароскопической левосторонней
экстирпация прямой кишки
гемиколэктомии (см. рис. 12-15-12-18). Нижнюю
брыжеечную артерию пересекают с помощью степле-
ра или устройства «LigaSure», брыжейку ободочной
кишки мобилизуют в направлении от центра к
латеральной поверхности, рассекают. Также с помощью
линейного степлера пересекают левый отдел
ободочной кишки. Диссекцию прямой кишки продолжают
книзу, в сторону полости таза в бессосудистом слое,
который находится снаружи от собственной фасции
мезоректум.
ОПЕРАЦИЯ
Мезоректум
Собственная фасция
брыжейки прямой
кишки
Гонадные
сосуды
) Мочеточник
Симпатические нервы
Линия скобок
на нижней брыжеечной
артерии
Рис. 12-30. Прямую кишку полностью мобилизуют до дна
полости таза, начиная от ее задней поверхности. В процессе
диссекции прямой кишки из полости таза ассистент, который
находится слева относительно пациента, с силой подтягивает
кишку вправо, влево и кпереди. На этом этапе операции
хорошая тракция играет ключевую роль. Для мобилизации
передней поверхности ассистент с силой тянет прямую
кишку книзу. Диссекция в правильном слое практически
бескровна. Большинству пациентов не требуется наложения
клипс или скобок, так как средние геморроидальные сосуды
проходят вдоль мышц тазового дна, а не в латеральной
связке.
При заболевании доброкачественной природы диссекцию
проводят вблизи от стенки прямой кишки. В случае
злокачественной опухоли диссекцию необходимо проводить
кпереди от фасции Денонвилье. В этом случае четко
визуализируются простата и семенные пузырьки. Диссекцию
сверху завершают, когда прямая кишка уже мобилизована
ниже верхушки копчика сзади и латерально. Передняя
диссекция заканчивается сразу ниже уровня семенных
пузырьков у мужчин и далеко внутри ректовагинальной
перегородки у женщин (из: Milsom и Bohm [20]).
Глава 12. Лапароскопическая колэктомия 155
РЕЗУЛЬТАТЫ
За последнее десятилетие была доказана возможность
выполнения лапароскопической резекции ободочной
кишки в случае, если ее проводит опытный хирург.
К преимуществам минимально инвазивной резекции
ободочной кишки относятся лучшие косметические
эффекты, меньший болевой синдром, более быстрое
восстановление перистальтики кишечника, короткий
период госпитализации и более быстрое
возвращение к обычной активности. Вследствие сомнений
относительно онкологических исходов, которые имелись
на раннем этапе освоения методики, большинство
хирургов соответственно начинают приобретать опыт
в лапароскопической колэктомии с
доброкачественных состояний. Однако результаты недавно
проведенных проспективных рандомизированных
исследований показали, что онкологические исходы
лапароскопических резекций эквивалентны таковым при
выполнении открытых резекций. Эти данные имели большое
значение и сняли некоторые последние препятствия
к широкому распространению минимально инвазив-
ных технологий в лечении заболеваний ободочной
кишки [21].
В целом показания к лапароскопическим
операциям при доброкачественных заболеваниях ободочной
кишки не отличаются от показаний к традиционным
операциям. Лапароскопическая резекция показана
при дивертикулите, воспалительных заболеваниях
кишечника и пролапсе прямой кишки. Плановая
резекция при хроническом дивертикулезе часто идеально
подходит для лапароскопии [22]. Несмотря на
отсутствие рандомизированных исследований,
нерандомизированные исследования четко описали
преимущества лапароскопической резекции сигмовидной кишки
при неосложненном дивертикулезе. К этим
преимуществам относят уменьшение частоты развития раневых
инфекций, образования свищей, легочных осложне-
Рис. 12-31. Для того чтобы оценить диссекцию, проведенную
сверху, хирург может вставить палец в перчатке в анус
(или во влагалище у женщин). После полной мобилизации
прямой кишки начинают промежностный этап операции.
Из брюшной полости выпускают углекислый газ и проводят
промежностное иссечение ануса и прямой кишки
по стандартной методике. Затем через порт в области
будущей колостомы вводят эндоскопический зажим, которым
захватывают дистальный конец нисходящей ободочной
кишки и подтягивают его к передней брюшной стенке. Далее
проводят колостомию. Для этого вытаскивают троакар,
расширяют пальцем отверстие в фасции и подтягивают
конец кишки до уровня кожи. Для того чтобы убедиться
в том, что нисходящая кишка не перекручена, ее необходимо
осмотреть с помощью лапароскопа. Полость таза затем
орошают, при этом головной конец стола приподнимают.
В полость таза устанавливают силиконовый дренаж.
Промежностную рану зашивают, колостому формируют
по стандартной методике (из: Milsom и Bohm [20]).
ний и продолжительности госпитализации [23-26].
Для проведения операции по поводу дивертикулеза
необходимо точное знание анатомии, чтобы
идентифицировать и защитить от повреждения жизненно
важные тазовые структуры, так как воспаление,
связанное с этой патологией, может затруднять диссекцию.
Это особенно справедливо в условиях осложненного
дивертикулита, когда лапароскопическая резекция
кишечника сопровождается повышенной частотой
осложнений и высокой частотой конверсии [27].
Проведение лапароскопической операции возможно
и при воспалительных заболеваниях кишечника, если
пациент находится в стабильном состоянии. В
большинстве случаев представляется возможным
адекватно защитить жизненно важные структуры, но такие
последствия воспалительного процесса, как абсцессы,
фистулы и значительные нарушения анатомии, могут
потребовать конверсии в открытую операцию. При
болезни Крона можно применить множество минимально
инвазивных методов, включая диагностическую
лапароскопию, операции по отведению каловых масс и
резекции кишечника [28]. Многочисленные наблюдения,
2 рандомизированных контролируемых исследования
[29, 30] и недавно проведенный метаанализ [31],
сравнивавший лапароскопические и открытые подвздошно-
ободочные резекции, показали следующие
преимущества лапароскопического доступа в ранних результатах,
традиционных для минимально инвазивных операций:
низкую частоту послеоперационных осложнений, более
короткий период госпитализации и лучшую функцию
легких. Однако потенциальные отдаленные
преимущества, например снижение образования спаек, частоты
кишечной непроходимости, грыжеобразования и
хронического болевого синдрома, все еще не изучены в
проспективных исследованиях [32].
Лапароскопическая хирургия при язвенном колите
развивалась медленнее, что было связано с технической
156 Лапароскопическая хирургия. Атлас
сложностью таких операций, как субтотальная кол-
эктомия, тотальная проктоколэктомия и
реконструктивная проктоколэктомия [33]. Даже в руках экспертов
в минимально инвазивной колоректальной хирургии
лапароскопические реконструктивные проктоколэкто-
мии занимают больше времени, хотя имеют отдельные
преимущества в длительности послеоперационной
госпитализации и косметических эффектах и
эквивалентные функциональные достижения по сравнению
с открытыми операциями [34-36].
Минимально инвазивную хирургию применяют
и при других доброкачественных заболеваниях
ободочной кишки (например, при пролапсе прямой
кишки). Лапароскопия имеет отличные функциональные
результаты как при колоректальной резекции, так
и при ректопексии и операции Уэллса (Wells) [37].
Рандомизированное исследование, которое сравнивало
лапароскопическую и абдоминальную ректопексию,
показало уменьшение интенсивности болевого синдрома
и частоты послеоперационных осложнений, снижение
потребности в наркотиках и более низкие показатели
маркеров стрессового иммунного ответа в
лапароскопической группе [38]. Важно отметить, что
функциональный исход и частота рецидивов через 5 лет после
операции были эквивалентны в обеих группах [39].
После первого опыта, полученного при проведении
операций на доброкачественных заболеваниях
ободочной и прямой кишки, неизбежным стало
применение лапароскопии при лечении колоректального рака.
Сразу же был поднят вопрос о соответствии
лапароскопического доступа классическим онкологическим
принципам. Закономерность подобных вопросов была
подтверждена данными ранних серий
лапароскопической колэктомии о рецидивных опухолях в местах
введения троакаров в 6% случаев [40]. Данные сообщения
привели к тому, что Американское общество колорек-
тальных хирургов в 1992 г. ввело негласный мораторий
на лапароскопическую колэктомию по поводу рака вне
проспективных исследований [41]. В течение
последующих 10 лет было проведено большое количество
проспективных рандомизированныхх исследований,
моноцентровых [42-50] и мультицентровых [51-54],
результаты которых привели ученых к тому, что
период сомнений был забыт, и лапароскопическая
хирургия колоректального рака у тщательно отобранных
пациентов в руках опытных хирургов стала безопасной
и эффективной. Эти исследования и последующий ме-
таанализ [55-57], кроме того, показали, что
лапароскопические операции по сравнению с открытыми имеют
важные преимущества, касающиеся раннего
послеоперационного периода.
Задачи лапароскопической колэктомии,
проводимой по поводу рака, не отличаются от таковых при
открытой операции. Онкологические принципы требуют
широкой резекции, адекватного удаления лимфоид-
ной ткани и избегания контаминации опухолевыми
клетками. Благодаря тому что локализацию опухоли
определяют перед операцией, с помощью
лапароскопической техники представляется возможным
провести адекватную резекцию. В исследовании
«Клинические результаты хирургического лечения» (COST)
для лапароскопической или открытой колэктомии
по поводу рака были рандомизированы 872 пациента.
Оказалось, что край резекции менее 5 см от опухоли
отмечался только в 5% лапароскопических и 6%
открытых колэктомии [52]. Кроме того, исследование
Европейской группы по лапароскопической и открытой
резекции по поводу рака ободочной кишки (COLOR)
выявило равную частоту положительных краев
резекции (2%) при лапароскопическом и открытом доступе
[54]. В то же время исследование Медицинского
исследовательского совета Великобритании по обычной
и лапароскопически-ассистированной хирургии
колоректального рака (MRC CLASICC) показало
эквивалентную частоту положительных круговых краев
резекции при лапароскопической и открытой резекции
(7 и 5% соответственно) [53]. Адекватная лимфодис-
секция важна для получения адекватных
онкологических исходов. Ей способствует проксимальная
перевязка брыжеечных сосудов [58]. В исследовании COST
среднее количество удаленных лимфатических узлов
составляло 12 в обеих группах [52].
Аналогичным образом два последних метаанализа
рандомизированных исследований, в которых
специально документированы параметры резекции с
лимфатическими узлами, не показали значимых различий
между лапароскопией и открытыми методами [55, 56].
Ранние сообщения о метастазах в места
лапароскопических портов были основным фактором,
ограничивающим восприятие лапароскопической колэктомии
по поводу рака как альтернативного варианта
вмешательства. Первые сообщения об этом осложнении
были анекдотическими и несли мало объективной
информации [40]. Хотя точный механизм возникновения
этих рецидивов рака неизвестен, к способствующим
фактором относят травму брюшной стенки при
введении троакара и имплантацию опухолевых клеток
в процессе операции. В ходе последующих
исследований было выявлено, что метастазы в местах
лапароскопических портов отмечаются не чаще, чем импланта-
ционные метастазы в рану после открытой операции
[59]. Lacy et al. [47] сообщили только об одном
метастазе в место лапароскопического порта в проспективной
рандомизированной серии из 106 лапароскопических
резекций, a Jacob et al. [60] — об отсутствии
рецидивов у 129 пациентов при среднем сроке наблюдения
61 мес. В исследовании COST общее количество
метастазов в послеоперационную рану было одинаковым
в лапароскопической (0,5%) и открытой (0,2%) группах
при средней длительности наблюдения 4,4 года [52].
Глава 12. Лапароскопическая колэктомия 157
Для профилактики развития метастазов в
послеоперационную рану при лапароскопической колэктомии
необходимо соблюдать следующие четкие принципы:
• фиксацию троакаров;
• минимальные манипуляции с пораженным
сегментом кишки;
• защиту брюшной полости от обсеменения из
просвета кишки во время операции (окклюзию
проксимального и дистального концов кишечного
сегмента, если его пересекают интракорпорально);
• изоляцию удаленного образца перед извлечением
в эндоскопическом контейнере;
• применение устройства для защиты раны, через
которую извлекают препарат;
• орошение мест портов цитотоксическими
препаратами (например, повидон-йодом) [61].
Лапароскопическая резекция ободочной кишки,
проведенная в соответствии с указанными выше
онкологическими принципами, обеспечивает сходные
периоперативные морбидность и смертность и
отдаленные результаты в сравнении с обычной операцией.
Подавляющее большинство ранних сравнительных
исследований подтвердили эквивалентную частоту
рецидивов и показателей выживаемости после
лапароскопических и открытых резекций, включая знаковое
моноцентровое рандомизироваанное исследование,
проведенное Lacy et al. в 2002 г. [47]. Однако только
после того как исследование COST показало
статистически эквивалентные частоту осложнений, перио-
перативную смертность и 3-летнюю выживаемость
при лапароскопически-ассистированной (86%) и
открытой (85%) колэктомии [52], минимально инвазив-
ная хирургия при раке ободочной кишки получила
широкое распространение. Последующая публикация
данных многоцентровых исследований COLOR [54]
и MRC CLASICC [53] в Европе поддержала полученные
ранее данные о ранних результатах с использованием
лапароскопического доступа, хотя отдаленные
результаты этих исследований еще недоступны.
Аналогично другим минимально инвазивным
процедурам лапароскопическая хирургия ободочной
кишки предлагает большое количество преимуществ в
раннем послеоперационном периоде, включая снижение
кровопотери, послеоперационного болевого синдрома,
раннее возвращение функции кишечника и
физической активности и более короткую продолжительность
госпитализации. Метаанализ, недавно проведенный
Tilney et al. [57], показал, что кровопотеря при
лапароскопической колэктомии снижена примерно до 60 мл,
в то время как в схожем исследовании Abraham et al.
[55] лапароскопическая резекция сопровождалась
снижением частоты развития раневой инфекции. В этих
и других исследованиях лапароскопическая колэктомия
сопровождалась, помимо всего прочего, более
коротким периодом потребности в наркотических средствах
и ранним восстановлением функции кишечника (все
показатели отличались примерно на 1 день) [52, 54, 55].
Перечисленные кратковременные преимущества
ведут к снижению продолжительности госпитализации
на 1-3 дня [52, 54-57]. Эти данные были далее
поддержаны и суммированы в недавно опубликованном ме-
таанализе Cochrane Collaboration, проведенном Schenk et
al. [56], который включал данные 25
рандомизированных исследований. Кроме того, нужно отметить, что
небольшие разрезы, улучшавшие косметический эффект
при использовании малоинвазивной хирургии, были
весьма востребованы самими пациентами. Собранные
вместе, все эти преимущества могут привести к
улучшению качества жизни в периоперационном периоде
лапароскопических операций на ободочной кишке [51].
Однако потенциальные преимущества минимально
инвазивной хирургии ободочной кишки имеют свою
цену. Так, продолжительность операции при
лапароскопической колэктомии на 33% выше, что приводит
к повышению стоимости [52, 55-57]. Это особенно
заметно в ситуациях, потребовавших конверсии в
открытую операцию (до 29% в некоторых сериях), что может
привести к увеличению количества ранних
осложнений [62, 63]. Прямые затраты системы
здравоохранения на проведение лапароскопической колэктомии
явно выше, чем на эквивалентную открытую операцию
[46, 64, 65]. При промежуточном анализе данных
исследования COLOR Janson et al. [65] обнаружили, что,
если брать в расчет снижение потери продуктивности
(то есть раннее возвращение к работе) в
лапароскопической группе, значительных различий в общей
стоимости лечения не отмечалось. Для уточнения этих
данных необходим анализ отдаленного периода
наблюдения в рамках рандомизированных исследований.
ЗАКЛЮЧЕНИЕ
В течение последних 10 лет лапароскопические
операции в лечении доброкачественных и
злокачественных заболеваний ободочной кишки как альтернатива
открытой хирургии широко распространились в
хирургическом сообществе. Сопротивление этому
новому подходу с технической и онкологической точки
зрения постепенно исчезло после внедрения
улучшенных инструментов и опубликования результатов
рандомизированных исследований. Однако это новое
направление в хирургии ободочной кишки подняло
дополнительные вопросы: какую новую технологию
необходимо развивать для дальнейшего продвижения
вперед в этой области? Какие операции лучше
проводить таким доступом? Кто должен проводить эти
операции и как новое поколение общих и колоректальных
хирургов будет обучаться этим новым операциям?
Как подчеркнули Pappas et al. [21] в 2004 г., количество
лапароскопических резекций ободочной кишки значи-
158 Лапароскопическая хирургия. Атлас
тельно вырастет в течение следующих 10 лет. Для того
чтобы это свершилось, необходимо адаптировать
программы тренинга резидентов и саму колоректальную
СПИСОК ЛИТЕРАТУРЫ
1. Garcia-Ruiz, Milsom J.W., Ludwig K.A. et al. Right colonic arterial
anatomy // Dis. Colon Rectum. — 1996. — Vol. 39. — P. 906-911.
2. Msika S., Deroide G., Kianmanesh R. et al. Harmonic scalpel in
laparoscopic colorectal surgery // Dis. Colon. Rectum. — 2001. —
Vol. 44. — P. 432-436.
3. Morino M., Rimonda R., Allaix M.E. et al. Ultrasonic versus
standard electric dissection in laparoscopic colorectal surgery:
a prospective randomized clinical trial // Ann. Surg. — 2005. —
Vol. 242. — P. 897-901.
4. Heniford B.T., Matthews B.D., Sing R.R et al. Initial results with
an electrothermal bipolar vessel sealer // Surg. Endosc. — 2001. —
Vol. 15. — P. 799-801.
5. Takada M., Ichihara Т., Kuroda Y. Comparative study of
electrothermal bipolar vessel sealer and ultrasonic coagulating
shears in laparoscopic colectomy // Surg. Endosc. — 2005. —
Vol. 19. — P. 226-228.
6. Taragona E.M., Balague C, Marin J. et al. Energy sources for
laparoscopic colectomy: a prospective randomized comparison
of conventional electro-surgery, bipolar computer-controlled
electrosurgery and ultrasonic dissection // Surg. Innov. — 2005. —
Vol. 12. — P. 339-344.
7. Marcello P.W., Roberts PL., Rusin L.C. et al. Vascular pedicle
ligation technique during laparoscopic colectomy // Surg.
Endosc. — 2006. — Vol. 20. — P. 263-269.
ff. Ballantyne G.H., Leahy RE Hand-assisted laparoscopic colectomy:
evolution to a clinically useful technique // Dis. Colon. Rectum. —
2004. — Vol. 47. — P. 753-765.
9. Darzi A. Hand-assisted laparoscopic colorectal surgery // Semin.
Laparosc. Surg. — 2001. — Vol. 8. — P. 153-160.
10. Targarona E.M., Gracia E., Rodriguez M. et al. Hand-assisted
laparoscopic surgery // Arch. Surg. — 2003. — Vol. 138. — P. 133-
141.
11. Rang J.C, Chung M.H., Chao PC. et al. Hand-assisted laparoscopic
colectomy vs open colectomy // Surg. Endosc. — 2004. —
Vol. 18. — P. 577-581.
12. Schadde E., Smith D., Alkorashi A.S. et al. Hand-assisted
laparoscopic colorectal surgery (HALS) at a community hospital //
Surg. Endosc. — 2006. — Vol. 20. — P. 1077-1082.
13. Chang Y.J., Marcello P.W., Rusin L.C. et al. Hand-assisted
laparoscopic sigmoid colectomy: helping hand or hindrance? //
Surg. Endosc. — 2005. — Vol. 19. — P. 656-661.
14. Lee S.W., Yoo J., Dujovny N. et al. Laparoscopic vs. hand-assisted
laparoscopic sigmoidectomy for diverticulitis // Dis. Colon.
Rectum. — 2006. — Vol. 49. — P. 464-69.
15. Targarona E.M., Gracia E., Garriga J. et al. Prospective randomized
trial comparing conventional laparoscopic colectomy with hand-
assisted laparoscopic colectomy: applicability, immediate clinical
outcome, inflammatory response, and cost // Surg. Endosc. —
2002. — Vol. 16. — P. 234-239.
16. HALS Study Group: Hand-assisted laparoscopic surgery vs
standard laparoscopic surgery for colorectal disease: a prospective
randomized trial // Surg. Endosc. — 2000. — Vol. 14. — P. 896-901.
хирургию как дисциплину к увеличению количества
хирургов, обученных проведению данной операции
безопасно и профессионально.
I
17. Nakajima К., Lee S.W., Cocilovo С. et al. Laparoscopic total
colectomy: hand-assisted vs standard technique // Surg. Endosc. —
2004. — Vol. 18. — P. 582-586.
18. Rivadeneira D.E., Marcello P.W., Roberts PL. et al. Benefits
of hand-assisted laparoscopic restorative proctocolectomy: a
comparative study // Dis. Colon. Rectum. — 2004. — Vol. 47. —
P. 1371-1376.
19. Maartense S., Dunker M.S., Slors J.F. et al. Hand-assisted
laparoscopic versus open restorative proctocolectomy with ileal
pouch anal anastamosis // Ann. Surg. — 2004. — Vol. 240. —
P. 984-992.
20. Laparoscopic Colorectal Surgery / Eds J.W. Milsom, B. Bohm. —
New York: Springer-Verlag, 1996.
21. Pappas T.N., Jacobs D.O. Laparoscopic resection for colon cancer:
the end of the beginning? // N. Engl. J. Med. — 2004. — Vol. 350. —
P. 2091-2092.
22. Senagore A.J. Laparoscopic sigmoid colectomy for diverticular
disease // Surg. Clin. North Am. — 2005. — Vol. 85. — P. 19-24
23. Senagore A.J., Duepree H.J., Delaney C.P. et al. Cost structure of
laparoscopic and open sigmoid colectomy for diverticular disease:
similarities and differences // Dis. Colon. Rectum. — 2002. —
Vol. 45. — P. 485-490.
24. Dwivedi A., Chahin F., Agrawal L. et al. Laparoscopic colectomy
versus open colectomy for sigmoid diverticular disease // Dis.
Colon Rectum. — 2002. — Vol. 45. — P. 1309-1314.
25. Lawrence D.M., Pasquale M.D, Wasser Т.Е. Laparoscopic versus
open sigmoid colectomy for diverticulitis // Am. Surg. — 2003. —
Vol. 69. — P. 499-503.
26. Alves A., Panis Y., Slim K. et al. French multicentre prospective
observational study of laparoscopic versus open colectomy for
sigmoid diverticular disease // Br. J. Surg. — 2005. — Vol. 92. —
P. 1520-1525.
27. Kockerling E, Scheider C, Reymond M.A. et al. Laparscopic
resection of sigmoid diverticulitis: results of a multicenter study//
Surg. Endosc. — 1999. — Vol. 13. — P. 567-571.
28. Milsom J.W. Laparoscopic surgery in the treatment of Crohn's
disease // Surg. Clin. North Am. — 2005. — Vol. 85. — P. 25-34.
29. Milsom J.W., Hammerhofer K.A., Bohm B. et al. Prospective,
randomized trial comparing laparoscopic versus conventional
surgery for refractory ileocolic Crohn's disease // Dis. Colon.
Rectum. — 2001. — Vol. 44. — P. 1-8.
30. Maartense S., Dunker M.S., Slors J.F. M. et al. Laparoscopic-assisted
versus open ileocolic resection for Crohn's disease: a randomized
trial // Ann. Surg. — 2006. — Vol. 243. — P. 143-149.
31. Rosman A.S., Melis M., Fichera A. Meta-analysis of trials
comparing laparoscopic and open surgery for Crohn's disease //
Surg. Endosc. — 2005. — Vol. 19. — P. 1549-1555.
32. Martel C, Boushey RP. Laparoscopic colon surgery: past, present, and
future // Surg. Clin. North Am. — 2006. — Vol. 86. — P. 867-897.
33. Wexner S.D., Cera S.M. Laparoscopic surgery for ulcerative colitis //
Surg. Clin. North Am. — 2005. — Vol. 85. — P. 35-47.
Глава 12. Лапароскопическая колэктомия 159
34. Marcello P.W., Milsom J.W., Wong S.K. et al. Laparoscopic
restorative procto-colectomy: case-matched comparative study
with open restorative procto-colectomy // Dis. Colon. Rectum. —
2000. — Vol. 43. — P. 604-608.
35. Dunker M.S., Bemelman W.A., Slors J.F. et al. Functional
outcome, quality of life, body image, and cosmesis in patients
after laparoscopic-assisted and conventional restorative
proctocolectomy: a comparative study // Dis. Colon. Rectum. —
2001. — Vol. 44. — P. 1800-1807.
36. Larson D.W., Dozois E.J., Piotrowicz K. et al. Laparoscopic-assisted
versus open ileal pouch-anal anastamosis: functional outcome in a
case-matched series // Dis. Colon. Rectum. — 2005. — Vol. 48. —
P. 1845-1850.
37. Mabdouly K.M., Senagore A. J., Delaney C.P. et al. Clinically based
management of rectal prolapse: comparison of the laparoscopic
Wells procedure and laparoscopic resection with rectopexy // Surg.
Endosc. — 2003. — Vol. 17. — P. 99-103.
38. Solomon M.J., Young C.J., Eyers A.A. et al. Randomized clinical
trial of laparoscopic versus open abdominal rectopexy for rectal
prolapse // Br. J. Surg. — 2002. — Vol. 89. — P. 35-39.
39. Kariv Y., Delaney СР., Casillas S. et al. Long-term outcome after
laparoscopic and open surgery for rectal prolapse: a case-control
study // Surg. Endosc. — 2006. — Vol. 20. — P. 35-42.
40. Wexner S.D., Cohen S.M. Port site recurrence after laparoscopic
colorectal surgery for cure of malignancy // Br. J. Surg. — 1995. —
Vol. 82. — P. 295-298.
41. American Society of Colon and Rectal Surgeons: Position statement
on laparoscopic colectomy // Dis. Colon. Rectum. — 1992. —
Vol. 35. - P. 5A.
42. Stage J., Schulze S., Moller P. et al. Prospective randomized study
of laparoscopic vs open colonic resection for adenocarcinoma //
Br.J. Surg. — 1997. — Vol. 84. — P. 391-396.
43. Schwenk W., Bohm В., Muller J.M. Post-operative pain and
fatigue after laparoscopic or conventional colorectal resections:
a prospective randomized trial // Surg. Endosc. — 1998. —
Vol. 12.— P. 1131-1136.
44. Milsom J.W., Bohm В., Hammerhofer K.A. et al. A prospective,
randomized trial comparing laparoscopic versus conventional
techniques in colorectal cancer surgery: a preliminary report //
J. Am. Coll. Surg. — 1998. — Vol. 187. — P. 46-57.
45. Curet M.J., Putrakul K., Pitcher D.E. et al. Laparoscopically assisted
colon resection for colon carcinoma: perioperative results and long-
term outcome // Surg. Endosc. — 2000. — Vol. 14. — P. 1062-1066.
46. Braga M., Vignali A., Zuliani W. et al. Laparoscopic versus
open colorectal surgery: cost-benefit analysis in a single-center
randomized trial // Ann. Surg. — 2003. — Vol. 238. — P. 67-72.
47. Lacy A.M., Garcia-Valdecasas J.C., Delgado S. et al. Laparoscopy-
assisted colectomy versus open colectomy for treatment of non-
metastatic colon cancer: a randomized trial // Lancet. — 2002. —
Vol. 359. — P. 2224-2229.
48. Hasegawa H., Kabeshima Y, Watanabe M. et al. Randomized
controlled trial of laparoscopic versus open colectomy for advanced
colorectal cancer // Surg. Endosc. — 2003. — Vol. 17. — P. 636-640.
49. Kaiser A.M., Kang J.C., Chan L.S. et al. Laparoscopic-
assisted vs open colectomy for colon cancer: a prospective
randomized trial // J. Laparoendosc. Adv. Surg. Tech. — 2004. —
Vol. 14. — P. 329-334.
50. Leung K.L., Kwok S.P., Lam S.C. et al. Laparoscopic resection of
rectosigmoid carcinoma: prospective randomized trial // Lancet. —
2004. — Vol. 363. — P. 1187-1192.
51. Weeks J.C., Nelson H., Celber S. et al. Short-term quality-of-life
outcomes following laparoscopic-assisted colectomy vs open
colectomy for colon cancer // JAMA. — 2002. — Vol. 287. —
P. 321-328.
52. The Clinical Outcomes of Surgical Therapy Study Croup: A
comparison of laparoscopically assisted and open colectomy for
colon cancer // N. Engl. J. Med. — 2004. — Vol. 350. — P. 2050-
2059.
53. Cuillou P. J., Quirke P., Thorpe H. et al. Short-term endpoints of
conventional versus laparoscopic-assisted surgery in patients with
colorectal cancer (MRC CLASSIC trial) // Lancet. — 2005. —
Vol. 365.— P. 1718-1726.
54. COLOR Study Croup: Laparoscopic surgery versus open surgery for
colon cancer: short-term outcomes of a randomized trial // Lancet
Oncol. — 2005. — Vol. 6. — P. 477-484.
55. Abraham N.S., Young J.M., Solomon M.J. Meta-analysis of short-
term outcomes after laparoscopic resection for colorectal cancer //
Br. J. Surg. — 2004. — Vol. 91. — P. 111-1124.
56. Schwenk W, Haase O., Neudecker J. et al. Short-term benefits for
laparoscopic colorectal resection // Cochrane Database Syst. Rev. —
2005. — Vol. 3:CD003145.
57. Tilney H.S., Lovegrove R.E., Purkayastha S. et al. Laparoscopic
vs open subtotal colectomy for benign and malignant disease //
Colorectal. Dis. — 2006. — Vol. 8. — P. 441-450.
58. Polignano E, Henderson N., Alishahi S.M. et al. Laparoscopic
colectomy for cancer and adequate lymphadenectomy // Surg.
Endosc. — 2006. — Vol. 20. — P. 996-997.
59. Reilly W.T., Nelson H., Schroeder C. et al. Wound recurrence
following conventional treatment of colorectal cancer: a rare
but perhaps underestimated problem // Dis. Colon. Rectum. —
1996. — Vol. 39. — P. 200-207.
60. Jacob B.P., Salky B. Laparoscopic colectomy for colon
adenocarcinoma: an 11-year retrospective review with 5-year
survival rates // Surg. Endosc. — 2005. — Vol. 19. — P. 643-649.
61. Balli J.E., Franklin M.E., Almeida J.A. et al. How to prevent port-site
metastases in laparoscopic colorectal surgery // Surg. Endosc. —
2000. — Vol. 14. — P. 1034-1036.
62. Moloo H., Mamazza J., Poulin E.C. et al. Laparoscopic resections
for colorectal cancer: does conversion affect survival? // Surg.
Endosc. — 2004. — Vol. 18. — P. 732-735.
63. Casillas S., Delaney СР., Senagore A.J. et al. Does conversion of a
laparoscopic colectomy adversely affect patient outcome? // Dis.
Colon Rectum. — 2004. — Vol. 47. — P. 1680-1685.
64. Phillipson B.M., Bokey E.L., Moore J.W. et al. Cost of open versus
laparoscopically assisted right hemicolectomy for cancer // World
J. Surg. — 1997. — Vol. 21. — P. 214-217.
65. Janson M., Bjorholt I., Carlsson P. et al. Randomized clinical trial
of the costs of open and laparoscopic surgery for colon cancer //
Br. J. Surg. — 2004. — Vol. 91. — P. 409-417.
160 Лапароскопическая хирургия. Атлас
шш©;
Лапароскопическая
холецистэктомия
Дэвид Синдрэм, Кфер Бэн-Дэвид
Хотя желчные камни впервые были описаны в V в.
греческим врачом Александром Траллианосом (Alexander
Trallianos), хирургическое лечение желчнокаменной
болезни не проводили вплоть до 1867 г., когда Джон
Стаф Боббс провел первую холецистостомию с
удалением желчных камней у 32-летней женщины с водянкой
желчного пузыря. За этим последовала первая
холецистэктомия, проведенная в 1882 г. в Берлине Лангенбухом.
Его пациент был выписан из больницы через 7 нед после
этой новой операции. В течение первой половины XX в.
наиболее значительные достижения в данной области
касались преимущественно улучшения диагностики.
Хирургическое лечение желчнокаменной болезни
оставалось в общем неизменным до введения в практику
лапароскопической холецистэктомии. Хотя в имеющихся
опубликованных данных до сих пор можно встретить
споры о том, кто заслуживает признания в связи с
заслугами в этой области, некоторые исследователи,
тем не менее, указаны на рис. 13-1.
АНАТОМИЯ
Нормальная анатомия билиарной системы
представлена на рис. 13-2. Желчный пузырь имеет длину от 7
до 10 см, максимальную ширину от 2,5 до 3 см в
области дна, его обычный объем составляет около 30 мл,
хотя при значительном растяжении желчный пузырь
может содержать до 300 мл жидкости. Он
находится в ямке желчного пузыря между правой и левой
долей печени, на нижней поверхности печени. Его
прикрепление к печени может варьировать в
широких пределах: от внутрипеченочного расположения
до наличия истинной брыжейки. Желчный пузырь
снабжает кровью пузырная артерия, которая в 95%
случаев отходит от правой печеночной артерии,
но может ответвляться и от левой печеночной,
общей печеночной, гастродуоденальной или верхней
брыжеечной артерии. Двойные пузырные артерии
отмечаются в 8% случаев, а добавочные пузырные
артерии — у 12% пациентов.
Пузырный проток имеет длину от 2,5 до 4 см. Он
проходит очень близко к свободному правому краю
желудочно-печеночной связки, обычно соединяясь
с общим печеночным протоком под острым углом.
Внутри протока имеется много спиральных складок,
известных как клапаны Гейстера (Heister), которые
могут затруднить проведение катетера при интраопе-
рационной холангиографии. Иногда пузырный
проток может проходить более длинное расстояние кзади
Основные вехи в диагностике и лечении желчнокаменной болезни
Исследование
Страна
1867
1882
1890
1924
1953
1987
1988
John Stough Bobbs
Carl Langenbuch
Ludwig Courvoisier
Evarts Graham и Warren Cole
Eric Yuhl
Phillipe Mouret
Eddie Reddick and Douglas Olsen
США
Берлин
Базель
США
США
Франция
США
Операция
Первая холецистостомия
Первая холецистэктомия
Первая холедохолитотомия
Первая холецистография у человека
Первая холесцинтиграфия
Первая лапароскопическая холецистэктомия
Первая лапароскопическая холецистэктомия в США
Рис. 13-1. Основные вехи в диагностике и лечении желчнокаменной болезни.
Глава 13. Лапароскопическая холецистэктомия 161
Правый
печеночный .
желчный проток \,;
„,ЧГ^^^
JP^^*
s^f i
Пузырная артерия Ж
Фатеров сосок -lis
Панкреатодуо—^
денальные
сосуды
/Правая печеночная
/ артерия
■уА~ё~ J / Левый печеноч-
( ИРрг
v \?*Л;
-«•T^^el
JKw: шш
^тШв№г
^^Щйй^
ИрЯрР' ' ^
'-^"S^-^^Щ
5И "^ \ \
/ ный проток
^^ Левая
йр печеночная
^. артерия
jS£ :^-- Воротная
aegj^ вена
щШР^^
Общая
печеночная артерия
Гастродуоденальная
артерия
Рис. 13-2. Нормальная анатомия билиарной системы.
от общего печеночного протока и впадать в него в
области задней полуокружности.
ПАТОФИЗИОЛОГИЯ, КЛИНИЧЕСКАЯ
КАРТИНА И ДИФФЕРЕНЦИАЛЬНАЯ
ДИАГНОСТИКА
Холецистэктомию применяют при лечении
симптоматической желчнокаменной болезни, бескаменного
холецистита, а также при очень специфических
обстоятельствах (например, «фарфоровом» желчном пузыре
при иммуносупрессии) у бессимптомных пациентов.
Иногда показанием к холецистэктомии может служить
подтвержденная дискинезия желчных путей или
«хрустальная» болезнь.
Хронический холецистит характеризуется
рецидивирующими приступами боли в правом верхнем
квадранте или эпигастрии, которые обычно возникают
после приема пищи и могут иррадиировать в спину.
Часто боль сопровождается тошнотой, чувством
полноты или вздутием живота. Приступы обычно длятся
от 30 мин до 24 ч. Дискомфорт при хроническом
холецистите, вероятнее всего, вызван желчной коликой,
а не воспалением. Комплекс симптомов, который
включает боль, скорее всего, связан с хроническим
холециститом, даже при наличии камней в желчном пузыре.
Острый холецистит характеризуется острым
бактериальным воспалением желчного пузыря, обычно
возникающим вследствие обструкции пузырного протока
камнями (95% случаев). Персистирующая боль и
чувствительность при пальпации в правом верхнем квадранте
присутствуют почти во всех случаях. Тошнота и рвота
имеются у 2/3 пациентов и, возможно, они вызваны
быстрым повышением давления в желчном пузыре.
Лихорадку отмечают у 80% пациентов. Симптомы
раздражения брюшины, например симптом Мерфи,
становятся более частыми при прогрессировании
заболевания. Количество лейкоцитов в крови возрастает
в 85% случаев. На рис. 13-3 указаны часто встречаемые
заболевания, которые могут симулировать острый
холецистит.
Дифференциальная диагностика холецистита
Острый аппендицит
Дуоденальная язва
Язва желудка
Острый панкреатит
Гепатит
Правожелудочковая сердечная недостаточность
Синдром Фитц-Хью-Кёртиса {Fitz-Hugh-Curtis)
Пиелонефрит
Гастродуоденальный рефлюкс
Корешковая боль
Ишемическая болезнь сердца
Рис. 13-3. Дифференциальная диагностика холецистита.
недостатки лапароскопи-
о сравнению с открытым
Преимущества
Меньший разрез
Меньшая болезненность
Быстрое возвращение к полной повседневной активности
Меньшая продолжительность госпитализации
Меньшая общая стоимость лечения
Реже встречаются нарушения легочной функции
Недостатки
Необходимость в специальном оборудовании
Более трудный контроль кровотечения
Несколько большая частота повреждения желчного протока
Трудности при операциях на общем желчном протоке
Ограничение показаний при наличии спаек и воспаления
Рис. 13-4. Преимущества и недостатки лапароскопического доступа по сравнению с открытым.
162 Лапароскопическая хирургия. Атлас
Хотя лапароскопический доступ при холецистэк-
томии значительно снизил время выздоровления, это
не означает, что показания к холецистэктомии
расширились. В первую очередь обычно решают вопрос,
показана ли пациенту холецистэктомия, а во вторую —
какой из доступов более уместен в данной ситуации:
лапароскопический или открытый. Несмотря на то что
лапароскопический доступ имеет много преимуществ
(рис. 13-4), все еще существуют пациенты, которым
показана открытая холецистэктомия.
ТЕХНИКА ОПЕРАЦИИ
На рис. 13-5—13-14 представлена хирургическая
техника лапароскопической холецистэктомии.
ПОДГОТОВКА
Наркозный
аппарат
Монитор
Монитор Инсуффлятор
Электрокоагулятор
Первый ассистент
Ассистент с камерой
Лоток с инструментами
Рис. 13-5. Обстановка операционной
при лапароскопической
холецистэктомии. Наличие
в операционной отдельного
ассистента с камерой —
дополнительная необязательная
опция, поскольку многие хирурги
предпочитают оперировать с камерой
в левой руке и инструментом
для манипуляций в правой. Перед
анестезией вводят предоперационную
дозу антибиотиков, обычно
цефалоспоринов I поколения.
Пациенту, находящемуся под общим
наркозом, устанавливают
назогастральный зонд.
Глава 13. Лапароскопическая холецистэктомия 163
Срединно-ключичная
линия
5-мм троакар
5-мм троакар
Опционное место
установки
10-мм троакара
10-мм троакар
с видеокамерой
и инсуффляцией
Рис. 13-6. Пациента укладывают в ЗО-градусное положение
Тренделенбурга с разведенными руками. Доступ в брюшную
полость — инфраумбиликальный, через 10-миллиметровый
кожух, установленный с помощью закрытой (игла Вереша)
или открытой (троакар Хэссона) техники. После инсуффляции
диоксида углерода до 15 мм рт.ст. в брюшную полость вводят
лапароскоп и осматривают ее. Затем пациента укладывают
в обратное положение Тренделенбурга и наклоняют влево
для лучшей визуализации желчного пузыря и окружающих
структур. Далее под лапароскопическим контролем
устанавливают два троакара в правом подреберье
и 10-миллиметровый троакар в эпигастрии. Иногда в левом
подреберье устанавливают пятый троакар — для ретракции,
что позволяет лучше визуализировать структуры,
находящиеся в воротах печени.
ОПЕРАЦИЯ
10-мм троакар
5-мм троакар
5-мм троакар
Диссекция
пузырного
протока
Желчный
проток
Рис. 13-7.Тракция желчного пузыря за дно в краниальном
направлении и за шейку вправо приводит к натяжению
пузырного протока под правосторонним углом к общему
желчному протоку, тем самым сводя к минимуму шанс
спутать эти два протока. Затем начинают диссекцию
в направлении справа налево, идентифицируют пузырный
проток и мобилизуют его в достаточной степени, чтобы точно
идентифицировать.
Рис. 13-8. Важным аспектом диссекции являются ретракция
дна желчного пузыря в краниальном направлении и тракция
шейки книзу и латерально. Необходимо тщательно
мобилизовать шейку желчного пузыря для того, чтобы
обнажить переход желчного пузыря в пузырный проток.
Затем создают «окно» и проводят инструмент за пузырный
проток и артерию, демонстрируя отсутствие в этой
зоне других образований, идущих к желчному пузырю
или к печени. Это необходимая картина безопасности.
Клипсу на пузырный проток накладывают не ранее чем будет
проведена полная диссекция треугольника Кало и инструмент
будет проведен за пузырной артерией и протоком. Если
осталась хоть тень сомнения, необходимо провести
конверсию в открытую операцию.
164 Лапароскопическая хирургия. Атлас
Рис. 13-9. На этом этапе проводят холангиографию, если
она показана. Затем на проксимальный участок пузырного
протока накладывают две клипсы и пересекают его
ножницами.
Рис. 13-11. Шейку желчного пузыря далее наклоняют
вправо для того, чтобы натянуть переходную складку
брюшины левого края желчного пузыря. Натяжение кпереди
в значительной мере способствует этому этапу диссекции.
Переходную складку брюшины затем рассекают с помощью
электрокоагулятора.
Рис. 13-10. После пересечения пузырного протока
диссекцию продолжают влево, чтобы обнаружить пузырную
артерию. Пузырную артерию пересекают после наложения
трех клипс.
Рис. 13-12. Аналогично рассекают правую переходную
складку брюшины, используя маневр «поворот влево».
Диссекцию необходимо проводить с осторожностью, чтобы
идентифицировать заднюю ветвь пузырной артерии ниже
места пересечения. В случае обнаружения ее дважды
клипируют и пересекают.
Глава 13. Лапароскопическая холецистэктомия 165
Источники кровотечения
коагулированы
Рис. 13-13. При рассечении переходной складки
брюшины желчный пузырь отделяют от его печеночного
ложа с помощью электроножа с осторожностью, чтобы
не пропустить добавочные желчные протоки, входящие
в желчный пузырь непосредственно из печеночного ложа.
Мелкие очаги кровотечения контролируют с помощью
электрокоагуляции. Более выраженное кровотечение
из печеночных синусов на этом этапе можно остановить
путем аппликации «Gelfoam» (Pharmacia & Upjohn Co.,
Kalamazoo, Mi) и придавливания тупым зажимом.
Зажим, введенный
через пупочный порт,
визуализируется
с помощью камеры,
установленной
в 10-мм троакар
Рис. 13-14. Теперь желчный пузырь поднимают над краем
печени. В брюшную полость через пупочный порт вводят
пластиковый контейнер {«Endo Catch bag»; US Surgical, Norwalk,
CT), в который помещают желчный пузырь. Затем контейнер
закрывают и вытаскивают из брюшной полости. При наличии
больших камней может понадобиться расширение разреза
апоневроза или удаление камней из контейнера, которое
проводят, избегая контаминации раны.
РЕЗУЛЬТАТЫ
В течение прошедших двух десятилетий
лапароскопическая холецистэктомия укоренилась в качестве
стандартного метода лечения холелитиаза и острого и
хронического холецистита. Скорейшее выздоровление
и более короткий период госпитализации — главные
преимущества лапароскопической холецистэктомии
при отсутствии в то же время более высокого числа
осложнений. Крупные исследования и метаанализы
показали, что лапароскопическая холецистэктомия
безопасна, особенно если большое внимание уделяется
диссекции треугольника Кало с критической оценкой
своих действий, и имеет низкий уровень частоты кон-
версий в открытую операцию [1, 2].
ЛАПАРОСКОПИЧЕСКАЯ ОЦЕНКА
ОБЩЕГО ЖЕЛЧНОГО ПРОТОКА
Холедохолитиаз встречается у 8-15% пациентов с хо-
лелитиазом. Примерно 90% камней общего желчного
протока имеют диаметр менее 4 мм и проходят в
двенадцатиперстную кишку без каких-либо вмешательств.
Перед внедрением лапароскопической
холецистэктомии вопрос, когда проводить интраоперационную
холангиографию, был спорным. В настоящее время
с развитием лапароскопической холецистэктомии этот
вопрос вызывает среди хирургов еще больше споров.
Показания к интраоперационной холангиографии
перечислены на рис. 13-15. В пользу выполнения холан-
гиограммы в обязательном порядке всем пациентам
могут быть перечислены следующие позиции:
• необходимость оценить, остались ли в общем
желчном протоке камни, чтобы избежать других инва-
зивных вмешательств;
• необходимость в изображения анатомии, чтобы
избежать пропуска повреждений общего желчного
протока;
• недостаточность тактильных ощущений при
оценке протоков.
Аргументы против рутинной холангиографии
следующие:
• исследования, показывающие редкость клинически
значимых оставшихся камней;
• увеличение времени операции;
• ошибочная идентификация пузырного протока, что
приводит к повреждению, поскольку для
выполнения процедуры необходимы скобка и надрез.
Согласно результатам нескольких крупных
исследований, было показано наличие остаточных камней
менее чем у 1,5% пациентов, которым не проводили
холангиографию, но которые имели факторы риска
развития холедохолитиаза. В ходе предыдущих исследова-
1 бб Лапароскопическая хирургия. Атлас
ний не было доказано, что проведение холангиографии
в плановом порядке позволяет избежать повреждения
желчного протока [3-6]. Тем не менее последние
исследования баз данных показали любопытные результаты:
у пациентов, которым проводили рутинную интрао-
перационную холангиографию, частота повреждений
оказалась ниже [7]. Во всех этих анализах
присутствуют некоторые неточности и не продемонстрирована
причинно-следственная связь. В исследованиях,
посвященных значению холангиографии, частота
повреждений общего желчного протока у пациентов, которым
выполняли лапароскопическую холецистэктомию с
селективным выполнением холангиографии, составила
от 0 до 0,5% [8-15]. Очевидно, что селективное
использование холангиографии не приводит к увеличению
количества остаточных камней или повреждения
желчного протока. Этот вывод напоминает о неопределенности
встречаемых в литературных источниках сообщений
вследствие отсутствия проспективных
рандомизированных исследований, имеющих научное значение.
Авторы настоящего издания считают предпочтительным
селективный подход с дотошным разбором и
критичным взглядом на каждую конкретную ситуацию.
ХИРУРГИЧЕСКАЯ ТЕХНИКА
На рис. 13-16—13-20 представлена хирургическая
техника лапороскопической холангиографии. После
адекватной идентификации соединения шейки пузы-
Рутинное применение
Неясная анатомия
Патологические печеночные тесты
Расширенный общий желчный проток
Желтуха
Множественные мелкие камни желчного пузыря
Рентгенологические признаки камней в общем желчном
протоке
Расширенный пузырный проток
Панкреатит
Холангит
Одиночные граненые камни (во время открытой
холецистэктомии)
Поддержание хирургических навыков Рис. 13-15. Показания к холангиографии.
Глава 13. Лапароскопическая холецистэктомия 167
ря и протока единственную эндоскопическую скобку
накладывают через проксимальную часть пузырного
протока для предотвращения утечки содержимого
желчного пузыря (рис. 13-16). Если на этом этапе
анатомические особенности еще не ясны, хирург
может не накладывать скобку. Затем используют
эндоскопические ножницы для выполнения переднего
разреза вдоль проксимального пузырного протока
дистальнее скобки (рис. 13-17). Холангиокатетер
проводят через верхний правый порт или через
дополнительный переход над пузырным протоком.
Было разработано множество видов холангиокате-
теров. Несколько наиболее часто используемых
катетеров представлены на рис. 13-18-13-20 и 13-23. Катетер
«Taut» (Geneva, IL) и катетер с баллоном на конце
предупреждают обратный ток контраста. Остальные
катетеры заполняют через зажимное устройство и крепят
на месте; обратный ток предотвращают путем
наложения скобки, когда катетер точно установлен. Простой
холангиокатетер может быть проведен в пузырный
проток и затем закреплен к месту единственной
скобкой на наружном конце.
Холангиокатетер может быть введен в пузырный
проток не более чем на 4-5 мм (рис. 13-21). После того как
катетер зафиксирован, а все инструменты, которые могут
помешать при выполнении холангиографии, удалены,
выполняют холангиографию с введением 10 мл
полуконцентрированного ренографина (Renografin, Sanofi-Winthrop,
New York, NY) под рентгеноконтролем (рис. 13-22).
ОПЕРАЦИЯ
Клипса, наложенная
на пузырный проток
А ! !:\
/ » 1
^^^ТИ!
/111
Линия разреза ' /
кистозного протока
/
■и JP5 ■
■Hfc-
**k \
J\\~ Общий
желчный проток
Рис. 13-16. Через 10-миллиметровый эпигастральный
порт вводят эндоскопический клипатор и с его помощью
накладывают клипсу поперек проксимальной части
пузырного протока для профилактики вытекания
содержимого желчного пузыря в брюшную полость. Если
анатомия на этом этапе неясна, хирург может не накладывать
клипсы.
Рис. 13-17. Далее через эпигастральный порт вводят
эндоскопические ножницы, которыми рассекают половину
окружности пузырного протока сразу же дистальнее ранее
наложенной титановой клипсы.
168 Лапароскопическая хирургия. Атлас
Рис. 13-18. Холангиокатетер с баллонным кончиком
вводят через отверстие в браншах холангиографического
зажима и проводят через эпигастральный или срединно-
ключичный порт в брюшную полость. В случаях, когда
для улучшения доступа в эти порты необходимо ввести
зажимы для ретракции, можно установить еще один порт
или ввести холангиокатетер через перкутанно установленный
ангиокатетер, что позволит избежать установки
дополнительного порта.
Рис. 13-19. Катетер направляют в частично пересеченный
проксимальный конец пузырного протока. Можно
манипулировать катетером с помощью эндоскопического
граспера вместо холангиографического зажима. Если имеются
трудности при проведении катетера в проток, может помочь
проводник, введенный в проток через холангиокатетер.
Катетер вводят на 4-5 мм.
Рис. 13-20. Затем для фиксации катетера на месте
и предотвращения экстравазации при введении контрастного
вещества раздувают баллон. Перед введением контрастного
вещества лапароскоп удаляют из брюшной полости,
при этом стоит внимательно убедиться в том, что все
рентгеноконтрастные предметы удалены из области
холангиографии. Далее через катетер вводят 10 мл
наполовину разведенного ренографина {Sanofi-Wintorp,
New York, NY) и в это время делают снимок. Необходимо
убедиться, что кончик не мигрировал в общий желчный
проток, так как при этом получится холангиограмма
без ретроградного контрастирования. В случае, когда
пузырный проток тесно прилежит к общему желчному
протоку, раздувание баллона в просвете пузырного
протока может вызвать вдавление стенки общего желчного
протока, что даст ложное впечатление о наличии камня. Во
многих клиниках предпочитают использование цифрового
рентгенотелевидения вместо стандартной рентгенографии.
Глава 13. Лапароскопическая холецистэктомия 169
АЛЬТЕРНАТИВНАЯ ТЕХНИКА
На рис. 13-21—13-26 показана альтернативная техника холецистохолангиографии.
Рис. 13-22. Вариант второй. Катетер со стандартным Рис. 13-23. Катетер направляют в пузырный проток
кончиком проводят перкутанно через переднюю брюшную и фиксируют на месте с помощью зажима, контрастное
стенку в брюшную полость по направлению к пузырному вещество вводят, как продемонстрировано на рис. 13-20.
протоку, используя эндоскопические грасперы. Катетер
вводят в частично пересеченный проксимальный отдел
пузырного протока и фиксируют на месте с помощью
наложения клипсы на пузырный проток. Контрастное
вещество вводят и делают рентгенографию, как показано
на рис. 13-20.
170 Лапароскопическая хирургия. Атлас
Рис. 13-24. Фотография правильно
проведенной холангиографии через
пузырный проток.
Рис. 13-25. Лапароскопическое
ультразвуковое изображение общего
желчного протока с четко видимой
тенью камня в протоке (собственность
Michael S. Nussbaum, MD, University of
Cincinnati).
Рис. 13-26. На лапароскопической
холангиограмме того же пациента,
что и на рис. 13-25, определяется
камень в общем желчном протоке
(собственность Michaels. Nussbaum,
MD, University of Cincinnati).
УЛЬРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
БИЛИАРНОЙ СИСТЕМЫ
Лапароскопическое ультразвуковое исследование
желчных путей — альтернатива холангиографии, оно
имеет несколько интересных преимуществ. УЗИ дает
информацию о наличии камней в желчных протоках
без вхождения в них и может быть повторено
много раз, если в этом возникает необходимость; кроме
того, данный метод дешевле и занимает меньше
времени, чем холангиография. Хотя он доступен с 1981 г.
[16] и применялся тогда для лапароскопической холе-
цистэктомии, однако в те годы не приобрел широкой
популярности. В исследованиях, которые
проводились с 1990 г., показали, что этот метод по своим
возможностям сравним с холангиографией [17, 18]. Один
из недостатков, который мешает более широкому его
распространению, — зависимость метода от оператора
и курса обучения. Однако в опытных руках интраопе-
рационное лапароскопическое УЗИ является весьма
привлекательной опцией [19, 23]. На рис. 13-25 и 13-26
показаны камни общего желчного протока, верно
выявленные с помощью УЗИ, что было подтверждено
последующим проведением холангиографии.
РЕЗУЛЬТАТЫ
Лапароскопическая холангиография остается
интегральной частью операции лапароскопической холе-
цистостомии. Хотя среди исследователей не
прекращаются споры по поводу того, следует ли холангиографию
проводить всем пациентам подряд или выборочно,
навыки ее выполнения необходимы каждому хирургу,
выполняющему холецистэктомию. Технический успех
холангиографии, описанный как возможность
получения холангиограммы достаточно удовлетворительного
качества для ее интерпретации, по данным крупных
исследований, может быть достигнут в 90-98%
случаев в руках опытных операторов. Осложнения при этой
процедуре встречаются редко, и их можно легко
избежать, если придерживаться рекомендаций,
содержащихся в настоящей главе.
ЛАПАРОСКОПИЧЕСКОЕ ЛЕЧЕНИЕ
ХОЛЕДОХОЛИТИАЗА
Холедохолитиазом называют наличие камней в
любых отделах общего желчного протока, хотя
наиболее частая их локализация — суженный отдел
протока в области фатерова соска. Камни в общем
печеночном протоке составляют только 5% всех
камней в желчной системе. Для того чтобы
диагностировать холедохолитиаз, необходимо подвергать
тщательному и придирчивому осмотру всех
пациентов с желчными камнями. Было выработано
множество клинических критериев в попытке предсказать
риск расположения камней в общем желчном
протоке у пациентов с холелитиазом (рис. 13-27) [24,
27]. В общем предоперационные клинические, ла-
Глава 13. Лапароскопическая холецистэктомия 171
бораторные и рентгенологические данные надежно
предсказывают отсутствие холедохолитиаза более
чем в 95% случаев. Благодаря большому количеству
пациентов с камнями желчного пузыря остается
значительное количество случаев, когда камни общего
желчного протока находят во время операции в
ситуации, когда ничто не вызывало подозрений.
ЛЕЧЕНИЕ ХОЛЕДОХОЛИТИАЗА
В эру минимально инвазивной хирургии,
эндоскопической ретроградной холангиопанкреатографии
(ЭРХПГ) и сложной интервенционной радиологии
многих пациентов с холедохолитиазом можно
безопасно и успешно лечить, не применяя разрез в верхнем
правом квадранте и открытую ревизию общего
желчного протока. К абсолютным исключениям относятся
пациенты с холангитом, перфорацией желчного
пузыря, панкреатитом, подозрением на рак или крупными
осложненными камнями. В таких случаях минимально
инвазивные методы, требующие больших временных
затрат, часто уступают стандартным методам
лекарственного и хирургического лечения, имеющим
доказанную эффективность.
Пациенты с неосложненным холедохолитиазом,
однако, служат отличными кандидитами для проведения
минимально инвазивных операций. Для
лапароскопического хирурга эти пациенты обычно делятся на две
категории:
• пациенты с холедохолитиазом, у которых
подозревают холедохолитиаз по результатам
предоперационного обследования;
• пациенты, подвергающиеся лапароскопической хо-
лецистэктомии, у которых холедохолитиаз
установлен интраоперационно.
Лечебные стратегии для каждой из этих групп
пациентов немного различаются.
Пациентам с подозрением на холедохолитиаз перед
операцией необходимо предпринять попытку
проведения предоперационной ЭРХПГ для извлечения камней
из общего желчного протока. Это называется очисткой
протока. Сообщают, что успех удаления камней из
общего желчного протока перед операцией с помощью
ЭРХПГ составляет 95%, хотя в центрах с малым
опытом проведения ЭРХПГ ее успешность будет меньшей.
Поскольку позитивная предсказательная ценность
клинических параметров при холедохолитиазе в луч-
Клинические, лабораторные,
рентгенологические
и интраоперационные критерии
предполагаемого холедохолитиаза
Клиническая картина
Желтуха (в настоящее время, ранее или рецидивирующая)
Светлый цвет фекалий (отсутствие в стуле желчных
пигментов или «ахоличный» стул)
Темный цвет мочи (содержит билирубин)
Лихорадка (в настоящее время или ранее)
Лабораторные данные
Билирубин сыворотки более 1,2 мг/дл
Сывороточная щелочная фосфатаза более 250 ЕД/л
Радиологические исследования
Множественные мелкие камни
Диаметр общего желчного протока более 6 мм
Камни общего желчного протока
Интраоперационные данные
Множественные мелкие камни
Диаметр общего желчного протока более 10 мм
Диаметр пузырного протока более 5 мм
Показания к предоперационной
эндоскопической ретроградной
холангиопанкреатографии
у пациентов с подозрением
на холедохолитиаз
Клинические подозрения на холедохолитиаз
Наличие множественных камней
Мелкий пузырный проток или общий желчный проток
(может помешать безопасной ревизии через пузырный
проток)
Пожилой пациент
Высокий операционный риск
Эндоскопист с небольшим опытом удаления камней (если
это, в конце концов, понадобится после операции)
Хирург с небольшим опытом лапароскопического лечения
холедохолитиаза
Просьба пациента (сильное желание избежать открытой
операции)
Рис. 13-27. Клинические, лабораторные, рентгенологические
и интраоперационные критерии предполагаемого
холедохолитиаза.
Рис. 13-28. Показания к предоперационной эндоскопической
ретроградной холангиопанкреатографии у пациентов
с подозрением на холедохолитиаз.
172 Лапароскопическая хирургия. Атлас
шем случае составляет 50%, при плановом
обязательном назначении предоперационной ЭРХПГ многие
пациенты подвергнутся ненужному дополнительному
исследованию. Относительные показания к
предоперационной очистке протока перечислены на рис. 13-30
и представляют собой стратегию :елективной
предоперационной ЭРХПГ.
Показанием к ЭРХПГ, заслуживающим особенного
внимания, считают наличие холедохолитиаза у
пожилых пациентов. Преимуществом ЭРХПГ в этом случае
считают возможность проведения быстрой холецист-
эктомии, поскольку холангиограмма и ревизия
протока не потребуются. Более того, некоторые
исследователи ставят под сомнение вопрос о необходимости
последующей холецистэктомии у таких пациентов,
поскольку риск рецидивирования проблем с желчными
путями после эндоскопического удаления камней у
пожилых пациентов равен примерно 10% в течение 5 лет,
что сравнимо с риском холецистэктомии.
ОПЕРАЦИЯ
Рис. 13-29. Процедуру проводят во время
лапароскопической холецистэктомии после
интраоперационной холангиографии. Пузырную артерию
находят и дважды клипируют. Пузырный проток находят
и клипируют ближе к желчному пузырю для профилактики
вытекания желчи и камней. Холангиокатетер удаляют.
Если холангиограмму проводили через пузырный проток,
отверстие в нем используют для холангиоскопии. Если
пузырный проток не рассекали (как на рисунке), желчный
пузырь оттягивают кверху и медиально с тракцией пузырного
протока и проток рассекают поперек на половину его
диаметра примерно на 1,5-2 см проксимальнее его соустья
с общим печеночным протоком.
Если лапароскопический хирург и эндоскопист
имеют опыт удаления камней из желчных протоков,
и пациент — подходящий кандидат для оперативного
лечения, предоперационная ЭРХПГ не нужна.
Пациента можно сразу же подвергать лапароскопической
холецистэктомии, планируя удаление камней
лапароскопическим доступом или эндоскопически, после
операции. Также, независимо от объема предоперационного
обследования, в некоторых случаях холедохолитиаз
будет диагностирован только интраоперационно
после холангиографии. Ниже представлены два сценария
для применения лапароскопического лечения при
камнях общего желчного протока [28].
ТЕХНИКА ОПЕРАЦИИ
На рис. 13-29—13-38 показана хирургическая техника
лапароскопической ревизии общего желчного протока
через пузырный проток.
Рис. 13-30. Гибкий эндоскоп с наружным диаметром
2,7-3,3 мм проводят через порт, расположенный в правом
верхнем квадранте, и продвигают в пузырный проток.
Очевидно, что чем меньше диаметр эндоскопа, тем легче
его будет провести. Имеется большое количество
эндоскопов маленького диаметра («ACMI-Circon»,
«Olympus», «Intramed Laboratories», «Karl Storz Endoscopy-America»),
которые изначально разрабатывают какуретероскопы
или холедохоскопы. Захватывать эндоскоп необходимо
осторожно и только атравматическим зажимом. Некоторые
авторы для облегчения доступа в проток предпочитают
использовать гидрофильный проводник.
Глава 13. Лапароскопическая холецистэктомия 173
Рис. 13-31. Если в пузырный проток невозможно ввести самый маленький
из имеющихся эндоскопов, его можно осторожно бужировать с помощью
механических конических бужей или системы для баллонной ангиопластики.
Бужирование пузырного протока можно безопасно проводить до диаметра 4мм.
Бужирование до 8мм не рекомендуется. Очевидно, что необходимо избегать
сильной дилатации узкого пузырного протока и отказаться от процедуры, если
не удается полностью провести холангиоскоп. Если при силовом бужировании
разрывается соустье пузырного и общего желчного протока, для его пластики может
понадобиться открытая операция. Может быть полезным внутривенное введение
2 мг глюкагона, который способствует релаксации гладких мышц пузырного протока.
Камень_
в ампуле
Камень в ампуле
фатерова соска
при эндоскопии
Рис. 13-32. После того как холангиоскоп прошел в общий
желчный проток, видеокамеру необходимо снять
с лапароскопа и присоединить к холангиоскопу, чтобы
получить изображение с максимальным разрешением.
Холангиоскоп осторожно продвигают дистально в общий
желчный проток до тех пор, пока не увидят камень (вкладка).
Общий желчный проток иногда можно визуализировать
с помощью осторожного скручивания холангиоскопа
кпереди, чтобы нивелировать острый угол между пузырным
и общим печеночным протоком. Приложения избыточной
силы необходимо избегать, так как это может привести
к разрыву системы протоков.
Камень проталкивают
через сосок
с помощью эндоскопа
Камень вымывают
через сосок жидкостью
из катетера
£l л
н
Jm
ft
щ
-тГ
Камень извлекают
с помощью корзинки
:
Рис. 13-33. Камни часто можно
вытолкнуть в двенадцатиперстную
кишку с помощью осторожного
давления холангиоскопом.
Рис. 13-34. Если камни
не выталкиваются при осторожном
давлении холангиоскопом,
можно предпринять несколько
маневров. В общий желчный проток
через пузырный проток можно
провести катетер из красной
резины или что-либо подобное
для промывания.
Рис. 13-35. В случаях, когда
холангиоскоп имеет достаточно
крупный рабочий канал (1-1,5 мм),
можно использовать корзинку
для извлечения камней.
174 Лапароскопическая хирургия. Атлас
Камень извлекают
с помощью
баллонного катетера
Вид очищенного
протока
при эндоскопии
Рис. 13-36. Наконец, для извлечения камня можно
использовать ЗР-катетер Фогарти для эмболэктомии. Этот
способ может быть затруднительным, поскольку существует
вероятность попадания камня в общий печеночный проток,
что сделает камень не подлежащим удалению.
Рис. 13-37. Когда камни удалены, холангиоскоп вводят снова
и осматривают ампулу.
Заключительная
холангиография
лХ. ъ?А
^Ч**. ^^w. ^^^*^^w. iV~4l J^
^^^^^^^^к^В":
^^Чв^^^) ^т-r\W '^
5||L
Ллга
Рис. 13-38. Затем для подтверждения очищения протока
проводят заключительную холангиографию. Лигирование
пузырного протока после обширных манипуляций
и дилатации — важный этап операции. Хотя при обычной
холецистэктомии, как правило, используют обычные
эндоскопические клипсы, после транспузырной ревизии
общего желчного протока более предпочтительным будет
применение одной или двух эндоскопических петель. Перед
зашиванием устанавливают закрытую дренажную систему
Джексона-Пратта.
Глава 13. Лапароскопическая холецистэктомия 175
РЕЗУЛЬТАТЫ
Данные о накопленном опыте лапароскопического
лечения холедохолитиаза, приведенные в
опубликованных исследованиях, свидетельствуют, что
успешное очищение протока отмечается в 93-100% случаев
(по результатам нескольких серий исследований) [29-
32]. Однако эти результаты приводятся авторами с
обширным опытом проведения сложных
лапароскопических операций. В других литературных источниках
сообщают об успехе этих процедур в 58-75% случаев [9,
11, 13, 33, 34], что более соответствует опыту среднего
общего хирурга в США.
В настоящей главе описан наиболее популярный
метод транспузырной ревизии общего желчного
протока, хотя имеется много других методов
обнаружения и удаления камней. К ним относятся: литотрипсия
пульсовым окрашенным лазером или
электрогидравлическая литотрипсия, установка Т-образного
дренажа через пузырный проток для применения лазера,
установка в общий желчный проток интродьюсера
при множественных камнях, ревизия желчного
протока под рентгеноскопическим контролем, антеградное
продвижение камня с помощью баллонного катетера,
интраоперационное УЗИ или ЭРПХГ,
лапароскопическое бужирование сфинктера Одди или супрадуоде-
нальная лапароскопическая ревизия общего желчного
протока [30, 35, 36].
Независимо от применяемого метода в любом
случае необходимо соблюдать традиционный
хирургический принцип, который гласит: «В первую
очередь — не навреди». Как и при открытой
ревизии общего желчного протока, имеется
потенциальный риск развития осложнений со стороны общего
f ' " " '" ' ' |и ' '" """■"'"' ii i - ' ■
СПИСОК ЛИТЕРАТУРЫ
-
1. Keus R, de Jong J.A., Gooszen H.G., van Laarhoven C.J.
Laparoscopic versus open cholecystectomy for patients with
symptomatic cholecystolithiasis // Cochrane Database Syst. Rev. —
2006. — Vol. 4:CD006231.
2. Gurusamy K.S., Samraj K. Early versus delayed laparoscopic
cholecystectomy for acute cholecystitis // Cochrane Database Syst.
Rev. — 2006. — CD005440.
3. Clair D.G., Brooks D.C. Laparoscopic cholangiography: the case for
a selective approach // Surg. Clin. North Am. — 1994. — Vol. 74. —
P. 961-966.
4. Clair D.G., Carr-Locke D.L., Becker J.M., Brooks D.C. Routine
cholangiography is not warranted during laparoscopic
cholecystectomy// Arch. Surg. — 1993. — Vol. 128. — P. 551-554;
discussion — P. 554-555.
5. Lillemoe K.D., Yeo C.J., Talamini M.A. et al. Selective
cholangiography. Current role in laparoscopic cholecystectomy //
Ann. Surg. — 1992. — Vol. 215. — P. 669-674; discussion —
P. 674-666.
176 Лапароскопическая хирургия. Атлас
желчного протока, особенно ишемии протока,
образования стриктуры и холангита. Метаанализ
исследований, изучавших вопрос, в действительности ли
эндоскопическая папиллосфинктеротомия — более
предпочтительный метод, чем лапароскопическая
операция на общем желчном протоке, показал
аналогичные исходы применения обоих методов [28, 31,
37]. Однако вследствие наличия отличных
результатов эндоскопического очищения протока (более 95%
во многих сериях) и в свете хорошо обоснованных
доказательств того, что большинство камней диаметром
менее 3,0 мм выходят самостоятельно без каких-либо
симптомов, применение трудного
лапароскопического доступа при камнях общего желчного протока,
возможно, не оправдано.
ВЫВОДЫ
Лапароскопическая холецистэктомия — стандартная
операция при лечении холедохолитиаза и
холецистита. Благодаря обучению лапароскопии всех хирургов
лапароскопическая холецистэктомия стала обычной
в их практике операцией. Однако для поддержания
наиболее низкого уровня вероятности развития
осложнений решающими факторами в пользу ее проведения
считают бдительность при осуществлении операции
и низкий порог конверсии в открытую холецистэкто-
мию. С разработкой новых технологий и освоением
хирургами сложных лапароскопических методик
(лапароскопическое УЗИ), применением роботов и новых
инструментов с дополнительными степенями свободы
лапароскопическое лечение желчнокаменной болезни
продолжит совершенствоваться, что даст
дополнительные преимущества всем пациентам.
6. Cantwell D.V. Routine cholangiography during laparoscopic
cholecystectomy // Arch. Surg. — 1992. — Vol. 127. — P. 483-484.
7. Flum D.R., Dellinger E.P., Cheadle A. et al. Intraoperative
cholangiography and risk of common bile duct injury during
cholecystectomy // JAMA. — 2003. — Vol. 289. — P. 1639-1644.
8. Kullman E., Borch K., Lindstrom E. et al. Value of routine
intraoperative cholangiography in detecting aberrant bile ducts
and bile duct injuries during laparoscopic cholecystectomy //
Br. J. Surg. — 1996. — Vol. 83. — P. 171-175.
9. Fiore N.E, Ledniczky G., Wiebke E.A. et al. An analysis of
perioperative cholangiography in one thousand laparoscopic
cholecystectomies // Surgery. — 1997. — Vol. 122. — P. 817-821;
discussion — P. 821-823.
10. Hammarstrom L.E., Holmin Т., Stridbeck H., Ihse I. Routine
preoperative infusion cholangiography versus intraoperative
cholangiography at elective cholecystectomy: a prospective study in
995 patients // J. Am. Coll. Surg. — 1996. — Vol. 182. — P. 408-416.
11. Kondylis P.D., Simmons D.R., Agarwal S.K. et al. Abnormal
intraoperative cholangiography. Treatment options and long-term
follow-up // Arch. Surg. — 1997. — Vol. 132. — P. 347-350.
12. Metcalfe M.S., Ong Т., Bruening M.H. et al. Is laparoscopic
intraoperative cholangiogram a matter of routine? // Am. J. Surg. —
2004. — Vol. 187. — P. 475-481.
13. Roush T.S., Traverso L.W. Management and long-term follow-
up of patients with positive cholangiograms during laparoscopic
cholecystectomy// Am. J. Surg. — 1995. — Vol. 169. — P. 484-487.
14. Wagner A.J., Sobrino M.A., Traverso L.W. The long-term follow-
up of patients with positive intraoperative cholangiograms
during laparoscopic cholecystectomy // Surg. Endosc. — 2004. —
Vol. 18. — P. 1762-1765.
15. Amott D., Webb A., Tulloh B. Prospective comparison of routine
and selective operative cholangiography // ANZ J. Surg. — 2005. —
Vol. 75. — P. 378-382.
16. Fukuda M., Mima S., Tanabe T. et al. Endoscopic sonography of
the liver: diagnostic application of the echolaparoscope to localize
intrahepatic lesions // Scand. J. Gastroenterol. Suppl. — 1984. —
Vol. 102. — P. 24-38.
17. Birth M., Ehlers K.U., Delinikolas K., Weiser H.F. Prospective
randomized comparison of laparoscopic ultrasonography using
a flexible-tip ultrasound probe and intraoperative dynamic
cholangiography during laparoscopic cholecystectomy // Surg.
Endosc. — 1998. — Vol. 12. — P. 30-36.
18. Kubota K., Bandai Y., Sano K. et al. Appraisal of intraoperative
ultrasonography during laparoscopic cholecystectomy // Surgery. —
1995. — Vol. 118. — P. 555-561.
19. Catheline J., Rizk N, Champault G. A comparison of laparoscopic
ultrasound versus cholangiography in the evaluation of the biliary
tree during laparoscopic cholecystectomy // Eur. J. Ultrasound. —
1999.— Vol. 10.— P. 1-9.
20. Falcone R.A., Jr., Fegelman E.J., Nussbaum M.S. et al. A prospective
comparison of laparoscopic ultrasound vs intraoperative
cholangiogram during laparoscopic cholecystectomy // Surg.
Endosc. — 1999. — Vol. 13. — P. 784-788.
21. Halpin V.J., Dunnegan D., Soper N.J. Laparoscopic intracorporeal
ultrasound versus fluoroscopic intraoperative cholangiography:
after the learning curve // Surg. Endosc. — 2002. — Vol. 16. —
P. 336-341.
22. Machi J., Oishi A. J., Tajiri T. et al. Routine laparoscopic ultrasound
can significantly reduce the need for selective intraoperative
cholangiography during cholecystectomy // Surg. Endosc. —
2007. — Vol. 21. — P. 270-274.
23. Thompson D.M., Arregui M.E., Tetik C. et al. A comparison
of laparoscopic ultrasound with digital fluorocholangiography
for detecting choledocholithiasis during laparoscopic
cholecystectomy // Surg. Endosc. — 1998. — Vol. 12. — P. 929-932.
24. Barkun A.N., Barkun J.S., Fried G.M. et al. Useful predictors of bile
duct stones in patients undergoing laparoscopic cholecystectomy.
Mc Gill Gallstone Treatment Group // Ann. Surg. — 1994. —
Vol. 220. — P. 32-39.
25. Prat E, Meduri В., Ducot B. et al. Prediction of common bile duct
stones by noninvasive tests // Ann. Surg. — 1999. — Vol. 229. —
P. 362-368.
26. Sgourakis C., Dedemadi C, Stamatelopoulos A. et al.
Predictors of common bile duct lithiasis in laparoscopic era //
World J. Gastroenterol. — 2005. — Vol. 11. — P. 3267-3272.
27. Shiozawa S., Tsuchiya A., Kim D.H. et al. Useful predictive factors
of common bile duct stones prior to laparoscopic cholecystectomy
for gallstones // Hepatogastroenterology. — 2005. — Vol. 52. —
P. 1662-1665.
28. Martin D.J., Vernon D.R., Toouli J. Surgical versus endoscopic
treatment of bile duct stones. — Cochrane Database Syst. Rev. —
2006. — Vol. 2:CD003327.
29. Hunter J.C. Laparoscopic transcystic common bile duct
exploration // Am. J. Surg. — 1992. — Vol. 163. — P. 53-56;
discussion — P. 57-58.
30. Lyass S., Phillips E.H. Laparoscopic transcystic duct common bile
duct exploration // Surg. Endosc. — 2006. — Vol. 20 (Suppl.). —
P. 441-445.
31. Rhodes M., Sussman L., Cohen L., Lewis M.P. Randomised trial of
laparoscopic exploration of common bile duct versus postoperative
endoscopic retrograde cholangiography for common bile duct
stones // Lancet. — 1998. — Vol. 351. — P. 159-161.
32. Stoker M.E. Common bile duct exploration in the era of
laparoscopic surgery // Arch. Surg. — 1995. — Vol. 130. — P. 265-
268; discussion — P. 268-269.
33. Lauter D.M., Froines E.J. Laparoscopic common duct exploration
in the management of choledocholithiasis // Am. J. Surg. — 2000. —
Vol. 179. — P. 372-374.
34. Giurgiu D.I., Margulies D.R., Carroll B.J. et al. Laparoscopic
common bile duct exploration: long-term outcome // Arch. Surg. —
1999. — Vol. 134. — P. 839-843; discussion — P. 843-844.
35. Duensing R.A., Williams R.A., Collins J.C, Wilson S.E. Managing
choledocholithiasis in the laparoscopic era // Am. J. Surg. —
1995. — Vol. 170. — P. 619-623.
36. Fitzgibbons R.J., Jr., Gardner G.C. Laparoscopic surgery and the
common bile duct // World J. Surg. — 2001. — Vol. 25. — P. 1317-
1324.
37. Clayton E.S., Connor S., Alexakis N., Leandros E. Meta-analysis
of endoscopy and surgery versus surgery alone for common bile
duct stones with the gallbladder in situ // Br. J. Surg. — 2006. —
Vol. 93.— P. 1185-1191.
Глава 13. Лапароскопическая холецистэктомия 177
Осложнения
лапароскопической
холецистэктомии
Дана Д. Портнер, Дэвид Синдрэм
Марк В. ОнаитисЭдвард Ж. Чекан
Лапароскопическая холецистэктомия стала методом
выбора при лечении симптоматической
желчнокаменной болезни. Ускоренное выздоровление и
удовлетворенность пациентов результатами привели к быстрому
началу применения лапароскопических методик в
хирургии желчного пузыря. В процессе эволюции этой
техники в 1980-1990-х гг. стало ясно, что она имеет
более высокий риск развития осложнений (особенно
повреждений крупных желчных протоков) в
сравнении с открытой холецистэктомией. Первоначально это
связывали с курсом обучения, но затем стало понятно,
что частота развития данного осложнения была выше,
даже несмотря на адекватное обучение лапароскопии
и хирургический опыт, — в этом аспекте открытая
холецистэктомия обладает небольшим преимуществом
[1-3]. Крупные исследования популяционных баз
данных показали, что при лапароскопической
холецистэктомии отмечается повышенная частота встречаемости
повреждений общего желчного протока [4]. Однако
при метаанализе крупных исследований схожих
данных получено не было, и поэтому в большинстве
случаев лапароскопическую холецистэктомию следует
предпочитать открытой операции [5].
Несмотря на осознание, что лапароскопическая
холецистэктомия сопровождается более высокой
частотой повреждений желчных протоков, преимущества
лапароскопической холецистэктомии способствовали
продвижению этой техники (и, возможно, всей
лапароскопической хирургии) на новый уровень. С
признанием лапароскопии появилось много новых
возможностей, но также и ограничений, рекомендаций и правил,
которые были разработаны для профилактики
развития осложнений. В настоящее время эти рекомендации
должны быть известны всем хирургам, проводящим
лапароскопическкую холецистэктомию, они включают
такие термины, как «критический взгляд» и
«невозможность прогресса». Понимание ограничений
возможностей техники, поддержание низкого порога кон-
версий в открытую операцию или даже возможность
прекращения операции с оставлением холецистосто-
мы — все это должно прочно укорениться в сознании
каждого хирурга. Однако осложнения при
проведении данной методики все еще встречаются. Факторы,
обычно способствующие развитию осложнений,
представлены на рис. 14-1. В данной главе приведено
обсуждение этих осложнений.
АНАТОМИЯ
Для того чтобы избежать развития осложнений,
необходимо детальное знание нормальной анатомии и
аномалий развития билиарной системы. Часто
встречаемые аномалии строения печеночных артерий и
протоков могут повысить опасность неудачного исхода
лапароскопической холецистэктомии (рис. 14-2). Желчный
пузырь обычно расположен справа от общего желчно-
Факторы, способствующие развитию
интраоперационных осложнений
Проблема Результат
Отсутствие опыта работы
с оборудованием
Неадекватный тренинг
Неспособность провести
холангиографию
Непонимание
электрохирургических
принципов
Плохие визуализация
и доступ
Самоуверенность,
незнание анатомии,
не проведенная конверсия
в открытую операцию
перед повреждением
Незнание анатомии
Термальное повреждение
Рис. 14-1. Факторы, способствующие развитию
интраоперационных осложнений.
Глава 14. Осложнения лапароскопической холецистэктомии 179
Правый печеночный проток
Правая печеночная артерия
Общий
печеночный проток
Пузырная артерия
Пузырный проток
Желчный пузырь
Рис. 14-2. Наиболее частые аномалии анатомии артерий печени и желчных протоков, которые могут повысить опасность проведения
лапароскопической холецистэктомии. А — обычная анатомия артерий и протоков. Б — правая ветвь печеночной артерии сзади
от общего печеночного протока. В — аберрантная печеночная артерия исходит из верхней брыжеечной артерии. Г-И — варианты
впадения пузырного и дополнительных протоков во внепеченочные желчные протоки.
го протока, а соустье пузырного и общего желчного
протоков находится сразу же выше начального отдела
немобилизованной поджелудочной железы. Соустье
может располагаться в любом месте внепеченочных
желчных путей: от печеночных протоков выше
бифуркации до интрапанкреатического отдела общего
желчного протока и по всей окружности общего
печеночного протока. В литературных источниках
описаны различные «вероломные» конфигурации желчных
протоков, к которым относятся «скрытый» пузырный
проток [6] и низкое впадение 7-го и 8-го
печеночного сегментарного протока [7]. Эти аномальные соустья
дистальных протоков встречаются нередко, примерно
у 10-15% пациентов. Аномальная анатомия протоков
может сделать диссекцию более утомительной и
трудной, но не должна привести к крупным осложнениям.
Методы, позволяющие избежать повреждений даже
в этих ситуациях, описаны ниже.
Аберрантная печеночная артерия, в особенности
правая печеночная артерия, имеется у 10-20%
пациентов. Обычно встречаются следующие варианты
ветвления правой печеночной артерии: медиальная правая
печеночная артерия, которая проходит сзади общего
желчного протока (60%), медиальная правая
печеночная артерия, проходящая кпереди от общего
желчного протока (25%), и аберрантная печеночная артерия,
Типы повреждений
Классическое повреждение: резекция внепеченочного билиарного дерева
Пузырный проток: повреждение общего желчного протока
Пузырный проток: повреждение правого печеночного протока
Клипирование/пересечение правого печеночного протока
Латеральный разрыв общего желчного протока
Послеожоговая стриктура
Истечение желчи из пузырного протока
Рис. 14-3. Типы повреждений.
180 Лапароскопическая хирургия. Атлас
исходящая из верхней брыжеечной артерии и
проходящая сзади от общего желчного протока (15-25%
случаев). Задняя, или аберрантная, правая печеночная
артерия представляет собой опасность при любой дис-
секции ниже пузырного протока, ее диссекцию
необходимо проводить в воротах печени.
ЖЕЛЧНЫЕ ОСЛОЖНЕНИЯ
В результате многолетних наблюдений были
установлены наиболее часто встречаемые осложнения
(рис. 14-3).
Классическое повреждение и его варианты
являются наиболее частыми и грозными осложнениями;
также возможны термические повреждения,
истечение желчи и оставление камней в протоках.
Классическое повреждение
Классическое лапароскопическое повреждение
происходит во время диссекции, в начале холецистэкто-
мии, когда общий желчный проток принимают за
пузырный (рис. 14-4).
Варианты классического повреждения
Часто встречается следующий вариант
классического повреждения: из-за недостаточной диссекции
или тракции, натягивающей общий желчный проток,
после правильно наложенной на проксимальный отдел
пузырного протока клипсы дистальную клипсу
накладывают на общий желчный проток. Пузырный проток
пересекают рядом с его соустьем с общим желчным
протоком, что ведет к образованию тотального
проксимального желчного свища и обструкции общего
желчного протока. Эти повреждения чаще
встречаются у пациентов с коротким пузырным протоком
или при его отсутствии. Общепринята классификация
повреждений вследствие неправильной
идентификации Страсберга (Strasberg) [8, 9]. Эта классификация
приведена на рис. 14-5, ее должен знать каждый
лапароскопический хирург, занимающийся операциями
на желчных путях, так как с ее помощью можно
установить несколько важных «ловушек» неправильной
идентификации.
КЛАССИЧЕСКОЕ ПОВРЕЖДЕНИЕ
li""-' = \
Р\\ -^Я
К—:^ л» -~~--jM
v^:; \ la
Пересеченные
печеночные -""*
протоки
I
■
Sp|^: /
\Жи
//
/й
/
1
ИР:
ШЫ
Рис. 14-4. Мелкий сосуд, сопровождающий общий желчный проток или подходящий
к нему, принят за пузырную артерию, клипирован и пересечен. Затем крупные
протоки подверглись диссекции из окружающих структур в воротах печени,
клипированы, пересечены и удалены вместе с желчным пузырем. При этом
поврежден общий желчный проток и резецированы сегменты крупных
внепеченочных желчных протоков. В таком случае часто повреждается правая
печеночная артерия вследствие ее близости к протокам, мобилизованным в области,
которая ошибочно была принята за ложе желчного пузыря. Проксимальные
протоки пересечены начиная от уровня, расположенного сразу ниже бифуркации
печеночного протока до уровня значительно выше бифуркации.
Глава 14. Осложнения лапароскопической холецистэктомии 181
Рис. 14-5. Классификация повреждений билиарного тракта при лапароскопической холецистэктомии Страсберга {Strasbergetal. [9]).
Термическое повреждение
Второй по распространенности тип крупных
повреждений билиарной системы связан с
избыточной электрокоагуляцией, вызывающей образование
стриктур желчных протоков. Это может произойти
при неоправданном использовании
электрокоагуляции во время первичной мобилизации пузырного
протока (рис. 14-6). Пересечение протоков и сосудов
в этой области нельзя проводить с помощью
электрокоагулятора, так как распространение термальной
энергии на протоки может привести к
катастрофическим результатам. Термическое повреждение влечет
за собой коагуляцию и нарушение кровоснабжения
тонких протоков нормальной билиарной системы,
имеющих маленький калибр. Кровоснабжение может
быть нарушено и в связи с аномальным
кровоснабжением, которое особенно повышает риск повреждения
(рис. 14-7). Эти повреждения могут быть
диагностированы через недели и месяцы после операции, и
реконструкция их очень сложна.
ТЕРМИЧЕСКОЕ ПОВРЕЖДЕНИЕ
Термическое повреждение
общего печеночного
протока
<^^9^h.
Мв:-~:
£е?ь~"~ -'■'"""-•51Я
i
1 1
te^":7^K'
Ив!
/$^]йШШ
f^f <ifr"\
Am
W
Такое направление
диссекции (если ему
1 следовать) приведет
1 к случайному пересечению
1 правого печеночного протока
гда
| W$F Термическое
Г/ ^ повреждение
BSs. правого
' J печеночного
протока
Рис. 14-6. Неправильное применение электрокоагуляции
или лазера на начальном этапе диссекции пузырного протока.
Термальная энергия может коагулировать кровеносные
сосуды или непосредственно повреждать общий желчный
проток, приводя к рубцеванию и формированию стриктуры.
Рис. 14-7. Лазерная или электродиссекция желчного пузыря
от его ложа, которую проводят на неадекватном расстоянии
от стенки правого печеночного протока, может привести
к пересечению протока или его стриктуре.
182 Лапароскопическая хирургия. Атлас
Желчеистечение
Желчеистечение после лапароскопической холецист-
эктомии могут обусловить различные повреждения
билиарного дерева или другие технические проблемы.
Желчеистечение после операции возможно при
классическом повреждении и его вариантах, частичном
разрыве протока (рис. 14-8), повреждении
добавочного желчного протока и из пузырного протока.
Истечение желчи из ложа желчного пузыря или мелкого
добавочного протока трудно распознать во время
операции [10]. Небольшое истечение желчи наблюдается
чаще, чем этого следовало ожидать, но не приводит
к побочным эффектам [11]. Значительное истечение,
однако, в итоге ведет к развитию желчного перитонита
или болям, при которых требуется проведение
обследования. Фактически жалобы любого пациента на дис-
ЖЕЛЧЕИСТЕЧЕНИЕ
Рис. 14-8. Разрыв латеральной стенки общего желчного
протока, который приводит к послеоперационному
истечению желчи, может быть вызван слишком агрессивной
латеральной тракцией шейки желчного пузыря.
комфорт после операции, часто сразу после выписки,
[СТ_ должны заставить хирурга провести обследование
лия на предмет возможного желчеистечения, которое мо-
мы жет быть отдаленным проявлением нераспознанного
гас- повреждения протоков [12]. Истечение желчи при от-
юм сутствии повреждений крупных протоков обычно
оч- прекращается после стентирования, дренирования
Ис- брюшной полости перкутанными дренажами или при-
ого менения комбинации двух этих методов. Подтекание
,пе- желчи из культи пузырного протока может отмечаться
тся при неадекватном наложении клипсы или ее миграции
цит (рис. 14-9) либо когда она наложена слишком грубо
гие, и вызвала некроз протока в результате сдавления. Это
ита особенно характерно для случаев острого холецистита,
:ле- когда ткани отечные и рыхлые.
Рис. 14-9. Неаккуратно наложенная клипса может слететь
с пузырного протока при манипуляциях с желчным пузырем
или пузырной артерией, что приведет к послеоперационному
желчеистечению.
Глава 14. Осложнения лапароскопической холецистэктомии 183
Диагностика
Повреждение желчных путей может оказаться
нераспознанным во время операции, даже в случае
проведения холангиографии [13]. Обзор видеосъемок
операций, при которых случались повреждения, показал,
что ключ к источнику повреждения следовало искать
во время операции [14]. Специфическими ключами
к выявлению повреждений желчных протоков
являются: пузырный проток с большим, чем обычно,
диаметром; наличие необъяснимой желтой желчи
печеночного типа; необычное кровотечение; кровотечение
из мест, в которых его трудно остановить, или
пересечение двух разных протоков.
Большинство пациентов жалуются на наличие боли
как начального симптома повреждения (рис. 14-10).
Полная обструкция желчных путей или холангит
обычно нехарактерны для повреждения желчных
протоков. Лапароскопическая холецистэктомия, как
правило, не сопровождается сильными болями после
операции, и пациенту с неадекватными болями, которые
персистируют после операции, необходимо провести
РХПГ или КТ (рис. 14-11). Простой и неинвазивный
тест для определения желчетечения — радионуклид-
ный метод с использованием 99mTc-IDA (HIDA scan).
Небольшое подтекание желчи в ложе желчного пузыря
или моррисонов карман можно обнаружить с
помощью изотопного сканирования, а желчный асцит
может располагаться по всей брюшной полости или
скапливаться в отлогих местах.
Если подозревают желчеистечение или
обструкцию желчных путей, первым методом обследования
в алгоритме лечения станет РХПГ (рис. 14-12). С ее
помощью можно установить полную обструкцию
общего желчного протока при классическом
повреждении или одном из его вариантов либо
неполную обструкцию или утечку желчи. Помимо этого,
при использовании РХПГ возможно проведение
других инвазивных процедур (стентирования, бужиро-
вания стриктуры, сфинктеротомии или экстракции
камня). Для диагностики проксимальных
повреждений желчных путей и для выявления источника
утечки желчи полезно провести чреспеченочную
холангиографию. Дренажи, которые устанавливают
во время чрескожной чреспеченочной
холангиографии, важны для интраоперационной
идентификации поврежденных протоков. Если планируются
ревизия и реконструктивная операция, их
необходимо установить с двух сторон. Проведение КТ после
установки перкутанных дренажных трубок и
введения контраста может способствовать дренированию
скоплений желчи и предоперационной
стабилизации состояния пациента. Первостепенную важность
имеют быстрая диагностика и направление в
специализированные центры [12, 14-20].
Признаки и симптомы
повреждения
Признак или
симптом
Боль в животе
Лихорадка
Тошнота/рвота
Вздутие живота
Желтуха
Анорексия
Причина
Химический/
бактериальный
перитонит
Холангит,
перитонит
Перитонит, илеус
Илеус, билома
Обструкция
желчного
протока
Илеус, билома,
обструкция
Метод
тоды диагностики повреждени:
Доступные методы
На что он указывает лечения
Эндоскопическая ретроградная Дистальную анатомию
холедохопанкреатография
Компьютерная томография
Перкутанная чреспеченочная
холангиография
Радионуклидные методы
протоков, утечку желчи,
локализацию стриктур
Скопление желчи,
расширение протоков
Проксимальную
анатомию протоков,
места утечки желчи,
разрывов, стриктур
Утечку желчи/
скопление желчи,
обструкцию
Баллон для
папиллотомии,
камни
Дренирование
абсцесса/биломы
Стенты для
идентификации
протоков/
дренирования,
баллонная дилатация
Нет
Рис. 14-10. Признаки и симптомы
повреждения.
Рис. 14-11. Методы диагностики повреждений.
184 Лапароскопическая хирургия. Атлас
Подозреваемое
повреждение
ЭРХПГ
Культя
пузырного протока
Стриктура
Висмут
1 или 2
\ 7
ПЧХ или ЭРХПГ, баллонная
дилатация,стентирование j
в течение 3-6 мес
Реконструктивная
операция, если это необходимо!
Висмут
Зили4
ЧЧХ и двустороннее
стентирование
Реконструктивная
операция
Рис. 14-12. Алгоритм лечения повреждений желчных протоков. ЭРХПГ — эндоскопическая ретроградная
холангиопанкреатография; ЧЧХ — чрескожная чреспеченочная холангиография.
Лечение
Классическое повреждение и его варианты подлежат
реконструкции с помощью гепатикоеюноанастомоза
по Ру (рис. 14-13). Так поступают независимо от
времени выявления повреждения, будь то во время
операции или, как это обычно бывает, через дни и недели
после первичной процедуры. Перед операцией
необходимо точно идентифицировать анатомию холедоха
и установить чреспеченочные дренажи (рис. 14-14).
С помощью гепатикоеюноанастомоза по Ру можно
реконструировать большинство повреждений, в том
числе и повреждения внутрипеченочных желчных
протоков (рис. 14-15). Необходимо, чтобы операцию
проводил опытный гепатобилиарный хирург,
поскольку наилучшие отдаленные результаты имеет именно
первая попытка реконструкции [15, 21-24].
Термальное повреждение или рубцовый процесс
могут вызвать образование стриктуры,
напоминающей рак желчного протока. Плотность и структура
поврежденной ткани могут очень затруднить интра-
операционную идентификацию анатомии протоков
и последующую реконструкцию. Удаленную рубцовую
ткань необходимо послать на гистологическое
исследование. Стриктуры внепеченочных протоков могут
быть вызваны неправильным наложением клипсы
на проток или термальной энергией. Небольшая часть
стриктур поддается лечению с помощью перкутанной
или ретроградной (при РХПГ) баллонной дилатации,
в то время как большинство из них требуют гепатико-
еюностомии. Подтекание желчи из пузырного протока
или при небольших повреждениях общего желчного
протока обычно прекращается после чрескожного
дренирования или при выполнении его комбинации с
эндоскопическим стентированием. В таких ситуациях
РХПГ позволяет диагностировать и излечивать
сопутствующую патологию (к примеру, оставшиеся в про-
Методы лечения истечения желчи
Повреждение
Полный разрыв
протока
Стриктура
Истечение желчи
Полный разрыв
Неполный разрыв
протока
Добавочный
проток
Культя пузырного
протока
Лечение
Гепатикоеюностомия
Гепатикоеюностомия, баллонная
дилатация, стентирование
Гепатикоеюностомия
Реконструкция, стентирование/
папиллотомия
Гепатикоеюностомия, стентирование/
папиллотомия, лигирование
Стентирование/папиллотомия,
реконструкция, октреотид
Рис. 14-13. Методы лечения желчеистечения.
Глава 14. Осложнения лапароскопической холецистэктомии 185
токах камни). Октреотид может снизить объем утечки
и ускорить заживление. Если все перечисленные меры
не привели к достижению желаемого эффекта, в ито-
Рис. 14-14. Перед операцией необходимо провести
чрескожную чреспеченочную холангиографию и установку
дренажей с двух сторон для идентификации протоков
во время оперативного вмешательства.
ге может понадобиться оперативное вмешательство
для прекращения желчеистечения.
Рис. 14-15. Может потребоваться большое количество
анастомозов, хотя некоторые протоки можно мобилизовать
и анастомозировать отдельно. Крайне важно иссекать
всю рубцовую ткань и провести анастомоз «слизистая
к слизистой» на нормальной ткани протока. Анастомозы
необходимо маркировать рентгенопозитивной подковой,
а Y-образный сегмент кишки по Ру следует прикрепить
к передней брюшной стенке и отметить клипсой
или коронарным о-кольцом. Все это способствует
последующему облегченному доступу к билиарному дереву
без чрескожной чреспеченочной холангиографии.
ЛЕЧЕНИЕ
186 Лапароскопическая хирургия. Атлас
Профилактика повреждений
Почти всех повреждений желчных путей во время
лапароскопической холецистэктомии можно
избежать (рис. 14-16) [3, 8, 12, 14]. Перед началом любой
диссекции необходимо четко визуализировать на
мониторе дно желчного пузыря и область ворот печени
(рис. 14-17—14-19). Желудок, двенадцатиперстная
кишка, ободочная кишка или печень не должны
заслонять операционное поле. Анализ видеозаписей
операций, при которых произошло повреждение, показал,
что неадекватная визуализация из-за неопытности
хирурга или механических трудностей может
привести к неправильной интерпретации анатомии и
последующему повреждению. До тех пор, пока с точностью
не будет определено место перехода пузырного протока
в шейку желчного пузыря, нельзя накладывать клипсы
или пересекать трубчатые структуры.
Наиболее важны четыре признанных метода
идентификации анатомии: холангиография, критическая
оценка ситуации, инфундибулярная техника и дис-
секция основных желчных протоков таким образом,
чтобы идентифицировались общий желчный, общий
печеночный и пузырный протоки в местах их слияний.
Страсберг заявляет, что два последних метода
неприемлемы, так как могут ввести оператора в заблуждение
или потенциально принести много вреда. Другими
специалистами, в том числе и авторами настоящей главы,
рекомендуется метод критической оценки ситуации
[8, 25]. Проводят адекватную мобилизацию
треугольника Кало, которая позволяет убедиться в том, что нет
структур, идущих в сторону печени, а имеются только
структуры, соединенные с воронкой желчного пузыря.
Через «окно», образовавшееся при диссекции,
проводят инструмент, что и доказывает правильную
интерпретацию анатомии.
Интраоперационная холангиография особенно
необходима для профилактики повреждений желчных
путей [4, 12, 26-31]. С ее помощью можно
идентифицировать добавочные желчные протоки, и тогда (в
небольшом числе случаев) на основании проведенной
интраоперационной холангиографии будет изменен
план операции. Вопрос об обязательности
проведения холангиографии остается спорным. Однако ее
необходимо провести при возникших затруднениях
относительно анатомии протоков, осложненной
диссекции или в случае неопытности хирурга. Недавно
проведенное исследование, включавшее 171 пациента
с повреждениями желчных путей при
лапароскопической холецистэктомии, показало, что если проводили
интраоперационную холангиографию, тяжесть и
степень повреждения по Висмуту были менее тяжелыми.
К тому же во многих случаях правильная
интерпретация холангиограмм может препятствовать переходу
повреждения на более серьезный уровень. В
заключение необходимо отметить, что следует всегда
придерживаться консервативных взглядов относительно
конверсии лапароскопической холецистэктомии в
открытую операцию. Конверсию в открытую операцию
следует воспринимать не как осложнение или признак
неопытности, а как проявление здравомыслия.
Методы, позволяющие избежать
повреждений
Четкая, незатрудненная визуализация воронки/
треугольника Кало
Хорошая краниальная ретракция дна пузыря, ретракция
воронки книзу и латерально
Диссекция жировой/ареолярной ткани от воронки по
направлению к общему желчному протоку и никогда
наоборот
Абсолютная визуализация соустья пузырного протока
и желчного пузыря, освобожденных от других тканей
Холангиография для подтверждения анатомии
и исключения другой патологии
Добавочные/аномальные протоки встречаются редко,
не надо искать их там, где их нет
Проток, который шире, чем стандартная клипса, является
общим желчным протоком, за исключением случаев, когда
не доказано другое мнение
Нельзя вслепую применять клипирование или
электрокоагуляцию для остановки кровотечения
Часто для очистки операционного поля и оптимизации
обзора необходимо применять орошение
Рутинно применяют от шести до восьми клипс, если
необходимо большее их количество, надо провести
конверсию в открытую операцию
Задайте себе вопрос, ведь, возможно, если вам приходится
проводить конверсию в открытую операцию, то это значит,
что вы должны это сделать
Рис. 14-16. Методы, позволяющие избежать повреждений.
Глава 14. Осложнения лапароскопической холецистэктомии 187
ПРОФИЛАКТИКА
ПОВРЕЖДЕНИЙ
yf
0^£-—-\=Ё~
JH===. -•-—
i5n^_: ■' -V-j
plv-=3
fl * ~-:,
1 Щ
Щ ;;=.^И
/
i
1
IB
Правильное
направление
диссекции малого
сальника от пузырного
протока тупым путем
Шшё
Ши
1ш
II т х
1К
Рис. 14-17. Адекватная тракция желчного пузыря весьма
важна для визуализации слияния пузырного протока
и желчного пузыря. Необходимо максимально оттянуть дно
пузыря в краниальном направлении, а шейку — латерально
и книзу, под углом 90° к общему желчному протоку. Тракция
должна быть сильной, но не избыточной (для профилактики
втяжения общего желчного протока в операционное поле).
Рис. 14-18. Необходимо проводить диссекцию
адвентициальной жировой ткани, окружающей шейку
желчного пузыря, в направлении от шейки к общему
желчному протоку и никогда наоборот. Этот принцип
диссекции «от желчного пузыря» справедлив и для выделения
пузырной артерии.
Общий печеночный
проток скрыт
за пузырным протоком
Рис. 14-19. А — неадекватная
по силе и направлению краниальная
тракция шейки желчного пузыря
может привести к линейному
расположению пузырного протока (а)
и общего желчного протока (б). Это
предрасполагает к тому, что общий
желчный проток неправильно
идентифицируется (как дистальный
отдел пузырного протока), что ведет
к классическому повреждению.
Идентифицированы правый (в)
и левый (г) печеночные протоки.
Б — неадекватная медиальная
и краниальная тракция шейки
предрасполагает к повреждению
общего печеночного и правого
печеночного протоков даже в случае
правильной идентификации
пузырного протока.
188 Лапароскопическая хирургия. Атлас
РАЗНООБРАЗНЫЕ ОСЛОЖНЕНИЯ
Кровотечение
Источником кровотечения, не связанного с
повреждением желчного протока, может быть диссекция
около ворот печени, культя пузырной артерии или само
ложе желчного пузыря. Кровотечение из ворот печени
должно стать показанием к конверсии в открытую
операцию, так как неточное клипирование или
электрокоагуляция могут повредить желчный проток или
усилить кровотечение. Культю пузырной артерии можно
захватить и повторно наложить клипсы или петлевой
узел. Если это окажется трудным из-за интенсивности
кровотечения, необходимо немедленно перевести
операцию в открытую форму. Кровотечение из ложа
желчного пузыря можно прижать самим органом, если он
еще не отсечен. Можно еще коагулировать отдельные
источники кровотечения, а для тампонады
кровотечения из печеночного ложа использовать местные гемо-
статические агенты. Продолжающееся кровотечение,
которое трудно остановить, или кровотечение,
исходящее из ворот печени, могут привести к повреждению
желчных протоков, поэтому в таком случае показана
конверсия в открытую холецистэктомию.
Камни, выпавшие из желчного пузыря
Камни могут выпасть из желчного пузыря во время
диссекции его от ложа или при извлечении желчного
пузыря из брюшной полости (рис. 14-20).
Попадание камней в брюшную полость обычно
не вызывает осложнений, но описаны подпеченочные
и внутрибрюшные абсцессы, обусловленные
такими камнями. В этих случаях требуются лапаротомия,
удаление камней и дренирование абсцесса.
Существуют сообщения о миграции камней в ткань печени,
желудочно-кишечный тракт, а также через диафрагму
в ткань легкого, что вызвало выделение камней с
мокротой и холелиторею [32-38]. Сответствующая анти-
биотикотерапия, аспирация желчи и орошение
брюшной полости в случае наличия оставшихся в брюшной
полости камней приводят к тому, что
послеоперационный период не отличается от такового при отсутствии
перфорации желчного пузыря.
Электрохирургическое повреждение
Очевидно, что использование электрохирургии
весьма важно для проведения лапароскопической холе-
цистэктомии. Детальный обзор этой темы находится
за рамками темы данной главы, но она хорошо описана
в других источниках. Для безопасного использования
электрохирургии в лапароскопии требуется
понимание некоторых основных принципов (рис. 14-21).
Длина лапароскопических инструментов
достигает 30-50 см. Однако поле зрения на мониторе в
процессе операции составляет обычно не более 5-10 см
в диаметре. Таким образом, все происходящее с
проксимальными 20 см инструмента при работающем
электрооборудовании остается за пределами
видимости хирурга. Хотя большинство инструментов имеет
изоляцию, адекватную для стандартного применения,
большая часть изолированной поверхности
инструмента хирургу не видна. Если защитный слой
повреждается, может произойти электротравма окружающих
органов брюшной полости [39].
С распространением лапароскопии в общей
хирургии резко увеличилось количество конструкций
инструментов. В качестве одного из неудачных
сочетаний можно назвать комбинацию металла и
пластика при изготовлении троакара и его канюли.
Прохождение металлической канюли через пластиковую
втулку необходимо признать негодным из-за ее
способности создавать емкостную пару с последующим
Потенциальные
осложнения,
вызываемые
выпавшими камнями
Абсцесс
Подпеченочный
Поддиафрагмальный
Межкишечный
Миграция камней
Трансдиафрагмальная
Внутрипеченочная
Трансбронхиальная
Опасность применения электрохирургического
оборудования и возможные осложнения
Опасность
Повреждение изоляции
Комбинация металла и пластика в
конструкции троакара и его кожуха
Узкое поле зрения
Утрата тактильной чувствительности
Потенциальные последствия
Искровой разряд в прилежащие органы
брюшной полости
Формирование емкостной пары
с разрядом в прилежащие органы
брюшной полости
Электрохирургические осложнения,
происходящие вне поля зрения
Интенсивное образование тепла на
концах длинных инструментов
Рис. 14-20. Потенциальные
осложнения, вызываемые выпавшими
камнями.
Рис. 14-21. Опасность применения электрохирургического оборудования
и возможные осложнения.
Глава 14. Осложнения лапароскопической холецистэктомии 189
разрядом электрической энергии в полые органы
(рис. 14-22). К тому же инструменты с
присоединенным монополярным источником тока могут случайно
контактировать с лапароскопом. Если используется
цельнометаллический кожух, ток безопасно проходит
через троакар и брюшную стенку. Однако если кожух
пластиковый, ток может проходить через
прилежащие органы, находящиеся вне операционного поля,
потенциально вызывая их повреждение. Электро-
ЭЛЕКТРОХИРУРГИЧЕСКОЕ
ПОВРЕЖДЕНИЕ
Лапароскопическкая холецистэктомия в настоящее
время — «золотой стандарт» в лечении
симптоматических камней желчного пузыря. Эта операция
безопасна, а осложнения встречаются достаточно редко [5,40].
Однако возникшие осложнения могут вызывать
тяжелые последствия. Поскольку требования к хирургии
желчного пузыря в настоящее время такие, что
некоторые врачи проводят лапароскопическую холецист-
эктомию как хирургию одного дня [41-43], наличие
тяжелых осложнений может весьма негативно
сказаться как на пациенте, так и на самом хирурге.
Неудивительно, что это привело к быстрому росту количества
судебных исков относительно врачебной
ответственности и сделало повреждение желчных путей наиболее
частой причиной судебных разбирательств в гастро-
интестинальной хирургии [44]. Внедрение в практику
лапароскопической холецистэктомии привело к
некоагулятор при соприкосновении с тканями активно
генерирует тепло. Тепло, которое передается во
время диссекции пузырного протока, пузырной артерии
или окружающих тканей на билиарное дерево, может
вызвать ишемию и образование стриктур внепече-
ночных или внутрипеченочных желчных протоков.
Для профилактики грозных осложнений
рекомендуется крайне осторожное использование
электрохирургического оборудования.
Рис. 14-22. Электрический разряд от инструмента
с дефектами изоляции либо вследствие образования
емкостной пары, который может вызвать ожог
двенадцатиперстной или ободочной кишки с последующей
перфорацией или ожог желчного протока с последующим
образованием стриктуры.
большому увеличению частоты возникновения
наиболее серьезных повреждений желчных путей, хотя
точная информация на эту тему отсутствует. Частота
образования повреждений, по данным различных
современных исследований, составляет примерно от 0,3
до 0,6%.
Избежать наиболее серьезных осложнений
помогают строгое следование рекомендациям в отношении
диссекции треугольника Кало и получение
«необходимого вида» операционного поля либо же осознанная
конверсия в открытую операцию или даже холецисто-
стомию. Хотя авторы главы и применяют холангиогра-
фию селективно, неправильная идентификация
анатомических структур все еще приводит к ятрогенным
повреждениям, и при исследовании больших групп
населения получены интересные данные, которые
показали снижение частоты образования повреждений
РЕЗУЛЬТАТЫ
190 Лапароскопическая хирургия. Атлас
при плановом применении холангиографии [4]. В
действительности пока нельзя сделать точных выводов
по этому вопросу, и его разрешение будет возможным
только в случае проведения достаточно масштабного
проспективного рандомизированного исследования.
Данное исследование поможет выяснить, приемлем ли
такой метод.
Если осложнение уже имеет место, разумным
будет направить пациента в специализированный центр
СПИСОК ЛИТЕРАТУРЫ
1. Archer S.B., Brown D.W., Smith CD. et al: Bile duct injury during
laparoscopic cholecystectomy: results of a national survey // Ann.
Surg. — 2001. — Vol. 234. — P. 549-558; discussion — P. 558-559.
2. Calvete J., Sabater L., Camps B. et al. Bile duct injury during
laparoscopic cholecystectomy: myth or reality of the learning
curve? // Surg. Endosc. — 2000. — Vol. 14. — P. 608-611.
3. Misra M., Schiff J., Rendon C. et al. Laparoscopic cholecystectomy
after the learning curve: what should we expect? // Surg. Endosc. —
2005. — Vol. 19. — P. 1266-1271.
4. Flum D.R., Dellinger E.P., Cheadle A. et al. Intraoperative
cholangiography and risk of common bile duct injury during
cholecystectomy // JAMA. — 2003. — Vol. 289. — P. 1639-1644.
5. Keus E, de Jong J.A., Gooszen H.G., van Laarhoven C.J.
Laparoscopic versus open cholecystectomy for patients with
symptomatic cholecystolithiasis // Cochrane Database Syst. Rev. —
2006. — Vol. 4:CD006231.
6. Strasberg S.M., Eagon C.J., Drebin J.A. The «hidden cystic
duct» syndrome and the infundibular technique of laparoscopic
cholecystectomy: the danger of the false infundibulum //
J. Am. Coll. Surg. — 2000. — Vol. 191. — P. 661-667.
7. Meyers W.C., Peterseim D.S., Pappas T.N. et al. Low insertion of
hepatic segmental duct VII-VIII is an important cause of major
biliary injury or misdiagnosis // Am. J. Surg. — 1996. — Vol. 17. —
P. 187-191.
8. Strasberg S.M. Avoidance of biliary injury during laparoscopic
cholecystectomy // J. Hepatobiliary Pancreat. Surg. — 2002. —
Vol. 9. — P. 543-547.
9. Strasberg S.M., Hertl M., Soper N.J. An analysis of the problem of
biliary injury during laparoscopic cholecystectomy // J. Am. Coll.
Surg. — 1995. — Vol. 180. — P. 101-125.
10. Spanos C.P., Syrakos T. Bile leaks from the duct of Luschka
(subvesical duct): a review // Langenbecks Arch. Surg. — 2006. —
Vol. 391. — P. 441-447.
11. Dominguez E.P., Giammar D., Baumert J., Ruiz O. A prospective
study of bile leaks after laparoscopic cholecystectomy for acute
cholecystitis // Am. Surg. — 2006. — Vol. 72. — P. 265-268.
12. Strasberg S.M. Biliary injury in laparoscopic surgery: part 2.
Changing the culture of cholecystectomy // J. Am. Coll. Surg. —
2005. — Vol. 201. — P. 604-611.
13. Davidoff A.M., Pappas T.N., Murray E.A. et al. Mechanisms of
major biliary injury during laparoscopic cholecystectomy // Ann.
Surg. — 1992. — Vol. 215. — P. 196-202.
14. Branum C, Schmitt C, Baillie J. et al. Management of major biliary
complications after laparoscopic cholecystectomy // Ann. Surg. —
1993. — Vol. 217. — P. 532-540; discussion — P. 540-541.
Глава 14. (
для проведения соответствующей реконструкции.
Повреждения потенциально сопровождаются высокой
частотой послеоперационных осложнений и
значительным уровнем смертности [12,15,16,18,19,21,22,45].
Новые методы периоперационной идентификации
и изображения анатомии сосудов и желчных протоков
помогут еще более снизить частоту образования
повреждений при лапароскопической холецистэктомии
[46,47].
15. Connor S., Garden O.J. Bile duct injury in the era of laparoscopic
cholecystectomy // Br. J. Surg. — 2006. — Vol. 93. — P. 158-168.
16. de Santibanes E., Palavecino M., Ardiles V, Pekolj J. Bile duct
injuries: management of late complications // Surg. Endosc. —
2006. — Vol. 20. — P. 1648-1653.
17. Lillemoe K.D. Evaluation of suspected bile duct injuries // Surg.
Endosc. — 2006. — Vol. 20. — P. 1638-1643.
18. Melton G.B., Lillemoe K.D., Cameron J.L. et al. Major bile duct
injuries associated with laparoscopic cholecystectomy: effect
of surgical repair on quality of life // Ann. Surg. — 2002. —
Vol. 235. — P. 888-895.
19. Mercado M. A. Early versus late repair of bile duct injuries // Surg.
Endosc. — 2006. — Vol. 20. — P. 1644-1647.
20. Savar A., Carmody I., Hiatt J.R., Busuttil R.W. Laparoscopic bile
duct injuries: management at a tertiary liver center // Am. Surg. —
2004. — Vol. 70. — P. 906-909.
21. Bachellier P., Nakano H., Weber J.C. et al. Surgical repair after bile
duct and vascular injuries during laparoscopic cholecystectomy:
when and how? // World J. Surg. — 2001. — Vol. 25. — P. 1335-
1345.
22. Lillemoe K.D., Martin S.A., Cameron J.L. et al. Major bile duct
injuries during laparoscopic cholecystectomy. Follow-up after
combined surgical and radiologic management // Ann. Surg. —
1997. — Vol. 225. — P. 459-468; discussion — P. 468-471.
23. Lillemoe K.D., Melton G.B., Cameron J.L. et al. Postoperative bile
duct strictures: management and outcome in the 1990s // Ann.
Surg. — 2000. — Vol. 232. — P. 430-441.
24. Sicklick J.K., Camp M.S., Lillemoe K.D. et al. Surgical management
of bile duct injuries sustained during laparoscopic cholecystectomy:
perioperative results in 200 patients // Ann. Surg. — 2005. —
Vol. 241. — P. 786-792; discussion — P. 793-795.
25. Callery M.P. Avoiding biliary injury during laparoscopic
cholecystectomy: technical considerations // Surg. Endosc. —
2006. — Vol. 20. — P. 1654-1658.
26. Debru E., Dawson A., Leibman S. et al. Does routine intraoperative
cholan-giography prevent bile duct transection? // Surg. Endosc. —
2005. — Vol. 19. — P. 589-593.
27. Lillemoe K.D., Yeo C.J., Talamini M.A. et al. Selective
cholangiography: current role in laparoscopic cholecystectomy //
Ann. Surg. — 1992. — Vol. 215. — P. 669-674; discussion —
P. 674-676.
28. Metcalfe M.S., Ong T, Bruening M.H. et al. Is laparoscopic
intraoperative cholangiogram a matter of routine? // Am. J. Surg. —
2004. — Vol. 187. — P. 475-181.
эжнения лапароскопической холецистэктомии 191
29. Nickkholgh A., Soltaniyekta S., Kalbasi H. Routine versus
selective intraoperative cholangiography during laparoscopic
cholecystectomy: a survey of 2130 patients undergoing laparoscopic
cholecystectomy // Surg. Endosc. — 2006. — Vol. 20. — P. 868-874.
30. Soper N.J., Dunnegan D.L. Routine versus selective
intraoperative cholangiography during laparoscopic cholecystectomy //
World J. Surg. — 1992. — Vol. 16. — P. 1133-1140.
31. Traverso L.W. Intraoperative cholangiography lowers the risk of bile
duct injury during cholecystectomy // Surg. Endosc. — 2006. —
Vol.20.— P. 1659-1661.
32. Assaff Y., Matter I., Sabo E. et al. Laparoscopic cholecystectomy for
acute cholecystitis and the consequences of gallbladder perforation,
bile spillage, and «loss» of stones // Eur. J. Surg. — 1998. —
Vol. 164.— P. 425-431.
33. Brockmann J.G., Kocher Т., Senninger N.J., Schurmann G.M.
Complications due to gallstones lost during laparoscopic
cholecystectomy// Surg. Endosc. — 2002. — Vol. 16. — P. 1226-1232.
34. Hashimoto M., Matsuda M., Watanabe G. Reduction of the risk
of unretrieved stones during laparoscopic cholecystectomy //
Hepatogastroenterology. — 2003. — Vol. 50. — P. 326-328.
35. Mc Donald M.P., Munson J.L., Sanders L. et al. Consequences of
lost gallstone // Surg. Endosc. — 1997. — Vol. 11. — P. 774-777.
36. LaufFer J.M., Krahenbuhl L., Baer H.U. et al. Clinical manifestations
of lost gallstones after laparoscopic cholecystectomy: a case report
with review of the literature // Surg. Laparosc. Endosc. — 1997. —
Vol. 7. — P. 103-112.
37. Memon M.A., Deeik R.K., Mam T.R., Fitzgibbons R.J., Jr. The
outcome of unretrieved gallstones in the peritoneal cavity during
laparoscopic cholecystectomy. A prospective analysis // Surg.
Endosc. — 1999. — Vol. 13. — P. 848-857.
38. Zamir G., Lyass S., Pertsemlidis D., Katz B. The fate of the dropped
gallstones during laparoscopic cholecystectomy // Surg. Endosc. —
1999.— Vol. 13.— P. 68-70.
39. Berry S.M., Ose K.J., Bell R.H., Fink A.S. Thermal injury of the
posterior duodenum during laparoscopic cholecystectomy // Surg.
Endosc. — 1994. — Vol. 8. — P. 197-200.
40. Gurusamy K.S., Samraj K. Early versus delayed laparoscopic
cholecystectomy for acute cholecystitis // Cochrane Database Syst.
Rev. — 2006. — Vol. 4:CD005440.
41. Lillemoe K.D., Lin J.W., Talamini M.A. et al. Laparoscopic
cholecystectomy as a «true» outpatient procedure: initial experience
in 130 consecutive patients // J. Gastrointest. Surg. — 1999. —
Vol. 3. — P. 44-49.
42. Calland J.F., Tanaka K., Foley E. et al. Outpatient laparoscopic
cholecystectomy: patient outcomes after implementation of a
clinical pathway // Ann. Surg. — 2001. — Vol. 233. — P. 704-715.
43. Vuilleumier H, Halkic N. Laparoscopic cholecystectomy as a day
surgery procedure: implementation and audit of 136 consecutive
cases in a university hospital // World J. Surg. — 2004. — Vol. 28. —
P. 737-740.
44. Strasberg S.M. Biliary injury in laparoscopic surgery: part
1. Processes used in determination of standard of care in
misidentification injuries // J.Am. Coll. Surg. — 2005. —
Vol. 201. — P. 598-603.
45. Flum D.R., Cheadle A., Prela С et al. Bile duct injury during
cholecystectomy and survival in medicare beneficiaries // JAMA. —
2003. — Vol. 290. — P. 2168-2173.
46. Ausch C, Hochwarter G., Taher M. et al. Improving the safety
of laparoscopic cholecystectomy: the routine use of preoperative
magnetic resonance cholangiography // Surg. Endosc. — 2005. —
Vol. 19. — P. 574-580.
47. Machi J., Oishi A. J., Tajiri T. et al. Routine laparoscopic ultrasound
can significantly reduce the need for selective intraoperative
cholangiography during cholecystectomy // Surg. Endosc. —
2007. — Vol. 21. — P. 270-274.
192 Лапароскопическая хирургия. Атлас
наш:
Лапароскопическая
резекция печени
Сриневас К. Редди, Брайн М. Клэри
Gagner et al. [1] сообщили о первой
лапароскопической резекции печени (ЛРП) в 1992 г. Неанатомическая
ЛРП была проведена двум пациентам — с очаговой
нодулярной гиперплазией и метастазом колоректаль-
ного рака. Первая анатомическая резекция (левая
латеральная сегментэктомия) была проведена Azagra et
al. [2] в феврале 1993 г. Хотя минимально инвазивная
хирургия распространилась в других областях
хирургии, возникло несколько препятствий для широкого
применения ЛРП. К ним относились трудности в вое-
проведении техники мобилизации и рассечения,
которые применяются при открытой резекции, страх перед
неконтролируемым кровотечением или газовой
эмболией, возможность метастазирования в места портов,
недостаточный опыт операторов в лапароскопической
и печеночной хирургии и отсутствие
рандомизированных исследований по ЛРП. Задача этой главы —
обзор приобретенного к настоящему времени опыта
в ЛРП и описание авторской методики левосторонней
латеральной секционэктомии, левосторонней геми-
гепатэктомии и клиновидной резекции с ручной ас-
систенцией. Лапароскопическое лечение кист печени
не обсуждается. Авторы не представляют чьих-либо
корпоративных интересов.
ОПЫТ ПРОВЕДЕНИЯ РЕЗЕКЦИИ
В НАСТОЯЩЕЕ ВРЕМЯ
На рис. 15-1 кратко описаны результаты ранних
серий ЛРП при солидных опухолях. Среди этих ранних
серий техники рассечения печеночной ткани, частота
использования маневра Прингла (Pringle) перед
резекцией и подбор пациентов в значительной степени
различаются. Редко проводилась резекция более чем двух
сегментов. Такое значительное различие в ранних
результатах после ЛРП в этих сериях, как, например,
частота конверсии в открытую операцию от 0 до 20%,
необходимость в переливании крови после операции
от 0 до 35% и продолжительность госпитализации,
поддерживает точку зрения о необходимости
длительного курса обучения проведению ЛРП. Несмотря
на то что ЛРП находится еще на заре своего развития,
частота послеоперационных осложнений и смертность
приближаются к результатам открытой операции.
Принципы, извлеченные из этих ранних исследований,
которым следуют и по сегодняшний день, гласят:
• в связи со сложностью операции и
потенциальной необходимостью конверсии в лапаротомию
из-за неконтролируемого кровотечения попытку
проведения ЛРП должны предпринимать только
врачи с большим опытом в лапароскопии и
печеночной хирургии, имеющие в своем распоряжении
необходимые технологии;
• перед началом каждой резекции необходимо
проводить интраоперационное УЗИ, которое нужно
для определения точной локализации
образования относительно основных сосудистых структур
и желчных протоков, диагностики сопутствующей
печеночной патологии, не выявленной перед
операцией, подтверждения диагноза с помощью биопсии
под ультразвуковым контролем и определения
границ резекции, что гарантирует получение
негативного края резекции [3, 6, 8, 10].
Анализ современных крупных серий ЛРП
показывает, что четко определенных показаний к этим
операциям не существует. На рис. 15-2 вкратце описаны
результаты этих исследований. Большинство пациентов
в данных сериях (или все пациенты в некоторых из
серий) оперированы по поводу злокачественных
опухолей, что говорит об аналогичности показаний к ЛРП
и открытой резекции. Хотя большинство
исследователей все еще подбирают для ЛРП пациентов с более
мелкими опухолями, небольшое количество опытных
хирургов резецируют достаточно крупные опухоли
(>5см) и проводят резекции крупных участков печени.
Глава 15. Лапароскопическая резекция печени 193
Однако частота применения окклюзии сосудов ворот
печени и гемостатических агентов на основе
фибрина все еще варьирует в широких пределах. В то время
как уровень смертности (0-6%) и повторных операций
(0-5%) относительно низкий, частота конверсии в
открытую операцию (0-26%), частота
послеоперационных осложнений (5-33%) и продолжительность
послеоперационной госпитализации все еще очень
разнятся. В основном это можно объяснить отсутствием
общепринятой методики проведения ЛРП. Важен тот
факт, что сообщается всего об одном случае
метастаза в место лапароскопического порта (при разрыве
печеночного метастаза почечно-клеточного рака [15])
и трех случаях газовой эмболии [23, 25]. Эти данные
подтверждает большой обзор литературы,
проведенный Gagner et al. [26], который показал, что газовая
эмболия была отмечена только у двух человек,
подвергшихся ЛРП. Общая средняя продолжительность
госпитализации составила 7 дней, примерная крово-
потеря — 315 мл, средняя продолжительность
операции — 198 мин. Общая послеоперационная смертность
составила 0,3%, частота осложнений — 12%, при этом
наиболее частыми осложнениями были асцит и
гидроторакс. Частота выявления послеоперационных
кровотечений, желчных свищей, потребовавших
вмешательства, и печеночной недостаточности составила
1,1; 0,7 и 0,7% соответственно. Конверсия в открытую
операцию потребовалась 2,7% пациентов, чаще всего
из-за интраоперационного кровотечения.
Хотя рандомизированных исследований по данной
тематике не проводили, ретроспективные и
проспективные исследования, сравнивающие пациентов с
соответствующими клиническими случаями,
подвергшихся ЛРП или открытой резекции, показали, что
минимально инвазивная хирургия имеет преимущества
перед открытой и не оказывает дополнительного
негативного влияния на безопасность пациента и
отдаленные результаты операции. На рис. 15-3 кратко
изложены результаты некоторых из этих исследований.
Патологическая картина резецированных образований
и окружавшей их ткани печени отличалась, причем
пять исследований включали только пациентов со
злокачественными опухолями, а два — только пациентов
с циррозом. Частота конверсии в лапаротомию была
низкой во всех исследованиях. В большинстве серий
продолжительность ЛРП была меньшей, чем открытой
резекции, или такой же. Три из десяти исследований
показали более низкую кровопотерю (ПК) после ЛРП.
В остальных исследованиях значительных различий
в этом показателе отмечено не было. В трех из четырех
исследований отметили более быстрое время
возвращения к пероральной диете и в восьми из десяти —
более короткую продолжительность послеоперационной
госпитализации при ЛРП по сравнению с открытой ре-
Исследование
Sue//era/. [4]
Marks etai. [10]
17
Berendsetal. [5] 10
Katkhoundaetal.[6] 43*
Descottesetal. [7] 16
Cherquietal.[8] 30
Kanekoetal.[9] 11
28*
Huscner era/. [11] 20
Edwin et al. [12]
Метод рас-
нние серии лапароскопических резекции
Обшир-
Два ная Злока- Мор- Конвер-
сег- резек- чествен- Смерт- бид- сия в от-
мента ция ные ность ность крытую
2002-2004 УД,ЭПШ,ЭС,ЕС 12 5 5(29) 1(6) 4(24)
(71) (29)
0
1993-2000
1990-1997
1994-1999
1996-1999
1993-1995
1989-1995
1993-1995
1998-2000
р,эз,уд
УД,Р
УД, зажим
«Lucane»
ЕС
УД
Nd:YAG,yfl,P
Р,УД
Р,УД,ЕС
2(20)
2(5)
4(25)
8(27)
3(27)
2(7)
8(40)
2(25)
0
0
Кб)
КЗ)
0
0
3(15)
0
3(30)
0
2(13)
12(40)
7(64)
1(4)
18(90)
7(88)
0
0
0
0
0
0
1(5)
0
0
6(14)
1(6)
6(20)
0
6(21)
-
1(12)
2(20)
3(7)
Кб)
2(7)
1(9)
3(11)
0
0
ШШт
ш
ж
Рис. 15-1. Ранние серии лапароскопических резекций печени по поводу солидных опухолей. Обширные резекции — резекции трех
и более сегментов. АК — аргоновый коагулятор; Р — раздавливание с помощью зажима; ЭЗ — эндоскопический зажим; ВП —
внепеченочный;ЭПШ — электрокоагуляция с плавающим шариком; ЛЛС — левосторонняя латеральная секционэктомия; ЛРА —
194 Лапароскопическая хирургия. Атлас
зекцией. Важен тот факт, что ни одно из исследований
не выявило значительных различий в частоте
послеоперационных осложнений и смертности между
указанными методами, что исключает негативное влияние
лапароскопического доступа на безопасность
пациента. В ходе трех исследований показаны отдаленные
результаты у пациентов с печеночно-клеточным раком,
причем разницы в выживаемости без рецидива
заболевания и общей выживаемости после гепатэктомии
между пациентами, подвергшимися ЛРП и открытой
резекции,продемонстрировано не было.
В настоящее время авторы не рекомендуют
проведение ЛРП пациентам, которым показана обширная
гепатэктомия; с декомпенсированным циррозом;
которым, вероятнее всего, потребуются резекция и
реконструкция желчных протоков; которые, вероятнее
всего, имеют мелкие опухоли (как те, которые
получили неоадъювантную терапию или имеют
выраженный стеатоз); пациентам с образованиями, которые,
по данным предоперационных методов визуализации,
расположены близко к крупным сосудам.
ЛАПАРОСКОПИЧЕСКАЯ ОПЕРАЦИЯ
С РУЧНОЙ АССИСТЕНЦИЕЙ
Лапароскопия с ручной ассистенцией (ЛРА) имеет
несколько преимуществ перед полностью
лапароскопической техникой. Наличие руки в операционном
поле повышает безопасность резекции печени [33-
37]. Тактильная чувствительность позволяет точно
идентифицировать ранее выявленные образования
и их взаимосвязь с крупными сосудами и
желчными протоками и снижает риск разрывов паренхимы
благодаря точной установке эндоваскулярного сте-
плера и других инструментов для рассечения печени.
Ретракция печени с помощью руки способствует
мобилизации и улучшает визуализацию перед
рассечением печени как при открытой операции, что трудно
осуществить при чисто лапароскопическом доступе.
Ручная ассистенция позволяет хирургам
симулировать этапы открытой резекции и тем самым снижает
общую продолжительность курса обучения
минимально инвазивному доступу. Пальцевая компрессия
отдельного венозного кровоточащего сосуда или края
резекции печени — отличный способ временного
гемостаза до того, как будут подготовлены средства
для осуществления постоянного гемостаза
(например, аргоновая коагуляция или лигатура для
ушивания). Рука или GelPort (Applied Medical, Rancho Santa
Margarita, CA) позволяют проводить быструю
конверсию в лапаротомию посредством умеренного
увеличения длины разреза. С помощью ручной ассистен-
ции авторы данной главы и другие авторы проводят
резекцию печени при образованиях задней
поверхности правой доли, в то время как опухоли этой ло-
ПК, мл
В среднем 288
Комментарии
В среднем 2,9 ЛРА, без пережатия ворот или ВП венозного контроля
В среднем 156; гемотранс-
фузия у 3 пациентов
Кровь не переливали
В среднем 6 Пациентов с циррозом не было, средняя ДО — 180 мин
В среднем 4,7 Пациентов с циррозом не было, средняя ДО — 179 мин, диета на ПОД № 1,
ВП венозный контроль при ЛЛС
В среднем 5,2 Среднее время до пероральной диеты и ДО — 2,8 и 232 мин соответственно
В среднем 100; гемотранс-
фузия у 1 пациента
Кровь переливали у 3
пациентов
В среднем 9,6
В среднем 7,7
Гемотрансфузия у 7 пациентов В среднем 11
Гемотрансфузия у 7 пациентов В среднем 3
Средняя ДО — 214 мин; маневр Принта и ВП венозный контроль — у 20
пациентов. Включены пациенты с циррозом А по Чайлду
Подъемники для передней брюшной стенки вместо пневмоперитонеума,
включены пациенты с циррозом и хроническим гепатитом
Пациенты с циррозом А по Чайлду с крупной левой и маленькой правой
долей; маневр Принта использовали у 17 из 20 пациентов
Среднее ДО — 165 мин; не использовали ВП венозного контроля и маневр
Принта, в среднем 1 день потребности в опиатах
лапароскопия с ручной ассистенцией; УС — ультразвуковой скальпель, «Harmonicscalpel» {Ethicon Endo-Surgery, Inc., Cincinnati, OH);
ДГ — длительность госпитализации; ДО — длительность операции; ПОД — послеоперационный день; ЭС — эндоваскулярныи степлер;
УД — ультразвуковая диссекция, ПК — приблизительная кровопотеря.
Глава 15. Лапароскопическая резекция печени 195
кализации традиционно избегают при чисто
лапароскопическом доступе [34, 38, 39]. При
злокачественных образованиях ЛРА облегчает стадирование перед
резекцией, демонстрируя признаки внутри- и внепе-
ченочного опухолевого поражения, которые не были
обнаружены методами предоперационной
визуализации и с помощью лапароскопического УЗИ.
Мануальная пальпация во время рассечения также
упрощает следование ранее намеченной линии резекции,
увеличивая вероятность получения негативного края
резекции. Недостаток ЛРА — необходимость в
разрезе длиной 7 см, который хотя и не такой длинный,
как традиционный лапаротомный разрез (и не
требует продления в сторону фланка), но все же снижает
сохранность брюшной стенки и косметические
преимущества чистой минимально инвазивной
хирургии. Устройство «GelPort», которое используют
авторы, толстое, поэтому проблемой может быть утечка
воздуха вокруг порта для ручной ассистенции. Этот
дефект можно свести к минимуму, применяя новые
устройства «Gel» и «HandPort» (Smith&Nephew, Inc.,
Mississauga, Ontario, Canada), которые обеспечивают
хорошую герметичность порта.
ГЕМОСТАЗ
При ЛРП, как и при открытой резекции,
применяют множество способов гемостаза. Для окклюзии
приносящих портальных сосудов при маневре При-
нгла тупым путем обнажают портальную триаду.
Компрессия приносящих печеночных сосудов до-
упные современные серии лапароскопических резекции печени
Обшир-
Исследование
Buelletal. [13]
Паци- Метод рас-
енты, п сечения
100
У, TUP
Злокаче- Размер резек-
ственные, % опухоли, см ция, % ДО, мин
35
В среднем 6 31 В среднем 132
Конверсия
в открытую, %
0
Vibertetal. [14,
15]
O'Rourke etal. [16]
Belli etal. [17]
Descoffesefo/.[18]
Gigotetal. [19]
Kanekoetal. [20]
Mala etal. [21]
Chang etal. [22]
Cherqui et al. [23]
Hashizimetal. [24]
Koffron etal. [25]
Koffron etal. [25]
89
28
16
87
37
52
53
36
27
70
197
138
У,Э
У,ЭС
УС
У,УС,Р
Р,КК,УС,ЭС,У
мтэсдэс,
кн
А, У
УС,ЭС,Э
УС,У
МТЭСДУС
-
_
65
100
100
0
100
>77
85
56
100
67
29
34
-
-
В среднем 2,9
В среднем 6,0
В среднем 3,3
-
В среднем 3
В среднем 4,3
В среднем 3,3
-
-
_
43
25
0
3
5
0
0
0
4
20
37
12
Обширные в
среднем 360,
небольшие в
среднем 180
В среднем 150
В среднем 152
-
-
-
-
В среднем 171,5
В среднем 240
-
В среднем 134
_
13
9,4
6
10
13,5
2
б
3
26
4,2
0
3
* ДГ была дог,
"** Только зна
*** Не отмен
\ыие после резекции более одного сегмента.
чительная морбидность.
ено метастазов в места лапароскопических п
ортов not
ле резекции з
пок,
ячее
твенных опухолей.
Рис. 15-2. Крупные современные серии лапароскопических резекций печени по поводу солидных образований. Цифровые значения
указаны в соответствии. Обширной считается резекция трех и более сегментов. А — «Autosonix» (Misonix, Inc. Farmingdale, NY); P — раздавливание
зажимом; МКР — метастаз колоректального рака в печень; КН — коагуляционные ножницы; Э — электрокоагуляция; ЛРА — лапароскопия
196 Лапароскопическая хирургия. Атлас
стигается с помощью использования в качестве
турникета пупочной ленты, которую проводят вокруг
ворот, а затем, вне брюшной полости, через просвет
резинового катетера. В качестве альтернативного
варианта ворота можно пережать зажимом «бульдог»,
наложенным через порт для ручной ассистенции.
К этому зажиму затем прикрепляют длинный кусок
пупочной ленты, который выводят из брюшной
полости наружу для надежного контроля над зажимом.
По сравнению со многими другими группами врачей
авторы не применяют окклюзию главной
портальной ножки в качестве обыденного или срочного
маневра Прингла. При локальной гепатотомии можно
использовать лигирование отдельных воротных
сосудов (рис. 15-4) [40]. При стандартной левосто-
по поводу солидных образований
роннеи гемигепатэктомии применяют наложение
эндоваскулярного степлера на левую главную ножку
перед рассечением печени. При всех остальных ЛРП
(левосторонняя латеральная сегментэктомия,
правосторонняя гемигепатэктомия и клиновидная
резекция печени) они считают лигирование воротных
сосудов перед началом резекции «золотым
стандартом». Сосуды, приносящие кровь в печень во время
резекции, захватывают в сосудистый степлер.
Существует два метода лигирования вен. Некоторые
хирурги перед резекцией печени обычно обнажают
печеночную вену и пересекают ее с помощью
эндоваскулярного степлера. Авторы же настоящей главы
лигируют внепеченочные вены с помощью степлера
в конце процедуры резекции.
Повтор-
рации, % ДГ, дни
Смерт- Морбид-
ность ность, % Комментарии
В среднем 3 1
В среднем 11 1
23
30
ЛРА без пережатия ворот; гемостатическая губка на основе фибринового
полимера, основными осложениями были кровотечение, желчные свищи
и абсцессы печени
ЛРА в некоторых случаях; диссекция ворот при обширных гепатэктомиях
(маневр Прингла — у 10 пациентов), 40 сопутствующих хирургических
операций, МКР/ПКР: 3-летняя ОВ — 87 и 66% соответственно***
В среднем 6
1 В среднем 5* 0
В среднем 7* 0
14**
13
5
22
10
2-летняя ОВ составляла 75% при МКР, 1 метастаз — в место порта; HALS
применяли при правосторонних гепатэктомиях
Все пациенты имели ПКР и цирроз; гемостатическая губка на основе фибринового
полимера; без гемотрансфузий, рецидивов в области резекции не отмечено
Маневр Прингла — в 9%; фибриновый клей — в 49% случаев; 6%
гемотрансфузий; без рецидивов при наблюдении**
Фибриновые гемостатические губки и маневр Прингла — в 16%; ЛРА — в 8%
случаев; 16% гемотрансфузий; в 19% случаев — сопутствующие хирургические
процедуры; 63% — МКР/ПКР — 2-летняя ОВ составляла 100 и 63% соответственно
ЛРА при патологии верхнего сегмента; ДО снизилась с опытом ***
0
3
4
0
-
В среднем 3,5
В среднем
7,8
В среднем
15,2
В среднем
1,4
-
0
0
0
1
0
0
16
16
33
5
7
Маневр Прингла не применяли, в среднем 1 день потребности в опиатах
Маневр Прингла — в 67%; без гемотрансфузий***
У всех ПКР и хроническое заболевание печени: 74% имели цирроз, 100%
маневр Прингла, 11% гемотрансфузий, 3-летняя ОВ — 93%
Фибриновая гемостатическая губка, два случая газовой эмболии
6% конверсии в ЛРА; один случай газовой эмболии; четыре резекции
хвостатой доли; 1% гемотрансфузий***
ЛРА в 50% случаев; 4% гемотрансфузий
с ручной ассистенцией; КК — коагуляционный крючок; ПКР — печеночно-клеточный рак; МТК — микроволновой тканевый коагулятор; У —
ультразвуковой диссектор/ножницы/аспиратор; УС — ультразвуковой скальпель; ДГ — длительность госпитализации; ДО — длительность
операции; ОВ — общая выживаемость; ЭС — эндоваскулярный степлер;TL — устройство «TissueLinc» {TissueLincMedical, Dover, NH).
Глава 15. Лапароскопическая резекция печени 197
МЕТОДЫ РАССЕЧЕНИЯ
Для рассечения ткани печени при ЛРП применяют
несколько методов, как показано на рис. 15-1 и 15-2
[41]. Некоторые японские хирурги применяли
микроволновой коагулятор для профилактики
кровотечения из ткани печени, расположенной рядом с линией
резекции. Инструмент посылает энергию микроволн
с частотой 2450 МГц к монополярному игольчатому
электроду, который коагулирует ткань печени.
«Ультразвуковой хирургический аспиратор «Кавитрон»
(Cavitron Ultrasonic Surgical Aspirator — CUSA) фраг-
ментирует и аспирирует ткани, бедные коллагеном
(к примеру, ткань печени). В ультразвуковом
скальпеле (harmonic scalpel — «Ethicon Endo-Surgery», Inc.,
Cincinnati, Ohio) использованы высокочастотные
вибрации для денатурации белков и склеивания мелких
сосудов и желчных протоков. Ультразвуковая
резекция имеет несколько преимуществ перед
электрорезекцией: небольшое количество дыма, ограниченную
теплопродукцию и минимальный электрический ток;
все это снижает вероятность термического поражения
других органов. Для рассечения применяют и другие
ультразвуковые устройства: ультразвуковые ножницы
(harmonic shears), ультразвуковой диссектор, ножницы
и аспиратор. Для симуляции техники раздавливающего
зажима, которую применяют при открытой резекции,
используют раздавливающие зажимы. Некоторые
хирурги предпочитают применять для рассечения печени
водоструйный диссектор (струйный резак) и говорят,
что это устройство позволяет провести резекцию бы-
Kanekoetal. [27]
1993-200323'4
авнительные серии лапароскопических
Buell etal. [13]
2002-2004
Huscheretal.[11]
1993-1995
Rau etal. [28]
1994-1997
Пациенты, п
Возраст, годы
Мужчины,%
Злокачественные
опухоли, %
Цирроз, %
Размер, см
2 сегмента, %
>2 сегментов
Конверсии
ДО, мин
ПК, мл
Свободный режим
Пероральный режим
ДГ, дни
Смертность, %
Морбидность, %
ПЛВ,%
ОВ, %
30
59
60
100
27
3
33
0
1
182
350
2,81
1,81
14,91
0
10
31
61
28
61
64
100
21
3,1
29
0
-
210
505
3,8
2,5
14,9
0
18
29
62
17
55,4
41
29
18
7,6
35
29
0
1681
2881
-
-
2,91
6
24
-
-
100
-
-
-
8,7
-
-
-
-
270
485
-
-
6,5
-
-
-
-
20
63
80
100
50
-
40
15
0
193
397,59
-
-
111,1
5
45
-
-
65
-
-
100
-
-
-
-
-
179
279,5
-
-
-
5
33
-
-
17
48
-
12
0
-
-
-
1
183,51
457,6
-
11
5,81
0
6
-
-
17
46,8
-
12
0
-
-
-
-
128,51
555,9
-
-
11,6
0
6
-
-
' р <0,05 против открытой резекции.
2 Использовали подъемник для передней брюшной стенки.
3 Отмечено также значительное снижение хирургического стресса и показателей общего риска после лапароскопической резекции
в сравнении с открытой.
4 Включены только пациенты с ПКР.
5 Отмечены большая частота применения маневра Прингла и его продолжительность в открытой группе.
6 Отмечено более длительное время зажатия ворот при маневре Прингла в открытой группе.
7 Включены только пациенты с метастазами колоректального рака. Отмечено, что среднее количество дней после операции, когда
необходимы опиоиды было меньшим в лапароскопической группе (1 день), чем в открытой (5 дней).
Рис. 15-3. Сравнительные серии лапароскопических и открытых резекций печени. За размер в данном случае считали размер опухоли
в наибольшем измерении. Понятие «сегменты» означает количество резецированных сегментов печени. Конверсиями называли
число первичных случаев лапароскопических операций, потребовавших конверсии в открытое оперативное вмешательство. Понятия
198 Лапароскопическая хирургия. Атлас
стрее и с меньшей кровопотерей, чем CUSA. К другим
устройствам для рассечения относятся: устройство FB
3.0 с флотирующим шариком («TissueLink»; TissueLink
Medical Dover, NH), Nd: YAG-лазер, коагуляционный
крючок, биполярная диатермия и «LigaSure» {Valleylab,
Boulder, CO). Некоторые хирурги применяют зажим Лу-
кана (Lucane) для внутрипаренхиматозного
сосудистого контроля перед рассечением. Исследования,
сравнивающие эффективность одной техники рассечения
относительно другой при ЛРП, проведены не были.
Так же как и большинство групп, которые
применяют степлеры для печеночной вены, портальной ножки
и других крупных сосудов (рис. 15-1,15-2), авторы с
помощью гибкого эндоскопического сосудистого
сшивающего аппарата с вращающейся головкой проводят
основной объем рассечений паренхимы во время ЛРП.
Степлером раздавливают и рассекают ткань на
расстоянии, которое на несколько миллиметров меньше,
чем реальная длина линии скобок, что способствует
гемостазу. Длина картриджа 60 мм позволяет
проводить эффективное рассечение. Для левосторонней
латеральной секционэктомии требуется 7 таких
картриджей. Узкие скобки шириной 2,5 мм позволяют
получить эффективный гемостаз и снижают вероятность
разрыва паренхимы при рассечении. Вращающаяся
головка эндоваскулярного степлера имеет преимущества
при формировании прямой линии резекции. Для
повышения эффективности рассечения печени с
использованием степлера и улучшения гемостаза в области
линии резекции сначала «истончают» печень с помо-
и открытых резекции печени
Shimadaetal. [29] Morino et al. [30] Laurent et al. [31]
1994-200024 1997-2001 1998-200045
Lesurtel et al. [32] Mala et al. [33] Farges et al. [34]
1996-20026 1998-20017 1999-20018
17
62
88
100
77
2,6
41
0
0
325
400
-
121
0
6
12
45
38
63
63
100
75
2,5
-
0
-
280
800
-
22
0
11
-
35
30
56
47
47
10
4,2
43
0
0
148
3201
-
6,41
0
7
-
_
30
58
37
83
30
4,1
43
0
-
142
479
-
8,7
0
7
-
-
13
62,6
77
100
100
3,4
23
0
2
2671
620
-
15,3
0
36
12
8913
14
65,9
71
100
100
3,4
21
0
-
182
720
-
17,3
14
50
-
5513
18
55
39
33
28
4,6
100
0
2
2021
2361
-
8
0
11
-
_
20
47
25
35
30
5,3
100
0
-
145
429
-
10
0
15
-
_
13
68
69
100
0
2,6
47
13
0
187
600
1
41
0
13
-
_
14
59
71
100
0
3
21
14
-
185
500
1
8,5
0
29
-
_
21
38
0
0
0
4,9
38
0
0
177
218
1,81
5,11
0
10
-
-
21
39
0
0
0
-
38
0
-
156
285
2,6
6,5
0
10
-
-
" Отметили, что общая доза морфина была меньше после лапароскопии, чем после открытой резекции (в среднем 15,5 против 31,6 л
' Отметили, что у 35% пациентов, подвергшихся лапароскопической резекции, потребовалась гемотрансфузия против 18% при
открытой резекции.
"' Отметили, что ДГ после лапароскопической операции была короче в сравнении с открытой группой, но не указали данные для
открытой группы.
" Отметили, что в лапароскопической группе больше пациентов начали пероральный прием пищи на первый день после операцж
чем в открытой группе.
12 Не отмечено большой разницы в ПИВ.
и Сообщается о данных 3-летней выживаемости.
«свободный режим» и «пероральный режим» означают первый день свободного режима и перорального питания. ПЛВ — 5-летняя
выживаемость без заболевания; ПК — примерная кровопотеря; Лап — лапароскопическая резекция печени; ДГ — длительность
госпитализации; ДО — длительность операции; ОВ — общая 5-летняя выживаемость.
Глава 15. Лапароскопическая резекция печени 199
Рис. 15-4. А, Б — линии гепатотомии для раздельного пересечении
передней ножке (2), левой главной ножке (3) и левой латеральной н
щью рассечения капсулы Глисона и рассекают первые
20-30% толщины паренхимы печени ультразвуковым
скальпелем, затем завершают резекцию с помощью
степлера. Несмотря на преимущества при гемостазе,
не советуют применять степлер для резекции цирроти-
ческой печени вследствие вероятности возникновения
сильного кровотечения после рассечения паренхимы.
ХИРУРГИЧЕСКИЕ МЕТОДИКИ
Метод лапароскопической левосторонней
латеральной секционэктомии, предложенный авторами, описан
полностью, поскольку он является наиболее
распространенным и простым методом анатомической
резекции. Ниже описаны его отличия от других методов
резекции.
Левосторонняя латеральная секционэктомия
Пациента укладывают в низкое литотомическое
(«французское» или «обратное Y») положение. Хирург
становится между ног пациента, а первый ассистент —
слева от хирурга (рис. 15-5). Делают разрез в левом
верхнем квадранте, соответствующий размерам руки
оперирующего хирурга, и через него
устанавливают «GelPort». Через «GelPort» вводят троакар Хэссо-
на и создают карбоксиперитонеум до давления 15 мм
рт.ст. Некоторые хирурги усстанавливают «GelPort»
или другое устройство для ручной ассистенции после
создания карбоксиперитонеума, чтобы снизить частоту
миграции порта при инсуффляции, но авторы с такой
проблемой не сталкивались. Не следует устанавливать
«GelPort» слишком низко, чтобы избежать
необходимости тянуться рукой для достижения печени. Затем с
помощью 30-градусного лапароскопа ревизуют брюшную
полость, чтобы подтвердить наличие
патологического образования и выявить внутри- и внепеченочные
очаги патологического процесса, не обнаруженные
в результате предоперационного обследования. Далее
устанавливают порты, как это показано на рис. 15-5.
Все порты размещают по принципу Верса и использу-
воротных ножек. Доступы к правой задней ножке (1), правой
эжке (5) (из: Launois [42]).
ют 12-миллиметровые троакары, которые позволят
менять положение камеры и устройства для рассечения,
чтобы обеспечить множество углов резекции и
визуализацию в разных ракурсах. Другие группы хирургов
применяют баллонные порты, за которые можно
тянуть, чтобы создать тракцию в противоположном
направлении с минимальным риском миграции порта.
Через все эти порты можно также интраоперационно
провести УЗИ. В качестве альтернативы обычный
ультразвуковой датчик можно ввести через «GelPort».
Затем серповидную связку печени отсекают от брюшной
стенки с помощью ультразвукового скальпеля,
введенного через срединный порт, камера при этом
находится в правом нижнем порте, как показано на рис. 15-6.
Серповидную связку рассекают настолько, чтобы ее
было удобно применять для тракции. Рука
оказывает неоценимую помощь в ретракции печени при ли-
гировании серповидной связки. Ее снова используют
для ретракции печени при рассечении ультразвуковым
скальпелем левой коронарной связки. Такой доступ
позволяет снизить вероятность повреждения
окружающих органов, в частности желудка (рис. 15-7). После
этого опять же с помощью руки приподнимают левую
половину печени, чтобы обнажить сальниковую
сумку, которую вскрывают ультразвуковым скальпелем
для доступа к хвостатой доле (рис. 15-8). В этом
заключается необходимая мобилизация печени. Авторы
издания не проводят холецистэктомию во время левой
латеральной секционэктомии, если для этого нет
показаний (холелитиаза и признаков воспаления
желчного пузыря). Как было сказано выше, они не
практикуют пережатия портальных сосудов и печеночных
вен перед началом резекции. Для маркировки линии
резекции применяется аргоновый коагулятор.
После введения камеры через надпупочный порт печень
рассекают ультразвуковым скальпелем вдоль этой
линии (рис. 15-9). Авторы применяют ультразвуковой
скальпель для «истончения» печени, что способствует
применению эндоваскулярного степлера. Печень рас-
200 Лапароскопическая хирургия. Атлас
секают ультразвуковым скальпелем примерно на 30% н
ее толщины. Во время пересечения рука хирурга при- з
носит большую пользу, обеспечивая ретракцию левой о
латеральной секции и компрессию, которая снижает в
кровотечение. Затем через правый нижний порт вводят к
эндоваскулярный степлер (60x2,5 мм). Гибкие степл еры и
используют таким образом, чтобы выполнить линей- (]
ную резекцию (рис. 15-10). Обычно для пересечения h
печени необходимо от 5 до 8 картриджей. Для прове- и
дения верхней части разреза рядом с печеночной ве- р
ной степлер можно ввести через правый верхний порт. л
На рис. 15-11 продемонстрирована последовательная к
линия резекции, а на рис. 15-12 — наложение степлера о
'% на левую печеночную ножку. Левую печеночную вену
и- захватывают вместе с паренхимой печени. Удаленный
)й образец помещают в эндоскопический контейнер и из-
ет влекают через «GelPort». Затем применяют аргоновый
ят коагулятор для коагуляции сосудов в месте резек-
>ы ции, снижая при этом давление пневмоперитонеума
й- (рис. 15-13). Авторы не используют «Tisseal» (Baxter
1я Immuno AG, Deerfield, II), FloSeal (Baxter, Deerfield, IL)
е- или другие гемостатические агенты, так как их трудно
е- распылять при лапароскопическом доступе. Для выяв-
>т. ления желчеистечения обычно устанавливают дренаж
1я к месту резекции, который удаляют через день после
за операции, если выделения без примеси желчи.
Рис. 15-5. Установка портов и положение хирурга
при лапароскопической левосторонней латеральной
секционэктомии. «Ge/Porf» установлен в левом верхнем
квадранте в достаточно высоком положении — так, чтобы
хирургу не приходилось тянуться, чтобы обеспечивать
ретракцию печени. 12-миллиметровые порты устанавливают
таким образом, чтобы можно было менять местами камеру,
ультразвуковой скальпель (harmonic scalpel «Ethicon Endo-
Surgery», Inc., Cincinnati, ОН) и эндоваскулярный степлер.
Например, при рассечении серповидной и треугольной
связок ультразвуковым скальпелем работают через
надпупочный порт, а камера введена через правый
нижний порт. Позже, по ходу резекции, эндоваскулярный
степлер можно ввести в правый верхний порт, а камеру —
в надпупочный порт для завершения наложения скобок
рядом с левой печеночной веной.
ПОДГОТОВКА
Глава 15. Лапароскопическая резекция печени 201
ОПЕРАЦИЯ
Рис. 15-6. Печень мобилизуют путем лигирования круглой
связки с помощью ультразвукового скальпеля {«Ethicon
Endo-Surgery», Inc., Cincinnati, ОН). С этой целью можно также
использовать «LigaSure» {Valleylab, СО) и ультразвуковой
диссектор. Обратите внимание, что для создания натяжения
круглой связки и облегчения ее диссекции печень отводят
книзу рукой.
Рис. 15-8. Рукой печень отводят кверху и выворачивают
левую часть печени, чтобы визуализировать малый сальник.
Малый сальник пересекают с помощью ультразвукового
скальпеля {«Ethicon Endo-Surgery», Inc., Cincinnati, ОН), при этом
обнажается хвостатая доля печени.
Рис. 15-7. Пересечение левой коронарной связки с помощью
ультразвукового скальпеля {«Ethicon Endo-Surgery», Inc.,
Cincinnati, ОН). При этом рукой защищают другие органы
(печень и левую печеночную вену). Поскольку патологическое
образование не расположено вблизи от печеночной вены,
этот сосуд не был обнажен при диссекции.
Рис. 15-9. После маркировки линии резекции
непосредственно рядом с пупочной фиссурой с помощью
аргонового коагулятора печень рассекают с помощью
ультразвукового скальпеля {«Ethicon Endo-Surgery», Inc.,
Cincinnati, ОН). Толщина печени уменьшается, что способствует
ее рассечению с помощью эндоваскулярного степлера.
Обратите внимание, что руку используют для захвата левой
латеральной секции и еетракции, что благоприятствует
рассечению печени.
202 Лапароскопическая хирургия. Атлас
Рис. 15-10. Для рассечения печени используют
эндоскопический сосудистый сшивающий аппарат
с вращающейся головкой размером 60x2,5 мм. Рукой степлер
вводят в паренхиму печени.
Рис. 15-12. Наложение эндоваскулярного степлера на левую
печеночную ножку.
Рис. 15-11. Линия скобок после рассечения печени
с помощью степлера. Обратите внимание на мобилизованную
левую печеночную ножку.
Рис. 15-14. Бранши эндоваскулярного степлера введены
через гепатотомию в основании сегмента 4Ь и, таким образом,
заключают в себе левую портальную ножку. При прошивании
ножку пересекают, что приводит к отделению левой
половины печени. Обратите внимание, что для поднятия
печени используют руку, которая позволяет визуализировать
и контролировать наложение браншей степлера.
Глава 15. Лапароскопическая резекция печени 203
Левосторонняя гемигепатэктомия
Установка портов для обычной левосторонней
гемигепатэктомии обычно соответствует таковой при
левосторонней латеральной секционэктомии. У крупных
пациентов «GelPort» устанавливают вверху, по средней
линии вместо левого подреберья. Дополнительный
12-миллиметровый порт располагают в области
латеральной брюшной стенки справа. Печень мобилизуют,
так же как и при левосторонней латеральной
секционэктомии, рассекая левую коронарную и серповидную
связки. Не нужно пытаться отдельно мобилизовать
общий ствол срединной и левой печеночной вены
или отдельно левую печеночную вену. Перед
пересечением проводят селективный контроль притока крови
к левой половине печени с помощью внутрипаренхи-
матозного пережатия. Этого можно достичь с
помощью гепатотомии с использованием
электрокоагулятора в основании сегмента 4b, сразу правее от пупочной
фиссуры (см. рис. 15-4). Тонкие бранши
универсального степлера (шириной 2,5 мм) вводят через гепато-
томию, заключая левую портальную ножку в бранши
степлера (рис. 15-14), который затем приводят в
действие. Далее проводят пересечение печени вдоль
образовавшейся демаркационной линии с помощью
ультразвукового скальпеля и эндоваскулярного степлера,
как и при левосторонней латеральной
секционэктомии. Когда опухоль находится далеко от средней линии
печени (линии Кантли), линию резекции выбирают
произвольно слева от нее, избегая повторного
перекрещивания с проекцией срединной печеночной вены.
Левую печеночную вену снова берут в толще печени,
так как она проходит поперек наиболее поверхностной
части разреза паренхимы. После извлечения
удаленного препарата края паренхимы коагулируют с помощью
аргонового коагулятора.
Правосторонняя гемигепатэктомия
Лапароскопическая правосторонняя гепатэктомия
более сложна технически и требует больших затрат
времени, чем левосторонние резекции печени [42]. Установка
портов и «GelPort» при правосторонней гепатэктомии
принципиально отличается (рис. 15-15) от описанной
выше. «GelPort» устанавливают справа от пупка, а
затем вводят три 12-миллиметровых порта: медиальнее,
латеральнее «GelPort» и в эпигастрии по средней линии.
Латеральный 5-миллиметровый порт служит для
ретракции. При правосторонней гемигепатэктомии рука
хирурга играет важную роль в мобилизации верхушки
печени и тракции на этапе пересечения правой
коронарной связки. Для диссекции авторы предпочитают
использовать «LigaSure», чтобы быть уверенными в
надежной коагуляции мелких сосудов. Сначала
рассекают серповидную связку, а затем брюшину над правой
и средней печеночной веной (рис. 15-16). Затем
рассекают правую коронарную связку на латеральной
поверхности правой половины печени, а нижнюю
поверхность печени отделяют от забрюшинных структур
(рис. 15-17). С помощью руки проводят тупую диссек-
цию (как при ОР), правую половину печени полностью
мобилизуют до уровня НПВ (рис. 15-18). Если
образование расположено вблизи от НПВ, авторы предлагают
освобождать переднюю поверхность НПВ от ее мелких
притоков с помощью «LigaSure» или гемостатических
клипс. После этого удаляют желчный пузырь. Затем
паренхиму печени рассекают вдоль линии, которая
находится латеральнее НПВ и распространяется в
краниальном направлении и поперек внутрипеченочной
части правой печеночной вены, без окклюзии входящих
и исходящих сосудов (рис. 15-19-15-21), аналогично
технологии, описанной выше. Удаленный препарат
извлекают и коагулируют место резекции.
204 Лапароскопическая хирургия. Атлас
ПОДГОТОВКА К ПРАВОСТОРОННЕЙ
ГЕПАТЭКТОМИИ
Ассистент
Операционная
сестра
Рис. 15-15. Установка портов и положение хирурга
при правосторонней гепатэктомии с ручной ассистенцией.
Первым, справа от пупка, устанавливают «GelPort». Затем
устанавливают три 12-миллиметровых порта: медиальнее,
латеральнее от «GelPort» и в эпигастрии по средней линии.
Для ретракции устанавливают латеральный 5-миллиметровый
порт.
ПРАВОСТОРОННЯЯ ГЕПАТЭКТОМИЯ
Рис. 15-16. С помощью комбинации тупой диссекции и «Liga-
Sure» {Valleylab, Boulder, CO) рассекают брюшину, окружающую
правую и срединную печеночную вену. Обратите внимание,
что руку используют для обнажения брюшины и защиты
печеночных вен от повреждения, в основном как это делается
и при открытой операции.
Рис. 15-17. Нижнюю поверхность правой половины печени
отделяют от забрюшинных структур, используя «LigaSure»
(Valleylab, Boulder, CO).
Глава 15. Лапароскопическая резекция печени 205
Рис. 15-18. Правую половину печени полностью мобилизуют
до уровня нижней полой вены.
Рис. 15-20. Степлер наложен на внутрипеченочный отдел
правой печеночной вены.
206 Лапароскопическая хирургия. Атлас
Рис. 15-19. Эндоваскулярным степлером пересекают печень
вдоль линии, которая проходит сразу же латеральнее линии
Кантли.
Рис. 15-21. При правосторонней гепатэктомии печень
рассекают (указано стрелками) вдоль линии, расположенной
латеральнее нижней полой вены.
Клиновидная резекция
Выбор техники клиновидной резекции в значительной
степени зависит от размера и расположения опухоли
в толще печени. При наличии мелких образований,
расположенных по самой периферии тонкой секции печени
(например, в левой латеральной секции), можно легко
провести V-образную клиновидную резекцию с помощью
двух картриджей универсального степлера. Аналогично
расположенные еще более мелкие образования можно
удалить с применением электрокоагуляции или других
гемостатических инструментов (ультразвуковых
ножниц или «LigaSure»). В случае более крупных образований
делают попытку мобилизации печени по воображаемой
линии резекции. Если этот маневр окажется удачным,
можно легко наложить степлер для пересечения
печени. При расположении образования в правой половине
печени часто бывает трудно провести линию резекции
таким образом, чтобы она не включала избыточное
количество ткани. В таком случае с помощью
электрокоагулятора делают циркулярный, или эллиптический, разрез
печени, окружающий опухоль. Затем рассекают
паренхиму глубже и глубже с помощью ультразвуковых
ножниц или «LigaSure». Крупные соссуды, которые при этом
встречаются, лучше клипировать.
СПИСОК ЛИТЕРАТУРЫ
1. Gagner M., Rheault M., Dubuc J. Laparoscopic partial hepatectomy
for liver tumor // Surg. Endosc. — 1992. — Vol. 6. — P. 99.
2. Azagra J.S., Goergen M., Gilbart E., Jacobs D. Laparoscopic
anatomical (hepatic) left lateral segmentectomy: technical aspects //
Surg. Endosc. — 1996. — Vol. 10. — P. 758-761.
3. Strasberg S.M. Nomenclature of hepatic anatomy and resections:
a review of the Brisbane 2000 system // J. Hepatobiliary Pancreat.
Surg. — 2005. — Vol. 12. — P. 351-355.
4. Buell J.F., Thomas M.J., Doty T.C. et al. An initial experience and
evolution of laparoscopic hepatic resectional surgery // Surgery. —
2004. — Vol. 136. — P. 804-811.
5. Berends F.J., Meijer S., Prevoo W. et al. Technical considerations in
laparoscopic liver surgery // Surg. Endosc. — 2001. — Vol. 15. —
P. 794-798.
6. Katkhouda N., Hurwitz M., Gugenheim J. et al. Laparoscopic
management of benign solid and cystic lesions of the liver // Ann.
Surg. — 1999. — Vol. 229. — P. 260-466.
7. Descottes В., Lachachi E, Sodji M. et al. Early experience with
laparoscopic approach for solid liver tumors: initial 16 cases // Ann.
Surg. — 2000. — Vol. 232. — P. 641-645.
8. Cherqui D., Husson E., Hammoud R. et al. Laparoscopic liver
resections: a feasibility study in 30 patients // Ann. Surg. — 2000. —
Vol. 232. — P. 753-762.
9. Kaneko H., Takagi S., Shiba T. Laparoscopic partial hepatectomy
and left lateral segmentectomy: technique and results of a clinical
series // Surgery. — 1996. — Vol. 120. — P. 468-475.
10. Marks J., Mouiel J., Kafkjouda N. et al. Laparoscopic liver surgery: a
report on 28 patients // Surg. Endosc. — 1998. — Vol. 12. — P. 331-
334.
11. Huscher C.G. S., Lirici M.M., Chiodini S., Recher A. Laparoscopic
surgery section: current position of advanced laparoscopic surgery of
the liver // J.R. Coll. Surg. Edinb. — 1997. — Vol. 42. — P. 219-225.
12. Edwin В., Mala Т., Gladhaug I. et al. Liver tumors and minimally
invasive surgery: a feasibility study // Laparoendosc. Adv. Surg.
Tech. A. — 2001. — Vol. 11. — P. 133-139.
13. Buell J.R, Koffron A.J., Thomas M.J. et al. Laparoscopic liver
resection // J.Am. Coll. Surg. — 2005. — Vol. 200. — P. 472-480.
14. Vibert E., Kouider A., Gayet B. Laparoscopic anatomic liver
resection // НРБ. — 2004. — Vol. 6. — P. 222-229.
15. Vibert E., Perniceni Т., Levard H. et al. Laparoscopic liver
resection // Br.J. Surg. — 2006. — Vol. 93. — P. 67-72.
16. O'Rourke N., Shaw I., Nathanson L. et al. Laparoscopic resection of
hepatic colorectal metastases // HPB. — 2004. — Vol. 6. — P. 230-
235.
17. Belli G., Fantini C, DAgostino A. et al. Laparoscopic liver
resections for hepatocellular carcinoma (HCC) in cirrhotic
patients // HPB. — 2004. — Vol. 6. — P. 236-246.
18. Descottes В., Glineur D., Lachachi F. et al. Laparoscopic liver
resection for benign liver tumors: results of a multicenter European
experience // Surg. Endosc. — 2003. — Vol. 17. — P. 23-30.
19. Gigot J., Glineur D., Azagra J.S. et al. Laparoscopic liver resection
for malignant liver tumors: preliminary results of a large multicenter
European study // Ann. Surg. — 2002. — Vol. 236. — P. 90-97.
20. Kaneko H. Laparoscopic hepatectomy: indications and outcomes //
J. Hepatobiliary Pancreat. Surg. — 2005. — Vol. 12. — P. 438-443.
21. Mala Т., Edwin В., Rosseland A.R. et al. Laparoscopic liver
resection: experience of 53 procedures at a single center //
J. Hepatobiliary Pancreat. Surg. — 2005. — Vol. 12. — P. 298-303.
22. Chang S., Laurent A., Tayar С et al. Laparoscopy as a routine
approach for left lateral sectionectomy // Br. J. Surg. — 2007. —
Vol. 94. — P. 58-63.
23. Cherqui D., Laurent A., Tayar С et al. Laparoscopic liver resection
for peripheral hepatocellular carcinoma in patients with chronic
liver disease // Ann. Surg. — 2006. — Vol. 243. — P. 499-506.
24. Hashizume M., Shimada M., Sugimachi K. Laparoscopic
hepatectomy: a new approach for hepatocellular carcinoma //
J. Hepatobiliary Pancreat. Surg. — 2000. — Vol. 7. — P. 270-275.
25. Koffron A., Celler D., Gamblin T.C, Abecassis M. Laparoscopic
liver surgery: shifting the management of liver tumors //
Hepatology. — 2006. — Vol. 44. — P. 1694-1700.
26. Gagner M., Rogula Т., Selzer D. Laparoscopic liver resection:
benefits and controversies // Surg. Clin. North Am. — 2004. —
Vol. 84.— P. 451-462.
27. Kaneko H., Takagi S., Otsuka Y. et al. Laparoscopic liver resection
for hepatocellular carcinoma // Am. J. Surg. — 2005. — Vol. 189. —
P. 190-194.
28. Rau H.G., Buttler E., Meyer G. et al. Laparoscopic liver resection
compared with conventional partial hepatectomy: a prospective
analysis // Hepatogastroenterology. — 1998. — Vol. 45. — P. 2333-
2338.
29. Shimada M., Hashizume M., Maehara S. et al. Laparoscopic
hepatectomy for hepatocellular carcinoma // Surg. Endosc. —
2001. — Vol. 15. — P. 541-544.
Глава 15. Лапароскопическая резекция печени 207
30. Morino M., Morra I., Rosso E. et al. Laparoscopic vs open resection:
a comparative study // Surg. Endosc. — 2003. — Vol. 17. —
P. 1914-1918.
31. Laurent A., Cherqui D., Lesurtel M. et al. Laparoscopic liver
resection for subcapsular hepatocellular carcinoma complicating
chronic liver disease // Arch. Surg. — 2003. — Vol. 138. — P. 763-
769.
32. Lesurtel M., Cherqui D., Laurent A. et al. Laparoscopic versus open
left lateral hepatic lobectomy: a case-control study // J. Am. Coll.
Surg. — 2003. — Vol. 196. — P. 236-242.
33. Mala Т., Edwin В., Gladhaug I. et al. A comparative study of the
short-term outcome following open and laparoscopic liver resection
of colorectal metastases // Surg. Endosc. — 2002. — Vol. 16. —
P. 1059-1063.
34. Farges O., Jagot P., Kirstetter P. et al. Prospective assessment of the
safety and benefit of laparoscopic liver resections // J. Hepatobiliary
Pancreat. Surg. — 2002. — Vol. 9. — P. 242-248.
35. Abel-Atty M.Y., Farges O., Jagot P., Belghiti J. Laparoscopy extends
the indications for liver resection in patients with cirrhosis //
Br. J. Surg. — 1999. — Vol. 86. — P. 1391-1400.
36. Fong Y., Jarnagin W, Conlon K.C. et al. Hand-assisted laparoscopic
liver resection // Arch. Surg. — 2000. — Vol. 135. — P. 854-859.
37. Huang M., Lee W., Wang W. et al. Hand-assisted laparoscopic
hepatectomy for solid tumor in the posterior portion of the right
lobe: initial experience // Ann. Surg. — 2003. — Vol. 238. — P. 674-
679.
38. Cuschieri A. Laparoscopic hand-assisted surgery for hepatic and
pancreatic disease // Surg. Endosc. — 2000. — Vol. 14. — P. 991-
996.
39. Antonetti M.C., Killelea В., Orlando R. Hand-assisted laparoscopic
liver surgery // Arch. Surg. — 2002. — Vol. 137. — P. 407-412.
40. Lanunois B. The intrahepatic Glissonian approach
to liver resection // Surgery of the Liver and Biliary
Tract/Eds L.H. Blumgart, Y. Fong — New York: W.B. Saunders,
2000. — P. 1639-1657.
41. Tang C, Wah-Li M. Laparoscopic-assisted liver resection //
J. Hepatobiliary Pancreat. Surg. — 2002 — Vol. 9. — P. 105-110.
42. O'Rourke N., Fielding G. Laparoscopic right hepatectomy: surgical
technique // J. Gastrointest. Surg. — 2004. — Vol. 8. — P. 213-216.
208 Лапароскопическая хирургия. Атлас
Лапароскопические
паллиативные операции
при периампулярных опухолях
Ванесса А. Олцес, Теодор Н. Паппас
К периампулярным опухолям относятся опухоли
головки поджелудочной железы, дистального отдела
общего желчного протока, двенадцатиперстной кишки
и фатеровой ампулы. Наиболее часто встречается аде-
нокарцинома головки поджелудочной железы (85%)
[1]. Поскольку большинство этих опухолей
обнаруживают на очень поздних стадиях и только 20-40% из них
резектабельны, хирургическое вмешательство в таких
случаях обычно бывает паллиативным [2-6]. У 70%
пациентов отмечается безболевая желтуха, у 25%
имеется стеноз выходного отдела желудка, и оперативное
вмешательство, проведенное по поводу этих
симптомов, может улучшить качество жизни пациентов
в их последние месяцы жизни [1, 4, 7]. Ограниченная
ожидаемая продолжительность жизни у пациентов
с периампулярными опухолями требует проведения
окончательной операции с коротким периодом
госпитализации, низкой частотой послеоперационных
осложнений и минимальной потребностью в
повторных вмешательствах при прогрессировании
заболевания. При желтухе и обструкции выхода из желудка
могут быть сделаны соответственно желчный и
желудочный шунты. Обе эти операции можно провести ла-
пароскопически или традиционным открытым путем.
Вследствие того что хирурги становятся более
опытными в лапароскопической хирургии, лапароскопические
операции в данных ситуациях более привлекательны,
так как они сопровождаются меньшей смертностью
и частотой послеоперациооных осложнений в
сравнении со стандартными открытыми операциями [1, 5,
8]. Однако новшества эндолюминальной терапии,
например стентирование желчных путей и дуоденальное
стентирование, также считаются признанными
альтернативными эндоскопическими методами, имеющими
дополнительные преимущества [3, 9, 10, 11]. Эта глава
посвящена лапароскопическому паллиативному
лечению периампулярных опухолей.
АНАТОМИЯ
Важнейшее условие для успешного проведения
лапароскопических операций на органах желудочно-
кишечного тракта — знание анатомических
взаимоотношений желудка и двенадцатиперстной
кишки со структурами, находящимися в печеночно-
двенадцатиперстной связке [12]. Анатомически
желудок разделен на пять отделов — кардиальный отдел,
дно, тело, антральный отдел и привратник (рис. 16-1).
Примечательно, что истинно функциональным из них
является только привратник. Другие отделы можно
назвать условными, они служат лишь для планирования
и проведения различных резекций желудка. Желудок
богато васкуляризирован. Основные артериальные
сосуды — левая и правая желудочные артерии, которые
снабжают кровью малую кривизну. Большая
кривизна снабжается кровью из левой и правой желудочно-
сальниковых артерий. Короткие желудочные артерии
снабжают кровью дно, а гастродуоденальные арте-
Кардиальный отдел
— Дно
Привратник
Большая
кривизна
Антральный отдел
Рис. 16-1. Пять отделов желудка: кардиальный отдел, дно, тело,
антральный отдел и привратник. Показана большая и малая
кривизна.
Глава 16. Лапароскопические паллиативные операции при периампулярных опухолях 209
рии — область привратника (рис. 16-2). Венозные
сосуды желудка проходят параллельно артериальным,
а большинство вен желудка опорожняется в систему
воротной вены. Однако необходимо знать, что вены,
собирающие кровь от желудочно-пищеводного соустья
и кардии, формируют коллатерали с системой нижней
полой вены. Анатомической границей, используемой
для идентификации привратника, служит препилори-
ческая вена Мейо.
Общий желчный проток образуется при слиянии
правого и левого печеночных протоков (рис. 16-3).
Нужно отметить, что правая печеночная артерия
обычно проходит сзади от общего желчного протока, но
спереди от правой воротной вены. Соустье пузырного и
печеночного протоков обычно считают началом общего
желчного протока. Внепеченочные портальные
триады находятся в толще печеночно-двенадцатиперстной
связки. Желчные протоки обычно проходят справа
от печеночных артерий и кпереди от воротных вен.
Общий желчный проток разделен на супрадуоденальный,
ретродуоденальный и интрапанкреатический отделы.
Общий желчный проток снабжается кровью из мелких
ветвей пузырной, печеночной и гастродуоденальной
артерий. Они соединяются и формируют коллатеральную
сосудистую сеть, которая проходит в положении от 3
до 9 ч условного циферблата.
Двенадцатиперстная кишка — первый отдел
тонкого кишечника, который находится в основном ретропе-
ритонеально. Она состоит из четырех отделов, первый
и четвертый из которых расположены интраперитоне-
ально. В теле человека она имеет характерную
конфигурацию в виде С-петли, которая начинается сразу же
дистальнее привратника и продолжается до связки
Трейтца. Внутри С-петли двенадцатиперстной кишки
расположена головка поджелудочной железы. Общий
желчный и панкреатический проток сливаются друг
Левая печеночная
артерия
Правая печеночная \
артерия \
Пузырная ^w
артерия ' ■—__J
Общая печеночная
артерия ~~
Гастродуоденальная ^^
артерия
/ |
Пр
желу/
арт
III
Левая
желудочная
артерия
Чревный \ ; Jj
ствол \ ^^
«fc.
Б^^Р
Праваяжелудочно- )
сальниковая артерия
Jt/bilf
Шт&
TSV- К
Mv Iх
V (/ /1"
Короткие артерии
желудка
Щш^Хш^Ш^ШШ!* \|
^. Jr\^ Селезеночная
Зг44^ артерия
^^ Левая
1 желудочно-
' сальниковая
V артерия
Желчный пузырь
Правый и левый
печеночные протоки
Ворота печени
Общая печеночная артерия
Воротная вена
Общий желчный проток
Поджелудочная железа
Рис. 16-2. Желудок — хорошо
васкуляризированный орган.
Основные артерии желудка — парные
желудочные и желудочно-сальниковые.
Обычно можно без риска провести
одновременное лигирование любых трех
из этих сосудов. Короткие желудочные
артерии вносят свой вклад в обильное
кровоснабжение желудка.
Рис. 16-3. Анатомические особенности,
знание которых необходимо
для формирования желчных шунтов.
210 Лапароскопическая хирургия. Атлас
с другом и впадают в пищеварительный тракт во
втором отделе двенадцатиперстной кишки в виде фатеро-
вой ампулы.
Протяженность тощей кишки составляет 2/5
расстояния от связки Трейтца до илеоцекального клапана.
Сосуды брыжейки, исходящие из верхней брыжеечной
артерии, снабжают тощую кишку кровью, а венозный
отток осуществляется через верхнюю брыжеечную
вену в портальную венозную систему.
ЛАПАРОСКОПИЧЕСКИЙ ЖЕЛЧНЫЙ ШУНТ
Попытку хирургического паллиативного лечения об-
структивной желтухи, вызванной злокачественной
опухолью, предпринимают у пациентов с нерезек-
табельными (что обнаруживают при лапароскопии)
периампулярными опухолями, которые имеют
удовлетворительное общее состояние и ожидаемую
продолжительность жизни от 3-6 мес [1, 4, 6, 13]. Также
эта операция показана пациентам, предшествующие
попытки неоперативного паллиативного лечения
которых не привели к успеху [6, 7]. Желчный шунт
может быть проведен в виде холедохоеюностомии (ХДЕ),
холецистоеюностомии (ХЕС) или холедоходуодено-
стомии (ХДД). В качестве альтернативного варианта
лечения можно провести паллиативную операцию
Уиппла (Whipple) (панкреатикодуоденэктомию).
Паллиативная панкреатикодуоденэктомия
характеризуется повышенным риском развития
послеоперационных осложнений, не имеет преимуществ в
выживаемости и обычно не рекомендуется в такой ситуации
[1]. С лапароскопической точки зрения технически
наиболее проста ХЕС — это тип лапароскопического
желчного шунта, который применяют чаще всего [14],
хотя имеются ограниченные сообщения об успехе
лапароскопической ХДЕ [5]. Для успешного
проведения ХЕС расстояние от опухоли до соустья пузырного
и печеночного протоков должно быть более 1 см [1,15].
К тому же в желчном пузыре не должно быть камней
и соустье пузырного и печеночного протоков должно
функционировать. Если имеются какие-либо
сомнения в проходимости соустья пузырного и печеночного
протоков, необходимо провести интраоперационную
холангиограмму. Существуют данные, позволяющие
предположить, что в большинстве случаев
злокачественной билиарной обструкции это соустье поражено
опухолью [15]. Принимая во внимание соответствие
пациента критериям, необходимым для проведения
ХЕС, ХЕС становится лапароскопической операцией
выбора при паллиативном лечении злокачественной
обструкции желчных путей. Значимым недостатком
считают увеличение частоты поздних дополнительных
вмешательств на желчных путях после ХЕС в
сравнении с ХДЕ [16].
Существует много новшеств в области эндолюми-
нальной терапии злокачественной обструкции
желчных путей, и эти методы во многом заменили
традиционные хирургические вмешательства как основу
паллиативного лечения периампулярных опухолей [10, 11].
Широкое применение расширяющихся металлических
стентов снизило частоту возникновения рецидивных
желтух. Однако эндоскопические вмешательства в
целом имеют тенденцию к повышению частоты развития
поздних осложнений по сравнению с хирургическими
вмешательствами [10, 11].
Техника операции
Обстановка операционной и техника
лапароскопической ХЕС изображены на рис. 16-4—16-17.
Послеоперационное ведение пациента
Диету в послеоперационном периоде назначают
сразу же после восстановления перистальтики
кишечника. Послеоперационный болевой синдром обычно
выражен незначительно.
Глава 16. Лапароскопические паллиативные операции при периампулярных опухолях 211
ПОДГОТОВКА
Видеокамера
Ассистент
Голова
Видеокамера
Хирург
Операционная
сестра
Столик
для инструментов
Рис. 16-4. Обстановка операционной для проведения
вмешательства по формированию лапароскопического
билиарного шунта напоминает применяемую
для лапароскопической фундопликации по Ниссену.
На рисунке показано положение хирурга и ассистента.
Рис. 16-5. Троакары устанавливают, как указано на рисунке. После установки
пупочного порта для камеры в левом верхнем квадранте по среднеключичнои
линии на 5-10см ниже реберной дуги устанавливают 5-миллиметровый порт.
10-миллиметровый порт вводят в левом верхнем квадранте живота по передней
подмышечной линии у края реберной дуги. В заключение в правом верхнем
квадранте (по передней подмышечной линии у края реберной дуги) устанавливают
12-миллиметровый порт.
212 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Рис. 16-6. Через надпупочный 5-миллиметровый порт
вводят в брюшную полость мягкий зажим для полного
визуального осмотра живота. Цель осмотра — установить
наличие возможных повреждений в результате введения
троакаров, а также патологию, не обнаруженную ранее. Особое
внимание уделяют области, которая находится вокруг головки
поджелудочной железы и двенадцатиперстной кишки. Если
считают, что объем опухоли большой и она распространяется
на двенадцатиперстную кишку, можно одновременно
провести формирование желудочного шунта. После того
как установлено, что холецистоеюностомию в данном случае
провести можно, находят связку Трейтца, прослеживают
тонкую кишку и выбирают ее участок, который подводят к дну
желчного пузыря кпереди от ободочной кишки.
Рис. 16-8. А — через 12-миллиметровый порт в правом верхнем
квадранте вводят 5-миллиметровый коагуляционный крючок,
которым делают маленькое отверстие на противобрыжеечном
Рис. 16-7. Второй граспер вводят через порт в левом верхнем
квадранте, дно желчного пузыря осторожно захватывают
граспером. Тощую кишку и желчный пузырь сопоставляют
таким образом, чтобы избежать излишнего натяжения.
крае тощей кишки, через которое потом введут кончик
эндоскопического степлера. Б — энтеротомическое отверстие
расширяют с помощью граспера.
Глава 16. Лапароскопические паллиативные операции при периампулярных опухолях 213
Рис. 16-9. А — аналогичным образом в области дна желчного пузыря формируют холецистотомическое отверстие. Б — отверстие
расширяют.
Рис. 16-10. Энтеротомическое и холецистотомическое Рис. 16-11. В брюшную полость через 12-миллиметровый
отверстие сопоставляют. Грасперы не снимают до тех пор, порт вводят эндоскопический степлер. Одну браншу степлера
пока не будет успешно установлен степлер. вводят в холецистотомическое отверстие.
214 Лапароскопическая хирургия. Атлас
Рис. 16-12. Далее свободную браншу степлера вводят Рис. 16-13. Степлер осторожно закрывают. Аккуратно
в тощую кишку через энтеротомическое отверстие. проводят осмотр, чтобы убедиться в отсутствии случайного
попадания других структур в область анастомоза
и в правильном положении и сопоставлении структур.
Рис. 16-14. Используя 2 зажима в портах над пупком Рис. 16-15. После удаления степлера анастомоз
и левом верхнем квадранте, осматривают головку степлера раскрывают с помощью зажима. Линию скобок проверяют
и свободную часть тощей кишки, чтобы убедиться, на непрерывность и гемостаз.
что кишечник, желчный проток или ободочная кишка
не попали в бранши степлера. Только после этого степлер
приводят в действие. Затем степлер с осторожностью
удаляют, чтобы не повредить линию скобок.
Глава 16. Лапароскопические паллиативные операции при периампулярных опухолях 215
Рис. 16-16. Анастомоз завершают с помощью поперечного
наложения скобок на оставшийся дефект.
ЛАПАРОСКОПИЧЕСКАЯ
ГАСТРОЕЮНОСТОМИЯ
Обычные симптомы у пациентов с периампулярными
опухолями — отрыжка и рвота. С прогрессированием
заболевания примерно у 25% пациентов развивается
истинная механическая обструкция дуоденальной петли
[1, 3]. После проведения нескольких крупных
исследований было показано, что профилактическая гастроею-
ностомия имеет минимальную смертность и частоту
послеоперационных осложнений, и был сделан вывод
о необходимости ее применения у данной группы
больных [1,2,4-6,13]. Однако другие авторы оспаривают это
положение, говоря, что большинство пациентов с нере-
зектабельными периампулярными опухолями умирают
до того, как появятся симптомы злокачественной
обструкции желчных путей или желудка [7].
Лапароскопическую гастроеюностомию проводят
профилактически во время первичной лапароскопии
пациентам с нерезектабельными опухолями и
ожидаемой продолжительностью жизни от 3 до 6 мес,
если они подходят для проведения данной
процедуры по общему состоянию, или пациентам, у которых
развилась клиническая картина стеноза выходного
отдела желудка [1, 3,4, 6]. Как было показано при
других лапароскопических операциях, к преимуществам
216 Лапароскопическая хирургия. Атлас
Рис. 16-17. Анастомоз завершают с помощью поперечного
наложения скобок на оставшийся дефект.
лапароскопии относятся снижение
послеоперационного дискомфорта и непродолжительная
госпитализация, что позволяет считать эту операцию
процедурой выбора у отдельных пациентов в подготовленных
клиниках [5, 8]. Необходимо отметить, что имеется
определенный прогресс в процедуре
эндоскопического дуоденального стентирования, которое, по от-_
дельным данным, сопровождается даже более
короткой продолжительностью госпитализации и
сниженным временем до начала перорального приема пищи
в сравнении с лапароскопическими операциями,
однако широкого распространения этот метод пока
не получил [9-11].
Техника операции
Техника лапароскопической гастроеюностомии
представлена на рис. 16-18—16-24.
Послеоперационное ведение пациентов
Пациентам с признаками значительного пареза
желудка или значительного его расширения вследствие
стеноза выходного отдела, возможно, придется
оставить назогастральный зонд до тех пор, пока функция
желудка не восстановится. Как при любой
лапароскопической операции, послеоперационные боли обычно
выражены умеренно.
ПОДГОТОВКА
Наркозный
аппарат
Видеомонитор
Анестезиолог
Видеомонитор
Операционная сестра
Ассистент
с камерой
-Сестра-циркулятор
Мечевидный
отросток
Край реберной дуги -
12-ммпорт -
5-ммпорт —
~?& *"
©W
-5-ммпорт
10-мм пупочный порт
Рис. 16-18. Обстановка операционной для проведения
лапароскопической гастроеюностомии.
Рис. 16-19. Предполагаемое введение троакаров
для лапароскопической гастроеюностомии. После общей
анестезии устанавливают назогастральный зонд и катетер
Фолея для минимизации вероятности повреждения
желудка и мочевого пузыря во время введения троакаров.
Порт для камеры — 10-миллиметровый, его можно ввести
супра-, интра- и инфраумбиликально. После создания
адекватного пневмоперитонеума проводят эксплоративную
лапароскопию. Если не показана операция Уиппла, можно
провести лапароскопическую гастроеюностомию. Остальные
троакары устанавливают под визуальным контролем.
12- и 5-миллиметровый порты устанавливают в правом
верхнем квадранте в виде равнобедренного треугольника
с предполагаемым местом гастроеюностомии в области
его верхушки. Второй 5-миллиметровый порт для первого
ассистента вводят в левом верхнем квадранте.
Глава 16. Лапароскопические паллиативные операции при периампулярных опухолях 217
ОПЕРАЦИЯ
[
Рис. 16-20. А — связка Трейтца найдена, выбирают адекватный
сегмент тощей кишки таким образом, чтобы он дотягивался
до передней поверхности желудка без натяжения (примерно
]
30 см от связки Трейтца). Б — тощая кишка ориентирована
таким образом, чтобы избежать перекрута брыжейки.
Рис. 16-21. После выбора сегмента тощей кишки ориентацию
тощей кишки и желудка поддерживают с помощью
наложения якорных швов под визуальным контролем.
Серозно-мышечные швы накладывают на стенку желудка
и двенадцатиперстной кишки и выводят из брюшной
полости наружу через переднюю брюшную стенку. При этом
используют прямую иглу и зажим или проводник для иглы.
Эти наводящие швы необходимо наложить, по крайней
мере, на расстоянии 6см в сторону, чтобы можно было
сформировать гастроеюностому с широким просветом.
Швы натягивают таким образом, чтобы расправить
желудок и двенадцатиперстную кишку для их адекватного
сопоставления.
218 Лапароскопическая хирургия. Атлас
Рис. 16-22. С помощью электрокоагулятора проводят Рис. 16-23. Через 12-миллиметровый порт проводят
гастротомию и энтеротомию. Каждый из этих разрезов эндоскопический степлер. Одну его браншу осторожно
должен быть достаточно большим для введения бранши вставляют в гастротомию, а другую — в еюнотомию.
эндоскопического степлера. Устройство приводят в действие столько раз, сколько
окажется необходимым, чтобы получить анастомоз длиной
60-90 мм.
Рис. 16-24. Оставшуюся часть энтеротомического отверстия устройства). В качестве альтернативы можно сформировать
можно закрыть с помощью эндоскопического степлера (А) весь анастомоз с помощью ручного шва.
или швов (Б) (ручного шва или автоматического сшивающего
Глава 16. Лапароскопические паллиативные операции при периампулярных опухолях 219
ЗАКЛЮЧЕНИЕ
Лапароскопическая хирургия продолжает
развиваться, хирурги становятся более опытными, а
технические новшества позволяют исследовать новые
методики. Пациентам с ограниченной ожидаемой
продолжительностью жизни, например с нерезектабельными
периампулярными опухолями, минимально инвазив-
ная хирургия позволяет снизить связанные с
вмешательством смертность и частоту послеоперационных
осложнений по сравнению с открытыми операциями.
Для пациентов, продолжительность жизни которых
измеряется месяцами, эти преимущества имеют
огромную важность.
СПИСОК ЛИТЕРАТУРЫ
1. Chekan E.G., Clark L., Wu J. et al. Laparoscopic biliary and enteric
bypass // Semin. Surg. Oncol. — 1999. — Vol. 16. — P. 313-320.
2. Hamade A.M., Al-Bahrani A.Z., Owera A.M. A. et al. Therapeutic,
prophylactic, and preresection applications of laparoscopic gastric
and biliary bypass for patients with periampullary malignancy //
Surg. Endosc. — 2005. — Vol. 19. — P. 1333-1340.
3. House M.C., Choti M.A. Palliative therapy for pancreatic/biliary
cancer // Surg. Clin. North Am. — 2005. — Vol. 85. — P. 359-371.
4. Lillemoe K.D., Cameron J.L., Hardacre J.M. et al. Is prophylactic
gastrojejunostomy indicated for unresectable periampullary
cancer? // Ann. Surg. — 1999. — Vol. 230. — P. 322-330.
5. Rothlin M.A., Schob O., Weber M.: Laparoscopic gastro- and
hepatico-jejunostomy for palliation of pancreatic cancer // Surg.
Endosc. — 1999. — Vol. 13. — P. 1065-1069.
6. Sohn T.A., Lillemoe K.D., Cameron J.L. et al. Surgical palliation
of unresectable periampullary adenocarcinoma in the 1990s //
J. Am. Coll. Surg. — 1999. — Vol. 188. — P. 658-666.
7. Espat N.J., Brennan M.F., Conlon K.C. Patients with
laparoscopically staged unresectable pancreatic adenocarcinoma
do not require subsequent surgical biliary or gastric bypass //
J. Am. Coll. Surg. — 1999. — Vol. 188. — P. 649-657.
8. Choi Y.B. Laparoscopic gastrojejunostomy for palliation of gastric
outlet obstruction in unresectable gastric cancer // Surg. Endosc. —
2002. — Vol. 16. — P. 1620-1626.
9. Mittal A., Windsor J., Woodfield J. et al. Matched study of three
methods for palliation of malignant pyloroduodenal obstruction //
Br. J. Surg. — 2003. — Vol. 91. — P. 205-209.
10. Maosheng D., Ohtsuka Т., Ohuchida J. et al. Surgical bypass versus
metallic stent for uresectable pancreatic cancer // J. Hepatobiliary
Pancreat. Surg. — 2001. — Vol. 8. — P. 367-373.
11. Taylor M.C., Mc Leod R.S., Langer B. Biliary stenting versus bypass
surgery for the palliation of malignant distal bile duct obstruction:
a metaanalysis // Liver Transpl. — 2000. — Vol. 6. — P. 302-308.
12. SchulickR.D. Hepatobiliary anatomy// Greenfield's
Surgery/Ed.M. W Mul-holland. — Philadelphia: Lippincott
Williams and Wilkins, 2006. — P. 892-908.
13. Van Heek N.T., De Castro S.M. M., van Eijck C.H. et al. The need
for prophylactic gastrojejunostomy for unresectable periampullary
cancer // Ann. Surg. — 2003. — Vol. 238. — P. 894-905.
14. Date R.S., Siriwardena A.K. Current status of laparoscopic biliary
bypass in the management of non-resectable peri-ampullary
cancer // Pancreatology. — 2005. — Vol. 5. — P. 325-329.
15. Tarnasky PR., England R.E., Lail L.M. et al. Cystic duct patency
in malignant obstructive jaundice // Ann. Surg. — 1995. —
Vol. 221.— P. 265-271.
16. Urbach D.R., Bell СМ., Swanstrom L.L. et al. Cohort study of
surgical bypass to the gallbladder or bile duct for the palliation
of jaundice due to pancreatic cancer // Ann. Surg. — 2003. —
Vol. 237. — P. 86-93.
220 Лапароскопическая хирургия. Атлас
Лапароскопическая
спленэктомия
Элизабет Т. Трайси, Михаэль С. Харниш
)
ИСТОРИЧЕСКАЯ СПРАВКА
Селезенка, названная TanenoM«organum plenum misterii»,
была предметом множества интриг и споров более
2000 лет. Аристотель утверждал, что селезенка не
является жизненно необходимым органом для
существования человека. Его утверждение не проверялось вплоть
до 1549 г., когда Andriano Zaccarello из Италии удалил
увеличенную селезенку у молодой женщины, которая
прожила после этого еще 6 лет [1, 2]. Первая
спленэктомия по поводу травмы произошла еще через 300 лет,
когда Британский военно-морской хирург О 'Brien
удалил селезенку из резаной раны у мексиканского
портного в 1816 г. Пациент выздоровел, несмотря на
сопутствующее повреждение почки [3]. Первая истинная
спленэктомия по поводу заболевания селезенки была
проведена Jules Pean в 1867 г. по поводу крупной кисты
селезенки у 20-летней женщины [3].
К середине XX в. маятник качнулся в сторону
довольно свободного выбора показаний к спленэктомии,
в частности при травме. «Предостерегающих голосов»
не слышали до тех пор, пока King и Shumacker в 1952 г.
не сообщили о случае тяжелого сепсиса после
спленэктомии по поводу врожденной гемолитической
анемии [4]. Поскольку другие исследователи
подтвердили опасность развития молниеносного сепсиса после
спленэктомии, особенно у детей, возросло количество
авторов, которые выступали за сохранение селезенки.
В середине 1960-х гг. Leon Morganstern et al. стали
пионерами субтотальной спленэктомии. Через несколько
десятков лет в связи с ростом интереса к лапароскопии
появились первые сообщения о лапароскопической
спленэктомии — в конце 1991 и начале 1992 г. от
независимо работавших групп Delaitre (Франция), Carroll
(США), Cushiere (Великобритания) и Poulin (Канада).
В течение следующих 20 лет лапароскопическая
спленэктомия стала стандартной операцией для планового
удаления нормальной или немного увеличенной
селезенки. В это же время начала возрастать популярность
частичной лапароскопической спленэктомии. На
сегодняшний день лапароскопическая спленэктомия
стала процедурой выбора при большинстве
гематологических заболеваний селезенки и может стать
стандартной операцией при всех спленэктомиях.
АНАТОМИЯ И ФИЗИОЛОГИЯ
Селезенка расположена в левом подреберье и
ограничена сверху диафрагмой, сзади — левой почкой
и дном желудка, спереди — селезеночной кривизной
ободочной кишки (рис. 17-1). Она залегает глубоко,
на уровне IX-XI ребра. Селезенка образуется из
скопления мезенхимальных клеток в левом дорсальном
мезогастрии на 5-й неделе гестации. Дорсальная
брыжейка желудка подвешивает развивающийся желудок
Рис. 17-1. Анатомические взаимоотношения селезенки,
диафрагмы, дна желудка, хвоста поджелудочной железы,
селезеночного изгиба ободочной кишки с IX и XI ребром.
Глава 17. Лапароскопическая спленэктомия 221
к дорсальной стенке тела и дает начало желудочно-
селезеночной связке, которая содержит короткие
желудочные сосуды. К другим крупным брюшинным
связкам селезенки относятся селезеночно-ободочная,
селезеночно-диафрагмальная, селезеночно-почечная
и диафрагмально-ободочная. Хвост поджелудочной
железы, который лежит в толще селезеночно-почечной
связки, заканчивается примерно в 1 см от
селезенки в 73% и достигает селезенки в 30% случаев [5].
Диафрагмально-ободочная связка служит как гамак
или «лифчикообразная» структура для нижнего
полюса селезенки, т.е. связкой, подвешивающей селезенку
(рис. 17-2) [5]. Комбинация обширных брюшинных
связок представляет собой уникальный
поддерживающий механизм, позволяющий защитить этот хрупкий
орган. Незаконченное мезенхимальное слияние
приводит к образованию добавочной селезенки, которая
примерно в 80% случаев может быть обнаружена в
воротах селезенки или примыкающих связках (рис. 17-3)
[6]. В серии из 3000 аутопсий частота дополнительной
селезенки составляла 10% [7], хотя ее
распространенность выше у пациентов с гематологическими
заболеваниями [8].
Селезенка снабжается кровью из чревного ствола.
Основную массу крови она получает
непосредственно из селезеночной артерии, которая обычно
проходит вдоль верхнего края поджелудочной железы, а
затем разветвляется в воротах селезенки или несколько
проксимальнее относительно них. Существует два типа
ветвления: магистральный и рассыпной [9]. При
магистральном типе, который встречается примерно у 30%
пациентов, основная селезеночная артерия длинная
и разделяется рядом с воротами на три или четыре
крупные терминальные ветви, которые входят в
селезенку в области, занимающей от У до У ее медиальной
поверхности (рис. 17-4).
При рассыпном типе строения, отмеченном
примерно у 70% пациентов, имеется короткий ствол
селезеночной артерии и 6-12 длинных ветвей, которые
начинаются на расстоянии от 3 до 13 см от ворот и входят
в селезенку в области, занимающей 3/4 ее медиальной
поверхности (рис. 17-5) [10]. Эти сосуды дают
ветви в трабекулярный соединительнотканный каркас
и оканчиваются центральными артериями в
паренхиме селезенки. Кровь из селезенки оттекает в
селезеночную вену, которая в итоге соединяется с верхней
брыжеечной веной, формируя воротную вену.
Три основные функции селезенки — это
фильтрация, хранение и иммунологическая функция. С
кровотоком примерно 300 мл/мин селезеночная фильтрация
через связки Бильрота эффективно осуществляется
ретикулярными клетками. При фильтрации
происходят отбраковка состарившихся клеток, разрушение
патологических эритроцитов и удаление включений,
находящихся в эритроцитах. В селезенке может
содержаться примерно У, всех имеющихся в организме
тромбоцитов и гранулоцитов, и, таким образом, в
нормальных условиях она служит хранилищем этих клеток
[11]. В случае развития патологии селезенка способна
изолировать до 98% всех тромбоцитов организма [12].
Гистологическая структура селезенки хорошо
приспособлена для таких иммунологических процессов,
как опсонизация, фагоцитоз и представление
чужеродных антигенов. Она, кроме того, крайне важна для
продукции туфтсина, пропердина и пептидов, которые
играют большую роль в стимуляции фагоцитоза рети-
Кардия
Желудочно-селезеночная
Короткие свя,зка
желудочные вены
Малый сальник
Желудочно-ободочная
связка
Селезеночно-почечная
связка
Большой сальник
Желудочно-
сальниковая артерия
Диафрагмально-
ободочная связка
Подвешивающая
связка селезенки
Селезеночно-
ободочная связка
Рис. 17-2. Анатомическое расположение
различных подвешивающих связок
селезенки (из: Poulin etal. [24]).
222 Лапароскопическая хирургия. Атлас
Рис. 17-3. Расположение добавочной селезеночной ткани.
А — ворота селезенки. Б — селезеночная артерия и хвост
поджелудочной железы. В — селезеночно-ободочная связка.
Г — сальник. Д — брыжейка. Е — пресакральная область. Ж -
придатки матки. 3 — перитестикулярная область. В воротах
селезенки, включая область хвоста поджелудочной железы,
локализуется 2/3 всей добавочной селезеночной ткани.
Короткие желудочные артерии
АО
Левая \ Верхняя
желудочная \ терминальная артерия
артерия
Печеночная
артерия
Верхнеполярная
артерия
Предпоследняя
ветвь
Нижняя
терминальная
артерия
Нижнеполярная
артерия
Рис. 17-4. Магистральный (или пучковый)
тип строения селезеночных сосудов.
Главная селезеночная артерия, которая
встречается примерно в 30% случаев,
длинная и разделяется рядом с воротами
на 3 или 4 крупные терминальные ветви,
которые входят в селезенку в области,
занимающей 7, или 74 ее медиальной
поверхности. Более компактные и узкие
ворота потенциально затрудняют
диссекцию и изоляцию сосудов. АО —
аорта; БПА — большая панкреатическая
артерия.
Глава 17. Лапароскопическая спленэктомия 223
Поперечные анастомозы
Короткие
желудочные артерии
Верхнеполярная
артерия
Предпоследняя ветвь
АО
Левая
желудочная артерия
Печеночная
артерия
Конечная ветвь
■ Верхняя
терминальная
артерия
"Поперечные
анастомозы
Нижнеполярная
артерия
Левая
желудочно-сальниковая
артерия
Рис. 17-5. Рассеянный тип ветвления
селезеночных сосудов. Встречается
примерно в 70% случаев, характеризуется
наличием короткого ствола селезеночной
артерии и 6-12 длинных ветвей, которые
начинаются на расстоянии от 3 до 13 см
от ворот и входят в селезенку на площади,
занимающей более 3/4 медиальной
поверхности селезенки. Повышенное
количество долек, бугорков, выемок
в топографии селезенки указывают
на рассеянный тип васкуляризации
и более сложное кровоснабжение. АО —
аорта; БПА — большая панкреатическая
артерия.
кулоцитами и в системе комплемента [13,14]. В
селезенке созданы все необходимые условия для первичного
антительного ответа, приводящего к синтезу
иммуноглобулинов класса М после первичного появления
чужеродного антигена [15]. Селезенка — место
первичного фагоцитоза бактерий с полисахаридной капсулой.
Таким образом, у пациентов, перенесших спленэктомию,
отмечается риск развития угрожающего жизни сепсиса
при инфицировании инкапсулированными патогенами.
Совокупный риск губительной инфекции у взрослых,
перенесших спленэктомию, составляет 0,28-1,9%; выше
риск у младенцев, детей и лиц, показанием к сплен-
эктомии у которых было гематологическое
заболевание (в отличие от травмы) [16]. При инфекциях после
спленэктомии в 50% случаев высевается Streptococcus
pneumoniae, реже — Haemophilus influenzae и Neisseria
meningitides [17]. Таким образом, пациентам после
спленэктомии следует проводить вакцинацию против
Streptococcus pneumoniae поливалентным капсулярным
полисахаридом. Хотя исследования, подтверждающие
преимущества такого подхода, у людей проведены
не были, большинство хирургов предпочитают
вводить вакцину за 1-2 нед до плановой спленэктомии.
Если антипневмококковую вакцинацию до операции
не проводили, ее необходимо провести после операции,
так как пациенты после спленэктомии способны
практически к такому же сильному антительному ответу,
как и пациенты с нормальной функцией селезенки [18].
Несмотря на то что вакцинация против Haemophilus
influenzae и Neisseria meningitides необязательна, ее часто
проводят пациентам с риском заражения этими
патогенами. Кроме того, пациентам с высоким риском
возникновения тяжелой инфекции, включая детей и пациентов
с иммунодефицитом, часто назначают антибиотикоте-
рапию, направленную непосредственно на Streptococcus
pneumoniae, поскольку эффективность вакцинации
составляет примерно 80% [17].
ПОКАЗАНИЯ
В настоящее время показания к лапароскопической
спленэктомии не отличаются от показаний к
открытой спленэктомии. Спленэктомия показана при ряде
доброкачественных гематологических заболеваний,
злокачественных заболеваниях системы
кроветворения, вторичном гиперспленизме и других
анатомических патологиях селезенки (рис. 17-6), при
нормальной или умеренно увеличенной селезенке (длиной
до 20 см). Спленэктомия преследует одну из трех
терапевтических целей:
• профилактику анемии в результате селезеночной
изоляции деформированных эритроцитов при ге-
моглобинопатиях, дефектах мембраны эритроцитов
и нарушениях работы ферментных систем
эритроцитов;
• лечение селезеночной изоляции при первичном
или вторичном гиперспленизме;
• стадирование при злокачественных заболеваниях,
например при болезни Ходжкина [2].
При первичной доброкачественной патологии
селезенки (кистах и гамартомах) показана
лапароскопическая частичная спленэктомия.
Лапароскопическая спленэктомия стала «золотым
стандартом» хирургического лечения
доброкачественной патологии системы кроветворения [19, 20]. Чаще
всего спленэктомию применяют при иммунной тром-
боцитопенической пурпуре, при которой происходит
аутоиммунное разрушение тромбоцитов. Спленэктомия
показана в случаях, когда лечение глюкокортикоидами
224 Лапароскопическая хирургия. Атлас
Показания к спленэктомии
Доброкачественные гематологические заболевания
Наследственный сфероцитоз и эллиптоцитоз
Серповидно-клеточная анемия
Талассемия
АГА
ИТП
ттп
Синдром Эвана
Синдром Фелти
Злокачественное заболевание селезенки
Ходжкинская лимфома
Неходжкинская лимфома
Волосатоклеточная анемия
Вторичный гиперспленизм
Цирроз
Кистозный фиброз
Миело- и лимфопролиферативные заболевания
Саркоидоз
Болезнь Гоше
Доброкачественная патология селезенки
Киста селезенки
Гамартома
Травма селезенки
Другие
Аневризма селезеночной артерии
Кавернозная гемангиома
Роль лапароскопической спленэктомии (ЛС)
ЛС является операцией выбора
ЛС для тканевой диагностики, стадирования, при цитопении
ЛС при нормальной или умеренно увеличенной селезенке
ЛРА может быть альтернативой открытой спленэктомии при крупной или
гигантской спленомегалии
ЛС является стандартом
У гемодинамически стабильного пациента ЛС может рассматриваться
как альтернатива неоперативному лечению
ЛС является операцией выбора
Рис. 17-6. Показания к спленэктомии. АГА — аутоиммунная гемолитическая анемия; ЛРА — лапароскопическая хирургия с ручной
ассистенцией; ИТП — идиопатическая тромбоцитопеническая пурпура; ТТП — тромботическая тромбоцитопеническая пурпура.
и внутривенными у-глобулинами оказалось
безуспешным или если для профилактики рецидива требуется
длительная терапия глюкокортикоидами.
Необходимость в лапароскопической спленэктомии еще возникает
при анемиях, вызванных ферментными расстройствами
эритроцитов, дефектами мембран эритроцитов и гемо-
глобинопатиями, при которых разрушение эритроцитов
в селезенке ведет к хронической анемии. К другим
заболеваниям, при которых показана лапароскопическая
спленэктомия, относится иммунная
тромбоцитопеническая пурпура, устойчивая к консервативной терапии.
При злокачественной патологии спленэктомию
наиболее часто применяют для стадирования. Стади-
рование заключается в тщательной ревизии брюшной
полости, спленэктомии, биопсии печени,
лимфатических узлов и костного мозга из подвздошного
гребня. В связи с тем что предельно точное стадирование
с помощью минимально инвазивных методов
большинству пациентов больше не нужно, его обычно
проводят, чтобы установить присутствие или инфра-
диафрагмальное распространение заболевания у
бессимптомных пациентов в клинических стадиях I и II
болезни Ходжкина [21]. Спленэктомия при
злокачественной патологии показана также при гиперспле-
низме, цитопении и для тканевой диагностики. Хотя
лапароскопический доступ при злокачественной
патологии часто осложняют крупные размеры селезенки,
увеличение кровопотери и увеличение
продолжительности операции, тем не менее последние исследования
показали, что частота послеоперационных
осложнений и длительность госпитализации в таком случае
соответствуют показателям для спленэктомии при
доброкачественной патологии [22]. Сокращение сроков
госпитализации и снижение времени выздоровления
Глава 17. Лапароскопическая спленэктомия 225
способствуют более раннему началу антинеопластиче-
ской терапии при этих заболеваниях [22].
В настоящее время лапароскопическая спленэк-
томия играет лишь небольшую роль в лечении травм
селезенки. У гемодинамически стабильных пациентов
обычно проводят неоперативное лечение
повреждений селезенки. Однако в последнее время возник
интерес к лапароскопическому доступу у гемодинамически
стабильных пациентов с обширными повреждениями
селезенки в условиях политравмы [23].
ПРОТИВОПОКАЗАНИЯ
Большинство кандидатов для плановой спленэктомии
становятся одновременно кандидатами для
лапароскопического доступа. Основные противопоказания к
лапароскопической спленэктомии соответствуют общим
противопоказаниям к лапароскопической хирургии:
невозможность общей анестезии (при тяжелой сердечно-
легочной патологии), неконтролируемая коагулопатия,
выраженный спаечный процесс или вздутие кишечника,
препятствующие доступу в брюшную полость, и
необходимость в лапаротомии (включая большинство травм
селезенки). Противопоказанием остается и портальная
гипертензия [24]. Хотя спленэктомия может снизить
уровень тромбоцитопении у пациентов с гиперсплениз-
мом, который есть следствие цирроза и портальной ги-
пертензии, существует опасность усиления имеющейся
гипертензии. Таким пациентам предпочтительнее
провести портальную декомпрессию, которая обычно
увеличивает количество тромбоцитов [21].
Как было указано выше, размер селезенки —
весьма важный показатель (см. классификацию, рис. 17-7).
Размер селезенки более 20-25 см традиционно
считался относительным противопоказанием к
лапароскопической спленэктомии. Однако внедерение в практику
ЛРА позволило расширить возможности
лапароскопического доступа, оставляя относительным
противопоказанием к лапароскопическому доступу только
предельную спленомегалию.
ТЕХНИКА ОПЕРАЦИИ
Подготовка к лапароскопической спленэктомии
требует такой же тщательной предоперационной оценки
Классификация селезенок
в соответствии с их длиной
Класс
Нормальный размер
Умеренная спленомегалия
Массивная спленомегалия
Мегаселезенка
Длина, см
i
7-11
12-20
21-30
>30
Рис. 17-7. Классификация селезенок в соответствии с их длиной
(m:Poulinetal. [24]).
и планирования, как и большая хирургия. Как было
сказано выше, пациенты, которые подвергаются
спленэктомии, должны быть вакцинированы против
инкапсулированных микроорганизмов, по крайней мере,
за 1-2 нед до операции. При планировании
хирургического доступа помогает проведение предоперационной
визуализации селезенки для оценки ее размеров
селезенки и типа кровоснабжения. ЛРА можно применять
при размерах селезенки более 20-25 см, а при размерах
более 30 см следует ожидать технических трудностей
[24]. При планировании частичной резекции полезно
провести предоперационное исследование сосудов
ворот селезенки для определения объема резекции и
минимизации интраоперационной кровопотери.
За 30 мин до разреза в вену вводят антибиотики.
При показаниях вводят стрессовую дозу стероидов
и продукты крови по стандартной схеме. При
иммунной тромбоцитопенической пурпуре тромбоциты
перед операцией не переливают, так как они могут быстро
разрушиться. Если есть необходимость в переливании
тромбоцитов, это обычно делают после лигирования
селезеночной артерии. После анестезии вводят зонд
в желудок и катетер в мочевой пузырь.
Лапароскопическую спленэктомию проводят
передним или латеральным доступом. Передний доступ
обычно применяют при спленомегалии или гигантской
селезенке, так как чем крупнее селезенка, тем сильнее
она выпячивается из селезеночной ямки, при этом ось
ворот и кровеносные сосуды поднимаются и
ротируются в более вертикальное положение. При переднем
доступе также легче устанавливать порт для ручной
ассистенции и проводить ЛРА. Пациента укладывают
на спину, часто в модифицированное литотомическое
положение, которое позволяет хирургу оперировать
между ног пациента, а ассистенты стоят по сторонам
от стола. Открытым путем устанавливают
10-миллиметровый пупочный троакар, затем осторожно вводят
3 или 4 дополнительных порта в форме полукруга в
левом верхнем квадранте (рис. 17-8). Троакары следует
вводить осторожно, чтобы не повредить увеличенную
селезенку. Описаны разные позиции установки порта
для ручной ассистенции (по средней линии, в левом
верхнем квадранте, подреберье, правом гипогастрии
или подвздошной ямке); оптимальное место введения
зависит от анатомии пациента и опыта оператора.
При латеральном доступе, который применяют
чаще всего, пациента укладывают в правое
латеральное боковое положение, несколько наклоняя в
дорсальном направлении под углом 45° к
операционному столу. Фиксацию тела в этом положении
облегчает «ложе» из подушки вдоль тораколюмбального
отдела позвоночника или подушка, наполненная
пенорезиной (рис. 17-9). Операционный стол сгибают
для увеличения расстояния между нижними
ребрами и подвздошным гребнем. Три 12-миллиметровых
226 Лапароскопическая хирургия. Атлас
троакара вводят спереди вдоль левого края реберной
дуги, а четвертый троакар — кзади от подвздошного
гребня. Такое расположение троакаров
характеризуется максимальной гибкостью и универсальностью
при смене инструментов, установка троакаров
слишком близко к подвздошному гребню ограничит
мобильность и оперативный простор. Опытный хирург
может заменить один или два 12-миллиметровых
порта на 5-миллиметровые, что улучшает косметический
эффект (рис. 17-10). Хотя передний доступ, возможно,
более применим в случае спленомегалии, авторы
издания предпочитают использовать латеральный доступ
для более «рутинной» спленэктомии, так как считают,
что он имеет много преимуществ. К преимуществам
латерального доступа относятся: возможность диссек-
ции сосудов селезенки в относительно бессосудистом
забрюшинном пространстве, гравитационная
ретракция селезенки, улучшенный доступ к диафрагмально-
ободочной связке, облегченное рассечение желудочно-
селезеночной и селезеночно-почечной связки, лучшая
идентификация хвоста поджелудочной железы и
тенденция к скоплению крови при интраоперационной
кровопотере вдали от ворот, а не вокруг них [25].
Для тщательного исследования брюшной
полости и выявления добавочных селезенок используют
30-45-градусный лапароскоп. Добавочные селезенки
имеются у 10% людей в общей популяции, чаще они
встречаются у пациентов с гематологическими
заболеваниями [26]. Для улучшения обзора желудок
можно отвести в медиальном направлении. Основная
масса добавочных селезенок расположена в области
ворот селезенки и ее сосудистой ножки (54 и 25%
соответственно), хотя значительное их количество
находят и в области хвоста поджелудочной железы,
селезеночно-ободочной связки и в большом сальнике.
Идентификацию и резекцию добавочных селезенок
легче проводить перед удалением основной селезенки,
в относительно бескровном операционном поле.
Далее переходят непосредственно к
селезенке. Селезеночный изгиб мобилизуют путем
рассечения селезеночно-ободочной связки с переходом
на желудочно-ободочную и желудочно-селезеночную
связки (рис. 17-11). Хвостовую часть диафрагмально-
ободочной связки, связку, подвешивающую селезенку,
и селезеночно-ободочную связку рассекают у
нижнего полюса селезенки. При диссекции могут
встречаться множественные ветви желудочно-сальниковых
сосудов, идущие к нижнему полюсу селезенки,
которые необходимо осторожно пересечь. Остатки
пересеченных селезеночно-ободочной и диафрагмально-
ободочной связок, прикрепленных к селезенке снизу
и латерально, можно использовать в качестве
рукоятки при мобилизации и отведении хрупкой селезенки
(рис. 17-12). Латеральные и задние связки
селезенки вначале сохраняют — так будет удобнее держать
селезенку подвешенной к латеральной или задней
стенке живота. Проникновение в сальниковую
сумку с помощью рассечения желудочно-селезеночной
и селезеночно-почечной связок приводит к
формированию «селезеночного тента», улучшая визуализацию
и доступ к селезеночным сосудам (рис. 17-13). «Пол»
тента представлен задней стенкой желудка. Левый
лоскут или стенка тента — желудочно-ободочная
связка — содержит короткие желудочные сосуды. Правый
лоскут — селезеночно-почечная связка — содержит
селезеночную артерию, вену и хвост поджелудочной
железы. Выбор доступа к сосудистой ножке зависит
от индивидуальной анатомии селезеночных
сосудов (пучкового или магистрального типа строения
селезеночной артерии). Ножку подвергают
диссекции и визуализируют спереди и сзади в зависимости
от индивидуальной анатомии и строения тела
каждого пациента. Иногда проведению диссекции может
помочь «перебрасывание» селезенки поочередно вперед
и назад (рис. 17-14). Предельно важно определить
место окончания хвоста поджелудочной железы, чтобы
избежать, если это возможно, повреждения или
рассечения ее паренхимы. При первичном гемостазе
ветвей сосудов ворот селезенки можно применить
хирургические клипсы или лапароскопическое лиги-
рование отдельных сосудов в зависимости от их
размера. Для хорошего гемостаза и рассечения основной
селезеночной сосудистой ножки авторы
предлагают в качестве альтернативного варианта одиночное
или серийное наложение сосудистого степлера (рис.
17-15). При прогрессирующей деваскуляризации
паренхима селезенки изменит цвет, что подтвердит
адекватность перевязки питающих сосудов. При
диссекции желудочно-селезеночной связки в
краниальном направлении хирург сталкивается с короткими
желудочными сосудами, которые нужно осторожно
пересечь до или после пересечения основной
сосудистой ножки. При диссекции, рассечении
подвешивающих связок, пересечении коротких желудочных
сосудов авторы отдают предпочтение устройству
«LigaSure» (Valleylab, Boudler, СО), хотя с этой целью
можно применять большинство коммерчески
доступных устройств (рис. 17-16). После этого можно
пересечь селезеночно-диафрагмальную связку и ткани,
прикрепляющие селезенку сзади (рис. 17-17).
Удаленную селезенку помещают медиальнее
операционного поля с помощью атравматического зажима,
который не вызовет разрыва хрупкого органа.
Осматривают сосуды ворот, хвост поджелудочной железы
и большую кривизну желудка, чтобы убедиться в
адекватности гемостаза, выявить признаки повреждений
и добавочную ткань селезенки. Проводят орошение
и тщательную аспирацию в области левого верхнего
квадранта живота. Дренаж обычно не нужен, за
исключением случаев, когда подозревают повреждение
Глава 17. Лапароскопическая спленэктомии 227
хвоста поджелудочной железы. Через
12-миллиметровый порт вводят пластиковый эндоскопический мешок
для извлечения удаленного органа и осторожно
помещают в него селезенку (рис. 17-18). Отверстие мешка
закрывают с помощью противотяги за его шнурки.
Край мешка с селезенкой выводят через отверстие
12-миллиметрового порта, которое при
необходимости можно расширить. На этом этапе селезенку обычно
'О- подвергают морцелляции с помощью пальца или окон-
ок чатого зажима, после чего достают образец. Необходи-
ie- мо делать морцелляцию осторожно, чтобы избежать
ка попадания фрагментов селезенки в брюшную полость
;и. как рядом с отверстием мешка, так и при разрыве меш-
ие ка, так как это может привести к спленозу. Затем заши-
:о- вают фасцию всех отверстий для троакаров размером
но 10 мм и более, после чего сопоставляют края кожи.
Операционная
сестра
Рис. 17-9. Правое латеральное положение пациента
для лапароскопической спленэктомии. Хирург стоит
у операционного стола лицом к животу пациента. Ассистент
стоит у противоположного конца стола.
Рис. 17-8. Передний доступ для лапароскопической
спленэктомии. Доступ в брюшную полость проводят
периумбиликально, с помощью 10-миллиметрового порта,
создают пневмоперитонеум. Вводят лапароскоп с угловой
оптикой, остальные троакары вводят стратегически
по изогнутой линии в виде буквы L, центр которой будет
находиться в левом верхнем квадранте. В подмечевидной
области вводят 5-миллиметровый троакар для ретракции
и два 12-миллиметровых операционных порта в левой
части среднего отдела живота. Если необходимо, между 1 -м
и 2-м портом можно установить 5-миллиметровый троакар.
Пятимиллиметровые порты можно заменить одним портом
или более диаметром 12 мм.
ПОДГОТОВКА
228 Лапароскопическая хирургия. Атлас
Рис. 17-10. Латеральный доступ для лапароскопической
спленэктомии.Три 12-миллиметровых троакара вводят
спереди, вдоль левого края реберной дуги, а четвертый
троакар — сзади от подвздошного гребня, что позволяет
обеспечить максимальную гибкость и чередование
инструментов. Однако в опытных руках 12-миллиметровые
троакары можно заменить одним или двумя
5-миллиметровыми портами для улучшения косметических
результатов.
ОПЕРАЦИЯ
Рис. 17-11. Показано рассечение селезеночно-ободочной
связки с помощью устройства «LigaSure» {Valleylab, Boudler,
СО). Диссекцию продолжают вдоль медиальной поверхности
селезенки, распространяясь на желудочно-ободочную
и желудочно-селезеночную связки.
Рис. 17-12. Маленький участок рассеченной селезеночно-
ободочной связки слева от нижнего полюса селезенки
будет служить рукояткой для манипуляций при диссекции
селезенки.
Глава 17. Лапароскопическая спленэктомия 229
Рис. 17-13. Селезеночный тент. Вхождение в малый
сальник и осторожная диссекция желудочно-селезеночной
и селезеночно-почечной связок способствуют выделению,
визуализации и рассечению их сосудистых компонентов.
Осторожная тракция нижнего полюса селезенки кверху
поможет продемонстрировать «тент». Успешно удалить
селезенку лапароскопически позволяют осторожная
диссекция и рассечение этих структур.
Рис. 17-14. Визуализация передней поверхности селезеночных сосудов
и их пересечение (А). Визуализация задней поверхности ворот и сосудов селезенки
и их диссекция (Б, В). Перебрасывание селезенки из стороны в сторону позволяет
осмотреть обе поверхности ворот и иногда помогает выбрать оптимальный доступ
для пересечения селезеночных сосудов и обнаружения терминального отдела хвоста
поджелудочной железы.
230 Лапароскопическая хирургия. Атлас
Рис. 17-15. Рассечение сосудистой
ножки селезенки с помощью
серийного (3) наложения степлера.
Степлер подводят (А) к нижней
части сосудистого пучка и приводят
в действие. Ревизия линии
скобок (Б) показала приемлемый
гемостаз. Для полного пересечения
кровеносных сосудов селезенки
осталось еще несколько шагов
степлера (В, Г).
Рис. 17-16. Короткие желудочные
сосуды, проходящие в краниальном
отделе желудочно-селезеночной
связки, рассечены с помощью
устройства «LigaSure» (Valleylab, Boud-
ler, CO).
Рис. 17-17. После рассечения
основного сосудистого пучка
и коротких желудочных сосудов
оставшиеся ткани, связывающие
заднюю поверхность селезенки
с брюшной стенкой, можно легко
рассмотреть и пересечь.
Рис. 17-18. Часто наиболее
проблемным этапом операции
становится осторожная укладка
селезенки в эндоскопический
контейнер.
Глава 17. Лапароскопическая спленэктомия 231
НАПРАВЛЕНИЯ ДАЛЬНЕЙШЕГО РАЗВИТИЯ
Кроме общепризнанной и обычно применяемой
техники, которая описана выше, в настоящее время освоено
несколько инновационных подходов к
лапароскопической спленэктомии. Один из вариантов
лапароскопического лечения спленомегалии, популярность
которого сейчас все возрастает, — ЛРА. Хотя формально
больше не существует противопоказаний к
лапароскопической спленэктомии, массивная спленомегалия
ограничивает пространство для внутрибрюшинных
манипуляций, увеличивает длительность операции,
может потребовать установки дополнительных
троакаров, а также характеризуется повышенным риском
конверсии в открытую спленэктомию [27].
Предварительные исследования по применению порта для
ручной ассистенции, который необходим изначально
для поддержания пневмоперитонеума и обеспечения
прямых манипуляций с селезенкой, показали, что его
использование снижает продолжительность операции,
кровопотерю и имеет более низкий процент
конверсии в открытую операцию при очень больших
селезенках (>1000 г) [27]. Сообщают, что ручная ассистен-
ция уменьшает продолжительность операции на 30%
(в сравнении с полностью лапароскопическими
операциями) и снижает частоту конверсии в открытые
операции до 8% [2]. Хотя операции с ручной ассистен-
цией и критикуют за отказ от полностью
лапароскопического доступа, их приверженцы подчеркивают,
что многие преимущества чистых лапароскопических
операций сохраняются и операции с ручной ассистен-
цией можно считать перспективными при массивной
спленомегалии.
Существует нескольких других модификаций
обычного лапароскопического доступа. Сообщается,
что применение устройства для склеивания сосудов
«LigaSure» (используется биполярная энергия для
склеивания сосудов с помощью их сплавления) может
служить альтернативой традиционной ультразвуковой
коагуляции с последующим применением эндостепле-
ра для контроля сосудов. В небольшом количестве
исследований, проведенных к настоящему времени, этот
метод показал себя таким же безопасным, как и
традиционные методы, и в то же время он снижает
кровопотерю в детской популяции [27, 28].
Рис. 17-19. Инструмент в виде лассо для захвата нижнего
полюса селезенки в целях ретракции и при необходимости —
для проведения различных манипуляций.
К другим модификациям современной
лапароскопической техники относится применение
специальных зажимов для оптимизации положения селезенки
и лучшей визуализации. Зажим в виде лассо для
поддержания селезенки описали Beldrini et al. (рис. 17-19)
[30], a Brody описал змеевидный ретрактор с кончиком,
который может самостоятельно замыкаться,
оборачиваясь вокруг ворот селезенки (рис. 17-20) [30].
Роботассистированная лапароскопическая сплен-
эктомия — еще один развивающийся метод. В
ограниченном количество исследований, которые можно
проанализировать на сегодняшний день,
роботизированная операция с использованием системы «Da
Vinci» оказалась технически выполнимой и
безопасной (по показателям интраоперационных осложнений
и конверсии в открытую операцию) [31-33]. Однако
преимущества роботизированной техники еще не
доказаны. Одно из исследований, в котором сравнивали
первые шесть роботизированных спленэктомии,
проведенных в этой клинике, с шестью обычными
лапароскопическими спленэктомиями показало, что
роботизированный доступ характеризуется увеличением
продолжительности операции и более высокой
стоимостью самой процедуры [32].
РЕЗУЛЬТАТЫ
Лапароскопическая спленэктомия — операция
выбора при плановом удалении селезенки. Хотя
рандомизированных проспективных исследований,
сравнивающих лапароскопическую и открытую
спленэктомию, не проводили, результаты крупных серий
и нерандомизированных сравнительных
исследований по спленэктомии при доброкачественных
гематологических заболеваниях показали, что
лапароскопическая спленэктомия по своим
положительным результатам эквивалентна открытой спленэкто-
Рис. 17-20. Змеевидный ретрактор, подведенный вокруг
сосудистой ножки, отводит и в то же время фиксирует
«свободно висящую» селезенку.
232 Лапароскопическая хирургия. Атлас
мии или даже превосходит ее. Частота немедленных
позитивных ответов в раннем периоде в крупных
сериях исследованных пациентов достигает 83%,
а количество пациентов, находящихся в длительной
ремиссии при иммунной тромбоцитопенической
пурпуре, приближается к 77% [26]. Как и при других
лапароскопических операциях, широко
распространенные результаты таковы: снижение
интенсивности послеоперационных болей, улучшенная функция
легких, снижение продолжительности
госпитализации и сниженный процент нетрудоспособности.
Продолжительность госпитализации после
лапароскопической спленэктомии составляет 2,5-5 дней,
что примерно на 4 дня короче, чем при открытой
спленэктомии [26, 34-36]. При лапароскопической
спленэктомии реже отмечается послеоперационный
парез кишечника, причем среднее время
восстановления перистальтики составляет всего 29 ч [34].
ОСЛОЖНЕНИЯ
К осложнениям лапароскопической спленэктомии
относят конверсию в открытую операцию, обычные
послеоперационные осложнения, длительный курс
обучения, персистирование добавочных селезенок и
тяжелый постспленэктомический сепсис.
Частота конверсии при лапароскопических
спленэктомиях, по данным крупных серий, составляет от 3
до 8% — при доброкачественной патологии и 14-21% —
при злокачественной (при которой выше частота спле-
номегалии и кровотечений) [24]. В этих сериях
основными причинами конверсии в открытую операцию
были спленомегалия и кровотечение из ворот селезенки
[29,37]. Во многих из этих исследований конверсии в
открытую операцию отмечались в первых 50-100 случаях.
Лапароскопическая спленэктомия требует
длительного обучения, поскольку имеется корреляция между
частотой конверсии и количеством проведенных
лапароскопических спленэктомии. В большинстве
сообщений такие тяжелые осложнения, как конверсия
в открытую форму вмешательства или кровотечение,
требующее трансфузии, отмечали у первых 58
пациентов, а в более мелких сериях — 6 конверсии в открытую
операцию зафиксировали в первых 8 случаях, в то
время как только одна конверсия приходилась на
следующие 25 случаев [26,28]. По результатам средних по
размеру серий исследований лапароскопических
спленэктомии у детей установлена необходимость в
аналогичном длительном курсе обучения. При сравнении 15
последних пациентов с первыми 20 стали очевидными
статистически значимое снижение конверсии в
открытую операцию, сниженная кровопотеря и изменение
продолжительности госпитализации и длительности
операции [39].
Во многих сериях частота послеоперационных
осложнений при лапароскопической и открытой
спленэктомии была эквивалентной [26]. Однако сами
осложнения весьма разнились. Послеоперационные
осложнения при лапароскопической спленэктомии
обычно более легкие: чаще всего диагностировали
парез кишечника, серомы в местах введения троакаров
и плевральный выпот [26]. Напротив, в крупных
сериях было показано, что при открытых спленэктомиях
преобладают тяжелые осложнения — тромбоэмболия
легочной артерии (ТЭЛА), поддиафрагмальный
абсцесс, требующий повторной операции, и
панкреатический свищ [26, 40]. Тромбоз воротной вены —
серьезное осложнение открытой спленэктомии (частота его
развития составляет 6-10% при открытой операции),
может с той же частотой встречаться и при
лапароскопической спленэктомии, хотя к настоящему времени
на этот счет имеются только результаты небольших
предварительных исследований [26, 41].
Оставление добавочных селезенок вызывало
критику оппонентов в раннем периоде применения
лапароскопической спленэктомии. Вследствие
ограниченного доступа при лапароскопической операции
по сравнению с открытой формой возник страх
оставления большого количества добавочных селезенок,
что привело бы к неполному излечению многих
доброкачественных гематологических образований. Более
80% добавочных селезенок находят в области ворот
селезенки и ее сосудистой ножки — области, которую
трудно полностью визуализировать или критически
исследовать при лапароскопическом доступе. Однако
количество выявленных дополнительных селезенок
в лапароскопических сериях варьировало от 6 до 39%,
что соответствует данным открытых серий [26].
Тяжелые инфекции все еще осложняют как
лапароскопические, так и открытые спленэктомии. Их
частота варьирует от 0,5% у пациентов с травмой
селезенки до 20% у пациентов после спленэктомии по поводу
гематологических заболеваний [2]. Наиболее высок
риск инфицирования у детей и в первые 2 года после
спленэктомии. Основная стратегия, снижающая
частоту развития этого осложнения, — профилактические
меры в виде предоперационной вакцинации.
Глава 17. Лапароскопическая спленэктомия 233
СПИСОК ЛИТЕРАТУРЫ
■
1. Coon W.W. The spleen and splenectomy // Surg. Gynecol.
Obstet. — 1991. — Vol. 173. — P. 407-414.
2. Uranues S., Alimoglu O. Laparoscopic surgery of the spleen // Surg.
Clin. North Am. — 2005. — Vol. 85. — P. 75-90.
3. Morganstern L. A history of splenectomy // Surgical Diseases of
the Spleen/Eds J.R. Hiatt, E.H. Phillips, L. Morgenstern. — Berlin:
Springer-Verlag, 1997. — P. 7-9.
4. King H., Shumacker H.B., Jr: Splenic studies: I. Susceptibility to
infection after splenectomy performed in infancy // Ann. Surg. —
1952. — Vol. 136. — P. 239-242.
5. Poulin E.C., Thibault С The anatomical basis for laparoscopic
splenectomy // Can. J. Surg. — 1993. — Vol. 36. — P. 484-88.
6. Seufert R., Mitrou P. The diseased spleen // Surgery of the Spleen /
Ed. HA. Reber. — New York: Theme, 1986. — P. 27-32.
7. Halpert C, Gyorkey E Lessons observed in accessory spleens of 311
patients // Am. J. Clin. Pathol. — 1959. — Vol. 32. — P. 165-168.
8. Gigot J.-E, Legrand M., Cadiere G.-B. et al. Is laparoscopic
splenectomy a justified approach in hematologic disorders?
Preliminary results of a prospective multicenter study // Int.
Surg. — 1995. — Vol. 80. — P. 299-303.
9. Ssoson-Jaroschewitsch A. Zur chirurgischen Anatomie des
Milzhilus // Z. Gesamte Anat. Abt. — 1937. — Vol. 84. — P. 218-
224.
10. Michels N.A. The variational anatomy of the spleen and splenic
artery // Am. J. — 1942. — Vol. 70. — P. 21-72.
11. Aster R.H. Pooling of platelets in the spleen // J. Clin. Invest. —
1966. — Vol. 45. — P. 645-657.
12. Hill-Zobel R.L., McCandless В., Kang A. et al. Organ distribution
and fate of human platelets: studies of asplenic and splenomegalic
patients // Am. J. Hematol. — 1986. — Vol. 3. — P. 231-238.
13. Constantopoulos A., Najjar V.A., Wish J.B. Defective phagocytosis
due to tuftsin deficiency in splenectomized subjects // Am. J. Dis.
Child. — 1973. — Vol. 125. — P. 663-665.
14. Frank E.L., Neu H.C. Postsplenectomy infection // Surg. Clin.
North Am. — 1981. — Vol. 61. — P. 135-155.
15. Sullivan J.L., Ochs H.D., Schiffmann G. et al. Immune response
after splenectomy // Lancet. — 1978. — i: P. 178-181.
16. Lynch A.M., Kapila R. Overwhelming postsplenectomy infection //
Infect. Dis. Clin. North Am. — 1996. — Vol. 10. — P. 693-707.
17. Shaw J.H. E, Print C.G. Postsplenectomy sepsis // Br. J. Surg. —
1989. — Vol. 76. — P. 401-403.
18. Ruben F.L., Hankins W.A., Zeigler Z. et al. Antibody responses to
meningococcal polysaccharide vaccine in adults without a spleen //
Am. J. Med. — 1984. — Vol. 76. — P. 115-121.
19. Silecchia G., Raparelli L., Casella G., Basso N. Laparoscopic
splenectomy for non-traumatic diseases // Minerva Chir. —
2005. — Vol. 60. — P. 363-374.
20. Gigot J.F., Lengele В., Gianello P. et al. Present status of laparoscopic
splenectomy for hematologic diseases: certitudes and unresolved
issues // Semin. Laparosc. Surg. — 1998. — Vol. 5. — P. 147-167.
21. Schwartz S.I. Role of splenectomy in hematologic disorders //
World J. Surg. — 1996. — Vol. 20. — P. 1156-1159.
22. Rosen M., Brody E, Walsh R.M. et al. Outcome of laparoscopic
splenectomy based on hematologic indication // Surg. Endosc. —
2002. — Vol. 16. — P. 272-279.
23. Huscher C.G., Mingoli A., Sgarzini G. et al. Laparoscopic treatment
of blunt splenic injuries: initial experience with 11 patients // Surg.
Endosc. — 2006. — Vol. 20. — P. 1423-1426.
24. Poulin E.C., Schlachta СМ., Mamazza J. Laparoscopic
splenectomy // ACS Surgery / Eds W.W. Souba, M.P. Fink,
G.J. Jurkovich et al. — New York: WebMD, 2004. — P. 521-544.
25. Poulin E.C., Schlatcha СМ., Mamazza J. Laparoscopic
splenectomy // Operative Techniques in General Surgery. —
2004. — Vol. 6. — P. 42-54.
26. Katkhouda N., Manhas S., Umbach T.W., Kaiser A.M. Laparoscopic
splenectomy // J. Laparoendosc. Adv. Surg. Tech. A. — 2001. —
Vol. 11.— P. 383-390.
27. Targarona E.M., Gracia E., Rodriguez M. et al. Hand-assisted
laparoscopic surgery // Arch. Surg. — 2003. — Vol. 138. — P. 133-
141; discussion — P. 141.
28. Romano E, Caprotti R., Franciosi С et al. The use of LigaSure
during pediatric laparoscopic splenectomy: a preliminary report //
Pediatr. Surg. Int. — 2003. — Vol. 19. — P. 721-724.
29. Romano E, Caprotti R., Franciosi С et al. Laparoscopic
splenectomy using Ligasure. Preliminary experience // Surg.
Endosc. — 2002. — Vol. 16. — P. 1608-1611.
30. Bedirli A., Sozuer E.M., Saglam A., et al. Grasper-assisted versus
traditional laparoscopic splenectomy in the management of
hematologic disorders // J. Laparoendosc. Adv. Surg. Tech. A. —
2003. — Vol. 13. — P. 359-363.
31. Bodner J., Lucciarini P., Fish J. et al. Laparoscopic splenectomy
with the Da Vinci robot // J. Laparoendosc. Adv. Surg. Tech. A. —
2005.— Vol. 15.— P. 1-5.
32. Bodner J., Kafka — Ritsch R., Lucciarini P. et al. A critical
comparison of robotic versus conventional laparoscopic
splenectomies // World J. Surg. — 2005. — Vol. 29. — P. 982-985;
discussion — P. 985-986.
33. Corcione E, Esposito C, Cuccurullo D. et al. Advantages and limits
of robot-assisted laparoscopic surgery: preliminary experience //
Surg. Endosc. — 2005. — Vol. 19. — P. 117-119.
34. Chowbey P.K., Goel A., Panse R. et al. Laparoscopic splenectomy
for hematologic disorders: experience with the first fifty patients //
J. Laparoendosc. Adv. Surg. Tech. A. — 2005. — Vol. 15. — P. 28-
32.
35. Friedman R.L., Hiatt J.R., Korman J.L. et al. Laparoscopic or
open splenectomy for hematologic disease: which approach is
superior? // J. Am. Coll. Surg. — 1997. — Vol. 185. — P. 49-54.
36. Glasgow R.E., Yee L.F., Mulvihill S.J. Laparoscopic splenectomy: the
emerging standard // Surg. Endosc. — 1997. — Vol. 11. — P. 108-
112.
37. Park A.E., Birgisson G., Mastrangelo M.J. et al. Laparoscopic
splenectomy: outcomes and lessons learned from over 200 cases //
Surgery. — 2000. — Vol. 124. — P. 660-667.
38. Bagdasarian R.W., Bolton J.S., Bowen J.C. et al. Steep learning curve
of laparoscopic splenectomy // Laparoendosc. Adv. Surg. Tech.
A. — 2000. — Vol. 10. — P. 319-323.
39. Cusick R.A., Waldhausen J.H. The learning curve associated with
pediatric laparoscopic splenectomy // Am. J. Surg. — 2001. —
Vol. 181. — P. 393-397.
40. Miniati D.N., Padidar A.M., Kee S.T et al. Portal vein thrombosis
after laparoscopic splenectomy: an ongoing clinical challenge //
Jsls. — 2005. — Vol. 9. — P. 335-338.
41. Harris W, Marcaccio M. Incidence of portal vein thrombosis after
laparoscopic splenectomy // Can. J. Surg. — 2005. — Vol. 48. —
P. 352-354.
234 Лапароскопическая хирургия. Атлас
шша:
Лапароскопическая
адреналэктомия
Эрих С. Хуанг, Джон А. Олсон-мл.
Надпочечники расположены в забрюшинном
пространстве с обеих сторон, рядом с верхнемедиальной
поверхностью почек (рис. 18-1). Надпочечники имеют
золотисто-коричневый цвет и узловатую поверхность,
масса каждого из них у взрослых составляет примерно
4 г. Они продуцируют альдостерон, кортизон, половые
гормоны и катехоламины. Хирургическое удаление
надпочечника показано при альдостерономе, кортико-
стероме, феохромоцитоме, злокачественных опухолях,
опухолях коры надпочечника, продуцирующих
половые гормоны, и крупных афункциональных аденомах
коры надпочечников.
С момента первого описания в 1992 г.
лапароскопическая адреналэктомия заняла место открытой адрена-
лэктомии в качестве операции выбора при
большинстве мелких доброкачественных заболеваний
надпочечников [1, 2]. Гормонально-активные и афункцио-
нальные аденомы или феохромоцитомы тоже очень
подходят для лапароскопического удаления,
поскольку имеют мелкие размеры и их визуализация при
лапароскопии часто лучше, чем при открытой адреналэк-
томии. Обычные преимущества лапароскопической
хирургии, включая меньшую болезненность и
сниженную продолжительность госпитализации,
подтверждены данными нескольких исследований [3]. Во многих
случаях пациентов выписывают на следующий день
после операции. Лапароскопический доступ не следует
применять, если имеются подозрения на наличие
первичной злокачественной опухоли надпочечников.
При планировании адреналэктомии
необходимо помнить некоторые анатомические особенности.
Во-первых, забрюшинное расположение желез
позволяет выбрать доступ (забрюшинный или
трансабдоминальный). Большинство хирургов, проводящих
лапароскопическую адреналэктомию, предпочитают
трансабдоминальный доступ, потому что он
позволяет получить большее рабочее пространство,
облегчить конверсию в открытую операцию, если это
Правая и левая
средние надпочечниковые артерии
Правая нижняя
диафрагмальная артерия
Правая верхняя
надпочечниковая артерия'
Правый надпочечник-.
Правая.
надпочечниковая
вена
Правая нижняя -
надпочечниковая
артерия
Левая нижняя
диафрагмальная артерия
Левая верхняя
надпочечниковая артерия
Левый надпочечник
Левая
надпочечниковая вена
Левая нижняя
надпочечниковая
артерия
Нижняя полая вена
Рис. 18-1. Анатомия надпочечников
и их взаимоотношения с почками,
аортой и нижней почечной веной.
Обратите внимание на близость правого
надпочечника к нижней полой вене и его
короткую центральную вену.
Глава 18. Лапароскопическая адреналэктомия 235
необходимо, и способствует удалению более крупных
опухолей. Во-вторых, между правым и левым
надпочечником имеются важные анатомические различия,
что выражается в близости правого надпочечника
к нижней полой вене и соответственно более
короткой надпочечниковой веной с этой стороны. Слева
анатомия вен менее «вероломна», но доступ к левому
надпочечнику более трудный. В этой главе сначала
описана правосторонняя адреналэктомия, затем —
левосторонняя, а кроме того, уделено внимание
различиям между этими операциями.
ПОДГОТОВКА
В добавление к стандартному оборудованию, которое
применяется при общехирургических
лапароскопических операциях, полезно иметь правосторонний
диссектор, печеночный ретрактор, контейнер для
извлечения препарата и устройство «LigaSure» (Valleylab,
Boudler, СО). На рис. 18-2 показано, как может быть
устроена операционная для лапароскопической адре-
налэктомии. Хирург и первый ассистент стоят рядом
или по разные стороны от пациента, второй ассистент
стоит с противоположной стороны, а операционная
сестра находится рядом со вторым ассистентом.
Ассистент с камерой (если таковой имеется) будет
располагаться напротив операционной сестры. Используют
два монитора, каждый из которых находится по
сторонам от пациента, на уровне выше плеч.
Пациента укладывают на операционный стол
с приподнятой под углом 30-45° стороной
интереса (подкладывают валик или подушку, наполненную
пенорезиной). Проводят анестезию, устанавливают
орогастральный зонд и катетер в мочевой пузырь.
Дополнительные мониторы и оборудование используют
в соответствии с диагнозом пациента и его
сопутствующей патологией. Перед наркозом всем пациентам
надевают устройства для перемежающейся компрессии,
так как результаты крупных исследований указывают
на высокий риск развития ТЭЛА.
ПРАВОСТОРОННЯЯ АДРЕНАЛЭКТОМИЯ
Укладка и подготовка
После введения в наркоз пациента укладывают на
правый бок под углом 30-45°. В этом положении его
фиксируют с помощью валиков и подушек, наполненных
пенорезиной. Подмышечный валик подкладывают
в левую подмышечную область, правую руку кладут
поперек грудной клетки, удерживая ее на месте с
помощью подушек или подставки для руки с мягкой
прокладкой. Операционный стол необходимо согнуть
в области талии пациента. После подготовки живота
и фланковой области операционное поле
обрабатывают кзади, насколько это возможно, так как стерильная
зона должна распространяться до задней
подмышечной линии. Стерильная поверхность распространяется
спереди за срединную линию тела, ниже уровня
подвздошного гребня и до уровня мечевидного отростка
вверху. После обкладки операционного поля пациента
наклоняют вправо, что делает живот более плоским
и облегчает установку первичного троакара.
Установка портов
На рис. 18-3 представлена установка портов при
правосторонней адреналэктомии. Десятимиллиметровый
порт для камеры устанавливают с помощью открытой
методики выше и справа от пупка. Вводят
30-градусный лапароскоп и проводят первоначальный осмотр
четырех квадрантов живота. Под прямым визуальным
контролем устанавливают 5-миллиметровый порт
для печеночного ретрактора, выше порта для камеры
и на несколько сантиметров ниже мечевидного
отростка. По срединно-ключичной линии
устанавливают дополнительный 5-миллиметровый порт. В
заключение, после введения печеночного ретрактора
и отведения печени для изучения анатомии,
устанавливают наиболее латеральный 5-миллиметровый порт
примерно по переднеподмышечной линии. Для того
чтобы инструменты не мешали друг другу, расстояние
между портами по горизонтали должно составлять
не менее 5 см, а лучше — еще больше.
Пятимиллиметровый срединно-ключичный порт можно заменить
10-12-миллиметровым портом для степлера, если он
понадобится в процессе операции.
Диссекция
После того как ассистент приподнимет печень, хирург
определяет, закрыт ли правый надпочечник
печеночным изгибом. Если закрыт, проводят мобилизацию
печеночного изгиба с одновременной его ретракцией
в медиальном и каудальном направлениях с помощью
мягкого зажима, который ассистент держит левой
рукой. Хирург тянет в противоположном направлении
и рассекает брюшинные связки изгиба и желудочно-
ободочную связку с помощью устройства «LigaSure»
(рис. 18-4). Аналогичным образом обнажают
верхний полюс правой почки, двенадцатиперстную кишку
и надпочечник. Иногда визуализацию надпочечника
затрудняет большое количество жировой клетчатки
в забрюшинном пространстве. Различие в цвете между
ярко-желтым надпочечником и бледно-желтым жиром
позволяет различить эти образования.
Диссекцию начинают с мобилизации печени
для создания рабочего пространства. В забрюшинное
пространство входят латеральнее нижней полой вены
и продолжают диссекцию в краниальном направлении
для мобилизации правой доли печени от забрюшин-
ного пространства в области моррисонова кармана.
Для дальнейшего отведения печени в медиальном
направлении можно пересечь правую треугольную связку.
236 Лапароскопическая хирургия. Атлас
После создания рабочего пространства начинают
диссекцию надпочечника в области его задне-медиального
края и продолжают кверху между ним и нижней полой
веной (рис. 18-5). Отделению надпочечника от нижней
полой вены способствует его осторожное отведение
в латеральном направлении. Для диссекции полезно
использовать «LigaSure» или Harmonic scalpel («Ethicon
Endo-Surgery», Cincinnati, ОН). Рядом с местом
слияния нижней полой и правой почечной вен, особенно
в области нижней поверхности надпочечника, можно
столкнуться с мелкими забрюшинными сосудами (рис.
18-6). Мелкие сосуды склеивают и пересекают с
применением «LigaSure» либо отдельно лигируют
клипсами и при необходимости пересекают. Затем диссекцию
продолжают в краниальном направлении выше
верхнего полюса надпочечника, в то же время проводя
латеральную диссекцию для идентификации диафрагмы.
При этой осторожной диссекции находят центральную
вену правого надпочечника, обычно на уровне средней
части железы. Она обычно имеет длину 1 см и ширину
до 1 см, поэтому ее мобилизацию необходимо
проводить с осторожностью, чтобы не разорвать, так как это
может привести к неконтролируемому кровотечению
из нижней полой вены. После мобилизации правую
надпочечниковую вену клипируют клипсами
соответствующего размера и перерезают «холодным»
инструментом. Эту вену нельзя безопасно пересечь с
помощью «LigaSure» или Harmonic scalpel. Иногда необходим
сосудистый степлер, хотя его наложение будет
затруднено из-за недостаточной длины вены. После
мобилизации медиальной поверхности надпочечника
хирург проводит диссекцию задней поверхности железы
в медиальном направлении. Медиальную поверхность
железы мобилизуют от латеральной поверхности
нижней полой вены с применением соответствующих тяги
и противотяги.
Затем необходимо пересечь оставшиеся ткани в
области латеральной поверхности и верхнего края
надпочечника. Мелкие сосуды пересекают, используя
«LigaSure». После полного удаления железу помещают
в пластиковый контейнер и извлекают из брюшной
полости через разрез 10-миллиметрового порта. Часто
для извлечения требуется расширение этого разреза
(рис. 18-7).
Далее проводят осмотр ложа удаленного
надпочечника, его орошение раствором натрия хлорида с
последующей аспирацией. Остальные порты удаляют
под визуальным контролем для подтверждения
гемостаза, 10-миллиметровые отверстия для портов
зашивают толстыми полигликолевыми лигатурами.
После полной эвакуации пневмоперитонеума отверстие
порта для камеры зашивают восьмиобразным швом
толстой рассасывающейся лигатурой. Кожные раны
орошают и сопоставляют с помощью
рассасывающихся подкожных швов или цианакрилатного
хирургического клея.
Глава 18. Лапароскопическая адреналэктомия 237
ПОДГОТОВКА
Наркозный
аппарат
Анестезиолог
Лапароскопический
монитор
Лапароскопический
монитор
Первый ассистент
Хирург•
Рис. 18-2. Обстановка операционной
для лапароскопической
адреналэктомии. При право-
и левосторонней адреналэктомии
хирург располагается слева
относительно пациента.
Рис. 18-3. Расположение портов при правосторонней (X)
и левосторонней (Y) адреналэктомии. Хирург работает
с помощью двух портов, установленных в средних отделах
живота, из которых хотя бы один обязательно должен иметь
диаметр 10мм. Другой порт (для недоминантной руки)
может быть 5-миллиметровым. Ассистент устанавливает
2 порта по средней линии: один для печеночного ретрактора
под мечевидным отростком, а другой — между портом
для камеры и подмечевидным портом. Камеру устанавливают
по средней линии над пупком. ППЛ — передняя подмышечная
линия.
238 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Рис. 18-4. Диссекция правого надпочечника. Диссекцию
железы начинают с ее нижнемедиального края и продолжают
кверху между железой и нижней полой веной. Отделению
надпочечника от нижней полой вены способствует его
осторожная латеральная ретракция. Для диссекции удобно
использовать «LigaSure» или Harmonic scalpel («Ethicon
Endo-Surgery»; Cincinnati, ОН). Мелкие сосуды склеивают
и пересекают с помощью «LigaSure». Центральную вену
надпочечника находят рядом с медиальной поверхностью
железы.
Рис. 18-5. Центральную вену правого надпочечника
осторожно мобилизуют, клипируют и пересекают. Затем
диссекцию продолжают в краниальном направлении выше
верхнего полюса надпочечника, в то же время проводя
латеральную диссекцию для идентификации диафрагмы.
Рис. 18-6. После полного удаления железу помещают
в пластиковый контейнер и извлекают из брюшной полости
через разрез 10-миллиметрового порта. Часто требуется
расширение этого разреза.
Глава 18. Лапароскопическая адреналэктомия 239
ЛЕВОСТОРОННЯЯ АДРЕНАЛЭКТОМИЯ
Укладка и подготовка пациента
Укладка пациента для левосторонней
адреналэктомии — зеркальное отражение укладки при операции
на противоположной стороне. Пациента вводят в
наркоз в положении лежа на спине, а затем поворачивают
на левый бок под углом 30-45°. Проводят обработку
и обкладку операционного поля, как было описано
для операции на противоположной стороне.
Установка портов
На рис. 18-3 показана установка портов для
левосторонней адреналэктомии. Установка порта для камеры
является зеркальным отображением установки этого
порта при операции с правой стороны.
Устанавливают два 5-миллиметровых порта примерно на 5 см ниже
края реберной дуги по левой срединно-ключичной
линии и передней подмышечной линии. Обычно для
левосторонней адреналэктомии требуются два
5-миллиметровых порта и порт для камеры. При
необходимости можно установить дополнительный порт для
ретракции под мечевидным отростком.
Диссекция
Для обнажения левого надпочечника мобилизуют
селезеночный изгиб ободочной кишки. Ассистент
начинает диссекцию, оттягивая нисходящую ободочную
кишку в медиальном направлении, а хирург при этом
рассекает латеральные брюшинные связи кишки (рис.
18-7). Диссекцию продолжают в проксимальном
направлении, к селезеночно-ободочной связке. После
достижения этого образования ассистент кончиком
зажима приподнимает нижний полюс селезенки
и натягивает связку. Этот маневр следует выполнять
с осторожностью, чтобы избежать повреждения
селезенки. На данном этапе диссекции полезно применять
«LigaSure» или Harmonic scalpel. Для обнажения
верхнего полюса левой почки необходимо в достаточной
мере мобилизовать селезеночный изгиб ободочной
кишки. Латеральные прикрепления селезенки
отсекают от ее нижнего полюса вплоть до диафрагмы, чтобы
селезенка отклонилась в медиальном направлении.
Если мобилизации препятствует левый латеральный
сегмент печени, можно рассечь ее левую треугольную
связку.
Хирург находит надпочечник выше и несколько ме-
диальнее верхнего полюса почки, ассистент при этом
продолжает отводить селезенку и селезеночный
изгиб, чтобы обнажить забрюшинное пространство.
Во время мобилизации селезенки необходимо
убедиться, что мобилизуется также и хвост
поджелудочной железы. Поскольку железа может быть в
некоторой степени «захоронена» в забрюшинной жировой
клетчатке, пользу могут принести различия в цвете
тканей, о которых упомянуто выше. Диссекцию
начинают в области нижнелатерального края
надпочечника (рис. 18-8). Тракцию надпочечника в медиальном
по отношению к аорте направлении можно проводить,
захватив остатки связок в области его латеральной
поверхности. Центральную вену левого
надпочечника находят вдоль медиального края, где она проходит
в каудальном направлении к почечной вене.
Необходимо осторожно обнажить диафрагмальную вену,
которая часто образует общий ствол с надпочечниковой
веной у впадения в левую почечную вену. Надпочеч-
никовую вену дважды клипируют (как и справа) и
пересекают (рис. 18-9, 18-10). Диссекцию продолжают
с помощью «LigaSure» вдоль медиальной поверхности
надпочечника до его верхней точки рядом с
диафрагмой. Часто к медиальной поверхности надпочечника
плотно прилегает диафрагмальная вена, ее надо
пересечь проксимальнее, а затем — дистальнее, в области
верхушки надпочечника. Затем железу
приподнимают и пересекают ткани, фиксирующие ее заднюю
поверхность (рис. 18-11). Проводят диссекцию
латеральной поверхности железы, обнаруживают,
клипируют и пересекают ее основные артериальные сосуды
(на этом этапе можно применять «LigaSure»). После
диссекции задней поверхности освобождают область
верхушки и извлекают надпочечник из брюшной
полости в эндоскопическом контейнере. Раны зашивают
аналогично тому, как это было описано для
правосторонней адреналэктомии.
240 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Рис. 18-8. Ассистент обеспечивает доступ, приподнимая
селезенку кончиком зажима, опуская ободочную кишку
другим зажимом. После этого обнажается забрюшинное
пространство, и железу находят в забрюшинной
жировой клетчатке по ее особенному цвету. Необходимо
руководствоваться расположением верхнего полюса почки.
Аналогичным образом вначале проводят диссекцию вдоль ее
латеральной и нижней поверхностей.
Рис. 18-7. Мобилизация селезеночного изгиба. Ассистент
начинает диссекцию, оттягивая нисходящую ободочную
кишку в медиальном направлении, а хирург при этом
рассекает латеральные брюшинные связки кишки. Диссекцию
продолжают в проксимальном направлении, к селезеночно-
ободочной связке. После достижения этого образования
ассистент кончиком зажима приподнимает нижний полюс
селезенки и натягивает связку. Этот маневр следует
выполнять с осторожностью, чтобы избежать повреждения
селезенки. На этом этапе диссекции удобно применять
Harmonic scalpel {«Ethicon Endo-Surgery»; Cincinnati, ОН) или «Liga-
Sure» {Valleylab, Boulder, CO).
Рис. 18-9. Клипирована центральная вена левого
надпочечника.
Глава 18. Лапароскопическая адреналэктомия 241
Рис. 18-10. Пересечение центральной вены левого
надпочечника.
ЗАДНЯЯ И ЛАТЕРАЛЬНАЯ
РЕТРОПЕРИТОНЕАЛЬНАЯ
ЛАПАРОСКОПИЧЕСКАЯ
АДРЕНАЛЭКТОМИЯ
Хотя на замену открытому ретроперитонеальному
доступу пришла лапароскопическая трансперитоне-
альная адреналэктомия, были описаны также задняя
и латеральная ретроперитонеальная
лапароскопические методики этой операции [10]. Вкратце: заднюю
ретроперитонеоскопическую адреналэктомию
проводят в положении пациента лежа на животе с
доступом в забрюшинное пространство ниже XII ребра.
Хирурги, практикующие такой доступ,
обнаружили, что при этом для создания адекватного рабочего
пространства требуется более высокое давление ин-
суффляции (до 28 мм рт.ст.), что не привело,
однако, к повышению риска развития газовой эмболии
и циркуляторной нестабильности [11]. При лате-
Рис. 18-11. Диссекция левого надпочечника. После этого
железу приподнимают и пересекают ткани, фиксирующие
ее заднюю поверхность. Проводят диссекцию латеральной
поверхности железы, обнаруживают, клипируют и пересекают
ее основные артериальные сосуды либо применяют при этом
«LigaSure» (Valleylab, Boulder, СО). После диссекции задней
поверхности освобождают область верхушки и удаляют
надпочечник из брюшной полости в эндоскопическом
контейнере. Раны зашивают аналогично тому, как это было
описано для правосторонней адреналэктомии.
ральной ретроперитонеоскопической
адреналэктомии пациента укладывают на бок, а операционный
стол сгибают. Ретроперитонеум создают
аналогичным образом, ниже XII ребра. Противопоказаниями
к этим операциям служат крупные опухоли
вследствие высокого риска их злокачественности,
трудности при манипуляциях в небольшом забрюшинном
пространстве и высокий индекс массы тела
пациента, который соответственно увеличивает
продолжительность операции.
ПОСЛЕОПЕРАЦИОННЫЙ УХОД
В послеоперационном периоде пациент начинает
прием жидкой пищи уже после пробуждения и переходит
к нормальному питанию на следующее утро. Выписку
проводят, как только пациент начинает
самостоятельно себя обслуживать, продолжительность
послеоперационной госпитализации обычно составляет 2-3 дня.
242 Лапароскопическая хирургия. Атлас
СПИСОК ЛИТЕРАТУРЫ
1. Thompson G.B., Grant C.S., van Heerden J.A. et al. Laparoscopic
versus open posterior adrenalectomy: a case-control study of 100
patients // Surgery. — 1997. — Vol. 122. — P. 1132-1136.
2. Gagner M., Pomp A., Heniford B.T. et al. Laparoscopic
adrenalectomy: lessons learned from 100 consecutive procedures //
Ann. Surg. — 1997. — 226. — 238-246.
3. Gagner M., Breton G., Pharand D., Pomp A. Is laparoscopic
adrenalectomy indicated for pheochromocytomas? // Surgery. —
1996. — Vol. 120. — P. 1076-1079.
4. Dun Q.Y., Siperstein A.E., Clark O.H. et al. Laparoscopic
adrenalectomy: comparison of the lateral and posterior
approaches // Arch. Surg. — 1996. — Vol. 131. — P. 870-875.
5. Brunt L.R., Doherty CM., Norton J.A. et al. Laparoscopic
adrenalectomy compared to open adrenalectomy for benign adrenal
neoplasms // J. Am. Coll. Surg. — 1996. — Vol. 183. — P. 1-10.
6. Prinz R.A. A comparison of laparoscopic and open
adrenalectomies // Arch. Surg. — 1995. — Vol. 130. — P. 489-494.
I
7. Gagner M., Lacroix A., Prinz R.A. et al. Early experience with
laparoscopic approach for adrenalectomy // Surgery. — 1993. —
Vol. 114.— P. 1120-1125.
8. Suzuki K., Kageyama S., Ueda D. et al. Laparoscopic adrenalectomy:
clinical experience with 12 cases // J. Urol. — 1993. — Vol. 150. —
P. 1099-1102.
9. Gagner M., Lacroix A., Bolte E. Laparoscopic adrenalectomy in
Cushing's syndrome and pheochromocytoma // N. Engl. J. Med. —
1992. — Vol. 327. — P. 1033.
10. Sung G.T., Hsu Т.Н., Gill I.S. Retroperitoneoscopic adrenalectomy:
lateral approach // J. Endourol. — 2001. — Vol. 15. — P. 505-511.
11. Walz M.K., Alesina P.F., Wenger F.A. et al. Posterior
retroperitoneoscopic adrenalectomy: results of 560 procedures in
520 patients // Surgery. — 2006. — Vol. 140. — P. 943-948.
Глава 18. Лапароскопическая адреналэктомия 243
Торакоскопические
операции на перикарде
и средостении
Брайн Лима, Томас А. Д'Амико
шшапз
ПЕРИКАРД
Патология перикарда, которая требует хирургического
вмешательства, обычно делится на две категории — пе-
рикардиальный выпот и констриктивный перикардит.
До недавнего времени хирургический доступ к
перикарду традиционно требовал левосторонней торако-
томии, срединной стернотомии или подмечевидного
доступа. Развитие минимально инвазивных методов
позволило успешно применить торакальную
хирургию с видеоассистенцией при заболеваниях перикарда.
Как и при открытом доступе, торакоскопическая
оценка перикарда позволяет получить диагностическую
информацию, которая касается этиологии
заболевания перикарда, и облегчить гемодинамические
последствия перикардиального выпота и констриктивного
перикардита.
Анатомия
Париетальный листок перикарда состоит из плотных
волокон коллагена и эластина с внутренней серозной
выстилкой из однослойного мезотелия. Париетальный
листок перикарда — мешковидное образование,
которое окружает сердце и сливается с адвентицией
проксимальных отделов крупных сосудов (рис. 19-1).
Висцеральный листок перикарда охватывает поверхность
сердца и состоит из тонкого слоя фиброзной ткани,
покрытой мезотелием. Париетальный и висцеральный
листки сращены в местах прикрепления к
проксимальным отделам крупных сосудов. Связки фиксируют
перикард к грудине спереди, позвоночному столбу сзади
и диафрагме снизу. Диафрагмальный нерв и перикар-
диодиафрагмальная артерия проходят вдоль
латеральной поверхности перикарда с обеих сторон. В норме
в полости перикарда содержится до 50 мл серозной
жидкости, которая служит смазкой, способствующей
движению сердца. Перикард снижает трение между
сердцем и окружающими тканями и фиксирует сердце
в средостении. Экспериментальные данные показали,
что перикард осуществляет важную физиологическую
функцию по выравниванию гидростатических сил,
ограничению растяжения сердца и диастолическому
гемодинамическому сопряжению [1].
Патофизиология
Перикардиальный выпот может появиться после
острого перикардита или травмы. Чаще всего
встречаются следующие виды перикардиального
выпота: неопластический, идиопатический,
инфекционный и травматический. Полный список представлен
Париетальный -
листок перикарда
Перикардиодиафраг-
мальная артерия
Диафрагмальный -
нерв
Левое средостение
Рис. 19-1. Анатомия перикарда. Показаны перикард,
диафрагмальный нерв и перикардиодиафрагмальная артерия
в средостении.
Глава 19. Торакоскопические операции на перикарде и средостении 245
Перикардиальный выпот
Неопластический
Легкие
Молочная железа
Лимфома
Идиопатический
Инфекционный
Пиогенный
Туберкулезный
Грибковый
Системное заболевание
Васкулит при коллагенозе
Уремия
Заболевания щитовидной
железы
Травматический
Проникающее и тупое
повреждения
Катетеризация сердечных
полостей
После операций на сердце
Постперикардиотомический
синдром
Облучение
Медикаменты
и гиперчувствительность
Рис. 19-2. Перикардиальный выпот.
а—д Полость перикарда
Правое предсердие
20 60 100 140 180 220
Объем 0,9% раствора натрия хлорида, введенного в полость перикарда,
мл
Рис. 19-3. Экспериментальная тампонада перикарда,
полученная с помощью введения 0,9% раствора натрия
хлорида в полость перикарда. По мере нарастания объема
перикардиальной жидкости среднее артериальное давление
падает, а давление в правом предсердии и перикарде растет.
КД — кровяное давление (из: Fowler [18]).
на рис. 19-2. Острое воспаление перикарда приводит
к повышению сосудистой проницаемости и
отложению фибрина. Типичны фиброзные спайки и
экссудация. Могут развиваться осложнения фиброза (кон-
стрикция) и выпота (тампонада). Тампонада перикарда
возможна, если скопление жидкости вызывает
повышение внутриперикардиального давления (норма
составляет от -5 до +5 см вод.ст.). Это повышение
давления зависит от объема выпота и скорости его
накопления. При длительном выделении выпота возможно
скопление больших объемов (1500 мл) без риска для
гемодинамики. Однако острый выпот перикардиальной
жидкости объемом всего 150-250 мл может вызвать
острую тампонаду перикарда (рис. 19-3). Повышенное
внутриперикардиальное давление снижает наполнение
желудочков, систолический объем сердечного выброса
и, таким образом, снижает минутный объем
сердечного выброса. Снижение систолического объема
компенсируется повышением частоты сердечных сокращений
и симпатическим тонусом. При неэффективности
компенсаторных механизмов снижается системная
перфузия и наступает кардиогенный шок.
Клиническая картина
и дифференциальная диагностика
Острый перикардит характеризуется болями в
грудной клетке, шумом трения перикарда и изменениями
на электрокардиограмме (ЭКГ). Боль в грудной клетке
имеет различную локализацию и может усиливаться
в положении лежа на спине и при глубоком дыхании.
Классический шум трения перикарда имеет 3
компонента, которые соответствуют систоле предсердий,
систоле желудочков и наполнению желудочков во
время диастолы. Описаны 4 стадии изменений на ЭКГ
при остром перикардите. Во время I стадии происходит
подъем сегмента ST во всех отведениях, за
исключением AVR и V . Во II стадии происходит нормализация
сегмента ST и уплощение зубца Г. Позже, в III стадии,
зубец Г становится отрицательным. В IV стадии зубец
Г нормализуется. Острый перикардит обычно
проходит без последствий. Однако при тампонаде сердца
из-за перикардиального выпота, констрикции
вследствие фиброза или по обеим этим причинам могут
развиваться гемодинамические осложнения.
Начало тампонады сердца может быть внезапным
и незаметным. Тампонада характеризуется
расширением вен шеи, слышимыми на расстоянии
сердечными сокращениями и гипотензией (рис. 19-4). Эта
триада симптомов известна как триада Бека [2]. При
тампонаде отмечается парадоксальный пульс, который
характеризуется падением артериального давления
на вдохе более чем на 10 мм рт.ст. Могут также
присутствовать цианоз, тахикардия и тахипноэ. В общем
доминируют симптомы кардиогенного шока. На ЭКГ
возможны снижение вольтажа зубцов, фазовая
альтерация в амплитуде зубца R. На рентгенограмме
грудной клетки можно обнаружить увеличение тени
сердца. Инвазивный мониторинг показывает повышение
центрального венозного давления со снижением
минутного объема сердечного выброса и среднего
артериального давления.
Эхокардиография — наиболее чувствительный
метод диагностики перикардиального выпота. Он
позволяет обнаружить признаки ранней сердечной
тампонады. Повышение дыхательных вариаций клапанного
кровотока, диастолический коллапс правого
желудочка и утрата нормального коллабирования нижней
246 Лапароскопическая хирургия. Атлас
Признаки сердечной тампонады
Гипотензия
Расширение шейных вен
Слышимость сердечных
тонов на расстоянии
Парадоксальный пульс
Тахикардия
Тахипноэ
Рис. 19-4. Признаки сердечной тампонады.
Дифференциальная диагностика
сердечной тампонады
Напряженный
пневмоторакс/гемоторакс
Гиповолемический шок
Инфаркт миокарда
Застойная сердечная
недостаточность
ТЭЛА
Синдром верхней полой
вены
Констриктивный
перикардит
Рис. 19-5. Дифференциальная диагностика сердечной
тампонады.
полой вены на вдохе служат точными индикаторами
тампонады сердца. Тампонаду сердца
дифференцируют от других серьезных патологий грудной клетки,
вызывающих шок и гипотензию (рис. 19-5). К этим
заболеваниям относятся пневмоторакс, гемоторакс,
острый инфаркт миокарда, застойная сердечная
недостаточность, ТЭЛА, синдром нижней полой вены
и констриктивный перикардит.
Показания к операции
Хирургическое дренирование перикардиального
выпота показано в случае неудачи консервативного лечения
или если требуется постановка специфического
диагноза для того, чтобы начать лечение. Могут
отмечаться ранние клинические симптомы тампонады или ее
признаки на ЭКГ. Цели хирургического лечения —
дренирование выпота, профилактика рецидивов и
постановка специфического диагноза.
Хирургический доступ к перикарду осуществляют
с помощью правой или левой передней торакотомии,
подмечевидного доступа или торакоскопии.
«Окно» в перикарде может быть проведено с
помощью подмечевидного доступа под местной анестезией
и обычно хорошо переносится пациентами. Эта
операция — отличная терапевтическая опция для многих
пациентов, но она не должна применяться, когда основное
заболевание, вызвавшее образование выпота, может
привести к констриктивному перикардиту (например,
у пациентов с туберкулезом, инфекцией, вызванной
Haemofilus influenzae, или при лучевых перикардитах).
Это прежде всего связано с ограниченной
протяженностью перикардиальной резекции, которую позволяет
подмечевидный доступ, что приводит к возникновению
рецидивов в 10-18% случаев [3-5]. Торакотомия
позволяет провести более основательную резекцию
перикарда и характеризуется снижением частоты рецидиви-
рования выпота [4]. Однако этот доступ более инвази-
вен и сопровождается дополнительной морбидностью
вследствие необходимости в общей анестезии.
Торакоскопический доступ с видеоассистенцией
позволяет провести расширенную резекцию перикарда
с одновременной оценкой патологии легких и плевры,
избегая торакотомии. Послеоперационные боли
менее выражены, чем после торакотомии [6], хотя общая
анестезия и раздельная вентиляция одного легкого все
еще необходимы. Если имеются симптомы тампонады,
перед общей анестезией необходимо выполнить пери-
кардиоцентез.
Подводя итоги, нужно отметить, что подмечевидный
доступ имеет преимущества, поскольку позволяет
использовать местную анестезию, не требует вентиляции
одного легкого и поворота пациента на бок (этот маневр
плохо переносится пациентами с выраженными
клиническими симптомами тампонады). Недостаток
подмечевидного доступа состоит в том, что другая патология
грудной клетки при таком доступе выявлена не будет,
а кроме того, он характеризуется более высокой
частотой рецидивирования перикардиального выпота,
чем при видеоассистированной торакоскопии. К
преимуществам видеоторакоскопического доступа относят
улучшенный доступ и визуализацию перикарда,
которые позволяют провести более обширную резекцию
перикарда и осуществить сопутствующие
диагностические и терапевтические процедуры (дренирование
плеврального выпота, декортикацию, биопсию легких
или плевры).
К недостаткам видеоторакоскопии можно отнести
необходимость в общей анестезии, раздельной
вентиляции легких, латеральном положении пациента и
необходимость декомпрессии полости перикарда перед
индукцией анестезии у нестабильных пациентов.
Техника операции
На рис. 19-6—19-11 продемонстрирована
хирургическая техника видеоторакоскопической перикардэкто-
мии.
Глава 19. Торакоскопические операции на перикарде и средостении 247
ПОДГОТОВКА
Видеомонитор
Первый
ассистент
Операционная
сестра
Наркозный аппарат
Анестезиолог
4^abvg
Ноги
Видеомонитор
и осветитель
Хирург
Ассистент
с камерой
Столик
для инструментов
Рис. 19-6. Обстановка операционной для операции
по формированию перикардиального «окна».
248 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Расположение портов
Перикард -
Диафрагмальный
нерв
Диафрагма
^Ножницы
Торакоскоп
Граспер
Перикардэктомия
Рис. 19-7. Пациента интубируют
двухпросветной эндотрахеальной
трубкой для раздельной
вентиляции легких. Устанавливают
назогастральный зонд и катетер
Фолея. При значительной тампонаде
перед началом анестезии необходимо
выполнить перикардиоцентез.
Пациента укладывают в левое
латеральное положение
и начинают вентиляцию легкого.
Предпочитают правосторонний
доступ, за исключением случаев,
когда имеется сопутствующая
патология левого легкого и плевры.
Доступ в плевральную полость
осуществляют с помощью тупой
диссекции выше VIII ребра (седьмое
межреберье) по срединной
лопаточной линии сзади.
Устанавливают 10-миллиметровый
порт и вводят торакоскоп.
Осматривают плевральную полость.
Два 5-миллиметровых порта вводят
на одно межреберье выше (шестое)
по срединной лопаточной и передней
подмышечной линии. Далее вводят
зажим и ножницы.
Z-ножницы
Граспер
Перикард■
Диафрагмальный
нерв
Рис. 19-8. Находят перикард и диафрагмальный нерв.
Перикард захватывают кпереди от диафрагмального нерва
и рассекают. Необходимо проявлять осторожность, чтобы
не повредить лежащее под перикардом сердце.
Рис. 19-9. Переднюю поверхность перикарда широко
иссекают. Если имеется осумкованное скопление жидкости
по задней поверхности, можно провести заднюю резекцию
перикарда.
Глава 19. Торакоскопические операции на перикарде и средостении 249
Рис. 19-10. Перикард удален. Область резекции осматривают
на адекватность гемостаза.
Результат
Результаты видеоторакоскопической резекции
перикарда обнадеживающие. Hazlerrigg et al. [7] сообщили
о проведении торакоскопической перикардэктомии
у 35 пациентов. Злокачественный выпот отмечался
более чем у половины (52%) пациентов. Летальных
случаев во время операции не было,
продолжительность госпитализации составила в среднем 4,6 дня.
За время наблюдения в течение 9 мес рецидивов
выпота отмечено не было. Liu et al. [8] получили
аналогичные результаты в группе из 28 пациентов, которых
подвергли видеоторакоскопической перикардэктомии.
У 60% из них была установлена плевропульмональная
патология, которую невозможно было бы обнаружить
в случае подмечевидного доступа. Авторы полагают,
что возможность одновременной коррекции плевро-
пульмональной патологии была значительным
преимуществом для пациентов с обоими заболеваниями.
Данные по торакоскопическому лечению пери-
кардиального выпота у 230 пациентов, полученные
в клинике, где работают авторы главы, подтверждают
безопасность и терапевтическую эффективность этого
хирургического доступа. По сравнению с
традиционными подмечевидным и торакотомическим доступами
пациенты после видеоторакоскопической
перикардэктомии имеют меньшее число рецидивов и более
низкую смертность (неопубликованные данные). Другие
исследования также показали большую эффективность
видеоторакоскопической перикардэктомии по
сравнению с подмечевидным доступом [9, 10].
Применение видеоторакоскопической перикардэктомии было
еще более веско обосновано в недавнем исследовании
250 Лапароскопическая хирургия. Атлас
Рис. 19-11. Устанавливают плевральный дренаж 28 или 32 F
и направляют его к перикарду. Проверяют надежность
гемостаза в местах введения портов и извлекают торакоскоп.
пациентов с несвежим гемоперикардом или выпотом
после операций на сердце [11]. Видеоторакоскопиче-
ская перикардэктомия, кроме того, может служить
эффективной терапевтической опцией у гемодинамиче-
ски стабильных пациентов с проникающим ранением
сердца [12].
Видеоторакоскопическое формирование «окна»
в перикарде — новая альтернатива торакотомии и под-
мечевидному доступу. Эта методика позволяет
провести широкую резекцию перикарда, избегая морбидно-
сти, которой сопровождается открытая торакотомия.
Первые сообщения обнадеживают и показывают
низкую частоту рецидивирования выпота в раннем
периоде наблюдения.
СРЕДОСТЕНИЕ
Средостение, которое является центральной частью
грудной клетки, находится между правой и левой
плевральной полостью и простирается от грудины спереди
до позвоночного столба сзади (рис. 19-12). Это
пространство содержит все органы грудной полости, за
исключением легких. Поскольку многие опухоли и кисты
средостения имеют характерную локализацию,
средостение можно искусственно разделить на различные
отделы, чтобы облегчить локализацию специфических
патологических образований. Большинство авторов
подразделяют средостение на 3 отдела: переднее,
среднее и заднее. Передним отделом средостения называют
область, которая находится сзади от грудины, спереди
от сердца и крупных сосудов и содержит тимус,
лимфатические узлы средостения и жировую клетчатку.
В среднем отделе средостения находятся сердце, пе-
рикард, легочная артерия и вены, восходящий отдел
и дуга аорты, брахиоцефальные сосуды, полая вена,
трахея, бронхи и лимфатические узлы. Задний отдел
средостения находится сзади от сердца и содержит
пищевод, нисходящий отдел аорты, непарную вену,
ганглии и нервы автономной нервной системы, грудной
проток, лимфатические узлы и жировую ткань.
Образования средостения имеют различную
природу: от медленно растущих доброкачественных
образований, имеющих минимальные симптомы, до
агрессивных инвазивных опухолей, которые могут активно
метастазировать. Образования средостения
наиболее часто отмечаются в переднем средостении (56%),
реже — в заднем (25%) и еще реже — в среднем (19%)
средостении [13]. Хотя в некоторых сериях приведены
различия в относительной распространенности
опухолей и кист средостения, чаще всего встречаются
опухоли из нервной ткани (20%), тимомы (19%), первичные
кисты (18%), лимфомы (13%) и герминальноклеточные
опухоли (10%). Наиболее распространенные опухоли
средостения, в соответствии с их локализацией,
перечислены на рис. 19-13.
Пациенты с опухолями средостения могут не иметь
каких-либо клинических симптомов заболевания,
и диагноз устанавливают случайно, при обычной
рентгенографии грудной клетки. И наоборот, у пациентов
могут отмечаться системные симптомы или связанные
с механическими эффектами инвазии или компрессии.
К наиболее распространенным симптомам относятся
боль в грудной клетке, лихорадка, кашель и диспноэ.
Симптомы, связанные с компрессией или инвазией
органов средостения, например синдром верхней полой
вены, синдром Горнера, охриплость голоса или
сильные боли, обычно более характерны для
злокачественной патологии, хотя могут отмечаться и у пациентов
с доброкачественными заболеваниями.
Основная цель диагностической оценки пациентов
с образованиями средостения — постановка точного
гистологического диагноза, что позволит подобрать
оптимальную терапию. Для гистологической
диагностики можно провести чрескожную игольную
биопсию, особенно пациентам с образованиями переднего
средостения. Однако низкодифференцированные
злокачественные опухоли переднего средостения, в
частности тимомы, лимфомы, герминогенные опухоли
и первичный рак, могут иметь в значительной мере
схожие цитологические и морфологические признаки.
Если игольная биопсия противопоказана или не дала
достаточного количества ткани для установления
гистологического диагноза, нередко может возникнуть
необходимость в более инвазивных процедурах —
медиастиноскопии и торакоскопии. Медиастиноско-
пия — полезная методика для оценки и проведения
биопсий при образованиях среднего отдела
средостения. Для биопсии и резекции разных образований сре-
Отделы средостения
м
Нижнее средостение
Все, что ниже
верхнего средостения,
делится на три
Верхнее средостение
От I ребра до линии,
соединяющей грудино-ключичное
сочленение с диском между T|V и Tv
Переднее
Среднее
v г
Рис. 19-12. Отделы средостения.
Наиболее распространенные
образования средостения
и их локализация
Переднее
Тимома
Лимфома
Терминально-
клеточная опухоль
Киста тимуса
Липома
Зоб
Среднее
Лимфома
Бронхогенная
киста
Киста перикарда
Заднее
Нейрогенные
опухоли
Рис. 19-13. Наиболее распространенные образования
средостения и их локализация.
достения у тщательно отобранных пациентов
используют торакоскопические операции. Хотя большинству
пациентов можно безопасно проводить хирургические
операции, больные с образованиями средостения
средних и крупных размеров, в частности дети, имеют
повышенный риск развития тяжелых кардиореспиратор-
ных осложнений во время общей анестезии. Пациенты
с постуральным диспноэ и синдромом верхней полой
вены относятся к группе повышенного риска. У
пациентов с обструкцией дыхательных путей или верхней
полой вены риск общей анестезии значительно
возрастает, и попытки верифицировать диагноз
гистологически должны быть ограничены игольными биопсиями
Глава 19. Торакоскопические операции на перикарде и средостении 251
или открытыми операциями под местной анестезией.
Большая часть этих образований — злокачественные
и нерезектабельные.
Переднее средостение
Видеоторакоскопия — полезный диагностический
и терапевтический метод, применяемый при
работе с образованиями переднего средостения.
Дифференциальную диагностику при лимфоме, тимоме
или герминально-клеточной опухоли трудно
провести на основании одного только цитологического
исследования. В связи с тем что тонкоигольная аспи-
рационная биопсия образований переднего отдела
средостения часто неинформативна,
видеоторакоскопия может играть важнейшую роль в получении
адекватного количества ткани для постановки
точного гистологического диагноза. Более того,
видеоторакоскопия позволяет диагностировать
опухолевую инвазию или метастатическое распространение,
которое не было обнаружено при предоперационном
обследовании, и позволяет провести
непосредственное удаление опухолей, имеющих выраженную
капсулу. У пациентов с инвазивными опухолями,
требующими резекции, видеоторакоскопия помогает
выяснить, какой из доступов будет наиболее оптимальным
при конверсии: торако- или стернотомия.
Для большинства пациентов с опухолями
переднего отдела средостения видеоторакоскопию применяют
в первую очередь для диагностики [14]. Хотя с ее
помощью возможно проведение резекции некоторых
опухолей (например, мелких тимом) переднего
отдела средостения, стандарт лечения в таких ситуациях
в настоящее время — открытая резекция (рис. 19-14).
У пациентов с кистами переднего средостения или
генерализованной миастенией без тимомы с помощью
Рис. 19-14. Крупная тератома переднего средостения.
Видеоторакоскопическую биопсию осуществляют перед
окончательной резекцией с помощью срединной стернотомии.
252 Лапароскопическая хирургия. Атлас
видеоторакоскопии можно проводить полную
резекцию образования [14].
Техника операции
Оперативное лечение пациентам с образованиями
переднего отдела средостения обычно проводят в
латеральном положении. Общую анестезию
осуществляют через двухпросветную эндотрахеальную
трубку для коллабирования легкого на стороне
поражения. Первый 10-миллиметровый порт устанавливают
по срединно-подмышечной линии в шестом или
восьмом межреберье. Плевральную полость исследуют
с помощью 30-градусной оптики. Остальные порты
используют в зависимости от того, какие инструменты
необходимы для ретракции и диссекции. Эти порты
устанавливают несколько ближе кпереди, чтобы
образовалась фигура треугольника с портом для камеры.
После рассечения плевры над опухолью делают
биопсию или удаляют образование. Если предполагается,
что образование имеет сосудистое происхождение,
можно провести его аспирационную биопсию.
После тщательного гемостаза вводят дренажную трубку
для кратковременного контроля выделений.
ВИДЕОТОРАКОСКОПИЧЕСКАЯ
ТИМЭКТОМИЯ ПРИ ГЕНЕРАЛИЗОВАННОЙ
МИАСТЕНИИ
У пациентов с нетимоматозной генерализованной
миастенией видеоторакоскопию используют все чаще в
качестве эффективной терапевтической опции. Этот
доступ приносит симптоматическое улучшение
большинству пациентов с минимальными периоперационной
смертностью и частотой послеоперационных
осложнений [15, 16]. Видеоторакоскопическую тимэктомию
можно провести из лево-, право- и двустороннего
доступа. Левосторонний видеоторакоскопический доступ
обеспечивает превосходный обзор левого диафрагмаль-
ного нерва, который повреждают чаще, чем правый,
и позволяет провести обширное удаление перитимоид-
ной ткани в аортолегочном окне и левом перикардио-
диафрагмальном углу. Приверженцы правостороннего
доступа при видеоторакоскопии утверждают, что
важное преимущество этого метода — увеличенное
операционное поле в более широкой плевральной полости.
Кроме того, слияние двух брахиоцефальных вен,
формирующих верхнюю полую вену, четче визуализируется
справа. Право- и левосторонний доступы имеют очень
сходные результаты вмешательства [16].
Правостороннюю видеоторакоскопическую
тимэктомию (рис. 19-15—19-21) осуществляют в
положении пациента лежа на боку, под углом 45° к
горизонтальной плоскости, с валиком или подушкой
из пенорезины, подложенными под правую
половину грудной клетки. Первичный 10-миллиметровый
порт устанавливают по срединно-ключичной линии
в седьмом межреберье. Два других порта используют
для введения рабочих инструментов. Эти
5-миллиметровые порты устанавливают в третьем и пятом
межреберном промежутке по передней подмышечной
линии. Затем мобилизуют правый нижний полюс тимуса
в краниальном направлении с помощью
электрокоагулятора и диссекции острым и тупым путямм. С
помощью осторожной тракции можно обнажить и рассечь
ножницами ткани, соединяющие тимус с щитовидной
железой. Артерии тимуса, входящие в верхние
полюса, — это ветви внутренних маммарных артерий,
которые клипируют и пересекают. Безымянная вена
четко идентифицируется, и венозные притоки от
тимуса также клипируют и пересекают. Затем проводят
диссекцию правого цервикального рога вместе с пе-
ритимической тканью вблизи безымянной и верхней
полой вен. После этого идентифицируют левый край
тимуса от задней поверхности железы и отделяют его
от париетальной плевры слева. Необходимо
действовать с осторожностью, чтобы не повредить левый
диафрагмальный нерв. Теперь левый нижний полюс
полностью мобилизован, и грудинная диссекция
завершена. Тимус помещают в защитный контейнер
и извлекают через отверстие переднего порта. После
этого проверяют гемостаз в средостении и
оставшейся жировой ткани переднего средостения. Для
кратковременного дренирования устанавливают один
плевральный дренаж.
АЛЬТЕРНАТИВНЫЙ МЕТОД
Рис. 19-15. Правосторонняя видеоторакоскопическая
тимэктомия: обстановка операционной.
Внутренняя
маммарная
артерия
Тимус
Левый
диафрагмальный
нерв
Рис. 19-16. Правосторонняя видеоторакоскопическая
тимэктомия: этап 1.
Глава 19. Торакоскопические операции на перикарде и средостении 253
Правый нижний
рог тимуса
\ /^
^к yjl
1 iffit
i
ш
Правое легкое
1 \ И^^"^>
\ VjI^B
\ ^ШР ^
^1/ ^/
^г"
\^ Вену тимуса
-""'"Д клипируют
/^~^ Безымянная
вена
Рис. 19-17. Правосторонняя видеоторакоскопическая
тимэктомия: этап 2.
Рис. 19-18. Правосторонняя видеоторакоскопическая
тимэктомия: этап 3.
Рис. 19-19. Правосторонняя видеоторакоскопическая
тимэктомия: этап 4.
Рис. 19-20. Правосторонняя видеоторакоскопическая
тимэктомия: этап 5.
Левая половина
диафрагмы
Левый
диафрагмальный
нерв
Рис. 19-21. Правосторонняя видеоторакоскопическая
тимэктомия: этап б.
254 Лапароскопическая хирургия. Атлас
Среднее средостение
Образования среднего средостения — чаще всего
доброкачественные кисты и лимфаденопатия. Биопсию
лимфатических узлов для исключения злокачественной
опухоли обычно удается провести с помощью шейной
или передней медиастиноскопии, однако при более
сложных случаях может понадобиться
видеоторакоскопия. К кистам средостения относятся бронхогенные,
кишечные (дупликационные) и перикардиальные
кисты, которые могут вызывать такие симптомы, как боли
в грудной клетке, диспноэ, кашель и стридор.
Бронхогенные кисты (рис. 19-22) выглядят, как гладкие
плотные узлы на уровне карины, которые могут сдавливать
пищевод, что можно определить при исследовании
с глотанием бария. Дупликационные кисты средостения
происходят из заднего отдела первичной кишки, из
которой образуется верхний отдел желудочно-кишечного
тракта. Эти кисты встречаются реже, чем бронхогенные
или перикардиальные, и обычно имеют связь с
пищеводом. Для профилактики возможных осложнений
бронхогенные и дупликационные кисты необходимо
удалять. Перикардиальные кисты, для которых характерно
расположение в переднем реберно-диафрагмальном
углу, резецируют при симптомах, вызывающих
подозрение на их малигнизацию, или при рецидивировании
кист после аспирации.
Техника операции
Оперативные вмешательства при образованиях
среднего отдела средостения проводят в положении пациента
латерально. Общую анестезию проводят с помощью
двухпросветной эндотрахеальной трубки для
одностороннего коллабирования легкого. По средней
подмышечной линии в восьмом межреберном промежутке
устанавливают 10-миллиметровый порт и осматривают
грудную клетку с помощью 30-градусной оптики.
Второй разрез (длиной примерно 3 см) делают в четвертом
или пятом межреберном промежутке спереди. Легкое
отводят в сторону от кисты, которая наиболее часто
имеет паратрахеальную или субкаринальную
локализацию. Кисту мобилизуют от окружающих структур с по-
Рис. 19-22. Бронхогенная киста.
мощью тупой и острой диссекций. Аспирация кисты
может облегчить ее мобилизацию. Иногда плотное
прилегание кисты к жизненно важным органам может
препятствовать ее полному иссечению. В этих трудных
случаях электрокоагуляция слизистой оболочки остатков
стенки кисты должна снизить риск рецидивирования.
Заднее средостение
Наиболее распространенные внелегочные
патологические образования заднего средостения — нейрогенные
опухоли [нейролеммомы или нейрофибромы
симпатической нервной цепочки либо межреберного нерва
(рис. 19-23)]. Эти опухоли могут характеризоваться
корешковыми болями или просто патологическими
изменениями на рентгенограмме грудной клетки. Было
показано, что видеоторакоскопия — эффективный
хирургический метод удаления доброкачественных нейро-
генных опухолей, который отличает более быстрое
выздоровление пациента после операции (по сравнению
с открытой резекцией) [17]. Обычно торакоскопически
можно резецировать опухоли диаметром менее 5 см.
Техника операции
Операции при опухолях заднего средостения
проводят в латеральном положении пациента. Общую
анестезию осуществляют с помощью двухпросветной
эндотрахеальной трубки для одностороннего
коллабирования легкого. Десятимиллиметровый порт вводят
по срединно-подмышечной линии в шестом или
восьмом межреберном промежутке в зависимости от
расположения опухоли. Грудную клетку осматривают
с помощью 30-градусной оптики. Передний разрез
делают в четвертом межреберном промежутке. Диссек-
цию начинают с рассечения плевры вокруг опухоли.
Опухоль мобилизуют, ее сосуды находят, клипируют
и пересекают. Нервы, выходящие из опухоли, также
находят, клипируют и пересекают. Затем опухоль
помещают в эндоскопический контейнер и извлекают
через торакотомию. Проверяют надежность гемостаза
и устанавливают плевральный дренаж через отверстие
порта для кратковременного дренирования.
Рис. 19-23. Доброкачественная нейрогенная опухоль (указана
стрелкой) в заднем средостении.
Глава 19. Торакоскопические операции на перикарде и средостении 255
СПИСОК ЛИТЕРАТУРЫ
1. Spodick D.H. The normal and diseased pericardium: current
concepts of pericardial physiology, diagnosis and treatment //
J.Am. Coll. Cardiol. — 1983. — Vol. 1. — P. 240-251.
2. Beck C.S. Two cardiac compressor triads // JAMA. — 1935. —
Vol. 104. — P. 714.
3. Naunheim K.S., Kesler K.A., Fiore A.C. et al. Pericardial drainage:
subxiphoid vs. transthoracic approach // Eur. J. Cardiothorac.
Surg. — 1991. — Vol. 5. — P. 99-103; discussion — P. 104.
4. Piehler J.M., Pluth J.R., SchaffH.V. et al. Surgical management
of effusive pericardial disease. Influence of extent of pericardial
resection on clinical course // J. Thorac. Cardiovasc. Surg. —
1985. — Vol. 90. — P. 506-516.
5. Sugimoto J.Т., Little A.C, Ferguson M.K. et al. Pericardial window:
mechanisms of efficacy // Ann. Thorac. Surg. — 1990. — Vol. 50. —
P. 442-445.
6. Landreneau R.J., Hazelrigg S.R., Mack M.J. et al. Postoperative
pain-related morbidity: video-assisted thoracic surgery versus
thoracotomy // Ann. Thorac. Surg. — 1993. — Vol. 56. — P. 1285-
1289.
7. Hazelrigg S.R., Mack M.J., Landreneau R.J. et al. Thoracoscopic
pericardiectomy for effusive pericardial disease // Ann. Thorac.
Surg. — 1993. — Vol. 56. — P. 792-795.
8. Liu H.P., Chang C.H., Lin P.J. et al. Thoracoscopic management
of effusive pericardial disease: indications and technique // Ann.
Thorac. Surg. — 1994. — Vol. 58. — P. 1695-1697.
9. Liberman M., Labos C, Sampalis J.S. et al. Ten-year surgical
experience with ontraumatic pericardial effusions: a comparison
between the subxiphoid and transthoracic approaches to pericardial
window // Arch. Surg. — 2005. — Vol. 140. — P. 191-195.
10. O'Brien P.K., Kucharczuk J.C., Marshall M.B. et al. Comparative
study of sub xiphoid versus video-thoracoscopic pericardial
«window» // Ann. Thorac. Surg. — 2005. — Vol. 80. — P. 2013-
2019.
11. Katara A.N., Samra S.S., Bhandarkar D.S. Thorocoscopic window
for a post-coronary artery bypass grafting pericardial effusion //
Indian Heart J. — 2003. — Vol. 55. — P. 180-181.
12. Navsaria P.H., Nicol A.J. Video-assisted thoracoscopic pericardial
window for penetrating cardiac trauma // S. Afr. J. Surg. — 2006. —
Vol. 44. — P. 18-20.
13. Davis R.D., Jr., Oldham H.N., Jr., Sabiston D.C., Jr. Primary cysts
and neoplasms of the mediastinum: recent changes in clinical
presentation, methods of diagnosis, management, and results //
Ann. Thorac. Surg. — 1987. — Vol. 44. — P. 229-237.
14. Demmy T.L., Krasna M.J., Detterbeck F.C. et al. MulticenterVATS
experience with mediastinal tumors // Ann. Thorac. Surg. —
1998. — Vol. 66. — P. 187-192.
15. Manlulu A., Lee T.W., Wan I. et al. Video-assisted thoracic surgery
thymectomy for nonthymomatous myasthenia gravis // Chest. —
2005. — Vol. 128. — P. 3454-3460.
16. Tomulescu V, Ion V, Kosa A. et al. Thoracoscopic thymectomy
mid-term result // Ann. Thorac. Surg. — 2006. — Vol. 82. —
P. 1003-1007.
17. Bousamra M., II, Haasler G.B., Patterson G.A., Roper C.L. A
comparative study of thoracoscopic vs open removal of bening
neurogenic mediastinal tumors // Chest. — 1996. — Vol. 109. —
P. 1461-1465.
18. Fowler N.O. Physiology of cardiac tamponade and pulsus
paradoxus. I: mechanisms of pulsus paradoxus in cardiac
tamponade // Mod. Concepts Cardiovasc. Dis. — 1978. —
Vol. 47.— P. 109-113.
256 Лапароскопическая хирургия. Атлас
шша
Торакоскопическая
резекция легкого
Эдвард Канту Шу Томас А. Д'Амико
Ж. Чад Хъюес, Дэвид X. Харполе-мл.
Первая торакоскопия была проведена в 1910 г.
Jacobaeous [1] в целях рассечения плевральных спаек.
Однако вследствие ограниченности инструментария
и плохой визуализации использование этого
метода вызывало мало энтузиазма у клиницистов в
течение последующих 80 лет [2]. После внедрения
надежной видеотехнологии в конце 1980-х гг. торакоскопия
(или видеоассистированная торакальная хирургия)
стала весьма важным методом для диагностики и
лечения многих заболеваний в общей торакальной
хирургии [3]. В этой главе описаны видеоторакоскопическая
клиновидная резекция узлового образования легкого
неясной этиологии и заключительная
торакоскопическая лобэктомия по поводу рака.
ТАКТИКА ЛЕЧЕНИЯ ПРИ ОДИНОЧНОМ
УЗЛОВОМ ОБРАЗОВАНИИ ЛЕГКОГО
Дифференциальная диагностика одиночного
узлового образования легкого, случайно обнаруженного
при обзорной рентгенографии легких, представлена
на рис. 20-1. Большинство узлов имеют
доброкачественную природу. Только 5% из них в итоге
оказываются злокачественными. Однако если показаниями
к резекции служат крупный размер и быстрый рост,
примерно 40% резецированных узлов будут иметь
злокачественную природу. Именно поэтому решение
провести биопсию или резекцию легочного узла имеет
решающее значение.
Пациенту с впервые выявленным узловым
образованием легкого необходимо провести тщательный сбор
анамнеза и физикальное обследование, уделяя
особое внимание наличию в анамнезе курения, контакта
с химикатами, асбестом или работе в угледобывающей
промышленности. Кроме того, необходимо отметить
следующие симптомы: одышку, боли в грудной
клетке, кашель, кровь в мокроте или потерю массы тела.
При физикальном обследовании обязательно нужно
оценить наличие шейной, надключичной или
подмышечной лимфаденопатии и провести тщательную
аускультацию всех легочных полей.
Следует просмотреть результаты всех когда-либо
проведенных визуальных исследований, обращая
внимание на свежие и ранее проведенные
рентгенографические исследования легких, которые могут сразу же
Дифференциальная диагностика
узловых образований легких
Артериовенозные пороки развития
Гамартома
Гематома
Инфекция
Грибковая (вызванная Histoplasma, Coccidioides,
Aspergillus species)
Пневмония
Абсцесс легких
Туберкулез
Опухоли
Доброкачественные
Аденома
Мезотелиома
Папиллома
Злокачественные
Аденокарцинома
Карциноид
Крупноклеточный рак
Мезотелиома
Вторичные опухоли (метастазы внелегочных опухолей)
Плоскоклеточный рак
Инфаркт легкого
Рис. 20-1. Дифференциальная диагностика узловых
образований легких.
Глава 20. Торакоскопическая резекция легкого 257
дать требуемую диагностическую и прогностическую
информацию. Размер, скорость роста и внешний вид
узла могут позволить предположить его
злокачественную или доброкачественную природу. Например,
одиночное узловое образование легкого размером менее
Зсм, рентгенографически неизменное в течение 2 лет
наблюдения, может считаться доброкачественным
и не требующим дальнейшей диагностической
оценки. Помимо этого, такие рентгенологические
признаки, как ровный контур, диффузная кальцификация
Критерии неоперабельности
рака легких
Синдром Горнера (за исключением опухолей верхней
борозды)
Поражение легкого с другой стороны
Отдаленные метастазы
Поражение трахеи
Опухоль главного бронха с другой стороны
Метастазы в лимфатические узлы с другой стороны
Обструкция верхней полой вены
Кровянистый плевральный выпот
Раковые клетки в плевральном выпоте
Рис. 20-2. Критерии неоперабельности рака легких.
Предоперационная диагностика
узлового образования легкого
Бронхоскопия
КТ
Тестирование функции легкого
Медиастиноскопия
Рис. 20-3. Предоперационная диагностика узлового
образования легкого.
Преимущества применения
видеоторакоскопии
при резекции легких
Меньшая выраженность послеоперационной боли
Короче период дренирования плевральной полости
Снижение продолжительности госпитализации
Снижение общей стоимости
Раннее возвращение к повседневной активности
Сохранение функций легких
Меньшее количество осложнений
Меньшая выраженность цитокинового воспалительного
ответа
Позволяет предложить проведение резекции и
адъювантной терапии большему числу пациентов
Рис. 20-4. Преимущества применения видеоторакоскопии
при резекции легких.
или кальцификация в виде зерен попкорна,
свидетельствуют о доброкачественной природе опухоли. Однако
образование более 3 см в диаметре, независимо от
других признаков или скорости роста, обычно является
злокачественным.
Если полученные клинические и
рентгенологические данные кажутся неопределенными или есть
подозрение на злокачественную опухоль, необходима
дальнейшая диагностическая оценка. Ее нужно начать
с КТ грудной клетки, печени и надпочечников. При
отдаленных метастазах, выраженной аденопатии
средостения, поражении трахеи, опухоли бронха или лим-
фаденопатии с противоположной стороны рак
считается неоперабельным и обычно смертельным.
Дополнительные критерии неоперабельности рака легких
указаны на рис. 20-2.
При отсутствии неоперабельного заболевания
необходимо провести биопсию всех узловых образований
легких при подозрении на их злокачественную
природу. Предоперационная диагностика (рис. 20-3)
должна включать бронхоскопию для выявления эндоброн-
хиального распространения опухоли или компрессии
бронхов извне, которые могут оказывать влияние
на функции легких. КТ грудной клетки и
надпочечников с внутривенным контрастированием позволяет
точно определить расположение и размеры узлового
образования легкого, диагностировать лимфадено-
патию средостения или корней легких, установить
наличие заболевания на противоположной стороне
или исключить отдаленные метастазы. Если при сборе
анамнеза или физикальном обследовании обнаружена
какая-либо нейрогенная патология, необходимо
назначить КТ головы. Радиоизотопное исследование костей
следует проводить, только когда имеются симптомы,
признаки или лабораторные данные,
свидетельствующие о возможном опухолевом поражении костей.
После завершения обследования необходимо провести
тестирование функций легких для определения
легочного резерва, необходимого для осуществления
клиновидной резекции, лобэктомии и, возможно, пнев-
монэктомии. Пациенты с объемом форсированного
выдоха за 1 с (OOBj) менее 60% должного не подходят
для пневмонэктомии. У пациентов с OOBj и
диффузионной емкостью легкого для диоксида углерода менее
40% должного отмечается повышение уровня
послеоперационных осложнений и смертности после
лобэктомии, хотя отдельные пациенты все-таки могут стать
кандидатами для резекции. Однако торакоскопическая
клиновидная резекция может быть безопасно
проведена у пациентов с OOBj не более 25% должного [4].
Все пациенты, которым показана открытая биопсия
легких, могут быть кандидатами для
видеоторакоскопии. Как показано на рис. 20-4, клиновидная резекция
легкого с помощью видеоторакоскопии имеет
несколько преимуществ перед обычной торакотомией. К ним
258 Лапароскопическая хирургия. Атлас
Критерии для проведения
видеоторакоскопической
клиновидной резекции
Некальцифицированное образование диаметром менее 3 см
Локализация в области наружной трети паренхимы легкого
Отсутствие эндобронхиального распространения опухоли
Рис. 20-5. Критерии для проведения видеоторакоскопической клиновидной резекции.
.левая и сегментарная анатомия легк
Левое легкое Правое легкое
Доля
Верхняя
Отдел
Верхний
Язычковый
Нижний
Сегмент
Апикальный задний
Передний
Верхний
Нижний
Верхний
Переднемедиальный
Латеральный базальный
Задний базальный
Доля
Верхняя
Средняя
Нижняя
Сегмент
Апикальный
Задний
Передний
Латеральный
Медиальный
Верхний
Медиальный
базальный
Передний
базальный
Латеральный
базальный
Задний
базальный
Рис. 20-6. Долевая и сегментарная
анатомия легкого.
относятся: улучшенная визуализация, снижение
интенсивности послеоперационных болей и
минимальные косметические дефекты, а также потенциальное
снижение продолжительности госпитализации и
раннее возвращение к трудовой деятельности.
Наиболее значительным недостатком видеоторакоскопии,
по сравнению с торакотомией при резекции легкого,
остается потеря тактильной обратной связи у хирурга.
Критерии для проведения видеоторакоскопической
клиновидной резекции перечислены на рис. 20-5. В
общем видеоторакоскопическую клиновидную резекцию
можно провести у большинства пациентов с некальци-
фицированными узлами диаметром менее 3 см.
Видеоторакоскопическую резекцию образований,
расположенных в области наружной трети легкого, достаточно
легко осуществить с меньшим риском повреждения
сегментарных сосудов или бронхов. При
определении местоположения узла в значительной степени
помогает КТ, которая в общем оказалась единственным
необходимым методом для определения локализации
образования. Если патологическое исследование
замороженных срезов подтверждает злокачественную
природу образования, необходимо провести лобэктомию
с помощью видеоторакоскопии или открытой торако-
томии. Лобэктомия требуется даже в случае маленькой
опухоли в стадии Т . Эту возможность необходимо
детально обсудить с пациентом перед операцией. Группа
по исследованию рака легких (The Lung Cancer Study
Group) [5] в рандомизированном исследовании
сравнила результаты клиновидной резекции и лобэктомии
при опухолях Т N и установила повышенную частоту
возникновения местных рецидивов в группе с
меньшим объемом резекции. Клиновидная резекция может
стать приемлемым компромиссом только для
пациентов, которые не в состоянии перенести более
обширную операцию вследствие ограниченного легочного
резерва [6].
АНАТОМИЯ
Анатомия легкого определяется ветвлением каждого
бронха (рис. 20-6, 20-7). В каждую долю входят ветви
долевых бронхов. Легочная артерия разделяется слева
Глава 20. Торакоскопическая резекция легкого 259
базальный бронх
Средняя доля
Латеральный бронх
Медиальный бронх
Передний базальный бронх
Нижняя доля
Латеральный базальный бронх
Правое легкое
Апикальный бронх
Передний бронх
Задний бронх
Верхняя доля
Верхний
Левое легкое
Передний бронх
Апикальный бронх
Задний бронх
Верхняя доля
Верхний язычковый бронх
Нижний язычковый бронх
Верхний бронх
Передний базальный бронх
Медиальный базальный бронх
Латеральный базальный бронх
Задний базальный бронх
Нижняя доля
Задний базальный бронх Медиальный базальный бронх
Рис. 20-7. Анатомия легких. Показана топическая анатомия
легких и бронхиального дерева. Правое легкое состоит
из трех долей. Косая (большая) фиссура отделяет нижнюю
долю от верхней и средней долей, а горизонтальная
(малая) фиссура разделяет верхнюю и среднюю доли.
Левое легкое состоит из двух долей, разделенных косой
(большой) фиссурой. Детальное знание топических
признаков легких и их взаимоотношений с рядом лежащими
анатомическими образованиями необходимо для применения
видеоторакоскопии по поводу резекции легкого.
от восходящего отдела аорты. Правая ветвь проходит
за восходящим отделом аорты, а левая идет вдоль
вогнутости дуги аорты. В воротах каждая легочная
артерия дает крупную первую ветвь или передний ствол,
который снабжает кровью один или более сегментов
верхней доли. Дальнейшее ветвление происходит
параллельно ветвлению бронхиального дерева.
Легочные вены отходят от сплетений легочных
капилляров в альвеолах. Венулы проходят в интерло-
барных пространствах и образуют стволы легочных
вен. От каждого легкого отходят два основных ствола
(один от верхнего и один от нижнего отдела), которые
впадают в левое предсердие по задней поверхности.
Бронхиальные артерии снабжают кровью
паренхиму легких и начинаются непосредственно от аорты
или аортальных межреберных сосудов. Их может
быть от 1 до 3, и они сопровождают бронхиолы,
идущие к легочным долькам. Ниже корня легкого
расположены легочные связки, которые образованы двумя
слоями плевры, формирующими отдельные связки,
которые прикрепляются начиная от нижнего края
перикарда до нижней части медиастинальной
поверхности плевры.
ТЕХНИКА ОПЕРАЦИИ
На рис. 20-8—20-18 представлена хирургическая
техника видеоторакоскопической резекции. В качестве
демонстрационного примера описана клиновидная
резекция узла левой верхней доли, за которой следует
заключительная лобэктомия.
260 Лапароскопическая хирургия. Атлас
ПОДГОТОВКА
Наркозный
аппарат\
Хирург
Операционная -
сестра
Столик для инструментов
-Первый
ассистент
Ассистент с камерой
Рис. 20-8. Оборудование операционной и обстановка
для видеоторакоскопии. К специальному оборудованию,
которое полезно иметь для проведения видеоторакоскопии,
относятся торакальные троакары или порты, оптические
системы (угловая оптика), веерный ретрактор,
торакоскопический легочный зажим, эндоскопические
степлеры и эндоскопический ультразвуковой датчик.
Применение торакоскопических портов способствует
беспрепятственным движениям видеокамеры во время
видеоторакоскопии, но их использовать необязательно.
Часто можно работать стандартными инструментами
для торакотомии, введенными в плевральную полость через
маленькие разрезы.
После укладки пациента в латеральное положение
и правильного введения двухпросветной эндотрахеальной
трубки соответствующее легкое необходимо исключить
из механической вентиляции, пока хирурги обрабатывают
руки. Этого времени достаточно для полного спадения
легкого. Инсуффляция при видеоторакоскопии нужна
редко. Если декомпрессия легкого оказалась неадекватной,
для установки инструментов можно применить
инсуффляцию. В таких случаях давление инсуффляции
должно быть ограничено 10мм рт.ст., и при этом необходимо
отслеживать признаки ухудшения венозного возврата
и снижения сердечного выброса. Расположение хирурга
и ассистента/ассистентов соответствуют таковому
при открытой торакотомии. Видеомониторы расположены
на прямой линии, проведенной между оператором
и мишенью оперативного лечения. В случае образований
верхних отделов легкого мониторы находятся обычно по обе
стороны от головного конца стола, а при образованиях
нижней части легкого — по обе стороны от ножного конца
стола. Видеоторакоскопия обеспечивает обзор анатомии
грудной клетки через маленькое, увеличенное поле зрения.
Таким образом, весьма важно ориентировать операционное
поле, как это видно на дисплее. Два поля зрения,
рекомендуемые при видеоторакоскопии, получают путем
введения оптики через задний или нижний порт. При обзоре
через задний порт анатомия грудной клетки может быть
ориентирована аналогично тому, как видит это хирург
при открытой торакотомии. При левосторонней торакоскопии
с использованием стандартного видеомонитора образования,
расположенные спереди, оказываются сверху, задние
образования находятся сзади, нижние — слева, а верхние —
справа. Для лучшего обзора апикальных образований грудной
клетки видеоторакоскоп может быть введен через порт,
расположенный снизу, по срединно-подмышечной линии.
При такой ориентации апикальные образования оказываются
в верхней части экрана, нижние — сзади, передние
структуры — слева, а задние — справа.
Глава 20. Торакоскопическая резекция легкого 261
Разрез ^^
в четвертом межреберье/ /
длиной 4-5 см ^ /ft
Порт
в пятом межреберье
(передний) —4
J§J
ж
\
1 ^ Порт
■)^ в пятом межреберье
/ (задний)
*"""-~^ 1,5-см разрез
в восьмом межреберье
для камеры
^ Место порта
для камеры
в седьмом межреберье
Рис. 20-9. Установка портов имеет первостепенное значение
для успеха видеоторакоскопической резекции и зависит
от локализации образования, подлежащего резекции.
Порты необходимо расположить в виде бейсбольного
ромба, в котором видеокамера будет домашней базой
относительно патологического образования легкого,
расположенного в области второй базы. Рабочими портами
для ретрактора, граспера и степлера служат первая
и третья базы. Широкое размещение портов дает большее
пространство для эффективной ретракции и адекватных
движений инструментами. Первичный порт вводят с помощью
открытой техники. Для установки порта (обычно диаметром
10мм) и видеокамеры межреберные мышцы раздвигают
под визуальным контролем с помощью тонзиллярного
зажима до париетальной плевры. Плевру вскрывают
острым путем, затем вводят палец, чтобы подтвердить
попадание в полость для введения троакара и видеокамеры.
Большинство хирургов используют 3 или 4 троакара, хотя
лобэктомию обычно можно провести с помощью только
двух разрезов. Первый разрез, для 10-миллиметрового
первичного троакара, необходим преимущественно
для торакоскопа, его устанавливают в седьмом и восьмом
межреберном промежутке по средней подмышечной линии.
Второй разрез — для переднего доступа (длиной 4,5-6 см) —
нужен для диссекции и извлечения препарата, его делают
в пятом или шестом межреберье, сразу же ниже молочной
железы или большой грудной мышцы. Расположение этого
разреза выбирают для диссекции в области корня, в более
широком межреберном промежутке, обычно независимо
от того, планируют верхнюю или нижнюю лобэктомию.
Можно применять дополительные разрезы — в области
подмышечной впадины или кзади от нее — для улучшения
визуализации или обеспечения ретракции.
262 Лапароскопическая хирургия. Атлас
Рис. 20-10. Первичный торакоскопический осмотр.
После того как сделан второй разрез, хирург проводит
торакоскопическую ревизию, которая включает
подтверждение расположения опухоли, исключение
или подтверждение наличия плевральных метастазов
и рассечение легочной связки. Поверхность легких
необходимо тщательно исследовать, чтобы исключить
их повреждение троакарами либо выявить выпуклости
или впадения на висцеральной плевре, которые точно
могут указать на локализацию легочной патологии.
Необходимо уделить дополнительное время обследованию
средостения на наличие патологических лимфатических
узлов. Дополнительные порты вводят трансторакально
под визуальным контролем. Успешной установке портов
в виде бейсбольного ромба способствует пальпация
наружной поверхности грудной клетки относительно
образования, подлежащего удалению. Места разрезов
выбирают таким образом, чтобы они не мешали друг другу,
обеспечивая адекватную визуализацию ворот. Необходимо
отметить, что степлер лучше вводить в тот разрез, который
обеспечивает лучший угол со структурами ворот. Выбор
инструментов для торакоскопической лобэктомии весьма
важен для успешного проведения операции. Необходимо
использовать 30-градусный торакоскоп, чтобы панорамная
визуализация во время диссекции была оптимальной
и используемые инструменты как можно меньше
мешали друг другу. Для диссекции можно применять ряд
инструментов, включая обычные инструменты и специальные
для торакоскопии и лапароскопии. Особенно помогает
при ретракции и диссекции использование длинных
изогнутых инструментов, так как это позволяет свести
к минимуму помехи и столкновения их друг с другом.
Торакоскопические (линейные) механические степлеры,
к примеру «EndoGIA» {US Surgical, Norwalk, СГ), используют
для пересечения сосудов (2- или 2,5-миллиметровые
степлеры), бронхов (3,5- или 4,8-миллиметровые степлеры)
и фиссуры.
Глава 20. Торакоскопическая резекция легкого 263
Первый захват
степлером
Рис. 20-11. Захват узла и первичное наложение степлера.
После обнаружения узла в легком для его резекции
применяют эндоскопический степлер. В большинстве случаев
пораженный участок можно захватить такими инструментами,
как окончатый зажим, зажим Бэбкока или легочный
зажим, чтобы сформировать выпирающий край легкого
для наложения степлера. Если узел расположен на плоской
поверхности, на которую невозможно наложить бранши
эндоскопического степлера, для создания выпирающего края
легочной ткани можно использовать лазер.
Рис. 20-12. Линия скобок при клиновидной резекции.
После приведения степлера в действие бранши инструмента
открывают и осматривают линию скобок, чтобы убедиться,
что скобки легли правильно, нет кровотечения и утечки
воздуха. Часто для резекции одного образования необходимо
несколько раз перезаряжать степлер. После каждого
прошивания следует менять положение удаляемого
препарата, чтобы легочная ткань входила в бранши степлера
без помех.
Удаление
препарата
в контейнере
Край
3-го захвата
со скобками
2-й захват
1-й захват
Рис. 20-13. Препарат помещают в защитный контейнер.
Для того чтобы свести к минимуму возможность местной
контаминации мест введения троакаров клетками вероятно
имеющейся раковой опухоли, препарат перед извлечением
из грудной клетки необходимо изолировать с помощью
эндоскопического контейнера.
264 Лапароскопическая хирургия. Атлас
Рис. 20-14. Диссекция в воротах легкого (легочная вена).
После того как исследование замороженных срезов
подтвердило диагноз злокачественной опухоли, может быть
проведена лобэктомия. В то время как большинство хирургов
при открытой лобэктомии сначала проводят диссекцию
фиссуры для получения доступа к артериальным ветвям,
торакоскопическую лобэктомию полностью осуществляют
в области ворот, и диссекцию фиссуры не проводят до тех
пор, пока не пересекут все структуры, расположенные
в воротах. Диссекцию ворот проводят через разрез
для первичного доступа в целях визуализации и мобилизации
структур, находящихся в воротах. При любой анатомической
торакоскопической лобэктомии диссекцию ворот начинают
с мобилизации легочной вены, диссекции способствует
тракция легкого кзади и книзу. Перемещение торакоскопа
в передний разрез может улучшить визуализацию верхней
части ворот или способствовать наложению линейного
степлера для верхней лобэктомии, если торакоскоп введен
через подмышечный порт. Легкое отводят кзади, находят
и мобилизуют верхнюю легочную вену, затем обходят левую
верхнюю легочную вену с помощью изогнутого зажима.
Диссекция за верхней легочной веной позволяет обнаружить
легочную артерию. Далее накладывают степлер и пересекают
верхнюю легочную вену, обнажая легочную артерию.
Рис. 20-15. Диссекция в воротах легкого (легочная артерия).
После этого мобилизуют апикальную и переднюю ветви
левой легочной артерии; этот прием облегчается диссекцией
лимфатического узла, который находится в области передней
поверхности верхнедолевого бронха. Эти ветви затем
пересекают с помощью степлера. Сейчас можно увидеть
и пересечь степлером заднюю артерию, если она не включена
в апикально-передний ствол.
Рис. 20-16. Диссекция в воротах (бронх). На данном этапе
можно увидеть левый верхнедолевой бронх и пересечь его
степлером. Если бронх расположен кпереди от апикальной
и передней артерий, сначала завершают работу с бронхом.
Глава 20. Торакоскопическая резекция легкого 265
Рис. 20-17. Далее степлер накладывают на язычные ветви.
В заключение завершают мобилизацию доли по фиссуре
и извлекают препарат.
Рис. 20-18. Установка дренажа в плевральную полость.
После удаления препарата грудную клетку необходимо
еще раз внимательно осмотреть с помощью видеокамеры.
Грудную полость следует частично заполнить 0,9% раствором
натрия хлорида и раздуть легкое для проверки линии швов
на герметичность и наличие кровотечения. Затем вводят
плевральный дренаж через самый нижний из портов,
направляют его в сторону верхушки под визуальным
контролем и соединяют с вакуумным устройством
с разряжением 20см вод.ст. после зашивания мест введения
троакаров.
266 Лапароскопическая хирургия. Атлас
езультаты: видеоторакоскопическая хирургия и торакотоми
Исследование
Пациенты, n
Время
операции,
мин
Частота
конверсии.
%
ДГ, дни
Видеоторакоскопическая клиновидная резекция/сегментэктомия против торакотомии
Hazerligg etal. [11]
Allen etal. [U]
Santambrogio et al.
[14]'
Ayed и Raghunathan et
С7/Л24]1
Miller etal. [25Y
1820
118
44 (22/22)
61 (32/29)
44 (20/22)
Видеоторакоскопическая лобэктомия
Loscertalesetal. [26]
Walker etal. [27]
Kasedaetal. [32]
Wmefo/. [33]
Solainietal. [34]
Dome/5 его/. [15]
Roviaroetal. [7]
McKennaetal. [8]
Ош/f/s его/. [31]
Mrby его/. [28]
Sug/era/. [29]
Craig etal. [30]
72
150
130
214
105
110
344
1100
500
55 (25 и 30)
100 (48 и 52)
41 (22 и 19)
83,42
НС
97и 1312
45 и 602,3
40 и 372
против торакотомии
1642
1442
НС
НС
НС
НС
НС
НС
НС
161 и 1754
НС
141 и 1214
24
45,8
22,7
0
НС
4,3
11,8
1,5
0,9
5,7
1,8
23,1
1,8
1,6
10,7
4,1
НС
5,12
ЗибЗ
5и82,4
3 и 52,4
ЗиЗЗ
6,82
6,72
НС
6,82
6,22
33
52
33
33
7,1 и 8,322,4
НС
8,6 и 7,94
Смертность,
%
2,52
0
0
0и6,8
0и0,9
4,3
2
0,8
0,5
НС
3,6
0,6
0,8
1
0
НС
0
5-летняя
выживаемость
НС
НС
НС
НС
НС
НС
НС (3-y:l 94, II
57, III 25)
НС (4-у: 190)
НС
НС (3-у: 190)
НС
68,9
72
НС(2-у: 185, >П
77)
НС
85 и 904
НС
' Рандомизированное клиническое исследование.
■ Средний показатель.
' Медиана.
* p=ns.
*р<0,05.
Рис. 20-19. Сравнение результатов видеоторакоскопической хирургии и торакотомии. ДГ — длительность госпитализации; НС
не сообщается.
РЕЗУЛЬТАТЫ
В среднем частота конверсии в открытую торакото-
мию при обширных резекциях легких варьирует от 1,8
до 23% [7-9]. Результаты применения
видеоторакоскопии для лечения узловых образований легких неясной
этиологии суммированы на рис. 20-19.
В ранний период применения этого метода всем
пациентам после видеоторакоскопической клиновидной
резекции для проведения обширной резекции при
выявлении рака в результате гистологического
исследования замороженных срезов требовалась конверсия
в открытую операцию. На сегодняшний день в центрах
с большим опытом выполнения этих операций
конверсия требуется реже. Типичные показания к конверсии
в открытую торакотомию представлены на рис. 20-20.
Торакоскопическая клиновидная резекция имеет
100% чувствительность и специфичность при диагно-
Показания к конверсии в открытую
торакотомию
Слишком большое количество спаек (плевральная полость
облитерирована)
Неконтролируемое кровотечение
Повреждение межреберного сосудисто-нервного пучка
троакаром
Поломка оборудования
Невозможность найти узел
Гипоксемия или гиперкапния
Рис. 20-20. Показания к конверсии в открытую торакотомию.
стике рака и характеризуется минимальной частотой
послеоперационных осложнений [10]. К наиболее
распространенным осложнениям относятся длительная
утечка воздуха, ателектаз, пневмоторакс, пневмония
Глава 20. Торакоскопическая резекция легкого 267
Осложнения торакоскопической
резекции легкого
Предсердная аритмия
Пневмоторакс
Персистирующая утечка воздуха
Кровотечение
Перфорация диафрагмы
Ателектаз
Неадекватные края резекции
Повреждение легкого
Повреждение межреберного сосудисто-нервного пучка
Поломка оборудования
Инфекция
Рис. 20-21. Осложнения торакоскопической резекции легкого.
и предсердные аритмии [9-14]. Каждое из осложнений
отмечается менее чем у 2% пациентов. Другие
осложнения, которые возможны после видеоторакоскопии,
перечислены на рис. 20-21. Продолжительность
госпитализации после видеоторакоскопической
клиновидной резекции варьирует от 2 до 5 дней [9-14].
После постановки диагноза рака легких в
результате исследования замороженных срезов необходимо
провести радикальную операцию. Показания к
торакоскопической лобэктомии аналогичны показаниям
к открытой лобэктомии. Она рекомендована
пациентам с доказанным или подозреваемым раком легкого
(клиническая стадия I), которым рекомендована
радикальная резекция посредством лобэктомии.
Абсолютные противопоказания к лапароскопической
лобэктомии — невозможность проведения полной резекции
путем лобэктомии опухоли в стадии Т3 и Т , N2 или N ,
а также отсутствие возможности проведения
отдельной вентиляции противоположного легкого.
Относительными противопоказаниями считают опухоль,
видимую при бронхоскопии, и наличие лимфаденопа-
тии доброкачественной или злокачественной природы
в воротах легких, которая может осложнить диссекцию
сосудов.
Были доказаны безопасность и эффективность
торакоскопической лобэктомии у пациентов с ранней
стадией рака легких [7, 8, 15-23]. Опубликовано
достаточное количество исследований (как одно-, так
и многоцентровых), чтобы сделать заключение о том,
что торакоскопическая лобэктомия — приемлемый
метод лечения пациентов с I клинической стадией рака
легких (см. рис. 20-19).
Daniels etal. [15] сообщили о результатах
торакоскопической лобэктомии у ПО пациентов.
Тридцатидневная летальность составила 3,6%, интраоперационной
смертности не зафиксировано. Частота конверсии
составляла 1,8%, ни одна из конверсии не была
экстренной. Средняя продолжительность дренирования
плевральной полости — 3 дня, средняя продолжительность
госпитализации тоже составила 3 дня. Группа по раку
и лейкемии (Cancer and Leukemia Group В) [16]
сообщила о результатах многоцентрового исследования 97
пациентов, подвергшихся торакоскопической
лобэктомии. В этой серии смертность находилась в
пределах 2%, время операции — 130 мин, а средняя
продолжительность госпитализации составила 3 дня. Было
опубликовано множество других серий исследований,
и в качестве резюме можно сказать, что исходы
торакоскопической лобэктомии оказались эквивалентными
опубликованным результатам торакотомии и
лобэктомии по показателям безопасности и онкологической
эффективности, которые измерялись частотой
проведения полной резекции, временем операции, объемом
лимфодиссекции, интраоперационной летальностью
и выживаемостью в раннем периоде. К признанным
преимуществам торакоскопической анатомической
резекции относятся меньшая выраженность
послеоперационных болей, меньшая продолжительность
операции и сохраненные функции легких.
СПИСОК ЛИТЕРАТУРЫ
1. Jacobaeus H. Ueber die Moglichkeit die Zystoskopie bei
untersuchung seroser hohlungen anzuwenden // Munchen Med.
Wochenschr. — 1910. — Vol. 57. — P. 2090-2092.
2. Bloomberg A.E. Thoracoscopy in perspective // Surg. Gynecol.
Obstet. — 1978. — Vol. 147. — P. 433-443.
3. Sedrakyan A., van der Meulen J., Lewsey J., Treasure T. Video
assisted thoracic surgery for treatment of pneumothorax and
lung resections: systematic review of randomised clinical trials //
BMJ. — 2004. — Vol. 329. — P. 1008.
4. Datta D., Lahiri B. Preoperative evaluation of patients undergoing
lung resection surgery // Chest. — 2003. — Vol. 123. — P. 2096-2103.
5. Ginsberg R. The role of limited resection in the treatment of early stage
lung cancer // Lung. Cancer. — 1994. — Vol. 11 (Suppl. 2). — P. 35.
6. Kaiser L.R., Shrager J.B. Video-assisted thoracic surgery: the
current state of the art // AJR Am. J. Roentgenol. — 1995. —
Vol. 165.— P. 1111-1117.
7. Roviaro G, Varoli R, Vergani C. et al. Video-assisted thoracoscopic
major pulmonary resections: technical aspects, personal series
of 259 patients, and review of the literature // Surg. Endosc. —
2004. — Vol. 18. — P. 1551-1558.
8. Mc Kenna R.J., Jr., Houck W., Fuller C.B. Video-assisted thoracic
surgery lobectomy: experience with 1100 cases // Ann. Thorac.
Surg. — 2006. — Vol. 81. — P. 421-425; discussion — P. 425-426.
9. Alien M.S., Deschamps C, Jones D.M. et al. Video-assisted thoracic
surgical procedures: the Mayo experience // Mayo Clin. Proc. —
1996. — Vol. 71. — P. 351-359.
268 Лапароскопическая хирургия. Атлас
10. Mack M.J., Hazelrigg S.R., Landreneau R.J.,
Acuff Т.Е. Thoracoscopy for the diagnosis of the indeterminate
solitary pulmonary nodule // Ann. Thorac. Surg. — 1993. —
Vol. 56. — P. 825-830; discussion — P. 830-832.
11. Hazelrigg S.R., Nunchuck S.K., Lo Cicero J., III. Video Assisted
Thoracic Surgery Study Group data // Ann. Thorac. Surg. —
1993. — Vol. 56. — P. 1039-1043; discussion — P. 1043-1044.
12. Allen M.S., Deschamps C, Lee R.E. et al. Video-assisted
thoracoscopic stapled wedge excision for indeterminate pulmonary
nodules // J. Thorac. Cardiovasc. Surg. — 1993. — Vol. 106. —
P. 1048-1052.
13. Landreneau R.J., Hazelrigg S.R., Mack M.J. et al. Postoperative
pain-related morbidity: video-assisted thoracic surgery versus
thoracotomy // Ann. Thorac. Surg. — 1993. — Vol. 56. — P. 1285-
1289.
14. Santambrogio L., Nosotti M., Bellaviti N.,
Mezzetti M. Videothoracoscopy versus thoracotomy for the diagnosis
of the indeterminate solitary pulmonary nodule // Ann. Thorac.
Surg. — 1995. — Vol. 59. — P. 868-870; discussion — P. 870-871.
15. Daniels L.J., Balderson S.S., Onaitis M.W.,
D'Amico T.A. Thoracoscopic lobectomy: a safe and effective
strategy for patients with stage I lung cancer // Ann. Thorac.
Surg. — 2002. — Vol. 74. — P. 860-864.
16. Swanson S., Herndon J., DAmico T. et al. Results of CALGB 39802:
feasibility of VATS lobectomy for lung cancer // Proc.Am. Soc. Clin.
Oncol. — 2002. — Vol. 21. — P. 290 A.
17. Demmy T.L., Curtis J.J. Minimally invasive lobectomy directed
toward frail and high-risk patients: a case-control study // Ann.
Thorac. Surg. — 1999. — Vol. 68. — P. 194-200.
18. Mc Kenna R.J., Jr., Fischel R.J., Wolf R., Wurnig P. Video-assisted
thoracic surgery (VATS) lobectomy for bronchogenic carcinoma //
Semin. Thorac. Cardiovasc. Surg. — 1998. — Vol. 10. — P. 321-325.
19. Nagahiro I., Andou A., Aoe M. et al. Pulmonary function,
postoperative pain, and serum cytokine level after lobectomy: a
comparison of VATS and conventional procedure // Ann. Thorac.
Surg. — 2001. — Vol. 72. — P. 362-365.
20. Nomori H., Horio H., Naruke Т., Suemasu K. What is the advantage
of a thoracoscopic lobectomy over a limited thoracotomy procedure
for lung cancer surgery? // Ann. Thorac. Surg. — 2001. —
Vol. 72. — P. 879-884.
21. Yim A.P., Wan S., Lee T.W, Arifi A.A. VATS lobectomy reduces
cytokine responses compared with conventional surgery // Ann.
Thorac. Surg. — 2000. — Vol. 70. — P. 243-247.
22. Yim A.P. VATS major pulmonary resection revisited: controversies,
techniques, and results // Ann. Thorac. Surg. — 2002. — Vol. 74. —
P. 615-623.
23. Petersen R.P., Pham D., Toloza E.M. et al. Thoracoscopic
lobectomy: a safe and effective strategy for patients receiving
induction therapy for non-small cell lung cancer // Ann. Thorac.
Surg. — 2006. — Vol. 82. — P. 214-218, discussion — P. 219.
24. Ayed A.K., Raghunathan R. Thoracoscopy versus open lung biopsy
in the diagnosis of interstitial lung disease: a randomised controlled
trial // J. R. Coll. Surg. Edinb. — 2000. — Vol. 45. — P. 159-163.
25. Miller J.D., Urschel J.D., Cox G. et al. A randomized, controlled
trial comparing thoracoscopy and limited thoracotomy for lung
biopsy in interstitial lung disease // Ann. Thorac. Surg. — 2000. —
Vol. 70. — P. 1647-1650.
26. Loscertales J., Jimenez-Merchan R., Arenas-Linares C. et al. The
use of video-assisted thoracic surgery in lung cancer: evaluation
of resectability in 296 patients and 71 pulmonary exeresis with
radical lymphadenectomy // Eur. J. Cardiothorac. Surg. — 1997. —
Vol. 12. — P. 892-897.
27. Walker W.S. Video-assisted thoracic surgery (VATS) lobectomy:
the Edinburgh experience // Semin. Thorac. Cardiovasc. Surg. —
1998. — Vol. 10. — P. 291-299.
28. Kirby T.J., Mack M.J., Landreneau R.J., Rice T.W. Lobectomy:
video-assisted thoracic surgery versus muscle-sparing thoracotomy.
A randomized trial // J. Thorac. Cardiovasc. Surg. — 1995. —
Vol. 109. — P. 997-1001; discussion — P. 1002.
29. Sugi K., Kaneda Y, Esato K. Video-assisted thoracoscopic
lobectomy achieves a satisfactory long-term prognosis in patients
with clinical stage IA lung cancer // World J. Surg. — 2000. —
Vol. 24. — P. 27-30; discussion — P. 231.
30. Craig S.R., Leaver H.A., Yap P.L. et al. Acute phase responses
following minimal access and conventional thoracic surgery //
Eur.J. Cardiothorac. Surg. — 2001. — Vol. 20. — P. 455-463.
31. Onaitis M.W, Petersen R.P., Balderson S.S. et al. Thoracoscopic
lobectomy is a safe and versatile procedure: experience with 500
consecutive patients // Ann. Surg. — 2006. — Vol. 244. — P. 420-
425.
32. Kaseda S., Aoki Т., Hangai N. Video-assisted thoracic surgery
(VATS) lobectomy: the Japanese experience // Semin. Thorac.
Cardiovasc. Surg. — 1998. — Vol. 10. — P. 300-304.
33. Yim A.P. C, Izzat M.B., Liu H. et al. Thoracoscopic major lung
resections: an Asian perspective // Semin. Thorac. Cardiovasc.
Surg. — 1998. — Vol. 10. — P. 326-331.
34. Solaini L., Prusciano E, Bagioni P. et al. Video-assisted thoracic
surgery major pulmonary resections: present experience //
Eur. J. Cardiothorac. Surg. — 2001. — Vol. 20. — P. 437-442.
Глава 20. Торакоскопическая резекция легкого 269
Торакоскопическая
редукция
объема легких
Томас А. Д'Амико
Ашиш С. Шах, Р. Дуэйн Дэвис-мл., Дэвид X. Харполе-мл.
ШШ©
Эмфизема находится на четвертом месте среди
лидирующих причин смерти в США: ежегодно от нее умирают
примерно 120000 человек. Кроме того, она считается
основной причиной утраты трудоспособности,
зафиксированной примерно у 3 млн американцев. В целом
это заболевание отмечают примерно у 14 млн человек
в США [1]. Консервативное лечение, включая отказ
от курения, применение бронходилататоров,
стероидов и легочную реабилитацию, играет основную роль
в лечении пациентов с эмфиземой, но приводит лишь
к умеренному улучшению качества жизни.
Хирургическое лечение эмфиземы, которое впервые
было введено в практику в 1959 г. Brantigan и Muller [2],
сопровождалось высокой интраоперационнои
летальностью и имело минимальную эффективность. Cooper
et al. [3] повторно внедрили хирургическую редукцию
объема легких (ХРОЛ) в 1993 г. При проведении
операции у первых 150 пациентов авторы отмечали
значительное улучшение качества жизни, функции легких
и переносимости физической нагрузки, а также
снижение потребности в поддерживающем применении
кислорода. Данное исследование стимулировало
возникновение большого интереса к усовершенствованию
хирургического доступа при этой патологии.
ПАТОФИЗИОЛОГИЯ
На сегодняшний день достаточно хорошо описаны
патологические изменения, к которым приводит
хроническая обструктивная болезнь легких (ХОБЛ). К ним
относятся деструкция паренхимы легких и
патологическая дилатация воздушных полостей, которые
находятся дистальнее терминальных отделов бронхиол.
Это заболевание приводит к утрате легкими их
растяжимости и эластической отдачи, что приводит
к уменьшению OOBj и увеличению объема мертвого
дыхательного пространства. При макроскопическом
исследовании легкого у таких пациентов
диагностируют явные признаки деструкции и скопление воздуха
в отдельных пузырях и пузырьках. Типичная буллез-
ная болезнь обычно локализуется в апикальных
отделах легких, но при эмфиземе поражение может быть
и диффузным. Стандартными и неизбежными
последствиями могут стать прогрессивное истощающее
диспноэ и хроническая гипоксия [4].
ХИРУРГИЧЕСКАЯ РЕДУКЦИЯ
ОБЪЕМА ЛЕГКИХ
Хирургические вмешательства, посредством
которых уменьшают объем легких, основываются на том
принципе, что удаление пораженного участка
легкого восстановит функциональную емкость оставшейся
легочной ткани. Истинное влияние ХРОЛ на легочную
функцию до сих пор полностью не изучено, однако
проведенные исследования показали, что после
операции отмечается улучшение показателей ОФВ^
функциональной остаточной емкости, механики грудной
клетки, и, что наиболее важно, операция оказывает
положительное влияние на переносимость физических
нагрузок и диспноэ [1,5].
ПРЕДОПЕРАЦИОННАЯ ОЦЕНКА И ОТБОР
ПАЦИЕНТОВ
Пациент обязательно должен пройти полное
исследование функций легких, электрокардиографию,
измерение содержания газов в артериальной крови,
6-минутный прогулочный тест, рентгенографию грудной
клетки, КТ грудной клетки и вентиляционно-перфузионное
сканирование (V/Q). Кроме того, пациент должен быть
подвергнут 6-дневному курсу легочной
реабилитации. Оптимальный подбор пациентов остается
спорным вопросом, который еще изучается. Однако
работа, проведенная в течение нескольких последних лет,
и Национальное исследование по лечению эмфиземы
(National Emphysema Treatment Trial) позволили опре-
Глава 21. Торакоскопическая редукция объема легких 271
Относите]
Критерии пригодности
Хроническая обструктивная
болезнь легких, рефрактерная
к медикаментозной терапии
ОФВ, <35%
Возраст <70 лет
Возможность полной
послеоперационной реабилитации
рии пригодное
тикХРОЛ
Критерии непригодности
Курение сигарет в течение
предшествующих 3-6 мес
Болезненное ожирение или кахексия
(<80% или >120% идеальной массы
тела)
Выраженная легочная гипертензия
(среднее давление — >30-35 мм рт.ст.)
Гиперкапния (РаС02> — 50 мм рт.ст.)
Тяжелая гипоксия (потребность в 02—
>4 л/мин)
Преднизолон — >20 мг/дм
Предшествующая обширная резекция
легкого
Нестабильная стенокардия
Рис. 21-1. Относительные критерии
пригодности и непригодности к ХРОЛ.
ОФВ, — объем форсированного выдоха
за первую секунду.
делить относительные критерии пригодности и
непригодности пациентов для проведения им ХРОЛ (рис.
21-1). Пациенты считаются кандидатами для ХРОЛ,
только если у них имеется тяжелое диспноэ, которое
рефрактерно к медикаментозной терапии, и диагноз
ХОБЛ подтвержден данными КТ. Все эти параметры
служат объектами для дальнейшего изучения и могут
варьировать в разных клиниках.
Техника операции
На рис. 21-2—21-8 изображена хирургическая
техника двусторонней видеоторакоскопической ХРОЛ.
В качестве альтернативного варианта можно провести
ХРОЛ посредством срединной стернотомии. Для
усиления линии скобок, чтобы минимизировать риск
просачивания воздуха, можно использовать, например,
политетрафторэтилен [6].
272 Лапароскопическая хирургия. Атлас
ПОДГОТОВКА
Наркозный
аппарат
Монитор
Хирург
Первый ассистент
Операционная
сестра
- Ассистент с камерой
Рис. 21-2. Обстановка операционной
для видеотораскопической
хирургической редукции объема
легких. Пациента укладывают
в латеральную позицию,
располагая его руки, как показано
на рисунке (как при традиционных
видеоторакоскопических резекциях).
Эндотрахеальную интубацию
двухпросветной трубкой проводят
с применением инвазивного
мониторинга, включая установку
артериального катетера.
Глава 21. Торакоскопическая редукция объема легких 273
ОПЕРАЦИЯ
Краниальное
Торакоскоп
1. Задний порт
2. Срединно-подмышечный
порт
3. Передний порт
4. Угол лопатки
Рис. 21-3. Положение троакаров определяется локализацией
патологического очага. Первичный порт устанавливают
в пятом-седьмом межреберье по среднеподмышечной линии.
Показано типичное расположение портов для апикальной
резекции.
Рис. 21-4. Далее через первичный порт вводят камеру,
в плевральную полость входят при спавшемся легком. Второй
порт вводят под непосредственным визуальным контролем
сзади от первичного, после чего осторожно разделяют
спайки. Особое внимание уделяют верхушке, рядом с которой
обычно расположены плотные спайки. Необходимо найти
все крупные буллы. Цель операции при типичной форме
заболевания — резекция примерно 50% верхней доли
или 20-30% всего легкого.
Типичная линия
резекции
при апикальной
резекции
Рис. 21-5, А, Б. Теперь определяют линию резекции,
демаркационная зона лучше видна после рассечения буллы.
Можно применять другие приемы, такие как форсированный
вдох через эндотрахеальную трубку. Для определения места
резекции можно использовать предоперационные методы
визуализации. У пациентов с диффузным заболеванием
для маркировки предполагаемой линии резекции предлагают
использовать электрокоагуляцию.
274 Лапароскопическая хирургия. Атлас
Рис. 21-6. Затем проводят резекцию в направлении спереди Рис. 21-7. Завершенная линия механического шва.
назад с помощью «EndoGIA» (45-60; Tyco International, Princeton, Резецированный препарат извлекают из грудной клетки
NJ) с усиленной линией скобок. через латеральный порт. Если остается большое пространство
в плевральной области или имеется просачивание воздуха,
можно укрыть линию резекции плевральным лоскутом.
С помощью электрокоагулятора делают разрез париетальной
плевры, которую затем мобилизуют от поверхности грудной
клетки марлевым тупфером.
Глава 21. Торакоскопическая редукция объема легких 275
РЕЗУЛЬТАТЫ
В 1998 г. для сравнения эффективности ХРОЛ и
консервативной терапии было начато Национальное
исследование лечения эмфиземы. Необходимо отметить,
что это было первое исследование, начатое по
инициативе Medicare, спонсируемое из федерального бюджета,
целью которого было определить, оправдано ли
«возвращение» этой хирургической операции. С января
1998 по июль 2003 г. были исследованы 3777 пациентов
и 1218 пациентов были рандомизированы в 17 центрах
(608 — для ХРОЛ и 610 — для медикаментозного
лечения) [7]. Значимых различий в общей выживаемости
за период 2-летнего наблюдения отмечено не было.
Однако ХРОЛ приводила к улучшению показателей
выживаемости, качества жизни и увеличению объема
физических нагрузок у пациентов с
преимущественной эмфиземой верхней доли. Это функциональное
улучшение нивелировались через 3-5 лет. Несмотря
на возвращение показателей к базовому уровню, у
пациентов, перенесших ХРОЛ, клинические
преимущества перед их оппонентами, подвергшимися
медикаментозной терапии, сохранялись в течение 5-летнего
срока наблюдения.
Частота периоперационной летальности
варьировала от 0 до 9% у пациентов, подвергшихся
двусторонней торакоскопической ХРОЛ [7-10]. Наиболее
распространенными осложнениями были легочная
недостаточность, пневмония, утечка воздуха и длительное
нахождение в отделении интенсивной терапии и
клинике [8-11]. Послеоперационная легочная
реабилитация — необходимая часть периода выздоровления, и,
возможно, она напрямую связана с долговременными
функциональными преимуществами [12].
Также было показано, что торакоскопический
доступ при ХРОЛ имеет много преимуществ перед
срединной стернотомией [9-11]. Торакоскопический
доступ позволяет лучше визуализировать нижний
и задний легочные сегменты. У пациентов, которым
проводят такое оперативное лечение, кроме того,
зафиксирована более низкая частота
послеоперационной легочной недостаточности и ранней смертности
[10-11]. Помимо всего перечисленного, в случае
проведения видеоторакоскопического вмешательства
снижаются продолжительность госпитализации,
частота дыхательных осложнений и стоимость
операции [11].
СПИСОК ЛИТЕРАТУРЫ
1. Fein A.M. Lung volume reduction surgery: answering crucial
questions // Chest. — 1998. — Vol. 113. — P. 277-282.
2. Brantigan O., Muiler E. Surgical treatment of pulmonary
emphysema // Am. Surg. — 1957. — Vol. 23. — P. 789-804.
3. Cooper J.D., Trulock E.P., Triantafillou A.N. et al. Bilateral
pneumonectomy (volume reduction) for chronic obstructive
pulmonary disease // J. Thorac. Cardiovasc. Surg. — 1995. —
Vol. 109.— P. 106-119.
4. Cotran R.S., Kumar V., Robbins S.L. The respiratory system //
In: Robbins Pathologic Basis of Disease. — Philadelphia:
W.B. Saunders, 1989. — P. 766-770.
5. Scuirba EC, Rogers R.M., Keenan R.J. et al. Improvement of
pulmonary function and elastic recoil after lung reduction surgery
for diffuse emphysema // N. Engl. J. Med. — 1996. — Vol. 334. —
P. 1095-1099.
6. De Camp M.M., Blackstone E.H., Naunheim K.S. et al. Patient and
surgical factors influencing air leak after lung volume reduction
surgery: lessons Learned from the National Emphysema Treatment
Trial // Ann. Thorac. Surg. — 2006. — Vol. 82. — P. 197-207.
7. National Emphysema Treatment Trial Research Croup: A
randomized trial comparing lung volume reduction surgery with
medical therapy for severe emphysema // N. Engl. J. Med. —
2003. — Vol. 348. — P. 2059-2073.
8. Sabanathan A., Sabanathan S., Shah R. et al. Lung volume reduction
surgery for emphysema: a review // J. Cardiovasc. Surg. — 1998. —
Vol. 39. — P. 237-243.
9. Kotoloff R.M., Tino G., Bavaria J.E. et al. Bilateral lung volume
reduction surgery for advanced emphysema: a comparison of
median sternotomy and thoracoscopic approaches // Chest. —
1996. — Vol. 110. — P. 1399-1406.
10. McKenna R.J., Jr., Benditt J.O., De Camp M. et al. Safety and
efficacy of median sternotomy versus video-assisted thoracic
surgery for lung volume reduction surgery // J. Thorac. Cardiovasc.
Surg. — 2004. — Vol. 127. — P. 1350-1360.
11. Roberts J.R., Bavaria J.E., Wahl P. et al. Comparison of open and
thoracoscopic bilateral volume reduction surgery: complications
analysis // Ann. Thorac. Surg. — 1998. — Vol. 66. — P. 1759-
1766.
12. Celli B.R. Pulmonary rehabilitation for patients with advanced lung
disease // Clin. Chest. Med. — 1997. — Vol. 18. — P. 521-534.
276 Лапароскопическая хирургия. Атлас
Лапароскопический доступ
к пояснично-крестцовому отделу
позвоночника для дискэктомии
и спондилодеза
Дана Д. Портенер, Кеки Р. Балсара
Ж. Роберт Стефенсон-мл., Джеффри X. Лаусон, Фредрик Броди
ШШ&1В&
Лапароскопические операции чрезвычайно
изменили общую хирургию. К преимуществам
лапароскопической хирургии относят такой технический фактор,
как улучшение видимости анатомического
образования, и такие человеческие факторы, как уменьшение
интенсивности послеоперационного болевого
синдрома, ранняя выписка из клиники и отсутствие
послеоперационного пареза кишечника. Малоинвазивная
техника распространилась и на операции на пояснично-
крестцовом отделе позвоночника. В этой главе описан
передний лапароскопический доступ к пояснично-
крестцовому отделу позвоночника для дискэктомии
и спондилодеза. Такой доступ к нижнему отделу
позвоночника технически затруднен из-за расположенных
здесь сосудистых, нервных и висцеральных структур.
В соответствии со статистическими данными
Национального института здоровья (National Institutes of
Health), в США ежегодно проводят примерно 400000
операций на пояснично-крестцовом отделе
позвоночника. Для снижения частоты послеоперационных
осложнений и продолжительности госпитализации
было разработано несколько минимально инвазив-
ных операций [1]. К ним относятся
лапароскопический, эндоскопический, чрескожный доступы и мини-
дискэктомия. В этой главе внимание сосредоточено
на переднем лапароскопическом доступе в связи с тем,
что он оказался наиболее распространенным доступом
к пояснично-крестцовому отделу позвоночника,
используемым общими хирургами.
Первое сообщение о патологии межпозвонкового
диска опубликовал Virchow в 1857 г. В 1909 г. Oppenheim
и Krause описали нижний срединный позвоночный
доступ для резекции «эндохондромы». Obenchein провел
в 1991 г. первую частичную дискэктомию посредством
лапароскопического доступа [2, 3]. В настоящее время
передний лапароскопический доступ служит для
множества различных манипуляций на позвоночнике,
включая дискэктомию и спондилодез.
Лапароскопическая и открытая операции имеют сходные летальность
и частоту послеоперационных осложнений. Кроме
того, недавно проведенные ретроспективные обзоры
показали равную эффективность открытого и
минимально инвазивного доступа в руках опытных
хирургов [3].
ПРЕИМУЩЕСТВА ПЕРЕДНЕГО
ЛАПАРОСКОПИЧЕСКОГО ДОСТУПА
Передний лапароскопический доступ к пояснично-
крестцовому отделу позвоночника имеет несколько
особенных преимуществ перед задним доступом,
который, однако, используют чаще. Передний доступ
позволяет избежать рассечения задних мышц или
связок и вскрытия позвоночного канала. Как результат,
при осуществлении переднего доступа реже отмечают
послеоперационный хронический болевой синдром
и эпидуральный фиброз. При данном виде доступа
значительно снижена интенсивность острых
послеоперационных болей и потребность в наркотических
препаратах. Передний лапароскопический доступ
характеризуется, помимо этого, более короткой
продолжительностью госпитализации и скорейшим
восстановлением функции кишечника при проведении
одноуровневого спондилодеза межпозвонкового
пространства \Sl [4].
ОСЛОЖНЕНИЯ ПЕРЕДНЕГО
ЛАПАРОСКОПИЧЕСКОГО ДОСТУПА
Общая частота послеоперационных осложнений
при переднем лапароскопическом доступе
составляет 5%, что сравнимо с открытой операцией.
Частота повреждения крупных сосудов в большинстве
опубликованных серий варьировала от 2,1 до 25%
[5]. Для доступа к межпозвонковому диску Ly-S
Глава 22. Лапароскопический доступ к пояснично-крестцовому отделу позвоночника... 277
необходимо отвести ректосигмоидный отдел
ободочной кишки вправо. Затем нужно отвести общие
подвздошные вены и артерии в латеральном
направлении для полного обнажения межпозвонкового
диска. В опубликованных сериях исследований
наиболее часто повреждалась правая внутренняя
подвздошная вена. Следует также найти и лигировать
срединные крестцовые сосуды или прижечь их с
помощью биполярного коагулятора. Избыточная дис-
секциия над крестцовым мысом может привести
к кровотечению из пресакрального венозного
сплетения. Кроме того, вдоль превертебральной фасции
в продольном направлении лежит
парасимпатическая нервная цепь. Это образование нужно
полностью мобилизовать тупым путем с минимальным
применением коагуляции для того, чтобы избежать
повреждения парасимпатических нервов, которое
может вызвать ретроградную эякуляцию у мужчин.
В проспективном мультицентровом исследовании,
проведенном Regan et al. [6], авторы сравнили
результаты открытого и лапароскопического спонди-
лодеза позвоночника. Было доказано, что
лапароскопический доступ — безопасный и эффективный
способ лечения одноуровневого дегенеративного
заболевания диска по сравнению с открытой
операцией. Вследствие небольшого количества пациентов,
которые подверглись многоуровневым операциям,
определенных заключений сделать нельзя.
Исследователи, кроме того, показали, что частота
осложнений находится в обратной зависимости от опыта
хирурга, и предложили установить длительность
курса обучения в 5-10 операций [6]. Escobar et al. [5]
в своем ретроспективном обзоре сравнили
видеолапароскопический и открытый методы спондилодеза
спинного мозга. Их данные показали, что при
проведении лапароскопии с инсуффляцией отмечалось
повышенное количество сосудистых повреждений,
а нейрогенные проблемы были характерны только
для трансперитонеальной техники с инсуффляцией
[5]. Обзор большинства серий показал, что наиболее
часто встречаются следующие осложнения
переднего лапароскопического доступа: длительный
послеоперационный парез кишечника, ретроградная
эякуляция, тромбоз бедренной вены и
послеоперационная инфекция. Имеется несколько сообщений
о повреждениях крупных сосудов и органов
мочеполовой системы [7].
При некоторых мультиуровневых процедурах
лучше обнажать только один уровень и работать на нем.
Попытка работать на нескольких уровнях сразу может
привести к окклюзии общей подвздошной артерии
или значительному повреждению места слияния
общих подвздошных вен и нижней полой вены.
Наиболее частой причиной повторной операции
после лапароскопического спондилодеза может быть
неадекватная дискэктомия, которая характеризуется
рецидивирующим болевым синдромом или радикуло-
патией и обычно требует задней стабилизации или
открытого доступа. Такая ситуация отмечается
примерно в 10% случаев [8]. Другим недостатком переднего
лапароскопического доступа может послужить тот
факт, что межпозвонковое пространство Ь:-1д,
доступно только слева, в результате чего доступ к некоторым
частям диска затрудняется. Хотя большинство из
опубликованных исследований показывают отличные
клинические результаты в отношении уменьшения
выраженности симптомов, продолжительности
госпитализации и восстановления функции,
рандомизированные контролируемые исследования для
обоснования выбора в пользу лапароскопического доступа пока
проведены не были.
ОТБОР ПАЦИЕНТОВ
Лапароскопическая поясничная дискэктомия
Пациенты, которые подвергаются лапароскопической
поясничной дискэктомии, должны иметь
преимущественно корешковую боль в ноге, которая
сопровождается болью в спине. При физикальном
обследовании у пациента должны быть обнаружены признаки
радикулопатии, к которым относятся положительный
результат теста поднятия прямой ноги, рефлекторная
асимметрия и нарушения чувствительности.
Клинические данные пациента должны коррелировать с
грыжей ипсилатерального диска на соответствующем
уровне позвоночного столба, что лучше всего
определяется при МРТ. Кроме того, попытки
консервативного лечения, включая применение физиотерапии и
нестероидных противовоспалительных средств, должны
быть неудачными.
Лапароскопический спондилодез пояснично-
крестцового отдела позвоночника
Пациенты, отобранные для лапароскопического
спондилодеза, должны иметь в анамнезе боли в нижней
части спины, обычно сопровождающиеся болью в ноге.
Неоперативное лечение, проводившееся как минимум
3 мес, должно быть неудачным. Кроме того, у пациентов
должны иметься данные рентгенографических методов
(обзорной рентгенографии, КТ или МРТ), которые
подтверждают наличие патологии межпозвонкового
пространства. В идеальном случае у пациента не должно
быть лишней массы тела, ему следует пройти
исследование сосудистой анатомии (наиболее важные отделы —
аорта и нижняя полая вена краниальнее
межпозвонкового диска Iy-Sj). Относительное противопоказание —
наличие в анамнезе множества операций на органах
брюшной полости и таза. Такие операции часто
приводят к образованию множества спаек и, возможно, к на-
рушениию анатомии тазовых структур.
278 Лапароскопическая хирургия. Атлас
Выбор доступа
Межпозвонкового пространства Iy-Sj легче всего
достичь с помощью переднего лапароскопического
доступа. К другим доступным хирургу методам
относятся перкутанный, эндоскопический и недавно
введенный в практику открытый мини-доступ [9].
Методика переднего лапароскопического спондилоде-
за довольно стандартизирована и обсуждается ниже.
Однако в последние годы были доказаны
преимущества эндоскопических ретроперитонеальных методов.
В связи с тем что межпозвонкового пространства Ly-Sj
нельзя достичь с помощью ретроперитонеальной
эндоскопической операции, для тех пациентов, которым
требуется спондилодез на многих уровнях пояснично-
крестцового отдела позвоночника, включая Ly-S,
предпочтительным доступом будет передний
лапароскопический. Очень важно, чтобы хирург, который проводит
минимально инвазивную операцию, был хорошо
знаком с техникой операции и анатомией.
ОБОРУДОВАНИЕ И ИНСТРУМЕНТАРИЙ
Наряду со стандартным лапароскопическим
инструментарием для проведения этой операции необходимо
высококачественное видеооборудование,
позволяющее визуализировать мелкие сосуды в
ретроперитонеальной жировой клетчатке. Для адекватной
визуализации межпозвонкового пространства рекомендуют
применять лапароскоп с 45- или 30-градусной оптикой.
Фиксацию грудного и поясничного отделов
позвоночника осуществляют с помощью Z-пластины (Z-plate,
Sofamor-Danek, Memphis, TN) или системы «Bagby And
Kuslich» (ВАК) соответственно [10].
ТЕХНИКА ОПЕРАЦИИ
На рис. 22-1—22-7 представлена техника операции
переднего доступа и спондилодеза поясничного
отдела позвоночника [10]. Техника,
продемонстрированная здесь, — модификация, описанная Sachs
и Schwaitzberg [11].
ПОДГОТОВКА
Наркозный
аппарат ч
Анестезиолог
Первый ассистент
(хирург-лапароскопист)
Второй ассистент
Стойка Мейо-
' Монитор
Операционная сестра
Монитор
Рис. 22-1. Обстановка операционной.
Пациента укладывают на спину
со слегка согнутыми коленями
и бедрами. После общей анестезии
устанавливают назогастральный
зонд и катетер Фолея, кожу пациента
обрабатывают и обкладывают
от мечевидного отростка до лобкового
симфиза, а в латеральном
направлении —до подвздошных
остей. Необходимо использовать
операционный стол, пропускающий
рентгеновские лучи, если
для установки металлоконструкции
на шурупах необходима рентгеновская
С-дуга (из: Sachs и Schwaitzberg [11]).
Глава 22. Лапароскопический доступ к пояснично-крестцовому отделу позвоночника... 279
ОПЕРАЦИЯ
Рис. 22-2. Через периумбиликальный разрез в брюшную
полость устанавливают троакар Хэссона. Далее — инсуффля-
ция брюшной полости углекислым газом до давления 15 мм
рт.ст, после чего операционный стол переводят в
30-градусное положение Тренделенбурга, что способствует смещению
кишечника в краниальном направлении. Два 5-миллиметровых
троакара устанавливают в области средней части пути,
который проходит нижняя эпигастральная артерия между пупком
и лоном. Ретракторы, введенные через эти порты,
используют для отведения кишечника от крестцового мыса. После
идентификации межпозвонковых пространств L^-Ц, и l^-S,
и ретракции сосудов вводят 18-миллиметровый надлобковый
порт параллельно необходимому межпозвонковому
пространству. Перед установкой 18-миллиметрового порта в нужное
межпозвонковое пространство первоначально устанавливают
перкутанный гвоздь Штейнманна (из: Sachs и Schwaitzberg [11 ]).
Гвоздь Штейнманна
Рис. 22-4. Далее диссекцию продолжают в поперечном
направлении вдоль межпозвонкового промежутка l^-S,.
Кольцо очищают в латеральном направлении с помощью
диссектора Kitner для того, чтобы мобилизовать левую подвздошную
вену и правую подвздошную артерию. Гвозди Штейнманна
затем осторожно вставляют в межпозвонковый промежуток
L^-S,, фиксируя таким образом латеральную поверхность
диска, что способствует латеральной тракции этих сосудов
(из: Sachs и Schwaitzberg [11 ]).
Рис. 22-3. Для того чтобы обнажить брюшину, покрывающую
межпозвонковое пространство L^-S,, сигмовидную и слепую
кишку отводят в латеральном направлении. Брюшину на этом
участке осторожно рассекают. Путем тупой диссекции
диссектором Kitner и атравматическими зажимами ткани
забрюшинного пространства раздвигают в продольном
направлении и находят подвздошные и срединные
крестцовые сосуды. Электрокоагуляцию используют точечно
во избежание повреждения парасимпатической цепочки
и подвздошных сосудов. Срединные крестцовые сосуды
клипируют или рассекают биполярным коагулятором
(из: Sachs и Schwaitzberg [11]).
280 Лапароскопическая хирургия. Атлас
Внутренняя пластинка позвонка
Костные трансплантаты
с выемкой между ними
Рис. 22-6. Делают забор костного аутотрансплантата
из подвздошного гребня, а затем придают трансплантату
требуемые размеры. Нужно придать костному
трансплантату трапециевидную форму с отверстием
в центре для проведения одиночного шва через него,
чтобы облегчить манипуляции с ним внутри брюшной
полости. Затем этот участок кости помещают в брюшную
полость и вводят его в межпозвонковый промежуток
с помощью дистрактора, после чего уплотняют получившееся
соединение костной трамбовкой. После введения первого
участка кости дистрактор удаляют и вводят второй
участок кости для заполнения свободного пространства.
Лигатуру, которую использовали для манипулирования
костью, срезают и извлекают из брюшной полости. Наряду
с аллотрансплантатами для спондилодеза применяют
синтетические матрицы, начиненные собственными костными
клетками. Матрицы устанавливают лапароскопически,
а правильность их установки проверяют с помощью
рентгеноскопии. Спондилодез происходит с участием
пересаженных клеток костной ткани (из: Sachs и Schwaitzberg
[11]).
Рис. 22-7. Операционный стол разгибают, гвозди Штейнманна
удаляют. Проверяют надежность гемостаза и сводят края
париетальной брюшины над местом операции. Зашивают
фасцию всех лапароскопических портов диаметром более
5 мм с помощью специального сшивающего инструмента.
После удаления пневмоперитонеума пациента переводят
из положения Тренделенбурга в горизонтальное положение
(из: Sachs и Schwaitzberg [11 ]).
СПИСОК ЛИТЕРАТУРЫ
Cummings R.S., Prodoehl J.A., Hermantin F.U. et al. Percutaneous
laser discectomy using a flexible endoscope: technical
considerations // Proceedings of the Eight Annual Meeting of the
North American Spine Society. — San Diego: North American
Spine Society, 1993.
Taikumar S., Kim D.H., Kam A. C. History of minimally invasive
spine surgery // Neurosurgery. — 2002. — Vol. 51 (Suppl. 2). —
P. 1-13.
Thongtrangan I., Le H., Park J., Kim D.H. Minimally invasive spinal
surgery: a historical perspective // Neurosurg. Focus. — 2004. —
Vol. 16. — P. 1-10.
Lieberman I.H., Willsher PC, Litwin D.E. M. et al. Transperitoneal
laparoscopic exposure for lumbar interbody fusion // Spine. —
2000. — Vol. 25. — P. 509-514.
Escobar E., Transfeldt E., Garvey T. et al. Video-assisted versus
open anterior lumbar spine fusion surgery // Spine. — 2003. —
Vol. 28. — P. 729-732.
Regan J. J., Yuan H., Mc Afee P. Laparoscopic fusion of the lumbar
spine: minimally invasive spine surgery: a prospective multicenter
study evaluating open and laparoscopic lumbar fusion // Spine. —
1999. — Vol. 24. — P. 402-411.
7. Bianchi C, Ballard J.L., Abou-Zamzam A.H. et al. Anterior
retroperitoneal lumbosacral spine exposure: operative technique
and results // Ann. Vase Surg. — 2003. — Vol. 17. — P. 137-142.
8. Mahvi D.M., Zbeblick T.A. A prospective study of laparoscopic
spinal fusion: technique and operative complications // Ann.
Surg. — 1996. — Vol. 224. — P. 85-90.
9. Kaiser M.C., Haid R.W., Subach B.R. et al. Comparison of the mini-
open versus laparoscopic approach for anterior lumbar interbody
fusion: a retrospective review // Neurosurgery. — 2002. —
Vol. 51. — P. 97-105.
10. Kim D.H., Jaikumar S., Kam A.C. Minimally invasive spine
instrumentation // Neurosurgery. — 2002. — Vol. 51 (Suppl. 2). —
P. 15-25.
11. Sachs B.L., Schwaitzberg S.D. Lumbosacral (I^-Sj) discectomy and
interbody fusion technique // Atlas of Endoscopic Spine Surgery. —
St. Louis: Quality Medical Publishing, 1995. — P. 275-291.
Глава 22. Лапароскопический доступ к пояснично-крестцовому отделу позвоночника... 281
Лапароскопические
урологические
операции
В. Купер Бушемейр III, Дэвид М. Албала
гшаша
ЛАПАРОСКОПИЧЕСКАЯ НЕФРЭКТОМИЯ
В 1869 г. Gustav Simon (Гейдельберг, Германия)
сообщил о первой успешной нефрэктомии [1]. Однако
выжили только 2 из первых 10 пациентов, подвергшихся
нефрэктомии. С развитием хирургической техники,
улучшением инструментария, знания анатомии,
применением асептической техники летальность и мор-
бидность открытой почечной хирургии значительно
снизились. Несмотря на успехи современной
хирургии, открытая почечная хирургия часто
сопровождается значительной частотой послеоперационных
осложнений, к которым можно отнести интенсивный
послеоперационный болевой синдром, длительную
госпитализацию и выздоровление, а также обезображивание
тела послеоперационным рубцом. Травматичность
и осложнения, которые характерны для доступа через
мышцы брюшной стенки, побудили многих хирургов
выбрать лапароскопический вариант этой операции.
Первая лапароскопическая нефрэктомия была
проведена dayman et al. [2] в 1990 г. Вклад этих
исследователей в развитие лапароскопической почечной
хирургии был огромным. С тех пор лапароскопическая
нефрэктомия стала стандартным доступом при любой
доброкачественной патологии, требующей
нефрэктомии, и при злокачественных опухолях почек.
Хирургическая анатомия
Почки расположены ретроперитонеально в паравер-
тебральном канале, высоко на задней поверхности
брюшной стенки. Правая почка расположена каудаль-
нее левой, так как над ней находится печень, тем не
менее обе почки лежат преимущественно выше края
реберной дуги. Почки расположены на косой линии,
параллельной поясничной мышце. Сзади от них
находятся квадратная мышца поясницы и диафрагма.
Позади диафрагмы на этом уровне локализуется реберно-
диафрагмальный плевральный синус, нижняя граница
которого достигает середины левой почки, и
повреждение этого синуса во время открытой операции может
привести к пневмотораксу. Сзади от почек на задней
стенке живота проходят подвздошно-гипогастральный
и подвздошно-паховый нервы, а также подреберный
сосудисто-нервный пучок. В норме правый
надпочечник, имеющий пирамидальную форму, и серповидный
левый надпочечник расположены в области верхних
полюсов почек. Слева и латеральнее находится
брюшная полость, медиальнее — сальниковая сумка, а между
этими образованиями проходит селезеночно-почечная
связка. Хвост поджелудочной железы расположен
между воротами левой почки сзади и брюшиной
спереди. Нижний полюс почки отделен от брюшины
селезеночным изгибом ободочной кишки. Правая почка
граничит с печеночно-почечным моррисоновым
карманом, а между воротами правой почки и брюшиной
лежит второй отдел двенадцатиперстной кишки.
Печеночный изгиб ободочной кишки расположен между
нижним полюсом правой почки и брюшиной. Ворота
каждой из почек находятся на расстоянии примерно
5 см от средней линии, приблизительно на уровне I
поясничного позвонка, и повернуты немного кпереди
и медиально. Сзади от верхнего полюса левой почки
лежит XI ребро, а верхний полюс правой почки
находится на уровне XII ребра. Ворота почек
открываются в почечную лоханку, которая расположена кпереди
от почечных сосудов и конусовидно сужается, прежде
чем продолжиться мочеточником.
Паранефральная жировая клетчатка (капсула
Герота) находится снаружи от почечной капсулы и
полностью окружает почку. Жир капсулы Герота покрыт
очень тонким (почти незаметным) слоем ареолярной
ткани, называемой почечной фасцией. В области
ворот этот слой обычно более плотный и
прикрепляется к почечным сосудам и мочеточнику. Мочеточники
проходят в каудальном направлении от почечной ло-
Глава 23. Лапароскопические урологические операции 283
ханки и лежат вдоль кончиков поперечных отростков
позвонков. Левая и правая почечная артерии отходят
от латеральной поверхности аорты под прямым углом.
В воротах они расположены позади почечной вены,
и каждая почечная артерия делится примерно на 5
сегментарных концевых артерий. Сегментарные артерии
не связаны друг с другом анастомозами, поэтому
прекращение кровотока по сегментарной артерии
приведет к инфаркту соответствующего почечного сегмента.
Следует отметить, что сегментарные артерии могут
ответвляться нестандартно, вплоть до прямого отхожде-
ния от аорты.
Каждую почку дренируют сегментарные почечные
вены, которые обычно соединяются медиальнее от
ворот и образуют одну почечную вену. Эта вена впадает
в нижнюю полую вену (НПВ). Слева в почечную вену
впадают гонадная и надпочечниковая вены. В
ветвлении почечных сосудов часто отмечаются значительные
вариации, которые больше характерны для почечных
вен. В результате определенного анатомического
расположения аорты и нижней полой вены правая почка
имеет длинную почечную артерию и короткую
почечную вену. Кроме того, правая почечная артерия лежит
сзади от нижней полой вены, а левая почечная вена
проходит кпереди от аорты. Верхняя брыжеечная
артерия проходит кпереди от левой почечной вены.
Особенности операции и ее техника
В настоящее время показаниями к лапароскопической
нефрэктомии считают следующие доброкачественные
заболевания, требующие удаления почки с лечебной
целью: реноваскулярную гипертензию, хроническую
обструкцию мочевыводящих путей с болями,
хроническую инфекцию, рефрактерную к медикаментозной
терапии, и мультикистозную дисплазию почки. На
сегодняшний день стандартно применяют и
лапароскопическую радикальную нефрэктомию, хотя раньше
к ней относились скептически. Почку удаляют интак-
тно, в одном блоке с лимфатическими узлами и
надпочечником при опухолях верхнего полюса (так же,
как и при открытой операции). Перед извлечением
из тела пациента почку помещают в эндоскопический
контейнер. Это позволяет провести операцию в
соответствии с онкологическими принципами и полной
гистологической оценкой.
Отбор пациентов — важный момент в
лапароскопической почечной хирургии, как и при любой другой
хирургической операции. Первостепенную роль
играют полный сбор анамнеза и физикальное обследование
[3]. Особое внимание необходимо уделять любым
предшествующим операциям на органах брюшной полости,
таза или почках и наличию сопутствующей патологии.
Помимо этого, следует обращать внимание на
наличие в анамнезе абдоминального сепсиса, воспаления
или лучевой терапии, а также сердечной или легочной
патологии, препятствующей безопасному созданию
пневмоперитонеума. При физикальном обследовании
отмечают и документируют наличие
послеоперационных рубцов и грыж. Генерализованный перитонит,
инфекция брюшной стенки и коагулопатия —
абсолютные противопоказания к лапароскопии. Рубцы
от предшествующих операций могут обусловливать
определенные места установки троакаров и устройств
для ручной ассистенции. Лапароскопический хирург
всегда должен помнить, что спайки, образовавшиеся
после предшествующих операций, могут находиться
вдали от кожных разрезов и, таким образом, должен
с осторожностью устанавливать троакары у любого
ранее оперированного пациента. Пациенту тоже
следует это понимать и дать свое согласие на открытую
операцию, если в ней возникнет необходимость.
Пациенту проводят полную подготовку кишечника
с помощью цитрата магния. Его инструктируют о
необходимости прекращения приема любых антитром-
боцитарных препаратов, включая аспирин,
нестероидных противовоспалительных средств и
антикоагулянтов за 7 дней до операции. Проводят лабораторные
исследования, чтобы убедиться в адекватности функций
почек, общего анализа крови и системы свертывания;
определяют группу крови и резус-принадлежность.
Рис. 23-1 (А-В). Устройства для лапароскопической нефрэктомии с ручной ассистенцией.
284 Лапароскопическая хирургия. Атлас
Лапароскопическая нефрэктомия может быть
проведена посредством транс- и ретроперитонеального
доступов. Трансперитонеальный доступ может быть
либо полностью лапароскопическим, либо с
использованием устройства для ручной ассистенции (рис. 23-
1), которое позволяет оперирующему хирургу вводить
руку в брюшную полость с сохранением пневмопе-
ритонеума. Преимущество ретроперитонеального
метода — прямой доступ к почке без необходимости
в отведении таких органов брюшной полости, как
ободочная и тонкая кишка, а также ранний доступ к
воротам почки, когда почечная артерия попадает в поле
зрения и лигируется раньше почечной вены [4].
Однако при забрюшинном доступе рабочее пространство
очень ограничено, а удаленную почку невозможно
поместить в эндоскопический контейнер, не сделав пери-
тонеотомии.
После анестезии пациенту, который уложен на
спину, устанавливают катетер Фолея в мочевой пузырь
и назогастральный зонд. Это делают для того, чтобы
убедиться в декомпрессии всех наполненных
органов брюшной полости и минимизировать риск их
повреждения при введении иглы Вереша или троакара.
Для профилактики тромбоэмболии на ноги надевают
чулки для пневматической компрессии. Затем
пациента укладывают в модифицированное латеральное
положение для трансперитонеального доступа или полное
латеральное положение для ретроперитонеального
доступа (рис. 23-2). Подушка, наполненная пенорезиной,
помогает сохранить правильное положение пациента.
Пациента закрепляют в этом положении с помощью
ленты, защитив прокладками все места, которые
подвержены сдавлению. Затем обрабатывают весь живот
и область фланка от линии сосков до уровня ниже лона
с запасом (ниже подвздошного гребня).
Пневмоперитонеум при трансперитонеальном
доступе создают с помощью иглы Вереша или техники
Хэссона. Затем вводят лапароскоп и осматривают всю
брюшную полость на наличие спаек. Для проведения
нефрэктомии требуются порт для камеры и как
минимум два рабочих порта. Если операция полностью
лапароскопическая, необходимо как минимум три
рабочих порта. При использовании устройства для ручной
ассистенции можно обойтись только двумя портами
для инструментов (рис. 23-3).
Все спайки в операционном поле разделяют
электроножницами. Рассекают брюшину по линии Тольдта
и отводят ободочную кишку в медиальном
направлении (рис. 23-4). Рукой проводят тракцию ободочной
кишки и мобилизацию в слое между мезоколоном
и фасцией Герота. Диссекцию продолжают вдоль
селезеночного или печеночного изгиба до того
момента, пока ободочная кишка не отойдет в медиальном
направлении, обнажая двенадцатиперстную кишку
справа и аорту слева. Справа проводят мобилизацию
по Кохеру (отведение двенадцатиперстной кишки в
медиальном направлении). Необходимо быть
осторожными при мобилизации селезеночного изгиба, чтобы
не разорвать капсулу селезенки, так как здесь часто
имеются фиброзные спайки; важно также не
проводить тракцию за селезенку. На данном этапе диссекции
хирург должен помнить о близости поджелудочной
железы. Справа может оказаться полезной тракция
печени во время диссекции верхнего полюса, которую
проводят рукой или с помощью веерного ретрактора.
После завершения мобилизации ободочной кишки
освобождают верхний полюс почки и ее латеральную
поверхность. Если нефрэктомию проводят по поводу
опухоли почки, фасцию Герота оставляют интактной
и удаляют вместе с почкой. Диссекция верхнего полюса
почки, по всей вероятности, является самым трудным
этапом операции. При этом требуется осторожное
использование диссекции острым путем и электродис-
секции. Далее мобилизуют нижний полюс почки.
После этого находят мочеточник и гонадные
сосуды (рис. 23-5). Мочеточник клипируют и
пересекают. Некоторые хирурги предпочитают находить
и пересекать мочеточник в начале операции, перед
мобилизацией почки, поскольку после этого
мочеточник можно будет использовать для тракции почки.
При необходимости можно клипировать и пересечь
гонадные сосуды. После пересечения мочеточник
мобилизуют в краниальном направлении до лоханочно-
мочеточникового сегмента. Затем мобилизуют
нижний полюс почки и полностью освобождают ее
латеральную поверхность. Далее проводят диссекцию
в воротах почки. Обычно первой находят почечную
вену. Как правило, за веной пальпируется почечная
артерия. Часто у пациента может быть несколько
почечных артерий. С помощью ножниц проводят
диссекцию в воротах почки, чтобы мобилизовать
основные сосуды на адекватном расстоянии. Диссекции
способствует натяжение ворот и ретракция
мочеточника кверху и в латеральном направлении. На этом
этапе удобно полностью мобилизовать заднюю
поверхность почки и повернуть почку кпереди, чтобы
облегчить мобилизацию основных сосудов. Слева
находят надпочечниковую, гонадную и восходящую
поясничную вены. Возможно, для «получения»
почечной вены адекватной длины для наложения степлера
«Endo GIA» (US Surgical, Norwalk, CT) понадобится
пересечение и клипирование этих вен. Справа почечная
вена обычно не имеет притоков.
Почечную артерию клипируют
11-миллиметровыми клипсами, при этом на проксимальную культю
накладывают как минимум три клипсы, а на дисталь-
ную — две. Затем артерию рассекают между
клипсами. На этом этапе вену осматривают, чтобы убедиться
в полном ее коллабировании. Наполнение вены
после пересечения артерии предполагает наличие одной
Глава 23. Лапароскопические урологические операции 285
или более добавочных артерий. Затем вену пересекают
сосудистым степлером, которым накладывают 3 ряда
скобок на каждую из пересеченных сторон. Перед
пересечением важно убедиться, что конец степлера с
запасом заходит за дистальный край вены и на линии
скобок нет наложенных клипс.
После пересечения почечной артерии и вены
остается мобилизовать только медиальную поверхность
почки и верхний полюс рядом с надпочечником (рис. 23-
7). При удалении опухолей, расположенных в средней
или нижней части почки, надпочечник не удаляют.
Необходимость в его удалении возникает только в
случае наличия опухолей верхнего полюса. Верхний
полюс почки мобилизуют с помощью наложения клипс,
электродиссекции или иногда путем
последовательного наложения сосудистого степлера. Теперь почка
полностью мобилизована, и ее укладывают в нижнем
отделе живота.
После этого давление пневмоперитонеума снижают
и внимательно исследуют брюшную полость для
исключения кровотечения из ворот почки, почечного ложа
или мест введения троакаров. Затем препарат
помещают в эндоскопический контейнер и извлекают из
брюшной полости через разрез для ручной ассистенции либо
расширив один из разрезов для установки троакара
(рис. 23-8). Разрезы для троакаров зашивают нерасса-
сывающимися нитями толщиной 0 восьмиобразными
фасциальными швами, стараясь избежать при этом
подхватывания сальника или кишечника. Большой разрез
зашивают последним, используя эти же нити.
Подкожную ткань зашивают рассасывающимися лигатурами
3-0, кожу сводят клейкими полосками.
ПОДГОТОВКА
Рис. 23-2.Укладка пациента для левосторонней
нефрэктомии.
/
А
/'
/"
/
J
\
о
о
ч
4
\
Рис. 23-3.Установка устройства для ручной ассистенции и троакаров. А — левосторонняя нефрэктомия. Б — правосторонняя
нефрэктомия.
286 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Рис. 23-4. Мобилизация ободочной кишки и рассечение
фасции Герота.
Рис. 23-5. Мобилизация мочеточника.
Рис. 23-6. Клипирование почечной артерии.
Рис. 23-7. Ворота почки после лигирования всех сосудов.
Рис. 23-8. Препарат после его извлечения из тела пациента.
Глава 23. Лапароскопические урологические операции 287
ЛАПАРОСКОПИЧЕСКАЯ РЕЗЕКЦИЯ ПОЧКИ
Радикальная нефрэктомия остается стандартом
лечения локализованного почечно-клеточного рака.
Однако все возрастает популярность нефронсохраняющей
хирургии как эффективной альтернативы нефрэкто-
мии у отдельных пациентов с маленькими опухолями
почки (<4см). Эта операция показана также
пациентам с почечной недостаточностью и пациентам с
единственной почкой. Лапароскопическую резекцию почки
проводят во многих центрах, однако она остается
технически сложной процедурой и поэтому не стала
методом повседневной практики. Многие урологи даже
не пытаются делать эту операцию из-за ограниченного
опыта в лапароскопии. Внедрение ручной ассистенции
привело к увеличению числа проводимых
лапароскопических частичных нефрэктомий. Урологи,
обладающие хорошей оперативной техникой и большим
опытом, могут безопасно проводить и полностью
лапароскопическую частичную нефрэктомию.
ЛАПАРОСКОПИЧЕСКАЯ
АДРЕНАЛЭКТОМИЯ
Лапароскопическая адреналэктомия стала стандартом
оперативного лечения большинства опухолей
надпочечников. Впервые лапароскопическую адреналэкто-
мию выполнили Gagner et al. [5] в 1992 г. Надпочечник
(так же, как и почку) можно удалять с использованием
как трансперитонеального, так и ретроперитонеально-
го доступа [6].
Хирургическая анатомия
Хирургическая анатомия, знание которой необходимо
для лапароскопической адреналэктомии, была
описана ранее, в разделе, посвященном лапароскопической
почечной хирургии. Однако имеются некоторые
дополнительные анатомические особенности.
Надпочечник снабжают кровью три надпочечниковые
артерии, отходящие от нижней диафрагмальной артерии
непосредственно от аорты и от почечной артерии.
Эти артерии мелкие и редко вызывают значительное
кровотечение. Их часто лигируют вместе с
окружающей тканью во время диссекции. Центральная вена
правого надпочечника впадает в нижнюю полую
вену. Ее отрыв или неадекватное лигирование во
время диссекции могут привести к сильному
кровотечению. Центральная вена левого надпочечника впадает
в левую почечную вену.
Предоперационная оценка и техника
операции
Показанием к операции в настоящее время служит
наличие гормонопродуцирующих опухолей
надпочечников (альдостероном, феохромоцитом, андроген/эстро-
ген- или глюкокортикоидпродуцирующих аденом),
симптоматических кист надпочечников и миолипом.
Двусторонняя лапароскопическая адреналэктомия
может быть проведена при двусторонней гиперплазии
надпочечников при синдроме или болезни Кушинга.
Не рекомендуется выполнение лапароскопической
резекции крупных злокачественных опухолей
надпочечников, например при адренокортикальном раке.
Надпочечник не имеет истинной капсулы, что в
значительной мере повышает риск местной инвазии. Многие
хирурги предпочитают открытый доступ при заведомо
известном диагнозе злокачественной опухоли
надпочечника и более крупных образованиях (>8-10см).
Несмотря на эти рекомендации, имеется множество
сообщений о полном и эффективном лапароскопическом
удалении злокачественных опухолей надпочечников.
Сообщается о случаях проведения лапароскопической
адреналэктомии по поводу метастазов в надпочечник
[7].
Авторы не задавались целью полностью и поэтапно
описать оценку пациента с образованием
надпочечника. Каждому пациенту необходимо провести
диагностику всех патологических образований с помощью
радиологических методов и полную метаболическую
диагностику. Пациенты с подозрением на
злокачественную опухоль нуждаются в проведении поиска
бессимптомных метастазов. Полная
эндокринологическая оценка заключается в исследовании показателей
сывороточных электролитов, концентрации гормонов
сыворотки, катехоламинов, исследовании мочи на
наличие катехоламинов и их метаболитов. Перед
операцией необходимо сделать свежий анализ электролитов
сыворотки, чтобы не пропустить возможные
значительные электролитные расстройства.
Транс- и ретроперитонеальный доступы для
адреналэктомии много обсуждали в различных
исследованиях. Большинство хирургов понимают, что хотя
ретроперитонеальный доступ имеет ограниченное
рабочее пространство, его преимущество в том,
что позволяет избежать риска попадания в брюшную
полость. Кроме того, ретроперитонеальный доступ
позволяет быстро выполнить мобилизацию и
лигирование надпочечниковой вены (особенно слева).
Это крайне необходимо при феохромоцитомах и
злокачественных опухолях.
Пациента укладывают на бок (45-60°) стороной
поражения кверху с поддержкой в виде подушки,
наполненной пенорезиной, и защитным подмышечным
валиком. Операционный стол обычно не сгибают.
Подушка с пенорезиной позволяет стабилизировать
положение пациента и способствует фиксации шелковой
ленты, которой закрепляют пациента, так как имеет
для этого специальные крепления; места контакта
ленты с кожей защищают полотенцами. Ногу,
находящуюся снизу, необходимо согнуть в бедре и колене,
верхнюю ногу оставляют выпрямленной. Все места,
288 Лапароскопическая хирургия. Атлас
которые подвергаются сдавлению, включая обе ноги
и подмышечную область, защищают прокладками.
Руку, расположенную сверху, поддерживают
подушкой или специальной подставкой, прикрепленной
к операционному столу снизу. Это положение
должно быть очень знакомым большинству урологов, так
как оно совпадает с положением для фланкового
доступа при удалении почки или реконструктивных
операциях на почке. На нижние конечности
необходимо надеть чулки для пневматической компрессии,
чтобы снизить венозный стаз и риск тромбоэмболии.
Затем обрабатывают и обкладывают живот пациента
по стандартной методике.
Хирург стоит лицом к животу пациента, а первый
ассистент — лицом к спине пациента. Ассистент с
камерой и операционная сестра стоят на стороне
хирурга. Хирург обычно работает атравматическим зажимом
в недоминантной руке и рабочим инструментом в
доминантной. Для создания пневмоперитонеума можно
использовать иглу Вереша или открытую технику Хэс-
сона в зависимости от предпочтений хирурга. Нужно
соблюдать осторожность, чтобы избежать
повреждения селезенки при введении иглы Вереша в подреберье
вдоль передней подмышечной линии. Брюшную
полость перед введением троакаров раздувают до
давления 20 мм рт.ст.
Места установки троакаров могут различаться в
зависимости от предпочтений хирурга (рис. 29-9,29-10).
Необходимо принимать в расчет размер образования,
его локализацию и форму тела пациента. Для
проведения этой операции обычно используют четыре
троакара. Троакары устанавливают под краем реберной дуги
на стороне поражения. Два 10-12-миллиметровых
троакара используют в качестве центральных, что
позволяет хирургу менять лапароскоп на большой клипатор
и в любой позиции получать наиболее благоприятный
для работы угол. Обычно используют два
5-миллиметровых троакара на любой стороне от линии для
введения ретрактора и зажима. Центральные троакары
располагают на переднеподмышечной и на срединно-
ключичной линии. Внешние троакары устанавливают
по средней и заднеподмышечной линии. Все троакары,
за исключением первого, необходимо устанавливать
под непосредственным визуальным контролем. Затем
давление пневмоперитонеума снижают и
поддерживают на уровне 15 мм рт.ст. в течение всей операции.
Глава 23. Лапароскопические урологические операции 289
ПОДГОТОВКА
Рис. 23-9. Установка троакаров
для трансперитонеальнои операции.
Рис. 23-10. Установка троакаров
для ретроперитонеальнои операции.
290 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Селезенка
-"-"тЗйяй
/
/ )
щ
, Селезеночно-ободочные связки
^^ Надпочечник
■jk Левая почка
^Г
Рис. 23-11. Разрез на задней поверхности брюшины.
Рис. 23-12. Диссекция селезеночно-ободочной
и селезеночно-почечной связок.
Рис. 23-13. Клипирование правой надпочечниковои вены.
Рис. 23-14. Ретроперитонеальный доступ.
Глава 23. Лапароскопические урологические операции 291
ПРАВОСТОРОННЯЯ
ТРАНСПЕРИТОНЕАЛЬНАЯ
АДРЕНАЛЭКТОМИЯ
После адекватной инсуффляции с помощью иглы
Вереша во всех отделах живота перкуторно должен
определяться тимпанит. Необходимо быть
осторожными при латеральной инсуффляции, избегая
попадания иглы в печень или селезенку. В начале
операции брюшную полость внимательно осматривают
и рассекают все спайки, вызывающие помехи. Доступ
к правому надпочечнику зависит от адекватности
мобилизации печени. Треугольные связки печени
рассекают и печень осторожно отводят в
краниальном направлении. Заднюю поверхность брюшины
рассекают вблизи края печени, от линии Тольдта,
в латеральном направлении и до нижней полой вены
в медиальном направлении с помощью
электроножниц (рис. 23-11). Обычно мобилизуют нисходящую
ободочную кишку и печеночный изгиб, после чего
рассекают фасцию Герота.
Далее находят верхний полюс почки и проводят
диссекцию в паранефральной жировой клетчатке
выше полюса, вблизи нижней полой вены, обнажая
при этом надпочечник. Мобилизуют верхнюю и
переднюю поверхности надпочечника (рис. 23-12).
Мелкие кровеносные сосуды контролируют с помощью
электрокоагуляции и лапароскопических клипс. Дис-
секция вдоль латеральной поверхности нижней полой
вены позволяет идентифицировать центральную вену
правого надпочечника. Необходимо отметить, что
диссекцию следует проводить очень осторожно, чтобы
избежать разрыва вены. После выделения
центральную вену клипируют как минимум двумя клипсами
на стороне полой вены и одной или двумя клипсами
на стороне надпочечника (рис. 23-13). Затем
центральную вену пересекают между клипсами. Мобилизуют
нижнюю и латеральную поверхности надпочечника.
Диссекцию надпочечника облегчает использование
Harmoic scalpel («Ethicon Endo-Surgery», Cincinnati, ОН).
Надпочечник полностью мобилизуют от окружающих
тканей. Препарат помещают в эндоскопический
контейнер перед его удалением через один из разрезов
для 10-12-миллиметрового троакара. Затем давление
в брюшной полости снижают до 5 мм рт.ст. и
операционное поле внимательно осматривают на наличие
возможного кровотечения перед тем, как зашить
отверстия для троакаров. На отверстия для
10-12-миллиметровых троакаров необходимо наложить апонев-
ротические швы (рассасывающимися лигатурами 2-0).
Такое сшивающее устройство, как «Puncture Closure
Device» (ConMed Corp., Utica, NY), позволяет избежать
трудностей при сшивании апоневроза, которое часто
проводят вслепую. Кожу сопоставляют с помощью
подкожных швов рассасывающейся лигатурой 4-0.
ЛЕВОСТОРОННЯЯ
ТРАНСПЕРИТОНЕАЛЬНАЯ
АДРЕНАЛЭКТОМИЯ
При левосторонней адреналэктомии пациента
укладывают в левое латеральное положение. Троакары
устанавливают, как было описано выше, и
осматривают брюшную полость с применением 30-градусного
лапароскопа. С помощью эндоскопических ножниц
или ультразвукового скальпеля делают разрез
брюшины в области селезеночного изгиба по линии Тольдта.
Диссекцию продолжают в краниальном направлении,
чтобы мобилизовать селезенку до уровня дна
желудка. Верхний полюс почки обнажают, рассекая задне-
латеральную часть селезеночно-почечной связки
по направлению к диафрагме. Затем проводят
мобилизацию в слое между фасцией Герота и хвостом
поджелудочной железы. Селезенку отводят кверху и
медиально для обнажения надпочечника в забрюшинном
пространстве. Этот прием позволяет обнажить
надпочечник и начать диссекцию в правильном слое.
Первой мобилизуют верхнюю часть надпочечника, затем
диссекцию продолжают в медиальном направлении.
Диссекцию нижнего полюса железы выполняют в
последнюю очередь, так как если начать с нижнего
полюса, то в результате тракции железы кверху можно
получить ненужное кровотечение. Мелкие нижние диа-
фрагмальные сосуды клипируют после мобилизации
верхнего полюса надпочечника. Медиальнее можно
обнаружить центральную вену в месте ее слияния с
левой почечной полой веной. Левую надпочечниковую
вену мобилизуют и клипируют как минимум двумя
клипсами с медиальной стороны. Затем вену
пересекают между клипсами. Далее диссекцию продолжают
вдоль нижней поверхности железы. Мелкие сосуды ли-
гируют и пересекают. Диссекция латеральной и задней
поверхностей полностью освобождает железу.
Надпочечник извлекают в эндоскопическом контейнере через
самый нижний из разрезов для введения троакара,
минимально раздвинув косые мышцы с помощью зажима
Келли. Операционное поле осматривают при давлении
пневмоперитонеума 5 мм рт.ст., чтобы убедиться в
отсутствии активного кровотечения. Разрезы для
троакаров зашивают, как это было описано выше.
РЕТРОПЕРИТОНЕАЛЬНАЯ
АДРЕНАЛЭКТОМИЯ
Ретроперитонеальную адреналэктомию можно
провести с помощью латерального фланкового доступа [8,
9] или заднего поясничного доступа (рис. 23-14) [10].
Латеральный фланковый доступ позволяет получить
большее рабочее пространство, но при его
использовании в случае крупных опухолей может затруднять
визуализацию надпочечниковых сосудов. Задний
поясничный доступ позволяет получить прямой доступ
292 Лапароскопическая хирургия. Атлас
к основным надпочечниковым сосудам до начала
манипуляций с надпочечником. Ретроперитонеальный
доступ можно использовать у пациентов с ожирением
и пациентов с абдоминальными операциями в
анамнезе. Однако рабочее пространство при этом доступе
меньше, чем при трансперитонеальном, что обычно
требует более длительного курса обучения.
При более распространенном латеральном
доступе пациента укладывают в полное латеральное
положение (90°) и фиксируют по стандартной методике.
Хирург стоит лицом к спине пациента, ассистент —
на противоположной стороне. Сначала делают
маленький разрез длиной 2 см по срединно-ключичной
линии, сразу же над подвздошным гребнем. Разрез
углубляют до забрюшинного пространства. С
помощью пальцевой диссекции мобилизуют заднее пара-
нефральное пространство. Затем вводят в полученное
пространство стандартный баллонный дилататор.
Баллон раздувают для получения адекватного
рабочего пространства. Паранефральное пространство
находится снаружи фасции Герота. Вводят
10-12-миллиметровый троакар и раздувают параренальное
пространство с помощью инсуффляции углекислого газа
до давления 15 мм рт.ст. Затем вводят лапароскоп и
последующие троакары устанавливают под визуальным
контролем. 10-12-миллиметровый троакар
устанавливают сразу же ниже края реберной дуги по задней
подмышечной линии. С помощью диссекции тупым
путем брюшину отводят в медиальном направлении.
10-12-миллиметровый троакар вводят по передней
подмышечной линии ниже края реберной дуги. Если
необходимо, вводят дополнительный
5-миллиметровый троакар для ретракции над подвздошным гребнем
вдоль передней подмышечной линии.
Фасцию Герота широко вскрывают в краниально-
каудальном направлении. При этом следует быть
осторожными, чтобы случайно не повредить брюшину.
Не нужно сразу входить в паранефральную жировую
клетчатку в поисках надпочечника, так как это может
привести к кровотечению, затрудняющему осмотр. Па-
раренальную жировую клетчатку мобилизуют от
прилежащих структур, к которым относятся диафрагма
(сверху), поясничная мышца (сзади) и поджелудочная
железа (медиально слева) или печень (медиально
справа). В некоторых случаях в идентификации
надпочечника может помочь ультразвуковой датчик.
Далее выполняют диссекцию паранефральной
жировой клетчатки для выявления слоя между верхним
полюсом почки и надпочечником. Надпочечник
осторожно подтягивают кверху, а почку отводят книзу.
Мелкие сосуды коагулируют или клипируют. Затем
обнажают центральную вену надпочечника и нижнюю
полую вену. Центральную вену мобилизуют,
клипируют, а затем пересекают. Необходимо с большой
осторожностью проводить латеральную тракцию
надпочечника, чтобы избежать разрыва центральной вены
надпочечника и нижней полой вены справа.
Остальную часть надпочечника освобождают от окружающих
структур. Препарат удаляют с помощью
эндоскопического контейнера через самый широкий из разрезов.
Давление инсуффляции снижают до 5 мм рт.ст. и перед
удалением троакаров осматривают операционное поле
на адекватность гемостаза. Разрезы зашивают
рассасывающимися лигатурами.
ЛАПАРОСКОПИЧЕСКАЯ ПРОСТАТЭКТОМИЯ
На сегодняшний день радикальная простатэктомия —
несомненно, наиболее эффективный метод лечения
локализованного рака простаты. Усовершенствование
и развитие этой операции Walsh et al. [11], снижение
смертности и частоты послеоперационных
осложнений наряду с открытием простатспецифического
антигена и ранней диагностикой привели к
значительному повышению требований к ней. Первое сообщение
о проведении лапароскопической радикальной про-
статэктомии датируется 1992 г. [12]. Однако операция
не приобрела широкого признания до появления
роботизированного доступа. В настоящее время в связи
с широкой доступностью роботизированной
технологии популярность лапароскопической радикальной
простатэктомиии возрастает. Вопрос, превосходит ли
лапароскопическая операция открытую позадилон-
ную простатэктомию, которая служит в настоящее
время «золотым стандартом», все еще остается
спорным. Однако большинство урологов согласны с тем,
что эта операция по меньшей мере сравнима с
открытой по показателям летальности, частоты осложнений
и онкологической эффективности.
Хирургическая анатомия
Простата — тазовый орган, в норме имеющий размеры
2x3x4 см и массу примерно 20 г. Простата расположена
каудальнее мочевого пузыря и краниальнее
мочеполовой диафрагмы. Через предстательную железу
проходит уретра, которая является продолжением шейки
мочевого пузыря. Простата имеет широкое основание
(головной конец), которое сливается с шейкой
мочевого пузыря, и узкую верхушку (каудальный конец), через
который простатическая уретра выходит из простаты
и становится мембранозной уретрой при
прохождении через мочеполовую диафрагму. Мембранозная
уретра на этом уровне окружена поперечно-полосатым
сфинктером и подвержена повреждению во время
операции. Простата расположена ниже лонных костей
и прикреплена к ним лоно-простатическими
связками, отходящими от передней поверхности простаты,
рядом с верхушкой. Наиболее важная структура,
расположенная кпереди от простаты, — дорсальный
венозный комплекс, который служит продолжением
глубокой дорсальной вены полового члена. Это образова-
Глава 23. Лапароскопические урологические операции 293
ние получает множественные венозные притоки
кпереди от предстательной железы в области ее верхушки.
Внутритазовая фасция, покрывающая мышцу,
поднимающую задний проход (т. levator ani), прикреплена
к переднелатеральной поверхности простаты, а между
ней и простатой находятся латеральные притоки
дорсального венозного комплекса. Латеральные
поверхности ограничены лоно-копчиковой мышцей, частью
т. levator ani. Сзади и латеральнее от простаты
находится париетальная тазовая фасция, которая содержит
сосудисто-нервный пучок. Для сохранения
кавернозных нервов во время нервсохраняющей операции
париетальную тазовую фасцию необходимо рассекать
кпереди от сосудисто-нервного пучка и латеральнее
от простаты. Задняя поверхность простаты отделена
от прямой кишки фасцией Денонвилье. Общепринято
мнение, что простата имеет тонкую (0,5 см) капсулу.
Однако эта капсула обычно неполная и не
определяется в области шейки мочевого пузыря или
верхушки. Простату снабжают кровью простатическая ветвь
нижней пузырной артерии и обычно маленькие ветви,
отходящие от внутренней половой и средней
ректальной артерий. Венозная кровь оттекает в дорсальный
венозный комплекс, который дренируется во
внутренние подвздошные вены.
Лимфатический отток первично идет во
внутренние подвздошные узлы, некоторая часть лимфы
попадает в наружные подвздошные лимфатические узлы.
Подготовка к операции и ее техника
Необходимо провести полный сбор анамнеза и фи-
зикальное обследование. Во время физикального
обследования фиксируют наличие
послеоперационных рубцов и грыж. Абсолютные противопоказания
к лапароскопической операции: распространенный
перитонит, инфекция брюшной стенки в анамнезе
и коагулопатия. Наличие послеоперационных рубцов
может диктовать положение мест установки
троакаров. Особенно важно отметить, что у пациентов
после паховой герниорафии может быть повышен риск
возникновения осложнений в связи с наличием сетки
в диссекционном слое.
Пациент должен быть предупрежден о возможной
необходимости открытой операции и дать на это
согласие. Как и при других лапароскопических операциях,
описанных ранее, необходима полная подготовка
кишечника с помощью цитрата магния и антибиотиков.
Определяют группу крови и резус-принадлежность.
В настоящее время наиболее распространена
лапароскопическая простатэктомия с использованием
робота, и ниже описана именно такая операция.
Лапароскопическую простатэктомию без
применения робота проводят, по существу, аналогичным
образом, исключая установку роботизированных
троакаров и стыковку с ними робота.
После анестезии пациенту, лежащему на
спине, в мочевой пузырь устанавливают катетер Фолея
с 30-миллилитровым баллоном. Катетер с
заполненным до 30 мл баллоном можно использовать для трак-
ции во время операции. Затем вводят назогастральный
зонд, чтобы гарантировать надежную декомпрессию
органов брюшной полости и свести к минимуму риск
их повреждения при введении иглы Вереша или
троакаров. На ноги надевают чулки для пневматической
компрессии в целях профилактики тромбоэмболии.
Затем ноги пациента укладывают на подставки в
дорсальное литотомическое положение. Пациента
фиксируют в этом положении, защищая подкладками все
места, подвергающиеся сдавлению. Затем стол
нагибают в высокое положение Тренделенбурга, проводят
обработку и обкладку операционного поля.
На этом этапе устанавливают и фиксируют
ректальный буж. Затем делают 12-миллиметровый разрез
кожи на 2 см выше и слева от пупка. С помощью иглы
Вереша или техники Хэссона создают пневмоперито-
неум с давлением 20 мм рт.ст. После этого
устанавливают 12-миллиметровый троакар для камеры.
Брюшную полость осматривают с помощью введенной в нее
камеры, чтобы обнаружить спайки или анатомические
аномалии. Остальные троакары вводят под
визуальным контролем (рис. 23-15).
Справа и слева от порта для камеры устанавливают
два 8-миллиметровых роботизированных троакара.
Пятимиллиметровый троакар располагают сразу же
медиальнее и выше передней верхней подвздошной
ости. Сразу же медиальнее и выше передней верхней
подвздошной ости справа устанавливают
12-миллиметровый троакар. Второй 5-миллиметровый порт
располагают справа от порта для камеры по срединно-
ключичной линии. После введения всех троакаров
мочевой пузырь наполняют до 200 мл 0,9% раствором
натрия хлорида через катетер Фолея, а соединительную
трубку, идущую от катетера, пережимают. Затем
проводят стыковку троакаров с роботом.
В процессе стыковки ассистент крепит к роботу крюч-
ковидный электрод и зажим, которые вводит в брюшную
полость через роботизированные порты. Хирург
начинает диссекцию, сидя за консолью. Проводят диссекцию
мочевого пузыря от передней брюшной стенки до
внутренних паховых колец с обеих сторон (рис. 23-16).
Находят и пересекают оба семявыносящих протока, чтобы
улучшить обзор. Диссекцию продолжают книзу до
внутренней поверхности лонной дуги, а в каудальном
направлении — до внутритазовой фасции. На этом этапе
ассистент должен опорожнить мочевой пузырь, сняв
зажим с катетера Фолея. Для ретракции и улучшения
обзора ассистент может ввести 5-миллиметровый зажим
через левый 5-миллиметровый порт.
Затем хирург рассекает внутритазовую фасцию
сначала справа, а затем слева. Диссекцию проводят
294 Лапароскопическая хирургия. Атлас
в бессосудистом слое между простатой и латеральной
стенкой таза. После этого удаляют жировую клетчатку
с передней поверхности простаты.
На этом этапе на дорсальный венозный комплекс
накладывают М-образный шов нитью Викрил О
(«Ethicon», Somerville, NJ) на игле СТ 1 (рис. 23-17),
шов затягивают. Затем с помощью электрокоагулятора
рассекают переднюю поверхность шейки мочевого
пузыря (рис. 23-18). После вскрытия просвета мочевого
пузыря катетер Фолея из него удаляют, и тракция
ассистентом кпереди позволяет визуализировать заднюю
поверхность шейки мочевого пузыря. Далее
пересекают заднюю поверхность шейки и продолжают диссек-
цию книзу, до семявыносящих протоков с двух сторон.
Затем семявыносящие протоки пересекают. Семенные
пузырьки полностью мобилизуют, оставляя их
прикрепленными только к простате (рис. 23-19). Этого легче
достичь, используя электродиссекционный крючок
и диссекцию тупым путем. Затем диссекцию
продолжают книзу, до фасции Денонвилье. Фасцию Денонви-
лье рассекают после того, как подвигают ее ректальным
бужом и убедятся, что в области диссекции нет прямой
кишки (рис. 23-20). Далее мобилизуют заднюю
поверхность простаты от прямой кишки.
На этом этапе операции к роботу стыкуют
биполярный зажим и ножницы. Проводят диссекцию
сосудисто-нервного пучка от предстательной железы
острым путем с минимальным использованием
исключительно биполярной коагуляции (рис. 23-21).
Для выполнения гемостаза применяют клипсы,
которые позволяют полностью мобилизовать обе
латеральные поверхности простаты. Мобилизацию
продолжают в каудальном направлении, к верхушке простаты,
завершая заднюю диссекцию.
Затем ассистент отводит мочевой пузырь с помощью
атравматического зажима, используя откос для
экспозиции зоны диссекции, после чего он же отводит
простату кпереди, чтобы убедиться в отсутствии связей
простаты с окружающими тканями по задней
поверхности.
Далее хирург острым путем пересекает
дорсальный венозный комплекс ближе к передней уретре
(рис. 23-22). При пересечении уретры стараются
сохранить максимально возможную ее длину. Ассистент
подтягивает катетер с помощью зажима, что позволяет
визуализировать заднюю уретру. Затем заднюю уретру
пересекают. Пересекают ректоуретральную мышцу,
что должно полностью освободить заднюю
поверхность простаты. Ассистент вводит в брюшную полость
эндоскопический контейнер, в который хирург
помещает удаленную простату.
Теперь можно выполнить диссекцию тазовых
лимфатических узлов. Первоначально находят наружную
подвздошную вену и пакет лимфатических узлов,
который находится кнутри от вены, в запирательном
отверстии. Необходимо быть внимательными, чтобы
не повредить запирательный нерв. Пакет лимфоузлов
удаляют и посылают в лабораторию для нарезки и
гистологического исследования.
Для того чтобы начать уретральный анастомоз,
связывают вместе две 6-дюймовые нити Монокрил 2-0
(«Ethicon», Sommerville, NJ) (рис. 23-23). Анастомоз
накладывают с помощью непрерывного шва с нахлестом
поперек задней поверхности шейки мочевого пузыря,
начиная с 3-часовой позиции «снаружи внутрь» на
мочевом пузыре и «изнутри наружу» на уретре,
обычно до 9-часовой позиции. Снаружи шов
накладывают «снаружи внутрь» на уретру и «изнутри наружу»
на мочевой пузырь, он проходит по всей передней
поверхности шейки мочевого пузыря.
Затем ассистент под визуальным контролем
устанавливает в мочевой пузырь катетер Фолея и
наполняет баллон 20 мл стерильной воды. После этого катетер
промывают, чтобы подтвердить его внутрипузырное
положение. Далее хирург связывает друг с другом две
вышеуказанные лигатуры достаточно сильно, чтобы
получить водонепроницаемый анастомоз. Для
подтверждения внутрипузырного положения катетера
Фолея мочевой пузырь наполняют снова.
После снижения давления инсуффляции до 5 мм
рт.ст. проводят повторный осмотр операционного
поля. Через 5-миллиметровый троакар вводят дренаж
Джексона-Пратта диаметром 7F, который укладывают
поперек анастомоза. Простату удаляют из брюшной
полости в контейнере через отверстие для троакара.
Затем проводят расстыковку робота и убирают его
от операционного стола.
Дефект брюшной стенки, через который
удаляли препарат, зашивают фасциальными лигатурами
Викрил 0 на игле UR 6. Все троакары нужно удалять
под визуальным контролем, осматривая отверстия
в брюшной стенке на наличие возможного
кровотечения. Все места троакаров размером более 5 мм
зашивают лигатурой Викрил 0. Если
5-миллиметровые троакары устанавливают с помощью осевой ди-
латации и фасциальных дефектов не обнаруживают,
фасциальные швы на такие раны не накладывают.
Далее дренаж Джексона-Пратта крепят к коже
живота шелковой лигатурой 2-0. Кожу зашивают
рассасывающейся лигатурой 4-0. При желании можно
использовать кожный клей, после чего накладывают
повязку.
Глава 23. Лапароскопические урологические операции 295
ОПЕРАЦИЯ
Рис. 23-15. Установка троакаров: порт для камеры (черный),
роботизированные порты (синие), 5-10-миллиметровые
порты для рабочих инструментов (красные)
и 5-миллиметровый порт для наконечника отсоса (зеленый).
^Передняя
/ \/Л бРюшная
/ * стенка
JrM х
//' \
i \
1 . Мочевой пузырь . х
/ 1
»
Рис. 23-1 б. А, Б — мобилизация мочевого пузыря.
296 Лапароскопическая хирургия. Атлас
Сосудисто-нервный
пучок
/
Дорсальный ^-^
венозный комплекс
А
.^(ЙвйРч^
^
\
^^^^^^|
.^гДИ^]^^—
1
" Простата \ \
■ W
Рис. 23-17. А, Б — лигирование дорсального венозного комплекса.
Рис. 23-18. Диссекция шейки мочевого пузыря.
Рис. 23-19. А, Б — диссекция семенного пузырька.
Глава 23. Лапароскопические урологические операции 297
Простата -
Ножка простаты
Мочевой
пузырь
Ножка простаты
Рис. 23-20. А, Б — рассечение фасции Денонвилье.
Рис. 23-21. Сохранение сосудисто-нервных пучков.
Рис. 23-22. А, Б — апикальная диссекция.
298 Лапароскопическая хирургия. Атлас
Рис. 23-23. А, Б — уретровезикальный анастомоз.
СПИСОК ЛИТЕРАТУРЫ
1. Moll E, Karenberg A. Gustav Simon (1824-1877) and the
development of nephrectomy: the surgeon and his intention //
J. Med. Biogr. — 2000. — Vol. 8. — P. 140-145.
2. Clayman R.V, Kavoussi L.R., Soper N.J. et al. Laparoscopic
nephrectomy: initial case report // J. Urol. — 1991. — Vol. 146. —
P. 278-282.
3. Albala D.M. Laparoscopic nephrectomy and adrenalectomy //
Semin. Surg. Oncol. — 1994. — Vol. 10. — P. 417-421.
4. Kerbl K., Figenshau R.S., Clayman R.V. et al. Retroperitoneal
laparoscopic nephrectomy: laboratory and clinical experience //
J. Endourol. — 1993. — Vol. 7. — P. 23-26.
5. Gagner M., Lacroix A., Bolte E. Laparoscopic adrenalectomy in
Cushing's syndrome and pheochromocytoma // N. Engl. J. Med. —
1992. — Vol. 327. — P. 1033.
6. Gill I.S., Clayman R.V, Albala D.M. et al. Retroperitoneal and
pelvic extraperitoneal laparoscopy: an international perspective //
Urology. — 1998. — Vol. 52. — P. 566-571.
7. Heniford B.T., Area M.J., Walsh R.M. et al. Laparoscopic
adrenalectomy for cancer // Semin. Surg. Oncol. — 1999. —
Vol. 16. — P. 293-306.
8. Suzuki K. Laparoscopic adrenalectomy: retroperitoneal approach //
Urol. Clin. North Am. — 2001. — Vol. 28. — P. 85-95.
9. Sung G.T., Hsu Т.Н., Gill I.S. Retroperitoneoscopic adrenalectomy:
lateral approach // J. Endourol. — 2001. — Vol. 15. — P. 505-511.
10. Baba S., Iwamura M. Retroperitoneal laparoscopic adrenalectomy //
Biomed. Pharmacother. — 2002. — Vol. 56 (Suppl. 1). — P. 113-
119.
11. Walsh PC, Lepor H., Eggleston J.C. Radical prostatectomy with
preservation of sexual function: anatomical and pathological
considerations // Prostate. — 1983. — Vol. 4. — P. 473-485.
12. Schuessler WW, Schulam P.G., Clayman R.V. et al. Laparoscopic
radical prostatectomy: initial short-term experience // Urology. —
1997. — Vol. 50. — P. 854-857.
Глава 23. Лапароскопические урологические операции 299
/ ' ' ,,И-,1п,,,М,,»,.,М1.пПтп,1,1,,,,,,,,-
Лапароскопия
у беременных
Себастиан Ж. де па Фуенте, Гек:
Джошуа Е. Роллер
i
В течение последних 10 лет весьма распространилось
применение лапароскопии при неакушерской
патологии во время беременности как с диагностической,
так и с терапевтической целью. Примерно 2% женщин
на разных стадиях беременности [1] потребуется
проведение какого-либо хирургического вмешательства,
что выливается в 80000 операций, проводимых
ежегодно в США у беременных [2]. Этот факт объясняется
тем, что частота неакушерской патологии у женщин
детородного возраста во время беременности не
снижается. Наиболее распространенными неакушерскими
заболеваниями, требующими хирургического
вмешательства, считаются аппендицит (4000:12 000; 0,1-0,3%
[3]), холецистит (2000:4000; 0,05-0,1% [4]) и
тонкокишечная непроходимость [5].
У беременных, как и у других пациенток, эти
заболевания проявляются прогрессирующими болями в
животе, тошнотой и рвотой. Однако точная диагностика
желудочно-кишечных заболеваний у беременных
иногда бывает нелегкой, поскольку достаточно сложно
отделить физиологические симптомы, сопровождающие
нормальную беременность, от тошноты, рвоты и
диффузной боли в животе как симптомов, вызванных
патологией. Диагностика также затруднена из-за
анатомических изменений, вызванных смещением
органов растущей маткой и необходимостью ограничить
объем рентгенологических исследований (рис. 24-1).
Как и при других причинах острой боли в животе,
задержка в диагностике может привести к повышению
летальности и частоты послеоперационных
осложнений у матери и плода. И наоборот, неправильный
диагноз может подвергнуть плод повышенному риску
вследствие осложнений медикаментозной терапии
и манипуляций с маткой при диагностической
операции. Частота ошибочной диагностики и напрасно
проведенных аппендэктомий у беременных достигает 50%
[6, 7]. Этим объясняется желание свести к минимуму
1
ж. Лакасси,
*
стресс для матери и плода, связанный с хирургическим
вмешательством, и сделать вмешательство настолько
малоинвазивным, насколько это возможно.
Учитывая такую предпосылку, диагностическая и лечебная
лапароскопия — перспективный метод для лечения
беременных с абдоминальной патологией, требующей
хирургического вмешательства. Опытные хирурги
показали, что в случае правильного предоперационного
планирования и умелой хирургической техники
лапароскопические операции можно безопасно выполнять
беременным без повышения риска для матери или
плода [8, 9].
Хотя преимущества лапароскопической хирургии
четко установлены у небеременных, точные данные
об эффектах лапароскопической хирургии для
женщины во время беременности и плода отсутствуют. К
преимуществам лапароскопии во время беременности
относятся: снижение интенсивности послеоперационной
боли, более короткий период выздоровления и более
Рис. 24-1. Высота стояния дна матки в зависимости от возраста
гестации (в неделях).
Глава 24. Лапароскопия у беременных 301
кратковременное действие наркотических
препаратов на организм плода [10]. Однако эти преимущества
еще предстоит подтвердить данными крупных
рандомизированных исследований. Несмотря на это,
исследования на животных, а также эпидемиологические
исследования не показали различий в исходах у беременных,
подвергшихся лапароскопии, в сравнении с другими
хирургическими операциями [1]. Например, исходы
у пациенток с нормальной внутриматочной
беременностью, подвергшихся лапароскопии в связи с
подозрениями на внематочную беременность, были такими же,
как и у обычных пациенток [11]. На сегодняшний день
хирургам, имеющим дело с беременными с
абдоминальной патологией, требующей оперативного
вмешательства, необходимо быть знакомыми с современными
рекомендациями по ведению таких пациенток.
ЭФФЕКТЫ ПНЕВМОПЕРИТОНЕУМА
ВО ВРЕМЯ БЕРЕМЕННОСТИ
В середине 1990-х гг. было проведено несколько
экспериментальных исследований по изучению
эффектов пневмоперитонеума при лапароскопии у крупных
и мелких животных. По существу, исследования на
небеременных особях показали, что у
экспериментальных животных инсуффляция С02 вызывает такой же
физиологический ответ, как и у человека. Однако было
проведено относительно немного исследований на
животных для определения влияния последствий инсуф-
фляции брюшной полости на здоровье и жизнь плода
[12]. Большинство исследований у беременных
животных показали, что С02-пневмоперитонеум может
вызывать дыхательный ацидоз, несмотря на активную
вентиляцию организма матери. Особую значимость
Рис. 24-2. Установка портов для лапароскопической
холецистэктомии у беременной на сроке б мес (А)
и для лапароскопической аппендэктомии на раннем сроке
гестации (Б). Лапароскопическая аппендэктомия на сроке
шара- имеет исследование, проведенное Luc et al. [13], ко-
^ства торое четко показало склонность плода к абсорбции
>андо- С02, хотя и не было посвящено проведению хирурги-
:ледо- ческих операций у матери. Сообщают об изменениях
иссле- кровотока и плацентарной перфузии. К сожалению,
иных, эти исследования на животных проведены с участием
^гими небольшого количества особей и в основном являются
сходы описательными.
>емен- Хотя данные об изменении маточного кровотока
],озре- и ацидоза достаточно важны, исследования,
изучавши же, шие отдаленные результаты этих изменений, проведе-
i день ны не были. В небольшом исследовании на беременных
[наль- морских свинках, проведенном нашей группой, были
атель- оценены поведенческие эффекты у молодых животных,
лире- подвергшихся созданию С02-пневмоперитонеума [14].
В исследовании авторов пневмоперитонеум во II
триместре беременности у морских свинок не повлиял на
продолжительность гестации, частоту невынашивания
или массу плода. Однако у животных отмечался более
высокий уровень локомоторной активности, чем в кон-
Ьшек- трольной группе. Хотя было показано, что постнаталь-
ых ная гиперактивность — чувствительный показатель
не- пренатального инсульта, данные небольшого исследо-
ль- вания авторов издания на животных теперь необходимо
ой же подтвердить в исследованиях на людях.
было
г*™ РЕКОМЕНДАЦИИ ПО АНЕСТЕЗИИ
[а жи-
нсуф- Благоприятный результат лапароскопии у беременных
плода зависит в первую очередь от вводного наркоза. В дан-
ивот- ной ситуации необходимо использовать технику быст-
:т вы- рого последовательного введения в общий наркоз, так
[вную как наличие беременной матки повышает риск аспи-
мость рации. Важно соответствующее дозирование опиатов
б мес гестации или более (В). На рисунке показано положение
червеобразного отростка на разных стадиях гестации (из: Gurbuz
и Peetz [8]).
302 Лапароскопическая хирургия. Атлас
и других лекарственных средств, чтобы избежать
передозировки ими плода. Нет единого мнения о связи
между техникой анестезии и частотой
преждевременных родов. Однако лучшей считается техника общей
анестезии из-за токолитического эффекта, который
некоторые из галогенных газов оказывают на матку.
Однако во время беременности общая анестезия в 7 раз
чаще сопровождается проблемами с дыхательными
путями, чем регионарная [15]. Исследование на
животных, недавно проведенное авторами, показало, что
общая анестезия усиливает системную и церебральную
оксигенацию [16].
В отношении действия применяемых лекарственных
средств на организм плода нужно отметить, что
примерно 60-80% концентрации лекарственного вещества
в материнской плазме попадает к плоду посредством
плацентарной диффузии. Таким образом,
поддержание адекватного уровня анестезии и аналгезии у плода
может быть предельно трудным. Для профилактики
сердечно-сосудистых осложнений у плода из-за такой
вариабельности лекарственной концентрации
обязательным считают проведение тщательного фетального
мониторинга.
ТЕХНИЧЕСКИЕ ОСОБЕННОСТИ
II триместр беременности — идеальный период для
хирургического вмешательства, поскольку органогенез
уже завершен, а матка в это время имеет еще
относительно небольшие размеры. Однако лапароскопические
операции можно безопасно проводить во всех трех
триместрах беременности [5, 17]. Во время вводного
наркоза беременная находится в полулежачем
положении, чтобы избежать обструкции нижней полой вены.
Этот прием особенно важен в III триместре, когда матка
своей массой может вызвать окклюзию нижней полой
вены. Ведут интенсивный мониторинг за материнской
гемодинамикой, продолжающийся в течение всего пе-
риоперативного периода. В ходе некоторых ранних
исследований осуществляли обязательный интраопера-
ционный фетальный мониторинг при выполнении
лапароскопических операций у беременных [5].
Несколько авторов описали использование
пункции иглой Вереша в правом верхнем квадранте, ла-
теральнее срединно-ключичной линии [8]. Однако
при применении этой техники были зафиксированы
повреждения матки, ее сосудов или самого плода [18].
Авторы всегда используют открытый метод с
установкой троакара Хэссона супраумбиликально. Место
установки троакара Хэссона определяется размером матки,
и его располагают по средней линии живота над
наиболее высокой частью матки. Инсуффляцию брюшной
полости проводят до давления 10 мм рт.ст. Если
сохраняется стабильность гемодинамики матери и ребенка,
давление постепенно повышают до 15 мм рт.ст. Во
время инсуффляции и в течение всей операции
осуществляют мониторинг уровней рС02 и максимальной
концентрации С02 в конце спокойного вдоха матери.
Манипуляций с маткой во время операции
необходимо избегать, а троакары нужно устанавливать
таким образом, чтобы матку не приходилось отодвигать
с операционного поля (рис. 24-1, 24-2). Фактически
проведенные исследования показали, что
лапароскопический доступ сводит к минимуму манипуляций
с маткой по сравнению с открытым доступом и
снижает риск преждевременных родов [19]. Если имеют
место признаки выраженного ацидоза матери или гемо-
динамическая нестабильность плода, газ из брюшной
полости немедленно выпускают. Если оба пациента
стабилизируются, давление пневмоперитонеума
постепенно повышают до предшествующих показателей.
В случаях, когда состояние пациента продолжает
ухудшаться или он не переносит повторной
инсуффляции, проводят конверсию в открытую операцию.
ЗАКЛЮЧЕНИЕ
Благодаря широкой доступности лапароскопической
хирургии Европейская ассоциация эндоскопической
хирургии и Американское общество гастроинтести-
Рекомендации по применению лапароскопии во время беременности
Предоперационная консультация акушера.
Если возможно, оперативное вмешательство необходимо отложить до II триместра, когда риск для плода наименьший.
Всегда, когда представляется возможным, необходимо использовать устройства для пневматической компрессии, чтобы
избежать венозного застоя в нижних конечностях.
Необходимо мониторировать фетальный и маточный статусы, а также максимальную концентрацию С02 в конце спокойного
вдоха матери и/или газы артериальной крови.
Матку необходимо защищать свинцовым фартуком, если нужно провести интраоперационную холангиографию;
рентгеноскопию необходимо использовать селективно.
При беременной матке абдоминальный доступ осуществляют с помощью открытой техники.
Для отведения матки от нижней полой вены нужно придать телу положение, вызывающее обвисание матки.
Давление пневмоперитонеума должно быть минимальным (до 8-12 мм рт.ст.) и не превышать 15 мм рт.ст.
Рис. 24-3. Рекомендации по применению лапароскопии во время беременности.
Глава 24. Лапароскопия у беременных 303
нальных и эндоскопических хирургов опубликовали
рекомендации по применению лапароскопии во время
беременности [20, 21]. Эти рекомендации обобщены
на рис. 24-3.
Хотя беременность и считали противопоказанием
к лапароскопии еще несколько лет назад, в настоящее
время доказано, что лапароскопические
вмешательства — отличная опция для лечения беременных,
которым требуется хирургическое вмешательство. Хирурги
показали, что эти операции можно выполнять
эффективно и безопасно, с небольшим риском или без риска
для матери и плода. Особенно четко преимущества
лапароскопии перед открытой операцией заметны
при лапароскопической холецистэктомии. По мере
роста опыта применения лапароскопических
операций у беременных показания к ним продолжают
расширяться, а техника становится более продвинутой
и сложной.
СПИСОК ЛИТЕРАТУРЫ
1. Mazze R.I., Kallen В. Reproductive outcome after anesthesia and
operation during pregnancy: a registry study of 5405 cases // Am.
J. Obstet. Gynecol. — 1989. — Vol. 161. — P. 1178-1185.
2. Nezhat F.R., Tazuke S., Nezhat C.H. et al. Laparoscopy during
pregnancy: a literature review // JSLS. — 1997. — Vol. 1. — R 17-
27.
3. Halvorsen A.C., Brandt В., Andreasen J.J. Acute appendicitis
in pregnancy: complications and subsequent management //
Eur. J. Surg. — 1992. — Vol. 158. — P. 603-606.
4. Scott L.D. Gallstone disease and pancreatitis in pregnancy //
Gastroenterol. Clin. North Am. — 1992. — Vol. 21. — P. 803-815.
5. Gurbuz А.Т., Peetz M.E. The acute abdomen in the pregnant
patient: is there a role for laparoscopy? // Surg. Endosc. — 1997. —
Vol. 11. —P. 98-102.
6. Maternal-Fetal Medicine: Principals and Practice. — Edn. 4 /
Eds R.K. Creasy, R. Resnik. — Philadelphia: W.B. Saunders
Company, 1999.
7. Thomas S.J., Brisson P. Laparoscopic appendectomy and
cholecystectomy during pregnancy: six case reports // JSLS. —
1998.— Vol.2.— P. 41-46.
8. Lanzafame R.J. Laparoscopic cholecystectomy during pregnancy //
Surgery. — 1995. — Vol. 118. — P. 627-633.
9. Gouldman J.W., Sticca R.P., Rippon M.B. et al. Laparoscopic
cholecystectomy in pregnancy // Am. Surg. — 1998. — Vol. 64. —
P. 93-98.
10. Bennett L., Estes E. Laparoscopic cholecystectomy in the second
trimester of pregnancy: a case report // J. Reprod. Med. — 1993. —
Vol. 38. — P. 833-834.
11. Samuellson S., Sjovall A. Laparoscopy in suspected ectopic
pregnancy // Acta. Obstet. Gynecol. Scan. — 1972. — Vol. 51. —
P. 31-35.
12. Reynolds J.D., Booth J.V., de la Fuente S. et al. A review of
laparoscopy for non-obstetric-related surgery during pregnancy //
Curr. Surg. — 2003. — Vol. 60. — P. 164-173.
13. Luks EL, Deprest J., Marcus M. et al. Carbon dioxide
pneumoamnios causes acidosis in fetal lamb // Fetal Diagn. Ther. —
1994. — Vol. 9. — P. 105-109.
14. De la Fuente S.G., Pinheiro J., Gupta M. et al. Early postnatal
behavior deficits after maternal carbon dioxide pneumoperitoneum
during pregnancy // Surg. Endosc. — 2003. — Vol. 17. — P. 1823-
1825.
15. Hawkins J., Chang J., Callaghan W. et al. Anesthesia-related
maternal mortality in the United States, 1991-1996: an update //
Anesthesiology. — 2002. — Vol. 96. — P. A1046.
16. Mc Claine R.J., Uemura K., de la Fuente S.G. et al. General
anesthesia improves fetal cerebral oxygenation without evidence
of subsequent neuronal injury // J. Cereb. Blood Flow Metab. —
2005. — Vol. 25. — P. 1060-1069.
17. Schwartzberg B.S., Conyers J.A., Moore J.A. First trimester of
pregnancy laparoscopic procedures // Surg. Endosc. — 1997. —
Vol. 11.— P. 1216-1217.
18. Barnett M.B., Lui D.T. Y. Complications of laparoscopy during early
pregnancy // Br. Med. J. — 1974. — Vol. 23. — P. 328.
19. Curet M.J., Allen D., Josloff R.K. et al. Laparoscopy during
pregnancy // Arch. Surg. — 1996. — Vol. 10. — P. 511-515.
20. Neudecker J., Sauerland S., Neugebauer E. et al. The European
Association for Endoscopic Surgery clinical practice guideline on
the pneumoperitoneum for laparoscopic surgery // Surg. Endosc. —
2002.— Vol. 16.— P. 1121-1143.
21. The Society of American Gastrointestinal and Endoscopic Surgeons
(SAGES): Guidelines for laparoscopic surgery during pregnancy. —
Available at http: //sages, org/sagespublication. php? doc=23.
304 Лапароскопическая хирургия. Атлас
Лапароскопическая
сальпингоофорэктомия
в лечении образований
придатков
Крэг Дж. Соболевски
еш&ш®.
Первая лапароскопическая оофорэктомия была
проведена Kurt Semm в 1980 г. [1]. С тех пор были доказаны
безопасность и преимущества этого доступа.
Показаниями к оофорэктомии служат персистирующие
локализованные боли, сомнительные или персистирующие
образования яичников, дисгенезия гонад и
профилактика у пациентов с распространенным раком молочной
железы или генетическими мутациями и синдромом
резидуального яичника. Новые хирургические
инструменты предполагают множество вариантов
хирургической техники.
Распространенность образований придатков в общей
популяции составляет от 0,17 до 5,9% у
бессимптомных женщин и от 7,1 до 12% — у симптоматических,
имеющих боли [2]. В связи с этим имеется большая
вероятность того, что патология придатков будет
выявлена неожиданно, при негинекологических операциях.
При принятии решения о необходимости
хирургического лечения нужно иметь в виду несколько
факторов, главный из которых — оценка злокачественного
потенциала опухоли. Возраст пациента — важный
показатель при принятии такого решения. Nezhat
et al. [3] в своем крупном исследовании
обнаружили, что до 80% образований у женщин младше 55 лет
были функциональными кистами или эндометриома-
ми, в то время как 8% оказались доброкачественными
опухолями и только 0,4% были злокачественными [3].
При увеличении возраста пациенток риск того, что
образование яичника будет злокачественным, возрастает
от 13% в предменопаузе до 45% в постменопаузе [4].
Следующими по степени важности после
возраста пациентки будут физические характеристики
образования. Granberg et al. [5] оценили 1017 опухолей
яичников и классифицировали их на основании
макроскопического исследования. При однокамерных
кистах риск злокачественности образования составлял
0,3%, при сложных мультилокулярных кистах — 36%,
а при преимущественно солидных образованиях —
39% [5]. Поскольку для установления окончательного
диагноза при таких образованиях требуется
хирургическое вмешательство, большее внимание было
уделено различным методам визуализации и их
способности «предсказать» злокачественность опухоли
перед операцией. Методом выбора в диагностике стало
предоперационное УЗИ. К ультразвуковым признакам,
вызывающим беспокойство, относятся папиллярные
разрастания внутри кисты, неровные границы, размер
более 10 см, толщина перегородок более 2 мм и асцит
[5-7]. Однокамерные кисты с тонкой стенкой и гипо-
эхогенным содержимым, вероятнее всего, будут
доброкачественными [2]. Хотя в соответствии с
классическими рекомендациями постменопаузальным пациенткам
показано хирургическое удаление любого кистозного
образования, случайно выявленного при УЗИ, было
установлено, что распространенность однокамерных
кист в этой группе женщин достигает 20% [4]. В
настоящее время принято считать, что данные кисты можно
безопасно наблюдать с помощью контрольных УЗИ.
Признаки, вызывающие беспокойство при УЗИ,
обнаруживаемые и при оперативном лечении, должны
вызвать у хирурга подозрение на возможность
повышенного риска злокачественной природы
образования. Особенное беспокойство вызывают
поверхностные разрастания, при наличии которых настоятельно
рекомендуется проведение биопсии и срочного
исследования замороженных срезов. Именно поэтому
со стороны хирурга будет предусмотрительно иметь
возможность срочно исследовать замороженные
тканевые срезы. Асцитическую жидкость необходимо
собрать и послать на цитологическое исследование, так
как результат такого исследования — важный элемент
хирургического стадирования в случае, если будет
диагностирована злокачественная опухоль. Следует
провести внимательный осмотр серозных поверхно-
Глава 25. Лапароскопическая сальпингоофорэктомия в лечении образований придатков 305
стей париетальной брюшины и кишечника. При
серьезных подозрениях на наличие злокачественной
опухоли стандартом остается конверсия в лапарото-
мию. Проведение соответствующего хирургического
стадирования, включающего оментэктомию,
радикальную лимфаденэктомию и полную циторедукцию,
если это возможно, имеет первостепенное значение,
если при исследовании замороженных срезов
выявлена злокачественная опухоль. По возможности
требуется немедленная консультация гинеколога-онколога.
Если предполагается, что дальнейшее выполнение
операции с применением лапароскопии будет
безопасным, необходимо попытаться избежать
случайного повреждения стенки кисты и попадания
потенциально злокачественных клеток в брюшную полость.
Хотя понятно, что спонтанный разрыв
злокачественной опухоли яичника ухудшает прогноз, тем не менее
последствия и влияние на прогноз случайного интра-
операционного разрыва злокачественной кисты
яичника остаются неясными [2, 3, 8]. В разных
исследованиях частота разрывов кист составляла от 6 до 27%
[2, 8]. Однако в некоторых исследованиях делали
различия между разрывом кисты при цистэктомии и ее
разрыве при оофорэктомии. Gal et al. [9] обнаружили,
что частота разрывов была схожей при удалении
всего яичника как лапароскопическим, так и открытым
доступом. В том же исследовании, однако,
отмечался значительно более высокий риск разрыва при
цистэктомии лапароскопическим доступом в сравнении
с открытой операцией. Лапароскопическая цистэкто-
мия может иметь доказанно более высокую частоту
подтекания содержимого в брюшную полость, чем ла-
паротомия, хотя эти данные окончательно не
подтверждены [9].
Поскольку остается неясным, повышается ли риск
возникновения рецидива при интраоперационном
разрыве кисты, в большинстве ситуаций пациентов
ведут как лиц, имеющих стадию рака 1С, осуществляя
им послеоперационную химиотерапию. Для того
чтобы избежать разрыва кисты и рассеивания опухоли
во время удаления кисты и в итоге избежать
осложнений химиотерапии, благоразумно будет сначала
поместить препарат в лапароскопический контейнер,
а затем провести контролируемую аспирацию
содержимого и декомпрессию кисты, пока она находится
в контейнере [8]. Такие манипуляции минимизируют
риск подтекания жидкости в брюшную полость.
Кроме того, необходимо, не колеблясь, расширить
абдоминальный разрез, если это требуется, для
безопасного удаления интактной опухоли. Есть предположение,
что удаление злокачественных образований из
брюшной полости через места введения лапароскопических
портов приводит к возрастанию вероятности метаста-
зирования и рецидивирования в этих местах. Частота
метастазирования в места установки троакаров
после гинекологических операций по поводу
злокачественных опухолей яичников неизвестна. Сообщают,
что она составляет от 0 до 2,3%, что выше, чем после
лапаротомии [10]. К возможным причинам
рецидивов рака в разрезы при лапароскопии относятся
гематогенное распространение, прямая контаминация
раны и имплантация, «эффект дымохода», аэрозоли-
зация клеток опухоли, местные иммунные реакции
и хирургическая техника [10]. Поскольку
подразумевается лечение всех образований яичника как
потенциально злокачественных, в случае неожиданного
обнаружения злокачественной опухоли при
гистологическом исследовании могут помочь
профилактические меры, включающие использование защитных
контейнеров для извлечения препарата, эвакуацию
пневмоперитонеума перед удалением троакаров,
зашивание отверстий для троакаров диаметром более
10 мм и орошение троакарных отверстий [10].
ХИРУРГИЧЕСКАЯ АНАТОМИЯ
Яичник подвешен кровеносными сосудами за оба
полюса. Проксимальной частью подвешивающего
аппарата служит воронко-тазовая связка (В-Т).
Яичниковые сосуды, являющиеся ветвями аорты, проходят
через это образование. В-Т-связка проходит над
общей подвздошной артерией в области тазового кольца
и находится сразу же медиальнее наружных
подвздошных артерии и вены. Мочеточник пересекает общие
подвздошные сосуды сразу же медиальнее В-Т-связки.
При планировании лапароскопической оофорэктомии
чрезвычайно важна внимательная идентификация
этих образований.
Мочеточник обычно можно обнаружить путем его
визуализации через поверхность брюшины под
яичником, в нижней части яичниковой ямки. Также его
можно найти, непосредственно вскрыв брюшину латераль-
нее В-Т-связки и параллельно ей, и обнаружить, как он
проходит вдоль медиального листка широкой связки.
Этот прием особенно важен при наличии
значительного нарушения анатомии или перитонеальном
фиброзе, например при эндометриозе. Дистальной частью
подвешивающего аппарата яичника служит маточно-
яичниковая связка, которая обеспечивает
коллатеральное кровоснабжение яичника. После того как оба
источника кровоснабжения яичника лигированы и
пересечены, остальные образования, прикрепляющие
яичник (относительно бессосудистые мезоовариум
и мезосальпинкс), пересекают лапароскопическими
ножницами с применением монополярной
коагуляции или без нее. Затем удаленный препарат помещают
в лапароскопический контейнер и извлекают его через
разрез для одного из портов. Препарат обычно бывает
слишком крупным, чтобы удалить его через интактное
отверстие для троакара, и для его удаления может
понадобиться разрез фасции или кожи.
306 Лапароскопическая хирургия. Атлас
ТЕХНИКА ОПЕРАЦИИ
На рис. 25-1—25-12 представлена обстановка операционной и хирургическая техника лапароскопической оофор-
эктомии при образованиях придатков.
ПОДГОТОВКА
Наркозный
аппаратч
Анестезиологический
персонал
Хирург Б
Видеомонитор
для хирурга Б
Операционная сестра
Видеомонитор
для хирурга А
Рис. 25-1. Обстановка операционной для выполнения
лапароскопической оофорэктомии. Обратите внимание,
что для операций на органах таза необходимо устанавливать
видеомониторы у ножного конца стола, а не у головного,
как это обычно делают при абдоминальных операциях. Ноги
необходимо расположить на подставках-стременах типа
«Allen», а руки фиксировать по бокам пациентки. Если нужно,
операционная сестра ассистирует с помощью маточного
манипулятора, введенного во влагалище.
Глава 25. Лапароскопическая сальпингоофорэктомия в лечении образований придатков 307
Рис. 25-2. Для вмешательства потребуется, по меньшей мере, три троакара.
Как минимум, один троакар должен иметь диаметр 10-12 мм для введения
эндоскопического контейнера. Остальные порты могут быть 5-, 10-
и 12-миллиметровыми в зависимости оттого, каким образом хирурги собираются
лигировать сосудистую ножку (или 5-миллиметровое устройство, склеивающее
сосуды, или 12-миллиметровый степлер/резак). Нижние порты необходимо
устанавливать латеральнее нижних подвздошных сосудов, обычно поблизости
от точки Мак-Бурнея.
ОПЕРАЦИЯ
Рис. 25-3. Нормальные анатомические взаимоотношения.
Обратите внимание на близость мочеточника к сосудам
В-Т-связки. Матку удерживают в антефлексио с помощью
маточного манипулятора.
308 Лапароскопическая хирургия. Атлас
Рис. 25-4. Мочеточник проходит ниже сосудов, идущих
в В-Т-связке, и параллельно им. У худой пациентки, такой
как представлена на рисунке, перистальтику мочеточника
можно увидеть через брюшину. Однако у пациентов
с ожирением или нарушениями анатомии это может оказаться
невозможным.
Рис. 25-6. В случае если мочеточник нельзя
идентифицировать через поверхность брюшины или он
находится слишком близко к сосудам, чтобы безопасно
их пересечь, найти мочеточник можно, вскрыв брюшину
латеральнее и параллельно сосудам, проходящим в В-Т-
связке. Его можно обнаружить в соединительнотканном
влагалище, прикрепленном к медиальному листку брюшины
боковой стенки таза.
Рис. 25-5. Поскольку В-Т-связка, внутренние подвздошные
сосуды и мочеточник находятся на близком расстоянии
друг от друга, идентификация мочеточника играет
первостепенную роль перед началом оофорэктомии. Кроме
визуализации перистальтики мочеточника, его можно
отличить от других находящихся поблизости трубчатых
образований, идентифицируя мелкие артериолы, проходящие
вдоль его поверхности.
Рис. 25-7. После того как станет понятно, что операцию
можно безопасно продолжить, необходимо
пересечь В-Т-связку. Часто для этой цели применяют
электрохирургические устройства. В этом случае
для пересечения сосудистой ножки используют биполярное
устройство, которое спаивает и режет сосуды («LigaSure»;
Valleylab, Boudler, СО). В качестве альтернативы можно сделать
фенестрацию брюшины под связкой и перевязать сосуды
лигатурой или применить линейный сосудистый степлер.
Глава 25. Лапароскопическая сальпингоофорэктомия в лечении образований придатков 309
Ч ф'
-ss jjd
■ j(jPH^?^^
::ШЯЯ^'
>
1
■^ Маточно-яичниковая
связка
■ML*--'
Рис. 25-8. Пересекают проксимальный отдел фаллопиевой
трубы.
Рис. 25-9. Пересекают маточно-яичниковую связку.
Не нужно захватывать эту связку слишком близко к матке,
так как в этом месте обычно расположено дуговое венозное
сплетение и при возникновении венозного кровотечения
будет трудно добиться гемостаза. После пересечения всех
этих трех сосудистых образований оставшиеся структуры,
удерживающие яичник (относительно бессосудистые
мезоовариум и мезосальпинкс), могут быть пересечены
с помощью ножниц или электроинструментов.
Рис. 25-10. На данном этапе
яичник полностью отделен от своих
сосудистых и соединительнотканных
прикреплений.
Рис. 25-11. Далее удаленный препарат
помещают в лапароскопический
контейнер. Возможна аспирация
кистозного компонента образования
перед закрытием контейнера.
Этот прием поможет удалить
препарат через маленький разрез
для лапароскопического порта.
Аспирация образования в контейнере
сводит к минимуму риск случайной
утечки жидкости в брюшную полость.
Рис. 25-12. В завершение операции
препарат удаляют через один
из портов. Как можно увидеть
на этом снимке, сначала нужно
удалить троакар, так как яичник
обычно слишком велик, чтобы
поместиться в просвет стандартного
лапароскопического порта. Иногда
приходится расширять разрезы
кожи или фасции, чтобы они
соответствовали размерам удаляемого
препарата.
310 Лапароскопическая хирургия. Атлас
СПИСОК ЛИТЕРАТУРЫ
■ -
1. Nezhat С. Laparoscopic operations on the ovary // Operative
Gynecologic Laparoscopy: Principles and Techniques. — 2nd ed. /
Eds C. Nezhat, A. Siegler, E Nezhat. et al. — New York: McGraw-
Hill, 2000. — P. 149-168.
2. Hilger W, Magrina J., Magtibay P. Laparoscopic management of
the adnexal mass // Clin. Obstet. Gynecol. — 2006. — Vol. 49. —
P. 535-548.
3. Nezhat E, Nezhat C, Welander C.E. et al. Four ovarian cancers
diagnosed during laparoscopic management of 1011 women with
adnexal masses // Am. J. Obstet. Gynecol. — 1992. — Vol. 167. —
P. 790-796.
4. McDonald M., Modesitt S. The incidental postmenopausal adnexal
mass // Clin. Obstet. Gynecol. — 2006. — Vol. 49. — P. 506-516.
5. Granberg S., Norstrom A., Wikland M. Comparison of endovaginal
ultrasound and cytologic evaluations of cystic ovarian tumors //
J. Ultrasound Med. — 1991. — Vol. 10. — P. 9.
6. Jeong Y.Y., Outwater E.K., Kang H.K. Imaging evaluation of ovarian
masses // Radiographics. — 2000. — Vol. 20. — P. 1445-1470.
7. Exacoustos C, Romanini M., Rinaldo D. et al. Preoperative
sonographic features of borderline ovarian tumors // Ultrasound
Obstet. Gynecol. — 2005. — Vol. 25. — P. 50-59.
8. Havrilesky L., Peterson В., Dryden D. et al. Predictors of clinical
outcome in the laparoscopic management of adnexal masses //
Obstet. Gynecol. — 2003. — Vol. 102. — P. 243-251.
9. Yuen P., Yu K., Yip S. et al. A randomized prospective study of
laparoscopy and laparotomy in the management of benign ovarian
masses // Am. J. Obstet. Gynecol. — 1997. — Vol. 177. — P. 109-
114.
10. Ramirez P., Wolf J., Levenback C. Laparoscopic port-site metastasis:
etiology and prevention // Gynecol. Oncol. — 2004. — Vol. 91. —
P. 179-189.
Глава 25. Лапароскопическая сальпингоофорэктомия в лечении образований придатков 311
/■ " ' " r"1'"""—■—
Педиатрическая
эндохирургия
Мэри Т. Остин, Гретхен П. Пур
У* i „ ,
ОСОБЕННОСТИ ЛАПАРОСКОПИЧЕСКОЙ
ХИРУРГИИ У НОВОРОЖДЕННЫХ И ДЕТЕЙ
В своем развитии минимально инвазивная хирургия
у детей прошла путь от адаптации к педиатрической
практике таких распространенных у взрослых
операций, как лапароскопическая холецистэктомия, до
применения лапароскопии и торакоскопии для
проведения операций, которые встречаются только в детской
хирургии, например реконструкции атрезии пищевода
и трахейно-пищеводного свища [1]. Эта глава
посвящена педиатрическим вариантам операций, обычно
проводимых у взрослых, а также некоторым неона-
тальным операциям, которые выполняют детские
хирурги — специалисты широкого профиля.
У детей имеются специфические анатомические
и физиологические особенности, что важно иметь
в виду при проведении минимально инвазивных
операций. У новорожденных и маленьких детей брюшная
стенка эластичная и верхушка мочевого пузыря
расположена интраперитонеально, что делает введение
троакаров потенциально опасным. У большинства
новорожденных и многих детей имеются пупочные
грыжи, которые могут стать удобным местом для
доступа в брюшную полость, а после операции можно
провести пластику грыжи. Печень новорожденного
обычно имеет пропорционально крупные размеры,
и даже небольшая травма может привести к профузно-
му кровотечению, которое трудно остановить. Все
лапароскопические порты у новорожденных
необходимо устанавливать значительно ниже уровня реберной
дуги, а при ретракции печени следует быть особенно
осторожными.
Доступны для применения короткие
эндоскопические порты диаметром 3,4 и 5 мм, как одноразовые, так
и многоразовые. У детей часто возникает
необходимость в установке портов вдалеке друг от друга и в
точках, не совпадающих с точками установки троакаров
\
J
при операциях у взрослых, чтобы избежать «дуэли»
инструментов в маленьком операционном поле
ребенка. Многие детские хирурги выполняют операции
через разрезы на животе, а не через порты, за
исключением портов для камеры или больших инструментов.
Широкий спектр операций на желудочно-кишечном
тракте, желчных путях, надпочечниках, селезенке и
органах мочеполовой системы можно безопасно провести
без использования портов, что значительно экономит
финансовые средства [2]. Лапароскопические
камеры и источники энергии для электрохирургии имеют
диаметр от 3 до 5 мм, но ультразвуковые коагуляторы
обычно имеют диаметр не менее 5 мм, а
эндоскопический степлер требует установки 10-миллиметрового
порта. Размер этих инструментов иногда ограничивает
минимальную инвазивность, которой можно было бы
достичь у новорожденных.
У детей обычно усилены механические и
физиологические эффекты пневмоперитонеума, инсуффляции
плевральной полости и вентиляции одного легкого.
В состоянии пневмоперитонеума у детей абсорбируется
пропорционально большее количество углекислого газа,
чем у взрослых, а абсорбция и выведение углекислого
газа зависят от возраста [3]. При инсуффляции для
проведения минимально инвазивных операций у
новорожденных отмечается снижение системного артериального
давления, которое обычно возможно скорригировать
повышением инфузии жидкости, но повышение
максимальной концентрации С02 в конце спокойного выдоха
часто невозможно вернуть к норме с помощью усиления
вентиляции, поэтому его поддерживают до завершения
операции [4]. У новорожденных при незрелости или
нарушении работы сердечно-сосудистой системы
особенно повышен риск возникновения побочных эффектов
во время длительного периода инсуффляции, и у них
оправдан тщательный мониторинг в периоперацион-
ном периоде. Пневмоперитонеум вызывает обратимую
Глава 26. Педиатрическая эндохирургия 313
анурию почти у всех новорожденных и олигурию у
многих детей, и эти изменения в мочевыделении не зависят
от объема интраоперационной инфузии [5]. Таким
образом, у детей во время поддержания пневмоперитонеума
инфузионная терапия не должна быть строго
ориентированной на объем выделенной мочи. К счастью,
эластичная брюшная стенка позволяет выполнить многие
абдоминальные операции с давлением инсуффляции 5-10 мм
рт.ст., а многие торакальные операции вообще не
требуют инсуффляции. Во всех случаях давление инсуффляции
должно быть ограниченным, с максимальным давлением
12 мм рт.ст. у младенцев с массой тела менее 5 кг [6].
Многие современные открытые операции
характеризуются приемлемыми косметическими и
отличными функциональными результатами. Преимущества
лапароскопических и торакоскопических операций
у новорожденных и детей необходимо оценивать
по современным критериям и учитывать недостатки
минимально инвазивных операций, которые могут
занимать больше времени, быть более дорогими и
приводить к нежелательным физиологическим эффектам.
По мере усложнения технологий и роста опыта
хирургов в выполнении минимально инвазивных операций
многие лапароскопические и торакоскопические
операции вероятнее всего станут рутинными в детской
хирургии.
АППЕНДЭКТОМИЯ
Аппендэктомия — наиболее распространенная
экстренная операция у детей. Впервые проведенная Stemm
в 1982 г. [7], лапароскопическая аппендэктомия в
настоящее время стала стандартом лечения неосложнен-
ного неперфоративного аппендицита у детей. После
такой операции большинство детей быстро
выздоравливают, а сопровождающие ее смертность и частота
послеоперационных осложнений низкие [8-10].
Техника операции у детей почти идентична
применяемой у взрослых. Доступ в брюшную полость
обеспечивает периумбиликальный порт для камеры. Хирург
проводит дисссекцию брыжейки червеобразного
отростка и его основания с помощью двух рабочих
портов, которые расположены в левом нижнем квадранте
и над лобком или в обоих нижних квадрантах живота.
Основание червеобразного отростка лигируют с
помощью эндоскопических петель или степлера.
Червеобразный отросток удаляют через пупочный порт после его
помещения в эндоскопический контейнер.
Лечение перфоративного аппендицита, который
встречается примерно в 30-50% случаев, пока остается
предметом дискуссий. Многие считают перфорацию
без признаков перитонита или сепсиса
противопоказанием к экстренной аппендэктомии, как открытой,
так и лапароскопической. Некоторые клиники
сообщают об успешном первоначальном неоперативном
лечении перфоративного аппендицита с помощью
внутривенного введения антибиотиков, чрескожного
дренирования абсцесса и отсроченной
аппендэктомии через 6-8 нед [11-16]. В этих исследованиях был
оценен ряд исходов с точки зрения стоимости и
продолжительности госпитализации, и они показали,
что медикаментозное лечение с отсроченной аппенд-
эктомией приводит к снижению частоты осложнений,
в том числе к снижению частоты проникновения
раневой инфекции и образования послеоперационных
абсцессов брюшной полости в сравнении с
экстренной аппендэктомией. Пациентам, у которых после
48-72 ч лечения развивались перитонит, кишечная
непроходимость или персистировали клинические
симптомы, требовалось проведение ургентной
аппендэктомии. Большинство детских хирургов согласны,
что отсроченная аппендэктомия бывает необходима
из-за риска рецидивирования аппендицита, но
некоторые предпочитают медикаментозное лечение без
отсроченной аппендэктомии, если первичная терапия
оказывается успешной [17, 18].
Транслюминальная хирургия через естественные
отверстия — развивающаяся область минимально ин-
вазивной хирургии. Сообщалось о проведении транс-
гастральной и трансректальной аппендэктомии у
животных и нескольких пациентов [19-21]. Роль
доступов через естественные отверстия у взрослых и детей
определят дальнейшие усовершенствования эндолю-
минального инструментария и исследования, которые
продолжаются в настоящее время.
ХОЛЕЦИСТЭКТОМИЯ
Лапароскопическая холецистэктомия — другая
распространенная минимально инвазивная операция,
которую безопасно и эффективно выполняют детям [22,
23]. Наиболее распространенным показанием служит
холелитиаз, хотя это заболевание и встречается реже,
чем у взрослых, и чаще связано с другой патологией,
например гематологической. Все больше
исследователей признают, что наиболее частая причина болей
в животе и непереносимости жирной пищи у детей —
дискинезия желчных путей. По крайней мере у 85%
детей с дискинезией желчных путей отмечают
исчезновение симптомов после холецистэктомии, и
гистологическое исследование желчного пузыря часто
обнаруживает признаки, соответствующие хроническому
холециститу [24,25]. Холецистит, желчные осложнения
парентерального питания или резекция подвздошной
кишки — другие частые причины для проведения
холецистэктомии у детей.
Лапароскопическая холецистэктомия — стандарт
помощи детям и взрослым, поскольку укорачивает
продолжительность госпитализации и способствует
раннему возвращению к обычной активности по сравнению
с открытой операцией. В США с 1996 по 2003 г.
отмечался рост числа холецистэктомии у детей без гемолитиче-
314 Лапароскопическая хирургия. Атлас
ской болезни (с 1,5 до 2,6 операции на 100 000 населения),
а также числа операций, проводимых лапароскопически
(с 77 до 91%) [26]. Основные этапы операции идентичны
у всех пациентов, но у детей важно увеличить
расстояние между троакарами, чтобы избежать
перекрещивания инструментов в операционном поле. У маленьких
пациентов устанавливают самые латеральные троакары
в правом нижнем квадранте, а эпигастральный троакар
можно расположить в левом подреберье.
Дети с хронической гемолитической анемией
(имеющие В-талассемию, серповидноклеточную анемию
и наследственный склерокистоз) часто нуждаются
в спленэктомии, но одновременно входят в группу
риска развития холелитиаза. Многие хирурги
предпочитают проводить предоперационный скрининг
на наличие желчных камней, после чего выполняют
сопутствующие спленэктомию и холецистэктомию,
если они показаны [27, 28]. Сообщалось о безопасном
одновременном завершении обеих операций
лапароскопически [29]. Обычно для вмешательства требуется
от 4 до 5 троакаров в зависимости от размеров
пациента и его селезенки. Большинство хирургов используют
периумбиликальный порт для камеры и
дополнительные троакары, установленные в эпигастрии, правом
и левом подреберье. Дополнительный 10- и
12-миллиметровый левосторонний троакар часто оказывается
необходимым для введения степлера, которым
пересекают селезеночные сосуды, и большого
лапароскопического контейнера для извлечения селезенки. У
пациентов со значительной спленомегалией минимально
инвазивным альтернативным вариантом операции,
предлагающей улучшенный доступ, может быть
применение порта для ручной ассистенции,
установленного через разрез Пфанненштиля [30].
ПИЛОРОМИОТОМИЯ
Наиболее распространенная хирургическая причина
рвоты и гастроинтестинальной обструкции у
новорожденных — гипертрофический пилоростеноз.
Лапароскопический доступ для пилоромиотомии был описан
в 1991 г. [31], и в настоящее время растущая
доказательная база подтверждает безопасность, эффективность
и косметические преимущества этой минимально инва-
зивной методики в сравнении с традиционной открытой
пилоромиотомией. Обзор ранних исследований,
посвященных лапароскопической пилоромиотомии, показал
лучший косметический эффект, равные эффективность
и частоту осложнений [32]. Однако последующие
ретроспективные обзоры выявили повышенное количество
осложнений, более длительное время операции и более
высокие расходы на лечение с помощью минимально
инвазивного доступа [33, 34]. В других исследованиях
показали одинаковое время операции и укорочение
периода выздоровления после лапароскопической
пилоромиотомии [35,36]. Метаанализ исследований,
сравнивающих открытую и лапароскопическую пилоромиото-
мию, показал, что открытая операция характеризуется
меньшим количеством осложнений, но более
длительным временем до начала полного кормления и большей
продолжительностью госпитализации, чем
лапароскопическая операция [37]. Недавно проведенное
рандомизированное контролируемое исследование, которое
сравнивало два этих доступа, не продемонстрировало
значительных различий в продолжительности
операции, времени до начала полного кормления,
продолжительности госпитализации и частоте возникновения
осложнений между двумя группами. У пациентов,
которые подверглись лапароскопической операции, реже
отмечались приступы рвоты, им реже требовалась
послеоперационная аналгезия [38]. Другое
рандомизированное исследование проводится в настоящее время,
но большинство детских хирургов считают оба
доступа безопасными и эффективными при лечении стеноза
привратника.
Лапароскопическая пилоромиотомия требует
только одного 3-5-миллиметрового порта для камеры,
который обычно устанавливают через пупочный дефект
апоневроза. Инструменты вводят в брюшную полость
через два разреза — в правом и левом верхнем
квадранте живота. Эти разрезы необходимо расположить
ниже уровня печени новорожденного, которая может
кровоточить при минимальной травме. Хирург
фиксирует двенадцатиперстную кишку с помощью атрав-
матического зажима, который он держит в левой руке,
и рассекает серозную оболочку привратника артроско-
пическим ножом. Этот разрез должен
распространяться от пилорической вены Мейо, которая служит
ориентиром пилородуоденального соустья, далеко в сторону
антрального отдела желудка. Лезвие артроскопическо-
го ножа втягивают и вращают тупой конец ножа в этом
разрезе, чтобы расщепить гипертрофированные
мышцы до белой, сверкающей подслизистой оболочки.
Миотомию завершают по всей ее длине с помощью пило-
рического расширителя (рис. 26-1). У большинства
новорожденных адекватной считают миотомию длиной
2 см [39], но информацию для предоперационного
планирования может дать и предоперационное
измерение длины пилорического канала с применением УЗИ.
Целостность слизистой оболочки можно подтвердить
путем инсуффляции 20-30 мл воздуха в желудок через
назогастральную трубку, «выдаивая» этот воздух
поперек зоны миотомии.
Каким бы доступом ни проводили пилоротомию,
открытым или лапароскопическим, важно провести
новорожденному адекватную интенсивную терапию
и полностью возместить все электролитные
нарушения перед операцией. Интенсивность кормления
обычно медленно увеличивают, начиная с 4-6 ч после
операции, а родителей следует предупредить, что
после операции возможна рвота.
Глава 26. Педиатрическая эндохирургия 315
ОПЕРАЦИЯ
ГАСТРОСТОМИЯ
Гастростомический дренаж устанавливают у детей
по различным показаниям, включая неврологические
нарушения с глотательной дисфункцией,
онкологические заболевания или другие хронические заболевания,
требующие поддерживающего питания, а также
неспособность питаться через рот при патологии головы
и шеи и травмах. Установить гастростому можно с
помощью лапаротомии, лапароскопии или перкутанно-
го доступа. Перкутанная эндоскопическая гастросто-
мия часто становится операцией выбора у взрослых,
но у маленьких детей она имеет намного более
высокий риск развития осложнений: перфорации
ободочной кишки, перитонита и кровотечения [40].
Лапароскопическая гастростомия позволяет непосредственно
осмотреть желудок, снижая риск перфорации полых
органов, и способствует идеальной установке
дренажа. Этот метод можно применять у новорожденных
с небольшой массой тела (<2кг), которые могут не
перенести эндоскопию гибким инструментом; и часто
для того, чтобы избежать второй анестезии для смены
дренажа, делают баллонную гастростомию во время
первичной операции.
Было описано несколько методик
лапароскопической гастростомии [41-43]. В области пупка или через
инфраумбиликальный срединный разрез (у
маленьких детей) устанавливают 2-, 3- или 5-миллиметровый
порт для камеры. Для осмотра желудка вводят
30-градусный лапароскоп, а для установки дренажа
выбирают соответствующее место в левом верхнем квадранте.
Обычно дренаж располагают примерно на середине
расстояния между уровнем пупка и реберной дугой,
осторожно, чтобы поместить трубку как минимум
на 2 см ниже края реберной дуги. Поскольку эластич-
Рис. 26-1. Лапароскопическая пилоромиотомия.
Гипертрофированный мышечный слой привратника
разделяют с помощью лапароскопического пилорического
расширителя до лежащего под ним подслизистого слоя.
ная детская брюшная стенка может значительно
растягиваться при инсуффляции, полезно маркировать
потенциальное место для выведения гастростомической
трубки перед наложением пневмоперитонеума.
Некоторые хирурги устанавливают 5-миллиметровый порт
в месте будущего расположения дренажа, в то время
как другие вводят инструменты без троакаров, через
маленький разрез. С помощью лапароскопического
граспера или зажима Бэбкока желудок
подтягивают к передней брюшной стенке. Отверстие в желудке
для дренажа должно находиться на достаточном
расстоянии от привратника, чтобы избежать обструкции
выходного отверстия желудка. Многие хирурги
выбирают место вдоль большой кривизны, а другие
предпочитают малую кривизну, чтобы снизить вероятность
возникновения гастроэзофагеального рефлюкса [42].
Желудок можно вытянуть наружу через разрез
в левом верхнем квадранте, что позволит наложить
фасциальные швы для фиксации желудка к передней
брюшной стенке и кисетный шов в месте гастростомы;
эта методика очень напоминает традиционную
гастростомию по Stamm. В качестве альтернативы желудок
можно фиксировать к передней брюшной стенке с
помощью трансабдоминальных швов, используя четыре
Т-фиксатора и два U-образных шва [41, 43]. Используя
этот доступ, гастростомическую трубку
устанавливают по Сельдингеру. Желудок раздувают воздухом через
назогастральный зонд и пунктируют иглой, введенной
через разрез брюшной стенки. В желудок проводят
J-образный проводник и последовательно дилатируют
гастростому. Гастростомический дренаж
соответствующего размера с баллоном устанавливают по
проводнику и раздувают баллон. На рис. 26-2 показана
лапароскопическая установка гастростомического дрена-
316 Лапароскопическая хирургия. Атлас
жа с помощью U-образных швов. Положение трубки
можно верифицировать визуально и путем раздувания
желудка через назогастральный зонд, демонстрируя,
что воздух выходит через гастростомический дренаж.
Перед затягиванием трансабдоминальных швов
необходимо провести десуффляцию брюшной полости,
чтобы быть уверенными, что желудок остается
фиксированным к передней брюшной стенке.
Трансабдоминальные швы удаляют через 2-5 дней после операции.
Некоторые хирурги ожидают восстановления функции
кишечника, прежде чем начать послеоперационное пе-
АНТИРЕФЛЮКСНЫЕ ОПЕРАЦИИ
Гастроэзофагеальный рефлюкс — распространенная
проблема у новорожденных и детей, особенно при
неврологических нарушениях. Антирефлюксные
операции показаны пациентам с такими осложнениями
рефлюксной болезни, как аспирационная пневмония,
задержка роста, прогрессирование болезни легких,
эзофагит или неудачно проведенная медикаментозная
терапия.
Необходимость выполнения антирефлюксной
операции у новорожденных с неврологической
патологией и детей, которым требуется гастростомия для
питания, — спорный вопрос. У многих из этих детей
имеется гастроэзофагеальный рефлюкс, и установка гастро-
роральное или дренажное кормление, но при
отсутствии осложнений питание можно начинать, как
только ребенок проснется после операции.
У детей и подростков, которые имеют толстые
брюшные стенки (>2 см) или абдоминальные операции
в анамнезе, лучшим методом гастростомии считается
лапароскопически ассистированная перкутанная
эндоскопическая гастростомия. Тридцатиградусный
лапароскоп, введенный через пупочный порт,
позволяет провести безопасную и аккуратную гастростомию
с помощью перкутанной методики [44].
Рис. 26-2. Лапароскопическая гастростомия
с использованием U-образных швов. А —
трансабдоминальными швами подтягивают желудок
к передней брюшной стенке и в просвет желудка вводят
иглу. Б — после последовательного бужирования
отверстия в желудке по проводнику устанавливают
баллонный гастростомический дренаж, баллон раздувают.
В — трансабдоминальные U-образные швы затягивают
для фиксации трубки.
стомы с фиксацией желудка к передней брюшной
стенке может повредить нижний пищеводный сфинктер,
что предрасполагает к развитию рефлюкса [45].
Некоторые хирурги рекомендуют проводить защитные
антирефлюксные операции при установке гастростомы
[46], но клинический анализ заставляет предпочесть
проведение гастростомии без защитной
антирефлюксной операции у детей с неврологической патологией
без предоперационных признаков рефлюкса [47]. У
детей с неврологической патологией отмечаются высокие
летальность и частота послеоперационных
осложнений, связанные с фундопликацией, хотя большинство
осложнений — результат основного заболевания
пациента, а не самой операции [48]. Большинство детских
Глава 26. Педиатрическая эндохирургия 317
хирургов предпочитают выделять пациентов с высокой
степенью риска и проводить фундопликацию только
у детей с рефлюксом, подтвержденным
предоперационными контрастными исследованиями желудочно-
кишечного тракта или рН-мониторингом [47, 48].
Наиболее распространенная антирефлюксная
операция у детей — лапароскопическая фундопликация
Ниссена, и ее основные этапы у детей и взрослых не
отличаются. Новорожденных и маленьких детей
укладывают на ножной конец операционного стола в позу
лягушки. Троакар для камеры устанавливают в области
пупка, печеночный ретрактор — через троакар,
расположенный высоко в эпигастрии или в правом верхнем
квадранте. Хирурги могут предпочитать разные места
установки портов, но в общем эти троакары должны
образовывать равнобедренный треугольник с
рабочими портами в основании и пищеводным отверстием
в области верхушки. Размером ребенка определяется
уровень установки рабочих портов, так как это важно
для выбора места на адекватном расстоянии от
пищеводного отверстия, чтобы проводить манипуляции
без усилий. Если планируется сопутствующая
установка гастростомы, для установки дренажа нужно выбрать
одно из отверстий для портов. Большинство хирургов
используют для этой операции пять 3- и
5-миллиметровых троакаров, но у маленьких худых
новорожденных и детей можно провести эту операцию с
одним портом для камеры и разрезами брюшной стенки
для остальных инструментов [49]. У новорожденных
короткие желудочные сосуды можно пересечь с
помощью электрокрючка. 360-градусную манжетку
формируют вокруг пищеводного бужа, соответствующего
по размерам массе тела пациента (рис. 26-3),
рекомендуемая длина манжетки составляет 2 см [50].
Фундопликация по Талю, передняя 180-градусная
манжетка, — другая распространенная
антирефлюксная операция, проводимая у детей, особенно со слабой
перистальтикой пищевода, так как частичная манжетка
снижает риск послеоперационной дисфагии, которая
может отмечаться после фундопликации по Ниссену.
Установка троакаров при обеих операциях, первые этапы
мобилизации дистального отдела пищевода и закрытие
пищеводного отверстия не различаются. При операции
по Талю обычно не требуется пересечения коротких
желудочных сосудов, если только дно не очень маленькое.
Фундопликацию формируют, подшивая дно желудка
к пищеводу, начиная с желудочно-пищеводного соустья
вдоль большой кривизны и продолжая кпереди и
затем книзу, на правую сторону пищевода для
завершения 180-градусной фундопликации. Операции
лапароскопической фундопликации по Ниссену, Талю и Тупе
имеют сходные отдаленные результаты, и при наличии
рефлюкса у ребенка можно применить любую из них,
основываясь на характеристиках пациента и опыте
хирурга [51, 52].
Рекомендуемый размер бужей
в соответствии с массой тела пациента
Масса, кг Размер бужа, French
2,5-4,0
4,0-5,5
5,5-7,0
7,0-8,5
8,5-10,0
10-15
20-24
24-28
28-32
32-34
34-36
36-40
Рис. 26-3. Рекомендуемый размер бужей в соответствии
с массой тела пациента.
ПАХОВАЯ ГЕРНИОРАФИЯ
Пластика паховой грыжи — одна из наиболее
распространенных хирургических операций в детской
хирургии. Грыжи у детей возникают при наличии необ-
литерированного влагилищного отростка у мальчиков
и канала Нука у девочек. Такие дефекты легко
поддаются лечению с помощью высокого лигирования
грыжевого мешка через маленький разрез, так как
внутреннее и наружное кольца у детей расположены очень
близко друг от друга.
Лапароскопию применяют для осмотра
противоположной стороны у пациентов с односторонними
паховыми грыжами. На рис. 26-4 показана
лапароскопическая картина внутреннего пахового кольца с грыжей
и без нее. При наличии грыжи с другой стороны обычно
проводят ее пластику открытым доступом, хотя
описана игольная (needlescopic) герниорафия с перкутанным
высоким лигированием грыжевого мешка [53]. Вопрос
о необходимости осмотра противоположной стороны
остается спорным. Двусторонние грыжи чаще
встречаются у детей, особенно недоношенных, чем у
взрослых. Риск пропущенной грыжи и повторной анестезии
может перевешивать опасность осложнений пахового
лапароскопического доступа с возможностью
повреждения структур семенного канатика. В нескольких
крупных исследованиях продемонстрировали
безопасность и эффективность лапароскопической ревизии
противоположного пахового канала через грыжевой
мешок, и их авторы поддерживают проведение этой
процедуры, основываясь на большом количестве не-
диагностированных и бессимптомных грыж, особенно
у маленьких детей [54-56]. Анализ принятия решений,
сравнивающий морбидность, летальность и стоимость
наблюдения при обычной открытой противоположной
паховой ревизии и лапароскопии, показал
преимущества наблюдения, несмотря на то что возможность
наличия грыжи с другой стороны была высокой [57].
В ранних сообщениях о ревизии с
противоположной стороны описывали двустороннюю ревизию через
маленький троакар, часто установленный в области
пупка [58], но на сегодняшний день общепринятой
318 Лапароскопическая хирургия. Атлас
Рис. 26-4. Вид внутреннего пахового кольца при
лапароскопии. А — большая левосторонняя паховая грыжа
у подростка. Семявыносящий проток и семенные сосуды видны
у медиального края кольца. Б — левый необлитерированный
считается ревизия через грыжевой мешок [59].
Грыжевой мешок вскрывают и устанавливают в брюшную
полость троакар диаметром от 2 до 4 мм, фиксируя его
лигатурой, наложенной на основание грыжевого
мешка. Создают пневмоперитонеум с низким давлением
и исследуют противоположный грыжевой регион с
помощью 70-градусной камеры, введенной в брюшную
полость. Даже если визуализация противоположной
стороны невозможна, грыжу с другой стороны иногда
можно обнаружить после инсуффляции, когда
паховый канал и мошонка наполняются газом.
ОПЕРАЦИИ ПРИ БОЛЕЗНИ ГИРШПРУНГА
Болезнь Гиршпрунга, или врожденный аганглионар-
ный мегаколон, характеризуется отсутствием ган-
глионарных клеток в миэнтерическом и подслизистом
сплетениях дистального отдела кишечника, что
приводит к функциональной непроходимости.
Пораженная кишка может иметь различную длину, начинаясь
от ануса. Лечение хирургическое, заключается в
резекции аганглионарной кишки с низведением
вышележащей кишки со страховочной колостомой или без нее.
Сообщают о проведении традиционных операций
Swenson, Soave и Duhamel лапароскопическим
доступом [60].
Отличные результаты демонстрируют операции
по первичному низведению кишки без страховочной
колостомы с лапароскопической ассистенцией, они
уже стали стандартом хирургического лечения болез-
влагалищный отросток у новорожденного. В — нормальное
правое паховое кольцо без функционирующего влагалищного
отростка у новорожденного.
ни Гиршпрунга. Лапароскопическая ассистенция
обеспечивает отличную визуализацию тазовой анатомии
с ограничением травмы промежности и
контаминации, а уровень пересечения кишки перед
низведением может быть установлен с помощью исследования
серозно-мышечных биоптатов. У пациентов, которые
подвергаются лапароскопическим операциям,
отмечаются меньший дискомфорт, раннее восстановление
функции кишечника и более короткая
продолжительность операции по сравнению с детьми, перенесшими
открытые операции [61-65]. Первичное низведение
противопоказано новорожденным или детям с
выраженными энтероколитами, сопутствующими
заболеваниями, угрожающими жизни, и при поздней
диагностике, приводящей к выраженной дилатации
проксимального отдела кишечника. Таким пациентам
показана уровневая колостомия. Впоследствии
проводят эндоректальное низведение с лапароскопической
ассистенцией, которое дает хорошие результаты [66].
Georgeson et al. [63] опубликовали технику Soave-
подобного лапароскопически ассистированного эндо-
ректального низведения в 1999 г.; эта операция и
сегодня оказывается наиболее распространенным
вмешательством при первичной коррекции болезни
Гиршпрунга. Диагноз болезни Гиршпрунга подтверждают
перед операцией с помощью аспирационной или пол-
нослойной ректальной биопсии. Новорожденного
на операционном столе можно расположить
поперечно, хирург будет стоять над его головой, а более стар-
Глава 26. Педиатрическая эндохирургия 319
ших детей укладывают в литотомическое положение,
хирург стоит справа по отношению к пациенту. В
зависимости от размера ребенка выбирают 3- или
5-миллиметровый порт. Порт для камеры устанавливают
в области пупка или ниже края печени в правом
верхнем квадранте, а рабочие порты располагают в левом
верхнем и правом нижнем квадрантах. Если нужно,
для обнажения и ретракции ободочной кишки можно
использовать надлобковый порт.
Переходную зону между расширенным
гипертрофированным проксимальным отделом кишечника и
подвергшимся декомпрессии аганглионарным дистальным
сегментом визуализируют и подтверждают данными
серозно-мышечной биопсии, проведенной с помощью
лапароскопических ножниц (рис. 26-5). При наличии
длинного пораженного сегмента большинство детских
хирургов предпочитают формирование колостомы
с отсроченными резекцией и низведением. Во время
ожидания результатов биопсии можно мобилизовать
дистальный отдел прямой кишки. Верхние
ректальные сосуды рассекают монополярным коагулятором
или ультразвуковым скальпелем, а аганглионарный
сегмент мобилизуют по окружности близко к стенке
прямой кишки. Диссекцию продолжают тупым путем
в бессосудистом слое сзади и на 1-2 см ниже брюшины
дугласова кармана спереди. Для того чтобы избежать
ненужной диссекции, формирование кишечной ножки
начинают только после того, как будет найден
гистологически нормальный уровень кишечника,
содержащий ганглионарные клетки. Брыжейку ободочной
кишки мобилизуют в проксимальном направлении
с сохранением краевой артерии до тех пор, пока кишка,
имеющая нервные узлы, не сможет дотянуться до таза
без натяжения.
Промежностную диссекцию начинают, рассекая
слизистую оболочку прямой кишки на 1-2 см проксималь-
нее зубчатой линии и накладывая тонкие тракционные
швы на проксимальный край слизистой оболочки.
Круговую мобилизацию в подслизистом слое продолжают
в проксимальном направлении, применяя диссекцию
тупым путем и электрокоагуляцию. После достижения
уровня внутренней диссекции входят в брюшную
полость по задней поверхности и соединяют по кругу слои
диссекции. Многие хирурги рассекают мышечный слой
прямой кишки по задней поверхности в целях
увеличения пространства для ректального резервуара. Кишку
выводят через анус и пересекают проксимальнее
уровня биопсии, подтверждающей отсутствие патологии
и наличие ганглионарных клеток. С помощью тонких
непрерывных рассасывающихся лигатур проводят
однослойный анастомоз между новой прямой кишкой
и анальным каналом. Для осмотра кишечной ножки
и выявления кровотечения, перекрута или внутренней
грыжи снова создают пневмоперитонеум.
Послеоперационный уход зависит от предпочтений
хирурга. Детей можно будет кормить после
восстановления функции кишечника и выписывать, если они
переносят обычную диету. Часто проводят анальные
дилатации, которые начинают через 2-3 нед после
операции.
Рис. 26-5. Лапароскопическая серозно-мышечная биопсия
кишечника при болезни Гиршпрунга. Переход между
дилатированным нормальным кишечником и аганглионарной
кишкой идентифицируют после декомпрессии; серозно-
мышечные биопсии таким детям проводят с помощью
3-миллиметровых инструментов (собственность Dr.
Harold N. Lovvorn, MD).
ОПЕРАЦИЯ
320 Лапароскопическая хирургия. Атлас
РЕКОНСТРУКЦИЯ ВЫСОКОГО
НЕПЕРФОРИРОВАННОГО АНУСА
С ЛАПАРОСКОПИЧЕСКОЙ АССИСТЕНЦИЕЙ
Понятие «неперфорированный анус» включает ряд
аномалий. «Низкие» аномалии (такие как
неперфорированный анус с промежностным свищом,
который открывается спереди от сфинктерного
механизма) реконструируют с помощью задней сагиттальной
аноректопластики. При «высокой» аномалии прямая
кишка обычно заканчивается свищом, который
соединяется с шейкой мочевого пузыря или уретрой, и
традиционно для лигирования свища перед низведением
кишки и аноректопластикой требуется лапаротомия.
Лапароскопический доступ позволяет рассечь
фистулу и аккуратно провести прямую кишку через тазовую
мускулатуру во время низведения [67]. В некоторых
исследованиях была подтверждена возможность
проведения лапароскопии для ассистенции при
низведении при высоком неперфорированном анусе и
показаны хорошие ранние результаты этой операции [68-70].
Дивертикул уретры — редкое осложнение [71].
Эффективность этой операции будет в итоге определена
частотой возникновения таких отдаленных осложнений,
как недержание кала и запоры.
Новорожденных с высоким неперфорированным
анусом первоначально подвергают колостомии со
слизистым свищом. Перед реконструктивной операцией
проводят контрастирование кишки через колостому
для определения длины дистального отдела ободочной
кишки и локализации свища. Живот и промежность
обрабатывают и устанавливают катетер Фолея.
Лапароскопическую мобилизацию ободочной кишки и лигирова-
ние свища проводят с помощью трех лапароскопических
портов диаметром от 3 до 5 мм, установленных в верхних
ОПЕРАЦИЯ
Рис. 26-6. Низведение с лапароскопической ассистенцией
при высоком неперфорированном анусе. А — дистальный
отдел прямой кишки мобилизуют в направлении уретрального
свища. Б — свищ пересекают ножницами и лигируют
отделах живота. Расположение и размер портов
определяются массой тела ребенка. Иногда для ретракции
ободочной кишки или мочевого пузыря необходим
четвертый порт. Мезоректум рассекают с помощью
электроинструментов или ультразвуковой коагуляции, начиная
с кармана брюшины. Конусообразно суживающуюся
прямую кишку прослеживают в дистальном
направлении до свища, соединенного с уретрой или шейкой
мочевого пузыря (рис. 26-6). Свищ лигируют с помощью
клипс или эндоскопических петель и пересекают.
Прямую кишку мобилизуют в проксимальном направлении,
чтобы она могла достичь таза без натяжения. Для
определения границ сфинктерного механизма применяют
транскутанную анальную стимуляцию и в этом месте
делают разрез длиной 8-10 мм. Проводят диссекцию
тупым путем в интрасфинктерном слое, для этого можно
применять радиально расширяющийся 10- или
12-миллиметровый лапароскопический порт, который вводят
со стороны промежностного разреза через центр лоно-
копчиковой мышцы под лапароскопическим контролем.
Мобилизованную прямую кишку протягивают через
неоанус после удаления троакара и формируют анорек-
тальный анастомоз с помощью тонких отдельных швов.
Затем повторно создают пневмоперитонеум для того,
чтобы осмотреть низведенную кишку и исключить ее
перекрут либо при необходимости фиксирования
прямой кишки к пресакральной фасции [67].
Большинство новорожденных могут начать
самостоятельное питание через несколько дней после
операции, так как у них имеется отводящая колостома.
Бужирование анального канала начинают через 2 нед
после операции. Колостому можно закрывать, когда
новорожденный достигнет нормальных для его
возраста размеров.
эндоскопической петлей. В — дистальный отдел прямой кишки
протягивают через центр мышц таза под лапароскопическим
контролем. Над прямой кишкой визуализируется
лигированный свищ (собственность Dr. Harold N. Lovvorn, /WD).
Глава 26. Педиатрическая эндохирургия 321
ОСНОВНЫЕ ТОРАКОСКОПИЧЕСКИЕ
ОПЕРАЦИИ, ПРИМЕНЯЕМЫЕ В ДЕТСКОЙ
ХИРУРГИИ
Видеоторакоскопические операции — безопасные
и эффективные процедуры при широком спектре
заболеваний у новорожденных и детей и имеют низкий
процент конверсии в торакотомию [72].
Преимущества минимально инвазивного доступа при патологии
грудной клетки — отсутствие косметических и
функциональных осложнений торакотомии, снижение
интенсивности послеоперационных болей и более
быстрое выздоровление после операции. Показаниями
к лапароскопии у детей служат врожденные аномалии,
эмпиема, спонтанный пневмоторакс,
диагностированные новообразования легких или метастатическая
болезнь, а также необходимость биопсии у
пациентов с необъяснимой дыхательной недостаточностью
или инфильтратами в легких. При различных
злокачественных опухолях грудной полости у детей с успехом
проводят их биопсию и резекцию [73-75], но
некоторые хирурги рекомендуют открытую торакотомию
для оценки распространенности заболевания при
такой патологии, как метастатическая остеогенная
саркома, при которой, как известно, рентгенологическими
методами можно недооценить количество метастазов.
При первичных мелких опухолях или метастазах,
которые было бы трудно выявить вследствие
невозможности пальпации, предпочтительно уточнять их
локализацию с помощью иглы. При секвестрации легких,
врожденной аденоматоидной кистозной аномалии,
бронхоэктазах, долевой эмфиземе и очаговых
злокачественных опухолях рекомендуется резекция доли
легкого [72, 76, 77]. Методика этих операций аналогична
применяемой у взрослых пациентов. Кроме того, детям
можно торакоскопически удалять метастазы или
проводить их биопсию [78, 79].
Оценка патологии дыхательных путей предельно
важна при осуществлении предоперационной
диагностики перед торакальными операциями. Образования
средостения могут вызывать критическую
обструкцию дыхательных путей, особенно после общей
анестезии. К факторам риска, предрасполагающим к
возникновению обструкции дыхательных путей у детей
с образованиями средостения, относятся наличие трех
или более респираторных признаков или симптомов
(например, кашля, поверхностного дыхания, ортопноэ,
плеврального выпота, стридора или дыхательной
недостаточности), признаки сдавления трахеи или сосудов
(например, верхней полой вены или левого предсердия
или наличие перикардиального выпота) и
послеоперационная инфекция [80]. Если имеются обоснованные
подозрения о наличии сдавления дыхательных путей,
лучше предпочесть местную или регионарную
анестезию или отсрочить проведение биопсии или резекции
до тех пор, пока объем опухоли не уменьшится в
результате неоадъювантной терапии.
Правильная укладка пациента и установка
троакаров имеют первостепенную важность и зависят
от вида планируемой операции. Для большинства
торакальных операций ребенка укладывают в положение
на боку. Однако для резекции образований переднего
или заднего средостения хирург может укладывать
пациента соответственно на спину или живот. Троакар
для камеры необходимо устанавливать немного
кпереди от средней подмышечной линии при образованиях
заднего средостения и кзади от средней подмышечной
линии при образованиях переднего средостения и
ворот легких.
Доступ в плевральную полость проводят с помощью
методики cutdown. Делают разрез кожи, затем тупым
путем разводят мягкие ткани и мышцы в межреберном
промежутке и вводят троакар непосредственно в
плевральную полость без туннелирования. При многих то-
ракоскопических операциях инсуффляция не нужна,
особенно если проводят раздельную вентиляцию
одного легкого. Если требуется инсуффляция, обычно
достаточно давления 5 мм рт.ст. Часто инструменты можно
было ввести непосредственно через грудную стенку,
что позволяло получить большую свободу движений,
чем при использовании торакоскопических портов.
В завершение операции можно установить дренажную
трубку через отверстие для одного из троакаров. Если
легкое не было повреждено, многие хирурги
предпочитают эвакуировать пневмоторакс и накладывать окклю-
зионную повязку вместо установки дренажа.
Торакоскопическая декортикация
Эмпиема встречается примерно у 2-8% детей,
госпитализированных по поводу пневмонии, и
традиционно ее лечат с помощью антибиотиков и торакоцентеза
или дренирования с помощью плеврального дренажа.
В настоящее время стандартом помощи при
эмпиеме у взрослых считают видеоторакоскопическую
декортикацию, а современные данные свидетельствуют
в пользу применения этого доступа и у детей. Два ме-
таанализа и недавно проведенное
рандомизированное контролируемое исследование показали снижение
продолжительности госпитализации, времени
дренирования плевральной полости, количества
необходимых рентгенограмм и дополнительных оперативных
вмешательств в случае выполнения первичной
лапароскопической декортикации по сравнению с торако-
томическим дренированием или только антибиотико-
терапией у детей с парапневмоническим выпотом [81-
83]. Ранняя (то есть ранее 4 дней после установления
диагноза) декортикация снижает продолжительность
госпитализации и количество интра- и
послеоперационных осложений, поэтому попытки неоперативного
лечения должны быть ограничены [84, 85].
322 Лапароскопическая хирургия. Атлас
Техника лапароскопической декортикации у детей
схожа с применяемой у взрослых. Часто нужен только
порт для камеры, а декортикация может быть
проведена с помощью инструментов, введенных через один
или более разрезов в стенке грудной клетки. Инсуф-
фляция с положительным давлением необходима
редко. Отличный инструмент для удаления фибринозного
экссудата у новорожденных и детей — изогнутый
зажим для желчной хирургии. Он меньше, чем зажим
для тупфера, который применяют у взрослых, и
обеспечивает доступ под разными углами из одного
разреза. В конце операции устанавливают один или
более плевральных дренажей через разрезы для портов
или отдельные разрезы.
Торакоскопический плевродез
и резекция булл
Видеоторакоскопия с резекцией булл и плевродезом —
радикальный метод лечения спонтанного
пневмоторакса; оперативная техника у взрослых и детей не
отличается. Вопрос о необходимости операции при
первичных симптомах, или при рецидивном
пневмотораксе, или при неэффективности плеврального
дренирования остается спорным. Одно из исследований,
проведенных детскими хирургами, показало, что
первичная операция приводит к снижению морбидности
и стоимости лечения [86]. Другие анализы принятия
решения и ценовой эффективности показали, что
операция при впервые произошедшем спонтанном
пневмотораксе — безопасный и выгодный по стоимости
подход [87, 88]. Многие детские хирурги
устанавливают детям плевральные дренажи в условиях
операционной под общей анестезией. В этих случаях, возможно,
было бы разумным ввести камеру через место
планируемой торакостомии и резецировать очевидно
имеющиеся буллы.
Торакоскопическая пластика
врожденных диафрагмальных грыж
К врожденным диафрагмальным грыжам относятся
задне-латеральные дефекты (грыжи Бохдалека),
обычно встречаемые при респираторном дистресс-синдроме
у новорожденных, и передне-медиальные дефекты
(грыжи Морганьи), которые обычно не имеют
симптомов и часто обнаруживаются случайно при
рентгенографии грудной клетки позднее, во взрослом возрасте.
Минимально инвазивный доступ применяют для
пластики обоих дефектов.
Грыжи Бохдалека сопровождаются гипоплазией
легких, и многие новорожденные при появлении на свет
имеют опасные для жизни легочную гипертензию
и сердечно-легочную недостаточность. Торакоскопи-
ческую пластику можно выполнять только клинически
стабильным новорожденным, которые смогут
перенести физиологические эффекты плевральной инсуф-
фляции. В ходе одного из исследований были
определены следующие критерии успешности минимально ин-
вазивной пластики: интактное пищеводное отверстие,
расположение печени в брюшной полости, что можно
установить с помощью рентгенографии брюшной
полости, и максимальная дыхательная поддержка с
пиковым давлением вдоха 24 мм рт.ст. [89]. Для пластики
новорожденного укладывают в полубоковое
положение и устанавливают три порта: один в шестом межре-
берье ниже сосковой линии, один в пятом или шестом
межреберном промежутке по срединно-подмышечной
линии и один ниже лопатки. Для выведения
содержимого брюшной полости из грудной используют инсуф-
фляцию с давлением 5-6 мм рт.ст. Дефект ушивают
отдельными лигатурами 2-0 или 3-0. При
необходимости латеральные швы можно провести вокруг ребер
и завязать экстракорпорально в подкожных тканях.
По окончании операции избыточный воздух удаляют
из плевральной полости и устанавливают тонкий
катетер «свиной хвостик» или плевральный дренаж —
на усмотрение оперирующего хирурга [89, 90].
Пластику грыж Морганьи обычно проводят лапа-
роскопически. Если ребенок маленький, то
оперирующий хирург стоит у ножного конца стола, а первый
ассистент — слева от пациента. Используют периум-
биликальный порт для камеры, а рабочие порты
устанавливают по левой и правой срединно-ключичной
линии, уровень установки определяется размерами
пациента (рис. 26-7). Если необходима
дополнительная ретракция, можно установить четвертый порт
по передней подмышечной линии. Грыжевой мешок
необходимо полностью иссечь с помощью
электроинструмента. Грыжевой дефект следует ушить, если
это возможно, при большой грыже используют поли-
тетрафторэтиленовый протез. Закрытие дефекта
начинают от его краев при сниженном давлении инсуф-
фляции, чтобы ограничить натяжение швов. В
сложных случаях швы, наложенные интракорпорально,
можно вывести через маленькие разрезы передней
брюшной стенки, что способствует затягиванию узлов
без натяжения [90].
Глава 26. Педиатрическая эндохирургия 323
ОПЕРАЦИЯ
Рис. 26-7. Установка троакаров при лапароскопической
пластике грыжи Морганьи у новорожденного. Наложение
трансабдоминальных швов облегчает закрытие грыжевого
дефекта (собственность Dr. Harold N. Lovvorn, /WD).
ВЫВОДЫ
Показания к лапароскопическим и торакоскопическим
операциям у детей продолжают расширяться.
Усовершенствование инструментария и хирургической
техники сделали возможной минимально инвазивную
коррекцию многих детских болезней. Наиболее точно
показания к минимально инвазивным операциям у
новорожденных и детей более старшего возраста
позволят определить правильно построенные исследования
с анализом отдаленных результатов.
СПИСОК ЛИТЕРАТУРЫ
1. Holcomb G.W., III, Rothenberg S.S., Вах К.М. A. et al.
Thoracoscopic repair of esophageal atresia and tracheoesophageal
fistula: a multi-institutional analysis // Ann. Surg. — 2005. —
Vol. 242. — P. 422-428.
2. Ostlie D.J., Holcomb G.W., III The use of stab incisions for
instrument access in laparoscopic operations // J. Pediatr. Surg. —
2003. — Vol. 38. — P. 1837-1840.
3. Mc Honey M., Corizia L., Eaton S. et al. Carbon dioxide elimination
during laparoscopy in children is age dependent // J. Pediatr.
Surg. — 2003. — Vol. 38. — P. 105-110.
4. Kalfa N., Allal H., Raux O. et al. Tolerance of laparoscopy and
thoracoscopy in neonates // Pediatrics. — 2005. — Vol. 116.—
P. 785-791.
5. Gomez Dammeier B.H., Karanik E., Gluer S. et al. Anuria during
pneumo-peritoneum in infants and children: a prospective study //
J. Pediatr. Surg. — 2005. — Vol. 40. — P. 1454-1458.
6. Bannister C.F., Brosius K.K., Wulkan M. The effect of insufflation
pressure on pulmonary mechanics in infants during laparoscopic
surgical procedures // Paediatr. Anaesth. — 2003. — Vol. 13. —
P. 785-789.
7. Stemm K. Endoscopic appendectomy // Endoscopy. — 1983. —
Vol. 15. — P. 59.
8. Gilchrist B.F., Lobe Т.Е., Schropp K.P. et al. Is there a role for
laparoscopic appendectomy in pediatric surgery? // J. Pediatr.
Surg. — 1992. — Vol. 27. — P. 209-212.
9. Ure B.M., Spangenberger W., Hebebrand D. et al. Laparoscopic
surgery in children and adolescents with suspected appendicitis:
Results of medical technology assessment // Eur. J. Pediatr. Surg. —
1992. — Vol. 2. — P. 336-340.
10. el Ghoneimi A., Valla J.S., Limonne B. et al. Laparoscopic
appendectomy in children: report of 1379 cases // J. Pediatr.
Surg. — 1994. — Vol. 29. — P. 786-789.
11. Bufo A.J., Shah R.S., Li M.H. et al. Interval appendectomy for
perforated appendicitis in children // J. Laparoendosc. Adv. Surg.
Tech. A. — 1998. — Vol. 8. — P. 209-214.
12. Gillick J., Velayudham M., Puri P. Conservative management of
appendix mass in children // Br. J. Surg. — 2001. — Vol. 88. —
P. 1539-1542.
13. Kogut K.A., Blakely M.L., Schropp K.P. et al. The association of
elevated percent bands on admission with failure and complications
of interval appendectomy // J. Pediatr. Surg. — 2001. — Vol. 36. —
P. 165-168.
14. Nadler E.R, Reblock K.K., Vaughan K.G. et al. Predictors of
outcome for children with perforated appendicitis initially treated
with non-operative management // Surg. Infect. (Larchmt). —
2004. — Vol. 5. — P. 349-356.
15. Vane D.W., Fernandez N. Role of interval appendectomy in
the management of complicated appendicitis in children //
World J. Surg. — 2006. — Vol. 30. — P. 51-4.
324 Лапароскопическая хирургия. Атлас
16. Weber T.R., Keller M.A., Bower R.J. et al. Is delayed operative
treatment worth the trouble with perforated appendicitis is
children? // Am. J. Surg. — 2003. — Vol. 186. — P. 685-688.
17. Ein S.H., Langer J.C., Daneman A. Nonoperative management of
pediatric ruptured appendix with inflammatory mass or abscess:
presence of an appendicolith predicts recurrent appendicitis //
J. Pediatr. Surg. — 2005. — Vol. 40. — P. 1612-1615.
18. Karaca I. Altintoprak Z., Karkiner A. et al. The management
of appendiceal mass in children: is interval appendectomy
necessary? // Surgery. — 2001. — Vol. 31. — P. 675-677.
19. Hochberger J., Lamade W. Transgastric surgery in the abdomen: the
dawn of a new era? // Gastrointest. Endosc. — 2005. — Vol. 62. —
P. 293-296.
20. Malik A., Mellinger J.D., Hazey J.W. et al. Endoluminal and
transluminal surgery: current status and future possibilities // Surg.
Endosc. — 2006. — Vol. 20. — P. 1179-1192.
21. Sumiyama K., Gostout C.J., Rajan E. et al. Pilot study of the porcine
uterine horn as an in vivo appendicitis model for development of
endoscopic transgastric appendectomy // Gastrointest. Endosc. —
2006. — Vol. 64. — P. 808-812.
22. Holcomb G.W., III, Morgan W.M., III, Neblett W.W., III et al.
Laparoscopic cholecystectomy in children: lessons learned from the
first 100 patients // J. Pediatr. Surg. — 1999. — Vol. 34. — P. 1236-
1240.
23. Miltenburg D.M., Schaffer R., Ill, Breslin T. et al. Changing
indications for pediatric cholecystectomy // Pediatrics. — 2000. —
Vol. 105. — P. 1250-1253.
24. Campbell B.T., Narasimhan N.P., Golladay E.S. et al. Biliary
dyskinesia: a potentially unrecognized cause of abdominal pain in
children // Pediatr. Surg. Int. — 2004. — Vol. 20. — P. 579-581.
25. Vegunta R.K., Raso M., Pollock J. et al. Biliary dyskinesia: the most
common indication for cholecystectomy in children // Surgery. —
2005. — Vol. 138. — P. 726-731.
26. Balaguer E.J., Price M.R., Burd R.S. National trends in the
utilization of cholecystectomy in children // J. Surg. Res. — 2006. —
Vol. 134. — P. 68-73.
27. Al-Salem A.H. Should cholecystectomy be performed
concomitantly with splenectomy in children with sickle-cell
disease? // Pediatr. Surg. Int. — 2003. — Vol. 19. — P. 71-74.
28. Pappis C.H., Galanakis S., Moussatos G. et al. Experience of
splenectomy and cholecystectomy in children with chronic
hemolytic anaemia // J. Pediatr. Surg. — 1989. — Vol. 24. — P. 543-
546.
29. Torelli P., Cavaliere D., Casaccia M. et al. Laparoscopic splenectomy
for hematological diseases // Surg. Endosc. — 2002. — Vol. 16. —
P. 965-971.
30. Leandros E., Alexakis N., Albanopoulos K. et al. Hand-assisted
laparoscopic surgery with a Pfannenstiel incision in beta-
thalassemia patients: initial experience // World J. Surg. — 2006. —
Vol. 30. — P. 1216-1220.
31. Alain J.L., Grousseau D., Terrier G. Extramucosal pyloromyotomy
by laparoscopy // Surg. Endosc. — 1991. — Vol. 5. — P. 174-175.
32. Downey E.C., Jr. Laparoscopic pyloromyotomy// Semin. Pediatr.
Surg. — 1998. — Vol. 7. — P. 220-224.
33. Campbell B.T., Mc Lean K., Barnhart D.C. et al. A comparison of
laparoscopic and open pyloromyotomy at a teaching hospital //
J. Pediatr. Surg. — 2002. — Vol. 37. — P. 1068-1071.
34. Sitsen E., Bax N.M., van der Zee D.C. Is laparoscopic
pyloromyotomy superior to open surgery? // Surg. Endosc. —
1998. — Vol. 12. — P. 813-815.
35. Fujimoto T, Lane G.J., Segawa O. et al. Laparoscopic extramucosal
pyloromyotomy versus open pyloromyotomy for infantile
hypertrophic pyloric stenosis: which is better? // J. Pediatr. Surg. —
1999. — Vol. 34. — P. 370-372.
36. Scorpio R.J., Tan H.L., Hutson J.M. Pyloromyotomy: comparison
between laparoscopic and open surgical techniques //
J. Laparoendosc. Surg. — 1995. — Vol. 5. — P. 81-84.
37. Hall N.J., Van Der Zee J., Tan H.L. et al. Meta-analysis of
laparoscopic versus open pyloromyotomy // Ann. Surg. — 2004. —
Vol. 240. — P. 774-778.
38. St Peter S.D., Holcomb G.W, III, Calkins CM. et al. Open versus
laparoscopic pyloromyotomy for pyloric stenosis: a prospective,
randomized trial // Ann. Surg. — 2006. — Vol. 244. — P. 363-370.
39. Ostlie D.J., Woodall C.E., Wade K.R. et al. An effective
pyloromyotomy length in infants undergoing laparoscopic
pyloromyotomy // Surgery. — 2004. — Vol. 136. — P. 827-832.
40. Zamakhshary M„ Jamal M., Blair G.K. et al. Laparoscopic vs
percutaneous endoscopic gastrostomy tube insertion: a new
pediatric gold standard? // J. Pediatr. Surg. — 2005. — Vol. 40. —
P. 859-862.
41. Aprahamian C.J., Morgan T.L., Harmon CM. et al. U-stitch
laparoscopic gastrostomy technique has a low rate of complications
and allows primary button placement: experience with 461
pediatric procedures // J. Laparoendosc. Adv. Surg. Tech. A. —
2006. — Vol. 16. — P. 643-649.
42. Plantin I., Arnbjornsson E., Larsson L.-T. No increase in
gastroesophageal reflux after laparoscopic gastrostomy in
children // Pediatr. Surg. Int. — 2006. — Vol. 22. — P. 581-584.
43. Tomicic J.Т., Luks EL, Shalon L. et al. Laparoscopic gastrostomy in
infants and children // Eur. J. Pediatr. Surg. — 2002. — Vol. 12. —
P. 107-110.
44. Yu S.C, Petty J.K., Bensard D.D. et al. Laparoscopic-assisted
percutaneous endoscopic gastrostomy in children and adolescents //
J. Soc. Laparoendosc. Surg. — 2005. — Vol. 9. — P. 302-304.
45. Papaila J.G., Vane D.W, Colville С et al. The effect of various types
of gastrostomy on the lower esophageal sphincter // J. Pediatr.
Surg. — 1987. — Vol. 22. — P. 1198-1202.
46. Ramachandran V, Ashcraft K.W., Sharp R.J. et al. Thai
fundoplication in neurologically impaired children // J. Pediatr.
Surg. — 1996. — Vol. 31. — P. 819-822.
47. Burd R.S., Price M.R., Whalen TV. The role of protective antireflux
procedures in neurologically impaired children: a decision
analysis // J. Pediatr. Surg. — 2002. — Vol. 37. — P. 500-506.
48. Esposito C, van der Zee D.C, Settimi A., et al. Risks and benefits of
surgical management of gastroesophageal reflux in neurologically
impaired children // Surg. Endosc. — 2003. — Vol. 17. — P. 708-
710.
49. Ostlie D.J., Miller K.A., Woods R.K. et al. Single cannula technique
and robotic telescopic assistance in infants and children who
require laparoscopic Nissen fundoplication // J. Pediatr. Surg. —
2003. — Vol. 38. — P. 111-115.
50. Ostlie D.J., Miller K.A., Holcomb C.W., III. Effective Nissen
fundoplication length and bougie diameter size in young children
undergoing laparoscopic Nissen fundoplication // J. Pediatr.
Surg. — 2002. — Vol. 37. — P. 1664-1666.
51. Esposito C, Montupet P., van der Zee D. et al. Long-term outcome
of laparoscopic Nissen, Toupet, and Thai antireflux procedures
for neurologically normal children with gastroesophageal reflux
disease // Surg. Endosc. — 2006. — Vol. 20. — P. 855-858.
Глава 26. Педиатрическая эндохирургия 325
52. Van der Zee D.C., Bax K.N. M. A., Ure B.M. et al. Long-term results
after laparoscopic Thai procedure in children // Semin. Laparosc.
Surg. — 2002. — Vol. 9. — P. 168-171.
53. Prasad R., Loworn H.N., III, Wadie CM. et al. Early experience
with needlescopic inguinal herniorrhaphy in children // J. Pediatr.
Surg. — 2003. — Vol. 38. — P. 1055-1058.
54. Valusek P.A., Spilde T.L., Ostlie D.J. et al. Laparoscopic evaluation
for contralateral patent processus vaginalis in children with
unilateral inguinal hernia // J. Laparoendosc. Adv. Surg. Tech. A. —
2006. — Vol. 16. — P. 650-653.
55. Van Glabeke E., Khairouni A., Gall O. et al. Laparoscopic diagnosis
of contralateral patent processus vaginalis in children under 1
year of age with unilateral inguinal hernia: comparison with
herniography // J. Pediatr. Surg. — 1999. — Vol. 34. — P. 1213-
1215.
56. Yerkes E.B., Brock J.W., III, Holcomb C.W., III. et al: Laparoscopic
evaluation for a contralateral patent processus vaginalis: Part III //
Urology. — 1998. — Vol. 51. — P. 480-483.
57. Burd R.S., Heffington S.H., Teague J.L. The optimal approach for
management of metachronous hernias in children: a decision
analysis // J. Pediatr. Surg. — 2001. — Vol. 36. — P. 1190-1195.
58. Lobe Т.Е., Schropp K.P. Inguinal hernias in pediatrics: initial
experience with laparoscopic inguinal exploration of the
asymptomatic contralateral side // J. Laparoendosc. Surg. —
1992.— Vol.2.— P. 135-140.
59. DuBois J. J., Jenkins J.R., Egan J.C. Transinguinal laparoscopic
examination of the contralateral groin in pediatric herniorrhaphy //
Surg. Laparosc. Endosc. — 1997. — Vol. 7. — P. 384-387.
60. Georgeson K.E., Robertson D.J. Laparoscopic-assisted approaches
for the definitive surgery for Hirschsprung's disease // Semin.
Pediatr. Surg. — 2004. — Vol. 13. — P. 256-262.
61. Bufo A.J., Chen M.K., Shah R. et al. Analysis of the costs of surgery
for Hirschsprung's disease: one-stage laparoscopic pull-through
versus two-stage Duhamel procedure // Clin. Pediatr. (Phila.). —
1999. — Vol. 38. — P. 593-596.
62. Georgeson K.E. Laparoscopic-assisted pull-through for
Hirschsprung's disease // Semin. Pediatr. Surg. — 2002. —
Vol. 11.— P. 205-210.
63. Georgeson K.E., Cohen R.D., Hebra A. et al. Primary laparoscopic-
assisted endorectal colon pull-through for Hirschsprung's disease: a
new gold standard // Ann. Surg. — 1999. — Vol. 229. — P. 678-682.
64. Georgeson K.E., Fuenfer M.M., Hardin W.D. Primary laparoscopic
pull-through for Hirschsprung's disease in infants and children //
J. Pediatr. Surg. — 1995. — Vol. 30. — P. 1017-1021.
65. Kumar R., Mackay A., Borzi P. Laparoscopic Swenson procedure:
an optimal approach for both primary and secondary pull-through
for Hirschsprung's disease // J. Pediatr. Surg. — 2003. — Vol. 38. —
P. 1440-1443.
66. Shah A.A., Shah A.V. Staged laparoscopic-assisted pull-through
for Hirschsprung's disease // J. Pediatr. Surg. — 2003. — Vol. 38. —
P. 1667-1669.
67. Georgeson K.E., Inge Т.Н., Albanese C.T. Laparoscopically
assisted anorectal pull-through for high imperforate anus: a new
technique // J. Pediatr. Surg. — 2000. — Vol. 35. — P. 927-930.
68. Lima M., Tursini S., Ruggeri С et al. Laparoscopically assisted
anorectal pull-through for high imperforate anus: three years'
experience // J. Laparoendosc. Adv. Surg. Tech. A. — 2006. —
Vol. 16. — P. 63-66.
69. Kudou S., Iwanaka T, Kawashima H. et al. Midterm follow-up
study of high-type imperforate anus after laparoscopically assisted
anorectoplasty // J. Pediatr. Surg. — 2005. — Vol. 40. — P. 1923-
1926.
70. Lin C.L., Wong K.K. Y., Lan L.C. L. et al. Earlier appearance and
higher incidence of the rectoanal relaxation reflex in patients
with imperforate anus repaired with laparoscopically assisted
anorectoplasty // Surg. Endosc. — 2003. — Vol. 17. — P. 1646-
1649.
71. Koga H., Okazaki Т., Yamataka A. et al. Posterior urethral
diverticulum after laparoscopic-assisted repair of high-type
anorectal malformation in a male patient: surgical treatment and
prevention // Pediatr. Surg. Int. — 2005. — Vol. 21. — P. 58-60.
72. Ure B.M., Schmidt A.I., Jesch N.K. Thoracoscopic surgery in
infants and children // Eur. J. Pediatr. Surg. — 2005. — Vol. 15. —
P. 314-318.
73. Holcomb C.W., III, Tomita S.S., Haase CM. et al. Minimally
invasive surgery in children with cancer // Cancer. — 1995. —
Vol. 76. — P. 121-128.
74. Saenz N.C, Conlon K.C, Aronson D.C et al. The application of
minimal access procedures in infants, children, and young adults
with pediatric malignancies // J. Laparoendosc. Adv. Surg. Tech.
A. — 1997. — Vol. 7. — P. 289-294.
75. Spurbeck W.W., Davidoff A.M., Lobe Т.Е. et al. Minimally invasive
surgery in pediatric cancer patients // Ann. Surg. Oncol. — 2004. —
Vol. 11.— P. 340-343.
76. Albanese C.T, Sydorak R.M., Tsao K. et al. Thoracoscopic
lobectomy for prenatally diagnosed lung lesions // J. Pediatr.
Surg. — 2003. — Vol. 38. — P. 553-555.
77. Rothenberg S.S. Experience with thoracoscopic lobectomy in
infants and children // J. Pediatr. Surg. — 2003. — Vol. 38. —
P. 102-104.
78. Partrick D.A., Rothenberg S.S. Thoracoscopic resection of
mediastinal masses in infants and children: an evaluation of
technique and results // J. Pediatr. Surg. — 2001. — Vol. 36. —
P. 1165-1167.
79. Petty J.K., Bensard D.D., Partrick D.A. et al. Resection of
neurogenic tumors in children: is thoracoscopy superior to
thoracotomy? // J. Am. Coll. Surg. — 2006. — Vol. 203. — P. 699-
703.
80. Ng A., Bennett J., Bromley P. et al. Anaesthetic outcome and
predictive risk factors in children with mediastinal tumors //
Pediatr. Blood Cancer. — 2007. — Vol. 48. — P. 160-164.
81. Avansino J.R., Goldman В., Sawin R.S. et al. Primary operative
versus non-operative therapy for pediatric empyema: a
metaanalysis // Pediatrics. — 2005. — Vol. 115. — P. 1652-1659.
82. Gates R.L., Caniano D.A., Hayes J.R. et al. Does VATS provide
optimal treatment of empyema in children? A systematic review //
J. Pediatr. Surg. — 2004. — Vol. 39. — P. 381-386.
83. Kurt B.A., Winterhalter K.M., Connors R.H. et al. Therapy of
parapneumonic effusions in children: video-assisted thoracoscopic
surgery versus conventional thoracostomy drainage // Pediatrics. —
2006. — Vol. 118. — P. 547-553.
84. Kalfa N., Allal H., Lopez M. et al. Thoracoscopy in pediatric pleural
empyema: a prospective study of prognostic factors // J. Pediatr.
Surg. — 2006. — Vol. 41. — P. 1732-1777.
85. Kalfa N.. Allal H, Montes-Tapia F. et al. Ideal timing of
thoracoscopic decortication and drainage for empyema in
children // Surg. Endosc. — 2004. — Vol. 18. — P. 472-477.
86. Qureshi F.G., Sandulache V.C., Richardson W. et al. Primary vs
delayed surgery for spontaneous pneumothorax in children: which
is better? // J. Pediatr. Surg. — 2005. — Vol. 40. — P. 166-169.
326 Лапароскопическая хирургия. Атлас
87. Morimoto Т., Fukui Т., Koyama H. et al. Optimal strategy for the
first episode of primary spontaneous pneumothorax in young men.
A decision analysis // J. Gen. Intern. Med. — 2002. — Vol. 17. —
P. 193-202.
88. Morimoto Т., Shimbo Т., Noguchi Y. et al. Effects of timing of
thoracoscopic surgery for primary spontaneous pneumothorax on
prognosis and costs // Am. J. Surg. — 2004. — Vol. 187. — P. 767-
774.
89. Yang E.Y, Allmendinger N.. Johnson S.M. et al. Neonatal
thoracoscopic repair of congenital diaphragmatic hernia: selection
criteria for successful outcome // J. Pediatr. Surg. — 2005. —
Vol. 40. — P. 1369-1375.
90. Area M.J., Barnhart D.C., Lelli J.L., Jr. et al. Early experience with
minimally invasive repair of congenital diaphragmatic hernias:
results and lessons learned // J. Pediatr. Surg. — 2003. — Vol. 38. —
P. 1563-1568.
Глава 26. Педиатрическая эндохирургия 327
Лапароскопическая
донорская
нефрэктомия
Стивен И. Ханиш, Карлос И. Марроквин,
Пол К. Куо, Дев М. Десай
шшаиза
ПРЕДПОСЫЛКИ
История трансплантации почки от живого донора
начинается с пересадки почки близнецу, проведенной
в 1953 г. За прошедшие 53 года исходы
трансплантации улучшились, в частности, в результате улучшения
хранения органов, применения средств для иммуносу-
прессии, хирургической техники и медикаментозной
терапии после пересадки, поэтому рост числа
трансплантаций в настоящее время ограничен только
доступностью органов. Терминальная стадия почечной
недостаточности остается растущей медицинской
проблемой в США, и хотя существуют другие формы
почечно-заместительной терапии, трансплантация
почек обеспечивает более длительный успех при лечении
терминальной стадии хронической почечной
недостаточности, чем консервативная терапия, с точки зрения
качества жизни пациента и экономического эффекта.
В настоящее время более 68000 человек ожидают
трансплантацию почки. В 2005 г. было проведено 16477
трансплантаций почки, при 6600 из которых
использовали органы, взятые от живых доноров, что
значительно больше по сравнению с 1800 трансплантациями,
которые были выполнены в 1988 г. (рис. 27-1). Данные
Научного регистра реципиентов для трансплантации
(The Scientific Registry of Transplant Recipiients)
свидетельствуют, что число трансплантаций почки за
прошедшие 18 лет удвоилось, но количество пересадок
от мертвых доноров остается на прежнем уровне,
что говорит о росте числа трансплантаций от живых
доноров, проведенных за последние 10 лет.
Одним из движущих факторов роста пересадок
почки от живых доноров стало внедрение в практику
лапароскопической донорской нефрэктомии. Среди
трансплантологов общепринято, что трансплантат,
полученный от живого донора, способствует улучшению
результатов операции, которая характеризуется лучшей
выживаемостью, но послеоперационные осложнения
и длительное выздоровление донора после открытой
нефрэктомии препятствуют расширению круга
доноров. В 1995 г. донорская нефрэктомия вступила в новую
эру своего развития в связи с внедрением в практику
лапароскопических методов. Многие исследования
показали, что функционирование трансплантатов после
лапароскопической и открытой операции не отличается,
однако в лапароскопической группе отмечают меньшую
болезненность, более короткий период
госпитализации, снижение кровопотери, скорейшее выздоровление
и возвращение к нормальной активности (рис. 27-2).
Ранние послеоперационные риски для доноров
низкие, летальность составляет 0,03%. Частота повторных
операций и обращений в клинику очень маленькая (1%
для каждого показателя). Общая частота
послеоперационных осложнений составляет примерно 3%. Риск
развития хронической почечной недостаточности
оставшейся почки — 0,04%.
Поскольку снабжение органами увеличивается
непропорционально потребностям в их транспланта-
70 000 —|
60000-
g 50000-
I 40000-
CU
(__
| 30000-
S 20 000 -
10000'
— Лист ожидания кандидатов
— Почечные трансплантаты
— МД
— ЖД
1995т1996 ' 1997 ' 1998 ' 1999' 2000' 2001Т2002Т2003' 20041
Год трансплантации
Рис. 27-1. Данные Научного регистра реципиентов
для трансплантации (The Scientific Registry of Transplant Recipiients)
за 1995-2004 гг. МД — мертвый донор; ЖД — живой донор
(данные на: http//www. unos. org).
Глава 27. Лапароскопическая донорская нефрэктомия 329
шшшшшк
нефрэктомия
Лапароскопическая
Преимущества Данные о безопасности при отдаленном наблюдении
Ретроперитонеальный доступ ограничивает
абдоминальные осложнения
Меньше продолжительность операции
Отличная ранняя функция трансплантата
Недостатки Большая выраженность послеоперационных болей
Возвращение к труду только через 6-8 нед
Длинный послеоперационный рубец, возможность
грыжи брюшной стенки
Более длительные сроки госпитализации
Открытая
Меньшая послеоперационная болезненность
Минимальный послеоперационный рубец
Быстрое возвращение к повседневной активности
и труду
Снижение сроков госпитализации
Увеличенное изображение почечных сосудов
Возможно, худшая ранняя функция трансплантата
Потеря или повреждение трансплантата во время
курса обучения
Пневмоперитонеум может ухудшить почечный
кровоток
Более длительное время операции
Тенденция к более коротким почечным сосудам
и множественным артериям
Дополнительные расходы на специальное
оборудование
Рис. 27-2. Лапароскопическая донорская нефрэктомия и открытая донорская нефрэктомия (из: Danovitch [5]).
ции, нефрэктомия у живых доноров прогрессировала
от нефрэктомии у близнецов со 100%
иммунологической совместимостью до нефрэктомии у неродственных
доноров. Внедрение лапароскопической нефрэктомии
способствовало развитию этого направления
трансплантологии и привлечению тех людей, которых от
добровольного согласия на донорство удерживал
длительный период неработоспособности и выздоровления.
ОЦЕНКА ЖИВЫХ ДОНОРОВ
Процесс оценки живых доноров включает проведение
всех обследований, необходимых в процессе скрининга
у возможного мертвого донора. Потенциальный донор
должен быть, во-первых, совместимым по группе
крови (АВО) и перекрестно не реагирующим на антигены
гистосовместимости (сыворотка реципиента не
должна реагировать на иммунные антигены донора), а
также не должен быть поражен кровяными вирусными
инфекциями (ВИЧ, гепатитами С и В). Затем
потенциального донора подвергают медицинскому,
хирургическому и психологическому обследованию.
Медицинское обследование сосредоточено на потенциальном
поиске будущей патологии трансплантата,
обусловленной такими заболеваниями, как гипертензия,
диабет, и различными нефропатиями. Психологическая
оценка должна установить потенциальную мотивацию
индивидуума к донорству (наличие принуждения,
финансовых или личных целей) и наличие средств и
социальной поддержки в послеоперационном периоде.
При хирургическом обследовании оценивают
возможность проведения хирургической операции, особенно
лапароскопической, у пациента с предшествовавшими
абдоминальными или тазовыми операциями,
оговаривают хирургические риски и преимущества,
осложнения и исходы. Если потенциальный донор прошел все
тесты и обследования, ему проводят КТ- или МРТ-
ангиографию для оценки анатомии почечных артерий,
вен, паренхимы и мочевыводящих путей. На рис. 27-3
даны общие рекомендации по оценке донора.
ХИРУРГИЧЕСКАЯ АНАТОМИЯ
Почки расположены в забрюшинном пространстве
на уровне Х-ХИ грудного позвонка. Обе почки
окружены уплотнением соединительной ткани — фасцией
Герота, которая заключает их в капсулу вместе со слоем
паранефральной жировой клетчатки толщиной 1-3 см.
Левая почка граничит медиально с аортой, спереди —
с нисходящей ободочной кишкой и ее селезеночным
изгибом и латерально — с передней брюшной стенкой.
Правая почка с медиальной стороны граничит с
нижней полой веной, латерально — с брюшной стенкой
и восходящей ободочной кишкой и ее печеночным
изгибом, а сверху — с печенью (рис. 27-4).
Анатомия сосудов и мочевыделительной системы
может быть аномальной примерно у 15% пациентов.
Множественные почечные сосуды, как артерии, так и вены,
не являются чем-то необычным и не служат
противопоказаниями к донорству почки. В большинстве случаев
при наличии множественных почечных сосудов это
будет касаться как артерий, так и вен обеих почек.
330 Лапароскопическая хирургия. Атлас
Оценка живого донора
Выявление заинтересованных членов семьи и неродственников и их ориентация
для донорской нефрэктомии
Полный анамнез и физикальное обследование
Иммунологические исследования
Группа крови
Определение HLA
Выявление перекрестных антигенов с донором
Социальная и психологическая оценка
Лабораторные исследования
Полный общий анализ крови, биохимическое исследование сыворотки,
показатели функций печени и системы свертываемости
Общий анализ мочи
Тест на толерантность к глюкозе
Обследование на наличие передаваемых с кровью инфекций: серологическое
исследование на гепатиты А, В, С, ЦМВ (IgG, IgM), вирус Эпштейна-Барр (IgG,
IgM), ВИЧ, БРП и посев мочи
ПСА у мужчин старше 50 лет
Тест на беременность, мазок по Папаниколау и маммография у женщин старше
40 лет или при соответствующем семейном анамнезе
Соотношение микроальбумина и креатинина в моче
24-часовое исследование мочи на наличие белка и клиренс креатинина при
сомнительных данных скрининговых исследований
Рентген органов грудной клетки
ЭКГ
Методы визуализации для оценки почечных сосудов
УЗИ почек
Почечная КТ-ангиография или МРТ/МРТ-ангиография
Рис. 27-3. Оценка живого донора.
ЦМВ — цитомегаловирус; ЭКГ —
электрокардиография; HLA —
человеческий лейкоцитарный
антиген; IgG — иммуноглобулин G;
IgM — иммуноглобулин М; ПСА —
простатспецифический антиген; БРП —
быстрый реагин плазмы (из: Stuart [6]).
Диафрагма
Нижняя
полая вена"
Поперечная
мышца живота"
Квадратная
мышца поясницы'
Большая
поясничная '
мышца
Правая общая
подвздошная
артерия
^~.Щк
ЯР
^/чв /W
Подвздошная
мышца
Ыь®Щ
щ шНп j|
1 1 т Л
§Ц|р fj|
ЧЩИР^^
Девая,
аШЧКЗ | _,
V
рг
Пищевод
^~ Аорта
Внутренняя
—"" семенная вена
Левая общая
~"~~ подвздошная
артерия
Рис. 27-4. Анатомия пациента, знание
которой необходимо при донорской
нефрэктомии у живого донора.
Хотя удвоение чашечно-лоханочной системы почек
встречается реже, чем вариации сосудистой анатомии,
это также не препятствует донорству почки в случае
выполнения ее нормальной функции. Данные в
пользу того, что варианты строения мочевыделительной
системы почек оказывают негативное влияние на ее
функцию, не получены.
Технические особенности в отношении венозной
или артериальной анатомии (количество почечных
сосудов, расположение левой почечной вены отно-
Глава 27. Лапароскопическая донорская нефрэктомия 331
Рис. 27-5. А, Б — КТ-ангиография
артериальной и венозной анатомии
почек. КТ-ангиография с измерениями
почечной вены и артерии от места
отхождения сосудов до первых крупных
ветвей.
сительно аорты и т.д.) можно определить с помощью
КТ-ангиографии, поэтому имеется возможность
соответствующего хирургического планирования (рис.
27-5, А, Б). Хотя трансплантация почки с множеством
сосудов и мочеточников может усложнить операцию
у реципиента и потенциально увеличить риск
технических осложнений, принцип «для начала — не навреди»
приложим и к донору почки, таким образом,
оставшаяся у него почка должна быть наиболее анатомически
нормальной из пары.
ТЕХНИКА ОПЕРАЦИИ
Лапароскопическая левосторонняя
донорская нефрэктомия
Лапароскопическую нефрэктомию выполняют под
общим эндотрахеальным наркозом. После анестезии
устанавливают катетер Фолея, устройство для
прерывистой пневматической компрессии и необходимые
приборы для мониторинга. Пациента укладывают
в левое или правое латеральное положение (правое —
для левой почки и левое — для правой), при этом
середина живота (уровень пупка) расположена над местом
перегиба стола/почечным промежутком.
Операционный стол затем сгибают таким образом, что плечи и
бедра отходят от операционного поля, делая
максимальным расстояние между краем реберной дуги и
передней верхней подвздошной остью (рис. 27-6, А). Авторы
обнаружили, что увеличение почечного промежутка
не играет большой роли в улучшении доступа, но
может привести к повышению числа осложнений.
Необходимо тщательно проложить прокладками
все места, которые подвергаются сдавлению в таком
положении пациента, следует подложить
подмышечный валик для профилактики растяжения или сдав-
ления плечевого сплетения. Для фиксации пациента
к операционному столу полезно использовать
подушку из пенорезины, однако она должна находиться
ниже уровня передней брюшной стенки, чтобы не
мешать установке троакаров и извлечению почки. Затем
пациента крепят к операционному столу в нескольких
местах за нижние конечности, бедро и грудную клетку.
Весь живот и область фланка широко обрабатывают
стандартным антимикробным хирургическим
раствором и обкладывают операционное поле.
Хирург стоит справа от пациента,
лапароскопические мониторы устанавливают у головы
пациента слева и справа. Первый ассистент располагается
слева от пациента, а ассистент с камерой — рядом
с хирургом, ближе к голове пациента (рис. 27-6, Б).
Пневмоперитонеум создают с помощью иглы Вере-
ша, так как пупочный порт отсутствует. Иглу Вереша
вводят сразу ниже края реберной дуги, по срединно-
ключичной линии, затем в этом месте устанавливают
5-миллиметровый порт. Остальные три порта
устанавливают под визуальным контролем:
5-миллиметровый порт — в середине эпигастрального отдела
для камеры, второй 5-миллиметровый порт — по
передней подмышечной линии и главный
12-миллиметровый рабочий порт — в среднем отделе живота
вдоль латерального края прямой мышцы (рис. 27-7).
На рис. 27-8—27-17 представлена хирургическая
техника лапароскопической левосторонней донорской
нефрэктомии.
Закрытие брюшной стенки и реинсуффляция
На апоневроз инфраумбиликального разреза, который
использовали для извлечения почки, накладывают
непрерывный шов рассасывающейся монофиламент-
ной лигатурой. Пневмоперитонеум создают повторно
и проверяют линию скобок на гемостаз. Если в
операционном поле сухо, ободочную кишку помещают в ее
нормальное положение и все порты удаляют под
визуальным контролем.
Лапароскопическая правосторонняя
донорская нефрэктомия
Хотя техника, оборудование и многие этапы при
проведении нефрэктомии с разных сторон совпадают,
существует несколько ключевых отличий, которые
весьма важны для успешного исхода операции.
Первое очевидное отличие — укладка пациента в
левое латеральное положение. Обстановка
операционной — зеркальное отображение таковой при
левосторонней донорской нефрэктомии. Ассистент с камерой стоит
слева в ногах у пациента, а хирург — слева у головного
конца. Первый ассистент стоит справа.
На рис. 27-18—27-25 показана хирургическая
техника правосторонней донорской нефрэктомии.
332 Лапароскопическая хирургия. Атлас
ПОДГОТОВКА
Пациент в правом латеральном положении изогнут на столе,
что облегчает доступ к правому подреберью
Наркозный аппарат
Анестезиолог
Операционная
сестра
Медсестра-
циркулятор
Рис. 27-6. А, Б — обстановка операционной. Пациента укладывают в латеральное
положение со слегка согнутыми коленями. Все точки, подвергаемые сдавлению,
защищены прокладками. Хирург стоит справа, ближе к ножному концу стола,
ассистент с камерой стоит справа, ближе к головному концу. Первый ассистент
находится слева и осуществляет ретракцию почки, используя 5-миллиметровый порт,
установленный по передней подмышечной линии.
Рис. 27-7. Установка портов.
Пациента широко обрабатывают —
от сосков до лобкового симфиза.
Порты устанавливают в следующем
порядке: 1) игла Вереша — срединно-
ключичная линия, сразу ниже края
реберной дуги; 2) 5-миллиметровый
порт в середине эпигастрального
отдела; 3) 5-миллиметровый порт
по передней подмышечной линии;
4) 12-миллиметровый порт вдоль
левого края прямой мышцы живота.
После создания пневмоперитонеума
иглу Вереша заменяют
5-миллиметровым портом.
Глава 27. Лапароскопическая донорская нефрэктомия 333
ОПЕРАЦИЯ
Рис. 27-8. А, Б — мобилизация левых отделов ободочной
кишки. С помощью Harmonic scalpel («Ethicon Endo-Surgery»;
Cincinnati, ОН) или другого устройства для электрорезекции
делают разрез по белой линии Тольдта от селезеночного
изгиба до сигмовидной кишки. Левые отделы ободочной кишки
мобилизуют в медиальном направлении в бессосудистом
слое между фасцией Герота сзади и латерально и брыжейкой
ободочной кишки спереди и медиально. Необходимо
соблюдать осторожность, чтобы не сделать отверстие
брыжейки ободочной кишки.
Рис. 27-9. Медиализация селезенки. Ее проводят с помощью
Harmonic scalpel {«Ethicon Endo-Surgery»; Cincinnati, OH),
сначала рассекая селезеночно-почечную связку, а затем,
в заднем направлении, ткани, фиксирующие селезенку
латерально. Важно, чтобы эта диссекция распространялась
до диафрагмы для возможности полной ротации селезенки
в медиальном направлении и ее удаления из операционного
поля. Для предупреждения повреждения селезенки
лапароскопический ретрактор «Kitner» устанавливают поперек
селезенки, таким образом равномерно распространяя усилие
ретракции на селезенку.
Рис. 27-10. Идентификация мочеточника. Обычно находят левую гонадную вену,
которая проходит вдоль медиального края поясничной мышцы. Гонадную вену
и окружающую ее забрюшинную клетчатку, в которой расположен мочеточник,
мобилизуют от поясничной мышцы. Необходимо соблюдать осторожность, чтобы
не повредить окружающие кровеносные сосуды и фасции. После мобилизации
гонадной вены и окружающей ее ткани мочеточник необходимо точно
идентифицировать под забрюшинной тканью, так как иногда он может проходить
медиальнее. Диссекцию мочеточника и гонадной вены выполняют от нижнего
полюса почки до уровня подвздошных сосудов. Затем делают «окно» путем
диссекции латеральных связей этого участка забрюшинной ткани таким образом,
чтобы можно было установить под мочеточник носатый тупой ретрактор, введенный
через наиболее латеральный порт. Мочеточник и окружающие ткани, содержащие
кровоснабжающие его сосуды, затем поднимают, при этом, в свою очередь,
поднимается почка, что позволяет выделить почечные сосуды на максимальную
длину.
334 Лапароскопическая хирургия. Атлас
Рис. 27-11. Идентификация почечной вены и ее ветвей.
Гонадную вену, которую уже обнаружили, прослеживают
кверху, до почечной вены, которая характерно
пересекает аорту. У небольшого числа пациентов имеется
позадиаортальная левая почечная вена, что не оказывает
влияния на хирургический доступ, но может привести
к уменьшению длины почечной вены. Эти данные должны быть
известны из предоперационного обследования. Проводят
диссекцию левой почечной вены тупым путем, вычленяя ее
основные ветви. Необходимо наложить клипсы или скобки
на гонадную (А, Б), надпочечниковую (В, Г) и поясничную
(Д, Е) вены. Невозможность нахождения одного или всех
этих сосудов может привести к необходимости конверсии
в открытую операцию.
Рис. 27-12. Идентификация
почечной артерии. Почечную
артерию обнаруживают лежащей
выше и несколько сзади от почечной
вены. Проводят ее диссекцию
от аорты по направлению к воротам.
Важно оставить как можно больше
длины артерии, чтобы облегчить
реимплантацию. Для облегчения
доступа к артерии на этом этапе
можно провести мобилизацию почки
от забрюшинной клетчатки. Это
позволит отвести орган от поясничной
мышцы, чтобы получить артерию
максимальной длины.
Рис. 27-13. Инъекция папаверина
в артерию. Для того чтобы свести
к минимуму артериальный спазм
в результате диссекции, в артерию
через пластиковый катетер вводят
папаверин.
Рис. 27-14. Мобилизация
надпочечника. После пересечения
надпочечниковой вены и мобилизации
почечной артерии надпочечник
можно отделить от почки с помощью
Harmonic scalpel («Ethicon Endo-Surgery»;
Cincinnati, ОН). Необходимо соблюдать
осторожность, чтобы не повредить
или не пересечь верхнеполярные
артериальные ветви. Таким образом,
лучше проводить мобилизацию
почечной артерии перед диссекцией
надпочечника.
Глава 27. Лапароскопическая донорская нефрэктомия 335
Рис. 27-15. Мобилизация верхнего полюса почки и ее латеральных связей.
Используя Harmonic scalpel {«Ethicon Endo-Surgery»; Cincinnati, ОН), окружающие почку
ткани отсекают от латеральной брюшной стенки и забрюшинного пространства,
придавая почке свободную подвижность. После завершения этого маневра орган
удерживает сосудистая ножка. После полной мобилизации таким образом, что орган
связан с телом только сосудистой ножкой и мочеточником, газ из брюшной полости
временно выпускают на время проведения экстракционного разреза. Выполняют
нижний срединный разрез длиной 6 см или разрез Пфанненштиля. Апоневроз
осторожно вскрывают, чтобы не повредить брюшину. В брюшную полость через
фасциальный разрез осторожно устанавливают 15-миллиметровый троакар таким
образом, чтобы можно снова создать пневмоперитонеум. В брюшную полость через
этот троакар вводят контейнер «EndoCatch» {Auto Suture, Norwalk, CT) и оставляют
его медиальнее, вдали от операционного поля, до тех пор, пока он не понадобится,
чтобы извлечь почку или отвести ее кверху и получить максимальную длину
почечных сосудов.
Рис. 27-16. А-Г — пересечение
мочеточника и сосудов степлером.
Мочеточник захватывают и пересекают
насколько можно дистально
заряженным эндоваскулярным
2-миллиметровым степлером,
чтобы иметь максимальную его
длину. Затем с помощью степлера
пересекают артерию (Б) и вену (В).
Почку полностью освобождают
от оставшихся связей.
Рис. 27-17. Подготовка почки к извлечению. Мобилизованную почку теперь
помещают в ранее введенный контейнер «EndoCatch» {Auto Suture, Norwalk,
CT) для быстрого, осторожного и безопасного извлечения. На этом этапе
экстракционный разрез полностью раскрывают и извлекают почку. Этот период
тепловой ишемии должен быть сведен к минимуму, насколько это возможно, и после
пересечения почечной артерии пересечение почечной вены и извлечение почки
следует проводить максимально быстро. Помещение почки в контейнер «EndoCatch»
после отсечения мочеточника, но перед пересечением почечных сосудов, а также
использование двух эндоваскулярных степлеров (одного для артерии, а другого —
для вены) — приемы, которые уменьшают период тепловой ишемии.
336
Лапароскопическая хирургия. Атлас
АЛЬЕРНАТИВНАЯ ОПЕРАЦИЯ
Рис. 27-18. Установка портов. Количество, размер
и расположение портов при право- и левосторонней
донорской нефрэктомии различны. При выполении
левосторонней нефрэктомии иглу Вереша вводят сразу ниже
края реберной дуги слева по срединно-ключичной линии,
тогда как при правосторонней нефрэктомии иглу Вереша
вводят вдоль латерального края правой прямой мышцы
живота на уровне пупка для профилактики повреждения
печени, которая может распространяться значительно
ниже края реберной дуги справа. Для оптимизации угла
эндоваскулярного степлера относительно почечных
сосудов, чтобы получить максимальную их длину,
применяют два 12-миллиметровых порта. Дополнительно
устанавливают 5-миллиметровый порт по средней линии
ниже мечевидного отростка, через который вводят гибкий
ретрактор для отведения левой доли печени при обнажении
верхнего полюса почки. Порт для камеры располагают вдоль
латеральной границы прямой мышцы ниже уровня пупка.
^% \
Рис. 27-19. А, Б — печеночный
ретрактор. Тонкие связи между
задней поверхностью правой
доли печени и забрюшинным
пространством рассекают с помощью
электрохирургических инструментов
и отводят правую долю печени кверху,
обнажая забрюшинно расположенный
верхний полюс правой почки.
Рис. 27-20. А, Б — мобилизация
восходящего отдела ободочной
кишки и печеночного изгиба.
Ободочную кишку мобилизуют
в бессосудистом слое, отводя ее
в медиальном направлении и отделяя
передне-медиальную поверхность
брыжейки ободочной кишки отзадне-
латеральной поверхности почки.
Диссекцию продолжают книзу,
в сторону слепой кишки. При этом
обнажаются двенадцатиперстная
кишка и нижняя полая вена.
Глава 27. Лапароскопическая донорская нефрэктомия 337
Рис. 27-21. А-В — обнажение верхнего полюса почки.
Наиболее безопасное место рассечения забрюшинного
пространства находится над верхним полюсом почки.
После вхождения в забрюшинное пространство диссекцию
продолжают в медиальном направлении до латерального края
подпеченочного отдела нижней полой вены. Почку мобилизуют
от нижней полой вены тупым путем, продолжая диссекцию
книзу, до соустья нижней полой вены и почечной вены.
Рис. 27-22. А, Б — идентификация и мобилизация
мочеточника. На данном этапе находят мочеточник, рассекая
забрюшинное пространство сразу ниже нижнего полюса
почки. Клетчатку забрюшинного пространства, расположенную
латеральнее нижней полой вены, через которую обычно
проходит мочеточник, мобилизуют от поясничной мышцы
тупым путем. Иногда правый мочеточник может проходить
медиальнее, несколько более кзади или вообще позади нижней
полой вены. Таким образом, мобилизуемую инфраренальную
клетчатку необходимо тщательно исследовать, чтобы
убедиться, что она содержит мочеточник. Мочеточник
мобилизуют книзу, до уровня подвздошных сосудов. Гонадная
вена справа впадает в нижнюю полую вену. Гонадную вену
можно пересечь или, если она проходит относительно
поверхностно, ее можно отвести в медиальном направлении
с помощью диссекции тупым путем и отделить от забрюшинной
клетчатки, содержащей мочеточник.
Рис. 27-23. А, Б — мобилизация почки. При левосторонней
донорской нефрэктомии латеральные связи почки пересекают
в конце диссекции, но в случае выполнения правосторонней
донорской нефрэктомии почку отводят в медиальном
направлении для облегчения мобилизации правой почечной
артерии, которая расположена позади нижней полой
и почечной вен.
338 Лапароскопическая хирургия. Атлас
Рис. 27-24. А-В — доступ к почечным артерии и вене сзади.
Правую почечную артерию мобилизуют с помощью диссекции
тупым и острым путями, отделяя ее от почечной вены и нижней
полой вены спереди. После диссекции почечной артерии в нее
можно ввести папаверин для профилактики вазоспазма.
Рис. 27-25. Дисссекция надпочечника. Почку отводят назад, в ее нормальную
физиологическую позицию, надпочечник отделяют от верхнего полюса почки путем
электродиссекции. Диссекцию нужно проводить осторожно для профилактики
повреждения верхнеполярных артерий. На этом этапе правую почку необходимо
полностью мобилизовать таким образом, что она остается прикрепленной только
мочеточником и сосудами. Пересечение мочеточника и сосудов и извлечение почки
не отличаются от таковых при левосторонней донорской нефрэктомии.
СПИСОК ЛИТЕРАТУРЫ
1. Outcome of laparoscopic live donor nephrectomy in 2005: national
survey of Japanese transplantation centers // Transplantation. —
2006. — Vol. 82 (Suppl. 2). — P. 800-801.
2. Rocca X., Espinoza O., Hidalgo E, Gonzalez F. Laparoscopic
nephrectomy: safe and comfortable surgical alternative for living
donors and for good results of graft function // Transplant. Proc. —
2005. — Vol. 37. — P. 3349-3350.
3. Barry J.M., Conlin M., Golconda M., Norman D. Strategies to
increase living donor kidney transplants // Urology. — 2005. —
Vol. 66 (Suppl.). — P. 43-46.
6.
Rajamahanty S., Simon R., Edye M. et al. Accuracy of three-
dimensional CT angiography for preoperative vascular evaluation
of laparoscopic living renal donors // J. Endourol. — 2005. —
Vol. 19. — P. 339-341.
Danovitch G.M. Handbook of Kidney Transplantation. — 4th ed. —
Philadelphia: Lippincott Williams and Wilkins, 2004.
Stuart E, Abecassis M., Kaufman D. Organ Transplantation. —
2nd ed. — Austin: Landes Bioscience, 2003.
Глава 27. Лапароскопическая донорская нефрэктомия 339
Минимально
инвазивная
эзофагэктомия
С. Кристиан Энестведт, Блэйр А. Жобе
Частота аденокарциномы пищевода растет быстрее,
чем частота других солидных опухолей. Хотя на
первом месте в мире по распространенности среди
опухолей пищевода находятся плоскоклеточные раки,
в США чаще встречается именно аденокарцинома.
Был зафиксирован быстрый рост частоты
аденокарциномы желудочно-пищеводного перехода, которая
оказывается наиболее частым показанием к
эзофагэктомии. К доброкачественной патологии, которая
может потребовать эзофагэктомии, относят стриктуру
пищевода после ожога щелочью, повреждение, разрыв
пищевода, терминальную стадию ахалазии и другие
редкие заболевания. Дисплазия Барретта высокой
степени — безусловное показание к резекции
пищевода, поскольку она потенциально может переродиться
в инвазивный рак. Хотя распространены
эндоскопические и аблятивные методы лечения дисплазии
Барретта, возможно также и применение методов
минимально инвазивной хирургии.
Традиционные доступы к эзофагэктомии были
трехуровневыми: трансхиатальный доступ при шейной
эзофагэктомии, модифицированный доступ Ivor-Lewis
или техника трех разрезов. После внедрения и
развития в начале и середине 1990-х гг. полностью
лапароскопической трансхиатальной эзофагэктомии к этому
методу возник все более растущий интерес [1-5].
Усовершенствование хирургической техники и
возможность снижения частоты послеоперационных
осложнений привели к учащению использования
лапароскопического трансхиатального доступа в крупных
центрах [6]. Как комбинированный торакоскопический,
так и трансхиатальный лапароскопический доступ,
пропагандируемый Luketich et al. [7], были тщательно
усовершенствованы в специализированных центрах.
К возможным преимуществам этих минимально инва-
зивных доступов относятся: отличное интраопераци-
онное стадирование и более полная лимфаденэктомия,
лучший гемостаз, более низкая заболеваемость
послеоперационной пневмонией, более короткий период
госпитализации и скорейшее выздоровление [8].
Как при лечении других онкологических
заболеваний, максимальную пользу пациентам с
заболеваниями пищевода приносит мультидисциплинарный
подход. Скоординированные усилия хирургов,
гастроэнтерологов, медицинских онкологов, онкологов-
радиологов и сестринского онкологического
персонала приводят к более высокой удовлетворенности
пациентов результатами лечения и более
благоприятным исходам.
КЛИНИЧЕСКАЯ КАРТИНА
И ДИАГНОСТИКА
Важными факторами, предрасполагающими к
развитию дисплазии и рака, считают гастроэзофагеаль-
ную рефлюксную болезнь, носительство Helicobacter
pylori и терапию, направленную против него, а также
курение, ожирение и атипичный рефлюкс,
известный как ларингофарингеальный рефлюкс. К
сожалению, большинство злокачественных опухолей
пищевода проявляются дисфагией, распространенным
местным ростом опухоли и малыми шансами на
излечение. У некоторых пациентов с дисфагией и
потерей массы тела может встречаться такое
доброкачественное заболевание, как ахалазия, но всем этим
пациентам необходимо проводить оценку слизистой
оболочки с помощью эндоскопии (рис. 28-1, 28-2).
Дисплазия Барретта высокой степени и инвазивный
рак могут быть обнаружены у пациентов с
симптомами гастроэзофагеального рефлюкса, однако
эти пациенты составляют лишь небольшую часть
из числа всех пациентов, у которых развивается рак.
На самом деле существует реальная необходимость
в улучшении техники скрининга и стратификации
рисков.
Глава 28. Минимально инвазивная эзофагэктомия 341
Нормальная
слизистая оболочка
Рис. 28-1. При эндоскопическом исследовании определяется
замещение нормального плоскоклеточного эпителия дисплазией
Барретта проксимальнее гастроэзофагеального перехода.
После эндоскопического исследования в
стандартный перечень обследования пациентов с
установленным диагнозом рака пищевода входят КТ и
эндоскопическое ультразвуковое исследование (рис. 28-3,
28-4). Доказано, что эндоскопическое УЗИ обладает
большей чувствительностью при определении стадии
Т, чем КТ, оно позволяет провести игольную
биопсию подозрительных лимфатических узлов. К
дополнительным исследованиям относят позитронно-
эмиссионную томографию (ПЭТ) и комбинацию
ПЭТ-КТ. У пациентов с серьезными сопутствующими
заболеваниями (сердечно-сосудистыми и легочными)
предоперационное обследование должно включать
сердечный стресс-тест с консультацией кардиолога.
Все пациенты должны проходить тестирование
функций легких.
Минимально инвазивная эзофагэктомия показана
при дисплазии Барретта высокой степени, инвазивном
раке и терминальной стадии доброкачественных
заболеваний. У пациентов с дисплазией Барретта и раком
в стадии Т шанс поражения лимфатических узлов
низкий, и в таком случае авторы используют минимально
инвазивный трансхиатальный доступ с применением
инверсионной техники. У пациентов с опухолью,
прорастающей в подслизистый слой или глубже, авторы
используют комбинацию минимально инвазивных
торакального и абдоминального доступов с шейным
анастомозом. Авторы также начали выполнять
минимально инвазивный внутригрудной анастомоз с помощью
степлера для концевого анастомоза. В их практике нео-
адъювантная терапия не может считаться
противопоказанием для минимально инвазивной эзофагэктомии
(рис. 28-5).
ЛОГИЧЕСКОЕ ОБОСНОВАНИЕ
ХИРУРГИЧЕСКОГО ДОСТУПА
И АНАТОМИЧЕСКИЕ ПРЕДПОСЫЛКИ
Хирургическое лечение пациентов с патологией
пищевода, особенно имеющих онкологические и
предраковые заболевания, должно преследовать несколько
целей. Во-первых, первостепенная цель — оценка и
получение адекватного края резекции. Восстановление
непрерывности пищеварительного тракта в
значительной степени улучшает качество жизни пациентов,
имеющих дисфагию. При использовании кишечной
или желудочной интерпозиции важно попытаться
сохранить функцию привратника и, таким образом,
физиологическое опорожнение желудка. У пациентов
с дисплазией высокой степени или инвазивным
раком, не выходящим за пределы слизистой оболочки,
авторы используют минимально инвазивную эзофа-
гэктомию с сохранением вагусов, которая заключается
в инверсии пищевода в проксимальном направлении,
Рис. 28-2. Вид рака, частично
обтурирующего просвет пищевода
при эндоскопическом исследовании.
Рис. 28-3. На компьютерной томограмме
определяется круговая, почти
вызывающая обструкцию опухоль
дистального отдела пищевода в стадии Т .
Край опухоли
^Дь /^г^^Ъ^ШЯ а
1 ^NdP
Увеличенный
лимфатический узел
1
1
■
■
Рис. 28-4. При эндоскопическом
ультразвуковом исследовании
определяются опухоль в стадии Т3
и увеличенный периэзофагеальный
лимфатический узел (указаны стрелками).
342 Лапароскопическая хирургия. Атлас
Показания к разным видам минимально инвазивных эзофагэктомий
ависимости от вида onyxoj
Комбинированная
Патология
Лапароскопическая
трансхиатальная
Доброкачественная патология
HGD Барретта
т,Л
т,Л
ТД
TaN0
Т.-ТД
Спасительная
X
X
X
лапароскопическая
и торакоскопическая
Инверсия + сохранение вагусов
Рис. 28-5. Показания к разным видам минимально инвазивных эзофагэктомий в зависимости от вида опухоли. HGD ■
высокой степени.
■дисплазия
как описали Akiyama et al. [9]. Исследователи показали,
что сохранение вагусов приводит к снижению частоты
демпинга и диареи в послеоперационном периоде,
повышению приема калорий и почти нормальному
опорожнению желудка [10].
Существует две анатомические особенности,
которые отличают хирургию пищевода от других
операций на органах желудочно-кишечного тракта.
Первая — отсутствие у пищевода серозной выстилки,
что не препятствует радиальному росту опухоли.
Вторая — наличие обширного продольно
ориентированного лимфатического сплетения в подслизистом слое.
Кроме того, имеются прямые трансмуральные лим-
Рис. 28-6. Обширная подслизистая сеть лимфатических сосудов
способствует раннему метастазированию рака пищевода
(1лз: Feithetal. [11]).
фатические связи между подслизистым слоем и
регионарными лимфатическими узлами (рис. 28-6) [11].
Эти анатомические особенности предрасполагают
к раннему и быстрому распространению рака и локо-
регионарному распространению на момент
установления диагноза. Таким образом, в попытке
радикально излечить больного авторы предлагают выполнять
пациентам с поражением подслизистого слоя двух-
полостную резекцию одним блоком, чтобы удалить
все лимфатические структуры, которые могут
содержать раковые клетки, не обнаруженные при
клиническом стадировании. Этот подход улучшает прогноз
для клиницистов, пациента и его семьи.
Расположение опухоли диктует выбор
определенного хирургического доступа. Опухоли,
локализованные в проксимальной трети пищевода, требуют
комбинированного торакоскопического/
лапароскопического доступа и выполнения шейного
анастомоза. В такой ситуации операцию начинают с
доступа в грудную полость для определения резектабель-
ности. Если опухоль переходит через пищеводно-
желудочный переход, начинают с лапароскопического
доступа для исключения карциноматоза. Поскольку
более агрессивная резекция желудка будет
ограничивать длину трансплантата, анастомоз следует
выполнять в грудной полости, поэтому после лапароскопии
выполняют торакоскопию.
АНЕСТЕЗИЯ И ПОДГОТОВКА ПАЦИЕНТА
Если планируют торакоскопическую мобилизацию
пищевода, необходима двупросветная эндотрахеаль-
ная трубка для раздельной вентиляции легких, если же
нет, достаточно будет обычной трубки. Не позднее 1 ч
до нанесения кожного разреза вводят цефалоспорин
I или II поколения. Анестезиолог устанавливает
артериальный и центральный венозные катетеры. В
желудок вводят назогастральный зонд для медленной по-
Глава 28. Минимально инвазивная эзофагэктомия 343
стоянной аспирации. Перед наркозом устанавливают
эпидуральный катетер, хотя его обычно не используют
для минимально инвазивной эзофагэктомии.
Проводят эндоскопическое исследование и бронхоскопию
на операционном столе, чтобы хирург оценил точное
расположение опухоли и анатомические
взаимоотношения. Уточняют положение двухпросветной эндотра-
хеальной трубки, после чего правое легкое выключают
из вентиляции.
ТЕХНИКА ОПЕРАЦИИ: ТОРАКОСКОПИЯ
Торакоскопическая мобилизация пищевода
продемонстрирована на рис. 28-7—28-12. При использовании
комбинированного торакоскопического/лапароскопи-
ческого доступа операцию обычно начинают с грудной
клетки, если только не планируется внутригрудной
анастомоз. После установки порта для камеры
необходимо провести внимательный осмотр
соответствующей половины плевральной полости. Признаки
инвазии опухоли в крупные сосуды и воздухопроводящие
структуры, не выявленные при предоперационном
обследовании, следует считать противопоказаниями
к резекции.
При внутригрудном анастомозе торакоскопиче-
скую диссекцию пищевода продолжают книзу, до диа-
фрагмального отверстия. В этом случае торакоскопии
предшествуют лапароскопия и формирование
желудочной трубки, что описано ниже, с тем важным
исключением, что желудочный кондуит необходимо
прикрепить к дистальной линии резекции с помощью
нескольких интракорпоральных швов. Это
позволяет подтянуть кондуит кверху, в грудную полость,
для формироввания анастомоза. Проксимальный
участок пищевода пересекают примерно на 2-3 см выше
уровня непарной вены с помощью эндоскопического
степлера с вращающейся головкой. Порт,
установленный в восьмом межреберье, расширяют для
извлечения удаленного пищевода, помещенного в контейнер
«EndoCatch» (Auto Suture, Norwalk, CT), и введения
степлера для анастомоза «конец в конец». Затем
головку 25-миллиметрового степлера крепят в
проксимальном участке пищевода с помощью кисетного
шва. На передней стенке желудка делают гастрото-
мию для введения степлера. Формируют анастомоз
«конец в конец» с желудочным кондуитом, избегая
линии скобок на малой кривизне. Гастротомическое
отверстие закрывают с помощью эндоскопического
степлера в горизонтальном направлении.
По завершении торакоскопического этапа
необходимо внимательно осмотреть грудную полость на
адекватность гемостаза, подтекания лимфы и на предмет
повреждения мембранозного отдела трахеи
(проводят вентиляцию правого бронха с положительным
давлением, наполнив при этом область ворот легкого
физиологическим раствором натрия хлорида, чтобы
выявить повреждение). Легкое раздувают под торако-
скопическим контролем. В передний и задний отделы
грудной клетки устанавливают два плевральных
дренажа 24 F. Если выполнялся внутригрудной анастомоз,
то рядом с ним оставляют дренаж Jackson-Pratt. На все
разрезы для троакаров накладывают глубокие и
подкожные швы рассасывающимися нитями.
344 Лапароскопическая хирургия. Атлас
ПОДГОТОВКА
Рис. 28-7. Пациента укладывают в левое латеральное
положение. Операционный стол сгибают в области бедер
после надежной фиксации пациента с помощью подушки,
наполненной пенорезиной. Правая рука пациента адекватно
поддерживается, все места, подвергаемые сдавлению,
тщательно защищены прокладками. Хирург стоит справа
от пациента, а ассистент — слева. Основной монитор должен
быть расположен на удобной высоте рядом с левым плечом
пациента (из: Alvelo-Riveira et al. [12]).
Рис. 28-8. Десятимиллиметровый порт для камеры
устанавливают по срединно-ключичной линии, в седьмом
межреберье. Сзади устанавливают два 5-миллиметровых
рабочих порта, один в области угла лопатки, а другой —
в восьмом межреберном промежутке, сразу кзади
задней подмышечной линии. Эти два порта будут
служить для инструментов в левой и правой руке
хирурга соответственно. Второй 10-миллиметровый
порт устанавливают спереди, в четвертом межреберье
по передней подмышечной линии, для передней ретракции
пищевода и легкого. В порт вводят самоудерживающийся
ретрактор для профилактики растяжения легкого во время
работы отсоса (из: Alvelo-Riveira et al. [12]).
Глава 28. Минимально инвазивная эзофагэктомия 345
ОПЕРАЦИЯ
\Л\ к I
Непарная вена
Бронх
и легочные
сосуды
Пищевод
Рис. 28-9. На центральную сухожильную часть диафрагмы
наложен шов и проведен на кожу под краем реберной дуги
для тракции книзу. Тракция диафрагмы книзу улучшает
визуализацию нижнего отдела средостения и дистального
отдела пищевода в области хиатуса. Осуществляя переднюю
и верхнюю тракцию легкого, пересекают нижнюю легочную
связку до уровня нижней легочной вены. Находят слой
между перикардом и пищеводом и проводят в нем
диссекцию в медиальном направлении к противоположной
плевральной полости. Диссекцию продолжают кверху до тех
пор, пока не обнаружат правый главный бронх и карину.
Все лимфатические структуры удаляют вместе с пищеводом.
После диссекции лимфатических узлов 7-го уровня диссекцию
продолжают вдоль трахеи и мобилизуют все лимфатические
узлы 4R (из: Alvelo-Riveira et al. [12]).
i ^ iLi,
Пересечение
непарной вены
Рис. 28-10. Непарную вену пересекают гибким
эндоскопическим степлером после формирования «окна»
выше и ниже этого сосуда (из: Alvelo-Riveira etal. [12]).
346 Лапароскопическая хирургия. Атлас
Рис. 28-11. Проксимальнее уровня непарной вены
диссекцию следует проводить близко к поверхности
пищевода, чтобы избежать повреждения возвратного нерва.
Мобилизацию продолжают в направлении входа в грудную
полость.
ТЕХНИКА ОПЕРАЦИИ: ЛАПАРОСКОПИЯ
Техника выполнения трансхиатальной эзофагэктомии
с инверсией детально описана на рис. 28-13-28-30.
Пневмоперитонеум создают с помощью иглы Вере-
ша, введенной через маленький супраумбиликальный
разрез. Создают пневмоперитонеум с максимальным
давлением 15 мм рт.ст. Перед разрезами в места
установки портов вводят местные анестетики. Порт для
камеры располагают первым — для тщательного
осмотра брюшной полости на наличие микрометастазов.
Остальные порты устанавливают только после полной
ревизии.
После начала диссекции необходимо оценить
чревные лимфоузлы на наличие метастазов. Оценка
чревных лимфоузлов позволяет провести раннее лигиро-
вание левых желудочных сосудов (рис. 28-18). Этот
маневр теоретически позволяет кондуиту лучше
приспособиться к венозному застою и сниженному
артериальному притоку.
При диссекции большой кривизны крайне важно
попытаться сохранить правую желудочно-сальниковую
артерию и аркады между правой и левой желудочно-
Рис. 28-12. По задней поверхности пищевода помечают
плевру с помощью электрокоагулятора вдоль непарной
вены, которая остается на месте. Все парааортальные
лимфатические узлы и ареолярную ткань удаляют вместе
с пищеводом, а артериальные ветви пересекают. Грудной
проток идентифицируют и клипируют на уровне диафрагмы.
Диссекцию продолжают в передне-медиальном направлении,
пока не встретятся со слоем ранее проведенной передней
диссекции. Сейчас, после круговой мобилизации пищевода,
вокруг него проводят дренаж Penrose. Круговую диссекцию
продолжают в дистальном направлении до ножек диафрагмы,
но в брюшную полость не входят, чтобы поддерживать
пневмоперитонеум во время лапароскопического этапа
двухполостного доступа (из: Alvelo-Riveira et al. [12]).
сальниковой артерией (рис. 28-19). Эти сосуды
необходимо идентифицировать перед пересечением коротких
желудочных сосудов. Кроме того, снижение степени
травмирования дна желудка в результате осторожной
работы с ним позволяет сохранить наиболее нежный
отдел кондуита.
При планировании формирования шейного
анастомоза особенно важны два приема. Во-первых,
важно освободить большую кривизну желудка от правого
отдела ободочной кишки, так как эта область —
источник натяжения при проведении желудка в грудную
полость. Во-вторых, необходимо обеспечить
адекватную длину желудочной трубки для шейного
анастомоза, для этого мобилизуют двенадцатиперстную кишку
по стандартной методике Кохера.
У пациентов с дисплазией Баррета высокой
степени используют трансхиатальный инверсионный метод
с шейным анастомозом. Вагуссохраняющая
техника — важное дополнение к инверсионному методу, так
как позволяет сохранить физиологию желудка.
Стволы блуждающего нерва идентифицируют и осторожно
мобилизуют от дистального отдела пищевода прок-
Глава 28. Минимально инвазивная эзофагэктомия 347
симальнее желудочно-пищеводного соустья. После
подведения вокруг обоих стволов сосудистых петель
их осторожно отводят вправо относительно пациента.
Нервы отделяют от желудка вдоль проксимальных 4 см
малой кривизны. Формирование желудочного
кондуита (рис. 28-22) начинают проксимальнее погружения
вагусов, рядом с привратником.
Шейный анастомоз проводят по методике, обычно
применяемой при открытой эзофагэктомии. Всегда,
когда это возможно, предпочитают методику с
применением степлера, описанную Orringer et al. [13]. Если
эта операция невыполнима, предлагают накладывать
однорядный анастомоз вручную, с помощью полиди-
оксаноновых лигатур.
Подготовка
Наркозный
аппарат
Монитор
Монитор
Операционная
сестра
Рис. 28-13. Пациента укладывают на спину, ноги разводят.
Адекватная защита мест, подвергаемых сдавлению, имеет
первостепенную важность. Необходим доступ от подбородка
до лобка. Легкого разгибания шеи пациента достигают,
подкладывая свернутое полотенце под плечи. Руки пациента
укладывают вдоль туловища, используя локтевые подкладки.
С помощью проложенных подкладками подставок для ног
и ступней пациента крепят к операционному столу в высоком
обратном положении Тренделенбурга. Хирург, стоящий между
ног пациента, занимает позицию, удобную для проведения
операции и позволяющую получить отличную визуализацию
желудка и пищевода. Первый и второй ассистенты находятся
соответственно слева и справа от пациента.
348 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Рис. 28-15. Диссекцию начинают с осторожного рассечения
печеночно-желудочной связки с помощью Harmonic scalpel
(«Ethicon Endo-Surgery»; Cincinnati, ОН). Для соответствия
онкологическим принципам диссекция должна быть
настолько широкой, чтобы удалить все регионарные
лимфатические узлы вместе с органом.
Рис. 28-14. Для минимально инвазивнойтрансхиатальной
эзофагэктомии используют шесть портов. 10-миллиметровый
порт для камеры расположен по срединно-ключичной
линии на 15 см ниже края реберной дуги. 10-миллиметровый
порт для правой руки хирурга устанавливают ниже
левого реберного края, примерно в 12 см от мечевидного
отростка по передней подмышечной линии. Для левой
руки хирурга необходим 12-миллиметровый порт на 4-6см
ниже правого края реберной дуги, справа от серповидной
связки. Латеральная установка и небольшое отклонение
этого порта кверху обеспечивают отличный доступ
для эндоскопического степлера во время формирования
кондуита. Первичным рабочим портом для первого
ассистента служит 5-миллиметровый порт, установленный
вдоль левого реберного края по срединной подмышечной
линии. При опущении желудка этот порт может быть
расположен несколько ниже. Через 5-миллиметровый порт,
установленный с помощью режущего троакара ниже и слева
от мечевидного отростка, вводят ретрактор Nathanson
для отведения левого латерального печеночного сегмента.
Последний (третий) 5-миллиметровый порт устанавливают
в середине правого отдела живота пациента для отведения
желудка кверху во время мобилизации большой кривизны.
Вследствие вариаций в анатомии этот порт устанавливают
последним под визуальным контролем.
Рис. 28-16. Тракция поддиафрагмальной жировой прокладки
книзу способствует натяжению френоэзофагеальной
мембраны и диссекции в стороне от верхней части правой
ножки диафрагмы и верхушек ножек. После достижения
верхушки хиатуса френоэзофагеальную мембрану рассекают
вдоль левой ножки. Диссекцию продолжают кзади, обнажая
желудочно-диафрагмальную мембрану. Эти ареолярные
связи между желудкой и диафрагмой рассекают с помощью
Harmonic scalpel {«Ethicon Endo-Surgery»; Cincinnati, OH).
Глава 28. Минимально инвазивная эзофагэктомия 349
100^ ^ffg
Правая ножка а^ИМк
Пищевод
m
Ч.» Левая ножка
Рис. 28-17. При доступе к хиатусу слева с помощью
диссекции тупым путем и Harmonic scalpel ножки отделяют
от желудочно-пищеводного перехода и дистального отдела
пищевода. Такая диссекция очень напоминает диссекцию,
которую применяют при фундопликации, за исключением
того, что орган удаляют вместе с лимфатическими узлами
и жировой тканью. При крупной массивной опухоли можно
иссечь часть любой из ножек.
Рис. 28-18. В малом сальнике идентифицируют
левую желудочную артерию. Ассистент захватывает
поддиафрагмальную жировую прокладку, поднимая ее
по направлению к брюшной стенке с отклонением влево.
Сейчас левые желудочные сосуды натянуты, и их можно
увидеть в месте вхождения в малую кривизну. Циркулярно
мобилизуют левые желудочные сосуды рядом с местом
их отхождения, формируя «окно». Необходимо проводить
диссекцию осторожно, чтобы избежать повреждения
печеночной артерии, которая должна быть обнаружена
при этой диссекции. Левые желудочные сосуды пересекают
с помощью гибкого эндоскопического степлера.
Рис. 28-19. Хирург захватывает большую кривизну и отводит
ее вправо относительно пациента, а ассистент обеспечивает
противотягу за сальник снаружи сосудистой аркады.
Желудочно-селезеночную связку и левые желудочные сосуды
пересекают с помощью Harmonic scalpel {«Ethicon Endo-Sur-
gery»; Cincinnati, ОН), осторожно избегая сальниковой аркады.
Рис. 28-20. После пересечения коротких желудочных
сосудов и связки и обнажения верхнего полюса селезенки
выполняют мобилизацию позадипищеводного пространства
с помощью ультразвуковых ножниц. Необходимо тщательно
очищать от лимфатических узлов область желудочно-
пищеводного перехода, скелетируя диафрагмальные мышцы
и ножки. Желудок отведен кпереди и вправо относительно
пациента. Начиная от основания левой ножки, мобилизуют
«окно» позади пищевода, соединяясь со слоем, полученным
при диссекции правой ножки. После тщательного
формирования этого окна пищевод обходят с помощью
дренажа Penrose, который используют в качестве держалки
до конца операции.
350 Лапароскопическая хирургия. Атлас
Рис. 28-21. Заднюю поверхность желудка осторожно
мобилизуют от забрюшинного пространства. Заднюю
желудочную артерию идентифицируют и пересекают
с помощью эндоскопического степлера или Harmonic
shears («Ethicon Endo-Surgery»; Cincinnati, ОН). Диссекцию
продолжают в дистальном направлении, проводя ретракцию
антрального отдела и тела желудка кпереди и кверху.
Важные образования, находящиеся в этой области, —
поджелудочная железа, правая желудочно-сальниковая
и гастродуоденальные артерии и брыжейка поперечной
ободочной кишки. Когда пульсация гастродуоденальных
артерий станет явной, эту часть позадижелудочной
диссекции считают завершенной, после чего проводят
мобилизацию по Кохеру. Осторожная тракция дна желудка
книзу позволяет обнажить для диссекции печеночно-
двенадцатиперстную связку при отведении ассистентом
желчного пузыря кпереди и краниально. Связку пересекают
ультразвуковыми ножницами и продолжают диссекцию
вдоль второго и третьего отдела двенадцатиперстной кишки.
После рассечения наиболее поверхностных сращений
для мобилизации двенадцатиперстной кишки и головки
поджелудочной железы применяют диссекцию тупым путем.
Рис. 28-23. После формирования кондуита проксимальный
отдел желудка пересекают сразу же ниже кардии
под эндоскопическим контролем.
Рис. 28-22. После полной мобилизации желудка формируют
желудочную трубку путем множества прошиваний гибким
линейным эндоскопическим степлером. Перед применением
степлера назогастральный зонд необходимо оттянуть
в проксимальный отдел пищевода. Если это возможно,
нужно сохранять правые желудочные сосуды. Наиболее
часто начинают формировать неопищевод на расстоянии
6см проксимальнее привратника. Как и на других этапах
операции, ассистент и хирург должны работать одним
ансамблем, чтобы сформировать кондуит адекватной
длины, шириной 5-6см, все время с осторожностью работая
с желудком.
Рис. 28-24. Удаленный препарат малой кривизны извлекают
в заключительной стадии операции и дистальный край
резекции отправляют для исследования замороженных срезов.
Глава 28. Минимально инвазивная эзофагэктомия 351
Рис. 28-25. Делают косой разрез вдоль передне-медиального
края левой грудино-ключично-сосцевидной мышцы.
Подкожную ткань и подкожную мышцу рассекают с помощью
электроинструмента. Глубже подкожной мышцы используют
только диссекцию тупым или острым путем, чтобы избежать
термического повреждения возвратного нерва. После полной
мобилизации шейного отдела пищевода через эзофаготомию
проводят зонд для флебэктомии в дистальном направлении.
Рис. 28-27. К венозному зонду прикрепляют «грибок»
и место гастротомии укрепляют отдельными швами. Длинную
шелковую лигатуру калибра 0 привязывают к концу венозного
зонда для прямого прохождения плеврального дренажа
для протягивания кондуита.
Рис. 28-26. После достижения зондом линии скобок
в области кардии его кончик лапароскопически
визуализируют. Желудок рассекают в центре линии
скобок и венозный зонд выводят наружу через разрез
для абдоминального порта.
Рис. 28-28. При использовании полностью трансхиатального
доступа хирург пересекает аортальные пищеводные ветви,
насколько это возможно далеко в средостении. Обычно такую
диссекцию можно провести под визуальным контролем
примерно до уровня карины.
352 Лапароскопическая хирургия. Атлас
Рисунок 28-29. А, Б — ассистент тянет за венозный зонд
со стороны шеи, выворачивая пищевод в средостение.
При этом хирург рассекает оставшиеся сращения в теперь
>ЕЗУЛЬТАТЫ
1оказано, что минимально инвазивная эзофагэкто-
шя — безопасный и эффективный метод лечения
патентов с доброкачественными заболеваниями и раком
[ищевода. Частота конверсии в открытую операцию
[изкая (<10%) [14, 15]. Такие показатели, как после-
перационная морбидность, продолжительность го-
питализации и качество жизни, при проведении дан-
:ых вмешательств лучше, чем при открытых традици-
нных операциях [145]. В одной крупной серии было
оказано снижение общего количества осложнений
ри малоинвазивных операциях по сравнению с откры-
ыми (38,2 против 61,6% соответственно) [16]. Сниже-
ие частоты развития пневмоний — одно из принци-
иальных преимуществ торакоскопического доступа
еред открытой операцией Ivor-Lewis. Частота несо-
гоятельности анастомоза после лапароскопической
«открытом» заднем средостении до тех пор, пока пищевод
не будет извлечен через шейный разрез (схема А адаптирована
№:Jobeetal. [6]).
Рис. 28-30. После удаления пищевода из шейного разреза
с помощью шелковой лигатуры, ранее привязанной
к венозному зонду, проводят плевральный дренаж. Кончик
кондуита крепят к плевральному дренажу двумя отдельными
швами. Ассистент протягивает кондуит в средостение,
а хирург контролирует этот процесс снизу. Обязательно
необходимо предупредить перегиб и перекручивание
кондуита, так как это может вызвать сдавление сосудов
и обструкцию.
и комбинированных операций аналогична показателю
открытого доступа и составляет от 5 до 20% [6, 14, 15,
17]. Частота стриктур анастомоза также соответствует
показателю открытой операции (20-25%, по данным
недавно проведенных исследований) [6, 14].
Выживаемость после минимально инвазивной эзофагэктомии
эквивалентна, если не выше, выживаемости после
традиционных операций [16]. Несмотря на то что лучшие
результаты минимально инвазивных операций могут
указывать на наличие предвзятости отбора, улучшение
выживаемости и снижение морбидности оправдывают
проведение дальнейших исследований. Для
подтверждения преимуществ минимально инвазивной
эзофагэктомии требуется проведение рандомизированных
контролируемых исследований, сравнивающих
минимально инвазивный и открытый доступ у правильно
подобранных пациентов.
Глава 28. Минимально инвазивная эзофагэктомия 353
* """ " "■»—■"■■ МП lllllll III II Villi 11 Mil IТГ1111П lllllll 1Г1П1ИГ
СПИСОК ЛИТЕРАТУРЫ
1. Cuschieri A. Endoscopic subtotal oesophagectomy for cancer using
the right thoracoscopic approach // Surg. Oncol. — 1993. — Vol. 2
(Suppl. 1). —P. 3-11.
2. Cuschieri A., Shimi S., Banting S.: Endoscopic oesophagectomy
through a right thoracoscopic approach // J. R. Coll. Surg. Edinb. —
1992.— Vol. 37.— P. 7-11.
3. De Paula A.L., Hashiba K., Ferreira E.A. et al. Laparoscopic
transhiatal esophagectomy with esophagogastroplasty // Surg.
Laparosc. Endosc. — 1995. — Vol. 5. — P. 1-5.
4. Sadanaga N., Kuwano H., Watanabe M. et al. Laparoscopy-assisted
surgery: a new technique for transhiatal esophageal dissection //
Am. J. Surg. — 1994. — Vol. 168. — P. 355-357.
5. Swanstrom L.L., Hansen P. Laparoscopic total esophagectomy // Arch.
Surg. — 1997. — Vol. 132. — P. 943-947; discussion — P. 947-949.
6. Jobe B.A., Kim C.Y., Minjarez R.C. et al. Simplifying minimally
invasive transhiatal esophagectomy with the inversion approach:
lessons learned from the first 20 cases // Arch. Surg. — 2006. —
Vol. 141. — P. 857-65, discussion — P. 865-866.
7. Luketich J.D., Nguyen N.T., Weigel T. et al. Minimally invasive
approach to esophagectomy // JSLS. — 1998. — Vol. 2. — P. 243-247.
8. Cadiere СВ., Torres R., Dapri G. et al. Thoracoscopic and laparoscopic
oesophagectomy improves the quality of extended lymphadenectomy //
Surg. Endosc. — 2006. — Vol. 20. — P. 1308-1309.
9. Akiyama H., Tsurumaru M., Ono Y. et al. Esophagectomy without
thoracotomy with vagal preservation // J. Am. Coll. Surg. —
1994. — Vol. 178. — P. 83-85.
10. Banki E, Mason R.J., De Meester S.R. et al. Vagal-sparing
esophagectomy: a more physiologic alternative // Ann. Surg. —
2002. — Vol. 236. — P. 324-335; discussion — P. 335-336.
11. Feith M., Stein H.J., Siewert J.R. Pattern of lymphatic spread of
Barretts cancer // World J. Surg. — 2003. — Vol. 27. — P. 1052-
1057.
12. Alvelo-Rivera M., De Hoyos A., Luketich J.D. Laparoscopic and
thoracoscopic esophagectomy // Oper. Tech. Thorac. Cardiovasc.
Surg. — 2005. — Vol. 9. — P. 157-176.
13. Orringer M.B., Marshall В., lannettoni M.D. Eliminating the
cervical esophagogastric anastomotic leak with a side-to-side
stapled anastomosis // J. Thorac. Cardiovasc. Surg. — 2000. —
Vol. 119.— P. 277-288.
14. Collins C, Johnson E., Kroshus T. et al. Experience with minimally
invasive esophagectomy // Surg. Endosc. — 2006. — Vol. 20. —
P. 298-301.
15. Luketich J.D., Alvelo-Rivera M., Buenaventura P.O. et al. Minimally
invasive esophagectomy: outcomes in 222 patients // Ann. Surg. —
2003. — Vol. 238. — P. 486-494; discussion — P. 494-495.
16. Braghetto I., Csendes A., Cardemil G. et al. Open transthoracic
or transhiatal esophagectomy versus minimally invasive
esophagectomy in terms of morbidity, mortality and survival //
Surg. Endosc. — 2006. — Vol. 20. — P. 1681-1686.
17. Bizekis C, Kent M.S., Luketich J.D. et al. Initial experience with
minimally invasive Ivor Lewis esophagectomy // Ann. Thorac.
Surg. — 2006. — Vol. 82. — P. 402-406; discussion — P. 406-407.
354 Лапароскопическая хирургия. Атлас
f
Бариатрическая
хирургия
Себастиан Ж. де ла Фуенте, Эр
По оценкам Всемирной организации здравоохранения
(ВОЗ), в 2005 г. примерно 1,6 млрд взрослых в возрасте
15 лет и старше имели лишнюю массу тела и по
крайней мере 400 млн взрослых страдали ожирением.
Эксперты ВТО подсчитали, что к 2015 г. в мире будет
насчитываться примерно 2,3 млрд взрослых людей с
избыточной массой тела и 700 млн человек, страдающих
ожирением [1]. В США при проведении
Национального исследования здоровья и питания (National Health
and Nutrition Examination Survey) было установлено,
что примерно У взрослых старше 20 лет в стране
имеют избыточную массу тела и более 32% из них страдают
ожирением [2]. Национальное исследование здоровья
и питания охватило 34,6 млн женщин и 30,1 млн
мужчин, что в сумме составляет 64,7 млн людей, имеющих
избыточную массу тела или ожирение только в США.
Эта статистика базируется на данных группы
экспертов, собранных такими подразделениями
Национального института здоровья, как Национальный
институт сердца, легких и крови и Национальный институт
диабета, заболеваний почек и пищеварения. Эксперты
определили избыточную массу тела как индекс массы
тела (ИМТ), составляющий 25-29,9 кг/м2 или более,
а ожирение — как ИМТ, равный 30 кг/м2 или более.
Распространенность избыточной массы тела и
ожирения неуклонно росла во всех половых, возрастных,
этнических и социально-экономических группах [3].
Фактически с 1960 по 2002 г. частота избыточной
массы тела выросла с 44,8 до 65,2% среди взрослого
населения США, а частота ожирения — с 13,3 до 30,5%
за тот же период наблюдения, с наиболее выраженным
подъемом в последние 20 лет [4]. Эти цифры имеют
большое значение, так как пациенты с ожирением
подвержены повышенному риску смерти от всех причин
на 10-50% чаще по сравнению с людьми с нормальной
массой тела. В соответствии с данными недавно
проведенного исследования по анализу затрат, связанных
Дж. Де Мария
с повышенной массой тела и ожирением, медицинские
расходы на эти цели составили 9,1% всех медицинских
расходов США и более 78,5 млрд долларов в 1998 г.,
достигнув 92,6 млрд долларов в 2002 г. [5]. Ожирение
является известным фактором риска развития
диабета, ишемической болезни сердца, высокого
содержания холестерина в крови, инсульта, гипертензии,
желчнокаменной болезни, остеоартрита, ночного
апноэ и других нарушений дыхания, а также некоторых
форм рака (рака матки, молочной железы, ободочной
и прямой кишки, почки и желчного пузыря). Кроме
того, оно связано с осложнениями при беременности,
нерегулярным менструальным циклом, гирсутизмом,
стрессовым недержанием мочи, таким
психологическим расстройством, как депрессия, и повышенным
хирургическим риском.
Несмотря на огромное количество стратегий по
снижению массы тела, бариатрическая хирургия остается
наиболее эффективным методом при морбидном
ожирении и может приводить к выздоровлению или
улучшению состояния пациента при наличии
сопутствующих заболеваний. Следует осознавать, что
бариатрическая операция — единственная процедура, которая
приводит к стойкой потере избыточной массы тела
более чем на 50% и способствует излечению от
сопутствующих заболеваний. В течение нескольких
последних десятилетий произошла значительная эволюция
бариатрической хирургии от направленных только
на мальабсорбцию операций, (еюноилеальное
шунтирование) до более физиологичных методов, задача
которых — потеря массы тела и предотвращение
возникновения осложнений, которые отмечались при ранних
вмешательствах [6]. В настоящее время в
бариатрической хирургии применяют рестриктивные или мальаб-
сорбтивные операции или их комбинацию (рис. 29-1).
На сегодняшний день наиболее распространены
четыре вида бариатрических операций:
Глава 29. Бариатрическая хирургия 355
Наиболее распространенные
бариатрические операции
Техника
Y-образный шунт по Ру
Лапароскопическое
регулируемое
бандажирование
Вертикальная
гастропластика с
бандажированием
Билиопанкреатический
шунт
Дуоденальное отключение
Механизм действия
Рестриктивный и
мальабсорбтивный
Рестриктивный
Рестриктивный
Мальабсорбтивный
Мальабсорбтивный
Рис. 29-1. Наиболее распространенные бариатрические
операции.
• желудочный шунт (стандартный, на длинной
или очень длинной петле по Ру) в качестве
монотерапии или в сочетании с вертикальной бандажной
гастропластикой;
• лапароскопическое регулируемое бандажирование
желудка;
• вертикальная бандажная гастропластика;
• билиопанкреатическое шунтирование и
дуоденальное отключение [7].
КРИТЕРИИ ОТБОРА ПАЦИЕНТОВ
В 1991 г. на конференции Совета Национального
института здоровья по гастроинтестинальной
хирургии при морбидном ожирении были собраны вместе
гастроэнтерологи, эндокринологи, психиатры,
диетологи и другие специалисты для того, чтобы
выступить с наиболее важными докладами, касающимися
болезненного ожирения. Совет сделал вывод, что
пациенты с ИМТ, превышающим 40кг/м2, становятся
кандидатами на операцию, если они очень хотели бы
значительного снижения массы своего тела.
Пациентам с менее выраженным ожирением, с ИМТ между
35 и 40кг/м2, тоже можно предлагать бариатриче-
скую операцию при наличии высокого риска
сопутствующей патологии, такой как угрожающие жизни
сердечно-сосудистые нарушения (выраженное ночное
апноэ, синдром Пиквика, связанная с ожирением кар-
диомиопатия), тяжелый сахарный диабет или
связанные с ожирением физические проблемы, мешающие
жизни (например, болезни суставов, размеры тела,
которые становятся помехой в работе, семейные
проблемы и затрудненное передвижение). Эти критерии
все еще используют сегодня в большинстве
высококвалифицированных клиник. В нашем центре верхним
пределом массы тела были 400 фунтов, эту цифру
диктует размер КТ-сканера. Фактически КТ-сканирование
после операции может быть затруднено у пациентов
с болезненным ожирением из-за избыточной массы
тела и окружности. Пациентам моложе 21 года и
старше 65 лет бариатрические операции в центре, где
практикуют авторы, обычно не проводят. Однако имеется
повышенный интерес к такой хирургии у подростков,
так как была показано, что бариатрические операции
безопасны и способствуют значительной потере массы
тела, коррекции сопутствующих заболеваний и
улучшению самооценки и социализации [8].
ПЕРВИЧНАЯ ДИАГНОСТИКА
Кандидата для бариатрической хирургической
процедуры лучше оценивать с помощью мультидисципли-
нарной команды специалистов с участием диетологов,
психологов, медицинских сестер и хирургов. Эти
пациенты часто приходят после множества неудачных
попыток снижения массы тела неоперативными методами.
Предельно важно осознавать при первичном осмотре,
что эти попытки весьма ценны, так как чем ниже масса
тела перед операцией, тем больше вероятность
успешного исхода процедуры [9,10]. При необходимости
более тщательного и всестороннего обследования
нужно привлекать других специалистов: эндокринологов,
кардиологов и психиатров.
При планировании бариатрического
вмешательства важно иметь в виду, что сопутствующие
заболевания могут повысить оперативный риск [11]. Например,
морбидное ожирение может сопровождаться
увеличением левого желудочка и систолической или диастоли-
ческой дисфункцией [12]. Кроме того, риск
фибрилляции предсердий в этой группе возрастает до 50% [13],
и у пациента с ожирением чаще встречаются факторы,
связанные с развитием ишемической болезни сердца:
гипертензия, гиперлипидемия и сахарный диабет.
Пациенты со средним и высоким риском должны
проходить дополнительное неинвазивное тестирование
работы сердца. Необходимо тщательно изучить
распространенность обструктивного ночного апноэ.
Морбидное ожирение сопровождается гиперкоагуляцией,
и следует сделать все возможное, чтобы предупредить
развитие тромбоза глубоких вен интра- и постопера-
ционно. Строгий периоперативный контроль
гликемии снижает летальность и частоту
послеоперационных осложнений и должен проводиться
дисциплинированно.
В отчете Американского общества бариатрической
хирургии за 2004 г. подчеркивается важность
тщательного физикального обследования этих пациентов [7].
Более того, Американское общество бариатрической
хирургии в своих рекомендациях оговаривает, что,
помимо анамнеза, физикального обследования и
лабораторных исследований, необходимо провести
предоперационное обсуждение или обучающий семинар,
который дает информацию о послеоперационном вы-
356 Лапароскопическая хирургия. Атлас
здоровлении, изменениях в диете, активности и
клинических исходах; его должны проводить диетолог,
бариатрическая медсестра и обязательно бариатриче-
ский хирург.
К рутинным предоперационным методам
исследования относятся базовый биохимический анализ,
полный общий анализ крови, исследование уровня ти-
реоидных гормонов, кортизола, триглицеридов и
холестерина. В некоторых центрах в плановом порядке
проводят эндоскопическое исследование для
исключения язвенной болезни или другой патологии желудка.
Однако эти исследования не рекомендованы для
применения у молодых пациентов без симптомов
заболеваний желудка в анамнезе. Шире применяется УЗИ
правого верхнего квадранта живота для исследования
желчного пузыря, однако необходимость
профилактической холецистэктомии у бессимптомных пациентов
остается спорным вопросом.
АНАТОМИЧЕСКИЕ ОСОБЕННОСТИ
Создание желудочного резервуара начинается с
доступа в сальниковую сумку. После входа в нее на-
Рис. 29-2. Анатомия верхнего отдела желудка: правая ножка (А);
левая ножка (Б); левая желудочная артерия (1) — дает первую
(1 а) и вторую (1 б) аркады; селезеночная артерия (2); общая
печеночная артерия (3).
правляют степлер в сторону угла Гиса, формируя
желудочный резервуар объемом примерно 15-30 мл.
Линия диссекции проходит между первой и второй
аркадой левой желудочной артерии по малой
кривизне (рис. 29-2). Этот этап необходимо выполнять
с осторожностью, чтобы избежать повреждения
селезеночных сосудов, ворот селезенки или
поджелудочной железы. Создание малого желудочного
резервуара вызывает чувство насыщения при растягивании
его пищей. Остаток желудка полностью отделяют
от сформированного резервуара.
После проведения Y-образной еюноеюностомии
по Ру в брыжейке поперечной ободочной кишки
делают отверстие латеральнее связки Трейтца, если петля
будет проходить позадиободочно. Это отверстие
служит туннелем для проведения петли по Ру. Длина би-
лиопанкреатической петли и петли по Ру определяется
ИМТ пациента.
ТЕХНИКА ОПЕРАЦИИ
На рис. 29-3—29-7 представлены обстановка
операционной и техника бариатрической операции.
Глава 29. Бариатрическая хирургия 357
ПОДГОТОВКА
Наркозный аппарат
Видеомонитор
и камера,
осветитель
Видеомонитор,
инсуффлятор
Операционная
сестра
Оперирующий
хирург
Первый
ассистент
Ассистент
с камерой
Ассистент
с камерой
Рис. 29-3. Обстановка операционной.
После получения письменного
информированного согласия
на проведение вмешательства
пациента укладывают на спину
на операционный стол. На обе нижние
конечности устанавливают устройства
для прерывистой компрессии,
вводят мочевой катетер. Начинают
проведение общего эндотрахеального
наркоза и внутривенно вводят дозу
антибиотиков широкого спектра
действия (например, цефазолина).
Живот обрабатывают и обкладывают
в стерильных условиях. Необходимо
иметь инструменты для лапаротомии
на случай возможной конверсии
в открытую операцию.
358 Лапароскопическая хирургия. Атлас
ОПЕРАЦИЯ
Рис. 29-4. Установка троакаров. Пневмоперитонеум создают
с помощью иглы Вереша, введенной в левый верхний
квадрант ниже края реберной дуги или с помощью открытой
техники Хэссона в области пупка. При использовании иглы
Вереша ее впоследствии заменяют на 5-миллиметровый
троакар для ассистента (А). В брюшную полость
инсуффлируют углекислый газ до давления 15 мм рт.ст.
Второй 5-миллиметровый троакар устанавливают над лобком,
по средней линии, он будет служить для введения камеры
(Б). Дополнительный 5-миллиметровый троакар располагают
супраумбиликально для печеночного ретрактора (В). Хирург
работает через 5- (Г) и 12-миллиметровые (Д) троакары,
установленные в правом верхнем квадранте.
Рис. 29-5. Формирование Y-образной петли по Ру. Связку
Трейтца находят, поднимая поперечную ободочную кишку
и сальник. Делают позадиободочное «окно», если планируют
проведение анастомоза позадиободочно. Затем с помощью
дренажа Penrose подводят петлю по Ру к желудку. Примерно
на 50 см дистальнее связки Трейтца пересекают тощую кишку
с помощью 60/2,5-миллиметрового степлера «Endo GIA» (US
Surgical, Norwalk, CT). На этом этапе предельно важно сохранять
пространственную ориентацию и не спутать проксимальный
и дистальный концы. В этом убеждаются, придавая тощей
кишке С-образную форму (А). Брыжейку тощей кишки
рассекают для получения дополнительной подвижности.
Затем проходят по тощей кишке в дистальном направлении
примерно на 50см и проводят еюноеюнальный анастомоз «бок
в бок» с помощью 60/2,5-мм степлера (Б). Дефект в брыжейке
закрывают непрерывным швом 2-0. Если гастроеюнальный
анастомоз планируют проводить впередиободочно, то находят
средний отдел большого сальника и рассекают его до края
ободочной кишки, что позволяет легко провести петлю тощей
кишки по Ру спереди от ободочной кишки и желудка.
Глава 29. Бариатрическая хирургия 359
АЛЬТЕРНАТИВНЫЕ МЕТОДЫ
Лапароскопическое бандажирование
желудка
Лапароскопическое бандажирование желудка — чисто
рестриктивная операция, которая состоит в создании
маленького желудочного резервуара и соустья с
помощью установки ленты вокруг желудка (рис. 29-8).
На сегодняшний день одобрен только один
стандартный набор для применения в США — LAP-BAND
Adjustable Gastric Banding System (Allergan, Irvine, CA),
хотя лапароскопические операции по бандажирова-
нию желудка — наиболее распространенные
процедуры в Европе, Австралии и Южной Америке.
Верхний желудочный резервуар формируют таким
образом, чтобы он имел объем примерно 15 мл и
находился спереди от мобилизованной малой кривизны
360 Лапароскопическая хирургия. Атлас
Рис. 29-6. Через подмечевидный порт вводят печеночный
ретрактор и фиксируют его под левой долей печени, при его
подъеме можно увидеть желудочно-пищеводное соустье.
Затем рассекают малый сальник и разделяют желудок
с помощью последовательных прошиваний степлером
по направлению к углу Гиса, формируя желудочный
резервуар объемом примерно 30 мл.
Рис. 29-7. Далее позадиободочно и позадигастрально
проводят петлю по Ру и формируют двухрядный
гастроеюноанастомоз. После гастротомии и энтеротомии
вводят степлер «Endo GIA» (US Surgical, Norwalk, CT)
размером 45x3,5 мм. После завершения гастроеюностомии
энтеротомию закрывают с помощью непрерывного шва 2-0
Polysorb (US Surgical, Norwalk, CT). Всю линию скобок и зашитую
энтеротомию укрывают с помощью непрерывного шва 2-0.
На этом этапе проводят эндоскопическое исследование
для оценки внутрипросветного кровотечения, патентности
и непрерывности анастомоза. На дистальный отдел Ру-петли
накладывают кишечный зажим, что позволяет растянуть
анастомоз. Хирург погружает анастомоз в 0,9% раствор
натрия хлорида, а эндоскопист при этом накачивает воздух
в желудочный резервуар. Наличие пузырьков свидетельствует
о необходимости наложения дополнительных швов
для профилактики послеоперационной недостаточности
анастомоза.
Противобрыжеечный край петли по Ру подшивают
к брыжейке поперечной ободочной кишки непрерывным
нерассасывающимся швом 2-0. Этот маневр продолжают
книзу до пространства Петерсена, чтобы облитерировать эту
область и предотвратить образование послеоперационных
внутренних грыж.
желудка. Манжетку фиксируют к передней стенке
желудка с помощью швов, захватывающих стенку
желудка. Порт для раздувания и сдувания манжетки крепят
к апоневрозу прямой мышцы живота. Необходимую
регулировку желудочной манжетки проводят во время
ее первичной установки и часто в послеоперационном
периоде (рис. 29-9). К возможным осложнениям
лапароскопической перетяжки желудка относят пролапс
желудка, обструкцию соустья, дилатацию пищевода
и желудочного резервуара, эрозию и некроз желудка
и проблемы, связанные с портом.
Вертикальная гастропластика
с бандажированием
Вертикальная гастропластика с бандажированием
состоит в формировании маленького верхнего желудоч-
ного резервуара с узким соустьем с остальной частью
желудка. Основной этап этой операции обычно
проводят так же, как и при ее открытом варианте. Вдоль
малой кривизны желудка формируют резервуар объемом
15-25 мл с помощью кольца из силиконового
эластомера и сетки Marlex (рис. 29-10). Отдаленными
осложнениями этой операции могут быть рвота и застой
частиц пищи в просвете кольца или ленты. Эти проблемы
обычно можно решить эндоскопически, однако при
выраженной стриктуре возникает необходимость в
хирургическом вмешательстве, если область гастропластики
не поддается эндоскопическому бужированию.
Билиопанкреатическое шунтирование
и дуоденальное отключение
Билиопанкреатическое шунтирование и
дуоденальное отключение — мальабсорбтивные операции. Они
состоят из резекции желудка с остаточным объемом
желудка 100-150 мл. При формировании билиопан-
креатического шунта проводят горизонтальную
резекцию желудка с позадиободочной гастроеюностомией.
Длинную петлю по Ру, несущую кишечное
содержимое, затем анастомозируют с билиопанкреатической
петлей, создавая общий канал (рис. 29-11, А). При
дуоденальном отключении проводят вертикальную
резекцию желудка в виде рукава с сохранением привратника
и анастомозом проксимальной дуоденальной
манжетки с позадиободочной кишечной петлей (рис. 29-11, Б).
Эти операции могут осложняться диареей и
дефицитом витаминов, минералов, питательных веществ
и белков.
АЛЬТЕРНАТИВНЫЕ ОПЕРАЦИИ
Рис. 29-8. Лапароскопическое желудочное бандажирование — чисто рестриктивная
операция, которая представляет собой формирование маленького желудочного
резервуара и соустья с помощью установки манжетки вокруг желудка.
Глава 29. Бариатрическая хирургия 361
Рис. 29-9. При рентгенографии с контрастированием
определяется установленная желудочная манжетка. В порт,
который находится в передней брюшной стенке, вводят 0,99
раствор натрия хлорида под контролем рентгеноскопии.
Затем пациент глотает раствор бария, после чего можно
увидеть конфигурацию желудочного резервуара.
Рис. 29-10. Вертикальная гастропластика с помощью кольца из силиконового эластомера (А). Вертикальная ленточная
гастропластика (Б).
362 Лапароскопическая хирургия. Атлас
Рис. 29-П.Билиопанкреатическая диверсия (А) и дуоденальное
РЕЗУЛЬТАТЫ
Желудочный Y-образный шунт по Ру, впервые
описанный более 30 лет назад, стал «золотым стандартом»
в лечении пациентов с болезненным ожирением,
которым требуется проведение бариатрической операции.
Процедура состоит из рестриктивной и мальабсорб-
тивной части. Рестриктивный фактор достигается
с помощью формирования маленького желудочного
резервуара, а мальабсорбция возникает в результате
обхода дистального отдела желудка и
проксимального отдела двенадцатиперстной кишки, при этом длина
тощей кишки варьирует в зависимости от длины
петли по Ру. В нескольких рандомизированных
контролируемых исследованиях сообщалось о значительном
снижении массы тела и выздоровлении от
сопутствующих ожирению заболеваний пациентов, подвергшихся
операции по формированию желудочного Y-образного
шунта по Ру. Кроме того, масса тела после операции
снижается примерно на 60-70% при избыточной
массе, превышающей нормальный ИМТ на 35%, в течение
примерно 2 лет после процедуры. Потеря массы тела
устойчива во времени, и процентное отношение
потери избыточной массы в течение 5 лет варьирует от 48
до 74% [14] и превышает 50% в течение 14 лет [15]. По-
с пересечением двенадцатиперстной кишки (Б).
мимо послеоперационного снижения массы тела,
после бариатрических процедур отмечается разрешение
таких сопутствующих заболеваний, как сахарный
диабет [15], ночное апноэ и связанная с ожирением гипо-
вентиляция [16, 17], гипертензия [18], патологический
уровень сывороточных липидов [19, 20]. Хотя после
формирования желудочного шунта по Ру [21] процесс
избавления от сопутствующих заболеваний более
выраженный, некоторые исследователи получили
аналогичные результаты и при использовании других
оперативных методов [22, 23].
С внедрением минимально инвазивной техники
лапароскопический желудочный шунт приобрел
широкую популярность среди бариатрических хирургов
и пациентов. В течение последних лет были проведены
несколько исследований, подтвердивших безопасность
и эффективность лапароскопического Y-образного
шунта по Ру. В настоящее время опубликованы
результаты трех проспективных рандомизированных
исследований, сравнивающих исходы операций
лапароскопическим и открытым доступом при выполнении
Y-образного шунта по Ру [24-26]. Эти исследования
показали, что снижение массы тела и разрешение
сопутствующих заболеваний при сравнении этих двух
подходов не различаются. Nguyen et al. [25] выявили,
Глава 29. Бариатрическая хирургия 363
что лапароскопическая операция характеризуется
более длительной продолжительностью, но в этой
группе отмечаются снижение кровопотери, более
короткая госпитализация и скорейшее выздоровление. Это
исследование также показало, что при
лапароскопической операции возрастают интраоперационные
затраты, которые возмещаются меньшими затратами
на пребывание в клинике, а кроме того, значительно
сокращается количество раневых инфекций.
Несмотря на признанные преимущества
лапароскопического желудочного шунта по Ру, открытая бариа-
трическая хирургия все еще играет большую роль в
лечении пациентов с предельно высокими значениями
ИМТ, множественными предшествующими
абдоминальными и бариатрическими операциями. Другой
недостаток лапароскопического доступа — длительный
курс обучения этим технически сложным процедурам;
рекомендовано, чтобы эти операции проводили
хирурги, прошедшие специальную подготовку по
бариатрической хирургии.
Послеоперационные осложнения бариатрической
хирургии разделяют на ранние и поздние.
Послеоперационная 30-дневная смертность после проведения
желудочного шунта составляет примерно 0,5%, общая частота
осложнений — 5% (ТЭЛА, недостаточность анастомоза,
кровотечение, раневая инфекция). К отдаленным
осложнениям относят демпинг-синдром, стриктуру
анастомоза, краевые язвы, разрыв линии скобок и внутренние
грыжи. После операции пациентам рекомендуют прием
внутрь или внутримышечное введение витамина В12,
железа, фолиевой кислоты и кальция, чтобы избежать
дефицитных состояний (к примеру, анемии). В общем, после
открытого проведения шунта наиболее распространены
вентральные грыжи. У пациентов после формирования
желудочного шунта имеется риск дилатации дистально-
го отдела желудка в случае тонкокишечной обструкции,
что может привести к разрыву и смерти, если быстро
не провести дистальную желудочную декомпрессию.
Данные Международного регистра
бариатрической хирургии по 38 501 пациенту, подвергшемуся
бариатрической операции, показывают, что 87,2%
больных после любой из бариатрических операций
не имели 30-дневных осложнений, 3,4% имели
тяжелые 30-дневные осложнения и 9,5% — небольшие
осложнения. Наиболее распространенным
30-дневным осложнением была недостаточность гастроинте-
стинального анастомоза (0,7%), а наиболее частыми
мелкими осложнениями — выделения из раны, се-
ромы или инфекция (1,8%). Отсутствие осложнений
в 30-дневном периоде отмечено после шунтирующих
операций у 86,42% пациентов и у 89,36% пациентов
после рестриктивных операций без шунта. В этой
серии наиболее распространенными осложнениями
шунтирующей операции были недостаточность га-
строинтестинального анастомоза (0,73%), желудочно-
кишечное кровотечение (0,44%), обструкция тонкого
кишечника (0,4%). Тридцатидневная летальность
в этой серии составила 0,24%, а наиболее частой
причиной смерти стала ТЭЛА, за которой следовали
острая сердечная патология и недостаточность га-
строинтестинального анастомоза [27].
ВЫВОДЫ
Хотя для лечения болезненного ожирения
разработано несколько оперативных методов, было
убедительно доказано, что желудочный шунт в данной
ситуации — наиболее безопасная и эффективная
процедура. Ежегодно в США проводят более 140 000 операций
по формированию желудочного шунта.
Выполнение бариатрической операции показано пациентам
с ИМТ более 40кг/м2 или при наличии
сопутствующих заболеваний у пациентов с ИМТ более 35кг/м2.
Лапароскопический желудочный шунт —
эффективный метод лечения, так как обеспечивает устойчивое
снижение массы тела и излечение от сопутствующих
заболеваний.
364 Лапароскопическая хирургия. Атлас
СПИСОК ЛИТЕРАТУРЫ
1. World Health Organization: Fact sheet N. 311,
September 2006. — Available at http: //www. who.
int/mediacentre/factsheets/fs311/en/.
2. Ogden C.L., Carroll M.D., Curtin L.R. et al. Prevalence of
overweight and obesity in the United States, 1999-2004 //
JAMA. — 2006. — Vol. 295. — P. 1549-1555.
3. Mokdad A.H., Ford E.S., Bowman B.A. et al. Prevalence of obesity,
diabetes, and obesity-related health risk factors, 2001 // JAMA. —
2003. — Vol. 289. — P. 76-79.
4. National Center for Health Statistics: Chartbook on Trends in the
Health of Americans. — Hyattsville, MD: Public Health Service, 2005.
5. Finkelstein E.A., Fiebelkorn I.C., Wang G. National medical
spending attributable to overweight and obesity: how much, and
who's paying? // Health Aff. — 2003. — Vol. 3. — P. 219-226.
6. DeMaria E. J., Jamal M.K. Surgical options for obesity //
Gastroenterol. Clin. North Am. — 2005. — Vol. 34. — P. 127-142.
7. Buchwald H. Consensus Conference Panel: Consensus conference
statement bariatric surgery for morbid obesity: health implications
for patients, health professionals, and third-party payers // Surg.
Obes. Relat. Dis. — 2005. — Vol. 1. — P. 371-381.
8. Sugerman H.J., Sugerman E.L., DeMaria E. J. et al. Bariatric surgery
for severely obese adolescents // J. Gastrointest. Surg. — 2003. —
Vol. 7. — P. 102-107.
9. Ma Y., Pagoto S.L., Olendzki B.C. et al. Predictors of weight status
following laparoscopic gastric bypass // Obes. Surg. — 2006. —
Vol. 16. — P. 1227-1231.
10. Lutfi R., Torquati A., Sekhar N., Richards W.O. Predictors of
success after laparoscopic gastric bypass: a multivariate analysis
of socioeconomic factors // Surg. Endosc. — 2006. — Vol. 20. —
P. 864-867.
11. Wong C.Y., O'Moore-Sullivan T. et al. Alterations of left ventricular
myocardial characteristics associated with obesity // Circulation. —
2004. — Vol. 110. — P. 3081-3087.
12. Wang T.J., Parise H, Levy D. et al. Obesity and the risk of new-onset
atrial fibrillation // JAMA. — 2004. — Vol. 292. — P. 2471-2477.
13. DeMaria E. J., Carmody B.J. Perioperative management of special
populations: obesity // Surg. Clin. North Am. — 2005. — Vol. 85. —
P. 1283-1289.
14. Sugerman H.J., Kellum J.M., Engle K.M. et al. Gastric bypass for
treating severe obesity // Am. J. Clin. Nutr. — 1992. — Vol. 55. —
P. 560-566.
15. Pories W.J., Swanson M.S., MacDonald K. G. et al. Who would have
thought it? An operation proves to be the most effective therapy for
adult-onset diabetes mellitus // Ann. Surg. — 1995. — Vol. 222. —
P. 339-350.
16. Charuzi I., Lavie P., Peiser J., Peled R. Bariatric surgery in morbidly
obese sleep-apnea patients: short- and long-term follow-up // Am.
J. Clin. Nutr. — 1992. — Vol. 55. — P. 594-596.
17. Sugerman H.J., Fairman R.P., Sood R.K. et al. Long-term effects of
gastric surgery for treating respiratory insufficiency of obesity //
Am. J. Clin. Nutr. — 1992. — Vol. 55. — P. 597-601.
18. Benotti P.N., Bistrain В., Benotti J.R. et al. Heart disease and
hypertension in severe obesity: the benefits of weight reduction //
Am. J. Clin. Nutr. — 1992. — Vol. 55. — P. 586-590.
19. Brolin R.E. Results of obesity surgery // Gastroenterol. Clin.
North Am. — 1987. — Vol. 16. — P. 317-338.
20. Gleysteen J.J. Results of surgery: long-term effects on hyperlipi-
demia // Am. J. Clin. Nutr. — 1992. — Vol. 55. — P. 591-593.
21. Kushner R.F., Noble C.A. Long-term outcome of bariatric surgery: an
interim analysis // Mayo Clin. Proc. — 2006. — Vol. 81. — P. 46-51.
22. Spivak H., Hewitt M.F., Onn A., Half E.E. Weight loss and
improvement of obesity-related illness in 500 U. S. patients
following laparoscopic adjustable gastric banding procedure //
Am. J. Surg. — 2005. — Vol. 189. — P. 27-32.
23. O'Brien P.E., Dixon J.B., Brown W et al. The laparoscopic adjustable
gastric band (Lap-Band): a prospective study of medium-term
effects on weight, health and quality of life // Obes. Surg. —
2002. — Vol. 12. — P. 652-660.
24. Higa K.D., Но Т., Boone K.B. Laparoscopic Roux-en-Y gastric
bypass: technique and 3-year follow-up // J. Laparoendosc. Adv.
Surg. Tech. A. — 2001. — Vol. 11. — P. 377-382.
25. Nguyen N.T., Goldman C, Rosenquist C.J. et al. Laparoscopic versus
open gastric bypass: a randomized study of outcomes, quality of life,
and costs // Ann. Surg. — 2001. — Vol. 234. — P. 279-289.
26. Lujan J.A., Frutos M.D., Hernandez Q. et al. Laparoscopic
versus open gastric bypass in the treatment of morbid obesity: a
randomized prospective study // Ann. Surg. — 2004. — Vol. 239. —
P. 433-437.
27. Gastrointestinal surgery for severe obesity. Proceedings of a
National Institutes of Health Consensus Development Conference.
March 25-27, 1991, Bethesda, MD // Am. J. Clin. Nutr. — 1992. —
Vol. 55. — P. 487-619.
Глава 29. Бариатрическая хирургия 365
Эндолюминаяьная
хирургия: инструменты
и основы техники
Дьюи Кан Фам, Аврора Д. Приор
иш&шш
Эндоскопию для осмотра различных органов начали
использовать еще в XVIII в. Однако эта область
медицины не развивалась до изобретения George Wolf
гибкого эндоскопа в 1932 г. В дальнейшем разработка фи-
брооптических систем в 1957 г. Basil Hirschowitz и Larry
Curtiss привела к резкому скачку в развитии
эндоскопии как диагностического и терапевтического метода.
В этой главе даны общие рекомендации по
использованию эндоскопического инструментария и описаны
последние разработки в области эндолюминальной
терапии.
КАБИНЕТ ДЛЯ ЭНДОСКОПИИ
Эндоскопические процедуры необходимо проводить
либо в специальном кабинете, либо в операционной.
Кабинет должен быть оборудован необходимыми
эндоскопическими инструментами (эндоскопом,
осветителем, монитором или видеооборудованием и
эндоскопическими инструментами), а также устройством
для мониторинга гемодинамики. В инструкциях
Общества американских эндоскопических хирургов,
Американского общества гастроинтестинальной эндоскопии
и Американского общества колоректальных хирургов
перечислены требования к разрешению на проведение
эндоскопии из официального отчета за июнь 2001 г.
[1]. Кроме того, персонал должен быть
сертифицирован для проведения пациентам седации и безопасного
проведения дыхательного и гемодинамического
мониторинга. В качестве альтернативы седацию может
выполнять специально приглашенный анестезиолог.
ОБОРУДОВАНИЕ
Эндоскопы
В качестве эндоскопов обычно используют
гастроскопы и колоноскопы (рис. 30-1). Помимо этих
инструментов, существуют еще специальные дуоденоскопы
и холедохоскопы. Гастроскопы имеют длину 1050-1250
и диаметр 6-13 мм. Колоноскопы крупнее, длиной
примерно 1700 и толщиной 11-13 мм. Кончики
гибких эндоскопов могут двигаться, сгибаясь вверх/вниз
под углами 180-210/90-180° и вправо/влево под
углами 105-160/90-160° (рис. 30-1, Б). Такое сгибание
обеспечивает угол обзора от 100 до 140°. Эндоскопы
имеют разные углы обзора и разные характеристики
Рис. 30-1. Эндоскопы. Гастроскопы и колоноскопы могут иметь разные диаметр и длину (А). Все гибкие эндоскопы имеют рукоятку
для контроля изгиба кончика вверх/вниз и вправо/влево (Б). При осмотре кончика эндоскопа (В) видны каналы для инсуффляции,
орошения и один или два рабочих канала для введения эндоскопических инструментов и аксессуаров.
Глава 30. Эндолюминаяьная хирургия: инструменты и основы техники 367
изображения. Все снабжены как минимум одним
каналом диаметром от 2 до 5 мм (рис. 30-1, В). Эти каналы
используют для введения инструментов. На рукоятке
эндоскопа имеются кнопки для контроля инсуффля-
ции, аспирации и ирригации (рис. 30-1, Б). Кроме этих
кнопок, на передней поверхности, на правой стороне
рукоятки, расположены три кольца. Наружное
кольцо служит для нейтрализации положения кончика.
Среднее кольцо сгибает кончик вверх/вкниз, а
внутреннее — вправо/влево. Две кнопки контролируют
аспирацию (верхняя кнопка) и инсуффляцию/ирри-
гацию (нижняя кнопка). Дистальная кнопка имеет
отверстие. Осторожное закрытие этого отверстия
вызывает инсуффляцию. Нажатие на эту кнопку вызывает
орошение жидкостью. И, наконец, снизу, на передней
поверхности рукоятки эндоскопа, имеется канал, через
который можно ввести различные петли.
Осветитель
Для адекватного освещения желудочно-кишечного
тракта необходим высокоинтенсивный источник
света. В современных системах применяют галогеновые
или ксеноновые лампы мощностью 150-300 Вт.
Большинство осветителей совмещены в один прибор с
насосом для инсуффляции и ирригации. Кроме того,
возможно присоединение к ним отсоса.
Мониторы и видеооборудование
Видеопроцессоры и мониторы доступны в
разнообразных конфигурациях. Вкратце, гастроскоп
соединяется с осветителем, который, в свою очередь,
соединен с видеопроцессором. Видеопроцессор убирает
шумы с изображения и посылает его на видеомонитор.
В настоящее время доступны системы телевидения
с высоким разрешением (HDTV) и одним или двумя
осветителями и видеопроцессорами. Монитор
может быть жидкокристаллическим или плазменным
или на основе стандартной катодной трубки.
Аксессуары
В настоящее время на рынке представлено
множество эндоскопов разных фирм (рис. 30-2). Для
лечения кровоточащих желудочных язв применяют
инъекционные иглы (рис. 30-2, А). Образец
ткани можно получить с помощью петли (рис. 30-2, Б)
или биопсийных щипцов (рис. 30-2, В). Биопсийные
щипцы могут быть двух видов: с иглой у основания
бранш щипцов для лучшего захвата ткани и без иглы.
Рис. 30-2. Эндоскопические аксессуары. Эндоскопическую иглу
(А) используют для инъекций адреналина при кровоточащих
язвах или коллагена (или полиметилакрилата) для усиления
нижнего пищеводного сфинктера. Эндоскопические петли (Б)
необходимы для удаления полипов. Биопсийные щипцы (В)
могут иметь центральное острие, быть плоскими или иметь
зубцы на концах браншей. Эти щипцы позволяют получить
образцы тканей для гистологического исследования.
Гастроинтестинальные стриктуры можно лечить с помощью
стентов с покрытием (Г) или баллонной ангиопластики (Д) (А -
собственность «Olympus»; В-Д — собственность «Boston
Scientific»).
368 Лапароскопическая хирургия. Атлас
Для гемостаза к петлям или биопсийным щипцам
может быть присоединен электрокоагулятор. Кроме
того, имеются эндоскопические стенты с покрытием
или без (рис. 30-2, Г) и устройства для баллонной
ангиопластики (рис. 30-2, Д), применяемые для лечения
мест сужения или стриктур.
Канюля для эндоскопической ретроградной
холедохопанкреатографии
Для выполнения эндоскопической ретроградной
холедохопанкреатографии требуется более гибкая
и подвижная канюля (рис. 30-3). Дуоденоскоп,
который немного длиннее гастроскопа и имеет меньший
угол обзора, используется вместе с проводником
и специальными аксессуарами, нуждающимися в
проводнике. Сфинктеротом может иметь просвет разного
диаметра для одновременных манипуляций с
проводников, инъекционным или режущим устройством.
Желчные камни можно извлекать с помощью
корзинки (рис. 30-3, А) или специального баллона (рис.
30-3, Б). Существует множество билиарных стентов
(рис. 30-3, В), по-разному изогнутых (прямой, с
дуоденальным или центральным изгибом) и имеющих
разный диаметр (7-10F).
Ультразвуковое исследование и специальные
эндоскопы
УЗИ желудочно-кишечного тракта можно проводить
с помощью эндоскопов. Эти эндоскопы имеют
ультразвуковой датчик с переменной частотой, который
встроен в кончик эндоскопа (рис. 30-4). Линейное
эндоскопическое УЗИ (рис. 30-4, А) считалось «золотым
стандартом» эндоскопической сонографии,
ультразвуковой эндоскоп обладал такой же подвижностью,
как и обычный. Радиальные датчики (рис. 30-4, Б)
посылают звуковые волны радиально и позволяют
получать одновременно изображение всей окружности
под углом 360°, таким образом делая ненужными
постоянные передвижения датчика. Все датчики имеют
каналы, через которые можно проводить
диагностические (тонкоигольную аспирацию) и лечебные
(дренирование кист) процедуры.
Рис. 30-3. Билиарные инструменты. Заболевания билиарной
системы можно успешно лечить эндоскопически с применением
билиарных инструментов. Для безопасных манипуляций
в билиарной системе разработано множество инструментов,
которые должны обладать большой подвижностью. Желчные
камни, застрявшие в общем желчном протоке, можно извлечь
с помощью корзинок (А) или баллонной системы (Б). Пациентам
с острыми или хроническими стриктурами желчных путей можно
временно устанавливать билиарные стенты (В) (собственность
«Olympus»).
Рис. 30-4. Эндоскопическое
ультразвуковое исследование. Первые
версии эндоскопических ультразвуковых
устройств имели линейный датчик,
встроенный в кончик эндоскопа (А).
Новые эндоскопические ультразвуковые
устройства имеют радиальный датчик
(Б) и позволяют получать одновременно
изображение всей окружности
под углом 360°, таким образом
исключая необходимость постоянного
передвижения датчика. Эндоскопические
ультразвуковые датчики снабжены
каналом для игольных биопсий, который
позволяет получить образцы ткани
экстралюминальных образований
(собственность «Pentax»).
Глава 30. Эндолюминальная хирургия: инструменты и основы техники 369
ПОДГОТОВКА ПАЦИЕНТА
Пациент должен перестать принимать пищу и
питье (за исключением приема необходимых лекарств)
как минимум за 6 ч до эндоскопического
исследования. В общем, пациенты для выполнения им
эндоскопии верхнего отдела пищеварительного тракта
не нуждаются в какой-либо дополнительной
подготовке. Некоторым пациентам с дисфагией или
подозрением на ахалазию рекомендуют воздерживаться
от приема пищи и жидкости более длительное
время. Для проведения эндоскопического исследования
нижних отделов пищеварительного тракта требуется
подготовка кишечника для адекватной визуализации
просвета кишки. Пациентам назначают жидкую
диету за день до процедуры. Адекватной будет
подготовка кишечника с помощью трех унций «Phospho-soda»
(СВ. Fleet, Lynchburg, VA) и одного галлона «GoLytely»,
«Half-Lytely» или «NyLytely» (Braintree Laboratories,
Braintree, MA) до тех пор, пока выделения не
очистятся до такой степени, что в них не будет частиц кала.
Пациентам нужно напомнить о необходимости
достаточного употребления жидкости в процессе
подготовки кишечника.
Укладка пациента и основы
эзофагогастродуоденоскопии
Пациенты во время эндоскопических процедур
обычно лежат в левом латеральном положении (рис. 30-5).
Интубированным пациентам эндоскопия может быть
проведена и в положении на спине. Введению
эндоскопа способствует специальный мундштук, который
Рис. 30-5. Укладка для эндоскопии. Пациентов для эндоскопии
укладывают в латеральное положение. При эндоскопии
верхнего отдела пищеварительного тракта пациент лежит
лицом к эндоскописту (А), а при эндоскопии нижнего отдела
служит для профилактики укуса эндоскопа пациентом
и создания сопротивления его введению.
При введении эндоскопа в ротоглотку для его
дальнейшего продвижения необходимо четко
визуализировать язык, трахею, надгортанник и пищевод. Эндоскоп
продвигают в просвет пищевода с осторожностью.
Осторожная инсуффляция препятствует спадению
стенок пищевода перед эндоскопом. Областями с
наиболее высоким риском перфорации считают глотку
и верхний отдел пищевода. При достижении нижнего
пищеводного сфинктера можно диагностировать хиа-
тальные грыжи. Эндоскопист может распознать
желудок по его характерным складкам. Желудок
необходимо обследовать на наличие язв, опухолей или
патологически измененной слизистой оболочки. Пилориче-
ский сфинктер можно пройти с помощью осторожной
подачи воздуха для расслабления сфинктера. Многие
патологические изменения могут быть
диагностированы во время извлечения эндоскопа.
Укладка и основы эндоскопии нижнего
отдела пищеварительного тракта
Осмотр ануса и прямой кишки можно провести с
помощью аноскопа, ректоскопа и гибкого эндоскопа. Ано-
скопию и ректоскопию лучше проводить в коленно-
локтевом положении пациента. Однако сигмоидоско-
пию или колоноскопию с помощью гибкого эндоскопа
обычно выполняют в латеральном положении
пациента. Перед введением любого из инструментов
необходимо проводить тщательное ректальное исследование.
Анус следует осмотреть снаружи на наличие геморроя
пищеварительного тракта — наоборот (Б). Видеооборудование
обычно находится рядом с эндоскопистом. Монитор лучше
установить в головном конце кровати, экраном к эндоскописту.
370 Лапароскопическая хирургия. Атлас
или опухолей и прощупать изнутри на наличие
стеноза или опухолей. С помощью аноскопа можно увидеть
зубчатую линию, внутренний геморрой, низкие
ректальные или анальные опухоли. Ригидный ректоскоп,
имеющий длину 20-25 см, позволяет четко
визуализировать прямую кишку практически до кармана
брюшины. Гибкие сигмоидоскопы длиной 700 мм
используют для осмотра сигмовидной кишки. Колоноскопы
позволяют осмотреть всю ободочную кишку и иногда
терминальный отдел подвздошной кишки.
Ректоскоп, сигмоидоскоп или колоноскоп вводят
осторожно, с аккуратной инсуффляцией. При
попадании в прямую кишку проходят три складки, примерно
на 6, 8 и 12 см от края анального отверстия.
Необходимо проявлять осторожность при прохождении этих
ректальных клапанов, так как перфорация прямой
кишки отмечается наиболее часто в области
среднего и верхнего клапанов. Эндоскоп продвигают только
при условии четкой видимости просвета. Осторожное
нажатие на живот пациента может помочь в
ориентировке в области селезеночного и печеночного изгибов.
Маленькие полипы на ножке можно удалить у
основания с помощью петли (рис. 30-2, Б). Крупные полипы,
которые нельзя удалить эндоскопически, подлежат
биопсии и маркировке тушью.
ЭНДОЛЮМИНАЛЬНОЕ ЛЕЧЕНИЕ БОЛЕЗНИ
ГАСТРОЭЗОФАГЕАЛЬНОГО РЕФЛЮКСА
Гастроэзофагеальная рефлюксная болезнь
характеризуется как симптомами рефлюкса (изжогой, регур-
гитацией), так и его осложнениями (дыхательными
симптомами, дисфагией, одинофагией). Гастроэзофа-
геальную рефлюксную болезнь обычно лечат путем
модификации образа жизни, а также медикаментозно
(антацидами, антагонистами Н2-рецепторов или
ингибиторами протонного насоса). Пациенты,
рефрактерные к оптимальной медикаментозной терапии и не
желающие постоянно принимать лекарства, подвергаются
Рис. 30-6. NDO-пликатор {NDO Surgical, Mansfield, MA).
Пликатор — модификация эзофагогастродуаоденоскопа (А),
он имеет два кончика, способных к ретрофлексии (Б). Пликатор
вводят в желудок, располагая его на 1 см дистальнее желудочно-
пищеводного соустья, и проводят его ретрофлексию (В). Зубцы
пликатора открывают, обнажая тканевый ретрактор, который
вводят в стенку желудка через все ее слои (Г). Затем зубцы
пликатора закрывают (Д) и прошивают заранее завязанными
швами с прокладками (Е). Получается полнослойная пликация
«слизистая к слизистой», что приводит к восстановлению
антирефлюксного барьера (Ж).
Глава 30. Эндолюминальная хирургия: инструменты и основы техники 371
хирургическому вмешательству. Для больных, которые
по каким-либо причинам не подходят для операции
или предпочитают менее агрессивное хирургическое
лечение, лучшей альтернативой может стать эндолю-
минальная терапия гастроэзофагеальной рефлюксной
болезни. Большинство из этих процедур можно
выполнить амбулаторно, и они не осложняют проведение
хирургических вмешательств в будущем.
NDO-пликатор
NDO-пликатор (NDO Surgical, Mansfield, MA)
разработан для полнослойной пликации в области
желудочно-пищеводного соустья под
непосредственным эндоскопическим контролем. Пликация
изменяет структуру антирефлюксного барьера,
усиливая компетентность кардии желудка. Эта
амбулаторная процедура занимает примерно 15-20 мин.
Само устройство было одобрено в 2003 г. US Food
and Drug Administration. Пликатор, представленный
на рис. 30-6, — модификация эзофагогастродуодено-
скопа. После первичного эндоскопического осмотра
через просвет привратника вводят проводник Savory
и удаляют эндоскоп. Расстояние до желудочно-
пищеводного перехода отмечают перед
удалением эндоскопа. По проводнику вводят пищеводный
буж 54F. Буж удаляют, а корпус пликатора вводят
по проводнику до уровня примерно на 5 см ниже
желудочно-пищеводного соустья. Затем через канал
пликатора вводят детский эндоскоп и проводят
ретрофлексию корпуса устройства. Зубцы пликатора
открывают, обнажая центральный тканевый ретрак-
тор (рис. 30-6, Е), который вводят в стенку желудка
через все слои в области желудочно-пищеводного
соустья. Затем прошивают заранее завязанными
полипропиленовыми 2-0 швами с прокладками
(рис. 30-6, Д), формируя пликацию в области
кардии желудка и восстанавливая клапанный механизм
желудочно-пищеводного перехода.
В мультицентровом исследовании с участием 64
пациентов были показаны значительное облегчение
симптомов болезни гастроэзофагеального рефлюкса
и уменьшение заброса кислоты в течение 6 мес [2].
Пациенты хорошо переносили процедуру, и 74% из них
не понадобился прием ингибиторов протонного
насоса в течение 6 мес. При мультицентровом
исследовании и наблюдении в течение 12 мес (п=36) после
процедуры с применением пликатора II поколения 68%
пациентов не понадобился прием ингибиторов
протонного насоса в течение всего срока наблюдения [3].
Полученные результаты были подтверждены
данными Североамериканского мультицентрового
исследования, включавшего 57 пациентов [4].
«EndoCinch»
При применении устройства «EndoCinch» (C.R. Bard
and Davol, Murray Hill, NJ) восстанавливают антиреф-
люксный барьер с помощью формирования складки
в области желудочно-пищеводного соустья (рис. 30-
7). Складку формируют и фиксируют серией швов,
которые накладывают с помощью «EndoCinch».
С помощью эндоскопа «EndoCinch» вводят до
уровня желудочно-пищеводного соустья (рис. 30-7, Б).
Рис. 30-7. «EndoCinch» {C.R. Bard and
Davol, Murray Hill, NJ). С помощью
эндоскопа продвигают устройство
«EndoCinch» (А) до уровня желудочно-
пищеводного соустья (Б). Далее с его
участием накладывают восьмиобразный
шов на прилежащие друг к другу участки
нижнего пищеводного сфинктера
(В). Шов завязывают, сопоставляя
противоположные части сфинктера
и формируя складку (Г). Это усиливает
нижний пищеводный сфинктер
и восстанавливает антирефлюксный
барьер.
372 Лапароскопическая хирургия. Атлас
Используя его, накладывают восьмиобразный шов
на прилежащие друг к другу области нижнего
пищеводного сфинктера (рис. 30-7, В). Швом
сопоставляют противоположные части сфинктера и
формируют складку (рис. 30-7, Г), что усиливает нижний
пищеводный сфинктер и восстанавливает антиреф-
люксный барьер.
Первые исследования метода «EndoCinch»
показали его перспективность. Отмечались улучшение
симптомов и нормализация уровня рН через 3 и 12
мес после операции [5, 6]. Однако в более крупном
исследовании с длительным сроком наблюдения
было доказано, что эти результаты не были стойкими
[7]. И, наконец, проспективное исследование,
которое сравнивало результаты применения «EndoCinch»
и лапароскопической фундопликации по Ниссену
[8], установило, что пациенты в группе «EndoCinch»
были менее удовлетворены результатами лечения
(66 против 93%; р=0,1) и потребность в приеме
ингибиторов протонного насоса была выше в группе
«EndoCinch» (32 против 13%; р=0,03). Было показано,
что у этого устройства имеются некоторые
перспективы при лечении другой патологии желудка:
недавно сообщили о его успешном использовании для
закрытия желудочно-желудочной фистулы у пациента
после желудочного шунтирования [9].
Stretta
Впервые радиочастотную абляцию для усиления
нижнего пищеводного сфинктера применил Utley.
В результате была разработана система Stretta {Curon
Medical, Fremont, CA) (рис. 30-8), которая получила
одобрение US Food and Drug Administration для
применения в лечении гастроэзофагеальной рефлюксной
болезни в 2000 г. Это амбулаторная процедура,
занимающая 40 мин или менее; радиочастотная энергия
доставляется с помощью гибкого четырехканально-
го бужа с радиально установленными электродами
(рис. 30-8, А). На кончике имеются каналы для
аспирации и ирригации холодной водой для
температурного контроля. Мониторируют сопротивление
и температуру ткани, чтобы избежать повреждения
слизистой оболочки. Устройство отключается, если
сопротивление превышает 1000 Ом или температура
превышает безопасные пределы (100° для мышц и 50°
для слизистой оболочки).
Для обнаружения желудочно-пищеводного
перехода и установки в желудок гибкого проводника
проводят эндоскопическое исследование. Эндоскоп
удаляют, и катетер Stretta вводят по проводнику,
располагая его на уровне желудочно-пищеводного перехода
(рис. 30-8, А). Баллон раздувают, при этом электроды
соприкасаются с нижним отделом пищевода и
радиочастотный сигнал включают на 90 с, чтобы достичь
температуры 85 "С. После ротации баллона на 45°
получается восемь очагов повреждений (рис. 30-8,
Б). Катетер продвигают по 0,5 см с интервалами,
чтобы получить четыре кольца повреждений. Наиболее
проксимальное кольцо находится на расстоянии 0,5 см
от перехода плоского эпителия в цилиндрический,
а дистальное расположено в области кардии. В конце
процедуры проводят завершающее эндоскопическое
исследование. Со временем ткань заживает и
сокращается, восстанавливая антирефлюксный барьер.
Исследования, которые изучали действие
процедуры Stretta, показали ее перспективность. В
рандомизированном двойном слепом контролируемом
исследовании с участием 64 пациентов [10] было
показано, что у пациентов, леченных с помощью
радиочастотного устройства, отмечалось улучшение
симптомов гастроэзофагеальная рефлюксной
болезни через 6 мес. Кроме того, анализ ранних и
отдаленные результатов лечения с помощью системы Stretta
показал улучшение баллов по системе DeMeester,
снижение длительности контакта с кислотой и
потребности в использовании ингибиторов протонного
насоса [11, 12]. Хотя не было проведено исследований,
напрямую сравнивавших результаты
лапароскопической фундопликации по Ниссену и процедуры
Stretta, пациентам, рефрактерным к радиочастотной
абляции, обычно рекомендуют хирургическое
вмешательство.
Рис. 30-8. Stretta (Curon Medical,
Fremont, CA). Пациенту, находящемуся
под седацией, устанавливают катетер
Stretta в пищевод на уровне желудочно-
пищеводного перехода с помощью
проводника (А). Затем катетер используют
для приложения радиочастотной энергии
к нижнему пищеводному сфинктеру
и кардии желудка (Б). Со временем ткань
заживает и сокращается, восстанавливая
антирефлюксную защиту.
Глава 30. Эндолюминальная хирургия: инструменты и основы техники 373
ТРАНСЛЮМИНАЛЬНАЯ ХИРУРГИЯ
ЧЕРЕЗ ЕСТЕСТВЕННЫЕ ОТВЕРСТИЯ
Транслюминальная хирургия через естественные
отверстия — область множества исследований,
разработок и споров; она расширяет возможности эндоскопии,
выводя ее за пределы просвета кишки с
диагностическими и терапевтическими целями. Начатая с
исследований на животных, транслюминальная хирургия
через естественные отверстия в настоящее время
позволяет успешно проводить у животных наложение
степлера на желудок [13-15], холецистэктомию [16],
спленэктомию [17] и аппендэктомию [18]. Этот новый
метод, при котором эндоскоп используют для
проникновения в брюшную полость через разрез в стенке
желудка или другого органа брюшной полости, позволяя
избежать разреза брюшной стенки и провести
хирургическое вмешательство, был успешно применен у
людей и проходит стадию клинических исследований.
СПИСОК ЛИТЕРАТУРЫ
1. Executive Committee of Society of American Gastrointestinal
Endoscopic Surgeons, the American Society for Colon and Rectal
Surgeons, and the American Society for Gastrointestinal Endoscopy:
Granting of privileges of gastrointestinal endoscopy. — Available at
http: //www. sages, org/sagespublica-tion. php? doc=ll.
2. Pleskow D., Rothstein R., Lo S. et al. Endoscopic full-thickness
plication for the treatment of GERD: a multicenter trial //
Gastrointest. Endosc. — 2004. — Vol. 59. — P. 163-171.
3. Haber G, Sakai P., Maluf-Filho F. et al. The Plicator procedure
for the treatment of GERD: 12-month multicenter results //
Gastrointest. Endosc. — 2005. — Vol. 61. — P. AB17.
4. Pleskow D., Rothestein R., Lo S. et al. Endoscopic full-thickness
plication for the treatment of GERD: 12-month follow-up for
the North American open-label trial // Gastrointest. Endosc. —
2005. — Vol. 61. — P. 643-649.
5. Mahmood Z., Ang Y. «EndoCinch» treatment for GERD: where it
stands // Gut. — 2005. — Vol. 54. — P. 1820-1821.
6. Arts J., Lerut Т., Rutgeerts P. et al. A one-year follow-up study of
endoluminal gastroplication («EndoCinch») in GERD patients
refractory to proton pump inhibitor therapy // Dig. Dis. Sci. —
2005. — Vol. 50. — P. 351-356.
7. Schiefke I., Zabel-Langhennig A., Neumann S. et al. Long-term
failure of endoscopic gastroplication («EndoCinch») // Gut. —
2005. — Vol. 54. — P. 752-758.
8. Chadalavada R., Lin E., Swafford V et al. Comparative results of
endoluminal gastroplasty and laparoscopic antireflux surgery for the
treatment of GERD // Surg. Endosc. — 2004. — Vol. 18. — P. 261-265.
9. Merrifield В., Lautz D., Thompson С Endoscopic repair of gastric
leaks after Roux-en-Y gastric bypass: a less invasive approach //
Gastrointest. Endosc. — 2006. — Vol. 63. — P. 710-714.
10. Corley DA., Katz P., Wo J.M. et al. Improvement of
gastroesophageal reflux symptoms after radiofrequency energy: a
randomized, sham-controlled trial // Gastroenterology. — 2003. —
Vol. 125. — P. 668-676.
11. Lutfi R.E., Torquati A., Kaiser J. et al. Three year's experience
with Stretta procedure: did it really make a difference? // Surg.
Endosc. — 2005. — Vol. 19. — P. 289-295.
12. Wolfsen H.C., Richards W.O. The Stretta procedure for the
treatment of GERD: a registry of 558 patients // Laparoendosc. Adv.
Surg. Tech. A. — 2001. — Vol. 12. — P. 395-402.
13. Felsher J., Rosen M., Farres H et al. A novel endolaparoscopic
intragastric partitioning for treatment of morbid obesity // Surg.
Laparosc. Endos. Percutan. Tech. — 2004. — Vol. 14. — P. 243-246.
14. Ни В., Kantsevoy S.V The technical feasibility of endoscopic
gastric reduction: a pilot study in a porcine model // Gastrointest.
Endosc. — 2005. — Vol. 61. — P. AB80.
15. Awan A.N., Swain C.P. Endoscopic vertical band gastroplasty with
an endoscopic sewing machine // Gastrointest. Endosc. — 2002. —
Vol. 55. — P. 254-256.
16. Park P.O., Bergstrom M., Ikeda K. et al. Experimental studies
of transgastric gallbladder surgery: cholecystectomy and
cholecystogastric anastomosis // Gastrointest. Endosc. — 2005. —
Vol. 61. — P. 601-606.
17. Kantsevoy S.V, Ни В., Jagannath S.B. et al. Transgastric endoscopic
splenectomy: is it possible? // Surg. Endosc. — 2006. — Vol. 20. —
P. 522-525.
18. Unger E., Mayr W, Gasche С Design and instrumentation of new
devices and methods for performing appendectomy at colonoscopy //
Gastrointest. Endosc. — 2005. — Vol. 61. — P. AB106.
374 Лапароскопическая хирургия. Атлас
*\
Лапароскопическая
хирургия
поджелудочной железы
Джин С. Йо, Аврора Д. Приор
Лапароскопическая хирургия поджелудочной железы
первоначально применялась только с
диагностической целью — для стадирования рака
поджелудочной железы или проведения паллиативных операций
при неоперабельном раке. За последние 10 лет
использование лапароскопии при заболеваниях
поджелудочной железы расширилось до некрэктомии
при панкреонекрозах, дренирования
панкреатических псевдокист и резекции опухолей поджелудочной
железы. В общем, к преимуществам минимально ин-
вазивной хирургии относят уменьшение
интенсивности послеоперационных болей и выраженности
пареза кишечника, более короткий период
госпитализации и более быстрое выздоровление после операции.
Все это объясняется тем, что лапароскопия позволяет
избежать проведения большого лапаротомного
разреза и значительных манипуляций с органами
брюшной полости для получения операционного доступа,
что характерно для открытых операций. Кроме того,
лапароскопия дает отличную анатомическую картину,
что имеет первостепенное значение при
панкреатической хирургии из-за наличия крупных сосудов в зоне
операции и забрюшинного расположения
поджелудочной железы. Эта глава посвящена
предоперационному обследованию, показаниям к операции и
хирургической технике дистальной панкреатэктомии с
сохранением и без сохранения селезенки. Кроме того,
затронуто обсуждение операций при псевдокистах
и панкреатикодуоденэктомии.
ЛАПАРОСКОПИЧЕСКАЯ РЕЗЕКЦИЯ
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
ПРИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЯХ
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Чаще всего (>70% случаев) лапароскопическую
резекцию выполняют при доброкачественных опухолях
поджелудочной железы (цистаденомах) и таких
локализованных неироэндокринных опухолях, как инсули-
номы. В общем, злокачественные опухоли
поджелудочной железы служат противопоказанием к
лапароскопической операции. Однако имеются данные в пользу
того, что лапароскопическая резекция
злокачественных опухолей поджелудочной железы может быть
проведена безопасно, с соблюдением онкологических
принципов и, что более важно, без отрицательного
влияния на общий прогноз [1-4]. Недостатками этих
исследований считают небольшое количество
пациентов и короткий период наблюдения (<5 лет). Для того
чтобы подтвердить эти данные, необходимо
проведение дальнейших исследований, а до тех пор
лапароскопическая резекция при установленном диагнозе рака
поджелудочной железы должна проводиться только
в условиях клинического исследования. Повсеместно
встречаются ситуации, когда оказывается, что опухоль
поджелудочной железы, которая считалась
доброкачественной в результате предоперационной
диагностики, на самом деле имеет злокачественную природу
при окончательном гистологическом исследовании.
К таким случаям надо подходить индивидуально, имея
в виду следующие данные:
• наличие или отсутствие рака в крае резекции;
• будет ли протяженность повторной резекции, в
случае ее необходимости, соответствовать
онкологическим требованиям;
• доступность и эффективность дополнительной
терапии;
• сопутствующие заболевания пациента.
Предоперационная диагностика
Пациенту с кистой или образованием поджелудочной
железы, которому может понадобиться хирургическая
операция, необходимо выполнить:
• соответствующие визуальные методы обследования
для определения анатомии;
Глава 31. Лапароскопическая хирургия поджелудочной железы 375
• возможно, биохимические исследования, если
признаки и симптомы свидетельствуют о возможности
обнаружения гормонально-активной опухоли.
Первый тест, который рекомендуют провести
авторы, — это КТ по протоколу поджелудочной железы
с 3-4-миллиметровыми срезами через поджелудочную
железу для ориентации хирургического доступа. Если
возникли подозрения о злокачественной природе
образования или необходимо уточнение анатомии
протоков, могут быть применены эндоскопическое УЗИ
с биопсией или без и/или ретроградная холангиопан-
креатография с щеточной биопсией или без нее.
Определение биохимических маркеров осуществляют
выборочно, основываясь на наличии у пациента
признаков или симптомов, которые могут быть характерны
для гормонально-активной нейроэндокринной
опухоли, так как почти все эти пациенты имеют симптомы
заболевания. К примеру, инсулинома — наиболее
распространенная нейроэндокринная опухоль
поджелудочной железы. Пациенты с инсулиномой классически
имеют триаду симптомов Уиппла: гипогликемию,
глюкозу в крови менее 50 мг/дл и облегчение симптомов
при назначении глюкозы. Инсулиномы равномерно
распределяются в поджелудочной железе, и те из них,
которые расположены в области тела или хвоста,
подходят для дистальной панкреатэктомии. Для точного
установления диагноза и локализации образования,
возможно, понадобится проведение дополнительных
провокационных тестов или локализующих
исследований (селективной ангиографии).
ЛАПАРОСКОПИЧЕСКАЯ ДИСТАЛЬНАЯ
ПАНКРЕАТЭКТОМИЯ
Показания и противопоказания
Показания к проведению лапароскопической
дистальной панкреатэктомии соответствуют таковым для
открытой операции, за исключением того, что
лапароскопический доступ в настоящее время применяется
только при предположительно доброкачественной
патологии. С помощью этого доступа могут быть
резецированы опухоли и псевдокисты, расположенные в
области тела и хвоста поджелудочной железы.
Абсолютными противопоказаниями,
специфичными для лапароскопической дистальной
панкреатэктомии, служат опухоли поджелудочной железы, которые
определены перед операцией как злокачественные,
и неопытность хирурга в проведении открытых
операций на поджелудочной железе или сложных
лапароскопических вмешательств.
СОХРАНЕНИЕ СЕЛЕЗЕНКИ
Существует три основных варианта проведения
дистальной панкреатэктомии:
• с удалением селезенки одним блоком;
• с сохранением селезенки и селезеночных сосудов;
• с пересечением селезеночных сосудов проксималь-
нее патологического образования по линии
пересечения железы и затем снова в области ворот
селезенки; при этом жизнеспособность селезенки
поддерживается за счет коллатерального кровотока.
Логическим обоснованием сохранения
селезенки служит сохранение иммунитета против
микроорганизмов, имеющих капсулу (Haemophilus, Neisseria,
Streptococcus). Хирурги, обычно не сохраняющие
селезенку, оправдывают это тем, что, хотя некоторые
исследования и показывают, что сохранение селезенки
ведет к снижению периоперационной заболеваемости
и смертности [5] (особенно это касается
инфекционных осложнений), имеются исследования, в которых
не находят такой разницы [5-10]. Кроме того,
сохранение селезеночных сосудов усложняет и без того
трудную лапароскопическую операцию. Сохранение
селезенки только с коллатеральным кровоснабжением (то
есть короткими желудочными сосудами и мелкими
сосудами, проходящими в селезеночно-ободочной
связке) позволяет сохранить селезенку, снижая сложность,
которую добавляет попытка сохранения селезеночных
сосудов [11]. Этот подход легче и требует меньше
времени, чем попытки сохранить селезеночные артерию
и вену, так как не нужна скрупулезная и осторожная
мобилизация сосудов от селезенки с лигированием
всех мелких ветвей во время диссекции [12]. Однако
такой доступ связан с более высоким риском инфаркта
селезенки в сравнении с сохранением артерии и вены.
К счастью, большинство из таких инфарктов
бессимптомны и очаг некроза со временем рассасывается,
что описано в литературных источниках,
посвященных эмболизации селезеночной артерии при травмах
[11, 13, 14]. По данным некоторых из этих серий,
инфаркты, которые происходили при эмболизации
селезеночной артерии, обычно были множественными,
мелкими, периферическими и рассасывались со
временем [13]. Кроме того, селезенка имеет потенциал к
регенерации, что было продемонстрировано в
опубликованных данных по детской хирургии, посвященной
частичной спленэктомии [15].
Авторы рекомендуют сохранение селезенки с
пересечением селезеночных сосудов всегда, когда это
возможно технически, чтобы снизить частоту
послеоперационных осложнений. Если опухоль или панкреатическая
псевдокиста тесно прилежит к селезенке, сохранение
селезенки может оказаться невозможным в связи с
соблюдением онкологических принципов или по техническим
причинам соответственно. Портальная гипертензия —
другое относительное противопоказание к сохранению
селезеночных сосудов из-за риска сильного
кровотечения. Техника сохранения селезенки, которая описана
здесь в деталях, позволяет сократить время операции
с минимальными летальностью и кровопотерей в
результате [12, 16].
376 Лапароскопическая хирургия. Атлас
ТЕХНИКА ОПЕРАЦИИ
На рис. 31-1—31-9 показана техника лапароскопической хирургии поджелудочной железы.
ПОДГОТОВКА
Оперирующий,
хирург
' Ассистент
Операционная
сестра
Рис. 31-1. После анестезии и эндотрахеальной интубации
устанавливают катетер Фолея и укладывают пациента
в правое полулатеральное положение. При образованиях,
расположенных близко к головке поджелудочной
железы, рекомендуют укладывать больного на спину,
а при образованиях, которые находятся вдали от головки,
лучше применять полулатеральное положение пациента.
Для профилактики тромбоза глубоких вен на каждую ногу
надевают устройство для прерывистой компрессии. Затем
живот обрабатывают и обкладывают в стерильных условиях.
Хирург стоит справа от пациента, а ассистент — слева.
ОПЕРАЦИЯ
/
Печеночный *'"
ретрактф^А У ^ Ji Ь5
"грЦ// p2fA^U
диссектор 30-градусный \
лапароскоп \
Рис. 31-2.12-15-миллиметровый порт Хэссона устанавливают
через пупок или над ним и создают пневмоперитонеум
до давления 15 мм рт.ст. Вводят видеолапароскоп и ревизуют
брюшную полость на наличие ранее не выявленной
патологии. В зависимости от предпочтений хирурга
используют 30- или 45-градусную оптику. Авторы обычно
применяют 5-миллиметровый 45-градусный лапароскоп,
который способствует визуализации пространства позади
поджелудочной железы и в воротах селезенки. Три
5-миллиметровых порта устанавливают под визуальным
контролем. Установка портов полукругом позволяет
проводить смену расположения инструментов и камеры.
При более крупных опухолях (>7см) можно воспользоваться
ручной ассистенцией, которая требует проведения
вертикального срединного разреза длиной 6-7см между
мечевидным отростком и пупком для порта в целях ручной
ассистенции [2,17].
Глава 31. Лапароскопическая хирургия поджелудочной железы 377
Рис. 31-3. Доступ к поджелудочной железе можно получить
путем диссекции через малую или большую кривизну
с мобилизацией селезеночного изгиба ободочной кишки,
чтобы войти в сальниковую сумку. К образованиям,
расположенным в средней части тела поджелудочной железы,
лучше подходить через малую кривизну, а к образованиям,
находящимся более дистально, лучший доступ можно
получить с помощью рассечения желудочно-сальникового
отдела сальника с сохранением желудочно-сальниковой
аркады желудка. Необходимо избегать пересечения коротких
желудочных сосудов, чтобы сохранить селезенку.
Рис. 31-4. Благодаря первичной диссекции получен
адекватный доступ к поджелудочной железе. Поджелудочная
железа попадает в поле зрения после отведения желудка
в краниальном направлении и вправо относительно
пациента. При необходимости для интраоперационной
локализации опухоли можно использовать
лапароскопическое ультразвуковое исследование,
прикладывая датчик к передней поверхности железы.
Этот прием позволяет определять место пересечения
с соответствующим хирургическим краем при патологии,
не требующей резекции слишком большого количества
паренхимы поджелудочной железы. Ультразвуковое
исследование также помогает идентифицировать крупные
кровеносные сосуды при образованиях, расположенных
в области тела и перешейка железы.
378 Лапароскопическая хирургия. Атлас
Рис. 31-5. Первым мобилизуют нижний край поджелудочной
железы с помощью раскрытия пространства в жировой
клетчатке между корнем брыжейки поперечно-ободочной
кишки и передней фасции поджелудочной железы (фасция
Fredet). Затем мобилизуют переднюю поверхность железы
в области образования и идентифицируют селезеночные
артерию и вену, если это представляется возможным. Место
пересечения должно быть расположено по крайней мере
на 1 см проксимальнее опухоли, чтобы получить адекватный
край резекции. Выбор относительно тонкого участка железы
снижает техническую сложность операции.
Рис. 31-6. Линия пересечения определяется при диссекции
перед наложением степлера.
о НглЯДИ
t v VHHB9
к
Рис. 31-7. Сосуды, которые плотно прилежат к паренхиме
поджелудочной железы, не мобилизуют от ткани железы.
Эти сосуды пересекают вместе с паренхимой с помощью
линейного степлера (3,5 мм). При отдельной мобилизации
сосуды рассекают линейным 2-2,5-миллиметровым
эндоскопическим степлером. Линию скобок усиливают
биоабсорбтивным материалом. При утолщенной,
воспаленной или фиброзной поджелудочной железе
применяют 4,8-миллиметровый линейный степлер, также
с усилением линии скобок. В качестве альтернативного
варианта перед наложением степлера можно пересечь часть
железы с помощью электрохирургического устройства.
Затем осматривают линию скобок на ее непрерывность.
При расхождении линию скобок дополнительно обшивают.
Если имеется ретроградное кровотечение из селезеночной
артерии или вены, можно применять клипирование.
Рис. 31 -8. После достижения гемостаза поджелудочную
железу мобилизуют от тканей забрюшинного пространства
от медиального края к латеральному вместе с заключенными
в ней селезеночными артерией и веной.
Глава 31. Лапароскопическая хирургия поджелудочной железы 379
Рис. 31-9. Далее подходят к левому латеральному краю
поджелудочной железы и пересекают селезеночные
сосуды как можно дальше от ворот. Необходимо соблюдать
осторожность, чтобы сохранить короткие желудочные сосуды
и потенциальные коллатеральные сосуды, идущие от сальника
и селезеночного изгиба ободочной кишки. Резецированный
сегмент поджелудочной железы затем помещают в «Endo-bag»
и удаляют из брюшной полости. Повторно осматривают культю
поджелудочной железы, при этом к ней можно приложить
фибриновый гемостатический агент для минимизации риска
кровотечения. В забрюшинное пространство устанавливают
один дренаж Blake, который подводят к культе поджелудочной
железы. Затем зашивают разрезы для установки троакаров
по стандартной методике.
При необходимости спленэктомии селезенку можно
мобилизовать двумя способами: либо в направлении
от латерального края к медиальному (сначала селезенку),
либо от медиального края к латеральному (сначала
поджелудочную железу). Первый доступ предпочитают
при образованиях хвоста поджелудочной железы,
а последний — при образованиях, расположенных в области
тела. При использовании любого из доступов селезеночные
сосуды вдоль поджелудочной железы пересекают вместе
с ней. Связи селезенки с желудком, ободочной кишкой
и забрюшинным пространством рассекают перед удалением
селезенки и поджелудочной железы одним блоком
или отдельно. Для удаления препарата(ов) одним блоком
может понадобиться расширение разреза для пупочного
порта. Для улучшения обзора при операции с доступом
от латерального края к медиальному можно повернуть
пациента из положения лежа на спине в правое латеральное
положение.
Щ Резу
Исследование
льтаты лапароскопической дистальной панкреа
(исследования с 10 и более пациентами)
Периопе-
Кон- рационная
Пациен- Среднее время Средняя вер. смертность,
ты, п операции, мин ДГ, дни сии, % %
тэктомии
Общая
периопе-
рационная
морбид-
ность, %
Недостаточность
анастомоза/
фистула, %
Patterson etal. [18]
Park wHeniford etal.
[19]
Fabre etal. [20]
Fernandez-Cruz etal. [21]
Mabrutetal.[3]
D'Angelica etal. [2]
Опыт университета
Duke
13
25
13
19
96
17
12
264 (96-336)
144(108-420)*
280(180-480)*
НС
200 (65-400)
196(128-235)
221(135-358)*
6(1-26)
4,4 (2-8)*
5-22
5/7
7 (3-67)
5,5(4-18)
4 (2-7)*
15
8
15
0
15
11
16
0
0
0
0
0
0
0
38
17
30
НС
42
26
НС
23
4
7
15
16
20
50
'Среднее значе
Рис. 31-10. Результаты лапароскопической дистальной панкреатэктомии. ДГ — длительность госпитализации; НС — не сообщается.
380 Лапароскопическая хирургия. Атлас
ы минимизации частоты панкреатических
>сле дистальной панкреатэктом
Методика Данные
Обшивание культи поджелудочной железы
Использование для усиления линии скобок
биоабсорбтивных агентов «SteamGuard» {WL Gore and
Associates, lnc.,Newark, DE)
Пересечение поджелудочной железы с помощью
ультразвукового скальпеля
Селективное обшивание панкреатического протока
Пересечение поджелудочной железы с помощью
ультразвукового скальпеля и селективное обшивание
панкреатического протока
Пересечение поджелудочной железы точно в месте, где
лигируют тонкие панкреатические ветви селезеночных
сосудов (при сохранении селезенки)
Частота панкреатических свищей в 4% у 25 пациентов, подвергшихся
лапароскопической дистальной панкреатэктомии при рутинном
применении этой методики
Неопубликованные данные группы Mattews показывают снижение
частоты фистул от 24 до 11% при рутинном применении этой
методики
Исследование на животных (свиньях), проведенное в институте
Johns Hopkins, показывает, что ультразвуковой скальпель имеет
преимущества перед степлером при лапароскопическом
пересечении поджелудочной железы [22]; надо отметить, что при
этом сначала необходимо найти и лигировать сосуды
Невозможность найти и отдельно лигировать панкреатический
проток является одним из факторов, приводящих к утечке
панкреатического секрета после открытой дистальной
панкреатэктомии [23]
Suzuki etal. сообщают о снижении частоты фистул от 26 до 4%
с помощью рутинного использования комбинации этих двух методик
[24]
Uranues etal. [25] аргументируют, что эта методика сводит к минимуму
ишемию и некроз в области линии пересечения
Рис. 31-11. Методы минимизации частоты панкреатических свищей после дистальной панкреатэктомии.
Рис. 31-12. Трансгастральный лапароскопический
доступ к псевдокисте. Лапароскоп вводят в брюшную
полость. Затем желудок раздувают с помощью эндоскопа.
Порты устанавливают через переднюю брюшную
стенку и стенку желудка. Обычно используют порт
диаметром от 2 до 5 мм и один 12-миллиметровый порт.
Эндоскоп можно использовать для визуализации вместо
одного из 5-миллиметровых портов. При передней
цистогастростомии для определения локализации
псевдокисты можно использовать ультразвуковой датчик
или пункцию иглой таким образом, чтобы к кисте можно было
подойти без повреждения селезеночных сосудов.
Рис. 31-13. Диссекцию при цистогастростомии начинают
с помощью электрокрючка или ультразвукового диссектора,
а затем выполняют цистогастростомию ромбовидной формы
с применением 3,5-миллиметрового гибкого линейного
степлера. Для формирования цистогастростомии необходимо
сделать 4 линейных пересечения, как показано выше. Стенку
псевдокисты посылают на гистологическое исследование
для исключения злокачественной патологии. В последующем
переднюю гастротомию закрывают с помощью скобок
или швов.
Глава 31. Лапароскопическая хирургия поджелудочной железы 381
ПОСЛЕОПЕРАЦИОННЫЙ УХОД
Катетер Фолея и назогастральный зонд удаляют
сразу после операции. Пациентам разрешают принимать
жидкую пищу уже на следующий день после
вмешательства, затем диету расширяют по мере переносимости.
При переходе пациента на обычную диету определяют
уровень амилазы в жидкости из дренажа Blake. Если
уровень амилазы повышен, дренаж не удаляют до
первого посещения пациентом клиники через 1-2 нед после
операции. В это время подсчитыват объем отделяемого
из дренажа, и, если он минимальный (<30 мл за 24 ч),
дренаж удаляют. Необходимо отметить, что
большинство хирургов обычно считают панкреатическим
свищом ситуацию, когда уровень амилазы в жидкости
из дренажа в 3 или более раз превышает сывороточный
уровень амилазы на 5-й день после операции.
РЕЗУЛЬТАТЫ
Хирургия поджелудочной железы широко не
распространена, и, таким образом, проведение
контролируемых исследований с адекватным количеством
участников, сравнивающих лапароскопический и открытый
доступы, не представляется возможным. Было проведено
большое количество ретроспективных исследований,
отражающих индивидуальный опыт центров,
проводящих лапароскопическую панкреатэктомию, однако
они характеризуются небольшим количеством
пациентов и не являются проспективными и
рандомизированными. Почти все исследования показали, что
лапароскопическую резекцию можно выполнить с низкой
периоперационной летальностью (<1%), небольшим
количеством осложнений, соответствующим открытым
операциям, и, возможно, со снижением
продолжительности госпитализации. В самом крупном Европейском
исследовании, проведенном Marbut et al. [3], описаны
исходы у 127 пациентов, которые подверглись
лапароскопической хирургии поджеледочной железы в 25
центрах за период с 1995 по 2002 г. Около 75% из них была
проведена дистальная панкреатэктомия (у более чем 2/3
больных — с сохранением селезенки). Второй по
распространенности операцией стала энуклеация (17%).
Общая частота конверсии составила 14% (и=17), у 6
пациентов конверсия была проведена из-за больших
размеров образования, а еще у 11 — из-за трудностей
при создании доступа или диссекции, кровотечения
и наличия положительного края резекции. Периопера-
ционная летальность составила 0%, а частота
осложнений после дистальной панкреатэктомии со спленэк-
томией и без нее — 27 и 36% соответственно. Общая
частота панкреатических свищей находилась в пределах
17%, поджелудочную железу пересекали с помощью
эндоскопического линейного степлера в 90%
случаев, а селективное ушивание протока проводили в 24%
случаев. Эти результаты сходны с данными множества
более мелких серий исследований (рис. 31-10). Для
простоты оценки были исключены исследования с числом
пациентов менее 10. Продолжительность операции
в среднем составляла 200 мин, а частота конверсии —
от 0 до 16%, причем в большинстве исследований она
составляла от 11 до 16%. Средняя длительность
госпитализации варьировала от 4 до 7 дней, с периопераци-
онными осложнениями и летальностью соответственно
от 17 до 42 и 0%. Частота панкреатических
свищей/фистул варьировала от 4 до 50%. Эти результаты были
сопоставимы с данными единственного крупного анализа
открытой дистальной панкреатэктомии,
опубликованного Lillemoe et al. [10].
ОСЛОЖНЕНИЯ, СВЯЗАННЫЕ
С ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗОЙ
По данным крупного многоцентрового европейского
исследования, общее число осложнений при
лапароскопической хирургии поджелудочной железы составляет
31% [3]. Осложнения, связанные с поджелудочной
железой, остаются наиболее распространенными. Частым
осложнением считают истечение панкреатического
секрета и образование затеков после операций на
поджелудочной железе, а их частота сильно варьирует в
литературных источниках (от 0 до 50%) со средней частотой
свищей 13% при открытых дистальных панкреатэкто-
миях (3,5-26%) [3]. В наиболее крупном исследовании
с участием 235 пациентов, которое было проведено
в Институте Johns Hopkins, была отмечена частота
свищей 5% после открытой дистальной панкреатэктомии
[10]. В соответствии с проведенными исследованиями,
количество свищей после лапароскопической
дистальной панкреатэктомии соответствовало данным
открытой операции. В одном из крупнейших одноцентровых
исследований, проведенных Park и Heniford [19],
частота панкреатических свищей после лапароскопической
дистальной панкреатэктомии составляла 4%. Свищ был
отмечен у 1 пациента из 25 и проявлялся псевдокистой,
что потребовало выполнения чрескожного
дренирования. По данным многоцентрового исследования,
проведенного Mabrut et al. [3], частота клинически
проявившихся свищей составила 17%. Было опубликовано
несколько исследований, которые анализировали
методики, позволяющие снизить частоту образования
свищей. Ниже указаны некоторые методики, которые
сейчас используют для снижения частоты возникновения
свищей в разных центрах (краткий обзор представлен
на рис. 31-11).
ДРУГИЕ ЛАПАРОСКОПИЧЕСКИЕ ОПЕРАЦИИ
НА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЕ
Лапароскопический доступ при псевдокистах
впервые описали Frantzides et al. [26] в 1994 г. С тех пор
этот доступ приобретал все большую популярность
382 Лапароскопическая хирургия. Атлас
по мере развития лапароскопической хирургии и стал
альтернативой чрескожному дренированию, которое
имеет высокую частоту рецидивирования [27, 28].
Панкреатические псевдокисты необходимо
дренировать хирургическим путем при наличии симптомов
или отсутствии спонтанного рассасывания после 6 нед
наблюдения. Чрескожное дренирование
предпочтительнее, если общее состояние пациента не
позволяет провести хирургическую операцию или в случае
инфицирования псевдокисты. Псевдокисты, которые
выпирают кпереди, в сторону задней стенки желудка,
можно оперировать с применением трансгастрально-
го лапароскопического доступа, а другие, выбухающие
книзу или в передне-латеральном направлении,
подлежат лапароскопической цистоеюностомии. Для
уменьшения числа разрезов на желудке при выполнении
трансгастрального дренирования можно использовать
эндоскоп, комбинируя эндолюминальный и
лапароскопический доступы (рис. 31-12, 31-13). Однако при
визуализации с помощью эндоскопа возможна
дезориентация. Противопоказаниями к лапароскопическому
дренированию псевдокист служит их многокамерность
или наличие в просвете кисты большого количества
секвестров, что можно определить при
предоперационной визуализации. Такие образования с большей
вероятностью могут иметь злокачественную природу,
и лапароскопическое вмешательство в этом случае
будет более сложным.
Лапароскопическую энуклеацию применяют при
доброкачественных опухолях поджелудочной железы,
при которых возможно проведение меньшего объема
резекции, чем панкреатикодуоденэктомия или дис-
тальная панкреатэктомия. Размер опухоли при этом
не должен превышать 2 см и она должна быть
поверхностной. Противопоказанием считается
непосредственная связь опухоли с панкреатическим протоком
или ее близкое прилегание к протоку из-за высокого
риска истечения панкреатического секрета. Принять
решение об объеме резекции можно, применив
лапароскопический ультразвуковой датчик, с помощью
которого возможны:
• оценка признаков опухоли, вызывающих
подозрения о ее злокачественности (например, нечеткий
край образования);
• оценка ее расположения относительно
панкреатического протока.
Техника энуклеации заключается во вскрытии
передней фасции поджелудочной железы и
вылущивании опухоли путем ультразвуковой диссекции
или электрокоагуляции. Гемостаз выполняют с
помощью клипирования и наложения лигатур. Все
исследования, опубликованные к настоящему моменту,
отражают опыт лапароскопической энуклеации у 2-6
пациентов. Shepperd и Hunter [17] сделали обзор пяти
публикаций, в котором определили частоту конверсии
в 18% (от 0 до 25%) и частоту свищей — в 28% (от О
до 40%) случаев.
Лапароскопическую панкреатикодуоденэктомию
впервые описали Gagner и Pomp в 1994 г. [29], и ее
внедрение в клиническую практику было ограниченным,
поскольку данная процедура не имела каких-либо
преимуществ перед открытой операцией, требуя при этом
значительно большего времени даже в руках опытного
хирурга [30]. Основная масса исследований
основывалась на ограниченной выборке пациентов, а наиболее
крупными сериями были исследования,
опубликованные Dulucq etal.[l]n Huscher et al. [4], которые
сообщили о проведении лапароскопической панкреатикодуо-
денэктомии у 25 и 33 пациентов соответственно. Хотя
результаты этих исследований соответствовали
данным открытых серий, доказанных преимуществ
установлено не было. В настоящее время, по
единогласному мнению панкреатических хирургов, у большинства
пациентов с патологией головки поджелудочной
железы малоинвазивный доступ не имеет преимуществ
по двум причинам. Во-первых, большой лапаротом-
ный разрез, который требуется для проведения
открытой операции, — это лишь минимальный компонент
операционного стресса. В то же время основные
составляющие операционного стресса — обширная ин-
траабдоминальная диссекция и сложная
реконструкция желудочно-кишечного тракта — не уменьшаются
в результате применения минимально инвазивного
лапароскопического доступа. Во-вторых, риск
нарушения онкологических норм высок, а польза от
проведения операции лапароскопическим доступом (то есть
более короткая продолжительность госпитализации,
снижение интенсивности послеоперационных болей
и т.п.), в лучшем случае минимальная. В отличие от
лапароскопической панкреатикодуоденэктомии, исходы
лапароскопической дистальной панкреатэктомии,
энуклеации и панкреатических дренирующих
операций предполагают, что пациент выиграет от
использования минимально инвазивного доступа, который,
в отличие от открытой операции, характеризуется
снижением интенсивности послеоперационных болей
и более быстрым выздоровлением без каких-либо
дополнительных осложнений.
Глава 31. Лапароскопическая хирургия поджелудочной железы 383
СПИСОК ЛИТЕРАТУРЫ
1. Dulucq J.L., Wintringer P., Mahajna A. Laparoscopic
pancreaticoduodenectomy for benign and malignant diseases //
Surg. Endosc. — 2006. — Vol. 20. — P. 1045-1050.
2. DAngelica M., Are C, Jarnagin W. et al. Initial experience
with hand-assisted laparoscopic distal pancreatectomy // Surg.
Endosc. — 2006. — Vol. 20. — P. 142-148.
3. Mabrut J.Y., Fernandez-Cruz L., Azagra J.S. et al. Laparoscopic
pancreatic resection: results of a multicenter European study of 127
patients // Surgery. — 2005. — Vol. 137. — P. 597-605.
4. Huscher C.G. S. Laparoscopic Whipple procedure // Current
Surgical Therapy / Ed. J. L. Cameron. — Elsevier Mosby:
Philadelphia, 2004. — P. 1266-1274.
5. Shoup M., Brennan M.F., Mc White K. et al. The value of splenic
preservation with distal pancreatectomy // Arch. Surg. — 2002. —
Vol. 137.— P. 164-168.
6. Aldridge M.C., Williamson R.C. Distal pancreatectomy with and
without splenectomy // Br. J. Surg. — 1991. — Vol. 78. — P. 976-
979.
7. Benoist S., Duque L., Sauvanet A. et al. Is there a role of
preservation of the spleen in distal pancreatectomy? // J. Am. Coll.
Surg. — 1999. — Vol. 188. — P. 255-260.
8. Covil S., Imrie CW. Value of splenic preservation during distal
pancreatectomy for chronic pancreatitis // Br. J. Surg. — 1999. —
Vol. 86. — P. 895-898.
9. Hutchins R.R., Hart R.S., Pacifico M. et al. Long-term results of
distal pancreatectomy for chronic pancreatitis in 90 patients // Ann.
Surg. — 2002. — Vol. 236. — P. 612-618.
10. Lillemoe K.D., Kaushal S., Cameron J.L. et al. Distal
pancreatectomy: indications and outcomes in 235 patients // Ann.
Surg. — 1999. — Vol. 229. — P. 693-698; discussion — P. 698-700.
11. Warshaw A.L. Conservation of the spleen with distal
pancreatectomy // Arch. Surg. — 1988. — Vol. 123. — P. 550-553.
12. Sato Y., Shimoda S., Takeda N. et al. Evaluation of splenic
circulation after spleen-preserving distal pancreatectomy by
dividing the splenic artery and vein // Dig. Surg. — 2000. —
Vol. 17. — P. 519-522.
13. Killeen K., Shanmuganathan K., Boyd-Kranis R. et al. CT findings
after emboli-zation for blunt splenic trauma // J. Vase Interv.
Radiol. — 2001. — Vol. 12. — P. 209-214.
14. Fecher A., Pappas Т., Pryor A. Splenic preservation during
laparoscopic pancreatic tail resection // The Society for Surgery of
the Alimentary Tract. — Chicago, 2005.
15. de Buys Roessingh A.S., de Lagausie P., Rohrlich P. et al. Follow-up
of partial splenectomy in children with hereditary spherocytosis //
J. Pediatr. Surg. — 2002. — Vol. 37. — P. 1459-1463.
16. Lukish J.R., Rothstein J.H., Petruziello M. et al. Spleen-preserving
pancreatectomy for cystic pancreatic neoplasms // Am. Surg. —
1999. — Vol. 65. — P. 596-599.
17. Sheppard B.C., Hunter J.G. Laparoscopic pancreatic resections //
Current Surgical Therapy /Ed. J. L. Cameron. — Philadelphia:
Elsevier Mosby, 2004. — P. 1261-1266.
18. Patterson E.J., Gagner M., Salky B. et al. Laparoscopic pancreatic
resection: single-institution experience of 19 patients // J. Am. Coll.
Surg. — 2001. — Vol. 193. — P. 281-287.
19. Park A.E., Heniford B.T. Therapeutic laparoscopy of the pancreas //
Ann. Surg. — 2002. — Vol. 236. — P. 149-158.
20. Fabre J.M., Dulucq J.L., Vacher С et al. Is laparoscopic left
pancreatic resection justified? // Surg. Endosc. — 2002. —
Vol. 16. — P. 1358-1361.
21. Fernandez-Cruz L., Martinez I., Gilabert R. et al. Laparoscopic
distal pancreatectomy combined with preservation of the spleen for
cystic neoplasms of the pancreas // J. Gastrointest. Surg. — 2004. —
Vol. 8.— P. 493-501.
22. Hanly E.J., Mendoza-Sagaon M., Hardacre J.M. et al. New tools for
laparoscopic division of the pancreas: a comparative animal study //
Surg. Laparosc. Endosc. Percutan. Tech. — 2004. — Vol. 14. —
P. 53-60.
23. Bilimoria M.M., Cormier J.N., Mun Y. et al. Pancreatic leak after
left pancreatectomy is reduced following main pancreatic duct
ligation // Br. J. Surg. — 2003. — Vol. 90. — P. 190-196.
24. Suzuki Y, Fujino Y, Tanioka Y et al. Randomized clinical
trial of ultrasonic dissector or conventional division in distal
pancreatectomy for non-fibrotic pancreas // Br. J. Surg. — 1999. —
Vol. 86.— P. 608-611.
25. Uranues S., Alimoglu O., Todoric B. et al. Laparoscopic resection
of the pancreatic tail with splenic preservation // Am. J. Surg. —
2006. — Vol. 192. — P. 257-261.
26. Frantzides СТ., Ludwig K.A., Redlich P.N. Laparoscopic
management of a pancreatic pseudocyst // J. Laparoendosc. Surg. —
1994. — Vol. 4. — P. 55-59.
27. Criado E. et al. Long term results of percutaneous catheter drainage
of pancreatic pseudocysts // Surg. Gynecol. Obstet. — 1992. —
Vol. 175. — P. 293-298.
28. Adams D.B., Anderson M.C. Percutaneous catheter drainage
compared with internal drainage in the management of pancreatic
pseudocyst // Ann. Surg. — 1992. — Vol. 215. — P. 571-576.
29. Gagner M., Pomp A. Laparoscopic pylorus-preserving
pancreatoduodenectomy // Surg. Endosc. — 1994. — Vol. 8. —
P. 408-410.
30. Gagner M., Pomp A. Laparoscopic pancreatic resection: is it
worthwhile? // J. Gastrointest. Surg. — 1997. — Vol. 1. — P. 20-26.
384 Лапароскопическая хирургия. Атлас
ПРИГЛАШЕНИЕ К СОТРУДНИЧЕСТВУ
Издательская группа «ГЭОТАР-Медиа» приглашает к сотрудничеству
авторов и редакторов медицинской литературы,
литературы по ветеринарии и агротехнике.
ИЗДАТЕЛЬСТВО СПЕЦИАЛИЗИРУЕТСЯ НА ВЫПУСКЕ
учебной литературы для вузов и колледжей, атласов,
руководств для врачей, переводных изданий
По вопросам издания рукописей обращайтесь в отдел по работе с авторами.
Тел: (495) 921-39-07.
Научно-практическое издание
Лапароскопическая хирургия
Атлас
Под редакцией Теодора Н. Паппаса, Авроры Д. Приор, Михаэля С. Харниша
Перевод с английского под редакцией профессора С.С. Харнаса
Зав. редакцией
С.А. Меренкова
Выпускающий редактор
B.C. Шабалина
Корректор
Е.В. Маурина
Компьютерная верстка
П.А. Чикин
Подписано в печать 22.06.2012. Формат 60x90 Vg.
Бумага мелованная. Печать офсетная. Объем 48,5 п.л.
Тираж 2000 экз. (Первый завод — 1000 экз.). Заказ № 10732
Издательская группа «ГЭОТАР-Медиа».
115035 Москва, ул. Садовническая, 9, стр. 4 (м. Новокузнецкая);
тел.: (495) 921-39-07; факс: (499) 246-39-47;
e-mail: info@geotar.ru, http://www.geotar.ru.
SPAUDA
Пр. Лайсвес 60,
LT-05120 Вильнюс, Литва
www.spauda.com
ISBN 978-5-9704-2234-2
9 785970 4223421 >
ЛАПАРОСКОПИЧЕСКАЯ
m
АТЛАС
Под редакцией
Теодора Н. Паппаса, Авроры Д. Приор, Михаэля С. Харниша
Перевод с английского под редакцией
профессора С.С. Харнаса
Атлас содержит детальные иллюстрации, фотографии,
таблицы и схемы с подробными объяснениями, которые
сопровождаются научными статьями, обзорами и рекомендациями, поэтому
может рассматриваться и как исчерпывающее руководство,
посвященное хирургическим методам лапароскопии и торакоскопии.
В него включены главы, описывающие инструменты и
технические основы, лапароскопическое лечение травм живота, паховую
и вентральную герниорафию, антирефлюксные операции,
лапароскопическую миотомию Геллера при ахалазии пищевода,
лапароскопическую пластику диафрагмальных грыж,
лапароскопическую биопсию печени, торакоскопическую перикардэктомию,
торакоскопическую редукцию объема легких,
лапароскопический доступ к поясничному отделу позвоночника для дискэктомии
и спондилодеза и педиатрическую эндохирургию.
W?\ ИЗДАТЕЛЬСКАЯ ГРУППА
' 1 «ГЭОТАР-Медиа»
www.geotar.ru
www.medknigaservis.ru
ISBN 978-5-9704-2234-2
9 '785970422342 >