Author: Архаров А.М. Марфенина И.В.
Tags: пневмоэнергетика машины и инструменты холодильная техника холодильное оборудование теплоэнергетика теплотехника криогенные системы
ISBN: 5-217-02854-8
Year: 1996
Подготовил стр. 1-399
m.m.pustovalov@mail.ru
Подготовил стр.400-конец
3666377@gmail.com
А.М.Архаров, И.В.Марфенина, Е.И.Микулин
КРИОГЕННЫЕ
СИСТЕМЫ .
том!
Основы теории и расчета
Издание третье,
переработанное и дополненное
Рекомендовано Министерством общего и профессионального
образования Российской Федерации в качестве учебника для студентов
высших учебных заведений, обучающихся по специальности
“Техника и физика низких температур"
а.
Моава
"Манввостроение” 1996
ББК 31.392
А87
УДК 621.59(075.8)
Рецензент — кафедра криогенной техники
Санкт-Петербургской государственной академии
холода и пищевых технологий /
Архаров А.М. и др. ।
(
А87 Криогенные системы: Учебник для студентов вузов по
специальности "Техника и физика низких температур":
В 2 т. Т.1. Основы теории и расчета / А.М. Архаров, И.В.
Марфенина, Е.И. Микулин. — 3-е изд., перераб. и доп. —
М.: Машиностроение, 1996. — 576 с.: ил.
ISBN 5-217-02854-8 (Общ.) !
ISBN 5-217-02584-0 (Т.1)
В фетьем издании (1-е изд. — "Теория и расчет криогенных систем".
1978 г.; 2-е изд. - "Криогенные системы: Основы теории и расчета", 1988 г.)
отражены современный уровень развития криогеники и методы расчета 1
криогенных систем. *
2705070000-042
А----------------- Без объявл.
038 (01) - 96
ББК 31.392
(
ISBN 5-217-02854-8 (Общ.)
ISBN 5-217-02584-0 (Т.1)
© А.М. Архаров, И.В. Марфенина,
Е.И. Микулин, 1996
© Издательство "Машиностроение”, 1988
© Издательство "Машиностроение", 1978
ОГЛАВЛЕНИЕ
Предисловие......................................................... 5
Глава 1. О развитии криогеники...................................... 7
§ 1.1. Что такое криогеника и чем определяется ее важнейшее
промышленное и научное значение.................................. 7
§ 1.2. Развитие криогеники........................................ 8
Глава 2. Основные термодинамические понятия и законы............... 18
§ 2.1. Контрольная система. Параметры и функции состояния.
Условия равновесия.............................................. 18
§ 2.2. Принцип сохранения массы. Материальный баланс.
Стехиометрический принцип....................................... 19
§ 2.3. Принцип сохранения энергии. Энергетический баланс......... 20
§ 2.4. Теорема об изменении импульса............................. 23
§ 2.5. Принцип возрастания энтропии. Уравнение энтропийного баланса.
Необратимость и затраты энергии................................. 24
§2.6. Принцип аддитивности энергетических потерь. Термодинамический
анализ распределения затрат энергии в криогенных системах........ 33
§ 2.7. Принцип однородности размерностей Фурье. Связь между
размерной и безразмерной формами уравнений при описании
рабочих процессов. Подобие...................................... 41
§ 2.8. Термодинамическая (абсолютная) температура. Международная
практическая температурная шкала................................ 49
§ 2.9. Принцип недостижимости нуля термодинамической температуры .. 52
§ 2.10. Основные термодинамические соотношения................... 53
Глава 3. Свойства рабочих веществ криогенных систем................ 61
§ 3.1. Равновесные состояния и фазовые переходы чистых веществ... 61
§ 3.2. Равновесные состояния и фазовые переходы бинарных систем.. 68
§ 3.3. Идеальное газовое состояние............................... 72
§ 3.4. Реальные газы............................................. 83
§ 3.5. Воздух и основные продукты его разделения. Озон и фтор.... 109
§ 3.6. Водород................................................... ИЗ
§ 3.7. Гелий-4 и гелий-3 ........................................ 117
§ 3.8. Теплофизические свойства твердых тел..................... 125
§ 3.9. Электрическая проводимость и сверхпроводимость........... 139
§ 3.10. Механические свойства .................................. 149
§ 3.11. Теплофизические свойства биоматериалов.................. 154
Глава 4. Основные процессы для получения низких температур.........157
§ 4.1. Процессы, сопровождающиеся понижением температуры в
адиабатных условиях. Холодонроизводящие процессы в циклах ....... 157
§ 4.2. Изменение основных термодинамических величин при сжатии
реального газа................................................. 163
§ 4.3. Процесс i = const. Дросселирование ...................... 165
§ 4.4. Процесс и = const........................................ 176
§ 4.5. Процесс s = const. Равновесное адиабатное расширение газа.
Расширение газа в детандерах................................... 178
§ 4.6. Процесс asH = const. Выхлоп или свободный выпуск газа из
баллона. Процесс впуска ....................................... 187
§ 4.7. Процессы в адиабатной системе с переменной массой........ 192
3
§ 4,8. Расширение газа в адиабатной вихревой трубе Ранка— Хилта........ 194
§ 4.9. Процессы волнового расширения газа ................................ 199
§ 4.10. Откачка паров кипящей жидкости.................................... 203
§ 4.11. Процессы охлаждения с использованием рабочей среды
в твердом состоянии ...................................................... 207
§ 4.12. Процессы охлаждения, основанные на использовании свойств
4Не и Не...................................................... 225
§ 4.13. Различные процессы охлаждения..................................... 231
Глава 5. Идеальные циклы. Холодопроизводительность и эффективность
криогеииых систем.............................................................236
§ 5.1. Идеальные циклы и процессы......................................... 236
§ 5.2. Классификация криогенных установок и циклов........................ 254
§ 5.3. Реальные цикты. Холодопроизводительность, потери,
эффективность реальных циклов.................................. 260
§ 5.4. Энергетический баланс отдельных ступеней охлаждения................ 266
Глава 6. Циклы криогенных установок...........................................278
§ 6.1. Структура циклов, выбор исходных данных для расчета................ 278
§ 6.2. Циклы с дросселированием .......................................... 290
§ 6.3. Детандерные циклы.................................................. 317
§ 6.4. Комбинированные циклы с дросселированием и расширением
рабочего вещества в детандерах............................................ 332
§ 6.5. Особенности расчета циклов (процессов) в газоразделительных
установках..................................................... 365
§ 6.6. Циклы газовых холодильных машин.................................... 374
Глава 7. Разделение газовых смесей, адсорбция и теплообмен при низких
температурах..................................................................401
§ 7.1. Основные термодинамические зависимости при расчете процесса
разделения....................................................... 401
§ 7.2. Диаграммы для определения равновесных параметров состояния
паровой и жидкой фаз........................................... 407
§ 7.3. Процессы кипения, дистилляции и конденсации бинарной смеси .. 413
§ 7.4. Процесс ректификации бинарной смеси................................ 418
§ 7.5. Схемы ректификационных колонн для разделения бинарных
смесей и воздуха ......................................................... 431
§ 7.6. Методика термодинамического расчета ректификационных
колонн для разделения бинарной смеси........................... 441
§ 7.7. Влияние давления в воздухоразделительных колоннах на процесс
ректификации................................................... 454
§ 7.8. Термодинамический анализ процесса ректификации бинарной
смеси..................................................................... 457
§ 7.9- Расчет процесса ректификации тройной смеси О2—Ar—N2.. 465
§ 7.10. Процессы сорбции и их применение в криогенной технике. 470
§ 7.11. Разделение газовых смесей на мембранах..........................'. 507
§ 7.12. Разделение воздуха на электрохимических мембранах................. 519
§ 7.13. Особенности теплообмена в криогенных системах.
Теплопроводность............................................... 525
§ 7.14. Конвективный обмен................................................ 533
§ 7.15. Теплообмен при кипении ........................................... 539
§ 7.16. Теплообмен при движении двухфазною потока в каналах............ 546
§ 7.17. Теплообмен в жидком Hell.......................................... 551
Список основной литературы................................................... 557
Список дополнительной литературы............................................. 557
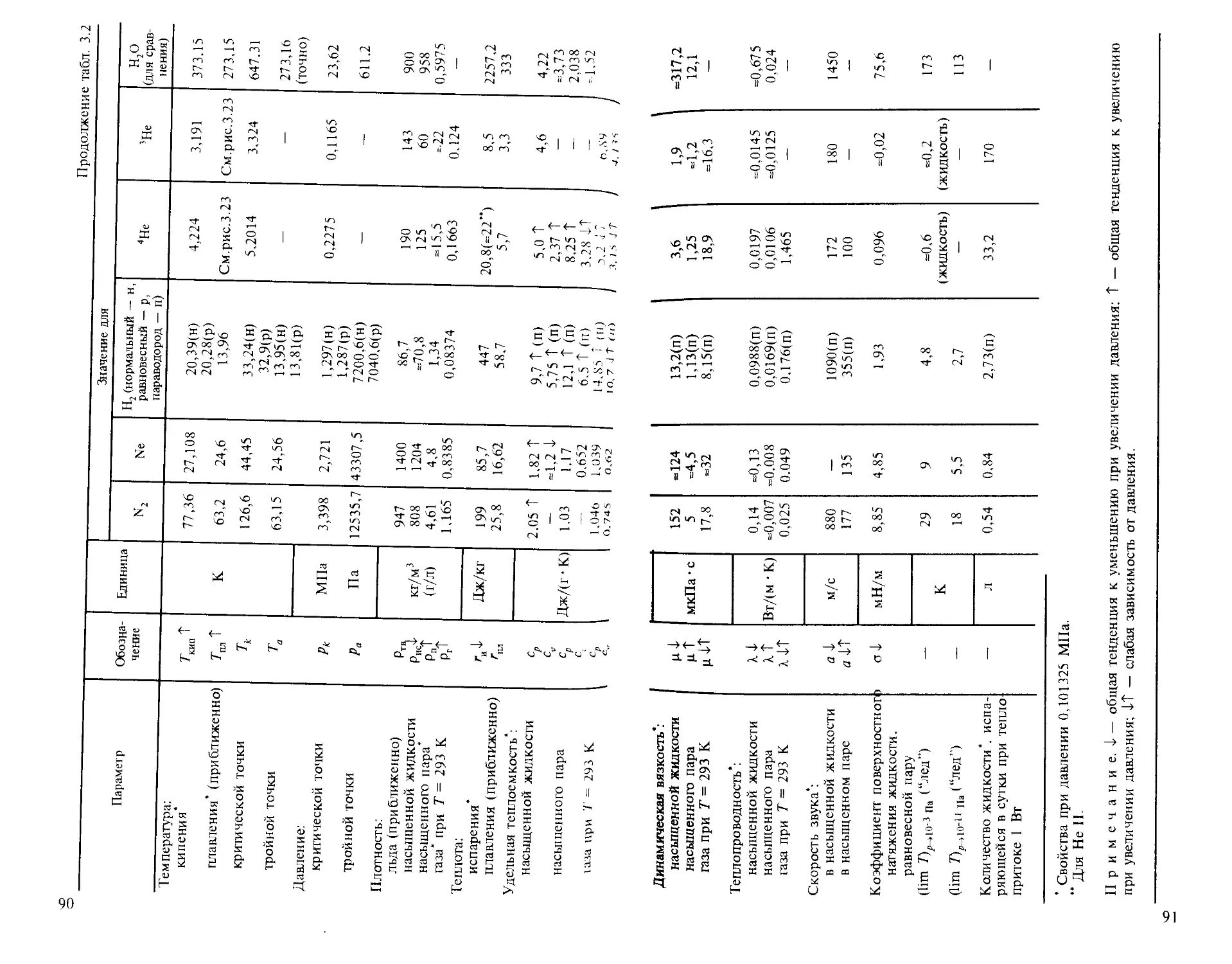
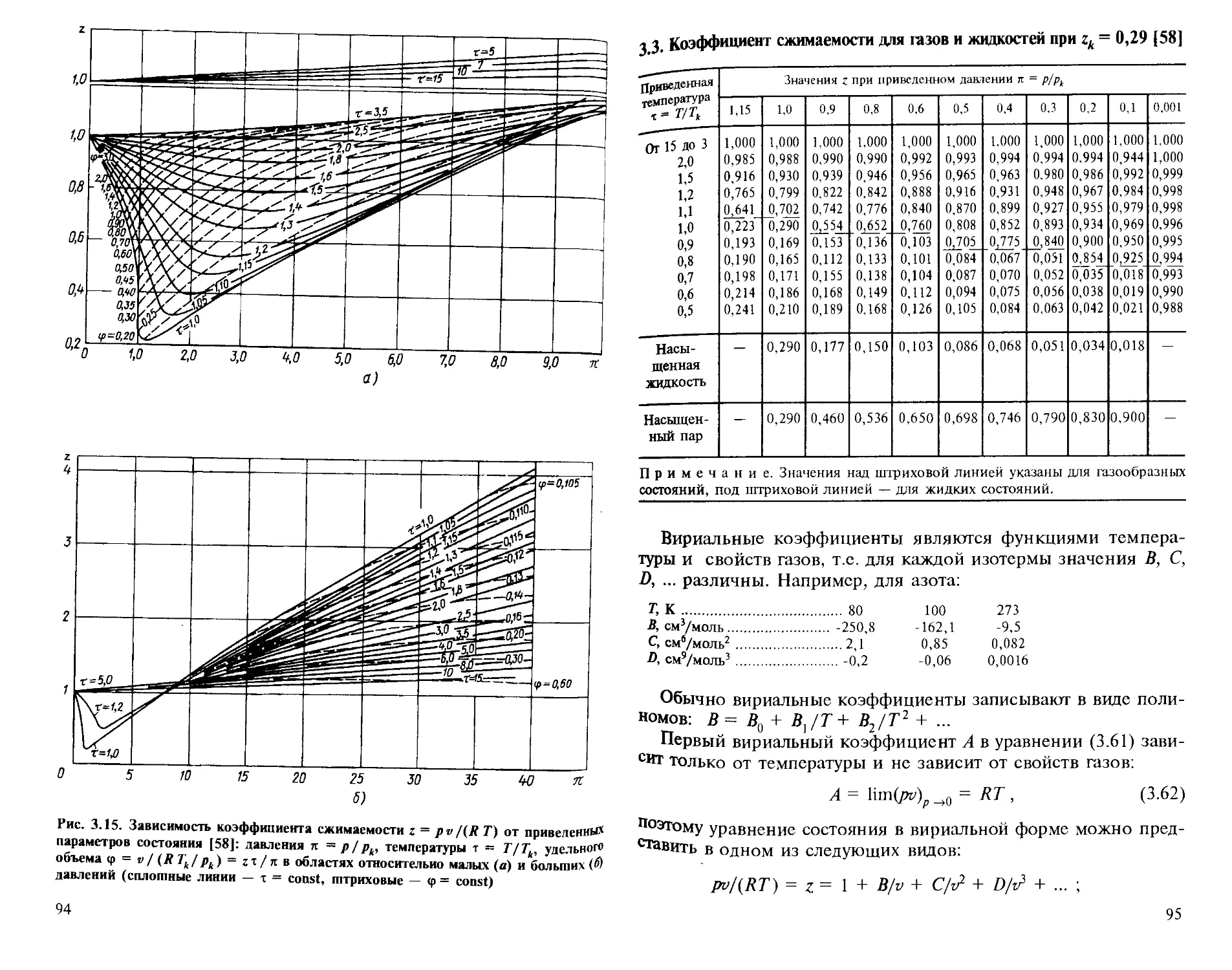
Приложение. Диаграммы состояния криогенных веществ........................... 560
ПРЕДИСЛОВИЕ
Атьма -матер — МГТУ’
им. Н.Э. Баумана и нашим
учителям посвящается
Прошло почти 20 лет с момента выхода в свет первого
издания этой книги. В мире, в науке, в технике произошли
глубокие изменения, в том числе и в результате использования
температур криогенного диапазона. Осуществлены крупнейшие
национальные программы: "Энергия — Буран", "Токомак",
"Накопитель — ускоритель" и др. Высокие достижения отечест-
венной криогеники были обусловлены государственной полити-
кой, направленной на развитие ряда важнейших отраслей, в
первую очередь таких, как энергетика, авиация, металлургия,
химия, ракетостроение, космонавтика, для которых криогеника
имеет решающее значение. Криогенные технологии активно
внедряются в медицину, биологию, пищевую промышленность,
электронику, экспериментальные физику и химию.
Криогеника и сегодня сохраняет и в обозримой перспективе
будет сохранять свое значение "ключа к будущему". Широкое
использование природного сжиженного газа и водорода в
авиации, энергетике, на транспорте — новый этап на пути
развития криогенных систем. Спрос на мировом рынке на
промышленные газы (азот, кислород, аргон, ксенон, криптон,
гелий, неон, метан, водород и др.), которые являются продуктами
криогенных технологий, продолжает расти. Быстро увеличивается
потребность в особо чистых промышленных газах, с содержанием
примесей на уровне 10—50 ppb. Это примерно на три порядка
меньше, чем в недалеком прошлом. Развитие и осуществление
различных космических программ также невозможно без
совершенствования и создания новых криогенных систем.
Россия остается державой с высокоразвитой криогеникой. Все
криогенные центры, заводы, институты бывшего СССР, за
исключением Харьковских и Одесских, работают в России: в
Москве, Санкт-Петербурге, Ленинградской области, Балашихе,
Протвино, Дубне, Омске, Екатеринбурге и других городах.
Условия глубокого экономического кризиса безусловно негативно
отразились на развитии криогеники. Однако к чести коллективов
многих предприятий нашей отрасли следует отметить, что
научный задел сохранен, а на ряде предприятий и преумножен.
5
Сохраняются и традиции, сложившиеся в ведущих вузах, по
подготовке инженерных кадров по специальности "Техника и
физика низких температур", суть которых состоит в формирова-
нии прочного фундамента для восприятия новых научных идей
и достижений, а также для понимания того, как следует проекти-
ровать низкотемпературную технику', чтобы она работала в кон-
кретных условиях максимально эффективно и надежно.
Первое и второе издания подтвердили оправданность общей
структуры учебника, посвященного научным основам криоге-
ники, и авторы ее в основном сохранили. Эти издания переве-
дены на английский и испанский языки. Опыт практического
использования учебника помог определить необходимые измене-
ния и дополнения, которые и были сделаны, — третье издание
является наиболее полным.
Авторы убеждены, что в подготовке инженерных и научных
кадров, обеспечивающих развитие криогеники, заинтересованы
все без исключения республики Содружества Независимых
Государств и многие другие страны, и надеятся, что их труд будет
способствовать этому и в будущем.
В написании учебника участвовали: А.М. Архаров — гл. 1-7,
И.В. Марфенина — гл. 5-7, Е.И. Микулин — гл. 3-7; материал
§ 7.10 подготовлен И.А. Калинниковой и Ю.В. Никифировым,
§ 7.11 — Ю.В. Никифировым, § 7.12 — В.В. Белоусова.
Авторы учебника благодарят за содействие в его издании
УНЦ "Криоконсул" при МГТУ им. Н.Э. Баумана, СП "Айсблик"
и МП "Хром".
Глава 1
О РАЗВИТИИ КРИОГЕНИКИ
§ 1.1. ЧТО ТАКОЕ КРИОГЕНИКА
И ЧЕМ ОПРЕДЕЛЯЕТСЯ ЕЕ ВАЖНЕЙШЕЕ
ПРОМЫШЛЕННОЕ И НАУЧНОЕ ЗНАЧЕНИЕ
В переводе с греческого “крио” означает холод, “генос” —
рождение. В наши дни под криогеникой понимают не
холодильную технику и технологию вообще, а только те их
области, которые связаны с получением или использованием
температур ниже 120 К (это значение принято на ХШ Конгрессе
по холоду в 1971 г.). Таким образом, криогеника {криогенная
техника) — это техника создания и применения наиболее низких
температур, которые в естественных условиях Земли и около-
земного пространства не наблюдаются.
Исключительно важное промышленное и научное значение
криогеники, огромный интерес к ее достижениям и быстро
расширяющиеся сферы ее приложения объясняются следующим.
Во-первых, постоянно увеличивается потребление многими от-
раслями промышленности (металлургия, химия, энергетика, атом-
ная, авиационная, ракетная и космическая техника, сельское
хозяйство, медицина, пищевая промышленность и др.) различ-
ных так называемых промышленных газов: кислорода, азота,
метана (природного газа), аргона, водорода, гелия, неона, крип-
тона и некоторых других. Эти газы, используемые как в жидком,
так и в газообразном состоянии, имеют низкие температуры кипе-
ния, лежащие в области криогенных, поэтому технология их
получения, применения, транспортирования, хранения органи-
чески связана с криогеникой и составляет ее обширную область.
Во-вторых, при низких температурах уменьшается электричес-
кое сопротивление и обнаруживаются такие свойства материи,
как сверхпроводимость и сверхтекучесть. В настоящее время
широко используется охлаждение до очень низких температур
обмоток электрических машин и аппаратов, а также сверхпровод-
ников в энергетике, приборостроении, на транспорте и в ряде
новых перспективных областей техники. В последние годы
открыто явление высокотемпературной сверхпроводимости и
7
созданы материалы, переходящие в сверхпроводящее состояние
при температурах 92...98 К и даже более высоких. Плотность тока
в них пока ограничена значением К)3 А/см2. Практическое
использование этих материалов неизбежно приведет к принци-
пиальным техническим преобразованиям, когда плотность тока
достигнет порядка К)5 А/см2.
В-третьих, при снижении температуры уменьшается энтропия,
а следовательно, и внутренние “шумы”. Практическое исполь-
зование этого явления для дальней космической радиосвязи, в
инфракрасной и лазерной технике трудно переоценить.
Необходимо также отметить, что такие низкотемпературные
процессы, как вымораживание, конденсация и криосорбция,
имеют большое самостоятельное значение, так как являются
эффективными средствами достижения высокого и сверхвысо-
кого вакуума. Кроме того, биологическими и медицинскими
исследованиями установлено, что воздействие низких темпера-
тур на живые ткани и биоматериалы обнаруживает их новые
важные свойства и открывает большие возможности для дальней-
шего развития биологии, медицины и сельскохозяйственного
производства. Наконец, криогенные приборы и установки зани-
мают особое положение как средства обеспечения сложнейших
физических исследований.
Таким образом, криогенная техника, криоэнергетика, криофи-
зика, криоэлектроника, криобиология и криомедицина —
важнейшие составные части науки о холоде и его применении.
Эта наука называется криологией. Как уже было отмечено,
криогеника объединяет области техники и технологии получения
и применения температур ниже 120 К. Результаты, достигнутые
в развитии криогеники передовыми странами, позволили реали-
зовать колоссальные научные и технические программы. Успех
решения фундаментальных проблем человечества во многом
определяется исключительными возможностями, открываю-
щимися благодаря использованию очень низких температур.
§ 1.2. РАЗВИТИЕ КРИОГЕНИКИ
История криогеники неразрывно связана с развитием физики
и в первую очередь с разработкой методов получения низких
температур, ожижения газов и исследованиями физических
свойств веществ при низких температурах (табл. 1.1). Вместе с
тем постоянно расширявшееся практическое применение низких
8
1.1. Хронологическая таблица
искусственно полученных наиболее низких температур
Год Темпера- тура, К Метод, условия (исследователи)
До 1740 Около 252 Смешение льда и поваренной соли; эффект охлаждения описан и объяснен М.В.Ломоносопым
Примерно 1800 Около 223 Смешение льда и хлористого кальция
1840-1845 Около 163 Смешение твердой углекислоты и спирта (или эфира) под колоколом вакуумного насоса (М. Фарадей)
1877 Около 90 Однократное адиабатное расширение сжатого и предварительно охлажденного газа (кислорода). Достигнутые температуры сохранялись несколько секунд (Л.Кальете и Р.Пикте). В опытах Р.Пикте впервые использован каскадный цикл для предва- рительного охлаждения кислорода, сжатого до дав- ления 20 МПа
1878 Около 77 Тс же исследователи тем же методом, что и в 1877 г., расширяя окись углерода и азот, получили кратковременные температуры, близкие к темпера- турам насыщения этих газов
1883-1885 77 Однократное адиабатное расширение газа, сжатого и предварительно охлажденного кипящим под вакуумом этиленом; получены устойчивые темпе- ратуры жидкого кислорода, воздуха, азота (Э.Оль- шевский и С.Вроблевский)
1884-1890 Около 55 Вакуумирование жидкого кислорода (Э.Ольшев- ский и С.Вроблевский)
1898 20,3 Метод дросселирования с использованием эффекта Джоуля—Томсона в сочетании с теплообменным аппаратом и предварительным охлаждением жидким воздухом, кипящим под вакуумом; осуществлено ожижение водорода (Дж.Дьюар)
1900 Около 14 Вакуумирование жидкого водорода (Дж.Дьюар)
1905-1906 Около 2 Однократное адиабатное расширение сжатого и предварительно охлажденного гелия; признаки насыщения наблюдались в течение 1 с (Э.Ольшев- ский и Г.Камсрлинг-Оннес)
1908 4,2 Метод дросселирования гелия с использованием эффекта Джоуля—Томсона и предварительным охлаждением жидким водородом; получены устойчивые температуры жидкого гелия (Г.Камер- линг-Оннес)
1908 1,72 Вакууммирование жидкого гелия при давлении 1333,2 Па (Г.Камерлинг-Оннес)
1909 1,38 То же при давлении 293 Па (Г.Камерлинг-Оннес)
1910 1,04 То же при давлении 26,65 Па (Г.Камерлинг-Оннес)
1919 1,0 То же при давлении 25,3 Па (Г.Камерлинг-Оннес)
1922 0.83 Вакуумирование жидкого гелия с помощью насоса Лэнгмюра при давлении 1,73 Па
9
Продолжение табл. 1.1
Гол Темпера- тура, К Метод, условия (исследователи)
1932 0.71 Вакуумирование жидкого гелия при помощи батареи мощных масляных диффузионных насосов (В.Кизом)
1933 0.27 Однократное адиабатное размагничивание парамаг- нетика (сульфата гадолиния); получены кратковре- менные температуры (В. Джиок и Д. Мак-Дугалл)
1935 0,0044 То же в усовершенствованных установках (В. де Гааз)
1940-1950 0.00114 Тем же методом в различных лабораториях получены кратковременные температуры
1954 0,2-0.3 Метод адиабатного размагничивания парамагнетиков; с помощью магнитной холодильной машины получены устойчивые температуры в стационарном режиме (Дж.Доунт, К.Ьарнес и К.Хир)
195b 0,00002 Однократное адиабатное размагничивание ядра атома меди; получены кратковременные температуры (Н.Кюрти, Ф.Симон, Ф.Робинсон, Д.Спор)
1963 1,2- 10’6 То же (Н.Кюрти с сотрудниками)
1965 0,025 (в настоя- щее время до 0.002) Метод адиабатного растворения жидкого 3Не в жидком 4Не; получены устойчивые температуры в стационарном режиме (Б.Неганов. Н.Борисов и М.Либург в ОИЯИ, г. Дубна). Метод теоретически обоснован в 1951 г. X.Лондоном. Способ предложен в 1962 г. Х.ЛондоноМ. Е.Мендозой и Г.Кларком
1965 0,018 (в настоя- щее время до 0,001) Метод адиабатного сжатия смеси твердого и жидко- го 3Не при Т < 0,32 К (метод предложил В1950 г. акад. Г.И.Померанчук); получены устойчивые тем- пературы в стационарном режиме (Ю.Ануфриев)
температур формировало различные области криогенной техники
и технологии. До 60-х гг. основное промышленное значение
имели криогенные воздухоразделительные установки (ВРУ) с
уровнем температур до 70 К. Начиная с 60-х гг. интенсивно
развивается промышленное производство водородных и гелиевых
систем с уровнем температур до 4 К. В 80-е гг. практическое
использование получили гелиевые установки, работающие на
уровне температур около 1,8 К. Большое самостоятельное
значение приобрела в последние годы технология ожижения,
транспортирования и хранения природного газа и метана.
Постоянно растет потребление аргона, неона и других редких
газов и их изотопов. Созданы новые эффективные криогенные
системы: системы охлаждения сверхпроводящих обмоток элект-
рических машин и магнитов; системы охлаждения лазеров и
мазеров; установки для очистки газовых сред методами низко-
температурной сорбции и ректификации; мощные крионасосы,
10
обеспечивающие создание высокого вакуума; медицинское
криохирургическое оборудование и др. В 90-е гг. уровень
температур, используемых в практических целях, понизился до
0,33 К. Наряду с созданием крупнейших ожижителей и крио-
генераторов развитие радиоэлектроники и вычислительной
техники потребовало разработки миниатюрных охладителей.
Микрокриогенная техника выделилась в самостоятельное направ-
ление криогеники. Важнейшие этапы развития криогеники отра-
жены в табл. 1.2.
1.2. Хронологическая таблица
наиболее важных технических достижений криогеники
Год Исследователь, страна, достижение
1857 В. Сименс в Германии построил первый поршневой детандер, в котором безуспешно пытался ожижить воздух. Впервые применил в установке рекуперативный противоточный теплообменник
1877 Р. Никте во Франции построил первую каскадную холодильную машину, с помощью которой удалось получить жидкий кислород
1892 Дж. Дьюар в Англии применил сосуды с двойными стенками для хранения ожиженных газов (изолирующее свойство вакуума Дж.Дьюар использовал впервые в 1874 г.)
1895-1896 К. Линде в Германии и В. Хемпсон в Англии построили первые лабораторные ожижители воздуха непрерывного действия. Ожижи- тели работали по циклу с простым дросселированием. Осуществлено частичное разделение воздуха при испарении
1898 Дж. Дьюар построил первый лабораторный водородный ожижитель
1900 К. Линде построил установку для ожижения воздуха с предваритель- ным аммиачным охлаждением
1902 Ж. Клод во Франции осуществил ожижение воздуха в установке с детандером
1902 К. Линде построил колонну однократной ректификации
1902-1906 Ж. Клод усовершенствовал процесс разделения воздуха в ректифика- ционной колонне с дефлегматором
1903 К.Э. Циолковский в России обосновал эффективность применения ожиженных водорода и кислорода в ракетной технике
1903-1907 В различных странах: использование жидкого воздуха для создания вакуума методом адсорбции при низких температурах; очистка тазов и жидкостей методом вымораживания; применение низких темпе- ратур в технологических операциях
1906 II. Гейландт в Германии создал установку с детандером высокого давления для ожижения воздуха и получения жидкого кислорода
1907 К. Линде разработал и осуществил процесс разделения воздуха в колонне двукратной ректификации
1907-1909 А. Мессер в Германии использовал в установках разделения воздуха уходящий сухой азот для предварительного (азотоводяного) охлаж- дения сжатого воздуха, понизив его температуру на 10 К
1908 Ж. Клод выделил неоногелиевую смесь и разделил ее методом адсорбции на угле
11
Продолжение табл. 1.2
Год Исследователь, страна, достижение
190S I. Камерлипг-Оннес в Голландии (Лейденская лаборатория) постро- ил нятикаскадную холодильную установку, в которой достигались температуры до 14 К, а также первый гелиевый ожижитель
1912 В Германии и Франции построены воздухоразделительные уста- новки производительностью 250 м3/ч
1912 В Бельгии на сталеплавильньк заводах опробован способ обогаще- ния кислородом воздуха в процессе дутья
1915 К. Линде впервые получил аргон ректификацией аргонной фракции, отбираемой из верхней колонны
1919 В Лейдене созданы гелиевые ожижители производительностью 2 л/ч
1921 В США построены гелиевые заводы суточной производительностью до 1000 м3 газообразного гелия
1921-1925 1926 Освоение производства криптона из воздуха Фирма “Линде" применила регенераторы в воздухоразделительных установках
1926 1929-1930 Ф. Симон применил адиабатную десорбцию для ожижения гелия В.П. Глушко, Ф.А. Цандер, С.П. Королев в СССР создали жидкост- ные ракетные двигатели, окислителем в которых служил жидкий кислород
1930-1935 Производительность воздухоразделительных установок для получе- ния технологического кислорода достигла 3500—5000 м3/ч
1932 Фирма “Линде” применила в воздухоразделительных установках турбодетандеры активного типа
1932 Ф. Симон осуществил ожижение гелия однократным адиабатным расширением (так называемый экспансиопный метод Симона)
1934 Акад. ПЛ. Капица, работая в Англии, построил первый гелиевый ожижитель с детандером; температура гелия после расширения в детандере достигла 11 К. Эти работы положили начало промышлен- ному ожижению гелия
1937-1939 Акад. П.Л. Капица в СССР создал высокоэффективный активно- реактивный турбодетандер, что позволило построить возду- хоразделительные установки на основе цикла одного низкого дав- ления. На основе цикла низкого давления П.Л. Капицы построены все современные крупнотоннажные установки разделения воздуха
1943-1950 Создание ведущими странами криогенного оборудования для использования больших количеств жидкого кислорода в ракетной технике
1945-1955 С. Коллинз в США разработал несколько типов промышленных гелиевых ожижителей с детандерами
1950-1955 Производительность установок для получения технологического кислорода достигла 15 000 м3/ч, ожижителей водорода — 500 л/ч. ожижителей гелия — 50 л/ч
1954 Дж. Келлер и К. Джонкерс в лабораториях фирмы “Филипс” (Голландия) создали эффективную газовую холодильную машину, работающую по обратному циклу Стирлинга для ожижения воздуха, и установки с этими машинами для разделения воздуха
12
Продолжение табл. 1.2
Год Исследователь, страна, достижение
1955-1958 В СССР под руководством проф. М.П. Малкова разработан промышленный способ выделения дейтерия методом дистилляции жидкого водорода
1955-1958 1959 Созданы первые дроссельные микроохладители Фирмой “Линде” разработана эффективная слоистая экрановакуум- ная изоляция (так называемая суперизоляция)
1959 В. Гиффорд и X. Мак-Магон в США реализовали новый ориги- нальный цикл для миниатюрных газовых холодильных машин
1959 Проф А.П. Клименко в СССР предложил однопоточный каскадный цикл для ожижения газов. Эти работы послужили началом примене- ния газовых смесей в качестве рабочих тел криогенных систем
1960-1965 Производительность установок для получения технологического кислорода достигла 30 000 м3/ч, ожижителей водорода—15 000 л/ч. ожижителей гелия — 150 л/ч
1963 Фирмой “Филине” разработана двухступенчатая машина (Стир- линга) для ожижения водорода
1965—1968 1965-1970 Начато практическое использование сверхпроводимости В ведущих странах созданы мощные конденсационные (криогенные) насосы для достижения сверхвысокого вакуума
1965-1970 В ведущих странах построены первые теплоиспользующие газовые холодильные машины типа Вюлемье—Такониса
1968-1972 В ведущих странах разработаны первые электрические машины со сверхпроводящими обмотками мощностью до 5 МВт
1970-1972 С. Коллинз с сотрудниками разработал парожидкостный детандер; его применение позволило увеличить выход жидкого гелия на 25 %
1970-1975 Производительность установок для получения технологического кислорода достигла 60 000—70 000 м3/ч, ожижителей водорода — 33 000 л/ч, ожижителей гелия — 800—2000 л/ч
1973-1975 Достигнута температура 6,7 К с помощью двухступенчатой машины Гиффорда — Мак-Магона без дроссельной ступени и температура около 8 К с помощью трехступенчатой машины типа “Стирлинг- Филипс"
1976—1978 Использование сверхпроводящих магнитов для МГД-генераторов и в крупномасштабных установках для физических исследований. Мощность электрических машин со сверхпроводящими обмотками достигла 20 МВт
1978-1980 Разработаны сверхпроводящие квантовые интерферометры (СКВИДы), позволяющие измерять силу тока до 10"14 А, напряже- ние — до 10'16 В, магнитную индукцию — до 10-14 Тл
1980-1983 В лаборатории А. Наказа (Франция) созданы магнитные рефрижера- торы непрерывного действия холодопроизводительностью 1,35—2,4 Вт при температуре 1,8-2,1 К
1980-1985 Мощность электрических машин со сверхпроводящими обмотками достигла 300 МВт. В СССР такой электрогенератор построен под руководством акад. И.А. Глебова
1980-1985 В СССР в МВ1У им. Н.Э. Баумана разработаны первые волновые криогенераторы. В ведущих странах разработаны уникальные установки криообеспечения для ускорителей заряженных частиц и плазмодинамических систем. В СССР под руководством чл.-корр. АН СССР В.П.Белякова созданы такие установки для токамаков и ускорителя с энергией 3 ТэВ
13
Продолжение табл. 1.2
Год Исследователь, страна, достижение
1982-1984 В СССР проф. Г.А. Головко разработал ректификационно- адсорбционный метод промышленного производства аргона особой чистоты (объемное содержание 99,99995 %)
1984-1987 В ЧССР созданы установки со сверхпроводящими машитами для сепарации руд
1985-1989 В СССР и США построены уникальные криотермовакуумные установки для имитации условий космического пространства объемом 10 000 м3 и более.
1985—1990 В СССР, США, Англии, Германии создано оборудование нового поколения для длительного хранения и транспортирования жидких криопродуктов. Полезная емкость стационарных хранилищ дости- гла 1400 м3, емкость автотранспортных сосудов для перевозки гелия и других ожиженных газов — 40 000 л
1986—1988 В СССР, США, Японии и Германии получены первые высоко- температурные сверхпроводники с температурой перехода в сверхпроводящее состояние 92—98 К и плотностью тока до 103 А/см2.
1987-1990 В СССР в МВТУ им. Н.Э. Баумана разработана технология очистки воздуха от радиоактивного 85Кг
1989—1991 В США фирмой PRAXAIR создано новое поколение крупных воздухоразделительных установок; адиабатный КПД турбодетанде- ров этих установок достигает 91—92 %; развиваемая мощность используется для дожатая рабочего потока воздуха
1990—1992 В России созданы водородные турбодетандеры, работающие в цик- лах среднего и высокого давлений
1991-1992 В России осуществлены первые пробные полеты авиалайнеров КБ им. А.Н. Туполева с использованием в качестве топлива сжиженного природного газа
1993—1995 Чистота продуктов разделения воздуха (по требованию потребителя) может достигать 1—10 ppb
1995 В США фирмой PRAXAIR построен крупнейший ожижитель водорода мощностью до 800 т/сут.
До 1931 г. СССР не имел собственной машиностроительной
базы для производства криогенных воздухоразделительных
установок. Большая заслуга в развитии производства воздухо-
разделительной аппаратуры принадлежит В.В. Куйбышеву и
Г.К. Орджоникидзе. Первая отечественная установка для полу-
чения кислорода, разработанная под руководством профессоров
С.Я. Гсрша, Н.А. Доллежаля и С.Н. Семихатова, изготовлена в
1932 г. С 1933 г. освоен серийный выпуск кислородных
установок. Первое общесоюзное совещание по применению кис-
лорода в черной металлургии было проведено по инициативе ЦК
ВКП(б) в 1933 г. XVIII съезд ВКП(б) в 1938 г. поставил задачу
о переводе черной металлургии на кислородное дутье. В
14
предвоенные годы образован Институт физических проблем АН
СССР. Коллективом этого института под руководством акад.
П.Л. Капицы выполнены основополагающие работы по созданию
крупных воздухоразделительных и гелиевых рефрижераторно-
ожижительных установок, получившие всемирное признание (см.
табл. 1.2). В 1942 г. создан Главкислород во главе с П.Л. Капицей.
В 1943—1946 гг. организованы ВНИИКИМАШ, Гипрокислород
и специализированные заводы.
В короткий исторический срок наша страна превратилась в
ведущую державу по криогенному машиностроению и начала
экспортировать криогенное оборудование. Созданы мощные
агрегаты комплексного разделения воздуха — установки
Кт-70 производительностью по кислороду до 70 000 м3/ч,
КтК-32-2 и КтА-33 производительностью по кислороду до
35 000 м3/ч с попутным извлечением криптоноксенонового
концентрата и неоногелиевой смеси. В ЛТИХП (ныне
СПбГАХПТ) разработаны эффективные технологии получения
сверхчистых аргона, кислорода и других газов. Создано оборудо-
вание для транспортирования, хранения и газификации
криогенных жидкостей. Увеличен выпуск гелиевого холодо-
производящего и емкостного оборудования. Освоен серийный
выпуск гелиевых рефрижераторов и ожижителей КГУ-500/4,5,
КГУ-600 и КГУ-1600/4,5, в том числе с турбодетандерами;
микрокриогенных систем; оборудования для использования
холода в сельском хозяйстве, медицине, биологии и др.
Развитие техники низких температур требовало совершенство-
вания подготовки специалистов ведущими учебными заведе-
ниями. МГТУ им.Н.Э. Баумана, СПбГАХПТ, МЭИ, МГАХМ,
ОГАХ. В этих вузах сложились научные школы в области
криогеники, старейшей из которых является научная школа
МГТУ им. Н.Э.Баумана. В 1932 г. в этом вузе (тогда он назывался
ммми им. Н.Э. Баумана) проф. С.Я. Герш впервые прочитал
курс “Глубокое охлаждение”. Перед началом Великой Отечест-
венной войны здесь была создана лаборатория глубокого холода,
которая окончательно сформировалась в 1943—1944 гг. В 1957 г.
на базе учебной и научно-исследовательской лабораторий
организована проблемная лаборатория глубокого холода, а в
1984 г. — отраслевая лаборатория безмашинных газодинамичес-
ких методов получения низких температур.
Для обеспечения развития криогеники в период между 1956
и 1976 гг. были созданы специализированные предприятия,
существенно расширены области применения низких температур,
15
организованы новые исследовательские криогенные лаборатории,
Харьковский физико-технический институт низких температур,
Советский национальный комитет по холоду, в состав которого
вошли несколько комиссий по важнейшим направлениям
криогеники. Советские специалисты принимали активное
участие в деятельности Международного института холода.
В 1976 — 1985 гг. под руководством академиков И.А.Глебова,
А.П.Александрова, Н.А.Доллежаля, В.А.Кириллина, А.Е.Шейд-
лина, Б.А.Кадомцева, Е.П.Велихова, А.И.Логунова созданы
уникальные мощные электрические машины и эксперименталь-
ные физические установки со сверхпроводящими обмотками.
Получили развитие черная и цветная металлургия, химическая
и газовая промышленность и другие области техники, широко
использующие достижения криогеники. Наряду с этим прове-
дены работы в области ядерной физики, физики плазмы, твердо-
го тела, которые широко использовали низкие температуры.
Расширено производство важнейшего криогенного оборудования,
увеличена мощность (производительность) криогенных устано-
вок, созданы новые криогенные машины, аппараты, установки,
системы и их элементы. В существенной мере этому способство-
вали использование ЭВМ, рациональная организация всего цикла
научно-исследовательских, опытно-конструкторских работ и
производства, а также унификация деталей и узлов криогенных
систем. Эти мероприятия были проведены по инициативе и под
руководством генерального конструктора по криогенной технике
чл.-корр. РАН В.П.Белякова. Было создано прогрессивное
криогенное, вакуумное, холодильное оборудование на основе
новых технологических процессов, сокращены в 3—4 раза сроки
разработки и освоения новой техники, повышена в 1,5—2 раза
ее производительность и надежность, уменьшена металлоемкость
оборудования, максимально унифицированы узлы и детали,
внедрены средства микропроцессорной техники.
Успешному развитию техники низких температур в последние
годы способствовал широкий размах научных и прикладных
исследований. Решение важнейших задач, стоящих перед
криогеникой, было сопряжено с необходимостью проведения
многочисленных конкретных исследований в области низко-
температурной ректификации, сорбции, теплообмена при кипе-
нии, конденсации и кристаллизации, вымораживания, нестацио-
нарных тепловых процессов, изучения термодинамических
свойств газов и жидкостей, исследования низкотемпературных
лопаточных машин и машин объемного типа, изучения изоляции
16
различных типов, свойств конструкционных материалов.
Важнейшую роль сыграли исследования новых технологических
процессов и низкотемпературных циклов, создание новых
эффективных криогенсраторов и криоаппаратуры и особенно
работы по практической реализации сверхпроводящих систем.
К этим исследованиям относятся такие крупные работы, как
разработка промышленного способа выделения дейтерия мето-
дом низкотемпературной дистилляции; создание ВРУ серий КтК,
КтА, Кт, криоконденсационных и криовакуумных насосов и
крупных гелиевых систем криогенного обеспечения (АО “Крио-
генмаш”); разработка и создание гелиевых рефрижераторов и
ожижителей (АО “Гслиймаш”); создание нового стационарного
транспортного, транспортабельного криооборудования, микро-
криогенных установок (АО “Сибкриотсхника”); криоэнергети-
ческих установок; разработка крупнейших водородных пузырько-
вых камер в ОИЯИ, МГД-систем в И ВТ РАН, токамаков в АО
“Криогенмаш”, НИКИЭТс и ИАЭ им. И.В.Курчатова, ускорите-
лей, испытательных камер и других технических, технологических
и научных приборов и систем. Мировое признание получили
работы отечественных ученых в области криофизики.
В самые последние годы в связи с экономическим кризисом
темпы развития криогеники несколько замедлились. Тем не
менее, по ряду направлений достигнуты важные результаты.
Производительность гелиевых ожижителей АО “Гслиймаш”
увеличилась до 700 л/ч. В АО “Криогенмаш” созданы ВРУ с
комплексной осушкой и очисткой воздуха в адсорберах и с
использованием энергии турбодетандсров для дожития воздуха
основного технологического потока. Начат серийный выпуск
автомобилей-рефрижераторов, работающих на жидком азоте.
Активно ведутся работы по создании! новых типов машин и
аппаратов, в частности водородных турбодетандеров высокого
давления, воздухоразделительных колонн с регулярными насад-
ками, адсорбционных систем разделения инертных газов и др.
В Протвино осуществляется монтаж уникальной гелиевой
системы криостабилизации магнитов мощнейшего ускорителя
протяженностью около 20 км. В Дубне в 1994 г. пущен в
эксплуатацию крупнейший в Европе ускоритель со сверхпроводя-
щими магнитами. Акционерным обществом “Крпокор” создано
оборудование для утилизации энергии сжатого природного газа
в криогенных установках. Российскими и иностранными фирма-
ми подписан ряд взаимовыгодных контрактов по совместным
исследованиям и созданию новых криогенных установок.
2 Закал ль 1592
Глава 2
ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ
И ЗАКОНЫ
§ 2.1. КОНТРОЛЬНАЯ СИСТЕМА.
ПАРАМЕТРЫ И ФУНКЦИИ СОСТОЯНИЯ.
УСЛОВИЯ РАВНОВЕСИЯ
Расчет криогенных систем и их теоретический анализ
базируются на основных физических законах. Их применение
предусматривает прежде всего выделение так называемой
контрольной системы, ограниченной контрольной поверхностью.
Контрольной системой может быть любой реальный объект
исследования, например, криогенная установка в целом или ее
отдельный аппарат, машина, часть аппарата или машины и др.
Через контрольную поверхность система может обмениваться
веществом и энергией с окружающими телами. К контрольной
поверхности могут быть приложены внешние силы. Система
может быть неподвижной или перемещающейся в пространстве.
Если через контрольную поверхность не происходит переноса
массы, ограничиваемую ею систему называют замкнутой или
закрытой. Термин открытая или разомкнутая, система преду-
сматривает наличие потоков вещества через контрольную
поверхность. Контрольную поверхность можно рассматривать как
идеально жесткую (механическая изоляция; процессы при
V = const) или идеально гибкую (процессы при р = const).
Контрольной поверхности можно придать свойства идеальной
тепловой изоляции (адиабатные системы) и другие качества.
Термин изолированная система предполагает, что система не
взаимодействует с окружающей средой.
Совокупность потенциалов и координат состояния образует
параметры системы. Например, для термомеханической системы,
обменивающейся с окружающими телами энергией в форме
теплоты и работы, параметрами являются давление р и темпера-
тура Т (потенциалы), удельный объем v и энтропия 5 (коорди-
наты). При анализе термомеханических систем независимые
переменные можно выбирать из следующей совокупности пар
параметров: р, v\ Т, х; х, v\ s, р\ Т, v\ Т, ,р.
18
Известно, что для термомсханической системы функциями
состояния являются:
внутренняя тепловая энергия U (или и );
энтальпия / (или i);
свободная энергия F (или /);
свободная энтальпия (или потенциал Гиббса) Ф (или <р).
Выбор независимых переменных и функции состояния для
исследования системы определяется в каждом конкретном случае
характером процесса, протекающего в системе.
Термодинамические функции принимают наименьшее значе-
ние, когда изолированная система достигает состояния равно-
весия:
U = «min <du = °)
' = Zmin <di = °)
f=fmin (df=V
Ф = Фпип № = °)
при 5 = const и v = const;
при .s’ = const и p = const;
при T = const и v = const;
при T — const и p = const.
Это известные условия равновесия, которые широко исполь-
зуют при анализе равновесных состояний, например двухфазных
сред.
Система является стационарной, если се параметры и характе-
ристики не изменяются во времени. В стационарной системе
могут протекать типично стационарные процессы: в нее могут
втекать и из нее вытекать стационарные потоки массы и энер-
гии. Вместе с тем есть такие установки, аппараты и машины, в
которых рабочие процессы протекают циклически в условиях,
типично нестационарных. Установившимися режимами работы
таких машин называют режимы, при которых усредненные за
время одного цикла параметры и характеристики постоянны в
течение всего периода работы.
§ 2.2. ПРИНЦИП СОХРАНЕНИЯ МАССЫ.
МАТЕРИАЛЬНЫЙ БАЛАНС.
СТЕХИОМЕТРИЧЕСКИЙ ПРИНЦИП
Для обычных (нерелятивистских) систем сумма всех масс,
вошедших и вышедших через контрольную поверхность, равна
изменению массы системы, ограниченной данной контрольной
поверхностью (рис. 2.1):
(2.1)
19
2*
Рис. 2. J. Схема контрольной систе-
мы, ограниченной контрольной
поверхностью [к уравнению мате-
риального баланса (2.1)]
где G, — z-й (входящий или вы-
ходящий) поток массы, кг/(с • м2):
G. = с, pt (с, — усредненная
составляющая скорости движения
z-ro потока относительно конт-
рольной поверхности, нормаль-
ная к последней, м/с; р(. — плот-
ность вещества в z-м потоке,
кг/м3); - площадь сечения,
через которое втекает или выте-
кает z-й поток, м2; \т — изменение массы системы в единицу
времени, кг/с (для стационарных режимов \т — 0; для устано-
вившихся режимов усредненное по времени значение Azr? = 0
либо \т = const, например в процессах наполнения или опорож-
нения).
Если потоки массы неоднородны по составу (например, сме-
си), то при отсутствии химических реакций для л-го компонента
X (2 2)
/
где у1п — концентрация л-го компонента в z-м потоке, кг/кг;
,\тп — изменение массы л-го компонента в системе, кг/с (для
стационарных состояний \тп — 0, для установившихся —
\тп = 0 или \тп = const).
Если в системе происходит какая-либо химическая реакция,
то в соответствии со стехиометрическим принципом число
атомов (для некоторых реакций число молекул), участвующих
в реакции, сохраняется.
§ 2.3. ПРИНЦИП СОХРАНЕНИЯ ЭНЕРГИИ.
ЭНЕРГЕТИЧЕСКИЙ БАЛАНС
Для любой системы алгебраическая сумма всех внешних
воздействий, которыми система обменивается с окружающими
телами через контрольную поверхность, равна изменению энер-
гии системы (рис. 2.2):
X всех внешних воздействий = ДЭ. (2.3)
Понятие внешнее воздействие употребляют в самом широком
смысле: оно объединяет количества энергий всех видов, кото-
рыми система обменивается с окружающими телами.
20
Рис. 2.2. Схема к уравнению (2.3)
энергетического баланса
При анализе криогенных
систем в левой части урав-
нения (2.3) могут быть сле-
дующие величины:
L — механическая или
электрическая работа, Дж
или Вт • ч (для процессов
намагничивания — работа
намагничивания);
/—удельная работа,
Дж/кг или Вт • ч/кг;
pv — работа гидродина-
мических сил каждой еди-
ницы массы на входе и выходе контрольной системы, Дж/кг
(р — давление, Па; v — удельный объем, м3/кг); работа гидро-
динамических сил на входе и выходе в общем случае пропорцио-
нальна удельному объему и нормальным напряжениям в пото-
ке; если градиент скорости мал, нормальная составляющая
напряжений практически равна давлению р\
и — внутренняя тепловая энергия каждой единицы массы,
пересекающей контрольную поверхность системы, Дж/кг;
и еп — кинетическая и потенциальная энергия каждой еди-
ницы массы, пересекающей контрольную поверхность, Дж/кг
ек = 0,5с2;
i = и + pv — энтальпия либо удельная энергия потока (при
малых скоростях) на входе или выходе системы, Дж/кг;
/ад = и + pv + 0,5с2 — полная энтальпия, называемая также
энтальпией адиабатически заторможенного потока, либо удель-
ная энергия потока на входе или выходе системы, Дж/кг;
Q и q — теплота, передаваемая контрольной системе либо
теряемая ею под действием разности температур на контрольной
поверхности либо при лучеиспускании, Дж и Дж/кг.
Величина ДЭ в правой части уравнений (2.3) представляет
собой изменение энергии системы. Например, для термодинами-
ческой системы (без учета электростатических и электромагнит-
ных составляющих)
\Э = ДС/+ ДЭК + ДЭп, (2.4)
где AU— изменение внутренней тепловой энергии системы, Дж;
= Д(0,5тС2) — изменение кинетической энергии системы, Дж
(С скорость центра масс т системы, м/с); ЛЭп = Д (mgh) —
изменение потенциальной энергии системы, Дж (т — масса,
21
h — координата центра масс системы, м; g = 9,81 м/с2 -
ускорение свободного падения).
В общем случае для термомеханической системы:
закрытой
X Ln + X Qm = ДЭ ; (2.5)
п т
открытой (за время т)
X £„ + X (ц Л'ад,) + X = д э. (2.6)
п i т
Для стационарных режимов ДЭ — 0, для установившихся
ЛЭ = 0 или ДЭ =const.
В технической термодинамике применяют условное правило
знаков, согласно которому работу, совершенную системой, и
количество теплоты, сообщенное системе, считают положитель-
ными (и наоборот), поэтому в уравнениях (2.6) первое слагаемое
записывают со знаком минус. Так как это правило условное, то
его не всегда придерживаются. В ряде практических случаев при
составлении уравнений энергетического баланса удобнее исполь-
зовать простую алгебраическую сумму внешних воздействий
[уравнение (2.6)]. С учетом условного правила знаков уравнения
энергетического баланса записывают для наиболее характерных
частных случаев следующим образом.
Для модели закрытой системы при ДЭК = 0 и ДЭП = О
Q - L = U2 - Ц; £ dQ = £ dL . (2.7)
Эту модель практически можно применять к различным
замкнутым криогенным и энергосиловым циклам и системам,
а также к некоторым отдельным процессам. Уравнения (2.4)-
(2.7) справедливы как для реальных, так и для идеальных
условий. В такой системе механическая работа при идеальных
(равновесных) процессах без трения
I — J р dv. (2.8)
V
Для модели стационарной или находящейся в установившемся
состоянии открытой системы (рис. 2.3) с одним транзитным
стационарным (установившимся) потоком при Дт = О
q = I + i2 - z\ + 0,5 (с22- с2) + g (h2 - hj. (2.9)
22
Рис. 2.3. Схема термодинамической
_ открытой системы в стационарном или
установившемся состоянии с одним
и транзитным потоком (q/j р] = с2/2р2)
Эту модель системы можно
применять, например, к турбо-
j детандеру, компрессору, порш-
'/////// новому детандеру, турбине,
процессам дросселирования и выхлопа, истечения и др.
Уравнение (2.9) справедливо как для случая течения с тре-
нием, так и для идеальных условий. Для такой системы меха-
ническая работа при идеальных процессах без трения
2
I = J v dp + 0,5 (с22- с2) + g (h2 - Aj). (2.10)
i
Для реальных процессов с трением механическую работу в
рассматриваемых системах можно выразить уравнениями (2.8)
и (2.10), добавив к правой части с соответствующим знаком
работу / , совершаемую для преодоления сил трения, или рав-
ное количество теплоты <7гр, выделяемой при трении.
Для различных теплообменных аппаратов часто также состав-
ляют уравнения энергетического баланса для установившихся
состояний. Такие выражения, называемые обычно уравнениями
теплового баланса, в общем случае имеют вид
Z (Qm/T) + Z Gtft = 0, (2.11)
т i
гДе X (СтЛ) — алгебраическая сумма тепловых нагрузок,
т
включающая теплопритоки из окружающей среды, Вт.
§ 2.4. ТЕОРЕМА ОБ ИЗМЕНЕНИИ ИМПУЛЬСА
При анализе силовых воздействий потоков криогенных
жидкостей и газов, в частности на обтекаемые профили в лопа-
точных машинах, и расчете эжекторов широко используют
теорему об изменении импульса (количества движения):
[Скорость изменения полного импульса системы] =
= [Равнодействующая всех внешних сил].
При отсутствии внешних сил полный импульс системы
постоянен. Эта теорема является следствием 2-го закона
23
Рис. 2.4. Схема к теореме об изменении
импульса
Ньютона и в гидродинамичес-
кой форме выражается уравне-
нием Эйлера (рис. 2.4)
<1(тС)1<к = F,
где т — масса системы, кг; С — скорость центра масс системы,
м/с; F — результирующая внешних сил, Н.
Для стационарных и установившихся режимов (при \т = 0)
d (тС )/dr = 0.
Поскольку с. и С — векторы, то импульсы — тоже векторы.
Сумма проекций скоростей изменения импульсов на любую из
осей равна проекции результирующей внешней силы на эту ось.
При стационарном вращательном движении алгебраическая
сумма моментов импульсов секундных масс всех входящих и
выходящих потоков относительно оси вращения равна моменту
результирующей внешней силы относительно той же оси:
где г. — кратчайшее расстояние от вектора с(. до оси вращения,
м; MF — момент результирующей внешней силы F, Н • м.
Произведение момента Мр и угловой скорости <х> определяет
мощность, Вт:
N = MFo>.
§ 2.5. ПРИНЦИП ВОЗРАСТАНИЯ ЭНТРОПИИ.
УРАВНЕНИЕ ЭНТРОПИЙНОГО БАЛАНСА.
НЕОБРАТИМОСТЬ И ЗАТРАТЫ ЭНЕРГИИ
Принцип возрастания энтропии является обобщающим резуль-
татом второго начала термодинамики и вытекающих из него
следствий. Второе начало термодинамики устанавливает невоз-
можность передачи теплоты от тел с более низкой температурой
телам с более высокой температурой без компенсации, или в
другой формулировке — невозможность создания вечного двига-
теля 2-го рода. Исходя из этого, можно установить, что для
24
любой системы, находящейся в равновесном состоянии или
претерпевающей равновесные, т.е. обратимые изменения, суще-
ствует однозначная функция состояния, называемая энтропией.
Энтропия является координатой состояния и в этом смысле
определяет количество теплоты при равновесных тепловых
взаимодействиях. Для изолированной в тепловом отношении сис-
темы тел (адиабатная система) суммарное изменение энтропии
X As( всех тел и подсистем, участвующих в любых обратимых
i
процессах, и изменение энтропии окружающей среды Д50 (если
окружающая среда - часть рассматриваемой изолированной сис-
темы), равно нулю. Все изложенное выше можно записать сле-
дующим образом:
£ ds = 0; d°Q = Т ds; £ As(. + As0 = 0. (2.12)
I
Эти уравнения выражают второе начало термодинамики для
равновесных систем и обратимых процессов; верхний индекс 0
у знака дифференциала означает, что в общем случае Q (или £)
не является функцией состояния, a d°Q (или d} L) — полным
дифференциалом.
Реальные процессы неравновесны и необратимы. При любых
необратимых процессах в замкнутой адиабатной системе (общая
масса не изменяется) энтропия системы возрастает, т.е. конечное
значение энтропии всей системы лк становится больше началь-
ного 5Н. Если лн = Е \ н + W V; £ \ к П к, то
I I
\ = z Ах,. + Ду, > 0.
/
Условие внешней тепловой изоляции на контрольной поверх-
ности всей рассматриваемой системы, т.е. условие адиабатич-
ности, является единственным ограничением. Таким образом,
общее выражение для суммарного изменения энтропии в замкну-
той адиабатной системе тел при любых типах протекающих в
системе процессов (рис. 2.5) имеет вид
X Ау + As0 0. (2.13)
I
Когда в качестве части общей адиабатной системы тел рас-
сматривается реальная криогенная установка или система, а в
ней в свою очередь выделяются подсистемы (компрессор, тепло-
обменник, детандер, адсорбер и др.), для обозначения возраста-
ния энтропии вследствие необратимости реальных процессов
25
целесообразно использовать термин “производство энтропии”,
(а не приращение), поскольку сама криогенная установка и
каждая ее часть находятся обычно в установившемся состоянии,
и энтропия, как и другие параметры рабочего тела, не изменя-
ется (или циклически повторяет свои значения). Криогенная
система или ее часть может находиться также в нестационарном
состоянии (например, заполнение емкости жидким криопродук-
том, пусковые режимы). В этом случае энтропия изменяется, и
это должно учитываться. Наконец, криогенная система или
установка может быть замкнутой, т.е. закрытой и не обмени-
ваться потоками массы с окружающей средой (например,
криогенная газовая машина — КГМ) и разомкнутой, т.е.
открытой (например, ВРУ). Тогда для общего случая члены
уравнения (2.13) можно представить так:
Z AS,. = z As',. + Z AS,.T + Aso T; As0 = As0 + AsOm,
i i i
где У As',. — производство энтропии вследствие необратимости
реальных процессов в элементах криогенной установки (для
обратим ых процессов Z As',. = 0); Z As, — изменение энтропии
вследствие нестационарности (для стационарных и установив-
шихся состояний Z As, = 0 при Ат = 0); As0T — изменение
энтропии охлаждаемого тела; As0 — изменение энтропии
окружающей среды вследствие теплообмена с криогенной уста-
новкой или обмена энергией; AsOm — изменение энтропии
окружающей среды в результате массообмена.
Для сложной адиабатной системы, подобной схематически
изображенной на рис. 2.5, включающей окружающую среду,
охлаждаемые объекты и любую низкотемпературную установку
с любым числом подсистем, должен выполняться энтропийный
баланс. Если предположить, что в низкотемпературной установке
все рабочие процессы обратимы (т.е. равновесны) или, иными
словами, установка — термодинамически абсолютно совершен-
ная, то для достижения желаемого результата, ради которого
функционирует низкотемпературная установка, требуется совер-
шить минимальную работу 1^. Уравнение энтропийного баланса
в этом случае имеет вид
А5о.т + АЧ + Чт = °- <2-14)
26
Рис. 2.5. Схема замкнутой адиабатной системы тел, включающей криогенную систему
с подсистемами, окружающую среду и охлаждаемое тело [к уравнениям (2.13), (2.14),
(2.21), (2.23)]
Уравнение (2.14) показывает также, что при таких условиях
производство энтропии в системе отсутствует и происходит
только равновесное перераспределение энтропии между подсис-
темами, на которое и затрачивается энергия, равная /min. В
реальных низкотемпературных установках реализуются необрати-
мые (неравновесные) процессы, в результате которых осуществ-
ляется непрерывное производство энтропии, требующее непре-
рывного совершения дополнительной (сверх L^) работы Д£.
Поскольку сама установка находится в установившемся состоя-
нии, дополнительно подводимая внешняя энергия, равная работе
&L (как и ), неизбежно передается в окружающую среду и
рассеивается в ней. Уравнение энтропийного баланса в этом
случае определяет производство энтропии в системе:
Ч.Т + ЛЧ + Алот = £ АЛ- (2.15)
Принцип возрастания энтропии и уравнения энтропийного
баланса имеют исключительно важное практическое значение.
Прежде всего они дают возможность получить общие выражения
Для определения минимально необходимой работы (или электро-
27
энергии) при осуществлении ряда важных процессов и решении
актуальных задач техники низких температур с помощью термо
динамически абсолютно совершенных (закрытых или открытых,
аналогов машин и низкотемпературных установок. Такими про
цессами и задачами являются: сжатие газов и паров, охлаждение,
ожижение и отвердевание газов, криостатирование, конденсация
в жидкое и твердое (вымораживание) состояния, разделение и
очистка газовых смесей и др. Так, для низкотемпературных уста-
новок, предназначенных для охлаждения или криостатирования,
работающих в установившихся режимах и представляющих собой
термодинамически закрытую систему (ДхОт= 0), если As0T~ s2 -v
— изменение энтропии охлаждаемого или термостатируемого
тела от состояния 1 до состояния 2 и Дх0 = (Q + Tmin)/7^) —
изменение энтропии окружающей среды (Q — количество теп-
лоты, отводимой от охлаждаемого или термостатируемого тела;
/.1ШП — минимальная работа, совершаемая в цикле; Tf) — темпе-
ратура окружающей среды), то в соответствии с выражением
(2.14) получим
откуда
х2 - ,?1 + (Q + L^/T, = 0,
^min “ % '
(2.16)
Выражение (2.16) является общим для закрытых систем. Если
процесс охлаждения осуществляется при р = const, то Q = Д - Л.
если тело охлаждается при V = const, то Q = Ц - Ц; наконец,
при термостатировании = Q/Tx и £niin = Q(T0 - Тх)/Тх, где
Тх — температура термостатируемого тела. Подробнее — см
§ 5.1.
Для открытой криогенной системы с одним транзитным пото-
ком без учета изменения ее положения уравнение энергети-
ческого баланса можно записать так |см. уравнение (2.6)];
;вх ” 4ых'
т п
Если все процессы обратимы и криогенная система остается
в стационарном состоянии, уравнение (2.14) при As0T = 0 прини
мает вид
5вых - + [ 4nin + Ц,х - 'выхЭМ = °-
откуда минимальная работа, совершаемая для достижения необ
ходимого результата в открытой системе:
4nin ^(/5вх ~ 'вых-* * <'вх ” ^вых)’ 1 - '
28
Выражение (2.17) является общим для открытых систем и
определяет, в частности, работу изотермического сжатия газа,
минимальную работу ожижения, отвердевания, вымораживания,
разделения смеси. С помощью уравнения (2.17) легко найти,
например, минимальную работу разделения газовой смеси:
U = - X <2-'8)
где П — доля у-го выходящего потока от потока на входе
(X п, =1>-
Обычно давление продуктов разделения принимают равным
начальному давлению смеси. В этом случае согласно уравнению
(2.18), где 5ВХ = У ^jSBxj ’ минимальная работа разделения равна
сумме работ изотермического сжатия компонентов от их парци-
ального давления в смеси до парциального давления в продуктах
разделения. Например, для 1 кг воздуха, рассматриваемого как
бинарная идеальная смесь, в соответствии с уравнением (2.18)
найдем
-уТ % [(5о2 Тр=ро'
здесь К — доля кислорода как продукта, получаемого из 1 кг пере-
рабатываемого воздуха, кг/кг; индексы пив означают, что значе-
ния энтропии азота и кислорода определены соответственно в
продукте и воздухе при их парциальных давлениях в потоках.
Уравнение (2.18) справедливо как для идеальных, так и для
реальных смесей. Для идеальной смеси второе слагаемое
(разность энтальпий) равно нулю. Поскольку для многих
реальных смесей определены количества теплоты смешения qcM,
то минимальную работу разделения целесообразно также
выразить через qcM. Это можно сделать, если условно разложить
процесс разделения реальной смеси, осуществляемый на
температурном уровне Т и сопровождающийся выделением
теплоты смешения +<7СМ, на процесс разделения идеальной смеси
и процесс отвода выделяющейся теплоты смешения в окружаю-
щую среду. Тогда просуммировав минимальные работы, необхо-
димые для осуществления этих элементарных процессов, найдем
'™= ’«(а, -X «А™,) + ^(т«/т- й
если теплота при разделении поглощается (-<7СМ), то соответст-
венно изменяется знак второго слагаемого.
29
Определение минимально необходимой энергии для реализа-
ции какой-либо реальной технической или технологической
задачи имеет важное практическое значение. Зная значение
можно объективно сравнивать реальные криогенные системы по
степени их термодинамического совершенства. В общей форме
степень термодинамического совершенства любой криогенной
установки или системы определяют как отношение
Д = и;,и n, = (2.19)
где L — действительная работа; N — действительная мощность.
Иногда величину условно называют термодинамическим
КПД. В частности, при получении низких и сверхнизких темпе-
ратур отношение L/Q= <р (ватт мощности/ватт холодопроизво-
дительности) называют коэффициентом удельных затрат мощ-
ности (величина обратна холодильному коэффициенту е). Для
термодинамически совершенного криогенератора, вырабатываю-
щего холод при постоянной температуре Гх , коэффициент
удельных затрат мощности <pmin = <рс = L^JQ = (Го - Гх)/Гх не
зависит от свойств рабочего тела цикла и определяется только
температурами Го и Гх. Здесь <рс — коэффициент удельных затрат
мощности в цикле Карно. Степень термодинамического совер-
шенства (термодинамический
КПД) реального криогенера-
тора определяется отноше-
нием
Д = <Pmin/<P- (2’2°)
На рис. 2.6 приведена за-
висимость <pmin(T) и для срав-
нения показан диапазон сред-
нестатистических действи-
тельных значении <р и т| г
Рис. 2.6. Зависимость относительных
минимальных и действительных затрат
мощности от температуры при получе-
нии холода:
7 — минимально необходимые затра-
ть1 (<Pmin=<Pc); ~ область средних
действительных затрат (статистические
данные); 3 — ориентировочные значе-
ния степени термодинамического
совершенства реальных установок
Для реальных процессов производство энтропии вследствие
их необратимости при переходе из начального равновесного
состояния в конечное равновесное (неравновесен только сам
переход) является мерой необратимости этого процесса,
физическими причинами необратимости является неравенство
потенциалов (например, давлений, температур, химических
потенциалов, напряженностей магнитных полей) при осущест-
влении реальных процессов, а также различные виды трения.
Из уравнения энтропийного баланса (2.15) для реальной крио-
генной установки, рассматриваемой как закрытая система
(А50т = 0), следует:
- Е АУ,- + S2 - + (L + Q)/Tq = 0.
/
Сравнив это выражение с уравнением (2.16), получим
L~L^+ (2.21)
/
Для криогенной установки, рассматриваемой как открытая
система с одним транзитным потоком (Дзот = 0), уравнение (2.15)
имеет вид
- Z A.V',. + 5ВЫХ - 5ВХ + [L + (ZBX - /вых)] /го = 0,
откуда с учетом уравнения (2.17) легко получить формулу (2.21).
Таким образом, приходим к уравнению Гюи—Стодола:
ДА = То Е АУ,-, (2.22)
/
которое определяет работу, совершаемую для компенсации
производства энтропии. Величину ДА часто называют “потерями”
энергии, что не вполне точно, так как энергия при этом не
теряется, а затрачивается на поддержание необратимых процес-
сов в установке и передается в конечном итоге в форме теплоты
в окружающую среду. Другими словами, произведение Го У ДУ.
и определяет дополнительную (сверх А^Д электрическую (или
механическую) работу ДА для поддержания криогенной системы
В’установившемся состоянии при осуществлении в ней необрати-
мых процессов. Таким образом,
L = L. + ДА. (2.23)
Известно, что реальные низкотемпературные установки могут
функционировать не только при компенсации Amin и производ-
31
ства энтропии внешней работой или электроэнергией, но и за
счет подвода внешней энергии в форме теплоты. Заметим, что
коэффициент преобразования теплоты в работу не равен единице
как для электроэнергии, и поэтому в подобных случаях целесооб-
разно использовать понятие эксергии теплоты.
Например, криогенератор типа машины Вюлемье — Такониса
работает за счет подвода теплоты от источника высокого потен-
циала (температура источника выше температуры окружающей
среды Го). В этом случае работе L соответствует эксергия Е под-
водимой теплоты, — минимально необходимая эксергия £mjn
подводимой теплоты; Д£ — потери эксергии Д£ подводимой
теплоты:
E^Emin + \E. (2.24)
Минимальную эксергию £min находят по тем же уравнениям,
что и Е^п, для частных задач криогеники Е^ = L^. Потери
эксергии Д£ также определяют по уравнению (2.22), но численно
значения Д£ и Д£ могут быть не равны (при £min = £min)
вследствие качественных и количественных различий, присущих
самим процессам. Следует напомнить, что эксергия теплоты
равна работе обратимого цикла, т.е. определяет количество теп-
лоты, которая потенциально может быть превращена в работу
и вычислена по формуле Карно. В более широком смысле поня-
тие эксергии определяет энергию, теоретически пригодную для
технического использования. Наряду с эксергией теплоты приме-
няют такие понятия, как эксергия потока, химическая эксергия
топлива и др. Например, эксергия потока Е = I - T^s.
Важно отметить, что в отличие от энтропии эксергия не яв-
ляется функцией состояния рабочего тела, ее можно рассматри-
вать лишь как функцию состояния системы, состоящей из
рабочего тела и окружающей среды.
Принцип возрастания энтропии определяет направление
какого-либо процесса или химической реакции в адиабатной
макросистеме. Он отражает возможность или невозможность
протекания процесса и определяет условия, необходимые для их
осуществления. Принцип возрастания энтропии не является
абсолютным, его применимость ограниченна. Например, для
микросистем (по размерам сопоставимых с молекулами), для
систем в возбужденных состояниях, а также для систем неогра-
ниченных размеров этот принцип неприменим.
32
„ 2.6. ПРИНЦИП АДДИТИВНОСТИ ЭНЕРГЕТИЧЕСКИХ ПОТЕРЬ.
Термодинамический анализ распределения затрат
ЭНЕРГИИ В КРИОГЕННЫХ СИСТЕМАХ
Рабочие процессы в машинах и аппаратах криогенных систем
протекают в сложных физических условиях. Для многих
процессов характерно одновременное существование нескольких
необратимых взаимодействий, например, массо- и теплообмена,
трения и неравновесного расширения или сжатия, смешения и
др. В результате этих необратимых процессов изменяются
параметры рабочего тела и в первую очередь температура и
энтропия. Изменения этих параметров могут существенно
отличаться по абсолютному значению от их изменений в соответ-
ствующих идеальных (обратимых) процессах. По результатам
численного сравнения изменений указанных параметров в
обратимых и необратимых процессах можно судить о мере
необратимости и энергетических потерях (доли энергии,
затраченной на компенсацию необратимости и потерянной для
полезного использования) в любом узле установки.
При анализе рабочих процессов в установках используют
принцип аддитивности потерь, являющийся следствием аддитив-
ности энтропии и применяемый в нескольких вариантах. Напри-
мер, в § 2.5 этот принцип использован для многоэлементной
криогенной системы, в которой выделены подсистемы — узлы
или элементы (теплообменники, ректификационные колонны,
детандеры и др.); при этом обусловлено, что для каждого узла
определено производство энтропии \s't при осуществлении
реального рабочего процесса. Общее производство энтропии в
криогенной системе найдено как сумма производства энтропий
в ее подсистемах:
Es' = Дя’. + Es'-, + As', + ...
К.V 1 2 A
Производство энтропии в необратимых процессах обусловли-
вает соответствующие им энергетические потери, поэтому общие
потери" энергии в криогенной системе определены как сумма
энергетических потерь вследствие необратимости реальных
рабочих процессов в отдельных элементах системы [см. уравне-
ние (2.22)]. Парциальные энергетические потери (или вклад
каждого элемента в сумму потерь) должны быть известны для
направленного улучшения характеристик криогенных установок.
В другом варианте использования принципа аддитивности
сложный рабочий процесс в рассматриваемом элементе расчле-
3 Заказ № 1592 3 3
няют на ряд элементарных (А, Б, В,...) и общее изменение
энтропии в этом процессе определяют как сумму изменений
энтропий в элементарных процессах:
А5 = Д5д + А5б + Д5В + ...
Иногда подобный метод применяют для определения прира-
щения температуры в каком-либо сложном процессе:
А7? = Л 7. + А 73- + A Tn + ...
Add
Анализ распределения затрат энергии и энергетических потерь
по отдельным элементам низкотемпературных установок осу-
ществляют следующим образом. Прежде всего необходимо, чтобы
схема установки и ее параметры были полностью детерминиро-
ваны по отдельным узлам и определены все внешние энергети-
ческие и массовые потоки.
В установках, в которых рабочее тело функционирует в
газообразном (парообразном) и жидком состояниях, рефрижера-
торные и технологические циклы реализуются с помощью машин
сжатия и расширения (компрессоров, вакуумных насосов,
жидкостных насосов и детандеров). В одной установке может
быть несколько машин сжатия и расширения, поэтому работу
(затраты электроэнергии) для таких установок можно представить
в общем виде алгебраической суммой:
L = Е£к + Е£н - Е£д + ... (2.25)
При определении энергетических потерь в этих машинах
следует учитывать, что их энергетическая эффективность тради-
ционно оценивается с помощью различных КПД. Для компрес-
сорных машин и вакуумных насосов это так называемый изотер-
мический КПД Пиз:
LK = L /п (2.26)
для детандеров — изоэнтропный (или адиабатный) КПД ф
(см. § 4.5):
Л, = '',ч; <2.27)
для жидкостных насосов — КПД насоса т]н:
А, = А/,„ , (2.28)
где h — изменение энтальпии в изоэнтронпом процессе расши-
рения.
Таким образом, энергетические потери в этих машинах одно-
значно определяются значениями Г)из, ф и т]и (которые обычно
34
задают на основе среднестатистических экспериментальных
данных) согласно зависимостям:
А/к = То Алк = К(1ИЗ /пиз - /из) = АГ/ИЗ(1/Т1ИЗ - 1);
А/д = То Л5Д =Ж- = ДЛО - П,); (2-29)
А/н = То А5н — //(/нт/ Пн - /н.т) ~ ^нт^/Пн 1),
где I _ теоретическая работа насоса; К, Д и Н — потоки
(расходы) рабочего тела, перерабатываемые в этих машинах,
обычно отнесенные к общему потоку рабочего тела через уста-
новку; часто для основного компрессора принимают Косн = 1, а
остальные потоки и энергетические потери для всех без исключе-
ния элементов установки вычисляют по отношению к 1 кг
(1 молю или 1 м3 при нормальных условиях) сжимаемого
рабочего тела в основном компрессоре.
Следует отчетливо понимать, что требующаяся для компен-
сации производства энтропии в элементах установки работа
(электроэнергия) совершается (затрачивается) именно в компрес-
сорах и нагнетателях (в очень малых количествах и в жидкостных
насосах) и практически приводит к увеличению либо необходи-
мой степени сжатия (при заданной производительности), либо
необходимого расхода сжимаемого газа (при заданной степени
сжатия).
Поскольку одна и та же установка может реализовывать
различные практические задачи (ожижение газов, разделение,
криостатирование и др.), то уравнения (2.21) и (2.23) следует
записать в общем виде:
21^+X Ьц ^min+ X А£к+ X АЛцЗ- ZA£jj+ Т() X А^-К-ИД
или
~ 2 Z'rnin + 2 ALK + X ALH + X А£д + Ха7; кцд , (2.30)
We X — производство энтропии в результате неравновес-
ных процессов во всех элементах установки исключением
компрессоров, насосов и детандеров; А£;_кнд — парциальные
затраты энергии на компенсацию необратимости процесса, т.е.
энергетические потери в соответствующих элементах установки:
К.Н.Д ~ А 5/-к.н.д •
В качестве этих элементов наиболее часто фигурируют различ-
ные теплообменники, конденсаторы, испарители, вентили, сме-
сители, дроссельные устройства, эжекторы, ректификационные
колонны, адсорберы, абсорберы и другие аппараты, в которых
потоки рабочего тела обмениваются теплотой, энергией, вещест-
вом или дросселируются. В общем виде производство энтропии
в таких аппаратах можно вычислить как алгебраическую сумму
изменений энтропии потоков в этих аппаратах:
а?; = (2Ц )иеобр, (2.31)
где bj — j-м поток рабочего тела в аппарате, отнесенный к
общему потоку; \Sj — изменение энтропии j-ro потока,
определяемое как разность конечных и начальных их значений:
^SJ = Ц)к - (5у)н
В идеальных аналогах всех этих аппаратов рабочие процессы
предположительно обратимы, т.е. сумма изменений энтропий
потоков в них равна нулю:
( X )обр = 0 . (2.32)
Обратимыми при бесконечно малой разности потенциалов и
отсутствии трения можно считать все процессы в адиабатных
системах. При отсутствии тепловой изоляции единственно
возможным обратимым процессом является изотермический. Это
замечание имеет непосредственное отношение к формированию
представления об идеальных аналогах низкотемпературных аппа-
ратов. Почти все аппараты низкотемпературных установок имеют
внешнюю тепловую изоляцию, т.е. работают в квазиадиабатных
условиях. Однако не для всех из них идеальные аналоги являются
адиабатными. Например, процессы в идеальных аналогах тепло-
обменников, эжекторов, смесителей потоков одинаковых веществ
являются адиабатными, а идеальные модели разделительных
аппаратов для ректификационных колонн, адсорберов, абсорбе-
ров требуют подвода и отвода теплоты на всех температурных
уровнях в самом процессе и поэтому не могут быть представлены
как адиабатные. Иными словами, следует иметь в виду, что
реальные схемы низкотемпературных установок могут включать
узлы и аппараты, для которых в адиабатных условиях невоз-
можно представить идеального аналога и процессы в которых
заведомо необратимы.
Минимально необходимую работу (затраты электроэнергии)
для реализации необходимых технологических задач (ЕА^)
определяют для термодинамически абсолютно совершенного
прототипа установки, весьма часто не имеющего прямой
аналогии с анализируемой схемой реальной установки (см. § 2.5
и § 5.1). Значение £/mjn находят приведением к единице
массы основного потока.
Уравнение (2.30) можно записать в приведенной форме с
учетом выражений (2.29) — (2.31):
£ ^из/Пиз + ЧЛ “
= X 4nin + 21 + X А/К + X А(д + X А/н+ X М-К.Н.Д- (2-33)
Все члены уравнения (2.33) определены в долях основного
потока через установку, т.е. принято А"осн = 1.
Пренебрегая затратами энергии в жидкостных насосах (как
исключительно малыми в сравнении с ее затратами в компрес-
сорах), из выражения (2.33) получим
| А^К + - К..Н.Д
X «„/л„
или в относительных величинах:
1 — Z /min + X + 21 А/к + X А/д + X Д/;.. к н д. (2.34)
Здесь все относительные (безразмерные) величины опреде-
лены по отношению к действительной работе, совершаемой в
компрессорах установки. Для низкотемпературных установок
величина 21 ДЬЛ , т.е. работа газа, совершаемая в детандерах,
эквивалентна создаваемой ими холодопроизводительности. В
общем случае два первых слагаемых в уравнении (2.34) выражают
ту часть работы (электроэнергии), которая совершается (затрачи-
вается) для достижения необходимых технологических результа-
тов. Остальные слагаемые выражают отношения работы (затрат
электроэнергии) для компенсации производства энтропии в ма-
шинах и аппаратах установки, т.е. являются составляющими
энергетических потерь. Независимо от числа различных компрес-
соров в установке при одинаковых значениях т]из относительные
энергетические потери в них определяют как
I - V • (2-35)
36
37
Относительные энергетические потери в детандерах и /-М узле
установки соответственно:
£ А/д
2 «'„Л,
То X As f
Ы. = --------------•
/из/Пиз
(2.36)
Иногда при расчете бывает достаточно анализа распределения
затрат энергии по элементам схемы криогенной установки в
долях от работы изотермического сжатия в ее компрессорах.
Действительно, величину т]из (как и т,. ) легко исключить из урав-
нений (2.33) и (2.34). В результате эти уравнения принимают вид
Е % /Из = £ /ши + + X А/д + X А/; _ К Н Д ,
или в безразмерной форме:
1 = /min + + £ А/д + £ А/; к н д
Н/И
Однако упрощенный вариант анализа не позволяет оценить
относительные энергетические потери в компрессорах установки,
и остальные потери оказываются отнесенными не к действи-
тельной работе, а к ее теоретическому значению.
Выражения (2.34) — (2.37) позволяют строить наглядные диа-
граммы распределения затрат энергии и энергетических потерь
по отдельным узлам и элементам криогенной установки. На
рис. 2.7 в качестве примера показана подобная диаграмма для
ВРУ. Следует учитывать, что потери в узлах установки взаимо-
связаны, так как при их изменении меняются параметры рабочих
процессов.
Полезно еще раз обратить внимание на то, что As^ (как и
значения эксергии) можно вычислить, если известны параметры
рабочего тела и потенциалы реальных взаимодействий, в част-
ности, температуры (разности температур), давления (разности
давлений), неравновесные разности концентраций. При расчете
криогенных систем этими величинами обычно задаются исходя
из практического опыта (как и значениями КПД, характеризую-
щими эффективность различных машин, коэффициентами
трения, удельными теплопритоками и др.). В некоторых случаях
указанные параметры можно определить теоретически. ЭВМ
позволяют выполнять сложные поисковые многовариантные
расчеты, в результате которых определяются оптимальные соче-
тания параметров криогенной установки. Критерием термо-
38
Рис.2.7. Схема распределения затрат
энергии от энергетических потерь в воз-
духоразделительиой установке низкого
давления (изотермический КПД ком-
прессора •qlo= 0,65, степень чистоты
кислорода 95 %, азота 99 %):
1 - 12 — энергетические потери (1 —
в компрессоре 35 %; 2 — от необрати-
мости теплообмена в регенераторах 5,7 %;
3 — от гидросопротивлений в узле
охлаждения 12,3 %; 4 — от смешения
перед турбодетандером и утечек 4,8 %;
5 — суммарные потери в узле охлаж-
дения 21,8 %; 6 — от необратимости
массообмена в нижней колонне 3,9 %;
7 — от необратимости массообмена в
верхней колонне 8,4 %; 8 — от гидро-
сопротивления колонн 3,2 %; 9 — от
необратимости теплообмена в конден-
саторах 3,8 %; 10 — суммарные в узле
ректификации 19,3 %; 11 — от тепло-
притоков 3 %; 12 — в турбодетандере
0,7 %); 13 — холодопроизводитель-
ность — энергия, возвращаемая турбо-
детандерами 2,8 %; 14 — минимально
необходимая энергия для осуществ-
ления технологического процесса раз-
деления воздуха 16,4 %
динамической оптимальности схемы на стадии расчета является
минимум энергетических потерь.
Сопоставление затрат энергии по элементам установки
Позволяет определить, какие узлы установки требуют совершен-
ствования. Например, из схемы на рис. 2.7 следует, что компрес-
сор, узлы охлаждения и ректификации заключают в себе большие
резервы для снижения затрат энергии и повышения общей
эффективности. Однако одна лишь картина распределения
энергетических потерь не может полностью показать решающее
Значение для установки параметров отдельных ее машин и
аппаратов. Например, малые потери в детандере [по сравнению
с Потерями в компрессорах (см. рис. 2.7)] могут создавать ложное
представление о несущественном значении . В связи с этим
Для процессов генерации холода всякий раз необходимо оцени-
вать коэффициент удельных затрат мощности (р или обратную
ему величину — холодильный коэффициент е, при которых
становится очевидной роль r)f :
ф = _1________Вт затраченной мощности___________ @
е Вт полученной холодопроизводительности
39
Обычно мощность относят к полезной холодопроизводитель-
ности. Если холод вырабатывается для осуществления технологи-
ческих процессов, необходимо определять удельные затраты
энергии на получение продуктов с заданными параметрами:
[дго] _ кВт • ч затраченной электроэнергии (2 39)
э кг (или м3, или кмоль) продукта
Кроме того, целесообразно оценивать изменение характерис-
тик технологических процессов в зависимости от параметров
машин и аппаратов. Например, для ВРУ роль коэффициента Г|(
особенно велика, так как он влияет на величину детандерного
потока, вводимого в верхнюю колонну, и в конечном итоге на
коэффициент извлечения компонентов из воздуха (подробнее см.
том 2).
Сильное влияние адиабатического КПД детандера т| 5 , как и
изотермического КПД компрессора т| из, на величину <р можно
показать на примере простейшего замкнутого низкотемператур-
ного цикла с идеальным рабочим телом (см. рис. 6.19). Для
такого цикла относительное изменение коэффициента удельных
затрат мощности ср при изменении значений г] и постоянных
значениях Т| из и прочих параметров определяют по формуле
= Тл_)1Оо%,
<Р] <Р] V Пй ’
изменение 5ср/срг в зависимости от эффективности компрессора
г] из при постоянных значениях Г| г и других параметов находят
так:
<Р1 ' <Р2 _ 5(Р = Л _
<Р1 Ф1 V ' П„з2
т.е. в рассмотренном случае КПД детандера и компрессора в
одинаковой степени влияют на эффективность цикла.
Подобные примеры можно привести и для теплообменной
аппаратуры, роль которой в низкотемпературных установках
огромна. Таким образом, значение каждого аппарата или
машины в криогенной системе сугубо индивидуально, и анализ
затрат энергии в установке, дающий отчетливое представление
о распределении этих затрат и энергетических потерях в агрегатах
установки, не может претендовать ни на что большее, кроме
этого в оценке их роли и эффективности.
) 100 %,
40
к 2 7. ПРИНЦИП ОДНОРОДНОСТИ РАЗМЕРНОСТЕЙ ФУРЬЕ.
СВЯЗЬ МЕЖДУ РАЗМЕРНОЙ И БЕЗРАЗМЕРНОЙ ФОРМАМИ
УРАВНЕНИЙ ПРИ ОПИСАНИИ РАБОЧИХ ПРОЦЕССОВ.
ПОДОБИЕ
Любой из рабочих процессов в аппаратах, машинах, сосудах,
трубопроводах криогенных установок (как в целом, так и
расчлененный в соответствии с принципом аддитивности на ряд
более простых) можно описывать системой основных уравнений
и соответствующих граничных условий. В зависимости от
степени приближения число взаимосвязанных величин и число
уравнений в системе, описывающей этот процесс, могут быть
разными. При этом для любого правильно составленного уравне-
ния должен быть выполнен принцип однородности размерностей
— принцип Фурье, согласно которому все члены одного уравне-
ния имеют одинаковую размерность, а следовательно, любое
уравнение можно привести к безразмерной форме, например,
путем его почленного деления на одно из слагаемых либо путем
использования соответствующей методологии. Принцип Фурье
справедлив для любых уравнений (алгебраических, дифферен-
циальных, интегральных), в том числе уравнений, включающих
сложные функции в виде безразмерных коэффициентов. Этот
принцип подтверждает независимость вида уравнений от единиц
входящих в него физических величин. При переходе от одной
системы единиц к другой в уравнениях могут появиться размер-
ные постоянные.
Сущность методологии преобразования уравнений в безраз-
мерную форму на основе л-теоремы сводится к следующему.
Входящие в основные уравнения рабочих процессов величины
можно отнести к одной из трех следующих категорий.
1. Первичные величины (П) — физические величины, единицы
которых не зависят от единиц других величин. Например, для
процессов в криогенных установках термомеханического типа
первичными величинами являются масса /д, длина /, время т,
температура Т. При этом конкретная задача может включать
любое число этих первичных величин от 1 до 4. Размерность Z
любой первичной величины П определяется се единицей в
первой степени: Zm = m; ZT = Т и т.д.
2. Вторичные (или производные) величины (В) — физические
величины, которые определяются по соответствующим зависи-
мостям, связывающим их с первичными. Для термомеханических
41
систем размерность любой вторичной величины можно опреде-
лить по соотношению Бриджмена
Z„ = та 1ьхс Td ,
D
где т, I, т и Т — размерности массы, длины, времени и
температуры в соответствующих степенях a, b, с, d.
Для описания процессов в криогенных установках применяют
большое число различных вторичных величин: объем, давление,
плотность, площадь, скорость, энтальпию, теплоемкость, энтро-
пию, тепловые потоки, потоки массы и энергии (в том числе
различные коэффициенты — теплопередачи, теплопроводности,
диффузии) и многие другие величины.
Полезно отметить, что понятия первичная и вторичная величина относительны.
Дело в том, что существует определенная зависимость размерностей величин от
способов их измерения. Для некоторых задач вместо длины в качестве первичной
величины можно принять скорость, а длину определить как вторичную величину
через время и скорость. Такого рода задачи в этой книге не рассмотрены.
3. Безразмерные величины — величины или комплексы
величин, размерности которых сократились, т.е. в уравнении
Бриджмена а = 0; b = 0; с = 0; d = 0. Можно говорить, что
единицей безразмерной величины является 1.
Кроме того, как уже указывалось, в основных уравнениях
могут фигурировать размерные постоянные, такие, как газовая
постоянная, коэффициенты уравнений состояния и т.п. Опера-
ции над ними нс вызывают каких-либо осложнений. Эти размер-
ные постоянные обычно являются вторичными величинами и
должны быть отнесены к их числу.
Если в уравнении для рассматриваемого процесса известны
все существенные для него первичные величины (их число равно
лп) и все существенные вторичные величины (их число ив), то
при приведении этого уравнения к безразмерной форме число
тс существенных безразмерных комплексов в нем равно общем\
числу пп + «в существенных для процесса величин за вычетом
числа г величин, которые не могут быть объединены в какой-
либо безразмерный комплекс:
п = пп + па - г. (2.40)
lit» х
Обычно г равно минимальному числу к размерностей величин,
необходимых для составления исходного уравнения, и весьма част»
г= к = лп; при этом п — tiR. В общем случае следует принимать
г < к. Уравнение (2.40) выражает известную л-теорему, которая
является результатом работ Фурье, Бертрана, Рэлея, Федермана.
42
Бэкингема, Рябушинского, Афанасьевой-Эренфест, и устанавли-
вает связь между величинами, входящими в уравнения в размер-
ной и безразмерной форме.
Безразмерную форму уравнений не следует переоценивать,
поскольку “никакая обработка информации не может увеличить
ее объема” (Н.Винер). Более того, решение систем дифферен-
циальных уранений процессов с граничными условиями дает
более широкие возможности для анализа этих процессов и
несомненно представляется более информативным. В частности,
такие решения обычно служат надежной основой для формиро-
вания безразмерных комплексов, характерных для изучаемых
процессов. Тем не менее безразмерную форму уравнений широко
применяют на практике для решения ряда задач тепло- и массо-
переноса, реализуемых в криогенных системах, благодаря
следующим преимуществам.
Прежде всего, безразмерная форма более лаконична. Немало-
важно, что при переходе к уравнениям в безразмерной форме
число членов в уравнениях сокращается, т.е. сокращается число
независимых величин, что приводит к упрощению вычислений,
например при табулировании функций. Безразмерная форма
удобна для обобщения и накопления результатов, в том числе
и экспериментальной информации. Безразмерная форма
использована при создании рабочего аппарата теории подобия;
при этом безразмерные комплексы приобретают смысл критериев
подобия: их равенство является необходимым и достаточным
условием подобия сопоставляемых процессов. Это имеет
принципиальное значение, так как открывает возможности для
моделирования, т.е. определения параметров объектов, на
которых непосредственно эксперимент не проводился. Наконец,
безразмерная форма позволяет сопоставлять разнородные
процессы, описываемые различными уравнениями в размерной
форме.
Следует также отметить,что понимание особенностей метода
использования безразмерных комплексов дает большие преиму-
щества при анализе решений систем основных уравнений для
рассматриваемых процессов и при обработке эксперименталь-
ных данных, л-теорсма не дает способов отыскания определяю-
щих величин для данной задачи и правил образования характер-
ных безразмерных комплексов, не позволяет определить, какой
из них наиболее существен, а какими можно пренебречь. В этом
отношении теория подобия имеет некоторые преимущества. В
методологии применения л-теоремы предусмотрено лишь самое
43
общее положение: в системе безразмерных комплексов должны
фигурировать, по крайней мере, один раз, все величины, сущест-
венные для процесса (как независимые, так и зависимые). При
этом размерности, из которых образованы размерности всех
величин, должны быть независимыми. Если уравнение в безраз-
мерной форме включает все величины, существенные для про-
цесса, и содержит требуемое л-теоремой число безразмерных
комплексов, то преобразование выполнено правильно. Поскольку
в принципе число возможных вариантов безразмерных комплек-
сов может быть очень большим, то всякий раз возникает
проблема выбора, которая в отношении некоторых комплексов
может решаться субъективно (по интуиции, по договоренности,
по традиции и т.п.).
Необходимость понимания этих обстоятельств важна, хотя
история науки подтверждает, что в подавляющем большинстве
случаев безразмерные комплексы были введены в результате
анализа решения задач в классической форме. Именно в резуль-
тате решения систем основных дифференциальных уравнений
в частных производных с соответствующими граничными усло-
виями для различных задач газодинамики, теории пограничного
слоя, для всевозможных случаев тепло- и массопереноса были
постепенно сформированы (и продолжают формироваться) без-
размерные комплексы — числа. Их обычно называли по фами-
лиям известных ученых, работавших над соответствующими
научными проблемами. Приведем некоторые из чисел, имеющих
наиболее существенное значение для решения ряда характерных
задач при описании сложных рабочих процессов и широко
используемых при расчетах и моделировании машин и аппаратов
криогенных установок, а также при обработке и систематизации
результатов экспериментальных исследований. Физический
смысл этих чисел указан для классических задач, в других задачах
он может быть иным. В этом проявляется их своеобразная
условность как мер соотношения сил (потенциалов), энергий или
свойств-.
1. Теплопередача через стенку — характерная составляющая
рабочих процессов (в аппаратах, машинах, сосудах, трубопрово-
дах) характеризуется числом Био
Bi = a//X, (2.41)
где а — коэффициент теплоотдачи, Вт/(м2, К); / — характерный
размер, например толщина стенки, м; X — теплопроводность
материала стенки, Вт/(м • К).
44
Число Био — своеобразная мера отношения температурного
перепада в стенке к температурному напору между стенкой и
средой.
2. Изменение поля температур в твердых телах в процессах
охлаждения и нагревания узлов и конструкций характеризуется
числом Фурье
Fo = атт0/ I1 ,
(2.42)
где ат — температуропроводность тела, м2/с; т0 — заданное
время, с; / — характерный размер, заданный по условию,
например координата х, м.
Число Фурье выражает соотношение между временем т0,
характеризующим скорость изменения температуры в окружаю-
щей тело среде, и временем характеризующим скорость
перестройки температурного поля в теле.
3. Вынужденное течение сплошной среды в процессах,
происходящих в теплообменных аппаратах, трубопроводах,
каналах, характеризуется числами Маха М, Рейнольдса Re и
Эйлера Ей.
Число Маха, равное отношению скоростей потока с и звука
а, м/с:
(2.43)
М = с / а ,
разграничивает две области течения с принципиально противо-
положными свойствами. При М < 1 адиабатное течение по
сужающемуся каналу является ускоренным, а по расширяюще-
муся — замедленным; при М > 1 — наоборот. В случае неадиа-
батного течения нагревание потока при М < 1 его ускоряет, при
М > 1 — замедляет.
Число Рейнольдса
Re = c//v, (2.44)
где с — скорость потока, м/с; / — характерный размер, например
эквивалентный диаметр, м; v — кинематическая вязкость, м2/с,
выражает соотношение между силами инерции и внутреннего
трения в потоке (являясь своеобразной мерой этого соотноше-
ния) и характеризует перенос количества движения. Для многих
задач существует критическое значение числа Re, разграничиваю-
щее области ламинарного и турбулентного режимов течения.
Например, для течения в прямых круглых трубах это значение
близко к 2300.
45
Число Эйлера
Ей = Ар / (р с2), (2.45)
где Др — потери давления в потоке (гидросопротивление), Па.
р — плотность, кг/м3; с — скорость, м/с, является мерой отноше-
ния перепада статических давлений в потоке к его динамичес-
кому напору.
4. Перенос теплоты в потоке и теплообмен со стенками при
вынужденном движении сплошной среды в процессах, происходя-
щих в теплообменниках и трубопроводах, характеризуется числа-
ми Пекле Ре, Прандтля Рг, Нуссельта Nu, Стэнтона St.
Число Пекле
Ре = cl/aa , (2.46)
где с — скорость, м/с; / — характерный размер, м; ап — темпера-
туропроводность текущего вещества, м2/с, характеризует перенос
количества теплоты и является условной мерой соотношения
переноса теплоты в потоке вследствие конвекции и теплопровод-
ности движущейся среды.
Число Прандтля
Рг = v/nn = Pe/Rc (2.47)
образовано соотношением постоянных, характеризующих движу-
щуюся среду, и поэтому является своего рода физической
константой. Для газов Рг = 1; для жидкостей Рг > 1.
Число Нуссельта
Nu = a//X, (2.48)
где a — коэффициент теплоотдачи, Вт/(м2- К), является безраз-
мерной формой коэффициента теплоотдачи. Существует (для
стабилизированного ламинарного режима течения) минималь-
ное значение числа Numin = 3,65; при этом = 3,65 X//.
Число Стэнтона
St = «/(^^)=//2, (2.49)
где a — локальный коэффициент теплоотдачи, Вт/(м2, К); ср —
локальная теплоемкость, Дж/(г- К); vm — массовый расход, г/с.
/— локальный коэффициент трения, также является безразмер-
ной формой коэффициента теплоотдачи и выражает гидродина-
мическую аналогию между теплопередачей и трением; если
известен локальный коэффициент трения, можно определить
локальный коэффициент теплоотдачи и наоборот. Число Стэн-
тона характеризует отношение двух удельных потоков теплоты
— нормального к поверхности и параллельного ей.
46
5. Диффузия и перенос массы в движущейся среде в процессах,
происходящих в массообменных аппаратах, характеризуются
числами Шмидта Sc и Льюиса Lu, а также диффузионными
числами Пекле Ре0 , Нуссельта Nu0 , Стэнтона St0 .
Число Шмидта
Sc = v/D , (2.50)
где v __ кинематическая вязкость, м2/с; D — коэффициент
диффузии, м2/с, является диффузионным числом Прандтля для
Процесса переноса массы: Sc = Рг0 .
Число Льюиса является отношением температуропроводности
и коэффициента диффузии:
Lu =an/D. (2.51)
Числа Sc и Lu подобно числу Рг являются специфическими
константами среды.
Диффузионное число Пекле
Ре0 = cl/D (2.52)
является условной мерой соотношения перераспределения
концентраций (или массы какого-либо компонента) конвектив-
ного переноса и диффузии.
Диффузионное число Нуссельта является безразмерной
формой коэффициента массообмена:
Nud=KI/D, (2.53)
где К — коэффициент массообмена, единица которого зависит
от выбранных единиц концентраций. Например, если концентра-
ция измеряется в моль/м3, а поток вещества в моль/(м2,с), то
К в м/с.
Диффузионное число Стэнтона
St0 = К/с , (2.54)
где с — скорость потока, м/с, также является безразмерной
формой коэффициента массобмена. Заметим, что для газов при
Рг = 1 теоретическим результатом является равенство всех трех
коэффициентов: v = ап = D.
Для перехода от размерной формы уравнений к безразмерной
не существует какого-либо теоретического обоснования рацио-
нального вида используемых в конечном счете уравнений. В
практике инженерных расчетов и при обработке результатов
47
экспериментов уравнения рабочих процессов в безразмерной
форме обычно имеют вид степенных зависимостей, который
следует расценивать как чисто вычислительный прием:
Nu = A Re"1 Рг” %, Х2 ;
Nufl = Ad Re”*2 Рг”2 X Х4 ;
St = В Re”1' Pr”1 X, Х2 ;
Stfl - BD Re”1’ Pr”3 X3 ;
Eu = C Re"14 X} X2 , (2.55)
где А, В, C, ... — числовые коэффициенты; X}, X2, X3, X4, ... —
дополнительные безразмерные величины, характеризующие
существенные специфические условия, в которых происходит
процесс.
Значения коэффициентов А, В, С, ... и показателей степеней
(т}, ..., т4, ..., nv ..., п3) находят в результате обработки экспери-
ментальных данных по существующим методикам, в том числе
и с помощью ЭВМ. Физический смысл подобия при использова-
нии степенных уравнений не искажается, так как для конкретной
задачи оно обусловлено только равенством характерных безраз-
мерных комплексов, а следовательно, и их значений в одинако-
вых степенях. Важно, что каждое конкретное степенное выраже-
ние имеет границы применимости, обычно заданные диапазоном
допустимых значений независимых безразмерных комплексов -
чисел Re, Рг, Хр Х2 и др.
Для математического описания подобных процессов опреде-
ленного типа может существовать и.другой вид уравнений.
Например, известное уравнение политропы (pvn = р / pn = const),
в котором при некоторых условиях показатель п можно
расценивать как критерий подобия. Действительно, показатель
п можно представить как относительную величину:
n=-dP?P .
dp/ Р
Опыт применения уравнения политропы показал, что этот вид
функциональной зависимости является практически универсаль-
ным для описания рабочих процессов в машинах, так как
усредненным (по времени) значением показателя п может быть
учтено одновременное влияние самых различных физических
48
факторов на рабочий процесс: трения, утечек, натсчск, тепло-
обмена со стенками, смешения (массообмена) и т.п. Именно
такая множественность составляющих характерна для рабочих
процессов в поршневых машинах. Можно утверждать, что
показатель п является критерием подобия только при условии,
что в сравниваемых процессах (машинах) влияние одинаковых
физических факторов на показатель п одинаково. Это условие
выполняется автоматически в простейшем случае, когда для
процесса существен только один фактор, например теплообмен,
а другие, например трение или массообмен, — несущественны.
В сложном многофакторном рабочем процессе численное
значение соответствующей доли п для каждого из факторов
определить трудно. По сути это можно сделать, только решив
частную задачу, поэтому чаще всего это условие принимают как
допущение. Вследствие этого, несмотря на явное преимущество
этого способа описания сложных рабочих процессов — простоту,
возможность его применения ограничена его специфической
условностью. В то же время при описании однофакторных
рабочих процессов или интегральных оценках для сложных
процессов, например, с целью прогнозирования использование
уравнения политропы весьма результативно.
§2.8. ТЕРМОДИНАМИЧЕСКАЯ (АБСОЛЮТНАЯ) ТЕМПЕРАТУРА.
МЕЖДУНАРОДНАЯ ПРАКТИЧЕСКАЯ ТЕМПЕРАТУРНАЯ ШКАЛА
Абсолютная термодинамическая шкала температур предло-
жена У.Кельвином в 1848 г. и носит его имя. Официально она
принята только в 1954 г. Температуру, измеренную по этой
шкале, называли абсолютной. В наше время шкалу и соот-
ветствующую температуру называют термодинамическими.
Термодинамическая шкала позволяет установить величину
градуса по одной реперной точке. Значение температуры в
реперной точке принципиально может быть принято произволь-
ным. В качестве реперной точки выбрана тройная точка воды,
Для которой в 1968 г. значение температуры было принято
равным 273,16 К (точно). Это значение выбрано исходя из
практических соображений. По существовавшей до этого
стоградусной международной шкале температура тройной точки
воды составляла +0,0099 градуса (округленно 0,01 градуса). В
связи с этим для сохранения традиционной разности (100
градусов) между температурами кипения воды (373,15 К) и
плавления льда (273,15 К) при нормальном давлении и тем
Заказ № 1592 4 9
самым исключения необходимости пересчета всех тепловых
величин необходимо было установить температуру тройной
точки, равной 273,16 К.
В резолюции № 3 XII Генеральной конференции по мерам
и весам (1967-1968 гг.) записано: “Основной температурой
является термодинамическая температура, символ Т, единица
которой кельвин, символ К. Кельвин есть 1/273,16 часть термо-
динамической температуры тройной точки воды. Температура
Цельсия, символ Z, определяется выражением
(Г- 273,15 К) °C. (2.56)
Единица, применяемая для выражения температуры Цельсия,
есть градус Цельсия, символ °C, равный кельвину. Разность
температур выражают в кельвинах, она может быть также
выражена в градусах Цельсия”.
Сохранение шкалы и градуса Цельсия объясняется исключи-
тельно широким их практическим использованием в различных
странах, особенно для указания высоких температур.
Для практической термометрии и в первую очередь для
градуировки термометров Международным комитетом мер и
весов в 1968 г. принята Международная практическая температур-
ная шкала (МПТШ-68), которая заменила существовавшую до
этого Международную практическую шкалу 1948 г. с поправками
1960 г. МПТШ-68 определена так, чтобы температура по этой
шкале была по возможности максимально приближена к термо-
динамической температуре, т.е. чтобы разность этих температур
оставалась в пределах современной точности измерений. По
МПТШ-68 различают международную практическую температуру
Кельвина и международную практическую температуру Цельсия.
Соотношение между этими температурами определяется
уравнением (2.56). В диапазоне температур от 13,81 до 903,89 К
в качестве эталонного прибора рекомендован платиновып
термометр сопротивления. Основные постоянные точки МПТШ-
68 приведены в табл. 2.1.
В области температур ниже 13,81 К приняты следующие прок
тические шкалы температур: в интервале от 4,2 до 13,81 К -
температурная шкала германиевого термометра сопротивления:
в интервале от 1,5 до 4,2 К — шкпа 4Не 1958 г., основанная ня
зависимости давления насыщенных паров гелия-4 от темпера-
туры; в интервале от 0,8 до 1,5 К — шкала ?Не 1962 г., осно-
ванная на зависимости давления насыщенных паров гелия-3 oi
температуры; в интервале от 0,01 до 0,8 К — температурная
50
2.1. Основные постоянные точки МПТШ-68*1
Фазы различных вещеов. находящиеся в равновесии Принятое значение международной прак- тической температуры Iloipeiii- ноегь, К
7; к t. 'С
Твердая, жидкая и парообразная фазы равновесною водорода (тройная точка равновесною водорода) 13.81 -259.34
Жидкая и парообразная фазы равновес- ного водорода при давлении 33 330. о Па (25/76 нормального давления) 17,042 -256.108
Жидкая и парообразная фазы равно- весного водорода (точка кипения равновесного водорода)'2 20,28 -252.87 0.01
Жидкая и парообразная фазы неона (точка кипения неона) 27.108 -246.048
Твердая, жидкая и парообразная фазы кислорода (тройная точка кислорода) 54,361 -218.789
Жидкая и парообразная фазы кисло- рода (точка кипения кислорода) 90,188 -182.962 —
Твердая, жидкая и парообразная фазы воды (тройная точка поды)*’ 273.16 0.01 1 очно4
Жидкая и парообразная ([тазы воды (точка кипения воды) 373,15 100 0.005
Твердая и жидкая фаты цинка (точка затвердевания цинка) 692,73 419,58 0.03
Твердая и жидкая ([тазы серебра (точка затвердевания серебра) 1235.08 961.93 0.2
Твердая и жидкая фаты золота (точка затвердевания золота) 1 337.58 1064.4 7 0.2
За исключением тронных точек и одной точки равновесною водорода
(17,042 К) принятые яктчетптя температур даны дтя состояния равновесия при
Давлении р = К)] 325 ||;1.
9^ РяДИовесные .коти пара- и оргомо.нтфикании в точке кнттення составляют
-79 % и 0.21 соответственно
3 I»
<4 ,С1|°льзуемая вода но н ютонному составе должна соответ с т вона тъ океанской
По определению
шкала магнитной восприимчивости, основанная на зависимости
магнитной восприимчивости цериймагнисвого нитрата от
температуры, которая выражается законом Кюри.
§ 2.9. ПРИНЦИП НЕДОСТИЖИМОСТИ НУЛЯ
ТЕРМОДИНАМИЧЕСКОЙ ТЕМПЕРАТУРЫ
Третье начало термодинамики, так же как первое и второе,
является результатом обобщения большого практического опыта.
Одну из формулировок третьего начала дают в форме принципа
недостижимости нуля абсолютной температуры (абсолютного
нуля): никакая совокупность конечного числа процессов не
может понизить термодинамическую температуру тела до нуля,
иными словами, нуль термодинамической температуры достижим
только асимптотически. К значению Т= О К можно приближать-
ся сколь угодно близко, никогда его не достигая. Действительно,
накопленный практический опыт на пути достижения экстре-
мально низких температур (см. табл. 2.1) убедительно показы-
вает, что с понижением достигаемой температуры в возрастаю-
щей прогрессии увеличиваются трудности для дальнейшего ее
снижения. Третье начало термодинамики отражает фундамен-
тальные свойства материи при низких температурах, сущность
которых раскрывается двумя другими формулировками, а также
вытекающими из них следствиями. Так, в соответствии с форму-
лировкой Нернста — Симона при Г —> 0 изменение энтропии
конденсированной системы в равновесном изотермическом
процессе
0- (2.57)
Например, для термомеханической системы [Эх/Эрт >
для термомагнитной [Эх/ЭТ/Д -> 0.
При Т -> 0 энтропия перестает быть функцией состояния,
зависящей от параметров системы, а изотерма и адиабата
неразличимы (рис. 2.8). При Т -> 0 энтропия приближается к
постоянному значению sT^0 —> х°, поэтому существует и такая
формулировка третьего начала термодинамики: значение
энтропии х° не может быть достигнуто никакой конечной
совокупностью процессов. Движение материи, в частности
молекулярное, не исчезает при Г -> 0, поэтому кинетическая
энергия не равна нулю. Внутренняя энергия при Г -> 0
приближается к некоторой постоянной величине, называемой
нулевой энергией ит 40 -> и°. Нулевая энергия может быть
Рис. 2.8. Кривые, характеризующие
охлаждение последовательным осу-
ществлением процесса адиабатного
размагничивания, в координатах Г s
(Н — напряженность магнитного поля)
относительно большой, например для жидкого гелия она при-
мерно втрое превышает теплоту испарения. Этим объясняется
устойчивость твердых состояний гелия только при давлении
более 2.5 МПа. При более низком давлении колебания атомов
гелия столь значительны, что не позволяют образовать кристал-
лическую решетку даже при температурах, близких к абсолют-
ному нулю. В кристалле твердого водорода (при температуре,
близкой к 1 К) энергия нулевых колебаний столь велика, что
молекулы, находясь в кристаллической решетке, получают
свободу вращения, и в этой области температур наблюдается
необычное пиковое увеличение удельной теплоемкости водорода.
Важны следствия принципа недостижимости нуля термодина-
мической температуры. Так как теплоемкость определяет
изменение внутренней энергии при изменении температуры, то
с приближением к абсолютному нулю теплоемкость также
стремится к нулю:
|с, = (Эп/ат),, = T(ds/dT\}T^ 0:
|с = (а//ац, = T(ds/3T)p\ r^ -э о.
Температурные коэффициенты объемного расширения |3 и
давления а также стремятся к нулю при Т —> 0:
Эх
ди
52
53
Из последнего соотношения следует, что при Т -> 0 давление
насыщенных паров приближается к постоянному значению и
перестает зависеть от температуры:
|Эр/ЭТ]м 0.
В связи с существованием устойчивых возбужденных состоя-
ний тел с отрицательной термодинамической температурок
следует отметить, что достижение этих состояний обеспечивается
не уменьшением внутренней энергии, как при охлаждении, а,
напротив, ее увеличением. Такие состояния не имеют ничего
общего с “холодом” (за исключением того, что для их реализации
в ряде случаев применяют охлаждение), поэтому здесь их не
обсуждаем. Принципы сохранения энергии, возрастания энтро-
пии и недостижимости нуля термодинамической температуры
(т.е. недостижимости состояний с наивысшей внутренней энер-
гией) для состояний тел при отрицательных абсолютных темпера-
турах сохраняются, и в этом проявляется замечательное свойство
термодинамической симметрии.
§ 2.10. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ СООТНОШЕНИЯ
Функциональную связь параметров термомеханической систе-
мы определяют на основании первого и второго начал термо-
динамики:
du = Т ds - р dv. (2.58)
Для определения остальных термодинамических функций
(/, f ф) следует использовать преобразование Лежандра. Для заме-
ны одной независимой переменной (например, и) другой пере-
менной, канонически с ней сопряженной (т.е. /?), необходимо
из зависимой переменной и вычесть произведение этих двхх
канонически сопряженных независимых переменных (в нашем
примере pv), В соответствии с этим правилом для указанных
термодинамических функций получим
и = //(.у, г); / = z(.s; р) = и + pv\ f = ДГ, ф = и - Ts\
(2.59)
ф = ф (Г, р) = и - Ts + pv = i - Ts,
откуда с учетом уравнения (2.58) найдем
di = du + pdv + vdp = Tds + vdp'. (2.6(>)
df = du - Tds — sdT = - sdT - pdv.
(2.61)
t/ф = di - Tds - sdT = - sdT + vdp. (2.62)
Дифференцирование любой из этих функций по какому-либо
параметру даст канонически сопряженный с ним параметр,
например:
(du/ds\, = Т; (du/dv)s = -р ; (di/ds)p = Т; (di/dp)s = v ‘,
(2.63)
(Эф/Э Т)р = -s\ (д<р/др)т = v и т.д.
Каждая термодинамическая функция обладает этим свойством
только при выборе соответствующих независимых переменных.
Вместе с тем каждую из этих функций можно выразить как
функцию любых двух независимых переменных, например:
и = и (Т, v); и = и (р, v); i = i (р, Т~) и т.д. (2.64)
Поскольку du, di, df и t/ф являются полными дифференциа-
лами этих функций, то в соответствии со свойствами уравнений
в полных дифференциалах накрест взятые производные должны
быть равны. Полученные таким образом дифференциальные
соотношения термодинамики, известные как уравнения Макс-
велла, определяют количественные связи между различными
процессами:
(dT/dv)s = -(Эр/Эх),; (2.65)
(дТ/др\,= (dv/ds)p; (2.66)
(i)s/dv)T= (dp/dTf; (2.67)
-(ds/dp)T = (dv/dT)p. (2.68)
Для характеристики определенных свойств веществ вводят так
называемые температурные коэффициенты:
объемного расширения (изобарической сжимаемости)
1 v \ дТ /Р
(2.69)
54
55
du \ ( du \ ,
---- dT + ----- dp ;
dT >p \ dp >
изотермической сжимаемости хг
гости при Т = const
и модуль объемной упру-
(2.76)
v ' др ' Т
; (2.70)
- dv/v Т Ху.
адиабатической сжимаемости xs и модуль объемной упругости
при 5 = const
давления
_1 I др I
р ' dT lv
Теплоемкость с определяют из уравнения
Тds = с dT,
(2-72)
(2.73)
МЦ dT + (——) dp = c dT + ) dp; (2.77)
\ dT >p \ dp It p \ dp It
dT + dv = dT + (2-78)
dT lv \ dv It T \ dv
I ds \ I ds \ c I ds \
dp=^dT+ —— dp. (2.79)
\ dT }p \ dp Jr T \ dp It
Производные (du/dv)T и (di/dp)T определим из выражений
(2.58) и (2.60) с учетом уравнений Максвелла (2.67) и (2.68):
(du/dv)T = Т(dp/dT)v - р = р (аТ- 1); (2.80)
которое выражает связь понятий элементарного количества
теплоты в термодинамике Tdsvi калориметрии с dT. Теплоемкость
газов зависит от характера процесса. В частном случае для
процессов при р = const и v = const из уравнения (2.73) получим
ср = T(ds/dT)p; Cv = T(ds/dT\ . (2.74)
Продифференцировав выражение (2.60) по Т при р = const и
уравнение (2.58) при v - const и сравнив полученные соотноше-
ния с уравнениями (2.74), получим
%= $1/дТ\; cv = (du/dT\ . (2.75)
В результате происходящих в термомеханической системе про-
цессов изменяются значения ее параметров, причем значения
р, v и Т можно достаточно просто и точно измерить. В связи с
этим первостепенное значение имеют соотношения для опреде-
ления важнейших термодинамических параметров в зависимости
от совокупности независимых переменных; Тар, Т и v, р и v.
Полные дифференццдлы внутренней энергии, энтальпии и энтро-
пии в переменных Г—г и Т—р с учетом уравнений (2.74) и (2.75)
можно записать в следующем виде:
л _ /ди \ / d и \ , jt i \
du = ---- dT + ------ dv = с. dT + ----- dv;
' dT 'v \ dv 'T ‘ \ dv ' T
(di/dp)T = -T(dv/dT)p + v = v(l - PT), (2.81)
ще (du/dv)T— внутреннее давление, обусловленное силами взаимо-
действия молекул; Т(dp/dT\ — “тепловое” давление; р — внешнее
давление.
После преобразования уравнений (2.80) и (2.81) получим
du = с dT+ [ - р
v I \ dTlv
di= c dT + + v
p I ' dT!p
dv = cv dT + р аГ- 1 dv; (2.82)
dp = cp dT + rll- рГ 1 dp. (2.83)
Выражения для ds с учетом уравнений Максвелла приводим
к виду
ds = (cp/T)dT - (dv/dT)pdp^ (ср/Т )dT — $vdp; (2.84)
ds = (cJT}dT + (dp/dT)vdv - (cJT)dTT ap dv. (2.85)
Из уравнений (2.84) и (2.85) легко найти общее выражение
Для элементарного количества теплоты:
d°q= cpdT — T(dv/dT)pdp = cpdT- $vT dp; (2.86)
d°q=cvdT+ T(dp/dT)dv = cdT + apT dv. (l.^T)
56
57
Здесь верхний индекс 0 означает, что d°q — неполный диффе-
ренциал.
Разделив любое из этих двух уравнений на dT, найдем соотно-
шение между с, и с . Например, из уравнения (2.87)
откуда
Приняв dT - 0 и приравняв уравнения (2.86) и (2.87), най-
дем
(dT/dp)v(dp/dv)T(dv/ дТ)р = - 1
или
р = р а хт .
Запишем основные уравнения в переменных р и v:
du = cv($Tfdp)vdp + — /?] dv;
di = cpQT/dv)pdv + [сДЭТ/Эр),, + v] dp;
(2.89)
ds= (cv/T)(dT/dp)vdp + (cp/T)(t)T/dv)pdv;
d°q= cv(dT/dp)vdp + cp(dT/dv)pdv.
Из приведенных соотношений можно получить уравнения в
общем виде для любых процессов при различных независимых
переменных. Например, для адиабатного равновесного процесса,
приняв d°q = 0, найдем:
при переменных Г и г из уравнения (2.87)
(Э77Э^ = _(Т7с,)(Э^/Э7)г, = ~Тр V./Cv; (2.90)
при переменных Т и р из уравнения (2.86)
(dT/i)p)s = (T/cp)(dv/dr)p = Tv$/cp. (2.91)
при переменных р и v из последнего уравнения (2.89)
(Э^/Эр\. - ~(cJcp^T^p\^v/HT\ = -v^fk. (2.92)
58
Здесь к — показатель адиабаты Пуассона:
к = cp/cv. (2.93)
Из уравнения (2.92) следует, в частности, что изотермичес-
кая сжимаемость в к раз больше адиабатной. Действительно,
(dt)fdp)s— xj1>_ vx.rj./k, откуда
к = x-T/'x-s- (2-94)
Для изобарного процесса (без трения) из уравнений (2.86),
(2.83) и (2.69), приняв dp = 0, получим
dq = di = cpdT= Т ds; dv = dT.
Для изохорного процесса (без трения) из уравнений (2.87),
(2.82) и (2.72)
dq = du = cvdT = Т ds; dp = p a dT.
Из уравнения Максвелла (2.67) можно получить уравнение
Клапейрона—Клаузиуса. Для чистого вещества температура
фазового перехода постоянна и As = r/Т; тогда
dp/dT= r/\T(v2-v^ (2.95)
где г — удельная теплота фазового перехода; индексы 1 и 2 —
номера фаз.
Наконец, общее выражение для скорости звука имеет вид
а = V (с,/с,) (Э/?/Эр)г = л/ к (Э^/Эр)7 . (2.96)
Решение приведенных уравнений и получение числовых
результатов возможно в каждом конкретном случае только при
известных уравнениях состояния рабочего тела или значениях
коэффициентов а, р и к. Аналогичные общие термодинамичес-
кие соотношения можно получить для функций свободной
энергии и свободной энтальпии.
Применение математического аппарата равновесной термо-
динамики предусматривает равновесность состояний изучаемой
системы. Однако необходимо подчеркнуть, что при рассмотрении
Двух равновесных состояний основное уравнение (2.58), напри-
МеР, для термомеханической системы справедливо независимо
07 характера процесса, в результате которого система перешла
Из °ДНого равновесного состояния в другое. По существу уравне-
59
ние (2.58) выражает связь параметров и функций состояния в
равновесной системе. Оно может быть проинтегрировано только
между равновесными состояниями; других ограничений нет.
Именно поэтому и только в этом смысле возможно применение
математического аппарата равновесной термодинамики при
анализе изменений состояния в результате таких типично
необратимых процессов, как дросселирование, диффузия и др.
Уравнение (2.58) справедливо независимо от характера процесса,
но необходимо помнить, что только для обратимых процессов
количества внешних воздействий (теплоты и работы) определя-
ются параметрами системы d°q = Тds и dQl - р dv; для необра-
тимых процессов d°q / Tds; d°l / pdv. В равной степени это
относится и к другим общим термодинамическим соотношениям
(2.60) - (2.62).
Глава 3
СВОЙСТВА РАБОЧИХ ВЕЩЕСТВ
КРИОГЕННЫХ СИСТЕМ
S 3.1. РАВНОВЕСНЫЕ СОСТОЯНИЯ
И ФАЗОВЫЕ ПЕРЕХОДЫ ЧИСТЫХ ВЕЩЕСТВ
Равновесные состояния веществ характеризуются значениями
параметров состояния. Соотношения, выражающие связи пара-
метров состояния с температурой, называют уравнениями состоя-
ния. Например, для чистых (однокомпонентных) веществ в
газообразном и жидком состояниях связь параметров р и v с
температурой Т записывают в общем виде так:
Т = f (р, v), или F(p, v, Т) = 0. (3.1)
Общий вид уравнения парамагнитного состояния парамагне-
тиков таков:
М = f(T, Н), или F(T, М, Н) = 0,
где М — магнитный момент; Н — напряженность магнитного
поля.
Геометрически уравнение состояния F(p,v, Т) = 0 интерпре-
тируется как поверхность состояний. Поверхности состояний ре-
альных веществ (рис. 3.1) отражают их общее свойство —
возможность существования в различных агрегатных состояниях
(газообразном, жидком и твердом). Область жидких состояний
ограничена (см. рис. 3.1, а) участком поверхности к{кеа; твердых
— участком nebf; газообразных — участком kxkdgmmv Если при
затвердевании объем уменьшается, то твердая фаза (“лед”) таких
веществ тонет в жидкости, т.е. их плотность в твердом состоянии
больше, чем в жидком (например, СО2, О2, N2, Н2, Не, Ar, No,
Кг). Кроме указанных на термодинамических поверхностях есть
несколько характерных областей (обычно называемых гетероген-
ными), в которых вещество распадается на две фазы: эти фазы
сосуществуют, а температура является функцией только дав-
ления. Например, такими областями являются область akd
кипения — конденсации; область ceab плавления — затвердева-
ния и область fbdg сублимации — вымораживания.
61
Рис. 3.1. Поверхность состояний p^v—T
(а — общий вид; б, в — проекции)
реального вещества, объем которого
при затвердевании уменьшается:
А, Б, В — области соответственно
газообразной, жидкой и твердой фаз;
Г, Д, Е — области равновесия соответ
ственно жидкой и газообразной фаз
(кипение — конденсация), жидкой и
твердой фаз (плавление — затверде-
вание), твердой и газообразной фаз
(сублимация — вымораживание)
V
б)
Значения давления и температуры, при которых любые две
фазы находятся в равновесии, называют давлением насыщения
и температурой насыщения, а сами фазы — насыщенными
(насыщенный пар, насыщенная жидкость, насыщенный “лед”).
Жидкость или кристалл при температуре ниже температуры
насыщения, соответствующей их давлению (другими словами,
находящиеся при давлении больше давления насыщения, соот-
ветствующего их температуре), называют недогретой жидкостью
и недогретым “льдом”; не следует путать с метастабильными
состояниями перенасыщенного пара или перегретой жидкости.
Ранее эти состояния называли переохлажденными. На рис. 3.1, а
точки линии ак соответствуют состоянию насыщенной жидкости,
точки линии dk — состоянию насыщенного пара, находящегося
в равновесии с жидкостью. По мере приближения к критической
точке к значения плотностей жидкости и пара сближаются. В
Критической точке жидкость и пар неотличимы и имеют
одинаковые плотности. То же относится и к точкам линии кхк.
В критической точке
=0; =0; (^)=0; = 0; (Д-) = 0;
\ Эг' 'Г ' Эх 'т ' dv 'р ' Эх 'р ' Эу2 'т
(2!L) = o. (32)
1 dv2 'р 'Эх2 'р
В критической точке изотермический ит и изобарный Р
коэффициенты сжимаемости, а также теплоемкость с —
величины неопределенные.
Переход из области газообразных состояний в область жидкос-
ти и в обратном направлении при давлении, превышающем
давление в критической точке (р > рк~), реализуется непрерывно
без признаков фазового перехода. На рис. 3.1, а этот переход
обозначен линией I—II. В этом смысл (по Ван-дер-Ваальсу) так
называемой непрерывности газообразных и жидких состояний.
При давлении меньше рк переход газа в жидкое состояние и
обратно не происходит непрерывно: существует гетерогенная
область кипения — конденсации, в которой в равновесном
состоянии вещество находится в двух фазах (линия 4—5 на рис.
3.1, б). Следовательно, необходимым условием ожижения любого
газа и получения его в состоянии равновесия с паром является
уменьшение его температуры ниже критической. При темпера-
туре выше критической вещество может существовать в жидком
состоянии только в равновесии со своим льдом (при высоких
Давлениях): состояния в области ceab плавления — затвердева-
ния (см. рис. 3.16, 3.23).
Фазами являются не только различные агрегатные состояния
вещества, но и различные его аллотропические разновидности.
Характерная особенность фаз — наличие четких границ раздела
Между ними. Любое вещество может находиться в различных
агрегатных состояниях, но аллотропические разновидности из-
вестны не для всех веществ. Обычно аллотропия присуща ве-
ществам в твердом состоянии и может проявляться в различ-
ном структуре льда (его кристаллической решетки). Например,
Вода имеет семь кристаллических модификаций, сера — две
^Ромбическую и моноклиническую); твердый гелий — три (см.
Рис. 3.23). Аллотропические изменения характерны также для
62
63
твердых кислорода, азота, фтора. На термодинамической поверх-
ности в области параметров твердого состояния всем аллотропи-
ческим разновидностям соответствуют определенные участки,
между которыми образуются гетерогенные области — области
сосуществования аллотропических разновидностей.
В соответствии с правилом фаз Гиббса для системы число сте-
пеней свободы
'св = 'к - 'ф + 2’ (3.3)
где /к — число компонентов; — число фаз.
Для чистого вещества /к = 1 и в однофазном состоянии
(/ф = 1) число степеней свободы /св = 2. Это значит, например,
что температура и давление являются независимыми парамет-
рами и могут быть выбраны произвольно. В двухфазных областях
(/ф = 2) /св = I. В этих областях давление и температура
взаимоопредслены: каждому значению температуры насыщения
соответствует определенное значение давления насыщения. Зада-
ваясь, например, значением р, можно определить Т, и наоборот.
Для каждой из двухфазных областей уравнение поверхности
состояний чистого вещества имеет вид F(Т, р) — 0. Это линей-
чатые поверхности (их образующие параллельны оси они
перпендикулярны плоскости р — Т и проектируются на нее в
виде линий. В результате получаем наиболее наглядную диаграм-
му р — Тдля чистого вещества (см. рис. 3.1, 3.19, 3.23).
Кривая сублимации отражает зависимость между температу-
рой насыщения и давлением насыщения в областях равновесия
твердой и газообразной фаз, кривая кипения — для жидкой и
газообразной фаз, кривая плавления — для твердой и жидкой
фаз. Кривая кипения ограничена критической точкой к (см. рис.
3.1, а). Кривая плавления не ограничена, поскольку критическая
точка для процессов перехода из жидкого состояния в твердое
пока не обнаружена даже в области очень высоких давлений, и
этот переход сопровождается скачком плотности. Это явление
можно объяснить и с точки зрения молекулярной структуры
твердого тела. Силы притяжения удерживают молекулы около
центров равновесия, образующих упорядоченную решетку-
Тепловое движение (в данном случае колебание молекул около
центров равновесия) оказывает несущественное влияние. При
повышении температуры колебания усиливаются и при достиже-
нии температуры плавления разрушают упорядоченную решетку-
Для большей части веществ температуры кипения и сублима-
ции снижаются при уменьшении давления (см. рис. 3.1). Однако
64
есть исключения: например, для воды температура плавления
снижается при увеличении давления, и кривая плавления на
диаграмме р — Т отклоняется влево от точки а.
Три двухфазные поверхности имеют общую точку а, называе-
i^yio тройной. Число степеней свободы в тройной точке равно
нулю, состояние называют инвариантным. При давлении ра и
температуре Та тройной точки в равновесии могут находиться
одновременно три фазы — пар, жидкость и “лед”. Параметры
критической и тройной точек некоторых газов приведены в
табл. 3.2. При увеличении числа возможных аллотропических
состояний усложняется вид диаграммы р — Г; число “тройных”
точек равно числу кристаллических модификаций. Однако только
в одной тройной точке а, иногда называемой основной, в равно-
весии находятся газообразная, жидкая и одна из твердых фаз.
Исключение составляет гелий, не имеющий основной тройной
точки; при давлении меньше 2,5 МПа гелий остается жидким
вплоть до Т -> 0 (см. рис. 3.23).
В процессах кипения — конденсации, плавления — затверде-
вания и вымораживания — сублимации (возгонки) изменяются
энтропия и плотность. Эти переходы классифицируют по Эрен-
фесту как фазовые переходы первого рода: первые производные
термодинамического потенциала Гиббса, сохраняющего постоян-
ное значение при фазовых переходах [см. уравнения (2.62) и
(2.63)], s = - (Э<р/ЭГ)р и v = (Э<р/Эр)г изменяются скачкообразно.
В связи с этим функции внутренней энергии, энтальпии и
свободной энергии также претерпевают конечные изменения [см.
уравнение (2.59) и рис. 3.2]. Поскольку температура и давление
постоянны, то значения с, р и хг для двухфазной системы во
время фазового перехода неопределенны:
(3.4)
ЧГ Ip V 1 ЭТ Ip V 1 Эр 1т
На основании этого иногда говорят, что в области двухфазных
состояний указанные величины теряют свой физический смысл.
Это относится и к критической точке — как точке, находящейся
в Двухфазной области жидкость — пар (рис. 3.3). Теплоемкость
cv остается величиной определенной, хотя и изменяется. Линия
Фазового равновесия р = f(7) описывается известным уравне-
нИем (2.95) Клапейрона—Клаузиуса.
Экспериментальные данные о равновесном давлении насы-
щенных паров над жидкостью и над кристаллом для многих газов
5 За«аз № 1592 65
Рис. 3.2. Характерные изменения потенциала Гиббса <р, внутренней энергии и,
энтропии s = -(Эф/ЭГ^, плотности р = 1/ (Эф/Э/>)г и удельных теплоемкостей ср и
с, при фазовых переходах первого рода
Рис. 3.3. Зависимость молярной теплоемкости воздуха (Тк 133 К) от температуры
и давления
и нт претерпевают конечные изменения, то такие фазовые
переходы называют переходами второго рода, так как каждый
из этих параметров можно определить как вторую производную
термодинамического потенциала Гиббса:
аппроксимируются с точностью до 2 % простыми зависимостями
вида lg р = А - В/Т, где А и В — постоянные коэффициенты,
зависящие от свойств вещества. Значения А и В для различных
веществ над жидкостью скобках) при р в гПа: (без скобок) и над кристаллом
Газ ,...n2 о2 Н2 Кг
А ..7,175 7,165 5,7 7,416
(7,79) — (4,742) (7,869)
В . 325,52 377,15 54,56 537,5
(359,36) — (47,01) (576,6)
Характерной особенностью фазового перехода первого рода
является постепенное образование новой фазы. Доля новой фазы
увеличивается по мере подвода или отвода скрытой теплотй
фазового перехода.
Существуют фазовые переходы высших порядков, при кото-
рых энтропия и объем (плотность) не изменяются. При этом Т<
р, ф, /, и, f также остаются неизменными. Если при этом с , Р
66
1 Э2ф
v ЪТдр'
(3.5)
х7.= -1 ( iL) =
v ' Эр т v др2
Надо отметить, что фазовые переходы второго рода в чистом
виде реализуются очень редко; в качестве примера можно
привести переход из состояния сверхпроводимости в нормальное
при отсутствии магнитного поля.
Одним из фазовых переходов высшего порядка является так
называемый Х-переход, получивший свое название вследствие
л°В"адения кРив°й ср = f(T) по форме с греческой буквой
н М да' При ^-переходе у, v, Г, р, и, i, f и ф остаются постоян-
и. а величины ср, 0 и ху становятся неопределенными.
Н₽тгМ/ерЬ) ^'пеРех°да: ферромагнетик — парамагнетик: Нс! —
11 (подробнее см. с. 120).
5*
67
§ 3.2. РАВНОВЕСНЫЕ СОСТОЯНИЯ
И ФАЗОВЫЕ ПЕРЕХОДЫ БИНАРНЫХ СИСТЕМ
Термодинамическая поверхность многокомпонентных веществ
в областях однофазных, газообразных и жидких состояний по.
добна термодинамической поверхности чистого вещества, у
областей сосуществования разных фаз, т.е. фазового равновесия
имеются характерные отличия. Анализ закономерностей фазовых
изменений многокомпонентных систем ограничим обсуждением
основных положений для двухкомпонентных (бинарных) систем.
Состояние бинарной системы определено, если заданы темпе-
ратура Т, давление р и объемная или массовая доля х одного из
компонентов. В области однофазных состояний эти три незави-
симые переменные можно изменять и выбирать произвольно;
бинарная система имеет три степени свободы [см. уравнение
(3.3)]. В областях фазового равновесия (кипения — конденсации,
плавления—затвердевания, сублимации—вымораживания) число
степеней свободы / для бинарной системы (zK = 2) на единицу
больше, чем для чистого вещества, т.е. /св = 2. При равновесии
давления и температуры фаз должны быть одинаковыми, и
каждому значению доли х компонента в одной фазе должно
соответствовать определенное равновесное значение доли у этого
же компонента в другой фазе. Это обстоятельство является
следствием равенства химических потенциалов компонентов в
фазах в условиях равновесия. Таким образом, в областях
двухфазного равновесия только два параметра бинарной смеси
независимы и могут быть выбраны произвольно. Любой совокуп-
ности значений р и Т соответствует определенное значение х, а
следовательно, и у; любой совокупности значений Т и *
соответствуют определенные р и у; любой совокупности р и X
— определенные значения Т и у.
В координатах Т — р — *
Р
Рис. 3.4. Участки равновесных поверх-
ностей в координатах Т—р—х
можно изобразить поверхнос-
ти равновесных состояний
каждой из двух фаз (рис. ЗЛУ
Поскольку при равновесий
значения р и Т для обеих Ф33
одинаковые, то равновесный
состояниям соответствуют тоЧ-
ки пересечения этих поверх
ностей с перпендикулярами
плоскости р — Т (точки а и W'
Как и для чистого вещества, область двухфазных состояний
бинарной смеси ограничена определенным диапазоном парамет-
ров р, Т, х, поэтому поверхности состояний двух фаз образуют
в пространстве сложную фигуру (рис. 3.5).
Различные смеси имеют разные формы равновесных поверх-
ностей. Линии пересечения равновесных поверхностей с плос-
костями х = 0 и х = 1 представляют собой линии кипения чистых
компонентов; Т = f( р}. Проекции сечений равновесных поверх-
ностей дают широко используемые на практике диаграммы рав-
новесных состояний (рис. 3.6). Равновесные кривые являются
проекциями линий пересечения равновесных поверхностей с
плоскостями Т = const и р' = const, поэтому каждой кривой
соответствуют определенные значения температуры (в коорди-
натах/? — х) и давления (в координатах Т — х). Верхнюю равно-
весную кривую называют кривой конденсации, нижнюю —
кРивой кипения. При увеличении давления вследствие повы-
шения температуры кипения равновесные кривые на графике
поднимаются (рис. 3.6, а). При достижении критической тсм-
_Р туры Тк1 одного из компонентов равновесные кривые удаля-
Пп_я 07 пРямой х = 1 и при дальнейшем повышен™ температуры
пенно сокращаются и исчезают при достижении критической
69
68
Рис. 3.6. Типы равновесных кривых в координатах Т— х и р— х (pt < р2 < ... < />5;
7j < Т2 < ... < Т4)
температуры Тк2 второго компонента. В координатах р — х
(рис. 3.6, б) равновесные кривые имеют аналогичный характер.
Для бинарных смесей, критические температуры компонентов
которых резко различаются, равновесные кривые могут иметь
иной вид (рис. 3.6, в).
Если бинарную смесь с х = х0 медленно охлаждать при
постоянном давлении, то процесс изображается линией 00
(рис. 3.6, г). При этом конденсация начинается в точке А, и
первые капли жидкости имеют состав, соответствующий пара-
метрам точки В на кривой кипения; причем этот состав сущест-
венно отличается от состава паровой фазы. Дальнейшая конден-
сация происходит при снижающейся температуре (в отличие от
конденсации чистых веществ, протекающей при постоянной
температуре). При этом состав жидкости изменяется от точки
В до С, а состав пара — от точки А до D. Состав последних
частиц пара соответствует точке D. Когда исходная смесь
полностью перейдет в жидкую фазу (точка Q, ее состав будет
начальным (х0). В промежуточной точке Н соотношение между
количествами жидкости g и пара G можно определить по соотно-
шению g/G = (у - х0 )/(х0 - х) = EH/HF.
Это характерно и для процессов конденсации смеси при
постоянном давлении по линии 00 (рис. 3.6, д') и по линиям
00 и 0'0' (рис. 3.6, е). Однако процесс охлаждения смеси вдоль
линии РР (рис. 3.6, д), расположенной справа от критической
точки к, отличается от рассмотренного. Исходная жидкая смесь
в точке А начинает распадаться на две фазы. При дальнейшем
охлаждении количество паровой фазы сначала увеличивается,
а затем начинает уменьшаться, и в точке С весь пар полностью
конденсируется. Такой процесс называют обратной конденса-
цией. Возможен случай, когда при определенных концентрациях
бинарная смесь конденсируется как чистое вещество — при
постоянной температуре (рис. 3.6, е, линия QQ). Точку L назы-
вают азеотропной.
Кроме рассмотренных, широко используют равновесные диаг-
раммы Т — р — х — у; х — у; х — / и Т — р — i — х — у
(уравнения фазового равновесия и диаграммы — см. гл. 7).
Если сконденсированную бинарную смесь продолжать охлаж-
дать, можно достичь состояний, при которых начинается образо-
вание твердой фазы (выпадение кристаллов). При кристаллиза-
ции смеси соотношение долей компонентов в жидкости х\ и
кристалле х°; теоретически определяется уравнением Шредера
— ван-Лаара:
где у', — коэффициент активности компонента в жидкости;
гпл / и Т’пл / — теплота и температура плавления, z-ro компонента;
ГФ/и ^ф/ — теплота и температура фазового перехода в кристалле.
При кристаллизации в смесях с существенно различающимися
температурами кипения компонентов, например, смеси азота N2
и фреонов R13, R14, могут выпадать кристаллы чистого компо-
нента (рис. 3.7, б). В этом случае х°;= I и уравнение (3.6) опре-
деляет предельную растворимость компонента в жидкой фазе.
Трехфазная равновесная бинарная смесь имеет одну степень
свободы, и в отличие от чистого вещества область трехфазных
Равновесных состояний изображается не линией, а участком
Поверхности. При этом определенному давлению соответствуют
70
71
О 0,1 0,Z 0,3 0,0 0,5 0,6 0,7 0,8 0,9 х
О, a) Мг
Рис. 3.7. Диаграммы состояния жидкость—твердое
тело для смесей (Ж и Т — области соответственно
жидких и твердых состояний):
а — с близкими температурами тройных точек
компонентов (О2 — N2); б — с существенно
различающимися температурами тройных точек
компонентов (N2 — R14) при р = 0,15 МПа; в —
трехкомпонентной (N2 — R13 — R14) при Т= 75 К
и р -- 0,15 МПа (по Н.Д.Захарову)
определенные значения температуры и долей компонентов. Для
бинарной системы также может быть достигнуто состояние, при
котором система инвариантна, т.е. число степеней свободы равно
нулю. В этом случае в равновесии находятся три фазы: твердым
и жидкий растворы, паровая фаза и один из компонентов
(обычно в твердой фазе). Подобное состояние называется эвтек-
тическим и имеет своим аналогом тройную точку для однокомпо-
нентной системы. Как и в случае равновесия газообразной и
жидкой фаз, при равновесии твердой и жидкой фаз устанавли-
вается определенная равновесная разность концентраций (см.
рис. 3.7, а, б). Таким образом, при переходе из жидкого
состояния в твердое (и обратно) концентрация какого-либо
компонента в жидком и твердом растворах постоянно изме-
няется. Изображение этого процесса в координатах Т — х анало-
гично показанному на рис. 3.6, г.
§ 3.3. ИДЕАЛЬНОЕ ГАЗОВОЕ СОСТОЯНИЕ
Все так называемые законы идеальных газов (Бойля
Мариотта, Гей-Люссака, Шарля, Джоуля, Дальтона, Авогадро.
Амага) установлены на основании результатов экспериментов с
реальными газами при малых давлениях. В связи с этим
72
эмпирически установленному понятию идеального газового
состояния (идеального газа) соответствует такой газ, свойства
которого в первом приближении идентичны свойствам реального
газа при низких давлениях. С точки зрения молекулярно-
кинетических представлений модель идеального газа является
совокупностью молекул, движущихся во всех направлениях. Все
направления движения равновероятны. Размеры молекул
ничтожно малы по сравнению с расстояниями между ними,
поэтому объем, занимаемый собственно молекулами, прене-
брежимо мал. Силы взаимодействия между молекулами отсутст-
вуют. Молекулы взаимодействуют одна с другой и стенками
сосуда только при взаимных столкновениях, причем характер
этих столкновений является идеально упругим.
Уравнения состояния. В идеальном состоянии газ подчиняется
уравнению состояния Бойля — Гей-Люссака; соответственно для
1 кг и G кг газа:
pv = RT и pV = GRT; (3.7)
здесь р — в Па; v — в м3/кг; V ~ в м3; R — удельная газовая
постоянная, Дж/(кг- К) (табл. 3.1).
Известна также другая форма уравнения состояния идеального
газа — уравнение Менделеева — Клапейрона:
pV=NMRyT, pV=GRyT/M; PVu=RyT, (3.8)
где NM — число киломолей газа; М — масса одного киломоля
[количество вещества, содержащего столько же молекул (атомов,
частиц), сколько атомов содержится в нуклиде углерода (С) массой
12 кг (точно)]; VM — V/NM— объем одного киломоля;
Ry= 8314,19 Дж/(кмоль- К) — универсальная газовая постоянная.
Удельная газовая постоянная, Дж/(кг* К)
R= Ry/M. (3.9)
Кроме того, уравнение состояния идеального газа можно
записать в виде
pV - пкТ, (3.10)
где п — число молекул в объеме V; к — постоянная Больцмана.
Для всех газов
к = Rm = Ry/N = 1,38 - 10'23 Дж/К, (3.11)
где щ — масса одной молекулы; N — число молекул в одном
КИломоле.
73
3.1. Значения R и М для некоторых газов
Газ Химическая формула м. кг/кмоль R. Дж/(кг • К)
Азот N2 28,016 296,766
Аргон Аг 39.944 208,146
Воздух — 28,966 287,033
Водород Н2 2,016 4124,102
Гелий-4 4Не 4,003 2076,989
Гелий-3 ’Не 3,016 2780,000
Кислород о2 32,000 259,818
Криптон Кг 83,000 99,215
Ксенон Хе 131,300 63,322
Метан сн4 16,040 518,341
Неон Ne 20.183 411,940
Окись углерода СО 28,011 296,819
Углекислота со2 44,011 188,912
Фтор F2 38,000 218,794
Этан СН3СН3 30,070 276,494
Этилен с2н4 28,054 296,364
Экспериментально определено, что в одном киломоле любого
вещества содержится 6,024 • 1026 молекул независимо от химичес-
кого состава и свойств, т.е.
N= Ry/k = 6,024- 1026. (3.12)
При одинаковых давлении и температуре объем одного кило-
моля любого газа в идеальном состоянии одинаков, например,
при нормальных условиях он равен примерно 22,4 м3.
Поверхность состояний идеального газа показана на рис. 3.8.
Изотермы в плоскости р — v являются гиперболами.
Рис. 3.8. Поверхность состояний
идеального газа в координатах
р—V— Т
74
Тепловые свойства. Зная урав-
нения состояния и используя
фундаментальные соотношения
термодинамики, можно опреде-
лить основные тепловые свойства
идеального газа.
Внутренняя энергия и энталь-
пия идеального газа не зависят от
давления и плотности и определя-
ются только температурой.
Действительно, для идеального
газа (Эр/Э Т)р = р/Т~ R/v = const;
(ди/дТ)р = v/T = R/р = const.
Подставив эти выражения в уравнения (2.80) и (2.81), по-
дучим:
(Эи/Э^у. — 0; (Эм/Эр)7<= 0; (di/dp)T— 0; (di/dv)T = 0. (3.13)
Теплоемкости ср и с, идеального газа зависят только от тем-
пературы [см. выражения (3.13), (2.76) и (2.77)]:
cv= (Э«/ЭП=/(Т); cp=(di/dT)p=f(J). (3.14)
Из выражения (2.88) получим уравнение Майера
(•>-£ = * (3.15)
Согласно уравнению (2.80) в идеальном газе внешнее давле-
ние уравновешено только тепловым давлением. Внутреннее
давление, обсуловленное силами молекулярных взаимодействий,
отсутствует.
Для любого процесса в идеальном газе изменение внутренней
энергии и энтальпии соответственно [см. уравнение (2.76) и
(2.77)]:
du=cvdT-, di=cpdT. (3.16)
Температурные коэффициенты объемного расширения р и
давления а [см. уравнения (2.69) и (2.72)] для идеального газа
равны:
р = а = 1/Т. (3.17)
Коэффициент изотермической сжимаемости идеального газа
[см. уравнение (2.70)]
1 / RT
ХТ ( 2
V ' р
Модуль объемной упругости при Т = const
гт=р. (3.19)
Коэффициент адиабатической сжимаемости
xf = 1/(кр). (3.20)
Модуль объемной упругости при s = const
es = кр, (3.21)
где к ~ ср/с — показатель адиабаты Пуассона.
(3.18)
75
Из уравнения (3.10) следует, что при одинаковых давлении
и температуре в равных объемах содержится равное число
молекул и при постоянных Т и V давление газа определяется
числом молекул л и не зависит от рода молекул. Таким образом,
общее давление смеси идеальных газов равно сумме парциальных
давлений компонентов при тех же объеме и температуре:
Pvt ~ Р\ Pi ~ (X ру (3.22)
Парциальное давление компонента
Pi = х.р, (3.23)
где xt — молярная или объемная доля z-го компонента в смеси.
Другими словами, в смеси идеальных газов каждый компонент
ведет себя так, как если бы он находился один в данном объе-
ме при данной температуре смеси. Объем, занимаемый смесью
идеальных газов, равен сумме парциальных объемов компонентов
при температуре и давлении смеси:
УрТ=(^)рТ. (3.24)
Парциальный объем /-го компонента
И = Xi V. (3.25)
/, ср и R для смеси идеальных газов
У cpi mi Е Ri mi
; с = —--------; R = -----------, (3.26)
Удельные значения и,
определяют по формулам:
У и. m. У /,. т.
и = --------; / = --------
т т
где т — масса смеси; тп;. — масса /-го компонента.
Уравнение равновесной адиабаты Пуассона (2.92) для идеаль-
ного газа принимает вид
(dv/dp)s = - v/(kp), (3.27)
или
pvk = const. (3.28)
Для изохорного процесса
Т/р = const; (3.29)
для изобарного
T/v = const;
(3.30)
для изотермического
pv = const. (3.31)
Скорость звука в идеальном газе согласно уравнению (2.96)
а = к RT. (3.32)
Рассмотренные свойства идеальных газов определены непо-
средственно из уравнения состояния и общих соотношений
термодинамики. Однако необходимо подчеркнуть, что все эти
свойства определены первоначально по результатам эксперимен-
тов с реальными газами при низких давлениях. Действительно,
уравнения (3.18) и (3.31) выражают закон Бойля — Мариотта,
уравнения (3.17) и (3.30) — закон Гей-Люссака, уравнения (3.17)
и (3.29) — закон Шарля, уравнение (3.22) — закон Дальтона,
уравнения (3.13) — закон Джоуля, выведенный им на основании
опытов своих и Гей-Люссака. Уравнение (3.24) отражает закон
Амага, уравнения (3.10) и (3.12) — закон Авогадро. Эти исследо-
вания сыграли определяющую роль в установлении понятия
идеального газа и описании его свойств.
Газокинетические свойства. В ряде случаев при исследовании
и расчете некоторых криогенных машин и аппаратов необходимо
знать также и основные молекулярно-кинетические характерис-
тики идеального газа, определяемые по кинетической и кванто-
вой теориям.
Наиболее вероятная скорость молекул массой т
= 2кТ/т = 2RT, (3.33)
где к — постоянная Больцмана.
Средняя арифметическая скорость молекул
с~= у/ 8 к Т/(лт) = /2,546 7? Т = 1,128 с, . (3.34)
Средняя квадратическая скорость молекул (квадратный корень
из среднего значения квадратов истинных скоростей)
с = 4 ЗкТ/т = 3 RT - 1,223 Cj . (3.35)
С увеличением R и Т возрастает скорость движения молекул.
76
77
Давление газа
р = пт с7 /3. (3.36)
Число столкновений в единицу времени для одной сфери-
ческой молекулы диаметром о в единице объема с числом
молекул п
Г = V2 л п с1 с~~ 7,09 (р о2 / к) R / Т . (3.37)
Длина свободного пути молекулы
/ = с / Г = 1 / ( л/ 2 л л о2) = 0,225 кТ/(рсг). (3.38)
Число молекул, ударяющихся о поверхность площадью f в
единицу времени,
Nf= 0,25 fn с =fn к T/(2nm) = 0,4 (fp I к) R/T. (3.39)
Внутренняя энергия идеального газа равна сумме потенциаль-
ной и кинетической энергий его молекул. Потенциальная энер-
гия молекул идеального газа не зависит от объема; обычно се
принимают равной нулю, поэтому для 1 кмоль одноатомного газа
Молекулы одноатомного газа обладают тремя степенями
свободы в поступательном движении. Как следует из первого
уравнения (3.40), на каждую степень свободы приходится
кинетическая энергия, равная 0,5кТ. Для двухатомной молекулы
сохраняются три степени свободы в поступательном движении
центра масс. Вместе с тем, начиная с определенной температуры
Т , возникает вращательное движение, а при достижении
температуры Ткол — колебательное движение атомов. Двухатом-
ная молекула имеет две степени свободы при вращательном
движении и одну при колебательном движении (рис. 3.9). На
каждую степень свободы во вращательном движении приходится
кинетическая энергия, равная 0,5кТ, и на каждую степень
свободы в колебательном движении — кинетическая энергия,
равная 0,5£Т. В этом заключается так называемый закон
z
Ряс. 3.9. Двухатомная молекула с шестью степенями свободы — тремя в
поступательном движении центра массы (а), двумя во вращательном движении (б),
одной в колебательном движении (в)
равномерного распределения энергии по степеням свободы. При
колебаниях кинетическая энергия переходит в потенциальную,
поэтому полная энергия, приходящаяся на одну степень свобо-
ды в колебательном движении, равна кТ.
Таким образом, для идеального двухатомного газа (1 кмоль)
в области температур выше Гвр до Гкол
325 / ди , 5
и = - RT+ - RT = -RVT; с = —= - Я ;
М 2 у 2 у 2 у * ' ЭТ 2 у
(3.41)
5 7 с 7
Ср ~ ~i Ry + Лу ” ? Лу ’ к - Г '
V
При температуре выше Ткол
3 2 7
«М = - RyT +-RyT+ RyT = -RyT,
(3-42)
7 9 9
cv = ~R-, c= - R , £=-= 1,285.
2 y p 2 y 7
В соответствии с квантовой теорией молекула может нахо-
ДИться лишь в стационарных состояниях, которым соответствуют
определенные значения энергии. Молекула может воспринимать
энергию только определенными порциями (квантами); при этом
°На переходит из одного стационарного состояния в другое.
Дискретные уровни энергии для вращательного и колебательного
79
78
Рис. 3.11. Зависимости безразмерной
теплоемкости некоторых газов от
температуры
Рис. 3.10. Теоретическая зависимость
безразмерной теплоемкости от темпера,
туры (7, II и III — вклады колеба.
тельного, вращательного и поступатель-
ного движений соответственно)
движений вполне определенные. При достижении температуры
Твр или ^кол не все молекулы начинают вращательное или
колебательное движение, а те из них, которые начали вращаться
или колебаться, находятся на самых низших (из возможных)
дискретных уровнях энергии, характерных для этих движений.
В связи с этим теплоемкость постепенно увеличивается с повы-
шением температуры (рис. 3.10, 3.11). Теоретические значения
характерных температур Твр и Ткол определены квантовой
теорией:
Кр = Л7(8я2Л); Ткол = hv^/k, (3.43)
где h — постоянная Планка; I — момент инерции молекулы;
v0 — частота колебаний; к — постоянная Больцмана.
Значения Ткол обычно соответствуют области высоких темпе-
ратур, а Твр, как правило, — области весьма низких температур:
Газ...........о. n2 н.
7„г. К.......2,059 2,85 84,97
Дол, К....... 2230 3340 6100
Исключение составляет водород — самый легкий газ с малым
моментом инерции молекул. Для водорода Твр = 85 К, и до
температуры примерно 300 К значения с см к существенно
зависят от температуры газов (см. рис. 3.11). Для идеальных мно-
гоатомных газов теория теплоемкостей значительно усложняется-
80
Важным результатом молекулярно-кинетической теории
идеального газа являются выражения для коэффициентов пере-
носа теплоты, импульса (количества движения) и массы.
В соответствии с элементарной кинетической теорией
коэффициент теплопроводности, Вт/(м • К)
А = /срс.,
где cv - в Дж/(кг • К).
Если cv в ДжДмоль • К), то к - I ср cv/(3M), где М — молеку-
лярная масса (см. табл. 3.1).
Более точное решение для модели твердых взаимодействую-
щих сфер с эффективным диаметром о имеет вид
к = 8,33 • КГ2 Т/М / о2, (3.44)
где к — в Вт/(м - К); о - в А (1 А - 0,1 нм); М — в кг/кмоль.
Коэффициент внутреннего трения или динамическая вязкость
(отношение напряжения сдвига к градиенту скорости)
ц - 1ср/3 (в Па-с) или более точно
ц = 2,67 • 10’6 {МТ / о2, (3.45)
Коэффициент самодиффузии D и коэффициент диффузии Dn
молекул газа 1 в газе 2:
1 - 1 / п, - п? , - \
D=-IC', А2=Г -----------’---Z1C1 + J.....~Z2C2
3 3 ' «] + «2 «] + «2
Точные решения для модели невзаимодействующих твердых
сфер имеют вид
D - 2,662 • IO’4 у!т3 / М / (р о2); п ...
(М; + М2 ) / (М, М2 )
Р [( О] + °2 V2 I2
гДе D и Dn — в см2/с; р — в МПа; М — в кг/кмоль.
Все коэффициенты переноса могут быть связаны довольно
Простыми зависимостями. Физически это ясно, так как динами-
Неская вязкость определяет диффузию избыточного (сообщае-
мого) импульса молекул, а теплопроводность — диффузию
Избыточной (сообщаемой) кинетической энергии молекул.
6 Заказ № 1592 8 ]
Важно обратить внимание на следующее. Так как длина / сво-
бодного пути молекул обратно пропорциональна, а плотность р
прямо пропорциональна изменению давления, то согласно
уравнениям (3.44) и (3.45) теплопроводность X и динамическая
вязкость р не зависят от давления, что хорошо согласуется с
экспериментальными данными. Лишь при очень больших и
очень малых давлениях наблюдаются заметные отклонения. При
малых давлениях, когда длина свободного пути соизмерима с
определяющим размером d сосуда, теплопроводность и вязкость
уменьшаются и стремятся к нулю пропорционально давлению.
При весьма больших давлениях, когда длина свободного пущ
молекул соизмерима с их размерами, наблюдается тенденция к
увеличению теплопроводности и вязкости с повышением давле-
ния. В соответствии с элементарной теорией динамическая
вязкость и теплопроводность с повышением температуры увели-
чиваются пропорционально уГт. Эксперименты показывают, что
в действительности эти характеристики увеличиваются с повы-
шением температуры в несколько большей степени, чем V 7
Дело в том, что при повышении температуры нс только уве-
личивается скорость молекул, но и уменьшается эффективный
диаметр о, вследствие чего увеличивается длина свободного пуги
|см. уравнение (3.38)|. Это позволяет предположить, что опреде-
ленные безразмерные отношения примерно одинаковы для pas-
ных газов и незначительно зависят от температуры. Действи-
тельно, используя уравнения (3.44) — (3.46), (3.40) и (3.30),
найдем следующие значения чисел Прандтля, Шмидта и Льюиса
для одноатомного газа:
р с 2 р 5 Рг 4
Рг = 0,67 х. sh = ~- = 0,83 - Lu = -------= 0,8 = - .
К 3 р D 6 Sh '
(3.4?)
Эти значения удовлетворительно корреспондируются со зна-
чениями для большей части реальных газов в области умсрсншЛ
температур и давлений.
Необходимо привести теоретические результаты, обеспечива-
ющие достаточную точность для сильно разреженных газон П
широко используемые при расчете высоковакуумных систем-
Так, исходя из уравнения (3.39) для молекулярных режимов тече-
ния, характеризующихся числами Кнудсена Кп = l/d> 1, найдсМ
S2
секундный объем молекул газа, ударяющихся о поверхность
пдошадью /,
К = (3.48)
п 2п т
часто называемый пропускной способностью отверстия. Напри-
мер, Для азота, учитывая выражение (3.12), при температуре
293 К и /в м2, можно записать
J 1,38 • IO 23 - 293 • 6,02 - 1026 3
у = fV—-------------------------= 117,5/м/с, (3.49)
с у 2-3,14-28,016
если/—в см2, то Ис = 11,75/л/с.
Умножив Ус на разность давлений, найдем результирующий
поток газа из области с давлением р} в область с давлением р2 в
единицах, принятых в вакуумной технике:
О = К (р, - Л) = /(Р, -Р2> л///7- <3'50)
Скорость откачки через отверстие
S=Q/p}; (3-51)
при р -> 0 значение S -> Ус.
§ 3.4. РЕАЛЬНЫЕ ГАЗЫ
Для описания свойств газов при низких температурах или
больших давлениях модель идеального газа не является достаточ-
ной: она не учитывает характера молекулярных взаимодействий.
Молекулярные взаимодействия. Между молекулами реальных
газов существуют силы взаимодействия, характер и значения
которых определяются индивидуальными свойствами, строением
Молекул и значениями основных параметров — давления и тем-
пературы. Значения этих сил определяют внутреннюю потен-
циальную энергию молекул реального газа. При больших давле-
ниях и плотностях свойства газов зависят от размеров самих
Молекул. Молекулы не имеют определенных (жестких) размеров;
Размеры атомов и молекул могут изменяться в некоторых преде-
лах. Эти изменения обусловлены причинами, вызывающими
6* 83
деформацию электронных оболочек, поэтому в различных агре-
гатных состояниях и при разных по характеру взаимодействиях
“эффективные”, т.е. проявляющиеся в условиях конкретного
эксперимента, диаметры атомов и молекул могут быть различ-
ными. Обычно эффективные газокинстические диаметры атомов
находятся в пределах 0,2—0,5 нм; диаметр ядра атома оцени-
вается в 10‘5 нм. Электронные оболочки атомов непрерывно
колеблются относительно ядра даже при нулевой термодинами-
ческой температуре. Колебания электронных оболочек обуслов-
ливают появление электрических полей и объясняют механизм
возникновения сил притяжения Ван-дер-Ваальса. В молекулах
двухатомных газов ( Н2, N2, О2, F2, С12) атомы имеют общие
электроны (точнее, спаренные валентные электроны), образую-
щие общие электронные оболочки; такие связи называют гомсо-
полярными или ковалентными. В молекулах валентные элект-
роны находятся на более низких энергетических уровнях, чем в
атомах; разность уровней обусловливает значение энергии диссо-
циации. Если молекулы (или атомы) сближены так, что их элект-
ронные оболочки начинают проникать одна в другую, возни-
кает отталкивающая сила, быстро увеличивающаяся с уменьше-
нием расстояния и в конце концов превышающая силу притя-
жения.
Рис. 3.12. Зависимость энергии взаимо-
действия молекул некоторых газов (по-
тенциальное поле межмолекулярных сил)
от расстояния между молекулами
Теоретические кривые на
рис. 3.12 характеризуют меж-
молекулярное силовое поле
некоторых газов. Чем больше
силы притяжения между моле-
кулами (больше площадь так
называемой потенциальной
ямы), тем легче может быть
ожижен газ (например, СО2),
и, наоборот, для трудноожи-
жаемых газов (например, Н2 и
Не) с весьма низкой крити-
ческой температурой характер'
на малая энергия притяжения.
Предложены различные зави-
симости для выражения потеН'
циальной энергии взаимодей-
ствия молекул как функций
межмолекулярного расстояния
г. Все потенциальные функций
отражают тот факт, что при определенном сближении молекул
Притяжение сменяется отталкиванием. Наиболее широкое
применение получила зависимость Леннарда — Джонса для
неполярных молекул (не характеризующихся каким-либо
специфическим распределением электрического заряда). Это так
называемый потенциал “6-12” Леннарда—Джонса
Ф = 4г0 |(о/г)12 - (о/г)6], (3.52)
да е — постоянная, соответствующая минимуму потенциальной
энергии или максимуму энергии притяжения (т.е. глубина потен-
циальной ямы на рис. 3.12 равна отрицательному значению е0).
Вместо е0 часто используют отношение е0Д. Постоянная о
представляет собой межмолекулярное расстояние, при котором
ф (г) = 0. Другими словами, по физическому смыслу о — это
расстояние между двумя молекулами в момент наибольшего
сближения, поэтому собственный объем Ьо молекул одного моля
в соответствии с гипотезой “твердых сфер” определяют таким
образом:
/>0 = у л АФ3, (3.53)
где N — число Авогадро.
Параметры о и е0 можно надежно определить либо по диа-
грамме р—и—Т, либо по экспериментально найденным вязкости
и теплопроводности (табл. 3.2). Это существенно снижает прак-
тическую ценность потенциальной функции, оставляя за ней
ведущую роль при описании свойств реальных газов.
Приближенно при коэффициенте сжимаемости в критической
точке zk = 0,288 по данным Р. Схвеле
г0/к = 0,757; ; (3.54)
/>0 = 2 л No3/ 3 = 17,287;/^ . (3.55)
Более точные значения е0/к и а, определенные по экспери-
Ментальным значениям вязкости для различных газов:
Газ... сн О, Аг F, N2 Ne
с, нм .. 0,3758 2 0,3467 0,3542 0.3357 0,3798 0,282
е0/*, К ... 148.6 106,7 93,3 112,6 71,4 32,6
СМ3/МОЛЬ ... ... 66,98 52,6 46,08 47,75 69,14 28,3
Газ... н 4Не Кг Хе Н,0
°о> нм.... .. 0,2827 0,2551 0,3655 0,4047 0,2641
еоА, К .... 59.7 10,22 178.9 231,0 809,1
см3/моль... .... 28,5 20,95 61,62 83,66 23.25
84
85
Сжимаемость. Объемы единицы массы реального и идеального
газов могут различаться при одинаковых давлениях и температуре
в основном вследствие наличия межмолекулярных сил. Первые
систематические исследования сжимаемости газов проведены
еще в 1870 г. французским ученым Е.Амага. Произведение
для идеального газа при заданной температуре постоянно, т.е
объем газа обратно пропорционален давлению. Если при одина-
ковых давлении и температуре произведение pv для реального
газа меньше, чем для идеального, то единица массы реального
газа имеет меньший объем, т.е. сжимаемость реального газа
больше сжимаемости идеального (рис. 3.13). На рис. 3.13 отчет-
ливо прослеживаются следующие фундаментальные свойства
газов: lim (pVM)p 0 не зависит от рода газа и является функ-
цией температуры; частное от деления lim(pEM) на соответствую-
щую температуру не зависит ни от рода газа, ни от температуры
[универсальная газовая постоянная Яу = 8314,19 ДжДкмоль- К)].
Рис. 3.13. Изотермы различных газов в
координатахpV* - р (р* = 0,101325 МПа
— атмосферное давление)
Рис. 3.14. Кривые сжимаемости рсаль*
ных газов:
1 — кривая Бойля; 2 — идеальная
кривая; 3 — кривая инверсии эффекта
Джоуля-Томсона (Гивв„ и 7ИЯВ „ '
соответственно верхняя и нижняя
температуры инверсии; штриховые
линии — изотермы идеального мза)
Гжимаемость газов зависит от температуры и давления; откло-
ейИЯ от изотермы идеального газа (горизонтальная линия) в
бщем случае тем существеннее, чем больше давление и масса
молекул и ниже температура.
Для характеристики степени сжимаемости Е.Амага ввел без-
размерную величину
РА = Р^/(Р^)р^Ро, г- т„ = W(m)’ <3-56)
получившую название числа Амага или степени сжимаемости.
В знаменателе этого выражения значение произведения povo берут
для данного реального газа при начальных условиях.
Для идеального газа число Амага постоянно при заданной
температуре (рА ид = Т/То) и не зависит от давления, т.е. все
изотермы в координатах рА — р параллельны оси абсцисс. Для
реальных газов число Амага зависит не только от температуры,
но и от давления, причем характер этой зависимости в различных
областях состояний неодинаков. На рис. 3.14 приведена типичная
диаграмма изменений числа Амага для реальных газов. В области
высоких температур и небольших давлений изотермы в коорди-
натах рА — р близки к горизонталям (т.е. к изотермам идеального
газа) й отклоняются вверх при увеличении давления, т.е. при
каком-либо выбранном давлении р произведение pv для реаль-
ного газа больше, чем для идеального, следовательно, объем 1 кт
реального газа больше объема 1 кт идеального газа, а сжимае-
мость реального газа меньше.
При снижении температуры до некоторого значения, называе-
мого температурой Бойля Тв, принципиальный характер изотерм
не изменяется и лишь влияние давления проявляется более
сильно (кривизна изотерм увеличивается). При понижении тем-
пературы до значения ниже Тв (точка В на рис. 3.14) изотермы
в координатах рА — р имеют экстремум, где изменяется знак
производной (ЭрА/Эр)г. Температура Бойля для некоторых газов:
.........Воздух Ar О2 N2 Ne Н2 Не
Гв- К........347 412 423 326 121 109 18,2
Сжимаемость газа и определенной области состояний строго
°Пределяется знаком производной (ЭрА/др)г. При (ЭрА/Э/?)7 < 0
с*ймаемость реального газа больше сжимаемости идеального;
пРи (ЭрА/Э^)г > о — меньше, а при (ЭрА/Эр)г - 0 сжимаемости
Реального и идеального газов равны. Последнее справедливо
лько для точек экстремума, называемых точками Бойля; в них
86
87
3.2. Основные свойства газов и криогенных жидкостей
Параметр Обозна- чение Единица Значения для
Хе Кт сн4 О2 Аг Г во 1духа
Температура: кипения* плавления* (приближенно) критической точки тройной точки Давление: критической точки тройной точки Плотность: льда (приближенно) насыщенной жидкости насыщенного пара* газа’ при Т = 293 К Теплота: испарения* плавления (приближенно) Удельная теплоемкость: насыщенной жидкости’ насыщенного пара’ газа* при Т = 293 К Динамическая вязкость : насыщенной жидкости* насыщенного пара* газа’ при Т = 293 К Теплопроводность : насыщенной жидкости* насыщенного пара* газа’ при Т = 293 К Скорость звука’: в насыщенной жидкости в насыщенном паре Коэффициент поверхностно натяжения жидкости, равно весной пару (Пт Т)р^ з Па (“лед”) dim 7)„ >1() -и па С’-'юд”) Количество жидкости’, испаряющейся в сутки при теплопритоке 1 Вт г ? кип дл тк та рк Ра Ртв Р.Л рЛ рЛ г Л Гиа cf С СР СР ц 4- цТ ц ?? к ? к? к 4? а ? о?? ГО <3 -1- К МПа Па кг/м3 (г/л) Дж/г Дж/(г • К) мкПач Вт/(м • В м/с мН/м К Л 1 1 2 1 65,05 61,39 89.74 61,35 5,84 1600 3423 2941 10,0 5,49 95,7 17,26 ),349 0,16 3,168 0.16 1.096 450 13,3 23,0 0,0706 0,00315 0,00547 645,2 18,5 58,5 38,0 0,307 119,78 115,79 209,39 115.76 5,51 73190 2794 2413 8,803 3,40 107,6 22,6 0.545 0,263 0,25 0,147 372 10,8 25,0 0,09 0,0040 0,0093 684,3 15,5 42,5 27,5 0,33 111,7 90,7 191,06 90.66 4,64 11667.66 500 424,5 1,8 0,6679 509,54 58,6 3,45 2,09 = 1,55 2.22 1,69 102,8 4,49 11,0 = 0,2 4 =0,012 1 =0,032S 1430 = 270 13,3 39 24 0,4 90,188 54,4 154,78 54,361 5,107 152 1400 1142 4,8 1.331 212,76 13,95 1.696? 0,925? 0,964? 0,666? 0,922? 0,6581? 196 6,85 20,7 0,1515 0,0085 0,0261 900 175 13,45 34 22 0,36 87,29 83,85 150,72 83,81 4,864 68920 1624 1400 5,7 1,66 163,02 29,55 1,14 0,575 0,53 0,523 0.312 240 = 7 = 23 = 0,1 5 =0,00 0,016 819 12,5 33 20 0,31 84.95 53,5 144,31 53,481 5.215 252 1907 1510 5.63 1.58 175,5 13,4 1,5? 0,803 0,812? 0,561? 0.824? 0,6041? \ =265 7,5 = 23,5 2 =0,15 57 =0,00 7 =0.02 854 158 3 - 0,33 = 78,8 = 133 3,769 = 873 4,48 1,205 205,5 = 1,96? = 1,02 1.01 0,72 178 = 5,6 = 18 0,146 7 =0,0073 4 0,0255 177 0,48
Продолжение табл. 3.2
Параметр Обозна- чение Единица Значение для
Ne II, (нормальный — н, равновесный — р, параводород — п) 4Не ’Не н2о (для срав- нения)
Температура: кипения* т Т кип 77,36 27,108 20,39(H) 4,224 3,191 373.15
плавления* (приближенно) т Т пл К 63,2 24,6 20,28(р) 13,96 См.рис.3.23 См.рис.3.23 273,15
критической точки Тк 126,6 44,45 33,24(н) 5.2014 3,324 647.31
тройной точки Та 63,15 24,56 32,9(р) 13,95(н) 273,16
Давление: критической точки Рк МПа 3,398 2,721 13,81(р) 1,297(h) 0,2275 0,1165 (точно) 23,62
тройной точки Ра Па 12535,7 43307,5 1,287(р) 7200.6(h) 611.2
Плотность: льда (приближенно) Рта Ри< — 947 1400 7040,6(р) 86,7 190 143 900
насыщенной жидкости кг/м3 808 1204 =70,8 125 60 958
насыщенного пара Рг.; (г/л) 4,61 4.8 1,34 = 15,5 =22 0 5975
газа при Т = 293 К РгТ 1,165 0,8385 0,08374 0,1663 0,124
Теплота: испарения* Дж/кг 199 85,7 447 20,8(=22") 5,7 8 5 2257 2
плавления (приближенно) 'пл 25,8 16,62 58,7 3,3 333
Удельная теплоемкость’: насыщенной жидкости ср — 2.05 Т 1,82 Т 9,7 Т (п) 5.0 Т 4,6 4,22
насыщенного пара Са СР Дж/(г- К) 1,03 = 1,2 J, 1.17 5.75 Т (п) 12,1 Т (п) 2,37 Т 8,25 Т — =3,73 2,038
С. — 0.652 6.5 Т (п) 3.28 И 52
газа при 1 - 293 К ср 1.04b 1.039 14.85 ’ (п) J.2 : : .
с„ 0.745 0.62 10,7 J T (пУ Л/.sjr / 4./VS /
Динамическая вязкость*: насыщенной жидкости насыщенного пара газа при Т = 293 К ц 4 цТ ц J-T мкПа-с 152 5 17,8 =124 =4,5 =32 13,2(п) 1,13(п) 8,15(п) 3,6 1,25 18,9 1,9 =1,2 =16,3 =317,2 12,1
Теплопроводность : =0,0145 =0,675
насыщенной жидкости 0,14 =0,13 0,0988(п) 0,0197
насыщенного пара к? Вт/(м • К) =0,007 =0.008 0,0169(п) 0,0106 =0,0125 0,024
газа при Т = 293 К ш 0,025 0.049 0.176(п) 1,465 — —
Скорость звука’: 180 1450
в насыщенной жидкости a i м/с 880 — 1090(п) 172
в насыщенном паре a J-T 177 135 355(п) 100 — —
Коэффициент поверхностно? натяжения жидкости. равновесной пару ) с 4- мН/м 8,85 4,85 1,93 0,096 =0,02 75,6
(Ит Т^ю-з Па (“лея”) — К 29 9 4,8 =0,6 (жидкость) =0,2 (жидкость) 173
(1тт Т)^10-н Па(“лед”) — 18 5,5 2,7 — — ИЗ
Количество жидкости’, испа- ряющейся в сутки при тепло притоке 1 Вт — Л 0,54 0,84 2,73(п) 33,2 170 —
’ Свойства при давлении 0,101325 МПа.
*' Для Не II.
Примечание. Ф — общая тенденция к уменьшению при увеличении давления: Т — общая тенденция к увеличению
при увеличении давления; J.T — слабая зависимость от давления.
объем газа при данной температуре обратно пропорционален
давлению. Совокупность точек экстремумов образует кривую
Бойля. Кривая Бойля и ось ординат ограничивают область, t
которой (дрА/др)т < 0, и сжимаемость реального газа болыц.
сжимаемости идеального газа; в остальных областях сжимаемое^
реального газа меньше сжимаемости идеального.
Изотермы реального и идеального газов при температуре Hiixt
температуры Бойля пересекаются в точках а, в которых реальньц.
газ отвечает уравнению состояния идеального газа. Геометричес.
кое место этих точек образует так называемую идеальную
кривую. В области между кривой Бойля и идеальной кривой
(участок ab) сжимаемость реального газа меньше сжимаемости
идеального, однако абсолютные значения объемов (при данных
давлении и температуре) реального газа меньше объемов идеаль-
ного газа. Таким образом, идеальная кривая и ось ординат огра-
ничивают область, в которой объемы реальных газов меньше
объемов идеальных газов при одинаковых Тир.
Методика исследования сжимаемости постоянно совершен-
ствуется. К настоящему времени накоплен большой объем
информации о сжимаемости газов и жидкостей в разных диапа-
зонах параметров. Практическая важность этой информации
заключается в том, что она не только устанавливает связь пара-
метров состояния в простой форме, но и позволяет определить
и объяснить изменение всех термодинамических функций
Например, изменение энтальпии (i = и + pv) и инверсия
эффекта Джоуля — Томсона полностью определяются измене-
нием сжимаемости газов при изменении параметров состояния.
Уравнения состояния. Простейшее по форме эмпирическое
уравнение состояния реального газа, полученное по результатам
исследования сжимаемости, имеет вид:
для 1 кг газа
pv = zRT;
для G кт газа
pV=zGRT, (3.57)
или в форме уравнения Менделеева — Клапейрона (3.8)
pV=zN„RyT; pV„ = zRyT; PV=zGRyT/M. (3-581
Безразмерный коэффициент
Z = pv/(RT) (3.591
называется коэффициентом сжимаемости.
92
Если знаменатель числа Амага отнести к идеальному газу, что
доПУстимо’ так как ПРИ низких давлениях газы ведут себя как
идеальные, то между числом Амага и коэффициентом сжимае-
мости можно установить следующую связь:
z=—Г,/Г=рл/Рл„,- (3.60)
RT То
Как и рА, коэффициент сжимаемости z является функцией
давления и температуры. Изотермы в координатах z — Р имеют
тот же характер, что и в координатах рА — р\ отличие состоит
лишь в том, что все изотермы в координатах z — р исходят из
одной точки с ординатой, равной единице, и абсциссой, равной
нулю [см. уравнение (3.60)]. На рис. 3.15 даны универсальные
графики для определения коэффициентов сжимаемости в
приведенных (безразмерных) координатах. Вследствие термоди-
намического подобия для реальных газов, находящихся в соот-
ветственных состояниях, при одинаковых приведенных пара-
метрах коэффициенты сжимаемости равны. Однако подобие не
является вполне строгим, например, в критической точке зна-
чения коэффициента сжимаемости zk несколько различаются:
Газ Не н2 Ne n2 о2 Аг
% 0,3 0,292 0,296 0,291 0,292 0,290
Газ Кг Хе СО сн4 со2 н2о
** 0,291 0,290 0,294 0,290 0,274 0,23
Для более точного определения следует использовать специ-
альные таблицы, в которых приведены значения z, вычисленные
при разных zk [60]. Однако для ряда газов эти отличия несущес-
твенны, поэтому практически значения z можно определить при
среднем zk = 0,29 (табл. 3.3). Теоретические методы определения
коэффициента сжимаемости z с использованием потенциала
Деннарда — Джонса не имеют особого практического значения
вследствие большой погрешности.
Вириальная форма уравнения состояния
ЦЛЯ представления экспериментальных данных без раскрытия
Механизма, управляющего поведением молекул, впервые
предложена в 1901 г. Камерлинг-Оннесом:
pv = А(1 + B/v + C/w2 + I)/»3 + ... ), (3.61)
Г21е В, С, D — вириальные (“силовые”) коэффициенты.
93
Рис. 3.15. Зависимость коэффициента сжимаемости z = pv/(R Т) от приведенный
параметров состояния [58]: давления тг = р /рк, температуры т = Т/Тк, удельного
объема <р = v/ (RTk/рк) = zt/я в областях относительно малых (а) и больших (Й
давлений (сплошные линии — т = const, штриховые — <р = const)
94
3 з. Коэффициент сжимаемости для газов и жидкостей при zk = 0,29 [58]
Значения z при приведенном давлении п = р/рк
температура х = Т/Т, 1,15 1,0 0,9 0,8 0,6 0,5 0.4 0.3 0,2 0,1 0,001
Or 15 до 3 1,000 1,000 1,000 1,000 1,000 1,000 1,000 1,000 1,000 1,000 1,000
2,0 0,985 0,988 0,990 0,990 0,992 0,993 0,994 0,994 0.994 0,944 1,000
1,5 0,916 0,930 0,939 0,946 0,956 0,965 0,963 0.980 0,986 0,992 0,999
1,2 0,765 0,799 0,822 0,842 0,888 0,916 0,931 0,948 0,967 0,984 0,998
1,1 0,641 0,702 0,742 0,776 0,840 0,870 0,899 0,927 0,955 0,979 0,998
1,0 0,223 0,290 0,5 54_ 0,652 _0,760 0,808 0,852 0,893 0,934 0,969 0,996
0,9 0,193 0,169 0,15Т 0,13б| 0,103 £70£ 0£75 0,840 0,900 0,950 0,995
0,8 0,190 0,165 0,112 0,133 0,101 0,084 0,067 0,051 0,854 0,925 0,994
0,7 0,198 0,171 0,155 0,138 0,104 0,087 0,070 0,052 0,035 0,018 0,993
0,6 0,214 0,186 0,168 0,149 0,112 0,094 0,075 0,056 0,038 0,019 0,990
0,5 0,241 0,210 0,189 0,168 0,126 0,105 0,084 0,063 0,042 0,021 0,988
Насы- щенная жидкость — 0,290 0,177 0,150 0,103 0,086 0,068 0,051 0,034 0,018 —
Насыщен- ный пар — 0,290 0,460 0,536 0,650 0,698 0,746 0,790 0,830 0,900 —
Примечание. Значения над штриховой линией указаны для газообразных
состояний, под штриховой линией — для жидких состояний.
Вириальные коэффициенты являются функциями темпера-
туры и свойств газов, т.е. для каждой изотермы значения В, С,
О, ... различны. Например, для азота:
т, К........................ 80 100 273
В, см3/моль............... -250,8 -162,1 -9,5
С, смб/моль2 .............. 2,1 0,85 0,082
D, см’/моль3 ..............-0,2 -0,06 0,0016
Обычно вириальные коэффициенты записывают в виде поли-
номов: в = в0 + в}/т+ в2/т2 + ...
Первый вириальный коэффициент А в уравнении (3.61) зави-
сит только от температуры и не зависит от свойств газов:
А = liinQw^ _^0 - RT , (3.62)
Поэтому уравнение состояния в вириальной форме можно пред-
^вить в одном из следующих видов:
pv/(RT) = z ~ 1 + B/v + C/v2 + D/v2 + ... ;
95
pv/(RT) = z — 1 + В p + Ср2 + D p3 + ... ;
p = RTp + S'p2 + C'p3 + D'p4 + ... , (3.63)
где В' = RTB, C = RTC и т.д.
Иногда предпочитают разложение коэффициента сжимае-
мости в ряд по степеням давления:
pv/(RT) = z= 1 + В"р + Ср2 + D"p3 + ... (3.64)
Вириальные коэффициенты в уравнениях (3.63) и (3.64) связа-
ны простыми зависимостями:
RT с„ = С - В2 Р-ЗВС+2В3
В RT2 RT3
(3.65)
Для многих промышленных газов (азота, кислорода, воздуха,
водорода, гелия и др.) наиболее широко используют следующий
вид уравнения состояния:
10 7
z = 1 + Z Z BnJ , (3.66)
л=1 j-u
где со = р / р*. — приведенная плотность; т = Т/Тк — приве-
денная температура; Bnj — коэффициенты, определяемые мето-
дом наименьших квадратов. В настоящее время для большинства
криопродуктов на основе уравнения (3.66) составлены таблицы
стандартных справочных данных [18].
Примерно до 40-х гг. вириальную форму уравнения состояния
рассматривали лишь как способ представления эксперименталь-
ных данных. Работами Н.Н.Боголюбова и Дж.Майера доказано,
что теоретическое уравнение состояния реальных газов также
имеет вириальную форму. Успехи, достигнутые в развитии экспе-
риментальной и теоретической термодинамики, статистической
физики и квантовой механики, позволили разработать различные
методики определения значений вириальных коэффициентов. На
этой основе были обобщены и экстраполированы эксперимен-
тальные р — v — Т данные, результаты исследования тепловых
свойств и построены подробные термодинамические номограм-
мы и таблицы практически для всех промышленных газов (сМ-
приложение — диаграммы) и их смесей [18, 29].
В качестве примера приведем единое уравнение состояния
смеси N2 — О2, предложенное в 1982 г. и тщательно проверенное
96
яа основе имеющихся экспериментальных данных. Методика
получения уравнения базируется на известном полуэмпиричес-
ком правиле Кричевского — Казарновского, которое для бинар-
ной смеси реальных газов имеет вид
^см = % + % + -W12 -
(3.67)
где Z2 — коэффициенты сжимаемости чистых компонентов
при плотности р (молярном объеме V) и температуре смеси Т;
у}> у2 — молярные доли компонентов в смеси; г12 — поправка,
учитывающая межмолекулярное взаимодействие разнородных
молекул, являющаяся достаточно точной функцией плотности
и температуры и не зависящая от состава.
Для определения г12 (К Т) достаточно найти эксперименталь-
но р — v ~ Т - свойства смеси любого постоянного состава.
Для смеси N2 — О2 при этом используют р — v — Т - свойства
воздуха, считая его бинарной смесью N2 и О2 с эффективной
молярной долей азота = 0,7821.
Из уравнений (3.66) и (3.67) можно получить общее уравнение
для смесей N2 — О2:
10 7
^см У) - [1 + X X (Dn • <o"N / TyN ) ] yN +
И-1 jM) 2 2 2
10 7 .1
+ [i + E £ (B2nj<o”N? A7n, ) I уо2 +
L n=\
10 7 ]
+ [L X (S12„Xn2/T 4) 1ж-4 • <3-68)
* n=\ j=0
Коэффициенты B2nj и S]2n/ определяют по формулам.
По2 V / ^O2 V
^XN2 ^n2
1 / ткВ у/
Жв1о2в ' 7jtN2 ' '
5N2 nj
Уо2в "l"j
где BnJ — коэффициенты уравнения (3.67); индексы N2,
относятся соответственно к N2, О2 и воздуху.
2 Заказ № 1592
(3.69)
О2 и В
97
Практическое использование уравнения (3.68), как и уравне-
ния (3.66), предполагает применение ЭВМ. Это особенно необхо.
димо, когда независимыми термодинамическими параметрами
являются температура и давление. Для решения нелинейного
алгебраического уравнения (при нахождении плотности смеси)
удобно применять метод половинного деления (метод дихо-
томии).
Уравнение (3.68) можно рекомендовать для расчета плотности
смесей N2 - О2 в интервале температур 65-600 К при давлении
до 60 МПа, исключая околокритическую область изменения
параметров (0,9 < Т/Т^ < 1,1; 0,9 < р/рпк < 1,1, где Тпк и рпк -
псевдокритическис температура и давление), в которой погреш-
ность может составлять 5-40 %. Псевдокритические параметры
смеси Тпк и рт определяют по правилу Кэя: Тпк = Z У,Тк1\
Aik = Z У^к1
Уравнение (3.68) позволяет, используя известные термодина-
мические уравнения связи параметров, определить летучесть,
энтальпию, энтропию и другие свойства смесей N2 — О2, а также
рассчитать фазовое равновесие.
Для параметров бинарных смесей вблизи критических точек
справедливо полуэмпирическое уравнение
у - ук= В (Т - Тк)$,
где Тк — критическая температура смеси; у и ук — доли компо-
нента в жидкости (или паре) и в критической точке; В —
индивидуальный коэффициент для данного вещества; р — так
называемый критический индекс (обычно р = 0,33).
Правило Кричевского — Казарновского [уравнение (3.67)|
можно использовать и для расчета многокомпонентных смесей
реальных газов; в этом случае его записывают в виде
гсм = Z г,-у, + £ , (3.70)
1 Д1
где Zjj — поправка, учитывающая межмолекулярное взаимодейст-
вие разнородных молекул в бинарных смесях компонентов i И )
Эмпирические уравнения состояния, записанные в вир'иаль-
ной форме, в настоящее время наиболее употребимы, хотя не
раскрывают механизма, управляющего поведением молекул
реального газа. Наряду с этим известно множество эмпирически*
уравнений состояния с различными индивидуальными коэффИ'
98
^лентами, введением которых их авторы пытались учесть все
многообразие и сложность молекулярных взаимодействий,
цапримср, конечный объем молекул и силы их притяжения,
склонность к ассоциациям в двойные и тройные комплексы,
несимметричность и другие особенности реальных веществ. В
качестве примеров можно привести уравнения:
Дюпре р (v - b) = RT ;
Гирна (р + n)(v - b) = RT ;
Ван-дер-Ваальса (р + a/v2) (у - 6) = RT;
Бертло [ р + а/ (Tv2) ](& - b) — RT ;
Дитгеричи
а
vRT \
ре I (у - Ь) = RT;
Редлиха—Квонга
+ Д_______________
Р Т°-5 v(v + b)
(у - b) — RT .
(3.71)
Кроме того, используют уравнения Клаузиуса, Цейнера, Тум-
лирца, Риттера, Гудснуфа, Календера, Вукаловича—Новикова,
Битти—Бриджмена, Бенедикта—Вебба—Рубина. Последние два
уравнения наиболее точные, но содержат соответственно пять
и восемь коэффициентов. Известно более 150 уравнений состоя-
ния такого типа с различным числом коэффициентов. Ряд урав-
нений можно представить в общем виде в форме уравнения
Амага
lp+f№]f2^ = RT. (3.72)
Важно отметить, что все уравнения можно преобразовать для
записи их в вириальной форме (табл. 3.4).
Если уравнение Ван-дер-Ваальса записать в виде
р - RT/(v - 6) - alv2 , (3.73)
10 легко определить первую и вторую производные и, приравняв
Их нулю [см. уравнение (3.2)], найти в результате решения
сИстемы уравнений значения критических параметров или полу-
пить выражения для их определения (см. табл. 3.4). Из двухпара-
метрических кубических уравнений состояния наиболее точнос
уравнение Редлиха — Квонга. Значения коэффициентов а и ь
для газов различны:
Газ.........................N2
а, МПа • К0'5 • (л/моль)2... 1,56
СН4 Ne
3,19 0,175
0,03 0.014
й, л/моль..............0,027
Уравнение Редлиха — Квонга часто используют при описании
фазового равновесия и прогнозировании критических и других
параметров смесей. В несколько измененном виде оно известно
как уравнение Редлиха — Квонга — Соава:
, °
Р + ---------------
v (у + Ь)
(v - b) = RT.
Закон соответственных состояний. Если поверхности состоя-
ний разных газов геометрически подобны, то при соответствую-
щем масштабном преобразовании они должны совпадать. Термо-
динамическая поверхность, которая представляет собой ряд
совмещенных (масштабными преобразованиями) поверхностей
состояний нескольких газов, должна описываться уравнением,
нс содержащим индивидуальных коэффициентов. Впервые на
возможность получения такого уравнения указал Ван-дер-Ваальс.
Согласно табл. 3.4 между коэффициентами a, b, R и параметрами
рк, ик и Тк существует однозначная связь, поэтому а, b и R можно
исключить из уравнений состояния. Подставив в уравнение Ван-
дер-Ваальса выражения для а, b и R, включающие критические
параметры, получим
р + 3 у ]_ 8 Т
Рк (v/Vk? Vk 3 3 Тк
Используя приведенные параметры (р/рк — тс — давление,
v/vk = (р — объем, Т/Тк = т — температура), получим уравнение
(л + 3/(р2) (Зф - 1) - 8т , (3.74)
известное как приведенное уравнение Ван-дер-Ваальса.
Уравнение Редлиха — Квонга в обобщенной форме
п = т/((р - 0,0867) - 0,4278/[т°’5(р (ф + 0,0867)]. (3.75)
Таким образом, все вещества можно описать одним уравнение#
состояния, если оно выражено через приведенные переменные. Это
100
101
весьма важный закон термодинамического подобия — закон
соответственных состояний. Два или несколько различных ве-
ществ с двумя равными одноименными приведенными пара-
метрами находятся в соответственных состояниях. При этом,
несмотря на присущие телам различия, их термодинамические
поверхности совпадают; в результате и свойства тел (опреде-
ляемые характером поверхности) в этих состояниях одинаковы.
Закон соответственных состояний имеет большое прикладное
значение как основа обобщения теоретических и эксперимен-
тальных данных для реальных веществ (см., например, значения
коэффициента сжимаемости на рис. 3.15). В действительности
приведенные термодинамические поверхности различных реаль-
ных веществ полностью не совпадают, и подобие является
приближенным. Одним из дополнительных условий, при котором
подобие выполняется более строго, является условие равенства
коэффициентов сжимаемости zk в критической точке.
В 1969 г. Роулинсом и Ватсоном предложена расширенная
форма закона соответственных состояний, согласно которой в
соответственных состояниях равны коэффициенты сжимаемости
и приведенные конфигурационные части свободной энергии,
обусловленные межмолекулярными взаимодействиями и опрсде-
Р
ляемые как J (^ - 1) dp / р . При этом п, ср, т неодинаковы,
о
Внутренняя энергия. Теплоемкость. Межмолекулярные силы
определяются давлением и температурой, поэтому и внутренняя
энергия реального газа зависит от этих параметров. Из уравнения
(2.80) и пояснения к нему следует, что для реального газа
внешнее давление уравновешивается нс только “тепловым”, но
и внутренним давлением, обусловленным силовым взаимодейст-
вием молекул. Интегрированием (Эи/Э0г [см. уравнение (2.76)]
можно определить внутреннюю энергию, если известно урав-
нение состояния. Например, для газа Ван-дер-Ваальса из уравне-
ния (3.73)
(dp/dT)v= R/(v - Ь). (3.76)
Подставив это выражение в уравнение (2.80), получим
(du/dv)T = RT/(y - b) - р = a/v2. (3.77)
Тогда
и — и0(Т) - a/v, i = и0(Т) - a/v + pv. (3.7Ю
102
В общем случае теплоемкости реального газа с и cv зависят
де только от температуры, но и от давления (плотности). Однако
теплоемкость cv газов, подчиняющихся уравнению состояния
типа уравнения Амага (3.72), является функцией только темпера-
туры (как и для идеального газа). Например, для газа Ван-дер-
Ваальса
Э2и
ди дТ
(3.79)
Э / а \
— --- = о
дТ ' v2 '
Независимость cv от плотности с физической точки зрения
объясняет совпадение шкалы газового термометра, термометри-
ческим веществом которого является газ Ван-дер-Ваальса, с
термодинамической (абсолютной) шкалой температур. Теплоем-
кость многих реальных газов следует этому закону с достаточно
хорошим приближением, поэтому, в частности, изохорные сече-
ния поверхности состояний реального газа имеют существенно
более простую конфигурацию, чем изобарные, а сами изохоры
в координатах Т — х близки к конгруэнтным (параллельным)
линиям.
Все термодинамические функции и теплоемкости реального
газа можно выразить через коэффициент сжимаемости Z- Напри-
мер, соотношение Майера [см. выражения (2.88) и (3.15)] примет
следующий вид;
ср—cv —Rk\ R/cp = (k- l)/(fcx); R/cv = (к - 1)/х, (3.80)
Z \ дТ 1р \ дТ >v'
Л d 1 Р
^граммы
Основные термодинамические таблицы и диаграммы реальных
Веществ. Термодинамические таблицы и диаграммы имеют
большое практическое значение; их используют при расчете
Криогенных систем и установок. В них отражен огромный объем
^формации о свойствах реальных веществ в различных агрегат-
ных состояниях. Издана серия могографий по термодинами-
ческим свойствам Не, N2, О2, воздуха, метана и других газов
1 °> 29]. Наряду с этим для упрощенных расчетов и графических
Построений практически применяют следующие диаграммы.
а м м а Т — s (рис. 3.16). Основное преимущество
Т — х заключается в наглядности и простоте изобра-
Ния важнейших рабочих процессов (изоэнтропы — вертикаль-
103
Рис. 3.16. Общий вид диаграммы
T—s для чистого вещества:
А, Б, В — области соответственно
газообразных, жидких и твердых
состояний: Г . Д, Е — области
соответственно кипения—конден-
сации, плавления—затвердевания,
сублимации
ные линии; изотермы — горизонтальные линии; количества теп-
лоты — площади под линиями процессов; изобары в первом при-
ближении отражают процессы в теплообменниках). Из уравне-
ний (2.74) угловые коэффициенты изобар и изохор соответст-
венно равны:
0773^=77^; (ЭТ/Э^ Т/с,- (3.81)
Производная (3 T/ds) всегда положительна, поэтому изобары
для однофазных состояний — всегда восходящие кривые. Для
двухфазных состояний ср не имеет смысла. В области насыщения
для чистого вещества изобары совпадают с изотермами.
Изохора, исходящая из одной точки с изобарой, располагается
выше, поскольку всегда ср > cv и
(37735)., > (Э77Э5)р. (3.82)
В области насыщения cv не теряет своего физического смысла,
но численно изменяется, поэтому изохоры при “вхождении'’ в
область насыщения обычно имеют точку перелома на линии
насыщения; в этой точке изменяется угловой коэффициент. При
пересечении с изотермой тройной точки (7^) изохора имеет
разрыв.
Угловой коэффициент изоэнтальпы в координатах Т — s опре-
делим из выражения (2.60) подстановкой полного дифференциала
функции р = f (Т, s):
-к-_______!_____1 _!_______= г- 1/Ц , (,и)
' Зх п (dv/dT)p/v i v (dp/dT)s v(dp/dT)s
где Р — температурный коэффициент объемного расширения (2.69)-
104
Знаменатель этого выражения положительный, и характер
цзоэнтальп определяется соотношением Т и 1/р. В той части
области газообразных состояний и области насыщения, где
1/Р < Т, изоэнтальпы представляют собой падающие кривые.
Дри больших плотностях, наоборот, 1/Р > Т, и в этой области
состояний изоэнтальпы — восходящие линии. В точках экстре-
мума (максимума) угловой коэффициент (ЭТ/Эх), = 0, и уравнение
кривой, являющейся геометрическим местом точек экстремумов,
в соответствии с выражением (3.83) имеет вид
QvfiT)p = v/T (3.84)
и представляет собой уравнение линии инверсии. В этих точках
частная производная (дТ/Ър\ также обращается в нуль.
При построении диаграмм Т— s существенно определение
абсолютных значений 5 или выбор начала отсчета. Для ряда
диаграмм принято 5 = 0 при Т— 0 на основании формулировки
третьего начала термодинамики, данной М. Планком. Однако
принципиально возможно принять за начало отсчета (т.е. 5 = 0)
любое состояние — такой прием равноценен условному выбору
точки начала координат. Например, часто за начало отсчета при-
нимают точку пересечения двух пограничных кривых (точка а
на рис. 3.16). Иногда при построении диаграмм принимают и
другие условия, поэтому практическое использование различных
диаграмм требует внимательного отношения к выбору начала
отсчета. Если при расчете криогенной системы приходится
использовать разные диаграммы для одного и того же вещества,
то для исключения ошибок необходимо проверить совпадение
точек начала отсчета для энтропии и энтальпии и, если необходи-
мо, привести их значения к общему началу отсчета. Это в равной
степени справедливо для всех термодинамических диаграмм.
Диаграмма i — s. Из выражений (2.60) и (2.68) можно
найти угловой коэффициент изотермы в координатах i — s:
= Т- 1 = Т- 1/₽ . (3.85)
(dv/dT)p/v
В области Т > 1/Р изотермы являются восходящими кривы-
ми, в области Т < 1/Р — падающими. Таким образом, по
Характеру прохождения изотермы в диаграмме i — 5 обратны
Изоэнтальпам в координатах Т — s. В точках инверсии производ-
8ая (di/ds)T обращается в нуль. Изохоры в координатах i — 5
^Уче изобар (рис. 3.17).
105
Рис. 3.17. Общий вид диаграммы i—s
Рис. 3.18. Общий вид диаграммы i—T
(а — тройная точка; ab — участок
пограничной кривой плавления)
В области двухфазных состояний (dv/dl") поэтому
(di/ds)T = (Э//Эх)р = Т= const; здесь изотермы совпадают с изоба-
рами и являются прямыми линиями. С повышением темпера-
туры угол наклона прямых увеличивается.
Диаграмму i — s используют при предварительных расчетах
и исследовании детандерных машин.
Диаграмма i — Т часто является исходной при построе-
нии других диаграмм; ее широко используют в практике низко-
температурных расчетов, особенно теплообменных аппаратов.
Эту диаграмму строят следующим образом. Для давления
р —> 0, при котором газ можно считать идеальным, вычисляют
функцию i = f(T): i = z0 + cpT. Такая зависимость при ср = const
является линейной. Постоянную /0 выбирают условно из расчета,
чтобы в наиболее употребимых областях диаграммы были поло-
жительные значения i. Для других давлений изобары строят на
основе экспериментальных
данных об интегральном
эффекте Джоуля — Том-
сона. При построении диа-
граммы i — Т особые труД'
ности представляет нанесе-
ние пограничных кривых:
их строят по значениям
теплоты парообразования-
В точках инверсии изобарь1
пересекаются (рис. 3.18).
106
Кроме рассмотренных диаграмм широко применяют и другие,
яапример диаграммы pv — р; i — 1g р; z — р\ р — Т (рис. 3.19),
а также диаграммы для различных газовых смесей.
Теплопроводность. Вязкость. Диффузия. Теория переноса теп-
лоты, импульса и массы в реальных газах достаточно развита.
Например, теория Чэпмена — Энскога учитывает потенциальную
энергию <р(г), и общие решения имеют вид
А = 8,33- 10‘Н Т/М (о2 QJ1; (3.86)
ц = 2,67- МтЧ МТ (о2 Q J'1; (3.87)
. / ,,, IМ. + М,
D„ = 1,884- К)’4 Т3/2 А 3 2
12 у \ М] л/2
/ о, + о,\2
-1
, (3.88)
где X — теплопроводность, Вт/(м-К); ц — динамическая вяз-
кость, Па • с ; Dn — коэффициент диффузии, см2/с; о — в А;
р — в МПа; Cl v и Q D -— интегралы столкновений, определяемые
на основе принимаемой потенциальной функции.
Если интеграл столкновений, например определяют для
потенциальной функции Леннарда — Джонса, постоянные кото-
рой (о и £0) вычислены по экспериментальным данным о вяз-
кости, то уравнение (3.87) с высокой точностью описывает
изменение вязкости при небольших давлениях. То же относится
и к другим коэффициентам. В табл. 3.5 приведены значения для
потенциала Леннарда — Джонса.
Пример. Вычислить вязкость азота при 'Г = 293 К и нормальном атмосферном
давлении.
По табл. 3.5 найдем постоянные потенциальной функции Леннарда — Джонса
Для азота: с = 3,798 А (0.3798 нм); e0/fc = 71,4 К.
Приведенная температура Т' = кТ/ед = 293/71,4 = 4,1.
Согласно табл. 3.5 при Т' = 4,1 интеграл столкновений Я = 0,9649.
Динамическая вязкость [по формуле (3.87)]
ц = 2,67 • 10’6 V 28 • 293 (3,7982 • 0,9649 )'' = 17,4 мПа • с;
экспериментальное значение вязкости (см.табл. 3.2) ц = 17,8 мПа-с.
Сопоставив выражения (3.44) — (3.46) с уравнениями (3.86)—
(3.88) и учтя данные табл. 3.5, можно убедиться в том, что меж-
^ОДекулярныс взаимодействия в реальном газе существенно вли-
ЯЮт на значения коэффициентов переноса в области низких тем-
ператур. Вместе с тем результаты экспериментальных исследо-
ваний подтверждают, что в диапазоне давлений от 133 до 2 МПа
107
3.5. Значения интеграла столкновений £1 v при разных
приведенных температурах Т*
т" Я, Т т' Я,
0,3 2,785 1.6 1.279 3,5 0,9999
0,35 2,628 1,65 1.264 3.8 0,9811
0.4 2,492 1,7 1.248 4.0 0,97
0,45 2.368 ! 1.8 1,221 i 4,1 0,9649
0,5 2,257 1 [’9 1,197 4,4 0,9507
0,6 2.065 ; 1,95 1.186 4,7 0,9382
0,7 1.908 1 2,0 1,175 5,0 0,9269
0.8 1,780 i 2J ! 2 2 1.156 6,0 0,8963
0.9 1,675 1,138 7.0 0,8727
1.0 1,587 i 2,4 1,107 9,0 0,8379
1,1 1,514 ! 2,6 1,080 10 0,8242
1,2 1,452 1 2,8 1,058 20 0,7432
1,3 1,399 3,0 1,039 40 0,671
1,4 1,353 3,2 1,022 60 0,633
1,5 1,314 3,4 1,007 100 0,588
вязкость и теплопроводность практически зависят только от
температуры, и влияние давления при инженерных расчетах
можно не учитывать. При этих условиях значения лиц для газов
можно определить по интерполяционным формулам Сазерленда:
Х293(77293)1’5(293 + С)/(Г + Q; (3.89)
ц293(77293)1’5(293 + Q/(T + Q, (3.90)
где л293 и ц293 — теплопроводность и динамическая вязкость при
температуре 293 К (см. табл. 3.2); С — постоянный коэффициент:
Газ.. СН4 О2 Лг N2 Ne Н2 4Не Кг Хе Воздух
С.... 162 131 142 114 56 73 78 188 290 124
При указанных выше условиях % и ц связаны зависимостью,
которая выражается модифицированным уравнением Эйкена
X = р (1,77 - 0,45Д)ср, (3.91)
где к = cp/cv\ ср — в Дж/(кг • К).
Надежные данные о значениях X и ц при низких (меньше 130
Па) и высоких (больше 2 МПа) давлениях, а также для жидких И
твердых состояний получены экспериментально и обобщены в
работах [18, 58]. Некоторые из этих данных указаны в табл. 3.2-
Следует отметить, что вязкость неныотоновых жидкостей (раствоРь1
108
полимеров, краски и др.) зависит не только от температуры и
давления, но и от силы сдвига или градиента скорости.
Коэффициент диффузии для реальных газов можно рассчитать
до эмпирической формуле Фуллера
^12 1,01325 • 10'4 г3/2 1 + 1 (3.92)
Р [ К11/з + 1^3 ]2 V Му м2 ’
где L К1 и )12 — в см2/с; Р — в МПа; и М2 — молекулярные массы; И2 — атомные или молекулярные диффузионные объемы:
Газ.. V..... Н ....1,98 О 5,48 N 5,69 Н2 7.07 N2 17,9 о2 16,6 со 18,9 со2 26,9
Газ.. V..... ... N2O ....35,9 Аг 16.1 Кг 22,8 Хе 37,9 Не 2,88 NH3 14,9 Воздух 20,1 Н2О 12,7
Кроме того, можно использовать приближенную зависимость
коэффициентов диффузии и самодиффузии от температуры и
давления:
D- Do(po/p)(T/Toy, (3.93)
ще Do — коэффициент диффузии при температуре То и давлении
р0; п — показатель степени (для одноатомных газов п — 1,66,
для двухатомных и многоатомных п — \,"П, для насыщенных
паров п = 2 [58]).
Основные физические свойства наиболее широко используе-
мых криогенных жидкостей и газов приведены в табл. 3.2; там
же указаны и свойства воды, что облегчает сравнение.
§ 3.5. ВОЗДУХ И ОСНОВНЫЕ ПРОДУКТЫ ЕГО РАЗДЕЛЕНИЯ,
озон И ФТОР
Азот, кислород, аргон, неон, криптон, ксенон — это основные
Продукты разделения воздуха, извлекаемые из него в промыш-
пеяных масштабах методами низкотемпературной ректификации
и сорбции. Кроме указанных, в воздухе содержится много других
компонентов (табл. 3.6).
Практически на высоте до 100 км состав атмосферы Земли,
7”3 Учета влаги, углекислоты и углеводородов, в среднем посте ян-
г4111- Лишь на высоте 25 км увеличивается содержание озона
называемое “озонное одеяло” Земли). На больших высотах
^-Тав изменяется по высоте и в значительной степени зависит
109
3.6. Состав сухого атмосферного воздуха у поверхности Земли
Компонетп Содержание компонента при нормальных условиях. см7м’ Обье м 1 >ая доля. % Массовая доля. °<
Азот N, 780 870 78.087 75.52 ~~
Кислород О, 209 500 20.95 23.15
Аргон Аг 9 300 0.93 1.282
Двуокись углерода СО, 300 0,03 0.046
Неон Ne 18 18 • 10'4 12,5 10 4
1 един Не 5.24 5,24- 10'4 0,72 • К) 4
Углеводороды 2,03 2,03 10- 1.28 • 10-
Метан СН4 1.5 1,5 • 104 0,8 • 10-
Криптон Кг 1,14 1.14- 10~4 3.3- 10 1
Водород Н, 0.5 0.5 • 10- 0,035 • 10-
Закись азота N,O 0.5 0.5 • 10- 0,8 • 10 -
Ксенон Хе 0.08 0.08 • 10 4 0,36 • 10-
Озон О( 0,01 0,01 • 10- 0.015 10-
Радон Rn 6 • 10 N 6 • Ю’1* 7 • 10- '
X 999 999 99.9999 99.9999
от времени суток и активности Солнца. Вместе с тем даже на
уровне моря локальное распределение компонентов в атмосфере
неравномерно. Так, в плоскости экватора содержание кислорода
больше, чем в полярных областях. Среды с большим содержа-
нием азота, аргона и других инертных газов могут вызывать
удушье и требуют осторожности в обращении.
Азот. Известны два стабильных изотопа азота с массовыми
числами 14 и 15; соотношение этих изотопов К) ООО ; 37, т.е.
объемная доля 15N составляет всего 0,37 %. В жидком состоянии
азот является прозрачной бесцветной жидкостью. Лсд азота имеет
большую плотность, чем жидкость и тонет в ней. Значения скрытой
теплоты испарения и плавления для азота на порядок меньше, чем
для воды (см. табл. 3.2), в то время как плотность жидкого азота
только на 15 % меньше плотности воды. При температуре около
35,6 К твердый азот подвержен аллотропическим изменениям,
сопровождающимся увеличением теплоемкости. Теплота фазового
перехода около 8,2 Дж/г. Азот инертен, нетоксичен, не обладает
магнитными свойствами, не имеет запаха. Тем нс менее обращение
с жидким азотом требует некоторой осторожности вследствие опас-
ности не только холодного ожога, но и накопления конденсирУ'
юшихся в жидком азоте взрывоопасных газов; поэтому, в частности,
не следует допускать длительного контакта жидкого азота е
атмосферным воздухом и углеводородами.
НО
Кислород. Кислород имеет три стабильных изотопа с массо-
выми числами 16, 17 и 18 в соотношении 10 000 : 4 : 20, т.е.
объемная доля изотопа 17О составляет 0,04 %, изотопа 18О —
0 2 % В жидком и твердом кислороде образуется очень
небольшое количество полимера О4; полагают, что именно
поэтому конденсированный кислород имеет светло-голубой цвет.
Температура кипения кислорода почти на 13 К выше темпера-
туры кипения азота, а температура затвердевания почти на 9 К
ниже температуры затвердевания азота. Плотность жидкого кис-
лорода больше плотности азота и воды (см. табл. 3.2). Лед кис-
лорода тонет в жидкости. При температурах около 44 и 24 К
твердый кислород претерпевает аллотропические изменения. При
температуре 44 К теплота фазового перехода больше теплоты
плавления и приближенно равна 23 Дж/г, а при температуре
24 К — всего 2,94 Дж/г. В отличие от других газов кислород
является парамагнетиком. Магнитными свойствами обладают
также и некоторые газообразные соединения кислорода, напри-
мер окись азота NO. По изменению магнитной восприимчивости
можно определить изменение концентрации кислорода в смеси
диамагнитных газов.
Кислород — химически активный газ, сильный окислитель.
В смесях с углеводородами он особенно опасен; присутствие в
жидком кислороде детонирующих примесей кристаллических
углеводородов неоднократно являлось причиной взрывов и аварий.
Недопустимо соприкосновение жидкого кислорода с маслами,
жирами, углем, древесиной, асфальтом, тканями. При работе с
кислородом необходимо строго соблюдать правила техники
безопасности. При разработке и проектировании кислородного
оборудования следует тщательно выбирать конструкционные и
Рабочие материалы (изоляция, адсорбенты, опоры и т.п.). Кисло-
род токсичен; граница токсичности находится вблизи его концент-
рации 60 % при нормальном давлении. Чистый кислород можно
использовать для дыхания только при пониженных давлениях.
Аргон — третий по объемному содержанию компонент
атмосферного воздуха. Он имеет три стабильных изотопа с
^ассовыми числами 40, 38 и 36, находящимися в соотношении
000 ; 6,3 : 33,8. Разность температур кипения и плавления
аргона составляет всего 3,44 К. Аргон отличается относительно
массовой теплоемкостью как в жидком, так и в газо-
?“Разном состоянии (см.табл. 3.2). Характерно, что критерий
разового превращения (отношение теплоты испарения к теплоте
еРеохлаждения жидкости на 1 К) для аргона почти в 1,5 раза
111
больше, чем для азота, поэтому аргон легко эвакуировать криш
генными методами откачки. Аргон инертен, нетоксичен
Жидкий аргон бесцветен, прозрачен. Плотность жидкого аргона
больше плотности кислорода. Лед аргона тонет в жидкости.
Неон. Три стабильных изотопа неона с массовыми числами
20, 21 и 22 находятся в неоне, извлекаемом из воздуха, в
соотношении 10 000 : 28 ; 971, т.е. объемная доля 22Ne составляет
9,71 %. Обладая низкой температурой кипения (27,108 К) и срав-
нительно высокой плотностью, неон является перспективным
хладагентом, особенно при использовании турбомашин. Жидкий
неон прозрачен и бесцветен. Лсд неона имеет большую плот-
ность, чем жидкость, и тонет в ней (см. табл. 3.2).
Криптон — инертный, бесцветный газ, не имеющий запаха.
Жидкость также прозрачна и бесцветна. В извлекаемом из
воздуха криптоне содержится шесть стабильных изотопов с
массовыми числами (в скобках — объемная доля, %): 78 (0,354)-
80 (2,27); 82 (11,56); 83 (11,55); 84 (57,02); 86 (17,37).
Ксенон инертен, нетоксичен. Существует девять стабильных
изотопов ксенона, содержащихся в воздухе. Наибольшая
объемная доля приходится на изотопы с массовыми числами
(объемными долями, %); 129 (26,44); 130 (4,08); 131 (21,18); 132
(26,89); 134 (10,44); 136 (8,87). Плотность жидкого ксенона почти
в 3 раза превышает плотность воды. Жидкий ксенон прозрачен.
Озон. В молекуле озона связаны три атома кислорода. Озон
токсичен, имеет характерный резкий запах, является очень ак-
тивным окислителем. При объемной доле озона в воздухе более
1,1 ’ 10’4%: возможно отравление. Нормальная температура
кипения озона 161,25 К, температура тройной точки 80,65 К,
поэтому чистый жидкий озон можно легко переохладить с
помощью кислорода, азота или воздуха. Однако и при сильном
переохлаждении даже небольшое возбуждение может вызвать
детонацию озона. Озон легко детонирует не только в жидкой
фазе, но и в твердом состоянии при резких воздействиях,
поэтому его практическое применение пока проблематично.
Фтор имеет один стабильный изотоп с массовым числом 19-
Химически наиболее активен и в высшей степени токсичен.
Обладает едким запахом. Жидкий фтор имеет светло-желтый
цвет. Плотность жидкого фтора в 1,3 раза больше плотности
кислорода. Температура его кипения только на 5,64 К ниже
температуры кипения кислорода (см. табл. 3.2). Лед фтора также
желтый, тонет в жидкости. В переохлажденной твердой фазе пр1’
Т = 45,6 К наблюдается аллотропическое изменение состояния:
при этом лед фтора приобретает белый цвет.
112
фтор является наиболее активным окислителем. Он реагирует
со всеми органическими материалами, водой и почти со всеми
неорганическими веществами. Даже керамические соединения
в порошковом виде могут быть сожжены в среде фтора. На
поверхности большей части металлов при контакте с фтором
образуется тонкая защитная пленка, препятствующая развитию
реакции. В связи с этим при низких и умеренных температурах
(примерно до 470 К) в среде фтора можно использовать кор-
розионно-стойкие стали, никель, монель, латунь, медь и алю-
миний как конструкционные материалы с применением сварки
и пайки твердыми серебряными припоями и пассивированием
рабочих поверхностей.
Для уплотнения резьбовых соединений допускается примене-
ние эластичной тонкой фторопластовой ленты. Оборудование
должно быть тщательно промыто, обезжирено, обезвожено, про-
дуто сухим азотом. И тем не менее при заполнении аппаратуры
фтором, особенно при сс первом контакте с фтором, необходимо
предусмотреть возможность принятия экстренных мер безопас-
ности. Вследствие высокой токсичности широкое применение
фтора пока маловероятно.
§ 3.6. ВОДОРОД
Существует три изотопа водорода; протий Н с массовым
числом 1; дейтерий Д с массовым числом 2, тритий Т с массовым
числом 3. В ядре атома протия один протон, дейтерия — протон
и нейтрон, трития — один протон и два нейтрона. У всех
изотопов по одному электрону. Протий и дейтерий стабильны.
Период полураспада трития составляет 12,262 года; продуктом
Распада является ’Нс.
Известно несколько промышленных методов получения водо-
рода. Наиболее экономичны методы получения Н2 из природного
газа и газов, сопутствующих процессам добычи и переработки
Нефти (попутные газы). Содержащиеся в этих газах углеводороды
(Метан, пропан, бутан и др.) подвергаются так называемой
Каталитической конверсии с водяным паром:
СН4 + Н2о С СО + ЗН2 + СО + Н2О -э СО2 + Н2 + 02.
(3.94)
г4е Qt и Q2 — количества теплоты, выделяющейся при реакции,
о
° Заказ XI 1592 113
Первая реакция протекает при температуре до 1073 К на нц-
кслисвом катализаторе, вторая — при температуре около 773 К
на окислах железа и хрома. Получаемый газ содержит до 25 %
смеси (СО + СО2), очисткой от которой завершается процесс
производства Н2. В техническом водороде содержание примесей
не должно превышать 2,0 — 2,5 %. Используют также метод
неполного окисления углеводородов 95 %-ным кислородом при
давлении около 4 МПа и температуре до 1773 К:
СН4 + 0,5О2 -> СО2 + 2Н2 + Q. (3.95)
В крупнотоннажном производстве большие количества водо-
рода получают также из газов, образующихся при переработке
нефти. Например, газы каталитического риформинга могут
содержать 40-80 % водорода, газы пиролиза этана — до 60 %
водорода. Для получения из них водорода используют криоген-
ные методы очистки. При получении водорода в сравнительно
небольших количествах применяют электролиз воды. Однако,
несмотря на высокую степень чистоты получаемого водорода (до
99,9 %), этот метод неэкономичен (расход электроэнергии
достигает 60-70 кВт-ч на 1 кг Н2). Водород высокой чистоты
(99,99 %) получают диффузионной очисткой палладием.
Во всех случаях в получаемом водороде содержится до 99,987 %
атомов протия. Содержание атомов дейтерия колеблется от 0,013
до 0,016 %. Так как молекула водорода двухатомная, то большая
часть атомов дейтерия соединена в молекулы с атомами протия,
образуя так называемый водородный дейтерид НД, содержание
которого составляет 0,026 — 0,032 %. Температура кипения НД
около 22,13 К, поэтому его можно извлечь методом низкотемпе-
ратурной ректификации. Впервые такой способ разделения раз-
работан группой ученых под руководством проф. М.П. Малкова.
Орто-парасостав и орто-параконверсия водорода. Существуют
две модификации водорода: ортоводород (о-Н2), параводороД
(п-Н2). Они различаются направлением вращения ядер, т.е. ядер'
ными спинами (рис. 3.20). При разных температурах равновес-
ный состав орто-парамодификаций различен:
/.К............. 20,39 30 40 70 120 200 250 3°°
Доля молекул пара-
водорода в равновес- _ -
ном водороде, % ..99,8 97,02 88,73 55,88 32,96 25,97 25.26 25.6'
Рис. 3.20. Схема молекул ортоводорода (а) и параводорода (б)
При обычных температурах водород представляет собой смесь
75 % ортомодификации (ядерные спины одного направления) и
25 % парамодификации (ядерные спины противоположных на-
правлений); такой водород называют нормальным (см. табл. 3.2).
С понижением температуры доля парамодификации увеличи-
вается. При равновесии в жидком водороде содержится 99,8 %
парамодификации и 0,2 % ортомодификации, т.е. равновесный
жидкий водород практически является параводородом. Процесс
орто-парапревращения называют орто-парапереходом или орто-
параконверсией. В газообразном состоянии орто-параконверсия
возможна только в присутствии катализаторов. В жидкой фазе
она протекает самопроизвольно, весьма медленно. Например,
ожиженный нормальный водород вначале имеет состав исход-
ного газообразного водорода; доля молекул параводорода (хп_н )
Увеличивается с течением времени:
хп.н2 = (0,25 + 0,00855 т)/(1 + 0,00855 т), (3.96)
гДе т — время, ч.
Например, через 100 ч аи_н составляет 0,595, а через 1000 ч —
°КОДо 0,92. Процесс конверсии2сопровождается выделением тепло-
При низких температурах (15К<Г<70К) теплота орто-
‘‘Фаперехода примерно одинакова и составляет около 706 Дж/г; с
ЫШением температуры она быстро уменьшается и, например,
200 К составляет только 219 Дж/г. Общее количество тепло-
выделяющейся при орто-парапревращении (теплота конвер-
^Дьн1 НоРмального состояния до равновесного), весьма значи-
8*
114
115
/. К.................. 15 20,39
Q, Дж/г............... 527 525
Т. К ..................75 100
Q. Дж/г............... 185 88.3
30 50 60 70
506 364 285 216
125 150 175 200 250
37,5 15,1 5,7 2,06 0.23
Отсюда видно, что теплота, выделяющаяся при конверсии в
сжиженном нормальном водороде, больше теплоты испарения
(447 Дж/г), поэтому даже в идеально изолированном сосуде
нормальный жидкий водород может испариться в процессе орто-
парапревращения. Потери жидкости при этом составляют около
18 % за первые сутки, а через 100 ч остается менее 60 % жид-
кости.
Для уменьшения потерь жидкого водорода при хранении в
процессе его ожижения обязательна ускоренная конверсия в
присутствии твердых катализаторов. Конверсию чаще всего
проводят на нескольких температурных уровнях: например, при
температурах 65-75 и 20 К. Ускорение конверсии в присутствии
катализатора объясняется тем, что на его поверхности происхо-
дит процесс установившейся адсорбции: попадающие на поверх-
ность катализатора молекулы ортоводорода покидают ее в сос-
тоянии парамодификации. Катализаторами могут быть различ-
ные твердые вещества: активированный уголь, окислы метал-
лов, гидроокиси железа, никеля, хрома, марганца. Катализаторам
придают зернистую структуру (размер зерен около 1 мм). Про-
цесс конверсии в жидком нормальном водороде можно ускорить
также с помощью ультразвука. Однако практически этот способ
не используют. Если жидкий параводород испарить и нагреть,
то он длительное время будет оставаться в парамодификации
даже при температуре выше 300 К. Для возвращения к равно-
весному составу водород нагревают до температуры 1000 К в при-
сутствии катализаторов (никеля, вольфрама, платины).
Водород обладает рядом уникальных свойств. Это самый
легкий газ, его плотность во всех состояниях меньше плотности
других веществ, поэтому его удельная массовая теплоемкость в
любых агрегатных состояниях самая большая. Скорость движения
молекул водорода больше, чем любых других газов [см. уравнение
(3.33)], поэтому он характеризуется и наибольшей скоростью
диффузии. В газообразном состоянии водород имеет наибольшУ50
теплопроводность и наименьшую вязкость (см. табл. 3.2). ПлоТ'
ность льда водорода, как и других криогенных веществ, болЫИе
плотности жидкости. Физические свойства орто- и пар3'
модификаций различаются. При этом различия плотное?11'
116
^пдоты испарения, теплоты плавления, теплопроводности жид-
jjjjcTH, скорости звука невелики, что можно не принимать во
^цмание при инженерных расчетах. Наибольшие отличия харак-
^рны только для теплоемкости, а следовательно, и тепло-
проводности [см. уравнение (3.91)] в интервале температур 80-
250 К, т.е. в области вырождения вклада вращательного движе-
дЯЯ в теплоемкость (см. рис. 3.10). В указанном интервале темпе-
ратур значения теплоемкости и теплопроводности параводорода
jioiyr на 20 % превышать их значения для нормального водорода.
Растворимость гелия в жидком водороде при давлении меньше
0,3 МПа близка к нулю. В этой связи газообразный более
холодный гелий можно использовать, например, для переохлаж-
дения жидкого водорода, организуя барботажный процесс.
Водород горит в присутствии воздуха или кислорода бледно-
голубым или почти бесцветным (если нет примесей) пламенем
с высокой нормальной скоростью фронта его распространения
(2,7 м/с) и низкой излучательной способностью. Воспламеняе-
мость смесей водорода с воздухом и кислородом зависит от
концентрации водорода. Например, для смеси с воздухом при
атмосферном давлении и температуре 293 К диапазон воспламе-
няемости соответствует объемной доле водорода 4-75 %, а особо
взрывоопасный диапазон — 18-65 %. Газообразный водород в
значительной мере пожаровзрывоопасен, и обращение с ним
требует определенных мер предосторожности. Детонация
(устойчивая детонационная волна) возникает преимущественно
при воспламенении в ограниченных объемах (аппаратах, трубах,
машинах, помещениях и др.) и редко наблюдается в открытом
пространстве. При использовании жидкого водорода дополни-
тельно возникает опасность взрыва вследствие образования
Детонирующих конденсированных смесей: жидкий водород —
твердый кислород и жидкий водород — твердый, обогащенный
Кислородом воздух, поэтому особое внимание придают чистоте
*ИДКого водорода и контролю за его составом.
*3.7. ГЕЛИЙ-4 И ГЕЛИЙ-3
^1з всех известных газов только 4Не и 3Не остаются жидкими
^И давлении меньше 2,5 МПа и вплоть до температуры 7" -> 0.
- объясняется большой нулевой энергией, которая для 4Не
oJz*ePHo в 3 Раза больше теплоты испарения. В ядре атома 3Не
нейтрон, а атома 4Не — два нейтрона; вокруг ядра враща-
117
ются по два электрона. Оба изотопа гелия инертны. Основных,
источником 4Не является природный газ, в котором его содержа,
ние может достигать1-2 %. Обычно промышленной переработке
для извлечения 4Не подвергают природный газ с содержание^
гелия более 0,005%. Гелий получают последовательной очисткоц
исходного сырья. Вначале природный газ очищают от СО
осушают и, конденсируя углеводороды, получают так называе.
мый “сырой” гелий, содержащий 70-97 % Не в зависимости oi
схемы установки и состава сырья. Затем сырой гелий очищают
от азота, водорода и других примесей низкотемпературной
конденсацией и адсорбцией. В окончательном продукте объемная
доля примесей не должна превышать 0,2 % для технически
чистого гелия и 0,015 % для гелия высокой чистоты. Доля легкою
изотопа 3Не в 4Не обычно составляет (0,6 ... 2,0) 1(Г7, а доля 3Не
в 4Не, полученном из воздуха, — 1,2- 10’6, поэтому в основном
3Не получают при радиоактивном распаде трития, образующегося
в ядерных реакторах. Для очистки от следов трития 3Не
подвергают низкотемпературной адсорбции, после чего содер-
жание трития обычно не превышает 10 10 %. Свойства этих двух
изотопов гелия существенно различаются.
Поверхность р — v — Т для 4Не схематически показана на
рис. 3.21. В области газообразных состояний 3Не и 4Не нс имеют
отличительных свойств. Верхняя температура инверсии 4Не
около 43 К, нижняя (точка на пограничной кривой) 4,5 К.
Газообразный гелий — второй после водорода газ, отличающийся
высокими теплоемкостью (рис. 3.22), теплопроводностью и малой
плотностью (см. табл. 3.2). Благодаря этим свойствам и нейтраль-
ности он является превосходным теплоносителем. Схематические
Рис. 3.21. Поверхность р—v—-Т для 4Не
118
диаграммы р — Тдля 4Не и 3Не
приведены на рис. 3.23), коор-
динаты точек даны в табл. 3.7
Штриховые линии разделяю1
области с положительным И
отрицательным температурный
коэффициентом объемного
расширения р. В области сосЮ'
яния, где р > 0, жидкий гелий
расширяется при нагревании-
гелия нет равновесной крив011
сублимации, т.е. твердая
газообразная фазы ни при
jjgc. 3.22. Зависимость тепло-
^ости газообразного 4Не от
^оературы при разных давле-
jgix условиях не могут
сосуществовать в равно-
весии. Твердый гелий
щожет находиться в рав-
новесии только с жид-
костью. Известны три
Кристаллические моди-
фикации твердых 3Не и
4Не: с гексагональной
(Г), кубической объемно-
центрированной (КОЦ) и кубической гранецентрированной
(КГЦ) решетками. Область жидких состояний 4Не не разделена
1-линией. Слева от Х-линии жидкий гелий находится в особом
состоянии, называемом сверхтекучим и обозначаемом Hell.
Справа от Х-линии жидкий гелий находится в обычном (вяз-
кдм), характерном для любой жидкости состоянии, обозначаемом
Не1.
3.7. Параметры характерных точек на диаграмме р — Т для 4Не
и 3Не (см. рис. 3.23)
Характерные точки для 4 Не т, к р, МПа Характерные точки для 3Не т, к р, МПа
(критическая точка) 1 (нижняя Х-точка) 5,2014 0,2275 к (критическая точка) 3,324 0,1165
2.172 0,005036 Х-линия =0.003
7 (верхняя Х-точка) 1.763 3,0134
1 (В = 0) 1,14 0,7093 -10'4 1 (Р = 0) 0,502 0,2736-10^
2 (В = 0) 0,59 2,5331 2 (В = 0) 1,26 4,7623
(р^р . ) п (Равновесие 0,775 2.5291 3 О’=Anin) 0,32 2,9303
1,463 2,6273 4 (равновесие 3,138 13,7234
Не11-КОЦ-Г) жидкий 3Не-
5(В = о) 1.8 3,1309 КОЦ-Г) 5 (равновесие 17,78 162,93
жидкий 3Не-
6 (Равновесие Не1- oF4'r) 14.9 106,3912 КГЦ-Г)
(точка кипения Ри нормальном -^№НИИ) 4,224 0.101325 0 (точка кипения 3,191 0,101325
при нормальном давлении)
119
Рис, 3.23. Диаграммы р — Т для 4Не (а) и 3Не (б)
Переход из области состояний Не1 в области Hell называется
^-переходом, являющимся характерным свойством жидкого 4Не.
Для 3Не ^-переход обнаружен при Т ~ 0,003 К; ^-переход про-
исходит без скачка плотности (кривая плотности в окрестности
Vточки имеет пологий максимум), без выделения или поглоще-
ния скрытой теплоты и сопровождается резким изменением
теплоемкости жидкого гелия (рис. 3.24 и 3.25). Визуальные
наблюдения дают следующую характерную картину ^-перехода.
При откачке паров гелия из криостата жидкость кипит во всем
объеме, оставаясь в значительной мере “светлой”, и ее темпе-
ратура постепенно снижается. По мере охлаждения интенсив-
ность кипения уменьшается, о чем можно судить по снижению
интенсивности образования пузырьков. Это происходит вслед-
ствие уменьшения теплоемкости жидкости: чем меньше тепло-
емкость, тем меньше надо отвести теплоты при охлаждении Я
тем меньше испаряется жидкости. При достижении температур1’1
7) жидкость резко вскипает, во всем объеме образуется мно-
жество пузырьков и жидкость на короткое время становитсЯ
малопрозрачной. Затем интенсивность образования пузырько5
быстро уменьшается. Вскоре видимое кипение прекращается'
и жидкость становится идеально спокойной — это Hell. ЕсЛ11
продолжать откачку паров, то температуру можно снизить. 1)0
120
рве. 3.24. Кривые изменения плотности Рис. 3.25. Зависимость удельной тепло-
те и 3Не на границе кривой двухфаз- емкости жидких 4Не и 3Не на линии
вой системы жидкость—пар насыщения от приведенной температуры
тут;
не более чем до 0,5 К, поскольку давление становится очень
малым и количества испаряющейся жидкости недостаточно для
компенсации дальнейшего увеличения скрытой теплоты испаре-
ния и тепловых потерь. При откачке паров жидкого 3Не можно
достичь температуры около 0,20 К.
Hell обладает рядом уникальных свойств. Акад. П.Л. Капица
экспериментально показал, что в жидком Hell сосуществуют две
жидкости с различными свойствами: так называемые нормальная
и сверхтекучая компоненты. Сверхтекучая компонента образо-
вана атомами гелия с нулевой энергией и энтропией, близкой
к нулю. Атомы нормальной компоненты находятся в обычном
состоянии. Компоненты не взаимодействуют. Их соотношение
зависит от температуры (рис. 3.26). Вязкость сверхтекучей ком-
поненты практически отсутствует, поэтому полная вязкость Hell
Уменьшается с понижением температуры. Специфическими свой-
ствами сверхтекучей компоненты объясняется и тот факт, что
значения кажущейся вязкости Hell, измеренные разными мето-
дами, различаются (рис. 3.27). Сверхтекучая компонента может
Протекать через отверстия и щели размером не более 0,5 мкм,
Непроницаемые даже для газа. Явление сверхтекучести Hell
открыто в 1937 г. акад. П.Л. Капицей. Две компоненты могут
Двигаться одна навстречу другой. Так, если “бульбочку” с
^Пилляром поместить в жидкий НеП (рис. 3.28, а) и нагревать,
Из капилляра будет непрерывно вытекать затопленная струя
^Ндкости. Бульбочка пополняется, так как сверхтекучая компо-
‘вползает” по стенкам капилляра навстречу потоку жид-
Известно явление образования тонких движущихся пленок
121
Рис. 3.26. Зависимость соотношений
плотностей нормальной рн н сверх-
текучей рс компонент в жидком Hell
от температуры Г(рс / р + рн / р = 1)
Рис. 3.27. Зависимость вязкости жидкого
3Не н кажущейся вязкости жидкого 4Не от
температуры при определении вязкости
методами вращающегося цилиндра (кривая
I), колеблющегося диска (кривая 2), капил-
ляра (кривая 3); при Т > Тх результаты
определения по всем методам совпадают
на поверхности твердых тел, соприкасающихся с жидким НсЛ.
Такие пленки образуются и на стенках криостата, в котором
находится Hell. Пленка движется в направлении более высокой
температуры. Толщина пленки приблизительно 2 • 10 5 мм, поэтому,
например, уровень жидкого гелия в пробирке (рис. 3.28, б) уста-
навливается на одном уровне с жидким Hell в криостате незави-
симо от того, был ли он первоначально ниже или выше уровня
Hell в криостате. Известен также и опыт с гелиевым фонтаном
(см. рис.3.28, в).
Описанные опыты являются частными случаями проявления
так называемого термомеханического эффекта в жидком Hell.
Рнс. 3.28. Схемы, иллюстрирующие термомеханический эффект в жидком Hell:
а — затопленная струя из бульбочки с нагревателем; о — ползущие тонкие плен#1,
в — фонтанирование; г — перетекание пленки Hell в смесях 3Не—4Не пр11
Т < 0,8 К (н и с — нормальное и сверхтекучее состояние)
градиент температуры вызывает появление градиента давления
Л как следствие, движение нормальной компоненты в направле-
нии градиента температуры, одновременно возникает встречное
движение сверхтекучей компоненты к источнику теплоты.
’1'ермомеханический эффект можно использовать для создания
насосов жидкого Hell. Существует и обратный эффект — механо-
термический. Следует также иметь в виду, что низкотемпера-
турной фильтрацией сверхтекучего 4Не можно добиться обога-
щения 3Не в рабочей зоне перед фильтром.
Закономерности течения Hell в трубах зависят от скорости
И температуры, т.е. от содержания сверхтекучей компоненты,
в условиях вынужденного течения (при больших скоростях)
атомы сверхтекучего гелия могут переходить в возбужденное
состояние и взаимодействовать со стенками и нормальной
компонентой, т.е. в сверхтекучем гелии может развиваться турбу-
лентность. Следует также иметь в виду, что низкотемператур-
ной фильтрацией сверхтекучего 4Не можно добиться обогащения
3Не в рабочей зоне перед фильтром.
Теплопроводность вязкого Нс1 слабо уменьшается с пониже-
нием температуры (рис. 3.29). Необычно реализуется перенос
теплоты в Hell. При наличии температурного градиента в
нормальной компоненте возникают потоки фононов. Кроме того,
встречные потоки нормальной и сверхтекучей компонент (термо-
механический эффект) резко увеличивают так называемую
кажущуюся (или эффективную) теплопроводность Hell. Она
3.29. Зависимость теплопроводности жидкого Не! и кажущейся тепло-
т*®йодности Hell от температуры (диаметр образца 1 мм: grad Т — градиент
те*И|ературы — по Т. Фредеркингу)
123
122
достигает максимума при Т= 1,8...1,9 К и примерно в 1000 ра-3
превышает теплопроводность меди при нормальной температуре
(см. рис. 3.29). Вместе с тем при передаче теплоты от поверхности
твердых тел к жидкому Hell возникает заметное пристеночное
термическое сопротивление (сопротивление Капицы). Оно пр0.
является в виде скачка температуры; иногда его называют “скач-
ком Капицы”. Это сопротивление пропорционально 1/Т ’ й
быстро увеличивается при понижении температуры.
Необходимо отметить также характерные свойства смесей
жидких изотопов гелия. Теплота смешения 3Не и 4Не довольно
значительная; например, при Т= 1,02 К для 8,6 %-ного раствора
она составляет 0,7116 Дж/моль. Теплоемкость смеси больше теп-
лоемкости чистых компонентов до смешения, поэтому в адиабат-
ных условиях процесс смешения сопровождается снижением
температуры. Замечательная особенность растворов 3Не — 4Нс -
их самопроизвольное расслоение (разделение) при температуре
ниже 0,827 К. Атомы более тяжелого сверхтекучего 4Не выде-
ляются из раствора и накапливаются в нижней части сосуда.
Между жидкими 3Не и 4Не образуется четкая граница раздела
(см. рис. 3.28, г).
На диаграмме Т — х жидких состояний (рис. 3.30, а) область
расслоения ограничена так называемой кривой расслоения (х =
Рис. 3.30. Диаграммы, иллюстрирующие свойства растворов 3Не и 4Не:
а — диаграмма Т— х жидких состояний системы 3Не — 4Не; б — зависим06^
энтальпии чистого 3Не (кривая 1) и парциальной энтальпии 3Не в растворе (кривая
от температуры
124
;= 6,37 % при Т = 0). При охлаждении раствора с начальной
концентрацией х по линии 1-2 он расслаивается и распадается
йа Две фазы: нормальную (н) и сверхтекучую (с). Концентрация
К 3Не в нормальной фазе резко увеличивается, а в сверхтекучей
(« ) — резко уменьшается. Концентрации определяют по точкам
4 пересечения изотермы, проходящей через точку 2, с кривой
расслоения. Соотношение объемов нормальной и сверхтекучей
фаз определяется отношением отрезков: (2-3)/(2-4) = хнДс.
При Т -> 0 абсцисса кривой расслоения равна 6,37 % — это
лошимальная растворимость 3Не в 4Не при Т = 0.
Рассмотренные свойства смесей изотопов гелия использованы
для достижения температуры ниже 0,2 К (подробнее — см. гл. 4).
§ 3.8. ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ
Теплофизические свойства твердых тел, как и газов, и жид-
костей, существенно зависят от температуры. Можно утверждать,
что при низких температурах происходит радикальное изменение
свойств. Практически все физические свойства твердых тел в
конечном итоге определяются взаимным расположением, харак-
тером взаимодействия и интенсивностью движения атомов
кристаллической решетки, а также поведением свободных элект-
ронов. Если рассматривать идеальный кристалл, атомы которого
расположены в узлах решетки, то методами классической
статистической механики легко получить выражения для внут-
ренней энергии, теплоемкости, коэффициентов переноса и
Других важных характеристик. Однако при низких температурах
такой подход дает неверные результаты, и точные решения могут
быть найдены лишь методами квантовой механики. Квантово-
Механические эффекты особенно значительны при низких
температурах, так как тепловая энергия становится мала и не
препятствует проявлению более тонких эффектов. Наряду с
Расчетно-теоретическими широко используют эксперименталь-
ные методы определения свойств твердых тел. Обширная инфор-
мация о свойствах тел при низких температурах приведена в
справочной литературе J17]; здесь рассмотрим физическую
сущность явлений, определяющих изменение этих свойств.
Наряду с теплофизическими свойствами, такими, как теплоем-
к°сть, теплопроводность, тепловое расширение и т.п., рассмот-
рим другие физические свойства, важные для криогенных
систем — электропроводность и прочностные характеристики.
125
Теплоемкость. Для определения теплоемкости (у твердого тела
с, = с ) необходимо знать внутреннюю энергию и, а затем по
формуле (2.75) можно найти с,. Расчеты максимально упрощают-
ся при относительно высоких температурах, когда внутреннюю
энергию можно определить на основе закона о ее равномерной
распределении по степеням свободы (см. § 3.3). Согласно этому
закону на одну степень свободы приходится энергия Ej = 0,5кТ.
Внутренняя энергия твердого тела обусловлена гармоническими
колебаниями атомов в узлах кристаллической решетки. При
колебании атомов имеется три степени свободы; если при этом
учесть, что частица имеет как кинетическую, так и потенциаль-
* ную энергию, то полная энергия е = ЗкТ. Для одного моля
вещества, состоящего из N4 частиц (N4 = 6,022 1023 моль 1
число Авогадро), полная внутренняя энергия
и = 3NAkT = 3RT \
(3.97)
тогда теплоемкость cv = Ъи/ЪТ= 3R ~ 25 Дж/(моль-К). Этот
результат хорошо подтверждается экспериментом и соответствует
эмпирическому закону Дюлонга—Пти; здесь и далее R — R,.
Другой предельный случай соответствует Г ч О К: при этом
из третьего начала термодинамики следует: cv —> 0. Таким
образом, теплоемкость в интервале между высокой температурой
и абсолютным нулем должна уменьшаться от 25 Дж/(моль’К)
до нуля. Зависимость с, = f(T) качественно хорошо описывается
теорией Эйнштейна, который первым применил квантовые
закономерности для определения энергии атомов. Согласно
квантовой теории средняя энергия, приходящаяся на одну
степень свободы каждого осциллятора (колеблющегося атома),
е = hv/(ehvHkT) - 1),
(3.98)
где h = 6,62 • 10 34 Дж • с — постоянная Планка; v — частота
колебаний, с"1; к = 1,38 • 10"23 Дж/К — постоянная Больцмана.
Полная энергия одного моля и = 3NA е ; тогда на основании
соотношения с, = Ъи/ЪТ с учетом того, что NAk = R, теплоеМ-
где 0£ = h\'/(kT) — характеристическая температура.
Формула (3.99) дает качественную зависимость си от темпер®'
туры. Количественная неточность формулы Эйнштейна обуслоИ'
126
^fD{T/QD) - 3 j
дена тем, что он принял постоянное значение частоты колебаний
v для всех атомов твердого тела.
Дебай разработал более точную теорию с учетом различия
дастот v и непрерывности их спектра. При этом возможное число
всех видов колебаний равно 3NA. Ограничив спектр максималь-
ной частотой vm, Дебай определил энергию колебательной
системы, используя для энергии отдельной частицы ту же
зависимость (3.98). Теплоемкость, Дж/(моль-К), найденная
дифференцированием энергии:
с₽= ЗА(77ед)3/д(Т/ед), (3.100)
«D/r
------- dx — функция Дебая; х = hv / (кТ).
(ех - I)2
о
В этой теории важное значение имеет дебаевская температура
eD = hvm/k-
(3.101)
Параметр 0Д по своему физическому смыслу определяет для
каждого вещества температурную границу, ниже которой начи-
нается существенное изменение теплоемкости в зависимости от Т,
т.е. проявляются квантовые эффекты. При высоких температурах
(Т> 0Д ) из (3.100) в предельном случае получается классический
результат cv = 3R. При весьма низких температурах Т « 0Д
(практически Т < 0Д /12) достигается другой предельный случай,
когда теплоемкость, Дж/(моль- К),
Cv - 234/? (T/O^ )3 = а Г3, (3.102)
т.е. уменьшение теплоемкости пропорционально Т3.
Теория Дебая хорошо согласуется с экспериментальными
Данными и может служить основой для расчетов теплоемкости
Многих материалов. Значения функции fD(T/Q^ определены, и
Расчеты по формуле (3.100)
। Предусматривают использо-
I ®ание графиков или таблиц
ФИс. 3.31, табл. 3.8 и 3.9).
3.31. Зависимость безразмерной
’’*л°емкости ct, /R твердых тел от прн-
^еаной температуры Г/О,,
127
3.8. Дебаевская функция удельной теплоемкости
г/ев 9,/R т/ов 5"/ео с,/Я
0.05 0.1191 0,45 2,3725 1,60 2,9422 "
0,09 0,1682 0,50 2,4762 1,70 2,9487
0,10 0,2275 0,60 2,6214 1.80 2,9542
0.12 0,3733 0,70 2,7149 1,90 2,9589
0.14 0,5464 0,80 2,7481 2,00 2,9628
0,16 0.7334 0,90 2,8227 2,20 2,9692
0,18 0,9228 1,00 2,8552 2,40 2,9741
0,20 1,1059 1,10 2,8796 2,60 2,9779
0,25 1,5092 1,20 2,8984 2,80 2,9810
0.30 1,8231 1,30 2,9131 3,00 2,9834
0,35 2,0597 1,40 2,9248 4,00 2,9844
0,40 2,2376 1,50 2.9344 5,00 2,9900
3.9. Температура Дебая 0D и коэффициент электронной
теплоемкости у для некоторых веществ
Вещество мДж Вещество ед,к мДж
моль♦К моль • К
Алюминий 426 1,36 Ниобий 320 7,9
Вольфрам 465 1,3 Олово 195 1,75
Железо 464 3,1 Титан 420 3,4
Золото 165 0,74 Хром 610 1,47
Кремний 640 — Свинец 96 3,1
Медь 344 0,687 Углерод:
Никель 440 7,0 графит 420 0.01
алмаз 2230 —
Малые значения 0Д , например, для свинца свидетельствуют
о том, что его теплоемкость значительна даже при весьма низких
температурах. Противоположные свойства характерны для алмаза.
Теория Дебая относительно проста, она получила широкое приме-
нение на практике. Неточности теории (вследствие пренебреже-
ния истинным спектром частот атомов) обычно компенсируют
подбором значений 0Д , наиболее соответствующих эксперимен-
тальным данным.
Электронная теплоемкость. Свободные
электроны в металле также вносят свой вклад в теплоемкость.
Однако этот вклад не равен 37?/2, как это следует из классичес-
кой теории, а гораздо меньше. Только очень небольшая часть
свободных электронов может поглощать тепловую энергию. Это
свойство электронного газа обусловлено тем, что кинетичсска^
энергия поступательного движения его частиц имеет квантовЫ#
128
характер. Электронный газ является “вырожденным”; законо-
мерности его поведения подчиняются статистической теории Фер-
ми — Дирака. Теплоемкость свободных электронов, Дж/(моль • К),
с,э- Атг2(770о)/2 = УТ, (3.103)
где 0о — характерная температура вырождения.
Несмотря на то, что электронная теплоемкость при обычных
температурах пренебрежимо мала, она может стать определяю-
щей при очень низких температурах. Это обусловлено тем, что
фононная (решеточная) теплоемкость очень резко убывает с
понижением температуры — пропорционально ее кубу [см. фор-
мулу (3.102)]. На рис. 3.32 сопоставлены теплоемкости алюминия:
с > cv при Т < 4 К. Для меди при Т = 1 К электронная тепло-
емкость в 4 раза больше решеточной. Суммарную теплоемкость
в этом случае целесообразно определять в соответствии с (3.102)
и (3.103) по формуле cv = аТ3 + у Г; значения у для ряда веществ
приведены в табл. 3.9.
Магнитная теплоемкость. Для получения
низких температур, в основном ниже 1 К, используют системы
адиабатного размагничивания (см. § 4.11). Рабочим веществом
этих систем являются парамагнитные вещества, для которых
характерны высокие значения магнитной теплоемкости, опреде-
ляемой энергией ем взаимодействия магнитных диполей. При
некоторой температуре 05 энергия
ем имеет тот же порядок, что и
тепловая энергия кТ, откуда следу-
ет0.= Т= гм/к.
При температурах, близких к 0f ,
выявлен максимум магнитной
теплоемкости см (при отсутствии
внешнего поля). При повышении
температуры Т > Bs магнитная
теплоемкость см уменьшается, так
Как снижается энергия взаимо-
действия диполей. В этой области
см== RA/T3 = 0,257? (0f/Г)2. (3.104)
При Т < 0( ( Г- > 0) теплоемкость
снижается в соответствии с
третьим началом термодинамики.
“Рактер изменения магнитной
9 ч
аказ № 1592
Рис. 3.32. Зависимость электрон-
ной (кривая 1 ), решеточной
(кривая 2) и полной (кривая 3)
теплоемкости алюминия от темпе-
ратуры
129
Рнс. 3.33. Зависимость относительной
магнитной теплоемкости ряда веществ от
температуры:
1 — железоаммониевый сульфат; 2 —
хромокалиевые квасцы; J — хромометила-
ми новые квасцы; 4 — сульфат гадолиния;
5 — гадолипиево-галлиевый (ранат GGG
(на 1 ион)
Рнс. 3.34. Зависимость объемной
теплоемкости ряда веществ от тем-
пературы:
1 — медь; 2 — свинец; J — суяьфи.1!
европия; 4 - гелий (0,4 МПа,
теплоемкости для ряда веществ в зависимости от темперам ры
показан на рис. 3.33. Теплоемкость с , связанная с колебаниями
решетки, при таких низких температурах становится пренебре-
жимо малой.
Аномалии теплоемкости. Монотонность
функций с = f(T) и с_г) = ф(Т) иногда нарушается вследствие
влияния дополнительных факторов, что выражается в появлении
пиков на кривой теплоемкости. Под действием различных (рак-
торов твердые тела становятся способными поглощать уве ш-
чсннос количество энергии при плавном повышении темпера-
туры. К таким дополнительным факторам относятся фазовые
переходы в твердых телах (сверхпроводящий переход, ферромаг-
нетизм, структурный переход в сплавах), вращательные переходы
молекул, спиновые переходы и др. Так, сверхпроводящий фаз-
ный переход приводит к скачку теплоемкости, определяемом)
уравнением (3.124). На рис. 3.34 приведены характерные кривые
изменения объемной теплоемкости: для РЬ и Си — гладкие кри-
вые 1 и 2, для соединения EuS (сульфид европия) — кривая 3 е
аномалией. При наличии аномалий теплоемкость определяю! по
экспериментальным данным. Теплоемкость гелия (кривая
130
увеличивается с понижением температуры, а затем также стрс-
Л^ится к нулю (на рисунке не показано).
Теплопроводность. Поток теплоты через твердое тело с пло-
щадью сечения F равен Q = - Х(ЭT/dx)F, где коэффициент
теплопроводности X. характеризует механизм переноса тепловой
энергии Q. отнесенной к градиенту температуры (ЭТ/Эх), через
единицу площади F. Теплопроводность твердого тела опреде-
ляется двумя факторами: движением свободных электронов и
распространением колебаний кристаллической решетки. Преобла-
дание того или иного вида переноса зависит от типа материала
и его свойств. В проводниках тепловой поток переносится элект-
ронами, в диэлектриках — колебаниями атомов, в материалах
t промежуточными свойствами происходит смешанный перенос.
Таким образом, в общем случае
X = Хф + \, (3.105)
где Хф и X., -- соответственно фононная (решеточная) и электро-
нная теплопроводность.
Явление электронной теплопроводности объясняют на основе
модели свободного электронного газа, согласно которой элект-
роны участвуют в хаотичном тепловом движении наподобие
молекул идеального_газа. Для электронного газа также существует
понятие длины I м свободного пути частиц и их средней
скорости с .
При описании фононной теплопроводности, обусловленной
распространением колебаний кристаллической решетки, удобно
использовать понятие фононного газа. Распространение тепло-
вых волн, связанных с энергией упругих колебаний решетки,
Можно рассматривать как движение квазичастиц — носителей
тепловой энергии, называемых фононами. Энергия фононов
имеет квантовую природу, определяется частотой колебаний v
И постоянна для фононов данного вида. Скорость фононов равна
скорости распространения упругих колебаний в твердом теле.
Т.е. скорости звука. В отличие от атомов и электронов число
фононов непостоянно: оно увеличивается при повышении темпе-
ратуры. Движение фононов сопровождается столкновениями и
Рассеянием их энергии, следовательно, существует понятие дли-
ны свободного пути фононов.
Таким образом, движение частиц электронного и фононного
Газов обусловливает теплопроводность твердого тела. Это позво-
ляет использовать уравнение теплопроводности, полученное на
9*
131
основе молекулярно-кинетической теории идеального газа, длу
объяснения процесса теплопроводности твердого тела. С этой
целью рассмотрим твердое тело как объем, заполненный эле к.
тронным и фононным газами. Этот подход не дает точного коли-
чественного результата, но качественно хорошо объясняет харак-
тер изменения коэффициента теплопроводности при низких тем-
пературах. Используя формулу переноса теплоты в идеальном
газе (см. § 3.3) ____
Л. = / с р cv /3, (3.106)
рассмотрим изменение каждого множителя в зависимости от Т
как для фононной, так и для электронной теплопроводности.
Фононная теплопроводность. Фононы
играют определяющую роль при переносе теплоты в неметаллах.
Анализ составляющих формулы (3.106) для фононного газа
(рис. 3.35) приводит к следующим выводам. Изменение
теплоемкости cv определяется формулой Дебая (3.100). Скорость
фононов с равна скорости звука, которая очень мало зависит
от температуры. Длина свободного пути, максимальная при
Т = 0, резко уменьшается с понижением Т, что обусловлено
увеличением числа фононов и частоты их столкновений. Резуль-
тирующая кривая теплопроводности (рис. 3.35, г) получается
перемножением ординат кривых на рис. 3.35, а, б, в и имеет
максимум, зависящий от характеристики материала.
Дефекты решетки (примеси, дислокации, границы между
кристаллами и др.) уменьшают среднюю длину свободного пути
/ и фононную теплопроводность Л.ф. Особенно малы значения
Л.ф для материалов с неупорядоченной структурой (стекло,
пластмассы); при этом максимум сдвигается в область высоких
Рис. 3.35. Зависимость от температур14
составляющих теплопроводности:
а — теплоемкостей фононной и э.теК1
ронной с1ЛЭ; б — скорости частип: « "
длины свободного пути; г — результ"
рующая кривая
т
S)
132
температур. При Т -> 0, когда I = const, характер зависимости
Хф от Т обусловлен ходом кривой теплоемкости cv, которая
определяется формулой (3.102). Очевидно, что теплопроводность
Хф резко уменьшается и при абсолютном нуле также становится
равной нулю.
При сверхнизких температурах, когда энергия и число фоно-
нов малы, средняя длина свободного пути / определяется разме-
рами отдельных кристаллов. Так, при температуре 1 К теплопро-
водность кварцевого стекла, состоящего из мелких кристалликов,
составляет 0,01 теплопроводности монокристалла кварца.
Электронная теплопроводность
характерна для металлов, электроны которых почти полностью
определяют процесс переноса теплоты. Характер изменения
отдельных множителей формулы (3.106) также отражают
зависимости на рис. 3.35. Теплоемкость единицы объема
электронного газа с'^ = pcv3 определяется формулой (3.103) и
линейно уменьшается с понижением температуры (рис. 3.35, а).
Скорость электронов не зависит_от температуры (рис. 3.35, б).
Средняя длина свободного пути I электронов максимальна при
низких температурах и уменьшается с ее повышением, так как
при этом увеличиваются число фононов и число их столкнове-
ний с электронами — рис. 3.35, в. Взаимодействие противопо-
ложно влияющих факторов приводит к появлению максимума
на результирующей кривой (рис. 3.35, г). При низких темпера-
турах длина свободного пути / = const и электронная тепло-
проводность Л.э уменьшается по линейному закону аналогично
теплоемкости. При Т ~ 0 теплопроводность \ = 0. Наличие
примесей и дефектов решетки, в свою очередь, приводит к
Дополнительному рассеянию энергии электронов, уменьшению
их свободного пути, в результате теплопроводность также сни-
жается. Таким образом, наличие примесей в материале и
характер его обработки влияют на теплопроводность, которая
Максимальна для чистых и недеформированных металлов.
В очень чистых металлах почти весь тепловой поток перено-
сится электронами; вклад фононов невелик. Для металлов с при-
месями и сплавов значения и имеют одинаковый порядок.
,ак> для коррозионно-стойкой стали доля Л.э составляет 75 %,
Доля Хф — 25 % общего потока теплоты. Для всех веществ зако-
номерность изменения теплопроводности определяется кривыми
с Максимумом (рис. 3.35, г). На рис. 3.36 и 3.37 приведены
экспериментальные кривые теплопроводность — температура для
133
Рис. 3.36. Экспериментальные зависимости теплопроводности некоторых веществ
от температуры:
а — чистые металлы и техническая медь М3; б — гадолиниево-галлиевый гранат
GGG (1 — монокристалл; 2—4 — поликристаллы различной структуры)
некоторых чистых металлов, технической меди М3 и неметалла
GGG (на рис. 3.37 — при Т < 1 К). Высокие значения А. имеет
чистая медь (99,999 %), теплопроводность стали на несколько
порядков меньше.
Особый характер изменения теплопроводности отличает мате-
риалы, находящиеся в сверхпроводящем состоянии. Переход из
нормального в сверхпроводящее
состояние сопровождается резким
уменьшением теплопроводности,
так как сверхпроводящие электро-
ны перестают участвовать в пере-
носе теплоты. Кривые теплопро-
водности для Zn и Al в нормаль-
ном и сверхпроводящем состоя-
нии приведены на рис. 3.37; раз-
личие весьма существенно. Это
Рис. 3.37. Экспериментальные зависимости
теплопроводности ряда веществ от темпера-
туры при Г < 1 К [Си (в) — высокочистая
медь; Си (б) — техническая медь; нормаль-
ное состояние — сплошные линии, сверхпро-
водящее состояние — штриховые линии!
134
явление позволяет управлять теплопроводностью путем перевода
материала в сверхпроводящее состояние и вывода из него.
Тепловое расширение. Термомеханический эффект теплового
расширения имеет большое значение для материалов, исполь-
зуемых при криогенных температурах. Тепловое расширение тел
связано с изменением положений атомов, находящихся на
различных энергетических уровнях. Потенциальные кривые,
характеризующие силы притяжения и отталкивания атомов в
зависимости от расстояния г между ними, для твердых тел и
тазов аналогичны (см. рис. 3.12). Так, вблизи абсолютного нуля
энергия минимальна и достигается равновесное положение
атомов; расстояние между ними минимально. С повышением
температуры энергия колебательного движения атомов возрастает
и, как следствие, увеличиваются межатомные расстояния,
характеризующие положение их равновесия. Это обусловлено
асимметрией потенциальной ямы, так как силы отталкивания
увеличиваются быстрее сил притяжения. В итоге тела расши-
ряются. Количественно эффект расширения характеризуется тем-
пературным коэффициентом объемного расширения р [формула
(2.69)]. Для твердых тел широко используют понятие темпера-
турного коэффициента линейного расширения
1 / а/ \
а = — ----- ,
/ \ ат/а
(3.107)
где / — линейный размер; о — напряжение в материале.
Для изотропных веществ а - р/3. Характер температурной
зависимости коэффициентов а и р устанавливают следующим
образом. Из уравнения Максвелла (2.68): (dv/3T)p = -(ds/dp)T', при
Т —> 0 согласно третьему началу термодинамики (ds/dp)T -> 0.
Очевидно, что при этом р = (l/v)(dv/dT) --> 0 и а - -> 0. С
повышением температуры а
Увеличивается. Зависимость
Коэффициента а от Г для
Некоторых металлов приведена
На рис. 3.38. Приближенно
коэффициент р можно опреде-
лить по термодинамическому
3.38. Зависимость коэффициента а
температуры для металлов:
свинец; 2 — алюминий; J — .медь;
~~ никель; 5 — титан
уравнению состояния твердого тела, предложенному Грюнсц,
зсном,
3 = У*7’с!У,/’ (3-108)
где у — константа Грюнейзена (для большей части материалов
у = 2); — изотермическая сжимаемость [см. формулу (2.70)];
cv/V — теплоемкость единицы объема.
Значения у и мало зависят от температуры, следовательно,
изменение коэффициента [3 в основном определяется характером
изменения теплоемкости cv. Это позволяет приближенно рассчи-
тывать коэффициент р по соотношению
Рт/Рзоо ~ cvt/cv3oo ’ (3.109)
где cvT — теплоемкость, рассчитываемая по функции Дебая (3.100);
индекс 300 соответствует нормальной температуре, а индекс Т~
температуре, при которой находят значение Рр
Быстрое уменьшение температурного коэффициента линейного
расширения с понижением температуры приводит к тому, что при
температуре ниже 50 К температурная деформация становится
несущественной. В практических расчетах часто используют
понятие среднего температурного коэффициента линейного
расширения а в интервале ДТ; тогда изменение размера
вследствие температурной деформаций находят следующим
Рис. 3.39. Зависимость относительной
температурной деформации различных
материалов от температуры:
1 — инвар; 2 — пирекс; 3 — бериллий;
4 — ниобий; 5 — стекло оптическое;
6 — сталь ШХ15; 7 — сталь 12ХНЗА;
8 — текстолит НТК; 9 — монель; Ю
— константан; И — сталь 12Х18Н9Т;
12 — бронза бериллиевая; 13 — медь
Ml; /«/ — бронза БрОФ6,5—0,15; /5—
латунь Л63; 16 — алюминий
образом. Согласно равенству (3.107) для интервала А Г можно
записать ~аЛТ = &1/10 = (/0 — /г)//0, где /0 — начальный размер
При температуре То; I — размер при температуре Г, отсюда
lT = l0 (1 - оГдГ). (3.110)
На рис. 3.39 приведена зависимость относительной темпера-
турной деформации (/0 — /г)//0 от температуры; ход кривых свиде-
тельствует о том, что при температуре ниже 50 К изменение раз-
меров практически прекращается. Для различных материалов зна-
чения а и соответственно Д///о могут различаться в несколько раз.
Тепловое излучение — это процесс переноса энергии электро-
магнитными волнами. Тепловое излучение представляет собой
один из основных механизмов переноса теплоты в криогенной
теплоизоляции. При температуре ниже 300 К тепловое излучение
Происходит в инфракрасной области спектра, при длинах волн
% = 10 мкм и более. Излучательная способность вещества харак-
теризуется степенью его черноты
е = £/£., (3.111)
где Е — плотность излучения вещества; Es = csT4 — плотность
излучения абсолютно черного тела при той же температуре;
cs — постоянная Стефана — Больцмана.
В соответствии с законом Кирхгофа степень черноты е равна
поглощательной способности а тела при данных длине волны и
температуре. Изучение оптических свойств металлов на основе
классической теории электронного газа позволяет получить при-
ближенное выражение для поглощательной способности
а = 0,365 д/р/Х , (3.112)
Ще р — удельное электрическое сопротивление, Ом • м; X — длина
волны, м.
Механизм этого процесса таков; при воздействии на поверх-
ность металла излучение обусловливает вынужденные колебания
свободных электронов, которые создают отраженную волну.
Затухание электромагнитных волн в поверхностном слое металла,
Сопровождающееся отражением части потока энергии, опреде-
ляет поглощательную способность тела. Зависимость (3.112) уста-
навливает, что поглощательная и излучательная способности
вещества зависят от его электрической проводимости а = 1/р.
"Материалы с низкой излучательной способностью должны иметь
**алое значение р, т.е. быть хорошими проводниками элекгри-
137
чества. Так как р пропорционально температуре, то с пониже-
нием Т уменьшается и излучательная способность. При низких
температурах формула (3.112) не дает верного результата вследст-
вие появления дополнительного поверхностного эффекта (ано-
мальный скин-эффект), связанного с увеличением длины свобод-
ного пути электронов. В результате излучательная способность
увеличивается, влияние температуры уменьшается.
Другим важным фактором, влияющим на е, является состоя-
ние поверхности материала. Нарушение упорядоченной криста ь
лической структуры в поверхностном слое уменьшает электри-
ческую проводимость, и е увеличивается. Излучательная способ-
ность е минимальна при снятии напряжений в поверхностном
слое (отжиг, травление); механическое полирование приводит к
увеличению е, поэтому рациональнее электролитическое полиро-
вание. Большое значение имеет также степень шероховатости
поверхности. Степень черноты е может меняться в широких
пределах (от 0,01 до 0,9) в зависимости от указанных факторов.
Наиболее точные значения е получены экспериментально. В
табл. 3.10 приведены значения е при различных температурах
для ряда технических материалов; температура излучающего тела
около 300 К.
Из приведенных в таблице данных следует, что материалы с
высокой электрической проводимостью и нешероховатой чистой
поверхностью, не нарушенной механическими воздействиями,
имеют минимальные значения е.
3.10. Степень черноты некоторых материалов
Материал Значения г при температуре. К
300 76 4,2
Алюминий, отожженный электро- 0,03 0,018 0,011
полированный Алюминий (чистая шероховатая 0,055 —
поверхность) Медь, механически полированная 0,03 0.019 0,015
Медь, электролитически полированная — 0,0082 0,0062
Медь с окисленной поверхностью 0,78 — —
Серебро с чистой поверхностью 0,02 0,01 —
Латунь 0.06 — —
Сталь коррозионно-стойкая, 0,08 0,048 —
механически полированная Сталь углеродистая 0,6 — —
Бакелитовый лак (пленка) — 0,87 —
Стекло 0.94 — __Z—-—
138
§ 3.9. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ И
СВЕРХПРОВОДИМОСТЬ
Электрические свойства твердых тел так же, как тепловые,
существенно зависят от температуры. В отдельных случаях
изменения настолько значительны, что возникают принципи-
ально новые явления. Наиболее характерный пример — сверх-
проводимость ряда металлов и сплавов. Физическую сущность
электромагнитных явлений при низких температурах можно
объяснить наиболее полно лишь на атомно-молекулярном уровне
с учетом квантовой теории. Рассмотрим наиболее характерные
свойства твердых тел при низких температурах.
Электрическая проводимость. Перенос электрического заряда
в проводниках обусловлен движением свободных электронов,
находящихся в электрическом поле. Электроны проводимости
перемещаются под действием электрического поля направленно
и упорядоченно. Они встречают на своем пути препятствия, что
приводит к рассеянию их энергии, т.е. к уменьшению проводи-
мости и увеличению электрического сопротивления. Подобными
препятствиями являются тепловые колебания решетки (фононы),
а также дефекты решетки, обусловленные примесями и наруше-
ниями структуры кристалла. В результате столкновений с фоно-
нами и дефектами скорость электронов уменьшается, а затем
снова увеличивается под действием электрического поля. Очевид-
но, что такой механизм переноса заряда существенно зависит
от средней скорости с электронов и длины I их свободного пути.
Классическая теория электрической проводимости, рассматри-
вающая движение идеального электронного газа и взаимодейст-
вие его с фононами, исходит из следующих представлений.
Время г между столкновениями и длина I свободного пути
связаны соотношением т = I/ с .За время т электрон ускоряется
в направлении приложенного поля. В соответствии со 2-м зако-
ном Ньютона ускорение а = еЕ/т, где е — заряд электрона
Массой т,Е — разность потенциалов. Под действием ускорения
а электрон приобретает скорость и направленного движения,
среднее значение которой и = ai/'l = е Е1/(тс ). Плотность тока
1 ~~ это произведение числа п свободных электронов в единице
объема, их скорости и и заряда е:
пе2Е I
! = пей = ----— .
т с
139
Эта формула представляет собой закон Ома, из которого опре-
деляют электрическое сопротивление р = E/j или электрическую
проводимость
рте
Отсюда следует, что зависимость проводимости от темпера-
туры определяется изменением длины свободного пути / = /'( £>
(см. рис. 3.35), так как остальные величины постоянны. Процессы
переноса теплоты и электричества в проводниках аналогичны
по своей природе и осуществляются электронным газом, поэтому
теплопроводность X и электрическая проводимость о связаны
между собой простым соотношением. Для идеального газа тепло-
емкость единицы объема можно записать так:
сv = 3 и к / 2. (3.114)
Подставив это выражение в формулу (3.106) с учетом тою,
что тс2/2 = ЗкТ/1, из (3.113) найдем
к.у/а = 3(к/ё)2Т = LT. (3.115)
где £ = 25 нВт-Ом/К2 — постоянная.
Эта формула представляет собой полученное эксперимен-
тально правило Видемана — Франца. Оно хорошо выполняется
при температуре выше 100 К, однако при более низких темпера-
турах возможны отклонения, так как длина свободного пути
различна для £ и о. Более точная теория электрической проводи-
мости основана на использовании законов квантовой механики
при описании свойств системы электронный газ - кристалли-
ческая решетка. Эта теория основана на применении статистики
Ферми — Дирака, которой подчиняется электронный газ. Наибо-
лее точный результат при вычислении электрического сопротив-
ления дает формула Грюнейзена:
ру./р0 = 1,056(7/6)746/7), (3.116)
где рЛ — сопротивление проводника при температуре 7"; р, —
сопротивление проводника при температуре 6, близкой к темпе-
ратуре Дебая 6И (см. табл. 3.9).
Значения относительного сопротивления pz/pG в функции
отношения 6/7", рассчитанные по формуле (3.116):
140
е/г Рт/Ре — 0.1 .„10.55 0.2 5.268 0.4 2,617 0.5 2.083 0.6 1.725 0.8 1,274 1.0 1,000 1.2 0.8’13 1.5 0,623
0/Г 1.6 1.8 2,0 7 S 3.0 3.5 4.0 5.0 6.0
Ру/Ро' ... 0,574 0.493 0.426 0.304 0.22 0.164 0,1216 0,0679 0.03849
0/Г 7.0 8.0 9,0 10,0 12.0 14.0 16.0 20.0
Ру/Ре .. 0.0222 0.01308 0,00791 0.00492 0.00207 0.00097 0.0005 0.000164
Если известно электрическое сопротивление материала при
некоторой температуре То, то сопротивление при любой другой
температуре Т можно определить из соотношения
= Ч УЧУ;’
При низких температурах (Т< 0,1 9Д) электрическое сопротив-
ление быстро уменьшается пропорционально Т5; в этой области
формула (3.116) неточна. При высоких температурах (Т > 0,5 йд)
изменение ру. прямо пропорционально Т.
При определении полного электрического сопротивления р
необходимо учитывать дополнительную составляющую р0, опре-
деляемую рассеянием энергии электронов на примесях и дефек-
тах решетки. Эта составляющая нс зависит от температуры и
создает остаточное сопротивление, сохраняющееся вплоть до 0 К.
Для хороших проводников высокой чистоты р0 << р7, влияние
с0 начинает проявляться при низких температурах (80 К и ниже)
и становится определяющим при температуре порядка 10 К. Для
чистых материалов отношение электрических сопротивлений при
нормальной и гелиевой температурах Р300/Р4 2 = Ю2...10?. Влияние
р0 возрастает с увеличением содержания примесей и дефектов.
Суммарное электрическое сопротивление (по правилу Матти-
сена)
р=р7 + р(). (3.117)
На рис. 3.40 приведены зависимости удельного электрического
сопротивления металлов от температуры. Горизонтальные участ-
ки на кривых соответствуют остаточному сопротивлению р();
согласно рис. 3.40, б р() изменяется на два порядка в зависимости
от содержания примесей. Указанное относится к проводникам
Достаточно высокой чистоты. Проводимость сплавов даже при
Нормальной температуре определяется в основном концентра-
цией примесей, т.е. сопротивлением р0. В этом случае сопротив-
ление очень мало зависит от температуры. Так, для латуни в
Интервале температур 300—4,2 К сопротивление уменьшается в
2 раза, для коррозионно-стойкой стали — в 1,4 раза.
141
нов и приводит к увеличению
Рис.3.40. Зависимость удельноГ(|
электрического сопротивления о?
температуры:
а — для различных металлов (/ - сц.
2 — А1; 3 - Na; 4 — Be); o' - ,L1J)
алюминия с различной степеньк
чистоты (/ — 99,7 % А1; 2 — ЧЧ.1) <-г
А1; 3 - 99.99 % А1; 4 - 99,999 °с .щ
При низких температурах
электрическое сопротивление
металлов зависит также от
напряженности и ориентации
магнитного поля. Наложение
магнитного поля изменяет
характер движения электро-
p. Этот эффект особенно
проявляется в чистых материалах при сильных магнитных по-
лях; при продольном магнитном поле сопротивление увели-
чивается меньше, чем при поперечном. Для ряда металлов
зависимость р от параметров магнитного поля изучена экспери-
ментально [17].
Сверхпроводимость. Удельное электрическое сопротивление
сверхпроводников р = 0; этот эффект реализуется только при
очень низких температурах. Явление сверхпроводимости открыто
Камерлинг-Оннесом в 1911 г. при исследовании электрического
сопротивления ртути. Сопротивление ртути становилось равным
нулю при Т ~ 4,2 К. Полное исчезновение электрического сопро-
тивления подтверждается тем, что электрический ток, наве-
денный в замкнутом контуре из сверхпроводника, циркулирует
без затухания сколь угодно долго. В сверхпроводящее состояние
могут переходить многие вещества, в том числе 24 чистых
металла, сотни сплавов и соединений. Существует критическая
температура перехода Гс в сверхпроводящее состояние; для
различных веществ она лежит в интервале от 0,15 К до значений,
несколько превышающих 20 К.
Область А (рис. 3.41) сверхпроводящего состояния ограничена
критической температурой Тс и критической напряженностью
магнитного поля Яс; Нс максимальна при Т = 0 (Яс = Д(|) И
уменьшается до нуля при Т = Гс. Очевидно, что при Т < Тс
вещество может находиться в сверхпроводящем (область А) илй
нормальном (область В) состоянии в зависимости от напряжен-
ности поля Н. Сверхпроводимость исчезает под действием
142
рис. 3.41. Зависимость критической
Напряженности магнитного поля от темпс-
ржтуры:
а — общий вид границ фазового перехода
от сверхпроводимости (область Л) к
нормальному состоянию (область В ); б —
зависимость Яс = f(T) для некоторых
сверхпроводников
внешнего магнитного поля при Н > Нс или поля, создаваемого
протекающим по сверхпроводнику током. Следовательно, наряду
с критической напряженностью существует критическая сила
тока /с = <?(Т).
Согласно правилу Силсби внешнее поле и протекающий по
сверхпроводнику ток одинаково влияют на сверхпроводимость,
т.е. критическая сила тока / создает критическую напряженность
поля Но . Это правило справедливо для чистых металлов.
Критическая напряженность поля связана с температурой
приближенным уравнением
Нс = Яо[1 - (Г/Гс)2]. (3.118)
Ниже указаны значения Но и Гс для некоторых сверхпровод-
ников:
Вещество
К....
Но, кА/м
. Ti Zn
0,39 0,875
..8 4
Al Sn
1,196 3,72
7,9 24
Hg Pb
4,153 7,19
33 64
Nb Nb3Sn
9?6 18,1
157 15900
Отсюда следует, что чистые вещества имеют очень низкие
значения критической напряженности магнитного поля
(рис. 3.41, б).
Наряду с условием р = 0 для сверхпроводников характерно
Другое фундаментальное свойство — отсутствие магнитной
Индукции. Внутри сверхпроводника магнитная индукция В = О
(рис. 3.42). Это явление, называемое эффектом Мейснера,
143
Рис. 3.42. Схемы, иллюстрирующие эффект Мейснера:
а — нормальное состояние (Т > Тс); б — сверхпроводящее состояние (Т < Тс)
обусловлено тем, что внешнее поле наводит в сверхпроводнике
незатухающие круговые поверхностные токи; собственное поле
этих токов компенсирует внешнее поле, не давая ему проникнуть
внутрь проводника. Следовательно, сверхпроводник является
идеальным диамагнетиком; магнитное поле может проникать
только на очень малую глубину порядка 0,1 мкм. Из выражения
для магнитной индукции В = Н + 4яЛ/ определим объемную
намагниченность сверхпроводника (В = 0) М = -Н/(4я).
Намагниченность единицы массы
М = - W(47t), (3.119)
где и — удельный объем сверхпроводника.
Рассмотрим термодинамические свойства сверхпроводника.
Фазовый переход из нормального в сверхпроводящее состояние
происходит обратимо; кривая Нс = f(T) на рис. 3.41, а является
равновесной линией, разделяющей две фазы по аналогии с
равновесием системы пар — жидкость. Свободная энергия маг-
нитной системы (без учета давления) F = и - Ts - НМ, где и —
внутренняя энергия; у — энтропия.
Дифференциал свободной энергии
dF — -sdT - MdH. (3.120)
При Т = const изменение F определяется работой магнитных
н
сил J М dH. При наложении магнитного поля напряженностью Н
о
свободная энергия равна сумме ее значения 7^0) при Н = 0 и
н
работы магнитных сил, т.е. F^ = 7^0) - J МdH, где индекс 5
о
относится к сверхпроводящей фазе.
144
Используя выражение (3.119), найдем
С учетом этого выражения, приравняв свободные энергии
обеих фаз на линии их раздела (Н = fQ-.F^ = F^, что характе-
ризует условие равновесия, получим
^(0) = ^ДО) + Яс2<8я), (3.121)
где индекс п относится к нормальной фазе.
При этом работа магнитных сил нормальной фазы пренебре-
жимо мала, т.е. Fn^ - Fn(0). Из выражения (3.121) следует, что
свободная энергия проводников в сверхпроводящем состоянии
меньше, чем в нормальном, на величину H2v/(8n). Формула
(3.121) позволяет определить другие термодинамические характе-
ристики сверхпроводящего вещества. Из уравнения (3.120) при
Н= const следует: 5 = ~(dF/dT)ff; с учетом этого выражения из
(3.121) получим
Так как dHc/dT < 0 [см. рис. 3.41 и формулу (3.118)], то
энтропия проводника в сверхпроводящем состоянии меньше, чем
в нормальном. При сверхпроводящем состоянии более упоря-
дочена электронная структура и фазовый переход сопровождается
скачком энтропии. Зная разность энтропий, можно определить
теплоту фазового перехода Q = T(sn - ss). Из выражения (3.122)
также следует: '
dHjdT= -4л(х„-^)/(Я^). (3.123)
Это выражение является аналогом известного уравнения Кла-
пейрона — Клаузиуса (2.95) и связывает параметры сверхпрово-
дящего вещества при фазовом переходе. Из формулы (3.122)
Можно также определить разность теплоемкостей фаз, используя
соотношение с = T(ds/dT)H:
(3.124)
Для образцов сложной геометрической формы невозможен
полный переход из сверхпроводящего состояния в нормальное.
Внутри такого образца сосуществуют одновременно обе фазы,
Заказ № 1592 1 45
и данное состояние называется промежуточным. По мерс уведи,
чения напряженности Н поля количество нормальной фазы
постепенно увеличивается, а количество сверхпроводящей
уменьшается до нуля.
Термодинамическое описание нс охватывает всех сторон
такого сложного явления, как сверхпроводимость, для понимания
которого разработан ряд теорий. Так, К.Гортер и Г.Казимир
предложили двухжидкостную модель сверхпроводимости; Ф и
Х.Лондоны разработали электродинамическую теорию сверх,
проводников. А.Пиппард модернизировал теорию Лондонов,
предложив нелокальную теорию связи между напряженностью
поля и силой тока в сверхпроводниках. Эти исследования были
полезными для понимания явления сверхпроводимости.
Микроскопическая теория сверхпроводимости, наиболее
полно объясняющая физическую сущность этого явления, разра-
ботана Д.Бардином, Л.Купером и Д.Шриффером (теория БКШ)
в 1957 г. Они показали, что между электронами может возник-
нуть особый тип взаимодействия, приводящий к сверхпроводи-
мости. При низких температурах возможно образование связан-
ных пар электронов (купсровские пары). Энергия пар меньше
энергии свободных электронов на величину энергии связи
2А = 3,52^7^ (при Т = 0). Пары обладают свойством сверх-
проводимости. Пары образуются в результате взаимодействия
электронов с фононами (квантами колебаний решетки). При
этом оказалось, что силы притяжения между электронами
превышают кулоновские силы отталкивания одноименных заря-
дов и в результате создаются пары. Образование таких пар
возможно только при низких температурах, так как тепловая
энергия мала и не может разорвать межэлектронные связи.
Движение пар без рассеяния энергии обусловлено тем, что
энергия фононов меньше энергии связи электронов и взаимо-
действие фонона с электроном нс приводит к разрыву пары.
Поток электронов, состоящий из парных частиц, движется через
решетку без сопротивления, т.е. возникает сверхпроводимость.
При Т = Тс ширина энергетической щели уменьшается до нуля,
происходит разрыв пар и скачкообразно возрастает сопротивле-
ние. Теория БКШ позволила объяснить многие свойства сверх-
проводников и дала хорошее соответствие с результатами
экспериментов.
Свойства сверхпроводников в значительной степени зависят
от значения и направления поверхностной энергии на границе
раздела фаз. Влияние этого фактора наиболее полно отражено
146
в теории В. Гинзбурга и Л. Ландау, развитой впоследствии
д. Абрикосовым и Л. Горьковым (теория ГЛАГ). В зависимости
(УТ знака поверхностной энергии различают сверхпроводники
первого и второго рода.
Сверхпроводники с положительной поверхностной энергией
называются сверхпроводниками первого рода; для них характер-
ны эффект Мейснера, четкий фазовый переход, низкие значения
Т и Нс. Сверхпроводники второго рода имеют отрицательную
поверхностную энергию, и их характеристики существенно
отличаются. Эта группа сверхпроводников включает большое
число сплавов и интерметаллических соединений, а также
ниобии. Отрицательная поверхностная энергия вызывает дробле-
ние сверхпроводящей фазы на перемежающиеся нормальные и
сверхпроводящие области с большой поверхностью раздела.
Характеристика сверхпроводников второго рода, для которых
существуют два значения напряженности критического магнит-
ного поля НсХ и /7с2, приведена на рис. 3.43.
При напряженности поля меньше Нс] сверхпроводники второ-
го рода ведут себя как сверхпроводники первого рода; у них
проявляется эффект Мейснера и другие свойства. При более
высоких значениях Н в интервале от Нс] до Нс2 существует
область смешанного состояния, для которой характерно проник-
новение магнитного поля внутрь сверхпроводника в виде нитей
магнитного потока. При этом материал сохраняет сверхпрово-
дящие свойства вплоть до Н = Нс2. Это состояние обеспечивает
максимальную поверхность раздела фаз, что энергетически более
выгодно, когда поверхностная энергия отрицательна.
Для сверхпроводников вто-
рого рода с однородной крис-
таллической структурой (идеаль-
ных) не сохраняется сверх-
проводимость при протекании
слабых токов, так как изменя-
ющееся магнитное поле внутри
сверхпроводника создаст Э-ДС,
выделяется теплота и материал
Переходит в нормальное состоя-
ние. Иначе ведут себя сверхпро-
водники второго рода с нерегу-
лярной структурой, имеющие
пРИмеси и дефекты решетки
(Жесткие сверхпроводники).
10*
Рис. 3.43. Зависимость Нс — f(T) для
сверхпроводников второго рода:
I — область проявления эффекта
Мейснера (В = 0); II — область
смешанного состояния
147
Неоднородности структуры являются фиксирующими центрами,
которые удерживают нити магнитного потока в определенном
положении; при этом ток большой силы может течь без сопро-
тивления по сверхпроводящим участкам. Сверхпроводники этого
класса имеют наибольшее практическое значение в технике.
Сверхпроводящие материалы и щ
свойства. Для технических систем (электромагнитов, генераторов,
электродвигателей и др.) применяют жесткие сверхпроводники
второго рода, главным образом выполненные на основе ниобия.
Для сплава Nb3Ge: Тс = 23,2 К; Нл = 320 кА/см. Для интер-
металлического соединения Nb3Sn; Гс = 18,06 К; Нс2 = 180 кА/см;
плотность тока, текущего по сверхпроводнику, может достигать
105 А/см2; механические свойства этого материала (хрупкость)
ограничивают его широкое использование. Более распростра-
нены соединения типа Nb — Zn, Nb — Ti, Nb — Zr — Ti. Так,
для материалов состава Nb + (25...50 %) Zr: температура Гс = 11 К,
критическая плотность тока 104 А/см2, Яс2 ~ 35 кА/см; для
материалов состава Nb + (40...60 %) Ti: Тс ~ 10 К; На ~ 60 кА/см,
В нашей стране выпускают сверхпроводящие сплавы: 65БТ
(65 % Nb, 25 % Ti, 8 % Zr ); НЦ-50 (Nb - Zr) и НТ-50
(Nb - Ti) [17].
Сверхпроводники обычно используют в виде кабеля, состоя-
щего из тонких жил диаметром 0,01-0,2 мм. Такая конфигурация
позволяет обеспечивать более высокие значения допускаемой
плотности тока. Максимальные значения плотности тока и
критической напряженности магнитного поля могут быть
различны для одного и того же материала. Они в значительной
степени зависят от конструкции сверхпроводящей системы и
эффективности ее охлаждения. Допустимая плотность тока для
сверхпроводящего кабеля существенно меньше, чем для опытных
коротких образцов. Это обусловлено нестабильностью сверх-
проводящего состояния, локальными нарушениями сверхпро-
водимости и тепловыделениями. Для обеспечения надежного
функционирования сверхпроводников применяют различные
способы их стабилизации. Один из этих способов состоит в обес-
печении интенсивного и эффективного теплоотвода жидким s
гелием. Другой способ заключается в том, что сверхпроводник
монтируют в матрицу из металла (меди) с низким электрическим |
сопротивлением, через которую замыкается ток при нарушении
сверхпроводимости.
Особый случай — сверхпроводники в переменных магнитных i
полях. При этом сверхпроводники первого рода сохраняют свои
148 I
свойства, а в сверхпроводниках второго рода происходит выделе-
ние теплоты, вызываемое изменением намагниченности и
частоты магнитного поля.
В 1986 г. экспериментально открыты сверхпроводящие мате-
риалы с критической температурой Г, ~ 90... 100 К. Они
Представляют собой сплавы на основе редкоземельных металлов,
а также Ва, Си и О, по структуре близкие к керамике. Сейчас
ведется изучение этого класса сверхпроводников, использование
которых в электротехнике весьма перспективно.
§ З.Ю. МЕХАНИЧЕСКИЕ СВОЙСТВА
Механические свойства материалов, так же как тепловые и
электрические, существенно зависят от температуры. Эта зависи-
мость проявляется в виде значительных изменений таких проч-
ностных характеристик, как предел текучести, предел прочности,
сопротивление разрыву, относительное сужение, ударная вяз-
кость и др. Прочностные свойства металлов в значительной
степени зависят от расположения атомов в кристаллической
решетке, что в свою очередь определяется типом решетки,
наличием примесей и дефектов. Из-за сложности явлений и
разнообразия ситуаций теоретического описания не существует
и данные по механическим свойствам при низких температурах
приводятся только в виде экспериментальных зависимостей. В
то же время установлен ряд общих принципов, определяющих
характер изменения механических свойств.
Так, при снижении температуры сопротивление пластической
Деформации (предел текучести от, временное сопротивление с ,
твердость) возрастает. Для некоторых материалов значения от
и ов увеличиваются примерно в 1,5 2,0 раза при снижении
температуры в интервале 300—80 К. Характер пластической
Деформации определяется сдвигом одной атомной плоскости
кристаллической решетки относительно другой; при этом важное
значение имеет понятие дислокаций, представляющих собой
Нарушение структуры решетки. Процесс деформации твердого
тела сопровождается перемещением дислокаций; при отсутствии
Дислокаций (в материале с регулярной структурой) необходимы
значительные силы для сдвига атомных плоскостей.
Воздействие низкой температуры на перемещение дислокаций
проявляется в уменьшении колебаний атомов, что затрудняет
Движение дислокаций в материале, увеличивая его прочность
(рис. 3.44).
149
б, МПа
б, МПа
Вис. 3.44. Прочностные характеристики металлов при низких температурах:
а — зависимость предела текучести (штриховые линии) и временного
сопротивления (сплошные линии) от температуры {1.2— медь; 3, 4 — никель;
5, б — углеродистая сталь); о — зависимость напряжений в латуни от
относительной деформации г при различной температуре Т
Предел усталости материала, определяемый напряжением, при
котором происходит разрушение после заданного числа циклов
поперечного изгиба, также возрастает при понижении температу-
ры. Это увеличение примерно такое же, как и при пластической
деформации.
Снижение температуры особенно сильно влияет на пластичес-
кие свойства - ударную вязкость ан (рис. 3.45), относительное
удлинение 5 и сужение \р. Для многих материалов снижение Т
приводит к уменьшению пластичности; возникает тенденция к
хрупкому разрушению (хладноломкость).
На поведение материалов при низких температурах влияют
многие факторы. Так, большое значение имеет структура
кристаллической решеткй-
Металлы с гранецентрирован-
ной кубической решеткой
Рис. 3.45. Зависимость ударной в«3'
костн от температуры для металлов:
/ — аустенитная сталь; 2 — ч,еДь
отожженная; 3 — углеродистые стаДИ-
4 — алюминий деформированный
/уедь, никель, алюминий,
стали аустенитного класса)
соХРаняют высокую пластич-
ность при низких температурах.
Металлы с объемно-центриро-
ванной кубической и гексаго-
нальной решетками становятся
хрупкими (углеродистые стали);
для таких материалов харак-
терно резкое уменьшение удар-
ной вязкости даже при уме-
ренно
низких температурах.
Химический
состав
сплава
Рис. 3.46. Зависимость ударной вяз-
кости от температуры для легированной
стали с различным содержанием никеля
значительно
влияет на механичес
кие свойства. При увеличении в стали количества углерода H
фосфора пластичность уменьшается при низких температурах
Противоположное влияние оказывают на пластичность сталей
Такие добавки, как никель, хром, молибден, ванадий. Добавки
никеля наиболее резко увеличивают пластичность (рис. 3.46).
Термообработка также существенно влияет на механические
свойства металлов при низких температурах. Стали с мелко
зернистой структурой имеют повышеную ударную вязкость;
стали, подвергнутые закалке и отпуску, обладают существенно
более высокой пластичностью.
Отмеченные особенности поведения металлов при низких
Температурах определили материалы, используемые в криогенных
системах. Это цветные металлы (медь, алюминий, их сплавы) и
легированные стали. В ранние годы развития криогеники в
Основном применяли медь и ес сплавы на основе цинка
(латуни), в 60-х гт. резко увеличилось применение легирован-
ных сталей, сейчас — тенденция к резкому увеличению исполь-
зования алюминиевых сплавов.
Стали. Для криогенных систем наиболее пригодны высоко-
легированные стали аустенитного класса со значительным содер-
жанием никеля (до 9 — J0 %). Наиболее распространена сталь
12X18 НЮТ, содержащая 0,08—0,12 % С. Эта сталь имеет высокие
Пластичность и коррозионную стойкость, ее можно применять
Вплоть до гелиевых температур. Сталь отличается высоким
Пределом выносливости, эффективна при циклическом нагруже-
Пйи. Недостатки этой стали — невысокая прочность и значитель-
ная стоимость, обусловленная большим содержанием никеля.
Пригодны стали с меньшим содержанием никеля (до 3—6 %),
°ДНако их применение ограничено, главным образом, вследствие
151
3.11. Механические характеристики сталей при низких
температурах
Сталь Химический Т. СТт 8 V
состав к МПа кДж/.м2
12Х18Н10Т 18 % Сг; 293 590 245 55 70 1570
(высоколе- 10 % Ni; 77 1180 312 42 50 1470
тированная) = 0,1 % С 20 1810 635 32 42 1175
18Х2Н4ВА 1,5 % Ст; 293 1220 1025 — 63 1100~"
(низколеги- 4 % Ni; 77 1645 1280 — 54 425
ро ванная) I % W; 0,15-0,20 % С 20 1740 1470 — 3 145
СтЗ (угле- 0,15-0,25 % С 293 370-490 215-340 25-30 62-70 980-196?
родистая) 77 765-860 755-830 8-10 1-4 10-19
пониженной пластичности. Низколегированные стали приме-
няют при температурах до 120 К, углеродистые — при темпера-
турах выше 230 К. В табл. 3.11 приведены механические
характеристики некоторых сталей при низких температурах.
Медь и ее сплавы. В криогенике применяют медь М3, а также
медно-цинковые сплавы — латуни различного состава (табл. 3.12),
Ударная вязкость этих металлов даже увеличивается при пони-
жении температуры, однако прочность их невелика. Один из
недостатков латуни — коррозионное растрескивание при
нахождении ее в атмосфере металлургических и химических
заводов. Дефицитность меди — существенное ограничение для
применения этих материалов.
Алюминий и его сплавы все более широко применяют в
криогенных системах, что обусловлено их хорошими пластичес-
кими свойствами и доступностью. Ограничением является низкая
прочность этих материалов. Алюминиевые сплавы используют
главным образом для изготовления теплообменной аппаратуры
колонн, сосудов, емкостей для сжиженных криоагентов. Характе-
ристики алюминия и некоторых его сплавов даны в табл. 3.12.
Пластмассы. В криогенных системах применяют многие
пластмассы, обладающие рядом важных качеств, таких, как
низкая теплопроводность, малая плотность, эластичность,
антифрикционные свойства и др. Эти материалы состоят из
молекул с длинными цепями, что существенно определяет их
свойства. Прочность и пластические свойства многих из этих
материалов также достаточно высоки. Некоторые пластмассы,
такие, как фторопласт, поликарбонаты, имеют малую прочность,
152
jj2. Механические характеристики цветных металлов при
00КИХ температурах
.—•— “ — Материал Химический состав 7. к пв аг <5 а . н кДж/м
МПа %
14едь М3 99,5 % Си 293 225 87 30 70 1750
77 342 — 41 72 2080
20 450 — 48 74 2110
— — Латунь ЛЬЗ 62 % Си. 293 352 132 65 62,4 1235
остальное Zn 77 500 183 79 66,2 1510
Латунь Л С 59—1 59 % Си, 293 410 128 42,7 49,7 587
1 % РЬ, 77 565 198 52,2 47,8 578
остальное Zn
Латунь 59 % Си, 293 476 208 37 52,7 636
ЛЖМц 59-1 — 1 1 % Ее, 77 615 304 41.5 41,5 685
1 % Мп,
остальное Zn
" АД1 99,5 % Al 293 77 31 35 71 910
90 158 39 48 67 1550
" АМц 1,0-1,6 % Мп, 293 123 62 30 63,5 676
остальное AI 77 242 84 43 — 550
20 298 — 26 — —
АМгб 5,8-6,8 % Mg, 293 334 157 20 28 294
0,5-0,8 Мп, 77 432 177 25 25 286
остальное А1 20 520 200 19 22 275
но высокую эластичность; их применяют в качестве уплотни-
тельных материалов вплоть до гелиевых температур. Текстолит,
тетинакс и ряд других пластмасс имеют более высокую проч-
ность; их используют в качестве теплоизолирующих прокладок,
пар трения и других элементов криогенных систем.
Наряду с пластмассами эффективны и композиционные
Материалы, особенно стеклопласты (такие, как АГ-4С и 27-63С).
Имеющие прочность такого же порядка, как у сталей, но гораздо
более низкую теплопроводность. Так, для стали 12Х18Н10Т
13 Вт/(м • К), тогда как для стеклопластов X =- 0,4 Вт/(м • К).
обусловило их применение в качестве элементов опор и
аРМатуры, где важны малые теплопритоки в сочетании с высокой
Прочностью.
Применение пластмасс и композиционных материалов в
Криогенных системах постоянно расширяется, и в дальнейшем
Роль будет возрастать.
153
§ 3.11. ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА БИОМАТЕРИАЛОВ
Наряду с традиционными криогенными системами, такими
как установки ожижения и разделения газов, системы криостц.
тирования различных объектов, в настоящее время существуют
устройства для замораживания биологических сред. Известны два
основных типа таких устройств. Один из них предназначен для
замораживания биоматериалов с целью их длительного хранения
при низких температурах (обычно при температуре жидкого
азота) и последующего отогрева с восстановлением жизненных
функций. Так, широко известны системы для замораживания и
хранения крови, костного мозга человека, спермы сельскохозяй-
ственных животных и отдельных органов для последующе ii их
пересадки.
Системы другого типа предназначены для проведения криохи-
рургических операций замораживанием новообразований в
организме человека с последующим отторжением омертвленной
замороженной зоны. Криохирургические операции успешно
проводят в онкологии и ряде других отраслей медицины.
Расчет и эффективное проведение процессов замораживания
биоматериалов возможны лишь при наличии информации об их
свойствах при низких температурах. К таким свойствам в первую
очередь относятся теплопроводность, теплоемкость и темпера-
туропроводность. Данные по свойствам биоматериалов при
низких температурах пока весьма ограниченны. Экспсримен пль-
ное и расчетное определение этих свойств затруднено тем, что
биоткани имеют весьма сложную структуру, нередко они анизо-
тропны, а в процессе замораживания и многофазны (жидкость —
лед). В общем случае биоткани состоят из трех основных компо-
нентов — воды, белка, жира; причем определяющая роль при-
надлежит воде, которая составляет в организме человека в
среднем 60 %, колеблясь от 85 % для мозга до 15 % для жировой
ткани. Однако значительная часть воды в биотканях содержится
не только в свободном виде, но и в связанном, что обусловлено
межмолекулярными связями — взаимодействием между моле-
кулами воды и белка.
По этой причине переход воды в организме в твердое состоя-
ние происходит не при 0 °C (273 К), а в широком интервале
температур — в основном от 273 до 243 К, но даже при весьМ3
низких температурах (около 200 К) в биотканях еще остается
до 10—20 % незамерзшей воды (рис. 3.47).
154
Характер изменения тепло-
проводности и теплоемкости
ярИ снижении температуры
должен отражать перечислен-
ие факторы, учитывать харак-
тер изменения состояния воды.
Теплопроводность.
(Механизм переноса теплоты в
биоматериалах значительно
отличается от такового в твер-
дых телах, газах и жидкостях,
физическую модель биоткани
Можно представить в виде
капиллярно-пористой струк-
туры, имеющей две фазы
(твердую и жидкую) при их
взаимном переходе. Кроме
того, при относительно высо-
Рис. 3.47. Зависимость доли W* в
иезамерзшей воды в биотканях собаки
от температуры охлаждения:
1 — мышца; 2 — мышца щенка; J —
гемангиома; 4 — печень; 5 — меланома
ких температурах на перенос
теплоты влияет кровоток в
капиллярах биоткани. Все это
позволяет говорить лишь об
условном или эффективном
коэффициенте теплопроводности комплексно учитывающем
влияние всех разнородных факторов. Достаточно надежные
Данные о ХЭф можно получить только экспериментально.
Значения теплопроводности различны для различных видов
биотканей, но закономерность изменения имеет общий ха-
рактер (рис. 3.48). В интервале от исходной температуры 310 К
(*= 37 °C) до 273 К значение А.эф почти постоянно. В интервале
273...243 К теплопроводность резко увеличивается, что обуслов-
лено образованием льда, теплопроводность которого в 4 раза
больше, чем для воды. Ход кривых А.эф = /(7) в этом интервале
отражает закономерность вымораживания связанной воды. При
температуре ниже 240 К значение А.эф стабилизируется, но при
Охлаждении до температуры жидкого азота теплопроводность
Несколько уменьшается. Это явление предположительно объяс-
няется появлением микротрещин в биоткани вследствие различия
Температурных коэффициентов расширения компонентов
биоткани. Повторное охлаждение — отогрев приводит к
Появлению гистерезиса в ходе кривой X ф = f(T), достигающего
20-25 % в интервале температур 273...258 К. Природа гистерезиса,
155
Рис. 3.48. Зависимость теплого
водности биотканей челове1('
и воды (льда) от температуры- *
1 — вода; 2 — лед; J — пече'щ,
( Hz = 76 %); 4 — поперечно
полосатая мышца ( Ш = 72
4а — вдоль волокон; 46 — поце
рек волокон); 5 — коХа
(IV — 58 %); 6 — жировая ткань
(IV = 25 %); 7 — мышца (сухой
остаток)
видимо, сивана со структурно-механическими изменениями в
биотканях яри повторном охлаждении — отогреве.
Теплоемкость. Для сложной многокомпонентной и
многофазной структуры биоткани целесообразно определять
усредненную эффективную теплоемкость сэф, учитывающую
влияние отельных составляющих и их зависимость от темпе-
ратуры.
Достаточно надежные данные по теплоемкости можно полу-
чить с использованием принципа аддитивности, т.е. при незави-
симом учете вклада отдельных составляющих в полную эффек-
тивную теплоемкость. Таким образом,
Ч|, = (теС'с + тн.вСн.в + т^1т + ГАИУДТ,
где т и с - соответственно масса и теплоемкость; индексы л.
н.в. и с относятся ко льду, невымороженной воде и сухому
биологическому остатку; т — полная масса всех компонентов
биоткани; г- теплота фазового перехода.
Второе слагаемое в правой части учитывает вклад в теплоем-
кость теплоты фазового перехода г при замерзании доли воды
А И7 в интервале температур АТ (см. рис. 3.47). Температура
начала замерзания воды Т для различных биотканей составляет
273-269 К. Данные по воде и льду достаточно хорошо известны;
по имеющимся ограниченным данным, теплоемкость сухого остат-
ка различны;видов биоматериалов сс = 1,25...1,50 кДж/(кг • К) при
230 К и мало зависит от температуры. Ориентировочные значения
теплоемкости биотканей: при Т> Т* с, = 2,5...4,0 кДж/(кг’Ю-
при Т< Т* c4= 1,3 ... 2,0 кДж/(кг • К). Теплоемкость изменяется
особенно значительно в зоне перехода основной массы воды я
лед при Т < Г.
[лава 4
ОСНОВНЫЕ ПРОЦЕССЫ
ДЛЯ ПОЛУЧЕНИЯ НИЗКИХ ТЕМПЕРАТУР
§4.1. ПРОЦЕССЫ, СОПРОВОЖДАЮЩИЕСЯ ПОНИЖЕНИЕМ
ТЕМПЕРАТУРЫ В АДИАБАТНЫХ УСЛОВИЯХ.
ХОЛОДОПРОИЗВОДЯЩИЕ ПРОЦЕССЫ В ЦИКЛАХ
Для непрерывного искусственного охлаждения реализуют
разнообразные циклы криогенных установок. Любой цикл
включает несколько процессов, и по крайней мере один из них
должен сопровождаться эффектом понижения температуры в
адиабатных условиях или поглощения теплоты в изотермических
условиях (табл. 4.1). Кроме этого, для организации циклов
необходимы другие процессы: сжатия газов и паров; охлаждения
сжатого рабочего тела и передачи теплоты сжатия в окружающую
среду или какому-либо приемнику теплоты; передачи теплоты
от охлаждаемого тела в цикл; процессы конденсации, рекупе-
рации холода и др. В результате процессов рекуперативного (или
регенеративного) теплообмена обеспечивается достижение
заданной низкой температуры.
Для любого цикла криогенной установки, непрерывно выраба-
тывающей холод, принципиальным является наличие процесса
или совокупности процессов, обеспечивающих получение холо-
да. Такие процессы назовем холодопроизводящими. Для низко-
температурных циклов с потоком рабочего тела холодопроизводя-
Щими являются процессы внешнего взаимодействия (или энерге-
тического разделения), в результате которых энтальпия потока
рабочего тела (или его части) уменьшается. Без холодопроизводя-
Щих процессов невозможно осуществить непрерывное получение
Холода. Для одноразового охлаждения достаточно использовать
Любые процессы (эффекты), сопровождающиеся необходимым
Понижением температуры и реализуемые с запасом рабочих
Веществ (см. табл. 4.1).
Важно отметить, что процессы, сопровождающиеся пониже-
нием температуры, могут не быть холодопроизводящими процес-
сии в циклах установок. Уменьшение энтальпии потока рабо-
чего тела в цикле обеспечивают созданием условий для соверше-
ния потоком работы и передачи ее во внешнюю среду либо
157
4.1. Основные процессы, сопровождающиеся понижением
температуры в адиабатных условиях (или поглощением теплоты
в изотермических условиях)
Название и сущность процесса или физичес- кого >ффекта Область применения в интервале температур. К Характе ри стик а процесса
300-120 120-0,7 0,7—>0
Дросселирование — адиабатное расширение газа в условиях стацио- нарного течения без совершения внешней работы и приращения скорости Широкая Широкая Не при- меняется Процесс характеризу- ется условием coxp.t нения энтальпии (/ - = = const); реализуется при помощи дрос- сельных вентилей, ка- пилляров, дюз; не яв- ляется в цикле холо- д о п р о и з в о д я щ и м : температура может понижаться или по- вышаться в зависи- мости от параметров состояния
Детапдировалие — адиабатное расширение с совершением внеш- ней работы (процесс в идеальных условиях является квазиравно- весным) В отдель- ных уста- новках То же Идеальный процесс характеризуется усло- вием s = const; явля- ется в цикле холодо- производящим; тем- пература всегда пони- жается; реализуемся при помощи поршне- вых детандеров и тур- бодетандеров
Адиабатное расшире- ние газа с совершени- ем внешней работы, осуществляемое в не- равновесных условиях. Процесс выхлопа (свободного выпуска) То же Широкая в микро - криоген- ных сис- темах; один из рабочих процес- сов пор- шневых детанде- ров Процесс характер и <у- ется условием а1Ч = = const; является хо- лода про изводя ши м; температура всеша понижается; реализу- ется быстрым выпус- ком газа из сосхла
158
Продолжение табл. 4.1
Название и сущность Процесса или физичес- кого эффекта Область применения в юпервале температур, К Характеристика процесса
300-120 120-0.7 0,7 -> 0
Адиабатное расшире- ние газа из объема в объем без совершения внешней работы Практически не применяется Не при- меняется Процесс харакгеризу- ется условием и = = const; не является холодопроизводя- шим; тем н ер ату р а всегда понижается
Волновое расширение газа — расширение в условиях установивше- гося течения с генера- цией волновой (акус- тической) энергии и отводом ее части в окружающую среду в преобразованном виде (например, в форме теплоты, электроэнер- гии и др.) Вероятно примене- ние вместо дроссе- лирования Го же Холодо производя - щий процесс в цикле; реализуется в волно- вых криогенераторах (ВКГ), не имеющих, как и дроссели, дви- жущихся деталей. Раз- работан в МВ'ГУ им. Н.Э.Баумана в 1980- 1987 гг.
Вихревое энергетичес- кое разделение — возникновение темпе- ратурного расслоения (градиента температу- ры) при расширении газа в условиях стаци- онарного вихревого течения в результате энергетического взаи- модействия частиц в вязком завихренном потоке Узкая Реализуется в вихре- вых трубах, поток раз- деляется на горячий (периферийный) и холодный (централь- ный); для охлажден- ной части потока про- цесс является холодо- производящим
Энергетическое разде- ление (температурное Расслоение) при рас- ширении газа в устрой СТве с пульсирующим Давлением при впуске И выпуске В уста- новках малой мощ- ности Редко в микро- криоген- ных системах Реализуется в различ- ных пульсационных трубах и устройствах, в одной части кото- рых газ охлаждается, в другой — нагревается
159
Продолжение табл. 4 ;
Название и сущность процесса или фиитчсс- кого эффекта Область применения в интервале температур, К Характеристика процесса
300-120 120-0.7 0.7—>0
Адиабатная откачка паров кипящей жид- кости; испарение уменьшает энергию остающейся жидкости, которая при этом охлаждается В отд ед ib- ных уста- новках Широкая дитя полу- чения не- догретых криоген- ных жид- костей Не при- меняется Реализуется с помо щью вакуумных насо сов различных типов, для остающейся частя ж идкости я вляетс и холодопроизводящи м процессом в цикле, практически дос гит ются температуры: 7n == 64 К; То - 54 К; 7Н ~ 13,9 К; 74fk - - 0,6 К; ГзНе ~ 0,2 К
Внешнее адиабатное испарение жидкости при барботировании газа Узкая В отдель- ных уста- новках Реализуется в систе- мах азот о-водя но।о охлаждения BPS. применяется для ох- лаждения криогенных жидкостей
Лчнабатпая oi качка парой твердой фазы (криснылов); откачи- ваемые молекулы уменьшают энергию твердой фазы, и ее температура снижается Не при- меняется 1 о же Для остающейся части твердой фазы является холодоиро изводящим процессом. Практи- чески могут быть по- стигнуты температу- ры: Гц о =-150... 120 К: 7’ - з! К; Г. =.- 40 К: л2 2 Т,, ~ 0.2 К м2
Адиабатная десорб- ция — от качка с по- верхности адсорбента молекул адсорбата, которые, покидая по- верхность, уменьшают энергию остающихся молекул и адсорбента Го же Метод одноразовою охлаждения. Этим ме- тодом в 1932 । Ф.Симон ОЖИЖИЛ IC- лий. Процесс является холодоцроИЗВОДЯ ШИМ —
160
Продолжение табл. 4.1
Название и сущность процесса или физичес- кого эффекта Область применения в интервале температур, К Характе р истика процесса
300-120 120-0,7 0,7^0
Термомеханический тепловой эффект дегидрирования гидри- дов интерметалличес- ких соединений (ИМС) В опыт- ных ус- тановках Пока не применя- ется (воз- можны установки до 70 К Не при- меняется (ИМС)-НХ^(ИМС) + + н2 - Q. Значение теплового эффекта для различ- ных ИМС колеблется от 160 до 1250 Дж/г
Адиабатное сжатие смеси твердого и жидкого 3Не при Т ц 0,32 К (эффект1 Померанчука); при этом жидкость пере- ходит в твердую фазу и температура сни- жается То же Не при- меняется В опыт- ных уста- новках Метод одноразового охлаждения; отлича- ется большой удель- ной холодопроизво- дительностью; позво- ляет достичь темпера- туры примерно 0,001 К
Смешение или рас- творение веществ в жидком, твердом или газообразном состо- янии, сопровождаю- щееся отрицательным тепловым эффектом - растворения (темпера- тура снижается, так как теплоемкость сме- си больше суммы Парциальных теплоем- костей компонентов) Узкая То же В серий- но выпус- каемых рефриже- раторах раство- рения Методом растворения жидкого 3Не в 4Не11 достигнуты температу- ры примерно 0,002 К в стационарном режи- ме; процесс не являет- ся холодопроизводя- щим для цикла
Адиабатное размагни- чивание парамагнети- ков, тяжелых редкозе- мельных металлов и ИХ сплавов, кристал- лов, обладающих маг- нитной анизотропией, Л_др Нс при- меняется В опыт- ных уста- новках при Т = = 1,8 К В лабора- торных установ- ках Процесс холодопро- изводящий: широко использовали для по- лучения сверхнизких температур до созда- ния рефрижераторов растворения
Заказ № 1592 161
Продолжение табл. 4 ।
Название и сущность процесса или физичес- кого эффекта Область применения в интервале температур, К Характеристика процесса
300-120 120-0,7 0,7-»0
Адиабатное размагни- чивание ядер, облада- ющих ядерным маг- нитным моментом То же То же В отдель- ных уни- кальных установ- ках Этим методом при размагничивании ялра меди достигнуты тем- пературы ниже 0,00002 К в импульс- ном режиме
Прохождение тока через спаи разнород- ных полупроводников дырчатою и электрон- ного типов (эффект Пельтье) В серий- но выпус- каемых приборах и холо- дильни- ках Не при- меняется Охлаждающие устрой- ства называют термо электрическими В многоступенчатых (се- микаскадных) сисю- мах достигнуты тем- пературы около 150 К. Процесс холо- допроизводящий
Возникновение темпе- ратурного градиента в проводнике при прохождении через него тока в магнитном поле; градиент возни- кает в направлении, перпендикулярном то- ку и полю (эффект Эт^ тинсгаузена-Нернста) В опытных устройствах То же Охлаждающие устрой- ства называются галь- ваномагнитными. В сочетании с каскад- ными термоэлектри- ческими холодильни- ками могут обеспе- чить температуру 70...100 К
Продавливание сверх- текучего Hell через капилляр (механотер- мический эффект) То же Узкая Достигнута мини- мальная температура около 0,7 К
Переход сверхпровод- ников в нормальное состояние На практике пока не применяют
Механическое растя- жение
Разрядка электричес- ких элементов
Разрядка электричес- ких конденсаторов
162
условий для передачи теплоты (в общем случае энергии) от
потока или его части внешним телам. При этом часть энергии
рабочего тела передается в окружающую среду и его энтальпия
(или энтальпия его части) уменьшается. К таким процессам
относятся: процессы сжатия с одновременным или последующим
охлаждением рабочего тела (в определенной области параметров
состояния); процессы расширения газов с совершением внешней
работы; волновые процессы расширения; процессы охлаждения
дополнительными внешними источниками холода; процессы
откачки паров; динамические процессы температурного расслое-
ния, при которых происходит энергетическое разделение потока,
И др. Именно эти процессы являются холодопроизводящими и
обеспечивают генерацию холода в циклах. Холодопроизводитель-
ность цикла равна суммарному изменению энтальпии во всех
холодопроизводящих процессах [см. уравнения (5.34) и (5.35)].
Ответственность холодопроизводящих процессов за генерацию
колода не умаляет значения других процессов цикла, в частности,
Сопровождающихся в адиабатных условиях эффектом понижения
температуры (см. табл. 4.1). Без них организация цикла также
Невозможна. Многие из этих процессов являются одновременно
И холодопроизводящими, другие (например, процессы дроссели-
рования, растворения), не являясь холодопроизводящими, обес-
печивают необходимое изменение температуры рабочего тела.
Анализу наиболее часто используемых процессов посвящена
Данная глава.
14.2. ИЗМЕНЕНИЕ ОСНОВНЫХ ТЕРМОДИНАМИЧЕСКИХ
ВЕЛИЧИН ПРИ СЖАТИИ РЕАЛЬНОГО ГАЗА
Сжатие газа — необходимый и важнейший процесс холодиль-
Вого цикла при использовании газо- или парообразных рабочих
*вл. Процессы сжатия реализуются в компрессорных машинах
В могут протекать по-разному в машинах различных типов,
Характеризоваться разной степенью необратимости. Газ можно
Охлаждать одновременно со сжатием или сразу после компрес-
сора в концевых холодильниках.
<' Принципиально важно сравнить состояния сжатого и несжа-
того газа при одинаковой температуре (рис. 4.1). Внутренняя
Сергия и энтальпия идеального газа не зависят от давления и
Фи одинаковой температуре в состояниях Г и 1 одинаковы [см.
Фавнение (3.13)]. Внутренняя энергия реального газа в сжатом
,,ш 163
Рис. 4.1. Графики к сравнению энтальпий сжатого г, и несжатого iy реального газа
при одинаковой температуре
состоянии при одинаковой температуре всегда меньше. Физи-
чески это объясняется тем, что при сближении молекул потен-
циальная составляющая внутренней энергии уменьшается [см.
уравнение (3.52)]. Например, для газа Ван-дер-Ваальса разность
внутренних энергий [см. уравнение (3.78)]
Ли = и} - uv - a(l/vr - 1/vJ < 0. (4.1)
Если внутренняя энергия реального газа при изотермическом
сжатии всегда уменьшается, то характер изменения энтальпии
в разных областях состояний неодинаков:
М = - iY = (z/j - иг) + ^wjl - pvvv/(pYvx)\
или
Л1 = («] - Mj.) + /^,(1 - Zr/Z])- (4-2)
Разность z/j - uv в выражениях (4.2) всегда отрицательна, а
знак второго слагаемого определяется значениями коэффициен-
тов сжимаемости Z- В области состояний, где Ц Zr, энтальпия
газа, как и внутренняя энергия, уменьшается при изотермичес-
ком сжатии (см. рис. 4.1). В области состояний, где > Zr, вто-
рое слагаемое в выражении (4.2) положительно и знак А/
определяется соотношением абсолютных значений слагаемых,
т.е. в этой области состояний энтальпия реального газа при
изотермическом сжатии может и увеличиваться, и уменьшаться-
Если энтальпия сжатого газа уменьшается (см. рис. 4.1. й).
то Д/ = - /г равна площади ТаЬ2, теплота изотермического
164
сжатия <?сж — площади 1'acl, работа изотермического сжатия в
открытой системе /сжо = Аф = <рх - <рг — площади Г2ЬсГ,
л > /
Чсж сж.о
Если энтальпия сжатого газа увеличивается (см. рис. 4.1, б),
то А/ = i - iY равна площади Г2Ь(г, #сж — площади Гас1,
U = Аф = Ф1 - Фг - площади Г2Ьс1, <?сж < /сжо.
Свободная энергия f и свободная энтальпия <р при изотерми-
ческом сжатии всегда увеличиваются. При этом изменение
свободной энергии равно по абсолютному значению работе изо-
термического сжатия в закрытой системе (индекс з), а измене-
ние свободной энтальпии равно по абсолютному значению
работе сжатия в открытой системе (индекс о) [см. уравнения
(2.6), (2.7), (2.10) и (2.59)]:
А/= Л ~ /г = - «г - Г(^ - *г) = - uY + = /сжз;
(4-3)
Аф = ф, - Ф1. = - /г - T(S1 - Sr) = /, - iv + = /сжо.
Из последнего соотношения следует: если ix < iY, то коли-
чество теплоты qcx, отводимой при сжатии, численно больше
работы, совершаемой при изотермическом сжатии газа в
открытой системе:
<?сж = U.0 + (Zr - Z1)- (4-4)
Это позволяет считать, что в области состояний, где энталь-
пия уменьшается при изотермическом сжатии, компрессор в
совокупности со своей системой охлаждения обеспечивает
создание холодопроизводительности в цикле, которая может быть
реализована при простом адиабатном расширении газа без
совершения внешней работы (например, при дросселировании).
В этом случае холодопроизводительность равна разности
энтальпий в состояниях 7'и 7.
§ 4.3. ПРОЦЕСС 1= CONST. ДРОССЕЛИРОВАНИЕ
Адиабатное расширение газа, пара или жидкости в открытой
системе в условиях стационарного течения без совершения внеш-
ней работы и приращения скорости на контрольной поверхности
Называется дросселированием. Следует подчеркнуть, что стацио-
нарность течения предполагает в первую очередь постоянство
165
°)
Рис. 4.2. Установка Джоуля—Томсона для исследования дросселирования газов (и)
и ее расчетная схема (б)
давления и отсутствие пульсаций до и после дросселирования
а условие отсутствия приращения скорости течения на контроль
ной поверхности не исключает возможности ее местного увели-
чения (или уменьшения) внутри системы, например в самом
дроссельном устройстве. Важно также, что и система в целом
не может совершать никаких колебаний, т.е. является жесткой
(рис. 4.2, б).
Для практического осуществления этого процесса на пути по-
тока устанавливают какое-либо гидравлическое сопротивление:
дроссельный вентиль, заслонку, калиброванное отверстие, капит-
ляр и пр.
Дж. Джоуль и У. Томсон исследовали этот процесс следующим
образом (рис. 4.2, а). По медной трубке 3 медленно протекал
установившийся поток газа (начальная температура 7j), проходя
через пробку 2, защищенную экранами 1. В экспериментах фик-
сировали изменения температуры при изменении перепада
давлений бр = рх - р2. Рассмотрим медленно текущий поток
вещества в сечениях 1-1 и 2-2 (см. рис. 4.2, б), расположенных
по разные стороны от пробки (дросселя) и достаточно удаленных
от нее (расстояния от сечений до дросселя около 20 калибров,
т.е. 20 диаметров трубок > 20<У; х2 > 2QD), где движение можно
считать стационарным. Применив уравнение (2.9) при условии,
что скорости потока в рассматриваемых сечениях одинаковы, а
разность координат h2 — h} мала, для процесса дросселирова-
ния при /вн = 0 и <7Ы| = 0 получим
/2 = = const или и} + pxvx — и2 + p2v2 — const. (4.5)
166
Никаких предположений о свойствах вещества не делали, поэ-
тому полученный результат справедлив как для идеального, так
и для реального газа: при дросселировании энтальпия вещества
нс изменяется. Для идеального газа изменение внутренней
энергии и энтальпии в любом процессе определяется выраже-
ниями (3.16), откуда следует: если di = 0, то dT = 0 и du = 0.
Таким образом, при дросселировании идеального газа
di = 0 (z = const); dT = О (Т = const); du = 0 (u = const). (4.6)
Для реального вещества в любом состоянии из уравнения (4.5) не
следует постоянство температуры и внутренней энергии при
дросселировании. При расширении реального газа или пара увели-
чиваются расстояния между молекулами и совершается работа про-
тив молекулярных сил притяжения. Кроме того, в потоке реального
газа (пара) работа гидродинамических сил каждой единицы массы
на входе и выходе контрольной системы, равная произведению pv.
различна вследствие разной сжимаемости. Эти работы предопреде-
ляют изменение температуры и увеличение внутренней энергии,
поэтому в общем случае для реального вещества при дросселировании
di = 0 (z = const); dT § 0; du > 0 (zzK > zzH). (4.7)
Таким образом, температура реального вещества при дроссе-
лировании может снижаться или повышаться. Внутренняя же
энергия при дросселировании всегда увеличивается, так как уве-
личиваются расстояния между молекулами. В этом целесообразно
убедиться, определив соответствующие значения u = z — pv с
помощью таблиц термодинамических данных для любого вещест-
ва при одинаковых значениях z. В частности, этим объясняется
образование паров при дросселировании насыщенной жидкости.
Процесс дросселирования необратим. Для идеального газа он
Необратим полностью, так как не сопровождается эффектами,
которые могли бы способствовать возвращению в исходное
состояние. Приращение энтропии максимально и равно убыли
энтропии при изотермическом сжатии идеального газа. Процесс
Дросселирования реального вещества (пара) частично обратим,
так как сопровождается изменением температуры; при этом
создается «тепловой резервуар» с температурой более высокой
Или более низкой и появляется возможность использования
Перепада температур для получения работы (эту работу' можно
Использовать для возвращения газа в исходное состояние).
Приращение энтропии при дросселировании реального газа не
равно изменению энтропии при его изотермическом сжатии.
167
Определим изменение температуры реального вещества при
дросселировании из уравнения (2.83), приняв di = 0:
= = (4S1
Величина (дТ/др\ = а,. — дифференциальный эффект Джоуля
Томсона, определяющий изменение температуры при бесконечно
малом падении давления в процессе дросселирования; Р — тем-
пературный коэффициент объемного расширения.
Уравнение справедливо как для газов, так и для жидкостей.
Из уравнения (3.59)
поэтому
или
(dv/dT)p = Rz/p + (RT/p)(dz/dT)p, (4-9)
RT2 P i dz. ) \ dT)p (4.Ю)
vT Z / dz ) \dT)p' (4.И)
Практически при дросселировании всегда имеется конечная
разность давлений, поэтому для такого процесса [см. также выра-
жение (4.21)]
Л Рг
ЦкШ- "к <4121
Pl р
Это выражение определяет так называемый интегральный
эффект Джоуля — Томсона (изменение температуры при конеч-
ной разности давлений).
Интегральный эффект дрос-
селирования обычно определя-
ют по таблицам или термодина-
мическим диаграммам (рис. 4.3),
либо строят специальные гра-
фики (рис. 4.4).
Из уравнений (4.8) — (4.12)
следует, что знак эффекта дрос-
селирования может быть раз-
Рис. 4.3. Процесс дросселирования в
диаграмме Т — s
168
Р'МПа
Рис. 4.4. Диаграмма изменения температуры гелия при дросселировании до давления
0,1 МПа (штриховая линия — кривая инверсии; р и Т — давление и температура
неред дросселированием; х — доля жидкости после дросселирования)
личным. Если &Т/кр = (Т2 - 7)) / (р2 - р}) > 0, то Т2 < Tv
поскольку всегда р2 < рх (охлаждение в области состояний, где
а; > 0); если А Т/\р < 0, то Т2 > Tv что соответствует нагреванию
(в области состояний, где а( < 0). Изменение знака дроссельного
эффекта называют инверсией. В точке инверсии (дТ/др^ = 0.
Состояния, в которых (дТ/др^ = 0, определяются уравнением
кривой инверсии
Т(dv/dT)p - v = 0 (4-13)
или
(dv/dT)p = v/T. (4.14)
Как следует из уравнений (4.11) и (4.8), в точках кривой
инверсии (dz/dT)p = 0 и р = 1/Т.
Кривая инверсии (рис. 4.5) разграничивает области положи-
тельного (охлаждение) и отрицательного (нагревание) эффектов
Дросселирования. Область под кривой инверсии соответствует
Положительному дроссельному эффекту. Уравнение кривой
инверсии в относительных (приведенных) координатах для газа,
169
г) д) е)
Рис. 4.5. Кривые инверсии для некоторых газов:
а — гелия; б — неона; в — азота; г — воздуха; д — водорода; е — газа Ван-дер-
Ваальса (в приведенных координатах)
подчиняющегося уравнению Ван-дер-Ваальса (см. рис. 4.5, о,
имеет вид
л = 24 V17 - 12т - 27,
(4.15)
где л = р/рк, т = Т/Тк(рки Тк~ давление и температура в кри-
тической точке).
В соответствии с рис. 4.3 и 4.5 для каждого вещества сущес-
твует максимальная температура инверсии Т в, выше которой
при любых давлениях дроссельный эффект отрицателен. Эту тем-
пературу называют верхней температурой инверсии. Существует
и так называемая нижняя температура инверсии Т н в области
жидкости.
В координатах Т — s кривая инверсии (штриховая линия на
рис. 4.3) проходит через экстремальные значения изоэнтальп
(z = const) и асимптотически приближается к Тинвв как к темпе-
ратуре инверсии малых давлений. Верхняя температура инверсии
для разных веществ различна (см. рис. 4.5). Для некоторых газов
(воздуха, азота, кислорода) верхняя температура инверсии выше
средней температуры окружающей среды, для других (гелия.
170
неона, водорода) — ниже. В соответствии с рис. 4.3 для
охлаждения газа при дросселировании необходимо прежде всего
понизить его температуру до значения ниже верхней температу-
ры инверсии Тинвв. Если это условие выполнено, то возникает
вопрос: до какого давления следует сжать газ, чтобы достичь
максимального интегрального эффекта А Т при известной началь-
ной температуре То (где То — обычно температура окружающей
среды или температура предварительного охлаждения). Продиф-
ференцировав выражение (4.12) по р и приравняв полученное
нулю, найдем
(dW),.= 0. (4.16)
Это выражение является условием того, что искомая точка
(см. рис. 4.3) находится на кривой инверсии, а искомое давление
равно давлению инверсии при данной температуре. Это ясно и
из геометрического рассмотрения рис. 4.3 — при расширении
газа из точки а до точки b значение ДТ максимально. Однако в
циклах с дросселированием практически (экономически)
целесообразное давление сжатия может быть меньше давлений
точки инверсии, например, в случае сжатия воздуха, когда при
Т = 300 К ограничиваются давлением р = 20 МПа вместо
39 МПа. В гелиевых и водородных циклах с дросселированием
оптимальные давления сжатия близки к давлению инверсии.
При небольших давлениях значение а(. для данного газа зави-
сит практически только от температуры. Например, Джоуль и
Томсон, проводившие опыты до давлений 0,6 МПа в диапазоне
температур 273...373 К, получили эмпирическую зависимость
а,. = Л0(273/Т)2, (4.17)
где Ао — постоянная.
Из соотношений типа (4.17) следует, что в области газооб-
разных состояний при снижении Т дифференциальный эффект
Дросселирования возрастает. Однако при дросселировании
Жидкости понижение температуры перед дросселем уменьшает
изменение температуры и долю образующегося пара. При
определенных условиях дросселирование недогретой жидкости
вообще может нс сопровождаться образованием паровой фазы.
Следует также обратить внимание на то, что при дросселирова-
нии жидкости, состоящей из нескольких компонент (например,
Жидкий воздух) неизбежно изменение концентраций компонент
в паровой и жидкой фазах после дросселирования.
171
При увеличении плотности газа а; начинает зависеть от дав-
ления. Экспериментально установлено, что а(. уменьшается при
увеличении давления, а зависимость от р близка к линейной:
а; = (Ло - Б0р)(273/Т)2, (4.18)
где Вн — постоянная.
Влияние давления на а(. практически может сказываться
только при давлениях в несколько мегапаскалей.
Из изложенного ясно, что для увеличения интегрального эф-
фекта начальную температуру процесса дросселирования газа
следует понижать. Однако надо четко понимать, что в низкотем-
пературных циклах с дросселированием холодопроизводительность
теоретического цикла (без потерь холода) не зависит от темпе-
ратуры начала дросселирования (процесс дросселирования в цикле
не является холодопроизводящим). Увеличение интегрального эф-
фекта дросселирования при снижении температуры открывает
лишь принципиальную возможность увеличения холодопроизводи-
тельности. Практически для этого необходимо так называемое
предварительное охлаждение. Роль предварительного охлаждения
сводится к созданию теплового резервуара с температурой 7J, более
низкой, чем температура окружающей среды То. При этом в
области положительного дроссельного эффекта увеличивается
разность энтальпий сжатого и несжатого газов при одинаковой
температуре, что и обусловливает увеличение холодопроизводи-
тельности в цикле. Эту разность энтальпий, часто используемую
при инженерных расчетах, обозначают в общем случае А/г и
называют тепловым (или изотермическим) эффектом дроссе-
лирования. Значение Д/г находят по таблицам или тепловым
диаграммам как разность энтальпий сжатого и несжатого газов при
данной температуре, например при Т= То (см. рис. 4.3):
А/г = ф - i} = iv - ir (4.19)
Термин «тепловой (или изотермический) эффект дроссели-
рования» можно объяснить следующим образом. Если сравнить
два состояния, соответствующие точкам 1 и 2 (см. рис. 4.3), то
разность энтальпий /г - /2 определяет количество теплоты, ко-
торую можно отнять у тела, находящегося при температуре
окружающей среды, используя эффект снижения температуры
при дросселировании. С другой стороны, А/г равна изменению
энтальпии при изотермическом сжатии или расширении газа.
Для того, чтобы в условиях стационарного течения расширить
172
газ без совершения внешней работы и изменения температуры,
т.е. изотермически, необходимо было бы подвести количество
теплоты, равное Д/у, При положительном дроссельном эффекте
Д/г определяет вклад компрессора в холодопроизводительность
цикла, а при отрицательном — является соответствующей долей
потерь холодопроизводительности. При положительном дрос-
сельном эффекте возможно создание регенеративного низко-
температурного цикла для ожижения, например, воздуха, а при
отрицательном дроссельном эффекте — регенеративного газо-
вого нагревателя.
Остановимся на физических причинах изменения темпера-
туры и существования инверсии при дросселировании. Из
уравнения (2.77)
= (дТ/др\ = - (\/cp}(di/dp)r (4.20)
Это уравнение связывает а; с дифференциальным тепловым
эффектом дросселирования (di/dp)^ т.е. с изменением энтальпии
в элементарном процессе изотермического сжатия.
Из выражения (4.20)
ДТ= Т2- Т, ==(/)- /Г)/С. (4.21)
Это уравнение дает более точный результат, если ср опреде-
ляют как среднее значение при давлении в конце процесса
расширения в интервале температур 7j — Т2.
В свою очередь [см. уравнение (2.59)]
(д1/др~)т = (ди/др)т + [d(pv)/dp]T.
Таким образом,
а'= 1(1Ят+(4’22)
где производная (др/др)т определяет характер изменения степени
сжимаемости (числа Амага) реального газа.
Эти соотношения вскрывают физическую сущность явлений
Инверсии и четко определяют эффект дросселирования как
эффект индивидуальных термодинамических свойств данного
Газа. Знак производной (ди/др)т (изотермическое сжатие) всегда
отрицателен: внутренняя энергия любого газа в процессе изотер-
мического сжатия уменьшается [см. выражение (4.1)], поэтому
в уравнении (4.22) слагаемое — (д)и/др)т/ср всегда определяет
Положительную часть а(.. Знак и абсолютное значение второго
173
слагаемого в уравнении (4.22) могут изменяться. В соответствии
с рис. 3.14 для области состояний, ограниченной осью ординат
и кривой Бойля (область большей сжимаемости), производная
(др/др)т < 0, в других областях она положительна. В точках
кривой Бойля (др/др)т = 0. Таким образом, в области большей
сжимаемости всегда а(. > 0, т.е. при дросселировании температура
газа снижается (ДУ < 0). В области других состояний, где
(др/др)т > 0, значение aj и его знак определяются абсолютными
значениями слагаемых (ди/др)т и p^v (др/др)т.
Аналогичные результаты можно получить в интегральной
форме. Для любого реального газа Т= (i - u)/(zR). Тогда разность
температур в состояниях 1 и 2 определяется выражением
ДТ= Тг - Tj = (Д/ - \u)/(Rzx) + Т2(1 - z2/Zt), (4.23)
где Д/ = /2 - /р Дм = w2 - Мр
Для процесса дросселирования Д / = 0; м2 > м( и первый член
отрицателен (положительная составляющая дроссельного
эффекта 77, < Тх). Знак и абсолютное значение второго
слагаемого в уравнении (4.23) определяются отношением коэф-
фициентов сжимаемости Z2/Zr Наглядно это также можно
показать на примере газа Ван-дер-Ваальса [см. уравнение (3.73)|.
Выражение (4.21) в обозначениях рис. 4.1 принимает вид:
ДТ = Т2-Т{ =-•
;1 ~ ;Г— _______+ RT ( 1
ср I vy ~ uj 4 1- b/v.
1
1 - b/v,.
Так как > u|5 то первое слагаемое этого выражения (про-
порциональное изменению внутренней энергии при изотер-
мическом сжатии) всегда отрицательно. Знак интегрального
эффекта дросселирования ДТ определяется соотношением двух
слагаемых, второе из которых пропорционально изменению
сжимаемости. Очевидно, что в конечном итоге изменением знака
ДТ «управляет» величина b/г (напомним, что в уравнении Ван-
дер-Ваальса константа b характеризует объем, занимаемый
самими молекулами).
При одинаковых параметрах эффект дросселирования для раз-
личных газов и вещества может существенно различаться.
Необходимо обратить внимание на то, что межмолекулярные
взаимодействия и термодинамические свойства газовых смесей
в большой степени зависят от состава и индивидуальных свойств
компонентов. На рис. 4.6 и 4.7 приведены зависимости Д/7 Д-1Я
азотофреоновых смесей (данные Н.Д.Захарова) от давления:
174
Рис. 4.6. Зависимость теплового эф-
фекта дросселирования при Т = 330 К
чистого азота (кривая 7) и смеси
1Ч2—R13—R14—Ne (кривая 2) при
различных ее составах (штриховые
линии) и давлении р2 ~ 0,101 МПа от
давления
Рис. 4.7. Зависимость теплового эффекта дросселирования смеси N2—R13—R14—
Ne (содержание азота 60 % ) при р2 = 0,101 МПа от температуры и давления
значения Д/’г для смесей примерно в 2,5 раза больше, чем для
чистого азота. Область выпадения твердой фазы из этой смеси
Можно оценить по рис. 3.7, в. Формирование подобных смесей
является практическим методом создания эффективных рабочих
тел для дроссельных криогенных систем. Отечественная практика
создания микроохладителей, работающих на смесях, полностью
это подтвердила.
На рис. 4.8 приведена схема дроссельного вентиля, с помощью
которого часто реализуют дросселирование газа. Вентиль обычно
выполняют регулируемым. При перемещении шпинделя (чаще
Всего без вращения вокруг оси) изменяется площадь поперечного
сечения щели, из которой газ перетекает из полости высокого
Давления в полость низкого давления. При этом изменяется рас-
ход. Важно подчеркнуть, что в самом дроссельном устройстве
рабочий процесс не характеризуется условием i = const, т.е. не
Является процессом дросселирования. В дроссельном вентиле
Обычно реализуется внешнеадиабатное расширение газа в
175
Рис. 4.8. Схема дроссельного вентиля (в закрытом положении):
1 — наконечник шпинделя с наклонным пазом; 2 — корпус с уплотнительным
седлом; 3 — уплотнение
условиях стационарного течения без совершения внешней рабо-
ты, но с существенным изменением скорости; иными словами,
энергия сжатого газа преобразуется в энергию струи. Такой
процесс называют истечением, поэтому для расчета дроссельных
вентилей и определения проходных сечений применяют формулы
для процессов истечения. После дросселя энергия струи не
утилизируется, поэтому в старой русской литературе по
термодинамике процесс дросселирования назывался мятием
газов и паров, что весьма точно по смыслу характеризует
физическую картину, когда поток, способный производить
полезную работу, теряет частично или даже полностью свою
работоспособность. Тем не менее в технике низких температур
этот процесс имеет исключительно важное значение, в том числе
и потому, что он реализуется с помощью исключительно простых
безмашинных устройств. Процесс дросселирования организуется
также в устройствах с равномерно (или неравномерно) распреде-
ленным по пути движения газа гидравлическим сопротивлением,
а также с использованием калиброванных отверстий (дюз).
§ 4.4. ПРОЦЕСС U= CONST
Если процесс расширения газа осуществить при тех же
условиях, что и процесс дросселирования, т.е. без теплообмена
с окружающими телами и совершения внешней работы, но в
закрытой системе, т.е. не в условиях стационарного течения, а
в устройстве с жесткими стенками, то полная внутренняя
энергия газа в такой системе будет постоянна. Это процесс
расширения и — const; какого-либо характерного названия он
не имеет. Схема реализации процесса и = const (рис. 4.9) воспро-
176
Рис. 4.9. Схема реализации процесса и = const (а) и его изображение в диаграмме
Т — s (6)
72‘
определить
изводит схему опыта Джоуля — Гей-Люссака. Исследуемая
система 1 состоит из двух сосудов с жесткими стенками. Сосуды
контактируют один с другим и отделены от окружающей среды
слоем изоляции 2. Начальные давления газа в сосудах различны,
а температуры одинаковы: в начальном стационарном состоянии
температура 7j. С помощью вентиля 3 можно выравнивать
давления газа в сосудах. При выпуске газа из одного сосуда
давление и температура в нем снижаются; в это время в другом
сосуде при втекании в него газа давление и температура повы-
шаются. После выравнивания давлений в течение некоторого
времени происходит выравнивание температур газа, пока система
не придет в стационарное состояние с температурой
ние температуры газа в процессе и = const можно
из уравнений (2.76):
(dT/dv)u = - (i/cv)(du/dv)T
или
(дТ\ _ _ (ди/др)т
llpL ~ ~ ' (ди/дТ) ’
Из выражения (2.58)
(ди/дТ)р = ср - ррр;
Тогда
(ди/др)т
а ~-----------—
Ср - $vp
Для идеального газа (du/dv)T = (ди/др)т = О,
dT = 0 в процессе и = const. Этот результат, установленный в
(4-24)
(4.25)
(4.26)
и
12 Заказ № 1592
177
опытах Джоуля — Гей-Люссака при расширении газов в облас,ц
малых давлений еще в 1807 г., явился доказательством фундамен-
тальных положений о том, что внутренняя энергия идеальною
газа есть функция только температуры и не зависит от давления
(плотности).
Однако если этот опыт провести при расширении си.и ч(1
сжатых газов, то температура нс будет постоянной, а снизили
Т2 < Тх. Это следует, например, из выражения (4.24). Tar ;\i
образом, в процессе и = const для любого реального газа о
всегда положительная величина, т.е. температура снижаем я.
Например, для газа Ван-дер-Ваальса (du/dv)T = a/v2 [см. выраже-
ние (3.77)] из уравнения (4.24) найдем:
(дТ/ди)и = (4.7)
Интегральный эффект изменения температуры в процессе
и = const (см. рис. 4.9)
ДТ= т2 - Ту =- Ьит= const/Cv = (М1 - Uy.)/cv. (4 28)
Значения их и и}. находят по таблицам. Если по каким-либо
причинам это невозможно, а энтальпия и параметры состояния
известны, их определяют по термодинамическим диаграммах’.
Процесс и = const не имеет пока столь большого практическо-
го значения, как процесс дросселирования i= const, однако при-
веденные соображения позволяют глубже понять сущншть
процессов внешнеадиабатного расширения газа без совершения
внешней работы в условиях открытых и закрытых сис ем,
реализуемых с помощью безмашинных устройств.
§ 4.5. ПРОЦЕСС 5= CONST. РАВНОВЕСНОЕ АДИАБАТНОЕ
РАСШИРЕНИЕ ГАЗА. РАСШИРЕНИЕ ГАЗА В ДЕТАНДЕРАХ
Процесс расширения газа в адиабатных условиях, т.е !.ри
отсутствии внешнего теплообмена, может протекать без изм не-
ния энтропии только при отсутствии каких бы то ни было : ут-
ренних процессов трения. В связи с этим для удовлетвор пня
условия 5 = const необходимо всю располагаемую энернио
сжатого газа преобразовать во внешнюю работу. Очевидно тго
при этом уменьшение внутренней энергии газа в закрытой систе-
ме и энтальпии в открытой системе .максимально (по ерш пе-
нию с другими процессами расширения при прочих одинако-
вых условиях, начальных параметрах и степени расширения).
178
поэтому такой процесс сопровождается наибольшим снижением
температуры. Работа, совершаемая газом в этом процессе,
должна быть обязательно полностью передана изолированному
от газа устройству.
Так как реальные процессы течения и расширения газа нс
могут происходить без трения, то в адиабатных условиях процесс
s = const в действительности осуществить невозможно. Его
рассматривают как идеальное приближение для реальных процес-
сов, поэтому его анализ имеет существенное значение.
Работа, совершаемая газом, и тождественно равные ей
тепловые эффекты для закрытой и открытой систем в процессе
5= const различаются [см. уравнения (2.7) — (2.10)];
(ди/ди)у = р\ р = q. = - и2(, = \pdv, (4.29)
V
(^АН = w; 4 = <7(, = = 1 ус/р- (4-3°)
р
Последнее выражение справедливо при одинаковых скоростях
газового потока на входе и на выходе.
Изменение температуры в изоэнтропном процессе в открытой
и закрытой системах одинаково и при различных независимых
переменных определяется выражениями (2.90) — (2.91). Наиболее
широко используют соотношение (2.91):
= (дТ/др)у = (Т/ср)(дь/дТ)р = Tv$/cp. (4.31)
Определив производную (dv/дТ) из уравнения (3.59), после
преобразований получим
V—(4.32)
ср I у дТ 'pt
Воспользовавшись соотношениями (3.80) для реального газа,
Преобразуем уравнение (4.32):
а = ZHjlDL + 1. (4,зз)
ркк I \()Т /р1
Сравнив выражения (4.31) и (4.8) или (4.32) и (4.10), найдем
= а(. + и/с . (4.34)
Разделив почленно последнее выражение на ос, с учетом соот-
ношения (4.31) получим
af/as = 1 - 1/ф 7). (4.35)
12*
179
Выражение (4.34) можно также получить, непосредственно
продифференцировав выражение (2.77) по давлению при
.v = const с учетом уравнения (4.20).
Из полученных соотношений можно установить следующее.
]. Значения ал положительны практически в любой области
состояний рабочего тела, физически допускающих расширение
(исключения не рассматриваем), что предопределяет широкие
потенциальные возможности практического использования этих
процессов в низкотемпературных циклах.
2. С повышением температуры а(, возрастает; при этом соот-
ветственно увеличивается и работа расширения. Это обстоятель-
ство, в частности, теоретически обусловливает стремление к
реализации принципа каскадного расширения рабочего тела в
низкотемпературных циклах.
3. С уменьшением давления, т.е. с увеличением удельных объ-
емов и уменьшением плотности рабочего тела, аг увеличивается.
В процессе расширения при х = const ots — переменная величина,
поэтому, в частности, нижнее давление в циклах с детандерами
не нужно завышать: его следует выбирать с учетом возможности
натсчск и изменения удельной холодопроизводительности.
Весьма часто нижнее давление в циклах принимают близким к
атмосферному. Однако есть отдельные системы с нижним давле-
нием цикла как больше атмосферного (например, машины типа
Стирлинга—Филипса), так и меньше атмосферного (например,
турбохолодильные машины типа ТХМ-30).
4. Вблизи критических состояний и в области состояний кипя-
щей жидкости значения а$ и aj наиболее близки. Соотношения
между as. н а зависят от параметров и индивидуальных свойств
газов и состава смесей. Например, для метана в области
температур около 293 К и давлений около 6 МПа отношение
а./а 1,2/2,3 = 0,5215; для воздуха в области этих же температур
и давлений а,/а(. = 0,22/1,2 = 0,1835. Чем больше отношение
а;./а , тем, в общем случае, менее результативно применение
детандеров. Вопрос о целесообразности применения детандеров
вместо дроссельных устройств, работающих в области парожпД"
костных состояний, решается в конечном итоге в процессе опти-
мизации конкретной установки при минимизации стоимости
единицы массы криопродукта.
Значение at для реального газа может быть больше иД11
меньше, чем для идеального, в зависимости от знака ос(.
180
ряс. 4.10. Зависимость отношения
ojas от давления и температуры
для воздуха
Охлаждение реальных газов при адиабатном расширении
можно представить как сумму двух эффектов, обусловленных
действием межмолекулярных сил ам и внешней работой apdv.
as = «м + apdv- (4-36)
Доля эффекта охлаждения за счет внутренних сил им по срав-
нению с общим эффектом охлаждения аг зависит от давления и
температуры. При р —> 0 отношение o.M/af -э 0, а следовательно,
внутренние силы не производят действия, так как молекулы
удалены одна от другой. На рис. 4.10 приведены зависимости
отношения о^/а^. от давления для воздуха при разных температурах.
Значение аг для данного газа полностью определяется его
Параметрами р и Т. Действительно, все величины, входящие, на-
пример, в уравнение (4.33), являются функциями давления и тем-
пературы. Уравнение (4.33) можно проинтегрировать только в
Том случае, если известны функциональные связи z= z(p, Т) и
к = к(р, Т). Например, х = z при постоянных z и к [см. вы-
ражения (3.80)]. Тогда
! (4.37)
Это известное уравнение Пуассона, откуда
- ДТ= 7\ - Т2 = ТД1 - (р^-^]; (4.38)
Здесь индексы 1 и 2 соответствуют началу и концу процесса.
В действительности значения z и к в разных областях со-
стояний несомненно различаются. Вместе с тем для большей
Части реальных газов, используемых в криогенной технике
181
(кроме водорода), изменение температуры в изоэнтропных
процессах можно вычислить по формуле (4.38) с точностью
вполне достаточной для практических расчетов. Весьма сущест-
венно, что уравнение (4.38) справедливо для этих реальных га
в широкой области состояний, в том числе и вблизи пограничной
кривой. Исключением является водород. Если для гелия, неона,
азота, воздуха вероятная погрешность определения темпера гур
по формуле (4.38) не превышает 3 %, то для водорода при
постоянном значении к = 1,407 она может достигать 20—Зы %
(при температуре ниже 130 К). С физической стороны зта
особенность водорода объясняется тем, что в интервале
температур 85—250 К теплоемкость и показатель Пуассона к в
значительной степени зависят от температуры. Напомним в связи
с этим, что для водорода характеристическая температура Т
(температура вырождения вклада вращательного движения моле-
кул в теплоемкость) весьма высока (=85 К), поэтому при темпера-
турах, близких к 85 К и более низких, теплоемкость ср водорода
становится практически равной теплоемкости cv одноатомного
газа (см. рис. 3.11). Для исключения больших погрешностей при
вычислении изменения температуры водорода по уравнению
(4.38) значения показателя Пуассона следует выбирать как
средние для процесса .у = const. В этом случае достигают необхо-
димой точности.
Объяснение этого уникального обстоятельства, когда уравне-
ние Пуассона (4.37) с хорошей практической точностью
«работает» для реальных газов (кроме водорода), можно дать с
помощью соотношения (4.32). Сумма двух членов этого уравне-
ния остается близкой единице. В области состояний, где z > Е
величина (dz/dT)p < 0, так как при постоянном давлении с
повышением температуры z уменьшается, приближаясь к I (см.
рис. 3.15).
В области состояний, где z < 1, при повышении Т величина
Z увеличивается, приближаясь к 1, и величина (dz/dT) > 0.
Изменение энтальпии в процессе 5 = const можно определить
по выражению (2.77):
(di/dT\ = ср + (di/dp)r(dp/dT)s , (4.39)
откуда
(di/dT)s. = ср(\ - a;/oQ. (4.40)
182
i Подставив сюда значение cx(./af из соотношения (4.35), полу-
чим
(di/dT)s= cp/(fiT). (4.41)
Так как произведение рТ мало изменяется, то решающее
значение имеет теплоемкость с, различная для разных газов (см.
Шабл. 3.2). Если принять, что для газа z и к постоянны и равны
рх средним значениям в процессе 5 = const, то [см. уравнение
|3.8°)]
I Р = 1/Т; ср = zRk/(k - 1). (4.42)
яГогда
- (di/dT)s = ср = zRk/(k - 1), (4.43)
угкуда
М = hs = z.RATk/(k - 1).
(4.44)
Ориентировочно ki(h^ можно оценить по уравнению Д/ ~
е In^//^) z R/ Рср- Следует заметить, что погрешность определе-
шя Д/ по формуле (4.44) больше погрешности определения ДТ
Ю (4.38). Однако в большинстве случаев для реальных газов
U' (/zt) определяют по таблицам или диаграммам.
В безмашинных расширительных устройствах условие 5 =
= const наиболее точно выполняется для той части газа, которая
остается в изолированном сосуде после выпуска из него газа
подробнее см. §§ 4.6 и 4.7). Эти процессы ограниченно исполь-
|уются в рефрижераторах периодического действия и при
«одноразовом» охлаждении. Практически же наиболее распрост-
>анены процессы расширения газов с совершением внешней
)аботы, реализуемые в различных расширительных машинах,
которые называют также детандерами. В детандерах энергия
Жатого газа преобразуется в работу, и процесс в той или иной
«ере приближается к изоэнтропному. Работа (энергия) расшире-
1ия передается или на тормозное устройство, или какой-либо
внешней среде, которую обязательно изолируют от расширяю-
Цегося газа. Существует много конструктивных разновидностей
(етандерных машин, однако все их можно подразделить на два
□тасса: объемные и лопаточные (газодинамические). Рабочие
гроцессы в машинах этих классов существенно различаются.
Тоясним лишь основные принципы, не затрагивая анализ рабо-
Мх процессов.
183
Адиабатное расширение газа с совершением внешней работы в
объемных машинах. В объемных машинах энергия газа преобра
зуется в работу непосредственно за счет его давления. Наиболее
характерный пример — поршневой детандер (рис. 4.11). Давление
газа действуют на поршень, энергия газа через механизм движе-
ния передается на тормозное устройство. Давление газа с точ-
ностью до бесконечно малой величины уравновешено силами
сопротивления тормоза, и теоретически процесс расширения
является равновесным. Работа детандера носит циклический
характер. В течение каждого цикла повторяется определенная
совокупность процессов в рабочем объеме машины, т.е. в прост-
ранстве между стенками цилиндра и поршнем. Эта последова-
тельность процессов отражена теоретической индикаторной
диаграммой. Она включает процессы: впуска (6-1), наполнения
(1-2), внутреннего расширения (2-3), выхлопа (3-4), выталки-
вания (4-5) и обратного сжатия (5-6). Газ поступает в машину
через клапан впуска и выходит через клапан выпуска. Точка 6
Рис. 4.11. Схема криогенного поршневого
детандера и теоретическая индикаторная
диаграмма:
1 — клапаны; 2 — цилиндр; 3 —
поршень; 4 — поршневое уплотнение;
5 — линия привода клапанов; 6 —
система регулирования; 7 — механизм
движения; 8 — тормозное устройство
РвЬПг iSi'x
184
ра индикаторной диаграмме соответствует началу открытия
рдускного клапана, точка 2 — его закрытию. Выпускной клапан
Обрывается в точке 3 и закрывается в точке 5, после чего
оставшийся в цилиндре газ сжимается поршнем. Участок 1-2
хода поршня, на котором клапан впуска открыт, часто называют
отсечкой наполнения; относительную отсечку наполнения (по
отношению к полному ходу поршня) обозначают с0. Участок 5-
^хода поршня называют отсечкой выталкивания, относительную
отсечку выталкивания обозначают />0.
«Мертвый» объем (объем рабочего пространства при крайнем
нижнем положении поршня) всегда реально существует, а для
Некоторых типов машин, например для бесклапанного детандера,
Является необходимым. Относительный мертвый объем обозна-
чают о0. При изменении а0, Ьо и с0 вид индикаторной диаграммы
изменяется. Известны разнообразные типы детандеров с различ-
ными теоретическими индикаторными диаграммами. Для идеаль-
ного адиабатного детандера работа
7д = 4аза = ^dp= hs. (4.45)
В реальных конструкциях детандерных машин необратимые
Процессы вызывают увеличение энтропии, и действительное
изменение температуры АГ оказывается существенно меньше,
чем в идеальном процессе. Эффективность работы детандеров
обычно оценивают так называемым изоэнтропным КПД
П,= 1 - 28/пА/^, (4.46)
к
где 5 ink — вклад различных реально существующих факторов
(трение, теплообмен, утечки, смешение) в уменьшение холодо-
производительности, т.е. в увеличение энтальпии рабочего тела
на выходе из детандера.
Удельная (на 1 кг расширяющегося газа) холодопроизводи-
|тельность детандера
' = (4-47)
I Для детандеров классического типа с клапанами впуска и вы-
пуска значение адиабатного КПД = 0,7...0,9; для детандеров,
Осуществляющих рабочие процессы в парожидкостной области
состояний, = 0,6...0,75.
Адиабатное расширение газа с совершением внешней работы в
Лопаточных машинах (турбодетандерах). В поршневом детандере
Энергия газа преобразуется в работу за счет действия на поршень
185
давления газа. Очевидно, такую же внешнюю работу газ может
совершить, если энергию сжатого газа преобразовать в энергию
потока и использовать последнюю для получения работы
Конечно, при этом подразумевают, что степень расширения 1(
начальные параметры газа одинаковые. Рабочий процесс в турбо-
детандере принципиально отличается от рабочего процесса в
поршневом детандере, однако все интегральные соотношения
энергетического баланса [см. уравнения (4.45)—(4.47)] полностью
справедливы при условии равенства скоростей газа на входе и
выходе машины.
Необходимо отметить, что преобразование энергии сжатого газа
в энергию потока и последующее ее использование для получения
внешней работы можно реализовать различными путями. На-
пример, можно сначала полностью расширить газ в неподвижном
сопловом аппарате, а затем направить движущийся с большой ско-
ростью поток газа на лопатки турбины и заставить вращаться
лопаточный диск. В этом случае принято называть турбодетандер
активным. Можно полностью расширить газ непосредственно в
межлопаточном пространстве колеса без какого-либо предварите ль-
ного расширения в сопловом аппарате. В этом случае турбодстан-
дер называют реактивным. Однако экономически наиболее
выгодно сочетание этих двух путей. Практически так и поступают
(рис. 4.12). Воздух при давлении подают в сопловой направля-
ющий аппарат, в котором он расширяется до промежуточного
давления р и затем с большой скоростью поступает в межлопа-
Рис. 4.12. Схема криогенного турбодетандера:
1 — неподвижный (направляющий) сопловой аппарат; 2 — вращающееся колесо
с лопатками; 3 — улитка; 4 — уплотнение; 5 — выходной диффузор; 6 — редуктор-
7 — тормозное устройство
186
<1очные каналы турбины, где происходит его дальнейшее расшире-
ние до давления рг Направление движения газа в сопловом
аппарате и колесе турбо детандера может быть радиальным, осевым
или радиально-осевым.
Эффективность работы турбодетандеров, как и поршневых де-
тандеров, оценивают изоэнтропным КПД т) t [см. уравнение
(4.46)], а действительную удельную холодопроизводительность
определяют по соотношению (4.47). В зависимости от размеров
(расхода газа) для турбодетандсров т)у = 0,65...0,92; для
парожидкостных турбодетандсров Т|у = 0,6...0,7.
§ 4.6. ПРОЦЕСС АЯ1 = CONST. ВЫХЛОП ИЛИ СВОБОДНЫЙ
ВЫПУСК ГАЗА ИЗ БАЛЛОНА. ПРОЦЕСС ВПУСКА
Рассмотрим процесс внешнсадиабатного расширения газа при
выпуске его из какой-либо емкости (баллона, цилиндра и пр.).
Такой процесс часто называют выхлопом или свободным
выпуском газа. Этот процесс — один из самых распространен-
ных. Особенно часто его используют в низкотемпературных
машинах как один из рабочих процессов циклов этих машин.
Используется он также в рефрижераторах и ожижителях одно-
разового действия. Схема организации процесса выхлопа весьма
проста. Баллон со сжатым газом имеет выпускной клапан, после
открытия которого газ быстро вытекает из баллона и направля-
ется в трубопровод (рис. 4.13).
Выхлоп — это нестационарный и неравновесный адиабатный
процесс расширения газа с совершением внешней работы.
Теплообмен газа со стенками исключен по условию, и неравно-
Весность обусловлена тем, что при изменении объема силы
Давления на контрольной поверхности системы не уравновешены
силами противодавления. Для анализа процесса удобно восполь-
зоваться схемой, приведенной на рис. 4.13. Начальные параметры
газа в баллоне Тн и д(. Баллон герметично закрыт клапаном-
задвижкой. После освобождения задвижка начинает двигаться
без трения в выпускной трубе. Газ оказывает на задвижку дав-
ление, которое постепенно падает. С другой стороны на задвиж-
ку действует постоянная сила противодавления, так как газ выте-
кает в область постоянного давления рк. Когда давление в бал-
лоне достигнет рк, задвижка остановится. Это произойдет в
Момент времени тк. Через некоторое время после окончания
Процесса в результате диффузии и смешения во всех частях
187
Рис. 4.13. Схема реализации
процесса выхлопа и условные
диаграммы мгновенного и
равновесного распределения
температур в этом процессе
системы установится равновесная температура 7"к, которую
можно определить следующим образом. Для рассматриваемого
типично неравновесного процесса (на 1 кг газа в закрытой
системе)
'таза = Мк - = - PM - V <4-48)
Из выражений (2.50) и (3.51)
du = cvdT + (pT/z)(.dz/dT)vdv, (4.49)
поэтому при постоянных z и cv
- 7;) = р^ (Тк/рк - ТМ, (4.50)
откуда после преобразований получим
Т - Т = - — V
н к н к \ рн /
А = -------------------. (4.51)
К 1 + (РК/АМ - В
Снижение температуры газа при одинаковых Г , рн и рк в не-
равновесном адиабатном процессе меньше, чем в изоэнтропном
процессе. Следует обратить внимание на то, что при кр =
= (рн - рк) —> dp соблюдаются условия квазиравновесия. В этом
188
случае дифференциальные эффекты процесса выхлопа ав и
изоэнтропного процесса практически одинаковы:
ав = = к + ]• (4-52)
ДЛхн 1 ' дТ» р"
При принятых допущениях все выражения для рассматрива-
емого процесса [уравнения (4.51)] можно легко получить из
выражения (4.52), если принять
«в = (dT/dP\ = % = const- (4-53)
Действительно, при z = const
а^=(ТМ(к- (4-54)
Приняв, что в процессе выхлопа as.H = const [условие (4.53)],
из выражения (4.54) найдем изменение температуры, которое в
точности совпадает с результатом, полученным по формуле (4.51).
Таким образом, определена математическая форма уравнения
процесса выхлопа — формула (4.53). Учитывая связь ав и as,
можно полагать вполне удовлетворительной точность вычисления
температур реальных газов (кроме водорода) в процессе выхлопа
по уравнениям (4.51), полученным при постоянных z и к. Для
водорода, как и при вычислении температур в равновесном
адиабатном процессе, следует пользоваться средними значениями
показателя Пуассона.
Исходя из уравнения (4.53), нетрудно построить линии ав =
= ап| = const для процессов выхлопа в координатах Т — s при
заданных рн и Тн (рис. 4.14).
189
Анализ рисунка показывает, в частности, что при исполь-
зовании процесса выхлопа в качестве холодопроизводяикч0
нерациональны большие степени расширения в одной ступени
Чем меньше степень расширения, тем выше эффективность
процесса выхлопа, тем ближе изменение температуры к
изменению в изоэнтропном процессе. В связи с этим часто i но
не всегда) отношение давлений ры/р^ для этого процесса ограни-
чивают значениями 2...4 (5). Изменение энтальпии гаю в
процессе выхлопа, организуемого в открытой системе, мод но
определить из уравнения (4.50), учитывая, что / = и + ру
Ф - Ф = <ЛТи(1 - ^к/Л|) или /н - /к = ц,(/ф - pj. (4.S.S)
Выражения (4.55) определяют холодопроизводительношь
процесса выхлопа в открытой системе.
Если процесс выхлопа рассматривать во времени, то неш-
бежно приходится учитывать «температурное расслоение» или
возникновение температурного градиента в потоке выходящего
пз баллона газа (см. рис. 4.13). В течение всего процесса в
моменты времени т(, т2, тк температуры в выпускной трубе 7Н),
Г2н, 7кв выше температур газа в баллоне соответственно Г1(). 7,6,
Ткб. Температуру газа ТкГ), находящегося в баллоне в момент
окончания процесса выхлопа, в первом приближении можно
определить из уравнения адиабаты Пуассона (4.38), как д >я
равновесного адиабатного процесса. Это вполне корректно, так
как на контрольной поверхности (контур 5) подсистемы, которая
содержит .массу газа, оставшегося в баллоне к моменту оконча-
ния выпуска, можно считать выполняющимися условия кваш-
равновесия. Среднюю температуру Т газа, вышедшего к мо-
менту окончания выхлопа, просто вычислить из условия, соглас-
но которому после полного смешения всех порций газа, остав-
шихся и вышедших из баллона, их температура должна бшь
равна Гк. Так, при сделанных допущениях
т Z' р» ’ р*
„ср к
(4.56)
A, ’ P^P»/P^k~ l)A
Впервые процесс выхлопа был использован Л.Кальсге в IS7” 1.
для ожижения кислорода и других газов. Затем он был применен
Э.Ольшевским и С. Вроблевским для получения ожиженных
газов. В 1932 г. Ф. Симон успешно использовал этот процесс для
ожижения гелия. В 1959 г. У. Гиффорд и Мак-Магон построили
оригинальный криогснсратор, в котором циклически повторялся
190
процесс выхлопа (см. § 6.6). Процесс свободного выпуска газа
использован и в так называемой пульсационной трубе (см. § 6.6).
Выхлоп является одним из важнейших рабочих процессов
поршневых детандеров.
В заключение отметим, что обратным процессу выхлопа по
физическому смыслу является процесс впуска газа в какую-либо
емкость. В этом случае происходит неравновесное адиабатное
сжатие газа, предварительно находившегося в баллоне. Если сжи-
маемый газ, находившийся в баллоне, остается адиабатно
изолированным от входящих порций свежего газа, то, выполнив
преобразования, аналогичные сделанным при выводе уравнений
(4.51), найдем
i (4.57)
При впуске газа с температурой 7^ температуру Тк в баллоне
после заполнения определяют с учетом смешения сжимаемого
газа и вновь поступающего. Выполнив соответствующие вычис-
ления, получим
Т = --------------------- (4,58)
к +
Рассматривая процесс впуска во времени, необходимо также
учитывать возникновение температурного градиента в потоке
впускаемого газа. Температура в баллоне максимальна вдали от
впускного клапана в зоне сжатия газа, находившегося перед
впуском. Датчики температуры могут фиксировать кратко-
временно местное повышение температуры, теоретически
определяемое при отсутствии смешения уравнением (4.57).
Наиболее низкие температуры в струях газа вблизи от входного
окна или клапана. При интенсивном смешении температурный
градиент исчезает и в баллоне устанавливается температура,
теоретически определяемая уравнением (4.58). Неравномерное
поле температур в сосуде, в который входит газ, можно в
определенной конструкции стабилизировать во времени, и,
используя повышение температуры сжимаемого газа для пере-
дачи его энергии в окружающую среду, получить охлаждающее
устройство. Это показано У. Гиффордом и Р. Лонгсвортом,
осуществившими подобные процессы в пульсационной трубе
(см. рис. 6.55).
191
§ 4.7. ПРОЦЕССЫ В АДИАБАТНОЙ СИСТЕМЕ
С ПЕРЕМЕННОЙ МАССОЙ
Для многих криогенных систем, особенно в низкотемпера-
турных газовых машинах, рабочие процессы в отдельных частях
(полостях) протекают при переменной массе рабочего тела.
Вследствие быстротечности эти процессы можно рассчитывать
как адиабатные. Рассмотрим кратко основные закономерности
изменения параметров газа в открытой адиабатной системе при
переменном количестве рабочего тела.
Любую термодинамическую систему с переменным коли-
чеством рабочего тела можно проанализировать и описать с
использованием методов классической термодинамики. Однако
способы решения задач для систем с переменной массой могут
быть разными. Иногда для решения задачи удобно выбрать
подсистемы или дополнительные системы с постоянной массой
и рассмотреть их взаимодействие. В других случаях проще
непосредственно исследовать систему с переменной массой
рабочего тела.
На рис. 4.15 приведена схема адиабатной открытой системы,
контрольная поверхность которой совпадает с границами
рабочего объема. В сечении а — а в систему втекает поток с
температурой Та. При движении поршня параметры системы
(р; Т, И G) изменяются. Для получения уравнения, связывающего
изменение этих параметров, выполним следующие операции.
Продифференцируем уравнение состояния (3.51) и разделим
его на G:
Рис. 4.15. Схема простейшей
открытой адиабатной системы
с переменным количеством
рабочего тела
dp/p + dV/V - dT/T - dz/z- (4.59)
Уравнение закона сохранения и
превращения энергии для рассматри-
ваемой задачи запишем, используя
формулу (2.6), для открытой термо-
механической системы
idG dU + pdV. (4.60)
В более общем случае, когда в
систему входят или из системы вы-
ходят несколько потоков, левая часть
уравнения (4.60) должна включать
£ (/d G)^ а также dQ, если система
нсадиабатная.
192
Рассматривая рабочее тело при постоянных г, cv и с, найдем
dU= cvd(GT) = cvTdG + cjGdT, idG = cpTadG. (4.61)
Уравнение (4.60) запишем теперь так:
(кТа - Т) dG/G = dT + (к - \)TdV/V. (4.62)
Подставив в это выражение уравнение (4.59), найдем искомое
уравнение, связывающее текущие параметры газа в системе:
dp _ (Г- Т) dV/V - TdT/T
-р---------пггт„------------' <4'63*
В зависимости от условия задачи температура Та может быть
переменной или постоянной. Последнее выражение является
общим. Из него можно получить известные частные решения.
Например, если температура газа Та в сечении а—а остается все
время равной текущей температуре газа Т (что возможно в двух
случаях: когда газ в систему не поступает или когда газ уходит
из системы), то выражение (4.63) дает известное уравнение
равновесной адиабаты Пуассона
= __L_ (4.64)
р к - 1 Т
Если температура Та не равна температуре газа в системе, про-
исходит необратимое смешение. Уравнение (4.63) остается спра-
ведливым, если теплота смешения равна нулю. Например, для
процесса впуска газа в какой-либо объем dV = 0 и Та = 7вх =
= const. Тогда из уравнения (4.63)
_ т Jjl + т tLL = о ,4 65,
к р вх р ™ Т '
Приведя это выражение к виду, удобному для интегриро-
вания, получим
Это дифференциальное уравнение процесса впуска. Проинтег-
рировав его в пределах от рн до рк , получим выражение, пол-
ностью совпадающее с уравнением (4.58).
Другой типичный процесс с переменной массой — процесс
^Наполнения при постоянном давлении (dp = 0) и Та = Твх =
' const. В этом случае из уравнения (4.63) найдем
_ Твх dT
V Т'вх - т т
(4-67)
13 Заказ № 1592
193
или
dV/V = dT/Т- dT/(T - Tj. (4.6^
Это дифференциальное уравнение процесса наполнения при
р = const. Проинтегрировав выражение (4.68) в пределах oi (
до И , получим
= TRXVJ(V^ - И + VJ.JTJ. (4.09)
Таким образом, показано, что уравнение (4.63) действительно
является общим. Его можно применять и для необратимых
процессов, так как исходное уравнение (4.60) для рассмотрен ниц
системы в данных се границах допускает внутреннюю нерав.чо-
вссность. Если при этом теплотой смешения или внутренними
тепловыделениями можно пренебречь, то уравнение (4.63) дает
верный результат. Из уравнения (4.63) следует также, чгс в
процессе выхлопа (Та = 7) температура газа, остающегося и
баллоне, изменяется по адиабате Пуассона.
§ 4.8. РАСШИРЕНИЕ ГАЗА В АДИАБАТНОЙ
ВИХРЕВОЙ ТРУБЕ РАНКА-ХИЛША
В 1931 г. Ж. Ранк обнаружил эффект температурного раз ie-
ления газового потока при его вихревом течении. Схема устрой-
ства для реализации эффекта Ранка приведена на рис. 4.16. ('жа-
тый газ через тангенциальное сопло / подается в улитку 2. ; тс
194
'j устанавливается интенсивное круговое течение. При этом возни-
кает неравномерное температурное поле. Слои газа, находящиеся
вблизи оси, оказываются более холодными, чем входящий газ,
а периферийные слои закрученного потока нагреваются. Часть
газа ц в виде холодного потока отводится через диафрагму J,
. насадок 4 и щелевой диффузор 8. а другая часть (1 - ц) в виде
нагретого потока — через насадок 5 и лопаточный диффузор 6
с сеткой 7. Такая схема вихревой трубы близка к оптимальной.
Более простые конструкции выполняют без диффузоров. Работу
вихревой трубы можно регулировать дроссельной заслонкой на
теплом потоке.
Если часть газа (ц) оказалась после расширения более холод-
ной, а другая часть (1 - ц) — более горячей, значит, часть энергии
первого потока (р) передана второму потоку; поэтому вихревую
трубу иногда называют энергетическим разделителем потока.
Весьма сложный характер механизма течения газа в вихревой
трубе здесь не обсуждаем. Заметим только, что, как установлено
экспериментальными исследованиями, осевая скорость перифе-
рийных слоев закрученного потока направлена в сторону горя-
чего конца трубы. На расстоянии около 0,352) от оси осевая
скорость близка нулю. На меньших радиусах появляется посте-
пенно нарастающая осевая скорость, направленная в сторону
холодного конца трубы. Около оси осевая скорость снова умень-
шается. Угловая скорость центральных масс газа, начиная от оси
до определенного радиуса, практически постоянна; эта область
называется вынужденным вихрем. В периферийной области
закрученного потока угловая скорость уменьшается с увеличе-
нием радиуса; эта область называется свободным вихрем.
Простейшее объяснение эффекта температурного разделения
сводится к следующему. Частицы газа, движущиеся к центру,
стремятся сохранить угловой момент и должны были бы вра-
щаться с нарастающей угловой скоростью по мере приближения
к оси. Однако этому препятствует вязкость среды. В результате
Центральные слои вращаются практически с одинаковой ско-
ростью, и частицы газа, движущиеся к центру, вынуждены отда-
вать часть своей кинетической энергии другим слоям газового
вихря, охлаждаясь при этом. Периферийные слои вращающегося
газа, получая эту энергию, нагреваются, так как она в конечном
итоге превращается в теплоту. Существуют и другие концепции
температурного расслоения в вихревой трубе. В частности, одна
Из них исходит из предположения существования флуктуаций
Плотности (давления) в вйхревом потоке. Тогда естественно, что
13* 195
более разреженные и более холодные частицы будут стягиваться
к центру, а более плотные и теплые — к периферии. Эти объяс-
нения весьма приближенные и не учитывают многих реальных
явлений, возникающих в вихревой трубе.
Уравнение закона сохранения энергии для адиабатной вихре-
вой трубы имеет вид
Чх = Сх'х + Gt‘t ИЛИ 'вх = Н/х + (1 - Н)/г; (4.70)
здесь
ц-(7х/(7; 1-ц= GT/G; Gx + G = G, (4.71)
где Gx и GT — количества (расходы) соответственно холодного
и горячего газа.
Холодопроизводительность вихревой трубы
Св = - Q = Gr (4 - 'вх)- (4.72)
Удельная холодопроизводительность вихревой трубы
= М ('вх - 'х) = 0 - Н)(4 - 'вх)- (4-73)
При ср = const
Ъ = ^Ср (7вх - Гх) = ^ерАТх = (1 - Ц)Ср(Гг - Гвх) = О - HRpAT;-
(4.74)
Снижение температуры холодного потока АТХ даже в лучших
конструкциях вихревых труб достигает только 50—55 % разности
температур в изоэнтропном процессе. Отношение \ Tx/\Ts часто
называют температурной эффективностью вихревой трубы. Если,
кроме того, учесть, что холодный поток составляет всего 25—
35 %, становится очевидной низкая эффективность вихревой
трубы как генератора холода. Однако ее конструктивная простота
в некоторых случаях играет определяющую роль, особенно когда
экономические соображения не являются решающими.
На рис. 4.17 приведены типичные характеристики вихревой
трубы. Наибольшее изменение температуры холодного потока
АТХ наблюдается при ц ~ 0,25. Удельная холодопроизво-
дительность, характеризуемая произведением |г7"к, максимальна
при р ~ 0,6. На характеристики вихревой трубы влияют не только
термодинамические параметры газа, но в большей степени и
геометрические размеры, в частности, диаметр диафрагмы, длина
насадка для отвода горячего и холодного потоков и его геомст-
196
рис. 4.17. Типичные характеристики адиа-
батной вихревой трубы (рвх = 0,6 МПа;
[ = 303 К; рх = 0,101 МПа; рабочее
тело — воздух)
рия, размеры сопла. Поскольку
давление нагретого потока газа
всегда больше давления холодного
потока, выходящий горячий поток
(1 - ц) часто используют для
случае удается повысить
эжекции обратного потока ц. В этом
эффективность трубы и увеличить значение ц, при котором
достигается наибольшее изменение температуры холодного
потока, примерно до 0,35 (вместо 0,25). Согласно данным
В.И. Метенина, оптимальные размеры вихревой трубы ориенти-
ровочно определяют по следующим эмпирическим формулам (см.
рис. 4.16):
D = 3,57 <4; dK = 0,5Z> ;
/г = (3,0...3,5)7); /х = (3,0...3,5)с/х, (4.75)
где fc — площадь проходного сечения сопла, мм; 1*и 1г — длина
соответственно холодного и горячего диффузора.
Угол раскрытия холодного диффузора выбирают в пределах
3,5...7° , горячего — около 3,5°. Степень расширения газа в вихре-
вой трубе рвх/рх = 2...8 мало влияет на отношение ДТХ/Д7}. При
более высоких степенях расширения это отношение уменьша-
ется. В первом приближении можно считать, что и температура
на входе слабо влияет на S.TJS.T, если при этом рабочие
процессы происходят в области однофазных состояний.
В случае применения вихревой трубы в низкотемпературном
цикле последний имеет характерные отличия. На рис. 4.18 приве-
дена схема простого однокаскадного цикла с вихревой трубой
и условно изображены рабочие процессы в диаграмме Т— s. Сжа-
тый газ, пройдя рекуперативный теплообменник (точка 2), пода-
ется в вихревую трубу, где разделяется на холодный и горячий
потоки. В теплообменник II может быть направлен только холод-
ный газ ц после теплообменника нагрузки. Нагретый в трубе
Поток газа (1 - ц) должен быть выведен из системы. Это можно
сделать и без эжектора, однако при его использовании удается
Повысить эффективность всей установки. Из уравнения энерге-
тического баланса для системы, находящейся в пределах конт-
197
Рис. 4.18. Схема использования вихревой трубы в низкотемпературном цикле (о) и
условное изображение рабочих процессов цикла в диаграмме Т — s (6):
I — охлаждаемый компрессор; II — рекуперативный теплообменник; III
вихревая труба; IV — теплообменник нагрузки (охладитель); V — эжектор,
процессы 1-2 — охлаждение прямого потока в теплообменнике; 2-а — расширение
в сопле вихревой трубы; а-3 — формирование холодного потока ц в вихреы и
трубе; а-б — формирование горячего потока в вихревой трубе; б-в — сжатие
нагретого газа в диффузоре; 3-4 — снятие полезной нагрузки; 4-5 — нагревание
обратного поток:1 ц ; в-г — расширение нагретого потока (1 - р) в сопле эжектора,
5-6 — расширение потока ц в эжекторе; 6-7 и г-7 — смешение потоков ц и (1
7-8 — сжатие газа в диффузоре эжектора; 8-Г — охлаждение; Г-1 — сжатие г;на
рольной поверхности к, найдем полезную удельную холодопрон 1-
водительность
? — /8 - z’j - <7С
или
Q = 004 - *з) = '8 - *1 - (4.76)
где <?с — теплоприток из окружающей среды.
Цикл может быть как замкнутым, так и разомкнутым.
Исследования вихревого эффекта, вихревых труб и соответ-
ствующих установок наиболее полно отражены в работах
В.С. Мартыновского, В.П. Алексеева, А.П. Меркулова, В.И. Мстс-
нина, А.Д. Суслова, В.И. Епифановой, В.А. Сафонова, Ю.В. Чижи-
кова. В частности, в 70-х годах в МВТУ им. Баумана проф-
А.Д. Сусловым и его учениками был впервые реализован и экспе-
риментально изучен процесс дистилляции воздуха в вихревой трубе
при подаче в нее парожидкостной смеси. Обогащение одного из
потоков кислородом достигало 80 % и более.
198
§4.9. ПРОЦЕССЫ ВОЛНОВОГО РАСШИРЕНИЯ ГАЗА
При анализе процесса дросселирования, реализуемого в
безмашинном расширительном устройстве (см. § 4.3), указано,
что в дроссельном вентиле происходит процесс истечения с
преобразованием энергии сжатого газа в кинетическую энергию
потока. Для увеличения температурного эффекта расширения без
существенного усложнения самого расширительного устройства
необходимо найти способы преобразования кинетической
энергии потока в другие формы и отвода ее части без использо-
вания сложных машин — детандеров, обычно применяемых для
этих целей. Одним из практических путей является осуществле-
ние так называемого процесса волнового расширения: расшире-
ния в условиях установившегося течения с генерацией волновой
(акустической) энергии и отводом части этой энергии в преобра-
зованном виде от расширяющегося газа.
Исследования, проведенные в МГТУ им. Н.Э.Баумана
совместно с АО «Криогенмаш», «Гелиймаш», ВНИИХОЛОД-
МАШ и Акустическим институтом РАН, определили некоторые
возможные способы реализации волновых процессов расширения
применительно к криогенным и холодильным системам. Разра-
ботанные расширительные устройств;! названы волновыми крио-
генераторами (ВКГ), а сам метод получил название газодинами-
ческого безмашинного метода получения холода.
Для возбуждения волновых автоколебательных режимов
можно использовать скачки уплотнений, возникающие, напри-
мер, в недорасширснных струях при истечении газа через сужаю-
щееся сопло. За пределами сопла наблюдаются сверхзвуковые
скорости течения газа. На рис. 4.19, а показана структура
кольцевой недоросширенной струи. При втекании такой струи
в какую-либо замкнутую полость скачок уплотнения при опреде-
ленных условиях начинает осциллировать, генерируя волновой
процесс — эффект Гартмана.
Преобразование энергии колебаний среды в другие формы
Энергии и отвод ее от расширяющегося газа можно осуществлять
различными методами. Например, в волновых криогенераторах с
резонансными трубками сильно нагревается закрытый конец труб-
ки (эффект Шпренгера), и выделяющаяся теплота может быть
отведена (рис. 4.20, а). В другом типе волнового криогенератора
Использованы короткий резонатор-излучатель и эллипсоидный
концентратор (рис. 4.20, б). В левом фокусе эллипсоида распо-
ложен резонатор-излучатель, в правом — при фокусировании волн
199
Рис. 4.19. Схема кольцевой сверхзвуковой иедорасширенной струи, вытекающей в
свободное пространство (а), и положения струи, втекающей в замкнутое пространство
полой трубки в различных фазах установившегося резонансного цикла (б— е):
I — сужающееся сопло; 2 — стержень; 3 — граница трубы в зоне первой ячейки
("бочки"); 4 и 5 — первый и второй скачки уплотнений; 6 — граница отрыва
пограничного слоя
нагревателя приемник колебаний, теплота от которого также может
быть отведена. Возможны и другие конструкции, в том числе с
прямым преобразователем волновой энергии в электрическую.
Исследования рабочего процесса в ВКГ с резонансной труб-
кой (см. рис. 4.20, а) показали существование двух периодически
Рис. 4.20. Схемы волновых криогсисраторов:
а — с резонансной трубкой Гартмана; б — с эллипсоидным концентратором
(1 — сопло; 2 — стержень; 3 — осциллирующий скачок; 4 — резонансная трубка;
5 — резонатор-излучатель; 6 — поглотитель (приемник) волновой энергии: 7 —
эллипсоидный концентратор)
200
I
повторяющихся стадий процесса: входа газа в резонансную трубку
и выхода из нее навстречу потоку из сопла (см. рис. 4.19, б—е).
Таким образом, в резонансной трубке устанавливается автоколеба-
тельный процесс. Наличие центрального стержня 2 (см. рис. 4.20, а)
способствует стабилизации этого процесса. Основная резонанс-
ная частота автоколебаний газа (первая гармоника) в резонан-
сной трубке
/= а/(4Х), (4.77)
где а — скорость звука в газе; L — длина резонансной трубки.
Возникающие и отраженные от дна трубки волны сжатия и
разрежения, взаимодействуя между собой, образуют на некото-
ром расстоянии от открытого конца трубки ударную волну ко-
нечной амплитуды. Прохождение по трубке прямой и отражен-
ной от дна ударных волн проявляется в интенсивных колебаниях
- давления, росте энтропии и выделении теплоты. Режимы с мак-
симальной амплитудой колебания давления характеризуются наи-
большими устойчивостью и тепловыделениями. Амплитуда А
колебаний газа на основной резонансной частоте примерно на
8-15 дБ выше, чем на других частотах (рис. 4.21). Плотность
энергии в волновом процессе в первом приближении пропорцио-
нальна квадрату амплитуды колебаний, следовательно, на основ-
ной резонансной частоте переносится около 80-90 % всей
энергии.
Звуковое давление р, Па, и поток волновой энергии w, Вт/м,
определяют по формулам
р = 2 • Ю^20-5; w = />2/(Р «)> (4-78)
где А — амплитуда колебаний давления газа на основной резо-
нансной частоте, дБ; р — плотность газа, кг/м3.
Рис. 4.21. Спектрограмма
колебаний давления возду-
ха в резонансной трубке с
L/d = 60 при ри/р,ых = 5
и температуре 71х = 160 К
(сплошная линия),
Тп = 283 К (штриховая
Линия) по данным
Р.С. Мухамедова:
1-5 — номера гармоник
(2 — основная резонанс-
ная частота)
201
Существенно, что при понижении температуры на входе ампли
туда колебаний давления газа не уменьшается (см. рис. 4.21). Это
является необходимой предпосылкой для сохранения эффекта
охлаждения газа при низких температурах. Авторами этот процесс
экспериментально реализован для гелия при Т~ 10 К. Важно отметит ,
что при фиксированных диаметрах сопла D, стержня Ь, трубки d и
определенном отношении давлений Ркрры.у (см. рис. 4.20) режим с
максимальной амплитудой поддерживается при определенном
расстоянии S от среза сопла до трубки. Срез трубки должен нахе
диться в зоне первого 4 или второго 3 скачка (см. рис. 4.19, а\\
рекомендуются следующие геометрические соотношения:
S~ (1,5...2,0)D; />=0,75/); /ст = 0,55; L = (6O...9O)J;
</= 1,25D; а = 25...6O0; рвх/рвых = 2...5. (4.79)
Распределение температур по длине резонансной трубки зави-
сит от целого ряда конструктивных факторов и температуры газа
на входе (рис. 4.22). Конструктивными усовершенствованиями
можно повысить максимальную температуру в трубке для воздуха
до 800 К, для гелия до 1000 К.
Уменьшение энтальпии газа при расширении в волновом
криогенераторе определяет его холодопроизводительность:
'вх - 'вых = ^.80)
где q — количество отведенной теплоты.
Для ВКГ с резонансной
трубкой длину зоны тепло-
съема рекомендуется вы-
бирать равной (0,3—0,4)L.
Теплоотвод можно осу-
ществлять также отбором
части горячего газа с теп-
лой стороны трубки. В
этом случае ВКГ работает
как своеобразный энерге-
Рис. 4.22. Кривые изменения
температуры стенки по длине
резонансной трубки при расши-
рении воздуха и различных
(P.x/Z’.ux = 5; L/d = 60)
202
тический разделитель позока, сходный по производимому эффек-
ту с вихревой трубой.
В общем случае изменение температуры газа при расширении
в ВКГ
твх - гвь1Х = лгн,± дт;., (4.81)
где Л Т — понижение температуры газа в результате отвода части
волновой энергии; ДТ) — интегральный дроссельный эффект.
Отсюда
дт/дт; = дт;/л7; ± 1. (4.82)
Это отношение зависит от параметров и свойств рабочего
тела. Например, для воздуха оно может достигать 3—4, т.е. в
3—4 раза превышать интегральный дроссельный эффект, для
гелия в области температур 20—10 К это отношение составляет
1,05-1,2.
Эффективность ВКГ можно оценивать также адиабатным
КПД, т.е. как для «волнового детандера»:
= (4.83)
где Ms — разность энтальпий при изоэнтропном расширении.
При достигнутой степени совершенства ВКГ средние значе-
ния т| = 0,12...0,18, на отдельных режимах т|ад ~ 0,2...0,25 (для
наиболее совершенных конструкций). Несомненные преиму-
щества ВКГ как безмашинных генераторов холода — простота,
надежность, устойчивость работы в широкой области параметров
для различных газообразных рабочих тел. Осуществить эффектив-
ный рабочий процесс ВКГ в области состояний насыщения пока
не удалось. Это ограничивает их применение. При использова-
нии ВКГ в циклах гелиевых установок теплота от ВКГ передастся
на предварительную ступень охлаждения.
§ 4.10. ОТКАЧКА ПАРОВ КИПЯЩЕЙ ЖИДКОСТИ.
барботирование газа через жидкость
Процесс в жидкости при уменьшении давления над ее зеркалом
в изолированном сосуде напоминает процесс кипения. Через слой
Жидкости поднимаются пузырьки пара, который откачивается ваку-
умным насосом. Однако при откачке могут существовать режимы
только поверхностного испарения. Например, при откачке паров
Не после перехода через Л-точку видимый процесс кипения пре-
203
Рис. 4.23. Схемы откачки паров криогенной жидкости (а) и рефрижератора
замкнутого цикла с адсорбционным насосом для откачки газов (6):
I — испаритель; 2 — конденсатор; 3 — адсорбционный насос; ВН — вакуумный
насос, q, qK, д3№ и джс — количества теплоты соответственно подводимой,
конденсации, адсорбции и десорбции
кращается. Режимы поверхностного испарения наблюдаются также
при глубоком вакуумировании азота и кислорода. Во всех случаях
испаряющийся пар отнимает энергию у жидкости и внутренних
стенок сосуда, вследствие чего температура остающейся жидкости
и стенок снижается (рис. 4.23, а). Пусть г — скрытая теплота
испарения жидкости; т — масса жидкости в сосуде; шст — масса
внутренних стенок; сж и сст — теплоемкость жидкости и материала
стенок; Qc — теплоприток через изоляцию. Уравнение баланса эне-
ргии в элементарном квазиравновесном процессе в предположении
равенства температур жидкости и стенок запишем следующим
образом:
rdm = (т - dm)cdT + mcdT + dQ (4.84)
' ' /К. Cl CJ C '
Разделив это выражение на т и продифференцировав по вре-
мени т, получим
г dm
т di
где т а и d q с — удельные приведенные масса стенок и тепло-
притоки.
204
dT / dm \ __ dT dq
? ---11 - ---- I + c m ------+ ------- (4.S3)
ж dr \ ml CT CT dr dz '
К» (дР )
ЛТвН\ dt /Уи
(4.87)
Р
RT.
^вн
Ат Квн /ф \
RT,„ \ dt /квн’
(4.88)
Р
р
Скорость изменения температуры жидкости в сосуде опреде-
ленной геометрии зависит в основном от интенсивности откачки
ее паров, т.е. от производительности вакуумного насоса. При
давлении р и постоянной температуре на всасывании для
массы паров М, откачиваемых насосом, можно записать
М=рКм/(ЛТвН)=/(р; Им). (4.86)
Если dm = dM, то
dm
dx
или
dm_
dx
где КвН = (dV^/dt) — объемная производительность насоса при
условиях всасывания (для машин объемного типа — описанный
объем в единицу времени); Дт — продолжительность работы
насоса.
Следует учитывать, что производная (др/di) отрицательна.
Разные криогенные жидкости имеют различные зависимости
р = /(Г); сж = f(T), поэтому при использовании одинаковых
насосов скорость охлаждения, при прочих одинаковых условиям,
разная. Прекращение охлаждения (равновесие) происходит при
понижении давления до значения, при котором уменьшение
энергии компенсируется внешним теплопритоком. Согласно
формуле (4.88) dm/dt -> 0 при р -> 0 и др/дх -> 0. Например,
для 4Не при Т = 1 К давление насыщенных паров составляет
16 Па, а при Т — 0,5 К — лишь 2,18 Па, поэтому с помощью
даже самых Мощных вакуумных насосов температуру жидкого
4Не не удается получить ниже 0,5 К.
Используя усредненные параметры, легко вывести упрощен-
ные соотношения в интегральной форме, не учитывая динами-
ческих характеристик процесса откачки. Пусть Ьт — масса
испарившейся при откачке жидкости; гср — средняя теплота
испарения жидкости; сж ср и сст ср — средние теплоемкости жид-
кости и стенок. Тогда можно записать
г &т = (т - \т)с \Т + 0,5Дж ДГ + т с \Т + Q ,
vp Г1 ' лССр Ж-Vp Ы UJ .vp V
(4.89)
где /дн — начальная масса жидкости.
205
Разделив это уравнение на тн и обозначив относительные
массы и теплопритоки Ьт/тц = Aw; та/тн = та: Qc/m}l = ц
найдем в первом приближении снижение температуры жидкость
при откачке ее доли Aw :
О - Кер + °’5Д/Я Сж.ср + Wc-rCcpc-r'
На практике часто применяют этот метод для получения нсдо-
гретых (ранее называемых переохлажденными) жидкостей. В
реальных условиях возникают дополнительные потери, главным
образом вследствие неравновесности и недоиспользования скры
той теплоты испарившейся жидкости. Уходящий пар не находит-
ся в равновесии со всей массой остающейся жидкости, в которой
существуют температурные градиенты. Наиболее интенсивно
охлаждаются слои жидкости вблизи ее зеркала. Разность темпера
тур жидкости в режимах кипения обычно не превышает 2 К, а
в режимах поверхностного испарения (кроме Не) может дости-
гать 5 К. Дополнительные потери зависят от режимов откачки,
многих конструктивных факторов, наличия смесителей и др
Действительные значения А Т меньше рассчитанных по формуле
(4.90), которую можно уточнить, введя в числитель в чистом виде
дополнительные потери ~q доп:
дг=5 _________- УС - Удоп______________
и - Кер + °’5A7” Сж.ср + 'ЯеАр.ет
Откачку паров жидкостей можно выполнять различными
устройствами, в том числе и криогенными вакуумными насоса-
ми. На рис. 4.23, б показана принципиальная схема криорефри-
жератора с адсорбционным насосом. В процессе адсорбции
происходит откачка пара, и теплота испарения жидкости исполь-
зуется для охлаждения. В процессе десорбции одновременно
происходит процесс конденсации рабочего вещества в конденса-
торе, и этим процессом цикл замыкается.
Процесс охлаждения жидкости при насыщении ее парами газа,
барботирующего через слой жидкости, по физической сути близок к
рассмотренному выше. В отличие от процесса откачки паров процесс
барботирования осуществляется при неизменном давлении газа
носителя. Насыщение газа-носителя парами жидкости достигается за
счет испарения жидкости, которая при этом охлаждается. Процесс
реализуется не только в барботажных аппаратах, но и в пленочных.
206
(4.91)
Количество испарившейся жидкости определяют исходя из
условий равновесия в системе газ-жидкоств и режимов
барботирования. Например, оно зависит от давления, темпера-
туры, расхода газа-носителя, началвного содержания в нем паров,
времени контакта фаз и т.п. В свою очередв, по количеству
испарившейся жидкости можно легко найти понижение темпе-
ратуры оставшейся ее части подобно тому, как это было сделано
в задаче об откачке паров.
На практике широко используют способ охлаждения воды в скруб-
берах сухим азотом или воздухом (системы азото-водяного охлаждения
ВРУ). Существуют также опытные установки для охлаждения жидкого
водорода при барботировании через него гелия.
§4.11. ПРОЦЕССЫ ОХЛАЖДЕНИЯ С ИСПОЛЬЗОВАНИЕМ
РАБОЧЕЙ СРЕДЫ В ТВЕРДОМ СОСТОЯНИИ
Наиболее распространенный тип термодинамической систе-
мы, применяемой в криогенной технике, — термомеханическая
система с рабочей средой в газообразном или жидком состоянии.
Рассмотренные выше классические процессы построены на ис-
пользовании именно такой термомеханической системы. Однако
в ряде случаев для охлаждения целесообразно применять твердые
тела; при этом вместо механического проявляются такие типы
взаимодействия, как магнитные и электрические.
Существует ряд термодинамических процессов, пригодных для
получения низких температур и основанных на использовании
рабочей среды в твердом состоянии. Некоторые из них (адиа-
батное размагничивание и термоэлектрическое охлаждение)
нашли широкое применение, другие используют редко, но они
перспективны и, возможно, получат распространение в будущем.
Рассмотрим ряд процессов получения низких температур с
Использованием твердых тел в качестве рабочей среды.
Адиабатное размагничивание. Процесс охлаждения какого-либо
тела связан не только с уменьшением его температуры 7) но и
снижением энтропии х. Причем фактором, воздействующим на
тело, может быть параметр состояния. Наиболее распростра-
ненный термомеханический способ уменьшения .у изменением
давления р становится неэффективным при температурах,
близких к 1 К, так как в этой области неупорядоченность
(энтропия) слабо зависит от параметров р и v. Для охлаждения
вблизи 1 К необходима иная физическая система, энтропия
207
которой могла бы существенно изменяться при изменении
параметра состояния X.
В 1926 г. В.Джиок и П.Дебай независимо друг от друга пред-
ложили использовать в качестве такой системы парамагнетики.
Однако еще в 1905 г. ПЛанжевен показал, что изменение намаг-
ниченности парамагнитного вещества должно сопровождаться
обратимыми изменениями температуры. Парамагнитное веще-
ство можно рассматривать как систему, состоящую из элементар-
ных магнитных диполей, обладающих магнитным моментом, но
очень слабо взаимодействующих между собой. Вплоть до
гелиевых температур диполи расположены хаотически, что обус-
ловлено их тепловым движением и слабым взаимодействием.
Однако их можно ориентировать (перевести в упорядоченное
состояние) наложением внешнего магнитного поля. Причем
сделать это можно только, если энергия колебаний решетки мала
и не влияет на магнитную систему. Появляется возможность
уменьшить энтропию системы при помощи внешнего магнит-
ного поля, напряженность которого Н можно рассматривать в
качестве параметра состояния X. Таким образом, получаем
принципиальную возможность использовать эту систему для
охлаждения.
Рассмотрим некоторые соотношения термодинамики примени-
тельно к термомагнитной системе, для которой энтропия является
функцией температуры и напряженности поля: s = f(T, Н). В
общем случае выражение для элементарной работы в термодина-
мике имеет вид dL = XdY, где X— обобщенная сила; У— обоб-
щенная координата. В термомеханической системе работа связана
с изменением объема, т.е. X — р; Y = V. В магнитной системе
работа состоит в поляризации диполей при наложении внешнего
магнитного поля напряженностью Н; при этом изменяется намаг-
ниченность материала М. Очевидно, что X = Н А/м и У =
= М (А‘ м)/кг, следовательно, dL — —HdM. Знак минус показы-
вает, что при увеличении намагниченности работа производится
над магнетиком. В этом случае первое начало термодинамики
можно записать в форме du — dq + HdM (изменение объема
магнитного вещества при этом не учитываем). С учетом второго
начала запишем
du = Tds + HdM. (4.92)
Очевидно, что таким же образом можно ввести магнитную
энтальпию е = и — НМ.
208
Определим изменение температуры при использовании маг-
нитной системы для охлаждения. Рассмотрим наиболее эффек-
тивный обратимый процесс охлаждения — изоэнтропное размаг-
ничивание. Используем соотношение s = f(T, Н) для процесса
s = const:
ds = (ds/dT)ffdT + (ds/dH)T dH = 0
или
(дТ/дН\ = - (ds/dH)T/(ds/dT)H. (4.93)
Для процесса Н = const из соотношения Tds = cHdT получим
(ds/dT)H= сн/Т, (4.94)
где сн — теплоемкость парамагнитного вещества при постоянной
напряженности поля Н, Дж/(моль • К).
Введя термодинамический потенциал Гиббса для магнитного
вещества ср = е - Ts = и - НМ - Ts и определив его дифференциал
с учетом (4.92) Jcp = - sdT - MdH, получим 4-е уравнение
Максвелла для магнитной системы
(ds/dH)T = (dM/dT)ff. (4.95)
Подставив (4.94) и (4.95) в формулу (4.93), получим магни-
токалорический коэффициент
ам = (дТ/дН\ = - (Т/сн)(дМ/дТ)н. (4.96)
Это уравнение по структуре сходно с аналогичным уравне-
нием для процесса s = const в термомеханической системе
[формула (2.91)]. Оно характеризует дифференциальный эффект
процесса охлаждения. В принципе любое магнитное вещество
(парамагнетик или ферромаг-
нетик) можно использовать
для охлаждения, если ам дос-
таточно велик.
Принцип магнитного ох-
лаждения удобно проиллюст-
рировать с помощью диа-
граммы Т — 5 для парамаг-
нитного вещества (рис. 4.24,
где Но,..., Н4 — линии посто-
₽Ис. 4.24. Процесс магнитного охлаж-
дения в диаграмме Т — s
14 3 а к а 1 Де 1592
209
я иной напряженности, причем Hf} < Н} < ... < Н4). Магнитное
охлаждение состоит из двух этапов: процесса А-В изотерм и
ческого намагничивания от Нп = 0 до Н. при постоянной
начальной температуре Т(|; процесса В-С изоэнтропного размаг-
ничивания, в результате которого напряженность поля уменьша-
ется от //, до Но = 0 при sB — const и температура снижается д(;
При изотермическом намагничивании парамагнитного вс
щества (процесс A-В) магнитные диполи ориентируются парад
лельно полю, энтропия уменьшается от sA до процесс сопри
вождастся отдачей теплоты q = Т — sB) в окружающую среду
Аналогом этого процесса для термомеханической системы явля
ется изотермическое сжатие газа. При адиабатном размагничива
нии (процесс В-С) температура падает до Тк при постоянной
энтропии. Аналог этого процесса — расширение газа в детандере.
Метод адиабатного размагничивания применяют для получе-
ния низких температур, чаще всего в интерваде от 1 до 0,001 к.
Верхняя граница применимости метода определяется температу-
рой То, выше которой тепловые колебания очень интенсивны,
и система не может быть упорядочена воздействием внешнего
магнитного поля. Нижняя граница определяется температурои
0(„ при которой энергия взаимодействия частиц ем становится
сравнимой с их тепловой энергией кТ. При этом достигается
упорядоченное состояние самопроизвольно без наложения внеш
него магнитного поля; 0v е /£.
На рис. 4.25 показаны этапы процесса адиабатного размагни-
чивания. Образец / парамагнитного вещества помещен н
а — охлаждение; б — па.маптнчивание; в — откачка теплообменною ыза: <•
раз.ма;ничииапие; / — образен; 2 — контейнер; J — вентиль; 4 — магии;
210
контейнер 2, находящийся в ванне с жидким гелием. Вначале
происходит охлаждение образца; при этом контейнер заполня-
ется газообразным гелием, способствующим переносу теплоты
между жидкостью и парамагнетиком; жидкий гелий в ванне
вакуумируется обычно до температуры Г}| = 1 К. Затем образец
намагничивается при Тн = const; теплота намагничивания пере-
дается жидкому гелию. Далее откачивается теплообменный газ
из контейнера 2 для создания адиабатных условий. После этого
магнитное поле снимается (Я = 0), образец размагничивается и
температура падает до Тк.
Для определения конечного изменения температуры по
формуле (4.96) необходимо использовать уравнение состояния
парамагнитного вещества /(Г, Я, М) = 0. Рассматривая различ-
ные возможные энергетические состояния парамагнитного мате-
риала, Бриллюэн методами квантовой статистики получил урав-
нение для намагниченности М невзаимодействующих парамаг-
нитных ионов;
M=0,5W^(Q, (4.97)
где п — число атомов в единице массы вещества; g — атомная
константа (фактор расщепления Ланде); — магнетон Бора;
В(С) — функция Бриллюэна.
График функции (4.97) дан на рис. 4.26. При высоких магнит-
ных полях или очень низких температурах (отношение Н/Твели-
ко) происходит магнитное
насыщение парамагнитного
материала, и намагничен-
ность М приближается к
постоянному значению.
В частном случае, при
Небольших Н и не очень
низких температурах, фор-
Рис. 4.26. Зависимость намагничен-
ности М (в магнетонах Бора на
1 моль) от отношения Н/Т для
Ризных веществ по уравнению (4.97):
1 — хромокалиевые квасцы; 2 —
*елезоалюминиевые квасцы; 3 —
сульфат гадолиния
14*
211
мулу (4.97) можно привести к виду
М= СН/Т, (4.98)
где С — постоянная Кюри, Дж - К/[(А/м2)ч].
Это выражение носит название закона Кюри и является прос-
тейшей формулой уравнения состояния парамагнитного веще-
ства. Уравнение (4.98) характеризует свойства «идеального»
парамагнетика, являясь в некотором роде аналогом уравнения
состояния идеального газа.
Закон Кюри становится несправедливым при больших Н/Т,
т.е. при весьма низких температурах, поскольку при Т -> О
неограниченно возрастает намагниченность М, что противоречит
(4.97) (см. рис. 4.26).
Для определения изменения температуры при размагничи-
вании необходимо также знать зависимость магнитной теплоем-
кости сн от температуры и напряженности поля. Для идеального
парамагнетика при постоянной намагниченности М
cMdT= dw, (4.99)
тогда для процесса Н — const
cHdT=dQ=Tds. (4.100)
Отсюда с учетом (4.92) найдем
сн= см~ Н(дМ/дТ)н . (4.101)
Характер функции см — f(T) показан на рис. 3.33; при Т> 0(.
эта функция соответствует формуле (3.104). Использовав эту за-
висимость с учетом, что из (4.98) следует
(дМ/дТ)н = - СН/Т2, (4.102)
получим, подставив значения всех величин в (4.101):
сн = (RA + СЯ2)/Т2, (4.103)
где А = 0//4.
Изменение температуры в процессе адиабатного размагни-
чивания от Тн = до Тк = Г2 определим по формуле (4.96) с
учетом выражений (4.102) и (4.103): (3T/dH)s = HT/(RA/C + Н2)-
Отсюда (при размагничивании до Н = 0)
г2 о
\dT/T = \HdH/(RA/C + Я2).
Л Ъ
212
Окончательно
Т2= -----. (4.104)
л/1 + CH?/(RA)
Очевидно, материалы с высоким значением С/(Л4) обеспе-
чивают наиболее низкие температуры при адиабатном размаг-
ничивании. При использовании (4.104) следует учитывать огра-
ничения, определяемые законом Кюри. При малых значениях
Н/Т до тех пор, пока соблюдается линейность зависимости
М = уравнение (4.104) дает верный результат.
В качестве парамагнитных веществ применяют парамагнитные
соли типа железоаммониевых, хромокалиевых, хромометилам-
мониевых квасцов; сульфаты (медно-калиевый, кобальто-
аммониевый, гадолиния) и др. Каждая парамагнитная соль имеет
ограниченный интервал температур, в котором ее применение
наиболее эффективно. Границы этого интервала зависят от
температуры, при которой магнитная теплоемкость максимальна,
а также определяются соотношением между энергией взаимо-
действия магнитных ионов ем и их тепловой энергией кТ. Наибо-
лее распространенные соли хорошо изучены, для них известны
весьма полные данные по энтропии, энтальпии и теплоемкости.
В табл. 4.2 даны характеристики некоторых парамагнитных
веществ.
Дальнейшая разработка метода адиабатного размагничивания
связана, в частности, с применением двухступенчатого процесса.
Идея метода заключается в использовании двух последовательно
соединенных образцов различных парамагнитных солей. Низкая
температура, достигнутая при размагничивании первого образца,
является начальной температурой для второго образца, при раз-
магничивании которого достигается минимальная температура.
4.2. Характеристики парамагнитных веществ
Парамагнитное вещество Химическая формула С-IO14. Дж-К (Л • м)2/г es, К С/(Л4) • 1010, (А/м)~2
Нитрат цериево- магниевый Ce,Mg3(NO4)„-24H2O 0,658 0,0055 795
Сульфат медно- калиевый CuK2(SO4)2-6H2O 1,6 0,053 14,13
Квасцы хромокалиевые КСг (SO4)2-12Н2О 5,9 0,245 2,22
Сульфат гадолиния Gd2(SO4)3"8H2O 32,4 1,33 0,47
213
Возможность получения еще более низких температур откры
вается в случае использования явления парамагнетизма, обуслов
ленного ядерными спинами. Магнитные свойства ядер (в отли
чис от магнетизма, обусловленного электронными спинами
выражены значительно слабее. Магнитный момент у ядер при
мерно в 1000 раз меньше, чем у электронов. По этой причине
подобные материалы можно использовать для охлаждения толью,
при начальных температурах порядка 0,01 К, так как при более
высоких значениях Т посторонние воздействия нарушают ориен
тацию ядерных магнитных моментов.
Процесс реализуют по схеме, аналогичной двухступенчатому
размагничиванию. На верхней ступени обычный парамагнитный
материал обеспечивает уровень порядка 0,01 К — исходный для
ядерного размагничивания. Впервые процесс осуществлен
Н.Кюрти в 1956 г.; в качестве рабочей среды была применен;,
медь. Температура, достигнутая при использовании метода
ядерного размагничивания, составляет несколько микрокельви
нов, однако следует учитывать, что речь идет не о температуре
всего образца, а лишь о температуре системы ядерных спинов.
Материал в целом может быть охлажден этим методом дс
температуры порядка 10-4 К.
Магнитные криогенные машины. Даль
нейшее развитие метода адиабатного размагничивания привел.,
к созданию магнитных машин непрерывного действия, позво
ляющих устранить существенный недостаток этих систем
одноразовость процесса. Первая такая машина создана Даунтом
(рис. 4.27). В криостате с жидким гелием (Т}1 ~ 1 К) расположен
вакуумный контейнер 6, внутри которого находится парамагни;
нос вещество 2 (железоаммониевые квасцы) и охлаждаемый
объект 5. Два тепловых ключа 1 и 4 обеспечивают тепловой
контакт между объектами 2 и 5, а также с гелиевой ванной
Магнитное поле создастся магнитом 3; малые магниты 7 управ-
ляют тепловыми ключами.
Последовательность процессов в машине; I) изотермическое
намагничивание (линия АВ); ключ 1 открыт, 4 закрыт; напря-
женность поля увеличивается от НА до Нв (ТА = consi):
выделяется и отводится к гелию теплота QA = TA(sA — sc); 2)
адиабатное размагничивание (линия ВС ); оба ключа закрыты -
система адиабатна; напряженность поля уменьшается до :
температура снижается до Гс; 3) изотермическое размагничи-
вание (линия CD ); ключ / закрыт, 4 открыт; процесс изотер-
мичен вследствие поглощения теплоты от объекта 5 и передачи
214
Рис. 4.27. Магнитная криогенная машина:
а — схема; о — цикл в Т— s - диаграмме
ее рабочему веществу 2; напряженность поля падает до Яо при
Тс = const; поглощенная теплота Qc = Tc(s4 - sc); 4) адиабатное
намагничивание (линия DA ) при закрытых ключах 1 и 4\ система
возвращается в исходное положение. Согласно диаграмме Т — л
машина работает по циклу Карно; т|с = ТС/(ТА - Тс).
Важный элемент этой машины — сверхпроводящие тепловые
ключи. Как отмечено в § 4.8, теплопроводности в нормальном и
сверхпроводящем состояниях резко различаются (см. рис. 3.37 —
кривые для Zn и AI). Очевидно, что вводом материала в сверх-
проводящее состояние и выводом из него можно делать его то
хорошим проводником теплоты, то теплоизолятором. Для уп-
равления ключами (перевода из сверхпроводящего состояния в
нормальное и наоборот) предназначены магниты 7(см. рис. 4.27).
Машина Даунта малоэффективна; в интервале 0,2—1 К се
КПД составляет 20 % при холодопроизводительности около
7 мВт. В то же время эта машина явилась прототипом совре-
менных магнитных систем непрерывного действия.
Установлено, что ряд материалов на основе редкоземельных
металлов имеет высокий магнитокалорическпй (МК) коэффи-
циент ач |см. формулу (4.96)| в довольно широком диапазоне
температур — вплоть до нормальной. На рис. 4.28, а приведены
экспериментальные данные, полученные в МГТУ им. Н.Э.Баума-
215
a)
Рис. 4.28. Зависимость магнитокалорического эффекта различных материалов от
температуры:
а — при В = 6,02 Тл (7 — тербий, 2 — диспрозий, 3 — гольмий, 4 — эрбий);
б — гадолиниево-галлиевый гранат GGG (1 — В = 3,26 Тл, 2 — В = 4,65 Тл)
на и МГУ и свидетельствующие о большом МК-эффекте при
температуре перехода антиферромагнетизм — парамагнетизм для
ряда материалов: 232 К для тербия, 178 К для диспрозия, 132 К
для гольмия, 85 К для эрбия, 58 К для туллия. Дополнительные
максимумы возникают при переходе из антиферромагнитной
фазы в ферромагнитную.
Материалы, применяемые для магнитного охлаждения, кроме
высоких значений МК-эффекта, должны иметь высокую тепло-
проводность и малую фононную (решеточную) теплоемкость,
которая обусловливает поглощение теплового эффекта размагни-
чивания.
В настоящее время наибольшее практическое применение
получил гадолиниево-галлиевый гранат Gd2Ga5O12 (GGG), МК-
эффект для которого отражает зависимость на рис. 4.28, б (дан-
ные Т.Хашимото и др.). Этот материал нашел применение в
области температур 1,5—4,5 К, хотя его можно использовать и
до 20 К.
С использованием GGG были созданы образцы эффективно
работающих магнитных машин, функционирующих по циклу
Карно и позволяющих снижать температуру от 4,2 до 1,8 К.
Переход от 4,2 до 1,8 К имеет важное практическое значение
и, в частности, позволяет существенно улучшить характеристики
сверхпроводящих магнитов, обеспечить работу высокочувстви-
тельных приемников инфракрасного излучения и др. Прибли-
женная расчетная диаграмма Т з для GGG дана на рис. 4.29.
где энтропия 5 отнесена к газовой постоянной R.
216
Рис. 4.29. Диаграмма Т — s для гадолиниево-
галлиевого граната (GGG)
Рис. 4.30. Конструктивная схема поршневой
магнитной криогенной машины
На рис. 4.30 представлена конструктивная схема поршневой
магнитной машины двойного действия, созданной Лаказом и др.
Шток 5 с магнитными вставками из GGG перемещается возврат-
но-поступательно в изолированном корпусе 5; опоры 4 выпол-
нены из алюминиевого порошкового сплава. По обе стороны
от штока находятся сверхпроводящие магниты 7. Наружная
полость омывается жидким гелием Не1 при Т = 4,2 К; охлаж-
даемый объем заполнен Hell при температуре 1,8-2,1 К. В этой
машине теоретически осуществляется цикл Карно ABCD (см. рис.
4.27, б) для магнитной системы. Процесс А—В намагничивания
при ТА = 4,2 К = const происходит при введении штока с GGG
в поле верхнего магнита 7. При этом теплота намагничивания
Qa отводится к жидкому гелию, который кипит при 4,2 К и
обеспечивает изотермичность намагничивания. Процесс В—С —
размагничивание в адиабатных условиях (sc = const) от ТА до
Тс — происходит при опускании штока 5 (быстрое перемещение
без теплообмена). В конце этого процесса GGG попадает в ванну
с Hell при ТА = 1,8 К и полностью размагничивается при
Тс = const (процесс С—D); при этом отводится теплота от Hell
и реализуется полезная холодопроизводительность Qc. Замыкаю-
щий процесс намагничивания D—А при sA = const обеспечивается
217
быстрым возвратом GGG в магнитное поле. Такой же цикл
совершает и образец GGG, помещенный в нижней части штока
При осуществлении цикла Карно полезная холодопроизводи-
тельность, Дж/(г* К),
2С = Tc(sA - ,vc). (4.105»
Теплота намагничивания, отводимая гелием, Дж/(г* К):
Qa= TA(sA- sc). (4.106)
Для реального цикла характерны потери, уменьшающие Q,
по сравнению с теоретическим значением. Рассмотрим основные
источники потерь в этой машине. Температуры GGG и жидких
Не! и Hell различаются. Теплопроводность GGG высокая (с.м.
рис. 3.36, б) — достигает 400 Вт/(м- К) для монокристалла и 50
Вт/(м'К) для прессованных образцов GGG. Это облегчаш
теплоотвод от образца. С другой стороны, вследствие наличия
термического сопротивления создается температурный градиеи :
между жидкостью и образцом: со стороны Не! (4,2 К) разноси
А Г] обусловлена теплоотдачей при кипении; со стороны Hell
(1,8 — 2,1 К) разность ДТП обусловлена термическим сопротивле
нием Капицы Ак = 1/«к, т.е. A7)f = Qc/(v.KF). Разность А 7,
можно уменьшить, увеличив площадь поверхности образца GGG
В поршневой машине это обеспечивают нанесением микрокана
вок на поверхности GGG (размерами 3,8x0,14 мм).
Кроме того, имеются потери теплоты на трение в опорах и
трение между штоком и гелием, потери в окружающую среду, а
также от переноса жидкого гелия из полости в полость.
Идеальный цикл ABCD (см. рис. 4.27, б) практически нс рса
лизуется, действительные процессы идут по линиям, близким к
АВ'и CD'. Тем не менее магнитная машина высокоэффективна.
Так, при площади поверхности магнитного материала F = 40 см',
диаметре штока 24 мм, частоте 0,6—1,0 Гц, максимальной индук-
ции поля 4 Тл получены следующие характеристики; Qc - 2,35 Вт
при Тс = 2,1 К (=131 Вт/дм3); Qc - 1,35 Вт при Тс = 1,8 К
(75 Вт/дм3). Максимальный термодинамический КПД г]; = 65 Т
при 2,1 К и г], = 40 % при 1,8 К. Эти данные свидетельствуют о
больших возможностях магнитных криогенных машин. Для
больших холодопроизводитсльностей (порядка десятков и сотен
ватт) целесообразны магнитные машины вращающегося типа
(рис. 4.31). Диск с ободом из GGG вращается так, что части
его поочередно намагничиваются (входя в область А), затем
218
рис. 4.31. Схема магнитной машины
вращающегося типа
размагничиваются. Переходя из
одной области в другую, обод
диска то отдает теплоту при-
емнику (Не!) при 4,5 К, то
отнимает се (от Hell) при
Т- 1,7 К, создавая полезную
холодопроизводительность Qc.
Эта машина в принципе может
осуществлять цикл, являющий-
ся магнитным аналогом цикла
Карно.
Термоэлектрическое охлаждение. Известен ряд термоэлектри-
ческих явлений, связанных с взаимным превращением тепловой
и электрической энергии, — это эффекты Зеебека, Пельтье и
Томсона. Метод термоэлектрического охлаждения основан на
эффекте Пельтье (1834 г.), который заключается в выделении
(или поглощении) теплоты Q в месте контакта двух различных
проводников, включенных в электрическую цепь, при прохожде-
нии через нее тока. Рабочей средой в такой электрической цепи
из двух разнородных проводников является электронный газ,
который переносит энергию от холодного контакта к теплому.
Кинетику термоэлектрических явлений объясняют на основе
статистической теории электронного газа. При движении
электронов в металлическом проводнике под действием разности
потенциалов их средняя кинетическая энергия различна для
разных материалов. При переходе электронов из одного
материала в другой этот избыток (или недостаток) энергии
выделяется (или поглощается) в виде теплоты в зоне контакта.
Термическая неравновссность проводника также приводит к
диффузии электронов из теплой зоны в холодную, влияя на
термоэлектрические явления. Если учесть еще и джоулеву
теплоту, то полная картина явлений в проводнике с током
оказывается достаточно сложной.
Эффект Пельтье у металлов мал, у полупроводников он зна-
чительно выше, особенно в парах разнородных полупроводников
дырочного (р~) и электронного (л) типов. Схема термоэлемента,
состоящего из двух последовательно соединенных полу-
проводниковых ветвей А и В, приведена на рис. 4.32. При
прохождении тока в зоне с низкой температурой Е поглощается
219
Рис. 4.32. Схема термоэлемента, состоящего из пары
полупроводников
теплота 0х, необходимая для образования
пары электрон—дырка, которая движется
в зону с высокой температурой То, где
эта пара аннигилирует с выделением теп-
лоты Qo. Количество теплоты Qx прямо
пропорционально силе тока / и темпера-
туре Тх холодного конца:
0х = а/Гх, (4.107)
где а — коэффициент термоЭДС, завися-
щий от рода материала.
Полная термоЭДС пары проводников А и В определяется раз-
ностью абсолютных значений а для каждого проводника: а =
= аА - ав. Таким образом, количество теплоты, поглощаемой
на холодном конце, или холодопроизводительность элемента
(при отсутствии потерь), Вт,
2хо - («и - «д) 1 К-
(4.108)
Увеличение силы тока I приводит к росту (?хо, но одновре-
менно увеличиваются и потери за счет джоулсвой теплоты
Qj = 0,512 R, где множитель 0,5 учитывает выделение половины
количества теплоты в холодной зоне; R = pl/f — полное элект-
рическое сопротивление, Ом (р — удельное электрическое сопро-
тивление, Ом • м).
Другой вид потерь обусловлен теплопроводностью ветвей тер-
моэлемента: Qr = К(Т0 - Тх), где К = £ (/А//),.; А — теплопровод-
ность; lnf~ длина и площадь поперечного сечения каждой
ветви термоэлемента.
Уравнение теплового баланса для контакта, находящегося в
холодной зоне, при отсутствии теплопритока из окружающей
среды имеет вид
(ал - ад)/Гх = 0х + 0,512 R + К(Т0 - Гх), (4.109)
где Qx — полезный эффект охлаждения.
Минимально возможная температура Тх может быть достиг-
нута при Qx = 0; тогда из (4.109) разность температур
Д - 1\ = [(а, - ав)1Тх - 0,5/2Я|//С (4.1 Ю)
220
Оптимальную силу тока / , соответствующую наибольшей
разности температур (То - Гх)тах, можно определить из (4.110),
используя условие максимума д(Т0 - TJ/dl = 0. Тогда / =
= (ал - aB)Tx/R. Подставив / t в (4.110), получим
(Т0 ' = (а, - ад)2Гх2/(2/?Л) = 0,5ZTx2, (4.111)
где Z = (аА - aB)2/(KR) — комплекс, определяющий физические
свойства материалов термоэлементов.
Для ветвей А и В с одинаковыми размерами и свойствами
(а = аА = - ag)
Z=a2/(Xp). (4.112)
С увеличением Z, отражающего тепловые, электрические и
термоэлектрические свойства, возрастает эффективность охлаж-
дения. Для различных полупроводников Z= (1,5...4,0) 10'3 К'1,
причем Z зависит от температуры. На рис. 4.33 приведены
зависимости Z = f(T) для ряда материалов; ниже 200 К отсутст-
вуют полупроводники p-типа с высокими Z. Одни из лучших
материалов для термоэлементов — полупроводники из сплавов
Bi — Те и Bi — Sb. На рис. 4.34 приведена характеристика
термоохладителя ДГ = То - Tx=f(I). Увеличение АГ приводит
к резкому уменьшению холодильного коэффициента е = QJL-
Рис. 4.33. Зависимость Z для термоэлектри-
ческих материалов от температуры (сплошные
штриховые линии — материалы п- и р- типа):
1 — Bi3 Те2; 2 — Bi, Те3 ; 3 — Bi2 Те3; 4 — Sn
с Bi92Sbg ; 5 — Bi9,Sb8 ; 6 — Bi8JSb15 ; 7 —
Bi85Sbl5 (В = 1 Тл)
Рис. 4.34. Характеристика
термоохладителя (То = 298 К,
Z= 2,67-Ю’3 К1)
22!
В результате совершения работы L выделяется джоулсва теплоia
и создается термоЭДС:
L = I2R + (аА - ай)(Тп - 7\)I . (4.113)
Коэффициент с резко уменьшается при понижении темпер.!
туры вследствие потерь джоулевой теплоты и теплопроводное ) и
При А 7 ~ 7() — /)- 50...60 К коэффициент t- 0.
Увеличения эффективности и снижения температуры модно
достичь применением многокаскадных схем. В каскадной
термобатарее несколько элементов последовательно охлаждаю,
один другой; в этом случае сравнительно легко обеспечивается
охлаждение до 180—200 К при r|z = 1...2 %. С помощью
восьмикаскадной батареи достигнута температура 7^ = 134 К. В
такой батарее между ступенями должен быть обеспечен хороший
тепловой контакт, но электрически их изолируктг одну от другой:
питание каждой ступени индивидуалы юс.
Преимущества термоэлектрического охлаждения — простота,
отсутствие движущихся частей, высокая надежность. Однако
низкие термодинамические характеристики нс позволяют пока
применять эти устройства для эффективной работы при темпе-
ратуре ниже 170 К. Для систем с малой холодопроизводитель-
ностью, например для охлаждения инфракрасных приемников
излучения, эти устройства могут оказаться наиболее подходя-
щими.
Десорбционное охлаждение. Процесс физической адсорбции
можно использовать для создания систем охлаждения. Мены
предложен и впервые применен Ф.Симоном (1928 г.). Рабочая
среда находится в газообразном состоянии, а уменьшение
энтропии происходит в результате проявления адсорбционных
сил, возникающих между поверхностью твердого тела и
адсорбируемым газом. Природа этих сил обусловлена ионным
взаимодействием. В качестве адсорбентов обычно исполыхюг
активированный уголь, цеолиты и другие поверхностно-активные
материалы. Процесс адсорбции и обратный ему процесс
десорбция сопровождаются эффектом выделения и поглощения
теплоты (см. § 7.10).
Захват молекул газа поверхностью твердого тела (адсорбция)
приводит к выделению теплоты, эквивалентной изменению
кинетической энергии молекул газа. Отрыв молекул от поверх-
ности адсорбента (десорбция) требует затрат энергии и сопро-
вождается поглощением теплоты. Десорбция, проведенная в
адиабатных условиях, приводит к снижению температуры.
222
Рис. 4.35. Схема аппарата для
десорбционного охлаждения
На рис. 4.35 приведена схема
аппарата для реализации этого
процесса охлаждения. Аппарат
состоит из сосуда Дьюара 4, в
котором расположен вакуумный
кожух 3. Внутри кожуха имеется
сосуд 2, заполненный адсорбентом
(активированным углем). Охлаж-
даемая камера 7 предназначена для
экспериментальных целей. Сосуд
Дьюара заполнен жидким водоро-
дом, вакуумный кожух — теплооб-
менным газом (гелием) для уста-
новления теплового контакта
между жидким Н2 и адсорбентом.
Охлажденный водородом адсор-
бент интенсивно поглощает газо-
образный гелий, поступающий по
линии 7. Выделяющаяся теплота адсорбции поглощается жид-
ким водородом; процесс изотермичен. Температура жидкого
водорода (Го = 20 ... 14 К) является исходным уровнем процесса
охлаждения. Откачкой водорода из сосуда 2 вакуумным насосом
по линии 5 можно обеспечить Го до 10 К. Затем теплообменный
газ удаляется вакуумированием по линии 8, адсорбент адиабати-
чески изолируется, начинается десорбция гелия откачкой его
вакуумным насосом через линию 6; в результате в изолированном
сосуде 2 (с адсорбентом) температура падает до Тх ~ 4,0 К.
Если вместо водорода использовать жидкий воздух или кисло-
род (То = 90 К), а вместо гелия - неон, то в интервале давлений
0,17—1,6 МПа можно достичь температуры Т_ = 68 К (Д7'= 22 К).
Десорбционное устройство просто по конструкции; холодо-
производительность достаточно велика, однако в его классичес-
ком варианте (показанном на рис. 4.35) возможна реализация
лишь одноциклового процесса без регенерации теплоты. В МГТУ
им. Н.Э.Баумана разработан непрерывно действующий регенера-
тивный десорбционный охладитель (рис. 4.36). Между регенера-
тором 1 и адсорбером 2 расположен теплообменник нагрузки 3.
Клапаны 4—7 обеспечивают движение потоков газа.
223
Рис. 4.36. Непрерывно действующий десорбционный охладитель:
а — схема и температурная диаграмма (прямой поток — сплошная линия,
обратный — штриховая) рабочего процесса; б — характеристики охладителя
(Qn — полезная холодопроизводительность; ЕД С — потери холода; ц — КПД)
В первый период (адсорбция) газ G высокого давления р2 че-
рез клапан 4 проходит регенератор 1, охлаждаясь до Гх, затем
теплообменник 3 и попадает в адсорбер 2, где частично поглоща-
ется адсорбентом при повышении давления в этом аппарате.
Теплота адсорбции с частью потока газа Go выносится через
клапан 6.
Второй период (десорбция) происходит при снижении давле-
ния до р^ и обратном движении потока через клапаны 7, 5 и
аппараты 2, 5, I. Уменьшение давления вызывает десорбцию газа
в аппарате 2, поток охлаждается в десорбере до Т'х < Тх,
обеспечивая полезный эффект
G„ = - G'c'rjdt.
О
Пройдя регенератор, этот поток нагревается до температуры
окружающей среды.
Экспериментальный адсорбер заполнен активированным
углем СКТ; длина адсорбера 120 мм, диаметр 30 мм, рабочий
газ — азот, расход азота G ~ 7 кг/ч. Регенератор таких же
размеров снабжен насадкой из мелкой сетки. Частота цикла
0,3 Гц. Давления потоков р2 = 1,6 МПа, р{ = 0,17 МПа. При
охлаждении от температуры окружающей среды достигнута
температура Тх = 177 К.
Установлено, что основные потери в этом устройстве опреде-
ляются тем, что существенная часть теплоты адсорбции не отво-
дится в окружающую среду, а поглощается в процессе десорбции.
224
Имеются существенные резервы для улучшения характеристики
такой системы. Получаемый в рассмотренном устройстве холод
можно использовать для интенсификации процесса сорбции в
газоразделительных и других устройствах.
§ 4.12. ПРОЦЕССЫ ОХЛАЖДЕНИЯ, ОСНОВАННЫЕ
НА ИСПОЛЬЗОВАНИИ СВОЙСТВ 4НЕ И 3НЕ
Гелий широко используют в криогенных системах; он отно-
сится к основным рабочим веществам, применяемым при темпе-
ратурах ниже 80 К. Обычно гелий (его широко распространен-
ный изотоп 4Не) применяют в системах, использующих процессы
дросселирования и изоэнтропного расширения (см. § 4.2 — 4.7).
Однако эти классические процессы непригодны для охлаждения
при температурах ниже 1 К. Предельно достигаемая температу-
ра, получаемая вакуумированием паров 3Не, около 0,3 К. В то же
время можно реализовать другие эффекты охлаждения для дос-
тижения сверхнизких температур, используя особые свойства гелия.
Оба стабильных изотопа гелия: 4Не и 3Не — единственные в
природе квантовые жидкости, в которых квантовые эффекты
проявляются в макроскопических масштабах и определяют
особое поведение этих сред. Это обстоятельство и позволяет
применять изотопы гелия для получения сверхнизких температур.
Некоторые свойства гелия обсуждались в гл. 3; здесь рассмотрим
процессы, основанные на использовании этих свойств.
Охлаждение растворением 3Не в 4Не. В 1951 г. ГЛондон обос-
новал метод получения сверхнизких температур, основанный на
использовании теплового эффекта при растворении жидкого 3Не
в 4Не. Поглощение теплоты в процессе растворения возможно
благодаря особым свойствам и характеру взаимодействия этих
ожиженных изотопов. Гелий-4 имеет нулевой ядерный спин; его
квантово-механическое описание подчиняется статистике Бозе
— Эйнштейна. Гелий-3 имеет ядерный спин 1/2, поведение его
следует статистике Ферми — Дирака. Этим объясняется различие
свойств 3Не и 4Не.
В рассматриваемой области температур (ниже 1 К) жидкий
4Не находится в сверхтекучем состоянии, имеет почти нулевую
вязкость и энтропию, которая снижается пропорционально Г3.
Очевидно, эта жидкость является инертной в гидродинамическом
И тепловом отношении. Другому изотопу 3Не такое поведение
несвойственно; он не переходит в сверхтекучее состояние вплоть
15 Заказ 15С|2 225
до 3 • 10-3 К, его энтропия существенно выше, чем у 4Не. Тепло-
емкость 3Не также значительно больше теплоемкости 4Не. При
растворении 3Не в 4Не атомы этих жидкостей не взаимодей-
ствуют между собой вследствие инертности 4Не, следовательно,
переход 3Не в объем, заполненный 4Не, где содержание атомов
3Не мало, аналогичен процессу его расширения в пустоту, сопро-
вождающемуся поглощением энергии. При этом в слабом раст-
воре возникает как бы газообразная фаза атомов 3Не, для кото-
рых 4Не является лишь поддерживающей средой.
Таким образом, процесс растворения приводит к изменению
(уменьшению) упорядоченности системы в результате перехода
жидкость—газ; энтропия 3Не возрастает. Растворение сопровож-
дается поглощением теплоты перехода из одной фазы (чистый
3Не) в другую (слабый раствор 4Не), как и при испарении обыч-
ной жидкости. Растворение в адиабатных условиях приводит к
охлаждению.
В настоящее время свойства 3Не и его слабого раствора в 4Не
достаточно хорошо изучены. Наиболее полная теория учитывает
взаимодействие между частицами 3Не и базируется на модели
слабо взаимодействующего газа, частицы которого подчиняются
статистике Ферми — Дирака. В первом приближении для слабого
раствора 3Не в 4Не теплоемкость cv = (3/2)7? (идеальный газ);
при Т < 0,4 К это значение теплоемкости начинает линейно
уменьшаться.
Другое важное свойство раствора 3Не — 4Не — естественный
(спонтанный) процесс фазовой сепарации. При Т< 0,86 К в рас-
творе 3Не — 4Не появляются две фазы, расположенные одна над
другой. Верхняя фаза — почти чистый 3Не, нижняя — слабый
раствор 3Не в 4Не (см. рис. 3.30). Переход атомов 3Не из верхней
фазы в нижнюю через границу раздела представляет собой как
бы испарение жидкого 3Не в объем с 4Не. Установлено, что
растворимость 3Не в 4Не — величина конечная, и минимальная
равновесная доля 3Не примерно равна 6,4 %. Первые удачные
опыты по растворению 3Не в 4Не осуществлены в 1964 г., а
первая эффективно работающая установка создана Б. Негано-
вым, Н. Борисовым и Н. Дибургом в 1965 г.
Принципиальная схема рефрижератора, использующего эф-
фект растворения, дана на рис. 4.37. Почти чистый газообразный
3Не из вакуумного насоса 1 при р — 5...6 кПа направляется в
линию прямого потока. Газ последовательно охлаждается жидким
гелием до Т = 4,2 К и конденсируется в ванне 2 с 4Не, кипящим
при Т ~ 1,2 К. Далее 3Не в жидкой фазе проходит капилляр
226
(дроссель) 3, где его давление уменьшается (капилляр определяет
расход 3Не). После этого поток 3Не поступает в змеевик
испарительной ванны 4 (Т ~ 0,6...0,7 К), где охлаждается, затем
идет в теплообменник 5, в котором вновь охлаждается обратным
потоком до температуры Тр после чего поступает в смесительную
ванну 6.
В смесительной ванне происходит расслоение фаз: почти чис-
тый 3Не располагается в верхней части, а внизу концентрируется
слабый раствор 3Не — 4Не ( 6,4 % 3Не). Переход 3Не из верхней
концентрированной фазы в раствор сопровождается ростом эн-
тропии и, соответственно, поглощением теплоты; в адиабатных
условиях это приводит к снижению температуры, а в изотерми-
ческих — обеспечивает холодопроизводительность Q.
Из смесительной ванны обратный поток 3Не через теплооб-
менник 5 направляется в испарительную ванну. При этом 3Не
в теплообменнике движется через почти стационарный столб
4Не, охлаждая прямой поток, поступающий в смесительную
Ванну.
Температура в испарителе выше, чем в смесителе, и соответ-
ствующая равновесная доля 3Не составляет 1 %, однако давление
Паров 3Не (при температуре в испарителе 0,6 К) примерно в 1000
раз выше, чем у 4Не; в результате из этой ванны испаряется
15*
227
почти чистый ’Нс. Давление 3Нс в испарителе около 10 Па
обеспечивается откачкой вакуумным насосом. Таким образом
осуществляется непрерывный замкнутый цикл рефрижератора.
Температурный уровень в смесительной ванне обычно поддержи
вается в интервале 0,1-0,01 К. Минимально достигнутая темпера
тура в таких рефрижераторах составляет 0,002 К. Движение и i
смесительной ванны в испарительную (обратный поток в тепло-
обменнике) обусловлено разностью осмотических давлений в
этих двух ваннах. Эта разность Пд/ - П5 возникает лишь при
движении атомов 3Не. Для идеального раствора из условия
равновесия [химический потенциал ц4(х; д; Т) = 0]
Ту * П5 = (R/v^)(TuxM - Tsxs), (4.114)
где Тм, Ts и хм, xs — соответственно температуры и доли ’Нс в
смесительной и испарительной ваннах; v4 — молярный объем 4Не.
При отсутствии потока 3Не Пд/ = 1Ц. Из этих соотношении
следует: при Тм = 0,01 К, Т\, = 0,7 К и хм - 6,4 % доля = 0,8 %.
Парциальное давление 3Не в испарителе при этом составляв)
около 9 Па; гидродинамические потери при движении 3Нс не
должны превышать разности давлений Пм - П5.
Для определения холодопроизводительности Q надо знать раз-
ность энтальпий потока 3Нс при входе в смесительную ванну
z03(r) и после процесса растворения /3(Д/ Г); тогда количество
теплоты, поглощенной в процессе растворения, Вт,
Q “ "з^'зри, Т) ~ zo3(7;)l’ (4.115)
где и3 — расход циркулирующего 3Не, моль/с.
Энтальпию жидкости и раствора 3Не можно определить из
выражения di = cdT, так как для 3Не, являющегося Ферми-газом,
теплоемкость есть линейная функция температуры: с = аТ. И)
этого следует, что энтальпия как чистого 3Не, так и его раствора,
является квадратичной функцией температуры; значения энталь-
пии, Дж/моль, при Т < 0,04 К: z03(r) = 12 7[2; /3(Д/ = 12 Г2.
Энтальпии этих фаз 3Не приведены на рис. 4.38 в широком
интервале температур; энтальпия потока раствора JHe в теплооб-
меннике z3n = 54Т2 Дж/моль при Т < 0,04 К. В соответствии с
(4.115) холодопроизводительность в процессе растворения
2- «3(947'2 - 12Г/) (4.116)
затрачивается на охлаждение 3Не от Т\ до Т и на полезный эффект.
При высокой эффективности теплообменника 5 (см. рис. 4.37)
22S
Рис. 4.38. Зависимость энтальпии от
температуры дла жидкого 3Не (<01), его
раствора в 4Не (г,) и потока раствора
3Не в теплообменнике (i3 и)
разность температур 7) - Т мала
(TJT~ 1); в этом случае холодо-
производительность, Дж/моль,
максимальна, и согласно (4.116)
Q/щ = 82 Т2. (4.117)
Холодопроизводительность
пропорциональна квадрату
температуры. Из формулы
(4.116) следует также, что
Q = О при 7/7). = 0,36, т.е. в
этом предельном случае вхо-
дящий поток может снизить
свою температуру примерно в
3 раза. Таким образом, возможный интервал 7/7) = 1...0,36.
Различие 7) и Т обусловлено эффективностью теплообменника
5; очевидно, чем больше разность между 7) и Т, тем меньше
полезная тепловая нагрузка.
В предельном случае при 7/7) = 0,36 (Q = 0) и при темпера-
туре в смесительной ванне Т= 0,01 К 7)тах = 0,01/0,36 = 0,028 К;
следовательно, разность температур на холодном конце тепло-
обменника должна быть очень мала: АТтах = 0,028 — 0,01 =
= 0,018 К. Из этого следует, что теплообменник 5 должен
обладать высокой эффективностью, обеспечивая малую разность
температур потоков 7). - Т. Этот теплообменник играет ключе-
вую роль в работе рефрижератора 3Не — 4Не. Вследствие значи-
тельно более высокой энтальпии раствора 3Не по сравнению с
энтальпией жидкого 3Не разность температур на теплом конце
теплообменника велика. С другой стороны, его эффективность
сильно ограничена большой разностью температур на границе
между гелием и поверхностью:
А Т= RKQ/F
(4.118)
где RK ~ 5Q/T3 — тепловое сопротивление Капицы; Q — тепло-
вой поток; F — площадь поверхности теплообмена.
В рефрижераторах используют различные конструкции тепло-
обменников: трубчатые противоточные аппараты (трубки диамет-
229
ром около 1 мм и менее), теплообменники, заполненные медным
или серебряным порошком (частицы размером около 40 мкм),
и другие типы аппаратов, в частности, состоящие из трех — пяти
отдельных ступеней.
На эффективность процесса влияют также осевая теплопро-
водность, теплоприток из окружающей среды, вязкостный нагрев
при течении 3Не. Влияние потерь приводит к тому, что реальный
эффект охлаждения при Т= 0,1 К в 3—5 раз меньше теоретичес-
кого. В существующих рефрижераторах растворения для потока
3Не и3 = 10~4 моль/с. Холодопроизводительность таких рефриже-
раторов обычно составляет 0,2 мВт при Т = 0,1 К и снижается
до 0,01 мВт при Т - 0,04 К. Минимально достигнутая темпера-
тура 0,002 К.
Рефрижераторы растворения постоянно совершенствуются и
широко применяются в научных исследованиях. Непрерывность
действия этих систем и относительно высокая холодопроизводи-
тельность обеспечивают их преимущество по сравнению с систе-
мами адиабатного размагничивания. Есть основания полагать,
что рассмотренный метод позволит применить сверхнизкие
температуры и для технических целей.
Охлаждение адиабатной кристаллизацией (эффект Померан-
чука). В 1950 г. И.Я.Померанчук предложил метод охлажде-
ния, основанный на особых свойствах изотопа 3Не. Кривая
плавления р = отражающая равновесие жидкой и твер-
дой фаз для 3Не, имеет совершенно особый характер по срав-
нению с остальными веществами (см. рис. 3.19). При темпера-
туре 0,32 К и равновесном давлении 2,93 МПа кривая плавле-
ния 3Не имеет минимум. В этой точке энтропии твердой и
жидкой фаз одинаковы и равны х = /?1п2. При дальнейшем
снижении температуры ход изменения энтропии обеих фаз
определяется особыми квантово-механическими свойствами
3Не. В обычных системах энтропия жидкости всегда больше
энтропии кристалла, поскольку в кристалле упорядоченность
выше. В 3Не при Т < 0,32 К энтропия твердой фазы, наобо-
рот, больше энтропии жидкости, которая имеет более высо-
кую упорядоченность. Вследствие этого переход жидкость —
кристалл в результате сжатия при Т = const сопровождается
скачком энтропии и поглощением теплоты Q. Этот переход
при адиабатных условиях (х = const) приводит к снижению
температуры.
На рис. 4.39 дана диаграмма T—s для 3Не при Т < 0,32 К,
где показан процесс охлаждения адиабатным сжатием. Полный
230
Рис. 4.39. Область плавления на
диаграмме T—s для 3Не ($ж и sTB —
энтропии жидкой и твердой фаз)
процесс включает два этапа:
а) предварительное ожижение
3Не и начальное его охлажде-
ние ниже 0,32 К, что обеспе-
чивает состояние с более низ-
кой энтропией, чем в твердой
фазе при той же температуре
(точка Л); б) кристаллизация
3Нс изоэнтропным сжатием
жидкости (процесс Л—В), в
результате которого темпера-
RLn2
S, Дж/(ноль-К)
тура снижается на Д7’= Тн - Тк. Теплоту, поглощаемую при
изотермическом сжатии, можно определить как теплоту фазового
перехода Q = Т(хтв - лж). Энтропия твердого 3Не при Т < 0,32 К
примерно постоянна (атв = Я1п2). Характер изменения энтропии
жидкости при Т < 0,025 К близок к линейному (лж = 4,67?7); тогда
количество поглощенной теплоты на 1 моль твердой фазы, Дж,
Q = T\s= Rl\\n2 - 4,6Т). (4.119)
Очевидно, что холодопроизводительность здесь выше,
чем у рефрижераторов растворения, где она падает пропор-
ционально Т2. Изменение ДТ можно непосредственно оп-
ределить по диаграмме T-s. Потери в этом процессе связа-
ны с выделением теплоты трения при сжатии; это опреде-
ляет основные технические трудности при реализации
метода. Рассмотренный метод получил практическое под-
тверждение для получения сверхнизких температур в
интервале 0,01-0,002 К.
§ 4.13. ДРУГИЕ ПРОЦЕССЫ ОХЛАЖДЕНИЯ
Наряду с рассмотренными процессами возможны и другие,
основанные на использовании различных сред и различных
эффектов.
При использовании любого процесса охлаждения обязатель-
ным условием является наличие термодинамической системы,
231
энтропию которой можно значительно изменить за счет измене-
ния некоторого параметра состояния X:
s = f(T,X). (4.120)
Так, для термомеханической системы X — это давление р, для
магнитной — напряженность поля И, для рефрижератора раство-
рения — концентрация раствора х (химический потенциал), для
термоэлектрической системы — плотность электронов (Ферми-
газа) в проводниках и т.д.
Изменение энтропии обеспечивает поглощение теплоты Q,
т.е. холодопроизводительность. В общем случае для обратимого
процесса dQ = Tds, для изотермического процесса (Т = const)
Q=T\s, (4.121)
где Дх — - .sy (sH — высокое значение энтропии, соответствую-
щее неупорядоченному состоянию рабочей среды, — низкое зна-
чение энтропии, соответствующее упорядоченному состоянию).
Так, при испарении жидкости энтропия пара (хн) значительно
больше энтропии жидкости (ху); то же относится к сжатому и
расширенному газам. Существенно зависит Дх от \Н для
парамагнетиков (см. рис. 4.24). В рефрижераторе растворения
энтропия для раствора 3Не существенно выше, чем для чистой
жидкости. Энтропия для адсорбированного газа значительно
меньше, чем для десорбированного.
Таким образом, возможна реализация процесса охлаждения
в самых различных термодинамических системах, для которых
существует возможность изменения энтропии (неупорядоченное
— упорядоченное состояние микрочастиц) за счет воздействия
на систему обобщенной силы X. Некоторые из систем такого
рода кратко рассмотрены ниже.
Электрокалорический эффект охлаждения (ЭК-эффект). Этот
процесс охлаждения во многом аналогичен рассмотренному
ранее магнитокалорическому (см. § 4.11). Рабочей средой в ЭК-
систсме являются сегнетоэлектрики-диэлектрики со значитель-
ной зависимостью дипольного электрического момента Р от
напряженности Е электрического поля. Диаграмма Т— хдля такой
системы соответствует рис. 4.24, где вместо напряженности Н
магнитного поля фигурирует напряженность Е электрического
поля. Рабочей средой на микроуровне являются электрические
диполи (ионы), способные изменять ориентацию (энтропию) в
зависимости от напряженности Е приложенного электрического
232
поля, выполняющего в данном случае функции обобщенной си-
лы X. В соответствии с первым началом термодинамики для
диэлектрика
du = Tds + EdP . (4.122)
Отсюда можно получить выражение для электрокалорического
коэффициента в адиабатном процессе
аэ = (дТ/дЕ\ = - (Т/сЕ\дР/дТ)Е. (4.123)
где сЕ — теплоемкость при Е = const.
Процесс охлаждения в такой системе осуществляют изотерми-
ческой поляризацией сегнетоэлектрика путем наложения поля
напряженностью Е с отводом теплоты. В итоге энтропия снижа-
ется, а последующее изоэнтропное уменьшение Е определяет
падение температуры \Т. Преимущество метода в том, что
создать электрическое поле технически легко; эффект может
быть реализован в широком интервале температур: от 0 до 300 К.
Максимум эффекта находится вблизи точки Кюри; так для
КН2РО4 = 122 К. Однако ДТ мало и не превышает 0,5—1 К
при изменении Е в интервале 0—4 МВ/м. Предполагают, что в
ряде случаев такие системы могут быть эффективны.
Термомагнитное охлаждение основано на эффекте Этгингс-
хаузена (1886 г.) и реализуется следующим образом. Вдоль
полюсов магнита помещают полупроводниковый стержень
(брусок), к торцам которого подводят ток. Взаимодействие
электрического и магнитного полей приводит к возникновению
в стержне разности температур вдоль вертикальной оси, перпен-
дикулярной к направлению тока и магнитного поля. У нижней
грани стержня образуются пары электрон — дырка с поглоще-
нием теплоты Qx, у верхней грани происходит рекомбинация пар
с выделением теплоты Qo. Наилучший материал для такой систе-
мы висмут—сурьма (3 % Sb); эффект охлаждения ДТ составляет
10 К и более.
Намагничивание сверхпроводников. Переход металла из нор-
мального в сверхпроводящее состояние сопровождается умень-
шением энтропии, так как при этом упорядочивается электрон-
ная структура [см. (3.122)]. Очевидно, обратный процесс — сни-
жение упорядоченности — в соответствии с (4.121) приведет к
поглощению теплоты. Такую систему можно использовать для
охлаждения, реализуемого следующим образом. Образец предва-
рительно охлаждают до температуры Тн, которая ниже темпера-
233
туры перехода в сверхпроводящее состояние Тс. После этого
образец адиабатически изолируют и накладывают внешнее маг-
нитное поле напряженностью Н, что приводит к изоэнтропному
переходу в нормальное состояние. Так как поглощаемая теплота
отбирается от массы самого образца, он охлаждается на Д Т =
= Тн - Тк. Метод можно осуществлять только при Т < Тс, т.е. в
интервале 0—20 К; однако его эффективность мала, так как
теплоемкость твердых тел при таких температурах очень низкая.
Механокалорический эффект. При обсуждении свойств
жидкого Hell в § 3.7 отмечено, что его поведение качественно
хорошо объясняется с помощью «двухжидкостной» модели,
предусматривающей существование нормальной и сверхтекучей
компонент в жидкости. Поскольку сверхтекучая компонента не
имеет вязкости, она проходит свободно через тонкий капилляр,
соединяющий две емкости с Hell. В то же время вязкая нормаль-
ная составляющая через капилляр не проходит и как бы отфильт-
ровывается. В результате происходит разделение Hell на две
жидкости — одна богата сверхтекучей составляющей, другая —
нормальной.
Так как энтропия сверхтекучей компоненты равна нулю,
тонкий капилляр должен действовать как «энтропийный фильтр»,
не пропускающий вязкую нормальную составляющую. В резуль-
тате происходит понижение температуры после фильтра, обус-
ловленное тем, что энтропия сверхтекучей составляющей, про-
шедшей через фильтр, близка к нулю. Этот эффект впервые
обнаружен П.Капицей и получил дальнейшее экспериментальное
подтверждение.
Охлаждение смешением. Тепловой эффект смешения также
можно использовать для охлаждения. В § 4.12 метод рассмотрен
применительно к растворам квантовых жидкостей 3Не — 4Не.
Процесс смешения необратим, поэтому энтропия смеси обычно
больше суммы энтропий отдельных компонентов. Так, при сме-
шении компонентов идеального газа дополнительное возрастание
энтропии (энтропия смешения)
Д5см = - R £ х, In , (4.124)
i
где х. — доля /-го компонента.
В данном случае доля является обобщенной силой, приводя-
щей к изменению энтропии системы. Смешение в изотерми-
ческих условиях приводит к поглощению теплоты, в адиабатных
— к снижению температуры. В процессе смешения могут участ-
234
вовать газы, жидкости, твердые тела. Классический эффект
охлаждения смешением — снижение температуры в смеси пова-
ренной соли и воды (льда). Смешение соли со льдом и образо-
вание раствора, содержащего 21 % NaCl, приводит к снижению
температуры от 273 до 252 К. Учитывая необратимость процесса
смешения и необходимость последующего разделения смеси при
возвращении компонентов в исходное состояние, трудно
рассчитывать на высокую эффективность метода. В то же время
в ряде случаев он может оказаться достаточно экономичным и
целесообразным, например для одноразового охлаждения. Рас-
четные оценки показывают, что при смешении газов с сильно
отличающимися критическими параметрами получают наиболь-
ший эффект охлаждения. Так, для смеси метан — гелий при
Т = 200 К и р ~ 10 МПа снижение температуры ДТ = 50 К;
КПД процесса достигает 50 %.
Деформация упругой среды. Упругая деформация (сжатие —
растяжение) — обратимый процесс, который в принципе можно
использовать для охлаждения. Основное уравнение термо-
динамики для упругого стержня можно представить так:
Tds = du - \\fdl. (4.125)
где \|/ — сила, действующая на стержень; / — линейный размер.
Применив общие соотношения термодинамики к такой систе-
ме, можно вычислить ее энтропию, энергию и другие характе-
ристики, а также конечное изменение температуры при адиабат-
ной деформации
\Т= - аТсро/(ср), (4.126)
где а — температурный коэффициент линейного расширения
(см. § 3.8) материала стержня; Тср — средняя температура; о —
напряжение; с — теплоемкость; р — плотность.
Так как Г, сир положительны, то знак ДТ определяется зна-
ками о и а. Напряжение положительно при растяжении и
отрицательно при сжатии. Обычно а > 0, и лишь для резины
а < 0. Это исключение касается и энтропии, которая обычно
возрастает при изотермической деформации, а у резины умень-
шается, так как ее длинные молекулярные цепи упорядочиваются
при растяжении. Таким образом, металлические стержни при
растяжении охлаждаются, резина нагревается. Этот эффект у
металлов невелик. Так, для стали ДТ = 0,16 К при о = 200 МПа,
Для резины ДТдостигает 8 К.
Глава 5
ИДЕАЛЬНЫЕ ЦИКЛЫ,
ХОЛОДОПРОИЗВОДИТЕЛЬНОСТЬ
И ЭФФЕКТИВНОСТЬ КРИОГЕННЫХ СИСТЕМ
§5.1. ИДЕАЛЬНЫЕ ЦИКЛЫ И ПРОЦЕССЫ
Из большого числа задач, которые стоят перед криогеникой,
выделим основные и рассмотрим их в общем виде без учета кон-
кретных технических характеристик и областей назначения.
Такими задачами в первую очередь являются термостатирование,
охлаждение вещества или какого-либо объекта, конденсация и
кристаллизация чистого вещества или отдельных составляющих
смеси, ожижение газов, разделение газовых смесей на состав-
ные части. Для решения этих задач необходимы рабочее веще-
ство (криоагент) и устройство для снижения температуры вещес-
тва. Низкотемпературные системы являются энергоемкими. Даже
в теоретическом случае, когда все процессы (и внутренние, и
внешние) обратимы, затраты энергии существенны и возрастают
при снижении температуры.
Общий расход энергии в установке условно можно разделить
на две части: минимальный — численно равный работе Lniin,
необходимой для осуществления идеальных (обратимых) процес-
сов, и дополнительный — численно равный работе АЛ, необходи-
мой для компенсации потерь в реальных процессах. Значение
АЛ весьма существенно и может превышать в 1,5 — 10 раз
и более. Рассмотрим подробнее расчет минимальной работы в
системе применительно к решению основных задач криогеники.
Термостатирование. Криогенное термостатирование — это
процесс поддержания постоянной температуры (на уровне ниже
120 К) в каком-либо объекте, веществе или среде. При этом
необходимо обеспечить перенос теплоты с нижнего температур-
ного уровня Гх на верхний То, равный температуре окружающей
среды. Представим себе идеальную установку с обратимыми
процессами во всех ее элементах (рис. 5.1, 5.2); она включает
компрессор К1 для изотермического сжатия газа при температуре
окружающей среды, детандер Д1 для изоэнтропного расширения,
детандер Д2 для изотермического расширения газа при темпера-
туре Тх и компрессор К2 для изоэнтропного сжатия. Детандер
236
Рис. 5.1. Схема обратимого цикла
термостатирования
Рис. 5.2. Обратимый цикл термо-
статирования в диаграмме Т — s
Д2 размещен в камере с термостатируемой средой; процесс в
детандере Д2 протекает при непрерывном подводе теплоты qx к
расширяющемуся газу из камеры. Пусть все процессы установив-
шиеся. Для обеспечения постоянства температуры среды в
камере из нее следует непрерывно отводить выделяющуюся
теплоту и передавать ее в окружающую среду. Процесс отвода
теплоты осуществляют при помощи рабочего вещества — крио-
агента, циркулирующего в установке. Обычно в качестве рабо-
чего вещества в реальных установках используют такие газы, как
азот, гелий, неон и др.
Количество теплоты Q*, отводимой в единицу времени при
температуре ниже температуры окружающей среды, называют
полезной холодопроизводительностью и измеряют в ваттах. Часто
для получения удобных для расчета значений холодопроизводи-
тельность Q* относят к расходу циркулирующего рабочего
вещества. Полученную величину qy обычно называют удельной
холодопроизводительностью или удельной полезной холодо-
производительностью. При переходе к полным характеристикам
необходимо удельное значение умножить на расход рабочего
вещества G:
Q* = (5-D
Изобразим процессы, происходящие в установке, на диаграм-
ме Т — s (см. рис. 5.2); они последовательно повторяются и пред-
ставляют собой единый замкнутый или, как говорят, круговой
Процесс (цикл), в котором рабочее вещество не расходуется и
237
после завершения цикла возвращается к начальным условиям.
При этом в процессе 7-2 происходит обратимое изотермическое
сжатие рабочего вещества, в процессе 2-3 — изоэнтропнос рас-
ширение, в процессе 3-4 — обратимое изотермическое расшире-
ние с отводом теплоты от низкотемпературного источника (с
температурой Тх), в процессе 4-1 — изоэнтропное сжатие.
Уравнение энергетического баланса в рассмотренном круго-
вом процессе соответствует уравнению (2.7), и минимальная ра-
бота (см. рис. 5.1 и 5.2)
U = <?К - ?х> <5-2)
где — количество теплоты, отводимой от рабочего вещества
в окружающую среду в процессе 7-2; q.. — количество теплоты,
подводимой к рабочему веществу в изотермическом процессе 3-
4, равное количеству теплоты, отводимой от охлаждаемого объек-
та (удельная полезная холодопроизводительность).
Здесь и далее строчными буквами (/, q и .?) обозначены удель-
ные (или молярные) характеристики, отнесенные к массе (коли-
честву) рабочего вещества; при этом слово «удельная» (и «моляр-
ная») для краткости опускаем.
При изотермическом сжатии в компрессоре К1 необходимо
совершить работу /к; в компрессоре К2 — работу /'к для сжатия
рабочего вещества в процессе 5 = const. Часть затраченной при
этом энергии возвращается в результате совершения работы /д
и /д при расширении рабочего вещества в детандерах Д1 и Д2.
Суммарная минимальная работа
4nin ~ 4с + ^К " (д " ^Д' (5-3)
Количество теплоты
«к = Го (51 - 5г)’ (5-4)
где .s’j и s2 — энтропии рабочего вещества в точках 7 и 2.
Количество теплоты qx, подводимой в процессе 3-4,
«X = Гх (54 ’ 5з)’ <5'5)
где у и .s4 —- энтропии рабочего вещества в точках 3 и 4.
Подставив значения ?ки в выражение (5.2) с учетом усло-
вий организации процесса Sj = s4 и s2 = s3, получим
'min = (*4 - Wo - Гх)- (5.6)
238
Работе /min на диаграмме Т — s соответствует площадь прямоу-
гольника 1234, а количеству теплоты qx — площадь прямо-
угольника аЬ43.
Если все процессы протекают в области влажного пара, то
для чистого вещества изотермы То и Гх под пограничной кривой
(рис. 5.3) совпадают с изобарами р0 и р*. Схема такой установ-
ки включает машины К и Д (рис. 5.3, а), в которых происходят
изоэнтропные процессы сжатия 4-1 и расширения 2-3, а также
теплоотдатчик (конденсатор) Т1 и теплоприемник (испаритель)
Т2, обеспечивающие обратимые процессы передачи теплоты.
Здесь также справедливы формулы (5.5) и (5.6), если все
процессы этого цикла обратимы.
Обратимый цикл, состоящий из двух изотерм и двух изоэн-
троп, получил название цикла Карно. Цикл Карно может быть
прямым, тогда его называют тепловым, и обратным (см. рис. 5.1
и рис. 5.3), тогда его называют холодильным. Если бы удалось
получить холод при помощи такого цикла в заданных темпера-
турных пределах с двумя фиксированными температурами (70 и
Тх), то расход энергии в нем был бы минимальным.
Мерой эффективности цикла Карно является холодильный
коэффициент ес, определяемый отношением
ес ~ ^хЛпиГ
Для сравнения эффективности реальных термостатируемых
систем используют степень термодинамического совершенства
= е/ес = W7’
где / — работа, совершаемая в реальном цикле для получения
холодопроизводительности <?х; е — холодильный коэффициент
Рис. 5.3. Обратимый цикл термостатироваиия в области влажного пара:
асхема; б — диаграмма Т— s
239
а)
Рис. 5.4. Изобарио-изотермический цикл термотестирования:
а — схема; б — диаграмма Т— s
S)
s
Холодильный коэффициент рефрижератора Карно сущест-
венно зависит от температуры Тх; например, при То = 300 К и
Т = 77,4 К ес = 0,3477, при Т = 20,3 К ег = 0,07258, при
Тх = 4,2 К ес - 0,0142.
Кроме цикла Карно с двумя изоэнтропами, можно представить
себе другие обратимые циклы для получения холода на уровне
температуры Тх. Такие циклы в термодинамике называют обобщен-
ными циклами Карно [52]. Обобщенный цикл Карно состоит из двух
изотерм и двух конгруэнтных линий. Работу в таком цикле
также можно определить по формулам (5.2) или (5.6). В качестве
примера рассмотрим известный цикл (рис. 5.4), состоящий из двух
изотерм (То и Т ) и двух изобар (р3 и р4); этот цикл называют также
обратным циклом Эриксона [1, 4]. Для осуществления цикла
необходимы компрессор К и детандер Д работающие при постоян-
ных температурах соответственно То и Тх, а также идеальный
теплообменный аппарат Т и рабочее вещество, обладающее свойст-
вами идеального газа. В аппарате Тдолжна передаваться теплота
от сжатого рабочего вещества при изобарном процессе 2'-3 расши-
ренному рабочему веществу, нагревающемуся при изобарном
процессе 4-7. Для обеспечения полной рекуперации теплоты без
потерь давления необходимо, чтобы температуры сжатого и
расширенного газа во всех сечениях теплообменника были равны,
а гидравлические потери отсутствовали. Такой цикл в реальной
установке осуществить невозможно. Минимальная работа в цикле
U = 1к - 1а = R (То - гх) 1п (73/д)
240
или
U = (*4 - <о - Ы (5-7)
где /к — работа, численно равная энергии, затрачиваемой на
изотермическое сжатие рабочего вещества при температуре То;
/д — работа, численно равная энергии, получаемой при изо-
термическом расширении рабочего вещества при температуре Г;
R — газовая постоянная.
Сравнение выражений (5.6) и (5.7) показывает, что работа
в обоих циклах одинакова, если одинаковы холодопроизводитель-
ности qx и температуры То и Тх.
Охлаждение. Процесс охлаждения вещества отличается от тер-
мостатирования тем, что температура охлаждаемого объекта
снижается от температуры Т'х до Т"х. Процесс охлаждения можно
осуществлять различными способами. В качестве примера
рассмотрим охлаждение газа при установившемся изобарном
процессе, применяемом достаточно часто. Если температура
охлаждаемого вещества снижается от Т'х до Т"х, то от единицы
массы вещества отводится теплота
в, =<5-8)
где i'x и Г'х — энтальпии охлаждаемого вещества при давлении
рх и температурах соответственно Т'х и Т"х.
Представим себе обратимый цикл для осуществления этого
процесса охлаждения (рис. 5.5, 5.6). Рабочее вещество сжимается
в компрессоре К1 при температуре окружающей среды (процесс
Рис. 5.5. Схема обратимого цикла для
охлаждения газа (сплошная линия — рабочее
вещество, штриховая — охлаждаемый газ)
Рис. 5.6. Цикл охлаждения газа в
диаграмме T—s
16 Заказ № 1592
241
1-2), затем расширяется в детандере Д при 5 = const (процесс
2-3), нагревается в аппарате Т (изобарный процесс 3-4); при
этом к рабочему веществу подводится теплота qx от охлаждаемого
газа — источника теплоты. Затем рабочее вещество сжимается
в компрессоре К2 при 5 = const (процесс 4-1). Температура
охлаждаемого вещества при этом снижается от состояния 4' до
3' (штриховая линия на рис. 5.5). Процесс теплообмена в аппа-
рате Т характеризуется отсутствием гидравлических потерь, а
также равенством температур охлаждаемого и расширенного
газов во всех сечениях аппарата. Энергия, затрачиваемая в таком
цикле, минимальна. Ее можно определить из уравнения энерге-
тического баланса:
4nin “ At + ^К ' = ^К ’ Ях-
При анализе циклов здесь и далее примем, что изменения
кинетической и потенциальной энергий потока газа много мень-
ше изменения энтальпии, и этими энергетическими членами в
уравнениях пренебрегаем. После подстановок и преобразований
получим
4nin “ % " " (Z4 ' ?з)- (5.9)
Минимальной работе на рис. 5.6 эквивалентна площадь 1234.
а количеству отведенной теплоты qx — площадь аЬ43, равная
площади аЬ43'. В общем случае обратимый процесс 3-4 может
быть не только изобарным; тогда минимальная работа
б
1ып = Го(51 - Sl) - JC dT’ (5-I(,)
т,
где с — удельная теплоемкость рабочего вещества в процессе 3-4.
Конденсация и кристаллизация. Конденсацию и кристал-
лизацию можно осуществить по-разному: при постоянном
давлении, при постоянном объеме, а также другими способами.
Рассмотрим наиболее часто встречающийся на практике
изобарный процесс.
При конденсации и затвердевании чистого вещества темпера-
тура не изменяется, теплота qx выделяется за счет фазового
перехода на соответствующем температурном уровне Тх. Следова-
тельно, тепловые процессы в криогенном устройстве подобны
процессам термостатирования объекта. Отличие заключается в
природе возникновения теплового потока; здесь он возникает
вследствие фазового перехода.
242
При конденсации или затвердевании какой-либо примеси из
потока вещества, представляющего собой смесь, задача
усложняется: изменяется масса примеси в охлаждаемой смеси,
уменьшается парциальное давление примеси и, следовательно,
снижаются температуры конденсации и затвердевания смеси.
Циклы с постоянной температурой Тх (см. рис. 5.1 и 5.2) не
являются обратимыми для решения данной задачи, Здесь нужен
цикл с переменной температурой в процессе 3-4 и идеальным
теплообменником.
Ожижение. Ожижение газа при минимальном расходе энергии
можно представить по-разному. Пусть первоначальному состоя-
нию газа на диаграмме Т — s соответствует точка 1 (рис. 5.7).
Если газ сначала сжать в компрессоре при постоянной темпера-
туре, равной температуре окружающей среды То, до очень
высокого давления р2 (процесс 1-2}, а затем расширить в детан-
дере (процесс 2-f при х = const), то можно получить жидкость в
состоянии, соответствующем точке f. Если оба процесса обрати-
мы, то минимально необходимая для ожижения газа работа
и=/к-/д- (5-11)
При изотермическом сжатии сжижаемого газа необходимо
совершить работу
/к = 7^(5, - х2) - (/• - /2), (5.12)
где /] и /2 — энтальпии газа соответственно в начале и в конце
процесса сжатия.
При изоэнтропном расширении газа в детандере совершается
работа (при х2 = хЦ
(ц ~ z2 z/’ (5-13)
где — энтальпия жидкости.
В соответствии с уравне-
ниями (5.11)—(5.13) и равенст-
вом .S’j = Ху
4mn ~ % sfi (zi lfi-
(5.14)
Рис. 5.7. Процесс сжижения газа в
Диаграмме Т — s
16*
243
Рис. 5.8. Схема идеального цикла для ожижения газа (тонкие линии — рабочее
вещество, жирная - ожижаемый газ)
Процесс ожижения газа можно организовать иначе. Пусть для
ожижения газа используется наиболее естественный процесс -
изобарный (р} = const). Тогда газ необходимо предварительно
охладить при постоянном давлении р} до температуры конденса-
ции Тх, а затем сконденсировать (линия Г3'f на рис. 5.8, а).
При охлаждении газа у него отнимается теплота ^охп (площадь
с Г3'Ь), при конденсации — теплота </ко1Щ (площадь b3'f'a).
Общее количество теплоты, отведенной от единицы массы
газа при его ожижении в изобарном процессе Г-З'-f,
= ^охл + = Т - У- (515)
Представить реализацию этого процесса с минимальным рас-
ходом энергии можно с помощью так называемого идеального
цикла для ожижения газов [7] (ни один из ранее описанных цик-
лов для этого нс подходит). Представим себе установку, состоя-
щую из компрессора К. детандера Д и теплообменника Т (рис.
5.8, б). Рабочее вещество (криоагент) сжимается в компрессоре
при постоянной температуре То (процесс 1-2), расширяется в
детандере при постоянной энтропии (х2 = const) до состояния
жидкости / и направляется в теплообменник Т, где вступает в
тепловой контакт с ожижаемым газом (криопродуктом); причем
во всех сечениях аппарата рабочее вещество и ожижаемый газ
имеют одинаковые параметры состояния и свойства, но отделены
один от другого теплопередающей поверхностью. Следовательно,
параметры состояния рабочего вещества в точках 7, 3, f соот-
244
ветственно равны параметрам состояния ожижаемого газа в точ-
ках Г, 3', f и точки на диаграмме Т — s (рис. 5.8, а) совпадают.
Запишем уравнение энергетического баланса цикла
'к ’ <т = <516)
где qK — теплота, отдаваемая в окружающую среду в процессе
1-2; ее можно определить по формуле (5.4); qK — теплота,
отбираемая криоагентом у ожижаемого газа.
Теплота qK численно равна теплоте, отведенной от единицы
массы газа при его охлаждении и ожижении, и может быть
найдена по формуле (5.15). Она условно определяет полезную
удельную холодопроизводительность цикла при переменном
уровне температуры от То до Т. После подстановки соответ-
ствующих значений в выражение (5.16) получим.
4nin ~ % " " (zl * z/)’
где учтено, что ф = ф и /ф = /ф.
Эта формула идентична выражению (5.14). На диаграмме
Т — s (см. рис. 5.8, д) работе эквивалентна площадь 12f3.
Характеристика идеальных циклов. Минимальная работа /mjn,
необходимая для ожижения 1 кт и 1 л различных газов, указана
в табл. 5.1; для сравнения приведена примерная действитель-
ная работа ожижения тех же газов.
На рис. 5.9 приведены результаты расчета обратимых циклов
для получения холода при температуре Т.. и ожижения некоторых
газов; сплошная кривая характеризует температурную зависи-
мость отношения работы в цикле Карно /с к холодопроизводи-
5.1. Минимальная /min и примерная действительная / работа
ожижения некоторых газов при р = 0,1013 МПа и ф = 300 К [17]
Газ '> ~ '/> кДж кг 4шП /
кВт -ч КГ кВт • ч л кВт • ч кг кВт • ч л
Азот 433,3 0,213 0,172 1,2-1,8 1-1,5
Аргон 273,1 0,134 0,186 0,8-1 1.1-1,4
Водород 3953 3,31 0,235 22-42 1.5-3,0
Воздух 428,3 0.205 0,179 1.2-1,8 1-1,5
Гелий 1563 1.9 0,237 16-32 2-4
Кислород 406.9 0.177 0.202 1-1,5 1.2-1,7
Метан 912.7 0,307 0,13 0,6-1 0.25-0.5
Неон 368,6 0,372 0,445 3,5-5,5 3-4.5
245
Рис. 5.10. Зависимость удельной ра-
боты в цикле Карно /с/^х (линия) и
в идеальном цикле ожижения газов
(точки) от температуры
при То = 300 К, Р] = 0,1 МПа:
1 — метан; 2 — кислород; 3 — азо;.
4 — неон; 5 — водород; 6 — гелий
тельности q, или величину,
обратную холодильному ко-
эффициенту ес; точки 1-6
соответствуют отношению
минимальной работы ожиже-
ния lmjn к количеству теплоты
/] - if (площадь l'3'fabc на
рис. 5.8, а), которую отбира-
ют при ожижении газа и
условно рассматривают как
удельную полезную холодопроизводительность ожижительного
цикла. Анализ полученных результатов показывает, что при
низких температурах минимальная работа, необходимая для
получения холода, весьма существенна. При одинаковой холодо-
производительности работа ожижения газа в идеальном цикле
меньше работы, необходимой для получения такого же количес-
тва холода в цикле Карно при температуре Тх, равной темпера-
туре конденсации газа.
При ожижении газа из состояния, соответствующего точке /
(рис. 5.10), существенная доля теплоты на участке 1-3 отводится
при сравнительно высоких уровнях температур. Следовательно,
цикл Карно 52/45 с нижней постоянной температурой Гх для
охлаждения газа от температуры Го до температуры Гх нс являет-
ся обратимым. Рассмотрим этот вопрос подробнее. При исполь-
зовании цикла Карно для ожижения газа вся теплота qx от
ожижаемого газа сообщается криоагенту при температуре кон-
Рис. 5.9. Идеальный цикл и цикл Карно
для ожижения газа в диаграмме Т — г
246
денсации газа Гх (площадь 43fabcd на рис. 5.10). Для передачи
этой теплоты в окружающую среду с температурой Г() необходимо
совершить работу
1с = (Г0 - 7хХД - у) . (5.17)
Этой работе эквивалентна площадь прямоугольника 52f4. Так
как (х4 - у)Тх = ?х и?1- i\ - if, то
1с =0'1-'/) (То - TJ/TX. (5.18)
Например, для ожижения азота при постоянном давлении от
состояния 7(7] = То= 300 К, ру = 0,1 МПа) при помощи цикла
Карно требуется, согласно формуле (5.18), затратить удельную энер-
гию, равную работе /с = 433,3 (300 - 77,24)/77,24 = 1249 кДж/кг.
Минимальная работа ожижения, определенная по формуле (5.14),
равна 769,6 кДж/кг, т.е. в 1,62 раза меньше, чем /с, а отношение
минимальной работы к работе в цикле Карно равно 0,617. Раз-
ность этих работ /с - /^in = (То - Тх)(у - у) - Т0(у - у) + (/, - /}).
После преобразований с учетом равенства Тх(.ч4 - у) = - i?
получим [7]
'с-U= I5-1’)
На рис. 5.10 Ах соответствует увеличению энтропии системы
вследствие потерь при теплообмене с большой разностью тем-
ператур ожижаемого газа и рабочего вещества цикла Карно на
участках 1-3 и 3-4', произведение 7nA.v определяет дополнитель-
ную работу в цикле Карно. Следовательно, для правильного
определения минимальной работы необходим цикл, состоящий
только из обратимых процессов.
В ряде случаев для решения одной и той же задачи можно
предложить несколько схем обратимых циклов с одинаковыми
затратами минимальной энергии, поэтому все обратимые циклы
можно назвать идеальными. На практике осуществить идеаль-
ный цикл невозможно. Однако он представляет большой теоре-
тический интерес: с помощью этого цикла можно рассчитать
минимальную работу, необходимую для осуществления криоген-
ного процесса, степень совершенства и эффективность реальных
циклов.
Разделение газовой смеси. Затраты энергии при разделении
газовой смеси на составные части зависят от применяемого
способа. Однако и здесь существует минимальный теоретический
предел затрат энергии [6, 7, 14, 37, 62].
247
2, 3, ..., п\ из камеры выходят
Рис. 5.11. Схема процесса разделения
газовой смеси
Установившийся процесс раз-
деления смеси газов можно пред-
ставить схемой, изображенной на
рис. 5.11. В камеру 7 поступает
разделяемая смесь в количестве
М. состоящая из компонентов 1,
продукты разделения в количес-
тве А}, А2>..., Ап. Камера расположена в среде с постоянной тем-
пературой TQ, между камерой и внешней средой возможен обмен
теплотой Q, для осуществления процесса разделения необходи-
мо совершить работу L.
Состав разделяемой смеси обычно выражают через молярные,
объемные или массовые доли. Молярная доля компонента 1 в смеси
х( — + М2 +...+ Mj +...+ (5.20)
где — количество вещества компонента 1, содержащегося в
смеси, моль; Л/2,..., Л/.,..., Мп — количество вещества компонента
соответственно 2, ..., 7,..., содержащегося в смеси, моль.
Аналогичные выражения можно получить для компонентов 2.
3 и т.д. Молярные доли компонентов в смеси связаны равенством
х] + х2 +...+ х;. +...+ хп = 1. (5.21)
Если продукты разделения — чистые газы, то А{= М}=...= А = Мп.
Пусть газовая смесь представляет собой смесь идеальных газов
из п компонентов. Поведение смеси определяется аддитивностью
парциальных давлений (закон Дальтона) и парциальных объемов
(закон Амага) компонентов смеси.
Энтропия идеального газа зависит от температуры и давле-
ния, поэтому энтропия 5(. (/г, 7) чистого 7-го компонента в смеси
при температуре Т и его парциальном давлении /г отличается
от энтропии №7 (/?, Т) 7-го компонента при той же температуре,
но при давлении р смеси.
Энтропия идеальной газовой смеси [37, 48]
•SL = txisi(P,^ г) = 1 ХЛ° (А Т) - Яу£ yin (5.22)
<-1 i=i /-I
где 7? — универсальная газовая постоянная.
248
Суммарная энтропия чистых компонентов, составляющих
смесь, при давлении и температуре смеси
= 1>А0(А Т). (5.23)
<=1
Разность энтропий, известная как энтропия смешения, —
положительная величина:
Цч = h - 4 = ' Ryt х,111 х, (5-24)
1=1
Здесь и далее в § 5.1 энтропии хр х;°, Ахсм в
Дж/(моль • К).
Следовательно, при изотермическом разделении идеальной га-
зовой смеси, если смесь и полученные из нес компоненты имеют
одинаковые давления, энтропия уменьшается; поэтому даже при
обратимом процессе разделения смеси на чистые компоненты
надо затратить энергию, равную минимальной работе разделения
[16, 14, 37, 48]
/ • = Тп Ах . (5.25)
р min 0 см \ 7
При температуре окружающей среды То с учетом (5.24) можно
записать
U = - (5.26)
Работа / min зависит от состава смеси и температуры Т() и нс
зависит от способа разделения смеси [см. также выражение
(2.18)]. Работа / min, отнесенная к массе (количеству) /-го компо-
нента,
min )/• ~ min/XZ ' (5-27)
Рассмотрим процесс разделения идеальной газовой смеси в
идеализированном устройстве с полупроницаемыми перего-
родками. Это известный идеальный процесс, схема которого
несколько приближена к одному из возможных способов техни-
ческого решения задачи разделения смеси газов. Идеализи-
рованный процесс впервые описан Гиббсом. Кратко рассмотрим
его с целью определения минимальной работы разделения смеси
на чистые компоненты. Для упрощения примем смесь бинарной,
состоящей из компонентов 1 и 2. Пусть в цилиндре Ц (рис. 5.12,
положение Г) при давлении /?(| и температуре То содержится
смесь в количестве М. включающая компонент 1 в количестве
249
Рнс. 5.12. Схема процесса разделения в цилиндре с
полупроницаемыми поршнями
= ххМ и компонент 2 в количестве М2 = х2М. Парциальные
давления этих газов в смеси р} = х{р0 и р2 = х2р0 = (1 - х])/’о. В
цилиндре размещены два поршня, перемещающиеся без трения,
причем поршень 777 проницаем для газа 7, а поршень 772 — для
газа 2. Медленно перемещая поршни таким образом, чтобы
давление pi} и температура То во всех частях системы нс
изменялись, достигнем положения II. в левой части цилиндра
соберется газ 7, в правой — газ 2. В теоретическом случае эти
газы представляют собой чистые компоненты 7 и 2. На разделе-
ние смеси газов затрачивается энергия. Если процесс строго
изотермичен, то эти затраты равны работе изотермического
сжатия газов, составляющих смесь, от их парциальных давлений
до общего давления смеси р.л. Если М = 1 моль, то
/pmin = RyT0 i Х/1П О’о/Л) = - RyT0 I Х/1П
Г=1 Г=1
что точно соответствует формуле (5.26). При этом xj = pjp§ =
= MJM.
Для примера вычислим минимальную работу разделения
1 моля воздуха на чистые азот и кислород, условно считая
воздух идеальной бинарной смесью; при этом в формуле (5.26)
7?у = 8,314 Дж/(моль-К); То = 303 К; п = 2; Xj = хо^ =
= 0,209 — молярная доля О2 в воздухе; х2 = xN — 0,791 -
молярная доля N2 в воздухе. Работа I min - —8,314-303 х
х (0,209 In 0,209 + 0,791 In 0,791) = 1291 РДж/моль.
Идеальная работа разделения уменьшается при понижении
температуры в процессе разделения [см. формулу (5.26)]. Однако
если температура процесса ниже температуры окружающей
среды, то должна быть совершена дополнительная работа для
поддержания низкой температуры процесса, чтобы обеспечить
отвод теплоты от системы в окружающую среду.
Если рассматривать воздух как идеальную тройную смесь
(л = 3), состоящую из кислорода, аргона и азота с молярными
250
долями соответственно xQ = 0,2095, хЛг = 0,0093, xN^ = 0,7812,
то при полном разделении 1 моля смеси на чистые компоненты
при принятых ранее условиях необходимо совершить работу
1421 Дж/моль. Та же работа, условно отнесенная к 1 молю
чистого продукта, согласно формуле (5.27) составит: для кисло-
рода 6782, для аргона 152795, для азота 1819 Дж/моль. При
уменьшении доли компонента в смеси минимальная работа
выделения 1 моля чистого компонента увеличивается.
Реальная работа существенно больше теоретической. Степень
термодинамического совершенства установки для разделения
газовой смеси можно вычислить по формуле (2.20), или с уче-
том нового обозначения
Lvmn/L=lvmn/l, (5.28)
где Lp mn = М / mjn [в общем случае минимальная работа раз-
деления неидеальной смеси отличается от / вычисленной
по формуле (5.26)].
Если в установке получают какой-либо один продукт (напри-
мер, в количестве Aj) из газовой смеси, то при определении уде-
льной действительной работы всю совершенную работу делят на
количество продукта: /л/ = L/Al. При одновременном получении
нескольких продуктов разделения иногда вводят понятие
«условный газ»; при разделении воздуха за условный газ часто
принимают чистый газообразный кислород (100 % О2) при
Го = 293 К и рГ) = 0,1 МПа [14]. При этом считают, что из смеси
М получается условный газ в количестве Г; тогда
/у.г = L/Г. (5.29)
Количество условного газа определяют с учетом количества
получаемых продуктов разделения и их эксергий [3|:
Г=ЕС(Л4Л-уг, (5.30)
i
где ст — коэффициент, учитывающий относительное различие
эффективностей процессов получения /-го продукта разделения;
ej — удельная (молярная) эксергия продукта разделения; At —
количество продукта (обычно расход в единицу времени); еу1 —
удельная (молярная) эксергия условного газа.
В формуле (5.30) коэффициент ci является приближенным,
что снижает точность расчета; однако таким способом можно
сравнить по энергетическим показателям хотя бы в первом
приближении ВРУ с различными схемами и разными продукта-
251
ми. При комплексном разделении воздуха и использовании всех
его компонентов в качестве продуктов разделения степень термо-
динамического совершенства установки выше, чем при выде-
лении лишь некоторых продуктов.
При решении технической задачи выделения из атмосферного
воздуха какого-либо одного компонента (например, кислорода)
и возвращении других компонентов в атмосферу (параметры
которой практически не изменяются) может возникнуть необхо-
димость в определении минимальной работы, необходимой для
выделения только кислорода, которая меньше работы, опреде-
ляемой по формуле (5.26). Определение работы выделения
кислорода из воздуха (условно принятого за идеальную бинарную
смесь азота и кислорода) рассмотрено в работе [62]; схема уст-
ройства приведена на рис. 5.13. Примем, что поршень 2 и
поршень в кислородном компрессоре 7 движутся без трения.
Патрубки 6 и 9 отделены от цилиндра / полупроницаемыми
перегородками 5 и 10. Воздух при атмосферном давлении рь
поступает в цилиндр 1 по трубке 4 через клапан 3 при ходе
поршня вниз (клапаны за перегородками закрыты). При ходе
поршня 2 вверх азот при парциальном давлении pN поступает
в патрубок 9 и через полупроницаемую перегородку 8 выходит
в атмосферу и обратимо смешивается с ней (клапаны за перего-
родками открыты). Кислород при парциальном давлении р(у по-
ступает в компрессор 7, где изотермически обратимо сжимается
до давления pt:. при температуре Т^. Работа сжатия кислорода
соответствует минимальной работе разделения
*К min у Л) *О21п (/’о /М ’
где 72 и р.л — температура и давление атмосферного воздуха.
Работа поршня 2 теорети-
чески равна нулю, так как
давление при всасывании и
нагнетании отличается от р^
на бесконечно малую величи-
ну, а потери на трение отсут-
ствуют. При этом процессе
разделяемая смесь должна
представлять собой окружаю-
Рис. 5.13. Схема процесса выделения
кислорода из воздуха в устройстве с
полупроницаемыми перегородками [62]
252
щую среду и возвращение в нее части смеси из установки не
должно изменять состава этой среды. Однако в установках разде-
ления воздуха газы, которые не являются продуктами разделения,
получают при атмосферном давлении и выбрасывают в атмос-
феру; поэтому обычно минимальную работу рассчитывают с уче-
том выхода всех составляющих воздуха, как и при разделении
любой другой смеси.
При выделении из смеси только одного чистого компонента
в качестве продукта идеальная работа его выделения меньше,
чем при полном разделении смеси на все компоненты. В
качестве примера опять рассмотрим тройную смесь O2-Ar-N7
состава хо = 0,2095, хЛ[ = 0,0093, xN = 0,7812. При полном
разделении 1 моля смеси на чистые компоненты О2, Аг и N2
необходимо совершить работу 1421 Дж/моль, если То = 303 К
(см. стр. 251). Если из смеси выделять только Аг, а два других
компонента (О2 и N2) нс разделять, минимальную работу
разделения следует определять по формуле (5.26), условно считая,
что п = 2, Xj = х^ = 0,0093 и х2 = хо + xN = 0,9907. Тогда при
разделении 1 моля смеси 4,^= 8,314- 303 j0,0093 1п(1/0,0093) +
+ 0,9907 1п(1/0,9907)| = 133 Дж/моль 124].
При разделении бинарной смеси на два продукта с составами,
отличными от чистых компонентов, вместо формулы (5.26)
следует использовать выражение |14, 15]
Zp min = ' 1пХм1 + (1 - Хщ) ln(! - *М1) -
(А/7^)1Х(Л1)1 + (1 X(Jj)l) ln(l ХЦ)])1
+ (1 ~ X(J2)l^nU “ Х(Л2)])1Ь (5-31)
где хм], х(Л)|, x(aai ~ молярные доли компонента 1 в разделяемой
смеси (И) и продуктах разделения (Т, и Л2); при этом А}/М =
= <ХМ1 - Х(Л2)1)/(ХЫ1)1 - хы2)Л А2/М= 1 - AJM.
В ВРУ часто приходится совмещать процессы разделения
смеси и ожижения одного из получаемых продуктов. При опреде-
лении минимальной работы получения жидкого кислорода и
газообразного азота из воздуха процесс можно представить в виде
двух обратимых процессов: разделения воздуха на газообразные
азот и кислород; ожижение кислорода. Тогда минимальная
работа, отнесенная к 1 молю кислорода,
= ('рпыА + U- (5'32)
253
5.2. Минимальная работа, кДж/моль, получения жидких
кислорода или азота из воздуха при полном его разделении
на чистые О2 и N2 (начальная температура То = 303 К,
воздух принят за бинарную смесь О2 — N2)
Продукт р rninX’ (разделение воздуха) min (ожижение продукта) min (получение жидкого продукта из воздуха)
Кислород 6,18 20,74 26,92
Азот 1,63 22,12 23,75
где (/pmin), — минимальная работа разделения воздуха [см. форму-
лу (5.27)]; — минимальная работа ожижения 1 моля кислоро-
да [см. формулу (5.14)].
При разделении воздуха (при р(} — 0,1 МПа) на азот и кисло-
род и получении из него жидких кислорода или азота для
определения минимальной работы можно использовать данные,
приведенные в табл. 5.2 [15]; при этом верхняя строка таблицы
соответствует работе, необходимой для получения 1 моля О2,
нижняя — 1 моля N2. Подробнее процесс разделения воздуха
рассмотрен в гл. 7.
Идеальные процессы термостатирования, ожижения газов и
разделения газовых смесей можно только представить; все реаль-
ные процессы в низкотемпературных системах — необратимы,
и, следовательно, работа, необходимая для их осуществления,
существенно больше 1^. Основные необратимые эффекты, кото-
рые приходится учитывать при расчете криогенных систем, сле-
дующие: 1) приток теплоты из окружающей среды; 2) разности
температур между потоками вещества при теплообмене; 3) поте-
ри давления вследствие трения в трубопроводах и элементах
системы; 4) дросселирование; 5) отсутствие фазового равновесия
между фазами при массообмене.
§ 5.2. КЛАССИФИКАЦИЯ КРИОГЕННЫХ УСТАНОВОК И
ЦИКЛОВ
Циклы криогенных установок многочисленны и разно-
образны. Известно, что последовательная совокупность отдель-
ных процессов, составляющих цикл, может быть реализована
различным сочетанием этих процессов, в результате возникло
многообразие циклов, причем их число продолжает увеличи-
254
ваться. Это обстоятельство приводит к необходимости классифи-
цировать установки и циклы для сведения многочисленных
вариантов в единую, логически обоснованную систему.
В основе классификации должны лежать существенные
признаки, изменение которых приводит к появлению новых
элементов в структуре циклов. Число таких признаков довольно
велико; в первую очередь к ним могут быть отнесены следую-
щие: назначение цикла; способы получения холода (типы термо-
динамических процессов охлаждения); число ступеней охлаж-
дения; вид и число рабочих веществ; температурный уровень
охлаждения; полезная холодопроизводительность; типы приме-
няемого оборудования и др.
Приводимая ниже система классификации использует два
наиболее существенных признака — назначение установки и
способ получения холода. Эта система может быть развита при
использовании других признаков.
По назначению все криогенные установки подразделяют на
четыре основные группы, рефрижераторные, ожижительные,
комбинированные и газоразделительные.
1. Рефрижераторные установки. Эта группа
обширна и предназначена для решения таких задач криогеники,
как охлаждение и термостатирование. Как правило, эти задачи
решают одновременно; объект охлаждают до заданного тем-
пературного уровня и поддерживают в этом состоянии компен-
сацией притока теплоты с помощью того или иного процесса
охлаждения.
В качестве примера можно указать криогенные рефрижератор-
ные установки для охлаждения и поддержания низкой темпера-
туры в исследовательских криостатах, в системах инфракрасной
техники и квантовой электроники, высоковакуумных камерах,
сверхпроводящих устройствах (генераторы, двигатели, кабели,
магниты и др.), в биологии и хирургии, а также в ряде других
областей науки и техники.
Каждая область применения обусловливает определенные тре-
бования к температуре, холодопроизводительности, массе, габа-
ритам, энергозатратам, времени пуска, надежности и другим
характеристикам установок. Следствием этого является различие
типов применяемых циклов.
2. Ожижительные установки. Для решения
другой основной задачи криогеники — перевода вещества в жидкое
состояние, а иногда и в твердую фазу — применяют ожижительные
установки. При использовании термина «ожижительный цикл»
255
необходимо подчеркнуть, что понятие «цикл» относится к замкну-
тым круговым процессам, когда система возвращается к началь-
ному состоянию. Однако при ожижении газа цикл замыкается
не полностью, часть рабочего вещества отводится в жидком
состоянии. Для удобства изложения в дальнейшем будем приме-
нять термин «цикл» и для ожижения газа, понимая под процессом
простые случаи изменения состояния (сжатие, теплообмен,
расширение и пр.), а под циклом — комплекс этих процессов. Это
относится и к газоразделительным установкам, производящим
жидкий продукт. Наиболее широко криогенные ожижительные
системы применяют для ожижения природного газа (метана),
кислорода, азота, водорода, гелия. Каждое вещество имеет свою
температуру конденсации - от 112 К для метана до 4,2 К для гелия.
Кроме того, сильно различаются производительности установок —
от нескольких литров ожиженного криоагента в час до десятков
тысяч литров в час. Крупные установки должны иметь более
экономичные и, следовательно, более сложные циклы.
3. Комбинированные установки. В
настоящее время широко применяют установки, позволяющие
одновременно (или последовательно) ожижать газ и производить
термостатированис в рефрижераторном режиме. Такое совмеще-
ние функций делает установки наиболее универсальными, гиб-
кими, способными решать различные задачи. Наиболее распрост-
ранены гелиевые ожижители-рефрижераторы.
4. Газоразделительные установки.
Разделение газовых смесей на составные компоненты также
относится к основным задачам криогеники. В процессе разделе-
ния, как правило, газовую смесь охлаждают до температуры
конденсации.
Основная исходная газовая смесь — это атмосферный воздух,
из которого получают азот, кислород, аргон, а также редкие газы
(криптон, ксенон, неон). Такие же процессы используют для раз-
деления природных и попутных газов, для выделения редких изо-
топов. Установки формируют с учетом свойств рабочего вещес-
тва, производительности, вида получаемого продукта и ряда
других факторов.
Классификация криогенных установок по назначению
(рис. 5.14) дает наглядное представление об областях применения
криогенных систем. Однако такой подход к классификации не
может быть исчерпывающим, поскольку не учитывает термо-
динамических факторов. Необходимо подчеркнуть, что один и
тот же термодинамический цикл может быть применен в
256
s
n
S
<v
i
s
ex
о
о
ex
о
t=5
о
17 Заказ № 1592
Рнс. 5.14. Схема классификации криогенных установок по назначению
257
рефрижераторных, ожижительных и газоразделительных установ-
ках, выполняющих различные задачи.
В связи с этим необходима классификация по способу
получения холода, позволяющая подразделять циклы на группы,
каждая из которых включает ряд типов в зависимости от
процесса охлаждения. Будем учитывать только те процессы,
которые достаточно широко применяют на практике.
1. Циклы на основе термомеханической системы, для которой
рабочей средой является газ или жидкость. В этой системе про-
цессы осуществляются под воздействием давления р (обобщен-
ной силы) на объем v (обобщенную координату). В этих циклах
используют следующие термодинамические процессы охлаж-
дения: дросселирование, расширение в детандере, выхлоп из
постоянного объема, изотермическое расширение с подводом
теплоты, испарение жидкого криоагента. В ряде циклов исполь-
зуют сочетание этих процессов.
2. Циклы с использованием рабочей среды в твердом состоя-
нии. В этих циклах применяют такие процессы охлаждения, как
адиабатное размагничивание и термоэлектрическое охлаждение.
3. Циклы на основе свойств изотопов гелия. К этой группе
можно отнести циклы, использующие особые свойства такой
рабочей среды, как ожиженные изотопы гелия 3Не и 4Не. В
частности, достаточно широко применяют процесс растворения
3Не в 4Не.
Первая из указанных групп циклов наиболее обширна и
является основной в криогенной технике, поскольку в промыш-
ленных установках используют именно термомеханическую
систему. Адиабатное размагничивание и растворение 3Не в 4Не
предназначено главным образом для получения сверхнизких
температур (ниже 1 К). Эти системы используют в физических
экспериментах; промышленного применения они практически
не имеют.
В схему классификации циклов по способу охлаждения
(рис. 5.15) дополнительно включены циклы КГМ; нестационар-
ность процессов и особая организация способа регенерации
теплоты в этих устройствах существенно изменяют структуру
цикла и конструкцию системы.
Отдельно выделены методы охлаждения, находящиеся в
стадии разработки и лабораторных исследований. Возможно,
некоторые из этих методов со временем получат широкое
применение.
258
Криогенные циклы и методы охлаждения
I_______________
В стадии разработки
Газ,
жидкость
(термомех а-
инческие
системы)
I___________________
Широко используемые
Термоэлектрическое
охлаждение
Тепловой эффект
смешения
Десорбционное
охлаждение
Электрокалорнческое
охлаждение
Термомагнитное
охлаждение
Намагничивание
сверхпроводников
Механокалорнческий
эффект
Адиабатная
кристаллизация 3Не
Твердые
вещества
Адиабатное размагничивание
Деформация упругой
среды
Изотопы
гелия
Растворение 3Не в 4Не
Рис. 5.15. Схема классификации циклов по способу охлаждения
Дальнейшее развитие данного подхода к классификации
состоит в более детальном рассмотрении каждого типа циклов,
так как один и тот же процесс охлаждения может быть применен
в разных вариантах. Пример такой более детальной классифи-
кации циклов дан на рис. 5.16 применительно к системам,
использующим процесс дросселирования. Простое дросселиро-
вание дополняют предварительным охлаждением в разных
вариантах, вводят циклы с двойным дросселированием. Развитие
многоступенчатого процесса дросселирования приводит к циклам
с дросселированием смеси рабочих веществ. Возможны циклы
с полезным использованием энергии расширенного потока.
17* 259
Циклы с дросселированием (i = const)
Рис. 5.16. Схема классификации циклов с дросселированием
Очевидно, общая исходная схема классификации совместно с
ее более детальной расшифровкой позволяет установить место
каждого цикла во всем многообразии криогенных устройств.
§ 5.3 РЕАЛЬНЫЕ ЦИКЛЫ. ХОЛОДОПРОИЗВОДИТЕЛЬНОСТЬ,
ПОТЕРИ, ЭФФЕКТИВНОСТЬ РЕАЛЬНЫХ ЦИКЛОВ
Идеальные циклы, рассмотренные в § 5.1, представляют инте-
рес прежде всего как эталоны для сравнения, образцы для
возможного совершенствования реальных систем. Все процессы,
протекающие в реальных условиях, в той или иной степени
необратимы; следствием этого является существенное различие
характеристик идеальных и реальных циклов. Это различие
сказывается в уменьшении холодопроизводительности и увеличе-
260
нии затрат энергии, необходимой для получения одного и того
же эффекта по сравнению с идеальными циклами.
Таким образом, к основным характеристикам реальных
циклов относятся холодопроизводительность и минимальная
работа.
Холодопроизводительность. В начале § 5.1, где дано опреде-
ление этой характеристики, она рассмотрена применительно к
идеальным циклам. В реальных системах холодопроизводитель-
ность 0Х (Вт) определяется также произведением ее удельной
величины <7Х (Дж/кг) на расход G (кг/с):
бх = Gqx. (5.33)
Следует различать полную и полезную холодопроизводитель-
ность. Независимо от вида реального цикла его полную удель-
ную холодопроизводительность можно определить как уменьше-
ние энтальпии единицы массы рабочего вещества А/ во всех
холодопроизводящих процессах данного цикла (см. гл. 4), т.е.
^х.полн 2 ’ ^х.полн ^х.полн ’ (5.34)
к
Полезную удельную холодопроизводительность определяют
как разность между ее полной величиной <7Х 110ЛН и суммой
удельных потерь холодопроизводительности q^.
Ух Ух.тюлн Z Уп i (5.35)
Потери холодопроизводительности, определяемые необрати-
мостью различных процессов в реальных системах, включают
различные составляющие:
Е = <7Н + + «ут + (5-36)
где qH — потери от неполноты рекуперации теплоты; qz — потери
от теплопритоков из окружающей среды; q^ — потери от утечек.
Более подробно отдельные составляющие потерь и их значе-
ния рассмотрены в § 6.1.
Понятие холодопроизводительности применяют не только к
рефрижераторным, но и к ожижительным циклам. Отличие ожи-
жительных циклов состоит в том, что их холодопроизводитель-
ность реалйзуется не в виде теплового потока, отводимого от
охлаждаемого объекта, а в виде выводимой из системы части
потока рабочею вещества с пониженной энтальпией.
261
В ожижительных циклах используют понятие коэффициента
ожижения х, равного отношению количества ожиженного газа
к количеству поступившего газа. Коэффициент х определяет
долю рабочего вещества, перешедшего в жидкое состояние и
полученного из установки в виде полезного продукта. Для
идеального цикла х = 1. Удельная холодопроизводительность
определяется теплотой, отведенной от газа в процессе его
ожижения,
qK = х (/) - if) , (5.37)
где /j — энтальпия газа при температуре окружающей среды;
ij-— энтальпия жидкости.
Минимальная работа. Для получения полезного эффекта
(холодопроизводительности) необходимо совершить работу
(затратить энергию), зависящую от вида используемого термо-
динамического цикла. В идеальных циклах эта работа мини-
мальна и определяется зависимостями, приведенными в § 5.1.
В реальных циклах кроме минимальной работы Lmn совершается
дополнительная работа АЛ для компенсации потерь, обуслов-
ленных необратимостью процессов в реальных системах. В
наиболее распространенных термомеханических криогенных
системах основной составляющей является работа, совершаемая
при сжатии компрессором рабочего вещества.
Работа сжатия 1 кг идеального газа
Лк= Т?Г01п(р2/Л)/т]ю, (5.38)
где R — газовая постоянная; р21Р\ — отношение давлений;
г]из — изотермический КПД.
Полные затраты энергии равны совершенной работе
L = ± Лдоп, (5.39)
где Лдоп — дополнительная работа, совершенная, например, за
счет внешних источников холода, таких, как сжиженный крио-
агент, криогенная машина (+ЛД0П), или энергии, возвращаемой
в детандерах (-*Ддоп).
Способы расчета Лдоп приведены в гл. 6 применительно к кон-
кретным циклам.
На практике широко используют понятие удельного расхода
энергии и удельной работы /0 — отношения полной работы L к
полученному эффекту (холодопроизводительности qK, доли х
жидкости, доли М: продуктов разделения):
262
для рефрижераторных циклов (Дж/Дж)
/0 = Л/<7Х; (5.40)
для ожижительных циклов (кДж на 1 кг жидкости)
/0 = L/x ; (5.41)
для газоразделительных циклов (кДж на 1 м3 продукта)
/0 = L/Mt. (5.42)
При проектировании криогенных систем стремятся так
выбирать параметры циклов, чтобы обеспечить минимальное
значение /0.
При проведении термодинамического анализа криогенных
циклов используют другое выражение для определения полной
работы, позволяющее выявить влияние отдельных видов потерь
на суммарную работу и эффективность цикла. Это выражение,
следующее из второго начала термодинамики, в соответствии с
(2.21) записывают так:
= А™ + (5.43)
где Lmin — минимальная работа, совершаемая в идеальном
обратимом цикле; АЛ = То £ As,- — дополнительная работа,
необходимая для компенсации потерь (То — температура окру-
жающей среды); £ As,. — суммарное изменение энтропии всех
тел, участвующих в данном процессе или цикле.
Значение As, для каждого отдельного процесса (элемента)
криогенной установки обусловлено потерями. Непосредственная
связь между As,. и потерями рассмотрена в гл. 6.
Формулу (5.43) широко используют для термодинамического
анализа криогенных установок. Этот анализ позволяет опреде-
лить влияние потерь в отдельных элементах (машинах, аппара-
тах) и указывает пути повышения экономичности криогенных
систем. Наряду с удельной холодопроизводительностью и удель-
ной работой используют и другие характеристики, позволяющие
сопоставить криогенные циклы и оценить их эффективность.
Холодильный коэффициент е представляет собой отношение
полезной холодопроизводительности qK к совершенной работе:
е = qJL . (5.44)
263
Холодильный коэффициент е является не термодинамической
характеристикой, а лишь мерой эффективности охлаждения на
единицу совершенной работы. Коэффициент е используют для
сопоставления между собой циклов, работающих на одинаковых
температурных уровнях и выполняющих одинаковую задачу.
Холодильный коэфициент больше для цикла, в котором потери
и, следовательно, затраты энергии меньше. Из формул (5.40) и
(5.41) следует, что коэффициент г — величина, обратно пропор-
циональная /0. Для идеального рефрижераторного цикла Карно
в соответствии с формулами (5.5) и (5.6)
ес = VU = гх/(^о - К). (5.45)
Для идеального ожижительного цикла в соответствии с фор-
мулами (5.15) и (5.14)
еид = 0'1 - *})/1 го(Д - М - О'] - у)]. (5.46)
Степень термодинамического совершенства т|7 , иногда
называемая термодинамический КПД, характеризует эффектив-
ность реального цикла по сравнению с соответствующим идеаль-
ным прототипом. Это понятие широко используют в криогенной
технике; r|t позволяет оценить потери холодопроизводительности
от необратимости процесса, установить их относительное значе-
ние. Степень термодинамического совершенства определяют как
отношение холодильного коэффициента реального цикла ер к
холодильному коэффициенту эквивалентного идеального цикла
£ид-
П,= %/еид- (5-47)
Очевидно, что всегда т| < 1, и только при полной обратимости
цикла г]7 = 1. Величину г]7 можно выразить и другим способом.
Так как у сопоставляемых циклов (реального и идеального)
должна быть одинаковая холодопроизводительность qK, с учетом
формулы (5.44) запишем
Ч,= -^~= L,„JL. (5.48)
л' ^min
Таким образом, значение Г]; легко вычислить как отношение
затрат энергии в идеальном и реальном циклах. Необходимо
уточнить, что под идеальным циклом обычно понимают обра-
тимый цикл, термодинамически наиболее совершенный для
реализации данной задачи. Так, для термостатирования при
264
постоянной температуре 7’х идеальным является цикл Карно;
тогда с учетом формулы (5.45) можно записать
Пг=Ер/ес = ер(Т0/7;- !)• (5-49)
Для идеального цикла ожижения с учетом формулы (5.46)
получим
Пг = £р ДИд = Ер[Г0(51 - sf) - (/[ - /})] /(/) - if) . (5.50)
Приведенные формулы просты и удобны, однако они характе-
ризуют влияние потерь интегрально, не позволяя оценить эффек-
тивность отдельных процессов и элементов в криогенных уста-
новках. Более глубокую характеристику реальных циклов можно
получить, используя формулу (5.43). Из выражений (5.43) и (5.48)
Пг= (Л - Tol^)/L = 1 - injL . (5.51)
i i
Ранее отмечено, что выражение = ЪП(= Пх + П2 +
i i
+ ... + Пп является суммой дополнительных затрат энергии
вследствие потерь от необратимости отдельных процессов крио-
генного цикла. Таким образом, формула (5.51) позволяет анали-
зировать структуру величины Г| t и определять влияние отдельных
потерь П1 = T0Ast на степень термодинамического совершенства.
При этом суммарную необратимость всего цикла выражают через
необратимости отдельных простых процессов. Применение фор-
мулы (5.51) для термодинамического анализа криогенных циклов
показано в § 6.6.
Эксергетический КПД т|г — это отношение потоков эксергии,
отведенной из системы Е и подведенной к ней Ео:
Д = Е/Е,. (5.52)
Отводимая эксергия является разностью подводимой эксергии
и ее потерь 'LE^ , т.е. Е = £() - ^Eni. Очевидно, для обратимых
процессов Zfnj = 0 и Е = Ео (т|е = 1).
Исследование потоков эксергии и ее превращений в различ-
ных элементах криогенных установок даст информацию о термо-
динамическом совершенстве этих элементов и установки в целом
[4J. Для вычисления т|е необходимо знать потоки эксергии и
их зависимость от параметров состояния системы. Эксергию
можно определить по эксергетическим диаграммам или по фор-
муле En = I - То s . Эксергетический КПД т|е, как и термодина-
мический [см. формулу (5.51)], используют для термодинами-
ческого анализа криогенных процессов и циклов.
265
Рассмотренные характеристики циклов широко применяют
при расчете и анализе криогенных систем. Следует отметить, что,
как правило, невозможно обеспечить оптимальное значение
сразу всех характеристик. Так, высокие удельная холодопроизво-
дительность qK и коэффициент х часто не соответствуют высо-
кому холодильному коэффициенту е и минимальному расходу
энергии. По этой причине в каждом конкретном случае к
криогенной установке предъявляют определенные требования,
удовлетворение которых создает паи лучшие условия работы.
Расчет цикла обычно сопровождают его оптимизацией, суть
которой состоит в выполнении серии расчетов при изменении
различных параметров (давлений, температур, допустимых потерь
и др.). В результате принимают те значения параметров, которые
обеспечивают оптимальные или близкие к оптимальным показа-
тели по одной или нескольким характеристикам. Наиболее
полную информацию об эффективности циклов, источниках
потерь и методах их уменьшения дает термодинамический анализ
с использованием соотношений (5.51) или (5.52).
§ 5.4. ЭНЕРГЕТИЧЕСКИЙ БАЛАНС ОТДЕЛЬНЫХ
СТУПЕНЕЙ ОХЛАЖДЕНИЯ
Каждая криогенная установка имеет в своей основе низкотем-
пературный термодинамический цикл, представляющий собой
совокупность различных процессов. Для термо механической сис-
темы такими процессами обычно являются сжатие, теплообмен,
расширение. Криогенная установка обеспечивает необходимый
эффект (охлаждение, термостатирование, ожижение) в результате
последовательной реализации этих простых процессов. Конст-
руированию и разработке криогенной установки обычно пред-
шествуют выбор термодинамического цикла и его расчет.
В задачи расчета цикла входят определение потоков теплоты
и массы рабочего вещества, а также определение параметров
состояния во всех характерных точках. При расчете цикла многие
исходные данные обычно приходится выбирать заранее, в част-
ности КПД машин, давления потоков, температуры, теплоприто-
ки из окружающей среды, гидравлические потери и др. Выбран-
ные и найденные в результате расчета параметры криогенной
установки должны соответствовать оптимальным значениям тех
или иных показателей эффективности (см. § 5.3). Несмотря на
многочисленность и разнообразие криогенных циклов, их расчет
можно построить на основе единого подхода к самым различным
вариантам, на единой методологической основе.
2(16
Сущность такого подхода состоит в том, что любой сложный
цикл можно представить как последовательную совокупность от-
дельных ступеней охлаждения. На каждой ступени осущест-
вляется какой-либо процесс охлаждения, обеспечивающий функ-
ционирование ступени и цикла в целом. Чаще всего используют
такие процессы, как дросселирование, расширение в детандере,
их сочетание, а также внешнее охлаждение (ожиженным
хладагентом или с помощью отдельного холодильного цикла).
Несмотря на разнообразие криогенных циклов число вариан-
тов их ступеней сравнительно невелико. Очевидно, для построе-
ния общего метода расчета нужно получить формулы, позволяю-
щие определить все расчетные характеристики для отдельных
типовых ступеней. Формулы для вычисления потоков теплоты
и массы обычно получают из уравнений энергетического и
материального баланса для отдельных ступеней охлаждения.
Метод энергетического баланса широко применяют при
расчете криогенных установок и систем. Он базируется на
фундаментальном физическом принципе сохранения энергии.
В общей форме принцип сохранения энергии представлен в гл. 2
[уравнением (2.6)], где рассмотрены и различные частные случаи.
При расчете криогенных циклов чаще всего приходится иметь
дело с открытыми термомеханическими системами, работаю-
щими в стационарном режиме. В этом случае, исходя из общей
формулы (2.6), получим следующее выражение энергетического
баланса:
+ + (5.53)
i i i
где Lt — работа, численно равная энергии, полученной или
отданной системой, Дж; G) — масса z-го потока, поступающего
в систему или покидающего ее, кг; ii — удельная энтальпия
потока G), Дж/кг; Qi — теплота, получаемая или теряемая
системой, Дж.
Следует учесть, что такими составляющими энергетического
баланса, как изменение кинетической и потенциальной энергии,
пренебрегают. При использовании уравнения (5.53) необходимо
учитывать знаки величин.
Порядок использования формулы (5.53) применительно к
криогенным циклам рассмотрен ниже для отдельных ступеней
охлаждения. Уравнение энергетического баланса обычно состав-
ляют, приняв за единицу поток, вводимый в цикл (поступающий
из компрессора), т.е. С?к = I. Этот прием является наиболее
общим для ожижительных, рефрижераторных и газораздели-
тельных циклов.
267
Рассмотрим некоторые, наиболее часто встречающиеся в
криогенных циклах ступени охлаждения и составим для них
уравнения энергетического баланса. Есть определенное различие
для ступеней ожижительных и рефрижераторных циклов, поэто-
му последовательно рассмотрим вначале ступени ожижительных
циклов, а затем их варианты, применяемые для рефрижера-
торных криогенных систем.
Ожижительные циклы. Ступени с внешним ох-
лаждением. На рис. 5.17, Z7, б приведены схемы двух вари-
антов таких ступеней, на рис. 5.17, в показан процесс охлажде-
ния в диаграмме Т — s.
Вариант по рис. 5.17, а предусматривает использование жид-
кого хладагента (поток Go) в качестве источника внешнего охлаж-
дения. Поток (?0 поступает в сосуд С (точка 6), где кипит, испа-
ряется и отводит теплоту от рабочего вещества &, температура
которого при этом понижается от Т3 до (точки 3~4\, здесь и
далее цифровые индексы соответствуют номерам точек на схемах
и диаграммах. Жидкость получают в отдельных установках или
во вспомогательном цикле, функционирующем параллельно с
основным. Для этой цели обычно используют такие вещества,
как аммиак, фреон, азот, водород и др.
Вариант по рис. 5.17, б предусматривает отвод теплоты от
основного потока с помощью КЕМ или газового цикла. Как и
в предыдущем варианте, теплота отводится в интервале темпера-
Рис. 5.17. Схемы ступеней с внешним охлаждением:
а — схема с использованием жидкого азота; б — схема с криогенной газовой
машиной; в — диаграмма Т— s
268
тур от Т3 до Т4. Индексы во всех характерных точках и обозначе-
ния потоков для обоих вариантов одинаковы. Последователь-
ность протекания всех процессов в ступени следующая. Прямой
поток рабочего вещества Gf поступает при температуре Т2 с
давлением р2. Этот поток проходит теплообменник Т, в котором
охлаждается обратным потоком до температуры Т3; затем для
снижения температуры от Т3 до Т4 теплота отводится внешним
источником. Охлажденный до температуры Т4 прямой поток
направляется в следующую ступень. Идущий в обратном
направлении холодный поток поступает с температурой Т\; в
количестве Gj - х (х — доля ожиженного газа, отведенного из
цикла на его заключительном этапе). Обратный поток подогрева-
ется в теплообменнике до температуры Тг и выводится из
ступени. Давление обратного потока р(, разности температур
между потоками (обусловленные неполнотой рекуперации
теплоты): &7\ на верхнем (теплом), ДТ5 на нижнем (холодном)
уровне температур ступени; приток теплоты из окружающей
среды qc. Запишем уравнение энергетического баланса, из кото-
рого найдем количество теплоты <?0, отводимой внешним источ-
ником, а также необходимую массу (70 охлаждающего потока:
Gi Z2 + (Gi ’ X)Z5' + Gi Чс + G>) Z6 = Gi Z4 +(Gi - X)‘r + G0 Z7 •
Энтальпии обратного потока в точках Т и 5 (см. диаграмму
Г- 5)
Zr = h - Cp^TV k- = Z5 - Cp^T5 (5-54)
Сгруппировав члены уравнения энергетического баланса,
получим
Ч0 = Go(iT - ‘б)=х (‘г - ‘5> + Gi KZ5 - Z4> - (Z1 - Z2) + Cp (A Tl - A T5> + tfj-
Введем обозначения:
(г5 - *4) ~ ^т5 ’ (z'i ~ z2) ~ АгГ[ ’ (5.55)
где Az'y, и &iT — изотермические эффекты дросселирования на
основных уровнях температур соответственно Т5 и Т\.
С учетом принятых обозначений окончательно запишем
Ч0 ~ GoUt ~ Zfi) ~ Х (Zr z5') Gi [(Azr5 - Azrl) Ср(А^1 " A^) 4cl-
(5.56)
269
Правая часть формулы (5.56) определяет полную удельную
холодопроизводительность данной ступени, левая часть — холо-
допроизводительность q0 внешнего источника, необходимую для
компенсации этих затрат. Из формулы (5.56) можно найти массу
охлаждающего потока (?0.
Ступень с расширением потока в де-
тандере. На рис. 5.18, а дана схема ступени, на рис. 5.18, б
показан процесс в диаграмме Т — .v. В данном случае реализуется
внутренний процесс охлаждения расширением в детандере части
основного потока рабочего вещества. Прямой поток Gt + Dt
поступает при температуре Т3 с давлением р3. Этот поток
охлаждается в теплообменнике Т1 в интервале температур от Т2
до Т3, затем часть его Dt идет в детандер Д, где расширяется до
давления рх обратного потока; при этом его температура пони-
жается до Ту. В идеальном детандере процесс расширения изо-
энтропный с совершением внешней работы (5 = const), разность
энтальпий в этом процессе his: в действительности КПД
детандера т]й < 1 и изменение энтальпии при расширении в
детандере /г&т|^ = i3 - i5.. Остальное количество Gt рабочего
вещества проходит теплообменник Т2, где охлаждается обратным
потоком и покидает ступень при температуре Т3. Обратный поток
Gi — х входит в ступень при температуре Ту и смешивается с
Рис. 5.18. Процесс охлаждения в ступени с расширением потока в детандере:
а — схема; б — диаграмма 7 — s
270
потоком Di. Далее весь поток (общее количество газа G + £). —
— х) проходит теплообменники Т2 и Т1, где подогревается до
температуры Т\. , и выходит из ступени. Неполнота рекуперации
и приток теплоты, как и в предыдущем случае, обозначены АГ
и #с. Для определения количества расширяющегося потока D и
его холодопроизводительности Цд составим уравнение энергети-
ческого баланса:
(& + Д,)/2 + (G, - х)/5. + G, дс = (?, /4 + ((?,. + Д,- - х)/’. + Д,. /д,
где /д — работа расширения газа в детандере:
1П = = 'з - '5- (5-57)
Использовав соотношения (5.54) и (5.55), преобразуем уравне-
ние энергетического баланса:
<7д = Л(АЛ + А/7, - 6рД Г1) = +
+ <д[(А/7;. - А/^) + с, (А Г] - АГ5) + де]. (5.58).
Правая часть этого уравнения определяет затраты холода на
данной ступени, левая - необходимую холодопроизводительность
Уд. В этом случае холодопроизводительность реализуется при рас-
ширении потока Д; и определяется изменением энтальпии в де-
тандере h,r г] iy, а также изотермическим эффектом дросселирования
№т. Из суммарного эффекта охлаждения исключают потери вслед-
ствие неполноты рекуперации ср А 7).
Возможны и другие варианты ступеней с детандером. Приме-
няют ступень, в которой весь прямой поток Gi + Д; проходит
теплообменники TI и Т2 и расширяется до промежуточного
давления р (pi < рпр < а затем поступает в следующую
ступень. Используют также вариант, когда поток £); проходит
через детандер в соответствии со схемой на рис. 5.18, а,
расширяется до давления /?пр и после детандера идет в последую-
щую ступень. Циклы с такими ступенями рассмотрены в гл. 6.
Уравнения энергетического баланса аналогичны по структуре
выражению (5.58), но включают энтальпию при неизвестном
промежуточном давлении рп .
Ступень с расширением потока в
дроссельном устройстве. На рис. 5.19 даны
схема ступени с дросселированием и изображение процесса в
диаграмме Т — х. Ступень с дросселированием обычно относится
271
Рнс. 5.19. Процесс охлаждения в ступени с дросселированием:
а — схема; б — диаграмма T—s
к ступени окончательного охлаждения; она замыкает цикл и
создает полезный эффект на самом нижнем уровне температур
Ту = Tj. Поступающий при температуре Т2 поток Gt (i = ri) охлаж-
дается в теплообменнике Т до температуры Т3, дросселируется
до состояния, соответствующего точке 4 (двухфазной области).
В результате образуется смесь жидкости и пара (/^ — энтальпия
жидкости, /5, — энтальпия пара). Полученная жидкость в коли-
честве х отводится от установки; таким образом реализуется
полезный эффект ожижительного цикла. Пар в состоянии 5
поступает в теплообменник Г, где подогревается до температуры
Ту и выводится из ступени. Значения А 7^ и qc соответствуют
неполноте рекуперации теплоты в теплообменнике и тепло-
притоку из окружающей среды. Из уравнения энергетического
баланса ступени Gni2 + Gnqc — xi^-T (Gn — x)z’r с учетом (5.54) и
(5.55) получим холодопроизводительность <?др, реализуемую при
расширении потока в дросселе,
<4р = Gn^T, = х(;г - + Gn(cP^Ti + Че)- (5-59)
Изотермический эффект дросселирования Д/'7 при тем-
пературе входа в ступень Тг = Т2 определяет холодопроизводи-
тельность, а правая часть формулы (5.59) — затраты холода.
272
Рефрижераторные циклы. В рефрижераторных циклах жид-
кость не отводится (х = 0); при этом по замкнутому контуру
циркулирует одно и то же количество рабочего вещества —
прямой поток равен обратному. Другая особенность состоит в
том, что на некоторых (главным образом, нижних) ступенях
окончательного охлаждения, обеспечивается полезная холодопро-
изводительность qK, которая отводится от охлаждаемого объекта.
Характер распределения по ступеням полезной холодопроизво-
дительности qK зависит от типа охлаждаемого объекта и условий
работы рефрижераторной установки. Рассмотрим некоторые
варианты ступеней рефрижераторных циклов.
Ступени с внешним охлаждением. Эта
схема для рефрижераторного режима аналогична схеме для
ожижительного цикла (см. рис. 5.17), однако прямой и обратный
потоки Gt равны (х = 0). Уравнение энергетического баланса в
этом случае имеет вид
/2 + Gt i5. + Gt qc + Go i6 = Gt i4 + Gt iv + Go iT .
Сгруппировав члены и введя замену в соответствии с форму-
лами (5.54) и (5.55), получим выражение для холодопроизводи-
тельности на этой ступени:
«о = Go<Jt - = W'r5 - Д'/)) + ср№т1 - + (5-60)
Ступень с расширением в детандере.
Отличие схемы для рефрижераторного режима от схемы, при-
веденной на рис. 5.18, заключается лишь в равенстве прямого и
обратного потоков. Уравнение энергетического баланса имеет вид
(<7 + Д)/2 + б-/5. + Gz = Gti4 + (С. + Д.)/г + L\ /д.
Выполнив преобразования и использовав ранее принятые
обозначения, получим выражение для холодопроизводитель-
ности, создаваемой расширенным в детандере потоком:
<?д = Di(h^is + Д'т, - СР^Т1) = Gi 1<Д'т5 - Д^) + ср<^Т\ - Д Ts) + qc}.
(5.61)
Сопоставление уравнений (5.60) и (5.61) с формулами (5.56)
и (5.58) показывает, что в рефрижераторном режиме затраты
холода меньше, чем в ожижитсл ,ном, так как х = 0.
18 Заказ ,\'i 1392
273
Ступени окончательного охлаждения
с расширением в детандере и дроссельном устройстве. Эти
ступени замыкают цикл и обеспечивают полезный эффект
(холодопроизводительность qK) на самом нижнем температурном
уровне Гх. Схемы обоих вариантов приведены на рис. 5.20.
Прямой поток охлаждается в теплообменнике в интервале
температур от Г2 до Т3. После расширения в детандере или в
дросселе (процесс 3-4) температура потока снижается до
минимального значения Т4 = Тк. Далее в теплообменнике Т2
рабочее вещество подогревается (процесс 4-5'); при этом
отводится теплота от охлаждаемого объекта, т.е. реализуется
полезная холодопроизводительность qK = Gn(js - /4). При
использовании варианта с детандером рабочее вещество находит-
ся в газообразном состоянии, поэтому в процессе его подогрева
(процесс 4-5') температура потока повышается. При использова-
нии варианта с дросселем рабочее вещество обычно находится
в двухфазном состоянии (влажный пар) и Г4 = Т-. = const.
Уравнение энергетического баланса для ступени с расширением
в детандере имеет вид
Gn
(5.62)
h + 4К+ Gnqc- Gn ir + Gn /д .
Рис. 5.20. Схемы ступеней окончательного охлаждения рефрижераторных циклов:
а — с дроссельным вентилем; о — с детандером
274
Использовав ранее принятые обозначения и замены, получим
следующее выражение для полной холодопроизводительности
ступени:
<?Д = Gn<hns^ns + = <?х + Gn<SAri + ^)- <5’63)
Аналогичным образом составляют уравнение энергетического
баланса для ступени с расширением в дроссельном вентиле ДВ:
Gn h + ?х + GA = Gn h-’
отсюда
<7др = GnAir} = «х + Gn(Cp^\ + «Л (5-64)
Затраты холода [в правых частях формул (5.63) и (5.64)] ком-
пенсируются соответствующими процессами охлаждения —
расширением в детандере и дросселированием сжатого газа.
Рассмотренные примеры иллюстрируют методику составления
уравнений энергетического баланса для ожижительных и рефриже-
раторных ступеней с различными процессами охлаждения. Приме-
ры являются типовыми и не исчерпывают всего многообразия воз-
можных вариантов, из которых формируются циклы криогенных
установок. Полученные зависимости (5.56) — (5.64) позволяют
сделать вывод, что затраты холода на различных ступенях можно
представить в виде общего выражения
<7/ = <?xn + Gi КА'т5 + + Ср (АЛ - А75) + (5-65)
Первое слагаемое q^ представляет собой часть холодопроиз-
водительности, затрачиваемую на создание полезного эффекта.
Для ожижительных циклов q^-x (zr - z5.) — количество теплоты,
отводимой от ожижаемой части потока. Для рефрижераторных
циклов qxj] = qx — полезная тепловая нагрузка, отводимая от ох-
лаждаемого объекта. Во многих случаях qm реализуется только
на одной нижней ступени; тогда для отдельных ступеней q = 0.
Второе слагаемое в правой части формулы (5.65) представляет
собой часть холодопроизводительности, идущую на компенсацию
потерь, включая изменение дроссельного эффекта. В дальнейшем
для краткости используем обозначение
КА'т5 - Azr) + ср(\1\ - АГ.) + ^с]( - q^. (5.66)
Рассмотрим отдельные составляющие этого выражения. Сла-
гаемое (Azr - Az'f ) равно разности дроссельных эффектов на
18*
275
нижнем и верхнем уровнях температур. Эта разность отражает
свойства реального газа, для которого всегда Д/г > Д/'г, следо-
вательно, для компенсации разности дроссельных эффектов
нужно отвести теплоту. На z-й ступени это — затраты холода,
однако при рассмотрении всего цикла в целом в итоге получают
значительный положительный дроссельный эффект на нижней
ступени окончательного охлаждения, где этот эффект полезно
используется.
Слагаемое ср (Д Т\ - Д Г5) представляет собой теплоту, эквива-
лентную разности потерь от неполноты рекуперации на верхнем
и нижнем уровнях температур ступени. В криогенных циклах
всегда 7\ > Т5, так как потери от неполноты рекуперации
уменьшаются с понижением уровня температуры, что позволяет
компенсировать основную долю этих потерь более выгодным
образом, т.е. при более высоких температурах. Если теплоемкость
обратного потока — величина переменная, то это слагаемое
равно с^^ДГ! - ср(Г5)ДГ5.
Теплоприток qc из окружающей среды необходимо компен-
сировать на каждой ступени.
Для нижних ступеней, замыкающих цикл, выражение (5.66) не-
сколько изменяется: из него исключаются отдельные слагаемые
[см. формулы (5.59), (5.63), (5,64)|. Множитель Gj в (5.65) опреде-
ляет долю рабочего вещества, покидающего данную ступень. Ана-
лиз общей формулы (5.65) позволяет утверждать, что на каждой
ступени должна быть реализована холодопроизводительность qt,
определяющаяся двумя составляющими: полезным эффектом
охлаждения qm и теплотой qYi, необходимой для компенсации по-
терь. Эта холодопроизводительность обеспечивается одним из
известных и рассмотренных выше способов охлаждения.
Таким образом, используя выражение энергетического баланса
(5.65), нетрудно записать систему уравнений, позволяющих опре-
делить все неизвестные характеристики, т.е. рассчитать цикл. Для
ожижительного цикла, состоящего из ступеней охлаждения, эта
система имеет вид
0, = x(zr - i5.\ + Grq^
Qi = x(iY - is)i+ G^^- (5.67)
Qn = x Or - + Gn Kn-
276
Для рефрижераторного цикла с полезной нагрузкой qx только
на нижней (и-й) ступени система имеет вид
2, =
(5.68)
Qn = + Gn <hn
Расчет циклов сводится к решению этих систем, причем число
уравнений равно числу ступеней охлаждения. При определении
всех искомых характеристик (G/t Dt, х, qx) необходимо дополни-
тельно использовать уравнения материального баланса.
Следует отметить, что не всегда системы (5.67) и (5.68)
замкнуты. Так, при использовании ступени с последовательным
включением детандера появляется неизвестный параметр —
промежуточное давление В этом случае необходимо зада-
ваться неизвестными давлениями или массами потоков и с
помощью расчетных уравнений согласовывать между собой все
искомые величины.
Глава 6
ЦИКЛЫ КРИОГЕННЫХ УСТАНОВОК
§6.1. СТРУКТУРА ЦИКЛОВ.
ВЫБОР ИСХОДНЫХ ДАННЫХ ДЛЯ РАСЧЕТА
При создании криогенной установки в первую очередь необ-
ходимо выбрать наиболее целесообразный термодинамический
цикл и принять оптимальные значения его параметров, чтобы
обеспечить высокие экономичность и надежность, а также прос-
тоту конструкции.
Прежде чем рассматривать конкретные схемы криогенных
циклов, остановимся на общих вопросах, решение которых
предшествует расчету цикла и определению его параметров.
Ранее отмечено, что ряд исходных данных необходимо принять
предварительно, причем этот выбор должен быть логически обос-
нованным и соответствующим оптимальным характеристикам.
Сначала следует выбрать сам цикл, т.е. его принципиальную
схему, которая обеспечит наиболее целесообразное решение пос-
тавленной задачи. При этом нужно определить: необходимое число
ступеней охлаждения, способ охлаждения на каждой ступени,
температурные интервалы (уровни) Т- каждой ступени, давления
потоков рабочего веществар}, р2. Кроме того, необходимо принять
значения допустимых потерь (вследствие неполноты рекуперации
теплоты с А Т, притока теплоты через изоляцию qc, гидравлических
потерь), КПД машин, используемых в установке. В отдельных
случаях необходим выбор и других исходных параметров.
Целесообразное число ступеней охлаждения. Рассмотрим этот
вопрос вначале применительно к ожижительным циклам. Для
этой цели обратимся к идеальному циклу (см. рис. 5.7), приняв
во внимание, что в этом цикле две стадии отвода теплоты or
ожижаемого потока. На участке 1-3 при переменной температуре
(от Г, до Гх) отводится теплота q(} = i} - ir На участке 3-J
отводится теплота конденсации при qK = i2 - у при Т* = const.
Охлаждение в интервале Г, ... Тх при переменной температуре --
характерная особенность данного идеального цикла, определяю
щая его эффективность при ожижении газа. Соотношение междх
количествами теплоты q0. отводимой при переменной темпе
278
ратурс, и теплоты qK, отводимой при постоянной температуре,
зависит от вида рабочего вещества и температуры его конденса-
ции Т. Чем ниже Т, тем меньше теплота конденсации qK по
сравнению с q{y Так, значения теплоты, Дж/моль: для азота
(Тх = 77,36 К) qn = 6500, qK = 5530; для гелия (7/ = 4,215 К)
q0 = 6150, qK = 81, т.е. для азота значения q() и qK близки, а для
гелия почти вся теплота отводится в интервале охлаждения
Л - к
В реальных циклах практически невозможно обеспечить
непрерывный отвод теплоты q{} в интервале температур Т}... Т.
Некоторого приближения к такому способу охлаждения можно
достичь применением ряда ступеней отвода теплоты на несколь-
ких промежуточных температурных уровнях. Очевидно, увеличе-
ние числа таких ступеней приближает реальный цикл к идеаль-
ному, но, с другой стороны, это усложняет цикл, затрудняет экс-
плуатацию установки, уменьшает ее надежность. Число ступеней
должно возрастать с понижением Т', однако их целесообразное
число следует определять более точно.
Рассмотрим многоступенчатый способ ожижения газа с отводом
теплоты на ряде температурных уровней 7] j, Т(, Tj+} и т.д. Для
этой цели примем схему каскадного теоретического цикла с
включением ряда детандерных последовательно соединенных
ступеней (см.рис.5.18), на каждой из которых отводится теплота
<7(. (часть qQ) от ожижаемого газа; в каждую ступень поступает поток
Gj. Отвод теплоты происходит за счет расширения в детандере
части потока рабочего вещества 7).. На рис. 6.1, а приведены две
смежные ступени этого цикла — /'-я и (/-1)-я; в общем случае
полное число ступеней равно п. На рис. 6.1, б дана диаграмма
T—s всего цикла. На последней ступени охлажденный до
температуры 7/ газ в количестве х ожижается и отводится из цикла;
все расширенные в детандерах потоки возвращаются в компрессор.
Масса газа, сжимаемого в компрессоре в интервале давлений от
до и поступающего в цикл, составляет 1 кг; очевидно, что
Z D. + х = 1 кг. Удельную работу /., которую необходимо совер-
i ‘
шить, чтобы обеспечить функционирование любой /-Й ступени,
можно определить как долю полной минимально необходимой
работы, пропорциональную массе рабочего вещества Dt. обеспечи-
вающего охлаждение на z-й ступени:
о, 1 in (р2/рх}
МиПмек]-
(6.1)
279
где первое слагаемое в квадратных скобках соответствует работе
сжатия в компрессоре, второе — энергии, возвращаемой при
расширении в детандере (г]мех — механический КПД).
Преобразуем это выражение, приняв следующие допущения:
газ идеальный, потери от неполноты рекуперации и притока теп-
лоты отсутствуют. Используем уравнение (5.58) энергетического
баланса z-й ступени такого цикла; с учетом принятых допущений
это уравнение принимает вид
<6'2)
или для идеального газа (см. рис.6.1)
DiCp(T*- Ti) = xcp(TjX - Т(), (6.3)
где Т‘ — температура потока на входе в детандер; Tt — темпе-
ратура потока после расширения в детандере.
При изоэнтропном расширении идеального газа (s = const)
температура в конце процесса
т;(Рх/р^к-х}/к. (6.4)
КПД детандера
%=(<- - т,). (6.5)
Рис. 6.1. Теоретический цикл
с каскадным включением
детандеров:
а — схема двух смежных
ступеней цикла; б — диа-
грамма Т— s
280
Исключив из уравнений (6.4) и (6.5) Ть., получим
т; = г,{1 - nji - (px/p2r wk]}-1. (6.6)
Подставив Т* в (6.3), можно записать
Z); = х(Т; _ j - Т;), (6.7)
где параметр
а, = Пв I1 ' <Р1 /Р1)(к ’ 1)Д 1 0 - По I’ - (Р\/Р2>(к' 1}/к I}’1- <6-8)
Отсюда искомое отношение потоков в (6.1)
^/х= (Т^/1]- ])/«,.. (6.9)
Тогда исходное выражение (6.1) с учетом (6.9) и соотношения
г] Л. = ср Т\ а, можно записать так:
(6.к»
'Л /' л из ai
Для исключения неизвестных температур 7] и TjA из формулы
(6.10) необходимо определить закономерность изменения темпе-
ратур от ступени к ступени. Для этого используем зависимость
(6.21), а из (6.18) и (6.17) (при а = const) найдем Т1Л/Т= "AT-JT*.
Кроме того, следует учесть работу /к, совершаемую для отвода
теплоты конденсации qK = к - i^ = г. Поскольку Т = const, то
на этом участке целесообразно применить цикл Карно; тогда
/к = г(Д\/Т* - 1). Так как полная минимально необходимая работа
в этом цикле 4 = 2 ( + /к, то окончательное выражение примет
вид
----- г \п(Рт/Р\) Li--------------------1
t- (37/7 -1) »-Т —-1- - <т; р+ чг./г, -1).
(6.П)
Влияние числа ступеней п при различных температурах кон-
денсации Тх на минимально необходимую работу в таком много-
ступенчатом цикле удобнее всего анализировать графически.
Результаты расчетов по формуле (6.11) приведены на рис. 6.2
(Tj = 300 К; к= 1,67; г|^= 0,75; г]мех = 0,8; Т]из = 0,6). Теплота кон-
денсации г = qk определена из зависимости r/l\ = 1g Тх + 8,3,
дающей удовлетворительное приближение для криогенных жид-
костей. Значение комплекса [In (p2/Pi)]/a = 2,7 минимально при
рх = 0,1 МПа.
281
Рис. 6.2. Зависимость работы ожиже-
ния от температуры Тх и числа ступеней
охлаждения п в теоретическом каскад-
ном цикле
Из рис. 6.2 следует, что
влияние числа ступеней п на
минимально необходимую
работу существенно возрас-
тает для веществ с низкой
температурой конденсации.
При 7’х > 150 К нет необходи-
мости применять многосту-
пенчатые циклы. Значения
полной минимально необхо-
димой работы при более
низких температурах Тх для ряда значений п даны в табл. 6.1.
Штриховая кривая на рис. 6.2 построена по формуле (5.14)
для и характеризует минимальную работу в идеальном цикле
ожижения.
Приведенные данные получены без учета ряда потерь, но в
принципе верно отражают влияние числа ступеней на энергети-
ческие показатели. На основании этих данных можно утверж-
дать, что для ожижения воздуха (О2, N2) достаточно применять
циклы с одной—двумя ступенями, для ожижения водорода —
циклы с двумя—тремя ступенями; при ожижении гелия число
ступеней должно быть не менее трех. Большее число ступеней
нс обеспечивает существенного уменьшения и лишь приводит
к неоправданному усложнению криогенной установки.
При выборе числа ступеней необходимо также учитывать
требования надежности и простоты эксплуатации. При разработ-
6.1. Полная минимально необходимая работа ожижения
некоторых криоагентов
Криоагент ГХ,К l.L. МДж/моль, при числе ступеней п
1 2 3 4
Воздух 80 41,5 32,0 — —
Водород 20 162 72,3 57,8 —
Гелий 4,5 660 164 101 83,3
282
ке ожижителей небольшой производительности предпочтение
отдают максимальной простоте, и число ступеней должно быть
невелико. При создании крупных энергоемких установок
вопросы экономичности играют определяющую роль;в этих
случаях применяют более сложные, но более эффективные
циклы с большим числом ступеней.
По условиям работы рефрижераторные системы отличаются
от ожижительных. Если исходить из идеального рефрижератор-
ного цикла (цикла Карно) с холодопроизводительностью qx на
нижнем уровне температур Тх, то нет необходимости применять
многоступенчатое охлаждение. Однако на практике многоступен-
чатые рефрижераторные циклы применяют широко, поскольку
работа совершается не только для обеспечения полезной холодо-
производительности qx, но и для восполнения потерь, которые
в одноступенчатом цикле необходимо компенсировать на самом
низком уровне температур Т. Введение многоступенчатых цик-
лов позволяет компенсировать значительную часть всех потерь
qz при промежуточных температурах, превышающих Тх, что
безусловно термодинамически целесообразно и приводит к
уменьшению суммарной работы. Полную минимально необходи-
мую работу в рефрижераторном многоступенчатом цикле можно
записать в виде
п
4 = U+ £/,.. (6-12>
где 4nin “ ^х/ех — работа, обеспечивающая полезную тепловую
нагрузку qx при Т = Т; l{ = qL{/г. — работа, совершаемая для
компенсации потерь на z-й ступени (qZi — часть суммарных
потерь qL, которую следует компенсировать на данной ступени;
Ef — холодильный коэффициент при отводе теплоты qLj).
С повышением температуры 1\ увеличивается холодильный
коэффициент г, и уменьшается работа /;. Анализ формулы (6.12)
показывает, что для рефрижераторных циклов зависимости
качественно идентичны приведенной на рис. 6.2. Однако при
том же значении Тх целесообразное число ступеней п несколько
меньше, чем в ожижительных циклах.
Температурные уровни. Для многоступенчатых циклов необхо-
димо знать температурные интервалы каждой ступени. Для цикла
в целом обычно заданы только два значения температуры: 7) —
температура поступающего в цикл потока (как правило, принимают
равной температуре окружающей среды То) и Тх — наинизшая тем-
пература, равная температуре ожиженного газа или охлаждаемого
283
объекта. Промежуточные температуры 71 между ступенями нельзя
выбирать произвольно, так как значения 71 должны удовлетворять
оптимальным характеристикам цикла. Для ожижительных циклов
эта задача решена П. Л. Капицей применительно к теоретической
схеме с каскадным включением детандеров (см. рис. 6.1). В качестве
исходной предпосылки принято допущение об отсутствии потерь
(газ идеальный). При этом уравнение энергетического баланса де-
тандерной ступени (5.58) принимает вид выражения (6.2), которое
в результате преобразований [см. (6.3) — (6.8)] позволяет получить
7),. = х(7]..1/Т;- 1)/а,.. (6ЛЗ)
Эта формула определяет зависимость количества газа 7);,
поступающего в детандер, от коэффициента ожижения х, пара-
метра процесса расширения сх(. и отношения температур на гра-
ницах ступеней 71 ч/71.
Количество газа, поступающего во все п детандеров цикла,
L 4 = 4—(2^-1). (6.14)
Затраты энергии в таком цикле минимальны, если сумма по-
токов, поступающих во все детандеры, минимальна при х = const.
Найдем минимум суммы £/) в зависимости от искомой темпера-
туры 7):
где из всего ряда значений 7>; взяты только два члена, включаю-
щие 71 .
После дифференцирования (6.15) получим
-^.Дц.Т]2) + 1/(а;+17].+1) = 0, (6.16)
откуда приходим к ряду постоянных отношений
= ... = А = const. (6.17)
а,-7). а/+]7].+1
284
Перемножив все п членов ряда, а затем первые i членов,
найдем
Tj/(TX Oj а2 ... ал) = Л" ; (6.18)
Тх/(Т^а2... а() = Л'. (6.19)
Исключив постоянную А, получим формулу для определения
искомой температуры после каждой ступени:
\ . (а,а, ... а )'
Т = \ Т" Г v 1 ---------. (6.20)
' ' 1 х (ot1ot2 ... а.)"
Если отношение давлений р2/рх и КПД детандеров т]^ посто-
янны, то сх; = const; тогда формула (6.20) примет вид
Ti = Т” Т'. (6.21)
Формулу (6.20) можно использовать не только для циклов с
детандерами, но и во всех случаях, когда холодопроизводитель-
ность процесса на данной ступени прямо пропорциональна ее
температуре 7), т.е. q, = СТ) (где С — коэффициент). При этом
условии из уравнения энергетического баланса можно получить
выражение вида (6.13), приводящее к формуле (6.20). К такому
же результату приходят при расчете КЕМ, однако коэффи-
циентом пропорциональности в этой формуле является не а;, а
КПД криогенной газовой машины г|7 , значение которого следует
подставлять в (6.20) вместо а;.
Пример 6.1. Определить температурные уровни после каждой ступени в цикле
с каскадом из трех ступеней (п = 3). Исходные температуры 7) = 300 К, = 10 К.
По формуле (6.20) находим промежуточные температуры:
= з/з003 -1 • 10 = 96,5 К; = л/зоо3 ’2 • 102 = 31 К.
Рассмотренный способ определения температур неприменим
к определению температуры перед ступенью с дросселированием.
При дросселировании холодопроизводительность определяется
дроссельным эффектом Д/'г, т.е. свойствами реального газа,
которые не учитывали при выводе формулы (6.20). Эти свойства
реального газа определяют обратный эффект по сравнению с
получаемым в ступени с детандером — понижение температуры
не уменьшает, а увеличивает холодопроизводительность. Темпе-
ратурный уровень дроссельной ступени существенно влияет на
КПД всего цикла, поэтому вначале принимают ее ориентиро-
вочное значение, а затем, изменяя эту температуру, находят
оптимальные значения 7)..
285
Для рефрижераторных циклов также необходимо знать темпе-
ратурные уровни Т\, однако определить их можно с меньшей
степенью достоверности. Снова обратимся к циклу с каскадным
включением детандеров; тогда для рефрижераторного режима
исходным будет уравнение энергетического баланса (5.61). При-
нятие прежнего допущения об отсутствии потерь и свойствах
идеального газа автоматически приводит к равенству нулю пра-
вой части уравнения (5.61), поскольку данная ступень служит
только для компенсации потерь. В данном случае логичнее
допустить, что суммарные потери пропорциональны ширине
температурного интервала ступени:
СЛи= Kcp(Th} - 7).), (6.22)
где К — коэффициент пропорциональности.
Тогда уравнение (5.61) вследствие того, что >> Azr -
- с АТ) , примет вид
= Kcp(TiA- 7)), (6.23)
что приводит к формуле, аналогичной (6.13):
Dt= К (TlA/Tt- 1)/а,.. (6.24)
С помощью преобразований (6.14) — (6.19) получим для
рефрижераторных циклов формулу (6.20), при использовании
которой необходимо помнить о ее приближенности и учитывать
все ограничения, о которых сказано ранее. Точные значения
оптимальных температур 7). могут быть получены путем вариант-
ных расчетов цикла.
Давление потоков. Во многих случаях криогенные циклы
имеют два основных потока — прямой и обратный, давления
которых примем равными р2 и pv Давление р} обратного потока
обычно изменяется мало и составляет около 0,1 МПа, т.е. близко
к атмосферному. Давление прямого потока р2 может изменяться
в широких пределах, достигая десятков мегапаскалей. Это давле-
ние существенно влияет на энергетические и термодинамические
характеристики криогенных установок, поэтому его выбор дол-
жен быть четко обоснован. Изменением р2 (при р} ~ const)
достигают максимума таких важных характеристик цикла, как
холодильный коэффициент е и степень термодинамического
совершенства р t. Очевидно, что принятое значение р2 должно
соответствовать этому максимуму. Величины е и pz одинаковым
образом зависят от р2 и рх, поскольку р; = е/евд, а £вд не является
286
Рис. 6.3. Зависимость холодильного
коэффициента е от отношения давлений
потоков рг/рх
функцией давления. Общее выражение для холодильного коэф-
фициента е в соответствии с формулой (5.44) имеет вид
Е = qJL = hi (p2/pj + £доп] ’. (6.25)
Значения qx находят в зависимости от давлений потоков,
решая систему уравнения (5.67) — (5.68). Дополнительная работа
£доп также зависит от давления и определяется типом цикла (см.
далее в гл.6). Серия расчетов по формуле (6.25) позволяет найти
максимум функций е = f(pv р2). Типичный график этой функции
приведен на рис. 6.3 — максимальное значение соответствует
искомому давлению. Зависимость Е = f (pv р2) нередко имеет
пологий характер, поэтому можно принимать несколько меньшие
значения р2-
Приведенная информация не исчерпывает всех возможных
случаев. Так, для некоторых циклов характерны дополнительные
потоки с давлением pi или потоки с промежуточным давлением
рпр. Оптимальные давления находят во всех случаях расчетом
ряда вариантов и выбором энергетически наиболее выгодного.
Подобные примеры даны в § 6.2.
Допускаемые потери и коэффициенты. Приведенные в гл. 5
расчетные формулы для отдельных ступеней и цикла в целом
включают ряд характеристик и коэффициентов, значения кото-
рых зависят от потерь и поэтому существенно влияют на эконо-
мичность криогенных систем.
1. Потери вследствие не идеальности теплообмена в теплооб-
менных аппаратах. Покидающий теплообменный аппарат холод-
ный поток рабочего вещества имеет более низкую температуру,
чем поступающий теплый поток. Эта разность температур АГ
характеризует неполноту рекуперации теплоты; ей соответствуют
потери q}{ — срЬ.Т. Иногда эти потери называют потерями от
недорекуперации.
287
2. Приток теплоты из окружающей среды к холодным элемен-
там криогенной установки. Эти потери qc обычно относят к еди-
нице массы рабочего вещества в цикле; они зависят от вида и
качества теплоизоляции, размеров криогенной установки.
3. Гидравлические потери Ар, вызванные трением и отрывом
потока при его движении через каналы и коммуникации крио-
генной системы.
4. Дополнительные потери, в частности: потери от утечек по-
тока через неплотности q, потери при выделении теплоты qy,
в низкотемпературной зоне вследствие некоторых процессов
(адсорбции, конверсии, отогрева). Возможны и другие виды
потерь.
5. Потери вследствие необратимости процессов сжатия и
расширения в криогенных машинах (компрессорах, детандерах,
КГМ, насосах). Эти потери характеризуются: изотермическим
КПД Г]из компрессора, адиабатным КПД Г|5 детандера, а также
значением Г] г для криогенных газовых машин.
Ниже приведен ряд рекомендаций по выбору приемлемых
значений наиболее характерных параметров и коэффициентов,
установленных на основе практического опыта.
Разность температур А Г потоков на теплом конце тепло-
обменника, возникающая вследствие несовершенства процесса
теплообмена, должна быть минимально возможной, так как она
определяет удельные потери от неполноты рекуперации теплоты
qH = с &Т. В то же время чрезмерно низкие значения АТ приво-
дят к увеличению размеров и массы теплообменников. В много-
ступенчатых циклах значения АТ различаются для каждой ступе-
ни. Наибольшее влияние на характеристики цикла оказывает А Т
для ступени окончательного охлаждения. При температуре потока
на входе в первую ступень цикла 7\ = То обычно ДТ= 5...10 К.
внешнее охлаждение на верхней ступени допускает увеличение
ДТдо 15...20 К. Для ступени окончательного охлаждения гелие-
вых циклов допустимое значение ДТ= 1,0...0,5 К. При промежу-
точных температурах значение АТ можно оценить по линейной
зависимости
М]=а7], (6.26)
где а - 0,02...0,06.
Такой способ выбора А Т позволяет разумно ограничивать <?н •
Приток теплоты qc из окружающей среды вследствие несовер-
шенства теплоизоляции определяют на основе опытных данных,
полученных при эксплуатации криогенных установок. Для обыч-
288
ной (насыпной) теплоизоляции, применяемой при Т > 80 К,
q = 6... 10 кДж/кг для средних и небольших установок и
q = 3...4 кДж/кг для крупных установок производительностью
более 10 000 м3/ч. Для вакуумной теплоизоляции (Т < 80 К) qc
составляет 3-5% холодопроизводительности (перепада энтальпий
в детандере, изотермического эффекта дросселирования и др.).
Гидравлические потери приводят к уменьшению разности
давлений р2 — р} и уменьшению холодопроизводительности.
Гидравлические потери прямого Др2 и обратного Ьр} потоков раз-
личны. Влияние потерь особенно велико при малых давлениях,
так как возрастает отношение t\p/p. В этой связи допускаемые
потери по обратному потоку обычно Lpy = 0,02... 0,04 МПа.
Допускаемые потери по прямому потоку зависят от абсолютного
значения рг Если р2 велико (2—20 МПа), то Др2 = 0,1...0,3 МПа;
если мало (0,5—1,0 МПа), то Др2 = 0,3...0,6 МПа.
Коэффициенты полезного действия машин. КПД машин
существенно зависят от их конструкции, производительности и
условий работы. Наиболее стабилен изотермический КПД
компрессора; обычно Лиз “ 0,55...0,65.
Адиабатный КПД детандеров изменяется в более широких
пределах. Так, для большей части поршневых детандеров
Т]^ = 0,7...0,8, для турбодетандеров т|^ = 0,72...0,85. КПД машин
отдельных типов выходят за указанные пределы. Более высокие
КПД имеют машины большей производительности.
Остановимся на современном подходе к расчету криогенных
циклов и установок. На начальном этапе проектирования, при-
няв схему цикла и ряд исходных данных, выполняют термодина-
мический расчет, определяя потоки теплоты и массы, расход
энергии, коэффициенты эффективности. Обычно число перемен-
ных и число уравнений [(5.67), (5.69)] велико, и расчет стано-
вится громоздким. Вследствие необходимости определения пока-
зателей цикла при различных значениях р2, промежуточных тем-
ператур Т\ и других параметров целесообразно применять ЭВМ
(более подробно см. § 6.4).
Окончательный расчет и оптимизацию можно выполнить
только при учете большого числа факторов, определяющих
работу криогенной установки. Отметим основные из них: харак-
теристики используемых криогенных машин (компрессоров,
Детандеров); характеристики тепло- и массообменных аппаратов;
Данные по эксплуатационным затратам; данные по надежности
оборудования; сведения о различных режимах работы установки.
Нередко влияние отдельных факторов весьма противоречиво.
19 Зака 4 .V 1592 289
Так, увеличение плошали поверхности тсплобмснника приводит
к уменьшению ДТ” (потери от неполноты рекуперации), но при
этом растут гидравлические потери Др и приток теплоты qc.
Очевидно, существуют оптимальные сочетания значений этих
параметров.
Таким образом, полная оптимизация установки требует
проведения комплексного расчета, при котором термодинами-
ческие характеристики цикла определяют с учетом характеристик
оборудования и других отмеченных факторов. Такой расчет
сложен и громоздок, поэтому обычно при расчете учитывают
только основные факторы.
Далее даны примеры термодинамических расчетов циклов,
которые представляют собой основу полного комплексного
расчета. На примере анализа простого детандерного цикла (см.
§ 6.3) рассмотрен метод комплексного подхода при оптимизации
цикла с учетом характеристик его теплообменной аппаратуры.
§ 6.2. ЦИКЛЫ С ДРОССЕЛИРОВАНИЕМ
Группа циклов, основанных на использовании процесса дрос-
селирования (z = const), относится к наиболее распространенным
в криогенной технике. Это обстоятельство вызвано исключитель-
ной простотой и надежностью в работе дроссельного устройства,
что в значительной мере компенсирует недостатки дросселирова-
ния, обусловленные его высокой необратимостью и, как следст-
вие, низкой экономичностью.
Термодинамические характеристики дросселирования рас-
смотрены в гл.4; здесь познакомимся с тем, как реализуют этот
процесс для обеспечения функций криогенных циклов. Рассмот-
рим циклы с дросселированием в соответствии со схемой класси-
фикации (см. рис. 5.16), переходя от простых к более сложным.
Цикл с простым дросселированием был первым криогенным
циклом, нашедшим применение в технике. Его широко исполь-
зуют и сейчас как в первоначальном виде, так и в различных
модификациях. Наконец, этот цикл (в виде отдельной ступени
с дросселированием) является элементом большей части совре-
менных криогенных установок.
Впервые цикл с дросселированием реализовали в 1895 г.
независимо друг от друга К. Линде в Германии и Д. Хэмпсон в
Англии. Как известно, использование дросселирования для
охлаждения возможно лишь в том случае, когда исходный
290
температурный уровень процесса существенно ниже температуры
инверсии рабочего вещества. Это условие необходимое, но
недостаточное для достижения весьма низких температур.
Применение процесса непосредственного дросселирования к
сжатому газу, находящемуся при температуре окружающей
среды, позволяет лишь немного снизить его температуру.Так,
температура воздуха, расширяемого в процессе z = const от
р2 = 20 МПа до р} - 0,1 МПа при То = 300 К, снижается на
ДТ = 35 К. Для получения значительно более низких температур
и для ожижения газов процесс дросселирования необходимо
дополнить процессом регенеративного теплообмена.
Принцип регенеративного теплообмена сейчас используют
практически во всех криогенных циклах, которые можно рас-
сматривать как различные комбинации каких-либо процессов ох-
лаждения совместно с регенеративным теплообменом. Суть этого
принципа состоит в том, что в цикле осуществляется регенера-
тивный теплообмен между прямым (теплым) потоком рабочего
вещества и обратным (холодным) потоком. В результате темпе-
ратура рабочего вещества снижается перед тем как реализуется
эффект охлаждения (расширения) на существенно более низком
температурном уровне по сравнению с первоначальным. Необхо-
димо подчеркнуть, что этот теплообмен внутренний, не связан-
ный с обменом энергией с окружающей средой.
Рассмотрим, каким образом можно использовать процесс
дросселирования совместно с регенеративным теплобменом для
получения низких температур. Обратимся к принципиальной
схеме цикла с простым дросселированием (рис. 6.4). Характерные
о — схема: б — диаграмма Т— s
19* 291
точки на схеме и диаграмме T—s обозначены одинаково.Основ-
ные элементы схемы: компрессор К с концевым холодильником
X. теплообменник 7”, дроссельный вентиль ДВ и сосуд С. Проана-
лизируем детально этот цикл, используя формулы § 5.4. Вначале
рассмотрим теоретический цикл без потерь в теплообменнике.
Рефрижераторный режим (теоретический
цикл). По замкнутому контуру циркулирует 1 кг рабочего
вещества. Последовательно рассмотрим, как функционирует цикл
без регенерации теплоты, затем пусковой и установившийся
режимы при регенерации теплоты. Вначале все элементы
криогенной системы имеют одинаковые температуры, равные
температуре окружающей среды Тх = Т[}. В компрессоре К
сжимается 1 кг газа от давления рх до д2. Этот процесс (линия
1-2 на рис. 6.4, б) предполагается изотермическим (Г, = Г2), теп-
лота сжатия qK отводится в окружающую среду в холодильнике
X. Сжатый газ в состоянии, соответствующем точке 2 (или 3)
(теплообменник Т отсутствует), поступает в дроссельный вентиль
ДВ, где расширяется до давления р} при i = const (процесс 2-4')\
в результате температура снижается от Т2 = Тх до Т$. Очевидно,
теперь можно нагреть газ от Т$ до Тх (при р} = const), используя
его в качестве охлаждающей среды для отвода теплоты от какого-
либо объекта в интервале от Т$ до Tv Отнимаемая теплота
(эффект охлаждения) на 1 кт газа
7, = Zj - Z4. = Zj - Z2 = Az’r, (6.27)
где Azr — изотермический эффект дросселирования (соответ-
ствует холодопроизводительности процесса).
На диаграмме T-s площадь ab 14' определяет теплоту qx = Azy.
Рассмотренный процесс протекает без регенеративного тепло-
обмена, и полученное снижение температуры IsT — Т{ - T# —
предельное, которое можно достичь. Введение теплообменника
Т позволяет существенно снизить уровень охлаждения вплоть
до температуры конденсации Гх. Для этого газ после дросселиро-
вания в состоянии Тц (первая порция) направляется через
теплообменник Т в обратном направлении, подогреваясь до
температуры Тх и охлаждая при этом вторую порцию газа
(1 кг), поступающего из компрессора в состоянии, соответству-
ющем точке 2. Эти потоки обмениваются количеством теплоты
q = z - z4. = z2 - z3.; в результате температура прямого потока
снижается до Ту. Затем прямой поток дросселируется (процесс
3-4"), охлаждаясь до более низкой температуры Г4.., и возвраща-
292
ется через теплообменник, охлаждая третью порцию газа (1 кг).
Баланс теплоты в этом случае имеет вид: q = i{ - z’4.. = z, - z3„.
Температура прямого потока при этом снижается до Т,... Третье
дросселирование обеспечивает охлаждение до Тг и т. д.
Процесс охлаждения продолжается до тех пор, пока темпера-
тура не понизится до минимального значения 7х; при этом рабо-
чее вещество находится уже в двухфазной области, Тх однозначно
определяется давлением рх и образуется жидкость /. Только
уменьшив давление рх, можно снизить Тх.
В установившемся режиме, когда достигнута наинизшая тем-
пература Тх, последовательность осуществления всех процессов
такова. Сжатый в компрессоре К газ охлаждается в теплообмен-
нике Т в интервале температур от Т2 до Т3 , дросселируется от
температуры Т3 до Г4 = Тх и частично конденсируется. К сосуду
С, где находится жидкость, подводится полезная тепловая нагруз-
ка qxl, отнимаемая от охлаждаемого объекта при температуре Т.
В результате подвода теплоты q^ жидкость в сосуде С испаряется,
энтальпия уходящего потока повышается до z5. Очевидно, реали-
зуемая при этом холодопроизводительность (на 1 кг рабочего
вещества)
<7ХТ = i5 - ir (6.28)
На диаграмме T-s площадь а'Ь'54 равна q . Рабочее вещество
в состоянии, соответствующем точке 5, поступает в теплооб-
менник, подогревается до температуры Т\= Т2и возвращается
в компрессор; цикл замыкается.
Определим qxy из уравнения теплового баланса теплообмен-
ника Т Прямой поток, охлаждаясь от Т2 до Т3, понижает свою
энтальпию, отдавая теплоту qT = i2 - i3 . Обратный поток нагре-
вается от Тх до Tj, получая теплоту qT = i3 - i5. Из условия
баланса теплоты в теплообменнике
4т ~ ~ — “ z5 (6.29)
или
Z5 - Z3 = Z1 - Z2 (6.30)
Так как i3 = z4, a z} — i2 = ,МТ [см. (6.27)], можно записать
4„ = Z5 - Z4 = А/7” <6'31)
Этот результат имеет принципиальное значение, так как при-
водит к выводу, что холодопроизводительность qXj = qx |см. фор-
мулы (6.27) и (6.31)] не зависит от уровня температур, на кото-
293
ром реализуется эффект дросселирования; она одинакова как при
так и при Тх и в обоих случаях определяется изотермичес-
ким эффектом дросселирования при сжатии газа в компрессоре:
#хт — ~ Z1 “ Z2 — Z5 - Z4 ' (6.32)
В процессе сжатия 1-2 уменьшение энтальпии газа (z’j - z2)
определяется свойствами реального газа. Таким образом, в про-
цессе изотермического сжатия от рх до р2 создается потенциаль-
ная возможность охлаждения рабочего вещества при возвраще-
нии его к первоначальному давлению рх . Этот эффект проявля-
ется в процессе дросселирования и не зависит от температуры
дросселирования.
Дроссельный вентиль не создает холодопроизводительности,
а лишь обеспечивает ее реализацию, теплообменник же позво-
ляет перенести эффект Д/г на более низкий температурный уро-
вень. Уровень охлаждения не обязательно должен определяться
температурой конденсации Тх, он может быть любым в интервале
температур от Тх до Тх. Независимо от уровня температуры
холодопроизводительность <?хт постоянна и равна Azr.
Реальный цикл с дросселированием. При
рассмотрении действительного (рис. 6.5) цикла надо учесть, что
для него характерны потери, обусловленные двумя обстоя-
тельствами. Вследствие неидеальности теплообмена происходит
неполная рекуперация теплоты, т.е. температура 7\. уходящего
обратного потока ниже температуры Т2 = Тх поступающего
Рис. 6.5. Реальный цикл с дросселированием:
а — схема; б — диаграмма Т— s
294
прямого потока на А Г (точка Г). В результате сжатый газ не
может охладиться до температуры в теоретическом цикле Т3т, и
будет иметь более высокую температуру Ту.
Состояние после дросселирования определяется точкой 4' с
энтальпией, более высокой, чем энтальпия /4т в теоретическом
цикле. В результате располагаемая холодопроизводительность
уменьшится на qK = z4. - z'4t = iy - i3r и qx = z5. - z4.. На диаграмме
T—s qB определяется площадью a4}4'c. Связь между состояниями
Г и 3' устанавливаем из уравнения теплового баланса тепло-
обменника:
qy = z2 - iy — iy - iy . (6.33)
Сопоставив уравнения баланса для теоретического (6.29) и
реального (6.33) циклов (при z'3 = /Зт и z5 = z5.) получим выражение
для потерь вследствие неполноты теплообмена
<7Н = Д - Z3t = z'i * zr • <6-34)
Обычно qf[ выражают иначе; приняв в интервале от Тг до Т,
теплоемкость ср = const, запишем
?н = h - zr = ср^Г- (6-35)
где разность температур \ Т определяет потери вследствие непол-
ноты рекуперации qw
Другой причиной уменьшения холодопроизводительности
является приток теплоты qc из окружающей среды вследствие
неидеальности теплоизоляции. Приток теплоты qc приводит к
тому, что прямой поток газа при давлении р2 охладится не до
температуры Ту, а до более высокой температуры (энтальпии)
— точка 3 на рис. 6.5:
z2 “ Д - = i2 * z3 - (6.36)
т.е.
= Z3 - Д = Z4 - Z4" (6-37)
В результате полезная холодопроизводительность уменьшится
на qc. На диаграмме T-s это количество теплоты эквивалентно
площади c4'4d.
Окончательно удельная холодопроизводительность реального
Цикла с учетом рассмотренных потерь равна площади d45'b
(см. диаграмму) и
’ <6-38)
где q^ = Мт; qL = q„ + qc.
295
Уравнение (6.38) можно получить и формальным составле-
нием энергетического баланса для данного цикла.
О ж и ж и т е л ь н ы й режим. Рассмотрим последова-
тельность протекания процессов в цикле ожижения. В этом
режиме также реализуется эффект дросселирования сжатого газа,
но он используется не для охлаждения объекта, а для ожижения
части рабочего вещества. Схема цикла остается та же (см.
рис. 6.5), но в схему дополнительно включен вентиль В, через
который отводится полученная жидкость в количестве х; ее
энтальпия L. При этом обратный поток меньше прямого и соста-
вит (1 - х); цикл не является замкнутым. Для того, чтобы
компрессор по-прежнему подавал 1 кг сжатого газа, необходимо
к обратному потоку в состоянии, соответствующем точке 1 на
диаграмме, добавить рабочее вещество в количестве, равном
количеству х отведенной жидкости. Для жидкости х находят из
уравнения энергетического баланса в соответствии с методикой,
приведенной в § 5.4. Рассмотрев реальный цикл с учетом потерь
qH и qc, запишем уравнение энергетического баланса для ограни-
ченной контуром зоны на рис. 6.5, а\
h + Qc = х if+ О ’ х) zr • (6.39)
Использовав выражение (6.35), найдем коэффициент ожиже-
ния
где q^-CpbT + <7С — суммарные потери.
В числителе формулы (6.40) — полезная холодопроизводитель-
ность, в знаменателе — количество холода, необходимое для
ожижения 1 кг газа. Очевидно, что для теоретического цикла
= 0 и
х = Az?,/(Z] - z^) . (6.41)
Характеристики цикла. В цикле с дросселирова-
нием затраты энергии определяются работой сжатия в компрес-
соре /к в интервале давлений от рх до р2 . Удельную работу для
циклов находят следующим образом (см. § 5.3):
теоретического рефрижераторного
I RT, 1п(р0/р,)
L = ; (6.42 >
А/,
296
реального рефрижераторного
z = J= R7\ In (р2/Р/ .
0 nm(AzT- ’
(6.43)
реального ожижительного
° х Пиз*
В соответствии с общим выражением (5.44) холодильный
коэффициент:
для теоретического цикла
ет = А/г/[/?7’11п (р2/Р1)]', (6.45)
для реального цикла
е = (Дгт~ ^)Пиз (6.46)
RT} In (Pi/pJ
Степень термодинамического совершенства вычисляют по
формулам (5.47)—(5.50).
Оптимальные параметры цикла. Формулы для
удельной холодопроизводительности (6.38) и коэффициента
ожижения (6.40) позволяют утверждать, что максимальные
значения и х полностью определяются максимумом дроссель-
ного эффекта Az./.. Другие величины, входящие в эти формулы,
практически постоянны, a Ыт = f(T, р) — рис. 6.6. Характер
Дж/моль
4
I
О
У 10 рМПа О 4 д 12 р, МПа
а) 6)
Рис. 6.6. Зависимость изотермического эффекта дросселирования AZ, от давления
при различных температурах для воздуха (а) и неона (б)
297
этой зависимости подробно рассмотрен в § 4.3. Значение &iT
существенно возрастает с понижением исходной температуры Т2,
однако для данного цикла обычно Т2 = То = const.
Влияние давления р2 (pt = const) имеет сложный характер.
Вначале повышение р2 приводит к возрастанию Д/г вплоть до
состояния инверсии. Дальнейшее повышение р2 вызывает умень-
шение Ыт . Очевидно, максимум Ыт соответствует давлению ин-
версии ринв = f(T), которое находят по кривым инверсии (см.
рис. 4.5). Нередко принимают р2 < ринв , учитывая пологий мак-
симум зависимости Ыт = f(p).
Пример 6.2. Определить удельную холодопроизводительность qv удельную работу
/0, коэффициенты е и т| г для рефрижераторного цикла с простым дросселированием в
теоретическом и действительном вариантах. Рабочее вещество — воздух; температура
сжатия в компрессоре = 300 К, давления потоков р, = 0,098 МПа; /у = 19,6 МПа;
Тх = 78,6 К, неполнота рекуперации Л.Т = 5 К; приток теплоты <7С = 6 кДж/кг;
т| ю = 0,6; теплоемкость ср - 1 кДж/(кг К); газовая постоянная R = 0,287 кДж/кг.
По диаграмме Т— s для воздуха находим энтальпию в характерных точках (см.
рис. 6.5): = 300 кДж/кг; = 266 кДж/кг. Холодопроизводительность теорети-
ческого цикла [см. формулу (6.32)]
q^ = 300 - 266 = 34 кДж/кг .
Потери вследствие неполноты рекуперации
= ср АТ = 1 • 5 = 5 кДж/кг;
тогда удельная холодопроизводительность действительного цикла |см. формулу
(6.38)]
qx — 34 - 5 - 6 = 23 кДж/кг.
Удельная работа [см. формулы (6.42) и (6.43)]
1^ = [0,287-300 In (19,6/0,098)]/34 = 13,8 кДж/кДж;
/0 = [0,287 • 300 In (19.6/0,098)]/(0,6 • 23) = 33 кДж/кДж.
В данном случае холодильный коэффициент — величина, обратная /0,
следовательно: ет = 1/13,8 = 0,072, е = 1/33 = 0,0303.
При вычислении т|, принимаем в качестве эталона цикл Карно, для которого
холодильный коэффициент
ес = 78,6/(300 - 78,6) = 0,356.
Тогда по формуле (5.49) найдем для теоретического и действительного цикла:
т|п = 0,072/0,356 = 0,202; т], = 0,0303/0,356 = 0,0852.
Пример 6.3. Определить коэффициент ожижения х, удельную работу /0, а также
коэффициенты е и т|, для действительного ожижительного цикла с простым дроссе-
лированием. Рабочее вещество — воздух; все исходные величины — см. пример
6.2; расчетная схема — см. рис. 6.5.
По диаграмме T—s определим энтальпию жидкости if = - 128 кДж/кг в точке f
Коэффициент ожижения [см. (6.40)]
х = ((300 - 266) - (5 + 6)]/(300 + 128 - 5) = 0,0533.
298
Минимально необходимая работа:
на единицу массы ожиженного газа (см. (6.44)J
/0 = 0.287-300 In (19,6/0.098)/(0.06 • 0,0533 • 10’) = 14,2 МДж/кг;
на 1 л жидкого воздуха
/ох = 14.2-0,873 = 12,4 МДж/л,
где 0,873 кг/л — плотность жидкого воздуха.
Холодильный коэффициент согласно формуле (6.46) имеет такое же значение,
как и для рефрижераторного цикла: е = 0,0303. Значение т], определим по отноше-
нию к идеальному ожижительному циклу, для которого холодильный коэффициент
(см. формулу (5.46), где s, = 6,85 кДж/(кг- К) и sf= 2,96 кДж/(кг- К) определены
по диаграмме Т— s для воздуха]:
еид = (30° + 128)/300 • (6,85 - 2,96) - (300 +128) = 0,576;
т|, = 0,0303/0,576 = 0,0527.
В примерах 6.2 и 6.3 расчеты выполнены при давлении
р2 = 19,6 МПа. Возрастание р2 приводит к увеличению qx и
других характеристик цикла. На рис. 6.8 даны зависимости х и
/0 от р2 для ожижительного цикла. Увеличение р2 до давления
инверсии позволяет несколько улучшить эти характеристики, но
дальнейший их рост невозможен. В целом примеры 6.2 и 6.3
свидетельствуют о малой эффективности цикла с простым
дросселированием. Даже в теоретическом случае Г]г ~ 20%, в
ожижительном варианте реальное значение т|г немного превы-
шает 5%. Очень мала и доля получаемой жидкости (х = 5,33%).
Для рабочих веществ с более высокой температурой кон-
денсации Тх свойства реального газа проявляются сильнее, а
цикл имеет заметно лучшие характеристики. Так, для метана
(Тх — 111,7 К) в действительном ожижительном цикле т|г = 20%.
Рассмотренный цикл абсолютно непригоден для рабочих ве-
ществ, у которых температура инверсии ниже температуры
поступающего в цикл потока Т2, так как при этом Д/'г < 0.
Цикл с предварительным охлаждением и дросселированием.
Характеристики цикла с дросселированием можно значительно
улучшить предварительным снижением температуры рабочего
вещества, поступающего в дроссельную ступень.
Это существенно увеличивает для любого реального газа
(см. рис. 6.6). Особенно характерно изменение Д/Гдля неона, у
которого при температуре окружающей среды (То ~ 300 К)
Д/‘г < 0. Только значительно снизив его температуру, можно
получить достаточно большой положительный дроссельный эф-
фект Д/у. Аналогичная ситуация характерна для гелия и водорода.
299
Предварительное охлаждение может выполнять две функции:
а) увеличивать дроссельный эффект Д/’г для веществ, у которых
Тинв > (воздух, О2, N2, СН4 и др.); б) обеспечивать положи-
тельное значение Д/7 для веществ, у которых Тиив < То (Ne, Н2.
Не). Кроме того, предварительное охлаждение обеспечивает ком-
пенсацию части потерь <?н + q.
Предварительное охлаждение можно осуществить любым
внешним циклом; чаще всего для этого применяют жидкий
хладагент, ожижаемый в отдельной установке. При этом цикл
становится двухступенчатым, так как в нем используют два
низкотемпературных процесса — дросселирование и внешнее
предварительное охлаждение. Схема цикла и его изображение в
диаграмме Т— s даны на рис. 6.7. Схема представляет собой
две последовательно соединенные ступени (см. рис. 5.17 и 5.19).
В компрессоре К (см. рис. 6.7) сжимается 1 кг газа в интервале
давлений от р, до р2 при температуре Т\ = То — const (процесс
1-2)\ теплота сжатия передается в окружающую среду. Затем
поток охлаждается в теплообменнике Т1 в интервале температур
от Т2 до Тт, после чего теплота отводится сжиженным хладаген-
том (Со) в ванне В, и температура снижается от Тт до Т2- .
Дальнейшее охлаждение происходит в теплообменнике Т2 (от
Т2. до Т3); поток дросселируется в вентиле ДВ (процесс 3-4) и
Рис. 6.7. Цикл с дросселированием и предварительным внешним охлаждением:
а — схема; б — диаграмма Т— s
300
частично ожижается. В рефрижераторном режиме к сосуду С
подводится теплота <ух, в ожижительном - отводится жидкость
в количестве х.
Обратный поток в количестве 1 кт (при ожижении 1 - л) про-
ходит теплообменники Т1 и Т2, подогревается и выводится из
цикла. Охлаждающая жидкость GQ обеспечивает температуру
предварительного охлаждения Т? = Тц на уровне Тх неполнота
рекуперации составляет Д7), на уровне Тп = Т2 - & Т2 соответст-
вующие притоки теплоты из окружающей среды — qci и qc2.
Рассмотрение дроссельной ступени цикла (ниже температуры
Тп) и сопоставление ее со схемой цикла с простым дросселиро-
ванием (см. рис.6.5) показывает их полную идентичность.
Отличие состоит лишь в том, что температура Тг потока на входе
в эту ступень существенно ниже температуры окружающей среды
То. Верхняя ступень (выше Тп), помимо охлаждения рабочего
вещества потоком Со, обеспечивает рекуперацию теплоты
уходящего обратного потока (Т6. — Т{.) в теплообменике Т1.
Расчетные уравнения этого цикла можно получить составлением
энергетического баланса для обеих ступеней. Проще восполь-
зоваться уравнениями энергетического баланса для таких
ступеней (см. § 5.4), изменив индексы в соответствии с рис. 6.7.
Рефрижераторный режим. Полезная удельная
холодопроизводительность [см. формулу (5.64)] при Gn = 1 кг
- (с>дг2 + ^2) = д/г2. - <h.2 ’ (6-47)
где Д/т^ = /6 - /2, — изотермический эффект дросселирования
при температуре Т). = Тп (Д/г больше Д/?, , соответствующего
температуре окружающей среды).
Необходимо обратить внимание на то, что из Д/у. вычитают
только потери </х2, которые относятся к нижней ступени.
Теплоту, отводимую внешним источником охлаждения в
ванне В, определяют из уравнения энергетического баланса
верхней ступени |см. выражение (5.60)]
<7о = G(A - z7) = 1А/72. - + “ А7г) + ^11- (6.48)
Эта теплота расходуется на компенсацию потерь вследствие
теплопритока qc} от разности неполноты рекуперации теплоты,
равной сДДТ] - ДТ2), а также вследствие увеличения дроссель-
ного эффекта от Д/г до &iT Из уравнения (6.48) легко
301
определить необходимое количество охлаждающей жидкости Go.
Здесь возможны два варианта: а) используется только теплота
испарения жидкости г — тогда пары выводятся прямо из ванны
В, минуя теплообменник Т1\ б) используется также холод пара;
при этом он подогревается в теплообменнике Т1 (см. рис. 6.7, а).
Ожижительный режим. Коэффициент ожижения
|см. уравнение энергетического баланса ступени (5.59)]
х = - СР^Т2- Дг)/^б * - СР А т2>- (6.49)
По структуре эта формула полностью соответствует выраже-
нию (6.40) для цикла с простым дросселированием; однако здесь
х существенно увеличивается, так как , а в знаменателе
Теплота, отводимая в ванне В от прямого потока внешним
хладагентом (Go) [см. уравнение (5.56)],
<70 = G0 (18 - '7) = %(гГ - г6') + 1Д/Т2. - Агт1 + Ср (АЛ - А7Р + ^011-
(6.50)
Эта теплота расходуется на понижение энтальпии ожижаемого
потока в интервале температур от 7] до Т, а также на компенса-
цию потерь и увеличение дроссельного эффекта от Д/
до Аг,, .
72'
Так как неполнота рекуперации ДД не влияет на основные
показатели цикла и х, то обычно принимают более высокие
значения А 7) (вплоть до 15-20 К). Это позволяет существенно
уменьшить размеры теплообменника Т1, хотя и определяет
избыточный расход Go жидкости.
Характеристики цикла. В данном цикле полная
минимально необходимая работа складывается из работы сжатия
газа в компрессоре £к и дополнительной работы 7до|| получения
жидкости (Go), т.е. L = £к + £ где
^ДОГ.= GoV <6’51)
где /Од — удельная минимально необходимая для получения
единицы массы хладагента работа.
Иногда целесообразно работу £доп определять так:
'доп ^0 /^Од ’
(6.52)
где — удельная холодопроизводительность установки, произ-
водящей хладагент, например аммиак или фреон.
302
Значения /0 и qOa известны, а Со или q,, находят из расчета
цикла по формулам (6.48), (6.50). Удельная минимально необхо-
димая работа:
в рефрижераторном цикле
I = + Аюп = RT\111 (Л?/А) + А 1од . (6 53)
° ъ дА2.'^2’
в ожижительном цикле
l = Lk + Аюп = АА ^(^Z^i) + А) 4)д . /6 54)
0 х пИз* х
Сопоставим показатели для этого цикла и цикла с простым
дросселированием на числовом примере.
Пример 6.4. Определить удельную холодопроизводительность коэффициент
ожижения х, минимально необходимую работу /0 и коэффициенты е и ц,;и!я цикла
с предварительным охлаждением и дросселированием в рефрижераторном и
ожижительном режимах. Рабочее вещество — воздух. Исходные данные — см.
пример 6.2, схема и диаграмма — см. рис. 6.7. Температура предварительного
охлаждения 7П = 228 К; хладагент — аммиак; удельная холодопроизводительность
дОя = 1,165 кДж/кДж. Приток теплоты общий q,. = 6 кДж/кг, по ступеням <?с1 =
= qa = 3 кДж/кг; неполнота рекуперации теплоты Д7) = 15 К, Д7^ = 5 К.
По диаграмме Т— л для воздуха находим энтальпию (кДж/кг) в характерных
точках: / — 300; i2 = 266; i6 = 230; z2. = 165; t\. = 285; i6 = 225; if — - 128.
Изотермические эффекты дросселирования при температурах 7] и 7). = Тп:
Ыт = - i2 = 300 - 266 = 34 кДж/кг;
Д(г = z6 " 'г = 230 - 165 = 65 кДж/кг.
Рефрижераторный цикл. Полезная холодопроизводительность [см.
формулу (6.47)]
qx = 65 - (1 • 5 +3) = 57 кДж/кг.
Теплота, отводимая хладагентом (аммиаком) [см. формулу (6.48)]:
д0 = [65 - 34 + 1 • (15 - 5) + 3] = 44 кДж/кг.
Удельная минимально необходимая работа [по формуле (6.53) с учетом (6.52)]
0,287 • 300 In (19,6/0,098) 44
0 0,6-57 1,165-57 '
Ожижительный цикл. Коэффициент ожижения [см. формулу (6.46)]
х = (65 - 1 • 5 - 3)/(230 + 128 - 1 • 5) = 0,162.
Теплота, отводимая охлаждающей жидкостью [см. формулу (6.50)].
дй = 0.162-(285 - 225)+ [65 - 34 + 1 -(15-5) + 3] = 53.7 кДж/кг.
303
Удельная минимально необходимая работа |см. формулу (6.54)]
0.287-300 In (19.6/0,098)
СиГо.162 • 10’
ПбГ0Л^1Р = 4.7 + 0.284 = 4.984 МДж/к.
Холодильный коэффициент:
для рефрижераторного цикла г = l//tl = 1/13.96 = 0,0715;
для ожижительного цикла
е = х((1 - у)/(Ак + /,доп) =
0,162 - (300 + 128)_____________
0,287-3001п(19.6/0,098) 53,7
0,6 1,165
= 0.086.
Значения i], - е/гид; значения ес и <ид — см. примеры 6.2 и 6.3; для
рефрижераторного цикла i]; = 0,0715/0,356 = 0,201; для ожижительного цикла
ц, = 0,086/0,576 = 0,149.
Сравнение результатов расчета в примерах 6.2-6.4 показало.
что предварительное охлаждение существенно улучшает пока-
затели цикла с дросселированием. Такие характеристики, как е.
Г] t увеличились в 2,5 — 3,0 раза, причем дополнительная работа
/доп незначительна по сравнению с работой сжатия в компрессоре
/к. Зависимости /0 и х от р2 для рассмотренных циклов ожижения
воздуха приведены на рис. 6.8 (исходные данные; Т{ = 303 К;
Рис. 6.8. Характеристики циклов с
дросселированием при наличии предва-
рительного охлаждения (7^ = 228 К)
и без него (Т} = 303 К) при ожижении
воздуха
Улучшение характеристик
сопровождается усложнением
криогенной установки, поэтому
использование этого цикла для
воздуха и его компонентов
ограничено. Более распростра-
нен такой цикл для рабочих
веществ, температура инверсии
которых Тии£ < То и предвари-
тельное охлаждение обязательно.
К этим веществам, в частности,
относятся водород и неон. При-
менение цикла для Н2 и Ne
целесообразно, если для предва-
рительного охлаждения приме-
няют жидкий азот или воздух
(Тп = 80 К). Температуру Ти
можно снизить вакуумированием
парового пространства ванны В
(см. рис. 6.7); при этом требуется
304
Рис. 6.9. Зависимость коэффициента ожижения
х водорода (а) и иеоиа (б) от температуры Гп
и давления р2 в цикле с предварительным
охлаждением и дросселированием
установка вакуумного насоса на выходе потока Go — точка 8.
Минимально достижимая температура при вакуумировании азота
составляет 63,2 К (тройная точка), на практике 65 К. Смесь О2—
N2 под вакуумом позволяет снизить Та до 51 К.
Циклы для Н2 и Ne рассчитывают по формулам (6.47)—(6.54);
рекомендуются следующие исходные данные: Д 7) < 3 К;
ДТ) = 10...15 К; qc = (0,03...0,05)Д/'г. Удельная работа, соверша-
емая для получения 1 кг жидкого N2 или воздуха, /0 = 4...5 МДж,
причем действительный расход С() хладагента может превышать
расчетный вследствие потерь и расходов на дополнительные нуж-
ды. На рис. 6.9 приведены зависимости х = f(p2) для Н2 и Ne
при различной температуре 7) предварительного охлаждения.
Графики свидетельствуют о значительном влиянии Тп на коэффи-
циент ожижения х. Максимумы кривых соответствуют давлению
инверсии (для водорода 12 ... 14 МПа, для неона — 22 ... 24 МПа).
Пример 6.5. Определить коэффициент ожижения х, поток Go и удельную работу
7() в цикле ожижения водорода с предварительным охлаждением и дросселировани-
ем (см. рис.6.7). Исходные данные: Т) = 300 К; = 0,098 МПа; р2 = 11.8 МПа:
ДТ) = 15 К; ДТ2 = 3 К; д, = дл = 6 кДж/кг; т]ю = 0.6: /Оч = 4.5 МДж/кг; удельная
теплоемкость обратного потока Н2 ср] = 14,3 кДж:/(кг-К) при 300 К. с2 =
~ 11,2 кДж/(кг-К) при 70 К: = 4,12 кДж/(кг-К).
По диаграмме Т—.$ для водорода определим энтальпии в характерных точках
(кДж/кг): 12 = 4285; = 4225; i2 = 1030: ib = 1250; ф = 4010; Z6 = 1216; if = 272.
По диаграмме T-s для азота: /7 = 29.5: (. = 448.
Изотермические эффекты дросселирования: АЛ, = ( = i2 = 4225 - 4285 =
~ - 60 кДж/кг; Д/7 = /ь - Z,. = 1250 - 1030 = 220 кДж/ю. По формулам (6.49) и
(6.50) 2
х = (220 - 11.2 • 3 - 6)/(1216 - 272 - 11,2 • 3) = 0.192;
?о = G0(z8- z7) = 0,192 (4010 - 1216)+|(220+60)+( 14,3 • 15 - 11.2 • 3)4-6] = 1002 кДж/кг;
20 Заказ .V 1592 3 0 5
отсюда удельный расход азота на 1 кг водорода
Go = 1002/(448 - 29.5) = 2.40 кг.
Удельный объемный расход азота на 1 л Н2с учетом дополнительных затрат
азота (25%)
,_1.25 -2.40 рн, _ 3.00 0,0708
G° х 0,192 0,804 “ *’3'
где рн, и рч. — плотности жидких водорода и азота.
Удельная работа [см. формулу (6.54)]:
на 1 кг жидкого водорода
4,12-300-1п(11,8/0,098) , _ _ 4,5 5 ,
/п = —----------1---------' + 1,25 -2,40 ---=123,5 МДж/кг;
0 0.6-0,192-103 0,192
соответственно на 1 л жидкого водорода
// = /0 рн = 123,5-0,0708 = 8,75 МДж/л.
х
Рис. 6.10. Схема цикла
ожижения водорода и гелия
с двумя уровнями предвари-
тельного охлаждения
Циклы с несколькими ступенями
предварительного охлаждения. Примене-
ние нескольких уровней предваритель-
ного охлаждения характерно для криоген-
ных веществ с очень низкой темпера-
турой конденсации, а именно для водо-
рода и гелия. При этом циклы сущест-
венно усложняются, но заметно улучша-
ются их термодинамические характе-
ристики, повышается экономичность.
Рассмотрим циклы с несколькими уров-
нями предварительного охлаждения. На
рис. 6.10 дана схема ожижения водорода
с охлаждением прямого потока в двух
ваннах В1 и В2 и последующим дроссе-
лированием. По сравнению со схемой на
рис. 6.7 добавлены ванна В2 и теплооб-
менник Т2; охлаждающий поток, как и
ранее, жидкий азот. В ванне В1 поток
азота кипит при атмосферном давлении
(Т3 = ТП1 = 80 К). В ванне В2 поток азота
Go2 кипит под вакуумом (Т5 = Тп2 ~ 65 К).
Такая организация цикла позволяет
уменьшить общий расход азота по срав-
нению с расходом в цикле по рис. 6.7,
где в одной ванне весь азот кипит под
вакуумом. Холодные пары вакуумного
306
потока 602 в небольших установках выводятся из цикла сразу
после теплообменника Т1; это упрощает процесс откачки паров
вакуумным насосом, хотя потери холода увеличиваются. Расчет
цикла предусматривает определение х, G0|, G02, а также
характеристик /0, е, ц,. Коэффициент ожижения х и поток G02
находят по формулам (6.49) и (6.50), полученным для аналогич-
ных ступеней. При этом необходимо учесть индексы, принятые
на рис. 6.10. Расчетная формула для верхней ступени отличается
от рассмотренных ранее вариантов, так как через нее проходит
дополнительный обратный поток G02. Из уравнения энергети-
ческого баланса этой ступени получим
<?0] — Gq](/12 - /ц.) — х (/[. - /'[Q.) + [(А/^ - Az^) +
+ Ср^Т\ АС) + ^С11 ' ^02^'15 " z'14) • (6-55)
При использовании этого метода для гелия необходимо учи-
тывать, что температура его инверсии очень низкая (Тинв = 40 К),
следовательно, предварительное охлаждение гелия можно обеспе-
чить лишь жидким водородом. Для этого целесообразно приме-
нять схему цикла с двумя ваннами предварительного охлажде-
ния и двумя охлаждающими потоками G()1 и G02 (см. рис. 6.10).
В ванне В1 кипит жидкий азот (Тп1 = 80 К), в ванне В2 --
жидкий водород (Тп2 = 20... 14 К). При атмосферном давлении
водород кипит при температуре 20,4 К, под вакуумом темпера-
туру можно снизить до 14-16 К (тройная точка 13,95 К).
Все потоки в этом цикле находят из уравнения энерге-
тического баланса для трех ступеней: для 1-й ступени — в
интервале температур от Т2 до Т3, для 2-й ступени — в интервале
от Т3 до Т5, для 3-й ступени — в интервале от Т5 до Т?.
Коэффициент ожижения рассчитывают по формуле (6.49),
причем его значение определяется изотермическим эффектом
дросселирования Д/’г при температуре Т3 водородной ванны.
Зависимость коэффициента х от давления р2 и температуры
Т5 приведена на рис. 6.11. Максимумы кривых соответствуют
Давлению инверсии (для гелия /?инв = 3 МПа); на практике
применяют р2 — 2,5...2,2 МПа. Снижение Т5 с 20 до 14 К приво-
дит к увеличению коэффициента х примерно в 3 раза. Неполнота
рекуперации на 3-й ступени АС = Т5 - Т9. сильно влияет на
Коэффициент х; обычно принимают А 7^=0,5 ... 1,0 К. Приток
теплоты = (0,03...0,05) . Количество водорода Gu„ = G02
Находят из формулы (6.50) с учетом индексов по рис. 6.10.
20*
307
Для 2-й ступени неполнота рекуперации Л7’; = 7) - Tw --
= 2 ... 3 К. Поток жидкого азота GN = G01 можно определить
из формулы (6.55), так как верхние ступени в этих двух циклах
одинаковы: &Т, = Т2 - Ту = 10... 15 К.
Работа, совершаемая в этом цикле, определяется работой
компрессора и работой получения жидких водорода и азота
/0 = In (^2//’1)1(пи.)х) + G^/^/x + G^/^/x , <6.561
где /()[| и /0N2 — удельная работа ожижения Н2 и N2.
Другой вариант гелиевого ожижительного цикла основан на
дальнейшем развитии схемы, приведенной на рис. 6.10, введе-
нием третьего уровня предварительного охлаждения. В этом
случае жидкий водород кипит в двух
давлении и под вакуумом. Между
ваннами размещают еще один тепло-
обменник. Схема цикла, построен-
ного по такому принципу, но преду-
сматривающего получение жидкого
Н2 непосредственно в самом гелие-
вом ожижителе, дана на рис. 6.12.
Рис. 6.11. Зависимость коэффициента ожижения
гелия от температурного уровня и давления в
цикле с предварительным охлаждением и дроссе-
лированием
Рис. 6.12. Схема цикла ожижения гелия дроссе-
лированием с тремя уровнями предварительного
охлаждения и встроенным водородным циклом
ваннах: при атмосферном
308
Для функционирования этого цикла необходим только жидкий
азот, а также два компрессора К! и К2. Этот цикл универсальный
й позволяет, кроме гелия, получать из ванны В2 жидкий водород.
В ванне ВЗ водород кипит под вакуумом. Количество х жидкого
гелия и вакуумного водорода в можно найти по формулам
(6.49) и (6.50). Зависимость х от давления р2 и температуры С
аналогична приведенной на рис. 6.11. Количество Сн , поступаю-
щего в никл водорода, находят из уравнения энергетического
баланса 2-й ступени в интервале температур от Т\ до Т4. Коли-
чество жидкого азота легко определить, рассматривая верхнюю
ступень цикла как состоящую из двух самостоятельных частей
(гелиевой и водородной) и используя для каждой из них формулу
(6.50). Рекомендации по выбору исходных величин аналогичны
приведенным для цикла рис. 6.10.
Цикл с дросселированием, предварительным охлаждением в
КГМ и эжектором. Схемы таких циклов принципиально не
отличаются от схем с внешним охлаждением жидкостью и с
дросселированием, однако применение газовых машин сущест-
венно меняет конструк-
тивные формы криоген ой
установки. Схема такого
цикла применительно к
ожижению гелия приведе-
на на рис. 6.13; в схеме
дополнительно предусмот-
рен эжектор Э. Гелий
сжимается в компрессоре
Кло давления р2 ~ 2 МПа,
последовательно проходит
теплообменники Т1—Т4,
причем после каждого
поступает в рабочие по-
лости двухступенчатых га-
зовых машин КГМ1 и
КГМ2, где дополнительно
охлаждается. Газовые ма-
шины обеспечивают отвод
теплоты на четырех уров-
Рис. 6.13. Схема цикла ожижения гелия с
Дросселированием и использованием двухступен-
чатых КГМ для предварительного охлаждения
309
нях температур (Тп ~ 100; 65, 30 и 15 К). Затем этот поток
поступает в 5-ю (дроссельную) ступень, где расширяется в
эжекторе Э до давления 0,25 МПа. После теплообменника Тб
гелий дросселируется до давления р} = 0,1 МПа, жидкость л
выводится, а давление обратного потока (1 — х) повышается в
эжекторе Э от 0,1 до 0,25 МПа. Затем обратный поток
возвращается в компрессор через теплообменники Т5—Т1.
Коэффициент ожижения х находят по формуле (6.49)
(зависимость х от р и Т — см. рис. 6.11). Тепловую нагрузку
газовых машин qOj на каждом температурном уровне находят из
уравнения энергетического баланса ступеней [см. (5.56)].
Характерная особенность этого цикла — применение эжек-
тора, который частично утилизирует кинетическую энергию
расширяющегося газа при дросселировании, в результате чего
повышается давление обратного потока до 0,25 МПа и соответст-
венно снижаются затраты энергии. Если поддерживать давление
р, ~ 0,1 МПа, то эжектор позволяет создать вакуум в емкости С
с гелием и, следовательно, снизить его температуру. Холодопро-
изводительность Д/г не изменяется при включении в схему
эжектора.
Другой способ полезного использования энергии дроссели-
руемого потока — применение криоволновых генераторов холода
(см. § 4.9).
Цикл с двойным дросселированием и циркуляцией части пото-
ка. В циклах с дросселированием улучшение показателей до сих
пор обеспечивали предварительным охлаждением и соответст-
вующим увеличением дроссельного эффекта Ыт. Существует
другой способ улучшения таких характеристик, как /0, е и Т],, —
рациональным выбором давлений потоков и особой схемой орга-
низации цикла.
Формула для расчета холодильного коэффициента теоретичес-
кого цикла с простым дросселированием имеет вид |см. (6.45)]
ет = —у*- =-----------= f(JT, Р,)- (6.57)
r / RT} In^/pj)
Здесь работа I пропорциональна In (рг/Р])- Холодопроизводи-
тельность Мт является сложной функцией давлений р} и рг , но
в первом приближении пропорциональна разности давлений
(Р2 - Р\>-
Очевидно, увеличение конечного давления р = рх (при
р2 = const) приводит к значительному уменьшению знаменателя
по сравнению с числителем; в результате ег увеличивается. Так,
310
для воздуха при Г, = 293 К и
р2 ~ 20 МПа увеличение рк от
0,098 до 9,8 МПа приводит к
увеличению ет в 3,2 раза. Данные
более детального анализа приве-
дены на рис. 6.14. Наибольшая эф-
фективность соответствует макси-
муму кривых (р2 = 20...28 МПа).
Расчеты выполнены для воздуха
при Г, = 288 К. Предварительное
охлаждение нс изменяет харак-
тера зависимости, но приводит к
увеличению абсолютного значе-
ния ет. Такой цикл можно осу-
ществить по обычной схеме (см.
Рис. 6.14. Зависимость отношения
qjl от начального рг и конечного рк
давлений в цикле с дросселированием
рис. 6.14), повысив давление обратного потока р{ до рк. Однако
это возможно только в замкнутом рефрижераторном варианте.
При получении жидкого продукта, который почти всегда
используют при давлении окружающей среды, неизбежны
дросселирование жидкости от давления рк до атмосферного и
частичная потеря жидкости. Для исключения этого одну часть
газа дросселируют до более высокого (промежуточного) давления
рпр, а другую часть — до атмосферного давления. Циркулирую-
щий поток при повышенном давлении рпр = рк повышает эффек-
тивность процесса охлаждения.
Схема такого цикла и его изображение в диаграмме Т— s
Приведены на рис. 6.15. Газ в количестве Z>2 сжимается в ком-
прессоре К1 в интервале давлений от р, до рк = рпр. В точке 2 к
нему присоединяется циркулирующий поток D}. Суммарный
поток (£>2 + £>] = 1) сжимается в компрессоре К2 до высокого
давления р2 (сжатие изотермическое). Весь поток в состоянии,
соответствующем точке 3, поступает в теплообменник Т при
температуре Г3, охлаждается до температуры Т4 и дросселируется
вентилем ДВ1 в сосуд С1 до промежуточного давления р .
После этого часть £>, потока, давление которого рпр , возвра-
щается через теплообменник Т в компрессор К2. Другая часть
дросселируется вентилем ДВ2 до давления рх в сосуд С2 (точки
7-8} ц частично (в количестве х) ожижается, а оставшиеся пары
(Z>2 — х) подогреваются в теплообменнике Т и выводятся из
Цикла при температуре 1\.. В сосуде С1 после первого дрос-
селирования может образоваться парожидкостная смесь, если
Лл> < Рк (см- рис. 6.15, б). Если рпр > рк, то изобара д||р пройдет
зп
Рис. 6.15. Цикл с двойным дроссели-
рованием и циркуляцией части потока 1)}
при промежуточном давлении:
а — схема; б — диаграмма 7 — s
выше пограничной кривой, и в сосуд С2 дросселируется газ.
Циркулирующий при > рк поток Z), обеспечивает эффектив-
ный процесс охлаждения с более высоким коэффициентом г
Особенность цикла состоит в том, что для него требуется два
компрессора; в теплообменнике Т два обратных потока D} и
Z>2 — х; неполнота рекуперации соответственно АТ32. и Л/фр-
Цикл — двухступенчатый. Первое дросселирование обеспечивает
полезный эффект и компенсацию всех потерь в интервале темпе-
ратур от Tj до Т5, второе — в интервале температур от Т5 до Т(.
Определим коэффициент ожижения из уравнения энергетическо-
го баланса для всего цикла в целом: /3 + qc = D,iT + (#2 - x)z‘r 4
+ xij. Преобразуем это уравнение с учетом того, что D{ = 1 - D^.
Заменив ф = - cp}AT3v и ф, = ф - с2Дф.2., получим
Л' [ ф - ф ср Д । ] — ф - ф + £ф [ /ф - ф +
+ (ср2 Д ^3-2' “ ‘ Ср2 Д ^3-2’ + • (6.58)
Отсюда можно найти количество жидкости х. Если принять
одинаковые теплоемкость и неполноту рекуперации для обоих
обратных потоков (ср1АТ3_г = <ф2Д7ф_2. = с АТ), то
Д/г + D-,AiT - (с ДТ + <7 )
_____2 р______(6.59:
ф-ф-с,ДТ
где Air = L - L ; Дф = ф - ф .
‘2-3 2 3’ '1-2 1 2
312
Это уравнение несколько отличается от соответствующего
вЫражсния (6.40) для цикла с простым дросселированием, так
как различен интервал давлений для разных потоков. Сумма
+ D2&ii\_2
несколько меньше полного дроссельного эффекта
12
'1-3
что приводит к некоторому уменьшению
коэффициента х по сравнению с циклом, включающим простое
дросселирование. Преимущество цикла состоит лишь в умень-
шении работы сжатия в обоих компрессорах
А‘г2-з
‘1 '
AT, In (р2/рпр) + Д21п (Рнр/Р,)
(6.60)
Уменьшение потока D2 приводит к уменьшению работы /0,
однако произвольно уменьшать поток D2 нельзя. Связь между
Р2, D, и х можно установить из уравнения теплового баланса
теплообменника
‘3 - >4 + <k= DS 'l2' - 'б) + <6-61)
Выражения (6.59), (6.61) и уравнение материального баланса
D, + D2 = 1 позволяют определить все потоки в цикле. Цикл
можно использовать и в рефрижераторном варианте; тогда его
холодопроизводительность определяется числителем формулы
(6.59). Работа /0 зависит от потока D2 и промежуточного давления
рпр. На рис. 6.16 приведена такая зависимость для воздуха
ср&Т + qc = 9,7 кДж/кг. Оптимальное промежуточное давление
рпр = 3...5 МПа; значение D2 = 0,2 близко к минимально допус-
каемому. При р = р, кривые сходятся в одной точке, соответст-
вующей циклу с простым дросселированием.
Рис. 6.16. Зависимость удельной
работы /0 от промежуточного дав-
ления />пр при ожижении воздуха в
Цикле с двойным дросселированием
и Циркуляцией (/>, = 0,098 МПа,
Рг = 19,6 МПа); сплошные линии
~~ Цикл без предварительного ох-
лаждения, штриховые — цикл с
Предварительным охлаждением до
К = 233 К
Пример 6.6. Параметры цикла с двойным дросселированием для ожижения
воздуха: 7\ = 300 К; р{ = 0,098 МПа; р2 = 19.6 МПа; р = 4 Mila; D2 = 0.25 ki
Неполнота рекуперации ДТ= 5 К; приток теплоты <7=6 кДж/кг; с = 1 кДж/(к! • К).
И„з = 0-6. Определить долю жидкости х и удельную работу' /(1.
По диаграмме 7—5 для воздуха находим (см. примеры 6.2 и 6.3) энтальпии
(кДж/кг): /, = 300. /2 = 292, ц = 266. i. . = - 128. По формуле (6.59) при Д/Л
= 292 - 266 = 26 кДж/кг и Дгг = 300 - 292 = 8 кДж/кг
л = (26 + 0.25 • 8 (1 • 5 +6)]/(300 + 128-15) = 0.045.
Удельная (отнесенная к массе жидкого воздуха) работа |см. формулу (6.60)|
/0 = 0.287-300[1п(19,6/4) + 0,25 • 1п(4/0.098)]/(0.6 • 0,045 • 103) = 8,03 МДж/кг
Предварительным охлаждением можно еще больше повысить
экономичность цикла, но его применяют в основном для водо-
рода, который необходимо охладить до температуры ниже Тинв.
Схема такого цикла и его расчетная характеристика по удельной
работе приведены на рис. 6.17. В схему дополнительно введены
5)
Рис. 6.17. Цикл с предварительным охлаждением
и двойным дросселированием для ожижения
водорода:
а — схема: б — зависимость удельной работы of
давлений р2 и />пр
314
6.2. Характеристика циклов с дросселированием
Цикл X 4)' МДж/кг Л, кДж/кг
С простым дросселированием 0.0543 14 0,0528 11
С двойным дросселированием 0,045 8.03 0,092 11
С дросселированием и предвари- тельным охлаждением (Тп = 228 К) 0,162 4,98 0,148 8
С двойным дросселированием и 0,137 3,24 0,228 9,7
предварительным охлаждением (Тп = 228 К) Идеальный цикл ожижения 1 0,738 1 0
ванна предварительного охлаждения В и теплообменники Т2 и
ТЗ. Внешнее охлаждение обеспечивается жидким азотом C?N
(Т = 80...65 К). В остальном последовательность процессов
аналогична приведенной на рис. 6.15, а. Удельная работа (см.
рис. 6.17, б) вычислена при Тц = Т\ = 65 К, АТ3_8 = 1 К,
qc = 0. Минимальное значение /0 соответствует р = 2...3 МПа,
причем р = р2/1. Увеличение р2 свыше 8 МПа не приводит к
увеличению /0. Коэффициент х в этом цикле следует рассчи-
тывать по уравнению (6.59), записанному для интервала темпера-
тур от Т3 до Tj.
Сравнительная характеристика циклов с дросселированием
для ожижения воздуха дана в табл. 6.2. Исходные данные:
Т= 300 К; р2 = 19,6 МПа; рх = 0,098 МПа.
Дроссельный цикл на многокомпонентных смесях. Дальнейшее
развитие и совершенствование циклов с дросселированием
привело к созданию эффективных циклов с газовой смесью в
качестве рабочей среды. Первый такой одноступенчатый
каскадный цикл предложен А.П. Клименко в 1951 г. для ожиже-
ния углеводородных газов. В качестве рабочей среды используют
смесь хладагентов с различной температурой конденсации каждо-
го из них — от То до Тх; схема цикла дана на рис. 6.18. Примене-
ние такой смеси позволяет организовать как бы многократное
дросселирование, используя для этого сконденсированные при
различных температурах компоненты смеси. Для смесей также
характерен высокий дроссельный эффект Д/'г. Ранее исполь-
зовали такие рабочие смеси, как метан — пропан — бутан и
метан — пропан. Смесь хладагентов сжимается в компрессоре
К до давления р2, теплота сжатия отводится в холодильнике
X. В этом холодильнике на уровне То конденсируется часть
Потока — компонент Dx с высокой температурой конденсации.
315
Рис. 6.18. Принципиальная схема
однопоточного цикла на многокомпо-
нентных смесях с дросселированием
В сборнике Ci происходит раз-
деление фаз; пар идет в тепло-
обменник Т1, где охлаждается,
а жидкость дросселируется вен-
тилем ДВ1 в обратный поток и
охлаждает оставшуюся часть
прямого потока. После охлажде-
ния в теплообменнике Т2 часть
прямого потока Z>2 снова кон-
денсируется, и жидкость отде-
ляется в сборнике С2, пар про-
ходит в следующий теплообмен-
ник ТЗ. Жидкая фаза вентилем
ДВ2 дросселируется в обратный
поток, охлаждая прямой поток
при более низкой температуре.
Процесс продолжается до дос-
тижения наинизшей темпера-
туры Тх, определяемой свойст-
вами того компонента смеси,
который имеет минимальную
температуру конденсации при
давлении рг
Дальнейшая проработка цик-
ла позволила существенно
упростить его структуру. Так, сохранив классическую схему цикла
с простым дросселированием (см. рис. 6.5) и использовав для
него многокомпонентные смеси, можно повысить эффектив-
ность цикла.
Причины улучшения характеристик цикла на смесях следую-
щие. Смеси можно составить так, что эффект дросселирования
Добудет выше, чем для чистого вещества с близкой температу-
рой конденсации. Компоненты смеси с более высокой критичес-
кой температурой имеют большое значение Д/г.
Другой важный момент состоит в том, что смесь включает
компоненты с высокой (даже близкой к То) температурой кон-
денсации. В результате в теплообменнике конденсируется часть
прямого потока в интервале температур от Т2 до 7) (см. рис. 6.5)
и испаряется часть обратного потока в интервале температур от
Т5. до Ту. Различие давлений р2 и а следовательно, и значений
теплоты фазовых переходов приводит к существенному умень-
шению разности температур прямого и обратного потоков в
316
холодной зоне теплообменника, соответственно уменьшаются
потери от необратимости процесса, и эффективность цикла воз-
растает. К недостаткам такой рабочей среды относится пере-
менность температуры кипения в сборнике жидкости, возмож-
ность выделения твердой фазы из смеси после дросселирования,
g этой связи большую роль играет выбор состава смеси. В
качестве компонентов, кроме указанных, используют азот, аргон,
углеводороды, фреоны. Методы расчета энтальпий смесей доста-
точно сложны. Рассмотренный цикл на смесях по природе ре-
фрижераторный: его применяют в установках конденсации
природного газа и в микрокриогенных системах.
§ 6.3. ДЕТАНДЕРНЫЕ ЦИКЛЫ
Газовые детандерные циклы. К рассматриваемой группе
циклов обычно относят рефрижераторные циклы установок, в
которых детандеры включены на нижнем уровне температур. В
качестве рабочих веществ цикла используют различные газы, но
преимущественно воздух, азот, неон и гелий. Схема цикла и
число ступеней охлаждения в нем зависят от условий работы,
требуемой холодопроизводительности и уровня температуры
охлаждения. Рассмотрим известные простые циклы.
Одноступенчатый цикл. Схема цикла (его
называют также циклом Сименса—Клода [1]) и изображение
процессов на диаграмме Т— s приведены на рис. 6.19. После
сжатия в компрессоре К газ охлаждается в холодильнике X до
температуры Г2 (точка 2) и поступает в теплообменник Т. В
компрессоре затрачивается энергия, численно равная работе /к
и отводится теплота q^ , в холодильнике от газа отводится теплота
<?к'. После теплообменника (точка 3 ) газ подается в детандер Д,
где расширяется до низкого давления (при этом производится
работа /д), и направляется в низкотемпературную камеру НК
(объект охлаждения). В камере к газу подводится теплота <?х, и
газ нагревается от температуры Т4 (точка 4) до Т5 (точка 5).
Затем газ (обратный поток) подогревается в теплообменнике до
состояния, соответствующего точке 7', забирая теплоту от сжа-
того газа (прямой поток), текущего через теплообменник в
Противоположном направлении. На теплом конце теплообмен-
ника разность температур потоков газа А Гт = 7\ - Т\..
317
Рис. 6.19. Одноступенчатый детандерный цикл:
а — схема; б — диаграмма Г— s
Теплообменник Т, детандер Д и камера НК изолированы от
окружающей среды.
Удельную полезную холодопроизводительность q,. определим
из уравнения энергетического баланса для детандерной ступени
охлаждления (на рис. 6.19, а ограничена контуром /). С учетом
принятых обозначений для 1 кг сжатого газа, поступающего в
теплообменник Т, получим
- /2 + Мг) - (^с + с/Тт). (6.62)
Здесь слагаемые в первых скобках правой части уравнения
характеризуют удельное количество холода, полученного в цикле
за счет изотермического дроссельного эффекта сжатого газа
= zi ‘ z2 и Расширения газа в детандере /г^ (hs — разность
энтальпий газа в точках 3 и 4S в процессе у = const). Сумма
членов во вторых скобках правой части уравнения характеризует
удельные потери холода в цикле. Если температура Т2 газа,
поступающего в теплообменник, выше температуры инверсии,
то разность /] - /2 становится отрицательной и соответственно
уменьшается количество полученного холода. Подобные условия
возможны, например, при использовании в рассматриваемом
цикле в качестве рабочего вещества таких газов, как гелий,
водород или неон.
318
Удельная работа в цикле без учета утечки газа
1= /К - /Д П мех = 111 "К - М.Пмсх, (6-63)
где _ степень сжатия газа в компрессоре; Т]из — изотермичес-
кий КПД компрессора; г|мех — коэффициент, характеризующий
долю работы расширения газа в детандере, возвращаемую в цик-
ле (механический КПД детандера).
Степень сжатия лк = р2/рх связана с отношением давлений
в детандере лд зависимостью
як = j Яд , (6.64)
где j — приведенный коэффициент гидравлических потерь:
/ = (1 + Др/^)/(1 - Др0/р0), (6.65)
где &р/р и ^pJPq — безразмерные потери давления соответствен-
но для прямого и обратного потоков; р и р0 — давления до и после
детандера (для рассматриваемого цикла р - рг и р0 = рД
Если в камере необходимо поддерживать постоянную темпе-
ратуру, равную Т, то в качестве идеального цикла следует при-
нять цикл Карно (см. § 5.1). Температура рабочего вещества на
выходе из камеры НК в реальном цикле должна быть ниже тем-
пературы Тх, т.е.
Т5=ТХ-^ТИК, (6.66)
где ДГНК — разность температур рабочего вещества на выходе
из камеры и среды в камере (в теоретическом случае можно
допустить АТНК = 0 и Т5 = Тх).
Для каждого значения температуры Тх при выбранном обору-
довании существуют оптимальные значения параметров цикла,
соответствующие максимуму холодильного коэффициента цикла
е [13, 52].
Вначале рассмотрим упрощенную задачу о рациональном вы-
боре отношения давлений газа до и после детандера (лд = р/р>.)
при неизменных значениях других параметров. При увеличении
Яд возрастают количество полученного холода q.. и удельная
работа /. Характер изменения значений q.. и / различный, и при
наличии потерь холода в цикле существует оптимальное значение
Яд (обозначим его лд ), которому соответствует максимум холо-
дильного коэффициента. Для определения лд t следует решить
Уравнение
rfe/t/Яд = 0. (6.67)
319
Вместо холодильного коэффициента иногда удобнее использо-
вать обратную функцию
V = 1/е = (/к - /дПмех)/<7Х’ <6-68>
ГЛС 1К = /из/Пиз-
Минимуму функции ц/ соответствует оптимальное отношение
давлений Яд , при котором должно выполняться условие
йЛ|//й^д = 0. (6.69)
Примем известными и постоянными J, Цмех, T|s, циз, Т2, 7\.
qc, Р4.
Если свойства криоагента удовлетворяют модели идеального
газа, то уравнение (6.69) можно продифференцировать, предвари-
тельно преобразовав его с учетом выражений (6.63)-(6.65) и
следующих зависимостей:
=сР(тз~ ТАУ, = ср (Т5 - Т4) — с (Т3 - Т4 - Д Тх);
(6.70)
тз - т4 = (1 - Л-) ; Д тх = Д Tr + qc /ср- к = (к - 1)Д;
здесь к — показатель адиабаты; с — удельная изобарная
теплоемкость; ДТХ = Т3 - Т5 — разность температур на холодном
конце теплообменника.
После дифференцирования и преобразования уравнения (6.68)
с учетом условия (6.69) получим уравнение, для решения
которого можно также использовать методику, изложенную в
работе [19]:
- (1 - У) In (1 - У) = (1 + а0) У - (Zq + «0)’ <6-71)
где у = (Т3 - T4)/(tisT3) и zQ = ДTx/(r[sT3) — безразмерные
комплексы, характеризующие соответственно холодопроизводи-
тельность и потери холода в цикле; «0 = х In j - цизГ)мех Д Тх/Т} —
безразмерный комплекс, зависящий от гидравлических потерь
и КПД машин.
При выбранных значениях J, цмех, Т|из, д Т5 опреде-
лим «0 и Zq и из уравнения (6.71) найдем оптимальное значение
у (равное yopt)- Тогда оптимальное отношение давлений Лдор(,
соответствующее минимуму функции ц/,
Tlopt = О - Eopt)’VX- (6-72)
Вследствие слабого изменения функции е в интервале значе-
ний Лц, близких к Лдор(, в ряде случаев (особенно при использо-
320
вании турбомашин) можно уменьшить лд в 1,3-1,8 раза по срав-
нению со значением лДорГ полученным по формуле (6.72); при
этом е существенно не уменьшается.
На рис. 6.20 приведены рассчитанные по диаграмме Т—.ч
зависимости холодильного коэффициента е гелиевого цикла при
различных температурах охлаждения 7х от лд при следующих
условиях: изоэнтропный КПД детандера r]s = (),7; изотермичес-
кий КПД компрессора Г)из = 0,6; давление газа обратного потока
р0 = 0,1 МПа; гидравлические потери отсутствуют, энергия
расширения газа в цикле не используется. Согласно рис. 6.20 с
понижением температуры охлаждения холодильный коэффи-
циент уменьшается, а при изменении лд и Тх = const кривые
имеют максимум, соответствующий оптимальному отношению
давлений лд opt .
При сравнении результатов расчета цикла для реального гелия
с вариантом расчета, при котором свойства гелия удовлетворяют
модели идеального одноатомного газа, выявлено, что для области
температур выше 30 К и р < 1,5 МПа значения етах достаточно
близки; несколько больше различаются значения лДорГ
Оптимальная степень сжатия
^Kopt 7 лд opt- (6.73)
Изложенный расчет оптимальных значений является упро-
щенным и недостаточно точным. На энергетические характерис-
тики цикла (кроме лд) существенно влияют КПД машин, геомет-
рические характеристики, гидравлические потери и температур-
ный напор АТ в теплообменном аппарате и другие параметры.
Значения лд и А Т — взаимно
независимые. Гидравлические
потери в теплообменном ап-
парате зависят от А Т, а также
от типа теплообменного аппа-
рата, его геометрических ха-
рактеристик, параметров сос-
тояния и скоростей рабочего
вещества. При выбранном
типе аппарата и принятых
скоростях потоков
7= у (АТ), (6.74)
Так как А» и Ад. зависят от
АТ.
21 □
*• Эаказ № 1542
Рис. 6.20. Зависимость холодильного
коэффициента г. детандерного цикла от
отношения Яд = р/рй и температуры Тх
при дг, = 5 к (гх = 20 к при дт; = 3 К)
321
Холодопроизводительность qx зависит от отношения давлений
Лд, а степень сжатия тск и холодильный коэффициент е зависят
от Яд и АТ, так как
лк=У(АТ)лд; (6.75)
1 (ЛГ1/Пиз) 1пяк - М,Пмех ’
Для определения оптимальных значений лд и АТ необходимо
решить систему уравнений, соответствующую условию макси-
мума холодильного коэффициента. Если вместо температурного
напора в качестве независимой переменной принять разность
температур на теплом конце теплообменника ДТт, а температур-
ный напор выразить через эту разность, то система уравнений
для определения оптимальных значений лд и Д Т примет вид
(бе/Фтд)д7, = 0; (д£/ФДТт)Яд = 0, (6.77)
причем КПД детандера и компрессора, а также qc и Т5
постоянны, алди ДГТ изменяются.
Аналитически решить систему уравнений (6.77) даже для
простого детандерного цикла часто невозможно, поэтому обычно
применяют численные методы расчета [19, 52]. Сначала при
различных значениях лд и постоянном ДТт вычислим холо-
дильный коэффициент цикла е и определим его максимум,
которому соответствует оптимальное значение лд, т.е. лДор( •
Затем повторим аналогичные вычисления при других значениях
АТт и получим новые значения лДор1 и соответствующие им
максимумы холодильного коэффициента; назовем эти макси-
мумы локальными, а значения холодильного коэффициента в
точках локальных максимумов обозначим ем. Таким образом,
получим зависимости лДор( = п(п) и ем = /(Ядopt, п) — рис. 6.21,
где п = \ Тт/Тг — безразмерная приведенная разность температур.
Каждому значению п соответствуют оптимальное значение лд opt
(рис. 6.21, а) и определенный локальный максимум ем холодиль-
ного коэффициента (6.21, б). Сравнив все полученные значения
гм при различных п, видим, что определенному значению п
(обозначим его п ) соответствует точка максимума функции е^,
а этой точке — лДор1 (обозначим его лд ). Таким образом,
вычисленные значения п и лд соответствуют максимуму холо-
дильного коэффициента. На одной из кривых рис. 6.21, б указана
точка М максимума функции i'M и соответствующее оптимальное
значение п. Кривые получены для цикла с пластинчато-
322
Рис. 6.21. Зависимость оптимального
отношения давлений в детандере Яд opt
(а) и холодильного коэффициента ем
(б) от приведенной разности температур
л (7Х = 50 К)
ребристым теплообменником. Геометрическая характеристиа
поверхности теплообмена: гидравлический диаметр 4,64 мм;
отношение площади полной поверхности теплообмена к свобод-
ному объему (компактность) 862 м2/м3; длина ребер 6 мм; шаг
4 мм [15]. Изотермический КПД компрессора и изоэнтропный
КПД детандера при расчетах приняты постоянными (т| = 0,6;
— 0,7( работа расширения в цикле не используется); криоагент
— гелий, свойства которого соответствуют идеальному газу.
Давление после детандера р0 и массовые скорости газа прямого
потока со для кривых 1-5 указаны ниже (массовые скорости и
Размеры каналов для прямого и обратного потоков одинаковые):
Кривая на рис. 6.21........ 1
Ра> МПа...................0,196
кг/(м2-с)...............6,12
2 3 4 5
0,196 0,147 0,196 0,196
7,40 6,12 9,75 13,9
21*
323
На рис. 6.21 приведены также зависимости (штриховые
линии) холодильного коэффициента е^и оптимального отноше
ния давлений в детандере Лдор[ от п для вариантов расчета цикла
без учета гидравлических потерь (т.е. при А р = А ра = 0 и
7=1, 0). Сравнение показывает, что не только значения е^ и
opt отличаются от рабочих оптимальных значений ем и 7Сд
но различен и характер линий: исчезают экстремумы функций
при промежуточном значении и; наибольшее значение е^ и наи-
меньшее значение л'1ор( соответствуют п = 0. Если гидравличес-
кие потери в цикле учесть условно, приняв приведенный коэф-
фициент у = const без учета уравнения (6.74), то значения
холодильного коэффициента будут меньше а по характеру
изменения функция £м будет идентична функции е^ . В действи-
тельности при уменьшении п возрастают гидравлические потери
в теплообменном аппарате, и при малых значениях п их влияние
становится настолько существенным, что холодильный коэффи-
циент цикла уменьшается. Этот эффект проявляется тем резче,
чем больше массовые скорости потоков в теплообменнике (кри-
вые 4 и 5 на рис. 6.21). Возвращение работы расширения в цикл
практически не влияет на оптимальные параметры, но при
относительно высоких температурах охлаждения вызывает увели-
чение термодинамического КПД.
Термодинамический КПД цикла при снижении температуры
охлаждения вначале возрастает, а затем, достигнув максимума,
начинает уменьшаться; наибольшим значениям ф цикла соответ-
ствует интервал температур Тх примерно от 100 до 50 К; опти-
мальное значение степени сжатия при этом заметно возрастает
при уменьшении температуры Тх.
При комплексном расчете цикла с учетом газодинамических
характеристик поверхности теплообмена и использовании
уравнения связи (6.74) между гидравлическими потерями и
разностью температур в теплообменном аппарате удается опреде-
лить более рациональные значения параметров цикла, чем при
термодинамическом расчете цикла без учета характеристик
теплообменного аппарата [19]. Однако и такой расчет в ряде
случаев не позволяет надежно определить оптимальные значения
параметров цикла, так как при изменении параметров состояния
и расходных характеристик рабочего вещества возможно
изменение как типа, так и КПД машин. При учете изменения
характеристик компрессора и детандера оптимальное значение
степени сжатия может отличаться от значения, полученного в
расчете цикла при постоянных КПД [41].
324
В действительности полный расчет цикла, включающий опре-
деление оптимальных значений основных параметров, сложнее
описанного, так как их рациональный выбор невозможно надеж-
но обосновать с учетом только энергетических характеристик.
Это объясняется тем, что отдельные параметры по-разному
влияют на расход энергии и стоимость установки. Например,
во всех практически целесообразных случаях увеличение ско-
рости рабочего вещества приводит к росту гидравлических потерь
и дополнительному расходу энергии; с другой стороны, при
очень низких скоростях рабочего вещества увеличиваются разме-
ры теплообменного аппарата, а следовательно, и его стоимость.
Противоречивое влияние на энергетические и стоимостные
характеристики установки оказывает также температурный напор
в теплообменном аппарате. На рис. 6.22 приведены качественные
зависимости холодильного коэффициента е и относительной
площади поверхности регенеративного теплообменника F/F * от
среднего температурного напора АГ в теплообменнике. Значение
F* соответствует максимуму холодильного коэффициента (точка
М) и оптимальному температурному напору АГ в теплообмен-
ном аппарате. С увеличением температурного напора уменьша-
ются холодильный коэффициент цикла е и площади поверхности
теплообмена F, следовательно, увеличивается расход энергии на
единицу холодопроизводительности и уменьшается стоимость
теплообменного аппарата. Последняя зависит от размеров и типа
теплообменника, поэтому выбор рациональных скоростей рабо-
чего вещества, температурного напора и геометрических характе-
ристик теплообменного аппарата невозможно обосновать только
термодинамическим расчетом и определенными с его помощью
энергетическими характерис-
тиками. Энергетически опти-
мальный температурный напор
может не совпадать с эконо-
мически оптимальным [52].
Кроме изложенных сообра-
жений, при расчете и создании
установки необходимо обеспе-
чить надежность ее работы и
по возможности использовать
Уже освоенное оборудование.
В связи с этим задача расчета
Любой схемы установки и ее
Цикла еще больше усложня-
Рис. 6.22. Зависимость холодильного
коэффициента е и относительной
поверхности регенеративного тепло-
обменника F/F* от среднего темпера-
турного напора А 7'
325
ется. На примере простого цикла с одной ступенью охлаждения
рассмотрим подход к решению задач по оптимизации основных
параметров. В работах [4, 13, 19, 41, 52] приведены отдельные
методики расчета, которые можно использовать при исследова-
нии газовых детандерных циклов.
Цикл с двумя ступенями охлаждения. На
рис. 6.23 приведена схема рефрижераторного цикла с
параллельным включением детандеров и изображены процессы
на диаграмме T-s. Преимущество этого цикла по сравнению с
рассмотренным простым циклом — меньшая оптимальная
степень сжатия и несколько большее ее значение Т]р поскольку
потери холода компенсируются более эффективным способом
— получением холода на разных температурных уровнях. При
температурах охлаждения выше 100 К двухступенчатые циклы
не дают существенной энергетической выгоды по сравнению с
простым циклом.
Схема цикла включает компрессор К с концевым холо-
дильником, теплообменники Tl, Т2 и ТЗ, детандеры Д1 и Д2,
низкотемпературную камеру НК. Газ проходит теплообменник
Т1, после которого (точка 6) часть газа D. отводится в детандер
Д1, расширяется в нем и поступает в теплообменник Т2 в качест-
Рис. 6.23. Детандерный цикл с параллельным включением детандеров:
а — схема; б — диаграмма Т— s
326
ве обратного потока. Оставшаяся часть газа Т>2 после теплообмен-
ников Т2 и ТЗ расширяется в детандере Д2 (точка 4) и подастся
в камеру НК. После камеры (точка 5) газ в качестве обратного
потока проходит теплообменник ТЗ и присоединяется к газу 7^,
выходящему из детандера Д1. Удельную холодопроизводи-
тельность определим из уравнения энергетического баланса
нижней ступени охлаждения (ограничена на рисунке контуром
II) [см. (5.68)]. Для единицы массы газа, поступающего в
теплообменник Tl : D2 = 1 - L),. С учетом принятых обозначений
запишем выражение для количества полученого холода
<К = (1 - ^)1^2Пз2 + k - h - <k2 - ср(Т. - т,)], (6.78)
где hs2 — разность энтальпий /3 — i4s для детандера Д2; т) (.2 —
изоэнтропный КПД детандера Д2; qc2 — приток теплоты из
окружающей среды в нижнюю ступень охлаждения, отнесенный
к массе поступающего в ступень газа.
Долю D] детандерного потока определим из уравнения энерге-
тического баланса для верхней ступени цикла, ограниченной на
рис. 6.23 контуром I. С учетом обозначений на рис. 6.23, а также
условия £)] + D2 = 1 кг уравнение энергетического баланса
можно записать в виде
+ I'i - '2 - Ср<Т1 - = С1 - Л)Х
х[/8 " h ~ (zi " z2) + ср(?\ ~ Tv Т, + 7g. ) + qcl], (6-79)
где hsX = i6 - /gj; qc} - удельный приток теплоты в верхнюю
ступень.
Общее уравнение энергетического баланса цикла
MPLi + D2 hs2 t1f2 + /\ - /2 = <7С1 + D2qc2 + срАТт + qx (6.80)
обычно используют для проверки правильности полученного
решения, так как новой информации по сравнению с двумя
Уравнениями баланса для верхней и нижней ступеней охлаж-
дения оно не дает.
Вместо верхнего детандера Д1 для промежуточного охлажде-
ния рабочего вещества можно использовать также газовую
холодильную машину (ГХМ) или испарительную ванну с жидким
хладагентом [13, 19].
Сравнительные характеристики газовых циклов. На рис. 6.24
приведены зависимости степени термодинамического совершен-
ства т|? различных циклов от температуры Гх с учетом опублико-
ванных данных. Все значения T]z для газовых детандерных циклов
327
Рис. 6.24. Зависимость коэффициента д, от температуры 7Х для газовых криогенных
циклов:
1 — одноступенчатой ГХМ; 2 — воздушной холодильной машины при qK = т|,
= 0,9: 3 — двухступенчатой ГХМ; 4, 5 — газовой установки с детандером при
= 0,6; Л3 = 0,8; АТ) = 5 К (4-лмех = 1,7 = 1, <JC = 0; 5 - Л^х = 0,;= 1.0:-
</с = 6,3 кДж/кг); 6, 7 — установки с ГХМ и детандером (6 — ту = 0,7'-,
Пю = 0,6, г|мех = 0,9, п = 0,025; j = 1,15, m = 0,005; 7 — ту = 0,8, т]ш = 0.7,
дмех = 1,0. п = 0,014, m = 0,003); 8 — диз ту = 0,56, дмех = 1, « = m = 0, j = 1
(кривые 4-7) получены при энергетически оптимальных степенях
сжатия. Для сравнения приведены аналогичные зависимости для
одноступенчатой (кривая 1) и двухступенчатой (кривая 3) ГХМ
работающих по обратному циклу Стирлинга (см. § 6.6 и работу
[1]). Кривые 4-/построены по расчетным значениям т]г детандер-
ных циклов, полученным с учетом основных потерь при постоян-
ных КПД компрессора и детандера, причем кривые 4 и 5
соответствуют одноступенчатому циклу (рис. 6.19, а), кривые 6
и 7 — двухступенчатому с ГХМ на промежуточном уровне
температур и детандером на нижнем уровне [19]. При этом в
варианте расчета для кривой 7 значения КПД машин г|из и р,
приняты существенно большими, чем в варианте для кривой б.
Значения коэффициента т|? ГХМ для обоих вариантов расчета
выбраны в соответствии с опубликованными данными в зависи-
мости от температурного уровня включения ГХМ в цикле.
Удельный приток теплоты qc к теплообменным аппаратам в
вариантах расчета 6 и 7 учтен с помощью безразмерною
параметра: m = qc/(c &ТС), где ДГС — разность температур на
входе и выходе прямого потока из теплообменника (для нижнеи
ступени охлаждения за температуру выхода принята температура
Т5 рабочего газа после холодильной камеры). В вариантах расчета
328
4 — 8 в качестве рабочего газа принят гелий, удовлетворяющий
додели идеального газа. Расчетная кривая 2 построена по дан-
ным работы [52] для простого воздушного цикла, где приняты
высокие значения изоэнтропных КПД компрессора т]к и детан-
дера т] . Анализ графиков показывает, что повышение КПД
машин - одно из основных условий создания эффективных
рефрижераторных установок с детандерами в областях как
умеренных, так и криогенных температур.
Расчетная кривая 8 соответствует значениям Г|г для цикла на
рис. 6.19, а при отсутствии всех эксергетических потерь, кроме
потерь в машинах; таким путем можно оценить верхнюю теоре-
тическую границу совершенства цикла с реальными машинами.
Термодинамический анализ реального цикла. Для более полного
раскрытия физической сущности потерь в установке выполняют
термодинамический анализ цикла, используя для этого эксерге-
тический или энтропийный методы исследования (см. гл. 5 и
работы [4, 35, 62]) Рассмотрим в качестве примера изменение
энтропии в процессах, происходящих в основных элементах
рефрижераторной установки, которая работает по детандерному
циклу (см. рис. 6.19). Несмотря на простоту цикла в него
включены основные процессы, происходящие в любых более
сложных циклах. Аналогичные задачи рассмотрены в работах [13,
17 и др.]. Определим изменение энтропии системы в отдельных
процессах, составляющих цикл. Пусть рабочее вещество — иде-
альный газ. Суммарное увеличение энтропии при сжатии 1 кг
рабочего вещества в компрессоре К (если 7\ = То) определим
как алгебраическую сумму изменения энтропии при отводе
теплоты сжатия qcx в окружающую среду с температурой То и
изменения энтропии As при обратимом изотермическом сжатии
газа, т.е. Дхк = q^/Tt. - Дхиз или
А'к = (Я/Пиз) In лк - А In = (1/циз - 1)/? In , (6.81)
где R — газовая постоянная; лк — степень сжатия в компрессоре;
Лиз — изотермический КПД компрессора.
Увеличение энтропии системы при расширении 1 кг рабочего
вещества в адиабатном детандере
Дхд = Х4 - 53 + hsX]s (1 - Пмех)/7!)’ <6-82)
где 53 и х4 — удельная энтропия рабочего вещества до и после
Детандера.
Последнее слагаемое правой части выражения (6.82) характе-
ризует дополнительное увеличение энтропии системы вследствие
329
потери части работы, произведенной в детандере. Для идеального
газа формулу (6.82) можно преобразовать к виду
Д\', = с |1п -----------+ ——— (1 - ri )]. (6.83)
Д р1 ?4 - (! - П,)7) то
Для идеального газа л* = T3/T4s; х = (к - \)/к\ .s4 - .s4f =
= 5,1л (T4/T4s)-, 4s = (Т3 - Т4)/(Т3 - T4s).
Если температура рабочего вещества Т2 равна температуре
окружающей среды То, гидравлические потери отсутствуют и
расходы прямого и обратного потоков одинаковы, то увеличение
энтропии системы в процессе теплообмена для 1 кг газа
Ч = 5г - - (52 - 5з) - Яс/Tq (6.84)
Если свойства рабочего вещества соответствуют идеальному
газу, то увеличение энтропии при 7) = 1\ = То
^ = ср{1п [(Х-Д^/ГДД+Д^/^Д-^^-ДТ;)/^}, (6.85)
где Д7Х = Т3 - Г5; Д Тт = Т} - Гг ; qjcp = Д Гх - ДГТ .
При наличии гидравлических потерь в теплообменнике возни-
кают дополнительные необратимые потери. Определим ориенти-
ровочно увеличение удельной энтропии вследствие этих потерь,
приняв его равным увеличению энтропии в процессе дроссели-
рования идеального газа:
= Я In ' + . (6.86)
Р Ра' 4Л 1 ’ кРа/Ра
Преобразуем эту зависимость с учетом выражения (6.65):
\s'T ~ R In j — и cplnj , (6.87)
где R = (к - i)cp/k = хс .
Увеличение энтропии при взаимодействии 1 кг рабочего веще-
ства с охлаждаемой средой низкотемпературной камеры, изоли-
рованной от окружающей среды,
4k=VV (6-88)
где 7Х — температура охлаждаемой среды, принятая постоянной.
Для идеального газа
A'iK = СР Un ' (^ - Т4)/К] (6-89)
Вследствие разности температур на теплом конце теплооб-
менника (в многоступенчатых циклах — на теплом конце верх-
330
него теплообменника) возникают дополнительные небольшие
потери вследствие необратимости процесса Г-1. Предположим,
что 1 кг рабочего вещества подогревается при постоянном давле-
нии от температуры (Г, — ДГТ) до температуры окружающей
среды Го (равной 7,) при взаимодействии с окружающей средой.
Тогда возникают дополнительные потери при необратимом
процессе теплообмена, приводящие к увеличению энтропии
Чоп = - сР1п (1 - дгт/г1) - срдгт/г1 ’ (6.90)
которое мало по сравнению с ранее полученными.
Зная изменение энтропии, можно вычислить эксергетические
потери П; = 1ц Дя- в элементах установки, оценить эффективность
отдельных процессов и определить, какие из них требуют улуч-
шения в первую очередь. Для этого обычно вычисляют приведен-
ные эксергетические потери [35]
П; = То Д5,.// (6.91)
и степень термодинамического совершенства цикла
П, = 1 - Еп,. ,
/
где I — удельная работа, совершаемая в цикле.
Процессы, происходящие в технической системе, обычно
взаимосвязаны, поэтому необходимо помнить, что при устране-
нии необратимости в каком-либо одном процессе следует
обязательно учесть возможные изменения, происходящие при
этом и в других частях системы. При анализе простого рефри-
жераторного цикла установлено, что основная доля эксергети-
ческих потерь обусловлена несовершенством машин и зависит
от КПД компрессора и детандера. Приведенные эксергетические
потери П . в элементах простой рефрижераторной установки
составляют до 40% для компрессора, до 20% для детандера и
примерно столько же для теплообменника.
Несмотря на большое число работ, посвященных термо-
динамическому анализу циклов и систем, он актуален и в настоя-
щее время. Это объясняется рядом причин: большой энерго-
емкостью систем; созданием новых, более сложных систем;
возможностью более корректного учета эксергетических потерь
в системе в связи с новыми исследованиями процессов и исполь-
зованием более точных методов расчета при помощи ЭВМ.
331
6.4. КОМБИНИРОВАННЫЕ ЦИКЛЫ С ДРОССЕЛИРОВАНИЕМ
И РАСШИРЕНИЕМ РАБОЧЕГО ВЕЩЕСТВА В ДЕТАНДЕРАХ
Циклы среднего и высокого давления с двумя ступенями
охлаждения. Циклы рассматриваемой группы эффективны и
находят широкое применение в установках средней мощности
для получения холода и ожижения газов. При нижней темпера-
туре газа в цикле около 80 К обычно применяют две ступени
охлаждения: нижнюю ступень выполняют дроссельной, верхнюю
— детандерной. Использование детандера вместо дроссельного
вентиля для расширения части потока газа позволило создать
более эффективные циклы, так как дросселирование является
необратимым процессом. Такие циклы впервые осуществлены
в начале XX в. Ж. Клодом, а затем П. Гейландтом в установках
среднего и высокого давления с поршневыми детандерами для
получения жидкого воздуха. На рис. 6.25 и 6.26 приведены
принципиальные схемы циклов и процессы на диаграмме Т—s ,
обозначения точек на схемах и диаграммах одинаковые.
в)
Рис. 6.25. Схемы циклов высокого и среднего
давления с дросселированием и расширением
газа в детандере на исходном (а) и промежу-
точном (6) уровнях температуры
Рис. 6.26. Диаграммы Т — '
процессов для циклов, изобра-
женных иа рис. 6.25, а, б
332
Ож и ж ите л ь н ы й режим. Газ сжимается в компрес-
соре К до давления р3. охлаждается в холодильнике X (точка 2)
и подается в теплообменник Т1 (процессы сжатия газа в
компрессоре и охлаждения в холодильнике на диаграмме T—s
не показаны). Последовательно пройдя теплообменники, газ
охлаждается (точка 6) и расширяется в дроссельном вентиле ДВ
до двухфазного состояния (точка 7). Жидкость в количестве х
в состоянии, соответствующем точке /, отводится из сосуда С,
а пар (точка 8) в качестве обратного потока проходит через
теплообменники и подогревается (точка /'). Часть D сжатого газа
в состоянии, соответствующем точке 3 (в варианте для схемы
на рис. 6.25, а параметры состояния газа в точках 2 и 3 одинако-
вы), направляется в детандер Д’, где расширяется до давления р}
(точка 4'), и присоединяется к газу обратного потока из сосуда С.
Процесс расширения газа в адиабатном идеальном детандере на
рис. 6.26 изображен линией 3-4 , состояние газа после реального
детандера соответствует точке 4' (при КПД детандера Т] , < 1).
Вместо отведенной из сосуда С жидкости в компрессор дополни-
тельно поступает газ в количестве х. Цикл, изображенный на
рис. 6.25, а известен как цикл Гейландта. Давление газа в цикле
около 20 МПа, доля детандерного потока примерно 0,6, опти-
мальное значение температуры газа на входе в детандер близко
к температуре окружающей среды. Цикл на рис. 6.25, б называют
циклом Клода. Давление воздуха в цикле среднее (около 4 МПа)
и в детандер поступает большая доля воздуха, чем в цикле
Гейландта. Энергия, выделяемая при расширении газа в детан-
дере, может быть использована в установке или (в небольших
установках) рассеиваться в окружающую среду при помощи
тормозных устройств. Количество получаемой жидкости при этом
не изменяется, но в первом варианте несколько уменьшается
необходимая работа в цикле.
Способы получения холода в обоих вариантах схемы иден-
тичны, поэтому уравнения энергетического баланса одинаковы.
Рассмотрим уравнение энергетического баланса для части схемы,
ограниченной на рис. 6.25 контуром I (она включает детандер-
ную и дроссельную ступени). Вводится энергия с потоками газа,
и поступает теплота из окружающей среды (/’2 + D i4. + дД, а
отводится энергия с потоками газа [(1 - х) /). + D i3 + xi^\. При
Установившемся режиме работы должно соблюдаться уравнение
энергетического баланса
/2 + D /4. + <?с = (1 - х) iy + D i3 + х ij-, (6.92)
333
где D — доля газа, отводимого в детандер; х — доля жидкости
(или коэффициент ожижения); qc — приток теплоты из окру-
жающей среды, отнесенный к единице сжатого газа (в точке 2).
Из этого выражения
х = (zr - /2 + D - ^с)/(/г - if) , (6.93)
где hs = i3 - i4s.
Действительная холодопроизводительность детандера
h = hsv\s= z3 - z4.. (6.94)
Для выбора КПД детандеров при расчете циклов можно
использовать рекомендации, приведенные в § 6.1 и работах [11,
15, 17, 20, 40]. Преобразуем формулу (6.93) с учетом равенства
ср Л Гт = z'j - zr; тогда
х = (z\ - Z2 + Dh - qc - СрДГДД^ - if - сЛЦ (6.95)
где ДГТ — разность температур потоков газа на теплом конце
теплообменника Т1, возникающая вследствие неполной рекупе-
рации теплоты.
Согласно уравнению (6.95) коэффициент ожижения х зависит
от: разности энтальпий z^ - z2 расширенного и сжатого газа при
температуре сжатого газа на входе в теплообменник Т1 (как и в
циклах с дросселированием); разности энтальпий h в детандере;
доли D детандерного потока; потерь холода qn = qc + с;АТт.
Характер зависимости коэффициента ожижения х от этих
величин различный, поэтому даже при термодинамическом
расчете цикла и определении его расходных и энергетических
характеристик необходимо выполнить вариантные расчеты.
В результате охлаждения газа в детандере компенсируется
часть потерь холода и увеличивается изотермический эффект
дросселирования в нижней (дроссельной) ступени охлаждения.
Дроссельная ступень на рис. 6.25 ограничена контуром Ц.
Запишем уравнения энергетических балансов для каждой
ступени охлаждения (на единицу массы газа после компрессора).
Подобные уравнения получены в § 5.4. Учитывая здесь новые
обозначения расчетных точек (см. рис. 6.26) для дроссельной
ступени охлаждения, вместо выражения (5.59) получим
(1 - Д)(/4- z5) = x(z4.-z^) + (1-D) [ср(Т4- Г4.) +<7с2] (6.96)
или
(Д - z5 - Qc2)D + (Д - if)х= if - i5 - Ял > (6.97)
334
где 1 - D — доля газа, поступающего в дроссельную ступень;
^с2 — приток теплоты, отнесенный к массе газа, на входе в дрос-
сельную ступень.
Для детандерной ступени вместо уравнения (5.58) получим
D IW '1 - ‘2 - СР<Т1- Тг) - 1 = х (')' - 'т) +
(6.98)
+ (1 - Д)[/4 - /5 - (/' - /2) + ср(Т} - Т}.) - ср(Т4 - Т,) + <7С]]
или
(z3 - i5)D + (Z4, - z’r) х = i4. - i5 - ij. + z2 + qcl , (6.99)
причем <?cl + (1 - = qc, где qc] — приток теплоты, отнесен-
ный к массе сжатого газа на входе в детандерную ступень.
Доля D газа, отводимого в детандер, влияет на х сложным
образом: вначале при увеличении D коэффициент ожижения
растет, затем уменьшается. Это объясняется различным характе-
ром изменения доли дроссельного потока и энтальпии z’5 (в точке
5) при увеличении D. Доля дроссельного потока уменьшается
настолько, насколько увеличивается детандерный поток, так как
Z) — 1 - D. В то же время энтальпия /5 вначале уменьшается
сильно, затем слабее и, наконец, практически не зависит от D.
Произведение (1 - Z))(z'4 - z5) пропорционально холодопроиз-
водительности, получаемой в дроссельной ступени; если оно
увеличивается, то х также растет. Это увеличение происходит
до определенного значения D = Dopt. При D > Z)opt холод обрат-
ного потока не полностью рекуперируется в теплообменнике,
так как количество охлаждаемого сжатого газа мало, а количество
обратного холодного потока слишком велико. В результате
возрастает разность температур ЛТт на теплом конце теплообмен-
ника Т1 и уменьшается коэффициент ожижения х. Значение Dopt
зависит от минимально допускаемой разности температур А 7^п
Прямого и обратного потоков газа в теплообменнике. В связи с
этим при термодинамическом расчете цикла необходимо учесть
зависимость
D=f^T^. (6.100)
Чем меньше разность температур между прямым и обратным
Потоками при прочих одинаковых условиях, тем эффективнее
процесс — меньше потери от необратимости при теплообмене.
Согласно второму началу термодинамики во всех сечениях
реальных теплообменников при передаче теплоты от прямого
335
потока к обратному температура прямого потока должна быть
выше температуры обратного потока. Следовательно, во всех без
исключения сечениях теплообменников необходимо обеспечить
положительные значения разности температур прямого и обрат-
ного потоков (Л.Т > 0). В предельном теоретическом случае
разность АТ в каком-либо сечении аппарата можно представить
себе бесконечно малой, приближающейся к нулю Следует также
знать, что полученные при расчете положительные значения
разности температур потоков на концах теплообменника не
свидетельствуют еще о возможности нормального теплообмена
в других сечениях; поэтому необходимо проверить значения А 7
во всех сечениях аппарата. Такая проверка особенно нужна в
случаях, когда произведение с G какого-либо потока существенно
изменяется по длине аппарата при изменении температуры; это
наиболее характерно для теплообменников с потоками газа
высокого и среднего давления и особенно при охлаждении
водорода и гелия. Разность температур потоков может быть
минимальной в различных сечениях теплообменников и зависит
от схемы цикла и термодинамических свойств газа. Так, в цикле,
схема которого показана на рис. 6.25, а, разность температур
минимальна в промежуточном сечении теплообменника Т1, а в
цикле на рис. 6.25, б — на холодном конце или в промежуточном
сечении теплообменника Т2.
В формулах (6.97) и (6.99) неизвестны х, D и /5. В качестве
третьего расчетного уравнения можно использовать зависимость
(6.100). Однако вид этого уравнения часто тоже неизвесен, поэ-
тому вначале обычно задаются разностью температур на холод-
ном конце теплообменника детандерной ступени А ТХ1 = Т5 - Т4.
и определяют значения х и D по уравнениям (6.97) и (6.99). Для
проверю! правильности полученного результата рассчитывают
разности температур Л 7) во всех сечениях теплообменника и
находят сечение с минимальной разностью А 7^ . Это значение
сравнивают с допускаемым и при необходимости повторяют
расчет,задаваясь новым значением разности А7’ ,. При расчете
без использования ЭВМ для проверки решения применяют
графический способ (см. пример 6.7)
Для цикла на рис. 6.25, а при помощи графика, построенного
в кординатах q—T, можно получить дополнительное уравнение,
связывающее расходы газов с минимальной разностью темпера-
тур в одном из сечений теплообменника Т1. Уравнение имеет
вид [7]
Р = (1 - х)/(1 - D) (6.101)
336
или
= 1 - 3(1 - D),
(6,102)
где Р — коэффициент массового соотношения газов прямого и
обратного потоков, зависящий от минимальной разности темпе-
ратур Л 7)111 п'
Для определения коэффициента [} необходимо в координатах
q-T построить изобары рг и р} газа соответственно прямого и
обратного потоков (рис. 6.27). Изобара р} обратного потока на
графике почти прямолинейна, изобара р, сжатого газа представ-
ляет собой кривую линию, так как удельная теплоемкость ср газа
зависит от температуры. Коэффициент р определяют из условия
постоянства разности температур АТ) потоков газа на теплом
конце теплообменника Т1 и принятой минимальной разности
температур А Ттп в одном из сечений теплообменника. Для этого
на диаграмме q—T наносят точки 2 и Г (они соответствуют
аналогичным точкам на рис. 6.25, а и 6.26, а); отрезок 2-/'равен
разности температур А 7). Из точки Г проводят касательную
(штриховая линия) Т-5т к изобаре р2 с точкой касания а. Линия
7-5 характеризует возможное теоретическое изменение темпе-
ратуры обратного потока при разности температур на теплом
конце теплообменника АТ) и нулевой разности температур газов
в точке а (при температуре прямого потока То). От точки а
откладывают отрезок ab, равный принятому значению A7min
(обычно в этих циклах ATmjn = 3...5 К); чем меньше ДТ, тем
меньше потери от необратимости при теплообмене, но одновре-
менно больше гидравлические потери и размеры аппарата. Из
точки b опускают перпендикуляр на ось температур и находят
точки с и d пересечения перпендикуляра с изобарой р} и осью
температур [7].
Рассмотрим процесс тепло-
обмена в интервале температур
от Т2 до Tb: 1 кг сжатого газа,
охлаждаясь от температуры Т2
До Та, отдает количество теп-
лоты, пропорциональное от-
резку bd; 1 кг газа обратного
Потока, нагреваясь от темпера-
ТУРЫ Ть до 7)., получает коли-
чество теплоты, пропорцио-
нальное отрезку cd. Уравнение
Теплового баланса для рассмат-
Заказ .V 1.592
Рис. 6.27. График к определению
коэффициента fi
337
риваемого участка теплообменника Т1 имеет вид (при <7сТ1 — 0).
(1 - D) bd = (1 - х) cd , откуда в соответствии с выражением
(6.101) получим
P = W/c^. (6.103)
Решив систему уравнений (6.97), (6.99), (6.101) и (6.103)
найдем р, х, D и /5 при условии положительной разности
температур во всех сечениях и минимальной разности Л 7min в
одном из сечений теплообменника.
Решение можно получить также, используя уравнения (6.93).
(6.102) и (6.103); тогда для рассматриваемого цикла
х= |Р(/,. - /2) + (Р - 1)^п5- Р^С]/[Р(/Г - у) - (6.104)
7>opt = 13('г - 9 - (z2 - 9 - ‘/сИЗО'г - 9 - hs^s I- (6-105)
Для цикла на рис. 6.25, а оптимальные значения р и D зависят
от разности температур Л7( на теплом конце теплообменника
Т1. При увеличении А7ги постоянстве Л 7^ в промежуточном
сечении теплообменника доля D детандерного потока увеличи-
вается, а коэффициент ожижения х вначале увеличивается, а
затем уменьшается (рис. 6.28). Например, в воздушном цикле
высокого давления при р2 = 20 МПа, Т2 = 77 = 300 К максималь-
ному значению х соответствует разность температур Л 7]. = 12 К.
При дальнейшем увеличении Л7( значение х уменьшается, так
как потери холода увеличиваются быстрее, чем количество
холода Dh, получаемого в детандере [7].
Коэффициент ожижения х зависит также от отношения давле-
ний лд = р2/рх и температуры Т3 на входе в детандер. Каждому
значению р2 соответствует оптимальная доля дроссельного пото-
ка, уменьшающаяся при снижении давления. Оптимальное зна-
чение температуры газа Т3 также уменьшается при снижении
давления р2. В работах [7, 17] приведены характеристики цикла
для ожижения воздуха при изменении р2,
Т3 и (1 - D). В качестве примера на рис.
6.29 показаны известные из литературы
расчетные зависимости оптимальных
значений температуры воздуха Т3 перед
Рис. 6.28. Зависимость коэффициента ожижения х и
доли D детандерного потока от разности температур
Л 7) на теплом конце теплообменника Т1 в цикле-
схема которого показана иа рис. 6.25, а
Рис. 6.29. Зависимость оптимальных зна-
чений доли (1 - D) дроссельного потока и
температуры воздуха Т3 перед детандером
от давления р2 при />, = 0,098 МПа
Рис. 6.30. Характеристики циклов
ожижения воздуха (см. рис. 6.25) при
= 0,098 МПа и различных значе-
ниях />2
детандером и доли дроссельного потока 7)др = 1 - D от давления
воздуха р2. При понижении р2 оптимальное значение доли
дроссельного потока 7)др уменьшается и в детандер может быть
направлено больше газа. Этим графикам соответствуют средний
температурный напор в теплообменниках Т1 и Т2, равный 10 К,
приток теплоты из окружающей среды qc = 8,37 кДж/кг,
изотермический КПД компрессора Т)из = 0,6, изоэнтропный КПД
детандера т]^ = 0,7; принято, что 70 % энергии, выделяемой при
расширении воздуха используется в цикле (т)мех = 0.7).
На рис. 6.30 приведены расчетные зависимости удельной
работы ожижения воздуха /0 от доли D детандерного потока при
оптимальных значениях температуры Т3 и различных значениях
Р2 (для циклов на рис. 6.25). Каждому значению р2 соответствует
оптимальное значение D, при котором удельная работа мини-
мальна [24].
Для определения работы /0 используем формулу (5.41), в
Которой работа (с учетом утечки газа 5)
L== о + ^lK-Dla = к1 + 5)7? 7’11п7Гк1/т1из- D М.Пмех' <6-106)
Где ~ работа, совершаемая при сжатии 1 кг газа в компрес-
СоРе; /д — работа расширения 1 кг газа в детандере, возвращае-
мая в цикл; 5 = 0,05...0,07 — потери сжатого газа вследствие
Утечек и продувки в долях от массы газа, поступающего в цикл;
22*
339
338
R — газовая постоянная; як — степень сжатия в компрессоре;
г]мех — механический КПД детандера.
Гидравлические потери в аппаратах и коммуникациях обычно
учитывают в последующих более точных расчетах. Однако и здесь
при расчете цикла для определения энергетических характерис-
тик, наиболее соответствующих рабочим условиям, в формуле
(6.106) принимают степень сжатия
Як=7>2/Р1; (6.107)
здесь j — приведенный коэффициент гидравлических потерь,
определяемый по формуле (6.65); если потери не учитывают, ю
J = 1,0; при рабочих условиях j = 1,1... 1,3 (меньшее значение
соответствует циклам высокого давления).
Необходимая работа /0 (для получения 1 кг жидкого воздуха)
изменяется от 2,88 до 5,76 МДж (от 0,8 до 1,6 кВт-ч) в
зависимости от схемы цикла и производительности установки.
Создание поршневых детандеров с большим отношением дав-
лений Яд в одной ступени вызывает технические трудности. В
общем случае давление газа после детандера определяется
условиями построения холодильного цикла. Например, при
использовании детандерного цикла во ВРУ охлажденный воздух
поступает в разделительный аппарат с давлением около 0,6 МПа,
а затем дросселируется. Для получения результатов расчета
воздушного цикла, близких к рабочим характеристикам ВРУ,
обычно расчетное давление после детандера принимают 0,6 —
0,7 МПа и считают, что в дальнейшем давление уменьшается
при дросселировании (см. пример 6.7). При больших значениях
Яд можно также организовать двухступенчатое расширение г;1.за
как с промежуточным подогревом газа, так и без него [7, 15, 19|.
Некоторые расчетные технические характеристики цикла
высокого давления для ожижения воздуха при включении детан-
дера на исходном уровне температуры приведены в табл. 6.3.
Принято; воздух расширяется в детандере в интервале давлений
20-0,7 МПа; доля детандерного потока соответствует оптималь-
ному значению при минимальной разности температур в тепло
обменнике ATmjn — 5 К; энергия расширения газа в цикл не
возвращается; Т\ = 303 К.
Термодинамический расчет цикла выполняют в следующем
порядке (см. рис. 6.26);
1) определяют параметры состояния в точках, для которые
известны значения р и Т (например, в точках 1, Г, 2, f и др);
340
6.3. Технические показатели цикла ожижения воздуха
(см. рис. 6.25, а) при различных значениях А Тт
(П, = V7; Чи,= 0,59) [7]
Показатель Значения показателя (на 1 кг)* при Д7’т, К
5 8 11 14 17 23,5
дс + ДГТ. кДж 11,5 14.5 17,5 20,5 23.6 30.2
ПорГ кг 0,427 0,459 0,484 0,508 0,531 0,543
X, кг 0,185 0,188 0.190 0,189 0,1885 0,176
/0, МДж 4.21 4,15 4,11 4,13 4,15 4,43
70 — на 1 кг жидкого воздуха, остальные показатели — на 1 кг воздуха
(высокого давления).
2) находят отдельные характеристики (например, hs, h) и
параметры состояния (в точках 3, 4' и др.);
3) определяют основные характеристики цикла D и х из
системы уравнений (6.97), (6.99) и (6.102);
4) проверяют разности температур газа в сечениях теплооб-
менника и при необходимости проводят повторные уточняющие
расчеты для определения окончательных значений D и х;
5) рассчитывают параметры состояния в других точках цикла;
6) определяют энергетические характеристики цикла.
Параметры состояния газа после детандера (в точке Д')
определяют с помощью метода, рассмотренного в гл. 4. При
определении параметров состояния газа на входе в детандер (в
точке 3), если известны параметры на выходе, используют метод
последовательных приближений. Если состояние на выходе
соответствует насыщенному пару, то для определения параметров
состояния на входе в детандер, кроме указанного метода, можно
также применить графический способ [7].
Для пояснения методики расчета цикла рассмотрим пример.
Пример 6.7. Определить удельный расход энергии и коэффициент ожижения
воздуха в установке, принципиальная схема цикла которой приведена на
рис. 6.31, а. Давление воздуха на входе в теплообменник Т1 р2 = 16 МПа.
температура 7] = Г2 = 300 К. Часть воздуха после теплообменника Т1 расширяется
в Детандере Ддо давления 0,6 МПа (точка 10) и затем дросселируется в вентиле
ДВ2 до давления = 0,1 МПа. В остальном цикл аналогичен показанному на
Рис. 6.25, б. Температура воздуха перед детандером Т} = 276 К; изоэнтропный
КПД детандера гц = 0,7; изотермический КПД компрессора циз = 0,6. На теплом
Конце теплообменника Т1 разность температур ДГТ = 5 К; приток теплоты из
окружающей среды к детандерной ступени ?с| = 4 кДж на 1 кг воздуха высокого
Давления, к дроссельной ступени qc2 = 3,5 кДж на 1 кг дроссельного потока.
341
Рис. 6.31. Схема цикла (а) и диаграмма
Т — s (б) к примеру 6.7
Гидравлические потери учтем только при определении расхода энергии.
Примем коэффициент гидравлических потерь j = 1,15; механический КПД
детандера т]мех = 0,8. Расчет выполним по диаграмме T—s для воздуха [2].
Сведем значения параметров состояния в табл. 6.4. Параметры состояния точек
1;Г; 2; 3; 8 и f можно определить по диаграмме Г-s (рис. 6.31, б).
1. Приток теплоты из окружающей среды распределим следующим образом:
к теплообменнику TI <7сТ1 = 0 К, к теплообменнику Т2 дсТ2 = <?с1 = 4 кДж на 1 кг
воздуха высокого давления, к теплообменнику ТЗ <?cT3 - дс2 = 3,5 кДж на 1 кг
дроссельного потока.
2. Определим разности энтальпий Л, и Л при расширении воздуха в детандере
и параметры состояния воздуха в точках 4', 10 и 10, (запишем их в табл. 6.4):
hs = z3 - z10j = 6955 - 2682 = 4273 кДж/моль; Л = 4273-0,7 = 2991 Дж/моль.
Параметры состояния воздуха в точке 10 il0 = z3 - h = 6955 - 2991 = 3964 Дж/моль;
Г10 = 141,5 К; в точке 4' i\. = z10 = 3964 Дж/моль; Г4. = 138 К.
Зададимся разностью температур на холодном конце теплообменника Т2 и
определим параметры состояния воздуха в точке 5. Пусть ДГх1 = 8 К; так как
ДГх1 = Г5 - Г4. = Г4 - Г4., то Г5 = Г4. + ДГХ1 = 138 + 8 = 146 К;
z, = 400 Дж/моль.
3. Составим систему из уравнений (6.97),(6.99) для определения хи Л
Согласно уравнению (6.99)
(6955 - 400)7) + (3964 - 8565) х = 3964 - 400 - 8565 + 7840 + 4-28,96
или
65557) - 4601 х = 2955; (а)
здесь произведение 4 • 28,96 Дж/моль — приток теплоты из окружающей среды.
342
Согласно уравнению (6.97)
(3964 - 400 - 3,5-28,96)1) + (3964 + 3692) х =
3964 - 400 - 3,5 -28,96 или 3463D + 7656х - 3463, (б)
Определитель Д канонической неоднородной системы уравнений (а)—(б)
6555 (-4601)
Д =
= 6612 • 104.
3463 7656
Найдем определители:
2955 (-4601) 6555
= 3856 • 104; Дх =
3463 7656 3463
2955
3463
= 1247 • 104.
Вычислим D и х по формулам Крамера:
D = Дд/Д = 3856 • 104/(6612 • 104) = 0,583 моль/моль;
х = Дх/Д = 1247 • 104/(6612 • 104) = 0,189 моль/моль.
4. Проверим полученные значения графическим методом в системе координат
q— Г; предварительно определим параметры состояния в точке 9' из уравнения
энергетического баланса теплообменника TI: z2 - z3 + = (1 - x)(zr - z9.), откуда
zg. = 8565 - (7840 - 6955)/(1 - 0,189)= 7474 Дж/моль;
Т9.= 257,5 К.
Запишем полученные значения в табл. 6.4.
Построим изобары в координатах (рис. 6.32 — точки соответствуют
аналогичным точкам на рис. 6.31, б). Для этого можно использовать табличные
данные [64] или диаграмму z— Т для воздуха (в изобарном процессе q = Ы).
Нанесем изобару р2 = 16 МПа на координатную плоскость q — Т в интервале
температур 140 ... 300 К. Допустим, что теплоемкость ср обратного потока воздуха
изменяется незначительно, и изобары представляют собой прямые линии. Для
6.4. Параметры состояния воздуха в расчетных течках
Точка на рис. 6.31, б Т, К р, МПа /, Дж/моль Точка на рис. 6.31, б т, К А МПа Дж/моль
1 300 0,1 8715 7 — 0,1 —
Г 295 0,1 8565 8 =82 0,1 2280
2 300 16 7840 9' 257,6 0,1 7475
3 276 16 6955 10 141,5 0,6 3964
4' 138 0,1 3964 — 0,6 2682
5 146 16 400 f =79,5 0,1 - 3692
6 __ 16 —
343
5, отложим от нее горизонтальный отр
точки 4'м 9'прямой линией. Прямая
Рис. 6.32. График к определению разности
температур прямого и обратного потоков
в теплообменнике (к примеру 6.7)
их построения от точки 2 отложим гори-
зонтальный отрезок, соответствующий по
длине АТт = 5 К, и отметим точку Г. На
изобаре р2 найдем точку J, проведем через
нее горизонталь и отметим точку 9' при
температуре Тч. = 257,6 К. Соединим
точки Г и 9' прямой линией; она
характеризует изменение температуры
воздуха низкого давления в тещюобмен-
нике 77. Далее на изобаре р2 найдем точку
юк 5-4\ соответствующий ДТх1 и соединим
"-9' характеризует изменение температуры
газа обратного потока в теплообменнике 72. Сечение с наименьшей разностью
температур находится внутри теплообменника Т2; эту разность ДТУд ~ 3 К считаем
допускаемой и уточняющий расчет не выполняем. В противном случае следует
задаться новым значением Л7’х| и повторить расчет. Необходимо также учитывать,
что при уменьшении Д7т.Г| увеличиваются гидравлические потери в теплообмен-
нике, которые в рассматриваемой методике расчета не учтены.
5. Для определения параметров состояния остальных точек (би 7) следует
использовать уравнение энергетического баланса теплообменника TJ. Здесь эти
вычисления не приводим. Результаты решения должны также удовлетворять
уравнению (6.92).
6. Работу, отнесенную к 1 молю воздуха высокого давления, определим по
формуле (6.106) при 8 = 0, = 2991 Дж/моль и Ry = 8,314 Дж/(моль • К):
L = 8,314-300-In (1.15 • 16/0,1)/0,6 - 0,583-2991-0,8 = 20 283 Дж/моль.
Работа, отнесенная к 1 молю жидкого воздуха, согласно формуле (5.41)
70 = 20 283/0,189 = 107,6 • 103 Дж/моль = 3,71 МДж/кг.
Учтем возможные утечки воздуха и потери на продувку, пусть 8 = 0,07; тогда
удельная работа Zo’ = 3,98 МДж на 1 кг жидкого воздуха.
Рефрижераторный режим. Сосуд С в рефрижера-
торной установке представляет собой низкотемпературную
камеру, в которой к рабочему веществу подводится теплота qx.
Формулы (6.97) и (6.99) справедливы и здесь, если принять в
них х = 0 и учесть подвод теплоты qx. Тогда для дроссельной
ступени
<7Х = (<4' - Ч - <7с2)О * (6.Ю8)
где qx — количество холода, условно отнесенное к массе сжатого
газа, поступающего в теплообменник Т1; <?с2 — приток теплоты
из окружающей среды на единицу массы сжатого газа, втекаю-
щего в дроссельную ступень.
344
Для детандерной ступени
(/3 - i5)D = i2 - ir + /4. - /5 + ^с1. (6.109)
Методика расчета этого режима аналогична методике расчета
ожижительного режима. Оптимальная доля детандерного потока
в рефрижераторном режиме обычно меньше, чем в ожижи-
тельном, при прочих равных условиях.
Цикл низкого давления с турбодетандером. Цикл предложен
акад. П.Л.Капицей, в крупных установках предполагалось
использовать только турбомашины. Для этого цикла П.Л. Капица
создал высокоэффективный турбодетандер с { - 0,80...0,85.
Схема цикла использована впервые в 1938 г. в установке для
ожижения воздуха [7, 17, 53], позднее — в установках для
получения жидкого кислорода. Особенность цикла — включение
в него эффективного турбодетандера низкого давления, в
котором расширяется большая часть газа, в результате
значительное количество теплоты от ожижаемого газа отводится
с помощью детандерной ступени охлаждения.
Схема цикла и диаграмма Т— s показаны на рис. 6.33. Воздух
(точка 7) сжимается в турбокомпрессоре К до давления 0,6-0,7 МПа,
охлаждается в холодильнике X и поступает в регенераторы Р
(точка 2), где охлаждается (точка 3). Примем количество сжатого
газа за единицу. Основное количество D газа направляется в
турбодетандер ТД и расширяется (точка 4'). Вторая часть газа
(1 - D) охлаждается и конденсируется в теплообменнике-
конденсаторе ТК (процесс 375'5 на рис. 6.33, б). Жидкость (точка
л
Рис. 6.33. Цикл низкого давления установки с турбодетандером:
о — схема; б — диаграмма Т— s
345
5) дросселируется через вентиль ДВ и частично испаряется
(точка 4). Жидкость в количестве х (состояние /) отводится из
системы, а газ в количестве (1 - D - х) смешивается с детандер-
ным потоком и нагревается в теплообменнике-конденсаторе ТК
(точка 6) и регенераторах (точка 7’). Температура воздуха перед
турбодетандером должна быть такой, чтобы воздух после расши-
рения был перегрет на 1-3 К по сравнению с насыщенным па-
ром. Коэффициент ожижения х можно вычислить по уравнению
(6.93), в котором D < 1 - ах. Коэффициент а = 1,1...1,25 зависит
от степени испарения жидкости при ее дросселировании:
а = 1/(1 - cQ, (6.110)
где ап — доля испарившейся при дросселировании жидкости.
Доля дроссельного потока
Ядр>ох. (6.111)
Эффективность цикла в ожижительной установке возрастает
при увеличении доли детандерного потока и КПД детандера.
Коэффициент ожижения х ~ 5,8% от количества сжатого газа
при КПД rij = 0,8; /0 ~ 5,76 МДж (1,60 кВт’ч) на 1 кг жидкого
воздуха.
Сравнительно высокий расход энергии в цикле объясняется
малым значением удельной холодопроизводительности и вследст-
вие этого большим удельным весом потерь холода. При исполь-
зовании турбомашин (компрессора и детандера) с высокими КПД
и эффективных теплообменных аппаратов, а также при неболь-
шом увеличении давления сжатия р2 воздуха можно уменьшить
затраты работы и повысить эффективность цикла [17].
Рис. 6.34. График к определению
разности температур потоков в тепло-
обменных аппаратах
На рис. 6.34 приведены кри-
вые изменения температуры по-
токов воздуха в регенераторах Р
и теплообменнике-конденсато-
ре ТК (обычно устанавливают
не менее двух регенераторов,
работающих параллельно; о
конструкции и работе регенера-
торов — см. [5, 12, 15, 16, 20])-
Ломаная линия а характеризует
изменение температуры воздуха
обратного потока в аппаратах
ТК (участок 4'-6) и Р (участок
346
6-Г), а линия b — изменение температуры сжатого воздуха в
аппаратах Р (между точками 2 и 3) и ТК (между точками 3 и
5). В аппарате ТК на участке 3-7 происходит охлаждение газа,
на участке 7-5' — конденсация; кроме того, возможно охлаж-
дение образовавшейся жидкости (участок 5'-5).
При низком давлении в установке можно использовать
регенераторы, в которых воздух не только охлаждается, но осу-
шается и очищается от СО2. Кроме того, воздух не загрязняется
парами масла, так как сжатие и расширение происходит в
трубомашинах; имеются и другие технологические преимущества
цикла низкого давления.
Под руководством акад. П.Л. Капицы были разработаны и
изготовлены несколько ВРУ низкого давления; наиболее крупная
установка была рассчитана на часовую производительность 1500 кг
жидкого кислорода [3]. Эти работы предопределили разработку
и создание всех современных установок на основе цикла низкого
давления с высокоэффективным турбодетандером, особенно
установок для разделения воздуха и получения газообразных
кислорода и азота [3, 4, 14, 17, 62].
Даже в самых экономичных установках работа ожижения газа
существенна и в несколько раз превышает минимально необхо-
димую работу в идеальном цикле, поэтому поиск новых более
эффективных схем циклов и уточнение методик расчета и сейчас
является насущной задачей.
Для работы в области более низких температур, а именно для
гелиевых и водородных криогенных систем, используют более
сложные циклы с расширением газа в детандерах и дросселиро-
ванием. Дальнейшее развитие классических схем идет по двум
основным направлениям — применение предварительного ох-
лаждения и увеличение числа детандеров, т.е. использование
каскада детандеров. В результате формируют сложные много-
ступенчатые циклы, обеспечивающие достаточно высокую
эффективность при весьма низких температурах. Остановимся
на некоторых наиболее распространенных циклах такого типа.
Цикл с расширением в детандере, дросселированием и
предварительным охлаждением. Трехступенчатый цикл с внешним
охлаждением жидким криоагентом, расширением части потока
в детандере и дросселированием широко используют в ожижи-
тельных и рефрижераторных криогенных установках, главным
образом, гелиевых. Примененный впервые ПЛ. Капицей в 1934 г.
Для гелиевого ожижителя с детандером, этот цикл явился про-
тотипом целой группы подобных криогенных установок. Схема
347
т
Т2
Т6
Рис. 6.35. Цикл с расширением в детандере
дросселированием и предварительным охлаждением,
а — схема; б — диаграмма Т— s
цикла и его изображение в диаграмме T — s даны на рис. 6.35;
схему с небольшими изменениями используют как в ожижитель-
ном (<ух = 0), так и в рефрижераторном (х = 0) варианте
Рассмотрим вначале ожижительный цикл.
Прямой поток в количестве 1 кг поступает из компрессора А'
в теплообменник Т1, где охлаждается обратным потоком до
температуры Т3, затем дополнительно до Т4 в ванне В жидкостью
Gq. Далее прямой поток охлаждается в теплообменнике Т2, после
чего в точке 5 разветвляется на две части. Одна часть (Z>2) идет
в детандер Д, где расширяется до давления рх (точка 10'),
понижая температуру и энтальпию, затем смешивается с образ-
ным потоком, обеспечивая необходимую холодопроизводитель-
ность на этой ступени.
Другая часть (Z>3) охлаждается в теплообменнике ТЗ до
температуры Т6, поступает в дроссельную ступень, пройдя
теплообменник Т4, дросселируется в сосуд С до давления рх и
при этом частично ожижается (процесс 7-8). Жидкость х
выводится из цикла, обратный поток (£>3-х) возвращается через
теплообменник Т4 в точке 10' соединяется с потоком из детан-
дера Д. Общий поток (1-х) проходит теплообменники, подо-
348
гревается до температуры Тг и возвращается в компрессор.
Дополнительно в компрессор поступает поток х. равный коли-
честву отведенной жидкости.
Расчетные формулы для цикла можно записать на основе
уравнений энергетического баланса (5.56), (5.58) и (5.59) (индек-
сы — см. рис. 6.35 с учетом номера ступени):
Ц)(йз " йг) — х Ц' " йг) + 1А/г4 ‘ +
+ Ч4 - <Ср^Т2 + ^с2)1 = Х(ЙГ - Ло) +
+ ZXj[(Az^ ~ + ср(^^2 ~ + ^cjL
D3MT6 = x(z10. - if) + ^[с^АГз + ?с3]. (6.112)
Уравнение материального баланса имеет вид: Z>2 + Z>3 = 1.
Решение системы этих четырех уравнений позволяет определить
следующие искомые величины: коэффициент ожижения х,
потоки D2, Л3 и Go. Энтальпии потоков, дроссельные эффекты
Azr и перепад энтальпий в детандере hsT\s = i5 - z’10. определяют
по термодинамическим диаграммам.
При ожижении гелия в качестве криоагента для внешнего
охлаждения Go, как правило, применяют азот ( Г = 80 К).
Теплоприток на каждой ступени qc составляет 3-5 % от эффекта
охлаждения. Неполноту рекуперации на различных ступенях
можно оценить по линейной зависимости А 7) = аТг При
349
жения (х = 6...8 %) по сравнению с гелиевым циклом с дроссели-
рованием (см. рис. 6.11), так как дросселируемый поток D-. < 1.
Оптимум х при изменении температуры Г6 дроссельной ступени
обусловлен противоположным изменением дроссельного эффекта
Д/т и потока ZX.
7б 3
Удельная работа
RT, In (Рт/рЛ
k =------+ А • (б.пз)
п из х
Энергия, возвращаемая детандером (D = hs г]^т]мех), мала, и,
как правило, ее не учитывают. Эта схема цикла применительно
к ожижению водорода описывается той же системой уравнений
(6.112); при этом Г6 = 50...60 К.
Для рефрижераторного варианта цикла х — 0; обратный поток
в теплообменнике Т4 равен D3 (в остальных теплообменниках
1 кг). Полезная холодопроизводительность <?х реализуется при под-
воде теплоты от охлаждаемого объекта к сосуду С с температурой
жидкого гелия Т*. При расчете потоков используют формулы (5.60),
(5.61) и (5.64), а также уравнения материального баланса:
ЭДз Z'12) — ^т4 ^Zr2 + Ср(^Л * ^^2) + «сР
^2 + (СрА^2 + ~ Az't4 +
+ ср(\Т2 - Л7Д + <7с2];
D3MT6 = 0Х + D3[cpbT3 + <ус3]; Z>2 + Z>3 = 1. (6.114)
Решением этой системы находят тепловую нагрузку <2Х = D3q*
и потоки D2, D3 и Go. Все рекомендации по выбору значений
р2, Т6, qcjn других характеристик аналогичны приведенным
для ожижительного варианта цикла.
Расчет завершают определением параметров в характерных
точках цикла, которые находят из уравнений теплового баланса
теплообменных аппаратов. При этом возможно нарушение
условий теплообмена, что обычно бывает в аппарате Т4 из-за
неблагоприятного соотношения прямых и обратных потоков и
изменения теплоемкости с . Подобная ситуация обсуждена на
с. 337, где приведен графический метод расчета цикла, обеспе-
чивающий нормальную работу теплообменника. Для рассматри-
ваемых и других подобных циклов обычно применяют провероч-
ный расчет работоспособности теплообменника графическим
построением изобар q—T (см. рис. 6.32).
350
При нарушении теплообмена (пересечение изобар р2 и pt)
обычно вводят добавочное дросселирование в средней части
теплообменника Т4 для уменьшения давления р2 до 1,2-1,5 МПа.
При этом теплоемкость гелия увеличивается, изобара р2 в
координатах i—Tизменяет угол наклона, и теплобмен протекает
нормально.
Циклы с расширением потока в нескольких детандерах и
дросселированием. В дальнейшем комбинированные циклы
совершенствовали в направлении увеличения числа детандеров.
Существенный вклад в разработку таких циклов сделан С.Кол-
линсом, который предложил теоретический цикл с каскадным
включением четырех детандеров и дросселированием. Схема
этого теоретического цикла и его диаграмма T-s в принципе
соответствуют рис. 6.1. На нижней ступени предусмотрено
дросселирование; на каждой детандерной ступени отводится
теплота в интервале температур от 7)j до Тг При отсутствии
потерь этот цикл имеет высокие термодинамические характерис-
тики; расчетный КПД такого цикла т]г = 76%. Осуществить
реальный цикл с большим числом детандеров затруднительно,
кроме того, потери существенно снижают его КПД.
Криогенные гелиевые установки С.Коллинса вместо верхнего
детандера имели внешнее охлаждение жидким азотом в двух
вариантах: с двумя и с тремя детандерами.
Схема наиболее распространенного цикла с двумя детанде-
рами дана на рис. 6.37. Прямой поток из компрессора К прохо-
дит теплообменник Т1 и азотную ванну В (1-я ступень), затем
последовательно две детандерные ступени, в каждой из которых
расширяется часть прямого потока (Т)2 и D3), обеспечивая
необходимый эффект охлаждения. Остальной газ поступает в
нижнюю ступень, дросселируется и частично ожижается.
Сопоставление схем, приведенных на рис. 6.35 и 6.37, показы-
вает, что во второй из них добавочная детандерная ступень
позволила заметно уменьшить необратимость цикла. Так,
суммарный поток , идущий в два детандера Д1 и Д2 (см. рис.
6.37), меньше потока D2, идущего в один детандер (см. рис. 6.35).
Соответственно возрастает коэффициент ожижения х (см. рис.
6.39).
Основные исходные характеристики в цикле Коллинса (р2, 7),
А 71 и др.) имеют те же значения, что и в цикле с одним
Детандером. При большой производительности установок обычно
Используют турбодетандеры, что приводит к некоторому
изменению классической схемы каскадного цикла.
351
Рис. 6.37. Схема цикла с предвари-
тельным охлаждением, расширением в
двух детандерах и дросселированием
Рис. 6.38. Схема цикла с предваритель-
ным охлаждением, расширением в двух
турбодетандерах н дросселированием
Рассмотрим такой цикл отечественной гелиевой установки
(КГУ-450/4,5), работающей как в ожижительном, так и в рефри-
жераторном режиме (рис. 6.38). Сжатый в компрессоре К до
давления р2 гелий двумя потоками проходит теплообменники Т1а
и Т16 и азотную ванну В. В теплообменнике Т1а гелий охлажда-
ется только парами азота. При работе в рефрижераторном режи-
352
Рис. 6.39. Зависимость коэффи-
циента ожижения х (сплошные
линии) и удельной работы /0 (штри-
ховые линии) от отношения давле-
ний для многоступенчатых гелиевых
ожижительных циклов (тц = 0,75;
а = 0,02):
1 — с двумя детандерами и дроссе-
лированием; 2 — с тремя детанде-
рами и дросселированием; 3 — с
азотным охлаждением, одним
детандером и дросселированием; 4
— с азотным охлаждением, двумя
детандерами и дросселированием
ме азот не используют, и теплообменник не работает. После
теплообменника Т2 часть прямого потока (=74%) идет в
турбодетандер ТД1, где расширяется до давления рир, охлаждаясь
до 38 К. Затем эта часть гелия охлаждается в теплообменнике
Т4, расширяется в турбодетандере ТД2ро давления рх = 0,1 МПа,
охлаждаясь до температуры Т12 - 10 К, и поступает в обратный
поток после теплообменника Т5. Другая часть гелия Z>4 (= 26%)
охлаждается в теплообменниках ТЗ, Т4, Т5, Тб, дросселируется
вентилем ДВ1 до давления 0,65 МПа, проходит теплообменник
Т7 и дросселируется до давления рг в вентиле ДВ2. Образующаяся
жидкость х идет к потребителю, а обратный поток (Z>4 - х) — в
теплообменник Т7.
В рефрижераторном режиме поток О4 после охлаждения в
теплообменнике Т7 делится на две части: небольшая доля
дросселируется в сосуд С, а остальная часть охлаждается в змее-
вике сосуда, затем через вентиль ДВЗ идет к потребителю СП
и, возвратившись, поступает в обратный поток через теплообмен-
ник Т7. При этом в турбодетандеры поступает больший поток
гелия, чем по схеме рис. 6.37, что улучшает характеристики этих
машин. Установка КГУ-450/4,5 перерабатывает 1200 м3/ч гелия;
холодопроизводительность в рефрижераторном режиме 450 Вт.
Сопоставление коэффициентов ожижения х и удельной рабо-
ты /0 для ряда каскадных циклов с детандерами при ожижении
гелия показано на рис. 6.39.
Кривые 3 и 4 (циклы с внешним охлаждением) соответствуют
схемам на рис. 6.35 и 6.37. Характер кривых свидетельствует о
существенных преимуществах цикла с внешним охлаждением и
Двумя детандерами, тогда как другие варианты близки между
23 Заказ № 1592
353
собой. В этой связи очевидна целесообразность цикла Капицы
(внешнее охлаждение и один детандер) как более простого ц
надежного варианта.
Циклы с парожидкостными детандерами. Далее циклы с
детандерами совершенствовали дополнительным введением
парожидкостного (двухфазного) детандера вместо дроссельного
вентиля. При этом существенно возрастает эффективность
ступени окончательного охлаждения и цикла в целом. Обычно
поршневой двухфазный детандер применяют в гелиевых ожижи-
телях и рефрижераторах.
На рис. 6.40, а дана схема включения парожидкостного
детандера Д (ДЗ) к циклам, показанным на рис. 6.37 и 6.3S,
Такой способ включения детандера ДЗ позволяет сохранить рабо-
тоспособность установки при выключенном детандере, пуская
поток через дроссель ДВ2. Наличие детандера обеспечивает более
совершенный, чем дросселирование, близкий к изоэнтропному
процесс расширения (8-9), что увеличивает эффективность
установки на 30-40 % и более.
В детандер ДЗ гелий поступает в закритическом состоянии,
после расширения до Г9 двухфазная среда может образовываться
при давлении обратного потока р}', более эффективно расширс-
18
16
/4
12
10
8
6
4
Г
у б)
Рис. 6.40. Ступень окончательного охлаждения с парожидкостным детандером:
а — схема ступени; б — зависимость коэффициента ожижения х и удельной работы
/0 от давления р2 для каскадного цикла (см. рис. 6.41) при наличии парожидкост-
ного детандера (сплошные линии) и без него (штриховые линии)
354
ние до пограничной кривой жидкости. Для этих машин г|л. может
достигать 80-90 %. На рис. 6.40, б приведены характеристики
цикла (схему - см. рис. 6.37) для вариантов с дросселем (при
Т7 = 12 К) и с двухфазным детандером при различных температу-
рах входа в ступень окончательного охлаждения Г7. Характерис-
тики получены при следующих значениях параметров: КПД
детандеров г] f = 0,75 для Д1; т] = 0,8 для Д2\т\5 = 0,85 для ДЗ ;
коэффициент а = 0,05 (АГ712 = 0,3 К). Результаты расчета
свидетельствуют о существенном улучшении характеристики при
включении парожидкостного детандера вместо дросселя ДВ2.
Особенности циклов универсальных установок. Выше
рассмотрены циклы криогенных систем, работающих либо в
ожижительном, либо в рефрижераторном режиме. Однако в
настоящее время гелиевые системы представляют собой универ-
сальные установки, работающие одновременно в ожижительном
и рефрижераторном режимах. Такая задача возникает, в частнос-
ти, при охлаждении крупных сверхпроводящих (СП) объектов.
Так, на рис. 6.38 показана ступень окончательного охлажде-
ния, позволяющая получать жидкость и в то же время термо-
статировать СП-объект с холодопроизводительностью <?х. Такой
же цикл (с парожидкостным детандером вместо вентиля ДВ2)
используют в крупной установке ОРГ-ЗО-1800/4,5 холодопроиз-
водительностью 1800 Вт для получения жидкого гелия (300 л/ч)
на номинальном режиме. Соотношение между количеством х
получаемой жидкости и холодопроизводительностью q* устанав-
ливают из уравнения энергетического баланса ступени оконча-
тельного охлаждения. Так, для цикла на рис. 6.38 уравнение
энергетического баланса нижней ступени (ниже Г7) имеет вид:
(1 - Т>2)(/7 + ^) + q* = (1 - D2 - х) /12 + xij. Отсюда, преобразовав
в соответствии с § 5.4, получим
(1 - Т)2)(А/7 - ^) = х(/12 - /}) + <7х , (6.115)
где = Dv(in - i10) — холодопроизводительность; £)ц — доля
Потока, поступающего в охлаждаемый объект (СП); q^ — потери.
Очевидно, при фиксированной суммарной холодопроизводи-
тельности [левая часть формулы (6.115)] между х и qx сущест-
вует линейная связь: <?х — 0 при максимальном х, и наоборот.
Графическая характеристика цикла, работающего в смешанном
Режиме, дана на рис. 6.41; в пределах <утах - хтах возможен любой
Режим (точка р — расчетный режим). При форсировании режима
Работы установок, а следовательно, при изменении характерис-
2з*
355
Рис. 6.41. Характеристика универсальной
криогенной установки при работе в смешан-
ном режиме
тик отдельных машин и аппаратов
зависимость q* (х) на рис. 6.41
может видоизмениться, приобре-
тая нелинейный характер.
Связь криогенных циклов с объектами охлаждения. Функцио-
нирование криогенных циклов в значительной мере зависит от
характера связи между криогенной установкой и охлаждаемым
объектом, образующим криогенную систему. Охлаждаемый
объект (для гелиевых рефрижераторов — обычно сверхпроводя-
щее устройство) может иметь переменную нагрузку, дополни-
тельные источники потерь, нуждается в повышенном давлении
охлаждающего потока, регулировании холодопроизводительности
и т.п. Это сказывается на работе криогенной установки, особен-
ностях ее цикла.
Рассмотрим наиболее распространенные варианты связей
между ступенью окончательного охлаждения и охлаждаемым
объектом. К наиболее простым вариантам относятся однокон-
турные системы, в которых охлаждаемый объект погружен в
охлаждающую жидкость или двухфазный поток проходит через
объект охлаждения. Более сложные системы предусматривают
принудительную, в том числе многократную циркуляцию крио-
агента в закритическом или двухфазном состоянии через охлаж-
даемый объект.
На рис. 6.42 приведены типовые варианты связи между
криогенным циклом и потребителем холода; холодопроизводи-
тельность реализуется в дроссельной ступени окончательного
охлаждения. На рис. 6.42, а приведена система, обеспечивающая
циркуляцию части Z) потока гелия при закритическом давлении.
Эта часть отбирается перед дроссельным вентилем ДВ при
давлении р > ркр, охлаждается в ванне В с жидкостью, проходит
каналы охлаждаемого объекта О и возвращается в обратный
поток. Избыточное давление потока £)ц позволяет преодолевать
значительное сопротивление.
Жидкость в ванне В образуется при дросселировании другой
части потока D}. Такая схема (см. рис. 6.38) достаточно проста,
но не обеспечивает многократной интенсивной циркуляции;
356
принудительной циркуля-
фрижсратором (ступенью
и охлаждаемым объектом:
ция однофазного потока
нии; б — многократная
тотока с использованием
:ая циркуляция двухфаз-
>тока с использованием
я циркуляция с помощью
- теплообменник; ДВ —
дроссель; В — сборник жидкого криоагента; Э —
эжектор; Н — насос; О — охлаждаемый объект
кроме того, закритический охлаждающий поток имеет переменую
температуру.
Значительное распространение получили схемы с эжекторами,
которые можно устанавливать как на закритическом (рис. 6.42, б),
так и на двухфазном потоке (рис. 6.42, в). Прямой поток, расши-
ряясь в эжекторе Э, захватывает циркулирующий поток, повы-
шает его давление и обеспечивает интенсивную циркуляцию
через охлаждаемый объект О. Кратность циркуляции может
составлять 3-4 и более по отношению к прямому потоку. Применя-
ют различные схемы включения эжекторов, в том числе позволя-
ющие снижать температуру охлаждаемого потока (гелия) до 3,5 К.
На рис. 6.42, г приведена схема с циркуляционным механичес-
ким насосом Н (обычно центробежного типа). Включение в схему
насоса приводит к дополнительным тепловым потерям, но обес-
печивает многократную интенсивную циркуляцию независимо
от работы криогеной установки. Через насос может циркули-
ровать рабочее вещество в закритическом или в двухфазном
состоянии.
Значительный интерес представляют двухконтурные сател-
литные схемы охлаждения, целесообразные для очень крупных
объектов, например, для больших ускорителей элементарных
частиц, в которых охлаждаемые объекты расположены на значи-
357
тельном расстоянии один от другого. Сателлитные системы стро-
ят по следующему принципу. Крупный центральный ожижитель,
расположенный в центре, подает жидкий гелий к серии пери-
ферийных рефрижераторов-сателлитов, обычно расположенных
по окружности длиной в несколько километров. Ожижитель и
сателлиты также связаны по обратному потоку.
Такой сателлит (рис. 6.43, а) имеет собственный компрессор
и криогенный блок. Простейший вариант предусматривает цикл
сателлита с одним дросселем или с одним двухфазным детанде-
ром. Жидкий гелий от центрального ожижителя (обычно в
количестве у, составляющем несколько процентов от количества
циркулирующего в сателлите гелия) обеспечивает внешнее
охлаждение, необходимое для работы, и создает избыточный
обратный поток.
Системы с дросселем без избыточного обратного потока
(у = 0) неработоспособны из-за низкой температуры инверсии
гелия. Цикл сателлита замыкается при у = 0,015, затем его
холодопроизводительность быстро растет (рис. 6.43, б). Циркуля-
цию потока через охлаждаемый объект можно осуществить с
помощью любой системы (рис. 6.42). Сателлитная схема охлаж-
дения имеет много преимуществ: она достаточно проста, мобиль-
на; корректируя у, можно быстро менять холодопроизводи-
тельность.
Рис. 6.43. Сателлитный гелиевый рефрижератор с избыточным обратным потоком:
а — схема (К — компрессор; Т — теплообменник; С — сборник жидкого
криоагента; О — охлаждаемый объект; Д — детандер); б — зависимость удельной
холодопроизводительности qx и удельной работы /0 от у при Т = 4,5 К (/ "
схема с дросселем, 2 — схема с детандером при т)5 = 0,85)
358
Холодопроизводительность сателлита определяют из урав-
нения энергетического баланса (вариант с детандером — см.
рис. 6.42, а):
/2 + yif + qx + qc = (1 + у’)'г + /!Л.
где hi\ = z, - /4 — перепад энтальпий в детандере.
Выполнив преобразования, определим холодопроизводитель-
ность
<2Х = (1 + Ж = hs^s + У (‘у - if) - [Л'т, + Ср^Т2-Г + (6-116)
где qx — холодопроизводительность на 1 кг газа, подаваемого
компрессором.
Составляющая холодопроизводительности у (z'r - zp значитель-
на даже при малом у, так как велика разность z'r - z^. В
квадратные скобки заключены потери, к которым относится и
дроссельный эффект Az'r для гелия. Для рабочих веществ с
положительным дроссельный эффектом при нормальной темпе-
ратуре (воздух, N2, О2 и др.) знак Azr изменяется, и эта характе-
ристика переходит в разряд источников холода.
Сателлиты можно дополнять эжектором, насосом или двух-
циркуляционным устройством.
Для расчетов циклов с каскадным включением детандеров
используют уравнения энергетического баланса отдельных ступе-
ней. За основу можно принять систему уравнений (6.112) для
ожижительного варианта, причем ее необходимо дополнить урав-
нениями типа (5.58) — одним или двумя (по числу применяемых
ступеней с детандером). Для рефрижераторного цикла аналогич-
ным образом принимают за основу систему (6.114) и дополни-
тельные уравнения (5.61). Рассмотренные циклы из-за их слож-
ности целесообразно применять только для установок большой
производительности, обычно порядка 100 л/ч жидкого гелия и
более, а в рефрижераторном режиме 200-250 Вт и более.
Рассмотрим пример расчета криогенной установки, работаю-
щей по циклу с внешним охлаждением и каскадным включением
двух детандеров (см. рис. 6.37).
Пример 6.8. Рассчитать ожижитель производительностью ИНе = 100 л/ч по
Жидкому гелию, работающий по каскадному четырехступенчатому циклу с
предварительным охлаждением жидким азотом, расширением в двух детандерах
и дросселированием (см. рис. 6.37) Исходные параметры цикла: давления потоков
= 1,96 МПа, = 0.098 МПа; температуры 71 = 300 К. 7) = 80 К. 7) = 11 К,
Г/ = 2"х = 4,2 К; изотермический КПД компрессора циэ = 0,6. КПД детандера Д1
Пи = 0.75, детандера Д2 цй = 0,82. Неполнота рекуперации на нижней ступени
359
= 7) - Тп = 1 К; коэффициент а = 0.05; приток теплоты из окружающем
среды <7cj = 1.5 кДж/кг. Определить коэффициент ожижения х, потоки О2иО3в
детандеры, дросселируемый поток Т>4 = 1 - D2 - 7>3, расход азота I), = G,., удельные
затраты работы /0.
Температурный уровень /5 после 2-й ступени определим по формуле (6.20);
в данном случае 7] = Т3 = 80 К. а Тх = Т7 = 11 К при п = 2 (; = 1). Формула
(6.20) имеет вид
7'5 = 7( Г7 а3 г/.; /а,.
По формуле (6.8), где для гелия к = 1,67,
1.67 - 1
Тогда Т5 = з/80-ll- 1,33/1,09 = 32,7 К.
Примем Т5 = 33 К и температурные интервалы ступеней: I — от 300 до 80 К;
II — от 80 до 33 К; III — от 33 до 11 К; IV — от 11 до 4.2 К.
Неполнота рекуперации на каждой ступени Д71 = aTt. Обозначим Д73 = 7\ -
- 714; кТ2 = 73 - Т16; ДТ, = Т2 - 1\.. Тогда Д7/ = 0,05 • 33 = 1,65 К (принимаем
2 К); Д7'2 = 0,05 • 80 = 4 К; Д7] = 0,05 • 300 = 15 К.
Используя уравнения энергетического баланса (5.56), (5.58), (5.59) и уравнение
материального баланса /Л + 7)3 + Т>4 = 1 получим систему
(1 - Д2 - дз)(д'т, - СРДГ4 - <7о4> ,, . |7.
X = -------------:--Г---L; (6.11/)
Z12 ' Z/
x(il4-il2) + (1 - D2-D3)[(MT7-MTs) + ср(ЬТ3-ЬТ4) + <7c3]
Й52Пй + д175- (cp^ + ^ ' (6Л18>
n _ *0'16 - ’14) + 0 - Д2ИД'Л - &T, + cp(M'2 - ДТ3) + gc2]
2 Vk "Д ДЦ +
x(i,. " ',*) + Кд'т " д'т) + сл(Д7' " д7?) + '?<>]
Dt = Go = —!-------------------V/---El—1------V----. (6.120)
('19 " '18)n2
Решение этой системы позволяет найти неизвестные х, Т>2, 7>3, Т>4 и Go.
Предварительно определим численные значения ряда величин. В соответствии
с принятой неполнотой рекуперации по ступеням найдем температуры; К:
Т12 = 10, Т’14 = 31, Т16 = 76, Ту = 285. Температуру Т4 на входе потока в детандер
Д1 и изоэнтропный перепад энтальпии hsl определим из соотношения Л41 т)51 =
= ;4 - /14 по диаграмме Т— s для гелия. При известных р2 и р1 задаемся Т4(14У-
360
при 5 = const находим й51, а затем произведение т|л|; разница ;4 - й51г|31 должна
быть равна 114. При несовпадении расчет следует повторить (подбором). Аналогично
определим Т6 и йл2 для детандера Д2. В итоге имеем: Т4 = 63 К, йл1 = 233 кДж/кг;
Т6 = 24 К, Ил = 83,5 кДж/кг.
По диаграмме Т— s для гелия по известным Т и р определим ряд значений
энтальпии, необходимых для расчета (кДж/кг): ;'2 = 1585; ;3 = 435; ;4 = 345;
(5 = 183; /б = 132.5; ;7 = 51.5; ;12 = 65,0; ;14 = 176,0; ;1б = 412; I,. = 1495; if = 10.5.
По этой диаграмме найдем также изотермические эффекты дросселирования при
температурах входа в каждую ступень (кДж/кг): Д;7| = - 8.0; &iT} = - 2.7; ДгЛ = 4,5;
ДгЛ_ = 19,0. При р{ — 0,098 МПа удельная теплоемкость гелия с = 5,2 кДж/кг.
Подставим найденные значения в формулы (6.117)—(6.119):
х = 0,225(1 - /X - Р3);
7), = 1,82х (1 - D2 - 7>3) 0.35;
D2 = 1,58х 4- (1 - Р2) 0,128.
Решив эту систему, получим: х = 0,096 кг/кг; = 0,32 кг/кг; Д2 = 0,246 кг/кт.
Поток, идущий на дросселирование: /1. = 1 - D2 - Д3 = 0,434 кг/кг.
Удельный расход азота на предварительное охлаждение найдем по уравнению
(6.120), причем энтальпии ;19 и ;'18 определим по диаграмме 7 — з для азота при
= 0,098 МПа; ;18 = 29,4 кДж/кг; /19 = 441,8 кДж/кг (7), = 285 К).
г. _ 0,096 (1495 - 412) + (- 2,7+8) + 5,2(15 - 4) + 1,5 _ од
441,8 - 29,4
С учетом дополнительных затрат и потерь примем действительный расход азота
Go = 0.5 кг/кт.
Определим полные расходы газа. Подача компрессора: массовая GK =
= ^неР//х= 100-0,125/0.096 = 131 кг/ч; объемная VK = GK/pJJe = 131/0.1785 =
= 734 м3/ч; ру= 0,125 кг/л — плотность жидкого гелия в точке /; рНе= 0,1785 кг/м3
— плотность газообразного гелия. Потоки в детандерах и через дроссель, кг/ч:
Т>2 = 131-0,246 = 32.2; Д3 = 131-0,32 = 41,9; Д4 = 131-0,434 = 56,9. Расход
азота 6’х, = G0GK = 0,5 • 131 = 64,5 кг/ч в объемных единицах (pNj = 0,8 кг/л —
плотность жидкого азота) 1\., = 65,5/0,8 = 82 л/ч. Расход азота, отнесенный к
1л гелия, K0N2 = 82/100 = 0.82 л/л. Удельные затраты работы определим по
формуле (6.113). приняв работу на получение жидкого азота /0 = 5 МДж/кг,
2.08-300 1п(19,6/0.098) 5 ,
0 0,6-0,096- 103 + 0,3 0,096 52,8 МДж/кг
Удельный расход энергии, отесенный к 1 л жидкого гелия:
/ож = zoP/= 52,8-0,125 = 6,6 МДж/л.
Расчет криогенных циклов с применением компьютеров. Расчет
циклов криогенных систем связан с большой вычислительной
работой даже в том случае, когда его выполняют для одного
(номинального) режима. Помимо вычислений, приведенных в
примере 6.8, для этого цикла требуется определить температуры
(энтальпии) во всех характерных точках и работоспособность
теплообменников.
36 I
Обычно расчет сопровождается оптимизацией; при этом
анализируют характеристики цикла (/0, е, Г],) при изменении
давлений, температур, КПД машин, недорекуперации и ряда
других параметров, что по существу требует многократного
повторения всех этапов полного расчета. Расчеты универсальных
систем проводят как для ожижительного, так и для рефриже-
раторного режима. Нередко определяют изменение всех
параметров цикла при переменной холодопроизводительности.
Наиболее полные расчетные методики предусматривают учет
зависимости КПД машин, характеристик теплообменников и
другого оборудования от расхода. Очевидно, что такие
громоздкие расчеты целесообразно проводить с применением
ЭВМ; это существенно упрощает анализ и оптимизацию циклов.
Для этой цели разработан ряд методик и программ, успешно
применяемых на практике. Ниже описана одна из таких методик.
1. Исходные данные и расчетные зависимости. Исходными
данными обычно являются: холодопроизводительность 0Х (или
объем Кжидкого криоагента для ожижителей); давления потоков
/г, граничные температуры 7\, Тр КПД машин Г](., теплопритоки
qct, недорекуперации А 7) или коэффициент а и др. Некоторые
из этих величин постоянны (pv 7\, Тр Г)из, qct), другие являются
параметрами, изменяемыми в процессе расчета с целью оптими-
зации цикла (р2, Tf, Г](., а и др.). Помимо указанного, необходимо
знать энтальпии для различных состояний рабочего вещества и
их изменение в различных процессах. Для этого используют
уравнения состояния или таблицы данных.
Расчетные зависимости включают системы балансовых урав-
нений типа (5.67), (5.68) или в конкретном виде типа (6.117) -
(6.120), зависимости для определения температур между
ступенями типа (6.22), уравнения для определения затрат работы
вида (6.113), коэффициентов е, Г]г и др.
2. Программа для ЭВМ, формирование задания. Программы
составляют отдельно для ожижительных и рефрижераторных
режимов и записывают на одном из алгоритмических языков.
Основная программа имеет ряд дополнительных подпрограмм,
выполняющих следующие функции: вычисление параметров на
пограничных кривых; выполнение линейной интерполяции;
вычисление перепадов в детандерах hsj, разности температур А 7]
по краям и в различных сечениях теплообменников; контроль
выполнения предельных условий типа Т3 > Т4, Т5 > Т(> (здесь и
далее обозначения — см. рис. 6.37).
362
На рис. 6.44 приведена укрупненная схема алгоритма расчета
многоступенчатых рефрижераторных циклов (обозначения
соответствуют рис. 6.37).
Для расчетов на ЭВМ в память машины вводят информацию
о свойствах рабочего вещества (обычно в виде таблиц). Эта
информация имеет большой объем, и ее целесообразно вводить
на внешний носитель (магнитный диск).
Термодинамические свойства определяются соотношениями:
i = f(p- ту, Г = ф (р; /•); i = Ф (Р- sy, s = F(p- Ту V = f(p- Т).
Эти данные задаются массивами. Для конкретной программы
расчета (см. рис. 6.44) они заданы массивами соответственно G, s,
Е, F, А.
Задание для ЭВМ образует список записей (файл), представ-
ляющий собой обращение к операционной системе ЭВМ. Файл
включает инструкции, обеспечивающие доступ к программе, и
исходные данные цикла. Для цикла, схема которого дана на
рис. 6.37 (рефрижераторный вариант), исходные данные в файле
представлены следующим списком:
Q*'Pv Pi’ -^2’ ^7’ ^3’ 'П^Д! > Пи,> ДГ7.12; (6.121)
При формировании задания на один выход ЭВМ может
просчитывать несколько вариантов исходных данных. Для
исходных данных (6.121) устанавливают пределы их изменения,
например:
О '< т],д < 1; 0 < qc < 5,0; 0,01 < а < 0,1. (6.122)
3. Этапы решения и выводимая из ЭВМ информация. В
приведеной на рис. 6.44 схеме алгоритма выделены четыре
основных этапа расчета. Блок 1 определяет ввод всех исходных
данных, в том числе термодинамических свойств, данных (6.121)
и констант. Блок 3 предусматривает контроль соблюдения
условий типа (6.122). При ошибках задание снимается с решения;
при верном задании рассматриваются параметры а(, температуры
7] и энтальпии il в разных точках системы.
Блок 7 предусматривает проверку соблюдения предельных
условий с выводом на печать при наличии ошибок. Далее (блок
10) вычисляются дроссельные эффекты, перепады в детандерах,
разности энтальпий С(; часть данных выводится на печать (блок
11). Блоки 12-14 контролируют неравенство нулю знаменателей
в системе уравнений типа (6.117)—(6.120). Далее вычисляются
потоки Д. и холодопроизводительность с соответствующим
363
Рис. 6.44. Схема алгоритма расчета циклов
364
контролем этих величин. Блоки 19-24 выполняют проверку
работоспособности теплообменников 5 и 6.
Блоки 25, 26 вычисляют и выводят на печать массовые
расходы (£>;), удельную работу /0. Для чтения вводимой
информации используются идентификаторы печати по принятым
обозначениям. Меняя исходные данные (6.121), можно легко
проводить полный анализ и оптимизацию цикла. Описанная
программа позволяет рассчитывать циклы при различных
вариантах отдельных ступеней (с детандером, с внешним
охлаждением, с дросселированием), что дает возможность
рассчитывать и анализировать целую группу циклов.
§ 6.5. ОСОБЕННОСТИ РАСЧЕТА ЦИКЛОВ (ПРОЦЕССОВ)
В ГАЗОРАЗДЕЛИТЕЛЬНЫХ УСТАНОВКАХ
В газоразделительных установках совмещены холодильные и
технологические процессы, т.е. процессы получения низких
температур, ожижения газов и разделения газовой смеси на
составные части. Протекающие в установке процессы частично
или полностью разомкнуты (цикл не образуется). Кроме того,
характеристики холодильных и технологических процессов
взаимосвязаны, поэтому при расчете должны быть увязаны
параметры узлов охлаждения и разделения (преимущественно
узла ректификации). Все низкотемпературные аппараты уста-
новки изолированы от притоков теплоты из окружающей среды
и объединены в специальный блок, который часто называют
блоком разделения. Кроме блока разделения и компрессоров для
сжатия газа в установку, в зависимости от ее схемы и назначе-
ния, включают аппараты для осушки и очистки газа от примесей,
теплообменные аппараты, детандеры и другое оборудование для
получения холода, оборудование для перекачивания и сжатия
продуктов разделения, сосуды, баллоны, газгольдеры для хране-
ния продуктов разделения, а также арматуру, приборы и комму-
никации. Рассмотрим только те элементы установок, в которых
протекают процессы, связанные с получением холода для
производства жидкости и разделения газовой смеси на составные
части.
Современные газоразделительные установки различают по
схеме и производительности. Выпускают небольшие установки,
в которых перерабатывается несколько килограммов газовой
смеси в 1 ч, и установки средней и большой производительности,
365
в которые поступают десятки тысяч килограммов газовой смеси
в 1 ч [3, 8, 15, 20, 30]. Давление газа в установках также
существенно различается: от 0,6 МПа (установки низкого
давления)до 20 МПа (установки высокого давления).
Основной составной частью себестоимости продуктов разделе-
ния, получаемых на крупных газоразделительных установках,
являются затраты энергии. В связи с этим одна из задач при
выборе схемы и ее термодинамическом расчете состоит в
определении оптимальных характеристик, при которых расход
энергии минимальный. Однако в ряде случаев создание более
эффективных установок приводит к существенному усложнению
их схемы, в результате которого возрастают капитальные затраты,
а также может снизиться надежность установки. В связи с этим
только один показатель — минимальный расход энергии — не
может быть достаточным при окончательном выборе схемы уста-
новки, типов машин и аппаратов и значений термодинамических
параметров рабочих веществ. Все это вместе взятое существенно
усложняет задачу расчета при проектировании газоразделитель-
ных установок, особенно большой производительности; расчет
становится многовариантным, и его успешное выполнение часто
требует использования ЭВМ. Рассмотрим основные отличия
термодинамического расчета установки для разделения газов от
расчета ожижительной установки.
Методы термодинамического расчета различных схем в прин-
ципе аналогичны. Многие циклы, описанные в § 6.2 и 6.4, при
некотором изменении можно применить и в газоразделительных
установках. При этом в установку необходимо дополнительно
включить разделительный аппарат (ректификационную колонну)
и согласовать параметры процессов охлаждения и разделения
газовой смеси. Примем в качестве разделяемой смеси воздух,
причем условно представим его состоящим из двух компонентов:
кислорода О2 и азота N2 (к последнему отнесем все остальные
газы, содержащиеся в воздухе).
При термодинамическом расчете учтем основные потери
холода, свойственные любой низкотемпературной установке:
потери в теплообменном аппарате вследствие неполной рекупе-
рации теплоты и притока теплоты из окружающей среды. Приток
теплоты qc можно принять на основании опытных данных,
приведенных в работах [8, 12]. Для упрощения расчета примем,
что, воздух на входе в блок разделения не содержит влаги и
других примесей (в том числе СОД. При более точном и полном
расчете установки необходимо предварительно выбрать способы
366
очистки ии осушки воздуха, которые определяют схему движения
потоков и параметры состояния рабочего вещества [8, 12, 15,
20].
Для пояснения методики расчета рассмотрим простейшую
известную схему блока разделения установки с процессом
дросселирования воздуха (рис. 6.45). Основные аппараты,
входящие в блок разделения воздуха: теплообменники Т1 и Т2
и ректификационная колонна РК. Воздух В (точка 2) в тепло-
обменнике охлаждается до состояния, соответствующего точке
3, и направляется в ректификационную колонну через дроссель-
ный вентиль ДВ. Из колонны выходят продукты разделения
воздуха — газообразный азот А и кислород К. Здесь и далее
обозначение К соответствует продукту разделения с небольшой
примесью N2, А — продукту разделения с примесью О2.
Молярные доли компонента N2 в этих продуктах соответствуют
ук и уА. Азот А проходит теплообменник Т1, где подогревается
(точка 5). Если кислород отводится из колонны также в газо-
образной фазе, то он подается (точка 4) в теплообменник 72,
где подогревается до состояния, соответствующего точке 6. При
этом жидкий кислород не отбирается (запорный вентиль ЗВ2
закрыт), а поток воздуха делится на две части (запорные вентили
ЗВ1 и ЗВЗ открыты).
При термодинамическом расчете такой системы обычно
известны давления продуктов разделения р5 и р6, давление в
колонне ррк, температура воздуха в точке 2, расход воздуха и
его состав, состав получаемого кис-
лорода (К). При расчете находят
количество кислорода (К) и азота
(А), давление воздуха, параметры
состояния воздуха и продуктов
разделения в основных точках, а
также энергетические характерис-
тики системы. При расчете зада-
ются разностями температур на
теплых концах теплообменников Т1
и 72 (ДТТ] = Т2 - Т5; А7Т2 = Т2 -
Т(>) и притоком теплоты qQ из
окружающей среды. Следует учиты-
вать, что при получении продукта К
заданного состава молярная доля N2
(уЛ) в уходящем азоте А зависит от
типа и конструкции разделитель-
Рис. 6.45. Схема блока разделения
367
ного аппарата, если оба продукта выходят из блока разделения
в газовой фазе при температуре, близкой к температуре
окружающей среды. При получении из воздуха жидкого кисло-
рода его количество зависит от холодопроизводительности уста-
новки, а состав газообразного азота А — не только от схемы и
конструкции разделительного аппарата, но и от холодопроизво-
дительности установки. Рассмотрим оба режима подробнее (при
установившемся процессе).
При термодинамическом расчете режима работы для получе-
ния газообразного кислорода выбирают тип разделительного
аппарата и задают значение уЛ в потоке А. Затем составляют для
блока разделения:
общее уравнение материального баланса
В=А + К- (6.123)
уравнение материального баланса по низкокипящему компо-
ненту — N2
ВУц = аУа + КУк'> (6.124)
уравнение энергетического баланса
В+ В qc — А ц + К if,; (6.125)
здесь уА, уъ, — молярные доли N2 в потоках соответственно
В, А и К.
Из уравнений (6.123)-(6.125) определяют значения К, А и ir
Энтальпии /2, /5 и z'6 следует вычислять по диаграмме /—х для
смеси О2~N2 или по различным диаграммам, соответствующим
определяемому продукту. На диаграммах для разных веществ
выбраны различные точки начала отсчета энтальпий, поэтому
предварительно необходимо согласовать диаграммы или привести
уравнение (6.125) к выражению, содержащему разности энталь-
пий. Этим расчет отличается от расчета цикла, описанного в
§ 6.2. Расчет по диаграмме, построенной для смеси, более точен,
так как абсолютно чистых веществ в установке не получают.
Однако для продуктов разделения с небольшим содержанием
примесей других компонентов можно использовать соответствую-
щие диаграммы для чистых веществ [16].
Используем уравнение энтальпийного баланса при смешении
веществ, допустив, что теплота смешения равна нулю:
В L ~ A L. + К z’lK , (6.126)
где Zj, /]4 и z'1K - энтальпии воздуха, азота А и кислорода К
при одинаковых давлении р} и температуре Т} (обычно прини-
36S
мают рх равным давлению на входе в компрессор, а температуру
Т равной температуре воздуха Тг на входе в блок разделения).
Преобразуем уравнение (6.125). Для этого из уравнения (6.126)
вычтем уравнение (6.125):
Д (z'l - z2) = А (/1Л - /5) + X"(z1K - z6) + Bqc. (6.127)
В правой части уравнения (6.127) сумма двух первых слагае-
мых определяет потери холода вследствие неполной рекуперации
теплоты в аппаратах Т1 и Т2, а последнее слагаемое соответствует
притоку теплоты из окружающей среды. Следовательно,
Zl’Z2=?Zn’ (6-128)
где = (^/0)(Z1A - z5) + (к/ВХ1\к - l'e) + потери холода
в установке.
Разности энтальпий при определении значения qZn можно вы-
разить через разности температур на теплых концах теплообмен-
ников, так как удельные теплоемкости срЛ и с к выходящих
потоков А и К практически не изменяются в интервалах
температур Т2 ... Г5 и Т2 ... 7/: /1Л - z5 = с^Т^, z1K - z6 - с^АТ/,.
В пусковой период для охлаждения установки и накопления
жидкости в элементах ректификационной колонны холодопроиз-
водительность должна быть больше q2.,. Холодопроизводитель-
ность обычно увеличивают, повышая давления сжатого воздуха.
Разность z’j - /2 соответствует изотермическому эффекту
дросселирования и определяет количество полученного холода.
Это количество (если продукты разделения выводятся в газо-
образной фазе) численно равно потерям qL в установке. Из
уравнения (6.128)
/2=/1-<7Ь1. (6.129)
По энтальпии г2 и температуре Т2 определяют с помощью
термодинамических диаграмм или таблиц давление воздуха на
входе в блок разделения. Обычно это давление в рассмат-
риваемом цикле составляет 5-6 МПа. Например, если темпера-
тура Т2 = 300 К, давление = 0,1 МПа, приток теплоты
Из окружающей среды qc = 200 Дж/моль, разности температур
А7^! = &ТТ2 = ДГТ = 5 К, то qZn = срАТт + qc = 29 • 5 + 200 =
= 345 Дж/Моль. Здесь молярные теплоемкости продуктов
Разделения А и К приняты одинаковыми: срА ~ срК = ср ~
= 29 Дж/(моль • К). Такое допущение возможно при низких дав-
лениях и сравнительно высоких температурах (7/ = 7/ = 295 К).
369
24 Заказ .V’ 1592
По формуле (6.129): при z'j = 8715 Дж/моль (энтальпия воздуха
при давлении 0,1 МПа и температуре 300 К) энтальпия z2 -
= 8715 - 345 = 8370 Дж/моль. На диаграмме T—s для воздуха
[2] значениям /2 и Т2 соответствует давление р2 ~ 5,5 МПа.
При термодинамическом расчете установки, из которой отво-
дится жидкий кислород в состоянии, соответствующем точке /
(вентиль ЗВ2 открыт, вентили ЗВ1 и ЗВЗ закрыты, теплообмен-
ник Т2 отключен), также используют уравнения (6.123) и (6.124);
уравнение (6.125) запишем с учетом изменения параметров
состояния кислорода:
Bi2 + Bqc — Ais + Klf. (6.130)
Выполнив преобразования, аналогичные ранее рассмотренным,
получим
Д(г\ - i2) = A (z1A - z5) + K(i^ - if) + Bqc, (6.131)
где К (z1K - zy) — количество теплоты, которую следует отвести
от продукта К для его охлаждения и ожижения при постоянном
давлении pv A (z'1A - z’5) — потери холода с газом А вследствие
неполной рекуперации теплоты в аппарате Т1.
Из системы уравнений (6.123), (6.124) и (6.131) определим
значения К, А, уА (давлением воздуха р2 обычно задаются с
учетом характеристик выбранного оборудования).
Из уравнения (6.123): А = В - К. Подставим полученное
выражение для А в уравнение (6.131) и решим относительно К:
к = в h ~ 01A.~ Zs).~ = в1:А?5>а.а7п - ъ (6132)
Z1K Z/ " (Z1A " Zs) Z1K Zy СрА^Лт
Молярная доля N2 в газе А [см. уравнение (6.124)]
уА= (Дув - Кук)/(В- К). (6.133)
Работа, необходимая для получения 1 моля жидкого кислорода,
/0 = В1к/К, (6.134)
где /к — работа, совершаемая для сжатия воздуха в компрессоре,
Дж/моль; В и К — расход воздуха и кислорода, моль/с.
При получении жидкого кислорода из воздуха в рассматри-
ваемой задаче значения энергетических характеристик близки
соответствующим показателям цикла с простым дросселирова-
нием для ожижения воздуха, поскольку числители формул (6.40)
и (6.132) по существу содержат одинаковые величины, а в
370
знаменателях разность энтальпий z'1K - /^для кислорода отлича-
ется от соответствующей разности - у для воздуха не более,
чем на 5 %. При правильно рассчитанных параметрах должен
выполняться энергетический баланс узла разделения; для рас-
смотренного режима получения жидкого кислорода соответст-
вующее уравнение имеет вид
& 13 + - ZA + % lf ’
J
где (2сРК — приток теплоты из окружающей среды в ректифи-
кационную колонну через изоляцию,'тю тепловым мостам и
опорам; z'A — энтальпия потока Д^выходящего из колонны.
Описанная схема с дросселированием воздуха отличается
исключительной простотой; однако вследствие малой эффек-
тивности ее используют только в небольших установках. Для
разделения воздуха применяют более сложные, но и более
эффективные установки с поршневыми детандерами и турбо-
детандерами [12, 14, 15]. Известны установки высокого давления
с расходом энергии 3,6—4,3 МДж на 1 кг жидкого кислорода
(1,0—1,2 кВт-ч/кг) [15]. В отдельных установках предусмотрено
комплексное разделение воздуха. Для получения кислорода и
азота из воздуха используют также установки среднего давления
с детандерами [14, 20]. Схемы этих установок существенно
отличаются от рассмотренной [3, 15].
Для получения больших количеств технологического кисло-
рода (95 — 98 % О2) применяют установки, работающие при
низком давлении воздуха (иногда с частью воздуха высокого
давления). На этих установках можно одновременно получать
некоторое количество чистого кислорода или чистого азота,
жидкого кислорода, а также продукты, обогащенные редкими
газами, содержащимися в воздухе.
В нашей стране построены крупные установки низкого давле-
ния для производства газообразного кислорода и азота из воздуха
с применением высокоэффективных турбодетандеров [3, 12, 20,
30]. Давление сжатого воздуха в таких установках около 0,65 МПа,
Количество перерабатываемого воздуха до 350 тыс. м3/ч; изоэн-
тропный КПД турбодетандеров т]5 = 0,82...0,85 [3, 14, 15].
Например, в крупнейшей установке Кт-70 перерабатывается
350 тыс. м3/ч воздуха, из которого получают 66 тыс. м3/ч газо-
образного технологического кислорода, 5050 кг/ч жидкого кисло-
рода, 30 тыс. м3/ч чистого газообразного азота, а также нсоно-
гелиевую смесь и криптоноксеноновый концентрат [3, 17, 30].
Жидкий кислород представляет собой продукт, молярная доля
24* 371
Рис. 6.46. Упрощенная схема блока
разделения установки низкого давления
О2 в котором примерно 99,7 %;
в технологическом газообраз-
ном кислороде — около 95 %.
Установки низкого давления
выпускают с регенераторами и
пластинчато-ребристыми тепло-
обменниками; расход энергии
на 1 м3 кислорода около 0,4—
0,5 кВт• ч [ 14].
На рис. 6.46 [14] показана
одна из принципиальных схем
воздухоразделительной установ-
ки низкого давления в очень
упрощенном виде. Воздух В
(точка 1) после узла компрессии поступает в регенераторы Р
(или реверсивные теплообменники) и после охлаждения в них
(точка 2) делится на три потока. Один поток идет в
ректификационную колонну РК, другой — в турбодетандер Д\
третий поток П в качестве так называемого петлевого потока
возвращается в регенераторы, где подогревается до состояния,
соответствующего точке 9. Поток П также поступает в
турбодетандер, предварительно смешиваясь с холодным воздухом
(после смешения состояние воздуха перед турбодетандером
соответствует точке 7). После расширения в турбодетандере
(точка 8) воздух подается в одно из сечений верхней части
ректификационной колонны, работающей при давлении около
0,13 МПа.
В нижней части колонны (при давлении около 0,56 МПа)
происходит предварительное разделение воздуха (см. гл.7).
Продукты разделения отводятся из верхней части колонны, это
— газообразный азот А, газообразный кислород К и некоторое
количество жидкого кислорода А^. Для установившегося режима
уравнение энергетического баланса блока разделения, включаю-
щего узлы охлаждения I и ректификации II, [14] имеет вид
Btsa^ + Dh Bqc + AcpA(T} Т4) + КсрК(Д\- Т6) + A^(z]K - /]0),
где — изотермический эффект дросселирования при темпе-
ратуре 1\, h — разность энтальпий воздуха при расширении его
в детандере; qQ — приток теплоты из окружающей среды; Tv
Т4, ^6’ zio “ температуры и энтальпия газа и жидкости в соответ-
ствующих точках схемы; г1К — энтальпия кислорода при атмос-
ферном давлении и температуре Г,.
372
Значение h зависит от параметров состояния воздуха в точке
7и КПД турбодетандера r|f и равно hxv\s.
Для определения z7 используют уравнения.
теплового баланса регенераторов
Д (z\ - z2 + 4сР) = A (z4 - z3) + К (z6 - z5) + П (z9 - z2);
смешения потоков перед турбодетандером
П (z9 1т) ~ D (i-j - z2),
где qcP ~ приток теплоты из окружающей среды к регенераторам;
индексы при z соответствуют точкам на схеме.
Для определения h, D и используют итерационный метод.
Параметры узла охлаждения и количество детандерного потока
влияют на работу ректификационной колонны и концентрацию
продуктов разделения. Количество детандерного потока в таких
установках (обычно не превышает 25 % от количества перераба-
тываемого воздуха) определяют из уравнений энергетического
баланса блока разделения и условий работы ректификационной
колонны. Выше приведены основные балансовые уравнения;
расчет установок такого типа значительно сложнее, чем здесь
указано [14—16].
Степень термодинамического совершенства ВРУ составляет
9—20 %, следовательно, на компенсацию потерь вследствие
необратимости процессов приходится соответственно 91—80 %
совершенной работы. В работе [17] приведены расчетные при-
мерные характеристики потерь вследствие необратимости про-
цессов в установке низкого давления при разделении воздуха с
Г],= 15 %. Согласно [17] энергия в такой установке расходуется
на совершение минимальной работы разделения (=15 %) и ком-
пенсацию потерь вследствие необратимости процессов в узлах
установки (=85%). Последняя составляющая распределяется
примерно так: при сжатии воздуха в компрессоре = 40 %, в ректи-
фикационной колонне =16%, в теплообменной аппаратуре =21 %,
в детандере = 3 %, при дросселировании = 2%; потери, связанные
с притоком теплоты из окружающей среды, =3%. Термодинами-
ческий анализ схем ВРУ подробно изложен в работах [4, 14, 62].
373
§ 6.6. ЦИКЛЫ ГАЗОВЫХ ХОЛОДИЛЬНЫХ МАШИН
ГХМ получили широкое применение благодаря компактности
и эффективности. Существуют несколько типов поршневых
ГХМ. Наиболее распространены машины, работающие по
обратному циклу Стирлинга, а также по циклам Гиффорда—Мак-
Магона и Вюлемье—Такониса.
Цикл Стирлинга. В замкнутом цикле Стирлинга рабочее тело
участвует в круговом процессе, состоящем из четырех этапов (две
изохоры и две изотермы на рис. 6.47). Теплота отводится из
цикла в окружающую среду при температуре Го в процессе
сжатия, а теплота от охлаждаемого тела передается в цикл при
температуре Т в процессе расширения. Регенерация теплоты в
цикле осуществляется теоретически в процессе v— const. Если
рабочим телом является газ Ван-дер-Ваальса, то работа:
процесса сжатия 1-2
= li-2 = Щ(6.135)
сж 2 и М] - h \ v2'
процесса расширения 3-4
V, - h /1 1 \
/ =/3_4 = АГ1п —- а I---------, (6.136)
р w2 - h \ v2 /
где а и h — коэффициенты в уравнении Ван-дер-Ваальса.
Количество теплоты:
отведенной в окружающую среду:
^н2о - RT0 In [(n2 - b)/(vx - />)]; (6.137)
сообщенной рабочему телу в процессе расширения
q = АГ In [(n, - b)/(v2 - />)]• (6.138)
Холодильный коэффициент цикла Стирлинга, как и цикла
Карно,
estr = <= Г/(Г0- Г) = гс- (6.139)
Изменение внутренней энергии в процессе сжатия 1-2
Az/j 2 = Az/pe = z/, - и2 = a(l/w2 - l/wi)- (6.140)
Холодопроизводительность идеальной холодильной машины
Стирлинга с реальным рабочим телом больше работы расши-
рения:
q = /n + Az/T . (6.141)
Р 70
374
5)
a) 5
Рис. 6.47. Обратный (холодильный) цикл Стирлинга:
а — диаграммы р—v и 7—5; б — схема реализации в поршневой машине с двумя
поршнями, регенератором Р, холодильником и охладителем (?но — теплота,
отводимая в холодильнике в окружающую среду; q — теплота, подводимая в
охладителе и передаваемая в полость расширения)
Результат, выраженный формулой (6.141), является следствием
регенеративного теплообмена в условиях v = const.
Для изохорного процесса
dp = dl\dp/dT)v. (6.142)
Согласно уравнению (3.73)
(др/дТ\ = R/(v- by (6.143)
тогда изменение давления в процессах регенерации теплоты
2-3 и 4-1:
р2- Py=^ R(T0 - T)/(v2 - by
Р\- R(To - Т)/(ЗУ - by (6.144)
Составим уравнение теплового баланса и определим тепловую
нагрузку регенератора:
- и4 = иг- и3; (6.145)
2рег= ^<Р2-Р^/(к- !); (6-146)
здесь V — объем сжатого газа, проходящего через регенератор.
375
Если регенератор считать внешним по отношению к рабочему
объему машины, то процесс регенерации теплоты является стро-
го изохорным, и соотношения (6.141)-(6.146) справедливы.
Однако конструктивно регенератор обычно расположен внутри
рабочего объема и имеет свободный («мертвый») объем. В этом
случае процесс регенерации теплоты, протекающий в системе с
постоянным объемом, не является изохорным, а тепловая нагруз-
ка регенератора (в первом приближении)
2рег = < V + ^рег)(Р2-Ш^- О- (6-147)
Для идеальных машин наличие мертвого объема допустимо,
если при этом не возникают необратимые эффекты. В частном
случае для идеальной машины Стирлинга это условие выполня-
ется, холодильный коэффициент остается равным ес, поэтому
для идеальной машины Стирлинга можно принимать 1^ег = 0 и
1^сг Ф 0. Согласно уравнениям (6.146) и (6.147) процесс регенера-
ции теплоты при Ерег = 0 можно считать изохорным.
Принципиальный способ реализации обратного цикла Стир-
линга в поршневой машине иллюстрирует рис. 6.47. Два поршня
движутся в цилиндре прерывисто с углом сдвига по фазе р. В
рабочем пространстве между поршнями размещен регенератор
Д, который делит рабочую полость на две части — теплую и
холодную. Иногда их условно называют полостями сжатия и
расширения. В теплой полости поддерживается постоянная тем-
пература 7), за счет отвода теплоты <7Н 0 в холодильнике. В холод-
ной полости температура Т постоянна (за счет подвода теплоты
q через охладитель). В действительности цикл чаще всего реали-
зуют в машине с гармоническим движением поршней, причем
существует несколько конструктивных схем подобной машины
(см. рис. 6.49).
Цикл Эриксона. Замкнутый цикл Эриксона образован двумя
изотермами и двумя изобарами. Однако он может быть и
разомкнутым. Для идеального газа холодильный коэффициент
цикла равен холодильному коэффициенту цикла Карно. Для
реального газа такого совпадения нет, так как существует необра-
тимое приращение энтропии в процессе регенерации теплоты
при р = const.
Холодопроизводительность цикла
Q=L + MT. (6.148)
Р 'о
376
Циклы Стирлинга и Эриксона в машинах с гармоническим
движением поршней. Диаграммы перемещений поршней (см.
рис. 6.47 и 6.49) показывают, что прерывистое движение поршней
может быть заменено гармоническим. Введение гармонического
закона движения поршней в идеальной машине нс вносит
дополнительной необратимости, т.е. холодильный коэффициент
остается равным холодильному коэффициенту цикла Карно.
В конструктивном отношении для холодильных машин такого типа
характерны следующие схемы: с двумя рабочими поршнями
(рис. 6.48, а); с одним рабочим поршнем и поршнем-вытеснителем,
не нагруженным в идеальной машине давлением (рис. 6.48, б-г\, с
одним рабочим поршнем и подвижным регенератором, играющим
одновременно роль вытеснителя (рис. 6.48, г). Под рабочим
подразумевается поршень, нагруженный давлением.
Рис. 6.48. Схемы (а—г) и диаграммы (д) газовых холодильных машин, работающих
по обратному циклу Стирлинга:
а — с двумя рабочими (нагруженными) поршнями; о — с одним рабочим поршнем
И поршнем-вытеснителем (с двумя цилиндрами); в — с одним рабочим поршнем
И поршнем-вытеснителем, расположенными соосно; г — с одним рабочим
Поршнем и перемещающимся регенератором-вытеснителем; I - «компрессорный»
Или рабочий поршень; 2 — водяной (или воздушный) холодильник; 3 —
Регенератор; 4 — «детандерный» поршень или вытеснитель; 5 — теплообменник
ДЛя снятия нагрузки (охладитель)
377
В машинах с вытеснителем и вытеснителем-регенератором
рабочий поршень и вытеснитель могут быть расположены соосно
в одном цилиндре (см. рис. 6.48, <?) или в разных цилиндрах (см.
рис. 6.48, г).
Различные схемы машин с вытеснителем и вытеснителем-
регенератором имеют определенные практические преимущества.
Например, при соосном расположении рабочего поршня ц
вытеснителя цилиндр вытеснителя является как бы продолже-
нием цилиндра рабочего поршня (диаметры цилиндров могут
быть разными). Такая схема отличается компактностью, возмож-
ностью уменьшения мертвых объемов, однако в конструктивном
отношении она несомненно более сложная.
В настоящее время разработаны методы расчета ГХМ, кото-
рые строго учитывают реальный характер рабочих процессов ц
предполагают применение ЭВМ. Здесь рассмотрим классический
анализ и простейшую схему расчета, которые можно применять
на первых стадиях проектирования.
В предположении изотермичности процессов расширения и
сжатия в тепловой машине Стирлинга и идеальности процесса
регенерации теплоты Шмидтом получено соотношение
q = л ~р Ко 5 sin 0/[ 1 + (1 - 82)0,5], (6.149)
где q — холодопроизводительность за один цикл (для холодиль-
ной машины — теплота, передаваемая в охладителе; для тепловой
машины — получаемая работа); ~р — среднее давление рабочего
тела за цикл; Ко — максимальный объем полости расширения;
3 — безразмерный коэффициент; 0 — угол фазового сдвига между
максимальным давлением и минимальным объемом полости
расширения.
Угол фазового сдвига определяют по уравнению
со sin ср
tg 0 = —т-------------------- ;
Ь Т + СО COS ф
здесь со = (Укmax ' ^Kmin)/^o “ отношение максимальных
объемов полостей сжатия и расширения; ср — угол фазового
сдвига между максимальными объемами полостей сжатия и рас-
ширения (изменение объема полости сжатия Ик опережает на
угол ср меняющийся объем полости расширения — см.
рис. 6.49); т = Т^/Т — отношение температур холодильника И
охладителя.
Безразмерный коэффициент
3 = (т 2 + 2т со cos ср + со2)0,5/(т + со + 2'а1).
(6.150)
(6.151)
378
Здесь aY — суммарный относительный приведенный мертвый
объем
at ~ ’ (6.152)
где — суммарный относительный мертвый объем; Г —
средняя температура рабочего тела в мертвом объеме:
Тср = а£/ Z
Значение aY рассчитывают по формуле
аЪ = «К + flX + аР + fl0 + «доп’ (6.153)
где ак, ах, ар, а0 — относительные мертвые объемы полостей
сжатия, холодильника, регенератора и расширения (все относи-
тельные объемы вычисляют по отношению к Ио); ядоп —
дополнительный мертвый объем рабочего пространства.
Отношение максимального давления рабочего тела к мини-
мальному определяет степень расширения (или сжатия):
° = /’maximin = U + 5)/0 * 8).
(6.154)
Отношение максимального давления к среднему
/’max/ 7 = 1(1+ 8)/(1 - б)]0,5.
(6.155)
машины с гармоническим движением
соосно расположенных поршней
379
Теоретическая холодопроизводительность идеальной холо-
дильной машины Стирлинга с гармоническим движением
поршней
— л п —— jr 6 sin 9 /z л
р 1 + (1 - ’ <61561
где Q — в Вт; п — в мин'1; Ио — в м3; р — в Па.
Тепловой поток в окружающую среду через холодильник
Л пп _,. 5 sin (ср - 0) ., ,
Он.о^^ 1+(|- (6157>
Мощность привода идеальной машины
= бн2о- Q- (6158)
Для реальной машины, развивающей такую же холодопро-
изводительность на том же температурном уровне, что и идеаль-
ная машина, мощность привода и тепловой поток в окружающую
среду
- Л/ид/Поти- бн2о = ^+ Q’ (6-159)
где Г|отн — относительный КПД (в данном случае — степень
термодинамического совершенства).
При одинаковой с идеальной машиной потребляемой энергии
холодопроизводительность реальной машины
ед=2пота- (6-160)
Относительный КПД определяет потери вследствие неполноты
рекуперации, теплопритоков, гидравлических сопротивлений и
пр. (например, Г]отн = 0,3 ... 0,4 для Т = 70...80 К).
При анализе цикла и расчете подобных машин важны также
кинематические соотношения. Приняв за начало отсчета угла
поворота коленчатого вала положение «детандерного» поршня
или вытеснителя в верхней мертвой точке, найдем текущие
(отмечены чертой) перемещения «детандерного» и «компрес-
сорного» поршней:
Тд = гд(1 - cos а) + 0,5(Гд//д) sin2a; (6.161)
Тк = rK[l - cos (а - Р)] + O,5(rj?//K) sin2(a - р), (6.162)
где гк и Гд — длины компрессорного и детандерного кривоши-
пов; /к и /д — длины компрессорного и детандерного шатунов;
Р — конструктивный угол между кривошипами (см. рис. 6.49)-
380
Соответствующие этим перемещениям текущие значения
описываемых объемов:
ТГд = 0,5 ИД1 - cos а + 0,5 (гд//д) sin2a];
ТГК = 0,5 Ик[1 - cos (а - р) + 0,5(rK//K) sin2(a - р), (6.163)
где Пд и Ик - полные описанные объемы.
При движении поршней изменяются и текущие объемы
полостей сжатия и расширения и .
Для всех идеализированных машин независимо от конструк-
тивной и компоновочной схем (см. рис. 6.48)
= *д и идтах = ^0- <6-164)
Значения и !-(. тождественны только для идеальных машин
с двумя рабочими поршнями (см. рис. 6.48, а), поэтому в общем
случае текущий суммарный рабочий объем
«к+ «д+ (6-165)
где V — суммарный мертвый объем.
Для машин с вытеснителем изменение суммарного рабочего
объема (без учета диаметра штока) определяется только положе-
нием компрессорного поршня; если не учитывать конечную
длину шатуна, суммарный рабочий объем можно определить по
формуле
= 0,5 Гк 11 - cos (а - ₽)] + Исопй , (6.166)
где Zconst — постоянный объем, определяемый суммарным
объемом регенератора и холодильника Ирх и углом р между
кривошипами (Kconst > Ирх). _
С другой стороны, для объема между двумя поршнями
(см. рис. 6.49) можно записать
K'WKx- (6Л67)
Тогда
(7 = 0,5rK[l-cos(a-p)]-0,5ro(l-cosa)+ ГсопЯ - Крх. (6.168)
Угол а фазового сдвига следует определять из условия
д /да = 0. (6.169)
После дифференцирования получим
tg ср = z sin р /( z cos Р - 1), (6.170)
381
где z — И</^а — отношение полных описанных объемов.
С учетом диаметра dmY штока вытеснителя можно записать
tg Ф = z sin Р /(z cos Р - ц). (6.171)
Здесь
М = 1 - «/Яц)2- (6.172)
где Du — диаметр цилиндра, внутри которого проходит шток.
Уравнение (6.156) можно использовать как общее выражение
для вычисления холодопроизводительности машин Стирлинга
разных компоновочных схем; при этом для каждой конкретной
схемы необходимо определить со = f (z, Р) и дополнительный
мертвый объем в полости сжатия.
Следует различать значения со' и со:
® Hi max / max max / И) ’
V - V V v '
гДтах Дтт *0
где со' — отношение максимального абсолютного объема полости
сжатия к максимальному объему полости расширения; со
отношение максимального изменяющегося объема полости сжа-
тия к максимальному объему полости расширения.
Для всех компоновочных схем 1дгшп = 0, a CKmin = 0 только
для схемы с двумя рабочими поршнями и для схемы с соосным
расположением поршней при равенстве диаметров цилиндров.
В соответствии с расчетной схемой Шмидта, применяя урав-
нение (6.156) для разных схем, необходимо использовать вели-
чину со.
Рассмотрим вначале общий случай соосно расположенных
поршней (см. рис. 6.48, в);
^Kmin= (! - Яд2ЛОк2)-0,5^11 - соя (ч> - Р)Ь (6.174)
где 7)д и ТУ — диаметры цилиндров в полостях соответственно
расширения и сжатия. _
По уравнению (6.168) при = Hemin и а = Ф
^const - И’.х = O’W1 - cos Ф) - °,5 едШ 1 - сой(ф - ₽)] (6.175)
Из условия IZR = (кmax ПРИ “ = 180° + Ф ПОЛУЧИМ
max = O’W1 - 7>д>к) + о,5 rK( 1 + D^D>) cos (ф - Р) - И-jCOS 9-
(6.176)
382
f Из уравнений (6.176) и (6.174)
/
!a>' = 0,5z(l- D2/Dl) + 0.5Z (1 + Dn2/^) cos (<p - 0) - cos <p; (6.177)
(o = z cos (<p - 0) - cos (p . (6.178)
Сравнение выражений (6.177) и (6.178) показывает, что
o' = со при £)д = . Выражение (6.178) с помощью уравнения
co=^z2-2z cos Р + 1 (6.179)
или, с учетом диаметра штока,
а> у/ Z2 Ц2 - 2 z ц cos р + 1 . (6.180)
При определении Q по формуле (6.156) необходимо учесть
дополнительный мертвый объем в полости сжатия
^о..= ,ZKmin- (6.181)
Из выражений (6.174) и (6.181) следует, что для схемы с
соосным расположением поршней И (Ш = 0 при £)д = DK. Отно-
сительный приведенный дополнительный мертвый объем полос-
ти сжатия адоп - KKminT0/(F0 Тсж). Приближенно
а , 1k™, £ (, . <-)|1 . ; -----„1.(6.182)
д™ I, 2 1 Окг /I (Z2 - 2 z cos |) + !)“’ 1
Значение ~а следует учесть при определении .
Для компоновочных схем с вынесенным вытеснителем (см.
рис. 6.48,6) выражения (6.166)—(6.168) справедливы, поэтому
связь между ср, z и Р также определяется уравнениями (6.170) и
(6.171). Соотношение со, z и р найдем, исходя из следующего.
При а = <р и 7К = VKmin * 0
rKmin " °-5po(1 + COS ф) + °’5 Hi 11 ‘ COS(<P ’ Р)1- (6.183)
Тогда из уравнения (6.168)
- »£х = (6.184)
Поэтому при а = 180° + ср
со' = ККтах/К0 = 0,5 (1 + z + Z2 - 2 z cos р + 1 ); (6.185)
<0 = (Истах " ^КпипЖ = Z COS Р + f (6.186)
383
или при учете диаметра штока
со = V z2 - 2 z Ц cos р + р2 . (6.187)
Сравнив уравнения (6.179), (6.180), (6.186) и (6.187), можно
убедиться, что для рассмотренных схем различия расчетных
значений со обнаруживаются только при учете р.
Относительный приведенный дополнительный мертвый объем
полости сжатия для схем с вынесенным вытеснителем [см. выра-
жения (6.175), (6.178) и (6.183)]
%.„ = + г - (6.188)
или с учетом р
«доп = °’5ро + z “)' (6.189)
Для машин с двумя рабочими поршнями все выражения
имеют самый простой вид, так как в этом случае
ф = Р и со' = о> = Z • (6.190)
Угол фазового сдвига V Д™ всех компоновочных схем машин
Стирлинга находим из условия dV^/da — 0:
tg v = ю sin ф/(1 - со coscp). (6.191)
Для удобства расчета рассмотренный материал скомпонован
в табл. 6.5.
Давление в идеализированной машине зависит от угла пово-
рота:
Р = /’max(l ‘ §)/[1 ' §cos(a ’ 0)1- (6.192)
Характер индикаторных диаграмм идеализированной машины
и эквивалентной ей по холодопроизводительности реальной ма-
шины показан на рис. 6.50. Для реальной машины индикаторные
диаграммы построены без учета гидравлических сопротивлений
(при проведении этих опытов давление индицировали в полости
сжатия). Количество (масса) рабочего тела в полостях расшире-
ния, сжатия и мертвом пространстве идеализированной машины:
А/д - р Ко(1 - cos а)/(2Я 7Д; (6.193)
Мк = pa Ко[1 - cos (а - <р)] /(R То); (6.194)
Ma=pVa/(RTcp). (6.195)
384
6.5. Значения параметров машин и формулы для их определения
Компоновочная схема И. . К. min (0 и z и =/(z, ₽) <Р = Ж Р)
Два рабочих поршня (см. рис. 6.48, а) 0 со' ~ со = z (6.190) <р = Р 0
Соосное расположение поршней Da = DK (см. рис. 6.48, в) со’ - со СО * Z (6.179) (6.180) (6.171)
Соосное расположение поршней /Л( * DK (см. рис. 6.48, в) (6.174) со' * со * z (6.182)
Вынесенный вытеснитель (см. рис. 6.48, б и г) (6.183) (6.186) (6.187) (6.188) (6.189)
Примечание. Общие данные для всех схем: Ид min = 0;
у - (6.191); 6 - (6.150); Q - (6.156).
Согласно практическим данным одноступенчатые холодиль-
ные машины Стирлинга применяют для генерации достаточно
больших количеств холода на уровне 150—70 К и до 40 К при
малой производительности. Их широко используют также для
ожижения газов. Упрощенная схема такой машины приведена
на рис. 6.51. Болес низких температур в холодильной машине
Стирлинга достигают организацией ступенчатого расширения
рабочего тела. На практике это единственно возможный метод,
поскольку КПД регенератора уже достиг реально достижимых
Рис. 6.50. Индикаторные диаграммы реальной газовой холодильной машины с
соосным вытеснителем или р = 2,55 МПа (сплошные линии) и идеализированной
машины (штриховые линии) одинаковой холодопроизводительности
25 Заказ № 1592 585
Рис. 6.51. Упрощенная схема газовой холодильной машины для ожижения воздуха,
работающей по циклу Стирлинга:
1 — рабочий («компрессорный») поршень; 2 — шатун рабочего поршня; 3 — шатун
поршня-вытеснителя; 4 — холодильник (водяной); 5 — регенератор; 6 — поршень-
вытеснитель с теплоизоляцией; 7 — нижняя часть теплообменника-охладителя для
съема полезной нагрузки (охлаждения и ожижения воздуха); 8 — верхняя часть
теплообменника-охладителя (вымораживание влаги и углекислоты из атмосферного
воздуха); 9 — баллон с гелием; 10 — электродвигатель
в 7
а)
Рис. 6.52. Схемы двухступенчатых холодильных машин Стирлинга:
а — с соосным расположением поршней; б — с вынесенным поршнем-
вытеснителем; 1 — рабочий поршень; 2 — холодильник; 3 и 5 — регенератор
первой и второй ступени; 4 и 6 — охладитель первой и второй ступени; 7 и 8 —
поршень-вытеснитель первой и второй ступени
386
успешно применяют для ожижения водорода (на уровне 20 К),
а наиболее низкая температура, достигнутая использованием
трехступенчатой машины, около 8,5 К.
Схемы ГХМ с двумя полостями расширения приведены на
рис. 6.52. Вывод уравнения (6.156) позволяет формально привести
схему двухступенчатой машины Стирлинга к схеме одноступен-
чатой. Смысл приведения заключается в том, что при вычисле-
нии безразмерного коэффициента 5 по формуле (6.151) и угла 0
по формуле (6.150) параметры т и со для двухступенчатой машины
вычисляют иначе.
Отношение температур
х=Г0/Тпр, (6.196)
где 7пр определяют из соотношения
УТпр = хх/Тх + хи/Тц, (6.197)
где 7) и Тп — температуры в полостях расширения ступени соот-
ветственно I и II; Xj и хп — доли описанных объемов полостей
расширения для ступени соответственно I и II (x'j + хп = 1).
Значения хт и хп определяют по уравнениям:
хг = = r+V; г “г- <6'198) 01 г0П *01 + *0П
Параметр Vv - Vv .
со = ; Kmax Kmin = ц) (6Д99) *01 + Гоп
вычисляют по тем же формулам, что и для одноступенчатой
схемы (см. табл. 6.5), а отношение z — по формуле
Z = V(roi+ Гоп). (6.200)
Остальные выражения не меняются. В результате холодо-
производительность по ступеням [см. уравнение (6.156)]
п = — V a sin 0_________
60 Р 01 1 + (1 - 52)0-5 ’
/-> тш — ., 6 Sin 9 ,, ~.
011 “ 60~ Р 011 ТТ(1 - 52)0,5 ; (6'201)
где К01 и Коп — в м3; ~р — в Па; Q — в Вт.
25* 387
Пример 6.10. После эскизной проработки известны следующие параметры
одноступенчатой машины с соосным вытеснителем: И(1 = 100 см’; р = 70';
" = 2.5; ц = 0,97; ~а ъ = 2; ртах = 3.9226 МПа; п = 1500 мин’1. Выполнить
проверочный расчет.
Предположив, что машиной достигается заданный уровень температуры
охлаждения (например, Т = 80 К), найдем остальные параметры.
1. По формуле (6.196) параметр т = 300/80 = 3.75.
2. Согласно уравнению (6.180)
ш = V 2,52 0,972 - 2 • 2,5 • 0,97 • 0,342 + 1 = 2,28.
3. Согласно уравнению (6.171)
tg <р = 2,5 • 0,94/(2,5 • 0,342 - 0,97) = - 20,428.
откуда ф = 98° 48’.
4. Согласно уравнению (6.150)
tg 0 = 2.28-0,998/(3,75 - 2,28 • 0,0488) = 0,626,
откуда 0 = 32°.
5. Согласно уравнению (6.151)
5 = (3,752 - 2-3,75-2,28-0,0488 + 2,28)°'5/(3,75 + 2,28 + 2 • 2) = 0,429.
6, Из уравнения (6.155)
__ /1- 0 42Q
Р = РЮах Id - 5)/(1 + 8)]0’5 = 3,922 = 2,46 МПа.
7. Согласно уравнению (6.154)
о = (1 + 0,429)/(1 - 0,429) = 2,5.
8. Холодопроизводительность идеальной машины Стирлинга [уравнение (6.156)]
= 3,14 • 1500 ' 1()6 . 1()о, 10.6 0,429-0,53 = 232Q Вт
60 1 + (1 - 0,4292)0,5
9. Согласно уравнению (6.157)
= 3,14- 1500 . 1Q6. ]оо _ 10.6.2 0,429-0,873 = 8720 Вт
'9° 60 1 + (1 - 0,4292)0,5
10. Согласно уравнению (6.158)
Nm = 8720 - 2320 = 6400 Вт.
11. Для реальной машины при той же затрате мощности (6400 Вт) и
относительном КПД г|отн = 0,3 уравнению (6.160)
бд = 2320 • 0,3 = 695 Вт и QH 0 = 6400 + 695 = 7095 Вт.
12. Холодильный коэффициент
ед = 695/6400 = 0,1086.
Затем проводят графический анализ работы машины, вклю-
чающий построение кривых изменения давлений, объемов и масс
388
рабочего тела. Такой анализ возволяст судить о средних скорос-
тях рабочего тела в различных сечениях, знание которых необхо-
димо при расчете процессов теплообмена.
Цикл Гиффорда—Мак-Магона. В 1959 г. Гиффорд и Мак-
Магон предложили оригинальную охлаждающую систему с не-
равновесным расширением рабочего тела и передачей энергии
в форме теплоты в окружающую среду (рис. 6.53). Позже
разработаны подобные системы с двух- и трехступенчатым рас-
ширением. В 1960 г. Гиффорд построил несколько измененную
машину с газовым приводом поршня-вытеснителя. Такие маши-
ны проще, чем машины Стирлинга, но термодинамически менее
эффективны, так как холодопроизводящим процессом является
процесс выхлопа. Криогснсратор типа Гиффорда—Мак-Магона
работает следующим образом. После открытия впускного клапана
рабочее тело с температурой Го заполняет теплую полость А
цилиндра 4, происходит впуск, и температура газа в теплой
полости цилиндра повышается в общем случае от Тн до Тк
(процесс Г-2' — рис. 6.53, в). Согласно выражению (4.58)
Рис. 6.53. Криогснсратор Гиффорда—Мак-Магоиа:
а — схема; б, в — диаграммы р—v и Т— s ,1,2 — ресиверы; 3 — регенератор;
4 — рабочий цилиндр с вытеснителем; 5 — компрессор; 6 и 7 — клапаны
соответственно впускной и выпускной; А и Б — соответственно теплая и холодная
Полости цилиндра
389
Затем при открытом впускном клапане поршень-вытеснитель
поднимается, и газ перемещается в холодную полость Б цилинд-
ра 4, где температура близка к Т (процесс 2'-4'). Одновременно
в связи с тем, что в регенераторе газ охлаждается и его объем
уменьшается, через впускной клапан в регенератор поступает
дополнительное количество газа
\G~ ^(l/T- l/TJ/T?, (6.203)
где 7ц — объем цилиндра 4.
Очевидно, что температура газа на входе в регенератор (точка
3') является температурой смешения потока от компрессора (АС?)
с температурой То и потока из теплой полости цилиндра с темпе-
ратурой Тн (процесс 2'-3'~).
Когда вытеснитель достигает верхней мертвой точки, впуск-
ной клапан закрывается, и вслед за этим открывается выпускной
клапан. Происходит выхлоп — очень быстрое расширение газа
в процессе свободного выпуска из цилиндра, и температура газа
падает (процесс 4'-5'~). Затем при открытом выпускном клапане
поршень-вытеснитель опускается, и газ из холодной полости ци-
линдра проталкивается через регенератор (процесс б'-Г). К хо-
лодной полости цилиндра или регенератора подводится теплота
q (полезная холодопроизводительность). Выходя на теплой сторо-
не из регенератора, газ частично направляется в компрессор и
там сжимается; другая часть газа заполняет теплую полость А
цилиндра 4. Когда поршень-вытеснитель достигает нижней мерт-
вой точки, выпускной клапан 7 закрывается, вслед за этим снова
открывается впускной клапан 6, и цикл повторяется.
При условии полной регенерации теплоты и адиабатичности
стенок цилиндра, теплота, выделившаяся при впуске (сжатие
остаточного газа) в теплой полости цилиндра и переданая затем
регенератору, полностью выносится из регенератора обратным
потоком и должна быть в конечном итоге передана в окру-
жающую среду. Очевидно, что вытеснитель теоретически (при
отсутствии гидравлических сопротивлений в регенераторе) не
совершает работы, подобная система может производить холод
только в случае, если средняя температура обратного потока на
теплой стороне регенератора (точка 7') выше То, что и соответ-
ствует действительности (см. рис. 6.53).
Кривошипно-шатунный механизм вытеснителя можно заме-
нить пневмоприводом, принцип действия которого показан на
рис. 6.54. Вращающейся равномерно золотник 7 открывает
вначале доступ сжатому газу в полость /1, и вытеснитель опус-
390
рис. 6.54. Схемы одно- (о) и
двухступенчатой (б) машины
Гиффорда—Мак-Магона с
золотниковым газораспреде-
лителем:
I — вращающийся золотник;
2 и 3 — регенератор соответ-
ственно первой и второй
ступени; А — рабочая по-
лость пневмопривода вытес-
нителя; Б — теплая полость
цилиндров; В и Г — холод-
ная полость соответственно
первой и второй ступени
кается. Затем открывается отверстие, сдвинутое на 90°, через
которое газ поступает в теплую полость Б цилиндра. Через неко-
торое время полость А сообщается с полостью низкого давления,
и вытеснитель снова поднимается; затем открывается отверстие
для выхода газа из холодной полости В через регенератор, и
происходит процесс свободного выпуска газа.
Для определения холодильного коэффициента е = Q/z необхо-
димо учитывать, что одна часть рабочего тела сжимается в ком-
прессоре, а другая его часть — в теплой части цилиндра в про-
цессе впуска, т.е. адиабатно неравновесно. Допустив, что началь-
ная температура газа в теплой части цилиндра близка к То.найдем
£= T(Pl/p2- 1)
•То А /А” т)111 (А / А )
Например, если Т = 100 К и То = 300 К, то ес = Т/(Т0 - Т) =
= 0,5. Подсчитав £ и Г] = е/ес при разных степенях сжатия
(расширения) pjpv получим:
PjP:1,2 2
е.......0,418 0,288
П.......0,839 0,576
3 4 5
0,277 0,196 0,177
0,454 0,392 0,354
8 10 50
0,147 0,134 0,08636
0,294 0,268 0,167
Отсюда видно, что с увеличением степени расширения холо-
дильный коэффициент и степень термодинамического совер-
шенства машины Гиффорда—Мак-Магона уменьшаются. При
Р\/р2 ~ 2 идеальная машина Гиффорда примерно в 2 раза менее
эффективна идеальной машины Карно.
391
При практических расчетах удельную холодопроизводитель-
ность идеальной машины за цикл и в единицу времени можно
определить по формулам:
q = GRT[\ - = 1), (pj - д2); Q=~-(pi-p2), (6.205)
где Ио — объем холодной полости, м3; рх и р2 — давление, Па;
и — в мин-1; q — в Дж; Q — в Вт.
Холодопроизводительность реальной машины меньше вслед-
ствие потерь от гидравлических сопротивлений, недорекупера-
ции, теплопритоков и переноса теплоты вытеснителем.
Экспериментально установлено, что одноступенчатый холо-
дильный цикл Гиффорда—Мак-Магона можно применять для
генерации небольших количеств холода на уровне до 35 К, а
двухступенчатый — на уровне до 7 К. В двухступенчатой машине
наиболее низкая достигнутая температура 6,7 К. Достижение в
двухступенчатой машине Гиффорда—Мак-Магона более низкой
температуры, чем в трехступенчатой машине Стирлинга, подчер-
кивает важные особенности этих машин. Если в термодинами-
чески менее совершенной машине Гиффорда можно практически
легко реализовать сравнительно высокие степени расширения
(например, 3—5), то в машине Стирлинга степень расширения
(сжатия) зависит от целого ряда параметров [см. формулы (6.154)
и (6.151)] и ее повышение связано с большими конструктивными
и технологическими трудностями.
Криогенератор Гиффорда—Мак-Магона применяют для ох-
лаждения и термостатирования, а также для ожижения газов при
очень малой производительности. Реальные конструкции таких
машин отличаются высокой надежностью благодаря исключи-
тельной простоте конструкции.
Пульсационные криогенераторы. Для создания охлаждающего
устройства (криогенератора) необходимо найти способ передачи
части энергии рабочего газа в окружающую среду в форме работы
или теплоты. Так, в циклах Клода, Стирлинга и Капицы энергия
рабочего тела уменьшается при совершении работы. В циклах
Линде, цикле с вихревой трубой и цикле Гиффорда—Мак-
Магона часть энергии рабочего тела передается в окружающую
среду в виде теплоты. В 1964 г. Гиффорду и Лангеворту удалось
построить оригинальное охлаждающее устройство без вытесни-
теля, в котором, как и в машине Гиффорда—Мак-Магона, часть
энергии рабочего тела передается в окружающую среду в вид6
теплоты. В 1964 г. Гиффорду и Лонгсворту удалось построить
392
pgc. 6-55. Схема одноступенча-
той пульсационной трубы и гра-
фики распределения температур
газа по ее длине (Тст — темпе-
ратура стенок трубы)
оригинальное охлаждаю-
щее устройство без вытес-
нителя, в котором, как и
в машине Гиффорда —
Мак-Магона использован
процесс выхлопа и оказа-
лась возможной передача
энергии в виде теплоты в
окружающую среду непо-
средственно во время впуска газа. Авторы изобретения назвали
это устройство пульсационной трубой (рис. 6.55).
В основе принципа действия пульсационой трубы лежит
физическое явление возникновения градиента температур при
впуске и выпуске газа (см. § 4.5). После открытия впускного
клапана 1 газ поступает в регенератор 5, где охлаждается, а затем
входит в теплообменник 4 и в свободное рабочее пространство
А с герметично закрытым дальним концом, где расположен
водяной холодильник 5. В процессе заполнения газ сжимается
неравномерно. Более высокие давления, а следовательно, и
температуры наблюдаются у закрытого конца трубы, вблизи
холодильника 5. Градиент температур тем более отчетливо
выражен, чем меньше турбулентность в свободном пространстве
трубы и чем меньше теплопритоки в этот период. После
окончания наполнения необходима небольшая пауза для того,
чтобы теплота могла быть передана воде в холодильнике 5. Вслед
за этим открывается выпускной клапан 2 и осуществляется
свободный выпуск газа; при этом его температура снижается.
Так как часть энергии газа в виде теплоты Q[{ 0 передана в
Окружающую среду, появляется возможность ввести в систему
некоторое количество теплоты Q в виде полезной холодо-
производительности:
Q = бн2о - G (/вх - /вых) - 0С , (6.206)
Тде <2С — теплоприток из окружающей среды.
Механизм переноса теплоты вдоль рабочего пространства
трубы в направлении от холодного к теплому концу рассмотрен
в работах акад. Б.П. Константинова и проф. У. Гиффорда. Рас-
393
смотрим на рис. 6.55 элемент газа \т на расстоянии х, от начала
отсчета. Перед началом впуска температура газа близка к
температуре стенки (точка а на диаграмме -- рис. 6.55). В про-
цессе впуска элемент газа сжимается и перемещается вправо к
теплому концу рабочего пространства трубы. Процесс впуска
протекает быстро, поэтому, оказавшись на расстоянии от начала
отсчета, элемент газа будет иметь более высокую температуру
(точка б) по сравнению с температурой стенки Т^.. В течение
последующей паузы элемент охлаждается, отдавая теплоту
стенкам, примерно до температуры точки в. Во время выхлопа
элемент газа расширяется и перемещается влево, в перво-
начальное положение. При этом его температура становится
ниже температуры стенок (точка г). Снова следует небольшая
пауза, и газ нагревается, отнимая теплоту от стенок и нагреваясь
до температуры, примерно равной температуре в точке а.
Очевидно, что с каждым элементом газа в рабочем пространстве
А происходят подобные изменения. В результате таких взаимо-
действий газа со стенками вдоль трубы осуществляется перенос
теплоты в направлении к теплому концу,где расположен холо-
дильник 5.
Рабочий процесс в пульсационной трубе типично нестаци-
онарный, а при использовании клапанов для впуска и выпуска
дополнительно проявляется существенная неравновесность. В
связи с этим каждая конкретная конструктивная разновидность
подобного устройства может иметь индивидуальные характерис-
тики, оптимальные геометрические формы и размеры. Можно
охарактеризовать качественное влияние ряда показателей. Повы-
шение давления газа способствует увеличению холодопроизво-
дительности, так как с ростом давления увеличивается объемная
теплоемкость, но при этом усиливается теплообмен в процессах
впуска, что отрицательно сказывается на работе трубы. Диаметр
и длина трубы также должны иметь оптимальные значения.
Большие диаметры облегчают развитие турбулентных течений в
трубе, а при малых диаметрах мала поверхность теплообмена.
С увеличением длины трубы уменьшается тепловой поток по
стенкам от теплой стороны к холодной; это сказывается положи-
тельно. Однако при большой длине (и одинаковой частоте
пульсаций) скорость в осевом направлении больше, что способст-
вует развитию турбулентности. Наконец, и продолжительность
цикла (частота пульсаций) влияет на характеристики трубы. С
увеличением числа циклов возрастает холодопроизводительность,
однако при этом должны быть достаточными по продолжи-
394
тельности паузы между впуском и выпуском для обмена теплотой
газа со стенками. В связи с этим и частота пульсаций, несомнен-
но, имеет оптимальные значения.
По степени термодинамического совершенства пульсационная
труба практически уступает машине Гиффорда—Мак-Магона с
вытеснителем, поскольку в ней не удается полностью избежать
турбулентных потоков и теплообмена со стенками во время
процессов впуска и выпуска, а эти явления существенно ухуд-
шают работу такого криогенератора. Например, в первых конст-
рукциях одноступенчатой трубы диаметром около 19 мм и дли-
ной 150 мм с гелием в качестве рабочего газа при частоте 42
цикла в минуту, степени расширения около 2 и давлении на
входе порядка 2 МПа достигнута температура около 180 К. В
двухступенчатой трубе (рис. 6.56) удалось понизить температуру
до 140 К, в трехступенчатой — приблизились к 100 К.
В усовершенствованном варианте пульсационной трубы с
дополнительным ресиверным объемом и дюзой, разработанном
в МГТУ им.Н.Э.Баумана (рис. 6.57, а) достигнута минимальная
температура около 100 К при расширении воздуха (ръх/ръъа ~ 5)
в одной ступени. При истечении через дюзу 5 в реверсивный
объем Б газ совершает дополнительную работу, которая транс-
формируется в теплоту и отводится в холодильнике. Известно
предложение о замене в цикле
пульсационной трубы процессов
впуска и выпуска процессами
сжатия и расширения, для чего
теплый конец регенератора
соединяют непосредственно с
поршнем. Впускной и выпуск-
ной клапаны при этом не нуж-
ны. Такая система теоретически
д
7
Несомненно выгоднее, так как
энергия, выделяемая при рас-
ширении газа, возвращается
₽ис. 6.56. Схема двухступенчатой пульсационной
трубы:
1 — компрессор; 2 и 3 — впускной и выпускной
Клапаны; 4 и 5 — регенератор соответственно
первой и второй ступени; 6 — охладитель второй
ступени; 7 — теплообменник — охладитель
Первой ступени (холодильник второй ступени);
— холодильник первой ступени
395
Рис. 6.57. Схемы усовершенство-
ванных конструкций пульсационной
трубы:
а — с клапанами; б — с присоеди-
ненным поршнем; 1 и 2 — впуск-
ной и выпускной клапаны; J —
регенератор; 4 — теплообменник-
охладитель; 5 — дюза (дроссельное
отверстие); 6 — холодильник; 7 —
концевой холодильник; 8 — комп-
рессор-детандер; А — рабочее про-
странство грубы; Б — ресиверный
объем
поршню. В усовершенствованном варианте подобного устройства
с дополнительным ресиверным объемом (рис. 6.57, б) при работе
на гелии достигнута температура около 60 К при частоте циклов
15—30 Гц и степени расширения примерно 2. Повышение эффек-
тивности пульсационных труб открывает широкие возможности
для их практического использования.
ВНИИгазпром и зарубежными фирмами разработаны так
называемые пульсационные охладители газа (ПОГ). Их основное
отличие от рассмотренных конструкций пульсационных труб
заключается в большой длине рецепторов — приемных труб, в
которые (периодически вращающимся газораспределительным
устройством) подается расширяющийся газ (рис. 6.58, а). В
рецепторах нет регенераторов, и энергия газа в них трансформи-
руется в теплоту и отводится во вне. При диаметре рецептора
14 мм, длине 2260 мм и частоте циклов 40—280 Гц максимальные
значения адиабатного КПД достигают 60% при температуре
воздуха Твх » 300 К и 2,5 < рвх/рвых < 4.
Рис. 6.58. Схемы пульсацион-
ных охладителей газа:
а — с длинными рецептора-
ми и механическим газорас-
пределением: б — замкнутого
типа со «стоячей» волной;
1 — рецепторы; 2 — уплотне-
ние; 3 — вращающийся зо-
лотник (газораспределитель);
4 — электро или газовый
привод; 5 — волновод-резо-
натор; б — колеблющаяся
мембрана; 7 — электропри-
вод; 8 — плоскопараллельная
насадка; А — ресиверный
объем
396
В 1983 г. опубликованы результаты испытаний так называемой
акустической тепловой машины со стоячей волной, работающей
в режиме генератора холода (рис. 6.58, б). Пульсационное
устройство Уитли—Свифта—Миглиори является замкнутым и
включает U-образный полый резонатор, в конце которого распо-
ложена насадка (из пластин) высотой около 150 мм с расстоя-
нием между пластинами примерно 1 мм. Длина резонатора около
1/4 длины волны основной гармоники. Акустическая стоячая
волна создается колеблющейся с частотой 300-400 Гц мембраной.
При работе такого пульсационного криогенератора дальний от
мембраны конец насадки разогревается, ближний — охлаждается.
Цикл Вюлемье—Такониса. В последнее время все больший
интерес вызывают холодильные машины, работающие по циклам
без затрат внешней работы с использованием трех резервуаров
теплоты на различных температурных уровнях.
Термодинамический анализ подобной идеально работающей
системы сводится к следующему (рис. 6.59). Представим
механически замкнутую систему, состоящую из холодильной
машины и двигателя, причем последний развивает мощность,
необходимую холодильной машине. Для такой системы
/ = <7о - <7ДВ; ? = I = q,(T0 - То’)/То; q = /77(Г0- - Т);
% = <7дв + <?х = <7о + (6-207)
Рис. 6.59. Схема идеальной холодильной системы, работающей между тремя
источниками теплоты с постоянной температурой:
7 — термостатируемое тело; 2 — источник теплоты с промежуточной температурой;
3 — источник теплоты с наивысшей температурой: 4 — идеальный двигатель
Карно; 5 — идеальная холодильная машина Карно
397
Отсюда
Т(Т0 + То’)
т - т)
T(TQ - TQ')
ТО\ТО-Т) ’
m - т)
W - Т)
(6.208)
(6.209)
(6.210)
Выражения (6.208)—(6.210) определяют наилучшие теорети-
чески возможные соотношения между количествами переданной
и отданной теплоты («холода»). Для иллюстрации приведем зна-
чения этих отношений, вычисленные при То = 300 К, То' = 77 К
и разных температурах Т:
г, к 40 зо (9/?о)юах 0,805 0,476 (9/9о)юах °Л46 0,322 1,8 1,476 ес=7/(70-Г) 0,154 0,111 20 10 0,261 0,111 0,207 0,1 1,26 1,11 0,0715 0,0345
Организация такого цикла требовала создания машины, в
которой вся совокупность процессов осуществляется за один
цикл. Принцип ее работы сводится к следующему (рис. 6.60). В
цилиндрах различных диаметров расположены вытеснители.
Рабочий объем машины постоянный (с точностью до ц). Давле-
ние в цикле меняется за счет теплообмена с источниками теп-
лоты.
В фазе I-II при неподвижном холодном вытеснителе рабочее
тело проталкивается через регенератор из промежуточного
объема Упр в теплый объем V. В результате подвода теплоты к
газу давление увеличивается (линия ав). В фазе при
неподвижном теплом вытеснителе рабочее тело проталкивается
через регенератор холодного цилиндра из объема И в холодный
объем Ко. Одновременно сообщается теплота Q (полезная
нагрузка), однако суммарный эффект от подвода теплоты Q и
отвода теплоты Q в регенераторе приводит к уменьшению
давления (линия ос). В фазе III-IV происходит аналогичный
процесс переталкивания рабочего тела из теплого объема V в
промежуточный И при неподвижном холодном вытеснителе,
398
Рис. 6.60. Схема действия холодильной машины Вюлемье—Такониса с двумя
вытеснителями и диаграммы рабочего процесса:
1 и 4 — теплый и холодный цилиндры; 2 и 3 — теплый и холодный вытеснители;
5 — охладитель (температура Т); 6 и 8 — регенераторы холодного и теплого
цилиндров; 7 — промежуточный теплообменник; 9— теплообменник
сопровождающийся уменьшением давления (линия cd). В заклю-
чительной фазе IV-I рабочее тело из холодного объема пере-
талкивается в полость 1^ при некотором повышении давления
(линия da).
Практически, как и цикл Стирлинга, эту последовательную
совокупность процессов можно реализовать в машине с гармони-
ческим движением поршней, причем для идеализированной ма-
шины гармоническое движение поршней не должно приводить
к дополнительной необратимости.
Холодопроизводительность такой машины, Вт
Q = si"P / д + ь + е\
60 с 2 + d2 - 1с d cos Р ' V (a+b+e)2-c 2-d2-1 с cos р 2
х [а + b + е + с cos 0 - d cos (9 - Р)| . (6.211)
Количество теплоты, передаваемой в теплый объем V, Вт:
0 = — Kc;?niaxsinP Л а + b + е \
60 с 2+d 2-1 с d sin р ' у!(а+Ь+е)2-с 2-d 2-1 с d cos Р '
х [а + b + е + с cos 0 - d cos (9 - Р)| . (6.212)
399
Количество теплоты, отводимой из промежуточного объема I :
Qo'= Q + Со-
В этих выражениях: Ио К / Т \ а = — 11 + I ; 2Т \ То' I и К — в м3; о в Па; п — в мин"1 Vi Та \ Ь = 1 + -А- ; 2Т0 1 Го’ >
V , Т ; V ! Тп \
с = 1 ; 2Т \ Т’ т0 и1 и11 е = Р’х + р-х 1 ср J ср d= - 1 ; 2Т \ 7” / Z70 "'О (6.213)
здесь и ИрХ — свободные объемы регенераторов и тепло-
обменников (по полостям); и — средние температуры
рабочего тела в регенераторах и теплообменниках;
ртах = <TR [а + Ь + е + с cos 0 - d cos (0 - Р)]’1; (6.214)
а + b + е - с cos 0 + d cos (0 - В)
о = = 1 — (6.215)
Лит a+b+e+c cos 0 - d cos (0 - Р)
tg В = d sin P/(d cos p - c). (6.216)
Как и любую ГХМ, криогенсратор Вюлемье—Такониса можно
выполнить многоступенчатым (рис. 6.61). Наивысшая темпера-
тура цикла (То) в зависимости от типа источника теплоты может
изменяться в широком диапазоне значений, например, от 500
до 1200 К. Практически в таких
машинах наиболее сложной пробле-
мой является повышение степени
сжатия, поэтому даже в лучших
образцах криогенераторов Вюлемье—
Такониса наинизшие достигнутые
температуры охлаждения 15—30 К.
Рис. 6.61. Схема машины Вюлемье
Такониса с тремя вытеснителями:
1, 2, 3 — соответственно «горячий-
промежуточный и «холодный» вытес-
нитель; 4, 5, 6 — регенератор соответ-
ственно холодной, промежуточной и
горячей ступени; 7. л. 9 — теплообмен-
ники
Глава 7
разделение газовых смесей, адсорбция и
ТЕПЛООБМЕН ПРИ НИЗКИХ ТЕМПЕРАТУРАХ
§ 7.1. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ЗАВИСИМОСТИ
ПРИ РАСЧЕТЕ ПРОЦЕССА РАЗДЕЛЕНИЯ
Общие положения. Известны многие способы разделения
смесей на составные части: кипение, конденсация, дефлегмация,
ректификация, адсорбция, с помощью полупроницаемых
перегородок и др. В низкотемпературных установках наиболее
часто применяют процессы ректификации и адсобрции.
Сырьем в газоразделительных установках служат различные
газовые смеси, такие, как воздух, природных газ, нефтяной газ,
газ синтеза аммиака и др. Большая часть смесей содержит много
компонентов (так, воздух представляет собой смесь газов — см.
табл. 3.6), но для упрощения расчета разделительных аппаратов
многокомпонентные смеси иногда рассматривают как более
простые системы, состоящие из двух, трех или четырех
компонентов. Так, основными компонентами воздуха являются
азот и кислород, поэтому в ряде случаев воздух условно
рассматривают как бинарную смесь, состоящую из 20,9 % О2 и
79,1 % N2, относя к последнему аргон. При точных расчетах
разделительных аппаратов и, конечно, при получении из воздуха
аргона, азота и кислорода воздух рассматривают как тройную
систему О2—Аг—N?; это тем более необходимо, что в отдельных
сечениях аппарата молярная доля аргона в смеси может достигать
15—18 %. При расчете аппаратов для получения криптонового
концентрата разделяемую смесь обычно рассматривают как
бинарную, состоящую из кислорода и криптона, условно относя
К последнему ксенон. Можно привести и другие примеры.
Состав смеси выражают в молярных долях компонентов,
которые определяют по формуле (5.20). Для бинарной смеси
Достаточно указать молярную долю одного компонента; моляр-
ную долю второго компонента можно рассчитать используя ра-
венство (5.21). При этом компонент с более высокой темпера-
турой кипения называют высококипяшим, второй компонент —
Низкокипящим. Содержание низкокипящего компонента в жид-
кой и паровой фазах обозначим х и у соответственно. При
26 Заказ № 1592 401
составлении уравнений материальных балансов аппаратов
низкокипящему компоненту все члены, соответствующие моля
ним потокам, следует умножать на молярную долю низкокипя
щего компонента в смеси (аналогичному правилу необходим
следовать и для высококипящего компонента).
Рассмотрим термодинамические основы процесса разделен
бинарных смесей, равновесные параметры состояния парово
и жидкой фаз, методы расчета процессов кипения, конденсац
и ректификации бинарных смесей и воздуха. Низкотемперату ,
ные методы разделения смесей широко применяют в промыш
ленности, так как во многих случаях они экономичнее др
способов. При этом газовую смесь следует предварительн
охладить, а в ряде случаев частично или полностью ожижи
Процессы собрции и их применение для очистки и разделен
газовых смесей рассмотрены в § 7.10, способы разделены
газовых смесей с использованием мембранной технологии, в то
числе на твердых электролитах в § § 7.11 и 7.12. ,
Условия фазового равновесия. Движущая сила процесс
разделения смеси. Рассмотрим систему, состоящую из парово
и жидкой фаз. Для описания термодинамических свойств каждо
фазы обычно используют две переменные из характеристик
р, Т, и, i, s и массу (или количество) вещества в каждой фазе. ’
Термодинамические функции U, I, F, Ф являются аддитивн
ми, т.е. их значения пропорциональны массе системы. Рассмо
рим в качестве примера внутреннюю энергию системы U = и
где и — удельная (отнесенная к массе или количеству вещества
внутренняя энергия; М — масса (количество) вещества.
С учетом выражения (2.58) можно записать *
dU — udM + Mdu = udM + M (Tds - pdv), (7.
а также dS = sdM + Mds; dV= vdM + Mdv или Mds = dS - sdf£.
Mdv=dV-vdM. .
Подставив два последних выражения в уравнение (7.1) !-Й-
сгруппировав члены с дифференциалом dM, получим 4
dU = TdS - pdV + (и - Ts + pv) dM; (7.2)^
здесь выражение в скобках представляет собой производнуЮ
(dU/dM)s v; кроме того, Т= (dU/dS)v м; -р= QUfoV)s м. *
Аналогичные выкладки можно привести для любого из терм х
динамических потенциалов. Так как установившиеся процесс
в разделительных аппаратах обычно происходят при постоянной
давлении, то для характеристики процессов часто используюф
402 2'
г
термодинамический потенциал Гиббса Ф = М<р(р, Т) — см.
гл. 2. Дифференциал
t/Ф = (ЭФ/ЭТ)А м dT + (ЭФ/Эр)г м dp + (ЭФ/ЭЛ/)Г р dM.
С учетом значений частных производных можно записать
б/Ф = - SdT + Vdp + (ЭФ/ЭЛ/)7 р dM. Производная (ЭФ/ЭЛ/)т р
характеризует изменение термодинамического потенциала Гиббса
рассматриваемой фазы системы вследствие изменения массы
(количества) вещества М при неизменных параметрах /? и Т. Эта
величина названа химическим потенциалом р. Частные произ-
водные других термодинамических потенциалов по массе (коли-
честву) вещества при постоянных значениях соответствующих
независимых переменных также определяют химический потен-
циал; например, (ЭГ//ЭЛ/ )Л v= р. С учетом изложенного уравне-
ние (7.2) можно записать так:
dU = TdS-р dV+ р dM.
Каждую фазу бинарной системы можно описать уравнением
2
dU = TdS-pdV+YVidMi, (7.3)
j=i
где pj и ц2 — химические потенциалы первого и второго
компонентов, составляющих систему:
Pi = (dU/dM^s v> р2 = (dU/dM2)Sr v м^;
Т= QU/ZS)V> Му Мг- -р = Му Мг.
Рассмотрим двухфазную бинарную систему; при этом примем,
что в совокупности обе фазы представляют собой изолированную
систему. Для каждой фазы системы согласно зависимости (7.3)
можно записать
2
dS' = dU'/Т’ + (р /Т ')dV' - Е (р;./Т ’) dM \;
г-i
2
dS" = dU"/Т" + (р"/Т ")dV " - Z (р,;/7’") dM ,
/-1
где величины, помеченные одним штрихом, относятся к жидкой
фазе, двумя — к паровой.
Энтропия изолированной системы в состоянии равновесия
максимальна; дифференциал энтропии
dS = dS' + dS" = 0. (7.4)
26*
403
Кроме того, для изолированной системы должны выполняться *
равенства: >;
dU' + dU7= 0; dV' + dV"= 0; dM't + dM = 0. (7.5) J.
После суммирования дифференциалов dS' и dS” с учетом ’
равенств (7.5) для всей гетерогенной системы в состоянии ;
фазового равновесия получим [6]
(l/T’-1/T”)dU’ +(P/T'-p7T")dV'-Yt(ii'i/T’-VL"./тn}dM\= 0.5I
l~ 1 J’ :
c7-6) । ;
Условие (7.6) для равновесной системы, состоящей из паровой ’
и жидкой фаз, выполняется, если ।
Т'=Т"- р'=р"- ц’2 = ц"2 (7.7)1
(влияние капиллярных эффектов не учитывается).
Это означает, что в рассматриваемой системе фазовое >
равновесие характеризуется равенствами температур и давлений (
фаз, а также химических потенциалов каждого компонента в > :
соответствующих фазах системы.
В общем случае химический потенциал зависит от темпера-
туры, давления и состава фазы и для одного компонента в раз- $
личных фазах описывается различными функциями состава, тем-
пературы и давления
(Л = И’,- р', хр х2, ..., хр ..., хп_у, (7.8)
g"i = И"/ <Т", р", хр х2, ..., Х[, ..., хп_г), (7.9)
где п — число компонентов; хР у;. — молярные доли /-го
компонента соответственно в жидкой и паровой фазах. •
В соответствии с правилом фаз Гиббса [см. формулу (3.3) и >
§ 3.2] при фазовом равновесии в термодинамической гетероген-
ной системе (на которую влияют только такие внешние факторы,
как температура и давление) число термодинамических степеней
свободы равно 2, если число компонентов п ~ 2 и число фаз
/ф = 2. Следовательно, равновесие бинарной двухфазной системы
является бивариантным: только два параметра состояния можно
выбрать произвольно, значения остальных параметров являются
при этом функционально определенными.
При контакте неравновесных фаз пар — жидкость протекает
процесс массопередачи и происходит перераспределение компо- ;
404 •
нентов между фазами. Если значения химического потенциала
каждого компонента в паровой и жидкой фазах различны, возни-
кает возможность макроскопического перехода этих компонентов
через границу раздела фаз. Таким образом, химический потен-
циал имеет смысл обобщенной силы и определяет возможность
перехода вещества из одной фазы в другую [48]. Процесс идет
в направлении установления равновесия в обеих фазах согласно
равенствам (7.7). Разность химических потенциалов является
движущей силой процесса массопередачи. Удельный диффузион-
ный поток z-ro компонента, перешедшего из жидкой фазы в
паровую через единицу площади поверхности контакта фаз в
единицу времени,
Л = ^-(И/- И?), (7.10)
где — коэффициент скорости массопередачи z-ro компонента.
Каждый компонент переходит из фазы с большим значением
химического потенциала в фазу, где его значение меньше. В
технических расчетах часто вместо разности химических потен-
циалов используют эквивалентные ей разности молярных долей
данного компонента в паровой и жидкой фазах, характеризую-
щие отклонение системы от состояния равновесия. Их удобнее
использовать в расчетах, так как составы фаз, наряду с темпера-
турой и давлением, можно непосредственно измерить при
экспериментальном исследовании системы и протекающих в ней
процессов. Тогда применительно к бинарной системе диффу-
зионный поток низкокипящего компонента из одной фазы в
другую через единицу поверхности в единицу времени
j= ку J = кх(х ~ хр)’ (7.11)
где ку и кх — коэффициенты массопередачи, отнесенные соответ-
ственно к паровой и жидкой фазе, молярные доли низкокипя-
щего компонента в которых соответственно равны у и х; ур —
молярная доля низкокипящего компонента в паровой фазе,
равновесной жидкости (х); хр — молярная доля низкокипящего
компонента в жидкой фазе, равновесной пару (у).
Действительные (рабочие) составы всегда отличаются от
равновесных, и разность между равновесной и рабочей моляр-
ными долями определяет движущую силу процесса массообмена
(эту разность в расчетах берут с положительным знаком). При
расчете процесса разделения смеси необходимо знать свойства
растворов, данные по фазовому равновесию растворов и
действительные составы фаз (х и у) в сечениях аппарата.
405
Равновесные составы пара и жидкости в бинарных системах.
Используя термодинамическую теорию растворов и данные о
свойствах чистых ксгмпонентов, можно рассчитать равновесные $
составы фаз идеальной системы, подчиняющейся законам Рауля
и Дальтона. Рассмотрим идеальную бинарную систему, состоя-
щую из двух фаз. Для нес, согласно закону Дальтона, парциаль-
ное давление низкокипящего компонента в паровой фазе
Л. = УР> (7-12)
где у — молярная доля низкокипящего компонента в паре; р —
давление пара.
Согласно закону Рауля парциальное давление лара, равновес-
ного жидкости,
где х — молярная доля низкокипящего компонента в жидкой
фазе; — давление пара чистого низкокипящего компонента
при температуре системы.
Аналогичные зависимости можно записать для второго
(высококипящего) компонента:
Рв= Р» = хъРо*’ (7-14)
где ув и хв — молярные доли высококипящего компонента
соответственно в парс и жидкости; рОв — давление лара чистого
высококипящего компонента при температуре системы.
Приравняем правые части выражений (7.12) и (7.13), посколь-
ку при фазовом равновесии левые части равны; тогда
У = xPoJP (7-15)
Отношение (ур /х). для /-го компонента при фазовом равнове-
сии пара и жидкости называют коэффициентом распределения
и обозначают К{. Для идеальных фаз парового и жидкого раство-
ров согласно (7.12) - (7.14) Кн = р^/р и Кв = рПв/р. Ц,пя
реальной двухфазной системы коэффициент Kj определяют с
учетом экспериментальных данных в зависимости от р и Т. Зная
значения Кв для компонентов бинарной системы, можно
вычислить равновесные составы пара и жидкости.
Определим функциональную зависимость между равновес-
ными составами у и х для идеального бинарного раствора.
Согласно выражениям (7.14) и (7.15) с учетом равенства (5.21)
можно записать р = х рОн /У = *в РОъ / Уи тогда
У Рон х
1 - у А>в
1 - X
406
Симплекс Роц/Ров называют относительной летучестью или
коэффициентом разделения и обозначают ал. Введя в последнее
выражение относительную летучесть ал, получим известную
зависимость, определяющую равновесные составы пара и
жидкости для идеального бинарного раствора;
у = ал х/ [ 1 + (а;1 - 1) х]. (7.16)
Давление р равновесного пара над идеальным раствором
зависит от состава последнего
Р» к = хр01{ + (I - х) рОъ. (7.17)
Так как р0 > р, то согласно выражению (7.15) молярная доля
низкокипящего компонента в паре больше, чем в равновесной
жидкости (у > х). Этот закон, известный в теории растворов
как первый закон Коновалова, соблюдается и для неидеальных
растворов, если раствор неазеотропный.
Для идеальной бинарной системы значение ал определяется
только давлениями паров чистых компонентов. Для реальных
бинарных систем ал зависит также от состава раствора.
Реальные системы отклоняются от закона Рауля и законов
для идеальных газов; для них характерны изменение объема
раствора при смешении и теплота смешения. Конкретный вид
зависимости между равновесными составами пара и жидкости
для реальной бинарной смеси обычно находят с учетом экспери-
ментальных значений; в общем случае се можно представить при
р = const функциональной зависимостью
УР=/(А (7-18)
Эту зависимость можно выразить в аналитической, численной
или графической форме. Первый способ выражения удобнее для
расчетов процесса с помощью ЭВМ; при ручных расчетах часто
используют последний способ, как более наглядный.
§ 7.2. ДИАГРАММЫ ДЛЯ ОПРЕДЕЛЕНИЯ РАВНОВЕСНЫХ
ПАРАМЕТРОВ СОСТОЯНИЯ ПАРОВОЙ И ЖИДКОЙ ФАЗ
Диаграмма Т—х. Наиболее типичные диаграммы Т—х для
бинарной системы при р = const приведены на рис. 3.6, г, д, е.
При этом диаграмма на рис. 3.6, г соответствует смеси двух
компонентов, критическое давление каждого из которых выше
давления р, например, для смеси О2— N2 при давлении
407
Р < ^Kp.N < Ркр.о ’ диаграмма на рис.3.6, д— к смеси, в которой
критическое давление одного компонента ниже давления р смеси
(например, для смеси N2 — Н2 при ркр > р >Гкр.н2)- Диаграмма
на рис. 3.6, е соответствует смеси с азеотропной точкой L, в
которой смесь ведет себя как чистое вещество. Здесь и далее
для упрощения записи индекс “р” в выражениях типа (7.15)—
(7.17), а также на графиках рис. 3.6, 7.1, 7.2 и др. опущен, но
при этом указано, что составы равновесны. Там, где одновремен-
но присутствуют равновесные и рабочие концентрации смеси,
индекс “р” в обозначении равновесных составов сохранен:
например, (ур - у).
Диаграмма у — х. Удобной формой представления зависи-
мости (7.18) является графическое изображение ее на плоскости
в системе координат у— х (см.рис.7.1 и 7.2), где по оси абсцисс
откладывают молярную долю х низкокипящсго (или ав высоко-
кипяшсго) компонента в жидкой фазе, а по оси ординат моляр-
ную долю у того же компонента в равновесной паровой фазе
при постоянном давлении. Температура равновесных фаз на
диаграмме у—х нс показана, ее определяют по диаграммам
Т—х (см. рис. 3.5, 3.6, 3.7, a) Tpi-x-y, Т—р—х [7, 8, 15, 17]
и другим или с помощью табулированных функций [15, 29].
На рис. 7.1 приведены экспериментальные данные по равно-
весию бинарной системы О2—N2 в координатах у—х при различ-
ных давлениях. Согласно диаграмме содержание низкокипящего
Рис. 7.1. Диаграмма у—х бинарной
системы О2- N2 (у и х — молярные доли
N2 соответственно в равновесном паре и
жидкости)
Рис. 7.2. Диаграмма у~х бинарной
системы О2— Аг (у и х — молярные
доли Аг соответственно в равновесном
паре и жидкости)
408
компонента (азота) в равновесном паре увеличивается при
понижении давления. Например, если молярная доля азота в
жидкости х = 0,2, то молярная доля азота в равновесном паре
при давлении 98,06 кПа равна у = у = 0,51, а при давлении
980,6 кПа у — ур = 0,355, т.е. в первом случае ур - х = 0,31, во
втором — ур - х = 0,155.
На рис. 7.2 изображены равновесные кривые системы
О7 — Аг 115]. Разности между равновесными долями низкокипя-
щего компонента в паре и жидкости в системе О2 — Аг меньше,
чем в системе О2 — N2, а при большом содержании аргона они
особенно малы. С уменьшением этой разности усложняется
разделение смеси и требуется большая поверхность контакта
между фазами. Если ал = 1 и ур = х (равновесная кривая на
диаграмме у—х совпадает с диагональю), то ни кипением, ни
конденсацией, ни ректификацией разделить смесь невозможно.
Диаграмма i—x. Тепловые эффекты в массообменных аппара-
тах характеризуют разностью энтальпий, если процессы происхо-
дят при постоянном давлении. На рис. 7.3 приведена диаграмма
для бинарной смеси. На диаграмме изображены изобары кипения
(кривая 7) и конденсации (кривая 2). Область, расположенная
ниже кривой кипения, характеризует жидкость, область выше
линии конденсации — пар. Для многих бинарных систем обычно
пренебрегают теплотой смешения паров, тогда изотермы на
диаграмме в области пара изображают прямыми линиями,
удовлетворяющими уравнению
4м = у к: + а - у)
где /см — энтальпия смеси; /|1" и — энтальпии пара чистых
компонентов (низкокипящего и высококипящсго) при одинако-
вых температуре и давлении; у — молярная доля низкокипящего
компонента в смеси.
В отдельных случаях пренебрегают теплотой смешения компо-
нентов в жидкой фазе; тогда изотермы в области жидкости также
являются прямыми линиями. Способ построения диаграммы
7 - х изложен в работах [10, 16]; для системы О2—N2 можно
также использовать данные табл. 7.1.
Для некоторых бинарных смесей изобары кипения и конден-
сации на диаграмме i — x представляют собой почти прямые
линии. Точки а и b (см. рис. 7.3), соответствующие равновесным
составам жидкости и пара, лежат на прямой линии ab —
изотерме влажного пара. Углы наклона изотерм к оси абсцисс
на диаграмме в области влажного пара зависят от его состава и
409
Рис. 7.3. Диаграммы i—х и Т~х бинар-
ной системы при давлении />,
I
Рис. 7.4. Диаграмма г—х бинарной
системы
давления. При р = const и среднем содержании низкокипящего
компонента в смеси угол наклона изотермы к оси абсцисс
наименьший; для чистых компонентов изотермы Тн и Гв — >'
вертикальные прямые. Отрезки гн и гв характеризуют значения :
теплоты преобразования чистых компонентов (низкокипящего ’
и высококипящего). При построении изотерм влажного пара на
диаграмме i — х используют табличные данные для соответствую-
щей бинарной системы [15, 17, 29 и др-], диаграммы Т — х, >
7.1. Значения температуры и энтальпии на кривых кипения и
конденсации диаграммы i — х системы О2 — N2 (24]
Моляр- ная доля n2 Температура, К, при р, кПа Энтальпия, Дж/моль, при р, кПа *
101,3 506,6 101,3 506,6
Жидкость Пар Жидкость Пар Жидкость Пар Жидкость Пар 1 <
0,0 90.2 90,2 108,9 108,9 419 7252 1315 7536 1
0,1 87,7 89,5 106,3 107,9 461 7231 1403 7507
0,2 85,7 88,7 104,2 106,7 519 7210 1499 7478
о,з 84,1 87,7 102,5 105,6 599 7185 1591 7448 1
0,4 82,5 86,7 100,9 104,3 682 7151 1675 7415
0,5 81,3 85,6 99,7 103,0 779 7118 1758 7377
0,6 80,4 84,3 98,5 101,5 879 7084 1851 7339
0,7 79,6 83,1 97,4 100,0 984 7042 1947 7298
0,9 78,1 79,7 95,6 96,6 1181 6933 2152 7201 1
1,0 77,4 77,4 94,2 94,2 1273 6871 2248 7147 а
410
Т — р — х или строят вспомогательную диаграмму Т— х на
диаграмме (как на рис. 7.3). В последнем случае для построения
изотермы влажного пара, например Тмх, следует на изобары
кипения и конденсации нанести точки а и Ь, абсциссы которых
равны абсциссам точек А и В, лежащих на вспомогательной
диаграмме Т—х и соответствующих температуре Тл;г На рис. 7.3
левее точки а и правее точки b штриховыми линиями показано
продолжение изотермы Тлв в областях жидкости и перегретого
пара; там же дана изотерма при Т> ТАВ.
В координатах /—х можно построить также совмещенную
диаграмму для различных давлений. Например, на рис. 7.4
приведена диаграмма i—x для давлений рх и р2. С помощью такой
диаграммы удобно рассчитывать процессы, происходящие в
ректификационных колоннах, при давлениях рх и р2 в отдельных
секциях колонны, а также процессы дросселирования. На
диаграмме показаны изотермы Т( и TD, проходящие через точки
С и D, которым соответствуют различные давления. Точка С
характеризует параметры состояния кипящей жидкости при
давлении р2; ей равновесен пар, параметры состояния которого
удовлетворяют координатам точки С"; температура пара и
жидкости равна Т(. Пусть точка D на диаграмме ix совпадает
с точкой С. Давление в точке D равно рх < р2, точка D
характеризует парожидкостную смесь с температурой TD.
Параметры состояния равновесного пара и жидкости,
образующих эту смесь, определяются координатами точек D" и
О' при давлении рх; температура в точках D" и D' равна Тп.
Изотерма Тс, соответствующая большему давлению р2, в области
влажного пара проходит круче изотермы Т& и разность ус„ - хс
меньше разности yD„ - xD, при меньшем давлении р{.
Процесс смешения. Пусть смешиваются две смеси
с количеством вещества соответственно пгх и ш2. Параметры
состояний смесей характеризуются координатами точек 7 и 2 на
диаграмме (см. рис. 7.3). Количество вновь полученной смеси и
параметры состояния определим с помощью уравнений баланса.
Запишем общее уравнение материального баланса по низко-
кипящему компоненту:
тх + т2 ~ то * (7-19)
тх Xj + т2 х2 = т0 хм, (7.20)
где ти0 — количество вновь полученной смеси; хх, х2, хм —
молярные доли низкокипящего компонента в смесях соответст-
венно тх, т2, т0.
411
Уравнение энергетического баланса для процесса смешения?
имеет вид
тх г; + т2 i2 = mQ iM, (7.21) •
ч
где iM — энтальпия смеси т0 , Дж/моль. J
Из уравнений (7.19)—(7.21) после преобразований получим |
~ (х2 ~ Хм)/(ХМ ~ Х1) — (z2 “ ZAfV(ZAf “ zl)- (7.22) t
Параметры состояния хми iM вновь образованной смеси на’
диаграмме i—х характеризуются координатами точки М, которую
согласно выражению (7.22) можно получить делением отрезка .
1—2 на части, пропорциональные отношению т2/ту
1М/ М2= т2/тг (7.23) J
X
Отсюда ясно, что любая точка N, лежащая на изотерме ab
по правилу смешения (7.23) делит прямую ah на отрезки aN и :
Nb, пропорциональные долям пара и жидкости в парожидкост- \
ной смеси. [
Процесс дросселирования. Рассмотрим '
процесс дросселирования жидкости в интервале давлений от р2 j
до рг Пусть параметры состояния жидкости до дросселирования -
удовлетворяют координатам точки С на диаграмме i—x (см. рис.
7.4). После дросселирования энтальпия и состав смеси не |
изменяются: ic = const, хс = const. Следовательно, если точка
D характеризует смесь после дросселирования до давления рх, 3
то она должна иметь те же координаты, что и точка С (т.е. точки ?
С и D на диаграмме совпадут, а температура и давление в них Й
различные). При дросселировании часть жидкости испарится, j
поэтому точка I) находится на диаграмме в области влажного t
пара. Доля образовавшегося пара равна отношению отрезков s
a = D'D/D’D". ?
Диаграмма для тройной системы О2—Ar—N2 [14, 15]. При Д
расчете воздухоразделительных аппаратов правильнее воздух Д
представлять как тройную систему О2—Ar— N2. Для обозначения |
состава смеси используют индексы I, 2 и 3 соответственно |
компонентам О2, Аг и N2, причем паровую фазу обозначают
У (Уц Уг> УЛ жидкую — х (хр х2, х3). На рис. 7.5 приведена
диаграмма равновесных составов жидкости и пара тройной
системы О2—Аг—N2 при р = 133,8 кПа в координатах у,—у2. Зная
состав жидкости, можно определить равновесный состав пара
(и наоборот) и температуру. Например, точка А соответствует
412
кипящей жидкости. Состав жидкости Xj = 80 % О2; х2 = 10 % Аг;
молярная доля азота в жидкости х3 = 100 - xt - х2 = 100 - 80 - 10 =
= 10 % N2; температура кипящей жидкости ТА ~ 90 К. Состав
равновесного пара: уг = 60 % О2; у2 = 12 % Аг и у3 = 100 -60-
-12 = 28%N2.
§ 7.3. ПРОЦЕССЫ КИПЕНИЯ, ПЕРЕГОНКИ, КОНДЕНСАЦИИ
И ДЕФЛЕГМАЦИИ БИНАРНОЙ СМЕСИ
Кипение. В процессе кипения жидкого раствора образующийся
пар можно либо оставлять в контакте с жидкостью, либо по мере
образования удалять из системы и конденсировать.
В последнем случае процесс называют периодической простой
перегонкой (иногда фракционным испарением). Рассмотрим
процесс кипения при постоянном давлении и при условии, что
образующийся пар остается в контакте с жидкостью и равновесен
ей. Пусть начальное количество жидкости равно Мо; этой
жидкости на диаграммах Тх и /—х (рис. 7.6) соответствует точка
413
Рис. 7.6. Диаграммы Т—х (а) и i—x (б) процесса кипения
А'. Состав равновесного пара определится абсциссой точки А".
Если жидкость частично выкипела, то в сосуде находятся равно-
весные пар и жидкость в количестве V и М молей. Запишем^
уравнения материальных балансов
Мо - М + Г; (7.24);
х(1 - Мх + Vy, (7.25>J
где х(), х и у — молярные доли низкокипящего компоненту
соответственно в смеси, жидкости и паре. 7
Из этих уравнений *
(х0 - х)/(у - ХО). (7.26) Г
Средний состав смеси независимо от количества пара и жиц<*.
кости в сосуде не изменится и останется равным х0. Процессу^
кипения на диаграммах Т—х и i—x соответствуют линии А' В".
Для промежуточного состояния (точка С) отрезки С'С и СС" f
пропорциональны количествам пара и жидкости согласи©
выражению (7.26). Из уравнений (7.24) и (7.25) также можно
получить -•) '
Е/Л/о = (х0 - х)/(у - х), М/М. = (у - х0)/(у - х).
При кипении жидкости ее состав непрерывно изменяется от
точки А' к точке В', а температура кипения возрастает от ТА до
414
Тв. Последние капли жидкости имеют состав хк, определяемый
точкой В'. Чистые продукты при таком процессе получить нельзя.
Простая перегонка. Рассмотрим периодический процесс, при
котором жидкий раствор в выпарной сосуд дополнительно не
поступает, а перегонке подвергается исходный раствор в
количестве Мо. При испарении раствора пар (дистиллят)
непрерывно отводится, а состав его равновесен составу жидкости
в сосуде. Пусть в момент времени т от начала процесса в сосуде
находится жидкий раствор М, молярная доля низкокипящего
компонента в нем х. Молярная доля этого же компонента в паре
при испарении dM молей жидкости [7]
ур = d(Mx)/dM = (xdM + М dx)/ dM. (7.27)
Изменение состава пара и жидкости в процессе описывается
дифференциальным уравнением
dM/M = dx/(yp - х), (7.28)
интегрированием которого получим
In (Мк /Ц) = J dx/(yv - х).
(7.29)
Здесь ур — молярная доля низкокипящего компонента в
равновесном паре; М{) — начальное количество жидкости; М* —
конечное количество жидкости; х0 и хк — молярные доли
низкокипящего компонента в жидкости соответственно Мо и Л/к.
Если значение интеграла в уравнении (7.29) определяют
графическим способом (рис. 7.7), то на диаграмме у—х строят
подынтегральную функцию
9 = (у - х)1. Отрезки между
равновесной кривой и диаго-
налью квадрата равны разности
- х (например, у0 - х0 и ук - хк);
вертикальные отрезки (Ь х0, fx,
ахк и др.) характеризуют ло-
кальные значения подынте-
гральной функции, а площадь
x^bf а хк соответствует значе-
нию интеграла, доля молярная
доля низкокипящего компо-
нента в оставшейся жидкости
равна хк.
Рис. 7.7. График к определению
интеграла в (7.29)
415
Рис. 7.8. Зависимости молярных долей N2 в жидкости и паре от количеств*
испарившейся жидкости (а) и сконденсировавшегося пара (б) ,
Перегонкой можно получить в выпарном сосуде почти чистый
высококипящий компонент, но количество его мало. На
рис. 7.8, а приведена зависимость содержания азота в паре й(
жидкости от количества испарившейся жидкости при простой '
перегонке жидкого воздуха при давлении 0,1 МПа [7]. По оси-
абсцисс отложено отношение количества испарившейся жид-
кости Мн к начальному количеству Л/о; по оси ординат —
молярные доли низкокипящего компонента в оставшейся в
сосуде жидкости и в равновесном с ней паре. j
В процессе перегонки при необходимости можно получить ,
несколько фракций дистиллята различного состава по низко- I
кипящему компоненту; для этого образовавшийся пар по мере
выкипания жидкости следует отводить в разные сосуды, предва-
рительно сконденсировав его. Перегонку с выделением отд ель- ;
ных фракций пара разного состава называют фракционной. i
Конденсация пара. Конденсация — это процесс, обратный *
кипению; он может быть организован без отвода сконденсиро-
вавшегося пара и с непрерывным отбором конденсата (фракци-
онная конденсация). В последнем варианте в паровом остатке «
можно получить в малом количестве низкокипящий компонент.
Проводя рассуждения, подобные приведенным ранее, получим
уравнение для процесса равновесной конденсации с отводом
конденсата:
У*
ln(K„/Kr) = J / (ур - у), (7.30)
J'o
где Vq — начальное количество пара; V* — количество оставше-
гося в сосуде пара; >'о и ук — молярная доля низкокипящего
компонента в паре соответственно и К.
На рис. 7.8, б показано изменение содержания азота при
равновесной конденсации воздуха с отбором конденсата при
давлении 0,1 МПа. По оси абсцисс отложено отношение коли-
чества сконденсировавшегося пара V* к начальному количеству
пара Ко [7].
При фракционной конденсации выход низкотемпературного
компонента мал; однако некоторые смеси с резко различными
критическими температурами компонентов и малым содержа-
нием одного из них (например, азотно-гелиевые и ей подобные
смеси) могут быть разделены достаточно эффективно.
Дефлегмация. Дефлегмация представляет собой сложный
процесс фракционной конденсации с отводом теплоты, сопро-
вождающийся массообменом между неравновесными паром и
жидкостью, движущимися в одном и том же объеме аппарата.
Схема движения потоков зависит от типа конструкции аппарата,
который называют дефлегматором (иногда конденсатором-
дефлегматором). Процесс может быть использован в установках
для предварительного разделения воздуха и в других системах.
На рис. 7.9 показан трубчатый дефлегматор с противоточной
схемой движения жидкости и пара. Паровая смесь М при
температуре конденсации поступает в
трубки, которые охлаждаются хладаген-
том L, подаваемым в межтрубное про-
странство. Пар G, поднимаясь по труб-
кам, частично конденсируется, образо-
вавшаяся жидкость g стекает вниз на-
встречу пару. Эта жидкость по условию
фазового равновесия содержит больше
высококипящего компонента, чем пар,
поэтому пар, поднимаясь вверх, обога-
щается низкокипящим компонентом. В
конденсате, образующемся в выше рас-
положенных сечениях аппарата, моляр-
ная доля низкокипящего компонента
больше, чем в конденсате в нижних
сечениях в начале процесса конден-
сации. В верхней части пар Da — почти
чистый низкокипящий компонент, в
нижней части — жидкость R.
Рис. 7.9. Дефлегматор
417
27 Заказ № 1592
В трубках аппарата наряду с конденсацией пара протекает?
процесс массообмена между неравновесными паром и жид-
костью, в результате количество получаемого низкокипящего:
продукта Da при дефлегмации больше, чем при фракционной
конденсации из одного и того же количества смеси М. Напри-1
мер, из сжатого (примерно до 0,4 МПа) воздуха, рассматри-
ваемого как бинарная система О2—N2, в процессе дефлегмации
в теоретическом варианте можно получить жидкость R, обога-,
щенную кислородом до хд =• 47 %, и почти чистый азот Da
(молярная доля у/}) в количестве 55 % от первоначального объема
воздуха. Иными словами, около 70 % N2, содержащегося в ;
воздухе М, можно получить в виде продукта Da. Наибольший ,
выход азота Da получается в случае, когда жидкость R, отводимая
из дефлегматора, содержит максимальное количество О2 (т.е.
равновесное пару М). В действительном процессе эти значения
не достигаются; кроме того, чем чище продукт Da, тем больше
должны быть поверхность массообмена и высота аппарата при
прочих равных условиях.
Способ дефлегмации не нашел широкого применения в ВРУ, i
хотя в отдельных вариантах такие схемы известны [7, 15, 20, 72].
Конденсаторы-дефлегматоры и конденсаторы-испарители приме- ;
няют в качестве одной из ступеней разделения многокомпонент- ;
ных смесей, в частности, в установках разделения природного
газа и других установках для выделения низкокипящих компо- s
нентов из смеси, а также для разделения смесей с резко различ- •
ными критическими температурами компонентов.
§ 7.4. ПРОЦЕСС РЕКТИФИКАЦИИ БИНАРНОЙ СМЕСИ [
Исходные положения. Ректификацией называют процесс <
тепло- и массообмена между потоками неравновесных жидкости .
и пара (состоящих из одинаковых компонентов) обычно с *
противоточной схемой движения в адиабатном аппарате с ,
постоянным давлением. Ректификация является массообменным >,
(диффузионным) процессом, в котором можно получить низко-
и высококипящие компоненты с достаточно большой степенью
извлечения. Для осуществления этого процесса необходимо j
организовать движение неравновесных пара и жидкости и /
обеспечить достаточную поверхность контакта между ними. При J
этом в паре, встречающемся со стекающей жидкостью, содер-
жится больше высококипящего компонента, чем в равновесном i
418
паре. Стекающую в колонне жидкость называют флегмой, а
отношение расходов жидкости g и пара G, проходящих через
рассматриваемое поперечное сечение колонны, — флегмовым
отношением
f=g!G. (7.31)
Для осуществления процесса необходимы аппараты с развитой
поверхностью контакта между фазами; такие аппараты называют
ректификационными колоннами. Конструкция контактного
устройства может быть различной; известны ректификационные
колонны тарельчатые, насадочные, с распылителями (полые),
роторные и др. В низкотемпературной технике используют
главным образом колонны первых двух видов [12].
Насадочные колонны заполняют насадкой разного вида,
обеспечивающей непрерывное изменение состава потоков по
высоте колонны. В тарельчатой колонне используют колпачко-
вые, ситчатые, решетчатые и другие тарелки, обеспечивающие
ступенчатое изменение составов потоков. Для реализации про-
цесса массообмена между паром и жидкостью необходимо подво-
дить и отводить теплоту в колонне при разных температурах.
Смесь, подаваемую на разделение в колонну криогенной
установки, обычно охлаждают до низких температур. Продукты
разделения, отводимые из установки в газовой фазе, подогревают
до температур, близких к температуре окружающей среды. Для
охлаждения смеси и подогрева продуктов разделения используют
теплообменные аппараты [4, 12, 14, 20].
Для пояснения принципа работы колонны рассмотрим ее
схему с ситчатыми тарелками (рис. 7.10). Колонна состоит из
куба 1 с испарителем, конденсатора 5, расположенного в верхней
части колонны, корпуса 2, в котором размещены устройства для
обеспечения контакта между фазами — тарелки 8. На каждой
тарелке находится жидкость, через которую барботирует пар. По
переливным устройствам (переливам) 9 жидкость стекает на
расположенную ниже тарелку, на которой установлены перего-
родки 11 (входной и сливной пороги). Конструкции тарелок
разнообразны [3, 12, 15, 20].
Разделяемая смесь М вводится в середину колонны по трубе
3. Пар поднимается навстречу стекающей жидкости. Часть пара
конденсируется в трубках конденсатора 5, и конденсат стекает
вниз в качестве флегмы для обеспечения процесса массообмена.
Оставшийся пар в количестве Da отводится из колонны по трубе
4; он состоит преимущественно из низкокипящего компонента
27* 419
1
Рис. 7.10. Ректификационная колонна:
а — схема колонны; б — схема движе-
ния потоков пара и жидкости на и-й
тарелке
(продукт разделения Da можно отводить и в жидкой фазе).
Жидкость, стекая по колонне, обогащается высококипящим
компонентом, и часть ее R отводится из куба по трубе 10. В
испаритель подводится теплота QR для получения пара из части
жидкости, стекающей в куб. В межтрубное пространство
конденсатора по трубе 6 подается жидкий хладагент, который
кипит за счет теплоты конденсации пара в трубках. Пар хлад- (
агента уходит из колонны по трубе 7. ;
Обычно в колонне температуры в верхнем и нижнем сечениях
и в сечении питания (ввода разделяемой смеси) поддерживаются
внешними факторами: температурами хладагента и теплоноси-
теля, температурой и составом смеси, поступившей на разделе-
ние. При этом самая высокая температура достигается в нижней
части колонны, самая низкая — в верхней; давление по высоте ,
колонны практически постоянно (если не учитывать гидравли-
ческое сопротивление тарелок). В результате температура подни-
мающегося пара несколько выше температуры текущей сверху
420 >
жидкости, и жидкость содержит больше низкокипящего компо-
нента, чем при равновесии с паром. Вследствие неравновесности
возникает возможность перехода компонентов смеси через
границу раздела фаз, и при контакте фаз происходит процесс
встречной диффузии вещества между паром и жидкостью и
изменение составов пара и жидкости в направлении установле-
ния равновесия согласно зависимостям (7.11) и (7.18).
В равновесном паре содержится больше низкокипящего
компонента, чем в жидкости (если смесь неазеотропна). Если
параметры состояния поступающих к одному промежуточному
сечению колонны жидкости и пара условно характеризовать
точками соответственно С и В" (см. рис. 7.6, а), то пар при
взаимодействии с жидкостью обогатится низкокипящим, а жид-
кость — высококипящим компонентом. Так как процесс идет
между движущимися паром и жидкостью, то они переместятся
к другим сечениям колонны с неравновесными составами пара
и жидкости. В результате при достаточно большой поверхности
контакта между паром и жидкостью и соответствующей схеме
движения потоков в колонне можно значительно повысить
содержание высококипящего компонента в стекающей жидкости
и низкокипящего компонента в поднимающемся паре. Направле-
ние изменения составов фаз условно на рис. 7.6, а определяется
линиями В”С"А" для пара и CB'D' для жидкости. Этот процесс
массообмена по высоте колонны сопровождается также измене-
нием температуры потоков пара и жидкости. При установив-
шемся режиме работы в сечениях колонны устанавливаются
определенные составы пара и жидкости, различные по высоте,
причем чем выше сечение, тем больше низкокипящего компо-
нента содержится в паре и жидкости.
Для обеспечения протекания процесса необходимы тепло-
носитель для подвода теплоты в кубе и хладагент для конденса-
ции пара в конденсаторе; количество теплоты в том и другом
случае определяется условиями работы и свойствами разделяемой
смеси.
На рис. 7.10, б показана схема движения потоков пара и
жидкости на и-й тарелке. Количество протекающей жидкости
вследствие массообмена изменяется от gn до gnA; количество
пара, барботирующего через жидкость, — от Gnl до Gn. Моляр-
ные доли низкокипящего компонента в жидкости на п-й тарел-
ке также изменяются от хп до хп1, а в паре — от упЛ до уп.
При ректификации можно достичь почти полного разделения
смеси. Степень извлечения компонентов из смеси при ректифи-
421
кации существенно больше, чем при кипении и конденсации: в'
раде случаев в продукт переходит 96—98 % вещества, содержа-
щегося в смеси, поданной на разделение. Однако абсолютно,
чистые компоненты получить принципиально невозможно, так ’
как невозможно создать аппараты с бесконечно большой •
поверхностью контакта фаз. В действительном процессе время
и поверхность соприкосновения фаз отраничены и равновесные
составы в сечениях колонны не достигаются.
Методы расчета разделительных массообменных аппаратов.
При расчете разделительного действия необходимо определить
площадь поверхности соприкосновения фаз или фазового кон-
такта, а затем геометрические размеры аппарата. Для некоторых ,
аппаратов эту площадь можно вычислить с учетом геометричес-
ких характеристик, однако часто это не удается, так как поверх- !
ность фазового контакта бывает геометрически неопределима. J
Тогда применяют способы косвенной ее оценки, используя
разные методики расчета. Основные из них две: с помощью так
называемого метода числа единиц переноса массы и с помощью
метода ступеней фазового контакта (числа теоретических таре-
лок). Первую методику чаще применяют при расчете колонн с =
непрерывным контактом фаз.
Рассмотрим вначале применение основного уравнения массо-
передачи [см. (7.11)] для определения поверхности фазового
контакта. Количество низкокипящего компонента dMv перешед-
шего из одной фазы в другую в единицу времени при установив-
шемся процессе через поверхность контакта площадью dF:
dMl =ку(УР~ У) dF- (7-32) е
Равновесные составы фаз в бинарных системах характери- \
зуются функциональной зависимостью (7.18). Действительные
составы фаз в теории массообмена называют рабочими. Они
связаны функциональной зависимостью
у=Ч(х), (7.33) \
конкретный вид которой определяется условиями работы ко- i
лонны.
Для расчетного участка ректификационной колонны площадь ;
поверхности массообмена [см. соотношение (7.32)]
гк dM, fK d(Gy) ч J
УО ку(УР-У) ТО ку(УР-У) :
422
где у0 и ук — молярные доли низкокипящего компонента в паре
соответственно в начальном и конечном сечениях расчетного
участка колонны; G — расход пара в колонне.
Если ку = const и G = const, то
G гК dy
I—— • (735)
ку У,-У
Интеграл
Ук ж
f dy
N= I -------— (7.36)
/о - У
называют общим числом единиц переноса массы.
Для части колонны, в которой содержание низкокипящего
компонента в паре изменяется от у0 до J’K, используем среднее
значение движущей силы процесса Ду. Подставив его в выра-
жение (7.32), после интегрирования (при dMx = G dy и ку = const)
получим ук - у0 = ку F Ду /G. Значение Ly в реальных колоннах
зависит от равновесных и рабочих составов смеси, а также от
гидродинамических условий работы колонны. Отношение
(ук - у0)/ Ау зависит от коэффициента массопередачи, площади
поверхности контакта между фазами и расхода пара. Из сравне-
ния полученного выражения с (7.35) и (7.36):
N= (Ук - % )/ ДУ-
Число единиц переноса N характеризует интенсивность массо-
передачи и общую разделительную способность рассматриваемой
части колонны. Одна единица переноса соответствует участку
колонны, на котором изменение состава одной из фаз равно
средней движущей силе (аналогичные выражения можно полу-
чить и для жидкости).
Зная площадь поверхности F, в дальнейших расчетах можно
определить геометрические характеристики аппарата. Если в
качестве характеристики для разделительной секции колонны
выбрать высоту аппарата, то
Яс = F/ (a, S),
или с учетом выражений (7.35) и (7.36):
Яс= G N/(kyavS) = hN N,
где av — удельная (отнесенная к объему) площадь поверхности
контакта фаз; 5 — площадь сечения; hN — G / (ку av S').
423
A I Рис. 7.11. Схема движения потоков пара и жидкости на
И И участке ректификационной колонны
Комплекс hN представляет собой высоту
аппарата, эквивалентную единице переноса; (
это кинетическая характеристика; ее значение
находят с учетом экспериментальных данных.
Определим функциональную зависимость
(7.33) для участка ректификационной колонны
между двумя сечениями, одно из которых —
I ▼ текущее (рис. 7.11); для другого сечения (с >
индексом 0) значения параметров известны. Запишем уравнения
материального баланса — общее и по низкокипящему компо-
ненту:
G-g=GQ-g0; (7.37),
Gy - gx = (70 у0 - g0 х0, (7.38) ;
где у и х — молярные доли низкокипящего компонента в паре
и жидкости в произвольном (текущем) сечении колонны.
Из уравнения (7.38)
у = gx/G + (Go у0 - g0 Xq) I G. (7.39)
Выражение (7.39), называемое уравнением рабочей линией, -
характеризует зависимость между рабочими составами пара и
жидкости у и х в любом (но одном и том же) сечении колонны.
Запишем уравнение энергетического баланса для того же
участка колонны без учета притока теплоты в колонну из окружа- ,
ющей среды:
Gi"-gi'= Go i0" - gQ V, (7.40)
где /" 10"и Г, Iq— энтальпии пара и жидкости в текущем и
исходном сечениях.
Если пренебречь теплотой смешения, а также принять, что
i" = Г + г, то после преобразования уравнений (7.37), (7.38) и
(7.40) получим [7]
G-G.rjr, (7.41) ( ,
где г0 и г — значения теплоты парообразования смеси в соответ- ?
ствущих сечениях колонны.
Здесь и далее (в § 7.4—7.9) i, г, q — молярные величины; для
краткости в тексте “молярный”, “молярная” опускаем. Расходы • ।
смесей G, g, М, R, Da, К, А и др. при расчетах следует выразить | |
в моль/с или, если М = 1 моль, — в долях от М. . ।
424
Количество пара, протекающего через сечение колонны, а
следовательно, и количество стекающей жидкости зависит от
теплоты парообразования г. Известно, что с увеличением доли
низкокипящего компонента в смеси теплота парообразования
уменьшается (г < г0), поэтому для рассматриваемого участка
колонны G > (70, и согласно зависимости (7.37) g > gG, так как
пар, поднимаясь по колонне, обогащается низко кипящим
компонентом. Если смесь состоит из компонентов с близкими
значениями теплоты парообразования, то расходы пара и
жидкости в различных сечениях колонны примерно одинаковы:
G = (70 и g « g0. В этом случае рабочая линия на диаграмме
у—х становится прямой с тангенсом угла наклона к оси абсцисс,
равным флегмовому отношению f
При расчете тарельчатых колонн обычно используют метод
ступеней контакта, часто называемый методом теоретических
тарелок. Под теоретической понимают тарелку, на которой
происходит процесс массообмена до установления равновесия
между паром и жидкостью, уходящими с тарелки; кроме того,
предполагают, что жидкость на тарелке, а также пар над и под
ней перемешиваются полностью. Такую тарелку выполнить
нельзя, поэтому ее называют теоретической [7, 12, 15, 17].
Эффективность рабочей тарелки оценивают коэффициентом
эффективности тарелки (в отдельных случаях превышающем
единицу) [17]
Ет п = (Уп - Уп п - Уп -!>’ (7-42)
где урп— молярная доля низкокипящего компонента в уходящем
с тарелки паре, равновесном стекающей с и-й тарелки жидкости
(см. рис. 7.10, б).
Иногда коэффицент эффективности тарелки называют коэф-
фициентом Мерфри, а иногда — КПД тарелки. Для характерис-
тики диффузионного процесса на тарелке используют также
понятие коэффициента локальной (точечной) эффективности
тарелки
Ят< О = (у® - ) /(ур<« - у„<_',>), (7.43)
где уп^, у®, у^ — те же характеристики, что и в (7.42), но
отнесенные к отдельной точке (или части) тарелки.
Коэффициент Еуп характеризует разделительный эффект
тарелки и является сложной функцией физических свойств пара
и жидкости, конструкции и режима_работы тарелки. Для разных
тарелок одной и той же колонны Еу п может быть различным.
425
Эффективность рабочих тарелок на участке колонны также i
характеризуют общим коэффициентом эффективности тарелок
Г|т, который обычно находят экспериментально (т| т — 0,3.„О,9).,
При расчете определяют число теоретических тарелок и затем
число действительных тарелок (
«д = «Т/Т1т- (7-44) ;;
Иногда высоту насадочной колонны определяют по числу ?
теоретических тарелок; для этого необходимо знать высоту Лэ, ]
эквивалентную одной теоретической тарелке, обычно опреде- j
ляемую экспериментально. В этом случае высота насадочной '
колонны t
H=nTh3. (7.45) ‘
•j
При определении числа теоретических тарелок в колонне для
разделения бинарной смеси в инженерной практике часто при-
меняют графические методы: по диаграмме у—х (метод предло-
жен Мак-Кэбом и Тиле) и по диаграмме I—х (метод предложен *.
Понтоном) [16, 17]. В последнее время вместо графических ♦
методов используют методы расчета с помощью ЭВМ, особенно <
для многокомпонентных смесей.
При расчете числа теоретических тарелок первым методом на
диаграмме у—х, кроме равновесной линии ур = /(х), строят
рабочую линию у = £ (х) Для давления в колонне рк = const
(рис. 7.12, а). Координаты точек рабочей линии характеризуют 11
рабочие составы пара и жидкости в одном и том же сечении
Рис. 7.12. Графики к определению состава пара и жидкости на теоретической (а)
и действительной (б) тарелках
426
колонны. Например, координаты точки А соответствуют содер-
жанию низкокипящего компонента в паре и жидкости в сечении
под п-й тарелкой (см. рис. 7.10, б). Пар, уходящий с теорети-
ческой тарелки, должен быть равновесен жидкости, стекающей
с тарелки; тогда молярная доля низкокипящего компонента в
паре ур п определяется ординатой точки В, принадлежащей
равновесной кривой ур = /(х). В сечении над теоретической
тарелкой движутся потоки жидкости и пара, содержание низко-
кипящего компонента в которых характеризуется координатами
точки С, лежащей на рабочей линии. Ординаты точек В и С
должны быть равны, так как тарелка теоретическая. Таким
образом, катеты треугольника АВС, построенного между равно-
весной и рабочей линиями с вершиной прямого угла на равно-
весной линии, соответствуют изменению содержания низкокипя-
щего компонента в паре (АВ ) и жидкости (СВ ) при прохождении
ими одной теоретической тарелки. Число треугольников, постро-
енных на расчетном участке колонны в интервале между край-
ними значениями содержания низкокипящего компонента в сме-
си, определяет число теоретических тарелок. Угол наклона рабо-
чей линии к оси абсцисс на диаграмме у—х зависит от флегмо-
вого отношения f и может изменяться в определенных пределах.
Аналогичным способом на диаграмме у—х можно построить
треугольники с катетами, определяющими изменение составов
пара и жидкости на действительных тарелках. При этом должны
быть известны значения уп-1 и Ет п для каждой тарелки. Тогда
согласно выражению (7.42) уп = упА + Етп (ур п - упА). По
значению уп на диаграмме у—х находят значение хп (рис. 7.12, б),
соответствующее молярной доле низкокипящего компонента в
жидкости, поступающей на действительную тарелку. Расчет
последовательно повторяют для следующих тарелок. Число
треугольников, построенных между ломаной линией а и рабочей
линией на расчетном участке колонны, соответствует числу
действительных тарелок [58].
Для упрощения расчета теплоту парообразования смеси в
сечениях участка колонны считают постоянной; тогда расходы
пара и жидкости (а также флегмовое отношение) постоянны по
высоте расчетного участка, и рабочая линия на диаграмме у—х
является прямой. Если теплота парообразования смеси изменя-
ется существенно при изменении ее состава, то флегмовое отно-
шение, расходы пара и жидкости переменны. В этом случае
следует учесть изменение расходов и построить соответствующую
рабочую линию [например, с помощью уравнений (7.39) и (7.41)|.
427
Можно также разделить колонну на небольшие участки, в каж-
дом из которых принять средние постоянные значения расходов
пара G и жидкости g, или использовать метод расчета по
диаграмме i—х, при котором учитывают изменение теплоты
парообразования.
Рассмотрим метод расчета числа тарелок по диаграмме z—х.
Для произвольного сечения участка адиабатной колонны (см.
рис. 7.11) в соответствии с уравнениями (7.37), (7.38) и (7.40)
справедливы выражения ,
G - g = const; Gy - g х = const; G i" - g i'= const. (7.46) з
Л
где G и g — расходы пара и жидкости в произвольном сечении
колонны. i
Для любого сечения колонны из системы уравнений (7.46) >
получим I
(G у - g х) / (G - g) = X; (7.47)
(Gr-gV)/ (G-g) = I, (7.48) \
где X и I — приведенные концентрация и энтальпия.
Точку с координатами X и I на диаграмме называют полюсом 1
Р (рис. 7.13, а). Из выражении (7.47) и (7.48) определим флег- .•
мовое отношение g/G и приравняем правые части полученных !
зависимостей: t
(X - у) / (X - х) = (/ - /") / (/ - /’)• (7.49)
Уя *л Ув * Хп-i Ут Урл * х,у
а) б)
Рис. 7.13. Диаграммы iх к определению числа теоретических тарелок
428
Выражение (7.49) представляет собой условие прохождения
прямой линии на диаграмме i—x через три точки с координатами
(х, Г), (у, i") и (X I); они характеризуют жидкость и пар в одном
и том же межтарельчатом сечении колонны и полюс Р. Так как
этот результат получен при рассмотрении произвольного сече-
ния, то он справедлив для любых других сечений рассматри-
ваемого участка колонны. Линии, проходящие через полюс,
называют полюсными. На рис. 7.13, а показаны полюсные линии
АВР, А'ВР и RR'P и координаты точек А, В и Р. Все полюсные
линии расчетного участка колонны образуют, таким образом,
пучок лучей с общей точкой в полюсе Р. Из подобия
треугольников APD и ВРС с учетом выражения (7.49) запишем
f-^/G^PB/PA. (7.50)
Следовательно, флегмовое соотношение / можно найти деле-
нием отрезка луча РВ между полюсом и точкой В, лежащей на
линии конденсации, на длину луча РА между полюсом и точкой
А на линии кипения. Для сечения колонны, расположенного ниже
(или выше) сечения АВ, например, для сечения Л'В' флегмовое
отношение имеет другое значение: fAB' = РВ’ / РА'. Если полюс
расположен выше изобары конденсации (см. рис. 7.13, а), то
флегмовое отношение f < 1; если полюс расположен ниже изо-
бары кипения, то/> 1 (например, для полюса Р2 на рис. 7.22).
Рассмотрим на диаграмме i—х изменение составов пара и
жидкости при прохождении ими одной теоретической тарелки.
Пусть направление потоков на тарелке соответствует рис. 7.10, б,
а диаграмма i—x — рис. 7.13, б. Координаты полюса, а также
параметры состояния жидкости, стекающей с тарелки, характе-
ризуются на диаграмме координатами точек Р и А; тогда моляр-
ная доля низкокипящего компонента в паре, поступающем на
тарелку, равна l (точка D). Уходящий с теоретической тарелки
пар должен быть равновесен жидкости, стекающей с тарелки
(точка А); следовательно, точка В, характеризующая уходящий
пар, на диаграмме /—х расположится в точке пересечения
изотермы влажного пара АВ с изобарой конденсации 2. Пара-
метры состояния жидкости, поступающей на тарелку, опреде-
ляются координатами точки С пересечения луча РВ с линией
кипения 1. Таким образом, изотерме влажного пара АВ соответ-
ствует одна теоретическая тарелка. Проводя подобные построе-
ния изотерм влажного пара (АВ, СЕ и т.д.) и полюсных линий
(РА, РВ и т.д.) в заданном интервале состава смеси, определяют
429
число теоретических тарелок на расчетном участке колонны; оно
равно числу изотерм влажного пара.
Пар, уходящий с теоретической тарелки, содержит меньше
низкокипящего компонента, чем пар, равновесный с жидкостью,
поступающей на тарелку, поэтому точка В на диаграмме располо-
жена левее точки Е, и полюсная линия, проходящая через точки
Р и В, круче изотермы влажного пара СЕ. Угол наклона
полюсных линий на диаграмме зависит от положения полюса
Р. При совпадении полюсной линии с изотермой влажного пара
АВ (предельный теоретический случай, соответствующий беско-
нечно большому числу тарелок) полюс расположится в точке Рт,
а угол наклона полюсной линии к оси абсцисс будет минималь-
ным. При этом условии ректификацию смеси в необходимом
интервале составов осуществить невозможно. Чем круче полюс-
ная линия на диаграмме i-x, тем меньше теоретических тарелок
требуется для изменения содержания низкокипящего компонента
в паре и жидкости в заданном интервале значений у и х (или
тем больше изменяются составы потоков на одной тарелке).
Например, если полюс находится в точке Р, то на одной теорети-
ческой тарелке изменение состава жидкости характеризует
отрезок СА, состава пара — отрезок DB. Если полюс расположен
в точке Р' (полюсная линия становится круче), то изменение
состава жидкости и пара на тарелке определяют отрезки
соответственно СА и D'B, причем С'А > СА и D'B > DB.
Минимальное число теоретических тарелок соответствует
бесконечно удаленному полюсу; тогда полюсные линии представ-
ляют собой вертикальные прямые, а составы пара и жидкости
в одном и том же сечении колонны равны. Такой режим
возможен в предельном случае, когда продукты разделения из
колонны не отводят (колонна работает “сама на себя”)- Эффек-
тивность процесса в колонне уменьшается при увеличении орди-
наты полюса Р по сравнению с ординатой полюса Рт вследствие
увеличения потерь от необратимости процесса разделения; число
тарелок при этом уменьшается (см. § 7.6 и 7.8).
При расчете тарельчатых колонн расчетные сечения обычно
проводят между тарелками; изменением составов потоков в
межтарельчатом пространстве пренебрегают, режим работы
считают установившимся. Число теоретических тарелок ит в
общем случае не равно числу единиц переноса N для одного и
того же участка колонны.
430
§ 7.5. СХЕМЫ РЕКТИФИКАЦИОННЫХ КОЛОНН ДЛЯ
РАЗДЕЛЕНИЯ БИНАРНЫХ СМЕСЕЙ И ВОЗДУХА
Характеристика колонн. Существует много типов ректифика-
ционных колонн, различающихся назначением, способом образо-
вания поверхности контакта фаз, принципом действия, составом
разделяемой смеси, конструкцией и другими признаками [7, 15,
17, 56].
По назначению колонны для разделения бинарных смесей
можно разделить на три вида: для получения высококипящего
компонента; для получения низкокипящего компонента; для
получения продуктов, обогащенных как высококипящим, так и
низкокипящим компонентами. Эти колонны отличаются не
только получаемыми продуктами, но и схемами ввода разделяе-
мой смеси и направлениями тепловых потоков. Обычно эти
колонны называют исчерпывающей (рис. 7.14, а), укрепляющей
(рис. 7.14, 6) и сдвоенной (см. рис. 7.10, а). В литературе иногда
исчерпывающую колонну называют отгонной, укрепляющую —
концентрационной. Кроме указанных используют и другие
признаки для характеристики колонн. Воздухоразделительные
колонны, например, различают
по кратности ректификации:
известны колонны однократ-
ной (рис. 7.15 и 7.16), двукрат-
ной (рис. 7.17 и 7.18) и много-
кратной ректификации.
По принципу действия ко-
лонны подразделяют на перио-
дически и непрерывно дейст-
вующие, последние имеют
существенно большее примене-
ние; в дальнейшем рассматри-
ваем преимущественно непре-
рывно действующие колонны
при установившемся режиме
работы.
Исчерпывающая и укрепляю-
щая колонны. В исчерпываю-
щую колонну (см. рис. 7.14, а)
разделяемая смесь М в жидкой
фазе подается в верхнее сече-
ние. В кубе колонны подво-
рие. 7.14. Схемы ректификационных
колонн:
а — исчерпывающей; б — укреп-
ляющей
431
дится теплота QR. Часть жидкости кипит, образующийся пар
поднимается навстречу стекающей жидкости и обогащается
низкокипящим компонентом. Из колонны отбирается пар в
количестве Da; содержание низкокипящего компонента в паре
< Уд р, где Уд р — молярная доля низкокипящего компонента
в паре, равновесном жидкости, подаваемой в верхнее сечение
колонны. Из такой колонны нельзя получить чистый низкокипя-
щий компонент. В кубе колонны получается продукт R —
высококипящий компонент, отводимый из колонны в жидкой
или паровой фазах.
В укрепляющую колонну (рис. 7.14, б) смесь М вводится в (
нижнее сечение обычно в паровой фазе; в верхней части над
колонной установлен конденсатор, в котором отводится теплота :
QB и конденсируется пар. Часть сконденсировавшегося пара
вновь направляется в колонну для обеспечения процесса
ректификации, оставшийся пар является продуктом, который >
состоит в основном из низкокипящего компонента. Его можно \
отвести из колонны как в жидкой, так и в паровой фазе. |
Сдвоенная колонна. Принцип работы этой колонны описан i
ранее (см. рис. 7.10, а). Колонна состоит из двух секций, 1
расположенных одна над другой. В этой колонне бинарную смесь
М можно разделить на два практически чистых продукта: I
низкокипящий Da и высококипящий R. Поднимаясь, пар •»
обогащается низкокипящим компонентом; жидкость, стекая
навстречу пару, постепенно обогащается высококипящим »
компонентом, поэтому температура в нижней части колонны >
выше, чем в верхней. Отношение расхода стекающей жидкости |
к расходу получаемого низкотемпературного продукта Da >
называют флегмовым числом:
= g / Da . (7.51) 1
По аналогии с колоннами для получения низкокипящего
продукта отношение расхода g' стекающей жидкости в исчерпы-
вающей колонне к расходу R получаемого высококипящего
продукта также можно назвать флегмовым числом:
vR = g'/K. (7.52)
Колонны для разделения воздуха. Рассмотренные схемы в
принципе можно применить и в ВРУ, однако для осуществления
рабочего процесса в них необходим специальный холодильный
цикл для отвода теплоты из конденсатора при низкой темпера-
432
туре. В ректификационную колонну подводится воздух, предва-
рительно осушенный и очищенный от СО2 и других примесей
и охлажденный до криогенных температур. Температура внутри
колонны низкая и изменяется примерно от 100 до 79 К, поэтому
колонны хорошо изолируют от теплопритоков из окружающей
среды. Подвод теплоты для обеспечения процесса разделения в
криогенных ректификационных колоннах осуществляют за счет
“внутренних ресурсов”, используя для этого теплоту воздуха и
продуктов разделения; в этом состоит существенное отличие
колонн для разделения воздуха от колонн, изображенных на рис.
7.10 и 7.14. Существует много схем воздухоразделительных
колонн; рассмотрим основные и в то же время простые схемы
[7, 14-16, 20].
Колонны однократной ректификации.
На рис. 7.15 приведена схема колонны для получения жидкого
азота; как и в колонне, изображенной на рис. 7.14, б, пары азота
здесь конденсируют при помощи специального хладагента.
Колонна 2 соединена с газовой холодильной машиной 7. Особен-
ностью колонны является то, что давление в ней практически
равно атмосферному. Такая колонна впервые изготовлена
фирмой “Филипс” (Голландия) для азотной установки. Воздух
по трубе 6 поступает через сетчатый теплообменник 5 в среднее
сечение колонны 2 в состоянии, близком к насыщенному пару.
Водяной пар и СО2, находящиеся в воздухе, вымерзают в сетках
теплообменника. Поверхность
контакта фаз в ректифика-
ционной колонне образована
насадкой. Пары, поднимаясь в
колонне навстречу жидкости,
обогащаются азотом и затем
конденсируются на холодной
головке ГХМ (см. § 6.6). Часть
жидкого азота возвращается в
качестве флегмы на орошение
колонны при помощи газлифта
3 (в него подводится теплота
0Г); оставшаяся часть жидкого
азота сливается в сосуд Дьюара
по трубе 9. Флегма, стекая в
куб 4, обогащается кислородом,
содержание которого в кубовой
жидкости составляет примерно
Рис. 7.15. Упрощенная схема колонны
с газовой холодильной машиной
433
28 Заказ № 1592
70-80 %. Эта жидкость кипит за счет теплоты, передаваемой
воздухом; одна часть потока пара направляется в колонну через
вентиль 8, другая — нагревается за счет контакта с воздухом и
выходит в атмосферу по трубе 7. Колонны такой конструкции
используют в ВРУ небольшой производительности [12].
На рис. 7.16 приведены еще две схемы воздухоразделительных
колонн. Колонна, изображенная на рис. 7.16, а служит для полу-
чения кислорода, колонна, показанная на рис. 7.16, б, — для
получения азота. Первая из этих колонн представляет собой
вертикальную башню 1 с кубом 2. Охлажденный сжатый воздух
М подается в змеевик 3, дополнительно охлаждается и затем '
дросселируется в вентиле 4. После дросселирования жидкий г
воздух (с небольшой долей пара, образовавшегося при дроссели- ?
ровании) поступает в верхнее сечение колонны; давление в ней ;
составляет 0,13—0,14 МПа. Жидкость, стекая по колонне, обога-
щается кислородом при взаимодействии с потоком поднимающе-
гося пара. В кубе колонны часть жидкости испаряется за счет
теплоты воздуха, проходящего внутри змеевика, и образовав-
шийся пар поднимается, постепенно обогащаясь азотом. В уходя-
щем из колонны паре А содержится значительное количество
кислорода, так как в верхнее сечение колонны подается жидкий
воздух. В работающих колоннах молярная доля N2 в паре А,
выходящем из колонны, как правило, не превышает 92 %. В
колонне можно получить достаточно чистым только высоко-
кипящий продукт (кислород К) как в жидкой, так и в паровой
фазе. Существенный недостаток колонны — малый коэффициент
извлечения компонента О2: более 1/3 его теряется с азотом А.
Потоки, выходящие из колонны в паровой фазе, обязательно
направляют в теплообменни-
ки для рекуперации холода;
поток А после теплообмен-
ника выходит в атмосферу.
В колонне на рис. 7.16, б
кроме куба 2 со змеевиком 3,
вверху имеется конденсатор-
испаритель 5. Сжатый и ох-
лажденный воздух М после
Рис. 7.16. Схемы колонн однократной
ректификации:
а — для получения кислорода; б —
для получения азота
434
дросселирования в вентиле 6 подается на разделение. В верхней
части колонны 1 получается практически чистый азот А. Часть
азотного пара, сконденсировавшегося в трубах, стекает в качестве
флегмы для обеспечения процесса ректификации. Для конденса-
ции паров азота из куба 2 через дроссельный вентиль 4 жидкость
R, обогащенная кислородом, подается в межтрубное простран-
ство конденсатора-испарителя 5 (в испаритель), где жидкость
кипит при более низком давлении (около 0,13 МПа), чем
давление в колонне. Образовавшийся пар в количестве R
отводится из испарителя колонны. Вследствие разности давлений
в конденсаторе-испарителе создается достаточный температур-
ный напор, и азот в трубках конденсируется; теплота конден-
сации передается жидкости, кипящей в межтрубном простран-
стве конденсатора-испарителя.
Особенность работы рассмотренных колонн заключается в
том, что холодильный и технологический потоки в них совме-
щены, поэтому в испарителе теплота подводится, а в конденса-
торе отводится технологическим потоком воздуха или его
продуктами разделения.
Колонны двукратной ректификации.
На рис. 7.17 и 7.18 приведены схемы воздухоразделительных
колонн двукратной ректификации, применяемых в промышлен-
ности. В колоннах такого типа возможно практически полное
разделение бинарной смеси. Аппарат состоит из двух колонн 1
и 2 и конденсатора-испарителя 3. Процесс ректификации в
нижней колонне 1 (или колонне высокого давления) происходит
при давлении 0,55—0,58 МПа, в верхней колонне 2 (или колонне
низкого давления) при давлении 0,13—0,14 МПа. При этом в
конденсаторе-испарителе создается достаточный температурный
напор (обычно 2—3 К). Для работы этих колонн также не нужен
специальный хладагент для конденсации азота.
По конструктивному решению колонны различаются: первая
(см. рис. 7.17) представляет собой двойную колонну со встроен-
ным конденсатором-испарителем, а вторая (см. рис. 7.18)
выполнена в виде колонны, разеделенной на три части: колонны
1 и 2 и конденсатор-испаритель 3. Конденсатор-испаритель
может состоять из одного или нескольких аппаратов, соединен-
ных между собой трубами. Колонны этого вида используют в
крупных ВРУ низкого давления. Особенность колонны состоит
также в том, что в колонну 1 вводится часть воздуха М}; другая
часть М2 расширяется в турбодетандере и направляется в колонну
2 в состоянии, близком к насыщенному пару. Колонна 2 состоит
28* 435
Рис. 7.17. Схема колонны двухкратной
ректификации
Рис. 7.18. Схема колонны двухкратной
ректификации с вводом детандерного
потока в колонну низкого давления
из трех секций, разделенных потоками R и Л/„ колонна 1 имеет
одну секцию. Количество детандерного потока рассчитывают;
оно обычно не превышает 0,25 (М{ + М2) 115].
Рассмотрим подробнее схему колонны двукратной ректифика-
ции (см. рис. 7.17). Воздух М входит в колонну через дроссель-
ный вентиль 8; в нижней части колонны / получается жидкость
(кубовая), обогащенная кислородом. Эта жидкость кипит за счет
теплоты воздуха, проходящего по змеевику. Образовавшийся пар
поднимается навстречу стекающей по тарелкам жидкости и
обогащается низкокипящим компонентом. Вверху колонны
находится практически чистый азот, который конденсируется в
аппарате 3 (в трубках). Часть образовавшейся жидкости стекает
навстречу поднимающемуся пару и обогащается кислородом,
другая часть Da из азотных карманов 5 через дроссельный
вентиль 7 подается в вер,чнюю колонну. Кубовая жидкость R
подается также в колонну 2 после дроссельного вентиля 6. Для
43о
охлаждения потоков R и Da услано rich аппарат 4 (переохладите ль
флегмы). Из верхней колонны отводятся продукты разделения
— азот А и кислород К.
Из верхней пасти колонны /, изображенной на рис. 7.18.
отводятся пары азота Dtl в конденсатор-испаритель 2, где они
конденсируются, и жидкость возвращается в бачок 6,
размешенный в верхней части колонны /. Из бачка часть
жидкого азота Da через дроссельный вентиль поступает на
орошение колонны 2; остальная жидкость служит флегмой в
колонне /. Жидкий кислород Ао из колонны 2 отводится в
конденсатор-испаритель 5, где кипит. Часть пара (А’о — К)
возвращается в колонну 2 для обеспечения процесса ректифи-
кации, другая часть (А ) является продуктом. Потоки жидкого
азота Da и кубовой жидкости R обычно пропускают через
охладители флегмы 4 и 5, где в качестве хладагента используют
газообразный азот А из колонны низкого давления 2. Оконча-
тельное разделение воздуха на кислород А и азот А происходит
в колонне 2. Концентрация продуктов разделения зависит от
назначения установки. При расчете колонн двукратной ректифи-
кации можно использовать экспериментальные значения соста-
вов продуктов разделения воздуха, приведенные в табл. 7.2. и
методики расчета из работы (16].
В нижних колоннах ВРУ устанавливают примерно 24 тарелки,
в верхних 36-45; в установках для получения чистых продуктов
А' и А тарелок в колоннах больше: 36 - в нижней и 48-58 в
верхней [17].
Колонны крупных ВРУ обычно предназначены для комплекс-
ного разделения воздуха, т.е: для получения наряду с азотом и
кислородом аргона, крилтоноксеноновой и неоногелисвой
смесей. В результате блок разделения воздуха усложняется по
сравнению с описанными колоннами, однако рассмотренные
7.2.Содержание кислорода в продуктах разделения воздуха
(без извлечения аргона) [8]
Продую ра щенения (молярная доля 0,1 Молярная доля О,. %, в установке
высокого и среднего давления НИ зКО! О давления
Кубовая жидкое ль (л’й) 36-39 36—38
Азотная флегма (х'в) 1-5 1—4
Азот (у'л) 0,8-6 1-3
КИСЛОРОД (А'к ИЛИ y’J 99,3- 99,7 95—99,5
437
колонны являются частью рабочих блоков разделения воздуха !
[12, 15, 20].
Коэффициент извлечения. Разделительную 1
способность колонны иногда характеризуют коэффициентом
извлечения компонента из смеси. Например, при получении
кислорода из воздуха коэффициент извлечения О2
₽ = /Г/к/(Л//м), (7.53)
где К — количество получаемого продукта — кислорода; М —
количество разделяемой смеси; у'м и у'к — молярная доля О2
соответственно в разделяемой смеси и продукте. Для колонн ,«
двукратной ректификации р = 0,96...0,97.
Получение инертных газов из воздуха. При разделении воздуха
приходится учитывать наличие в нем инертных газов и в первую
очередь аргона. Присутствие аргона делает невозможным одно- *
временное получение из колонны чистых кислорода и азота: если
весь аргон соберется в продукционном кислороде, то объемная
доля О2 в продукте не будет превышать 95 %; если весь аргон «
перейдет в азот, то доля азота в продукте составит не более
98,7 %. В связи с этим для получения чистых продуктов аргонная
фракция должна быть выведена из верхней колонны.
Инертные газы, содержащиеся в воздухе, находят широкое
применение, поэтому на крупных ВРУ в виде побочных продук- «
Рис. 7.19. Упрощенная схема узла
ректификации с отбором смесей, обога-
щенных инертными газами
тов разделения получают газо- 1
вые смеси, обогащенные инерт-
ными газами, такими как, Хе,
Кг, Ar, Ne и Не. Из них затем
получают чистые инертные газы
[15, 17, 20]. Эти обогащенные j
смеси называют “первичным '
концентратом” или “сырым”
газом. Например, на крупней-
шей установке Кт-70 можно
получить 0,26 м3/ч криптоно-
ксенонового концентрата [в
пересчете на 100 % (Кг + Хе)]
и 3.82 м3/ч неоногелиевой >
смеси [в пересчете на 100 %
(Ne + Не)] [3].
На рис. 7.19 приведена упро-
щенная принципиальная схема
узла ректификации с указанием
438
мест отбора первичных продуктов разделения [15, 17]. Неон и
гелий (как компоненты с самой низкой температурой
конденсации) ни в одном сечении колонны конденсироваться
не могут (возможно небольшое растворение этих компонентов
в жидком азоте) и накапливаются в паровой смеси в верхнем
сечении конденсатора нижней колонны 2 при давлении около
0,56 МПа. Эта смесь Г, содержащая N2, Ne и Не, отводится в
аппарат 5 (дефлегматор), где охлаждается жидким азотом Da с
температурой около 80 К. При этом часть азота из смеси Г
конденсируется, а общее содержание Ne и Не в остаточном газе
увеличивается до 50 %. Если неоногелиевая смесь не является
продуктом разделения, то она будет накапливаться в конденса-
торе и вызовет повышение давления в нижней колонне; эту
газовую смесь необходимо периодически продувать в атмосферу
для обеспечения нормального режима работы.
Криптон и ксенон с наиболее высокой температурой кон-
денсации накапливаются в кислороде (их содержание в кисло-
роде примерно в 5 раз больше, чем в воздухе). Этот кислород
из колонны 1 отводится в колонну 4 в виде жидкости П или
пара (тогда колонну 4 выполняют двухсекционной). Из нижней
части колонны 4 отводится в испаритель (на рисунке не показан)
обогащенная жидкость, из которой получают первичный крип-
тоновый концентрат, содержащий 0,1—0,2 % (Кг + Хе). Кислород
из испарителя возвращается в колонну 4.
Аргон накапливается в сред-
ней части колонны 7, так как
его температура кипения лежит
между температурами кипения
О2 и N2. Свойства тройной
системы О2—Аг—N2 таковы,
что в результате процессов,
происходящих в колонне 1,
содержание Аг в смеси на
некоторых тарелках значитель-
но больше содержания его в
воздухе [8, 12, 15]. На рис. 7.20
Рис. 7.20. Кривые изменения молярной
доли у2 аргона в паре па тарелках
верхней колонны (пт — номер тарелки
сверху, <Хф — доля аргонной фракции от
количества воздуха, поступающего в
колонну [8, 17])
приведен график изменения содержания Аг (у2) на тарелках ко-
лонны 1 (см. рис. 7.19); наибольшая молярная доля Аг — 17,35 % •?
[8, 17]. При отборе аргонной фракции максимальное значение >
у? обычно достигается на тарелках, расположенных ниже ввода
кубовой жидкости. Из колонны 1 аргонная фракция Ф в паровой
фазе отводится для концентрирования в аргонную колонну 3,
из которой получается “сырой” аргон С (примерно 80-95 % Аг, >
10-3 % N2, остальное кислород). Фракцию выводят из сечения,
расположенного несколько ниже сечения с максимальным ’
содержанием аргона в смеси. Это позволяет получить аргонную '
фракцию с меньшим содержанием азота и облегчить режим ;
работы аргонной колонны. Флегма, необходимая для работы
аргонной колонны, образуется из пара в конденсаторе аргонной !
колонны 3; теплота конденсации передается части кубовой (
жидкости R, кипящей в межтрубном пространстве конденсатора
флегмы. Флегма стекает вниз навстречу пару и затем отводится ’
в колонну 1.
Состав “сырого” аргона, распределение аргона по высоте j
верхней колонны, количество отбираемой фракции и степень )
извлечения Аг из воздуха существенно зависят от типа ВРУ и \
режима ее работы; подробнее — см. [8, 14].
Периодически действующие ректификационные колонны, i
Периодически действующие колонны в промышленности приме- ]
няют реже, чем непрерывно работающие и преимущественно для ]
малотоннажных производств и в лабораторных установках. Схема
установки в простейшем варианте включает: куб с обогревом (в
который загружается разделяемая смесь в жидкой фазе); •
ректификационную адиабатную колонну, установленную над '
кубом; конденсатор-дефлегматор с охлаждающим устройством 5
для конденсации пара, поступающего из колонны. Часть образо- *
вавшегося конденсата направляется назад в колонну в качестве
флегмы для обеспечения процесса ректификации, остальной •
конденсат является продуктом-дистиллятом. ?
Ректификационная колонна может работать либо в режиме
получения дистиллята постоянного состава, либо в режиме »
работы с постоянной флегмой. Первый процесс протекает при
непрерывно изменяющемся флегмовом числе: наименьшим в
начале процесса и наибольшим — в конце. По мере отгонки '
кубовой жидкости содержание низкокипящего компонента в ней
уменьшается и требуется непрерывное и правильное регулиро-
вание питания колонны паром и флегмой, что затрудняет
ведение процесса. Чаще используют второй режим работы i
440 ?
колонны — в условиях постоянного флегмового числа. По мере
протекания процесса содержание низкокипящего компонента в
кубовой жидкости и соответственно в дистилляте уменьшается,
в результате получают дистиллят среднего состава.
Для повышения качества разделения и получения более
чистых продуктов применяют так называемую фракционную
периодическую ректификацию [37, 57], т.е. последовательное во
времени разделение полученных продуктов в повторных про-
цессах. Расчет колонны периодического действия усложняется
вследствие изменения во времени параметров всех элементов
установки.
1
§ 7.6. МЕТОДИКА ТЕРМОДИНАМИЧЕСКОГО РАСЧЕТА
РЕКТИФИКАЦИОННЫХ КОЛОНН ДЛЯ РАЗДЕЛЕНИЯ
БИНАРНОЙ СМЕСИ
Общие положения. При термодинамическом расчете ректи-
фикационной колонны определяют: количества получаемых про-
дуктов; тепловые потоки; флегмовые отношения и числа; коэф-
фициенты извлечения; параметры состояния жидкости и пара;
число единиц переноса или число тарелок в колонне.
Исходные данные для расчета обычно включают: параметры
состояния и состав разделяемой смеси, количество (обычно
расход) смеси, а также состав и параметры состояния продуктов
разделения, тип и схему ректификационной колонны. Иногда
вначале колонну рассчитывают, принимая количество разделя-
емой смеси М= 1 моль; тогда потоки А, К, 7? и др. выражают в
долях от М.
При расчете ректификационную колонну делят на участки и
для каждого из них находят уравнение рабочей линии или
координаты полюса на диаграмме i—x. Число рабочих линий и
число полюсов зависит от числа вводов и выводов потоков в
различные сечения рабочего пространства колонны, включая
нижнее и верхнее сечения. Если в одном и том же сечении
колонны несколько вводов и выводов потоков, то при определе-
нии числа рабочих линий их условно рассматривают как один
суммарный поток. С учетом изложенного для рассчитываемой
секции колонны при числе потоков в различных сечениях можно
считать число рабочих линий «л = z — 1- Например, колоннам,
изображенным на рис. 7.14, а, б, 7.16, а и колонне высокого дав-
ления на рис. 7.18 соответствует одна рабочая линия (или один
441
полюс); колоннам, показанным на рис. 7.10. о. 7.15. 7.16, о, а
также верхней и нижней колоннам на рис. 7.17 — две рабочие
линии; колонне низкого давления на рис. 7.18 — три рабочие
линии. При определении уравнений рабочих линий и координат
полюсов используют метод составления балансовых уравнении,
рассмотренный ранее. При определении числа тарелок в колонне
। идравлическис потери обычно не учитывают, а тарелки считаю!
адиабатными.
Методика расчета количества получаемых продуктов, флегмо-
вых чисел, тепловых потоков и числа тарелок в колонне. Рассмот-
рим колонну, изображенную на рис. 7.10, так как она состоит
из двух основных секций — укрепляющей и исчерпывающей;
последние входят в состав самых различных колонн. Пусть смесь
А/ состоит из двух компонентов с близкими значениями теплоты
парообразования; состояние этой смеси кипящая жидкость.
Запишем уравнения материштьных балансов для всей колонны:
A/-Z)fl + /?; (7.54)
ХМ ~ Уй 1 XR' (7.55)
где yD и xR молярные доли низкокипящего компонента в про-
дуктах D(i и R, отводимых из колонны (эти значения обычно
задают); aw молярная доля низкокипящего компонента в
смеси М.
Количество получаемых продуктов (из уравнении (7.54) и
(7.55)]
A/(aw - А'л)/(ур - Ад); _
(7..Э6)
/? А/ - Da — А/ (j-р - A^l/ij’p - Ад).
Определим вид уравнений рабочих линий для верхней и
нижней частей колонны; для этого проведем произвольные сече-
ния <7 — а и h b и запишем уравнения материальных балансов
(общее и по ни зкокипяще.му компоненту) для верхнего и нижне-
го участков колонны.
G g " Da- ('У g-x 1 Duvd\ G' = g'- R; G'y = g'x - R xR.
(7.57)
откуда
У = g x ; G + Da yD / G\ (7.58)
У "- g' x / G' - R xR / G\ (7.59)
442
Рис. 7.21. Рабочие линии на диаграмме
здесь g if 6' — расходы жидкос-
ти и пара в сечении а—а ко-
лонны (или нагрузка по жид-
кости и нагрузка по пару); g' и
С — расходы жидкости и пара
в сечении b—b: а и у молярные
доли н изкоктшящст о компонен-
та соответственно в жидкости и
парс в текущем иечентш колон-
ны (для верхнего сечения часто
принимают xD = у0).
Зависимости (7.58) и (7.59)
представляют собой уравнения
рабочих линий / и 2 (рис. 7.21)
для верхней и нижней секций колонны. При г — const рабочие
линии на диатрамме изображаются прямыми линиями CD и CR
и флегмовые отношения в верхней ( / = g/ G ) и нижней ( Г - gi
G'} секциях колонны для всех сечении соответствующей секции
не изменяются. Флегмовые числа для верхней и нижней секций
колонны определяют по формулам (7.51) и (7.52). Подставив vD
и pR в уравнения (7.58) и (7.59), получим уравнения рабочих
линии, содержащие флегмовые числа:
у - VD х / (1 + VD) vD / (I + vdY.
(7.60)
у ~ z'R x / (rA - I) - xR j (vR I). (7.61)
Координаты точки С пересечения рабочих линий на диаграм-
ме определим из уравнений (7.58) тт (7.59):
ас -- Aj / A; ус - g хс ! G + Da уп / G, (7.62)
где А, - Dn yD / G + R xR / G'; A “ g / G' - g / G.
Число теоретических тарелок в колонне найдем построением
треугольников между равновесной тт рабочей линиями на диа-
грамме у—л (см. § 7.2 и 7.4), число действительных тарелок
но формуле (7.44). При подаче в колонну кипящей жидкости
абсцисса точки пересечения рабочих линий л — дл/. а сама точка
лежит на линии АВ. При смешанном (парожидкостном) питании
колонны точка пересечения рабочих линий находится внутри
угла В'АВ на прямой. проведенной ты точки А под углом 6 к
линии АВ' [37], при этом
ig е (i - о.л/) / «А/.
443
где 6 — угол между горизонталью АВ' и прямой, отложенной от;
линии Л 2?'по часовой стрелке (прямая не показана); ам — доля4
пара в смеси М (при смешанном питании 0 < ам < 1; при подаче;
в колонну сухого насыщенного пара ам = 1, и точка пересечения >
рабочих линий лежит на линии АВ').
Тепловые потоки определим из уравнения энергетического ?
баланса колонны: J
М iM^ М qc + Qr — + Da iD + R iR , (7-63)
где iM, iD, iR — энтальпии потоков соответственно М, Da, R;
qc — приток теплоты из окружающей среды (при расчете числа
тарелок его обычно не учитывают).
Дополнительным условием может быть задание фазовой
неравновесности в сечении ввода смеси (например, задана
разность ув - ус — см. рис. 7.21) или флегмового отношения
/= g/G = tg V|/ для верхнего участка колонны с учетом минималь-
ного флегмового отношения (см. далее § 7.6). Так как g = f (7,
то из уравнения материального баланса для верхнего сечения
колонны (перед конденсатором) получим G = g + Da или G —
~ Da/ (1 - / ). Если конденсируемое количество пара равно коли-
честву флегмы, то тепловой поток в конденсаторе QD — g rD,
где — теплота парообразования смеси в конденсаторе.
Из уравнения (7.63) найдем QR, а затем qD = QD / Da и
qR = QR j R. Количество флегмы, поступающей в нижнюю
секцию колонны в сечении питания, g’ — g + (1 - ам) М, где
ам — доля пара в смеси питания М.
Для установившегося режи-
ма работы рассчитаем число
тарелок в этой же колонне (см.
рис. 7.10) по диаграмме i—x
(рис. 7.22). Вначале на диа-
грамме i—x отмстим точку 1,
характеризующую смесь М
(энтальпия смеси ix — iM, мо-
лярная доля низкокипящего
компонента = хм), и точки
2 и 3, соответствующие продук-
там разделения Da и R. Затем
определим координаты полю-
сов, для чего составим урав-
нения материальных и энер-
444
’i
s
6
Рис. 7.22. График к определению числа
теоретических тарелок по диаграмме
i—x
I
гетичсских балансов для участков колонны, находящихся выше
сечения а—а и ниже сечения b—b (см. рис. 7.10). Тогда для
верхнего участка колонны
G-g=Da; Gy - gx = DayD- Gi"-gi'= Dai2 + Qd. (7.64)
Согласно зависимостям (7.47), (7.48) и (7.64) координаты
полюса для укрепляющей секции колонны
^1 = Уд> А ~ А + &а = А + Уд- (7.65)
Для участка колонны, расположенного ниже сечения b—b
G'-g--R-, G'y-g’x--Rxr, Gi"-gi'= -Ri3 + Qr, (7.66)
где i3 = iR.
Используя зависимости (7.47), (7.48) и (7.66), получим коорди-
наты полюса для исчерпывающей части колонны
— xR, А — А ~ Qr / R ~ ~ Qr (7.67)
Из уравнения энергетического баланса колонны (7.63) при
qc - 0 с учетом (7.54) найдем: R (q - i3 + q^ = Da (i2 + qD - i^.
Вместо R и Da подставим соответствующие значения из выраже-
ний (7.56) и после преобразования получим
1А - (А ~ / <хм " xr> = (А + <1д - А) / <Уд ~ хм) •
Это выражение представляет собой условие прохождения
прямой линии через три точки: точку 7 ввода смеси (координаты
хм» А) и два полюса — А (координаты i2 4- qB) и Р2 (коорди-
наты xR; i3 - qR). Эту линию называют главной полюсной линией
(главной линией полюсов). Если главная полюсная линия совпа-
дает с изотермой влажного пара 1—1", то процесс ректификации
в интервале заданных составов (от xR до уп) осуществить невоз-
можно: число тарелок в колонне становится бесконечно боль-
шим. Для работающей колонны любая полюсная линия на диа-
грамме должна быть круче изотермы влажного пара. Следова-
тельно, рабочий полюс Pj должен быть выше полюса Р1т, а полюс
Р2 — ниже полюса Р^. Ординаты полюсов зависят от количества
теплоты qn и qR, с их увеличением рабочие полюсы удаляются
от теоретических. Минимальные значения количества теплоты
в рассматриваемой колонне соответствуют на диаграмме отрез-
кам qDmin и qRmin (теоретический случай). Если продукты разде-
ления из колонны не отводят (Da - R= 0), то qD и qR становятся
бесконечно большими, в этом случае все полюсные линии пред-
ставляют собой вертикальные прямые.
445
На рис. 7.22 показан оптимальный режим, при котором точка
1 ввода смеси находится на главной линии полюсов, и участки
1—Рх и 1—Р^ главной линии являются полюсными линиями
сечения под нижней тарелкой укрепляющей секции и над
верхней тарелкой исчерпывающей секции колонны. В рабочих
колоннах разделяемая смесь может поступать выше или ниже
оптимального сечения. В результате в пространстве между
секциями колонны смешиваются два потока: жидкость, стекаю-
щая с нижней тарелки укрепляющей секции, и жидкость М,
вводимая в колонну и имеющая другой молярный состав.
Расчетное число тарелок в секциях колонны при смешении
потоков с разными составами отличается от числа тарелок при
оптимальном режиме [7, 48].
Число теоретических тарелок определяют описанным ранее
методом построения изотерм влажного пара и полюсных линий.
Для нижней секции колонны полюсные линии проводят через
полюс Р2, а изотермы строят от точки 3, пока одна из них не
пересечет главную полюсную линию. В верхней секции полюс-
ные линии проводят через полюс Pv Разделяющее действие куба л
колонны соответствует одной теоретической тарелке, поэтому
общее число тарелок в колонне можно уменьшить на 1.
Метод расчета колонн с более сложными схемами аналогичен
рассмотренному. Колонны делят на секции, для каждой из
которых находят материальные и тепловые потоки и уравнения ,
рабочих линий. Предварительно выбирают схему колонны и
принимают значения ряда параметров, таких как состав продук-
тов разделения, давление в колонне, температурный напор в
конденсаторе-испарителе, состав промежуточных фракций и
некоторые другие. В качестве примера рассмотрим расчет колон-
ны двукратной ректификации для разделения воздуха (рис. 7.23) ;
и получения газообразных азота и кислорода. Из уравнений i
материальных балансов для всей колонны и для нижней колонны
определим материальные потоки:
К = М (ул - хм) / (уА - ук); А = М - К , > 1
(7.68) ;
— М (хм - xR) / (xD - xR); R — M - Da, ?_ |
где yA, xM, yK, xrm xD — молярные доли N2 (значения их обычно |
задают; часто принимают xD — уА) в соответствующих потоках > ’
А, М, К, R и Da. I
446
Энтальпию /5 воздуха, поступающего в колонну (точка 5),
найдем из уравнения энергетического баланса для всей колонны:
М i5 + М qc = А /А + К /к , (7.69)
где qc — приток теплоты в колонну из окружающей среды; гк и
(д — энтальпии продуктов разделения в точках 6 и 7.
Из уравнения (7.69) энтальпия воздуха, вводимого в колонну,
Здесь принято, что потоки Dan R перед входом в верхнюю
колонну не охлаждают. При наличии переохладитсля флегмы (см.
рис. 7.17) энтальпию /д в уравнении (7.69) необходимо вычислять
с учетом подогрева азота в переохладителе: iA = /7 + срА АТ^ф,
где АТ^ф — повышение температуры газообразного азота в пере-
охладителе флегмы.
Давление в нижней части верхней колонны обычно около
0,13 МПа; давление р2 в нижней колонне зависит от температуры
Тк кипения кислорода и температурного напора А 7кив конден-
саторе-испарителе. Для того, чтобы азот конденсировался в труб-
ках конденсатора при кипении кислорода в верхней колонне,
температура конденсации TD азота должна быть выше темпера-
туры кислорода (для нижней колонны кипящий кислород явля-
ется хладагентом): TD = Тк + А7^и. Это можно обеспечить,
повысив давление в нижней колонне (р2 > р^). Зная температуру
TD и состав азотного пара, по диаграммам (или таблицам) можно
определить давление р2, необходимое для нормальной работы
нижней колонны. Обычно А7^и== 2,0...3,0 К и р2~ 0,55...0,58 МПа.
При малом температурном напоре заметно влияние гидростати-
ческого столба кипящего кислорода на АТКИ, поэтому температу-
ру кипения Тк в испарителе иногда определяют при среднем дав-
лении р' — рх + 0,5 • 9,81 Н рк, где рх — давление над зеркалом
кипения кислорода в верхней колонне, Па; Н — высота столба
жидкого кислорода, м; рк — плотность жидкого кислорода, кг/м3.
Тепловой поток QD из конденсатора в испаритель определим
из уравнений энергетического баланса для верхней или нижней
колонны. Для нижней колонны
Qd ~ М iM + Мqc - Da iD - R iR, (7-71)
где qc'— приток теплоты из окружающей среды к нижней
колонне; iD и iR — энтальпии жидкостей Da и R, выходящих из
нижней колонны (точки 2 и J); iM = i5.
447
Рис. 7.23. Схема колонны двукратной ректификация
с расчетными точками *
Потоки пара и флегмы над верхней
тарелкой нижней колонны G = QD / rDn
g = G - Da. Тепловой поток в кубе
колонны QR = М (i5 - /4). Температуру
воздуха в точке 4 выбирают с учетом'
температуры Т3 кипения жидкости в кубе:
Т4 - Т3 = АТЛ, обычно ^TR— 3...5 К.
Уравнения рабочих линий для верхней
и нижней секций колонны определим
ранее описанным методом сечений и ба-
лансовых уравнений для участков колон-
ны, отделенных сечениями а—а и b—b и
контурами, показанными штриховыми
линиями на рис. 7.23. Для верхней и
нижней секций колонны после преобразо-
вания балансовых уравнений получим
соответственно
(7.72)
где g и g' — потоки флегмы в верхней и нижней секциях
колонны.
Рис. 7.24. График к расчету нижней
колонны в координатах у—х
На рис. 7.24 показаны рабочие
линии 1—2 и 1—3 для верхней и
нижней секций колонны при р2 =
= const. Изменение молярного
состава жидкости в кубе нижней
колонны такое же, как на одной
теоретической тарелке. Пар, под-
нимающийся из куба, равновесен
жидкости состава xR; молярная
доля N2 в жидкости, стекающей с
нижней тарелки в куб, — xR. (из-
менение состава происходит в ку-
бе вследствие кипения жидкости).
448
Число теоретических тарелок в
секциях колонны определяют
построением треугольников
между равновесной и рабочей
линиями (штриховые линии).
На рис. 7.25 даны диаграммы
i—x с изобарами рх и р2 для
верхней и нижней колонн. На
диаграмме указаны основные
точки. Точка 5 (вход воздуха в
змеевик) лежит на вертикали
х = хм в точке пересечения ее с
прямой 6—7, если qc = 0 (при
qc > 0 точка 5 смещается вниз в
точку 5' на величину, равную
#с); энтальпия /5 = iM. Точки 6
и 7 своими координатами харак-
теризуют параметры состояния
кислорода К и азота Л, отбирае-
мых из верхней колонны (i6 = iK,
Ус = Ук и h = *а> У1 = Уа)- Точка
4 на диаграмме совпадает с точ-
кой 1, а точки 9 и 8 — с точками
3 и 2 (если нет переохладителя
флегмы), но температуры и дав-
ления в них различны. Так как
изобара конденсации рх для сме-
си О2— N2 почти прямолинейна,
то ордината точки 5 слабо зави-
сит от состава потоков Аи X.
При получении жидкого кисло-
рода (точка 6’) энтальпия посту-
пающего в колонну воздуха равна
ординате точки (рис. 7.25, а).
Координаты полюсов находят
ранее описанным способом.
Поскольку нижняя колонна во
Ряс. 7.25. Графики к расчету ношей (а)
и верхней (б) колонн координатах 1—х
многом идентична колонне,
показанной на рис. 7.10, координаты полюсов Рг и Р2 соот-
ветствуют уравнениям (7.65) и 7.67). Отличаются лишь коор-
динаты полюса (здесь 2Q = xD; так как из колонны отбирают
жидкость Da, то точка 2 лежит на изобаре кипения; при этом
29 Заказ № 1592
449
часто принимают xD = >’А), а также способ организации теплового
потока QR [теплота в кубе подводится за счет охлаждения воздуха
от точки 5 до точки 4 : QR = М (i5 - /4)]. Тепловой поток QD
определяют из уравнения (7.71). Если состав кубовой жидкости
известен, то положение полюса Ру на диаграмме i—x соответст-
вует точке пересечения прямой 3—5 с вертикалью х = xD, что
следует из уравнения (7.65), а также из уравнений (7.54) и (7.55),
справедливых и здесь. Главная полюсная линия для нижней
колонны Р] Р2 должна пройти через точку 7, характеризующую
своими координатами состояние воздуха в сечении питания
после дроссельного вентиля (см. рис. 7.23 и 7.25, а). Число
теоретических тарелок равно числу изотерм влажного пара; на
рис. 7.25, а штриховыми линиями показаны только по одной
изотерме для верхней и нижней секций. Угол Д, между лучами
Рх—2 и Р}— 1 соответствует области построения полюсных линий
и изотерм для верхней секции нижней колонны, а угол р2 —
области для нижней секции. Отрезки 5—7 и Р2 3 характеризуют
отношения теплоты, отдаваемой воздухом в кубе колонны, соот-
ветственно к потокам М (qR м = QR / М) и R (qR = QR / R);
отрезок Ру—2 соответствует теплоте, передаваемой в конденса-
торе-испарителе от конденсирующегося азота кипящему кисло-
роду (qD — Qd/ Da). Верхнюю колонну рассчитывают аналогично.
Рассмотрим ее расчет с помощью диаграммы i—х.
На рис. 7.25, б приведена диаграмма с основными точками,
характеризующими процесс в верхней колонне. Наименьшая
теоретическая молярная доля N2 в жидком азоте соответствует
абсциссе точки 2т (или <?т), являющейся точкой пересечения
изотермы влажного пара Т7 (для давления р}) с изобарой кипения
р2. При нормальной работе колонны х2 < xD < >’А; нами принято
ранее, что xD = уА (см. рис. 7.25, а). Координаты двух полюсов
для верхней колонны вычисляют описанным выше способом —
методом сечений и решением балансовых уравнений. Тогда для
верхней секции колонны координаты полюса Р3:
= (Gy - #х) / (G - ё) = (А УА - Da XD> / (А - Da)~’
(7.73)
А = (А /7 - Da i2) / (A- D) (при xD = уА Х3 = уА).
Для нижней секции координаты полюса Р4:
Л| ~ Тк ~ ^6’ А ~ *6 " ^к ’ (7-74)
где qK= QK/ К.
450
Тепловой поток к кислороду опрсдсляк’'г по формуле (7.71);
представим его в другом виде;
бд = = °«««= * «к • <7-75>
Количейтва теплоты qK и qp характеризуют отрезки 6—Р4 и
2— Р{ на рис. 7.25. ОтрезокХ5—10 опред^яст теплоту q^ м,
передаваемую кислороду, нб условно отне^нную к количеству
воздуха: qK м — QK/ М, это можно доказ^ь с учетом формул
(7.68) из подобия треугольников 6— 7— Р4 5—7—10. Точка 10
лежит на прямой 2—3 при х = хм. Зная уложение точек 7 и
10, можно графическим способом определМь положение точки
Р4 (обычно это свойство отрезков на диагр^ме i—х используют
для контроля правильности расчета).
Главная линия полюсов — Р3 — 9—Р4. ’|исло теоретических
тарелок определяют с помощью изотерм важного пара и соот-
ветствующих полюсных линий. Построений ^зотерм и полюсных
линий можно осуществлять как снизу колс^ны, так и сверху (от
полюса Р3); здесь показаны только две из<??ермы Т6, и Тг
При xD < уА абсцисса Х3 может быть боЛрше единицы. Поло-
жение полюса за пределами диаграммы вполне возможно, так
как координаты полюса не всегда характеризуют действительное
состояние потока, а лишь разности между потоками Ли Da [см.
выражение (7.73)]. Например, если моляр^^я доля N2 в жидком
азоте Da равна x'D (причем х2 т < x'D < /А) и соответствует
абсциссе точки 2' на рис. 7.25, б. то пол?)£ Р3 переместится в
точку Р3, где Х3 > 1; при этом полюс должен лежать на
вертикали х = xj (на рис. 7.25, а полюс не показан).
Более подробные методики расчета ректификационных
воздухоразделительных колонн графически*1 способом приведены
в работах [7, 16, 19].
Аналитические зависимости для определения числа теорети-
ческих тарелок. Число теоретических та^лок для разделения
идеальной бинарной смеси в отдельных с/учаях определяют по
аналитическим зависимостям. Приведем наиболее простые из
них.
При постоянном коэффициенте разделе^ ия схл без отбора дис-
тиллята из колонны (Ва = 0) число те^ ретических тарелок
согласно уравнению Фенске [10, 17]
хп (1 - хк) /
«тпнп = 1П --------------/ 1п ’
XR (1 - xD)
451
29*
где xD и хл — молярные доли низкокипящего компонента в
жидкостях Da и R.
Значение «Tmin характеризует минимальное число тарелок, так
как рабочая линия совпадает с диагональю и наиболее удалена
от равновесной линии.
Для участков колонны, в которых равновесная линия с допус-
тимой погрешностью аппроксимируется прямой линией, число
теоретических тарелок также легко определить по аналитическим
зависимостям. Обычно это необходимо при значениях х, близких
к 0 и 1 (т.е. при разделении сильно разбавленных растворов или
при получении очень чистых продуктов), когда графические
способы расчета неточны и даже неприменимы. Для верхнего и
нижнего участков колонны равновесная линия близка к прямой
линии, которая описывается уравнениями: 1 - урв = крв (1 - х)
при х —> 1, урн = fcpH х при х -> О, где £рв и fcpH — угловые
коэффициенты прямых (верхнего и нижнего) участков
равновесной линии, причем крв = 1/ ал; fcpH = ал.
При этих условиях число теоретических тарелок [10, 171
„ _ 1 (XD - *к.в) (к ал ’ О , Д
в 1g (к ал) 6 I (1 - xD) (ал - 1) J
П = 1 1J [ к'~ Ц . J
н ЫалМ') I хд(ал-1) Г ;
При выводе этих формул принято: бинарная смесь —
идеальный раствор; угловые коэффициенты рабочих линий
верхнего и нижнего участков соответственно к = g / (g + Da) и
к' = g'/ (g' - R). ;
В последние годы расчеты и особенно оптимизацию парамет-
ров ректификационных колонн выполняют с помощью ЭВМ [10,
14, 23]. При этом задают исходную информацию, включающую t
как внешние, так и частично внутренние параметры, в которых 1
отражены общие, физические, технологические и конструктив-
ные условия. В частности, в исходной информации следует ’
отразить тип колонны, тип контактного устройства, расход, j
свойства и параметры состояния разделяемой смеси, харакгерис- л
тики продуктов разделения. Кроме того, вносят ряд дополнитсяь- ,
ный характеристик, таких, как состав смеси в отдельных сече-
ниях, разности температур, коэффициент эффективности тарелок
и др.
Затем разрабатывают математическую модель процесса —
совокупность уравнений и условий, связывающих характеристики
452
колонны с исходной информацией и целевой функцией. Обычно
это — система уравнений материального, покомпонентного и
энергетического балансов типа уравнений (7.54), (7.55), (7.63),
(7.64), (7.66), уравнения фазового равновесия типа (7.18),
уравнения рабочих линий типа (7.33), уравнения для определения
термодинамических функций и др. Кроме того, формулируют
ограничения с учетом физически возможных и технически
осуществимых значений, например, у < ур, v > и др. Далее
разрабатывают или подбирают готовый алгоритм. Отдельные
указания по расчету приведены в работах [10, 14, 23].
Расчет числа тарелок существенно усложняется тем, что
приходится учитывать влияние гидродинамических условий
работы тарелок и изменение коэффициента эффективности
тарелок по высоте колонны. Достаточно полно учесть все
основные факторы, определяющие поверхность контакта фаз,
при ручном расчете в ряде случаев невозможно.
Минимальные и действительные флегмовые числа. Эффектив-
ность процесса ректификации и высота колонн зависят от
флегмового числа. В качестве примера рассмотрим режим работы
колонны (см. рис. 7.10) при питании жидкой смесью. Ордината
ус (см. рис. 7.21) точки пересечения рабочих линий зависит от
тангенсов углов наклона к оси абсцисс, которые определяются
флегмовыми числами. Для верхней секции тангенс угла наклона
рабочей линии к оси абсцисс tg у = f= vD/ (1 + vD).
Наивысшее теоретическое положение рабочей линии соответ-
ствует прямой DB с точкой В, лежащей на равновесной кривой.
В этом случае угол у минимальный и, следовательно, tg у =
= Vmin; f = 4in И VD = VD min- Число тарелок при этом
бесконечно велико. Осуществить такой режим в колонне невоз-
можно, его следует рассматривать как предельный с минималь-
ным флегмовым числом и равновесными составами пара и
жидкости в сечении питания колонны. Если точка пересечения
рабочих линий находится на диагонали, то tg у = 1; / = 1 и
vD —> «о. Эти условия характерны для режима работы колонны
без отвода из нее продукта (Da = 0). Иногда их создают при
исследовании колонны для облегчения определения рабочих
составов пара и жидкости, так как в этом случае в любом сече-
нии колонны состав пара и жидкости одинаковый (у = х). При
паровом питании колонны верхние теоретические положения
рабочих линий на диаграмме соответствуют прямым DB' и RB\
нижние — диагонали у = х.
453
При конечном числе тарелок (пт < и получении продукта <
из колонны (Da > 0) точка С пересечения рабочих линий должна .«
находиться внутри области, ограниченной равновесной кривой •
ур — f (х) и диагональю у — х; следовательно, должны выпол- ,
няться неравенства fmin < f< 1 и &nmin < vd < “•
При уменьшении флегмового числа рабочие линии на
диаграмме у—х приближаются к равновесной кривой ур = f (х),
и потери вследствие необратимости процесса разделения умень-
шаются (уменьшается разность у — у). В связи с этим в колон-
нах рабочие флегмовые числа стремятся уменьшить; в воздухо-
разделительных колоннах они обычно больше минимального в
1,1—2,0 раза (в зависимости от схемы и участка, колонны).
Однако при уменьшении флегмового числа неизбежно увели-
чивается требуемая поверхность контакта между фазами и
возникают дополнительные потери вследствие увеличения
гидравлических потерь и притока теплоты из окружающей среды.
§ 7.7. ВЛИЯНИЕ ДАВЛЕНИЯ В ВОЗДУХОРАЗДЕЛИТЕЛЬНЫХ
КОЛОННАХ НА ПРОЦЕСС РЕКТИФИКАЦИИ
Колонна однократной ректификации. Повышение давления в
колонне (рис. 7.16, а) приводит к уменьшению коэффициента
извлечения кислорода. Несмотря на то, что ректификация
возможна почти до критического давления на практике уже при
сравнительно небольших давлениях рк она экономически
нецелесообразна. На рис. 7.26
приведены расчетные значения
коэффициента р извлечения
кислорода из воздуха, вычис-
ленные по формуле (7.53) при
условии у'к « 1,0; у'м = 0,21 для
двух вариантов: кривая 7 соот-
ветствует неравновесности пара
в верхнем сечении колонны
Aj’] = ур - уА = 0 и разности
температур между воздухом и
кубовой жидкостью при выходе
воздуха из куба А Т3 м = 0 К
Рис. 7.26. Расчетные зависимости
коэффициента р от давления рк
454
(теоретический вариант, бесконечно высокая колонна); кривая
2 — Лу =?= 0,02 и ЛТЗМ= 3 К. Согласно приведенным зависимо-
стям увеличение давления всего до 1,4 МПа приводит к резкому
уменьшению выхода О2 [33]. При повышенном давлении в ко-
лонне целесообразно использовать турбодстандер на потоке А
для получения дополнительного холода и уменьшения расхода
энергии.
Колонна двукратной ректификации. Повышение давления в
верхней колонне неизбежно сопровождается повышением давле-
ния в нижней колонне, так как иначе невозможна конденсация
азота в конденсаторе-испарителе. Однако это давление имеет
предельное значение, которое зависит от концентрации полу-
чаемых продуктов разделения — азота А и кислорода К (см.
рис. 7.23), а также от фазового состояния отводимого кислорода
— газообразного или жидкого. Предельное значение давления
тем меньше, чем чище получаемые продукты, а при получении
жидкого кислорода это давление существенно ниже, чем при
получении газообразного кислорода того же состава. Так, при
получении газообразно 99 %-ного кислорода %-ного азота
А ректификация возможна до давления в нижней колонне около
1,9 МПа, при получении жидкого 99 %-ного кислорода — около
1,2 МПа (указанные значения соответствуют теоретическому
варианту — бесконечно большому числу тарелок в колонне). На
рис. 7.27 приведены качественные зависимости предельных
значений xR для кубовой жидкости от давления р2 в нижней
колонне.
Процесс разделения в колонне может происходить, если
значение xR удовлетворяет неравенствам xR < xR < xR max.
Кривая 3 (см. рис. 7.27) соответствует наибольшему (предель-
ному) содержанию N2; кривые
1 и 2 — наименьшему содержа-
нию N2 в кубовой жидкости
соответственно при получении
жидкого и газообразного кис-
лорода. При увеличении дав-
ления р2 в колонне разность
(xr max - XR min) уменьшается.
При некотором давлении р2 (и
соответствующем ему давлении
Pt) XR max = XR mini П₽И еИ*е
больших давлениях xR ma). ста-
новится меньше хк , и из
л пни
Рис. 7.27. Зависимости предельных
значений хк от давления р2 [19]
455
колонны невозможно получить принятые в расчете составы про-
дуктов К и А даже в предельном теоретическом варианте. Анализ
энергетических затрат при получении кислорода под повышен-
ным давлением непосредственно из ректификационной колонны
и некоторые дополнительные результаты расчета р2* и xR приве-
дены в работе [29].
В качестве примера рассмотрим методику определения xR
и xRlnax для колонны, изображенной на рис. 7.23. Для нагляд-
ности используем способ расчета с помощью диаграммы i—x для
смеси О2—N2 (рис. 7.28) с изобарами кипения и конденсации
для верхней (pt) и нижней (р2) колонн. Точки на диаграмме
соответствуют аналогичным точкам на рис. 7.23 (для отличия
теоретического режима работы от реального использован допол-
нительный индекс “т”). Приток теплоты в колонну принят
дс = 0; кроме того, принято допущение о прямолинейности
изобар кипения и конденсации для упрощения расчета при
небольшой погрешности результатов; вследствие этих допущений
точки 5 и 10 лежат на изобарах конденсации р{ и кипения р2
соответственно.
Точки 1 и 4 характеризуют состояние воздуха после дроссель-
ного вентиля и перед ним (на диаграмме они совпадают, но
и хЯтк[ по диаграмме i—x
давления в них различны: в точке
1 — Ру в точке 4 — р^ ~р5, т.е.
равно значению давления возду-
ха в змеевике). Количество теп-
лоты, переданное в змеевике
кубовой жидкости в расчете на
1 моль воздуха, характеризует
отрезок 5—4:
^R,M= Qr / ^ ~ h ~ h ’> Z4 ~ Ч •
Согласно уравнению (7.69) и
новым обозначениям энтальпия
/5=(Л/7 + Х/6)/М
В теоретическом варианте
наименьшая концентрация азота
Da, поступающего в верхнее
сечение верхней колонны соот-
ветствует точке 8 v (с ней совпа-
дает точка 2Т), лежащей на изо-
терме Ту (точки 7'—7).
456
Главная линия полюсов для нижней колонны должна пройти
через точку 7; в теоретическом варианте она совпадает с
изотермой влажного пара Т\ при давлении рт Точка пересечения
линии х = xDi. и продолжения изотермы определяет полюс
Р1т (координаты Хдт; <2г + ^Дт)- Прямая Р1т 5, пересекает изобару
кипения р2 в точке Зт, абсцисса которой характеризует
наименьшее содержание N2 в кубовой жидкости (xR В
реальных режимах работы полюс Р, должен находиться выше
полюса Р1т (xR >xRiain).
Количество теплоты, передаваемое в испаритель верхней
колонны и условно отнесенное к 1 молю воздуха, характери-
зуется отрезком 5—10 (#к м = / М). Положение полюса Р4
(координаты >к; z6 — <?к) для нижней секции верхней колонны
определяет точка пересечения линии х = ук с линией,
проведенной через точки 7 и 10. Полюс Р3 т находится в точке
пересечения полюсной линии <?т—7 с главной линией полюсов,
которая в теоретическом варианте совпадает с изотермой влаж-
ного пара Ти (линия 1Г—1Г) для давления р1 и при продолже-
нии изотермы пройдет через полюс Р4 (главная линия проводится
методом последовательного подбора). Абсцисса точки пересече-
ния 11 т главной линии с изобарой кипения р2 характеризует
наибольшее предельное значение хКтах. При повышении давле-
ния рх (и следовательно р2) значения увеличиваются (точка
9Т смещается вправо), а уменьшаются (точка 11 т смещается
влево); при некотором значении р^ xR = xR max.
Основной характеристикой, определяющей предельное давле-
ние при выбранных значениях ук и уА, является количество теп-
лоты, передаваемое воздухом в колонне. Так как колонна рабо-
тает без дополнительных внешних источников теплоты и холода
и тепловой баланс в ней замкнут “на себя”, то при некотором
давлении р2 теплоты оказывается недостаточно для получения
из колонны продуктов разделения заданного состава (продукты
разделения получаются менее чистыми).
§ 7.8. ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ ПРОЦЕССА
РЕКТИФИКАЦИИ БИНАРНОЙ СМЕСИ
В ВРУ при получении газообразного кислорода и азота расход
энергии примерно в 5-8 раз больше минимального и степень
термодинамического совершенства г), установки менее 0,2 [12,
17, 37]. Примем воздух за идеальную бинарную смесь N2 и О2.
457
При разделении ее в идеальной колонне наряду с другими усло-
виями (отсутствие гидравлических потерь, разностей температур
при теплообмене, притока теплоты из окружающей среды и др.)
необходимо обеспечить фазовое равновесие между жидкостью
и паром в каждом сечении колонны и бесконечно малое нару-
шение равновесия между паром и жидкостью при переходе с
одной тарелки на другую. Если это требование представить себе
выполненным, то рабочая линия на диаграмме г—х должна сов-
падать с равновесной кривой; при этом число тарелок л -» <*>.
В идеальной колонне ко всем тарелкам ниже сечения ввода
смеси следовало бы обратимо подводить соответствующие коли-
чества теплоты и отводить теплоту от всех тарелок в сечениях,
расположенных выше места ввода; флегмовое число в идеальной
колонне непрерывно изменяется по высоте. Кроме тою необхо-
димо представить себе осуществление идеального теплообмена
между поступающим в колонну воздухом и выходящими газо-
образными продуктами разделения. Г.Гаузен описал схему уста-
новки с идеальной ректификационной колонной и определил
минимальные затраты энергии (минимально необходимую работ}
min разделения воздуха); они соответствуют тому же значению.
Рис. 7.29. Адиабатная колонна:
а — схема, б, в — диаграммы у—х и i—x
458
какое получается по формуле
(5.26) 117, 37|. Такую колон-
ну создать невозможно.
Схемы рабочих колонн
отличаются от схемы идеаль-
ной колонны. Основное от-
личие заключается в том, что
теплота подводится в ниж-
ней части рабочей колонны
при самой высокой темпера-
туре /к, а отводится вверху
при самой низкой темпе-
ратуре ГА; участок колонны
с тарелками является адиа-
батным. Такую колонну часто
называют адиабатной. Рас-
смотрим ее работу в ндеали-
зированных условиях [17|.
Пусть в колонну (рис. 7.29, а)
входит поток воздуха М при
атмосферном давлении в
состоянии сухого насыщен-
ного пара (рис. 7.29,б,в — точка т) и выходят чистые азот А и
кислород К в таком же состоянии (точки к и а на рис. 7.29,в).
Охлаждение воздуха от температуры окружающей среды 70 до
осуществляется за счет холода продукционных потоков А и
К. В кубе колонны подводится теплота (температура ТК ), а
в конденсаторе отводится теплота при температуре Т4 (причем
Т4 < ТК). Рабочие линии 2 и 3 (рис. 7.29,о) для верхней и нижней
частей колонны в теоретическом случае имеют точку пересече-
ния, лежащую на равновесной кривой /. Создать такую идеали-
зированную колонну также невозможно, и число тарелок в ней
/?т —> оо. Для разделения смеси в адиабатной колонне требуется
затратить существенно больше энергии, чем в идеальной колон-
не. В адиабатной колонне увеличение затрат объясняется отсутст-
вием фазового равновесия практически во всех сечениях колон-
ны (рабочие линии не совпадают с равновесной; в сечениях
колонны возникает неравновесность, выраженная разностью
Ур- у > 0) 114, 17, 371.
Минимальная работа разделения в адиабатной колонне
пип ’
где £д — работа, необходимая для осуществления обратимого
процесса переноса теплоты с уровня температуры 7Д в окру-
жающую среду с температурой Го; /.R — работа, которую можно
получить при обратимом процессе переноса теплоты с уровня
?о на Гк.
В качестве идеальных устройств, обеспечивающих перенос
теплоты и (7К, можно представить холодильную машину и
двигатель, работающие по циклу Карно. Тогда
nun = То - Л)/Л - <2к (Го - Гк)/тк . (7.77)
Для разделяемой смеси при отсутствии притока теплоты из
окружающей среды справедливо уравнение MiM ~ AiA 4 KiK и
(7Д ~ С>к При Работе колонны с минимальным флегмовым чис-
лом тепловые потоки в колонне минимальны (Qlllin). Работа раз-
деления, отнесенная к потоку кислорода А,
(Щ,Лк = ^£>„„„(1/^- 1/Гк)/А'. (7.78)
Минимальное количество теплоты можно определить по диа-
грамме /— а (рис. 7.29, в). Для этого из точки (определяющей
состояние вводимого в колонну воздуха) следует провести изо-
терму mm' (до линии кипения /’) и продолжить ее до пересече-
ния с вертикалями л — 0 и х = J. Точки Р2г и характеризуют
459
Л-АЛ гк + дгк
положения полюсов при числе тарелок п -> <*>. Отрезки Р1та и
Рък равны соответственно <?Amin = Q^/A и <7Kmin = Q^/K.
Для смеси Q2 — N2 при р = 0,1 МПа, ТА = 77,3 К и Тк= 90,2 К;
9Kmin ~ 17100 Дж/моль и qA = 4518 Дж/моль. При этих
условиях и То = 303 К
('адПпп)к = 303 ‘17100 (V77>3 - W2) = 9586 Дж/моль.
Для идеализированной адиабатной колонны т|, = 6180/9586 =
= 0,645 [где (Zp min)K = 6180 —. см. табл. 5.2]. Следовательно,
никакой агрегат, в котором использована адиабатная колонна
не может иметь степень термодинамического совершенства
больше 64,5 %. Если v > i^, то полюс Р, будет расположен выше
Р1т, а полюс Р2 — ниже точки Р^,; в результате тепловые потоки
возрастут и значение т], уменьшится. В сечении ввода смеси
возникает неравновесность, определяемая разностью &хм.
Особенно существенное уменьшение вызывает наличие разности
температур в конденсаторе (АТД) и испарителе (АТК). В этом
случае при v =
Q
/ I \ _ ГГ' Ж'Ш1П
Мад1к
Если АТД = АТК = 3 К, то tj z = 0,44. Кроме этих потерь
существуют и другие, как в колонне, так и в элементах
установки.
В колонне двукратной ректификации (см. рис. 7.23) даже при
идеализированных условиях т] t = 0,4, поскольку при давлении в
верхней колонне, равном атмосферному (= 0,098 МПа), давление
в нижней колонне должно быть более 0,35 МПа (при этом давле-
нии разность температур в конденсаторе-испарителе АТКН ~ 0);
в противном случае азот не сможет конденсироваться и колонна
работать не будет. Следовательно, воздух должен быть сжат в
теоретическом случае до давления 0,35 МПа; в действительности
давление составляет примерно 0,55 МПа [7].
Для повышения эффективности процесса ректификации и
снижения эксергетических потерь в рабочих колоннах необходи-
мо обеспечить выполнение ряда основных условий: 1) уменьше-
ние притока теплоты из окружающей среды; 2) уменьшение
разности температур в конденсаторе-испарителе, так как увели-
чение'температурного напора на 1 К вызывает увеличение давле-
ния в нижней колонне примерно на 0,035 МПа; 3) уменьшение
гидравлического сопротивления, так как увеличение гидравли-
460
ческого сопротивления в верхней колонне на 10'2 МПа требует
повышения давления в нижней колонне примерно на 0,035 МПа;
4) уменьшение неравновесности между паром и жидкостью в
процессе массообмена; т.е. необходимо обеспечить по возмож-
ности малую разность равновесной и рабочей концентраций,
уменьшив флегмовое число (приблизив его к минимальному);
5) уменьшение давления. Если часть воздуха ввести в промежу-
точное сечение верхней колонны в несжатом и охлажденном до
температуры конденсации состоянии, то расход энергии на раз-
деление можно уменьшить (так называемый способ Лахмана);
теоретически ввести можно до 40% всего воздуха, поступающего
в колонну. Однако трудности с охлаждением несжатого воздуха
и особенно с осушкой и очисткой его от примесей не позволили
использовать этот способ в работающих установках.
Создание турбодетандеров с высокими КПД позволило
выпускать крупные установки низкого давления с вводом в
среднюю часть верхней колонны расширенного в турбодетандере
сжатого воздуха (см. рис. 6.46 и 7.18); с помощью турбодетандера
получается также основное количество холода, необходимого для
работы установки [14, 15]. Вследствие уменьшения количества
азотной флегмы и кубовой жидкости рабочие линии на диаграм-
ме у—х для верхней колонны существенно приближаются к
равновесной по сравнению с обычной колонной (рис. 7.17), в
результате неравновесность в процессе разделения уменьшается
(разность ур - у становится меньше, однако количество тарелок
при этом увеличивается). В турбодетандере расширяется до 25%
сжатого воздуха; энергию, выделяемую при расширении обычно
используют.
Уменьшение флегмового числа также можно осуществить
отбором части газообразного чистого азота (до 15-25% от пере-
рабатываемого воздуха) из конденсатора нижней колонны. Этот
азот после небольшого подогрева направляют в турбодетандер,
а затем в теплообменные аппараты [14, 17].
Разность концентраций ур — у в адиабатных колоннах ВРУ
уменьшают также путем ступенчатого подвода и отвода теплоты
в разных секциях верхней колонны на разных уровнях темпера-
туры [14].
Для повышения эффективности процесса разделения необхо-
димо использовать сочетание различных способов с целью усо-
вершенствования колонны как предварительного, так и оконча-
тельного разделения воздуха. Существенный эффект можно
получить при понижении давления ректификации в нижней
461
колонне при соответствующей организации теплообмена в
конденсаторах-испарителях [7, 14, 17, 20]; например, для конден-
сации азота и кипения кислорода используют в качестве хлад-
агента и теплоносителя воздух или смеси, по составу близкие к
нему, вместо кипящего кислорода, как в конденсаторе-испари-
теле обычной колонны двукратной ректификации. В результате
процесс разделения при той же разности температур в конденса-
торе-испарителе протекает при меньшем давлении, а следова-
тельно, при меньшем расходе энергии. Схемы таких блоков раз-
деления становятся, конечно, сложнее, но этот способ является
одним из эффективных для снижения расхода энергии при раз-
делении воздуха в колоннах с адиабатными секциями [7, 14, 20].
Однако в таком варианте эксергетические потери вследствие
необратимости собственно процесса адиабатной ректификации
полностью исключить невозможно без изменения принципа
осуществления процесса (даже в теоретическом варианте); эти
потери нельзя уменьшить ни интенсификацией массообмена, ни
конструктивными изменениями колонны.
Для повышения эффективности ректификационной колнны
надо изменить принцип разделения, приблизив его к условиям
работы идеальной колонны: т.е. исключить адиабатность про-
цесса и осуществить отвод или подвод теплоты по всей высоте
разделительной секции колонны (использовать так называемую
неадиабатную ректификацию). Такие схемы в литературе
известны [14, 20, 72]; в частности, для предварительного разде-
ления воздуха вместо нижней колонны с адиабатными тарелками
применяют неадиабатный аппарат типа дефлегматора; верхнюю
колонну для окончательного разделения выполняют из несколь-
ких адиабатных секций с подводом и отводом теплоты на разных
температурных уровнях. В одной из известных схем, названной
схемой ВРУ с конденсационно-испарительным разделением [14],
для предварительного разделения использован тепло-массо-
обменный аппарат конденсационно-испарительного типа. Аппа-
рат заменяет нижнюю ректификационную колонну, и в нем
происходит предварительная ректификация воздуха при его
парциальной конденсации как в дефлегматоре. Верхняя колонна
выполнена из нескольких адиабатных секций. Конденсация пара
в конденсаторе-испарителе осуществляется за счет кипения жид-
кости, причем процесс организован таким образом, что по мере
увеличения содержания N2 в паре, содержание О2 в кипящей
жидкости уменьшается. В результате можно понизить давление
воздуха, поступающего в блок разделения, до 0,4 МПа (вместо
462
обычного значения 0,55-0,58 МПа) при небольшой, но доста-
точной разности температур в аппарате.
Рабочая линия на диаграмме у— х для такой неадиабатной
колонны предварительного разделения становится кривой и
более приближенной к равновесной линии ур = /(х), чем рабочие
линии для секций адиабатной колонны. Однако для успешной
реализации подобных схем особенно для крупных установок
требуется создание ректификационных устройств с достаточно
надежными конструктивными решениями, обеспечивающими
эффективный массообмен по всей высоте аппарата, равномерное
распределение пара и жидкости по сечению и развитую поверх-
ность контакта фаз. Кроме того, изменение температуры охлаж-
дающей среды (хладагента) должно соответствовать изменению
температуры конденсирующегося пара. В неадиабатной секции
колонны флегмовое число существенно изменяется по высоте;
количество пара в верхней части меньше, чем в нижней, вслед-
ствие частичной конденсации его по мере движения вверх. Про-
пускная способность по пару в нижней части ограничена коли-
чеством пара, которое может пройти при относительно большом
количестве стекающей жидкости. В результате эффективность
разделения может быть различной в разных сечениях колонны
и чувствительной к небольшим изменениям теплового потока.
Для процесса адиабатной ректификации бинарных систем с
близкими температурами кипения компонентов допускают
возможность протекания эквимолярного массообмена, при
котором с поверхности контакта фаз испаряется и на ней же
конденсируется равное число молей низко- и высококипящего
компонента соответственно [20, 22]. На границе раздела фаз
состав диффундирующего вещества определяют в соответствии
с законами термодинамического равновесия.
В неадиабатной колонне имеет место как контактная (за счет
диффузионных потоков эквимолярного массообмена), так и
термическая ректификация (разделение смеси, вызванное пар-
циальной конденсацией пара или испарением жидкости вслед-
ствие отвода или подвода теплоты). Причем оба эффекта прояв-
ляются одновременно и оказывают взаимное влияние, т.е. как
бы совмещаются два процесса: конденсация пара, вызывающая
конвективный поток к охлаждаемой стенке, и собственно ректи-
фикация, определяемая эквимолярным массообменом [20, 22].
Движущую силу межфазного переноса массы при неадиабатной
ректификации определяет не только разность химических потен-
циалов взаимодействующих фаз, но и разность температуры.
463
Теория совместно протекающих процессов тепло- и массо-
обмена применительно к криогенным устройствам изучена еще
недостаточно, хотя такие работы из литературы известны.
Неадиабатные колонны в принципе могут обеспечить такую же
степень разделения, как и адиабатные.
В МГАХМе выполнены исследовательские работы по разделе-
нию газовой смеси в противоточных дефлегматорах трубчатого
и пластинчатого типов и применению их для предварительного
разделения воздуха (вместо нижней колонны) при более низком
давлении, чем в установках с колонной двукратной ректифика-
ции [20]. Однако для создания крупных ВРУ с надежными техно-
логическими характеристиками и меньшим расходом энергии по
сравнению с лучшими образцами работающих установок и при
использовании процесса неадиабатной ректификации необхо-
димы уточненные мезодики расчета и новые ректификационные
устройства, которые еще не имеют достаточно надежного
решения.
Уменьшение неравновесности (Др, АГ, Ду, Да) в протекающих
процессах неизбежно вызывает увеличение габаритов, а уменьше-
ние скоростей потоков приводит большей частью к понижению
эффективности процессов теплообмена и массообмена, поэтому
при создании установок необходимы вариантные расчеты и
анализ результатов с целью определения оптимальных значении.
Кроме того, приходится также учитывать дополнительные требо-
вания, такие, как условия работы, наличие освоенного оборудо-
вания, допустимые габариты и массу и некоторые другие.
Указанные ранее значения т] t получены без учета необратимых
полерь в других узлах установки; в действительности их доля
существенна (см. § 6.5). В связи с этим для уменьшения расхода
энергии в ВРУ наряду с усовершенствованием узла ректифика-
ции необходимо уменьшать потери во всех узлах установки. В
работе [14] приведены расчетные характеристики по возможному
в перспективе уменьшению расхода энергии в крупных ВРУ при
усовершенствовании узла ректификации, уменьшении потерь
холода в окружающую среду, повышении КПД машин и аппара-
тов, а также уменьшении гидравлических потерь в установке,
разности температур в конденсаторах-испарителях и потерь
воздуха вследствие утечек. При этом указано, что расход энергии
в перспективе может быть уменьшен до 0,31-0,34 кВт- ч/м3 (25-
27 кДж/моль) при получении технологического кислорода
(молярная доля О-, в котором 95 %) [ 14|.
4Ь4
Современные схемы ВРУ, расчет и анализ их работы подроб-
нее описаны в работах [3, 5, 7, 8, 12, 15, 16]; термодинамический
анализ систем ожижения газов и разделения газовых смесей при
криогенных температурах — в работах |4, 13, 23, 62].
§ 7.9. РАСЧЕТ ПРОЦЕССА РЕКТИФИКАЦИИ ТРОЙНОЙ
СМЕСИ O2-AR-N2
Несмотря на малое содержание аргона в воздухе (0,932%), в
отдельных сечениях верхней колонны содержание его значи-
тельно, так как аргон по отношению к азоту представляет собой
высококипящий компонент, а по отношению к кислороду —
низкокипящим. Точный расчет ректификационной колонны для
разделения воздуха нельзя выполнить без учета влияния аргона.
Влияние аргона особенно сильно зависит от чистоты получае-
мою кислорода. При определении числа теоретических тарелок,
если молярная доля О2 в уходящем кислороде yR1 < 96%, влияние
аргона не столь велико, и при расчете часто допустимо считать
воздух бинарной системой О, — N2. В табл. 7.3 приведены
результаты расчета числа теоретических тарелок в верхней
колонне для двух вариантов смеси — бинарной и тройной [14|.
7.3. Число лт теоретических тарелок, рассчитанное для процесса
в верхней колонне по диаграмме равновесия для тройной
(О2—Ar—N2) и бинарной (О2—N2) систем [ 14]
З’К! - % О, Тип *1 колон- ны V п %<\ Доля детан- дерного воздуха м2 Смесь лт для секции Е л
ниж- ней сред- ней верх- ней
I 1,0 0 Тройная 12 — 15 27
99,5 Бинарная 5 — 7 12
II 4,0 0,26 Тройная 8 2 25 35
Бинарная 4 0 7 11
I 1,0 0 Тройная 5,5 — 4,3 9,8
95,0 Бинарная 5,3 — 3,7 9,0
II 1,0 0,26 Тройная 9 1 6 16
Бинарная 8,4 1 5,1 14,5
1 Тип 1 соответствует колонне па рис. 7.17, тип II — колонне на рис. 7.18
? УА|— молярная доля О., в уходящем азоте А, %
30 Заказ № 1592
465
Известны графические и аналитические методы расчета ,
процесса разделения тройной смеси О2—Ar—N2. Графические
методы наиболее наглядны и позволяют лучше понять физичес-
кую сущность процесса ректификации, поэтому их иногда ис-
пользуют и в настоящее время наряду с машинными расчетами
при выполнении отдельных расчетов не очень сложных колонн.
Известно несколько методик расчета, в том числе и методики,
разработанные М.Б.Столпером [19] и Г.Б.Наринским [14,15].
Рассмотрим кратко последнюю методику; она достаточно точна,
наиболее полно разработана и снабжена табличными данными
и специально построенными диаграммами у;. — смесей двух
компонентов.
При расчете дополнительно используют рассмотренную ранее
диаграмму i — х бинарной системы О2 — N2 для определения
теплоты паробразования смеси, флегмовых отношений и других
параметров. В расчете принято допущение о малом влиянии
аргона, содержащегося в смеси, на изменение теплоты парообра-
зования и флегмового отношения в сечениях расчетного участка
колонны. Вычисленные по диаграмме / — х для смеси О2 — N2
значения флегмовых отношений используют для построения
рабочих линий на диаграммах yr — для кислорода и у2 — х2
идя аргона. На рис. 7.30 и 7.31 приведены такие диаграммы для
Рис. 7.30. График к определению числа теоретических тарелок в колонне при
разделении тройной смеси О2—Ar—N2 [15]
466
Рис. 7.31. Схема к определению числа теорети-
ческих тарелок [14]
Рис. 7.32. Схема колонны
системы О2—Ar—N2 с координатами — х} и у2 — х2 (jq и х2 —
молярные доли О2 и Аг в жидкости; yi и у2 — молярные доли
этих же компонентов в паре). На диаграммах нанесены равновес-
ные линии постоянного содержания О2 и Аг в паре (у. и у2 )
[15,16].
Рассмотрим расчет процесса разделения на примере колонны,
изображенной на рис. 7.32, она по разделительному действию
соответствует колонне 1 на рис. 7.18. В колонну поступает смесь
М, из колонны отводятся продукты разделения — жидкости R
и Da. Молярные доли О2, Аг и N2 в смеси равны соответственно
хмх, ХМ2 и хмз- Определим составы получаемых продуктов; при
этом зададимся полным составом одного из продуктов разделе-
ния и содержанием кислорода в другом продукте. Зададимся
составом продукта Da (т.е. xDX, xD2, xD3)\ тогда молярную долю
аргона в кубовой жидкости определим из уравнения материаль-
ного баланса колонны по аргону: xR2 = (М хМ2 - Da xD^)/R.
Молярную долю азота в жидкости найдем из равенства (5.21)
с учетом принятых обозначений, задаваясь значением (т.е.
молярной долей О2 в жидкости R): xR3 — 1 - xRl - xR2.
Координаты полюса определим так же, как указано ранее при
расчете процесса разделения бинарной смеси. Для участка колон-
ны, расположенного над сечением а—а, найдем:
G-g = Da; Gyx - gx}- DaxD1; Gy2- gx2= DaxD2, (7.80)
где x и у — молярные доли О2 или Аг в жидкости и паре; индекс
1 относится к кислороду, индекс 2 — к аргону.
30* 467
Координаты полюса Рх вычислим из выражений (7.80) с
учетом зависимости (7.47): = (G}\ - gx^/lG - g) — xD ।;
Л2 = (G y2 - gx2)/(G - g) = Хд2. Для указаний, к какой части
диаграммы у—х относится полюс Pv в индексе обычно ставят
вторую цифру в соответствии с принятым ранее обозначением
компонента. Так, если полюс размещен на кислородной части
диаграммы у, — хр то его обозначают Р]р если на аргонной
части диаграммы у2 — х2, то его обозначают Р|2. При = л01 и
л2 ~ 113 зависимостей (7.80) определим значения у, и у9:
у, — yD| = xD( и у, = yD2 — xD2. Следовательно, абсциссы полюсов
и Л? Равны ltK ординатам.
Для изображения на диаграмме рабочих линий необходимо
знать флегмовое отношение /, определяющее тангенс утла накло-
на а рабочей линии к оси Л' (см. рис. 7.30). Так как флегмовое
отношение изменяется по высоте колонны, то для повышения
точности расчета обычно вносят поправку. Значения флегмового
отношения необходимо уточнять прежде всего в сечениях колон-
ны, для которых рабочая линия на диаграмме близка к равновес-
ной; можно принять среднее значение флегмового отношения
или две рабочие линии для верхнего и нижнего участков рассмат-
риваемой секции колонны 115]. Пусть флегмовое отношение для
колонны/] — tg а = где &1 и ^1 — средние расходы флегмы
и пара для сечений рассматриваемой колонны.
Угол наклона о. рабочих линий к оси х на обеих частях диа-
граммы (y’j — a'j и у2 — х2) одинаковый. Зная угол наклона о. и
полюсы Рц и Рп, можно построить рабочие линии. Рабочая
линия на части диаграммы У] — а^ ограничена точкой Rv для
ее построения надо знать координаты хЛ| и уЛ|. Обычно значе-
ние А'Л ] задают, а уЛ] находят по диаграмме г — х для бинарной
смеси О2 — N2. Для этого на диаграмме (см. рис. 7.13, а) отме-
чают полюс Р и точку Л, характеризующую кубовую жидкость.
Затем проводят полюсную линию PR и находят точку' пересече-
ния R' этой линии с изобарой конденсации. Абсцисса точки R '
(у — УR) характеризует молярную долю N, в паре, поступающем на
нижнюю тарелку; молярная доля О2 в этом же паре уЛ1 = 1 -yR.
Если воздух подается в куб колонны в состоянии сухого насы-
щенного пара, то точка Л/, характеризующая состояние воздуха,
совпадает на диаграмме с точкой R ’ (при этом yR = 79,1% N2
или уЛ1 = 20,9% О2).
Число теоретггчесюгх тарелок определяют, выполняя построе-
ние из полюсов Рп и Р{2 (см. рис. 7.30) до тех пор. пока содержа-
ние аргона в жидкости, стекающей с тарелки, не станет равным
468
содержанию аргона в жидкости R (допустимо небольшое отли-
чие — примерно до 0,1% Аг [14, 15]). Если полученное значение
сильно отличается от xR7, то расчет повторяют, задавшись новым
содержанием аргона в жидком азоте.
Построение выполняют следующим образом. Из полюса
проводят вертикаль до пересечения ее с линией равновесных
долей аргона у,р = у,(1) (см. рис. 7.31); ордината полученной
точки пересечения / характеризует молярную долю кислорода в
жидкости Aj111, стекающей с верхней (первой) тарелки. Анало-
гично на части диаграммы у, — а7 из полюса Р]2 проводят верти-
каль до пересечения ее с линией равновесного содержания
кислорода в паре у. ~ У]'1’ и определяют содержание аргона в
жидкости а\(|), стекающей с первой тарелки. Далее из точки 1
на обеих частях диаграммы проводят горизонтальные линии до
пересечения их с рабочими линиями (жирные линии). Абсциссы
точек пересечения характеризуют молярные доли кислорода и
аргона в парах у/2’. у,(2\ поднимающихся от второй тарелки к
первой. Таким образом, проводя построение прямоугольных
треугольников между рабочей и соответствующими равновес-
ными линиями (у1р, у7р), определяют число теоретических таре-
лок. Положение вершин прямых углов треугольников на равно-
весных линиях зависит от содержания аргона и кислорода в паре.
Кроме того, так как содержание аргона в паре и жидкости при
переходе от верхней тарелки к нижней сначала увеличивается,
а затем уменьшается, то треугольники, характеризующие измене-
ние состава смеси на теоретической тарелке, в правой части
диаграммы (см. рис. 7.30) при построении сначала смешаются
вверх, а затем вниз к точке /?2. Точка /?2 лежит на рабочей линии
и имеет ординату xR2. Число треугольников соответствует числу
теоретических тарелок. Число действительных тарелок опреде
ляют по формуле (7.44).
Рассмотрены только основы метода расчета. Методика расчета
значительно сложнее |8, 14 -16|. Графические расчеты исполь-
зуют для определения предварительных рекомендаций; вследст-
вие их большой трудоемкости и недостаточной точности расчеты
ректификационных колонн для разделения тройной смеси в
настоящее время выполняют с помощью ЭВМ; при этом могут
быть вычислены термодинамически оптимальные значения рабо-
чих характеристик колонны, включенной в установку’. При
расчете ректификационной колонны ВРУ определяют изменение
концентраций компонентов на каждой тарелке с учетом конст-
руктивных характеристик тарелок, а также с учетом изменения
4б9
свойств потоков пара и жидкости и коэффициентов эффектив-
ности по всей высоте колонны. Подробнее см. работы [12, гл. I; ’
14, §2.4].
§ 7.10. ПРОЦЕССЫ СОРБЦИИ И ИХ ПРИМЕНЕНИЕ В
КРИОГЕННОЙ ТЕХНИКЕ
Физическая сущность сорбции. Сорбция — поглощение »
веществ, входящих в состав одной фазы, веществом другой фазы.
Поглощаемое вещество, находящееся в газовой или жидкой фазе,
называют сорбтивом, а после перехода в сорбированное состоя- [
ние — сорбатом. Вещество, на поверхности или в объеме
которого произошло концентрирование поглощаемого вещества,
называют сорбентом.
Сорбцию принято разделять на химическую и физическую.
Химическая сорбция (хемосорбция) сопровождается химическим
взаимодействием между сорбатом и сорбентом с образованием
химического соединения на поверхности сорбента. Хемосорбция
может распространяться с поверхности на весь объем сорбента.
Примером хемосорбции является поглощение кислорода поверх-
ностью металлов, в результате чего образуются окисные пленки.
Физическая сорбция не сопровождается образованием новых
химических соединений и обусловлена силами взаимного притя-
жения молекул сорбента и сорбата. Различают процессы абсорб-
ции — поглощение вещества, сопровождающееся диффузией его
в глубь абсорбента, с образованием раствора и адсорбции —
поглощение газа или жидкости адсорбентом с развитой внутрен-
ней поверхностью или большим объемом микропор. Здесь
рассматриваем только процессы адсорбции, так как они более
широко используются в криотехнологии.
В результате притяжения содержание газообразного вещества
на поверхности адсорбента становится больше, чем в газовой
фазе. В этом случае говорят, что газ адсорбируется поверхностью
твердого тела. Адсорбция — процесс, полностью обращаемый.
Обратный процесс, т.е. удаление молекул газа из адсорбента,
называют десорбцией. В подавляющем большинстве случаев
адсорбция — процесс экзотермический, и выделяющуюся при
этом теплоту называют теплотой адсорбции. В этом случае
десорбция — процесс эндотермический. В некоторых случаях,
например при адсорбции на полимерах, процесс поглощения
является эндотермическим.
470
Для технического применения создают специальные адсор-
бенты с развитой поверхностью или микропористой структурой.
Взаимодействие между молекулами адсорбата и адсорбента
может иметь различный характер. При физической адсорбции
в общем случае проявляются межмолекулярные силы: электро-
статические и дисперсионные (обусловливающие притяжение
атомов и молекул) и силы отталкивания. Электростатические
силы проявляются при адсорбции полярных молекул на поверх-
ностях, несущих постоянные электростатические заряды (ионы,
диполи), а также в случае, когда заряды молекул на поверхности
адсорбента вызывают появление дипольных моментов у неполяр-
ных молекул адсорбата, или наоборот, заряды молекул адсорбата
вызывают появление дипольных моментов в адсорбенте (индук-
ция). Дисперсионные силы обусловлены согласованным движе-
нием электронов в сближающихся молекулах. Вследствие
движения электронов все молекулы обладают флуктуирующими,
т.е. колеблющимися по направлению, отклонениями электрон-
ной плотности от среднего значения. В результате флуктуации
электронной плотности в молекулах образуются флуктуирующие
диполи, квадруполи и др. При сближении молекул взаимодейст-
вие флуктуирующих диполей, квадруполей вызывает притяжение
молекул. Силы, вызывающие это взаимодействие, получили
название дисперсионных или электрокинетических, так как они
вызваны отклонениями от средней по времени симметрии. При
нарушении симметрии на некоторое время может возникнуть
дипольный или квадрупольный момент. Силы отталкивания
проявляются при таком сближении молекул (атомов) адсорбата
и адсорбента, при котором начинается взаимное проникновение
электронных оболочек атомов. Характер этих сил связан с прин-
ципом Паули, запрещающим нескольким электронам находиться
в одном и том же состоянии. Возникающие силы отталкивания
весьма значительны в условиях непосредственного контакта
частиц и быстро убывают с увеличением расстояния (Ц)Т ~ г'12).
В процессе адсорбции силы притяжения (электростатические и
дисперсионные) уравновешиваются силами отталкивания.
В состоянии адсорбционного равновесия молекулы адсорбата,
удерживаемые на поверхности адсорбента, непрерывно заменя-
ются новыми молекулами, но общее их число не изменяется.
Молекулы адсорбата, удерживаемые на поверхности адсорбента,
могут мигрировать по поверхности. При определенных условиях
молекулы покидают поверхность, и их место занимают другие
молекулы. Таким образом, при адсорбционном равновесии поток
471
молекул к поверхности адсорбента равен потоку молекул от
поверхности. Если на поверхности адсорбента удерживается один
слой молекул адсорбата, адсорбцию называют мономолекуляр-
ной, если несколько слоев — полимолекулярной.
Адсорбенты. Все адсорбенты, природные и синте-
зированные, разделяют на непористые и пористые. К непорис-
тым относят адсорбенты, радиусы кривизны поверхности кото-
рых весьма велики и стремятся к бесконечности, например, это
графитированная сажа, однородная поверхность металлов, поли-
рованное стекло и т.д. Пористые адсорбенты имеют поры
различных типов. Акад. М.М. Дубинин ввел классификацию пор
адсорбентов: макропоры, переходные поры (мезопоры), микро-
поры и супермикропоры. Эффективные радиусы, нм: макропор —
100—200 (удельная площадь поверхности 0,5—2,0 м2/г), мезопор
1,8—100 (удельная площадь поверхности 10—400 м2/г), микропор
менее 1,5—1,6 (удельный объем 0,2—0,8 см3/г). Адсорбция на
поверхности макропор пренебрежимо мала, а сами макропоры
играют главным образом транспортную роль. На поверхности
мезопор происходит как мономолекулярная, так и полимолеку-
лярная адсорбция, завершающаяся объемным заполнением пор
по механизму капиллярной конденсации.
К пористым адсорбентам относят активные угли, силикагели,
алюмогели и гидратированные алюмосиликаты (цеолиты).
Активные угли (АУ) — пористые промышленные адсорбенты,
состоящие в основном из углерода — неправильно упакованных
сеток шестичленных углеродных колец. Их получают из различ-
ных видов органического сырья: твердого топлива различной
степени метаморфизма (фтор, уголь, антрацит), дерева и продук-
тов его переработки, отходов кожевенной промышленности и
др. В последние годы получили распространение так называемые
углеродные молекулярные сита (УМС), которые получают прес-
сованием порошкообразных битуминозного угля и специальных
смол или путем модификации промышленных АУ смолами.
Пористая структура углеродных адсорбентов представлена
гаммой пор всех размеров (табл. 7.4).
7.4. Типичное распределение пор в активных углях
Тип угля Удельный объем, см3/г
микропор мезопор макропор
АУ крупнопористые 0,1-0,2 0,6—0,8 0,4
АУ тонкопористые 0,6—0,8 0,1 0,3
Активный кокс 0,1 0,1 0,1
УМС 0,25 0,05 0,1
472
В зависимости от цели процесса выбирают структурный тип
угля.
Силикагели — высушенные гели кремниевой кислоты порис-
того строения с сильно развитой внутренней поверхностью. Гель
получают действием серной или соляной кислоты на раствор
силиката натрия; при этом выделяется гель состава Si О2 • п Н2О.
В силикагеле поры однородны и равномерно распределены,
размеры пор зависят от методов обработки в процессе его полу-
чения. Промышленность выпускает три сорта силикагелей раз-
личной пористости: микропористый (средний диаметр пор менее
2,0 нм), среднепористый (2,0 — 4,0 нм) и крупнопористый (5,0 —
8,0 нм). Силикагели применяют для осушки воздуха и газов,
улавливания паров органических соединений, разделения и
очистки газов и жидкостей, (например, тонкая очистка неоно-
гелиевой смеси от азота, очистка кубовой жидкости от углеводо-
родов и др.).
Алюмогели — смеси нормального гидрата окиси алюминия
А1(ОН)3 с полигидратами окиси алюминия. По сорбционным
свойствам близок к силикагелю, но в отличие от него стоек к
воздействию жидкостей. Применяется как осушитель, адсорбент
для хроматографии, катализатор или носитель активных центров.
Цеолиты — кристаллические гидратированные алюмосили-
каты — встречаются в природе (около 36 типов) и могут быть
синтезированы. Состав цеолита в общем виде можно выразить
формулой: А12О3 • п Si О2 • (Rt • R2) • О2 • т Н2О, где R, — однова-
лентный катион (Na+, К+ и др.); R2 — двухвалентный катион
(Са++, Ва++ и др.).
Известно около 100 разновидностей синтетических цеолитов,
однако практическое значение имеют лишь несколько типов.
Промышленность выпускает цеолиты с кристаллической решет-
кой трех типов А, X, Y. В зависимости от преобладающих
катионов цеолиты обозначают NaA, КА и т.д. Цеолиты —
типичные микропористые адсорбенты, размеры входных окон
в полости, образованных каркасом, соизмеримы с размерами
молекул. Ниже приведены обозначения цеолитов общего назна-
чения по классификациям СССР и США.
Классификация СССР....................КА
Классификация США....................ЗА
Диаметр входного окна d- 1О10, м......3
NaA СаА СаХ
4А 5А 10Х
NaX
13Х
9
4 5 8
В табл. 7.5 приведены усредненные значения свойств рассмот-
ренных типов промышленных адсорбентов.
473
7.5. Свойства промышленных адсорбентов
Адсорбент Рн> кг/м3 Рисг’ кг/м3 к Вт/(м-К) С, кДж/(кг • К) М2/г %. см3Д' d3, нм
цеолиты 600- 900 2100— 2400 0,9 1,25 1100— 1500 0,205 —0,235 0,3 —5
активные уши 200— 600 1750— 2100 0,17- 0,29 0,84 500— 1200 0,2- 0,5 1—7
силика- гели 100- 800 2100— 2300 0,20 0,92 300- 700 — 1-7
алюмо- гели 350— 850 3250— 3500 — — 200— 400 — 1-7
* Данные рентгенострукгурного анализа.
В табл. 7.5 приняты обозначения: рн — насыпная плотность;
рисг — истинная плотность; к — теплопроводность адсорбента; i
С — удельная теплоемкость адсорбента при 30 °C; 5уд — удельная
поверхность; Wo — предельный объем адсорбционного простран-
ства; d3 — размер гранул. Более подробную характеристику
промышленных адсорбентов можно найти в монографии [47].
Основные уравнения равновесной адсорбции индивидуального
вещества. В 1928 г. Гюккель предложил называть зависимость
между величиной адсорбции а, давлением газа р (или концентра-
цией с) и температурой Т термическим уравнением адсорбции:
F (а, р, Т) = 0. (7.81)
В частных случаях получим уравнения:
изотермы адсорбции (Т — const)
FT(a, р) = 0; (7.82)
изобары адсорбции (р = const)
Fp (а, Т) = 0; (7.83)
изостеры адсорбции (а = const)
Г„(ЛГ) = 0. (7.84)
На практике процесс адсорбции (или десорбции) обычно
протекает в условиях, близких к изотермическим, поэтому урав-
нение изотермы адсорбции является наиболее важным. Известно
шесть типов изотерм адсорбции (рис. 7.33) Они определяют
474
Рис. 7.33. Типы изотерм адсорбции
процесс адсорбции в следующих характерных случаях: мономоле-
кулярная адсорбция (тип /); полимолекулярная адсорбция (типы
II— VI); объемная адсорбция с заполнением микропор адсорбен-
та (типы I— VI); объемная адсорбция с заполнением промежу-
точных пор адсорбента и капиллярной конденсацией адсорбата
в порах (типы I— VI). Стрелки на рис. 7.33 соответствуют
направлениям процессов адсорбции и десорбции; ps — давление
насыщенного пара. Обычно изотермы адсорбции и десорбции
совпадают (типы I— И), но известны случаи, когда они не совпа-
дают, т.е. появляется сорбционный гистерезис (тип VI).
Пока нет единой теории равновесной адсорбции индивидуаль-
ного вещества, справедливой для известных адсорбентов в широ-
ком диапазоне изменения параметров а, р, Т. Разработаны раз-
личные теории равновесной адсорбции, содержащие определен-
ные допущения; в связи с этим та или иная теория удовлетворяет
только конкретному ряду систем адсорбат — адсорбент и спра-
ведлива только в определенной области изменения параметров
а, р, Т. Кратко охарактеризуем теории равновесной адсорбции
и их основные уравнения, которые получили наибольшую из-
вестность и наиболее широкое применение.
Уравнение Генри для изотермы адсор-
бции. При малых давлениях газа и содержании вещества в
газовой фазе величина адсорбции а пропорциональна давлению
или молярной доле адсорбата в газовой фазе:
а=Ктр, (7.85)
где Кт — константа Генри; р — давление адсорбата.
475
Это уравнение называют уравнением Генри для изотермы
равновесной адсорбции. В начальной области заполнений, когда
число адсорбированных молекул так мало, что их взаимодействие
отсутствует или незначительно, процесс адсорбции описывается
уравнением Генри. В связи с этим любое теоретическое урав-
нение изотермы равновесной адсорбции в пределе (при р 0)
должно переходить в уравнение Генри. Константа Генри Кг
зависит от температуры, химической природы компонентов
системы адсорбент — адсорбат и определяется выражением
In Ar = (q/R) Т } + с, (7.86)
где q — дифференциальная теплота адсорбции; R — газовая
постоянная; с — постоянная инте1рирован1£я.
При наличии семейства изостер адсорбции, линейных в коор-
динатах 1п р — Г1, дифференциальная теплота адсорбции опре-
деляется тангенсом угла наклона изостеры согласно уравнению
Клапейрона Клаузиуса
<?//?=-(Э In р/ЭТ ^. (7.87)
Значения констант Генри обычно определяют эксперимен-
тально; расчетным путем на основе молекулярной статистики
удалось определить значения констант для ограниченного числа
систем адсорбат — адсорбент.
В табл. 7.6 приведены экспериментальные значения констант
Генри, полученные в совместных работах МГТУ им. Баумана и
ИФХ РАН.
Уравнение Фрейндлиха для изотермы
а д с о р б ц и и. В L909 г. Н.Фрейндлих предложил
эмпирическое уравнение изотермы адсобции чистого вещества:
а = к р]/п, (7.88)
где кип — константы, зависящие от температуры и химической
природы компонентов системы адсорбат-адсорбент, причем п
всегда положительное целое число (0 < 1/л < I).
Для удобства использования уравнение (7.88) представляют
lg а = 1g к + (л ’) 1g р. (7.89)
Тогда в координатах lg а — 1g р уравнение изотермы адсорбции
графически представляет собой прямую, тангенс угла наклона
которой дает значение константы 1/л , а отрезок, отсекаемый
прямой на оси координат, определяет 1g к.
47b
7.6. Константы Генри и теплоты адсорбции для различных систем
Система Т, К Хг-105, ММОЛЬ г-Па п -10 4, Па 4. кДж МОЛЬ
255,7 0,285 8,0
214,6 0,935 1,330
О,, - NaA 195,1 1,900 0,800 13,0
175,1 4,860 0,266
154,4 15,900 0,200
255,7 1,зз 1,330
N, - NaA 214,6 9,57 0,200 21,7
195,1 33,40 0,053
303,8 0,175 2,0
О2 - NaX 272,7 0,276 1,0 ю.ь
235,2 0,393 0,65
303,8 0,419 0.40
N, — NaX 272,7 1,119 0.25 18.7
235,2 2,127 0,14
Примечание pllp — давление, соответствующее верхней границе области
1 енри.
Уравнение Фрейндлиха часто хорошо описывает изотермы
адсорбции газов и паров на неоднородных поверхностях в
средней области заполнений адсорбционного пространства. С
повышением температуры константа (1/л) увеличивается,
приближаясь к предельному значению, равному I; при этом
значения к уменьшаются.
Уравнение изотермы адсорбции Л е н г -
м ю ра. В основе теории Ленгмюра, идеи которой опубликованы
в 1918 г., лежат три постулата: поверхность твердого тела
представляет собой набор равноценных в энергетическом
отношении адсорбционных центров; на одном адсорбционном
центре может адсорбироваться только одна молекула, т.е. на
поверхности образуется монослой адсорбированных молекул;
взаимодействием между адсорбированными молекулами можно
пренебречь.
В своих работах И. Ленгмюр дал кинетический вывод урав-
нения изотермы адсорбции; позднее М. Фолмер опубликовал тер-
модинамический вывод уравнений И. Ленгмюра, а Р. Фаулер и
477
Э. Гуггснгейм получили это уравнение методами статистической
физики. Уравнение изотермы адсорбции Ленгмюра имеет вид
а=ат bp/(l+ Ьр), (7.90)
где ат — предельная величина адсорбции при полном заполне-
нии мономолекулярного слоя на поверхности адсорбента; Ь —
константа уравнения Ленгмюра, которая зависит от температуры
Т и рода адсорбента.
Математически уравнение (7.90) представляет собой уравнение '
равносторонней гиперболы, причем возможны два предельных
случая:
bp « 1 — область малых значений р, при которых уравнение ;
(7.90) переходит в уравнение Генри для изотермы адсорбции:
а~атЬр = Кгр ; (7.91)
bp » 1 — область больших значений р; в этом случае
« = (7.92) ’
Уравнение Ленгмюра может быть применено к системам, в -
которых процесс не осложняется полимолекулярной адсорбцией,
адсорбцией в микропорах и капиллярной конденсацией. Эти 1
условия соблюдаются в случае адсорбции газов на непористых (
и крупнопористых адсорбентах при температурах выше критичес- ’
кой (Т > Тк ). В технической адсорбции уравнение вида (7.90) /’
применяют в качестве равновесного интерполяционного соот-
ношения при расчете кинетики и динамики процессов поглоще- ,
ния веществ слоем адсорбента.
Уравнение полимолекулярной адсорб-
ции БЭТ. Теория БЭТ (Брунауэра, Эммета и Теллера) явилась
следующим шагом развития теории Ленгмюра. Авторы изменили
второй постулат теории: на одном адсорбционном центре может
адсорбироваться не одна, а несколько молекул адсорбата при
этом во втором и последующих слоях адсорбированные молекулы
не взаимодействуют с твердым телом, а взаимодействуют только
одна с другой. Энергия взаимодействия адсорбированных моле-
кул характеризуется теплотой конденсации адсорбата. Теория
БЭТ создана для случая адсорбции паров, т.е. при температурах
Т < Тк. Уравнение изотермы БЭТ имеет вид
а =________°" С- , (7.93)
(1 - P/Pt) [1 + (с - 1) р/р,\
478
где с = g exp [(^ - L)/{R /)] — константа (g — энтропийный
множитель; qt — теплота адсорбции 7-го слоя; L — теплота кон-
денсации адсорбата); рх — давление насыщенного пара.
При малом отношении p/ps и с » 1 уравнение БЭТ преобра-
зуется в уравнение Ленгмюра (7.90). Если р/рх мало и с« 1, то
уравнение (7.93) переходит в уравнение изотермы адсорбции
Генри (7.85).
Уравнение БЭТ часто используют для определения удельной
поверхности адсорбентов. Для этого экспериментальную изо-
терму стандартного пара на исследуемом адсорбенте строят в
координатах p/ps - (р/р)/\а (1 - р/р)] уравнения БЭТ, представ-
ленного в линейной форме:
P/Ps 1 + с - \ р
a()~P/Ps) атс атс рх
(7.94)
В указанных координатах изотерма адсорбции — прямая,
отсекающая на оси ординат отрезок, равный 1/(ат с); тангенс
угла наклона прямой к оси абсцисс равен (с - l)/(«w с). Определив
для монослоя значение ат, легко найти площадь поверхности
адсорбента
= “т *а > (7-95)
где Na — число Авогадро; <»; — площадь, приходящаяся на
одну молеулу /-го адсорбата в плотном монослое.
Обычно при измерении удельной поверхности в качестве
адсорбента используют азот, эксперименты проводят при
Г = 77 К.
Уравнение БЭТ обычно хорошо выполняется в области
относительных давлений p/ps — 0,05...0,35.
Теория Полян и. Потенциальная теория Поляни
разработана в 1914 г. и сформулирована главным образом для
дисперсионных сил взаимодействия, которые не зависят от
температуры. М.Поляни исходил из предположения, что
адсорбированный газ или пар находится в сжатом состоянии под
действием сил притяжения, и ввел понятие адсорбционного поля
и адсорбционного потенциала. Адсорбционное поле — это объем
твердого или жидкого тела вблизи его поверхности, где действуют
в основном дисперсионные силы (объем адсорбционного
пространства). Каждой точке адсорбционного поля соответствует
адсорбционный потенциал е, который является функцией
расстояния от этой точки до поверхности адсорбента и представ-
ляет собой работу, необходимую для равновесного перехода
479
вещества из состояния пара или газа в адсорбированное состоя-
ние. М.Поляни постулировал, что при температурах ниже крити- f
ческой весь адсорбат на поверхности твердого тела находится в
жидком состоянии, т.е. объем адсорбционного пространства
а , где г>ж — молярный объем жидкости. Давление пара •
непосредственно над поверхностью адсорбированной жидкости
равно давлению ps насыщенного пара над жидкостью при нор- <
мальных условиях. Если газовую фазу, равновесное давление |
которой вдали от поверхности адсорбента равно р, считать
идеальной, то работа перехода газа с поверхности жидкого
адсорбата в равновесную газовую фазу, т.е. от давления р к >
давлению р (работа против адсорбционных сил), составит
е = J vdp = RTln(ps/p). (7.96) ;
Р
Это уравнение — основной вывод теории Поляни. Важным
положением теории Поляни является и то, что объем адсорб-
ционного пространства Wи адсорбционный потенциал е связаны
зависимостью £ = /(И^), называемой характеристической кривой,
которая не зависит от температуры. Инвариантность характерис-
тической кривой подтверждена экспериментально на многих
системах адсорбент — адсорбат, хотя есть случаи, когда она не
выполняется. Вместе с тем, характеристическая кривая зависит
от рода поглощаемого вещества. Отношение потенциалов е для
двух различных веществ на одном и том же адсорбенте при
равных адсорбционных объемах постоянно; это отношение
называют коэффициентом аффинности и обычно обозначают рв.
Коэффициент Ра может быть вычислен с помощью метода
П.А. Васьковского через отношение парохоров:
pfl = 7%/РЛ0, (7.97)
где Ph — парохор исследуемого вещества; Рй0 — парохор
стандартного вещества (чаще азота или бензола).
Инвариантность характеристической кривой позволяет вычис-
лять изотермы адсорбции любых веществ в области температур
Т < Тк по одной экспериментальной изотерме стандартного
вещества. Потенциальная теория применима к физической
адсорбции на неполярных поглотителях при поглощении непо-
лярных веществ, когда дисперсионная составляющая играет
определяющую роль в адсорбционном взаимодействии. В то же
время теория Поляни не дает уравнения для изотермы адсорбции
в явном виде.
480
Теория объемного заполнения микро-
пор (ТОЗМ). М.М. Дубинин с сотрудниками разработали
теорию равновесной адсорбции вещества на микропористых
адсорбентах; термодинамические аспекты этой теории разра-
ботаны Б.П. Берингом и В.В. Серпинским. Согласно ТОЗМ
адсорбция характеризуется объемным заполнением адсорбцион-
ного пространства микропор без последовательного образования
адсорбционных слоев. Основным геометрическим параметром
микропористого адсорбента является объем микропор, а не
площадь их поверхности. Рассматриваемая теория является
термодинамической, и в основу ее положены такие термодина-
мические функции, как свободная энергия, энтропия и энталь-
пия. Если для вычисления изменения этих функций в качестве
стандартного состояния принять объемную жидкую фазу адсор-
бата, находящуюся в равновесии с ее насыщенным паром при
давлении ps, или летучести fs, то дифференциальная максималь-
ная молярная работа адсорбции А равна по величине, но проти-
воположна по знаку изменению свободной энергии Гиббса Л (7:
А = - AG = A/ln (ps/p). (7.98)
В уравнении (7.98) и всех последующих выражениях неидеаль-
ность газовой фазы легко учесть, вводя летучесть вместо давле-
ния. Дифференциальная молярная энтропия адсорбата AS, отсчи-
тываемая от уровня энтропии, соответствующего адсорбируемому
веществу в виде жидкости при температуре опыта:
А5 = - (Э AG/anfl = (ал/аг)с. (7.99)
Изменение энтальпии А/ равно по абсолютному значению
дифференциальной теплоте адсорбции q: ч 1 1
А1 = - q~ AG+ TAS = - А + Т^А/ЪТ)а. (7.100)
Используя известный в математической статистике закон
распределения Вейбулла, М.М. Дубинин и В.А. Астахов получили
уравнение изотермы адсорбции в аналитической форме:
О = а/а0 = exp [- (AfE)n ], (7.101)
-
где 0 — степень заполнения объема микропор; а0 — предельная
величина адсорбции при температуре 7; Е — характеристическая
свободная энергия адсорбции; п — безразмерный параметр (при
адсорбции на углеродных адсорбентах п — 2, на микропористых
углях п = 3, на цеолитах п — 3...6).
31 Заказ № 1592
481
Зависимость А = Ef( 6; п) названа характеристической кривой. '•
Основные исходные положения ТОЗМ: постоянство объема 4
адсорбционного пространства, т.е. объема микропор адсорбента;
температурная независимость (инвариантность) харакгеристи-
ческой кривой (следствием является постоянство параметров Е
и п функции распределения); подобие характеристических
кривых для различных паров.
Первое исходное положение ТОЗМ позволяет определять
предельную величину адсорбции а0 при любой температуре Т,
если она определена при стандартной температуре То, по
уравнению
я0 = о° ехр [ - а (Т - Го)], (7.102)
где а® — предельная величина адсорбции при стандартной ;
температуре То (обычно принимают равной температуре тройной
точки); а — термический коэффициент предельной адсорбции,
который можно вычислить по физическим константам адсорбата.
Температурная инвариантность характеристической кривой
означает, что зависимость дифференциальной молярной работы
адсорбции от степени заполнения 6 одна и та же для всех темпе-
ратур данной системы адсорбат—адсорбент. Термодинамически
установлена нижняя граница строгого соблюдения температурной
инвариантности 0 — 0,15...0,20. При степени заполнения 0 < 0,15
расчетный аппарат ТОЗМ неприменим даже в относительно
нешироком температурном интервале. Подобие характеристичес-
ких кривых для различных паров позволяет рассчитать изотерму
адсорбции любого пара по одной измеренной стандартной изо-
терме адсорбции с помощью коэффициента аффиности (см.
7.97).
В рамках основного уравнения ТОЗМ (7.101) дифференциаль-
ные молярные энтропия и энтальпия адсорбции согласно уравне-
ниям (7.99) и (7.100) имеют вид:
ДА = - (а Е/п) (In 0)1/п *1 ; (7.103)
А/ = - q = - Е [(In 0)1/" + а 7/n)(ln 0) х’п'1 ]. (7.104)
При п — 2 уравнение (7.101) переходит в известное уравнение
Дубинина—Радушкевича:
а = а„ ехр { - В (Т2/₽2 )[lg (ру/р)]2 ), (7.105)
где В = — константа.
482
Дальнейшее развитие ТОЗМ было направлено на область
адсорбции газов при температурах Т > Тк. Если химический
потенциал адсорбтива в стандартном состоянии определяется
некоторым параметром Z, а не давлением ps, изменение энергии
Гиббса
AG = R Т In (Z/p) . (7.106)
В этом случае уравнение изотермы ТОЗМ имеет вид
а = а0 ехр { - [RT Ел In (Z/p)]2 }, (7.107)
При условии линейности изостер адсорбции в интервале
температур Т < Тк и Т > Тк, найдем параметр Z, определяющий
стандартное состояние газа при Т > Тк :
In Z = к----< с-----\ In
Т I R '
«о ехр [ - а (Т - То)]
}, (7.108)
где к и с — константы уравнения изостеры адсорбции In р =
= к - с/Т.
Полученные приближенные уравнения (7.107) и (7.108) позво-
ляют рассчитать изотерму адсорбции вещества при наличии
минимальной экспериментальной информации для области
температур Т > Тк (необходима только одна точка изотермы).
Пример 7.1. Разработать алгоритм расчета серии изотерм адсорбции при
температурах 7j, Тг и Тг некоторого вещества на выбранном адсорбенте, для
которого известна изотерма стандартного пара (азота) при То.
1. Определяем предельную величину адсорбции стандартного пара путем
экстраполяции (или интерполяции) равновесной величины адсорбции а(р, То) в
область высоких относительных давлений (p/ps > 0,3), в которой она практически
постоянна.
2. По уравнению (7.101) определяем величину адсорбции для харак-
теристической точки при A sE(Q= 1/е); a = ар 0,368 ай(Т^.
3. По стандартной изотерме а (р, То) определяем значение ре, соответствующее
= «<• <Ре> 70).
4. Определяем характеристическую энергию стандартного пара: Ео = 1,989 То х
х In (pes/ ре).
5. По нескольким точкам стандартной изотермы адсорбции определяем
параметр л(. = lg (а0 (А,/Ео), тде Л(. определено по формуле (7.98). Полученное
значение округляем до ближайшего целого числа п.
6. Уточняем параметры а0 и Ео по линейной зависимости при известном
значении и: lg а = lg а0 - 0,434 An/EJ, перестроив изотерму стандартного пара в
координатах 1g а — Ап.
7. Определяем коэффициент аффинности 0а ^Ph/Ph^.
8. Вычисляем характеристичускую энергию адсорбции данного адсорбата Е =
9- Определяем термический коэффициент предельной адсорбции: а — 1g (рх/
/рк)/[0,434 (Тк - 7’ЮП1)], где рж — плотность адсорбата в жидкой фазе при темпе-
483
31
ратуре кипения адсорбата 7^ и давлении р = 0,1 МПа; рк — плотность адсорбата
при Т- Тк
10. По уравнению (7.102) вычисляем значение нового вещества для заданных
температур 7j, Т2, Ту По уравнению (7.101) рассчитываем изотермы адсорбции
заданного адсорбата при Tv Т2, и Ту
Основные уравнения равновесной адсорбции многокомпонент-
ных смесей веществ. Пракгичсеские задачи очистки и разделения
газов методом адсорбции сводятся к процессам взаимодействия
с адсорбентом не одного вещества, а двух и более. При изучении
равновесной адсорбции многокомпонентных смесей резко воз-
растают трудности, связанные с увеличением числа переменных,
характеризующих адсорбционное равновесие в многокомпо-
нентных системах, по сравнению с адсорбцией чистых веществ.
Состояние газовой смеси определяется давлением смеси, ее
температурой и составом, поэтому статическая емкость адсор-
бента по каждому компоненту является функцией всех трех
перечисленных параметров. Для Д’-компонентной смеси
равновесная адсорбция будет описываться системой термических
уравнений адсорбции вица:
Pv Pi’ Pn) ~
F2 (а2, Т, рх, р2, ..., pN) = 0; (7.109)
Pv Pi’ Pf^ ~
Основная задача теории адсорбции смесей заключается в
определении термических уравнений для смеси по известным
термическим уравнениям адсорбции компонентов. Эта задача
может быть сведена к определению изотерм адсорбции смеси
по изотермам адсорбции ее компонентов.
Теория равновесной адсорбции многокомпонентных газовых
смесей развивалась в направлении обобщения концепций, разра-
ботанных для случая адсорбции одного компонента на твердом
адсорбенте. Е.Маркгем и А.Бентон обобщили классическую
модель Ленгмюра на случай адсорбции бинарных смесей, сохра-
нив постулаты, положенные в основу модели
а\ = aml blPl I U + Ь1 Pl + biPi>’ (7.110)
ai = ami bi Pi / G + bl Pl + bi Pi)-
484
Уравнения (7.110) — (7.111) содержат константы, определен-
ные по изотермам чистых газов. Позднее была показана некор-
ректность уравнений (7.110) — (7.111), в частности, согласно
модели Ленгмюра должно выполняться условие ат = ami = ат2.
С учетом этой поправки уравнения (7.110) — (7.111) часто
применяют для практических расчетов адсорбации двухкомпо-
нентных смесей на крупнопористых адсорбентах. Теория БЭТ
была обобщена на случай адсорбции газовой смеси Т. Хиллом,
а позднее Б.П. Берингом, ТОЗМ (в варианте Дубинина —
Радушкевича) на случай адсорбции смеси паров — Б.П. Берингом,
В.В. Серпинским и С.И. Суриновой.
Уравнение адсорбции многокомпонентной смеси паров,
полученное в обобщенной теории объемного
заполнения микропор. Величину суммарной адсорбции
компонентов смеси по заданным равновесным парциальным
давлениям д, и индивидуальным изотермам адсорбции при той
же температуре с учетом свойств объемных растворов этих
компонентов можно определить по уравнению
а = Е а{ = СХР I - 1g — ] (7.112)
I 2-i xi xt Pj / i Pj
i i
где xt — молярная доля z-го компонента в адсорбционном
растворе при равновесном парциальном давлении д; vt —
молярный объем компонента i в смеси; |3( — коэффициент
аффинности компонента i.
Уравнение (7.112) позволяет определить только суммарную
величину адсорбции компонентов. Для нахождения парциальных
величин адсорбции необходимо еще одно уравнение, в качестве
которого авторы использовали полуэмпирическое уравнение
Льюиса, хорошо выполняющееся для ряда систем. При постоя-
ном общем давлении р^ = рх + р2 = const величины адсорбции
компонентов бинарной смеси а} и а2 связаны соотношением
ат1аг~ (7.113)
где «Р и а2 — величины адсорбции, определенные по индиви-
дуальным изотермам адсорбции при давлении р^ = р2 — р^
Так как ах ,тос помощью уравнений (7.112) и (7.113)
можно определить все параметры адсорбционного равновесия
бинарной смеси паров. Этот метод расчета адсорбции бинарных
смесей паров проверен на ряде экспериментально исследованных
систем: этил — диэтиловый спирт — активный уголь, хлороформ
485
— диэтиловый эфир — активный уголь, сероводород — пропан
— цеолит Na X и др.
Теория идеального адсорбционного раствора.
А. Майерс, Б.П. Беринг и В.В. Серпинский на основе термо-
динамического подхода разработали метод расчета равновесия
многокомпонентных систем. Для равновесной адсорбционной
системы дифференциал функции G (потенциал Гиббса) в изо-
барно-изотермических условиях
dG = о dS + ца d пл + Z |ik/ dnki = 0, (7.114)
где о — межфазное поверхностное натяжение; S — площадь
поверхности раздела фаз; па и nkj — число молей адсорбента и
z-ro компонента соответственно; ца и цк/ — химические потен-
циалы адсорбента и /-го компонента соответственно.
После интегрирования и преобразований уравнение (7.114)
принимает вид
nkid^ki= (7.115)
i
где Ф =о s/na - (ца - ца ); ца и ца — химические потенциалы
чистого и заполненного адсорбента.
В термодинамике растворов принято считать, что 5 ~ 0, и
поэтому членом с dS в уравнении (7.114) можно пренебречь. В
термодинамике адсорбции предполагается, что химический
потенциал не изменяется в процессе адсорбции (ра = const), т.е.
роль адсорбента сводится только к созданию внешнего по отно-
шению к адсорбату адсорбционного поля.
Функцию Ф для микропористых адсорбентов, когда можно
пренебречь площадью внешней поверхности кристаллов S, т.е.
принять о dS — 0, вычисляют по формуле
d<^ = Y,(nki/п&) d\iki = Y ak.d\iki. (7.116)
i i
Учитывая, что для идеальной газовой фазы — RT In pki
имеем „
Pki
Ф = R ТX J akl J(ln рй) . (7.117)
i О
Если известны аналитические зависимости изотерм чистых
компонентов — fk(p\), функцию Фъ для произвольного
компонента можно представить в виде
А Рк , О'
ФЛ° = R т J J(ln pk°) = R Т J ~~~^~dpk . (7.118)
о о Рк
486
Установлено, что для идеальных двухкомпонентных растворов
(коэффициенты активности компонентов адсорбционного раст-
вора ук = 1) на линии Ф = const выполняется соотношение
Льюиса (7.113). В этом случае в координатах а—а2 точки,
соответствующие условию Ф = const (d Ф = 0), лежат на прямой
и для парциальных давлений компонентов в газовой фазе спра-
ведливы соотношения:
Pi ~ xiPi° — + Р\ , Рг~ х2 Р2 ~ а + а Pi ’ (7.119)
где рх и р2 — парциальные давления компонентов в газовой фазе,
соответствующие величинам адсорбции а{ и а2; р® и р2 —
давления чистых компонентов в газовой фазе, равновесные
величинам адсорбции t/j0 и а2 чистых компонентов, лежащих
на линии Ф = const, проходящей через точку {ар а2}.
Пример 7.2. Определить, при каких парциальных давлениях гелия рг и неона
р2 величины адсорбции этих газов (из смеси) на угле АГ-2 при температуре
Т = 77 К будут сответственно равны oj = 1 см3 /г и а~2 = 60 см3 /г. Изотермы
адсорбции чистых гелия и неона описываются уравнениями Фрейндлиха (7.88):
а® = 0,01 • (р®)°’93 и = 0,79 • (р® )0,68, хде а® и а2 в см3/г (объем приведен к
нормальным условиям), р® и р® в мм рт. ст.
1. Находим в общем виде зависимость функции ФА(. для чистых компонентов
от величины адсорбции:
Ф(» = -Д- dPl° = RT$ kl dp° = -^—RT;
о А° о Р1° Й1
f д,® д/
Ф2® = RT J Ц- dp2® = — RT.
о Рг «2
2. Из условия Qt® = Ф2® = 0 находим зависимость а2° от на линиях
Ф = const:
а1°/и1 = ^/«2 ИЛИ °2° = «2 °1°/Л1 •
3. Совместив последнюю зависимость и уравнение Льюиса (7.113), получаем
д,® = а{ + nv д2/и2; Cj® = tij + «2 .
Линия Ф = const определяется двумя точками {аД 0} и {а р а2}. Значение
доопределяем путем подстановок заданных значений a t и а2.
4. Определяем давления р t° и р 2® для значении адсорбции a t® и а 2 (на
линии Ф = const):
а f - ot + -3^ = kt (р,0)"’; a1°=c2 + -^-fli=A2<b0>2'’
F?=t^-<»2
*1 «2 *2 "1
487
)
5. Вычисляем парциальные давления гелия и неона в смеси, используя
уравнение изотермыр, = а( /(ах + Cj):
_ а. г 1 — И1 — 11/и'
Р! = —----——(ot + —fl2) =
a j + а 2 1 кх Wj J
1,0 г 1 0,93 f/o.93
--------- -------( 1,0 +------60,0 ) <= 268 мм рт. ст. « 36 кПа;
1,0 +60,01 0,01 0,68 *
_ 60,0 г 1 0,68 ]М0.«8
р 2 =----------- --------( 1,0 +--------60,0 ) “ 580 мм рт. ст. •» 77 кПа.
1,0 + 60,01 0,79 0,93 J
Полученные значения давления р t и р 2 близки к реальным: отношение
объемов неона гелия в сыром неоне при разделении неоно-гелиевой смеси
составляет примерно 3:1.
Коэффициент разделения смеси. При равновесной адсорбции
под термодинамическим коэффициентом разделения понимают
величины
(1-х,)/^. ’
(7.120)
где xt и у.{ — молярные доли /-го компонента соответственно в
адсорбционном растворе и газовой фазе.
В общем случае коэффициент разделения зависит от температу-
ры, давления смеси и состава газовой фазы, т.е. а = у(Т. рш, у;.).
В области малых заполнений адсорбционного пространства,
когда реализуется закон Генри, коэффициент разделения
определяется отношением констант Генри индивидуальных
изотерм адсорбции компонентов. Для бинарной смеси газов
а Лр|/
(7.121)
где ХГ1 и — константы Генри компонентов 1 и 2.
Нетрудно показать, что если изотермы адсорбции газов
описываются уравнением Ленгмюра, то коэффициент разделения
также не зависит от давления и состава газовой смеси и опреде-
ляется отношением констант Генри, т.е. уравнением (7.121).
Температурная зависимость констант Генри определяется уравне-
нием (7.86), следовательно, зависимость коэффициента разделе-
ния от температуры для бинарной смеси газов имеет вид
1П а = (?2° - + In (<i/q), (7.122)
где qU, q£ — начальные значения дифференциальной теплоты
адсорбции чистых компонентов смеси; ср с2 — константы.
488
Для идеальной газовой фазы уравнение (7.120) имеет вид
а = (Pi/P2) (а^г)- С-123)
Если это выражение прологарифмировать, а затем продиффе-
ренцировать по параметру Т 1 при ах — const и а2 = const получим
(Э In а\ / Э In \ / Э In р, \ а, - а.
------ = ------9- - -----гЧ = , (7-124)
\ ЭГ’1 ХЭГ’1 /°1>а2 R
где qx и q2 — значения дифференциальной теплоты адсорбации
компонентов 1 и 2 бинарной смеси газов.
Таким образом, во всей области температур, где изостеры
компонентов газовой смеси линейны, величина In а обратно
пропорциональна Т:
In а = (q2 - q^RT) + с (av aj, (7.125)
где с (ар а2) — константа интегрирования, не зависящая от
температуры и являющаяся функцией и а2 .
Изменение коэффициента разделения при постоянстве ах и
а2 однозначно определяется разностью qx и q2 . Так, согласно
экспериментальной температурной зависимости коэффициентов
разделения смеси N2 и О2 на различных адсорбентах (рис. 7.34)
при qx > q2 (для углеродного сита УМС-4А) а увеличивается, а
при qx < q2 (для цеолитов NaA, СаА, NaX) а уменьшается с
повышением температуры. На сите УМС-4А при температуре
244 К (точка А) разделения смеси N2 — О2 не происходит (а = 1).
При адсорбции смеси неидеальных газов коэффициент разде-
ления не может определяться уравнением (7.125), поскольку зна-
чения дифференциальной теп-
лоты адсорбции компонентов
смеси даже при линейных изо-
стерах зависят от всех термо-
динамических параметров, в
том числе и от температуры.
Зависимость коэффициента
разделения от давления смеси
и ее состава в общем случае
адсорбции неидеальной газовой
смеси изучена мало. Экспери-
ментально исследована эта за-
висимость для адсорбции смеси
N2 — О2 на цеолитах. В резуль-
Рис. 7.34. Температурная зависимость
коэффициента разделения смеси при
использовании различных адсорбентов:
1 — уголь УМС-4А; 2—4 — цеолиты
NaA (2), СаА (3) и NaX (4)
489
Рис. 7.35. Кинетические кривые алсорб
иии пара иди гача
тате показано, что при адсорб-
ции этой смеси на цеолите
NaX, СаА. СаХ коэффициент
разделения уменьшается с уве-
личением давления, причем это
уменьшение более существенно
при низких температурах.
Кинетика адсорбции. Процесс адсорбции всегда происходит
с конечной скоростью. Скорость поглощения вещества зависит
от природы и пористости адсорбента, внешних параметров (тем-
пературы, давления и др.) и свойств самого вещества. Кинетика
адсорбции изучает скороеib поглощения вещества единичными
гранулами адсорбента или тонкими слоями толщиной в одну-
две гранулы при постоянных значениях р и Т.
Зависимость величины адсорбции а от времени г называют
кинетической кривой (рис. 7.35; ор — равновесная величина
адсорбции).
В большинстве случаев для описания кинетики адсорбцион-
ного процесса может быть использована диффузионная модель
перемещения адсорбтива в пористой среде и соответственно
следующая система уравнений:
я=/(сг.; -^-з A(D. до, (7.126)
' Эт дт '
где а — величина адсорбции, кг/кг; с - - локальная концентрация
адсорбтива в среде, кг/м3; т время адсорбции, с; ZX коэф-
фициент внутренней диффузии адсорбтива в грануле адсорбтива,
м2/с.
Система уравнений (7.126) применима для однороднопорис-
гых адсорбентов при допущении о наличии локального равнове-
сия в каждой точке гранулы адсорбента. Уравнения (7.126) также
справедливы для гранул с бидисперсной пористой структурой в
случае, когда скорость процесса адсорбции лимитируется диффу-
зией во вторичной пористой структуре (транспортные поры).
Дтя микропористых адсорбентов или бидисперсных адсорбен-
тов с определяющей диффузией в микропорах (Di » Da) приме-
няют уравнение вида
Эо/Эт = Da к1 a , (7.127)
где Da — коэффициент диффузии в микропорах.
490
Если коэффициент Da сравним с Р( используют систему
(7.126); при этом вводят эффективный коэффициент диффузии
£>)ф, определяемый для линейной изотермы соотношением
•= Р,/(1 + Кг), где Кг = ка/кс.
Внешнедиффузионный процесс. В реальных
условиях большое влияние на процесс поглощения вещества
оказывают условия течения газа. Для слоя из зернистого
материала ламинарный режим сохраняется, если критерий
Рейнольдса Re < 20 , турбулентный режим — если Re > 200,
при 20 < Re < 200 возникает переходный режим. Если предполо-
жить, что адсорбция происходит мгновенно, а диффузия молекул
адсорбтива между кристаллами адсорбента совершается значи-
тельно быстрее, чем приближение молекул адсорбтива к поверх-
ности адсорбента, то внешнедиффузионный массообмен является
лимитирующим в кинетике адсорбции. В этом случае уравнение
кинетики адсорбции имеет вид;
рн dajdx = Ро (с - с ), (7.128)
где рн — насыпная плотность адсорбента, кг/м3; Ро — фиктивный
коэффициент массоотдачи, отнесенный к I м слоя, с1; с —
концентрация адсорбтива в газовом потоке, кг/м'; с — концент-
рация в газовой фазе адсорбтива. находящегося в равновесии с
поглощеным веществом, кг/м'.
Основная задача кинетики адсорбции — определение кинети-
ческих коэффициентов для использования их в уравнениях
динамики адсорбции, поэтому разумным подходом к решению
этой задачи является определение кинетических коэффициентов
при изучении динамики адсорбции. Кинетический коэффициент
обычно определяют из опытов по изучению начальной (первой)
стадии динамики адсорбции, которая описывается уравнением
с/с0 = exp (-р., L/м-), (7.129)
где с0 — содержание адсорбтива на входе в слой адсорбента;
с — содержание адсорбтива, равновесное с поглощенным веще-
ством; р, — эффективный кинетический коэффициент; L
длина слоя адсорбента; и’ — скорость газового потока.
При наличии продольного переноса компонента, обусловлен-
ного молекулярной диффузией, коэффициент массоотдачи Ро
уменьшается; в этом случае вводят эффективный коэффициент
р, = и- ( J 1 + 4 Ро £)‘ к'2 - 1) / (2 Z)’), (7.130)
491
где w — скорость газа, отнесенная к площади полного сечения
аппарата, м/с; Ро = 0 /, ₽ — коэффициент массоотдачи,
м3/(с • м2); / — удельная площадь поверхности массообмена,
м2/м3; D* — коэффициент продольного переноса (обычно
if < 0,5 м> d9; d3 — эквивалентный диаметр зерна адсорбента, м).
В практических расчетах, если неизвестно точное значение
коэффициента ро для данной системы, его определяют по эмпи-
рическим критериальным уравнениям
Num - 0,883 Re0’47 Ргте0’33 (Re < 30); (7.131)
Num = 0,53 Re0-64 Prm0’33 (30 < Re < 150). (7.132)
где Num = Рэ d JD; Re = vv rf3/v; Prm = v/Z), причем D — коэф-
фициент молекулярной диффузии компонента в смеси, м2/с;
v — кинематическая вязкость газа, м2/с.
Внутридиффузионный процесс. Внутридиффу-
зионный процесс лимитирует скорость процесса поглощения
вещества при сравнительно больших скоростях газового потока.
В этом случае для практических целей используют приближенное
уравнение кинетики адсорбции — уравнение Глюкауфа
da/di = р. (а* - а), (7.133)
где Р, — кинетический коэффициент внутренней диффузии;
а — величина адсорбции, равновесная текущей концентрации
адсорбтива в потоке внешней поверхности гранул.
Кинетический коэффициент внутренней диффузии зависит от
диаметра зерна адсорбента, степени его заполнения 0, типа ад-
сорбента и природы адсорбируемого вещества. С увеличением
степени заполнения значение pf уменьшается.
Если известен коэффициент внутренней диффузии кото-
рый обычно определяют по экспериментальным данным, то
коэффициент Р- можно вычислить по формуле
р, = 4 л2 D.J d2. (7.134)
Коэффициент внутренней диффузии можно также найти
расчетом:
Д= Кфг2/(п2^), (7.135)
здесь — коэффициент, зависящий от формы гранул (для про-
мышленных адсорбентов = 0,1 ... 0,6); т0 5 — время отработки
половины емкости гранулы.
492
Численное значение Dt при отсутствии молекулярно-ситовых
эффектов часто лежит в интервале (1 ... 20) 10'5 см2/с. Следует
иметь в виду, что коэффициент Dt носит формальный характер,
так как гранулы промышленных адсорбентов имеют не одно-
родную, а бидисперсную пористую структуру.
В общем случае, когда происходит и внешнедиффузионный,
и внутридиффузионный массообмен, уравнение кинетики ад-
сорбции имеет вид
da/di = рэ (а - а), (7.136)
где Рэ — определяется соотношением
1/₽э = !/₽„ + 1/₽, + (7.137)
Динамика адсорбции. Расчет процессов и аппаратов адсорб-
ционного разделения и очистки газовых смесей основан на
теории динамики адсорбции, задачами которой являются нахож-
дение функции распределения содержания адсорбированного
вещества в слое адсорбента во времени и определение содержа-
ния адсорбтива в газовой фазе. Решение этих задач сводится к
определению явного вида функций
aj=f(i, х, у, z) и с. = ф(т, х, у, z), (7.138)
где х, у, z — координаты слоя адсорбента; i — текущее время.
Искомые функции (7.138) можно найти двумя путями:
феноменологическим и статистическим. При феноменологи-
ческом подходе функциональные зависимости, характеризующие
динамику адсорбции, рассматривают с макроскопической точки
зрения. При статистическом подходе адсорбент рассматривают
как дискретную среду, через которую движется хаотический
ансамбль адсорбируемых молекул, а процесс динамики адсорб-
ции характеризуется вероятностными функциями распределения
частиц между подвижной и неподвижной фазами. В учебнике
процессы динамики адсорбции рассмотрены с позиций фено-
менологического подхода.
Полная система уравнений динамики адсорбции составлена
В.В.Рачинским. Система состоит из четырех уравнений гидро-
динамики (Навье—Стокса, неразрывности, состояния подвижной
фазы и распространения теплоты в потоке), определяющих про-
странственно-временное распределение поля скоростей и темпе-
ратур в потоке, и уравнений адсорбционного взаимодействия для
каждого компонента (баланса веществ, кинетики и статики
493
процесса), определяющих пространственно-временное распреде-
ление содержаний адсорбата и адсорбтива:
а) р ——— = F - grad р + ц V^w + — ц grad (div w);
от 3
б) dp/dx + div (р w) — 0;
в) р = р (ср с2, ..., с„, р, ТУ, (7.139)
N
г) с р ~~ = div (X grad Г)+ X й,- 7,- + ц Ф»Л ^cPiJi Erad '
uT uT i i
д) Эо./Эт 4- Эс /Эт + div (c. w) = DmJ (V2cf + x. V2T);
e) Ъа./Ът = v(q, c2, cn, a., w, T, p, p0, p.);
э*с) f;= ГДср c2, c„, of, T).
Здесь p — плотность смеси газов; w — вектор действительной
скорости потока; т — время; F — вектор напряжений от внешней
нагрузки; р — давление смеси газов; ц — динамическая вязкость;
Д2 — оператор: V2 = Э^Эх2 + Э^Эу2 + Э^Э^2; ct — содержание
z-го компонента; ср и cpi — теплоемкости смеси и z-го компонен-
та; Т — температура смеси газов; D/Эт = Э/Эт + wx д/дх +
+ wy д/ду + d/dz; X — теплопроводность; й, — энтальпия смеси
газов; 1{ — дополнительный массовый поток z-го компонента,
образованный в результате фазовых или химических превраще-
ний; Фн, — функция Рэлея; J. — диффузионный поток z-го »
компонента; at — величина адсорбции z-го компонента; Dmi —
коэффициент молекулярной диффузии z-го компонента; к. —
коэффициент термодиффузии; р0 и р,- — коэффициенты
внешнего и внутреннего массопереноса.
Уравнение Навье—Стокса записано в приближенном виде.
Коэффициент второй вязкости (по Ландау) принят равным нулю.
В правой части уравнения (7.139, г) первый член характеризует
перенос теплоты за счет теплопроводности, второй — наличие
источников теплоты, третий — выделяющуюся теплоту за счет
диссипации энергии движения (т.е. работы внутренних сил
трения), четвертый — диффузионный перенос теплоты.
В зависимости от конкретной задачи задают начальные и
граничные условия. Полная система уравнений (7.139) ввиду
494
сложности до настоящего времени не решена. Опубликованные
решения ограничиваются рассмотрением частных случаев при
пренебрежимо малом значении перепада давлений по слою
адсорбента. Наиболее изучена изотермическая модель процесса,
допускающая постоянство скорости и плотности потока по длине
слоя. Эта модель описывается уравнениями (д, е, ж) системы
(7.139). Член, учитывающий продольную диффузию в уравнении
(д) системы (7.139), обычно записывают в виде D* д2с/д^. Такие
процессы адсорбции обычно называют очисткой. Система
уравнений (д, е, ж) имеет два решения:
при наличии градиента концентраций в колонне
^=w/[l + a'(C/)]; (7.140)
при обрывном фронте
W Со/(со + а0). (7.141)
Здесь принято, что содержание адсорбтива скачкообразно
меняется от с = с0 до с = 0.
В табл. 7.7 приведены сравнительные характеристики переноса
концентрационного фронта адсорбтива при различных условиях
адсорбции в неподвижном слое.
При анализе процесса разделения газовых смесей количество
поглощаемого компонента значительно, поэтому скорость, а
следовательно, и плотность потока по длине слоя адсорбента
переменны во времени. В этом случае уравнения (д, е, ж)
системы (7.139) должны быть дополнены как минимум уравне-
нием (в) системы (7.139). Детальное построение данной и ряда
других моделей, а также решения соответствующих систем диф-
ференциальных уравнений рассмотрены в монографии [40].
Дальнейшим развитием работ по моделированию процессов
разделения газовой смеси является модель циклических про-
цессов, происходящих в установках адсорбционной очистки и
разделения газовых смесей, разработанная в 1980-1990 гг.
Е.А. Устиновым и А. К. Акуловым. Эта модель разрабатывалась
применительно к безнагревным технологическим процессам
очистки и разделения газовых смесей; технология безнагревных
циклических процессов основана на разности давлений в слое
адсорбента в режимах продуцирования и регенерации. Регене-
рацию осуществляют в несколько стадий: понижение давления
от 0,3 — 0,6 МПа (характерного для режима продуцирования)
до атмосферного; продувки слоя адсорбента частью продувного
495
* 7.7. Уст условия: ановление с адсорбщ режима п <и в непощ араллельного переноса концентрационного фронта при различных ионном слое
Учет про- дольного эффекта Характер кинетики сорбции Форма изотермы Длина работаю- щего слоя Поведение фронта адсорбции Скорость движения концентрационной точки формы Зависимость т(х)
Z)’=0 Рэ Выпуклая 8-> 0 Сжатие _ ~Со
кривая со + ср(с0) т - x/v
Прямая 8 -> const Сохранение размытия Прогресси- рующее размытие — ...
Вогнутая 8 —> т со + Ор(с0) W т — x/v
"с 1 + а'(с)
₽э " конечное Выпуклая кривая Сжатие (параллель- ный перенос размытого фронта) Размытие Прогресси- рующее размытие v = W С° т °Р(СР) [ w
значение Прямая со + ср(с0) Т — — WC0 Г1 / X - 1п( - - Lp с Г‘ТХ 1) + In - - 11) c JJ
Вогнутая кривая 8 - VT 8 - т t с0 + ср<со) W ’ WC0 1 /т- j ’ Рэ C0 /
"с 1 + а'(с)
32 Заказ № 1592
. X Л*# 0 ₽э ~ Выпуклая кривая Прямая Вогнутая кривая 8* Дт) 8-д/Т 8 - т Сжатие (параллель- ный перенос размытого фронта) Размытие Прогресси- рующее размытие со V = w С0 + °р(Со) со Ч + S<co) Vc ~ 1 + а' (с) т = [х - <p(c)]/f t = (х ± 2 w fl т )/ vCo
конечное значение Выпуклая кривая Прямая 8*Дт) 8 - т Сжатие (параллель- ный перенос) Размытие со V = W —Г Т—. Со + ср<со) со \ + ^о) т = [х - ф(с)]/у т = (х ± 2 w А т )/ % F
* Романов П.Г., Лепидин В.Н. Непрерывная адсорбция паров и газов. Л.: Химия. 1968. 228 с.
Примечание. Здесь введены обозначения:
w = w(c/c0); П = D* еДСр + ар(с0)]; Р - параметр, определяемый по изотерме
D* [1 + с0/ар(с0)] f г
ф(с) ----------------------с -
w * 1
\о
с0 а(с) Г1
--------- ас.
ор(со) 1
потока; повышение давления в слое адсорбента (разделяемой
смесью или продуктом) и др. Модель циклического процесса
также соответствует уравнениям (в, д, е, ж) системы (7.139); при
этом связь между отдельными стадиями процесса учитывается
соответствующими начальными и граничными условиями. Значе-
ния величин, определяющих конечное состояние слоя адсорбента
на предыдущей стадии, одновременно являются начальными
условиями для последующей стадии. В качестве примера
приведем запись модели для разделения двухкомпонентной смеси
при линейных изотермах адсорбции, бесконечно больших
скоростях адсорбции ф оо), уравнении состояния идеальной
газовой фазы:
дс w/dx + (е + IQ Вс/Вт = 0; (7.142)
Bq w/Bx + (е + KJ Bq /Вт = 0; с + q = p/(RT) = /(т).
Решение системы выполнено численным методом и экспери-
ментально проверено на примере системы азот—кислород—
цеолит NaX.
Для удаления одного компонента из смеси газов при линей-
ных изотермах, vq = const и конечном коэффициенте внешней
массоотдачи ф0) получено аналитическое выражение для опреде-
ления среднего содержания целевого компонента
|(1-Х)^ехр(-%О-ехр(-1Я)
к ехр(-Х£) - ехр(-ХН) П^И и * . ’ ...
и / (7.143)
(Я-х-£)/(#+£ + 1) при = 1.
Здесь
/ = (с * - с£)/(с0 - q ); у = (а~ - aL)/(aG - q);
aL = й*(с£); Ли= kw к, '’ х = (*и - + *);
н = kw/ke‘’ £ = ₽о x/w; Н = ро L/w,
где ки — коэффициент избытка; kw — отношение скоростей пото-
ков на стадиях адсорбции и десорбции; кх — отношение продол-
жительности стадий десорбции и адсорбции; — отношение
коэффициентов массоотдачи на стадиях адсорбции и десорбции;
а0 и aL — величины адсорбции в конце стадий адсорбции и
десорбции; q, cL — начальные значения содержания компонен-
тов в газовой фазе на стадиях адсорбции и десорбции; (Г* —
среднее за цикл приращение концентрации в газовой фазе;
498
а — средняя за цикл величина адсорбции; р0 — коэффициент
внешней массоотдачи на стадии адсорбции; х — координата по
оси слоя сорбента; w — скорость потока смеси на стадии адсорб-
ции; L — длина слоя сорбента; а* — величина адсорбции, равно-
весная с концентрацией компонента в газовой фазе.
Для решения задач динамики адсорбции многокомпонентных
смесей применяют численные методы расчета на ЭВМ. Вместе
с тем используют уравнения динамики адсорбции в интегральной
форме, например, уравнение Шилова. Примем обозначения
(рис. 7.36): L — длина слоя адсорбента (шихты); V — объемная
скорость газового потока; с0 — начальное значение содержания
вещества в газовом потоке; спр — проскоковое содержание адсор-
бируемого вещества за слоем адсорбента); h — длина неисполь-
зованного слоя адсорбента; v — скорость перемещения фронта
адсорбции. Временем защитного действия слоя тпр = 0 называют
время работы слоя адсорбента до момента появления проскоко-
вого содержания на выходе из адсорбера. На основании много-
численных экспериментальных исследований Н.А. Шилов уста-
новил линейную зависимость между временем защитного дейст-
вия 0 и длиной слоя адсорбента L:
0 = к (L-h), (7.144)
где к — коэффициент защитного действия слоя к = V/v.
Степень использования статической активности в динами-
ческих условиях равна отношению динамической активности
слоя к равновесной: у = Лд/Лр < 1. Согласно уравнению
Н.А. Шилова имеем
Рис. 7.36. Схема защитного слоя, работающего в динамических условиях (а), и
графическая интерпретация уравнения В. А. Шилова (б, в)
32*
499
Если все поглощенное количество вещества условно отнести \
к слою длиной L (рис. 7.36,6), то отрезок АВ будет соответст-
вовать слою, который остался неиспользованным. Площади
заштрихованных на рис. 7.36,6 участков должны быть равны. На
рис. 7.36,в дана графическая интерпретация уравнения Шилова.
Уравнение справедливо для слоя, который находится на расстоя-
нии £0 от начала координат — прямолинейный участок кривой.
Степень использования шихты у определяется тремя факторами:
скоростью адсорбции (кинетикой), продольным переносом и
формой изотермы равновесной адсорбции. Эти факторы приво-
дят к размыванию фронта адсорбции и неполной отработке
адсорбента к моменту проскока. Чем больше эффективный кине-
тический коэффициент р, тем больше у и меньше размытие
фронта адсорбции.
На практике для решения задач динамики адсорбции часто
используют экспериментальные методы, в том числе для опреде-
ления коэффициентов массопереноса. Известны три метода:
1) экспериментальное построение изохрон, которые соответст-
вуют перемещению фронта адсорбции по длине слоя. В резуль-
тате получают семейство кривых с = f (£) при il = const;
2) экспериментальное построение выходных кривых, которые
соответствуют нарастанию концентрации адсорбтива за слоем
адсорбента с = <р(т) при а = const. По выходной кривой легко
определить значение Ад и объемный коэффициент массопере-
дачи;
3) изучение кривых изменения концентрации вещества во
времени по слою. В этом случае получаем семейство кривых
т = у(£) при с( = const.
Пример 7.3. Определить время защитного действия и динамическую емкость
слоя адсорбента длиной 0,25 м для удаления двуокиси углерода из воздуха.
Объемная доля СО2 на входе в слой адсорбента ЗКГ4. Считать, что проскоковая
доля составляет 0,05 входной; коэффициент массоотдачи, определенный по
критериальному уравнению (7.31), сос-
тавляет р0 = 3,0 см/с; насыпная плот-
ность адсорбента составляет 650 кг/м3;
изотерма адсорбции описывается урав-
нением а = 28,3 р (с в кг/кг, а р — в
кг/м3); фиктивная скорость потока
(рассчитанная на полное сечение аппа-
Рис. 7.37. Зависимость относительной
выходной концентрации с/с0 от приведен-
ного времени
500
рата) составляет 0,1 м/с; пористость слоя е = 0,41 м3/м3; удельная площадь поверх-
ности массообмена (поверхности гранул) f = 1050 м2/м3.
Для линейной изотермы адсорбции время защитного действия адсорбента мож-
но определить с помощью кривых Шумана по методике, изложенной в работе [61].
1. Находим фиктивный коэффициент массоотдачи
"р = Ро/= 3 • IO 2• 1050 = 31,5 с’1.
2. Определяем приведенную длину, соответствующую выходному сечению слоя
адсорбента
xL = р L/w = 31,5-0,25/0,1 = 78,8.
3. На линии х = xL = 78,8 по рис. 7.37 определяем значение приведенного
времени Z^ при с^/сй = 0,05: Znp •= 56.
4. Время проскока находим из соотношения Ztv = (Ро/^("Гщ, - е L/yv). Так
как в этом примере коэффициент пропорциональности в уравнении изотермы
является размерной величиной (Г - 28,3 м3/кг), то Кт = Г рв. Тогда
Гр„ е! 28,3-650 0,4-0,25 „ .
: = 4™ = -J-s- +----- = 56 ------+ -Ц---—«= 3,27- Ю4 с - 9 ч.
"Р р0 w 31,5 0,1
О применении процессов сорбции в криогенной технике.
Процессы физической адсорбции широко применяют в криоген-
ной технике для осушки, очистки, разделения и хранения газов,
а также для получения вакуума. Рассмотрим подробнее техничес-
кие задачи криогеники, решаемые с использованием собрцион-
ных процессов.
Осушка газов. Смесь газов, например, воздух или
природный газ, должна быть осушена перед поступлением ее в
разделительную установку. Для этого применяют адсорбционный
блок осушки воздуха. В качестве примера на рис. 7.38 приведена
схема блока осушки воздуха, поступающего в воздухоразделитель-
ную ректификационную установку. Два адсорбера 1 и 2 попе-
ременно работают в режиме
адсорбции и десорбции. Вре-
мя работы в каждом режиме
не менее 6 ч. Воздух по ли-
нии А после компрессора
проходит масловлагоотдели-
тель 5 и поступает в адсорбер
1 или 2. После адсорбера
воздух проходит через фильт-
ры 3 или 4 и поступает на
разделение по линии Б. Для
регенерации адсорбента ад-
сорбер продувают нагретым в
Рис. 7.38. Схема блока осушки воздухо-
разделительной установки
501
теплообменнике 6 азотом, забираемым из разделительного аппа-
рата. В качестве адсорбента используют синтетические цеолиты
NaA и NaX, силикагели.
В этом блоке одновременно с водой адсорбируется двуокись
углерода и ацетилен.
Замена химического метода осушки, ранее осуществляемого
с помощью твердого едкого натра, адсорбционными блоками
комплексной очистки и осушки воздуха повысила эффективность
ВРУ, уменьшила их взрывоопасность и улучшила условия
обслуживания установок. В промышленных цеолитовых блоках
достигается влажность воздуха, соответствующая точке росы (при
рабочем давлении) до 200 К; остаточное содержание СО2 и С2Н2
соответствен© до 1,5 и 5 • 10'3 см3/м3. Объемная скорость газа в
адсорбционых блоках осушки практически (при условиях эксп-
луатации) может колебаться в пределах 0,05-0,50 л/(мин-см2).
В АО “Криогенмйш” разработан ряд цеолитовых блоков осушки
и очистки воздуха промышленного серийного изготовления.
Низкотемпературная адсорбционная
очистка газов. Удаление компонентов, содержание
которых не превышает 1—2 % , для получения продуктов особой
чистоты методом низкотемпературной адсорбции оказывается
эффективнее известных химических методов, особенно в
сочетании с предварительной ректификацией. Удаление приме-
сей воздуха в водороде, кислорода в аргоне или азота в неоно-
гелиевой смеси методом низкотемпературной адсорбции позво-
ляет получать газы, содержащие не более 10'3 % примесей. Для
очистки аргона от примесей кислорода используют молекулярно-
ситовой эффект, заключающийся в том, что при температурах
ниже 90-100 К атомы аргона не могут преодолеть потенциальный
барьер входного окна цеолита NaA, так как диаметр входного
окна близок к критическому диаметру атома аргона. Кинетичес-
кий диаметр молекулы кислорода меньше диаметра атома аргона
на 0,01 нм, что обеспечивает возможность адсорбции его цеоли-
том NaA Такой же ситовой эффект по отношению к адсорбции
смеси О2—Аг имеют цеолиты КА, Ag Na А и Li Na А; ниже
указаны рекомендуемые диапазоны давления и температуры:
Цеолит...................NaA КА AgNaA
р, МПа................0,14-0,47 0,14-0,77 0,14-1,22
Т, К...................93-105 99-112 99-120
В 1975 г. на Ижорском заводе им. А А. Жданова введена в
эксплуатацию разработанная в ЛТИХП (ныне СПб ГАХПТ)
502-
промышленная ВРУ КТ-1000 Арч, оснащенная цеолитовым
адсорбционным блоком для очистки аргона от кислорода.
Газообразная аргонокислородная смесь при Т = 93 К и р =
0,13...0,16 МПа пропускается через слой синтетического цеолита
NaA-б, который практически полностью поглощает примеси
кислорода, а также следы азота и другие микропримеси, а
выходящий из адсорбера аргон содержит менее 5-10 4 %
кислорода. Установка имеет три поочередно переключающихся
адсорбера, содержащих по 260 кг цеолита. Время переключения
адсорберов 24-40 ч, производительность по чистому аргону 14-
23 м3/ч.
Сорбционный метод разделения газов.
При определенных условиях метод адсорбционного разделения
может конкурировать с ректификационным. Его также
используют при разделении азеотропных смесей, для которых
метод ректификации неприменим. Селективную адсорбцию газов
и паров применяют для разделения многих смесей: этилен—этан,
этилен—двуокись углерода и др. Применение низкотемператур-
ной адсорбции расширило круг разделяемых газовых смесей: это
Ne-Не, Кт—Хе, Oe-N2, О2-Аг, СН4-Не, СН4-Н2, N2-H2,
N2—СО2 и др.
Адсорбция неона при температуре 77 К превышает адсорбцию
гелия примерно в 20 раз, что позволяет разделять эту смесь
адсорбционным методом, используя активные угли АГ-2, СКТ,
БАУ. Чистый неон при этом может быть получен в процессе
десорбции, который можно осуществить двумя способами:
фракционированной изотермической адсорбцией (откачка газов)
или повышением температуры адсорбента.
В АО “Криогенмаш” разработан адсорбционно-ректифика-
ционный способ обогащения и разделения криптоноксеноновой
смеси, включающий два основных этапа: процесс адсорбцион-
ного обогащения криптона и выделения ксеноновой фракции;
процесс ректификации смеси азот—метан—криптон для
получения чистого криптона. Создана промышленная установка
УАРК-1 для переработки 120 м3/ч первичного криптоноксеноно-
вого концентрата. Применение низкотемпературной адсорбции
исключает промежуточное окисление углеводородов (что резко
уменьшает размеры установки), а также позволяет получать
чистые Кг и Хе без их разделения на специальной установке.
Развитие адсорбционного способа разделения воздуха вызвано
растущей потребностью в кислороде и азоте. Сейчас в мире
примерно на 70 заводах работают адсорбционные ВРУ с суточной
503
производительностью по кислороду 0,5-40 т. Получение кисло-
рода методом короткоцикловой адсорбции со степенью чисто- •
ты до 95 % требует энергетических затрат 0,8-1,2 кВт-ч/м3.
Метод низкотемпературной ректификации требует затрат энергии
около 0,4 кВт • ч/м3 на производство 95 %-го кислорода. Однако
более низкие энергозатраты в ректификационных установках
достигаются при их высокой производительности. Адсорбцион-
ный метод получения кислорода и азота из воздуха в масштабах
малой производительности конкурирует с методом низкотемпера-
турной ректификации. Адсорбционные установки просты в изго-
товлении, менее металлоемки, удобны в эксплуатации, легко
автоматизируются и не требуют длительного пускового периода.
Адсорбционные установки разделения воздуха серийно выпус-
кают в США, Германии, Великобритании и др. Установки
изготовляют по модифицированной схеме Скарстрома и выпус-
кают в нескольких вариантах: с четырьмя, тремя и двумя адсор-
берами. В качестве адсорбента в них используют цеолиты СаА
и NaX. В ряде промышленных установок, выпускаемых фирмой
“Малер” (Германия), в качестве адсорбента используют сорбенты
типа УМС, избирательно поглощающее кислород из воздуха, что
позволяет получать азот в режиме адсорбции. Производитель-
ность этих установок достигает 1200 м3/ч, степень обогащения
воздуха кислородом — 50-80 %, удельные энергозатраты состав-
ляют 0,4 кВт* ч/м3 для продукта со степенью обогащения 60 %.
В МГТУ им. Н.Э. Баумана совместно с АО “Наука” разра-
ботаны несколько типов адсорбционных ВРУ малой производи-
тельности для получения кислорода со степенью чистоты от 65
до 92 %.
На рис. 7.39 дана схема
адсорбционной низкотемпера-
турной установки (холодиль-
ная машина не показана),
которая позволяет обогащать
кислородом воздух или водо-
родом газовую смесь, содержа-
щую Н2, С2Н4, СН4, С2Н6, СО
и пары воды. Установка рабо-
тает циклично в интервале
Рис. 7.39. Схема адсорбционной низко-
температурной установки для разделения
газовых смесей
504
температур от 210 до 170 К. Цикл включает два режима:
адсорбционный и десорбционный. Через определенные интер-
валы времени режимы в адсорберах меняются автоматическим
переключением клапанов. В режиме адсорбции газовая смесь при
давлении 0,11-0,3 МПа проходит регенераторы 3 и 4, адсорбер
1, регенератор 7, холодильник 9 и регенератор 5, который
охлаждается за это время до рабочей температуры. В это время
адсорбер 2 находится в режиме десорбции; смесь газов из него
поступает в регенератор 8, холодильник 10, регенератор 6 и насос
11, который создает давление в адсорбере около 5 кПа.
Капсулирование газов. Сорбционные процессы
можно применять и для хранения криогенных газов. Явление
капсулирования газов цеолитами основано на молекулярно -
ситовом действии, когда кинетический диаметр молекулы
адсорбата несколько больше диаметра входного окна в поры
цеолита и при нормальных и низких температурах молекулы
адсорбата не могут проникнуть в поры цеолита. Однако при
достаточном повышении температуры вследствие увеличения
кинетической энергии молекул газа и амплитуды колебаний
атомов решетки твердого адсорбента, становится возможной
диффузия газа в полости цеолита. Так как с повышением темпе-
ратуры адсорбция газа при данном давлении уменьшается, для
увеличения количества поглощаемого цеолитом газа необходимо
повышать его давление. Если после насыщения цеолита систему
охладить до нормальной температуры, а затем уменьшить давле-
ние, то адсорбированные молекулы газа окажутся “запертыми”
в полостях цеолита. Цеолит, насыщенный таким образом газом,
длительное время можно хранить при нормальной или низкой
температуре, при любом давлении и даже вакууме. Для удаления
газа из цеолита необходимо снова нагреть его; скорость нагрева
определяет скорость десорбции газа. Для этой цели применимы
цеолиты с малым диаметром (до 0,4 нм) входных окон: К Na А,
Cs Na A, Pb Na А, Ва Са А и др. Результаты экспериментальных
исследований показали, возможность капсулировать азот, крип-
тон, кислород, водород, ксенон, метан, неон и другие газы.
Известны три способа хранения газов, которые применяют
в промышленности: баллонный (самый распространенный), в
виде химических соединений (надперекиси, гидриды металлов,
хелатные соединения, перхлораты и др.) и криогенный (хранение
газов в криостатах или сосудах Дьюара в ожиженном, твердом
состояниях или при критических параметрах). Последний
наиболее выгодный по массовым и объемным характеристикам,
505
но вследствие утечек не всегда применим при долгосрочном
хранении (например, радиоактивного криптона). Хранение газов
в виде химических соединений ограничено областью применения
и повышенной взрывоопасностью для некоторых соединений.
Новый способ хранения газов, капсулированных микропорис-
тыми адсорбентами, конкурентоспособен по массовым и
объемным характеристикам с баллонным, но применим пока
лишь для хранения относительно малых количеств газа.
Адсорбцонная откачка. Достаточно высокая
скорость поглощения промышленными адсорбентами таких газов
как О2, N2, Аг, Ne, Кг, Хе и Не, при низких температурах
позволяет эффективно использовать адсорбцию для получения
вакуума. Адсорбционные вакуумные насосы обеспечивают
получение сверхвысокого и так называемого “чистого” вакуума,
когда резреженная среда в реципиенте не загрязнена парами
вакуумных масел, применяемых в обычных форвакуумных и
диффузионных насосах.
В АО “Криогенмаш” разработан ряд конструкций адсорбци-
онных насосов. На рис. 7.40 показан насос, применяемый для
откачных постов при обезгаживании катодов электронных ламп.
Основой конструкции насоса является адсорбционная кассета с
пористым экраном 2, имеющая стабильные характеристики при
давлении 105 — 1 Па. В центре сферического корпуса 1 диамет-
ром 220 мм на тонкостенной трубке подвешена адсорбционная
кассета, которая представляет собой сферический сосуд 5, к
внешней поверхности которого приварено ребро 6 из меди. К
ребру, соосно сосуду, приварен сферический пористый экран 2.
Полусферы экрана изготовлены спеканием медного порошка.
Пространство между сосудом для хладагента и пористым экраном
заполнено адсорбентом 4, в качестве которого используют цеолит
СаА-4В или СаЕН-4В. При давлении 5-10~4 < р < З Ю1 Па
быстрота откачки насоса является величиной постоянной и
составляет соответственно 56,
43 и 40 л/с при работе на
азоте, кислороде и аргоне.
Рис. 7.40. Адсорбционный вакуумный
насос:
1 — корпус насоса; 2 — пористый
экран; 3 — горловина; 4 — адсорбент;
5 — внутренний сосуд; 6 — ребро;
7 — присоединительный фланец; 8 —
штуцер вакуумметра
506
Адсорбционные вакуумные насосы подобного типа, разработан-
ные Харьковским физико-техническим институтом, обладают
двумя недостатками — ограниченным ресурсом между последо-
вательными регенерациями и высоким предельным давлением.
В связи с этим более перспективны откачные средства с движу-
щимся адсорбентом, обеспечивающие непрерывную откачку газа.
Вакуумный насос непрерывного действия с адсорбционным эле-
ментом в виде непрерывной ленты из углеволокнистого мате-
риала позволяет откачивать воздух от атмосферного давления до
10 7 Па.
§ 7.11. РАЗДЕЛЕНИЕ ГАЗОВЫХ СМЕСЕЙ НА МЕМБРАНАХ
В технике термином мембрана обозначают слой технологи-
ческого материала, который обеспечивает разделение газообраз-
ных или жидких смесей за счет своей селективной проницае-
мости по отношению к ее компонентам. Разделение может про-
исходить как без химических превращений, так и с химическими
превращениями с помощью введенных в мембрану катализаторов
и ферментов. В качестве мембран используют полимерные плен-
ки, тонкие металлические или керамические пластины, слой
жидкости и т.д.
Мембраны, применяемые в технологии разделения веществ,
классифицируют по материалу, способу получения, структуре,
фазовому составу, назначению.
Мембранный модуль (рис. 7.41) обеспечивает разделение
исходного потока F на два: один из них (пермеат) V проходит
через мембрану, второй (сбросываемый поток) L — уносится на
а)
Рис. 7.41. Плоскокамерный (а) и трубчатый (б) L
модули (н и д — напорный и дренажный каналы '
соответственно; ря > ря) 5)
507
следующую ступень разделения или сбросывается. В технологи
ческом отношении организация процесса разделения на мембра
нах отличается простотой и широко применяется на практике,
например при получении из воздуха азота и кислорода. Л
Перенос вещества через мембрану осуществляется под дейст-
вием полей потенциалов различной природы (полей давления,
температуры, концентрации, гравитации, электромагнитной при-
роды и др.). Потоки вещества через мембрану бывают диффузи-
онными, осмотическими, ионными, электрофоретическими и т.ц,
Массовый поток в мембране ориентирован по нормали к раз-
деляющей поверхности. Движущая сила переноса компонента
определяется разностью химических потенциалов в напорном И
дренажном каналах, разделенных мембраной. Скорость массо-
переноса через мембрану изменяется по длине мембранного эле-
мента и зависит от термо- и гидродинамических параметров в
рассматриваемой точке напорного или дренажного канала.
При определении интегрального массового потока через мем-
брану употребляют характеристику “проницаемость”, которая,
учитывает различные стадии процесса массопереноса. Удельную
проницаемость вещества обычно определяют по формулам: ./
Kcl = Q S/{S(cni - сд/)]; Kpi = Q b/[S(pHl - рд/)], (7.146))
где Q — расход Z-го компонента через мембрану, м3/с; 5 — \
толщина мембраны, м; S — площадь поверхности мембраны, м2; >
Phi и Рд1 ~ парциальные давления z-го компонента соответст- ?
венно в напорном и дренажном каналах, Па; cHi и сд1 — доли
/-го компонента соответственно в напорном и дренажном кана-
лах. >
Разделительную способность мембраны по отношению к ком- >
понентам / и j характеризуют фактором разделения мембраны
aU=KPi/KPJ- (7147> t
Проницаемость, определенная согласно (7.146), характеризует
перенос вещества не только через мембрану, но и через ее
пограничные слои, поэтому величины Kci и Kpi, строго говоря,
зависят от экспериментальных условий, при которых они были
определены. Для диффузионного потока выделяют пять стадий
массопереноса через мембрану (рис. 7.42): I — диффузия через
пограничный слой ПС; II — сорбция внутри мембраны; III —
диффузия через мембрану; IV — десорбция из мембраны; V —
диффузия через пограничный слой. Каждая стадия характери-
зуется определенным сопротивлением процессу массопереноса.
508
Рис. 7.42. Схема массопереноса через
мембрану:
1 и 3 — кривые изменения содержания
i-го компонента до и после мембраны
соответственно; 2 — то же в мембране
ПС
Иногда физическую картину
процесса можно упростить.
Например, при разделении газо-
образных смесей стадии I и Г ис-
ключают и пренебрегают сопро-
тивлением на стадиях II и IV.
Массоперенос в мембране,
происходящий под действием
градиента химического потен-
циала, является диффузионным
процессом, описать который возможно на базе статистического,
термодинамического или феноменологического подхода.
Наиболее часто используют последний [26, 54].
В основе феноменологической теории диффузии лежит гипо-
теза Фика о пропорциональности скорости переноса дифунди-
рующего вещества градиенту концентрации в направлении, нор-
мальном к плоскости этого сечения; математическую запись этой
гипотезы называют первым уравнением Фика
Ji= - Dmi^d ci’ (7.148)
где — поток /-го компонента, м/с; Dmi — коэффициент диффу-
зии, м /с; Cj — объемная доля /-го компонента.
В уравнении (7.148) поток Jt определяет превышение скорости
ut перемещения /-го компонента по сравнению со средней ско-
ростью и0 потока в нормальном сечении неподвижного аппарата:
Л = (ui ~ ci = Nt~uo ci i (7.149)
m m
u0=% ct, (7.150)
f=l м
где Nt — диффузионный поток /-го компонента относительно
неподвижного аппарата.
В случае, когда uG пренебрежимо мало, для одномерного
диффузионного потока получаем уравнение, которое обычно ис-
пользуется для описания процесса диффузионного массопереноса
через мембрану:
N(= J(= - Dmidc{/dx. (7.151)
509
Следует отметить, что при экспериментальном определении
потока z-ro компонента через мембрану измеряют величину Nt,
а не Jt, поэтому аппроксимация экспериментальных результатов
уравнением (7.148), строго говоря, некорректна. В случае значи-
тельного потока через мембрану пренебрежение вторым членом
uQ ct в уравнении (7.149), как правило, приводит к значительной
погрешности.
В мембранной технологии разделения смесей часто сталкива-
ются с нестационарными потоками диффундирующих веществ
через мембрану, например, при насыщении или извлечении из
мембраны одного из диффундирующих компонентов. В этом
случае текущее распределение z-ro компонента определяется
вторым уравнением Фика:
DC1/dT = B„iV2c„ (7.152)
где D ct/&i — субстанциональная производная. ,
Для мембранного разделения газообразных смесей в большинстве
случаев влияние слагаемого и0 ct незначительно, поэтому извест-
ные случаи решения уравнений (7.148), (7.150) могут быть
использованы для описания процесса массопереноса в различных
мембранных элементах (пористые и непористые плоские пласти-
ны, полые волокна и др.) при заданных начальных и граничных
условиях.
Наиболее полно решения задачи об определении стационар-
ного и нестационарного диффузионных потоков в мембранах
различных типов рассмотрены в работе [54].
Диффузия в непористых неорганических материалах. В технике
газоразделения используют также мембраны из металлической
фольги, стекол и др. Например, для выделения водорода из
смеси газов применяют паладиевую фольгу, а для отделения
гелия — кварцевые капилляры. Для систем с проникновением
газа через кремний и неорганические соли справедливы соотно-
шения (7.146). Процесс диффузии газов через металлическую
фольгу хорошо аппроксимируется уравнением Ричардсона—Сми-
теллса:
Q = *» (~р7, - ) 1ехР (- в/т)]/ъ,
где к0 — коэффициент для выбранной системы газ—металл,
прямо пропорциональный площади поверхности мембраны и
коэффициенту диффузии; В — константа, для выбранной сис-
темы газ—металл определяемая через теплоту диффузии.
510
Осмос и диализ. Осмос можно рассматривать как диффузион-
ный процесс переноса растворителя через мембрану из области
с меньшей концентрацией в более концентрированный раствор,
а диализ — как разделение растворенных веществ, различаю-
щихся молярными массами, за счет различных скоростей диффу-
зии этих веществ. Процессы осмоса и диализа могут быть
усилены наложением электрических и температурных полей.
Течение газов через трубы и отверстия. При описании
процессов массопереноса через пористую мембрану часто
используют различные модели течения как вязкого, так и молеку-
лярного потока. Структура пор мембраны сложна, а часто и
неизвестна, поэтому для правильного применения уравнений
течения газов при расчете процессов мембранного разделения
необходимо учитывать структуру и размер пор (эквивалентный
диаметр, длину канала, удельную площадь поверхности, распре-
деление пор по размерам и др.). Для вязкого потока размер пор
должен быть достаточно велик по сравнению с длиной свобод-
ного пути молекул газа. Наибольшее распространение получили
два уравнения, определяющие значение вязкого потока (в моль/с)
в пористой среде:
уравнение Дарси
Q = 4,55 • 10“ А, (р„ - ) S/(L ц); (7.153)
уравнение Хагена—Пуазейля
С= я г4 (Р„2-Рд2) /(16 RTLfi), (7.154)
где — проницаемость мембраны по Дарси, Д (1Д = 1,02 • 10’12 м2);
рл и ри — давления в дренажном и напорном каналах соответст-
венно, Па; S — площадь поверхности мембраны, м2; L — длина
канала, м; ц — динамическая вязкость, Па-с; г— радиус канала, м;
R — универсальная газовая постоянная, ДжДмоль • К); Т — тем-
пература, К.
Согласно уравнению Дарси поток газовой фазы через мембра-
ну прямо пропорционален градиенту давления. При этом сопро-
тивление движению потока обусловлено силами внутреннего
трения. Уравнение (7.154) Хагена—Пуазейля справедливо при
следующих допущениях: среда несжимаема, распределение
скоростей по сечению канала постоянно по всей длине L, турбу-
лентное движение отсутствует, скорость течения у стенок капил-
ляра равна нулю.
Известное уравнение Козени—Кармана, аналогичное по
форме (7.153), дополнительно учитывает отклонение формы пор
от идеальной (цилиндрической).
511
Молекулярное течение газа через цилиндрический капилляр*
описывается уравнением Кнудсена f
е = 8 я г3 (р„- Рд) /[3 L (2 я R ТМ)" ], (7.15$
где Q — расход газа через мембрану, моль/с; г — радиус'
капилляра, м; М — молярная масса, кг/молъ.
Для бесконечно тонкой мембраны справедливо уравнение'
Клаузинга f
о = s (Р„- Рд) /О- * R тМ),/2 ]. (7.155)'
В мембранной технологии зависимость удельной проницае- ,
мости и коэффициента диффузии от температуры и давления в
некоторых случаях является определяющим фактором при
выборе схемы процесса, поэтому данный вопрос представляет
значительный практический интерес. Р. Бэррер показал, что i
зависимость удельной проницаемости (К), коэффициентов
диффузии (D) и растворения газов (а) в мембранах различного
типа от температуры подчиняется закону Аррениуса:
ехр [- E/(R Т)]; D = Do = ехр [- EX/(R Г)];
(7.157)
0 = о0 ехр [-EH/(R Т)].
Значения Кд , Do , Е, Ех, ЕН определены Р. Бэррером экспе-
риментально для большого числа систем полимерная мембрана—
диффундирующий компонент и различные вицы стекол—диффун-
дирующий газ. Для полимерных мембран Е= 27,2... 44,7 кДж/моль,
Ех = 36,4 ... 49,7 кДж/моль, ЕН = 2,1 ... 8,4 кДж/моль. Численные
значения DQ и Кд для исследованных систем приведены в работе
[26]. Впоследствии справедливость соотношений (7.157) была
подтверждена для полимерных мембран других типов.
Зависимость коэффициентов К и D от давления для известных
систем слабая и не носит универального характера. Например,
при диффузии молекул с относительно малыми размерами через
полимерные пленки было показано, что с увеличением давления
проницаемость практически не изменяется или возрастает по
слабой экспоненциальной зависимости [54]:
К = Кд ехр (т Ер), (7.158)
где т — эмпирическая константа; Ер — перепад давлений на
мембране.
512
Для ряда полимерных мембран зависимость константы т от
температуры определяют с помощью уравнения
In [т (Т)/т (Ткр)] = А + В Т^/Т, (7.159)
где А и В — константы; 7^р — критическая температура.
Экспериментальные данные по проницаемости СО2 , С2Н6 ,
С2Н4 и N2O через полиэтиленовую пленку, приведенные в работе
[54], адекватны зависимости (7.159), при этом все эксперимен-
тальные точки хорошо ложатся на одну прямую.
Зависимость коэффициентов диффузии и растворимости от
давления апроксимируют полуэмпирическими соотношениями
вида:
D = Do ехр [а(///0)]; с = о0 ехр [р а0//(1 - Р о0/)]> (7.160)
где а — константа, зависящая от температуры; р — коэффи-
циент, характеризующий концентрационную зависимость коэф-
фициента растворимости; f и — значения фугитивности
(летучести) диффундирующего вещества соответствующие
текущему и начальному состояниям.
Уравнения (7.160) удовлетворительно описывают процесс
диффузии указанных веществ через полиэтиленовую пленку,
причем при значительных температурах проницаемость стано-
вится не зависимой от давления. Однако распространять этот
вывод на другие виды систем следует с достаточной осторож-
ностью.
На значения коэффициентов диффузии существенное влияние
также может оказать выбранная структура полимерной пленки,
наличие легирующих добавок в непористых мембранах (каврце-
вое стекло, керамика), ориентация полимерных пленок и полых
волокон, как в процессе их получения, так и при растяжении
их в мембранном элементе, а также сильное взаимное влияние
диффундирующих компонентов смеси.
Например, согласно [54] постоянство основных свойств насту-
пает в полимерах с гибкими цепями при значениях молярной
массы свыше 5000 г/моль, а в полимерах с жесткими цепями —
свыше 2000 г/моль. Согласно данным по проницаемости стекол
[39] наличие незначительных легирующиих добавок может су-
щественно изменить коэффициент диффузии при идентичных
условиях эксперимента.
Технология мембранного разделения газов. Установки и
системы мембранного разделения могут быть классифицированы
по способу организации процесса, как показано на рис. 7.43. На
33 Заказ N» 1592 513
Установки разделения
Рис. 7.43. Классификация мембранных установок разделения газов
рис. 7.44 даны схемы организации потоков в мембранных эле-
ментах, образующих в сборке мембранный аппарат. Газ в напор-
ном и дренажном каналах может двигаться: а — прямотоком,
б — противотоком, в — перекрестным током.
По конструктивному признаку выделяют четыре типа мемб-
ранных модулей: плоско камерные, рулонные, волоконные и
трубчатые (см. рис. 7.41).
Один каскад разделения в большинстве случаев не обеспечи-
вает изменения состава разделяемой смеси до требуемого уровня.
В этом случае применяют многокаскадные (многоступенчатые)
установки. При расчете процесса разделения по схеме многокас-
Рис. 7.44. Схемы организации потоков в мембранных аппаратах
514
б)
Рис. 7.45. Схемы многокаскадных установок без рециркуляции потоков с постоянной
(а) и переменной (ф поверхностями массопереноса на каждой ступени
кадных установок без рециркуляции (рис. 7.45) каждую ступень
рассматривают как участок, на котором устанавливается равно-
весие, а отклонения от идеальных условий учитывают путем
введения на каждой ступени фактора эффективности. На схемах
(см. рис.7.45) прошедший через мембрану поток V является
единственным питающим следующую ступень (п -1), поэтому
выходящий из установки продукт даже при незначительном
числе ступеней сильно изменяется; при этом значительная часть
неизвлеченного целевого компонента уходит в сбрасываемый
поток L. В связи с этим схемы такого типа используют при
разделении только дешевых компонентов, например, при полу-
чении из воздуха обогащенного кислорода.
Если исходная смесь достаточна дорога, для ее разделения
используют схемы с рециркуляцией потоков, показанные на
рис. 7.46. В установках обогащения с каждой следующей ступени
на вход предыдущей возвращается сбрасываемый поток (схема а);
в установках отгонки — пермеат (схема б); при этом сбрсывае-
мый поток с каждой предыдущей ступени подается на вход сле-
дующей.
На основании работ Хванга С.-Т. для инженерных расчетов
процесса мембранного разделения газовых смесей можно при-
менять метод Мак-Кэба и Тиля с построением в координатах
xF, Ту равновесной кривой и рабочей линии процесса. Исполь-
зуемый здесь термин равновесная кривая для мембранного моду-.
33*
515
q) S)
Рис. 7.46. Схемы многокаскадных установок с рециркуляцией потоков
ля не адекватен используемому в термодинамике, поэтому в ряде
книг (например, [38]) применяют термин кинетическая кривая.
В случае, если в мембранном элементе под действием про-
дольного перемешивания в фазах пермеата и разделяемой смеси
устанавливается усредненная концентрация при незначительном
перепаде давлений в каналах для бинарной смеси 1 — 2 справед-
ливы следующие балансовые уравнения:
Г yv = К. S (рн xL - рд ук)/8;
(7.161)
V (1 - yv) = К2 S[pK (1 - xL) - рд (1 - yF)]/5,
где xL и у у — соответственно молярные доли компонента 1 в
напорном и дренажном каналах соответственно.
Совместное решение уравнений (7.161) дает уравнение
состояния
, (7162)
1 - Уу 1 - xl ’ 9 О - Уу>
где а — фактор разделения: а = Кх /К2 , у — отношение давле-
ний: ср = рд /рн .
516
Очевидно, соотношение (7.162) в значительной степени зави-
сит от величины 6 = V/F, при этом общий материальный баланс
определяет дополнительное условие
xF = 0yF + (1 - 0)х£. (7.163)
Зависимость yv = f(xF) при 0 = const, определяемую уране-
ниями (7.162) и (7.163), называют равновесной кривой.
На состояние, определяемое равновесной кривой, существен-
ное влияние могут оказать эффекты, называемые в мембранной
технологии вторичными: концентрационная поляризация, про-
дольное перемешивание, перепад давлений вдоль мембраны.
Концентрационная поляризация связана с накоплением или
истощением вещества в граничном слое, прилегающем к мемб-
ране, что в свою очередь ухудшает перенос вследствие снижения
движущей силы процесса. При расчетах процессов разделения
газовых смесей этим снижением, как правило, можно прене-
бречь. Продольное перемешивание всегда ведет к выравниванию
поля концентрации в каналах и отрицательно влияет на процесс
разделения. В расчетных схемах обычно выделяют два случая:
полное перемешивание и идеальное вытеснение. Снижение дав-
ления вдоль мембранного канала за счет гидродинамического
сопротивления также ухудшает массоперенос.
Вид рабочей линии зависит от выбранной схемы установки
и определяется материальным балансом ее ступеней, например,
для верхней части установки обогащения л-й ступени (контур I
рис. 7.46, а) имеем
К+1 ~ + & > Уп+1 К+1 ~ Хп Ln + Уо
где Ln — сбрасываемый поток (концентрат) л-й ступени;
Vn+i — поток исходной смеси, поступающей в л-ю ступень;
D — фильтрат ступени п — 1; уп+1 — доля целевого компонента
в потоке Vn+l ; хп — доля целевого компонента в потоке L .
Уравнение рабочей линии имеет вид
Уп+1 = Хп /Vn+i+ У в
Величину 0 для ступени п определяют как 0И = Fn/(Fn+1 + £лЛ) =
= Уп/(Уп+1 + Vn - D) (контур II на рис. 7.46, а).
Уравнение, позволяющее вычислить потоки от верхней до
нижней ступени, имеет вид
и.. =(1 -еи) К/К
и+l X п ' пг п
517
Введя обозначение £ = (1 - 0П )/0и и выполнив алгебраические ?
преобразования, получим
п Г я л 1
к, ru,+ П [1 + X (ПО]-
г=1 г=2
С учетом равенства Ln = (Vn+l - D) окончательное уравнение
рабочей линии для установки из п ступеней обогащения прини-
мает вид
п п п
= ь.---г2—, м »
г1П^,+л[1 + Е(П^
r=l z=2 J=i
D
п г п п
Щ,+ D [1 + z ( Щ,
r=l r=2 J—i
(7.164)
Аналогично можно вывести уравнение рабочей линии для
установки отгонки, показанной на рис. 7.46, б.
При выполнении практических расчетов обычно рассматри-
вают один из трех вариантов. 0n = const и Vn = const; 0И = const
и К = var; 0„ = var и К = var.
Для практических расчетов большой объем эксперименталь-
ных данных по удельной проницаемости для различных систем
можно найти в специальной литературе [38, 39, 59 и др.].
Пример. 7.4. Определить содержание кислорода в получаемом продукте при
его разделении на силоксановой мембране (а = 2,2; Ар = 0,5 МПа; рд = 0,1 МПа)
в одноступенчатом модуле. Определить степень извлечения кислорода и удельные
(отнесенные к объему получаемого кислорода) энергозатраты. Для определения
содержания кислорода в обогащенном воздухе используем уравнения (7.162) и
(7.163). Степень извлечения воздуха определяем как у = 1 '0 уг/0,21. Результаты
расчета сведены в табл. 7.8.
7.8. Результаты расчета мембранного модуля
Вариант расчета е Уу V ри, МПа /уд, МДж/м3
1 0,05 32,5 7,7 20,56
2 0,10 31,7 15,1 0,6 10,48
3 0,50 26,5 63,1 2,45
4 0,1 32,8 15,6 1,0 13,03
518
Анализ результатов расчета показывает:
для получения продукта с более высоким содержанием кис-
лорода необходимо использовать двух- и трехкаскадные уста-
новки;
мембранные установки разделения воздуха с целью получе-
ния кислорода имеют низкое значение степени извлечения кис-
лорода и требуют значительных удельных энергозатрат.
§ 7.12. РАЗДЕЛЕНИЕ ВОЗДУХА НА ЭЛЕКТРОХИМИЧЕСКИХ
МЕМБРАНАХ
Электрохимический метод разделения воздуха основан на
применении твердых электролитов и обеспечивает высокую
степень селективности. Развитие электрохимического метода
получения кислорода продиктовано потребностью многих отрас-
лей промышленности в особо чистом кислороде. Использование
твердых электролитов имеет существенные преимущества — это,
прежде всего, простота и надежность конструкционного испол-
нения электрохимических ячеек и униполярный характер прово-
димости, что позволяет исключить эффекты, связанные с одно-
временным переносом ионов разных веществ.
Рассмотрим принципиальные особенности разделения воздуха
на высокотемпературных твердых электролитах.
Классификация твердых электролитов. Большинство твердых
электролитов относится к ионным кристаллам, которые состоят
из положительных и отрицательных ионов. Эти ионы образуют
кристаллическую решетку за счет того, что кулоновское притяже-
ние между ионами противоположного знака сильнее, чем куло-
новское отталкивание между ионами одного знака. Важнейшая
черта, отличающая большую часть твердых электролитов от
других твердых материалов, — их аномально высокая ионная
проводимость, составляющая 0,1...1,0 (Ом*см)'1, т.е. близкая к
проводимости расплавов и концентрированных растворов
сильных электролитов.
Механизм, обеспечивающий высокую ионную проводимость
твердых электролитов, физически связан с высокой подвиж-
ностью одного типа ионов в жесткой структуре, образованной
другими ионами. Для реализации такого механизма необходимо
одновременное выполнение следующих условий.
1. Жесткая структура (каркас) должна содержать больше
вакансий, чем мобильных ионов, которые могут их занять.
519
2. Вакансии должны располагаться в кристаллической решетке
так, чтобы энергия активации перехода между ними была не
слишком велика.
Решающий шаг к пониманию механизмов транспортных про-
цессов в твердых телах был сделан Френкелем и Шоттки,
которые показали, что при любой температуре в кристалле j
существует равновесная концентрация точечных дефектов
(междоузельных атомов и вакансий). Массоперенос в таком
кристалле осуществляется поступательным движением катионов
и анионов А по вакансиям (рис. 7.47, а) или по междоузлиям и
вакансиям (рис. 7.47, б). В соответствии с этим кристаллические
твердые электролиты по своей дефектной структуре, определяю-
щей их транспортные характеристики, подразделяют на три
основных класса: 1 — с собственной; 2 — с примесной; 3 — со
структурной разупорядоченностью.
В твердых электролитах с собственной разупорядоченностью
дефекты имеют термическую природу и обусловлены разупорядо-
ченностью собственной кристаллической решетки.
В примесных твердых электролитах наличие точечных дефек-
тов обусловлено необходимостью компенсации избыточного
заряда ионовалентных примесных ионов. Концентрация дефек-
тов определяется содержанием примеси, что позволяет, в опре-
деленной мере, управлять свойствами примесных твердых
электролитов. К такого типа высокотемпературным твердым
а) б)
Рис. 7.47. Модели разупорядоченности кристалла:
а — по Шотки (с равным числом вакансий ( □ ) в катионной и анионной
решетках); б — по Френкелю (с числом вакансий в катионной решетке, равным
числу междуузельных ионов)
520
электролитам относятся наиболее широко используемые в прак-
тике твердые растворы со структурой флюорита: МО2 — М'О и
МО2— М2" О3, где М — Zr, Hf, Се, Th; М' = Са, Sr, Ва;
М" = Sc, Y и лантаниды.
В последние десятилетия наиболее интенсивно изучаются
твердые электролиты со структурной разупорядоченностью, в
которых одна из подрешеток обладает высокой степенью разупо-
рядоченности. Ионы в такой подрешетке с равной вероятностью
могут распределяться по всей совокупности разрешенных пози-
ций, образуя некоторое подобие жидкости. К таким электро-
литам можно отнести высокотемпературную кубическую модифи-
кацию 5 — Bi2 О3.
Высокая ионная проводимость обнаружена также в ряде
гетерофазных систем, например, жидкоканальных зерногранич-
ных структурах (ЖЗГС), представляющих матричную распреде-
ленную структуру, в которой матрица состоит из жидких каналов,
локализованных на границах зерен.
Явления переноса в твердых электролитах. Основные движу-
щие силы переноса ионов в твердых электролитах имеют элект-
рическую или химическую природу.
Перенос ионов в электрическом поле описывается законом
Ома. Плотность тока ионов к через электролит вдоль оси х в
соответствии с законом Ома пропорциональна напряженности
электрического поля:
ik = -ck^. (7.165)
Л Л 1 '
ах
Коэффициент пропорциональности ок — это к-я составляю-
щая удельной электропроводности:
ck = Zkenk Uk, (7.166)
где zk — валентность ионов к; е — элементарный электрический
заряд; пк — концентрация ионов к , Uk — подвижность ионов к,
численно равная скорости движения ионов ик = Uk dy/dx в поле
единичной напряженности.
Перенос ионов в химическом (концентрационном) поле опи-
сывается уравнением Фика. Плотность потока ионов к через
электролит пропорциональна градиенту концентрации этих
ионов:
Л = -Л-?-‘’ <7лб7>
Л Л 7-/-V
521
где Dk — коэффициент диффузии ионов к, который связан с их
подвижностью соотношением Нернста—Эйнштейна
(7168)
Перенос ионов в кристалле, находящемся одновременно в
электрическом и химическом полях (в электрохимическом поле),
при условии независимости этих движущих сил описывается
уравнением Вагнера
Л “ Аэл + Лдиф ’ (7.169)
где Jk эл и ^диф — вклады в общий поток электрических и хими-
ческих (диффузионных) движущих сил.
Плотность потока ионов к через кристалл пропорциональна
градиенту электрохимического потенциала:
Jk=-e-P~, (7.170)
ах
где 6 — экспериментальный коэффициент; цк — электрохими-
ческий потенциал ионов к :
Mfc = + Zk е ф .
(7.171)
В отсутствие градиента химического потенциала выражение
(7.170) должно переходить в закон Ома. С учетом этого, а также
соотношения ik — zke Jk эл из (7.165) и (7.171) следует, что коэф-
фициент 0 связан с парциальной проводимостью ск равенством
е = -Л—. (7.172)
V*2
Подставив выражения (7.171) и (7.172) в (7.170), получим
уравнение для потока ионов
dx dx
(7.173)
которое можно обобщить и на более сложный случай, когда к
электрической и химической движущим силам добавляется
тепловая, если электролит находится в температурном поле. Де
Гроот на основании термодинамики необратимых процессов
522
Ь.
получил уравнение для потока ионов в электрическом, хими-
ческом и температурном полях:
Jk = _ + Zk е
Zk2 dx Т dx Т dx
(7.174)
где еЛ — энергия переноса ионов к.
Уравнение (7.174) можно считать основным для процесса
переноса ионов в твердых электролитах. Необходимо отметить,
что все рассмотренные уравнения переноса применимы только
для слабых полей.
Транспортные характеристики электрохимических мембран.
Согласно уравнениям (7.165)—(7.174) основными транспортными
характеристиками электрохимических мембран являются ионная
проводимость и коэффициенты диффузии, которые определя-
ются концентрацией носителей и энергией активации их переме-
щения. Концентрацию носителей можно варьировать дефект-
ностью (образование одиночных дефектов или простейших пар-
ных комплексов). Что касается энергии активации, в настоящее
время нет единых модельных представлений, на основании
которых ее можно целенаправленно изменять.
Разделение воздуха с учетом экономической эффективности
выгоднее проводить на электрохимических мембранах, облада-
ющих высокой смешанной (ионно-электронной) проводимостью,
поскольку в этом случае отпадает необходимость в дорогих
электродах из благородных металлов.
Для описания процесса прохождения потока анионов и элект-
ронов сквозь электрохимическую мембрану используем уравне-
ние (7.173). Примем, что анионы и электроны мигрируют со ско-
ростями, определяемыми условием электронейтральности. Обоз-
начив потоки ионов кислорода и электронов J( и Je, моль/(см • с),
соответственно получим
°, / + f у
Z? Г2' dx 1 dx '
Z2 F2^ dx dx '
(7.175)
(7.176)
где zt и ze — абсолютные заряды ионов кислорода и электронов
соответственно; of и се — парциальные электропроводности
ионов и электронов.
523
Условие электронейтральности запишем в виде
^ + ^Л = °- <7-177)
Воспользовавшись уравнениями (7.175)—(7.177), выразим
производную
do 1 /О, dp, о, dp, ч
— =--------------( ---(7.178)
dx (oi + ое) F ' Zi dx ze dx '
подставив ее в (7.175), получим выражение для потока ионов
кислорода:
- о, о. (7.179)
(о,. + ое) z2 F2'dx Ze dx '
С учетом равенств ze = -1 и z, = -2 уравнение (7.179) примет
вид
о, су / dp, dp, ч
X =---------- / _Л_ 2 —(7.180)
4 (oz + се) F2 ' dx dx '
Использовав уравнение ионизации О = О2 - 2 е, можно
выразить химические потенциалы следующим образом:
р0 = Р,-2ре. (7.181)
С учетом выражения (7.181) поток кислорода через электро-
химическую мембрану под действием градиента химического
потенциала
Ci
4 {ci + ое) F2 dx
(7.182)
Если вместо химического потенциала подставить доступные
измерению парциальные давления кислорода Ро:
Ро2 = ЯТ1прО2
и предположить, что с. и ое не зависят от ро , уравнение (7.182)
можно представить в виде
7 _ clce RT Рог
(ct + Ge) 4LF2ln p’Oi
(7.182)
где L — толщина мембраны; рОг = 0,02 МПа; Ро2«Ро2 •
524
Таким образом, согласно уравнению (7.183) поток кислорода
определяется электронной проводимостью мембраны, если
се < ct или ионной проводимостью, если о, < се.
§ 7.13. ОСОБЕННОСТИ ТЕПЛООБМЕНА В КРИОГЕННЫХ
СИСТЕМАХ. ТЕПЛОПРОВОДНОСТЬ
Работа криогенных установок и систем связана с процессами
переноса теплоты. Так, рассмотренные в гл.6 схемы циклов
построены на основе принципа регенерации теплоты и обяза-
тельно включают один или несколько теплообменных аппаратов.
В криогенных теплообменниках необходимо обеспечивать малую
разность температур потоков, что может быть достигнуто только
при высокой интенсивности теплообмена. Криогенные системы
работают при температурах, гораздо более низких, чем темпера-
тура окружающей среды, это требует применения специальной
теплоизоляции с малой теплопроводностью. Нередко для крио-
генных блоков используют изоляцию (с дисперсной или много-
слойной структурой) в вакууме; теплоперенос в такой среде —
одна из проблем криогенной теплопередачи.
К другим задачам теплообмена, характерным для криогенных
систем, относят: перенос теплоты через тепловые “мосты”, кон-
тактную теплопроводность, нестационарные периодические на-
грев и охлаждение массы и др.
Главная особенность теплообмена при низких температурах
состоит в значительном изменении теплофизических свойств
криоагентов и конструкционных материалов. Данные, приведен-
ные в гл. 3, свидетельствуют о том, что такие важные в теории
теплообмена характеристики, как теплопроводность X, теплоем-
кость с, вязкость ц, плотность р, значительно зависят от темпе-
ратуры.
Для криогенных систем типична ситуация, при которой состо-
яние рабочего вещества близко к критическому. При этом
изменение физических свойств становится особенно значитель-
ным — даже небольшие колебания температуры могут приводить
к изменению показателей свойств в несколько раз (см. рис. 7.52).
Это значительно усложняет методы расчета процессов тепло-
обмена.
Известно, что теплообмен при фазовых переходах зависит от
свойств рабочей среды и контактирующей с ней поверхности.
Влияние этих факторов наиболее четко проявляется в криоген-
525
ных системах, так как многие процессы в них происходят при
изменении фазового состояния вещества. В криогенных аппара- i
тах часто циркулируют двухфазные потоки вещества. Расчет
тепломассообмена и гидродинамических процессов при охлажде-
нии, хранении и траспортировании криоагентов представляет
важную инженерную задачу.
В криостатах, работающих при низких температурах, допусти-
мы очень малые притоки теплоты из окружающей среды (поряд-
ка 1 нВт). Конструирование этих аппаратов требует тщательного
расчета теплопритоков.
Совершенно особые случаи теплообмена характерны для
сверхтекучего жидкого гелия (Hell), который по механизму
переноса теплоты отличается от обычных жидкостей. При этом
наблюдают такое явление, как скачкообразное возрастание
теплопроводности, которая на порядок превышает теплопровод-
ность меди и серебра; кроме того, между гелием и поверхностью
возникает пограничный скачок температуры (“сопротивление
Капицы”). Это термическое сопротивление усложняет процесс
теплообмена.
Даже этот неполный перечень определяет широкий круг задач
теплообмена, характерных для криогенной техники, при решении
которых необходимо учитывать влияние низких температур на
поведение и свойства вещества. Указанные задачи решают на
основе классической теории теплообмена, базирующейся на
общих законах механики и термодинамики. Эта теория описы-
вает процессы теплопереноса в любых системах; исключением
является жидкий Hell, свойства и поведение которого описывают
на основе квантово-механической ^теории.
Рассмотрим, каким образом общую теорию теплообмена
используют при расчете теплообменных процессов в криогенных
установках. Этот вопрос является основным. Особо следует под-
черкнуть, что здесь речь вдет только о расчете процессов тепло-
обмена, а способы расчета теплообменников конкретных типов
рассмотрены в специальной литературе [12, 36].
Теплопроводность. В криогенных системах довольно часто
приходится рассматривать теплоперенос в твердых телах тепло-
проводностью. Типичный пример — теплопередача через слой
теплоизоляции, через подвески, опоры, тяги, корпуса детандеров,
арматуру, трубопроводы и другие элементы конструкций, рабо-
тающих при разности температур окружающей среды (Т()) и
холодной зоны (Тх). Через изоляцию и по указанным элементам
теплота из окружающей среды поступает в низкотемпературную
526
область, приводя к потерям и снижая эффективность установок.
Механизм теплопроводности определяет значительную часть
притока теплоты к холодной аппаратуре. В ряде случаев низкая
теплопроводность стенки, разделяющей потоки в теплообменных
аппаратах, приводит к значительному ухудшению теплообмена.
Нестационарная теплопроводность существенно влияет на
время процесса и затраты криоагента при охлаждении различных
объектов до рабочих температур. Для решения этих и подобных
задач применяют классическую теорию теплопроводности, бази-
рующуюся на гипотезе Фурье о пропорциональности удельного
теплового потока градиенту температуры:
q—— XgradT, (7.184)
где X — теплопроводность, Вт/(м-К); grad Т — дТ/дп (п —
координата по нормали к изотермической поверхности).
Применив гипотезу Фурье к элементарному объему твердого
тела dv — dx dy dz и составив для него уравнение теплового
баланса за время dt, можно получить дифференциальное урав-
нение теплопроводности, которое для изотропной среды имеет
вид
ЭТ Э /- ЭТ \ , Э л ЪТ \ Э л ЭТ \ 1Qj-s
ср---=----(X---- +---- X--- +----IX---- + q„, (7.185)
Эт Эх ' Эх ' ду\ Эу > dz Эг '
где с — удельная теплоемкость, кДж/(кг-К); р — плотность, кг/м3;
qn — теплота, поглощаемая (выделяемая) внутренним источни-
ком, кВт/м3.
Теплопроводность X и теплоемкость с зависят от температуры,
поэтому в общем случае уравнение (7.185) является нелинейным.
В большинстве случаев принимают постоянные средние значения
X и с, что существенно упрощает решение уравнения (7.185),
однако это не всегда допустимо для криогенной области темпе-
ратур.
Уравнение (7.185) описывает изменение температурного поля
тела во времени. Уравнения (7.184) и (7.185) вместе с краевыми
условиями позволяют решать многие задачи теплопроводности
твердых тел.
Стационарная теплопроводность.
Практически важным случаем является стационарный тепло-
обмен для одномерного потока теплоты. Примеры такой системы
— плоская стенка или стержень с адиабатной боковой поверх-
527
ностыо; тогда поток теплоты вдоль оси х, нормальной к поверх- '
ности F [см. уравнение (7.184)]: i
Q=-’kFdT/dx. (7.186)
При F = const и X = const для стенки толщиной 5 с темпера- ?
турами на границах Тх и Т2 (7\ > Т2)
е=(Х/8)(7;- Т2) F. (7.187)
Формулу (7.187) широко используют в расчетной практике,
но только при соблюдении принятых при выводе условий. Для
криогенной области температур допущение X = const часто явля-
ется слишком грубым; в действительности X = f(T) и может
изменяться более чем на порвдок (см. гл.З). С учетом этого
обстоятельства, используя выражение (7.186), значение Q следует
определять по формуле
т,
Q = (F/б) J X dT. (7.188)
т2
Как правило, зависимость X =/(7) дают в виде графиков или
таблиц; поэтому целесообразно интеграл (7.188) заменить сум-
мой, разбив интеграл от Тх до Т2 на п участков:
Q=W) Е XfATp (7.189)
где Х; — средняя теплопроводность в интервале температур ДТГ
Иногда расчет удобнее вести по формуле (7.187), подставив
в нее среднеинтегральную теплопроводность. Согласно теореме
о среднем
Л = [ j1 Л drl / (Т, - Г2) = [ f X, ДТ, ] / (Г, - Т2). (7.190)
1 т2 J I F=1 J
Среднюю теплоемкость сср также можно расссчитывать по
формуле (7.190).
Гораздо сложнее задачи двух- и трехмерной стационарной
теплопроводности и, особенно, о нестационарной. Такие задачи
при X = f(T) удобнее всего решать численными методами.
Нестационарная теплопроводность.
Решение уравнения (7.185) позволяет определить температурное
поле, время охлаждения различных объектов и количество
отнимаемой теплоты. Получены решения ряда задач для
некоторых тел правильной геометрической формы (плоская
528
Рис. 7.48. Схема к расчету нестационар-
ного температурного поля в твердом теле
конечно-разностным методом
стенка, цилиндр, шар, куб) при
различных краевых условиях;
однако при этом теплофизи-
ческие параметры (X, с), как
правило, принимали постоян-
ными. Для тел сложной геомет-
рической формы и при значи-
тельных изменениях теплофи-
зических свойств общее урав-
нение (7.185) можно решать
только численными методами с
использованием ЭВМ. В этом
случае переходят от дифферен-
циальных уравнений к выраже-
ниям в конечных разностях.
Расчетные формулы получают
применением закона Фурье и соответствующих краевых условий
к составлению уравнений тепловых балансов для отдельных эле-
ментов рассматриваемого тела.
Для линейной задачи элементом является интервал Ах, для
двумерной — плоскость Ах Ау, для объемной — параллелепипед
Ах Ay Az- В пределах одного элемента закон изменения темпера-
туры принимают линейным, теплофизические параметры си/,
постоянными для каждого интервала времени Ат. Принимают
также, что в течение времени Ат средний тепловой поток АС в
элементе пропорционален начальному значению градиента тем-
пературы. Составим уравнение теплового баланса для двумер-
ной области (рис. 7.48). В основе расчетной схемы дан элемент
со сторонами Ах и Ду; значение Т в его центре является расчет-
ным.
Тепловые потоки за время Ат [см. уравнение (7.186)]:
через левую и правую грани элемента соответственно
АЛ = - X J Т~- Т-х--^- ) Ау Ат; (7.191)
\ Ах '
ДС2 = - ( Т~ ТхГ-~ ) Ду (7.192)
' Ах '
34 Заказ № 1592
529
через нижнюю и верхнюю грани
Дб3 = - XT ( Ту-^ ) Ах Ат;
' Ду /
AQ4 = - XT ( — Ту+&у ) Ах Ат.
\ Ау >
Уравнение теплового баланса представляет собой алгебраичес-
кую сумму тепловых потоков через все грани; температура эле-
мента изменяется за время Ат от Т до 7^
4
Z Qt = A6i + Лб2 + Абз + А04 = СТ р Ах Ау (Тт+Д<1 - Т). (7.193)
Г=1
Подставив значения Qt и выполнив преобразования, получим
=А1Т+ А2(Тх_.х + Т^) + А3(Т^у + Ту^у), (7.194)
где Ах = 1 - ат Ат (1/Ах2 + 1/Ау2); А2 = ат Дт/Ах2;
А3 = ат\т/\у-, аТ= ,кт/(стр) — температуропроводность.
По формуле (7.194) можно найти температурное поле в
моменты времени т + Ат; т + 2 Ат,..., т + i Ат вплоть до наступ-
ления стационарного состояния. За исходное состояние прини-
мают начальное распределение температуры. Отдельные члены
уравнения (7.193) могут отличаться от приведенных выше; так,
для граничного элемента (см. рис. 7.48) ACj = а (Т - То) Ау Ат,
где а — коэффициент теплоотдачи; То — температура окружаю-
щей среды.
В результате несколько изменяется формула (7.194) для всей
левой границы. Температуропроводность ат изменяется во
времени и пространстве [аг = <р(Т)], поэтому в начале каждого
цикла вычислений принимает новое значение ат. При составле-
нии программы расчета необходимо установить ограничение
шага по времени Ат. Минимально допустимое значение
определяют при условии Тх+1л > 0, т.е. Ах > 0; при этом
At < (1/Дх 2 + 1/Лу2)] '. (7.195)1
Этот метод расчета легко обобщить для трехмерной задачи,
он позволяет учитывать источники теплоты и всегда дает иско-
мый результат, хотя требует гормоздких вычислений. Точности
расчета зависит от временных Ат и пространственных (Ах, Ау, А^)
530
интервалов и может быть обеспечена соответствующим выбором
этих интервалов.
Перенос теплоты в криогенной теплоизоляции. К особому
случаю теплопроводности в криогенных системах относится
перенос теплоты в различных видах тепловой изоляции насып-
ной, порошково-вакуумной и многослойно-вакуумной. Обычно
газонаполненная теплоизоляция имеет зернистую, волокнистую
или ячеистую структуру и находится под атмосферным давле-
нием. Порошково-вакуумная изоляция имеет зернистую струк-
туру (давление р « 10 Па). Многослойно-вакуумная (наиболее
эффективная) теплоизоляция состоит из чередующихся слоев
низкотеплопроводной стеклоткани и алюминиевой фольги;
давление газа в теплоизоляционной полости р - 0,1...0,01 Па.
Механизм передачи теплоты через такую дисперсную среду,
как теплоизоляция, имеет сложный характер и определяется радом
составляющих (теплопроводностью твердых частиц, контактным
теплообменом в местах касания частиц или слоев, конвекцией и
теплопроводностью газа, излучением между частицами).
Эффективную теплопроводность приближенно определяют по
формуле
Чф = К + Ч, + К, (7.196)
где Хт — теплопроводность твердого тела и зон контакта; лиз —
теплопроводность излучением; Хг — теплопроводность остаточ-
ного газа (в вакууме Хг -> 0).
Очевидно, что определенное таким образом значение ХЭф
является условным и интегрально учитывает все виды тепловых
потоков. В то же время этот
простой формулой (7.187) для
Теплопроводность изоляции
зависит от температуры, плот-
ности и давления газа, степени
черноты материала, размера
частиц.
Рис. 7.49. Зависимость теплопровод-
ности волокнистых теплоизоляционных
материалов от температуры:
1, 5— хлопковая вата (7 — р = 81 кг/м3;
5 — р = 42 кг/м3); 2, 3, 7 — мине-
ральная вата (2 — р = 400 кг/м3;
3 — р = 200 кг/м3; 7 — р = 95 кг/м3);
4 — стеклянная вата (р = 50 кг/м3);
6 — шелковые очесы (р = 58 кг/м3)
34*
подход позволяет пользоваться
определения теплового потока.
Рис. 7.50. Зависимость теплопроводности от давления в интервале температур
290... 80 К теплоизоляционных материалов вакуумных типов:
а — порошковых и волокнистых [1 — магнезия; 2 — минеральная вата; 3 — перлит;
4 — стекловата (20 мкм); 5 — стекловата (5—7 мкм); 6 — кремнегель; 7 — мипора;
8 — аэрогель]; б — многослойных (алюминиевая фольга — стеклоткань) при
различном числе слоев и (7 — и = 26; 2 — и = 40; 3 — и = 51)
На рис. 7.49 и 7.50 приведены зависимости теплопроводности
криогенной теплоизоляции от температуры и давления. При сни-
жении температуры в интервале 300 ... 80 К эффективная тепло-
проводность Хдф обычной теплоизоляции уменьшается в 2 ... 4 раза
(см. рис. 7.49).
Для изоляции вакуумных типов давление остаточного газа
очень сильно влияет на их теплопроводность, причем зависи-
мость имеет сложный характер (см. рис. 7.50). Высококачествен-
ные образцы многослойно-вакуумной теплоизоляции имеют наи-
меньшую теплопроводность; среднее значение в интервале тем-
ператур 300 ... 80 К около 10 4 Вт/(м • К).
Контактная теплопроводность. Этот вид
теплопроводности — определяющий для некоторых видов
соединительных элементов криогенных систем. К ним относятся
подвески и опоры, обычно называемые тепловыми “мостами”.
Тепловые мосты изготовляют из материала с низкой теплопро-
водностью (коррозионно-стойкая сталь, пластмасса); детали
выполняют значительной длины и малого поперечного сечения,
применяя для этого трубчатые конструкции. Тепловые потоки
вдоль этих элементов можно определить по формулам (7.188)—
(7.189). Приток теплоты по мостам может превышать 50 %
общего теплопритока, поэтому применяют специальные конст-
рукции, уменьшающие тепловые потери.
532
Рис. 7.51. Зависимость теплопроводности
от давления при различных температурах
для пластин из коррозионно-стойкой
стали (8 = 0,025 мм)
Основной метод улучшения
характеристик тепловых мос-
тов — применение элементов с
большим контактным тепло-
вым сопротивлением и, следо-
вательно, низкой теплопровод-
ностью. К таким элементам
относятся подвески в виде це-
пей и опоры, выполненные из
набора большого числа тонких
пластин. Контактная теплопро-
водность двух поверхностей обычно мала, а применение боль-
шого числа контактирующих пластин существенно уменьшает
тепловой поток вдоль оси теплового моста. На рис. 7.51 приве-
дена зависимость теплопроводности от давления и температуры
для элементов с контактным тепловым сопротивлением. Следует
отметить, что X зависит от толщины пластин 5. Уменьшение 5
от 0,5 до 0,02 мм приводит к уменьшению X примерно в 4 раза.
Наилучшие характеристики имеют пластины с 6 = 0,02 мм; для
опоры из таких пластин q ~ 2 % теплового потока по сплошному
металлу.
§ 7.14. КОНВЕКТИВНЫЙ ТЕПЛООБМЕН
Процесс передачи теплоты между потоком рабочей среды и
поверхностью твердого тела называют конвективным теплообме-
ном. Этот процесс характерен для криогенных систем, особенно
для теплообменных аппаратов, а также для охлаждения сверхпро-
водников и других объектов. Механизм такого теплообмена более
сложен, чем теплопроводность; теплоперенос в значительной
степени обусловлен переносом массы рабочей среды. Конвектив-
ный теплообмен определяется гидродинамикой потока, тепло-
физическими свойствами жидкости, геометрией поверхности и
рядом других факторов. Расчеты конвективного теплообмена
основаны на понятии коэффициента теплоотдачи а Вт/(м2 • К),
который характеризует интенсивность теплообмена между средой
533
и поверхностью тела F. Тепловой поток при конвективной тепло-:
отдаче находят по формуле Ньютона—Рихмана:
Q = aF(Tn- Тс), (7.197).
где Тп — температура потока вещества; Тс — температура
поверхности тела.
Процесс конвективного теплообмена зависит от большого
числа факторов. Так, однофазную конвекцию подразделяют на
естественную и вынужденную; поток по характеру течения —
на ламинарный, переходный и турбулентный. Разнообразны гео- |
метрические формы поверхностей теплообмена: различают дви- '
жение внутри каналов и различные варианты внешнего обтека-
ния тел. При этом способы определения коэффициента теплоот-
дачи а различны. !
Несмотря на значительные достижения аналитической теории ;
конвективного теплообмена, для расчетов наиболее широко
используют обобщенные эмпирические и полуэмпирические
формулы. Обобщение результатов эксперимента выполняют на
основе теории подобия, в результате формируют безразмерные
числа подобия, включающие коэффициент а и переменные, от
которых он зависит.
Связь между числами подобия, описывающими процесс
теплообмена, устанавливают на основании опытных данных. Для
конвективного теплообмена обычно используют следующие
основные критерии подобия: Нуссельта Nu = ad/X; Рейнольдса
Re = copd/ц; Прандтля Рг = ц.ср/Х; Грасгофа Gr — g^p2^ bl/р2-,
Стэнтона St = Nu/(Re Рг) — a/(copcp); геометрический критерий
l/d и др.
Эмпирические формулы часто представляют в виде
Nu = С Re" Рг"1 , (7.198)
где С, п, ш — постоянные.
Входящие в зависимости такого вида критерии подобия (Nu,
Re, Рг и др.) определяются теплофизическими параметрами —
теплопроводностью X, вязкостью р, теплоемкостью ср, плот-
ностью р и др. Эти параметры нередко сложным образом зависят
от температуры (см. гл. 3), в результате коэффициент тепло-
отдачи а также является функцией температуры.
Так, для турбулентного потока в канале обычно используют
уравнение
Nu = 0,023 Re0’8 Рг °’4,
(7.199)
534
из которого следует (при постоянном массовом расходе)
а = const X0’6 (ср/м)0’4 = <р (Т). (7.200)
Формулы вида (7.198) широко применяют для расчета
теплообмена в криогенных системах, причем в большинстве
случаев коэффициент а определяют при средней температуре
теплоносителя 7^р при которой вычисляют X, ср, р. Однако такой
подход не всегда возможен; нередко теплофизические свойства
меняются очень сильно, например, если криоагент в процессе
теплообмена переходит из газообразного состояния в жидкое.
В этих случаях следует разбивать весь интервал изменения
температуры теплоносителя на п участков и для каждого участка
определять коэффициент а.
Таким образом рассчитывают криогенные теплообменные
аппараты, в которых теплообмен происходит при р = const,
учитывая изменение температуры и свойств вдоль потока рабо-
чего вещества. Однако возможны и другие ситуации, когда
теплофизические свойства изменяются настолько сильно, что это
изменение необходимо учитывать не только вдоль канала, но и
в его поперечном сечении — по радиусу; последнее обстоятель-
ство приводит к деформации профиля скорости, изменению
гидродинамики потока и, следовательно, изменению а. Следст-
вием такого явления является сложная зависимость а (Т),
причем общепринятые уравнения теплообмена данный фактор
не учитывают и становятся непригодными.
Прежде всего следует установить области состояния вещества,
в границах которых необходимо учитывать влияние переменных
свойств на теплоотдачу. Существенное изменение свойств проис-
ходит вблизи критической точки; значения рк и Тк для криоаген-
тов приведены в табл. 3.2. Область состояний при Р> Рк (свёрх-
критическое состояние) является зоной, где влияние свойств на
теплообмен наиболее значительно.
Характер изменения свойств вблизи критической точки Тк для
азота показан на рис. 7.52; при этом существенное значение
имеют максимум теплоемкости и температура Тт, соответст-
вующая этому максимуму. Температура Тм несколько выше 7}.;
она переменна и зависит от давления; так, для гелия при измене-
нии р от 0,3 до 3 МПа Тт повышается от 5,56 до 11,1 К.
На некотором удалении от критической точки, ориентиро-
вочно при Т/Тт< 0,85 или Т/Тт > 1,3 и р/рк > 3,0 для веществ
в однофазном сверхкритическом состоянии характерна область
535
Рис. 7.52. Зависимость теплофизи-
ческих свойств азота |i, 1, р, ср от
температуры вблизи критической
точки (р = 5,0 МПа)
рЮ''кг/мг}Ш,вт/(мК);рЮ^Пас
5 -Ю
умеренного изменения свойств.
Границы этой области размы-
ты и четко не определены. Для
областей сильного и умерен-
ного изменения свойств при-
меняют отдельные корреляции
для расчета коэфициентов теп-
4 -
J - Р
А
оч
вО 120 160 200 Т,К
лоотдачи.
Область умеренного изменения свойств. Существует несколько •
различных подходов, позволяющих рассчитывать теплообмен при
переменных физических параметрах. Так, изменение свойств »
косвенно учитывают выбором некоторой определяющей темпера-
туры, при которой вычисляют свойства. При постоянных свойст-
вах в качестве такой температуры принимают температуру Тп
ядра потока. При переменных свойствах нередко ее среднее
значение 7^= 0,5 (Тс + Тп) принимают в интервале от 7с до Тп,
где Тс — температура поверхности теплообмена.
Другой способ учета влияния температуры на свойства состоит
в том, что в уравнение теплообмена типа (7.198), (7.199) вводят
дополнительные числа подобия
(Ргп/Ргс)р; (н„/Ис)'; (Т„/Те)*, (7.201)
где показатели степени р, I, к определяют экспериментально для
конкретных рабочих веществ и условий теплообмена.
Ограниченность таких зависимостей очевидна; однако они
наиболее точны и нашли широкое применение. Чаще всего из
этих чисел подобия на практике используют температурный
фактор (Тп/Т^к или его обратную величину.
Ниже приведены некоторые формулы для определения коэф-
фициента а в сверхкритическом состоянии (р >рк), полученные
для ряда криоагентов при турбулентном течении в каналах.
Для азота и кислорода
Nu = 0,021 Re0’8 PiX)-4 (Тс/Гп)' °-5.
(7.202)
536
Пределы применимости этого выражения: Тп > 1,1 Тт; при
этом Тс > Ттпр/рк > 1,2; TJT^ = 1,40...3,75; Re = 2,7х104...1,4х
х 105; q = 40...400 кВт/м2.
Для водорода рекомендуется зависимость, учитывающая
влияние входного участка ljd\
Nu = 0,023 Re0’8 Рг°’4 (7с/Тп)' (0>57 ’!’59d/l\ (7.203)
Эта формула хорошо аппроксимирует экспериментальные
данные при р/рк > 2,8 и 1,00 < Тп /Тк < 0,75.
Для гелия характерно влияние переменных свойств даже в
области, удаленой от критической точки. Так, для жидкости
хороший результат дает зависимость
Nu = 0,015 Re0-8 Рг0’4 (7.204)
в пределах измерения Re = (2,6...7,3)104. Эта зависимость
пригодна и для газа. Следует отметить отличие числового коэф-
фициента формулы (7.204) и классической зависимости (7.199).
При Тт < Тп, Тс > Тт, р > рк и Re = 1О4...Ю6 для сверхкрити-
ческого гелия применима формула
Nu = 0,0259 Re0’8 Рг0’4 (Тс/Тп)-°>716. (7.205)
Во всех приведенных формулах теплофизические свойства,
определяющие критерии Nu, Re, Рг, вычисляют при температуре
потока Тп. Таким образом, при умеренном изменении свойств
процесс теплоотдачи криоагентов в закритическом состоянии
рассчитывают по зависимости вида (7.198) с введением в них
температурного фактора.
Область значительного изменения свойств. Границы этой
области, также относящиеся к сверхкритическому состоянию,
определяются соотношением температур потока Тп, поверхности
нагрева Тс и псевдокритической температуры Тт. Зону наиболь-
шего влияния свойств обычно определяют как
Т„ s тп < Тс . (7.206)
Это означает, что по радиусу канала в узком интервале
температур между 7^ и Тс возникает пик теплоемкости. При этом
свойства ядра потока и пристеночного слоя могут различаться
в несколько раз. В такой ситуации приведенные выше уравнения
теплообмена непригодны, так как на теплоотдачу дополнительно
537
влияют плотность теплового потока и массовая скорость ра>; при ,
увеличении #/(ра>) возрастает влияние свойств на теплообмен.
Механизм переноса теплоты в этой зоне для сверхкритического .<
состояния изучен недостаточно. Установлено, что по длине кана-
ла режим теплоотдачи может быть различным — улучшенным
или ухудшенным по сравнению с нормальным теплообменом, I
при постоянных по радиусу свойствах.
При давлениях, близких к критическому, при Тп < Тт и ;
Тс = Тт теплоотдача более интенсивна, чем это соответствует ?
уравнению (7.199). С другой стороны, при условии (7.206) реали-
зуется ухудшенный режим и теплоотдача может ухудшаться в ,
несколько раз. Ухудшение теплоотдачи и соответствующее повы-
шения температуры стенки Тс наблюдают при увеличении удель-
ного теплового потока q. В некоторых случаях наблюдается пуль-
сация потока теплоносителя. '
Получен ряд эмпирических зависимостей для расчета тепло-
обмена в этой области, однако неполнота знаний о теплообмене
ограничивает ценность таких формул. Для криогенных систем
наибольший интерес представляют данные по темлообмену
сверхкритического гелия, так как это рабочее вещество целесооб-
разно использовать при термостатировании некоторых типов
сверхпроводящих устройств.
Преимущество сверхкритического гелия по сравнению с двух-
фазным гелием определяется в основном меньшим перегревом
стенок канала при высоких значениях q, что улучшает стабили-
зацию сверхпроводников. Для расчета теплоотдачи сверхкрити-
ческого гелия можно рекомендовать зависимость
St = St„ (рс/р')1’45 [0,6/(p/ptУ + 11, (7.207)
где St = <7/|р<х> (/с - /п)] — критерий Стэнтона (/с и /п — энталь-
пии при температурах стенки и потока; рсо — массовая скорость
потока); St0 = £/8 (£ — коэффициент сопротивления, опре-
деляемый по обычным зависимостям для однофазного турбу-
лентного потока); рс — плотность потока у стенки канала; р —
средняя плотность потока в интервале температур от Тс до Тп.
Тепловой поток q = а (Тс - 7П).
Формула (7.207) обобщает экспериментальные данные, полу-
ченные при диаметре канала d < 2,13 мм.
538
§ 7.15. ТЕПЛООБМЕН ПРИ КИПЕНИИ
Процессы теплообмена при фазовых превращениях (кипении
и конденсации) происходят во многих аппаратах криогенных
систем и установок; например, в конденсаторах-испарителях
ректификационных колонн, ваннах предварительного охлажде-
ния, газификаторах и емкостях, системах охлаждения энерге-
тических устройств криоагентами и др. Фазовые переходы
связаны с изменением структуры вещества и сопровождаются
выделением (поглощением) энергии, называемой теплотой фазо-
вого перехода.
Теплообмен при кипении зависит от многих факторов:
комплекса физических параметров рабочей среды, состояния и
формы поверхности, характера образования центров новой фазы,
давления, температуры, теплоты фазового перехода, условий
распространения теплоты в каждой из фаз.
Теплообмен при фазовых превращениях, особенно при
кипении, отличается большой сложностью и, пожалуй, относится
к тем видам теплообмена, для которых имеется наиболее
противоречивая и наименее достоверная информация. Кипение
и конденсация могут происходить в интервале температур между
тройной и критической точками.
Процесс кипения происходит, когда температура поверхности
Тс превышает равновесную температуру насыщения жидкости
7н при данном давлении. Жидкость бывает несколько перегрета
относительно Тн, однако принято считать, что движущая сила
процесса теплообмена при кипении определяется разностью
ДГ = Тс — 7Н. Характер образования паровой фазы внутри
жидкости, ее рост и движение определяют различные режимы
теплообмена при кипении. Существуют три основных режима
кипения: пузырьковый, переходный и пленочный. Различают два
типа систем, в которых происходит кипение: соответственно в
большом объеме и при вынужденном движении жидкости.
Для описания процесса переноса теплоты при кипении исполь-
зуют такие характеристики, как коэффициент теплоотдачи а, плот-
ность теплового потока q и разность температур АТ = Тс - Тн,
связанные известным соотношением
q = а АТ. (7.208)
Экспериментальные зависимости по кипению обычно пред-
ставляют в виде функции q =/(ДТ) или а = <р(АТ). На рис. 7.53
приведена типичная кривая кипения в большом объеме для азота
539
Рис. 7.53. Зависимость удельного теплового потока от разности температур при
кипении азота в большом объеме
при атмосферном давлении. Крайняя левая часть графика
(область малых ДТ) относится к зоне свободной конвекции одно-
фазной жидкости. С возрастанием Д Тначинается кипение, плот-
ность теплового потока увеличивается до критического (макси-
мального) значения . (режим I пузырькового кипения), затем
в узком интервале Д Т тепловой поток уменьшается (переходный
режим II) до минимального значения qKp2. После этого наступает
устойчивый режим III пленочного кипения, при котором
большие значения разности ДТ соответствуют сравнительно
малым значениям q. Это обусловлено образованием между жид-
костью и поверхностью нагрева сплошной паровой пленки со
значительным термическим сопротивлением.
Ясно, что наиболее благоприятен режим пузырькового кипения
при q < qKp. Процессы, аналогичные отраженным на рис. 7.53,
характерны и для кипения в условиях вынужденного движения
в каналах, однако они существенно меняются по длине канала.
Вначале рассмотрим наиболее полно изученный режим —
кипение в большом объеме.
Пузырьковое кипение. Данные по пузырьковому кипению, как
правило, эмпирические. Пока теоретически не описан полностью
механизм образования пузырьков на поверхности в зависимости
от ее микроструктуры. По пузырьковому кипению криогенных
жидкостей получены обширные экспериментальные данные, но,
к сожалению, отсутствуют достаточно удовлетворительные обоб-
щающие зависимости. Результаты, полученью разными исследо-
вателями, нередко различаются в несколько раз, что обусловлено
сложностью процесса влияния многочисленных факторов.
540
На рис. 7.54 приведены экспериментальные данные по пу-
зырьковому кипению криоагентов, полученные различными
исследователями в форме q = /(ДТ). Эти данные соответствуют
левой ветви I кривой кипения (см. рис. 7.54). Эксперименты
проводили в разных условиях: различались материал поверхности
нагрева, его геометрия (трубка, диск, торец стержня, проволока),
размеры и состояние поверхности, ориентация (вертикальная,
горизонтальная), характер изменения теплового потока (увели-
чение или уменьшение). В работе [9] дана подробная инфор-
мация об условиях получения этих экспериментальных данных.
На рис. 7.54 приведены также расчетные зависимости 1-4
различных авторов. Широко известная зависимость 1 получена
С. Кутателадзе в виде Nu — /(Re, Рг, Ga, Кр) обобщением
большого числа экспериментальных данных для некриогенных
жидкостей. Зависимости 2 и 3 построены Д. Лабунцовым на
основе теоретических представлений о механизме переноса
теплоты от поверхности нагрева к пузырькам пара. Зависимость
4 получена Ю. Кириченко.
Расчетные зависимости достаточно хорошо описывают экспе-
риментальные данные, но не учитывают большого числа частных
факторов, перечисленных выше и присущих конкретным усло-
виям кипения. Особенно велик разброс данных для гелия (см.
рис. 7.54, а). При повышении давления плотность теплового по-
тока существенно возрастает, что можно оценить расчетными зави-
симостями, учитывающими влияние давления р. Анализ рис. 7.54
показывает, что при температурном напоре А/ ~ 1 К значение
q для гелия на порядок больше, чем для азота.
Критические удельные тепловые потоки <?кр1 и #кр2 определяют
границы областей пузырькового и пленочного кипения (см.
рис. 7.53). Верхняя граница эффективного и устойчивого пузырь-
кового режима кипения определяется значением </кр1 и соответст-
вующим значением А/кр. Минимальное критическое значение
#кр2 в свою очередь определяет начало развития пленочного
режима кипения. Между указанными режимами находится
переходная зона неустойчивого режима кипения. Практически
целесообразно, чтобы процесс кипения протекал в пузырьковом
режиме при высоких q < qKpl; если же неизбежен пленочный
режим, то должно быть q > #кр2.
С. Кутателадзе предложил зависимость для определения
теплового потока г/кр1, Вт/м2, при кипении в большом объеме
= к r Рп к о (Рж ~ Ри)/Рп I"’25’ <7-209)
541
ts)
о,Вт/м2
^>/ П !
7// О
°о’
J 0 00/ °/у пР d/f К?,°с \/~2 О
О ^7 Qrr г1// о о о >
о
и к и о
/1
"ОС! Луо / ( кк ° w* 0 №< ; °
/ // L J
7/
ц %
0 / jl f
О Л Т/ ч. <
о /1 Lu / /
ю'! 2 4 6 8 10° 2 it 6 SAT,К
fl)
tz Рис. 7.54. Опытные (точки) и расчетные (линии 7—4) данные
w о — гелия; б — водорода; в — азота; г — кислорода
по пузырьковому кипению (р - 0,1 МПа):
Сопоставление зависимости
Рис. 7.55. Зависимость приведенного
максимального критического теплового
потока от параметра Хк при пузырько-
вом кипении в большом объеме
(расчетные данные, точки — экспери-
ментальные
где К — постоянная; г —
теплота фазового перехода,
Дж/кг; g — ускорение свобод-
ного падения, м/с2; о — по-
верхностное натяжение, Н/м;
рж и рп — плотность жид-
кости и пара, кг/м3.
(7.209) с экспериментальными
данными свидетельствует об их удовлетворительной сходимости.
Сравнение расчетного и опытных значений для криогенных
веществ дано на рис. 7.55 в форме </кр1 /(г рп) = Хк, где
Хк = К [g о (рж - рп)/р2]0,25, откуда следует, что опытные точки
наиболее плотно ложатся в интервале значений К= 0,16...0,09.
С увеличением давления q^ возрастает, достигая максимума при
р/рк = 0,3...0,4. Значению </кр1 соответствует разность температур
ДГкр1 при пузырьковом режиме кипения. Примерные значения
критических параметров г/кр1 и ДГкр1 для криогенных жидкостей,
кипящих в большом объеме при атмосферном давлении, можно
определить по максимальным значениям q (см. рис. 7.54); Д 7^.р1
изменяется в пределах 8—12 К для N2 и 0,5—1 К для Не. Мини-
мальные тепловой поток <7кр2 можно определить при известном
4кр1, используя соотношение
^кр1 /^кр2 Рж/Рп *
(7.210)
Пленочное кипение. Режим пленочного кипения имеет мень-
шее практическое значение, чем режим пузырькового кипения,
однако в некоторых случаях может оказаться неизбежным.
Экспериментальные данные по пленочному кипению в большом
объеме имеют меньший разброс, чем по пузырьковому кипению.
Пленочный режим, в отличие от пузырькового, поддается
довольно точному теоретическому расчету. Расчетная модель про-
цесса, впервые предложенная Бромли, построена на той же
основе, что и теория пленочной конденсации: термическое
544
сопротивление низкотеплопроводного слоя пара между стенкой
и жидкостью определяет удельный тепловой поток q и коэффи-
циент теплоотдачи а. Решение задачи в такой постановке приво-
дит к следующей зависимости для кипения на поверхности
горизонтального цилиндра:
а = 0,62 [\’р„ (рж - р„) А ТО)!0-25, (7.211)
где Хп и |in — теплопроводность и динамическая вязкость пара;
г’ — теплота фазового перехода; D — диаметр цилиндра.
При кипении на вертикальной стенке числовой коэффициент
примерно равен 0,72; вместо диаметра D подставляют высоту
стенки Н. Все параметры для паровой фазы определяют при
средней температуре Т^. Величина г’ включает теплоту испарения
жидкости г и часть теплоты перегрева пара: г' = г + 0,5с Л 7. В
дальнейшем Брин и Уэстуотер уточнили формулу (7.211), расши-
рив диапазон ее применимости; полученная ими зависимость
имеет вид
а = [0,59 + 0,069 (Лкр/2>)] [Х„3р„ (рж - р„) gr’/ftx, ДТЛ^)]0-25,
(7.212)
где Лкр — наименьшая критическая длина волны, определяющая
границу гидродинамической неустойчивости поверхности раздела
двухфазной системы жидкость—пар:
Л„ = 2ж з/ o/[g (рх - рп)]. (7.213)
Существует целый ряд других формул для пленочного кипе-
ния.
Расчетные данные, полученные по формуле (7.212) для крио-
агентов, удовлетворительно согласуются с экспериментальными.
При D > 1 см диаметр не влияет на интенсивность теплообмена.
В некоторых случаях возможно несовпадение расчетных и экспе-
риментальных характеристик, особенно при малых диаметрах
цилиндра.
Экспериментальные данные по пленочному кипению Не, N2,
О2 и Н2 приведены на рис. 7.56 в виде обобщенной зависимости
Nu =/(Gfy РгД Эти данные обобщают результаты исследований
режима кипения на поверхности цилиндров диаметром D =
= 5,5 • 10‘3 ... 19,5 мм. Все физические параметры в этом случае
взяты для пара при Т^ = 0,5 (Тс + 7^); принятая форма связи
между критериями позволяет хорошо обобщить результаты.
35 Заказ № 1592
545
NuT
10°
101
Nuf
10г
10
0 12 3 4 3 6lg(GrfPrf)
Рис. 7.56. Зависимость Nu = /(GiyPiy) для теплообмена при пленочном кипении
криоагентов
При охлаждении объектов погружением в жидкость возникают
большие разности температур ДТи происходит малоэффективное
пленочное кипение. Один из методов уменьшения Д/’и перехода
в область пузырькового кипения состоит в покрытии поверхности
тела слоем низкотеплопроводного материала (пластмасса, лак и
др.). В результате ДТуменьшается (ДТ< Д7кр j) и интенсивность
теплообмена возрастает.
§ 7.16. ТЕПЛООБМЕН ПРИ ДВИЖЕНИИ ДВУХФАЗНОГО
ПОТОКА В КАНАЛАХ
Этот вид теплообмена, сочетающий кипение и конвективный
теплоперенос при вынужденном движении, наиболее сложный f
и недостаточно изученный. Гидродинамика процесса и, следова- У |
тельно, теплообмен определяются движением как пузырьков |
пара, так и основной массы жидкости и пара, т.е. происходит V I
двухфазное течение потока. По характеру процесс существенно f i
отличается от кипения в большом объеме, причем данный случай
наиболее близок к условиям теплообмена в реальных криогенных |
системах. |
546 *
Рис. 7.57. Схема изменения режимов
течения и теплоотдачи насыщенной кипящей
жидкости в вертикальном канале при вынуж-
денном движении
При движении жидкости в
обогреваемом канале происходит
постепенный переход от однофаз-
ного течения к пузырьковому,
затем снарядному, кольцевому
(пленочному), эмульсионному
(дисперсному) течению, а в конце
течет однофазный поток пара.
Жидкость вначале кипит при
недогреве, а затем при насыще-
нии. Характер течения различен в
вертикальных и горизонтальных
каналах, в которых происходит
расслоение, — газ собирается в
верхней, а жидкость — в нижней
части канала.
Изменение режимов течения и
теплообмена в вертикальном
канале иллюстрирует схема на
рис. 7.57. Вначале режим близок
к обычному пузырьковому кипению, а при кольцевом и дисперс-
ном течении теплообмен происходит переносом теплоты через
тонкую кольцевую пленку жидкости.
Для характеристики теплообмена при двухфазном течении
используют такой дополнительный параметр, как массовое
паросодержание х — доля пара в полном массовом расходе в
данном сечении. Другая важная характеристика таких потоков
— параметр двухфазности Мартинелли
Пар
Жидкость
Кольцевое
течение
Однофазное
течение
жидкости
Пузырьковое
течение
Дисперсное
течение
Снарядное или
пенистое течение
Однофазный
поток
пара
Режим
течения
Режим
теплоо)
!дачи
Конвективная
теплоотдача
к перегретону
пару
Режим недостатка жидкости.
Теплоотдача
через жидкую
пленку
при вынужденной
конвекции
Пузырьковое
кипение
Кипение при недогреве
Конвективная
теплоотдача
к жидкости
/1-х / Рд / Ц* V’1
” ' X / \ рж / \ цп /
(7.214)
Получено много зависимостей, обобщающих частные резуль-
таты по теплообмену при двухфазном течении, но они не имеют
универсального характера.
В области пузырькового кипения простейший способ расчета
состоит в раздельном определении коэффициентов теплоотдачи
35* 547'
для кипения акип и для движения однофазной среды аконв с
последующей их суперпозицией. Так, С. Кутателадзе предложил
формулу
« = «конв I1 + (“кип /«конв )21 ’ > <7’215)
где аконв вычисляют по формуле (7.200) для жидкой фазы, а акип —
по экспериментальным или расчетным данным для кипения (см.
рис. 7.54).
Для переходной зоны надежные данные отсутствуют. Для
устойчивой области пленочного кипения при двухфазном потоке
имеется ряд корреляций, которые целесообразно применять для
тех криоагентов, для которых они были получены. Так, для
водорода можно рекомендовать уравнение
Nu = Nu„ [1/(0,7 + 2,4 х„ ) + 0,15]. (7.216)
Характер аппроксимации экспериментальных данных этой
зависимостью показан на рис. 7.58. Значение Nu0 в уравнении
(7.216) вычисляют по формуле (7.199), заменив численый коэф-
фициент 0,023 на 0,021; критерии Re и Рг определяют для паро-
вой фазы при средней по сечению температуре 0,5 (Тс + Тп),
а плотность (в выражении для Re) — как среднюю для пара и
жидкости, т.е.
Pep = 1*/Р„ + (1 - *)/pJ ' *• (7.217)
Согласно рис. 7.58 в двухфазной области коэффициент тепло-
отдачи (число Nu) может быть больше и меньше, чем для одно-
фазного потока, в зависимости от Значение зависит от
Рис. 7.S8. Экспериментальные (точки) и расчетные (кривые) данные по теплоотдаче
двухфазного потока водорода в области пленочного кипения
548
паросодержания х, которое может изменяться от 0 до 1; этот
параметр заранее неизвестен, и его рассчитывают методом после-
довательных приближений. Можно также принимать среднее
(приближенное) значение х; так, если температура стенки изме-
няется не более чем на 30 К, то хср = 0,22 хвых (при %вх — 0).
Для гелия теплоотдача при движении двухфазного потока имеет
большое практическое значение, так как широко применяют
сверхпроводниковые циркуляционные системы, охлаждаемые
кипящим гелием. В двухфазном потоке при достаточно высоком
паросодержании (х = 0,1...0,5) следует использовать формулу
а = о» 11,5 • 103 Во0'8 +(!/%„ )°-“],
(7.218)
где а0 находят по формуле (7.204) для жидкости; Во = q/(rG) —
число кипения; G — массовая скорость, г/(см2,с); г — теплота
испарения, Дж/г; q — тепловой поток, Вт/см2.
При х > 0,5 коэффициент теплоотдачи к гелию можно рассчи-
тывать по формуле (7.204) для чистого пара.
Для приближенной оценки критического теплового потока
при кипении и вынужденном движении гелия можно исполь-
зовать формулу
где хвх — массовое паросодержание на входе; I и d3 — соот-
ветственно длина и диаметр канала; <?кр t — критический тепло-
вой поток при кипении в большом объеме [см. зависимость
(7.209) и рис. 7.55].
Отметим, что всегда ^крв < q t, т.е. движение потока влияет
на кризис кипения. Более подробно вопрос о теплоотдаче и кри-
зисе кипения при движении двухфазных потоков криоагентов
рассмотрен в работе [65].
Потери давления при течении двухфазных потоков. При
движении парожидкостного потока потери давления на трение
Др существенно больше, чем для однофазного потока. Относи-
тельные потери давления на единицу длины канала для двухфаз-
ных потоков (Лр/Л/)2ф обычно определяют по отношению к поте-
рям на трение при движении жидкости (Ьр/Ы )ж:
Ф2 = (Др/Д/^ДДр/Д/),.
(7.220)
Параметр Ф зависит от характера движения потока пара в
канале и принятой модели течения потока. Значение Ф определя-
549
ется объемной долей пара ап в данном сечении канала, которая
в свою очередь связана с массовым паросодержанием х. Для
расчета Ф и &р2ф обычно используют модели кольцевого и одно-
родного течения. При кольцевом течении учитывают относитель-
ное скольжение потоков пара и жидкости. Для этой модели
объемное паросодержание ап можно определить по соотношению
Локарта—Мартинелли ап = /(%п), например, так:
«л = (1 + 0>378- (7.221)
При одинаковых коэффициентах трения одно- и двухфазного
потоков
Ф = 1/(1 - ап). (7.222)
При упрощенной однородной модели течения двухфазного
потока потери давления определяют через среднюю скорость и
плотность, что приводит к выражению
Ф = (1/(1 - ап)]°'5. (7.223)
При турбулентном течении фактор трения f во всех случаях
для двухфазного потока
/= 0,07 Re ' °’25. (7.224)
Рис. 7.59. Экспериментальные (точки) и расчетные (кривые) данные по потерям
давления в двухфазных потоках криоагентов:
о — 1 — водород (однородная модель); 2 — азот (однородная модель) при
р « 0,1 МПа; 3 — расчет по соотношению (7.222); темные точки — водород,
светлые — азот; б — гелий (1 — однородная модель; 2 — соотношение Локарта—
Мартинелли)
550
Приведенные на рис. 7.59 экспериментальные данные свиде-
тельствуют о том, что нельзя говорить об однозначной пригод-
ности той или другой модели; следует принимать расчетную
схему, ближе всего соответствующую экспериментальным дан-
ным для данного вещества и данных условий. Кроме потерь на
трение, в двухфазных потоках существенное значение могут
иметь потери давления, связанные с изменением количества дви-
жения (плотности), т.е.
Лрм = G1 bv, (7.225)
где G — массовый расход потока, кг/(м2 • с); Nv — изменение
удельного объема потока, м3/кг;
V = х2/^ рп + (1 - х)2/[(1 - oQ рж]. (7.226)
Суммируя Ар и Арм, находят общие потери давления.
§ 7.17. ТЕПЛООБМЕН В ЖИДКОМ НЕП
Сверхтекучий жидкий Hell представляет собой рабочую среду
криогенных систем при наиболее низких температурах (Т< 2,19 К).
В настоящее время температуры ниже 2 К стали привлекать
значительное внимание и находят все большее практическое
применение. Основные области использования этого температур-
ного диапазона и, соответственно, Hell: рефрижераторы раство-
рения (0,1—0,01 К); высокочувствительные инфракрасные при-
емники излучения — ИК-телескопы (=1,5 К); сверхпроводящие
магниты с высокой стабильностью, уменьшенной массой и боль-
шой плотностью тока (1,6—2,1 К); исследовательские криостаты
(0-2 К).
В то же время по свойствам, особенностям поведения и в
частности механизму теплопередачи Hell принципиально отли-
чается от других жидкостей и заслуживает отдельного обсужде-
ния. Свойства Hell подробно рассмотрены в гл. 3; главная осо-
бенность этого криоагента состоит в резком изменении свойств
при Т < 2,19 К (Х-точка), приводящем к появлению в жидкости
двух компонент (сверхтекучей и нормальной), скачку тепло-
емкости и теплопроводности, термомеханическому эффекту и
ряду других явлений, обусловленных проявлением квантовых
эффектов в макроскопическом масштабе.
551
Несмотря на большое число исследований свойств Hell,
многие вопросы до конца не ясны; это относится и к теплообме-
ну в жидком Hell.
Теплопроводность. Hell обладает очень выской теплопровод- .
ностью, которая превышает теплопроводность жидкого Не] в
106—107 раз, а меди и серебра — в несколько раз. Теплопровод- '
ность Hell имеет максимум при Т — 1,9 К, а затем резко
уменьшается при Т -> 0. Исходя из представлений о том, что
Hell состоит из двух компонент — нормальной и сверхтекучей
(с нулевыми энтропией и теплоемкостью), теплопроводность
этой жидкости трактуют следующим образом.
Теплоту может переносить только нормальная компонента;
она движется от поверхности нагрева, обусловливая теплопере-
нос. Навстречу движется сверхтекучая компонента, не несущая
теплоты, но обеспечивающая баланс массы. У поверхности
нагрева сверхтекучая компонента переходит в нормальную,
возвращается, и процесс продолжается. Градиент температур в
жидкости ДГприводит к перепаду давлений Др, связанному с
термомеханическим эффектом:
Др=р„яДТ, (7.227)
где ри — плотность нормальной компоненты; s — удельная энт-
ропия.
Перепад давлений вызывает движение нормальной компо-
ненты со скоростью wn и обусловливает тепловой поток
q=pnsMwn. (7.228)
Таким образом, теплопроводность в Hell вызвана конвектив-
ным движением внутри жидкости, а следовательно, имеет при-
роду, отличную от той, которая следует из гипотезы теплопровод-
ности Фурье. Высокая теплопроводность Hell приводит к тому,
что в объеме жидкости отсутствуют значительные перепады тем-
ператур. Так как теплопроводность Hell зависит сложным обра-
зом от многих факторов (температуры, ее градиента Д Т/L, вяз-
кости, плотности, энтропии), имеет смысл говорить об эффек-
тивном значении 1Эф (рис. 7.60).
В жидком Hell возможны различные режимы теплообмена,
но качественно они соответствуют общему характеру кривой
кипения q = f(&T) для всех жидкостей (см. рис. 7.53). Однако
иной характер свойств и другой механизм переноса теплоты не
позволяют отождествлять теплоотдачу в Hell с кипением обыч-
552
Рис. 7.60. Зависимость эффективной
теплопроводности жидкого Hell от тем-
пературы Т и ее градиента KT/L
ных жидкостей. Так, в Hell отсутствует пузырьковый режим
кипения, очень высокая теплопроводность НеП ведет к быстрому
переносу теплоты через весь слой жидкости к ее поверхности,
и пузырьки не образуются. На теплоотдачу влияют глубина
погружения образца и другие геометрические факторы.
Принято рассматривать две основные области теплоотдачи в
Hell: область “беспленочного” кипения от малых значений LT
и q до максимального критического теплового потока q^p и
область пленочного кипения.
Беспленочное кипение; сопротивление Капицы. Эта область
соответствует левой ветви до q = $кр t на рис. 7.53. При малых
АТ и q (ДТ < 0,01 К) реализуется режим сопротивления Капицы.
При теплообмене в этой области справедлива линейная зависи-
мость q= Д(ДТ), где АТ — термическое сопротивление, возни-
кающее в поверхностном слое на 1ранице жидкость—твердое
тело (“сопротивление Капицы”). Пограничный скачок темпера-
туры обнаружен П. Капицей в 1940 г. Это термическое сопротив-
ление зависит от физических свойств поверхности и среды и
характерно не только для НеП, но и для 3Не и других сред при
низких температурах. И. Халатников теоретически обосновал это
явление и предложил формулу, представляющую собой кубичес-
кую зависимость сопротивления от температуры. Теория дает
верное качественное описание явления, но количестенные значе-
ния можно надежно определить только экспериментально.
Термическое сопротивление Капицы
RK = bT/q- {1.229)
соответственно площадь поверхности теплообмена F — RKQ/2^Т
Часто используют обратную величину (“проводимость Капицы”),
имеющую смысл коэффициента теплоотдачи между поверхно-
стью и жидким гелием:
ак = 1/RK. (7.230)
553
Для определения /?к или ак в соответствии с теорией обычно
используют выражение вида
Як = К/Т\ (7.231)
где К — постоянная величина; и = 2.5...3,5.
Такая зависимость от Т свидетельствует о сильном возраста-
нии термического сопротивления при снижении температуры.
Коэффициент К тависит от многих факторов, главным обрагом
от вида материала и способа обработки его поверхности. Для
одного и того же материала значения К могут различаться в
несколько раз, в основном вследствие разного состояния поверх-
ности. Для чистых полированных поверхностей после обработки,
снимающей поверхностные напряжения, сопротивление RK
может быть в 5-6 раз меньше, чем дня поверхностей, окисленных
или подвергнутых обычной механической обработке.
В настоящее время недостаточно экспериментальных данных
для обобщения и надежных рекомендаций по определению /?к
или ак. Ниже указаны максимальные значения проводимости,
полученные для различных материалов при Т — 1.9 К:
Материал.... Pb Au Ag Sn Си Ni SiO. Al,О
<xK. Bi/(cm2 • К) . 3.2 0,88 0.6 1,25 0.75 0.40 0,57 0 jо
Для шероховатых поверхностей значения ок существенно
меньше. Так, для меди (Т = 1,9 К) экспериментальные значения
а.к = 0,12 ... 0,75 Вт/(см • К). При температуре ниже 0,3 К для
меди и коррозионно-стойкой стали в среде Tie. Ч1е и их
растворов можно принять стабильное значение /?к, см2, К/Вт:
Як = (40 ... 50)/ / '. (7.232)
Подробные данные по (и ак) приведены в работе |9|.
Понятие проводимости Капицы ак введено для малых ДГи
q, однако целесообразно распространить его на всю область бес-
пленочного кипения вплоть до критического удельного теплового
потока. При этом температурн ый напор АТ увеличивается и ста-
новится того же порядка, что и температура жидкости (А 7- Г ).
Такую экстраполяцию обычно проводят следующим образом:
ок аК0/(А7/7ж). (7.233)
где ако — известное (из эксперимента) значение проводимости
Капицы для данной поверхности (малые АГ):
./(АГ/Г ) = I + |,5 АГ/Г + (АГ/Г,.)2 + 0,25 (АГ/Г )3. (7.234)
Лк УТ. Ж ' УТ к
554
Применение формулы (7.234) для вычисления аА при больших
А Г дает хорошие результаты; некоторое отклонение в сторону
завышения расчетных данных происходит при увеличении АТ
до его критического значения.
Критические удельные тепловые потоки. При увеличении
удельного теплового потока беспленочное кипение сменяется
пленочным. Смена режимов происходит через кризис, соответст-
вующий неустойчивому пленочному кипению и образованию
максимального q^ и минимального ^2 тепловых потоков. При
превышении * происходит перегрев и переход в нормальное
состояние сверхпроводника, охлаждаемого Hell. Значение <7п*ах
может изменяться в широких пределах и зависит от многих
факторов: температуры Hell, размеров образца, глубины его
погружения в НеП. Интервал возможных изменений qmia весьма
широк (в среднем от I до 10 Вт/см’), но может быть значительно
больше. Наибольших шачений q^ достигает при Г[1еП = 2,0 К
при увеличении глубины потружения образца и уменьшении его
размеров. Следует отметить, что ориентация образца не влияет
на 11 ^пш1 вследствие высокой теплопроводности. Характерная
зависимость от температуры и глубины погружения дана на
рис. 7.61. Аналогичный характер имеет зависимость и при мини-
мальном тепловом потоке q‘jn. Пока нет обобщенных корреля-
ций для вычисления q“ при различных условиях.
Пленочное кипение. Этот режим теплоотдачи I lell аналогичен
поведению обычных жидкостей. Между поверхностью нагрева
и НеП образуется паровая прослойка с низкой теплопровод-
ностью, которая определяет термическое сопротивление процесса
Рис. 7.61. Зависимость максимального
удельною теплового потока от глубины
погружения h и температуры Ts юлия
Рис. 7.62. Зависимость коэффициента
теплоотдачи а при пленочном кипении
НеП от глубины h погружения и
температуры Tt Hell (штриховые линии
— неустойчивое "шумное'' кипение)
у 55
теплообмена. Однако и здесь свои отличия, заключающиеся в
отсутствии пузырей и влиянии размеров образца, а также глуби-
ны его погружения на теплообмен. Пленочное кипение подразде-
ляют на “шумное” и “бесшумное”. ,
Теплоотдача в этом процессе возрастает с увеличением раз- .
меров образца и глубины его погружения. Рост давления также .<
увеличивает теплоотдачу. Примерные пределы изменения а от 1
0,2 до 2 кВт/(м2 • К). На рис. 7.62 приведена экспериментальная
зависимость коэффициента теплоотдачи от температуры Hell и глу- ;
бины потружения А. Температура поверхности натрева Тс = 80 К.
Существуют аналитические методы расчета режима пленоч- .
ного кипения Hell [9], однако их использование требует опреде- ]
ления теплового потока на границе раздела фаз; это ограничивает j
применимость методов. Таким образом, известную информацию ’
о теплообмене в Hell можно использовать для оценочных расче- i.
тов, однако пока нет исчерпывающих данных по этой проблеме.
Экспериментальное изучение потерь давления для Hell пока- *
зало, что с достаточной точностью по известным соотношениям I.:
ПуазейДя (ламинарный поток) и Блазиуса (турбулентный поток) t
можно определить коэффициенты гидравлического сопротив-
ления £. t
Говорим спасибо:
Балдыгину Алексею (400стр.-конец)
Пустовалову Михаилу (1-399стр.)
e-mail: 3666377@gmail.com
icq: 3666377
список основной ЛИТЕРАТУРЫ
1. Архаров А.М. Низкотемпературные газовые машины (криогенераторы).
М.Машиностроение, 1969. 224 с.
2. Архаров А.М., Марфенина И.В., Микулин Е.И. Криогенные системы:
Основы теории и расчета: Учебник для студентов вузов. 2-е изд. М.: Машино-
строение, 1988. 464 с.
3. Беляков В.П. Криогенная техника и технология. М.: Энергоиздат, 1982. 272 с.
4. Бродянский В.М., Семенов А.М. Термодинамические основы криогенной
техники. М.: Энергия, 1980. 448 с.
5. Будневич С.С. Процессы глубокого охлаждения. М.-Л.: Машиностроение.
Лснингр. отд-ние, 1966. 260 с.
6. Вукалович М.П., Новиков И.И. Термодинамика: Учебное пособие для вузов.
М.: Машиностроение, 1972. 671 с.
7. Герш С.Я. Глубокое охлаждение: Учебник для студентов вузов. 3-е изд. М.-
Л.: Госэнергоиздат. 4.1, 1957. 392 с.; Ч.П, I960. 496 с.
8. Головко Г.А. Криогенное производство инертных газов. Л.: Машино-
строение. Ленингр. отд-ние. 1983. 416 с.
9. Григорьев В.А., Павлов Ю.М., Аметистов Е.В. Кипение криогенных
жидкостей / Под ред. Д.А.Лабунцова. М.: Энергия, 1977. 289 с.
10. Кафаров В.В. Основы массопередачи: Учебное пособие для вузов. 2-е изд.,
перераб. М.: Высш, школа, 1972. 494 с.
11. Криогенные поршневые детандеры/Под ред. А.М. Архарова. М.: Машино-
строение, 1974. 240 с.
12. Криогенные системы. Основы проектирования аппаратов и установок:
Учебник для студентов вузов/ А.М. Архаров, В.П. Беляков, Е.И. Микулин и др.
М.: Машиностроение, 1987. 536 с.
13. Микулин Е.И. Криогенная техника: Учебное пособие для вузов. М.:
Машиностроение, 1969. 270 с.
14. Наринский Г.Б. Ректификация воздуха. М.: Машиностроение, 1978. 248 с.
15. Разделение воздуха методом глубокого охлаждения. 2-е изд./ Под ред.
В.И. Епифановой, Л.С. Аксельрода. М.: Машиностроение, 1973. Т. 1. 472 с.; Т.2.
568 с.
16. Расчет криогенных установок. 2-е изд., перераб.: Учебное пособ. для вузов/
Под ред. С.С. Будкевича. Л.: Машиностроение. Ленингр. отд-ние, 1979. 368 с.
17. Справочник по физико-техническим основам криогеники/ Под ред.
М.П. Малкова 2-е изд. М.: Энергия, 1975. 512 с.; 3-е изд. М.: Энергоиздат, 1985. 432 с.
18. Термодинамические свойства гелия/ В.В.Сычев, АА. Вассерман, А.Д. Козлов
и др.М.: Изд-во стандартов, 1984. 319 с.
19. Техника низких температур. 2-е изд./ Под ред. Е.И. Микулина,
И.В. Марфениной, А.М. Архарова. М.: Энергия, 1975. 512 с.
20. Усюкин И.П. Установки, машины и аппараты криогенной техники. М.:
Легкая и пищевая промышленность. Ч. 1. 1976. 343 с.; ч. 2. 1982. 296 с.
21. Фастовский В.Г., Петровский Ю.В., Ровинский А.Е. Криогенная техника.
2-е изд. М.: Энергия, 1974. 496 с.
СПИСОК ДОПОЛНИТЕЛЬНОЙ ЛИТЕРАТУРЫ
22. Александров И.А. Массопередача при ректификации и адсорбции
многокомпонентных смесей. Л.: Химия. Ленингр. отд-ние, 1975. 320 с.
23. Алексеев В.П., Вайнштейн Г.Е., Герасимов П.В. Расчет и моделирование
-аппаратов криогенных установок. Л.: Энергоатомиздат. Ленингр. отд-ние, 1987. 280 с.
557
24. Баррон Р.Ф. Криогенные системы: Пер. с англ. 2-е изд. М.: Энергоатом-
издат, 1989. 408 с.
25. Берд Р., Стьюарт В., Лайфут Б. Явление переноса: Пер. с англ. 2-е изд.
М.: Химия, 1974. 678 с.
26. Бэррер Р. Диффузия в твердых телах: Пер. с англ./ Под ред. З.С.Суворовой.
М.: Изд-во иностр, лит., 1948. 504 с.
27. Брнжан И.М., Лейтес И.Л. Эксергетический анализ технологических схем
мембранного разделения газовых смесей//Химическая промышленность. 1987.
с. 462-466.
28. Бруиауэр С. Адсорбация газов и паров: Пер. с англ./Под ред.
М.М. Дубинина. М.: Изд-во иностр, лит., 1948. 748 с.
29. Вассерман А.А., Казавчинский Я.З., Рабинович В.А. Термодинамические
свойства воздуха и его компонентов. М.: Наука, 1966. 376 с.
30. Взрывобезопасность воздухоразделительных установок/ Под ред.
В.П. Белякова, В.И. Файнштейна. М.: Химия. 1986. 224 с.
31. Водород. Свойства, получение, хранение, транспортирование, применение:
Справ, изд./ Д.Ю. Гамбург, В.П. Семенов, Н.Ф. Дубовкин, Л.Н. Смирнова. Под
ред. Д.Ю. Гамбурга, Н.Ф. Дубовкина. М.: Химия, 1989. 672 с.
32. Газоразделительные установки с использованием полупроницаемых мембран:
Обзорная информация. Сер. ХМ-6 /Чекалов Л.Н., Талакин О.Г., Бабенков А.А. М.:
ЦИНТИХимнефтемаш. 1983. 20 с.
33. Герш С.Я., Марфенина И.В. Получение кислорода под повышенным
давлением// Кислород. 1947. № 3.
34. Гщнпфельдер Дж., Кертис Ч., Берд Р. Молекуллярная теория газов и жидкостей:
Пер. с англ./ Под ред. Е.В.Сгупаченко. М.: Изд-во иностр, лиг., 1961. 932 с.
35. Гохштейн Д.П. Современные методы термодинамического анализа
энергетических установок. М.: Энергия, 1969. 368 с.
36. Григорьев В.А., Крохин Ю.И. Тепло-массообменные аппараты криогенной
техники. М.: Энергия. 1982. 311 с.
37. Додж Б.Ф. Химическая термодинамика: Пер. с англ./ Под ред.
В.А. Киреева, М.: Изд-во иностр, лит., 1950. 786 с.
38. Дытнерский Ю.И., Брыков В.П., Кармаганов Г.Г. Мембранное разделение
газов. М.: Химия, 1991. 344 с.
39- Дэшман С. Научные основы вакуумной техники. 2-е изд.: Пер. с англ./ Под
ред. М.М.Меньшикова. М.: Мир, 1964. 716 с.
40. Епифанова В.И. Компрессорные и расширительные турбомашины
радиального типа. М.: Машиностроение, 1984. 376 с.
41. Епифанова В.И. Технико-экономическая оптимизация теплообменных
аппаратов криогенных установок// Изв. вузов. Машиностроение. 1977. № 9.
С. 64-69.
42. Исаченко В.П., Осипова В.А., Сукомел А.С. Теплопередача. М.: Энергия.
1975. 486 с.
43. Каганер М.Г. Тепломассообмен в низкотемпературных конструкциях. М.:
Энергия, 1979. 256 с.
44. Калитин П.П., Пронько В.Г., Давыденков И.А. Основные направления
развития криогенного гелиевого оборудования// Химическое и нефтяное
машиностроение. 1977. № 7. С. 5-8.
45. Капица П.Л. Адиабатический метод ожижения гелия// Успехи физических
наук. 1935. Т. 16. Выл. 2. С. 164.
46. Капица П.Л. Расчет гелиевого ожижительного цикла с каскадным
включением детандеров// ЖТФ. 1950. Т. XXIX. Вып. 4. С. 427-432.
47. Кельцев Н.В. Основы адсорбционной техники. М.: Химия, 1976. 572 с.
48. Кириллин В.А., Шейцдлин А.Е., Шпильрайн Э.Э. Термодинамика растворов.
2-е изд. М.: Энергия. 1980. 288 с.
558
49. Кутателадзе С.С. Основы теории теплообмена. М.: Наука. 1970. 659 с.
50. Лопаткин А. А. Теоретические основы физической адсорбции. М.: Изд-во
МГУ, 1983. 344 с.
51. Лыков А.В. Теория теплопроводности: Учеб, пособие для вузов. М.: Высш,
школа. 1967. 600 с.
52. Мартыновский В.С. Анализ действительных термодинамических циклов.
М.: Энергия, 1972. 219 с.
53. Научные труды. Физика и техника низких температур/П.Л. Капица. Мл
Наука, 1989. 392 с.
54. Николаев Н.И. Диффузия в мембранах. М.: Химия, 1981. 232 с.
55. Новотельное В.Н., Суслов АД., Полтораус В.Б. Криогенные машины: Учебник
для вузов. C-Пб.: Политехника, 1991. 335 с.
56. Павлов К.Ф., Гоманков П.Г., Носков А.А. Примеры и задачи по курсу
процессов и аппаратов химической технологии: Учебное пособ. для вузов. 10-е
изд./Под ред. П.Г.Романкова. Л.: Химия, 1987. 576 с.
57. Плановский А.Н., Николаев П.И. Процессы и аппараты химической и
нефтехимической технологии: Учебник для вузов. 3-е изд., перераб. и доп. М.:
Химия, 1987. 496 с.
58. Промышленные тепломассообменные процессы и установки/Под ред.
А.М.Бакластова. М.: Энергоматомздат, 1986. 228 с.
59. Рейтлингер Р. Проницаемость полимерных материалов. М.: Химия. 1974.
270 с.
60. Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей: Справ.
пособие/Пер. с англ, под ред. Б.И. Соколова. 3-е изд., перераб. и доп. Л.: Химия.
Ленингр. отд-ние, 1982. 592 с.
61. Серпионова Е.Н. Промышленная адсорбция газов и паров: Учебн. пособие
для вузов. 2-е изд., перераб. и доп. М.: Высш, школа, 1969- 415 с.
62. Соколов Е.Я., Бродянский В.М. Энергетические основы трансформации
тепла и процессов охлаждения: Учебн. пособие для вузов. 1-е изд. М.: Энергия,
1968. 336 с.; 2-е изд. М.: Энергоиздат. 1981. 320 с.
63. Теплофизические свойства неона, аргона, криптона и ксенона/ Под ред.
В.А. Рабиновича. М.: Изд-во стандартов, 1976. 636 с.
64. Термодинамические свойства воздуха./Сычев В.В., Вассерман АА., Козлов
А.Д., Спиридонов Г.А., Цымарный В .А.// ГСССД. Серия монографии. М.: Изд.
стандартов, 1978. 276 с.
65. Успехи теплопередачи: Сборник статей: Пер. с англ./ Под ред.
Н.А. Анфимова и др. М.: Мир, 1971. 576 с.
66. Физика низких температур: Пер. с англ./ Под. ред. А.И.Шальникова. М.:
Изд-во иностр, лит., 1962. 938 с.
67. Филин Н.В., Буланов А.Б. Жидкостные криогенные системы. Л.:
Машиностроение. Ленингр. отд-ние, 1985. 244 с.
68. Филин Н.В. Исследование динамических процессов в сложных
гидравлических системах// Труды НПО Криогенмаш. Вып. 15. 1973. С. 118-129.
69. Хванг C.-Т., Каммермейер К. Мембранные процессы разделения: Пер. с
англ./ Под ред. Ю.И. Дыгнерского. М.: Химия, 1981. 464 с.
70. Химическая энциклопедия. М.: Изд-во Большая Российская энциклопедия.
1992. Т.З. 640 с.
71. Haselden G.G. Cryogenic fundamentals. Academic Press, 1971. 757 p.
72. Haselden G.G. An approach to minimum power consumption in lowtemperature
gas separation// Frans Insth. Ehem. Engrs., 1958. V.36. N 3. P. 123-132.
73. Jungnickel H., Agsten R., Kraus W.E. Grundlagen der
Kaltetechnik, 2. Auflage, VEB, Verlag Technik Beilin, 1985. 356 s.
74. Timmerhaus K.D., Fleen T.M. Cryogenic Process Engineering. Plenum Press.
1989. 612 p.
559
Приложение. ДИАГРАММЫ СОСТОЯНИЯ
КРИОГЕННЫХ ВЕЩЕСТВ
В приложении приведены термодинамические диаграммы,
широко применяемые при расчете криогенных систем. Диаграм-
мы даны для наиболее распространенных криоагентов. По этим
диаграммам можно определять давление р, удельный объем v,
температуру 7, энтропию s, энтальпию i, теплоемкость, изотер-
мический эффект дросселирования и другие термодинамические
характеристики. Ниже приведен перечень диаграмм:
диаграмма Т—s для кислорода (100—28 К);
диаграмма Т— s для воздуха (350—70 К);
диаграмма T—s для азота (400—60 К);
диаграмма T—s для неона (300—60 К);
диаграмма T—s для неона (80—25 К);
диаграмма Т— s для водорода (300—140 К);
диаграмма Т—s для водорода (150—15 К);
диаграмма Т— s для гелия (300—15 К);
диаграмма Т— s для гелия (25—3 К).
300 1,Дж/(моль-
6 Заказ № 1592
561
562
т,к
340
320
300
280
260
240
220
90 100 110 120 130 140 150 160 170 180 190 200 s, Дж/(моль-К)
Диаграмма
T-S
для Воздуха
р-адсолшпное дадление
. Т-температура
S-энтропия
1-знтальпия
340
320
300
280
260
240
220
'/III
т,к
390
л
380
370
360
350
360
330
Диаграмма Т-з
для азота
{от 60 дабООК)
I - энтальпия,Л»/ноль
v- оЗъем, см 31моль
р-давление, МПа
wi
irfffJiMF/ill
।
320
ЗЮ
300
290
280
270
260
250
260
230
220
210
200
190
180
900 1
'/Zi
170
160 —
Энтропия и энтальпия
для идеального кристалла
150
HO
130
ПО
110
100
90
80
70
60
Ими
1Я
шшштш
NI и i //,
71^
»
чйллаппм)
1/
ЯиИК™' *
SW
fieWiS'Zli
250
120
90
60
70
60
и
s®.
I =3000'Дж/моль 3500
6000
гоо
150
100
50
в=20м/Ю
__1
271*^
—
'^acta Г7~~
----------------
-----'З'оео
-----^OOo
---\r3Offff
---2?&оо
-.1'000
— 'оодо
'од?о
Т'ООО
_ОООо
рооо
кс*л.зазаяжел^.
wo
no
564
irfia'jivi'rftbf/.BS'ifirj'firfiJirfmnriviarivA'flH'fli/Hai
r’iW'Biih_______________
______:11Ш1111ШППВХШЛИШ№Ш1П\
------------
~н 390
1‘июоо^/^ 3go
r^J/i/77y-4jy/l///|/I /1/1 У |/|
77300
370
'Ш№
17000
16300
л/пмгл№пг1г«?1'»ц№ам1/вма
^Л'!^К1аШШКА1М'т1
ivMJir^ifaii.tiWni^hL___________
-------£/j'ffl,nVJ/ffj71F/7*<{/ir/Mfirjn«HrJU7IHahMiWHV1
____________,__jj»;.*i'fr/fjffi«aa»ew?L_
\Ш^вШ11Ш1^№Л'^ВВ1Ч911йЛ11№Я1тЛШПШ1Л
360
350
340
330
зго
16000
310
“ZwM/ш//(/1 1/ Ц-aL Л / JOst- -4--
ijlfl Луг / Ш \f,\l /llirll/г /
кж
75000
300
230
Z80
270
//’>|П'хпммп'л^1Г1'лм^№'лмжааг1ааг1№В1*аиЯ
__________:м«ииааив11гм-----------------
______________----й'Лйиииаивамв___.
яммиа№м^в/1г//жжагАаа?.в151К!^'
в.;4'1жжижм^лжжжлмг/вмваглпви
/ЛД^1Г/'Л7«1П^И|Ж7^/п.«ЦПГЛИ8ДИВГ1ВГ1ВВ
^Г>в//4'>71№иЖ№Г1М'аЛ'/йГ^!"Л№В'ЛВЛ8Яа№
' /JUMW ШМП 'НвЛА И ИЖ ИКВ алии »ЯЙ,ВЙЙЙГ1|
,1яяп'гшв^шшшиив1яияю1яаш----------------
иММ7|:<ЛИ1Г<МЖК!¥Г£М'ЛЛАииЛПМЛ1----
Ksr/z^'ariArju^uf^rjaaifiiarf-
/у/ / Л'М г Л/ ЭД 11М 1\ л I \/л // / /Л
14500
рш/'l [ -
' Л 14000 -
260
250
240
-13500
230
13000
12500
12000
11000
10500
10000
9500
6500
0000 —
8500
'p^l,01237МПа
7000 ----7500
220
210
200
130
130
130
по
750
160
170
180
ПО
160
150
140
130
120
110
100
90
30
70
60
190 з.Дх'Кнопь-К)
565
70
65
60
5
Диаграмма T-s
для неона
p~ введение ,мпа
' p- платность,i/сцЗ
i - энтальпия, Дж/г
iviiiitiriJih'iufliiiiwitfjuu'iiiiiiii'B.iiiia
^тШШШНиШ1ЙШГ
isTi шшлвим iiui n in niuinain i
UM?IWUI№MIIIIDi2№ini№UII№iniiUI
-----"Z‘iiiaiitiiiHnr
MAnuiKi.viiNKiiiiiiiiiuiiBitiiss::::::;
^ha f i iLTir ЛП1 w in ihihiiiihi « uh if ii
Ш<Л1«Л11'11ки1Ш£1Ш11НГНИ«1|Л1ЛГ'1
-----»i л№.* пн я mi иш v num
-----------------------fssjfim---------
105
KI Ml N ill I TbLLl!
W
90
IWPaU.B IM'IXniillSi'llIII lllllfllfllllll
•BiWiM.’iic_“2z:zz";z"zzz:::zz"z.“
_ WJBif.WI'll WiWIMIUIIIiSS! IIIII1JIIIIBI
riMriWII'JhVlH/iVIMIIieaillKinifiwiiHi
JihVril.ilFHVni'IHarJI^IIIIIUIIfllllin'IIIWIIBi
riira^iVMiiiUiiifrmiiib'iuiiaiinajiiifiiiiwi
iiiflriWJWAWiMiiiuMai/iHWffiMjjczzzrzzzzz:
tofAWIN 41'111Ж/HhWI fl U№£9 ШН Ulf Ml
an^riri л hi •« нтчпшнш кмина bi
ikwiutaii •'«if imwiiM ifiiHBiKiiiunisi
es
75
I i\ I fl ГК I III III II
i I II ill I
та»
МММ
zwiwin
по----
Ш/?У/}7УУ| LllM-KA
',W
Г/
55
JO
25
^bb
no
\125—
______________luiw/miiMiDiBiHiiiiaifil
a/^a'^iafiisiiiirii^^n’iiFB/iffjiiifiraairiiai
r/7^»o»1wrtiraiBW--------------------------
ooi
Вг////л^,аТ111.а№а^'«|ш1
E/'AiSwnae a R лш
r////^r,ss» siv.auR awn
0
I
Л’
H
г
WO
jti-OSJlM/o
л л
ilKl
290
>тюдж!г
200
270
260
Диаграмма T-s
для но он а
р-даОлонио, МПа
р-ппотность^/сн1
i- энтальпия,Дж/г
330
390'
260
330
260
320
230
220
210
200
190
160
iviiifii iiiiiiifiiiBiiirrf
«liiififuifliiiiiflii/a/iiiiaiaiii/iiii
i illfifl If nUIH iri WllU l/IFf 1111111111111
lilliltilll'lHviiiiHiiiiiiniriiurui
"»!f Hl и ни ||f| HnilWntMl НГ
asssreesee
-----------riinf .ijfjj'HMtni.-f
310
300 -
•гы —
уоо
?Я
170
7U
1Я
1Я
но
130
120
110
100
90
00
?0
— .1*0,
----ПОИ-
1U
«4
1Я)
200
190
»Л,Ж?Л5.""Ж!»Ж!£?5'.!?5'?ЕЯ
•по
5b7
89S
574
УЧЕБНОЕ ИЗДАНИЕ
Архаров Алексей Михайлович,
Марфенина Ирина Васильевна,
Микулин Евгений Иванович
КРИОГЕННЫЕ СИСТЕМЫ.
Т. 1: ОСНОВЫ ТЕОРИИ И РАСЧЕТА
Редактор О.Ф.Корсун
Обложка художника В.Н.Погорелова
Технические редакторы Е.П.Смирнова, А.Я.Дубинская
Корректор Л.Г.Изосимова
ИБ № 7578
Лицензия ЛР № 080003 от 15.08.91
Сдано в набор 17.07.95. Подписано в печать 26.09.96.
Формат 60x88 . Бумага офсетная.
Гарнитура литературная. Печать офсетная.
Усл. печ. л. 35,28. Усл. кр.-отт. 35.28. Уч.-изд. л. 35.92.
Тираж 1000 экз. Заказ № 1592
Ордена Трудового Красного Знамени издательство "Машиностроение",
107076, Москва, Стромынский пер., 4. Телефон редакции 269 4998.
Отпечатано с готового оригинал-макета в Смоленской областной
ордена "Знак почета" типографии им. Смирнова, 214000, г. Смоленск,
проспект им. Ю. Гагарина, 2.
Говорим спасибо:
Балдыгину Алексею (400стр-конец)
Пустовалову Михаилу (1-399стр.)
e-mail: 3666377@gmail.com
icq: 3666377