Tags: морфология растений растения анатомия ботаника
Year: 1980
Text
Anatomy of Seed Plants
2nd Edition
Katherine Esau
Professor of Botany, Emeritus
University of California
Santa Barbara, California
John Wiley and Sons
New York/Santa Barbara/London/Sydney/Toronto
К. ЭЗАУ
Анатомия
семенных
растений
Книга 1
Перевод с английского
д-ра биол. наук А. Е. ВАСИЛЬЕВА,
д-ра биол. наук Ю. В. ГАМАЛЕЯ
и д-ра биол. наук М. Ф. ДАНИЛОВОЙ
под редакцией
акад. А. Л. ТАХТАДЖЯНА
Издательство «Мир»
Москва 1980
(УДК 581.4)
Одна из лучших в мировой литературе монографий по анатомии
растений. Автор ее — глава анатомов Калифорнийского университе-
та Кэтрин Эзау, уже известная советскому читателю по книге
«Анатомия растений» (М.: Мир, 1969), сумела отобрать и обобщить
новейшие данные об анатомическом строении растений.
Русское издание выходит в двух книгах. В первой книге рас-
сматриваются вопросы, связанные с развитием зародыша; дается
краткая характеристика роста, дифференциации и морфогенеза се-
менного растения; приводятся данные о структуре клетки и клеточ-
ной оболочки; описываются различные типы растительных клеток
и тканей.
Книга представляет большой интерес для студентов, аспирантов
и научных работников ботанических и агрономических специаль-
ностей.
Редакция литературы по биологии
260 504 0000
~ 21006—130
Э 041(01)—80130—80
© 1977 by John Wiley and Sons, Inc. All Rights
Reserved. Authorised translation from English
language edition published by John Wiley and
Sons, Inc.
© Перевод на русский язык, «Мир», 1980
Предисловие редактора перевода
За последние десятилетия исследования в области анатомии
растений получили широкое развитие. Это объясняется многими
причинами и прежде всего тем, что перед анатомией растений
встали новые задачи, связанные с изучением онтогенеза структур
и их эволюционным истолкованием. Появляется все больше ра-
бот по онтогенетической и эволюционной анатомии. Если в про-
шлом главным объектом исследований по анатомии растений бы-
ли вегетативные органы, а репродуктивные занимали в них лишь
относительно небольшое место, то в последние годы анатомиче-
ское изучение цветка, плода и семени вызывает все больший ин-
терес. Благодаря развитию микроскопической техники и особен-
но — широкому использованию электронного микроскопа появи-
лась возможность изучать тонкое строение всех клеточных эле-
ментов и прежде всего ультраструктуру клеточной оболочки.
Мощным стимулом развития анатомии растений служит ее все
возрастающее значение для систематики (в первую очередь эво-
люционной), физиологии, экологии и палеоботаники, а также
для растениеводства, фитопатологии, изучения дикорастущих по-
лезных растений и многих других областей ботанической науки.
Вполне понятно поэтому, что преподаванию анатомии растений
уделяется все больше внимания. Во многих странах и на разных
языках, главным образом на английском, постоянно публикуют-
ся новые обобщающие труды, справочные пособия и учебники по
анатомии растений. Хотя учебных пособий по анатомии растений
много, можно с уверенностью сказать, что «Анатомия семенных
растений» К. Эзау, особенно второе, заново переработанное из-
дание,— едва ли не лучшее введение в современную анатомию.
По сравнению с книгой того же автора, переведенной на русский
язык в 1969 г., настоящее издание представляет собой более крат-
кое и более популярное руководство, вполне доступное как для
студентов первых двух курсов, так и для широкого круга чита-
телей, имеющих лишь начальную подготовку в области ботаники.
Все термины, в том числе и самые элементарные, объяснены в
специальном словаре, что значительно облегчает чтение книги.
«Анатомия семенных растений» К. Эзау отличается рядом круп-
ных достоинств. Прежде всего книга написана на вполне совре-
менном уровне и отражает новейшие достижения как световой,
так и электронной микроскопии. Книга посвящена анатомии ра-
6
Предисловие редактора перевода
стений в самом широком ее понимании, но она включает также и
некоторые элементы эмбриологии, что вполне оправдано. Она на-
писана хорошим языком и прекрасно иллюстрирована удачно
подобранными рисунками и микрофотографиями, в том числе элек-
тронными.
Имя К. Эзау, одного из ведущих современных анатомов, поль-
зуется широкой известностью. В настоящее время она является
заслуженным профессором Калифорнийского университета в
Санта-Барбаре (в отставке). К. Эзау, американка немецкого про-
исхождения, родилась в России, окончила женскую гимназию в
Одессе и училась на Голицинских высших женских сельскохозяй-
ственных курсах в Москве. Американцы и англичане произносят
ее фамилию по правилам английской фонетики как Исо, но сама
она предпочитает первоначальное немецкое произношение своей
фамилии — Эзау — и хотела бы, чтобы оно было сохранено в рус-
ском написании. Она в совершенстве владеет русским языком, и
ей нравится, когда русские коллеги называют ее Екатериной
Ивановной. Мы надеемся, что Екатерина Ивановна Эзау останет-
ся довольна переводом ее книги, выполненным сотрудниками
Лаборатории анатомии и морфологии растений Ботанического
института имени В. Л. Комарова АН СССР.
Л. Л. Тахтаджян
Предисловие
Первое издание «Анатомии семенных растений» было опубли-
ковано 16 лет назад. Это немалый срок, если учесть, что за пос-
леднее время благодаря техническому прогрессу во всех обла-
стях изучения живой материи объем биологических знаний зна-
чительно увеличился. Новые представления, возникшие в резуль-
тате более правильной интерпретации структуры и развития рас-
тений и более глубокого понимания взаимоотношений между их
структурой и функцией, необходимо довести до сведения учащих-
ся. Однако курс анатомии растений, в котором студент, возмож-
но, впервые ознакомится с этой областью ботаники, должен
включать также все основные данные о структуре растений. Сле-
довательно, перед автором учебника по анатомии растений стоит
сложная задача — изложить материал таким образом, чтобы бы-
ло достигнуто правильное соотношение между давно известными
основными фактами, с одной стороны, и новыми интересными от-
крытиями и их интерпретацией — с другой.
Для решения такой задачи объем первого издания этой книги
был явно недостаточен. Поэтому переработанное издание по-
требовало расширения текста и дополнения его новыми иллюст-
рациями, а также некоторых изменений в распределении матери-
ала. В связи с обилием информации о субклеточной структуре
растений было нецелесообразно включать описание клетки в гла-
ву о паренхиме, а данные о клеточной оболочке — в главу о скле-
ренхиме. Клетка и клеточная оболочка выделены теперь в отдель-
ные главы. Весьма значительное увеличение объема исследова-
ний, касающихся репродуктивных частей растения, обусловило
расширение разделов, в которых обсуждается строение цветка, и
подразделение этой темы на две главы. Вследствие того, что ре-
продуктивному циклу семенных растений уделено теперь больше
внимания, было логично перенести главу, посвященную зароды-
шу, в конец книги.
Учтя замечания некоторых читателей первого издания книги,
мы изъяли из текста ключ для определения древесины, а отли-
чительные признаки, используемые для ее определения, привели в
систему, так что преподаватель или студент сам может составить
ключ, если в курсе обучения предусмотрены практические занятия
по определению древесины. Введение новых представлений и по-
нятий потребовало расширения словаря терминов. Были сделаны
8
Предисловие
некоторые изменения, касающиеся таксономических вопросов так,
названия семейств даны теперь в соответствии с классификацией
Тахтаджяна1.
Расширена теоретическая часть тех глав, в которых речь идет
о меристемах и их активности, о происхождении и развитии
листьев, а также об онтогенетическом и филогенетическом про-
исхождении проводящей системы. Чтобы объяснить онтогенети-
ческую и функциональную специализацию проводящих клеток в
ксилеме и флоэме, были использованы данные, полученные с по-
мощью ультраструктурных исследований
Одним из источников удовлетворения при работе над этой
книгой было сознание того, что исследования по анатомии расте-
ний получили новый импульс в связи с заметным повышением ин-
тереса к структуре растений у специалистов самых различных
областей ботаники. Данные ультраструктурных исследований по-
казали, что для физиолога и биохимика растений понимание
структуры растения становится все более важным. Анатомия ра-
стений имеет также огромное значение и для эколога, изучающе-
го взаимоотношения между растением и окружающей средой, и
для фитопатолога, стремящегося понять зависимость между ра-
стением-хозяином и паразитом.
Благодарности
Поскольку в новом издании книги сохранены части старого
издания, остаются в силе и благодарности, выраженные в преди-
словии к первому изданию. В книгу включено много новых ил-
люстраций с относящимися к ним подписями, в которых указа-
ны источники и названы лица, любезно предоставившие в распо-
ряжение автора негативы и отпечатки фотографий. Г-н Пол
Л. Конант (Paul L. Conant) и на этот раз разрешил воспользо-
ваться его микроскопическими препаратами, чтобы сфотографи-
ровать их и описать признаки, используемые при определении
древесины. Г-н Роберт X. Гилл (Robert Н. Gill) оказал исключи-
тельно большую помощь в изготовлении ряда электронных мик-
крофотографий. Автор признателен профессорам Рею Ф. Эверту
(Ray F. Evert) и Томасу Л. Росту (Thomas L. Rost) за то, что
они прочитали рукопись и сделали критические замечания. Эти
замечания, а также личное обсуждение рукописи с проф. Эвертом
были особенно полезны в том отношении, что они выявили точки
зрения лиц, занимающихся преподавательской деятельностью.
Декабрь 1959 г Д’. Эзау 1
1 Takhtajan Armen Flowering plants, Washington, D C , Smithsonian Institu-
tion Press, 1969
Предисловие к первому изданию
Опубликование второй книги по анатомии растений, написан-
ной тем же автором, что и первая, нуждается, по всей вероятно-
сти, в кратком пояснении. Замысел настоящей книги начал скла-
дываться сразу же после того, как в 1953 г. вышла в свет моя
первая книга «Анатомия растений». Еще в то время, когда я ее
писала, мне было известно, что издатели предпочли бы выпустить
относительно краткий учебник, по которому можно было бы про-
читать курс лекций в течение одного семестра. У меня же было
намерение написать обширный научный труд, в котором я могла
бы достаточно полно изложить теоретические представления и
включить подробный материал по онтогенезу структуры растения.
Мои издатели весьма деликатно воздержались от возражений и
оказали мне полное содействие в этом моем предприятии. Высо-
ко оценив их отношение, я обещала им написать позднее краткий
учебник по анатомии растений. После того, как первая книга
прошла испытание в аудиториях и получила отзывы преподавате-
лей и исследователей, мысль написать новую, более краткую кни-
гу стала все больше привлекать меня. Кроме того, поскольку в
течение последнего десятилетия в области анатомии растений про-
водились интенсивные исследования, мне захотелось привести весь
материал в соответствие с современным уровнем знаний.
Чтобы дать некоторое представление о настоящей книге, лучше
всего сравнить ее с моей первой книгой. Новая и старая книги
существенно сходны в их подходе к подаче материала: в обеих,
согласно «классическому» методу, сначала рассматриваются клет-
ки и ткани, а затем состоящие из них части растения. Однако в
новой книге содержится меньше подробностей, касающихся раз-
вития растений, при определении понятий привлекается меньше
исторических фактов, а при введении терминов, образованных от
греческих или латинских слов, не указывается их происхождение.
Вместе с тем в эту книгу включен словарь терминов, составлен-
ный с учетом современного состояния научных представлений и
терминологии. В конце глав даны краткие библиографические
списки, которые к тому же состоят главным образом из ссылок
на работы, опубликованные после выхода в свет первой книги.
В первой главе указывается, что это ограничение введено по той
причине, что ссылки на более ранние и классические работы по
анатомии растений можно найти в старой книге. Это, по-видимому,
10
Предисловие к первому изданию
является наилучшим решением проблемы цитирования быстро
накапливающейся в последнее десятилетие ботанической литера-
туры.
При составлении плана настоящей книги усилия были направ-
лены на то, чтобы добиться краткости не за счет сокращения
материала, а путем соединения тесно связанных между собой
тем. Так, протопласт и клеточная оболочка рассматриваются не в
отдельных главах, как в старой книге, а вместе с паренхимой,
колленхимой и склеренхимой. Камбий описывается после ксилем-
ной ткани — такой порядок облегчает объяснение расположения
клеток в камбии. Наконец, апикальные меристемы представлены
в главах, посвященных корню и стеблю, а не в самостоятельных
разделах. Следовательно, активность этих меристем может быть
изучена в тесной связи с частями растения, которые они форми-
руют. Подобный подход особенно оправдал себя при изложении
современных данных об апикальных меристемах, в котором боль-
шое место занимают причинные аспекты специфической органи-
зации частей растения. Следует упомянуть еще о двух особенно-
стях расположения материала в книге. Во-первых, главы, касаю-
щиеся развития зародыша, помещены перед описанием отдельных
тканей и органов. Эти главы используются для изложения суще-
ствующих представлений о росте, дифференциации и организа-
ции растения. Во-вторых, корень освещается раньше стебля, так
как, используя относительно простую структуру корня, легче вве-
сти концепции, связанные с разделением проводящих и непрово-
дящих зон в растении.
Поскольку эта книга в основном предназначается для сту-
дентов, имеющих относительно ограниченный опыт в изучении
растений, не будет излишним сказать несколько слов о значении
анатомии растений в системе ботанических дисциплин. Незави-
симо от того, имеем ли мы дело с растением как садоводы, агро-
номы, лесоводы, фитопатологи или экологи, мы должны знать,
что собой представляет растение и как оно функционирует. Мы
получаем эти знания, изучая структуру растения, его развитие и
различные функции. Было бы идеально, если бы мы могли изу-
чать растение во всех этих аспектах одновременно, но мы счита-
ем более целесообразным сосредоточиться сначала на каком-
либо одном аспекте, а затем уже переходить к следующим. По-
этому изучением организмов занимаются несколько разделов био-
логии, прежде всего два более широких — морфология и физио-
логия, каждый из которых делится на более узкие разделы,
такие, как цитология, анатомия, таксономия, экология и другие.
Ясно, что все эти области науки не обособлены одна от другой;
более того, изучение одного раздела неизменно поднимает вопро-
сы, ответы на которые могут быть получены только при обраще-
нии к другим разделам.
Предисловие к первому изданию 11
В этом взаимодействии наук анатомия играет главную роль.
Правильная интерпретация физиологом той или иной функции,
выполняемой растением, должна опираться на глубокое знание
структуры клеток и тканей, связанных с этой функцией. Яркими
примерами функций, пониманию которых существенно способст-
вовало изучение структуры растений, служат фотосинтез, дви-
жение воды, передвижение питательных веществ и поглощение
веществ корнями. Знание анатомии растений необходимо также
для успешной работы в области фитопатологии. Влияние парази-
та на растение не может быть полностью понято, если не изве-
стна нормальная структура пораженного растения. Более того,
защита растения от влияния паразита и даже устойчивость само-
го паразита могут быть обусловлены структурными изменениями
или структурными особенностями хозяина. Объяснение успехов
или неудач многих садоводческих приемов, таких, как прививка,
обрезка, вегетативное размножение, и связанных с ними явлений,
например образование каллуса, заживление ран, регенерация и
развитие придаточных корней и почек, становятся более осмыс-
ленными, если правильно поняты структурные особенности, ле-
жащие в основе всех этих явлений. Эколог добивается положи-
тельных результатов в своей работе тогда, когда он сопоставля-
ет поведение растений, произрастающих в различных условиях
внешней среды, с их структурными особенностями. Знаменатель-
но, что изучение развития формы и организации растения — од-
на из наиболее интенсивно развивающихся областей современных
ботанических исследований — часто основывается на представле-
нии о постоянной корреляции между биохимическими и структур-
ными изменениями в растении. Благодаря такому подходу полу-
чена гораздо более полная картина развития растений, чем в том
случае, если бы биохимические изменения рассматривались в от-
рыве от изменений числа, размеров и структуры клеток. Нако-
нец, анатомия растений интересна и сама по себе. Она дает ис-
следователю благодарный материал, на котором можно просле-
дить онтогенетическое и эволюционное развитие структурных
особенностей растений и составить представление о высокой сте-
пени сложности и замечательной упорядоченности их организа-
ции.
Благодарности
Лица, которые упомянуты в подписях к иллюстрациям, лю-
безно предоставили в распоряжение автора материалы разного
рода, что позволило включить в книгу большое число новых ил-
люстраций. Проф. Джон И. Сасс (John Е. Sass) был особенно
щедр — в книге помещено много микрофотографий, сделанных с
12
Предисловие к первому изданию
его негативов и препаратов. От г-на Пола Л. Конанта (Paul L.
Conant) были получены препараты, использованные при состав-
лении ключа для определения древесин. Г-жа Марджери П. Манн
(Margery Р. Mann) любезно помогла при выполнении микрофо-
тографий.
Я хочу также выразить благодарность проф. Вернону И. Чид-
лу (Vernon I. Cheadle), проф. Чарлзу Ламотту (Charles LaMot-
te) и г-ну Чарлзу X. Ламурё (Charles Н. Lamoureux) за чтение
рукописи и критические замечания. Д-р Джеймс Дж. Даннинг
(James J. Dunning) облегчил мне задачу подготовки словаря
терминов, составив исходный перечень слов и определений. Я
очень признательна г-же Мэри М. Бринтон (Магу М. Brinton),
которая с исключительной добросовестностью и аккуратностью
перепечатала рукопись.
К. Эзау
Декабрь 1959 г.
Глава 1
Введение
Эта книга посвящена внутренней структуре современных се-
менных растений, причем особое внимание в ней уделено покры-
тосеменным, хотя рассматриваются также и некоторые особен-
ности вегетативных органов голосеменных. В заключительных
главах описывается анатомия цветка, плода и семени покрытосе-
менных.
Семенное растение обладает хорошо развитым телом, которое
несет признаки структурной и функциональной специализации,
выраженной, с одной стороны, во внешнем расчленении этого
тела на органы, а с другой — во внутренней его дифференциации
на различные категории клеток, тканей и тканевых систем. Обыч-
но в теле растения различают три вегетативных органа: корень,
стебель и лист. Цветок рассматривается как совокупность орга-
нов, одну часть которых относят к репродуктивным (тычинки и
плодолистики), а другую — к стерильным (чащелистики и лепест-
ки). В отношении внутренней структуры растения большое зна-
чение придают отличительным особенностям клеток и тканей и на
основе обнаруженных различий устанавливают их типы.
Расчленение тела растения на составные части и связанная
с ним разработка типологии этих частей — логичный и удобный
способ изучения растения, позволяющий выдвинуть на первый
план проблему структурной и функциональной специализации от-
дельных частей растения. Однако не следует слишком увлекаться
таким подходом, чтобы не утратить представления о растении
как о едином целом. То, что растение является целостным орга-
низмом, ощущается особенно ясно тогда, когда оно изучается в
развитии, так как это дает возможность наблюдать постепенное
появление органов и тканей из относительно недифференцирован-
ного тела молодого зародыша. Подобные же изменения — от ме-
нее дифференцированного к более дифференцированному, от ме-
нее расчлененного к более расчлененному—имели место и в эво-
люции семенных растений. Поэтому по общепринятой трактовке
корень, стебель, лист и органы цветка составляют филогенетиче-
ски взаимосвязанные части растения, а различные клетки и ткани
рассматриваются как производные неспециализированных клеток
такого типа, к которому теперь относят паренхимные клетки Да-
же при статическом изучении частей взрослого растения выяв-
ляется их единство и взаимозависимость; всем им свойственны
одни и те же системы тканей.
14
Глава 1
Следовательно, расчленение растения на органы может быть
сделано только приблизительно. Невозможно, например, провести
четкую границу между побегом и корнем или между стеблем и
листом, цветок же во многих отношениях напоминает вегетатив-
ный побег. Сходным образом не наблюдается резких границ и
между внутренними структурами растения, так как отдельные
категории клеток и тканей имеют много промежуточных форм.
Внутренняя организация тела растения
Тело растения состоит из морфологически четко очерченных
единиц — клеток, каждая из которых заключена в свою собствен-
ную клеточную оболочку и соединена с другими клетками посред-
ством межклеточного цементирующего вещества. В этой связанной
воедино массе отдельные группы клеток различаются между
собой либо в структурном, либо в функциональном, либо в том
и другом отношении. Подобные группы клеток называются тка-
нями. Структурная вариабельность тканей основана на различи-
ях в составе клеток и характере их связи друг с другом. Неко-
торые ткани структурно относительно просты в том смысле, что
они состоят из одного типа клеток; другие же, содержащие клет-
ки нескольких типов, являются сложными.
Расположение тканей в целом растении и в его главных орга-
нах подчинено определенной структурной и функциональной ор-
ганизации. Ткани, занятые проведением питательных веществ и
воды, —проводящие ткани — образуют непрерывную систему,
проходящую через каждый орган и все растение. Эти ткани свя-
зывают места поглощения воды и питательных веществ с зона-
ми роста, развития и запасания. Непроводящие ткани также не-
прерывны, и их расположение служит показателем специфических
взаимосвязей (например, между запасающими и проводящими
тканями )и специфических функций (таких, как опора или запа-
сание веществ). Чтобы подчеркнуть, что ткани представляют со-
бой крупные скопления объединенных между собой клеток (орга-
низация, отражающая общую целостность тела растения) приме-
няется выражение система тканей.
Хотя классификация клеток и тканей носит несколько произ-
вольный характер, она необходима для более точного описания
структуры растения. Более того, если классификация является
результатом широкого сравнительного исследования, в котором
отчетливо выявляются и правильно интерпретируются вариабель-
ность признаков и их взаимные переходы, то такая классифика-
ция имеет не только описательное значение, но и отражает есте-
ственные связи классифицируемых единиц.
Введение
15
В соответствии с классификацией Сакса (Sachs, 1875), в этой
книге главные ткани сосудистого растения сгруппированы на ос-
нове их топографической непрерывности в три системы тканей:
покровную, проводящую и основную. Покровная система включа-
ет эпидерму, т. е. первичный наружный защитный слой, покры-
вающий тело растения, и перидерму — защитную ткань, которая
замещает эпидерму главным образом в тех частях растения, ко-
торые претерпевают вторичные утолщения. Проводящая система
состоит из двух типов проводящих тканей — флоэмы (проведе-
ние питательных веществ) и ксилемы (проведение воды).
Основная система включает ткани, которые в определенном
смысле составляют основу растения, но в то же время обнару-
живают различную степень специализации. Главными из этих тка-
ней являются: паренхима во всем ее разнообразии, колленхи-
ма — толстостенная опорная ткань, родственная паренхиме, и
склеренхима — главная опорная ткань с толстыми, твердыми, ча-
сто одревесневшими стенками.
В пределах одного растения различные ткани распределены
характерным образом в зависимости от того, в какой части ра-
стения они находятся и к какому таксону принадлежит данное
растение. По существу, характер их распределения сходен в том
отношении, что проводящая ткань всегда бывает погружена в ос-
новную, а покровная ткань составляет наружный защитный слой
тела растения. Главные изменения в характере распределения
тканей связаны с относительным положением проводящей и ос-
новной тканей. У двудольных, например, проводящая ткань стеб-
ля образует полый цилиндр, а основная ткань находится внутри
цилиндра (сердцевина) и вокруг него — между проводящими и
покровными тканями (первичная кора). В листе проводящая
ткань представляет собой анастомозирующую систему, погружен-
ную в основную ткань, дифференцированную здесь как мезофилл.
В корне проводящий цилиндр может не содержать сердцевины,
но первичная кора в нем присутствует.
Клетки и ткани растения обычно развиваются из зиготы (опло-
дотворенной яйцеклетки) через промежуточные стадии развития?
осуществляемые в зародыше. Эмбриональная стадия, однако, не
прекращается полностью после того, как зародыш разовьется во
взрослое растение. Растения обладают уникальным свойством
неограниченного роста, обусловленным присутствием в них эмб-
риональных тканевых зон — меристем, в которых продолжается
образование новых клеток в то время, когда другие части расте-
ний уже достигли зрелого состояния. Меристемы, находящиеся
на кончиках корней и верхушках побегов, — апикальные мери-
стемы — образуют клетки, производные которых дифференциру-
ются в новые части корня и побега. Этот рост называется пер-
вичным. Тело растения, сформировавшееся в результате первич-
£6
Глава 1
ного роста, представляет собой первичное тело растения. У мно-
гих растений стебли и корни нарастают в толщину путем добав-
ления к первичному телу проводящих тканей. Такое утолщение
обеспечивается камбием и называется вторичным ростом Обыч-
но вторичный рост сопровождается также появлением перидермы,
которую формирует особая меристема — феллоген Камбий и
феллоген получили название латеральные меристемы вследствие
того, что они расположены параллельно боковым поверхностям
стебля и корня.
Краткая характеристика типов клеток
и тканей
Как уже указывалось в начале этой главы, разделение клеток
и тканей на категории в некотором смысле противоречит тому
факту, что их структурные признаки не только варьируют и свя-
заны между собой взаимными переходами, но способны также
трасформироваться друг в друга. Тем не менее клетки и ткани
приобретают различные свойства в зависимости от их положения
в теле растения. Классификации клеток и тканей позволяют при
рассмотрении вопросов, касающихся дифференциации и вытекаю-
щего из нее разнообразия частей растения, делать выводы отно-
сительно общих и частных признаков у представителей родствен-
ных и неродственных таксонов. Они дают возможность прово-
дить сравнительное и систематическое изучение явлений онтоге-
нетической и филогенетической специализации. Ниже приводятся
краткие сведения об основных категориях клеток и тканей семен-
ных растений.
ЭПИДЕРМА
В том случае, когда структура тела растения является пер-
вичной, эпидермальные клетки образуют непрерывный слой на
его поверхности. Они обнаруживают ряд особых признаков, свя-
занных с их поверхностным расположением. Собственно эпидер-
мальные клетки, составляющие основную часть эпидермы, разно-
образны по форме, но часто они бывают таблитчатыми. К эпи-
дермальным клеткам относятся также замыкающие клетки
устьиц и различные трихомы, в том числе и корневые волоски.
Эпидерма может включать секреторные и склеренхимные клетки.
Главные отличительные особенности эпидермальных клеток над-
земных частей растения — наличие кутикулы на наружных стен-
ках клеток и кутинизация некоторых или всех остальных клеточ-
ных стенок. Эпидерма обеспечивает механическую защиту и уча-
ствует в регулировании транспирации и газообмена. В стеблях
Введение
17
и корнях, характеризующихся вторичным ростом, эпидерма обыч-
но замещается перидермой.
ПЕРИДЕРМА
Перидерма состоит из пробковой ткани, или феллемы, проб-
кового камбия, или феллогена, и феллодермы. Феллоген распола-
гается вблизи поверхности осевых органов, характеризующихся
вторичным ростом, и сам по своему происхождению также явля-
ется вторичным. Он закладывается в эпидерме, коре, флоэме или
в перицикле и производит на своей внешней стороне феллему, а
на внутренней — феллодерму. Феллодерма либо образуется в не-
большом количестве, либо вообще отсутствует. Клетки пробки
имеют обычно таблитчатую форму, плотно сомкнуты, в зрелом
состоянии лишены протопластов и имеют опробковевшие стенки.
Феллодерма обычно состоит из паренхимных клеток.
ПАРЕНХИМА
Паренхимные клетки образуют сплошную ткань в коре стеб-
ля и корня и в мезофилле листа. Они встречаются также в виде
вертикальных тяжей и лучей в проводящих тканях. По проис-
хождению они первичны в коре, сердцевине и листе; в проводя-
щих тканях они могут быть первичными или вторичными. В ти-
пичном случае паренхимные клетки представляют собой живые
клетки, способные к росту и делению. Они разнообразны по фор-
ме, часто имеют вид многогранника, но могут быть также звезд-
чатыми или сильно удлиненными. Для них характерны первич-
ные оболочки, но нередко встречаются и вторичные. Паренхим-
ные клетки связаны с процессом фотосинтеза, служат для хране-
ния различных веществ, заживления ран и формирования доба-
вочных структур, а также могут быть специализированы как сек-
креторные структуры.
КОЛЛЕНХИМА
Клетки колленхимы образуют тяжи или непрерывные цилиндры
вблизи поверхности первичной коры в стеблях и черешках и вдоль
жилок вегетативных листьев. В корнях она обнаруживается редко.
Колленхима представляет собой живую ткань, близкородственную
паренхиме; фактически ее обычно и рассматривают как форму
паренхимы, специализированную в качестве опорной ткани моло-
дых органов. Форма клеток колленхимы варьирует; некоторые из
них представляют собой короткие призмы, другие же бывают бо-
лее удлиненными. Наиболее характерная особенность клеток этой
ткани — неравномерно утолщенные первичные клеточные обо-
лочки.
2 К. Эзау, кн. 1
18
Глава 1
СКЛЕРЕНХИМА
Склеренхимные клетки либо образуют сплошную ткань, либо
располагаются в виде небольших групп или поодиночке среди дру-
гих клеток. Они могут развиваться в какой-нибудь одной или во
всех частях тела растения, характеризующихся как первичным,
так и вторичным строением, и являются элементами, укрепляю-
щими сформировавшиеся части растения. Склеренхимные клетки
имеют толстые вторичные оболочки, часто одревесневшие, и в
зрелом состоянии обычно лишены протопластов. Различают два
типа склеренхимных клеток — склереиды и волокна. По своей
форме склереиды варьируют от многогранных до удлиненных и
могут быть разветвленными. Волокна, как правило, представля-
ют собой тонкие удлиненные клетки.
КСИЛЕМА
Клетки ксилемы образуют сложную как в структурном, так и
в функциональном отношении ткань, которая вместе с флоэмой
проходит, не прерываясь, по всему телу растения. Эта ткань со-
стоит из нескольких типов клеток и служит для проведения во-
ды, отложения питательных веществ в запас и для опоры. По
своему происхождению ксилема может быть первичной или вто-
ричной. Основными проводящими воду элементами являются тра-
хеиды и членики сосудов. Отдельные членики смыкаются конец
в конец, образуя сосуды. Запасные вещества откладываются в
паренхимных клетках, которые расположены вертикальными ря-
дами, а также образуют лучи во вторичной ксилеме. Механиче-
ские элементы представлены волокнами и склереидами.
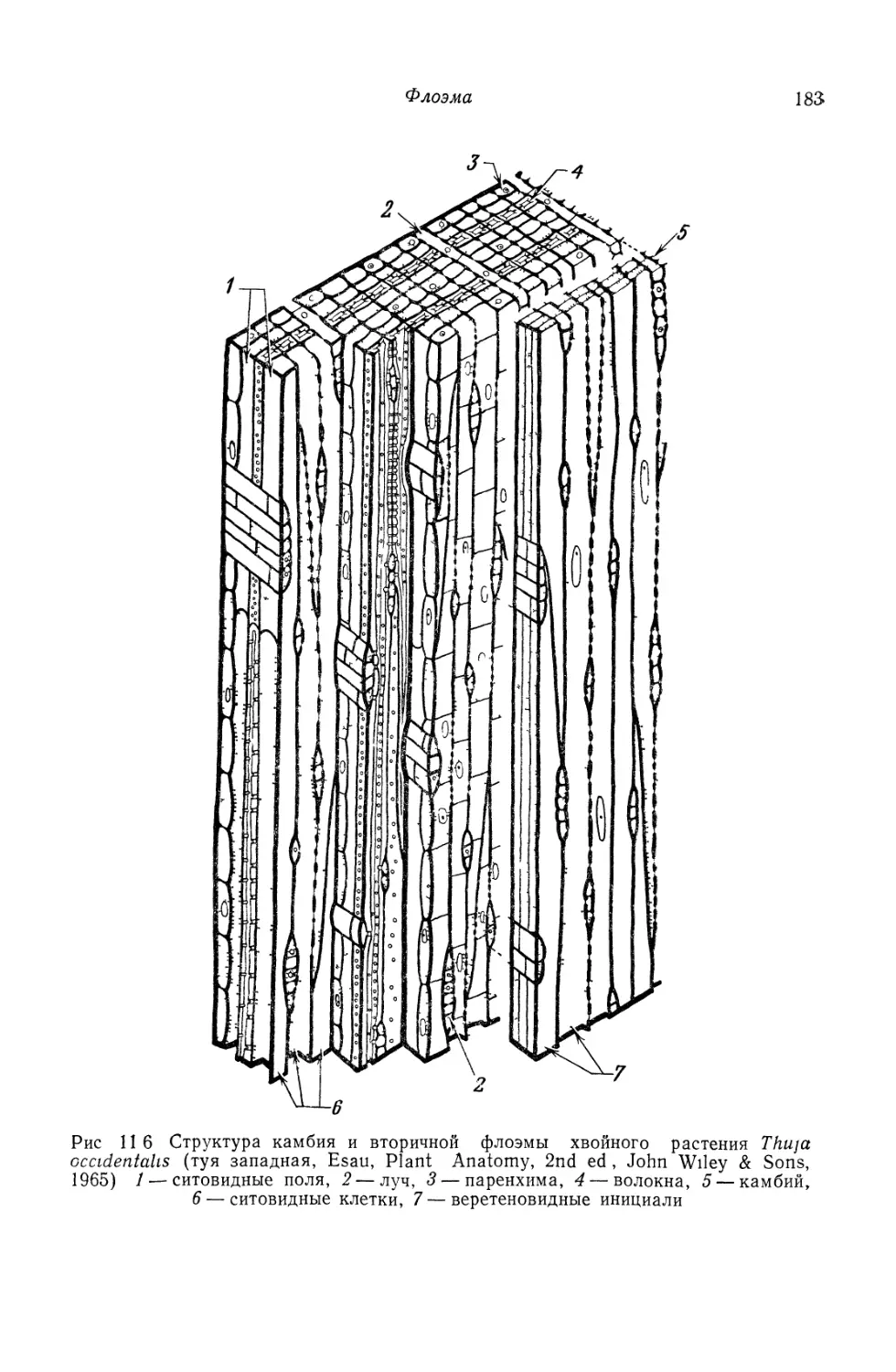
ФЛОЭМА
Флоэма представляет собой сложную ткань, состоящую из не-
скольких типов клеток. Эта ткань вместе с ксилемой проходит, не
прерываясь, по всему телу растения и по своему происхождению
может быть первичной или вторичной. Флоэма является опорной,
проводящей питательные вещества и запасающей тканью. Глав-
ными проводящими элементами служат ситовидные клетки и чле-
ники ситовидных трубок, причем в зрелом состоянии и те и дру-
гие лишены ядер. Членики ситовидных трубок соединяются конец
в конец, образуя ситовидные трубки, и связаны с паренхимными
клетками, называемыми клетками-спутниками. Другие паренхим-
ные клетки флоэмы располагаются вертикальными рядами. Вто-
ричная флоэма также содержит паренхиму в виде лучей. Опор-
ные клетки представлены волокнами и склереидами.
Введение
19
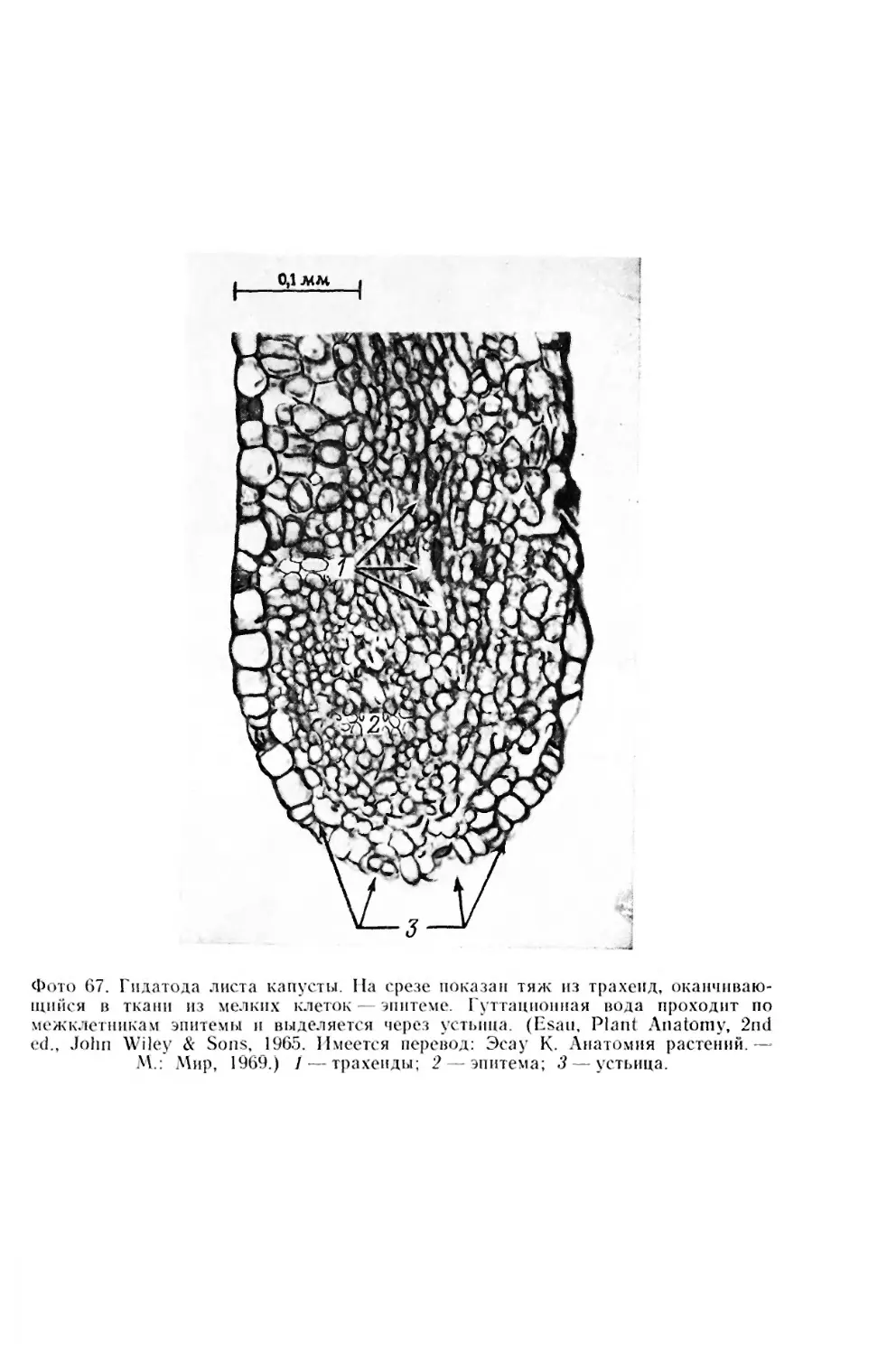
СЕКРЕТОРНЫЕ СТРУКТУРЫ
Секреторные клетки — клетки, производящие различные сек-
реторные продукты, — не образуют четко обособленных тканей,
но встречаются в других тканях, как первичных, так и вторич-
ных, в виде отдельных клеток, групп или рядов клеток, а также
в виде более или менее определенно организованных структур на
поверхности растения. Главными секреторными структурами на
поверхности растения являются железистые эпидермальные клет-
ки, волоски и различные железки, как, например, цветочные и
экстрафлоральные нектарники, некоторые гидатоды и пищевари-
тельные железки. Железки обычно дифференцированы на секре-
торные клетки, расположенные на поверхности, и несекреторные
клетки, поддерживающие секреторные. Внутренние секреторные
структуры представлены секреторными клетками, межклеточными
полостями или каналами, выстланными секреторными клетками
(смоляные ходы, масляные каналы), и секреторными полостями,
возникающими в результате разрушения секреторных клеток
(масляные вместилища). К внутренним секреторным структурам
могут быть отнесены и млечники. Они представляют собой или
одиночные клетки (нечленистые млечники), обычно сильно раз-
ветвленные, или ряды клеток, объединенных благодаря частич-
ному разрушению стенок (членистые млечники). Млечники со-
держат жидкость, называемую латексом, который может быть
богат каучуком. Обычно они многоядерные.
ОБЩИЕ ЗАМЕЧАНИЯ
Большая часть библиографических ссылок, помещенных в кон-
це каждой главы, начиная со второй, взяты из последних работ,
но обширный список литературы, приведенный в книге Эзау «Ана-
томия растений» (Esau, 1965), был также использован для пред-
ставления и интерпретации некоторых данных. Ниже приводится
перечень ряда отечественных и иностранных книг по анатомии
растений, а также нескольких книг по морфологии растений.
Большинство их посвящено семенным растениям, но включены
также и некоторые работы, касающиеся структуры низших сосу-
дистых растений.
СПИСОК ЛИТЕРАТУРЫ
Александров В. Г. Анатомия растений. — 2-е изд. — М.: Высшая школа, 1966.
Bailey I. W. Contributions to plant anatomy, Waltham, Massachusetts, Chronica
Botanica Company, 1954.
Biebl R., Germ H. Praktikum der Pflanzenanatomie, 2nd ed., Wien, Springer,
1967.
Bierhorst D. W7. Morphology of vascular plants, New York, Macmillan, 1971.
Bold H. C. Morphology of plants, 3rd ed., New York, Harper and Row, 1973.
Boureau E. Anatomie vegetale, 3 vols., Paris, Presses Universitaires de France,
1954, 1956, 1957.
2*
20
Глава 1
Braune W.f Leman A., Taubert H. Pflanzenanatomisches Praktikum, 2nd ed., Jena,
Gustav Fischer, 1971.
Carlquist S. Comparative plant anatomy, New York, Holt, Rinehart and Winston,
1961.
Clowes F. A. L., Juniper В. E. Plant cells, Oxford, Blackwell Scientific Publications,
1968.
Cutler D. F. Anatomy of the monocotyledons. IV. Juncales, Oxford, Clarendon
Press, 1969.
Cutter E. G. Plant anatomy: experiment and interpretation. Part I. Cells and tis-
sues. Part 2. Organs, London, Edward Arnold, 1969 and 1971.
De Bary A. Comparative anatomy of the vegetative organs of the phanerogams
and ferns. (English translation by Bower F. O., Scott D. H.), Oxford, Claren-
don Press, 1884.
Eames A. J. Morphology of vascular plants. Lower groups, New York, McGraw-
Hill, 1936.
Eames A. J. Morphology of the angiosperms, New York McGraw-Hill, 1961.
Eames A. J., MacDaniels L. H. An introduction to plant anatomy, 2nd ed., New
York, McGraw-Hill, 1947.
Esau K. Plant anatomy, 2nd ed., New York, John Wiley and Sons, 1965.
Fahn A. Plant anatomy, 2nd ed., Oxford, Pergamon Press, 1974.
Foster A. S., Gifford E. M., Jr. Comparative morphology of vascular plants, 2nd
ed., San Francisco, Freeman W. H., 1974.
Haberlandt G. Physiological plant anatomy, London, Macmillan and Company,
1914.
Hayward H. E. The structure of economic plants, New York, Macmillan, 1938.
Jackson B. D. A glossary of botanic terms, 4th ed., New York, Hafner Pub-
lishing Co., 1953.
Jane F. W. The structure of wood, 2nd ed., Revised by Wilson K., White D. J. B.,
London, Adam and Charles Black, 1970.
Jeffrey E. C. The anatomy of woody plants, Chicago, University of Chicago Press,
1917.
Haussmann В. Pflanzenanatomie, Jena, Gustav Fischer, 1963.
Linsbauer K. Handbuch der Pflanzenanatomie, Vol. 1 and following, Berlin,
Gebriider Borntraeger, 1922—1943.
Mansfield W. Histology of medicinal plants, New York, John Wiley and Sons,
1916.
Metcalfe C. R. Anatomy of the monocotyledons. I. Gramineae. V. Cyperaceae, Ox-
ford, Clarendon Press, 1960 and 1971.
Metcalfe C. R., Chalk L. Anatomy of the dicotyledons, 2 vols, Oxford, Clarendon
Press, 1950.
Rauh W. Morphologic der Nutzpflanzen, Heidelberg, Quelle und Meyer, 1950.
Sachs J. Textbook of botany, Oxford, Clarendon Press, 1875.
Sinnott E. W. Plant morphogenesis, New York, McGraw-Hill, 1960.
Solereder H. Systematic anatomy of the dicotyledons, 2 vols. (English translation
by Boodle L. A., Fritsch F. E.), Oxford, Clarendon Press, 1908.
Solereder H., Meyer F. J. Systematische Anatomie der Monokotyledonen, Berlin,
Gebriider Borntraeger, No. 1, 1933; No. 3, 1928; No. 4, 1929; No. 6, 1930.
Tomlinson P. B. Anatomy of the monocotyledons. II. Palmae. III. Commelinales —
Zingiberales, Oxford, Clarendon Press, 1961 and 1969.
Troll W. Praktische Einfiihrung in die Pflanzenmorphologie. Part 1: Der vegeta-
tive Aufbau. Part 2: Die bliihende Pflanze, Jena, Gustav Fischer, 1954 and*
1957.
Wardlaw C. W. Organization and evolution in plants, London, Longmans, Green
and Co., 1965.
Zimmermann W., Ozenda P., Wulff H. D., eds., Encyclopedia of plant anatomy
(Handbuch der Pflanzenanatomie), Vol. 2 and following, Berlin and Stuttgart^
Borntraeger, 1951 and following.
Глава 2
Развитие семенного растения
Зародыш
Голосеменные и покрытосеменные, составляющие основную
часть наземных растений, отличаются большим разнообразием
форм, которые в ряде случаев кажутся очень мало связанными
между собой. Тем не менее при изучении семенных растений в
процессе их развития у них обнаруживаются одинаковый план
строения и удивительное сходство на ранних стадиях роста. Вы-
сокоорганизованное тело семенного растения представляет собой
спорофитную фазу его жизненного цикла. Растение начинает свое
существование обычно с оплодотворенной яйцеклетки — зиготы,.
которая развивается в зародыш, проходя характерные этапы раз-
вития, воспроизводящие организацию взрослого растения ( гл.
24).
Клеточные деления, в результате которых одноклеточная зи-
гота превращается в многоклеточное растение, уже на ранних
стадиях развития зародыша, часто с самого первого деления,
происходят в определенных направлениях. Это приводит к уста-
новлению характерного порядка в расположении клеток, и за-
родыш в целом (рис. 2.1) принимает особую форму, в которой
можно различить ось зародыша и один или большее число листо-
подобных придатков — семядолей. Стеблеподобная ось, располо-
женная ниже семядолей, называется гипокотилем. На своем
нижнем конце (корневом полюсе) гипокотиль несет зачаток кор-
ня, а на верхнем конце (полюсе побега) выше семядолей —зача-
ток побега. Зачаток корня может быть представлен меристемой
(апикальной меристемой корня) или образовавшимся из нее за-
родышевым корешком. Точно так же апикальная меристема по-
бега, расположенная на полюсе побега над семядолями, может
начать развиваться в побег, а может оставаться и в недифферен-
цированном состоянии. Зародышевый побег называется эпикоти-
лем, или плюмулой.
В основе организации тканевых систем лежат происходящие в
зародыше клеточные деления с последующим дифферен-
циальным ростом и вакуолизацией вновь образованных клеток
[13]. По своему составу ткани зародыша остаются еще меристе-
матическими, но по расположению и цитологическим характери-
стикам они уже обнаруживают сходство со зрелыми тканями, ко-
торые появляются в развивающемся впоследствии проростке.
Будущая эпидерма представлена поверхностным меристемати-
22
Глава 2
Рис 2 1 Схема строения зародыша
двудольного растения А Продоль-
ный срез Апикальная меристема по-
бега (апекс побега) расположена
между семядолями, апикальная ме-
ристема корня (апекс корня) покры-
та корневым чехликом Прокамбий
проходит через весь гипокотиль и се-
мядоли Б Поперечный срез через
семядоли и апикальную меристему
побега Прокамбий расположен в
виде трех пучков в каждой семядо-
ле 1 — семядоля, 2 — апекс побега;
3 — гипокотиль; 4 — прокамбий, 5 —
апекс корня, 6 — корневой чехлик.
ческим слоем, называемым протодермой (или дерматогеном). Под
ней лежит хорошо различимая благодаря более сильной, чем в
соседних тканях, вакуолизации основная меристема булушей ко-
ры. Менее вакуолизированная ткань, расположенная ближе к
центру и проходящая через всю гипокотиль-корневую ось и семя-
доли, представляет собой меристему будущей первичной прово-
дящей системы. Эта меристема носит название прокамбия (рис.
2.1). Если необходимо подчеркнуть предназначение этой ткани,
то ее называют также проваскулярной тканью, или проваскуляр-
ной меристемой. Вследствие продольных делений и растяжения
в длину прокамбиальные клетки приобретают узкую вытянутую
форму. У зародышей растений, относящихся к разным таксонам,
прокамбий имеет различное строение, но во всех случаях — это
согласованно развивающаяся упорядоченная система, образую-
щая сплошной слой между семядолями и гипокотиль-корневой
осью. Проводящая система проростка, образующегося из заро-
дыша, представляет собой увеличенный и дифференцированный
слепок с эмбриональной прокамбиальной системы (гл. 24).
Развитие семенного растения
23
От зародыша к взрослому растению
После того как семя прорастает, апикальная меристема по-
бега начинает формировать в правильной последовательности
листья, узлы и междоузлия (рис. 2.2). Из апикальных меристем,
находящихся в пазухах листьев, образуются пазушные побеги,
которые в свою очередь дают начало дополнительным пазушным
побегам. В результате такой активности на главном стебле рас-
тения развивается система ветвей. Если пазушные меристемы
остаются неактивными, то на побеге не образуется ветвей, что на-
блюдается, например, у многих пальм. Из апикальной меристе-
мы корня, расположенной на конце гипокотиля или корешка (ес-
ли последний уже сформировался), развивается главный (пер-
вичный) корень. У многих растений из новых апикальных мери-
стем, закладывающихся глубоко в главном корне (эндогенное
происхождение), возникают боковые (вторичные) корни, которые
в свою очередь дают начало боковым корням следующего поряд-
ка. В конечном счете у растения развивается сильно разветвлен-
ная корневая система. У некоторых растений, преимущественно
у однодольных, корневая система взрослого растения состоит из
придаточных (адвентивных) корней, возникающих на стебле. Та-
кие корни могут напоминать щетку или кисть (мочковатая кор-
невая система), так как они сходны между собой по длине и
форме.
Описанный выше рост представляет собой вегетативную ста-
дию жизни семенного растения. В соответствующее время, опре-
деляемое отчасти эндогенным ритмом роста, а отчасти внешни-
ми условиями, особенно светом и температурой [11], вегетатив-
ная апикальная меристема побега превращается в репродуктив-
ную апикальную меристему, называемую у покрытосеменных
флоральной апикальной меристемой, из которой развивается цве-
ток или соцветие. Таким образом, за вегетативной стадией в жиз-
ненном цикле растения следует репродуктивная стадия.
Стадия развития, которая заканчивается тем, что все более
или менее прямые производные апикальных меристем переходят
в зрелое состояние, называется стадией первичного роста. Все
тело растения, включая корни, стебли, листья, цветки, плоды и
семена, а также системы покровной (эпидерма), основной и про-
водящей тканей, образуется в результате первичного роста.
У некоторых двудольных (мелкие однолетники) и большинства
однодольных первичный рост наблюдается на протяжении всего
жизненного цикла растения. Однако у большей части двудольных
и голосеменных обнаруживается и вторичный рост, обусловлен-
ный активностью камбия. В результате деятельности этой мери-
стемы увеличивается количество проводящей ткани, что вызывает
утолщение оси растения (стебля и корня; рис. 2.2). Предполага-
24
Глава 2
Рис. 2.2. Схема многолетнего
двудольного растения, иллю-
стрирующая ветвление побега
и корня, утолщение стебля и
корня, обусловленное вторич-
ным ростом, и развитие пери-
дермы и коры на утолщенной
оси растения. Верхушки глав-
ного и боковых (пазушных)
побегов несут различные по
размеру примордии листьев.
На некотором расстоянии от
кончиков главного (стержнево-
го) и боковых корней располо-
жены корневые волоски. (Вос-
производится из работы Rauh,
Morphologie der Nutzphlanzen,
Quelle und Meyer, Heidelberg,
1950, с некоторыми изменения-
ми.) 1 — апекс главного побе-
га; 2— пазушная почка; 3—
пазушный побег; 4 — стебель с
молодой перидермой; 5 — спя-
щая почка; 6 — стебель с че-
шуйчатой корой; 7 — стержне-
вой корень с перидермой;
8 — боковой корень; 9 — пери-
дерма; 10 — корневые воло-
ски; 11 — апекс главного кор-
ня.
Ь---------------------11
ется, что образование защитной ткани — перидермы, замещающей
эпидерму, также происходит путем вторичного роста. Вторичное
отложение проводящих тканей и защитного покрова обеспечива-
ет развитие крупных, сильно разветвленных растений, представ-
ленных древесными формами.
Развитие семенного растения
25
Хотя и принято считать, что растение, развиваясь из одной-
единственной клетки в сложную, но интегрированную структуру,
способную к самовоспроизведению, становится «взрослым», или
«зрелым», тем не менее семенное растение и в зрелом состоянии
представляет собой непрерывно изменяющийся организм. Бла-
годаря активности апикальных меристем побегов и корней (фо-
то I)1 оно сохраняет способность добавлять новые части к сво-
ему телу, а благодаря активности латеральных меристем — увели-
чивать объем вторичных тканей. Внешние проявления роста свя-
заны с соответствующими процессами, происходящими на кле-
точном уровне. Для поддержания роста и дифференциации требу-
ются синтез и распад веществ, входящих в состав протопласта и
клеточной оболочки, что сопровождается обменом органических
и неорганических веществ, циркулирующих по проводящим тка-
ням и диффундирующих от клетки к клетке к конечному месту
назначения В специализированных органах и тканях протекает
множество различных процессов, обеспечивающих образование
органических веществ, участвующих в метаболизме. Характерной
особенностью живого растения является то, что постоянные изме-
нения происходят в нем в высшей степени согласованно и в стро-
го определенной последовательности [22]. Более того, растения,
как и другие живые организмы, обнаруживают в своей жизнедея-
тельности определенную ритмичность, которая в ряде случаев
отчетливо связана с периодичностью явлений окружающей сре-
ды, что указывает на способность растений измерять время [21].
Апикальные меристемы и их производные
Формирование новых клеток, тканей и органов, обусловленное
активностью апикальных меристем, связано с делением клеток.
Некоторые клетки меристемы делятся таким образом, что одна
из вновь образовавшихся клеток становится новой клеткой тела
растения, а другая остается в меристеме. Клетки, остающиеся в
меристеме, могут быть названы инициалями, а клетки, входящие
в состав тела растения, — производными. Однако такое подраз-
деление клеток на инициали и производные может быть принято
лишь с той оговоркой, что в генетическом отношении инициали
не отличаются от своих производных и могут быть замещены ими.
В последующих разделах этой книги концепция инициалей и
производных рассматривается с различных точек зрения в связи
с описанием камбия (гл. 10) и апикальных меристем корня (гл.
14) и побега (гл. 16) Здесь же достаточно указать, что, согласно
общепринятым представлениям, некоторые клетки в меристемах
1 Все фотографии помещены в конце книги — Прим ред
26
Глава 2
действуют как инициали главным образом потому, что они зани-
мают соответствующее данной функции место в теле растения и
что апикальные меристемы корней и побегов высших сосудистых
растений (голосеменных и покрытосеменных) содержат группы
инициалей.
Термин «апикальная меристема» относится к комплексу клеток,
состоящему из инициалей и их непосредственных производных
(фото 1). Производные обычно также делятся и образуют одно
или большее число поколений клеток до того, как вблизи кончика
корня или верхушки побега произойдут цитологические измене-
ния, связанные с дифференциацией специфических типов клеток и
тканей. Более того, деления продолжаются и на тех уровнях, где
такие изменения уже наметились. Другими словами, рост, в смыс-
ле клеточных делений, не ограничен только самым кончиком
корня или верхушкой побега, но распространяется и на уровни,
значительно удаленные от зоны, обычно называемой апикальной
меристемой. В действительности деления, происходящие на не-
котором расстоянии от апекса, даже более активны, чем в самом
апексе [5]. В побеге на тех уровнях, где закладываются новые
листья, наблюдается более интенсивная меристематическая дея-
тельность, чем в верхушке, а в процессе удлинения стебля деле-
ние клеток распространяется на несколько междоузлий ниже апи-
кальной меристемы [15].
Клеточные деления в меристематических тканях сочетаются
с ростом клеток, образующихся в результате делений. В целом
интенсивность растяжения клеток возрастает в направлении от
молодой меристематической ткани к более старой (фото 1) и в
конце концов становится главным фактором, определяющим на-
растание того или иного участка корня или побега в толщину и
длину. Клетки, уже прекратившие деления, но еще способные ра-
стягиваться, постепенно дифференцируются в специфические
клетки, характерные для тех участков побега и корня, где эти
клетки располагаются. Таким образом, различные явления роста
и дифференциации частично накладываются друг на друга в од-
ной и той же клетке; более того, на одном и том же уровне по-
бега или корня различные участки могут находиться на разных
стадиях роста и дифференциации.
Взаимосвязь между делением и растяжением клеток, возни-
кающая в ходе меристематической деятельности растения, ана-
лизировалась с точки зрения генетического контроля, установлен-
ного над формой растения.. Стеббинс [17] проводит различие
между состоянием меристемы, характеризующимся детерминиро-
ванными митотическими делениями, и ее состоянием, при котором
детерминировано удлинение (точнее растяжение) клеток. В связи
с этим он предлагает следующую гипотезу. Гены, контролирую-
щие форму листьев и других частей высших растений, так же как
Развитие семенного растения
27
и гены, управляющие числом и расположением частей растения,
проявляют свое действие, влияя, во-первых, на темп и распреде-
ление митозов и, во-вторых, определяя время перехода от одного
детерминированного состояния к другому.
Ввиду постепенного превращения апикальных меристем во
взрослые первичные ткани и наличия взаимных переходов между
явлениями клеточного деления, растяжения и дифференциации
клеток нельзя ограничить применение термина «меристема» толь-
ко в отношении верхушки побега или кончика корня. Части побе-
га и корня, в которых будущие ткани и органы уже в определен-
ной степени детерминированы, но деления и растяжение клеток
еще продолжаются, также являются меристематическими. Если
желательно провести различие между апикальной меристемой и
подстилающими ее тканями, то можно говорить об апикальных
меристемах и лежащих под ними первичных меристематических
тканях, но можно использовать термины «апекс корня» и «апекс
побега» в широком смысле, объединяя апикальную меристему и
подстилающие ее первичные меристематические ткани.
Дифференциация, специализация
и морфогенез
Процесс постепенного превращения структурно простой мери-
стематической ткани в сложные и разнообразные ткани или i ом-
плексы тканей, входящие в состав тела взрослого растения, на-
зывается дифференциацией. Переход от недифференцированного
меристематического состояния к дифференцированному взрос-
лому состоянию затрагивает как химический состав клеток, так и
их морфологические характеристики и может изучаться на уров-
нях одной клетки, ткани, системы тканей, органа или целого ра-
стения. Дифференциацию можно рассматривать как двойной про-
цесс, в ходе которого клетки и ткани приобретают свойства, от-
личающие их, во-первых, от меристематических предшественни-
ков и, во-вторых, от соседних клеток или тканей.
Когда мы сравниваем клетки, которые закончили свою диф-
ференциацию, мы видим, что одни из них отличаются от мери-
стематических клеток в значительно большей степени, чем др) гие,
и что более глубокие изменения связаны с их более выраженной
специализацией в отношении тех функций, которые эти клетки
выполняют в теле растения. Высокая степень специализации до-
стигнута, например, проводящими воду клетками ксилемы, кото-
рые в зрелом состоянии имеют относительно толстые стенки и
лишены живого содержимого, а также проводящими питатель-
ные вещества ситовидными элементами флоэмы — клетками,
которые в зрелом состоянии не содержат ядер. Менее глубокие
28
Глава 2
изменения происходят в процессе дифференциации фотосинтези-
рующей паренхимной клетки в мезофилле листа. Такая клетка
может по форме сильно отличаться от своего меристематического
предшественника, но она имеет умеренно утолщенную оболочку и
в ней полностью сохраняется протопласт. Наиболее отличитель-
ной чертой такой клетки является наличие в ней многочисленных
хлоропластов.
Если дифференцированная клетка сохраняет протопласт, то
ее можно стимулировать к возобновлению меристематической ак-
тивности. Поранение листа, например, может вызвать деление
клеток мезофилла и последующее формирование опробковевшей
защитной ткани. Клетки мезофилла можно также культивиро-
вать in vitro [12]. Формирование ткани каллуса вдоль поверхно-
сти среза — другой пример реактивации клеточного деления в па-
ренхиме, причем такая паренхима по своему возрасту может быть
многолетней [2]. Дифференцированные живые клетки могут спон-
танно возобновить свою меристематическую активность, что на-
блюдается при формировании перидермы в стеблях. Развитие
придаточных побегов или корней благодаря реактивации клеточ-
ных делений в диференцированной паренхиме часто также пред-
ставляет собой спонтанный процесс.
Рост и дифференциация, совершающиеся в ходе индивидуаль-
ного развития, или онтогенеза, растения, координируются таким
образом, что окончательно сформированное растение приобрета-
ет специфическую форму; иными словами, в развивающемся ра-
стении осуществляются процессы морфогенеза. Термин «морфо-
генез» можно применять по отношению к развитию как внешней
формы, так и внутренней организации. В этом смысле дифферен-
циация и специализация представляют собой элементы морфоге-
неза.
Для выяснения причинных связей и контролирующих механиз-
мов клеточной дифференциации и морфогенеза были проведены
исследования, в которых растения изучали в процессе их разви-
тия, а также в условиях различных экспериментальных воздей-
ствий [3]. Эти исследования включают наблюдения над нормаль-
ным развитием клеток, тканей, зародышей, частей растений или
целых растений; они касаются также аномального роста, реак-
ции растений на различные внешние стимулы или хирургическое
вмешательство [23]; особенно успешные опыты проводятся на
клетках, тканях или органах, отделенных от растений и культи-
вируемых in vitro [7, 18, 20]. Как мелкие, так и более крупные
части растений — от целых органов до одиночных клеток или да-
же свободных протопластов [8] — можно заставить расти и фор-
мировать целые растения. Процесс формирования растения в
культуре сводится по существу к объединению вновь возникаю-
щих корня и побега в целый организм [9].
Развитие семенного растения
29
Способность одиночных клеток, культивируемых in vitro, обра-
зовывать целые растения указывает на тотипотентность их раз-
вития. Согласно наиболее распространенному взгляду, клетки
тотипотентны, так как все они в конечном счете происходят из
одной и той же клетки — зиготы и, следовательно, являются, ве-
роятно, генетически идентичными. Но в таком случае возникает
вопрос — каким образом потомки одинаковых тотипотентных кле-
ток становятся в ходе развития растения столь различными по
структуре и функции. Модель, предложенная для объяснения раз-
нообразия генетически идентичных клеток, постулирует, что не
все гены одного и того же хромосомного набора проявляют свою
активность в клетке одновременно. По словам Хеслопа-Харрисо-
на [Ю], изменения, происходящие в процессе развития растения,
основаны на изменении соотношения репрессированных и дереп-
рессированных генов. Соответствующие внешние воздействия мо-
гут вызывать активацию одних генов и репрессию других. В ре-
зультате клетки становятся способными реагировать на опреде-
ленные стимулы и следовать специфическими путями развития.
На молекулярном уровне активация определенных генов некото-
рыми агентами, например гормонами [1, 19], вызывает синтез
специфических ферментов, определяющих путь, по которому пой-
дет дифференциация клетки. Поскольку образование тех или
иных ферментов обычно предшествует морфологическим измене-
ниям в клетках и тканях, можно сказать, что способность клетки
реагировать на воздействия соответствующим образом проявля-
ется раньше, чем обнаруживаются внешние признаки дифферен-
циации.
В дополнение к объяснению того, какие причины заставляют
отдельную клетку следовать по определенному пути развития,
необходимо принять во внимание тот факт, что специфические
типы клеток дифференцируются в соответствующих местах тела
растения, т. е., другими словами, клеточная дифференциация в
растительном организме подчиняется определенным закономер-
ностям Развитие системы тканей и органов, характерных для ра-
стения, ясно показывает, что отдельные клетки, составляющие
тело растения, не обнаруживают своей тотипотентности, когда
они являются структурными компонентами организма. Клетки
подвергаются позиционным ограничениям и обнаруживают только
некоторые из своих потенциальных возможностей. Тип ограниче-
ния (репрессированные гены) варьирует в зависимости от место-
положения клеток, так что клетки, находящиеся в разных частях
растения, следуют различными путями развития. Соображения
такого рода привели к предположению о том, что соседние клетки
взаимодействуют друг с другом, хотя пока не совсем ясно, каким
образом осуществляется это взаимодействие.
Было постулировано, что клетки передают друг другу некото-
30
Глава 2
рые вещества, необходимые для роста и дифференциации [24].
При этом между ними могут возникать индуцирующие взаимодей-
ствия, которые приводят либо к образованию расположенных
рядом специфических клеток (одинаковых или различных), либо
к появлению взаимной несовместимости между сходными струк-
турами или состояниями. Хорошим примером индуцирующих воз-
действий служит последовательность процессов, наблюдаемых при
регенерации поврежденных проводящих пучков (гл. 8) и при
дифференциации замыкающих побочных клеток в эпидерме ли-
ста (гл. 7). Некоторые исследователи усматривают взаимную
несовместимость в наличии замкнутых участков активных клеточ-
ных делений, например в зачатке листового примордия, который,
по-видимому, препятствует переходу соседних клеток к меристе-
матической активности [4].
При проведении исследования, в котором рост клеток в сус-
пензии сравнивался с ростом клеток такого же типа, но собран-
ных в виде агрегата, было получено экспериментальное доказа-
тельство существования взаимодействия между клетками [24].
Известное число клеток, растущих в суспензии, побуждалось к
реагрегации путем их переноса в ограниченное пространство, соз-
даваемое нейлоновым цилиндром. В клеточных суспензиях экс-
поненциальная скорость роста (измеренная по числу клеток и
весу культуры) не зависела от числа клеток, в то время как в
агрегатах такая зависимость наблюдалась: скорость была тем
выше, чем больше было число клеток. В той же работе на при-
мере склереид было также показано, что взаимодействие клеток
влияет на их дифференциацию [24]. Как указывают авторы, раз-
витие зародыша из оплодотворенной яйцеклетки или из клетки в
суспензионной культуре тоже свидетельствует о том, что взаимо-
действие клеток является лимитирующим фактором организован-
ного развития и что последовательный характер дифференциации
зародыша определяется числом составляющих его клеток.
В связи с обсуждением роста и дифференциации на клеточном
и тканевом уровнях возникают вопросы, касающиеся детермина-
ции формы органов растения и соответственно формы растения в
целом. Говоря словами Хеслопа-Харрисона [10], на уровне орга-
ногенеза контроль выходит за пределы влияния соседних клеток
друг на друга. Взаимодействия, возникающие между различными
тканями и органами, осуществляются, вероятно, благодаря пере-
носу гормонов и питательных веществ. Наличие такого дистан-
ционного взаимодействия можно рассматривать как доказатель-
ство интегрированного развития тела растения, в основе которого
лежит взаимное влияние его отдельных частей. Еще одно явле-
ние, указывающее на существование общего регуляторного меха-
низма морфогенеза растений, представляет собой полярность, ко-
торая проявляется в физиологических и структурных различиях
Развитие семенного растения
31
между двумя концами растения или его отдельных органов. По-
лярность— это одна из форм асимметрии в организации расте-
ния. Хотя есть данные о том, что в создании полярности важную
роль играют внешние условия [4,6], биполярный тип развития
можно обнаружить сразу же после того, как зародыш начинает
развиваться; биполярность и в дальнейшем остается одним из
доминирующих факторов дифференциации [16]. В культуре кле-
ток асимметрия и полярность выявляются, как только клетки,
возникшие в результате клеточных делений, образуют агрегаты
[18]. Полярность обусловливает появление различий в характере
развития клеток одного и того же агрегата.
Влияние полярного роста у растения может проявляться по-
степенно, распространяясь от одного уровня к другому, и выра-
жается либо в изменениях характера структур, либо в их распо-
ложении, либо в том и другом вместе. Проявлением полярности
можно считать также то, что клеткам и тканям свойственна раз-
личная физиологическая активность.
Например, в развивающемся проростке два полюса оси расте-
ния (корневой полюс и полюс побега), по-видимому, доминируют
над остальными частями тела растения, но в переходной зоне
между побегом и корнем наблюдается постепенный переход от
одной структуры к другой, что обеспечивает гармоничное разви-
тие корня и побега (гл. 24). Тенденция к постепенному переходу
между несходными структурами интерпретируется как доказа-
тельство ступенчатого характера распределения факторов при
дифференциации, т. е. наличия градиентов дифференциации [16].
В клетках и тканях могут возникать различные градиенты — гра-
диенты диффундирующих продуктов метаболизма, температуры,
pH и т. д.
Возникает вопрос, является ли полярность фактором, контро-
лирующим дифференциацию, или проявлением дифференциации
[6]. Этот вопрос особенно уместен в связи с данными о том, что
полярность может быть обнаружена и в отдельных клетках. В яй-
цеклетках и зиготе отчетливо выявляется полярное расположение
клеточного содержимого, причем ядро занимает будущий апикаль-
ный конец, а вакуоль располагается в будущем базальном конце
(гл. 21). При митотических делениях клеток, в которых содержи-
мое распределено неравномерно, возникают различающиеся по
своим размерам дочерние клетки. Неравные деления могут про-
исходить, например, в эпидерме корней, в которых будущая во-
лосковая клетка может значительно отличаться от ее сестринской
клетки в морфологическом и биохимическом отношениях (гл. 7).
Неравные деления характерны также и для эпидермы листа, осо-
бенно для развивающихся устьиц (гл. 7). Таким образом, разви-
тие высшего растения ясно свидетельствует о том, что явления
дифференциации можно наблюдать на различных уровнях орга-
32
Глава 2
низации растения. Специализация структуры растения является
результатом сложных взаимодействий между генетическими и
биохимическими факторами; в значительной степени она зависит
также и от внешних условий [14, 16].
СПИСОК ЛИТЕРАТУРЫ
1. Abeles F. В. Ethylene in plant biology, New York, Academic Press, 1973.
2. Barker W. G. Proliferative capacity of the medullary sheath region in the stem
of Tilia americana, Amer. J. Bot, 40, 773—778 (1953).
3. Brookhaven Symposium: Basic mechanisms in plant morphogenesis, Proc.
Symp. Upton, N. Y., 1973; Brookhaven Symposia in Biology No. 25, Upton,
N. Y., Brookhaven National Laboratory, 1974.
4. Banning E. Morphogenesis in plants, Surv. Biol. Prog., 2, 105—140 (1952).
5. Buvat R. Structure, evolution et fonctionnement du meristeme apical de quel-
ques Dicotyledones, Ann. Sci. Nat, Bot. Ser. 11, 13, 202—300 (1952).
6. Cutter E. G. Plant anatomy: experiment and interpretation. Part 1. Cells and
tissues, London, Edward Arnold, 1969.
7. Gautheret R. J. Factors affecting differentiation of plant tissues grown in vitro.
In: Cell differentiation and morphogenesis, Internatl. Lecture Course, Wagenin-
gen, North Holland Publishing Company, 1966.
8. Grambow H. J., Kao K- N., Miller R. A., Gamborg O. L. Cell division and
plant development from protoplasts of carrot cell suspension cultures, Planta,
103, 348—355 (1972).
9. Halperin W. Morphogenesis in cell cultures, Ann. Rev. Plant Physiol., 20,
395—418 (1969).
10. Heslop-Harrison J. Differentiation, Ann. Rev. Plant Physiol., 18, 325—348
(1967).
11. Hillman W. S. The physiology of flowering, New York, Holt, Rinehart and
Winston, 1962.
12. Joshi P. C., Ball E. Growth of isolated palisade cells of Arachis hypogaea in
vitro, Devel. Biol., 17, 308—325 (1968).
13. Meyer C. F. Cell patterns in early embryogeny of the McIntosh apple, Amer.
J. Bot, 45, 341—349 (1958).
14. Mohr H. Lectures on photomorphogenesis, New York, Springer Verlag,
1972.
15. Sachs R. M. Stem elongation, Ann. Rev. Plant Physiol., 16, 73—96 (1965).
16. Sinnott E. W. Plant morphogenesis, New York, McGraw-Hill, 1960.
17. Stebbins G. L. Some relationships between mitotic rhythm, nucleic acid syn-
thesis, and morphogenesis. In: Brookhaven Symposia in Biology No. 18,
1965.
18. Steward F. C. From cultured cells to whole plants: the induction and control
of their growth and morphogenesis, Proc. Roy. Soc., London, B175, 1—30
(1970).
19. Steward F. C., ed. Plant physiology. A treatise, Volume IVB. Physiology of
development: the hormones, New York, Academic Press, 1972.
20. Street H. E.f ed. Plant tissue and cell culture, Berkeley, University of Califor-
nia Press, 1973.
21. Sweeney В. M. Rhythmic phenomena in plants, New York, Academic Press,
1969.
22. Torrey J. G. Development in flowering plants, New York, Macmillan, 1967.
23. Wardlaw C. W. Morphogenesis in plants, 2nd ed., London, Methuen, 1968.
24. Wilbur F. H., Riopel J. L. The role of cell interaction in the growth and dif-
ferentiation of Pelargonium hortorum cells in vitro.
I. Cell interaction and growth, Bot. Gaz., 132, 183—193 (1971).
II. Cell interaction and differentiation, Bot. Gaz., 132, 193—202 (1971).
Глава 3
Клетка
Живые организмы состоят из одиночных клеток или совокуп-
ности многих клеток. В многоклеточном организме клетки не про-
сто собраны вместе, а связаны друг с другом и функционируют
согласованно как одно гармоничное целое. Клетки сильно варь-
ируют по размерам, форме, структуре и функции. Одни из них
измеряются микрометрами, другие — миллиметрами или даже
сантиметрами (волокна некоторых растений). Одни клетки отно-
сительно просты по своей внутренней организации, другие обла-
дают сложной структурой. Одни клетки выполняют разнообраз-
ные функции, другие специализированы в своей деятельности, но,
несмотря на необычайное разнообразие клеток, уже первые ми-
кроскописты поняли, что эти структурные единицы являются го-
мологичными. Как отмечает Зитте [55], это было большим науч-
ным достижением.
Все клетки растений и животных представляют собой разно-
видности одного основного типа структурной единицы. Это об-
щепринятое положение основано на клеточной теории, сформу-
лированной в первой половине XIX в. Матиасом Шлейденом и
Теодором Шванном. Однако многие другие исследователи также
внесли свой вклад в распространение взгляда на клетки как на
структурные единицы живых организмов, после того как в 1665 г.
Роберт Гук впервые ввел термин клетка при описании полостей
в срезах пробковой ткани. Вначале Роберт Гук видел только раз-
граниченные клеточными оболочками полости, но позднее он об-
наружил в них «сок». В конце концов содержимое клеток стали
рассматривать как живое вещество, которое получило название
протоплазмы. Производным от этого слова — протопластом — стали
называть содержимое отдельной клетки. Важным шагом к уста-
новлению сложности строения протопласта было открытие в
1831 г. Робертом Брауном ядра. Вскоре за этим открытием по-
следовали сообщения о делении клеток. В 1846 г. Гуго фон Моль
обратил внимание на различие между протоплазматическим ма-
териалом и клеточным соком, а в 1862 г. Кёлликер применил тер-
мин цитоплазма, для вещества, окружающего ядро. Наиболее за-
метные включения в цитоплазме — пластиды — долгое время
считались просто уплотнениями протоплазмы. Концепция об обо-
собленности и преемственности этих органелл утвердилась толь-
ко в конце XIX в. [29].
3 К Эзау, кн 1
34
Глава 3
Представление о клетках как о структурных единицах выдер-
жало испытание временем. Оно полностью подтверждается со-
временными исследованиями, проведенными на культуре тканей.
Их результаты показывают, что отдельные клетки, выделенные
из сложного организма, ведут себя как независимые существа.
Изолированные клетки растут, делятся и могут производить точ-
ные копии родительских организмов. Более того, ультрамикроско-
пические и биохимические исследования ясно свидетельствуют о
принципиальном сходстве клеток, будь то клетки одноклеточных
или многоклеточных организмов, клетки растений или животных.
Как органическая единица клетка располагает средствами
для изоляции своего содержимого от окружающей среды. Эта
изоляция осуществляется мембраной, называемой плазматической
мембраной, или плазмалеммой. Растительные клетки (как и неко-
торые животные клетки) имеют, кроме того, жесткое покрытие —
клеточную оболочку, откладываемую снаружи от плазмалеммы.
Клетка может освобождать и переносить энергию, необходимую
для роста и поддержания метаболических процессов. Клетка ор-
ганизована так, что может сохранять и переносить информацию,
в результате чего ее развитие и развитие ее потомства происхо-
дят упорядоченным образом. Таким путем поддерживается цело-
стность организма, частью которого являются клетки.
По степени сложности их внутренней организации клетки
можно разделить на два основных типа. Клетки первого типа —
прокариотические — просты по морфологии и не содержат осо-
бых внутриклеточных частиц, предназначенных для выполнения
специфических функций. Вещество наследственности — дезокси-
рибонуклеиновая кислота (ДНК) — занимает значительную
часть прокариотической клетки и не заключено в мембранную
оболочку. К организмам, для которых характерны прокариотичес-
кие клетки, относятся бактерии и сине-зеленые водоросли.
Клетки второго типа — эукариотические, свойственные всем
организмам, за исключением бактерий и сине-зеленых водорослей,
состоят из нескольких обособленных отсеков (фото 2), выполня-
ющих разные функции. ДНК, ответственная за хранение и пере-
дачу информации, локализована в хромосомах, которые заклю-
чены в ограниченную мембраной органеллу — ядро. В ядре со-
держится ядрышко (часто более одного)—тельце, участвующее
в переносе информации. Фотосинтез происходит в хлоропластах —
особых пластидах, содержащих хлорофилл. Аэробное дыхание
осуществляется другой органеллой — митохондрией. Диктиосома
связана с секрецией веществ, из которых состоит клеточная обо-
лочка, и других продуктов. Синтез белка является функцией ри-
босом и мембранной системы, называемой эндоплазматическим
ретикулумом (ЭР). Особые органеллы — микротельца—содержат
ферменты, необходимые для различных процессов метаболизма.
Клетка
35
В клетках присутствуют и другие структуры, роль которых окон-
чательно не выяснена. Клоус и Джунипер [11] приводят следую-
щие цифры, выражающие возможное число органелл на клетку:
1 ядро, 20 пластид, 700 митохондрий, 400 диктиосом, 500 тыс. ри-
босом, 500 млн. и более молекул ферментов, представленных
10 тыс. различных типов. Все обособленные части протопласта
погружены в жидкий матрикс — основную цитоплазму, в которой
электронный микроскоп пока не обнаружил определенной струк-
туры.
В противоположность большинству животных клеток клетки
растений имеют внутреннюю водную фазу — вакуоль, которая
ограничена мембраной, называемой тонопластом, В результате
клеточной активности не только освобождается энергия для роста
и дифференциации клеток, но и образуются запасные вещества
и отбросы, носящие общее название оргастические вещества.
К ним относятся крахмал, жировые вещества, белковые включе-
ния, таннины и кристаллы различного состава.
С помощью мембран обеспечивается компартментация (под-
разделение на отсеки) эукариотической клетки. Под электрон-
ным микроскопом мембраны различных живых организмов имеют
удивительно сходный вид. При соответствующей фиксации клеток
мембрана выглядит как структура, состоящая из двух темных сло-
ев толщиной около 25 А (ангстремов) каждый и расположенного
между ними слабоокрашенного слоя толщиной 35А (фото 10,Л).
Мембрану такого типа Робертсон [49] назвал элементарной
мембраной. Ее общая структура была предсказана ранее Дани-
елли и Дэвсоном [12]. Элементарная мембрана интерпретирует-
Рис. 3.1. Модель трехслойной (белок — липид — белок) биологической мембраны
(схема). В бимолекулярном липидном слое молекулы липидов направлены своими
гидрофильными, или полярными, концами (обозначены кружками) к слоям бел-
ков. В зонах гидрофильных пор полярные концы липидных молекул обращены
друг к другу. Белковые слои состоят из отдельных субъединиц. Некоторые из них
(туннельные белки) пересекают всю мембрану. (Воспроизводится из работы Sit-
te, Biomembranen: Structur und Funktion, Ber. Dtsch. Bot. Ges., 82, 329—383,
1969, с некоторыми изменениями.) 1 — туннельный белок; 2— белковый слой;
3 — двойной липидный слой; 4 — гидрофильная пора.
3*
36
Глава 3
ся как бимолекулярный липидный слой, покрытый с каждой сто-
роны слоем белка Сейчас эта модель уже недостаточна для объ-
яснения связи между структурой и функцией всех известных кле-
точных мембран. Одна из ее многочисленных модификаций пока-
зана на рис. 3.1. Тем не менее понятие о бимолекулярном слое
липидов служит пока наилучшим объяснением универсальных
свойств биологических мембран [7], и термин «элементарная
мембрана» продолжает использоваться для обозначения зритель-
но различимого структурного компонента мембранных образова-
ний в клетке. При подготовке материала для электронной микро-
скопии по методу замораживания — травления элементарные
мембраны расщепяются по липидному слою и на их внутренней
поверхности, обнажаемой при разломе мембраны, обнаруживают-
ся частицы (рис. 32 и фото 3). Число, размер и распределение
этих частиц у разных мембран различны и изменяются в зави-
симости от функционального состояния клеток [40, 61].
Мембраны отделяют протопласт от окружающей среды и ог-
раничивают в клетке различные органеллы. Они служат не просто
физическими границами, а представляют собой жидкие динамич-
ные функциональные поверхности [54]. Мембраны являются теми
местами, где происходят многие биохимические процессы, такие,
как активное поглощение органических и неорганических веществ,
окислительное и фотосинтетическое фосфорилирование, преобра-
зование световых квантов при фотосинтезе и др. Мембраны позво-
ляют осуществлять пространственное разделение биохимических
реакций и таким образом обеспечивают их последовательное про-
текание в одной и той же клетке [56].
Компартментация клеточного содержимого означает разделе-
ние труда на субклеточном уровне. В многоклеточном организме
Рис 3 2 Схема элементарной мембраны тилакоида хлоропласта после заморажи-
вания и частичного разлома Разлом прошел по липидному слою и обнажил
внутренние поверхности мембраны, несущие частицы (Воспроизводится из ра-
боты Muhlethaler, Studies on freeze-etching of cell membranes, Internat Rev
Cytol, 31, 1—19, 1971, с некоторыми изменениями) 1 — элементарная мембрана,
2— строма (наружная поверхность), 3 — полость тилакоида (внутренняя поверх-
ность), 4 — наружная поверхность разлома, 5 — внутренняя поверхность раз-
лома
Клетка
37
разделение труда происходит также и на клеточном уровне, по-
скольку клетки дифференцируются и становятся более или менее
специализированными в отношении определенных функций. Функ-
циональная специализация находит свое выражение в морфоло-
гических различиях между клетками, обусловленных сложностью
структуры многоклеточного организма.
Цитоплазма
Как уже упоминалось, термин «цитоплазма» был введен для
обозначения протоплазматического матрикса, окружающего яд-
ро. Со временем в этом матриксе были обнаружены обособлен-
ные структуры: сначала те, которые находились в пределах раз-
решающей способности светового микроскопа, а позднее и более
мелкие, выявленные с помощью электронного микроскопа. Мож-
но предполагать, что в дальнейшем будут открыты новые ультра-
микроскопические структуры. Таким образом, представление о
цитоплазме постепенно изменяется, но все еще остается не пол-
ным. Очень часто к ней относят и некоторые обособленные части-
цы (рибосомы, микротрубочки), а также мембраны (ЭР, плазма-
лемму, тонопласт), которые не являются частью четко отграничен-
ных органелл. В то же время допускается существование бес-
структурного основного вещества, свободного от этих частиц и
мембран. Для того чтобы отличить это вещество от цитоплазмы
в широком смысле, иногда используются термины «основная
плазма» или «гиалоплазма» [11]. «Основная цитоплазма» и «ци-
топлазматический матрикс» — одинаково приемлемые термины
для обозначения внешне бесструктурной части цитоплазмы.
Основная цитоплазма содержит белки, липиды, нуклеиновые
кислоты и другие вещества, растворимые в воде, т. е. не связан-
ные с обособленными структурами. Цитоплазма имеет вязкую кон-
систенцию и способна к образованию геля. В живых клетках
часто наблюдается движение, или ток, цитоплазмы, выявляемое
по перемещению органелл и других частиц. Точно не установле-
но, зависит ли ток цитоплазмы от какого-то особого компонента
протопласта, но многие исследователи связывают движение ци-
топлазмы с наличием в клетках пучков микрофиламентов [42].
Цитоплазма отграничена от клеточной оболочки элементарной
мембраной —плазмалеммой, а от вакуоли — другой элементарной
мембраной — тонопластом (фото 5). Самую наружную зону ци-
топлазмы иногда называют кортексом — термином, заимствован-
ным из цитологии животных. В последующих параграфах описы-
ваются различные компоненты, погруженные в матрикс цитоплаз-
мы.
38
Глава 3
Ядро
В большинстве клеток высших растений содержится одно ядро
(фото 2). Некоторые специализированные клетки могут быть
многоядерными (ценоцитными) либо только во время их разви-
тия, либо в течение всей жизни. В некоторых одноядерных клет-
ках происходит многократная репликация ДНК, в результате
чего ядро становится полиплоидным (эндополиплоидия). Это яв-
ление часто сопровождает соматическую дифференциацию.
Как хранилище наследственной информации ядро играет ос-
новную роль в клеточном делении. Оно претерпевает циклические
изменения в зависимости от стадии деления. Между делениями,
т. е. в интерфазе, ядро представляет собой обособленную органел-
лу, окруженную оболочкой и содержащую одно или несколько яд-
рышек (фото 2). Хромосомы находятся в раскрученном состоя-
нии, и их с трудом можно отличить от матрикса ядра, или нуклео-
плазмы, Однако у многих видов часть хроматина сохраняется в
конденсированной форме и выявляется в интерфазе в виде плот-
ных глыбок. Такой хроматин называют гетерохроматином в отли-
чие от эухроматина, который составляет основу хромосом. Ядра
могут содержать белковые включения в кристаллической, фиб-
риллярной или аморфной форме [63]. Какую функцию выполня-
ют эти включения, пока неизвестно.
Ядерная оболочка состоит из пары элементарных мембран,
между которыми находится перинуклеарное пространство (фото
4,А). Очевидно, пока не получено никаких определенных сведе-
ний о содержимом этого пространства. По структуре оболочка на-
поминает цистерну эндоплазматического ретикулума. Оба типа
этих мембранных комплексов могут быть связаны между собой
таким образом, что перинуклеарное пространство и полость цис-
терны ЭР непосредственно сообщаются друг с другом Ядерная
оболочка имеет поры (фото 4), расположенные у некоторых ра-
стений в довольно правильном порядке. Мембраны оболочки смы-
каются вокруг каждой поры и образуют при этом края поры.
Ядерная пора не является простым отверстием, а представляет
собой сложную структуру, в которой можно различить несколько
частей: кольцо (аннулус), окружающее пору, центральную гра-
нулу и систему фибрилл между гранулой и кольцом [16] (фото
4,5). Несмотря на эти явные структурные преграды, поры, как
показывают опыты, открыты для молекул определенного размера
[14].
У многих диплоидных видов ядро содержит два ядрышка —
по одному ядрышку на каждый гаплоидный набор хромосом. Из-
вестны диплоидные виды, у которых в образовании ядрышек уча-
ствует более одной пары хромосом [65]. Во время интерфазы
ядрышки часто сливаются в одно тельце. Ядрышко имеет плот-
Клетка
39
ную структуру, в которой можно различить элементы двух ти-
пов— гранулярные и фибриллярные. Некоторые из гранул со-
держат рибонуклеиновую кислоту (РНК) и сравнимы по (величи-
не с цитоплазматическими рибосомами. Более мелкие гранулы
могут представлять собой белок. Фибриллярный компонент, как
известно, содержит ДНК [11]- В ядрышках видны слабоокрашен-
ные зоны, обычно называемые вакуолями (фото 2). Было найде-
но, что в живых культивируемых клетках эти вакуоли претерпе-
вают многократные сокращения, что может быть вызвано проис-
ходящим в ядрышке синтезом рибосомной РНК [24]. Ядрышко
не имеет ограничивающей мембраны и часто связано с опреде-
ленной частью хроматина, которая, вероятно, является ядрышко-
вым организатором, т. е. участком хромосомы, ответственным за
формирование ядрышка после завершения ядерного деления [27].
Существуют два типа деления ядер: митоз, во время которого
хромосомы удваиваются и дочерние клетки получают то же самое
число хромосом, что и исходная клетка, и мейоз, во время кото-
рого дочерние клетки получают половину первоначального числа
хромосом. Митоз дает начало соматическим клеткам (гл. 4), а
мейоз — репродуктивным (гл. 21). При обоих типах деления ядер-
ная оболочка почти всегда, за исключением лишь нескольких
случаев, распадается на фрагменты, которые становятся неотли-
чимыми от цистерн ЭР. При формировании новых ядер на стадии
телофазы цистерны ЭР объединяются и образуют две новые обо-
лочки. Ядрышки во время деления рассеиваются (за немногими
исключениями) и вновь образуются во время телофазы.
Всю серию процессов, происходящих между делением одной
клетки и делением клетки следующей генерации, называют кле-
точным, или митотическим, циклом [11]. Интерфаза этого цикла
не является стадией покоя; напротив, к ней приурочен синтез
ДНК, т. е. подготовка к репликации хромосом. Период синтеза
ДНК называют S-периодом (от анг. слова synthesis). S-период
протекает между Gi- и Ог-периодами — промежуточными стадия-
ми, во время которых в клетке происходит биохимическая подго-
товка к синтезу ДНК (Gi) и митозу (G2).
Помимо репликации генетического материала ядро выполняет
еще одну важнейшую функцию—контроль за синтезом белка в
клетке. При транскрипции ДНК синтезируется РНК особого ти-
па— матричная, или информационная, РНК (мРНК). Закодиро-
ванная в мРНК информация переносится к рибосомной РНК, на-
ходящейся в цитоплазме, где происходит синтез белков, в основ-
ном ферментов. Ферменты определяют характер метаболизма и
тем самым ход развития клетки. Поскольку каждая клетка на-
следует от оплодотворенной яйцеклетки одну и ту же ДНК, ее
рибосомы могут получить от ядра потенциально одинаковую ин-
формацию. Тем не менее в одном и том же организме клетки
40
Глава 3
развиваются по расходящимся путям и приобретают различные
формы и функции. Согласно широко распространенной точке зре-
ния, такая дифференциация оказывается возможной потому, что
разные клетки используют различную генетическую информацию
в зависимости от того, какие гены (т. е. линейные отрезки хро-
мосомной ДНК) участвуют в создании этой информации.
Пластиды
Пластиды — характерные органеллы эукариотических расти-
тельных клеток. Форма и размеры их очень разнообразны. Клас-
сифицируются пластиды главным образом по наличию или отсут-
ствию в них тех или иных пигментов. Они часто совмещают в
себе признаки нескольких типов (пластид, причем один тип может
превращаться в другой. К основным типам пластид относятся
хлоропласты, хромопласты и лейкопласты. Хлоропласты (фото 5)
содержат хлорофилл и участвуют в фотосинтезе. Они встречаются
в зеленых частях растения и особенно многочисленны и хорошо
развиты в листьях. Хромопласты обычно содержат желтые и
оранжевые каротиноидные пигменты. Они находятся в лепестках
и других окрашенных частях цветка, в плодах и некоторых кор-
нях. Лейкопласты — непигментированные пластиды — представ-
ляют собой нечетко отграниченную категорию пластид. Иногда
их отождествляют с пропластидами — молодыми, относительно
недифференцированными пластидами, которые встречаются в ме-
ристематических клетках. Лейкопластами называют также непиг-
ментированные пластиды тканей, скрытых от солнечного света и
запасающих или какой-либо один вид растительных продуктов,
например крахмал (амилопласты), белки (протеинопласты), жи-
ры (элайопласты), или все эти продукты, но в разных сочетани-
ях [38]. Крахмал, фитоферритин (железосодержащее соединение)
и липиды в форме глобул (пластоглобул) [30] могут находиться
в различных пластидах, в том числе в хлоропластах.
Происхождение пластид можно рассматривать с двух точек
зрения—онтогенетической и филогенетической. Широко распро-
странено мнение о том, что пластиды передаются по крайней
мере через яйцеклетку от одного поколения клеток к другому
[55]. Унаследованные таким образом пластиды делятся и диф-
ференцируются в зависимости от типа клетки, в которую они по-
падают. Благодаря онтогенетической связи между пластидами
молодых и более старых клеток термин «пропластида» имеет
лишь теоретическое значение. Стадия пропластиды может быть
крайне короткой. Например, развитие хлоропластов из пропластид
в молодом побеге происходит так близко к апикальной меристе-
Клетка
41
ме, что пластиды продолжают делиться и после того, как по
структуре и функции они становятся хлоропластами [43].
Пластиды содержат ДНК и рибосомы и поэтому могут быть
генетически автономными. Данные о такой автономности привели
к представлению о том, что филогенетически пластиды возникли
как свободно живущие прокариоты, которые в дальнейшем попа-
ли в примитивные эукариотические клетки и закрепились в
клетке-хозяине как постоянные симбиотические элементы [46].
Однако эта точка зрения не является общепринятой [5].
Пластида окружена оболочкой, состоящей из двух элементар-
ных мембран (фото 5) [44]. Внутреннее содержимое пластиды
дифференцировано на два основных компонента — мембранную
систему и матрикс, или строму, в которую погружена эта систе-
ма. Мембранная система состоит из уплощенных мешков, назы-
ваемых тилакоидами [35]. Степень развития тилакоидной систе-
мы варьирует в зависимости от типа пластиды. Наименее диф-
ференцированные пропластиды содержат лишь небольшое число
тилакоидов или лишены их совсем. В ходе дифференциации про-
пластид число тилакоидов увеличивается. Из внутренней мембра-
ны оболочки формируются уплощенные пузырьки, которые выстра-
иваются в ряды и образуют в конце концов характерную систему.
В хлоропластах высших растений тилакоидная система состо-
ит из гран, представляющих собой пачки дисковидных тилакои-
дов, и тилакоидов стромы, или фретов,— уплощенных канальцев,
пересекающих строму между гранами и связывающих их между
собой (рис. 3.3 и фото 6). Смежные тилакоиды в гранах настоль-
ко тесно прижаты друг к другу, что их мембраны образуют двой-
ные слои в виде перегородок, разделяющих соседние отсеки, или
полости, тилакоидов ([62], рис. 3.3 и фото 6,А). Длительные ис-
следования организации тилакоидной системы привели к заклю-
чению о том, что тилакоиды не являются изолированными еди-
ницами, а связаны друг с другом таким образом, что их полости
оказываются непрерывными [41]. Мембраны хлоропластов состо-
ят примерно из одинакового количества липида и белка. В тила-
коидных мембранах находится хлорофилл. Внутренние поверхно-
сти мембран хлоропластов, обнажаемые при разломе после замо-
раживания препаратов, несут больше частиц на единицу площа-
ди, чем любая другая до сих пор исследованная мембранная си-
стема (фотоЗ) [7]. Некоторые из этих гранул рассматривались как
квантосомы — мембранные субъединицы, которые представляют
собой морфологические частицы, участвующие в световых реак-
циях фотосинтеза. Согласно более поздним исследованиям, квак-
тосомная гранула не обязательно является функциональной еди-
ницей [41]. Хлоропласты содержат мелкие рибосомы; в них ча-
сто обнаруживаются лишенные стромы зоны, в которых находит-
ся тонкая сеть нитей ДНК. В строме содержатся ферменты,
42
Глава 3
1
Рис 3 3 Схема, изображающая
часть тилакоидной системы, состоя-
щей из трех гран и связывающих
их вместе тилакоидов стромы (фре-
тов). (Воспроизводится из работы
[62] с некоторыми изменениями)
1 — тилакоид стромы (фрет), 2—
грана; 3—полость тилакоида; 4—
перегородка между тилакоидами;
5 — тилакоид граны (отсек).
ответственные за фиксацию двуокиси углерода и превращение ее
в сахар. При определенных физиологических условиях хлороплас-
ты образуют и накапливают крахмал (фото 9, Л).
Когда лист растет в темноте, возникающие из внутренней
мембраны пузырьки превращаются в трубки, которые сливаются
друг с другом и образуют паракристаллическую решетку — про-
ламеллярное тельце (фото 7) [20]. Если выросший в темноте
лист поместить на свет, то проламеллярное тельце дает начало
тилакоидной системе. У выросших в темноте растений хлоро-
пласты с проламеллярными тельцами для удобства называются
этиопластами [28].
Хромопласты часто образуются из хлоропластов, но могут
происходить и из менее дифференцированных пластид. Сущность
дифференциации хромопластов заключается в синтезе и накоп-
лении в них каротиноидных пигментов, таких, как каротин (мор-
ковь Daucus-, рис. 3.5, Г) или ликопин (томат Lycopersicon; рис.
3.5, В). Образование пигментов связано с видоизменением или
даже полным разрушением тилакоидов, в результате чего возни-
кает большое число липидных глобул. У одних хромопластов пиг-
мент запасается в глобулах (лепестки Ranunculus repens и желтые
плоды Capsicum [И], околоцветник Tulipa [31], плод Citrus
[57]), у других накапливается в многочисленных белковых фиб-
риллах (красные плоды Capsicum [11], гипантий розы [55]).
У хромопластов третьего типа пигмент откладывается в виде
кристаллоидов. У красного томата кристаллический ликопин свя-
зан с тилакоидными мембранами. Некоторые кристаллы ликопи-
на становятся очень длинными и по мере их образования тилако-
иды также удлиняются [21] .В корне моркови кристаллоиды ка-
ротина образуются во время распада внутренней структуры пла-
стиды и остаются связанными с липопротеидной оболочкой [18].
Клетка
43
Развитие хромопластов не является необратимым процессом. Бы-
ло обнаружено, что хромопласты плодов цитрусовых и корней
моркови способны к обратной дифференциации в хлоропласты; при
этом они теряют каротиновый пигмент и образуют тилакоидную
систему и хлорофилл [19, 58] (гл. 22).
Митохондрии
При максимальных увеличениях светового микроскопа мито-
хондрии выглядят как шарики и стерженьки. Под электронным
микроскопом они выявляются в виде сферических, удлиненных,
чашевидных, иногда лопастных телец с состоящей из двойной
мембраны оболочкой и внутренними мембранными структурами,
называемыми кристами (фото 8) [44]. Кристы происходят из
внутренней мембраны оболочки (фото 7) и имеют форму складок
или трубочек. В мембраны крист встроены ферменты, в том чис-
ле ферменты цикла Кребса. Митохондрии участвуют в дыхании,
приводящем к освобождению энергии, и процессах ее запасания
в форме, доступной для энергозависимых функций. Считается,
что наиболее вероятным способом воспроизводства митохондрий
является деление, которому предшествует рост этих органелл [4].
Митохондрии содержат ДНК и рибосомы, однако их генетические
возможности ограничены. Тем не менее некоторые исследователи
[46] строго придерживаются взгляда, что митохондрии, подобно
пластидам, автономны по своему филогенетическому происхож-
дению и оказались связанными с эукариотической клеткой в ка-
честве «внедрившихся симбионтов». Другие исследователи [5]
считают, что эукариотическая клетка развивалась по пути, не
зависимому от симбиоза.
Микротельца
Микротельца встречаются во многих тканях у большого числа
видов растений. Они обычны для хлоренхимы двудольных и од-
нодольных, где они часто связаны с хлоропластами. Микротельца
имеют одну ограничивающую мембрану и гранулярный или фиб-
риллярный матрикс (фото 9, Д), в котором может находиться
один кристалл (фото 9,5). Микротельца содержат ферменты, на-
бор которых меняется в зависимости от типа клетки и степени ее
дифференциации [17, 47, 60]. Микротельца называют пероксисо-
мами, если они участвуют в метаболизме гликолата, и глиоксисо-
мами, если они содержат ферменты глиоксилатного цикла, при-
водящего к разрушению липидов. Микротельца называют также
цитосомами [55].
44
Глава 3
Вакуоли
Вакуоль (фото 2) является важным компонентом протоплас-
та растений. Она содержит воду и разнообразные органические
и минеральные вещества, многие из которых находятся в раство-
ренном состоянии. Эти вещества могут быть запасными соедине-
ниями, такими, как сахара, органические кислоты, белки, фосфа-
тиды, или экскреторными продуктами, как, например, оксалат
кальция, таннинсодержащие соединения, антоциановые пигменты.
Часть веществ, присутствующих в вакуолях, кристаллизуется, а
иногда все их содержимое сгущается и превращается в твердое
вещество (включения таннина, белковые тельца в сухих плодах
и семенах). Тонопласт, окружающий вакуоль, обладает избиратель-
ной проницаемостью и поэтому участвует в регуляции осмоти-
ческих процессов, связанных с вакуолью, особенно в поддержании
тургора в клетке. Электронно-микроскопические исследования,
проведенные в сочетании с определениями локализации фермен-
тов, показали, что вакуоли не просто пассивно накапливают про-
дукты метаболизма, но и участвуют в биохимическом кругообо-
роте веществ в клетке [10, 15, 34]. Они осуществляют разруше-
ние компонентов клетки или запасных веществ. Образующиеся
при этом продукты используются в синтетических реакциях или
трансформируются в соответствии с дифференциацией той или
иной специализированной (например, секреторной) клетки. Та-
ким образом, вакуоль может вести себя как органелла, выполня-
ющая важную функцию в таких процессах метаболизма, как ста-
рение, дифференциация и мобилизация запасных веществ.
Хорошим примером вакуолей, обнаруживающих гидролитиче-
скую активность, служат вакуоли запасающих клеток [9, 34].
В семядолях семян бобовых запасной белок образуется в вакуо-
лях в виде зерен, каждое из которых окружено тонопластом.
При прорастании семян в вакуолях выявляются кислые гидрола-
зы. Под их воздействием белок расщепляется, а вакуоли слива-
ются друг с другом в одну крупную центральную вакуоль.
Переваривание клеточных компонентов может происходить и
в хорошо развитых центральных вакуолях паренхимных клеток
[15]. При этом в разных местах вакуоли тонопласт образует
впячивания, которые затем отделяются. В результате возникают
взвешенные в вакуоли пузырьки, которые могут содержать раз-
личные клеточные компоненты — митохондрии, пластиды, рибо-
сомы и др. После лизиса содержимого ограничивающая мембра-
на пузырька исчезает.
Онтогенетическое происхождение вакуолей — предмет длитель-
ной дискуссии. В плотной цитоплазме меристематических клеток
(за исключением клеток камбия, которые сильно вакуолизирова-
ны) имеются многочисленные мелкие вакуоли (фото 2). Когда
Клетка
45
клетка разрастается и дифференцируется, вакуоли также увели-
чиваются в размерах и сливаются в одну крупную вакуоль, зани-
мающую центр клетки. Согласно одним исследователям, перво-
начальные мелкие вакуоли возникают в результате притяжения
воды к определенным участкам клетки; по мнению других иссле-
дователей, вакуоли имеют предшественников в форме мелких ор-
ганелл, которые набухают вследствие поглощения воды и превра-
щаются в вакуоли. Некоторые специалисты по электронной микро-
скопии полагают, что вакуоли возникают при расширении цистерн
ЭР или пузырьков, происходящих из ЭР. С образованием вакуо-
лей связывали также пиноцитозные пузырьки, формирующиеся
путем инвагинации плазмалеммы [10]. Вполне вероятно, что ва-
куоли возникают несколькими способами.
По своему гидролитическому действию вакуоли напоминают
лизосомы. Органеллы под таким названием впервые были обна-
ружены в животных клетках, где они были описаны как поли-
морфные тельца, ограниченные одной мембраной и содержащие
гидролитические ферменты [11] .В цитологии растений термин
«лизосома» не используется для обозначения какого-либо особого
морфологического компонента. Растительные клетки содержат
большое число гидролаз, способных переваривать компоненты
цитоплазмы и метаболиты, однако эти ферменты находятся в раз-
личных ограниченных мембраной структурах, среди которых важ-
нейшее место принадлежит вакуолям. Гидролазы встречаются да-
же в клеточной оболочке, т. е. во внеклеточном пространстве.
Для обозначения всех структур растительных клеток, в которых
происходит гидролиз, были предложены термины «лизосомный
клеточный комлартмент» [34] и «лизосомная система» [64].
В связи с этим Матиль [34] предложил применять термин «лизо-
сома» только в биохимическом смысле.
Парамуральные тельца
В материале, подготовленном для электронной микроскопии,
нередко обнаруживаются впячивания плазмалеммы, имеющие
различную форму. Иногда между клеточной оболочкой и цито-
плазмой образуются кармашки. Частое присутствие в них трубо-
чек и пузырьков привело к предположению, что кармашки явля-
ются функциональными органеллами, участвующими в росте кле-
точной оболочки, а также, возможно, и в других взаимодействиях
между цитоплазмой и клеточной оболочкой. При инвагинации
плазмалемма может впячиваться в вакуоль, вдавливая в нее то-
нопласт. Такие впячивания часто отделяются от плазмалеммы и
внедряются в цитоплазму в виде так называемых мулътивезику-
лярных телец или остаются во взвешенном состоянии в вакуоли.
46
Глава 3
Подобные образования впервые были обнаружены у грибов
и получили название ломасом [11]. Позднее для всех мембран-
ных структур, связанных с плазмалеммой, был предложен тер-
мин «парамуральные тельца» [32]. Если в их образовании участ-
вует только плазмалемма, то их называют плазмалеммасомами,
если же они формируются при участии и других мембран, то они
носят название ломасомы [32]. Неизвестно, все ли эти структуры
являются компонентами, присущими интактной клетке. Возмож-
но, что по крайней мере часть из них образуется в результате
обработки препаратов в процессе их приготовления для электрон-
ной микроскопии.
Рибосомы
Рибосомы — частицы диаметром около 170—230 А (фото 4, Б
и 10, Б)—являются местом синтеза белков из аминокислот [6].
Рибосомы состоят из субчастиц с различными коэффициентами
седиментации, удерживающихся вместе благодаря присутствию
в них ионов магния. Рибосомы содержат почти одинаковое коли-
чество белка и РНК. При синтезе белка рибосомы объединяются
в полирибосомы (или полисомы\ фото 10, Б, В) с помощью
мРНК, переносящей генетическую информацию от ядра к белку.
Аминокислоты, из которых синтезируются белки, переносятся к
полирибосомам растворимой, или транспортной, РНК, находя-
щейся в цитоплазме. Источником энергии для синтеза служит
гуанозинтрифосфат.
Полирибосомы обычно связаны с ЭР (фото 11, А), не прикреп-
ленные к ЭР рибосомы распределены по цитоплазме поодиночке
или группами. Ядерная оболочка также может нести полирибосо-
мы. Рибосомы встречаются в ядрах, пластидах (фото 6 и 7) и
митохондриях (фото 9,5). Рибосомы органелл, по-видимому, от-
личаются от рибосом цитоплазмы.
Диктиосомы
Диктиосомы — органеллы, состоящие из пачек плоских округ-
лых цистерн, каждая из которых ограничена элементарной мемб-
раной (рис. 3.4 и фото 10, А). Край цистерны часто более или ме-
нее сильно продырявлен. При большом числе отверстий эта часть
цистерны выглядит в виде состоящей из трубочек сети (фото
10,5), что находит свое отражение в названии органеллы (дик-
тио значит сеть). Время от времени от этой сети или от края не-
продырявленной цистерны отщепляются пузырьки. Совокупность
всех диктиоссш и происходящих из них пузырьков в данной клет-
Клетка
47
Рис. 3 4 Схема диктиосомы,
состоящей из 5 цистерн, с не-
сколькими секреторными пу-
зырьками. (Esau, Cheadle,
Univ. Calif. Pubs. Bot., 36,
253—344, 1965.) 1 — дисталь-
ная, или секреторная, сторона;
2 — пузырек; 3 — самая старая
цистерна; 4 — проксимальная,
или образующая, сторона; 5 —
самая молодая цистерна.
ке составляет аппарат Гольджи [36], и соответственно диктиосо-
мы часто называют тельцами Гольджи.
В состав диктиосом растений входят от 2 до 7 (иногда и бо-
лее) цистерн. Отдельные цистерны стопки физически не связаны
друг с другом, и между ними сохраняется определенное минималь-
ное расстояние даже после их выделения из клеток. В функцио-
нальном отношении диктиосомы действуют согласованно, что по-
зволяет предположить существование информационной непрерыв-
ности между ними .В промежутках между цистернами обнаруже-
ны параллельно расположенные фибриллярные или трубчатые
элементы. Функция их неизвестна.
Диктиосомы участвуют в секреции. Секретируемое вещество
накапливается в пузырьках, которые переносят его в предназна-
ченное для него место. В активно секретирующих диктиосомах
происходит энергичное образование пузырьков, вследствие чего
вся цистерна в конце концов распадается на пузырьки. Исчезаю-
щая цистерна замещается новой. Во всех этих процессах диктио-
сомы обнаруживают полярность: на одной стороне стопки (ди-
стальной, или секреторной, стороне) происходит формирование
пузырьков, приводящее к разрушению цистерн, а на другой (прок-
симальной, или образующей, стороне)—добавление новых цистерн
(рис. 3.4). В соответствии с этим степень продырявленности цис-
терн возрастает от проксимальной к дистальной стороне. Новые
цистерны, по-видимому, образуются из мембранного материала,
происходящего из ЭР (фото 10, Д) [37]. В той или иной клетке
может увеличиваться также и численность самих диктиосом, но
каким образом происходит это увеличение, точно неизвестно. Од-
ним из возможных способов является фрагментация существующих
диктиосом.
Секретируемое вещество синтезируется не только в диктиосо-
мах, но, возможно, и в других структурах, например в эндоплаз-
матическом ретикулуме, в диктиосоме же происходят лишь кон-
48
Глава 3
денсация и видоизменение этого продукта. Секретируемые ве-
щества представляют собой главным образом полисахариды или
полисахаридно-белковые комплексы, обладающие высокой «вяз-
костью. Эти вещества могут включаться в клеточные оболочки
или экскретироваться наружу (например, слизи в кончиках кор-
ней). Когда пузырек, транспортирующий вещество в оболочку,
достигает плазмалеммы, его мембрана сливается с ней, а содер-
жимое освобождается в оболочку. Образовавшиеся из диктиосом
пузырьки участвуют также в процессе формирования новой кле-
точной оболочки, происходящем после митоза (гл. 4).
Эндоплазматический ретикулум
Эндоплазматический ретикулум (ЭР) — сложная мембранная
система, трехмерная структура которой полностью еще не выяс-
нена. В этом отношении многообещающей является высоковольт-
ная электронная микроскопия в сочетании со стереоскопическим
микрофотографированием [33]. Протяженные части ЭР представ-
ляют собой плоские цистерны, которые на срезах (сбоку) выгля-
дят как две элементарные мембраны с узким промежутком меж-
ду ними (фото И). На препаратах клеток кончика корня лука,
приготовленных по методу замораживания — травления, ЭР име-
ет вид обширных продырявленных листков [8]. Вместо цистерн
в нем могут образовываться и трубочки. ЭР является, по-види-
мому, анастомозирующей системой неопределенной протяженно-
сти, и поэтому термин «органелла» редко применяют для обозна-
чения этого клеточного компонента. ЭР может быть соединен с
ядерной оболочкой, которая рассматривается как часть системы
ЭР. Разнообразные связи внутри системы ЭР, вероятно, изменя-
ются в зависимости от состояния клетки. ЭР имеет определенное
отношение к плазмодесмам — цитоплазматическим тяжам, пере-
секающим клеточные оболочки (фото 11,5). Обычно считают
[48], что цистерны ЭР по обе стороны от клеточной оболочки
соединены между собой трубочкой ЭР, или десмотрубочкой, об-
разующей центральную часть плазмодесмы, однако увидеть эти
трубочки удается лишь в редких случаях. ЭР называют шерохо-
ватым, или гранулярным, если к его поверхности прикреплены
рибосомы (фото И, Л). При отсутствии рибосом ЭР называют
гладким, или агранулярным.
Связь рибосом с ЭР рассматривается как свидетельство его
участия в синтезе белка. Морфология ЭР позволяет предполо-
жить, что он служит системой внутриклеточной циркуляции, пе-
реносящей сахара, аминокислоты и АТФ (аденозинтрифосфат) к
местам их использования или хранения. Наличие плазмодесм
делает также вероятным и межклеточный транспорт. ЭР может
Клетка
49
быть местом конденсации определенных веществ и в результате
расширения может превращаться в содержащие белок цистерны.
Большая поверхность ЭР обеспечивает дифференцированное рас-
пределение содержащихся в нем ферментов. ЭР способен к значи-
тельному увеличению своего объема без каких-либо признаков
включения в него мембранного материала извне. Это наблюдение
наводит на мысль о том, что мембраны обладают способностью
к самосборке.
Липидные глобулы
В клетках различных тканей часто встречаются глобулы, ко-
торые становятся более или менее электроноплотными после фик-
сации клеток четырехокисью осмия (фото 2). Реакция с осмием
указывает на присутствие в глобулах липидов (триглицеридов)
[34], различия же в плотности определяются степенью насыщен-
ности данных липидов [13]. Глобулы, очевидно, идентичны силь-
но преломляющим свет гранулам, которые можно различить в
живых клетках при большом увеличении светового микроскопа,
а также осмиофильным глобулам, присутствующим в пластидах
{фото 5) [30].
Электронно-микроскопические исследования не привели к од-
нозначной интерпретации природы и структуры осмиофильных
глобул Они описываются то как органеллы (сферосомы), заклю-
ченные в элементарную мембрану, то как липидные капли, не
имеющие ограничивающей мембраны. Согласно представлению,
объединяющему обе эти точки зрения, глобулы возникают как
содержащие масло пузырьки, отщепившиеся от ЭР и превратив-
шиеся затем в масляные капли. Липидные глобулы отождеств-
лялись также с ограниченными мембраной органеллами, в кото-
рых находятся гидролазы, связанные с триглицеридами [34].
В большинстве случаев глобулы, вероятно, представляют собой
окруженные цитоплазмой капли, содержащие липид в качестве
основного компонента. Интенсивное восстановление осмия на
поверхности раздела липида и цитоплазмы обычно приводит к
появлению тонкой плотной линии, проходящей по периферии
капли [13]. Эта линия часто принимается за мембрану. Некото-
рые микроскописты считают, что эта тонкая линия составляет
половину элементарной мембраны [52].
Микротрубочки
Микротрубочки относятся к обычным компонентам эукариоти-
ческой клетки. Они представляют собой полые трубки, диаметр
4 К Эзау, кн 1
50
Глава 3
которых в среднем равен 240 А (фото 12), и состоят из глобуляр-
ных белковых субъединиц [39]. Микротрубочки являются компо-
нентами митотических и мейотических веретен и фрагмопласта,
который участвует в образовании новой клеточной оболочки при
цитокинезе (гл. 4). Они встречаются также в периферической ци-
топлазме вблизи растущей оболочки. Распространенность микро-
трубочек и характер их распределения в клетках привели к пред-
ставлению о том, что они участвуют в создании формы клетки и
в процессах, связанных с внутриклеточными движениями [59].
В растительных клетках микротрубочки, по-видимому, опреде-
ляют положение новой стенки в делящихся клетках и последую-
щий упорядоченный рост оболочки в толщину. Это представление
подтверждается экспериментальными данными: разрушение мик-
ротрубочек дифференцирующихся клеток колхицином вызывает
значительные аномалии в развитии клеточных оболочек [22,23].
Эргастические вещества
Крахмал
Крахмал, представляющий собой обычное эргастическое веще-
ство, встречается в виде зерен в пластидах. После целлюлозы он
является самым распространенным в растительном мире углево-
дом [45]. Крахмал образуется в хлоропластах во время фотосин-
теза. Позже он разрушается и синтезируется вновь в амилоплас-
тах как запасной крахмал. Амилопласт (рис. 3.5, Е) может со-
держать одно или более крахмальных зерен. Если в одном амило-
пласте возникает несколько крахмальных зерен, то они могут об-
разовать сложное крахмальное зерно (рис. 3, 16, Ж)-
Крахмальные зерна имеют разную форму (рис. 3.5, Д—Ж,
Н, О) и обычно обнаруживают слоистость вокруг одной точки,
называемой образовательным центром (рис. 3.5, Д), который
может располагаться в центре зерна или сбоку. В радиальных
направлениях от образовательного центра часто отходят трещи-
ны, появляющиеся, вероятно, в результате обезвоживания зерна.
Возникновение слоистости приписывают чередованию двух угле-
водов — амилозы (линейные молекулы) и амилопектина (раз-
ветвленные молекулы). Амилоза лучше растворяется в воде, чем
амилопектин, и поэтому при помещении зерна в воду различия
в набухании этих двух веществ делают слоистость более выражен-
ной. В крахмале хлебных злаков слоистость зависит от суточно-
го ритма, а в крахмале картофеля периодичность, обусловливаю-
щая слоистость, определяется эндогенными факторами [18].
Присутствие в слоях радиально расположенных молекул, соеди-
ненных между собой параллельными водородными связями, при-
Клетка
51
Рис. 3 5 Пластиды и эргастические включения протопластов. А. Хромопласты
дисковидных цветков Gaillardia Б. Ядро (с двумя ядрышками) и хромопласты
из перикарпия красного перца (Capsicum). В живом материале тельца в пла-
стидах имеют густой оранжево-красный цвет. В. Пигментные тельца из пери-
карпия томатов (Lycopersicon). Г. Пигментные тельца из корня моркови (Dau-
cus). Д. Крахмальные зерна из семян фасоли (Phaseolus) Е Крахмальные зер-
на и пластиды из корневища Iris. Пластиды представляют собой лейкопласты
(или элайопласты), образующие крахмал и масло Ж, 3 Простые и сложные
крахмальные зерна (Ж) и друза кристаллов (3) из корня сладкого картофеля
(Ipomoea). И, К Кристаллы из вторичной флоэмы Juglans (И) и Pinus (К).
JI. Стилоидный кристалл в удлиненной клетке среди клеток мезофилла Iris.
М. Клетка с рафидными кристаллами из кончика корня Vitis. Н, О Крахмаль-
ные зерна из млечников двух разных видов Euphorbia. I — ядрышко; 2 — ядро;
3—образовательный центр крахмального зерна; 4 — крахмальное зерно; 5 —
пластида; 6 — стилоид; 7—рафиды
4*
52
Глава 3
водит к появлению в зерне кристаллических участков [2]. Крах-
мальное зерно является сферокристаллом, который в поляризо-
ванном свете выглядит в виде мальтийского креста. Раствором
иода в иодистом калии крахмал обычно окрашивается в синева-
то-'черный цвет.
Запасной крахмал находится в паренхимных клетках первич-
ной коры, сердцевины и проводящих тканей стеблей и корней; в
паренхиме мясистых листьев (чешуй луковиц), корневищ, клуб-
ней, плодов и семядолей, а также в эндосперме семян. Товарный
крахмал получают из различных источников [51], например из
эдосперма хлебных злаков, мясистых корней тропического расте-
ния Manihot esculenta, клубней картофеля, клубневидных корне-
вищ орхидных, из стеблей Metroxylon sagu.
Таннины
Таннины — гетерогенная группа фенольных производных, ши-
роко распространенная среди растений. В некоторых случаях они
хорошо заметны на срезах клеток в виде грубо- или тонкограну-
лярных скоплений или телец различных размеров, окрашенных в
желтый, красный или коричневый цвета. Нет ни одной ткани, ко-
торая была бы полностью лишена таннинов. Особенно богаты тан-
нинами листья многих растений, проводящие ткани, перидерма,
незрелые плоды, семенная кожура и патологические новообразо-
вания. Они встречаются в цитоплазме и вакуолях и могут также
импрегнировать оболочки. Иногда они присутствуют во многих
клетках данной ткани, а иногда лишь в одиночных клетках (тан-
ниновых идиобластах), разбросанных по всей ткани. Они могут
локализоваться в очень крупных клетках, называемых танниновы-
ми мешками. Наличие фенольных соединений в растениях исполь-
зуют в качестве дополнительного признака при установлении так-
сономических связей [3]. Таннины находят и практическое приме-
нение, особенно в дубильном производстве, где они используются
уже на протяжении многих сотен лет для получения прочных кож
из шкур животных.
Белки
Запасные белки встречаются в плодах и семенах многих рас-
тений в виде твердых белковых телец, или алейроновых зерен,
В такой форме белки находятся в семядолях у Fabaceae и в на-
ружном (алейроновом) слое эндосперма зерновок у Роасеае. Бел-
ковые тельца окружены элементарной мембраной и имеют аморф-
ный матрикс, который иногда содержит включения в виде белко-
вого кристаллоида и аморфного небелкового (состоящего из
Клетка
53
фитина) глобоида [25, 50]. В некоторых белковых тельцах встре-
чаются кристаллы оксалата кальция (у представителей сем. Apia-
сеае). Запасные белки накапливаются в вакуолях. В процессе их
накопления крупные вакуоли распадаются на более мелкие; при
созревании запасающей ткани каждая мелкая вакуоль превраща-
ется в белковое тельце с тонопластом, сохраняющимся в виде ог-
раничивающей мембраны [9, 29]. При прорастании семян белок
переваривается и многочисленные вакуоли опять сливаются в одну
крупную вакуоль [9, 26]. Белок в форме кристаллоидов может
встречаться и в цитоплазме, например в периферической парен-
химе клубня картофеля, среди крахмальных зерен в семенах Musa
и в паренхиме плода Capsicum.
Жиры, масла и воска
Жиры, масла и воска относятся к чрезвычайно важному в
практическом отношении классу оргастических веществ [51]. Вос-
ка— это эфиры жирных кислот и одноатомных спиртов, а масла
и жиры — глицериды некоторых органических кислот. Масла и
жиры различаются в основном по физическим свойствам: жиры
при обычной температуре представляют собой твердые вещества,
а масла — жидкие. Жиры и масла являются запасными формами
липидов. В настоящем разделе под термином «жир» понимаются
как жиры, так и масла.
Жиры встречаются во всех таксонах растений и, хотя бы в
малом количестве, присутствуют, вероятно, в каждой клетке [29].
Они находятся в твердом или, что бывает чаще, в жидком состоя-
нии в форме липидных капель. Кристаллический жир встречается
редко. В качестве примера можно привести эндосперм пальмы
Elaeis, клетки которого заполнены короткими игловидными крис-
таллами жира [29]. Жиры образуются, видимо, в цитоплазме или
пластидах — элайопластах (рис. 3.5, £). Воска находятся в виде
защитного слоя на эпидерме, но могут откладываться и внутри
клеток (перикарпий Rhus vernicifera). Большинство растений со-
держит слишком мало воска, чтобы его можно было использовать
для практических целей. Исключение составляет пальма Coperni-
cia cerifera, которая дает товарный карнаубский воск, и растение
Simmondsia chinensis (джоджоба), в семядолях которого находит-
ся жидкий воск, по качеству сходный с кашалотовым жиром [53].
К маслам с низким молекулярным весом относятся эфирные масла,
которые секретируются в специальные клетки или экскретируют-
ся в межклетные полости (гл. 13). Масла и жиры можно иден-
тифицировать по красноватой окраске после их обработки Суда-
ном III или IV.
54
Глава 3
Кристаллы
Кристаллы, содержащиеся в растениях, чаще всего состоят из
оксалата кальция. Образование кристаллов является одним из
многих путей накопления кальция в растительных тканях [1].
Кристаллы оксалата кальция имеют несколько различных форм.
Это рафиды — кристаллы в виде пучков игл (листья винограда,
Impatiens, Arum, стебель Tradescantia*, рис. 3.5, Л4), стилоиды —
удлиненные колонновидные кристаллы (лист Eichhornia crassi-
pes; рис. 3.5,Л), прямоугольные или пирамидальные призмы
(флоэма Acer, Tilia, Ficus, Quercus, листья Begonia, Hyoscyamus
niger, Vicia sativa\ рис. 3.5,К), друзы — шаровидные скопления
призматических кристаллов (корневище ревеня, корень Ipomoea
batatas, листья Datura stramonium, Ruta graveolens; рис. 3.5,3),
кристаллический песок — очень мелкие кристаллы, встречающие-
ся обычно в виде больших скоплений (стебель Aucuba japonica,
Sambucus nigra, листья Atropa belladonna). Поскольку форма и
локализация кристаллов могут быть видоспецифичными, их мож-
но использовать для таксономической классификации [29]. Кри-
сталлы карбоната кальция редко встречаются у высших растений.
В форме цистолитов это соединение иногда бывает связано с кле-
точной оболочкой (гл. 13). Кристаллы образуются обычно в ва-
куолях. При образовании рафид появляющаяся в вакуоли мемб-
рана подразделяет ее на камеры, в которых затем происходит
формирование кристаллов, так что каждый из них оказывается
заключенным в собственную оболочку [1]. Кристаллы часто клас-
сифицируются как экскреторные вещества, но возможно, что часть
кальция повторно включается в обмен веществ.
СПИСОК ЛИТЕРАТУРЫ
1. Arnott Н. J., Pautard F. С. Е. Calcification in plants. In: Biological calcifica-
tion: cellular and molecular aspects, Schraer H., ed., pp. 375—446, New York,
Appleton-Century-Crofts, 1970.
2. Badenhuizen N. P. Occurrence and development of starch in plants. In: Starch:
chemistry and technology, Whistler R. L., Paschall E. F., eds., vol. 1, pp. 65—
103, New York, Academic Press, 1965.
3. Bate-Smith E. C. The phenolic constituents of plants and their taxonomic sig-
nificance, J. Linn. Soc. London, Bot., 58, 95—173 (1962).
4. Baxter R. Origin and continuity of mitochondria. In: Origin and continuity
of cell organelles, Reinert J., Ursprung H., eds., pp. 46—64, New York, Sprin-
ger, 1971.
5. Bogorad L. Evolution of organelles and eukaryotic genomes, Science, 188,
891—898 (1975).
6. Bracket J. Quelques aspects moleculaires de la cytologie et de embryologie,
Biol. Rev., 43, 1—16 (1968).
7. Branton D. Membrane structure, Ann. Rev. Plant Physiol., 20, 209—238
(1969).
8. Branton D., Moor H. Fine structure in freeze-etched Allium сера L. root tips,
J. Ultrastruct. Res., 11, 401—411 (1964).
Клетка
55
9. Briarty L. G., Coult D. A., Boulter D. Protein bodies of developing seeds of
Vicia faba, J. Exp. Bot, 20, 358—372 (1970). Protein bodies of germinating
seeds of Vicia faba, J. Exp. Bot., 21, 513—524 (1970).
10. Buvat R. Origin and continuity of cell vacuoles. In: Origin and continuity of
cell organelles, Reinert J., Ursprung H., eds., pp. 127—157, New York, Sprin-
ger, 1971.
11. Clowes F. A. L., Juniper В. E. Plant cells, Oxford, Blackwell Scientific Publi-
cations, 1968.
12. Danielli J. F., Dav son H. A contribution to the theory of permeability of thin
films, J. Cell. Compar. Physiol., 5, 495—508 (1935).
13. Fawcett D. W. The cell. Its organelles and inclusions. An atlas of fine stru-
cture, Philadelphia and London, W. B. Saunders Company, 1966.
14. Feldherr С. M., Harding С. V. The permeability characteristic of the nuclear
envelope at interphase, Protoplasmatologia, 5 (part 2), 35—50 (1964).
15. Fineran B. A. Ultrastructure of vacuolar inclusions in root tips, Protoplasma,
72, 1 — 18 (1971).
16. Franke W. W. On the universality of nuclear pore complex structure, Z. Zell-
forsch. u. Mikroskop. Anat., 105, 405—429 (1970).
17. Frederick S. E., Newcomb E. H. Cytochemical localization of catalase in leaf
microbodies (peroxisomes), J. Cell BioL, 43, 343—353 (1969).
18. Frey-Wyssling A., Milhlethaler K. Ultrastructural plant cytology, with an
introduction to molecular biology, Amsterdam, Elsevier, 1965. [Имеется пере-
вод: Фрей — Висслинг А., Мюлеталер К. Ультраструктура растительной клет-
ки.— М.: Мир, 1968.]
19. Gronegress Р. The greening of chromoplasts in Daucus carota L., Planta, 98,
274—278 (1971).
20. Gunning В. E. S., Jagoe M. P. The prolamellar body. In: Biochemistry of
chloroplasts, Goodwin T. W., ed., pp. 655—676, New York, Academic Press,
1967.
21. Harris W. M., Spurr A. R. Chromoplasts of tomato fruits. II. The red tomato,
Amer. J. Bot., 56, 380—389 (1969).
22. Hepler P. K-> Fosket D. E. The role of microtubules in vessel member differen-
tiation, Protoplasma, 72, 213—236 (1971).
23. Hepler P. K-, Newcomb E. H. Fine structure of cell plate formation in the
apical meristem of Phaseolus roots, J. Ultrastruct. Res., 19, 498—513 (1967).
24. Johnson J. M. A study of nucleolar vacuoles in cultured tobacco cells using
radio-autography, actinomycin D, and electron microscopy, J. Cell Biol., 43,
197—206 (1969).
25. Jones R. L. The fine structure of barley aleurone cells, Planta, 85, 359—375
(1969).
26. Jones R. L., Price J. M. Gibberellic acid and the fine structure of barley aleuro-
ne cells. III. Vacuolation of the aleurone cells during the phase of ribo-
nuclease release, Planta, 94, 191—203 (1970).
27. Jordan E. G., Chapman J. M. Ultrastructural changes in the nucleoli of Jeru-
salem artichoke (Helianthus tuberosus) tuber discs, J. Exp. Bot, 22, 627—634
(1971).
28. Kirk J. T. O., Tilney-Bassett R. A. E. The plastids: their chemistry, structure,
growth and inheritance, San Francisco, Freeman, 1967.
29. Kuster E. Die Pflanzenzelle, 3rd ed., Jena, Gustav Fischer, 1956.
30. Lichtenthaler H, K. Plastoglobuli und Plastidenstrukturen, Ber. Deut. Bot.
Ges., 79, 82—88 (1966).
31. Lichtenthaler H. K. Die Feinstruktur der Chromoplasten in plasmochromen
Perigon-Blattern von Tulipa, Planta, 93, 143—151 (1970).
32. Marchant R., Robards A. W. Membrane systems associated with the plasma-
lemma of plant cells, Ann. Bot., 32, 457—471 (1968).
33. Marty F. O. Observation au microscope electronique au haute tension (3 MeV)
56
Глава 3
de cellules vegetales au coupes epaisses de 1 a 5 ц. C. R. Acad. Sci. Paris D.,
277, 2681—2684 (1973).
34. Matile P. Lysosomes. In: Dynamic aspects of plant ultrastructure, Ro-
bards A. W., ed., Chapter 5, pp. 178—218, London, McGraw-Hill Book Company
(UK) Limited, 1974.
35. Menke W. Structure and chemistry of plastids, Ann. Rev. Plant Physiol., 13,
27—44 (1962).
36. Mollenhauer H. H., Morre D. J. Golgi apparatus and plant secretion, Ann. Rev.
Plant Physiol., 17, 27—46 (1966).
37. Morre D. J., Mollenhauer H. H., Bracker С. E. Origin and continuity of Golgi
apparatus. In: Origin and continuity of cell organelles, Reinert J., Ursprung H.,
eds., pp. 82—126, New York, Springer, 1971.
38. Newcomb E. H. Fine structure of protein-storing plastids in bean root tips,
J. Cell Biol., 33, 143—163 (1967).
39. Newcomb E. H. Plant microtubules, Ann. Rev. Plant Physiol., 20, 253—288
(1969).
40. Parish G. R. Seasonal variations in the membrane structure of differentiating
shoot cambial zone cells demonstrated by freeze etching, Cytobiologie, 9, 131—
143 (1974).
41. Park R. B., Sane P. V. Distribution of function and structure in chloroplast
lamellae, Ann. Rev. Plant Physiol., 22, 395—430 (1971).
42. Parthasarathy M. V., Miihlethaler K. Cytoplasmic microfilaments in plant
cells, J. Ultrastruct. Res., 38, 46—62 (1972).
43. Possingham J. V., Saurer W. Changes in chloroplast number per cell during
leaf development in spinach, Planta, 86, 186—194 (1969).
44. Racker E., ed. Membranes of mitochondria and chloroplasts, New York, Rein-
hold, 1970.
45. Radley J. A. Starch and its derivatives, Vol. 1, 3rd ed., New York, John Wiley
& Sons, 1954.
46. Raven P. H. A multiple origin of plastids and mitochondria, Science, 169,
641—646 (1970).
47. Richardson M. Microbodies (glyoxysomes and peroxisomes) in plants, Sci.
Progr. Oxford, 61, 41—61 (1974).
48. Robards A. W. Plasmodesmata, Ann. Rev. Plant Physiol., 26, 13—29
(1975).
49. Robertson J. D. The membrane of the living cell, Sci. Amer., 206, 64—72
(1962).
50. Rost T. L. The ultrastructure and physiology of protein bodies and lipids from
hydrated dormant and nondormant embryos of Setaria lutescens (Gramineae),
Amer. J. Bot., 59, 607—616 (1972).
51. Schery R. W. Plants for man, New York, Prentice-Hall, 1952.
52. Schwarzenbach A. M. Observations on spherosomal membranes, Cytobiologie,
4, 145—147 (1971).
53. Sherbroke W. C., Haase E. F. Jojoba: a wax-producing shrub of the Sonoran
desert, Arid Lands Resource Information Paper No. 5, Tucson, Arizona, 1974.
54. Singer S. J., Nicolson G. L. The fluid mosaic model of the structure of cell
membranes, Science, 175, 720—731 (1972).
55. Sitte P. Bau und Funktion der Pflanzenzelle, Stuttgart, Gustav Fischer,
1965.
56. Steward F. C., Mott R. L. Cells, solutes, and growth: salt accumulation in
plants reexamined, Internatl. Rev. CytoL, 28, 275—370 (1970).
57. Thomson W. W. Ultrastructural development of chromoplasts in Valencia oran-
ges, Bot. Gaz., 127, 133—139 (1966).
58. Thomson W. W., Lewis L. N., Coggins C. W. The reversion of chromoplasts to
chloroplasts in Valencia oranges, Cytologia, 32, 117—124 (1967).
59. Tilney L. G. Origin and continuity of microtubules. In: Origin and continuity
Клетка
57
of cell organelles, Reinert J., Ursprung H., eds., pp. 222—260, New York, Sprin-
ger, 1971.
60. Tolbert N. E. Microbodies — peroxisomes and glyoxisomes, Ann. Rev. Plant
Physiol., 22, 45—74 (1971).
61. Wang A. Y.-I., Packer L. Mobility of membrane particles in chloroplasts, Bio-
chem. Biophys. Acta, 305, 488—492 (1973).
62. Weier T. E., Stocking C. R., Shumway L. K. The photosynthetic apparatus in
chloroplasts of higher plants, Brookhaven Symposia in Biology No. 19, 353—
374 (1966).
63. Wergin W. P., Gruber P. J., Newcomb E. H. Fine structural investigation of
nuclear inclusions in plants, J. Ultrastruct. Res., 30, 533—557 (1970).
64. Wilson C. L. A lysosomal concept for plant pathology, Ann. Rev. Phytopathol,
11, 247—272 (1973).
65. Wilson G. B., Morrison J. H. Cytology, New York, Reinhold, 1961.
Глава 4
Клеточная оболочка
Клеточная оболочка — типичный компонент растительной клет-
ки. Благодаря наличию оболочки растяжение протопласта осмо-
тически активной вакуолью ограничено, а размер и форма клет-
ки, достигшей зрелости, перестают изменяться. Тип клеточных
оболочек определяет текстуру данной ткани. В периферических
тканях клеточные оболочки содержат вещества, которые защища-
ют лежащие глубже клетки от высыхания. Оболочки, особенно
толстые и жесткие, служат механической опорой для* органов
растения. Они оказывают влияние на такие важные стороны дея-
тельности растительных тканей, как поглощение, транспирация,
транспорт и секреция.
Макромолекулярные компоненты и их организация
в оболочке
Основным соединением оболочек растительных клеток явля-
ется целлюлоза — полисахарид, имеющий эмпирическую формулу
(С6НюО5)п. Ее молекулы состоят из линейных цепей глюкозы,
длина которых может достигать 4 мкм. В клеточной оболочке
целлюлоза связана с другими полисахаридами — гемицеллюлоза-
ми и пектиновыми веществами (полиуронидами). Оболочки мно-
гих типов клеток инкрустируются лигнином — полимером, состоя-
щим из фенилпропаноидных единиц. Лигнин представляет собой
сложное гетерогенное вещество, придающее оболочке жесткость
[20]. В оболочках содержится также вода и много других ве-
ществ, органических и неорганических, количество которых варь-
ирует в зависимости от природы клетки. К органическим вещест-
вам относятся кутин, суберин и воска — жировые вещества, ко-
торые чаще всего обнаруживаются в защитных поверхностных
тканях растения: кутин в эпидерме, суберин во вторичной покров-
ной ткани — пробке, или феллеме. Воска встречаются в комби-
нации с кутином и суберином, а также отдельно на поверхности
кутикулы (слоя кутина, покрывающего наружную стенку эпи-
дермы) .
Архитектура клеточной оболочки в значительной степени оп-
ределяется присутствием целлюлозы. Этот углевод образует кар-
кас, который погружен в матрикс из нецеллюлозных углеводов.
Клеточная оболочка
59
Рис. 4.1. Тонкая структура клеточных оболочек. А. Тяж волокнистых кле-
ток. Б. Поперечный срез волокнистых клеток, показывающий крупные слои кле-
точной оболочки — слой первичной и три слоя вторичной оболочки. В. Фрагмент
среднего слоя вторичной оболочки, в котором видны макрофибриллы (белые по-
лосы) целлюлозы и межфибриллярное пространство (черные полосы), заполнен-
ное нецеллюлозными веществами. Г. Фрагмент макрофибриллы, показывающий
микрофибриллы (белые полосы), которые могут быть видны на электронных
микрофотографиях (фото 13). Пространство между микрофибриллами (черные
полосы) заполнено нецеллюлозными веществами. Д. Структура микрофибрилл,
состоящих из цепочковидных молекул целлюлозы, которые в определенных уча-
стках расположены упорядоченно. Эти участки представляют собой мицеллы.
Е. Фрагмент мицеллы, в котором участки цепочковидных целлюлозных молекул
образуют пространственную решетку. Ж. Два глюкозных остатка, связанных
между собой атомом кислорода — фрагмент молекулы целлюлозы. 1 — срединная
пластинка; 2 — первичная оболочка; 3 — трехслойная вторичная оболочка; 4 —
макрофибрилла; 5 — микрофибрилла; 6 — молекула целлюлозы; 7 — мицеллы.
60
Глава 4
Некоторые гемицеллюлозы, очевидно, служат в качестве важных
поперечных мостиков между нецеллюлозными полимерами и цел-
люлозой [12]. Инкрустирующие вещества, такие, как лигнин или
суберин, откладываются в матриксе. Согласно электронно-микро-
скопическим исследованиям, в которых идентификация лигнина
проводилась по его избирательной реакции с фиксатором, содер-
жащим перманганат калия, лигнин, вероятно, заполняет прост-
ранство между целлюлозными фибриллами каркаса [И]. При
этом лигнин химически связывается с полисахаридами [7].
Целлюлозный каркас представляет собой систему фибрилл,
состоящих из молекул целлюлозы (рис. 4.1). Фибриллы можно
разделить на несколько классов в зависимости от их размеров.
Самые крупные — макрофибриллы — различимы в световой мик-
роскоп. В электронном микроскопе можно видеть, что они состоят
из микрофибрилл шириной около 100 А (фото 13). С увеличением
разрешающей способности электронных микроскопов выявились
еще более мелкие фибриллы, которые были названы субъедини-
цами микрофибрилл [10].
Микрофибриллы на электронно-микроскопических препаратах
образуют узор, напоминающий тесное переплетение нитей тек-
стильной ткани. Такой вид они приобретают частично вследствие
обезвоживания оболочек при подготовке препаратов для микро-
скопии (фото 13). В клеточных оболочках живых тканей микро-
фибриллы менее плотно прилегают друг к другу.
Целлюлоза имеет свойства кристаллов, что объясняется упо-
рядоченным расположением ее молекул в микрофибриллах. Такое
расположение наблюдается только в определенных частях мик-
рофибрилл, которые называются мицеллами (рис. 4.1). Между
мицеллами и вокруг них находятся менее упорядоченно распо-
ложенные глюкозные цепи, образующие паракристаллические об-
ласти микрофибриллы. Кристаллическая структура целлюлозы
обусловливает анизотропию клеточной оболочки и как следствие
этого двойное лучепреломление при прохождении через нее по-
ляризованного света (фото 14).
Хотя клеточную оболочку можно рассматривать как оргасти-
ческое вещество протопласта, она поддерживает тесную связь с
цитоплазмой. Компонентами первичных оболочек, как известно,
являются белки, которые обычно содержат редкую аминокислоту
оксипролин [13]. Считается, что белок и полисахариды оболочки
образуют гликопротеид за счет ковалентных связей. Было найде-
но, что увеличение количества этого компонента служит причиной
прекращения роста оболочек растяжением [27].
Клеточные оболочки содержат ферменты, которые могут участ-
вовать в синтезе, переносе и гидролизе макромолекул оболочки,
а также в видоизменении внеклеточных метаболитов, облегчаю-
щем их транспорт в клетку. С помощью цитохимических методов
Клеточная оболочка
61
локализации ферментов в клеточных оболочках были выявлены
кислая фосфатаза [9] и пероксидаза [8].
Слоистость клеточной оболочки
Способ и интенсивность роста клеточной оболочки, а также
расположение в ней микрофибрилл, возникающих в процессе ее
постепенного формирования, обусловливают более или менее вы-
раженную слоистость клеточной оболочки. В каждом протопласте
рост оболочки происходит по направлению снаружи внутрь, по-
этому самый старый слой данной оболочки занимает самое на-
ружное положение в клетке, а наиболее молодой — самое внут-
реннее, непосредственно над протопластом. Слои, образовавшиеся
первыми, составляют первичную оболочку. Во многих типах клеток
откладываются дополнительные слои, которые образуют вторич-
ную оболочку (рис. 4.3).
Зона соединения первичных оболочек двух смежных клеток
называется срединной пластинкой, или межклеточным веществом.
Под электронным микроскопом срединная пластинка редко вы-
является в виде четкого слоя, за исключением углов клеток, где
откладывается наибольшее количество межклеточного вещества
(фото 15). Обнаружение срединной пластинки основано главным
образом на микрохимических реакциях и методе мацерации. Сре-
динная пластинка, состоящая в основном из пектина, в более ста-
рых клетках нередко одревесневает.
В толстостенных клетках древесины вторичная оболочка часто
состоит из трех основных слоев (рис. 4.1 и 4.2). Начиная с на-
ружного, эти слои обозначаются как Bb В2 и В3. Слой В2 — самый
толстый. Слой В3 может быть очень тонким или полностью от-
сутствовать. Некоторые специалисты по анатомии древесины счи-
тают, что слой В3 достаточно четко отличается от слоев Bi и В2,
и поэтому его следует называть третичной оболочкой [14]. Раз-
личия между отдельными слоями, в особенности между первичной
оболочкой и срединной пластинкой, часто неотчетливы. В клетках
с вторичными оболочками две смежные первичные оболочки и
срединная пластинка могут выглядеть как один слой, называемый
сложной срединной пластинкой.
Подразделение вторичной оболочки на три слоя обусловлено
в основном тем, что микрофибриллы в них имеют разную ориен-
тацию. В типичном случае микрофибриллы в клеточной оболочке
ориентированы по спирали (рис. 4.2). В слое Bi наклон спирали
образует большой угол с продольной осью клетки, так что мик-
рофибриллы оказываются расположенными почти горизонтально.
В слое В2 микрофибриллы ориентированы под малым углом, и
поэтому спираль имеет крутой наклон. В слое В3 так же, как и
62
Глава 4
Рис. 4.2. Схема, изображающая уча-
сток оболочки трахеиды. Показаны
слои оболочки и их микрофибрилляр-
ная структура. 1 — бородавчатый
слой; 2, 3 и 4 — слои вторичной обо-
лочки; 5 — первичная оболочка; 6 —
срединная пластинка. Слой 2 иногда
рассматривают как слой третичной
оболочки. (Воспроизводится из ра-
боты [14] с некоторыми изменения-
ми.)
в слое Bi, микрофибриллы откладываются под большим углом
к продольной оси клетки. Первичная оболочка отличается от вто-
ричной довольно беспорядочной укладкой микрофибрилл. У во-
локон и трахеид большинства видов древесных растений внут-
ренняя поверхность слоя В3 покрыта нецеллюлозной пленкой, на
которой часто находятся бугорки — так называемые бородавки.
Этот бородавчатый слой, по-видимому, состоит из остатков рас-
павшегося протопласта [2].
Клетки с вторичной оболочкой обычно имеют тонкую первич-
ную оболочку. Она сравнительно тонка и в метаболически актив-
ных паренхимных клетках различных типов, например в клетках
мезофилла листа и запасающей паренхимы корней и клубней.
Однако в колленхиме стеблей и листьев и в эндосперме некото-
рых семян первичная оболочка может достигать значительной
толщины. У толстых первичных оболочек может выявляться сло-
истость, обусловленная различным соотношением в них целлю-
лозы, нецеллюлозных компонентов и воды.
Межклетники
Значительный объем тела растения занят системой межклет-
ников. Хотя межклетники наиболее характерны для зрелых тка-
ней (фото 16), они обнаруживаются также и в меристематических
тканях, где делящиеся клетки интенсивно дышат. Примеры тка-
ней с крупными, связанными в единую систему межклетниками
можно найти в вегетативных листьях (гл. 18) и погруженных
органах водных растений.
Чаще всего межклетники возникают путем расхождения смеж-
ных первичных оболочек по срединной пластинке. Процесс начи-
Клеточная оболочка
63
кается с углов, где стыкуется более двух клеток, а затем распро-
страняется и на другие части оболочки. Межклетники этого типа
называются схизогенными, т. е. возникающими путем расщепле-
ния, хотя весьма вероятно, что механизм их образования вклю-
чает ферментативное удаление пектинов. Электронно-микроско-
пические исследования показывают, что формирование межклет-
ников— процесс сложный, поскольку появлению полостей между
клетками может предшествовать накопление мембранных струк-
тур [4]. Некоторые межклетники, называемые лизигенными
(т. е. возникающими путем растворения), образуются в резуль-
тате распада целых клеток. Обширные лизигенные межклетники
встречаются в некоторых корнях. Межклетники обоих типов мо-
гут служить также вместилищами разнообразных продуктов сек-
реции (гл. 13). При формировании межклетников схизогенный
путь может сочетаться с лизигенным.
Поры, первичные поровые поля
и плазмодесмы
Определения и структура
Вторичные клеточные оболочки имеют характерные углубле-
ния, называемые порами (рис. 4.3,5). Поры двух смежных клеток
обычно располагаются друг против друга. Две противолежащие
поры вместе называются парой пор. Каждая пора, входящая в
состав данной пары, имеет поровую камеру, при этом обе камеры
отделяются друг от друга тонким участком оболочки — замыкаю-
щей пленкой поры, или поровой мембраной. Поры возникают во
время онтогенеза клеточной оболочки в результате неравномерно-
го отложения вещества вторичной оболочки: над замыкающей
пленкой поры это вещество не откладывается, и поэтому поры
фактически являются местами, в которых вторичная оболочка
прерывается. Замыкающая пленка в каждой паре пор состоит из
двух первичных оболочек и срединной пластинки (рис. 4.3,5).
Первичные оболочки тоже могут иметь углубления — первич-
ные поровые поля, или примордиальные поры [3]. В настоящей
книге эти структуры называются также первичными порами.
В примордиальных порах первичная оболочка особенно тонка и
пронизана плазмодесмами (рис. 4.3, Д), однако она не прерыва-
ется в этих участках, за исключением только тех мест, где нахо-
дятся плазмодесменные каналы, иначе говоря, первичная оболочка
откладывается над замыкающей пленкой порового поля. Поры,
образующиеся во вторичной оболочке, располагаются над пер-
вичными поровыми полями. При использовании слова «поле»
в термине «поровое поле» принимается во внимание тот факт, что
64
Глава 4
Рис. 4.3. Первичные поровые по-
ля (А) и поры (Б). А. Клеточ-
ная стенка, состоящая из средин-
ной пластинки и двух слоев пер-
вичной оболочки. Плазмодесмы
пронизывают замыкающие пленки
поровых полей. Б. Клеточная
стенка, состоящая из срединной
пластинки, двух слоев первичной
оболочки и двух слоев вторичной
оболочки. В. Очертания поры, по-
казанной на Б, при рассматрива-
нии оболочки с поверхности. 1 —
первичная оболочка; 2— средин-
ная пластинка; 3 — первичное по-
ровое поле с плазмодесмами; 4 —
апертура поры; 5 — замыкающая
пленка поры; 6 — вторичная обо-
лочка.
над одной примордиальной порой во вторичной оболочке может
возникать несколько пор.
Важной физиологической особенностью первичных пор явля-
ется наличие плазмодесм, пересекающих замыкающую пленку
(рис. 4.3, Л и фото 17). Как уже говорилось в гл. 3, плазмодесмы,
вероятно, обеспечивают непрерывность цитоплазмы между сосед-
ними клетками. Канал плазмодесмы в оболочке выстлан плазма-
леммой, а в его центре находится десмотрубочка, непосредственно
переходящая в цистерны ЭР, расположенные напротив отверстий
плазмодесм. Остальная часть канала заполнена матриксом цито-
плазмы. Взаимоотношение между структурой и функцией плаз-
модесм как путей, связывающих между собой протопласты, пока
полностью не выяснено [24].
При образовании вторичной оболочки плазмодесмы в замыка-
ющей пленке поры сохраняются, обеспечивая связь между цито-
плазмой, заполняющей камеры пор двух соседних клеток. По мере
утолщения вторичной оболочки камеры превращаются в каналы.
Уменьшение внутренней окружности растущей оболочки может
вызвать слияние соседних поровых каналов. При этом образуется
так называемая ветвистая пора (гл. 6). Если клетка при дости-
жении зрелости лишается живого протопласта, то плазмодесмы и
цитоплазма в камерах пор исчезают.
Плазмодесмы обнаруживаются не только в порах. Вкрапления
плазмодесм обычно встречаются и в оболочках равномерной тол-
щины. Более того, электронная микроскопия показала, что во
многих случаях первичная оболочка утолщается именно там, где
находятся плазмодесмы (фото 15). Плазмодесмы могут ветвиться
Клеточная оболочка
65
с одной или с обеих сторон срединной пластинки. В канале плаз-
модесмы в зоне срединной пластинки часто образуется полость
(фото 17, А В), называемая медианной полостью. Она особенно
велика у разветвленных плазмодесм, так как ответвления часто
соединяются друг с другом через полость. Одно время считали,
что плазмодесмы встречаются и в наружных стенках эпидермы,
где они выявлялись с помощью определенных красителей в виде
линий. Им было дано название эктодесмы. Последующие иссле-
дования показали, что в наружных стенках эпидермы цитоплаз-
матические тяжи не встречаются, но от плазмалеммы к кутикуле
отходят канальцы, заполненные рыхлой сетью из целлюлозных
фибрилл. Они служат полярными путями при поглощении и экс-
креции веществ листом [5, 16]. Франке [6] предложил заменить
термин «эктодесма» термином «тейхода» (греч. тейхо — оболочка
и ходос — путь), чтобы исключить предположение о цитоплазма-
тической природе этих образований.
Типы пор
Поры различаются по размерам и тонкой структуре (гл. 6 и 8).
Вторичная оболочка может резко прерываться у краев камеры
поры, диаметр которой благодаря этому почти не изменяется по
всей толще вторичной оболочки. Поры этого типа называются
простыми, а комбинация двух простых пор — простой парой пор
(рис. 4.3,Б, В). Вторичная оболочка может нависать над камерой
поры в виде свода, образуя ее окаймление. Такие поры получили
название окаймленных, или окаймленной пары пор (рис. 4.4, А).
Поровая камера, ограниченная окаймлением, открывается в полость
клетки через отверстие в окаймлении — апертуру поры (рис. 4.4,
А—Г и фото 18,А). В ксилеме встречаются парные сочетания
окаймленных и простых пор, называемые полуокаймленными па-
рами пор (рис. 4.4, Г, Д),
В трахеидах голосеменных, в особенности у представителей
сем. Pinaceae, замыкающая пленка, которая разделяет окаймлен-
ную пару пор, имеет высокоспециализированную структуру. Утол-
щение в средней части замыкающей пленки образует торус
(рис. 4.4,А), остальная часть — краевая, или маргинальная, зо-
на — состоит из пучков микрофибрилл, большая часть которых
отходит в радиальных направлениях от торуса (фото 18,5). Рых-
лая структура краевой зоны обусловлена тем, что из нее удалены
нецеллюлозный матрикс первичной оболочки и срединная плас-
тинка [14]. Замыкающая пленка в маргинальной зоне эластична
и при определенном давлении (гл. 8) смещается к одной или
другой стороне окаймления, закрывая апертуру с помощью торуса
(рис. 4.4,5). В таком состоянии пора не функционирует в прове-
дении веществ и называется закрытой.
5 К. Эзау, кн. 1
66
Глава 4
Если вторичная оболочка очень толста, то соответственно утол-
щено и окаймление поры (рис. 4.4,Е, Ж). Камера такой поры
довольно мала и соединяется с клеточной полостью узким прохо-
дом в окаймлении — каналом поры. Этот канал имеет наружную
апертуру (отверстие), обращенную к полости клетки. У некоторых
пор поровый канал напоминает сжатую воронку и обе его апер-
туры различаются по размеру и форме. Наружная — небольшая
и круглая, а внутренняя — длинная и щелевидная. Внутренние
апертуры двух пор, образующих пару пор, располагаются крест-
Рис. 4.4. Схемы окаймленных и полуокаймленных пар пор. А. Две окаймленные
пары пор, в каждой из которых имеется торус (вид сбоку). Б. Окаймленная
пора (вид с поверхности). В. Закрытая окаймленная пара пор. Г, Д. По-
луокаймленные пары пор: вид с поверхности (Г) и сбоку (Д). Е, Ж. Окаймлен-
ная пора с удлиненной внутренней апертурой и редуцированным окаймлением
(Record, Timbers of North America, John Wiley & Sons, 1934). 1— торус;
2 — апертура; 3 — маргинальная зона; 4 — окаймление; 5 — замыкающая пленка
поры; 6 — полость поры; 7 — вторичная оболочка; 8 — канал поры; 9 — наруж-
ная апертура; 10 — внутренняя апертура; 11 — полость поры (под окаймлением).
Клеточная оболочка
67
накрест по отношению друг к другу (гл. 8). Такое расположение
связано со спиральной ориентацией микрофибрилл во вторичной
оболочке.
Образование клеточной оболочки
во время деления клетки
В процессе вегетативного роста за делением ядра (кариоки-
незом, рис. 4.5) обычно следует деление клетки — цитокинез, в
результате которого материнская клетка делится на две дочерние.
Исходную перегородку между дочерними клетками называют кле-
точной пластинкой (фото 19—21), так как ее природа еще недо-
статочно изучена. Поскольку клеточная пластинка незаметно пре-
вращается в клеточную оболочку, ее можно считать первым слоем
этой оболочки. Предположение о том, что клеточная пластинка
состоит из пектиновых веществ и превращается в срединную плас-
тинку, расположенную между первичными оболочками двух до-
черних клеток, полностью не проверено.
Клеточная пластинка возникает путем слияния пузырьков, ко-
торые оседают в экваториальной плоскости фрагмопласта—
скопления микротрубочек, протянувшихся между двумя дочерними
ядрами (рис. 4.5, А и фото 20). При соматическом митозе мито-
тическое веретено и фрагмопласт оказываются тесно связанными
друг с другом благодаря наличию в них общих микротрубочек,
хотя перед завершением формирования клеточной пластинки к
фрагмопласту добавляются новые микротрубочки. Клеточная
пластинка закладывается в виде диска, взвешенного в фрагмо-
пласте (рис. 4.5, Л и фото 19). На этой стадии фрагмопласт не
доходит до стенок материнской клетки, вследствие чего клеточная
пластинка не соприкасается с ними. Микротрубочки фрагмопласта
исчезают там, где уже произошло образование клеточной пластин-
ки, но затем они последовательно восстанавливаются у ее свобод-
ных краев (рис. 4.5,5, В и фото 21, Л). Расширяющийся фрагмо-
пласт позволяет клеточной пластинке расти латерально до тех
пор, пока она не присоединится к стенкам материнской клетки
(фото 21,5).
Согласно широко распространенной точке зрения [19], пузырь-
ки, образующие клеточную пластинку, происходят из диктиосом,
расположенных рядом с фрагмопластом (фото 21,Л). Однако в
формировании клеточной пластинки могут участвовать и пузырьки
ЭР. Микротрубочки фрагмопласта, по-видимому, направляют дви-
жение пузырьков в экваториальную зону. Возникшие из диктиосом
пузырьки переносят полисахарид“ы, в том числе пектиновые ве-
щества, которые служат строительным материалом для клеточной
пластинки. Когда пузырьки сливаются, их мембрана становится
5е
68
Глава 4
плазмалеммой. При слиянии пузырьков в клеточной пластинке
остаются небольшие бреши — плазмодесменные каналы, выстлан-
ные плазмалеммой (фото 21,5). Иногда в этих каналах бывают
видны попавшие в них трубочки ЭР.
Перед началом деления клетки ядро занимает определенное
положение. Если клетка сильно вакуолизирована, то в плоскости
будущего деления разрастается слой цитоплазмы — фрагмосома,
в который перемещается ядро. В изменении положения ядра могут
участвовать микротрубочки, образующие кольцевидный препро-
фаз ный тяж [21]. Этот тяж, состоящий из нескольких слоев мик-
Рис. 4.5. Образование оболочки во время клеточного деления. А. Формирование
клеточной пластинки в экваториальной плоскости фрагмопласта в телофазе.
Д В. Фрагмопласт на этой стадии располагается по краю круглой клеточной
пластинки (Б — вид сбоку, В — вид с поверхности). Г. Деление клетки закон-
чилось, и каждая дочерняя клетка сформировала свою собственную первичную
оболочку (показана точками). Д. Дочерние клетки выросли, их первичные обо-
лочки стали толще, а оболочка материнской клетки разорвалась по вертикаль-
ным сторонам клетки, / — ядро; 2 — клеточная пластинка; 3 — фрагмопласт;
4— срединная пластинка; 5 — ядра; 6—оболочка материнской клетки; 7 — но-
вая срединная пластинка; 8—оболочка дочерней клетки.
Клеточная оболочка
69
ротрубочек, намечает контур экваториальной плоскости будущего
митотического веретена и фрагмопласта.
Рост клеточной оболочки
Вслед за слиянием пузырьков с образованием клеточной пла-
стинки начинается отложение дополнительного материала оболоч-
ки по обеим сторонам от первоначальной пластинки, на что ука-
зывает увеличение толщины новой перегородки. Вещество новой
первичной оболочки откладывается также и поверх старой обо-
лочки материнской клетки, так что в каждой дочерней клетке
формируется сплошная первичная оболочка (рис. 4.5, Г, Д). Пу-
зырьки, возникающие из диктиосом, по-прежнему участвуют в
росте оболочки — как на первичной, так и на вторичной стадии
ее развития. Радиоавтографические исследования привели к пред-
ставлению о том, что источником полисахаридного материала,
который служит матриксом оболочки, являются диктиосомы, тогда
как синтез целлюлозы осуществляется в тесной связи с плазма-
леммой [18, 26, 29]. Экспериментальные исследования и электрон-
ная микроскопия указывают на то, что микротрубочки играют
важную роль в упорядоченном росте клеточной оболочки (гл. 3);
в частности, они определяют направление движения образовав-
шихся из диктиосом пузырьков к оболочке [15] и контролируют
процесс укладки микрофибрилл в оболочке [17].
Согласно классическим представлениям, рост оболочки в тол-
щину происходит двумя способами — аппозицией и интуссусцеп-
цией. При аппозиции (наложении) строительные блоки размеща-
ются один над другим, при интуссусцепции частицы нового мате-
риала включаются в уже имеющуюся структуру. Включение в
оболочку лигнина или кутина, вероятно, всегда осуществляется
путем интуссусцепции; что же касается целлюлозы, то интуссус-
цепция должна была бы приводить к переплетению ее микрофиб-
рилл. В одних оболочках микрофибриллы, по-видимому, действи-
тельно переплетаются, тогда как в других их расположение сви-
детельствует о росте оболочки путем аппозиции [2].
Клеточные оболочки растут не только в толщину, но и в по-
верхность (рост растяжением). Рост растяжением представляет
собой сложный и не до конца выясненный процесс [1, 23]. Он
связан с разрыхлением структуры оболочки — процессом, который
регулируется содержанием ауксина, тургорным давлением, син-
тезом белка и дыханием. Таким образом, изучение роста оболочек
растяжением свидетельствует о зависимости этого процесса от
деятельности живого протопласта. Поэтому исследователи, зани-
мающиеся ростом клеточной оболочки, придают особое значение
обнаружению в оболочке белков и ферментов.
Глава 4
70
Поверхностный рост оболочки, или рост растяжением, проис-
ходит в клетках, которые продолжают увеличиваться в размерах.
Такие клетки имеют нелигнифицированные первичные оболочки
со сравнительно небольшим содержанием целлюлозы. Микрофиб-
риллы реагируют на рост оболочки растяжением, изменяя свою
ориентацию: от почти горизонтального положения, которое они
занимают вначале, они постепенно переходят к более вертикаль-
ному (согласно терминологии Веена [28], от пологой спирали к
крутой). Последующие слои, откладываемые поверх старых слоев,
растягиваются все в меньшей степени. В связи с этим первичная
оболочка выглядит как стопка лежащих одна на другой сеток,
различающихся по ориентации и плотности содержащихся в них
микрофибрилл. Такая интерпретация роста оболочки получила на-
звание гипотезы многосеточного роста оболочки [25]. Эта гипо-
теза нашла широкое признание, хотя она, вероятно, и не может
объяснить рост всех существующих первичных оболочек [22].
СПИСОК ЛИТЕРАТУРЫ
1. Cleland R. Cell wall extension, Ann. Rev. Plant Physiol., 22, 197—222
(1971).
2. Clowes F. A. L., Juniper В. E. Plant cells, Oxford, Blackwell Scientific Publi-
cations, 1968.
3. Committee on Nomenclature, International Society of Wood Anatomists. Inter-
national glossary of terms used in wood anatomy, Trop. Woods, 107, 1—36
(1957).
4. Fagerlind F., Massalski A. The development of cell walls and intercellularies
in the root of Lemna minor L., Svensk. Bot. Tidskr., 68, 64—93 (1974).
5. Franke W. Mechanisms of foliar penetration of solutions, Ann. Rev. Plant Phy-
siol., 18, 281—300 (1967).
6. Franke W. Uber die Natur der Ektodesmen und einen Vorschlag zur Termi-
nologie, Ber. Deut. Bot. Ges., 84, 533—537 (1971).
7. Freudenberg R. Lignin: Its constitution and formation from p-hydroxycinna-
myl alcohols, Science, 148, 595—600 (1965).
8. Goff C. W. A light and electron microscopic study of peroxidase localization
in the onion root tip, Amer. J. Bot, 62, 280—291 (1975).
9. Halperin W. Ultrastructural localization of acid phosphatase in cultured cells
of Daucus carota, Planta, 88, 91 —102 (1969).
10. Hanna R. В., Cote W. A., Jr. The sub-elementary fibril of plant cell wall cellu-
lose, Cytobiologie, 10, 102—116 (1974).
11. Hepler P. R., Fosket D. E., Newcomb E. H. Lignification during secondary
wall formation in Coleus: an electron microscopic study, Amer. J. Bot., 57,
85—96 (1970).
12i Reegstra R., Talmadge R. W., Bauer W. D., Albersheim P. The structure of
plant cell walls. III. A model of the walls of suspension-cultured sycamore cells
based on the interconnections of the macromolecular components, Plant Phy-
siol., 51, 188—196 (1973).
13. Lamport D. T. A. Cell wall metabolism, Ann. Rev. Plant Physiol., 21, 235—
270 (1970).
14. Liese W. Elektronenmikroscopie des Holzes. Handbuch der Mikroskopie in der
Technik, Band V, Teil 1, pp. 109—170, Frankfurt am Main, Umschau Verlag,
1970.
Клеточная оболочка
71
15. Maitra S. С., De D. N. Role of microtubules in secondary thickening of diffe-
rentiating xylem element, J. Ultrastruct. Res., 34, 15—22 (1971).
16. Merkens IF. 3. W., de Zoeten G. A., Gaard G. Observations on ectodesmata and
the virus infection process, J. Ultrastruct. Res., 41, 397—405 (1972).
17. Newcomb E. H. Plant microtubules, Ann. Rev. Plant Physiol., 20, 253—288
(1969).
18. Northcote D. H. The Golgi apparatus, Endeavour, 30, 26—33 (1971).
19. O'Brien T. P. The cytology of cell-wall formation in some eukaryotic cells,
Bot Rev., 38. 87—118 (1972).
20. Pearl I. A. The chemistry of lignin, New York, Dekker, 1967.
21. Pickett-Heaps J. D., Northcote D. H. Organization of microtubules and endo-
plasmic reticulum during mitosis and cytokinesis in wheat meristems, J. Cell
Sci., 1, 109—120 (1966).
22. Preston R. D. Plant cell walls. In: Dynamic aspects of plant ultrastructure,
Robards A. W., ed., Chapter 7, pp. 256—309, London, McGraw-Hill Book Com-
pany (UK) Limited, 1974.
23. Ray P. M. The action of auxin on cell enlargement in plants, Devel. Biol.
Suppl., 3, 172—205 (1969).
24. Robards A. W. Plasmodesmata, Ann. Rev. Plant Physiol., 26, 13—29 (1975).
25. Roelofsen P. The plant cell wall. Handbuch der Pflanzenanatomie, Band 3,
Teil 4, 1959.
26. Roland L-С. The relationship between the plasmalemma and plant cell wall,
Internatl. Rev. Cytol., 36, 45—92 (1973).
27. Sadava D., Chrispeels M. J. Hydroxyproline-rich cell wall protein (extensin):
role in the cessation of elongation in excised pea epicotyls, Devel. Biol., 30,
49—55 (1973).
28. Veen B. W. Orientation of microfibrils in parenchyma cells of pea stem be-
fore and after longitudinal growth, Proc. Koninkl. Nederl. Akad. Wetenschap.
Amsterdam, Ser. C, 73, 114—117 (1970).
29. Wilson J. H. M., Cocking E. C. Microfibril synthesis at the surfaces of isolated
tobacco mesophyll protoplasts, a freeze-etch study, Protoplasma, 84, 147—159
(1975).
Паренхима и колленхима
Паренхима
Паренхима — главный компонент системы основных тканей.
В органах растения она или образует непрерывную ткань, как,
например, в первичной коре и сердцевине стеблей, первичной коре
корней, мезофилле листьев, или представлена отдельными клетка-
ми и группами клеток в сложных системах тканей — ксилеме и
флоэме.
Паренхимные клетки выполняют разнообразные функции в
зависимости от их положения в теле растений и от участия в
жизнедеятельности других клеток. Хотя паренхимные клетки мо-
гут быть более или менее высокоспециализированными по своим
функциям, они способны изменять свою активность. Такая физио-
логическая пластичность определяется наличием в клетках пол-
ного протопласта со всеми входящими в его состав органеллами.
Благодаря тому что разнообразные мембранные системы разде-
ляют протопласт на многочисленные отсеки, он фактически спо-
собен к одновременному выполнению многих функций (гл. 3).
Паренхимная клетка с нормальным, содержащим ядро протопла-
стом может также возобновлять меристематическую активность.
Такие явления, как заживление ран, регенерация, образование
придаточных корней и побегов, оказываются возможными вслед-
ствие возврата паренхимных клеток к меристематической актив-
ности. Более того, изолированные группы паренхимных клеток или
даже отдельные клетки могут образовывать целые растения
(гл. 2).
Содержимое клеток
Функциональные различия паренхимных клеток обычно отра-
жаются в изменении соотношения протоплазматических компонен-
тов. Интенсивно фотосинтезирующая паренхима, содержащая мно-
гочисленные хлоропласты, называется хлоренхимой. Эта ткань на-
иболее хорошо развита в мезофилле листьев (гл. 18), однако хло-
ропласты могут встречаться также в первичной коре, а иногда
и в глубже расположенных тканях стебля, даже в сердцевине [22].
Фотосинтезирующие клетки обычно сильно вакуолизированы и
образуют очень рыхлую ткань. Секреторные типы паренхимных
клеток часто имеют плотные протопласты, особенно богатые ри-
босомами, и в зависимости от типа образуемого секреторного про-
Паренхима и колленхима
73
дукта содержат или многочисленные диктиосомы, или сильно раз-
витой эндоплазматический ретикулум (гл. 13).
Паренхимные клетки могут приобретать характерные особен-
ности в связи с накоплением в них определенных эргастических
веществ. В крахмалоносных клетках пластиды имеют довольно
простое внутреннее строение и могут быть классифицированы как
амилопласты; они встречаются у многих семян и подземных за-
пасающих органов. Паренхимные клетки в цветках и плодах ча-
сто содержат хромопласты. У некоторых семян в паренхиме запа-
сающей ткани или зародыша хранятся твердый белок или жиры.
В различных органах растения паренхимные клетки могут стано-
виться особенно заметными благодаря накоплению в вакуолях
антоцианов или таннинов или вследствие отложения в них кри-
сталлов той или иной формы.
Форма и расположение клеток
Паренхимные клетки сильно варьируют по форме (рис. 5.1),
но в типичном случае паренхима основной ткани состоит из кле-
ток, у которых длина немногим больше, чем ширина, или из почти
изодиаметрических клеток. Однако паренхимные клетки могут
быть и сильно удлиненными или в разной степени лопастными
(рис. 5.1,В — Д). Даже если паренхимные клетки почти изодиа-
метричны, они не являются шаровидными, а имеют много граней,
которыми они соприкасаются с соседними клетками (рис. 5.2).
В относительно однородной паренхиме содержатся клетки, у ко-
торых число граней в среднем равно четырнадцати. Геометриче-
ски правильной 14-сторонней фигурой является многогранник с
восемью шестиугольными и шестью четырехугольными гранями
(рис. 5.2,Л). Эта идеальная форма редко встречается среди рас-
тительных клеток (рис. 5.2, 5) [11]. Обычно они имеют различное
число граней даже в такой однородной паренхиме, какая часто
обнаруживается в сердцевине стеблей (рис. 5.2, В — В) [10]. Из-
менение среднего числа граней на клетку зависит от таких фак-
торов, как наличие клеток разных размеров в одной и той же тка-
ни, развитие межклетников и изменение формы клеток.
В различных типах паренхимы расположение клеток варьиру-
ет. Запасающая паренхима мясистых стеблей и корней богата
межклетниками, тогда как эндосперм семян, который обычно яв-
ляется компактной тканью, если и содержит межклетники, то
лишь небольших размеров. Сильное развитие межклетников в ме-
зофилле и вообще в хлоренхиме связано с потребностью фотосин-
тетической ткани в газообмене. Воздухоносные межклетники осо-
бенно хорошо развиты у покрытосеменных, произрастающих на
заболоченных почвах или в водной среде [8, 15, 16]. Благодаря
обилию межклетников такую ткань называют аэренхимой. Счи-
74
Глава 5
Рис. 5.1. Форма и структура оболочки паренхимных клеток (содержимое клеток
не показано). А, Б. Паренхима сердцевины стебля березы (Betula). В более
молодом стебле (А) клетки имеют только первичные оболочки, а в более ста-
ром (Б) также и вторичные. В, Г. Паренхима аэренхимного типа (В), которая
встречается в лакунах черешков и средних жилок (Г) листьев Саппа. Клетки
могут иметь много отростков. Д. Длинная ветвистая клетка из мезофилла диско-
видного цветка Gaillardia. 1 — межклетник; 2 — межклетники.
тается, что она имеет значение для аэрации растения (гл. 14).
Кроме того, такая ткань, очевидно, эффективна и в структурном
плане, поскольку она обеспечивает необходимую прочность при
минимальном количестве материала [21].
Описанные выше межклетники в различных тканях обычно
имеют схизогенное происхождение (гл. 4). Они могут сильно уве-
личиваться, если контакт между расходящимися клетками нару-
шается на значительной площади их соприкасающихся поверх-
ностей. Такое расхождение клеток сопровождается разрастанием
ткани в целом. В растущей ткани клетки поддерживают ограни-
ченную связь друг с другом с помощью лопастей или «ветвей»,
образующихся вследствие неравномерного роста клеток (рис. 5.1,
В, Д) [8]. У некоторых видов растений клетки не только растут,
но даже делятся рядом с межклетниками. При таких делениях
новые перегородки закладываются перпендикулярно к клеточным
стенкам, ограничивающим межклетники [7].
Паренхима и колленхима
75
Рис. 5.2. Форма паренхимных клеток. А. Схема геометрически правильного
14-гранника с восемью шестиугольными и шестью четырехугольными гранями
[11]. Б. Схема клетки из сердцевины Ailanthus [11]. Клетка имеет одну семи-
угольную, четыре шестиугольные, пять пятиугольных и четыре четырехугольные
грани (всего 14 граней). Пример клетки, приближающейся по форме к геометри-
чески правильному 14-граннику. В — Е. Схемы клеток сердцевины Eupatorium
[10]. Число граней составляет соответственно 10, 9, 16 и 20.
Клеточная оболочка
Клетки в активной основной паренхиме вегетативных органов,
в том числе и в мезофилле листьев, имеют относительно тонкие
оболочки, которые классифицируются как первичные (гл. 4). Сре-
динная пластинка в них не всегда различима (рис. 5.1,4). Для
таких оболочек обычны плазмодесмы, которые иногда концентри-
руются в первичных порах или в утолщенных участках оболочки,
а иногда распределяются по стенкам, имеющим равномерную тол-
щину. Субмикроскопическая структура первичных оболочек па-
ренхимы, по-видимому, довольно сильно варьирует даже в пре-
делах одной клетки [4]. В стебле целлюлозные микрофибриллы,
находящиеся в стенках, параллельных вертикальной оси растения,
ориентированы почти горизонтально (приспособлены к изгибу),
а в корне располагаются по спирали (приспособлены к растяже-
нию). Микрофибриллы в составе поперечных стенок или перекре-
щиваются почти под прямым углом друг к другу, или имеют сфе-
роидальную ориентацию, обусловливающую изображение маль-
тийского креста в поляризованном свете.
Иногда первичная оболочка сильно утолщается [1], что осо-
бенно характерно для запасающей паренхимы семян некоторых
растений (Asparagus, Coffea arabica, хурма Diospyros, финиковая
пальма Phoenix dactylifera). Углеводы таких оболочек рассмат-
76
Глава 5
риваются как запасные вещества, используемые зародышем во
время прорастания. У представителей многих таксонов паренхим-
ным клеткам, участвующим в межклеточном транспорте раство-
ренных веществ на короткое расстояние, свойствен особый тип
первичного утолщения оболочки (гл. 8, 13 и 18). Утолщение имеет
вид локальных выростов различной длины, направленных внутрь
клетки (фото 22). Поскольку плазмалемма прилегает к оболочке,
поверхность ее благодаря этим выростам сильно увеличивается
и основная масса протопласта оказывается тесно связанной с
ней. Клетки с выростами оболочек, обращенными в сторону про-
топласта, называют передаточными клетками [6], хотя клетки,
лишенные таких модифицированных оболочек, также могут уча-
ствовать в межклеточном переносе веществ. Иногда паренхимные
клетки образуют в определенных местах вторичные оболочки
(рис. 5.1,5). Паренхимные клетки древесины и сердцевины часто
имеют одревесневшие вторичные оболочки. Такие склерифициро-
ванные паренхимные клетки трудно отличить от типичных клеток
склеренхимы — склереид (гл. 6).
Колленхима
Колленхима, которую рассматривают как опорную ткань, со-
стоит из толстостенных клеток. Она очень близка к паренхиме.
Клетки обеих тканей содержат протопласты со всеми органелла-
ми, способные к возобновлению меристематической активности.
Для той и другой ткани характерны первичные и нелигнифици-
рованные оболочки клеток. Различие между этими двумя тканями
состоит главным образом в том, что у более специализированной
колленхимы оболочки толще и клетки длиннее, чем у большинства
типов паренхимных клеток. Однако в местах контакта эти ткани
в меньшей степени различаются между собой по толщине оболо-
чек и форме клеток, постепенно переходя одна в другую.
Колленхима отличается от другого представителя опорных тка-
ней — склеренхимы — структурой оболочек и состоянием прото-
пласта. Она имеет относительно мягкие, пластичные неодревес-
невшие первичные оболочки, тогда как для склеренхимы типичны
твердые, более или менее жесткие, вторичные оболочки, которые
обычно бывают одревесневшими. Колленхима сохраняет активные
протопласты, способные удалять утолщения оболочки после во-
зобновления индуцированными клетками меристематической ак-
тивности, что наблюдается, например, при образовании пробково-
го камбия (гл. 12) или в ответ на поранение ткани (фото 24,5).
У склеренхимы оболочки более устойчивы. Их, очевидно, нелегко
удалить, даже если протопласт в клетке и сохраняется. В зрелом
состоянии многие склеренхимные клетки лишены протопластов.
Паренхима и колленхима
Клеточная оболочка
Наиболее характерную особенность колленхимы составляет
структура клеточных оболочек. На свежих срезах оболочки выгля-
дят толстыми и блестящими, утолщения их часто распределены
неравномерно (рис. 5.3). Кроме целлюлозы они содержат большое
Рис. 5.3. Оболочки колленхимных клеток. А, В. Уголковая колленхима Salvia на
поперечном (А) и продольном (В) срезах. Б. Пластинчатая колленхима Astran-
tia. (Gaberlandt, Physiologische Pflanzenanatomie, 1904, p. 146.) / — срединная
пластинка; 2 — эпидерма.
78
Глава 5
количество пектина и гемицеллюлоз [14], но в них нет лигнина.
Поскольку пектиновые вещества гидрофильны, оболочки клеток
колленхимы богаты водой, что можно продемонстрировать, обра-
батывая свежие срезы колленхимы спиртом. Обезвоживающее
действие спирта вызывает заметное сжатие оболочек. На ультра-
структурном уровне в оболочках клеток колленхимы различных
типов обнаруживается слоистость: ламеллы с поперечной ориен-
тацией микрофибрилл чередуются с ламеллами, в которых фиб-
риллы ориентированы продольно [3, 20]. В оболочках клеток кол-
ленхимы, особенно в тех, которые имеют довольно равномерную
толщину, часто встречаются первичные поры [5]. Характер рас-
пределения утолщений клеточной оболочки изменяется в зависи-
мости от типа колленхимы. Если оболочка утолщена неравномер-
но, то наибольшей толщины она достигает в углах клетки или на
двух ее противоположных — наружной и внутренней — тангенци-
альных стенках. Колленхима с утолщениями оболочки, локализо-
ванными в углах клеток, обычно называется уголковой колленхи-
мой (рис. 5.3, А, В и фото 23), а с утолщениями на тангенциаль-
ных стенках — ламеллярной, или пластинчатой, колленхимой
(рис. 5.3,5). С возрастом тип оболочки может меняться вследст-
вие отложения в ней дополнительных слоев. Так, например, пер-
воначальное распределение утолщений оболочки, характерное для
уголковой колленхимы, может становиться все более неразличи-
мым (фото 24, Д) по мере того, как просвет клетки на поперечном
срезе уменьшается [5].
Наличие межклетников не является обязательной характери-
стикой колленхимы. В том случае, когда межклетники присутству-
ют в уголковом типе колленхимы, к ним всегда обращены утол-
щенные стенки клеток. Колленхима с таким распределением утол-
щений оболочки иногда выделяется в особый тип, называемый
рыхлой (лакунарной) колленхимой (фото 24,5). Если колленхима
не образует межклетников, то в углах, где соединяются друг с
другом несколько клеток, срединная пластинка утолщается
(рис. 5.3 и фото 23,5). Это утолщение иногда увеличивается за
счет накопления межклеточного вещества в потенциальных меж-
клетниках. Скорость этого накопления, по-видимому, варьирует,
поскольку межклетники могут возникать на ранних стадиях раз-
вития и лишь позднее заполняются пектиновыми веществами.
Там, где межклетники крупные, эти вещества не заполняют их
целиком, а образуют скопления в виде гребней или бородавок,
выступающих в межклетники [2, 5].
Клеточные оболочки колленхимы служат примером толстых
первичных оболочек. Утолщение таких оболочек происходит во
время роста клеток. Иными словами, имеет место одновременное
увеличение поверхности и толщины клеточной оболочки. Благо-
даря развитию столь мощного первичного утолщения рост кле-
Паренхима и колленхима
79
точных оболочек колленхимы представляет собой удивительное и
сложное явление, требующее дальнейшего изучения [9, 19].
Расположение колленхимы в растении
При обсуждении этого вопроса следует отличать толстостен-
ную ткань, которая возникает независимо от проводящих тканей
и находится в периферических зонах стебля и листа, т. е. коллен-
химу в строгом смысле, от толстостенной паренхимы, связанной
с проводящими тканями [5]. Эта паренхима, встречающаяся в
периферических частях флоэмы (наружной части проводящего
пучка) или ксилемы (внутренней части пучка), а иногда и полно-
стью окружающая проводящий пучок, состоит из удлиненных кле-
ток с толстыми первичными оболочками. По характеру утолщения
оболочки такая паренхима может напоминать колленхиму, осо-
бенно тот ее тип, которому свойственны равномерно утолщенные
оболочки. Паренхиму подобного рода часто действительно назы-
вают колленхимой, но из-за того, что она связана с проводящими
тканями, ход ее развития несколько отличается от хода развития
независимой колленхимы. Тонкая структура клеточных оболочек
у этих двух типов ткани также может быть различной. Удлинен-
ные клетки с толстыми первичными оболочками, ассоциированные
с проводящими пучками, можно называть колленхиматозными
паренхимными клетками, если необходимо подчеркнуть их сход-
ство с колленхимой. Этот термин может применяться и для ло-
кализованной в любой части растения паренхимы, напоминающей
колленхиму. В настоящем изложении речь идет только о незави-
симой периферической колленхиме.
Для колленхимы очень характерно периферическое положение.
Она располагается либо непосредственно под эпидермой (фото
24,5), либо на расстоянии одного или нескольких слоев от нее
(фото 24, Д). В стеблях колленхима часто образует сплошной
слой, расположенный по окружности вдоль оси стебля (гл. 17).
Она встречается, иногда в форме тяжей, в выступающих ребрах
многих травянистых стеблей и тех деревянистых, которые еще не
вступили в стадию вторичного роста. В черешках колленхима рас-
пределяется так же, как и в стеблях. В листовой пластинке она
находится в тех жилках, в которых проходят более крупные про-
водящие пучки, причем иногда она располагается по обеим сто-
ронам жилок, а иногда только с одной, обычно нижней, стороны
(гл. 18). Корни редко содержат колленхиму.
Связь структуры с функцией
Колленхима, по-видимому, приспособлена прежде всего для
выполнения функции опоры растущих листьев и стеблей. Ее обо-
80
Глава 5
лочки начинают утолщаться на ранних этапах развития побега,
однако образующееся утолщение пластично и способно к растя-
жению. Поэтому оно не препятствует удлинению стебля и листа.
На более продвинутой стадии развития колленхима как опорная
ткань сохраняется в тех частях растения (многие листья, некото-
рые травянистые стебли), для которых не характерна сильно раз-
витая склеренхима. В связи с обсуждением опорной роли коллен-
химы интересно отметить, что в развивающихся частях растения,
подвергаемых механическим нагрузкам (действию ветра или гру-
за, приложенного к наклонным побегам), утолшение оболочки
начинается раньше и становится более массивным, чем у растений,
которые не подвергались таким нагрузкам [13, 17, 18].
Зрелая колленхима — это прочная гибкая ткань, которая со-
стоит из длинных (до 2 мм в длину) [5] перекрывающих друг
друга клеток с толстыми неодревесневшими оболочками. По проч-
ности на разрыв клетки колленхимы вполне сопоставимы с волок-
нами. В старых частях растения колленхима может становиться
жесткой или превращаться в склеренхиму путем отложения вто-
ричных одревесневших оболочек [5, 20]. Если она не претерпевает
этих изменений, то ее роль как опорной ткани снижается вслед-
ствие развития склеренхимы в более глубоких частях стебля или
черешка. Более того, в стеблях с вторичным ростом основной опор-
ной тканью становится ксилема благодаря преобладанию в ней
клеток с одревесневшими вторичными оболочками и обилию длин-
ных перекрывающих друг друга клеток.
СПИСОК ЛИТЕРАТУРЫ
1. Bailey I. W. Cell wall structure of higher plants, Indus. Eng. Chem., 30, 40—
47 (1938).
2. Carlquist S. On the occurrence of intercellular pectic warts in Compositae,
Amer. J. Bot., 43, 425—429 (1956).
3. Chafe S. C. The fine structure of the collenchyma cell wall, Planta, 90, 12—21
(1970).
4. Czaja A. T. Untersuchungen uber die submikroskopische Struktur der Zellwan-
de von Parenchymzellen in Stengelorganen und Wurzeln, Planta, 51, 329—377
(1958).
5. Duchaigne A. Les divers types de colenchymes chez les Dicotyledones: leur
ontogenie et leur lignification, Ann. Sci. Nat, Bot. Ser., 11, 16, 455—479
(1955).
6. Gunning В. E. S., Pate J. S. «Transfer cells» — plant cells with wall ingrowths,
specialized in relation to short distance transport of solutes: their occurrence,
structure and development, Protoplasma, 68, 107—133 (1969).
7, Hulbary R. L. The influence of air spaces on the three-dimensional shapes of
cells in Elodea stems, and a comparison with pith cells of Ailanthus, Amer.
J. Bot, 31, 561—580 (1944).
8. Kaul R. B. Diaphragms and aerenchyma in Scirpus validus, Amer. J. Bot.,
58, 808—816 (1971).
9. Magin T. L’ontogenie du collenchyme chez Lamiutn album L., Rev. Cytol. Biol.
Veg., 17, 219—258 (1956).
Паренхима и колленхима
81
10. Marvin J. W. Cell shape and cell volume relations in the pith of Eupatorium
perfoliatum L., Amer. J. Bot., 31, 208—219 (1944).
11. Matzke E. B. What shape is a sell? Teach. Biol., 10, 34—40 (1940).
12. Matzke E. B., Duffy R. M. Progressive three-dimensional shape changes of
dividing cells within the apical meristem of Anacharis densa, Amer. J. Bot.,
43, 205—225 (1956).
13. Раздорский В. Ф. Архитектоника растений. — М.: Советская наука, 1955.
14. Roelofsen Р. A. The plant cell wall, Handbuch der Pflanzenanatomie, Band 3,
Teil 4, 1959.
15. Stant M. Y. Anatomy of the Alismataceae, Bot. J. Linn. Soc., 59, 1—42
(1964).
16. Stant M. Y. Anatomy of the Butomaceae, Bot. J. Linn. Soc., 60, 31—60
(1967).
17. Venning F. D. Stimulation by wind motion of collenchyma formation in celery
petioles, Bot. Gaz., 110, 511—514 (1949).
18. Walker W. S. The effect of mechanical stimulation and etiolation on the col-
lenchyma of Datura stramonium, Amer. J. Bot., 47, 717—724 (1960).
19. Wardrop A. B. The mechanism of surface growth in parenchyma of Avena
coleoptiles, Aust. J. Bot., 3, 137—148 (1955).
20. Wardrop A. B. The structure of the cell wall in lignified collenchyma of
Eryngium sp. (Umbelliferae), Aust. J. Bot., 17, 229—240 (1969).
21. Williams W. T., Barber D. A. The functional significance of aerenchyma in
plants, Soc. Exp. Biol. Symp., 15, 132—144 (1961).
22. Завалишина С. Ф. Хлоропласты в тканях стелы у покрытосеменных расте-
ний. — ДАН СССР, 1951, № 78, с. 137—139.
6 К. Эзау, кн. 1
Глава 6
Склеренхима
Основные структурные особенности склеренхимы были описа-
ны в гл. 5, где сравнивались две главные опорные ткани — скле-
ренхима и колленхима. Клетки склеренхимы имеют вторичные
оболочки, которые откладываются внутрь от первичных оболочек
после того, как последние прекращают рост растяжением. Вто-
ричные оболочки образуются также у водопроводящих и часто у
паренхимных клеток ксилемы. Кроме того, склерификацию могут
претерпевать паренхимные клетки других тканевых зон. Таким
образом, вторичные оболочки характерны не только для клеток
склеренхимы, и следовательно, не существует четкой границы
между типичными склеренхимными клетками и склерифицирован-
ной паренхимой, с одной стороны, и водопроводящими клетками—
с другой. Трудности с отграничением склеренхимы как ткани воз-
никают еще и потому, что ее клетки часто разбросаны поодиночке
или небольшими группами среди клеток других типов.
В настоящей главе склеренхима рассматривается на примере
механических, или опорных, клеток, которые в основном и при-
дают тканям прочность или жесткость. Обычно склеренхимные
клетки подразделяются на две группы — склереиды и волокна.
Между яими нет резких различий, но волокно, как правило, пред-
ставляет собой длинную узкую клетку, длина которой во много
раз больше, чем ширина, тогда как склереиды варьируют по фор-
ме от почти изодиаметрических до значительно вытянутых в дли-
ну клеток; некоторые типы склереид могут сильно ветвиться. Хотя
в зрелых склеренхимных клетках протопласт может сохраняться,
это не является общим правилом. Такая вариабельность еще боль-
ше усложняет разграничение между склеренхимными клетками и
клетками склерифицированной паренхимы.
Склереиды
Склереиды широко распространены в теле растения и сильно
варьируют по форме. Обычно эти клетки имеют толстые вторич-
ные оболочки, сильно одревесневшие и снабженные многочислен-
ными, чаще всего простыми, порами. Склереиды классифицируют
по форме клеток, но такая классификация имеет ограниченное
применение, так как одна форма клеток часто незаметно переходит
Рис 6 1 Склереиды А, Б Каменистые клетки из мякоти плода груши (Pyrus)
В, Г Склереиды из первичной коры стебля воскового плюща (Ноуа, В — вид на
срезе, Г — вид с поверхности) Д, Е Склереиды эндокарпия плода яблони (Ма-
lus) Ж Колончатая склереида с разветвленными концами из палисадного мезо-
филла Hakea 3, И Склереиды из черешка Camellia К Астросклереида из пер-
вичной коры стебля Trochodendron Л Слой эпидермальных склереид в лукович-
ной чешуе чеснока (Allium sativum) М, Н Нитевидные склереиды из мезофилла
листа маслины (Olea) О — Р Склереиды из субэпидермального слоя семенной
кожуры фасоли (Phaseolus), имеющие форму песочных часов (О, П — вид сбо-
ку, Р — вид сверху) С, Т Эпидермальные склереиды — макросклереиды — с вы-
емчатыми утолщениями оболочки из семенной кожуры фасоли (Phaseolus,
С — вид сбоку, Т — вид сверху) 1 — ветвистая пора, 2 — простая пора 3 — по-
лость клетки
6*
84
Глава 6
в другую. Обычно выделяют следующие типы склереид: брахи-
склереиды, или каменистые клетки, имеющие приблизительно изо-
диаметрическую или несколько удлиненную форму (рис. 6.1,
А — Г); макросклереиды — удлиненные палочковидные клетки
(рис. 6.1, С); остеосклереиды — клетки, напоминающие по форме
трубчатую кость, т. е. столбчатые клетки, расширенные на кон-
цах; астросклереиды — звездчатые клетки с лопастями или ответ-
влениями, отходящими от центральной части клетки (рис. 6.1,/С);
трихосклереиды — клетки, напоминающие волоски растений с от-
ветвлениями, которые проникают в межклетники; нитевидные
склереиды — длинные, похожие на волокна клетки, иногда раз-
ветвленные (рис. 6.1,Л4,//). Астросклереиды и трихосклереиды
имеют сходное строение, а трихосклереиды связаны постепенными
переходами с нитевидными склереидами. Остеосклереиды на кон-
цах могут разветвляться, что сближает их с трихосклереидами.
Распределение склереид в растении
Распределение склереид среди других клеток представляет
особый интерес в связи с проблемами дифференциации клеток
у растений. Склереиды могут встречаться в виде более или менее
протяженных слоев или скоплений клеток, но часто они распола-
гаются поодиночке среди других типов клеток, от которых они
могут резко отличаться толстыми оболочками, а зачастую и при-
чудливой формой. Одиночные склереиды относятся к идиобластам.
Изучение дифференциации идиобластов выдвигает много пока еще
не решенных вопросов о причинных связях в развитии того или
иного рисунка тканей у растений [7].
Склереиды встречаются в эпидерме, основной и проводящих
тканях. В последующих разделах описываются склереиды из раз-
личных частей тела растения, за исключением тех, которые нахо-
дятся в проводящих тканях.
СКЛЕРЕИДЫ В СТЕБЛЯХ
По периферии проводящей зоны стебля Ноуа carnosa склереи-
ды образуют сплошной цилиндр, а в сердцевине стеблей Ноуа и
Podocarpus они встречаются группами. Эти склереиды имеют уме-
ренно толстые оболочки и многочисленные поры (рис. 6.1,В, Г).
По форме и размеру они напоминают смежные паренхимные клет-
ки. Это сходство часто рассматривается как свидетельство того, что
такие склереиды по своему происхождению являются склерифици-
рованными паренхимными клетками. Их склерификация, однако,
зашла настолько далеко, что их можно классифицировать как скле-
реиды, а не как паренхимные клетки. Примерами склереид этого
простого типа могут служить каменистые клетки, или брахискле-
Склеренхима
85
рейды. Сильно разветвленные астросклереиды находятся в пер-
вичной коре стебля Trochodendron (рис. 6.1,К). Несколько менее
ветвистые склереиды встречаются в первичной коре Pseudotsuga
taxifolia.
СКЛЕРЕИДЫ В ЛИСТЬЯХ
Листья являются особенно богатым источником склереид в
отношении разнообразия их формы. В мезофилле различаются
два основных типа распределения склереид — диффузное, когда
они рассеяны по всей ткани листа (Trochodendron, Osmanthus,
Olea, Pseudotsuga), и терминальное, когда они локализованы
только на концах мелких жилок [6—8]. У некоторых защитных
листовых структур, например у чешуй луковичек чеснока Allium
sativum, из склереид состоит вся эпидерма или часть ее (рис. 6.1,
Л).
Склереиды с четкими ответвлениями или только с шипиками
встречаются в основной ткани черешка Camellia (рис. 6.1,3, И)
и в мезофилле листа Trochodendron. Мезофилл Osmanthus и Hakea
содержит столбчатые склереиды, на каждом конце которых на-
ходятся разветвления (рис. 6.1,Ж). Monstera deliciosa, Nymphaea
(кувшинка) и Nuphar (кубышка) имеют типичные трихосклереи-
ды с ответвлениями, проникающими в крупные межклетники, или
воздушные камеры, характерные для листьев этих видов (гл. 19).
Ветвистые склереиды можно найти в листьях хвойных, например
у Pseudotsuga taxifolia.
Склереиды листа маслины (Olea еигораеа) представляют зна-
чительный интерес вследствие того, что они достигают большой
длины (рис. 6.1, М, Н), составляющей в среднем 1 мм [2]. Такие
склереиды правомерно называть волокновидными или нитевид-
ными. Они возникают как в палисадной, так и в губчатой парен-
химе, образуя в мезофилле густую сеть.
СКЛЕРЕИДЫ В ПЛОДАХ
В плодах склереиды занимают различное положение. У груши
(Pyrus) и айвы (Cydonia) одиночные или собранные в группы
каменистые клетки, или брахисклереиды, разбросаны в мякоти
плода (рис. 6.1,Л,Б). При образовании групп склереид в плодах
груши деления клеток происходят концентрически вокруг несколь-
ких сформировавшихся ранее склереид; новые клетки также ста-
новятся склереидами (гл. 22) [19]. Благодаря такому способу
развития возникает радиальное расположение паренхимных кле-
ток вокруг зрелых скоплений склереид. Склереиды в плодах гру-
ши и айвы часто содержат ветвистые поры, образующиеся в ре-
зультате слияния одного или нескольких каналов во время утол-
щения оболочки (рис. 6.1,5).
86
Глава 6
Яблоко (у Malus) служит еще одним примером распростра-
нения склереид в плодах. Его хрящевидный эндокарпий, окружа-
ющий семена, состоит из наклонно ориентированных слоев удли-
ненных склереид (рис. 6.1, Д,Е). Склереиды составляют также
твердую скорлупу ореховидных плодов и каменистый эндокарпий
каменистых плодов.
СКЛЕРЕИДЫ В СЕМЕНАХ
Затвердение семенной кожуры во время созревания семян про-
исходит часто в результате образования вторичных оболочек в
клетках эпидермы и лежащего под ней слоя (или слоев) тканей.
Хорошим примером такой склерификации являются семена бобо-
вых (гл. 23). В семенах фасоли {Phaseolus), гороха {Pisum) и
сои {Glycine) эпидерма состоит из столбчатых макросклереид,
а под эпидермой располагаются призматические склереиды
(рис. 6.1,0 — Р) или остеосклереиды, имеющие форму трубчатой
кости. Семенная кожура кокосовой пальмы {Cocos nucifera) со-
держит склереиды с многочисленными ветвистыми порами.
Волокна
Подобно склереидам, волокна встречаются в различных час-
тях растения. У двудольных волокна особенно характерны для
проводящих тканей. Это флоэмные и ксилемные (или древесин-
ные) волокна. У однодольных волокна или полностью окружают
каждый проводящий пучок наподобие обкладки, или образуют
тяжи с одной или обеих сторон проводящего пучка («пучковые
колпачки»); они составляют также тяжи или слои, которые, оче-
видно, не зависят от проводящих тканей. Волокна ксилемы будут
рассмотрены в гл. 8. Настоящая глава касается главным образом
экстраксилярных волокон (т. е. расположенных снаружи от кси-
лемы), включающих флоэмные волокна двудольных и волокна
однодольных независимо от того, связаны они с проводящими
пучками или нет.
Волокна — это длинные клетки с более или менее толстыми
вторичными оболочками. Обычно они образуют тяжи (фото 25),
которые и составляют технические «волокна». Для получения
технического волокна растения подвергают процессу, называемо-
му мочкой, в результате которого пучки волокон отделяются от
связанных с ними неволокнистых клеток. В отдельном тяже во-
локна расположены таким образом, что они перекрывают друг
друга, и благодаря этому пучки волокон приобретают особую
прочность. В отличие от оболочек колленхимы оболочки волокон
гидратированы лишь в небольшой степени. Поэтому они тверже
Склеренхима
87
оболочек колленхимы и упруги, но не пластичны. Волокна служат
опорными элементами для тех частей растения, которые уже
больше не удлиняются. Степень одревеснения волокон варьирует,
поры в них относительно редки и обычно щелевидны.
Флоэмные волокна встречаются во многих стеблях. Стебель
льна (Linum usitatissimum) содержит только одно кольцо волокон,
имеющее в ширину несколько слоев клеток и расположенное по
наружной границе проводящего цилиндра (фото 25). Эти волокна
возникают в самой ранней части первичной флоэмы, но созревают
как таковые лишь после того, как данная часть флоэмы перестает
выполнять функцию проведения веществ. Следовательно, волокна
льна относятся к первичным флоэмным волокнам. В стеблях бу-
зины (Sambucus), липы (Tilia), тюльпанного дерева (Lirioden-
dron), винограда (Vitis), робинии (Robinia pseudoacacia') и мно-
гих других растений волокна расположены по периферии флоэмы
(первичные флоэмные волокна), а также во вторичной флоэме
(вторичные волокна; рис. 6.4). Вторичные флоэмные волокна мо-
гут иметь и хвойные (Sequoia, Thuja).
На периферии проводящего цилиндра стебли некоторых дву-
дольных содержат первичные волокна, которые возникают не как
составные части флоэмной ткани, а снаружи от нее. Эти волокна
обычно называют перициклическими. Однако термин «перицикли-
ческие волокна» часто употребляется также и для первичных
флоэмных волокон (определение термина «перицикл» см. в гл. 16).
Технические волокна
Технические лубяные волокна представляют собой флоэмные
волокна двудольных [10]. Они классифицируются как мягкие, так
как независимо от того, одревеснели эти волокна или нет, они
сравнительно мягкие и гибкие. Ниже перечислены некоторые хо-
рошо известные волокнистые растения и изготовляемые из их
волокон изделия: конопля (Cannabis sativa)—канатно-веревоч-
ные изделия; джут (Corchorus capsularis)—канатно-веревочные
изделия и грубые ткани; кенаф (Hibiscus cannabinus)—грубые
ткани; лен (Linum usitatissimum) —ткани (например, полотно),
нитки; рами (Boehmeria nivea) —ткани. Флоэмные волокна не-
которых двудольных используются для изготовления бумаги [4 .
Волокна однодольных, обычно называемые листовыми [10],
так как их получают из листьев, классифицируются как твердые
волокна. Они имеют сильно одревесневшие оболочки, обусловли-
вающие их твердость и жесткость. Ниже приведены примеры рас-
тений с листовыми волокнами и изделий из них: абака, или ма-
нильская конопля (Musa textilis) канатно-веревочные изделия;
все представители рода Sansevieria — канатно-веревочные изделия;
генекен (различные виды Xgywe) — канатно-веревочные изделия,
88
Глава 6
грубые ткани; новозеландская конопля (Phormium tenax)—ка-
натно-веревочные изделия; Ananas comosus — ткани; сизаль
(Agave sisalana)—канатно-веревочные изделия. Листовые волок-
на (вместе с ксилемой) таких однодольных, как кукуруза (Zea
mays), сахарный тростник (Saccharum officinarum), эспарто
(Stipa tenacissima) и др., служат сырьем для изготовления бумаги
[4].
Длина отдельных волокон у различных видов растений значи-
тельно варьирует. Данные о таких колебаниях можно найти в
справочнике Харриса [10]. В качестве примеров лубяных волокон
можно привести джут (0,8—0,6 мм), коноплю (5—55 мм), лен
(9—70 мм), рами (50—250 мм), а листовых волокон — сизаль
(0,8—8,0 мм), представителей рода Sansevieria (1—7 мм), абаку
(2—12 мм), новозеландскую коноплю (2—15 мм).
Технический термин «волокно» часто употребляют для обозна-
чения материалов, которые в ботаническом смысле содержат по-
мимо волокон также и другие типы клеток и даже структуры,
вообще не относящиеся к волокнам. Так, листовые волокна одно-
дольных обычно включают проводящие элементы. Хлопковое во-
локно представляет собой эпидермальные волоски семян Gossypi-
ит (гл. 7), рафия состоит из сегментов листьев пальмы Raphia,
ротанг изготовляется из стеблей пальмы Calamus.
Развитие склереид и волокон
Развитие ветвистых и длинных склереид и волокон, которые
обычно имеют большую длину, связано со значительными меж-
клеточными перестройками, свидетельствующими об известной
независимости этих клеток от их положения, на что уже было
обращено внимание в гл. 2. В самом начале своего развития вет-
вистая склереида может по виду не отличаться от соседних па-
ренхимных клеток. Однако позднее, вместо того чтобы равномерно
увеличиваться в размерах, она образует выступы, которые удли-
няются и превращаются в ветви. Удлиняющиеся ветви не только
внедряются в межклетники, но и продвигаются между оболочками
других клеток (рис. 6.2) [9]. Таким образом, склереида в про-
цессе роста устанавливает новые контакты и достигает значи-
тельно большего размера, чем соседние клетки. Если ткань рых-
лая, то ответвления склереиды свободно проникают в межклет-
ники.
Рост клеток путем их внедрения между оболочками других кле-
ток носит название интрузивного, или интерпозиционного, роста,
в противоположность согласованному росту, во время которого
не происходит разъединения оболочек. Согласованный рост груп-
пы сходных клеток в однородной паренхимной ткани происходит,
100 мкм
Рис. 6.2. Развитие склереид в листе Osmanthus (Oleaceae). А — В. Дифферен-
цирующиеся склереиды изображены в виде клеток с крупными ядрами и точка-
ми вдоль оболочек. Г. Зрелые склереиды (отмечены поперечной штриховкой вто-
ричных оболочек). На всех рисунках клетки мезофилла и эпидермы указаны
кружками или овалами. Узкие межклетники, характерные для палисадной парен-
химы, не показаны. А. Будущая склереида отмечена с помощью условных обо-
значений, она пока еще не дифференцировалась от других палисадных клеток.
Б. Молодая склереида вышла за пределы палисадного слоя. В. Две молодые
склереиды достигли нижней эпидермы, пройдя через губчатый мезофилл. Г. Зре-
лые склереиды имеют несколько ответвлений, направленных параллельно эпи-
дерме или вдающихся в межклетники. Поры во вторичных оболочках распола-
гаются в тех частях склереид, которые во время роста не потеряли связи со
смежными клетками t[9]. 1 — слой палисадной паренхимы; 2 — трихом; 3 — эпи-
дерма; 4 — межклетники; 5 — палисадный мезофилл; 6 — губчатый мезофилл;
7 — жилка; 8 — устьице.
90
Глава 6
вероятно, тогда, когда пары смежных первичных оболочек растя-
гиваются с одинаковой скоростью, без нарушения контактов меж-
ду соседними клетками по срединной пластинке. Согласованный
рост не исключает того, что одни клетки могут стать длиннее
других. Если данная клетка прекращает делиться, в то время как
деление соседних клеток еще продолжается, неделящаяся клетка
становится длиннее, чем соседние с ней клетки, без нарушения
связи между их оболочками. В процессе роста склереиды согла-
сованный рост основного тела клетки сочетается с интрузивным
ростом удлиняющихся частей ответвлений. На рис. 6.2, Г показа-
но, что поры расположены в тех частях склереид, которые благо-
даря согласованному росту сохранили свой первоначальный кон-
такт со смежными клетками. Участки, лишенные пор, росли ин-
трузивно.
У волокон также наблюдается сочетание согласованного и
интрузивного роста. На самых ранних стадиях развития волокно
удлиняется без изменения клеточных контактов, в то время как
смежные паренхимные клетки еще продолжают активно делиться.
Несколько позднее начинается дополнительное удлинение волокна
путем интрузивного роста, происходящего по обоим его концам.
Во время удлинения волокно может стать многоядерным в ре-
зультате многократных ядерных делений без последующего об-
разования новых клеточных стенок. Пока волокно остается живой
клеткой, в его цитоплазме обнаруживается вращательное движе-
ние [И]. Опыты с применением красителей показали, что это
явление связано с межклеточным транспортом веществ.
Апикальный интрузивный рост был подробно изучен на при-
мере волокон льна [17]. Измеряя молодые и старые междоузлия
и содержащиеся в них волокна, авторы подсчитали, что если бы
волокна росли только путем согласованного роста, то их длина
достигала бы лишь 1—1,8 см. В действительности же они обна-
ружили волокна, длина которых колебалась между 0,8 и 7,5 см.
Таким образом, длина свыше 1,8 см может быть достигнута толь-
ко в результате апикального интрузивного роста. Растущие кон-
чики молодых волокон, извлеченные из живых стеблей, имели
тонкие оболочки, содержали густую цитоплазму (рис. 6.3, А — В)
с хлоропластами и не плазмолизировались. Когда кончики пере-
ставали расти, они заполнялись веществом вторичной оболочки
(рис. 6.3, Г — Е).
Интрузивный рост можно выявить на поперечных срезах стеб-
лей и корней по внешнему виду мелких клеток (растущих кончи-
ков волокон), расположенных среди более широких, не удлиня-
ющихся частей молодых волокон. Это можно наглядно проиллю-
стрировать на вторичных проводящих тканях Sparmannia
(Tiliaceae) (рис. 6.4,А) [16]. Первоначально упорядоченное ра-
диальное расположение клеток, наблюдаемые в камбии, сменяет-
Склеренхима
91
ся мозаичным их расположением в осевой системе флоэмы. На
данном срезе видно, что к каждой более широкой части молодого
волокна (выделенной на рис. 6.4, Л диагональной штриховкой)
путем интрузивного удлинения добавляются 3—5 растущих кон-
чиков волокон. Радиальное расположение клеток в осевой системе
ксилемы нарушается не столь сильно, так как ксилемные волокна
удлиняются в меньшей степени, чем флоэмные (рис. 6.3,Ж — Л).
Как можно видеть на продольных радиальных срезах, биполяр-
ный апикальный рост волокон приводит к тому, что эти клетки
разрастаются выше и ниже горизонтальных уровней камбиальных
клеток, среди которых они закладываются (рис. 6.4,5).
Рис 6 3 Апикальный интрузивный рост волокон стеблей А — Е Волокна из
флоэмы льна (Linum регеппе) [7] Ж— К Волокна из ксилемы Sparmannta
(Tiliaceae). Л Волокна из флоэмы Sparmannta 3, К Увеличенные изображения
частей волокон Е и И соответственно А — В Интрузивно растущие концы воло-
кон (внизу) имеют тонкие оболочки и густую цитоплазму Г — Е Концы воло-
кон после завершения роста заполнились веществом оболочки Ж — Л Волокна
разрослись в обоих направлениях от их первоначального положения в камбии
(между прерывистыми линиями) [15] Поры встречаются только в исходных
камбиальных частях Флоэмное волокно (Л) значительно длиннее ксилемных
волокон (Е, И) 1 — межклетник, 2 — вещество оболочки, 3 — пора, 4 — длина
камбиальной клетки
92
Глава 6
Рис. 6.4. Развитие волокон во вторичной флоэме и вторичной ксилеме Sparman-
nia (Tiliaceae), показанное на поперечном (А) и продольном радиальном (Б)
срезах стебля. (Воспроизводится из работы [16] с некоторыми изменениями.)
А. Цифрами / — IV обозначены ряды клеток осевой (продольной) системы.
Эти ряды чередуются с лучами. Флоэма и ксилема, расположенные рядом с
камбием, находятся в незрелом состоянии. Зрелая ксилема имеет вторичные
оболочки. В зрелой флоэме видны обозначенные точками клетки-спутники, кото-
рые служат для идентификации ситовидных элементов, и волокна, представлен-
ные клетками со вторичными оболочками. Клетки с диагональными линиями —
средние части молодых волокон. Им сопутствуют мелкие клетки, большая часть
которых представляет собой концы интрузивно растущих волокон. Расположен-
ные в ксилеме клетки с перекрестной штриховкой являются интрузивно расту-
щими концами ксилемных волокон. Б. Ксилемные волокна с обеих сторон вышли
за пределы камбиальной зоны i[16]. 1— осевая система; 2— волокно; 3— луч;
4 — ситовидный элемент; 5 — флоэма; 6 — камбий; 7 — ксилема; 8 — молодые
ксилемные волокна; 9 — зрелые ксилемные волокна; 10 — камбиальная зона;
11 — паренхима.
Склеренхима
93
Если во время интрузивного роста кончик волокна упирается
в другие клетки, то он изгибается или раздваивается (рис. 6.3,
И, К). Таким образом, наличие согнутых и раздвоенных концов
у волокон (и склереид)—еще один признак интрузивного роста.
Во вторичных оболочках интрузивно растущих частей волокна
поры обычно не образуются, и это позволяет измерять степень
апикального удлинения (рис. 6 3, Ж — Л) [15].
Длительный апикальный интрузивный рост волокон и некото-
рых склереид обусловливает довольно сложный характер вторич-
ного утолщения оболочек этих клеток. Как уже говорилось, вто-
ричная оболочка обычно наслаивается изнутри на первичную,
после того как последняя перестает растягиваться. У интрузивно
растущих волокон и склереид более старая часть клетки прекра-
щает свой рост, в то время как ее концы продолжают удлиняться.
Более старая экваториальная часть клетки начинает формировать
слои вторичной оболочки до завершения роста концов. Вторичное
утолщение распространяется от средней части клетки по направ-
лению к концам и завершается после прекращения их роста.
После отложения вторичной оболочки некоторые волокна и
склереиды претерпевают правильные митотические деления и раз-
деляются септами из первичных оболочек на два и более отсека
[12]. Септы контактируют, но не сливаются с вторичной оболочкой,
которая отделяет их от первичной оболочки клетки (рис. 6.5, Д).
По-видимому, нет никаких данных, указывающих на то, что при
таком типе цитокинеза в каждом отсеке происходит отложение
слоев первичной оболочки на вторичную, однако после деления
клеток иногда образуется дополнительная вторичная оболочка,
которая покрывает и септы (рис. 6.5,5) [3]. Волокна и склереиды,
разделенные септами, сформировавшимися после образования вто-
ричной оболочки, называют септированными.
В ряде работ были рассмотрены факторы, контролирующие
развитие склеренхимы. Нанесение надрезов на листья Camellia
[5] и Fagraea [14] вызывало дифференциацию склереид вблизи
обнаженной поверхности, и этот результат интерпретировался как
доказательство того, что в развитии склеренхимы большую роль
играет ее положение. Исследования гормональных факторов по-
казали, что на развитие склереид оказывает влияние уровень
ауксина в листе [I, 13]. Если концентрация ауксина была высо-
кой, то развитие склереид ускорялось, тогда как при низкой
концентрации гормона клеточные оболочки оставались тонкими
и не одревесневали. Развитие волокон также было объектом экс-
периментальных исследований [18]. Обработка гибберелловой
кислотой вызывала значительное увеличение длины и диаметра
первичных флоэмных волокон конопли, джута и кенафа. Наклон
щелевидных пор становился более крутым, их частота и ширина
уменьшались, а длина увеличивалась. Увеличение длины волокон
94
Глава 6
Рис 6 5 Л Септированное во-
локно из флоэмы стебля вино-
града (Vitis) Септы соприка-
саются с пористой вторичной
оболочкой Б Септированная
склереида из флоэмы Pereskia ЮОМКМ
(Cactaceae), септы покрыты
веществом вторичной оболочки
[3]. / — вторичная оболочка;
2 — септа.
у обработанных растений сопровождалось удлинением междоуз-
лий. Как уже говорилось, длина волокон коррелирует с длиной
междоузлий и при нормальном развитии. Было показано, что
влияние гибберелловой кислоты на поры связано с изменением
ориентации целлюлозных микрофибрилл, вызванным, очевидно,
интенсивным растяжением клеточной оболочки. Кроме того, на-
блюдалось увеличение толщины оболочки, что указывало на уси-
ленный синтез углеводов.
СПИСОК ЛИТЕРАТУРЫ
1. Al-Talib К. Н, Torrey J. G. Sclereid distribution in the leaves of Pseudotsuga
under natural and experimental conditions, Amer. J. Bot, 48, 71—79 (1961).
2. Arzee T Morphology and ontogeny of foliar sclereids of Olea europaea.
I Distribution and structure, Amer. J Bot, 40, 680—687 (1953) II Ontogeny,
Amer. J. Bot, 40, 745—752 (1953)
Склеренхима
95
3. Bailey I. W. Comparative anatomy of the leaf-bearing Cactaceae, II. Structure
and distribution of sclerenchyma in the phloem of Pereskia, Pereskiopsis and
Quiabentia, J. Arnold Arb., 42, 144—150 (1961).
4. Carpenter С. H., Leney L., Core H. A., Cote W. A., Jr., Day A. C. Papermaking
fibers, Tech. Publ. No. 74 of State University College of Forestry at Syracuse
University (1963).
5. Foard D. E. Pattern and control of sclereid formation in the leaf of Camellia
japonica L., Nature, 184, 1663—1664 (1959).
6. Foster A. S. Structure and ontogeny of terminal sclereids in Boronia serrula-
ta, Amer. J. Bot., 42, 551—560 (1955).
7. Foster A. S. Plant idioblasts: remarkable examples of cell specialization, Pro-
toplasma, 46, 184—193 (1956).
8. Govindarajalu E., Parameswaran IV. On the morphology of the foliar sclereids
in the Salvadoraceae, Beitr. Biol. Pflanz., 43, 41—57 (1967).
9. Griffith M. M. Development of sclereids in Osmanthus fragrans Lour., Phy-
tomorphology, 18, 75—79 (1968).
10. Harris M., ed. Handbook of textile fibers, Washington, Harris Research La-
boratories, 1954.
11. Mitchell J. W., Worley J. F. Intracellular transport apparatus of phloem fi-
bers, Science, 145, 409—410 (1964).
12. Parameswaran N., Liese W. On the formation and fine structure of septate
wood fibres of Ribes sanguineum, Wood Sci. Techn., 3, 272—286 (1969).
13. Rao A. N., Singarayar M. Controlled differentiation of foliar sclereids in
Fagraea fragrans, Experientia, 24, 298—299 (1968).
14. Rao A. IV., Vaz S. J. Morphogenesis of foliar sclereids. II — Effects of expe-
rimental wounds on leaf sclereid development and distribution in Fagraea
fragrans, J. Singapore Acad. Sci., 1, 1—7 (1970).
15. Schoch-Bodmer H. Spitzenwachstum und Tiipfelverteilung bei sekundaren
Fasern von Sparmannia, Beih. Z. Schweiz. Forstver., 30/107—112 (1960).
16. Schoch-Bodmer H., Huber P. Wachstumstypen plastischer Pflanzenmembranen,
Mitt. Naturforsch. Ges. Schaffhausen, 21, 29—43 (1946).
17. Schoch-Bodmer H., Huber P. Das Spitzenwachstum der Bastfasern bei Linum
usitatissimum und Linum perenne, Ber. Schweiz. Bot. Ges., 61, 377—404
(1951).
18. Stant M. Y. The effect of gibberellic acid on fibre-cell length, Ann. Bot., 25,
453—462 (1961). The effect of gibberellic acid on cell width and the cell wall
of some phloem fibres, Ann. Bot, 27, 185—196 (1963).
19. Staritsky G. The morphogenesis of the inflorescence, flower and fruit of Pyrus
nivalis Jacquin var. orientalis Terpo, Meded. Landbouwhogesch. Wageningen,
70, 1—91 (1970).
20. Worley J. F. Rotational streaming in fiber cells and its role in translocation,
Plant Physiol., 43, 1648—1655 (1968).
Глава 7
Эпидерма
Эпидерма — это система разнообразных по структуре и функ-
циям клеток, составляющих вместе покров первичного тела расте-
ния. Поскольку эта ткань находится в контакте с внешней средой,
многие ее структурные особенности связаны с теми специфичес-
кими функциями, которые обусловлены таким положением. При-
сутствие жирового вещества кутина в наружной стенке и на ее
поверхности (кутикула) ограничивает транспирацию. Устьица
связаны с газообменом. Благодаря компактному расположению
клеток и наличию относительно плотной кутикулы эпидерма вы-
полняет механическую функцию. Эпидерма молодых корней спе-
циализируется в направлении абсорбции, о чем свидетельствуют
тонкие стенки эпидермальных клеток и корневые волоски. Есть
вполне достоверные данные о том, что эпидерма является местом
первичного восприятия света в ходе возбуждения таких светоза-
висимых реакций растения, как циркадное движение листьев и
фотопериодическая индукция [20]. Эпидерма может существовать
в течение всей жизни данного растения или его части или позднее
может замещаться другой защитной тканью — перидермой (гл. 12).
Обычно эпидерма бывает однослойной (фото 26). Однако у
некоторых растений клетки протодермы листьев делятся парал-
лельно поверхности (периклинально) и их производные могут де-
литься вновь, в результате чего формируется ткань, состоящая из
нескольких слоев клеток, имеющих общее онтогенетическое про-
исхождение. Такая ткань называется многослойной эпидермой
(фото 27). Веламен корней (гл. 14) также служит примером мно-
гослойной эпидермы. В многослойной эпидерме листа наружный
слой клеток обладает особенностями, свойственными эпидермаль-
ным клеткам, тогда как другие слои обычно развиваются в бес-
хлоропластную ткань или ткань, содержащую сравнительно не-
большое количество хлоропластов. Одна из функций, приписывае-
мых такой ткани — запасание воды. У некоторых растений
субэпидермальные слои напоминают слои многослойной эпидер-
мы, но образуются из основной ткани. Следовательно, многослой-
ная эпидерма может быть идентифицирована только при изучении
ее в развитии.
Эпидерма
97
Рис. 7.1. Трехмерное изображение эпидермальных клеток листа Aloe aristata
(Liliaceae). Верхняя сторона на каждом рисунке соответствует наружной стенке
эпидермы, противоположная сторона является стенкой, обращенной к мезофил-
лу. (Matzke, Amer. J. Bot., 34, 182—195, 1947.)
СОСТАВ
Эпидерма состоит из относительно неспециализированных кле-
ток, слагающих основную массу ткани, и более специализирован-
ных клеток, рассеянных в этой ткани. Основные эпидермальные
клетки различаются по степени протяженности в глубину, но чаще
всего имеют таблитчатую форму (рис. 7.1). В удлиненных частях
растения, таких, как стебли, черешки, жилки листа и листья боль-
шинства однодольных, эпидермальные клетки вытянуты в направ-
лении длинной оси органа (рис. 7.2). В листьях, лепестках, завязях
и семяпочках эпидермальные клетки могут иметь волнистые вер-
тикальные (антиклинальные) стенки.
Рис. 7.2. Эпидерма злака — сахарного тростника (Saccharum); вид с поверхно-
сти листа А Нижняя эпидерма с устьицами. Б. Эпидерма стебля с опробковев-
шими и окремневшими клетками. 1 — побочная клетка; 2 — замыкающая клетка;
3 — опробковевшая клетка; 4 — окремневшая клетка.
7 К. Эзау, кн. 1
98
Глава 7
Эпидермальные клетки имеют живые протопласты и способны
запасать различные продукты обмена. В этих клетках есть пла-
стиды, которые обычно формируют всего несколько гран и, сле-
довательно, содержат сравнительно мало хлорофилла. Однако в
эпидерме растений затененных мест обитания встречаются фото-
синтетически активные хлоропласты. В пластидах эпидермальных
клеток могут присутствовать крахмал и белковые кристаллы, а в
вакуолях — антоцианы.
К группе специализированных эпидермальных клеток относят-
ся прежде всего замыкающие клетки устьиц, функционально свя-
занные с побочными клетками; этих последних иногда может и
не быть. У многих растений эпидермальные клетки формируют
выросты — трихомы, различающиеся по форме, структуре и функ-
циям. Наиболее распространенный вид трихом — волоски. Клетки,
содержащие таннины, масла, кристаллы и другие вещества, либо
разбросаны поодиночке (идиобласты), либо располагаются в оп-
ределенном порядке. У Роасеае (злаков), например, окремневшие
клетки (заполненные кремнеземом, затвердевающим в виде тел
различной формы) и опробковевшие клетки (имеющие суберини-
зированную оболочку) встречаются попарно и чередуются с более
крупными эпидермальными клетками вытянутой формы (рис. 7.2,
Б). Для Роасеае и других однодольных характерны также ряды
крупных пузыревидных эпидермальных клеток (гл. 19). У пред-
ставителей разных таксонов в эпидерме обнаружены склеренхим-
ные клетки. Роасеае могут иметь эпидермальные волокна длиной
300 нм. В некоторых семенах и чешуях эпидерма иногда преиму-
щественно или полностью образована склереидами (гл. 6). Эпи-
дерма некоторых частей растения может быть сформирована сек-
реторными клетками (гл. 13).
Развитие
Эпидерма дифференцируется из поверхностного слоя меристе-
мы— протодермы, или дерматогена, который образуется путем
лериклинальных делений клеток в развивающемся зародыше
(гл. 24). При дифференциации эпидермы протекают различные
процессы, обусловливающие разнообразие клеток в первоначаль-
но однородной меристематической ткани (гл. 2). У злаков, напри-
шер, асимметричные деления эпидермальных клеток приводят к
формированию коротких и длинных клеток, и только первые из
них лдают начало специализированным клеткам и клеточным ком-
плексам: трихомам, замыкающим клеткам устьиц, парам опроб-
ковевших и окремневших клеток [13]. Тот факт, что короткая
клетка имеет плотное содержимое, а длинная клетка сильно ва-
куолизирована, объясняют поляризацией цитоплазмы, предшест-
Эпидерма
99
Рис 7 3 Полоски эпидермы из корня
Elodea canadensis, показаны моло-
дые мелкие трихобласты, из которых
формируются корневые волоски (Л,
отмечены точками) и (Б) сходные
клетки, после того как из них разви-
лись корневые волоски [5] 1 — три-
хобласты, 2 — корневой волосок
вующей клеточному делению: цитоплазма скапливается в одном
конце клетки, из которого в дальнейшем формируется меньшая
из двух дочерних клеток [3]. Если описывать ход событий более
точно, то следует отметить, что ядро и окружающая его цитоплаз-
ма мигрируют в ту часть клетки, где должен произойти митоз.
Аналогичные миграции ядер наблюдаются в клетках, соседних с
предшественницей замыкающих клеток, при формировании побоч-
ных клеток (рис. 7.9).
У представителей некоторых таксонов неравные деления про-
исходят при развитии клеток, формирующих корневые волоски —
трихобласты (рис. 7.3). Мелкие плотные трихобластные дочерние
клетки характеризуются значительными цитологическими и био-
химическими отличиями. У Hydrocharis, например, трихобласты от-
личаются от более крупных и длинных сестринских клеток боль-
шими размерами ядра и ядрышка, более простыми пластидами,
более высокой ферментативной активностью, большим содержа-
нием нуклеогистонов, общего белка, РНК и ядерной ДНК [7].
Все эти особенности свидетельствуют о заторможенном развитии
клетки, которая готовится к интенсивному одностороннему росту,
приводящему к формированию корневого волоска.
Опробковевшие и окремневшие клетки эпидермы злаков'
(рис. 7.2), имея общую предшественницу, развиваются в различ-
ных направлениях Опробковевшая клетка растет и суберинизи-
руется, тогда как окремневшая клетка лишается протопласта и
заполняется кремнеземом. Отложение кремнезема происходит, по-
видимому, путем пассивного неметаболического механизма [30].
7*
100
Глава 7
Закономерное распределение специализированных клеток в
эпидерме обычно объясняют, исходя из концепции, согласно ко-
торой клетки или группы клеток, занимающие определенное поло-
жение и обладающие меристематической активностью — меристе-
моиды, — предотвращают появление других меристемоидов в не-
посредственной близости. Так, например, полагают, что развива-
ющееся устьице ингибирует закладку других устьиц в ближайшем
окружении [3, 16]. Исключения из этого правила, однако, не-
редки.
Зрелая эпидерма обычно не обладает меристематической ак-
тивностью, но часто сохраняет способность к росту в течение дли-
тельного времени. В стеблях многолетних растений, где перидерма
появляется поздно или не образуется совсем, эпидермальные клет-
ки продолжают делиться в связи с периферическим ростом осей.
В том случае если перидерма образуется, эпидерма может да-
вать начало ее меристеме — феллогену (гл. 12). Из эпидермы
могут возникать придаточные почки [10]. С появлением метода
культуры ткани стало возможно получать из эпидермальных кле-
ток зародышеподобные структуры [15].
Оболочка клетки
Оболочки эпидермальных клеток у разных растений, а также
в разных частях одного и того же растения сильно различаются
по толщине. В том случае, когда эпидерма в целом тонкостенная,
наиболее утолщенными являются наружные стенки оболочки. Эпи-
дерма с чрезвычайно утолщенными оболочками свойственна листь-
ям хвойных (гл. 19); эти утолщенные оболочки, которые, вероятно,
являются вторичными, почти целиком заполняют просвет клетки
и лигнифицируются. В некоторых случаях клеточная оболочка
может становиться окремнелой, как у злаков. На антиклинальных
и внутренних периклинальных (соседних с мезофиллом) стенках
оболочки эпидермальных клеток обычно встречаются первичные
поровые поля и плазмодесмы. Как упоминалось в гл. 4, на на-
ружных стенках эпидермальных клеток иногда наблюдаются об-
ласти с широкими межфибриллярными просветами — тейходы
(ранее именовавшиеся эктодесмами).
Важной особенностью эпидермы является наличие в клеточных
оболочках жирового вещества — кутина. Это вещество либо ин-
крустировано в наружной стенке, либо присутствует в виде само-
стоятельного слоя — кутикулы — на поверхности эпидермы [19].
Процесс пропитывания целлюлозной оболочки кутином носит на-
звание кутинизации, а формирование кутикулы — кутикуляриза-
ции. Кутикула варьирует по толщине, и на ее развитие большое
влияние оказывают условия окружающей среды [5]. Кутикула в
Эпидерма
101
виде сплошной пленки покрывает всю надземную часть растения,
а в некоторых случаях отмечено ее наличие в абсорбирующей
зоне корня и даже на корневых волосках. Кутикула снаружи
обычно покрыта восковым налетом, образованным гладкими плас-
тинками или палочками и филаментами, выступающими над по-
верхностью [Н]. Последний вид восковых отложений создает впе-
чатление «опушения», придающего листу серовато-зеленый отте-
нок. Характер распределения эпикутикулярного воска может быть
самым разнообразным, он хорошо выявляется при наблюдениях
в сканирующем электронном микроскопе [8]. Кутикула, кутинизи-
рованная оболочка под ней и поверхностный воск служат для
сокращения потери воды растением. При промышленном изготов-
лении изюма обработка винограда химикатами, ускоряющими вы-
сыхание плодов, вызывает спрессовывание восковых пластиночек
и их параллельную ориентацию. Это изменение, по-видимому, об-
легчает выход воды из плодов в атмосферу [25]. Эпикутикуляр-
ный воск обусловливает, кроме того, такое свойство эпидермаль-
ной поверхности, как несмачиваемость, препятствуя контакту жид-
кости с листовой поверхностью [9, 27].
Комплекс кутикулы и кутинизированной оболочки имеет слож-
ную организацию. В состав этого комплекса входят целлюлоза,
пектиновые соединения, кутин, воск и некоторые другие инкрусти-
рующие вещества. На рис. 7.4 в качестве примера показано рас-
пределение этих компонентов в наружной стенке нижней эпидермы
листа груши [23]. Начиная с нижней части схемы, слои идут в
следующем порядке: целлюлозная оболочка; слой пектина, про-
никающего частично в расположенный ниже целлюлозный слой
и расположенную выше кутикулу; кутикула с содержащимся в
ней вблизи поверхности воском, характеризующимся двойным лу-
Рис. 7 4 Схема организации наружной стенки клеток верхней эпидермы листа
груши (Pyrus communis) с детальным изображением кутикулярного и воскового
слоев [23]. 1 — кутиновый матрикс; 2 — эпикутикулярный воск; 3 — кутикула;
4— пектиновые вещества; 5 — целлюлозная оболочка; 6 — двоякопреломляющий
слой воска, погруженный в кутин; 7 — антиклинальная стенка.
102
Глава 7
чепреломлением; пластиночки эпикутикулярного воска. Кутикула
более проницаема там, где воск, отличающийся двойным луче-
преломлением, прерывается изотропным материалом. Двойное лу-
чепреломление чаще бывает прерывистым над антиклинальными
стенками эпидермальных клеток, там же обычно тоньше слой
воска. Известно, что поверхность, расположенная над антикли-
нальными стенками, легче, чем другие участки поверхности листа,
теряет воду и впитывает вещества, наносимые на лист. Показанное
на схеме сокращение толщины кутикулы над антиклинальной
стенкой является общим свойством эпидермы листьев.
Кутин и воск (или их предшественники) синтезируются в
живых протопластах и выделяются на поверхность через оболоч-
ку. Пока неясно, транспортируются ли эти вещества повсеместно
через оболочку или только по специальным каналам (тейходам,
например). Точно так же неясно, имеются ли специальные поры
для транспорта эпикутикулярного воска на поверхность. Посколь-
ку и кутин и воск выделяются на поверхность через оболочку,
они пропитывают ее на большем или меньшем протяжении. Иног-
да кутикулярные слои образуются также в кортикальных клетках,
в этом случае возникает защитная ткань, именуемая кутикуляр-
ным эпителием [4].
Устьица
Встречаемость и функции
Устьица представляют собой отверстия (устьичные щели или
апертуры) в эпидерме, ограниченные двумя специализированными
эпидермальными клетками, которые называют замыкающими
(фото 28). Замыкающие клетки, изменяя свою форму, вызывают
открывание или закрывание устьичной щели. Термином «устьице»
принято обозначать весь комплекс — отверстие и замыкающие
клетки. Устьица обычно окружены клетками, не отличающимися
от других основных клеток эпидермы (рис. 7.10,Л). Однако у
многих растений устьица ограничены с двух или со всех сторон
клетками, отличающимися по форме, а иногда и по содержимому
от обычных эпидермальных клеток. Эти особые клетки носят на-
звание побочных клеток (рис. 7.10, Б, В), они участвуют в изме-
нениях осмотического давления, приводящих в движение замыка-
ющие клетки.
Устьица встречаются на всех надземных частях растений, но
более всего они распространены в листьях. Корни обычно ли-
шены устьиц. Плотность распределения устьиц варьирует очень
сильно. Она различна и на разных частях одного листа, и на раз-
ных листьях одного и того же растения и в значительной степени
Эпидерма
103
10 мкм
Юмкм
Рис 7 5 Устьица у представителей разных групп растений А, Д, И Вид устьиц
с поверхности листа На других рисунках изображены срезы устьиц в плоско-
стях, показанных на рис А Б, Е, К — в плоскости аа, В, Ж, Л — в плоскости
bb, Г, 3, М — в плоскости сс Д Срез замыкающей клетки через центральную,
наиболее узкую часть На рис А радиальными линиями изображена радиальная
мицеттяция клеточной оболочки (Prunus и Pinus, Esau, Plant Anatomy, 2nd ed ,
John Wiley & Sons 1965 ) 1 — побочная клетка, 2 — замыкающая клетка, 3— не-
лигнифицированная оболочка, 4 — лигнифицированная оболочка
подвержена влиянию условий окружающей среды. В листьях
устьица могут располагаться на обеих сторонах или только на
одной из них, обычно нижней. Устьица также различаются по
уровню расположения относительно поверхности эпидермы. Не-
которые из них расположены вровень с другими эпидермальными
клетками, другие подняты выше или погружены ниже поверхности.
Замыкающие клетки у двудольных (рис. 7.5, А —Г) имеют фор-
му серпа с закругленными концами, или, говоря иначе, почковид-
104
Глава 7
ную форму — такими они видны с поверхности листа. На верхней
и нижней стенках оболочки или только на верхней имеются ха-
рактерные выступы (гребни). Кутикула, покрывающая наружную
стенку клеток, распространяется и на поверхности, обращенные
к устьичной щели и подустьичной камере. Устьица могут быть
полностью покрыты воском [28]. Каждая из замыкающих клеток
имеет крупное ядро и хлоропласты, которые периодически накап-
ливают крахмал. Вакуолярная система характеризуется различной
степенью расчленения на отдельные вакуоли.
Среди однодольных у Роасеае замыкающие клетки устьиц ха-
рактеризуются однообразной специфической структурой (рис. 7.5,
Д — 3). С поверхности листа видно, что клетки являются узкими
в средней части и расширены на обоих концах. Данные электрон-
ной микроскопии свидетельствуют о том, что протопласты замы-
кающих клеток связаны друг с другом посредством пор, располо-
женных в расширенных концах клеток. В связи с такой непрерыв-
ностью протоплазмы замыкающих клеток их следует рассматривать
как единое физиологическое целое, где изменения тургора проис-
ходят одновременно. Поры возникают в результате неполного раз-
вития оболочки [14, 31]. Ядро растянуто вдоль клетки, оно округ-
лое на обоих концах и узкое, почти нитевидное, в середине. У этих
растений обычно имеются две побочные клетки, по одной с каж-
дой стороны устьица.
Устьица голосеменных (рис. 1.Ъ,И — М) обычно глубоко по-
гружены в ткань и иногда кажутся как бы подвешенными к по-
бочным клеткам, которые нависают над ними. Характерной осо-
бенностью устьиц хвойных является то, что оболочки и замыкаю-
щих, и побочных клеток частично лигнифицированы, нелигнифи-
цированными остаются только тонкие участки оболочки, обращен-
ные к устьичной щели (рис. 7.5, Л).
Хотя у представителей большинства таксонов замыкающие
клетки имеют свои характерные черты строения, все они сходны
в том отношении, что антиклинальная стенка, удаленная от усть-
ичной щели (дорсальная стенка), тоньше и поэтому более эластич-
на, чем другие стенки, особенно тангенциальные. Принято считать,
что эта особенность имеет прямое отношение к способности за-
мыкающих клеток изменять форму в ответ на изменение тургора
и контролировать таким образом величину устьичного отверстия.
Согласно другой гипотезе, радиальное расположение микрофиб-
рилл целлюлозы (радиальная мицелляция, показанная радиально
ориентированными линиями на рис. 7.5, Я [1; 26]) в оболочке за-
мыкающих клеток играет более важную роль в движениях устьи-
ца, чем неравномерное утолщение оболочки. Радиальная ориен-
тация микрофибрилл в замыкающих клетках была установлена
с помощью поляризационной оптики и электронной микроскопии
[26].
Эпидерма
105
Возможная роль радиальной мицелляции в движении замыка-
ющих клеток была изучена с помощью специально сконструиро-
ванных моделей и проанализирована с привлечением математи-
ческого аппарата. Модели состояли из эластичных латексных ци-
линдров, соединенных в пары своими концами и укрепленных для
жесткости витками тесьмы. Витки тесьмы располагались радиаль-
но подобно мицеллам и предотвращали увеличение цилиндров в
длину при наполнении газом. На рис. 7.6 показаны результаты
таких экспериментов, на основании которых авторы считают ра-
диальную ориентацию микрофибрилл решающим фактором, об-
условливающим движение дорсальных стенок и раскрывание усть-
ичной щели.
Механизм устьичных движений является предметом интенсив-
ных исследований и дискуссий [18, 26]. Один из факторов, вызы-
вающих движение замыкающих клеток, — транспорт калия между
замыкающими и соседними клетками: устьице открывается при
увеличении количества ионов калия в замыкающих клетках. В ре-
акции устьиц на свет существенную роль играет изменение кон-
центрации СОг. При открывании устьиц, когда ионы калия входят
в замыкающие клетки, из хлоропластов исчезает крахмал; в пе-
риод закрывания устьиц восстановление запасов крахмала проис-
ходит параллельно потере ионов калия. Первоначальная гипотеза
о том, что расщепление крахмала вызывает увеличение осмоти-
ческого давления в замыкающих клетках вследствие образования
сахара, в настоящее время сменилась предположением, согласно
которому гидролиз крахмала приводит к накоплению органиче-
ских анионов, с чем и связано поглощение калия.
Рис. 7.6. Модели для изучения влияния радиального расположения микрофиб-
рилл в оболочке замыкающих клеток на механизм открывания устьиц. (Рисунки
по фотографиям из работы [1].) А. Два цилиндра из латекса, скрепленные на
концах и частично наполненные газом. Б. Та же модель при более высоком дав-
лении; между цилиндрами появляется узкий просвет. В. Витки тесьмы на наду-
тых цилиндрах имитируют радиальную мицелляцию клеточных стенок. Щель
шире, чем на Б. Г. Радиальные витки смещаются к концам цилиндров и некото-
рые из них ориентируются вдоль «вентральной» стенки. Дальнейшее наполнение
воздухом привело к еще большему расширению щели.
106
Глава 7
Вопрос о том, участвуют ли плазмодесмы в транспорте веществ
между устьичными и соседними клетками, не решен окончательно.
У одних видов в замыкающих клетках плазмодесмы либо вообще
не найдены, либо обнаруживаются только в развивающихся усть-
ицах; у других они обнаружены и в зрелых устьицах [29, 31].
Развитие устьичных комплексов
и их зрелая структура
Развитие устьиц в листе начинается незадолго до завершения
основного периода меристематической активности в эпидерме и
продолжается в течение значительной части периода роста листа
растяжением. В листьях с параллельным жилкованием и с рас-
положением устьиц продольными рядами (как у большинства
однодольных) формирование устьиц начинается вблизи верхушки
листа и распространяется к его основанию. В листьях с сетчатым
жилкованием (как у большинства двудольных) наблюдается мо-
заичное расположение устьиц, находящихся на различных стадиях
развития.
В ходе развития устьиц у покрытосеменных материнская клет-
ка, или клетка-предшественница замыкающих клеток, обычно об-
разуется в результате неравного деления протодермальной клетки
и является меньшей из двух дочерних клеток (рис. 7.7, А, Г). Эта
меньшая клетка в свою очередь образует две замыкающие клетки
(рис. 7.7, А,Б,Д), которые в результате неравномерного растя-
жения приобретают свойственную им форму. Межклеточное веще-
Рис. 7.7. Развитие устьиц в листе сахарной свеклы (Beta vulgaris). А, Г. Путем
деления протодермальных клеток образуются предшественницы замыкающих
клеток (материнские клетки). Б, Д. Материнская клетка делится на две замы-
кающие клетки. В, Г. Формируется устьичная щель. А — В. Виды с поверхности.
Г — Е. Срезы. 1 — предшественница замыкающих клеток; 2 — подустьичная ка-
мера.
Эпидерма
107
ство между замыкающими клетками набухает (рис. 7.7,5), и связь
между клетками ослабевает. Они разъединяются в средней части,
вследствие чего образуется устьичное отверстие (рис. 7.7, В,Е).
Взаимное расположение замыкающих и соседних с ними клеток
различно, так что замыкающие клетки могут либо возвышаться
над поверхностью эпидермы, либо погружаться в ткань листа.
Соседние клетки могут образовывать свод над замыкающими клет-
ками или располагаются под ними, внедряясь в подустьичную
камеру.
Побочные клетки и клетки других типов, соседние с устьицами,
могут возникать из тех же предшественниц, что и устьице, или из
клеток, которые не имеют непосредственного онтогенетического
родства с материнской клеткой замыкающих клеток. Исходя из
этого, выделяют три основных типа устьиц [24]: 1) мезогенный —
замыкающие и соседние с ними клетки, которые могут дифферен-
цироваться, а могут и не дифференцироваться как побочные клет-
ки, имеют общее происхождение (рис. 7.8); перигенный — соседние
или побочные клетки не имеют общего происхождения с замыка-
ющими клетками (рис. 7.9); мезоперигенный— по меньшей мере
одна из соседних или побочных клеток непосредственно связана
происхождением с устьицем, другие — не связаны.
В процессе развития устьица с мезогенными побочными клет-
ками (рис. 7.8) предшественница устьичного комплекса формиру-
ется путем асимметричного деления протодермальной клетки и в
результате двух последующих ее делений образуются материнская
Рис. 7.8. Развитие устьица с мезогенными побочными клетками в листе Thunber-
gia erecta (Paliwal, Phytomorphology, 16, 527—539, 1966). А. Эпидермальные
клетки делятся и дают начало небольшой клетке — предшественнице устьичного
комплекса. Б. Предшественница делится, давая начало одной из побочных кле-
ток. В. Формируются вторая побочная клетка и предшественница замыкающих
клеток. Г Устьичный комплекс сформирован полностью в результате деления
предшественницы замыкающих клеток. 1 — сестринские клетки; 2 — побочная
клетка; 3 — предшественница замыкающих клеток; 4 — замыкающие клетки.
108
Глава 7
Рис 7 9 Развитие устьичного комплекса в междоузлии овса (Avena sativa).
Побочные клетки являются перигенными. (Рисунки по микрофотографиям из
работы [14]). А. Две короткие клетки — предшественницы замыкающих клеток,
Б. Слева ядро длинной клетки в положении, предшествующем делению, приводя-
щему к образованию побочной клетки; справа такое деление уже завершилось.
В. Предшественница замыкающих клеток перед митозом. Г. Предшественница
замыкающих клеток в анафазе. Д. Сформированный, но еще не достигший зре-
лости устьичный комплекс из двух замыкающих и двух побочных клеток.
Е. Клетки устьичного комплекса в период растяжения. Ж. Зрелый устьичный
комплекс. 1 — предшественница замыкающих клеток; 2 — побочные клетки;
3— замыкающие клетки; 4 — ядра; 5 — клеточная оболочка.
клетка замыкающих клеток и две побочные. Еще одно деление
приводит к формированию двух замыкающих клеток.
Происхождение перигенных побочных клеток можно просле-
дить на схеме, иллюстрирующей последовательность дифферен-
циации устьичного комплекса у злаков (рис. 7.9). Предшествен-
ницей замыкающих клеток служит более короткая дочерняя клет-
ка, образующаяся путем неравного деления протодермальной
клетки. Побочные клетки образуются по сторонам от этой корот-
кой клетки в результате неравных делений двух смежных с ней
клеток. После образования замыкающих клеток ростовые взаи-
моотношения складываются так, что побочные клетки становятся
интегральными частями устьичного комплекса.
Разная последовательность событий в развитии приводит к
различиям в топографии устьичных комплексов. Характер распо-
ложения полностью дифференцированных замыкающих и соседних
Эпидерма
109
с ними клеток используется для таксономических целей. Следует,
однако, помнить, что морфологически сходные очертания могут
складываться в ходе неодинакового развития и что последователь-
ность событий в развитии не может быть восстановлена по окон-
чательной структуре устьица [32]. Поэтому Меткаф и Чок [21]
при классификации устьичных комплексов двудольных пользуют-
ся исключительно описательными терминами, не касаясь развития.
В зависимости от конфигурации эти авторы различают следующие
основные типы устьиц: 1) аномоцитный (беспорядочный)—усть-
ице не имеет побочных клеток (рис. 7.10,Л); 2) анизоцитный (не-
равноклетный)—устьице окружено тремя побочными клетками,
одна из которых заметно меньше, чем две другие (рис. 7.10,5);
3) парацитный (параллельноклетный)—одна или более побочных
клеток располагаются с каждой стороны устьица параллельно
длинной его оси (рис. 7.10,5); 4) диацитный (перекрестноклет-
ный)—устьице имеет две побочные клетки, смежные стенки ко-
торых перпендикулярны длинной оси устьица (рис. 7.10, Г);
5) актиноцитный (радиальноклетный)—устьице окружено не-
сколькими побочными клетками, длинные оси которых располага-
ются радиально по отношению к замыкающим клеткам. У одного
Рис. 7.10. Характер распределения замыкающих и соседних с ними клеток (вид
с поверхности листа). А. Аномоцитный (Citrullus). Б. Анизоцитный (Sedum)
В. Парацитный (Vigna). Г. Диацитный (Dianthus). 1 — побочные клетки.
no
Глава 7
Рис. 7.11. Типы развития устьиц у однодольных (схемы) [32]. Л. Неравное де-
ление, приводящее к формированию небольшой клетки-предшественницы (пока-
зана на Б), окруженной 4 клетками, расположенными крестообразно. В — Д.
Наклонные и другие деления соседних клеток, приводящие к образованию
4 производных (отмечены точками), находящихся в контакте с замыкающими
клетками. Е — 3. Формирование устьичных комплексов без наклонных делений.
Е. Контактными клетками становятся исходные соседние клетки, две латеральные
(/) и две терминальные (t). Ж. Контактными клетками становятся производные
двух латеральных клеток (отмечены точками) и две веделившиеся терминальные
клетки. 3. Контактными клетками становятся производные всех четырех сосед-
них клеток (отмечены точками). Д. Тип, характерный для пальм. Ж. Тип, свой-
ственный злакам.
и того же вида растений могут быть устьица разного типа, причем
характер клеток может меняться в процессе развития листа.
У большинства однодольных строение устьичного комплекса
более отчетливо связано с последовательностью развития. Том-
линсон [32], обследовавший около 100 видов из всех основных
семейств однодольных, выделяет следующие основные типы кон-
фигурации устьичных комплексов, связанные с особенностями их
развития (рис. 7.11). Предшественница замыкающих клеток на-
ходится в контакте с четырьмя окружающими клетками (Б). Они
могут не делиться и сохраняться как контактные клетки в зрелом
Эпидерма
11Г
комплексе (£). Иногда окружающие клетки делятся и дают про-
изводные (на рисунке они отмечены точками). Устьичный комп-
лекс в этом случае может быть определен как комбинация замы-
кающих клеток с соседними клетками и их производными (Ж)
или комбинация замыкающих клеток только с производными со-
седних клеток (Д, 3). Таким образом, либо все контактные клетки
являются производными (Д, 3), либо одни из них производные,
а другие — неделившиеся соседние клетки (Ж). У представителей
одних семейств производные соседних с устьицем клеток форми-
руются путем делений в плоскостях, расположенных под некото-
рым углом по отношению к предшественнице замыкающих клеток
(В — Д), у представителей других семейств такие деления не
встречаются (Е-3).
Трихомы
К трихомам (рис. 7.12 и гл. 13) относятся самые разнообраз-
ные выросты эпидермы, включая железистые (или секреторные)
и нежелезистые волоски, чешуйки, папиллы и абсорбционные во-
лоски корней [33]. Такие выросты встречаются на всех частях
растения и могут существовать в течение всей жизни органа или
быть эфемерными. Некоторые из постоянных волосков сохраня-
ются живыми; другие отмирают и становятся сухими. Трихомы
обычно очень разнообразны по структуре и внутри больших и
внутри малых групп растений, но иногда они отличаются большим
постоянством строения внутри определенного таксона, в связи с
чем их используют для таксономических целей [6, 21].
Функции большинства типов трихом неизвестны. Работы по
изучению влияния волосков на потерю воды растением не дали
однозначных результатов, но очевидно, что трихомы способны
защищать мезофилл от перегрева [2]. Изучение пузырчатых во-
лосков листьев Atriplex halimus (гл. 13) показало, что волоски
этого типа могут способствовать выведению солей из ткани листа
и таким образом предотвращать накопление токсичных солей в
растении [22]. Трихомы защищают растения от насекомых [17];
причем часто бывает так, что чем гуще опушено растение, тем
реже насекомые используют его в качестве пищи или места для
откладки яиц; соответственно и личинки насекомых реже поедают
опушенные растения. На крючковатые трихомы насекомые и их
личинки просто накалываются. Секреторные трихомы участвуют
в химической защите.
В зависимости от морфологии трихомы классифицируют на
несколько категорий. Вот некоторые из них: 1) волоски, которые
могут быть одноклеточными или многоклеточными, железистыми
(гл. 13) или нежелезистыми (рис. 7.12, Л, Д ТС С); 2) чешуйки
io мкм
Рис. 7.12. Трихомы. А. Простой волосок из листа Cistus-, у его основания форми-
руется полость в результате отложения окремневшей оболочки. Б. Однорядный
волосок из листа Saintpaulia. В, Г. Волосок в виде пучка из листа хлопчатника
(Gossypium). Д. Звездчатый волосок из листа грудинки колючей (Sida).
Е. Древовидный волосок из листа лаванды (Lavandula). Ж. Короткий много-
клеточный волосок из листа картофеля (Solanum). 3, И. Пельтатная чешуйка
из листа маслины (Olea). К. Двуклеточный волосок из стебля Pelargonium.
Л — И. Хлопчатник (Gossypium), эпидермальные волоски из семени (Л) в мо-
лодом возрасте (М) и зрелые, с вторичным утолщением оболочки (И). О. Пу-
зырчатый волосок Mesembryanthemum. П—С. Три стадии развития волосков
листа соевых бобов (Glycine). 1 — зародышевый мешок; 2 — нуцеллус; 3— про-
водящий пучок; 4 — интегумент; 5 — полость; 6 — вторичная оболочка.
Эпидерма 113
или пельтатные волоски (рис. 7.12,3,77); 3) водяные пузырьки,
которые образуются путем растяжения эпидермальных клеток
(рис. 7.12,О); 4) корневые волоски (гл. 14). Волоски могут рас-
полагаться в виде пучков (рис. 7.12,3,7"), в виде звезды (звезд-
чатые, рис. 7.12, Д), могут быть ветвящимися (дендроидными,
рис. 7.12,3). Волоски семян хлопчатника — сырье хлопчатобумаж-
ной промышленности [12]—являются одноклеточными и форми-
руют при созревании вторичную оболочку (рис. 7.12, Л — 77).
Развитие трихом варьирует по степени сложности в зависимо-
сти от их окончательной формы и структуры. Одноклеточные во-
лоски хлопчатника, например, образуются путем удлинения про-
тодермальных клеток (рис. 7.12, Л, М). Вторичная оболочка от-
кладывается после того, как удлинение полностью заканчивается
(рис. 7.12, Н). Многоклеточные трихомы имеют специфические за-
кономерности деления и роста клеток, иногда довольно простые
(рис. 7.12,77 — С), иногда более сложные [12].
СПИСОК ЛИТЕРАТУРЫ
1. Aylor D. Е., Parlange J.-Y., Krikorian A. D. Stomatai mechanics, Amer. J. Bot.,
60, 163—171 (1973).
2. Black R, F. The leaf anatomy of Australian members of the genus Atriplex.
I. Atriplex vesicaria Heward and A. nummularia LindL, Aust. J. Bot., 2, 269—
286 (1954).
3. Banning E. Morphogenesis in plants. Survey of Biological Progress, 2, 105—
140, New York, Academic Press (1952).
4. Calvin C, L. Anatomy of the aerial epidermis of the mistletoe, Phoradendron
flavescens, Bot. Gaz., 131, 62—74 (1970).
5. Cormack R. G. H. The development of root hairs by Elodea canadensis, New
Phytol., 36, 19—25 (1937).
6. Cowan J. M. The Rhododendron leaf; a study of epidermal appendages, Edin-
burgh, Oliver and Boyd, 1950.
7. Cutter E. G., Feldman L. J. Trichoblasts in Hydrocharis. I. Origin, differen-
tiation, dimensions, and growth, Amer. J. Bot., 57, 190—201. (1970) II. Nucleic
acids, proteins and a consideration of cell growth in relation to polyploidy,
Amer. J. Bot., 57, 202—211 (1970).
8. Davis D. G. Scanning electron microscopic studies of wax formation on leaves
of higher plants, Can. J. Bot., 49, 543—546 (1971).
9. Edlington G., Hamilton R. J. Leaf epicuticular waxes, Science, 156, 1322—
1335 (1967).
10. Gulline H. F. Experimental morphogenesis in adventitious buds in flax, Aust.
J. Bot., 8, 1—10 (1960).
11. Hall D. M., Matus A. I., Lamberton J. A., Barber H. N. Infraspecific variation
in wax on leaf surfaces, Aust. J. Biol. Sci., 18, 323—332 (1965).
12. Joshi P. C., Wadhwani A. M., Johri В. M. Morphological and embryological
studies of Gossypium L., Proc. Natl. Inst. Sci. India, 33, 37—93 (1967).
13. Kaufman P. B., Petering L, B., Soni S. L. Ultrastructural studies on cellular
differentiation in internodal epidermis of Avena sativa, Phytomorphology, 20,
281—309 (1970).
14. Kaufman P. B., Petering L. B., Yocum C. S., Bale D. Ultrastructural studies
on stomata development in internodes of Avena sativa, Amer. J. Bot., 57,
33—49 (1970).
8 К. Эзау, кн. 1
114
Глава 7
15. Konar R. N., Nataraja K. Experimental studies in Ranunculus sceleratus L. De-
velopment of embryos from the stem epidermis, Phytomorphology, 15, 132—
137 (1965).
16. Korn R. W. Arrangement of stomata on the leaves of Pelargonium zonule
and Sedum stahlii, Ann. Bot., 36, 325—333 (1972).
17. Levin D. A. The role of trichomes in plant defense, Quart. Rev. Biol., 48 (Pt. 1),
3—15 (1973).
18. Levitt J. The mechanism of stomatai movement — once more, Protoplasma,
82, 1 — 17 (1974).
19. Martin J. T., Juniper В. E. The cuticles of plants, London, Edward Arnold,
1970.
20. Mayer W., Moser L, Banning E. Die Epidermis als Ort der Lichtperzeption fur
circadiane Laubblattbexvegungen und photoperiodische Induktionen, Z. Pflan-
zenphysiol., 70, 66—73 (1973).
21. Metcalfe C. R., Chalk L. Anatomy of the dicotyledons, 2 vols., Oxford, Claren-
don Press, 1950.
22. Mozafar A., Goodin J. R. Vesiculated hairs: a mechanism for salt tolerance in
Atriplex halimus L., Plant Physiol., 45, 62—65 (1970).
23. Norris R. F., Bukovac M. J. Structure of the pear leaf cuticle with special re-
ference to cuticular penetration, Amer. J. Bot., 55, 975—983 (1968).
24. Pant D. D. On the ontogeny of stomata and other homologous structures, Plant
Sci. Ser. Allahabad, 1, 1—24 (1965).
25. Possingham J. V. Surface wax structure in fresh and dried Sultana grapes,
Ann. Bot., 36, 993—996 (1972).
26. Raschke K- Stomatai action, Ann. Rev. Plant Physiol., 26, 309—340 (1975).
27. Rentschler I. Die Wasserbenetzbarkeit von Blattoberflachen und ihre sub-
mikroskopische Wachsstruktur, Planta, 96, 119—135 (1971).
28. Rentschler I. Electron-microscopial investigations on wax-covered stomata.
Planta, 117, 153—161 (1974).
29. Robards A. W. Plasmodesmata, Ann. Rev. Plant Physiol., 26, 13—29 (1975).
30. Sangster A. G., Parry D. W. Silica deposition in the grass leaf in relation to
transpiration and the effect of dinitrophenol, Ann. Bot., 35, 667—677 (1971).
31. Srivastava L. M., Singh A. P. Stomatai structure in corn leaves, J. Ultrastruct.
Res., 39, 345—363 (1972).
32. Tomlinson P. B. Development of the stomatai complex as a taxonomic cha-
racter in the monocotyledons, Taxon, 23, 109—128 (1974).
33. Uphof J. С. T. Plant hairs, Handbuch der Pflanzenanatomie, Band 4, Teil 5
(1962).
Глава 8
Ксилема: общая структура
и типы клеток
Ксилема — основная водопроводящая ткань сосудистых рас-
тений. Пространственно она объединена с флоэмой — тканью, про-
водящей пластические вещества (рис. 8.1). Обе ткани вместе име-
нуются сосудистой или проводящей тканью (или тканями). Ком-
плекс ксилемы и флоэмы образует непрерывную проводящую сис-
тему, проходящую через все органы растения, включая все от-
ветвления стебля и корня.
По происхождению и развитию целесообразно проводить раз-
личие между первичной и вторичной проводящими тканями. Пер-
вичные ткани дифференцируются в процессе развития первичного
тела растения; меристемой, обеспечивающей формирование пер-
вичных проводящих тканей, является прокамбий. Вторичные про-
водящие ткани образуются в течение второй важной стадии раз-
вития растения, когда в связи с латеральным приростом новых
тканей происходит увеличение толщины осевых частей растения
(стебля и корня) и их крупных ответвлений. Это достигается в
результате активности камбия (рис. 8.1). Как было отмечено в
гл. 2, вторичный рост отсутствует у небольших по размерам од-
нолетних двудольных и у большинства однодольных.
Первичная и вторичная ксилемы имеют определенные гисто-
логические различия, но обе ткани сложны по составу и содержат
по меньшей мере водопроводящие элементы, паренхимные клет-
ки, а также некоторые другие типы клеток, в частности опорные
клетки. Свойства этих типов клеток и их взаимоотношения внутри
ткани лучше всего показать на примере вторичной ксилемы, или
древесины.
Общая структура вторичной ксилемы
Осевая и лучевая системы
Исследуя образец древесины при очень небольшом увеличении,
можно установить присутствие в нем двух разных систем клеток:
осевой (продольной или вертикальной) и лучевой (поперечной
или горизонтальной) (рис. 8.1). Осевая система содержит клетки
или ряды клеток, длинные оси которых ориентированы в стебле
и корне вертикально, т. е. параллельно главной (продольной) оси
8*
116
Глава 8
Рис. 8.1. Схема, иллюстрирующая структуру вторичных проводящих тканей,
и их пространственное расположение относительно друг друга, камбия и пери-
дермы. 1 — поперечный срез; 2 — ранняя древесина; 3— поздняя древесина;
4 — слой прироста; 5 — луч; 6 — камбий; 7 — волокна; 8 — перидерма; 9 — кора;
10— флоэма; 11 — тангенциальный срез; 12 — радиальный срез; 13— ксилема;
14 — осевая система.
этих органов или их ответвлений; лучевая система состоит из
рядов клеток, ориентированных горизонтально (перпендикулярно)
по отношению к осям стебля и корня.
Каждая из двух систем имеет свой характерный рисунок на
3 типах срезов, используемых при исследовании древесины (гл. 9).
На поперечных срезах, проходящих под прямым углом к главной
оси стебля или корня, клетки осевой системы разрезаются попе-
рек и имеют наименьшие размеры. Лучи, наоборот, на поперечных
срезах рассекаются продольно. Продольные срезы могут быть двух
типов: радиальные (по радиусу) и тангенциальные (перпендику-
лярно радиусу). Клетки осевой системы на обоих типах срезов
выглядят одинаково, будучи рассеченными продольно в обоих слу-
чаях, характер же изображения лучей различен. На радиальных
срезах лучи выглядят как горизонтальные ряды, лежащие поперек
осевой системы (рис. 8.1). Когда радиальный срез проходит через
середину луча, можно определить его высоту. На тангенциальных
срезах лучи разрезаются перпендикулярно их оси, в результате
на этих срезах хорошо видны ширина и высота луча. Таким об-
разом, на тангенциальных срезах легко измерить высоту луча (эта
Ксилема: общая структура и типы клеток 117
величина обычно характеризуется числом клеток) и определить,
является ли луч однорядным (шириной в одну клетку, рис. 8.4,Л)
или многорядным (шириной в две или более клеток, рис. 8.4,В).
Слои прироста
На малых увеличениях или даже без увеличения древесина
выглядит слоистой вследствие того, что в ней существуют более
или менее выраженные границы между соседними слоями при-
роста— кольцами прироста (рис. 8.1). Каждый слой может быть
продуктом роста в течение одного сезона, но в благоприятных
условиях за один сезон может сформироваться несколько слоев.
В тех случаях, когда слоистость видна отчетливо, каждый слой
прироста разделен на раннюю и позднюю древесины. Ранняя дре-
весина менее плотная, поскольку диаметр ее клеток больше, а
клеточные стенки тоньше, чем в поздней древесине. Граница коль-
ца образуется за счет резкого различия между клетками поздней
древесины и клетками ранней древесины следующего сезона, но
переход от ранней древесины к поздней внутри одного слоя может
быть более или менее постепенным. Количественное соотношение
между ранней и поздней древесинами определяется климатиче-
скими условиями и видовыми особенностями растений. Например,
у сосны неблагоприятные условия роста вызывают увеличение
относительного количества поздней древесины, у дуба же такие
условия, наоборот, приводят к сокращению относительного коли-
чества поздней древесины. В целом способность формировать слои
прироста определяется генетической конституцией видов и наблю-
дается у деревьев, произрастающих и в умеренной, и в тропиче-
ской зонах.
Заболонь и ядро
Ранее отложенные слои вторичной ксилемы обычно быстро
перестают функционировать и как проводящие, и как запасающие
ткани. Относительное количество нефункционирующей, ядровой,
древесины варьирует у разных видов, а также зависит от клима-
тических условий. У некоторых растений ядровая древесина во-
обще не образуется [33]. Ядровая древесина обычно имеет более
темный цвет, чем активная древесина — заболонь. Ядро образу-
ется в результате выведения запасных веществ или их преобра-
зования в ядровые вещества и гибели протопластов в паренхим-
ных и других живых клетках древесины. Считают [33], что об-
разование ядра представляет собой один из процессов, обуслов-
ливающих удаление из участков роста тех вторичных продуктов
метаболизма, которые могут ингибировать рост или даже обла-
дают токсическими свойствами для живых клеток. Передвижение
118
Глава 8
таких веществ, вероятно после их предварительной детоксикации,
происходит по лучам частично в направлении коры, частично в
направлении центра ствола, где накопление экскрета является
причиной гибели клеток. Так как этот процесс является непре-
рывным, граница между заболонью и ядром постоянно смещается
от центра к периферии ствола. Число слоев прироста, приходя-
щихся на долю заболони, широко варьирует у разных видов рас-
тений [29].
Типы клеток вторичной ксилемы
Клеточную структуру ксилемы изучают с помощью срезов трех
типов, о которых упоминалось в начале этой главы, и на мацери-
рованной древесине, т. е. на древесине, диссоциированной на
группы клеток или на отдельные клетки в результате химической
обработки, растворяющей срединную пластинку клеточных обо-
лочек.
Основные типы клеток, встречающиеся во вторичной ксилеме
(рис. 8.2 и фото 29), могут быть систематизированы так, как по-
казано в табл. 8.1.
Таблица 8.1
Типы клеток вторичной ксилемы
Типы клеток
Основные функции
Осевая система
Трахеальные элементы
Трахеиды
Членики сосудов
Волокна
Волокнистые трахеиды
Волокна либриформа
Паренхимные клетки
Лучевая система
Паренхимные клетки
Трахеиды у некоторых хвойных
> Проведение воды
Опорная функция; иногда
k функция запасания
Запасание и передвижение
пластических веществ
Трахеальные элементы
Трахеальные элементы представляют собой наиболее высоко-
специализированные клетки ксилемы; они выполняют функцию
проведения воды и растворенных в ней веществ. Эти клетки более
или менее вытянуты; в зрелом состоянии они мертвые. Для них
Ксилема: общая структура и типы клеток
119
Рис. 8.2. Типы клеток вторичной ксилемы, которые могут быть получены в ре-
зультате расчленения древесины дуба (Quercus). На стенках клеток показаны
разные типы пор. (Рисунки по фотографиям из работы Carpenter, Leney, 91 Pa-
permaking Fibers, Tech. Publ. 74, College of Forestry at Syracuse, 1952.) A — B.
Широкие членики сосудов. Г — Е. Узкие членики сосудов. Ж. Трахеида. 3. Во-
локнистая трахеида. И. Волокно либриформа. К. Клетки лучевой паренхимы.
Л. Тяж осевой паренхимы. 1 — лучевые клетки; 2—простая перфорационная
пластинка.
характерны лигнифицированные оболочки с вторичными утолще-
ниями и порами, варьирующими по своей структуре.
Два типа трахеальных клеток — трахеиды и членики сосудов —
отличаются друг от друга тем, что трахеиды являются неперфо-
120
Глава 8
рированными клетками, а членики сосудов имеют перфорации по
одной или несколько на каждом конце (рис. 8.2) и иногда также
на боковых стенках (рис. 8.2, £). Клетки, сходные с члениками
сосудов по форме и расположению, но не имеющие перфораций,
называют сосудистыми трахеидами и рассматривают как непол-
ностью развитые членики сосудов [23]. В трахеидах передвижение
воды из клетки в клетку осуществляется главным образом через
пары пор, поровые мембраны (замыкающие пленки пор) которых
отличаются высокой проницаемостью для воды и растворенных
вешеств, Ультраструктурные исследования показывают, что не-
целлюлозные компоненты поровой мембраны к моменту завер-
шения клеточного развития удаляются с помощью ферментов
[28]. По членикам сосудов вода движется свободно через перфо-
рации оболочки.
Продольные ряды члеников, связанных перфорациями (так,
как показано на рис. 8.2,Л), называются сосудами. Сосуды не
имеют определенной длины, хотя у некоторых видов, имеющих
исключительно широкие сосуды ранней древесины (кольцепоро-
вая древесина), они могут простираться почти на всю высоту
дерева [19]. Измерения числа члеников в сосудах стебля Scleria
(Сурегасеае) показали, что сосуды состоят из 2—5 клеток [6].
Вопрос о длине сосудов нуждается в дальнейшем исследовании
[26]. Движение воды из сосуда в сосуд происходит через поры,
которые непроницаемы для некоторых веществ. Поэтому путем
введения туши в ксилему можно установить наличие сосудов и
их длину.
Перфорированную часть оболочки членика сосудов называют
перфорационной пластинкой. Пластинка может быть простой, с
одной перфорацией, или сложной, если перфораций больше чем
одна (фото 29). Сложная пластинка в свою очередь может быть
лестничной, если перфорации имеют вытянутую форму и распо-
лагаются параллельно друг другу (фото 29,В), или сетчатой,
если перфорации расположены наподобие ячеек в сети.
Во вторичных оболочках трахеид и члеников сосудов встре-
чаются простые и окаймленные поры (рис. 8.2 и фото 29). Число
и характер распределения таких пор варьируют в значительной
степени даже на разных стенках одной клетки, завися от типа
клетки, граничащей с каждой стороны. Между соседними трахе-
альными элементами обычно расположено множество окаймлен-
ных пар пор (рис. 8.3,А — Ж, Р, С); между трахеальными эле-
ментами и волокнами пар пор меньше или совсем нет; между
трахеальными элементами и паренхимными клетками существуют
полуокаймленные или простые пары пор. В полуокаймленных
парах пор окаймление расположено со стороны трахеальной клет-
ки (рис. 8.3,Л).
Ксилема: общая структура и типы клеток
121
^Лестничная
поровость
Юмкм
Рис. 8.3. Поры и типы поровости оболочки. А — В. Лестничная поровость: вид
с поверхности (А) и сбоку (Б, В; Magnolia). Г — Д. Супротивная поровость;
вид с поверхности (Г) и сбоку (Д; Liriodendron). Е — Ж. Очередная поровость;
вид с поверхности (Е) и сбоку (Ж; Acer). А — Ж. Окаймленные пары пор в
члениках сосудов. 3 — К. Простые пары пор в паренхимных клетках; вид с по-
верхности (И) и сбоку (3, К)\ 3 — на боковой стенке, К—на торцевой стенке
(Fraxinus). Л. Полуокаймленные пары пор между сосудом и лучевой клеткой;
вид сбоку (Liriodendron). М, Н. Простые пары пор с щелевидной апертурой;
М — вид сбоку, Н—вид с поверхности (волокно либриформа). О, П. Окаймлен-
ные пары пор с щелевидной внутренней апертурой, не совпадающей с границей
порового окаймления; О — вид сбоку, П — вид с поверхности (волокнистая тра-
хеида). Р, С. Окаймленные пары пор с щелевидной внутренней апертурой, совпа-
дающей с границей порового окаймления; Р — вид сбоку, С — вид с поверхно-
сти (трахеида). М — С. Quercus.
У хвойных окаймленные пары пор большие, особенно в ранней
древесине. Общая особенность таких пар пор — округлая форма
(фото 30, А, Б) и сильно развитое окаймление, ограничивающее
обширную полость (фото 30,В). В центре поровой мембраны
имеется торус, который окружен тонким участком мембраны —
марго (гл. 4). Пучки микрофибрилл, образующие марго, иногда
объединяются вместе в фиксированном материале и становятся
видимыми в световой микроскоп (фото 30, Л). Между порами
могут иметься утолщения срединной пластинки и первичной обо-
122
Глава 8
лочки, покрытые вторичной оболочкой, — крассулы (фото 30,Л).
Торус обычно шире, чем отверстие окаймления (фото 30, Б, В), и
может блокировать это отверстие — тогда пара пор закупоривает-
ся (гл. 4). Закупоренные пары пор характерны для ядровой дре-
весины. Закупорка пор обычно начинается еще в заболони,
поэтому центральная часть древесины остается сухой; смещение
поровой мембраны, вероятно, происходит в тех трахеальных стен-
ках, которые лежат между трахеидами, одна из которых запол-
нена газом, а другая — водой [21]. Таким образом, окаймленные
поры функционируют как клапаны, предотвращающие поступле-
ние воздуха в проводящие трахеиды, который мог бы нарушить
непрерывность водяного столба [20]. У хвойных на мембранах
полуокаймленных пар пор, которые располагаются на стенках
между трахеидами и паренхимными клетками, торус не развива-
ется.
Волокна
Волокна представляют собой вытянутые клетки с вторичной,
обычно лигнифицированной, оболочкой. Толщина оболочки в во-
локнах варьирует, но, как правило, в одной и той же древесине
она толще, чем оболочка трахеид. Известны два основных типа
ксилемных волокон — волокнистые трахеиды (рис. 8.2,3) и во-
локна либриформа (рис. 8.2, И). Если в древесине одновременно
встречаются оба типа волокон, то волокна либриформа обычно
характеризуются большей длиной и более толстой оболочкой. В во-
локнистых трахеидах полости окаймленных пор меньше, чем по-
ровые полости трахеид или сосудов той же древесины (рис. 8.3,
О,П). Эти поры имеют поровый канал с округлой внешней апер-
турой и вытянутой или щелевидной внутренней апертурой (гл. 4).
В волокнах либриформа апертура поры щелевидная, а канал
сильно напоминает уплощенную воронку, поровой же полости как
таковой нет (рис. 8.3, М,Н). Иными словами, эти поры не окайм-
ленные, а простые. Определение пор волокон либриформа как
простых дает основание полагать, что между волокнами и волок-
нистыми трахеидами существует различие большее, чем принято
думать. Поры волокнистых элементов ксилемы по своей структуре
образуют ряд последовательных переходов — от пор с явно выра-
женным окаймлением к порам с рудиментарным окаймлением и
вообще без него. Поры промежуточных форм с различимым поро-
вым окаймлением для удобства относят к порам волокнистых
трахеид [29].
Волокна обоих типов могут быть септированными (гл. 6). Сеп-
тированные волокна широко распространены у двудольных; в зре-
лой заболони они обычно сохраняют живой протопласт и участву-
ют в запасании пластических веществ [17, 18]. Таким образом,
Ксилема: общая структура и типы клеток 123
живые волокна близки по структуре и функциям к клеткам кси-
лемной паренхимы. Различия между ними становятся совсем не-
значительными в тех случаях, когда паренхимные клетки форми-
руют вторичную оболочку и септы. Сохранность протопластов в
волокнах является показателем эволюционной продвинутости [1,
5], и там, где есть живые волокна, осевая паренхима обычно
слабо развита или отсутствует совсем [27].
Еще одна разновидность волокон — так называемые желати-
нозные волокна. Эти волокна имеют нелигнифицированный слой
оболочки (Ж-слой), который откладывается поверх Вз-, В2- или
даже Bi-слоев вторичной оболочки (гл. 4). Желатинозные волок-
на представляют собой обычный компонент реактивной древеси-
ны двудольных (гл. 9).
Филогенетическая специализация трахеальных элементов
и волокон
Вопросы, касающиеся основных направлений специализации
клеток и тканей, для ксилемы изучены лучше, чем для других
тканей сосудистых растений. Среди отдельных направлений осо-
бенно основательно изучена эволюция трахеальных элементов.
В процессе эволюции наземных растений специализация тра-
хеальных элементов шла преимущественно в направлении разде-
ления механической и проводящей функций [1]. Примерами наи-
менее выраженной специализации в этом отношении служат тра-
хеиды, совмещающие проводящую и механическую функции. По
мере дальнейшего развития специализации в древесине среди про-
водящих элементов появляются членики сосудов, более эффек-
тивные в проведении, чем в выполнении механических функций.
В противоположность этому волокна эволюционировали как спе-
циализированные опорные элементы. Следовательно, от прими-
тивных трахеид расходятся два направления специализации, одно
к сосудам, другое — к волокнам.
Эволюция сосудов шла независимо в нескольких таксонах выс-
ших растений. Множество данных позволяет предположить, что
у двудольных сосуды появились и совершенствовались сначала
во вторичной ксилеме, затем в поздней первичной ксилеме (ме-
таксилеме) и, наконец, в ранней первичной ксилеме (протоксиле-
ме). В первичной ксилеме однодольных возникновение и специа-
лизация сосудов сначала также имели место в метаксилеме, и
лишь позднее сосуды появились в протоксилеме; кроме того, у
растений этого таксона первые сосуды появились в корне, а затем
постепенно распространились в стебель [12, 16]. У двудольных
связь между появлением первых сосудов и типом органа полно-
стью не выяснена, но есть данные, свидетельствующие о запазды-
124
Глава 8
вании эволюции трахеальных элементов в листьях, частях цветка
и проростках [2].
В ходе эволюции сосуды могут и утрачиваться. Например,
считают, что отсутствие сосудов у некоторых водных растений,
сапрофитов, паразитов и суккулентов представляет собой резуль-
тат редукции ксилемной ткани. Редукция в данном случае озна-
чает неспособность потенциальных ксилемных элементов, в том
числе и члеников сосудов, подвергаться в онтогенезе типичной
дифференциации. Эти бессосудистые растения, несомненно, явля-
ются высокоспециализированными в отличие от тех 10 известных
родов примитивных бессосудистых (Trochodendron, Tetracentron,
Drimys, Pseudowinter а и другие), которые относятся к самым низ-
шим таксонам двудольных [1, 13, 24]. Сосудистые трахеиды, най-
денные у представителей некоторых эволюционно более развитых
семейств двудольных (Cactaceae, Asteraceae), также возникли в
результате эволюционной дегенерации члеников сосудов [4, 8].
Эволюционный ряд типов члеников сосудов во вторичной кси-
леме двудольных начинается с длинных трахеид, имеющих лест-
ничную поровость, и сходных с теми, которые обнаружены у не-
которых низших двудольных. Эти трахеиды сменяются члениками
сосудов, имеющими длинную узкую форму с заостренными конца-
ми (фото 29,В). Далее клетки постепенно укорачиваются, рас-
ширяются, их концевые стенки становятся все менее наклонными
и в конце концов оказываются поперечными (фото 29, Г — Е).
В наиболее примитивных из них перфорационная пластинка лест-
ничная с множеством перегородок, напоминающая лестнично рас-
положенные поры, но без поровых мембран. Развитие специали-
зации сопровождается сокращением числа перегородок (фото 29,
В), так что в конце концов они исчезают совсем и образуется
простая перфорация (фото 29, Г — Е). К регрессивным формам,
характерным для этой эволюционной линии, могут быть отнесены
перфорационные пластинки сетчатой или другой аномальной
структуры; такие пластинки характерны для представителей не-
которых специализированных семейств [8].
Характер поровости боковых стенок сосудов также изменялся
в ходе эволюции. Межсосудистая поровость, представленная окай-
мленными лестнично расположенными парами пор (рис. 8.3,А),
постепенно сменялась более мелкими окаймленными парами пор,
сначала супротивного расположения (рис. 8.3,Г), затем очеред-
ного (рис. 8.3, Е). Пары пор между сосудами и паренхимными
клетками изменялись от окаймленных к полуокаймленным и про-
стым.
Трахеиды не исчезли с появлением сосудов, но претерпели ряд
филогенетических изменений. Они стали короче, но все же не та-
кими короткими, как членики сосудов, и в характере поровости
Ксилема: общая структура и типы клеток 125
стенок появились черты, сближающие их с члениками сосудов.
Не изменилась существенно лишь их ширина.
В процессе специализации ксилемных волокон усиление ме-
ханической функции стало возможным благодаря увеличению
толщины стенок и сокращению ширины клеток. Одновременно
поры изменялись от удлиненных к округлым, окаймление посте-
пенно редуцировалось (рис. 8.3,0,П) ив конце концов совсем
исчезло (рис. 8.3,Л1, ТУ). Внутренние апертуры пор стали вытяну-
тыми, а затем щелевидными. Таким образом, эволюционная линия
идет от трахеид через волокнистые трахеиды к волокнам либри-
форма.
Более сложные эволюционные изменения претерпела длина
волокон. Укорачивание члеников сосудов коррелирует с укорачи-
ванием веретеновидных камбиальных инициалей (гл. 10), из ко-
торых образуются осевые клетки ксилемы. Следовательно, в дре-
весине с более короткими члениками сосудов волокна тоже он-
тогенетически возникают из более коротких инициалей. Другими
словами, с развитием специализации ксилемы волокна, казалось
бы, должны становиться короче. Однако поскольку в ходе онто-
генеза волокна подвержены интрузивному росту, а членики сосу-
дов растут мало или вообще не растут, в зрелой древесине волок-
на становятся значительно длиннее, чем членики сосудов, и из
двух видов волокон более длинными оказываются волокна либ-
риформа. И все же волокна высокоспециализированной древесины
обычно короче, чем их первичные предшественники — примитив-
ные трахеиды.
Направления эволюции ксилемы реконструированы в резуль-
тате сравнительного изучения существующих растений [3]. Су-
ществующие ныне сосудистые растения распределяются в широ-
ком диапазоне по степени специализации клеток, тканей и орга-
нов. Вариации отдельных признаков используются для
идентификации древесин (гл. 9).
Паренхимные клетки
Во вторичной ксилеме паренхима представлена осевой и лу-
чевой паренхимой. Клетки обоих комплексов в целом сходны по
структуре оболочки и цитоплазматического содержимого, но внут-
ри каждого из комплексов встречаются значительные вариации
клеточной структуры [10, 36]. Паренхимные клетки запасают
крахмал, жиры и многие другие эргастические вещества неизвест-
ного назначения. Обычными включениями являются таннинсодер-
жащие структуры и кристаллы. Типы кристаллов и характер их
распределения в паренхимных клетках используются в качестве
признаков для идентификации древесин [11, 32].
126
Глава 8
Рис. 8.4. Характер изображения лучей двух типов на тангенциальных (А, В)
и радиальных (Б, Г) срезах. А, Б. Fagus grandifolia. В, Г. Acer sac char ит.
1 — стоячие клетки лучей; 2 — лежачие клетки лучей.
Многорядный
гомоирллюлярный
луч
Оболочки клеток лучевой и осевой паренхимы могут иметь вто-
ричные утолщения и быть лигнифицированными [36]. Если вто-
ричная оболочка откладывается, то пары пор между паренхим-
ными клетками могут быть окаймленными, полуокаймленными
или простыми. Некоторые паренхимные клетки склерифицируются
в результате сильного утолщения оболочки — это склерифициро-
ванные клетки или склереиды. Кристаллоносные паренхимные
клетки часто имеют лигнифицированную оболочку с вторичным
утолщением и могут быть, кроме того, разделены перегородками
так, что каждая камера содержит по одному кристаллу.
Клетки осевой паренхимы образуются из удлиненных верете-
новидных камбиальных клеток. Если производные таких камби-
альных клеток дифференцируются в паренхимные клетки без
предварительных поперечных или наклонных делений, то образу-
ются веретеновидные паренхимные клетки. Если же указанные
деления происходят, то формируется паренхимный тяж (рис. 8.2,
Л). В обоих случаях интрузивный рост не наблюдается.
Клетки лучевой паренхимы классифицируются по форме. Два
наиболее распространенных типа — лежачие и стоячие клетки
(рис. 8.4). Лучевые клетки, длинная ось которых ориентирована
радиально, называются лежачими, клетки, вытянутые в верти-
кальном направлении, — стоячими. Оба типа лучевых клеток ча-
сто представлены в одном луче, причем стоячие клетки характер-
ны и для верхнего, и для нижнего краев луча (рис. 8.4, Л). Лучи,
сложенные из клеток одного типа, называются гомоцеллюлярными
(рис. 8.4, Д Г), лучи, которые содержат и лежачие и стоячие клет-
ки,— гетероцеллюлярными (рис. 8.4, А, Б).
Ксилема: общая структура и типы клеток
127
Первичная ксилема
Первичная ксилема содержит клетки тех же типов, что и вто-
ричная ксилема: оба вида трахеальных элементов (трахеиды и
членики сосудов), волокна и паренхимные клетки. Однако пер-
вичная ксилема не имеет лучей, и этим ее организация отличает-
ся от организации вторичной ксилемы, представляющей собой
комбинацию осевой и лучевой систем. В стеблях и листьях, а
также в частях цветка первичная ксилема объединена вместе с
первичной флоэмой в виде тяжей — проводящих пучков (фото 31).
В стеблях между проводящими пучками располагаются полосы
паренхимы — межпучковые зоны (гл. 16). Эти полосы часто на-
зывают медуллярными лучами и считают, что они являются ча-
стью основной ткани. В корне первичная ксилема либо образует
сплошной массив с паренхимой или без нее в центре, либо тоже
распределена в виде отдельных тяжей (гл. 14).
Протоксилема и метаксилема
Первичная ксилема обычно состоит из более ранней в онтоге-
нетическом отношении части — протоксилемы, и более поздней —
метаксилемы (фото 31 и рис. 8.5,Б). Обе части имеют свои отли-
чительные особенности, но в теле растения они настолько тесно
объединены, что граница между ними может быть проведена лишь
приблизительно.
Протоксилема дифференцируется в тех частях первичного тела
растения, которые еще не закончили полностью рост и дифферен-
циацию. В стебле протоксилема развивается среди активно удли-
няющихся тканей и, следовательно, подвергается определенному
воздействию с их стороны. Зрелые мертвые трахеальные элементы
протоксилемы растягиваются и в конечном счете разрушаются.
В корне протоксилемные элементы сохраняются дольше, посколь-
ку там они созревают уже за пределами зоны максимального
роста органа.
Метаксилема начинает дифференцироваться в еще растущем
первичном теле растения, но созревание ее происходит уже после
того, как удлинение органа в основном закончено. Она, таким
образом, испытывает меньшее влияние со стороны окружающих
тканей, чем протоксилема.
Протоксилема обычно содержит только трахеальные элементы,
погруженные в паренхиму, которую считают частью протоксиле-
мы. Когда трахеальные элементы разрушаются, они могут быть
полностью облитерированы окружающими паренхимными клет-
ками (фото 31). В ксилеме стебля многих однодольных растянутые
нефункционирующие элементы частично разрушаются, но не об-
литерируются полностью, в результате на их месте возникают
128
Глава 8
100 жм
Узел
6
2
3
з
11
10
I
I
2
I
X
I
1
I
Рис. 8.5. Фрагменты структуры и этапы развития первичной ксилемы. А. Схема
апекса побега, иллюстрирующая стадии развития ксилемы на разных уровнях.
Б — Г. Первичная ксилема клещевины (Ricinus) на поперечном (Б) и продоль-
ных (В, Г) срезах. 1 — апекс побега; 2— молодые листья; 3 — основание листа;
4 — пазушная почка; 5 — протоксилема; 6 — метаксилема; 7 — кольчатое утол-
щение; 8 — спиральное утолщение; 9 — лестничное утолщение; 10 — сетчатое
утолщение; И — пористое утолщение.
Узел
Узел
Узел
Узел
2
X
I
г
I
X
г
X
г
X
X
г.
X
д
Ксилема: общая структура и типы клеток
129
открытые каналы, так называемые протоксилемные лакуны, ок-
руженные паренхимными клетками (гл. И). Если срезы сделаны
очень тщательно, то вдоль края лакун можно обнаружить вто-
ричные оболочки нефункционирующих трахеальных клеток.
Метаксилема — более сложная по составу ткань, чем прото-
ксилема; в ней помимо трахеальных элементов и паренхимных
клеток могут содержаться волокна. Паренхимные клетки либо
рассеяны среди трахеальных элементов, либо располагаются ра-
диальными рядами, похожими на лучи. На продольных срезах
хорошо видна осевая ориентация таких паренхимных клеток. Ра-
диальная рядность паренхимных клеток, встречающаяся в мета-
ксилеме, а иногда и в протоксилеме, послужила поводом для не-
верной тенденции интерпретировать первичную ксилему многих
растений как вторичную на том основании, что такая рядность
составляет характерную особенность вторичных проводящих
тканей.
После завершения первичного роста трахеальные элементы ме-
таксилемы сохраняются полностью, но становятся нефункциони-
рующими по мере того, как формируется вторичная ксилема.
У растений, не имеющих вторичного роста, метаксилема функцио-
нирует и в зрелых органах.
Клеточная оболочка первичных трахеальных элементов
Трахеальные клетки первичной ксилемы имеют различные ти-
пы вторичного утолщения оболочки. Эти различия выявляются в
онтогенетических рядах клеток, в которых можно наблюдать про-
грессивное увеличение площади первичной оболочки, покрытой
вторичным утолщением (рис. 8.5). В самых ранних трахеальных
элементах вторичная оболочка может иметь форму колец, не свя-
занных друг с другом {кольчатые утолщения). Элементы, диффе-
ренцирующиеся вслед за ними, имеют спиральные утолщения. За-
тем следуют клетки с утолщениями, которые могут быть охарак-
теризованы как спирали, витки которых связаны между собой
(лестничные утолщения). Эти клетки в свою очередь сменяются
клетками с сетчатыми утолщениями и, наконец, элементами со
сплошными пористыми утолщениями.
Все типы вторичных утолщений не всегда представлены в пер-
вичной ксилеме данного растения или его части, с другой стороны,
нередко можно наблюдать большое число промежуточных типов
утолщений. Так, кольчатые утолщения в некоторых местах иногда
соединены перемычками; кольчатые и спиральные или спиральные
и лестничные утолщения могут быть скомбинированы в пределах
одной клетки; различие между лестничными и сетчатыми утолще-
ниями порой может быть столь незначительным, что в таких слу-
чаях их удобнее называть «лестнично-сетчатыми утолщениями»..
9 К. Эзау, кн. 1
130
Глава 8
Элементы с пористым утолщением также объединены переходны-
ми формами с более ранними онтогенетическими типами. В случае
лестничного или сетчатого утолщения неутолщенные участки обо-
лочки часто имеют вид пор, особенно если форма утолщений та-
кова, что образуется небольшое окаймление вокруг этих участков.
Пороподобные своды вторичной оболочки над неутолщенными уча-
стками первичной оболочки обычны для различных типов утолще-
ний, наблюдаемых в клетках первичной ксилемы. Кольца, спирали
и полосы лестнично-сетчатого утолщения обычно прикреплены к
первичной оболочке узким основанием так, что в полости клетки
лента вторичного утолщения расширяется и образует свод над
первичной оболочкой (фото 34,Л).
Постепенный характер нарастания поверхности вторичного
утолщения в клетках первичной ксилемы не дает возможности
расположить различные типы утолщений, наблюдаемых в прото-
и метаксилеме, в определенной последовательности. Первые тра-
хеальные элементы, которые являются протоксилемными элемен-
тами, обычно имеют минимальную поверхность вторичного утол-
щения. Здесь преобладают кольчатые и спиральные утолщения.
Эти типы утолщений существенно не препятствуют растяжению
зрелых протоксилемных элементов в процессе роста первичного
тела растения. Данные, свидетельствующие о наличии такого рас-
тяжения, очевидны; увеличение расстояния между кольцами утол-
щения в старых ксилемных элементах, изменение наклона колец,
частичное раскручивание витков спиралей (рис. 8.5, А).
В метаксилеме, созревающей после завершения роста органа,
могут содержаться элементы со спиральными, лестничными, сет-
чатыми и пористыми утолщениями; один или даже несколько ти-
пов утолщения могут отсутствовать. Если ткань содержит много
элементов со спиральными утолщениями, то в ряду последова-
тельных элементов спирали становятся все менее и менее круты-
ми— этот факт подтверждает, что некоторое растяжение элемен-
тов все-таки имеет место в ходе развития первых метаксилемных
элементов.
Есть убедительные данные, свидетельствующие о том, что тип
утолщения оболочки в клетках первичной ксилемы в значительной
степени зависит от окружающих условий, в которых эти клетки
дифференцируются. Кольчатые утолщения развиваются в том слу-
чае, когда ксилема начинает созревать до начала максимального
растяжения органа — так, например, это происходит в побегах
нормально растущих растений (рис. 8.5, А, узлы 3—5); они могут
отсутствовать, если первые элементы созревают после того, как
рост в основном завершен, что обычно для корней. Если рост
какого-либо органа подавить до того, как созревают первые кси-
лемные элементы, то один или несколько онтогенетически наибо-
лее ранних типов утолщений может не развиваться. Напротив,
Ксилема: общая структура и типы клеток
131
если рост стимулировать, например, путем этиоляции, то образу-
ется большее, чем обычно, число элементов с кольчатыми и спи-
ральными утолщениями.
По данным детального исследования зрелой и дифференциру-
ющейся прото- и метаксилемы покрытосеменных [6], в элементах
с более мощным, чем спиральное, утолщением вторичная оболоч-
ка откладывается в два этапа. Первым строится спиральный остов
(вторичная оболочка первого порядка), затем между кольцами
спирали откладывается дополнительная порция вторичной оболоч-
ки в виде пластин или тяжей или и тех и других сразу (вторичная
оболочка второго порядка). Эта концепция может быть исполь-
зована для объяснения действия окружающих условий на форму
оболочки: в зависимости от конкретных обстоятельств происходит
подавление или индукция образования вторичной оболочки вто-
рого порядка.
Последовательный переход от одних типов утолщения к другим
характерен не только для элементов первичной ксилемы. В связи
с этим разграничение первичной и вторичной ксилемы может быть
также затруднительным. При разграничении этих двух тканей
необходимо учитывать многие факторы, и среди них в первую
очередь длину трахеальных клеток (последние первичные элемен-
ты, как правило, длиннее, чем первые вторичные) и общую орга-
низацию ткани, особенно появление комплекса лучевой и осевой
систем, свойственного только вторичной ксилеме. Иногда развитие
одного или нескольких признаков вторичной ксилемы задержива-
ется; это явление называют педоморфозом [9].
В первичной ксилеме наиболее узкими обычно, но не всегда
бывают протоксилемные элементы. Позже дифференцирующиеся
метаксилемные элементы, как правило, имеют значительно боль-
шую ширину, но первые клетки вторичной ксилемы могут быть
достаточно узкими и по этому признаку легко отличимыми от
поздней ширококлеточной метаксилемы. В целом, однако, всегда
трудно провести четкие границы между последовательно разви-
вающимися типами ксилемных тканей.
Дифференциация трахеальных элементов
Во время стадий клеточного роста и отложения вторичной обо-
лочки в дифференцирующихся трахеальных элементах сохраняет-
ся живой протопласт (рис. 8.6, Д 25), который имеет полный набор
органелл, включая ядро и ограниченные тонопластом вакуоли.
Ядро в этих клетках, как известно, становится полиплоидным и
увеличивается в размерах [22]. Эндоплазматический ретикулум
представлен длинными цистернами, особенно многочисленными
между лентами вторичного утолщения оболочки (фото 32). Эта
мембранная система обеспечивает поступление полисахаридных
132
Глава 8
Рис. 8.6. Схема, иллюстрирующая развитие члеников сосудов со спиральным вто-
ричным утолщением. А. Клетка без вторичной оболочки. Б. Клетка достигла
окончательной ширины, ее ядро увеличилось; начала откладываться вторичная
оболочка, первичная оболочка в местах будущих перфораций слегка утолщена.
В. Клетка на стадии лизиса: вторичное утолщение завершено, тонопласт распал-
ся, ядро деформировано, оболочка в местах перфораций частично растворена.
Г. Зрелая клетка без протопласта; на обеих торцевых стенках появились пер-
форации, а первичная оболочка между кольцами вторичного утолщения частич-
но гидролизована. 1 — вторичная оболочка; 2 — край перфорации; 3 — место бу-
дущей перфорации; 4 — тонопласт; 5 — перфорация.
веществ к участкам интенсивного отложения оболочки, отводя эти
вещества от других участков. Заметное место в клетках занимают
диктиосомы (фото 32, Л, наконечники стрелок; фото 33,Б). Ра-
диоавтографическими исследованиями цитоплазмы установлено,
что и эндоплазматический ретикулум, и диктиосомы участвуют во
включении полисахаридных веществ в оболочку [31]. Возможно,
оно осуществляется посредством пузырьков Гольджи, которые дви-
гаются к периферии клетки, сливаются с плазмалеммой и высво-
бождают свое содержимое в оболочку (гл. 4). Такие заключения,
однако, делаются на основании наблюдения статичных снимков и
требуют подтверждения [28].
В период роста клеточной оболочки хорошо выявляются мик-
ротрубочки. Сначала они располагаются равномерно вдоль всей
поверхности гладкой оболочки, затем группируются в тяжи, ло-
кализованные в местах вторичного утолщения оболочки [30]
(фото 33). Значение ассоциации микротрубочек с оболочкой для
роста последней показано экспериментально. Обработка колхи-
цином, вызывающим разрушение микротрубочек, приводит к су-
щественным нарушениям формы утолщений и характера их рас-
пределения в клетке (гл. 4).
Ксилема: общая структура и типы клеток
133
После того как вторичная оболочка отложена, клетка вступает
в стадию, наиболее характерной особенностью которой является
процесс лизиса остатков протопласта и некоторых частей оболоч-
ки. По-видимому, вакуоли в данном случае функционируют как
лизосомы (гл. 3), поставляя гидролитические ферменты, необхо-
димые для автолиза. Цитоплазма подвергается действию гидролаз
в результате разрыва тонопласта [37] (рис. 8.6,В). Гидролазы
при этом получают также доступ к клеточной оболочке и воздей-
ствуют на ту часть первичной оболочки, которая не покрыта лиг-
нифицированными слоями вторичного утолщения. Боковые стенки
разрушаются частично: после удаления нецеллюлозных компонен-
тов остается тонкая сеть целлюлозных микрофибрилл [28] (фо-
то 34,Л). В местах формирующихся перфораций первичная обо-
лочка исчезает полностью (рис. 8.6,Г, фото 34, Б).
Участок оболочки, занимающий место будущей перфорации,
отчетливо выделяется среди окружающего его вторичного утол-
щения (фото 34, В; 35). Первичная оболочка здесь толще, чем в
других местах, и на очень тонких чистых срезах выглядит значи-
тельно светлее, чем другие участки первичной оболочки этой же
клетки (фото 34,В). Удаление этой стенки (фото 36) происходит
в результате постепенного растворения — сначала в ней появля-
ются небольшие отверстия, затем она исчезает полностью [25].
В лизируемой лестничной перфорационной пластинке можно ви-
деть тонкую сеть фибрилл, натянутых поперек узких перфораций
[7]. Поскольку эта сеть не обнаруживается в сосудах проводящей
ткани, полагают, что она удаляется транспирационным током.
Дифференциацию трахеальных элементов часто изучают для
выяснения причинных связей в морфогенезе [14, 15]. Данные
многочисленных морфогенетических исследований свидетельству-
ют о наличии гормонального контроля ксилемной дифференциа-
ции. При повреждении проводящей системы растений фактором,
лимитирующим дифференциацию ксилемы с целью восстановле-
ния утраченной связи между отдельными проводящими пучками,
является ауксин растущих листьев. Если листья и почки, распо-
ложенные над местом поранения, удалены, регенерации не про-
исходит; но она возобновляется, если на листовые следы нанести
ланолин, содержащий ауксин. Регенерация идет направленно в
связи с определенной направленностью движения ауксинов.
В культурах ткани дифференциацию ксилемы можно вызвать пе-
ресадкой почек в каллусную ткань или непосредственным введе-
нием ауксинов. В норме дифференциация ксилемы также регули-
руется ауксином, и ее можно значительно усилить, добавляя рос-
товые вещества в-молодые листья или в культуральную среду.
Используя результаты экспериментальной работы и наблю-
дения по развитию ксилемы в норме, исследователи пытаются вы-
яснить, из каких наиболее важных этапов складывается процесс
134
Глава 8
дифференциации трахеальных элементов. Прежде всего следует
отметить, что клетка, которая должна стать трахеальным элемен-
том, образуется в результате митоза. Некоторые авторы считают»
что митоз и связанный с ним синтез ДНК совершенно необходимы
для начала ксилемной дифференциации [34]. Это положение, од-
нако, противоречит данным, полученным на культивируемых экс-
плантатах сердцевинной ткани Lactuca sativa, в которых были
обнаружены сосуды, дифференцирующиеся без предварительного
синтеза ДНК или клеточного деления [35]. Далее, будущий тра-
хеальный элемент, сформированный в результате митоза, растет.
На этом этапе ДНК может синтезироваться в связи с эндомито-
тической редупликацией хромосом [22]. К этому же этапу может
быть приурочен синтез белков и веществ, слагающих первичную
оболочку. На следующем этапе синтезируются вещества вторич-
ной оболочки, они откладываются на поверхность первичной обо-
лочки и лигнифицируются. В течение всех перечисленных этапов»
пока живой протопласт активно участвует в метаболических про-
цессах, специфические преобразования регулируются специальны-
ми гормонами [34]. После того как отложение вторичной оболочки
заканчивается, доминирующими становятся литические процессы.
Протопласт разрушается, в оболочках члеников сосудов образуют-
ся перфорации, мембраны (замыкающие пленки) пор редуциру-
ются до редкой фибриллярной сети. Клетка начинает функциони-
ровать как проводящий элемент.
СПИСОК ЛИТЕРАТУРЫ
1 Bailey I. W. Evolution of the tracheary tissue in land plants, Amer. J. Bot»
60, 4—8 (1953).
2. Bailey I. W. Contributions to plant anatomy, Waltham, Massachusetts, The
Chronica Botanica Co., 1954.
3. Bailey I. W. The potentialities and limitations of wood anatomy in the study
of the phylogeny and classification of angiosperms, J. Arnold Arb., 38, 243—
254 (1957).
4. Bailey I. W. Additional notes on the vesselless dicotyledon, Amborella tricho-
poda Baill., J. Arnold Arb., 38, 374—378 (1957).
5. Bailey I. W., Srivastava L. M. Comparative anatomy of the leaf-bearing Cacta-
ceae. IV. The fusiform initials of the cambium and the form and structure of
their derivatives, J. Arnold Arb., 43, 187—202 (1962).
6. Bierhorst D. W., Zamora P. M. Primary xylem elements and element asso-
ciations of angiosperms, Amer. J. Bot., 52, 657—710 (1965).
7. Butterfield B. G., Meylan B. A. Scalariform perforation plate development in
Laurelia novae-zealandiae A. Cunn.: a scanning electron microscope study. Aust.
J. Bot., 20, 253—259 (1972).
8. Carlquist S. Comparative plant anatomy, New York, Holt, Rinehart and Win-
ston, 1961.
9. Carlquist S. A theory of paedomorphosis in plants, Phytomorphology, 12, 30—45
(1962).
10. Chattaway M. M. Morphological and functional variations in the rays of pored
timbers, Aust. J. Sci. Res. Ser. B., Biol. Sci., 4, 12—29 (1951).
Ксилема: общая структура и типы клеток
135
11. Chattaway М. М. Crystals in woody tissues. Part I, Trop. Woods (102), 55—74
(1955).
12. Cheadle V. I. Independent origin of vessels in the monocotyledons and dicoty-
ledons, Phytomorphology, 3, 23—44 (1953).
13. Cheadle V. I. Research on xylem and phloem — progress in fifty years, Amer.
J. Bot, 43, 719—731 (ft56).
14. Cutter E. G. Plant anatomy: experiment and interpretation. Part I. Cells and
tissues, London, Edward Arnold Ltd., 1969.
15. Esau K- Vascular differentiation in plants, New York, Holt, Rinehart and
Winston, 1965.
16. Fahn A. Metaxylem elements in some families of the Monocotvledoneae, New
Phytol., 53, 530—540 (1954).
17. Fahn A., Leshem B. Wood fibres with living protoplasts, New Phytol., 62,
91—98 (1963).
18. Frison E. De la presence d’amidon dans le lumen des fibres du bois, Bull. Agr.
Congo Beige Brussels, 39, 869—874 (1948).
19. Greenidge K. N. H. An approach to the study of vessel length in hardwood
species, Amer. J. Bot., 39, 570—574 (1952).
20. Gregory S. G., Petty J. A. Valve action of bordered pits in conifers, J. Exp.
Bot., 24, 763—767 (1973).
21. Harris J. M. Heartwood formation in Pinus radiata (D. Don.), New Phytol.,
53, 517—524 (1954).
22. Innocenti A. M., Avanzi S. Some cytological aspects of the differentiation of
metaxylem in the root of Allium сера, Caryologia, 24, 283—292 (1971).
23. Jane F. W. The structure of wood, 2nd ed., Revised by Wilson K., White D. J. B.,
London, Adam & Charles Black, 1970.
24. Lemesle R. Les elements du xyleme dans les Angiospermes a characteres pri-
mitifs, Bull. Soc. Bot. France, 103, 629—677 (1956).
25. Meylan B. A., Butterfield B. G. Perforation plate development in Knightia
excelasa R. Br.: a scanning electron microscope study, Aust J. Bot., 20, 79—86
(1972).
26. Milburn J. A., Covey-Crump P. A. К A simple method for determination of
conduit length and distribution in stems, New Phytol., 70, 427—434 (1971).
27. Money L. L., Bailey I. W., Swamy B. G. L. The morphology and relationships
of the Monimiaceae, J. Arnold Arb., 31, 372—404 (1950).
28. O'Brien T. P., Primary vascular tissues. In: Dynamic aspects of plant ultra-
structure, Robards A. W., ed., Chapter 12, pp. 414—440, London, McGraw-Hill
Book Company (UK) Limited, 1974.
29. Panshin A. J., de Zeeuw C. Textbook of wood technology, Vol. I, Structure,
identification, uses, and properties of the commercical woods of the United Sta-
tes and Canada, New York, McGraw-Hill Book Company, 1970.
30. Pickett-Heaps I. D. Incorporation of radioactivity into wheat xylem walls,
Planta, 71, 1 — 14 (1966).
31. Pickett-Heaps /. D. Xylem wall deposition. Radioautographic investigations
using lignin precursors, Protoplasma, 65, 181—205 (1968).
32. Scurfield G., Michel A. I., Silva S. R. Crystals in woody stems, Bot. J. Linn.
Soc., 66, 277—289 (1973).
33. Stewart С. M. Excretion and heartwood formation in living trees, Science, 153,
1068—1074 (1966).
34. Torrey J. G,, Fosket D. E., Hepler P. K. Xylem formation: a paradigm of cy-
todifferentiation in higher plants, Amer. Sci., 59, 338—352 (1971).
35. Turgeon R. Differentiation of wound vessel members without DNA synthesis,
mitosis or cell division, Nature, 257, 806—808 (1975).
36. Wardrop A. B., Dadswell H. E. The cell wall structure of xylem parenchyma,
Aust. J. Sci. Res. Ser. B., Biol. Sci., 5, 223—236 (1952).
37. Wodzicki T. J., Brown C. L. Organization and breakdown of the protoplast
during maturation of pine tracheids, Amer. J. Bot., 60, 631—640 (1973).
Глава 9
Ксилема: вариации структуры
древесины
Древесины обычно подразделяются на две основные группы —
мягкие и твердые. К «мягким» древесинам относят древесину го-
лосеменных, к «твердым» — древесину двудольных. Оба вида дре-
весин имеют существенные структурные различия, но необяза-
тельно эти различия сводятся только к степени плотности и твер-
дости. Древесина голосеменных структурно гомогенна (в ней
преобладают длинные клетки правильной формы), поэтому ее
легко обрабатывать. Этим же она ценна для бумажного произ-
водства. Многие из используемых в деревообрабатывающей про-
мышленности древесин двудольных характеризуются исключи-
тельной плотностью, твердостью и прочностью, что связано с вы-
соким содержанием в них волокнистых трахеид и волокон
либриформа (Qwercr/s, Carya, Eucalyptus, Acacia), но некоторые,
наоборот, очень легкие и мягкие [например, легчайшая и мягчай-
шая древесина бальсы (О chroma)]. Основными источниками про-
мышленных лесоматериалов среди голосеменных являются хвой-
ные, среди покрытосеменных — двудольные. Имеющие вторичный
рост однодольные все равно не образуют достаточно гомогенную
вторичную ксилему, которая могла бы иметь промышленное зна-
чение.
Древесина хвойных
Вторичная ксилема хвойных устроена сравнительно просто
[17] (рис. 9.1 и фото 37), проще, чем у большинства двудольных.
Одна из наиболее общих черт в ее строении — это отсутствие со-
судов. Трахеальные элементы неперфорированные и представлены
главным образом трахеидами Волокнистые трахеиды могут встре-
чаться в поздней древесине, но волокна либриформа отсутствуют.
Трахеиды — длинные узкие клетки, в среднем от 2 до 5 мм в длину
(фото 29,А). Их перекрывающиеся вершины могут быть искрив-
ленными или ветвящимися вследствие интрузивного роста. Вер-
шины имеют клиновидную форму, усеченная сторона вершин вид-
на на радиальном срезе (рис. 9 1).
Трахеиды ранней древесины имеют округлые окаймленные по-
ры с такими же округлыми внутренними апертурами (фото 30).
Трахеиды поздней древесины (или волокнистые трахеиды) обычно
Ксилема' вариации структуры, древесины
137
7
Рис 9 1. Структура камбия и древесины хвойного растения Thuja occidentalis
(туя западная) Осевая система состоит из трахеид и небольшого числа парен-
химных клеток Лучи содержат только паренхимные клетки (Esau, Plant Ana-
tomy, 2nd ed, John Wiley and Sons, 1965 ) 1 — веретеновидные инициали;
2— лучевые инициали; 3 — камбий, 4—поздняя древесина, 5 — ранняя древе-
сина, 6 — луч, 7 — трахеида, 8— паренхима.
138
Глава 9
имеют редуцированное окаймление с овальной внутренней апер-
турой. Это различие в структуре пор связано с увеличением тол-
щины оболочки клеток поздней древесины. Пары пор, располо-
женные между трахеидами, обычно имеют торусы. В большей
части кольца прироста поры встречаются только на радиальных
стенках (рис. 9.1); в поздней древесине и тангенциальные стенки
могут нести поры. Особенно многочисленны пары пор на перекры-
вающихся вершинах трахеид. Типичным для хвойных является
однорядное расположение пор, только у Taxodiaceae и Pinaceae
некоторые широкие трахеиды ранней древесины могут иметь два
или несколько рядов супротивно расположенных пор. Трахеиды
хвойных помимо сплошной пористой вторичной оболочки иногда
имеют спиральные утолщения.
Осевой паренхимы в древесине хвойных может и не быть. Так,
у Podocarpaceae, Taxodiaceae и Cupressaceae паренхима занимает
значительное место в древесине (рис. 9.1). У Araucariaceae, Pina-
ceae и Тахасеае она представлена скудно или же отсутствует во-
обще. У некоторых родов (JPinus, Picea, Larix, Pseudotsugd) осе-
вая паренхима встречается только в ассоциации со смоляными
ходами. В древесине некоторых видов Pinaceae имеются всегда
смоляные ходы (фото 37 и 38) и, кроме того, при поранениях они
образуются дополнительно (травматические смоляные ходы [9]).
У этих видов смоляные ходы встречаются и в осевой, и в лучевой
системах.
Лучи хвойных состоят из одного (рис. 9.1 и фото 37), очень
редко из двух рядов клеток в ширину и от 1 до 20 и даже 50 кле-
ток в высоту. Присутствие в лучах смоляных ходов создает впе-
чатление многорядности обычных однорядных лучей (фото 37,В).
Лучи состоят либо из одних паренхимных клеток, либо содержат
еще и лучевые трахеиды. Такие трахеиды по форме подобны па-
ренхимным клеткам, но в зрелом состоянии лишены протопласта
и имеют вторичную оболочку с окаймленными порами (фото 38,
А), Лучевые трахеиды характерны для большинства видов Pina-
ceae, а также встречаются у Sequoia и Cupressaceae. Они всегда
располагаются одним или двумя рядами вдоль края луча.
Каждая осевая трахеида находится в контакте с одним или
несколькими лучами (рис. 9.1). Между осевыми трахеидами и
клетками лучевой паренхимы располагаются полуокаймленные
пары пор, причем окаймление образуется только со стороны тра-
хеальной клетки (гл. 4); пары пор между осевыми и лучевыми
трахеидами являются окаймленными с обеих сторон. Форма, рас-
пределение и число пор между клетками лучевой паренхимы и
осевыми трахеидами на радиальных срезах имеют очень харак-
терную картину, называемую полем перекреста (рис. 9.3,А).
Структура полей перекреста используется для целей систематики
и таксономии хвойных.
Ксилема: вариации структуры древесины
139
Древесина двудольных
У двудольных древесина более разнообразна, чем у голосе-
менных. Сравнительно проста по структуре древесина примитив-
ных бессосудистых двудольных, у имеющих сосуды видов она уст-
роена значительно сложнее. Древесина наиболее продвинутых в
эволюционном отношении двудольных может включать сосуды и
трахеиды, различные виды волокон (гл. 8), осевую паренхиму,
лучи одного или нескольких типов (рис. 9.2, фото 39, 40).
Ярусная и неярусная древесины
На поперечных срезах вторичной ксилемы видна более или
менее выраженная радиальная рядность клеток — результат их
образования из тангенциально делящихся камбиальных инициа-
лей. В гомогенной древесине хвойных такая рядность выражена
явно (фото 37); у содержащих сосуды двудольных она может
иногда нарушаться в связи с онтогенетическим растяжением чле-
ников сосудов и смещением окружающих клеток (фото 39 и 40).
На радиальных срезах также легко обнаруживается радиальная
рядность, но одновременно на них видно, что радиальные ряды
клеток осевой системы располагаются друг над другом горизон-
тальными слоями или ярусами (фото 40). Тангенциальные срезы
разных древесин выглядят различно. У одних на тангенциальных
срезах горизонтальные слои имеют очень неровные очертания,
у других — горизонтальная слоистость выдерживается четко.
В первом случае древесину определяют как неярусную (фото 41,
Л; Castanea, Fraxinus, Juglans, Quercus), во втором — как ярусную
(фото 41,5; Aesculus, Cryptocarya, Ficus, Tilia, многие Fabales).
Ярусность выявляется особенно четко в тех случаях, когда высота
лучей соизмерима с высотой горизонтальных слоев клеток осевой
системы. В эволюционном аспекте ярусные древесины можно счи-
тать более высокоспециализированными, чем неярусные. Они об-
разуются из камбия с более короткими веретеновидными инициа-
лями. Между отчетливо ярусными древесинами и отчетливо не-
ярусными, происходящими из камбия с длинными веретеновидны-
ми инициалямп, существует множество промежуточных типов дре-
весин.
Распределение сосудов
Среди специалистов по анатомии древесины сосуды, видимые
на поперечном срезе, принято называть «порами». По распреде-
лению пор на поперечном срезе кольца прироста различаются два
типа древесин: 1) рассеяннопоровые древесины с более или менее
однообразными по размеру и равномерно распределенными по
140
Глава 9
Рис. 9.2. Структура камбия и древесины двудольного растения Liriodendron
tulipifera (тюльпанное дерево). Осевая система состоит из члеников сосудов с
лестничными перфорационными пластинками, волокнистых трахеид и тяжей осе-
вой ксилемной паренхимы, расположенных терминально. (Esau, Plant Anatomy,
2nd ed., John Wiley and Sons, 1965.) 1— поздняя древесина; 2 — ранняя древе-
сина; 3 — луч; 4 — волокно; 5 — сосуд; 6 — камбий; 7 — клетка осевой парен-
химы; 8— лежачая лучевая клетка; 9— стоячая лучевая клетка; 10 — веретено-
видная инициаль; 11 — лучевая инициалы, 12— сосуды; 13— осевая паренхима.
Ксилема: вариации структуры древесины
141
всему кольцу порами (фото 39 и 42, Л, 5; виды Acer, Betula, Car-
pinus; Fagus, Juglans, Liriodendron, Platanus, Populus, Pyrus)\
2) кольцепоровые древесины co значительно более крупными по-
рами ц ранней древесине (рис. 8.1 и фото 40 и 42, Г; виды Castanea,
Catalpa, Celtis, Fraxinus, Gleditsia, Morus, Quercus, Robinia, Ul-
mus). Помимо этих двух крайних типов древесин существуют
промежуточные. Кольцепоровый тип древесины, по-видимому, яв-
ляется высокоспециализированным и встречается у сравнительно
немногих видов, большинство из которых относится к обитателям
северной умеренной зоны. Проведение воды в кольцепоровой дре-
весине происходит главным образом по наружной части кольца
прироста и, несмотря на это, осуществляется приблизительно в
10 раз быстрее, чем в рассеяннопоровой.
В пределах этих основных типов топографии сосудов встреча-
ются менее значительные вариации, различающиеся по располо-
жению отдельных пор относительно друг друга. Поры называются
изолированными, когда сосуд со всех сторон окружен клетками
других типов (фото 40 или 42,В). Поры, сгруппированные по две
или более вместе, образуют сложные поры, среди которых могут
быть выделены радиальные (с радиальным расположением от-
дельных сосудов) и гроздевидные (с неупорядоченным располо-
жением сосудов в группах). Хотя на поперечных срезах древесины
отдельные сосуды или группы сосудов кажутся изолированными,
на самом деле они связаны между собой в различных плоскостях.
У одних видов сосуды соединены между собой только в пределах
слоя прироста, у других связь существует и между сосудами со-
седних слоев прироста [1].
Распределение осевой паренхимы
Существует много типов распределения осевой ксилемной па-
ренхимы. В зависимости от пространственной взаимосвязи с со-
судами различают два основных типа: апотрахеалъный, при ко-
тором положение паренхимы независимо от положения сосудов
(рис. 9.3, Л, Z>), и паратрахеальный, когда оба типа элементов
связаны между собой (рис. 9.3,В, Г), В свою очередь апотрахе-
альная паренхима подразделяется на диффузную (одиночные па-
ренхимные клетки или пучки паренхимных клеток рассеяны среди
волокон по кольцу прироста — фото 40), тяжевую (клетки сгруп-
пированы в виде полос — фото 42, В и рис. 9.3, Б) и пограничную
[12], или маргинальную (клетки или тяжи клеток сосредоточены
на одном краю кольца прироста; если они сосредоточены в начале
его, то это инициальная паренхима, а если в конце, то терминаль-
ная (фото 42, Б, Г и рис. 9.3, Л). Диффузная апотрахеальная па-
ренхима может быть рассеянной (фото 42,Л). Паратрахеальную
паренхиму разделяют на следующие типы: скудная вазицентри-
142
Глава 9
Рис 9 3 Распределение осевой паренхимы (показано точками) в древесине.
(Рисунки с фотографий S. J. Record, Timbers of North America, John Wiley and
Sons, 1934 ) А. Пограничная апотрахеальная (Michelia); Б Тяжевая апотра-
хеальная (Saccopetalum). В Вазицентрическая крыловидная паратрахеальная
(бобовые растения). Г. Сомкнутокрыловидная паратрахеальная (Тerminalia).
ческая, образующая сплошные обкладки вокруг сосудов; крыло-
видная вазицентрическая — паренхимные обкладки вокруг сосудов
имеют вид крыльев (рис. 9.3,В); сомкнутокрыловидная — крыло-
видные выросты сливаются и образуют неправильные тангенци-
альные или диагональные тяжи (рис. 9.3,Г). Если в ксилеме вмес-
то осевой паренхимы встречаются септированные волокна, то ха-
рактер их распределения такой же, как и у осевой паренхимы.
В эволюционном отношении апотрахеальный тип распределения
паренхимы и волокон, и особенно диффузный апотрахеальный,
являются наиболее примитивными [14].
Паратрахеальная паренхима имеет физиологические отличия
от паренхимы, рассеянной среди волокон [1, 5]. В процессе весен-
ней мобилизации запасных углеводов в паратрахеальных клетках
крахмал растворяется раньше, чем в диффузно рассеянных клет-
ках. Паратрахеальные клетки характеризуются более высокой
фосфатазной активностью. Они передают сахар в сосуды для бы-
строго транспорта к почкам и принимают участие в удалении воды
из тех сосудов, которые прекращают функционирование и запол-
няются газами. Паренхимные клетки, имеющие непосредственное
отношение к функционированию сосудов, получили наименование
контактных клеток [18]. Они являются аналогами клеток-спутни-
ков, участвующих в передвижении сахаров по ситовидным эле-
ментам флоэмы (гл. 11).
Структура лучей
В отличие от преимущественно однорядных лучей хвойных лу-
чи двудольных могут быть и однорядными (фото 39) и многоряд-
Ксилема: вариации структуры древесины
143
ними (рис. 9.2; фото 40 и 41); диапазон вариаций по высоте
лучей также велик — от одной до множества клеток (от несколь-
ких миллиметров до 3 см и более). Многорядные лучи часто имеют
однорядные края (фото 41,Л). Мелкие лучи могут быть сгруппи-
рованы так, что выглядят как один крупный луч. Такие группы
именуются составными лучами (Carpinus).
Вид лучей на радиальных и тангенциальных срезах положен
в основу их классификации. Лучи могут быть гомоцеллюлярными,
т. е. составленными из одинаковых по форме клеток (рис. 8.4, В, Г
и фото 40), либо лежачих, либо стоячих, и гетероцеллюлярными,
включающими оба типа клеток — стоячие и лежачие (рис. 8.4,
А,Б\ рис. 9.2 и фото 39). Вся лучевая система древесины в целом
может состоять либо только из гомоцеллюлярных, либо только из
гетероцеллюлярных лучей, либо эта система представляет собой
комбинацию лучей обоих типов (гомогенная лучевая система, ге-
терогенная и комбинированная [12]). Более тонкие особенности
структуры гомогенной и гетерогенной лучевой ткани связаны с
комбинированием однорядных и многорядных лучей или с отсут-
ствием многорядных лучей.
Особенности структуры и сочетания лучей имеют большое фи-
логенетическое значение. В качестве примера примитивной лучевой
ткани может быть приведена такая, как у Winteraceae (Drimys).
Такая ткань содержит лучи двух видов: гомоцеллюлярные (од-
норядные, состоящие только из стоячих клеток) и гетероцеллю-
лярные (многорядные, состоящие из радиально вытянутых или
почти изодиаметрических клеток в многорядной части и стоячих
клеток в однорядных краевых частях). Лучи обоих типов имеют
много клеток в высоту. Такая примитивная лучевая система дала
происхождение другим, более специализированным лучевым сис-
темам. Например, у Aesculus hippocastanum многорядные лучи
полностью исчезают, у Quercus увеличиваются в размере, у Fra-
xinus и многорядные, и однорядные лучи сокращаются в размере.
Эволюция лучей хорошо иллюстрирует положение о том, что
филогенетические изменения имеют ту же направленность, что и
онтогенетические. В каждой конкретной древесине специализация
лучевой структуры происходит постепенно. Структура лучей в
ранних кольцах прироста более примитивна, чем в поздних, по-
тому что камбий, прежде чем он начинает формировать лучи
более высокой специализации, подвергается ряду последователь-
ных изменений.
Клетки лучей выполняют те же функции, что и клетки осевой
паренхимы, и, кроме того, осуществляют радиальный транспорт
ассимилятов [1]. Клетки лучей, связанные с трахеальными эле-
ментами посредством пор (фото 38,А, для хвойных), функциони-
руют как контактные клетки, поставляя углеводы в сосуды [18].
Для них характерна быстрая мобилизация крахмала весной, пе-
144
Глава 9
риодически высокая фосфатазная активность, периодические из-
менения величины ядра, высокий уровень содержания жиров.
Контактные клетки лучей могут быть и стоячими и лежачими, но
обязательно имеют поровые контакты с сосудами. Клетки лучей,
которые не имеют контактов с сосудами — таких клеток много в
многорядных лучах, — запасают крахмал в начале лета и моби-
лизуют его ранней весной. Эти клетки являются преимущественно
лежачими. Весной они обнаруживают полярность по уровню фос-
фатазной активности: она сосредоточена близ той периклинальной
стенки, которая обращена к камбию. Эти клетки принимают уча-
стие в периодическом радиальном транспорте мобилизуемых уг-
леводов к реактивируемому камбию.
Тилы
У многих видов клетки осевой и лучевой паренхимы, располо-
женные рядом с сосудами, образуют через поры выросты в по-
лость сосудов, когда последние становятся нефункционирующими
(фото 40). Эти выросты называются тилами. Замыкающие пленки
пор, через которые тилы проникают в сосуды, изменяются в ре-
зультате отложения так называемого защитного слоя со стороны
паренхимной клетки [13]. Этот слой имеет рыхлую фибрилляр-
ную структуру и содержит полисахариды и пектины [6]. Отложе-
ние защитного слоя происходит на заключительной стадии диф-
ференциации ткани, вследствие чего паренхимные клетки изоли-
руются от зрелых сосудов. Дополнительный слой оболочки откла-
дывается не только над порой, но и над всей поверхностью кле-
точной стенки, обращенной к членику сосуда [10] (рис. 9.4), и,
кроме того, может возникать на стенках, расположенных между
соседними паренхимными клетками. По мере вторжения тилы в
полость сосуда замыкающая пленка поры разрушается с помощью
ферментов, а нелигнифицированный защитный слой испытывает
активный поверхностный рост, в результате чего в полости со-
суда тила раздувается в виде шара. Ядро и часть цитоплазмы
паренхимной клетки обычно мигрируют в тилу. Тилы способны
запасать эргастические вещества, откладывать вторичные оболоч-
ки и даже дифференцироваться в склереиды. Есть данные, что
тилы развиваются только там, где отверстие поры со стороны
сосуда имеет диаметр не менее чем 10 мкм [4]. Qiiercus (виды
белого дуба), Robinia, Vitis, Mortis, Catalpa, Juglans nigra, Mac-
lura — примеры растений, древесине которых свойственно массо-
вое тилообразование. Тилы встречаются также и в первичной
ксилеме и, как показали наблюдения на колеоптилях овса и листь-
ях фасоли, возникают из клеток, оболочки которых богаты кис-
лыми полиуронидами [16].
Ксилема: вариации структуры древесины
145
Рис 9 4 Схематическое изображение
лучевых клеток, образующих тилы,
которые через поры проникают в по-
лость сосуда Тилообразующий слой
называется также защитным слоем
^Схема составлена по данным Foster
’10], Meyer, Cote [13] ) 1 — пора с
плазмодесмами, 2— лучевая клетка,
3— сосуд, 4 — вторичная оболочка,
5 — первичная оболочка, 6 — тилооб-
разующий слой, 7 — тила
Тилы блокируют полость сосудов и снижают проницаемость
древесины. В техническом отношении это явление имеет значение
при отборе древесины для бондарного производства и при пропит-
ке древесины защитными составами. Влияние тилообразования
на проводящие свойства древесины изучено недостаточно. Извест-
но, что тилы блокируют сосуды в процессе формирования ядровой
древесины, в заболони закупоривание сосудов тилами происходит
только в ответ на поранения и инфекции.
Межклеточные каналы и полости
В древесине двудольных встречаются межклеточные каналы,
сходные со смоляными ходами голосеменных. Их часто называют
камедными ходами, хотя они могут содержать также смолы. Та-
кие каналы формируются и в осевой, и в лучевой системах в ре-
зультате нормального развития или как следствие травм. Размеры
каналов варьируют, и для некоторых из них более подходит тер-
мин «межклеточные полости». Межклеточные каналы и полости
могут иметь схизогенное происхождение, но могут формироваться
и в результате гуммоза — разрушения клеток. Каналы лизиген-
ного происхождения распространены в таких родах, как Amygda-
lus и Primus.
10 К Эзау, кн 1
146
Глава 9
Факторы, контролирующие развитие
вторичной ксилемы
Вторичная ксилема продуцируется камбием (гл. 10), поэтому
на ее развитие влияют все факторы, контролирующие камбиаль-
ную активность. Периодичность камбиальной активности, которая
в умеренной зоне является главным образом сезонной, отражают
кольца прироста древесины. Четкая граница между кольцами
образуется вследствие анатомических различий ранней и поздней
древесин (гл. 8). Причины этих различий до конца не ясны; боль-
шинство исследований, посвященных этому вопросу, выполнено
на проростках хвойных [25].
Согласно общепризнанному мнению, в период удлинения стебля
и развития листьев наблюдается высокий уровень ауксинов. В это
время продуцируются широкие клетки ксилемы, характерные для
ранней древесины. Снижение уровня способного к диффузии аук-
сина в связи с сокращением ростовых процессов в побегах и
листьях приводит к формированию узких плоских клеток, свойст-
венных поздней древесине. Однако следует отметить, что ауксин,,
стимулирующий вторичный рост, лишь частично образуется в ра-
стущих побегах. Дифференцирующиеся проводящие ткани, осо-
бенно ксилема, сами служат важным источником ауксина, кото-
рый поддерживает камбиальную активность после ее запуска
растущими побегами. Увеличение толщины оболочки в клетках
поздней древесины, причинно не связанное с изменением диамет-
ра клеток, обычно объясняется усилением синтеза полисахарид-
ных материалов оболочки за счет фотосинтеза текущего вегета-
тивного периода.
В целом проблема регуляции годичного прироста древесины
является очень сложной, поскольку в этом процессе несомненно
участвуют несколько типов природных стимуляторов и ингибито-
ров роста, причем активность стимуляторов находится в зависи-
мости от условий питания и водоснабжения. Многочисленные ва-
риации ширины колец прироста древесины могут быть следствием
изменяющихся условий питания, которые в свою очередь зависят
от климата. Обнаружение этих связей привело к развитию денд-
рохронологии, которая исследует закономерности годичного роста
у деревьев и использует эту информацию для оценки климатиче-
ских флуктуаций в прошлом и датирования исторических событий
[11].
Иногда удается обнаружить связь конкретных факторов с от-
дельными аспектами ксилемной дифференциации. Например, если
удалить верхушку у проростков Xanthium, то камбий сохраняет
свою активность, но дифференциация волокон во вторичной кси-
леме прекращается [21]. При введении нафтилуксусной кислоты
в декапитированные растения активность камбия восстанавливав
Ксилема: вариации структуры древесины 147
ется. Этот результат показывает, что ауксин влияет на дифферен-
циацию клеток ксилемы непосредственно [22], а не через индук-
цию клеточного деления (гл. 8). На примере срезанных стеблей
Fraxinus, выращиваемых на искусственной среде, в которой изме-
няли водный потенциал (контролируемый добавлением полиэти-
ленгликоля) и концентрацию ростовых веществ, было показано,
что ширина прироста ткани больше зависит от водного потенциа-
ла, чем от концентрации индолилуксусной и гибберелловой кислот
[8]. Характер роста раневого каллуса на срезанных стеблях Fra-
xtnus свидетельствовал также о том, что помимо определенной
концентрации ауксина для дифференциации ксилемы необходимо
определенное механическое давление [8]. Значение механического
давления для развития вторичных тканей было показано и путем
манипулирования с продольными полосками коры, частично от-
деленными вдоль дифференцирующейся ксилемы в стеблях Popu-
lus и Pinus [25]. Полоска коры, верхний конец которой оставался
прикрепленным к стволу, а нижний свисал свободно, формирова-
ла каллус на своей внутренней стороне. Через некоторое время в
каллусе развивался камбий, непрерывный с существовавшим ра-
нее камбием, и тем самым полоска коры превращалась в стебле-
подобную структуру. Примерно через три недели после того, как
полоска коры была отделена, наблюдалось нормальное образова-
ние ксилемы и флоэмы. Там же, где полоска коры была прикреп-
лена к древесине ствола (с полиэтиленовой пленкой между ними)
и прижата с некоторым давлением, образование каллуса было
ограничено и нормальное продуцирование ксилемы и флоэмы вос-
станавливалось очень быстро.
Развитие отдельных типов клеток ксилемы и их распределение
внутри ткани также могут быть использованы для анализа влия-
ния конкретных факторов. Упоминавшиеся выше опыты с Fra-
xinus [8] показали, что на развитие сосудов особенно влияет вве-
дение индолилуксусной кислоты. Увеличение концентрации этого
стимулятора приводит к образованию более широких сосудов, но
этот эффект снижается, если водный потенциал ослаблен. Авторы
указанной работы считают, что неравномерное распределение
крупных и мелких сосудов в древесине может быть результатом
неравномерного распределения ростовых веществ между ксилем-
ными инициалями. Возможно, отдельные клетки или группы кле-
ток обладают повышенными способностями к поглощению мета-
болитов, в связи с чем концентрация растворов в них повышается
и они получают определенные преимущества в конкурентной борь-
бе за воду. Успешно конкурирующие клетки быстро растут и диф-
ференцируются в членики сосудов.
При изучении на гистологическом уровне влияния развиваю-
щихся сосудов на окружающие клетки было обнаружено, что кон-
куренция играет важную роль в регуляции клеточного развития
10*
148
Глава 9
и дифференциации. Когда будущий сосудистый элемент начинает
растягиваться в зоне материнских клеток камбия, образование
новых клеток в одном или нескольких соседних рядах приоста-
навливается. Деление в этих рядах возобновляется только после
того, как сосуд заканчивает растяжение и камбий смещается в
наружном направлении. Если образующегося при этом простран-
ства недостаточно для размещения растягивающегося сосуда, он
оказывает давление на соседние клетки. Клетки, расположенные
между растущими сосудами, часто имеют неправильную форму
и в зрелом состоянии именуются дизъюнктивными паренхимными
клетками или дизъюнктивными трахеидами в зависимости от окон-
чательной специализации.
Обнаружение определенных связей между наличием ауксинов
и воды и дифференциацией сосудов кладет лишь начало анализу
факторов, которые вызывают появление глубоких различий среди
клеток, происходящих из внешне более или менее идентичных
камбиальных предшественников. Интрузивное удлинение волокон
(гл. 6), образование идиобластов из клеток, накапливающих спе-
цифические эргастические вещества или дифференцирующихся в
склереиды, различные типы функциональной специализации па-
ренхимных элементов ксилемы — все это примеры определенным
образом запрограммированных направлений клеточного развития,
которые нуждаются в объяснении с точки зрения контролирующих
факторов.
Реактивная древесина
Реактивная древесина образуется на нижней стороне ветвей,
в наклонных или изогнутых стволах хвойных; в таких же органах
двудольных она возникает на верхней стороне. Такая древесина
получила наименование реактивной (у хвойных — древесины сжа-
тия, у двудольных — древесины растяжения), потому .что ее об-
разование вызвано тенденцией ветвей и стволов противодейство-
вать нагрузкам, возникающим при наклонном положении [23].
Реактивная древесина встречается также и в корнях [24].
Исследования, включавшие экспериментальное изменение по-
ложения осей растения, обнаружили, что наиболее важными фак-
торами, обусловливающими развитие реактивной древесины, яв-
ляются гравитационные силы и распределение эндогенных стиму-
ляторов роста [3, 24]. Опыты с ауксинами и антиауксинами пока-
зали, что древесина растяжения двудольных формируется там„
где концентрация ауксинов относительно низкая [15]. В противо-
положность этому древесина сжатия голосеменных образуется в
зонах с повышенной концентрацией ауксинов [24]. Для того чтобы
успешно противодействовать нагрузкам, возникающим при на-
клонном положении, дифференцирующиеся клетки реактивной
Ксилема: вариации структуры древесины
149>
древесины подвергаются в большей мере лигнификации и утол-
щению оболочки [19].
Реактивная древесина отличается от нормальной и анатомиче-
ски и химически [7]. Древесина сжатия хвойных обычно более
плотная и темная, чем окружающая ткань; ее трахеиды короче,
чем трахеиды нормальной древесины. Клеточные стенки на попе-
речных срезах выглядят более округлыми и отличаются высокой
степенью лигнификации отдельных слоев. Внутренний слой в обыч-
ной трехслойной вторичной оболочке у таких клеток отсутствует.
В древесине растяжения двудольных наблюдается дедукция сосу-
дов по числу и диаметру, а волокна имеют толстый внутренний
слой оболочки, характеризующийся высоким коэффициентом пре-
ломления— так называемый желатинозный слой, состоящий в ос-
новном из целлюлозы. Оболочки таких волокон могут быть двух-
или четырехслойными, причем желатинозный слой обычно явля-
ется наиболее внутренним (гл. 8).
Определение древесин
Использование древесин для целей определения растений тре-
бует очень широких знаний структуры древесины и факторов, ее
изменяющих. В основу поиска диагностических признаков лучше
всего положить изучение коллекций, включающих образцы дре-
весины нескольких деревьев каждого вида, причем такое иссле-
дование следует вести обязательно с учетом положения данных
образцов в теле растения. Древесина приобретает зрелую струк-
туру не вблизи зоны камбиальной активности. Следовательно,
существует различие между древесиной небольших ветвей и ство-
ла. Кроме того, в определенных местах древесина имеет свойства
реактивной, что в той или иной степени изменяет те ее признаки,
которые считаются типичными для данного таксона. Характерные
для данной древесины диагностические признаки могут быть за-
вуалированы неблагоприятными или необычными условиями про-
израстания, а также неправильными методами приготовления
препаратов для микроскопии.
При определении древесин осложняющим обстоятельством
является и то, что анатомические признаки древесины часто менее
разнообразны, чем внешние морфологические признаки, позволяю-
щие с высокой точностью различать отдельные таксоны. Древеси-
ны крупных таксонов значительно отличаются друг от друга, но
внутри мелких близкородственных таксонов, таких, как виды или
даже роды, древесины могут быть столь однообразны, что устой-
чивых различий обнаружить не удается. В таких случаях прихо-
дится прибегать к использованию совокупности макроскопических
и микроскопических признаков древесин, а также их запаха и
вкуса.
150
Глава 9
Признаки, используемые при определении древесин
Существуют два крупных таксона, которые дают промышлен-
ную древесину и анатомия которых хорошо изучена,— хвойные
(мягкодревесинные) и двудольные (твердодревесинные). В клю-
чах для определения древесин эти два таксона всегда различаются
по присутствию сосудов: у хвойных — непоровые древесины (без
сосудов), у двудольных — поровые (с сосудами). Составляющие
исключение бессосудистые низшие двудольные (Dritnys, Zygogy-
пит и т. д.) могут быть определены по структуре лучей, которая
более разнообразна, чем у хвойных. Ниже приведены наиболее
важные диагностические признаки мягких и твердых древесин
с указанием основных родов и видов, для которых они харак-
терны.
ХВОЙНЫЕ
Несколько родов (Pinus, Picea, Larix и Pseudotsuga) имеют
нормальные смоляные ходы в осевой и лучевой системах, хотя у
Picea смоляные ходы часто не столь многочисленны, как у пред-
ставителей остальных трех родов. Другие хвойные (Abies, Sequoia,
Taxodium) могут иметь смоляные ходы травматического проис-
хождения, но они возникают только в осевой системе, где распо-
лагаются характерными, ориентированными в тангенциальной
плоскости рядами. Эпителиальные клетки смоляных ходов имеют
тонкие оболочки у Pinus и толстые у Picea, Larix и Pseudotsuga.
Тонкостенные клетки могут быть сжаты на срезах, особенно часто
это происходит с клетками смоляных ходов осевой системы; в лу-
чах их идентифицировать легче.
Лучевые трахеиды встречаются у Pinus, Picea, Larix, Pseu-
dotsuga, Cedrus, Tsuga, Chamaecyparis nootkatensis, изредка у Abi-
es balsamea. Поверхность оболочки лучевых трахеид может быть
зубчатой у одних сосен (Pinus strobus, Р. lambertiana) и глад-
кой— у других (Р. ponderosa).
Клетки лучевой паренхимы тоже имеют ряд диагностических
признаков. Их тангенциальные (концевые) стенки, видимые на
радиальных срезах, могут быть гладкими (Thuja, plicata, Chamae-
cyparis lawsoniana, Araucaria, Podocarpus chilinus, Sequoia semper-
virens, Taxodium distichum, Taxus baccata) или четковидными из-за
глубокой поровости (виды Cedrus, Tsuga, Abies pectinata, Pseu-
dotsuga, Picea, Larix). Поры на радиальных стенках клеток луче-
вой паренхимы, наблюдаемые внутри полей перекреста, варьиру-
ют по величине, числу, расположению и степени развития окай-
мления со стороны осевых трахеид. Сосны имеют либо 1—2 круп-
ные поры на поле перекреста (Pinus lambertiana), либо несколько
более мелких (Р. ponderosa), причем все поры с едва различимым
Ксилема: вариации структуры древесины
151
окаймлением или вообще без него со стороны трахеид. Большин-
ство других хвойных имеют одну или несколько пор с отчетливым
окаймлением со стороны смежных осевых трахеид (полуокаймлен-
ные пары пор). Поры в полях перекреста могут располагаться
рядами (в 1 или 2 ряда) или беспорядочно.
Спиральные утолщения, откладываемые на вторичные оболоч-
ки, обычно встречаются в осевых трахеидах Pseudotsuga, при
этом особенно хорошо они развиты в ранней древесине. Такие же
утолщения иногда обнаруживают в трахеидах поздней древесины
Larix и некоторых видов Picea, у Pinus их нет вообще. У Taxus
спиральные утолщения есть во всех осевых трахеидах; от Pseu-
dotsuga этот род отличается отсутствием нормальных смоляных
ходов и лучевых трахеид. Agathis и Araucaria отличаются от дру-
гих хвойных очередным расположением пор в осевых трахеидах
(в том случае, если они располагаются в два или несколько ря-
дов). Характерным признаком осевых трахеид Cedrus является
зубчатый край торуса в окаймленных порах.
Размер и форма лучей, которые хорошо видны на тангенци-
альных срезах, также используются при определении древесин
хвойных. У Pinus, Picea и Larix веретеновидные лучи, содержащие
смоляные ходы, сильно расширены в центральной части; выше
и ниже смоляного хода они становятся однорядными. У Pseudo-
tsuga контуры луча на тангенциальном срезе имеют более пра-
вильную веретеновидную форму. Лучи Sequoia sempervirens со-
стоят из довольно крупных клеток; в древесине этого вида много
двухрядных лучей. У близкого к нему вида Taxodium distichum
клетки мельче, двухрядные лучи редки. В разных таксонах лучи
могут сильно различаться по высоте. Cedrus имеет, например,
значительно более высокие лучи (иногда свыше 40 клеток), чем
Tsuga и Chamaecyparis nootkatensis, древесина которых по другим
признакам сходна с древесиной Cedrus. Характерным диагности-
ческим признаком может быть наличие осевой паренхимы (Se-
quoia, Taxodium).
ДВУДОЛЬНЫЕ
Твердодревесинные породы обычно подразделяются на две
большие группы по присутствию или отсутствию поровых колец
(сосудов ранней древесины) на поперечных срезах: 1) кольцепо-
ровые— сосуды ранней древесины значительно крупнее, чем со-
суды поздней древесины; 2) рассеяннопоровые — сосуды ранней
древесины не крупнее или лишь незначительно крупнее, чем сосу-
ды поздней древесины. Кольцевая поровость хорошо видна в обыч-
ную лупу на ровной поверхности спила. При определении древе-
сины отнесение ее к одному из этих двух типов вызывает затруд-
нения в случаях, когда сосуды ранней древесины значительно
152
Глава 9
крупнее остальных, но при переходе к поздней древесине сокра-
щаются постепенно (Сагуа), а также когда сосуды ранней дре-
весины не на много крупнее, чем сосуды поздней древесины,
и поэтому не выделяются среди них — в последнем случае древе-
сина классифицируется как полукольцепоровая или полурассеян-
нопоровая, в некоторых случаях одни и те же виды могут быть
отнесены к кольцепоровым древесинам или к одному из проме-
жуточных типов (Сагуа, Catalpa, Robinia)] и, наконец, затрудне-
ние может возникнуть тогда, когда сосуды преобладают в ранней
древесине, но они не крупнее, чем сосуды поздней древесины,—•
в этом случае древесина все равно должна классифицироваться
как рассеяннопоровая (Juglans, Tilia).
Кольцепоровые древесины различаются по степени выражен-
ности кольца пор и другим свойствам. У Fraxinus, Quercus и Ul-
mus переход от ранней древесины к поздней резкий, у Castanea
и Paulownia— постепенный. У Ulmus и Celtis сосуды поздней дре-
весины, трахеиды и паратрахеальная паренхима на поперечных
срезах собраны в волнистые тангенциальные полосы. Древесины
листопадных дубов отличаются от других кольцепоровых древесин
наличием комбинации очень широких высоких лучей, видимых
невооруженным глазом, и узких преимущественно однорядных
низких лучей. Эти дубы делятся на две группы: 1) красные дубы
(Quercus borealis, Q. palustris, Q. velutina), у которых сосуды ран-
ней древесины в ядре обычно свободны от тил, сосуды поздней
древесины округлые на поперечном срезе и имеют толстые стен-
ки, лучи крупные высотой 6—12 мм; 2) белые дубы (Q. alba,
Q. bicolor, Q. macrocarpa), у которых сосуды ранней древесины
в ядре закупориваются тилами, сосуды поздней древесины на по-
перечном срезе имеют неправильную форму, оболочка таких сосу-
дов сравнительно тонкая, высота лучей 12—32 мм. Тилы обычны
также для Carya, Maclura, Morus и Robinia.
Многие кольцепоровые древесины, такие, как у Catalpa, Celtis,
Gymnocladus, имеют спиральные утолщения в узких сосудах позд-
ней древесины. Древесина Sassafras обычно отличается лестнич-
ными перфорационными пластинками в сосудах поздней древеси-
ны, тонкостенными волокнами и масляными клетками в 1—4-ряд-
ных лучах. Представители Fabales, Cercis, Gleditsia, Gymnocladus
и Robinia имеют зубчатые окаймленные поры (см. словарь тер-
минов) .
Наряду с другими признаками при определении древесин мо-
гут успешно использоваться распределение осевой паренхимы и
структура лучей. Лучи редко бывают однообразными — гомоцел-
люлярными или гетероцеллюлярными. Однорядные гомоцеллю-
лярные лучи встречаются у Castanea и многорядные, тоже по
существу гомоцеллюлярные,— у Fraxinus, Gymnocladus, Paulow-
nia и Ulmus. Fraxinus имеет отчетливо выраженную вазицентри-
Ксилема: вариации структуры древесины
153
Таблица 9.1
Примеры древесин с различным распределением сосудов
Кольцепоровые
Carya pecan (пекан)
Castanea dentata (каштан американский)
Catalpa speciosa (катальпа)
Celtis occidentalis (каркас)
Fraxinus americana (ясень американский)
Gleditsia triacanthos (гледичия трехколючковая)
Gymnocladus dioicus (кентуккийское кофейное дерево)
Maclura pomifera (маклюра оранжевая)
Morus rubra (шелковица красная)
Paulownia tomentosa (адамово дерево)
Quercus spp. (листопадные дубы)
Robinia pseudoacacia (белая акация)
Sassafras albidum (сассафрас)
Ulmus americana (ильм американский)
Полукольцепоровые или полурассеяннопоровые
Diospyros virginiana (хурма виргинская)
Juglans cinerea (орех серый)
Juglans nigra (орех черный)
Lithocarpus densiflora (камнеплодник густоцветковый)
Populus deltoides (тополь дельтовидный)
Prunus serotina (черемуха поздняя)
Quercus virginiana (дуб виргинский)
Salix nigra (ива черная)
Диффузнопоровые
Acer saccharinum (клен серебристый)
Acer sac char um (клен сахарный)
Aesculus glabra (конский каштан голый)
Aesculus hippocastanum (конский каштан обыкновенный)
Alnus rubra (ольха красная)
Betula nigra (береза черная)
Carpinus caroliniana (граб американский)
Cornus florida (кизил флоридский)
Fagus grandifolia (бук крупнолистный)
Ilex ораса (падуб тусклый)
Liquidambar styraciflua (ликвидамбар смолоносный)
Liriodendron tulipifera (тюльпанное дерево)
Magnolia grandiflora (магнолия крупноцветковая)
Nyssa sylvatica (нисса лесная)
Platanus occidentalis (платан западный)
Tilia americana (липа американская)
Umbellularia californica (калифорнийский лавр)
ческую паренхиму. В древесине Сагуа апотрахеальная паренхима
образует 1—4-рядные тангенциальные полосы, видимые на попе-
речном срезе.
Среди таксонов с полукольцепоровой древесиной Diospyros
отличается явно выраженной ярусностью древесины и мелкой
154
Глава 9
межсосудистой поровостью. Prunus имеет спирали в сосудах и
очень малое количество осевой паренхимы. У Salix наблюдаются
однорядные гетероцеллюлярные лучи, у Populus — однорядные
гомоцеллюлярные. Quercus virginiana и Lithocarpus, подобно ли-
стопадным дубам, имеют лучи двух видов: многочисленные низ-
кие однорядные лучи и высокие многорядные лучи. Последние
могут быть простыми или составными. Составные лучи наиболее
характерны для Lithocarpus. У обоих видов вазицентрические
трахеиды и редкая паратрахеальная паренхима образуют обклад-
ки вокруг сосудов.
В таксонах с рассеяннопоровой древесиной для большинства
родов типичны лестничные перфорационные пластинки — это А1-
nus, Betula, Cornus, Ilex, Liriodendron, Liquidambar, Nyssa; в ос-
новном лестничные, но иногда и простые — Magnolia; простые,
лишь изредка лестничные — Carpinus, Fagus, Platanus. Характер
межсосудистой поровости также может быть полезным диагности-
ческим признаком. Она бывает лестничной у Cornus и Magnolia,
супротивной — у Liriodendron и Nyssa, супротивной или линей-
ной— у Liquidambar. Очень мелкая поровость характерна для
Betula, групповая — для Carpinus и Fagus, негрупповая — для А1-
nus и Platanus. Спиральные утолщения типичны для Ilex, Magno-
lia и Tiller, у Aesculus, Liriodendron и Nyssa они могут формиро-
ваться только в суженных кончиках члеников сосудов.
В заключение отметим некоторые характерные особенности
лучевой структуры: у Betula — гомоцеллюлярные 1—3-рядные
лучи; у Alnus и Carpinus — узкие простые и широкие составные
лучи; у Platanus — 3—14-рядные гомоцеллюлярные лучи более
3 мм в высоту. Лучи двух размеров встречаются у Fagus\ узкие,
в большинстве случаев однорядные низкие и широкие многоряд-
ные высокие — комбинация, сходная с той, которая характерна
для дубов. Два типа лучей могут быть найдены также у Acer
(в различных сочетаниях у отдельных видов) и ТШа. У Cornus
и Ilex однорядные лучи составлены полностью или в основном
из стоячих клеток, многорядные — из лежащих клеток в средней
части луча и стоячих по краям. Сходную лучевую систему имеет
Liquidambar, за исключением того, что доля стоячих клеток в лу-
чах относительно мала. Liquidambar может иметь травматические
камедные ходы. У Umbellularia в лучах содержатся масляные
клетки.
СПИСОК ЛИТЕРАТУРЫ
1. Braun Н. J. Funktionelle Histologie der sekundaren Sprossachse. I. Das Holz.
Handbuch der Pflanzenanatomie, Band 9, Teil 1, 1970.
2. Carlquist S. Comparative plant anatomy, New York, Holt, Rinehart and Win-
ston, 1961.
3. Casperson G. Zur Kambiumphysiologie von Aesculus hippocastanum L., Flora,
155, 515—543 (1965).
Ксилема: вариации структуры древесины
155
4. Chattaway М. М. The development of tyloses and secretion of gum in heart-
wood formation, Aust. J. Sci. Res. B., Biol. Sci., 2, 227—240 (1949).
5. Czaninski Y. Etude du parenchyme ligneux du Robinier (parenchyme a reserves-
et cellules associees aux vaisseaux) au cours du cycle annuel, J. Microscopic,
7, 145—164 (1968).
6. Czaninski Y. Observations sur une nouvelle couche parietale dans les cellules
associees aux vaisseaux du Robinier et du Sycomore, Protoplasma, 77, 211 —
219 (1973).
7. Dadswell H. E., Wardrop A. B., Watson A. J. The morphology, chemistry and
pulp characteristics of reaction wood. In: Fundamentals of papermaking fibres,
pp. 187—219, British Paper and Board Makers’ Association, 1958.
8. Doley D., Leyton L. Effects of growth regulating substances and water poten-
tial on the development of secondary xylem in Fraxinus, New Phytol., 67,
579—594 (1968). Effects of growth regulating substances and water potential
on the development of callus in Fraxinus, New Phytol., 69, 87—102 (1970).
9. Fahn A., Zamski E. The influence of pressure, wind, wounding and growth
substances on the rate of resin dust formation in Pinus halepensis wood, Israel
J. Bot., 19, 429—446 (1970).
10. Foster R. C. Fine structure of tyloses in three species of the Myrtaceae, Aust.
J. Bot., 15, 25—34 (1967).
11. Fritts H. C. Growth rings of trees: their correlation with climate, Science, 154,
973—979 (1966).
12. Jane F. W. The structure of wood, 2nd ed., Revised by Wilson K., White D. J. B.,
London, Adam & Charles Black, 1970.
13. Meyer R. W., Cote W. A., Jr. Formation of the protective layer and its role
in tylosis development, Wood Sci. Tech., 2, 84—94 (1968).
14. Money L. L., Bailey I. W., Swamy B. G. L. The morphology and relationships
of the Monimiaceae, J. Arnold Arb., 31, 372—404 (1950).
15. Morey P. R., Cronshaw J. Developmental changes in the secondary xylem of
Acer rubrum induced by gibberellic acid, various auxins and 2,3,5-tri-iodoben-
zoic acid, Protoplasma, 65, 315—326 (1968).
16. O'Brien T. P. Primary vascular tissues. In: Dynamic aspects of plant ultra-
structure, Robards A. W., ed., Chapter 12, pp. 414—440, London, McGraw-Hill
Book Company (UK) Limited, 1974.
17. Panshin A. J., de Zeeuw C. Textbook of wood technology, Vol. 1, Structure,
identification, uses and properties of the commercial woods of the United Sta-
tes and Canada, New York, McGraw-Hill Book Company, 1970.
18. Sauter J. J., I ten W., Zimmermann M. H. Studies on the release of sugar into
the vessels of sugar maple (Acer saccharum), Can. J. Bot., 51, 1—8 (1973).
19. Scurfield G. Reaction wood: its structure and function, Science, 179, 647—655
(1973).
20. Sheldrake A. R. Auxin in the cambium and its differentiating derivatives,
J. Exp. Bot., 22, 735—740 (1971).
21. Shininger T. L. The production and differentiation of secondary xylem in Xan-
thium pennsylvanicum, Amer. J. Bot, 57, 769—781 (1970).
22. Shininger T. L. The regulation of cambial division and secondary xylem dif-
ferentiation in Xanthium by auxins and gibberellin, Plant Physiol., 47, 417—422
(1971).
23. Sinnott E. W. Reaction wood and the regulation of tree form, Amer. J. Bot,
39, 69—78 (1952).
24. Westing A. H. Formation and function of compression wood in gymnosperms,
Bot. Rev., 31, 381—480 (1965); 34, 51—78 (1968).
25. Zimmermann M. EL, Brown C. L. Trees. Structure and function, New York,
Springer Verlag, 1971.
Глава 10
Камбий
Камбий представляет собой меристему, которая образует вто-
ричные проводящие ткани. Он является латеральной меристемой,
так как в противоположность апикальной занимает латеральное
положение в стебле и корне. Пространственно камбий организо-
ван как сплошной футляр вокруг ксилемы стебля, корня и их от-
ветвлений; в форме полос он проникает и в листья, если последние
обладают способностью к вторичному росту.
Структура камбия
Клетки камбия не соответствуют обычному представлению
о меристематических клетках как о клетках, имеющих плотную
цитоплазму, крупные ядра и более или менее изодиаметрическую
форму. Правда, в покоящемся камбии клетки содержат сравни-
тельно немного мелких вакуолей, но клетки активного камбия
всегда сильно вакуолизированы [18]. По форме выделяются два
типа камбиальных клеток. У клеток первого типа — веретеновид-
ных инициалей (рис. 10.1,Л)—длина в несколько, а иногда и во
много раз больше ширины. Клетки второго типа — лучевые ини-
циали (рис. 10.1,5)—лишь слегка удлинены или почти изодиа-
метричны. Хотя клетки первого типа по своему очертанию напо-
минают веретено, однако в средней части они имеют приблизи-
тельно призматическую форму, а на концах — клиновидную. Ост-
рые вершины клиньев видны на тангенциальных срезах, а усе-
ченные— на радиальных (рис. 10.1, Л). В тангенциальной пло-
скости клетки обычно шире, чем^ в радиальной.
В камбиальной зоне веретеновидные инициали и их производ-
ные составляют осевую систему, а лучевые инициали — радиаль-
ную. Камбий может быть ярусным или неярусным в зависимости
от того, расположены ли клетки на тангенциальных срезах гори-
зонтальными рядами или нет (фото 43). В ярусном камбии ве-
ретеновидные инициали короче и в меньшей степени перекрывают
друг друга, чем в неярусном. Расположение камбиальных инициа-
лей определяет организацию вторичных проводящих тканей. Клет-
ки осевой системы в этих тканях происходят из сходно располо-
женных веретеновидных инициалей, а клетки лучевой системы —
из лучевых инициалей; ярусный камбий дает начало ярусной дре-
Камбий
157
Рис. 10.1. Камбий и производные ткани. А. Схема веретеновидной инициали.
Б. Схема лучевой инициали. На обоих рисунках пунктиром показана плоскость
периклинального деления, приводящего к образованию клеток флоэмы и ксиле-
мы. В — Д. Флоэма, камбий и ксилема на срезах стебля Robinia pseudoacacia.
В. Поперечный срез. Г. Радиальный срез (показана только осевая система).
Д. Радиальный срез (показан только луч). 1 — периклинальное деление; 2 — ве-
ретеновидные инициали; 3— лучевые инициали; 4 — флоэма; 5 — камбий; 6 — кси-
лема; 7 — сосуд; 8 — волокна; 9 — ситовидные трубки; 10 — сосуды; И — кри-
сталл; 12— кольцо перфорации; 13— луч.
весине, а из неярусного камбия возникает неярусная древесина.
Когда камбиальные инициали образуют клетки вторичных
ксилемы и флоэмы, они делятся периклинально (рис. 10.1, А, Б).
Производные клетки откладываются попеременно то в сторону
ксилемы, то в сторону флоэмы, однако такое чередование не всег-
да бывает правильным. Таким образом, каждая инициаль обра-
зует два стыкующихся с ней радиальных ряда клеток, один из
которых обращен наружу, а другой — внутрь (рис. 10.1, В и фо-
то 44). Камбиальные деления, добавляющие клетки к вторичным
проводящим тканям, называются аддитивными делениями [2].
В период наибольшей активности камбия деление клеток про-
исходит столь быстро, что к моменту образования новых ранее
158
Глава 10
отложенные клетки еще остаются меристематическими, в резуль-
тате чего образуется широкая зона более или менее недифферен-
цированных клеток. В этой зоне, называемой камбиальной, только
одна клетка в каждом конкретном радиальном ряду может рас-
сматриваться как инициаль, так как после ее периклинального
деления одна из двух образовавшихся клеток остается инициалью,
а другая присоединяется к дифференцирующейся флоэме или кси-
леме. Инициали трудно отличить от их ближайших производных
вследствие того, что последние делятся тоже периклинально один
или несколько раз, перед тем как начать дифференцироваться в
клетки ксилемы или флоэмы. Поэтому некоторые исследователи
предпочитают использовать термин «камбий» для обозначения
всей камбиальной зоны [7].
Таким образом, камбиальная зона составляет более или ме-
нее широкий слой периклинально делящихся клеток, организован-
ных в виде осевой и лучевой систем. Приблизительно в медианной
плоскости этой зоны обычно выделяют один слой собственно
камбиальных инициалей. Примыкающие к нему снаружи и изну-
три слои делящихся клеток (фото 44) обозначают как флоэмные
и ксилемные инициали (или материнские клетки флоэмы и ксиле-
мы). В соседних радиальных рядах инициали располагаются не
всегда строго тангенциально по отношению друг к другу: в одном
ряду инициаль может находиться ближе к ксилеме или флоэме,
чем в другом [3]. Более того, одна из инициалей может вообще
перестать участвовать в аддитивных делениях, замещаясь своей
производной, которая берет на себя ее функции.
Изменения в инициальном слое
в процессе развития
По мере нарастания толщины вторичной ксилемы камбий сме-
щается наружу и длина его окружности увеличивается. Такое
увеличение достигается путем деления клеток, но у древесных
растений в этом процессе участвует целый комплекс явлений —
интрузивный рост, элиминация инициалей, образование лучевых
инициалей из веретеновидных. Изменения в структуре камбия
отражаются на клеточной организации производных тканей, по-
этому для анализа поведения камбия в прошлом можно исполь-
зовать серийные поперечные и тангенциальные срезы (особенно
срезы ксилемы).
Деления, приводящие к увеличению числа камбиальных ини-
циалей, называются мультипликативными [2]. В камбии с корот-
кими веретеновидными инициалями среди мультипликативных
делений преобладают радиальные антиклинальные деления
(рис. 10.2, Л) [6]. В результате на месте одной клетки появля-
Камбий
159
Рис 10 2 Деление и рост веретеновидных инициалей А Радиальное антикли-
нальное деление Б Латеральное антиклинальное деление В — Д Антиклиналь-
ные деления с разными углами наклона Е Ж Наклонные антиклинальные де-
ления с последующим апикальным интрузивным ростом (растущие вершины от-
мечены точками) 3, И Ветвление веретеновидных инициалей при интрузивном
росте (Juglans) К — М Внедрение веретеновидных инициалей в лучи (Li-
riodendron) (На всех рисунках показаны тангенциальные срезы клеток)
ются две расположенные рядом клетки, каждая из которых растет
в тангенциальном направлении У травянистых и кустарниковых
двудольных антиклинальные деления часто бывают латеральны-
ми, в этом случае оболочка одной и той же материнской клетки
рассекается дважды (рис 10 2, Б) [10] Длинные веретеновидные
160
Глава 10
рассекается дважды (рис. 10.2, Б) [10]. Длинные веретенобидные
3] (псевдотрансверсалъные деления; рис. 10.2,В — Д и фото 46,Л)
и каждая новая клетка удлиняется путем апикального интрузив-
ного роста (рис. 10.2, Е,Ж). В результате такого роста новые
сестринские клетки в конечном счете оказываются расположенны-
ми бок о бок в тангенциальной плоскости (рис. 10.2, Ж), что и
приводит к увеличению длины окружности камбия. При интрузив-
ном росте концы клеток могут ветвиться (рис. 10.2,3,77). Луче-
вые инициали также претерпевают радиальные антиклинальные
деления, если растение имеет двухрядные или многорядные лучи.
Формирование лучевых инициалей из веретеновидных инициа-
лей или их сегментов — обычное явление. Если сравнить слои приро-
ста, расположенные в разных частях ксилемы, то можно заметить
относительное постоянство соотношения между ее лучевыми и
осевыми компонентами [5]. Такое постоянство достигается за счет
добавления новых лучей по мере увеличения диаметра цилиндра,
образованного ксилемой, т. е. в камбии появляются новые луче-
вые инициали, происходящие из веретеновидных инициалей.
Инициали новых однорядных лучей могут возникать как одно-
клеточные сегменты, отделяемые от веретеновидных инициалей
в их средней части или вблизи вершин. Именно так закладывают-
ся новые однорядные лучи у хвойных [5]. У травянистых и ку-
старниковых двудольных новые лучи образуются путем попереч-
ных делений веретеновидных инициалей [8—10]. Формирование
лучей может быть достаточно сложным процессом, включающим
поперечные деления веретеновидных инициалей с образованием
нескольких клеток, утрату одних производных и трансформацию
других в лучевые инициали [2]. Утрата или элиминация иници-
альной клетки происходит в результате ее смещения в сторону
ксилемы или флоэмы и дифференциации в конечном счете в клет-
ку той или другой ткани, часто сопровождаемой ' постепенным
уменьшением ее размеров, которое можно наблюдать еще в ини-
циальном слое [1].
У хвойных и двудольных новые однорядные лучи вначале име-
ют высоту в 1—2 клетки и только постепенно они достигают высо-
ты, типичной для данного вида [5]. Увеличение высоты луча
происходит посредством поперечных делений уже существующих
лучевых инициалей и путем слияния лучей, лежащих друг над дру-
гом. Процесс формирования многорядных лучей -включает ради-
альные антиклинальные деления инициалей и слияние латерально
расположенных лучей. В пользу такого механизма свидетельст-
вует то, что одни веретеновидные инициали, заключенные между
лучами, в результате поперечных делений преобразуются в луче-
вые инициали, а другие смещаются к ксилеме или флоэме и вы-
ходят из инициальной зоны. Встречается также и обратный про-
цесс— расщепление лучей. Сущность этого процесса сводится к
Камбий
161
нарушению целостности группы лучевых инициалей вследствие
внедрения в нее веретеновидных инициалей (рис. 10.2, И — М и
фото 46, В).
Мультипликативные и аддитивные деления обычно приурочены
к концу периода максимального роста, связанного с сезонным
формированием ксилемных и флоэмных элементов [3, 5]. У расте-
ний с неярусным камбием такой характер согласования делений
приводит к тому, что в конце сезона камбий содержит более ко-
роткие веретеновидные инициали, чем в начале. Впоследствии
новые клетки удлиняются и средняя длина инициалей увеличива-
ется до тех пор, пока в конце следующего сезона не наступает
новый период делений.
Периодические изменения длины веретеновидных инициалей
находят свое отражение в разнообразии длины развивающихся ив
них клеток ксилемы. И у голосеменных, и у покрытосеменных
длина клеток, имеющих вытянутую форму (трахеиды, волокна) г
возрастает в процессе развития древесины [4]. Увеличение длины
ьеретеновидных инициалей наблюдается также при переходе от
начального этапа вторичного роста к следующим ростовым cesot
нам и продолжается до тех пор, пока длина инициалей более или
менее не стабилизируется; в последующем она может постепенно
сокращаться [12].
У некоторых хвойных антиклинальные деления веретеновидных
инициалей подчинены общей четко выраженной схеме [14]. На-
клонные стенки, формируемые в ходе мультипликативных деле-
ний, на значительных по протяженности участках камбия ориен-
тированы в одном направлении. Такие участки, различающиеся
по размеру и ориентации вновь закладываемых стенок, периоди-
чески чередуются вдоль камбиальной зоны. Однообразная ориен-
тация антиклинальных стенок и интрузивный рост вершин вновь
образуемых клеток в сочетании с частичной утратой инициалей
обусловливают формирование древесины со спиральной струк-
турой.
Приведенные выше данные о трансформациях в инициальной
зоне развивающегося камбия ясно показывают, что эта меристе-
ма находится в состоянии постоянных изменений. Концепция кам-
биальных инициалей должна учитывать это отсутствие стабильно-
сти. Наиболее показательной чертой в этом отношении является
элиминация камбиальных инициалей. Несмотря на то что инициа-
ли часто претерпевают изменения, функция инициации новых
клеток поддерживается в них постоянно, передаваясь «по наслед-
ству» от одной клетки к другой [16]. Признание непостоянства
клеточной организации камбия не вполне согласуется с концеп-
цией однорядности слоя камбиальных инициалей. В связи с этим
положение о том, что только один специфический слой следует
именовать инициальным слоем, часто ставится под сомнение [ 17]<.
11 К Эзау, кн. 1
162
Глава 10
Рис 10 3 Деление веретеновидных
инициалей А — В Три стадии фор-
мирования клеточной пластинки (ра-
диальные срезы) Г, Д Две стадии
формирования клеточной пластинки
(тангенциальные срезы) На Б и Д
показано, что клеточная пластинка
распространилась приблизительно на
7з клетки (Все схемы иллюстрируют
случай деления клетки в танген-
циальной плоскости ) 1 — фрагмо-
пласт, 2 — клеточная пластинка; 3—
ядра.
Однако исследования, проведенные на камбии хвойных, показали,
что мультипликативные деления, определяющие топографию кле-
ток в ксилеме и флоэме, встречаются только в одном определен-
ном слое [3]. Следовательно, несколько слоев камбиальной зоны,
сходные цитологически и претерпевающие деления, не эквивалент-
ны по степени их участия в формировании архитектуры вторичных
проводящих тканей. В каждый конкретный момент всего лишь
один слой функционирует как инициальный слой, обеспечивающий
биполярную модель клеточной организации.
Происходящий в камбии цитокинез — процесс формирования
новых клеток — представляет особый интерес в тех случаях, когда
клетки делятся продольно и новая оболочка закладывается вдоль
длинной оси клетки. При таком делении начальный диаметр фраг-
мопласта, образующегося во время телофазы (рис. 10.3, Д), на-
много короче, чем длинная ось клетки. Фрагмопласт и клеточная
пластинка достигают продольных стенок камбиальной клетки
вскоре после деления ядра (рис. 10 3, Д), но продвижение кле-
точной пластинки к противоположным концам клетки происходит
в течение довольно длительного времени (рис. 10.3, А — В). Фраг-
мопласт, который еще не дошел до боковых стенок, выглядит во
фронтальной плоскости как округлый ореол (рис. 10.3,Г). После
того как клеточная пластинка слилась с боковыми стенками, но
еще не достигла торцевых, фрагмопласт во фронтальной плоскости
образует два барьера, пересекающихся с боковыми стенками (фо-
то 46, £ и рис. 10.3 Д).
Ультраструктурные данные о цитокинезе длинных камбиаль-
ных клеток, делящихся продольно, сходны с теми, которые по-
Камбий
163
лучены на материале изодиаметрических клеток (гл. 4). Так как
делящиеся камбиальные клетки сильно вакуолизированы, обра-
зование цитоплазматического слоя, разделяющего вакуоль,—
фрагмосомы — кажется наиболее важной предпосылкой для дви-
жения фрагмопласта и клеточной пластинки от места расположе-
ния ядра к вершинам клетки. Фрагмосома хорошо различима на
поперечных срезах делящихся веретеновидных инициалей [13],
но пока еще не выявлена на продольных срезах. Возможно, что
она формируется не сразу, а постепенно по мере продвижения
фрагмопласта, образуя непрерывный слой, связанный с парие-
тальной цитоплазмой.
Камбиальная активность; закономерности
и причинные связи
Сезонные изменения активности камбия — хорошо изученная
тема, но по мере обнаружения причинных связей между ростом
и дифференциацией в ней открываются новые аспекты [15].
У древесных растений, произрастающих в умеренных широтах,
зимний период покоя сменяется возобновлением активности кам-
бия. Камбиальные клетки поглощают воду, растягиваются в ра-
диальном направлении и делятся периклинально (фото 45,5).
По мере того как клетки растягиваются, их радиальные стенки
становятся тоньше, в результате чего кора (флоэма и ткани, рас-
положенные снаружи от нее; гл. 12) легко отделяется от древе-
сины (фото 45, В). Клеточные деления не всегда начинаются в
инициальном слое. Первые деления могут происходить в перези-
мовавших материнских клетках ксилемы и флоэмы, и лишь за-
тем следуют аддитивные деления клеток в инициальном слое.
Отделение коры совершается не только по инициальному слою,
но часто и по дифференцирующейся ксилеме. У двудольных растя-
гивающиеся сосуды образуют очень слабую связь между корой
и древесиной в период камбиального роста. Аддитивные деления
достигают своего максимума через несколько недель после реак-
тивации камбия. Периодичность камбиальной активности наблю-
дается как у листопадных, так и у вечнозеленых растений, причем
она не ограничена только районами с умеренным климатом. Од-
нако в тропиках периодичность камбиальной активности менее
зависит от сезонных изменений внешних условий и может быть
слабо выраженной или отсутствовать вовсе.
Первый вклад инициального слоя может быть сделан или
в ксилему, или во флоэму — это зависит от видовой специфики
растения. Однако обычно ксилему пополняет большее число кле-
ток. Механизм добавления клеток к ксилеме и флоэме изучен на
11*
164
Глава 10
вновь образуемых вторичных тканях Eucalyptus [23] путем ис-
пользования меченого СО2, включаемого в клеточную оболочку
в виде полисахаридов, содержащих изотоп 14С. Эти наблюдения
показали, что отложение клеток в сторону ксилемы в 4 раза пре-
вышает их отложение в сторону флоэмы. Наиболее заметные
различия в этом отношении наблюдаются у хвойных. У Thuja
occidentalis в период интенсивного роста на флоэмную сторону
откладывается всего 12—16 клеток, тогда как на ксилемную за
то же время— 100 и более.
Инициация камбиальной активности весной тесно связана
с возобновлением роста почек. Такая связь наиболее выражена
у двудольных с рассеяннопоровой древесиной. Судя по легкости,
с которой кора начинает отделяться от древесины, камбиальная
активность появляется вначале ниже закладывающихся новых
побегов и распространяется базипетально в ствол и корень. Про-
межуток времени между реактивацией камбия, расположенного
под почками, и его реактивацией в корнях может составлять не-
сколько недель. Взаимосвязь между ростом новых побегов и во-
зобновлением деятельности камбия менее выражена у двудольных
с кольцепоровой древесиной и у хвойных. Однако эксперименталь-
ные работы, в том числе опыты по удалению почек и листьев,
показали, что и у этих растений первичный рост в побегах обычно
служит стимулом для возобновления вторичного роста в располо-
женных ниже осях. Соответственно прекращение камбиальной
активности в конце ростового сезона коррелирует с завершением
удлинения побегов [11].
Гормональная природа стимулов, индуцирующих камбиальную
активность, предполагалась уже в самых ранних работах по вто-
ричному росту. Последующие интенсивные исследования ясно
показали, что инициальная стимуляция камбиальной активности
связана с нисходящим движением ростовых веществ из развива-
ющихся почек [19]. При таком движении возникает градиент
концентрации гормонов и зависимое от него распространение
камбиальной активности [11]. Растущие почки обеспечивают на-
чальный импульс для возобновления камбиальной активности, но
поддержание этой активности происходит, по-видимому, незави-
симо от транспорта ауксинов из побегов. Как свидетельствуют
исследования вторичного роста, проведенные на отдельных меж-
доузлиях [21], продолжение камбиальной активности обеспечи-
вается локальным источником ауксинов. Анализ содержания аук-
синов в трех слоях камбиальной зоны — дифференцирующейся
ксилеме, камбии и дифференцирующейся флоэме — выявил, что
основным источником локальных ауксинов служит дифференци-
рующаяся ксилема. Высказано предположение [20], что этот аук-
син освобождается из автолизирующихся трахеальных клеток по
мере их превращения в мертвые проводящие элементы.
Камбий
165
Ауксин является, вероятно, одним из наиболее важных росто-
вых веществ, стимулирующих камбиальный рост, но существуют
и другие вещества, например цитокинины и гибберелловая кисло-
та, которые могут вместе с ауксином активизировать камбий и
поддерживать механизм дифференциации его производных. Более
того, гормональные регуляторы роста действуют всегда в сочета-
нии с другими ростовыми факторами, такими, как питательные
вещества (особенно сахара [22]) и вода, благоприятная темпе-
ратура и фотопериод, а также эндогенный ритм ростовых процес-
сов в данном растении.
СПИСОК ЛИТЕРАТУРЫ
1. Ваппап М. W. The vascular cambium and radial growth in Thuja occidental
Us L., Can. J. Bot., 33, 113—138 (1955).
2. Ваппап M. W. Some aspects of the elongation of fusiform cambial cells in Thuja
occidentalis L., Can. J. Bot., 34, 175—196 (1956).
3. Ваппап M. W. Anticlinal divisions and the organization of conifer cambium,
Bot. Gaz., 129, 107—113 (1968).
4. Bisset I. J. W., Dadswell H. E. The variation in cell length within one growth
ring of certain angiosperms and gymnosperms, Aust. Forestry, 14, 17—29
(1950).
5. Braun H. J. Beitrage zur Entwicklungsgeschichte der Markstrahlen, Bot. Stud.,
No. 4, 73—131 (1955).
6. Butterfield B. G, Developmental changes in the vascular cambium of Aeschy-
nomene hispida Willd., New Zeal. J. Bot., 10, 373—386 (1972).
7. Catesson A. M. Origine, fonctionnement et variations cytologiques saisonnieres
du cambium de Г Acer pseudoplatanus L. (Aceracees), Ann. Sci. Nat., Bot Ser.
12, 5, 229—498 (1964).
8. Cumbie B. G. Development and structure of the xylem in Canavalia (Legu-
minosae), Bull. Torrey Bot. Club., 94, 162—175 (1967).
9. Cumbie B. G. Developmental changes in the vascular cambium in Leitneria
floridana, Amer. J. Bot., 54, 414—424 (1967).
10. Cumbie B. G. Developmental changes in the vascular cambium of Polygonum
lapathifolium, Amer. J. Bot., 56, 139—146 (1969).
11. Digby J., Wareing P. F. The relationship between endogenous hormone levels
in the plant and seasonal aspects of cambial activity, Ann. Bot., 30, 608—
622 (1966).
12. Dinwoodie J. M. Tracheid and fibre length in timber. A review of literature,
Forestry (London), 34, 125—144 (1961).
13. Evert R. F., Deshpande В. P. An ultrastructural study of cell division in the
cambium, Amer. J. Bot., 57, 942—961 (1970).
14. Hejnowicz Z. Orientation of the partition in pseudotransverse division in cam-
bia of some conifers, Can. J. Bot., 42, 1685—1691 (1964).
15. Kozlowski T. T. Growth and development of trees. Vol. 2. Cambial growth, ro-
ot growth, and reproductive growth, New York, Academic Press, 1971.
16. Newman I. V. Pattern in meristems of vascular plants. I. Cell partition in li-
ving apices and in the cambial zone in relation to the concept of initial cells
and apical cells, Phytomorphology, 6, 1—19 (1956).
17. Phillipson W. R., Ward J. M., Butterfield B. G. The vascular cambium, London,
Chapman & Hall, 1971.
18. Robards A. W., Kidwai P. A comparative study of ultrastructure of resting
and active cambium of Salix fragilis L., Planta, 84, 239—249 (1969).
166
Глава 10
19. Samish R. M. Dormancy in woody plants, Ann. Rev. Plant Physiol., 5, 183—
204 (1954).
20. Sheldrake A. R. Auxin in the cambium and its differentiating derivatives, J.
Exp. Bot., 22, 735—740 (L971).
21. Sheldrake A. R., Northcote D. H. The production of auxin by tobacco internode
tissues, New Phytol., 67, 1—13 (1968).
22. Siebers A. M., Ladage C. A. Factors controlling cambial development in the
hypocotyl of Ricinus communis L, Acta Bot. Neerl., 22, 416—432 (1973).
23. Waisel Y., Noah I., Fahn A. Cambial activity in Eucalyptus camaldulensis
Dehn. II. The production of phloem and xylem elements, New Phytol., 65,
319—324 (1966).
Глава И
Флоэма
Флоэма — ткань семенных растений, проводящая пластические
вещества и пространственно связанная с ксилемой в общую про-
водящую систему. Подобно ксилеме, флоэма состоит из несколь-
ких типов клеток и может быть подразделена по времени своего
возникновения на первичную и вторичную ткани. Первичная флоэ-
ма возникает из прокамбия. Вторичная флоэма происходит из
камбия и в соответствии с организацией этой меристемы имеет
осевую и лучевую системы клеток. Флоэмные лучи в камбии смы-
каются с лучами ксилемы.
По общему развитию и структуре флоэмная ткань имеет боль-
шое сходство с ксилемой, но этой ткани свойственны и некоторые
структурные особенности, связанные с ее функциональной специ-
фикой. Флоэмная ткань менее склерифицирована и менее долго-
вечна, чем ксилема. Поскольку флоэма обычно занимает пери-
ферическое положение в стебле и корне, она претерпевает значи-
тельные изменения при увеличении окружности осевых органов
и в конечном счете сминается перидермой. Старая ксилема, нао-
борот, в структурном отношении остается относительно неизмен-
ной.
Типы клеток
Первичная и вторичная флоэмные ткани содержат одинаковые
типы клеток, но поскольку в первичной флоэме нет лучей, ее
клетки в отличие от клеток вторичной флоэмы не организованы
в виде осевой и лучевой систем. Схематический рисунок (рис. 11.1)
и перечень типов флоэмных клеток, приведенный в табл. 11.1,
отражают клеточный состав, характерный для вторичной флоэмы.
Ситовидные элементы
Ситовидные элементы являются наиболее высокоспециализиро-
ванными клетками флоэмы. К их характерным особенностям от-
носятся онтогенетически измененные протопласты с ограниченной
метаболической активностью и система межклеточных контактов
с соседними ситовидными элементами, осуществляемых посредст-
168
Глава 11
Рис. 11.1. Типы клеток, встречающиеся во вторичной флоэме двудольного Ro-
binia pseudoacacia. А — Д. Продольные срезы. Е — К. Поперечные срезы А, Д.
Волокна. Б. Членик ситовидной трубки. Е. Ситовидная пластинка. В, Ж. Клетки
флоэмной паренхимы (на В — паренхимный тяж). Г, 3. Кристаллосодержащие
паренхимные клетки. Д, И. Склереиды. Лучевые клетки на тангенциальном (Л),
радиальном (М) и поперечном (В) срезах флоэмы. 1 — ситовидная пластинка;
2 — ситовидное поле; 3 — клетка-спутник; 4 — кристалл.
Таблица 11.1
Типы клеток
Основная функция
Осевая система
Ситовидные элементы
Ситовидные клетки
Членики ситовидных трубок (с клетками-
спутниками)
Дальний транспорт пласти-
ческих веществ
Склеренхимные клетки
Волокна
Склереиды
Паренхимные клетки
Лучевая система
Паренхимные клетки
1 Опорная функция, иногда за-
J пасание пластических веществ
Запасание и радиальный
- транспорт пластических ве-
. ществ
Флоэма
169
вом специализированных участков клеточной оболочки (ситовид-
ных полей), пронизанных отверстиями.
КЛЕТОЧНАЯ ОБОЛОЧКА И СИТОВИДНЫЕ ПОЛЯ
Оболочки ситовидных элементов разнообразны по толщине,
но обычно они заметно толще, чем оболочки окружающих парен-
химных клеток (фото 52, А). На свежих срезах они обнаруживают
характерное свечение, за которое получили наименование перла-
мутровых (имеющих жемчужный блеск) оболочек. У представи-
телей некоторых таксонов оболочки ситовидных элементов сильно
утолщаются (фото 58,Г), и иногда они почти целиком заполняют
просвет клетки [14]. Когда оболочка значительно утолщена,
внутренние ее слои более или менее явно отличимы от внешних
и в некоторых случаях интерпретируются как вторичная оболочка
[11]. Ультраструктурные исследования толстой перламутровой
оболочки, проведенные на некоторых двудольных, обнаружили
параллельную ориентацию микрофибрилл и их концентрическое
расположение внутри оболочки [1]. У Pinus strobus утолщенная
оболочка имеет отчетливую многослойную структуру, причем мик-
рофибриллы располагаются параллельно плоскости оболочки под
углом более 45° к продольной оси клетки. Перламутровая оболоч-
ка имеет относительно рыхлую структуру и состоит из целлюло-
зы и пектиновых компонентов, но даже при значительной толщине
Рис 11 2 Детали ситовидной пластинки А, Г Вид с поверхности Б, В, Д, Е Вид
сбоку А, Б, Г, Д Ситовидная пластинка в период функционирования клетки
В, Е Ситовидная пластинка после прекращения ее функционирования или в про-
цессе отмирания 1 — каллоза, 2— срединная пластинка, 3— первичная оболоч-
ка, 4 — отверстия с содержимым
170
Глава 11
остается нелигнифицированной. Самый внутренний слой оболочки
часто выглядит электронноплотным (фото 52, Л) и обнаруживает
радиальную исчерченность (фото 51, В),
Ситовидные поля — это участки оболочки, пронизанные от-
верстиями, через которые сообщаются между собой протопласты
вертикально или латерально примыкающих друг к другу ситовид-
ных элементов (рис. 11.2, А, Б, Г, Д; фото 47, А Г и фото 51, В).
Ситовидные поля получили свое название на основе их сходства
с ситом. Отверстия ситовидных полей варьируют по величине от
сравнимых с порами, через которые проходят плазмодесмы, до
имеющих несколько микрометров в диаметре. У низших сосуди-
стых растений и голосеменных мелкие и сравнительно однообраз-
ные по размеру отверстия сосредоточены в ситовидных полях,
расположенных на разных стенках клетки. У покрытосеменных
размер отверстий, расположенных на разных стенках, сильно ко-
леблется даже в пределах одной клетки (рис. 11.3, А—В) [15].
Ситовидные поля с крупными отверстиями обычно встречаются
на концевых стенках (рис. 11.2,Д, Б) и лишь изредка — на боко-
вых. Участки оболочки, несущие более дифференцированные си-
товидные поля, т. е. поля с относительно крупными отверстиями,
называются ситовидными пластинками (рис. 11.1,5; 11.2 и фо-
то 47, Л). Этот термин является в какой-то мере аналогом назва-
ния «перфорационная пластинка», употребляемого при описании
перфорированных оболочек члеников сосудов.
На большинстве препаратов проводящей флоэмы каждое от-
верстие ситовидных полей выстлано каллозой (рис. 11.2, Г, Д).
Каллоза — углевод, окрашивающийся анилиновым синим и резор-
циновым синим в голубой цвет и образующий при гидролизе
глюкозу. Чем старше ситовидный элемент, тем больше в нем на-
капливается каллозы. В результате слой каллозы, выстилающий
отверстия, постепенно увеличивается и некоторое ее количество
появляется на поверхности ситовидного поля. По мере того как
ситовидный элемент переходит в состояние покоя или перестает
функционировать совсем, отверстия ситовидных полей все более
сужаются и в конце концов полностью облитерируются. На этой
стадии каллоза располагается в виде подушечки на ситовидном
поле (рис. 11.2, В, Е). В старых, полностью бездействующих си-
товидных элементах каллоза отсутствует, и в ситовидных полях
видны открытые перфорации. Если же флоэма находится в состоя-
нии покоя, то в ходе ее реактивации весной количество каллозы
в ситовидных элементах сокращается и непрерывность прото-
пластов в перфорациях восстанавливается вновь.
Хотя каллоза является характерным компонентом оболочки
ситовидных элементов, детальное исследование показало, что:
1) клетки, находящиеся в функционально активном состоянии,
содержат очень мало каллозы или не содержат ее вообще; 2) кал-
Флоэма
171
лоза исключительно быстро синтезируется в ответ на поранение
и, следовательно, появляется в проводящих клетках во всех тех
случаях, когда материал для исследования препарируется с недо-
статочными предосторожностями, что приводит к грубым повреж-
дениям живых клеток; 3) отложение каллозы на ранней стадии
развития ситовидных полей и в конце функционального периода
представляет собой ответ на внутренние стимулы, а не на внеш-
ние воздействия.
СИТОВИДНЫЕ КЛЕТКИ И ЧЛЕНИКИ СИТОВИДНЫХ ТРУБОК
Степень специализации ситовидных полей и особенности их
распределения вдоль оболочки данной клетки позволяют класси-
фицировать ситовидные элементы на ситовидные клетки и чле-
ники ситовидных трубок. В ситовидных клетках ситовидные поля
не отличаются высокой специализацией и не группируются в виде
ситовидных пластинок (рис. 11.3, А). В члениках ситовидных
трубок более высокодифференцированные ситовидные поля распо-
лагаются лишь на определенных участках оболочки, находящихся
обычно на торцевых стенках и носящих название ситовидных
пластинок (рис. 11.3,5— 3). Ситовидные пластинки обеспечивают
более тесный контакт между члениками ситовидных трубок, чем
менее дифференцированные латеральные ситовидные поля или
ситовидные поля ситовидных клеток. Эволюционное значение
этого различия, по-видимому, состоит в том, что клетки, имеющие
ситовидные пластинки, специализировались для продольного пе-
редвижения растворов в большей степени, чем ситовидные клет-
ки. Такие же различия в степени эффективности наблюдаются
при передвижении растворов по членикам сосудов, связанным
перфорационными пластинками, и трахеидам, соединенным по-
средством пор. Благодаря наличию в члениках сосудов перфора-
ционных пластинок, а в члениках ситовидных трубок ситовидных
пластинок эти два типа клеток, образующих продольные ряды,
действуют как один функциональный элемент. В ксилеме такие
проводящие элементы получили наименование сосудов (гл. 8),
а во флоэме — ситовидных трубок. Таким образом, ситовидная
трубка представляет собой ряд клеток, соединенных между собой
концами посредством ситовидных пластинок (фото 54, А). Так
же, как и в сосудах, концевые стенки могут быть строго попереч-
ными или в той или иной степени наклонными, в последнем случае
клетки перекрывают друг друга. Сравнительные исследования
показали, что голосеменные и низшие сосудистые растения, за
некоторыми исключениями, содержат ситовидные клетки, а по-
крытосеменные— как двудольные, так и однодольные — ситовид-
ные трубки [11].
172
Глава 11
Рис. 11 3. Видоизменения структуры ситовидных элементов. Д. Ситовидная
клетка Pinus pinea и связанные с ней лучи на тангенциальном срезе. На
остальных рисунках изображены членики ситовидных трубок с клетками-спутни-
ками на тангенциальных срезах флоэмы следующих растений: Juglans hindsii
(Б), Pyrus malus (В), Liriodendron tulipifera (Г), Acer pseudoplatanus (Д),
Cryptocarya rubra (E), Fraxinus americana (Ж), Wisteria sp. (3). На рис. Б — Ж
клеточная оболочка в области ситовидных пластинок и -полей выглядит более
утолщенной, чем на неперфорированных участках, из-за отложений каллозы.
1 — ситовидные поля; 2 — луч; 3— альбуминовая клетка; 4 — сложная ситовид-
ная пластинка; 5 — простая ситовидная пластинка; 6 — клетки-спутники; 7 — ла-
теральные ситовидные поля; 8 — ситовидное поле ситовидной пластинки.
Ситовидные поля и ситовидные пластинки покрытосеменных
весьма разнообразны по уровню дифференциации и характеру
их расположения в клетке. В определенной степени эти различия
Флоэма
173
связаны с длиной и формой клеток [15]. В длинных члениках
ситовидных трубок с наклонными концевыми стенками обычно
встречаются сложные ситовидные пластинки (рис. 11.3,5 — Г),
состоящие из нескольких ситовидных полей. Концы таких элемен-
тов имеют клиновидную форму, и ситовидные пластинки форми-
руются на скошенной стороне клина, которая является частью
радиальной грани клетки (фото 47,5 и рис. 11.3,5). Множест-
венные ситовидные поля могут иметь лестничное или какое-либо
другое, менее упорядоченное расположение.
Очень сложные ситовидные пластинки, характерные для силь-
но скошенных концевых стенок, часто содержат относительно уз-
кие отверстия (фото 47,5), и их ситовидные поля мало отлича-
ются от тех, которые располагаются на боковых стенках этих же
клеток. Такие членики ситовидных трубок у покрытосеменных
интерпретируются как довольно примитивные. Возрастание спе-
циализации характеризуется уменьшением угла наклона концевых
стенок, сокращением числа ситовидных полей в ситовидных пла-
стинках, увеличением размера отверстий и сопутствующим увели-
чением различий в специализации между латеральными ситовид-
ными полями и ситовидными полями ситовидных пластинок
(рис. 11.3,5—3). Большинство данных свидетельствует о том,
что наиболее высокоспециализированные ситовидные элементы
имеют простые ситовидные пластинки с большими отверстиями
на поперечных стенках и ситовидные поля с низкой степенью спе-
циализации на продольных стенках (рис. 11.3,3).
Приведенные выше данные показывают, что последователь-
ность эволюционных изменений в ситовидных элементах во многих
отношениях сходна с эволюцией члеников сосудов ксилемы. Од-
нако если для оценки эволюционной продвинутости члеников со-
судов в качестве критерия можно с успехом использовать длину
клеток, то этого нельзя делать в сравнительных исследованиях
члеников ситовидных трубок. Хотя короткие веретеновидные клет-
ки камбия дают начало коротким членикам ситовидных трубок,
производные длинных веретеновидных инициалей, расположенные
со стороны флоэмы, могут делиться, что приводит к сокращению
потенциальной длины члеников ситовидных трубок [13].
ПРОТОПЛАСТ
Протопласт ситовидного элемента в ходе его онтогенеза пре-
терпевает глубокие изменения (рис. 11.4). Отдельные клеточные
компоненты в разной степени затрагиваются этими изменениями,
п эти различия зависят как от таксономической принадлежности
растения, так и от положения клеток в теле растения. У семенных
растений ядро обычно дегенерирует. Оно либо сохраняется в клет-
ках как уплотненное тело, не имеющее внутренней структуры, ли-
174
Глава 11
Рис. 11.4. Схемы, иллюстрирующие последовательность дифференциации сито-
видных элементов. А. Клетка-предшественница ситовидного элемента в период
деления. Б. Ситовидный элемент с перламутровой оболочкой и Ф-белковым те-
лом вскоре после деления; клетка-предшественница (заштрихована) продолжает
делиться. В. Ядро в ситовидном элементе дегенерирует, тонопласт частично раз-
рушен, Ф-белок рассеян по клетке, в будущих ситовидных пластинках образова-
лись срединные полости; сбоку показаны два спутника (заштрихованы). Г. Зре-
лый ситовидный элемент; в ситовидных пластинках сформировались отверстия,
которые выстланы каллозой и содержат некоторое количество Ф-белка; эндо-
плазматический ретикулум не показан. 1 — плазмодесмы; 2 — пластида; 3— от-
верстие ситовидной пластинки; 4 — перламутровая оболочка; 5 — ядро; 6 — Ф-
белок; 7 — тонопласт; 8 — срединная полость; 9 — каллоза.
бо, что происходит значительно чаще, исчезает как обособленное
образование. Эндоплазматический ретикулум становится гладким,
и большая его часть оказывается уложенной в виде стопок, в ко-
торых белковый материал, имеющий, возможно, ферментативную
природу, накапливается между цистернами (фото 48). Не собран-
ный в стопки гладкий эндоплазматический ретикулум встречается
вблизи плазмалеммы, где он образует сеть, хорошо различимую
на срезах, проходящих вблизи клеточной поверхности [12]. Ко-
личество эндоплазматического ретикулума сокращается по мере
того, как клетка созревает, причем дольше сохраняется та его
Флоэма
175
часть, которая не уложена в виде стопок и расположена поблизо-
сти от плазмалеммы. Диктиосомы, активно продуцирующие пу-
зырьки в период формирования утолщения оболочки, в зрелых
клетках не обнаруживаются. Рибосомы также исчезают. Остаются
органеллы двух типов — пластиды и митохондрии (фото 51, В
и 52, Д). Пластиды бывают двух видов: в одних, которые почти
не имеют мембран, накапливается крахмал (фото 48 и 51, В),
а другие содержат белок в виде фибрилл (фото 51, Д, В) или
кристаллов (образование крахмала может происходить и в белок-
содержащих пластидах). Различия между пластидами ситовидных
элементов используются как таксономический признак [2].
Две пограничные цитоплазматические мембраны — плазма-
лемма и тонопласт — имеют различную судьбу. Плазмалемма со-
храняется в зрелых клетках и, по-видимому, обусловливает из-
бирательную проницаемость протопласта, о чем можно судить
по его способности к плазмолизу [8]. Тонопласт разрушается, и
граница между вакуолью и цитоплазмой исчезает (рис. 11.4, В, Г
п фото 51, В).
Ситовидные элементы обычно формируют белковые включе-
ния, которые прежде назывались слизью, а теперь получили наи-
менование Ф-белок (флоэмный белок) [11]. Этот белок часто
имеет вид нитей трубчатой формы со спиральным расположением
субъединиц (фото 49 и 50, Д). Трубки могут вытягиваться, осо-
бенно в зрелых ситовидных элементах. В этом случае благодаря
спиральной структуре в нитях появляется поперечная исчерчен-
ность (фото 50,В). Первоначально Ф-белок накапливается в виде
одного или нескольких тел (рис. 11.4, В), но затем он рассеива-
ется по цитоплазме, формируя тяжи или сеть (рис. 11.4, В).
У представителей некоторых таксонов Ф-белковые тела распада-
ются только частично, или не распадаются совсем. После разру-
шения тонопласта рассеянный по цитоплазме Ф-белок занимает
париентальное положение как в клеточной полости, так и в от-
верстиях ситовидных пластинок (рис. 11.4,В), что хорошо видно
на срезах, если при изготовлении препаратов соблюдаются все
необходимые предосторожности [17]. В противном случае он рас-
сеивается по всей клеточной полости и закупоривает отверстия
ситовидных пластинок.
ДИФФЕРЕНЦИАЦИЯ СИТОВИДНЫХ ПЛАСТИНОК
В молодых ситовидных элементах ситовидное поле (или по-
ля) формирующейся ситовидной пластинки пронизано нормаль-
ными плазмодесмами (рис. 11.4, В, В), с которыми связаны ци-
стерны эндоплазматического ретикулума (рис. 11.5 и фото 51,Г).
Эти плазмодесмы определяют положение будущих отверстий.
Цистерны эндоплазматического ретикулума локализованы с обеих
176
Глава 11
Рис 115 Объемное изображение половины будущей ситовидной пластинки,
иллюстрирующее связь между плазмодесмами и цистернами эндоплазматическо-
го ретикулума (1) в местах формирующихся перфораций Плазмалемма, нахо-
дящаяся между ЭР и каллозой, на рисунке не показана (Esau, Cheadle, Univ
Calif Pubs Bot, 36, 253—344, 1965 ) 2— продольная стенка оболочки, 3— гра-
ницы будущих отверстий, 4 — место отверстия, 5 — каллоза, 6 — плазмодесмы
сторон порового поля и соединены между собой десмотрубкой,
проходящей через канал плазмодесмы (гл. 3 и 4). В то время,
когда протопласт находится еще в интактном состоянии, вокруг
каждой плазмодесмы появляется каллозный чехол, который пре-
рывается только в районе срединной пластинки. Симметричные
каллозные отложения принимают форму пластиночек или воро-
нок с отверстием в центре — месте расположения плазмодесмы.
Когда ядро начинает дегенерировать, плазмодесменные каналы
расширяются, причем в зоне срединной пластинки часто образу-
ется полость (рис. 11.4,В и фото 51,Г). Как только отверстия
достигают окончательного размера, они освобождаются от ци-
стерн эндоплазматического ретикулума. Плазмалемма, которая
ограничивала исходные плазмодесмы, сохраняется (фото 50,5),
но трубка эндоплазматического ретикулума исчезает. Таким об-
разом, отверстие становится открытым в том смысле, что его
содержимое оказывается связанным с содержимым контактирую-
щих ситовидных элементов (рис. 11.4,Г). Формирование зрелой
ситовидной пластинки является одним из последних проявлений
автолитического процесса, происходящего в ситовидном элементе
Флоэма
177
во время его превращения в специализированную проводящую
клетку. Аналогичный процесс имеет место в дифференцирующихся
сосудах ксилемы, в которых образование перфораций в торцевых
стенках связано с деградацией протопласта (гл. 8).
СТРУКТУРА ОТВЕРСТИЙ В ЗРЕЛЫХ СИТОВИДНЫХ ЭЛЕМЕНТАХ
Еще в прошлом столетии физиологические исследования пере-
движения веществ по флоэме показали, что сок в ситовидном
элементе находится под положительным давлением, достигающим
30 атм [24]. В современных исследованиях такого рода использу-
ют меченые соединения и «медвяную росу», которую выделяют
тли, питающиеся флоэмным соком. Установлено, что тли, прони-
кая в ситовидные трубки [18], поглощают азотистые соединения
и выделяют сок, содержащий сахар («медвяная роса»). Различ-
ные опыты с использованием этих исследовательских инструмен-
тов обнаружили, что в проводящих трубках существует устойчи-
вое давление и что скорость движения ассимилятов варьирует в
пределах 10—100 см/ч.
Если растение срезается, содержимое ситовидных трубок обыч-
но вытекает под воздействием физических факторов. Экссудат
из перерезанных ситовидных трубок («флоэмный экссудат») пред-
ставляет собой транспортируемые по флоэме растворы, но он
также содержит некоторые компоненты протопласта, среди кото-
рых наиболее заметное место занимает Ф-белок [7]. Однако
Ф-белок вытекает не полностью. Часть его остается внутри от-
верстий (фото 50, £ и 51, В) и образует скопления — «слизевые
пробки» в ситовидной пластинке. Эти пробки препятствуют даль-
нейшему вытеканию экссудата из ситовидных трубок. Раневая
каллоза, быстро развивающаяся в поврежденной флоэме [10],
окончательно блокирует отверстия.
Приведенные данные согласуются с представлением о том, что
закупорка отверстий в проводящих ситовидных элементах Ф-бел-
ком и каллозой происходит в ответ на снятие давления и другие
нарушения, связанные с поранением флоэмы, и что в интактных
растениях отверстия открыты для передвижения транспортируе-
мых веществ. С точки зрения теории массового тока [5] открытые
отверстия являются необходимым условием передвижения ве-
ществ. Однако некоторые исследователи склонны думать, что от-
верстия ситовидных пластинок закупорены в неповрежденной тка-
ни, и это обстоятельство должно учитываться при разработке
теорий передвижения веществ по флоэме.
Последнее представление не подтверждается экспериментами,
в которых повреждение флоэмы при срезании растения удается
свести к минимуму. Для достижения этой цели растение можно
12 К Эзау, кн 1
178
Глава 11
быстро заморозить перед приготовлением препаратов флоэмы [6]
или за два дня до срезания у него можно удалить листья (это
удобно делать на проростках [17]), снизив тем самым концентра-
цию растворенных веществ в ситовидных трубках. Эксперименты
такого рода показали, что отверстия в интактных проводящих
ситовидных элементах не закупорены ни каллозой, ни Ф-белком.
% Клетки-спутники
Исследования транслокации веществ свидетельствуют о том,
что движение органических веществ по флоэме зависит от функ-
ционального взаимодействия между ситовидными элементами и
соседними паренхимными клетками. В тех тканях, где сахара
становятся пригодными для транспортирования, например в та-
ких, как фотосинтезирующий мезофилл или реактивируемая за-
пасающая паренхима, сахара передаются в проводящую систему
соседними паренхимными клетками (загрузка ситовидных эле-
ментов). В местах утилизации сахаров, т. е. там, где происходят
активные ростовые процессы или запасание веществ, паренхимные
клетки участвуют в выведении сахаров из проводящей системы
(разгрузка ситовидных элементов). Следовательно, флоэма яв-
ляется единой системой, состоящей из проводящих элементов и
смежных с ними клеток, обеспечивающих загрузку и разгрузку
проводящих элементов вдоль всего пути перемещения сахаров
от их источников к местам потребления. В результате постоянного
обмена сахарами между проводящими элементами и соседними
ядерными клетками поддерживается градиент концентрации са-
харозы, обеспечивающий определенную скорость и направление
движения [5]. Возможно, что вещества, выделяемые в ситовидные
элементы из соседних ядерных клеток, служат также источником
энергии для транспорта веществ в самих проводящих элементах
[21].
Клетки-спутники — это паренхимные клетки, которые специа-
лизируются в направлении функциональных связей с ситовидными
элементами, обеспечивая регуляцию передвижения веществ по
флоэме. Они связаны с ситовидными элементами плазмодесмами
(обычно ветвящимися со стороны клеток-спутников, фото 52,5),
и их длина зависит от смежных с ними ситовидных элементов.
Протопласты клеток-спутников отличаются теми особенностями,
какие характерны для метаболически активных клеток (фото 52,
А). Ядро и ядрышко в них сравнительно крупные. Клетки содер-
жат пластиды, часто дифференцирующиеся как-хлоропласты, мно-
жество крупных митохондрий и некоторое количество эндоплаз-
матического ретикулума. Наиболее характерной чертой является
Флоэма
179
обилие рибосом, нередко сочетающееся с высокой плотностью
гиалоплазмы. Клетки вакуолизированы в различной степени, при-
чем часто они содержат множество мелких вакуолей.
В целом клетки-спутники по своей ультраструктуре сходны
с секреторными клетками, и их способность выделять сахар \в
проводящие элементы против градиента концентрации позволяет
предполагать, что они выполняют секреторную функцию. У пред-
ставителей определенных таксонов двудольных клетки-спутники
образуют внутренние выросты оболочки в той части флоэмы, где
обмен между ситовидными элементами и соседними клетками осо-
бенно интенсивен (гл. 18). В результате образования таких вы-
ростов увеличивается внутренняя поверхность оболочки и приле-
гающей к ней плазмалеммы, что обеспечивает соприкосновение
последней с более обширными участками протопласта. Клетки
с внутренними выростами оболочки обычно называют передаточ-
ными клетками [20]; они встречаются в растении там, где наблю-
дается активный ближний транспорт растворенных веществ. Раз-
витие таких выростов в клетках-спутниках доказывает участие
этих клеток в обмене растворенных веществ и их транспорте в си-
товидные элементы. Отсутствие выростов, однако, не означает,
что клетки-спутники не могут функционировать как передаточные.
Присутствие или отсутствие выростов является показателем сте-
пени структурного выражения тех свойств, от которых зависит
функция межклеточного транспорта веществ.
Клетки-спутники образуются путем делений предшественников
ситовидных элементов и, следовательно, связаны с ними онтоге-
нетически (рис. 11.4). С каждым ситовидным элементом может
быть связана одна или несколько клеток-спутников, которые мо-
гут располагаться с одной или нескольких сторон ситовидного эле-
мента. У представителей некоторых таксонов клетки-спутники
располагаются вертикальными рядами (тяжи из клеток-спутни-
ков), образующимися в результате делений их непосредственных
предшественников. Онтогенетическое родство клеток-спутников
с ситовидными элементами обычно рассматривается как отличи-
тельная особенность этих клеток. Такое родство особенно харак-
терно для покрытосеменных — присутствие клеток-спутников яв-
ляется признаком, по которому членики ситовидных трубок отли-
чаются от ситовидных клеток. У голосеменных функциональные
аналоги клеток-спутников — альбуминовые клетки (клетки Страс-
бургера; рис. 11.3, А)—редко образуются из тех же предшест-
венников, что и ситовидные клетки, но по цитологическим и функ-
циональным характеристикам они подобны клеткам-спутникам.
Цитохимические исследования дыхания в клетках флоэмы Larix
(лиственницы) обнаружили повышенную респираторную и фос-
фатазную активности в альбуминовых клетках, которые были
связаны с полностью дифференцированными ситовидными клетка-
12*
180
Глава 11
ми. Более того, повышенная активность была ограничена теми пе-
риодами, когда происходила загрузка (источник — мобилизация
крахмала весной) и разгрузка (потребитель — накопление крах-
мала в начале лета) флоэмы [21].
Паренхимные клетки
Паренхимные клетки, содержащие различные эргастические
вещества, такие, как крахмал, таннины и кристаллы, являются
постоянными компонентами флоэмы. Во вторичной флоэме они
подразделяются на осевые (рис. 11.1, В, Г) и лучевые (рис. 11.1,
Л — Н) паренхимные клетки. Осевые клетки могут встречаться
в виде паренхимных тяжей или в виде отдельных веретеновидных
паренхимных клеток. Тяж образуется в результате деления клет-
ки-предшественницы на две или несколько клеток.
Кристаллообразующие паренхимные клетки могут делиться на
мелкие клетки, каждая из которых содержит один кристалл
(рис. 11.1,Г). Такие клетки обычно ассоциируются с волокнами
или склереидами и имеют лигнифицированные оболочки с вторич-
ными утолщениями.
Паренхимные клетки, расположенные рядом с ситовидными
элементами (фото 52, Д), могут участвовать в загрузке и раз-
грузке проводящих элементов; у Представителей некоторых так-
сонов в определенных участках тела растения они дифференци-
руются в передаточные клетки того типа, для которого характерно
формирование внутренних выростов оболочки [20]. Возможно
также, что между паренхимными клетками и ситовидными эле-
ментами существует онтогенетическое родство. У многих двудоль-
ных членики ситовидных трубок и некоторые паренхимные клетки
происходят из общих флоэмных инициалей; такие паренхимные
клетки отмирают одновременно с теми ситовидными элементами^
с которыми они связаны в развитии [13]. Флоэмная паренхима
этого типа занимает по отношению к ситовидным элементам по-
ложение, промежуточное между клетками-спутниками и клетками
запасающей паренхимы.
Склеренхимные клетки
Волокна (рис. 11.1. Д) относятся к обычным компонентам как
первичной, так и вторичной флоэмы. В первичной флоэме волок-
на встречаются только в периферической части ткани; во вторич-
ной флоэме они распределены по всей ткани среди других клеток
осевой системы. В зрелом состоянии волокна могут быть несепти-
рованными или септированными, живыми или мертвыми. Живые
волокна, как и в ксилеме, выполняют запасающую функцию.
Флоэма
181
У многих видов первичные и вторичные флоэмные волокна имеют
большую длину и толстые оболочки, благодаря этому такие рас-
тения используются как источники промышленного волокна (Li-
пит, Cannabis, Hibiscus).
Склереиды (рис. 11.1,Д,К) также часто встречаются во фло-
эме. Они могут находиться в комбинации с волокнами или без
них, причем могут присутствовать и в осевой и в лучевой систе-
мах вторичной флоэмы. Склереиды, как правило, образуются в
более старых частях флоэмы вследствие склерификации парен-
химных клеток. Склерификации иногда может предшествовать
интрузивный рост клеток. В ходе интрузивного роста склереиды
нередко становятся разветвленными или сильно удлиняются. Раз-
личия между волокнами и склереидами не всегда отчетливы, осо-
бенно если склереиды длинные и тонкие. К промежуточному типу
клеток относятся волокнистые склереиды.
Первичная флоэма
Первичная флоэма подразделяется на прото- и метафлоэму на
том же основании, на каком первичная ксилема подразделяется
на прото- и метаксилему. Протофлоэма созревает в тех частях
растения, которые еще продолжают интенсивно расти; ситовидные
’элементы протофлоэмы при этом растягиваются и очень скоро
перестают функционировать. В конечном счете они полностью
облитерируются (фото 53). Метафлоэма дифференцируется позже
и в растениях, в которых не наблюдается вторичного роста, со-
ставляет всю проводящую флоэму взрослого растения.
Ситовидные элементы протофлоэмы покрытосеменных расте-
ний— узкие и малозаметные клетки, но они лишены ядер и имеют
ситовидные поля, содержащие каллозу. С ними могут быть свя-
заны клетки-спутники, но последние могут и отсутствовать. Сито-
видные элементы располагаются либо группами или поодиночке
среди паренхимных клеток, либо, как у многих двудольных, среди
клеток, имеющих сильно вытянутую форму. У многих видов эти
вытянутые клетки представляют собой зачатки волокон. В то вре-
мя как ситовидные элементы утрачивают функциональное значе-
ние и облитерируются, зачатки волокон удлиняются, формируют
вторичные оболочки и дифференцируются как волокна (фото 54,
Б). Такие волокна в стеблях многих двудольных располагаются
по периферии флоэмной зоны и в связи с этим часто называются
периферическими волокнами (гл. би 16). Протофлоэмные волок-
на встречаются и в корнях.
Метафлоэма имеет большее число ситовидных элементов, и
они значительно шире, чем протофлоэмные. Клетки-спутники в
метафлоэме покрытосеменных присутствуют постоянно (фото 54,
182
Глава 11
Б), а волокна, наоборот, обычно отсутствуют. Паренхимные клет-
ки могут склерифицироваться после того, как флоэма перестает
функционировать.
Вторичная флоэма
В ветвях, стеблях и корнях на вторичную флоэму приходится
значительно меньшая доля их общего объема, чем на вторичную
ксилему. Это объясняется тем, что, во-первых, камбий обычно
производит меньше флоэмы, чем ксилемы, а, во-вторых, старая
нефункционирующая флоэма постепенно сдавливается и в конеч-
ном счете отделяется от ксилемы перидермой. Таким образом,
в то время как количество ксилемы в ветвях, стеблях и корнях
постепенно нарастает, количество флоэмы изменяется незначи-
тельно.
Термин «кора» объединяет флоэму с другими тканями, распо-
ложенными снаружи от камбия (гл. 12). Функционирующая (про-
водящая) флоэма составляет самую внутреннюю часть коры стеб-
лей и корней древесных растений.
Флоэма хвойных
У хвойных вторичная флоэма обычно имеет более простое
строение и отличается меньшим видовым разнообразием, чем у*
двудольных [9, И]. Осевая система состоит из ситовидных и па-
ренхимных клеток (рис. 11.6 и фото 55), причем некоторые из
этих последних могут дифференцироваться как альбуминовые
клетки. В осевой системе встречаются также волокна и склереиды.
Лучи однорядные и содержат паренхимные и альбуминовые клет-
ки (если последние вообще существуют у данных видов растений).
В большинстве случаев альбуминовые клетки располагаются на
концах лучей (рис. 11.3, Л). Смоляные ходы могут присутствовать
в обеих системах.
Ситовидные элементы представляют собой длинные клетки,
имеющие множество ситовидных полей, расположенных преиму-
щественно на радиальных стенках (рис. 11.3, Л). Паренхимные
клетки собраны в тяжи (фото 55, Б, В) или рассеяны поодиночке.
Волокна обычно отсутствуют у Pinus (фото 56) и всегда присут-
ствуют у Taxaceae, Taxodiaceae и Cupressaceae, у которых они
располагаются, как правило, в виде однорядных тангенциальных
полос (фото 55, Л), перемежающихся со сходными полосами па-
ренхимных и ситовидных клеток.
На поперечных срезах флоэмы хвойных только узкая полоса
клеток, приблизительно равная одному годовому приросту, может
быть отнесена к активной флоэме; остальные слои являются не-
проводящими. Если волокна отсутствуют, разрушение нефунк-
Флоэма
183
Рис 116 Структура камбия и вторичной флоэмы хвойного растения Thuja
occidentalis (туя западная, Esau, Plant Anatomy, 2nd ed , John Wiley & Sons,
1965) / — ситовидные поля, 2 — луч, 3 — паренхима, 4 —волокна, 5 — камбий,
6 — ситовидные клетки, 7 — веретеновидные инициали
184
Глава 11
ционирующих ситовидных клеток придает ткани свилеватый вид,
особенно заметный потому, что лучи становятся извилистыми
(фото 56). Паренхимные клетки увеличиваются в непроводящей
флоэме и остаются живыми до тех пор, пока не срезаются пери-
дермой (фото 55 и 56). Клетки лучевой паренхимы также сохра-
няются активными, кроме альбуминовых клеток, которые в не-
функционирующей флоэме разрушаются.
Флоэма двудольных
Вторичная флоэма двудольных различается по составу, распо-
ложению и размеру клеток, а также по структуре нефункциони-
рующей флоэмы (рис. 11.7 и фото 57). Ситовидные трубки, клет-
ки-спутники и паренхимные клетки относятся к постоянным ком-
понентам осевой системы, а волокна могут и отсутствовать (Ari-
stolochia). В том случае, когда волокна присутствуют, они либо
рассеяны поодиночке (Campsis, фото 58, В; Cephalanthus, Laurus),
либо собраны в виде тангенциальных полос, расположенных па-
раллельными рядами (Fraxinus, фото 57, A; Liriodendron, Magno-
lia, Robinia, Tilia, фото 58, Л) или менее регулярно (Ostrya\ фо-
то 58,В). Волокон может быть так много, что ситовидные трубки
и паренхимные клетки выявляются в виде небольших групп, окру-
женных волокнами (Сагуа). У некоторых видов склеренхимные
клетки, обычно склереиды или волокнистые склереиды, дифферен-
цируются только в нефункционирующей части флоэмы (Prunus).
Септированные волокна Vitis представляют собой живые клетки,
запасающие крахмал.
В зависимости от структуры камбия вторичная флоэма может
быть ярусной (Robinia) или неярусной (Betula, Quercus, Populus,
Liriodendron, Juglans). Длинные членики ситовидных трубок в
неярусной флоэме обычно имеют наклонные концевые стенки со
сложными ситовидными пластинками. В более или менее выра-
женной ярусной флоэме у ситовидных элементов обнаруживаются
слегка наклонные или почти поперечные концевые стенки, а их
ситовидные пластинки содержат или небольшое число ситовидных
полей, или всего одно.
Лучи имеют сходство с ксилемными лучами того же растения
и могут быть однорядными и многорядными, высокими и низкими;
различные виды лучей могут быть представлены в одной и той
же ткани. Лучи состоят в основном из паренхимных клеток (фо-
то 57), но могут также содержать склереиды или склерифициро-
ванные паренхимные клетки с кристаллами. В более старых ча-
стях флоэмы лучи могут дилатировать в связи с увеличением ок-
ружности осевого органа фото 58, Д). Дилатация лучей обусловле-
на радиальными антиклинальными клеточными делениями и рас-
тяжением клеток в тангенциальном направлении. Иногда такие
Флоэма
185
Рис 11 7 Структура камбия и вторичной флоэмы двудольного растения Lirio-
dendron tulipifera (тюльпанное дерево, Esau Plant Anatomy, 2nd ed , John Wi-
ley & Sons, 1965) 1 — флоэмная паренхима, 2 — клетка-спутник, 3 — луч, 4 — во-
локна, 5 — камбий, 6 — ситовидная трубка, 7 — ситовидная пластинка, 8 — ве-
ретеновидные инициали
186
Глава 11
деления происходят только в средней части луча, причем зона
делящихся клеток напоминает по своему характеру меристему
£19, 22]. Обычно только некоторые лучи становятся расширенны-
ми, другие же сохраняют ту же ширину, какая у них была в мо-
мент их возникновения в камбии (фото 58, Л). У некоторых видов
Eucalyptus широкие клинья ткани образуются в дилатирующей
флоэме в результате деления ее паренхимных клеток [4].
Признаки, характеризующие нефункционирующую флоэму, за-
висят от присутствующих в ней типов клеток и их дальнейшей
судьбы. Одним из таких отличительных признаков старой флоэмы
является дилатация лучей. Ситовидные трубки или полностью
сдавливаются, или остаются открытыми и заполняются газообраз-
ным содержимым. Паренхимные клетки часто увеличиваются и
вследствие этого сдавливают ситовидные трубки или внедряются
в их полость (тилоиды). Если ткань сморщивается из-за разру-
шения части клеток, лучи могут становиться изогнутыми. Парен-
химные клетки в нефункционирующей флоэме продолжают запа-
сать крахмал, пока они не отсекаются перидермой.
Количество функционирующей флоэмы обычно ограничено од-
ним годичным слоем, поскольку ситовидные элементы, возникаю-
щие из камбия весной, как правило, становятся непроводящими
и отмирают в конце сезона (Pyrus [16], Acer negundo [23]). Су-
ществуют, однако, исключения из этого правила. Например, у
Vitis ситовидные элементы к зиме утрачивают свою функциональ-
ную активность, но восстанавливают ее следующей весной. Ко-
личество нефункционирующей флоэмы очень сильно варьирует.
Если перидерма формируется повторно с короткими интервалами,
то старая флоэма не накапливается. У некоторых растений во
флоэме хорошо различимы слои годичного прироста. Это наблю-
дается в тех случаях, когда ранние ситовидные элементы заметно
шире, чем более поздние, или когда в поздней флоэме имеется
пояс склеренхимных клеток. Но чаще всего границы слоев бывают
нечеткими из-за изменений, происходящих в нефункционирующей
флоэме.
СПИСОК ЛИТЕРАТУРЫ
1. Behnke H.-D. Uber den Feinbau verdickter (nacre) Wande und der Plastiden
in den Siebrohren von Annona und Myristica, Protoplasma, 72, 69—78
(1971).
2. Behnke H.-D. Sieve-tube plastids in relation to angiosperm systematics — an
attempt towards a classification by ultrastructural analysis, Bot. Rev., 38,
155—197 (1972).
3. Chafe S. C., Doohan M. E. Observations on the ultrastructure of the thickened
sieve cell wall in Pinus strobus L., Protoplasma, 75, 67—68 (1972).
4 Chattaway M. M. The anatomy of bark. VI. Peppermints, boxes, ironbarks and
other eucalypts with cracked and furrowed barks, Aust. Jour. Bot., 3, 170—
176 (1955).
Флоэма
187
5. Crafts A. S., Crisp С. E. Phloem transport in plants, San Francisco, Califor-
nia, Freeman and Company, 1971.
6. Cronshaw J., Anderson R., Sieve plate pores of Nicotiana, J. Ultrastruct. Res.,
27, 134—148 (1969).
7. Cronshaw J., Gilder J., Stone D. Fine structural studies of P-proteins in Cu-
curbita, Cucumis, and Nicotiana, J. Ultrastruct. Res., 45, 192—205 (1973).
8. Currier H. B., Esau K., Cheadle V. I. Plasmolytic studies of phloem, Amer.
Jour. Bot., 42, 68—81 (1955).
9. Den Outer R. W. Histological investigations of the secondary phloem of gym-
nosperms, Med. Landbouwhogesch. Wageningen, Nederland, 67 (7), 119 p.
(1967).
10. Engleman E. M. Sieve element of Impatiens sultani. I. Wound reaction, Ann.
Bot., 29, 83—101 (1965).
11. Esau K. The phloem, Handbuch der Pflanzenanatomie, Band 5, Teil 2 (1969).
12. Esau K. Changes in the nucleus and the endoplasmic reticulum during diffe-
rentiation of a sieve element in Mimosa pudica L., Ann. Bot., 36, 83—101
(1972).
13. Esau R., Cheadle V. I. Significance of cell divisions in differentiating seconda-
ry phloem, Acta Bot. Neerl., 4, 348—357 (1955).
14. Esau R., Cheadle V. I. Wall thickening in sieve elements, Proc. Natl. Acad.
Sci., 44, 546—553 (1958).
15. Esau R., Cheadle V. I. Size of pores and their contents in sieve elements of
dicotyledons, Proc. Natl. Acad. Sci., 45, 156—162 (1959).
16. Evert R. F. Phloem structure in Pyrus communis L. and its seasonal changes,
Univ. Calif. Pubs. Bot., 32, 127—194 (1960).
17. Evert R. F., Eschrich W., Eichhorn S. E. P-protein distribution in mature sieve
elements of Cucurbita maxima, Planta, 109, 193—210 (1973).
18. Evert R. F., Eschrich W., Eichhorn S. E., Limbach S. T. Observations on
penetration of barley leaves by the aphid Rhopalosiphum maidis (Fitch), Pro-
toplasma, 77, 95—110 (1973).
19. Holdheide W. Anatomie mitteleuropaischer Geholzrinden, Handbuch der Mikro-
scopie in der Technik, Band 5, Teil 1, 195—367 (1951).
20. Pate J. S., Gunning В. E. S. Transfer cells, Ann. Rev. Plant Physiol., 23,
173—196 (1972).
21. Sauter J. J., Braun H. J. Cytochemische Untersuchung der Atmungsaktivitat
in den Strasburger-Zellen von Larix und ihre Bedeutung fiir den Assimilat-
transport, Z. Pflanzenphysiol., 66, 440—458 (1972).
22. Schneider H. Ontogeny of lemon three bark, Amer. Jour. Bot., 42, 893—905
(1955).
23. Tucker С. M., Evert R. F. Seasonal development of the secondary phloem in
Acer negundo, Amer. J. Bot., 56, 275—284 (1969).
24. Weatherley P. E. The mechanism of sieve-tube translocation: observation, ex-
periment and theory, Adv. Sci., 18, 571—577 (1962).
Глава 12
Перидерма
Перидерма представляет собой защитную ткань вторичного
происхождения, замещающую эпидерму в тех стеблях и корнях,
которые разрастаются в толщину путем вторичного роста. Раз-
витие перидермы наиболее характерно для древесных двудольных
и голосеменных растений. Листья обычно не образуют перидермы,
но у чешуй зимующих почек она может появляться. Перидерма
встречается и у травянистых двудольных, особенно в самых ста-
рых частях стебля и корня. Среди однодольных одни растения
имеют перидерму, другие — вторичную защитную ткань иного
типа.
Перидерма развивается на поверхностях, которые обнажаются
после опадения частей растений, например листьев и веток. Об-
разование перидермы представляет собой также важный этап в
развитии защитных слоев около поврежденных или мертвых
(некротизированных) тканей (раневая перидерма, или раневая
пробка, фото 59, В), появляющихся в результате или механиче-
ского поранения [15], или внедрения паразитов [21]. В некоторых
семействах двудольных перидерма (называемая межксилемной
пробкой) образуется в ксилеме в связи с нормальным отмиранием
однолетних побегов или образованием трещин в многолетних кор-
нях и стеблях [16].
Термин «перидерма» следует отличать от неспециального тер-
мина «кора». Хотя «кора» имеет слишком общий смысл и часто
употребляется в разных значениях, этот термин может оказаться
полезным, если дать ему правильное определение. Термин «кора»,
очевидно, более всего пригоден для обозначения всех тканей, на-
ходящихся снаружи от камбия: вторичной флоэмы, первичных
тканей, которые еще могут оставаться снаружи от вторичной флоэ-
мы, перидермы и мертвых тканей снаружи от перидермы. Отми-
рающие клетки, оказавшиеся изолированными снаружи от пери-
дермы, определяют границу между наружной неживой и внутрен-
ней живой корой. Функционирующая флоэма составляет внутрен-
нюю часть живой коры. Термин «кора» иногда применяется для
стебля, находящегося в состоянии первичного роста. В этом случае
он включает первичную флоэму, первичную кору и эпидерму.
Однако первичную флоэму и первичную кору корня нельзя объе-
динить под общим названием «кора» из-за чередующегося распо-
ложения первичной ксилемы и флоэмы.
Перидерма
189
Структура перидермы и связанных
с ней тканей
Перидерма состоит из феллогена (пробкового камбия)—ме-
ристемы, образующей всю эту ткань, феллемы, (обычно называе-
мой пробкой)—защитной ткани, откладываемой феллогеном по
направлению к периферии органа, и феллодермы — живой парен-
химной ткани, откладываемой меристемой внутрь (фото 59, Д).
Отмирание тканей, лежащих снаружи от перидермы, происходит
в результате образования прокладки из неживой пробки между
этими тканями и живыми внутренними тканями оси.
Феллоген имеет сравнительно простое строение. В отличие от
камбия он состоит из клеток только одного типа. На поперечном
срезе феллоген обычно выглядит как сплошной тангенциальный
слой (латеральная меристема), состоящий из прямоугольных уп-
лощенных по радиусу клеток, каждая из которых образует ра-
диальный ряд производных, переходящих снаружи в клетки проб-
ки, а внутри в клетки феллодермы (фото 59, Д). На продольных
срезах клетки феллогена имеют прямоугольные или полигональ-
ные очертания, иногда довольно неправильные.
Клетки пробки часто имеют почти призматическую форму (фо-
то 60,Дл5), хотя могут быть и довольно неправильными в тан-
генциальной плоскости (фото 60, £). Иногда они вытянуты вер-
тикально (фото 60, Д,Е), радиально (фото 60,5 — Д) или тан-
генциально (более узкие клетки на фото 60, А и 63, Д). Распола-
гаются они обычно компактно, так как межклетники в ткани от-
сутствуют. В зрелом состоянии клетки мертвы, но могут иметь
жидкое или твердое содержимое, окрашенное или бесцветное.
Клетки пробки характеризуются суберинизацией их оболочек.
Суберин (жировое вещество) обычно встречается в виде отдель-
ной пластинки, покрывающей исходную первичную целлюлозную
оболочку, которая может одревесневать. Субериновая пластинка
в электронном микроскопе выглядит слоистой, вероятно, из-за че-
редования суберина и восков [9]. Оболочки пробковых клеток
по толщине варьируют. У толстостенных клеток внутрь от субе-
риновой пластинки располагается еще один лигнифицированный
целлюлозный слой, так что пластинка оказывается заключенной
между двумя целлюлозными слоями. Оболочки пробковых клеток
могут быть окрашены в коричневый или желтый цвет.
Пробка, используемая в хозяйственных целях в виде бутылоч-
ной пробки, имеет тонкие оболочки и заполненные воздухом по-
лости. Она в высокой степени непроницаема для воды, устойчива
к действию масла, легка и имеет термоизолирующие свойства.
Зрелая пробка такого типа упруга, легко прессуется. Такие важ-
ные в техническом отношении свойства, как непроницаемость
для воды и изолирующая способность, позволяют пробке весьма
190
Глава 12
эффективно защищать поверхность растений. Мертвая ткань,
расположенная снаружи от перидермы, повышает изолирующие
качества пробки.
У многих видов растений феллема состоит из пробковых кле-
ток и несуберинизированных клеток, называемых феллоидными.
Как и пробковые клетки, они могут иметь толстые или тонкие
оболочки и иногда дифференцируются как склереиды (фото 60,Г).
У видов Abies слои пробковых клеток чередуются со слоями кле-
ток, имеющих толстые склерифицированные наружные танген-
циальные стенки [14]. Эта слоистость соответствует сезонным
приростам.
Клетки феллодермы напоминают клетки паренхимы первичной
коры. От последних они отличаются по своему расположению в
тех же самых радиальных рядах, что и клетки феллемы (фо-
то 59, Л).
Полидерма
В корнях и подземных стеблях представителей сем. Hyperica-
ceae, Myrtaceae, Onagraceae и Rosaceae встречается защитная
ткань особого типа, называемая полидермой [13, 18]. Она состоит
из чередующихся тканевых слоев — одноклеточных слоев частично
суберинизированных клеток и многоклеточных слоев несуберини-
зированных клеток (фото 61). Общая толщина полидермы может
достигать 20 слоев и более, причем мертвыми являются лишь са-
мые наружные слои. В живой части полидермы несуберинизиро-
ванные клетки функционируют как запасающие.
Ритидом
С увеличением возраста дерева перидерма постепенно закла-
дывается на все большей глубине, что вызывает накопление мерт-
вых тканей на поверхности стебля и корня (рис. 12.1 и фото 64).
Эта мертвая часть коры, состоящая из слоев прекратившей рост
перидермы, называется ритидомом. Ритидом, таким образом, фор-
мирует наружную кору. Особенно хорошо он развит в старых
стволах и корнях деревьев. У кустарников старая кора обычно
рано сбрасывается, что препятствует накоплению мощного рити-
дома.
Исследования коры у трех видов хвойных, основанные на ис-
пользовании криофиксации, показали, что ритидом у них вклю-
чает перидерму двух типов [17]. Исходная перидерма и несколько
закладывающихся вслед за ней слоев имеют коричневый цвет, а
позднее возникающие слои — красновато-фиолетовые. Помимо
окраски перидермы этих двух типов различаются по другим фи-
зическим и химическим признакам, а также по положению
Перидерма
191
в ритидоме. Слои последующей перидермы красноватого цвета
располагаются рядом с погруженной в ритидом мертвой флоэмой
и, по-видимому, служат для защиты живых тканей от влияния
разного рода воздействий, связанных с отмиранием клеток. По-
следующие слои коричневой перидермы появляются далеко не
всегда. Они отделены от мертвой флоэмы слоями красновато-
фиолетовой перидермы. Коричневая исходная перидерма и слои
последующей коричневой перидермы по своим свойствам сходны
и служат для защиты живых тканей от внешних воздействий:
исходная перидерма — до образования ритидома, а последующие
слои коричневой перидермы — после сбрасывания слоев ритидома.
На основе предполагаемых специфических функций перидермы
этих двух типов были предложены соответствующие термины:
некрофилактическая — для красновато-фиолетовых слоев после-
дующей перидермы и экзофилактическая— для коричневой пе-
ридермы, как исходной, так и более поздней [17].
Развитие перидермы
Исходная перидерма обычно появляется во время первого го-
да роста стебля и корня. Последующие более глубокие ее слои
могут закладываться позднее в этом же году или только через
много лет (виды Abies, Carpinus, Fagus, Quercus [14]), а могут
и вообще не появляться. Внешний вид как исходных, так и по-
следующих слоев перидермы различен у разных видов, на него
также оказывают влияние внешние условия. Кроме того, на вре-
менной порядок развития перидермы влияют обеспеченность во-
дой, температура и интенсивность освещения [3, 6, 14].
Первая перидерма стебля чаще всего закладывается в суб-
эпидермальном слое (рис. 12.2, Д), изредка в эпидерме. Однако
у некоторых видов (Berberis, Ribes, Viiis) она возникает довольно
глубоко в стебле (фото 62), обычно в первичной флоэме. У боль-
шинства корней первая перидерма закладывается в перицикле
(гл. 14), но она может появляться и у поверхности, как, напри-
мер, у корней некоторых деревьев и многолетних травянистых
растений, у которых первичная кора корня служит для запасания
питательных веществ. Последующие слои перидермы возникают
во все более глубоких слоях стебля (рис. 12.1) и в конце концов
закладываются в паренхиме вторичной флоэмы, в том числе в
клетках лучей.
Первый феллоген закладывается или сразу же по всей окруж-
ности оси, или в отдельных участках, которые соединяются в ре-
зультате латерального распространения меристематической актив-
ности. Последующие слои перидермы закладываются как преры-
вистые, но перекрывающие друг друга участки (рис. 12.1, фо-
192
Глава 12
то 63, £ и 64). Эти похожие по форме на створки раковин слои
возникают под трещинами лежащих снаружи слоев перидермы.
Последующие слои перидермы могут быть непрерывными по всей
окружности оси или по крайней мере в значительной ее части
(фото 63, В).
Феллоген (первый и последующие слои) возникает путем де-
ления клеток различных типов. В зависимости от положения фел-
логена это могут быть клетки эпидермы, субэпидермальной па-
ренхимы или колленхимы, паренхимы перицикла или флоэмы, в
том числе клетки флоэмных лучей. Обычно эти клетки не отличи-
мы от других клеток этого же типа; все они живые и поэтому
потенциально меристематические. Инициальные деления клеток
могут начинаться при наличии в них хлоропластов и эргастических
веществ — крахмала и таннинов, а также при сохранении толстых
первичных оболочек, таких, как у клеток колленхимы. Со време-
нем хлоропласты превращаются в лейкопласты, а эргастические
вещества и утолщения оболочки исчезают. Иногда субэпидермаль-
ные клетки, из которых возникает феллоген, не имеют колленхим-
ных утолщений и располагаются упорядоченно и компактно.
Феллоген закладывается путем периклинальных делений и про-
изводит феллему и феллодерму также путем периклинальных де-
лений (рис. 12.2). По мере увеличения окружности оси феллоген
Рис. 12.1. Схема, демонстрирующая раннюю (А) и позднюю (Б) стадии разви-
тия ритидома. А. В ритидом входят первичная кора и первичная флоэма.
Б. В ритидом входят многочисленные слои вторичной флоэмы. Первые слои ри-
тидома сброшены. 1 — ксилема; 2— камбий; 3— флоэма; 4 — вторичные флоэм-
ные волокна; 5 — ритидом; 6 — луч; 7 — первичные флоэмные волокна; 8— фел-
логен последующего слоя перидермы; 9 — исходная перидерма; 10 — феллоген
внутренней перидермы.
Перидерма
193
Рис. 12.2. Возникновение перидермы в стебле Pelargonium (поперечные сре-
зы). А. Периклинальные деления в субэпидермальном слое привели к образо-
ванию на периферии клеток феллогена и в направлении к центру — клеток фел-
лодермы (по одной клетке каждого типа из одной поделившейся клетки).
Б. Закладка перидермы завершена. 1 — закладка феллогена; 2 — эпидерма; 3—
феллема; 4 — феллодерма; 5 — первичная кора; 6 — антиклинальная стенка;
7 — феллоген.
не прерывается благодаря периодическим делениям его клеток
в радиальной антиклинальной плоскости (рис. 12.2,5).
Последовательность делений, приводящих к закладке пери-
дермы, довольно изменчива даже у растений одного и того же
вида, растущих в различных условиях окружающей среды. Фел-
логен закладывается либо сразу в виде одного слоя клеток, обыч-
но наружного из двух слоев, образованных исходными перикли-
нальными делениями, либо после того, как происходит несколько
подготовительных делений. Последний вариант обычно встреча-
ется в корнях.
Феллоген исходной перидермы отчленяет большинство клеток
наружу. Поэтому количество феллодермы обычно невелико и
иногда ограничено всего одним слоем клеток, оставшимся после
первых периклинальных делений на внутренней стороне феллогена
(фото 59, Л). Сравнительно широкая феллодерма наблюдается
в стеблях и корнях некоторых представителей сем. Cucurbitaceae
[7]. Расположенные глубже последующие слои перидермы также
имеют феллодерму. Обычно одна клетка феллогена образует за
год только несколько клеток пробки. У многих видов годичные
слои прироста едва различимы, однако у некоторых видов рано
образовавшиеся клетки пробки более широкие и имеют более
тонкие оболочки, чем те, которые образуются позже (Betala: фо-
то 60, В; Pranas, Robinia [24]), причем позднее образовавшаяся
пробка может иметь темное содержимое i[25].
13 К. Эзау, кн. 1
194
Глава 12
Защитная ткань у однодольных
Однодольные редко образуют перидерму, сходную с перидер-
мой двудольных [20]. У многих однодольных эпидерма сохраняет-
ся и, следовательно, поверхностные слои не сменяются. Эти слои
могут суберинизироваться и склерифицироваться без предвари-
тельных клеточных делений или после небольшого числа делений
(см. в словаре терминов термин «метакутинизация»). У древесных
однодольных, в том числе у пальм [23], выявлен особый способ
развития защитной ткани. Паренхимные клетки все более глубо-
кой закладки делятся несколько раз периклинально, и продукты
этих делений суберинизируются. Эта ткань за свой характерный
вид на поперечных срезах получила название ярусной пробки
(фото 65).
Раневая перидерма
Поранение у растений вызывает целый ряд метаболических и
связанных с ними цитологических изменений, которые при бла-
гоприятных условиях приводят к полному закрытию раны [12].
Залечивание ран представляет собой процесс, требующий син-
теза ДНК и белков [2].
Раневая перидерма по характеру возникновения и роста в ос-
новном сходна с естественной и содержит те же самые клеточные
компоненты [15]. Естественная перидерма развивается под по-
верхностью, которая надежно изолирована кутинизированной эпи-
дермой. Соответственно и образованию раневой перидермы пред-
шествует изоляция только что обнаженной поверхности с помощью
рубцовой ткани. Эта ткань включает мертвые (некротизирован-
ные) клетки на поверхности (фото 59,5) и живые клетки под
ними, которые суберинизируются и одревесневают, образуя так
называемый закрывающий слой [8]. Под этим слоем возникает
раневой феллоген, и после образования пробки рубцовая ткань
оттесняется наружу (фото 59, В). Успешное развитие раневой пе-
ридермы имеет важное значение для сельскохозяйственной прак-
тики в тех случаях, когда используемые при размножении части
растений должны обрезаться (например, клубни картофеля, кор-
ни батата). Опыты с дисками клубней картофеля, у которых про-
цессы заживления поранений задерживались или ингибировались
химической обработкой, указывают на важную роль раневой
перидермы в защите растений от заражения гнилостными орга-
низмами [1]. На развитие раневой перидермы заметное влияние
оказывают условия среды [15]. Возможно, устойчивые растения
отличаются от неустойчивых [21] способностью к образованию
раневой перидермы в ответ на внедрение паразитов.
Перидерма
195
Растения, входящие в различные таксоны, отличаются друг
от друга гистологическими особенностями залечивания ранений,
а также деталями естественного развития защитной ткани [8,
22]. В общем однодольные меньше реагируют на поранения, чем
двудольные. У двудольных и некоторых однодольных (Liliales,
Arecaceae, Pandanaceae) залечивание включает образование как
закрывающего слоя, так и раневой перидермы. У других однодоль-
ных никакой раневой перидермы не образуется. Так, у предста-
вителей пор. Zingiberales обнаруживается слегка суберинизиро-
ванный закрывающий слой, а у представителей сем. Arecaceae
и Роасеае этот слой лигнифицируется.
Раневая реакция наблюдается и тогда, когда перидерма оше-
лушивается до расположенных под ней живых клеток. Обнажаю-
щиеся при этом клетки отмирают, и под ними возникает новая
перидерма. Эта реакция используется при получении технической
пробки из пробкового дуба. При этом низкокачественная первая
пробка удаляется до феллогена, и развивающийся под рубцовой
тканью новый феллоген образует мощную пробку высокого ка-
чества.
Внешние особенности коры в зависимости
от ее структуры
Внешние особенности перидермы и ритидома варьируют в за-
висимости от структуры и развития перидермы и типов изолируе-
мых перидермой тканей. Если образуется только поверхностная
перидерма с тонкой пробкой, то поверхность остается гладкой.
Мощная пробка обычно дает трещины и разломы (фото 63, А).
Если образование пробки в течение года происходит в изолирован-
ных участках, в которых наружные слои пробки слущиваются, то
поверхность становится похожей на ту, которая образуется чешуй-
чатым ритидомом. Стебли некоторых видов растений (например,
Ulmus sp. [19])) образуют так называемую крыловидную пробку,
форма которой определяется симметричным продольным расщеп-
лением пробки, связанным с неравномерным разрастанием раз-
личных секторов стебля. Крыловидная пробка может быть также
результатом первоначально локальной деятельности феллогена
(Euonymus alatus) [4].
Ритидом имеет разный внешний вид. По характеру образова-
ния различают две формы коры — чешуйчатую и кольцеобразную.
Чешуйчатая кора встречается там, где последующие слои пери-
дермы образуются в виде узких перекрывающих друг друга слоев,
каждый из которых отрезает «чешуйку» ткани (рис. 12.1, фото 63,
Б и 64; Pinas, Pyrus). Кольцеобразная кора встречается реже.
Она образуется за счет последующих слоев перидермы, форми-
13ж
196
Глава 12
рующихся более или менее концентрически вокруг оси (Vitis, Cle-
matis, Lonicera, фото 63, В).
Что касается изолированных в ритидоме тканей, не входящих
в перидерму, то характерный облик коре придает волокнистая
ткань [11]. В том случае, когда волокна отсутствуют, кора рас-
трескивается на отдельные чешуйки или скорлупки (Pinus, Acer
pseudoplatanus). У волокнистой коры наблюдается трещиноватость
в виде сети (Tilia, Fraxinus).
Сбрасывание чешуек коры может иметь разную структурную
основу. Если в перидерме ритидома имеются тонкостенные клетки
пробки (феллоиды), то чешуйки .могут отделяться по этим клет-
кам (фото 60,Г). Трещины в ритидоме могут также проходить и
по клеткам тканей, не входящим в перидерму. У Eucalyptus тре-
щины проходят по клеткам флоэмной паренхимы [5], у Lonicera
lartarica — между волокнами и паренхимой флоэмы (фото 63,В).
Часто пробка представляет собой прочную ткань, обусловли-
вающую длительное сохранение коры даже при образовании глу-
боких трещин (виды Betula\ фото 60, В; Pinus, Quercus, Robinia,
Salix, Sequoia). Такая кора сбрасывается без образования чешуек.
Чечевички
Чечевичку можно определить как ограниченный участок пери-
дермы, в котором феллоген более активен, чем в остальных ме-
стах, и способен к образованию ткани, содержащей в отличие от
феллемы многочисленные межклетники. Межклетники встречают-
ся и в самом феллогене чечевичек. Из-за довольно рыхлого распо-
ложения клеток чечевички рассматриваются как структуры, обес-
печивающие поступление через перидерму воздуха.
Чечевички — обычные компоненты перидермы стеблей и кор-
ней. Снаружи чечевичка часто имеет вид вертикально или гори-
зонтально удлиненного массива рыхло расположенных клеток,
выступающего над поверхностью через трещину в перидерме (фо-
то 66,В). По размеру чечевички варьируют от структур, едва за-
метных невооруженным глазом, до образований длиной 1 см и
более. Они располагаются рядами или поодиночке. Вертикальные
ряды чечевичек иногда лежат напротив широких лучей, однако
обычно такое расположение не наблюдается.
Феллоген чечевички связан с феллогеном пробковой перидер-
мы, но, как правило, изогнут внутрь и поэтому кажется более
глубоко расположенным (фото 66). Рыхлая ткань, откладываемая
феллогеном чечевички наружу, называется добавочной, или вы-
полняющей, тканью [25], а откладываемая внутрь — феллодер-
мой.
Перидерма
Степень различия между выполняющей тканью и смежной
феллемой у разных видов растений варьирует. У голосеменных
выполняющая ткань состоит из клеток тех же типов, что и фел-
лема. Основное различие между этими тканями заключается в
том, что ткань чечевички имеет межклетники. Клетки чечевичек
могут иметь также более тонкие оболочки, и в отличие от ради-
ально уплощенных клеток феллемы у очень многих видов расте-
ний они вытянуты по радиусу. С помощью сканирующей микро-
скопии в чечевичках клубня картофеля на стенках клеток, обра-
щенных к межклетникам, были выявлены выросты из воска [10].
Этот воск, вероятно, играет роль в регуляции потери клубнем воды
и в предохранении входа через чечевички воды и, возможно, па-
тогенов.
У двудольных различают три структурных типа чечевичек [25].
У чечевичек первого типа, наиболее простого, выполняющая ткань
состоит из суберинизированных клеток [например, у видов Lirio-
dendron, Magnolia, Malus, Persea (фото 66, Б), Populus, Pyrus и
Salix].
Хотя эта ткань и содержит межклетники, она более или менее
компактна и формирует годичные слои из более тонкостенной
ткани, появляющейся вначале, и более толстостенной и компакт-
ной ткани, появляющейся позднее.
Чечевички второго типа, найденные у видов Fraxinus, Quercus,
Sambucus и Tilia, состоят главным образом из массива более или
менее рыхлой несуберинизированной выполняющей ткани, сме-
няемой в конце вегетационного периода более компактным слоем
суберинизированных клеток.
Чечевичкам третьего типа, примерами которого являются че-
чевички видов Betula, Fagus (фото 66, В), Prunus и Robinia, свой-
ственна наивысшая степень специализации. Здесь выполняющая
ткань подразделяется на слои, состоящие из рыхлой несуберини-
зированной и компактной суберинизированной тканей. Компактная
ткань образует закрывающие слои, каждый шириной от одного до
нескольких клеток, которые скрепляют рыхлую ткань, обычно
образующую слои из нескольких клеток. За один год образуется
несколько слоев ткани каждого типа. Закрывающие слои после-
довательно разрываются при образовании нового прироста.
Первые чечевички часто появляются под устьицами. При этом
паренхимные клетки под устьицем претерпевают несколько под-
готовительных делений, затем феллоген оттесняет расположенные
над ним клетки наружу и разрывает эпидерму (фото 66, А).
Чечевички сохраняются в перидерме до тех пор, пока она
растет; новые чечевички появляются время от времени в резуль-
тате изменения характера деятельности феллогена: вместо фел-
лемы он начинает формировать ткань чечевичек. Более глубокие
слои перидермы также имеют чечевички, которые обычно появля-
198
Глава 12
ются на дне трещин в ритидоме. Чечевички ритидома в основном
сходны с чечевичками исходной перидермы, однако их феллоген
менее активен, и поэтому они не столь хорошо дифференцированы.
СПИСОК ЛИТЕРАТУРЫ
1. Audia W. V., Smith W. L., Jr., Craft С. C. Effects of isopropyl N-(3-chlorophe-
nyl) carbamate on suberin, periderm, and decay development by Katahdin
potato slices, Bot Gaz., 123, 255—258 (1962).
2. Borchert R., McChesney J. D. Time course and localization of DNA synthesis
during wound healing of potato tuber tissue, Devel. Biol., 35, 293—301
(1973).
3. Borger G. A., Kozlowski T. T. Effect of water deficits on first periderm and
xylem development in Fraxinus pennsylvanica, Can. J. For. Res., 2, 144—151
(1972). Effects of light intensity on early periderm and xylem development
in Pinus resinosa, Fraxinus pennsylvanica, and Robinia pseudoacacia, Can. J.
For. Res., 2, 190—197 (1972). Effects of temperature on first periderm and xy-
lem development in Fraxinus pennsylvanica, Robinia pseudoacacia, and Ailan-
thus altissima, Can. J. For. Res., 2, 198—205 (1972).
4. Bowen W. R. Origin and development of winged cork in Euonymus alatus,
Bot. Gaz., 124, 256—261 (1963).
5. Chattaway M. M. The anatomy of bark. I. The genus Eucalyptus, Aust. Jour.
Bot, 1, 402—433 (1953).
6. De Zeeuw C. Influence of exposure on the time of deep cork formation in three
northeastern trees, New York State Col. Forestry, Syracuse Univ. Bui., 56,
(1941).
7. Dittmer H. J., Roser M. L. The periderm of certain members of the Cucurbita-
ceae, Southwest Nat., 8, 1—9 (1963).
8. El Hadidi M. N. Observations on the wound-healing process in some flowering
plants, Mikroscopie, 25, 54—69 (1969).
9. Falk H., El Hadidi M. N. Der Feinbau der Suberinschichten verkorkter Zell-
wande, Z. Naturforsch., 16b, 134—137 (1961).
10. Hayward P. Waxy structures in the lenticels of potato tubers and their possible
effects on gas exchange, Planta, 120, 273—277 (1973).
11. Holdheide W. Anatomie mitteleuropaischer Geholzrinden, Handbuch der Mikro-
skopie in der Technik, Band 5, Teil 1, 195—367 (1951).
12. Lipetz J. Wound healing in higher plants, Internatl. Rev. Cytol., 27, 1—28
(1970).
13. Luhan M. Das Abschlussgewebe der Wurzeln unserer Alpenpflanzen, Ber. Deut.
Bot. Ges., 68, 87—92 (1955).
14. Mogensen H. L. Studies on the bark of the cork bark fir: Abies lasiocarpa var.
arizonica (Merriam) Lemmon. I. Periderm ontogeny, Ariz. Acad. Sci. J., 5,
36—40 (1968). II. The effect of exposure on the time of initial rhytidome for-
mation, Ariz. Acad. Sci. J., 5, 108—109 (1968).
15. Morris L. L., Mann L. K. Wound healing, keeping quality, and compositional
changes during curing and storage of sweet potatoes, Hilgardia, 24, 143—
183 (1955).
16. Moss E. H., Gorham A. L. Interxylary cork and fission of stems and roots,
Phytomorphology, 3, 285—294 (1953).
17. Mullick D. B., Jensen G. D. New concepts and terminology of coniferous pe-
riderms: necrophylactic and exophylactic periderms, Can. J. Bot., 51, 1459—
1470 (1973).
18. Nelson P. E., Wilhelm S. Some aspects of the strawberry root, Hilgardia, 26,
631—642 (1957).
19. Smithson E. Development of winged cork in Ulmus^hollandica Mill., Proc.
Leeds Philos. Lit. Soc., Sci. Sec., 6, 211—220 (1954).
Перидерма
199
20. Solereder Н., Meyer F. J. Systematische Anatomie der Monokotyledonen.
Heft III, Berlin, Gebriider Borntraeger, 1928.
21. Struckmeyer В. E., Riker A. J. Wound periderm formation in white-pine trees
resistant to blister rust, Phytopathology, 41, 276—281 (1951).
22. Swamy B. G. L.} Sivaramakrishna D. Wound healing responses in monocoty-
ledons. I. Responses in vivo, Phytomorphology, 22, 305—324 (1972).
23. Tomlinson P. B. Anatomy of the monocotyledons. II. Palmae, Oxford, Claren-
den Press, 1961.
24 Waisel Y., Liphschitz N., Arzee T. Phellogen activity in Robinia pseudoacacia
L, New Phytol., 66, 331—335 (1967).
25. Wutz A. Anatomische Untersuchungen uber System und periodische Verande-
rungen der Lenticellen, Bot. Stud. No. 4, 43—72 (1955).
Глава 13
Секреторные структуры
Секрецией называют комплекс явлений, связанных с отделе-
нием веществ от протопласта или их изоляцией в отдельных ча-
стях протопласта. Секретируемыми веществами могут быть избы-
точные ионы, которые удаляются в форме солей; излишние асси-
миляты, выделяющиеся в виде сахаров или веществ клеточной
оболочки; соединения, являющиеся или не являющиеся конечными
продуктами метаболизма, которые, однако, не утилизируются или
утилизируются в физиологических процессах лишь частично (ал-
калоиды, таннины, терпены, смолы, различные кристаллы); ве-
щества, выполняющие после выделения особую физиологическую
функцию (ферменты, гормоны). Удаление веществ, не участвую-
щих в метаболизме клетки, иногда называют экскрецией. Однако
у растения четкой границы между экскрецией и секрецией прове-
сти трудно: одни и те же клетки накапливают разнообразные ве-
щества, часть которых представляет собой продукты отброса, а
часть вновь используется [35]. Кроме того, роль многих, возмож-
но даже большинства, секретируемых веществ точно не выяснена.
В данной книге термин «секреция» понимается штроко, в него
включены синтез, изоляция и выход веществ, которые либо функ-
ционально специализированы, либо предназначены для хранения
или экскреции. К секреции относится как удаление веществ из
клетки (на поверхность растения или во внутренние вместилища),
так и накопление секретируемых веществ в определенных отсеках
клетки.
При обсуждении процессов секреции у растений обычно под-
черкивается деятельность специализированных секреторных струк-
тур, таких, как железистые волоски, нектарники, смоляные кана-
лы, млечники и другие. По существу секреция происходит во всех
живых клетках и представляет собой часть их нормального ме-
таболизма. Она характеризует различные этапы накопления вре-
менных отложений в органеллах и вакуолях; мобилизации фер-
ментов, участвующих в синтезе и разрушении клеточных компо-
нентов; обмена веществ между органеллами и их транспорта от
клетки к клетке. При изучении специализированных секреторных
структур у растений нельзя упускать из виду широкое распростра-
нение секреторных процессов.
Четко дифференцированные секреторные структуры встречают-
ся во многих формах, которые варьируют в зависимости от вида
Секреторные структуры
201
Рис. 13.1. Секреторные трихомы. А — В. Железистые волоски листа лаванды
Lavandula vera с нерастянутой (А) и растянутой накапливающимся секретом
(Б, В) кутикулой. Г. Железистый волосок листа хлопчатника (Gossypium).
Д. Железистый волосок с одноклеточной головкой стебля Pelargonium. Е. Клей-
кий волосок молодого листа Pyrus. Ж- Перламутровая железка листа винограда
Vitis vinifera. 3. Жгучий волосок крапивы Urtica urens. 1 — кутикула; 2 — ра-
фиды.
секретируемого вещества. Высокодифференцированные секретор-
ные структуры, состоящие из большого числа клеток, называются
железками (рис. 13.1,Ж); более простые из них представляют
собой железистые образования, например железистые волоски
(рис. 13.ДЛД), железистая эпидерма или железистые клетки.
Различия между ними, однако, нечеткие, и железками часто на-
зывают самые разные, крупные и мелкие, волосковидные и более
сложные секреторные структуры.
По своей деятельности железки могут быть очень специфич-
ными, на что указывает преобладание одного или группы веществ
в содержимом, выделяемом данной железкой [21]. Одни желези-
стые структуры (гидатоды, слизевые железки, нектарники, соле-
202
Глава 13
вые железки) секретируют гидрофильные вещества, другие (мас-
ляные железки, эпителиальные клетки смоляных ходов) выделяют
липофильные вещества. В ультраструктурных исследованиях были
выявлены определенные цитологические различия между желе-
зистыми структурами этих двух типов. Так, секреция гидрофиль-
ных веществ происходит в присутствии многочисленных митохон-
дрий и хорошо развитых эндоплазматического ретикулума и дик-
тиосом. В масляных железках с секрецией, по-видимому, связана
прогрессирующая дегенерация первоначально плотных протопла-
стов [20]. Диктиосомы, столь активно функционирующие в сек-
реции полисахаридов, пектиновых веществ и слизей [28], в секре-
ции терпеноидов, очевидно, не участвуют [39].
Способы элиминации секрета из клеток выяснены лишь час-
тично. Так, если переносчиками секрета являются диктиосомные
пузырьки, то они выходят из протопласта путем слияния с плаз-
малеммой (гранулокриновая секреция). После этого, по-видимому,
секрет проходит через оболочку. У многих железок движение
секрета наружу через оболочку (апопластический перенос) обес-
печивается кутинизацией радиальных стенок в виде эндодермоид-
ного слоя клеток, расположенных под секреторными клетками
[34]. Если секретируемые молекулы имеют небольшой размер,
предполагается непосредственный переход их через плазмалемму
и оболочку (эккриновая секреция). Такое прохождение считается
пассивным, если оно контролируется градиентами концентрации,
и активным, если оно нуждается в метаболической энергии. Клет-
ки, секретирующие гидрофильние вещества, например клетки же-
лезок, выделяющих соли или углеводы, могут дифференцироваться
как передаточные клетки, для которых характерны протуберанцы
оболочки [29]. Эфирные масла часто накапливаются в секреторных
трихомах между клеточной оболочкой и кутикулой (рис. 13.1, Л —
В), Позднее кутикула может разрываться, и таким образом за-
вершается выход масла. В следующих разделах описаны характер-
ные примеры секреторных структур, находящихся на поверхности
растения, и структур, заключенных в различные ткани.
Наружные секреторные структуры
Трихомы и железки
Наружные секреторные структуры различаются по сложности.
Часто секреторной является просто часть эпидермы, иногда секре-
торные клетки представляют собой компоненты придатков — же-
лезистых трихомов и железок, — происходящих из одной эпидер-
мы или из эпидермы и субэпидермальных слоев. Трихомы часто
имеют одно- или многоклеточную головку, состоящую из клеток,
Секреторные структуры
203
продуцирующих секрет, и покоящуюся на ножке из нежелезистых
клеток (рис. 13.1, А—Д),
В трихомах Mentha, секретирующих масло [1], последнее по-
является в виде капель осмиофильного вещества в цитоплазме.
В многоклеточных трихомах Dictamnus масло обнаружено в пла-
стидах [2]. Эти пластиды, а позднее и целые клетки в центре
трихома разрушаются, и масло остается в образующейся в ре-
зультате этого полости. Масло освобождается на поверхность,
когда кутинизированный клювовидный вырост на верхнем конце
трихома разрывается.
Довольно сходный механизм освобождения содержимого (ве-
щества, стимулирующего мышцы [40]) обнаружен у жгучего во-
лоска крапивы Urtica urens (рис. 13.1,3). У крапивы пузыревид-
ный конец волоска погружен в эпидермальные клетки, которые
возвышаются над поверхностью. Верхняя часть волоска напоми-
нает тонкую капиллярную трубку с закругленным кончиком. Когда
волосок приходит в соприкосновение с кожей, кончик обламыва-
ется по заранее намеченной линии; появляющиеся в результате
острые края легко проникают в кожу, и жидкость выталкивается
в ранку под давлением, действующим на пузыревидную часть во-
лоска. У перламутровой железки Vitaceae эпидерма, покрывающая
крупные секреторные клетки, имеет открытое устьице, через ко-
торое секрет выделяется наружу (рис. 13.1, Ж).
Трихомы на листьях насекомоядных растений секретируют му-
кополисахариды, которые улавливают насекомых, и протеолити-
ческие ферменты, при участии которых эти насекомые перевари-
ваются. У Pinguicula, например, железки на ножках продуцируют
слизистое вещество, а сидячие железки образуют протеолитиче-
ские ферменты. При стимуляции соответствующим азотсодержа-
щим веществом, попавшим на поверхность листа, на эту поверх-
ность изливается жидкость, содержащая ферменты. Радиоавто-
графические исследования (с использованием белка, меченного
14С) показывают, что сидячие железки служат также и для по-
глощения переваренной пищи [16]. У других разнообразных при-
способлений для улавливания и переваривания насекомых листь-
ями, характерных для представителей некоторых таксонов, отме-
чены специализированные секреторные трихомы [5].
Образования, секретирующие соли, варьируют по структуре и
способу выделения соли. У видов лебеды Atriplex часть ионов,
переносимых транспирационным током, в конце концов достав-
ляется по цитоплазме и плазмодесмам в живые пузыревидные
клетки, прикрепленные к эпидерме (рис. 13.2 и гл. 19). В пузы-
ревидной клетке ионы секретируются в крупную центральную ва-
куоль (показана короткими стрелками на рис. 13.2). После раз-
рушения трихомов соль откладывается на поверхности листа. По-
скольку от мезофилла до пузыревидных клеток имеется значи-
204
Глава 13
Рис. 13.2. Схема секретирующего соль трихо-
ма вместе с частью листа лебеды (Atriplex).
Длинной изогнутой стрелкой показан путь
движения ионов из ксилемы жилки к пузыре-
видной клетке трихома. Короткие стрелки по-
казывают выход ионов в вакуоль. (Связь
трихомов с листом в целом см. гл. 19.)
1 — вакуоль; 2— пузыревидная клетка; 3—
клетка-ножка; 4 — кутикула; 5 — эпидерма;
6 — гиподерма; 7 — мезофилл; 8 — обкладка
пучка; 9 — ксилема.
тельный положительный градиент концентрации соли, перенос
ионов в вакуоли этих клеток является процессом, потребляющим
энергию [21].
В качестве примера железки, секретирующей соль непосред-
ственно наружу, рассмотрим железку у гребенщика Tamarix
aphylla. Эта железка представляет собой комплекс из восьми кле-
ток, из которых шесть являются секреторными, а две — базальны-
ми собирательными клетками (рис. 13.3). Группа секреторных кле-
ток заключена в кутикулярный слой, прерываемый лишь там, где
самые нижние секреторные клетки связываются плазмодесмами с
собирательными клетками. Процесс секреции соли представляется
следующим образом [37]. Соль входит в железку через плазмо-
десмы между собирательными клетками и мезофиллом и движется
по железке от клетки к клетке также по плазмодесмам. Она на-
капливается в микровакуолях, которые в конце концов сливаются
с плазмалеммой, выстилающей оболочку и ее протуберанцы. Соль
попадает в богатую пектином оболочку и движется к верхушке
железки, где выходит через поры в поверхностном слое. Обратный
ток соли через оболочки в мезофилл предотвращается кутикуляр-
ным слоем.
Солевые железки рассматриваются как приспособления для
обессоливания; они вероятно, поддерживают солевой баланс путем
секреции избытка соли. В соответствии с этим состав секретируе-
мой соли зависит от солевого состава среды обитания корней.
У многих древесных растений (Aesculus, Betula, Carya, Malus)
железистые волоски и более сложные придатки, называемые
Секреторные структуры
205*
Рис. 13.3. Схема секретирующей соль железки гребенщика Tamarix aphylla.
Комплекс из восьми клеток, из которых шесть являются секреторными и две
собирательными, погружен в эпидерму и находится в контакте с мезофиллом
(внизу). Кутикула и кутинизированная оболочка обозначены вместе как кути-
кулярный слой штриховкой крест-накрест. (Схема составлена на основе данных
работы [37].) 1 — поры; 2— кутикулярный слой; 3 — секреторные клетки; 4 —
собирательные клетки; 5 — вакуоль; 6 — плазмодесмы; 7 — протуберанцы обо-
лочки; 8 — микровакуоли; 9 — мезофилл.
клейкими волосками (рис. 13.1, Е), развиваются на молодых при-
мордиях листьев и производят клейкий секрет, который пропиты-
вает всю почку и покрывает ее поверхность. Когда почка раскры-
вается и листья разрастаются, железистые придатки высыхают и
отваливаются. Они, вероятно, обеспечивают защитное покрытие
покоящихся почек.
Нектарники
В солевых железках основным источником секретируемых рас-
творенных веществ является транспирационный ток, тогда как в
нектарниках в секреции жидкости участвуют как флоэма, так и
ксилема. Нектарники секретируют жидкость, содержащую сахар.
Они встречаются на цветках (флоральные нектарники) и на ве-
гетативных частях растения (экстрафлоральные нектарники). Нек-
тарники имеют вид железистых поверхностей (рис. 13.4, Г, Д) или
дифференцируются в специализированные структуры (рис. 13.4,
А — В, Е — 3). Флоральные нектарники занимают различное по-
ложение в цветке: они находятся на чашелистиках, лепестках, ты-
чинках, завязях или на цветоложе [8, 9, 18]. Экстрафлоральные
206
Глава 13
нектарники встречаются на стеблях, листьях, прилистниках и цве-
тоножках
Секреторная ткань нектарника может состоять только из эпи-
дермы или из нескольких слоев более глубоко расположенных
клеток (рис 13 4) Снаружи она покрыта кутикулой, и к ней до-
вольно близко подходит проводящая ткань Последняя иногда
представлена лишь следом к какой-то другой части цветка
Рис 13 4 Флоральные нектарники А — В Нектарник Ceanothus в виде лопаст-
ного диска прикрепленного к основанию гинецея (А) Г Д Нектароносная ткань
земляники (Fragaria) выстилает цветочную трубку под тычинками (Г) Е — 3
Лопастной нектарник (Ж) пойнсеттии Euphorbia pulchernma прикреплен к об-
вертке окружающей соцветие 1 — столбик, 2— проводящая ткань, 3— тычин-
ка 4 — пестичный цветок 5 — обвертка 6 — нектарник
Секреторные структуры
207
(рис. 13.4, Б, В), однако некоторые нектарники имеют свои соб-
ственные проводящие пучки (рис. 13.4, Ж), часто состоящие толь-
ко из флоэмы [12, 18]. Между относительным количеством флоэмы
в проводящей ткани, снабжающей нектарник, и концентрацией
сахара в нектаре существует тесная связь. Если в ней преоблада-
ет флоэма, то нектар может иметь до 50% сахара, и наоборот,
если в снабжающих нектарник проводящих тканях преобладает
ксилема, то содержание сахара может снижаться до 8% [13].
Нектарники не просто выводят поступающий из флоэмы сахар,
но в различной степени преобразуют его с помощью ферментов
[35]. Нектарники с проводящими пучками, в которых преобладает
ксилема, в физиологическом смысле являются переходным звеном
к гидатодам.
Секреторные клетки в нектарниках имеют плотную цитоплаз-
му и мелкие вакуоли, которые часто содержат таннины. Много-
численные митохондрии с хорошо развитыми кристами свидетель-
ствуют о том, что эти клетки интенсивно дышат. Они богаты эн-
доплазматическим ретикулумом (ЭР), компоненты которого иног-
Рис. 13.5. Детали строения нектарника Lonicera japonica. А, Б. Секретирующие
нектар волоски внутренней эпидермы трубки венчика до (А) и во время (Б)
секреции. В. Часть клеточной оболочки с протуберанцами, характерными для ак-
тивно секретирующего волоска. Темная линия, очерчивающая протуберанцы,
обозначает плазмалемму. Протуберанцы, видимые как изолированные структуры,
очевидно, связаны с оболочкой на иных, чем представлено на рисунке, уровнях.
(Схема составлена по данным работы [10].) 1 — кутикула; 2— вакуоль. 3—
секрет; 4 — вакуоли; 5 — протуберанцы оболочки.
*208
Глава 13
да собраны в пачки или закручены в спирали [7]. Максимального
объема ЭР достигает на стадии секреции нектара. У некоторых
нектарников (например, у Lonicera japonica [10]) в секреции са-
хара, очевидно, участвуют пузырьки, происходящие из ЭР, а не
из диктиосом.
В нектарнике Lonicera секретирующими нектар клетками яв-
ляются короткие волоски, расположенные на ограниченном участ-
ке внутренней эпидермы трубки венчика. Молодые волоски имеют
одну крупную вакуоль и плотно прилегающую к ней кутикулу
(рис. 13.5,Л). В активно секретирующих волосках вакуолярный
объем сокращается; на месте единственной крупной вакуоли по-
являются несколько мелких, и кутикула отделяется от оболочки
(рис. 13.5,5). На этой стадии оболочка волосков несет многочис-
ленные протуберанцы, покрытые плазмалеммой (рис. 13.5,5).
Гидатоды
Гидатоды выделяют воду на поверхность листа из его внут-
ренних частей. Этот процесс называется гуттацией. В структурном
плане гидатоды представляют собой модифицированные участки,
обычно расположенные по краю листа или на его верхушке, в ко-
торых выделяющаяся из ксилемы вода способна достигать по-
верхности листа. При этом вода проходит через более или менее
модифицированный мезофилл — эпитему — и покидает лист через
отверстия в эпидерме. Этими отверстиями являются устьица (фо-
то 67), неспособные к закрыванию и открыванию. Эпитема часто
представляет собой бесхлорофильную паренхиму, компактную
[33] или с хорошо развитыми межклетниками. Известно также,
что клетки эпитемы могут дифференцироваться в передаточные
клетки, снабженные внутренними выростами оболочки [30]. Кси-
лема гидатод состоит из трахеид (рис. 13.6), иногда в дополнение
к последним она содержит узелковые комплексы.
Одни гидатоды выделяют воду, по-видимому, пассивно, под
контролем корневого давления. Другие являются настоящими же-
лезками с эпитемой, активно секретирующей воду. Гидатоды могут
дифференцироваться также в железистые трихомы [14].
Некоторые опыты позволяют предположить, что гуттация слу-
жит для минерального питания в том случае, когда подавлена
транспирация. При этом растворенные вещества поглощаются
(возможно, с помощью передаточных клеток в эпитеме [30]) из
гуттационной воды, когда она движется вверх по растению [19].
Продукты гуттации при их накоплении и концентрировании или
при взаимодействии с пестицидами [17] иногда вызывают повреж-
дения растений.
Секреторные структуры
209
Внутренние секреторные структуры
Секреторные клетки
Внутренние секреторные клетки имеют очень разнообразное
содержимое. Если эти клетки заметно отличаются от соседних
клеток, среди которых они разбросаны, их называют идиобласта-
ми, а в том случае, если их содержимое предположительно пред-
ставляет собой продукты отброса, — экскреторными идиобластами
[11]. Иногда секреторные клетки сильно увеличены, особенно в
длину, и тогда их называют мешками или трубками. Обычно их
классифицируют по содержимому, однако такая классификация
недостаточно точна, так как в одних клетках их содержимое не
подвергалось химическому анализу, а в других обнаружены смеси
веществ. Тем не менее термины «секреторные клетки», «секретор-
ные полости и каналы» полезны для целей диагностики в таксо-
номических исследованиях [26].
Представители некоторых семейств растений, например Caly-
canthaceae, Lauraceae, Magnoliaceae, Simarubaceae и Winteraceae,
имеют секреторные клетки с маслянистым содержимым. Эти клет-
ки выглядят как увеличенные паренхимные клетки (фото 68,Л)
и встречаются в проводящих и основных тканях стебля и листа.
Клетки, сходные по виду с масляными клетками, но с неспецифи-
ческим содержимым, встречаются у представителей многих других
семейств (Clusiaceae, Hypericaceae, Rutaceae, Tetracentraceae,
Trochodendraceae), и их также часто называют масляными клет-
ками. Представители одних семейств двудольных (Meliaceae) име-
ют смоляные, а других (Cactaceae, Lauraceae, Magnoliaceae, Mal-
vaceae, Tiliaceae) — слизевые клетки. Слизевые клетки часто со-
держат рафидные кристаллы (фото 68,Б). В таких семействах,
как Capparidaceae, Brassicaceae и Resedaceae, были обнаружены
клетки, содержащие фермент мирозиназу. Эти клетки, названные
мирозиновыми, имеют удлиненную или разветвленную форму.
В масляных клетках образование или по крайней мере накоп-
ление липоидного секрета происходит в тилакоидах пластид [35].
Позднее масло в виде капель появляется в цитоплазме, однако в
конце концов все клеточные компоненты дегенерируют. В неко-
торых масляных клетках секрет заключен в масляные мешки,
имеющие свою собственную целлюлозную оболочку, прикреплен-
ную с помощью выроста в виде ножки к оболочке клетки (авокадо
Persea [36]).
В очень многих секреторных клетках наиболее заметным вклю-
чением является таннин. Он представляет собой обычное эргасти-
ческое вещество паренхимных клеток (гл. 3), однако некоторые
клетки содержат его в большом количестве и при этом их размеры
могут быть заметно увеличены. Танниновые клетки часто образу-
14 К. Эзау, кн. 1
210
Глава 13
ют единую систему, ассоциированную с проводящими пучками»
Танниновые идиобласты встречаются во многих семействах (Cras-
sulaceae, Ericaceae, Fabaceae, Myrtaceae, Rosaceae, Vitaceae). На-
глядными примерами их являются танниновые клетки в листьях
Sempervivum tectorum и видов Echeveria, а также трубковидные
длиной 1 см и более танниновые клетки в сердцевине и флоэме
стеблей Sambucus (фото 68, Д). Танниновые соединения в танни-
ноносных клетках окисляются в коричневые и красновато-корич-
невые флобафены, которые легко различаются под микроскопом.
Клетки в основной ткани плода Ceratonia siliqua содержат твер-
дые танноиды — включения, состоящие из таннинов в комплексе
с другими веществами.
Некоторые исследователи [11] к секреторным идиобластам
относят кристаллоносные клетки (гл. 3). Эти клетки могут не
отличаться от других паренхимных клеток, но могут быть и более
или менее специализированными по форме и содержимому. Хо-
роший пример такой специализации — клетки, содержащие цисто-
литы в листьях Ficus elastica, и рафидные клетки. Цистолиты
представляют собой структуры, в которых объединены вещества
оболочки, в том числе целлюлоза и каллоза, с карбонатом каль-
ция. У Ficus elastica цистолиты встречаются поодиночке в эпи-
дермальных клетках, и каждый из них прикреплен к наружной
эпидермальной стенке с помощью целлюлозной ножки (фото 68,
Г). Рафиды часто обнаруживают в длинных мешковидных клет-
ках, заполненных слизью. Во вторичных проводящих тканях обра-
зующая кристаллы клетка подразделяется на мелкие клетки, каж-
дая из которых содержит по одному кристаллу. Отмечены случаи,
когда кристалл изолируется от живой части протопласта стенкой
из целлюлозы.
Секреторные {полости и каналы
Полости и каналы отличаются от секреторных клеток тем, что
они представляют собой пространства, возникающие путем рас-
творения клеток (лизигенные пространства), или отделения их
друг от друга (схизогенные пространства). При образовании сек-
реторных пространств могут сочетаться оба пути. В лизигенных
секреторных полостях (Citrus, Gossypium) секрет образуется в
клетках, которые в конце концов разрушаются и освобождают
вещества в возникающую вследствие их разрушения полость. По
периферии полости встречаются частично разрушенные клетки
(фото 68,В).
Схизогенные секреторные полости обычно выстланы неповреж-
денными клетками (фото 68,£). Развитие схизогенной масляной
железки, исследованное у зародыша Eucalyptus [4], показано йа
рис. 13.6. Железка возникает путем делений одной эпидермальной
Секреторные структуры
211
Рис 13 6 Развитие эпидермальных масляных железок в зародыше Eucalyptus,
показанное на продольных (А — В) и поперечных (Г, Д) срезах. А, Б Две
стадии деления инициали железки и ее производных В После завершения де-
лений секреторные клетки (отмечены точками) окружены клетками обкладки
Г Схизогенное образование полости между секреторными клетками Д Зрелая
железка с секреторными клетками, образующими эпителий вокруг полости, со-
держащей масло (Схема основана на микрофотографиях из работы [4], длина
масштабных линий соответствует 10 мкм ) 1 — обкладочные клетки, 2— эпите-
лиальные клетки
клетки. Образующиеся в результате деления клетки затем диф-
ференцируются в эпителиальные и обкладочные клетки Некото-
рые из обкладочных клеток могут происходить из субэпидермаль-
ной клетки (рис. 13 6,5). Во время прорастания семени эпители-
альные клетки отделяются друг от друга в центре железки и в
появившийся межклетник секретируют масло
Содержимое секреторных полостей и каналов часто характе-
ризуется как маслянистое, хотя его состав точно не известен [26]
Лизигенные слизевые каналы найдены в чешуях почек Tilia сог-
data Схизогенные каналы со смолистым содержимым встречаются
у представителей сем. Asteraceae, а с содержимым неизвестного
состава — у представителей сем. Apiaceae. Дающие копал секре-
торные каналы некоторых тропических представителей пор. Faba-
les также возникают как схизогенные пространства [27]. Хорошо
известными схизогенными каналами являются смоляные ходы
хвойных. Подобные ходы у двудольных произвольно называют
камеденосными ходами. Смоляные ходы хвойных встречаются в
проводящих (гл. 9) и основных тканях всех органов растения и
в структурном отношении представляют собой длинные межклет-
ники, выстланные продуцирующими смолу эпителиальными клет-
ками [42].
14*
212
Глава 13
Как видно в электронный микроскоп [43], эпителиальные клет-
ки у сосны содержат пластиды с редкими тилакоидами, окружен-
ные обкладкой из цистерн эндоплазматического ретикулума.
В строме пластид, в пластидной оболочке, внутри цистерн эндо-
плазматического ретикулума около пластид и по обеим сторонам
плазмалеммы были обнаружены осмиофильные капли. Вещество
капель в самом канале напоминало смолу, а распределение капель
в клетке, по-видимому, указывало на место образования и способ
перемещения смолы из клетки в канал.
Секреторные полости и каналы, образующиеся в результате
нормального развития, иногда с трудом отличаются от каналов и
полостей, возникающих под влиянием повреждения. В древесине
голосеменных и двудольных смоляные и камеденосные ходы и
карманы часто являются травматическими образованиями, но их
развитие и содержимое могут быть сходны с теми, которые харак-
терны для этих древесин в норме.
Млечники
Млечники представляют собой клетки или ряды связанных
клеток, которые содержат латекс (млечный сок) — жидкость
сложного состава. Как и другие секреторные структуры, млечники
являются хранилищами веществ, часть которых относят к экскре-
там (терпены, смолы), а часть — к секретам в узком понимании
этого слова (ферменты).
Млечники по происхождению могут быть простыми и сложны-
ми. Простые млечники представляют собой одиночные клетки,
сложные возникают из рядов клеток. В более специализированном
состоянии ряды клеток в сложном млечнике соединяются путем
растворения смежных стенок; именно поэтому сложные млечники
обычно называются членистыми. В противоположность этому про-
стые млечники называются нечленистыми. Млечники обоих типов
могут быть ветвистыми или неветвистыми.
Млечники встречаются в различных тканях и органах расте-
ния, но иногда они локализуются только во флоэме [32, 38]. Ши-
рокое распространение млечников в растении является результа-
том способа их развития. Членистые млечники (фото 69) распро-
страняются в новые ткани путем добавления к ним клеток этих
тканей, т. е. определенные клетки вновь образованной ткани диф-
ференцируются в млечные клетки, если они находятся в контакте
с более старыми млечными клетками. Нечленистые млечники воз-
никают в зародыше как одиночные клетки [22] (фото 70,Л), ко-
торые затем по мере роста растения проникают в ткани, обра-
зуемые апикальными меристемами. Развитие таких одноклеточных
млечников характеризуется сочетанием согласованного и апикаль-
ного интрузивного роста. Их рост среди клеток напоминает рост
Секреторные структуры
213
гаустория или гифы гриба (фото 70,Б, В). У растений с вторич-
ным ростом млечники развиваются и во вторичных тканях. Не-
членистый млечник способен пройти через камбий и может со-
хранять целостность во время последующего роста тканей из кам-
бия [41].
Млечники имеют первичные нелигнифицированные клеточные
оболочки различной толщины. Членистые млечники становятся
многоядерными, когда ряды клеток сливаются друг с другом пу-
тем растворения общих стенок. Нечленистые млечники также ста-
новятся многоядерными по мере того, как они удлиняются и их
ядра многократно делятся [22]. Когда образуется латекс, прото-
пласты млечников находятся в живом состоянии, однако некото-
рые их клеточные компоненты во время этого процесса подверга-
ются автолизу [6].
Связь латекса и протопласта полностью не ясна. Термин «ла-
текс» обозначает жидкость, которая может быть извлечена из
млечника. Вид и состав этой жидкости варьируют. Часто она на-
поминает молоко, но может быть и совершенно прозрачной и
бесцветной, а иногда коричневой или оранжевой. Среди обычных
компонентов млечников находятся терпеноиды, одним из наиболее
известных представителей которых является каучук. Растения, со-
держащие этот политерпен в больших количествах (Hevea brasi-
liensis, Ficus elastica), служат источниками натурального техни-
ческого каучука. Каучук и другие политерпены встречаются в виде
частиц в цитоплазме или мелких пузырьках, которые обычно на-
зывают также вакуолями [3, 14, 23]. В более зрелых млечниках
эти частицы выделяются в крупную центральную вакуоль [6].
В латексе обнаружено много других веществ, таких, как алкалои-
ды (морфин, кодеин и папаверин у опийного мака Papaver som-
niferum), сахар (у представителей сем. Asteraceae), воска, белки,-
ферменты (протеолитический фермент у Carica papaya), кристал-
лы, таннины и крахмал, который часто присутствует в виде круп-
ных зерен необычной формы (гл. 3).
Упомянутые выше мелкие вакуоли характерны для структур,
содержащих латекс. Эти вакуоли варьируют по размеру и могут
быть такими же мелкими, как и митохондрии. По имеющимся
данным, они возникают как расширения цистерн эндоплазмати-
ческого ретикулума [38] или как диктиосомные пузырьки [24].
Вакуоли ограничены элементарной мембраной и окружены цито-
плазмой. Иногда они сливаются в более крупные единицы. У кау-
чуконосных растений мелкие вакуоли в млечниках обычно называ-
ют лютоидами [31]. Накоплены данные, указывающиие на то, что
пузырьки (или вакуоли) млечников содержат гидролитические фер-
менты, характерные для лизосом, и что они действуют как авто-
фаговые вакуоли, осуществляя внутриклеточное переваривание
значительной части цитоплазмы [24, 25]. Этот процесс приводит
214
Глава 13
к избирательному накоплению в вакуолях цитоплазматических
компонентов (лимонной кислоты, минерального фосфора и неко-
торых анионов [31]), а также, вероятно, к разрушению политер-
пеновых частиц [24].
Млечники встречаются у представителей нескольких семейств
и нескольких родов ряда семейств двудольных и однодольных.
Известно, что латекс содержится у представителей сем. Euphor-
biaceae, которое включает роды, являющиеся источником промыш-
ленного каучука, Hevea и Manihot, у нескольких родов сем. Aste-
гасеае [одуванчик (Taraxacum), осот (Sonchus), латук (Lactuca)]
и сем. Могасеае, включающего индийское каучуконосное растение
Ficus elastica.
СПИСОК ЛИТЕРАТУРЫ
1. Amelunxen F. Elektronenmikroskopische Untersuchungen an den Driisenhaaren
von Mentha piperita L., Planta Med., 12, 121—139 (1964).
2. Amelunxen F., Arbeiter H. Untersuchungen an den Spritzdriisen von Dictam-
nus albus L., Z. PflanzenphysioL, 58, 49—69 (1967).
3. Arreguin B. Rubber and latex, Handb. PflanzenphysioL, 10, 223—248 (1958).
4. Carr D. J., Carr S. G. M. Oil glands and ducts in Eucalyptus I’Herit. II. De-
velopment and structure of oil glands in the embryo, Aust. J. Bot, 18, 191—
212 (1970).
5. Cutter E. G. Plant anatomy: experiment and interpretation. Part I. Cells and
tissues, London, Edward Arnold, 1969.
6. Esau K. Laticifers in Nelumbo nucifera Gaertn.: distribution and structure,
Ann. Bot, 39, 713—719 (1975).
7. Eyme J. Nouvelles observations sur 1’infrastructure de tissus nectarigenes
floraux, Botaniste, 1/6, 169—183 (1967).
8. Fahn A. On the structure of floral nectaries, Bot. Gaz., 113, 464—470
(1952).
9. Fahn A. The topography of the nectary in the flower and its phylogenetic
trend, Phytomorphology, 3, 424—426 (1953).
10. Fahn A., Rachmilevitz T. Ultrastructure and nectar secretion in Lonicera japo-
nica, Bot. J. Linn. Soc., Suppl. 1, 63, 51—56 (1970).
11. Foster A. S. Plant idioblasts: remarkable examples of cell specialization, Pro-
toplasma, 46, 184—193 (1956).
12. Frei E. Die Innervierung der floralen Nektarian dikotyler Pflanzenfamilien,
Ber. Schweiz. Bot. Ges., 65, 60—114 (1955).
13. Frey-Wyssling A. The phloem supply to the nectaries, Acta Bot. Neerl., 4,
358—369 (1955).
14. Heinrich G. Elektronenmikroskopische Untersuchung der Milchrohren von
Ficus elastica, Protoplasma, 70, 317—323 (1970).
15. Heinrich G. Die Feinstruktur der Trichom-Hydathoden von Monarda fistulosa,
Protoplasma, 77, 271—278 (1973).
16. Heslop-Harrison У., Knox R. B. A cytochemical study of the leaf-gland enzy-
mes of insectivorous plants of the genus Pinguicula, Planta, 96, 183—211
(1971).
17. Ivanoff S. S. Guttation injuries in plants, Bot. Rev., 29, 202—229 (1962).
18. Карташова H. H. Строение и функция нектарников цветка двудольных рас-
тений.— Издательство Томского университета, 1965.
19. Klepper В., Kaufmann М. R. Removal of salt from xylem sap by leaves and
stems of guttating plants, Plant Physiol., 41, 1743—1747 (1966).
Секреторные структуры
215
20. Loomis W. D., Croteau R. Biochemistry and physiology of lower terpenoids,
Recent Adv. Phytochem., 6, 147—185 (1973).
21. Luttge U. Structure and function of plant glands, Ann. Rev. Plant Physiol.,
22, 23—44 (1971).
22. Mahlberg P. G., Sabharwal P. S. Mitosis in the non-articulated laticifer of
Euphorbia marginata, Amer. J. Bot., 54, 465—472 (1967). Origin and early
development of nonarticulated laticifers in embryos of Euphorbia marginata,
Amer. J. Bot., 55, 375—381 (1968).
23. Marty F. Infrastructure «des laticiferes differencies d'Euphorbia character L.,
C. R. Acad. Sci. Paris D., 267, 299—302 (1968).
24. Marty F. Vesicules autophagiques des laticiferes differencies d’Euphorbia cha-
racias L., C. R. Acad. Sci. Paris, D 272, 399—402 (1971).
25. Matile Ph., Jans B., Rickenbacher R. Vacuoles of Chelidonium latex: lysosomal
property and accumulation of alcaloids, Biochem. Physiol. Pflanz., 161, 447—
458 (1970).
26. Metcalfe C. R., Chalk L. Anatomy of the dicotyledons, 2 Vols., Oxford, Cla-
rendon Press, 1950.
27. Moens P. Les formations secretrices des copaliers congolais. Etude anatomique,
histologique et histogenetique, Cellule, 57, 33—64 (1955).
28. Mollenhauer H. H., Morre D. J. Golgi apparatus and plant secretion, Ann. Rev.
Plant Physiol., 17, 27—46 (1966).
29. Pate J. S., Gunning В. E. S. Transfer cells, Ann. Rev. Plant Physiol., 23, 173—
196 (1972).
30. Perrin A. Presence de «cellules de transfer» au sein de I’epitheme de quelques
hydathodes, Z. Pflanzenphysiol., 65, 39—51 (1971).
31. Ribaillier D., Jacob J.-L., d’Auzac J. Sur certains caracteres vaculolaires des
lutoides du latex d'Hevea brasiliensis Mull., Agr. Physiol. Veg., 9, 423—437
(1971).
32. Rosowski J. R. Laticifer morphology in the mature stem and leaf of Euphorbia
supina, Bot. Gaz., 129, 113—120 (1968).
33. Rost T. L. Vascular pattern and hydathodes in leaves of Crassula ar gentea
(Crassulaceae), Bot. Gaz., 130, 267—270 (1959).
34. Schnepf E. Zur Feinstruktur der schleimsezernierenden Driisenhaare auf der
Ochrea von Rumex und Rheum, Planta, 79, 22—34 (1968).
35. Schnepf E. Gland cells. In: Dynamic aspects of plant ultrastructure, Ro-
bards A. W., ed., Chapter 9, pp. 331—357, London, McGraw-Hill Book Com-
pany (UK) Limited, 1974.
36. Scott F. M., Bystrom B. G., Bowler E. Per sea americana, mesocarp, cell struc-
ture, light and electron microscope study, Bot. Gaz., 124, 423—428 (1963).
37. Thomson W. W., Berry W. L., Liu L. Ц Localization and secretion of salt by
the salt glands of Tamarix aphylla* Proc. Natl. Acad. Sci., 63, 310—317
(1969).
38. Thureson-Rlein A. Observations on the development and fine structure of the
articulated laticifers of Papaver somniferum, Ann. Bot., 34, 751—759 (1970).
39. Васильев A. E. О локализации синтеза терпеноидов в растительной клетке,
Растительные ресурсы, 5, 29—45, Акад. Наук СССР (1970).
40. Vialli М., Barbetta F., Zanotti L., Mihalyi К. Estendibilita del concetto di siste-
ma cellulare enterocromaffine ai vegetali. I, Inquadramento della questione
e contribute alia conoscenza istochimica dei peli di Urtica dioica L., Acta Histo-
chem., 45, 270—282 (1973).
41. Vreede M. C. Topography of the laticiferous system in the genus Ficus,
Ann. Jard. Bot. Buitenzorg, 51, 125—149 (1949).
42. Werker E., Fahn A. Resin ducts of Pinus halepensis Mill. — Their structure,
development and pattern of arrangement’, Bot. J. Linn. Soc., 62, 379—411
(1969).
43. Wooding F. В. P., Northcote D. H. The fine structure of mature resin canal
cells in Pinus pinea, J. Ultrastruct. Res., 13, 233—244 (1965).
Фото 1 Верхушка побега (/1) и кончик корня (Л) проростка льна (Linutn usi-
(atissimum) на продольных срезах Показаны апикальные меристемы и происхо-
дящие от них первичные меристематические ткани А. Присутствуют иримордии
листьев п пазушных ночек (Sass, Botanical Microtechnique. 3rd ed.. The Jowa.
State College Press. 1958). />. Апикальная меристема покрыта корневым чехлн-
ком 1 апикальная меристема побега: 2 иримордии листа; .7 прокамбии;
I протодерма; 5 пазушная ночка; 6 основная меристема; 7 апикальная
меристема корня; Л’ корневой чехлпк.
Фото 2. Кончик корня табака (Kicotiana tabacurn). Продольный разрез молодых
клеток. 1 - эндоплазматический ретикулум; 2 ядрышко; .? ядро; / клеточ-
ная оболочка; 5 митохондрия; 6 липидная глобула; 7- пластида; 5 — ядер-
ная оболочка; 9— вакуоль.
Фото 3. Электронная микрофо-
тография реплики тилакоидных
мембран изолированного хло-
ропласта Portuiaca devacea по-
сле замораживания и раз-
лома. (Фото предоставлено
W. Л1. Laetscli.) 1 — внутрен-
няя поверхность разлома: 2—
наружная поверхность разлома.
1 лскх
Фото I. Ядерная оболочка (2) из паренхимной клетки черешка Mimosa pudica в
ра. розе (/1) и с поверхности (IS, центральная часть). В порах (/) виден электро-
ноплотный материал, который на микрофотографии /> имеет форму кольца с
центральной гранулой; <3 — кольцо; -/ — рибосомы; 5 — микротрубочка.
1 мкм
Фото 5. Срез хлоропласта с гранами из листа табака (Nicotiana labarum). I
шиидная глобула; 2 оболочка хлоропласта; 3 плазмалемма: / тонопласт;
5 тилакоид стромы: 6 -грана; 7 периферический ретикулум; Л’ строма;
9 клеточная оболочка 10 вакуоль; II ядро.
Фото (). Фрагменты хлоропласТов мезофилла сахарной свеклы (Beta vulgaris),
в которых видны граны в разрезе (/1) н с поверхности (/>). На микрофотогра-
фии .1 различимы двойные перегородки между тилакоидами гран. / грана;
2 липидная глобхла.
Фото 7. Этиолированный хлоропласт с нроламеллярным гс.твпем в клетке листа
сахарного тростника (Sacdiarurn offidnarurn). Видно, что в митохондрии мече-
ная криста связана с оболочкой. В пластиде хороню различимы рибосомы. (Фо-
то предоставлено W. М. l.aelsch.) / криста; 2 митохондрия; 3 тилакоид;
•/ — оболочка хлоропласта; 5 проламеллярнос тельце.
Фото 8. Митохондрии в клетке листа табака (Nicotiana lubacuni). Оболочка ми
тохондрий состоит из двух мембран: кристы погружены в плотную строму.
15 цитоплазме видны рибосомы. / оболочка митохондрии; 2 криста; <7 ли-
пидная глобмла.
Фото 9. Органеллы в клетках листа сахарной свеклы (Beta vulgaris) (А) и та-
бака (Nico Папа tabacum) (Б). Микротельца окружены элементарной мембраной
в противоположность двумембранным оболочкам других органелл. Микротельце
(Б) содержит кристалл. В хлоропласте (А) и митохондрии (Б) можно различить
рибосомы. 1—крахмал; 2— микротельце; 3-— митохондрия; -/ — хлоропласт;
5 криста; G — рибосомы.
Фото 10. Диктиосомы и рибосомы в щстс табака (Nicotiana lubucum). А. Дик
тносома (в разрезе) с продырявленной дистальной стороной, обращенной к кле-
точной оболочке. /> Полприбосома, прикрепленная к поверхности ЭР. /Г Про-
травленная дистальная сторона диктиосомы в плане Некоторые пз отделяю-
щихся п\ шрьков несут окаймления Справа цистерна ЭР, покрытая полирибо-
сомамн (вид с поверхности). / шктиосома; 2- плазмалемма; 3 тонопласт;
/ окаймленный п\ *ырск
Фото II. Эндоплазматический ретикулум (ЭР) в клетках листа табака (Nicotia
па (abacum; /1) п сахарной свеклы (Beta vulgaris; Б). Л. Видно, что ЭР связан
с многочисленными рибосомами (гранулярный ЭР). Б. ЭР. на котором находится
меньшее число рибосом, соединен с электроноплотны.ми стержнями (десмотрубоч
ками) плазмодесм (видны только частично) Канал плазмодесм выстлан плазма-
леммой. Обратите внимание на то, что тонопласт и плазмалемма состоят из
трех слоев / эндоплазматический ретикулум; 2 ядерная оболочка; .7 ядро;
I -тонопласт; 5 плазмалемма; 6 плазмодесма; 7 клеточная оболочка.
Фото 12. Микротрубочки из клеток листа Mimosa pudica (А) и Nico Напа tabu
сит (Б) на продольном (Я) и поперечном (Б) разрезах. /— микротрубочки;
2— илазмалсмма; 3— клеточная оболочка.
Фото 13. Электронная микрофотография первичной оболочки паренхимной клет-
ки колеоптиля Агешс Продольная ось клетки совпадает с направлением мас-
штабной линейки. 11араллельно ориентированные микрофпбриллы находятся в
одном из углов клетки, в других местах микрофпбриллы обнаруживают менее
четкую ориентацию. Плазмодссмснные отверстия сгруппированы в овальном уча
стке, представляющем собой примордиальную пору. (Bohiner, Untersiicliungeii
fiber das Wachstum und den I'einbau der Zellwande in der Avena Koleoptile. Plan-
la, 50. 461—197, 1958.) I отверстие, через которое проходит плазмодесма.
Фото I I. Склереида первичной коры корня пихты Abies в обычном (/1) и поляризованном (/>) свете. Вследствие кристал-
лической природы целлюлозы клеточная оболочка обнаруживает двойное лучепреломление и выглядит блестящей в поля-
ризованном свете. Оболочка имеет концентрическую слоистость.
Фото 15. Участки клеток флоэмной ткани черешка Nelumbo nucifera Срединная
пластинка лучше всего заметна в углах клеток, в остальных местах она слабо
различима. В утолщенной зоне оболочки видны фрагменты плазмодесмы. В си-
товидном элементе находится пластида / пластида: 2 крахмал; .7 плазмо
дссма; Г первичные оболочки; 5 срединная пластинка.
Фото 1G. Тонкостенный тин паренхимы с клетками правильной формы и схизо-
гениыми межклетниками из черешка сельдерея (Apium). 1 оболочка (вид с
поверхности): 2 межклетники.
Фото 17. Первичные поровые поля и илазмодесмы в оболочках паренхимных кле-
ток черешка Mimosa pudiea. Плазмодесмы видны на продольных срезах (Л п Н)
н на поперечном (Ь). Слева на фото Ь видно, что срез лишь слетка коснулся
оболочки и прошел через группу микротрубочек На фото /> и Н различимы дес
мотругочки. / замыкающая пленка поры; 2 плазмодссма; 3 микротрубоч-
ка; •/ плазмодесмы; 5 —срединные полости; 6 срединная пластинка.
Фото 18. Окаймленные поры в трахеидах ранней древесины Pinus virginiana (Л)
и Pinus pungens (Б). В верхних двух порах (.4) видно окаймление с его апер-
турой. В нижней поре на фото /1 и в норе на фото Б окаймление удалено и за-
мыкающая пленка поры обнажена. Сплошной торус составляет контраст с сетью
фибрилл краевой зоны. (Фото предоставлено W. A. Cote, Jr.) 1—окаймление:
2 — апертура; 3 — маргинальная зона; 4 — торус.
Фото 19. Ранняя стадия образования оболочки (цитокинеза) после завершения
митоза (ранняя телофаза) в клетке мезофилла Nicotiana tabacum. Слой пу-
зырьков в экваториальной плоскости между двумя наборами дочерних хромосом
образует еще ^сформировавшуюся клеточную пластинку. При дальнейшем росте
она пересечет цитоплазму между вакуолями и достигнет материнской оболочки.
/ хлоропласт; 2 хромосомы; 3 клеточная оболочка; -/ вакуоль; 5—кле-
точная пластинка.
Фото 20. Детали ранней стадии цитокинеза в клетке мезофилла Nicoliana taba-
сит. Клеточная пластинка все еще состоит из отдельных пузырьков. Микротру-
бочки фрагмопласта встречаются но обе стороны от клеточной пластинки, а не-
которые из них пересекают ее. Показана также часть хромосомного материала
одного из двух будущих дочерних ядер. / хромосома; 2 микротрубочки; 3 -
клеточная пластинка.
Фото 21. Завершение цитокинеза в клетках мезофилла сахарной свеклы (Belo,
vulgaris). .4. Пузырьки клеточной пластинки слились в группы, оставив в ней
крупные перерывы. Пластинка еще не достигла оболочки материнской клетки
(справа), в которой сформировался выступ, направленный навстречу продвигаю-
щейся клеточной пластинке. В зоне перерывов можно различить несколько мик-
ротрубочек. Рядом с пластинкой находится диктиосома с недавно образовавши-
мися из нее пузырьками. Б. Формирование клеточной пластинки закончено. Остав-
шиеся в ней перерывы являются потенциальными плазмодесменными канальцами.
Вакуоли содержат цитоплазматический материал, что свидетельствует об авто-
фагии. /—клеточная оболочка; 2 диктиосома; 3— клеточная пластинка; 7—
микротрубочка; 5 вакуоль.
Фото 22. Поперечный срез паренхимной клетки (передаточной клетки) из пер-
вичной ксилемы стебля Phaseolus vulgaris с внутренними выростами оболочки
Выросты оболочки образуются только в тех стенках, к которым прилегают со
суды. (Негатив фото предоставлен .1. Cronshaw.) / — паренхимная клетка; 2
-япоплазма! ический ретикулум; 3 днктносома; / хлоропласт; 5 вакуоль;
6' я ipo; 7 митохондрия. <S внутренний вырост оболочки; .9 сосуд.
Фото 23. Уголковая колленхима черешка Rumex на поперечном срезе. (Препарат
предоставлен Е. М. Engleman.) / — эпидерма; 2 колленхима; 3 — паренхима;
/ полость клетки; 5—срединная пластинка.
0,1 мкм
Фото 21 Колленхимная ткань на поперечных срезах. А. Черешок сельдерея кор
нового (Apium graveolens). Колленхима уголкового типа. Б. Стебель Ambrosia.
Колленхима рыхлого типа с межклетниками и прилегающими к ним утолщения
ми оболочек. Неравномерно утолщенные оболочки колленхимы составляют рез-
кий контраст с равномерно утолщенными оболочками склеренхимы (внизу).
В Колленхима Ambrosia с клетками, претерпевшими деления вблизи раневой по-
верхности. (Б, В — препараты N. 11 Воке.)
ОД МКМ 0,1 мкм
Фото 25 Волокна льна. /1. Волокна на поперечном срезе стебля льна (l.iiium
tisHalissimuin). />. Фрагменты изолированных волокон (Carpenter, Lency, 91 Pa-
permaking l ibers. Tech. РнЫ. 71. College of 1'orcstrv at Syracuse. 1952.) / яш
дерма; 2 первичная кора; -i флоэмные волокна.; I камбии; 5 ксилема.
Фото 26. Поперечный срез листа ячменя (Hordeum vulgare). на котором видна
однослойная эпидерма, расположенная но обеим сторонам листовой пластинки
Устьица показаны стрелками Проводящие пучки различных размеров отделены
от мезофилла обкладками с бедным содержимым (Esau. Hilgardia. 27 15 -69,
1957.) /—обкладка; 2—мезофилл; 3 ксилема; / флоэма.
Фото 27 Поперечный срез листа Ficus elastica, иллюстрирующий развитие мно-
гослойной эпидермы. .1. Многие клетки верхней эпидермы делятся периклинально
.6 Эта эпидерма имеет 3 или 1 ряда клеток в глубину. Литоцисты не телятся
Нижняя эпидерма также становится многослойной / эпидерма: 2 литоцист;
3 устьице
Фото 28. Электронные микрофотографии устьиц листа сахарной свеклы (Beta
vulgaris). /]. Bn.i с поверхности. Б. Поперечный срез. I я 1ро; 2 митохондрия;
3 хлоропласт; -/ — вакуоль; 5— устьичная щель; 6 гребень; 7 кутикула;
8— подустьичная камера.
1
Фото 29. Трахеальные элементы (Carpenter, Leney, 91 Papermaking Fibers, Tech
Publ. 74. College of Forestry at Syracuse, 1952). А. Трахеида ранней древесины
сосны Лямберта (Pinus lambertiana). Б. Увеличенный фрагмент А. Членики со-
судов тюльпанного дерева (Liriodendron tulipifera, В), бука (Fagus grandifolia,
Г), тополя волоснстоплодного (Populus trichocarpa, Д), анланта (Ailanthus altis-
sima, Е). 1 — простая перфорационная пластинка: 2 — лестничная перфорацион-
ная пластинка; 3 —лучевая паренхима; •/- лучевые трахеиды; 5 -окаймленная
пора; 6 поры, обращенные к лучам.
Фото 30. Окаймленные поры в трахеидах хвойных на радиальных (/I. />) и по-
перечных (В) срезах древесины. Л. Tsuga canadensis. Б. Pinus strobus. В. Abies
nobilis. / торус; 2 марго; 3 крассула; i — окаймление; 5 апертура; 6
полость поры.
Фото 31. Проводящий пучок стебля Meili с a go sativa на поперечном срезе. Вид
ны первичная ксилема и флоэма. Камбий cine не продуцирует вторичных тканей.
Ранние ксилема и флоэма (протоксилема и протофлоэма) уже не функционируют
как проводящие ткани. Их клетки облитерировались. Функционирующими тка-
нями являются метаксилема и метафлоэма. I крахмалоносная обкладка; 2
смятые клетки протофлоэмы: 3 ситовидный элемент; •/ камбий; 5 мета-
ксилема; б -смятые клетки протоксилемы.
Фото 32. Дифференцирующиеся трахеальные элементы в листе сахарной свеклы
{Beta vulgaris). Видно вторичное спиральное утолщение, переходящее местами
в лестничное. А. Срез через полость клетки. Б. Срез через вторичное утолщение.
/ — вакуоль; 2- вторичная оболочка: 3- митохондрия: 4- пластида: 5 — эн-
доплазматический ретикулум; 6 ядро; наконечниками стрелок отмечены диктио-
сомы.
Фото 33. Фрагменты дифференцирующихсятрахеальных элементов из листьев фасоли (Phaseolus vulgaris, /1) и сахарной
свеклы (Beta vulgaris, Б). И на поперечном (И), и на продольном (Б) срезах видна связь микротрубочек с вторичным утол-
щением оболочки. / вторичная оболочка; 2— диктносома; 3 микротрубочка; -I эндоплазматический ретикулум.
Фото 31 Фрагменты продольных срезов трахеальных элементов из листьев та
бака (Лцо/кшн (abacum, /1. Л) и флеоли (Phaseolus vulgaris, В), иллюстрирую
щпе детали структуры оболочки. Л. Стенка между двумя трахеальными элемен-
тами (в центре снимка); первичная оболочка между вторичными у'толщениямп
редуцирована до фибрилл под действием гидролаз. Б Показана перфорация
торцевой стенки, ограниченная кольцом, состоящим из вторичных утолщений со-
седних клеток В Первичная оболочка, расположенная на месте будущей пер-
форации.» еще сохранилась. Она значительно толще, чем первичная оболочка в
других местах, и ограничена кольцом, вторичного утолщения / вторичная обо-
лочка 2 первичная оболочка.
Фото 35, Электронная микрофотография половины незрелой перфорационной
пластинки из сосуда древесины K/iightia excelsa, полученная с помощью скани-
рующего микроскопа На месте перфорации еще присутствует первичная обо-
лочка. (Фотография воспроизводится из работы |25| с любезного разрешения
д-ра В Л Mcylan.) 1 вторичная оболочка но краю перфорационной пластинки;
2 место перфорации; 3 пора па боковой стенке; 3 усохший протопласт.
Фото 36. Электронная микрофотография половины зрелой перфорационной пла-
стинки из сосуда древесины Knightia excelsa, полученная с помощью сканирую-
щего микроскопа. (Фотография воспроизводится из работы [25] с любезного
разрешения д-ра В. Л. Meylan.) / вторичная оболочка; 2— поровые мембраны
в парах пор на боковой стенке; .?— первичная оболочка; •/ перфорация.
Фото 37. Три среза хревеспцы сосны (Pinus sirobus): поперечный (Л), радиаль-
ный (Б) п тангенциальный (В). 1 ранняя древесина; 2 — поздняя древесина;
7 смоляной ход; / луч; 5 вершина трахеиды; 6 луч со смоляным
ходом
Фото 38. Более подробное строение древесины хвойных. А. Радиальный срез
древесины Larix laricina-, видны части осевых трахеид с окаймленными порами и
луч, состоящий из паренхимных клеток в середине и лучевых трахеид по краям.
Клетки лучевой паренхимы заполнены темно окрашенной цитоплазмой, которая
видна через норы полей перекреста. Лучевые трахеиды имеют окаймленные по-
ры и не содержат цитоплазмы. Б. Поперечный срез древесины Pseudotsuga ta-
xifoliir, видны два смоляных хода с толстостенными эпителиальными клетками.
/—лучевая паренхима; 2— поле перекреста; 3 лучевые трахеиды; -/ окай-
мленная пора; 5—луч; 6 —смоляной ход.
Фото 39. Трл среза древесины ивы (Salix nigra): поперечный (/1), радиальный
(/3) и тангенциальный (В). Рассеяннопоровая неярусная древесина с одноряд-
ными гетероцеллюлярнымп лучами. 1—луч; 2—ранняя древесина; 3— сосуд;
7 поздняя древесина; 5— сложная пора; 6 —стоячая лучевая клетка; 7 — ле-
жачая лучевая клетка; 8— однорядный луч.
Фото 40. Три среза древесины дуба (Querius alba): поперечный (/1), радиальный
(/>) и тангенциальный (13). Кольцепоровая неярусная древесина с высокими
многоряднымп и низкими однорядными лучами. Крупные сосуды закупорены
тила.мп. / — ранняя древесина; 2 — поздняя древесина; 3— сосуд с тилами; 7—
однорядный луч: 5— многорядный луч; 6 — паренхимная клетка; 7— паренхим-
ный тяж.
0.5 мм.
Фото 41. /1. Неярусная древесина карин (Carya pecan) Б. Ярусная древесина
хурмы (Dibspyros virginiana). Тангенциальные срезы
Фото 42. Распределение осевой паренхимы (показана стрелками) на поперечных
срезах древесины. A. Liquidambar styraciflua, паренхима очень редкая. Б. Acer
saccharum, пограничная паренхима. /< Carya pecan, апотрахеальная тяжевая па-
ренхима. Г. Fraxinus sp.} паратрахеальная и пограничная паренхима.
0,5 мм
I
Фото 43. Расположение клеток на тангенциальных срезах камбия. А. Неярусный
камбий Rhus ti/phina. Б. Ярусный камбий Wisteria sp. 1 — верстеновидная пни
пиаль; 2 — лучевые инициали.
1 Л4М
Фото 44. Проводящие ткани и камбий на поперечном (Л) и радиальном (Б)
срезах стебля сосны (Pinus sp.). / — луч; 2 —флоэма; 3 — камбий; -/ — ксилема.
Фото 45. Камбий на поперечных срезах стебая винограда (Viiis vinifera). А. Ак-
тивный камбий в конце периода роста Б Камбий в начальный период реакти-
вации с новыми тангенциальными стенками и разрывами в некоторых местах
антиклинальных стенок. В. Активный камбий на более поздней стадии; разрывы
образуются в самых молодых клетках камбия, что приводит к отделению коры
от ксилемы (Esau, Hilgardia, 18, 217 296. 1948.) ! Камбий; 2 ситовидный
элемент; 3 ксилема
Фото 46. Деление и рост веретеновидных инициалей. /1. Камбий Juglans (стрел-
ками пока таны антиклинальные стенки недавно поделившихся веретеновидных
инициален). /> Камбии Cryptocurya (стрелками показаны фрагмоиласты пери-
клинально делящихся веретеновидных инициален). Б. Флоэма Liriodenclron с
двумя лучами, перерезанными осевыми клетками в результате интрузивного
роста в период, когда ткань находилась еше в камбиальной зоне. (На всех трех
снимках показаны тангенциальные срезы )
Фото 47. А. Простые ситовидные пластинки Cucurbita, вид с поверхности. Б,
Б. Латеральные ситовидные поля ситовидных элементов и первичные поровые
поля паренхимных клеток Cucurbita, вид с поверхности. /'. Сложная ситовидная
пластинка Purus с множеством ситовидных полей (масштабные линии соответ-
ствуют 0.1 мм на А и Б, 50 мкм на Б и Г. Esau. Cheadle, Gifford, Amer. .1. Bot.,
40, 9 19, 1953). / паренхимная клетка: 2— ситовидная пластинка; 3 сито-
видное поле; 7 -латеральные ситовидные поля; 5- первичное поровое поле;
6 паренхимные клетки.
Фото 48. Участок протопласта в незрелом ситовидном элементе из кончика кор-
ня фасоли Phaseolus vulgaris, показывающий пластиду (/) с крахмалом (2).
расположенный рядом с ядром (<7) агрегированный (уложенный в виде стопки)
эндоплазматический ретикулум (5), небольшой участок диктиосомы (•/) с пу-
зырьками и множество рибосом (6). Стопка цистерн ЭР соприкасается с ядер-
ной оболочкой (7), которая сходна с цистернами ЭР; 8- клеточная оболочка.
Фото 49. Ф-белковые тельца в протофлоэме из кончика корня фасоли Phaseolus vulgaris на поперечном (Л) и продольном
(5) срезах, состоящие из трубчатых филаментов. На снимке Л видно паракристаллическое расположение трубочек.
Фото 50. Ф-бслок в ситовидных элементах табака Nicotiana tabacum (А) и Л’е-
lumbo nuctfera (Б). А. В негативно окрашенном флоэмном экссудате выявляется
двуспиральпая структура Ф-белкового филамента (снимок сделан при большом
увеличении) !7}. Б Ф-белок. заполняющий отверстие ситовидной пластинки,
обнаруживает горизонтальную исчерченность вытянутых филаментов / калло-
за, выстилающая отверстие ситовидной пластинки; 2 плазмалемма.
Фото 51. Пластиды ситовидных элементов Tetragonia expansa (А) и сахарной
свеклы (Beta vulgaris-, Б). А, Б Продольный и поперечный срезы кольца фиб-
риллярного белка. Б. Фрагменты двух ситовидных элементов из флоэмы листа
Nicotiana tabacum с расположенной между ними полностью сформированной си-
товидной пластинкой (•/). В отверстиях содержится небольшое количество Ф-бел-
ка. Клетка-спутник (5) имеет плотную цитоплазму и несколько митохондрий
(6). Ситовидный элемент, с которым непосредственно связана клетка-спутник
на снимке не виден Г Ситовидная пластинка из флоэмы листа Nicotiana taba-
си/п с тремя формирующимися отверстиями, каждое из которых имеет пару
каллозных подушек (светлый тон). Плазмалемма (А‘) покрывает оболочку, вклю-
чая и те места, где находится каллоза. Цистерны эндоплазматического ретику-
лума (7) располагаются вдоль плазмалеммы Справа видно, что эндоплазмати-
ческий ретикулум проникает в плазмодесмы (9) и соединяется с десмотрубочка-
ми, которые не показаны. Вдоль срединной пластинки располагаются срединные
полости (10). Масштабные линии соответствуют 0.5 мкм на А и Б и 1 мкм на
Б. и /'. / — пластида; 2 каллоза; 3— отверстие ситовидной пластинки.
Фото 52. Я. Два ситовидных элемента (/). каждый из которых имеет клетку-
спутник (2), в окружении клеток флоэмной паренхимы (поперечный срез жилки
листа Nicotiaria tabacum). Б. Фрагмент оболочки между ситовидным элементом
(/) и клеткой-спутником (2) с ветвящимися плазмодесмамп (поперечный срез
жилки листа Mimosa piidicu).
Фото 53. Поперечные срезы через проводящие пучки овса Avena saliva (две раз-
личные стадии дифференциации). А. Первые элементы протофлоэмы и протокси-
лемы достигли зрелости. (Esau, Amer. J. Bot., 44, 245 251. 1957.) Б. Появились
зрелые метафлоэма и метаксилема; протофлоэма сдавлена; на месте протокси-
лсмы образовалась лакуна. (Esau. Ililgardia, 27, 15 -69. 1957.) / -ситовидный
элемент протофлоэмы; 2 сдавленная протофлоэма; 3 ситовидный элемент ме-
тафлоэмы; 1 элемент протоксилемы; 5- сосуд метаксилемы; 6—лакуна про-
токсилемы.
Фото 54. Флоэма листа фасоли Phaseoltis zmlguris. ,-1. Продольный срез, на ко-
тором видна часть ситовидной трубки с двумя полными и двумя неполными
члениками В трех члениках видны веретсновпдные Ф белковые тельца. />. По-
перечный срез, на котором видны уже нефункиионирукмцая протофлоэма с во-
локнами, метафлоэма и небольшое количество вторичной флоэмы. (Масштаб-
ные линии соответствуют 50 мкм.) / крахмалоносная обкладка: 2 прото-
флоэмные волокна; <> таннинсодержашая клетка; •/ сдавленные клетки флоэ-
мы; 5 метафлоэма; 6 вторичная флоэма; 7 ситовидный элемент; А’ луч;
9 клетка-спутник.
Фото об. Гри среза вторичной флоэмы хвойного растения Thuja occidentalis (туя
западная) Ситовидные клетки, клетки флоэмной паренхимы и волокна, распо-
ложенные тангенциальными рядами, чередуются друг с другом. /1. Поперечный
срез. Б. Радиальный срез. Б. Тангенциальный срез. / камбии; 2 — ксилема;
.? паренхимная клетка; 7 ситовидная клетка; 5— волокно; 6 — луч; 7 —
паренхимный тяж
Фото 56. Поперечный срез вторичной флоэмы Pinus. Видно, что функционирую-
щей флоэмы значительно меньше, чем нефункционирующсй (последняя представ
лена на снимке не полностью), в которой все ситовидные клетки сдавлены и
только клетки осевой (темноокрашенные) и лучевой паренхимы сохраняются
интактными. / паренхимная клетка; 2 луч; 3— сдавленные ситовидные клет-
ки; / каллоза; 5 ситовидная клетка; 6 функпионирующая флоэма; 7
камбий; <S' ксилема.
Фото 57. Три среза вторичной флоэмы Fraxinus americiiiui (ясень американский).
1. Поперечный срез Б. Радиальный срез. В. Таш спинальный срез. I функцио-
нирующая флоэма: 2 волокна; 3 камбий; 7 луч; .5 паренхимная клетка;
6 ситовидный элемент; 7 ситовидная трубка; Л' паренхимный тяж.
Фото 58. Поперечные срезы вторичной флоэмы двудольных. A. Tilia, волокна
собраны в виде параллельных тангенциальных полос. Б. Ostrya, волокна собра-
ны в группы и полосы. Б Campsis, волокна рассеяны поодиночке. Г. Liriotlen-
dron, видны ситовидные элементы с перламутровыми утолщениями. (На фото
/1—Б масштабные линии соответствуют 0.5 мм, на фото Г—100 мкм.) / -во-
локна; 2 дилатирующий луч; 3— иедилатируюший луч; 4 камбий; 5 луч
6 - ситовидные элементы
Фото 59. Перидерма корня сладкого картофеля (Ipomoea balatas). А. Естествен
нам перидерма. Б, Н Края разрыва в конце периода заживления раны: после
пребывания в штабеле на поле края разрыва покрыты отмершими клетками
(Б); после пребывания в теплице под отмершими поверхностными клетками об-
разовалась раневая нерп герма, которая соединилась с естественной перидермой
(Б: справа) [15]. 1 феллема; 2 феллоген; 3 феллодерма; / мертвые по-
верхностные клетки; 5- естественная перидерма: 6 раневая перидерма.
Фото 60. Разнообразие структуры феллемы в стеблях. А. Б. У феллемы Rhus
typhina на поперечном (/1) и радиальном (Б} срезах видны слои прироста, вы-
являемые но чередованию узких и широких клеток В. Феллема березы Betula
populifolia с толстыми клеточными оболочками и хороню выраженными слоями
прироста (радиальный срез). Г. Гетерогенная феллема Rhododendron maximum,
состоящая и: клеток различного размера; некоторые слои, содержащие мелкие
клетки, состоят из склереид (радиальный срез) Д. Е. Феллема I 'actinium согут
bosum на радиальном (Д. слегка окрашенные клетки в центре) и тангенциаль
ном (Д) срезах. Форма ее клеток варьирует (Л). (Длина масштабных линий на
фото А и Б соответствует 0,5 мм, на фото В / 0.1 мм.)
Фото 61. Нолидерма корня земляники (/ragaria) на поперечных срезах Л. Ко-
рень на ранней стадии вторичного роста Феллоген уже заложи.ня. однако пер-
вичная кора еще не начала разрушаться 6 Болес старый корень Феллоген об-
разовал широкий слой полпдермы. Клетки. Ьбразующие те.мноокрашенные по-
лоски в полпдерме. субсрнпнзирован!.: Эти клетки чередуются с несуберинизи
рованными. причем и тс и другие представляют собой живые клетки. Неживые
субериннзированные клетки образуют наружное покрытие Первичная кора от-
сутствует [18]. / первичная кора: 2 полидерма; 3 эндодерма; 7 фелло-
ген: 5 камбий: 6 ксилема.
4
i
Фото 62. Возникновение перидермы \ винограда Vitis vbiifera (поперечные сре-
зы) Л. Стебель проростка, лишенный перидермы. В. Стебель более взрослого
проростка с Перидермой, заложившейся в первичной флоэме и вызвавшей отми
ранне и разрушение первичной коры. Снаружи от перидермы видны также пер-
вичные флоэмные волокна. В. Однолетняя лоза с перидермой снаружи от вто-
ричной флоэмы. (Длина масштабных линий на фото Л и /> соответствует 0,5 мм,
на фото В 1 мм: Esau. Hilgardia, 18, 217 296. 1948.) /— первичные флоэмные
волокна; 2— эпидерма и первичная кора; Л — перидерма; 7— вторичная флоэма
и перидерма; 5 луч; 6 вторичная ксилема.
Фото 63. Перидерма и ритидом на поперечных срезах стеблей. Л. Феллема с
глубокими трещинами у 7'alautna. Б. Ритидом с узкими слоями перидермы и ши-
рокими слоями отмершей флоэмной ткани у дуба Quercus alba. В. Ритидом
Lonicera tartarica из слоев перидермы, чередующихся со слоями, которые возник-
ли из вторичной флоэмы, содержащей флоэмные волокна. (Длина масштабных
линий соответствует 0,5 мм.) 1 феллема; 2— первичная кора; 3 — волокна и
склереиды; I — флоэма; 5- последующие слои перидермы; 6 мертвая флоэма;
7—ритидом; <S’ — флоэмные волокна; 9— ксилема.
Фото 64. Ритидо.м на поперечном срезе II-летнего стебля Cephalanthus occiden
tells (Rubiaccac). А. Внутренняя часть коры с функционирующей флоэмой п тре-
мя слоями перидермы Б. Наружная часть ритидома с шестью слоями перидер-
мы, чередующимися со слоями непроводящей вторичной флоэмы Общая шири-
на ритидома составляет 4,5 мм. (Esau, The formation of wood in forest trees,
AE II. Zimmermann cd.. Academic Press, New York, p. 14. 1964.) / перидерма;
2 ксилема.
Фото 65. Ярусная пробка Cordytiiie lermiiialis на поперечном срезе. (Фотография
любезно предоставлена V. I. Cheadle.) / производные одной клетки.
Фото 66. Чечевички на поперечных срезах стеблей. Молодая (/1) и старая (/>)
чечевички авокадо Persea americutui. Закрывающие слои отсутствуют. 8. Чече-
вичка с закрывающими слоями у бука Pagus grandifoiia. (Длина масштабных
линий соответствует 0,1 мм ) / — эпидерма; 2- феллоген; 3 выполняющая
ткань: I закрывающие слои.
I
0,1 лиц
I
Фото 67. Гидатода листа капусты На срезе показан тяж из трахеид, оканчиваю-
щийся в ткани из мелких клеток — эпитеме. Гуттационная вода проходит по
межклетникам эпитемы и выделяется через устьица. (Esau. Plant Anatomy, 2nd
ed., John Wiley & Sons, 1965. Имеется перевод: Эсау К. Анатомия растений.—
М.: Мир, 1969.) J — трахеиды; 2 -эпитема; 3— устьица.
\<
Фото 69. Членистые млечники Luctuca scariola с анастомозами Д. Поперечный
срез стебля. Млечники располагаются снаружи от флоэмы. Б Вид млечников на
продольном срезе частично мацерированной ткани стебля. / крахмалоносное
влагалище: 2 флоэма; 3 млечники. (Длина масштабных линий соответствует
0.1 мм )
Фото 68. Различные внутренние секреторные структуры Д. Масляные клетки на
тангенциальном срезе флоэмного луча тюльпанного дерева (Liriodendron). Б
Идиобласт, содержащий слизь и рафиды, на радиальном срезе флоэмы Hydran-
gea paniculata. В. Лизигенная масляная полость в листе лимона (Citrus; справа
вверху). Г. Увеличенная эпидермальная клетка каучуконосного растения Ficus
elast ica содержит цистолит осадок карбоната кальция на ножке из целлюлозы.
Клетка является частью многослойной эпидермы листа (все клетки над мезофил-
лом). Срез цистолита медианный, и поэтому основания ножки не видно. Д Тан-
чиповые мешки в сердцевине стебля бузины (Sarnhui us) на поперечном срезе.
/:'. Схизогенные секреторные каналы на поперечном срезе нефункционнруюшей
флоэмы Rhus typhina. (Длина масштабных линий соответствует 0.1 мм.) / ме-
юфилл.
Фото 70. Нечлснистыс ветвящиеся млечники Euphorbia sp. /1. Зародыш: квадра-
том обозначено место возникновения млечников Б. Разрез млечников, показыва-
ющий их многоядерное состояние. 13. Млечники, ветвящиеся в губчатой парен-
химе. на парадермальном срезе листа. [Препараты /I и /5 любезно предоставле-
ны К. С. Baker. Длина масштабных линий на фото /1 соответствует 0.5 мм и на
фото /> и /> 0.1 мм | / семядоля; 2 апикальная меристема; .? млечники;
/ межклетники.
ОГЛАВЛЕНИЕ
Предисловие редактора перевода 5
Предисловие 7
Благодарности 8
Предисловие к первому изданию 9
Благодарности 11
Глава 1. Введение 13
Внутренняя организация тела растения 14
Краткая характеристика типов клеток и тканей 16
Список литературы 19
Глава 2. Развитие семенного растения 21
Зародыш 21
От зародыша к взрослому растению 23
Апикальные меристемы и их производные 25
Дифференциация, специализация и морфогенез 27
Список литературы 32
Глава 3. Клетка 33
Цитоплазма 37
Ядро 38
Пластиды 40
Митохондрии 43
Микротельца 43
Вакуоли 44
Парамуральные тельца 45
Рибосомы 46
Диктиосомы 46
Эндоплазматический ретикулум 48
Липидные глобулы 49
Микротрубочки 49
Эргастические вещества А 50
Крахмал 50
Таннины 52
Белки 52
Жиры, масла и воска 53
Кристаллы 54
Список литературы 54
Глава 4. Клеточная оболочка 58
Макромолекулярные компоненты и их организация в оболочке 58
Слоистость клеточной оболочки 61
Межклетники 62
Поры, первичные поровые поля и плазмодесмы 63
Определения и структура 63
Типы пор 65
Образование клеточной оболочки во время деления клетки 67
Рост клеточной оболочки 69
Список литературы 70
Глава 5. Паренхима и колленхима 72
Паренхима 72
Содержимое клеток 72
Форма и расположение клеток 73
Клеточная оболочка 77
Колленхима 77
Клеточная оболочка 77
Расположение колленхимы в растении 79
Связь структуры с функцией 79
Список литературы 80
Глава 6. Склеренхима 82
Склереиды 82
Распределение склереид в растении 84
Волокна 86
Технические волокна 87
Развитие склереид и волокон 88
Список литературы 93
Глава 7. Эпидерма 96
Состав 97
Развитие 98
Оболочка клетки 100
Устьица 102
Встречаемость и функции 102
Развитие устьичных комплексов и их зрелая структура 106
Трихомы 111
Список литературы 113
Глава 8. Ксилема: общая структура и типы клеток 115
Общая структура вторичной ксилемы 115
Осевая и лучевая системы 115
Слои прироста 117
Заболонь и ядро 117
Типы клеток вторичной ксилемы 118
Трахеальные элементы 118
Волокна 122
Филогенетическая специализация трахеальных элементов и волокон 123
Паренхимные клетки 125
Первичная ксилема 127
Протоксилема и метаксилема 127
Клеточная оболочка первичных трахеальных элементов 129
Дифференциация трахеальных элементов Список литературы 131 134
Глава 9. Ксилема: вариации структуры древесины Древесина хвойных Древесина двудольных Ярусная и неярусная древесины Распределение сосудов Распределение осевой паренхимы Структура лучей Тилы Межклеточные каналы и полости Факторы, контролирующие развитие вторичной ксилемы Реактивная древесина Определение древесин Признаки, используемые при определении древесин Список литературы 136 136 139 139 139 141 142 144 145 146 148 149 150 154
Глава 10. Камбий Структура камбия Изменения в инициальном слое в процессе развития Камбиальная активность; закономерности и причинные связи Список литературы 156 156 158 163 165
Глава 11. Флоэма Типы клеток Ситовидные элементы Клетки-спутники Паренхимные клетки Склеренхимные клерки Первичная флоэма Вторичная флоэма Флоэма хвойных Флоэма двудольных Список литературы 167 167 167 178 180 180 181 182 182 184 186
Глава 12. Перидерма Структура перидермы и связанных с нею тканей Полидерма Ритидом Развитие перидермы Защитная ткань у однодольных Раневая перидерма Внешние особенности коры в зависимости от ее структуры Чечевички Список литературы 188 189 190 190 191 194 194 195 196 198
Глава 13. Секреторные структуры 200
Наружные секреторные структуры 202
Трихомы и железки 202
Нектарники 205
Гидатоды 208
Внутренние секреторные структуры 209
Секреторные клетки 209
Секреторные полости и каналы 210
Млечники 212
Список литературы 214