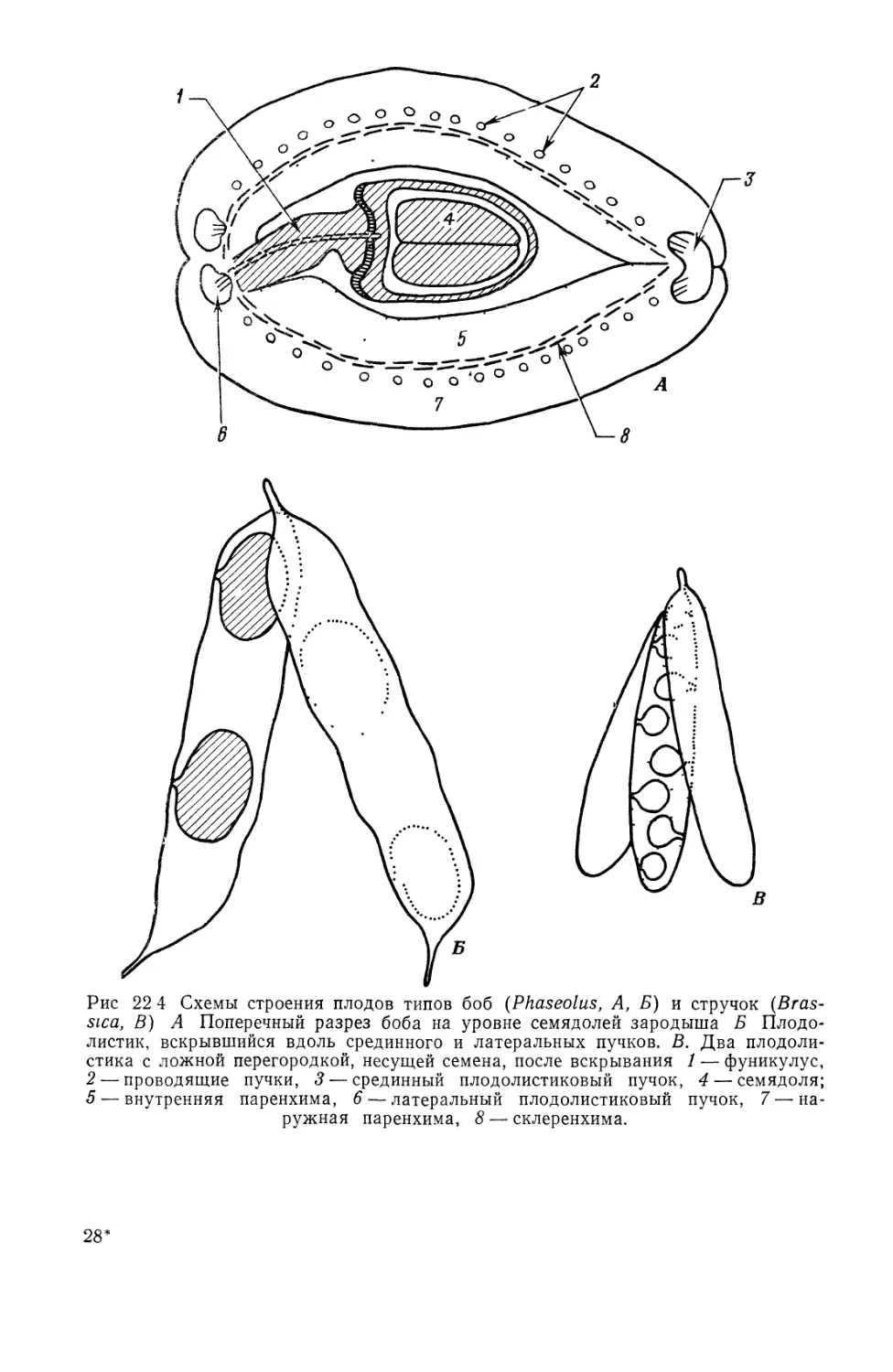
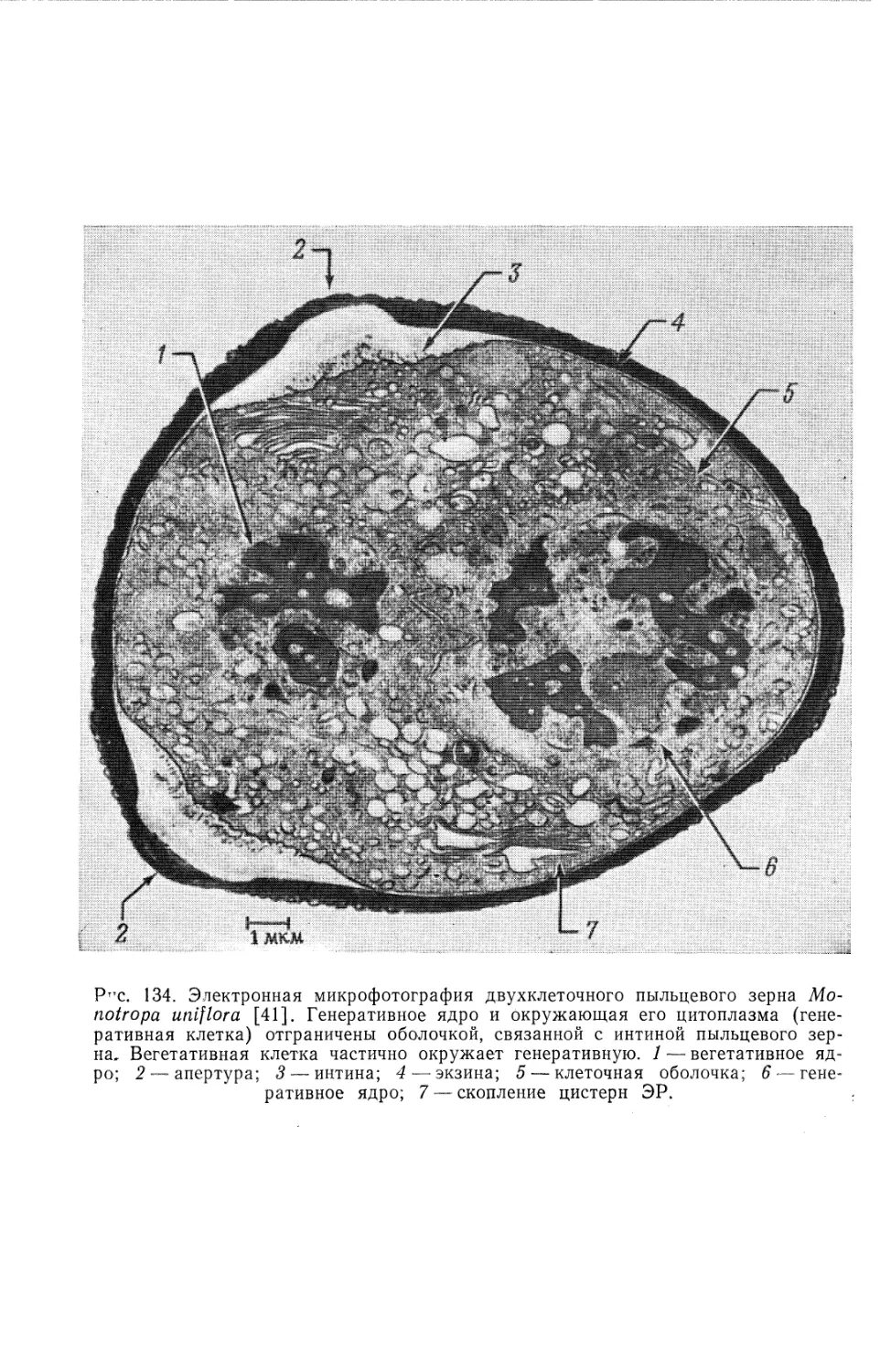
Text
Anatomy of Seed Plants
2nd Edition
Katherine Esau
Professor of Botany, Emeritus
University of California
Santa Barbara, California
John Wiley and Sons
<ew York/Santa Barbara/London/Sydney/Toronto
Анатомия
семенных
растений
Книга 2
Перевод с английского
д-ра биол. наук А. Е. ВАСИЛЬЕВА,
д-ра биол. наук Ю. В. ГАМАЛЕЯ,
д-ра биол. наук М. Ф. ДАНИЛОВОЙ
под редакцией
акад. А. Л. ТАХТАДЖЯНА
Издательство «Мир»
Москва 1980
УДК 581.4
Одна из лучших в мировой литературе монографий по анато-
мии растений. Автор ее — глава анатомов Калифорнийского универ-
ситета Кэтрин Эзау, уже известная советскому читателю по книге
«Анатомия растений» (М.: Мир, 1969), сумела отобрать и обоб-
щить новейшие данные об анатомическом строении растений.
Русское издание выходит в двух книгах. Вторая книга посвя-
щена вегетативным и репродуктивным органам растения; строению
зародыша, проростка, плода и семени.
Книга представляет большой интерес для студентов, аспирантов
и научных работников ботанических и агрономических специаль-
ностей.
Редакция литературы по биологии
2605040000
21006—130 *
Э 041 (01)—80 130~~80
© 1977 by John Wiley and Sons, Inc.
All Rights Reserved. Authorised transla-
tion from English language edition pub-
lished by John Wiley and Sons, Inc.
© Перевод на русский язык, «Мир», 1980
Глава 14
Корень: первичная форма роста
Типы корней
Первый корень семенного растения развивается из апикальной
меристемы на корневом полюсе зародыша. Этот корень называ-
ется стержневым, или первичным. У голосеменных и двудольных
стержневой корень и формируемые им боковые корни составляют
стержневую корневую систему (гл. 2). У однодольных первичный
корень живет обычно относительно короткое время, и корневая
система формируется придаточными корнями, возникающими на
побеге, часто в связи с пазушными почками. Хотя эти корни раз-
ветвляются, они образуют довольно однородную систему, назы-
ваемую мочковатой корневой системой. Стержневая корневая сис-
тема в общем проникает в почву более глубоко, чем мочковатая,
но последняя более прочно закрепляется в поверхностных слоях
почвы. Главный корень и его боковые ответвления претерпевают
вторичный рост, но мелкие абсорбирующие корни остаются в пер-
вичном состоянии и часто эфемерны. Придаточные корни одно-
дольных, как правило, способны к вторичному росту, но могут и
не обладать этой способностью.
Стержневая и мочковатая корневые системы у семенных рас-
тений наиболее обычны. Они выполняют функции закрепления
растения в почве, поглощения, накопления и проведения веществ.
Некоторые корни или их части специализируются для выполнения
какой-либо одной функции. Мясистая часть корня моркови (Dau-
cus), редиса (Raphanus), свеклы (Beta), батата (Ipomoea), ямса
(Dioscorea) и других растений специализирована как запасающий
орган. Мясистый запасающий корень часто связан с таким же мя-
систым гипокотилем и может иметь аномальную форму вторично-
го роста (гл. 15).
Тропические болотные растения (мангры) имеют большие воз-
душные опорные корни, несколько напоминающие ходули. Для
этих растений характерны также дыхательные корни (пневмато-
форы), которые растут вверх и поднимаются над поверхностью
ила. Некоторые лианы и эпифиты имеют воздушные корни, спо-
собные прикрепляться к поверхности, на которой могут расти по-
беги.
В паразитических ассоциациях высших растений корни пара-
зитов имеют гаустории; вследствие этого устанавливается связь,
обеспечивающая поступление питательных веществ от хозяина к
паразиту. При изучении способа питания полупаразита Odonites,
230
Глава 14
паразитирующего на корнях ячменя и Stellaria media, было обна-
ружено, что гаустории связаны с ксилемой, а использование ра-
диоактивных изотопов показало, что растворенные вещества дви-
жутся по этому транспортному пути непосредственно к паразиту
[25].
Контрактильные корни
Закреплению растения в почве с помощью корней может спо-
собствовать процесс сокращения корней, благодаря которому по-
беги притягиваются к земле, или — у луковичных растений (фо-
то 71)1 — глубже погружаются в почву. Сокращение корней ши-
роко распространено среди однодольных и травянистых многолет-
них двудольных растений. Оно обычно наблюдается у отдельных
корней и связано с их определенными частями (фото 71). Укоро-
чение корней зависит главным образом от изменения формы внут-
ренних клеток первичной коры, которые на определенной стадии
развития растягиваются в радиальном направлении и укорачи-
ваются— в продольном [53]. Для видов Hyacinthus было пока-
зано, что изменение формы клеток является результатом процесса
роста, поскольку при этом увеличивается как поверхность ради-
альной продольной стенки, так и ее толщина. В клеточной стенке
обнаружены также изменения угла спиральной исчерченности и
облитерация поровых полей [77]. Ткани корня, не участвующие
в этом росте, т. е. ткани центрального цилиндра и периферические
ткани первичной коры, скручиваются и сморщиваются.
Микориза
Физиологическая активность корня, связанная со снабжением
растения водой и питательными веществами, может быть усилена
путем его симбиотической ассоциации со специфическим грибом.
Такая ассоциация называется микоризой. Гриб внедряется в пер-
вичную кору, но клетки корня не обнаруживают при этом никаких
патологических симптомов и сохраняют свои характерные осо-
бенности.
Микоризы классифицируются в соответствии с взаимоотноше-
ниями гриба и клеток первичной коры корня хозяина. Различают
два их главных типа: 1) эктомикоризы, в которых гриб покрывает
весь кончик корня плотным чехлом, называемым гифальной ман-
тией, и проникает в межклетники, и 2) эндомикоризы, в которых
гриб не образует заметной мантии, но внедряется внутрь клеток.
1 Все фотографии помещены в конце книги. — Прим. ред.
Корень: первичная форма роста 231
Тип микоризного гриба, с которым связывается растение-хозяин,
определяется специфическими особенностями последнего.
Эктомикоризные корни короткие, разветвленные и выглядят
разбухшими. У таких корней развитие корневых волосков подав-
лено и объем апикальной меристемы и корневого чехлика может
быть уменьшен [14]. Эндомикоризные корни по форме сходны с
неинфицированными корнями, но отличаются от них более темной
окраской.
В естественных условиях обитания микоризные ассоциации
скорее являются правилом, чем исключением [27]. Главная роль
микоризных грибов, по-видимому, заключается в переводе мине-
ральных веществ почвы и разложившихся органических остатков
в форму, доступную для их использования хозяином. Растение-
хозяин, вероятно, секретирует сахара, аминокислоты и другие ор-
ганические вещества, делая их доступными для гриба. В экспе-
риментальной работе на сое было показано, что микоризная ин-
фекция усиливает рост растения-хозяина и способствует умень-
шению сопротивления транспорту воды в корне [60].
Корневые клубеньки
Корни могут образовывать ассоциации с бактериями (напри-
мер, с азотфиксирующими бактериями видов Rhizobium), что
представляет определенную выгоду для растения. Такие ассоциа-
ции приводят к развитию корневых клубеньков, особенно харак-
терному для сем. Fabaceae [6]. Бактерии проникают в корень
главным образом через корневые волоски и, размножаясь, обра-
зуют инфекционную нить, заключенную в футляр из камедеобраз-
ного материала. Нить проникает глубоко в корень и вызывает
пролиферацию внутренних клеток первичной коры. Возникающий
в результате пролиферации примордий, чрезвычайно сходный с
примордием бокового корня, становится клубеньком. Некоторые
авторы предполагают, что клубеньки представляют собой видоиз-
мененные боковые корни, но данные о развитии клубеньков не
подтверждают эту точку зрения [39]. Самая наружная абакси-
альная часть клубенька в течение длительного времени остается
меристематической зоной, а бактерии размещаются в его внут-
ренней части. Бактериальная ткань окружена разветвляющимися
проводящими пучками, которые связаны с центральным цилин-
дром корня. Каждый пучок имеет паренхимное влагалище и эн-
додерму. У некоторых видов растений в клетках влагалища раз-
виваются протуберанцы клеточных оболочек, характерные для
клеток, осуществляющих передачу веществ от одной клетки к
другой (передаточные клетки). Эта особенность указывает на
существование системы транспорта для обмена питательными ве-
ществами между бактериями и растением-хозяином [45].
232
Глава 14
Первичная структура
Внутреннее строение корня разнообразно, но в целом проще и
филогенетически более примитивно, чем строение стебля. Корень
представляет собой осевое образование, лишенное листоподобных
органов и не расчлененное на узлы и междоузлия. В соответствии
с этим расположение тканей в корне от уровня к уровню меняется
относительно мало, в то время как в стебле связь оси с листьями
находит свое отражение в различии структур узлов и междоузлий
и даже структур одного и того же междоузлия на разных уровнях.
На поперечном срезе корня в первичной стадии его роста вы-
является четкое различие между тремя обычными системами тка-
ней: эпидермой (системой покровных тканей), первичной корой
(системой основной ткани) и системой проводящих тканей (фо-
то 72). Проводящие ткани образуют сплошной цилиндр или, если
присутствует сердцевина, полый цилиндр (фото 73, А). Каждая
из перечисленных систем обладает чертами структуры, характер-
ными для корней. Корневой чехлик, который покрывает апикаль-
ную меристему корня, также является частью первичного тела.
Эпидерма
В молодых корнях эпидерма специализирована как абсорби-
рующая ткань и обычно несет корневые волоски, представляющие
собой трубчатые выросты эпидермальных клеток (рис. 14.1). Кор-
невые волоски значительно увеличивают поглощающую поверх-
ность корня. Расчеты, произведенные для корневой системы рас-
тений ржи [58], позволяют предположить, что сравнительно не-
большое число корневых волосков из общего* их числа может обес-
печить все потребности растения в воде для транспирации и роста.
Такая высокая эффективность корневых волосков имеет особенно
важное значение в тех случаях, когда доступная влага неравно-
мерно распределена в почве. Однако в поглощении принимают
участие не только корневые волоски, но и другие эпидермальные
клетки.
В абсорбирующей части корня, на клетках эпидермы, в том
числе на корневых волосках, была обнаружена тонкая кутикула.
Если эпидерма сохраняется долго, то она может претерпевать
значительную кутинизацию. Действительно, у некоторых травя-
нистых многолетников эпидерма как защитная ткань сохраняется
довольно долго, а зачастую вообще в продолжение всей жизни
корня [40]. Оболочки ее клеток утолщаются, а полости клеток
иногда заполняются интенсивно окрашенными веществами.
У воздушных корней тропических Orchidaceae и эпифитных
Агасеае, как и у некоторых наземных однодольных, эпидерма оаз-
вивается в многослойную ткань (сложная эпидерма), называемую
Корень: первичная форма роста
233
Рис. 14.1. Кончик корня Tradescantia.
А. Иллюстрация пространственных
отношений между корневым чехли-
ком и зоной корневых волосков. Б.
Корневой чехлик при большем увели-
чении. Некоторые клетки частично от-
делились от чехлика. В. Корневые
волоски на разных стадиях развития.
Клетки, формирующие корневые во-
лоски, отмечены точками. Г. Клетка
с примордием корневого волоска при
большем увеличении. (Рисунок вос-
произведен с некоторыми изменения-
ми из работы Braune, Leman, Tau-
bert, Pflanzenanatomisches Praktikum,
2nd ed., Jena, Gustav Fischer, 1971.)
веламеном. Веламен состоит из плотно сомкнутых мертвых кле-
ток, часто несущих вторичные утолщения клеточных оболочек в
форме многочисленных узких полос. Веламен рассматривается
обычно как абсорбирующая ткань, но в некоторых физиологиче-
ских исследованиях, проведенных на веламене орхидных, было
показано, что главной функцией этой ткани является механиче-
ская защита и предохранение растения от потери воды из первич-
ной коры [19].
Первичная кора
Первичная кора корня часто состоит только из паренхимных
клеток, однако если она сохраняется довольно долго, то она может
сформировать склеренхиму или превратиться в колленхиму. Для
первичной коры корня характерны межклетники (фото 72 и 73).
Первичная кора может дифференцироваться в аэренхиму, и тогда
межклетники образуют крупные полости. Такая первичная кора
присуща растениям, произрастающим во влажных условиях (на-
пример, рису), но встречается также и у видов, типичных для
сухих местообитаний. Сравнение нескольких видов однодольных
показало, что крупные воздушные полости в корнях могут возни-
кать схизогенным или лизигенным путем, а также в результате
обоих процессов, протекающих одновременно [50, 56]. Аэренхима
корней рассматривается как ткань, служащая для транспорта га-
234
Глава 14
зов, и как резервуар для кислорода, который требуется для дыха-
ния тканей, не имеющих прямого доступа к кислороду воздуха.
Некоторая часть кислорода диффундирует из корня в почву и,
очевидно, способствует улучшению неблагоприятных почвенных
условий, участвуя, например, в окислении токсических веществ
[1]. Клетки первичной коры сильно вакуолизированы. Их пластиды
обычно лишены хлорофилла, но аккумулируют различное количе-
ство крахмала. Самый внутренний слой первичной коры дифферен-
цирован как эндодерма, а один или несколько периферических
слоев образуют экзодерму (фото 72 и 73).
ЭНДОДЕРМА
В абсорбирующей зоне корня оболочки клеток эндодермы пре-
терпевают частичную суберинизацию. Суберинизированным ста-
новится участок поперечных и радиальных стенок, который пе-
ресекает эти стенки, окружая в виде полосы всю клетку [46]
(рис. 14.2). Эта полоса, называемая пояском Каспари, представ-
ляет собой не просто утолщение оболочки, но интегральную часть
первичной оболочки, так как отложение суберина распространя-
ется и на срединную пластинку. В электронно-микроскопических
исследованиях было показано, что поясок Каспари является слег-
ка утолщенной частью клеточной стенки, для которой характерно
интенсивное однородное окрашивание [7, 57]. Плазмалемма око-
Рис. 14.2. Структура эндодермы. А, Поперечный срез части корня вьюнка поле-
вого (Convolvulus arvensis), на котором видно положение эндодермы по отно-
шению к ксилеме и флоэме. Показаны поперечные стенки эндодермы, несущие в
центральной части пояски Каспари. Б. Схематическое изображение трех сосед-
них клеток эндодермы, ориентированных так же, как на рис. А. Поясок Каспари
имеется на поперечных и радиальных стенках (т. е. на всех антиклинальных
стенках), но отсутствует на тангенциальных стенках. 1 — эндодерма; 2— пери-
цикл; 3 — первичная флоэма; 4 — первичная ксилема; 5 — поясок Каспари.
Корень- первичная форма роста
235
Рис 14 3 Структура эндодермы при наблюдении в электронный микроскоп.
(Схема построена на основе электронно-микроскопических фотографий из рабо-
ты [7] ) А Гладкая плазмалемма вдоль зоны пояска Каспари и волнистая —
в других местах Б В плазмолизированных клетках плазмалемма прилегает к
пояску Каспари, но вне этой зоны она отходит от оболочек. 1 — плазмалемма;
2— поясок Каспари, 3— тонопласт, 4 — срединная пластинка; 5 — клеточная
оболочка.
ло пояска более толстая, имеет более правильные очертания, чем
в других местах клетки (рис. 14.3,Л), и плотно прилегает к обо-
лочке. В плазмолизированных клетках плазмалемма сохраняет
контакт с пояском, отделяясь от оболочки в остальных местах
(рис. 14.3,5). Прочное срастание плазмалеммы с пояском про-
исходит не с помощью плазмодесм, так как они в зоне пояска не
обнаружены. Возможной причиной срастания является взаимодей-
ствие между мембранными липидами или гидрофобной частью
мембранных белков и гидрофобной суберинизированной стенкой
в зоне пояска [7].
Присутствие суберинизированного пояска Каспари, прочно свя-
занного с плазмалеммой, существенно сказывается на передвиже-
нии раствора солей между первичной корой и центральным ци-
линдром. В одном из исследований [68] несколько видов расте-
ний, выращенных в водной культуре, были обработаны в воде хе-
латом свинца, а затем помещены в атмосферу сероводорода, что
вызвало отложение сульфида свинца на всем пути транспираци-
онного тока. Распределение преципитата показало, что в транс-
пирирующих растениях растворенное вещество передвигается че-
рез первичную кору по клеточным оболочкам (так называемый
236
Глава 14
«апопластический путь») Однако затем апопластическое передви-
жение блокируется пояском Каспари, и растворенные вещества
^вынуждены проходить через протопласты клеток эндодермы. На-
конец, в центральном цилиндре апопластическое передвижение
восстанавливается и происходит до тех пор, пока растворенное
вещество не войдет в трахеальные клетки. Таким образом, пере-
движение растворенных веществ находится под контролем изби-
рательно проницаемых мембран протопласта в эндодерме. Эф-
фективность пояска Каспари как барьера для апопластического
передвижения веществ показана на электронно-микроскопическом
уровне на корнях кукурузы, которым в питательную среду добав-
ляли лантан [43]. Поскольку катионы лантана не проникают че-
рез клеточные мембраны, они были найдены только в клеточных
оболочках первичной коры; дальнейшее передвижение было пол-
ностью остановлено пояском Каспари.
В корнях с интенсивным вторичным ростом эндодерма зачас-
тую сбрасывается вместе с первичной корой, но в корнях, оста-
ющихся в первичном состоянии (обычно это корни однодольных),
она часто формирует толстые вторичные оболочки (фото 72 и 73).
Эти оболочки, как правило, состоят из субериновой пластинки,
покрытой слоями лигнифицированной целлюлозы (фото 74). Часто
сильнее всего утолщается внутренняя тангенциальная стенка (фо-
то 73), но утолщение может быть и равномерным для всех стенок
(фото 72). Формирование вторичной оболочки может запаздывать
в эндодермальных клетках, расположенных напротив ксилемы.
Такие тонкостенные клетки (с пояском Каспари) в толстостенной
в других местах эндодерме называются пропускными клетками
(фото 72). Эндодерма обычно однослойна, но у многих Asteraceae
некоторые молодые эндодермальные клетки делятся тангенциаль-
но и в двухслойных зонах образуются схизогенные секреторные
каналы [26]. У некоторых видов, например у груш и яблонь, слои
первичной коры снаружи от эндодермы развивают утолшения
клеточных оболочек в виде выступов, как правило, принадлежа-
щих радиальным стенкам [55].
ЭКЗОДЕРМА
Экзодерма расположена под эпидермой. Ее клетки могут
иметь пояски Каспари, но более обычно для них, по-видимому,
наличие субериновой пластинки, покрытой целлюлозной оболоч-
кой. Экзодерма состоит или из однотипных клеток, или из корот-
ких и длинных клеток. Она может включать несколько слоев кле-
ток. У Роасеае (фото 73,А), Агесасеае и Сурегасеае первичная
кора под экзодермой подвергается склерификации. Если в корнях,
которые не теряют своей первичной коры, эпидерма разрушается,
экзодерма становится самым наружным защитным слоем [41].
Корень: первичная форма роста
237
Центральный цилиндр
Центральный цилиндр (стела) включает проводящие ткани и
один или несколько слоев непроводящих клеток — перицикл.
Включение перицикла в центральный цилиндр произошло отчасти
исторически: в концепции стелы (гл. 16) перицикл определяется
как ее пограничный слой. У семенных растений, кроме того, пе-
рицикл корня берет начало в той же самой части апикальной ме-
ристемы, что и проводящие ткани. Перицикл состоит исключи-
тельно из паренхимы (фото 72, рис. 14.2,Л и фото 75,4) или
содержит склеренхиму (фото 73). Он может прерываться элемен-
тами протоксилемы (фото 78). Перицикл обычно состоит из од-
ного слоя клеток, но бывает и многослойным. В перицикле Apia-
сеае имеются схизогенные секреторные каналы [12]. Как правило,
в перицикле закладываются боковые корни, часть камбия и у
многих корней феллоген.
Ксилема часто образует сплошной массив с лучевидными вы-
ступами, которые на поперечных срезах имеют вид радиальных
рядов клеток, тянущихся в направлении к перициклу (рис. 14.4).
При этом тяжи флоэмы чередуются с лучами ксилемы. Если кси-
лема в центре корня не дифференцируется, то центральное поло-
жение в нем занимает сердцевина, состоящая из паренхимы и
склеренхимы (фото 73 и 75,4 и рис. 14.4, Г).
Число лучей ксилемы варьирует у разных видов и среди кор-
ней одного и того же растения; в соответствии с этим корни на-
зываются диархными, триархными, тетрархными и т. д., или поли-
архными (рис. 14.4). Трахеальные клетки, занимающие крайнее
Диархный - Триархный Тетрархный. Полиархный
Рис. 14.4. Различные типы расположения групп первичной ксилемы на попереч-
ных срезах корня и положение бокового корня по отношению к ксилеме и флоэме
главного корня. Типы 4—В характерны для двудольных; тип Г найден у многих
однодольных. 1 — боковой корень; 2— флоэма; 3— протоксилема; 4 — метакси-
лема.
238
Глава 14
наружное положение в каждом ксилемном ряду, — самые узкие
и заканчивают дифференциацию раньше других. Они составляют
протоксилему и имеют спиральные или лестнично-сетчатые, а иног-
да кольчатые вторичные утолщения. Ближе к центру расположены
увеличивающиеся в поперечнике метаксилемные элементы, боль-
шинство которых, особенно самые поздние, обычно имеют вторич-
ные оболочки с окаймленными порами. Ксилема с центростреми-
тельным направлением дифференциации, как это имеет место в
корнях, называется экзархной.
Первичное строение корней однодольных (они редко обладают
вторичным ростом) сильно варьирует и часто бывает довольно
сложным. У некоторых из них центральная часть занята единст-
венным сосудом метаксилемы (в незрелом состоянии показан на
фото 76,5), у других кольцо таких сосудов окружает сердцевину
(фото 73 и 78). В корне лилии радиальные цепочки метаксилемы
расположены не совсем правильно и достигают центра корня (фо-
то 72). Число протоксилемных групп в крупных корнях пальм
может быть более ста, а у некоторых однодольных тяжи флоэмы
рассеяны по всему массиву ксилемы [70].
Первые зрелые ситовидные элементы, относящиеся к прото-
флоэме, занимают периферическое положение в центральном ци-
линдре; внутрь от них дифференцируется метафлоэма. Таким об-
разом, первичной флоэме, как и ксилеме, присущ центростреми-
тельный порядок дифференциации (фото 73,5 и 76). Клетки-спут-
ники характерны для метафлоэмы, они могут отсутствовать в
протофлоэме. У злаков каждый ситовидный элемент протофлоэмы
связан с двумя клетками-спутниками, причем три клетки такого
комплекса образуют обычно на поперечном срезе постоянную сим-
метричную группу (фото 73,5 и 76,5). В корнях, характеризую-
щихся вторичным ростом, клетки, расположенные между ксилемой
и флоэмой, приобретают функцию камбия (фото 75,5). В корнях,
лишенных вторичного роста, клетки, находящиеся в том же по-
ложении, дифференцируются как паренхимные или склеренхимные
элементы (фото 72 и 73).
Корневой чехлик
Корневой чехлик (рис. 14.1) рассматривается как образование,
защищающее апикальную меристему и помогающее растущему
корню продвигаться в почве. Он состоит из живых паренхимных
клеток, происходящих из апикальной меристемы в результате де-
лений, которые приводят к появлению клеток снаружи от апекса
(рис. 14.7). Эта часть апикальной меристемы часто выглядит как
самостоятельная меристема, называемая калиптрогеном. По мере
формирования новых клеток периферические клетки корневого
чехлика слущиваются (рис. 14.1, Д, 5). Измерение продолжитель-
Корень: первичная форма роста
239
ности митотического цикла в инициалях корневого чехлика и
числа клеток в его продольных клеточных рядах позволяет уста-
новить время, проходящее от формирования клетки до ее слущи-
вания с поверхности чехлика. Эта величина для овса Avena sativa,
например, равна самое большее 5—6 суток [30]. На развитие
корневого чехлика оказывают влияние внешние условия. Когда
растения, обычно произрастающие в почве, выращиваются в вод-
ной культуре, их корни могут не формировать чехлики [54]. Вме-
сте с тем водные растения часто имеют чрезвычайно крупные кор-
невые чехлики.
Кончики корней, растущих в почве, покрыты более или менее
значительным количеством слизи [34, 38]. По-видимому, корневой
чехлик является главным источником этой слизи, хотя слизь име-
ется также на поверхности молодого корня и на уровнях, свобод-
ных от чехлика и простирающихся до зоны корневых волосков.
Хорошо известным эффектом этого слизистого покрытия является
прилипание частиц почвы к кончикам корней и корневым волос-
кам.
С помощью химического анализа, электронной микроскопии и
радиоавтографии кончиков корней, инкубированных в радиоактив-
ной глюкозе [36, 42, 44], был изучен состав слизи и способ ее
секреции. Секретируемый продукт представляет собой высокогид-
ратированный полисахарид, по-видимому пектиновое вещество.
В корневом чехлике оно секретируется наружными клетками.
Процесс секреции является функцией диктиосом, которые имеют
цистерны увеличенного размера и формируют крупные пузырьки,
содержащие секреторный продукт. Пузырьки сливаются с плаз-
малеммой вдоль наружных стенок клеток и освобождают слизь
в пространство между плазмалеммой и клеточной оболочкой. От-
сюда секрет выходит через оболочку на ее наружную поверхность,
где он появляется в виде капельки. Функции, приписываемые сли-
зистому покрытию, заключаются в защите кончика корня от вред-
ных веществ почвы и от иссушения; слизь может также служить
в качестве абсорбирующей поверхности, осуществляющей обмен
ионов, растворяющей и, возможно, образующей хелатные комп-
лексы с некоторыми питательными веществами [38].
Корневой чехлик давно рассматривается как орган, контроли-
рующий георецепцию корня [62, 75]. Если корни, растущие нор-
мально вниз, ориентировать горизонтально, то последующий рост
в зоне растяжения будет осуществляться по кривой до тех пор,
пока не будет достигнута нормальная ориентация — кончиком вниз
(рис. 14 5). Если отрезать кончик корня или удалить чехлик, то
рост корня не прекращается, но геотропическая реакция пропа-
дает до тех пор, пока не регенерирует корневой чехлик [49].
Местом восприятия гравитации в корневом чехлике служит
центральная колонка клеток, в которых крахмалоносные амило-
240
Глава 14
Рис 14.5 Схема, иллюстрирую-
щая реакцию кончика корня
на гравитацию. А. Кончик кор-
ня, в норме растущий верти-
кально вниз, помещен горизон-
тально. Б. Через 23 ч кончик
корня изогнулся и возвратился
в вертикальное положение по
отношению к поверхности поч-
вы. (С некоторыми изменения-
ми из работы [49].) 1 — метка
тушью.
пласты действуют как статолиты, т. е. как рецепторы гравитации.
В вертикально растущих корнях амилопласты оседают на дисталь-
ные горизонтальные стенки клеток центральной колонки (рис. 14.6,
Л). Через несколько минут после того как корень ориентируется
горизонтально, амилопласты перемещаются к продольным стен-
кам, занимающим теперь нижнее положение (рис. 14.6, Б). В те^
чение 24 ч корень принимает нормальное вертикальное положе-
ние, нарастая по кривой (рис. 14.5), а амилопласты возвращаются
на свое прежнее место — ближе к дистальным горизонтальным
стенкам.
Согласно некоторым экспериментам, с удалением корневых
чехликов амилопласты начинают развиваться в обнаженной апи-
кальной меристеме корня, причем корень становится способным
реагировать на гравитацию раньше, чем начинается регенерация
корневого чехлика [3]. Эти данные не противоречат представле-
нию о том, что корневой чехлик является обычным местом вос-
приятия гравитации, но они показывают, что эта реакция присуща
не только корневому чехлику; кроме того, они, по-видимому, под-
тверждают роль амилопластов в рецепции гравитации. В проти-
воположность этому в тех работах, в которых кривая роста корня
и различные количественные данные, характеризующие амило-
пласты и их перемещения, были статистически обработаны, не
удалось выявить прямой зависимости между поведением амило-
пластов и георецепцией [47]. Таким образом, окончательно роль
амилопластов в реакции корня на гравитацию еще не выяснена.
Корень: первичная форма роста
241
Рис. 14.6. Схемы, иллюстрирующие реакцию амилопластов с крахмалом (мелкие
кружки) — статолитов — на гравитацию. А. В корневом чехлике корня, расту-
щего вертикально вниз, амилопласты находятся на дистальных горизонтальных
клеточных стенках. Б. В том же корне, помещенном горизонтально, амилопласты
смещаются к стенкам, занимавшим в нормально ориентированном корне верти-
кальное положение, а теперь расположенным параллельно поверхности почвы.
Это изменение в расположении отражает геотропизм, иллюстрируемый на
рис. 14.5. 1 — инициали корневого чехлика.
Более того, в некоторых работах предполагается, что в геотропи-
ческой реакции участвуют не амилопласты, а другие органеллы,
такие, как эндоплазматический ретикулум [71] и диктиосомы
[64].
Место восприятия гравитации — кончик корня — находится на
значительном расстоянии от места самой реакции на гравитацию—
зоны роста корня [33, 49] (рис. 14.5). Природа стимула, переда-
ваемого от кончика корня в зону растяжения клеток, не известна.
Некоторые исследователи утверждают, что геотропическая реак-
ция опосредуется ингибитором [3, 47]. В месте георецепции эн-
догенные ростовые вещества перераспределяются таким образом,
что ауксин накапливается на нижней стороне горизонтально ори-
ентированного корня и оттекает с его верхней стороны, вследствие
чего верхние клетки вытягиваются и корень искривляется.
Геотропическая реакция корня может быть вызвана не только
гравитацией, но и светом. Реакция на свет опосредована фито-
хромом, и эксперименты с облучением микродозами позволяют
предположить, что пигмент локализован в кончике корня [69].
16 К Эзау, кн. 2.
242
Глава 14
Развитие
Апикальная меристема
Главным событием в процессе закладки корня в зародыше яв-
ляется формирование апикальной меристемы корня [26] на ниж-
нем конце гипокотиля; иногда в зародыше представлена не только
меристема, но также и эмбриональный корень — корешок (гл. 24).
После прорастания семени апикальная меристема корня форми-
рует главный корень (первичный корень). По мере того как по-
следний растет, апикальная меристема приобретает определенные
черты клеточной организации, которые варьируют в разных так-
сонах. Боковые корни, а также и придаточные, если они разви-
ваются, имеют характерное расположение клеток в апикальной
меристеме, более или менее сходное с их расположением в глав-
ном корне. Архитектура апикальной меристемы корня изучалась
чаще всего с целью выяснения происхождения системы тканей.
Когда было обнаружено, что эта архитектура имеет характерные
различия, исследователи начали связывать их с таксономическим
подразделением растений. Были также предприняты попытки
вскрыть эволюционные тенденции апикальной организации [72].
Анализируя особенности расположения клеток в апикальной
меристеме, можно выявить плоскости клеточных делений и про-
следить за направлением роста клеток. При одном способе ана-
лиза дифференцирующиеся ткани прослеживают в направлении к
кончику корня с целью определить, существуют ли какие-либо
специфические клетки, которые могут дать начало одной или не-
скольким отдельным тканям. Таким путем установлено, что между
тканями и некоторыми расположенными в апексе клетками или
группами клеток имеется определенная корреляция, указывающая
на существование между ними онтогенетических связей, или, дру-
гими словами, что апикальные клетки функционируют как ини-
циали (гл. 2) этих тканей. У корней семенных растений обнару-
жены два главных типа пространственных отношений между тка-
невыми зонами и клетками в апексе. В одном из них центральный
цилиндр, первичная кора и корневой чехлик переходят в независи-
мые слои клеток апикальной меристемы, причем эпидерма диф-
ференцируется из наружного слоя первичной коры (рис. 14.7, Л,
Б) или из клеток, имеющих общее происхождение с клетками
корневого чехлика (рис. 14.7,В,Г). Другой тип характеризуется
тем, что все зоны, или по крайней мере первичная кора и корневой
чехлик, сходятся в одну группу клеток, вытянутых в поперечном
направлении (рис. 14.7, Д,Е). Эти особенности можно объяснить
тем, что в первом типе каждая из трех зон — центральный ци-
линдр, первичная кора и корневой чехлик — имеют свои собствен-
ные инициали; это закрытый тип апикальной меристемы [26].
Корень: первичная форма роста
243
Рис 14 7. Апикальная меристема и происходящие из нее зоны в корнях. А, Б.
Три яруса инициалей злака Stipa, среди них — инициали чехлика, формирующие
калиптроген. Эпидерма и кора имеют общее происхождение. В, Г. Три яруса
инициалей редиса (Raphanus) Эпидерма и корневой чехлик имеют общее проис-
хождение, причем первый ограничен на обеих сторонах корня периклинальными
стенками (показаны стрелками на рис Г) Д—Е. Все зоны корня ели (Picedj
происходят из одной группы инициалей Корневой чехлик имеет центральную
колонку поперечно делящихся клеток. От этой колонки в латеральном направ-
лении возникают производные клетки 1 — центральный цилиндр; 2 — первичная
кора, 3— перицикл; 4 — слизистый слой, 5 — эпидерма; 6 — калиптроген; 7 —
корневой чехлик, 8 — колонка
16*
244
Глава 14
Во втором типе все зоны имеют общие инициали; это открытый
тип апикальной меристемы. Апикальная меристема с общими ини-
циалями, вероятно, является филогенетически примитивной [72].
У многих низших сосудистых растений только одна клетка —
а именно апикальная — оказывается в центральном положении и
служит общей инициалью для всех частей корня.
Представление о происхождении тканей корня из обособлен-
ных инициалей в апексе соответствует положениям, сформулиро-
ванным Ганштейном [28, 29] в теории гистогенов. Согласно этой
теории, тело растения развивается из массивной меристемы, со-
стоящей из многих слоев клеток и содержащей три гистогена —
предшественника тканевых зон. При этом каждый из гистогенов
берет начало в апексе от одной или нескольких инициалей, рас
положенных ярусами друг над другом. Эти гистогены: дерматоген
(предшественник эпидермы), плерома (предшественник централь-
ного цилиндра) и периблема (предшественник первичной коры).
Подразделение на три гистогена не имеет универсального приме-
нения, так как оно редко выявляется в побегах, но оно бывает
удобно для описания дифференциации тканевых зон в корне.
Другой подход к анализу взаимоотношений между характером
расположения, роста и деления клеток, с одной стороны, и ростом
корня — с другой, отражен в теории тела — чехлика (Кбгрег—
Карре) [61], которая обращает внимание на направление плос-
костей делений, ответственных за увеличение числа вертикальных
клеточных рядов в меристематической зоне корня. При клеточном
росте продольные и поперечные деления комбинируются таким
образом, что в месте раздвоения рядов клеток поперечные и про-
дольные стенки в данном ряду располагаются в виде буквы Т
(или Y). Если корневой чехлик имеет свои собственные инициали,
то направление, соответствующее горизонтальной перекладине
буквы Т в клеточных рядах, резко отделяет корневой чехлик от
тела корня. Линия с изломом, соответствующая горизонтальной
перекладине буквы Т, в корневом чехлике обращена к основанию
корня, а в теле корня — к его апексу (рис. М.З^. Теория =
чехлика дает также представление о минимальном числе клеток
в апексе (только одна клетка у многих низших растений), кото-
рое необходимо для создания при их делении характерной струк-
туры корня. Эта группа клеток составляет, согласно Клаусу [16],
минимальный организующий центр, который, вероятно, соответ-
ствует зоне инициалей в теории гистогенов.
Анализ организации кончиков корней с точки зрения теорий
гистогенов и тела — чехлика позволяет получить сведения и о
характере роста, который имел место в норме и благодаря кото-
рому сформировалась определенная структура. Однако с помощью
физиологических и биохимических методов, используемых при изу-
чении роста корня, показано, что увеличение числа клеток в его
Корень: первичная форма роста
245
Рис. 14.8. Схема строения кон-
чика корня Linum usitatissi-
mum (фото 1), рассматривае-
мого в соответствии с теорией
активности апикальной мери-
стемы по типу тела—чехлика.
Т-фигуры, образующиеся в ре-
зультате сочетания продольных
и поперечных стенок в чехли-
ке (верхняя ломаная линия, со-
ответствующая горизонтальной
перекладине буквы Т, обраще-
на к основанию корня) и в те-
ле корня (та же линия обра-
щена к апексу корня) разли-
чаются. 1 — корневой чехлик;
2 — эпидерма; 3 — первичная
кора; 4 — перицикл.
кончике, вероятно, не зависит от непрерывной активности наибо-
лее дистальной небольшой группы апикальных клеток. Интенсив-
ные исследования нормально развивающихся корней и корней,
подвергнутых хирургической обработке, а также корней, облучен-
ных или получивших меченые вещества, участвующие в синтезе
днк, показали, что, как правило, инициали, ответственные за
организацию клеточного роста на первых стадиях, в основном
утрачивают митотическую активность на последующих стадиях
роста корня [15-17]. Вместо них митотическую активность про-
являют клетки, расположенные несколько глубже в теле корня.
Эти наблюдения послужили поводом для формулирования теории
покоящегося центра в апикальной меристеме. Согласно этой тео-
рии, самые дистальные клетки в теле корня (первые инициали
плеромы и периблемы) делятся редко, имеют приблизительно
одинаковые размеры и низкие скорости синтеза нуклеиновых кис-
лот и белка. Покоящийся центр (при исключении инициалей кор-
невого чехлика) имеет полусферическую или дисковидную форму
(рис. 14.9) и у некоторых изученных видов включает от 500 до
1000 клеток из 125—250 тыс. меристематических клеток, содер-
жащихся в апексе. Покоящийся центр варьирует в объеме, по-ви-
димому, в зависимости от размера корня, так как он сравнительно
небольшой или вовсе отсутствует в тонких корнях. В корнях с
246
Глава 14
Рис. 14 9 Схема строения кончика корня лука в продольном разрезе, иллюстри-
рующая распределение меристематической активности. Частота митозов соответ-
ствует плотности точек [35]. 1 — корневой чехлик; 2 — эпидерма; 3— первичная
кора; 4 — ситовидный элемент протофлоэмы; 5 — центральный цилиндр: 6 — по-
коящийся центр.
покоящимся центром митотически активные инициали (промери-
стема по Клаусу [15]) располагаются сразу же за проксимальной
поверхностью покоящегося центра.
Покоящееся состояние дистальных апикальных клеток не озна-
чает, что эти клетки совсем перестали функционировать [15, 17].
В покоящемся центре при нормальных условиях деления полно-
стью не прекращены. В корнях, экспериментально поврежденных
радиацией или хирургической обработкой, покоящийся центр спо-
собен восстанавливать меристему. Он возобновляет также деления
в процессе выхода из периода покоя, вызванного холодом. Когда
удален корневой чехлик, клетки покоящегося центра начинают
расти и претерпевают деления, происходящие в определенной по-
следовательности, благодаря чему восстанавливается корневой
чехлик [2].
Применяя методики включения в ядра меченого тимидина и
блокирования клеточного цикла в метафазе ингибиторами, можно
получить количественные данные о продолжительности митотиче-
ского цикла в различных зонах корневой меристемы [17]. Эти
данные свидетельствуют о том, что клетки покоящегося центра
делятся приблизительно в десять раз медленнее, чем соседние
клетки (табл. 1). Более того, импульсное введение в ядра мече-
ного тимидина показало, что различия в продолжительности ми-
тотических циклов вызваны главным образом различиями в дли-
тельности Gi-периода — времени между окончанием митоза и
началом синтеза ДНК.
Корень: первичная форма роста
247
Таблица 14.1
Продолжительность митотического цикла (в часах),
определенная по числу метафаз в делящихся ядрах в корневых меристемах,
обработанных ингибиторами, блокирующими митоз1)
Вид Покоящийся центр Инициалы кор- невого чехлика Центральный цилиндр
сразу над2) ПЦЗ) 200—250 мкм, над2) ПЦЗ)
Zea mays 174 12 28 29
Vicia faba 292 44 37 26
Sinapis alba 520 35 32 25
Allium sativum 173 33 35 26
’) Данные из работы [17] с некоторыми изменениями.
2) К основанию корня.
3) ПЦ — покоящийся центр.
О возможных причинах появления покоящегося центра в ра-
стущем корне было высказано много точек зрения. Согласно пред-
положению, основанному на результатах анализа особенностей
роста в кончиках корней, покой в определенном месте корневой
меристемы наступает вследствие антагонистической направленно-
сти клеточного роста в различных частях меристемы, причем осо-
бенно важную роль в подавлении роста играет корневой чехлик
([2]. В соответствии с другим представлением причиной отсутствия
активности в самом покоящемся центре является наличие быст-
ро делящихся клеток вокруг него [73]. Эта точка зрения основа-
на на следующем опыте. Если отрезанные корни, в которых син-
тез ДНК и митозы были заторможены голоданием, снабжать
затем сахарозой, то оба процесса восстанавливаются во всем
корне, в том числе и в покоящемся центре. Однако покоящийся
центр вскоре перестает участвовать в клеточной пролиферации.
Митотическую активность клеток, окружающих покоящийся центр,
и «антагонистические» направления роста этих клеток можно
рассматривать по их влиянию на покоящийся центр как явления,
дополняющие друг друга.
Рост кончика корня
Зона активно делящихся клеток в кончике корня распростра-
няется на значительное расстояние от апекса базипетально, т. е.
в направлении к более старой части корня. Эти деления сочета-
ются с растяжением клеток, а также в некоторых зонах корня
совпадают с дифференциацией определенных клеток. Максимум
митотической активности отмечен не только в апикальной зоне,
248
Глава 14
но и на некотором расстоянии от нее, причем это расстояние в
различных тканевых зонах варьирует (рис. 14.9). В корне Zea
скорость образования клеток возрастает до максимума на рас-
стоянии 1,25 мм от кончика корневого чехлика и снижается до
нуля на расстоянии примерно 2,5 мм [21]. От этого уровня в сто-
рону основания корня дальнейший рост корня в длину обеспечи-
вается только путем растяжения клеток.
Общий рост корней в длину был изучен методом фотографиро-
вания под микроскопом живых растущих корней и расчета эле-
ментарных скоростей роста (роста неопределенно малых частей).
В корне Phleum максимум элементарной скорости роста зареги-
стрирован на расстоянии 600—650 мкм от кончика [24]. У Zea
элементарная скорость роста была небольшой в непосредствен-
ной близости от апекса, возрастала до максимума в 4 мм от кон-
чика корневого чехлика, где клетки были вытянутыми, но уже не
делились, и снижалась до минимума на расстоянии 10 мм [20].
Рост корня довольно сложным образом регулируется ауксина-
ми [62]. Ауксин необходим для растяжения клеток корня, но в
то же время он способен тормозить клеточное растяжение и та-
ким образом регулирует его продолжительность. Механизм дей-
ствия ауксина при растяжении клеток раскрыт не полностью.
Вероятнее всего, в первую очередь он действует на клеточную
оболочку. Ауксин достигает зоны роста преимущественно путем
активного полярного транспорта, направленного от основания к
кончику корня.
Кончик корня не растет непрерывно с одной и той же скоро-
стью, особенно у многолетних растений. У корней Abies procera,
например, наблюдается периодическое ускорение роста и имеются
периоды покоя [74]. Переходу в состояние покоя предшествует
отложение жировых веществ, по-видимому суберина, в первичной
коре и корневом чехлике вдоль всего слоя клеток, который тя-
нется от эндодермы и покрывает апикальную меристему. Послед-
няя в результате одевается защитным слоем со всех сторон, за
исключением той, которая направлена к основанию корня. Сна-
ружи кончики таких корней выглядят коричневыми. При возобно-
влении роста коричневое покрытие разрушается и кончик корня
пробивается через него. Изучение изолированных корней показа-
ло, что ритм их роста может не зависеть от сезонных изменений,
а определяется внутренними факторами [66].
Первичная дифференциация
На различных расстояниях от апикальной меристемы клетки
разрастаются и приобретают специфические особенности в зави-
симости от своего положения в корне — они становятся диффе-
Корень: первичная форма роста
249
ренцированными. Меристемы трех тканевых зон корня — эпидер-
мы, коры и центрального цилиндра — дифференцируются близко
к апикальной меристеме (рис. 14.7 и 14.9). Первоначальную диф-
ференциацию тканевых зон определяют различия в распределении
митозов и в степени растяжения клеток на ранней стадии роста
(фото 1 и рис. 14.9).
Эпидерма
Протодерма корней однодольных происходит из тех же ини-
циалей, которые дают начало и первичной коре (рис. 14.7,Д, Б).
У двудольных протодерма отчленяется ступенчатообразными пе-
реклинальными делениями (Т-делениями) от производных слоя
инициалей, формирующего корневой чехлик (рис. 14.7,В, Г и
14.8). В корнях, не имеющих отчетливо выраженных ярусов ини-
циалей, протодерма имеет общее происхождение с корневым чех-
ликом и корой (рис. 14.7,Д, Е), и на ранних стадиях развития
выявить ее довольно трудно.
В той зоне корня, где дифференцируются проводящие ткани,
молодая эпидерма формирует корневые волоски (рис. 14.1). Клет-
ки, образующие корневые волоски, могут не отличаться от кле-
ток, лишенных волосков. У некоторых растений, однако, прото-
дермальные клетки, которые дают начало корневым волоскам,
мельче, чем их сестринские клетки; к тому же у них обнаружены
и другие особенности, указывающие на их специализацию в ка-
честве клеток, формирующих волоски (трихобласты, гл. 7). По-
казано, что присутствие в эпидерме корня трихобластов, обладаю-
щих определенными цитологическими характеристиками, является
таксономически значимым признаком [59].
Корневые волоски появляются в виде небольших сосочков
(папилл) в той зоне, где прекращаются клеточные деления, и
достигают полного развития на том уровне корня, где созревает
по крайней мере первый ксилемный элемент. Рост волоска про-
исходит у его кончика, где вследствие этого клеточная оболочка
остается мягкой. Затвердевание клеточной оболочки происходит
постепенно в акропетальном направлении от проксимальной части
волоска.
Одним из факторов, контролирующих рост корневого волоска,
часто считают наличие кальция [67]. Кальцификация пектиновых
веществ рассматривается как причина отвердевания клеточной
оболочки и последующего прекращения ее растяжения [18]. Рас-
тяжение оболочки корневого волоска происходит быстро (в кор-
не редиса со скоростью 0,1 мм/ч) [10]. В этом росте клеточной
оболочки, по-видимому, активно участвуют пузырьки диктиосом.
250
Глава 14
ПЕРВИЧНАЯ КОРА
Основная меристема первичной коры состоит из продольных
рядов клеток, достигающих максимального числа с помощью
периклинальных делений (Т-делений) недалеко от апекса (рис. 14.7
и 14.8). Увеличение числа коровых клеток по окружности проис-
ходит путем антиклинальных делений. Во многих корнях перикли-
нальные деления усиливаются в центростремительном направле-
нии, т. е. они повторяются несколько раз в самом внутреннем слое
развивающейся коры (рис. 14.8). Повторение делений в одном и
том же относительном положении обусловливает правильное рас-
положение клеток развивающейся ткани в виде более или менее
выраженных радиальных рядов (фото 76, Л). В некоторых корнях
наружная часть коры делится иначе и расположение клеток в ней
не совпадает с их расположением во внутренней части коры.
После того как периклинальные деления во внутренней коре за-
канчиваются, самый внутренний слой дифференцируется как эн-
додерма.
Межклетники, так хороню выраженные в первичной коре кор-
ня, возникают близко к апикальной меристеме. В живых корнях,
если их наблюдать под световым микроскопом в капле воды,
межклетники выглядят как черные штрихи, возникающие вслед-
ствие преломления света их газообразным содержимым.
ЦЕНТРАЛЬНЫЙ ЦИЛИНДР
Центральный цилиндр происходит из прокамбия, или из про-
васкулярной ткани, расположенной в виде колонки в центре кор-
ня. Если корень имеет сердцевину, последняя часто интерпрети-
руется как потенциально проводящая ткань, которая в процессе
эволюции перестала дифференцироваться. При такой интерпрета-
ции сердцевина рассматривается как часть центрального цилинд-
ра, происходящего из прокамбия. Противоположная точка зрения
заключается в том, что сердцевина в корне, как и в стебле, про-
исходит из основной меристемы (гл. 16).
Перицикл — это обычно первый хорошо выраженный слой кле-
ток в центральном цилиндре (рис. 14.8). Он ограничивает массив
проводящих тканей сразу же за апикальной меристемой. В самом
цилиндре укрупнение и прогрессирующая вакуолизация некоторых
клеток способствуют выявлению характера ксилемы (диархная,
триархная и т. д.; фото 76 и рис. 14.10). Поскольку клетки ме-
таксилемы превышают клетки протоксилемы в ширину, их можно
различить раньше, как только начинает увеличиваться диаметр
и наступает вакуолизация. Однако отложение вторичных оболо-
чек и функциональная специализация происходят сначала в про-
токсилеме и лишь позднее в метаксилеме. Таким образом, первич-
Корень: первичная форма роста
251
Рис. 14.10. Схема первичной диффе-
ренциации проводящих тканей в кор-
не гороха Pisum sativum. Корень,
изолированный от растения, был вы- 1500
ращен в питательной среде, но по-
следовательность и структурное про-
явление дифференциации в нем не
отличаются от соответствующих по-
казателей в корнях, не отделенных
от растения. (Torrey, Amer. J. Bot.,
40, 525—533, 1953.) 1— центростре- 1000
мительная дифференциация ксилем-
ных элементов; 2— эпидерма; 3 —
первичная кора; 4 — эндодерма; 5 —
первые дифференцированные ксилем-
ные элементы; 6 — недифференциро-
ванные ксилемные элементы; 7 — пер-
вые дифференцированные флоэмные 500
элементы; 8 — центробежное станов-
ление характерных признаков ксиле-
мы, 9 — апикальная меристема; 10 —
корневой чехлик.
мкм
2000
300
ная ксилема дифференцируется центростремительно (что можно
видеть на поперечных срезах корня) и является экзархной. Диф-
ференциация флоэмы осуществляется в том же направлении, т. е.
центростремительно, так как протофлоэма появляется непосред-
ственно под перициклом, а метафлоэма — глубже в центральном
цилиндре (фото 76).
Описанный выше ход дифференциации ксилемы типичен для
корней однодольных и двудольных [23, 51, 56], но встречаются
и исключения. У Cucurbita pepo, например, в то время, когда
дифференцируются протоксилема и ранняя метаксилема, цент-
ральная зона корня, как можно видеть на поперечных срезах,
напоминает сердцевину. Затем на расстоянии около 13 см от кон-
чика клетка в центре увеличивается в диаметре примерно в 4 раза
по сравнению с исходным ее размером и дифференцируется как
252
Глава 14
членик метаксилемного сосуда, что приводит к значительной пе-
рестройке в расположении окружающих клеток [31, 32].
Дифференциация первичных проводящих тканей в продольном
направлении осуществляется в корне акропетально, причем пер-
вый элемент флоэмы созревает ближе к апикальной меристеме,,
чем первый элемент ксилемы (рис. 14.10). Расстояние от апекса
до первого зрелого проводящего элемента, особенно ксилемного,
варьирует [23] и зависит от возраста корня, скорости роста, вида
растения, наличия заболевания, типа корня (короткий или длин-
ный, терминальный или латеральный) и других факторов [48, 56,
63]. В общем у медленно растущих корней дифференцированные
проводящие элементы располагаются ближе к апикальной мери-
стеме, чем у быстро растущих корней. Расстояние зрелых про-
водящих тканей от апекса может изменяться в одном и том же
корне под влиянием внешних условий. В период покоя многолет-
них растений, например, рост корня заторможен и дифференциа-
ция проводящих клеток заканчивается ближе к апексу.
Боковые корни
Боковые корни возникают на периферии центрального цилинд-
ра на разных расстояниях от апикальной меристемы. В связи с
тем что они закладываются в глубоко расположенных тканях
корня, их происхождение называют эндогенным. В зависимости от
порядка корня, дающего начало боковым ответвлениям, послед-
ние часто обозначаются как вторичные корни (боковые корни на
главном корне), третичные корни (боковые корни на вторичном
корне) и т. д.
Боковые корни голосеменных и покрытосеменных независимо
от того, возникают ли они на главных корнях или на их ветвях
или на придаточных корнях, закладываются большей частью в
перицикле (фото 77). Эндодерма также может образовать не-
сколько слоев клеток корневого примордия [4, 26]. Обычно клет-
ки эндодермального происхождения слущиваются после того, как
боковой корень выйдет из материнского корня [13, 63]. Образо-
вание боковых корней стимулируется ауксинами и другими регу-
ляторами роста [5], но оно может подавляться эндогенными ин-
гибиторами, которые ответственны за определенную частоту и
распределение боковых корней на родительском корне [66].
Благодаря перициклическому происхождению боковой корень
оказывается расположенным в непосредственной близости к про-
водящим тканям материнского корня, с которыми проводящие
ткани бокового корня устанавливают непосредственную связь.
Положение бокового корня относительно ксилемных групп ма-
теринского корня варьирует в зависимости от расположения про-
водящих тканей в материнском корне, но оно постоянно в корне
Корень первичная форма роста
253
с данным типом их локализации (рис. 14.4). В диархном корне
боковой корень закладывается между флоэмой и ксилемой, в три-
архном, тетрархном и т. д.— напротив ксилемы, в полиархном
корне однодольных — напротив флоэмы.
В начале закладки бокового корня в нескольких смежных
клетках перицикла цитоплазма становится плотной, и эти клетки
делятся периклинально. Появляющиеся в результате этих делений
клетки снова делятся периклинально и антиклинально. Постепен-
но увеличивающиеся в числе клетки образуют вырост — примор-
дий корня (фото 77). Нарастая в длину, примордий пробивает
кору и выходит на поверхность. Эндодерма часто делится только
антиклинально и таким образом сохраняет целостность во время
роста примордия, но другие коровые клетки деформируются, сми-
наются, отодвигаются в сторону и, вероятно, частично разрушают-
ся под действием ферментов [4, 8]. Из-за отсутствия связи между
растущим ооковым корнем и первичной корой материнского корня
в последнем образуется отверстие, через которое внутрь корня
могут проникать патогены. В процессе продвижения молодого
примордия через кору формируются апикальная меристема и кор-
невой чехлик и за апикальной меристемой намечаются централь-
ный цилиндр и первичная кора (фото 78).
В месте закладки бокового корня клетки родительного корня
испытывают различное влияние этого новообразования. Если бо-
ковой корень возникает близко к апикальной меристеме то клет-
ки материнского корня еще не полностью дифференцированы и
переходят к меристематической активности без каких-либо вы-
раженных гистологических изменений. Если эндодерма обладает
поясками Каспари в том месте, где закладываются боковые кор-
ни, то она обычно делится напротив пролиферирующего перицикла
и может сформировать пояски Каспари в новых клетках, по
крайней мере на какое-то время. Боковые корни, однако, возни-
кают также на том уровне корня, где перицикл и эндодерма име-
ют лигнифицированные вторичные оболочки (например, у Zea
mays [4, 37]. В таких случаях появлению меристематической
активности, связанной с закладкой бокового корня, предшествуют
значительные изменения, включающие делигнификацию и удале-
ние вторичных оболочек.
Когда в латеральном корне начинают дифференцироваться
флоэма и ксилема, эти ткани вступают в контакт с аналогичными
тканями в материнском корне в результате дифференциации про-
межуточных паренхимных клеток в проводящие элементы. Де-
лящийся перицикл отчленяет эти паренхимные клетки первыми.
В зависимости от протяженности соединительных звеньев между
проводящими тканями в их формировании могут принимать уча-
стие клетки материнского центрального цилиндра, примыкающие
254
Глава 14
к перициклу, которые делятся и затем дифференцируются в про-
водящие элементы [4, 23].
Развитие новых участков роста благодаря непрерывному на-
растанию в длину существующих корней и закладке новых боко-
вых корней может рассматриваться как важная особенность кор-
ней, связанная с поглощением ими различных веществ. Путем
роста создаются новые поглощающие поверхности, и это в свою
очередь обеспечивает контакт поверхности корня с новыми участ-
ками почвы.
Почки на корнях
Образование почек на корнях — известное явление [22, 52],
которое используется для размножения растений корневыми че-
ренками и одновременно представляет собой способ распростра-
нения некоторых сорных трав [9] и других вредных растений
[76]. Корневые почки часто образуются эндогенно, как и боковые
корни. Развитие структур обоих типов было подвергнуто сравни-
тельному изучению на корнях Convolvulus arvensis, культивируе-
мых in vitro [11]. Самые ранние стадии формирования корней и
почек, по-видимому, одинаковы, но более поздние стадии разли-
чаются не только по скорости развития, но и по гистологической
организации и по характеру участия материнских тканей в росте
примордия. Изучение фитохромной регуляции развития корневых
почек того же вида Convolvulus привело к пониманию очень важ-
ных взаимоотношений между ростом корня, регулируемым меха-
низмом георецепции (статолитами) и светорецепторной системой
(фитохромами), с одной стороны, и ростом почек, регулируемым
светом, который улавливается корнем при его случайном прибли-
жении к поверхности почвы [9],— с другой.
СПИСОК ЛИТЕРАТУРЫ
1. Armstrong W. A re-examination of the functional significance of aerenchyma,
Physiol. Plant., 27, 173—177 (1972).
2. Barlow P. W. Mitotic cycles in root meristems. In: The cell cycle in develop-
ment and differentiation, Balls M., Billet F. S., eds., Cambridge University
Press, 1973
3. Barlow P. W. Recovery of geotropism after removal of the root cap, J. Exp.
Bot, 25, 1137—1146 (1974).
4. Bell J McCully M. E. A histological study of lateral root initiation and
development in Zea mays, Protoplasma. 70. 179—205 (1970)
5. Blakely L. M., Rodaway S. J., Hollen L. B., Croker S. G. Control and kinetics
of branch root formation in cultured root segments of Haplopappus ravenii,
Plant Physiol., 50, 35—42 (1972).
6. Bond L. Origin and development morphology of root nodules of Pisum sati-
vum, Bot. Gaz., 109, 411—434 (1948).
7. Bonnett H. T., Jr. The root endodermis: fine structure and function, J. Cell
Biol, 37, 109—205 (1968).
Корень: первичная форма роста
255
8. Bonnett Н. Т., Jr. Cortical cell death during lateral root formation, J. Celt
Biol., 40, 144—159 (1969).
9. Bonnett H. T. Phytochrome regulation of endogenous bud development in root
cultures of Convolvulus arvensis, Planta, 106, 325—330 (1972).
10. Bonnett H. T., Jr., Newcomb E. H. Coated vesicles and other cytoplasmic com-
ponents of growing root hairs of radish, Protoplasma, 62, 59—75 (1966).
11. Bonnett H. T., Jr., Torrey J. G. Comparative anatomy of endogenous bud and
lateral root formation in Convolvulus arvensis roots cultured in vitro, Amer.
J. Bot, 53, 496—507 (1966).
12. Bruch H. Beitrage zur Morphologic und Entwicklungsgeschichte der Fenchel-
wurzel (Foeniculum vulgare Mill.), Beitr. Biol. Pflanz., 32, 1—26 (1955).
13. Byrne J. M. The root apex of Malva sytvestris. III. Lateral root development
and the quiescent center, Amer. J. Bot., 60, 657—662 (1973).
14. Chilvers G. A., Pryor L. D. The structure of eucalypt mycorrhizas, Aust. J.
Bot., 13, 245—259 (1965).
15. Clowes F. A. L. Apical meristems. Botanical Monographs Vol. 2, Oxford,
Blackwell, 1961.
16. Clowes F. A. L. The functioning of meristems, Sci. Prog. Oxford, 55, 529—
542 (1967).
17. Clowes F. A. L. Anatomical aspects of structure and development. In: Root
growth, Proc. Fifteenth Easter School in Agric. Sci. Univ. Nottingham, 1968r
London, Butterworth, 1969.
18. Cormack R. G. H. The development of the root hairs in angiosperms, Bot.
Rev., 15, 583—612 (1949). II. Bot. Rev., 28, 446-464 (1962).
19. Dycus A. M., Knudson L. The role of the velamen of the aerial roots of or-
chids, Bot. Gaz., 119, 78—87 (1957).
20. Erickson R. O., Sax К. B. Elemental growth rate of the primary root of Zea
mays, Proc. Amer. Phil. Soc., 100, 487—498 (1956).
21. Erickson R. O., Sax К- B. Rates of cell division and cell elongation in the
growth of the primary root of Zea mays, Proc. Amer. Phil. Soc., 100, 499—
514 (1956).
22. Esau K. Plant anatomy, 2nd ed., New York, John Wiley & Sons, 1965.
23. Esau K. Vascular differetiation in plants. New York, Holt, Rinehart and Win-
ston, 1965.
24. Goodwin R. H., Avers C. J. Studies on roots. III. An analysis of root growth
in Phleum pratense using photomicrographic records, Amer. J. Bot., 43, 479—
487 (1956).
25 Govier R. N., Brown J. G. S., Pate J. S. Hemiparasitic nutrition in angio-
sperms. II. Root haustoria and leaf glands of Odonites varna (Bell) Dum. and
their relevance to the abstraction of solutes from the host, New Phytol., 67,
963—972 (1968).
26. Guttenberg H. von. Der primare Bau der Angiospermenwurzel, Handbuch der
Pflanzenanatomie, Band VIII, Teil 5, 1968.
27. Hacskaylo E. Mycorrhiza: the ultimate in reciprocal parasitism?, BioScience,
22, 577—583 (1972).
28. Hanstein J. Die Scheitzelzellgruppe im Vegetationspunkt der Phanerogamen,
Festschr. Niederrhein. Ges. Natur- u. Heilkunde, 1868, 109—134 (1868).
29. Hanstein J. Die Entwicklung des Keimes der Monokotylen und der Dikotvlen,
Bot. Abhandl., 1, 1—112 (1870).
30. Harkes P. A. A. Structure and dynamics of the root cap of Avena sativa L.,
Acta Bot. Neerl., 22, 321—328 (1973).
31. Harrison-Murray R. S., Clarkson D. T. Relationships between structural deve-
lopment and the absorption of ions by the root system of Cucurbita pepor
Planta, 114, 1 — 16 (1973).
32. Hayward H. E. The structure of economic plants, New York;, Macmillan,
1938.
256
Глава 14
33. I ver sen Т.-H., Larsen P. Movement of amyloplasts in the statocytes of geotro-
pically stimylated roots. The preinversion effect, Physiol. Plant., 28, 172—181
(1973).
34. Jenny H., Grossenbacher K. Rootsoil boundary zones as seen in the electron
microscope, Proc. Soil Sci. Soc. Amer., 27, 273—277 (1963).
35. Jensen W. A., Kavaljian L. G. An analysis of cell morphology and the periodi-
city of division in the root tip of Allium сера, Amer. J. Bot., 45, 365—372
(1958).
36. Juniper В. E., Roberts R. M. Polysaccharide synthesis and the fine structure
of root cap cells, J. Roy. Mier. Soc., 85, 63—72 (1966).
37. Karas I., McCully M. E. Further studies of the histology of lateral root deve-
lopment in Zea mays, Protoplasma, 77, 243—269 (1973).
38. Leiser A. T. A mucilaginous root sheath in Ericaceae. Amer. J. Bot, 55, 391—
398 (1968).
39. Libbenga K. R., Harkness P. A. A. Initial proliferation of cortical cells in the
formation of root nodules in Pisum sativum L., Planta, 114, 17—28 (1973).
40. Luhan M. Das Abschlussgewebe der Wurzeln unserer Alpenpflanzen, Ber. Deut.
Bot. Ges., 68, 87—92 (1955).
41. Luhan M. Neues zur Anatomie der Alpenpflanzen, Ber. Deut. Bot. Ges., 72,
262—267 (1959).
42. Моггё D. J., Jones D. D., Mollenhauer H. H. Golgi apparatus mediated poly-
saccharide secretion by outer root cap cells of Zea mays. I. Kinetics and
secretory pathway, Planta, 74, 286—301 (1967).
43. Nagahashi G., Thomson W. W., Leonard R. T. The Casparian strip as a barrier
to the movement of lanthanum in corn roots, Science, 183, 670—671 (1974).
44. Northcote D. H., Pickett-Heaps J. D. A function of the golgi apparatus in po-
lysaccharide synthesis and transport in the root-cap calls of wheat, Biochem.
J., 98, 159—167 (1966).
45. Pate J. S., Gunning В. E. S., Briarty L. G. Ultrastructure and functioning of
the transport system of the leguminous root nodule, Planta, 85, 11—34
(1969).
46. Peirson D. R., Dumbroff E. B. Demonstration of a complete Casparian strip
in Avena and Ipomoea by a fluorescent staining technique, Can. J. Bot., 47,
1869—1871 (1969).
47. Perbal G. faction des statolithes dans la reponse geotropique des racines de
Lens culinaris, Planta, 116, 153—171 (1974).
48. Peterson R. L. Differentiation and maturation of primary tissues in white
mustard root tips, Can. J. Bot., 45, 319—331 (1967).
49. Pilet P. E. Geoperception et georeaction racinaires, Physiol. Veg., 10, 347—
367 (1972).
50. Pillai A., Pillai S. K. Air spaces in the roots of some monocotyledons, Proc.
Ind. Acad. Sci., 55, 296—301 (1962).
51. Popham R. A. Levels of tissue differentiation in primary roots of Pisum sati-
vum, Amer. J. Bot., 42, 529—540 (1955).
52. Raju M. V. S., Coupland R. T., Steves T. A. On the occurence of root buds
on perennial plants in Saskatchewan, Can. J. Bot., 44, 33—37 (1966).
53. Reyneke W. F., Van Der Schijff H. P. The anatomy of contractile roots in
Eucomis I’Herit, Ann. Bot., 38, 977—982 (1974).
54. Richardson S. D. The influence of rooting medium on the structure and deve-
lopment of the root cap in seedlings of Acer saccharinum L., New Phytol.,
54, 336—337 (1955).
55. Riedhart J. M., Guard A. T. On the anatomy of the roots of apple seedlings,
Bot. Gaz., 118, 191—194 (1957).
56. Riopel J. L., Steeves T. A. Studies on the roots of Musa acuminata. I. The
anatomy and development of main roots, Ann. Bot., 28, 475—490 (1964).
Корень: первичная форма роста
257
57. Robards A. W., Jackson S. М., Clarkson D. Т., Sanderson J. The structure of
barley roots in relation to the transport of ions into the stele, Protoplasma,
77, 291—311 (1973).
58. Rosene H. F. The water absorptive capacity of winter rye root-hairs, New Phy-
tol., 54, 95—97 (1955).
59. Row H. C., Reeder J, R. Root hair development as evidence of relationships
among genera of Gramineae, Amer. J. Bot., 44, 596—601 (1957).
60. Safir G. R., Boyer J. S., Gerdemann J. W. Nutrient status and mycorrhizal en-
hancement of water transport in soybean, Plant Physiol., 49, 700—703
(1972).
61. Schilepp O. Untersuchungen fiber Wachstum und Formwechsel von Vegetations-
punkten, Jb. Wiss. Bot., 57, 17—79 (1917).
62. Scott T. K. Auxins and roots, Ann. Rev. Plant Physiol., 23, 235—258 (1972).
63. Seago J. L. Developmental anatomy in roots of Ipomoea purpurea. I. Radicle
and primary root, Amer. J. Bot., 58, 604—615 (1971). II. Initiation and deve-
lopment of secondary roots, Amer. J. Bot., 60, 607—618 (1973).
64. Shen-Miller J., Hinchman R. R. Gravity sensing in plants: a critique of the
statolith theory, BioScience, 24, 643—651 (1974).
65. Street H. E. Physiology of root growth, Ann. Rev. Plant Physiol., 17, 315—
344 (1966).
66. Street H. E., Roberts E. H. Factors controlling meristematic activity in excised
roots. I. Experiments showing the operation of internal factors, Physiol. Plant.,
5, 498—509 (1952).
67. Tanaka Y., Woods F. W. Root and root hair growth in relation to supply and
internal mobility of calcium, Bot. Gaz., 133, 29—34 (1972).
68. Tanton T. W., Crowdy S. H. Water pathways in higher plants. II. Water path-
ways in roots, J. Exp. Bot., 23, 600—618 (1972).
69. Tepfer D. A., Bonnett H. T. The role of phytochrome in the geotropic behavior
of roots of Convolvulus arvensis, Planta, 106, 311—324 (1972).
70. Tomlinson P. B. Anatomy of the monocotyledons. II. Palmae. III. Commelina-
les — Zingiberales, Oxford, Clarendon Press, 1961 and 1969.
71. Volkmann D. Amyloplasten und Endomembranen. Das Geoperzeptionssystem
der Primarwurzel, Protoplasma, 79, 159—183 (1974).
72. Воронин H. С. Об эволюции корней растений, Бюлл. Московского общества
испытателей природы, отд. биол., 61, 47—58 (1956).
73. Webster Р. L., Langenauer Н. D. Experimental control of the activity of the
quiescent center in excised root tips of Zea mays, Planta, 112, 91—100 (1973).
74. Wilcox H. Primary organization of active and dormant roots of noble fir,
Abies procera. Amer. J. Bot., 41, 812—821 (1954).
75. Wilkins M. B. Geotropism, Ann. Rev. Plant Physiol., 17, 379—408 (1966).
76. Wilkinson R. E. Adventitious shoots on saltcedar roots, Bot. Gaz., 127, 103—
104 (1966).
77. Wilson K, Honey J. N. Root contraction in Hyacinthus orientalis, Ann. Bot.,
30, 47—61 (1966).
17 К. Эзау, кн. 2.
Глава 15
Корень: вторичная форма роста
и придаточные корни
Вторичный рост корней, как и стеблей, заключается в образо-
вании вторичных проводящих тканей из камбия и перидермы из
феллогена. Вторичный рост характерен для корней голосеменных,
но в той или иной степени выражен также и у большинства дву-
дольных. Как упоминалось в гл. 14, корни однодольных обычно
не обладают способностью к вторичному росту. Вторичный рост
корней характеризуется некоторыми особенностями, которые за-
висят от их функциональной специализации.
Обычный тип вторичного роста
Камбий образуется путем делений тех прокамбиальных кле-
ток, которые остаются недифференцированными между первичной
флоэмой и первичной ксилемой (рис. 15.1,Л — Г). Вначале кам-
бий имеет вид полосок, число которых зависит от типа корня
(рис. 15.1, В). В диархном корне имеются две полоски, в триарх-
ном— три и т. д. Затем клетки перицикла, локализованные сна-
ружи от выступов ксилемы, также проявляют камбиальную ак-
тивность и в результате камбий полностью окружает массив кси-
лемы. Этот ранний камбий имеет такие же очертания, как и кси-
лема; в поперечном сечении линия камбия в диархном корне
очерчивает овал, в триархном — образует треугольник и в поли-
архном — многоугольник. Камбий, локализованный на внутренней
поверхности флоэмы, начинает функционировать раньше, чем его
перициклическая часть. Вследствие формирования вторичной
ксилемы напротив флоэмы камбий смещается кнаружи, и в конце
концов его очертания в поперечном сечении становятся округлыми
(рис. 15.1,Д).
Периклинальными делениями камбий образует клетки флоэмы
и ксилемы (фото 79), а с помощью антиклинальных делений уве-
личивается в окружности. Камбий, появляющийся на внутренней
поверхности флоэмы, образует проводящие элементы и связан-
ные с ними клетки ксилемы и флоэмы (фото 79, Л). Камбий,
берущий свое начало в перицикле, образует в некоторых корнях
лучевую паренхиму (фото 79,5 и 89,5, В). Лучи появляются
также в других частях вторичных тканей (фото 79, В), но лучи,
17*
11
Рис. 15.1. Схемы и детальные рисунки поперечных срезов корня люцерны Medi-
cago sativa на различных стадиях развития. А, Б. Первичная стадия роста.
В, Г. Закладка камбия. Д, Е. Вторичный рост центрального цилиндра, клеточ-
ные деления в перицикле и разрушение первичной коры. Ж, 3. Вторичный рост
установился. 1— первичная ксилема; 2— перицикл; 3— эндодерма; 4 — камбий;
5 — первичная флоэма; 6 — первичные флоэмные волокна; 7 — первичная кора;
8— перидерма; 9 — вторичная ксилема; 10 — вторичная флоэма; 11 — ситовид-
ные элементы.
260
Глава 15
формирующиеся в перицикле напротив ксилемных выступов,
часто бывают самыми широкими. В некоторых корнях широкие
лучи не формируются и ксилема кажется довольно гомогенной
(фото 80,Л, Г).
Образование перидермы следует за началом вторичного роста
проводящих тканей. Перициклические клетки претерпевают пе-
риклинальные и антиклинальные деления (рис. 15.1, Г, Е и фо-
то 79, Л). Периклинальные деления обеспечивают увеличение
числа слоев перицикла в радиальном направлении. В результате
нарастания в толщину проводящих тканей и перицикла первичная
кора отодвигается наружу. Первичная кора не нарастает по ок-
ружности, а разрывается и сбрасывается вместе с эпидермой и эн-
додермой (рис. 15.1, Д), Феллоген берет начало в наружной части
перицикла и откладывает наружу феллему. Он может отклады-
вать внутрь феллодерму, но такую феллодерму трудно отличить
от перицикла, который пролиферировал еще до закладки фелло-
гена.
В многолетних корнях работа камбия длится многие годы.
Феллоген также сохраняет свою активность, но он может заме-
щаться феллогеном, возникающим в глубине корня. Если эта
возможность реализуется, то корень, подобно стеблю, образует
ритидом.
Травянистые двудольные
Вторичный рост у травянистых двудольных может быть про-
демонстрирован на примере корня люцерны Medicago sativa [10,
19]. Вторичная ксилема содержит сосуды различного диаметра
главным образом с лестничными и сетчато-пористыми вторичными
стенками. Сосуды сопровождаются волокнами и паренхимными
клетками. Широкие лучи паренхимы делят осевую ксилему на
секторы (фото 79, В), В процессе вторичного роста первичная
ксилема сильно изменяется в результате интенсивного роста пер-
вичной ксилемной паренхимы. Правильность расположения пер-
вичных трахеальных элементов в рядах нарушается, и они частич-
но разрушаются.
Флоэма состоит из ситовидных трубок с клетками-спутниками,
волокон и паренхимных клеток (рис. 15.1,3). Широкие ксилемные
лучи через камбий непрерывно переходят в сходные лучи во
флоэме (фото 79, В). Наружная флоэма состоит только из воло-
кон и запасающей паренхимы; старые ситовидные трубки разру-
шаются. Флоэма сливается непосредственно с перициклической
паренхимой, подстилающей перидерму, за исключением тех мест,
где присутствуют волокна. Пробка, происходящая из феллогена,
формирует защитную ткань.
Корень: вторичная форма роста и придаточные корни
261
Интенсивность вторичного роста у различных травянистых
двудольных, так же как структура тканей и степень развития
перидермы, варьирует (фото 80).
Древесные виды
Структура вторичных проводящих тканей в корнях древесных
видов напоминает только что описанную для корня люцерны [5].
Обычно корни деревьев имеют значительную долю элементов с
лигнифицированными вторичными оболочками (фото 81), но кор-
чи травянистых растений также могут стать сильно склерифици-
рованными (фото 80, Л). Для корней голосеменных (фото 81, Л)
характерен вторичный рост такого же типа, как и для корней
древесных двудольных (фото 81,5), за исключением того, что
их проводящие элементы находятся на более низкой ступени эво-
люционного развития (гл. 8 и 9).
Корни и стебли деревьев гистологически различаются, особен-
но в древесине. По сравнению со стеблями корни имеют меньше
элементов с лигнифицированными вторичными стенками в коре
и древесине и соответственно относительно больший объем парен-
химной ткани [7]. У видов Plaianus, например, корень характери-
зуется более высокими и широкими радиальными лучами, чем
стебель [21]. Древесина корня Plaianus имеет также более широ-
кие сосуды, чем стеблевая древесина, и они так равномерно рас-
пределены, что границы годичных приростов не выявляются. Более
того, изучение древесины Plaianus показывает, что древесина
корня филогенетически более примитивна, чем древесина стебля;
первая обладает более длинными паренхимными тяжами, более
длинными члениками сосудов с большим числом перемычек в
лестничных перфорационных пластинках, а также относительно
менее вытянутыми волокнами по отношению к длине члеников
сосудов. Эти наблюдения противоречат данным об эволюции
первичной ксилемы у однодольных, у которых специализация
трахеальных элементов прогрессирует от корня к надземным
частям (гл. 8).
Гистологические различия между вторичными тканями стеблей
и корней определяются в значительной степени различиями во
внешних условиях, в которых развиваются эти части рас-
тения. Если корни двудольных или голосеменных деревьев под-
вергнуть воздействию света и воздуха, то их древесина, которая
развивается после экспозиции, приобретает большинство призна-
ков, характерных для древесины стеблей [7, 14].
Важный садоводческий и экологический аспект вторичного
роста корня представляет собой способность корней различных
растений одного и того же вида к естественному срастанию —
явление, которое широко распространено среди двудольных и го-
262
Глава 15
Рис. 15.2. Схемы, иллюстрирующие процесс срастания между двумя воздушны-
ми корнями Ficus globosa (поперечный срез). А. У корней, растущих близко друг
к другу, сливаются эпидермальные волоски. Б. Разрастание корней за счет вто-
ричного роста сближает их. В зоне контакта ткани сдавливаются и начинают
пролиферировать лучи. В. В паренхиме закладывается новый камбий, происходя’
щий из пролиферированных лучей и связывающий камбий обоих корней. Г. Два
корня полностью объединяются. (Схемы построены по данным работы [15].)
1 — центральный цилиндр; 2 — пролиферирующие лучи; 3 — смятые ткани; 4 —
камбий; 5 — новый камбий; 6 — пролиферированная ткань луча.
лосеменных растений в тропиках и в умеренной зоне [2]. Два
корня одного и того же дерева также могут срастаться. Там, где
корни приходят в контакт один с другим, они объединяются бла-
годаря вторичному росту. При срастании корней устанавливается
непрерывность проводящей системы между обоими сросшимися
партнерами. Это было показано в эксперименте, когда краски,
яды и радиоактивные вещества вводили в одно дерево и обнару-
живали их в другом [2, 13]. Благодаря срастанию корней многие
деревья оказываются взаимосвязанными, и если некоторые из них
вырубаются, то пни еще долгое время остаются живыми [13, 18].
Срастание корней способствует быстрой передаче инфекции от од-
ного дерева к другому.
Развитие естественных корневых прививок было изучено в
надземных корнях Ficus globosa [15]. Эти корни имеют эпидер-
мальные волоски, которые сливаются с волосками другого корня,
Корень: вторичная форма роста и придаточные корни 263
когда два корня приходят в контакт друг с другом (рис. 15.2, А).
Когда корни увеличиваются в толщину в результате вторичного
роста, они приходят в тесный контакт и сдавливают друг друга.
Лучи, расположенные близко к зоне контакта, пролиферируют и
формируют паренхимную ткань. Эпидерма, а также сжатая кора
и флоэма обоих корней уничтожаются, и пролиферирующая па-
ренхима внедряется в ксилему (рис. 15.2,5). Пролиферирован-
ная паренхима двух корней сливается и образует камбий, который
переходит в камбий двух корней (новый камбий на рис. 15.2,В).
Новый сплошной камбиальный цилиндр образует проводящие тка-
ни так, как если бы он произошел от одного корня
(рис. 15.2,5).
Вариации во вторичном росте
Травянистые двудольные часто имеют ограниченный вторичный
рост, который характеризуется рядом особенностей. У Actaea,
например, проводящая часть вторичной проводящей ткани распо-
ложена обособленными тяжами, отделенными друг от друга ши-
рокими лучами крупноклеточной паренхимы. Эти лучи возникают
в перицикле напротив выступов ксилемы. Деления, способствую-
щие разрастанию лучей в радиальном направлении, осуществля-
ются на уровне камбия между ксилемой и флоэмой. Делящиеся
клетки в лучах можно интерпретировать соответственно как часть
камбия, хотя их нельзя четко идентифицировать на поперечных
срезах.
Actaea, Convolvulus и некоторые другие травянистые растения
с корнями, характеризующимися ограниченным вторичным ростом,
имеют поверхностную перидерму и поэтому сохраняют свою пер-
вичную кору. Подобно остальной части первичной коры эндодерма
разрастается по окружности благодаря радиальным делениям и
тангенциальному растяжению клеток {Actaea) или сминается {Con-
volvulus). В корнях Citrus sinensis перидерма формируется снача-
ла под эпидермой; позже более глубокая перидерма формируется
в перицикле. В некоторых семействах (Rosaceae, Myrtaceae, Onag-
гасеае, Hypericaceae) перицикл формирует защитную ткань, на-
зываемую полидермой (гл. 12). Производные инициального слоя
полидермы не представляют собой обычные клетки пробки, а со-
стоят из рядов несуберинизированных паренхимных клеток, че-
редующихся с рядами суберинизированных клеток, напоминаю-
щих клетки эндодермы.
Запасающие корни
Некоторые видоизменения во вторичной структуре происходят
в связи с развитием запасающих корней (обычно это сочетание
корня и гипокотиля). В корнях Apiaceae, например укропа (Foe-
264
Глава 15
ntculum) [3] или моркови (Daucus) [4], наблюдается вторичный
рост обычного типа, но в ксилеме и флоэме доминирует парен-
хима. У свеклы (Beta) [10], однако, основное разрастание в тол-
щину осуществляется в результате так называемого аномального
типа роста (фото 82). Ряды добавочного камбия, расположенные
примерно концентрически, возникают снаружи нормального ци-
линдра проводящей ткани. Камбиальные клетки отчленяются от
клеток перицикла и флоэмы и образуют несколько колец прово-
дящей ткани, каждый из которых состоит из запасающей парен-
химы и тяжей ксилемы и флоэмы, отделенных друг от друга ши-
рокими радиальными полосами паренхимы (фото 82, В).
Другой тип аномального роста осуществляется в мясистых
тканях придаточных корней батата, или сладкого картофеля
ipomoea batatas [10]. Ксилема содержит значительное количество
паренхимы и формируется обычным образом. В паренхиме вокруг
отдельных сосудов или групп сосудов развивается камбий. В нем
откладывается небольшое число трахеальных элементов в сторону
сосудов, небольшое число ситовидных трубок и млечников
в обратную сторону (от сосудов) и большое число клеток запа-
сающей паренхимы в обоих направлениях (фото 83,Л, Б). Таким
образом, добавочные флоэмные элементы оказываются в той части
корня, которая первоначально дифференцировалась как ксилема.
Камбий, занимающий нормальное положение, отделяет, как обыч-
но, ксилему от флоэмы, и перидерма перициклического происхож-
дения располагается на периферии (фото 83, Б). В мясистых
стержневых корнях и в стеблях некоторых Brassicaceae (турнепс,
редис, кольраби, брюква и др.) паренхима ксилемы и сердцевины
(если она присутствует) пролиферирует, и затем в этой паренхиме
возникают камбий и проводящие ткани [10] (фото 83, В, Г).
Общим признаком всех мясистых запасающих органов, проис-
ходящих из гипокотилей, корней, а иногда и стеблей [кольраби
(Brassica caulorapa)], является наличие большого количества за-
пасающей паренхимы, пронизанной проводящими тканями. Тесная
связь между проводящими и запасающими тканями достигается
благодаря различным модификациям вторичного роста.
Физиологические аспекты вторичного роста
в корнях
Тот факт, что изолированные корни не способны переходить
к вторичному росту, свидетельствует о том, что развитие камбия
в корнях зависит от какого-то фактора (или факторов), выраба-
тываемого в побеге [24]. В соответствии с этим объяснением при
изучении влияния фотопериода на рост корня было показано, что
утолщение запасающих корней, характерное для некоторых сель-
Корень: вторичная форма роста и придаточные корни
265
скохозяйственных растений, зависит от относительной длины дня
и ночи, при которых происходит развитие побега. Эта связь рас-
сматривается как доказательство того, что при надлежащем
фотопериодическом стимуле побег синтезирует вещества, которые
транспортируются к корням и там индуцируют и поддерживают
камбиальную активность. В экспериментах с изолированными
корнями, получавшими питание в агаровой среде в виде смеси
компонентов в различных комбинациях, эти вещества были иден-
тифицированы— к ним относятся сахар, витамины и гормоны.
Для корней требуются различные комбинации веществ разных
видов. Например, для вторичного роста корней гороха в среде
должны быть сахароза и ауксин в относительно высокой концен-
трации, в то время как корни редиса требуют дополнительно
цитокинин в низкой концентрации [23, 25].
Зависимость стимуляции камбиальной активности корня от
побега выражается также в особенностях сезонной камбиальной
активности, характерной для деревьев, у которых наблюдается
периодическое торможение роста. Как подчеркивалось в гл. 10,
возобновление камбиальной активности в побеге весной, очевидно,
стимулируется ростовыми веществами, синтезирующимися в про-
буждающихся почках. Многочисленные работы показали, что
стимул передается из почек вниз по стеблю в корни и к их кон-
чикам [7]. Таким образом, весеннее пробуждение камбия в корне
(если корень находится в полном покое) происходит после того,
как оно уже произошло в стебле. Прекращение вторичного роста
осенью также осуществляется в стебле в базипетальной последо-
вательности и, по-видимому, в корне совершается позже, чем в
стебле [6] Но, как показано работами на видах Pinus [71, в са-
мом корне волна камбиальной активности распространяется ба-
зипетально, как и в побеге, т. е. от кончика к основанию корня.
Придаточные (адвентивные) корни
Термин ,,придаточный” (адвентивный) корень имеет несколько
разных значений. В этой книге он широко используется для обо-
значения корней, которые закладываются на надземных частях
растения, на подземных стеблях и на более или менее старых
частях корня, особенно тех, которые подвержены вторичным из-
менениям. Придаточные корни могут развиваться у интактных
растений, растущих в естественных условиях, а также могут за-
кладываться в связи с их инфицированием болезнетворными
агентами (фото 84), в результате экспериментальных воздейст-
вий или каких-либо повреждений. Они могут развиваться на от-
резанных частях растений или в культуре ткани. Некоторые
придаточные корни развиваются из ранее заложившихся покоя-
266
Глава 15
щихся примордиев, и для начала их роста требуется дополни-
тельный стимул. Иногда нет четкого различия между придаточ-
ными и боковыми корнями. Боковые корни определяются как
корни, обычно формирующиеся в акропетальной последователь-
ности на материнских корнях, находящихся еще в первичной
стадии роста. Корни, дающие начало боковым корням, могут быть
стержневыми или придаточными или, наконец, боковыми различ-
ных порядков, развивающимися на корнях обоих этих типов.
Придаточные корни широко распространены среди всех сосу-
дистых растений и формируются на многих частях растения [1,
8]. Они встречаются на узлах в связи с пазушными побегами
(например, при кущении злаков), но могут быть также и неза-
висимыми от пазушных почек и развиваться на междоузлиях.
У некоторых видов придаточные корни образуются листьями,
отделяемыми от растения (Begonia, Peperomia, Sedum). Развитие
придаточных корней важно для распространения растений посред-
ством стеблевых черенков или отдельных листьев. Придаточные
корни составляют главную корневую систему у низших сосудистых
растений, однодольных и двудольных, которые размножаются по-
средством корневищ и усов, а также у водных растений, сапрофитов
и паразитов. Придаточная корневая система особенно характерна
для однодольных. Через несколько недель после прорастания
хлебное растение может дать 50 м корней, слагающихся из дю-
жины или большего числа придаточных корней, несущих в свою
очередь около 2000 боковых корней [16]. Одним из характерных
признаков однодольного растения является наличие придаточных
корней, рано замещающих стержневой корень проростка [22],
однако, когда развиваются придаточные корни, стержневой (глав-
ный) корень, по-видимому, отмирает не всегда [11, 12].
По происхождению и развитию придаточные корни сходны с
боковыми корнями: они обычно имеют эндогенное происхождение
и закладываются близко к проводящим тканям (фото 84), про-
растая через ткани, локализованые снаружи от места закладки.
В продолжение этого роста придаточный корень, закладывающий-
ся в относительно старом стебле, может наткнуться на препятст-
вие в виде влагалища из склеренхимы на периферии центрального
цилиндра, что будет способствовать отклонению корня от его нор-
мального радиального хода [20, 22].
В молодых стеблях двудольных и голосеменных придаточные
корни обычно возникают в межпучковой паренхиме, а в более
старых стеблях — в луче близ камбия. Таким образом, новый ко-
рень оказывается расположенным близко как к ксилеме, так и к
флоэме [17, 20]. Когда придаточные корни развиваются на че-
ренках, они могут закладываться в каллусной ткани, которая
часто формируется у основания черенков. Если считать, что при-
даточный корень закладывается в стебле голосеменных или по-
Корень: вторичная форма роста и придаточные корни
267
крытосеменных в перицикле, то изучение его развития показывает,
что в действительности эта ткань является первичной флоэмой
(гл. 16).
Придаточные и так называемые регенеративные боковые кор-
ни очень важны для роста деревьев. Хотя первоначально корни
деревьев состоят из главного корня и его боковых корней, в про-
цессе их роста в почве или во время пересадки деревьев, принятой
в садоводческой практике, они часто повреждаются, так что в
ходе их дальнейшего роста первичные корни замещаются кор-
нями, формирующимися близко к поврежденным поверхностям
(«замещающие корни»). Происхождение замещающих корней бы-
ло хорошо проиллюстрировано на примере изучения подрезанных
корней благородной пихты (Abies nobilis) [26]. Заживление раны
и образование каллуса (гл. 17) имеет место на подрезанной по-
верхности корней. Затем возникают замещающие корни, отчасти
из неразрушенных тканей, соседствующих с раневой поверхно-
стью, отчасти из производных каллуса. Более молодые подрезан-
ные корни образуют замещающие корни в тех же самых
положениях, где закладываются боковые корни, т. е. напротив
выступов протоксилемы, и они зарождаются в перицикле или
перициклическом каллусе. Если корень подрезан после того, как
сформировались некоторые вторичные ткани, замещающие корни
возникают в различных положениях по окружности центрального
цилиндра и закладываются в обычном камбии или в камбии, ко-
торый формируется в каллусе.
Зачатки придаточных корней образуются путем делений па-
ренхимных клеток (клеток каллуса или других паренхимных кле-
ток), напоминающих деления, ведущие к формированию боковых
корней в перицикле молодых корней. Прежде чем придаточный
корень выйдет из стебля или корня, он формирует апикальную
меристему, корневой чехлик, зачаточный проводящий цилиндр и
первичную кору. Когда в придаточных корнях дифференцируются
проводящие элементы, клетки каллуса или другие паренхимные
клетки, локализованные на проксимальном конце примордия,
дифференцируются в проводящие элементы и обеспечивают связь
с соответствующими элементами формирующегося органа.
Явление образования придаточных корней широко исследуется
в связи с изучением ростовых веществ. В черенках, которые ес-
тественным образом способны регенерировать корни, ауксины
увеличивают число и интенсивность развития придаточных корней,
в то время как гиббереллины сокращают их число. Чтобы понять
подобные антагонистические воздействия на цитологическом
уровне, было исследовано действие этих двух веществ на корневые
зачатки, взятые на различных стадиях развития интактного расте-
ния ивы [9]. Действие ауксина было изучено с помощью тормо-
жения его транспорта трииодбензойной кислотой. Гибберелловая
268
Глава 15
кислота добавлялась к питательному раствору, в который поме-
щались корни растения. Было показано, что более старые при-
мордии менее зависимы от базипетально распространяющегося
ауксина, чем примордии только что заложившиеся. Гибберелловая
кислота вызывала редукцию числа клеток в растущих приморди-
ях, но незначительно влияла на процесс закладки. Было сделано
заключение, что гибберелловая кислота блокирует действие аук-
сина на каком-то этапе уже после того, как корень заложился.
СПИСОК ЛИТЕРАТУРЫ
1. Баранова Е. А. Закономерности образования придаточных корней у расте-
ний, Труды Главного Ботанического сада, 2, 168—193 (1951).
2. Bormann F. Н. Root grafting and noncompetitive relationship between trees,
pp. 237—246, in: Tree growth, Kozlowski T. T., ed., New York, Ronald Press
Company, 1962.
3. Bruch H. Beitrage zur Morphologic und Entwicklungsgeschichte der Fenchel-
wurzel (Foeniculum vulgare Mill.), Beitr. Biol. Pflanz., 32, 1—26 (1955).
4. Esau K- Developmental anatomy of the fleshy storage organ of Daucus carota,
Hilgardia, 13, 175—226 (1940).
5. Esau K. Vascular differentiation in the pear root, Hilgardia, 15, 299—311
(1943).
6. Esau K. Plant anatomy, 2nd ed., New York, John Wiley & Sons, 1965.
7. Fayle D. C. F. Radial growth in tree roots, Fac. Forest., Univ. Toronto, Tech.
Rep., 9, 1—183 (1968).
8. Guttenberg H. von. Der primare Bau der Angiospermenwurzel, Handbuch der
Pflanzenanatomie, Band 8, Teil 5, 1968.
9. Haissig В. E. Meristematic activity during adventitious root primordium deve-
lopment. Influences of endogenous auxin and applied gibberellic acid, Plant
Physiol, 49, 886—892 (1972).
10. Hayward H. E. The structure of economic plants, New York, The Macmillan
Company, 1938.
11. Kausche W. Die Primarwurzel von Zea mays L., Planta, 73, 328—332 (1967).
12. Kausche W. Lebensdauer der Primarwurzel von Monokotylen, Naturwiss., 54,
475 (1967).
13. Miller L., Woods F. W. Root grafting in loblolly pine, Bot. Gaz., 126, 252—
255 (1965).
14. Morrison T. M. Comparative histology of secondary xylem in buried and expo-
sed roots of dicotyledonous trees, Phytomorphology, 3, 427—430 (1953).
15. Rao A. N. Development anatomy of natural root grafts in Ficus globosa, Aust.
J. Bot, 14, 269—276 (1966).
16. Russell R. S. Root systems and plant nutrition — some new approaches, Ende-
avour, 29, 60—66 (1970).
17. Satoo S. Origin and development of adventitious roots in layered branches of
4 species of conifers, J. Jap. Forestry Soc., 37, 314—316 (1955).
18. Schultz R. P. Intraspecific root grafting in slash pine, Bot. Gaz., 133, 26—
29 (1972).
19. Simonds A. O. Histological studies of the development of the root and crown
of alfalfa, Iowa State Col. J. Sci., 9, 641—659 (1935).
20. Stangler В. B. Origin and development of adventitious roots in stem cuttings
of chrysanthemum, carnation, and rose, N. Y. Agr. Exp. Sta. Mem., 342,
(1956).
21. Suss H., Milller-Stoll W. R. Zur Anatomie des Ast-, Stamm- und Wurzelholzes
von PlatanusXacerifolia (Ait.), Willd, Osterr. Bot. Z., 121, 227—249 (1973).
Корень: вторичная форма роста и придаточные корни
269
22. Tomlinson Р. В. Anatomy of the monocotyledons. II. Palmae, Oxford, Claren-
don Press, 1961.
23. Torrey J. G. Cellular patterns in developing roots, Symp. Soc. Exp. Biol., 17,
285—314 (1963).
24. Torrey J. G. Development of flowering plants, New York, The Macmillan Com-
pany, 1967.
25. Torrey J. G., Loomis R. S. Auxin-cytokinin control of secondary vaskular tis-
sue formation in isolated roots of Raphanus, Amer. J. Bot., 54, 1098—1106
(1967).
26. Wilcox H. Regeneration of injured root systems in noble fir, Bot. Gaz., 116r
221—234 (1955).
Глава 16
Стебель: первичная
орма роста
Внешняя морфология
Надземная осевая часть растения имеет более сложную струк-
туру, чем корень, так как стебель тесно связан с листьями. Чтобы
подчеркнуть эту связь, употребляют термин «побег», который
относится к стеблю с листьями как к единой системе.
В отличие от корня побег имеет междоузлия и узлы с одним
или большим числом листьев, прикрепленных к каждому узлу.
В зависимости от степени развития междоузлий внешний вид
побегов различен. Они могут быть удлиненными с хорошо раз-
личимыми узлами и междоузлиями или укороченными — без вы-
раженных междоузлий, с листьями, собранными в виде розетки
или луковицы. К другим особенностям, создающим разнообразие
внешней морфологии побега, относятся: расположение листьев,
способ их прикрепления, развитие или неразвитие пазушных по-
чек в боковые побеги, а также уровень, на котором происходит
ветвление. Различия связаны также с типом роста и биологиче-
скими особенностями побега, т. е. они зависят от того, развива-
ется ли побег в воздушной среде или под землей (корневища,
клубни, клубнелуковицы, луковицы), в воде или на земле и растет
ли он прямо, вьется или стелется.
Первичная структура
Стебель, подобно корню, состоит из тканей трех типов: по-
кровных, основных и проводящих (фото 85). Разнообразие пер-
вичной структуры стебля у представителей систематических групп
обусловлено главным образом тем, как располагаются друг отно-
сительно друга основная и проводящая ткани. У хвойных и дву-
дольных проводящая система междоузлий обычно выглядит как
полый цилиндр, разделяющий наружную и внутреннюю части
основной ткани соответственно на первичную кору и сердцевину.
Структурные элементы проводящей системы — проводящие пуч-
ки — отделены друг от друга более или менее широкими прослой-
ками основной паренхимы — межпучковой паренхимы, которая
связывает сердцевину и первичную кору (фото 85). Эта ткань
называется межпучковой, так как она расположена между пучка-
ми, или фасцикулами. Прослойка межпучковой паренхимы часто
называется сердцевинным лучом. Если межпучковые зоны узкие
Стебель: первичная форма роста
271
и состоят из одного или двух слоев клеток, то чтобы различить
отдельные структурные единицы проводящей системы, необходимо
исследовать процесс развития стебля [2].
Стебли многих папоротников, некоторых травянистых двудоль-
ных и большинства однодольных имеют сложное расположение
проводящих тканей. Как видно на срезах, пучки могут быть рас-
положены в виде нескольких колец (гл. 17) или рассеяны по все-
му срезу (фото 86, Д). Когда на поперечном срезе междоузлия
проводящие пучки не образуют кольца, деление основной ткани
на первичную кору и сердцевину выражено слабо или вообще
отсутствует.
Эпидерма
Важнейшие особенности структуры эпидермы надземных ча-
стей растений описаны в гл. 7. Наличие устьиц в эпидерме для
стеблей менее характерно, чем для листьев. Эпидерма стебля
обычно состоит из одного слоя клеток с кутинизированными обо-
лочками и имеет кутикулу. Это живая ткань, способная к митоти-
ческой активности. Важно отметить данную особенность в связи
с тем, что в процессе первичного и вторичного роста стебля в тол-
щину ткань испытывает натяжение. Эпидермальные клетки отве-
чают на это натяжение ростом в тангенциальном и делением в
радиальном направлениях. Устойчивая митотическая активность
в стеблевой эпидерме особенно хорошо выражена у видов с позд-
ним формированием перидермы (гл. 12).
Первичная кора и сердцевина
Первичная кора стеблей содержит паренхиму, обычно с хлоро-
пластами (фото 85,Б). Межклетники выражены, но иногда со-
средоточены в срединной части первичной коры. У многих водных
покрытосеменных первичная кора развивается как аэренхима с
системой крупных межклетников (гл. 17). Периферическая часть
коры часто содержит колленхиму (фото 85, Д) в виде тяжей или
более или менее непрерывного слоя. У некоторых растений, осо-
бенно у злаков, в качестве первичной опорной ткани в наружной
зоне стебля развивается не колленхима, а склеренхима (фото 86,
Б). Хвойные, как правило, не имеют специальной механической
ткани в коре.
Как мы уже обсуждали в гл. 14, самый внутренний слой пер-
вичной коры корней сосудистых растений обладает особыми свой-
ствами клеточных оболочек и называется эндодермой. В стеблях
хвойных и покрытосеменных морфологически дифференцирован-
ная эндодерма обычно отсутствует. В молодых стеблях самый
внутренний слой (или слои) может содержать большое количест-
272
Глава 16
во крахмала, и тогда его выделяют среди прочих слоев, называя
крахмалоносным влагалищем (фото 85). У некоторых двудольных,
однако, в самом внутреннем слое коры стебля развиваются пояски
Каспари [57]. Хорошо дифференцированную эндодерму имеют в
стебле и многие низшие сосудистые растения.
Когда в самом внутреннем слое коры крахмал не аккумулиру-
ется и никаких характерных признаков клеточных оболочек не
развивается, отличить кору от зоны проводящих тканей довольно
трудно. Однако независимо от того, отделена от первичной коры
зона проводящих тканей структурно или нет, она окружена фи-
зиологическим барьером, образующимся в результате химического
взаимодействия между веществами, поступающими из проводящих
тканей и из первичной коры. При определенных условиях хими-
ческие реакции могут вести к развитию поясков Каспари или к
отложению крахмала или к тому и другому одновременно [52].
В широком смысле слова термин эндодерма и образованное от
него определение эндодермоидный относятся к границе первичной
коры в любом из ее проявлений [12].
Сердцевина обычно состоит из паренхимы, которая может со-
держать хлоропласты. Во многих стеблях центральная часть
сердцевины в процессе роста разрушается. Часто такая деструкция
происходит только в междоузлиях, в то время как в узлах серд-
цевина сохраняется (узловые диафрагмы). Иногда ряды горизон-
тальных пластинок сердцевинной ткани остаются также в меж-
доузлиях (Juglans, Pterocarya). Сердцевина, по крайней мере в
центральной части, имеет хорошо выраженные межклетники. В ее
более долговечной периферической части клетки мелкие и распо-
ложены компактнее. Поскольку сердцевина называется также
медуллой, отчетливо выраженная периферическая зона сердце-
вины называется перимедуллярной зоной, или медуллярным вла-
галищем (гл. 17).
Как первичная кора, так и сердцевина могут содержать раз-
личные идиобласты с кристаллами и другими эргастическими
включениями, а также склереиды. Если растение имеет млечники,
они могут встречаться и в сердцевине, и в коре.
Проводящая система
ПРОВОДЯШИЕ ПУЧКИ
Первичная проводящая система семенных растений состоит из
тяжей, разнообразных по размеру и степени обособленности. Обо-
собленные индивидуальные тяжи обычно называют проводящими
пучками. Флоэма и ксилема в проводящих пучках могут распола-
гаться по-разному. Чаще всего встречается коллатеральное распо-
ложение тканей, при котором флоэма лежит по одну сторону
Стебель: первичная форма роста 273
(абаксиальную) от ксилемы (фото 85,5 и 86,5). У некоторых
папоротников, а также у некоторых двудольных растений (Аро-
cynaceae, Asclepiadaceae, Convolvulaceae, Cucurbitaceae, Solanaceae
и некоторые трибы Asteraceae) одна часть флоэмы располагается
снаружи, а другая — с внутренней стороны ксилемы. Такое распо-
ложение называется биколлатеральным (рис. 16.7,А), а соответ-
ствующие участки флоэмы называются наружной (абаксиальной)*
и внутренней (адаксиальной) флоэмой.
Проводящие пучки могут быть также концентрическими [12]„
при этом или флоэма окружает ксилему (амфикрибралъные пуч-
ки), или ксилема окружает флоэму (амфивазальные пучки). Ам-
фивазальные пучки, по-видимому, филогенетически довольно спе-
цифичны и встречаются иногда в стеблях ряда двудольных (серд-
цевинные пучки у Rheum, Rumex, Mesembryanthemum, Begonia) и
однодольных (Araceae, Liliaceae, Juncaceae, Сурегасеае). Амфи-
крибральные пучки наиболее обычны у папоротников, но встреча-
ются также и у покрытосеменных. Мелкие пучки в цветках, пло-
дах и семезачатках могут быть амфикрибральными (гл. 20).
ЛИСТОРАСПОЛОЖЕНИЕ И СТРУКТУРА
ПРОВОДЯЩЕЙ СИСТЕМЫ
Структура проводящих пучков в стебле семенного растения
отражает тесную взаимосвязь между стеблем и листьями. В каж-
дом узле один или большее число проводящих пучков отходит от
центрального цилиндра, состоящего из тяжей стебля, к листу
(или листьям), прикрепленному к данному узлу. Ответвления от
проводящей системы стебля к листьям называются листовыми сле-
дами. Листовой след тянется от места его слияния со стеблевым
пучком до выхода в лист. Один лист может иметь один или более
листовых следов (один на рис. 16.1 и 16.2, три на рис. 16.4). Сле-
ды бывают различной длины, как это показывает подсчет числа
междоузлий, пересекаемых листовым следом перед вхождением
в лист (менее 1 междоузлия у хвойных, от 1 до 35 у различных
видов двудольных [Ю]).
Листорасположение, пли филлотаксис, обнаруживает значи-
тельное разнообразие, но в основе его лежат три главных типа:
мутовчатое, когда от каждого узла отходит несколько листьев
(супротивное расположение двух листьев в каждом узле может
рассматриваться как подтип мутовчатого, рис. 16.19), супротивно-
очерёдное, или двурядное, когда листья располагаются по одному
в каждом узле, но на противоположных сторонах оси (рис. 16.3),.
и очерёдное, или спиральное (рис. 16.1, А, В).
Специалисты интересуются значением специфического листо-
расположения и используют различные признаки для анализа за-
кономерностей листорасположения в математических терминах
18 К. Эзау, кн. 2.
274
Глава 16
Рис. 16.1. Схема первичной проводящей системы Hectorella caespitosa. А. Попе-
речный срез верхушки стебля и листьев. Листовые следы и симподии пронумеро-
ваны по соответствующим листьям (мелкие цифры 1—19). Кривыми линиями
(штриховой и двойной штриховой) обозначена пара контактных парастих. Б. По-
перечный срез стебля вблизи узла листа 23. В отличие от симподиальных стеб-
левых пучков флоэмные участки листовых следов зачернены. В. Трехмерная
схема связей листовых следов со стеблевыми пучками. (Воспроизводится из ра-
боты [46] с некоторыми изменениями.) 1—листовые бугорки; 2 — генетическая
спираль; 3— листовой след; ф средние жилки; V основания листьев.
[8, 55]. Классическим приемом является применение угла расхож-
дения между двумя следующими друг за другом листьями. При-
меры расхождения: V2, 7з, 2/б, 3/s, 5/1з (ряды Фибоначчи, см. сло-
варь терминов) и другие доли окружности, которые приближаются
к 0,382 (угол расхождения 137,5°). Таким образом, говорят о
листорасположении V2, 7з, 2А и т. д. У растения с очерёдным ли-
сторасположением линия, проходящая от листа к листу и связы-
вающая листья в порядке их возникновения в верхушке побега,
Стебель: первичная форма роста
275
является спиралью, или парастихой, «генетической спиралью»
классических ботаников.
Выражение угла расхождения в виде дроби может дать опре-
деленную информацию о распределении листьев вдоль генетиче-
ской спирали. Например, при листорасположении 5/1з на каждые
пять витков вокруг оси приходится по 13 листьев, причем листья
п и п+13 находятся друг над другом (рис. 16.1, В; листья 13 и
26, 14 и 27, 15 и 28 и т. д.).
Помимо генетической спиральной парастихи на данном побеге
могут быть представлены системы и других парастих — одни бо-
лее пологие, другие более крутые, одни закрученные по часовой
стрелке, другие — против часовой стрелки. У растений с супро-
тивным или двурядным листорасположением расположенные друг
над другом листья можно соединить прямой линией. Такие ряды
листьев называются ортостихами.
На рис. 16.1, изображающем двудольное растение (Hectorella
[46]) с очерёдным листорасположением, генетическая спираль
представляет собой пологую закрученную против часовой стрелки
(как видно сверху) парастиху (рис. 16.1, В). Несколько более
крутые, закрученные против часовой стрелки парастихи можно
провести, соединив места прикрепления листьев с шагом в 3 меж-
доузлия, например 1—4—7—10—13; и еще более крутые, закру-
ченные по часовой стрелке парастихи получаются при шаге в 5
междоузлий, например 1—6—11—16—21.
Когда речь идет об интервалах между листьями одной и той
же парастихи, можно говорить не о числе междоузлий, а о пла-
стохроне. Этот термин обозначает интервал времени между
закладкой двух последовательных листьев в апексе. Таким обра-
зом, можно сказать, что на рис. 16.1, А листья в различных систе-
мах парастих находятся в пластохронных интервалах 1 (генети-
ческая спираль), 2, 3, 5 и 13.
Особенности филлотаксиса часто изучаются на поперечных сре-
зах верхушки побега, где молодые листья еще не разделены вытя-
нутыми междоузлиями. На таких срезах можно различать пара-
стихи: листья, закладывающиеся в апексе, располагаются вдоль
них проксимально один по отношению к другому. Такие пара-
стихи называются контактными [6]. На рис. 16.1, Л две группы
контактных парастих обозначены кривыми линиями, проведенны-
ми через одну парастиху в каждой группе. Одна группа состоит
из 5 парастих, проходящих через листья с пластохронным интер-
валом 5, вторая — из 3 парастих с пластохронным интервалом 3.
Некоторые парастихи на данном побеге проходят через листья,
непосредственно связанные друг с другом сосудами. Например, в
проводящей системе Abies (хвойное; рис. 16.2, Л) 13 парастих
листьев накладываются на 13 продольных пучков, каждый из
которых связан сосудами с листьями, отстоящими друг от друга
18*
276
Глава 16
7 2 105 -18 3 11 б 1 9 4 12
III IV VI VIII XII
Рис. 16 2. Структура первичной проводящей системы Abies concolor. А. Схема
проводящей системы (показана как бы развернутой). Римскими цифрами обо-
значены симподии, арабскими цифрами — листовые следы. Цифра 1 относится
к еще не сформировавшемуся листу в верхушке побега. Б. Поперечный срез
центрального цилиндра на уровне, показанном на рис. А штриховой линией.
Флоэмные участки листовых следов в отличие от симподиальных стеблевых пуч-
ков зачернены (Воспроизводится из работы [33] с некоторыми изменениями.)
V основания листьев
27
на 13 пластохронов (например, листья 33—20—7, 28—15—2
и т. д.).
Продольные пучки, от которых отходят листовые следы, отно-
сятся к стеблевым пучкам, называемым иначе осевыми, или кау-
линовыми (от слова caulis — стебель), пучками. Совокупность
стеблевых пучков с листовыми следами, которые от них ответвля-
ются, называется симподием. В побеге Abies (рис. 16.2, А) име-
ется 13 симподиев.
13 симподиев на рис. 16.2, А не связаны между собой прово-
дящей тканью, а составляют независимые структурные единицы
проводящей системы. Такой тип проводящей системы называется
открытым. Стебель Hectorella на фото 86, В также имеет 13 сим-
подиев, но так как каждый лист связан с двумя симподиями, от-
дельных, независимых симподиев нет; такая сосудистая система
называется закрытой.
Благодаря тому что симподии через листовые следы непрерыв-
но связаны с листьями, они могут быть пронумерованы по соот-
Стебель: первичная форма роста
277
ветствующим листьям. На схемах поперечных срезов стеблей, изо-
браженных на рис. 16.1, Б и 16.2,5, проводящие пучки обозначены
теми же номерами, что и листья, с которыми они связаны. Пучки
с флоэмой, обозначенной черным цветом, — это листовые следы.
Остальные пучки — стеблевые, перерезанные ниже уровня ответ-
вления тех листовых следов, номер которых они несут.
Схема проводящей системы стебля с нумерацией единиц
системы по листьям, с которыми они связаны, вовсе не означает,
что стебель не имеет своей собственной проводящей ткани. Она
подчеркивает, однако, что стеблевая проводящая система форми-
руется в связи с листьями. Более того, если стебель и лист имеют
филогенетически общее происхождение [17], никаких фундамен-
тальных различий между листовыми следами и стеблевыми пуч-
ками не существует. Соответствующие термины имеют описа-
тельное, топографическое значение.
Опыты по удалению листовых примордиев у папоротников и
покрытосеменных [13] дали результаты, подкрепляющие пред-
ставление о том, что обычная форма проводящей системы побегов
определяется взаимоотношениями листа и стебля, складывающи-
мися в ходе индивидуального развития. Если развитие листа по-
давлено, проводящая система стебля формируется в виде непре-
рывной колонки без листовых следов и этим напоминает прово-
дящую систему в тех осевых органах растений, в которых листья
отсутствуют или они мелкие и широко расставлены по оси (во мно-
гих корневищах, столонах, черешках, осях соцветий, корнях).
Структура листовых следов и стеблевых пучков не одинакова.
На поперечных срезах стеблей листовые следы округлые и имеют
большее количество ксилемы, чем стеблевые пучки. Как видно
Рис. 16.3. Поперечный срез вер-
хушки побега Zea mays, показы-
вающий двурядное расположение
листьев. Каждый лист окружает
стебель. Края всех листьев, кроме
самого молодого, перекрывают
друг друга. Молодые, интенсивно
растущие зоны отмечены точками
/ — ось побега; 2 — край листа;
3 — проводящие пучки.
278
Глава 16
Рис. 16 4. Схемы проводящей системы стебля двудольного (Ultnus). (Smithson,
Proc. Leeds Phil. Soc., 6, 211—220, 1954.) А. Поперечный срез. Б Продольное
изображение центрального цилиндра, который как бы разрезан по срединному
листовому следу 5 и развернут в плоскости Более мелкими цифрами на обоих
рисунках обозначены листовые следы. Поперечный срез на рис. А соответствует
самому верхнему уровню стебля на рис. Б. 1—колленхима; 2 — перидерма; 3—
листовой след; 4— листовая щель; 5 — симподиум; 6 — медианный след; 7 — ла-
теральный след.
на продольном срезе, листовые следы расширяются выше места
ответвления от стеблевых пучков [10] (рис. 16.4). Другой харак-
терной чертой листовых следов у представителей многих таксонов
является присутствие в сосудистых тканях паренхимных клеток,
которые имеют выросты клеточной оболочки и служат передаточ-
ными клетками [21]. Эти клетки особенно хорошо заметны в
ксилеме листового следа и менее развиты во флоэме. Тот факт,
что передаточные клетки связаны с ответвляющимися листовыми
следами, предполагает существование какого-то приспособления
к интенсивной передаче растворенных веществ в латеральном на-
правлении, которое должно располагаться вблизи апикальной
меристемы в проростке и пазушных почек во взрослом растении.
У однодольных сосудистые связи между листьями и стеблем
очень сложны, поскольку каждый лист имеет много листовых
следов и стебель соответственно имеет много отдельных проводя-
щих тяжей (фото 86, Л). Например, многочисленные проводящие
пучки, которые видны в листьях на поперечном срезе верхушки
Стебель: первичная форма роста
279
Рис. 16.5. Схема проводящей системы Rhapis excelsa. А. Пучки вертикальной
проекции. Листовые следы отходят от вертикальных пучков. Чем крупнее пучок,
тем он глубже расположен. Длина стебля уменьшена в четыре раза по сравне-
нию с диаметром. Б. Разделение листовых следов и вертикальных пучков. (Вос-
производится из работы [58] с некоторыми изменениями.) 1 — пучок средних
размеров; 2— листовой след; 3 — мелкий пучок; 4 — крупный пучок; 5 — круп-
ный листовой след; 6 — мелкий листовой след; 7 — основание листа; 8— почка;
9— вертикальные пучки; 10 — точки расхождения; 11 — соединения между пуч-
ками.
побега Zea mays (рис. 16.3), входят в стебель как отдельные тяжи
и связаны с равным числом стеблевых тяжей, разбросанных по
всему срезу.
Проводящие системы стеблей обычно изучают, зарисовывая
положение проводящих пучков на серийных срезах побега и за-
тем реконструируя по этим рисункам объемное изображение. Этот
метод анализа достаточно сложен даже по отношению к побегам,
имеющим всего один или несколько следов в листе; к однодоль-
ным же из-за сложности системы тяжей в их побегах он вообще
280
Глава 16
неприменим. Например, на поперечном срезе стебля кокосовой
пальмы видно около 20 000 проводящих пучков в центральной
части и десятки тысяч мелких пучков (которые также связаны с
листьями) в периферической зоне среза [61].
Существенный прогресс в понимании организации проводящей
системы однодольных был достигнут при использовании микроки-
носъемки серийных поперечных срезов стебля. Кинокадры проек-
тируются на чертежную бумагу так, чтобы можно было измерить
смещение пучков на последовательных срезах. Метод дает воз-
можность быстро проанализировать трехмерную структуру стеб-
ля [58—61]. Однако, когда необходимо сообщить о полученных
результатах лицам, не принимавшим участия в эксперименте,
приходится прибегать к помощи упрощенных схем. Две такие схе-
мы на рис. 16.5 изображают участки проводящей системы Rhapis
excelsa.
Листовые следы у Rhapis ответвляются от нескольких крупных
и множества мелких осевых тяжей. Мелкие тяжи образуют больше
листовых следов, чем более крупные (рис. 16.5,Л). В продольном
направлении тяжи в стебле идут по пологой спирали (не так, как
показано на рис. 16.5) и на разных уровнях побега располагаются
на различных расстояниях от периферии стебля. Крупные пучки
группируются ближе к центру, чем мелкие. В узлах тяж резко
поворачивает к месту прикрепления листа и делится на веточки
(рис. 16.5). Одна из двух крупных ветвей и есть листовой след, а
другая продолжается в вертикальный стеблевой пучок. Несколько
мелких пучков служат в качестве следов пазушного соцветия,
а остальные мелкие пучки образуют анастомозы с соседними
пучками (рис. 16.5, Б).
Изучение проводящей системы у крупных однодольных пока-
зало, что эти растения имеют две системы пучков — внутреннюю
и внешнюю [61]. Во внутренней системе листовые следы связаны
с непрерывными вертикальными пучками, а в наружной — с пуч-
ками, которые слепо оканчиваются в коре. Это различие — резуль-
тат относительно поздней дифференциации наружных пучков.
Некоторые однодольные имеют узловые пластинки с сетью
проводящих пучков (например, фестукоидные злаки [23, 27], ку-
куруза [28]). У этих растений проводящие пучки или разбросаны
(фото 86, Л), или расположены близко к периферии и на попе-
речных срезах стебля видны в виде кольца (гл. 17).
ЛИСТОВЫЕ ЩЕЛИ
В области узла, где листовой след ответвляется от проводя-
щего цилиндра стебля по направлению к основанию листа, в ци-
линдре формируется зона паренхимы (рис. 16.2, Б, см. листовые
следы 25—28), Эта зона, которая на поперечных срезах выглядит
Стебель: первичная форма роста
281
как довольно широкая межпучковая зона, называется листовой
щелью. Листовая щель, следовательно, представляет собой па-
ренхимную зону в центральном проводящем цилиндре стебля,
лежащую против (адаксиально) верхнего участка листового сле-
да, примерно на уровне прикрепления листа.
Листовые щели могут быть разной протяженности как в лате-
ральном, так и в вертикальном направлениях. Если центральный
проводящий цилиндр имеет много вытянутых вдоль оси межпуч-
ковых зон, щели сливаются с ними (рис. 16.4,5). В таких стеблях
о границах щели можно говорить только условно.
Число листовых следов и листовых щелей различно у разных
растений (рис. 16.6), а также может варьировать вдоль стебля
одного и того же растения. Таким образом, структура узлов име-
Рис. 16.6. Поперечные срезы стеолей с различными типами структуры узла [12].
В листовых следах ксилема зачернена. A. Spiraea; однолакунный тип. Б. Salix;
трехлакунный тип В. Brassica; трехлакунный тип. Г. Veronica; однолакунный
тип. Д. Rumex; многолакунный тип. Е. Clerodendron; однолакунный тип с двумя
следами 1—листовой след; 2 — срединный след; 3 — латеральный след; 4 —
листовые щели; 5 — следы веток; 6 — листовая и веточная щели.
282
Глава 16
ет другие формы, которые обозначаются специальными терминами.
Термин щель заменяется термином лакуна, и тогда говорят об
однолакунных, трехлакунных и многолакунных узлах в зависи-
мости от того, связан ли данный лист в узле с одной, тремя или
несколькими лакунами. Если к узлу прикрепляется более одного
листа, узел характеризуется только по одному из них (рис. 16.6,
Г). Если лист имеет более одного листового следа и ему противо-
стоят три или более щелей, то щель (и связанный с ней след),
находящаяся в срединном положении по отношению к листу,
называется срединной, а другие — латеральными (рис. 16.4,5 и
16.8,5, 5). Данный след может состоять более чем из одного
проводящего пучка (рис. 16.6, 5, срединный след).
У большинства сосудистых растений к каждой щели относится
только один след. Отклоняющийся тип анатомии узла представ-
лен двухследовой однолакунной структурой (рис. 16.6,5). Два
листовых следа ответвляются от различных симподиев и поэтому
рассматриваются как отдельные следы. Та точка зрения, что двух-
следовый однолакунный узел — исходный тип строения узла [5],
видимо, уступает место представлению о том, что более примитив-
ной является односледовая однолакунная структура [33, 36].
ВЕТОЧНЫЕ СЛЕДЫ И ВЕТОЧНЫЕ ЩЕЛИ
Почки обычно развиваются в пазухах листьев, так что в до-
полнение к листовым следам в зоне узла могут быть видны про-
водящие пучки, которые связывают главный стебель с веткой.
Эти тяжи называются следами веток (рис. 16.6,5 и 16.7,5).
В действительности следы веток являются листовыми следами, а
именно листовыми следами первых листьев на ветке, называемых
профиллами (рис. 16.7, я). У хвойных и двудольных два профил-
ла занимают супротивное положение и сориентированы так, что
плоскость, пересекающая оба профилла, параллельна плоскости
кроющего листа. Почку с главной осью стебля связывают два —
по одному к каждому профиллу — листовых следа, состоящих из
одного или большего числа пучков. У однодольных боковому
побегу также соответствуют два следа, хотя имеется только один
профилл (иногда его рассматривают как двойную структуру) у
основания пазушного побега.
Следы веток обычно ответвляются от проводящей системы
главного стебля справа и слева от срединного следа листа, несу-
щего ветку (или единственного следа, если никаких боковых
ответвлений нет), так что ветка и несущий лист имеют общую
щель (рис. 16.7,5). Следы веток тянутся на различное расстояние
вдоль главной оси и на определенном уровне присоединяются к
центральной проводящей системе.
Стебель: первичная форма роста
283
Рис. 16.7. Связь между стеблем, листом и пазушной почкой. А. Поперечный
срез побега Solatium tuberosum, сделанный ниже узла шестого от апекса листа.
Листья 7 и 8 пропущены (листья пронумерованы более мелкими цифрами). По-
казан лист 9, кроющий для пазушной почки. Номерами 1—6 на срезе стебля
обозначены проводящие пучки (изображена только ксилема) к соответствующим
листьям В черешке листа 9 изображен биколлатеральный проводящий пучок,
участки наружной и внутренней флоэмы на его краях сближены. Б. Схема связи
веточных следов и листового следа с проводящей системой в главном стебле
1— стебель, 2 — профиллы пазушной почки, 3 — следы веток; 4 — общая щель
листа и ветви, 5 — листовой след; 6 — внутренняя флоэма; 7— черешок; 8 —
ксилема; 9 — наружная флоэма.
ТЕОРИЯ СТЕЛЫ
Хорошо известная теория, касающаяся филогении первичной
проводящей системы в осевых органах,— теория стелы (стелярная
теория) была предложена [53] для анализа гомологий и эволю-
ции структуры осевых органов в различных таксонах растений.
Стела, что значит колонна,—это внутренний стержень осевой части
растения (стебля и корня), включающий проводящую систему и
все межпучковые зоны, лакуны, сердцевину (когда она присутст-
вует) и перицикл, расположенный на периферии проводящей
системы и относящийся к основной ткани. Осевая часть растения,
таким образом, состоит из центральной колонки, окруженной пер-
вичной корой, и эпидермы, формирующей поверхностный слой.
Стелярная теория оказалась полезной в сравнительных и фи-
логенетических исследованиях сосудистых растений. Со временем
284
Глава 16
сама теория и связанная с ней терминология изменились и тер-
мин стела стал обозначать скорее проводящую систему, чем ком-
бинацию проводящей и основной тканей в центральной колонке
осевой части растения. В самом деле, трудно применить целиком
первоначальную концепцию стелы к стеблю семенных растений,
так как в стеблях растений этой группы обычно нет четкой струк-
турной границы между корой и зоной проводящих тканей. Су-
ществование на границе стелы эндодермы и перицикла считается
важным доказательством реальности стелы как морфологически
единой структуры.
В некоторых стеблях двудольных на периферии цилиндра пер-
вичных проводящих тканей располагается непрерывный или почти
непрерывный цилиндр из волокон. Эти волокна могут происходить
из той же меристемы, что и флоэма (Pelargonium), но могут возни-
кать и снаружи от флоэмы (Aristolochia, Cucurbita), но внутри
крахмалоносного влагалища, которое является самым внутренним
слоем первичной коры семенных растений [3]. Таким образом, в
некоторых случаях между проводящей тканью и корой распола-
гается ткань нефлоэмного происхождения. Именно для этой ткани
первоначально был предложен термин перицикл, распространен-
ный затем на стебли всех растений, несмотря на то что в боль-
шинстве стеблей семенных растений флоэма соприкасается с ко-
рой и периферические волокна являются первичными флоэмными
волокнами. Когда волокна формируются внутри крахмалоносного
влагалища, но снаружи от флоэмы, их можно назвать топогра-
фическим термином периваскулярные волокна.
Классификация стел основывается главным образом на взаим-
ном расположении проводящих и непроводящих тканей в осевых
органах на первичной стадии развития. В простейшем типе сте-
лы, которая рассматривается как наиболее филогенетически при-
митивная, проводящая ткань образует сплошную колонку. Это
протостела. В протостеле флоэма окружает ксилему сравнительно
однородным слоем или же эти две проводящие ткани чередуются
в виде тяжей или пластинок. Протостелы обнаружены у Lycophyta
и Sphenophyta, но они встречаются также и у папоротников — в
нижних частях растения, и в стеблях у некоторых водных расте-
ний из покрытосеменных. Центральный цилиндр корней семенных
растений также считается протостелой.
Второй тип стелы — сифоностела, или трубчатая стела, в ко-
торой проводящая ткань окружает непроводящую — сердцевину.
Сифоностела и ее разновидности характерны для Lycophyta, Sphe-
nophyta и Pterophyta. К разновидностям сифоностелы относятся
эктофлойная сифоностела — с флоэмной тканью, расположенной
только снаружи от ксилемы, и амфифлойная сифоностела — с фло-
эмой, расположенной как с внешней, так и с внутренней стороны
ксилемного цилиндра. В своей простейшей форме сифоностела не
Стебель: первичная форма роста
285-
имеет листовых щелей. У некоторых папоротников листовые щели
в вертикальном направлении относительно короткие, и, поскольку
межпучковые зоны отсутствуют, проводящая ткань на поперечном
сечении междоузлия образует сплошное кольцо. У других папо-
ротников листовые щели вытянуты в вертикальном направлении
и перекрывают друг друга в междоузлиях, так что проводящий
цилиндр кажется рассеченным на тяжи, в каждом из которых
флоэма окружает ксилему (амфикрибральные концентрические*
проводящие пучки). Такая модификация сифоностелы называется
диктиостелой.
Стела голосеменных и покрытосеменных, представляющая со-
бой систему проводящих тяжей и межпучковых зон, называется
эустелой. Когда проводящая 'система состоит из широко рассеян-
ных пучков, как у некоторых однодольных, стелу называют атак-
тостелой (фото 86).
В течение длительного времени считалось, что эустела семен-
ных растений произошла от определенного типа сифоностелы,
найденной у папоротников (папоротниковый тип), путем рассече-
ния ее на тяжи преимущественно за счет удлинения и перекрыва-
ния листовых щелей [17]. Результаты интенсивного сравнитель-
ного изучения проводящей системы хвойных и двудольных в со-
четании с палеоботаническими данными привели, однако, к пред-
положению, что проводящая система семенных растений происхо-
Рис 16 8 Схемы, иллюстрирующие предполагаемое направление эволюции пер-
вичной проводящей системы проголосеменных и голосеменных A. Aneurophytorr.
Трехреберная сплошная протостела; след придатка (листа или предшественни-
ка листа) отходит в радиальном направлении и не оставляет щели. Б. Steno'-
myelon Трехпучковая проводящая система с сердцевиной; ответвление следа та-
кое же, как на рис. А. В. Archaeopteris. То же, но пучки больше и сердцевина
мощнее. Г. Хвойное. Осевых симподиальных тяжей больше, чем на рис В, и ход
их волнообразный, как у хвойных со спиральным листорасположением. Межпуч-
ковая зона выше отходящего листового следа напоминает листовую щель. (Вос-
производится из работы [33] с некоторыми изменениями) 1 — придатки; 2 —
первичная кора; 3— стела; 4 — «листовая щель»; 5 — листовые следы.
286
Глава 16
дит не от папоротникового типа сифоностелы, а непосредственно
от более древней протостелической структуры того типа, который
найден у птеридофитовых проголосеменных [1, 33, 47]. Возмож-
ный ход эволюции проиллюстрирован на рис. 16.8, на котором
приведены примеры стел птеридофитовых проголосеменных
(рис. 16.8,Л—В) и ныне живущих хвойных (рис. 16.8,Г).
В примитивных структурах следы к латеральным органам от-
ветвляются радиально от наружной поверхности протостелической
колонки, не оставляя лакун (рис. 16.8, А). Стела рассекается на
продольные колонки, вследствие чего появляется сердцевина
(рис. 16.8,Б). (В эволюционном смысле рассечение здесь озна-
чает замещение в онтогенезе некоторого количества проводящей
ткани паренхимой.) Дальнейшее рассечение колонок проводящей
ткани приводит к появлению многочисленных дискретных тяжей
(рис. 16.8,В, Г), которые в совокупности с листовыми следами
гомологичны стеблевым пучкам в симподиях современных хвой-
ных. Таким образом, согласно предложенной концепции эволюции
стелы, образование листовой щели не связано с рассечением
центрального цилиндра у предков семенных растений и поэтому
термин листовой след по отношению к этим группам растений
имеет только описательное значение.
Хотя эволюционная схема на рис. 16.8 заканчивается хвойны-
ми, она ведет к двудольным и, вероятно, также к однодольным,
так как структура стелы у хвойных и покрытосеменных в принципе
одна и та же [10].
Развитие
Верхушка побега
В верхушке побега располагаются апикальная меристема и
производимая ею меристематическая ткань, которые составляют
основу первичного тела растения. Стебель с его узлами и междо-
узлиями, листья, пазушные почки и развивающиеся из них боко-
вые побеги, а позже — репродуктивные структуры возникают из
апикальной меристемы. В зависимости от типа структур, форми-
рующихся на верхушке побега, различают вегетативные и репро-
дуктивные (или флоральные) апексы побега и апикальные ме-
ристемы.
Боковые органы формируются на верхушке побега, поэтому
структуру и активность апикальной меристемы следует обсуж-
дать в связи с происхождением боковых органов, особенно листь-
ев. Как уже говорилось в гл. 14, кончик корня не образует бо-
ковых органов и отличается от апекса побега также наличием
корневого чехлика.
Стебель: первичная форма роста
287
У семенных растений апикальная меристема первого побега
формируется в зародыше перед или после появления семядоли
или семядолей [20, 35, 43]. По общепринятым представлениям^
апикальная меристема состоит 1) из клеток-инициалей, которые
являются источником всех клеток тела растения, и 2) из произ-
водных от них клеток, которые активно делятся, но своим поло-
жением и направлением плоскостей делений предопределяют тка-
невые зоны, лежащие непосредственно под апикальной меристе-
мой.
Инициали и их производные — это наименее детерминирован-
ная часть апикальной меристемы. Ее принято называть промери-
стема, или протомеристема [25]. Этот термин можно употреблять
н том же смысле и применительно к апексу корня, но в этом слу-
чае он приобретает несколько другое значение (см. теорию по-
коящегося центра в гл. 14).
Число инициалей, расположение их по отношению друг к дру-
гу и к их производным различны в разных систематических груп-
пах растений [19, 38]. Изучение этого привело к описанию апи-
кальных меристем в побегах с точки зрения их пространственной
организации и характера развития. Благодаря совершенствованию*
экспериментальной техники появляется возможность соотносить
биохимические процессы с особенностями морфологии и развития
апикальной меристемы, включая изменения, относящиеся к пе-
риодической закладке листовых примордиев (пластохронные изме-
нения), к сезонной периодичности и к переходу апикальной мери-
стемы от вегетативной стадии к репродуктивной (гл. 20).
Апикальная меристема побега, подобно апикальной меристеме
корня, смыкается с дифференцирующимися тканями. По соседст-
ву с апикальной меристемой по мере роста клеток, изменения
степени вакуолизации, а также скорости и ориентации митозов<
(фото 87) прогрессивно дифференцируются тканевые зоны. Еще
дальше от апекса преобладают явления органогенеза (т. е. заклад-
ки листовых примордиев) и гистогенеза (дифференциации тка-
ней). Периферическая зона, из которой происходят зачатки листь-
ев, эпидерма, первичная кора и проводящие ткани, становится
отличимой от будущей сердцевины. В периферической зоне клетки
остаются меристематическими (относительно мелкими и слабова-
куолизированными) дольше, чем в сердцевинной зоне. Проводя-
щие ткани закладываются в виде прокамбия, клетки которого
принимают довольно узкую вытянутую форму вследствие того,
что преобладают продольные деления (фото 87). На этой стадии
их уже легко отличить от менее вытянутых, более широких и более-
вакуолизированных клеток основной меристемы — предшествен-
ника основной ткани. Тем временем протодерма постепенно при-
обретает специфические черты эпидермы. Таким образом, из апи-
кальной меристемы дифференцируются три системы тканей: эпи-
288
Глава 16
дермальная, проводящая и основная, сначала в форме их мери-
стематических предшественников (иногда называемых первичной
меристемой)—протодермы, прокамбия и основной меристемы,
которые затем становятся зрелыми тканями. Меристематическая
активность и явления дифференциации перекрывают друг друга,
поэтому завершение дифференциации в разных системах тканей
происходит неодновременно.
В дальнейшем мы рассмотрим разнообразие организации вер-
хушек побега и сделаем обзор противоречивых на первый взгляд
концепций функционирования апикальных меристем Описание
апикальных меристем низших сосудистых растений, которые име-
ют только одну клетку-инициаль, предшествует описанию апексов
побегов семенных растений.
АПИКАЛЬНЫЕ МЕРИСТЕМЫ С АПИКАЛЬНЫМИ КЛЕТКАМИ
В структурном отношении простейшие апикальные меристе-
мы— это те, в которых единственная крупная клетка-инициаль —
апикальная клетка—доминирует в дистальной группе клеток и,
по-видимому, является источником всех клеток побега (рис. 16.9).
Эта клетка иногда имеет вытянутую, но чаще пирамидальную
форму. Как правило, она делится в направлениях, параллельных
своим поверхностям (за исключением самой наружной поверхно-
сти), так что дочерние клетки располагаются закономерно, что
служит признаком их онтогенетической связи с апикальной клет-
кой (рис. 16.9, Л) и после того, как они сами делятся и дают на-
чало генерациям клеток (рис. 16.9, Б).
Одиночная апикальная клетка не только относительно круп-
ная, но и сильно вакуолизирована. Ближайшие производные клет-
Рис 16 9 Верхушки побегов с апикальными клетками. A. Equisetum hyetnale;
апикальная клетка в процессе деления Б. Polypodiutn peroussum\ поделившиеся
производные апикальной клетки изображены с более толстыми стенками. (Пере-
рисовано с микрофотографий из работы Bierhorst, Morphology of vascular plants,
New York, Macmillan, 1971, pp. 81, 299.) 1 — апикальная клетка; 2 — поделившая-
ся производная клетка; 3— производная клетка.
Стебель: первичная форма роста
289
ки также сильно вакуолизированы, но по мере их деления возни-
кают более мелкие клетки с густыми протопластами. Такие изме-
нения внешнего вида клеток заметны главным образом по пери-
ферии верхушки побега, где закладываются листовые зачатки;
сердцевинная меристема (если она есть) вакуолизирована силь-
нее.
О наличии апикальных меристем с одиночными апикальными
клетками у низших сосудистых растений часто судят по одиноч-
ным срединным продольным срезам, при этом принимаются в
расчет случайно встречающиеся фигуры деления в самой верхней
клетке и расположение ее предполагаемых производных. Сравни-
тельное изучение апексов папоротников, сочетающее анатомиче-
ский анализ с методом культуры тканей и наблюдениями над
поверхностным ростом в живых апексах, показывает, что, по
крайней мере у папоротников, уникальности апикальной клетки
можно придавать меньшее значение [31]. В этой группе растений
субповерхностные клетки, которые происходят от поверхностных
инициалей, функционируют как промеристема и производят боль-
шинство клеток, которые после дальнейших делений дают начало
внутренним тканям побега.
ОРГАНИЗАЦИЯ ПО ТИПУ ТУНИКИ — КОРПУСА
У голосеменных и покрытосеменных в апикальной меристеме
присутствуют группы апикальных инициалей. У покрытосеменных
клетки в дистальной части апекса расположены слоями (слоистая
меристема; фото 87 и 88); причем такое строение предполагает,
что два или большее число слоев растет независимо друг от друга
и что в меристеме присутствуют два или несколько рядов кле-
ток-инициалей, расположенных один над другим. Морфологически
инициали обычно не отличимы от первого поколения их дочерних
клеток.
Представление об обособленных рядах инициалей вылилось в
концепцию организации апекса по типу туники — корпуса, предло-
женную Шмидтом [44]. По этой теории инициальная зона апи-
кальной меристемы состоит: 1) из туники, включающей один или
несколько периферических слоев клеток, которые делятся в пло-
скостях, перпендикулярных поверхности меристемы (антиклиналь-
ные деления), и 2) из корпуса — нескольких слоев клеток, деля-
щихся в различных направлениях (рис. 16.10, фото 87 и 88). Та-
ким образом, корпус — это центральная группа клеток, в резуль-
тате роста которых увеличивается объем апикальной меристемы,
а туника — это как бы мантия из одного или нескольких слоев
клеток, непрерывность которой над разрастающимся корпусом
поддерживается путем роста в поверхность. Конечно, поверх-
ность и объем туники и корпуса не увеличиваются безгранично,
I? К. Эзау, кн 2.
290
Глава 16
так как образование в них новых клеток сопровождается перехо-
дом более старых клеток в зоны побега ниже апикальной мери-
стемы.
Корпус и каждый слой туники имеют свои собственные ини-
циали. В тунике они располагаются в центре по оси. Антиклиналь-
ными делениями эти клетки образуют поколения новых клеток,
часть которых остается в апексе в виде инициалей, а остальные
функционируют как производные, последовательными делениями
поставляя клетки в периферическую часть побега (рис. 16.10,5).
Инициали корпуса располагаются под инициалями туники. Путем
периклинальных делений (параллельно поверхности апекса) они
поставляют клетки в нижние слои корпуса, клетки которых делят-
ся в различных направлениях. Клетки, образовавшиеся в корпусе,
добавляются к центральной осевой области, т. е. к сердцевинной
меристеме, а также и к периферической зоне (рис. 16.10, А).
Инициали корпуса иногда образуют хорошо выраженный слой
в отличие от менее упорядоченно расположенных клеток в массе
корпуса (рис. 16.10). В этом случае границу между туникой и
корпусом провести трудно (фото 87, А и 88), но если верхушки
побега взяты на разных стадиях развития, то среди них можно
найти такой образец, в которо мсамый верхний слой клеток кор-
пуса находится в состоянии периодических периклинальных деле-
ний. После таких делений второй по порядку слой временно ока-
зывается в корпусе. Наружная часть корпуса при этом выглядит
слоистой (фото 87, Б и 88 [49]).
Некоторые исследователи включают непостоянные параллель-
ные слои корпуса в тунику и считают, что число слоев туники
Рис. 16 10 Верхушка побега Pisum А Клеточное строение, 5. Поясняющая схе-
ма. Рост сердцевинной меристемы происходит не типичным для колончатой ‘ме-
ристемы образом. 1 ^—антинлйИальное деление; 2 инициальный слой корпуса;
3 — двухслойная туника, 4<—листовой примордий, 5—.корпус, 6 сердцецци-»
цая меристема.
Стебель: первичная форма роста 29 Г
изменчиво. Для менее жестко очерченной туники предлагается
термин мантия, а для массива клеток, Покрытого мантией, — тер-
мин корпус [39].
Число слоев туники у покрытосеменных варьирует. Более по-
ловины изученных видов двудольных имеют двуслойную тунику.
Одни исследователи включают самый внутренний^ параллельный
слой в корпус, а другие — в тунику, поэтому иногда встречаются
описания туник из 4—5 слоев. Туника в один или два слоя обычна
у однодольных (фото 89).
За некоторыми исключениями (Araucaria, Ephedra), голосемен-
ные не имеют в верхушках побега структур типа туники—? корпу-
са [19], т. е. у них нет стабильных поверхностных слоев, клетки
которых делятся только антиклинально. Самый наружный слой
апикальной меристемы претерпевает периклинальные и антикли-
нальные деления и поставляет клетки в периферические и внутрен-
ние ткани побега (рис. 16.11 и фото 90). Инициалями считаются
поверхностные клетки, расположенные в апикальной меристеме
в срединном положении.
Точка зрения, согласно которой слои в апикальной меристеме
растений с организацией по типу туника—корпус относительно
независимы, поддерживается наблюдениями над периклинальны-
ми цитохимерами. Такие химеры представляют собой растения,
в которых клетки одного или нескольких слоев, параллельных
поверхности тела растения (отсюда название периклинальные
химеры), генетически отличаются от клеток соседних слоев. От-
личительные признаки служат маркерами, которые можно про-
следить в непрерывном ряду поколений клеток вплоть до клеточ-
ных слоев апикальной мерис гемы с такими же признаками. Не-
которым химерам свойственна комбинация слоев с диплоидными
и полиплоидными ядрами. Полиплоидизация ядер может быть
вызвана обработкой верхушек побега колхицином. В результате
клетки того цли другого слоя в апикальной меристеме становятся
полиплоидными, и этот признак распространяется в ряду поколе-
ний клеток, образующихся из этого слоя в дифференцирующемся
теле растения [9]. Периклинальные химеры также встречаются
среди мутантов с дефектными бесцветными пластидами. Как и в
ядерных химерах, отклоняющийся признак^ в данном случае де-
фектные пластиды, может быть прослежен в ряду происходящих
друг от друга клеток между апикальной меристемой ц зрелыми
тканями [48]. Брльшинство изученных растений-цитохцмер — дву-
дольные с двуслойной туникой. У них ясно ^различимы три неза-
висимых слоя в апикальной меристеме: дна слоя туники и один
слой инициалей корпуса. г
Результаты, полученные в работах с цитохимерами, также
подтверждают основное положение теории туники -^корпуса
о том, что дифференциация различных зон растения не предопре-
19*
292
Глава 16
делена в структуре апикальной меристемы даже в том случае,
если слои независимы. Правда, эпидерма происходит всегда из
самого наружного слоя меристемы, но предназначение более глу-
боких слоев не фиксировано. Производные второго слоя туники
делятся антиклинально и периклинально и поставляют клетки в
субэпидермальную часть периферической зоны. Производные
третьего слоя тоже делятся в различных направлениях и создают
центральную зону, а также вносят вклад в образование перифе-
рических тканей.
Представление об отсутствии предопределенности развития
тканевых зон в апикальной меристеме отличает концепцию ту-
ники— корпуса от классической гистогенной теории Ганштейна
[22], согласно которой эпидерма, кора и проводящий цилиндр
имеют особых предшественников в меристеме (дерматоген, пери-
блема, плерома), причем каждый из них обладает собственными
инициалями в апексе побега и корня (гл. 14).
ЦИТОГИСТОЛОГИЧЕСКАЯ ЗОНАЛЬНОСТЬ
Термин цитогистологическая зональность (см. словарь терми-
нов) относится к дифференциации в апексе побега зон с отчетли-
выми цитологическими характеристиками. В то время как концеп-
ция туники — корпуса способствует нашему пониманию располо-
жения и роста клеток в самой апикальной меристеме, распознава-
ние различных по характеру зон клеток в прилегающих к ней
областях помогает выявить вклад меристемы в дифференциацию
тканей и органов в побеге [27]. Зональность как результат кле-
точной дифференциации в апексах побегов была впервые описана
для Ginkgo [16], а затем была обнаружена и у других голосемен-
ных, а также у большинства покрытосеменных [19]. Изучение
зональности позволяет исследовать не только наименее детерми-
нированную часть апекса побега — промеристему,— но и произ-
водные зоны апикальной меристемы. Естественно, представление
об апикальной меристеме расширилось, и различие между тер-
минами апекс побега (апикальная меристема и производные ме-
ристематические зоны) и апикальная меристема стало менее от-
четливым [7].
Концепция цитогистологической зональности обсуждается да-
лее применительно к апексам побегов Ginkgo [16] и Pinus (фо-
то 90, А и рис. 16.11). Апикальная меристема у растений этих
двух родов включает группу инициалей на апикальной поверхно-
сти и их латеральные и центральные производные. Последние
образуют центральную зону материнских клеток. Во всей этой
дистальной группе клетки сильно вакуолизированы — черта, свя-
занная с относительно низкой скоростью митотической активно-
Стебель: первичная форма роста
293.
Рис. 16.11. Схема продольного среза
верхушки побега голосеменного рас-
тения (Pinus; фото 90,Л). Стрелки
указывают направление, в котором
участки апикальной меристемы от-
кладывают клетки. 1 — перифериче-
ская зона; 2 — переходная зона; 3—
центральные материнские клетки; 4 —
инициальный слой; 5 — колончатая
меристема.
сти. Более того, центральные материнские клетки часто имеют
утолщенные и отчетливо пористые первичные оболочки.
Апикальная меристема окружена периферической зоной, или
периферической меристемой (часто неточно называемой фланговой
меристемой, см. словарь терминов), а подстилающие ее централь-
ные материнские клетки представляют собой сердцевинную мери-
стему. Периферическая меристема происходит отчасти из лате-
ральных производных апикальных инициалей, отчасти из цент-
ральных материнских клеток. Сердцевинная меристема формиру-
ется в результате делений по периферии центральных материнских
клеток в слое, называемом переходной зоной. В состоянии макси-
мальной активности она похожа на камбий. Степень дискретности
переходной зоны, очевидно, зависит от интенсивности роста, так
как у одного и того же растения она может варьировать в связи
с сезонной и пластохронной периодичностью.
Клетки периферической зоны имеют густые, интенсивно кра-
сящиеся протопласты и обладают высокой митотической актив-
ностью. В определенных местах с особенно высокой активностью
закладываются лкстовые бугорки (фото 90,5). Периферическая
зона имеет отношение также к росту побега в длину (антикли-
нальные деления) и в толщину (периклинальные деления).
Сильно вакуолизированные клетки в сердцевинной меристеме
делятся поперечно, так что производные отдельных клеток обра-
зуют вертикальные ряды. Меристема с такими особенностями ро-
ста называется рядной, или колончатой, меристемой. На фото 90,
А рядная меристема действительно сохраняет те характерные
особенности роста, которые устанавливаются в переходной зоне.
Вертикальные деления также имеют место, в результате число
рядов увеличивается. У некоторых голосеменных центральная
группа вакуолизированных клеток и клетки колончатой меристемы
слабо дифференцированы и сердцевина выражена лишь немногими
слоями клеток, подстилающими апикальную меристему (фо-
то 90, Б).
294
Плава 16
ИДЕНТИФИКАЦИЯ АПИКАЛЬНЫХ ИНИЦИАЛЕН
Как было показано в гл. 14, меристематическая активность
в центре апикальной меристемы корня подавляется по окончании
первоначальной стадии развития корня. Меристематическую ак-
тивность проявляют затем ближайшие производные первичных
инициалей. В середине апикальной меристемы корня создается
покоящийся центр.
Сходная точка зрения на распределение меристематической
активности в верхушке побега защищается французскими цито-
логами [4, 35]. По их мнению, дистальные аксиальные клетки
(аксиальная зона) относительно инертны, а инициальными
участками являются периферическая и субтерминальная зоны,
зде образуются ткани стебля и закладываются зачатки листьев.
После того как в процессе эмбрионального и постэмбриойально-
го роста сформируется структура апекса, дистальная rpyrtna
клеток становится меристемой ожидания (meristeme d’attente),
так как она пребывает в покоящемся состоянии вплоть до начала
репродуктивной стадии, когдй меристематическая активность в
дистальных клетках возобновляется. На вегетативной стадии
меристематическая активность сосредоточена в инициальном коль-
це (anneau initial), соответствующем периферической зоне, и в
сердцевинной меристеме.
Гипотеза французских ученых стимулировала дальнейшее изу-
чение апикальной меристемы [7, 19, 35]. Различные эксперимен-
тальные подходы — подсчет митозов в различных зонах верхушки
побега (рис. 16.18), определение локализации белка, ДНК и
РНК и мест их синтеза методом радиоактивной метки, гистохи-
мические тесты и изучение расположения клеток в фиксированных
и живых апексах — позволили получить данные, подтверждающие
предположение об относительно редком проявлении митотической
активности в дистальной зоне. Этот вывод, однако, вовсе не ис-
ключает, что наиболее дистальные клетки являются в конечном
счете источником всех клеток в побеге. Рассматривая топографию
апекса, можно сказать a priori, что, так как рост производных
апикальной меристемы происходит экспоненциально, любое дан-
ное свойство генома (геном — это совокупность всех генов) ди-
стальных клеток через несколько делений распространяется в
больших клеточных популяциях. Периклинальные химеры часто
приводят как доказательство периодического поступления клеток
именно из дистальной зоны, поскольку потомки этих клеток об-
наруживаются в зрелых частях побега. В этом смысле дистальные
апикальные клетки могут рассматриваться как инициали.
Соотношение между инициалями и их прямыми потомками в
апикальной меристеме непостоянно. Не генетические особенности
клетки, а ее положение определяет, будет ли она функциониро-
вать как инициаль или нет (см. аналогичное представление об
Стебель: первичная форма роста
295
инициалях в камбии; гл. 10). Во время деления инициали невоз-
можно предсказать, какая из двух дочерних клеток унаследует
роль инициали (рис. 16.9, Л). Известно также, что данная клетка'
инициаль может быть замещена клеткой, которая ранее рассмат-
ривалась как производная от инициали.
По мнению Ньюмана [34], нет клеток, которые всегда функ-
ционируют только как инициали. На самом деле эту функцию вы-
полняют клетки, возникающие в ряду последовательных делений
и составлящие «непрерывный меристематический остаток». Эта
точка зрения лежит в основе предложенной Ньюманом классифи-
кации апикальных меристем, составленной для всех групп сосу-
дистых растений. Выделяются три типа апикальных меристем:
1) моноподиальная, как у папоротников (рис. 16.9, Б), — меристе-
матический остаток расположен в поверхностном слое и любого
рода деления способствуют росту в длину и ширину; 2) простая,
как у голосеменных (рис. 16.11),— меристематический остаток
находится в единственном поверхностном слое, и для роста в
толщину необходимы как антиклинальные, так и периклинальные
деления; 3) двойная, как у покрытосеменных (рис. 16.10,5),—
меристематический остаток находится по крайней мере в двух
поверхностных слоях с двумя различными типами роста: вблизи
поверхности деления происходят антиклинально, а глубже — не
менее чем в двух плоскостях.
Происхождение листьев
Когда в периферической зоне верхушки побега закладывается
листовой примордий, в результате локальных клеточных делений
вокруг оси образуются выросты (так называемые листовые бу-
горки; фото 87). В побегах со спиральным листорасположением
(рис. 16.1 и 16.18) деления в различных секторах окружности
апикальной меристемы чередуются, и периодическое разрастание
апекса в результате этих делений происходит асимметрично. В по-
бегах с супротивным листорасположением (рис. 16.13 и 16.19)
апекс разрастается симметрично благодаря интенсивной меристе-
матической активности одновременно на противоположных сторо-
нах. Таким образом, обособление листьев вызывает периодические
изменения в размерах и форме верхушки побега.
Как было показано для побега с супротивным листорасполо-
жением, увеличение размера апекса максимально как раз перед
заложением пары листовых примордиев (рис. 16.13, Л). Эта фаза
пластохронного роста апекса называется фазой максимальной
площади. По мере того как листовые зачатки приподнимаются над
апикальной меристемой, ее ширина уменьшается (рис. 16.13,
5 — 5). Эта фаза пластохронного роста апекса называется фазой
минимальной площади. Перед закладкой новой пары примордиев
296
Глава 16
Рис. 16.12. Продольный срез вер-
хушки побега Chrysanthemum se-
getum, в котором заложился бу-
горок семнадцатого листа (У).
Знаки в клетках показывают фи-
гуры ядерных делений, которые
наблюдались в верхушках десяти
различных растений, находивших-
ся в одной и той же стадии раз-
вития: О профаза; — метафаза;
= анафаза; о телофаза. (Вос-
производится с некоторыми изме-
нениями из работы Lance, Ann.
Sci. Nat., Bot. Ser. 11, 18: 91—421,
1957.)
'апекс возвращается в фазу максимальной площади. Рост теперь
происходит перпендикулярно самому длинному диаметру апекса
в предыдущей максимальной фазе, но разрастание апикальной
меристемы заметно также и между листьями одной пары, рост
которых ранее сопровождался уменьшением апекса (рис. 16.13, Д).
Соотношение между растущим листовым примордием и апи-
кальной меристемой довольно сильно варьирует у разных видов.
На рис. 16.13 изображен случай, когда апикальная меристема
между разрастающимися листовыми примордиями почти отсутст-
вует (рис. 16.13,Г). У других видов периодические изменения
размера апикальной меристемы гораздо меньше (фото 87), а у
видов, у которых апикальная меристема значительно приподнята
над зоной органогенеза, вообще нет пластохронных изменений
размера апекса (фото 89). Однако при любом соотношении меж-
ду периферической зоной, где закладываются листья, и дисталь-
ной зоной главный вклад в рост листового примордия вносит пе-
риферическая зона. В соответствии с этим в ней обнаруживается
большее число митозов (рис. 16.12), содержится больше РНК
и большее количество ядер метится 3Н-тимидином (тест на син-
тез ДНК), чем в других зонах верхушки побега, особенно в ди-
стальной осевой группе клеток.
Гистологические подробности закладки листьев известны для
многих растений различных систематических групп. У голосемен-
ных и двудольных деления, ведущие к закладке листовых при-
мордиев, обычно происходят во втором или третьем от поверх-
ности слое (фото 87, А). После периклинальных делений клетки
откладываются к периферии, и за латеральный рост примордия
главным образом ответственны деления именно этого типа. Ан-
тиклинальные деления происходят в самом поверхностном слое,
а также сопровождают периклинальные деления в более глубо-
ких слоях. У однодольных листовые зачатки часто возникают пу-
тем периклинальных делений в поверхностном слое.
Стебель: первичная форма роста
297
Производные клетки туники и корпуса делятся, в результате
чего формируется примордий. Если туника многослойная, весь
примордий может образоваться только из ее производных. Иначе
говоря, ткани листа можно проследить как до туники, так и до
корпуса (фото 88).
Листовые примордии возникают по окружности апикальной
меристемы в тех местах, которые соответствуют листорасположе-
нию побега. Ботаников давно интересовали причинные связи
упорядоченной инициации листьев. Одна точка зрения заключа-
ется в том, что новый лист закладывается в некотором участке —
«первом активном пространстве», достаточно удаленном от инги-
биторов, распространяющихся из апикальной меристемы и из но-
вообразованных листовых примордиев [54]. Некоторые авторы
Рис. 16.13. Этапы развития листового зачатка Kalanchoe на продольных (4—Д)
и поперечном (Е) срезах побегов, собранных в период возникновения и разви-
тия восьмой пары листьев. А. После пластохрона 7; апекс в максимальной фазе.
Б. Ранний пластохрон 5; заложена 8-я пара листьев. В. Листья 8-й пары не-
сколько вытянуты. Г. Средняя фаза пластохрона 8; апекс в минимальной фазе.
Д. Ранний пластохрон 9; примордии 9-й пары чередуются с примордиями 8-й па-
ры и поэтому не видны в плоскости рисунка; заметно увеличение размеров апек-
са между двумя примордиями 8. Е. Ранний пластохрон 8; фаза подобна той,
которая представлена на рис. Б. (Рисунки сделаны по микрофотографиям из
работы Stein, Stein, Amer. J. Bot., 47, 132—140, 1960.)
298
Глава 16
предполагают, что создание активного пространства зависит от
физиологических условий в апексе [7], но, возможно, важным
элементом в росте листьев на апексе являются и физические фак-
торы [55]. Более того, расположение листьев коррелирует со
структурой проводящей системы в стебле, так что пространствен-
ные отношения листьев друг с другом являются частью общей
.архитектоники побега. Складывающаяся в процессе развития
«стебля связь между листьями и листовыми следами предполагает,
7что процессы, определяющие специфическое листорасположение,
лроисходят не только в апикальной зоне [13].
Происхождение веток
У семенных растений ветки обычно закладываются в виде по-
чек в пазухах листьев. Пазушные почки появляются на различных
пластохронных расстояниях от апикальной меристемы, чаще
всего в пазухах второго или третьего от апекса листа, где ткань
обычно имеет вид типичной меристемы (фото 88 и 91, А), и ткани
формирующейся почки образуют непрерывную связь с апикальной
меристемой (фото 91,5 *и 92). По мере роста материнского по-
бега клетки пазушной меристемы вакуолизируются и она отде-
ляется от апикальной меристемы (фото 91, Б и 92). Если пазуш-
ная меристема закладывается на стадии позднего пластохрона,
она может быть отделена от апекса вакуолизированными клетка-
ми с самого начала и тогда ее называют разделительной мери-
стемой.
Когда формируется почка, в клеточных слоях пазухи листа
происходят периклинальные и антиклинальные деления, почечная
меристема приподнимается и образуется апикальная меристема
почки (фото 91,5). У многих растений происходят правильные
деления вдоль базальных и латеральных границ зарождающейся
почки и образуется зона параллельных дугообразных слоев, на-
зываемая щитовидной (фото 91,А) из-за ее формы, напоминаю-
щей щит. Предполагают, что специфические особенности клеточ-
ных делений, которые дают начало почкам, определяются на-
правлением и величиной натяжения в зоне, где закладывается
почка (фото 88), и что развитие щитовидной зоны — это ранняя
реакция на натяжение, возникающее в пазухе растущего листа
’30]. Щитовидная зона, возможно, обеспечивает рост почки вверх,
аналогично переходной зоне верхушки концевого побега
(фото 90,А), участвующей в активном выносе вверх апикальной
меристемы. Если пазушная почка не является покоящейся, за ее
ростом вверх следует закладка листовых примордиев, начиная с
профиллов (рис. 16.7,А).
Побеги могут развиваться из адвентивных почек. Такие почки
закладываются, не имея прямой связи с апикальной меристемой.
Стебель: первичная форма роста
299
Адвентивные почки могут развиваться на корнях, стеблях, гипо-
котилях и листьях. Они закладываются в каллусе черенков или
вблизи повреждений, в камбии или на периферии проводящего
цилиндра. Адвентивные почки может формировать также эпидер-
ма. В зависимости от глубины залегания материнской ткани почки
могут иметь экзогенное или эндогенное происхождение [40]. За-
кладка адвентивных почек в зрелых тканях связана с явлением
дедифференциации, т. е. превращением зрелой ткани в меристе-
матическую.
Очевидно, существует множество сложным образом зависящих
друг от друга факторов, которые определяют закладку и развитие
пазушных и адвентивных почек. Почки могут пребывать в покое
вследствие подавления их роста терминальным побегом (апикаль-
ное торможение). Среди пазушных почек может быть и конку-
ренция. Распределение стимуляторов роста и конкуренция за пи-
тательные вещества — наиболее важные факторы в формировании
почек [32, 51, 56], и на разных стадиях развития почки необхо-
димы различные комбинации факторов роста.
Первичный рост стебля
Интенсивность и структурные особенности первичного роста
определяют форму побега, особенно у травянистых растений.
Первичный рост в стебле — это удлинение и расширение осевой
части под апикальной меристемой. В обычных облиственных по-
бегах удлинение происходит главным образом в междоузлиях.
В верхушке стебля листья располагаются так близко один к дру-
гому, что узлов и междоузлий как таковых не существует. Позд-
нее в результате быстрого роста стебля в длину между зонами
прикрепления листьев, или узлами, образуются междоузлия (фо-
то 92 и рис. 16.14, А). Удлинение стебля происходит за счет ме-
ристемы колончатого типа, которая путем повторяющихся попе-
речных делений создает продольные ряды клеток в первичной коре
и сердцевине (фото 92). Впоследствии происходит также увеличе-
ние размеров клеток, в конечном счете замещающее клеточные
деления. Вытягивание междоузлий может происходить в значи-
тельной степени посредством растяжения клеток [26], но конечная
относительная длина междоузлия определяется скорее числом
клеток, чем их длиной [29]. Скорость удлинения междоузлий
в развивающемся растении изменяется [11], так что у взрослого
растения междоузлия оказываются неодинаковой длины
(рис. 16.14,Б), При розеточном росте, характерном для некото-
рых растений, вытягивания междоузлий не происходит, и листья
остаются скученными.
У покрытосеменных, и особенно у однодольных, степень удли-
нения междоузлия имеет первостепенное значение при морфоло-
300
Глава 16
Рис. 16.14. Рост в длину стеб-
ля однодольных (злаков). А.
Срединный продольный срез,
пересекающий плоскость распо-
ложения листьев на корневи-
ще Agropyron repens. Показа-
на связь развивающихся узлов
и междоузлий (вертикальные
линии под узлами) с дисками
закладки листовых примордиев.
Части одного и того же листа
изображены по обеим сторонам
оси, так как листья окружают
стебель (ср. рис. 16.3). Листья
(более мелкие цифры) и узлы
пронумерованы, начиная от
апекса книзу. Б. Стебли Triti-
cum aestivum с удаленными
листьями. Показаны сближен-
ные междоузлия (/—6) у ос-
нования и вытянутые междо-
узлия выше на стебле. Узлы
пронумерованы, начиная от са-
мых старых к более молодым.
Соцветия на верхушке. (Вос-
производится из работы [23] с
некоторыми изменениями.) 1 —
апекс побега; 2— пазушная
почка; 3— диск закладки 3;
4 — узел 4} 5 — узел 5; 6 —
узел 6\ 7 — узел 7.
гической характеристике видов [24]. Меристематическая актив-
ность, вызывающая удлинение междоузлия, может быть довольно
равномерно распределена вдоль него или же распространяется
волнообразно от основания междоузлия акропетально [18], или,
наконец, она может быть сосредоточена у основания междоузлия
[26]. Такой локальный участок меристемы в вытягивающемся
междоузлии называется интеркалярной меристемой} она как бы
вставлена между зонами более дифференцированных тканей.
Участок интеркалярной меристемы может сохранять способность
к росту в течение долгого времени после того, как закончится уд-
линение данного междоузлия. У злаков, например, возобновление
роста в интеркалярной меристеме в основании междоузлия (и
окружающего его листового влагалища) на той стороне стебля,
жоторая обращена к земле, помогает полегающим растениям под-
Стебель: первичная форма роста
301
ниматься с земли [12]. Зона, участвующая в этом росте, называ-
ется сочленением или подушечкой.
Сосудистая ткань дифференцируется в интеркалярной мери-
стематической зоне, но растяжение основной ткани влияет на
зрелые сосудистые элементы. В результате растяжения разруша-
ются трахеальные элементы, а их функции принимают на себя
лакуны, образующиеся на их месте, или же вновь дифференци-
рующиеся элементы [14]. Зрелые ситовидные элементы также
разрушаются. У Lolium регеппе [15] и пшеницы [37] разрушен-
ные ситовидные элементы замещаются новыми клетками не сразу
(в течение нескольких часов у пшеницы, одного-двух дней у Lo-
hum)\ в результате происходит сокращение или даже полная ос-
тановка транспорта питательных веществ, что, возможно, служит
для сосредоточения ассимилятов в меристеме.
Рост стебля в толщину связан с периклинальными делениями
и растяжением клеток как в сердцевине, так и в первичной коре.
5 различных растений первичное утолщение имеет свои особен-
ности. Оно обычно умеренное у видов со вторичным ростом
(рис. 16.15). Травянистым двудольным со специализированными
стеблями типа розетки и суккулентам [42], а также многим од-
нодольным свойствен интенсивный первичный рост. Первичный
Рис 16.15. Схематическое изображение про-
дольного среза молодого дерева Cordyline
austrafts (Agavaceae) — представителя круп-
ных однодольных. Схема составлена на ос-
новании измерений на экземпляре около
4 м в высоту до облиственной кроны. Вер-
тикальная ось укорочена в 16 раз по срав-
нению с диаметром стебля. Первичная ось
коническая, механическая прочность дости-
гается благодаря раннему вторичному ро-
сту. (Воспроизводится из работы [50] с не-
которыми изменениями.) 1 — апекс побега;
2 — листья; 3— первичная кора; 4 — пер-
вичная ткань; 5 — вторичная ткань; 6 —
уровень почвы
302
Глава 16
Рис. 16.16. Стабилизирухщий рост крупных однодольных. А. Ранняя подземная
часть стебля постепенно расширяется, но образуются очень короткие междоуз-
лий; рост в высоту с участием более длинных междоузлий начинается после то-
ю, как закончится утолщение стебля (на уровне земли). Такой процесс харак-
терен для большинства пальм. Б. У Р ndanus и некоторых других пальм рост
в высоту начинается рано; расширяющийся стебель поддерживается придаточ-
ными опорными корнями. (Воспроизводится из работы [60] с некоторыми изме-
нениями.) 1 — подземная ось; 2 — уровень почвы; 3 — междоузлие, 4 — опорный
корень; 5 — апекс побега; 6 — лист
рост обычно происходит так близко к апикальной меристеме, что
последняя оказывается как бы на низком конусе (рис. 16.16), на
плоском плато или даже в углублении. У двудольных первичное
утолщение сосредоточено или в сердцевине (медуллярное утолще-
ние), или в первичной коре (кортикальное утолщение), или рас-
пространяется по всему стеблю. У некоторых однодольных рост
в толщину происходит в относительно узкой зоне около периферии
стебля; эта хорошо выраженная зона называется меристемой пер-
вичного утолщения. Ее клетки расположены правильными анти-
клинальными рядами (фото 89).
В процессе первичного утолщения стебель принимает форму
перевернутого конуса, так как чем позже образовалось междоуз-
лие, тем оно шире. Если такой рост будет продолжаться неопре-
деленно долго, то в результате получится неустойчивый стебель.
У большинства двудольных и некоторых однодольных ось стаби-
лизируется за счет вторичного утолщения, начинающегося от ос-
нования стебля (рис. 16.15). У большинства однодольных, однако,
нет вторичного роста, поэтому у древовидных форм стебель при-
обретает устойчивость другими средствами [50, 60]. У большин-
ства древесных однодольных, в том числе у большей части пальм,
Стебель: первичная форма роста
303
рост проростка в высоту остается минимальным до тех пор, пока
не образуется стабилизирующая подземная ось в виде перевер-
нутого конуса. Рост в высоту начинается после того, как величина
кроны и диаметр стебля достигают размеров, свойственных взрос-
лому растению (рис. 16.16, Л). У некоторых пальм стабилизация
стебля происходит по мере удлинения междоузлий благодаря
развитию поддерживающих опорных корней (рис. 16.16,5).
Дифференциация проводящей системы
Изучение развития первичной проводящей системы ясно по-
казывает, что на стадии дифференциации по топографии своих
компонентов она является уменьшенной копией того, что имеет
место в развитой системе. Эта особенность показана на рис. 16.17,
на котором схема обсуждавшейся выше зрелой проводящей систе-
мы двудольного Hectorella (рис. 16.1, 5) наложена на коническую
фигуру, схематически изображающую верхушку побега. Длина
компонентов проводящих пучков и расстояния между витками
«генетической спирали» соответственно сокращены в направлении
к верхушке, чтобы показать, что верхние междоузлия еще не за-
кончили рост в длину.
Рис. 16 17. Схематическое изображение первичной проводящей системы Hectorel-
la caespitosa в области апекса побега. Цифрами обозначены листовые следы к
соответствующим листьям (ср. рис. 16.1). (Воспроизводится из работы [46]
с некоторыми изменениями.)
304
Глава 16
Далее на нескольких характерных примерах рассматриваются
принципы дифференциации первичной проводящей системы у се-
менных растений.
ПРОИСХОЖДЕНИЕ ПРОКАМБИЯ
На рис. 16.18 показана дифференциация прокамбия на при-
мере серийных поперечных срезов побега льна (Linuiri). В каче-
стве дополнения на фото 87 показаны продольные срезы побегов
еще одного двудольного (Sol а п и т tuhero^umS того же возраста
У обоих растений проводящая система стебля образует из листо-
вых следов и стеблевых пучков единый цилиндр. Выше уровня
закладки листьев никакой дифференциации сосудистых тканей
не обнаруживается (фото 87 и рис. 16.18, Д). Ниже, там где по-
являются зачатки листьев, наблюдается вакуолизация (отмечен-
ные и неотмеченные точками участки на рис. 16.18, Б). Это ука-
зывает на начало дифференциации первичной коры и сердцевины.
Сильная вакуолизация в первичной коре и сердцевине приводит
к тому, что на поперечных срезах видна почти кольцеобразная
зона (рис. 16.18, В). В описаниях эту меристематическую зону
называют остаточной меристемой [13]. Она выглядит так, как
если бы была остатком апикальной меристемы, сохранившимся
среди более дифференцированных тканей. Ниже места закладки
листового зачатка в остаточной меристеме путем продольных де-
лений, без последующего разрастания клеток в ширину, образу-
ются несколько вытянутые клетки первого прокамбия (фото 87
и 92).
Рис. 16.18 Поперечные срезы стеб-
ля льна, сделанные на разной вы-
соте, начиная с апикальной мери-
стемы (А) и кончая узлом, в ко-
тором представлены уже все пер-
вичные ткани (Д). Стадии диффе-
ренциации проводящей системы:
вакуолизация первичной коры (на-
чинается в примордии листа на
рис. Б) и сердцевины; обособле-
ние в результате этого будущей
зоны проводящих тканей в виде
остаточной меристемы, связанной
с прокамбиальными тяжами; за-
вершение дифференциации про-
камбия в остаточной меристеме.
1 — листовой бугорок; 2 — листо-
вой примордий; 3— листовая щель;
4 — прокамбий; 5 — остаточная
меристема; 6 — межпучковая зона.
Стебель: первичная форма роста
305
На следующих стадиях развития в остаточной меристеме диф-
ференцируется все больше и больше прокамбиальных тяжей
(рис. 16.18,Г). В то время как первые прокамбиальные тяжи —
это листовые следы ближайшего (самого старого) листового за-
чатка (рис. 16.18, В), более поздние тяжи представляют собой
стеблевые пучки и продолжение следов более высоко закладываю-
щихся (более молодых) листьев (рис. 16.18,Г). После того как
сформировались все проводящие пучки данного уровня стебля,
остаточная меристема дифференцируется в межпучковую парен-
химу (рис. 16.18, Д). В узлах часть остаточной меристемы стано-
вится паренхимой листовой щели. Щели обычно намечаются на
более ранних стадиях развития стебля, т. е. выше на побеге, чем
межпучковая зона (рис. 16.18, В).
Описанный ход развития обеспечивает непрерывность прокам-
бия между местами формирования листовых зачатков и проводя-
щим осевым цилиндром. По мере того как растущие листовые
зачатки приподнимаются над своими основаниями, в них диффе-
ренцируется прокамбий, представляющий собой продолжение
прокамбия ранее появившихся листовых следов (фото 87 и
рис. 16.13). О постепенно распространяющейся во все более
высоко расположенные междоузлия и в развивающиеся листовые
примордии дифференциации прокамбия говорят как об акропе-
тальной дифференциации прокамбия.
Непрерывная акропетальная дифференциация прокамбия в
листовых следах и стеблевых пучках описана для ряда хвойных
и двудольных [10, 13, 41]. У однодольных характер развития мо-
жет быть иным. У злаков (пшеница и Dactylis glomerata') более
ранние прокамбиальные листовые следы появляются в стебле на
уровне обособления листового примордия, более поздние следы—•
выше в самом листе. От места закладки дифференциация следов
распространяется базипетально в стебель, где они соединяются
с более старыми проводящими пучками, и акропетально — в раз-
вивающийся лист [23, 37, 45].
ПРОИСХОЖДЕНИЕ ФЛОЭМЫ И КСИЛЕМЫ
После дифференциации прокамбия начинают дифференциро-
ваться проводящие элементы, сначала в более старых, а затем
и в более молодых прокамбиальных пучках данного уровня стеб-
ля. Чем раньше начинают дифференцироваться пучки, тем круп-
нее они в зрелом состоянии, так что на поперечных срезах систе-
ма пучков имеет гетерогенный вид как в молодых, так и в зрелых
участках стебля.
В коллатеральных проводящих пучках первая флоэма появля-
ется во внешней части прокамбиального пучка, а ксилема — во
внутренней (гл. 11). Последующая дифференциация флоэмы про-
20 К Эзау.м 2
306
Глава 16
Рис. 16.19. Последовательная дифференциация проводящей системы у Lonicera,
побеги которой имеют супротивное листорасположение: акропетальная непрерыв-
ная дифференциация прокамбия и флоэмы; прерывистая закладка ксилемы и ее
дифференциация в двух направлениях. Первые флоэмные элементы достигают
зрелого состояния раньше, чем ксилемные. А—В. Схемы продольных срезов.
Г—Е. Схемы поперечных срезов.
«сходит центростремительно: новые элементы флоэмы появляются
ближе к центру стебля. Ксилема дифференцируется в противопо-
ложном направлении, т. е. центробежно, и называется эндархной
ксилемой. Этот термин означает, что в ксилемном пучке прото-
ксилемные элементы занимают самое внутреннее (по отношению
к центру стебля) положение (ср. с экзархной ксилемой в корне,
гл. 14).
Как у голосеменных, так и у двудольных продольная диффе-
ренциация первой флоэмы и первой ксилемы обычно происходит
также в противоположных направлениях [10, 13, 41]. Акропеталь-
ная дифференциация флоэмы идет почти вплотную к прокамбию
(рис. 16.19,А, Б). Ксилема обычно дифференцируется сначала
в базальной части листа или ниже, где-то в листовых следах, а
затем постепенно продвигается акропетально в лист и базипетально
в стебель (рис. 8.5 и 16.19, В), где соединяется с ксилемой более
старого проводящего пучка. В данном листовом следе первая
флоэма появляется раньше первой ксилемы (рис. 16.19). Если
Стебель: первичная форма роста
ЗОТ
растение имеет внутреннюю флоэму, она начинает дифференци-
роваться позже наружной.
Начальное развитие ксилемы и флоэмы у Triticutn aestivum
[37] происходит иначе, чем у двудольных и голосеменных. Хотя
в данном листовом следе флоэма появляется на 2—3 дня раньше'
ксилемы, последующий ход развития обеих тканей одинаков. Они
возникают сначала в местах, не занятых дифференцированными
проводящими тканями, и развиваются отсюда в двух направле-
ниях— вниз к стеблю и вверх к зачатку листа.
СВЯЗЬ ПРОВОДЯЩЕЙ СИСТЕМЫ ПОЧКИ И СТЕБЛЯ
Ход развития прокамбия в почечных следах зависит от харак-
тера почки [13]. Пазушная почка, которая закладывается вблизи:
апикальной меристемы и быстро развивается в ветку, связана
с проводящей системой стебля веточными следами, которые точно
так же, как листовые следы, соединяются с пучками стебля. Поч-
ка, развитие которой подавлено (например, апикальным тормо-
жением главного побега), сначала отделена от центрального ци-
линдра стебля вакуолизированной паренхимой. Когда такая почка*
начинает расти — спонтанно или после удаления верхушки побега*
(источника апикального торможения),— через вакуолизированную*
паренхиму устанавливается прямая сосудистая связь с ближай-
шими проводящими пучками в центральном цилиндре.
СПИСОК ЛИТЕРАТУРЫ
1. Beck С. В. The appearance of gymnospermous structure, Biol. Rev., 453
379—400 (1970).
2. Benzing D. H. Developmental patterns in stem primary xylem of woody Rana-
les. I. Species with unilacunar nodes, Amer. J. Bot., 54, 805—813 (1967).
II. Species with trilacunar and multilacunar nodes, Amer. J. Bot., 54, 813—
820 (1967).
3. Blyth A. Origin of primary extraxylary stem fibers in dicotyledons, Univ. Ca-
lif. Pubs. Bot., 30, 145—232 (1958).
4. Buvat R. Le meristeme apical de la tige, Ann. Biol., 31, 595—656 (1955).
5. Carlquist S. Comparative plant anatomy, New York, Rinehart and Winston,.
1961.
6. Church A. H. On the interpretation of phenomena of phyllotaxis, London, Ox-
ford University Press, 1920.
7. Cutter E. G. Recent experimental studies of the shoot apex and shoot morpho-
genesis, Bot. Rev., 31, 7—113 (1965).
8. Cutter E. G. Plant anatomy: experiment and interpretation. Part 2. Organs,
London, Edward Arnold, 1971.
9. Dermen H. Periclinal cytochimeras and origin of tissues in stem and leaf of
peach, Amer. J. Bot., 40, 154—168 (1953).
10. Devadas C., Beck С. B. Development and morphology of stelar components in'
the stems of some members of the Leguminosae Rosaceae, Amer. J. Bot., 58^
432—446 (1971). Comparative morphology of the primary vascular systems in
some species of Rosaceae and Leguminosae, Amer. J. Bot., 59, 557—567 (1972).
11. Enright A. M., Cumbie B. G. Stem anatomy and internodal development in
Phaseolus vulgaris, Amer. J Bot, 60, 915—922 (1973).
20*
308
Глава /6
12. Esau К. Plant anatomy, 2nd ed., New York, John Wiley & Sons, 1965.
13. Esau K. Vascular differentiation in plants, New York,, Holt, Rinehart and
Winston, 1965.
14. Evans P. S. Intercalary growth in the aerial shoot of Eleocharis acuta. R. Br.
Prodr. I. Structure of the growing zone, Ann. Bot., 29, 205—217 (1965).
15. Forde B. J. Differentiation and continuity of the phloem in the leaf intercalary
meristem of Lolium perenne, Amer. J. Bot., 52, 953—961 (1965).
16. Foster A. S. Structure and growth of the shoot apex in Ginkgo biloba, Bull.
Torrey Bot. Club, 65, 531—556 (1938).
17. Foster A. S., Gifford E. M., Jr. Comparative morphology of vascular plants,
2nd ed, San Francisco, California, W. H. Freeman and Company, 1974.
18. Garrison R. The growth of internode in Helianthus, Bot. Gaz., 134, 246—
255 (1973).
19. Gifford E. M., Jr., Corson G. E., Jr. The shoot apex in seed plants, Bot. Rev.,
37, 143—229 (1971).
20. Gregory R. A., Romberger J. A. The shoot apical ontogeny of the Picea abies
seedling. I. Anatomy, apical dome diameter, and plastochron duration, Amer.
J. Bot., 59, 587—597 (1972).
21. Gunning В. E. S., Pate J. S.^ Green L. W. Transfer cells in the vascular system
of stems: taxonomy, association with nodes, and structure, Protonlasma, 71,
147—171 (1970).
22. Hanstein J. Die Scheitelzellgruppe im Vegetationspunkt der Phanerogamen,
Festschr. Niederrhein. Ges. Natur- u. Heilkunde, 1868, 109—134 (1868).
23. Hitch P. A. Sharman В. C. The vascular pattern of festucoid grass axes, with
particular reference to nodal plexi, Bot. Gaz., 132, 38—56 (1971).
24. Holttum R. E. Growth-habits of monocotyledons, variations on a theme, Phy-
tomorphology, 5, 399—413 (1955).
25. Jackson B. D. A glossary of botanic terms, 4th ed., New York, Hafner Publi-
shing Co., 1953.
26. Raufman P. B., Cassel S. J., Adams P. A. On nature of intercalary growth and
cellular differentiation in internodes of Avena sativa, Amer. J. Bot., 126, 1 —
13 (1965).
27. Кондратьева E. А. О строении верхушки вегетативного побега покрытосемен-
ных, Ленинград, Унив. вест., сер. биол., геог. и геолог., 10, 3—15 (1955).
28. Kumazawa М. Studies on the vascular course in maize plant, Phytomorphology,
11, 128—139 (1961).
29. Lam О. C. JU, Brown C. L. Shoot growth and histogenesis of Liquidambar
styraciflua L. under different photoperiods, Bot. Gaz., 135, 149—154 (1974).
30. Lintilhac P. M. Differentiation, organogenesis, and the tectonics of cell wall
orientation. III. Theoretical consideration of cell wall mechanics, Amer. J. Bot.,
61, 230—237 (1974).
31. McAlpin B. W., White R. A. Shoot organization in the Filicales: the prome-
ristem, Amer. J. Bot., 61, 562—579 (1974).
32. McIntyre G. I. Environmental control of apical dominance in Phaseolus vul-
garis, Can. J. Bot., 51, 293—299 (1973).
33. Namboodiri К. K., Beck С. B. A comparative study of the primary vascular
system of conifers. I. Genera with helical phyllotaxis, Amer. J. Bot, 55, 447—
457 (1968). II. Genera with opposite and whorled phyllotaxis, Amer. J. Bot.,
55, 458—463 (1968). III. Stelar evolution in gymnosperms, Amer. J. Bot., 55,
464—472 (1968).
34. Newman I. W. Pattern in the meristems of vascular plants. III. Pursuing the
patterns in the apical meristems where no cell is a permanent cell, J. Linn.
Soc. London, Bot., 59, 185—214 (1965).
35. Nougarede A. Experimental cytology of the shoot apical cells during vegeta-
tive growth and flowering, Internatl. Rev. Cytol., 21, 203—351 (1967).
36. Pant D. D., Mehra B. Nodal anatomy in retrospect, Phytomorphology, 14,
384—387 (1964).
Стебель: первичная форма роста
309
37. Patrick J. IT. Vascular system of the stem of the wheat plant. I. Mature sta-
te, Aust. J. Bot., 20, 49—63 (1972). IL Development, Aust. J. Bot., 20, 65—
78 (1972).
38. Popham R. A. Principal types of vegetative shoot apex organization in vascu-
lar plants, Ohio J. Sci., 51, 249—270 (1951).
39. Popham R. A., Chan A. P. Zonation in the vegetative stem tip of Chrysanthe-
mum morifolium Bailey, Amer. J. Bot., 37, 476—484 (1950).
40. Priestley J. H., Swingle C. F. Vegetative propagation from the standpoint of
plant anatomy, U. S. Dept. Agr. Tech. Bull., 151 (1929).
41. Pulawska Z. Correlations in the development of the leaves and leaf traces in the
shoot of Actinidia arguta Planch, Acta. Soc. Bot. Polon., 34, 697—712 (1965).
42. Rauh W., Rappert F. Ober das Vorkommen und die Histogenese von Scheitel-
gruben bei krautigen Dikotylen, mit besonderer Beriicksichtigung der Ganz-
und Halbrosettenpflanzen, Planta, 43, 325—360 (1954).
43. Saint-Come R. Applications des techniques histoautoradiographiques et des
methodes statistiques a 1’etude du fonctionnement apical chez le Coleus blumei
Benth, Rev. Gen. Bot., 73, 241—324 (1966).
44. Schmidt A. Histologische Studien an phanerogamen Vegetationspunktenr Bot.
Arch., 8, 345—404 (1924).
45. Sharman В. C., Hitch P. A. Initiation of procambiol strands in leaf primordia
of bread wheat, Triticum aestivum, Ann. Bot., 31, 229—243 (1967).
46. Skipworth J. P. The primary vascular system and phyllotaxis in Hectorella
caespitosa Hook, f., New Zeal. J. Sci., 5, 253—258 (1962).
47. Slade B. F. Stelar evolution in vascular plants, New Phytol, 70, 879—884
(1971).
48. Stewart R. N., Semeniuk P., Dermen H. Competition and accomodation bet-
ween apical layers and their derivatives in the ontogeny of chimeral shoots
of PelargoniumxHortorum, Amer. J. Bot., 61, 54—67 (1974).
49. Sussex I. M. Morphogenesis in Solanum tuberosum L.: apical structure and de-
velopmental pattern of the juvenile shoot, Phytomorphology, 5, 253—273 (1955).
50. Tomlinson P. B., Esler A. E. Establishment growth in woody monocotyledons
native to New Zealand, New Zeal. J. Bot., 11, 627—644 (1973).
51. Tucker D. J., Mansfield T. A. Apical dominance in Xanthium strumarium;
a discussion in relation to current hypotheses of correlative inhibition, J. Exp.
Bot., 24, 731—740 (1973).
52. Van Fleet D. S. The cell forms, and their common substance reactions, in
the parenchyma-vascular boundary, Bull. Torrey Bot. Club, 77, 340—353 (1950).
53. Van Tieghem P., Douliot H. Sur la polystelie, Ann. Sci. Nat., Bot. Ser. 7, 3,
275-322 (1866).
54. Wetmore R. H. Growth and development in the shoot system of plants, Soc.
Devel. and Growth, Symposium, 14, 173—190 (1956).
55. Williams R. F. The shoot apex and leaf growth: a study in quantitative biolo-
gy, London — New York, Cambridge University Press, 1975.
56. Yun K.-B., Naylor J. M. Regulation of ce^ reproduction in bud meristems of
Tradescantia paludosa, Can. J. Bot., 51, 1137—1145 (1973).
57. Ziegenspeck H. Vorkommen und Bedeutung von Endodermen und Endoder-
moiden bei oberirdischen Organen der Phanerogamen im Lichte der Fluorosko-
pie, Mikroscopie, 7, 202—208 (1952).
58. Zimmermann M. H., Tomlinson P. B. Anatomy of the palm Rhapis excetsa,
I. Mature vegetative axis, J. Arnold Arb., 46, 160—178 (1965).
59. Zimmermann M. H., Tomlinson P. B. Vascular construction and development in
the aerial stem of Prionium (Juncaceae), Amer. J. Bot., 55, 1100—1109 (1968).
60. Zimmermann M. H., Tomlinson P. B. The vascular system in the axis of
Dracaena fragrans (Agavaceae), 1. Distribution and development of primary
strands, J. Arnold Arb., 50, 370—383 (1969). 2. Distribution and development
of secondary vascular tissue, J. Arnold Arb., 51, 478—491 (1970).
61. Zimmermann M. H., Tomlinson P. B. The vascular system of monocotvledo-
nous stems, Bot. Gaz., 133, 141 — 155 (1972).
Глава 17
Стебель: вторичная форма роста
и типы структуры
Вторичный рост
Вторичный рост, являющийся результатом деятельности кам-
бия (гл. 10), — это увеличение объема проводящей ткани в тех
частях стебля (побега или оси проростка) которые прекратили
расти в длину. Он способствует утолщению стебля, но не его уд-
линению. Вторичный рост происходит в основном в главном стеб-
ле и его ветках, но ib ограниченном масштабе может наблюдаться
также и в листьях, особенно в черешках и средних жилках. Он
характерен для голосеменных и древесных двудольных, но встре-
чается также и у травянистых двудольных. Некоторые травяни-
стые двудольные и большинство однодольных не имеют вторич-
ных утолщений. У однодольных существует вторичный рост осо-
бого типа. Термин «вторичный рост» подразумевает также форми-
рование перидермы из феллогена (гл. 12).
Закладка и распространение камбия
Камбий возникает частично из прокамбия в проводящих пуч-
ках, а частично из межпучковой паренхимы (фото 93). В зави-
симости от места образования участки камбия называются соот-
ветственно пучковым и межпучковым камбием. В тех стеблях^
в которых листовые следы и стеблевые пучки в латеральном на-
правлении почти сливаются, межпучковый камбий трудно отгра-
ничить от пучкового камбия, за исключением зон листовых щелей.
Вначале деления, приводящие к закладке камбия, в проводя»
щих пучках происходят раньше, чем в межпучковых зонах. Если
эти зоны широкие, деления могут начинаться в клетках, лежа-
щих рядом с пучковым камбием, и далее распространяться в тан-
генциальном направлении Этот факт заставляет предположить,
что развитие межпучкового камбия как-то стимулируется прово-
дящими пучками. Эксперименты, в которых исследовались меж-
пучковые зоны гипокотиля Rtcinus, не доказали существования
такой стимуляции [25]. В одних опытах фрагменты гипокотиля
вырезали и вставляли обратно перевернутыми, при этом адапта-
ции к новому положению не было обнаружено — межпучковый
камбий сформировался в обычном месте, хотя оно теперь находи-
лось не на одной линии с пучковым камбием (рис. 17.1). Более
того, камбий в перевернутом фрагменте образовал ксилему
и флоэму топографически в перевернутом положении, т. е. ради-
Стебель: вторичная форма роста и типы структуры
311
ильная полярность его клеток не изменилась. В других опытах
полоски межпучковой ткани, отделенные от соседней проводящей
ткани радиально вставленными лезвиями бритвы или отрезанные
и культивируемые в основной среде, обнаружили нормальное раз-
витие камбия и проводящих тканей. Эти результаты означают,
что будущие камбиальные клетки в межпучковых зонах изна-
чально детерминированы и имеют определенную радиальную по-
лярность задолго до начала камбиальной активности, которая
включается только на определенно(М уровне гипокотиля.
При вторичном росте обычного типа камбий превращается
в замкнутый цилиндр и производит непрерывные цилиндры вто-
ричной ксилемы и флоэмы (фото 94—96), каждый со своими осе-
вой и радиальной системами клеток (гл. 8—11), причем осевые
клетки происходят от веретеновидных камбиальных инициалей,
а радиальные— от лучевых инициалей (гл. 10).
Формирование камбия, как видно на поперечных срезах стеб-
ля, не протекает равномерно по всей окружности оси. Как уже
упоминалось в гл. 16, проводящие пучки, расположенные на том
уровне стебля, где происходит первичный рост, находятся на раз-
ных стадиях развития, так как связаны с листьями разных воз-
растов. Следовательно, одни пучки вступают в стадию вторично-
го роста раньше, чем другие. Переход от первичного роста к вто-
f
Рис. 17 1. Поперечный срез гипокотиля Ricinus communis, в котором прямо-
угольный участок ткани был вырезан, а затем опять вставлен, после того как
из него был вырезан и затем вставлен перевернутым фрагмент, заключенный
между короткими стрелками. На одной стороне этого фрагмента находилась
межпучковая ткань. К моменту опыта растение имело возраст 7 дней, вторич-
ный рост еще не начался. Данный срез был сделан через 10 дней после инверсии
участка ткани. Можно видеть результат раннего вторичного роста. Между стеб-
лем и привитым участком справа непрерывность камбия восстановилась. Камбий
инвертированного участка (слева) сформировался вне связи с камбием всего
стебля и откладывает ксилему наружу, а флоэму внутрь. (Рисунок сделан по
микрофотографии из работы [25].) 1 — прививочный рубец; 2— ксилема (за-
штрихована) ; 3 — флоэма (точки); 4 — вырезанный участок (перевернутый фраг-
мент между стрелками); 5 — пучковый камбий; 6 — межпучковый камбий.
312
Глава 17
ричному в стеблях Populus deltoides [16] происходит в междоуз-
лии первого зрелого листа книзу от апекса, и первые камбиаль-
ные деления появляются в проводящих пучках выше места от-
ветвления листовых следов следующего, более старого листа. От
этого места волна камбиальной активности распространяется по
стеблю акропетально вдоль парастихи (спирали), связывающей
листья в порядке их закладки в верхушке побега.
В ветках, развивающихся из пазушных почек, камбий форми-
руется так же, как и в главном стебле, причем камбий веток
и ствола образует непрерывный слой. Камбий стебля в свою оче-
редь переходит в камбии корня. Камбий появляется к концу пер-
вого года роста побега, после того как заканчивается рост меж-
доузлий в длину. Благодаря непрерывности камбия вдоль всего
дерева проводящие ткани самой старой его части через более
молодые участки связаны с зонами вторичного роста в побегах
первого года. Более того, вторичные ткани, расположенные в ос-
новании молодого побега, связаны с зоной первичного роста на
верхних уровнях того же побега. Непрерывная связь зон первич-
ного и вторичного роста в побеге может быть продемонстрирова-
на в таком опыте: через надрез в листе вводят раствор эозина
и затем прослеживают его передвижение через первичную ксиле-
му листового следа в стеблевые пучки и в конце концов во вто-
ричную ксилему [29].
Влияние вторичного роста на ранее
сформированные ткани
Образование вторичных проводящих тканей между первичной
флоэмой и первичной ксилемой вызывает значительные измене-
ния внутри стебля; это особенно касается тканей, располагающих-
ся снаружи от камбия. Сердцевина и первичная ксилема покры-
ваются вторичной ксилемой, первичные проводящие элементы пе-
рестают функционировать. Протоксилема полностью разрушается
(фото 96,5 и 97), но связанная с ней паренхима может сохра-
нять жизнедеятельность в течение ’многих лет. Иногда сердцевина
деформируется под давлением разрастающихся внутрь вторич-
ных тканей.
Первичная флоэма отодвигается кнаружи (фото 94). Она ста-
новится непроводящей, и у многих двудольных из протофлоэмы
образуются волокна (фото 96). Тонкостенные клетки спадаются
или разрушаются. Первичная кора может существовать в течение
многих лет. Ее периметр увеличивается благодаря растяжению
клеток в периклинальном направлении и делению клеток анти-
клинальными перегородками. Эпидерма также может сохранять-
ся, так как клетки растягиваются и делятся по мере увеличения
периметра стебля.
Стебель: вторичная форма роста и типы структуры 313
В процессе вторичного роста вторичная флоэма также подвер-
гается давлению изнутри от разрастающегося цилиндра древеси-
ны. В зависимости от структуры флоэмы ее внешний вид 'в боль-
шей или меньшей степени изменяется. Когда волокон много и они
располагаются в тангенциальных тяжах (фото 98), старая непро-
водящая флоэма может и не разрушаться. У других видов — с во-
локнами или без них — полностью разрушаются довольно боль-
шие массивы клеток (ситовидные элементы и непосредственно
связанные с ними клетки). Согласованный рост по окружности
осуществляется путем клеточных делений во флоэмной паренхи-
ме и лучах. Иногда он наблюдается только в определенных лу-
чах, которые расширяются (дилатируют) к периферии (фото 94,
95, Б и 98).
У многих видов в процессе вторичного роста образуется пери-
дерма, которая может оставаться на поверхности в течение не-
скольких лет (гл. 12). Если формируется ритидом, первичные тка-
ни, а затем также и последовательно откладываемые слои вто-
ричной флоэмы постепенно сбрасываются. Такая элиминация пе-
риферических слоев периодически снимает натяжение, возникаю-
щее вследствие увеличения периметра стебля.
ВЛИЯНИЕ ВТОРИЧНОГО РОСТА НА ЛИСТОВЫЕ ЩЕЛИ
И ЛИСТОВЫЕ СЛЕДЫ
Когда в паренхиме щели появляется межпучковый камбий,
соответствующие деления и последующее формирование ксилемы
и флоэмы происходят сначала вдоль краев щели, а затем распро-
страняются к ее середине (рис. 17.2). Если щель широкая, может
пройти два года, а то и больше, прежде чем камбий сформирует-
ся на протяжении всей щели. Щель в связи с этим суживается
ступеньками по мере последовательных отложений ксилемы (рис.
17.2, В, Г). Если процесс формирования ксилемы заканчивается
напротив щели, щель называется закрытой.
Листовой след, противостоящий листовой щели, претерпевает
существенные изменения (рис. 17.2). У растений с опадающей
листвой в конце первого сезона он отделяется от листового пучка.
Нижняя часть следа находится в цилиндре, образованном стеб-
левыми пучками, и перед опадением листа в ней формируется
пучковый камбий на одной линии с камбием других проводящих
пучков стебля. Верхняя часть следа направлена кнаружи и окан-
чивается в листовом рубце. Этот тупой конец следа обладает ли-
бо небольшой камбиальной активностью, либо вовсе ее лишен.
Если эта часть следа образует с центральным цилиндром неболь-
шой угол, проводящая ткань, сформировавшаяся выше в щелевой
зоне, в конце концов вызывает разрыв следа, и его обособленный
314
Глава 17
Рис. 17.2. Схема, иллюстрирующая влияние вторичного роста на листовые следы
и листовые щели на поперечных (А, В) и продольных (Б, Г, Д) срезах стебля,
сделанных в области узла. (Esau, Plant Anatomy, 2nd ed., John Wiley & Sons,
1965.) А, Б. Щель открыта. Г. Щель отчасти закрыта вторичными проводящими
тканями. В, Д. Щель закрыта и листовой след прерван. 1—листовой след; 2 —
листовая щель; 3— ксилема первого года; 4 — флоэма; 5 — первичная кора; 6 —
листовой рубец; 7 — ксилема.
конец .выносится наружу (рис. 17.2, Г, Д). Если же она направ-
лена горизонтально, то он погружается во (вторичную ткань без
разрыва.
ЗАЖИВЛЕНИЕ РАН И ПРИВИВКИ
С вторичным ростом и деятельностью камбия часто связаны
явления заживления ран и срастания подвоя с привоем. При по-
вреждении листьев, молодых веточек и других частей растения,
не имеющих вторичного роста, обычно прежде всего образуется
рубец, т. е. отмершие клетки разрушаются и откладываются ве-
щества, которые, по-видимому, защищают поверхность от высы-
хания и других вредоносных внешних факторов. Впоследствии из
Стебель* вторичная форма роста и типы структуры
315
Рис 17 3 Срастание привоя с подвоем при прививке в расщеп А Клин ткани
привоя, погруженный в щель в стебле подвоя Б Поперечный срез прививки в
расщеп в стебле Hibiscus [24] Перидерма образует сплошное кольцо вокруг
подвоя и привоя Камбии подвоя и привоя объединены за счет камбиальных
делений в каллусе Новый камбий ща'чйнает Сформировать проводящие ткани.
1 — привой, 2— подвой, 3— перидерма, 4 — вторичная флоэма, 5 — новая кси-
лема, 6 — старая ксилема, 7 — камбий, 8 — каллус, 9— камбий в каллусе
живых клеток, лежащих непосредственно под рубцом, развива-
ется перидерма. Когда повреждаются ветки или стволы, обла-
дающие вторичным ростом, образованию перидермы предшествует
развитие каллуса, при этом паренхимная ткань образуется за
счет пролиферации различных клеток вблизи поверхности раны.
Каллус также формирует ткани, благодаря которым восстанав-
ливается непрерывность камбия, если она была нарушена пора-
нением [24].
Срастание при прививках основано на явлении, сходном с за-
живлением ран. Продукты разрушения отмирающих клеток обра-
зуют на поверхностях срезов подвоя и привоя некротический, так
называемый контактный, слой [4, 8], который соответствует руб-
цу в заживающей ране Интактные клетки по соседству с контакт-
ным слоем увеличиваются в объеме, делятся и образуют каллус,
который заполняет пространство, остающееся между прижатыми
друг к другу подвоем и привоем. Очевидно, камбии привоя и под-
воя смыкаются один с другим через каллус в результате превра-
щения его клеток в камбиальные клетки (рис. 17 3). Если при
прикреплении привоя к подвою совместить камбии, это способст-
вует установлению камбиальной непрерывности и успешному объ-
единению образующихся впоследствии вторичных проводящих
тканей Каллус возникает ib зоне проводящих тканей из различ-
ных живых клеток, среди которых могут быть особенно активны
клетки флоэмных лучей и лучей молодой ксилемы.
316
Глава 17
Срастание привоя с подвоем связано со многими трудностями,
и причины успеха или неудачи не вполне ясны. Иногда прививка
не удается из-за методических ошибок, например из-за недоста-
точной подгонки камбиев подвоя и привоя. Полезно также уда-
лять древесину из почечного привоя [22] — это еще один пример
того, как важна здесь правильная методика. Разного рода осо-
бенности в структуре стебля рассматриваются иногда как помеха
для успешного срастания, но эту трудность, очевидно, можно пре-
одолеть усовершенствованием методических приемов. Так, удач-
ные прививки были получены даже у однодольных, которые при
нормальном развитии не обладают камбиальной активностью
[15, 19]. Наиболее серьезным лимитирующим фактором, однако,
являются не условия срастания, а генетически детерминированная
несовместимость, которая вызывает антагонистическое взаимо-
действие между привоем и подвоем [21].
Типы стеблей
Первичная и вторичная структуры стеблей разнообразны, так
что иногда полезно говорить о различных типах стеблей. Разли-
чают обычно древесные и травянистые стебли, лианы, стебли од-
нодольных и стебли с аномальным вторичным ростом.
Хвойные
В качестве примера стебля древесного хвойного растения рас-
смотрим стебель сосны. В первичном состоянии стебель имеет
обособленные проводящие пучки — листовые следы и стеблевые
пучки, разделенные сравнительно узкими межпучковыми зонами.
Камбий, состоящий из пучковой и межпучковой частей, форми-
рует сплошной цилиндр вторичной ксилемы и вторичной флоэмы
(фото 95, Л). (Структура этих тканей рассмотрена в гл. 9 и 11.)
Напротив щелей вторичные ткани образуются постепенно, так что
паренхима щели вдается во вторичную ксилему. Первичную кси-
лему проводящих пучков можно разглядеть рядом с сердцеви-
ной, но первичная флоэма полностью облитерируется. Границу
между флоэмой и первичной корой можно провести, когда раз-
рушенная первичная флоэма еще заметна. В противном случае
ее не видно, так как первичная флоэма не образует волокон. Ко-
ра содержит смоляные ходы, которые сильно разрастаются в тан-
генциальном направлении по мере того, как стебель увеличивает-
ся в окружности. Исходная перидерма возникает под эпидермой
и не замещается более глубокой перидермой в течение многих
лет.
Стебель: вторичная форма роста и типы структуры 317
Древесные двудольные
У большинства древесных двудольных межпучковые зоны уз-
кие (Salix, Prunus, Quercus) или очень узкие (Tilia). У этих ви-
дов цилиндр вторичных тканей сплошной, т. е. без широких лучей.
Tilia (Tiliaceae; фото 94, 95,5 и 98) свойствен ряд черт, об-
щих для стеблей древесных двудольных. Первичная ксилема на
внутреннем крае непрерывной вторичной ксилемы имеет вокруг
сердцевины несколько неровные очертания и может быть отгра-
ничена от вторичной ксилемы только приблизительно. Вторичная
ксилема несколько плотнее, чем первичная, и содержит (в осевой
системе) сосудистые элементы, трахеиды, волокна и клетки кси-
лемной паренхимы, сгруппированные «в паратрахеально распола-
гающиеся тяжи. Лучи встречаются как широкие, так и узкие..
Вторичная флоэма имеет характерный вид из-за дилатации не-
которых лучей и чередования тяжей волокон с тяжами ситовид-
ных трубок, спутников и паренхимных клеток. Исходная пери-
дерма закладывается под эпидермой и существует многие годы.
Первичная кора также сохраняется в течение всего этого време-
ни. Первичную кору можно легко отличить от флоэмы, так как
последняя содержит волокна как в периферической части (прото-
флоэмные волокна), так и в более глубоких слоях (вторичные
флоэмные волокна). Сердцевина паренхиматическая и содержит
слизевые клетки и полости. Наружная часть сердцевины долго
остается активной, функционируя как запасающая ткань. Ее на-
зывают перимедуллярным влагалищем или перимедуллярной зо-
ной (фото 94, А, Б).
Травянистые двудольные
Стебли многих травянистых двудольных обладают вторичным
ростом обычного типа и сходны со стеблями древесных двудоль-
ных такого же возраста. Примером является стебель Hibiscus
cannabinus (Malvaceae) [12] (фото 96). Во время раннего вторич-
ного роста стебель сохраняет эпидерму. В более старых стеблях
в ней закладывается перидерма с чечевичками. Один-два слоя:
коры под эпидермой содержат хлоропласты. Глубже располага-
ются два-три слоя колленхимы, затем паренхима со слизевыми
клетками и добавочная паренхима. Первичная флоэма содержит
волокна, граничащие с первичной корой (протофлоэмные волок-
на). Волокна развиваются также во вторичной флоэме, но не
в метафлоэме (фото 96, Б). Камбий отделяет флоэму от вторич-
ной ксилемы, которая образует компактный цилиндр. Лучи во
вторичных проводящих тканях молодых стеблей однорядные..
Позднее появляются также многорядные лучи. Более того, по ме-
ре старения стебля многие лучи в наружной флоэме становятся
-318
Глава Г7
дилатированными. Сердцевина паренхиматическая, но содержит
слизевые клетки. В сердцевине, коре, лучах и осевой паренхиме
могут присутствовать крахмал и кристаллы. Граница между кси-
лемой и сердцевйной неровная, так как Тяжи первичной кси-
лемы в большей или меньшей степени вдаются в сердцевину
(фото 96, А). Самые крупные пучки первичной ксилемы содержат
шротоксилему, в которой трахеальные элементы разрушены (фо-
то 97).
Стебель Pelargonium (Geraniaceae) имеет узкие межпучковые
зоны, так чти приводящие пучки в центральном проводящем ци-
линдре расположены плотно (рис. 17.10, А). Вторичные ткани об-
разуют сплошной цилиндр. Проводящая зона окружена несколь-
кими рядами волокон первичной флоэмы с одревесневшими вто-
ричными оболочками. Эти волокна берут начало в прокамбии,
как правило, вместе с ситовидными трубками, некоторые — меж-
ду тяжами флоэмы [2J. В более старом стебле эпидерма заме-
дцается перидермой субэпидермального происхождения (гл. 12).
Первичная кора и сердцевина паренхиматические.
У Hehanthus (Asteraceae) межпучковые зоны шире, чем
у Pelargonium (фото 99,5). Межпучковый камбий и сплошной
цилиндр проводящих тканей формируются в нижней части стебля.
В верхней части стебля нет вторичного роста, и межпучковая па-
ренхима склерифицируется. В межпучковых зонах и сердцевине
могут присутствовать (мелкие флоэмные пучки. Волокна первич-
ной флоэмы на поперечных срезах выглядят как массивные шап-
ки над пучками. Перидерма обычно отсутствует, и эпидермальные
клетки в тангенциальном направлении увеличиваются в размерах
и антиклинально делятся Стебли некоторых Asteraceae имеют
эндодерму с пояскамц Каспари
В стебле люцерны (Medtcago') проводящие пучки четко отде-
лены один от другого довольно широкими межпучковыми зонами
(фото 93,5). В основании стебля имеет место некоторый вторич-
ный рост, но межпучковый камбий образует очень небольшое ко-
личество флоэмы и преимущественно склеренхимные клетки йа
месте ксилемы. Такой тип вторичного роста, характерный для
многих травянистых Fabaceae, а также гистологические особен-
ности вторичной ксилемы отличают структуру травянистого стеб-
ля от строения стеблей родственных древесных видов. Следова-
тельно, часто высказываемое утверждение, что травянистый сте-
бель похож на стебель родственных древесных видов, не являет-
ся общим правилом [5, 6].
Стебель Coleus (Lamiaceae) также-обладает своеобразным ти-
пом вторичного роста. Участки ксилемы, содержащие трахеальные
элементы, и большая часть флоэмы формируются в пучковых "зо-
нах, склеренхима и небольшое число тяжей с (ситовидными струк-
турами — в межпучковых зонах (фото 100).
Стебель: вторичная форма роста и типы структуры
31*
У некоторых травянистых двудольных вторичные ткани не об-
разуются, и их проводящая система со свободно разбросанными
проводящими пучками «закрытого» типа похожа на проводящую
систему однодольных (Ranunculus, Ranunculaceae, фото 101,4;
Nelumbo, Nelumbonaceae)
Во всех описанных стеблях ксилема и флоэма расположены,
коллатерально. У Solanaceae, например у томатов, картофеля
и табака, присутствует внутренняя флоэма. Когда в этих стеблях
происходит вторичный рост, камбий появляется только между на-
ружной флоэмой и ксилемой [27]. Стебель Cucurbita (Cucurbita-
сеае) также имеет внутреннюю флоэму и по своему виду может
быть отнесен как к травянистым растениям, так и к лианам. Би-
коллатеральные проводящие пучки расположены в два ряда —
наружный и внутренний (фото 101,5) —и погружены в основную
паренхиму. Внутренняя часть сердцевины разрушается на ранних
стадиях первичного роста. Проводящая система и связанная
с ней основная паренхима заключены в цилиндр из периваскуляр-
ных волокон с одревесневшими вторичными оболочками и живыми
содержимым. Кора состоит из паренхимы и колленхимы. Крах-
малоносное влагалище расположено снаружи от периваскуляр-
ных волокон непосредственно за ними. Вторичный рост ограничен
только проводящими пучками, особенно участком между наруж-
ной флоэмой и ксилемой Некоторым Cucurbitaceae свойствен до-
вольно интенсивный вторичный рост с радиальным разрастанием
межпучковых зон и формированием перидермы.
Травянистые стебли могут в большей или меньшей степени
перестраиваться в связи с их главной функцией. Например, су-
щественная перестройка происходит в клубне картофеля [13].
Первичная проводящая система клубня более однородна по внеш-
нему виду, чем первичная проводящая система надземного стеб-
ля, так как листья чешуевидные и их следы невелики. Междо-
узлия остаются короткими. Вторичный рост незначителен. Основ-
ная масса запасающей ткани происходит из перимедуллярной
зоны, содержащей внутреннюю флоэму. Сердцевина, включающая
перимедуллярную зону, довольно обширна, и внутренняя флоэма
менее компактна, чем в подземном стебле или в корневище.
Двудольные растения — лианы
Характерной чертой стеблей лианного типа являются широкие
лучи, которые как бы рассекают вторичную структуру. В качест-
ве примера рассмотрим стебель винограда (Vitis\ гл. 12) [9].
Вначале проводящая система состоит из тяжей различных разме-
ров. Камбий закладывается в пучковой и межпучковой зонах,,
и отдельные его участки затем соединяются. Межпучковый кам-
бийк формирует паренхиму, так что широкие лучи переходят, нет
прерываясь, в межпучковые зоны. Время от времени в клинооб-
Г лава 17
«320
разных участках вертикальной системы появляются новые широ-
кие лучи. Они не сливаются с межпучковыми зонами, и благодаря
им сохраняется характерная рассеченность вторичной структуры
в процессе роста стебля в толщину. После того как первичная
флоэма (протофлоэма) теряет проводящую функцию, развивают-
ся волокна. Тангенциальные полоски волокон встречаются и во
вторичной флоэме. Первичная кора состоит из колленхимы и па-
ренхимы, причем клетки обеих тканей содержат хлоропласты.
Самый внутренний слой первичной коры представляет собой крах-
малоносное влагалище. Сердцевина состоит из паренхимы.
В стебле винограда исходная перидерма закладывается не
сразу под эпидермой, а глубже (гл. 12). Она появляется сначала
под волокнами первичной флоэмы и происходит от паренхим-
ных клеток метафлоэмы. Формируясь также и в межпучковой
паренхиме, феллоген постепенно образует непрерывное кольцо
по всей окружности стебля. Внешняя часть флоэмы и первичная
кора слущиваются сплошным куском («кольцевая корка»). Сле-
дующие слои перидермы закладываются постепенно во все более
глубоких слоях вторичной флоэмы.
Разделение сосудистых тканей на клинообразные блоки имеет
место также у Aristolochia (фото 102). Этому растению свойст-
венны также некоторые другие особенности, так что его иногда
относят к растениям с аномальным вторичным ростом. Вначале
паренхимная сердцевина окружена свободно рассеянными колла-
теральными проводящими пучками. Проводящая система и основ-
ная паренхима, в которую она погружена, заключены в цилиндр
из периваскулярных волокон. Флоэма не содержит волокон. Пер-
вичная кора состоит из паренхимы и колленхимы. Самый внут-
ренний слой первичной коры, прилегающий к периваскулярным
волокнам, представлен в 'молодых стеблях крахмалоносным вла-
галищем. В процессе вторичного роста отдельные тяжи разраста-
ются в радиальном направлении в клиновидные блоки. В неот-
четливо выраженном межпучковом камбии происходят клеточные
деления. Камбий образует лучи, состоящие из паренхимы, подоб-
ной паренхиме первичных межпучковых зон. По мере того как
проводящий цилиндр растет в толщину, в цилиндре из перивас-
кулярных волокон возникают разрывы, главным образом напро-
тив лучей (фото 102). Разрывы заполняются в результате роста
[10] примыкающих паренхимных клеток, которые могут диффе-
ренцироваться в склереиды. Сердцевина и межпучковые зоны
частично разрушаются. В колленхиме под эпидермой развивается
перидерма. Она закладывается в виде изолированных вертикаль-
ных полосок, тянущихся от узла к узлу, и требуется несколько
лет, чтобы она распространилась по всей окружности стебля.
Пробка слоистая вследствие чередования слоев толстых и тонких
клеток. Образуется также развитая феллодерма.
Стебель: вторичная форма роста и типы структуры
321
* Двудольные с аномальным вторичным
ростом стебля
Термином аномальный вторичный рост характеризуют те
формы камбиальной активности, которые отклоняются от обыч-
ной, свойственной хвойным и древесным двудольным умеренных
зон. Виды аномального вторичного роста очень разнообразны
и связаны переходными формами с нормальным типом [20].
У некоторых растений с аномальным вторичным ростом камбий
занимает обычное положение, но во вторичных тканях обнаружи-
вается необычное распределение флоэмы и ксилемы. У Leptadenia
(Asclepiadaceae), Sirychnos (Loganiaceae), Thunbergia (Acantha-
ceae) [17] флоэма откладывается не только наружу, но время от
времени также и внутрь. Таким образом, анастомозирующие друг
с другом тяжи вторичной флоэмы оказываются погруженными во
вторичную ксилему (рис. 17.4, А). У Amaranthaceae, Chenopodia-
ceae, Menispermaceae и Nyctaginaceae ряды камбия возникают
постепенно на все большем расстоянии от центра стебля, причем
каждый ряд откладывает ксилему внутрь, а флоэму кнаружи
(рис. 17.4,5; ср. корень сахарной свеклы, гл. 15). Флоэма и кси-
лема образуют тяжи, которые погружены в паренхимную ткань,
иногда называемую связующей тканью (фото 103). Эта ткань воз-
никает за счет камбиальной активности между проводящими пуч-
Рис. 17.4. Поперечные срезы стеблей с аномальным вторичным ростом. (Esau,
Plant Anatomy, 2nd ed., John Wiley & Sons, 1965.) A. Leptadenia spartium
(Asclepiadaceae). Тяж вторичной флоэмы погружен во вторичную ксилему (так
называемая включенная флоэма). Б. Boerhaavia diffusa (Nyctaginaceae). По-
следовательные слои прироста вторичных проводящих тканей, каждый состоит
из ксилемы, флоэмы и паренхимы. Каждый слой прироста формируется отдель-
ным камбиальным слоем. 1 — вторичная ксилема; 2— вторичная флоэма.
2 1 К. Эзау, кн. 2.
322
Глава 17
Рис 17 5 Схема поперечного сечения стебля с аномальным вторичным ростом,
найденным у Bignomaceae. Вторичная ксилема рассечена за счет внедрения
блоков флоэмы. Каждый блок имеет свой собственный камбий, который откла-
дывает клетки только наружу. Ксилема и периферический слой флоэмы сфор-
мированы камбием, откладывающим клетки в двух направлениях. 1 — ритидом;
2— вторичная флоэма, 3 — камбий, откладывающий клетки в двух направлениях;
4 — вторичная ксилема; 5 — камбий, откладывающий клетки в одном направлении
ками, которая сходна с деятельностью обычного межпучкового
камбия, но ограничена во времени.
Вторичный рост, связанный с поликамбиальностью, был изу-
чен у Bougainvillea spectabilis (Nyctaginaceae) [26]. У растений
этого вида нет нормального камбия, так что первичные проводя-
щие пучки не объединяются. Снаружи от них образуется сплош
ной цилиндр меристематической ткани. Как и камбий, она форми-
рует проводящие пучки и связующую ткань. Некоторые пучки
развиваются из клеток внутри этой камбиальной ткани, другие
формируются обычным для двудольных способом, причем флоэ-
ма возникает с внешней стороны, а ксилема — с внутренней. Во
втором случае новый слой камбия появляется снаружи от флоэ-
мы [И].
Представители Bignoniaceae служат примером еще одного ти-
па аномального роста (рис. 17.5) [7]. После того как в конце пер-
вичного роста сформируется обычный тип камбиального цилинд-
ра, четыре полоски камбия прекращают формировать ксилему,
но продолжают откладывать клетки в сторону флоэмы. Таким
образом, возникают два рода камбия, из которых один проявляет
активность в двух направлениях, а другой — только в одном. Об-
разованный аномальным камбием блок флоэмы оказывается глу-
боко погруженным в ксилему, так как нормальный камбий откла-
дывает ксилему по обеим сторонам от этого блока. Центробежно
f
Стебель' вторичная форма роста и типы структуры
323
формирующаяся флоэма отодвигается ’наружу, рассекая при этом
стационарную ксилему. По мере того как стебель растет в тол-
щину, дополнительные полоски камбия перестают откладывать
клетки в обе стороны и делают это теперь только в одном направ-
лении. Одни новые участки флоэмы развиваются рядом с ранее
отложенными, другие появляются в новообразованных зонах кси-
лемы. Каждый флоэмный блок ограничен с боков широкими лу-
чами и сохраняет свой первоначальный тангенциальный диаметр,
но по направлению кнаружи группа блоков разрастается в шири-
ну, так как в каждой группе добавляются все новые блоки
(рис. 17.5). Ксилема, таким образом, все время рассекается вновь
образующимися блоками флоэмы В старых стеблях ее целостность
нарушается еще и в результате дилатационного роста самой кси-
лемы и сердцевинной паренхимы.
В образовании аномальной структуры стебля у Bauchinia
(Caesalpiniaceae) важную роль играет дилатация (периферийное
расширение) паренхимы. Ксилема растрескивается, разрывы за-
полняются паренхимой, и в ней возникают новые сосудистые
пучки. Лентовидная форма стеблей у некоторых (видов этого рода
развивается вследствие торможения камбиальной активности на
двух противоположных сторонах стебля и ее усиления на двух
других сторонах [1].
Однодольные
Стебли (соломины) Роасеае, как видно на поперечных срезах,
имеют свободно рассеянные проводящие пучки, не собранные
в кольцо. Пучки расположены или в два круга (фото 104; Avena,
Hordeum, Secale, Triticum, Oryza), или рассредоточены по всему
срезу (Bambusa, Saccharum, Sorghum, Zea, гл. 16). У злаков с
круговым расположением пучков ближе к периферии образуется
сплошной цилиндр склеренхимы. В нее погружены внешние бо-
лее мелкие пучки. Между мелкими пучками и эпидермой прохо-
дят тяжи волокон, чередуясь с тяжами хлоренхимы. В эпидерме,
покрывающей хлоренхиму, имеются устьица. Сердцевина часто
разрушается, исключение составляет сердцевина в узлах стеблей
злаков с круговым расположением пучков. В стеблях с рассеян-
ными пучками никаких периферических волокон не развивается,
но субэпидермальная паренхима и паренхима более глубоких сло-
ев может быть склерифицирована [18]. В стеблях обоих типов
проводящие пучки целиком состоят из первичных тканей и заклю-
чены во влагалище из склеренхимы.
У однодольных, не относящихся к Роасеае, проводящие пучки
также рассеяны или расположены кольцами близко к периферии,
как это видно на поперечных срезах. У Tradescantia (Commelina-
21*
324
Глава 17
сеае) центральный цилиндр с рассеянными пучками ограничен
снаружи цилиндром из склеренхимы в 1—4 слоя клеток, а в уз-
лах проводящие пучки соединены друг с другом узловыми спле-
тениями проводящей ткани [14]. Уплотненная проводящая ткань,
характерная для гидрофитов, обычна у водных однодольных [23].
У Potamogeton (Potamogetonaceae), например, толстая кора, со-
стоящая из аэренхимы, окружает компактный центральный ци-
линдр, ограниченный мелкоклеточной эндодермой (фото 105). Ко-
личество сердцевинной ткани у различных видов этого рода не-
одинаково. Имеется восемь проводящих пучков, из которых два
miTLTv тлплгтттткт v nnnvniar n vto тля иипй гг ттпгтгпетФГ ггп\7паттпп пягпн-
V/ С-L XVI 1111 А-/А V АЛ V/ Чу/д^УА А Л-/ IVA Ч^^-ЦАЛ V4. АЛ А А ЧУ АЛ aavav^^akv-z^aaa J ^л^аа ~ a a
ложенных листьев Крупный пучок с флоэмой по обе стороны от
ксилемы (фото 105, 5, вверху) представляет собой комплекс из
трех листовых следов, которые на более высоком уровне того
же стебля идут отдельно друг от друга. Пучки, обозначенные на
фото буквами с и л, представляют собой срединный и латераль-
ные следы листа, прикрепленного к узлу выше того уровня, ко-
торый показан на срезе. Ксилема проводящих пучков представ-
лена лакуной, которая образовалась на месте трахеальных эле-
ментов, разрушенных во время роста междоузлия в толщину.
Флоэма, наоборот, хорошо развита и состоит из крупных ситовид-
ных элементов, отчетливо выраженных клеток-спутников и клеток
флоэмной паренхимы.
ВТОРИЧНЫЙ РОСТ
У однодольных обычно отсутствует вторичный рост за счет
камбия, но толстые стебли могут развиваться (например,
у пальм) благодаря делению и растяжению клеток основной па-
ренхимы. Такой рост называется диффузным вторичным ростом
[28]. У травянистых и древесных Liliflorae {Agave, Aloe, Cordyli-
ne, Dracaena, Sansevlerla, Yucca) и других систематических групп
вторичный рост обусловлен камбием особого рода [3, 30]. Этот
камбий непосредственно связан с первичной меристемой утолще-
ния [если последняя выявляется (гл. 16)], но функционирует
в той части стебля, которая закончила рост в длину. Камбий за-
кладывается в паренхиме кнаружи от первичных сосудистых пуч-
ков и производит вторичные проводящие пучки и паренхиму
внутрь и небольшое количество паренхимы кнаружи (фото 106).
В процессе развития проводящих пучков отдельные камбиальные
клетки делятся продольно; затем две или три дочерние клетки
повторяют продольные деления. Образовавшиеся клетки диффе-
ренцируются в проводящие элементы и связанные с ними скле-
ренхимные клетки. Ряды клеток смыкаются по вертикали и обра-
зуют проводящий пучок. Вторичные проводящие пучки могут
быть коллатеральными или амфивазальными и располагаются
Стебель: вторичная, форма роста и типы структуры
325
более или менее выраженными радиальными рядами. У некото-
рых однодольных образуется перидерма такого же типа; как
у двудольных (Aloe, Cocos, Roystoned)\ другие имеют в качестве
защитной ткани так называемую слоистую пробку (гл. 12).
СПИСОК ЛИТЕРАТУРЫ
1. Basson Р. W., Bierhorst D. W. An analysis of differential lateral growth in
the stem of Bauhinia surinamensis, Bull. Torrey Bot. Club, 94, 404—411
(1967).
2. Blyth A. Origin of primary extraxylary stem fibers in dicotyledons, Univ. Ca-
lif. Pubs Bot., 30, 145—232 (1958).
3. Cheadle V. I. Secondary growth by means of a thickening ring in certain mo-
nocotyledons, Bot. Gaz., 98, 535—555 (1937).
4. Copes D. Graft union formation in Douglas-fir, Amer. J. Bot, 56, 285—289
(1969).
5 Cumbie B. G. Anatomical studies in the Leguminosae, Trop. Woods, 113, 1—
47 (1960).
6. Cumbie B. G., Mertz D. Xylem anatomy in Sophora (Leguminosae) in relation
to habit, Amer. J. Bot., 49, 33—40 (1962).
7. Dobbins D. R. Studies of the anomalous cambial activity in Doxantha unguis-
cati (Bignoniaceae). II. A case of differential production of secondary tissues,
Amer. J. Bot, 58, 697—705 (1971).
8. Dormling I. Anatomical and histological examination of the union of scion
and stock in grafts of Scots pine (Pinus sylvestris L.) and Norway spruce
(Picea abies (L.) Karst.), Studia Forestalia Suecica No. 13, 136 p., 1963.
9. Esau R. Phloem structure in the grapevine, and its seasonal changes, Hilgar-
dia, 18, 217—296 (1948).
10. Esau R. On the anatomy of the woody plant, pp. 35—50, in: Cellular ultra-
structure of woody plants, W. A. Cote, Jr., ed., Syracuse University Press,
1965.
11. Esau R., Cheadle V. I. Secondary growth in Bougainvillea, Ann. Bot, 33,
807—819 (1969).
12. Esau R., Morrow I. B. Spatial relation between xylem and phloem in the stem
of Hibiscus cannabinus L. (Malvaceae), Bot J. Linn. Soc., 68, 43—50 (1974).
13. Hayward H. E. The structure of economic plants, New York, The Macmillan
Company, 1938.
14. Heyser W. Das Phloem von Tradescantia albiflora. I. Lichtmikroskopische
Untersuchungen, Flora, 159, 286—309 (1970).
15. Rrenke N. P. Wundkompensation, Transplantation und Chimaren bei Pflanzen,
Berlin, Jilius Springer, 1933.
16. Larson P. R., Isebrands J. G. Anatomy of the primary-secondary transition
zone in stems of Populus deltoides, Wood Sci. Tech., 8, 11—26 (1974).
17. Mullenders IF. L’origine du phloeme interxylemien chez Stylidium et Thmt-
bergia. Etude anatomique, Cellule, 51, 5—48 (1947).
18. Murdu W. H. The strengthening system in the stem of maize. Ann. Missouri Bot
Gard., 47, 205—226 (1960).
19. Muzik T. J. Role of parenchyma in graft union in vanilla orchid, Science, 127,
82 (1958).
20. Philipson W. R., Ward J. M., Butterfield B. G. The vascular cambium. Its de-
velopment and activity, London, Chapman and Hall, 1971.
21. Roberts R. H. Theoretical aspects of graftage, Bot. Rev., 15, 423—463
(1949).
22. Scaramuzzi F. Le basi istogenetiche dell’innesto «ad occhio». Ricerche sul pes-
co. [Researches on the histogenic process in bud-union of peach trees.] Ann
Sper. Agr., 6, 517—537 (1952).
.326
Глава 17
'23 . Schenk Н. Vergleichende Anatomie der submersen Gewachse, Bibl. Bot. Heft 1,
67 p., 1886.
24. Sharpies A., Gunnery H. Callus formation in Hibiscus Rosa-sinensis L. and
Hevea brasiliensis Miill., Arg. Ann., Bot., 47, 827—840 (1933).
25. Siebers A. M. Initiation of radial polarity in the interfascicular cambium of
Ricinus communis L., Acta Bot. Neerl., 20, 211—220 (1971). Differentiation of
isolated interfascicular tissue of Ricinus communis L., Acta Bot Neerl., 20,
343—355 (1971).
26. Stevenson D. W., Popham R. A. Ontogeny of the primary thickening meristem
in seedlings of Bougainvillea spectabilis, Amer. J. Bot., 60, 1—9 (1973).
27. Thompson N. P., Heimsch C. Stem anatomy and aspects of development in
tomato, Amer. J. Bot., 51, 7—19 (1964).
28. Tomlinson P. B. Anatomy of the monocotyledons. II. Palmae, Oxford, Claren-
J _ _ T1_____ 1 ЛГ» 1
uun t'lebb, lyoi.
29. Wareing P. F., Roberts D. L. Photoperiodic control of cambial activity in
Robinia pseudoacacia L., New Phytol., 55, 356—366 (1956).
30. Zimmermann M. H., Tomlinson P. B. The vascular system in the axis of Dra-
caena fragrans (Agavaceae), 2. Distribution and development of secondary
vascular tissue, J. Arnold Arb., 51, 478—491 (1970).
Глава 18
Лист: общая организация
и развитие
Морфология
Лист в широком значении этого термина чрезвычайно разно-
образен по структуре и функциям. Вегетативный лист обычно
специализируется как фотосинтетический орган, разрастаясь
в уплощенную структуру — пластинку. Пластинка может быть
прикреплена к стеблю при помощи черешка или без него (сидя-
чий лист). Если основание сидячего или черешчатого листа охва-
тывает стебель, то его называют влагалищным основанием. Иног-
да влагалищная часть листа развивается в явно выраженное ли-
стовое влагалище. Влагалищные основания, как правило, харак-
терны для растений с многолакунными узлами. Листья, связанные
с трехлакунными узлами, часто имеют прилистники — придатки,
расположенные у основания листа. Простые листья имеют одну
пластинку, сложные — две или более пластинок (листочков), при-
крепленных |К общей оси (рахису). Листочки в свою очередь тоже
могут быть сложными.
Еще две специализированные формы листьев — семядоли, пер-
вые листья на растении (гл.23 и 24), и катафиллы. Катафиллы
представлены разнообразными защитными и запасающими брак-
теями или чешуями. По форме и тканевой структуре они проще,
чем вегетативные листья. Первые брактеи на боновом побеге на-
зываются профиллами (гл. 16). За профиллами могут следовать
вегетативные листья или серия других брактей, промежуточных
по структуре между профиллами и вегетативными листьями.
Гистология листа покрытосеменных
Подобно корню и стеблю, лист состоит из покровной, прово-
дящей и основной тканевых систем (фото 107). Поскольку лист
обычно не имеет вторичного роста (за исключением очень незна-
чительного в черешках и крупных жилках), в качестве покровной
ткани у него сохраняется эпидерма. В почечных чешуях, однако,
может формироваться перидерма.
Эпидерма
Основные особенности эпидермы листа — компактное распо-
ложение клеток, а также наличие кутикулы и устьиц (гл. 7).
Устьица могут встречаться на обеих сторонах листа (амфистома-
328
Глава 18
тический лист, фото 107) или только на одной его стороне — верх-
ней (эпистоматический лист) или, гораздо более часто, нижней
(гипостоматический лист). У широких листьев двудольных устьи-
ца рассеяны вдоль всей поверхности без видимого порядка (фо-
то 107, £) В узких длинных листьях однодольных и хвойных они
распределены рядами, параллельными продольной оси листа.
Устьица могут быть расположены на том же уровне, что и осталь-
ные эпидермальные клетки, выше поверхности эпидермы (высту-
пающие устьица) и ниже ее (погруженные устьица). Некоторые
устьипа группируются по нескольку штук в углублениях назы-
ваемых устьичными ямками (криптами). Выступающие устьица
обычно связаны с гидрофитными условиями обитания, отличаю-
щимися избытком доступной воды, погруженные — с ксерофит-
ными условиями, характеризующимися недостатком доступной
воды. Хотя такая закономерность не является строгой, опыты
показывают, что приподнятое положение устьиц может быть вы-
звано экспериментально, если развивающиеся листья поместить
в атмосферу насыщенного пара [1]. Это наблюдение использу-
ется для объяснения, как правило, приподнятого положения усть-
иц, локализованных в устьичных криптах: крипты, обычно закры-
тые трихомами, по-видимому, содержат влажную атмосферу.
Мезофилл
Большая часть основной ткани листовой пластинки приходит-
ся на долю мезофилла, содержащего большое число хлоропластов
и имеющего значительный объем межклетников. Мезофилл мо-
жет быть относительно гомогенным либо дифференцированным
на палисадную и губчатую паренхиму (фото 107). Палисадная
паренхима состоит из клеток, вытянутых перпендикулярно по-
верхности пластинки. Хотя палисадная ткань на вид более ком-
пактна, чем губчатая (фото 107,Л), продольные стенки ее кле-
ток на значительном протяжении обращены к межклетникам (фо-
то 107, Г и 108). Листья могут иметь один или несколько рядов
палисадной паренхимы. У растений умеренных климатических зон,
для которых вода в почве обычно имеется в избытке (мезофит-
ные а стовия обитания), палисадная паренхима, как правило, раз-
мещена на верхней (адаксиальной, или вентральной) стороне
пластинки, а губчатая — на нижней (абаксиальной, или дор-
сальной) стороне Листья с подобной структурой носят название
бифациальных, или дорсовентральных. Если палисадная ткань
располагается с обеих сторон листа, что свойственно листьям
растений, произрастающих в ксерофитных условиях (гл. 19),
лист называется унифациальным, изобилатеральным или просто
изолатеральным.
Лист: общая организация и развитие
329
Губчатая паренхима состоит из клеток разнообразной формы,
часто неправильных, с боковыми выростами, соединяющими клет-
ки между собой. Присутствие таких соединений на концах вырос-
тов делает губчатый мезофилл подобным трехмерной сети с ячей-
ками, заключающими межклетники (фото 107, Д и 108). Что ка-
сается направления связей между клетками, то в губчатой парен-
химе клетки связаны преимущественно в горизонтальном направ-
лении (параллельно поверхности листа), в то время как в пали-
садной паренхиме они связаны главным образом в перпендику-
лярном относительно поверхности листа направлении.
Рыхлая структура мезофилла обусловливает большую общую
площадь поверхности клеток, обращенной к межклетникам. Эта
поверхность во много раз превышает поверхность эпидермы, ко-
торая обращена наружу. Из двух видов тканей мезофилла пали-
садная паренхима имеет большую свободную внутреннюю поверх-
ность, чем губчатая паренхима [6].
Проводящая система
Проводящая система листа пронизывает всю пластинку, по-
этому пространственно она тесно связана с мезофиллом. Прово-
дящие тяжи образуют единую систему, располагающуюся в ме-
дианной плоскости пластинки параллельно поверхности листа.
Проводящие пучки в листе обычно называются жилками, а систе-
ма ветвления жилок — жилкованием. Невооруженным глазом
можно видеть жилкование двух основных типов — сетчатое и па-
раллельное Сетчатое жилкование — это разветвленная система,
характеризующаяся последовательным утоньшением жилок, ко-
торые отходят подобно ветвям от более крупных жилок (фото 109).
В листьях с параллельным жилкованием тяжи сравнительно
близкого размера ориентированы продольно или почти продольно
(рис. 18.1,Л, Б). Определение «параллельное жилкование» явля-
ется не совсем точным, так как пучки расходятся у основания
и вновь сходятся к вершине листа и не бывают строго параллель-
ны даже в самой широкой части листа. Сетчатое жилкование
наиболее распространено у двудольных, параллельное — у одно-
дольных.
Листья с сетчатым жилкованием часто имеют среднюю жил-
ку — наиболее крупную жилку, проходящую в^оль медианной
продольной оси листа (фото 109). Средняя жилка связана лате-
рально с уступающими ей по величине боковыми жилками. Каж-
дая из них связана с еще более мелкими, а те в свою очередь
расчленяются на еще более мелкие. Число порядков ветвления,
определяемое по величине жилок и точкам ветвления, у двудоль-
ных варьирует от 2 до 5 и более [21]. Самые мелкие ветви об-
разуют ячейки, внутри которых замкнуты небольшие участки ме-
330
Глава 18
Рис. 18.1. Проводящая система листьев однодольных [6]. А. Жилкование в листе
злака. Б. Жилкование в листе Zantedeschia. В, Г. Распределение проводящих
пучков на поперечных срезах средней жилки (В) и черешка (Г) листа Zantede-
schia. 1 — колленхима.
зофилла — ареолы (фото 110). Внутри ареол могут встречаться
свободные окончания жилок, но их может и не быть [12, 40].
В системе жилкования, называемой открытой дихотомической,
замкнутые ячейки отсутствуют.
В листьях с параллельным жилкованием главные жилки мо-
гут различаться по размеру; иногда более крупные чередуются
с" более .мелкими. Продольные жилки 'связаны между собой зна-
чительно более ‘мелкими жилками — комиссуральными пучками,
которые располагаются поодиночке в виде простых поперечных
перемычек [2] или образуют сложную сеть [40]. Таким об-
разом, листья с параллельным жилкованием на микроскопическом
уровне тоже имеют сетчатую топографию проводящих пучков
(рис. 18.1,Л, 5).
В черешке и средней жилке число и характер расположения
проводящих пучков очень разнообразны (рис. 18.1, В, Г и 18.2).
Боковые жилки обычно состоят из одиночных тяжей, в которых
количество проводящих тканей постепенно уменьшается от боко-
вых жилок первого порядка до самых мелких окончаний. В окон-
чаниях пучков ксилемные элементы часто тянутся на большее
расстояние, чем флоэмные, но у некоторых растений флоэма со-
провождает ксилему до конца жилки (фото 111). Ксилема
в окончаниях жилок обычно состоит из коротких трахеид (фото
Лист общая организация и развитие
331
Рис 18 2 Расположение проводящих тканей в средних жилках (А, В, Д, Ж) и
черешках (Б, Г, Е> 3) листьев двудольных. 1 — склеренхима; 2 — ксилема; 3—
срлоома.
111, Л), флоэма — из коротких узких ситовидных элементов и
крупных клеток-спутников (фото 111,5). В зависимости от то-
го, к какой группе принадлежит растение, проводящие пучки мо-
гут быть коллатеральными или биколлатеральными, но в листь-
ях, имеющих внутреннюю (адаксиальную) флоэму, последняя
может исчезать в мелких жилках. В коллатеральных пучках кси-
лема располагается на адаксиальной стороне листа, флоэма — на
абаксиальной.
У двудольных мелкие жилки погружены прямо в мезофилл
(фото 107,5 и 112,5, стрелки), а крупные жилки заключены
в основную ткань, которая не дифференцируется как мезофилл
и содержит сравнительно мало хлоропластов. Ткань, ассоциирую-
щаяся с крупными жилками, возвышается над поверхностью ли-
ста и образует выступы, чаще всего выраженные с абаксиальной
стороны листовой пластинки (фото 112). В выступах жилок под
эпидермой с одной или с обеих сторон жилки могут присутство-
вать колленхима или склеренхима. Участок ткани, заключенный
между выступами жилок, называют «интеркостальной зоной».
В образовании этого термина используется латинское название
выступа — «costa» (ребро).
Небольшие проводящие пучки, локализованные в мезофилле,
окружены одним или несколькими слоями компактно сложенных
клеток, образующих обкладку пучка (фото 107,5). Обкладки
332
Глава 18
пучка могут быть паренхимными или склеренхимными либо об-
кладки обоих типов сочетаются. Суберинизация клеточных оболо-
чек в обкладках пучков, обнаруженная у некоторых видов, свиде-
тельствует о том, что клетки обкладки могут функционировать
как эндодерма [31]. Обкладки тянутся вплоть до самых оконча-
ний пучков (фото 111), так что проводящие пучки очень редко
контактируют непосредственно с межклетниками. Исключение со-
ставляют те гидатоды, через которые ксилемные элементы пуч-
ковых окончаний выделяют воду в межклетное пространство
(гл. 13). У многих двудольных обкладки пучков соединены с эпи-
дермой тяжами клеток, сходных с клетками обкладок (фото
107, Б). Эти тяжи именуются продолжениями обкладок пучков
[50]. Данный термин пригоден только для мелких проводящих
пучков, погруженных в мезофилл; он не относится к ткани высту-
пов, ассоциированной с крупными жилками. Обкладки проводя-
щих пучков и их продолжения встречаются также и у однодоль-
ных. У представителей некоторых таксонов они состоят из скле-
ренхимы.
В листьях отчетливо выражена корреляция между характером
проводящей системы и теми структурными особенностями непро-
водящих тканей, которые связаны с передвижением веществ. Сре-
ди непроводящих тканей эпидерма и губчатый мезофилл — тка-
ни, клетки которых имеют хорошо выраженную систему боковых
контактов, — вероятно, лучше приспособлены к передвижению
веществ в латеральном направлении, чем клетки палисадного ме-
зофилла, в котором доминируют контакты абаксиально-адакси-
ального направления. В соответствии с этими представлениями
отношение палисадной ткани к губчатой тесно связано с расстоя-
нием между жилками: чем выше это отношение, тем ближе жил-
ки располагаются друг к другу [37, 50]. Далее имеются данные,
что паренхимные продолжения пучковых обкладок осуществляют
проведение воды к эпидерме, которой присущ латеральный транс-
порт. В полном согласии с этим находится наблюдение, что жил-
кование обычно бывает менее плотным в тех случаях, когда
в листе есть продолжения обкладок.
МЕЛКИЕ ЖИЛКИ И ПЕРЕДВИЖЕНИЕ
РАСТВОРЕННЫХ ВЕЩЕСТВ
Небольшие жилки, погруженные в мезофилл, называют мел-
кими жилками (фото ИЗ), но они играют основную роль в транс-
порте воды и питательных веществ. Они распределяют транспи-
рационный ток по мезофиллу [4, 45] и служат начальными пунк-
тами сбора продуктов фотосинтеза и их транспорта из листа.
Характерная особенность мелких жилок — обилие пучковой
паренхимы, особенно во флоэмной части пучка Большинство кле-
Лист' общая организация и развитие
333
ток флоэмной паренхимы имеют плотные протопласты (фото 114)
и множество ветвистых плазмодесм (гл. 11), связывающих их
с ситовидными элементами. Цитоплазма оказывается плотной да-
же тогда, когда эти клетки имеют крупные вакуоли (фото ИЗ).
У некоторых видов плотные клетки особенно многочисленны
в окончаниях пучков, где они не всегда связаны непосредственно
с ситовидными элементами. Плотные клетки интерпретируются
как клетки-спутники или, если они не имеют онтогенетической
связи с ситовидными элементами, как клетки, функционально эк-
вивалентные клеткам-спутникам. Менее плотные клетки являются
клетками флоэмной паренхимы
Фишер [9] назвал плотные клетки промежуточными клетками,
имея в виду то, что эти клетки ib транспорте продуктов фотосин-
теза являются посредниками между мезофиллом и ситовидными
элементами. Термин «промежуточные клетки» теперь может быть
распространен и на менее плотные клетки, поскольку они тоже
участвуют в процессе загрузки мелких жилок ассимилятами.
У очень многих травянистых двудольных промежуточные клет-
ки формируют выросты оболочки, обеспечивающие увеличение по-
верхности плазмалеммы (фото 114), в связи с этим их называют
передаточными клетками [33, 34] (гл. 5 и 13). Показательно,
что выросты развиваются в клетках жилок тогда, когда диффе-
ренцирующийся лист превращается из потребителя в источник уг-
леводов и начинает экспортировать последние [34].
В передаточных клетках флоэмы мелких жилок обнаружены
две закономерности распределения выростов оболочки (фото 114).
В клетках a-типа (плотные клетки-спутники) выросты встречают-
ся на всех стенках, но менее выражены в тех местах, где плазмо-
десмы связывают клетки с ситовидными элементами. В клетках
б-типа (клетки флоэмной паренхимы) выросты развиваются пре-
имущественно на стенках, граничащих с ситовидными элемента-
ми и их спутниками.
Считается, что промежуточные клетки с выростами оболочки
или без них поглощают растворенные вещества и передают их
в ситовидные элементы независимо от того, являются ли эти ве-
щества продуктами фотосинтеза или поступают в лист с транспи-
рационным током. Одинаково возможны как симпластический
транспорт, локализованный в цитоплазме, так и апопластический
транспорт (происходящий в клеточных оболочках, составляющих
вместе с межклетниками свободное пространство) [3, 18, 34]. На
рис 18 3 сплошными линиями показан симпластический путь
транспорта, точками — апопластический; стрелками указано на-
правление движения. Растворенные вещества, поступающие в кси-
лему (точки), переносятся на различные расстояния по клеточ-
ным оболочкам, а затем достигают протопласта паренхимных
клеток и транспортируются симпластически в ситовидные эле-
334
Глава 18
менты. Растворенные вещества, образующиеся в ходе фотосинте-
за, передвигаются по симпласту сразу в ситовидные элементы или
поступают в оболочку; в последнем случае их путь к ситовидным
элементам оказывается комбинированным: и апопластическим,
и симпластическим.
Радиоавтографические исследования показали, что в экспорти-
рующих листьях меченые ассимиляты быстро поглощаются мел-
кими жилками. Накопление растворенных веществ и связанная
с ним осмотическая концентрация достигают в загружаемых жил-
ках более высокого уровня, чем в окружающем мезофилле [18].
Следовательно, загрузка жилок происходит против положитель-
ного градиента и поэтому должна рассматриваться как активный
процесс. Особенности цитологии и распределения промежуточных
клеток в мелких жилках хорошо согласуются с положением
о том, что эти клетки осуществляют энергозависимый транспорт
углеводов в проводящие элементы флоэмы.
Загрузка флоэмы сахаром связана с поступлением воды через
плазмалемму из водного раствора, находящегося в свободном
пространстве. Происходящий вследствие этого подъем гидроста-
тического давления в ситовидном элементе является главным фак-
тором дальнего транспорта по флоэме. Следовательно, движу-
щая сила транспорта генерируется в результате загрузки мелких
жилок. Движение по флоэме, кроме того, зависит и от наличия
потребляющих зон, где осмотическое давление ниже, чем в жил-
ках листьев, вследствие чего оастворенные вещества удаляются
Рис 18 3 Схема расположения клеток в мелкой жилке листа двудольных, ил-
люстрирующая движение растворенных веществ в процессе загрузки ситовидно-
го элемента. Сплошными линиями показан симпластический путь, пунктиром —
апопластический путь, стрелками — направление движения. Клетки, соседние с
ситовидными элементами, изображены как передаточные клетки, имеющие выро-
сты оболочки Они могут быть и промежуточными клетками без выростов (См.
фото 113; схема составлена по данным работы [34] ) 1 — ситовидный элемент;
2 — передаточная клетка; 3— плазмодесмы; 4 — хлоропласт; 5 — ксилемный эле-
мент; 6 — передаточные клетки; 7 — клетка обкладки проводящего пучка, 8 —
клетка мезофилла.
Лист: общая организация и развитие
335
из проводящих элементов флоэмы. Здесь клетки-спутники и клет-
ки флоэмной паренхимы активно участвуют в поглощении угле-
водов из ситовидных элементов для целей роста и запасания.
Взаимоотношения между промежуточными клетками и ситовид-
ными элементами в мелких жилках относятся к одним из наи-
более ярких проявлений функциональной зависимости безъядер-
ных проводящих элементов от клеток, имеющих ядра и метабо-
лически активные протопласты.
Развитие
Закладка листовых примордиев
Лист закладывается в результате деления клеток в перифери-
ческой зоне апекса побега, на большем или меньшем удалении от
дистальной зоны апикальной меристемы (гл. 16). Локализация
участков клеточных делений по отношению к местам формирова-
ния более ранних листьев определяется типом листорасположе-
ния у растения. У многих покрытосеменных первые деления про-
исходят в одном или нескольких слоях клеток, расположенных
под протодермой, и являются периклинальными по отношению
к поверхности апекса (рис. 18.4, Л, 5). За периклинальными деле-
ниями вскоре следуют антиклинальные в протодерме и лежащих
под ней слоях. У представителей некоторых таксонов клетки про-
тодермы делятся и периклинально (рис. 18.5) [27, 32]. Иници-
альные деления приводят к образованию на апексе побега боко-
вого выступа, часто называемого листовым бугорком (рис. 18.4,
Л, Б; 18.5, Б—Г и 18.6, Л) [И].
Рост в длину и ширину
Листовой примордий разрастается из исходного выступа
вверх в виде конического или иглоподобного выроста, называемо-
го осью листа (рис. 18.6,5, Е и 18.7,Л). Примордий является
дорсовентральным с момента своего возникновения [20]. На по-
следующих стадиях примордий увеличивается в высоту (длину)
и ширину и благодаря более активному росту с абаксиальной
стороны изгибается по направлению к апексу побега (рис. 18.6,
В, Д).
Увеличение листа в ширину включает латеральное разраста-
ние его основания, так что апикальная меристема оказывается
окруженной листовыми основаниями в той же степени, в какой
влагалища зрелых листьев охватывают стебель (рис. 18.6, В).
Часть основания листа, охватывающая апекс, может давать на-
336
Г лава 18
Рис 18 4 Образование листового примордия и пластинки у льна (Linum, Giro-
lami, Amer J Bot, 41, 264—273 1954) A—Г Продольные срезы Д—3 Попереч-
ные срезы А Б Возникновение примордия в результате периклинальных делений
и растяжения клеток, расположенных под поверхностным слоем В, Г Верхушеч-
ный рост примордия Д Примордий перед началом развития пластинки Е—3
Рост чпастичктя производные маргинальной меристемы формируют4 ппагтинаатл то
меристему, в которой доминируют интеркалярные антиклинальные деления Про
камбиальные клетки отмечены точками 1 — прокамбий
чало прилистникам (рис 18 6, Г, Д) или влагалищу, которое
особенно характерно для однодольных [25]
Рост, обеспечивающий латеральное разрастание примордия,
локализуется вдоль двух краев оси листа и в результате примор-
дий выше основания дифференцируется в среднюю жилку и две
полоски листовой пластинки (рис 18 7,5) Боковые жилки закла-
дываются в виде прокамбиальных тяжей по мере того, как пла-
стинка растет в ширину, а черешок (у листьев, имеющих его)
развивается из зоны примордия, расположенной между пластин-
кой и основанием листа (рис 18 7,5) Две части растущей пла-
стинки могут развиваться в одной плоскости по обе стороны от
средней жилки или под углом (рис 18 7,5), облегая апикальную
меристему и более молодые листовые примордии Средняя жилка
33?
Лист: общая организация и развитие
Рис. 18 5. Формирование листа у ячменя (Hordeum) [27]. А. Поперечный срез
стебля в месте образования примордия листа: в протодерме и субпротодермаль-
ном слое происходят периклинальные деления (отмечены соответственно темны-
ми и светлыми кружками). На некотором удалении от места закладки примор-
дия несколько периклинальных делений дают начало периферическому росту
основания будущего листа. Б—Ж. Продольные срезы примордия листа на по-
следовательных стадиях развития За периклинальными делениями в субпрото-
дермальном слое (светлые кружки на рис. Б) следуют такие же деления в про-
тодерме (темные кружки на рис. В). В кончике удлиняющегося примордия
(Г—Ж) происходят дополнительные периклинальные деления. На рис Е и Ж
стрелками показано увеличение числа клеточных слоев в листе 1 — местополо-
жение будущего примордия.
часто разрастается с адаксиальной стороны вследствие перикли-
нальных делений клеток внутри зоны, составляющей адаксиаль-
ную меристему (рис. 18.7, Г). Благодаря активности адаксиальной
меристемы утолщается и черешок.
Ранний роет листа обычно подразделяется на апикальный
и маргинальный; первый связан с удлинением примордия, вто-
рой— с латеральным разрастанием, в результате которого обра-
зуются две части пластинки. В соответствии с этим растущий
примордий имеет апикальную меристему на вершине и две марги-
нальные меристемы по бокам оси (рис. 18.7). Каждая меристема
имеет как минимум два слоя клеток в глубину, поскольку обычно
22 К. Эзау, кн. 2.
338
Глава lb
Рис 18 6 Развитие листа двудольного растения Oenothera biennis, схематически
показанное с помощью трехмерных изображении (Л—Д) и продольных срезов
(£, Ж) [20] Лист возникает как дорсовентральный выступ (Л), который растет
в высоту и ширину в соответствии с закономерностями, детерминированными рас
пределением меристематической активности (ее локализация отмечена точками
на рис А—Д) На продольных срезах показана зависимость между развитием
примордия и прокамбия На рис Е справа показан прокамбий перед началом ро
ста примюрдия Зона апекса, из которой начинает формироваться примордий,
отличается более высокой меристематической активностью (более плотное рас
пределение точек на рис Е и Ж), чем дистальная зона апекса (более редкое
распределение точек) 1—примордий листа 2 — апекс побега, 3— прилистники,
4 — прокамбий
у двудольных наружный слой — протодерма — растет путем ан-
тиклинальных делений независимо от подстилающих слоев
Внутренние ткани образуются из слоя или слоев, находящихся
под протодермой (рис 18 4) У представителей некоторых таксо-
нов, особенно у однодольных, наружный слой может добавлять
Лист общая организация и развитие
339-
Рис 18 7 Схема, объясняющая рост
листа двудольных А Недифферен-
цированный примордий (ось листа)
без пластинки и черешка, стрелками
показаны направления роста Б, В
Две стадии рост пластинки, обуслов-
ленный активностью маргинальных
меристем, и дифференциация круп-
ных жилок (а также удлинение че-
решка) Г Поперечный срез пластин-
ки, на котором показано положение
адаксиальной и маргинальной мери-
стем 1 — апикальная меристема, 2 —
маргинальная меристема, 3—средняя
жилка, 4 — маргинальные меристе-
мы, 5 — основание листа, 6 — адак-
сиальная меристема, 7 — черешок
клетки к внутренней ткани путем периклинальных делений (рис.
18.5).
Когда была сформулирована концепция апикального и марги-
нального роста листового примордия [И], представлялось, что
меристемы, соответствующие этим двум видам роста, имеют раз-
ные инициали. В частности, предполагалось, что протодерма про-
исходит из апикальных и маргинальных инициалей, делящихся
антиклинально, а внутренние ткани — из субапикальных и суб-
маргинальных инициалей, делящихся и антиклинально, и пери-
клинально в последовательности, характерной для каждого кон-
кретного вида. Концепция листовых меристем с раздельными ини-
циалями была сформулирована на основе результатов наблюде-
ний за расположением клеток на срезах листьев и построения
онтогенетических рядов клеток в соответствии с этим расположе-
нием. При составлении схем (рис. 18.8), изображающих связь
между клеточными слоями и предполагаемыми инициалями,
большое значение придавалось встречающимся время от времени
митозам и их ориентации в клетках, расположенных там, где
должны находиться инициали (рис. 18 4, Б. Е, Ж).
Более поздние исследования распределения митозов в ходе
раннего роста листьев показали, однако, что концепцию раздель-
ьых инициалей апикальных и маргинальных меристем нельзя счи-
тать универсальной. В частности, оказалось, что клетки, занима-
22*
34С
Глава 18
- Адаксиальная эпидерма
~ Палисадная паренхима
- Проводящие пучки и мезо фи и
' Средняя часть губчатой паренхимы
> Нижняя часть губчатой паренхимы
- Абаксиальная опидерма
- Адаксиальная опидерма
- Мезофилл
- Проводящие пучки и мезофилл
- Мезофилл
Абаксиальная опидерма
Рис. 18.8. Схема, иллюстрирующая два варианта онтогенетической связи между
маргинальной меристемой и производными клеточными слоями пластинчатой
меристемы, формирующей листовую пластинку. Маргинальный слой (/) продуци-
рует протодерму. Субмаргинальный слой (2) дает начало мезофиллу и прово-
дящей ткани.
ющие субапикальное и субмаргинальное положения, не обяза-
тельно онтогенетически связаны с внутренними слоями клеток,
как это предполагалось раньше [15, 17, 30, 43] (рис. 18.9). На-
блюдения на химерных растениях (гл. 16) также показали, что
онтогенетические связи между субмаргинальными клетками
и внутренними клеточными слоями пластинки могут быть очень
разнообразными. Так, у большого числа стабильных природных
химер с пестрыми листьями, имеющими 3 независимых слоя (С-1,
С-П, С-Ш) в апексе, внутренние ткани листа могут возникать по
меньшей мере из двух слоев апикальной меристемы — С-П
и С-Ш, причем вклад этих слоев может быть различным не толь-
ко у разных видов или разных особей, но и в разных листьях на
одном растении [44]. Если, например, пестролистное растение
имеет в апексе генотип 3—Б—3 (зеленый — белый — зеленый),
клетки Б (С-П)- и 3 (С-Ш)-типов встречаются в листе в различ-
ных комбинациях в зависимости от распределения частоты и про-
должительности делений среди производных Б- и 3-инициальных
клеток (рис. 18.10). Эти закономерности не могут быть объясне-
ны как результат раздельного происхождения тканей из субапи-
кальных и субмаргинальных инициалей и тем более как резуль-
тат происхождения таких инициалей из одного слоя, как это
обычно изображается на диаграммах (рис. 18.8).
Рис. 18.9. Схема, иллюстрирующая распределение меристематической активности
по краям листочков Lupinus двух размеров: 600 мкм в длину (А, Б) и 8500 мкм
в длину (В, Г) [17]. Короткими линиями показаны экваториальные плоскости
или клеточные пластинки делящихся клеток. Представленные на рисунках деле-
ния наблюдались на серийных срезах и затем методом наложения были объеди-
нены вместе: антиклинальные деления на рис. А п В, периклинальные — на
рис. Б и Г. Периклинальные деления, локализованные вдоль края листа, опре-
деляют число клеточных слоев в нем. Благодаря антиклинальным делениям (за
счет активности пластинчатой меристемы) происходит разрастание каждого из
клеточных слоев. 1 — протодерма.
Рис. 18.10. Различные варианты окраски листьев табака Nicotiana tabacum, об-
разующихся на химерных по пластидному составу побегах с генетической после-
довательностью слоев в апикальной меристеме З-Б-З: слой С-1 имеет потенциаль-
но зеленые пластиды (3); слой С-П — потенциально бесцветные пластиды (Б);
слой С-Ш — потенциально зеленые пластиды (3). Заштрихованными площадями
на рисунке показаны зеленые клетки, производные от слоя С-Ш. Относительный
вклад слоев С-П (Б) и С-Ш (3) в этих трех листьях значительно варьирует.
(Схема составлена на основании фотографий из работы [44].)
Рис. 18.11. Распределение митозов в третьей от семядолей паре листьев Paulow-
nia tomentosa ([24]; показан только один лист из данной пары). Короткими
линиями отмечены деления: одинарными линиями — на стадии метафазы, двой-
ными— на стадии анафазы или ранней телофазы. Ориентация линий показывает
направления делений по отношению к длинной и короткой сторонам листа.
В листьях, изображенных на рис. А (140 мкм) и Б (275 мкм), меристематиче-
ская активность распределена равномерно. В листе, изображенном на рис. В
(320 мкм), митотическая активность ослабевает в апикальной области. На по-
следующих стадиях меристематическая активность исчезает в базипетальном на-
правлении (Г—Е). Дифференциация боковых жилок происходит тоже базипе-
тально.
Лист: общая организация и развитие
343
Производные клеток, расположенных в апексе и по краям ли-
ста, в свою очередь тоже делятся. Такие интеркалярные деления,
распределенные без определенной закономерности, вносят наи-
больший вклад в увеличение размера листа. Интеркалярный рост
так близко следует за ростом апекса и краев пластинки, что при
общем взгляде на развивающиеся листья интеркалярную митоти-
ческую активность невозможно отграничить от апикальной и мар-
гинальной активности (рис. 18.9) [30]. Беспорядочность распреде-
ления митозов в растущих листьях показана на целых листьях
некоторых двудольных, которые были просветлены и окрашены
реактивами на ДНК по Фёльгену, т. е. способом, выявляющим
делящиеся ядра (рис. 18.11) [16, 24, 46].
Интеркалярная меристематическая активность у вершины ли-
ста исчезает раньше, нем у основания (рис. 18.11), так что ткани
листа дифференцируются и созревают в базипетальном направле-
нии. Более того, в апикальной зоне клеточные деления могут быть
менее многочисленны, чем в зонах, лежащих ниже ее, и это обу-
словливает большую ширину листа по направлению к основанию.
Базипетальная последовательность созревания тканей особенно
очевидна у длинных узких листьев однодольных, у которых рост
локализован исключительно в основании листовой пластинки
и во влагалище — зонах, относящихся к интеркалярным меристе-
мам (гл. 16).
Рост пластинки
У многих видов мезофилл между жилками сравнительно одно-
образен по толщине (гл. 19). Это обусловлено образованием оп-
ределенного, довольно ограниченного числа клеточных слоев
в маргинальной меристеме (рис. 18.4, Е—3; 18.8) и последующим
ростом слоев путем антиклинальных делений. Лист выглядит со-
ставленным из нескольких самостоятельных слоев клеток. Мери-
стематическая ткань, состоящая из параллельных слоев клеток,
делящихся антиклинально, называется пластинчатой меристемой.
Деления в этой меристеме дают основной вклад в интеркалярный
рост, посредством которого лист достигает своего окончательного
пазмера. Согласно некоторым исследованиям, активность плас-
тинчатой меристемы может приводить к стократному увеличению
площади листа, при этом число слоев клеток в мезофилле не
возрастает [41]. Однако у некоторых растений (Trifolium [5],
Xanthium [30]) в пластинчатой меристеме на значительном рас-
стоянии от края могут встречаться и периклинальные деления,
приводящие к увеличению толщины пластинки.
Рост по типу пластинчатой меристемы нарушается в местах
дифференциации проводящих пучков. Здесь антиклинальные, пе-
риклинальные и наклонные деления дают начало прокамбию
344
Глава 18
Рис 18 12 Соотношение между деления-
ми, отличающимися по углу наклона
клеточной пластинки к поверхности ли-
ста Xanthium. Гистограмма построена
на основании подсчета метафазных, ана-
фазных и телофазных картин, наблюдае-
мых в маргинальной области нескольких
листьев с известным пластохронным воз-
растом. Граница между маргинальной и
пластинчатой меристемами была уста-
новлена на расстоянии четырех клеточ-
ных диаметров от края листа. Общее
число делений в маргинальной меристе-
ме равнялось 111, в пластинчатой — 171
Доминирующая ориентация клеточных
пластинок и соотношения между отдель-
ными направлениями ориентации для
этих двух меристем различны (Данные
с некоторыми изменениями взяты из ра-
боты [30] )
и тканям, связанным с проводящими пучками, таким, как об-
кладка проводящих пучков или основная ткань выступов жилок
(рис. 18.4, Е—3 и 18.16,Л, Б).
Установление характерной слоистости в листовой пластинке
интерпретируется как функция маргинальной меристемы [17, 30].
В листьях Xanthium [30] протяженность маргинальной меристе-
мы считается равной четырем клеточным диаметрам, считая oi
края В ее наружном слое (протодерме) клетки делятся главным
образом антиклинально. В маргинальной и пластинчатой мери-
стемах, расположенных под протодермой, происходят различные
деления, соотношения между которыми варьируют: антиклиналь-
ные, периклинальные и наклонные (рис. 18.9). Высокий процент
антиклинальных делений в пластинчатой меристеме (рис. 18 12)
связан с интенсивным латеральным разрастанием листа. Продол-
жительность митотической активности в маргинальной меристе-
ме составляет по расчетам приблизительно 18 дней, в пластин-
чатой — около 23 дней.
Вариации в закономерностях развития
Листья более разнообразны по форме, чем два других вегета-
тивных органа — корень и стебель. Они могут быть радиально-
симметричными, подобно стеблям (Hakea), трубчатыми (насеко-
моядное растение Nepenthes') или мечевидными (однодольные).
Лист: общая организация и развитие
345
Рис 18 13 Развитие листа Pelargonium alternans [20]. А. Зрелый лист, состоя-
щий из рахиса и лопастных листочков Б—Г. Три стадии развития листочков
Листочки возникают по краям оси примордия (Б) и удлиняются в адаксиальном
относительно апекса побега направлении (В, Г) Эпидермальные волоски осо-
бенно хорошо видны на молодых листьях (В, Г) Прилистники были удалены
в ходе приготовления образцов 1 — рубчик прилистника, 2— примордий листоч-
ка, 3 — эпидермальные волоски, 4 — апекс побега
Многие растения имеют сложные листья с листочками, сидящими
на рахисе (рис 18 13, Д). Листья могут быть уплощены относи-
тельно стебля либо радиально, либо тангенциально (рис 18 14).
Несмотря на широкий спектр морфологических различий,
листья обнаруживают лишь вариации той основной закономерно-
сти развития, которая описана в предыдущих разделах Ограни-
ченный маргинальный рост обусловливает небольшую ширину ли-
стовой пластинки у многих покрытосеменных и у большинства
хвойных [32]. В сложном листе активность маргинальной мери-
стемы локализуется в отдельных центрах, каждый из которых
формирует отдельный листочек (рис. 18.13). Листочки проходят
те же стадии развития, что и простые листья.
В радиально-уплощенных унифациальных листьях, которые
имеют скорее радиальное, чем бифациальное распределение фо-
346
Глава 18
Рис. 18.14. Схемы поперечных сечений бифациальной (А Б) и унифациальной
(В, Г) листовых пластинок. На ранней стадии развития (Б) интенсивность роста
бифациального листа в маргинальном направлении явно отличается от интенсив-
ности роста в адаксиальном направлении. Унифациальный лист не имеет марги-
нального роста, он растет только в адаксиальном направлении. 1—стебель.
тосинтетической и проводящей тканей (рис. 18.14, В в противопо-
ложность рис. 18.14, А), (рост распределен иначе, чем в бифаци-
альных листьях. Маргинальная меристематическая активность
здесь подавлена, а адаксиальная ’меристема, наоборот, активи-
рована и вызывает радиальное разрастание листа [25]. Обнару-
жение общего принципа развития унифациальных и бифациаль-
ных листьев подтверждает гомологичность листьев однодольных
и двудольных [26].
Одно из наиболее сложных явлений в развитии листа—сег-
ментация листьев пальм. В качестве примера можно привести
лист кокосовой пальмы, пластинка которого сегментируется на
перья (листочки); листовая пластинка развивается на рахисе
в виде двух маргинальных долей, обращенных к апексу побега.
Сначала доли листовой пластинки выглядят гладкими, но вскоре
их края становятся изрезанными на мелкие сегменты (рис. 18.15, А).
На срезах, перпендикулярных сегментам, каждая доля пла-
стинки выглядит как серия взаимосвязанных зигзагообразно рас-
положенных складок (рис. 18.15,5). Далее начинается разделе-
ние долей пластинки по абаксиальным ребрам складок, прово-
дящие же пучки развиваются в каждом адаксиальном ребре, ста-
Лист: общая организация и развитие
347
новясь (Средней жилкой ласточка (рис. 18.15, В, Г). Краевые по-
лосы листовой пластинки, которые не участвуют в образовании
складок (рис. 18.15,Л), при созревании отделяются. Отделение
листочков друг от друга вызывается растяжением рахиса
(рис. 18.15, Г).
Механизм формирования складок sb развивающемся пальмовом
листе составляет предмет дискуссии. Некоторые исследователи
Рис 18 15 Интерпретация формирования листочков у пальмы Cocos nuctfera А
Молодой лист дифференцируется в основание листа, охватывающее апекс побега
(не показан), рахис и доли листовой пластинки, которые образуются путем мар-
гинального роста, локализованного по обе стороны рахиса Короткими парал-
лельными линиями показаны складки на долях пластинки Б Срез через пла-
стинку листа, приблизительно тангенциальный по отношению к рахису Более
поздняя стадия, чем на рис А Складки пластинки выявляются как два ряда
зигзагообразных перегибов В Несколько складок при большем увеличении Каж-
дый адаксиальный сгиб соответствует средней жилке листочка Вдоль абаксиаль-
ных сгибов проходит граница между соседними листочками, по которой проис-
ходит разрыв Г Фрагмент листа, в котором представлены рахис и основания
листочков (Рис А—В составлены по данным, взятым из работы [36], рис Г
воспроизводится из работы [47] с некоторыми изменениями ) 1 —абаксиальная
и адаксиальная поверхности, 2 — рахис, 3 — маргинальная полоска, 4 — доли
листовой пластинки, 5 — апекс побега, 6 — адаксиальная сторона, 7 — абакси-
альная сторона, 8 — отдельный листочек, 9 — средняя жилка, 10 — зоны раздела
Глава 18
34Я
предполагают, что дифференциальный маргинальный рост, сме-
няемый интеркалярным ростом, приводит к формированию чере-
дующихся гребней и бороздок — комбинации, создающей эффект
складчатости [36]. Другие авторы считают, что образование скла-
док происходит в результате расщепления ткани, т. е. разделения
соседних клеточных рядов по срединной пластинке их оболочек
[47]. Вполне вероятно, что в сложном процессе развития листа
участвуют оба процесса—и дифференциальный рост, и разделе-
ние клеточных слоев.
Если у данного растения на разных стадиях онтогенеза раз-
витие листьев различно, ювенильные и взрослые листья могут
сильно различаться по форме (гл. 19). Это явление получило на-
звание гетеробластии (в противоположность гомобластии, когда
все листья на растении имеют одинаковую форму).
Дифференциация мезофилла
В бифациальном листе двудольных дифференциация мезофил-
ла начинается с антиклинального растяжения будущих палисад-
ных клеток, сопровождаемого антиклинальными делениями
(рис. 18.16,Л). Клетки губчатой паренхимы тоже делятся анти-
Рис. 18.16. Дифференциация мезофилла по наблюдениям на поперечных срезах
листа Pyrus. А. Лист еще имеет компактную структуру. Б. В губчатой паренхи-
ме образована сеть межклетников, занимающих значительный объем; клетки па-
лисадной паренхимы приобретают характерные форму и ориентацию. В. Зрелый
лист.
Лист: общая организация и развитие 349
клинально, но реже, чем палисадные клетки. В процессе таких
делений они обычно остаются более или менее изодиаметрически-
ми по форме. В то «время как в палисадной ткани деления еще
продолжаются, соседние эпидермальные клетки прекращают де-
литься и растягиваются, главным образом в плоскости, парал-
лельной поверхности листа (парадермальной плоскости). Как бы-
ло показано на листе Xanthium, растяжение эпидермальных
клеток продолжается дольше и происходит с большей интенсив-
ностью, чем растяжение палисадных клеток. Поэтому в конце кон-
цов на одну эпидермальную клетку приходится несколько пали-
садных (рис. 18.16,В). Обычно наиболее продолжительные деле-
ния наблюдаются в палисадной ткани, и, согласно данным,
полученным на листьях Xanthium, синтез ДНК в палисадном слое
продолжается на 3,5 дня дольше и отличается более высоким тем-
пом, чем в эпидерме и губчатом мезофилле [30]. После заверше-
ния делений палисадные клетки полностью отделяются друг от
друга вдоль антиклинальных стенок (рис. 18.16,В). Формирова-
ние межклетников в губчатой паренхиме протекает так же, как
и в палисадной (рис. 18.16,В). Разделение клеток губчатой па-
ренхимы сопряжено с локальным ростом клеток, и это приводит
к образованию у многих видов (ветвистых клеток. Дифференциа-
ция устьиц совпадает по времени с развитием (межклетников в ме-
зофилле или следует за ним. Увеличение поверхности листа свя-
зано с увеличением числа и величины хлоропластов, а также ко-
личества хлорофилла [30, 39].
Развитие проводящих тканей
Развитие проводящих тканей листа у двудольных начинается
с дифференциации прокамбия в будущей средней жилке, это яв-
ление можно наблюдать, пока лист находится в ранней примор-
диальной стадии (рис 18.6,2?, Ж). Прокамбий дифференцируется
акропетально, сохраняя непрерывность с прокамбием листовых
следов оси. По мере латерального растяжения листа боковые
жилки первого порядка развиваются от средней жилки к краям
[40]. Боковые жилки разных порядков возникают среди произ-
водных маргинальных меристем (рис. 18 4). Более крупные бо-
ковые жилки закладываются раньше и ближе к маргинальным
меристемам, чем более мелкие. Самые мелкие жилки возникают
среди крупных сначала вблизи верхушки листа, затем распростра-
няются ниже в соответствии с базипетальным созреванием листа.
В закладке мелких жилок участвует меньшее число клеток, чем
в закладке крупных. Мельчайшие жилки могут быть однорядны-
ми по своему происхождению, т. е. они могут возникать из ряда
шириной в одну клетку [40]. Дифференциация прокамбия в пла-
стинке является непрерывным процессом в том смысле, что после-
350
Глава 18
дующие по времени образования прокамбиальные тяжи возника-
ют как продолжение ранее сформированных [40]. Образование
новых проводящих пучков происходит в течение псей стадии ин-
теркалярного роста листа во (все более и более вакуолизирован-
ной ткани )[ 12, 41].
Дифференциация ксилемы, которую удобно наблюдать на про-
светленных листьях, идет иногда различными путями в зависимо-
сти от особенностей роста пластинки |[7]. В большинстве жилок
обычно наблюдается непрерывное прогрессирующее созревание
трахеальных элементов от крупных к более мелким жилкам, но
в жилках любого порядка иногда можно обнаружить прерыви-
стость в этом процессе. Завершение созревания ксилемы в наи-
более мелких жилках происходит вслед за закладкой последних
прокамбиальных тяжей в направлении от верхушки листа к его
основанию.
Был разработан также метод исследования дифференциации
флоэмы на просветленных листьях [14, 15]. Его применение для
изучения листочков Lupinus разного возраста показало, что
в средней жилке дифференциация флоэмы происходит акропе-
тально и непрерывно, а из нее распространяется в крупные бо-
ковые жилки. Далее флоэма продолжает развиваться от более
крупных ко все более (мелким жилкам. Иногда связи между жил-
ками устанавливаются в результате двусторонней встречной диф-
ференциации флоэмы в связующих пучках.
Дифференциация проводящей системы в листовых пластинках
однодольных была исследована у трех злаков: Zea [42], Lolium
[10] и Triticum [35]. У этих злаков прокамбий крупных жилок
дифференцируется акропетально, а прокамбий мелких и попереч-
ных связующих жилок — базипетально. Сходная последователь-
ность дифференциации ксилемы и флоэмы—сначала акропеталь-
но, затем базипетально — отмечена у всех трех злаков (гл. 16).
Развитие проводящих тканей коррелирует с развитием других
тканей, что обеспечивает физиологическую зрелость листа. Каж-
дый лист переходит от гетеротрофного состояния к автотрофному,
импортируя ассимиляты в процессе быстрого роста и экспортируя
их по мере того, как возрастает собственная способность листа
к фотосинтезу" [23, 48]. Экспорт продуктов фотосинтеза начинает-
ся из наиболее рано созревающей апикальной части пластинки
листа Он направлен из листа, в то время как развитие нижней
части листа продолжает зависеть от импорта питательных ве-
ществ извне Импорт в развивающиеся листья идет из более ста-
рых экспортирующих листьев, которые поставляют ассимиляты
к определенным участкам пластинки молодого листа в соответст-
вии с детерминируемыми филлотаксисом связями проводящей си-
стемы экспортирующих и импортирующих листьев [28]. Базипе-
тальное развитие устьиц, мелких жилок и межклетников корре-
Лист общая организация и развитие
351
«пирует с базипетальным созреванием систем фотосинтеза и газо-
обмена, а также с базипетальным же развитием способности
к экспорту ассимилятов.
Опадение листьев
Активное отделение листа от ветви без повреждения ее живых
тканей называется опадением. Сезонный листопад деревьев явля-
ется результатом естественного опадения листьев, но причиной
листопада могут быть также различные повреждающие воздейст-
вия. Подобно листьям, могут сбрасываться и другие части расте-
ния. Опадение является приспособлением, которое служит для
удаления старых листьев, зрелых плодов и незавязавшихся цвет-
ков; сходным образом происходит самоочищение ствола, когда
образуется избыток побегов. В связи с усилением механизации
сельского хозяйства регулирование опадения в ходе таких прак-
тических мероприятий, как искусственная дефолиация, прорежи-
вание плодов и определение времени их опадения, становится ак-
туальной задачей.
Опадение листа обычно подготавливается цитологическими
и биохимическими изменениями клеток в расположенной у осно-
вания черешка зоне, вдоль которой лист отделяется от ветви
(или листочек от рахиса). Этот участок ткани называется зоной
отделения (фото 115). В зоне отделения могут быть выделены два
слоя: отделительный слой, по которому происходит разлом, и за-
щитный слой, который предохраняет обнажающуюся при опаде-
нии листа поверхность от иссушения и внедрения паразитов.
У большинства листьев, цветков, плодов и у некоторых стеб-
лей [22] формирование отделительной зоны происходит в течение
онтогенеза, но этот процесс может иметь место и как ответ на
условия, провоцирующие опадение. В структурном отношении от-
делительная зона часто характеризуется слабой прочностью, обу-
словленной сокращением количества механической ткани и кон-
центрацией проводящей системы в центре вместо ее обычного
распределения по периферии У некоторых листьев эти особенно-
сти отделительной зоны можно наблюдать, например, в месте
соединения черешка и листовой подушечки.
С явлением опадения связан ряд клеточных процессов, но не-
обязательно все они встречаются у одного и того же вида [19,
29, 49]. Отделению может предшествовать клеточное деление (фо-
то 115,5), причем вновь образованные клеточные оболочки под-
вергаются впоследствии специфическим деградационным измене-
ниям. В ходе этого процесса происходит также клеточное растя-
жение. Если оно локализовано в проксимальном районе, это
может приводить к возникновению в отделительном слое срезаю-
352
Глава 18
щих сил. У некоторых видов необходимым условием опадения
является старение клеток дистальной зоны и доставка питатель-
ных веществ в проксимальную зону. Одним из признаков старе-
ния может быть лигнификация клеточных оболочек в дистальной
зоне [38]. Перед опадением иногда происходит образование тил
в трахеальных элементах и отложение каллозы в ситовидных
элементах и паренхимных клетках. В конечном счете главным со-
бытием при опадении является ферментативное разрушение кле-
точных оболочек, приводящее к отделению клеток друг от друга.
Изменения оболочек включают утрату цементирующей способно-
сти срединной пластинки (отчасти в резулыле удаления из нее
кальция), гидролиз самих целлюлозных оболочек и разрыв скле-
рифицированных трахеальных элементов.
Защитный слой, или рубец, образуется в результате отложе-
ния в оболочках и межклетниках защитных веществ, таких, как
суберин или раневая камедь. У древесных растений защитный
слой рано или поздно заменяется перидермой, которая закладыва-
ется под защитным слоем и становится непрерывной с перидер-
мой остальной части стебля.
Сбрасывание листьев не обязательно связано с процессом рас-
творения клеточных оболочек. У большинства однодольных
и у некоторых травянистых двудольных опадение листьев, оче-
видно, вызывается чрезмерной физической нагрузкой. Механиче
ский отрыв без предварительных химических изменений можнс
наблюдать при сбрасывании хвои у Picea [8].
Многие исследования посвящены действию на опадение регу-
ляторных агентов [19, 29]. Наиболее изучены два из них — аук-
син и этилен. Действие других природных растительных гормо-
нов — гиббереллина, цитокинина и абсцизовой кислоты — выясне-
но менее детально [29]. Ауксин задерживает опадение в том
случае, если он вводится после того, как отделительная зона
сформировалась, но еще не подверглась ослабляющим ее струк-
турным изменениям. Ауксин может также ингибировать развитие
отделительной зоны. Наиболее эффективным агентом, ускоряю-
щим опадение, по-видимому, является этилен. В настоящее время
общепризнана точка зрения, что для осуществления опадения не-
обходим синтез определенных ферментов, особенно таких, кото-
рые разрушают клеточную оболочку и участвуют в дыхании.
К ним относятся пероксидаза, вызывающая усиление синтеза
этилена, и фосфатаза, связанная с процессами старения [19, 38].
СПИСОК ЛИТЕРАТУРЫ
1 Aykin S Hygromorphic stomata in xeromorphic plants, Istanbul Univ. Rev.
Fac Sci Ser В Sci Nat, 18,75—90 (1952)
2 Blackman E The morphology and development of cross veins in the leaves
of bread wheat (Triticum aestivum L), Ann. Bot, 35, 653—665 (1971).
Лист: общая организация и развитие
353
3. Cataldo D. A. Vein loading: the role of the symplast in intercellular transport
of carbohydrate between the mesophyll and minor veins of tobacco leaves, Plant
Physiol., 53, 912—917 (1974).
4. Crowdy S. H., Tanton T. W. Water pathways in higher plants. I. Free space
in wheat leaves, J. Exp. Bot, 21, 102—111 (1970).
5. Denne M. P. Leaf development in Trifoltum repens, Bot. Gaz., 127, 202—210
(1966).
6. Esau K. Plant anatomy, 2nd ed., New York, John Wiley & Sons, 1965.
7. Esau K. Vascular differentiation in plants, New York, Holt, Rinehart and
Winston, 1965.
8. Facey V. Abscission of leaves in Picea glauca (Moench.) Voss and Abies bal-
samea L., Proc. North Dakota Acad. Set, 10, 38—43 (1956).
9. Fischer A. Untersuchungen uber das Siebrohren-System der Cucurbitaceen,
Berlin, Gebriider Borntraeger, 1884.
10. Forde B. J. Differentiation and continuity of the phloem in the leaf intercalary
meristem of Lolium perenne, Amer. J. Bot., 52, 953—961 (1965).
11. Foster A. S. Leaf differentiation in angiosperms, Bot. Rev., 2, 349—372
(1936).
12. Foster A. S. Foliar venation in angiosperms from an ontogenetic standpoint,
Amer. J. Bot., 39, 752—766 (1952).
13. Foster A. S. The morphology and relationships of Circaeaster, J. Arnold Arb.,
44, 299—327 (1963).
14. Fuchs C. Recherches ontogeniques sur le phloeme de la foliole du Lupinus al-
bus L., C. R. Acad. Sci. Paris, D262, 91—94 (1966).
15. Fuchs C. Recherches ontogeniques sur le phloeme des nervures d’ordre supe-
rieur a 2 dans la foliole du Lupinus albus L., C. R. Acad. Sci. Paris, D262,
752—755 (1966).
16. Fuchs C. Observations sur 1’extension en largeur du limbe foliaire du Lupinus
albus L., C. R. Acad. Sci. Paris, D263, 1212—1215 (1966).
17. Fuchs C. Localisation des divisions dans le meristeme marginal des feuilles
des Lupinus albus L., C. R. Acad. Sci. Paris, D267, 722—725 (1968).
18. Geiger D. R., Giaquinta R. T., Sovonick S. A., Fellows R. J. Solute distribution
in sugar beet leaves in relation to phloem loading and translocation, Plant
Physiol., 52, 585—‘589 (1973).
19. Hagemann P. Histochemische Muster beim Blattfall, Ber. Schweiz. Bot. Ges.,
81, 97—138 (1971).
20. Hagemann W7. Studien zur Entwicklungsgeschichte der Angiospermenblatter,
Bot. Jb., 90, 297—413 (1970).
21. Hickey L. J. Classification of the architecture of dicotyledonous leaves, Amer.
J. Bot., 60, 17—33 (1973).
22. Hbster H. R., Liese W., Bottcher P. Untersuchungen zur Morphologie und
Histologie der Zweigabwiirfe von Populus «Robustra», Forstwiss. Centralbl.,
87, 321—384 (1968).
23. Isebrands J. G., Larson P. R. Anatomical changes during leaf ontogeny in
Populus deltoides, Amer. J. Bot., 60, 199—208 (1973).
24. Jeune B. Observations et experimentation sur les feuilles juveniles du Paulow-
nia tomentosa H. Bn., Bull. Soc. Bot. France, 119, 215—230 (1972).
25. Kaplan D. R. Comparative foliar histogenesis in Acorus calamus and its bea-
ring on the phyllode theory of monocotyledonous leaves, Amer. J. Bot., 57,
331—361 (1970).
26. Kaplan D. R. The monocotyledons: their evolution and comparative biology.
VII. The problem of leaf morphology and evolution in the monocotyledons,
Quart. Rev. Biol., 48, 437—457 (1973).
27. Klaus H. Ontogenetische und histogenetische Untersuchungen an der Gerste
(Hordeum distichon L.), Bot. Jb., 85, 45—79 (1966).
28. Larson P. R., Dickson R. E, Distribution of imported 14C in developing leaves
of eastern cottonwood according to phyllotaxy, Planta, 111, 95—112 (1973).
К. Эзау, кн. 2.
354
I лава 18
29. Leopold A. C. Physiological processes involved in abscission, Hort. Sci., 6,
376—378 (1971).
30. Maksymowych R. Analysis of leaf development, Cambridge University Press,
1973.
31. O'Brien T. B.t Carr D. J. A suberised layer in the cell walls of the bundle she-
ath of grasses, Aust. J. Biol. Sci., 23, 275—287 (1970).
32. Owens J. N. Initiation and development of leaves in Douglas fir, Can. J. Bot.,
46, 271—278 (1968).
33. Pate J. S., Gunning В. E. S. Vascular transfer cells in angiosperm leaves.
A taxonomic and morphological survey, Protoplasma, 68, 135—156 (1969),
34. Pate J. S., Gunning В. E. S. Transfer cells, Ann. Rev. Plant Physiol., 23,
174_____1QA /1079\
у.-,
35. Patrick J. W. Vascular system of the stem of wheat plant. II. Development,
Aust. J. Bot., 20, 65—78 (1972).
36. Periasamy K. Morphological and ontogenetic studies in palms — I. Develop-
ment of the plicate condition in the palm-leaf, Phytomorphology, 12, 54—64
(1962). II. Growth pattern of the leaves of Cocos nucifera and Borassus fla-
bellifer after the initiation of plications, Aust. J. Bot., 13, 225—234 (1965).
37. Philpott J. A blade tissue study of leaves of forty-seven species of Ficus, Bot.
Gaz., 115, 15—35 (1953).
38. Poovaiah B. W. Formation of callose and lignin during leaf abscission, Amer.
J. Bot., 61, 829—834 (1974).
39. Possingham J. V., Saurer W. Changes in chloroplast number per cell during
leaf development in spinach, Planta, 86, 186—194 (1969).
40. Pray T. R. Foliar venation of angiosperms. I. Mature venation of Liriodendron,
Amer. J. Bot., 41, 663—670 (1954). II. Histogenesis of the venation of Lirio-
dendron, Amer. J. Bot., 42, 18—27 (1955). III. Pattern and histology of the
venation of Hosta, Amer. J. Bot., 42, 611—618 (1955). IV. Histogenesis of the
venation of Hosta, Amer. J. Bot., 42, 698—706 (1955).
41. Schneider R. Histogenetische Untersuchungen fiber den Bau der Laubblatter,
insbesondere ihres Mesophylls, Osterr. Bot. Z., 99, 253—285 (1952).
42. Sharman В. C. Developmental anatomy of the shoot of Zea mays L., Ann.
Bot., 6, 245—282 (1942).
43. Shushan S., Johnson M. A. The shoot apex and leaf of Dianthus caryophyllus
L., Bull. Torrey Bot. Club, 82, 266—283 (1955).
44. Stewart R. N., Dermen H. A new leaf: flexibility in ontogenesis shown by ana-
lysis of the contribution of derivatives of the shoot apical layers to leaves on
periclinally chimeral plants, Amer. J. Bot., 62, 935—847 (1975).
45. Tanton T. W., Crowdy S. H. Water pathways in higher plants. III. The transpi-
ration stream within leaves, J. Exp. Bot., 23, 619—628 (1972).
46. Thomasson M. Quelque observations sur la repartition des zones de croissan-
ce de la feuille du Jasminum nudiflorum Lindl., Candollea, 25, 297—340
(1970).
47. Tomlinson P. B. Anatomy of the monocotyledons. II. Palmae, Oxford Claren-
don Press, 1961.
48. Turgeon R., Webb J. A. Leaf development and phloem transport in Cucurbit®
pepo, Planta, 113, 179—191 (1973).
49. Webster B. D. A morphogenetic study of leaf abscission in Phaseolus, Amer.
J. Bot., 57, 443—451 (1970).
50. Wylie R. B. The bundle sheath extension in leaves of dicotyledons, Amer. J.
Bot., 39, 645—651 (1952).
Глава 19
Лист: разнообразие структуры
Структура листа и окружающая среда
Растения, произрастающие в разнообразных местах обитания,
обнаруживают различия, которые обычно рассматривают как за-
крепленные в ходе эволюции приспособления к специфическим
условиям среды. Но разные растения, обитающие в одной и той
же экологической нише, приспосабливаются к неблагоприятным
условиям обитания различными путями. В условиях дефицита
воды, например, одни растения формируют приспособления, за-
щищающие надземные органы от излишней потери воды, другие
образуют под землей водозапасающие органы или формируют
корни, проникающие на большую глубину, а третьи сокращают
продолжительность жизни, которая приурочивается в этом случае
к тому период}, когда окружающая среда в должной мере обес-
печена запасами воды. Таким образом, разные приспособления
могут одинаково успешно обеспечивать растению возможность
существования в тех или иных условиях среды. Наиболее высоко-
го уровня адаптации растения, как правило, достигают путем
комбинирования различных приспособлений [7, 37].
Доступность воды является особенно важным фактором, влия-
ющим на форму и структуру растения. По потребности в воде
растения обычно разделяют на ксерофиты, мезофиты и гидрофи-
ты. Ксерофиты приспособлены к сухим местам обитания; мезо-
фиты требуют большого количества доступной воды в почве
и сравнительно влажной атмосферы; гидрофиты (или гигрофиты)
нуждаются в еще большем запасе влаги и могут расти частично
или полностью погруженными в воду. Структурные особенности,
присущие растениям различных мест обитания, или сами расте-
ния, имеющие такие особенности, описываются соответственно как
ксероморфные, мезоморфные и гидроморфные. Особенности пере-
численных растений наиболее выражены в листьях.
Черты, считающиеся характерными для мезофитов и гидрофи-
тов, указаны в описаниях листьев различных типов, приведенных
ниже в этой главе. Особенно много внимания в литературе уде-
ляется ксероморфным признакам, и мы обсудим их отдельно
« более подробно.
Ксероморфизм
Один из наиболее характерных признаков ксероморфных листь-
ев— высокое отношение объема к поверхности, такие листья
мелки и компактны [41, 45]. Эта особенность связана с опреде-
23*
Рис. 19.1. Поперечные срезы листьев, имеющих различные ксероморфные призна-
ки [41]. А. Весь мезофилл Sphaeralcea incana представлен палисадной тканью,
имеются трихомы. Б, В. Суккулентный лист Salsola kali с крупноклеточной во-
дозапасающей тканью, окруженной однослойной палисадной паренхимой. Неко-
торые клетки водозапасающей ткани (справа) находятся в увядшем состоя-
нии — реакция на истощение водных запасов. Г, Д. Низкое отношение поверх-
ности листа к объему у Greggia сатрогит, весь мезофилл дифференцирован
как палисадная ткань. Е, Ж. Пузыревидные волоски и изобилатеральный мезо-
филл в листе Atriplex canescens. 1 — водозапасающая ткань; 2— палисадная
ткань; 3 — гиподерма.
Лист' разнообразие структуры
357
ленными внутренними характеристиками, такими, как большая
толщина мезофилла; большее развитие палисадной ткани по
сравнению с губчатой или вообще наличие одной палисадной
(рис. 19.1,А, Д, Ж); малый объем межклетников; компактная
сеть жилок; относительно низкая плотность распределения про-
должений обкладок пучков; высокая плотность распределения
устьиц и, наконец, иногда мелкоклетность.
Многие представители ксерофитной флоры имеют листья, со-
держащие гиподерму [51] —ткань с малым числом хлоропластов
или (вообще без этих органелл (рис. 19.1,Ж). Общее свойство
всех ксерофитов — механическая прочность листьев, обусловлен-
ная развитием большого количества склеренхимы. Развитая
склеренхима в определенной мере предотвращает повреждающее
действие частичного увядания листьев [45], поэтому естественно,
что она более свойственна растениям, обитающим в районах, ха-
рактеризующихся продолжительными или периодическими засу-
хами, например в жарких пустынях [47]. У ксероморфных расте-
ний часто отмечаются толстые клеточные оболочки, особенно
в эпидерме (рис. 19.1, Д), и толстая кутикула, но вообще толщи-
на кутикулы у них варьирует в довольно больших пределах.
Устьица 1сосредоточены в углублениях — устьичных криптах (Afe-
rium oleander) или в бороздках (Ericales [23]), выстланных эпи-
дермальными волосками. Некоторые ксерофиты являются типич-
ными суккулентами со всеми свойственными им гистологически-
ми признаками, в частности наличием водозапасающей ткани
(рис. 19.1, В) и слабым развитием проводящей ткани.
Для многих ксерофитов характерно обилие трихом (рис. 19.1,
Л, Ж). Если виды с сильным опушением листьев имеют мезофит-
ную и ксерофитную формы, последняя обычно отличается более
плотным покровом из волосков. Влияние условий обитания на
развитие трихомов было исследовано на водном растении Poly-
gonum amphibium. Боковые почки, развивающиеся на воздухе,
дают начало плотно опушенным побегам, а те, которые развива-
ются в контакте с водой или в Насыщенной водой почве, остают-
ся гладкими на протяжении всего сезона [33]. Исследования
влияния трихомов на потерю воды листом дали различные ре-
зультаты, но, по-видимому, в некоторых случаях трихомы играют
определенную роль в защите мезофилла от избыточного теп-
ла [5].
Лсероморфные признаки, как и другие экотипические призна-
ки, имеют разную степень постоянства; у определенных видов они
могут быть прочно генетически закреплены. Тем не менее фак-
торы среды способны вызывать некоторую степень ксероморф-
ности у мезоморфных в норме листьев или усиливать ксероморф-
ные черты у ксерофитов [41, 47]. Дефицит влаги — только один
из таких факторов. Дефицит питательных веществ и холод мо-
353
Глава 19
Д
Рис. 19.2. Влияние факторов среды на структуру листа. А, Б. Поперечные срезы
листовой пластинки нормального (А) и суккулентного (£) листьев Baccharis ha-
limifolia, взятых с одного растения, но отличающихся тем, что срез, представлен-
ный на рис. Б, взят со стороны, обращенной к океаническому прибою [8].
В—Д. Поперечные срезы листьев Acer plantanoides, взятых с одного дерева, на
которых видно влияние света на структуру мезофилла: В — умеренно затенен-
ный лист из внутренней части кроны; Г — сильно затененный лист из глубины кро-
ны; Д — лист, находящийся на прямом солнечном свету [50]. 1 — продолжение
обкладки пучка.
гут вызывать более сильную (степень ксероморфизма, чем недо-
статок влаги [45]. В условиях недостатка азотистых веществ, на-
пример, усиливается суккулентность. Она может развиваться
у прибрежных растений, обдаваемых брызгами (Морской воды [8]
(рис. 19.2, А, Б), по-видимому, под действием хлористого натрия [6].
Другим важным формирующим фактором является свет.
Листья, развивающиеся на ярком свету, имеют более высокую
степень ксероморфно(Сти, чем находящиеся в условиях затенения.
Эта реакция является основой для дифференциации листьев на
световые и теневые. Часто можно наблюдать, что листья, разви-
вающиеся на прямом солнечном свету, (мельче, но толще и имеют
более мощную палисадную ткань, чем листья, развивающиеся
в тени [50] (рис. 19.2, В—Д).
Лист: разнообразие структуры
359
Морфология листа в связи с положением
на растении
Последовательное развитие листьев на растении связано с бо-
лее или менее выраженными различиями в их морфологии.
Листья претерпевают гетеробластическое развитие и в соответст-
вии с этим имеют определенный структурный градиент в пределах
целого растения. Изменение формы листьев ib ходе онтогенеза ча-
сто можно наблюдать еще на стадии проростков, так как сущест-
вует различие между ювенильными и взрослыми формами.
У растений, имеющих сложные листья, листья проростков могут
быть простыми (Fragaria, Fraxinus) или, наоборот, первые листья
могут быть сложными, а более поздние — простыми в результате
подавления развития листочков (Acacia). У Delphinium число
сегментов, на которые разделена листовая пластинка, с возра-
стом растения увеличивается, а у Ulmus увеличивается число
краевых зубчиков. У некоторых видов гетеробластное развитие
приводит к изменению природы боковых придатков. Так, юве-
нильные листья имеют форму нормальных листьев, а более позд-
ние модифицируются в филлодии (Oxalis), иглы (Ulex) или уси-
ки (Lathyrus aphaca).
У многолетних древесных растений первые листья нового по-
бега представляют собой почечные чешуи, или катафиллы, кото-
рые резко отличаются от листьев, следующих за ними, хотя иног-
да могут появляться и промежуточные по форме листья. Еще
одно изменение формы листьев происходит при переходе от веге-
тативной к репродуктивной стадии развития, в ходе которого ве-
гетативные листья сменяются брактеями, окружающими ветви
соцветия и цветки.
Факторы, вызывающие изменения в положении листьев, раз-
нообразны и действуют в комплексе, но в основном гетеробласт-
ное развитие рассматривается как реакция апикальной меристе-
мы на изменяющиеся физиологические условия в растении [1].
Внешние факторы, такие, как длина дня, температура, обеспечен-
ность водой и питательными веществами, влияют на физиологиче-
ское состояние растения. Так, например, формирование почечных
чешуй — сезонное явление, а формирование цветочных брактей
связано с фотопериодической индукцией цветения.
У Ipomoea, у которой ювенильные листья цельные, а взрос-
лые— лопастные, было обнаружено, что сахара оказывают уско-
ряющее действие на развитие взрослой формы, а казеиновый гид-
ролизат, наоборот, тормозит этот процесс. Некоторые ингибиторы
роста также ускоряют формирование зрелых листьев. Ньоку [34]
отмечает, что гипотеза о контролирующем действии углеводного
питания на гетеробластное развитие была выдвинута Гебелем
[19] еще в начале века.
360
Глава 19
На гетеробластное развитие листьев оказывают влияние эндо-
генные факторы, такие, 1как уровень гормонов, например гиббе-
реллиноподобных веществ [16], и некоторые неясные пока воз-
действия более старых листьев на более (молодые. У плюща Не-
dera helix, у которого различия между ювенильными и взрослыми
формами побегов выражаются не только в морфологии листьев,
но и в характере роста растения, зрелую форму можно стимули-
ровать к формированию ювенильных побегов, воздействуя на нее
гибберелловой кислотой [38].
Обычно ранние листья имеют более простую, менее дифферен-
цированную структуру, чем поздние. Особенно отчетливые разли-
чия наблюдаются в степени развития палисадной паренхимы. Так,
в поздних листьях палисадная ткань отличается большим числом
антиклинальных делений, содержит больше клеточных слоев
и имеет более длинные клетки {40]. У лжетсуги тиссолистной
различия между катафиллами и вегетативными листьями замет-
ны в период раннего роста примордиев; в катафиллах формиру-
ется простой мезофилл, не дифференцированный на палисадную
и губчатую паренхиму '[36]. Структурные преобразования листь-
ев, наблюдаемые на более высоких онтогенетических уровнях,
иногда описываются как изменения в направлении усиления ксе-
роморфизма [1].
Листья двудольных
Вариации структуры мезофилла
Многие травянистые двудольные имеют листья с относительно
недифференцированным мезофиллом. Для них характерны следу-
ющие признаки: палисадная ткань отсутствует или слабо разви-
та; большой объем межклетников; лист обычно тонкий; эпидерма
образует тонкую кутикулу; устьица в той или иной степени под-
няты над поверхностью листа. Эти признаки особенно отчетливо
выражены у гидроморфных растений, но в той или иной степени
они наблюдаются и у травянистых растений, произрастающих
в условиях более умеренного количества доступной влаги. В ка-
честве примеров листьев с относительно недифференцированным
мезофиллом можно привести листья Pisum sativum, Linum usita-
tissimum, Lactuca sativa. У сахарной свеклы (Beta vulgaris) форма
клеток мезофилла зависит от толщины листа. В тонких листьях
мезофилл состоит из коротких округлых клеток, в толстых листь-
ях большинство клеток имеют вытянутую форму.
Тонкий рыхло организованный мезофилл с одним рядом пали-
садных клеток найден у Ipomoea batatas, Pastinaca sativa (фо-
то 116, A), Raphanus sativus, Solatium tuberosum и Lycopersicon
Лист: разнообразие структуры
361
esculentum. Сходные по строению листья Cannabis sativa (гл. 18)
и Humulus lupulus имеют кристаллоносные клетки в эпидерме
и множество трихомов, железистых и нежелезистых. У люцерны
Medicago sativa палисадная ткань состоит из двух рядов довольно
коротких клеток. У другого рода сем. Fabaceae — сои (Glycine) —
клетки мезофилла, расположенные между жилками, представля-
ют собой длинные ветвящиеся клетки, контактирующие с клетка-
ми обкладки пучков на уровне флоэмы {49]. Тонкие листья хлоп-
чатника (Gossypiurri) имеют длинные палисадные клетки, кото-
рые занимают приблизительно 7з или 72 поперечника пластинки.
3 мезофилле листа хлопчатника имеются лизигенные «железки»,
а на абаксиальной поверхности выступа главной жилки — лунко-
образные нектарники с булавовидными папиллами.
Разные древесные и кустарниковые виды имеют листья с от-
четливо дифференцированной палисадной паренхимой на адакси-
альной стороне листа, т. е. типично дорсовентральные мезоморф-
ные листья (фото 116,5; Vitis, Syringa, Ligustrum, Pyrus) или
листья с различным сочетанием ксероморфных признаков. Листья
Citrus толстые, кожистые с толстой кутикулой, в которую включе-
ны слои воска. Компактная палисадная ткань резко отличается от
рыхлой толстой губчатой паренхимы (фото 116,5). В мезофилле
встречаются лизигенные полости (гл. 13). Листья Ficus имеют
свободную от хлорофилла гиподерму, образующуюся из эпидермы
(сложная эпидерма). Они содержат цистолиты в эпидерме (гл. 13)
и млечники в мезофилле.
В родах Artemisia, Atriplex (рис. 19.1,Ж), Chrysothamnus,
Sarcobatus и многих других из разных семейств обнаружен изо-
билатеральный мезофилл с палисадной паренхимой по обеим сто-
ронам листа (исероморфный признак) [32]. Разновидностью изо-
билатеральной структуры является центрическая структура [32],
встречающаяся в очень узких или близких к цилиндрическим
листьях. В таких листьях абаксиальные и адаксиальные палисад-
ные клетки образуют непрерывный слой (рис. 19.1,5). Близкий
к изобилатеральному лист образуется в том случае, когда пали-
садная и губчатая ткани мало отличаются одна от другой (фото
116,5).
У Salsola палисадная ткань окружает паренхиму, состоящую
из крупных бесцветных клеток, которые, как предполагают, со-
ставляют водозапасающую ткань (рис. 19.1,5). Такая ткань
встречается также в средней пасти плоских листьев (Haplopap-
pus spinulosus) [41] либо снаружи от мезофилла (гиподерма или
сложная эпидерма). В мясистых листьях Peperomia в сложной
эпидерме иногда насчитывается до 15 слоев клеток, что превыша-
ет толщину мезофилла [30].
Структура листьев водных растений варьирует в зависимости
от условий их роста. Одни растения имеют частично или пол-
362
Глава 19
ове в во
в- в в е е в
е е
е’е*в®ео
Рис. 19.3. Разнообразие структур листьев, наблюдаемое на поперечных срезах.
А. Плавающий лист Nymphaea, двудольного водного растения. Воздушные по-
лости расположены на стороне, находящейся в контакте с водой. Б—Д. Одно-
дольные: Б, В — полый трубчатый лист лука Allium сера; Г, Д— лист Iris, сре-
занный через унифациальную пластину (Г) и бифациальное влагалище (Д).
1 — трихосклереида.
ностью погруженные листья, другие — только плавающие,
третьи — и плавающие, и погруженные. Погруженные листья
обычно бывают оильнорассеченными в противоположность слабо-
рассеченным или цельным листьям, растущим у тех же растений
над поверхностью воды. Формирование рассеченных листьев яв-
ляется реакцией на определенные условия среды и может быть
вызвано экспериментально путем погружения стеблей или изме-
нения длины светового дня [14]. Гидроморфные листья имеют
общие черты: большие воздушные полости (рис. 19.3,Д), малое
количество склеренхимы и слабое развитие проводящей системы.
Лист: разнообразие структуры
Опорная ткань
363
У двудольных опорная ткань в листьях представлена коллен-
химой или склеренхимой и, кроме того, функцию опоры (выполня-
ют проводящие пучки. Колленхима встречается вдоль крупных
жилок с одной или с обеих сторон (гл. 18); клетки непроводящей
части ксилемы и флоэмы также могут иметь колленхиматозное
утолщение оболочки. Склеренхима встречается в виде «пучковых
колпачков» (в поперечном разрезе), обкладок проводящих пучков
и их продолжений, состоящих из волокнистых клеток, а также
в виде отдельных склереид, локализованных в мезофилле. При-
меры проводящих пучков, сопровождаемых склеренхимой, можно
найти в сем. Boraginaceae, Caryophyllaceae (фото 116, Г), Lamia-
ceae, Lauraceae, во всех семействах Fabales, в сем. Monimiaceae,
Proteaceae, у некоторых представителей сем. Rosaceae и Stercu-
liaceae [32].
Черешок
Черешок листьев двудольных содержит те же ткани, что и сте-
бель, и часто они расположены так же, как в стебле. Эпидерма
имеет небольшое число устьиц, а основная ткань содержит хлоро-
пласты. В качестве опорной ткани встречается колленхима или
склеренхима. Распределение проводящих тканей отличается боль-
шим разнообразием (гл. 18).
Некоторые растения имеют суставоподобные утолщения — ли-
стовые подушечки — у оснований черешков и у оснований чере-
шочков сложных листьев (фото 117). Листовые подушечки участ-
вуют в движениях листьев в ответ на различные экзогенные и эн-
догенные стимулы. Наиболее известны листовые подушечки,
встречающиеся у Fabales [9, 39, 48]. Листочки сложных листьев
у многих Fabales раскрываются на свету и складываются в тем-
ноте (никтинастическое движение). Такое «открывание» и «закры-
вание» листьев является циркадным процессом, который продол-
жается даже в том случае, если растения переводятся в условия
постоянного освещения или постоянной темноты. Хорошо извест-
ные движения листьев Mimosa pudica в ответ на прикосновение
или другие внешние воздействия также осуществляются за счет
активности листовых подушечек [48].
Листовые подушечки иногда набухают и поэтому обычно име-
ют морщинистую поверхность. Проводящая 'система сконцентри-
рована в центре подушечки даже в том случае, когда выше и ни-
же нее проводящие ткани располагаются по периферии черешка
(фото 117). Наибольший объем ткани приходится на долю тонко-
стенной паренхимы, содержащей межклетники. Устьиц мало или
нет вообще, тогда как трихомы могут присутствовать.
364
Глава 19
Движения листочков связаны с изменениями тургора и резки-
ми сокращениями или растяжения ми клеток основной паренхимы
на противоположных сторонах листовых подушечек. Листочки
сложены, когда сокращены клетки на адаксиальной (стороне ли-
стовой подушечки, и, наоборот, они раскрыты, когда сокращены
клетки на абаксиальной стороне. В том случае, когда весь лист
опускается (вниз, как у Mimosa, в ответ на стимуляцию сокраща-
ются абаксиальные клетки. Как было установлено для Albizzia,
изменение тургора ® листовых подушечках вызывается притоком
калия. Анализ содержания различных элементов и микрозондо-
вые исследования показали, что калий перемещается из сокраща-
ющихся клеток в растягивающиеся в количествах, достаточных
для достижения необходимого осмотического эффекта [39].
Транспорт калня является основой для движения листьев неза-
висимо от того, контролируется ли оно фитохромом или эндоген-
ным ритмом. Это находится в полном соответствии с концепцией,
согласно которой ключевую роль в листовых движениях играют
колебательные изменения мембранной проницаемости [13].
Листья однодольных
Листья однодольных разнообразны по форме и структуре, и
некоторые из них сходны с листьями двудольных. Листья одно-
дольных могут иметь черешок и пластинку (Саппа, Zantedeschia,
Hosta), но большинство листьев дифференцировано на пластинку
и влагалище, причем пластинка сравнительно узкая. Для листьев
однодольных характерно параллельное жилкование.
Анатомическая структура листьев однодольных варьирует
в пределах от гидроморфной до крайне ксероморфной. Гидрофи-
там из числа однодольных свойственны те же основные особенно-
сти, что и двудольным гидрофитам, в частности это относится к
обилию аэренхимы. У Butomaceae почти 80% объема растения
приходится на долю межклетников [46]. Дорсовентральные ли-
стья с палисадной паренхимой на адаксиальной стороне можно
наблюдать у Lilium (фото 116,Д’). Дорсовентральный лист банана
Musa sapientum толстый, имеет несколько слоев палисадной ткани
и широкую зону губчатой паренхимы с большими полостями [43].
Жесткие листья Carex (фото 118) отличаются значительным раз-
витием склеренхимы и большими воздушными полостями, содер-
жащими тонкостенные клетки.
Многие однодольные имеют частично унифациальные листья,
возникающие в результате замены маргинального роста на адак-
сиальный в период, когда лист находится на стадии примордия
(гл. 18). Лист Iris, например, имеет унифациальную пластинку,
уплощенную не тангенциально по отношению к оси, а перпенди-
Лист: разнообразие структуры
365
кулярно к ней. Проводящие пучки проходят частично в виде од-
ного ряда, частично в виде двух близко сомкнутых рядов, причем
в одной половине пучков ксилема обращена в одну сторону, а в
другой — в противоположную (рис. 19.3, Г). Влагалище этого же
листа развивается за счет маргинальной меристематической ак-
тивности, и пучки в нем располагаются по обычной для двух
половин листа схеме (рис. 19.3, Д). Некоторые виды Allium име-
ют трубчатые листья (рис. 19.3,Б, В). Палисадная паренхима
в них располагается под эпидермой по кругу, и под ней таким же
образом размещается губчатая паренхима. Центральная часть
листа представляет собой полость, окруженную остатками парен-
химных клеток, которые первоначально занимали всю полость.
В листьях многих однодольных формируется большое количе-
ство склеренхимы; склеренхимные волокна листа некоторых видов
используются в качестве важного источника твердых технических
волокон (гл. 6). Волокна связаны с проводящими пучками или
расположены в виде самостоятельных тяжей.
Листья злаков
Листья злаков обычно состоят из более или менее узкой пла-
стинки и влагалища, окружающего стебель. Между пластинкой
и влагалищем часто встречаются аурикулы и лигула. Проводящие
пучки разного размера чередуются в строгой последовательности
Рис. 19.4. Поперечный срез листа Bouteloua breviseta, имеющего структуру, ха-
рактерную для Сгфотосинтетического цикла. Естественно свернутый лист [42].
1 — склеренхима; 2 — флоэма; 3— ксилема; 4 — обкладка пучка; 5 — мезофилл;
6 — шарнирные клетки.
366
Глава 19
(рис. 19.4 и фото 119, Л, Б) и связаны друг с другом мелкими
поперечными комиссуральными тяжами (гл. 18). Средний пучок
может быть самым крупным (фото 119, Л) или средняя часть
пластинки утолщена с адаксиальной стороны [15].
У мезофилла злаков, как правило, нет отчетливой дифферен-
циации на палисадную и губчатую паренхиму, хотя иногда ряды
клеток под обоими эпидермальными слоями организованы более
регулярно, чем остальная ткань. У некоторых злаков, особенно
у Eragrostoideae и Panicoideae. клетки мезофилла окружают про-
водящие пучки таким образом, что каждая клетка ориентирована
своей продольной осью перпендикулярно пучку; в результате на
поперечных срезах клетки мезофилла выглядят расположенными
радиально вокруг пучков (рис. 19.4 и фото 119,Д Б). Клетки
мезофилла могут быть типично паренхимными (Pooideae) в ка-
кой-то степени лопастными (Bambusoideae), сильнолопастными
или даже ветвящимися (некоторые Eragrostoideae и Panicoideae)
[17].
Эпидерма злаков состоит из разнообразных клеток (гл. 7).
Основную массу составляют узкие вытянутые клетки, часто имею-
щие сильноволнистые антиклинальные стенки. Узкие замыкающие
клетки устьиц ассоциированы с околоустьичными клетками. Мо-
гут также присутствовать окремневшие клетки, опробковевшие
клетки и трихомы.
Сильно увеличенные эпидермальные клетки с тонкими анти-
клинальными стенками — пузыревидные клетки (фото 119)—часто
описываются как клетки, участвующие в скручивании и склады-
вании листьев злаков. У многих засухоустойчивых злаков пузы-
ревидные эпидермальные клетки расположены между выступами
жилок в адаксиальных бороздках и сопровождаются такими же
клетками мезофилла — шарнирными клетками (рис. 19.4; бес-
цветные клетки, согласно Меткалфу [31]). При чрезмерной по-
тере воды листом пузыревидные или шарнирные клетки, или од-
новременно клетки обоих типов теряют тургор, сокращаются и
способствуют тем самым складыванию или скручиванию листа
(рис. 19.5). Но потеря тургесцентности тех или иных крупных
тонкостенных клеток лишь один из факторов, вызывающих скру-
чивание листьев, поскольку листья, не имеющие таких клеток,
аналогичным образом отвечают на потерю влаги. Для скручива-
ния или складывания листьев имеют также значение неравномер-
ное увядание других тканей, характер распределения склеренхи-
мы и силы сцепления между тканями [42]. Разворачивание ли-
стьев в период их выхода из почек (рис. 19.5, А, Б) —это ростовое
явление, основанное на растяжении пузыревидных клеток и кле-
ток мезофилла.
Обкладки пучков у злаков имеют различия, которые исполь-
зуются в таксономических целях [10, 12] и для определения типа
Лист: разнообразие структуры.
36 Г
Рис. 19.5. Разная степень скрученности листа Bouteloua breviseta, показанная
на поперечных срезах [42]. А. Молодой, еще полностью скрученный лист. Б. Зре-
лый лист, слегка скрученный (см. рис. 19.4). В. Срез такого же, как на рис. Б,
листа, но оставленного сохнуть на воздухе в течение 48 ч перед фиксацией; сте-
пень скрученности выше, чем на рис. Б. Г. Зрелый лист, завядший на растении
естественным образом, скрученность большая, чем на рис. В.
фотосинтеза у разных видов растений. У злаков, относящихся
к Pooideae (или Festucoideae) (фото 119, В и 120, Б, В) , обычно
встречаются обкладки двух типов: внутренняя местомная обклад-
ка с утолщенными стенками и мелкими слабодифференцирован-
ными пластидами и внешняя паренхимная обкладка с тонкими
стенками и относительно более крупными пластидами (но более
мелкими, чем в мезофилле). Местомная обкладка может иметь
в клеточных стенках субериновую пластинку, т. е. быть аналогом
эндодермы [12, 35]. У Eragrostoideae (рис. 19.4 и фото 121) па-
ренхимная обкладка хорошо развита, ее клетки имеют более тол-
стые оболочки, чем клетки мезофилла, и содержат крупные пла-
стиды с гранами. Кроме паренхимной у них обычно есть внутрен-
няя более или менее толстостенная обкладка. У Panicoideae
(фото 119,А, Б и фото 120,Л) внутренняя обкладка, как правило,
отсутствует, а единственная паренхимная обкладка состоит из
крупных клеток с более толстыми оболочками, чем у клеток ме-
зофилла. Хлоропласты в обкладке такие же крупные или крупнее,
чем хлоропласты мезофилла, но они имеют мало гран или не
имеют их вообще.
Листья злаков отличаются мощным развитием склеренхимы.
Обычно волокна встречаются в виде продольных полос, тянущих-
ся от крупных проводящих пучков к эпидерме. Наиболее крупные
пучки окружены волокнами и, кроме того, связаны с полосками
волокон, расположенных по обе стороны пучка (фото 120, В).
Более мелкие пучки могут быть связаны только с одной полоской
волокон. У некоторых видов волокна встречаются в виде субэпи-
дермальных тяжей или полос, не имеющих контакта с проводя-
368
Глава 19
щими пучками (фото 120,5). Края листа также обычно содержат
волокна (фото 119, 5), у некоторых растений они встречаются и в
эпидерме.
Структура листьев злаков и тип фотосинтеза
После открытия С4-пути фотосинтеза, или пути Хэтча — Слей-
ка, у сахарного тростника [27] сравнительная анатомия листьев
злаков в связи с фотосинтезом стала темой интенсивных исследо-
ваний. Наиболее распространенный фотосинтетический цикл —
Сз-путь, или путь Кальвина — Бенсона, поставляет в качестве пер-
вичного продукта фотосинтеза трехуглеродное соединение—3-фос-
фоглицериновую кислоту. В С4-цикле на начальных стадиях
фиксации СО2 продуцируются четырехуглеродные кислоты. Расте-
ния, для которых характерен С4-путь (С4-растения), используют
СО2 более эффективно, чем растения, имеющие Сз-путь (Сз-расте-
ния), и в соответствии с этим у них обнаружен низкий процент
освобождения СО2 в процессе светозависимого дыхания (фото-
дыхания).
С4-цикл характерен для растений, нуждающихся в относитель-
но высоких температурах для pocia. Среди покрытосеменных этот
тип фотосинтеза обнаружен у представителей 10 семейств (Аша-
ranthaceae, Aizoaceae, Chenopodiaceae, Asteraceae, Cyperaceae,
Euphorbiaceae, Poaceae, Nyctaginaceae, Portulacaceae и Zygophyl-
laceae [27]). К С4-растениям относится около половины видов
сем. Роасеае [44]. С4-растения имеют тропическое происхождение
и широко распространены в ксерофитных условиях обитания. По-
скольку оказалось, что существует довольно мало покрытосемен-
ных, специализированных как растения с С4-фотосинтетическим
циклом, условия, обеспечивающие С4-цикл, рассматриваются как
условия более позднего происхождения, чем те, в которых сфор-
мировался С3-цикл [11]. Открытие С4-цикла и последующее его
исследование, главным образом на злаках, имели большое значе-
ние для понимания фотосинтеза и привели к появлению более яс-
ных представлений о взаимосвязи между метаболическими про-
цессами и физиологией, анатомией, экологией, эволюцией, а также
экономическими факторами, такими, как продуктивность растений
и их конкуренция [2].
С3- и С4-растения проявляют анатомические и ультраструктур-
ные различия, что отчетливо установлено на примере Роасеае
[12, 27]. Особенно важна для диагностики Сз- и С4-растений
структура паренхимных обкладок пучков. У Сз-растений эта об-
кладка имеет мало органелл и сравнительно мелкие хлоропласты,
так что при малых увеличениях клетки обкладки выглядят пусты-
ми и резко отличаются от богатых хлоропластами клеток мезо-
Лист: разнообразие структуры
36g
филла (фото 119,В и 120,5, В). У С4-растений обкладкам свой-
ственно высокое содержание органелл, особенно митохондрий и
микротелец [3], их хлоропласты темно-зеленые и крупные, обыч-
но они крупнее, чем хлоропласты мезофилла (фото 120, А и 121).
Хлоропласты в клетках обкладки могут быть локализованы либо
вблизи наружной тангенциальной стенки, либо, наоборот, в про-
тивоположной части клетки (фото 120, Л и 121) [25]. Стенки
клеток обкладки иногда утолщены. Когда с помощью фермента-
тивной обработки проводящие пучки С4-растений выделяются ив
мезофилла, обкладка выделяется вместе с ними, причем ее клетки
располагаются по двойной спирали вокруг пучка (фото 122, Л, Б)
[4].
По ряду характеристик хлоропласты обкладок С4-растений
обнаруживают разнообразие. Они могут формировать более мно-
гочисленные и более крупные, чем в хлоропластах мезофилла,
крахмальные зерна, но отличаются слабым развитием гран или
полным их отсутствием. В целом у С4-растений степень различий
между хлоропластами обкладки и мезофилла варьирует [3, 25],
Сравнительные биохимические исследования на С4-растениях по-
казали, что вариации морфологии и локализации хлоропластов
связаны с присутствием различных ферментов [21].
Более или менее постоянным признаком хлоропластов обкла-
док и мезофилла С4-растений является наличие в них перифери-
ческого ретикулума — системы анастомозирующих трубочек, при-
мыкающих к внутренней мембране оболочки хлоропласта. Однако,
поскольку этот ретикулум найден и у некоторых С3-растений, его
связь с С4-фотосинтезом не вполне ясна [27].
Часто упоминаемая анатомическая особенность С4-растений —
упорядоченное расположение клеток мезофилла по отношению
к обкладке пучков: мезофилл и обкладка образуют два концент-
рических слоя вокруг проводящих пучков, хорошо видимых на
поперечных срезах (рис. 19.4 и фото 119, Д, Б). Но в отличие от
обкладки слой клеток мезофилла имеет межклетники. Рыхлая упа-
ковка клеток мезофилла отчетливо видна на сделанных в скани-
рующем электронном микроскопе фотографиях изолированных из
листьев пучков, сохраняющих не только обкладку, но и прикре-
пленный к ней слой клеток мезофилла (фото 122, В) [4].
Концентрическая слоистоть мезофилла и обкладки, выявляе-
мая на поперечных срезах листьев С4-растений, варьирует от
очень выраженных форм, как у Buchloe \Т7] или Bouteloua
(рис. 19.4), до едва заметной как у Zea (фото 120, Д). Но несмот-
ря на эти различия, пространственная связь между мезофиллом
и проводящими пучками у С4-растений во всех вариантах являет-
ся, по видимому, более тесной, чем у С3-растений (фото 119, А,
Б и 120, Д, ср. с фото 119, В). Лист С4-злаков часто описывается
как комплекс стержневидных элементов, состоящих из проводя-
24 К. Эзау, кн. 2.
370
Глава /9
щих пучков и связанного с ними мезофилла (рис. 19.4, фото 119,
Л, Б и 122, В).
На основе наблюдаемого у некоторых злаков и осок концент-
рического расположения паренхимных слоев вокруг проводящих
пучков Габерландт [22] сравнил слой мезофилла с короной
(kranz), заметив, что его трубчатые клетки расходятся от обклад-
ки по радиусам. В литературе, посвященной особенностям С4-рас-
тений, понятие «корона» (kranz) в «корончатом типе» (kranz type)
включает одновременно и мезофилл и обкладку, а термин kranz
syndrome («корончатый синдром», или «С4-синдром») относится
к совокупности структурных и физиологических признаков С4-
растений [11, 27].
Специфическая анатомия С4-растений является ярким приме-
ром корреляции между структурой и функцией у растений. Одна-
ко предполагая, что растение, имеющее один признак С4-синдро-
ма, должно обладать всем комплексом признаков этого синдрома
[11], следует принимать во внимание существование видов, зани-
мающих промежуточное положение между растениями, которые
обнаруживают отчетливо выраженные Сз- или С4-признаки [26].
Листья голосеменных
Листья голосеменных менее разнообразны по структуре, чем
листья покрытосеменных, и они хуже реагируют на изменения
условий среды. Большинство голосеменных представляют собой
вечнозеленые растения. К хорошо известным исключениям из это-
го правила относятся Ginkgo, Larix и Taxodium. Листья хвойных,
которые составляют подавляющее большинство голосеменных
растений, изучены лучше других. Ниже мы рассмотрим сначала
листья сосны, а затем сравним с ними листья других хвойных и
других голосеменных.
Хвоинки сосны закладываются на карликовых веточках (уко-
роченных побегах) поодиночке или чаще группами от двух до
нескольких. В зависимости от числа хвоинок в группе форма их
поперечного сечения варьирует от почти овальной до треугольной
(фото 123, А и 124, Л). Хвоинка имеет толстостенную эпидерму
с мощной кутикулой и глубоко погруженными устьицами, над
которыми нависают околоустьичные клетки (гл. 7). Устьица встре-
чаются на всех сторонах хвоинки и располагаются вертикальными
рядами. Под эпидермой находятся склерифицированные волокна
гиподермы, которые прерываются только под рядами устьиц. Ме-
зофилл состоит из паренхимных клеток, имеющих вертикальные
выступы, обращенные внутрь клеток (фото 123). Выступы разви-
ваются путем впячивания слоя оболочки, расположенного по одну
сторону от срединной пластинки [24]. Две половинки выступа
образуют впячивание, имеющее вид складки («складчатый мезо-
Лист: разнообразие структуры
37 X
филл»). Мезофилл не дифференцирован на палисадную и губча-
тую паренхиму. Внутри ассимиляционной ткани встречаются смо-
ляные ходы.
Проводящая ткань обычно формируется в виде одного пучка
или двух расположенных рядом пучков и занимает центральное
положение в хвоинке. Ксилема находится на адаксиальной, флоэ-
ма— на абаксиальной стороне. Ксилема состоит из протоксилемы
и метаксилемы. Последняя имеет правильную радиальную ряд-
ность клеток, причем ряды клеток ксилемной паренхимы череду-
ются с рядами трахеид. Не исключено, что после завершения пер-
вичного роста хвоинки существует короткий период вторичного
роста, но основной объем ксилемы составляет все-таки метакси-
лема.
Проводящий пучок окружен специфической тканью, называе-
мой трансфузионной тканью. Она состоит из трахеид и паренхим-
ных клеток (фото 123,5, В). Те трахеиды, которые находятся
рядом с проводящим пучком, имеют удлиненную форму; более
удаленные от пучка трахеиды имеют такую же форму, как и па-
ренхимные клетки. Оболочки трахеид, хотя и покрыты вторичными
утолщениями, сравнительно тонки, слегка лигнифицированы и:
несут окаймленные поры. Трахеиды часто выглядят несколько
деформированными, возможно, в связи с-давлением на них сосед-
них живых паренхимных клеток. Рядом с флоэмой располагаются
клетки, отличающиеся плотной цитоплазмой и рассматриваемые
как альбуминовые клетки (фото 123, 5).
Проводящий пучок и связанная с ним трансфузионная ткань
окружены толстостенной эндодермой. В эндодерме, а также тка-
нях, которые она окружает, межклетники отсутствуют. Эндодерма
часто имеет пояски Каспари на ранних стадиях развития и субе-
риновую пластинку на более поздних [28]. В зрелом состоянии
клетки эндодермы имеют вторичные лигнифицированные оболочки
с суберином, сосредоточенным в антиклинальных стенках.
Вышеописанные структурные признаки встречаются у многих
хвойных, варьируя в количественном отношении, но у некоторых
они полностью отсутствуют [28]. Листья хвойных могут быть од-
ножилковыми и при этом чешуевидными (Taxodiaceae, Cupressa-
ceae, Podocarpaceae), одножплковыми и игловидными (Abies, La-
tix, Picea, Pinas), многожилковыми и овальными (Araucariaceae).
Помимо этих встречаются и другие формы.
Склерифицированная гиподерма имеет до пяти слоев в тол-
щину у Araucaria, у некоторых же хвойных она совсем отсутствует
(Taxus, фото 124, В; Тоггеуа). У большинства хвойных нет склад-
чатого мезофилла. Палисадная и губчатая паренхима дифферен-
цирована у родов Abies (фото 124,5), Cunninghamia, Dacrydium,
Sequoia, Taxus (фото 124, В), Тоггеуа, а у Araucaria и Podocarpus,
палисадная ткань располагается по обе стороны листа.
24*
372
Глава 19
Граница между проводящей тканью и мезофиллом в листьях
хвойных не всегда явно выражена [28]. Pinaceae (Abies, фото 124,
Г; Larix, фото 124,Б; Picea, Pinus, фото 124,Л) имеют отчетливо
дифференцированную эндодерму. У видов Taxus (фото 124, В),
Sequoia sempervirens, Metacequoia glyptostroboides, Juniperus com-
munis и Araucaria excelsa есть только паренхимная обкладка.
Трансфузионная ткань характерна для всех хвойных, но ко-
личество и организация ее различны [12, 28]. В таких родах, как
Cunninghamia, Juniperus, Cupressus, Thuja, Torreya, Sequoia и Ta~
Y1J<\ Г гЬпТП 194 R} ПИЯ ПЯСПППЯ ГЯРТСЯ СЯРКЯ U РППЯПЯ пт ппппппя-
--- ---------, — z, ~-x----------- ----— г------
щего пучка; у Araucaria, Dammara, Sciadopitys — в виде арки над
ксилемой; у Larix, Abies и Cedrus — слева и справа от проводяще-
го пучка, но на уровне флоэмы; у Pinus полностью окружает про-
водящий пучок (фото 124, Л). Трахеиды трансфузионной ткани
могут иметь сетчатую или пористую вторичную оболочку. Обычно
считают, что трансфузионная ткань имеет отношение к транспор-
ту воды и питательных веществ между проводящим пучком и ме-
зофиллом.
Помимо трансфузионной ткани, связанной с проводящим пуч-
ком, для Podocarpus [20] и Dacrydium [29] описана так называе-
мая добавочная трансфузионная ткань. Эта ткань состоит из
толстостенных удлиненных клеток, выступающих за пределы об-
кладки пучка в мезофилл. Она не имеет контакта с той трансфу-
зионной тканью, которая располагается рядом с проводящим
пучком.
Число и расположение смоляных ходов варьируют даже и у
одних и тех же видов. Среди родов, представители которых имеют
одножилковые листья, только у Taxus (фото 124, В) нет смоляных
ходов. У Cupressineae, Taxineae (кроме Taxus), Sequoia, Podo-
carpus, у большинства видов Tsuga в листе имеется один смоляной
ход, расположенный между жилкой и нижней эпидермой; у Abie-
tineae, за исключением Tsuga, два смоляных хода — слева и спра-
ва от пучка (фото 124, Г); у родов, представители которых имеют
многожилковые листья (Araucaria), есть по одному ходу между
каждой парой пучков. Кроме основных ходов, могут существовать
дополнительные. У Pinus два латеральных смоляных хода встре-
чаются практически постоянно (фото 123, А и 124, А), остальные
варьируют по числу и расположению.
В качестве примера листьев голосеменных, отличных от листь-
ев хвойных, ниже описано строение листьев Cycas и Ginkgo. Круп-
ные листья Cycadales относятся к сложным листьям, их широкие
одножилковые листочки жесткие и колючие. Лист Cycas revoluta
(фото 125, А) имеет толстую кутикулу, толстостенную эпидерму
и погруженные устьица на абаксиальной стороне. Мезофилл со-
стоит из палисадной и губчатой паренхимы. На адаксиальной
стороне располагается один или два слоя гиподермальной скле-
Лист: разнообразие структуры
373
ренхимы. Эндодерма есть и имеет клеточные оболочки, сходные
по толщине с оболочками клеток проводящих тканей. Ксилема об-
наруживает примитивную организацию: протоксилема обращена
к абаксиальной стороне, метаксилема — к адаксиальной. Прото-
ксилему окружает слой паренхимы. Рядом с флоэмой присутст-
вует небольшое количество вторичной ксилемы. По обе стороны
метаксилемы располагается некоторое количество трахеид транс-
фузионной ткани. Есть и добавочная трансфузионная ткань, сос-
тоящая из удлиненных паренхимных клеток и трахеид с окаймлен-
ными порами [28]. Клетки обоих типов лежат рядом с межклет-
никами.
У Ginkgo (фото 125, Б) лист широкий у верхушки и узкий
у основания. Он имеет многочисленные дихотомически ветвящие-
ся жилки. Эпидерма сравнительно тонкостенная, гиподермальная
склеренхима отсутствует. Замыкающие клетки слабопогруженные
и встречаются только на абаксиальной стороне. Палисадный слой
один, он состоит из относительно коротких лопастных клеток —
сразу под этим слоем располагается губчатая паренхима. Каждый
из многочисленных проводящих пучков имеет однорядную лигни-
фицированную эндодерму. Эндодермальная обкладка, особенно
мелких пучков, часто содержит в изобилии таннины. К ксилеме
каждого пучка примыкает несколько трансфузионных трахеид.
Проводящие пучки чередуются со слизевыми ходами.
СПИСОК ЛИТЕРАТУРЫ
1. Allsopp A. Shoot morphogenesis, Ann. Rev. Plant Physiol., 15, 225—254
(1964).
2. Black С. C., Jr. Photosynthetic carbon fixation in relation to net CO2 uptake,
Ann. Rev. Plant Physiol., 24, 253—286 (1973).
3. Black С. C., Mollenhauer H. H. Structure and distribution of chloroplasts and
other organelles in leaves with various rates of photosynthesis, Plant Physiol.,
47, 15—23 (1971).
4. Black С. C., Campbell W. H., Chen T. M., Dittrich P. The Monocotyledons:
their evolution and comparative biology. III. Pathways of carbon dioxide me-
tabolism related to net carbon dioxide assimilation by monocotyledons, Quart.
Rev. Biol., 48, 299—313 (1973).
5. Black R. F. The leaf anatomy of Australian members of the genus Atriplex.
I. Atriplex vesicaria Heward and A. nummularia Lindl., Aust. J. Bot., 2, 269—
286 (1954).
6. Black R. F. Effect of sodium chloride on leaf succulence and area of Atriplex
hastata L., Aust. J. Bot., 6, 306—321 (1958).
7. Bocher T. W., Lyshede О. B. Anatomical studies in xerophytic apophyllous
plants. II. Additional species from South American shrub steppes, Kon. Danske
Videnskab. Selskab Biol. Skr., 18, 4, 137 p. (1972).
8. Boyce S. G. The salt spray community, Ecological Monographs, 24, 29—67
(1954).
9. Brown H. S., Addicott F. T. The anatomy of experimental leaflet abscission in
Phaseolus vulgaris, Amer. J. Bot., 37, 650—656 (1950).
10. Brown W. V. Leaf anatomy in grass systematics, Bot. Gaz., 119, 170—178
(1958).
374
j
Глава 19
11. Brown W. V., Smith B. N. Grass evolution, the kranz syndrome, 13C/12C ratios,
and continental drift, Nature, 239, 345—346 (1972).
12. Carolin R. C.t Jacobs S. W. L., Vesk M. The structure of the cells of the meso-
phyll and parenchymatous bundle sheath of the Gramineae, Bot. J. Linn Soc.,
66, 259—275 (1973).
13. Cumming B. G., Wagner E. Rhvthmic processes in plants, Ann. Rev. Plant
Physiol., 19, 381—416 (1968).
14. Cutter E. G. Plant anatomy: experiment and interpretation. Part 2. Organs,
London, Edward Arnold, 1971.
15. Esau K. Plant anatomy. 2nd ed., New York, John Wiley & Sons, 1965
16. Feldman L. J., Cutter E. G. Regulation of leaf form in Centaurea solstitialis L.
I. Leaf development on whole plants in sterile culture, Bot. Gaz., 131, 31—39
(1970). II. The developmental potentialities of excised leaf primordia in sterile
culture, Bot. Gaz., 131, 39—49 (1970).
17. Freier F. Las celulas clorenchimaticas del mesofilo de las Gramineas, Rev. Ar-
gentina Agron., 26, 1—16 (1959).
18. Gathy P. Les feuilles de Larix. Etude anatomique, Cellule, 56, 331—353
(1954).
19. Goebel K. Einleitung in die experimentelle Morphologic der Pflanzen, Leipzig.
Teubner, 1908.
20. Griffith M. M. Foliar ontogeny in Podocarpus macrophyllus, with special re-
ference to the transfusion tissue, Amer. J. Bot., 44, 705—715 (1957).
21. Gutierrez M., Gracen V. E., Edwards G. E. Biochemical and cytological rela-
tionships in C4 plants, Planta, 119, 279—300 (1974).
22. Haberlandt G. F. J. Physiologische Pflanzenanatomie. 3te Aufl., Leipzig, Wil-
helm Engelmann.
23. Hagerup O. The morphology and systematics of the leaves in Ericales, Phyto»
morphology, 3, 459—464 (1953).
24. Harris W. M. Ultrastructural observations on the mesophyll cells of pine lea-
ves, Can. J. Bot., 49, 1107—1109 (1971).
25. Johnson, Sister C., Brown W. V. Grass leaf ultrastructural variations, Amer.
J. Bot., 60, 727—735 (1973).
26. Kennedy R. A., Laetsch W. M. Plant species intermediate for C3, C4 photosyn-
thesis, Science, 184, 1087—1089 (1974).
27. Laetsch W. M. The C4 syndrome: a structural analysis, Ann. Rev. Plant Phv-
siol., 25, 27—52 (1974).
28. Lederer B. Vergleichende Untersuchungen uber das Transfusionsgewebe eini-
ger rezenter Gymnospermen, Bot. Stud., No. 4, 1—42 (1955).
29. Lee C. L. The anatomy and ontogeny of the leaf of Dacrydium taxoides, Amer.
J. Bot., 39, 393—398 (1952).
30. Linsbauer K. Die Epidermis. In: Handbuch der Pflanzenanatomie, Linsbauer K.,
ed., Band 4, Lief. 27, 1930.
31. Metcalfe C. R. Anatomy of the monocotyledons. I. Gramineae, Oxford, Claren-
don Press, 1960.
32. Metcalfe C. R., Chalk L. Anatomy of the dicotyledons, 2 vols . Oxford, Claren-
don Press. 1950.
33. Mitchell R. S. Variation in the Polygonum amphibium complex and its taxo-
nomic significance, Univ. Calif. Pubs. Bot., 45, 1—65 (1968).
34. Njoku E. The effect of sugars and applied chemicals on heteroblastic develop-
ment in Ipomoea purpurea grown in aseptic culture, Amer. J. Bot., 58, 61 —
64 (1971).
35. O'Brien T. B.} Carr D. J. A suberized layer in the cell walls of the bundle
sheath of grasses, Aust. J. Biol. Sci., 23, 275—287 (1970).
36. Owens J. N. Initiation and development of leaves in Douglas fir, Can. J. Bot,
46, 271—278 (1968).
37. Pyykkd M. The leaf anatomy of East Patagonian xeromorphic plants, Ann.
Bot. Fenn., 3, 453—622 (1966).
Лист: разнообразие структуры
375
38. Rogler С. Е., Dahmus М. Е. Gibberellic acid-induced phase change in Hedera
helix as studied by deoxyribonucleic acid-ribonucleic acid hybridization, Plant
Physiol., 54, 88—94 (1974).
39. Satter R. L., Galston A. W. Potassium flux: a common feature of Albizzia
leaflet movement controlled by phytochrome or endogenous rhythm, Science,
174, 518—519 (1971).
40. Schneider R. Histogenetische Untersuchungen fiber den Bau der Laubblatter,
insbesondere ihres Mesophylls, Osterr, Bot. Z, 99, 253—285 (1952).
41. Shields L. M. Leaf xeromorphy as related to physiological and structural
influences, Bot. Rev., 16, 399—447 (1950).
42. Shields L. M. The involution mechanism in leaves of certain xeric grasses,
Phytomorphology, 1, 225—241 (1951).
43. Skutch A. F. Anatomy of leaf of banana, Musa sapientuni L., var. hort. Gros
Michel, Bot. Gaz., 84, 337—391 (1927).
44. Smith B. N.f Brown W. V. The kranz syndrome in the Gramineae as indicated
by carbon isotope ratios, Amer. J. Bot., 60, 505—513 (1973).
45. Stalfelt M, G. Morphologic und Anatomie des Blattes als Transpirationsorgan,
Handb. Pflanzenphysiol, 3, 324—341 (1956).
46. Stant M. Y. Anatomy of the Butomaceae, J. Linn. Soc. London, Bot., 60, 31—
60 (1967).
47. Василевская В. К. Формирование листа засухоустойчивых растений, Акад,
наук Туркм. ССР, с. 183, 1954.
48. Weintraub М. Leaf movements in Mimosa pudica L., New Phytol., 50, 357—
382 (1952).
49. Weston G. O., Cass D. D. Observations on the development of the paraveinal
mesophyll of soybean leaves, Bot. Gaz., 134, 232—235 (1973).
50. Wylie R. B. Differences in foliar organization among leaves from four loca-
tions in the crown of an isolated tree (Acer platanoides), Proc. Iowa Acad.
Sci, 56, 189—198 (1949).
51. Wylie R. B. Leaf organization of some woody dicotyledons from New Zealand,
Amer. J. Bot, 41, 186—191 (1954).
Глава 20
Цветок: строение и развитие
Общее представление
*
Цветок был объектом многочисленных исследований, касаю-
щихся его строения, органографии и онтогенеза, однако до сих
пор не существует единой концепции цветка 1[1, 2, 5, 10, 16, 31,
57]. Одним из препятствий для полного понимания природы
цветка является неполнота палеоботанических данных. Поэтому
ботаники склонны полагаться на сравнительные исследования
цветков у представителей существующих в настоящее время так-
сонов и использовать эти данные для теоретических построений
о связях цветка и его частей с другими органами растения и с ре-
продуктивными структурами у нецветковых растений.
Согласно классической теории о природе цветка, на которую
большое влияние оказали философские идеи Гёте [21], цветок
гомологизируется с вегетативным побегом, а отдельные его ча-
сти— с листьями, или филломами. Представление о том, что
листья, относящиеся к типу, характерному для папоротников, го-
лосеменных и покрытосеменных (мегафиллов), развились из си-
стем ветвей [6] (см. также теломную теорию [19]), привело к
мысли, что листья и части цветка при их параллельной эволюции
претерпели дивергенцию еще до того, как возникла листоподобная
форма. Тем не менее по закладке, онтогенезу и основным прин-
ципам организации проводящей системы части менее специализи-
рованных цветков обнаруживают значительное сходство с листья-
ми, тогда как части более специализированных цветков, связаны
с листоподобными структурами, как правило, через переходные
формы. Эти аспекты строения цветка объясняют длительную при-
верженность многих ботаников к теории побеговидной природы
цветка.
Однако некоторые авторы [53] особое значение придают укло-
няющимся формам, предполагая, что по крайней мере часть орга-
нов цветка не родственна листьям и что представление о цветке
нуждается в коренном пересмотре. Ниже цветок описывается в
соответствии с теорией о существовании гомологии между побегом
и цветком, но с необходимым учетом того, что отличительные
особенности цветков у представителей некоторых таксонов не
легко объяснить этой теорией.
Цветок: строение и развитие
377
Строение
Цветок, части цветка и их расположение
Цветок представляет собой совокупность стерильных и фер-
тильных (или репродуктивных) частей (органов), покоящихся на
оси, носящей название цветоложе (рис. 20.4). К стерильным ча-
стям цветка относятся чашелистики, образующие чашечку, и ле-
пестки, образующие венчик. Чашечка и венчик вместе называются
околоцветником. Если околоцветник не дифференцирован на ча-
шечку и венчик, то такой околоцветник называют простым, а от-
дельные его члены — листочками простого околоцветника. Репро-
дуктивные части цветка включают тычинки (микроспорофиллы)
и плодолистики, или карпели (мегаспорофиллы). Тычинки состав-
ляют андроцей, а плодолистики — гинецей.
Расположение частей цветка на оси и их отношение друг к дру-
гу весьма разнообразны, и это разнообразие имеет важное значе-
ние для таксономических и филогенетических исследований цвет-
ков. Если цветок рассматривается как видоизмененный побег, то
различия в его строении можно толковать как отклонения от ос-
новной формы побега, достигшие той или иной степени; в этом
смысле чем больше отклонение, тем более высоко специализиро-
ван цветок.
Вегетативный побег характеризуется недетерминированным
ростом. Цветок, напротив, обнаруживает детерминированный
рост, поскольку апикальная меристема после образования всех
частей цветка теряет свою активность. У более высокоспециализи-
рованных цветков период роста короче; они имеют более короткую
ось и меньшее, хотя и более определенное число частей, чем ме-
нее специализированные цветки. К другим признакам возрастаю-
щей специализации относятся: мутовчатое, а не спиральное рас-
положение частей; мутовка, 'растущая как единое целое (сраста-
ние членов мутовки); две и более различные мутовки, растущие
как единое целое (приращение одной мутовки к другой); билате-
ральная симметрия (зигоморфия), а не радиальная симметрия
(актиноморфия); нижняя завязь (эпигиния) вместо верхней за-
вязи (гипогинии). Некоторые части у цветка могут отсутствовать.
Если отсутствует гинецей или андроцей, то цветок называют од-
нополым, или неполным. Эти два вида однополых цветков носят
названия соответственно тычиночных и пестичных.
Цветки объединены в соцветия или располагаются поодиночке,
занимая терминальное положение на оси. Соцветия представляют
собой системы ветвей, несущих цветки и более или менее модифи-
цированные цветочные органы, часто в форме прицветников. Име-
ется много различных типов соцветий, которые развиваются в оп-
ределенной онтогенетической последовательности [19].
378
Глава 20
Наличие или отсутствие одной или нескольких частей цветка,
размер, пигментация и взаимное расположение частей определяют
большое разнообразие типов цветков. Все большее признание
получает мнение, что эволюционная интерпретация типологии
цветков должна учитывать приспособительные аспекты их строе-
ния, в особенности те, которые касаются опыления, рассеивания
плодов и семян [10, 18], а также защиты репродуктивных струк-
тур от уничтожения их организмами-потребителями [63]. По
способам опыления растения можно разделить на две крупные
экологические группы: растения, опыляемые абиотическими аген-
тами (ветром, водой, дождем) и характеризующиеся невзрачны-
ми цветками, и растения, опыляемые биотическими агентами (на-
секомыми, птицами и другими животными) и имеющие яркие
цветки [38] с разнообразными нектарниками (гл. 13).
У растений, опыляемых животными, разнообразие типов цвет-
ка может быть связано с чувствительным восприятием различных
классов опылителей. Давление отбора, осуществляемое при по-
средстве потребителей-опылителей, объясняет также определен-
ную специализацию соцветий. Так, зрительное восприятие цветков
усиливается благодаря их объединению в плотные яркие группы.
При высоком уровне специализации соцветия по своей форме и
окраске напоминают крупные отдельные цветки; примерами таких
соцветий могут служить цветочные головки Asteraceae, циатии
Euphorbiaceae и зонтики Apiaceae. У некоторых плотных соцветий
(Poinsettia, Cornus florida) яркая часть является ничем иным, как
обверткой. Представление о направленной эволюции цветков,
происходящей в условиях давления отбора под воздействием опы-
лителей, по всей видимости, подтверждается данными, получен-
ными при исследовании ископаемых остатков растений [39]. Та-
кая эволюция идет обычно в направлении от простых актиноморф-
ных цветков на нижних уровнях к сложным зигоморфным цветкам
на высших.
Чашелистик и лепесток
По своему внутреннему строению чашелистики и лепестки на-
поминают листья. Они состоят из основной паренхимы, более или
менее разветвленной проводящей системы и эпидермы (фото 126).
В них могут присутствовать также кристаллоносные клетки, млеч-
ники и другие идиобласты. В молодых лепестках часто образуется
крахмал. Зеленые чашелистики содержат хлоропласты, однако
в них редко происходит дифференциация на палисадную и губча-
тую паренхиму. Окраска лепестков, которая играет важную роль
в том, чтобы сделать цветки привлекательными для биотических
опылителей, обусловлена пигментами хромопластов (каротинои-
дами) и клеточного сока (флавоноидами, главным образом анто-
Цветок: строение и развитие
379
цианами), а также различными модифицирующими факторами,
например кислотностью клеточного сока [48].
При исследовании флавоноидных пигментов у Impatiens bal-
samina были обнаружены резкие различия в пигментации между
лепестками, с одной стороны, и чашелистиками и вегетативными
частями — с другой [21]. Эти различия интерпретируются как ука-
зание на то, что в лепестках, в которых пигмент выполняет спе-
цифическую функцию в связи с привлечением насекомых-опыли-
телей, силы естественного отбора, действующие в процессе эволю-
ции видов, привели к развитию специализированной пигментации.
У Rudbeckia hirta в основаниях лепестков содержатся флавоноид-
ные глюкозиды, которые поглощают ультрафиолетовый свет, бла-
годаря чему основания лепестков становятся различимыми в ка-
честве «нектарных ориентиров» для соответствующих насекомых-
опылителей [59]. Для цветков представителей сем. Brassicaceae,
которые также опыляются насекомыми, характерно разное отра-
жение ультрафиолетового света. Так как по этому признаку мож-
но различать близкородственные таксоны, он может иметь диаг-
ностическое значение в таксономии [27]. Эпидермальные клетки
лепестков часто содержат летучие масла, которые придают цвет-
кам характерный аромат.
У некоторых растений антиклинальные стенки эпидермы ле-
пестков имеют волнистую форму или несут внутренние ребра.
Наружные стенки могут быть выпуклыми или сосочковидными
(фото 126, 4), в особенности на адаксиальной стороне. Эпидерма
как лепестков, так и чашелистиков может иметь устьица и три-
хомы. Устьица на лепестках или сходны с устьицами вегетатив-
ных листьев, или дифференцированы неполностью.
Тычинка
Тычинка наиболее распространенного у покрытосеменных типа
представляет собой подразделенный на пыльцевые мешки, или
микроспорангии, пыльник, сидящий на тонкой ножке с одной
жилкой — тычиночной нити (рис. 20.1). Каждый пыльцевой мешок
имеет состоящую из нескольких слоев стенку и гнездо, в котором
образуются микроспоры. Для большинства покрытосеменных ха-
рактерны тетраспорангиатные пыльники, т. е. пыльники с двумя
1нездами в каждой из двух лопастей (рис. 20.4 и фото 127), не-
которые покрытосеменные имеют биспорангиатные пыльники с
одним гнездом в каждой половинке пыльника (гл. 21). При созре-
вании до начала растрескивания пыльников перегородки между
гнездами пыльника могут разрушаться (рис. 20.1,5) таким обра-
зом, что тетраспорангиатный пыльник становится похожим на
двугнездный, а биспорангиатный — на одногнездный. Некоторые
ботаники [11] придают таким вторичным модификациям диагно-
380
Глава 20
Рис. 20 1. Тычинка Prinus (А) и ее части: поперечные срезы пыльника (Б), про-
водящего пучка тычиночной нити (В), и стенки пыльника (Г, Д) Е Клетки эн-
дотеция с вторичной оболочкой (вид с поверхности и на срезе) 1 — гнездо пыль-
ника; 2— тычиночная нить; 3— ситовидный элемент; 4 — ксилемный элемент;
5 — эпидерма, 6 — стомиум; 7 — эндотеций
стическое значение и ошибочно трактуют тетраспорангиатные и
биспорангиатные пыльники с разрушившимися перегородками
соответственно как двугнездные и одногнездные.
Среди более примитивных двудольных представители некото-
рых таксонов имеют листоподобные тычинки с тремя жилками,
несущие микроспорангии на адаксиальной поверхности между
средней и боковыми жилками. Предполагается, что тычинки с од-
ной жилкой образовались в результате эволюционной редукции
ширины листоподобных тычинок, сопровождавшейся уменьшением
числа жилок [19]. Согласно результатам широкого обследования
покрытосеменных [64], 95% представителей этого класса имеют
тычинки с одной жилкой.
Тычиночная нить довольно проста по своей структуре. Прово-
дящий пучок, который может быть амфикрибральным, окружен
паренхимой (рис. 20.1, Б, В). В кутинизированной эпидерме мо-
гут присутствовать трихомы; нить и пыльник могут иметь устьица.
Проводящий пучок пересекает всю нить и заканчивается или в
Цветок: строение и развитие
38 Ь
основании пыльника, или в ткани связника, расположенной между
двумя половинками пыльника.
Пыльники обычно растрескиваются, т. е. раскрываются спон-
танно. У многих видов растрескиванию предшествует уже упо-
минавшееся выше разрушение перегородок между гнездами одной
и той же половинки пыльника (рис. 20.1,5). Позднее наружная
ткань в этой зоне, которая иногда представлена одним эпидер-
мальным слоем (рис. 20.1, Д), также разрушается, и пыльца вы-
сыпается через отверстие (стомиум), имеющее часто форму щели.
Субэпидермальный (слой стенки пыльника — эндотеций, несущий
вторичные утолщения оболочки в форме лент (рис. 20.1, Г, E)t
вероятно, способствует образованию стомиума путем неравномер-
ного сжатия высыхающего пыльника. У некоторых видов стомиум
представляет собой отверстие, расположенное на вершине или
боковой стороне лопасти пыльника.
Гинецей
Морфология гинецея и соответствующая терминология вызыва-
ют больше споров, чем те же вопросы в отношении любой другой
части цветка [16]. Наиболее противоречивые мнения высказыва-
ются по поводу 1) природы плодолистика в том смысле, является
ли он филломом, осевой структурой или органом особого типа, не
связанным в цветке с другими органами (sui generis); 2) значения
так называемого конгенитального объединения (срастания) плодо-
листиков, которое, как предполагается, происходит, если гинецей
возникает во время онтогенеза как единое целое, и 3) установле-
ния границ плодолистика или плодолистиков в цветках с нижней
завязью.
плодолистик
Согласно классическому определению, плодолистик является ос-
новной единицей гинецея. Цветок может иметь один или несколько
плодолистиков. Если их два и более, то они могут быть свободны-
ми, т. е. не связанными друг с другом (апокарпный гинецей;
рис. 22.1, А, В) или объединенными в единое целое (синкарпный
гинецей; рис. 22.1,5). Гинецей из одного плодолистика также
классифицируется как апокарпный.
По отношению к гинецею используется также давно укоренив-
шийся термин пестик. Им обозначают единственный плодолистик
в апокарпном гинецее (простой пестик) или весь синкарпный ги-
нецей (сложный пестик). Некоторые ботаники [16] предлагают
устранить термин «пестик»; однако в том смысле, в котором он
был определен выше, он и сейчас остается полезным.
Глава 20
Рис 20 2. Схемы поперечных срезов завязей, состоящих из одного (А—В) и
двух (Г) плодолистиков. А. Кондупликатно сложенный плодолистик с ламинар-
ной плацентацией. Б. Кондупликатно сложенный плодолистик с редуцированны-
ми краями. В. Плодолистик, завернутый при сложении внутрь. Г. Тип завязи,
характерный для Brassicaceae, с перегородкой, возникшей из пристенных плацент
(средний пучок обычно называют дорсальным, а боковой — вентральным). 1 —
средние пучки; 2 — боковые пучки; 3— семязачаток; 4 — слившиеся боковые
пучки, 5 — средний пучок.
Плодолистик имеет вид листоподобной структуры, сложенной
по длине таким образом, что ее адаксиальная поверхность обраще-
на внутрь, а края более или менее полностью сомкнуты. Согласно
широко распространенной точке зрения, структура плодолистика
является кондупликатной, т. е. такой структурой, при формирова-
нии которой края плодолистика остаются не завернутыми внутрь
(рис. 20.2, А и 20.5, Д). Предполагают, что эволюционные измене-
ния в плодолистике этого типа привели к сокращению его краевых
зон (рис. 20.2,5). В ‘соответствии с более старым представлением
при складывании плодолистика происходит завертывание краев
внутрь, так что шов оказывается выстланным абаксиальной по-
верхностью (рис. 20.2, В). В зрелом состоянии кондупликатный
плодолистик с редуцированными краями трудно отличить от пло-
долистика с завернутыми внутрь краями. Возможно, что тот или
иной тип сложения плодолистиков характерен для определенных
таксонов [16].
Объединение плодолистиков в синкарпном гинецее осуществля-
ется двумя основными путями: свернувшиеся плодолистики сра-
стаются своими абаксиальными поверхностями (рис. 20.3,В), а
плодолистики, находящиеся в полностью или частично развернутом
•состоянии, — своими краями (рис. 20.3,Г). В первом случае обра-
Цветок: строение и развитие
383>
Рис. 20 3 Плацентация в завязях на поперечных (Д В, Г) и продольных (Б, Д)'
срезах. А, Б, Antirrhinum, осевая плацентация, два плодолистика. В. Fuchsia,
осевая плацентация, четыре плодолистика Г Ribes, париетальная плацентация,
два плодолистика. Д. Dodecatheon, свободная центральная плацентация, пять
плодолистиков. 1 — плацента; 2— стенка завязи; 3— гнездо завязи; 4 — один
плодолистик; 5 — семязачаток; 6 — фуникулус.
зуется двугнездный или многогнездный гинецей (рис. 20,3, А, В),
а во втором — одногнездный (рис. 20.3,Г). Эти два основных спо-
соба объединения плодолистиков могут видоизменяться в результа-
те вторичных модификаций. Пример такой модификации можно
найти у представителей сем. Brassicaceae, у которых гинецей, сфор-
мированный из двух сросшихся краями плодолистиков, оказывает-
ся не одногнездным, а разделенным перегородкой, образовавшейся
из выростов плацент у краев плодолистиков (рис. 20.2,Г).
Плодолистик апокарпного гинецея и весь синкарпный гинецей
обычно дифференцируются на нижнюю фертильную часть—за-
вязь и верхнюю стерильную часть — столбик (рис. 20.4, Л и фото
127, Б). Более или менее протяженная периферическая часть стол-
бика дифференцируется в рыльце, обычно расположенное в верх-
ней зоне столбика. Если вытянутая структура, которую можно на-
звать столбиком, отсутствует, то рыльце описывается как сидячее,
т. е. сидящее на завязи. У менее специализированных покрытосе-
менных плодолистики имеют вид складчатых, лишенных столбиков
структур с рыльцевой тканью, покрывающей их несомкнутые края
(фото 131, Б).
384
Глава 20
ЗАВЯЗЬ
В завязи различают стенку, гнездо (полость) или гнезда, а у
'многогнездной завязи и перегородки. На определенных участках
^стенки завязи, расположенных на ее внутренней (адаксиальной)
стороне, образуются семязачатки. Участок, несущий семязачатки,
составляет плаценту. Каждый плодолистик имеет две плаценты,
которые располагаются или близко к его краям, или на некотором
расстоянии от них. На этой основе различают маргинальную
(рис. 20,2, В) и ламинарную (рис. 20.2, А) плацентацию, причем
последняя считается более примитивной. Плацента может пред-
ставлять собой довольно крупный вырост, иногда почти заполняю-
щий просвет в полости завязи (рис. 20.3, А, Б).
Положение плацент в завязи связано со способом объединения
плодолистиков [50]. В плодолистиках, сросшихся друг с другом
краями, плаценты размещаются на стенке завязи, и поэтому такая
плацентация называется париетальной (пристенной; рис. 20.3,Г).
Если плодолистики срастаются в сложенном состоянии с образова-
нием дву- или многогнездной завязи, то плаценты располагаются
в центре завязи, там, где сходятся края плодолистиков
(рис. 20.3,А, В). Плацентация такого типа называется осевой.
У представителей разных таксонов встречаются различные моди-
фикации этих двух основных типов плацентации. Так, исчезновение
перегородок в многогнездной завязи, которое может происходить
как в филогенезе, так и в онтогенезе [16], приводит к возникнове-
нию свободной центральной плацентации (рис. 20.3, Д). В одно-
гнездной завязи плацента может находиться у самого ее основа-
ния, и плацентация в этом случае называется базальной.
Пониманию характера плацентации в значительной степени со-
действует исследование проводящей системы плодолистика. Чаще
ъсего плодолистик имеет три жилки — одну среднюю («спинную»)
и две боковые («брюшные»; рис 20.2, А—В и 20.5, Д, Е}\ прово-
дящая система семязачатков обычно происходит из боковых пуч-
ков (рис. 20.5, Е). При осевой плацентации боковые пучки выявля-
ются в центре завязи (рис. 20.4,Б), причем флоэма у них обраще-
на внутрь (адаксиально), а ксилема — наружу (абаксиально).
Боковые пучки двух смежных краев одного и того же (рис. 20.2, Б
и фото 127, А) или двух различных (рис. 20.2, Е и 20.4, Б) плодо-
листиков в зависимости от плацентации могут быть более или ме-
нее полностью слившимися.
Концепцию о происхождении плаценты из плодолистиков мож-
но легко принять для многих представителей покрытосеменных.
Однако у некоторых из них связь между плодолистиками и семя-
зачатками не ясна. Поэтому было высказано предположение [43],
что плаценты, по крайней мере в некоторых группах растений, мо-
гут иметь осевое происхождение. При этом считают, что такие
плаценты находятся на цветоложе, образующем дно завязи (на-
Рис. 20.4. Схемы цветков на продольных (Д, Д) и поперечных (В, Г) разрезах.
А, Б. Lycopersicon, культурная разновидность томата с многими плодолистика-
ми; цветок подпестичный, плацентация осевая. В, Г. Ribes, цветок надпестичный,
плацентация париетальная. Прерывистые линии указывают ход проводящих пуч-
ков и их взаимосвязи. 1 — рыльце; 2 — тычинка; 3— лепесток; 4 — чашелистик;
5 — столбик; 6 — цветочная трубка; 7 — завязь; 8 — семязачаток; 9 — фуникулус.
25 К. Эзау, кн. 2.
386
Глава 20
пример, у Роасеае [4]) или приподнимающемся в ее центре (неко-
торые представители с центральной плацентацией). Эта точка зре-
ния оспаривается теми исследователями [17], которые настаивают
на том, что все плаценты возникают из плодолистиков независимо
от того, какой вид они приобретают в зрелом состоянии.
Еще труднее определить границы плодолистиков и происхожде-
ние плацент н цветках с нижней завязью (рис. 20.4, В, Г). Предпо-
лагается, что завязь в таких цветках погружена в ткань, не при-
надлежащую плодолистикам, а происходящую или из цветоложа
[37], или из цветочной трубки, т. е. из слившихся оснований чаше-
листиков, лепестков и тычинок [15]. Некоторые авторы [30] счита-
ют, что природа этой ткани в различных группах покрытосеменных
неодинакова. Трудность состоит также и в том, что не известно,
действительно ли плодолистики выстилают ткань, имеющую другое
происхождение, или они находятся только в верхней части гине-
цея, которая образует верхушку завязи и несет столбики [37].
Если принять последнее предположение, то из него следует, что
плаценты по своему происхождению не связаны с плодолистиками.
Природа чаши, которая в околопестичных цветках окружает ги-
нецей, но не срастается с ним (фото 127), также может интерпре-
тироваться по-разному.
В то время, когда цветок полностью раскрывается (период
цветения), завязь гистологически бывает еще не достаточно диф-
ференцированной и ее покров состоит в основном из паренхимы,
пронизанной проводящими пучками. Однако у некоторых таксонов
в гинецее могут развиваться склерифицированные слои и в качестве
защитных приспособлений накапливаются кристаллы и таннины
[63]. Наружная эпидерма кутикуляризуется и может иметь устьи-
ца. Основная гистологическая дифференциация завязи происходит
в то время, когда она превращается в плод.
СТОЛБИК И РЫЛЬЦЕ
Столбик является продолжением верхней части плодолистика
(рис. 20.5, Е). В синкарпных гинецеях с одним столбиком он воз-
никает из всех плодолистиков, образующих гинецей (рис. 20.4, Л,
В). Если плодолистики срастаются неполностью, то столбик может
образовать единую сложную структуру в основании и множествен-
ную— на вершине или число частей столбика (ветвей столбика,
или стилодиев) может быть равно числу плодолистиков в син-
карпной завязи. Столбики и стилодии могут быть сплошными или
с каналом в центре. У большинства покрытосеменных столбики
сплошные. Зрелое рыльце создает среду, благоприятную для про-
растания пыльцевых зерен. Когда рыльце достигает зрелого состоя-
ния, его называют воспринимающим. В одних случаях восприни-
мающие рыльца могут быть покрыты секретированным веществом
25*
1
Рис. 20.5. Части цветка Aquilegia. Общий вид чашелистика (Л), лепестка (Б)9
тычинки (В) и плодолистика (Г, Е). Д. Поперечный срез плодолистика. (Пере-
рисовано из работы [58].) 1 — пыльник; 2 — тычиночная нить; 3 — проводящий
пучок; 4 — средний пучок; 5 — семязачаток; 6 — боковые пучки; 7 — столбик.
388
Глава 20
(«влажные рыльца»), а в других — такое вещество может отсут-
ствовать («сухие рыльца») [29]. Влажный тип рыльца по существу
является железистой тканью. Эпидермальные клетки рыльца обыч-
но вытянуты в виде папилл (фото 128), коротких или длинных
ветвистых волосков (рис. 20.8). Ткань рыльца связана с семяза-
чатком в полости завязи с помощью проводниковой ткани, которая
служит средой, облегчающей продвижение растущей пыльцевой
трубки через столбик, и источником питательных веществ [36].
В столбиках, имеющих каналы, эти каналы выстланы проводнико-
вой тканью. .в сплошных столбиках проводниковая ткань образует
один или несколько тяжей, погруженных в основную ткань или
связанных с проводящими пучками.
По своему строению и выполняемой им функции железистое
рыльце напоминает нектарник. В его эпидерме и cj бэпидермаль-
ных слоях вырабатывается секрет, который образует пленку на
стенках эпидермы. Этот секрет, исследованный у многих покрыто-
семенных [40], если и содержит, то лишь незначительное количест-
во свободного сахара и состоит в основном из липидных и феноль-
ных соединений (антоцианов, флавоноидов, коричных кислот). Ли-
пиды, вероятно, соответствуют восковому компоненту эпидермаль-
ной стенки и служат для предотвращения потери воды. Фенолы
встречаются в виде гликозидов и эфиров, и их гидролиз приводит
к образованию сахаров, необходимых для прорастания пыльцы.
Фенолы могут выполнять также и другие функции, такие, как за-
щита от насекомых, подавление инфекционных болезней и стиму-
ляция или ингибирование прорастания пыльцы, что, вероятно,
связано с явлениями совместимости и несовместимости при
опылении. Исследование опыления у Brassica с помощью скани-
рующего электронного микроскопа (фото 128) показывает, что
барьер несовместимости не является чисто физическим, а создает-
ся каким-то веществом, обусловливающим несовместимость [47].
При обследовании около 80 семейств покрытосеменных было пока-
зано, что наружная поверхность папилл покрыта белковой плен-
кой. Авторы полагают, что такая гидрофильная белковая пленка
может служить для улавливания и гидратации пыльцевых зерен,
а также (может быть тем местом, где происходит распознавание
«чужого», связанное с явлением несовместимости.
Есть данные о том, что в цветках Raphanus, для которых харак-
терны железистые рыльца с папиллами, пыльцевая трубка прони-
кает через кутикулу папилл еще до того, как она начинает удли-
няться [14]. В нежелезистом рыльце хлопчатника пыльцевая труб-
ка растет по поверхности рыльцевого волоска [29]. У обоих типов
цветков пыльцевая трубка в конечном счете достигает проводнико-
вой ткани столбика. У хлопчатника, который имеет сплошной стол-
бик, эта ткань состоит из толстостенных клеток, расположенных
вертикальными рядами. Их слоистая оболочка богата пектиновы-
ми веществами, и растущая пыльцевая трубка проходит по одному
Цветок: строение и развитие
389
из этих слоев. У некоторых других видов, имеющих сплошные
столбики, проводниковая ткань состоит из клеток, окруженных
межклетным слизистым веществом пектиновой природы. Во время
онтогенеза столбика это вещество появляется в межклетниках в
результате нарушения первоначального контакта между клетками
[16, 52] и через него проходит растущая пыльцевая трубка.
В столбиках с каналами проводниковой является железистая
ткань, выстилающая канал. Пыльцевая трубка растет по поверх-
ности или в более глубоких слоях этой ткани, но, по-видимому, не
проникает в клетки. В пестиках лилии стенки проводниковой тка-
ни, обращенные в полость канала, имеют внутренние выросты та-
кого же типа, который описан для передаточных клеток [51]. Пе-
стик лилии использовался для изучения возможной регуляции
направления роста пыльцевой трубки с помощью веществ, обра-
зуемых гинецеем [51]. Результаты этой работы показали, что про-
водниковая ткань привлекает растущие на агаре пыльцевые трубки
и что в пестике хемотропная активность проводниковой ткани и ее
эксудата проявляется при цветении вначале в дистальной части
пестика, а затем распространяется по направлению к его основа-
нию, опережая растущую пыльцевую трубку.
Проводящая система
Проводящая система цветка интенсивно изучалась с целью
выяснения таксономических и филогенетических взаимоотношений
среди покрытосеменных, а также для получения сведений о морфо-
логической природе цветка и его частей [15, 16, 46, 49, 65]. Исполь-
зование особенностей проводящей системы для интерпретации
морфологии цветка считается оправданным, так как в процессе
эволюционной специализации проводящая система изменяется,
по-видимому, медленнее (является более консервативной), чем ор-
ган, который она обслуживает, и, следовательно, при ее изучении
можно обнаружить прежние границы, число и категории органов
в тех цветках, в которых индивидуальность и взаимоотношения их
отдельных частей маскируются вследствие редукции, скучивания и
различного объединения этих частей [46]. В то же время ценность
проводящей структуры как доказательства филогенетических свя-
зей зависит от ее таксономической принадлежности, и поэтому
данные об организации проводящей системы необходимо сопостав-
лять с данными о других признаках цветка.
Проводящая система относительно неспециализированных цвет-
ков сравнима с проводящей системой вегетативного побега. Прово-
дящую систему оси цветка можно описать как цилиндрический
комплекс симподиальных пучков, от которых отходят следы к от-
дельным частям цветка. На разных уровнях определенные пучки
отклоняются от центрального цилиндра и становятся частью обо-
390
Глава 20
собляющейся на данном уровне проводящей системы тех или иных
частей цветка. Вследствие того что междоузлия в цветках обычно
укорочены, а во взаимоотношениях частей цветка наблюдаются
различные видоизменения, проводящие пучки часто разветвляются
и объединяются друг с другом в значительно менее правильном
порядке, чем в вегетативном побеге [45, 56].
Число следов различных частей цветка варьирует в одном и том
же цветке. Ниже приводится типичное расположение пучков
[рис. 20.4 (прерывистые линии) и рис. 20.5]. В каждом чашелисти-
ке обнаруживается столько же пучков, сколько и в вегетативном
листе того же растения. Каждый лепесток двудольного растения
имеет один след, а каждый член околоцветника (листочек простого
околоцветника) однодольного растения — разное число следов, на-
чиная от одного. В чашелистике и лепестке проводящие пучки
образуют более или менее сложные системы, напоминающие та-
ковые в вегетативных листьях (рис. 20.5,А, Б). Для специализи-
рованного типа тычинки характерен один след, переходящий в виде
Рис. 20.6. Схема продольного разреза цветка Opuntia dilletiii. Цветок надпестич
ный, завязь погружена в осевую (рецептакулярную) ткань (цветоложе). Обращен-
ие пучки имеют флоэму (обозначена точками) на адаксиальной стороне. В верх-
ней части цветка находятся амфикрибральные пучки. (Перерисовано из работы
[60].) 1 — рыльце; 2 — тычинка; 3— обращенный пучок; 4 — осевая ткань; 5 —
семязачаток.
Цветок: строение и развитие
391
одного непрерывного пучка в тычиночную нить и пыльник
(рис. 20.5, В). Плодолистик имеет три следа (рис. 20.2, А —В),
которые могут давать ответвления, ограниченные пределами пло-
долистика (рис. 20.5, Г—Е). Семязачатки снабжаются ответвле-
ниями, отходящими обычно от двух боковых пучков плодолистиков
(рис. 20.5,Г). Проводящие пучки плодолистиков проходят, не пре-
рываясь, через весь столбик (рис. 20.4, Д, В). Как уже говорилось
в отношении плодолистиков, проводящие пучки частей цветка мо-
гут сливаться, если эти части объединяются.
У некоторых надпестичных цветков часть пучков имеет обра-
щенную ориентацию ксилемы и флоэмы (рис. 20.6). Такое рас-
положение рассматривается как указание на то, что завязь погру-
жена в рецептакулярную (осевую) ткань, тогда как отсутствие об-
ращенных пучков считается свидетельством аппендикулярной при-
роды ткани, находящейся вне плодолистиков (цветочной трубки).
Можно себе представить, что различие между этими двумя ти-
пами надпестичных цветков возникло в результате противополож-
ных морфогенетических процессов, происходивших в ходе их раз-
вития [30]. В цветке, в котором предполагается наличие цветочной
трубки, окружающей полость завязи, меристематически активный
флоральный апекс становится все более вогнутым, так как его
периферическая зона поднимается по мере возникновения после-
довательных органов цветка. Вогнутость усугубляется вследствие
направленного вверх зонального роста объединенных оснований
членов околоцветника. Из-за того что ткань, расположенная вокруг
апикальной меристемы, равномерно растет вверх, проводящие пуч-
ки следуют прямым путем в акропетальном направлении через
ткань, окружающую полость завязи и образующую над нею труб-
ку; при этом от проводящих пучков на определенных уровнях от-
ходят следы к отдельным органам (рис. 20.4, В, Г).
В цветке, завязь которого предположительно погружена в осе-
вую ткань [60], флоральные органы возникают, как обычно, по
периферии апикального купола. Одновременно ось разрастается
радиально, а затем приобретает форму чаши в результате того,
что по краям она растет вверх. Развивающаяся проводящая ткань
изгибается в соответствии с формой чаши, и поэтому части пучков,
расположенные ниже оснований тычинок и членов околоцветника,
проходят извилистый путь (рис. 20.6). Эта часть проводящей си-
стемы составляет обращенные пучки, флоэма в них появляется на
стороне, противоположной той, которую она занимает в вертикаль-
ных пучках.
Развитие
Когда растение достигает репродуктивной стадии развития, не-
которые или все апикальные меристемы на его побегах перестают
закладывать вегетативные листья и начинают формировать части
392
Глава 20
цветков в той последовательности, которая характерна для данного
вида растения, а между листьями и цветком появляется варьирую-
щее число прицветников. В этом процессе апикальные меристемы
переходят от недетерминированного роста к детерминированному,
поскольку образование цветка обычно является заключительным
событием в деятельности данной апикальной меристемы. У одно-
летних растений вступление в репродуктивную стадию означает
также, что приближается завершение всего жизненного цикла.
У многолетников цветение повторяется различное число раз в за-
висимости от продолжительности жизни растения.
Цветок может возникать либо у апекса главного побега, либо
у апексов боковых веток, либо и в том, и в другом месте. У многих
видов переход к цветению сопровождается формированием соцве-
тия, гистологически трудно отличимым от образования цветка, по-
скольку в соцветии оба эти процесса сливаются в непрерывную
цепь последовательно изменяющихся морфологических и физиоло-
гических состояний.
Часто наблюдаемое явление при переходе к репродуктивной
стадии — резкое и быстрое удлинение оси. Такой рост особенно по-
разителен у растений, для которых характерно образование розе-
ток на вегетативной стадии их развития. К ним относятся, напри-
мер, злаки и луковичные растения [4, 42]. Удлиненная ось образует
или один цветок, или целое соцветие. Если цветки образуются на
разветвленных соцветиях, то на приближение цветения указывает
ускоренное образование пазушных почек (фото 132, Д).
Индукция цветения
Закладка цветков контролируется внешними факторами, но
лишь в тех пределах, в которых растение способно реагировать на
данные воздействия [26]. Многие растения проявляют характерную
реакцию на длину дня (фотопериод) и на температуру, вступая в
репродуктивную фазу только при определенном сочетании этих
двух факторов. В зависимости от реакции на длину дня различают
длиннодневные, короткодневные и нейтральные растения. Способ-
ность растений к фотопериодическому измерению времени обуслов-
лена, очевидно, эндогенным циркадным ритмом. Кроме того, рас-
тение должно достигнуть определенной степени развития, прежде
чем наступит стадия готовности к цветению и оно сможет реагиро-
вать на требуемый фотопериод. Многие растения нуждаются в воз-
действии низких температур перед тем, как они начинают форми-
ровать цветки. В практике яровизации прорастающие семена таких
растений подвергаются холодовой обработке для того, чтобы уско-
рить последующее цветение.
В растении, готовом к цветению, под влиянием соответствую-
щего фотопериода, которое осуществляется через посредство фито-
Цветок: строение и развитие
393
хрома, происходит синтез способного к передвижению фактора,
называемого стимулом цветения. Согласно некоторым исследова-
ниям, этот стимул образуется в листьях, в том числе в семядолях,
и транспортируется к апикальным меристемам, где он вызывает
изменения, приводящие к последующему образованию цветков.
На стадии перехода к цветению в качестве самого раннего изме-
нения, наблюдаемого в апикальных меристемах нескольких видов
растений, было обнаружено усиление синтеза РНК [7, 54] и свя-
занное с ним увеличение количества общего белка и образование
новых рибосом [28]. Еще одним ранним изменением, которое про-
исходит вслед за поступлением стимула цветения в меристему, яв-
ляется повышение митотического индекса [32].
Количественные ультраструктурные исследования [23, 24] выя-
вили в переходных меристемах ряд цитологических изменений,
К самому раннему изменению из тех, которые можно обнаружить,
относится замещение унаследованных от вегетативных апексов
крупных вакуолей многочисленными мелкими вакуолями. Парал-
лельно с усилением активности сукцинатдегидрогеназы увеличива-
ется число митохондрий, что отражает повышение дыхательной
активности клеток. В более позднем периоде происходит увеличе-
ние размера ядрышек, сопровождающееся их заметной вакуолиза-
цией. Особый интерес представляет увеличение степени дисперсно-
сти хроматина в увеличенных ядрах. Вследствие этого отношение
диффузного хроматина к конденсированному в переходной мери-
стеме оказывается выше, чем в вегетативной. Исследования расти-
тельных и животных клеток показали [24], что диффузный хрома-
тин значительно более активен в осуществлении транскрипции ге-
нетической информации с ДНК, чем конденсированный хроматин.
После переходной стадии происходит активация синтеза ДНК
и наблюдается дальнейшее повышение митотической активности.
Оба процесса участвуют в образовании клеток, которые дают на-
чало примордиям цветков. Так растение вступает в фазу морфоге-
неза цветков. Если в переходной стадии онтогенетическая реверсия
репродуктивных меристем в вегетативное состояние еще может
произойти, то с наступлением морфогенетической стадии образо-
вание цветков становится почти неизбежным [7].
Флоральная меристема
Когда апикальная меристема вступает в репродуктивную ста-
дию, она претерпевает более или менее значительные морфологи-
ческие изменения (фото 129). Эти изменения связаны, по крайней
мере частично, с видоизмененным способом образования боковых
придатков после прекращения недетерминированного роста на ве-
гетативной стадии. Во время последней апикальная меристема ра-
стет вверх и перед началом нового листового пластохрона расши-
394
Глава 20
ряется. Напротив, во время развития цветка площадь апикальной
меристемы постепенно уменьшается по мере возникновения после-
довательных частей цветка (фото 129, Б, В). У одних цветков
некоторое количество апикальной меристемы сохраняется и после
закладки плодолистиков (фото 131,Ж), но при этом она утрачи-
вает свою активность; у других цветков плодолистики или семя-
зачатки, очевидно, образуются из терминальной части апикальной
меристемы (фото 129, £). В зависимости от типа цветка в одних
случаях его органы (или по крайней мере некоторые из них) раз-
виваются акропетально в спиральной последовательности [62], а в
других — органы данного типа возникают приблизительно на од-
ном уровне в виде одной мутовки или двух близко расположенных
друг к другу последовательных мутовок (фото 131). Мутовчатое
расположение считается более специализированным.
Небольшая глубина и довольно значительное разрастание в ши-
рину— обычные гистологические особенности флоральной мери-
стемы. Широкий апекс занят мантией из меристематических кле-
ток, покрывающей вакуолизированную центральную часть основ-
ной ткани, которая уже перестала расти вверх. Эти особенности
можно встретить в меристемах как отдельных цветков (фото
129,5), так и соцветий (фото 130). Организация апекса по типу
туника — корпус не всегда выявляется во флоральной меристеме.
Если она есть, то число слоев туники может быть таким же, как
и в вегетативном апексе данного вида растения, но бывает и мень-
шим, и большим [20].
Закладка органов цветка сопровождается как усилением мито-
тической активности, так и изменением ее распределения. Появ-
ляется однородная меристематическая зона мантии, возникающая
в результате стирания различий между менее активной дистальной
и более активной периферической зонами вегетативных апексов.
Митотическая активность и концентрация ДНК распределяются
более равномерно, чем во время формирования листьев [20].
Происхождение и развитие частей цветка
ГИСТОГЕНЕЗ
Органы цветка, подобно вегетативным листьям, закладываются
путем периклинальных делений клеток, расположенных более или
менее глубоко под протодермой [58, 61] или также и в самой про-
тодерме (часто у однодольных [4, 33]). Эти деления могут проис-
ходить на той же глубине, что и при закладке листьев у данного
вида, но глубина может и измениться, более того, она может
варьировать для различных частей одного и того же цветка.
Расположение инициальных делений часто используется для
выводов о гомологии органов цветка. Неглубокие деления рас-
Цветок: строение и развитие
395
сматриваются как свидетельство того, что орган подобен листу;
деления при более глубокой закладке, иногда наблюдаемые при
возникновении тычинок [12], предположительно указывают на их
осевую природу. Ценность этих данных подвергается сомнению в
работах, посвященных исследованию цитохимер (гл. 16 и 18), ко-
торые позволяют устанавливать происхождение ткани из опреде-
ленных слоев апикальной меристемы [13]. В таких исследованиях
обнаружена высокая степень вариабельности числа клеток в дан-
ном органе, образовавшемся из первых трех слоев апекса.
За инициальными периклинальными делениями следуют другие
деления, в том числе антиклинальные, в результате которых при-
мордий превращается в бугорок (фото 129,5). Как и в случае
примордия листа, рост бугорка в ширину и длину вскоре приводит
к появлению у него дорсовентральной формы. Исключение со-
ставляет тычиночная нить, которая остается узкой. Поскольку ор-
ганы цветка часто бывают довольно мелкими и возникают друг
за другом с небольшими интервалами, бугорки при их закладке
могут остаться невыявленными.
По своей закладке и развитию чашелистики очень сильно на-
поминают вегетативные листья. По характеру роста лепестки так-
же более или менее сходны с листьями. Тычинки возникают в виде
утолщенных коротких структур {фото 129, В, Г), а тычиночная
нить развивается позднее путем интеркалярного роста. Было пока-
зано, что удлинение нити у Cleome hassleriana находится под
контролем пыльника, который служит источником ауксина (индо-
лилуксусной кислоты), индуцирующего удлинение [34, 35]. Если
части околоцветника и тычинки срастаются или прирастают друг
к другу, то объединение может осуществляться либо конгениталь-
ным, либо онтогенетическим, либо и тем и другим способами. Если
происходит конгенитальное срастание, то продукт предполагаемо-
го объединения развивается как единая структура путем зонально-
го интеркалярного роста [30]. При прослеживании последователь-
ных поколений клеток в конгенитально сросшейся цветочной труб-
ке у цитохимерного персика (Prunus\ другой его вид показан на
фото 127) было найдено, что в соответствии с концепцией конге-
нитального объединения в трубке отсутствовали какие-либо следы
разграничения, свидетельствующие о наличии в ней составных ча-
стей, но имелись непрерывные концентрические слои производных
трех наружных слоев апикальной меристемы [13]. Вывод о том,
что трубка состоит из нескольких частей, можно сделать на основе
наблюдения над Downingia, у которой примордии чашелистиков
возникают обособленно и трубка образуется путем роста их обще-
го основания [30].
Развитие гинецея варьирует в деталях в отношении объедине-
ния плодолистиков друг с другом и с другими частями цветка.
Если плодолистики не объединены, то их отдельные примордии
396
Глава 20
закладываются в одной точке путем периклинальных делений в
апексе. Эта точка становится средней частью плодолистика, и от
нее деления распространяются в адаксиальном направлении, при-
водя к образованию подковообразной или округлой каймы
(рис. 20.7, Л—В и фото 131, Ж, 3). Благодаря направленному
вверх росту, сходному с краевым ростом листа, плодолистик при-
поднимается, принимая форму мешковидной структуры. У некото-
рых видов растений интеркалярное удлинение, наблюдающееся в
основании плодолистика, дает начало конгенитально слившейся
базальной части (рис. 20.7, Г, Д).
ТА гпикяпппкту члпсгчсгу гт пп и п п тлг ттл утл ВЮЗНИКЭЮТ В ВИЛО ОТЛРПЬ-
Л. л. л. л. Л. Ь. V4. Л. Л. Л. Л. Л-ЛЛ. X V-L 0/1 Al 1AVA ч/^Х-Ц ЧХ VI 11 \и* A XlAkXX U Olllllk VA A W A W и X А W К_/ X /Л. W A U
ных примордиев или слитно как единая структура, в которой труд-
но провести разграничение отдельных плодолистиков. У разных
видов в развивающемся гинецее наблюдается различная степень
конгенитального и онтогенетического слияний [22, 44]. Онтогенети-
ческое слияние может быть настолько прочным, что в зрелом со-
стоянии шов не распознается. При таком объединении происходит
увеличение размеров и взаимопроникновение эпидермальных кле-
ток, которые при этом иногда делятся [22]. Онтогенетическое сра-
Рис. 20.7. Стадии развития плодолистика Dritnys (вид сбоку). (Перерисовано
из работы [61].) 1 — абаксиальная сторона; 2 — рыльце; 3 — завязь; 4 — семя-
зачаток; 5 — боковые пучки; 6 — средний пучок; 7 — объединенная базальная
часть.
Цветок: строение и развитие
397
стание краев плодолистиков у цитохимерного персика, о котором
уже упоминалось, выявлялось по расположению производных двух
наружных апикальных слоев в виде тяжей, ориентированных ра-
диально по отношению к шву [13]. В зависимости от степени объ-
единения плодолистиков столбик синкарпного пестика вырастает
из завязи либо как единая структура, либо в виде свободных или
частично объединенных стилодиев, развивающихся из отдельных
плодолистиков.
ОРГАНОГЕНЕЗ
В противоположность вегетативным листьям, морфогенез кото-
рых характеризуется многократным образованием сходных струк-
тур, в развивающемся цветке картина морфогенеза изменяется в
процессе последовательного возникновения разных частей цветка.
Уже на ранних этапах онтогенеза можно заметить, что части цвет-
ка разных типов неодинаковы по своей форме. Эту особенность
развития цветка можно проиллюстрировать на примере цветка
однодольного Butomus umbellatus с помощью фотографий, сделан-
ных при малом увеличении, на которых показаны частично отпре-
парированные цветки, находящиеся на разных стадиях их разви-
тия (фото 131) [55]. Шесть листочков простого околоцветника
(3 наружных и 3 внутренних) возникают как боковые выступы,
которые вскоре приобретают дорсовентральную форму (В — Е);
девять тычинок, из которых шесть располагаются попарно и супро-
тивно наружным листочкам околоцветника, а три — одиночно и
супротивно внутренним листочкам, появляются в виде бугорков,
представляющих собой пыльники. Двухлопастной характер буду-
щих пыльников слегка проявляется на фото 131, Е. Шесть плодо-
листиков возникают в виде двух мутовок (Е), одна из которых
расположена супротивно наружным листочкам околоцветника,
а другая — внутренним. Закладываясь в виде округлых бугорков
со стороны апекса, плодолистики затем становятся подковообраз-
ными (Ж), а позднее в результате краевого роста — листовидны-
ми. Благодаря росту вверх они приобретают форму кондупликатно
сложенных листьев (3). Их адаксиальные края не сливаются, а на
дистальной краевой поверхности развивается сидячее рыльце (Б).
Над плодолистиками сохраняется некоторое количество остаточной
апикальной меристемы.
Последовательные изменения характера формирования органов
были хорошо показаны в работах, посвященных развитию соцве-
тий и цветков злаков [3, 4, 8, 9, 33]. Зрелые структуры колоска и
цветка злаков изображены на рис. 20.8 и фото 133, Е, Ж. В про-
цессе своего развития быстро удлиняющееся соцветие типа колоса
сначала образует ряд полукруглых валиков — примордиев листьев
(фото 132, Л). На более поздней стадии появляются двойные ва-
398
/ лава 20
Рис 20 8. Цветок злака. А. Частично отпрепарированный цветок в период цве-
тения Продольная (Б) и поперечная (В) диаграммы цветка. Г. Колосок. Лоди-
кулы представляют собой мелкие пленки, находящиеся снаружи от тычинок.
(Esau, Plant Anatomy, 2nd ed., John Wiley & Sons, Inc., 1965; первоначально
было перерисовано из работы Johnson, Taxonomy of the Flowering Plants, Appleton-
Century-Crofts, Inc., 1931.) 1 — завязь; 2 — пыльник; 3 — нижняя цветковая чешуя;
4 — верхняя цветковая чешуя; 5 — лодикула; 6 — рыльце; 7 — ось колоска; 8 —
тычиночная нить; 9— пустые колосковые чешуи.
лики (фото 132,5). Двойными они получаются в результате за-
кладки примордиев колосков в пазухах листовых примордиев,
рост которых по направлению к апексу колоска все более ослабе-
вает, и развивающиеся колоски перерастают их. В соцветии типа
метелки ветви первого или более высоких порядков возникают в
пазухах прицветников (фото 132, Д), а колоски образуются на
этих ветвях.
Чешуи, цветки и органы цветков в колосках развиваются в
акропетальной последовательности (фото 132, В, Г и 133, Л). Ги-
нецей у Роасеае и Сурегасеае часто интерпретируется как син-
карпный, состоящий из двух или трех плодолистиков. Однако он
появляется в апексе как одна кольцевидная структура, окружаю-
щая единственный семязачаток (фото 133,Л) [4]. У злаков над
завязью образуются два столбика (фото 133, Б—Е) и развивают-
ся рыльцевые волоски (фото 133, Д).
Цветок: строение и развитие
399
Морфологические и функциональные различия, свойственные
разным частям цветка, наводят на мысль, что дифференциация
цветка характеризуется не одним, а целым рядом последовательно
сменяющих друг друга физиологических состояний. Это представ-
ление находит подтверждение в опытах, в которых для установле-
ния времени наступления необратимых процессов во время орга-
ногенеза использовалась регенерация органов в хирургически рас-
сеченных на две половины апексах [25]. Было обнаружено, что
срединная дистальная ткань меристемы постепенно теряет способ-
ность к регенерации органа определенного типа, но что разные
растения обнаруживают заметные различия во времени, при кото-
ром флоральная меристема переходит к образованию того или ино-
го органа. В качестве возможного механизма, регулирующего этот
процесс, обсуждается последовательная активация генов, в ре-
зультате которой происходят изменения в наборе ферментативных
белков.
СПИСОК ЛИТЕРАТУРЫ
1. Andrews Н. N. Early seed plants, Science, 142, 925—931 (1963).
2. Arber A. The natural philosophy of plant form, Cambridge University Press,
1950.
3. Barnard C. Histogenesis of the inflorescence and flower of Triticum aestivum
L„ Aust. J. Bot., 3, 1—20 (1955).
4. Barnard C. Floral histogenesis in the monocotyledons. I. The Gramineae, Aust.
J. Bot., 5, 1—20 (1957). II. The Cyperaceae, Aust J. Bot., 5, 115—128 (1957).
5. Barnard C. The interpretation of the angiosperm flower, Aust. J. Sci., 24,
64—72 (1961).
6. Beck С. B. On the anatomy and morphology of lateral branch systems of
Archaeopteris, Amer. J. Bot., 58, 758—784 (1971).
7. Bernier G. Structural and metabolic changes in the shoot apex in transition
to flowering, Can. J. Bot., 49, 803—819 (1971).
8. Bonnett О. T. The development of the wheat spike, J. Agr. Res., 53, 445—
451 (1936).
9. Bonnett О. T. The development of the oat panicle, J. Agr. Res., 54, 927—
931 (1937).
10. Carlquist S. Toward acceptable evolutionary interpretations of floral anatomy,
Phytomorphology, 19, 332—362 (1969).
11. Davis G. L. Systematic embryology of the angiosperms, New York, John Wiley
& Sons, 1966.
12. Dengler N. G. Ontogeny of the vegetative and floral apex of Calycanthus
occidentalism Can. J. Bot., 50, 1349—1356 (1972).
13. Dermen H., Stewart R. N. Ontogenetic study of floral organs of peach (Pru-
nus persica) utilizing cytochimeral plants, Amer. J. Bot., 60, 283—291 (1973).
14. Dickinson H. G., Lewis D. Cytochemical and ultrastructural differences bet-
ween intraspecific compatible and incompatible pollinations in Raphanus, Proc.
Roy. Soc. London, B183, 21—38 (1973).
15. Douglas G. E. The inferior ovary, Bot. Rev., 10, 125—186 (1944). II. Bot. Rev.,
23, 1—46 (1957).
16. Eames A. J. Morphology of the angiosperms, New York, McGraw-Hill, 1961.
17. Eckardt T. Vergleichende Studie fiber die morphologischen Beziehungen zwi-
schen Fruchtblatt, Samenanlage und Blfitenachse bei einigen Angiospermen,
Neue Hefte zur Morphologic No. 3, 1—91 (1957).
400
Г лава 20
18. Faegri К., van der Pijl L. The principles of pollination ecology, 2nd ed., Ox-
ford, Pergamon Press, 1971.
19. Foster A. S., Gifford E. M., Jr. Comparative morphology of vascular plants,
2nd ed., San Francisco, Freeman and Company, 1974.
20. Gifford E. M., Jr., Corson G. E., Jr. The shoot apex in seed plants, Bot. Rev.,
37, 143—229 (1971).
21. JJagen C. W., Jr. The differentiation of pigmentation in flower parts. I. The
flavonoid pigments of Impatiens balsamina, genotype llHHPrPr, and their
distribution within the plant, Amer. J. Bot., 53, 46—54 (1966). II. Changes in
pigments during development of buds in Impatiens balsamina genotype
HHHPrPr, Amer. J. Bot., 53, 54—60 (1966).
22. Hartl D. Morphologische Studien am Pistill der Scrophulariaceen, Osterr. Bot.
Z., 103, 185—242 (1956).
23. Havelange A., Bernier G. Descriptive and quantitative study of ultrastructural
changes in the apical meristem of mustard in transition to flowering. I. The
cell and nucleus, J. Cell Sci., 15, 633—644 (1974).
24. Havelange A., Bernier G., Jacqmard A. Descriptive and quantitative study of
ultrastructural changes in the apical meristem of mustard in transition to flo-
wering. II. The cytoplasm, mitochondria and proplastids, J. Cell Sci., 16,
421-432 (1974).
25. Hicks G. S., Sussex J, M. Organ regeneration in sterile culture after median
bisection of the flower primordia of Nicotiana tabacum, Bot. Gaz., 132, 350—
363 (1971).
26. Hillman W. S. The physiology of flowering, New York, Holt, Rinehart and
Winston, 1962.
27. Horovitz A., Cohen Y. Ultraviolet reflectance characteristics in flowers of cru-
cifers, Amer. J. Bot., 59, 706—713 (1972).
28. Jacqmard A., Miksche J. P., Bernier G. Quantitative study of nucleic acids and
proteins in the shoot apex of Sinapis alba during transition from the vegeta-
tive to the reproductive condition, Amer. J. Bot., 59, 714—721 (1972).
29. Jensen W. A., Fisher D. B. Cotton embryogenesis: the tissues of the stigma
and style and their relation to the pollen tube, Planta, 84, 97—121 (1969).
30. Kaplan D. R. Floral morphology, organogenesis and interpretation of the in-
ferior ovary in Downingia bacigalupii, Amer. J. Bot., 54, 1274—1290 (1967).
31. Haussmann B. Pflanzenanatomie, Jena, Gustav Fischer, 1963.
32. King R. W. Timing in Chenopodium rubrum of export of the floral stimulus
from the cotyledons and its action on the apex, Can. J. Bot., 50, 697—702
(1972).
33. Klaus H. Ontogenetische und histogenetische Untersuchungen an der Gerste
(Hordeum distichon L.), Bot. Jb., 85, 45—79 (1966).
34. Koevenig J. L. Floral development and stamen filament elongation in Cleome
hassleriana, Amer. J. Bot., 60, 122—235 (1973).
35. Koevenig J. L., Sillix D. Movement of IAA in sections from spider flower
(Cleome hassleriana) stamen filaments, Amer. J. Bot., 60, 231—235 (1973).
36. Kroh M., Miki-Hirosige H., Rosen W., Loewus F. Incorporation of label into
pollen tube walls from myoinositol-labeled Lilium longiflorum pistils, Plant
Physiol., 45, 92—94 (1970).
37. Leins P. Das Karpell im ober- und unterstandigen Gynoeceum, Ber. Deut. Bot
Ges., 85, 291—294 (1972).
38. Leppik E. E. Morphogenic classification of flower types, Phytomorphology, 18»
451—466 (1968).
39. Leppik E. E. Paleontological evidence on the morphogenic development of
flower types, Phytomorphology, 21, 164—174 (1971).
40. Martin F. W., Brewbaker J. L. The nature of stigmatic exudate and its role
in pollen germination, pp. 262—272, in: Pollen development and physiology, J.
Heslop-Harrison, ed., London, Butterworth, 1971.
Цветок: строение и развитие
401
41. Mattsson О., Knox R. В., Heslop-Harrison J., Heslop-Harrison Y. Protein pellic-
le of stigmatic papillae as a probable recognition site in incompatibility reac-
tions, Nature, 247, 298—300 (1974).
42. Mitrakos K., Price L., Tzanni H. The growth pattern of the flowering shoot
of Urginea maritima L. (Liliaceae), Amer. J. Bot., 61, 920—924 (1974).
43. Moeliono В. M. Caulinary or carpellary placentation among dicotyledons,
2 vols., Assen, The Netherlands, Royal Van Gorcum Ltd., 1971.
44. Morf E. Vergleichend-morphologische Untersuchungen am Gynoeceum der Sa-
xifragaceen, Ber. Schweiz. Bot. Ges., 60, 516—590 (1950).
45. Moseley M. F., Jr. Morphological studies of the Nymphaeaceae. III. The floral
anatomy of Nuphar, Phytomorphology, 15, 54—84 (1965).
46. Moseley M. F., Jr., The value of the vascular system in the study of the flo-
wer, Phytomorphology, 17, 159—164 (1967).
47. Okendon D. J. Pollen tube growth and the site of the incompability reaction
in Brassica oleracea, New Phytol., 71, 519—522 (1972).
48. Paech K. Colour development in flowers, Ann. Rev. Plant Physiol., 6, 273—
298 (1955).
49. Puri V. The role of floral anatomy in the solution of morphological problems,
Bot. Rev., 17, 471—553 (1951).
50. Puri V. Placentation in agiosperms, Bot. Rev., 18, 603—651 (1952).
51. Rosen W. G. Pollen tube growth and fine structure, pp. 177—185, Pistil-pollen
interactions in Lilium, pp. 239—254, in: Pollen development and physiology, J.
Heslop-Harrison, ed. London, Butterworth, 1971.
52. Sassen M. M. A. The stylar transmitting tissue, Acta Bot. NeerL, 23, 99—108
(1974).
53. Sattler R. A new approach to gynoecial morphology, Phytomorphology, 24.
22—35 (1974).
54. Seidlova F. Changes in growth and RNA synthesis in shoot apical meristem
of Chenopodium rubrum as a consequence of photoperiodic induction, Z. Pflan-
zenphysiol., 73, 394—404 (1974).
55. Singh V., Sattler R. Floral development of Butomus umbellatus, Can. J. Bot.,
52, 223—230 (1974).
56. Sporne K. R. Some aspects of floral vascular systems, Proc. Linn. Soc. Lon-
don, B169, 75—84 (1958).
57. Takhtajan A. Die Evolution der Angiospermen, Jena, Gustav Fischer, 1959.
58. Tepfer S. S. Floral anatomy and ontogeny in Aquilegia formosa var. truncata
and Ranunculus repens, Univ. Calif. Pubs. Bot., 25, 513—648 (1953).
59. Thompson IF. R., Meinwald J., Aneshansley D., Eisner T. Flavonoids: pig-
ments responsible for ultraviolet absorption in nectar guide of flower, Science,
177, 528—530 (1972).
60. Tiagi У. D. Studies in floral morphology. II. Vascular anatomy of the flower
of certain species of the Cactaceae, J. Indian Bot. Soc., 34, 408—428 (1955).
61. Tucker S. C. Ontogeny of the inflorescence and the flower of Drimys winteri
var. chilensis, Univ. Calif. Pubs. Bot., 30, 257—336 (1959).
62. Tucker S. C. Phyllotaxis and vascular organization of the carpels in Michelia
fuscata, Amer. J. Bot., 48, 60—71 (1961).
63. Uhl N. W., Moore H. E., Jr. The protection of pollen and ovules in palms,
Principes, 17, 111 — 149 (1973).
64. Wilson C. L. The telome theory and the origin of the stamen, Amer. J. Bot.,
29, 759—764 (1942).
65. Wilson C. L., Just T. The morphology of the flower, Bot. Rev., 5, 97—131
(1939).
66. Wolff E. T. The terminology of plant reproduction, Plant Sci. Bull., 18, 14—
15 (1972).
26 К. Эзау, кн. 2.
Глава 21
Цветок: репродуктивный цикл
Темой настоящей главы является репродуктивный цикл у по-
крытосеменных, характеризующийся очень короткой гаплоидной
(гаметофитной) фазой, которая не приводит к формированию са-
мостоятельных в отношении питания гаметофитов. Развитие жен-
ского гаметофита (зародышевого мешка), образование женской
гаметы (яйцеклетки), оплодотворение и ранние этапы развития
нового спорофита (зародыша) происходят на родительском споро-
фите. Мужская гаметофитная фаза начинается с образования
пыльцевого зерна в пыльнике родительского спорофита и продол-
жается параллельно с развитием пыльцевой трубки на рыльце.
В типичном случае в процессе женского гаметогенеза мегаспора
отделена от женской гаметы тремя митотическими делениями, а
в процессе мужского гаметогенеза между образованием микроспо-
ры (одноядерного пыльцевого зерна) и мужских гамет (двух спер-
миев в пыльцевом зерне или в пыльцевой трубке) происходят
только два деления.
Небольшая продолжительность гаметофитных фаз и их лока-
лизация в тех же структурах, которые участвуют в спорогенезе
(пыльники и семязачатки), служат объяснением, почему для тычи-
нок и плодолистиков, функционирующих фактически в качестве
спорофиллов, приняты термины «андроцей» и «гинецей», означаю-
щие мужской и женский органы.
Микроспорогенез
Микроспорангий и микроспоры
Микроспорофилл (или тычинка) несет микроспорангии (или
пыльцевые мешки), функцией которых является образование мик-
роспор, или пыльцевых зерен. Микроспорангий состоит из споро-
генной ткани (а позднее — из микроспор), находящейся в гнезде
пыльника, и особых слоев оболочки, окружающих спорогенную
ткань и онтогенетически связанных с нею. Структурные особенно-
сти развивающегося на тычинке пыльника обусловлены тем, что
в нем формируются микроспорангии, из которых впоследствии вы-
сыпается пыльца.
В крупных таксонах ход развития микроспорангиев и их стенок
отличается постоянством. Процесс микроспорогенеза, характерный
для большинства двудольных, можно рассмотреть на примере
Цветок: репродуктивный цикл
403
Рис. 21.1. Развитие пыльцы у хлопчатника Gossypiutn arboreum. А. Тычинка,
имеющая двулопастную биспорангиатную структуру. Б—Ж. Фрагменты попереч-
ных срезов микроспорангиев. (Воспроизводится из работы [38] с некоторыми из-
менениями.) Б, В. Стадия археспория. Г, Д. Стадия после образования первич-
ного париетального и спорогенного слоев. Е, Ж. Стадия после образования всех
слоев пыльника и микроспороцитов. 1 — пыльник; 2 — тычиночная нить; 3 — па-
риетальный слой; 4 — археспориальный слой; 5 — первичный париетальный слой;
6 — первичный спорогенный слой; 7 — наружный тапетум; 8 — микроспороциты;
9 — средний слой (будущий эндотеций); 10 — будущий внутренний тапетум.
хлопчатника Gossypium arboreum [38]. Он имеет двулопастной и
биспорангиатный пыльник (рис. 21.1. А). В лопасти, которая еще
находится в меристематическом состоянии, в первом слое под про-
тодермой происходят периклинальные деления (рис. 21.1,Б, В).
Этот слой называется археспориальным, поскольку его внутренние
производные становятся первичными спорогенными клетками
(рис. 21.1, Г, Д). Наружные производные археспориального слоя,
составляющие первичный париетальный слой, также претерпевают
периклинальные деления, образуя два вторичных париетальных
слоя. Наружный из этих двух слоев делится периклинально, так
что всего образуются три париетальных слоя (рис. 21.1,Е, Ж):
26*
404
Глава 21
будущий эндотеций, расположенный под эпидермой, средний слой
и самый внутренний из них — тапетум. У некоторых двудольных
оба вторичных париетальных слоя делятся периклинально, участ-
вуя в образовании среднего слоя. Такая последовательность деле-
ний рассматривается как примитивная. У однодольных внутренний
вторичный париетальный слой делится периклинально, давая нача-
ло среднему слою и тапетуму, тогда как наружный слой прямо
дифференцируется в эндотеций.
По мере образования слоев стенки первичные спорогенные
клетки делятся или функционируют непосредственно как материн-
ские клетки спор, но только после значительного увеличения их
размеров (рис. 21.1, Е, Ж). Клетки претерпевают мейоз, в резуль-
тате которого образуются гаплоидные микроспоры. Таким образом,
материнские клетки спор являются микроспороцитами. Их называ-
ют также материнскими клетками пыльцы, так как пыльцевые
зерна на одноядерной стадии представляют собой микроспоры.
Первоначально микроспороциты расположены плотно (рис. 21.1,
Ж) и связаны между собой плазмодеемами. Во время ранней про-
фазы мейоза снаружи от плазмалеммы появляется массивное
отложение полимера типа каллозы — (р-1,3-глюкана, исходные обо-
лочки при этом разрушаются и микроспороциты становятся округ-
лыми [30]. Вместо плазмодесм микроспороциты соединяются меж-
ду собой широкими цитоплазматическими мостиками, пересекаю-
щими каллозу, что характерно, по-видимому, для покрытосеменных.
Каналы в каллозе могут иметь диаметр более 1,5 мкм и в скани-
рующем микроскопе выглядят как отверстия, выстланные плазма-
леммой или заполненные коагулировавшей цитоплазмой [63, 64].
Связи между микроспороцитами представляют собой контакты
низкого сопротивления, что показано электрофизиологическими ме-
тодами [53].
Можно видеть, что благодаря развитию каналов, пересекающих
каллозную оболочку, вся масса микроспороцитов в микроспоран-
гии превращается в ценоцит, через посредство которого осущест-
вляются быстрый транспорт и распределение питательных и росто-
вых веществ [26]. Тесная связь микроспороцитов между собой, ве-
роятно, обусловливает близкий к синхронному мейоз в микроспо-
рангии, часто наблюдаемый у покрытосеменных. У немногих голо-
семенных, исследованных в этом отношении, не было обнаружено
ни соединительных мостиков между спороцитами, ни синхронных
делений в микроспорангиях [55]. Перед мейозом II контакты меж-
ду микроспороцитами покрытосеменных нарушаются, и тетрады
спор, возникающие в результате мейотических делений, оказывают-
ся полностью изолированными от других тетрад, лежащих в том
же пыльцевом гнезде.
Существуют два типа микроспорогенеза, различающихся по
временной последовательности мейоза и цитокинеза. При симуль-
Цветок: репродуктивный цикл
405
Рис. 21.2. Схемы микроспорогенеза, приводящего к образованию тетрад с тетра-
гональным (Б—Г) и тетраэдральным (Д—Ж) расположениями микроспор. Л.
Мейоз I. Б, Д. Мейоз II. В, Е. Образование каллозной стенки между микроспо-
рами. Г, Ж. Тетрады микроспор, погруженные в каллозную оболочку, в начале
образования оболочки пыльцы. 1 — плазмалемма; 2— каллоза; 3— фрагмопласт.
тайном цитокинезе, который, как было показано [10], характерен
для 186 семейств покрытосеменных, после мейоза I клеточных
оболочек не образуется, хотя фрагмопласт обычно и появляется
(рис. 21.2,Л). После мейоза II фрагмопласты образуются между
всеми 4 ядрами (рис. 21.2, Б, Д). Роль этих фрагмопластов менее
ясна, чем роль фрагмопластов, образующихся при соматическом
цитокинезе; однако их появление сопровождается агрегацией и
слиянием пузырьков, расположенных в цитоплазме посредине меж-
ду смежными ядрами, а также инвагинацией плазмалеммы
(рис. 21.2, В, Е) [15, 62]. Члены тетрады в последующем отделяют-
ся друг от друга каллозной стенкой, которая соединяется с калло-
зой, окружающей всю тетраду (рис. 21.2,Г, Ж). При сукцессивном
цитокинезе клеточные оболочки появляются после первого и второ-
го делений [42]. Этот тип микроспорогенеза был обнаружен у
представителей 40 семейств, в основном однодольных. Преобла-
дающим является тетраэдральное (рис. 21.2, Ж) или тетрагональ-
ное (изобилатеральное, рис. 21.2, Г) расположение членов тетрад,
зависящее от ориентации осей мейотических веретен и от связан-
ных с ней плоскостей деления (рис. 21.2) [59]. Как было показано
на Triticum, во время премейотической профазы устанавливается
полярность, определяющая симметрию расположения микро-
спор [16].
Слои стенки микроспорангия
Тапетум представляет собой специализированный слой, разви-
тие которого протекает синхронно с процессами, происходящими
в смежной спорогенной ткани [21]. Он имеет двоякое происхожде-
ние. Тапетальные клетки, расположенные на внешней стороне
микроспорангия, происходят из первичного париетального слоя,
406
Глава 21
тогда как внутри микроспорангия формирование тапетума по ок-
ружности гнезда пыльника осуществляется за счет метаморфизи-
рованных клеток ткани связника (рис. 21.3, Л, Б). Перед микро-
спорогенезом тапетальные клетки имеют густую цитоплазму и мо-
гут становиться полиплоидными или многоядерными. Тапетум
полностью окружает гнездо; его функция, по-видимому, заключает-
ся в том, что он обеспечивает питанием дифференцирующиеся
пыльцевые зерна, перенося к ним питательные вещества или сразу
же после их поступления, или после метаболических превращений
[7, 21].
Различают два основных типа тапетума — секреторный (или
железистый) и амебоидный (или плазмодиалъный). Среди се-
мейств покрытосеменных секреторный тапетум встречается чаще,
чем амебоидный [10]. Когда мейоциты находятся в профазе, в сек-
реторном тапетуме сильно развит эндоплазматический ретикулум
и содержится большое число пузырьков, происходящих из диктио-
сом. После мейоза тапетум начинает разрушаться. Его оболочки
растворяются, и распадающаяся цитоплазма выходит в гнездо
пыльника, в котором ее уплотненные остатки, называемые трифи-
ной, откладываются на пыльцевых зернах в виде наружного покры-
тия [14]. Основными компонентами трифины являются липиды.
У амебоидного тапетума протопласты после лизиса оболочек
остаются интактными и внедряются в пространство между разви-
вающимися пыльцевыми зернами (рис. 21.3, Л, В — Е). Слияние
свободных протопластов по периферии гнезда дает начало так на-
зываемому периплазмодию (рис. 21.3, Д). У Tradescantia раство-
рение тапетальных оболочек происходит до мейоза и тапетальный
плазмодий внедряется между мейоцитами [43]. Связь плазмодия
с развивающимися пыльцевыми зернами сохраняется вплоть до их
созревания. Во время созревания пыльника, незадолго до начала
полного цветения, плазмодий высыхает и его остатки откладыва-
ются в виде трифины на поверхности пыльцевых зерен.
Число средних слоев, образующихся в пыльниках покрытосе-
менных, зависит от типа формирования стенки, но обычно как у
двудольных, так п однодольных образуется всего один слой [10].
Средний слой почти всегда рано дегенерирует. Затем он сдавлива-
ется между тапетумом и недозрелым эндотецием и наконец погло-
щается соседними клетками (рис. 21.3,Б).
Эндотеций представляет собой слой стенки пыльника, присут-
ствующий у всех покрытосеменных, за исключением только тех
случаев, когда вскрывание пыльника осуществляется при помощи
отверстий. Наиболее отличительная черта эндотеция — наличие в
нем утолщений вторичных оболочек, принимающих обычно форму
лент или обручей (гл. 20). Вследствие такого утолщения оболочки
эндотеций часто называют фиброзным слоем. Эти утолщения рас-
полагаются на антиклинальных и внутренних тангенциальных
Рис. 21.3. Развитие пыльцы у хлопчатника Gossypium arboreum. (Воспроизводит-
ся из работы [38] с некоторыми изменениями.) Фрагменты поперечных (А, Б)
и косых продольных (В—Е) срезов микроспорангиев. А, Б. Тетрады микроспор
в каллозной оболочке в начале образования экзины. BJ Г. Одноядерные пыльце-
вые зерна с экзиной и интиной; тапетум на стадии плазмодия. Д, Е. Зрелые
.двухъядерные двухклеточные пыльцевые зерна; тапетум образует периплазмо-
дий. 1— разрушенный средний слой; 2 — тапетум; 3— тетрада микроспор; 4 —
проводящий пучок; 5 — экзина; 6 — интина; 7 — одноядерное пыльцевое зерно;
<5 — амебоидный тапетум; 9 — эндотеций; 10 — эпидерма; И — двухклеточное
пыльцевое зерно; 12 — генеративная клетка.
408
Глава 21
стенках. На последних утолщение может быть равномерным, не
имеющим форму обруча. Клетки ткани связника, расположенные
на внутренней стороне микроспорангия, также могут образовывать
лентовидные вторичные утолщения (Lilium). В области стомиума,
т. е. щели, появляющейся в пыльниках в то время, когда происхо-
дит высыпание пыльцы, утолщения у эндотеция не развиваются.
В процессе развития пыльника эндотеций созревает довольно
поздно. Так, во время мейоза и развития оболочки в пыльцевых
зернах у него еще отсутствуют вторичные утолщения (рис. 21.3,
А—Г). Клетки его растягиваются в радиальном направлении, и
лишь незадолго до высыпания пыльцы в них образуются утолще-
ния (рис. 21.3, Д, Е). Высказано предположение, что продолжи-
тельность дифференциации эндотеция определяется необходи-
мостью рационального распределения питательных веществ на
разных стадиях микроспорогенеза [22]. Образование во время
микроспорогенеза довольно жесткого эндотеция могло бы также
препятствовать увеличению объема развивающейся спорогенной
ткани. Утолщения оболочек эндотеция иногда рассматриваются как
лигнифицированные или суберинизированные [20]. У Chenopodium
утолщения оболочёк состоят из ориентированной а-целлюлозы и
не содержат лигнина [22].
Пыльца
Характернейшая черта зрелого пыльцевого зерна — его оболоч-
ка, скульптурированная самым различным образом и в то же вре-
мя обнаруживающая высокую степень постоянства в отношении
своей организации, химического состава и развития. На основе
многочисленных исследований оболочки пыльцы была разработана
сложная терминология, включающая множество синонимов. В дан-
ной книге используются термины, принятые в работе Хеслопа-Хар-
рисона [27]. В типичном случае оболочка состоит из экзины и
интины (фото 134). Экзина или образует однородный футляр, или
подразделяется на наружный слой — сэкзину и внутренний —
нэкзину. Сэкзина представляет собой скульптурированную часть
оболочки и прикрепляется к нэкзине с помощью стерженьков
(бакул), верхние концы которых могут либо объединяться в тек-
тум, или покров (рис. 21.4, Л), либо оставаться свободными
(рис. 21.4,5). У пыльцы примитивных покрытосеменных бакулы
отсутствуют и нэкзина выглядит аморфной [60].
Пыльцевое зерно имеет апертуры (поры), т. е. небольшие
тонкостенные участки в экзине (фото 134), через которые обычно
выходит пыльцевая трубка во время прорастания и которые поз-
воляют пыльцевому зерну изменять объем при изменении влаж-
ности [59]. Апертуры могут быть округлыми (поратная пыльца)
Цветок: репродуктивный цикл
409
Рис. 21.4. Схемы, объясняющие организацию оболочки пыльцы. Терминология
основана на публикациях Г. Эрдтмана (G. Erdtman; перерисовано из работы
[25]). 1 — экзина; 2— сэкзина; 3 — нэкзина; 4 — покровная экзина; 5 — покров
(тектум); 6 — стерженек (бакула); 7 — нэкзина 1; 8 — нэкзина 2; 9 — интина;
10— палочковая экзина; 11 — палочка (пилум).
или бороздчатыми (кольпатная пыльца); число их варьирует.
Среди покрытосеменных однодольные и многие Ranales имеют
одну апертуру (однобороздчатая пыльца), а большинство дву-
дольных— три (трехбороздчатая пыльца) [20].
К наиболее характерным химическим компонентам оболочки
пыльцы относится спорополленин, который состоит из окисленных
полимеров каротиноидов и каротиноидных эфиров [52]. Споро-
полленин очень устойчив к различным химическим веществам,
высокой температуре и агентам, вызывающим естественное раз-
рушение органического вещества. Поэтому предполагают, что
именно спорополленин в основном отвечает за сохранность пыль-
цы в отложениях ископаемых растений, утративших большинство
других признаков биологической структуры. Устойчивость пыльцы
к геологическому выветриванию и биологическому разрушению
может усиливаться благодаря присутствию кремния, который был
обнаружен в экзине пыльцы некоторых двудольных [8]. Связь
спорополленина с другими компонентами оболочки легче всего
объяснить, рассматривая оболочку пыльцы в онтогенезе {25, 27}.
Развитие оболочки пыльцы начинается тогда, когда тетрады
еще заключены в каллозу. Вначале отдельные микроспоры не
имеют оболочек и их плазмалемма соприкасается с каллозой
(рис. 21.3,5). Исследования, проведенные на нескольких видах,
показали, что в тех зонах плазмалеммы, где впоследствии обра-
зуются уплощенные выступы, к ней примыкают цистерны эндо-
плазматического ретикулума (рис. 21.5, А, Б). Эти зоны намеча-
ют места будущих апертур. Там, где эндоплазматический рети-
кулум отсутствует, снаружи от плазмалеммы откладывается пер-
вый слой оболочки — примэкзина, Она состоит из целлюлозы и
выглядит тонкофибриллярной. Почти сразу же после отложения
примэкзина пересекается по радиусу будущими стерженьками
(пробакулами; рис. 21.5,5), по-видимому, состоящими из липида
и белка. К пробакулам добавляется дополнительный материал,
410
Глава 21
и они соединяются друг с другом своими основаниями и верши-
нами (в покровном типе экзины; рис. 21.4, Л и 21.5, В). В фор-
мирующейся в результате этого сетчатой структуре четко просле-
живаются черты организации зрелой экзины. Компонент, обра-
зующий сеть, становится все более электронноплотным и устойчи-
вым к ацетолизу, поскольку с ним связывается протоспоропол-
ленин.
В то время когда микроспоры еще заключены в каллозу [44]
или уже находятся в свободном состоянии после распадения тет-
рад микроспор в результате рас1ворения каллозной оболочки, их
размер увеличивается и в них откладывается новое вещество эк-
зины— спорополленин. Экзина приобретает зрелую структуру,
состоящую из сэкзины, стерженьков, нэкзины 1 и нэкзины 2
(последняя добавляется к экзине позже всех остальных компо-
Рис 21 5. Развитие оболочки пыльцы у Silene pendula (фрагменты срезов). (Вос-
производится из работы [25] с некоторыми изменениями.) А—В. Стадии, харак-
теризующиеся наличием каллозной оболочки вокруг микроспороцита. Г—Е. Раз-
витие микроспороцита после освобождения от каллозной оболочки. 1 — ЭР; 2—
плазмалемма; 3— примэкзина; 4 — пробакула (предстерженек); 5 — экзина; 6 —
интина; 7 — бакула (стерженек); 8 — зона апертуры.
Цветок: репродуктивный цикл
411
нентов). Вещество экзины распространяется и в области апертур,
в которых к этому времени появляется слой интины (рис. 21.5,Г).
Толщина интины увеличивается, причем она разрастается и за
пределы апертур; выпячивания плазмалеммы изчезают
(рис. 21.5, ДЕ). Интина состоит из пектина и целлюлозы и об-
наруживает слоистость. На завершающем этапе созревания пыль-
цы на ее поверхности откладываются вещества, происходящие из
тапетума.
У всех исследованных в этом отношении видов покрытосемен-
ных оболочка пыльцы содержит белки [28]. Многие из них яв-
ляются ферментами и белками аллергенного типа, вызывающими
сенную лихорадку (например, пыльца Ambrosia). Белки имеют
разное происхождение и могут определять некоторые различия в
реакциях несовместимости, наблюдаемые при исследовании опы-
ления.
Мужской гаметофит
Гаметогенез
Перед тем как пыльца высыпается из пыльника, в ней проис-
ходит митотическое деление с образованием вегетативного и ге-
неративного ядер, дающих начало двухклеточному гаметофиту.
Генеративная клетка делится митотически на две мужские га-
меты, или спермин, либо сразу после первого митотического де-
ления, либо после прорастания пыльцевого зерна. Среди иссле-
дованных покрытосеменных в 192 семействах пыльца высыпается
в двухклеточном состоянии, в 115 — в трехклеточном, а в осталь-
ных семействах этот признак варьирует [10].
Для выяснения природы гаметофитных клеток и в особенности
для разграничения их друг от друга были проведены ультра-
структурные исследования. За митотическим делением, приводя-
щим к образованию генеративного ядра, следует цитокинез, сход-
ный с цитокинезом соматических клеток [18]. Деление поляризо-
вано в том смысле, что премитотическое ядро микроспоры смеща-
ется к оболочке в той области зерна, которая наиболее удалена
от борозды или борозд прорастания (рис. 21.6, Л) [17, 49]<. Обра-
зовавшееся генеративное ядро отходит к оболочке. Происходя-
щий вслед за этим цитокинез (рис. 21.6,5) приводит к появлению
полушаровидной оболочки, окружающей ядро вместе с неболь-
шим количеством цитоплазмы. Новообразованная оболочка со-
единена с интиной и выстлана плазмалеммами вегетативной и
генеративной клеток (рис. 21.6, В и фото 134). Было обнаружено,
что у нескольких видов новая оболочка окрашивается лакмоидом
в светло-голубой цвет, а после обработки разбавленным раство-
Рис. 21.6. Стадии формирования генеративной клетки в пыльцевом зерне. Монтаж
рисунков, сделанных по электронным микрофотографиям. А. Пыльцевое зерно
Jasione montana перед митозом; ядро расположено в противоположной от зоны
апертуры области клетки [17]. Б. Цитокинез, происходящий в пыльцевом зерне
Haemanthus katharinae после митоза; растущая изогнутая клеточная пластинка
отделяет генеративную клетку от вегетативной; ядра обеих клеток находятся в
ранней телофазе [49]. В. Генеративная клетка, ограниченная изогнутой оболоч-
кой, которая связана с интиной пыльцевого зерна Linum usitatissimum [56].
Г. Генеративная клетка, отделяющаяся от оболочки пыльцы Linum usitatissimum;
на небольшом участке связь с интиной еще сохраняется [56]. Д. Генеративная
клетка, ограниченная двумя плазмалеммами, в цитоплазме вегетативной клетки
[56]. 1 — экзина; 2 — интина; 3 — вакуоль; 4 — зона апертуры; 5 — генеративная
клетка; 6 — клеточная пластинка; 7 — вегетативная клетка; 8 — пластида; 9 —
оболочка; 10 — вегетативное ядро; 11 — генеративное ядро; 12 — две плазмалеммы.
Цветок: репродуктивный цикл
413
ром анилинового синего обнаруживает интенсивную желтую флуо-
ресценцию (реакции, с помощью которых идентифицируется кал-
лоза) [23, 44]'. У Linutn [56] эта оболочка, по-видимому, содер-
жит плазмодесмы (рис. 21.6, В).
Сформировавшаяся генеративная клетка обособляется от обо-
лочки пыльцы и затем округляется, так что площадь контакта
с интиной постепенно сокращается (рис. 21.6, Г). Полностью
обособленная клетка окружается цитоплазмой вегетативной клет-
ки. У одних видов оболочка генеративной клетки исчезает и клет-
ка оказывается ограниченной только двумя плазмалеммами
(рис. 21.6, Д) [44, 56]; у других видов оболочка сохраняется, да-
ет положительную гистохимическую реакцию на углеводы и име-
ет плазмодесмы [37].
Как известно из работы, проведенной с помощью светового
микроскопа, в результате митоза генеративного ядра образуются
два ядра гамет [42]!. Представление о том, что два спермия яв-
ляются клетками, подтверждают электронно-микроскопические
исследования. У сахарной свеклы (фото 135) [29] и ячменя {4]
спермин, присутствующие в зрелом пыльцевом зерне, представ-
ляют собой обособленные удлиненные эллипсоидные клетки, огра-
ниченные двумя элементарными мембранами (плазмалеммами),
одна из которых принадлежит гамете, а другая — вегетативной
клетке. Между двумя мембранами находится узкое пространство.
В промежутке между стадиями микроспоры и зрелого гамето-
фита структура пыльцевого зерна претерпевает определенные из-
менения. К компонентам микроспоры относятся крупное ядро,
большая вакуоль и различные цитоплазматические органеллы; од-
нако эндоплазматический ретикулум относительно мало развит
(рис. 21.6,Л). Встречаются амилопласты, причем у некоторых
видов с большим количеством крахмала. У Impatiens крахмал
расходуется в молодых микроспорах в процессе формирования
оболочки на стадии тетрад [19]. В большом числе могут присут-
ствовать липидные глобулы. Пока оболочка продолжает расти,
в микроспорах можно заметить диктиосомы, продуцирующие пу-
зырьки.
После первого митоза крупная вакуоль, остающаяся в вегета-
тивной клетке, подразделяется на мелкие и вакуолярный объем
уменьшается. Число органелл вегетативной клетки увеличивается.
Эндоплазматический ретикулум у некоторых видов образует круп-
ные стопки цистерн (фото 134) [37, 41, 49]. Содержание крахма-
ла и липидов как запасных веществ, накапливающихся, по-види-
мому, перед прорастанием, может значительно повышаться [19]1
Генеративная клетка менее богата органеллами, чем вегета-
тивная, и этот отличительный признак сохраняется и в клетках
спермиев. Особый интерес представляет вопрос о том, содержат-
ся ли в гаметах пластиды, которые могли бы переходить в яйце-
414
Глава 21
клетку во время оплодотворения. У некоторых видов пластиды в
генеративной клетке и гаметах иногда встречаются [4, 29, 37, 56,
57]. У сахарной свеклы и ячменя в гаметах наблюдаются много-
численные микротрубочки, расположенные параллельно длинной
оси клетки. Высказано предположение, что они участвуют в конт-
рольных механизмах, определяющих форму спермиев [4] и гене-
ративной клетки [49].
Пыльцевая трубка
Обычно пыльца прорастает на рыльце, однако большинство
сведений о росте пыльцевой трубки получено при изучении пыль-
цы в культуре (рис. 21.7). Прорастание пыльцы происходит вско-
ре послетого, как ее помещают наподходящую среду (рис. 21.7, Б;
на рыльце хлопчатника — в течение одного часа [36]). Пыльце’
вая трубка растет быстро (в условиях in vitro скорость часто со-
ставляет несколько мм в час [47]', а в столбике хлопчатника —
2 мм/ч [36]). При культивировании пыльцы на искусственной
среде рост пыльцевой трубки сильно поляризован, будучи огра-
ничен небольшой, строго определенной зоной длиной около 3—
Рис. 21.7. Прорастание in vitro пыльцевого зерна Scilla (однодольное). Питатель-
ная среда: 2% агара, 7% тростникового сахара, следы стерильных дрожжей.
А. Покоящееся двухъядерное пыльцевое зерно. Б—Д. Стадии прорастания пыль-
цевого зерна после его переноса на питательную среду (соответствующее время
указано над рисунками). На последних рисунках (Д, Е) показан только кончик
пыльцевой трубки. В конце прорастания (Е) ядра становятся компактными.
(Воспроизводится из работы Brink, Amer. J. Bot., 11, 351—364, 1924 с некоторы-
ми изменениями.) 1 — генеративное ядро; 2 — вегетативное ядро; 3 — ядро
спермия.
Цветок: репродуктивный цикл
415
5 мкм, расположенной у вершины пыльцевой трубки. Каким об-
разом осуществляется рост пыльцевой трубки в столбике, неизве-
стно [48]. Факторами, инициирующими прорастание, очевидно,
являются поглощение воды и активация синтеза ферментов. Пе-
ред выходом пыльцевой трубки в пыльцевом зерне начинается
синтез белка, но зависимости прорастания от синтеза РНК не об-
наружено. Когда же пыльцевая трубка прорастает in vitro, число
полисом увеличивается и наблюдается синтез как белка, так и
РНК.
Оболочка пыльцевой трубки может быть тонкой или довольно
толстой. В более зрелых зонах ее микрофибриллы ориентированы
более правильно, чем у кончика. Обычно считают, что микрофиб-
риллы состоят из целлюлозы, однако в пыльцевой трубке Liliutn
longiflorum в состав оболочки входит в основном фибриллярный,
устойчивый к действию щелочи кристаллический (3-1,3-полиглю-
кан вместе с небольшим количеством обычных целлюлозных
|3-1,4-глюканов [24].
Взаимоотношение пыльцевой трубки и интины в зоне апертуры
исследовано недостаточно. По данным световой микроскопии,
пыльцевая трубка легко проходит через пластичный слой интины,
расположенный над апертурой, сдвигая его в сторону [1]. Элект-
ронный микроскоп показывает, что при прорастании пыльцы инти-
на сливается с оболочкой пыльцевой трубки [9, 13]!.
Цитоплазма растущей пыльцевой трубки обычно собирается у
ее кончика, причем между апикальной и субапикальной зонами
наблюдаются некоторые различия. В субапикальной зоне нахо-
дятся перенесенные из пыльцевого зерна вегетативное ядро, спер-
мин (или генеративное ядро), цитоплазматические органеллы и
небольшие пузырьки (рис. 21.7, Г,Д). Апикальная зона лишена
органелл и содержит многочисленные пузырьки. Эти пузырьки,
происходящие из диктиосом и, возможно, также из эндоплазма-
тического ретикулума, участвуют (по крайней мере некоторые
из них) в синтезе оболочки [54]. У многих видов старые участки
удлиняющейся пыльцевой трубки последовательно перекрываются
пробками из каллозы.
Мегаспорогенез
Семязачаток
Семязачаток, развивающийся на плаценте завязи (гл. 20), яв-
ляется местом образования мегаспор и развития зародышевого
мешка (женского гаметофита). Семязачаток обычно состоит из
следующих основных частей (рис. 21.8): нуцеллуса — централь-
ного тела с вегетативными клетками, окружающими спорогенные
клетки, одного или двух интегументов (соответственно однопо-
416
Глава 21
кровный или двупокровный семязачаток), окружающих нуцел-
лус, и фуникулуса (семяножки; рис. 21.8, В), связывающего се-
мязачаток с плацентой. Зона, в которой сливаются нуцеллус, ин-
тегументы и фуникулус, называется халазой. Границы этой зоны
обозначены не резко.
По мере того как репродуктивные клетки проходят через эта-
пы мегаспорогенеза и образуют зародышевый мешок, части се-
мязачатка постепенно обособляются. Как можно видеть на при-
мере лилии [3] (рис. 21.8), семязачаток появляется на плаценте
в виде конического выроста, содержащего первую спорогенную
(археспориальную) клетку, которая почти сразу же становится
различимой. Два интегумента (сначала внутренний, а затем на-
ружный) закладываются путем периклинальных делений в эпи-
дерме. Их появление приводит к отграничению нуцеллуса. Инте-
гументы растут подобно кольцевидному воротничку, постепенно
окружающему нуцеллус. Они заканчивают развитие к тому вре-
Рис. 21.8. Продольные срезы развивающихся семязачатков Lilium tigrinum. По
мере развития интегументов семязачаток изгибается и принимает анатропную
форму. (Рис. А, Б, Г, Е воспроизводятся из работы {3] с некоторыми измене-
ниями.) 1 — мегаспороцит; 2 — нуцеллус; 3— закладка внутреннего интегумента;
4 — наружный интегумент; 5 — интегументы; 6 — фуникулус; 7 — прокамбий,
6 — халазальная зона; 9 — яйцеклетка; 10 — внутренний интегумент; 11 — мик-
ропиле.
Цветок: репродуктивный цикл
417
мени, когда зародышевый мешок готов к оплодотворению. В том
месте, где внутренний интегумент нависает в виде арки над нуцел-
лусом, остается отверстие — микропиле. В образовании микропи-
ле могут участвовать один или оба интегумента (рис. 21.8, Д и
21.12) [10].
В связи с развитием сильно вакуолизированного тонкостенно-
го зародышевого мешка, окруженного интенсивно делящимися
интегументами, которые плотно облегают нуцеллус (рис. 21.8, Д),
возникает вопрос о том, каким образом зародышевый мешок со-
храняет свою форму и не сминается. Изучение зависимости меж-
ду ориентацией клеточных оболочек в семязачатке хлопчатника и
распределением сил натяжения и сжатия в двумерной пластико-
вой модели семязачатка позволяет предположить, что интегумен-
ты служат для защиты развивающегося зародышевого мешка, не
допуская, чтобы сдавливающие силы оказывали на него влияние
[39, 40].
Во время развития интегументов семязачаток может оставать-
ся прямым (атропный, или ортотропный, семязачаток) или изги-
баться на 180° (анатропный семязачаток; рис. 21.8). Кроме этих
основных типов семязачатков существует большое число других
форм, в различной степени изогнутых и носящих разные назва-
ния [10, 42, 50]!. Семязачатки варьируют также по размеру нуцел-
луса. Семязачаток с крупным нуцеллусом называется крассину-
целлятным, а с небольшим — тенуинуцеллятным.
К тому времени, когда женский гаметофит готов к оплодотво-
рению, семязачаток, как и завязь, гистологически остается еще
относительно недифференцированным. Его проводящая система,
связанная через фуникулус с проводящей системой плаценты и
достигающая халазы, представлена обычно одним тяжем. Однако
она бывает и более сложной, поскольку может развиваться так-
же в одном или обоих интегументах, становясь при этом ветвистой.
Основная ткань представляет собой паренхиму, а эпидерма не-
сет кутикулу. Благодаря тому что интегументы имеют обычно
эпидермальное происхождение, в них можно различить три ку-
тикулярных слоя: наружный — на внешней стороне наружного
интегумента и фуникулуса, средний, имеющий двоякое происхож-
дение и расположенный между двумя интегументами, и внутрен-
ний, также двойной, — между внутренним интегументом и нуцел-
лусом.
Во время развития зародышевого мешка и зародыша некото-
рые части семязачатка дезорганизуются. Так, вегетативная ткань
нуцеллуса может частично или полностью резорбироваться. В по-
следнем случае зародышевый мешок входит в соприкосновение с
внутренней эпидермой прилегающего к нему интегумента. Эта
эпидерма обычно дифференцируется как интегументальный тапе-
тум, или эндотелий, — слой сильно окрашивающихся клеток с
27 К. Эзау, кн. 2.
418
Глава 21
обильным эндоплазматическим ретикулумом. Разрушение ткани
семязачатка около тапетума и сохранение последнего вплоть до
созревания семени позволяет предположить, что тапетум играет
определенную роль в питании зародыша. Однако это предполо-
жение следует привести в соответствие с особенностями оболо-
чек тапетума и зародышевого мешка. Между зародышевым мешком
и эндотелием не были обнаружены плазмодесмы [12], напротив,
между ними выявлена двойная кутикула [58]. Вместе с тем обо-
лочка зародышевого мешка может нести направленные внутрь
выросты, что указывает на его значение как передаточной клет-
Мегаспоры
Мегаспоры возникают в результате мейотического деления ма-
теринской клетки мегаспор, или мегаспороцита. В крассинуцел-
лятных семязачатках археспориальная клетка претерпевает пе-
риклинальное деление, образуя париетальную клетку и мегаспо-
роцит. У тенуинуцеллятных семязачатков археспориальная клетка
функционирует непосредственно как мегаспороцит [10]
(рис. 21.8, А, Б). Обычная последовательность делений последне-
го (Polygonum-Twn) рассмотрена здесь на примере Solanum
(рис. 21.9, Л—Д) [61]1. Мегаспороцит имеет довольно густую ци-
топлазму или может быть в различной степени вакуолизирован-
ным. Клетка претерпевает два мейотических деления, в результа-
те которых образуется линейная тетрада гаплоидных мегаспор.
Мегаспора, находящаяся в зоне халазы, увеличивается в размере,
готовясь к первому митотическому делению гаметофита. Осталь-
ные три мегаспоры дегенерируют. Флюоресцентная микроскопия
показывает, что при мегаспорогенезе, как и при микроспорогене-
зе, имеет место временное отложение каллозы [46]. Каллоза по-
крывает подготавливающуюся к делению мегаспору и появляется
также на стенках, разделяющих дегенерирующие мегаспоры.
Вскоре вся эта каллоза исчезает.
Женский гаметофит
Митотические деления происходят в трех генерациях ядер га-
метофита, вследствие чего формируется восьмиядерный зароды-
шевый мешок (рис. 21.9, Д—3). Во время этих делений бывшая
клетка мегаспоры разрастается и сильно вакуолизируется. Вось-
миядерная клетка превращается в семиклеточный зародышевый
мешок путем отграничения клеточными оболочками шести ядер
вместе с окружающей их цитоплазмой (рис. 21.10, Л—В). При
этом три клетки, расположенные на микропилярном конце, обра-
Рис. 21.9. Мегаспорогенез и развитие зародышевого мешка у Solarium demissum.
А. Мегаспороцит. Б, В. Мейоз. Г. Четыре мегаспоры. Д. Одна функционирующая
и три дегенерировавшие мегаспоры. Е—3. Зародышевые мешки с 2, 4 и 8 ядра-
ми. (Перерисовано из работы [61].) 1 — дегенерировавшие мегаспоры.
27*
Рис. 21.10. Зародышевый мешок Solanum demissum. А—В. Части одного и того
же восьмиядерного семиклеточного зародышевого мешка. Яйцеклетка изображе-
на отдельно (В), для того чтобы показать, что между нею и синергидами суще-
ствуют различия в отношении локализации вакуолей и ядер. Г. Остаток пыльце-
вой трубки после оплодотворения; дегенерировавшие синергиды не показаны.
Д. Зигота и двухклеточный эндосперм. Е. Двухклеточный зародыш и многокле-
точный эндосперм. (Перерисовано из работы [61].) 1 — клетка-антипод; 2 — по-
лярные ядра; 3 — вторичное ядро эндосперма; 4 — яйцеклетка; 5 — синергида;
6— первичное ядро эндосперма; 7 — зигота; 8— пыльцевая трубка; 9 — эндо-
сперм; 10 — зародыш.
Цветок: репродуктивный цикл
421
зуют яйцевой аппарат, состоящий из яйцеклетки и двух синергид.
На противоположном конце зародышевого мешка находятся три
клетки, называемые антиподами. Между этими двумя группами
клеток располагается крупная центральная клетка, содержащая
два полярных ядра, одно из которых произошло из одной четы-
рехъядерной группы, а второе — из другой. Полярные ядра могут
сливаться до оплодотворения, образуя диплоидное вторичное яд-
ро эндосперма [10]. На примере хлопчатника показано [32], что
сливающиеся ядра сначала соединяются посредством цистерн эн-
доплазматического ретикулума, отходящих от ядерных оболочек.
На этом этапе наружные мембраны обеих ядерных оболочек ана-
стомозируют. Позднее внутренние ядерные мембраны также вхо-
дят в контакт друг с другом и сливаются, образуя мостики. Объе*
динение двух ядер завершается расширением и слиянием мо-
стиков.
При образовании зародышевого мешка у покрытосеменных
наблюдается много отклонений от основного типа [10, 20, 42].
Сравнение одного из таких отклоняющихся типов (Fritillaria-тнп,
встречающийся также у Lilium\ рис. 21.8) с Polygonum-Twnxm
(обычный тип, характерный, например, для Solanum; рис. 21.9 и
21.10), дано на рис. 21.11. У Fritillaria наблюдаются следующие
отличительные особенности формирования зародышевого мешка:
1) между ядрами мегаспор оболочек не образуется и 2) все че-
тыре ядра участвуют в развитии зародышевого мешка. Хромосомы
трех из этих ядер объединяются во время митоза таким образом,
что образующиеся в результате два ядра оказываются триплоид-
Рис. 21.11. Схемы, иллюстрирующие моноспорический (Л) и тетраспорический
(Б) типы мегаспорогенеза и развития зародышевого мешка. У Polygonum (А)
зародышевый мешок возникает из одной мегаспоры. У Fritillaria (Б) все четыре
образовавшиеся при мейозе ядра участвуют в формировании зародышевого меш-
ка. Более крупные кружки в зародышевых мешках Fritillaria обозначают трип-
лоидные ядра. 1 — антиподы; 2 — синергиды; 3 — яйцеклетка.
422
Глава 21
ними. В восьмиядерном зародышевом мешке четыре ядра явля-
ются триплоидными, а четыре — гаплоидными. Полярные ядра
сливаются в тетраплоидное вторичное ядро эндосперма. Polygo-
num-тип зародышевого мешка (рис. 21.11, верхний ряд) называ-
ется моноспорическим, поскольку он происходит от одного из че-
тырех образующихся при мейозе ядер. Fritillaria-тпп (рис. 21.11,
нижний ряд), называется тетраспорическим, поскольку он содер-
жит производные всех четырех образовавшихся при мейозе ядер.
Встречаются также зародышевые мешки биспорического типа
(Allium) [42]L
Компоненты зародышевого мешка цитологически значительно
отличаются друг от друга, что особенно хорошо выявляется при
электронно-микроскопических исследованиях. Антиподы у покры-
тосеменных отличаются сильно варьирующими особенностями
развития. У Zea mays [12], как и у других злаков, эти клетки
пролиферируют, образуя многоклеточную эфемерную ткань. Клет-
ки имеют направленные внутрь выросты оболочки в тех местах,
где оболочка граничит с нуцеллусом; то, что эти клетки богаты
соответствующими органеллами, указывает на высокую интенсив-
ность дыхания и синтетической активности. Центральная клетка
имеет два крупных полярных или одно слившееся ядро, большой
объем в ней занимают вакуоли. Среди органелл выделяются дик-
тиосомы. Встречаются также липидные тельца и пластиды с
крахмалом. Иногда образуются внутренние выросты оболочки.
Клетка выглядит метаболически активной, возможно, отчасти
потому, что она длительное время увеличивается в размерах [32].
К наиболее сложно устроенным клеткам зародышевого мешка
относятся синергиды, играющие важную роль в процессе опло-
дотворения [5, 35]. Их крупные вакуоли располагаются в хала-
зальной зоне, а ядра — ближе к микропилярному концу
(рис. 21.10. Б). В микропилярном конце находится нитчатый ап-
парат, состоящий из более или менее сложной системы направ-
ленных внутрь выростов оболочки (рис. 21.13, А, Г). Эта система
обладает рыхлой структурой и, очевидно, богата пектиновыми ве-
ществами и гемицеллюлозами. В цитоплазме, связанной с нитча-
тым аппаратом, находится большое число органелл. Каждая си-
нергида окружена неполной оболочкой, покрывающей 2/3 поверх-
ности клетки на ее микропилярном конце. На халазальном конце
синергиду от центральной клетки отделяет только плазмалемма.
В зародышевом мешке хлопчатника оболочка синергид состоит из
целлюлозы, гемицеллюлоз и пектина [31].
Яйцеклетки покрытосеменных значительно различаются по сво-
им размерам и структуре, но обычно они представляют собой силь-
но вакуолизированные клетки. Крупная вакуоль, как правило,
располагается на микропилярном конце клетки, а ядро — ближе
к ее противоположному концу [12] (рис. 21.10, Б. В). У хлопчат-
Цветок: репродуктивный цикл
423
ника, однако, вакуоль простирается в осевом направлении через
всю клетку [32]. У Zea и хлопчатника яйцеклетка, как и синерги-
ды, имеет частичную оболочку на микропилярном конце, а на про-
тивоположном конце она ограничена лишь плазмалеммой. У Сар-
sella [51] оболочка окружает всю клетку, но у халазального конца
в ней встречаются многочисленные перерывы. Электронно-микро-
скопические наблюдения позволяют предположить, что яйцеклетки
различаются по степени своей метаболической активности. Яйце-
клетка, ассоциированная с синергидами, обладает, по-видимому,
довольно низкой активностью, о чем можно судить по числу и со-
стоянию органелл [12, 32]. У одного вида Plumbago яйцеклетка
не связана с синергидами и содержит на микропилярном конце
нитчатый аппарат; ее цитологическая структура свидетельству-
ет о том, что клетка имеет относительно высокую метаболическую
активность.
Оплодотворение
Пыльцевая трубка, проходящая через столбик, в конце концов
достигает полости завязи. Здесь она переходит в проводниковую
ткань, выстилающую стенку завязи и плаценту, а иногда (напри-
мер, у Allium) также и фуникулус. Затем пыльцевая трубка вхо-
дит в соприкосновение с семязачатком и проникает в зародыше-
вый мешок через микропиле (рис. 21.10, Г и 21.12, А), а иногда
через халазальную ткань. У крассинуцеллятных семязачатков
между микропиле и зародышевым мешком находится нуцеллярная
ткань, через которую должна пройти пыльцевая трубка [38]
(рис. 21.12,5). У семязачатка хлопчатника колонка клеток, рас-
положенных в нуцеллусе, дегенерирует и таким образом подго-
тавливается проход для пыльцевой трубки [34].
У нескольких видов, исследованных в ультраструктурном от-
ношении [35], было обнаружено, что пыльцевая трубка проника-
ет через нитчатый аппарат в одну из синергид и освобождает
внутри нее свое содержимое. Весь этот ход событий можно про-
следить и в световом микроскопе [2]. Синергида, в которую по-
падает пыльцевая трубка, частично дегенерирует еще до того,
как последняя достигает ее. Это явление, вероятно, связано с
выделением хемотропных веществ, направляющих пыльцевую
трубку в измененную синергиду. Вторая синергида обычно деге-
нерирует позднее, однако у пшеницы она часто разрушается од-
новременно с первой (рис. 21.13, А). Процесс опорожнения пыль-
цевой трубки в деталях варьирует. В типичном случае пыльцевая
трубка прекращает свой рост, как только она проникает на не-
которое расстояние в синергиду, после чего она лопается и осво-
бождает свое содержимое. Вегетативное ядро и ядро синергиды
424
Глава 21
Рис 21 12 Схематические изображения продольных срезов семязачатков пока
зывающие различные пути которые проходят растущие пыльцевые трубки (точ
ки) в семязачатках разной структуры А Семязачаток однопокровный тенуину-
целлятный пыльцевая трубка проникает в синергиду через простое микропиле
Б Семязачаток двупокровный крассинуцеллятный пыльцевая трубка входит
в синергиду через двойное микропиле и нуцеллус (Хлопчатник воспроизводит-
ся из работы [38] с некоторыми изменениями) 1 — эндотелий 2 — нуцеллус,
3 — внутренний интегумент, 4 — наружный интегумент 5 — фуникулус
дегенерируют, превращаясь в так называемые X тельца Плазма-
лемма дегенерирующей синергиды исчезает Один из спермиев
входит в соприкосновение с плазмалеммой яйцеклетки, а дру-
гой— с плазмалеммой центральной клетки Была выдвинута ги-
потеза о том, что плазмалеммы спермиев сливаются с плазмалем-
мами этих двух клеток, после чего ядра спермиев проникают
внутрь клеток [35] У покрытосеменных при проведении элект-
ронно-микроскопических исследований целые спермин или их ор-
ганеллы не были обнаружены в яйцеклетке или центральной
клетке При изучении оплодотворения у пшеницы с помощью
светового микроскопа [2] было показано, что спермин после вы-
хода из синергиды скручивались в плотную спираль (рис 21 13, Б)
и в такой форме выявлялись в яйцеклетке и в центральной клет-
ке при слиянии с полярными ядрами (рис 21 13, В, Г)
Слияние ядер спермиев с ядром яйцеклетки и с полярными
ядрами или продуктом их слияния (двойное оплодотворение) про-
Цветок- репродуктивный цикл
425
Рис 21 13 Оплодотворение у пшеницы. А Мелкие удлиненные клетки спермиев
вошли в одну из синергид, обе синергиды содержат дегенерировавшие ядра Б
Скрученные в спирали спермин. В. Сливающиеся полярные ядра Г Яйцевой
аппарат из одного зародышевого мешка; один из спирализованных спермиев на-
ходится рядом с полярными ядрами, другой вошел в яйцеклетку (Воспроизво-
дится из работы [2] с некоторыми изменениями) 1 — яйцеклетка, 2 — ядрышки,
3— синергида, 4 — спермин; 5 — нитчатый аппарат
исходит таким же образом, как уже описанное слияние полярных
ядер. Вначале сливаются наружные мембраны ядерных оболо-
чек, а затем внутренние, в результате чего содержимое сливаю-
щихся ядер объединяется. Ядрышки сливаются после того, как
завершается объединение ядерных мембран [11JL Оплодотворен-
ная яйцеклетка становится зиготой, а продукт тройного слияния
ядер в центральной клетке — первичным ядром эндосперма.
Зигота
Зигота претерпевает более глубокие цитологические изменения,
чем яйцеклетка. Сплошная оболочка образуется и на ее хала-
зальном конце, объем вакуолей уменьшается, а число рибосом
увеличивается, при этом образуются крупные полисомы; в пласти-
дах накапливается крахмал. Очевидно, клетка снабжается веще-
426
Глава 21
ствами и информацией, необходимыми для приближающихся де-
лений. У хлопчатника уменьшение объема вакуолей сопровожда-
ется уменьшением размера зиготы почти вдвое по сравнению с
яйцеклеткой [33]. Зиготы других видов растений, исследованные
в ультраструктурном отношении, уменьшаются в объеме незна-
чительно (гл. 24). Первое деление зиготы (рис. 21.10, Е) часто
происходит после деления первичного ядра эндосперма, которое
дает начало образованию этой ткани (рис. 21.10, Д).
СПИСОК ЛИТЕРАТУРЫ
1. Bailey I. W. Some useful techniques in the study and interpretation of pollen
morphology, J. Arnold Arb., 41, 141 —148 (1960).
2. Батыгина T. Б. Эмбриология пшеницы. — Л.: Колос, 1974
3. Bouman F. The application of tegumentary studies to taxonomic and phyloge-
netic problems, Ber. Deut. Bot. Ges., 84, 169—177 (1971).
4. Cass D. D. An ultrastructural and Nomarski-interference study of the sperms
of barley, Can. J. Bot., 51, 601—605 (1973).
5. Cass D D., Jensen W. A. Fertilization in barley, Amer. J. Bot., 57, 62—70
(1970).
6. Cass D. D., Karas I. Ultrastructural organization of the egg of Plumbago
zeylanica, Protoplasma, 81, 49—62 (1974).
7. Christensen J. E„ Horner H. T., Jr. Pollen pore development and its spatial
orientation during microsporogenesis in the grass Sorghum bicolor, Amer. J.
Bot, 61, 604—623 (1974).
8. Crang R. E., May G. Evidence for silicon as a prevalent elemental component
in pollen wall structure, Can. J. Bot., 52, 2171—2174 (1974).
9. Crang R. E., Miles G. B. An electron microscope study of germinating Lych-
nis alba pollen, Amer. J. Bot., 56, 398—405 (1969).
10. Davis G. L, Systematic embryology of the angiosperms, New York, John Wi-
ley & Sons, 1966.
11. Deschamps R. d’A. Etude ultrastructurale de la double fecondation chez le Li-
num catharticum L., C. R. Acad. Sci. Paris, D279, 263—265 (1974).
12. Diboll A. G.. Larson D. A. An electron microscopic study of the mature me-
gagametophyte in Zea mays, Amer. J. Bot., 53, 391—402 (1966).
13. Dickinson H. G., Lewis D. Cytochemical and ultrastructural differences between
intraspecific compatible and incompatible pollinations in Raphanus, Proc. Roy.
Soc. London, B183, 21—38 (1973).
14. Dickinson H. G., Lewis D. The formation of the tryphine coating the pollen
grains of Raphanus, and its properties relating to the self-incompatibility sy-
stem, Proc. Roy. Soc. London, B184, 149—165 (1973).
15. Dietrich J. Le cloisonnement simultane des cellules-meres polliniques de deux
Dicotyledones: Paeonia tenuifolia (Renonculacees) et Campanula rapunculoid.es
(Campanulacees), C. R. Acad. Sci. Paris, D276, 509—512 (1973).
16. Dover G. A. The organization and polarity of pollen mother cells of Triticum
aestivum, J. Cell Sci., 11, 699—711 (1972).
17. Dunbar A. Pollen ontogeny in some species of Campanulaceae. A study by
electron microscopy, Bot. Notiser, 126, 277—315 (1973).
18. Dupuis F. Formation de la paroi de separation entre la cellule generatrice et la
cellule vegetative dans le pollen AGmpatiens balsamina L., Bull. Soc Bot.
France, 119, 41—50 (1973).
19. Dupuis F. Evolution of the plastidial system during the microsporogenesis in
Impatiens balsamina L., pp. 65—71, In: Fertilization in higher plants, H. F. Lins-
kens, ed., Amsterdam, North-Holland Publishing Company, 1974.
Цветок,: репродуктивный цикл 427
20. Eames A. J. Morphology of angiosperms, New York, McGraw-Hill, 1961.
21. Echlin P. The role of the tapetum during microsporogenesis of angiosperms,
pp. 41—61. In: Pollen development and physiology, J. Heslop-Harrison, ed.,
London, Butterworth, 1971.
22. Fossard R. A. De. Development and histochemistry of the endothecium in the
anthers of in vitro grown Chenopodium rubrum L., Bot. Gaz., 130, 10—22
(1969).
23. Gorska-Brylass A. The «callose stage» of the generative cells in pollen grains,
Grana Palynol., 10, 21—30 (1970).
24. Herth W., Franke W. W., Bittiger H., Kuppel A., Keilich G. Alkaly-resistant
fibrils of p-1,3- and P-l,4-glucans: structural polysaccharides in the pollen tube
wall of Lilium longiflorum, Cytobiologie, 9, 344—367 (1974).
25. Heslop-Harrison J. Ultrastructural aspects of differentiation in sporogenous tis-
sue, Symp. Soc. Exp. Biol., No. 17, Cell Differetiation, pp. 315—340 (1963).
26. Heslop-Harrison J. Cytoplasmic connections between angiosperm meiocytes,
Ann. Bot., 30, 221—230 (1966).
27. Heslop-Harrison J. The pollen wall: structure and development, pp. 75—98.
In: Pollen development and physiology, Heslop-Harrison J., ed., London, But-
terworth, 1971.
28 Heslop-Harrison J., Heslop-Harrison Y., Knox R. B., Howlett В Pollen-wall
proteins: «gametophytic» and «sporophytic» fractions in the pollen walls of
Malvaceae, Ann. Bot., 37, 403—412 (1973).
29. Hoefert L. L. Fine structure of sperm cells in pollen grains in Beta, Protoplas-
ma, 68, 237—240 (1969).
30. Horner H. T., Rogers M. A. A comparative light and electron microscopic stu-
dy of microsporogenesis in male-fertile and cytoplasmic male-sterile pepper
(Capsicum annuum), Can. J. Bot., 52, 435—441 (1974).
31 Jensen W. A. The ultrastructure and histochemistry of the synergids of cot-
ton, Amer. J. Bot., 52, 238—256 (1965).
32 Jensen W. A. The ultrastructure and composition of the egg and central cell
of cotton, Amer. J. Bot., 52, 781—797 (1965).
33. Jensen W. A. Cotton embryogenesis: the zygote, Planta, 79, 346—366 (1968).
34. Jensen W. A. Cotton embryogenesis: pollen tube development in the nucellus,
Can. J. Bot., 47, 383—385 (1969).
35. Jensen W. A. Fertilization in flowering plants, BioScience, 23, 21—27 (1973).
36. Jensen W. A., Fisher D. B. Cotton embryogenesis: the pollen tube in stigma
and style, Protoplasma, 69, 215—235 (1970).
37. Jensen W. A., Ashton M., Heckard L. R. Ultrastructural studies of the pollen
of subtribe Castilleiinae, family Scrophulariaceae, Bot. Gaz., 135, 210—218
(1974).
38 Joshi P. C., Wadhwani A. M., Johri В. M. Morphological and embryological stu-
dies of Gossypium L., Proc. Natl. Inst. Sci. India, 33, 37—93 (1967).
39. Lintilhac P. M. Differentiation, organogenesis, and the tectonics of cell wall
orientation. II. Separation of stresses in a two-dimensional model, Amer. J.
Bot., 61, 135—140 (1974).
40 Lintilhac P, M., Jensen W. A. Differentiation, organogenesis, and the tectonics
of cell wall orientation. I. Preliminary observations on the development of the
ovule in cotton, Amer. J. Bot., 61, 129—134 (1974).
41 Lutz R. W.} Sjolund R. D. Development of the generative cell wall in Mono-
tropa uniflora L. pollen, Plant Physiol , 52, 498—500 (1973).
42 Maheshwari P. An introduction to the embryology of angiosperms, New York,
McGraw-Hill, 1950.
43. Mepham R. H., Lane G. R. Formation and development of the tapetai periplas-
modium in Tradescantia bracteata, Protoplasma, 68, 175—192 (1969).
44. Mepham R. H., Lane G. R. Observations on the fine structure of developing
microspores of Tradescantia bracteata, Protoplasma, 70, 1—20 (1970).
428
Глава 21
45. Newcomb W., Steeves T. A. Melianthus annuus embryogenesis: embryo sac
wall projections before and after fertilization, Bot. Gaz., 132, 367—371 (1971).
46. Rodkiewicz B. Callose in cell walls during megasporogenesis in angiosperms,
Planta, 93, 39—47 (1970).
47. Rosen W. G. Ultrastructure and physiology of pollen, Ann. Rev. Plant Phy-
siol., 19, 435—462 (1968).
48. Rosen W. G. Pollen tube growth and fine structure, pp. 177—185. Pistil-pollen
interactions in Lilium, pp. 239—254. In: Pollen development and physiology,
Heslop-Harrison J., ed., London, Butterworth, 1971.
49. Sanger J. M., Jackson W. T. Fine structure study of pollen development in
Haemanthus katharinae Baker. I. Formation of vegetative and generative cells,
J. Cell Sci., 8, 289—301 (1971). II. Microtubules and elongation of the genera-
tive ceells, J. Cell Sci.. 8. 303—315 (1971). III. Changes in organelles during
development of the vegetative cell, J. Cell Sci., 8, 317—329 (1971).
50. Савченко M. И. Морфология семяпочки покрытосеменных растений. — Л.:
Наука, 1973.
51. Schulz Sister R., Jensen W. A. Capsella embryogenesis: the egg, zygote, and
young embryo, Amer. J. Bot., 55, 807—819 (1968).
52. Shaw G. The chemistry of sporopollenin, pp. 305—348. In: Sporopollenin,
J. Brooks, P. R. Grant, M. D. Muir, P. van Gijzel, G. Shaw, eds., London,
Academic Press, 1971.
53. Spitzer N. C. Lowresistance connections between cells in the developing anther
of the lily, J. Cell Biol., 45, 565—575 (1970).
54. VanDerWoude W. J., Morre D. J., Bracker С. E. Isolation and characterization
of secretory vesicles in germinated pollen of Lilium longiflorum, J. Cell Sci.,
8, 331—351 (1971).
55. Vasil 1. K. The new biology of pollen, Naturwiss., 60, 247—253 (1973).
56. Vazart B. Structure et evolution de la cellule generatrice du Lin, Linum usita-
tissimum L., au cours des premiers stades de la maturation du pollen, Rev.
Cytol. Biol. Veg., 32, 101—114 (1969).
57. Vazart J. Aspects infrastructuraux de la reproduction sexuee chez le Lin. Der-
niers stades de la differentiation du pollen. Structure inframicroscopique de
la cellule generatrice et des gametes, Rev. Cytol. Biol. Veg., 33, 289—310
(1970).
58. Vazart B., Vazart J. Infrastructure de 1’ovule de Lin, Linum usitatissimum L.
L’assise jaquette ou endothelium, C. R. Acad. Sci. Paris, 261, 2927—2930
(1965).
59. Walker J. W. Aperture evolution in the pollen of primitive angiospersm, Amer.
J. Bot., 61, 1112—1137 (1974)
60. Walker J. W.} Skvarla J. J. Primitively columellaless pollen: a new concept in
the evolutionary morphology of angiosperms, Science, 187, 445—447 (1975).
61. Walker R. I. Cytological and embryological studies in Solanum, section Tube-
rarium, Bull. Torrey Bot. Club, 82, 87—101 (1955).
62. Waterkeyn L. Les parois microsporocytaires de nature callosique chez Hellebo-
rus et Tradescantia, Cellule, 62, 225—255 (1962).
63. Whelan E. D. P. Discontinuities in the callose wall, intermeiocyte connections,
and cytomixis in angiosperm meiocytes, Can. J. Bot., 52, 1219—1224 (1974).
64. Whelan E. D. P., Haggis G. H, Ford E J Scanning electron microscopy of
the callose wall and intermeiocyte connection in angiosperms, Can. J Bot.,
52, 1215—1218 (1974).
Глава 22
Плод
Общее представление и классификация
Оплодотворение яйцеклетки вызывает развитие зародыша и
формирование семени. Этому сопутствуют специфические измене-
ния цветка, которые ведут к развитию плода. Основным или
единственным компонентом цветка становится гинецей; около-
цветник и тычинки обычно засыхают и опадают, столбик после
опыления также засыхает, за исключением тех видов, у которых
он служит для распространения плодов (различные Ranuncula-
сеае, некоторые Rosaceae [33]). Завязь, напротив, увеличивается
в размерах и претерпевает разнообразные гистологические изме-
нения, которые, как правило, связаны с формированием приспо-
соблений, облегчающих распространение семян. При этом у расте-
ний многих систематических групп с завязью срастается добавоч-
ная (внеплодолистиковая) ткань, которая в зрелом плоде может
даже преобладать над плодолистиковой. Внутренние структуры
самой завязи — ее стенка, перегородки в синкарпных гинецеях и
плаценты — также в той или иной степени участвуют в формиро-
вании плода. __,
Плоды могут развиваться без оплодотворения и образования
семян. Это явление, называемое партенокарпией, широко распро-
странено, в особенности среди видов с большим числом семяза-
чатков в плоде, таких, как банан, инжир, дыня, ананас и томат.
У одних видов партенокарпия возможна и без опыления (цитру-
совые, перец, тыква, томат), у других оно необходимо как сти-
мулирующий фактор (орхидеи). Бессемейные плоды могут так-
же развиваться в результате нарушения развития зародышей
(вишня, виноград, персик). Строго говоря, такие плоды не явля-
ются партенокарпическими, поскольку развитие семян в данном
случае инициируется оплодотворением [32].
Плоды и семена, функционирующие как приспособления для
распространения растений, в разной степени зависят друг от
друга. У более примитивных таксонов семя обладает такими
свойствами, которые позволяют использовать разнообразные спо-
собы диссеминации независимо от плода, но у более продвинутых
покрытосеменных единицей диссеминации становится плод, заме-
щая семя как таковое [33]. Таким образом функциональная и,
следовательно, морфологическая связь между плодом и семенем
очень изменчива, и экологическая роль плода имеет много аспек-
430
Глава 22
тов. Это создает трудности при определении понятия плода и раз-
работке систем классификации.
В узком смысле слова плод — это созревшая завязь. Однако
принято и более общее определение плода как производного ги-
нецея и любых внеплодолистиковых частей, с которыми он может
срастаться во время плодоношения. Цветоложе у земляники, ча-
шечка у шелковицы, кроющие листья у ананаса и цветочная труб-
ка или цветоложе в плодах, развивающихся из надпестичных
цветков, таких, как яблоко или тыквина, — примеры внеплодоли-
стиковых тканей в плоде.
В морфологической классификации плодов тип плода обычно
связывают с типом цветка и гинецея, из которых он развивается,
особое значение придавая взаимоотношениям плодолистиков друг
с другом и с другими частями цветка. Обычно различают следу-
ющие основные типы плодов. Простой плод развивается из одного
пестика и состоит из одного, двух или нескольких сросшихся пло-
долистиков (бобы, фасоль, томат, слива); сборный плод образу-
ется из апокарпного гинецея, плодолистики которого не срастаются
и в зрелом плоде (малина, земляника); сложный (множествен-
ный) плод развивается из соцветия, т. е. из объединенных гине-
цеев многих цветков (шелковица, ананас). Если в плод какого-
либо из этих типов входит внеплодолистиковая ткань, то к его
названию прибавляют слово дополненный [4]!. Так, яблоко яв-
ляется простым дополненным плодом, земляника — сборным до-
полненным плодом, тутовая ягода — сложным дополненным пло-
Рис. 22.1. Схемы продольных
разрезов цветков [10]. Типы
плодов по классификации Вин-
клера [54]. A. Ranunculus —
апокарпный, подпестичный цве-
ток (плод сборный, свободный).
Б. Solanum — синкарпный под-
пестичный (плод единичный,
свободный) В Rosa — апо-
карпный околопестичный цве-
ток (плод сборный, бокаловид-
ный) Г Comus — синкарпный
надпестичный цветок (плод
единичный, бокаловидный).
Плод
431
дом. Дополненные плоды называют также (довольно неудачно’)
ложными плодами.
Если рассматривать плод как продукт всего гинецея и любых
других частей цветка, которые либо закладываются как одно це-
лое с гинецеем, либо срастаются с ним в ходе онтогенеза, то тер-
мины «дополненный» и «ложный» применительно к плоду стано-
вятся ненужными. Для полной морфологической классификации
плодов при этом достаточно четырех понятий [54]: 1) сборный
плод — плодолистики не срастаются, 2) единичный плод — пло-
долистики объединены, 3) свободный плод — из верхней завязи,
4) бокаловидный плод — из нижней завязи, погруженной в «чашу»
из неплодолистиковой ткани, или из верхней завязи, сросшейся в
плоде с чашевидным гипантием. Сочетая эти варианты, можно вы-
делить четыре основных типа плодов: 1) сборный свободный плод,
развивающийся из апокарпного подпестичного цветка
(рис. 22.1, Л), 2) единичный свободный плод — из синкарпного
подпестичного цветка (рис. 22.1, Б), 3) сборный бокаловидный
плод — из апокарпного околопестичного цветка (рис. 22.1, В) и
4) единичный бокаловидный плод — из синкарпного надпестично-
го цветка (рис. 22.1,Г). В сборном плоде каждый отдельный
плодолистик образует так называемый плодик [55]. Дальнейшая
классификация производится на основе сочетания многих призна-
ков, среди которых особенно важными считаются расположение и
тип объединения плодолистиков, природа стенки плода, а также
то, является ли плод вскрывающимся [2].
Ни один из способов морфологической классификации плодов
не является общепринятым, в том числе подразделение плодов на
типы в соответствии со структурой цветков, из которых они раз-
виваются. Один из недостатков морфологических классификаций
состоит в том, что они пренебрегают функциональными модифика-
циями плодов. Однако введение особых терминов для каждой та-
кой модификации привело бы просто к беспорядочному и не-
управляемому увеличению числа терминов [33]. Морфологиче-
ские классификации остаются полезными при простом описании
плода и установлении связи между плодом и цветком в процессе
развития.
Стенка плода
Свойства стенки плода часто служат систематическим призна-
ком в описательных анатомических и морфологических класси-
фикациях плодов. Стенку называют перикарпиев, что в узком
смысле слова относится к созревшей стенке завязи. Если под тер-
мином «плод» подразумевается созревший гинецей с добавочной
тканью или без нее, то в понятие «перикарпий» включается и
432
Глава 22
внеплодолистиковая скань, если в плоде она срослась с завязью
[2]. Для того чтобы была ясна связь между цветком и плодом,
в настоящей главе термин «перикарпий» употребляется, только
когда необходимо подчеркнуть происхождение ткани из стенки
завязи, а стенкой плода называется или перикарпий в узком
смысле слова, или сочетание перикарпия и внеплодолистиковой
ткани. В плодах, развивающихся из надпестичных цветков, мож-
но отличить собственно перикарпий от приросшей ткани, в других
плодах такое разграничение невозможно. Как уже упоминалось
в гл. 20, некоторые ботаники придерживаются того мнения, что в
надпестичных цветках плодолистиковая ткань не ассоциирована
с гнездами завязи.
Стенка плода может быть в большей или меньшей степени
дифференцирована, и часто в собственно перикарпии отчетливо
видны два-три слоя. В этом случае говорят об экзокарпии (или
эпикарпии), мезокарпии и эндокарпии. Эти термины употребля-
ются только в описательных целях и не имеют отношения к онто-
генезу слоев. Экзокарпием, например, иногда называют одну эпи-
дерму, иногда — эпидерму вместе с несколькими слоями лежа-
щей под ней ткани. Исследователи часто расходятся во мнениях
даже при разграничении слоев перикарпия одного и того же ти-
па плода. В настоящей главе об отдельных слоях перикарпия го-
ворится лишь в тех случаях, когда это делают авторы цитируе-
мых работ.
Основываясь на свойствах тканей стенки плода, можно выде-
лить следующие типы плодов: сухие плоды (вскрывающиеся и
невскрывающиеся) и сочные плоды.
Типы плодов
Сухой плод
ВСКРЫВАЮЩИЙСЯ плод
Вскрывающиеся стенки обычно имеют плоды, содержащие не-
сколько семян. Вскрывающийся плод может развиваться из од-
ного плодолистика (листовка, боб) или из нескольких (коробочка,
стручок).
Способы вскрывания очень разнообразны [18]. Если завязь
образовалась из одного плодолистика, разрыв может проходить
продольно: 1) по шву вдоль линии смыкания краев плодолистика,
2) по спинной части плодолистика, 3) по шву и спинной части од-
новременно (рис. 22.2, Л—В). В синкарпных плодах с пристенной
плацентацией вскрывание может происходить либо по шву между
двумя плодолистиками, либо по спинной части плодолистиков
Плод
433
Рис. 22 2 Схемы поперечных разрезов сухих вскрывающихся плодов трех типов.
Еще не вскрывшиеся плоды: А. Один плодолистик. Г. Три плодолистика, при-
стенная плацентация. Ж. Три плодолистика, осевая плацентация. Вскрывание
плодов Б—В, Д—Е, 3—И. В каждом плодолистике обозначены срединный и
латеральные пучки На рис. Б, Е, И срединные пучки показаны расщепленными
на два. Объяснение см. в тексте. (Воспроизводится из работы [18] с некоторы-
ми изменениями.)
(рис. 22.2, Г—Е). В синкарпных плодах с осевой плацентацией
(рис. 22.2, Ж) разделение по линии объединения смежных плодо-
листиков, т. е. по септе (септицидное вскрывание), может соче-
таться с отделением плодолистиков от центральной колонки тка-
ни (рис. 22.2,3/ Вскрывание по спинной части плодолистиков
(локулицидное вскрывание) обнажает отдельные гнезда завязи
(рис. 22.2, И). В плодах названных выше типов продольное вскры-
вание может происходить не только по шву или средней жил-
ке [18]. Некоторые плоды вскрываются поперек по окружности,
охватывающей все плодолистики (кольцевое вскрывание) или же
отдельными отверстиями (порицидное вскрывание).
Хорошо известный пример сухих вскрывающихся плодов —
боб, встречающийся у многих Fabaceae. (Бобы и многие другие
сухие плоды обычно называют неточным, но удобным термином
«стручок».) Боб развивается из верхней завязи, образованной
одним плодолистиком. Он вскрывается по шву от краев плодоли-
стика и по средней жилке (рис. 22.2, В и 22.4, Б).
У бобов сои (Glycine), например, в перикарпии можно различить
следующие слои (начиная снаружи; рис. 22.3): экзокарпий, со-
стоящий из наружной эпидермы и гиподермы, клетки которых
28 К Эзау, кн 2
434
Глава 22
Рис 22 3 Перикарпии плода
Glycine. А Поперечный срез.
Б. Косой продольный срез.
В экзо- и эндокарпиях встре-
чаются склерифицированные
клетки. Проводящие пучки не
показаны (Воспроизводится из
работы [29] с некоторыми из-
менениями ) 1 — экзокарпий;
2 — мезокарпий, 3— эндокар-
пий
имеют утолщенные оболочки; паренхиму мезокарпия; эндокарпий,
включающий несколько слоев склеренхимных клеток и внутрен-
нюю эпидерму [29]. Клетки гиподермы и склеренхимы удлинен-
ные. Оси клеток этих двух тканей ориентированы в противопо-
ложных плоскостях, в результате этого наружные и внутренние
слои перикарпия сокращаются при высыхании в разных направ-
лениях и создается напряжение, которое способствует вскрыванию
обезвоженного зрелого плода. Неравномерное сокращение пери-
карпия у некоторых бобов связано с неодинаковой ориентацией
микрофибрилл клеточной оболочки в слоях склеренхимы — поло-
гими спиралями в одних слоях и крутыми — в других. Напряже-
ние в тканях плода, создающееся в процессе высыхания, у неко-
торых бобов так велико, что разделившиеся створки их скручи-
ваются.
У бобов фасоли (Phaseolus; рис. 22.4, А, Б) эпидерма и гипо-
дерма (они очень тесно связаны друг с другом и образуют так на-
зываемую кожуру) могут слущиваться, оставляя неровную по-
верхность на консервированных и замороженных зеленых бобах
[37]. Паренхима под гиподермой, простирающаяся до самой скле-
ренхимы, содержит хлоропласты с крахмальными зернами. Вбли-
зи склеренхимы располагается сеть мелких проводящих пучков
(рис. 22.4, Л), связывающих срединный пучок с латеральными.
К проводящим пучкам (особенно к крупному срединному и ла-
теральным) прилегает лигнифицированная склеренхима, что яв-
ляется причиной «волокнистости» некоторых сортов зеленой фа-
соли.
У Glycine склеренхима эндокарпия изнутри ограничена од-
ним слоем эпидермы (рис. 22.3). У Phaseolus клетки внутренней
эпидермы много раз делятся периклинально, и в результате об-
разуется мощный слой, как правило, нефотосинтезирующей внут-
ренней паренхимы (рис. 22.4,А). Пока эта ткань еще нежна и
прозрачна, зеленый боб фасоли наиболее ценен как продукт пи-
1
2
Рис 22 4 Схемы строения плодов типов боб (Phaseolus, А, Б) и стручок (Bras-
sica, В) А Поперечный разрез боба на уровне семядолей зародыша Б Плодо-
листик, вскрывшийся вдоль срединного и латеральных пучков. В. Два плодоли-
стика с ложной перегородкой, несущей семена, после вскрывания 1 — фуникулус,
2 — проводящие пучки, 3— срединный плодолистиковый пучок, 4 — семядоля;
5 — внутренняя паренхима, 6 — латеральный плодолистиковый пучок, 7 — на-
ружная паренхима, 8 — склеренхима.
28*
436
Глава 22
тания. В этот период наружная паренхима выглядит более зре-
лой, менее плотной и имеет более толстые оболочки. У некото-
рых бобовых {Pisum, Vicia faba) внутренняя паренхима образует
волосковидные выросты, глубоко вдающиеся в гнездо завязи:
вначале вблизи гнезда радиальные ряды клеток отделяются друг
от друга, затем слагающие их клетки удлиняются и формируются
многоклеточные волоски. Считается, что это приспособление для
поддержания благоприятных условий влажности внутри незрело-
го плода [20]1.
Другой тип вскрывающихся плодов — коробочка — состоит из
LTPrrrn ttritljv п ттп пр ттгтиггпп тл адп'Ж'Р'г прггпктр ^ТЬСЯ ПЯР.ЛИЧНЫМИ
X -* ' ^z X X V X X-Z ХХХХХХ XXV X z t/A А! ^z X XX ХА X-Z XX XVX XXX ^z X Х> X X k-/ X-ZX Х-/ VX X Х> -/ X кУ VX V А А1 XXX XXX IV X х X
способами (рис. 22.2, Г—И). У Linum usitatissimum наружная
часть перикарпия коробочки состоит из твердых, сильно одревес-
невших клеток, а внутренняя — из паренхимных клеток. В коро-
бочке Nicotiana tabacum тонкостенные клетки располагаются сна-
ружи, а толстостенные внутри. Для многих Brassicaceae характе-
рен стручок, который представляет собой особый тип коробочки.
Считается, что он состоит из двух плодолистиков со сросшимися
краями и ложной перегородки, которая развивается из краевых
плацент и делит гнездо завязи на две части (гл. 20). Клетки
экзокарпия и мезокарпия имеют тонкие оболочки, эндокарпий
состоит из склеренхимы. По линии срастания плодолистиков об-
разуется хорошо заметное ребро. По созревании плодолистики
отделяются друг от друга вдоль шва, а семена остаются прикреп-
ленными к ребру, которое рамкой (replum) окружает перегородку
(рис. 22.4, В).
НЕВСКРЫВАЮЩИЕСЯ ПЛОДЫ
Невскрывающийся плод обычно развивается из завязи, в ко-
торой созревает только одно семя, хотя семязачатков может быть
более одного. По своей структуре перикарпий невскрывающегося
плода часто похож на семенную кожуру. Настоящая семенная
кожура у таких плодов в значительной степени облитерируется
(семянка у Asteraceae, рис. 22.5) или сливается с перикарпием
(зерновка у Роасеае, рис. 22.6).
Семянка (у Asteraceae) развивается из нижней завязи и по-
этому должна называться нижним плодом [17]. Внеплодолисти-
ковая ткань в ней считается цветочной трубкой, однако стенка
плода не дифференцируется на перикарпий и добавочную ткань.
Семенная кожура, происходящая из единственного интегумента,
распадается и сдавливается, за исключением наружной эпидермы,
клетки которой имеют толстые оболочки. Стенка плода также в
значительной степени сминается, остаются лишь наружная скле-
рифицированная ткань и некоторое количество паренхимы [10]
(рис. 22.5, Г).
Плод
437
Плод злаков — зерновка — изучен очень подробно [41]. По-
кровные слои зерновки пшеницы состоят из перикарпия и остат-
ков семенной кожуры. В перикарпии имеются следующие слои
(начиная снаружи; рис. 22.6): покрытая кутикулой наружная
эпидерма; один или несколько слоев частично сдавленной парен-
химы; частично резорбированная паренхима; поперечные клетки,
вытянутые поперек длинной оси зерновки и имеющие толстые
одревесневшие оболочки, остатки внутренней эпидермы в виде
одревесневших клеток, вытянутых параллельно длинной оси зер-
новки (трубчатые клетки). В процессе развития семенной кожуры
наружный интегумент разрушается, внутренний деформируется и
сдавливается. Сдавленный внутренний интегумент с обеих сто-
рон покрыт кутикулой и содержит пигмент, дающий положитель-
ную реакцию на жировые вещества [6].
Под семенной кожурой располагается эндосперм, который по
весу составляет около 83% всею плода и содержит крахмал и
белки. Наружный слой эндосперма — это так называемый алей-
роновый слой, в нем находятся запасы липидов и белков и син-
тезируются ферменты, необходимые для инициации прорастания
(гл. 23). Алейроновый слой окружает крахмалистый эндосперм и
зародыш. Отруби, которые получаются при помоле пшеницы, по
весу составляют около 14% зерна; в них можно обнаружить пе-
Рис 22 5 Семянка Lactuca sativa А Общий вид плода с летучкой (хохолком)
Б Схема продольного разреза В Схема поперечного разреза Г Фрагмент по-
перечного разреза семенной кожуры с подлежащей тканью (Воспроизводится
из работы [10] с некоторыми изменениями) 1 — летучка (хохолок), 2 — семен-
ная кожура, 3 — семядоля, 4 — стенка плода, 5 — эндосперм
438
Глава 22
4
Рис. 22.6. А.
пия [10’. В,
работы [6].)
4 — семенная
трубчатая
Зерновка Triticum [10] Б. Фрагмент продольного среза ее перикар-
Г. Вид поверхности перикарпия. (Перерисовано с фотографий из
1 — бороздка; 2 — крахмалистый эндосперм; 3 — алейроновый слой;
кожура; 5—щиток; 6 — зародыш; 7 — кутикулярный слой; 8 —
клетка; 9 — перикарпий; 10 — эпидерма; 11— поперечные клетки.
рикарпип, остатки нуцеллуса и интегументов и алейроновый слой
[5]. Зародыш при помоле также отделяется: содержащееся в нем
масло ухудшает сохранность муки.
Свойства и качество хлеба из пшеничной муки определяются
главным образом белками клейковины. Для выпекания хорошего
хлеба необходимы также гликолипиды (комплексы углеводов и
липидов), поскольку они взаимодействуют с белками клейковины.
Плод
439
Исследование этого взаимодействия позволило усовершенствовать
процесс обогащения пшеничной муки белками [34].
Степень изменения, претерпеваемого семенной кожурой и пе-
рикарпием в процессе развития зерновки, различна у разных зла-
ков. В зерновке Zea [22] наружный перикарпий состоит из клеток
с толстыми содержащими поры оболочками и сильно сдавлен.
Центральный перикарпий разрушен, внутренний остается тонко-
стенным и в различной степени растягивается, разрывается и
сдавливается. Интегументы разрушены полностью. Между толсто-
стенной эпидермой нуцеллуса и перикарпием находится кутику-
лярный слой. У Sorghum перикарпий разрушается меньше, чем
у других хлебных злаков [42].
В связи с тем что прорастающая зерновка поглощает воду,
следует рассмотреть развитие в семенной кожуре кутикулярных
слоев. Такие слои образуются из интегументов и эпидермы ну-
целлуса, хотя жировые вещества может производить также и
внутренний слой перикарпия. В зрелой зерновке кутикулярные
слои по существу слиты в один слой, вплотную соединенный с
Рис. 22.7. Фрагмент медианного продольного разреза зрелого колоска ЕМпоМоа
utilis. Видна зона, где кутинизированная семенная кожура прерывается, а алей-
роновые клетки имеют направленные внутрь выросты оболочки, характерные для
передаточных клеток. (Воспроизводится из работы [58] с некоторыми измене-
ниями.) 1— части тычиночного цветка; 2— эндосперм; 3 — зародыш; 4 — про-
водящая ткань; 5 — алейроновый слой; 6 — кутинизированная семенная кожура;
7 — алейроновые передаточные клетки; 8 — нуцеллярные клетки; 9 — клетки пиг-
ментного тяжа; 10 — верхняя цветковая чешуя; 11 — лодикула; 12 — нижняя
цветковая чешуя; 13 — верхняя колосковая чешуя; 14 — нижняя колосковая
чешуя.
440
Глава 22
Рис 22 8 Схизокарпий (типа вислоплодника) Carum carvi (Apiaceae). А. Плод,
частично распавшийся на два мерикарпия. Б, В. Поперечные разрезы плода до
опадения Латеральные плодолистиковые пучки закрашены черным (Воспроиз-
водится из работы [19] с некоторыми изменениями.) 1 — масляный ход; 2 —
латеральные пучки; 3— семядоли; 4 — семенная кожура, 5 — эндосперм.
остатками семенной кожуры (рис. 22.6,5). В зерновке пшеницы
кутинизированная семенная кожура прерывается в области бо-
роздки, в том месте, где между продольным проводящим пучком и
эндоспермом проходит тяж пигментированной ткани [57]. Было
высказано предположение, что при прорастании вода проходит
по клеточным оболочкам пигментированного тяжа [23]1.
У ежовника (Echinochloa utilis) разрыв в кутинизированной
семенной кожуре невелик и располагается в основании зерновки
[58]. В разрыве находятся клетки двух типов — нуцеллярные и
клетки, сходные с клетками пигментного тяжа в зерновке пше-
ницы. Алейроновые клетки, расположенные напротив нуцелляр-
ных, приобретают направленные внутрь выросты оболочки и
становятся передаточными клетками (рис. 22.7). Аналогичные клет-
ки были описаны у Zea [22]. У Setaria их определяют как алей-
роновые передаточные клетки [40]1. Они, вероятно, способствуют
транспорту растворенных веществ к развивающемуся эндосперму
и зародышу через узкий разрыв в семенной кожуре. У злаков с
бороздкой разрыв вытянут вдоль пигментного тяжа, а алейроно-
вые клетки не имеют выростов оболочки [58].
Дробные плоды (схизокарпии) распадаются на односеменные
единицы (мерикарпии), каждая из которых развивается из одно-
го плодолистика. Хотя мы рассматриваем дробный плод в разде-
ле о невскрывающихся плодах, распадение его на мерикарпии
представляет собой приспособление к распространению семян и
Плод
441
аналогично вскрыванию плода. И действительно, некоторые бо-
таники рассматривают схизокарпий как промежуточный тип меж-
ду вскрывающимися и невскрывающимися сухими плодами [19].
В качестве примера дробного плода на рис. 22.8 изображен
вислоплодник (кремокарпий) Carum (Apiaceae). Он образуется
из нижней завязи; гистологических различий между перикарпи-
ем и добавочной тканью нет. Латеральные пучки и связанная с
ними ткань отдельных мерикарпиев слиты так, что образуют раз-
дваивающуюся на вершине колонку (рис. 22.8, А). На попереч-
ных срезах нижней части плода поэтому виден только один про-
водящий пучок (рис. 22.8, В), а в верхней части — две пары пуч-
ков (рис. 22.8,5). Каждый мерикарпий имеет пять ребер, в ко-
торых располагаются проводящие пучки. С проводящими пучка-
ми чередуются шесть масляных ходов. У некоторых видов Apia-
ceae при разделении плода на мерикарпии колонка не образуется.
Сочный плод
Как и сухие плоды, сочные плоды могут образовываться из
одно- или многоплодолистикового гинецея. Их стенки могут со-
стоять только из одного перикарпия или из перикарпия, сливше-
гося с внеплодолистиковыми тканями. Сочными могут становиться
либо только внутренняя или только наружная часть стенки плода,
либо вся стенка, при этом развивается особая сочная, часто сук-
кулентная, паренхима. Сочными могут стать не только стенка, но
и другие части плода: плаценты и перегородки в многогнездных
завязях.
С точки зрения эволюции возникновение сочного плода рас-
сматривается как сравнительно новый признак [33]. Согласно та-
кому представлению, первоначально сочной частью (мякотью)
был лишь вырост внутреннего слоя перикарпия («пульпа»), про-
никающий между семенами в гнездо завязи. Впоследствии весь
перикарпий превращается в сочную запасающую ткань, которая
привлекает животных, становящихся фактором распространения
семян.
ПЛОДЫ С КОЖУРОЙ
У цитрусовых, банана и представителей сем. Cucurbitaceae
сочная ткань плода окружена кожурой. Плод цитрусовых [43] —
гесперидий — развивается из верхней завязи и состоит примерно
из десяти плодолистиков (рис. 22.9, А, Б). Плацентация осевая.
Экзокарпий, или флаведо (желтая ткань), состоит из покрытой
кутикулой наружной эпидермы и плотной субэпидермальной па-
ренхимы с масляными железками и кристаллоносными клетками.
Мезокарпий, или альбедо (белая ткань), представлен паренхи-
442
Глава 22
Рис. 22.9. Плод цитрусовых. А. Продольный разрез молодой завязи из цветка
Citrus aurantifolia. Б. То же, поперечный разрез. В. Фрагмент поперечного раз-
реза молодого плода С. sinensis. Показан один плодолистик. Мешочки с соком
находятся на ранней стадии развития. (Рис. А—В выполнены по микрофотогра-
фиям из работы [43].) Г. Схема строения плода апельсина. Показаны два пло-
долистика целиком и часть — третьего. Мешочки с соком заполняют гнезда за-
вязи. 1— рыльце; 2 — каналы столбика; 3— масляная железка; 4 — столбик;
5 — проводящие пучки; 6 — семязачаток; 7 — завязь; 8 — нектарный диск; 9 — пе-
регородка завязи; 10 — перикарпий; 11— мешочки с соком; 12 — семя.
мой с крупными межклетниками и клетками с ветвистыми выро-
стами (аэренхима). В этой ткани располагается сеть проводящих
пучков. Эндокарпий состоит из внутренней эпидермы и несколь-
ких слоев плотной паренхимы. Перегородки между гнездами за-
вязи представляют собой выросты эндо- и мезокарпия. У некото-
рых сортов цитрусовых сегменты (плодолистики) в зрелом плоде
легко разделяются по внутреннему слою паренхимы перегородок.
Плод
443
«Кожура» зрелого плода состоит из экзокарпия и мезокарпия, за
исключением самого внутреннего слоя последнего.
В эндокарпии образуются мешочки с соком, целиком запол-
няющие гнезда завязи (рис. 22.9, Г). Эти мешочки представляют
собой многоклеточные булавовидные образования на длинных
тонких ножках. В зрелом плоде крупные сильно вакуолизирован-
ные содержащие сок клетки покрыты эпидермой, несущей кути-
кулу с выделениями воска [И]. Мешочки с соком развиваются
из эпидермы эндокарпия, иногда и из клеток субэпидермального
слоя. Вначале закладываются небольшие выпуклости, главным об-
разом на абаксиальной стороне плодолистиков (рис. 22.9, В). Они
удлиняются путем апикального роста, а основная часть мешочка
образуется за счет массивной меристемы, занимающей субтерми-
нальное положение. Мешочки начинают развиваться во время
раскрытия цветка и растут вплоть до того момента, когда засы-
хает столбик.
В паренхиме экзокарпия находятся хлоропласты, благодаря ко-
торым незрелые плоды имеют зеленый цвет. По мере созревания
плода они превращаются в хромопласты. Плоды растущего в Ка-
лифорнии валенсианского апельсина в зимние месяцы приобрета-
ют интенсивный оранжевый цвет, а весной снова становятся зеле-
ными. При этом происходит восстановление хлоропластов из хро-
мопластов, причем вновь формируются граны [51].
Тыквина Cucurbitaceae развивается из нижней завязи. Грани-
ца между плодолистиковыми и внеплодолистиковыми тканями не
видна (фото 136). Расположение плодолистиков и особенно тип
плацентации у Cucurbitaceae являются предметом серьезных раз-
ногласий среди ботаников [27]. Развивающиеся семена погруже-
ны в паренхимную ткань, и гнезда завязи как таковые не суще-
ствуют (фото 136 и рис. 22.10, А). Плаценты выглядят как постен-
ные, однако этому впечатлению противоречит наличие в центре
завязи типичных обращенных латеральных плодолистиковых пуч-
ков [27]. Кроме того, небольшая ворсистость заполняющей гнез-
до ткани свидетельствует о том, что семязачатки прикреплены не
к степке плода, а к загнутой внутрь полоске ткани (рис. 22.10, Б).
Схема расположения плодолистиков у тыквенных, соответст-
вующая данным о развитии завязи [15], представлена на
рис. 22.10. На рис. В плодолистики изображены так, как они вы-
глядели бы в незаполненных гнездах в отсутствие срастания с
внеплодолистиковой тканью. Края плодолистиков вначале заги-
баются в направлении к центру, образуя таким образом перего-
родки между гнездами завязи. Затем края плодолистиков выгиба-
ются еще раз, теперь в направлении от центра, и получаются пе-
регородки внутри каждого гнезда. Плаценты также загибаются и
разрастаются к центру (фото 136 и рис. 22.10, Л). Между краями
плодолистиков вдоль второго изгиба, а также между плацентами
444
Глава 22
Рис 22.10. А. Поперечный разрез завязи Citrullus vulgaris. Пунктиром обозначе-
ны зоны смыкания плодолистиков; сплошные линии отделяют друг от друга края
одного и того же плодолистика, а плаценты — от стенки плода (фото 136). Ла-
теральные пучки соседних плодолистиков объединены (фото 136). Б. Поперечный
разрез одного плодолистика с одной плацентой (окружающая ткань удалена).
(Рис. А и Б выполнены по фотографиям просветленных срезов из работы Mann,
Bot. Gas., 105, 257—262, 1943.) В. Схема, поясняющая расположение плодолисти-
ков в завязи тыквенных. Для простоты рисунка заполнение гнезд завязи и объ-
единение латеральных пучков не показаны. 1 — объединенные латеральные пуч-
ки; 2 — плацента; 3— гнездо завязи (на рис. А заполнено тканью); 4 — один
плодолистик; 5 — срединный пучок; 6 — латеральный пучок.
и спинной частью плодолистиков находится двойной эпидермаль-
ный слой (фото 136 и рис. 22.10, Л, сплошные линии). Между
краями смежных плодолистиков вдоль первого их изгиба линия
слияния не видна (рис. 22.10, Л, штриховые линии). Ткань, за-
полняющая гнезда, имеет плодолистиковое происхождение. У не-
которых Cucurbitaceae она становится частью центральной съедоб-
ной сочной ткани.
Изучение большого числа форм плодов тыквенных показало,
что при наличии у них ряда общих основных черт в гистологиче-
ских деталях могут быть различия [27]. Однослойная наружная
эпидерма у этих плодов покрыта кутикулой и имеет устьица.
Субэпидермальная ткань представлена паренхимой (зеленой,
желтой или бесцветной), иногда колленхимой и может быть раз-
ной ширины. Могут присутствовать также волокна и тяжи флоэ-
мы. У некоторых таксонов под ней залегает слой склереид, не-
прерывный или прерывистый. Под этой склеренхимой находится
паренхима, которая в зрелом плоде разрастается до самого цент-
ра плода (огурец, арбуз) или разрушается и в центре образуется
полость {Cucurbita maxima). Та паренхима, которая остается в
зрелом плоде, может быть сочной, крахмалистой или же прони-
зывается межклетниками. Внутренняя эпидерма стенки плода мо-
жет образовывать на поверхности семян пленчатый слой. Прово-
Плод
445
дящая система состоит главным образом из биколлатеральных
проводящих пучков: одни являются пучками плодолистиков, а
другие принадлежат внеплодолистиковой части, которая, вероят-
но, имеет аппендикулярное происхождение (цветочная труб-
ка) [27].
Наружная окраска плодов тыквенных определяется типом
пластид субэпидермальной паренхимы. В зеленых плодах пласти-
ды представлены хлоропластами, в желтых — хромопластами.
У одной из разновидностей Cucurbita pepo плоды могут спонтанно
позеленеть вторично в результате обратного превращения желтых
хромопластов в хлоропласты [9]). Окраска внутренней мякоти
также определяется хромопластами. У арбуза розовые и красные
Рис. 22 11. Поперечные разрезы плодов A. Musa acuminata, партенокарпический
плод Полость завязи заполнена мякотью, происходящей из перикарпия и пере-
городок завязи Б. То же, семяносный плод. Полость завязи занята семенами и
небольшим количеством мякоти (Рис А и Б воспроизводятся из работы [28]
с некоторыми изменениями) В Lycopersicon esculentum, плаценты заполнили
гнезда завязи, в них погружены семязачатки Ткань между семязачатками в зре-
лом плоде студенистая 1 — мякоть (пульпа); 2—заполненное гнездо завязи;
3— семя; 4 — перикарпий; 5 — плацента; 6 — перегородка; 7 — проводящие пуч-
ки. Черным цветом закрашены полости в гнездах завязи
446
Глава 22
пигменты образуют в клетках кристаллы в форме игл и пласти-
нок [27].
Плод банана (Musa acuminata) образуется из верхней завязи
и либо дает семена, либо развивается партенокарпически [28].
Три плодолистика располагаются по принципу осевой плацента-
ции (рис. 22.11, А, Б). В начале цветения структура завязи в се-
меносных и партенокарпических плодах одинакова. Затем семя-
зачатки партенокарпических плодов дегенерируют и гнезда за-
вязи заполняются мякотью, развивающейся из перикарпия и пе-
регородок (рис 22 11,/В Мякоть богата крахмалом. У семенос-
ной разновидности банана зрелые семена заполняют гнезда завя-
зи почти целиком, а мякоти образуется очень мало (рис. 22 11, Б).
В паренхиму стенки плода банана погружены многочисленные
вертикальные проводящие пучки с млечниками. Внутрь от этой
зоны располагаются аэренхима, а под ней зона с горизонтально
ориентированными проводящими пучками. Эта система связана с
вертикальными пучками перикарпия и с латеральными плодоли-
стиковыми пучками в центре плода (рис. 22.11,4,5). Очевидно,
кожура отделяется легко от плода благодаря аэренхиме.
ПЛОДЫ БЕЗ КОЖУРЫ
Хорошим примером плода, не имеющего кожуры и состояще-
го целиком из сочной ткани, является ягода томата Lycopersicon
escu1entum (Solanaceae). Как правило, у Solanaceae плод имеет
два плодолистика, однако плоды культурных сортов томата
(кроме сорта Черри) могут иметь и больше. Перикарпий, перего-
родки и крупные плаценты сочные. Плод имеет осевую плацен-
тацию, причем плаценты заполняют большую часть полости за-
вязи. Ткань плацент внедряется и в пространство между семяза-
чатками (рис. 22.11,5). По мере созревания эта часть плацентар-
ной ткани разрушается и становится студенистой. Возможно, в
этом процессе участвует целлюлаза [13].
Окраска плода томата в процессе созревания изменяется
вследствие превращения хлоропластов в хромопласты. Этот про-
цесс возбуждается светом: происходят поглощение красного све-
та фитохромом, образование этилена и другие биохимические ре-
акции [21]. Образуются хромопласты двух типов [24]'. Одни рас-
полагаются в студенистой ткани и содержат глобулярные вклю-
чения [3-каротина, другие находятся в перикарпии и помимо гло-
бул [3-каротина содержат крупные паракристаллические пластин-
ки ликопина.
Костянка (например, у Prunus)—это сочный плод, развива-
ющийся в околопестичных цветках из одного плодолистика
(гл. 20). У различных видов Prunus между краями плодолисти-
ков заметен вентральный шов в виде бороздки. У некоторых раз-
Плод
447
Рис. 22.12. Плод Prunus domestica. А. Продольный срез завязи. Б. Поперечный
срез. Полость в завязи закрашена черным цветом. Фрагменты поперечных сре-
зов: В. Наружная часть перикарпия через 6 нед после полного цветения. Г. То
же через 2 нед после опадения плода. Видны дезорганизованные протопласты и
частично смятые клеточные оболочки. Д. Внутренняя часть эндокарпия через
6 нед после полного цветения, по завершении деления клеток. Е. То же через
8 нед; начало одревеснения. (Рисунки выполнены по микрофотографиям из ра-
боты [48].) 1 — срединный плодолистиковый пучок; 2 — семязачаток; 3 — зона
мякоти; 4 — зона пор; 5 — проводящие пучки семязачатка; 6 — латеральные пло-
долистиковые пучки; 7 — производные внутренней эпидермы; 8 — кристалл.
новидностей Persica vulgaris бороздка особенно четко выражена
возле косточки; вероятно, сцепление по шву недостаточно, и это
вызывает растрескивание косточки [39].
Перикарпий можно подразделить на относительно тонкий эк-
зокарпий, состоящий из эпидермы и субэпидермальной колленхи-
448
Глава 22
мы, сочный мезокарпий и каменистый эндокарпий (стенку косточ-
ки, рис. 22.12). На плодах сливы имеется характерный налет,
обусловленный наличием тонких фибрилл воска на поверхности
кутинизированной эпидермы [45]. Химические и гистологические
различия в мезокарпии позволяют выделить два типа плодов пер-
сика: десертных, с более сочной мякотью, и идущих на консерви-
рование, с более плотной мякотью. У первых по мере созревания
плода толщина клеточных оболочек уменьшается и клетки раз-
рушаются. В плодах Primus domestica каменистый эндокарпий
образуется из трех слоев стенки завязи [48]. Внутренняя эпидер-
ма образована несколькими слоями вертикально вытянутых скле-
реид, над ней располагаются слои тангенциально вытянутых
склереид (рис. 22.12, Д, Е), а 2—4 наружных слоя состоят из
изодиаметрических склереид. В сочном мезокарпии и в камени-
стом эндокарпии встречаются проводящие пучки (рис. 22.12,5).
Отдельные костяночки малины (Rubus) образуют на выпуклом
цветоложе сборный плод (рис. 22.13, Л). Каждая костяночка име-
ет каменистый эндокарпий, состоящий из удлиненных изогнутых
склереид, различным образом ориентированных в разных слоях
(рис. 22.13,5, В) [36]|. Сочная мякоть представляет собой парен-
химный мезокарпий. На экзокарпии имеются эпидермальные во-
Рис. 22.13. Продольные срезы плода Rubus strigosus. А. Незрелый плод: собра-
ние костяночек на разросшемся цветоложе Б Отдельная костяночка. В Фраг-
мент перикарпия костяночки. Длинные оси склереид в соседних слоях эндокар-
пия ориентированы во взаимно перпендикулярных плоскостях. (Рисунки выпол-
нены по микрофотографиям из работы [36].) 1 — цветоложе; 2 — семя; 3— за-
родыш; 4 — эндокарпий; 5 — мезокарпий; 6 — экзокарпий.
Плод
449
Рис. 22.14. Поперечные срезы плода Pyrus malus. А. Незрелый плод. Б. Зрелый
плод (при большем увеличении). Обозначения даны в соответствии с трактовкой
внеплодолистиковой ткани как гипантия. (Рисунки сделаны на основе микрофо-
тографий из работы [12].) 1 — семязачаток; 2 — «кожура»; 3— срединные пло-
долистиковые пучки; 4 — проводящие пучки лепестков; 5 — латеральный плодо-
листиковый пучок; 6 — проводящие пучки чашелистиков; 7 — семя; 8 — перикар-
пий; 9 — гипантий.
лоски, которые в зрелом плоде удерживают костяночки вмес-
те [36].
Плод Pyrus (Р. malus, Р. communis)—яблоко развивается из
нижней завязи; его мякоть образована внеплодолистиковой частью
плода. Существует мнение, что внеплодолистиковая ткань имеет
аппендикулярное происхождение (цветочная трубка или гипан-
тий). Некоторые ботаники считают добавочную ткань частью цве-
толожа и называют наружную сочную часть плода корой. Мы
приводим описание плода типа яблока (у яблони и груши), со-
ответствующее представлению об аппендикулярном происхожде-
нии внеплодолистиковой ткани.
Пограничная зона между цветочной трубкой и завязью («сер-
дечко» плода) включает срединные пучки плодолистиков, но не
цветочной трубки (рис. 22.14,5). В зрелом плоде эта предпола-
гаемая граница обозначена тонким слоем компактно расположен-
ных клеток [12]. Завязь состоит из пяти плодолистиков, соединен-
ных по типу осевой плацентации. Края смежных плодолистиков,
которые, смыкаясь, образуют перегородки, различимы только
вблизи самого центра «сердечка», где перегородки имеют слегка
зубчатые контуры и в каждой проходят два латеральных плодо-
листиковых пучка (фото 137). На ранних стадиях роста края од-
ного и того же плодолистика не смыкаются, их срастание происхо-
29 К. Эзау, кн. 2.
450
Глава 22
дит позднее (рис. 22.14 и фото 137). В центре «сердечка» отвер-
стие может оставаться, а может закрываться краями плодоли-
стиков.
Ткани яблока имеют следующие особенности. Наружная эпи-
дерма покрыта кутикулой, которая утолщается по мере роста
плода. Поверхность кутикулы покрыта перекрывающими друг
друга пластинками воска [45]. В молодых плодах имеются устьи-
ца и трихомы. Позднее устьица заменяются чечевичками. При
поверхностном побурении яблок в наружных слоях плода разви-
вается пробка в виде пятен неправильной формы. Субэпидермаль-
ная ткань плотная, клетки имеют утолщенные оболочки. Вместе
с эпидермой она образует довольно жесткую «кожицу» плода
(рис. 22.14, то же у груши — фото 137). В кожице красных сор-
тов яблок содержатся антоцианы [16]. В периферических тканях
плодов имеются также хлоропласты, которые в процессе созре-
вания превращаются в хромопласты с каротиноидами. Исследо-
вание ультраструктуры показало, что пластиды эпидермы и суб-
эпидермальной ткани накапливают ферритин и ограниченные
мембраной белковые включения.
Основу внеплодолистиковой ткани составляет пронизанная
межклетниками паренхима. «Мучнистость» этой ткани в перезре-
лых плодах связана с тем, что клетки все больше отделяются друг
от друга и ткань пронизывается сетью воздушных полостей. Ос-
новные проводящие пучки цветочной трубки располагаются в па-
ренхиме (рис. 22.14 и фото 137). Ответвления этих пучков обра-
зуют систему анастомозов, пронизывающую всю мякоть.
«Сердечко» яблока состоит из тканей двух типов — паренхи-
мы, в которой лежат срединные и латеральные плодолистиковые
пучки, и хрящевидной ткани, выстилающей гнезда завязи и состоя-
щей из склереид. Обе ткани считаются перикарпием. Хрящевид-
ная ткань окружает эндокарпий. Каждое гнездо содержит два
семени (иногда больше).
У груши характерным элементом мякоти плода являются
склереиды. Они собраны в группы, хорошо заметные при неболь-
шом увеличении, особенно после окрашивания на лигнин флоро-
глюцином с соляной кислотой. Как показало исследование разви-
тия плода у Pyrus communis [14]*, дифференциация склереид на-
чинается через две недели после полного раскрывания цветка и
продолжается до двадцатой недели роста плода. Начинается этот
процесс глубоко в мякоти, постепенно распространяясь кнаружи.
Зачатки склереид сильно разрастаются гораздо раньше окружаю-
щих клеток и часто делятся один или два раза. Затем их рост
прекращается и образуются вторичные клеточные оболочки, кото-
рые сильно одревесневают. Клетки вокруг склереидных групп в
это время еще продолжают расти; они делятся концентрически и
удлиняются радиально по отношению к ним (рис. 22.15).
Плод
45 *
Рис. 22 15. Группы склереид на поперечном срезе перикарпия Pyrus nivalis. (Ри-
сунок выполнен по микрофотографии из работы [47].)
Рост плодов
Рост изучен лучше у сочных плодов, так как это важно для
садоводства. Поскольку подавляющее большинство плодов не от-
носится к сочным, сведения о росте плодов других типов ограни-
ченны [25].
По общим закономерностям роста сочные плоды подразделя-
ются на две группы. В плодах первой группы (авокадо, банан,
цитрусовые, яблоневые, дыня, томат) рост происходит по простой
сигмоидной кривой, т. е. вначале размеры увеличиваются экспо-
ненциально, а затем рост замедляется. В плодах второй группы
(виноград, инжир, маслина, косточковые) развитие носит цикли-
ческий характер, и кривая роста имеет двойную сигмоидную
форму [4, 25].
При увеличении размеров плода два процесса — деление кле-
ток (в сочетании с их разрастанием перед каждым митозом) и
увеличение их размеров — чаще всего происходят последователь-
но один за другим. Обычно начальное разрастание обусловлено
увеличением числа клеток, которое начинается до раскрытия
цветка и продолжается после завязывания плода. Этот этап по-
29*
452
Глава 22
степенно сменяется стадией растяжения клеток, имеющей наи-
большую продолжительность. Такая закономерность описана, на-
пример, для плодов цитрусовых [52] и яблоневых [16]. Исклю-
чением является авокадо, у которого число клеток увеличивается
в течение всего периода роста [З]1. Длительность и время про-
хождения этих двух стадий роста у разных плодов различны.
Окончательный размер плода может определяться размером от-
дельных клеток (косточковые) или их числом (яблоневые) [25].
Многие плоды увеличиваются в объеме в значительной степе-
ни вследствие развития межклетников в сочной паренхиме. В яб-
локах, например, воздушными полостями занято 25% объема, по-
этому во второй период роста объем увеличивается быстрее, чем
вес. У винограда, напротив, в последний период роста вес ягоды
увеличивается быстрее, чем ее объем [25].
Закономерности роста усложняются тем, что плод состоит из
тканей с разными геномами и разным числом хромосом: 2п — ро-
дительский спорофит, 2 п — зародыш, геном которого может быть
другим, Зп — эндосперм. Развитие плода происходит таким обра-
зом, что отдельные его части — перикарпий, кожура семени, эндо-
сперм и зародыш — растут не одновременно. Так, у косточковых
плодов сначала разрастается спорофитная часть семязачатка. За-
тем растут преимущественно эндосперм и зародыш; последним
разрастается мезокарпий [39]. Разные части плода могут иметь
разные кривые роста. У фасоли плод в целом имеет простую
сигмоидную кривую роста, а отдельные части семян—двой-
ную [7].
В различных систематических группах неоднородность струк-
туры плодов выражена неодинаково. У яблони и земляники плод
состоит в основном из родительской ткани, у злаков — из эндо-
сперма, у семянок Asteraceae — из зародыша. Таким образом,
центры роста в плодах различных типов могут быть разными.
У растущих плодов была исследована основная особенность
морфогенеза — полярность распределения делений и увеличения
размеров клеток (рис. 22.16) [30, 46]. Когда меняется направле-
ние роста, меняется отношение длины плода к диаметру, которое
служит в качестве параметра при аллометрических исследованиях
формообразования, т. е. при сравнении темпов роста отдельных
частей органа или организма [44]. У одной из разновидностей
груши отношение длины плода к диаметру в момент полного рас-
крытия цветка было 1,1, через 14 сут — 2,7, в созревшем для убор-
ки плоде (через 133 дня после цветения)—1,3 [1]. У одной из
разновидностей Capsicum аппиит наблюдалось непрерывное уве-
личение отношения длины плода к диаметру, начиная с 1,3 в мо-
мент полного раскрытия цветка и до 2,2 в зрелом плоде. Удли-
нение быстрее всего происходило в основании плода (рис. 22.16)
[30].
Плод
453
Рис. 22.16. Развитие плода Capsicum аппиит var. minimum [30]. Через 5 дней
после полного цветения на плоде тушью были сделаны метки на равном расстоя-
нии друг от друга. На рисунках плодов различных возрастов эти метки соеди-
нены линиями. Видно, что расстояние между ними увеличивается неравномерно:
быстрее всего рост происходит в основании плода.
Развитие плода регулируется многими факторами — как внут-
ренними, так и внешними. Один из внутренних факторов — разви-
тие семени [26, 47]. Открытие того, что при индуцировании роста
плода у земляники обработка плода пастой с ауксином вполне
заменяет семена [31]!, вызвало интенсивное исследование роли
ростовых веществ в развитии плода [25]. Изучение партенокар-
пических плодов привело к выводу, что в таких плодах есть мо-
лодые семязачатки, более того — они необходимы для их разви-
тия. Хотя бессемейные сорта обычно содержат меньше ауксинов
и гиббереллинов, чем семеносные, в развивающихся плодах влия-
ние семязачатков, вероятно, обусловлено тем, что они выделяют
ростовые вещества в решающий период цветения [32].
Вообще говоря, связь роста плодов с ростовыми веществами
очень сложна. Все типы растительных гормонов — ауксины, гиб-
береллины, цитокинины, ингибиторы и этилен — могут влиять на
развитие плода. Поскольку плод — орган сложный, различные его
компоненты растут в некоей предопределенной последовательно-
сти, на разных стадиях которой лимитирующими являются раз-
ные факторы [32]. Если на данном этапе развития плода необ-
ходима гормональная стимуляция, нужный гормон вырабатыва-
ется даже в том случае, когда для вегетативного развития расте-
ния его эффект нежелателен.
Примером связи гормона с определенной стадией развития
плода может служить активация этиленом процессов, ведущих к
созреванию плода. Так, происходит довольно резкое усиление ды-
хания, называемое дыхательным климактерием. Изменение интен-
сивности дыхания, как оказалось, зависит от содержания этиле-
454
Глава 22
на. Таким образом, усиление биосинтеза этилена, а не усиление
дыхания является первичным процессом при переходе плода от
роста к старению. Помимо интенсивного дыхания в плоде в этот
период происходит множество других вторичных процессов. Сре-
ди них — усиление синтеза РНК и белка, а также изменение кле-
точной проницаемости. Роудз [38] определяет термин «климак-
терий» как такой период в онтогенезе некоторых плодов (главным
образом сочных), когда многочисленные биохимические измене-
ния, с которых начинается переход плода от роста к созреванию
и старению, инициируются автокаталитическим образованием эти-
лена.
Опадение плодов
Большой проблемой в садоводстве является склонность плодов
к преждевременному опадению. Поэтому причины опадения пло-
дов, в частности влияние ростовых веществ, интенсивно исследу-
ются физиологами растений [25]. Плоды могут опадать на раз-
личных стадиях развития. В зрелом состоянии они опадают либо
вместе с заключенными в них семенами (невскрывающиеся пло-
ды, большинство сочных плодов), либо после того, как высыпят-
ся семена (вскрывающиеся плоды).
Положение зоны отделения у разных плодов различно, даже
одному и тому же типу плода может быть свойственно несколько
отделительных зон. Плоды типа яблока обычно отделяются у ос-
нования цветоножки. Сливы при раннем опадении отделяются
вместе с плодоножкой, при позднем — без нее. У вишен раннее
отделение происходит у основания плода, позднее — у основания
ножки (этот вариант наиболее удобен при уборке урожая на
продажу) и, наконец, у основания побега, несущего группу пло-
дов. У цитрусовых отделительный слой образуется под завязью,
там, где от цветоложа в плодолистики отходят проводящие пуч-
ки [43].
Степень дифференциации клеток отделительного слоя у раз-
ных плодов различна [10]|. В отделительной зоне у зрелых яблок в
нескольких слоях клетки увеличиваются в размерах, клетки скле-
ренхимы теряют анизотропные свойства вторичных оболочек, за-
тем растворяются срединные пластинки, первичные оболочки и
большая часть вторичных утолщений оболочек. Сосуды и волокна
разрываются. У цитрусовых в зоне отделения накапливается боль-
шое количество крахмала, пектин исчезает, в результате чего
уменьшается прочность клеточных оболочек [53]. Преждевремен-
ное опадение цитрусовых, которое причиняет большие убытки са-
доводам, можно в некоторой степени контролировать с помощью
2,4-дихлорфеноксиуксусной кислоты (2,4-Д). Такая обработка
предотвращает гидролиз пектиновых веществ.
Плод
455
У вишни (Prunus cerasus) отделительный слой между плодом
и плодоножкой появляется за 12—15 дней до созревания [50].
Он состоит из 5—8 рядов клеток и окрашивается гематоксилином.
Когда плод опадает, клетки разделяются без разрыва оболочек,
но позднее сплющиваются. У черешни (Prunus avium) отчетливо-
го отделительного слоя в основании плода не наблюдается.
Большая работа была проделана в связи с разработкой меха-
низированного способа сбора плодов вишен (путем раскачивания
стволов деревьев). При изучении влияния ростовых веществ на
опадение этих плодов специальным прибором измерили силу, не-
обходимую для отрыва плода от плодоножки. Оказалось, что на
ранних стадиях роста плода в связи с дифференциацией тканей
в ножке и плоде эта величина растет, но когда образуется отде-
лительный слой, быстро уменьшается [56]. В это время плод ста-
новится чувствительным к искусственной обработке этиленом, ко-
торая ускоряет потерю прочности на разрыв.
Гистохимическое определение ферментов в зоне отделения со-
зревающих плодов вишни показало, что в области соединения
цветоложа и тканей плода наблюдается особенно высокая актив-
ность дегидрогеназы, кислой фосфатазы и пероксидазы [35]. Бы-
ло обнаружено, что в зоне отделения плода происходит также
синтез белка и РНК [49]. Обработка циклогексимидом, ингибито-
ром синтеза РНК и белка, задерживала опадение плодов. Таким
образом, синтез РНК и белка, вероятно, связан с процессом опа-
дения; возможно, необходим синтез разрушающих оболочку
ферментов, например целлюлазы. Синтез этого фермента возра-
стает при обработке этиленом и абсцизовой кислотой — вещест-
вами, ускоряющими процесс отделения плода [35].
СПИСОК ЛИТЕРАТУРЫ
1. Bain J. М. Some morphological, anatomical, and physiological changes in the
pear fruit (Pyrus communis var. Williams bon Chretien) during development
and following harvest, Aust. J. Bot, 9, 99—123 (1961).
2. Bauman-Bodenheim M. G. Prinzipien eines Fruchtsystems der Angiospermen,
Ber. Schweiz. Bot. Ges., 64, 94—112 (1954).
3. Biale J. B., Young R. E. The avocado pear, chap. 1, pp. 1—63. In: The bioche-
mistry of fruits and their products, Hulme A. C., ed., vol. 2, London and New
York, Academic Press, 1971.
4. Bollard E. G. The physiology and nutrition of developing fruits, chap. 14,
pp. 387—425. In: The biochemistry of fruits and their products, Hulme A. C.,
ed., vol. 1, London and New York, Academic Press, 1970.
5. Bradbury D., Cull I. M., MacMasters M. M. Structure of the mature wheat
kernel. I. Gross anatomy and relationships of parts, Cereal Chem., 33, 329—
342 (1956).
6. Bradbury D., MacMasters M. M., Cull I. M. Structure of mature wheat kernel.
II. Microscopic structure of pericarp, seed coat, and other coverings of the
endosperm and germ of hard red winter wheat, Cereal Chem., 33, 342—360
(1956).
7. Car D. J., Skene K. G. M. Diauxic growth curves of seeds with reference to
French beans, Aust. J. Biol. Sci., 14, 1 —12 (1961).
456
Глава 22
8. Catesson А.-М. Evolution des plastes de pomme au cours de la maturation du
fruit. Modifications ultrastructurales et accumulation de ferritin, J. Microscopie,
9, 949—974 (1974).
9. Devide Z., Ljubesic N. The reversion of chromoplasts to chloroplasts in pump-
kin fruits, Z. Pflanzenphysiol., 73, 296—306 (1974).
10. Esau K. Plant anatomy, 2nd ed., New York, John Wiley & Sons, 1965. [Имеет-
ся перевод: Эсау К. Анатомия растений. — М.: Мир, 1969.]
11. Fahn A., Shotner I., Ben-Gera I. Occurence and structure of epicuticular wax
on juice vesicles of citrus fruits, Ann. Bot., 38, 869—872 (1974).
12. Fisk E. L., Millington W. F. Atlas of plant morphology. Portfolio II: Photo-
micrographs of flower, fruit and seed, Minneapolis, Minnesota, Burgess Publi-
shing Company, 1962.
13. Hall С. B. Cellulase activity in tomato fruits according to portion and maturi-
ty, Bot. Gaz., 125, 156—157 (1964).
14. Hauptli F. Die Sklereidendifferenzierung in Pyrus communis. Morphologische,
anatomosche und histochemische Untersuchungen, Ber. Schweiz. Bot. Ges., 81,
273—318 (1971).
15. Hayward H. E. The structure of economic plants, New York, Macmillan, 1938.
16. Hulme A. C., Rhodes M. J. C. Pome fruits, Chap. 10, pp. 333—373. In: The bio-
chemistry of fruits and their products, Hulme A. C., ed., Vol. 2, London and
New York, Academic Press, 1971.
17. Jackson B. D. A glossary of botanic terms, 4th ed., New York, Hafner Publi-
shing Co., 1953.
18. Каден H. H. Типы продольного вскрывания плодов, Бот. ж., 47, 495—505
(1962).
19. Каден Н. Н. К вопросу о дробных плодах, Бот. ж., 49, 966—973 (1964).
20. Kaniewski К. Hairs in the loculus of the broad-bean (Vicia faba L.) fruit, Bull.
Acad. Sci. Polon., Cl. V, 41, 585—594 (1968).
21. Khudari A. K. The ripening of tomatoes, Amer. Sci., 60, 696—707 (1972).
22. Kiesselbach T. A., Walker E. R. Structure of certain specialized tissues in the
kernel of corn, Amer. J. Bot., 39, 561—569 (1952).
23. Krauss L. Entwicklungsgeschichte der Friichte von Hordeum, Triticum, Bromus
und Poa mit besonderer Beriicksichtigung ihrer Samenschalen, Jb. Wiss. Bot.,
77, 733—808 (1933).
24. Laval-Martin D. La maturation du fruit de tomate cerise: mise en evidence,
par cryodecapage, de 1’evolution des chloroplastes en deux types de chromo-
plastes, Protoplasma, 82, 33—59 (1974).
25. Leopold A. C. Plant growth and development, New York, McGraw-Hill, 1964.
26. Luckwill L. C. Factors controlling the growth and form of fruits, J. Linn. Soc.
London, Bot, 56, 294—302 (1959).
27. Матиенко Б. T. Сравнительная анатомия и ультраструктура плодов тыквен-
ных.— Кишинев: Картя Молдовеняска, 1969.
28. Mohan Ram Н. Y., Ram М., Steward F. С. Growth and development of the
banana plant. 3. A. The origin of the inflorescence and the development of the
flowers. B. The structure and development of the fruit, Ann. Bot, 26, 657—673
(1962).
29. Monsi M. Untersuchungen fiber den Mechanismus der Schleuderbewegung der
Sojabohnen-Hiilse, Jap. J. Bot., 12, 437—474 (1943).
30. Munting A. J. Development of flower and fruit of Capsicum annuum L., Acta
Bot. Neerl., 23, 415—432 (1974).
31. Nitsch J. P. Growth and morphogenesis of the strawberry as related to auxin,
Amer. J. Bot, 37, 211—215 (1950).
32. Nitsch J. P. Hormonal factors in growth and development, Chapter 15, pp. 428—
472. In: The biochemistry of fruits and their products, Hulme A. C., ed., vol. 1,
London and New York, Academic Press, 1970.
33. Pijl L. van der. Principles of dispersal in higher plants, 2nd. ed., Berlin-Hei-
delberg-New York, Springer-Verlag, 1972.
Плод
457
34. Pomeranz Y. From wheat to bread: a biochemical study, Amer. Sci., 61, 683—
691 (1973).
35. Poovaiah B. W., Rasmussen H. P., Bukovac M. J. Histochemical localization
of enzymes in the abscission zones of maturing sour and sweet cherry fruit,
J. Amer. Soc. Hort. Sci., 98, 16—18 (1973).
36. Reeve R. M. Fruit histogenesis in Rubus strigosus. I. Outer epidermis, paren-
chyma, and receptacle, Amer. J. Bot, 41, 152—160 (1954). II. Endocarp tissues,
Amer. J. Bot., 41, 173—181 (1954).
37. Reeve R. M., Brown M. S. Histological development of the green bean pod as
related to culinary texture. 1. Early stages of pod development. 2. Structure
and composition at edible maturity, J. Food Sci., 33, 321—331 (1968).
38. Rhodes M. J. C. The climacteric and ripening of fruits, Chap. 17, pp. 521 —
533. In: The biochemistry of fruits and their products, Hulme A. C., ed., vol. 1,
London and New York, Academic Press, 1970.
39. Romani R. J., Jennings W. G. Stone fruits, Chap. 12, pp. 411—436. In: The
biochemistry of fruits and their products, Hulme A. C., ed., vol. 2, London and
New York, Academic Press, 1971.
40. Rost T. L., Lersten N. R. Transfer aleurone cells in Setaria lutescens (Grami-
neae), Protoplasma, 71, 403—408 (1970).
41. Rost T. L., Lersten N. R. A synopsis and selected bibliography of grass caryop-
sis anatomy and fine structure, Iowa State J. Res., 48, 47—87 (1973).
42. Sanders E. H. Developmental morphology of the kernel in grain sorghum, Ce-
real Chem, 32, 12—25 (1955).
43. Schneider H. The anatomy of citrus, Chap. 1, pp. 1—85. In: The citrus industry,
Reuther W, Batchelor L. D., Weber H. J., eds, Berkeley, California, University
of California, Division of Agricultural sciences, 1968.
44. Sinnott E. W. Plant morphogenesis, New York, McGraw-Hill, 1960.
45. Skene D. S. The fine structure of apple, pear, and plum fruit surfaces, their
changes during ripening, and their response to polishing, Ann. Bot., 27, 581—
587 (1963).
46. Skene D. S. The distribution of growth and cell division in the fruit of Cox’s
Orange Pippin, Ann. Bot., 30, 493—512 (1966).
47. Staritsky G. The morphogenesis of the inflorescence, flower and fruit of Py-
rus nivalis Jacquin var. orientalis Terpo, Med. Landbouwhogesch., Wagenin-
gen, 70, 1—91 (1970).
48. Sterling C, Developmental anatomy of the fruit of Prunus domestica L., Bull.
Torrey Bot. Club, 80, 457—477 (1953).
49. Stdsser R. Localization of RNA and protein synthesis in the developing abscissi-
on layer in fruit of Prunus cerasus L, Z. Pflanzenphysiol., 64, 328—334 (1971).
50. Stdsser R., Rasmussen H. P., Bukovac M. J. A histological study of abscission
laver formation in cherry fruits during maturation, J. Amer. Soc. Hort. Sci.,
94, 239—243 (1969).
51. Thomson W. W., Lewis L. N., Coggins C. W. The reversion of chromoplasts
to chloroplasts in Valencia oranges, Cytologia, 32, 117—124 (1967).
52. Ting S. V., Attaway J. A. Citrus fruits, Chap. 3, pp. 107—169. In: The biochemi-
stry of fruits and their products, Hulme A. C, ed., vol. 2, London and New
York, Academic Press, 1971.
53. Wilson W. C., Hendershott С. H. Anatomical and histological studies of abscis-
sion of oranges, Proc. Amer. Soc. Hort. Sci., 92, 203—210 (1968).
54. Winkler H. Versuch eines «naturlichen» Systems der Frfichte, Beitr. Biol.
Pflanz, 26, 201—220 (1939).
55. Winkler H. Zur Einigung und Weiterfiihrung in der Frage des Fruchtsystems,
Beitr. Biol. Pflanz, 27, 92—130 (1940).
56. Wittenbach V. A, Bukovac M. J. Cherry fruit abscission. Evidence for time of
initiation and the involvement of ethylene, Plant Physiol, 54, 494—498 (1974).
57. Zee S.-Y., O'Brien T. P. Studies on the ontogeny of the pigment strand in the
caryopsis of wheat, Aust. J. Biol. Sci, 23, 1153—1171 (1970).
58. Zee S.-Y., O'Brien T. P. Aleurone transfer cells and other structural features
of the spikelet of millet, Aust. J. Biol. Sci, 24, 391—395 (1971).
Глава 23
Семя
Общее представление и морфология
В семени проходят первые этапы развития нового спорофита —
зародыша, и именно семена обеспечивают преемственность между
сменяющими друг друга поколениями семенных растений. В этой
главе мы рассмотрим семя покрытосеменных. Оно развивается из
семязачатка в результате двойного оплодотворения. В зрелом
семени зародыш защищен окружающей его семенной кожурой и
обеспечен запасом питательных веществ. Семена имеют больше
шансов выжить и дать начало новым поколениям, чем споры.
Способность к семеобразованию позволила семенным растениям,
прежде всего покрытосеменным, завоевать господство в расти-
тельном мире: в последние геологические эпохи они доминируют
над споровыми растениями [23].
Семена являются важным продуктом питания животных и че-
ловека. Среди покрытосеменных представители семейства Роа-
сеае дают наибольшее количество пищевых семян по сравнению
с растениями других семейств; семейство Fabaceae в этом отно-
шении занимает второе место. Семена используются не только
для питания, но в самых разнообразных целях: из них приготов-
ляют напитки (кофе, какао, пиво), лекарства, волокна (хлопок),
технические масла [54]'.
Собственно семя представляет собой созревший семязачаток,
содержащий зародыш и запас питательных веществ, и интегумен-
ты, превратившиеся в защитную семенную кожуру, или тесту
(рис. 23.1). У растений существуют и другие единицы диссемина-
ции (диаспоры [16]), по функции аналогичные семенам. К та-
ким диаспорам относятся некоторые односеменные плоды, напри-
мер семянка Asteraceae, зерновка Роасеае, мерикарпий Apia-
сеае и др.
До тех пор пока вырастающий из семени спорофит не станет
способным к фотосинтезу, его существование поддерживается за
счет запасов питательных веществ в семени. Следовательно, од-
ной из основных функций семени является хранение запасных
питательных веществ. В некоторых семенах они располагаются в
основном вне зародыша — в эндосперме или перисперме. Эндо-
сперм развивается из двух полярных ядер, слившихся с ядром
спермия в центральной клетке зародышевого мешка, а пери-
сперм— это нуцеллярная ткань спорофита. Однако у многих
двудольных эти ткани недолговечны и целиком или частично по-
Семя
459
Рис 23 1 Схемы продольных срезов семени Crotalaria intermedia (Fabaceae),
сделанных параллельно (А) и перпендикулярно (Б) плоскости семядолей. В
Зародыш, извлеченный из семени (Воспроизводится из работы [31] с некото-
рыми изменениями) 1 — семенная кожура, 2— семядоля; 3 — гипокотиль, 4 —
эндосперм, 5 — корешок зародыша
глощаются развивающимся зародышем еще до того, как семя пе-
рейдет в состояние покоя. В этом случае запас питательных ве-
ществ содержится в тканях зародыша, особенно в семядолях
В процессе превращения семязачатка в семя его части так или
иначе изменяются. Большую часть семени занимает зародыш (один
или вместе с эндоспермом), тогда как интегументы по мере пре-
вращения в семенную кожуру обычно сильно уменьшаются в
толщину и подвергаются частичному распаду. Микропиле исче-
зает, иногда на его месте видно заполненное тканью отверстие.
Вся или часть семеножки (фуникулуса) отпадает от семязачат-
ка, оставляя рубчик (hilum). В анатропных семязачатках прирос-
шая к ним часть фуникулуса остается в виде продольного греб-
ня— семенного шва — с одной стороны семени.
Разнообразие морфологии семян среди покрытосеменных при
относительном постоянстве структуры в мелких систематических
группах позволяет использовать особенности семян в системати-
ке [29, 33, 54]. Однако, несмотря на большое значение опреде-
ления растений по семенам в сортоиспытательной и селекционной
работе, сравнительная морфология семян разработана довольно
слабо.
Из внешних признаков семян важны форма, размер, характер
поверхности семенной кожуры, расположение рубчика, наличие
или отсутствие таких структур, как присемянник, или ариллус
(вырост фуникулуса), карункула (вырост интегумента возле мик-
ропиле) и элайосом (маслянистый придаток, поедаемый муравья-
ми). При изучении поверхности семян чрезвычайно эффективным
оказался сканирующий электронный микроскоп [7, 58]. Что ка-
сается внутреннего строения, то анатомические признаки Семен-
460
Глава 23
Типы зародышей
а:
3
головчатый
(рурегасеаё)
латеральный
(Роасеае)
рудиментарный широкий
(Ranunculaceae) (tiymphaeacea^
St
(Chenopodiaceae)
* ПОДОТДЕЛ
Г" ЛИНЕЙНЫЕ
лопатчатый
(Rosaceae)
ПОДОТДЕЛ
МИНИАТЮРНЫЕ
’изогнутый складчатый заполняющий
(Moraceae) (Convolvulaceae) (Mlmosaceae)
Рис. 23.2. Продольные срезы зрелых семян. Классификация семян Марти-
на [29], сделанная на основе исследования величины, формы и положения
зародыша семян 1287 родов голосеменных и покрытосеменных. Зародыш заштри-
хован. В скобках в качестве примеров приведены названия семейств, для кото-
рых данный тип семени характерен. Впоследствии Мартин [29] объединил пери-
ферический и базальный типы зародыша в один тип. (Воспроизводится из ра-
боты [29] с некоторыми изменениями.)
ной кожуры имеют, по-видимому, наибольшее значение для уста-
новления связей между таксонами [31, 35, 54, 55, 60]. При иссле-
довании особенностей развития семян важным признаком явля-
ется положение семязачатка (прямое или различным образом
изогнутое) [11, 48]!. Мартин в качестве основного систематиче-
Семя
46 F
ского признака избрал зародыш, подразделив все семена по фор-
ме, размеру и положению зародыша на три группы и двенадцать
типов (рис. 23.2) [29].
Развитие семени
Двойное оплодотворение инициирует процесс, завершающийся
образованием семени. Рост и дифференциация семязачатка, заро-
дышевого мешка, эндосперма и зародыша представляют собой
взаимозависимые этапы, сменяющие друг друга в определенной
последовательности. На примере изменений относительного объе-
ма семязачатка, эндосперма и зародыша в развивающемся семе-
ни гороха можно проследить основные закономерности такого ин-
тегрального развития [28]. После оплодотворения рост семяза-
чатка вскоре сменяется ростом эндосперма (рис. 23.3). Разра-
стание эндосперма связано с увеличением размеров зародышево-
го мешка (рис. 23.4). Зародыш увеличивается в объеме послед-
ним, но после того, как эндосперм достигнет максимального объе-
ма, начинает расти очень быстро. Клетки в зародыше гороха пе-
рестают делиться, когда семя еще не сформировалось и наполо-
вину. Эта особенность была обнаружена и у других двудольных
[12]. Все последующее развитие является результатом роста от-
Рис. 23.3. Графики относитель-
ных изменений объема всего
семязачатка, эндосперма и за-
родыша в процессе развития
семени у Pisum sativum (ср.
рис. 23.4). Объем семязачатков
и зародышей определяли ме-
тодом вытеснения жидкости из
трубок различного диаметра.
Объем неклеточного эндоспер-
ма определяли, перенося его
жидкое содержимое в калибро-
ванные микропипетки. (Воспро-
изводится из работы [28] с не-
которыми изменениями.) О се-
мязачаток; ф зародыш; Д эн-
досперм.
Стадия развития (см рисЛЪА)
462
Глава 23
Рис 23 4 Развитие семени у Pisum sativum Чтобы показать соотношение между
ростом зародыша эндосперма (показан контур зародышевого мешка), с одной
стороны и всего семязачатка — с другой, рисунки сделаны при различном уве-
личении Представление о различии между собственно зародышем и подвеском
дают рис Б и Д Цифры под рисунками обозначают определенные стадии разви-
тия семени посте оплодотворения и соответствуют цифрам на оси абсцисс
рис 23 3 В стадии 7 (£) подвесок уже отсутствует Каждая масштабная ли-
нейка соответствует 1 мм (Воспроизводится из работы [28] с некоторыми из-
менениями ) 1 — зародышевый мешок, 2— зародыш, 3— подвесок, 4 — микро-
пиле
дельных клеток У гороха зародыш растет, потребляя эндосперм,
поэтому объем последнего уменьшается, а зародыш к наступле-
нию периода покоя почти полностью заполняет зародышевый ме-
шок (рис 23 3 и 23 4). Подвесок (суспензор) на этой стадии раз-
рушается [8]
Поглощение зародышем веществ из эндосперма было экспери-
ментально показано у Aescuius вводимые в зародышевый мешок
субстраты, меченные 14С, оказывались в семядолях [24]1. В расту-
щий зародышевый мешок вода и растворенные вещества поступа-
ют из смежных тканей семязачатка, а те в свою очередь снабжа-
ются водой, фотоассимилятами и азотом из вегетативных частей
растения через проводящие пучки в фуникулусе [39] Перенос
питательных веществ к зародышевому мешку через ткани семяза-
чатка связан с более или менее интенсивным перевариванием по-
следних
Семя
463
Развивающиеся эндосперм и зародыш содержат довольно боль-
шое количество гормонов [14, 24]. Было обнаружено, что у горо-
ха в растущих плодах изменение количества экстрагируемых гиб-
береллинов, ауксина и абсцизовой кислоты связано с изменением
темпа роста створок боба и семян; рост створок определялся об-
разующимися в семенах гормонами. Рост семязачатков иницииру-
ется оплодотворением; активируются уже имеющиеся гормоны и
индуцируется синтез новых.
Для более полного понимания семяобразования следует иметь
в виду, что эмбриогенез представляет собой подготовительный
этап, необходимый для успешного прорастания семени и что обе
эти фазы жизненного цикла следует рассматривать вместе [12].
В процессе эмбриогенеза питающие ткани как вне зародыша, так
и в самом зародыше синтезируют и запасают большое количество
питательных веществ. При прорастании тип обмена этих клеток
меняется на противоположный, и теперь они гидролизуют пита-
тельные вещества. При столь глубокой перестройке метаболизма
должны происходить активация одних генов и репрессия других.
Семенная кожура
В зависимости от специфических особенностей семязачатка
(числа и толщины интегументов, свойств проводящей системы,
характера превращения интегументов во время созревания семе-
ни и др.) структура семенной кожуры может быть различна. Се-
мена покрытосеменных имеют, как правило, сухую семенную ко-
журу, хотя у некоторых встречаются мясистые придатки (напри-
мер, элайосомы), иногда кожура содержит сочные слои (напри-
мер, съедобная наружная эпидерма семенной кожуры у Punica).
Мясистая семенная кожура обычна у голосеменных, а также у
палеозойских семенных папоротников. Как говорилось в гл. 22,
семена с сочными покровами рассматриваются как более прими-
тивные; на смену им пришли сначала семена с редуцированными
мясистыми съедобными, привлекающими животных частями (арил-
лусом, карункулой, элайосомом), а затем сухие семена, которые,
однако, могут быть заключены в сочную стенку плода.
Семенная кожура служит для защиты заключенного в ней за-
родыша, однако помимо того, что и защитная функция достаточно
сложна и многообразна, у некоторых семян кожура, вероятно,
влияет на прорастание, приурочивая его ко времени и условиям,
наиболее благоприятным для развития проростка [56]. Тормо-
жение прорастания может быть связано с высокой степенью не-
проницаемости семенной кожуры для воды или для кислорода
или для того и другого вместе. Такого рода эффект можно объяс-
нить наличием кутикулярных слоев и их распределением. В со-
464
Глава 23
здании непроницаемости семенной кожуры для воды, по-видимо-
му, участвуют также фенольные соединения [27]. У некоторых
видов (Fraxinus, Rosa, Crataegus) семенная кожура оказывает
росту зародыша механическое сопротивление.
Нарушение покоя семян зависит от соотношения между инги-
биторами и стимуляторами роста. Растение продуцирует целый
ряд ингибиторов прорастания, некоторые из них локализованы в
стенке плода или семенной кожуре [3]. Удаление семенной кожу-
ры, одной или вместе с приросшими к ней покровами (перикар-
пием и другими частями цветка у злаков) стимулирует прора-
стание семян; этот факт свидетельствует о том, что внешние по-
кровы семени содержат ингибиторы прорастания [13, 44].
Семенные покровы у некоторых видов растений нмеют особен-
ности, способствующие распространению семян [16]. Кожура се-
мян, поедаемых животными и человеком, может быть устойчива
к пищеварительным процессам, что позволяет семенам проходить
через пищеварительный тракт без всякого вреда. Эпидерма неко-
торых семян состоит из слизевых клеток и при контакте с водой
набухает и становится клейкой, благодаря чему такие семена мо-
гут прилипать к животным и переноситься ими в благоприятные
места для произрастания или, наоборот, прилипать к почве и та-
ким образом избегать переноса ветром или дождем в неблагопри-
ятные условия. Слизь может защищать прорастающие семена от
высыхания, а также влиять на сам процесс прорастания, препят-
ствуя поступлению кислорода в условиях избыточной влажности,
которое может повредить проростки. Распространение семян мо-
жет облегчаться благодаря срастанию их с соответствующими
структурами, развивающимися из других частей цветка; часто в
качестве приспособления к распространению семян развивается
плод [16]. Ниже описаны особенности семенных покровов у не-
которых растений.
Ricinus
Семя Ricinus (Euphorbiaceae) развивается из семязачатка с
двумя интегументами (двупокровного) и крупным нуцеллусом
(крассинуцеллятного, рис. 23.5, Л). В семязачатке проводящий
пучок проходит через фуникулус в халазальную зону и разветв-
ляется во внутреннем интегументе, образуя хорошо заметное на
поперечных срезах кольцо (рис. 23.5,5/ Зародышевый мешок
глубоко погружен в нуцеллус, который полностью закрыт интегу-
ментами. Микропиле образовано обоими интегументами. В него
немного вдается вырост плаценты, или обтуратор. После оплодо-
творения происходит следующее [50]!. В наружном интегументе
внешние эпидермальные клетки тангенциально разрастаются и
Семя
465
Рис 23 5. Семя Ricinus communis (Euphorbiaceae). А. Продольный разрез семя-
зачатка со зрелым зародышевым мешком. Б. Поперечный разрез семязачатка на
той же стадии развития, что и на рис. А. В Продольный разрез незрелого семе-
ни Г Продольный разрез зрелого семени (Рис А—В воспроизводятся из рабо-
ты [50] с некоторыми изменениями ) / — нуцеллус; 2 — микропиле; 3 — карун-
кула, 4 — обтуратор; 5 — зародыш; 6 — внутренний интегумент; 7— фуникулус;
8— зародышевый мешок; 9 — проводящая ткань; 10 — наружный интегумент;
11 — проводящие пучки; 12— эпидермальный слой; 13— эндосперм; 14 — семен-
ная кожура
накапливают коричневый пигмент, которым обусловлен цвет семе-
ни. Внутренние эпидермальные клетки принимают колоннообраз-
ную форму; мезофилл между двумя эпидермальными слоями раз-
рушается. Около микропиле развивается карункула, которая ото-
двигает обтуратор к плаценте. Клетки наружной эпидермы внут-
реннего интегумента удлиняются в радиальном направлении, рас-
полагаются палисадно и склерифицируются. Толстый слой мезо-
филла и внутренняя эпидерма внутреннего интегумента разруша-
ются. Нуцеллярные клетки в области микропиле по мере развития
эндосперма и зародыша разрастаются и вакуолизируются, а в
халазальной зоне многократно делятся. Семя растет в основном
благодаря этой меристематической активности. Затем микропи-
30 К Эзау, кн 2
466
Глава 23
лярные нуцеллярные клетки, за исключением тех, к которым при-
крепляется зародыш, разрушаются, в то время как халазальная
ткань вокруг разросшегося зародышевого мешка сохраняется
(рис. 23.5, В). По мере развития эндосперма нуцеллярная ткань
оттесняется кнаружи, превращаясь в слой смятых клеток, высти-
лающих семенную кожуру. В зрелом семени эндосперм занимает
большую его часть, зародыш располагается вдоль семени по всей
длине (рис. 23.5, Г).
Brassica и Sinapis
Двупокровные семязачатки Brassicaceae имеют довольно тол-
стые интегументы. Наружный содержит 2—5 слоев клеток, внут-
ренний— до 10. У многих видов эпидермальные клетки наружного
интегумента почти целиком заполняются слоями слизистого ве-
щества [53] (рис. 23 6). При соприкосновении с водой слизь, со-
стоящая из пектина и целлюлозы, набухает и у некоторых видов
разрывает наружную стенку клетки, образуя на поверхности се-
мени студенистую пленку [13]. По данным электронной микро-
скопии в семени Plantago ovata в образовании слизи и ее выде-
лении из клетки в виде пузырьков участвуют диктиосомы [19].
В семени Brassica мощные отложения целлюлозы на внутренней
тангенциальной стенке эпидермы могут образовывать радиально
ориентированные утолщения в форме балок, по одной в каждой
клетке (рис. 23.6,5). Если в наружном интегументе имеется суб-
эпидермальная паренхима, то она или разрушается (рис. 23 6, А),
или же в ее клетках образуются утолщенные оболочки
Рис 23 6 Поперечные срезы семенной кожуры и алейронового слоя (Cernohor-
sky, Graines des Cruciferes de Boheme Opera Botamca Cechica, vol. 5, 92 pp,
1947) A Brassica Б Stnapts 1 — слои слизи, 2— наружный интегумент, 3—
целлюлозная полоска; 4 — внутренний интегумент, 5 — пигментный слой, 6 —
алейроновый слой, 7 — крахмалистый эндосперм
Семя
467
(рис. 23.6,5/ Внутренняя эпидерма наружного интегумента —
палисадный слой — у большинства видов представляет собой наи-
более прочный слой, так как ее клетки имеют лигнифицирован-
ные утолщения на радиальных и внутренней тангенциальной
стенках [55]1 Эти клетки очень хорошо заметны и наиболее удоб-
ны для использования в качестве систематического признака.
Внутренний интегумент отмирает и сдавливается У некоторых
видов внутренняя эпидерма этого интегумента превращается в
пигментный слой. После того как клетки палисадного слоя от-
мирают, их оболочки также могут пигментироваться [13].
Cucurbita
Семя Cucurbitaceae (рис 23.7, А) развивается из двупокровно-
го крассинуцеллятного семязачатка, однако внутренний интегу-
мент разрушается уже на ранних стадиях развития семени. Та-
ким образом, семенная кожура происходит только из наружного
интегумента [49]. Внутренний интегумент тонкий, а наружный, до-
вольно толстый, состоит (в зависимости от вида растения) из 8—
14 клеточных слоев. После оплодотворения наружный интегумент
еще увеличивается в толщину за счет периклинальных делений и
дифференцируется на несколько хорошо различимых слоев (фото
138, А). По окончании периклинальных делений самый наружный
слой — теперь это эпидерма семенной кожуры — состоит из ради-
ально-удлиненных клеток (длиной 100—600 мкм) с более или
менее утолщенными неодревесневшими оболочками (на фо-
то 138, Л этот слой разрушен). Компактная гиподерма, которая
может быть различной толщины, состоит из мелких клеток с уме-
ренно утолщенными одревесневшими оболочками (утолщения обо-
Рис 23 7 Схемы поперечных срезов семян A Cucurbita Б Phaseolus 1 — про-
водящий пучок, 2 — склеренхима, 3 — семенная кожура, 4 — семядоля, 5 — груп-
па трахеид, 6 — рубчик, 7 — палисадный слой
30*
468
Глава 23
лочек имеют вид сети). Под гиподермой располагается слой скле-
ренхимы, состоящий из слабо ветвящихся склереид с толстыми
одревесневшими оболочками. Под склеренхимой находится рых-
лая паренхима (аэренхима), состоящая из разветвленных кле-
ток. Непосредственно под склеренхимой клетки паренхимы мел-
кие и располагаются плотно. Под аэренхимой лежат тангенциаль-
но вытянутые тонкостенные клетки хлоренхимы, самые внутрен-
ние из которых образуют внутреннюю эпидерму наружного инте-
гумента. Вблизи зародыша имеются несколько нуцеллярных и эн-
доспермальных клеток. Нуцеллус в зрелом семени представлен
2—4 слоями, его эпидерма имеет кутикулу. В сухих семенах хло-
ренхима обычно отделена от семенной кожуры и имеет вид тон-
кой зеленой пленки, которая вместе с внутренней эпидермой
плотно облегает зародыш и остатки внутреннего интегумента, ну-
целлуса и эндосперма.
Glycine и Phaseolus
Семя Fabaceae (рис. 23.7, Б) развивается из семязачатка с
двумя интегументами. Внутренний интегумент в процессе онто-
генеза исчезает, а наружный разделяется на несколько слоев.
Наружный слой — эпидерма — остается однорядным и превраща-
ется в палисадный слой склереид (макросклереиды, см. гл. 6) с
неравномерно утолщенными оболочками (фото 138,5 и 139). В об-
ласти рубчика палисадных слоев два, причем наружный образу-
ется из фуникулуса (фото 139,5). Клетки субэпидермального
слоя дифференцируются в так называемые колончатые клетки, на-
зываемые также клетками-опорами, клетками в форме песочных
часов, остеосклереидами или колбовидными склереидами в зави-
симости от характера утолщений оболочки и формы клеток (фо-
то 138,5, 139,5 и рис. 23.8). Расположенная под ними ткань
представляет собой рыхлую паренхиму, в наружных слоях кото-
рой клетки крупные, тангенциально вытянутые, а во внутренних —
более мелкие и сильнее разветвленные (фото 139,5). Субэпидер-
мальный слой и лежащая под ним паренхима имеют общее про-
исхождение (фото 139, Л). Проводящая система семян у многих
бобовых хорошо развита. От фуникулуса проводящий пучок про-
ходит до халазальной зоны и там разветвляется. В области руб-
чика находится компактная группа трахеид, функция которых
неизвестна (фото 139, В).
Палисадный слой вызывает особый интерес, так как очень низ-
кая проницаемость твердых семян некоторых бобовых, по-видимо-
му, связана с его структурой. Наиболее непроницаема, вероятно,
та зона палисадных клеток, которую называют светлой линией
(рис. 23.8). Впечатление светлой линии на срезе семени созда-
Семя
469
Рис 23 8 Схема строения семенной кожуры и сросшихся с нею тканей у Сго-
talaria intermedia (Fabaceae, поперечный срез) Семенная кожура 1 — кутикула,
2— светлая линия, 3 — макросклереиды, 4 — лагеносклереиды (колбовидной
формы) с межклетниками (5) между ними, 6 — паренхима (в основном разру-
шена) Сросшиеся с кожурой ткани 7—алейроновый эндосперм, 8 — эндосперм
под алейроновым слоем, 9 — семядоля Вторичные оболочки закрашены серым
(Воспроизводится из работы [31] с некоторыми изменениями ) ф запасной бе
лок, О липидные глобулы
ется вследствие очень сильного преломления света в узком уча-
стке оболочки эпидермальных клеток На срезах эти участки рас-
полагаются тангенциально несколько выше середины клеток или
вблизи наружных стенок Клеточная оболочка в зоне светлой ли-
нии представляется особенно плотной [17]
В твердых семенах бобовых поддерживается очень низкая
влажность, на которую не влияют колебания влажности окружа-
ющего воздуха Способность семян так сильно высыхать объяс-
няют тем, что семенная кожура чрезвычайно влагонепроницаема,
а рубчик действует как гигроскопический клапан [20] В рубчи-
ке вдоль бороздки имеется трещина, которая раскрывается в су-
хом воздухе и закрывается во влажном В результате внутрь
влага не поступает, а удаляется беспрепятственно
470
Глава 23
Запасающие ткани
Семена, запасающие питательные вещества в эндосперме (у
однодольных, см. рис. 23.10, Г и гл. 22) или перисперме (у Аша-
ranthaceae, Chenopodiaceae, Polygonaceae), называют белковыми,
а те, в которых этих тканей нет, — безбелковыми (рис. 23.7). Од-
нако разница между этими двумя типами семян не абсолютна,
так как обычно в семенах питательные вещества хранятся и в
зародыше, и вне его, так что отношение объема зародыша к объе-
му эндосперма и перисперма может быть различным.
Эндосперм характерен для покрытосеменных. Это триплоидная
ткань, так как происходит от трех гаплоидных ядер — двух по-
лярных и ядра спермия, — сливающихся в центральной клетке
зародышевого мешка. Однако в некоторых таксонах число слива-
Рис 23 9 Развитие эндосперма у Zea mays А, Б Зигота и несколько ядер эн-
досперма через 26 и 34 ч после опыления В, Г Зародыш, состоящий из не-
скотьких клеток, и делящиеся ядра эндосперма, переход от 128- к 256-свободно-
ядерной стадии через 3 сут после опыления Д Переход от свободноядерной
к клеточной стадии через 3,5 сут после опыления, фрагмопласты между ядрами
связаны с клеточными пластинками Е, Ж Клеточный эндосперм через 4 сут
посте опыления (Изображены срезы зародышевых мешков А, В, Е — попереч-
ные, Б, Г, Ж — продольные, Д— косой Перерисовано из работы [40].) 1—зи-
гота, 2— антиподы, 3 — зародыш
Семя
471
ющихся с мужской гаметой полярных ядер может быть иным
[26].
Считается, что существуют три способа образования эндоспер-
ма— ядерный, клеточный и гелобиальный (последний термин об-
разован по названию таксона однодольных Helobieae). В ядерном
эндосперме в результате свободных ядерных делений образуется
много ядер. Эндосперм может оставаться неклеточным или же
впоследствии появляются клеточные оболочки (рис. 23.9). В кле-
точном эндосперме образование клеточных оболочек начинается
одновременно с первым митозом (см. гл. 21) и продолжается все
время, пока эндосперм растет. В гелобиальном эндосперме заро-
дышевый мешок делится на две неравные клетки, из которых бо-
лее крупная (халазальная) обычно развивается неклеточным пу-
тем, а мелкая (микропилярная) может вести себя различно. Гело-
биальный тип встречается главным образом у однодольных [51].
По вопросу о филогенетических связях между тремя типами фор-
мирования эндосперма нет единого мнения [52, 59].
В эндосперме ядерного типа свободные ядра сосредоточива-
ются обычно в постенном слое цитоплазмы, а центр клетки занят
крупной вакуолью (рис. 23.9, Г). У Capsella, однако, ядра эндо-
сперма сосредоточены на противоположных концах зародышево-
го мешка; халазальный конец эндосперма участвует в перевари-
вании нуцеллярных клеток [45, 46]. У ряда растений нуцелляр-
ные клетки, перед тем как разрушиться около растущего зароды-
шевого мешка, сильно разрастаются и обогащаются цитоплазмой
(Aesculus [24], Allium [57], Capsella [45]). В опытах с Сар-
sella было обнаружено, что во время роста гипертрофированные
нуцеллярные клетки окрашиваются на белок и нуклеиновые кис-
лоты и быстро включают предшественники нуклеиновых кислот,
что, вероятно, объясняется полиплоидностью этих клеток. При
распаде нуцеллярных клеток крупные вакуоли в прилегающем
эндосперме заполняются пузырьками и продуктами разрушения
цитоплазмы. Гипертрофированные клетки нуцеллуса неправильно
называть «халазальной пролиферирующей тканью», поскольку
при их специализации деления клеток не происходит.
У Eranthis hiemalis (Ranunculaceae) ядерный эндосперм
поглощает прилежащие интегументальные клетки [38]. Когда обо-
лочки интегумента разрушаются, его ядра мигрируют в эндосперм
и распадаются там на отдельные фрагменты. К тому времени ког-
да в эндосперме образуются оболочки, число интегументальных
слоев, окружающих зародышевый мешок, уменьшается с 11 до 7.
Непосредственно перед переходом эндосперма в клеточное со-
стояние в росте семязачатка и эндосперма наступает период по-
коя, во время которого в эндосперме появляются многочисленные
автофаговые вакуоли. Эти вакуоли изолируют и переваривают
участки цитоплазмы и органеллы [9]. Некоторые авторы пред-
472
Глава 23
полагают, что этот процесс служит для переработки попавшего
в гаметофитный эндосперм цитоплазматического материала споро-
фита.
Образование клеточных оболочек в эндосперме начинается в
тот период, когда ядра занимают постенное положение. Сначала
клеточный эндосперм появляется в микропилярной зоне, около
зародыша (рис. 23.9, Е, Ж). Клеточные оболочки образуются
обычно при участии фрагмопластов и клеточных пластинок
(рис. 23.9, Е). У Stellaria media, однако, некоторые эндоспермаль-
ные оболочки формируются свободно, подобно тому как растут
направленные внутрь выросты оболочки [37]. Оболочки такого
типа образуются в микропилярной зоне одновременно с оболочка-
ми из клеточных пластинок. По данным электронной микроско-
пии, у Pisum эндоспермальные клетки откладывают слой оболоч-
ки рядом с наружной оболочкой зародыша, и, таким образом,
стенка между зародышем и эндоспермом представляет собой ти-
пичную межклеточную пограничную зону, состоящую из двух
первичных оболочек и срединной пластинки [28].
Клеточный эндосперм постепенно вытесняет центральную ва-
куоль. Образование клеток в постенной зоне может быть столь
же упорядоченным, как в камбии; в конце концов наружный слой
клеток превращается в алейроновый слой [13, 36, 40]. У Cocos
nucifera центральная полость остается не занятой клетками и за-
полняется соком — кокосовым молоком [10]. У некоторых расте-
ний эндосперм образует гаустории, которые врастают в различ-
ные ткани семязачатка и служат дополнительным приспособлени-
ем для питания растущего зародыша.
Основными запасаемыми питательными веществами являются
углеводы, белки и липиды. В семенах всегда содержится все три
типа соединений, но их относительное количество в семенах ра-
стений различных таксонов может быть различным [54]. Так,
семена хлебных злаков содержат 70—80% крахмала (в расчете
на сухой вес), семена гороха и фасоли — около 50%. Хотя основ-
ным запасным веществом у Zea является крахмал, большая
часть которого находится в эндосперме, зародыш содержит также
около 50% масла. В семенах рапса и горчицы (Brassicaceae) 40%
масла и 30% белка, сои (Fabaceae)—20%! масла и 40% белка.
Углеводы
Крахмальные зерна в виде простых или сложных гранул обра-
зуются в амилопластах. В эндосперме хлебных злаков часто встре-
чаются одновременно мелкие и крупные крахмальные зерна
(рис. 23.10, Л); последние появляются на более поздних стадиях
развития семени. Синтез крахмала в эндосперме пшеницы проис-
ходит в середине периода формирования периферического слоя,
Семя
473
Рис. 23.10. Эндосперм и зародыш. А. Крахмалистый эндосперм зерновки Secale
cereale. Б—Г. Asparagus officinalis. Б. Толстостенный эндосперм. В. Паренхима се-
мядоли с ядрами и запасными питательными веществами. Г. Продольный разрез
семени. (Рис. Б—Г воспроизводятся из работы Robbins, Borthwick, Bot. Gas., 80,
426—438, 1925.) 1 — семядоля; 2 — апекс побега; 3— корень; 4 — зародыш.
так что когда наступает период покоя, более старые внутренние
клетки накапливают крахмала больше, чем молодые наружные
[15]. У Zea такая зависимость накопления крахмала при перехо-
де от верхнего эндосперма к нижнему выражена еще сильнее
[22]. В зрелых семенах Роасеае и некоторых других семейств
крахмалистый эндосперм не живой и крахмальные зерна лишены
оболочки амилопластов [6, 34].
Во время прорастания поверхность крахмальных зерен стано-
вится изъеденной, так как начинается гидролиз крахмала. При
этом фосфорилазная активность сменяется а-амилазной и маль-
тазной. У хлебных злаков расщепление запасных веществ эндо-
сперма катализируется ферментами, секретируемыми алейроно-
вым слоем. Считается, что синтез ферментов в алейроновом слое
стимулируется гиббереллинами (ГКз), так как может быть вызван
в изолированном алейроновом слое экзогенной ГКз [6]. Цитохи-
мическое определение фосфатазы у ячменя in vitro и in vivo пока-
зало, что при набухании семян активность этого фермента возра-
стает независимо от добавления ГКз и что большая часть фер-
мента сосредоточена в клеточных оболочках. В присутствии ГК3
оболочка, однако, разъедается, и фермент высвобождается и пе-
реходит в эндосперм. Это наводит на мысль, что ГКз контроля-
474
Глава 23
рует выход фосфатазы, а синтез некоторых ферментов от нее не
зависит [2].
Биохимическая специализация наружного слоя эндосперма как
алейронового слоя характерна не только для хлебных злаков
(рис. 23.6 и 23.8). Было показано, что у некоторых Fabaceae рас-
щеплению углеводов в клетках эндосперма сопутствуют перевари-
вание белковых телец и разрушение клеточных оболочек в наруж-
ном слое эндосперма [41]. Следовательно, этот слой функциони-
рует как алейроновый, синтезируя за счет своих запасных белков
ферменты и секретируя их через разрушенные клеточные оболоч-
ки во внутренние слои эндосперма.
Образующаяся при гидролизе крахмала эндосперма хлебных
злаков глюкоза поглощается щитком, превращается в полисахари-
ды и транспортируется в растущий проросток. Необходимую для
этих процессов энергию поставляют в форме АТФ активно раз-
множающиеся митохондрии [6].
У некоторых семян углеводы запасаются в утолщенных обо-
лочках, которые в этом случае состоят в основном из гемицеллю-
лоз, дающих при гидролизе маннозу и другие моносахара [30].
Такой способ хранения запасных веществ встречается в эндо-
сперме Asparagus (рис. 23.10,Б — Г), Coffea, Diospyros, Iris, Phoe-
nix, Strychnos или семядолях Impatiens, Lapinas, Primula, Tropaeo-
lam.
Белки
Запасные белки синтезируются во время развития семени од-
новременно с запасными углеводами или липидами. Их следует
отличать от метаболических белков, с которыми связана нор-
мальная деятельность клеток, в том числе и синтез запасных бел-
ков. Как показано для представителей сем. Fabaceae, запасные
белки являются глобулинами и встречаются только в семенах
[32]'.
Белки запасаются в виде обособленных белковых телец
(рис. 23.8). В алейроновом слое их называют алейроновыми зер-
нами, но часто тот же термин употребляют в отношении белко-
вых телец и в других частях семени. Строение белковых телец
может быть разным. Одни из них гомогенны и не содержат в
белковом матриксе никаких включений, другие имеют одно или
несколько включений: глобоиды из нерастворимых солей фитино-
вой кислоты, белковые кристаллоиды, белково-углеводные тельца
и кристаллы оксалата кальция [1, 21].
Исследования ультраструктур показали, что запасные белки
накапливаются в вакуолях (гл. 3); сформировавшиеся скопления
имеют вид телец, окруженных элементарной мембраной, скорее
всего сохранившимся тонопластом [4]. В процессе прорастания
Семя
475
белки постепенно растворяются in situ и белковые тельца пре-
вращаются в вакуоли, которые могут сливаться в одну большую
вакуоль [5, 25, 43]. Запасные белки расщепляются протеиназа-
ми и пептидазами до аминокислот [6].
«Липиды
В цитоплазме запасающих масла тканях, как, например, в се-
мядолях белой горчицы или в щитке хлебных злаков, липиды на-
капливаются в виде масляных телец. Между липидными тельца-
ми и окружающей цитоплазмой заметна граница, возможно это
мономолекулярный слой фосфолипидов [42]1. Липидные тельца
называют также липидными вакуолями, или сферосомами; в этом
случае предполагается, что они ограничены элементарной мембра-
ной или полумембраной [47].
Запасные липиды семян представляют собой триглицериды,
in situ липазы расщепляют их на глицерин и жирные кислоты.
Последние используются при синтезе фосфо- и гликолипидов, ко-
торые входят в состав органелл; однако большая их часть пре-
вращается в сахара, которые транспортируются в тело растуще-
го проростка. В окислении липидов участвуют микротельца типа
глиоксисом [6].
СПИСОК ЛИТЕРАТУРЫ
1. Altschul А. М., Yatsu L. Y., Ory R. L., Engleman Е. М. Seed proteins, Ann.
Rev. Plant Physiol., 17, 113—136 (1966).
2. Ashford A. E., Jacobsen J. V. Cytochemical localization of phosphatase in bar-
ley aleurone cells: the pathway of gibberellic-acid-induced enzyme release,
Planta, 120, 81—105 (1974).
3. Barton L. V. Dormancy in seeds imposed by the seed coat, Handb. Pflanzen-
physiol., 15, 727—745 (1965).
4. Briarty L. G., Coult D. A., Boulter D. Protein bodies in developing seeds of
Vicia faba, J. Exp. Bot., 20, 358—372 (1970).
5. Briarty L. G., Coult D. A., Boulter D. Protein bodies of germinating seeds of
Vicia faba, J. Exp. Bot., 21, 513—524 (1970).
6. Ching T. M. Metabolism of germinating seeds, chap. 2, pp. 103—218. In: Seed
Biology, Kozlowski T. T., ed., Vol. 2, New York, Academic Press, 1972.
7. Chuang T.-L., Heckard L. R. Seed coat morphology in Cordylanthus (Scrophu-
lariaceae) and its taxonomic significance, Amer. J. Bot., 59, 258—265 (1972)
8. Cooper D. C. Embryology of Pisum sativum, Bot. Gaz., 100, 123—132
(1938).
9. Cresti М.» Pacini E., Sarfatti G. Ultrastructural studies on the autophagic va-
cuoles in Eranthis hiemalis endosperm, J. Submicr. Cytol., 4, 33—44 (1972).
10. Cutter V. M., Jr., Wilson R. S., Freeman B. Nuclear behavior and cell forma-
tion in the developing endosperm of Cocos nucifera, Amer. J. Bot., 42, 109—
115 (1955).
11. Davis G. L. Systematic embryology of the angiosperms, New York, John Wi-
ley & Sons, 1966.
12. Dure L. S. III. Seed formation, Ann. Rev. Plant Physiol., 26, 259—278
(1975).
476
Глава 23
13. Edwards М. М. Dormancy in seeds of charlock. I. Developmental anatomy of
the seed, Ann. Bot., 19, 575—582 (1968). II. The influence of the seed coat,
Ann. Bot., 19, 583—600 (1968). III. Occurrence and mode of action of an inhi-
bitor associated with dormancy, Ann. Bot., 19, 601—610 (1968).
14. Eeuwens C. J., Schwabe W. W. Seed and pod wall development in Pisum sati-
vum L. in relation to extracted and applied hormones, J. Exp. Bot., 26, 1—
14 (1975).
15. Evers A. D. Development of the endosperm of wheat, Ann. Bot., 34, 547—
555 (1970).
16. Fahn A., Werker E. Anatomical mechanisms of seed dispersal, chap. 4, pp. 151—
221. In: Seed Biology, Kozlowski T. T., ed., Vol. 1, New York, Academic Press,
1972.
17. Frey-Wyssling A. Die pflanzliche Zcllwand, Berlin, Springer-Verlag, 1959.
18. Gunn C. R. Seed collecting and identification, chap. 2, pp. 55—143. In: Seed
Biology, Kozlowski T. T., ed., Vol. 3, New York, Academic Press, 1972.
19. Hyde В. B. Mucilage-producing cells in the seed coat of Plantago ovata\ de-
velopmental fine structure, Amer. J. Bot., 57, 1197—1206 (1970).
20. Hyde E. О. C. The function of the hilum in some Papilionaceae in relation to
ripening of the seed and the permeability of the testa, Ann. Bot., 18, 241—
256 (1954).
21. Jacobsen J. V., Knox R. B., Pyliotis N. A, The structure and composition of
aleurone grains in the barley aleurone layer, Planta, 101, 189—209 (1971).
22. Kiesselbach T. A. The structure and reproduction of corn, Univ. Nebraska Coll.
Agric. Res. Bull., 161 (1949).
23. Kozlowski T. T., Gunn C. R. Importance and characteristics of seeds, chap. 1,
pp. 1—20. In: Seed Biology, Kozlowski T. T., ed., Vol. 1, New York, Academic
Press, 1972.
24. List A., Jr., Steward F, C. The nucellus, embryo sac, endosperm, and embryo
of Aesculus and their interdependence during growth, Ann. Bot., 29, 1—15
(1965).
25. Lott J. N. A., Vollmer С. M. Changes in the cotyledons of Cucurbita maxima
during germination. IV. Protein bodies, Protoplasma, 78, 255—271 (1973).
26. Maheshwari P. An introduction to the embryology of angiosperms, New York,
McGraw-Hill, 1950.
27. Marbach J., Mayer A. M. Permeability of seed coats to water as related to
drying conditions and metabolism of phenolics, Plant Physiol., 54, 817—820
(1974).
28. Marinos N. G. Embryogenesis of the pea (Pisum sativum). I. The cytological
environment of the developing embryo, Protoplasma, 70, 261—279 (1970).
29. Martin A. C. The comparative internal morphology of seeds, Amer. Midi. Nat.,
36, 513—660 (1946).
30. Meier H. On the structure of cell walls and cell wall mannans from ivory nuts
and from dates, Biochem. Biophys. Acta, 28, 229—240 (1958).
31. Miller R. H. Crotalaria seed morphology, anatomy, and identification, USDA
ARS Tech. Bull., 1373, 73 p., 1967.
32. Millerd A. Biochemistry of legume seed proteins, Ann. Rev. Plant Physiol., 26,
5372 (1975).
33. Mohana Rao P. R. Seed anatomy in some Hamamelidaceae and phylogeny,
Phytomorphology, 24, 113—139 (1974).
34. Muller D. Tote Speichergewebe in lebenden Samen, Planta, 33, 721—727
(1943).
35. Netolitzky F. Anatomie der Angiospermen-Samen. In: Handbuch der Pflanzen-
anatomie, Linsbauer K-, ed., Band. 10, Lief. 14, Berlin, Gebriider Borntraeger,
1926.
36. Neubauer B. F. The development of the achene of Polygonum pensylvanicum:
embryo, endosperm, and pericarp, Amer. J. Bot., 58, 655—664 (1974).
Семя
477
37. Newcomb W., Fowke L. C. The fine structure of the change from the free-nuc-
lear to cellular condition in the endosperm of chickweed Stellaria media, Bot.
Gaz., 134, 236—241 (1973).
38. Pacini E., Cresti M., Sarfatti G. Incorporation of integumentary nuclei in Eran-
this hiemalis endosperm and their disaggregation by the endoplasmic reticulum,
J. Submicr. Cytol., 4, 19—31 (1972).
39. Pate J. S., Flinn A. M. Carbon and nitrogen transfer from vegetative organs
to ripening seeds of the field pea (Pisum arvense L.), J. Exp. Bot., 24, 1090—
1099 (1973).
40. Randolph, L. F. Developmental morphology of the caryopsis in maize, J. Agric.
Res., 53, 881—916 (1936).
41. Reid J. S. G., Meier H. The function of the aleurone layer during galactoman-
nan mobilization in germinating seeds of fenugreek (Trigonella foenumgrae-
cum L.), crimson clover (Trifolium incarnatum L.) and lucerne (Medicago sa-
tiva L.): a correlative biochemical and ultrastructural study, Planta, 106, 44—
60 (1972).
42. Rest J. A., Vaughan J. G. The development of protein and oil bodies in the seed
of Sinapis alba L., Planta, 105, 245—262 (1972).
43. Rost T. L. The ultrastructure and physiology of protein bodies and lipids
from hydrated dormant and nondormant embryos of Setaria lutescens (Grami-
neae), Amer. J. Bot., 59, 607—616 (1972).
44. Rost T. L. The morphology of germination in Setaria lutescens (Gramineae):
the effects of covering structures and chemical inhibitors on dormant and non-
dormant florets, Ann. Bot., 39, 21—30 (1975).
45. Schulz P., Jensen W. A. Capsella embryogenesis: the chalazal proliferating tis-
sue, J. Cell Sci., 8, 201—227 (1971).
46. Schulz P., Jensen W. A. Capsella embryogenesis. The development of the free
nuclear endosperm, Protoplasma, 80, 183—205 (1974).
47. Schwarzenbach A. M. Observations on spherosomal membranes, Cytobiologie,
4, 145—147 (1971).
48. Singh B. Development and structure of angiosperm seed, Bull. Natl. Bot. Gard.
No. 89, 115 pp. (1964).
49. Singh D., Dathan A. S. R. Structure and development of seed coat in Cucur-
bitaceae. VI. Seeds of Cucurbita, Phytomorphology, 22, 29—45 (1972).
50. Singh R. P. Structure and development of seeds in Euphorbiaceae: Ricinus
communis L., Phytomorphology, 4, 118—123 (1954).
51. Swamy B. G. L., Krishnamurthy К. V. The helobial endosperm: a decennial re-
view, Phytomorphology, 23, 74—79 (1973).
52. Swamy B. G. L., Parameswaran N. The helobial endosperm, Biol. Rev., 38,
1—50 (1963).
53. Swarbrick J. T. External mucilage production by the seeds of British plants,
Bot. J. Linn. Soc., 64, 157—162 (1971).
54. Vaughan J. G. The structure and utilization of oil seeds, London, Chapman
and Hall, 1970.
55. Vaughan J. G., Whitehouse J. M. Seed structure and the taxonomy of the
Cruciferae, Bot. J. Linn. Soc., 64, 383—409 (1971).
56. Villiers T. A. Seed dormancy, chap. 3, pp. 219—281. In: Seed Biology, Kozlow-
ski T. T., ed., Vol. 2, New York, Academic Press, 1972.
57. Weber E. Entwicklungsgeschichtliche Untersuchungen fiber die Gattung Allium,
Bot. Archiv, 25, 1—44 (1929).
58. Whiff in T., Tomb A. S. The systematic significance of seed morphology in the
neotropical capsular-fruited Melastomataceae, Amer. J. Bot, 59, 411—422
(1972).
59. Wunderlich R. Zur Frage der Phylogenie der Endospermtypen bei den Angio-
spermen, Osterr. Bot. Z., 106, 203—293 (1959).
60. Wunderlich R. Some remarks on the taxonomic significance of the seed coat,
Phymorphology, 17, 301—311 (1967).
Глава 24
Зародыш и проросток
В гл. 2 мы познакомились с зародышем в качестве первой
стадии развития спорофита семенного растения, а в гл. 21 узна-
ли о том, что он происходит из оплодотворенной яйцеклетки
(зиготы). С зародышем как с существенной частью семени мы
встречались также в гл. 23. В настоящей главе особое внимание
уделено развитию зародыша, рассмотренному на нескольких
примерах, и предложена классификация зародышей, основанная
на сравнительном эмбриогенезе, в том числе на данных, полу-
ченных экспериментальным путем. Кроме того, в ней приводит-
ся краткое описание прорастания зародыша и структуры про-
ростка, представляющего собой переходную ступень от зароды-
ша к взрослому растению. Обсуждаются только зародыши по-
крытосеменных.
Зрелый зародыш
Число семядолей—одна у однодольных и две у двудольных—
рассматривается как основной признак, по которому различают-
ся эти два главных таксона покрытосеменных растений (рис. 24.1).
Семядоли у двудольных возникают в онтогенезе как боковые
органы на верхушке зародышевой оси и по положению относят-
ся к апикальной меристеме, так же как и вегетативные листья
побега, развивающиеся позже. Отношение единственной семядо-
ли однодольных к апикальной меристеме зародыша менее ясно.
Согласно французскому эмбриологу Суэжу [48], семядоля яв-
ляется по своему происхождению терминальной, верхушка побе-
га — латеральной, а однодольное растение в целом представляет
собой симподий боковых побегов. Однако существуют данные,
позволяющие предположить, что единственная семядоля возни-
кает как боковой орган, который в процессе роста смещает апи-
кальную меристему в положение, только кажущееся латераль-
ным [13]. Такое положение формирующегося побега может быть
результатом задержки развития апикальной меристемы, посколь-
ку оно начинается лишь после того, как семядоля достигнет зна-
чительного размера [55]. Верхушка побега часто запаздывает в
своем развитии также и у двудольных растений, но не смещает-
ся, так как две семядоли располагаются симметрично.
Зародыш и проросток,
479
Рис. 24.1. Схематическое изображение зародышей
двудольного (Д) и однодольного {Б) растений на
продольных срезах. Кончик побега и кончик кор-
ня отмечены точками, а гипокотиль—корневая
ось — заштрихованы. (Воспроизводится из работы
[35] с некоторыми изменениями ) 1 — семядоли
Зародыши различаются по своим относительным размерам и
по ориентации в семени (гл. 23) — особенностям, которые отча-
сти определяют, является ли зародыш прямым, скрученным или
изогнутым (рис. 24.2). Зародыши различаются также и по сте-
пени своего развития. Одни из них имеют более длинные, дру-
гие — более короткие гипокотили. Семядоли могут быть тонкими
(рис. 24.2, В, Г) или мясистыми в том случае, когда они служат
основным хранилищем запасных веществ (например, у зароды-
шей Fabaceae; гл. 23). Эпикотиль может быть представлен толь-
ко меристемой или в нем может развиться один и более первых
настоящих листьев и соответствующее число узлов. Корень так-
же может быть представлен либо апикальной меристемой, либо
более обширной частью зародышевой оси (гипокотиль-корневая
ось), т. е. зародышевым корешком (радикулой).
В зародыше обозначается прокамбий будущей проводящей
системы, который связан с одной стороны с осью, а с другой —
Рис. 24 2. Схема зародышей на продольных срезах, перпендикулярных плоскости
семядолей (Д—В, Д) и параллельных той же плоскости (Г). Прокамбий обозна-
чен точками. (Рис. А, В, Г воспроизводятся из работы [35] с некоторыми изме-
нениями ) 4. Pyrus malus. Б. Lycopersicon esculentum В, Г. Ricinus communis.
Д Allium сера 1 — семядоля; 2— апекс эпикотиля.
480
Глава 24
с семядолей (или семядолями). У некоторых видов в зародыше
выявляются инициали ксилемы и флоэмы [8]. Молодая эпидер-
ма, или протодерма, составляет поверхностный слой. Основная
ткань отличается от прокамбия менее вытянутыми и более ши-
рокими клетками, но оба типа клеток в зрелом покоящемся семе-
ни заполнены запасными веществами [32].
ЗАРОДЫШ ЗЛАКОВ
Зародыш злаков настолько сложен по своей морфологии и
относительно интерпретации его частей существует так много
противоречивых суждений, что он должен быть рассмотрен от-
дельно. Зародыш злаков достигает относительно высокой степе-
ни дифференциации (фото 140). В зрелой зерновке зародыш
прижат к эндосперму массивной семядолей — щитком (фото
140, А). Зародышевая ось кажется как бы прикрепленной сбоку
к щитку. Нижняя часть оси представлена корешком, несущим
на нижнем конце апикальную меристему и корневой чехлик.
Корень и его корневой чехлик заключены в колеоризу, которая
в молодом зародыше составляет одно целое с довольно крупным
суспензором. Выше корешка расположен узел щитка (следова-
тельно, гипокотиль как структура, отличающаяся от корешка,
отсутствует), затем следует эпикотиль с несколькими листовыми
примордиями. Первый и самый крупный из них — колеоптиль.
Часть оси между узлом щитка и колеоптилем представляет со-
бой междоузлие. Однако те ученые, которые рассматривают щи-
ток и колеоптиль как семядолю и ее влагалище, не считают эту
часть оси междоузлием и называют ее мезокотилем [10]. У не-
которых Роасеае напротив щитка образуется небольшой вы-
рост— эпибласт (фото 140, А). Побег и корень связаны между
собой прокамбиальной системой (рис. 24.3). Прокамбий в щитке
интенсивно ветвится [1]. Запасы питательных веществ (липиды,
белковые тельца, крахмал) распространены по всему зародышу,
включая щиток [38].
Щиток, имеющий щитоподобную форму, частично прикрыва-
ет зародышевую ось и эпикотиль (рис. 24.3). В процессе прора-
стания этот орган служит источником первоначального набора
гидролитических ферментов, вызывающих разрушение эндоспер-
ма [2], а также, по всей вероятности, и источником исходного
гиббереллинового стимула [51]. Абаксиальная эпидерма щитка
представляет собой секреторный эпителий, выделяющий фермен-
ты и гормоны в эндосперм. Складочки на эпидермальной по-
верхности иногда называют железками, но они являются частью
непрерывного секреторного слоя. Щиток служит также для по-
глощения питательных веществ из эндосперма. Как показано для
прорастающего риса, глюкоза, образующаяся в эндосперме из
Зародыш и проросток
481
Рис 24.3. Поперечный (А) и
продольный (Б) срезы заро-
дыша ячменя Hordeum sativum
из зрелых зерен, набухавших
в течение 24 ч. (Воспроизво-
дится из работы [22] с неко*
торыми изменениями.) 1—щи-
ток; 2— колеоптиль; 3 — апекс
побега; 4 — проводящая ткань;
5 — корешок, 6 — колеориза.
запасного крахмала, превращается в щитке в сахарозу, которая
затем транспортируется в зародышевую ось [25].
У большинства злаков колеоптиль представляет собой полый
конус с расположенным недалеко от верхушки отверстием, кото-
рое позволяет побегу пробиваться наружу во время прораста-
ния. Отверстие имеет форму щели, в которой внутренний и на-
ружный слои эпидермы сливаются между собой [28]. Оба слоя
содержат устьица, причем некоторые из них функционируют в
качестве гидатодных пор. Вследствие своей чувствительности к
свету колеоптиль, окружающий побег с его листовыми примордия-
ми, после прорастания зародыша направляет побег к поверхности
почвы, защищая его от повреждений.
Различные взгляды на природу частей зародыша злаков из-
ложены Брауном [5] в его пространном обзоре. Для иллюстра-
ции достаточно привести здесь два соответствующих мнения.
Согласно Гиньяру и Местре [И], щиток является новым типом
органа, который развился из единственной семядоли; колеоп-
тиль представляет собой первый лист, модифицированный как
защитная структура, а мезокотиль—первое междоузлие, распо-
ложенное между щитком и колеоптилем. Колеоризу интерпрети-
руют как дегенерировавший первичный корень, в то время как нор-
мальный корень, развивающийся выше колеоризы, относят к
адвентивным корням; эпибласт считается просто выростом ко-
леоризы. Браун [4] рассматривает щиток как семядолю, эпи-
бласт как вырост колеоризы, колеоптиль и мезокотиль как ново-
образования, не имеющие аналогов, а колеоризу как часть осно-
вания зародыша, остающуюся после того, как дифференцируется
настоящий первичный корень.
31 К Эзау, кн. 2.
482
Глава 24
Развитие зародыша
Яйцеклетка и зигота обладают осевой симметрией вследствие
того, что между халазальным и микропилярным полюсами этих
клеток обнаруживается цитологическое различие (гл. 21). Верх-
ний (халазальный) полюс является главным потенциальным
центром дальнейшего роста, так как собственно зародыш разви-
вается из клеток, сформированных на этом полюсе [7, 55]. Ниж-
ний полюс выполняет в сущности только вегетативную функцию.
Рост на этом полюсе приводит к образованию суспензора, кото-
рый закрепляет зародыш в микропиле, а также представляет
отбой одно из приспособлений для переноса питательных веществ
из окружающих тканей к зародышу.
На ранних стадиях дифференциации зародыши различных
таксонов покрытосеменных имеют много общих черт. Вначале
одноклеточная зигота делится обычно горизонтальной стенкой
(гл. 21; рис. 24.5, А), а затем образуется целая серия других
горизонтальных, вертикальных и косых стенок. До того момента,
когда в результате прогрессирующих делений зародыш диффе-
ренцируется на собственно зародыш и суспензор, вся эта струк-
тура часто называется проэмбрио (фото 141, А). Как только у
двудольных появляются признаки образования двух семядолей,
осевая симметрия сменяется билатеральной (фото 141, Д). Не-
которые эмбриологи рассматривают это изменение симметрии
как окончание стадии проэмбрио [7]. Однако различие между
собственно зародышем и суспензором обнаруживается еще до
того, как происходит изменение симметрии (фото 141), кроме
того, данный признак нельзя использовать для определения ста-
дии проэмбрио у однодольных. Таким образом, термин «проэмб-
рио» не следует понимать слишком узко, и если его применять,
то только для обозначения стадий, проходящих до того, как в
верхней части молодого зародыша обособляется протодерма (фо-
то 141, А; рис. 24.4, А и 24.5, А—Е).
Дифференциация зародыша из проэмбрио вариабельна в от-
ношении органогенетических потенций клеток, формируемых на
двух полюсах зиготы. Далее описывается развитие трех различ-
ных зародышей: один зародыш двудольного растения (С ар sel-
la bursa-pastoris) и два однодольных, причем один из них типи-
чен для амариллисовых (лук Allium сера), а другой—для злаков
(рассмотрен главным образом на примере Роа annua и
Hordeum vulgare).
ЗАРОДЫШ CAPSELLA
Врожденная осевая полярность раннего зародыша выявля-
ется в процессе первого деления: поперечная стенка делит зиго-
ту на две неравные клетки — крупную базальную и более мел-
Зародыш и проросток
483
кую апикальную [42]. В базальной клетке происходит ряд попе-
речных делений, что приводит к формированию нитевидного про-
эмбрио, а апикальная клетка, являющаяся предшественницей соб-
ственно зародыша, делится вертикальной стенкой (фото 141,Л).
Еще одно вертикальное деление и последующие поперечные пре-
вращают собственно зародыш в глобулярную структуру, состоя-
щую из двух октантов клеток. Верхний октант дает начало се-
мядолям и апикальной меристеме эпикотиля, в то время как
нижний октант развивается в гипокотиль. В процессе делений,
начиная с первого и кончая стадией глобулярного зародыша,
размер клеток уменьшается, а число рибосом и связанная с ним
плотность протопластов увеличиваются. Число клеток на глобу-
лярной стадии зародыша достигает 64. Зародыш сохраняет глобу-
лярную структуру и тогда, когда периклинальные деления при-
водят к образованию протодермы, а последующие вертикальные
деления вычленяют прокамбий проводящего цилиндра, отграни-
чивая его от основной меристемы коры (фото 141, Б, В).
Перед началом роста семядолей наблюдается уплощение за-
родыша, приводящее к билатеральной симметрии (фото 141, Д).
Теперь зародыш описывается как сердцевидный. Периклиналь-
ные и антиклинальные деления клеток, расположенных под про-
тодермой, и антиклинальные деления в последней обеспечивают
образование бугорков семядолей. Зародыш становится зеленым,
и в его пластидах образуются стопки тилакоидов [42]. Семядоли
и различимый теперь гипокотиль удлиняются — говорят, что за-
родыш становится торпедообразным (фото 141, Д и 142, Б). По
мере дальнейшего роста зародыш изгибается и семядоли дости-
гают халазального конца зародышевого мешка (фото 142, Б—Г).
Апикальная меристема между семядолями становится неболь-
шим возвышением, а прокамбий образует центральный стержень
гипокотиль-корневой оси и распространяется дальше в семядо-
ли. В процессе роста зародыша эндосперм переходит из свобод-
ноядерного в клеточное состояние и халазальная гипертрофиро-
ванная нуцелярная ткань усваивается зародышем (фото 142,
А, Б, Г; гл. 23).
Производные базальной клетки двухклеточного зародыша
включаются в собственно зародыш; самая верхняя клетка сус-
пензора в нитевидном зародыше (фото 141, А) делится попереч-
но, и верхняя из двух образовавшихся клеток становится гипо-
физой (фото 141, Б). Путем серии поперечных и продольных де-
лений гипофиза производит инициали коры и формирует корне-
вой чехлик и его инициальную зону (фото 141, В—Д). В зави-
симости от таксона апикальная меристема эмбрионального кор-
ня по своей клеточной организации может быть сходной с корнем
взрослого растения, но может и отличаться от него. У некото-
рых двудольных примордии адвентивных корней закладываются
31*
484
Глава 24
в гипокотиле зародыша [50]. Длинный суспензор у Capsella ос-
тается нитевидным на всем своем протяжении, за исключением
базальной клетки, которая несколько разрастается (фото 142,
Л) и приобретает иные специфические черты. Довольно сходную
структуру образуют клетки суспензора в зародыше Stellaria
media [24], и для удобства описания авторы проводят различие
между «базальной клеткой» и «халазальными клетками суспен-
зора». Эти обозначения используются в последующем изложе-
нии в отношении суспензора Capsella.
Ультраструктурные наблюдения показывают, что по сравне-
нию с клетками зародыша клетки халазального суспензора Cap-
sella более вакуолизированы и содержат больше эндоплазмати-
ческого ретикулума и диктиосом, но имеют меньше рибосом и
дают менее интенсивную реакцию на белок и нуклеиновые кис-
лоты при использовании соответствующих красителей [43].
Клетки суспензора связаны между собой и с базальной клеткой
многочисленными плазмодесмами, но в их стенках, обращенных
к полости зародышевого мешка, плазмодесмы отсутствуют. Ба-
зальная клетка сильно вакуолизирована и имеет развитую сеть
выступов клеточной оболочки на микропилярных и примыкаю-
щих боковых стенках. Базальная клетка и нижние (халазаль-
ные) клетки суспензора сливаются со стенкой зародышевого
мешка. В процессе своего разрастания базальная клетка сдавли-
вает интегумент. Халазальные клетки суспензора начинают деге-
нерировать на стадии сердцевидного зародыша и в конце концов
сминаются разрастающимся зародышем (фото 142, Г). Базаль-
ная клетка существует дольше. Исследования ультраструктуры
суспензора, проведенные на Capsella и Stellaria, подтверждают
представление о том, что этот орган является местом активного
метаболизма и служит для поглощения и передвижения пита-
тельных веществ к развивающемуся зародышу.
ЗАРОДЫШ ЛУКА
Первые деления ведут к образованию булавовидного зароды-
ша (рис. 24.4,Л). Позднее зародыш становится почти сфериче-
ским телом, расположенным на тонком суспензоре (рис. 24.4,
5, В). Семядоля растет вверх от сферического тела (рис. 24.4,
Г,Д). Небольшое углубление на одной стороне зародыша ука-
зывает место будущей апикальной меристемы. Пространствен-
ные отношения между углублением и семядолей хорошо иллю-
стрируют упоминавшееся ранее затруднение, с которым сталки-
ваются морфологи при решении вопроса о том, является ли един-
ственная семядоля однодольных терминальной или латеральной.
Это углубление, вначале совсем незначительное (рис. 24.4, Д),
становится все глубже по мере того, как ткань разрастается по
1
Зародыш и проросток
485
Рис. 24.4. Зародыш лука Allium сера на нескольких стадиях развития. А. Ста-
дия, на которой тело зародыша уже отличается от суспензора. Б. В дистальных
ярусах обособилась протодерма. В. Тело зародыша приобрело сферическую фор-
му. Г. Начало вытягивания дистального конца зародыша: закладка семядоли. Д.
Зародыш еще не созрел, но тканевые зоны уже обособились; углубление пред-
ставляет собой будущее место апикальной меристемы побега. 1 — протодерма;
2— семядоля; 3 — прокамбий; 4 — углубление; 5 — инициаль проводящего ци-
линдра; 6 — инициаль коры; 7 — инициаль корневого чехлика.
его краю. Такой маргинальный рост приводит к 'Образованию вла-
галищеподобного выроста семядоли (фото 143, А). Апикальная
меристема поднимается в виде небольшого холмика эмбриональ-
ных клеток на дне углубления, закладывая первый примордий ве-
гетативного листа. Когда семя прорастает, первый лист выходит
из закрытого чехла через щель, расположенную над влагалищем
(рис. 24.8). У основания короткого гипокотиля формируется апи-
кальная меристема корня и корневого чехлика с инициалями про-
водящего цилиндра, первичной коры и корневого чехлика, обра-
зующими три последовательных яруса (рис. 24.4, Д). Протодерма
сначала имеет общие инициали с корневым чехликом, а позднее—
с корой [12].
Дифференцированный зародыш содержит протодерму, несколько
вакуолизированную основную меристему и менее вакуолизирован-
486
Глава 24
ный прокамбий. Последний распространяется от корневой мери-
стемы к основанию семядоли, где он расширяется и образует ко-
роткую ветвь, направляющуюся в эпикотиль, и длинные ветви,
проходящие в семядолях.
ЗАРОДЫШ ЗЛАКОВ
Развитие зародыша у Роа annua, излагаемое по Суэжу [46],
иллюстрирует эмбриогенез, характерный для Роасеае, и служит
примером анализа^ который проводят эмбриологи для установле-
ше и органогенезом (рис. 24.5). Поперечное деление зиготы (А)
т
за которым следует вертикальное деление в апикальной клетке
и поперечное в базальной, ведут к образованию четырехклеточно-
го трехъярусного зародыша (Б). Последующие деления дают на-
чало четырем ярусам клеток (В): ярусу /, происходящему из
апикальной клетки, и ярусам 2—4, формирующимся из базальной
клетки. Деления клеток продолжаются в каждом ярусе (Г—Е),
но не обязательно строго согласованно, вследствие чего клеточное
строение ярусов у разных зародышей неодинаково и разграниче-
ние между соседними рядами не всегда бывает в равной степени
четким.
В соответствии с ходом развития зародыша, показанным на
рис. 24.5, протодерма обособляется в ярусе 1 (Ж), после чего ее
граница распространяется в базипетальном направлении (3, Я).
Верхняя часть семядоли (щитка) возникает из яруса 1, а нижняя
часть— из яруса 2 (К), колеоптиль имеет такое же происхожде-
ние (Л). Вся зародышевая ось и эпикотиль происходят из яруса
2, а колеориза — из яруса 3, причем корневой чехлик и эпибласт
составляют часть колеоризы (Л, М). Ярус 4 образует нижнюю
часть зародыша, которая соответствует по функции суспензору.
В отличие от Суэжа [46], выдвинувшего свою концепцию
эмбриогенеза у злаков, другие авторы не считают доказанным,
что по своему происхождению органы у Роасеае могут быть свя-
заны с определенными ярусами клеток молодого зародыша (напри-
мер, у Hordeum vulgare [22], Zea mays [34]).
Дополнительные детали, касающиеся эмбриогенеза злаков, в
частности Zea mays, показаны на фото 144. Примерно через 5
дней после оплодотворения зародыш кукурузы принимает була-
вовидную форму (А). Верхняя расширенная часть дает начале
основному телу зародыша; нижняя часть представляет собой сус-
пензор. 10-дневный зародыш имеет вытянутую форму и с одной
стороны утолщен вследствие роста щитка (Б). Напротив щитка
на зародышевой оси расположен апекс эпикотиля. Он становится
маленьким округлым выступом, окруженным кольцеобразным
валиком ткани — зарождающимся колеоптилем. В процессе даль-
м
Рис. 24.5. Развитие зародыша у Роа annua (Роасеае). А—В. Последовательные
этапы формирования четырех ярусов клеток. Г—3. Деление клеток в каждом
из четырех ярусов. И—Л. Продолжение деления клеток и начало дифференциа-
ции органа. М. Растущие примордии листа и внутреннее строение зародыша.
1—4 — ярусы клеток; 5 — протодерма; 6 — апекс эпикотиля; 7 — колеоптиль; 8 —
первый лист; 9 — щиток; 10 — эпибласт; И—колеориза; 12 — суспензор; 13 —
инициали корневого чехлика; 14 — инициали первичной коры (периблемы); 15 —
инициали центрального цилиндра (плеромы). (Воспроизводится из работы [46]
с некоторыми изменениями.)
488
Глава 24
нейшего развития колеоптиля (В) закладываются листовые при-
мордии и рост эпикотиля изменяет свое направление с латераль-
ного на вертикальное (Г). Щиток увеличивается в размере и об-
растает зародышевую ось (как показано для Hordeum, рис. 24.3,
Л) и в конце концов полностью закрывает узел щитка. На заро-
дыше пшеницы (фото 140, А) установлено, что эпибласт развива-
ется на довольно поздней стадии эмбриогенеза, лишь после того
как щиток значительно вырастет в длину, а апикальная меристема
окажется отчасти заключенной в колеоптиль.
На нижнем конце зародышевой оси, выше суспензора, форми-
руются корешок и корневой чехлик. Корешок сначала объединен
с тканью колеоризы, но затем в процессе развития зародыша от-
деляется от нее (фото 140, Б). Над щитковым узлом закладыва-
ются добавочные корни. Они называются зародышевыми адвен-
тивными корнями. После прорастания на стадии роста, известной
как стадия кущения, в узлах главного и боковых побегов разви-
ваются дополнительные адвентивные корни.
Изучение ультраструктуры зародыша ячменя Hordeum vulga-
re [26,27] проводилось на ранних стадиях развития, включая
стадию 20-клеточного зародыша (фото 145 и 146), что соответст-
вует стадиям развития зародыша Роа, изображенным на рис.
24.5, А—Д. Зародыш ячменя не развивает длинного, сильно ва-
куолизированного суспензора; как и другие зародыши злаков, он
лишь незначительно удлиняется в процессе раннего роста. На
стадии октанта в верхней части зародыша происходят довольно
упорядоченные клеточные деления, но у основания эти деления
носят нерегулярный характер. Зародыш вначале прикреплен к
нуцеллусу своими базальными клетками, но эта связь нарушает-
ся, когда зародыш достигает 20-клеточной стадии. В стенках зи-
готы и наружных стенках зародыша плазмодесмы отсутствуют, но
они соединяют между собой клетки зародыша.
Грушевидная форма зиготы свидетельствует об осевой поляр-
ности, которая, однако, выражена недостаточно четко во внут-
ренней организации зиготы (фото 145, А, Б). Ядро расположено
в более широкой верхней части зиготы, но ее микропилярный ко-
нец так же богат цитоплазмой, как и халазальный. Вакуоли рас-
пределены по периферии клетки таким образом, что органеллы
оказываются сосредоточенными вокруг ядра. В основании зиго-
ты находятся несколько более многочисленные вакуоли.
После нескольких делений зародыш становится приблизитель-
но цилиндрическим (фото 145, В). Вакуоли занимают еще пери-
ферическое положение, но в 13-клеточном зародыше в нижних
клетках находятся более крупные вакуоли, чем в зоне октанта
(фото 146, А). В процессе начальных делений размер клеток
уменьшается и вследствие этого 20-клеточный зародыш не отли-
чается по своим размерам от несколько более молодого зароды-
Зародыш и проросток
489
ша, а его ядра мельче, чем у зиготы. На этой стадии цитоплазма
менее «вакуолизирована и органеллы распределены более равно-
мерно. Когда зародыш состоит из 20 клеток, эндосперм все еще
находится в свободноядерном состоянии. Внутренний слой нуцел-
луса разрушается на ранних этапах эмбриогенеза.
ОТКЛОНЯЮЩИЕСЯ ФОРМЫ ЭМБРИОГЕНЕЗА
Редуцированные и аномальные зародыши, не соответствую-
щие по своему развитию нормальному типу, описанному на пре-
дыдущих страницах, широко распространены в различных таксо-
нах. Некоторые из них встречаются у паразитов и сапрофитов.
Зародыши могут отклоняться также и по своему происхожде-
нию. Некоторые из них формируются апомиктически, т. е. без
участия полового процесса, например из неоплодотворенной яй-
цеклетки (гаплоидный партеногенез) или из какой-либо другой
клетки гаметофита (гаплоидная апогамия). Если мейоз не проис-
ходит и формируется диплоидный гаметофит, то может иметь ме-
сто диплоидный партеногенез или диплоидная апогамия. Возмож-
ны и другие варианты [55]. Среди разнообразных путей развития
растений существует также и полиэмбриония, в результате кото-
рой появляются семена с двумя или несколькими зародышами.
Онтогенез изолированных зародышей, культивируемых в ис-
кусственной среде, осуществляется нормально или отклоняется
от нормы в зависимости от физических и химических факторов
внешней среды [33,55]. Если зародыш развивается из клеток кал-
луса, из изолированных соматических клеток или из пыльцевых
зерен, то до начала развития зародышеподобной структуры —
эмбриоида — происходит формирование более или менее крупного
комплекса меристематических клеток (проэмбриональной массы)
[13, 16]. Развитие такого типа напоминает развитие нормального
зародыша у некоторых видов, имеющих так называемый непра-
вильный, или точнее заторможенный, эмбриогенез [13]. Однако
возможно также и близкое соответствие между адвентивным
эмбриогенезом и нормальным; это обнаружено, например, при
формировании эмбриоидов из эпидермальных клеток растеньиц
Ranunculus sceleratus, происходящих из каллусной культуры [17].
Классификация зародышей
Зародыши обнаруживают большое разнообразие в отношении
происхождения их частей из ярусов клеток, образуемых первона-
чальными делениями зиготы. Исследования эмбриогенеза, касаю-
щиеся происхождения частей зародыша в онтогенезе, широко ис-
пользуются в качестве основы для установления категорий заро-
490
Глава 24
Заторможенный
эмбриогенез
Рис 24 6 Схема классификации зародышей, основанная на эмбриогенезе [13J_
А—Д Ранняя классификация, учитывающая степень участия апикальной и ба-
зальной клеток в формировании собственно зародыша (заштрихованные участки)*
и положение первой стенки в апикальной клетке A Onagrad Б Asterad Б Са-
ryophyllad Г Solanad Д Chenopodiad I—III Более поздняя упрощенная клас-
сификация Тип Caryophyllad имеет общие черты с типами I и II
дышей Крупный вклад в это направление был внесен Суэжем
[47] и его учениками К другим часто цитируемым эмбриологам,
имеющим дело с типологией зародыша, относятся Шнарф [41],
Джохансен [15] и Махешвари [20]
Схематические изображения обычно перечисляемых категорий
ранних зародышей двудольных даны на рис 24 6, Л—Е (сравни-
тельный анализ зародышей однодольных позволяет подразделить
их на те же категории) Самым заметным отличительным призна-
ком типа зародыша является относительное количество клеточно-
го материала, участвующего в формировании собственно заро-
дыша (заштрихованные зоны на рис 24 6) и суспензора, это ко-
личество меняется в зависимости от того, происходит ли зародыш
только от апикальной клетки (А, Г), от апикальной и частично от
базальной клеток (5, Д) или лишь от части апикальной клетки
(В). В качестве второго отличительного признака используется
положение первой стенки в апикальной клетке, так как эта стенка
может быть вертикальной (А, Б) или горизонтальной (В-Д)
Два указанных признака в различных сочетаниях дают пять кате-
горий, обозначения которых произведены от названий семейств,
выбранных для того, чтобы проиллюстрировать каждый данный
тип эмбриогенеза Первые пять категорий подразделяются далее
Зародыш и проросток
491
на основе различий, появляющихся в более поздних делениях.
Получающаяся в результате сложная схема классификации часто
подвергается критике из-за того, что на самом деле существует
много отклонений от основного типа, наблюдающихся не только
в пределах одного крупного таксона, но даже у одного вида или
одного растения.
Один из шагов, предпринятых для того, чтобы упростить схе-
му и сделать ее более пригодной для использования, заключает-
ся в предложении отказаться от учета положения первой стенки
в апикальной клетке [23]. Другое предложение сводится к добав-
лению еще одной категории, характеризующейся заторможенным
эмбриогенезом, т. е. эмбриогенезом, которому предшествует обра-
зование массы клеток путем относительно беспорядочных деле-
ний (Argemone, Fumaria, Tulipa) [13]. Упрощенная и сокращен-
ная классификация эмбриогенеза (рис. 24.6, I—III) обладает тем
преимуществом, что она менее ограничительна, а также и тем, что
она способствует унификации нормального эмбриогенеза in vivo
и адвентивного эмбриогенеза, происходящего как in vivo, так и
in vitro, поскольку развитие адвентивных зародышей укладыва-
ется в категорию, обозначаемую как заторможенный эмбриоге-
нез. Чтобы узаконить это единство, Хациус [13] предложила
упразднить термин «эмбриоид» и использовать для адвентивных
зародышей всех типов термин «зародыш».
Проросток
Прорастание семени и формирование проростка
Прорастание семени происходит при определенных условиях
окружающей среды после более или менее продолжительного
периода покоя, обусловленного различными внутренними факто-
рами, такими, например, как рудиментарность или физиологичес-
кая незрелость зародышей, механическая твердость или непрони-
цаемость семенной кожуры, а также присутствие ингибиторов
прорастания. Прорастание является в сущности возобновлением
роста зародыша в результате поглощения им воды и набухания
[54].
В процессе набухания содержание воды в семени возрастает
сначала, как правило, быстро, а затем медленнее; покоящаяся
ткань становится метаболически активной. Уже содержащиеся в
ней ферменты активизируются, но, кроме того, синтезируются и
новые ферментативно активные белки со специфичностью, направ-
ленной на переваривание и утилизацию разного рода запасных
веществ (гл. 23). Начинается растяжение и деление клеток, про-
текающее в соответствии с запрограммированным характером
развития. Для роста необходимо непрерывное снабжение разви-
492
Глава 24
вающегося организма водой и питательными веществами. Прежде
чем зародыш становится автотрофным проростком, он использует
запасные вещества эндосперма и собственные запасы питатель-
ных веществ.
Первоначальная ступень превращения сухого зародыша в рас-
тущий организм связана с характерными ультраструктурными из-
менениями: прогрессирующей потерей запасных веществ; измене-
нием структуры мембран, которые в сухом семени не выявляют-
ся, а в прорастающем становятся отчетливо различимыми; появ-
лением некоторых органелл и мембранных систем, по-видимому,
отсутствующих в покоящемся семени, и, наконец, началом деле-
ний и дифференциации клеток [49].
Ряд гистохимических и ультраструктурных работ был посвя-
щен изучению изменений, происходящих в семядолях прорастаю-
щих зародышей. При включении 14С-тимидина в семядоли Сисиг-
bita maxima, которые превращаются из запасающих органов в
крупные фотосинтезирующие листья, выяснилось, что время его
включения совпадало с развитием хлоропластов [18]. Фермента-
тивные изменения, наблюдающиеся в семядолях Melianthus аппи-
us при переходе от распада жира к фотосинтезу, показывают, что
микротельца утрачивают свою глиоксисомную функцию и начина-
ют выполнять функцию пероксисом [9]. В семядолях Pisum sati-
vum ядра увеличиваются в размерах и степень их рассеченности
возрастает [44]. В щитке пшеницы в пластидах появляются крах-
мальные зерна, белковые тельца гидролизуются, остающиеся на
их месте вакуоли сливаются, эпителиальные клетки вытягиваются,
так что их первоначальная длина удваивается [52].
К главным событиям, совершающимся в процессе дифферен-
циации зародыша во время его прорастания, относится начало
развития проводящих клеток в прокамбии. Более ранняя работа
по изучению проводящей системы на этой стадии развития расте-
ния [8] была дополнена исследованиями, касающимися диффе-
ренциации проводящих тканей в семядолях прорастающего семе-
ни гороха [45], в щитке пшеницы до и после прорастания заро-
дыша [52], в растущем колеоптиле овса и пшеницы [29, 30, 53] и
в растущем зародыше и молодом проростке пшеницы [52]. Раз-
ные этапы дифференциации проводящей системы связаны с раз-
личными физиологическими процессами [52]. Метаболизм в семя-
долях активируется и контролируется стимуляторами, поступаю-
щими из зародышевой оси; передвижение этих стимуляторов,
по-видимому, совпадает по времени с установлением между осью
и семядолями связи, осуществляемой через проводящую систему
[45]. На определенной стадии развития семядолей после прораста-
ния зародыша активность митохондриального дыхания у Cucurbita
сосредоточивается в жилках, возможно вследствие загрузки вновь
дифференцированной флоэмы продуктами фотосинтеза [19].
Зародыш и проросток
493
Здесь рассматриваются морфологические особенности прора-
стающего зародыша и проростка, характерные для двудольных
(на примере льна, Linum) и для некоторых однодольных, таких,
как лук, аспарагус и злаки. Как у однодольных, так и у двудоль-
ных прорастание может быть гипогеальным (подземным) с семя-
долями (или семядолей), остающимися под землей {Pisurn, Zea),
или эпигеалъным, когда семядоли (или семядоля) выносятся на
поверхность почвы вытягивающейся зародышевой осью {Ricinus,
Allium). Если семядоли, показавшиеся над землей, тонкие, они
становятся фотосинтетически активными {Ricinus communis).
Мясистые семядоли продолжают снабжать проросток питатель-
ными веществами до тех пор, пока их запас не будет израсходо-
ван и семядоли не отомрут и не опадут {Phaseolus vulgaris). Li-
num usitatissimum (рис. 24.7) представляет собой пример эпиге-
ального прорастания, типичного для двудольных. Первым проби-
вается корешок (4), который становится основной осью системы
главного корня. Гипокотиль вытягивается у основания и искрив-
ляется {Б). Возникающее в результате давление заставляет семя-
доли и закрытую семенную кожуру пробиваться на поверхность
почвы. Гипокотиль выпрямляется, семенная кожура опадает, се-
мядоли отделяются одна от другой >и разворачиваются {В). Вер-
хушка эпикотиля начинает формировать листья, узлы и междо-
узлия. Первые междоузлия остаются короткими (Г).
Allium сера [35,40] (фото 143 и рис. 24.8) относится к форми-
рующим луковицу однодольным растениям с эпигеальным прора-
станием. Первоначальное удлинение нижней и средней зон семя-
доли приводит к тому, что кончик корня и короткий гипокотиль
пробиваются через семенную кожуру на участке микропиле (рис.
24.8,4). Семядоля следует за ними и резко перегибается (Б).
Точка перегиба помогает части семядоли пробиваться через поч-
ву. Гаусториальный конец семядоли остается в семени и продол-
жает всасывать запасные вещества из эндосперма, в то время как
часть, выступающая над землей, становится зеленой и фотосинте-
зирующей. Та сторона семядоли, которая все еще прикреплена к
семени и находится в почве, прекращает рост, тогда как другая
сторона продолжает вытягиваться, становится искривленной и
испытывает натяжение (В). Натяжение заставляет более корот-
кую сторону и прикрепленное к ней семя пробиваться через поч-
ву. Семядоля начинает расти вертикально, но изгиб сохраняется
(Г). Семенная кожура опадает. Часть семядоли, находящаяся над
изгибом, постепенно засыхает, начиная от верхушки {Д). Тем вре-
менем закладываются адвентивные корни {Б — Д), и, наконец, че-
рез щель в семядоле пробивается первый лист (Д). Расположе-
ние эпикотиля по отношению к изгибу семядоли непостоянно (ср.
фото 143, Б и рис. 24.8, Б).
Рис. 24.7. Структура проростка льна Linum usitatissimum. А—Г. Прорастающее
семя и три стадии развития проростка, показывающие рост главного корня (ниже
наконечников стрелок) и вид ветвистых корней; удлинение гипокотиля (выше на-
конечников стрелок); развертывание семядолей и развитие эпикотиля. Д. Систе-
ма ксилемы зоны перехода, в которой соединяются корень и семядоли. Флоэма
должна располагаться с внешней стороны ксилемы. (Рис. А—Г выполнены Al-
va D. Graut; рис. Д воспроизводится из работы Grooks, Bot. Gaz., 95, 209—239,
1933.) 1 — эпикотиль; 2 — семядоля; 3 — эндархная ксилема; 4 — семядоли; 5 —
боковой пучок; 6 — средний пучок; 7 — протоксилема; 8 — части среднего пучка;
9 — первичная кора; 10 — сердцевина; 11 — метаксилема; 12 — экзархная кси-
лема.
Рис 24 8 Структура проростка лука Allium сера А Прорастающее семя Б—Д
Стадии развития проростка Б Начало удлинения семядоли и корня, семя еще
находится в земле В Удлинение семядоли происходит только на той стороне,
которая сливается с корнем Г Верхушка семядоли и семя вышли на поверх-
ность почвы Д Семенная кожура опала, и верхушка семядоли увяла Косой
штриховкой обозначена семенная кожура точками — эндосперм, стрелками ука-
заны зоны растяжения (Воспроизводится из работы [40] с некоторыми изме-
нениями ) 1 — семядольное влагалище 2 — первый лист, 3 — адвентивный корень
496
Глава 24
Рис. 24.9. Ранние стадии раз-
вития проростка Asparagus те-
deoloides. Семя и заключен-
ная в нем семядоля остаются в
земле. Побег вырос за пределы
семядольного влагалища. (Вос-
производится из работы [6] с
некоторыми изменениями.) 1 —
корень; 2 — побег; 3 — семя-
дольное влагалище; 4 — семен-
ная кожура; 5 — семядоля; 6 —
эндосперм.
В отличие от Allium сера однодольное лилейное Asparagus
[6, 36] (рис. 24.9) характеризуется подземным прорастанием. Се-
мядоля вытягивается у основания и выталкивает зародышевую
ось из семени (А). После этого происходит удлинение только кор-
ня и эпикотиля (Б, В). Последний пробивается через влагалище
семядоли и поднимается над землей, но семядоля остается погру-
женной в эндосперм (Г, Д). Эпикотиль образует ряд чешуй и па-
зушных почек, а гипокотиль формирует короткое разветвленное
корневище.
Прорастание семени у Роасеае также является гипогеаль-
ным, так как зерновка вместе со щитком остается ниже поверх-
ности почвы (рис. 24.10). В начале прорастания семени коле-
ориза удлиняется и пробивается через перикарпий, а затем через
колеоризу проходит корень. На другом конце зерновки появляет-
ся покрытый колеоптилем побег. У Zea все это образование вы-
носится на поверхность почвы в результате удлинения первого
междоузлия, но у пшеницы побег поднимается главным образом
вследствие роста второго междоузлия, т. е. междоузлия, располо-
женного над колеоптильным узлом [14].
Зародыш и проросток
497
Поскольку у Paniceae единица диссеминации образуется из
целого цветка, зерновка заключена в верхнюю и нижнюю цветко-
вые чешуи цветка. Верхняя цветковая чешуя имеет прикреплен-
ную к ней в виде клапана структуру площадью около 0,25 мм2.
В процессе прорастания колеориза выходит через эту «крышку
прорастания» [37,39]. На дистальном конце единицы диссемина-
ции между верхней и нижней цветковыми чешуями появляется
колеоптиль с заключенным в нем зачаточным побегом. У Zizani-
еае единица диссеминации представляет собой колосок, вследст-
вие чего корешок в процессе прорастания должен прорвать ко-
Рис. 24.10 Проросток Zea mays. (Воспроизводится из работы [31] ) 1 — первич-
ный корень, т. е. корень, который закладывается в колеоризе, 2 — адвентивные
корни I яруса; 3— адвентивные корни II яруса; 4 — зерно; 5 — колеориза; 6 —
первый (щитковый) узел; 7 — первое междоузлие, расположенное между щит-
ком и колеоптилем; 8—второй (колеоптильный) узел, 9—колеоптиль, 10—
первый лист, расположенный над колеоптилем; 11 — второй лист, 12 — третий
лист, 13 — четвертый лист
32 К. Эзау, кн. 2.
498
Глава 24
жистую верхнюю чешую. Было показано, что механическая проч-
ность чешуи является одним из факторов, обусловливающих со-
стояние покоя семени у Themeda iriandra [21].
После прорастания семени колеоптиль вытягивается до тех
пор, пока не достигнет поверхности почвы. Затем колеоптиль пе-
рестает расти, и через щель, расположенную поблизости от его
верхушки, пробивается первый лист эпикотиля. Адвентивные кор-
ни первого круга, которые закладываются в зародыше над узлом
щитка, начинают удлиняться. Позднее адвентивные корни разви-
ваются на стебле вблизи 6—10 верхних узлов. Эти расположенные
венчиками корни и составляют главную корневую систему расте-
ния. Возникающие в пазухах нижних листьев почки, каждая из
которых связана с соответствующими адвентивными корнями,
дают начало кущению. Формирование соцветия начинается лишь
после того, как закладывается свойственное данному растению
число листьев, большая часть которых остается еще в неразвер-
нутом состоянии.
Описания проростка злаков вызывают такие же споры, как и
обсуждения частей зародыша злаков и соответствующей термино-
логии. На рис. 24.10 на примере проростка Zea mays [31] пред-
ложен удобный способ стандартизации терминологии для частей
проростков злаков.
Зона перехода
Зародыш несет в себе начало той организации взрослого ра-
стения, которая определяется расположением его частично диф-
ференцированных меристематических тканей — протодермы, про-
камбия и основной меристемы. Зародыш представляет собой
осевую структуру с корневым полюсом и полюсом побега. Поляр-
ность, которую можно обнаружить в цитологической организации
яйцеклетки, выявляется также в процессе развития зародыша и
остается одним из доминирующих морфогенетических факторов
при дифференциации проростка. Эффект полярности отчетливо
проявляется в изменениях структуры и функциональной активно-
сти на всем протяжении оси проростка от одного ее конца до
другого. Так, на корневом полюсе проростка корневая природа
оси выражается в дифференциации цилиндра такого типа, кото-
рый характерен для корней. В противоположность этому побего-
вый конец растения обнаруживает организацию, типичную для
побега высшего растения и характеризующуюся тесной связью
между проводящими системами оси и листьев, которые формиру-
ются на этой оси (семядоли и гипокотиль у молодых пророст-
ков). Как видно на проростке двудольного, не содержащего внут-
ренней флоэмы (рис. 24.7), проводящая ткань гипокотиля навер-
ху разветвляется на тяжи, которые можно проследить в пластин-
Зародыш и проросток
499
ках семядолей. Эти тяжи представляют со-
бой листовые следы, в данном случае следы
семядолей.
Цилиндрическая система проводящих
тканей корня и система проводящих пуч-
ков верхнего гипокотиля соединяются друг
с другом на границе между двумя уров-
нями — уровнями побега и корня (рис.
24.7, Д). Если прослеживать эту связь от
уровня к уровню, начиная для удобства с
корня, то создается впечатление, что кор-
невая структура постепенно превращается
в структуру побега. Чем выше, тем менее
компактным становится цилиндр корня.
Если в корне сердцевина отсутствует, то на
более высоком уровне она может быть от-
четливо выражена. Еще выше проводящая
ткань отчетливо расчленяется на два или
большее число тяжей — семядольных сле-
дов.
Наряду с такими простыми различиями,
связанными с общей формой проводящей
системы на разных уровнях, могут наблю-
даться и более сложные изменения, касаю-
щиеся направления дифференциации кси-
лемных элементов в зависимости от их рас-
положения вдоль проростка (рис. 24.11).
Протоксилемные элементы занимают пери-
ферическое положение в проводящем ци-
линдре корня. Дифференцирующиеся позд-
нее метаксилемные элементы постепенно
располагаются все ближе к центру. Таким
образом, как видно на поперечном срезе,
дифференциация ксилемных элементов осу-
Рис. 24.11. Схемы, иллюстрирующие связи между
проводящими системами корня и семядолей у про-
ростка двудольного растения (Beta vulgaris). А. Ди-
архный корень. Первичная проводящая система кор-
ня переходит в гипокотиле в проводящую систему
семядолей (Ж). Между двумя уровнями (корнем и
семядолями) наблюдаются постепенные изменения в
пространственных отношениях между ксилемой и
флоэмой и в направлении дифференциации ксилемы.
(Воспроизводится из работы Esau, Plant Anatomy,
2nd ed., John Wiley and Sons, 1965, с некоторыми
изменениями.) 1 — корневой чехлик; 2 — протокси-
лема; 3— метаксилема; 4 — флоэма; 5 — листовой
след; 6 — кончик побега; 7 — лист; 8 — семядоля.
32*
500
Глава 24
ществляется в центростремительном направлении, т. е. ксилема яв-
ляется экзархной (Д). В семядольных пучках (или в первых пуч-
ках эпикотиля у некоторых растений) порядок дифференциации
ксилемы становится обратным. Протоксилемные элементы лока-
лизуются дальше от периферии, а метаксилемные элементы созре-
вают в центробежном направлении, следовательно, ксилема явля-
ется эндархной (Ж). Связь между экзархной ксилемой корня и
эндархной ксилемой побега устанавливается через ту часть прово-
дящей системы, в которой относительное положение ранних и позд-
них элементов ксилемы становится промежуточным (Б — Е).
Флоэма на всех уровнях дифференцируется в направлении от
периферии к центру, но если в корне она чередуется с ксилемой
радиально (рис. 24.11, Д), то в побеге она связана с ксилемой в
виде коллатеральных проводящих пучков (у растений, не имею-
щих внутренней флоэмы; рис. 24.11, Ж). Согласование между эти-
ми двумя типами расположения флоэмы осуществляется в зоне
перехода в результате замещения экзархной ксилемы эндархной.
Часть проростка, в которой стыкуются системы побега и корня
и наблюдается последовательное изменение особенностей структу-
ры, характерных для этих двух систем, называется зоной перехода.
Изменение структуры на разных уровнях зоны перехода осуще-
ствляется постепенно, что позволяет предположить наличие гра-
диента факторов, распространяющихся от корневого полюса к по-
люсу побега и ответственных за развитие специфических особен-
ностей структуры. Таким образом, в развивающемся проростке
обнаруживается существование градиентов дифференциации —
одного из обычных морфогенетических факторов.
Приведенное выше определение касается относительно просто-
го типа зоны перехода у двудольных. Многие двудольные имеют
более сложные связи между корнем и стеблем, а у однодольных
наличие только одной семядоли обусловливает асимметричную
структуру зоны перехода [3,14]. У голосеменных частое присут-
ствие более одной семядоли накладывает свой отпечаток на
структуру зоны перехода, усложняя ее [3].
СПИСОК ЛИТЕРАТУРЫ
Avery G. S., Jr. Comparative anatomy and morphology of embryos and seed-
lings of maize, oats, and wheat, Bot. Gaz., 89, 1—39 (1930).
Briggs D. E. Enzyme formation, cellular breakdown and the distribution of
gibberellins in the endosperm of barley, Planta, 108, 351—358 (1972).
Boureau E. Anatomie vegetale, Vol. 1, Paris, Presses Universitaires de Fran-
ce, 1954.
embryo, Phytomorphology, 10,
Phytomorphology, 15, 274—284
Brown W. V. The morphology of the grass
215—223 (1960).
Brown W. V. The grass embryo — a rebuttal,
(1965).
Зародыш и проросток
501
6. Courtot У. Recherches sur la morphologic, 1’anatomie, la croissance es les
movements revolutifs de deux Liliacees: Bulbine annua et Asparagus medeoloi-
des, Ann. Sci. Univ. Besan^on. Ser. 3, Bot. Fasc., 1, 1—98 (1966).
7. Сгё1ё P. Embryo, Chapter 7, pp. 171—220. In: Recent advances in the embryo-
logy of angiosperms, Maheshwari P., ed., International Society of Plant Mor-
phologists, University of Delhi, Ranchi, India, The Catholic Press, 1963.
8. Esau K. Vascular differentiation in plants, New York, Holt, Rinehart and Win-
ston, 1965.
9. Gerhardt B. Untersuchungen zur Funktionsanderung der Microbodies in den
Keimblattern von Helianthus annuus L., Planta, 110, 15—28 (1973).
10. Guignard J.-L. Recherches sur 1’embryogenie des Graminees; rapports des
Graminees avec les autres Monocotyledones, Ann. Sci. Nat., Bot. Ser. 12, 2,
491—610 (1961).
11. Guignard J.-L., Mestre J.-Ch. L’embryon des Graminees, Phytomorphology, 20,
190—197 (1970).
12. Guttenberg H. von. Der primare Bau der Angiospermenwurzel, Handbuch der
Pflanzenanatomie, Band 8, Teil 5 (1968).
13. Haccius B. Zur derzeitigen Situation der Angiospermen-Embryologie, Bot. Jb.,
91, 309—329 (1971).
14. Hayward H. E. The structure of economic plants, New York, Macmillan, 1938..
15. Johansen D. A. Plant embryology, Waltham, Mass., Chronica Botanica Com-
pany, 1950.
16. Jones L. H. Factors influencing embryogenesis in carrot cultures (Daucus ca-
rota L.), Ann. Bot., 38, 1077—1088 (1974).
17. Konar R. N., Thomas E., Street H. E. Origin and structure of embryoids ari-
sing from epidermal cells of the stem of Ranunculus sceleratus L., J. Cell Sci.,
11, 77—93 (1972).
18. Lott J. N. A. Changes in the cotyledons of Cucurbita maxima during germina-
tion. I. General characteristics, Can. J. Bot., 48, 2227—2231 (1970). III. Plas-
tids and chlorophylls, Can. J. Bot., 48, 2259—2265 (1970).
19. Lott J. N. A., Castelfranco P. Changes in the cotyledons of Cucurbita maxima
during germination. II. Development of mitochondrial function, Can. J. Bot.,
48, 2233—2240 (1970).
20. Maheshwari P. An introduction to the embryology of angiosperms, New York,
McGraw-Hill, 1950.
21. Martin С. C. The role of glumes and gibberellic acid in dormancy of Themeda
triandra spikelets, Physiol. Plant., 33, 171 —176 (1975).
22. Merry J. Studies on the embryo of Hordeum sativum — I. The development of
the embryo, Bull. Torrey Bot. Club, 68, 585—598 (1941).
23. Mestre J.-G. La signification phylogenetique de 1’embryogenie, Rev. Gen. Bot.,
74, 273—322 (1967).
24. Newcomb W., Fowke L. C. Stellaria media embryogenesis: the development
and ultrastructure of the suspensor, Can. J. Bot., 52, 607—614 (1974).
25. Nomura T., Kono Y., Akazawa T. Enzymic mechanism of starch breakdown in
germinating rice seeds. II. Scutellum as the site of sucrose synthesis; Plant
Physiol., 44, 765—769 (1969).
26. Norstog K. Early development of the barley embryo: fine structure, Amer. J.
Bot., 59, 123—132 (1972).
27. Norstog K. Nucellus during early embryogeny in barley: fine structure, Bot.
Gaz., 135, 97—103 (1974).
28. O'Brien T. P., Thimann К. V. Histological studies of the coleoptile. I. Tissue
and cell types in the coleoptile tip, Amer. J. Bot., 52, 910—918 (1965).
29. O’Brien T. P., Thimann К. V. Observations on the fine structure of the oat
coleoptile. III. Correlated light and electron microscopy of the vascular tissues,
Protoplasma, 63, 443—478 (1967).
502
Глава 24
30. O'Brien Т. Р., Zee S., Swift J. G. The occurrence of transfer cells in the vascular
tissues of the coleoptilar node of wheat, Aust. J. Biol. Sci., 23, 709—712 (1970).
31. Onderdonk J. J., Retcheson J. W. A standartization of terminology for the
morphological description of corn seedlings, Can. J. Plant Sci., 52, 1003—
1006 (1972).
32. Paulson R. E., Srivastava L. M. The fine structure of the embryo of Lactuca
sativa. I. Dry embryo, Can. J. Bot., 46, 1437—1445 (1968).
33. Raghavan V. Nutrition, growth and morphogenesis of plant embryos, Biol.
Rev., 41, 1—58 (1966).
34. Randolph L. F. Developmental morphology of the caryopsis in maize, J. Agric.
Res., 53, 881—916 (1936).
35. Rauh W. Morphologic der Nutzpflanzen, Heidelberg, Quelle & Meyer, 1950.
36. Riviere S. Les activites merisiematiques durant Tontogenese d’une plantule
de Monocotyledone a germination hypogee: V Asparagus officinalis L. (Lilia-
cees), C. R. Acad. Sci. Paris, D277, 293—296 (1973).
37. Rost T. L. The morphology of germination in Setaria lutescens (Gramineae):
the effects of covering structures and chemical inhibitors on dormant and non-
dormant florets, Ann. Bot., 39, 21—30 (1975).
38. Rost T. L., Lersten N. R. A synopsis and selected bibliography of grass caryop-
sis anatomy and fine structure, Iowa State J. Res., 48, 47—87 (1973).
39. Rost T. L., Simper A. D. The germination lid: a characteristic of the lemma in
the Paniceae, Madrono, 23, 68—72 (1975).
40. Sachs J. Ueber die Keimung des Samens von Allium сера, Bot. Z., 21, 57—62;
65—70 (1863).
41. Schnarf R. Vergleichende Embryologie der Angiospermen, Berlin, Gebriider
Borntraeger, 1931.
42. Schulz S. R., fensen W. A. Capsella embryogenesis: the egg, zygote, and young
embryo, Amer. J. Bot., 55, 807—819 (1968). Capsella embryogenesis: the early
embryo, J. Ultrastruct. Res., 22, 376—392 (1968).
43. Schulz S. P., Jensen W. A. Capsella embryogenesis: the suspensor and the ba-
sal cell, Protoplasma, 67, 138—163 (1969).
44. Smith D. L. Nuclear changes in the cotyledons of Pisum arvense L. during
germination, Ann. Bot., 35, 511—521 (1971).
45. Smith D. L., Flinn A. M. Histology and histochemistry of the cotyledons of
Pisum arvense L. during germination, Planta, 74, 72—85 (1967).
46. Soueges R. Embryogenie des Graminees. Developpment de 1’embryon chez le
Poa annua L., C. R. Acad. Sci. Paris, 178, 860—862 (1924).
47 Soueges R. Embryogenie et classification, Paris, Hermann, 1938, 1939, 1948, 1951.
48. Soueges R. L'origine du cone vegetatif de la tige et la question de la «termi-
nalite» du cotyledon des Monocotyledones, Ann. Sci. Nat., Bot. Ser. 11, 15,
1—20 (1954).
49. Srivastava L. M., Paulson R. E. The fine structure of the embryo of Lactuca
sativa. II. Changes during germination, Can. J. Bot., 46, 1447—1453 (1968).
50. Steffen R. Die Embryoentwicklung von Impatiens glanduligera Lindl., Flora,
139, 394—461 (1952).
51. Stoddart J. L., Thomas H., Robertson A. Protein synthesis patterns in barley
embryos during germination, Planta, 112, 309—321 (1973).
52. Swift J. G., O'Brien T. P. Vascularization of the scutellum of wheat, Aust. J.
Bot., 18, 45—53 (1970). Vascular differentiation in the wheat embryo, Aust.
J. Bot., 19, 63—71 (1971). The fine structure of wheat scutellum before germi-
nation, Aust. J. Biol. Sci., 25, 9—22 (1972). The fine structure of the wheat scu-
tellum during germination, Aust. J. Biol. Sci., 25, 469—486 (1972).
53. Thimann R. V., O'Brien T. P. Histological studies of the coleoptile. II. Compa-
rative vascular anatomy of coleoptiles of Avena and Triticum, Amer. J. Bot.,
52, 918—923 (1965).
54. Torrey J. G. Development in flowering plants, New York, Macmillan, 1967.
55. Wardlaw C. W. Embryogenesis in plants, New York, John Wiley & Sons, 1955.
Словарь терминов
б этом словаре даны определения терминов, используемых в анатомии
растений. Объясняются также некоторые цитологические и морфологические
термины, главным образом те, которые, как правило, забываются после ввод-
ного курса ботаники, или те, которые имеют несколько значений. Конечно, же-
лательно, чтобы каждый термин использовался для обозначения одного кон-
кретного понятия или явления, однако с углублением наших знаний смысл
тех или иных терминов нередко меняется. Иногда определения, приведенные
в словаре, не совсем соответствуют общепринятым определениям. Термины ла-
тинского и греческого происхождения могут быть найдены в словаре Джексона
(см. список литературы к гл. 1).
Абаксиальный. Направленный от оси. Противопоставляется адаксиальному
направлению.
Агрегатный луч. Встречается во вторичных проводящих тканях; группа
мелких лучей, расположенных таким образом, что все вместе они выглядят
как один большой луч.
Адаксиальная меристема. Меристематическая ткань на адаксиальной стороне
молодого листа, которая принимает участие в утолщении черешка и средней
жилки.
Адаксиальный. Направленный к оси. Противопоставляется абаксиальному.
Адвентивный (придаточный). Относится к структурам, возникающим не на
своих обычных местах, например к корням, формирующимся на стеблях или
на листьях, а не на других корнях, к почкам, развивающимся на листьях или
на корнях, а не на побегах в пазухах листьев.
Акропетальное развитие (или дифференциация). Закладка или дифферен-
циация структуры в направлении к апексу органа. Противопоставляется
базипетальному, но означает то же самое, что и базифугальное.
Актиноморфный. Относится к цветку, который может быть разделен на две
равные части более чем в одной продольной плоскости; радиально-симметрич-
ный, или правильный, цветок. Противопоставляется зигоморфному.
Актиностель. Протостель с звездообразным очертанием на поперечном срезе.
Алейрон. Гранулы белка (алейроновые зерна), содержащиеся в семенах
и расположенные обычно у самого наружного слоя — алейронового слоя эн-
досперма (лучше называть алейроновые зерна белковыми тельцами).
Алейроновый слой. Самый наружный слой эндосперма у хлебных злаков
и многих других групп растений, который содержит белковые тельца и фер-
менты, связанные с перевариванием эндосперма.
Альбедо. Белая ткань околоплодника цитрусовых.
Альбуминовые клетки. Во флоэме голосеменных; некоторые клетки лучевой
или флоэмной паренхимы, пространственно и функционально связанные с си-
товидными элементами, чем напоминают клетки-спутники покрытосеменных;
однако, как правило, эти клетки не имеют общих предшественников с ситовид-
ными элементами. Называются также клетками Страсбургера.
Амебоидный тапетум. В гнездах пыльника; тапетум, принимающий амебо-
идную форму, когда он разрушается при развитии оболочки пыльцевого зерна.
Амилопласт. Бесцветная пластида (лейкопласт), в которой образуются
крахмальные зерна.
504
Словарь терминов
Амфивазальный проводящий пучок. Концентрический проводящий пучок, в
котором ксилема окружает флоэму.
Амфикрибральный проводящий пучок. Концентрический проводящий пучок,
в котором флоэма окружает ксилему.
Амфифлойная сифоностела. Стела, в которой проводящая система имеет
вид трубки, а флоэма расположена как с наружной, так и с внутренней сто-
роны ксилемы.
Аналогия. Функциональное сходство структур, имеющих различное филоге-
нетическое происхождение.
Анастомоз. Относится к клеткам или тяжам клеток, которые взаимосвя-
заны между собой, как, например, жилки в листе.
Андроцей. Совокупность тычинок в цветке семенного растения, часть цвет-
ка, в котором осуществляется мужской гаметогенез.
Анизоцитное устьице. Устьичный комплекс, в котором устьице окружено
тремя побочными клетками, причем одна из этих клеток заметно меньше
двух других.
Аномальный вторичный рост. Общеупотребительный термин, определяющий
типы вторичного роста, которые отличаются от более распространенных.
Аномоцитное устьице. Устьице без побочных клеток.
Антиклинальный. Обычно относится к ориентации клеточной стенки или
плоскости клеточного деления: перпендикулярный к ближайшей поверхности.
Противопоставляется периклинальному.
Антиподы. Три или большее число клеток, расположенных на халазальном
конце зрелого зародышевого мешка покрытосеменных.
Антоциан. Водорастворимый синий, пурпурный или красный флавоноидный
пигмент, содержащийся в клеточном соке.
Апекс. Верхушка побега и кончик корня, содержащий апикальную мери-
стему.
Апертура в пыльцевом зерне. Углубление в оболочке, в котором толстая
интина покрыта тонкой экзиной; через апертуру прорастает пыльцевая трубка.
Апертура поры. Отверстие из полости клетки в пору. Если в окаймленной
поре имеется поровый канал, то различают две апертуры: внутреннюю — из
полости клетки в канал и наружную — из канала в полость поры.
Апикальная клетка. Единичная клетка, которая занимает дистальное по-
ложение в апикальной меристеме корня или побега; ее обычно рассматривают
как инициальную клетку в апикальной меристеме.
Апикальная меристема. Группа меристематических клеток в апексе корня
или побега, которые путем деления формируют предшественники первичных
тканей корня и побега. Апикальная меристема может быть вегетативной, даю-
щей начало вегетативным тканям и органам, и репродуктивной, производящей
репродуктивные ткани и органы.
Апокарпия. Строение цветка, характеризующееся отсутствием срастания
плодолистиков (свободные плодолистики).
Апомиксис. Формирование зародыша без мейоза и (или) слияния гамет.
Апотрахеальная паренхима. Во вторичной ксилеме; осевая паренхима, в
типичном случае не зависимая от сосудов («пор»). Включает пограничную
{инициальную или терминальную), тяжевую и диффузную апотрахеальную
паренхиму.
Аппарат Гольджи. Совокупность всех телец Гольджи, или диктиосом, в
данной клетке. Иногда этот термин применяется по отношению к одной дик-
тиосоме.
Аппозиция. Рост клеточной оболочки путем последовательного — слой за
слоем — отложения веществ, ее составляющих. Противопоставляется термину
интуссусцепция.
Ареола. Небольшой участок мезофилла в листе, ограниченный пересекаю-
щимися жилками.
Словарь терминов
505
Ариллус. Мясистый вырост, одевающий семя и обычно начинающий рост
от основания семязачатка.
Астросклереида. Разветвленная склереида.
Атактостела. Стела с проводящими пучками, рассеянными в основной ткани.
Ацикулятный кристалл. Игловидный кристалл.
Аэренхима. Паренхимная ткань, содержащая особенно крупные межклетни-
ки схизогенного, лизигенного или рексигенного происхождения.
Базипетальное развитие (или дифференциация). Закладка или дифферен-
циация структуры в направлении к основанию органа. Противопоставляется
акропетальному и базифугальному.
Базифугальное развитие. См. Акропетальное развитие.
Балки Санио. См. Крассулы.
Безбелковое семя. Семя, в зрелом состоянии лишенное эндосперма.
Безъядерная (клетка). Клетка, лишенная ядра.
Белковое семя. Семя, содержащее в зрелом состоянии эндосперм.
Биколлатеральный проводящий пучок. Пучок, имеющий флоэму, располо-
женную по обе стороны ксилемы.
Билатеральная симметрия. Относится к цветку, имеющему две соответст-
вующие Друг другу (комплементарные) стороны; такой цветок можно разде-
лить одной продольной плоскостью, проведенной через его ось, на две полови-
ны, зеркально отражающие одна другую. Противопоставляется радиальной сим-
метрии.
Бифациальный лист. Лист с палисадной паренхимой на одной стороне
пластинки и с губчатой — на другой. См. Дор со вентральный лист. С онтогене-
тической точки зрения — это лист, который развивается целиком из апекса пер-
вичного листового примордия и включает ткани как адаксиальной, так и абак-
сиальной стороны примордия. Ср. с унифациальным листом.
Боковой корень. Корень, берущий начало от другого, более старого корня;
называется также вторичным корнем, если более старый корень является пер-
вичным (главным) корнем.
Брахисклереида. Короткая, почти изодиаметрическая склереида, напоми-
нающая по форме паренхимную клетку; каменистая клетка.
Вазицентрическая паратрахеальная паренхима. Осевая паренхима во вто-
ричной ксилеме, формирующая сплошную обкладку вокруг сосудов. См. также
Паратрахеальная паренхима.
Вакуолизация. В онтогенезе под этим термином подразумевается развитие-
вакуолей в клетке; в зрелом состоянии — это наличие вакуолей в клетке.
Вакуоль. Полость в цитоплазме, заполненная водянистой жидкостью (кле-
точным соком) и окруженная элементарной мембраной (тонопластом). Участ-
вует в поглощении воды во время прорастания и роста, а также удерживает
воду в клетке. Содержит гидролитические ферменты и обладает литической
функцией.
Вакуолярная мембрана. См. Тонопласт.
Вакуом. Совокупность всех вакуолей в клетке, ткани или растении.
Вегетативная апикальная меристема. См. Апикальная меристема.
Веламен. Многослойная эпидерма, покрывающая воздушные корни некото-
рых тропических эпифитных орхидей и аронниковых. Встречается также на
корнях у некоторых наземных растений.
Венчик. Совокупность лепестков цветка.
Веретеновидная инициаль. В камбии; вытянутая клетка с заостренными, как
у веретена, концами, которая дает начало элементам осевой системы во вто-
ричных проводящих тканях.
506
Словарь терминов
Веретеновидная клетка. Вытянутая клетка, заостренная на концах.
Вертикальная паренхима. См. Осевая (аксиальная) паренхима.
Вертикальная система. Во вторичных проводящих тканях. См. Осевая
(аксиальная) система.
Верхняя завязь. См. Гипогиния.
Весенняя древесина. См. Ранняя древесина.
Ветвистая пора. Пора, которая кажется разветвленной вследствие того, что
сна формируется слиянием двух или нескольких простых пор в процессе утол-
щения вторичной оболочки.
Веточная щель. В узловой зоне стебля; участок паренхимы в центральном
цилиндре стебля, расположенный в том месте, где веточные следы отклоняются
по направлению к ветке. Обычно сливается со щелью листа, в пазухе которого
находится ветка.
Веточные следы. Проводящие пучки, соединяющие проводящие ткани вет-
ки и главного стебля. Они представляют собой листовые следы первых листьев
(профиллов) на ветке.
Включенная флоэма. Вторичная флоэма, включенная во вторичную ксилему
у некоторых двудольных. То же самое, что интерксилярная флоэма.
Влагалище. Листообразная структура, заключающая или окружающая дру-
гую. Применяется к трубчатой или свернутой в трубку части органа, такой,
например, как влагалище листа, а также к слою ткани, окружающему комплекс
другой ткани, как, например, пучковое влагалище (обкладка), окружающее про-
водящий пучок.
Влагалище листа. Нижняя часть листа, которая целиком или почти цели-
ком охватывает стебель.
Влагалищное основание. Основание листа, охватывающее стебель.
Внутренняя кора. См. Кора.
Внутренняя флоэма. Первичная флоэма, расположенная внутрь от первичной
ксилемы. То же самое, что интраксилярная флоэма.
Водоносный пузырек. Тип трихома. Разросшаяся сильно вакуолизированная
эпидермальная клетка.
Волокна веретена. Микротрубочки, собранные в веретеновидный комплекс,
простирающийся от полюса к полюсу в клетке с делящимся ядром. Термин
относится к образованиям, видимым под световым микроскопом.
Волокнистая склереида. Склеренхимная клетка со структурой, промежу-
точной между волокном и склереидой.
Волокнистая трахеида. Волокновидная трахеида во вторичной ксилеме;
обычно толстостенная, с заостренными концами и окаймленными порами, кото-
рые обладают различными апертурами — от линзовидных до щелевидных.
Волокно. Вытянутая, обычно заостренная на концах склеренхимная клетка
с лигнифицированной или нелигнифицированной вторичной оболочкой; в диф-
ференцированном состоянии иногда содержит живой протопласт.
Волокно либриформа. Ксилемное волокно, как правило, с толстыми стенка-
ми и простыми порами; обычно самая длинная клетка в ткани.
Вскрывание. Спонтанное открывание таких образований, как пыльник или
плод, способствующее высвобождению репродуктивных единиц, содержащихся
во вскрывающемся органе.
Вторичная клеточная оболочка. По данным световой микроскопии: клеточ-
ная оболочка, отложенная в некоторых клетках на первичную оболочку после
того, как ее поверхность перестает увеличиваться. По данным электронной ми-
кроскопии: клеточная оболочка, в которой целлюлозные микрофибриллы ориен-
тированы строго параллельно. Оба представления не всегда совпадают при
разграничении первичной и вторичной оболочек.
Вторичная ксилема. Ксилемная ткань сосудистого растения, сформирован-
ная камбием в процессе вторичного роста. Дифференцирована на осевую и
-Лучевую системы.
Вторичная оболочка. См. Вторичная клеточная оболочка.
Вторичная флоэма. Флоэмная ткань, сформированная у сосудистого расте-
Словарь терминов
507
ния камбием в процессе вторичного роста. Дифференцирована на осевую и
лучевую системы.
Вторичное тело. Часть тела растения, которая добавляется к первичному
телу благодаря активности латеральных меристем — камбия и феллогена. Со-
стоит из вторичных проводящих тканей и перидермы.
Вторичное тело растения. См. Вторичное тело.
Вторичные ткани. Ткани, сформированные камбием и феллогеном в процессе
вторичного роста.
Вторичное утолщение. Термин, используемый для обозначения как отло-
жений веществ вторичной клеточной оболочки, так и нарастания в толщину
стеблей и корней.
Вторичное флоэмное волокно. Волокно, расположенное в осевой системе
вторичной флоэмы.
Вторичное ядро эндосперма. Ядро, возникающее в результате слияния
двух полярных ядер в центральной клетке зародышевого мешка покрытосемен-
ных.
Вторичные проводящие ткани. Проводящие ткани (флоэма и ксилема) со-
судистого растения, сформированные камбием в процессе вторичного роста.
Дифференцированы на осевую и лучевую системы.
Вторичный корень. См. Боковой корень.
Вторичный рост. У голосеменных, большинства двудольных и некоторых
однодольных. Тип роста, характеризующийся увеличением в толщину стебля и
корня и являющийся следствием формирования камбием вторичных сосудистых
тканей. Обычно сопровождается активностью пробкового камбия (феллогена) у
образующего перидерму.
Выполняющая ткань. Рыхлая ткань, откладываемая феллогеном чечевички
наружу; может быть суберинизированной и несуберинизированной. Называется
также комплементарной тканью.
Гадром. Трахеальные элементы и связанные с ними паренхимные клетки
ксилемной ткани; специфические опорные клетки (волокна и склереиды) ис-
ключаются. См. также Лептом.
Гаплохейльное устьице. Тип устьица у голосеменных, побочные клетки ко-
торого не связаны онтогенетически с замыкающими клетками.
Гаусторий. Вырост клетки или ткани, который функционирует как прони-
кающий и абсорбирующий орган. У паразитических покрытосеменных модифи-
цированный корень способен проникать в ткани хозяина и поглощать питатель-
ные вещества.
Гемицеллюлозы. Полисахариды, более растворимые и с менее упорядочен-
ной структурой, чем целлюлоза; обычный компонент матрикса клеточной обо-
лочки.
Генотип. Генетическая конституция организма; противопоставляется
фенотипу.
Геотропизм. Рост, направление которого определяется гравитацией.
Гетероцеллюлярный луч. Луч во вторичных проводящих тканях, состоя-
щий из клеток нескольких типов: у двудольных — из лежачих и квадратных,
или стоячих, у хвойных — из паренхимных клеток и лучевых трахеид.
Гиалоплазма. См. Цитоплазма.
Гигроморфный. Синоним — гидроморфный.
Гидатода. Структурно модифицированные проводящие и основные ткани,
обычно встречающиеся в листе; такая модификация способствует выделению
воды через пору в эпидерме; гидатода может обладать секреторной функцией.
См. Эпитема.
Гидролиз. Расщепление крупных молекул при участии молекул воды.
Гидроморфный. Относится к структурным особенностям гидрофитов.
Гидрофит. Растение, которое нуждается в большом количестве воды и
может произрастать, будучи частично или полностью погруженным в воду.
508
Словарь терминов
Гинецей. Совокупность плодолистиков в цветке покрытосеменных; часть
цветка, в котором происходит женский гаметогенез.
Гиперплазия. Чрезмерное увеличение числа клеток.
Гипертрофия. Чаще всего аномальное разрастание. Гипертрофия клетки и
-ее частей не связана с клеточным делением. Гипертрофия органа может быть
обусловлена как растяжением клеток, так и аномальным увеличением их числа
(гиперплазией).
Гипогеальный (или подземный). Обозначает подземное прорастание семени,
когда семядоля или семядоли остаются ниже поверхности почвы.
Гипогиния. Структура цветка, характеризующаяся положением чашелисти-
ков, лепестков и тычинок под завязью (верхняя завязь).
Гиподерма. Слой или слои клеток, расположенные под эпидермой и отли-
чающиеся от лежащих под ними клеток основной ткани.
Гипокотиль. Осевая часть зародыша и проростка, расположенная между
семядолей (или семядолями) и корешком.
Гипокотиль — корневая ось. Осевая часть зародыша или проростка, состоя-
щая из гипокотиля и меристемы корня или корешка, если он есть.
Гипофиза. Самая верхняя клетка суспензора, от которой в зародыше про-
исходят часть корня и корневой чехлик.
Гипсофиллы. Листья, развивающиеся на высоких уровнях побега растения
в качестве цветковых брактей. Противопоставляются катафиллам.
Гистоген. Термин, предложенный Ганштейном для меристемы побега и
кончика корня, формирующей какую-либо определенную систему тканей в теле
растения. Различают три гистогена: дерматоген, периблему и плерому (см.
определение этих терминов).
Гистогенез. Формирование тканей; отсюда — гистогенетика, имеющая дело
с происхождением и формированием тканей.
Гистогенетика. См. Гистогенез.
Глиоксисома. Микротельце, содержащее ферменты, необходимые для пре-
вращения жиров в углеводы.
Гнездо. Полость в спорангии, содержащая споры (например, пыльцевые
зерна), или в завязи, содержащая семязачатки.
Годичное кольцо. Во вторичной ксилеме; кольцо прироста, формирующееся
за один сезон. Термин спорный, так как в течение одного года может быть
сформировано более одного кольца прироста.
Гомология. Общность филогенетического, эволюционного происхождения.
Гомологичные органы характеризуются различными структурой и (или) функ-
цией.
Гомоцеллюлярный луч. Луч во вторичных проводящих тканях, состоящий
из клеток только одной формы: у двудольных либо из лежачих, либо из квад-
ратных (или стоячих) клеток; у хвойных — только из паренхимных клеток.
Горизонтальная паренхима. См. Лучевая паренхима.
Горизонтальная система. См. Лучевая система.
Гормон. Химическое соединение, возникающее в одной части растения и
транспортируемое в другую часть, где оно производит специфическое действие.
Гранулокриновая секреция. Секреция такого типа, при которой секрет
переносится внутренней цитоплазматической мембраной, обычно мембраной пу-
зырька, и выделяется из клетки после того, как пузырек сольется с плазмалем-
мой и высвободит свое содержимое наружу. Ср. с эккриновой секрецией.
Граны (ед. ч. грана). Субъединицы хлоропластов, видимые как зеленые
гранулы в световом микроскопе и как стопки дисковидных цистерн (тилакои-
дов) в электронном микроскопе; в гранах локализованы хлорофиллы и кароти-
ноиды, участвующие в фотосинтезе.
Группа пор. См. Сложная пора.
Губчатая паренхима. Паренхима мезофилла листа с хорошо выраженными
^межклетниками.
Словарь терминов
509
Гуммоз. Симптом болезни, характеризующийся образованием камеди, ко-
торая либо накапливается в полостях или ходах, либо появляется на поверх-
ности растения.
Гуттация. Экссудация из листьев воды, вытекающей из ксилемы.
Двойное оплодотворение. Слияние яйцеклетки и спермия (с образованием
диплоидной (2п) оплодотворенной яйцеклетки — зиготы) и одновременное слия-
ние второй мужской гаметы с полярными ядрами (с образованием триплоид-
ного (Зп) первичного ядра эндосперма). Уникальная особенность покрытосе-
менных.
Двурядный. Расположение листьев в два вертикальных ряда, двурядное
расположение.
Двурядный луч. Луч шириной в две клетки во вторичной проводящей
ткани.
Двухпучковый однолакунный след. Характеризует узел стебля, в котором
два листовых следа, относящихся к одному листу, сопровождаются одной ли-
стовой щелью
Дедифференциация Процесс, обратный дифференциации, который, как по-
лагают, происходит тогда, когда более или менее полностью дифференцирован-
ная клетка (или ткань) восстанавливает меристематическую активность
Дендроидное жилкование. Тип жилкования, при котором мелкие жилки не
образуют замкнутых ячеек вокруг небольших участков мезофилла.
Дерматоген. Меристема, формирующая эпидерму и происходящая из неза-
висимых инициалей апикальной меристемы. Один из трех гистогенов по Ган-
штейну (плерома, периблема и дерматоген).
Десмоген. Меристематический тяж, который дифференцируется в прово-
дящий пучок Может быть первичным, т е. состоять из прокамбпальных кле-
ток, или вторичным, т е происходить из камбия у тех растений, у которых
вторичное тело состоит из проводящих пучков, находящихся во вторичной па-
ренхимной ткани
Десмотрубочка. Трубочка (часто имеющая вид сплошного стержня), связы-
вающая две цистерны эндоплазматического ретикулума, расположенные на
двух противоположных концах плазмодесмы.
Детерминированный (ограниченный) рост. Формирование ограниченного
числа боковых органов апикальной меристемой, характерен для флоральной
меристемы.
Диархная. Первичная ксилема в корне, имеющая два протоксилемных тяжа
(или два протоксилемных полюса).
Диафрагмы в сердцевине. Поперечные слои (диафрагмы) толстостенных
клеток, чередующиеся с зонами тонкостенных клеток, которые с возрастом мо-
гут спадаться.
Диацитное устьице. Устьичный комплекс, в котором устьице окружено
одной парой побочных клеток, при этом соприкасающиеся стенки последних
расположены под прямым углом к длинной оси замыкающих клеток
Диктиосома. Мембранная система, называемая также органеллой, состоя-
щая из стопки цистерн, каждая из которых образует по периферии пузырьки;
если этот процесс протекает очень активно, цистерна может выглядеть сетча-
той Называется также тельцем Гольджи, или аппаратом Гольджи.
Диктиостела. Стела, в которой крупные перекрывающие друг друга листо-
вые щели рассекают проводящую систему на анастомозирующие тяжи, состоя-
щие из флоэмы, окружающей ксилему.
Дилатация. Разрастание паренхимы путем деления клеток в сердцевине, в
лучах или в осевой системе проводящих тканей, вызывает увеличение окруж-
ности коры в стебле и корне
Дистальный. Наиболее удаленный от места возникновения или прикрепле-
ния Противопоставляется проксимальному.
510
Словарь терминов
Дифференциация. Физиологические и морфологические изменения, проис-
ходящие в клетке, ткани, органе или растении в процессе развития от мери-
стематической, или ювенильной, стадии до зрелой, или дефинитивной, стадии.
Обычно связана с возрастанием степени специализации.
Диффузная апотрахеальная паренхима. Осевая паренхима во вторичной
ксилеме; на поперечном срезе имеет вид одиночных клеток или тяжей, нерав-
номерно распределенных среди волокон. См. также Апотрахеальная паренхима.
Дихотомическое жилкование. Вид жилкования, при котором жилки много-
кратно разветвляются на две равные части.
Добавочный камбиальный слой. Камбий, закладывающийся во флоэме или
в перицикле снаружи от обычного камбия. Характерен для некоторых растений
с аномальным типом вторичного роста.
Дорсальный. В ботанической литературе эквивалентен термину абаксиальный.
Дорсовентральный лист. Лист, обладающий четко выраженными верхней и
нижней сторонами. Термин произошел вследствие обозначения абаксиальной и
адаксиальной сторон листа как соответственно дорсальной и вентральной.
Бифациальный лист.
Древесина. Обычно вторичная ксилема голосеменных и двудольных, но при-
меняется также и для обозначения любой другой ксилемы.
Древесина сжатия (креневая древесина). Реактивная древесина у хвойных,
которая формируется на нижних сторонах ветвей и лежачих или изогнутых
стеблей и характеризуется плотной структурой, сильным одревеснением и не-
которыми другими особенностями.
Друза. Шаровидный сложный кристалл оксалата кальция с многочислен-
ными кристаллами, выступающими над его поверхностью.
Дуговидное жилкование. См. Параллельное жилкование.
Желатинозное волокно. Волокно, слабо или совсем не лигнифицированное,
у которого часть вторичной оболочки имеет желеобразный вид.
Железистый волосок. Трихом, имеющий одноклеточную или многоклеточ-
ную головку, состоящую из секреторных клеток; обычно располагается на
ножке из нежелезистых клеток.
Железка. Многоклеточная секреторная структура.
Жилка. Тяж проводящей ткани в уплощенном органе, таком, как лист.
Отсюда — жилкование листа.
Жилкование. Расположение жилок в листовой пластинке.
Заболонь. Наружная часть древесины стебля или корня, содержащая жи-
вые клетки и запасные вещества и проводящая воду. Обычно более светлоокра-
шенная, чем ядерная древесина.
Завязь. Нижняя часть плодолистика (простого пестика) или гинецея, со-
стоящего из сросшихся плодолистиков (сложного пестика); содержит семяза-
чатки и дифференцируется в плод.
Закрывающий слой. Один из компактных слоев клеток, периодически фор-
мирующихся в чечевичке попеременно с рыхлой выполняющей тканью.
Закрытая пора. В древесине голосеменных; окаймленная пора, в которой
замыкающая пленка латерально смещена и торус закрывает апертуру.
Закрытое жилкование. Жилкование листа, характеризующееся анастомози-
рующими жилками.
Закрытый проводящий пучок. Пучок, не содержащий камбия.
Замыкающая пленка поры. Часть межклеточного слоя и первичной оболоч-
ки, которая ограничивает снаружи полость поры. Синоним — поровая мембрана.
Замыкающие клетки. Пара клеток, ограничивающих устьичную щель и обес-
печивающих открывание и закрывание щели путем изменения тургора.
Зародышевый мешок. Женский гаметофит покрытосеменных, состоящий в
большинстве случаев из семи клеток: яйцеклетки, двух синергид, трех (или
Словарь терминов
511
более) антипод (каждая с одним ядром) и центральной клетки (с двумя
ядрами).
Зародышевый придаточный корень. Корень, заложившийся в зародыше на
гипокотиле или на еще более высоком уровне оси зародыша.
Защитный слой. В отделительной зоне; слой клеток, который благодаря ве-
ществам, пропитывающим его оболочки, несет защитную функцию в рубце, об-
разующемся в месте опадения листа или другой части растения.
Звездчатый. Напоминающий по форме звезду.
Зигоморфный. Неправильный цветок. См. Билатеральная симметрия. Проти-
вопоставляется актиноморфному.
Зона перехода. Зона на оси растения, в которой сливаются побег и корень
и которая обнаруживает первые структурные признаки перехода между стеб-
лем и корнем. Лучше всего выражена в проростках.
Зубчатая пора. Окаймленная пора с выступами нависающей вторичной обо-
лочки на стороне, обращенной к полости.
Идиобласт. Клетка в ткани, которая заметно отличается по форме, размеру
или содержимому от других клеток той же ткани.
Изобилатеральный лист. Лист, в котором палисадная паренхима находится
на обеих сторонах листа. См. также У нифациальный лист.
Изобилатеральный мезофилл. См. Изобилатеральный лист.
Изолатеральный лист. Синоним — изобилатеральный лист.
Инициалы 1. Клетка в меристеме, которая путем деления дает начало двум
клеткам, одна из которых остается в меристеме, а другая добавляется к телу
растения. 2. Иногда используется для обозначения клетки в самой ранней ста-
дии ее специализации. В этом последнем случае ее чаще называют примордием.
Инициальная апотрахеальная паренхима. См. Пограничная апотрахеальная
паренхима.
Интегумент. Наружные слои клеток, окружающие нуцеллус семязачатка по-
крытосеменных; дифференцируются в семенную кожуру.
Интегументальный тапетум. Интенсивно окрашивающаяся внутренняя эпи-
дерма, выстилающая зародышевый мешок у некоторых групп покрытосемен-
ных и, очевидно, способствующая питанию зародыша. Называется также эндо-
телием.
Интеркалярная меристема. Меристематическая ткань, происходящая из
апикальной меристемы и на некотором расстоянии от последней сохраняющая
меристематическую активность; может быть расположена между тканями, ко-
торые уже не являются меристематическими.
Интеркалярный рост. Рост путем клеточного деления на некотором рас-
стоянии от меристемы, из которой происходят клетки.
Интерксилярная пробка. Пробка, развивающаяся в ксилемной ткани.
Интерксилярная флоэма. См. Включенная флоэма.
Интерпозиционный рост. См. Интрузивный рост.
Интина. Внутренний слой оболочки пыльцевого зерна или споры.
Интраксилярная флоэма. См. Внутренняя флоэма.
Интрузивный рост. Тип роста, при котором растущая клетка внедряется
своим концом между другими клетками, отделяя их одну от другой по сре-
динной пластинке.
Интуссусцепция. Рост клеточной оболочки путем внедрения нового мате-
риала в ранее сформированную оболочку. Противопоставляется аппозиции.
Калиптроген. В апикальных меристемах (апексах) корня; меристема, даю-
щая начало корневому чехлику и не зависимая от инициалей коры и централь-
ного цилиндра.
Каллоза. Полисахарид ₽-1,3-глюкан, образующий при гидролизе глюкозу.
Обычный компонент клеточной оболочки в ситовидных элементах; образуется
512
Словарь терминов
также в ситовидных элементах и паренхимных клетках вскоре после их по-
вреждения.
Каллус. Ткань, состоящая из крупных тонкостенных клеток, образующаяся
в результате повреждения на заживающих ранах или на прививках, а также в
культуре ткани. (Использование термина «каллус» для обозначения скопления
каллозы на ситовидных полях неправильно.)
Каллусная ткань. См. Каллус.
Камбиальные инициали. Клетки, расположенные в камбии таким образом,
что путем периклинальных делений они могут откладывать клетки или наружу,
или внутрь от оси; в камбии различают веретеновидные инициали (дающие на-
чало осевым клеткам ксилемы и флоэмы) и лучевые инициали (дающие начало
клеткам лучей).
Камбий. Меристема, клетки которой претерпевают периклинальные деления,
откладывая в двух направлениях производные, располагающиеся радиальными
рядами. Термин применяется преимущественно только к двум латеральным
меристемам — камбию и пробковому камбию, или феллогену.
Камеденосный ход. Канал, который содержит камедь.
Камедь. Неспециальный термин, применяемый к веществу, образующемуся
при разрушении растительных клеток, главным образом их углеводов.
Каменистая клетка. См. Брахисклереида.
Кариокинез. Деление ядра в отличие от деления клетки, или цитокинеза.
Кармашек. Чехол, покрывающий примордий бокового корня и происходя-
щий из эндодермы, в отличие от корневого чехлика, который закладывается в
перицикле.
Карункула. Мясистый вырост около рубчика семени.
Катафиллы. Листья, расположенные на низких уровнях растения или побе-
га (почечные чешуи, чешуи корневища и Др.). Противопоставляются гипсо-
филлам.
Каулиновый. Относящийся к стеблю или происходящий от него.
Квадратная лучевая клетка. Во вторичных проводящих тканях; лучевая
клетка, имеющая на радиальном срезе примерно квадратную форму (относится
к тому же морфологическому типу, что и стоячая лучевая клетка).
Квантосомы. Гранулы, располагающиеся на внутренней поверхности мемб-
ран хлоропласта, образующих тилакоиды. Полагают, что они являются функ-
циональными единицами фотосинтеза.
Кладофилл. Ветвь, напоминающая вегетативный лист.
Клейкий волосок. Многоклеточный вырост или многоклеточный волосок, вы-
деляющий клейкий секрет. Встречается на почках многих видов древесных ра-
стений.
Клейковина. Аморфный белок, находящийся в крахмалистом эндосперме
злаков.
Клетка. Структурная и физиологическая единица живого организма. Ра-
стительная клетка состоит из протопласта и клеточной оболочки; в отмер-
шем состоянии — только из клеточной оболочки или клеточной оболочки и не-
живых включений.
Клетка-спутник. Паренхимная клетка флоэмы покрытосеменных растений,
связанная с члеником ситовидной трубки и происходящая вместе с последним
из одной и той же материнской клетки.
Клетки Страсбургера. См. Альбуминовые клетки.
Клеточная оболочка. Более или менее твердая мембрана, окружающая
протопласт клетки и состоящая у высших растений из целлюлозы и других
органических и неорганических соединений.
Клеточная пластинка. Перегородка, появляющаяся в телофазе между двумя
ядрами, образованными в процессе митоза (а также мейоза), и характеризую-
щая раннюю стадию деления клетки (цитокинеза), осуществляемого посредством
формирования новой клеточной стенки; образуется в фрагмопласте.
Словарь терминов
513
Клубеньки. Вздутия на корнях растений, особенно у Fabaceae, в которых
поселяются азотфиксирующие бактерии.
Колеоптиль. Влагалище, окружающее эпикотиль у зародышей Роасеае;
иногда его рассматривают как первый лист эпикотиля.
Колеориза. Влагалище, окружающее зародышевый корешок у Роасеае.
Коллатеральный проводящий пучок. Пучок, в котором флоэма располага-
ется только с одной (обычно абаксиальной) стороны ксилемы.
Колленхима. Опорная ткань, состоящая из более или менее вытянутых жи-
вых клеток с неравномерно утолщенными нелигнифицированными первичными
оболочками. Обычно в зонах первичного роста стеблей и листьев.
Колончатая меристема. Меристематическая ткань, в которой клетки делятся
перпендикулярно продольной оси органа и формируют комплекс параллельных
вертикальных рядов (колонок) клеток. Особенно распространена в основной
меристеме органов, принимающих цилиндрическую форму. Называется также
рядная меристема.
Колумелла (колонка). Центральная часть корневого чехлика, в которой
клетки располагаются продольными рядами.
Кольцевая окаймленная пора. Окаймленная пора с кольцевой апертурой.
Кольцевая пробка. Тип ритидома, который возникает в результате форми-
рования последовательных слоев перидермы, обнаруживающих расположение
вокруг оси, близкое к концентрическому.
Кольцепоровая древесина. Вторичная ксилема, в которой «поры» (сосуды)
ранней древесины значительно более крупные, чем в поздней, и образуют на
поперечном срезе древесины хорошо различимую зону или кольцо.
Кольцо прироста. Слой прироста вторичной ксилемы или вторичной флоэмы,
хорошо различимый на поперечном срезе стебля или корня; это может быть
годичное кольцо или ложное годичное кольцо.
Кольчатое утолщение клеточной оболочки. В трахеальных элементах кси-
лемы; вторичное утолщение в форме колец.
Комиссуральный проводящий пучок. Небольшой пучок, соединяющий более
крупные параллельные пучки, как, например, в листьях злаков.
Компитум. Участок столбика синкарпного гинецея, в котором каналы стол-
бика вливаются в полость завязи; здесь пыльцевые трубки могут изменить на-
правление роста, переходя с одного плодолистика на другой.
Комплементарная ткань. См. Выполняющая ткань.
Контактная клетка. Клетка осевой паренхимы или луча, функционально
связанная с трахеальным элементом. Аналогична клетке-спутнику во флоэме,
а также клетке, примыкающей к устьицу.
Контрактильный (втягивающий) корень. Корень, который в течение опреде-
ленного промежутка времени в процессе развития подвергается укорочению и
благодаря этому способствует изменению положения побега по отношению к
уровню почвы.
Концентрический проводящий пучок. Проводящий пучок, в котором или
флоэма окружает ксилему (амфикрибральныи), или ксилема окружает флоэму
(амфивазальный).
Конъюнктивная (связующая) ткань. Вторичная паренхимная ткань, распре-
деленная среди проводящей ткани там, где последняя не образует сплошного
цилиндра, например у однодольных и двудольных с аномальным ростом.
Копал. Смолистое вещество, выделяемое различными тропическими деревь-
ями и затвердевающее на воздухе в виде округлой или неправильной формы ку-
сочков, бесцветных, желтоватых, красноватых или коричневых.
Кора. Неспециальный термин, применяемый ко всем тканям, расположенным
снаружи от камбия или ксилемы; в старых деревьях может быть подразделена
на мертвую наружную кору и живую внутреннюю кору, которая состоит из
вторичной флоэмы. См. также Ритидом.
Корешок. Эмбриональный корень. Образует базальное продолжение гипо-
котиля в зародыше.
33 К. Эзау, кн. 2.
514
Словарь терминов
Корневой волосок. Тип трихома в эпидерме корня, который представляет
собой простой вырост эпидермальной клетки и участвует в поглощении содер-
жащихся в почве веществ.
Корневой чехлик. Масса клеток, покрывающая в виде наперстка апикаль-
ную меристему корня.
Корпус. Участок апикальной меристемы, покрытый туникой и характери-
зующийся ростом в трех измерениях (объемным) путем деления клеток в раз-
личных плоскостях.
Крассулы (ед. ч. крассула). Утолщения срединной пластинки или первич-
ной оболочки вдоль верхнего и нижнего краев пары пор в трахеидах голосе-
менных; называются также балками Санио.
Крахмал. Нерастворимый углевод, главное запасное питательное вещество
растений, состоящее из безводных глюкозных остатков состава СбНюОз, на ко-
торые он легко распадается.
Крахмалоносное влагалище. Самая внутренняя зона (в один или несколько
слоев клеток) коры, если эта зона характеризуется интенсивным и довольно
постоянным накоплением крахмала.
Кристаллический песок. Массовые отложения очень мелких одиночных кри-
сталлов.
Кристаллоид. Кристалл белка с менее четко выраженными углами, чем у
минерального кристалла; набухает в воде.
Кристы (ед. ч. криста). Гребневидные складки внутренней мембраны мито-
хондрий.
Крыловидная паратрахеальная паренхима. Во вторичной ксилеме; вазицент-
рическая группа клеток осевой паренхимы, имеющая на поперечном срезе тан-
генциальные крыловидные выступы. См. также Паратрахеальная паренхима и
Вазицентрическая паратрахеальная паренхима.
Ксероморфный. Характеризует структурные особенности типичных ксеро-
фитов.
Ксерофит. Растение, приспособленное к жизни в засушливых местообита-
ниях.
Ксилема. Главная проводящая воду ткань сосудистых растений, характери-
зующаяся присутствием трахеальных элементов. Ксилема служит также опор-
ной тканью, что прежде всего относится к вторичной ксилеме (древесине).
Ксилемная инициаль. Камбиальная клетка на ксилемной стороне камбиаль-
ной зоны, которая является исходной для одной или нескольких клеток, воз-
никающих путем периклинальных делений и дифференцирующихся в ксилем-
ные элементы после дополнительных делений (или без них) в различных плос-
костях. Иногда называется материнской клеткой ксилемы.
Ксилемное волокно. Волокно ксилемной ткани. Во вторичной ксилеме раз-
личают волокна двух типов: волокнистую трахеиду и волокно либриформа.
Ксилемные элементы. Клетки, составляющие ксилемную ткань.
Ксилемный луч. Та часть луча проводящей системы, которая локализована
во вторичной ксилеме.
Ксилемный прокамбий. Часть прокамбия, которая дифференцируется в пер-
вичную ксилему. Называется также ксилическим или ксилойным прокамбием.
Ксилотомия. Анатомия древесины.
Кутикула. Слой жироподобного вещества — кутина, малопроницаемый для
воды и расположенный на наружных стенках эпидермальных клеток.
Кутикуляризация. Процесс формирования кутикулы.
Кутин. Комплекс жировых веществ, малопроницаемых для воды. Обнару-
жен в растениях как в виде пропитывающего вещества в стенках эпидермаль-
ных клеток, так и в виде отдельного слоя — кутикулы — на наружной поверхно-
сти эпидермы.
Кутинизация. Процесс пропитывания кутином.
Словарь терминов
515
Лакуна. Пространство. Обычно воздушное пространство между клетками,
которое может быть схизогенным, лизигенным, схизолизигенным или рексиген-
ным по происхождению. Лакуной называют также листовую щель.
Лакунарная колленхима. Колленхима, для которой характерны межклетни-
ки и утолщения клеточных стенок, обращенные к межклетникам.
Ламелла. Тонкая пластинка или слой.
Латекс. Жидкое содержимое млечников, часто имеющее вид молока; состо-
ит из различных органических и неорганических соединений, среди которых не-
редко встречается каучук.
Латеральная меристема. Меристема, расположенная по сторонам оси парал-
лельно ей: это камбий и феллоген (пробковый камбий).
Лежачая лучевая клетка. Во вторичных проводящих тканях; лучевая клет-
ка, длинная ось которой расположена в радиальном направлении.
Лейкопласт. Бесцветная пластида.
Лепесток. Составная часть венчика цветка.
Лептом. Ситовидные элементы и связанные с ними паренхимные клетки
флоэмной ткани; опорные клетки (волокна и склереиды) исключаются. См.
также Гадром.
Лестничная перфорационная пластинка. В членике сосуда ксилемы; тип
мультиперфорированной пластинки, в которой вытянутые перфорации располо-
жены параллельно одна другой, так что полосы клеточной оболочки между
ними располагаются в виде лестницы.
Лестничная поровость. В трахеальных элементах ксилемы; удлиненные по-
ры, расположенные параллельно одна другой наподобие лестницы.
Лестничная ситовидная пластинка. Сложная ситовидная пластинка с вытя-
нутыми ситовидными полями, расположенными параллельно друг другу в виде
лестницы.
Лестничное утолщение клеточной оболочки. В трахеальных элементах кси-
лемы; вторичная оболочка откладывается на первичную, образуя рисунок в
виде лестницы. Подобно спирали винтовой нарезки, в которой витки в интер-
валах связаны перемычками.
Лестнично-сетчатое утолщение клеточной оболочки. В трахеальных элемен-
тах ксилемы; вторичное утолщение, промежуточное между лестничным и сет-
чатым.
Летняя древесина. См. Поздняя древесина.
Лигнин. Органическое вещество (или смесь веществ) с высоким содержа-
нием углерода; производное фенилпропана и отличное от углеводов. В оболоч-
ках многих клеток лигнин связан с целлюлозой.
Лигнификация (одревеснение). Пропитывание лигнином.
Лизигенный. Название межклетников, образующихся при разрушении
клеток.
Лизис. Процесс дезинтеграции, или деградации.
Лизосома. Органелла, окруженная мембраной и содержащая кислые гид-
ролитические ферменты, способные разрушать белки и другие органические ма-
кромолекулы; у растений представлена вакуолями. См. Лизосомный компарт-
мент.
Лизосомный компартмент. Участок (отсек) протопласта или клеточной обо-
лочки, в котором локализованы кислые гидролазы, способные переваривать ком-
поненты цитоплазмы. Окружен в протопласте одиночной мембраной и состав-
ляет обычно вакуолярную систему. Эквивалентный термин — литический ком-
партмент.
Листовая подушечка. Разрастание черешка листа или черешочка листочка у
их основания. Структура, которая играет определенную роль при движениях
листа или листочка.
Листовая щель. Зона паренхимы в центральном цилиндре стебля, распо-
ложенная выше того уровня, на котором листовой след отходит к листу. На-
зывается также лакуной. Не нарушает непрерывности проводящих пучков.
33*
516
Словарь терминов
Листовка. Сухой, неопадающий, многосемянный плод, происходящий из
одного плодолистика и раскрывающийся вдоль шва.
Листовой бугорок. Латеральный вырост ниже апикальной меристемы, пред-
ставляющий собой начальную стадию развития листового примордия.
Листовой след. Часть проводящего пучка стебля, продолжающаяся в листе
и соединяющаяся с другим проводящим пучком в стебле. Лист может иметь
один и большее число листовых следов.
Листовые волокна. Технический термин для обозначения волокон, выделен-
ных из однодольных растений, главным образом из их листьев.
Литический компартмент. См. Лизосомный компартмент.
Литоцист. Клетка, содержащая цистолит.
Ложное годичное кольцо. Кольцо прироста во вторичной ксилеме, образо-
вавшееся сверх одного — обычного для сезонного прироста. Определяется на
поперечном срезе.
Лубяное волокно. Первоначально — флоэмное волокно, теперь — любое эк-
страксилярное волокно.
Луч. Блок ткани, варьирующий по высоте и ширине, сформированный лу-
чевыми инициалями камбия и простирающийся в радиальном направлении во
вторичной ксилеме и вторичной флоэме.
Лучевая инициаль. Меристематическая лучевая клетка в камбии, которая
дает начало лучевым клеткам вторичной ксилемы и вторичной флоэмы.
Лучевая паренхима. Паренхимные клетки луча во вторичных проводящих
тканях. Противопоставляется осевой паренхиме.
Лучевая система. Совокупность всех лучей во вторичных проводящих тка-
нях. Называется также горизонтальной системой и радиальной системой.
Лучевая трахеида. Трахеида в луче; встречается во вторичной ксилеме не-
которых хвойных.
Лютоиды. Пузырьки в млечниках, называемые также вакуолями, окружен-
ные одиночной мембраной и содержащие комплекс гидролитических ферментов,
способных разрушать большинство органических соединений клетки.
Макросклереида. Вытянутая склереида с неравномерно распределенными
вторичными утолщениями клеточных оболочек; обычна для эпидермы семян
Fabaceae.
Макроспора. См. Мегаспора.
Макрофибрилла. Агрегация (объединение) микрофибрилл в клеточной
оболочке, видимая в световой микроскоп.
Мальпигиева клетка. Синоним — макросклереида.
Мантия. Наружные слои апикальной меристемы, характеризующейся по-
слойным расположением клеток.
Маргинальная меристема. Меристема по краю листового примордия, обес-
печивающая маргинальный (краевой) рост пластинки.
Маргинальные инициали. Клетки, расположенные по краю растущей листо-
вой пластинки и принимающие участие в формировании протодермы.
Маргинальный рост. Краевой рост листового примордия, который приводит
к формированию листовой пластинки.
Материнская клетка. См. Прекурсорная клетка.
Материнская клетка ксилемы. Клетка, образованная камбием и являю-
щаяся исходной для определенных элементов ксилемы, таких, как осевые па-
ренхимные клетки, формирующие тяж паренхимы. В более широком смысле
термин используется как синоним ксилемной инициали.
Материнская клетка мегаспоры. См. Мегаспороцит.
Материнская клетка микроспоры. См. Микроспороцит.
Материнская клетка пыльцевого зерна. См. Микроспороцит.
Материнская клетка флоэмы. Клетка, происходящая из камбия и произво-
дящая некоторые элементы флоэмной ткани, такие, как ситовидный элемент и
Словарь терминов
517
клетки-спутники или паренхимные клетки флоэмы, формирующие паренхимный
тяж. В широком смысле термин используется как синоним флоэмной инициали.
Матрикс. Чаще всего этим термином обозначают среду, в которую что-
либо заключено.
Мацерация. Искусственное разделение клеток какой-либо ткани путем раз-
рушения срединной пластинки.
Мегагаметофит. Женский гаметофит гетероспоровых растений; зародышевый
мешок в семязачатке покрытосеменных.
Мегаспора. Гаплоидная (In) спора, развивающаяся в женский гаметофит
гетероспоровых растений.
Мегаспорангий. Спорангий, в котором образуются мегаспоры; нуцеллус
семязачатка у покрытосеменных.
Мегаспорофилл. Листоподобный орган, формирующий мегаспорангии; пло-
долистик, формирующий семязачаток у покрытосеменных.
Мегаспороцит. Диплоидная (2п) клетка, которая претерпевает мейоз и фор-
мирует четыре гаплоидные (In) мегаспоры. Синоним — материнская клетка ме-
гаспоры.
Мегафилл. Лист папоротников и семенных растений, более крупный, чем
микрофилл низших таксонов и обладающий листовым следом и листовой щелью.
Медулла. Синоним — сердцевина.
Медуллярное влагалище. См. Перимедуллярная зона.
Медуллярные пучки. Проводящие пучки, расположенные в зоне сердцевины.
Междоузлие. Зона между узлами стебля.
Межклетник. Пространство между двумя или большим числом клеток в
ткани; может иметь схизогенное, лизигенное, схизолизигенное или рексигенное
происхождение.
Межклеточное вещество. См. Срединная пластинка.
Межпучковая зона. Участок ткани, расположенный между проводящими
пучками в стебле; называется также медуллярным или сердцевинным лучом.
Межпучковый камбий. Камбий, формирующийся между проводящими пуч-
ками в межпучковой паренхиме.
Межсосудистая поровость. Поровость между трахеальными элементами.
Мезархная ксилема. Тяж ксилемы, в котором протоксилема находится в
центре и метаксилема дифференцируется как в центростремительном, так и
центробежном направлении.
Мезокарпий. Средний слой перикарпия.
Мезокотиль. Междоузлие между узлом щитка и колеоптиля в зародыше
и проростке Роасеае.
Мезоморфный. Относится к структурным особенностям мезофитов.
Мезофилл. Паренхима листовой пластинки, расположенная между двумя
эпидермальными слоями, в которой протекают процессы фотосинтеза.
Мезофит. Растение, требующее умеренных в отношении влажности условии
существования.
Меристела. Один из проводящих пучков диктиостелы.
Меристема. Первичная ткань, ответственная за синтез протоплазмы и об-
разование новых клеток путем деления.
Меристема массы. Меристематическая ткань, в которой деление клеток
происходит в различных плоскостях, вследствие чего ткань увеличивается в
объеме.
Меристематическая клетка. Клетка, синтезирующая протоплазму и обра-
зующая путем деления новые клетки; варьирует по форме, размерам, толщине
клеточных оболочек и степени вакуолизации, но имеет только первичную кле-
точную оболочку.
Меристемоид. Клетка или группа клеток, являющаяся центром меристема-
тической активности в ткани, состоящей из несколько более старых дифферен-
цирующихся клеток.
518
Словарь терминов
Местомное влагалище. Эндодермоидная обкладка проводящего пучка; внут-
ренняя из двух обкладок в листьях Роасеае, главным образом из подсемейства
фестукоидных.
Метаксилема. Часть первичной ксилемы, которая дифференцируется после
протоксилемы и до вторичной ксилемы, если какая-либо из последних форми-
руется в данной группе растений.
Метакутинизация. Отложение субериновой пластинки в наружных клетках
кончиков корней, которые в конце сезона перестают участвовать в процессах
роста и поглощения веществ. Поздняя суберинизация.
Метафлоэма. Часть первичной флоэмы, которая дифференцируется после
протофлоэмы и до вторичной флоэмы, если какая-либо из последних форми-
руется в данной группе растений.
Механическая ткань. См. Опорная ткань.
Микориза. Симбиотическая ассоциация грибов и корней высших растений.
Может быть эктотрофной (мицелий облегчает корень хозяина) или эндотрофной
(гифы внедряются в клетки корня).
Микрогаметофит. Мужской гаметофит гетероспорового растения; у семен-
ных растений пыльцевое зерно.
Микропиле. Отверстие в интегументах семязачатка, через которое пыльце-
вая трубка обычно входит в зародышевый мешок.
Микроспора. Гаплоидная (In) спора, развивающаяся в мужской гаметофит
у гетероспоровых растений; у семенных растений одноядерное пыльцевое зерно.
Микроспорангий. Спорангий, в котором формируются микроспоры; у по-
крытосеменных гнездо пыльника и его стенки.
Микроспорофилл. Листоподобный орган, несущий микроспорангии; у по-
крытосеменных модифицирован в тычинки.
Микроспороцит. Диплоидная (2п) клетка, которая претерпевает мейоз и
формирует четыре гаплоидные (In) микроспоры; называется также материнской
клеткой микроспоры, а у семенных растений — материнской клеткой пыльцевого
зерна.
Микротельце. Органнела, окруженная одиночной мембраной и содержащая
различные ферменты, за исключением гидролитических. Микротельца представ-
лены пероксисомами и глиоксисомами.
Микротрубочки. Не имеющие мембраны трубочки около 25 нм (250 А) в
диаметре и неопределенной длины. Располагаются в цитоплазме неделящейся
эукариотической клетки, обычно вблизи клеточной оболочки, а в делящейся
клетке образуют мейотическое или митотическое веретена и фрагмопласт.
Иногда микротрубочки относятся к органеллам.
Микрофибрилла. Нитевидный компонент клеточной оболочки, состоящий из
молекул целлюлозы и видимый только в электронный микроскоп.
Микрофилл. Мелкий лист, листовой след которого не сопровождается ли-
стовой щелью. Противопоставляется мегафиллу. См. также Энаций.
Миллимикрон. См. Нанометр.
Мирозиновая клетка. Клетка, содержащая глюкозинолаты («глюкозиды гор-
чичного масла»), а также мирозиназы — ферменты, гидролизующие глюкозино-
латы. Встречается в одиннадцати семействах двудольных, из которых два круп-
нейших — Brassicaceae и Euphorbiaceae.
Многолакунный узел. Узел стебля, имеющий многочисленные лакуны (щели)
и многочисленные листовые следы, относящиеся к одному листу.
Многорядный луч. Луч во вторичных проводящих тканях, состоящий из
нескольких или многих рядов клеток.
Многослойная эпидерма. Ткань из двух или большего числа слоев клеток,
происходящих из протодермы; только самый наружный слой дифференциру-
ется как типичная эпидерма.
Митохондрия. Клеточная органелла, окруженная двойной мембраной; свя-
зана с дыханием; содержит ферменты и является основным источником АТФ
в нефотоситезирующих клетках.
Словарь терминов
519
Мицеллы. Участки в целлюлозных микрофибриллах, в которых молекулы
целлюлозы расположены параллельно друг другу, так что образуется кристал-
лическая решетчатая структура.
Млечная клетка. Нечленистый, или простой, млечник.
Млечник. Клетка или ряды клеток, содержащие характерную жидкость,
называемую латексом.
Млечный сосуд. Членистый или сложный млечник, в котором клеточные
стенки между стыкующимися клетками частично или полностью разрушаются.
Моторная клетка. См. Пузыревидная клетка.
Мочка. Освобождение пучков волокон от других тканей с использованием
микроорганизмов, вызывающих в соответствующих влажных условиях дезинте-
грацию тонкостенных клеток, окружающих волокна.
Мочковатая корневая система. Корневая система, состоящая из многих
корней, одинаковых по длине и толщине; встречается у злаков и других од-
нодольных.
Мягкая древесина. Техническое определение древесины хвойных.
Наружная кора. См. Кора.
Наружная флоэма. Первичная флоэма, расположенная снаружи от первич-
ной ксилемы.
Невскрывающийся. Не вскрывающийся спонтанно; относится к определен-
ному типу плода.
Недифференцированный. В онтогенезе: структуры, еще находящиеся в ме-
ристематическом состоянии или сходные с меристематическими. В зрелом со-
стоянии: относительно неспециализированный.
Нектарник. Многоклеточная железистая структура, секретирующая жидкость,
которая содержит органические вещества, в том числе сахар. Встречается в цвет-
ках (флоральный нектарник) и на вегетативных частях растения (экстрафло-
ральный нектарник).
Неограниченный рост. Относится к апикальной меристеме, образующей не-
ограниченное число боковых органов; характерен для вегетативной апикальной
меристемы.
Неправильный цветок. Цветок, в котором один или большее число членов,
по крайней мере в одном круге околоцветника, отличаются по форме от других
членов того же самого круга и который не может быть разделен на две рав-
ные половины более чем одной плоскостью. См. Билатеральная симметрия.
Непористая древесина. Вторичная ксилема, не имеющая сосудов.
Неслоистая древесина. См. Неярусная древесина.
Неслоистый камбий. См. Неярусный камбий.
Нечленистый млечник. Простой млечник, состоящий из единственной, обыч-
но многоядерной, клетки. Может быть разветвленным и неразветвленным.
Неярусная древесина. Вторичная ксилема, в которой осевые клетки и лучи
не образуют на тангенциальных срезах горизонтальных рядов. Неслоистая дре-
весина.
Неярусный камбий. Камбий, в котором веретеновидные инициали и лучи
на тангенциальных срезах не образуют горизонтальных рядов. Неслоистый кам-
бий.
Нижняя завязь. См. Эпигиния.
Нитевидная склереида. Сильно вытянутая тонкая склереида, напоминаю-
щая волокно.
Нитчатый аппарат. Комплекс инвагинаций клеточной оболочки синергиды,
подобный тому, который встречается в передаточных клетках.
Нуцеллус. Внутренняя часть семязачатка, в которой развивается зародыше-
вый мешок. Обычно рассматривается как эквивалент мегаспорангия.
Обкладка проводящего пучка. Слой (или слои) клеток, расположенных во-
круг проводящего пучка в листе; может состоять из паренхимы или склерен-
химы.
520
Словарь терминов
Обоеполый цветок. Цветок, имеющий как плодолистики, так и тычинки.
Оболочка. См. Клеточная оболочка.
Обособленная меристема. Меристема, из которой формируется пазушная
почка; выглядит отчлененной от апикальной меристемы вследствие вакуолиза-
ции клеток, соединяющих обе меристемы.
Обтуратор. Вырост плаценты или ткани, выстилающей канал столбика, ко-
торая подводит структуры, проводящие пыльцу, близко к микропиле.
Одиночная «пора». «Пора» (поперечное сечение сосуда во вторичной кси-
леме), окруженная клетками другого типа.
Однолакунный узел. В стебле: узел с одной листовой щелью, относящейся
к одному листу. Если в таком узле прикрепляются два или несколько листьев,
каждый из них связан с одной щелью.
Однополый. Обычно относится к цветку, не имеющему тычинок или плодо-
листиков. Околоцветник может присутствовать или отсутствовать.
Однорядный луч. Во вторичных проводящих тканях: луч шириной в одну
клетку.
Окаймленная пара пор. Окаймленные поры соседних клеток, расположенные
друг против друга.
Окаймленная пора. Пора, в которой вторичная оболочка нависает в виде
свода над замыкающей пленкой поры.
Околоцветник. Совокупность лепестков и чашелистиков или тепалей (лис-
точков околоцветника).
Окремневшая клетка. Клетка, заполненная кремнием, как в эпидерме
злаков.
Онтогенез. Развитие организма, органа, ткани или клетки от закладки до
зрелого состояния.
Опадение. Опадение листьев, цветков, плодов или других частей растения
обычно после образования отделительной зоны.
Оплодотворение. Слияние двух гамет, включающее слияние их ядер, с
образованием диплоидной (2п) зиготы.
Опорная клетка. См. Опорная ткань.
Опорная ткань. Ткань, состоящая из клеток с более или менее утолщен-
ными оболочками, первичными (колленхима) или вторичными (склеренхима), и
способствующая устойчивости тела растения. Называется также механической
тканью.
Опорные корни. Адвентивные корни, развивающиеся на стебле выше уров-
ня почвы и служащие дополнительной опорой для растения.
Опыление. Перенос пыльцы из пыльника к воспринимающей поверхности —
рыльцу пестика у покрытосеменных.
Орган. Определенная, отчетливо дифференцированная часть растения, как
корень, стебель, лист или часть цветка.
Органелла. Определенное функционально специализированное образование
в цитоплазме клетки.
Организатор ядрышка (ядрышковый организатор). Участок определенной
хромосомы, связанный с формированием ядрышка.
Ортостиха. Вертикальная линия, вдоль которой прикрепляются ряды листь-
ев или чешуй на оси побега или побегообразного органа; часто неправильно
применяют к витку спирали, или парастихе.
Осевая (аксиальная) паренхима. Паренхимные клетки в осевой системе вто-
ричных проводящих тканей. Противопоставляются лучевым паренхимным клет-
кам.
Осевая (аксиальная) система. Все вторичные проводящие клетки, проис-
ходящие из веретеновидных камбиальных инициалей и ориентированные их
наибольшими диаметрами параллельно главной оси стебля или корня. Синонимы:
вертикальная система, продольная система.
Осевая трахеида. Трахеида в осевой системе вторичной ксилемы; противо-
поставляется лучевой трахеиде.
Словарь терминов
521
Осевой орган. Корень, стебель, ось соцветия или цветка без их придатков.
Основная меристема. Первичная меристема или меристематическая ткань,
происходящая из апикальной меристемы и дающая начало основным тканям.
Основная ткань. Ткань, не входящая в состав проводящих тканей, эпидер-
мы и перидермы; называется также фундаментальной тканью.
Остаточная меристема. Остаток последней дифференцированной части апи-
кальной меристемы. Ткань, которая относительно более меристематична, чем
связанные с ней дифференцированные ткани, прилегающие к меристеме. Дает
начало прокамбию и межпучковой основной ткани.
Остеосклереида. Склереида, напоминающая по форме берцовую кость, т. е.
имеющая колоннообразную среднюю часть и расширения на обоих концах.
Отделительная зона. Зона в основании листа, цветка, плода или другой
части растения, которая содержит отделительный слой и защитный слой, участ-
вующие в опадении какой-либо из этих частей растения.
Отделительный слой. В отделительной зоне; слой клеток, обособление или
разрушение которых вызывает опадение той или иной части растения.
Открытое жилкование. Жилкование листа, при котором крупные жилки сво-
бодно оканчиваются в мезофилле, а не связаны анастомозами с другими
жилками.
Открытый проводящий пучок. Пучок, в котором прокамбий дифференциру-
ется в камбий после того, как сформируются все первичные проводящие эле-
менты.
Очередная поровость. В трахеальных элементах: расположение пор диаго-
нальными рядами.
Пазуха. Верхний угол между стеблем и веткой или листом.
Пазушная меристема. Меристема, расположенная в пазухе листа и дающая
начало пазушной почке.
Пазушная почка. Почка в пазухе листа.
Палисадная паренхима. Паренхима мезофилла листа, характеризующаяся
вытянутой формой клеток и расположением их длинных осей перпендикулярно-
поверхности листа.
Паникоидный. Относящийся к подсемейству злаков Panicoideae.
Папилла (сосочек). Небольшой вырост эпидермальной клетки; тип трихома.
Парадермальный. Параллельный эпидерме. Относится, в частности, к срезу,
проведенному параллельно поверхности плоского органа, такого, например, как
лист; соответствует также тангенциальному срезу.
Пара пор. Две расположенные одна напротив другой поры двух соседних
клеток. Обязательными компонентами являются две полости пор и замыкающая
пленка пор.
Параллельная эволюция. Эволюция, идущая в сходном направлении в раз-
личных таксонах.
Параллельное жилкование. Главные жилки в пластинке листа расположе-
ны почти параллельно друг другу, хотя и сходятся у основания и у верхушки
листа.
Парастиха. Спираль, вдоль которой прикреплен ряд листьев или чешуй к
оси побега или побегообразного органа. См также Ортостиха.
Паратрахеальная паренхима. Осевая паренхима во вторичной ксилеме, свя-
занная с сосудами и другими трахеальными элементами. Включает крыловид-
ную, сомкнутую и вазицентрическую паренхиму.
Парацитное устьице. Устьичный комплекс, в котором одна или несколько
побочных клеток располагаются по бокам устьица параллельно длинной оси
замыкающих клеток.
Паренхима. Ткань, состоящая из паренхимных клеток.
Паренхимная клетка. В типичном случае — не отчетливо специализирован-
ная клетка, содержащая в протопласте ядро и связанная с одним или несколь-
522
Словарь терминов
кими различными физиологическими и биохимическими процессами растения.
Варьирует по размеру и форме, а также по структуре клеточной оболочки.
Париетальная цитоплазма. Цитоплазма, расположенная вблизи клеточной
оболочки.
Партенокарпия. Развитие плода без оплодотворения. Плод обычно бессе-
мянный.
Педоморфоз. Задержка в эволюционном развитии некоторых признаков по
сравнению с другими, что ведет к сочетанию в одной и той же клетке, ткани
или органе ювенильных и продвинутых признаков.
Пектиновые вещества. Группа сложных углеводов, производных полигалак-
туроновой кислоты, содержащихся в оболочках растительных клеток; особенно
в больших количествах входят в состав срединной пластинки.
Пельтатный волосок. Трихом, представляющий собой составленную из кле-
ток дисковидную пластинку, расположенную на ножке или прикрепленную
непосредственно к несущей базальной клетке.
Первичная клеточная оболочка. Представление, сложившееся на основе
данных световой микроскопии: клеточная оболочка, формирующаяся главным
образом в то время, когда клетка увеличивается в размере. Представление, ос-
нованное на данных электронной микроскопии: клеточная оболочка, в которой
микрофибриллы целлюлозы обнаруживают различную ориентацию — от беспо-
рядочной до более или менее параллельной, способную претерпевать значитель-
ные изменения в процессе роста (увеличения размеров) клетки. Данные свето-
вой и электронной микроскопии не всегда совпадают при разграничении пер-
вичной и вторичной оболочек.
Первичная кора. Зона первичной основной ткани между проводящей систе-
мой и эпидермой в стебле и корне. Термин используется также для обозначе-
ния периферической зоны протопласта клетки.
Первичная ксилема. Ксилемная ткань, дифференцирующаяся из прокамбия в
процессе первичного роста и дифференциации сосудистого растения. Обычно под-
разделяется на более раннюю протоксилему и более позднюю метаксилему. Не
дифференцирована на осевую и лучевую системы.
Первичная меристема. Часто применяется для обозначения каждой из трех
меристематических тканей, происходящих из апикальной меристемы: протодер-
мы, основной меристемы и прокамбия.
Первичная меристема утолщения. Меристема, происходящая из апикальной
меристемы и обусловливающая первичное нарастание оси побега в толщину.
Может быть представлена в виде отчетливой мантиевидной зоны. Часто встре-
чается у однодольных.
Первичная оболочка. См. Первичная клеточная оболочка.
Первичная пора. См. Первичное поровое поле.
Первичная флоэма. Флоэмная ткань, формирующаяся из прокамбия в про-
цессе первичного роста и дифференциации сосудистого растения. Обычно под-
разделяется на более раннюю протофлоэму и более позднюю метафлоэму. Не
дифференцирована на осевую и лучевую системы.
Первичное поровое поле. Тонкий участок первичной клеточной оболочки и
срединной пластинки, в пределах которого в процессе формирования вторичной
оболочки развивается одна или несколько пар пор. Называется также примор-
диальной порой или первичной порой.
Первичное тело (растения). Часть растения (или целое растение, если оно
не имеет вторичного роста), которая развивается из зародыша, апикальных ме-
ристем и производимых ими меристематических тканей и состоит из первичных
тканей.
Первичное ядро эндосперма. Ядро, образованное слиянием мужского гаме-
тофита и двух полярных ядер в центральной клетке зародышевого мешка.
Первичные проводящие ткани. Ксилема и флоэма, дифференцирующиеся в
прокамбии в процессе первичного роста и дифференциации сосудистого растения.
Словарь терминов
523
Первичные ткани. Ткани, происходящие из зародыша и апикальных мери-
стем.
Первичные флоэмные волокна. Волокна, расположенные на внешней гра-
нице центрального цилиндра и возникающие в первичной флоэме, обычно в
протофлоэме. Часто называются периищклическими волокнами.
Первичный корень. Главный корень. Корень, развивающийся в виде про-
должения зародышевого корешка.
Первичный рост. Рост последовательно формирующихся корней, а также
вегетативного и репродуктивного побегов со времени их закладки в апикальных
меристемах до завершения растяжения. Берет начало в апикальных меристемах
и продолжается в производных этой меристемы: протодерме, основной меристе-
ме и прокамбии, а также в частично дифференцированных первичных тканях.
Передаточная клетка. Паренхимная клетка с выростами (или инвагинация-
ми) клеточной оболочки, которые увеличивают поверхность плазмалеммы. По-ви-
димому, специализирована для транспорта растворенных веществ на короткое
расстояние. Клетки без выростов клеточной оболочки также могут функциони-
ровать как передаточные клетки. См. Промежуточная клетка.
Перекрестнопарность. Расположение листьев парами, которые чередуются
друг с другом под прямыми углами.
Переходная зона. В применении к апикальной меристеме — зона упорядо-
ченно делящихся клеток, расположенная близко к внутренней границе проме-
ристемы или, более точно, около группы центральных материнских клеток. Пе-
реходная между апикальной меристемой и субапикальными первичными мери-
стематическими тканями.
Переходная клетка. См. П ромежуточная клетка.
Периблема. Меристема, формирующая кору. Один из трех гистогенов, по
Ганштейну (плерома, периблема и дерматоген).
Перигиния. Строение цветка, характеризующееся наличием над цветоложем
чашевидного образования, несущего чашелистики, лепестки и тычинки. Чаша мо-
жет быть рецептакулярной или аппендикулярной (цветочная трубка) по проис-
хождению.
Перидерма. Вторичная защитная ткань, которая замещает эпидерму в стеб-
лях и корнях и, редко, в других органах. Состоит из феллемы (пробки), фелло-
гена (пробкового камбия) и феллодермы.
Перикарпий. Стенка плода, развивающаяся из стенки завязи.
Периклинальная химера . См. Химера.
Периклинальный. Обычно относится к ориентации клеточной стенки или
плоскости клеточного деления; параллельный окружности или ближайшей по-
верхности органа. Противопоставляется антиклинальному. См. также Тангенци-
альный.
Перимедуллярная зона. Периферическая зона сердцевины (медуллы); назы-
вается также медуллярным влагалищем.
Перинуклеарное пространство. Пространство между двумя мембранами,
формирующими ядерную оболочку.
Перисперм. Запасающая ткань в семенах, подобная эндосперму, но про-
исходящая из нуцеллуса.
Перицикл. Часть основной ткани стелы, расположенная между флоэмой и
эндодермой. У семенных растений обычно присутствует в корнях и отсутствует
в большинстве стеблей.
Перициклическая склеренхима. Склеренхима, располагающаяся на наружной
границе центрального цилиндра и формирующаяся не во флоэме. Синоним —
периваскулярная склеренхима.
Перициклическое волокно. Волокно, локализованное на наружной границе
центрального цилиндра в оси семенного растения и формирующееся не во
флоэме. Синоним — периваскулярное волокно.
Перламутровая оболочка. Нелигннфицированное утолщение клеточной обо-
лочки, которое часто встречается в ситовидных элементах и напоминает вторич-
524
Словарь терминов
ную оболочку, когда достигает значительной толщины; название отражает ха-
рактер свечения оболочки.
Пероксисома. Клеточная органелла из группы микротелец, участвующая в
метаболизме гликолевой кислоты, связанном с фотосинтезом.
Перфорационная пластинка. Перфорированная часть стенки членика сосуда.
Перфорационная пластинка с множественной перфорацией. В членике сосуда
ксилемы; перфорационная пластинка, которая имеет более одной перфорации.
Пестик. Эквивалентен всему синкарпному гинецею (сложный пестик) или
одиночному плодолистику в апокарпном гинецее (простой пестик). Состоит из
завязи, столбика и рыльца.
Пестичный. Относится к цветку с одним или несколькими плодолистиками,
но без функционирующих тычинок.
Пиноцитоз. Процесс поглощения вещества протопластом путем образования
инвагинаций плазмалеммы, отшнуровывающихся в виде пузырьков (пиноцитоз-
ных пузырьков), содержимое которых изливается в цитоплазму.
Пиноцитозные пузырьки. См. Пиноцитоз.
Плазмалемма. Одиночная мембрана, расположенная на границе цитоплазмы
с клеточной оболочкой. Типичная элементарная мембрана. Называется также
плазматической мембраной.
Плазматическая мембрана. См. Плазмалемма.
Плазмодесма. Канал в клеточной оболочке, связывающий протопласты двух
соседних клеток. Состоит из плазмалеммы, выстилающей канал, центральной
десмотрубочки, связывающей две цистерны эндоплазматического ретикулума, рас-
положенные около двух противоположных отверстий канала, и цитоплазмы
между плазмалеммой и десмотрубочкой.
Пластида. Окруженная двойной мембраной органелла, встречающаяся в
цитоплазме многих эукариот. Может быть связана с фотосинтезом (хлоро-
пласт) или накоплением крахмала (амилопласт) или содержать желтый или
оранжевый пигмент (хромопласт).
Пластинка листа. Пластинчатая или расширенная часть листа.
Пластинчатая колленхима. Колленхима, в которой утолщения клеточных
оболочек откладываются преимущественно на тангенциальные стенки. См. Ла-
меллярная колленхима.
Пластинчатая меристема. Меристематическая ткань, состоящая из парал-
лельных слоев клеток, делящихся только антиклинально по отношению к ши-
рокой поверхности ткани. Характерна для основной меристемы тех частей ра-
стения, которые, подобно листу, принимают уплощенную форму.
Пластоглобула. Глобула в пластиде, содержащая в качестве основного ком-
понента липид.
Пластохрон. Временной интервал между началом двух последовательно
повторяющихся событий, таких, как закладка листового примордия, достиже-
ние определенной стадии развития листа и т. д. Варьирует по продолжительно-
сти, если измеряется в единицах времени.
Плацента. Часть Завязи, на которой возникает семязачаток и к которой
он остается прикрепленным вплоть до созревания.
Плацентация. Характер положения плаценты в завязи.
Плерома. Меристема, формирующая центральную часть оси, которая со-
стоит из первичных проводящих тканей и сопровождающей их основной ткани,
составляющей сердцевину и межпучковые зоны. Один из трех гистогенов (пле-
рома. периблема, дерматоген) по Ганштейну.
Плодолистик (карпелла). Листоподобный орган покрытосеменных, форми-
рующий один или большее число семязачатков. Составная часть гинецея.
Плюмула (почечка). Эмбриональный побег над семядолей (или семядо-
лями) в зародыше. См. также Эпикотиль.
Побочная клетка. Эпидермальная клетка, связанная с устьицем и по край-
ней мере морфологически отличающаяся от эпидермальных клеток, составляю-
щих основную массу ткани.
Словарь терминов
525
Побочная почка. Почка, расположенная над главной пазушной почкой или
сбоку от нее.
Побочная трансфузионная ткань. Трансфузионная ткань, расположенная в
мезофилле, а не в проводящем пучке. В листьях некоторых голосеменных.
Побочные части плода. Части, не происходящие из завязи, но связанные с
ней в плоде.
Поверхность скола. Одна из двух внутренних поверхностей мембраны, ко-
торая обнажается при расщеплении мембраны в процессе скалывания, приме-
няемого в методе замораживания — травления. Имеются две поверхности ско-
ла: поверхность (на протоплазматической стороне мембраны), которая приле-
гает к цитоплазме, нуклеоплазме, строме пластиды или к митохондриальному
матриксу; поверхность, которая примыкает к экстрацеллюлярному, эндоплаз-
матическому и экзоплазматическому пространству (т. е. к вакуоли, диктиосом-
ному пузырьку). (Определение Брэнтона, см. Branton et al., Science, 190,
54, 1974.)
Пограничная апотрахеальная паренхима. Во вторичной ксилеме; осевые
паренхимные клетки, располагающиеся одиночно или составляющие однородный
слой в начале сезонного прироста {инициальная паренхима) или в конце его
{терминальная паренхима). См. также Апотрахеальная паренхима.
Поздняя древесина. Вторичная ксилема, сформированная в более поздней
части ростового слоя; более плотная и сложенная из более мелких клеток, чем
ранняя древесина. Синоним — летняя древесина.
Покоящийся центр. Инициальная зона в апикальной меристеме, которая на-
ходится в состоянии относительной неактивности; обычен для корней.
Покровная ткань. См. Система покровной ткани.
Покрытосеменные. Таксон растений, у которых семя формируется в зрелой
завязи (плоде).
Поле перекреста. Описательный термин, обозначающий рисунок, образуе-
мый стенками лучевых клеток и осевых трахеид, как он выглядит на радиаль-
ных срезах вторичной ксилемы хвойных.
Полиархная. Первичная ксилема корня, имеющая много протоксилемных
тяжей или протоксилемных полюсов.
Полидерма. Тип защитной ткани, в которой суберинизированные клетки
чередуются с несуберинизированными клетками паренхимы, причем оба типа
клеток обладают живыми протопластами.
Полимеризация. Химическое объединение мономеров, например глюкозы или
нуклеотидов, в результате которого образуются полимеры, такие, как крах-
мал, целлюлоза или нуклеиновая кислота.
Полирибосома (или полисома). Агрегация нескольких рибосом, по-видимо-
му, связанная с синтезом белка.
Полисахарид. Углевод, состоящий из многих моносахаридных единиц, объ-
единенных в цепь; например, крахмал, целлюлоза.
Полиэмбриония. Развитие более одного зародыша в одном и том же се-
мени.
Полный цветок. Цветок, имеющий все типы частей: чашелистики, лепестки,
тычинки и плодолистики или листочки околоцветника (тепали), тычинки и пло-
долистики.
Полость клетки. Пространство, окруженное клеточной оболочкой.
Полость поры. Все пространство поры от поровой мембраны до полости
клетки или до наружной апертуры поры, если имеется поровый канал.
Полуокаймленная пара пор. Пара пор, состоящая из окаймленной и про-
стой пор.
Полярное ядро. Одно из двух ядер, расположенных в центральной клетке
зрелого зародышевого мешка. Эти два ядра происходят из групп ядер, лежа-
щих на противоположных полюсах в восьмиядерном зародышевом мешке.
526
Словарь терминов
Поперечное деление (клетки). По отношению к клетке: деление, перпенди-
кулярное продольной оси клетки. По отношению к части растений: деление
клетки, перпендикулярное продольной оси данной части растения.
Поперечный срез. Срез, проведенный перпендикулярно продольной оси дан-
ной части растения.
«Пора». Термин, используемый при описании поперечных срезов сосудов
во вторичной ксилеме.
Пора. Углубление (или полость) в том месте клеточной оболочки, в кото-
ром первичная оболочка не покрыта вторичной. Порообразные структуры в пер-
вичной оболочке называют примордиальными порами, первичными порами или
первичными поровыми полями. Пора обычно является членом пары пор.
Ртппшшаа ТЛПГТТТАЛЛЯ ОГ\ ТТ АП П ТТТ П а
шил 11VUV1V.UU,
Поровое поле. См. Первичное поровое поле.
Поровый канал. Проход из полости клетки в камеру окаймленной поры.
(Пористые поры в толстых оболочках имеют каналовидные полости.)
Поясок (или полоса) Каспари. Лентовидное видоизменение части первичной
клеточной оболочки, содержащее суберин и лигнин; типичен для эндодермаль-
ных клеток в корнях, где он проходит по радиальным и поперечным антикли-
нальным стенкам.
Правильный цветок. См. Радиальная симметрия.
Прекурсорная клетка. Клетка, которая путем деления дает начало другим
клеткам. Материнская клетка.
Препрофазный поясок. Поясок, состоящий из микротрубочек и кольцеоб-
разно охватывающий экваториальную плоскость будущего митотического вере-
тена в клетках, готовящихся к делению.
Прививка. Срастание двух частей растения, одна из которых — привой —
внедряется в корень или стебель другой — подвоя.
Примордиальная пора. См. Первичное поровое поле.
Примордий. Орган, клетка или организованный ряд клеток в их самой
ранней стадии дифференциации, например листовой примордий, примордий си-
нергиды, примордий членика сосуда.
Прирастание. В цветке; объединение членов разных кругов, например ты-
чинок и лепестков.
Прирост. Увеличение объема тканей растения за счет активности меристемы
Пробковая клетка. Клетка феллемы, образуемая феллогеном; в дифферен-
цированном состоянии мертвая и обладающая суберинизированной оболочкой;
несет защитные функции, так как клеточная оболочка в высокой степени не-
пооницаема для воды.
Пробка. См. Феллема.
Пробковый камбий. См. Феллоген.
Проводниковая ткань, или ткань, проводящая пыльцу. Ткань в столбике
цветка, через которую прорастает пыльцевая трубка между рыльцем и полостью
завязи.
Проводящая система. Совокупность проводящих тканей в их специфиче-
ском расположении в растении или в органе растения.
Проводящий пучок. Тяж проводящей системы, состоящий из ксилемы и
флоэмы.
Проводящий цилиндр. Зона проводящих тканей в осевых частях растения.
Термин употребляется как синоним терминов стела или центральный цилиндр
или, в более узком смысле, когда исключается сердцевина.
Продесмоген. Меристема, предшествующая десмогену (прокамбию). Термин
имеет то же значение, что и остаточная меристема.
Продолжение обкладки проводящего пучка. Полоса основной ткани, про-
стирающаяся от пучкового влагалища к эпидерме листа; может быть пред-
ставлена на одной или двух сторонах пучка и может состоять из паренхимы
или склеренхимы.
Продольная паренхима. См. Осевая паренхима.
Словарь терминов
527
Продольная система. См. Осевая система.
Производная. Клетка, которая образуется при делении меристематической
клетки и вступает на путь дифференциации, превращаясь в клетку тела, ее
сестринская клетка может оставаться в меристеме.
Прокамбий. Первичная меристема или меристематическая ткань, которая
дифференцируется в первичную проводящую ткань.
Прокариотический. Организм, у которого ядерный материал не заключен
в ядерную оболочку, а генетический материал не организован в хромосомы и
который лишен ограниченных мембранами цитоплазматических органелл. К про-
кариотическим организмам относятся сине-зеленые водоросли, бактерии, мико-
плазмы. Противопоставляется эукариотическому.
Проксимальный. Расположенный близко к месту закладки или прикреп-
ления. Противопоставляется дистальному.
Промежуточная клетка. Паренхимная клетка (имеющая, хотя и не всегда,
выросты клеточной оболочки) во флоэме мелкой жилки, обеспечивает связь
между фотосинтезирующей гканью и системой ситовидной трубки; может быть
клеткой-спутником. См. Передаточная клетка.
Промеристема. Инициальные клетки и их более поздние производные в
апикальной меристеме. Называется также прото меристемой.
Пропластида. Пластида на самых ранних стадиях ее развития.
Пропускная клетка. Клетка в экзодерме или эндодерме, которая остается
тонкостенной в то время, когда другие клетки ткани развивают толстые вто-
ричные оболочки. В эндодерме имеет поясок Каспари.
Прорастание. Возобновление роста зародыша в семени, также начало роста
споры, пыльцевого зерна, почки или другого образования.
Простая перфорационная пластинка. В членике сосуда ксилемы; перфораци-
онная пластинка с единственной перфорацией.
Простая пара пор. Две простые поры, принадлежащие соседним клеткам и
расположенные друг против друга.
Простая пора. Пора, в которой часть полости, обращенная внутрь клетки,
в процессе вторичного роста становится шире, сохраняет постоянную ширину
или постепенно становится лишь немного уже.
Простая ситовидная пластинка. Ситовидная пластинка, состоящая из одно-
го ситовидного поля.
Простой млечник. Млечник, который состоит из единственной клетки.
Нечленистый млечник.
Протодерма. Первичная меристема или меристематическая ткань, дающая
начало эпидерме; также эпидерма в меристематическом состоянии. Может (но
не всегда) происходить из независимых инициалей в апикальной меристеме
Протоксилема. Элементы ксилемы, дифференцирующиеся первыми в том
или другом органе растения. Первая часть первичной ксилемы.
Протоксилемная лакуна. Пространство, окруженное паренхимными клет-
ками в протоксилеме проводящего пучка. Появляется у некоторых растений
после того, как трахеальные элементы протоксилемы перестают функциониро-
вать, растягиваются и разрушаются.
Протоксилемные полюса. Термин, определяющий местоположение ксилемных
элементов, которые созревают первыми в проводящей системе органа расте-
ния. Применяется при описании поперечных срезов.
Протомеристема. См. Промеристема.
Протоплазма. Живое вещество. Термин, определяющий все живое содер-
жимое одной клетки или целого организма.
Протопласт. Организованная живая часть одной клетки, включающая про-
топлазматические и непротоплазматические компоненты клетки, кроме клеточ-
ной оболочки.
Протостела. Простейший тип стелы, представляющий собой сплошной стер-
жень проводящей ткани, причем флоэма располагается снаружи, а ксилема —
внутри.
528
Словарь терминов
Протофлоэма. Элементы флоэмы, дифференцирующиеся первыми в том или
ином органе растения. Первая часть первичной флоэмы.
Протофлоэмные полюса. Термин, применяемый для обозначения мест лока-
лизации флоэмных элементов, дифференцирующихся первыми в проводящей си-
стеме того или иного органа растения. Используется при описании поперечных
срезов.
Профилл. Первый или один из двух первых листьев на боковом побеге.
Проэмбрио. Зародыш на ранних стадиях развития до того, как становятся
различимы главное тело и суспензор или прежде чем обособляется протодерма.
Пузыревидная клетка. Увеличенная эпидермальная клетка листьев злаков,
расположенная вместе с другими такими же клетками в продольных рядах.
Называется также моторной клеткой в связи с ее предполагаемым участием в
^механизме свертывания и развертывания листьев.
Пучковый камбий. Камбий, формирующийся из прокамбия в проводящем
пучке, или фасцикуле.
Пучковый колпачок. Склеренхима или колленхиматозная паренхима, имею-
щая на поперечных срезах вид колпачка на ксилемной или флоэмной стороне
проводящего пучка.
Пыльник. Часть тычинки, содержащая пыльцу.
Пыльца. Совокупность пыльцевых зерен.
Пыльцевая трубка. Трубчатый вырост клетки, образованный прорастающим
пыльцевым зерном; обеспечивает перенос мужского гаметофита в семязачаток.
Пыльцевое зерно. Микроспора семенных растений, заключенная в своеоб-
разно построенную оболочку (одна клетка). Также проросшая микроспора,
сформировавшая микрогаметофит — незрелый (две клетки) или зрелый (три
клетки).
Пыльцевой мешок. Гнездо пыльника, содержащее пыльцевые зерна.
Радиальная паренхима. См. Лучевая паренхима.
Радиальная рядность. Упорядоченное расположение каких-либо структур,
например клеток, в радиальном направлении. Характерна для камбиальных
производных.
Радиальная симметрия. Относится к цветку, который может быть разделен
на более или менее равные части двумя и большим числом продольных плоско-
стей, проходящих через ось цветка. Противопоставляется билатеральной сим-
Радиальная система. См. Лучевая система.
Радиальный срез. Продольный срез, проведенный вдоль радиальной плос-
кости цилиндрического тела, такого, например, как стебель.
Радиальный комплекс пор. См. Поровый комплекс.
Рамифицированная пора. См. Ветвистая пора.
Рамифицированный. Разветвленный.
Раневая камедь. Камедь, образующаяся в результате каких-либо повреж-
дений. См. также Камедь.
Раневая перидерма. Перидерма, образующаяся в ответ на поранение или
другое повреждение.
Раневая пробка. См. Раневая перидерма.
Ранняя древесина. Древесина, сформированная в первой части кольца
прироста и характеризующаяся более низкой плотностью и более крупными
клетками, чем поздняя древесина. Синоним — весенняя древесина.
Рассеяннопоровая древесина. Вторичная ксилема, в которой «поры» (со-
суды) равномерно распределены в пределах кольца прироста или постепенно
изменяются в размерах от ранней древесины к поздней.
Рафиды. Игловидные кристаллы, обычно собранные в пучки.
Реактивная древесина. Древесина с более или менее отчетливыми анатоми-
ческими признаками, сформированная в определенных частях стелющихся или
Словарь терминов
529
изгибающихся стеблей, а также на нижней (у хвойных) или на верхней (у
двудольных) сторонах ветвей. См. Древесина сжатия и Тяговая древесина.
Редифференциация. Обратный ход в дифференциации клетки или ткани и
последующая дифференциация в другой тип клетки или ткани.
Рексигенный. Применяется по отношению к межклеточному пространству,
возникающему в результате механического разрыва клеточных стенок.
Репродуктивная апикальная меристема. См. Апикальная меристема.
Рибосома. Клеточный компонент (называемый также органеллой), состоя-
щий из белка и РНК и осуществляющий в комплексе с мРНК синтез белка.
Находится в цитоплазме, ядре, пластидах и митохондриях.
Ризодерма. Первичный поверхностный слой корня. Этот термин подчерки-
вает, что данный слой не гомологичен эпидерме побега. См. также Эпиблема.
Ритидом (корка). Технический термин для наружной коры, которая состоит
из перидермы и тканей, изолированных ею, а именно тканей первичной коры и
флоэмы.
Рост. Увеличение размеров путем деления и (или) растяжения клеток.
Рубец. След, оставленный на месте поранения или отделения одной части
растения от другой (например, листа от стебля) и характеризующийся присут-
ствием веществ, защищающих обнаженную поверхность.
Рубцовая ткань. Состоящая из некротических клеток, поврежденных пора-
нением, и соседних клеток, пропитанных защитными веществами. См. также
Рубец.
Рубчик (хилум). Шрам, оставляемый отпавшим фуникулусом на семени.
Рыльце. Зона плодолистика, занимающая у представителей большинства
таксонов верхнюю часть столбика и служащая субстратом, на котором прора-
стает пыльца.
Рядная меристема. См. Колончатая меристема.
Ряды Фибоначчи. Ряды чисел, образованные последовательным сложением
двух последних: 1, 2, 3, 5, 8, 13, 21, 34 и т. д. Такая закономерность присуща
филлотаксису. Зависимость была сформулирована Леонардо из Пизы, извест-
ного под именем Фибоначчи (Fibonacci).
Сборный плод. Плод, развивающийся из единого гинецея (из одного цвет-
ка), состоящего из раздельных плодолистиков, как, например, плоды земляники
и малины.
Световая линия. Сплошная линия, параллельная поверхности, видимая на
поперечных срезах эпидермы некоторых семян бобовых; образуется в резуль-
тате свечения сильно преломляющих свет участков клеточных оболочек в мес-
тах смыкания эпидермальных клеток.
Свободноядерное деление. Ядерное деление (кариокинез), которое осущест-
вляется без формирования клеточной стенки (без цитокинеза); характерно для
эндосперма в некоторых группах растений.
Связник. Ткань между двумя лопастями пыльника.
Секреторная клетка. Живая клетка, специализированная в отношении секре-
ции или экскреции одного или нескольких, часто органических, веществ.
Секреторная полость. Обычно относится к полости лизигенного происхож-
дения, которая содержит секрет, образованный в клетках, разрушившихся при
формировании полости.
Секреторная структура. Любая из большого разнообразия структур, произ-
водящих секрет: простая или сложная, наружная или внутренняя.
Секреторный волосок. См. Железистый волосок.
Секреторный ход. Обычно относится к ходу схизогенного происхождения;
содержит секрет, выделяемый клетками, выстилающими ход (эпителиальными
клетками). См. Эпителий.
Семенная кожура. Наружный покров семени, происходящий из интегумента
или из интегументов. Называется также теста.
34 К. Эзау, кн. 2.
530
Словарь терминов
Семенной шов. Ребро семени, образуемое той частью фуникулуса, который
прилегает к семязачатку в анатропных семязачатках.
Семядольный след. Листовой след семядоли, проходящий в гипокотиле и
связывающий проводящую систему семядоли и корня.
Семязачаток. Структура у семенных растений, включающая женский гаме-
тофит и состоящая из нуцеллуса, одного или двух интегументов и фуникулу-
са; дифференцируется в семя.
Септа. Перегородка.
Септированное волокно. Волокно с тонкими поперечными стенками (септа-
ми), которые формируются после того, как в клетке разовьется вторичное утол-
щение клеточной оболочки.
Сердцевина. Основная ткань в центре стебля или корня. Гомология сердце-
вины в корне и стебле не установлена.
Сердцевинный луч. См. Межпучковая вона.
Сетчатое жилкование. Анастомозирующая система жилок в листовой пла-
стинке, в целом напоминающая сеть.
Сетчатая перфорационная пластинка. В членике сосуда ксилемы; тип мно-
жественно перфорированной пластинки, в которой окаймление перфораций об-
разует рисунок в виде сети.
Сетчатая ситовидная пластинка. Сложная ситовидная пластинка, в которой
ситовидные поля располагаются в виде сети.
Сетчатое утолщение клеточной оболочки. В трахеальных элементах ксиле-
мы; вторичная клеточная оболочка откладывается на первичную таким обра-
зом, что возникает рисунок в виде сети.
Сидячий. Относится к листу, не имеющему черешка, а также к цветку или
плоду, не имеющему ножки.
Симпластический рост. См. Согласованный рост.
Синдетохейльный. Тип устьица голосеменных; побочные клетки (или их
предшественники) происходят из той же самой протодермальной клетки, кото-
рая дает начало материнской клетке замыкающей клетки.
Синергиды. Две клетки на микропилярном конце зародышевого мешка, свя-
занные с яйцеклеткой и с яйцевым аппаратом у покрытосеменных. Играют опре-
деленную роль в оплодотворении.
Синкарпия. Строение цветка, характеризующееся срастанием плодолистиков.
Система основных тканей. Весь комплекс основных тканей растения.
Система покровной ткани. Наружная покровная ткань растения (эпидерма
или перидерма).
Система тканей. Ткань или ткани в растении или органе растения, струк-
турно и функционально организованные в единое целое. Обычно различают три
системы тканей: покровные, проводящие и основные.
Система тканей гетерогенных лучей. Лучи во вторичных проводящих тка-
нях: только гетероцеллюлярные или комбинированные — моноцеллюлярные и
гетероцеллюлярные. Термин не применяется по отношению к хвойным.
Система тканей гомогенных лучей. Лучи во вторичных проводящих тканях
полностью гомоцеллюлярные, состоящие только из лежачих клеток. Термин не
применяется по отношению к хвойным.
Ситовидная зона. Старый термин для относительно недифференцированных
«ситовидных зон, находящихся на тех частях клеточной оболочки, на которых
(отсутствуют ситовидные пластинки.
Ситовидная клетка. Тип ситовидного элемента, который имеет относительно
недифференцированные ситовидные поля (с узкими порами), довольно равно-
мерно распределенные по всем стенкам, т. е. здесь отсутствуют ситовидные
пластинки. Типична для голосеменных и низших сосудистых растений.
Ситовидная пластинка. Часть клеточной оболочки ситовидного элемента,
имеющая одно или несколько высокоспециализированных ситовидных полей.
Типична для покрытосеменных.
Ситовидная поровость. Расположение мелких пор ситовидными группами.
Словарь терминов
531
Ситовидная трубка. Ряд ситовидных элементов (члеников ситовидной труб-
ки), стыкующихся концами и взаимосвязанных через ситовидные пластинки.
Ситовидное поле. Поровидная зона в клеточной оболочке ситовидного эле-
мента с канальцами, обычно выстланными каллозой и занятыми протоплазма-
тическим содержимым, которое связывает протопласты соседних ситовидных
элементов.
Ситовидный элемент. Клетка во флоэмной ткани, служащая главным обра-
зом для проведения питательных веществ в продольном направлении. Подраз-
деляется на ситовидную клетку и членик ситовидной трубки.
Сифоностела. Тип стелы, в которой проводящая система представлена в
форме полого цилиндра, т. е. в ней присутствует сердцевина.
Складчатая клетка мезофилла. Клетка мезофилла со складками или высту-
пами клеточных оболочек, направленными в полость клетки.
Склереида. Склеренхимная клетка, варьирующая по форме, но в типичном’
случае не сильно вытянутая и имеющая толстые лигнифицированные вторичные
оболочки с многочисленными порами.
Склеренхима. Ткань, состоящая из склеренхимных клеток. Также совокуп-
ность склеренхимных клеток во всем теле или в отдельном органе растения.
Включает волокна, волокна-склереиды и склереиды.
Склеренхимная клетка. Клетка, варьирующая по форме и размерам и
имеющая более или менее толстые, часто лигнифицированные вторичные обо-
лочки. . Относится к категории опорных клеток и в зрелом состоянии может не
иметь протопласта.
Склерификация. Процесс превращения в склеренхиму, т. е. развитие вторич-
ных оболочек с последующей лигнификацией или без нее.
Склерифицированная паренхимная клетка. Паренхимная клетка, которая в
результате отложения толстой вторичной оболочки видоизменяется в склереиду.
Слепая пора. Пора, не имеющая комплементарной поры на стенке соседней
клетки и обычно обращенная к полости клетки или межклетнику.
Слизевая клетка. Клетка, содержащая слизи или камеди или другие сход-
ные с ними углеводы, характеризующиеся способностью к набуханию в воде.
Слизевая пробка. Накопление Ф-белка в ситовидном поле, обычно сопро-
вождаемое его внедрением в канальцы ситовидного поля.
Слизевое тело. Агрегация Ф-белка.
Слизевой ход. Ход, содержащий слизь или камедь или другие сходные с
ними углеводы. См. также Ход.
Слизь. См. Ф-белок.
Сложная «пора». Во вторичной ксилеме; группа из двух или нескольких
«пор» (поперечных срезов сосудов), скученных в определенных местах вдоль
поверхности контакта. Радиальная сложная «пора» — «поры», расположенные
радиальными рядами; гроздь «пор» — группа неправильно расположенных «пор».
Сложная ситовидная пластинка. Ситовидная пластинка, состоящая из не-
скольких ситовидных полей, с лестничным или сетчатым расположением.
Сложная срединная пластинка. Совокупность двух первичных оболочек и
срединной пластинки; обычно используется в тех случаях, когда настоящая сре-
динная пластинка не отличима от первичных оболочек. Может также включать
самые ранние слои вторичной оболочки.
Сложный млечник. См. Членистый млечник.
Сложный плод. Плод, развивающийся из нескольких завязей, каждая из
которых принадлежит отдельному цветку.
Слоистая древесина. См. Ярусная древесина.
Слоистый камбий. См. Ярусный камбий.
Слой прироста. Слой вторичной ксилемы или вторичной флоэмы, форми-
руемый в течение одного периода роста, который может продолжаться целый
сезон (годичное кольцо) или часть сезона (ложное годичное кольцо); в послед-
нем случае за один сезон формируется более одного слоя; называется также
приростом.
34*
532
Словарь терминов
Смоляной канал. См. Смоляной ход.
Смоляной ход. Ход схизогенного происхождения, выстланный клетками, се-
кретирующими смолу (эпителиальными клетками), и содержащий смолу.
Согласованный рост. Рост клеток, при котором не происходит обособления
клеточных оболочек; противопоставляется интрузивному росту, называется так-
же симпластическим ростом.
Сомкнутокрыловидная паратрахеальная паренхима. Во вторичной ксилеме;
•смыкающиеся крыловидные группы осевых паренхимных клеток, формирующие
неправильные тангенциальные или диагональные тяжи (на поперечном срезе).
См. также Паратрахеальная паренхима и Крыловидная паратрахеальная па-
ренхима.
Спиральное утолщение клеточной оболочки. В трахеальных элементах кси-
лемы: вторичная оболочка, отложенная на первичную или вторичную оболочку
в виде непрерывной спирали.
Спорополленин. Вещество, составляющее наружную оболочку, или экзину,
пыльцевого зерна или споры. Устойчивый циклический спирт.
Спорофилл. Модифицированный лист или листоподобный орган, который
несет спорангии. У покрытосеменных это тычинки и плодолистики.
Сосуд. Ряд члеников сосуда, образующих трубку и имеющих перфорации
на общих стенках.
Сосудистый элемент. См. Членик сосуда.
Срединная пластинка. Слой межклеточных веществ, главным образом пек-
тиновых, цементирующих первичные оболочки соседних клеток.
Сростнолистность (сростнолисточковость). В цветке; срастание членов од-
ного круга — чашелистиков с чашелистиками и лепестков с лепестками. То же —
спайнолистность.
Сросшийся. Относится к объединенным частям одного и того же круга в
цветке, как, например, лепестки, объединенные в трубку венчика.
Стела (колонка). Выделена Ван Тигемом как морфологическая единица тела
растения, включающая проводящую систему, связанную основной тканью (пе-
рициклом, межпучковыми зонами и сердцевиной). Центральный цилиндр оси
(стебля и корня).
Стенка плода. Наружная часть плода, происходящая или из стенки завязи
(перикарпий), или из стенки завязи и сросшихся с ней в плоде частей цветка.
Стереом. Совокупность элементов опорной ткани; противопоставляется
гадрому и ле пт о му.
Стержневая корневая система. Корневая система, образованная стержневым
корнем, который может иметь ответвления различных порядков.
Стержневой корень. Первый, или первичный, корень растения, формирую-
щийся как непосредственное продолжение корешка зародыша.
Стигматоидная ткань. Ткань, цитологически и физиологически довольно
сходная с тканью рыльца и служащая для передвижения пыльцевой трубки в
столбике. Предпочтительнее называть ее проводниковой тканью.
Стилодий. Ветвь столбика.
Стилоид. Вытянутый кристалл с заостренными или квадратными концами.
Столбик. Вытянутая (обычно в виде колонки) верхушка завязи, через ко-
торую растет пыльцевая трубка.
Стомиум. Щель или отверстие в лопасти пыльника, через которое высыпа-
ется пыльца. Его формирование представляет собой своего рода вскрывание
(пыльника).
Стоячая лучевая клетка. Во вторичных проводящих тканях; лучевая клет-
ка, ориентированная аксиально (вертикально вдоль оси) по отношению к ее
наибольшему диаметру.
Строма. Основное вещество пластид.
Стромацентр. Агрегированные фибриллы, каждая из которых имеет диаметр
85 А и неопределенную длину; обнаружены в строме хлоропласта, фиксирован-
ного глутаровым альдегидом (или акролеином) — четырехокисью осмия.
Словарь терминов
533
Субапикальная инициаль. Клетка под протодермой в верхушке листового
примордия, функционирующая, по-видимому, как инициаль внутренней ткани
листа. Спорное представление.
Суберин. Жировое вещество в клеточной оболочке пробковой ткани и в
пояске Каспари эндодермы.
Суберинизация. Пропитывание клеточной оболочки суберином или отложе-
ние субериновой пластинки на оболочку.
Субмаргинальные инициали. Клетки под протодермой по краям растущей
пластинки листа, которые, по-видимому, добавляют клетки к внутренней ткани
листа. Компоненты маргинальной (краевой) меристемы, связанной с маргиналь-
ным ростом.
Супротивная поровость. Поры в трахеальных элементах, расположенные
по горизонтали парами или короткими горизонтальными рядами.
Суспензор. Удлиненный вырост у основания зародыша, который прикреп-
ляет зародыш к зародышевому мешку и продвигает его в эндосперм.
Сферосомы. Сферические тельца в цитоплазме, содержащие главным обра-
зом липиды. Предполагают, что ограничивающая мембрана отсутствует или
представляет собой элементарную мембрану или половину элементарной мем-
браны.
Схизогенный. Применяется по отношению к межклетнику, образующемуся
в результате разделения клеточных стенок по срединной пластинке.
Схизолизигенный. Применяется по отношению к межклетнику, образующе-
муся в результате совместного участия двух процессов — разделения и разру-
шения клеточных стенок.
Сэкзина. Наружный слой экзины пыльцевого зерна. Скульптурированная
часть экзины.
Таблитчатый. Имеющий форму пластинки или плитки.
Таксон. Систематическая группа любой из категорий (вид, род, семейство
и т. д.), на которые подразделяются живые организмы.
Тангенциальный. Направление, перпендикулярное радиусу. Может совпа-
дать с периклинальным.
Тангенциальный срез. Продольный срез, проведенный под прямым углом
к радиусу. Применим к цилиндрическим структурам, таким, как стебель или ко-
рень, но используется также и для листовых пластинок, если срез делается
параллельно горизонтальной поверхности. Синоним для листа — парадермалъный.
Таннины. Гетерогенная группа фенольных производных. Аморфное, сильно
вяжущее вещество, широко распространенное в растениях и используемое
для дубления, окрашивания и приготовления чернил.
Тапетум. В пыльнике: слой клеток, выстилающих гнездо пыльника и пол-
ностью абсорбирующийся ко времени созревания пыльцевых зерен. В семяза-
чатке: эпидерма интегумента, окружающая зародышевый мешок; называется
также эндотелием.
Твердая древесина. Техническое определение древесины двудольных.
Тейход. Узкий участок в наружной стенке эпидермальной клетки, в кото-
ром фибриллярные компоненты располагаются более рыхло и свободно, чем в
других местах этой стенки. Синоним — эктодесма.
Телом. Одна из дистальных ветвей дихотомической оси; морфологическая
единица у примитивного сосудистого растения.
Теломная теория. Теория, которая рассматривает теломы как основные
единицы, на основе которых в процессе эволюции сформировались различные
типы листьев и спорофиллов сосудистых растений.
Тельце Гольджи. См. Диктиосома.
Теория гистогенов. Теория Ганштейна, постулирующая, что три первичные
системы^ тканей растения — эпидерма, кора и проводящая система, связанная с
основной тканью,—происходят из обособленных меристем — гистогенов, локали-
зованных в апикальных меристемах. См. Гистоген.
534
Словарь терминов
Теория туники — корпуса. Теория организации апикальной меристемы побега,
согласно которой эта меристема дифференцирована на две зоны, различающиеся
по способу роста: периферическую — тунику, в которой один или несколько
слоев клеток обнаруживают рост в поверхность (антиклинальные деления), и
внутреннюю — корпус, или массив клеток, обеспечивающих увеличение объема
(деления в различных плоскостях).
Тепаль (листочек околоцветника). Член околоцветника, не дифференциро-
ванного на чашечку и венчик.
Терминальная апотрахеальная паренхима. См. Пограничная апотрахеальная
паренхима.
Теста. Семенная кожура.
Тетрархная. Первичная ксилема корня, имеющая четыре протоксилемных
тяжя или протоксилемных полюса.
Тила. В ксилеме; вырост паренхимной клетки (осевой или лучевой), про-
никающий через пору в трахеальную клетку и частично или полностью бло-
кирующий полость последней. Ее росту предшествует отложение особого слоя
клеточной оболочки на стороне паренхимной клетки, которая образует стенку
тилы.
Тилакоиды. Мембранные образования в виде мешочков (цистерны, собран-
ные в стопки (граны) в хлоропластах и представленные в свободном состоя-
нии в строме (тилакоиды стромы или, фреты); в последнем случае они служат
связующими звеньями между гранами.
Тилоид. Вырост, напоминающий тилу. Примерами служат выросты парен-
химных клеток в ситовидные элементы флоэмы и эпителиальных клеток в меж-
клеточные смоляные ходы.
Ткань. Группа клеток, структурно и функционально связанных между собой
в единую систему. Клетки, составляющие ткань, могут быть одинаковыми (про-
стая ткань) и разными (сложная ткань).
Тонопласт. Одиночная цитоплазматическая мембрана, ограничивающая ва-
куоль. Разновидность элементарной мембраны.
Торус. Центральная утолщенная часть замыкающей клетки в окаймленной
поре, состоящая, как правило, из срединной пластинки и двух первичных обо-
лочек. Типичен для окаймленных пор у хвойных и некоторых других голосе-
менных.
Трабекула. Балковидная или похожая на катушку часть клеточной оболоч-
ки, пересекающая в радиальном направлении полость клетки. В инициалях и
производных камбия семенных растений.
Травматический смоляной ход. Смоляной ход, развивающийся в ответ на
повреждение.
Трансфузионная ткань. В листьях голосеменных; ткань, окружающая про-
водящий пучок или связанная с ним другим способом и состоящая из трахеид
и паренхимных клеток. См. также Сопутствующая трансфузионная ткань.
Трансфузионная трахеида. Трахеида в трансфузионной ткани.
Трахеальный элемент. Общий термин для водопроводящей клетки — трахеи-
ды или членика сосуда.
Трахеида. Трахеальный элемент ксилемы, который в противоположность
членику сосуда не имеет перфораций. Может встречаться как в первичной, так
и во вторичной ксилеме. Характеризуется любыми типами вторичных утолщений
клеточной оболочки, свойственными трахеальным элементам.
Трахея. Старое название сосудов ксилемы, указывающее на сходство с тра-
хеей животных.
Трехлакунный узел. В стебле; узел с тремя листовыми щелями, относящи-
мися к одному листу.
Триархная. Первичная ксилема корня, имеющая три тяжа ксилемы или три
полюса протоксилемы.
Трихобласт. Клетка в эпидерме корня, которая дает начало корневому во-
лоску.
Словарь терминов
535
Трихом(а). Вырост эпидермы. Трихомы варьируют по размеру и сложно-
сти; представлены волосками, чешуйками и другими структурами; могут быть
железистыми.
Трихосклереида. Тип разветвленной склереиды, обычно с волоскообразными
разветвлениями, внедряющимися в межклетники.
Тропизм. Движение или рост в ответ на внешний стимул, местоположение
которого определяет направление движения или роста.
Трубка венчика. Трубковидная часть венчика, образованная в результате
конгенитального или онтогенетического срастания лепестков.
Трубчатые клетки. Удлиненные клетки с лигнифицированными оболочками
во внутренней эпидерме перикарпа зерновки Роасеае.
Туника. Периферический слой или слои клеток в апикальной меристеме
побега, которые делятся в антиклинальной плоскости и таким образом способ-
ствуют росту поверхности меристемы. Формирует мантию над корпусом.
Тычинка. Орган цветка, в котором образуется пыльца; обычно состоит из
пыльника и тычиночной нити. Тычинки в совокупности составляют андроцей.
Тычиночный. Относится к цветку, имеющему тычинки, но не имеющему пло-
долистиков.
Тяговая древесина. Реактивная древесина двудольных, образуемая на верх-
них сторонах ветвей и полегающих или изогнутых стеблей; характеризуется от-
сутствием лигнификации и часто высоким содержанием желатинозных волокон.
Тяжевая апотрахеальная паренхима. Во вторичной ксилеме; осевая парен-
хима, сгруппированная (на поперечных срезах) в концентрические тяжи, в ти-
пичных случаях не связанная с сосудами («порами»). См. также Апотрахеаль-
ная паренхима.
Уголковая колленхима. Разновидность колленхимы, характеризующаяся тем,
что первичные утолщения оболочки наиболее выражены в углах, в которых со-
прикасаются несколько клеток.
Узел. Часть стебля, к которой прикрепляются один или большее число
листьев. Анатомически ограничен нерезко.
Узелковая конечная стенка. Клеточная стенка, расположенная под прямым
углом к продольной оси в клетке ксилемной паренхимы, которая кажется бу-
горчатой из-за глубоко погруженных пор.
Узловая (нодальная) диафрагма. Перегородка из ткани в узле, проходя-
щая через зону, занятую в других местах полой сердцевиной.
Унифациальный лист. Лист, имеющий одинаковую структуру на обеих
сторонах. В онтогенетическом смысле — это лист, развивающийся из ростового
центра абаксиально или адаксиально по отношению к апексу инициального ли-
стового примордия и, таким образом, включающий ткани только абаксиальной
или только адаксиальной стороны примордия. Обоснованность онтогенетической
концепции сомнительна. Ср. с бифациальным листом.
Устьичная ямка. Углубление на листе, эпидерма которого имеет устьица.
Устьичный комплекс. Устьица и связанные с ними эпидермальные клетки,
которые могут быть онтогенетически и (или) физиологически связаны с замы-
кающими клетками. Называется также устьичным аппаратом.
Устьице. Отверстие в эпидерме листьев и стеблей, ограниченное двумя за-
мыкающими клетками; служит для газообмена.
Фасцикула. Пучок.
Фасцикулярная (пучковая) система тканей. Система проводящих тканей.
Ф-белок. Флоэмный белок. Обнаружен в клетках флоэмы семенных ра-
стений, наиболее обычен в ситовидных элементах. Первоначально назывался
слизью.
Феллема (пробка). Защитная ткань, состоящая из неживых клеток с су-
беринизированными оболочками и формирующаяся как часть перидермы из
536
Словарь терминов
производных феллогена (пробкового камбия), откладываемых в центробежном
направлении. Замещает эпидерму в старых стеблях и корнях многих семенных
растений.
Феллоген (пробковый камбий). Латеральная меристема, формирующая пе-
ридерму — вторичную покровную ткань, общую для стеблей и корней семенных
растений. Периклинальными делениями образует феллему (пробку) в центро-
бежном направлении и феллодерму — в центростремительном направлении.
Феллодерма. Ткань, напоминающая паренхиму коры; откладывается в цент-
ростремительном направлении феллогеном (пробковым камбием). Составная
часть перидермы стебля и корня семенных растений.
Феллоидная клетка. Клетка, находящаяся в феллеме (пробке), но отли-
чающаяся от пробковой клетки отсутствием суберина в оболочках. Может быть
склереидой.
Фенотип. Сумма свойств какого-либо организма, сформировавшихся в ре-
зультате взаимодействия между генотипом (генетической конституцией) и ок-
ружающей средой.
Фестукоидный. Относящийся к подсемейству злаков Festucoideae.
Фибрилла. См. Микрофибрилла. Используется также для обозначения длин-
ных нитевидных субклеточных единиц в протопласте.
Филамент (нить). Ножка, поддерживающая пыльник в тычинке.
Филлодий. Предположительно плоский вытянутый черешок, замещающий
пластинку листа в выполнении функции фотосинтеза.
Филлотаксис (листорасположение). Характер расположения листьев на оси
побега.
Филогения. Эволюционная история видов или более крупных таксонов.
Фитохром. Пигмент белковой природы, содержащийся в цитоплазме зеле-
ных растений и служащий фоторецептором для красного и инфракрасного цве-
тов. Участвует в регулировании продолжительности некоторых процессов, таких,
как покой, формирование листа, цветение и прорастание семян.
Флаведо. Окрашенная в желтый цвет ткань перикарпия лимона.
Фланговая меристема. Термин, неправильно употребляемый для обозначе-
ния периферической зоны апикальной меристемы. Использование слова «фланго-
вый» предполагает наличие в структуре двух сторон. Термин следовало бы за-
менить названием периферическая меристема.
Флобафены. Безводные производные таннинов. Аморфные вещества желто-
го, красного или коричневого цвета; очень заметные включения в клетках.
Флоральная апикальная меристема. См. Апикальная меристема.
Флоральная меристема. Флоральная апикальная меристема. См. Апикальная
меристема.
Флоральный нектарник См. Нектарник.
Флориген. Гипотетический гормон, предположительно индуцирующий цве-
тение.
Флоэма. Главная проводящая питательные вещества ткань сосудистых ра-
стений, состоящая, как правило, из ситовидных элементов, различного рода
паренхимных клеток, волокон и склереид.
Флоэмная инициаль. Камбиальная клетка на флоэмной стороне камбиаль-
ной зоны, которая путем периклинальных делений производит одну или боль-
шее число клеток, дифференцирующихся во флоэмные элементы непосредствен-
но или после дополнительных делений в различных плоскостях. Иногда назы-
вается материнской клеткой флоэмы.
Флоэмная паренхима. Паренхимные клетки, расположенные во флоэме. Во
вторичной флоэме — это осевая паренхима.
Флоэмные элементы. Клетки флоэмной ткани.
Флоэмный луч. Та часть луча, которая расположена во вторичной флоэме.
Флоэмный прокамбий. Та часть прокамбия, которая дифференцируется в
первичную флоэму.
Словарь терминов
537
Фотодыхание. Светозависимое образование гликолевой кислоты в хлоро-
пластах и ее последующее окисление в пероксисомах.
Фотопериодизм. Реакция на продолжительность и смену дня и ночи, про-
являющаяся в характере роста, развития и цветения растений.
Фотосинтезирующая клетка. Клетка, содержащая хлоропласты и участвую-
щая в фотосинтезе.
Фрагмопласт. Нитчатое образование (при наблюдении в световом микро-
скопе), которое появляется между дочерними ядрами в телофазе и в котором
формируется первоначальная перегородка (клеточная пластинка), делящая ма-
теринскую клетку на две клетки (цитокинез). Появляется сначала в виде вере-
тена, связывающего два ядра, но позднее раздвигается в латеральном направ-
лении, располагаясь в виде кольца. Состоит из микротрубочек.
Фрагмосома. Слой цитоплазмы, пересекающий клетку в том месте, где
располагается делящееся ядро. Экваториальная плоскость появляющегося за-
тем фрагмопласта совпадает с плоскостью этого слоя цитоплазмы. В электрон-
ной микроскопии термин относится к содержащим ферменты микротельцам, ко-
торые, как предполагают, принимают участие в формировании клеточной пла-
стинки.
Фундаментальная ткань. См. Основная ткань.
Фуникулус. Ножка семязачатка.
Халаза. Часть семязачатка, расположенная напротив микропиле, где инте-
гументы и нуцеллус сливаются с фуникулусом.
Химера. Растение, состоящее из комбинации тканей различного генетиче-
ского состава. В периклинальной химере клетки различной природы расположе-
ны в виде периклинальных слоев.
Хлоренхима. Паренхимная ткань, содержащая хлоропласты; мезофилл ли-
ста и другая зеленая паренхима.
Хлоропласт. Хлорофиллоносная пластида с тилакоидами, образующими
граны и фреты (или тилакоиды стромы), погруженные в строму.
Ход. Вытянутая полость, сформированная путем отделения клеток друг от
друга (схизогенное происхождение), за счет разрушения клеток (лизигенное
происхождение) или при сочетании обоих процессов (схизолизигенное проис-
хождение); имеет отношение к секреции.
Хромопласт. Пластида, содержащая не хлорофилл, а другие пигменты —
обычно желтые и оранжевые каротиноиды.
Хрящевидный. Подобный хрящу; прочный эластичный прозрачный материал
или ткань.
Цветение. Время, в течение которого цветок остается полностью открытым:
от развития воспринимающего рыльца до оплодотворения.
Цветковая трубка. Трубка или чаша, образованная в результате срастания
оснований чашелистиков, лепестков и тычинок; часто в перигинных и эпигин-
ных цветках.
Цветоложе (рецептакула). Часть цветоножки, на которой располагаются
органы цветка.
Цветоножка. Ножка отдельного цветка.
Цветонос. Ножка соцветия.
Целлюлоза. Полисахарид 3-1,4 глюкан — главный компонент клеточных
оболочек у большинства растений; состоит из длинных цепеобразных молекул,
основной единицей которых являются безводные остатки глюкозы, имеющие
формулу C6Hio05.
Ценоцит. Агрегат из протопластов; многоядерное образование. Иногда при-
меняется к многоядерным клеткам семенных растений.
Центральные материнские клетки. Довольно крупные вакуолизированные
клетки, располагающиеся непосредственно под наружным слоем в апикальной
меристеме побега голосеменных.
538
Словарь терминов
Центральный цилиндр. Название проводящих тканей и связанной с ними
основной ткани в стебле и корне. В стебле и корне называется также стелой.
Центрический мезофилл. Модификация изобилатерального мезофилла, в ко-
тором адаксиальные и абаксиальные палисадные клетки образуют непрерывный
слой; встречается в узких или цилиндрических листьях.
Центробежное развитие. Возникновение или развитие при постепенном уда-
лении от центра.
Центростремительное развитие. Возникновение или развитие при постепен-
ном приближении к центру.
Циклоз. Движение цитоплазмы в клетке.
Цистерна. Уплощенный мешочковидный отсек, ограниченный мембраной, как,
например, в эндоплазматическом ретикулуме, диктиосоме или гранах хлоро-
пласта.
Цистолит. Скопление карбоната кальция на выросте клеточной оболочки.
Встречается в клетке, называемой литоцистом.
Цитогистологическая зональность. Наличие в апикальной меристеме зон,
имеющих различные цитологические характеристики.
Цитокинез. Процесс деления клетки (в отличие от деления ядра, или
кариокинеза).
Цитология. Наука о клетке.
Цитологическая зональность. См. Цитогистологическая зональность.
Цитоплазма. В узком смысле — по виду наименее дифференцированная часть
протоплазмы клетки, составляющая основную плазму, в которой содержатся
все другие компоненты протопласта. Называется также гиалоплазмой.
Цитохимера. Растение, состоящее из комбинации тканей, клетки которых
имеют различное число хромосом. См. также Химера.
Чашелистик. Структурная единица чашечки.
Чашечка. Совокупность чашелистиков.
Черешок. Ножка листа.
Чечевичка. Особая часть перидермы, отличающаяся от феллемы наличием
межклетников; ткань может быть суберинизирована.
Чешуйчатая кора. Тип ритидома, в котором последовательные отложения
перидермы развиваются как отдельные перекрывающие друг друга слои, причем
каждый из них срезает чешуевидный участок ткани.
Членик ситовидной трубки. Один из клеточных компонентов ситовидной
трубки. В нем обнаруживается более или менее выраженное различие между
ситовидными пластинками (широкие перфорации) и латеральными ситовидны-
ми полями (узкие перфорации). Также элемент ситовидной трубки и перестав-
ший функционировать сегмент ситовидной трубки.
Членик сосуда. Один из клеточных компонентов сосуда. Также сосудистый
элемент и вышедшая из строя часть сосуда.
Членистый млечник. Млечник, состоящий из более чем одной клетки с об-
щими стенками — либо интактными, либо частично или полностью разрушенны-
ми; анастомозирующий и неанастомозирующий. Сложный млечник.
Щитовидная зона. В примордиях пазушной почки; зона клеток, располо-
женных параллельными изогнутыми слоями, так что весь комплекс напоминает
щит. Результат правильных клеточных делений вдоль проксимальных границ
примордия.
Щиток. Семядоля зародыша Роасеае, специализированная для поглощения
питательных веществ из эндосперма.
Экзархная ксилема. Система ксилемы, в которой созревание клеток проис-
ходит в центростремительном направлении, т. е. самые старые элементы (про-
Словарь терминов
539
токсилема) находятся дальше всего от центра оси. Типичная для корня семен-
ных растений.
Экзина. Наружная оболочка споры или пыльцевого зерна.
Экзогенный. Берущий начало в поверхностных тканях, как, например, па-
зушная почка.
Экзодерма. Наружный слой (в одну или несколько клеток в глубину) коры
у некоторых корней; тип гиподермы, стенки которой могут быть суберинизиро-
ваны и (или) лигнифицированы.
Экзокарпий. Самый наружный слой или слои перикарпия. Эпикарпий.
Эккриновая секреция. Выделение секретируемого вещества из клетки в виде
отдельных молекул, проходящих через плазмалемму и клеточную оболочку. Ср.
с гранулокриновой секрецией.
Экстраксилярные волокна. Волокна, формирующиеся не в ксилеме, а в дру-
гих тканях.
Экстрафлоральный нектарник. Нектарник, образующийся не в цветке, а на
других частях растения. См. также Нектарник.
Эктодесма. См. Тейход.
Эктофлойная сифоностела. Стела, имеющая сердцевину и одну флоэмную
зону снаружи от ксилемы.
Элайопласт. Пластида из группы лейкопластов, образующая и накапли-
вающая масла.
Элайосом(а). Вырост на семени или плоде, накапливающий масла, слу-
жащие пищей для муравьев.
Элементарная мембрана. Исторически сложившееся представление об ос-
новной структуре мембраны, в которой обнаруживаются два слоя белка и
расположенный между ними внутренний липидный слой; все три слоя обра-
зуют единую структуру. Термин продолжает оставаться полезным для описа-
ния срезов (профилей) мембраны, на которых под электронным микроскопом
выявляются две темные линии, разделенные светлым промежутком.
Элемент ситовидной трубки. См. Членик ситовидной трубки.
Эмбриогенез (или эмбриогения). Формирование зародыша.
Эмбриоид. Зародыш, часто неотличимый от нормального, развивающийся не
из яйцеклетки, а из соматической клетки, нередко в культуре ткани.
Энационная теория. Теория, рассматривающая микрофиллы как простые
энации в противоположность мегафиллам, которые считаются происшедшими из
системы веток.
Энаций. Вырост стебля у некоторых примитивных наземных растений. См.
также Микрофилл.
Эндархная ксилема. Система ксилемы, в которой созревание клеток про-
исходит в центробежном направлении, т. е. самые старые элементы (протокси-
лема) расположены ближе всего к центру оси. Типична для стеблей семенных
растений, а также для листьев, у которых протоксилема находится на адакси-
альной стороне.
Эндогенный. Берущий начало в глубоко расположенной ткани, как, напри-
мер, латеральный корень.
Эндодерма. Слой основной ткани, образующий влагалище вокруг участка,
занятого проводящими тканями, и характеризующийся присутствием пояска
Каспари на антиклинальных стенках клеток; позже клетки могут иметь вто-
ричные оболочки. В корнях и стеблях семенных растений это самый внутрен-
ний слой коры.
Эндодермоид. Напоминающий эндодерму.
Эндокарпий. Самый внутренний слой или слои перикарпия.
Эндомембранная система. Общий термин для обозначения плазмалеммы, то-
нопласта, эндоплазматического ретикулума, диктиосом и ядерной оболочки.
Эндоплазматический ретикулум (ЭР). Система мембран, имеющих форму
цистерн или трубочек, разделяющих цитоплазму на отдельные «отсеки». Ци-
стерна на профилях срезов представлена в виде пары мембран. Мембраны мо-
540
Словарь терминов
гут быть покрыты рибосомами (шероховатый, или гранулярный, ЭР) или быть
свободными от рибосом (гладкий, или агранулярный, ЭР).
Эндосперм. Питательная ткань, формирующаяся в зародышевом мешке по-
крытосеменных из центральной клетки, содержащей первичное ядро эндосперма.
Эндотелий. Самый внутренний слой интегумента, выстилающий зародыше-
вый мешок у растений некоторых таксонов. Называется также интегументаль-
ным тапетумом.
Эндотеций. Слой стенки пыльника, обычно с вторичными утолщениями кле-
точных оболочек.
Эпигеальный (или надземный). Обозначает надземное прорастание семени,
когда семядоли поднимаются над поверхностью почвы. Противопоставляется ей-
погеалъному, или подземному.
Эпигиния. Строение цветка, характеризующееся положением чашелистиков,
лепестков и тычинок над завязью (нижняя завязь). Ткань, окружающая завязь
и несущая другие части цветка, интерпретируется как рецептакулярная ткань у
одних цветков и как аппендикулярная ткань (цветковая трубка) у других.
Эпибласт. Небольшое образование, расположенное напротив щитка в за-
родыше некоторых злаков.
Эпиблема. Термин, которым иногда обозначают эпидерму корня. См.
также Ризодерма.
Эпидерма. Наружный слой клеток растения, первичный по происхождению.
В многослойной эпидерме только наружный слой обладает признаками, свой-
ственными этой ткани.
Эпикарпий. См. Экзокарпий.
Эпикотиль. Побеговая часть зародыша и проростка над семядолей или се-
мядолями, состоящая из оси и зачатков листа. См. также Плюмула.
Эпипетальная тычинка. Тычинка, прикрепленная к венчику.
Эпителий. Плотный слой клеток, часто секреторных, покрывающий свобод-
ную поверхность или выстилающий полость.
Эпитема. Мезофилл гидатоды, принимающий участие в выделении воды.
Эргастические вещества. Пассивные продукты протопласта, такие, как крах-
мальные зерна, капли жира, кристаллы и жидкости; встречаются в цитоплазме,
органеллах, вакуолях и клеточных оболочках.
Эукариотический. Относится к организмам, обладающим окруженными мем-
бранами ядрами, организованным в виде хромосом генетическим материалом, и
цитоплазматическими органеллами, ограниченными мембранами. Противопостав-
ляется прокариотическому.
Эумеристема (собственно меристема). Меристема, состоящая из относитель-
но мелких клеток, приблизительно изодиаметричных по форме, плотно распо-
ложенных и имеющих тонкие оболочки, плотную цитоплазму и крупные ядра.
Эустела. Стела, в которой первичная проводящая ткань расположена в
тяжах вокруг сердцевины; типична для голосеменных и покрытосеменных.
Ядерная оболочка. Двухмембранная оболочка, окружающая ядро клетки.
Ядро. В биологии — органелла эукариотической клетки, окруженная двух-
мембранной оболочкой и содержащая хромосомы, ядрышки и нуклеоплазму.
Ядровая древесина. Внутренние слои вторичной ксилемы, которые прекра-
тили выполнять функции запасания и проведения и в которых запасные веще-
ства удалены или превращены в вещества ядровой древесины, обычно более
темного цвета, чем функционирующая живая древесина.
Ядрышко. Сферическое тельце, состоящее главным образом из РНК и бел-
ка; находится в ядре эукариотических клеток; в одном ядре может быть одно
или много ядрышек; место образования рибосом.
Яйцевой аппарат. Яйцевая клетка и две синергиды, расположенные на ми-
кропилярном конце женского гаметофита или зародышевого мешка у покры-
тосеменных.
Словарь терминов
541
Ярусная древесина. Древесина, в которой на тангенциальных поверхностях
осевые клетки и лучи расположены горизонтальными рядами. (Ярусными могут
быть и одни лучи.) Слоистая древесина.
Ярусная пробка. Защитная ткань, распространенная у однодольных. Субе-
ринизированные клетки расположены радиальными рядами, каждый из которых
состоит из нескольких клеток, происходящих из одной клетки.
Ярусный камбий. Камбий, в котором на тангенциальных поверхностях ве-
ретеновидные инициали и лучи расположены горизонтальными рядами. Слоистый
камбий.
Указатель латинских названий
Abies 190, 191, 275, 371, 372
— nobilis 267
— pectinata 150
— procera 248
Abietineae 372
Acacia 136, 137
Acanthaceae 321
Acer 54, 141
— negundo 186
— pseudoplatanus 196
'— saccharinum 153
’— saccharum 126, 153
Actaea 263
Aesculus 139, 203, 462
— glabra 153
hippocastanum 143
Agathis 151
Agave 87, 324
• — sisalana 88
Agropyron repens 300
Ailanthus
Aizoaceae 368
Albizzia 364
Allium 415
’— сера 362, 479, 485
— sativum 83
Alnus 154
’ — rubra 153
Aloe 324, 325
• — aristata 97
Amaranthaceae 321, 368, 470
Ambrosia 403
Amygdalus 145
Ananas comosus 88
Antirrhinum 383
Apiaceae 53, 211, 237, 266, 378, 458
Apocynaceae 273
Araceae 232, 273
Araucaria 151, 291, 371
’— excelsa 372
Araucariaceae 138, 371
Arecaceae 195, 238
Argemone 491
Aristolochia 184, 284, 320
Artemisia 361
Arum 54
Asclepiadaceae 273, 321
Asparagus 75, 474, 496
- — medeoloides 496
Asteraceae 211, 213, 236, 273, 318, 378,
436, 452, 458
Atriplex 202, 361
- — halimus 111
Atropa belladonna 54
Aucuba japonica 54
Avena 323
— sativa 241
Bambusa 323
Bambusoideae 366
Bauhinia 323
Begonia 54, 266
Berberis 191
Beta 229, 264
— vulgaris 106, 360
Betula 74, 141, 154, 184, 193, 196
— nigra 153
Bignoniaceae 322
Boehmeria nivea 87
Boraginaceae 363
Bougainvillea spectabilis 322
Bouteloua breviseta 367
Brassica 281, 388, 466
— caulorapa 264
Brassicaceae 209, 264, 383, 456, 472
Buchloe 369
Butomaceae 364
Butomus umbellatus 397
Cactaceae 94, 124, 209
Caesalpiniaceae 323
Calamus 88
Calycanthaceae 211
Camellia 83, 85
Campsis 184
Саппа 74
Cannabis 181
— sativa 87, 361
Capparidaceae 209
Capsella 249, 484
Capsicum 42, 53
— • annuum 452, 453
Carex 364
Carica papaya 213
Carpinus 141, 143, 154, 191
— caroliniana 153
Carum 441
Car у a 136, 152, 184, 203
— pecan 153
Caryophyllaceae 363
Castanea 139, 152
— deltata 153
Catalpa 141, 144, 152
— speciosa 153
Ceanothus 205
Cedrus 150, 372
Celtis 141, 152
Cephalanthus 184
Ceratonia siliqua 210
Указатель латинских названий
543
Cercis 152
Chamaecyparis nootkatensis 151
Chenopodiaceae 319, 368, 470
Chenopodium 400
Chrysothamnus 361
Citrullus 109
— vulgaris 444
Citrus 42, 112, 210, 361
— aurantifolia 442
Clematis 196
Cleome hassleriana 387
Clerodendron 281
Clusiaceae 209
Cocos 101
— nucifera 86, 345, 472
Coffea 75, 474
Coleus 318
Commelinaceae 323—324
Convolvulaceae 273
Convolvolus 263
— arvensis 234, 254
Copernicia cerifera 53
Corchorus capillaris 87
Cordyline 324
— australis 301
Cornus 154, 430
— florida 153, 378
Crassulaceae 210
Crotalaria intermedia 459, 469
Cryptocarya 139
Cucurbitaceae 273
Cunninghamia 371, 372
Cupressaceae 138, 182
Cupressineae 372
Cupressus 372
Cucurbita 284, 319
— maxima 492
— pepo 251, 445
Cycas 372
Cydonia 85
Cyperaceae 120, 236, 273, 398
Dacrydium 371, 372
Dactylis glomerata 305
Dammara 372
Datura stramonium 54
Daucus 42, 229, 264
Delphinium 359
Dianthus 109
Dictamnus 202
Dioscorea
Diospyros 75, 474
— virginiana 153
Dodecatheon 383
Downingia 395
Dracaena 324
Drimys 124, 143, 150, 396
Echeveria 210
Echinochloa 439
— utilis 440
Eichhornia crassipes 54
Elaeis 53
Elodea canadensis 99
Ephedra 291
Equisetum hyemale 288
Eragrostoideae 366
E rant his hiemalis 471
Eucalyptus 136, 164, 186, 196, 210, 211
Euonymus alatus 195
Eupatorium 75
Euphorbia pulcherrina 205
Euphorbiaceae 214, 368, 378, 464, 465
Fabaceae 52, 210, 433, 468, 472
Fabales 139, 152, 363
Fagraea 93
Festucoideae 367
Ficus 54, 139
— elastica 210, 214
— globosa 262
Foeniculum 263—264
Frag aria 205, 357
Fraxinus 121, 141, 147, 152, 184, 197, 359
— americana 153, 172
Fritillaria 421
Fuchsia 383
Fumaria 491
Gaillardia 74
Geraniaceae 318
Ginkgo 292, 370, 372, 373
Gleditsia 141, 152
Glycine 86, 112, 433, 434, 468
Gossypium 88, 112, 200, 210
— arboreum 403. 407
Greggia camporum 356
Gymnocladus 152
— dioicus 153
Hakea 83, 120
Haplopappus spinulosus 361
Hectorella 274—276
Heder a helix 360
Helianthus 318
— annuus 492
Hevea 214
— brasiliensis 213
Hibiscus 181
— cannabinus 87, 317
Hordeum 32, 337
— sativum 481
— vulgare 486, 488
544
Указатель латинских названий
Hosta 364 Ноуа carnosa 84 Humulus lupinus 361 Hyacinthus 230 Hydrocharis 99 Hyoscyamus niger 54 Hypericaceae 190, 209, 263 Maclura 144 — pomifera 153 Alagnolia 121, 153, 154, 184, 197 — grandiflora 153 Magnoliaceae 209 Malus 83, 197, 203 Malvaceae 209, 317 Manihot 52, 214
Ilex 154 — opaca 153 Impatiens 54, 405, 474 — hnlsnminn 37Q Ipomoea 359 — batatas 54, 264 Iris 364, 474 Medicago 318 — sativa 361 Meliaceae 209 Menispermaceae 321 Mentha 202 Mesembryanthetnum 112, 273 Metasequoia glyptostroboides 372 Metroxylon sagu 52 Michelia 142
J uglans 139 — cinerea 153 — nigra 144, 153 Juncaceae 273 Juniperus 372 Mimosa pudica 364 Monimiaceae 364 Monstera deliciosa 85 Moraceae 214 Al or us 141, 144, 152 Musa acuminata 445, 446 Myrtaceae 190, 210, 263
Kalanchob 297 Nelumbo 319 Nelumbonaceae 319
Lactuca 214 — sativa 134, 360, 437 Larix 138, 150, 151, 179, 370, 372 Lathyrus aphaca 359 Lauraceae 209 Laurus 184 Lavandula 112 — vera 200 Leptadenia 321 Ligustrum 361 Lilium 364, 408 — longiflorum 415 — tigrinum 416 Liliaceae 273 Linum usitatissimum 247, 404, 405 Liquidambar 154 — styractflua 153 Liriodendron 87, 121, 141, 154, 197 — tulipifera 140, 153, 172, 185 Lithocarpus 154 — densiflora 153 Loganiaceae 321 Lolium 350 — perene 301 Lonicera 196, 208, 306 — japonica 206, 208 Lupinus 341, 350, 674 Lycopersicon 42 — esculentum 361, 446 Lycophita 284 Nepenthes 344 Nerium oleander 357 Nicotiana tabacum 341 Nuphar 85 Nyctaginaceae 321, 368 Nymphaea 85 Nyssa 154 — sqlvatica 153 Ochroma 136 Odonites 229 Oenothera biennis 338 Olea 83, 85 — europea 85 Onagraceae 190, 263 Opuntia dillenii 390 Orchidaceae 232 Oryza 103, 323 Osmanthus 85, 89 Ostrya 184 Oxalis 359 Pandanaceae 195 Panicoideae 366 Papaver somniferum 213 Pastinaca sativa 360 Paulownia 152 — tomentosa 153 Pelargonium 112, 200. 284, 318
Указатель латинских названий
545
Peperomia 266, 361
Pereskia 94
Phaseolus 83, 86, 434, 435
Phleum 248
Phoenix 474
— dactylifera 75
Phormium tenax 88
Picea 138, 371
Pinguicula 202
Pinus 138, 148, 150, 182, 293, 371, 372
Pisum 86, 493
— sativum 251, 360, 461, 462
Plantago ovata 466
Platanus 141, 261
— occidentalis 153
Plumbago 423
Poa 488
— annua 482
Роасеае 98, 104, 195, 236, 386, 398
Podocarpaceae 138, 371
Podocarpus 84, 371, 372
— chilinus 150
Poinsettia 378
Polygonaceae 470
Polygonum 418, 421
Polypodium peroussum 288
Pooideae 366
Populus 141, 147, 184, 197
— deltoides 312
Portulacaceae 368
Potamogetonaceae 324
Primula 474
Proteaceae 363
Prunus 103, 145, 184, 193, 197, 317, 446
— serotina 153
Pseudotsuga 138, 150
— taxifolia 85
Pseudowintera 124
Pterocarya 272
Pterophyta 284
Pyrus 83, 141, 186, 195, 197
— malus 449, 479
— nivalis 451
Quercus 119, 121, 136, 139, 143, 144, 184,
191, 196
— virginiana 153, 154
Ranunculaceae 429, 471
Ranunculus 319, 430
— repens 42
Raphanus 229, 388
• — sativus 360
Raphia 88
Resedaceae 209
Rhapis excelsa 279, 280
Rhizobium 231
35 К. Эзау, кн. 2.
Rhus vernicifera 53
Ribes 191, 383
Ricinus 310, 456
— communis 493
Robinia 144, 152, 184, 193, 196, 197
— pseudoacacia 87, 153, 157, 168
Rosa 464
Rosaceae 190, 210, 263, 363, 429
Roystonea 325
Rubus 448
Rudbeckia hirta 379
Rumex 273, 281
Rutaceae 209
Ruta graveolens 54
Saccharum 97, 323
— officinarum 88
Saccopetalum 142
Saintpaulia 112
Salix 154, 196, 317
— nigra 153
Salsola 361
— kali 356
Salvia 77
Sambucus 58
— nigra 54, 197, 210
Sansevieria 87, 324
Sarcobatus 361
Sassafras albidum 153
Sciadopitys 372
Scleria 120
Secale 323
Sedum 109, 266
Sempervivum tectorum 210
Sequoia 87, 138, 196, 371, 372
— sempervirens 150
Set aria 440
Sida 112
Silene pendula 410
Simarubaceae 209
Sinapis alba 249, 466
Solanaceae 273, 319
Solanum 112, 430
— demissum 419, 420
— tuberosum 59
Sonchus 214
Sorghum 323
Sparmannia 90—92
Sphaeralcea incana 356
Sphenophita 284
Spiraea 281
Stellaria media 230, 472, 484
Sterculiaceae 363
Stipa tenacissima 88
Strychnos 321, 466
Syringa 361
546
Указатель латинских названий
Т amarix 203, 204
Taraxacum 214
Taxaceae 138, 182
Taxineae 372
Taxodiaceae 138, 182, 371
Taxodium 150, 151, 370
Taxus 150, 371
Terminalia 142
Tetracentraceae 209
Tetracentron 124
Themeda triandra 498
Thuja 87, 372
— occidentalis 137, 164
— plicata 150
Thunbergia 107, 321
Tilia 58, 139, 152, 154, 184, 196, 197, 317
— cor data 211
Tiliaceae 209, 317
Torrey a 371
Tradescantia 54, 233, 398
Trifolium 343
Triticum 350, 397
— aestivum 300
Trochodendraceae 209
Trochodendron 85, 124
Tropaeolum 474
Tsuga 151, 372
Tulipa 42, 491
Ulmus 141, 152, 195, 359
— americana 153
Umbellularia 153, 154
Urtica urens 200, 202
Veronica 281
Vicia faba 249
— sativa 54
Vigna 109
Vitaceae 202, 210
Vitis 87, 94, 144, 186, 191, 196, 361
Winteraceae 143, 209
Wisteria 172
Xanthium 119, 120, 125
Yucca 324
Zantedeschia 330, 364
Zea 248, 415
— mays 88, 249, 277, 414, 470, 486, 497
Zingiberales 195
Zizanieae 489
Zygogynum 150
Zygophyllaceae 366
Предметный указатель
Абсорбирующая ткань 233
Адвентивные почки 298, 299
Аддитивные деления камбия 157, 161
Алейроновые зерна 474
Алейроновый слой 437, 472—475
Андроцей 377
Аннулус 38
Апикальная клетка 288
— меристема 15, 21, 25—27
------ вступление в репродуктивную ста-
дию 393—395
----- инициали 287, 293—295
----- корня 242—249
-----организация по типу туника —
корпус 289
-----пластохронный рост 293
------ побега 286—296
----- производные 287
— — связь с образованием зародыша
478
----- цитогистологическая зональность
292
Апогамия 489
Ареолы мезофилла 330
Астросклереиды 84
Аэренхима 73, 324
— в корнях 233
----- плодах 440
----- семенах 468
----- стебле 271
Бзальная клетка 484
Безбелковые семена 470
Белки запасные 52
— клеточной оболочки 60
— семян 472
Ф-белок 175, 177
Белковые тельца 52, 474
Брахисклереиды 84
Вакуоль 35, 44, 45
Венчик 377
Веретеновидные инициали 125, 156
Ветвистые поры 64, 85, 86
Ветки, происхождение 297
Веточные следы 282, 307
— щели 282
Волокна 86—88, 90—94
— желатинозные 123, 149
— ксилемные 86, 91, 92, 122—124
— либриформа 122
— лубяные 88
— периваскулярные 284, 319, 320
— перициклические 87
— септированные 93, 122, 180, 184
Волокна
— технические 87
— флоэмные 180, 181, 184—186
— хвойных 87
Волокнистые склереиды 181
— трахеиды 121, 122
Воска 53, 58, 102
Вторичная ксилема 115—126, 136—154
— клеточная оболочка 61
Вторичный рост 16, 23
Выполняющая (добавочная) ткань в че-
чевичках 196, 197
Гаметогенез 411
Гаметофит женский 418
— мужской 411
Гаустории 229, 230
Гемицеллюлозы 58
Гетеробластия 348, 359, 360
Гетерогенная лучевая система 143
Гетерохроматин 38
Гетероцеллюлярные лучи 143, 152
Гиалоплазма 37
Гидатоды 200, 208
Гидроморфный лист 360, 361, 363
Гинецей 377, 381
Гипантий 449
Гиподерма 357
Гипокотиль 21
Гипофиза 483
Гистогены 244
— теория 244, 292
Глиоксисомы 43
Голосеменные, верхушка побега 291
— лист 370
— стебель 285, 286
— устьица 104
Гольджи аппарат 47
Гомобластия 348
Гомогенная лучевая система 143
Гомоцеллюлярные лучи 143, 152
Грана 41
Гранулокриновая секреция 201
Гуттация 208
Двудольные, древесина 139—145, 151 —
154
— лист 360
— стебель 317
— флоэма 184
Дендрохронология 146
Дерматоген 22, 244, 292
Диаспоры 458
Дизъюнктивная паренхима 148
548
Предметный указатель
Дизъюнктивные трахеиды 148
Диктиосомы 34, 46
— в железках 201
— нектарников 208
— роль в секреции слизи 239
— участие в геотропической реакции 241
Дифференциация, градиенты 31
— полярность 30, 31
Добавочная ткань 196
Дорсовентральные листья 364
Древесина 136—145, 149—154
— двудольных 139—149, 151—154
— кольцепоровая 141, 151, 152
— мягкая 136, 150
— непоровая 150
— определение 149—153
— поздняя 136, 138, 146
— поровая 150
— рассеянно-поровая 139, 151, 152, 164
— растяжения 148
— реактивная 148
— сжатия 148
— твердая 136, 150
— хвойных 136—138, 148—150
— ядровая 117
Друзы 54
Дыхательные корни 229
Жгучий волосок 200
Железистые волоски 200, 202
— трихомы 201
Железки 200—203
Жилки листьев 329—334
— мелкие 332—334
Жилкование 329—334
Жиры запасные 53
Жиры кристаллические 53
Заболонь 117
Завязь 384
Закрывающий слой на раневой поверх-
ности 194
------- чечевичках 197
Замыкающие клетки устьиц 98, 102—105
Замещающие корни 267
Запасающая ткань в семенах 470
Зародыш 21, 23, 478—491
— злаков 480—484, 486
— классификация 489—491
— прорастание 492
Зародышевый корешок 21
— мешок 419—422
Зачатки волокон 181
Защитная ткань у однодольных 194
Зерновка 436, 437, 496
Зигота 21, 425
Злаки, зародыш 480, 486
Злаки
— крахмал 52
— лист 330, 365
— плод 437—440
— цветок 397, 398
Идиобласты 52, 84, 98
— танниновые 210
— экскреторные 209
Инициали в апикальной меристеме 26,
242, 287, 294
— веретеновидные 156
— камбиальные 158, 161
— лучевые 156, 160
— производные 287
Интеркалярный рост 300, 343
Интеркостальная зона 331
Интрузивный рост 88—94, 159
Калиптроген 240
Каллоза 170
— в мегаспорогенезе 418
-----микроспорогенезе 404
— раневая 177
Каллус 315
Камбиальная зона 158
Камбий 16, 156—165
— изменения в процессе развития 158
— межпучковый 310
— неярусный 156
— осевой системы 156
— пробковый 17, 189
— пучковый 310
— сезонные изменения 163—165
— сосудистый, интрузивный рост 160
— структура 156
— ярусный 156
Камеденосные ходы 145, 212
-----травматические 154, 212
Карпели 377
Каспари поясок 234—236
-----в стебле 272, 318
Катафиллы 327, 359
Каучук в млечниках 213
Квантосомы 41
Клейкие волоски 204
Клетки 14, 33—54
— альбуминовые 179, 182, 371
— каменистые 84
— контактные ПО, 142, 144
— кристаллоносные 210
— масляные 209
— мирозиновые 209
— окремневшие 98
— паренхимные колленхиматозные 79
— передаточные 76
— побочные 102
Предметный указатель
549
Клетки
— прокариотические 34
— промежуточные 333
— пузыревидные 98, 366
— секреторные 209, 210
— собирательные в железках 203
— содержащие рафидные кристаллы 209
— танниновые 209
— типы 16—19
— форма и расположение 73
— ценоцитные 38
— - эукариотические 34, 40, 43, 49
Клетки-спутники 142, 178, 179
— тяжи 179
Клеточная оболочка 34, 58—70
белки 60
вторичная 61
----- первичная 61
-----перламутровая 169
----- пробки 189
----- ситовидных элементов 169—171
----- третичная 61
— пластинка 67, 162
— теория 33
Клеточное деление 67
Клеточный цикл 39
Климактерий 454
— при развитии плодов 454
Колеоптиль 480
Колеориза 480, 486
Колленхима 17, 76—79, 271
Колленхиматозные паренхимные клет-
ки 79
Колоночная меристема 293, 299
Кольцепоровая древесина 141, 151
Кольцесосудистая древесина 120, 152
Комиссуральные пучки 330, 366
Контактные клетки ПО, 142, 144
Кора 182, 188, 195
Корень (ни), апикальная меристема 26,
27, 242—249
— боковые 252—254
— воздушные 229, 232
— вторичный 252
— георецепция 239
— диархные 237
— замещающие 267
— запасающие 229, 263, 264
— контрактильные 230
— опорные 229, 303
— первичная дифференциация 248
----- структура 232
— первичный (стержневой) 229, 244
— перидерма 260
— перицикл 237, 250, 252, 253, 258
— полиархные 237
— почки 254
Корень (ни)
— придаточные (адвентивные) 229, 242,
265—268
— проводящие ткани 237, 238, 250
— протодерма 249
— рост, вторичная форма 258
-----первичная форма 229—254
-----теория тело—чехлик 244
— срастание 262, 263
— тетрархные 237
— триархные 237
— центральный цилиндр 237, 248
— экзодерма 236
— эндодерма 234
— эпидерма 231, 247
Корневая система 229
----- мочковатая 229
Корневой чехлик 238
Корневые волоски (трихобласты) 99,
111, 232, 233
— клубеньки 231
«Корончатый синдром» 370
Кортекс 37
Крассулы 122
Крахмалоносное влагалище 272, 284,
319, 320
Крахмальные зерна, образовательный
центр 50
Кристаллоиды 52
Кристаллы 54, 125
Кристы митохондрий 43
Ксероморфизм 355
Ксилема 18
— в зоне перехода 500
— вторичная 136—154
-----двудольных 139—145
----- развитие 131, 146—148
-----хвойных 136
— гидатод 208
— лакуна 324
— лучевая система 138, 142—144, 152
— паренхима 125, 138, 141, 152
— первичная 127—131, 238
-----дифференциация 305—307
— трахеальные элементы 118—122
— экзархная 238, 250, 500
— эндархная 306, 500
Культура ткани 29, 133
Кутикула 58
— нектарников 208
Кутикулярный слой листа 102
-----семенной кожуры 437, 439
Кутин 58, 102
Кущение 266, 488, 498
Латекс 213
Латеральная меристема 16, 156, 189
550
Предметный указатель
Лейкопласты 40
Лепестки 377—379
Лигнин 59, 60
Лизосомы 45
Липидные глобулы 49
Лист 89, 327—352, 355—373
— бифациальный 328, 346, 454
— гидроморфных растений 360, 361, 364
— голосеменных 370
— двудольных 360
— жилки 329—334
— злаковых 97, 330, 365
— изобилатеральный 328, 361
— изолатеральный 328
— ксероморфный 355
— мезоморфный 361
— морфология 327
— однодольных 364
— опадение 351
— пластинка 327
— проводящая система 329
— происхождение 295—298
— развитие 335—351
— С4-растений 368—370
— унифациальный 328, 345, 346, 364
— центрическая структура 361
Листовые бугорки 295, 335
— примордии 295—297, 335
— следы 273—282
— — влияние вторичного роста 313
— щели 280
----- влияние вторичного роста 313
-----дифференциация 305
Ломасомы 46
Лучевая паренхима в ксилеме 126, 150
— система в ксилеме 115, 143
Лучевые инициали 156, 160
— трахеиды 138, 150
Лучи веретеновидные 151
— двудольных 142, 143, 152
— типы клеток 126
— хвойных 138
Лютоиды 213
Макросклереиды 84
Маргинальная зона 65, 121
— меристема 337, 339, 344
Маргинальный рост листа 337, 339
Материнские клетки верхушки побега
292
Мегаспорогенез 415
Мегаспорофиллы 377
Мегаспороцит 418
Мегаспоры 418
Медианная полость 65
Медулярное влагалище 272
Межклетники 62, 63, 73, 74
Межпучковая паренхима 127, 270
Мезоморфные листья 361
Мезофилл 328, 360, 370
— дифференциация 348
Мейоз 39
Мембрана 34, 35
— элементарная 35
Меристема 15
— абаксиальная 335
— адаксиальная 335, 337
— апикальная 16, 21, 25—27
— интеркалярная 300, 343
— латеральная 16, 156, 189
— маргинальная 337, 339, 344
— основная 288
— остаточная 304
— первичная 27, 288
— первичного утолщения 302, 324
— периферическая 293
— пластинчатая 343, 344
— разделительная 298
— рядная (колоночная) 293
— сердцевинная 289, 290, 293
— флоральная 393
Меристемоиды 100
Метаксилема 127—131, 238, 250
— сосуды, специализация 123
Метакутинизация 194
Метафлоэма 181
Микориза 230
Микроспорогенез 402—408
Микроспорофиллы 377, 402
Микроспороциты 404
Микроспоры 404
Микротельца 34, 43, 475
Микротрубочки 49, 50
— в дифференцирующейся ксилеме 132
-----препрофазном тяже 68
-----фрагмопластах 67
Микрофибриллы 60, 75, 104
Митоз 39
Митохондрии 34, 43
Мицеллы 60
Млечники 19, 212—224
Морфогенез 27
Мультипликативные деления в камбии
158, 161
Некротизированные клетки 194
Некрофилактическая перидерма 191
Нектарники 200, 204—208
— флоральные 204
— экстрафлоральные 204
Неярусная древесина 139
— флоэма 184
Неярусный камбий 156
Предметный указатель
551
Обкладка пучков 331, 366, 368, 369
-----местомная 367
----- паренхимная 367
Облитерация флоэмных клеток 181
Однодольные, абсорбирующая ткань 233
— вторичный рост 324
— защитная ткань 194
— лист 364
— проводящая система 278—280
— стебель 299—302, 323—324
— устьица ПО
Окаймленная пара пор 65
Окаймленные поры 65, 121, 122
-----закрытые 65, 122
----- зубчатые 152
Околоцветник 377
Онтогенез 28
Опадение листьев 350
— плодов 454
Оплодотворение 423, 429
Опорная ткань 76, 82
----- листа 363
Опыление 378
Организация туника — корпус 394, 289
Ортостихи 273
Осевая система в камбии 156
----- ксилемная 115, 116
-----флоэмная 182
Осмиофильные глобулы 49
Основная цитоплазма 37
Остеосклереиды 84
Пазушные почки 298, 307
Папиллы 249
Пара пор 63
----окаймленная 65, 121, 122
---- полуокаймленная 65, 121
----простая 65, 120
Парамуральные тельца 45
Парастихи 273
Паренхима 17, 72—76
— лучевая 125
— осевая 125, 138, 141, 152
----у двудольных 141, 154
-------хвойных 138
— склерифицированная 76, 82, 84
Паренхимные клетки, дизъюнктивные
148
----колленхиматозные 79
----склерифицированные 126
Партеногенез 489
Партенокарпия 429, 446
Педоморфоз 131
Пектиновые вещества 58
Первичная клеточная оболочка 61
— кора 15
Первичная кора
----корня 233—236, 250
---- стебля 271
— ксилема 127—131, 238
---- отличие от вторичной 131
---- типы 144
Первичный рост 15, 23
Передаточные клетки в гидатодах 208
-------корневых клубеньках 231
-------листовых жилках 333
---------- следах 278
------- плодах злаковых 440
------- столбике 389
-------флоэме 179, 180
Переходная зона в апикальной меристе-
ме 293
Периблема 244, 292
Периваскулярные волокна 284, 319, 320
Перидерма 17, 24, 189—197
— в корнях 260
— некрофилактическая 191
— развитие 191
— раневая 188, 194
— экзофилактическая 191
Перикарпий 433, 438
Периклинальные химеры 291
Перимедулярная зона 272, 317, 319
Перимедулярное пространство 38
Перисперм 458
Периферический ретикулум хлоропла-
стов 369
Перицикл 284
— закладка перидермы 191
— корней 239, 250, 258
Перициклические волокна 87
Перламутровые клеточные оболочки 169
Пероксисомы 43
Перфорационная пластинка 120, 124
Пестик 381
Пиноцитозные пузырьки 45
Плазмалемма 34, 174, 175
— в ситовидных элементах 174, 175
Плазмалеммасомы 46
Плазматическая мембрана 34
Плазмодесмы 65, 66, 75, 100, 175
— в замыкающих клетках 106
---- ситовидных элементах 174—178
Пластиды 33, 34, 40—43
— оболочка 41
Пластинчатая меристема 343, 344
Пластоглобулы 40
Пластохрон 275
Плацентация 384, 386
Плерома 244, 292
Плод(ы) 429—455
— без кожуры 446
— вскрывающийся 432—436
552
Предметный указатель
Плод (ы)
— дыхательный климактерий 453, 454
— злаков 437—440
— классификация 430, 431
— невскрывающийся 436—441
— опадение 454
— рост 451
— с кожурой 441
— сочный 441—450
— стенка 431
— сухой 432—441
— типы 432—450
— хромопласты 443, 445
Плодолистики 377, 381, 396
Плюмула 21
Пневматофоры 229
Побег 24, 26, 270, 298
Покоящийся центр в апексе корня, тео-
рия 247—249
Покрытосеменные, лист 327—334
Поле перекреста 138, 150
Полидерма 190
Полирибосомы (полисомы) 46
Полиэмбриония 489
Полуокаймленные пары пор 65, 121
Пора(ы) 63—66
— ветвистая 64, 86
— в ксилемных элементах 120, 121, 124
— первичные 63
— простые 65
— ядерной оболочки 38
Поровые поля первичные 64—65
Почечные чешуи 327, 359
Почки адвентивные 298, 299
— на корнях, развитие 254
— пазушные 298, 307
Пробка, клеточная оболочка 189
— крыловидная 195
— ярусная 194
Проваскулярная меристема 22. См, так-
же Прокамбий
Проводниковая ткань 388, 389, 423
— система, дифференциация 303—307
----- зона перехода 498
----- в листе 329
----- стебле 272—286
----- цветках 389
— ткань 115, 157
-----в корне 237, 238, 250
----- вторичная 115
-----дифференциация в корне 250—252
----- листе 349
----- семядолях 492
--------------------- первичная 115
Проводящие пучки 127, 272, 273
----- в нектарниках 206
Прокамбий 22, 115, 288
— дифференциация в корне 250, 258
------- листьях 349
------- стебле 304
Прокариотические клетки 34
Проламеллярное тельце 42
Промежуточные клетки 333
Промеристема в апексах корня 248
------- побега 287
Пропластиды 40
Пропускные клетки 238
Прорастание семян 463, 464, 473, 491 —
498
Проросток 491—500
— зона перехода 498—500
Протодерма 22
— в листьях 339, 344
----- стеблях 288
Протоксилема 123, 127, 131
— в корнях 238, 251
— разрушение 310
Протомеристема верхушки побега 287
Протоплазма 33
Протопласт 33
Протофлоэма 181, 182, 238, 251
Профиллы 282, 298, 327
Проэмбрио 482
Пузыревидные клетки 98, 366
Пыльца 414, 415
— развитие 404—406
Пыльцевая трубка 388, 389, 414, 415
Радиальная система в камбии 156
Разделительная меристема 298
Раневая пробка (раневая перидерма)
188
----- залечивание 194, 315
Ранняя древесина 120, 136, 146
Рассеяннопоровая древесина 139, 151, 16z
Рафиды 54
Реактивация флоэмы 170, 186
Реактивная древесина 148
Рибосомы 34, 46
Ритидом 190, 195, 196
Рост вторичный 16, 23
-----аномальный 264, 321—324
-----диффузный 324
-----древесных 261
----- корня 243, 264
-----однодольных 324
----- стебля 310—316
----- травянистых 260
— интерпозиционный 88
— интрузивный 88, 90, 160
— первичный 15, 23
----- стебля 299—302
— согласованный 88, 90
Предметный указатель
553
Рубцовая ткань 194
Рубчик на семени 459, 468
Рыльце 383, 386
Рядная меристема 293
Связующая ткань 321
Секреторные структуры 19, 199—214
Секреция 199
Семенная кожура 458, 463
Семя(ена) 458—475
— безбелковые 470
— белковые 470, 474
— запасающие ткани 470
— крахмал 472
— липиды 475
— морфология 458—460
— прорастание 463, 464, 473, 491—498
— развитие 461
— углеводы 472
Семядоли 21
Семязачаток 415
Септированные склереиды 93
Сердцевина 15
— стебля 271, 273
Сердцевинный луч 270
Симподии в проводящей ткани 276
Система тканей 14
Ситовидная пластинка 170, 177
----дифференциация 175
— трубка 171
Ситовидные клетки 171, 179, 184
— поля 169—171
— элементы 167—178
----пластиды 174
---- протопласты 173
----способность к плазмолизу 175
Складчатый мезофилл 370
Склереиды 82—84, 126, 181
— в листьях 85
плодах 85
семенах 85
стеблях 84
- нитевидные 84
- развитие 88, 89, 93
- распределение 84
- септированные 93
Склеренхима 18, 82—94, 180, 271
Склерифицированные паренхимные клет-
ки 76, 82, 84
Слизевые пробки 177
Слизь в корневом чехлике 239
'ложная срединная пластинка 61
'.лои прироста в древесине 117, 146
------перидерме 193
Смоляные ходы 138, 145, 150, 201, 211
--- в лучах 151
------ флоэме 182
Смоляные ходы
-----травматические 138, 212
-----у хвойных 371, 372
Согласованный рост 88, 90
Солевые железки 203, 204
Сосудистые трахеиды 124
Сосуды 119, 120
— развитие 147
— распределение в древесине 139, 141
• — эволюция 123—125
Соцветие 377
Сочный плод 441—450
Специализация 27
— при дифференциации 27
Срастание корней 262, 263
— при прививках 315
Срединная пластинка 61
-----сложная 61
Стабилизирующая ось 303
Статолиты в корневом чехлике 240
Стебель 87
— апикальная меристема 286—295
— вторичный рост 310—316
— первичная кора 271, 272
— первичный рост 299—302
— перицикл 284
— проводящая система 272—286
— развитие 286
— сердцевина 271, 272
— типы 316—324
Стела (центральный цилиндр) корня 237
— папоротникообразных 284
Стелярная теория 283
Стилоиды 54
Столбик 383, 386, 388
Стомиум 381
Суберин 58, 189
Суспензор 482, 484. См. также Зародыш
Сухой плод 432—441
Сферосомы 49, 475
Таннины 52
Тапетум 404, 405
— интегументальный 417
Тейхода 65, 100, 102
Тело растения 14, 15, 23
----- развитие 21—32
Тело — чехлик, теория 244
Технические волокна 87
Тилакоиды 41, 42, 186
Тилы 144, 152
Ткань (и), классификация 16—19
— определение 14
— первичная меристематическая 27
— проваскулярная меристема 22
— проводящая 115
— типы 16
554
Предметный указатель
Тонопласт 35, 37, 44
— ситовидных элементов 175
Торус 65, 121, 122
Трансфузионная ткань 371, 372
----- добавочная 372
Травматические камеденосные ходы 154,
212
— смоляные ходы 138, 212
Трахеальные элементы 118—122
-----дифференциация 131—134
-----филогенетическая специализация
123—125
Трахеиды 120
— дизъюнктивные 148
— клеточная оболочка 62
— лучевые 138, 150
— сосудистые 124
Третичная оболочка 61
Трихобласты 99. См. также Корневые
волоски
Трихомы 111—113, 133
— железистые 201—203
— насекомоядных растений 202
Трихосклереиды 84
Тычинки 377, 379, 402
Узлы, структура 281, 282
Устьица 102
— в гидатодах 208
— голосеменных 104
— движения 104, 105
— модели 105
— развитие 104—111
— типы 107—109
Устьичные ямки (крипты) 328, 357
Устьичный комплекс 106
Феллем 189, 197
Феллоген 16, 189, 192, 260
— в чечевичках 196
Феллодерма 189
— в чечевичках 196
Феллоидные клетки 190, 196
Фенольные соединения 52
Фибоначчи ряды 274
Филломы 376
Филлотаксис 273
Фитоферритин 40
Фланговая меристема 293
Флоральная меристема 393
Флоральные нектарники 204
Флоэма 18, 167—186
— в зоне перехода 500
— внутренняя 319
— вторичная 167, 182—186
— двудольных 184—186
Флоэма
— листа 332—334, 350
— наружная 319
— нефункционирующая 182, 184, 186
— неярусная 184
— паренхимные клетки 180
— первичная 167, 181, 305—307
— передаточные клетки 179, 180, 333
— реактивация 170, 186
— транспорт веществ 179
— функционирующая 182
— хвойных 182, 183
— ярусная 184
Флоэмные волокна 86, 91, 92, 180, 181,
184, 185
— клетки 168
----- облитерация 181
Фрагмопласты 50, 67, 68, 162
— в микроспорогенезе 405
Фрагмосомы 68, 163
Фреты 41
Халазальная клетка 484
Хвойные, волокна 87
— древесина 136—138, 149—151
— камбий 160, 161
— ксилема 121
— лист 370—373
— поры в ксилеме 121
— проводящая система 273
— смоляные ходы 211, 372
— стебель 316
— трансфузионная ткань 371, 372
— флоэма 182
Химеры растений 340
— периклинальные 291
Хлоренхима 72
Хлоропласты 34, 40, 42
— обкладок пучков 368, 369
— периферический ретикулум 369
Хромопласты 40, 42
Хромосомы 34
Цветение, индукция 392
Цветок 376
— гистогенез 394—396
— злаков 397, 398
— органогенез 397
— проводящая система 389
— репродуктивные цикл 402—425
— строение 376
Цветоложе 377
Цветочная трубка 449
Целлюлоза 58, 60
Ценоцитные клетки 38
Предметный указатель
555
Цистолиты 54
Цитогистологическая зональность 292
Цитокинез в камбии 162
Цитоплазма 33, 37
— движение 90
Цитоплазматический матрикс 37
Цитосомы 43
Цитохимера 291, 395, 397
Чашелистик 377, 378
Чашечка 377
Чечевички 196
— выполняющая (добавочная) ткань
196, 197
Черешок 327, 363
Членики ситовидных трубок 171, 179
— сосудов 119, 120, 124, 132
Щиток 474, 480, 486
Экзодерма 236
Экзофилактическая перидерма 191
Эккриновая секреция 201
Экстраксилярные волокна 86
Экстрафлоральные нектарники 204
Эктодесмы 65
Эктомикориза 230, 231
Элайопласты 53
Эмбриогенез 463
Эмбриогения, отклоняющиеся формы 489
Эмбриоид 489, 491
Эндодерма корня 234
— пропускные клетки 236
— стебля 271, 272
Эндодерма хвойных 371
Эндомикориза 230, 231
Эндоплазматический ретикулум 34, 48,
174
-----в железках 201
------- нектарниках 206, 208
—------ситовидных элементах 176, 177
----- участие в геотропических реакциях
241
Эндополиплоидия 38
Эндосперм 458, 470—475
— гелобиальный 471
Эндотелий 417
Эндотеций 381, 404
Эпидерма 16, 96—113, 232, 249, 271, 327
— клеточная оболочка 100
— многослойная 96, 361
Эпикотиль 21
Эпикутикулярный воск 101
Эпитема 208
Эргастические вещества 35, 50—54
Этиопласты 42
Эукариотические клетки 34, 40, 43, 49
Эухроматин 38
Ядерная оболочка 38
Ядро 34, 38—40, 117
— полиплоидное 38
Ядрышко 34
Ядрышковый организатор 39
Яйцеклетка 422, 429
Ярусная древесина 139
— пробка 194
— флоэма 184
Фото 71. Луковицы пролески (Scilld) из сем. Liliaceae с контрактильными и не-
контрактильными корнями. Видно, что на контрактильных корнях в результате
сокращения происходит сморщивание поверхностной ткани. 1 — контрактильные
корни.
Фото 72. Поперечные срезы зрелого корня Lilium. А. Широкая первичная кора
состоит из паренхимы. Эпидерма отчасти разрушена, так что экзодерма на не-
которых участках обнажена. Центральный цилиндр не имеет сердцевины. Б.
Участок того же среза при большем увеличении. Видны толстостенная эндодер-
ма с пропускными клетками, преимущественно однослойный перицикл, и десять
групп клеток флоэмы, чередующихся с тем же числом групп клеток протоксиле-
мы. 1 — эпидерма; 2 — экзодерма; 3—пропускная клетка; 4 — эндодерма; 5 —
перицикл; 6 — флоэма; 7 — протоксилема; 8 — метаксилема.
Фото 73. Поперечные срезы развитых корней Zea mays. А. Широкая кора под
однослойной экзодермой склерифицирована; эпидерма отчасти разрушена. Про-
водящая ткань окружает сердцевину. Б. Участок того же среза при большем
увеличении. Видны толстостенная эндодерма и группа клеток флоэмы между
двумя радиальными рядами клеток ксилемы. 1 — эпидерма; 2— экзодерма; 5 —
эндодерма; 4 — метаксилема; 5-— флоэма; 6 — перицикл; 7 — протоксилема.
Фото 74. Электронная микрофотография среза через
антиклинальную стенку между двумя клетками эндодер-
мы корня Zea mays. Поздняя стадия дифференциации эн-
додермы: по обе стороны первичной оболочки видны су-
бериновые пластинки, покрытые слоями целлюлозной
оболочки [37]. 1—первичная оболочка; 2—суберино-
вая пластинка;' 3— вторичная оболочка.
Фото 75. Поперечные срезы корня земляники {Fragaria)
в первичной стадии роста (Л) и при закладке камбия
(Б). (Фотографии из работы Nelson, Wilhelm, Hilgar-
dia, 26, 631—642, 1957.) У —эндодерма; 2— перицикл;
3— флоэма; 4 — протоксилема; 5 — метаксилема; 6 —
эпидерма; 7— камбий.
Фото 76. Поперечные срезы дифференцирующихся корней. А. Три дифференци-
рованных элемента протофлоэмы томата Lycoperslcon esculentum. Вакуолизиро-
ванная средняя часть центрального цилиндра определяет триархную форму бу-
дущей ксилемы. (Rasa, Esau, Hilgardia, 30, 469—515, 1961.) Б. Центральный ци-
линдр ячменя Hordeum vulgare с восемью зрелыми ситовидными элементами
протофлоэмы, каждый из которых сопровождается двумя клетками-спутниками.
Ситовидные элементы метафлоэмы не дифференцированы. В ксилеме, которая
еще не дифференцирована, метаксилемные элементы более сильно вакуолизиро-
ваны, чем протоксилемные. (Esau, Hilgardia, 27, 15—69, 1957.) 1— корневой чех-
лик; 2— эпидерма; 3 — ситовидный элемент; 4 — эндодерма; 5 — перицикл; 6 —
первичная кора; 7—протофлоэма; 8 — метафлоэма; 9 — поздняя метаксилема;
10 ~ ранняя метаксилема; 11 — протоксилема.
Фото 77. Закладка боковых корней у подсолнеч-
ника Helianthus annuus. Представлены два корне-
вых примордия. Метаксилема материнского корня
еще не дифференцирована. Положение боковых
корней подобно тому, которое было представле-
но на рис. 14.4, В. Материнский корень на попе-
речном срезе. 1 — производные эндодермы; 2 —
производные перицикла; 3— протоксилема; 4 —
эндодерма; 5 — примордий корня; 6 — флоэма;
7— перицикл; 8 — делящаяся клетка перицикла.
Фото 78. Закладка бокового корня у костра (Brotnus mollis). Пред-
ставлен один зачаток корня. Его положение подобно тому, которое
показано на рис. 14.4, Г. Материнский корень на поперечном срезе.
(Esau, Hilgardia, 27, 15—69, 1957.) 1 —протоксилема; 2 — ранняя
метаксилема; 3 — поздняя метаксилема; 4 — смятая эндодерма; 5—-
эндодерма; 6 — флоэма; 7 — перицикл; 8—центральный цилиндр;
9— инициали первичной коры; 10 — корневой чехлик.
Фото 79. Поперечные срезы корня люцерны Medicago sativa, иллюстрирующие
детали вторичного роста. А, Б. Ранняя стадия вторичного роста, подобная той,
которая представлена на рис. 15.1, Д, Е. А. Расположение тканей по радиусу,
проходящему через флоэму; первичная кора (снаружи от перицикла) смята. Б.
Участок, противоположный протоксилемному полюсу. В. Корень на поздней
стадии вторичного роста, подобной той, которая представлена на рис. 15.1, Ж 3.
1 — флоэма; 2 — волокна; 3 — перицикл; 4 — камбий; 5 — луч; 6 — флоэмные
волокна; 7 — протоксилемный полюс; 8 — перидерма.
Фото 80. Поперечные срезы корней травянистых растений на стадии вторичного
роста. А. Томаты Lycopersicon esculentum. Б. Капуста Brassica oleracea. В.
Тыква Cucurbita sp. Г. Картофель Solatium tuberosum. 1 — феллоген; 2— дила-
тационный рост; 3 — вторичная ксилема; 4~ первичная ксилема; 5 —камбий.
t Л4М
Фото 81. Поперечные срезы корней древесных видов на стадии вторичного роста.
А. Пихта (Abies). Б. Липа (Tilia). (Esau, Plant Anatomy, 2nd ed., John Wiley
& Sons, 1965.) 1 — склеренхима во флоэме; 2 — вторичная ксилема; 3 -—камбий;
4 — вторичная флоэма; 5 — поздняя древесина; 6 — перидерма.
Фото 82. Поперечные срезы корня сахарной свеклы (Beta vulgaris), иллюстри-
рующие аномальный вторичный рост, осуществляемый за счет образования сна-
ружи от первичного камбия многих камбиальных слоев. Каждый из этих слоев
дает начало клеткам ксилемы и флоэмы, а также клеткам запасающей парен-
химы. (Artschwager, J. Agr. Res., 33, 143—176, 1926.) 1 — перидерма; 2 — след
бокового корня; 3 — первый слой вторичной ксилемы; 4—ксилема; 5 — один
слой прироста; 6 — запасающая паренхима; 7 — вторичная ксилема; 8 — вторич-
ная флоэма; 9 — камбий.
Фото 83. Поперечные срезы, иллюстрирующие аномальный вторичный рост в за-
пасающих корнях. А, Б. Сладкий картофель (Ipomoea batatas). А. Аномальный
камбий вокруг сосудов вторичной ксилемы. Б. Нормальный камбий. В, Г. Редис
Raphanus sativus с аномальным камбием во вторичной ксилеме. 1 — перидерма;
2-—флоэма; 3 — камбий; 4~ ксилема; 5 —клетки ксилемы; 6 — аномальный
камбий; 7 — первичная ксилема.
Фото 84. Поперечный срез стебля томата, инфицированного возбу-
дителем желтухи астры. Придаточный корень закладывается в па-
ренхиме наружной флоэмы. В ответ на поражение микоплазмами
наружная и внутренняя флоэмы дегенерируют. (Препарат пре-
доставлен Е. A. Rasa.) 1 — внутренняя флоэма; 2— наружная
флоэма; 5 —ксилема; 4 — придаточный корень.
Фото 85. Поперечные срезы стеблей травянистых двудольных в
первичной стадии роста. A. Lotus corniculatus, целый срез. (Han-
sen, Iowa State Goll. Jour. Sci., 27, 563—600, 1953.) Б. Trifoliutn
hybridum, фрагмент среза с двумя проводящими пучками. (Sass,
Botanical Microtechnique, 3rd. ed., Jowa State College Press,
1958.) 1 — танниновая клетка; 2 — колленхима; 3— эпидерма;
4— первичная кора; 5 — межпучковая зона; 6— сосудистые пуч-
ки; 7— крахмалоносное влагалище; 8— флоэма; 9 — ксилема;
10 — смятая протоксилема; И — нефункционирующая флоэма.
Фото 86. Поперечный срез стебля Zea mays. А. Проводящие пучки распределены
по всему поперечному сечению, но скапливаются по периферии. Б. Фрагмент
среза с проводящими пучками. 1 — склеренхима; 2— метафлоэма; 3— смятая
протофлоэма; 4 — пучковое влагалище; 5 — метаксилема; 6-—протоксилемная
лакуна.
Фото 87. Продольные срезы верхушек побега Solatium luberosum, показываю-
щие организацию апикальной меристемы по типу тупика—корпус и две стадии
формирования листового примордия: листовой бугорок (Л) и начало роста вверх
(Б) [49]. 1—листовой бугорок; 2 — двухслойная туника; 3 — листовой примор-
дий; 4 — корпус; 5 — прокамбий.
Фото 88. Продольный срез верхушки побега Coleus с двухслойной туникой. Срез
почки в пазухе листа в более поздней фазе пластохрона см. на фото 92. 1 —-
пазуха листа; 2 — двухслойная туника; 3— корпус.
Фото 89. Продольный срез верхушки побега Zea mays с однослойной туникой.
Части одного и того же листа расположены по обеим сторонам оси, так как
листья в процессе роста окружают стебель (см. рис. 16.3). 1 — самый молодой
листовой примордий; 2 — апекс побега; 3— однослойная туника; 4 — прокамбий;
5 —первичная меристема утолщения.
Фото 90. Продольные срезы верхушек побегов хвойных. A. Pinus strobus-, пере-
ходная зона сливается с колончатой меристемой. Б. Cupressus macrocarpa-, мате-
ринские клетки выражены неотчетливо, сердцевина вакуолизирована уже вблизи
апекса. 1 — периферическая зона; 2— инициальный слой; 3— антиклинальное де-
ление; 4—-центральные материнские клетки; 5 — переходная зона; 6 — пе-
риклинальная стенка; 7 — листовой примордий; 5 — колончатая меристема; 9 —
сердцевина. [Препараты предоставлены A. R. Spurr (А) и A. S. Foster (Б).]
Фото 91. Закладка пазушных почек у Solarium tuberosum
[49]. Продольные срезы узлов, показывающие раннюю (Л) и
более позднюю (Б) стадии развития почки. 1 — кроющий лист;
2 — щитовидная зона; 3 — пазушная почка.
Фото 92. Продольный срез побега Coleus. Сердцевина сфор»
мировалась по типу колончатой меристемы. 1—апекс побега;
2— молодой лист; 3— прокамбий; 4 — узел 1; 5 — узел 2;
6 — пазушная почка; 7-—узел 3; 8 — основание листа, окру-
жающего стебель; 9 — узел 4.
Фото 93. Поперечные срезы стеблей на ранней (А) и более поздней (Б) стадиях
активности пучкового и межпучкового камбия. (Фото предоставлены J. Е. Sass.
Фото Б воспроизводится из работы Sass, Botanical Microtechnique, 3rd ed. The
Iowa State College Press, 1958.) A. Lotus corniculatus Б. Medicago sativa. 1 —
нефункционирующая флоэма; 2— танниновая клетка; 3 — интактная флоэма; 4 —
межпучковый камбий; 5 — пучковый камбий; 6 — незрелая ксилема; 7 — флоэма;
8 — ксилема.
Фото 94. Поперечные срезы стебля Tilia, сделанные до (А, В) и после (Б, Г)
начала вторичного роста. (Esau, Plant Anatomy, 2nd ed., New York, John Wi-
ley & Sons, 1965.) 1— перимедуллярная зона; 2 — слизевой ход; 3— колленхи-
ма; 4 — первичная кора; 5 — первичная флоэма; 6 — первичная ксилема; 7—
камбий; 8 — пробка; 9 — вторичная флоэма; 10 — вторичная ксилема; 11 — ди-
латированные лучи во флоэме; 12 — листовые следы; 13 — сердцевина.
Фото 95. Поперечные срезы стеблей Pinus (А) и Tilia (Б) с перидермой и не-
сколькими слоями прироста вторичных проводящих тканей. (Esau, Plant Anato-
my, 2nd ed., New York, John Wiley & Sons, 1965.) 1 —камбий; 2 — кольцо при-
роста; 3 — листовая щель; 4 — вторичная флоэма; 5 — смоляные ходы; 6 — ди-
латированный флоэмный луч; 7 — ранняя древесина; 8 — поздняя древесина; 9 —
вторичная ксилема.
Фото 96. А. Поперечный срез стебля Hibiscus cannabinus на стадии вторичного
роста. Наиболее выраженные зоны протоксилемы обозначены наконечниками
стрелок. Б. Фрагмент того же среза. Протофлоэма представлена волокнами. Вто-
ричная флоэма с волокнами расположена между метафлоэмой и камбием [12].
1 — слизевые клетки; 2—камбий; 3— метаксилема; 4 — протоксилема; 5 — ме-
тафлоэма; 6 — протофлоэма; 7 — вторичная ксилема.
1
Фото 97. Клинья первичной ксилемы на поперечном срезе того же стебля Hibis-
cus cannabinus, который показан на фото 96 [12]. Л. Одни протоксилемные эле-
менты частично сдавлены, другие интактны, но вытянуты продольно, о чем сви-
детельствует отсутствие вторичной оболочки в некоторых участках (показаны
наконечниками стрелок). Б. Трахеальные элементы протоксилемы частично или
полностью разрушены, а паренхимные клетки интактны и претерпевают дила-
тационный рост. 1— метаксилема; 2—разрушенная протоксилема; <3 — дилата-
ция паренхимы.
Фото 98. Часть поперечного среза стебля четырехлетней липы [10]. Два луча
сильно дилатированы. Стрелками указаны только что поделившиеся клетки в
лучах. В осевой системе пучки волокон чередуются с пучками ситовидных эле-
ментов и клеток-спутников. 1 — первичная кора; 2— первичная флоэма; 3— вто-
ричная флоэма; 4 — вторичная ксилема.
Фото 99. Поперечные срезы стеблей травянистых двудольных на стадии первич-
ного роста. Стрелками указаны листовые следы. A. Pelargonium; узкие межпуч-
ковые зоны. (Esau, Plant Anatomy, 2nd. ed., New York, John Wiley & Sons,
1965.) Б. Helianthus; широкие межпучковые зоны. 1—частично слившиеся пучки.
Фото 100. Поперечный срез стебля Coleus (травянистое дву-
дольное) на стадии вторичного роста. Камбий сформировал
ксилему и флоэму в пучковых зонах; склеренхима распола-
гается преимущественно в межпучковых зонах. Растение име-
ет накрест-супротивное листорасположение. 1 — склеренхима;
2— проводящая ксилема; 3— пробка; 4 — первичная кора;
5 — флоэма; 6 — первичная ксилема.
Фото 101. Поперечные срезы стеблей травянистых двудоль-
ных. (Esau, Plant Anatomy, 2nd ed., New York, John Wiley &
Sons, 1965.) A. Ranunculus. Б. Cucurbita (лиана). 1 — ксилема;
2 — флоэма; 3— перициклические волокна; 4 — наружная
флоэма; 5 — внутренняя флоэма; 6 — колленхима.
1 мм
Фото 102. Поперечные срезы стебля Aristolochia (лианы) на
ранней (Л) и более поздней (Б) стадиях роста. (Esau, Plant
Anatomy, 2nd. ed., New York, John Wiley & Sons, 1965.) 1 —
смятая флоэма; 2 — перидерма; 3— смятая сердцевина; 4 —
вторичная ксилема; 5 — перициклические волокна; 6 — меж-
пучковый камбий; 7— лучи.
Фото 103. Часть поперечного среза стебля Bougainvillea spec-
tabilis [И]. Показано несколько слоев аномального вторич-
ного прироста, каждый из них содержит проводящие пучки,
погруженные в соединительную основную ткань (ср. рис.
17.4, Б). 1 — смятая флоэма; 2 — интактная флоэма; 3—сосуд
ксилемы; 4 — прирост; 5 — соединительная ткань; 6склерен-
хима.
Фото 104. Поперечные срезы стеблей злаков. A. Avena. Б. Hordeutn. В. Secale.
Г, Д. Trit team. Показаны стебель и листовое влагалище в середине междоузлия
(Г) и близ узла (Д). / — листовое влагалище; 2 — стебель; 3 и 4 — соответст-
венно наружные и внутренние проводящие пучки; 5 — сердцевина; 6 —скле-
ренхима; 7 — колленхиматозная тканы
I
0,5 мм
од мм
Фото 105. Поперечные срезы стебля водного однодольного Potamogeton. А Со-
стоящая из аэренхимы первичная кора окружает компактный центральный ци-
линдр. Б. Фрагмент того же снимка при большем увеличении (центральный ци-
линдр). Три следа ближайшего листа над местом среза обозначены буквами с
(срединный) и л (латеральные), / — ксилемная лакуна; 2 — флоэма; 3 — эндо-
дерма.
Фото 106. Вторичный рост в стебле однодольного Cordyline. А. Фрагмент попе-
речного среза вторичных проводящих тканей. (Cheadle, Amer., J. Bot, 30, 484—
490, 1943.) Б. Тангенциальный срез камбия [3]. / — камбий; 2 — молодой пучок;
3 — флоэма; 4 •— ксилема.
Фото 107. Структура листа сирени (Syringa). А, Б. Поперечные срезы мезофилла
с погруженными в него мелкими проводящими пучками. В—Е. Парадермальные
срезы через верхнюю эпидерму (В), палисадную паренхиму (Г), губчатую па-
ренхиму (Д) и нижнюю эпидерму (В). 1—палисадная паренхима; 2— обкладка
пучков и ее продолжение; 3 — губчатая паренхима.
Фото 108. Микрофотография участка живого листа фасоли Pha-
seolus vulgaris, полученная с помощью сканирующего электрон-
ного микроскопа по методу замораживания—скалывания. (Bole,
Parsons, J. Microscopy, 98, 91—97, 1973.) / — палисадная парен-
хима; 2 — эпидерма; 3— губчатая паренхима.
Фото 109. «Скелеты» листьев, имеющих сетчатый тип
жилкования. (Whittenberger, Naghski, Amer. J. Bot., 35,
719—722, 1948.) А. Ива (Salix). Б. Тюльпанное дерево
(Liriodendron). В. Бирючина (Ligustrum).
Фото НО. Фрагмент листа табака Nicotiana tabacum, частично просветленного
для выявления мелких жилок. Внутри некоторых ареол видны свободные окон-
чания пучков. 1 — окончания пучков; 2 — ареолы.
Фото 111. Окончания пучков листа сирени (Syringd) на парадермальных срезах.
А. Срез через терминальные трахеиды ксилемы. Б. Срез через терминальные си-
товидные элементы и клетки-спутники флоэмы, / — обкладка пучка; 2 — тра-
хеида; 3 — клетка-спутник; 4 — ситовидный элемент.
Фото 112. Структура средней жилки (Л) и мелкой жилки и
мезофилла (Б) листа конопли (Cannabis). На рис. Б стрелка-
ми без обозначений отмечены мелкие жилки в мезофилле. 1 —
ксилема; 2 — колленхима; 3 — флоэма.
Фото ИЗ. Электронная микрофотография мелкой жилки листа
сахарной свеклы (Beta vulgaris). Ситовидные элементы (1)
заметно уже, чем окружающие клетки. Видны также клетки-
спутники (2), паренхимные клетки (5), промежуточные клетки
(4), сходные с клетками-спутниками, три зрелых ксилемных
элемента (5) и один незрелый (6). (Esau, New Phytologist,
17, 161—168, 1972.)
Фото 111. Окончания пучков листа сирени (Syringd) на парадермальных срезах.
А. Срез через терминальные трахеиды ксилемы. Б. Срез через терминальные си-
товидные элементы и клетки-спутники флоэмы, / — обкладка пучка; 2 — тра-
хеида; 3 — клетка-спутник; 4 — ситовидный элемент.
Фото 112. Структура средней жилки (Л) и мелкой жилки и
мезофилла (Б) листа конопли (Cannabis). На рис. Б стрелка-
ми без обозначений отмечены мелкие жилки в мезофилле. 1
ксилема; 2 — колленхима; 3 — флоэма.
Фото 113. Электронная микрофотография мелкой жилки листа
сахарной свеклы (Beta vulgaris). Ситовидные элементы (7)
заметно уже, чем окружающие клетки. Видны также клетки-
спутники (2), паренхимные клетки (5), промежуточные клетки
(4), сходные с клетками-спутниками, три зрелых ксилемных
элемента (5) и один незрелый (6). (Esau, New Phytologist,
17, 161—168, 1972.)
Фото 114. Электронные микрофотографии групп клеток из мелких жилок листьев.
A. Senecio vulgaris (Asteraceae). Б. Armeria Corsica (Plumbaginaceae). Узкие си-
товидные элементы (7) находятся в контакте с промежуточными клетками, диф-
ференцирующимися как передаточные клетки, имеющие выросты оболочки (2).
Среди передаточных клеток выделяются клетки a-типа (клетки-спутники, 3) и
клетки б-типа (паренхимные клетки, 4) [33].
Фото 115. Отделительная зона у оре-
ха (Juglans, А, Б) и сливы (Prunus,
В), наблюдаемая на продольных сре-
зах через основание листа. У ореха
в отделительном слое происходит де-
ление клеток (А, Б), тогда как у сли-
вы клетки этого слоя начали отде-
ляться друг от друга [6]. 1 — отде-
лительный слой; 2 — защитный слой.
Умм
Фото 116. Разнообразие структур мезофилла, обнаруживаемое на поперечных
срезах листьев. Д. Пастернак (Pastinaca sativa). Б. Персик (Prunus persica).
В. Лимон (Citrus Нтоп). Г. Dianthus. Д. Lilium.
Фото 117. Структура листовых подушечек у Mimosa pudica. А. Схема, иллюстри-
рующая распределение листовых подушечек. Под влиянием стимуляции листоч-
ки «складываются» за счет активности листовых подушечек третьего порядка,
находящихся у их оснований; перья сближаются друг с другом за счет действия
писцовых подушечек второго порядка, расположенных у оснований рахисов;
ггхт опускаемся вниз за счет действия листовых подушечек первого порядка.
Б. Поперечный срез листовой подушечки первого порядка; паренхима на ее
нижней (абаксиальной) стороне сокращена под действием стимуляции. В. По-
перечный срез черешка выше листовой подушечки. На рис. Б я В адаксиальная
(верхняя) сторона листа находится вверху. Г. Поперечный срез через рахис
сложного листа и через два листочка, находящихся в «сложенном» состоянии.
Д. Продольный срез через листовую подушечку третьего порядка в стимулиро-
ванном состоянии: адаксиальная сторона (слева) сокращена. (Рис. Б и В вос-
производятся из работы Esau, Ann. Bot., 34, 505—515, 1970.) 7—-рахис сложного
листа; 2— листовые подушечки третьего порядка; 3 — листовые подушечки вто-
рого порядка; 4 — черешок; 5— листовые подушечки первого порядка.
Фото 118. Поперечный срез листа Carex, имеющего воздушные полости, которые содержат крупные тонкостенные клетки
без хлоропластов. (Препарат предоставлен J. Sass.) 1 — продолжение обкладки пучка; 2 — протоксилемная лакуна; 3— об-
кладка пучка; 4 — устьице; 5 — флоэма.
Фото 119. Поперечные срезы листьев злаков. А, Б. Сахарный тростник (Saccha-
гит), имеющий структуру, характерную для С4-фотосинтетического цикла. В.
Овес (Avena) имеет С3-цикд. Двойная обкладка пучков такая же, как у пшени-
цы (фото 120, Д В). Пространственные связи между мезофиллом и проводящи-
ми пучками у сахарного тростника выражены более отчетливо, чем у овса. (Пре-
параты предоставлены J. Sass.) 1 — пузыревидные клетки; 2— обкладка пучков;
3 — Флоэма: 4 — мезофилл: 5-—ксилема- 6 — склрпрнхимя
ОД ММ
Фото 120. Поперечные срезы листьев злаков. Д. С4-растение Zea mays. Пластиды
в обкладке пучков более крупные, чем в мезофилле. Они локализованы вблизи
стенки, наиболее удаленной от проводящих тканей. Б, В. Сз-растение Triticum,
имеющее мелкие (В) и крупные (В) жилки. Пучковые обкладки две, внутренняя
более мелкоклетная, чем наружная. В наружной обкладке содержится неболь-
шое число мелких хлоропластов. 1 — обкладка пучков; 2— склеренхима; 3—
внутренняя обкладка пучков.
Фото 121. Электронная микрофотография с поперечного среза листа С4-растения
Cynodon dac^ylon [3]. Отчетливо выраженная наружная обкладка имеет много
хлоропластов', значительно более крупных, чем хлоропласты мезофилла. Хлоро-
пласты сосредоточены вблизи стенки, общей с внутренней обкладкой. Межклет-
ники встречаются и между самими обкладками, и между внутренней обкладкой
и проводящим пучком. 1 — мезофилл; 2— внутренняя обкладка пучка; 3— кси-
лема; 4 — наружная обкладка пучка; 5 — флоэма; 6 — межклетник.
Фото 122. Микрофотографии тканей, изолированных из листьев С^злаков, еде-
ланные на сканирующем электронном микроскопе [4]. А. Обкладки пучков с
заключенными внутри них проводящими тканями из листа Pennisetum purpureum.
Б. Одинарная пучковая обкладка с заключенными внутри нее проводящими тка-
нями из листа росички Digitaria decumbens. В. Жилка листа свинороя Cynodon
dactylon с мезофиллом, сохраняющим связь с обкладкой, внутри которой нахо-
дится проводящая ткань.
Фото 123. Структура листа сосны Pinas monophylla. А. Поперечный срез целой
хвоинки. Б. Продольный срез через мезофилл и трансфузионную ткань. В. По-
перечный срез части проводящего пучка, трансфузионной ткани и эндодермы.
Кружочки, которые видны в клетках трансфузионной ткани, являются окаймлен-
ными порами трахеид, / —гиподерма; 2 — смоляной ход; 3— мезофилл; 4 — эн-
додерма; 5 — трансфузионная ткань; 6 — флоэма; 7 — устьице; 8 — ксилема; 9 —
альбуминовые клетки.
Фото 124. Поперечные срезы листьев хвойных. А. Сосна
Pinus nigra. Б. Лиственница (Larix). В. Тис Taxus cana-
densis, Г. Пихта (Abies), /—-трансфузионная ткань; 2 —
смоляной ход.
Фото 125. Поперечные срезы листьев нехвойных голосемен-
ных. А. Саговник Cycas revoluta. Б. Гинкго Ginkgo biloba.
1 — метаксилема; 2— устьице; 3 — трахеиды трансфузион-
ной ткани; 4 — протоксилема; 5 — слизевой ход.
Фото 126. Поперечные срезы лепестка розы (А) и лепестка (Б) и чашелистика
(В) Cassiope. (Препарат А предоставлен А. Т. Guard, а препараты Б и В —
В. F. Palser.)
Фото 127. Цветок Prunus virginiana на поперечном (Д) и продольном (5) срезах. Цветочная чаша (гипантий), выступаю-
щая над завязью, не объединена с ней. Цветок околопестичный. Единственный плодолистик окружает два семязачатка. Ты-
чинки заполняют гипантий, так как цветок еще не раскрылся. 1—проводящий пучок; 2 — плацента; 3 —- рыльце; 4 — венчик;
5 — чашечка; 6 — тычиночная нить; 7 — пыльник; 8 — столбик, 9 — семязачаток; 10 — завязь; 11— гипантий.
Фото 128. Микрофотографии рыльца капусты листовой (Brassica oleracea), полученные с помощью сканирующего электрон-
ного микроскопа. Л. Незрелое рыльце из бутона длиной 5 мм; папиллы тесно прижаты друг к другу. Б. Зрелые папиллы
имеют вздутые основания; с одной из паппилл связана трубка пыльцевого зерна [47]. (Фотографии были сделаны на Лонг-
Эштонской научно-исследовательской станции в Бристоле и предоставлены д-ромW. Е. Thomas.) 1 — пыльцевое зерно.
Фото 129. Ранние стадии развития цветка львиного зева (Antirrhinum; продоль-
ные срезы). А. Вегетативный (вверху) и флоральные (справа и слева под, веге-
тативным) апексы. Б. Цветок с чашелистиками и примордиями лепестков (ле-
пестки закладываются как обособленные единицы, но затем вследствие интер-
калярного роста их оснований образуется сростнолепестный венчик). В. Разрез
цветка в плоскости, открывающей примордии тычинок. Г. Цветок с гинецеем;
массивные плаценты окружены плодолистиками, которые еще не удлинились с
образованием столбика. (Схему, изображающую часть молодого столбика, см. на
рис. 20.3, Б.) / — лист; 2—чашелистики; 3— лепесток; 4 — чашелистик; 5 — ты-
чинка; 6~ завязь; 7 — венчик; 8— плаценты.
Фото 130. Вегетативный апекс побега (А) и часть флорального апекса (Б) у подсолнечника (Helianthus annuus). (А —
из работы Esau, Amer. J. Bot., 32, 18—29, 1945; Б — препарат, предоставленный А. Т. Guard.) 1 — апекс; 2 — колончатая
меристема; 3 — примордии цветков.
Фото 131. Развитие цветка Butomus umbellatus (вид в плане частично отпрепари-
рованных цветков). А. Целый цветок. Б. Зрелый гинецей. В—Е. Стадии развития
последовательно возникающих частей цветка, включая закладку плодолистиков.
Ж, 3. Две последовательные стадии развития плодолистика [55]. (Воспроизво-
дится с разрешения Национального совета научных исследований Канады и Ca-
nadian Journal of Botany, 52, 223—230, 1974.) / — наружный листочек около-
цветника; 2 —внутренний листочек околоцветника; 3— тычинка; 4 — рыльце;
5 — плодолистик; 6 — плодолистик наружной мутовки; 7 — плодолистик внутрен-
ней мутовки; 8 — флоральный апекс.
Фото 132. Закладка цветков у злаков. А—Г. Пшеница (Triticum) [3]. А. Веге-
тативный апекс с листодыми примордиями, несколько удлиненный перед заклад-
кой колоса. Б. Молодой колос с двойными валиками, состоящими из примордия
колоска и примордия кроющего листа. В. Колос с колосками, развивающими
первые примордии цветков. Г. Часть колоса с колосками, имеющими по несколь-
ку цветков. Д. Продольный разрез апекса побега Bromus на стадии перехода к
цветению; закладка ветвей метелки. (Sass, Skogman, Iowa State Coll. J. Sci.,
25, 513—519, 1951.) 1 — примордий листа; 2— примордий колоска; 3 — двойной
валик; 4— примордий цветка; 5 — верхняя цветковая чешуя; 6 — тычинки; 7 —
плодолистик; 8 — нижняя цветковая чешуя; 9 — колосковая чешуя; 10 — лист;
11—прицветники; 12 — ветви метелки.
Фото 133. Цветки Сурегасеае (А) и Роасеае (Б— Ж). А. Колосок Scirpus со спи-
ральным расположением чешуй и примордиев цветков; гинецей еще открыт, се-
мязачатки обнажены [4]. Б, Г, Д. Цветки овса (Avena) с гинецеем на трех ста-
диях развития [9]. В. Часть цветка пшеницы (Triticum) с молодым гинецеем
[8]. Е, Ж. Части колосьев пшеницы с колосками. (Фото предоставлены
О. Т. Bonnett.) Е— вид сбоку, Ж — вид с абаксиальной стороны (верхняя часть
рисунка). 1 — семязачаток; 2 — тычинка; 3 — гинецей; 4—столбик; 5— лодику-
ла; 6,— волоски рыльца; 7 — пустая колосковая чешуя; 8 ~ цветок; 9 — колосок.
Рт,с. 134. Электронная микрофотография двухклеточного пыльцевого зерна Мо-
notropa uniflora [41]. Генеративное ядро и окружающая его цитоплазма (гене-
ративная клетка) отграничены оболочкой, связанной с интиной пыльцевого зер-
на, Вегетативная клетка частично окружает генеративную. 1 — вегетативное яд-
ро; 2 — апертура; 5 —интина; 4—экзина; 5 — клеточная оболочка; 5 — гене-
ративное ядро; 7 — скопление цистерн ЭР.
Фото 135. Электронная микрофотография клеток спермиев и вегетативного ядра
из трехклеточного пыльцевого зерна сахарной свеклы (Beta vulgaris') [29]. Спер-
мин располагаются под прямым углом друг к другу. Они ограничены двумя
мембранами, интерпретируемыми как плазмалеммы, из которых наружная про-
исходит из вегетативной клетки, а внутренняя — из клетки спермия. 1 — вегета-
тивное ядро; 2 — клетка спермия.
Фото 136. Поперечный срез плода огурца Cucumis satiuus. Семена еще не созре-
ли. Стенка плода отграничена от плацент эпидермальными слоями, которые при-
сутствуют также между краями плодолистиков. В центре эти слои сходятся. Об-
ращенные латеральные пучки соседних плодолистиков объединены. 1 — перего-
родка; 2— плацента; 3 — семязачаток; 4 — эпидермальные слои; 5 — стенка пло-
да; 5 — проводящие пучки (биколлатеральные); 7 — объединенные латеральные
пучки (коллатеральные).
Фото 137. Микрофотография поперечного среза молодого плода Pyrus. Обозначе-
ния даны в соответствии с аппендикулярной теорией происхождения внеплодо-
листиковой ткани. Каменистые клетки в начальной стадии дифференциации. 1 —
проводящий пучок лепестка; 2 —пучок чашелистика; 3— срединный плодолисти-
ковый пучок; 4 перегородка; 5 — латеральный плодолистиковый пучок; 6 —
семязачаток.
Фото 138. Поперечные срезы семенной кожуры и частей зародыша. A. Cucurbita.
Б. Glycine. (Препарат предоставлен А. Т. Guard.) 1 — разрушенная эпидерма;
2— гиподерма; 3— склеренхима; 4 — паренхима; 5 — хлоренхима; 6 — нуцеллус
и эндосперм; 7 —семядоля; 8 — палисадный слой; 9 — субэпидермальный слой;
10 — эндосперм.
Фото 139. Поперечные срезы семенной кожуры Phaseolus. Две стадии дифферен-
циации. А. Молодое семя. Б. Почти зрелое семя. В. Зона рубчика в том же се-
мени, что и на фото Б. 1 — протодерма; 2 — палисадный слой; 3 —- субэпидер-
мальный слой; 4 —ветвистые клетки; 5— ткань фуникулуса; 6 — палисадные
слои; 7 — трахеиды.
Фото 140. Зародыши Triticum (Д) и Zea (Б) (Роасеа); оба среза сделаны в пло-
скости, близкой к медианной. Некоторые ткани зерновки и эпибласт показаны
только на рис. А. Первый узел является узлом щитка. 1 — алейроновый слой;
2 — крахмалистый эндосперм; 3 — щиток; 4 — колеоптиль; 5—апекс побега; 6 —
эпибласт; 7 — первый узел; 8— корешок; 9 — колеориза.
56 ММЛ
Фото 141. Зародыш Capsella bursa-pastoris на нескольких стадиях развития, показанный на продольных срезах семязачатков.
А. Апикальный ярус, из которого развивается собственно зародыш, содержит менее вакуолизированные клетки, чем сус-
пензор. Б. Глобулярный зародыш с эмбриональной протодермой; самая верхняя клетка суспензора представляет собой гипо-
физу. В. Глобулярный зародыш с протодермой и прокамбием; из гипофизы образовались два яруса производных клеток.
Г. Зародыш на ранней стадии развития, принявший сердцевидную форму, ниже протодермы в местах закладки семядолей
произошли антиклинальные деления. Д. Зародыш с частично развитыми семядолями, / — апикальный ярус; 2 — суспензор;
3 — протодерма; 4 — гипофиза; 5 — эндотелий; 6 — прокамбий; 7 — производные гипофизы; 8 — базальная клетка суспензо-
ра; 9 — семядоли.
Фото 142. Зародыш Capsella bursa-pastoris на нескольких стадиях развития, по-
казанный на продольных (А, Б, Г) и поперечном (В) срезах. Срезы через весь
семязачаток (А, Б) и семя (В, Г). А. Зародыш в глобулярной стадии, эндосперм
в свободноядерной стадии; под наружным интегументом находится внутренний
интегумент с эндотелием, примыкающим к зародышевому мешку. Б. Зародыш
на стадии изгибающихся семядолей; клеточный эндосперм. В, Г. Зрелый заро-
дыш; эндосперм сильно редуцирован. 1 — наружный интегумент; 2-—ядерный
эндосперм; 3 — эндотелий; 4 — апикальная меристема; 5 — фуникулус; 6 — ну-
целлярная ткань; 7 — базальная клетка суспензора; 8 — эндосперм; 9 — корешок;
10 — семядоля; // — прокамбий; 12 — клеточный эндосперм.
Фото 143. Зрелый зародыш лука Allium сера. А. Срединная часть зародыша с за-
ключенным в семядолю эпикотилем, срезанным через его первый лист. Б. Зрелый
зародыш в семени на продольном срезе. (Esau, Plant Anatomy, 2nd ed. John Wi-
ley and Sons, 1965.) 1 — прокамбий; 2 — влагалище семядоли; 3 — первый лист
эпикотиля; 4 — эндосперм; 5 — семенная кожура; 6 —семядоля; 7 — нуцеллус;
8 — гипокотиль; 9 — кончик корня; 10—апекс побега.
Фото 144. Зародыш кукурузы Zea mays на нескольких стадиях развития. Мате-
риал собран через 5 (А), 10 (5) и 15 (В, Г) дней после опыления. (С любезного
разрешения J. Е. Sass; фото Д воспроизводится из работы J. Е. Sass, Botanical
Microtechnique, 3rd ed. The Jowa State College Press, 1958.) 1 — щиток; 2 — сус-
пензор; 3 — колеоптиль; 4 — первый лист.
Фото 145. Продольные срезы зиготы (А, Б; размер детали 50X70 мкм) и пяти-
клеточного зародыша (В) ячменя (Hordeum vulgare), показывающие их ультра-
структуру. Клетки на рис. В обозначены цифрами 1—5. Срезы клеток 1, 2 к 4
находятся на довольно значительном расстоянии от медианной плоскости. Клетки
содержат многочисленные вакуоли, в пластидах видны крахмальные зерна. На-
конечники стрелок на рис. В указывают положение стенки между клетками сус-
пензора 4 и 5 [26]. 6 — ядро зиготы; 7 — внутренние тонкостенные клетки нуцел-
луса; 8 — пыльцевая трубка; 9 — зигота; 10 — содержимое пыльцевой трубки;
11 — эпидерма нуцеллуса; 12— дегенерированная синергида.
Фото 146. Ультраструктура зародышей ячменя Hordeum vulgare, состоящих из
13 (Л) и 20 (5) клеток (продольные срезы). Размеры зародыша: А—45Х
Х84 мкм; £ — 44X82 мкм. Клетки 9 и 10 на фото А находятся в профазе. Ва-
куолизация менее выражена, и распределение органелл более равномерное, чем
в зиготе. Обнаруживается неправильное расположение клеток и нечеткое отгра-
ничение зоны суспензора [26]. I —октант; 2— суспензор; 9—13 — клетки.
ОГЛАВЛЕНИЕ
Глава 14. Корень: первичная форма роста 229
Типы корней 229
Контрактильные корни 230
Микориза 230
Корневые клубеньки 231
Первичная структура 232
Эпидерма 232
Первичная кора 233
Центральный цилиндр 237
Корневой чехлик 238
Развитие 242
Апикальная меристема 242
Рост кончика корня 247
Первичная дифференциация 248
Эпидерма 249
Боковые корни 252
Почки на корнях 254
Список литературы 254
Глава 15. Корень: вторичная форма роста и придаточные корни 258
Обычный тип вторичного роста 258
Травянистые двудольные 260
Древесные виды 261
Вариации во вторичном росте 263
Запасающие корни 263
Физиологические аспекты вторичного роста в корнях 264
Придаточные (адвентивные) корни 265
Список литературы 268
Глава 16. Стебель: первичная форма роста 270
Внешняя морфология 270
Первичная структура 270
Эпидерма 271
Первичная кора и сердцевина 271
Проводящая система 272
Развитие 286
Верхушка побега 286
Происхождение листьев 295
Происхождение веток 298
Первичный рост стебля 299
Дифференциация проводящей системы 303
Список литературы 307
Глава 17. Стебель: вторичная форма роста и типы структуры 310
Вторичный рост 310
Закладка и распространение камбия 310
Влияние вторичного роста на ранее сформированные ткани 312
Типы стеблей 316
Хвойные 316
Древесные двудольные 317
Травянистые двудольные 317
Двудольные растения — лианы 319
Двудольные с аномальным вторичным ростом стебля 321
Однодольные 323
Список литературы 325
Глава 18. Лист: общая организация и развитие 327
Морфология 327
Гистология листа покрытосеменных. 327
Эпидерма 327
Мезофилл 328
Проводящая система 329
Развитие 335
Закладка листовых примордиев 335
Рост в длину и ширину 335
Рост пластинки 343
Вариации в закономерностях развития 344
Дифференциация мезофилла 348
Развитие проводящих тканей 349
Опадение листьев 351
Список литературы 352
Глава 19. Лист: разнообразие структуры 355
Структура листа и окружающая среда 355
Ксероморфизм 355
Морфология листа в связи с положением на растении 359
Листья двудольных 360
Вариации структуры мезофилла 360
Опорная ткань 363
Черешок 363
Листья однодольных 364
Листья злаков 365
Структура листьев злаков и тип фотосинтеза 368
Листья голосеменных 370
Список литературы 373
Глава 20. Цветок: строение и развитие 376
Общее представление 376
Строение 377
Цветок, части цветка и их расположение 377
Чашелистик и лепесток 378
Тычинка 379
Гинецей 381
Проводящая система 389
Развитие 391
Индукция цветения 392
Флоральная меристема 393
Происхождение и развитие частей цветка 394
Список литературы 399
Глава 21. Цветок: репродуктивный цикл 402
Микроспорогенез 402
Микроспорангий и микроспоры 402
Слои стенки микроспорангия 405
Пыльца 408
Мужской гаметофит 411
Г аметогенез 411
Пыльцевая трубка 414
Мегаспорогенез 415
Семязачаток 415
Мегаспоры 418
Женский гаметофит 418
Оплодотворение 423
Зигота 425
Список литературы 426
Глава 22. Плод 429
Общее представление и классификация 429
Стенка плода 431
Типы плодов 432
Сухой плод 432
Сочный плод 441
Рост плодов 451
Опадение плодов 454
Список литературы 455
Глава 23. Семя 458
Общее представление и морфология 458
Развитие семени 461
Семенная кожура 463
Ricinus 464
Brassica и Sinapis 466
Cucurbita 467
Glycine и Phaseolus 468
Запасающие ткани 470
Углеводы 472
Белки 474
Липиды 475
Список литературы 475
Глава 24. Зародыш и проросток 478
Зрелый зародыш 478
Развитие зародыша 482
Классификация зародышей 489
Проросток 491
Прорастание семени и формирование проростка 491
Зона перехода 498
Список литературы 500
Словарь терминов 503
Указатель латинских названий 542
Предметный указатель
547