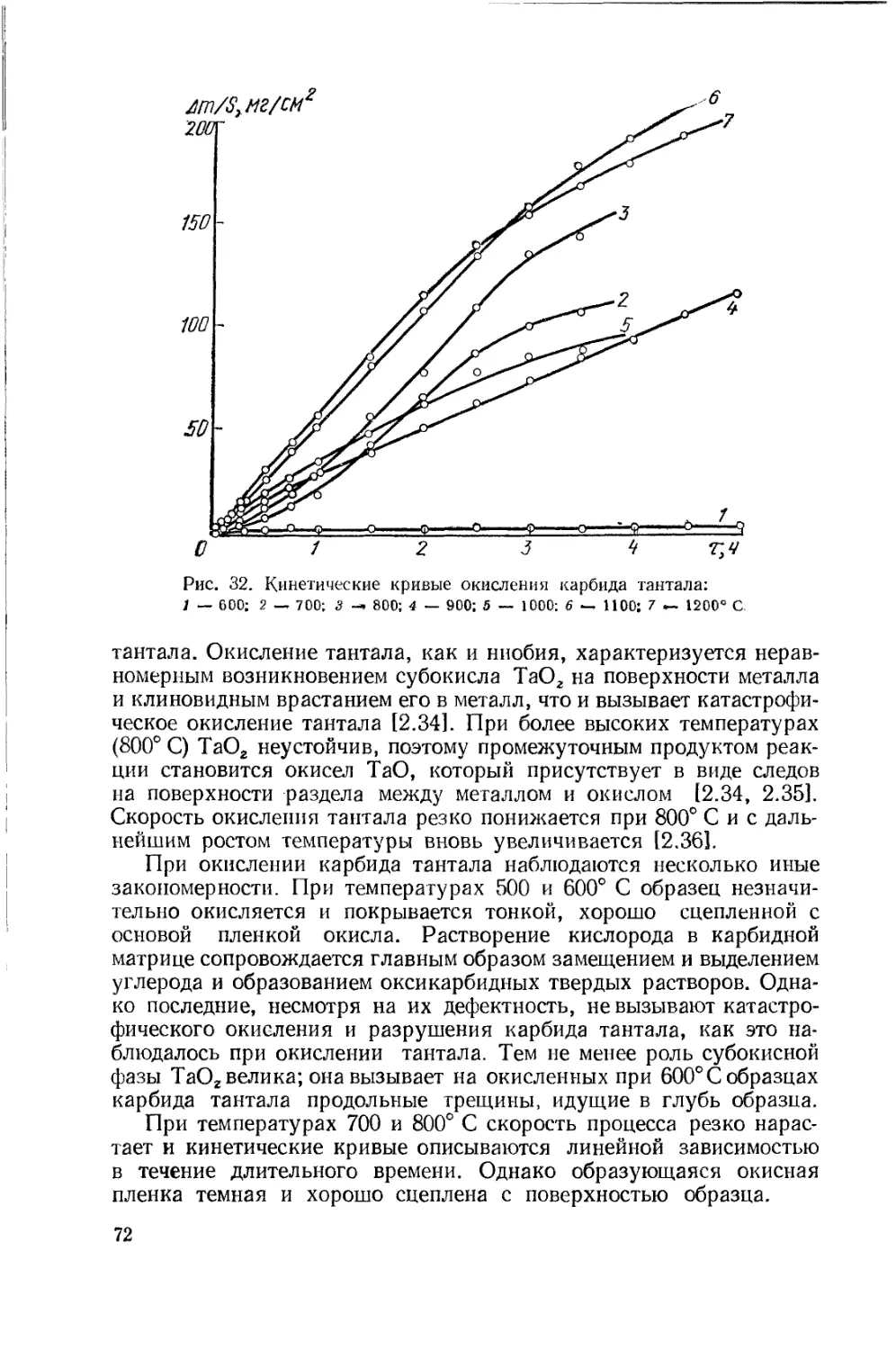
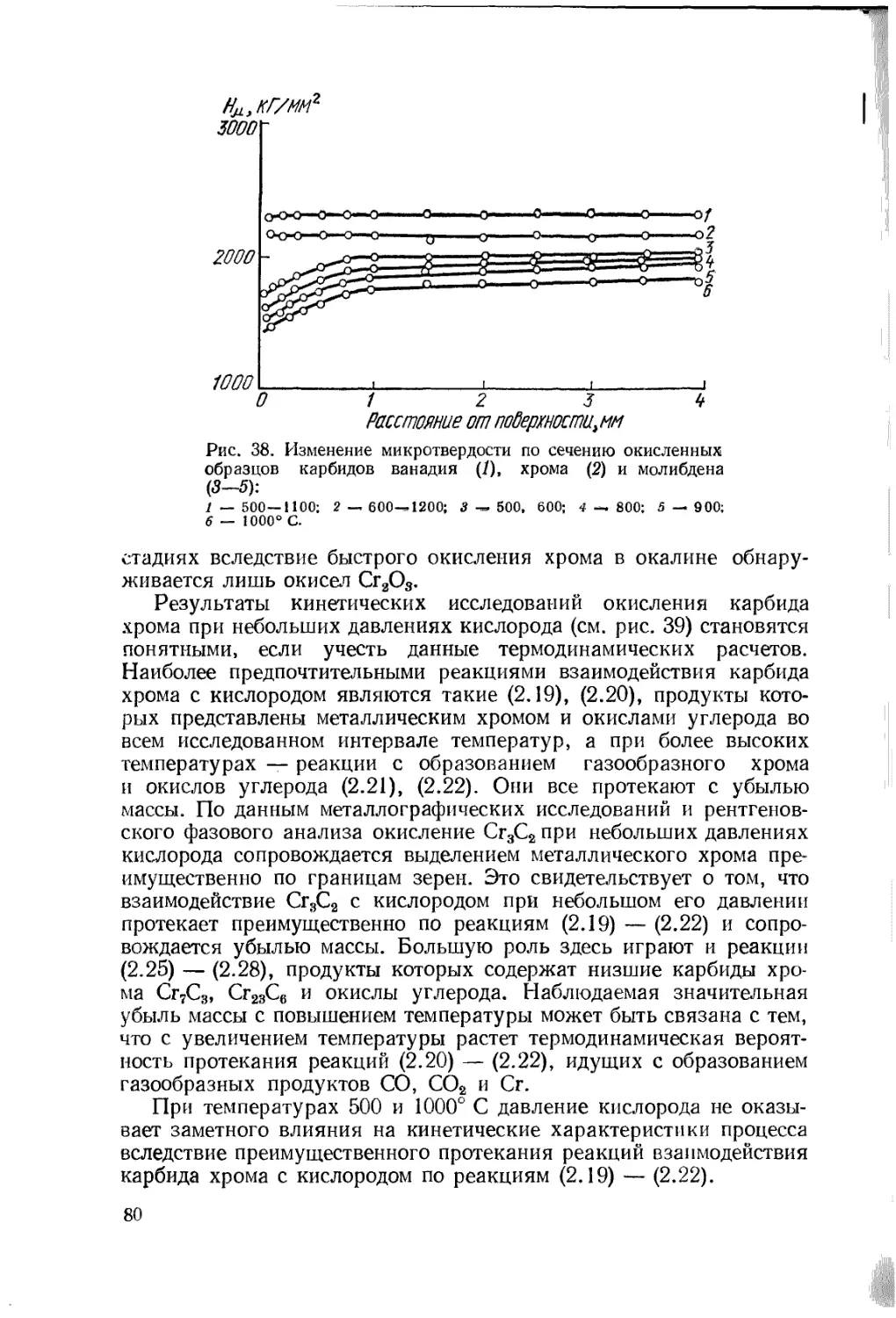
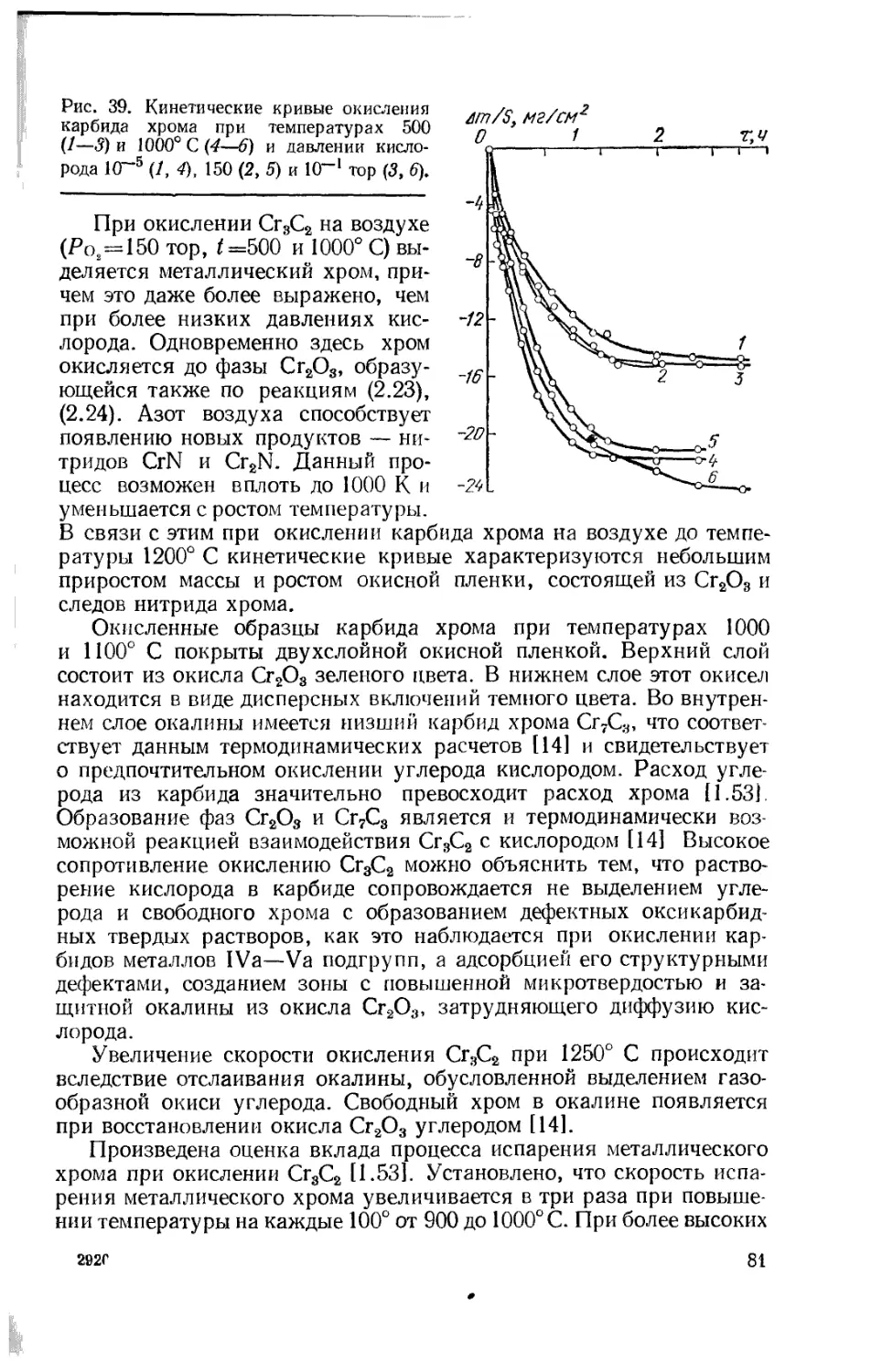
Text
kHlvliinillS
КШВДОВ
I ЩТРВДОВ
АКАДЕМИЯ НАУК УКРАИЕКЖОИ ССР
ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ
ИНСТИТУТ ПРОБЛЕМ МАТЕРИАЛОВЕДЕНИЯ
Р. Ф. Войтович
ОКИСЛЕНИЕ
КАРБИДОВ
II НИТРИДОВ
КИЕВ «НАУКОВА ДУМКА» 1981
УДК 661.8:001.55:661.665.1
Окисление карбидов и нитридов / Войтович Р. Ф.— Киев :
Наук, думка, 1981.— 192 с.
В монографии представлены результаты исследования
высокотемпературного окисления карбидов и нитридов переходных
металлов IV—VI групп, карбида бора, неметаллических
нитридов (BN, A1N, Si3N4) в различных средах в области температур
400—1200° С. Рассмотрены особенности механизма процессов
взаимодействия этих соединений с кислородом. Установлено,
что окисление карбидов и нитридов металлов IVa—Va подгрупп
сопровождается выделением соответствующего металла и
неметалла, а карбидов металлов Via подгруппы —
предпочтительным окислением углерода и образованием низких карбидов
данного металла. Показано, что выделение металлов и неметаллов
а процессе окисления карбидов и нитридов сопровождается
уменьшением микротвердости поверхностных зон оксикарбидных и
оксинитридных твердых растворов. Обсуждается влияние
углерода и азота на морфологические особенности и фазовый состав
окалины, стабилизацию окисных фаз, спекание окалины.
Рассчитана на научных работников, металловедов,
технологов, работников заводских лабораторий, преподавателей вузов,
аспирантов и студентов соответствующих специальностей.
Ил. 74. Табл. 19. Библиогр. в конце глав.
Ответственный редактор Т. Я. Косолапова
Рецензенты В. В. Фесенко, М. Д. Смолин
I с мкцпи химической литературы
"11.,0.|-2Г»(1 /—\
"м-.м(и4).нГис'8' шттт) ©Шдатгльстио «Наукова думка», 1981
ВВЕДЕНИЕ
В последние годы значительно возрос интерес к карбидам и нитри-
д.ш переходных металлов и материалам на их основе, обладающим
цепными физико-химическими свойствами. Карбиды и нитриды
переходных металлов нашли широкое применение в различных
областях современной техники. Карбиды металлов IVa—Via
подгрупп составляют основу всех современных твердых сплавов,
используемых при изготовлении режущих инструментов и износо-
сюпких деталей, работающих в вакууме и окислительных средах.
Карбиды и нитриды нашли широкое применение и в качестве
дисперсно-упрочненных фаз при разработке дисперсно-упрочненных
силапоп.
В настоящее время опубликованы монографии и справочники,
и которых рассмотрены данные о физических и физико-химических
свойствах карбидов и нитридов 11—20]. Тем не менее такие важные
физико-химические характеристики, как сопротивление их
окислению и особенности поведения в окислительных средах при высоких
температурах, не приводятся; имеются лишь отдельные данные
.> стойкости против окисления некоторых карбидов и нитридов.
Между тем актуальность проблемы изучения процессов окисления
карбидов и нитридов и необходимость детальных сведений о пове-
цении их в окислительных средах совершенно очевидны. В работах
j 18,19] сделана попытка систематизировать сведения о кинетических
характеристиках процесса окисления карбидов, нитридов, боридов
и силицидов.
Карбиды и нитриды очень чувствительны к примесям кислорода.
Как известно, кислород является наиболее трудно устраняемой
и одной из наиболее сложно определяемой примесью. Даже в
незначительных количествах он существенно влияет на различные
физико-химические свойства карбидов и нитридов и материалов
на их основе. С карбидами и нитридами металлов IVa—Va подгрупп
кислород образует оксикарбидные и оксинитридные твердые
растворы [12] МеСхОй и MeNj.0^ и оказывает влияние на дефектность
их решетки.
Исключительная сложность процесса взаимодействия карбидов
и нитридов с кислородом и многообразие факторов, влияющих
3
на особенности его протекания, служат причиной того, что
имеющиеся в литературе сведения об окислении карбидов и нитридов
немногочисленны и противоречивы.
Использование высокопористых образцов карбидов и нитридов
или порошкообразных препаратов вследствие мгновенного
окисления или сгорания выделяющегося из их решетки металла в
процессе растворения кислорода создало определенные трудности в оценке
механизма окисления и формирования фаз переменного состава
(оксикарбидов и оксинитридов) и влияния этого процесса на
структуру диффузионной зоны и фазовый состав окалины. Достаточно
отметить, что применение порошкообразных препаратов и
высокопористых образцов не позволило провести металлографические
исследования окалины, границы окалина — карбид (нитрид)
и поверхностной зоны твердых растворов и рассмотреть цвет
образующихся оксикарбидных и оксннитридных фаз, их изменение
по глубине поверхностной зоны в процессе окисления и с ростом
температуры. Это исключает также возможность определения
изменения механических свойств поверхностных зон оксикарбидных
и оксинитридных твердых растворов в процессе растворения
кислорода в зависимости от толщины зоны, температуры и времени
окисления.
Между тем выяснение влияния примесей кислорода на
механические характеристики поверхностных зон окисления карбидов
и нитридов представляет большой интерес для оценки условий
возможного использования указанных соединений и материалов
на их основе для работы при высоких температурах на воздухе
и в среде кислорода и приобретает исключительно важное значение
в связи с широким использованием карбидов и нитридов в качестве
дисперсных частиц при разработке дисперсно-упрочненных
сплавов на осниве тугоплавких металлов. Все это привело к
необходимости проведения систематического изучения процесса
высокотемпературного окисления компактных беспористых образцов
карбидов и нитридов переходных металлов IVa—Va подгрупп в
интервале температур 400—1200° С и длительном времени окисления.
При исследовании использовались термодинамический,
кинетический, рентгенографический, электронно-микроскопический,
металлографический методы анализа и измерения микротвердости.
Следует отметить, что значительный интерес представляют
сведения об особенностях поведения в окислительных средах
компактных беспористых образцов карбидов и нитридов, широко
используемых в технике.
Совместное рассмотрение данных о поведении карбидов и
нитридов в окислительных средах оправдано подобием их структур
и свойств. Среди соединений, образуемых атомами переходных
металлов и легких элементов (Н, В, С, N и О), только карбиды и
нитриды имеют близкие по типам связи, кристаллические структуры,
фазовые соотношения, электрические и магнитные свойства.
Кристаллические структуры соединений переходных металлов с азотом
4
и углеродом можно охарактеризовать как гаютнейшие (или близкие
к ним) упаковки металлических атомов, в междоузлиях которых
внедрены небольшие атомы неметаллов.
Такое сходство между карбидами и нитридами переходных
металлов объясняется подобием их электронной структуры,
размеров и электроотрицательности атомов углерода и азота. Этого не
наблюдается в случае боридов переходных металлов, в структуре
которых существуют четко выраженные локализованные связи
между атомами бора в виде цепочек, слоев или трехмерных
каркасов, что обусловливает определенную геометрию структуры [6].
Действительно, при изучении высокотемпературного окисления
карбидов и нитридов переходных металлов IVa—Va подгрупп на
воздухе, в вакууме и среде кислорода установлено, что механизм
поведения их в перечисленных средах довольно однотипен.
Окисление их сопровождается в первую очередь растворением кислорода
п выделением соответствующего металла и неметалла (С, N2) с
последующим образованием слоев окисных пленок, что указывает на
образование вакансий в металлической и металлоидной подрешет-
K.ix оксикарбидных и оксинитридных твердых растворов. Такие
результаты становятся понятными, если учесть гетеродесмичность
связей, характерную для тугоплавких соединений металлов IVa—
Va подгрупп [21—25].
В карбидах и нитридах металлов IVa—Va подгрупп заметный
вклад в энергию кристалла вносят взаимодействия Me—Me и Me—X
121—2131. А гоми неметалла (С, N, О) экранируют Me—Ме-связи
и гем сильнее, чем нише их элсктроотрпцательность,
существеннее перекрин.шпе г/.-орбигалеп атомов металла и больше
электроном, участвующих в Me—Ме-связи. В условиях сохранения
структуры типа NaCl перевод энергетически невыгодных экранированных
взаимодействий Me—Me в неэкранированные приводит к
образованию вакансий, число которых растет с увеличением степени
экранирования [1.70].
Электронно-микроскопическое и рентгенографическое изучение
процесса окисления плавленных и компактных беспористых
образцов позволило установить особенности выделения и
распределения в процессе растворения кислорода не только неметаллов
(углерода и азота), но и соответствующих металлов, а также
определить размеры и плотность металлических частиц в зависимости
от давления кислорода, температуры и времени окисления.
Показано, что с ростом температуры и давления кислорода количество
металлических частиц увеличивается, намечается их коагуляция
и быстрее протекает процесс их перехода в субокислы. На отдельных
зернах карбидов количество частиц металлов различно.
Выделение в процессе растворения кислорода в карбидах и
нитридах соответствующего металла и неметалла, обусловленное
образованием дефектов в обеих подрешетках оксикарбидных и
оксинитридных твердых растворов, определяет интересные
особенности протекания процесса. Так, при окислении карбидов
5
и нитридов в среде кислорода при малых парциальных давлениях
кислорода наблюдается испарение металла при сравнительно
невысоких температурах с образованием металлического зеркала
на поверхности кварцевого тигля. Испарение металла в
поверхностный слой протекает при сравнительно низких температурах
(1000° С, Р — Ю-5 -ч- 1СП4 тор) и не связано с затратой энергии
на разрыв связи Me—С, как это имеет место при испарении
карбидов (нитридов) при больших температурах в высоком вакууме,
а вызвано более легко протекающим выделением в поверхностный
слой металла, освобождающегося в процессе замещения углерода
(азота) кислородом.
Использование компактных беспористых карбидов и нитридов
позволило впервые провести электронно-микроскопическое и
металлографическое исследование поверхности окисленных в
кислороде и на воздухе образцов, слоя окалины, границы окалина —
карбид (нитрид), а также измерить микротвердость поверхностных
зон оксикарбидных и оксинитридных твердых растворов и
рассмотреть их цвет.
Выделение металла и неметалла (С, N2) при окислении карбидов
и нитридов металлов IVa—Va подгрупп, обусловленное
образованием вакансий в обеих подрешетках оксикарбидных и
оксинитридных твердых растворов, существенно влияет на механические
характеристики окисленных образцов карбидов и нитридов. Микротвердость
поверхностных диффузионных зон оксикарбидных и оксинитридных
твердых растворов, как правило, резко снижается в направлении
границы карбид (нитрид) — кислород, где содержание
растворенного кислорода выше. Это указывает на ухудшение механических'
свойств в процессе эксплуатации изделий и материалов на основе
карбидов и нитридов в окислительных средах. В этом случае даже
при низкотемпературном окислении, но длительной эксплуатации
постепенное внедрение кислорода в решетку карбидов и нитридов
может привести к значительному их разупрочнению.
Изучение вопросов химических и структурных изменений,
происходящих в карбидах в вакууме при высоких температурах,
имеет практическое и теоретическое значение. Карбиды металлов
IVa—Via подгрупп используются, в частности, в качестве
покрытий, нагревателей и других элементов электротехнического
назначения, оборудования, работающего в условиях вакуума при
высоких температурах. Однако в последнем случае происходит окисление
этих материалов остаточной средой.
Проведенные исследования показали, что поведение карбидов
и нитридов металлов IVa—Va подгрупп в вакууме 10~°—1(Р3 тор
даже при сравнительно невысоких температурах (500—700° С)
нельзя рассматривать как простой нейтральный отжиг. И здесь
имеет место внедрение кислорода (азота) в решетку карбидоБ и
нитридов, сопровождающееся выделением соответствующего металла
и неметалла (С, N2). Это связано с образованием вакансий в
металлической и неметаллической подрешетках оксикарбидных и ок-
6
синитридных твердых растворов и указывает на необходимость
"оздания более глубокого вакуума в технологических операциях,
язанных с необходимостью отжига и использования изделий
и деталей из карбидов и нитридов. При длительной эксплуатации
в вакууме материалов, содержащих карбиды, могут иметь место
значительные структурные и химические изменения.
Проведенные исследования позволили установить, что при
окислении карбидов металлов Via подгруппы Сг3С2 и WC,
характеризующихся отсутствием области гомогенности, выделения углерода
не наблюдается, а имеет место значительное увеличение их микро-
твердости. Последнее обусловлено тем, что в данном случае
кислород в отличие от карбидов металлов IVa—Va подгрупп не замещает
углерод в решетке карбидов, а происходит, как при окислении
металлов IVa—Va подгрупп, внедрение кислорода в октаэдриче-
ские междоузлия, сопровождающееся увеличением микротвердости.
Таким образом, установленная, как правило, довольно низкая
стойкость против окисления карбидов и нитридов металлов IVa—
Va подгрупп обусловлена не разрыхляющим влиянием
газообразных продуктов реакции (СО, С0.2, N2), выделяющихся в процессе
окисления, а главным образом особенностями процесса их
взаимодействия с кислородом, протекающего с выделением металла и
неметалла.
Проведенные исследования показали крайнюю
чувствительность карбидов и нитридов к незначительным примесям кислорода.
Это ука илпает на необходимость тщательной аттестации карбидов
п нитридов для при шильной оценки нх свойств.
11р(шед1'ипые исследования процессу высокотемпературного
окисления карбидов н нитридов металлов IVa—Va подгрупп позволили
установить механизм процесса их окисления.
Знание механизма процесса окисления карбидов и нитридов
позволяет значительно расширить область их применения,
температурный интервал их эксплуатации, оценить влияние кислорода
пй их коррозионные и механические свойства.
1. Самсонов Г. В., У майский Я- С- Твердые соединения тугоплавких металлов.—
М. : Мплллургиздат, 1957.— 388 с.
2. I onuthumidm X. Дою. Сплавы внедрения : В 2-х т.— М. : Мир, 1971.— Т. 1.
424 с; Т. 2. 4СЗ с.
3. Спюрмс Э. Тугоплавкие карбиды.— М. : Атомиздат, 1970.— 304 с.
4. Самсонов Г. В., Упадхая Г. Ш., Нешпор В. С. Физическое материаловедение
карбидов.— Киев : Наук, думка, 1974.— 454 с.
5. Косолапова Т. Я- Карбиды.— М. : Металлургия, 1968.— 299 с.
(5. Гот Л. Карбиды и нитриды переходных металлов.— М. : Мир, 1974.— 289 с.
7. Самсонов Г. В. Нитриды.— Киев : Наук, думка, 1969.— 378 с.
8. Самсонов Г. В. Неметаллические нитриды.— М. : Металлургия, 1969.— 265 с.
9. Самсонов Г. В., Серебрякова Т. И., Неронов В. А. Бориды.— М. : Атомиздат,
1975.— 386 с.
10. Самсонов Г. В., Дворина Л. А., Рудъ Б. М. Силициды.— М. : Металлургия,
1979.- 271 с.
11. Гелъд П. В., Сидоренко Ф. А. Силициды переходных металлов четвертого
периода.— М. : Металлургия, 1971.— 584 с.
7
12. Соединения переменного состава / Под ред. Б. Ф. Ормонта.— Л. : Химия,
1969.— 519 с.
13. Самсонов Г. В., Винницкий И. М. Тугоплавкие соединения ; Справочник.—
М. i Металлургия, 1976.— 558 с.
14. Войтович Р. Ф. Тугоплавкие соединения : Термодинам, характеристики.
Справочник.— Киев : Наук, думка, 1973.— 220 с.
15. Болгар А. С, Турчанин А. Г., Фесенко В. В. Термодинамические свойства
карбидов.— Киев : Наук, думка, 1973.— 270 с.
16. Андриевский Р. А., Ланин А. Г., Рымашевский Г. А. Прочность тугоплавких
соединений.— М. : Металлургия, 1974.— 232 с.
17. Андриевский Р. Л., Уманский Я. С. Фазы внедрения.— М. : Наука, 1977.—
240 г.
18. Войтович Р. Ф., Пугач Э. Л. Окисление тугоплавких соединений :
Справочник.— Киев ! Наук, думка, 1968.— 84 с.
19. Войтович Р. Ф., Пугач Э. А. Окисление тугоплавких соединений :
Справочник.— М. : Металлургия, 1978.— 108 с.
20. Straumanis M. Anisotropy single-crystal refractory compaunds.— New York s
Pergamon press, 1968.— 121 p.
21. Гелъд П. В., Цхай В. А. Средние плотности валентных электронов в FeO^,
VOjf и ТЮя.— Журн. структур, химии, 1963, 4, с. 235—244.
22. Цхай В. А., Гелъд П. В. О топографии вакансий в карбидах переходных
металлов IV и V групп со структурой NaCl.— Журн. структур, химии, 1964,
5, с. 576—582.
23. Цхай В. А., Гельд П. В., Швейкин Г. П., Переляев В. А. О некоторых
закономерностях в образовании окислов переходных металлов IVa и Va подгрупп.—
В кн.: Химия высокотемпературных материалов. Л. : Наука, 1967, с. 19—24.
24. Гельд П. В., Цхай В. А., Швейкин Г. П. О природе связей в карбидах
тугоплавких металлов.— Тр. Ин-та химии / АН СССР. Урал. науч. центр, 1967,
вып. 14, с. 5—17.
25. Гельд П. В., Цхай В. А., Швейкин Г. П., Переляев В. А. Влияние Me—Ме-
взаимодействий на структурные и термодинамические свойства карбидов,
нитридов и окислов металлов IVa и Va подгрупп.— Изв. АН СССР. Сер.
Неорган, материалы, 1967, 3, № 10, с. 1835—1841.
■ Глава 1
ДЕФЕКТЫ РЕШЕТКИ
КАРБИДОВ И ОКСИКАРБИДОВ
МЕТАЛЛОВ IVa-Va ПОДГРУПП
За последние годы в литературе появились работы, посвященные
исследованию процесса окисления карбидов металлов IVa—Via
подгрупп на воздухе и в среде кислорода. Тем не менее
систематические исследования этого процесса до настоящего времени не
проведены и механизм взаимодействия карбидов с кислородом
полностью не установлен. Знание структурных характеристик окси-
карбидов металла Via—Va подгрупп сыграло важную роль в
выяснении механизма окисления карбидов [1.1—1.21,1.24—12.7].
Окисление карбида титана изучено более широко, чем окисление
остальных карбидов металлов IVa—Via подгрупп [1.25,1.27—1.40].
Окислению подвергались в основном порошкообразные образцы.
Высказывались различные соображения о механизме процесса
взаимодействия TiC с кислородом, составе окалины, ее защитных
свойствах.
Защитное действие окалины на TiC, согласно [1.281,
обусловлено образованием моноокиси титана, изоморфной карбиду титана.
Изучено окисление плотных (1—2% пор) горячепрессованных
образцов карбида титана в интервале температур 400—1000° С
11.29] и высказано предположение о том, что механизм процесса
окисления состоит в образовании на карбиде в начальной стадии
процесса твердого раствора TiC—TiO с последующим
формированием на более поздней стадии довольно рыхлого слоя из высших
окислов титана. На возможность образования поверхностного
слоя твердого раствора TiC—TiO на начальной стадии окисления
карбида титана указывается в работе [1.33].
Исследовано окисление карбида титана, полученного
осаждением из газовой фазы на пластинки из А1203 в кислороде при
температурах 600—950° С [1.31]. Установлено, что процесс окисления
подчинялся параболлическому закону. Продуктом реакции
является рутил.
В процессе окисления карбида титана при температуре 1000р С
металл и углерод окисляются с одинаковой скоростью [1.32].
Вероятно, углерод, растворенный в рутиле, может изменить
концентрацию дефектов, что приводит к изменению скорости процесса.
9
В работах [1.32, 1.34] высказано предположение, что скорость
окисления карбида титана, так же как и титана, лимитируется
диффузией кислорода через слой окалины из ТЮ2. Промежуточный
слой продуктов реакции, содержащий углерод, был отнесен к
твердому раствору TiC—ТЮ [1.34]. Однако при исследовании горяче-
прессованных пластин из карбида титана [1.32] в окалине
обнаружено два слоя: внешний компактный и внутренний очень пористый.
Наличие внутреннего пористого слоя ставит под сомнение
правомерность допущения об односторонней диффузии кислорода как
стадии, контролирующей скорость окисления карбида титана
П.351.
Исследовано окисление порошкообразного карбида титана в
области температур 600—850° С и монокристаллов TiC при
температурах 900—1000° С и различных давлениях кислорода [1.35].
Экспериментально не доказано, что кислород растворяется в
карбиде титана. Установлено, что кристаллографическая ориентация
не оказывает влияния на скорость процесса. Во всех случаях
единственным продуктом реакции был рутил.
При окислении горячепрессованных образцов карбида титана
в интервале 300—450° С скорость процесса монотонно
увеличивается с ростом температуры, достигая максимума при 450° С, затем
значительно уменьшается с дальнейшим ростом температуры (до
1000° С) [1.37]. Выше температуры 700° С скорость процесса снова
нарастает по параболическому закону. Состав окалины изменялся
с ростом температуры [1.37]. При низких температурах (300—450° С)
образуется плохо сцепленный с карбидной матрицей слой анатаза,
который не является защитным. Скорость окисления описывается
линейным законом скорости. При более высоких температурах
окалина состояла из плотного слоя рутила. Следует, однако, отметить,
что образование анатаза в области низких температур не
связывалось авторами [1.37] со стабилизирующим влиянием углерода,
растворенного в решетке ТЮ2.
Отсутствие правильного подхода к рассмотрению механизма
окисления карбида титана не позволяет правильно оценить роль
углерода в данном процессе. Рассмотрены различные возможности
диффузии углерода к внешней фазовой границе в виде газообразных
компонентов СО или С02 и углерода. Так, наличие углерода в
ТЮ2 позволило [1.32, 1.34, 1.37] высказать предположение о том, что
в процессе окисления карбида титана углерод также диффундирует
через слой рутила и окисляется на внешней фазовой границе. Для
выявления роли углерода в процессе окисления карбида титана
были запрессованы куски монокристаллов рутила в
порошкообразный карбид титана [1.32]. Их нагревали в течение двух дней при
температурах 900 и 1000° С. Кристаллы рутила восстанавливались,
о чем свидетельствовало изменение их цвета, но наличие углерода
не установлено. По мнению авторов [1 351, такие результаты не
могут служить экспериментальным доказательством диффузии
углерода к внешней фазовой границе через слой окалины.
10
В работах [1.39,1.40] изучалась кинетика образования
газообразных и твердых продуктов реакции при окислении карбида титана
в среде кислорода, однако возможность формирования оксикарбид-
ных твердых растворов в процессе окисления не рассматривалась.
При окислении монокристаллов карбида титана [1.35]
образовывался черный, пористый промежуточный слой. Его структура
оказалась аналогичной структуре ТЮ2. Эти данные показывают,
что механизм окисления карбида титана, особенно роль
промежуточного продукта гипотетического состава TiC^O^, тогда еще
Оставался не установленным.
Значительную роль в понимании механизма процесса окисления
карбидов металлов IVa—Va подгрупп, и в частности карбида
титана, имеют работы по синтезу и исследованию структурных
характеристик фаз переменного состава — оксикарбидов металлов
IVa—Va подгрупп [1.1—1.21, 1.24—1.27]. Изучение основных
закономерностей фазовых превращений при окислении карбидов
металлов IVa подгруппы и VC позволило установить, что в
процессе их окисления на различных этапах выделяется углерод и
образуются промежуточные оксикарбидные твердые растворы,
построенные по типу внедрения—замещения, внедрения—вычитания,
замещения—вычитания [1.25—1.27].
Окисление порошкообразных образцов TiC0, 996 и TiCo.es в
интервале температур 310—1100° С начинается с адсорбции
кислорода структурными дефектами решетки [1.25]. Внедрение кислорода
в решетку близкого к стехиометрическому составу карбида титана
сопровождается уменьшением периода элементарной ячейки,
выделением свободного углерода и образованием промежуточного
твердого раствора (оксикарбида титана), построенного по типу
замещения—вычитания. Выделение свободного углерода
наблюдается лишь при достижении определенной температуры,
значительно превышающей температуру его заметного окисления
11.25].
Замещение части углерода кислородом должно приводить
к появлению дополнительных вакансий в обеих подрешетках
(металла и неметалла) образующейся оксикарбидной фазы. Это
реализуется в том случае, если из элементарной ячейки образующейся
фазы будет удаляться в поверхностный слой некоторое
дополнительное количество атомов углерода и титана [1.25]. Полученные в
работах [1.25—1.27] результаты хорошо согласуются с изложенными
представлениями.
Следует, однако, отметить, что использование главным образом
порошкообразных препаратов карбидов способствовало активному
их взаимодействию с кислородом и исключило возможность
определения в продуктах реакции металлических фаз, а также
проведения широких металлографических и электронно-микроскопических
исследований. Такие исследования окисленных беспористых
образцов карбидов переходных металлов IVa—Via подгрупп в среде
кислорода и при небольшом парциальном давлении кислорода
И
позволили нам не только наблюдать в поверхностных слоях
скопления углерода, но и изучить особенности распределения
выделившихся частиц металлов из решетки карбидов.
Исследованию окисления порошкообразного карбида циркония
в среде кислорода посвящено несколько работ [1.25, 1.41, 1.45].
Установлено, что уже в области низких температур (500—650° С)
и давлении 760 тор скорость окисления порошкообразного карбида
циркония описывается линейной зависимостью [1.41]. Изучено
окисление порошкообразного карбида циркония на воздухе, в
кислороде и смесях кислорода с гелием при температурах 450—580° С
и давлении 6,5- 10~5—1 тор [1.45].
Полученные результаты интерпретировались при допущении
двух независимых процессов: диффузии кислорода в решетке ZrC,
протекающей с некоторым замещением углерода, и реакции на
границе фаз ZxCxOy — Zr02. Рассчитанные значения энергии
активации процесса окисления составляли соответственно 53 и
46 ккал/моль. Примеси паров воды к кислороду увеличивали
скорость реакции. Процессы диффузии преобладали на ранних
стадиях окисления, а поверхностные реакции контролировали
скорость на более поздних.
При окислении плавленных образцов карбида циркония в среде
кислорода в интервале температур 1140—2160 К сделано
предположение, что процесс можно описать тремя типами реакционных
схем в зависимости от скорости окисления углерода [1.43]. В
окалине обнаружена фаза Zr02Ky6, стабилизированная атомами
углерода. Образование ее в значительной степени зависит от
температуры, давления кислорода, времени процесса и от количества
углерода, внедренного в решетку Zr02. Отмечено, что при окислении
карбида циркония предпочтительное взаимодействие циркония или
углерода с кислородом не наблюдается. Не исключается
возможность образования фазы ZrOCr„, но вследствие изоструктурности
ее с ZrC доказать это не удалось.
При изучении кинетики окисления порошкообразных образцов
карбида циркония при небольших давлениях кислорода
установлено отсутствие оксикарбидной фазы ZrCAOv ll .44, 1.45]. Окисление
карбида гафния изучено недостаточно [1.25, 1.43]. Так, при
окислении в среде кислорода при температуре 1140—2160 К плавленных
образцов карбида гафния найдено, что в области температур 1790—
2000 К окисление описывается линейным законом скорости
и протекает в основном по границам зерен 11.431.
При окислении порошкообразных образцов карбидов циркония
ZrQux; и ZrCo,7o и гафния HfNo.^s, HfN0,G2 стойкость к окислению
карбида циркония и гафния возрастает с уменьшением содержания
углерода, хотя температура начала заметного окисления в
указанном направлении убывает [1.25]. Это связано, как и в случае карбида
титана, с ростом числа центров адсорбции атомов кислорода при
увеличении количества вакансий в кристаллической решетке.
Как и при окислении ТЮЛ, внедрение кислорода в решетку ZrQ,.,
12
HfCx сопровождается в зависимости от времени выдержки и
температуры процесса уменьшением периода решетки и выделением
свободного углерода. При окислении ZrCo,7 и HfC0,62 свободный
углерод выделяется лишь при определенной температуре, превышающей
температуру начала их заметного окисления. В процессе окисления
образующиеся промежуточные оксикарбиды переходят
непосредственно в кубическую (типа NaCl) окисную фазу МеО^,
содержащую некоторое количество связанного углерода 11.251.
Данные об окислении карбида ванадия крайне ограничены
(1.25, 1.46, 1.471. Изучено окисление карбида ванадия VCo.ge и
оксикарбида УО0,бС0,7 в области температур 400—800° С при
различном давлении кислорода [1.471. Показано, что в области
температур 400—450° С при окислении оксикарбида образуется окисел
V205, а окисление карбида сопровождается лишь растворением
в нем кислорода. Карбид VCo.gs начинает активно окисляться
в области температур 800—1100° С [1.471. При окислении
порошкообразных образцов карбида ванадия VCo.es и VCo,74 в интервале
температур 385—780° С процесс протекает весьма интенсивно
11.251. Внедрение кислорода в дефектную решетку VQ. приводит
сначала*к некоторому увеличению периода решетки, а затем по мере
протекания процесса — к его уменьшению, что сопровождается
выделением свободного углерода. Количество последнего
зависит от степени дефектности исходного карбида. Выделение
металла при окислении не обнаружено.
К настоящему времени имеются данные о поведении карбида
ниобия в среде кислорода при высоких температурах [1.48—
1.501.
Изучена кинетика образования газообразных и твердых
продуктов реакции в процессе окисления карбида ниобия [1.49], однако
во внимание не принималась возможность образования оксикар-
бидных твердых растворов. Наиболее подробно исследовано
окисление компактных образцов NbC в интервале температур 400—
1000° С и давлении 3,5—40 тор [1.501. Установлено сложное
влияние давления кислорода на скорость процесса окисления. В
результате реакции образуется оксикарбид ниобия коричневого цвета.
В многофазной окалине обнаружены следующие фазы:
металлический ниобий, его субокислы (NbO^, NbO^, 1\1ЬОг), окислы
Nb205 и Nb02. Авторы [1.501 отмечают, что фазы Nb и Nb02
образуются не в процессе прямого окисления NbC (NbC^O^), а за
счет восстановления фазы Nb2Od при окислении карбида ниобия.
Следует, однако, отметить, что в соответствии с данными
термодинамических расчетов [141 восстановление окисла Nb205 углеродом
до металлического ниобия возможно лишь при температурах выше
1200° С. Появление металлического ниобия в слое окалины может
быть обусловлено особенностями формирования оксикарбидных
твердых растворов.
Данные об окислении ТаС крайне ограничены и относятся лишь
к сплавам, содержащим ТаС 11.311.
13
Из карбидов металлов VI группы по стойкости против
окисления карбиды хрома превосходят карбиды других переходных
металлов [1.51, 1.52]. Изучено окисление горячепрессованного
карбида хрома Сг3С2 на воздухе в интервале температур 500—1200° С
[1.51]. Исходя из данных термодинамического анализа, наиболее
вероятна реакция
МеС + Оа = Ме,0, + С.
Однако для окисления карбида хрома наиболее вероятна
реакция
Ме*Сы +Оа = МехС„ + СО.
Высший карбид хрома характеризуется высоким
сопротивлением окислению. Во всей исследованной области температур
обнаружены окислы Сг203, Сг02, Сг308. В интервале температур 700—
1000° С образовывалась фаза низшего окисла хрома.
Кинетика окисления порошкообразных и компактных образцов
карбида хрома CrgQ, Cr7C3 и Сг23С6 показала, что процесс
начинается при температуре 700° С. Компактные образцы Сг7С3
подвергаются воздействию кислорода, начиная с 800° С, тогда как образцы
карбидов Сг3С2 и Cr2SC6 практически устойчивы до 1000° С [1.52].
Изучена кинетика образования твердых и газообразных продуктов
реакции в процессе окисления Сг3С2 в среде кислорода [1.49, 1.53].
Исследовано окисление порошкообразных образцов Мо2С в
интервале температур 440—520° С в среде кислорода [1.451. В области
параболического закона скорости влияние давления кислорода
на скорость окисления было значительным. Энергия активации
процесса составляла 20 ккал/моль. При окислении
порошкообразный карбид вольфрама медленно реагирует с кислородом при
температуре 500° С [1.31, 1.45, 1.541. С ростом температуры скорость
окисления быстро нарастает [1.541. При температурах 700 и 1000° С
окисление характеризуется линейной зависимостью [1.311; при
1000° С наблюдается преимущественное окисление углерода. В
среде кислорода при 500—650° С [1.45] слой окалины был достаточно
рыхлым и характеризовался наличием трещин.
Следует, однако, отметить, что в подавляющем большинстве
случаев изучались порошкообразные образцы карбидов. Это не
позволило провести металлографические и
электронно-микроскопические исследования поверхности окисленных образцов и
измерения микротвердости поверхностных зон оксикарбидных твердых
растворов. За исключением работ [1.25—1.271, нигде не
учитывалась возможность растворения кислорода в карбидах в
процессе их окисления и образования оксикарбидных твердых
растворов, что исключило правильный подход к рассмотрению механизма
взаимодействия карбидов с кислородом.
14
:
СТАТИСТИКО-ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ
СВОЙСТВ КАРБИДОВ
При изучении высокотемпературного окисления карбидов и
нитридов металлов IVa—Va подгрупп показано, что взаимодействие
их с кислородом сопровождается выделением в поверхностный
слой соответствующих металлов и неметаллов (углерода, азота).
Это указывает на образование вакансий в решетке оксикарбидных
оксинитридных твердых растворов. В работах [1.1—1.14, 1.16—
20, 1.25—1.27] установлено наличие двойной дефектности в окси-
карбидах и оксинитридах металлов IVa—Va подгрупп.
Интерпретация выделения металлов и неметаллов в процессе
окисления карбидов и нитридов металлов IVa—Va подгрупп
становится возможной, если учесть теоретические представления
121—24] об экранирующем влиянии неметаллов (С, N, О) на Me—
Ме-взаимодействия.
Тугоплавкие соединения на основе металлов IVa и Va подгрупп
отличаются гетеродесмичностью связей, из которых существенную
роль играют Me—Х- и Me—Ме-взаимодействия. Согласно [21—24],
атомы неметалла (С, N, О) экранируют связи Me—Me, причем
эффект экранирования увеличивается с ростом их концентрации,
электроотрицательности неметалла, степени экранирования
dp-орбиталей атомов металла и числа электронов, участвующих
в связи Me—Me. В условиях сохранения структуры типа NaCl
перевод энергетически невыгодных экранированных
взаимодействии Me—Me в неэкранированные приводит к образованию
вакансий, число которых растет с увеличением степени
экранирования.
С помощью статистико-термодинамического анализа
тугоплавких соединений решены вопросы, связанные со структурными,
термодинамическими и энергозонными особенностями монокарбидов,
мононитридов и моноокислов металлов IVa и Va подгрупп, а также
их взаимных твердых растворов со структурой типа NaCl [1.55].
В основу статистико-термодинамического анализа положена
модель [1.56—1.59], согласно которой энергия кристаллической
решетки, например карбидов, в основном определяется Me—С-взаимо-
действиями. С появлением в решетке вакансий энергетические
уровни электронов Me—Ме-связей резко снижаются и оказываются
в полосе Me—С-взаимодействий. Степень заполнения Me—С-по-
лосы не изменяется (снижается лишь число состояний в ней), но
одновременно формируются новые неэкранированные Me—Ме-
связи (энергетическое состояние которых зависит от числа и
топографии вакансий). В связи с этим необходимо различать
экранированные и неэкранированные Me—Ме-связи (рис. 1).
Природа экранирования Me—Ме-взаимодействий при
комплектном окружении атомов металла атомами неметалла определяется
значительным перекрыванием de-орбиталей и сосредоточением
максимальной плотности электронного облака в местах наиболыне-
15
Рис. 1. Схема строения дефектного
карбида МеС1_л::
/. 2 — атомы углерода и металла; 3 —
вакансии; 4—6 — существенно неэкранированные, не-
экранированные и экранированные Me—Ме-связи
соответственно.
го сближения атомов неметалла.
Вынужденный обмен электронами Me—
Ме-связей и 2s 2/?-оболочек
смежных атомов возможен в
соответствии с принципом Паули только
для электронов с параллельной
ориентацией спин ж, что обусловливает стремление к
взаимному удалению атомов неметалла В условиях кристаллов с
решеткой типа NaCl это ведет к существенному увеличению их
энергии, т. е. к эффекту экранирования Me—Ме-взаимодействий,
величина которого определяется природой (включая размерные
характеристики) атомов-компонентов, структурой кристалла и
степенью его комплектности. Поэтому при обсуждении свойств
дефектных соединений с решеткой типа NaCl целесообразно
различать существенно экранированные, экранированные и
неэкранированные Me—Ме-связи, формирующиеся соответственно через
комплектное окружение атомов (см. рис. 1, 6), между атомами X
и вакансией (5) и между двумя вакансиями (4). Кроме того,
допускается, что энергия Me—С-, С—С- и С—□ -взаимодействий не
зависит от концентрации и распределения вакансий (□) П.581, так
как атомы углерода и вакансии во всех случаях находятся в окта-
эдрическом окружении атомов металла, атомы углерода
преимущественно электронейтральны и между партнерами развиваются лишь
близкодействующие (кулоновскне и обменные) взаимодействия.
Использование описанной модели позволяет объяснить многие
структурные, физические и термодинамические особенности
тугоплавких соединений. На основе этих представлений удалось
описать влияние состава карбидов МеС (со структурой типа NaCl)
на топографию вакансий в них (в подрешетке углерода) и установить
причины своеобразных структурно-вакансионных особенностей,
а также широких областей их гомогенности [22, 1.601. При этом
учитывалось, что образование одной вакансии в подрешетке
углерода ведет к появлению 12 неэкранированных связей [21, 1.601.
Полагая, что энергия Me—С-взаимодействий не зависит от
концентрации вакансий Л/а, при описании влияния состава на энергию
нестехнометрического карбида принималась во внимание лишь
зависимость от него вклада Me—Ме-связей. Учитывая числа (Nij)
и энергии (Vt-/) существенно экранированных (проходящих между
двумя атомами углерода), экранированных (между С и П) и
неэкранированных (между □ и П) связей, находим
U = Ш,-Уч = F + кТ In W = F + kT In -^щ-.
16
Выражая F в явном виде через Nih Уц и координационные
числа, а затем минимизируя по числу смежных вакансий N
выводим выражение для относительного числа смежных вакансий
пщ = NyJN. Оказалось, что пуу зависит не только от дефектности
подрешетки углерода, но и от энергетического параметра Уи
(определяемого соотношением энергий различных связей Уц).
В первом приближении
2 2
yw=-72,25.10-4-^-,
где п0 — общее число электронов Me—Ме-связей; d0 — расстояние
между смежными узлами в подрешетке углерода; е — заряд
электрона.
Анализ полученных соотношений показал, что в нестехиометри-
ческих карбидах ниобия и ванадия относительное число пар смежных
вакансий при Na ^ 0,25 невелико (<С0,03) и несколько
увеличивается при приближении к нижней границе области их гомогенности
(примерно до 0,08). Интересно, что при (1 —х) -*-0,75 в основном
наблюдается такое распределение вакансий, при котором они
всегда разделены одним атомом металла. Поскольку при этом
п = 0, то здесь реализуется упорядоченная структура. В то же
время в карбидах металлов IVa подгруппы все три типа
распределения вакансий всегда существенны, например в TiCi_x n я»
^0,24 при (1 — х) = 0,75.
В соответствии с рассматриваемой моделью в решетке МеуС1_д;
при Ыу > 0,33 ((1 —х) <. 0,67) должны присутствовать атомы
металла, граничащие с тремя смежными между собой вакансиями.
Такие структуры неустойчивы, так как атомы металла в них
удерживаются в своих позициях лишь тремя Me—С-связями и легко
могут смещаться под действием девяти-десятисильных неэкраниро-
ванных Me—Ме-связей. При этом появляются предпосылки для
формирования новой фазы Ме^С, чему предшествует некоторое
микронеоднородное распределение атомов металла [1.61—1.64].
Действительно, здесь Me—Ме-расстояния d3 при (1 — х) = 0,67
оказываются ббльшими, чем равновесные расстояния (dp),
рассчитанные по формуле Полинга (с учетом числа связующих
электронов), в силу чего неэкранированные Me—Me-взаимодействия
стремятся сблизить атомы металла, что делает их положение в
решетке неустойчивым. Поэтому при появлении третьей смежной
вакансии (Nfj > 0,33) структура типа NaCl перестает быть устойчивой
и наблюдается фазовый переход. Так обстоит дело в карбидах
Vd_„ NbQ_* и Tad-*.
В случае MeIVCi_^ наблюдается иная картина. Для них при
(1 — х) — 67 йэ мало отличается от dp, в связи с чем даже при
(1 — я) = 0,67 атомы металла сохраняют свою устойчивость
в решетке и фазы переменного состава со структурой типа NaCl
образуются в более протяженном интервале составов.
2 2920 17
На основе рассмотренной модели можно объяснить также
причины монотонного увеличения периода кристаллической решетки
с ростом содержания углерода в карбидах MevCi_* (вплоть до
(1 —х) ~> 1) и экстремальный характер зависимости d (1—х)
для карбидов MeIVQ_* [1.651.
Детальный анализ распределения вакансий в решетках
карбидов с учетом сил отталкивания между вакансиями позволил
установить [1.58, 1.62] не только концентрационные границы их
гомогенности, но и условия упорядочения в них вакансий (и,
следовательно, атомов углерода).
Статистико-термодинамические исследования поведения
бинарных тугоплавких соединений на примере карбидов тугоплавких
металлов со структурой типа NaCl [1.55] были затем
распространены и на изоструктурные им оксикарбиды и оксинитриды [1.66].
При этом учитывалось, что степень экранирования Me—Ме-свя-
зей зависит от природы атомов неметаллов, в связи с чем, например,
вакансионные свойства монокарбидов резко отличаются от
аналогичных характеристик моноокисей и мононитридов [1.56—1.57,
1.59]. С помощью квазихимического приближения и минимизации
выражения для свободной энергии кристалла удалось
полуколичественно рассчитать распределение атомов и вакансий в обеих
подрешетках. Показано, что, например, в оксикарбидах всегда более
благоприятно размещение атомов кислорода и углерода в смежных
позициях. Обусловленное этим упорядочение тем более совершенно, чем
больше интеграл перекрывания S (de, de), а также существеннее
различия в размерах и экранизующих действиях атомов
неметаллов, т. е. углерода и кислорода. Именно поэтому упорядочение
обсуждаемого типа предпочтительнее ожидать в оксикарбидах, чем
в оксинитридах и карбонитридах. Это согласуется с результатами
нейтронографических исследований, установивших наличие
дальнего порядка в оксикарбидах титана [1.67, 1.68] и ванадия [1.69] и не
обнаруживших его в оксинитридах и карбонитридах титана [12].
Кроме того, в связи с тем что интеграл перекрывания dg-орбита-
лей атомов циркония в кубических структурах значительно больше,
чем атомов титана (например, в моноокисях их отношение близко
к 15) [23], концентрация вакансий в металлической подрешетке
оксикарбида циркония существенно превышает таковую в окси-
карбиде титана при одинаковом содержании кислорода. Именно
поэтому богатые кислородом оксикарбиды циркония нестабильны
[1.9]. По тем же причинам кубический оксикарбид тантала устой-
чив лишь при весьма небольших концентрациях кислорода в
противоположность трехкомпонентной фазе на основе Та2С [1.18].
18
ДЕФЕКТЫ РЕШЕТКИ КАРБИДОВ МЕТАЛЛОВ
IVa—Va ПОДГРУПП
Известно, что тугоплавкие соединения на основе металлов IVa и Va
подгрупп отличаются гетеродесмичностью связей, из которых
существенную роль играют как Me—Х-, так и Me—Ме-взаимо-
действия. Согласно [21—23, 25, 1.56, 1.57, 1.621, атомы неметалла
(С, N, О) экранируют связи Me—Me, причем эффект экранирования
увеличивается с ростом их концентрации, электроотрицательности
неметалла, степени перекрывания ^е-орбиталей атомов металла
и числа электронов, участвующих в связи Me—Me.
В условиях сохранения структуры типа NaCI перевод
энергетически невыгодных экранированных взаимодействий Me—Me в не-
экранированные приводит к образованию вакансий, число которых
растет с увеличением степени экранирования Г 1.701-
Кубические (типа NaCI) карбиды переходных металлов IVa и Va
подгрупп обладают широкими областями гомогенности и имеют
незаполненные узлы только в подрешетке углерода [1, 3, 5, 1.56—
1.59]. В то же время металлическая подрешетка в пределах области
гомогенности карбидов остается комплектной; структурные
вакансии атомов металла в этой подрешетке отсутствуют [4, 1.15, 1.71 —
1.74]. Расчет значения степени заполнения подрешеток для TiC
в случае структуры типа NaCI показал, что металлическая
подрешетка карбида титана во всей области его гомогенности является
полностью заполненной, а степень заполнения углеродной подре-
шетки определяется атомным соотношением компонентов и достигает
максимального значения при эквиатомном составе [1.741. Богатые
углеродом монокарбиды ванадия содержат вакансии как в
подрешетке углерода, так и в подрешетке ванадия [1.751. Концентрация
последних быстро убывает с уменьшением содержания углерода.
Карбиды очень чувствительны к незначительным примесям
кислорода. Как будет показано дальше, наличие кислорода в
карбидных препаратах приводит к появлению структурных вакансий
и в металлической подрешетке.
ДЕФЕКТЫ РЕШЕТКИ ОКСИКАРБИДОВ МЕТАЛЛОВ
IVa—Va ПОДГРУПП
Процесс окисления карбидов сопровождается растворением в них
кислорода с образованием промежуточных оксикарбидных твердых
растворов с кубической структурой [1.24—1.27]. Дальнейшее
протекание процессов окисления и растворения кислорода в
значительной степени определяется (при условии образования рыхлой
окалины или окислов /г-типа) структурными особенностями фаз
переменного состава, определяющих диффузионную подвижность
атомов кислорода в их решетках.
Внедрение кислорода в решетку карбидов металлов IVa—Va
подгрупп и замещение части углерода кислородом сопровождаются
19
Таблица 1. Сопоставление экспериментальных и рассчитанных по уравнениям
типа «-л = Ах2 -\- Вх + С чисел частиц металла, приходящихся на элементарную
ячейку TiC^O
Состав оксикарбида
TIC^Oj,
Я
л
щ
0,20
0,10
0,12
0,21
0,42
0,50
0,32
0,71
0,46
0,81
0,86
0,40
0,20
0,67
0,73
0,21
0,40
0,31
0,84
0,11
0,09
У
0,53
0,64
0,63
0,55
0,35
0,27
0,46
0,28
0,56
0,21
0,17
0,70
0,93
0,27
0,27
0,80
0,62
0,71
0,20
0,95
0,99
х + У
0,73
0,74
0,75
0,76
0,77
0,77
0,78
0,99
1,02
1,02
1,03
1,20
1,13
0,94
1,00
1,01
1,02
1,02
1,04
1,06
1,08
а, А
4,2461
4,2202
4,2478
4,2577
4,2824
4,2940
4,2717
4,3160
4,2873
4,3185
4,3223
4,2735
4,2326
4,3132
4,3170
4,2408
4,2869
4,2686
4,3212
4,2120
4,2005
р.
г/см3
4,90
4,97
4,87
4,87
4,83
4,78
4,88
4,84
4,92
4,92
4,90
5,00
4,80
4,93
4,84
4,81
4,85
4,83
4,80
4,82
4,78
nTi
3,84
3,79
3,78
3,82
3,90
3,92
3,88
3,85
3,74
3,91
3,92
3,62
3,37
3,95
3,85
3,49
3,65
3,60
3,81
3,35
3,30
ni эксп
пС
0,77
0,38
0,45
0,80
1,64
1,96
1,25
2,74
1,72
3,16
3,37
1,45
0,67
2,65
2,81
0,73
1,46
1,12
3,20
0,36
0,30
nQ
2,04
2,43
2,38
2,11
1,36
1,06
1,80
1,08
2,10
0,82
0,67
2,53
3,13
1,07
1,04
2,79
2,26
2,56
0,76
3,18
3,25
rtTi теор
3,84
3,78
3,78
3,82
3,90
3,92
3,88
3,86
3,70
3,91
3,92
3,58
3,37
3,86
3,85
3,53
3,65
3,60
3,87
3,39
3,35
1
П Р.
о о
сп н
С Й
0
0,01
0
0
0
0
0
0,01
0,04
0
0
0,04
0,
0 09
0,
0 04
00
00
0,06
0,04
0,05
увеличением дефектности обеих подрешеток (металла и
неметалла) оксикарбидных фаз и образованием твердых растворов,
построенных по типу внедрения — замещения, внедрения —
вычитания и замещения—вычитания [1.25].
Появление вакансий при замещении атомов углерода и азота
атомами кислорода (с сохранением исходной структуры)
обусловлено переводом части экранированных связей Me—Me в более
энергетически выгодные неэкранированные состояния. Число
вакансий растет с увеличением степени экранирования [22, 1.56,
1.661.
Изучены трехкомпонентные соединения MeQO^ на основе
переходных металлов IV—V групп [1.1— 1.24]. Кубические
(типа NaCl) оксикарбиды N[eCxOy на основе переходных металлов
IV—V групп характеризуются широкими областями гомогенности
и наличием вакансий в обеих подрешетках [1.1—1.81. Степень
заполнения решетки оксикарбидов, титана, циркония и гафния
закономерно меняется с составом [1.2, 1.4, 1.6, 1.9, 1.10].
Исследовано [1.70] влияние состава на комплектность решетки TiC^O^
при 0,7 ^ (х + у) <! 1,2 (табл. 1). Это охватывает практически
всю область гомогенности оксикарбида титана [1.2]. Как следует
из табл., 1, в которой представлены характеристики части образ-
20
Рис. 2. Влияние состава на число
частиц титана nTi, приходящихся на
элементарную ячейку TiC^O^, для
разных значений х-\- у.
1 — 0,70; 2 — 0,80; 3 — 0,90: 4 — 1,00;
5 — 1,10; 6 — 1,20.
цов, полученных в работе [1.1],
обе подрешетки оксикарбида
титана Т\СхОу (металла и
неметалла) характеризуются вакантными узлами. Определена зависимость
nTi = / {х) для различных значений х + у и показано, что
кривые nTi = f (х) для всех образцов Т1СЛ0^ (х + у = 0,70 -5- 1,20)
могут быть описаны уравнениями вида nTi = Ахг + Вх + С [1.70].
Полученные концентрационные зависимости ftTi = / (х) при разных
значениях х -\- у представлены на рис. 2, а коэффициенты Л, Б
и С уравнения
/in = Лх2 + Бх + С
приведены в табл. 2 [1.70].
Результаты исследования характера концентрационной
зависимости комплектности решетки оксикарбидов металлов IVa—Va
подгрупп [1.1—1.24] согласуются с положениями, развитыми в
работах [22, 1.56, 1.66]. Рассмотрение концентрационной зависимости
nt = f (х) показало [1.70], что с увеличением суммы х + У в TiC^O^
(или с ростом относительного содержания кислорода) возрастает
и изменение общего числа частиц, приходящихся на элементарную
ячейку (пе) в пределах х от нуля до максимального значения. В этом
же направлении увеличивается и число вакансий в элементарной
ячейке Т\СхОу. Для каждой суммы х + у общее число вакансий
в решетке оксикарбида титана с увеличением содержания
кислорода также растет, что наиболее заметно при значениях у >> х.
Степень комплектности решетки оксикарбидов в значительной
степени зависит от содержания углерода и кислорода [1.76]. Так,
для кубического оксикарбида циркония в области его
гомогенности степень заполнения подрешетки металла в случае образцов
ZrCjj.0^ с х + у = 0,53 -V- 0,63 с уменьшением содержания
кислорода возрастает. У образцов с наименьшим у подрешетка металла
полностью комплектна (C„Zr = 4,0).
Таблица 2. Зависимость значений коэффициентов А, В, С в уравнении
йт. = Ах2 -\- Вх -j- С от суммы (х ~\- у)
х + у
0,70
0,80
0,90
А
—0,490
—0,219
—0,167
в
0687
0,613
0,646
с
3,76
3,65
3,53
х + у
1,00
1,10
1,20
А
—0,160
—0,066
—0,042
в
0,780
0,746
0,790
О
3,38
3,26
3,12
21
Оксикарбиды ZrCxOy с небольшим значением х + У (0,5—0,6)
и у (0,1) следует отнести к твердым растворам замещения. Замещение
углерода кислородом не вызывает появления структурных
вакансий в подрешетке металла
С увеличением содержания кислорода и, следовательно,
усилением его экранирующего действия на Me—Ме-взаимодействия
[21—23] заметно уменьшается комплектность решетки [1.4].
Поэтому при образовании оксикарбидов с относительно большими
величинами х + у (0,9—1,0) наблюдаются иные закономерности [1.4].
В этом случае замещение атомов углерода частицами кислорода
приводит к удалению из решетки части атомов металла (образование
вакансий) и равного им количества углерода. Здесь оксикарбиды
циркония можно рассматривать как твердые растворы замещения
(углерода кислородом)—вычитания (ZrCij0) [1.6, 1.10].
Отмечено [21, 1.56], что с ростом интеграла перекрывания
S (dede) и числа электронов Me—Ме-связей концентрация вакансий
в решетке эквиатомных окислов металлов IVa—Va подгрупп растет
от 15,5% для TiO до 25% для NbO. Кубические моноокиси
циркония, гафния и тантала, для которых должно было бы быть еще
большее перекрытие ^е-орбиталей, из-за неустойчивости структур
с высокими концентрациями вакансий в соответствующих системах
МеО не существуют [23]. Такие же особенности наблюдаются
и в оксикарбидах тугоплавких металлов [1.6]. Так, с ростом
содержания кислорода и, следовательно, с усилением его экранирующего
действия на Me—Ме-взаимодействие заметно уменьшается
комплектность решетки [1.70], влияние кислорода усиливается с
увеличением S(dede) [1.6].
При сопоставлении данных комплектности решетки
оксикарбидов титана, циркония и гафния с одинаковыми значениями х и у
(особенно при относительно больших у) установлено, что степень
заполнения их элементарной ячейки уменьшается в ряду TiC^O^ —
ZxCJdy — HfC^O^ [1.70] (табл. 3). В оксикарбиде гафния
концентрация вакансий в подрешетке металла с ростом содержания
кислорода быстро увеличивается и оказывается большей, чем в ZrC^O^ и
TiQp^ — [1.6]. В этом же направлении (Ti—Zr—Hf, V—Nb—Та)
увеличиваются и интегралы перекрывания dp-орбиталей атомов
металла [ 23].
Кроме того, комплектность решетки VC^O^, (при прочих равных
условиях) ниже, чем для TiQ.O^, так как при переходе от титана
к ванадию растет число электронов, участвующих в связи Me—Me
[1.70] (см. табл. 3). С другой стороны, в силу тех же причин область
гомогенности кубических оксикарбидов расширяется ..
уменьшением S (dede) и числа электронов, участвующих в Me—Ме-свя-
зях [1.6]. Так, ширина области гомогенности фаз переменного
состава на основе металлов IV группы уменьшается в ряду TiC,.CL —
ZrQP,—ШСхОу [1.2, 1.4, 1.6] и VCJCOi/--NbCjeOi,---TaCjeOi,
[1.3, 1.5, 1.18]. Если область существования кубического TiC^O^,
практически ограничивается прямыми проходящими через состя.вы
22
Таблица 3. Сопоставление комплектности элементарных ячеек оксикарбидо»
титана, циркония, гафния и ванадия при различных значениях х-\-у
Состав МС^О^
TiC0x,(A),33
^гС(),6{р0,33
Т'С(),65О0,28
^■"^о.бб^о.гв
^г^0.69^0,30
И^О.69^0,30
^г^0,75<->0,24
^^0,75^0,26
Т^О.бСрОЛб
^^0,й0^0,45
TiC021O093
^0.21^0.93
"М
3,84
3,75
3,86
3,83
3,83
3,75
3,86
3,78
3,80
3,60
3,35
3,28
"С
2,31
2,24
2,51
2,49
2,64
2,58
2,90
2,84
1,90
1,80
0,70
0,69
п0
1,27
1,24
1,08
1.07
1,15
1,12
0,93
0,98
1,71
1,62
3,11
3,05
2л
7,42
7,23
7,45
7,39
7,62
7,45
7,69
7,60
7,41
7,02
7,16
7,02
Литера
тура
—
11.4]
—
]1.4]
|1.41
[1.6]
[1.4]
[1.6]
—
11.3]
—
[1.3]
Примечания. Значения щ рассчитаны по уравнениям, представленным в рабо
те П 70]
ТЮ0,8—TiC0,4 и TiOo,2—TiCb0 U.2], то для системы Zr—С—О ему
отвечает состав ZrC0.b2O0.36 [1.4], а для Hf—С—О—состав с
несколько меньшим содержанием кислорода НГСо.бэОо.зо [1.6]. Область
гомогенности VC^O^ близка к наблюдаемой для TiC^O^ [1.2, 1.3]
и заметно протяженней, чем для NbQ.0^ 11.5] и особенно для ТаСхО^
[1.181, что обусловлено уменьшением .S {dede) и числа электронов,
участвующих в Me—Ме-связях [21—24]. Это подчеркивает
существенный вклад Me—Ме-взаимодействий в различных соединениях
тугоплавких металлов и дестабилизирующее действие неметаллов
с высокой электроотрицательностью.
Экранирующее действие атомов неметалла (С, О) на Me—Ме-
связи тем сильнее, чем выше их электроотрицательность (помимо
других факторов) [21—24]. Как следует из табл. 4 [16], для
появления, структурных вакансий в металлической подрешетке карбида
циркония требуется больше кислородных атомов, чем в случае
его нитрида.
Системы V—С—О и Nb—С—О характеризуются существованием
оксикарбидов с гексагональной и кубической структурами [1.3,
1.5], а система Та—С—О — наличием лишь гексагональных
оксикарбидов [1.18]. Кубические оксикарбиды ванадия и ниобия
обладают определенными областями гомогенности [1.5, 1.18].
Кубические оксикарбиды ванадия, ниобия характеризуются наличием
дефектов в металлической и металлоидной подрешетках [1.3, 1.5,
1.25].С ростом содержания кислорода (х + у = const) в ^СхОу
комплектность элементарной ячейки убывает в основном за счет Ме-
подрешетки [1.3].
23
Таблица 4. Комплектность подрешеток карбидов и нитридов циркония
различного состава
Состав
Z^O, 78 ^0,002
^Г^0,74<->0,02
ZrN1>05
ZrC0i74N0>04O0>02
ZrCo,73^0,l9
Zr4), 76 Ч),26
Zl^0,88^0,04<->0,02
Zr^0,85^0,15
Доля структурных дефектов в подрешетке
металлической
0,030
0,056
—
0,025
0,035
—
0,015
неметаллической
0,218
0,263
0,010
0,200
0,105
0,035
0,060
0,015
Литература
[1.77J
[1.77]
[20]
[1.77]
[1.4]
[1.4]
[1.77]
[1.4]
Сведения о степени комплектности элементарной ячейки
кубических (типа NaCl) оксикарбидов ванадия ограничены. В работе
[1.3] впервые установлено наличие структурных вакансий в обеих
подрешетках фазы VQO^. Сделаны попытки качественно
объяснить влияние взаимного замещения атомов неметалла на
дефектность VCjj.0^ [1.9, 1.14]. Рассмотрена концентрационная
зависимость степени заполнения элементарной ячейки кубического окси-
карбида ванадия и определены зависимости nv = / (х) [1.78].
Они аналогичны тем, которые наблюдались для оксикарбида
титана [1.70]. Из концентрационных изменений nt = / (х) видно
[1.78], что при х + у = const общее число вакансий в элементарной
ячейке оксикарбида ванадия с увеличением содержания углерода
уменьшается; наиболее заметно это выражено для значений х >
> у. С увеличением содержания кислорода при х + у — const
растет число вакансий в металлической подрешетке фазы VC^O^.
То же происходит при переходе от одной суммы индексов к другой
в сторону увеличения. Однако в общем случае рост относительного
содержания кислорода не всегда сопровождается повышением
концентрации структурных вакансий в металлической подрешетке
оксикарбида. Имеется ряд составов оксикарбидов ванадия, в которых
величина nv остается постоянной, несмотря на значительное
изменение «о и пс, а также их суммы [1.78]. Изменение состава
оксикарбида ванадия VCo.i—о,бОо,7о—о,8о не влияет на концентрации
структурных вакансий в металлической подрешетке.
В системе Nb—С—О образуются два типа достаточно
устойчивых оксикарбидов — гексагональная fi-фаза и кубическая гране-
центрированная б-фаза [1.5]. 6-Оксикарбид (кубический гранецен-
трированный) отличается дефектностью обеих подрешеток.
Элементарная ячейка гексагонального оксикарбида ниобия построена
более плотно, чем кубическая ячейка оксикарбида ниобия.
Вероятно, здесь имеются вакансии лишь в неметаллической подрешетке
[1.5].
24
В системе Та—С—О существуют как кубические (б), так и
гексагональные (Р) оксикарбиды [1.5, 1.18]. Первые отличаются
небольшим и трудно контролируемым содержанием кислорода, вторые —
широкими областями гомогенности однофазного существования.
Химический состав говорит о возможной дефектности подрешетки
металла (в ряде случаев х + у = 1). По-видимому, |3-оксикарбид
ниобия отличается более дефектной подрешеткой металла, чем
Nb2QP^ [12].
Наличие заметной двойной дефектности в решетках
кислородсодержащих (типа NaCl) трехкомпонентных соединений МеСхОу,
MeN20 на основе переходных металлов при у >> 0,02, по-видимому,
закономерно [1.70]. Действительно, это имеет место в случае окси-
карбидов и оксинитридов титана, циркония, гафния, ванадия,
ниобия, урана [1.1—1.6, 1.79—1.82], а также более сложных
(в частности, и оксикарбонитридных) фаз металлов IV—V групп.
Кубические оксикарбонитриды титана и циркония обладают
широкими областями гомогенности и характеризуются наличием
вакансий в обеих подрешетках [1.83].
Кристаллическая решетка образцов TiQP N2, богатых
кислородом (у ^0,10), имеет структурные вакансии в обеих частях,
причем с увеличением содержания кислорода число частиц металла,
приходящихся на элементарную ячейку (nt)f независимо от
значения суммы (х + у + z) убывает. То же наблюдается и для
кубических (типа NaCl) оксикарбидов и оксинитридов титана и
циркония [1.2, 1.4, 1.70, 1.79, 1.85].
Отсутствие четкой зависимости п( от а; и z для Т\СхОдЫг
связано [ 1.83] с определяющей ролью атомов кислорода при
формировании структурных вакансий, на что указывалось в работах
[21, 1.62, 1.66] для подобных бинарных и тройных
кислородсодержащих фаз типа NaCl, образующихся на основе металлов IVa—Va
подгрупп.
Таким образом, присутствие в кристаллической решетке
поликомпонентных типа NaCl кислородсодержащих фаз заметного
числа незанятых узлов в подрешетке металла и неметалла
закономерно [1.70]. Наблюдаемая заметная двойная дефектность в решетках
кислородсодержащих кубических типа NaCl трехкомпонентных
фаз МеСхО , МеЫгОу на основе переходных металлов является
следствием гетеродесмичности существующих в них связей и
определяется условиями взаимодействий Me—Me [1.70].
Рассмотрены механизмы формирования твердых растворов при
внедрении кислорода в решетку карбидов [1.11] и образования
твердых растворов при внедрении кислорода в решетку дефектных
карбидов [1.84], а также характер изменения степени комплектности
элементарной ячейки при последовательном внедрении кислорода
в решетку дефектных карбидов.
На рис. 3 и в табл. 5 приведены зависимости чисел частиц
титана, углерода и кислорода (п{), приходящихся на элементарную
ячейку оксикарбидов TiCxOyt образующихся в результате посте-
25
Рис. 3. Зависимость числа частиц
металла и неметаллов от содержания
кислорода в TiCxO^-фазе:
/ — титан: 2 — кислород: 3 — углерод.
пенного насыщения кислородом
карбида состава TiC0,5-
Использование такого карбида
позволило в широком интервале составов
проследить за изменением
степени комплектности элементарной
ячейки последовательно
формирующихся оксикарбидов TiC^CL
вплоть до максимально возможных значений х + у, равных 1,3
[1.84]. Табл. 5 составлена по результатам работ [1.70] с учетом того,
что в случае структуры типа NaCl при наличии образцов TiC^O^
сумма х + у <! 4,0. В пользу этого свидетельствуют данные [1.1].
Как видно из рис. 3 и табл. 5, при внедрении кислорода в
элементарную ячейку TiC до образования оксикарбида состава
TiC0.50o,i число частиц титана в ней остается равным четырем.
С увеличением содержания кислорода (индекс у изменяется от
0,2 до 0,8) величина nTi уменьшается, оставаясь в дальнейшем
постоянной (nTi = 3,08). В этом же направлении происходят
увеличение по и уменьшение пс, причем в интервале составов TiCo.sOo.i—
TiCo,5Oo,8 число частиц титана, покидающих решетку, в два
раза больше числа частиц углерода, уходящих из нее. Если рассмат-
Таблица 5. Влияние кислорода на характер изменения степени
комплектности элементарной ячейки TiC^ Oy -фазы
X
0,5
0,5
0,5
0,5
0,5
0,5
0,5
0,5
0,5
0,4
0,3
0,2
0,1
0,0
и
0,0
0,1
0,2
0,3
0,4
0,5
0,6
о;/
0,8
0,9
1,0
1,1
1,2
1,3
nTj
4,00
4,00
3,98
3,90
3,82
3,74
3,62
3,34
3,08
3,08
3,08
3,08
3,08
3,06
"С
2,00
2,00
1,99
1,95
1,91
1,87
1,81
1,67
1,54
1,23
0,93
0,63
0,31
—
"о
0
0,40
0,80
1,17
1,53
1,87
2,17
2,33
2,46
2,77
3,07
3,47
3,69
3,98
"С +
+ "0
2,00
2,40
2,79
3,12
3,44
3,74
3,98
4,00
4,00
4,00
4,00
4,00
4,00
3,98
Ч
6,00
6,40
6,77
7,02
7,26
7,48
7,60
7,34
7,08
7,08
7,08
7,08
7,08
7,04
д«т,
0
0,02
0,10
0,18
0,26
0,38
0,66
0,92
0,92
0,92
0,92
0,92
0,94
Дис
0
0,01
0,05
0,09
0,13
0,19
0,33
0,46
0,46
0,46
0,46
0,46
0,46
А"с
—
—
—
—
—
—
—
—
0,31
0,61
0,91
1,23
1,54
Апс +
+ Ап'с
—
—
—
—
—
—
—
—
0,77
1,07
1,37
1,69
2,00
Обозначения: An-p j , AtiQ — число частиц титана и углерода, удаляющихся из
ячейки карбида TiCg 5 за счет вычитания; дп, — число частиц углерода, замещающихся
равным числом частиц кислорода.
_J 1 1 I 1 1 1
О 0,2 0,Ь 0,6 0,8 1,0 1,2 1,4
уьпщ
26
риватъ аналогичные зависимости пМр = f {у) для твердых
растворов, образующихся на основе карбидов TiC0,6—0,9 ДО насыщения
их кислородом (х + у = 1,3), то и здесь числа /гТ! и пс,
удаляющихся из элементарной ячейки Т\СхОу, будут неодинаковыми [1.84].
Это связано с тем, что вычитание атомов титана и углерода из
кристаллической решетки обеспечивает стабильность структуры типа
NaCl [1.84] и обусловлено эффектом экранирования Me—Ме-вза-
имодействий атомами неметалла [1.66]. Как видно из рис. 3,
постепенное насыщение кислородом карбида TiCo.s приводит к
монотонному уменьшению пс в ячейке TiC^O^, и только начиная с
состава ТлСо.бОо.в кривая 3 претерпевает излом. Именно с данного
состава начинается замещение атомов углерода равным количеством
атомов кислорода (пс + п0 = 4,0).
Указанные особенности заполнения элементарной ячейки
TiQOp позволяют проследить за изменением типа образующихся
твердых растворов, которые могут формироваться, в частности,
при окислении карбида TiCo,5 (см. табл. 5). В интервале составов
TiC0,5—TiC0,50o,i появляются твердые растворы внедрения
кислорода в исходную матрицу.
В концентрационной области TiCo.sOo.i—o.e оксикарбиды
построены по типу внедрения (кислорода) — вычитания (углерода) —
вычитания (металла). Твердые растворы в области составов
TiCo.s—o,iOo.8—1,2 следует отнести к типу внедрения (кислорода) —
замещения (углерода кислородом) — вычитания (углерода) —
вычитания (металла). Перечисленные типы твердых растворов
формируются и при насыщении кислородом карбидов титана
других составов. В этом случае концентрационные границы их
существования будут другими [1.84].
Механизм образования TiC^O^ обсуждается и в работе [1.111.
С увеличением содержания кислорода в TiC^O^ комплектность под-
решетки Ti уменьшается [1.13, 1.14]. В частности, если за
исходный компонент при формировании оксикарбидов ряда TiQO^
(при х + У — const) брать карбид TiC^, то при замещении части
атомов углерода атомами кислорода из ячейки TiC^ должно
дополнительно удаляться некоторое количество не только атомов
титана, но и углерода [1.11]. При этом соотношение последних отвечает
монокарбиду TiCi>0o- Действительно, п0 + пс = (х + у) nTi, тогда
для х + у — const при замещении части атомов углерода (Дпс)
равнозначным числом атомов кислорода (Ди0 = Дпс) будет
соблюдаться следующее условие:
пс + Дмо — Д^с — 6>*е —. (х -\- у) пт\ — 6/гТь
где б/г-ri — число частиц титана, уходящее из ячейки Т\СХ
вследствие внедрения в нее Дп0 атомов кислорода; бпс — число частиц
углерода, дополнительно уходящих из ячейки TiCxOy для
обеспечения условия
у -f у = "c + no «= const (б/гт> = 5/гс).
tlTi
27
При этом бп{ <Ая,. Оксикарбид титана (при соблюдении условия
х + У = const) можно рассматривать как твердый раствор
внедрения — замещения (кислорода углеродом) в случае образования
TiQC)^ со стороны ТЮу и вычитания — замещения (углерода
кислородом) при формировании его на основе TiQ..
Как указывают авторы [1.11], существенное отличие
зависимости пс (х) от по (у) является следствием различного электронного
строения атомов углерода и кислорода. Атомы углерода, число
внешних электронов у которого меньше, чем у атомов кислорода,
обладают меньшей электроотрицательностью и размером. Это
приводит к более сильному экранированию связи Ti—Ti атомами
кислорода, из-за чего рост концентрации последнего в Т1СхОА
обусловливает уменьшение комплектности решетки оксикарбида [24].
При малых значениях у в TiC^O^ плотность электронных состояний
относительно низка, а число валентных электронов на ячейку
близко к восьми. В таких условиях вхождение в решетку
небольшого числа атомов кислорода вызывает сравнительно малый
дестабилизирующий вклад и сопровождается слабым изменением
комплектности ячейки. Напротив, при больших содержаниях
кислорода (у >» 0,5) плотность валентных электронов достаточно велика
(8,5) и его экранирующее действие ведет к значительному росту
концентрации вакансий в обеих подрешетках оксикарбида.
1 Вследствие увеличения дефектности решеток оксикарбидов тита-
тана, циркония и гафния в ряду TiC^O^—ZrQO^—ШСхОу [1.70] может
усилиться диффузия кислорода и азота через дефектные решетки
образующихся оксикарбидных твердых растворов в процессе
окисления карбидов. Данное обстоятельство должно играть важную
роль в увеличении склонности к окислению карбидов в ряду
TiC—HfC и VC—ТаС. Изменение степени дефектности карбидов
в процессе растворения кислорода и образование более дефектных,
чем карбиды, оксикарбидных фаз с вакансиями в металлической
и металлоидной подрешетках, увеличивающихся с ростом
концентрации кислорода [1, 25], может оказать определяющее влияние
на скорость процесса окисления. В случае окисления компактных
образцов карбидов при высоких температурах наряду с диффузией
через окисную пленку существенное значение имеет и
диффузионная подвижность атомов в решетках формирующихся окисных фаз
переменного состава, определяемая в основном их структурными
храктеристиками [1.85].
Более высокая дефектность оксикарбидных фаз по сравнению
с соответствующими карбидами определяет и более низкую стойкость
против окисления оксикарбидов [1.25, 1.66]. При одинаковых
условиях стойкость против окисления оксикарбидов циркония
и гафния ниже, чем их карбидов [1.26]. Карбиды циркония и
гафния характеризуются более высокой температурой начала
окисления, чем соответствующие оксикарбиды, т. е. устойчивость к
окислению карбидных фаз несколько выше, чем оксикарбидных.
При рассмотрении возможных путей диффузии атомов в моно-
28
карбидах показано [1.86], что междоузельный механизм не может
быть основным. Вероятно, диффузионные переходы атомов
углерода осуществляются с использованием вакансий в металлической
подрешетке, поэтому карбонитриды с комплектной металлической
подрешеткой [1.87] характеризуются исключительно высоким
сопротивлением окислению. Действительно, карбонитриды титана,
у которых подрешетка полностью комплектна и встречная диффузия
атомов азота и кислорода затруднена практическим отсутствием
вакансий, оказались более стойкими к окислению на воздухе
по сравнению с соответствующими оксикарбидами и оксинитрида-
ми [1.25, 1.85, 1.87], у которых подрешетки металла дефектны
[1.13, 1.14, 1.25, 1.79, 1.80].
Стойкость фаз TiQ.0^, TiN^O^ и TiCJN^ к окислению на
воздухе при температуре 900° С уменьшается в ряду TiC^N^—TiN^O^—
— TiQP^ [1.881. Такая закономерность сохраняется и при
высоких температурах (1100—1200° С) для компактных образцов, хотя
устойчивость фаз TiNX)^ и TiCxOy становится соизмеримой
[1.85, 1.89]. Повышенная стойкость к окислению компактных
образцов TiCJS^ по сравнению с ЛСхОу и Т1М20^ объясняется
в основном их структурными характеристиками [1.25, 1.85, 1.87].
В процессе окисления карбонитридов встречная диффузия их
атомов и атомов кислорода в решетке затрудняется практическим
отсутствием вакансий.
При исследовании процесса окисления кубических (типа NaCl)
TiCjP^-фаз с х + у — 0,56 -ь 0,79 установлено [1.901, что
наиболее стойкими к окислению являются оксикарбиды TiC^O^ с
максимально дефектной Х-подрешеткой при комплектной Ме-подре-
шетке. Это справедливо и для карбидов, нитридов и карбонитридов
титана [1.87, 1.91—1.92]. Значительная дефектность Ме-подрешетки
оксикарбида TiC^O^ (при наличии дефектов в Х-подрешетке)
существенно облегчает массоперенос как металла, так и неметалла
[1.90], что согласуется с теоретическими представлениями [1.86]
и подтверждается результатами сравнительного окисления окси-
карбидов TiC0.49O0.43 и TiCo,4800,i7 [1.90]. Примерно при
одинаковом окислении углерода первый из них характеризовался
значительной дефектностью обеих подрешеток, а второй — только
Х-подрешетки. Скорость окисления TiCo,4800,i7 при 800° С в 2,5
раза меньше по сравнению с TiCo,49 Оо,4з, хотя соотношение и
фазовый состав окислов у них приблизительно одинаковы.
Имеются данные, указывающие на существование
непосредственной связи между дефектностью решетки оксикарбидных и ок-
синитридных фаз и их физико-химическими свойствами.
Микротвердость оксикарбидов титана уменьшается с увеличением
количества вакансий (табл. 6) [1.89].
Изучение физико-химических свойств карбонитридов и окси-
нитридов титана показало, что составам TiC0,67 N0,39 и ТИМо.бвОо.зэ,
характеризующимся наибольшей комплектностью подрешетки
металла и неметалла, соответствовали наибольшие величины микро-
29
Таблица 6. Некоторые характеристики оксикарбидов титана Т|СЛ0^
Состав
ТЮ1,03
^'^0,12^0,98
Т'Ч),зОо,78
^^0,43^0,58
TiC0j57O0,44
*'Ч), 73^0,22
^^о^^олг
а, А
4,180
4,203
4,250
4,280
4,307
4,310
4,316
рпикн>
г/см3
4,95
4,70
4,84
4,89
4,98
4,90
4,80
кг /мм2
1300
1400
1560
1840
2170
2460
2780
п
ЭКСП
1J]
3,38
3,24
3,50
3,70
3,88
3,93
3,87
"С
—
0,39
1,05
1,63
2,21
2,87
3,24
"О
3,4»
3,18
2,73
2,15
1,71
0,86
0,46
2п
6,86
6,81
7,28
7,48
7,80
7,66
7,57
i«Tcop
7,88
7,63
7,70
7,92
7,96
7,80
7,84
Число
вакансий
1,02
0,82
0,42
0,44
0,16
0,14
0,27
твердости [1.85]. Некоторые физико-химические свойства (плотность,
твердость, термо-эдс, окисление и химическая стойкость) кар-
бонитридов, оксинитридов, оксикарбидов титана [1.89] в области
составов, в которых концентрация внешних электронов на
молекулу с учетом дефектности равна 8,2—8,5, аномальны. Эта
концентрация отвечает минимуму плотностного распределения электронов,
обеспечивающему повышенную энергию связи атомов в кубических
решетках со структурой типа NaCl [1.93].
1.1. Пивоваров Т. X., Вржец Е. Я., Креймер Г. С, Закиров Ф. Т. Вакантные
узлы в кристаллической решетке твердых растворов ТЮ—TiC.— Журн.
неорган, химии, 1967, 12, № 7, с. 1743—1746.
1.2. Богомолов Д. Т., Алямовский С. И., Швейкин П. Г., Любимов В. Д.
Некоторые структурные характеристики кубического оксикарбида
титана.— Изв. АН СССР. Сер. Неорган, материалы, 1970, 6, № 8, с. 1405—
1408.
1.3. Щетников Е. #., Гельд П. В., Швейкин Г. П., Алямовский С. И. О
термической устойчивости кубических оксикарбидов ванадия.— Изв. АН СССР.
Сер. Неорган, материалы, 1966, 2, № 1, с. 91—99.
1.4. Алямовский С. И., Зайнулин Ю. Г., Швейкин Г. П., Гальд П. В.
Концентрационная область устойчивости кубического (типа NaCl) оксикарбида
циркония и степень заполнения его элементарной ячейки.— Журн. неорган.
химии, 1971, 16, № 1, с. 7—11.
1.5. Алямовский С. И., Гельд П. В., Швейкин Г. П. О |3- и б-оксикарбидах
ниобия.— Изв. АН СССР. Сер. Металлургия и горн, дело, 1963, № 6, с. 139—
145.
1.6. Алямовский С. И., Зайнулин 10. Г., Швейкин Г. П., Гельд П. В. О
кубическом оксикарбиде гафния.— Журн. неорган, химии, 1971, 16, № 1,
с. 1480—1483.
1.7. Августиник А. И., Климашин Г. М., Голикова О. А., Смирнов Г. В.
Некоторые свойства оксикарбидов циркония в области гомогенности.— Изв.
вузов. Химия и хим. технология, 1970, 13, № 11, с. 1555—1557.
^ 1.8. Августиник А. И., Голикова О. А., Климашин Г. М., Козловский Л. В.
Влияние кислорода на некоторые свойства карбида титана.— В кн.:
Исследование в области химии силикатов и окислов. Л. : Изд-во АН СССР, 1965,
с. 244—247.
30
1.9. Алямовский С. Я., Зайнулин Ю. Г., Гельд П. В., Швейкин Г. П. О
концентрационной зависимости комплектности элементарных ячеек кубических
оксикарбидов титана и ванадия.— Журн. неорган, химии, 1970, 15, вып. 12,
с. 171—174.
1.10. Зайнулин Ю. Г. Физико-химические характеристики кубических (типа
NaCl) оксикарбидов и оксинитридов циркония и гафния : Автореф. дис. ...
канд. хим. наук.— Свердловск, 1972.— 26 с.
1.11. Алямовский С. И., Зайнулин Ю. Г., Гельд П. В. Концентрационная
зависимость степени заполнения элементарной ячейки кубического оксикарби-
да титана.— Тр. Ин-та химии / АН СССР. Урал. науч. центр, 1973, вып. 25,
с. 15—18.
1.12. Зайнулин Ю. Г. Концентрационная область устойчивости кубического
(типа NaCl) оксикарбида циркония при 1700" С.— Тр. Ин-та химии /
АН СССР. Урал. науч. центр, 1973, вып. 25, с. 26—32.
1.13. Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П., Гельд П. В. О
растворимости кислорода в карбиде циркония.— Изв. АН СССР. Сер. Неорган,
материалы, 1970, 6, № 1, с. 118—119.
1.14. Алямовский С. И., Щетников Е. #., Швейкин Г. В., Гельд П. В. О
комплектности решеток оксикарбидов и оксинитридов титана и ванадия.— Изв.
АН СССР. Сер. Неорган, материалы, 1969, 5, № 7, с. 1210—1213.
1.15. Алямовский С. И., Гельд П. В., Матвеенко И. И. Кубические фазы
карбидов ванадия.— Журн. структур, химии, 1961, 2, с. 445—448.
1.16. Гуревич М. А., Ормонт Б. Ф. Исследование фазового состава, строения
и границ области гомогенности фаз системы ванадий — углерод —
кислород.— Журн. неорган, химии, 1958, 3, № 2, с. 403—412.
1.17. Желянкин В. А., Куцее В. С, Ормонт Б. Ф. Исследование равновесия в
реакции восстановления НЮ2 углеродом при высоких температурах.—Журн.
физ. химии, 1961, 35, № 11, с. 2608—2610.
1.18. Дубровская Л. Б., Алямовский С. И., Швейкин Г. П., Гельд П. В. Оксикар-
бидные фазы тантала.— Журн. неорган, химии, 1968. 13, вып. 9, с. 2331 —
2339.
1.19. Швейкин Г. П., Гельд П. В., Алямовский С. И. Условия образования
оксикарбидов ниобия.— Жури, пеорган. химии, 1963, 8, вып. 3, с. 689—696.
1.20. Щетников Е. Н., Алямовский С. И., Швейкин Г. П., Гельд П. В.
Кубические оксикарбиды ванадия.— В кн.: Исследование физико-химических
свойств соединений редких тугоплавких элементов. Свердловск, 1970,
с. 25—28 (Тр. Ин-та химии / АН СССР. Урал, фил.; Вып. 17).
1.21. Волкова Н. М., Алямовский С. И., Гельд П. В. О концентрационных
пределах устойчивости карбида ванадия при 1800° С.— Изв. АН СССР. Сер.
Металлургия и горн, дело, 1963, № 5, с. 134—140.
1.22. Krainer H. Physikalische Untersuchungen an Hartmetallegierungen.— Arch.
Eisenhiittenwesen, 1950, 21, H. 3/4, S. 119—127.
1.23. Алямовский С. И., Швейкин Г. П., Гельд П. В. Инфракрасные спектры
поглощения карбидов и низших окислов ванадия, ниобия и тантала.— Журн.
неорган, химии, 1967, 12, вып. 7, с. 1738—1742.
1.24. Зайнулин Ю. Г., Алямовский С. И., Митрофанов Б. В., Любимов В. Д.,
Швейкин Г. П. Кубические оксикарбонитриды титана и циркония.— Изв.
АН СССР. Сер. Неорган, материалы, 1976, 12, №9, с. 1581 — 1584.
1.25. Жиляев В. А. Структурно-химические исследования высокотемпературного
окисления соединений некоторых переходных металлов IV—V групп с
углеродом, азотом и кислородом : Автореф. дис. ... канд. хим. наук.—
Свердловск, 1974.—28 с.
1.26. Жиляев В. А., Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П.
Высокотемпературное окисление оксикарбидов, оксинитридов, оксикарбонитри-
дов циркония и гафния.— Порошковая металлургия, 1972, № 8, с. 38—43.
1.27. Жиляев В. А., Любимов В. Д., Швейкин Г. П. Механизм фазовых
превращений при окислении карбида титана на воздухе.— Изв. АН СССР. Сер.
Неорган, материалы, 1974, 10, № 1, с. 47—51.
1.28. Щппа W., Rudiger О. Oxidation process of hard metals TiC and Co.— Arch.
Eisenhiittenw., 1953, 24, N 11/12, S. 535—542.
31
1.29. Самсонов Г. В., Голубева Н. К- Некоторые закономерности и механизм
окисления твердых тугоплавких соединений титана.— Журн. физ. химии, 1956,
30, вып. 6, с. 1258—1266.
1.30 Еременко В. Н., Натанзон ,#. В. Кинетика и механизм окисления карбида
титана с присадками хрома.— В кн.: Вопросы порошковой металлургии
и прочности материалов. Киев : Изд-во АН УССР, 1959, с. 7—17.
1.31. Munster M. Ober die Oxydation metallischer Harts toff е.—Z. Elektrochem.,
1959, 63, N 7, S. 806—819.
1.32. Webb W. W., Norton С. Т., Wagner С. Oxidation studies in metal — carbon
systems.—J. Electrochem. Soc, 1956, 103, N 6, p. 112—117.
1.33. Pollard F. M., Woodward P. The stability and chemical reactivity of titanium
nitride and titanium carbide.— Trans. Faraday Soc, 1950, 46, N 327, p. 190—
199.
1.34. Nikolaiski E. Ober die Oxydation von Titancarbid.— Z. phys. Chem., 1960,
24, N 5/6, S. 405—417.
1.35. Stewart R. W., Cutler J. B. Effect of temperature and oxygen partial pressure
on the oxidation of titanium carbide.— J. Amer. Ceram. Soc, 1967, 50, N 4,
p. 176—181.
1.36. Watt W., Cockett G. H., Hall A. R. Sintering of zirconium carbide by hot-
pressing : Some results of preliminary tests on oxidation resistance of
carbides.— Metaux, 1953, 28, N 336, p. 222—223.
1.37. McDonald N. F., Ransley С. Е. Oxidation of hot-pressed titanium carbide
and titanium boride in the temperature range 300—1000° С— Powder Met.,
1959, 3, p. 172—176.
1.38. Kieffer R., К.61Ы F. Ober das Zunderverhalten Hartlegierung auf Titancar-
bidbasis.— Planseeber. Pulvermetal., 1952, 1, N 1, S. 17—19.
1.39. Lavrenco V. A., Glebov L. A., Pomitkin A. P., Chuprina V. G., Protsen-
ko T. G.— High-temperature oxidation of titanium carbide in oxygen.—
Oxidat. Metals, 1975, 9, N 2, p. 171—179.
1.40. Глебов Л. А., Помыткин А. П., Лавренко В. А. Установка для
исследования кинетики взаимодействия материалов с газами микровесовым и хрома-
тографическим методами.— Журн. физ. химии, 1975, 49, № 10, с. 2701 —
2703.
1.41. Kuriakose А. К., Margrave J. L. Oxidation kinetics of zirconium diboride
and zirconium carbid at high temperature.— J. Electrochem. Soc, 1964, 111,
N 7, p. 827—831.
1.42. Bartell R. N.. Wadswort M. E., Cutler J. B. The Oxidation kinetik of
zirconium carbide— Trans. Metallurg. Soc. AIME, 1963, 227, N 2/3, p. 467—
472.
1.43. Berkowitz-Mattuk J. B. High-temperature oxidation. IV. Zirconium and
hafnium carbides.—J. Electrochem. Soc, 1967, 114, N 10, p. 1030—1033.
1.44. Dufour L. C, Simon J., Barret P. Oxydation d'echantillons puwerulents de
monocarbure de zirconium entre 450 et 700° С et sous des pressions d'oxygene
comprises entre 10-5 et 100 torr.—С. г. Acad, sci., Paris, 1967, 265, N 3,
p. 171—175.
1.45. Dufour L. C, Simon J. Cinetique d'oxydation sous faible pression d'oxygene
d'echantillons pulverulents de monocarbures de zirconium et de tungstene et
d'hemicarbure de molibdene.— Bull. Soc. chim. France, 1968, N 9, p. 3644—
3651.
1.46. Campbell J. J., Powell C, Nowicki D., Gonser B. The vapor-phase deposition
of refractory materials. I. General conditions and apparatus.— J. Electrochem.
Soc, 1949, 96, N 5, p. 313—333.
1.47. Santafe C, Borgianni C. Study of the oxidation kinetics of vanadium carbide.—
Oxidat. Metals, 1975, 9, N 5, p. 415—425.
1.48. Власов В. Г., Алабушев В. А., Бекетов А. Р. Окисление твердых растворов
монокарбидов урана и ниобия.— Атом, энергия, 1975, 38, вып. 6, с. 422—
425.
1.49. Помыткин А. П. Кинетика высокотемпературного окисления карбидов
титана, ниобия, хрома, бора и кремния в кислороде: Автореф. дис ...
канд. хим. наук.— Киев, 1975.— 26 с.
1.50. Алабушев В. А. Окисление карбидов урана, ниобия и твердых растворов
UC—NbC : Автореф. дис. ... канд. техн. наук.— Свердловск, 1973.—
28 с.
1.51. Gulbransen F. A., Andrew К. F. A preliminary study of the oxidation and
vapor pressure of chromium.— J. Electrochem. Soc, 1952, 99, N 10, p. 402—
406.
1.52. Косолапова Т. Я., Самсонов Г. В. Кинетика окисления карбидов хрома.—
Журн. физ. химии, 1961, 45, № 2, с. 363—366.
1.53. Лавренко В. А., Помыткин А. П., Глебов Л. А., Чуприна В. Г., Франце-
вич И. Н. Кинетика образования твердых и газообразных продуктов
высокотемпературного окисления карбидов хрома Сг3С2 в кислороде.— Докл.
АН СССР, 1975, 221, № 1, с. 130—133.
1.54. Newkirk A. Е. The Oxidation of tungstene carbide.— J. Amer. Chem. Soc,
1955, 77, N 12, p. 4521—4522.
1.55. Гельд П. В. Дополнение титульного редактора.— В кн.: Тот Л. Карбиды
и нитриды переходных металлов. М. : Мир, 1974, с. 264—291.
1.56. Цхай В. А., Гельд П. В. Влияние экранирования и величины перекрывания
d-орбит на некоторые свойства эквиатомных окислов и карбидов титана,
ванадия, ниобия.— Журн. структур, химии, 1964, 5, № 2, с. 275—280.
1.57. Цхай В. А., Гельд П. В. Об экранировании Me—Ме-связей в эквиатомных
окислах и карбидах переходных металлов со структурой типа NaCl.—
Физика металлов и металловедение, 1963, 16, вып. 3, с. 493—494.
1.58. Гельд П. В., Цхай В. А. Некоторые вопросы кристаллохимии кубических
окислов и карбидов Ti, V и Nb.— Тр. Межвуз. коллоквиума по твердым
фазам перемен, состава, 1962, вып. 32, с. 3—18.
1.59. Гельд П. В., Цхай В. А., Швейкин Г. П. Влияние Me—Ме-взаимодействий
на структурные и термодинамические свойства карбидов, нитридов и
промежуточных окислов переходных металлов IVa и Va подгрупп.— В кн. :
VII Междунар. конгр. и симпоз. по росту кристаллов (М., 1966) : Тез. докл.
М. : Наука, 1966, с. 50.
1.60. Цхай В. А., Гельд П. В. Концентрационные области гомогенности
карбидов переходных металлов IV—V группы со структурой NaCl.— Физика
металлов и металловедение, 1963, 16, иып. 3, с. 495—497.
1.61. Потороча В. И., Цхай В. А., Гельд П. В. Структура энергетических полос
монокарбидов переходных металлов IV и V групп. — Докл. АН СССР, 1972,
203, № 5, с. 1118—1121.
1.62. Цхай В. А., Гельд П. В. Влияние экранирования на некоторые фазовые
и структурные свойства кубических карбидов переходных металлов пятой
группы.— Журн. физ. химии, 1965, 39, № 5, с. 1150—1156.
1.63. Борухович А. С, Гельд П. В., Старцев В. Е. Гальваномагнитные свойства
монокарбидов переходных металлов IVa—Va подгрупп.— Изв. вузов.
Физика, 1973, № 5, с, 142—145.
1.64. Bernal J. Ergebnisse der Modernen Metallforschung.— Ergebnisse techn.
Rontgenkunde, 1931, 2, S. 225—239.
1.65. Цхай В. А., Алямовский С. И., Гельд П. В., Швейкин Г. П. О
концентрационной зависимости периодов решетки монокарбидов переходных
металлов IV и V групп.— Журн. неорган, химии, 1972, 17, № 3, с. 602—604.
1.66. Цхай В. А. Гельд П. В. Статистический расчет распределения атомов и
вакансий в оксикарбидах тугоплавких металлов.— Журн. физ. химии,
1971, 45, № 9, с. 2129—2138.
1.67. Зубков В. Г., Матвеенко И. И., Дубровская Л. Б., Богомолов Г. Д.,
Гельд П В. Нейтронографические исследования структуры оксикарбидов
титана.-- Докл. АН СССР, 1970, 191, № 2, с. 323—325.
1.68. Матвеенко И. И., Дубровская Л. Б., Богомолов Г. Д., Зубков В. Г.,
Гельд П. В. Электропроводность оксикарбидов титана.— Изв. АН СССР.
Сер. Неорган, материалы, 1970, 6, № 6, с. 1190—1191.
1.69. Зубков В. Г., Волкова Н. М., Гельд П. В. Упорядочение в структуре окси-
карбида ванадия.—Тр. Урал, политехи, ин-та, 1970, 186, с. 203—204.
1.70. Алямовский С. И., Зайнулин 10. Г., Швейкин Г. П., Гельд П. В.
Концентрационная зависимость степени заполнения элементарной ячейки кубического
3 2920 33
оксикарбида титана.— Изв. АН СССР. Сер. Неорган, материалы, 1973,
9, № 4, с. 596—599.
1.71. Brauer G., Rentier Н., Vernet M. Die Karbide des Niobs.— Z. anorg. und
allg. Chem., 1954, 277, N 5/6, S. 249—258.
1.72. Алямовский С. И., Гельд П. В., Швейкин Г. П. О карбидах ниобия.— Тр.
Урал, политехи, ин-та, 1959, вып. 92, с. 125—134.
1.73. Нешпор В. С, Климашин Г. М., Никитин В. П. Исследование
гальваномагнитных и электрических свойств сплавов TiC—TiO, TiN—TiO, TiC—TiN,
ZrC—ZrN.—В кн.: Тугоплавкие карбиды. Киев : Наук, думка, 1970, с. 169—
, 182.
v 1.74. Арбузов М. П., Хаенко Б. В., КачковскаяЭ. Т., Голуб С. Я-
Рентгенографические исследования карбида титана в области его гомогенности.— Укр.
физ. журн., 1974, 19, № 3, с. 497—501.
1.75. Нешпор В. С, Орданьян С. С. Влияние химического состава на структуру,
электро- и теплофизические свойства монокарбида ванадия в области
гомогенности.— Изв. АН СССР. Сер. Неорган, материалы, 1965, 1, №2, с. 173—
180.
1.76. Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П., Гельд П. В. К
вопросу о комплектности решетки кубического оксикарбида циркония в
области его гомогенности.— Журн. неорган, химии, 1973, 18, вып. 7, с. 1986—
1987.
1.77. Шевченко А. С, Андриевский Р. А., Калинин В. П., Лютиков Р. А.
Изучение рентгенографической и пикнометрической плотности фаз внедрения
на основе циркония.— Порошковая металлургия, 1970, № 1, с. 189—
191.
1.78. Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П., Дьячков Г. В., Шиля-
ева О. И. Концентрационная зависимость степени заполнения
элементарной ячейки кубического оксикарбида ванадия.— Изв. АН СССР. Сер.
Неорган, материалы, 1979, 15, № 3, с. 458—461.
1.79. Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П., Гельд П. В. Область
гомогенности оксинитрида циркония со структурой типа NaCl при 1500° С.—
Журн. неорган, химии, 1971, 16, № 2, с. 315—317.
1.80. Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П., Гельд П. В. О
кубическом оксинитриде гафния.— Изв. АН СССР. Сер. Неорган, материалы,
1971, 7, № 8, с. 1459—1460.
1.81. Поторочин А. А., Швейкин Г. П., Алямовский С. И. Область
существования и комплектность решетки кубического оксинитрида ванадия.— Изв.
АН СССР. Сер. Неорган, материалы, 1971, 7, № 8, с. 1355—1357.
1.82. Siraumanis M. E., Zyszczynski Z. Lattice parameters, thermal expansion
coefficients and densities of Nb and solid solutions Nb—O, Nb—N—О and
their defect structure.—J. Appl. Crystallogr., 1970, 3, N 1, p. 1—6.
1.83. Зайнулин Ю. Г., Алямовский С. И., Митрофанов Б. В., Любимов В. Д.,
Швейкин Г. П. Кубические оксикарбонитриды титана и циркония.— Изв.
АН СССР. Сер. Неорган, материалы, 1976, 12, № 9, с. 1581—1584.
1.84. Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П. Механизм
формирования твердых растворов при внедрении кислорода в решетку дефектных
карбидов.— Докл. АН СССР, 1975, 223, № 4, с. 904—906.
1.85. Богомолов Г. Д., Швейкин Г. П., Алямовский С. И., Зайнулин Ю. Г.,
Любимов Д. Д. Физико-химические свойства оксинитридов и карбонитри-
дов титана.— Изв. АН СССР. Сер. Неорган, материалы, 1971, 7, № 1,
с. 67—72.
1.86. Загрязкин В. Н. О механизме диффузии в монокарбидах переходных
металлов.— Физика металлов и металловедение, 1969, 28, № 2, с. 292—
297.
1.87. Жиляев В. А., Швейкин Г. П., Алямовский С. И., Любимов В. Д.,
Митрофанов Б. В. Кинетика высокотемпературного окисления карбонитридов
титана на воздухе.— Изв. АН СССР. Сер. Неорган, материалы, 1975, 11, № 2,
с. 2230—2235.
1.88. Швейкин Г. П., Слободин Б. В. Окисление оксикарбидов, карбонитридов
и оксинитридов титана.— Порошковая металлургия, 1970, № 2, с. 63—68.
34
1.89. Богомолов Г. Д., Любимов В. Д., Швейкин Г. П., Алямовский С. И.
Некоторые физико-химические свойства оксикарбидов титана.— Изв. АН СССР.
Сер. Неорган, материалы, 1970, 6, № 11, с. 1961—1963.
1.90. Жиляев В. А., Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П.
Механизм окисления соединений переменного состава в системе Ti—С—О.—
Изв. АН СССР. Сер. Неорган, материалы, 1976, 12, № 12, с. 2168—2171.
1.91. Жиляев В. А., Швейкин Г. П., Любимов В. Д., Алямовский С. И.
Исследование процесса окисления оксикарбидов титана на воздухе.— Изв.
АН СССР. Сер. Неорган, материалы, 1974, 10, № 6, с. 1006—1010.
1.92. Жиляев В. А., Алямовский С. И., Любимов В. Д., Швейкин Г. П. Механизм
и кинетика окисления нитридов и оксинитридов титана на воздухе.— Изв.
АН СССР. Сер. Неорган, материалы, 1974, 10, № 12, с. 2151—2155.
1.93. ВИг И. Uber Elektronen Zustande von Hartstoffen mit Natriurnchloridstruk-
tur.— Z. Phys., 1958, 153, N 3, S. 338—358.
3*
Глава 2
ОКИСЛЕНИЕ КАРБИДОВ МЕТАЛЛОВ
Va—Via ПОДГРУПП
В данной главе изложены результаты исследования процесса
высокотемпературного окисления компактных беспористых
образцов карбидов переходных металлов IVa—Via подгрупп.
Результаты спектрального анализа исходных материалов (тугоплавких
карбидов и нитридов) представлены в табл. 7.
Изучено окисление тугоплавких соединений стехиометрическо-
го состава (табл. 8) на образцах цилиндрической формы с диаметром
8 мм, полученных методом горячего прессования и последующим
гомогенизирующим отжигом. Для эксперимента отобраны образцы
с пористостью 0—1%. Для исследования процесса окисления
карбидов в области гомогенности карбиды различного состава
выплавлялись в дуговой вакуумной печи с расходуемым электродом из
соответствующего состава. Химический состав плавленных карбидов
приведен в табл. 9. Исследование кинетики процесса окисления кар-
Т а б лица 7. Результаты спектрального анализа карбидов и нитридов
Материал
TiC
ZrC
HfC
VC
.\TbC
TaC
Lr3L2
MoaC
WC
TiN
ZrN
HfN
VN
NbN
TaN
Содержание, мас.%
Al
0,01
0,01
—
—
0,01
0,01
—
—
0,01
0,01
0,01
—
• —
0,02
0,02
Ре
0,03
0,10
0,01
0,10
0,10
0,01
—
0,01
0
0,03
0,01
0,01
0,01
0,02
0,01
Si
0,01
0,05
0,01
0,03
0,05
0,01
0,03
0,01
0,01
0,01
—
0,01
0,03
0,01
0,01
Mg
0,01
0,01
0,01
0,01
0,01
—
0,01
0,01
—
—
—
0,015
0,01
—
0,01
Ni
—
—
—
—
—
0,01
—
—
—
—
—
0,01
—
—
Ti
Основа
0,03
0,01
—
—
—
—
—
—
Основа
0,03
0,01
—
—
—
36
Таблица 8. Химический состав исходных карбидов и нитридов, мас.%
Материал
TiC
ZrC
HfC
vc
NbC
TaC
Cr3L2
Mo2C
Металл
79,8
88,4
93,9
81,2
88,5
93,6
86,8
94,3
Неметалл
19,8
11,5
6,1
18,8
П.4
6,3
13,0
5,5
Свободный
неметалл
0,2
0,1
0.1
—
0,1
0,1
0,2
0,2
Материал
WC
TiN .
ZrN
HfN
VN
NbN
TaN
Металл
94,0
77,4
86,6
92,9
78,5
87,1
92,9
Неметалл
6,0
22,6
13,2
7,1
21,5
12,8
7,1
Свободный неме
талл
0,1
— '
—
—
—
—
—
Таблица 9. Химический анализ плавленных карбидов состава MeCx
Карбид
Т'^0,996
TiC0>9
^'^0,79
Т*С0,75
TiC0,7
TiC0,6l
Состав, мас.%
Me
79,8
81,9
83,1
84,1
84,8
86,4
Собщ
19,8
17,8
16,9
15,8
15,0
13,3
Чмв
0,15
0,1
0,1
0,1
Не обнаружено
» »
Карбид
TiC0,5i
^r^0,96
Zr(^0,83
Zr^0,73
ZrC07
Zr^0,6l
Состав, мас.%
Me
88,7
88,8
89,6
91,6
91,4
92,4
Ч)бщ
11,1
11,3
10,4
8,9
8,5
7,5
ссв
Не обнаружено
0,1
0,1
0.1
Не обнаружено
» »
бидов и нитридов проводилось на воздухе в интервале температур
400—1200° С через каждые 100° термогравиметрическим методом
с непрерывной фиксацией массы в течение 8 ч.
ОКИСЛЕНИЕ КАРБИДОВ МЕТАЛЛОВ
IVa ПОДГРУППЫ
Окисление TiC
Форма кинетических кривых окисления (рис. 4) и внешний вид
окисленных образцов (рис. 5) свидетельствуют о довольно
высоком сопротивлении окислению TiC. Металлографические и
рентгенографические исследования показали, что растворение кислорода
в решетке близкого к стехиометрическому составу карбида титана
сопровождается выделением свободного углерода и металлического
титана, обнаруженных в окалине в начальной и на более поздних
стадиях процесса в широком интервале температур (табл. 10;
рис. 6, а, б, см. вклейку), и уменьшением периода его элементарной
ячейки (на 0,002—0,004 А) [2.1—2.5].
При окислении карбида титана на воздухе в течение 6 ч
наблюдаются значительные изменения в поверхностном слое образца
и в образующейся окалине. При температуре 800° С край окислен-
37
Am/S.MZ/CM*
35V
Рис. 4. Кинетические кривые
окисления горячепрессованного карбида
титана при разных температурах:
/ — 500, П-14%; 2 — 700; 3 — 800; 4 —
1000; 5 — 1100; 6 — 1200; 7 — 1300; Н —
1400; 5» — 1500; 10 — 1600° С
ного образца ровный, тонкий
слой окалины окрашен в темный
цвет. По мере удаления от
центра образца расположены зоны с
нарастающим количеством
углерода, и на фазовой границе
окалина — карбид концентрация
углерода становится максималь-
1 ной (рис. 6, в). При
температурою—о—»—° ре 900° С характер окалины
изменяется; она становится
двухслойной g внешним белым
ободком и внутренним более
пористым слоем темного цвета. На
1 фазовой границе окалина — кар-
4■■■■-.. tjv бид имеется тонкая прослойка
металлического титана. Как и
при температуре 800° С, от середины образца количество
выделившегося углерода увеличивается по направлению к фазовой
границе карбид — окалина.
С ростом температуры до 1000—1100° С происходит дальнейшее
изменение характера окалины. Она также двухслойная, однако
внешний светлый слой значительно более толстый, чем при 900° С,
а внутренний пористый слой более выраженный. Металлическая
прослойка из чистого титана на границе окалина — карбид
представлена более толстым, чем при 900° С, слоем. В
поверхностном слое, прилегающем к окалине, видны значительные выделения
углерода (см. рис. 6, г). При температуре 1200° С окалина
значительно утолщается; внешний слой у нее светлый, внутренний —
более пористый. При этой температуре в окалине четко
наблюдаются два слоя металлической фазы, окаймляющие образец и
отделенные друг от друга прослойками из окисных фаз. Появление
металлических колец в слое окалины обусловлено особенностями
механизма процесса взаимодействия карбида титана с кислородом,
протекающего с выделением углерода и металлического титана.
Сохранение в слое окалины в области высоких температур
металлического титана объясняется особенностями формирования
окалины из рутила, протекающей в области высоких температур
(выше 900° С), путем предпочтительной диффузии титана к внешней
фазовой границе. Это исключает возможность участия кислорода
в процессе диффузии в слое окалины при окислении карбида.
Данные соображения подтверждаются также характером окалины при
38
Рис. 5. Внешний вид окисленных образцов карбида титана:
а — 700; б — 800; в — 900; г — 1000; д — И 00; е — 1200° С
таких температурах. Образование внешней плотной окалины и
внутреннего темного пористого слоя окалины вызвано двухсторонней
диффузией в процессе формирования окалины из Ti02 при
окислении титана и его карбида. Появление углерода и
металлического титана в слое окалины определяется особенностями
формирования оксикарбидных фаз в процессе растворения кислорода в
карбиде.
Оксикарбиды характеризуются наличием вакансий в подрешет-
ках металла и неметалла [1.1—1.14]. Формированием более
дефектных, чем исходный карбид, оксикарбидных твердых растворов,
сопровождающимся выделением углерода и титана, по-видимому,
объясняется и значительное уменьшение микротвердости зон,
представленных оксикарбидами, с ростом температуры и концентрации
кислорода в направлении границы окалина — карбид (рис. 7).
В интервале температур 1300—1600° С металлический титан
в окалине не обнаружен. Это может быть связано со значительным
уменьшением растворимости кислорода в решетке карбида
вследствие образования окалины из рутила путем преимущественной
диффузии межузельных катионов титана, что сопровождается
уменьшением микротвердости по всей толщине окисленных образцов.
Выделение углерода и металлического титана в процессе
растворения кислорода в карбиде влияет не только на особенности
диффузионной зоны, но и на фазовый состав и морфологические
особенности окалины. Металлический титан, вероятно,
восстанавливает фазу ТЮ2 до окислов Tin02n—1> обнаруживаемых в окалине
в широкой области температур.
При изучении окисления компактных беспористых образцов
карбида титана при небольшом давлении кислорода (10~5, Ю-1,
10 и 150 тор) и температурах 500, 800 и 1000° С установлены
закономерности выделения металлического титана и определено
количество этих выделений в зависимости от температуры, давления
кислорода и времени окисления.
Металлографические, электронно-микроскопические,
рентгенографические исследования показали, что растворение кислорода
в карбидной матрице сопровождается выделением в поверхностный
39
Таблица 10. Результаты рентгеновского
Карбид
TiC
ZrC
HfC
vc
NbC
TaC
Cr3L2
wc
Время
окисления
6 Ч
5 мин
6 ч
5 мин
6 ч
5 мин
6 ч
5 мин
6 ч
5 мин
6 ч
5 мин
6 ч
6 ч
6 ч
фазового анализа окалины, образован
Фазы, содержащиеся
500
Ti02 ,
2рут'
тю2 ;т tj
^анат>
—
ZrO, Zr,
гмоа>
Zr0%yo
2г02куб, Zr
НЮ2 , Hf
''мои
Hf02 , Hf
^мон'
v2o3, v
v2o3, v
a-Nb205
a-Nb205, Nb
Р-Та205, Та
р-Та2Об Та
Cr203, Cr
Mo203
-
600
ТЮ2 ,
*рут'
ТЮ2 , Ti
2рут'
ТЮ2анат' Ti
ZrO, , Zr
•^мон
&02 Л
2куб
ZrO„ л, Zr
Hf°2MOH' И
Hfo2MOH. Hf
va. v
v2o3) v
I—Nb02,
II—a-Nb20B
a-Nb205, Nb
P-Ta205
Р-Та205, Та
Cr203> Сг
Mo203
W03
700
TiO„ ,
2рут'
ТЮ2 , Ti
^анат
ТЮ2 . Ti
'анат'
Zr02 , Zr,
^MOH '
Zr02Ky6
Zr02Ky6. Zr
Hf02MOH, Hf
—
v3o5> v2o3) v2o6
v2o3, v
I—Nb02
II—a-Nb205
a-Nb205) Nb
P-Ta205,
—
\ыХп\^<^9 ч^Го^-'д
Mo203
W03
Обозначения: I — внутренний слой: II — внешний вид
слой углерода и металлического титана во всей изученной области
давлений и температур. При небольшом давлении кислорода
(10~5 тор) выделение металлического титана из решетки карбида
в поверхностный слой выражено незначительно и протекает в
основном по границам зерен. Однако с ростом давления кислорода
выделения металлического титана становятся более заметными. При
давлении кислорода Ю-5 тор они имеют вид круглых включений
незначительного размера (0,03—0,08 мкм). По-видимому, вследствие
высокой растворимости кислорода в решетке металлического
титана наблюдаемые выделения представляют собой твердый раствор
кислорода в титане. Увеличение количества металлических
включений с повышением давления кислорода указывает на то, что
степень замещения углерода в решетке карбида, а следовательно и
выделение металлического титана в поверхностный слой возрастают.
Выделение металла в процессе окисления карбида протекает
неравномерно от зерна к зерну. При давлении 10~3 тор и
температуре 500° С в пределах зерна включения металла распределены
довольно равномерно (рис. 8, см. вклейку), однако плотность их
распределения значительно изменяется от зерна к зерну и
составляет величину порядка 109/см2.
40
ной при окислении карбидов
в окалине при разных температурах,- *С
800
ТЮ- ,
"W1' .
ТЮ2Энат' Tl
ТЮ2анат. Ti
ZrO, , Zr,
2г02Куб
Zf02 „fi, Zi
HfOo , Hf
^moh' r..
Hf02 , Hf
%OH
V A. VoOc. V A
va, v
I—Nb02,
II—a-Nb205,
P-Nb805
a-Nb205, Nb
Р-Таа05
Р-Та205, Та
Сг7Сч, Сг2Оч
I—Mo4On '
II—Мо03
wo,
v'00 |
ТЮ2 ,
<=рут'
ТЮ2анат» Tl
ТАанат'
Ti09 , Ti
2рут'
Zr0W
z?2«y^
zr°2Ky6,Zr
HfO,
2MOF.
i-va, va,
n-vo2, va
—
I—Nb02,
II— a-NbA-
P-Nb80B
—
Р-Та20Б
—
^7^3. ^r2^3
i-MoAi,
II—Mo03
wo3
1000 J
Ti02 ,
T.n 2рут
^Аанат1
ТАанаг
TiO,n , Ti
2рут'
Zr02 ,
Zr02 ,,
•^куб'
Zr02 , Zr02
2куб> 2моь
нго.
''мон
HfO„ , Hf
^мон'
I-VOlJ8l V203>
II-V206
I—Nb02,
II—P-Nb20,
P-Nb206
P-TaA
—
Cr7C5, Cr203
Mo03
vvo3
1100
Ti02 ,
^ Л РУТ
Ti02
^аиат
Ti02 ,
ТЮ2 , Ti
2pyT>
2moh'
&°2КУ6
—
ню2
^MOb
i-v2o3> va,
II— V02, V205
—
P-Nb205
—
p-TaA
—
l_,r7L>5, L.r2U3
Mo03
W03
1200
Ti02
2py-i
Т102анат
Zr02 ,
•'мон
гкуб
—
HfO.
—
vo2, v3o5>
v2o5
P-NbA
—
Р-ТаА ^
—
Cr7C3, Cr203
Mo03
W03
Аналогичные результаты получены при окислении плавленных
крупнокристаллических образцов карбида титана TiCo,5i на
воздухе при температуре 600° С в течение 6 ч (рис. 9, а, см. вклейку).
Каждое зерно отличается от соседнего определенной ориентацией
кристаллографических плоскостей. Как видно из рис. 9, а,
распределение титановых включений неодинаково на различных
кристаллографических плоскостях и равно для разных зерен
соответственно 1 • 109; 0,25 • 10° и 0,1 • 109/см2, в то время как размеры
металлических частиц изменяются незначительно (от 0,09 до 0,14 мкм).
Такое неравномерное распределение выделений титана мс;хст быть
обусловлено различной диффузионной подвижностью кислорода
по разным зернам карбида титана и неодинаковой плотностью
упаковки атомов в решетке типа NaCl.
Из рис. 9, а следует также, что выделения титана по границам
зерен более существенны; они сливаются и образуют сплошной
непрерывный слой. Это указывает на то, что растворение кислорода
и выделение углерода и соответствующего металла
предпочтительнее происходят по границам зерен карбида и другим дефектам его
структуры.
В свете представленных в работе [1.84] данных о механизме
формирования твердых растворов при внедрении кислорода в решетку
41
Hji к Г/мм"
3000
2000-
1000
12 3 4
Расстояние от подерхности,мм
Рис. 7. Изменение микротвердости по сечению окисленных образцов
карбида титана:
/ — 600, 700; 2 — 800; 3 — 900; 4 — 1000; 5 — 1200; 6 — 1300; 7 — 1400; 8 —
1500 °С.
дефектных карбидов интересно рассмотреть результаты,
полученные при окислении карбида титана состава TiCo.si,
соответствующего нижней границе области гомогенности, окисленного на
воздухе при температуре 1000° С (рис. 9,6). Здесь в отличие от карбидов
стехиометрического состава или состава в области гомогенности
выделяется в основном лишь титан, равномерно
распределяясь на поверхности зерна. На горячепрессоваиных образцах TiC
выделения титана круглой формы. В случае плавленных образцов
карбида выделившийся металлический титан в пределах данного
зерна характеризуется несколько иной формой.
Аналогичные результаты получены в работе [2.7]. При
термическом травлении в вакууме кристаллов закиси меди при режимах,
соответствующих области существования меди, удалось
декорировать медью выход линий дислокаций на поверхности кристаллов
Cu20. Закись меди распадалась с выделением кислорода и меди,
которая покрывала окисел Cu20 не сплошным слоем, а отдельными
точечными образованиями. Плотность последних на поверхности
(2 • 1010/см2) по порядку величины всегда совпадала с плотностью
дислокаций. Это дало основание предположить [2.7], что медь
выделяется в первую очередь в местах выхода линий дислокаций
на поверхности кристаллов.
Вероятно, при окислении TiC в процессе выделения титана,
так же как и выделения меди при распаде Cu20, большую роль
играет диффузионный поток вдоль линий дислокаций. Выделение
42
титана происходит предпочтительно в местах выхода линий
дислокаций на поверхность кристалла. Отсюда можно заключить, что при
окислении крупнокристаллических образцов карбида титана
растворение и диффузия кислорода в отдельных зернах протекают
легче вдоль линий дислокаций. Поэтому замещение углерода, а также
выделение его и металлического титана в поверхностный слой
происходят в таких областях значительно интенсивнее.
Дислокации можно представить как каналы с повышенной
диффузионной проницаемостью [2.8]. Рассчитанная энергия
активации для атомов натрия в решетке LiF по дислокациям в пять раз
меньше, чем по совершенным местам кристалла. Как известно [2.9],
дислокации, обладающие особой активностью, служат центрами
наиболее интенсивного испарения, окисления или травления
кристалла [2.10—2.13].
Таким образом, можно предположить, что в процессе
окисления карбида титана растворение кислорода в его решетке
происходит преимущественно вдоль линий дислокаций. Это вызывает,
вероятно, более интенсивное замещение углерода кислородом,
сопровождающееся ускоренным выделением соответствующего
металла.
Выделение большого количества свободного металлического
титана в поверхностный слой при окислении карбида состава TiCo.si,
равного нижней границе области гомогенности (см. рис. 9, б),
находится в соответствии с результатами, полученными при изучении
структурных особенностей окснкарбидных фаз TiQO^,
образующихся в результате постепенного насыщения кислородом карбида
состава TiCo,5i [1.84]. Выделение свободного металлического
титана в поверхностный слой карбида титана является следствием
структурных особенностей окснкарбидных фаз титана (TiC^O^),
характеризующихся наличием дефектов в металлоидной и металлической
подрешетках [1.1, 1.2, 1.9, 1.14, 1.25, 1.27].
Следует отметить, что заметное увеличение количества
выделений металлического титана по границам зерен с повышением
давления кислорода является следствием изменения структурных
особенностей окснкарбидных фаз, которые происходят в
окснкарбидных твердых растворах с ростом содержания кислорода.
Действительно, в оксикарбидах титана концентрация вакансий в под-
решетке металла с ростом содержания кислорода быстро
увеличивается [1.1, 1.2, 1.9, 1.14, 1.25, 1.27], что обусловлено усилением
его экранирующего действия на Me—Ме-взаимодействие [21—24].
С повышением давления и температуры количество выделений
металлического титана и углерода в поверхностном слое карбида
титана увеличивается в результате создания дефектов в
металлической и металлоидной подрешетках карбидов. Это влияет и на
механические свойства поверхностных зон. Их микротвердость
уменьшается с ростом температуры и давления кислорода в направлении
границы окалина — карбид. Такие изменения в поверхностных
зонах указывают на ухудшение механических свойств изделий
43
и деталей из карбида титана, работающих в невысоком вакууме
и в средах с пониженным содержанием кислорода.
Металлографические исследования позволили изучить
процессы постепенного окисления частиц металлического титана до
образования сплошной окисной пленки. При температуре 500° С и
низком давлении кислорода (10~5 тор) вся поверхность образца
карбида титана покрыта мелкими выделениями металлического титана
(до 0,08 мкм), среди которых просматривается лишь небольшое
количество субокислов титана красного и синего цветов. При
окислении поверхность образца становится пористой, что
свидетельствует об окислении углерода и удалении газообразного окисла. С
ростом давления кислорода (Ю-1 тор) количество выделений
металлического титана увеличивается, что обусловлено более интенсивно
протекающим процессом растворения кислорода. В некоторых местах
они сливаются в отдельные крупные выделения металлического
титана. Однако последние чередуются с выделениями такого же
вида и формы, но оранжево-красного и синевато-зеленого оттенков.
Образования оранжево-красного цвета могут быть
идентифицированы как фазы окислов титана Ti203 и Ti305, зеленовато-синие —
как окислы с большим содержанием кислорода Ti5Og,
образующиеся в процессе постепенного взаимодействия металлического
титана с кислородом [2.14, 2.15].
Отмечено, что с ростом давления кислорода (от Ю-5 до
Ю-1 тор) вследствие интенсификации процессов растворения
кислорода выделение титана становится более заметным. При
дальнейшем увеличении давления (10 тор) значительно возрастает
количество выделений титана, которые теперь уже сами распределены среди
многоцветных образований субокислов титана оранжево-красного,
синего и зеленого цветов. Количество выделений свободного
углерода при этом уменьшается. По-видимому, выделившийся титан
и его окислы препятствуют растворению кислорода в карбидной
матрице. С повышением давления кислорода до 150 тор среди
отдельных синевато-зеленых выделений субокислов титана
появляются участки сплошной окисной пленки бежевого цвета —
ТЮ2. В отдельных ее частях пробиваются зеленые и красные
окислы.
С повышением температуры (800° С) окисная пленка становится
светлее. В ней видны большие включения металлического титана
и его низшие окислы зеленого и красного цветов. При температуре
1000° С и давлении 10~5 — Ю-3 тор окисная пленка более
темная, с заметным количеством выделений металлического титана;
сверху покрыта тонким светлым налетом из ТЮ2. При увеличении
давления от 10~' до 150 тор окалина становится светло-бурой
с большим количеством вкраплений металлического титана; размер
и количество выделений увеличиваются. При давлении кислорода
150 тор они приобретают форму палочек, равномерно
распределенных на поверхности образца.
44
Выделение металла из решетки образующихся оксикарбидных
фаз наряду е углеродом и образование вакансий в металлической
и металлоидной подрешетках обусловлены переходом (в условиях
сохранения структуры типа NaCl) энергетически невыгодных
экранированных взаимодействий Me—Me в неэкранированные [21—23].
При исследовании окисления порошкообразных карбидов TiQ.
показано [1.25], что внедрение кислорода в решетку карбида титана,
близкого к стехиометрическому составу, сопровождается
выделением свободного углерода и образованием промежуточного твердого
раствора — оксикарбида титана, построенного по типу замещения—
вычитания. Эти оксикарбиды характеризовались наличием
вакансий в обеих подрешетках. С ростом содержания кислорода
в оксикарбидах титана число частиц титана и углерода в
элементарной ячейке уменьшалось. Замещение части углерода кислородом
должно приводить к появлению дополнительных вакансий в обеих
подрешетках оксикарбидной фазы. Последнее имеет место, если
из элементарной ячейки образующейся фазы удаляется в
поверхностный слой некоторое дополнительное количество атомов
углерода и титана [1.25].
В пользу выделения титана говорят и наблюдаемые визуально
[1.901 точечные вспышки ярко-красного цвета на поверхности
окисляемых образцов оксикарбидов титана и резкое увеличение массы
образцов.
Необходимо отметить, что особенности формирования
оксикарбидных фаз карбида титана, протекающего с выделением в
поверхностный слой металлического титана и углерода, оказывают
влияние и на процесс испарения последних. Вследствие внедрения
кислорода в решетку карбида, происходящего с выделением
металлического титана и углерода в поверхностный слой, их испарение
в сравнительно невысоком вакууме (Ю-5, Ю-4 тор) протекает при
значительно более низких температурах (1000° С), чем при
испарении чистого металлического титана или карбида титана [15],
наступающем лишь в области высоких температур (1800° С) по схеме
TiC-*-Tira3 + Ств-
Таким образом, выделение углерода и металлического титана
в процессе окисления TiC указывает на возможность формирования
оксикарбидных фаз с дефектными Me- и Х-подрешетками.
Образование дефектов в Ме-подрешетке может значительно ускорить
массоперенос металла и неметалла и увеличить скорость процесса
[1.86].
При изучении окисления карбида титана при небольшом
давлении кислорода в пределах образования в основном лишь
оксикарбидных твердых растворов установлены некоторые особенности
механизма процесса, связанные с образованием вакансий в обеих
подрешетках. Так, кинетические кривые окисления при небольшом
давлении кислорода отличаются от кривых окисления на воздухе
(рис." 10).
45
Как показали металлографические исследования, при
небольшом давлении кислорода и сравнительно невысоких температурах
в поверхностном слое окисленных образцов карбида титана
выделяется в основном металлический титан, частично окисленный при
более высоких давлениях. Это свидетельствует об образовании
в данных условиях только оксикарбидных твердых растворов.
Убыль массы связана с механизмом их формирования.
При растворении кислорода в карбиде титана и замещении
части атомов углерода атомами кислорода из ячейки TiQ. должно
дополнительно удаляться некоторое количество атомов не только
титана, но и углерода с созданием вакансий в металлической и
металлоидной подрешетках [1.6, 1.11, 1.13, 1.141. При температурах
выше 600° С углерод окисляется до газообразных окислов.
Если бы образование оксикарбидных твердых растворов
сопровождалось исключительно лишь замещением углерода кислородом и
выделением соответствующего металла, то окисление TiC* и
формирование оксикарбидных твердых растворов (принимая во внимание
большую атомную массу атома кислорода по сравнению с атомом
углерода) сопровождались увеличением массы.
" Следовательно, кинетические кривые окисления карбида
титана при небольшом давлении кислорода могут служить косвенным
подтверждением правомерности механизма формирования
оксикарбидных фаз.
Следует отметить, что
некоторая убыль массы в
области более высоких температур
(1000 и 1200° С) частично
может быть вызвана испарением
лт/S, мг/см
О 1
4m/S,M2/CMz
60Х
5-
-Ж
0.6
0,8
с/ме
Рис. 10. Кинетические кривые
окисления карбида титана при температуре
1000° и различном давлении кислорода:
1 _ ю-5; 2 — 10—2; 3 — Ю-1; 4 — 10;
5 — 150 <гор.
Рис. 11. Зависимость окисления
карбида титана от содержания углерода
(время окисления 3 ч):
/ — 400; 2 — 600; 3 — 800; 4 — 1000;
5 — 1200° С.
46
выделяющегося титана, однако вклад этой величины
незначителен. Установлено, что окисление образцов дефектных
карбидов титана TiCo.g, TiCojg, TiCo,7, TiCo,6i и TiCo.si
начинается с адсорбции кислорода структурными дефектами решетки,
что подтверждается наличием симбатной зависимости между
температурой начала заметного окисления и степенью комплектности
окисленных карбидов (рис. 11). Кинетические кривые процесса
в зависимости от степени дефектности карбида отражают
прохождение ряда процессов — адсорбции кислорода структурными
дефектами решетки карбида, замещения кислородом углерода и его
выделения. При окислении карбида титана состава, близкого к сте-
хиометрическому, убыль массы может быть вызвана только
процессом замещения углерода кислородом в решетке карбида с
последующим его окислением, в то время как увеличение степени
дефектности карбида сопровождается увеличением доли адсорбированных
атомов и уменьшением степени замещения углеродом. При
температуре 400° С в процессе окисления TiCo,gg6 наблюдается убыль
массы, однако с увеличением степени дефектности решетки карбидов
в начальный период окисления наблюдается прирост массы,
вызванный адсорбцией кислорода. На более поздних стадиях при более
глубоком протекании процесса замещения углерода (6 ч) также
наблюдается некоторая потеря массы дефектных образцов и
образцов стехиометрического состава.
При температуре 600° С при окислении карбида TiC0,gg6
происходит незначительное убывание массы во всем исследованном
интервале времени, свидетельствующее о протекании процесса
замещения углерода даже в начальный период. Но с ростом дефектности
решетки карбида начальная стадия процесса, продолжительность
которого растет с уменьшением содержания углерода в карбиде
(TiCo.zg—TiCo,7), характеризуется в основном адсорбцией
кислорода дефектами решетки, в то время как дальнейшее
увеличение дефектности решетки карбидов (TiC0,Gi—TiCo,5i)
сопровождается уже во всем интервале времени некоторым привесом,
свидетельствующим об увеличении роли адсорбции кислорода
структурными дефектами решетки.
Визуальные и металлографические исследования показали, что
при температурах 400, 600° С, когда свободный углерод окисляется
незначительно, поверхность окисленных образцов TiCo,5i в течение
6 ч не изменяется. Это указывает на возможность внедрения
кислорода в решетку карбида без заметного выделения атомов
углерода. С ростом содержания углерода они темнеют, что вызвано
выделением свободного углерода из решетки по мере увеличения его
содержания в карбиде. С дальнейшим повышением температуры
протекание данных процессов становится более выраженным, с
глубоко идущими замещением, выделением и удалением углерода из
решетки карбида стехиометрического состава. Здесь масса
убывает лишь при окислении карбидов TiC0,og6—TiCo,?, а при
окислении TiCo,6i —только на более поздних стадиях. При окислении
47
TiCo,5i прирост массы наблюдается во всем исследованном
интервале температур.
При достаточно высоких температурах (1200° С), когда
формирование окалины из рутила осуществляется преимущественно
диффузией межузельных катионов титана [2.16], увеличение
дефектности решетки карбида и уменьшение сил межатомного
взаимодействия сопровождаются резким понижением стойкости их против
окисления (см. рис. 11), что может быть обусловлено более легким
переходом катионов титана в окалину из решетки нестехиометри-
ческих карбидов.
Металлографические и кинетические исследования показали
[2.5], что сопротивление окислению карбида титана увеличивается
с ростом дефектности его решетки в ряду TiCo.gge—TiCo.si- Это
согласуется с данными работы [1.90], в которой при изучении
окисления кубических (типа NaCl) TiQ-O^-фаз с х + у = 0,65 -ь
Ч- 0,79 установлено, что наиболее стойки к окислению препараты
ТЮдР^ с максимально дефектной Х-подрешеткой при комплектной
Ме-подрешетке. Выделение свободного углерода фиксируется лишь
при достижении определенной температуры, уменьшающейся с
ростом содержания углерода в карбиде и понижением его дефектности.
Внедрение кислорода в решетку карбидов TiC0j5i в отличие от
TiCo,996 сопровождается выделением преимущественно титана.
Выделение свободного углерода зависит от степени дефектности
карбида, времени и температуры.
При окислении TiCo.ei углерод выделяется только при
температурах выше 500° С, что согласуется с данными работы [1.90], в
которой показано, что при окислении TiCo,62 после первоначального
увеличения периода решетки, связанного с заполнением Х-вакансий
кислородом, начиная с 350° С, наблюдается его уменьшение. В то же
время углерод в свободном виде выделяется при более высоких
температурах (>500°С). Если допустить, что энергия единичной
связи Ti—С в комплектном октаэдрическом окружении металла
с увеличением отклонения от стехиометрии изменяется
несущественно, то особенности поведения углерода можно объяснить диффузией
углерода, вытесненного кислородом, в глубь решетки [1.90].
Металлографические и электронно-микроскопические
исследования показали [2.5], что окисление карбида нестехиометрического
состава, соответствующего или близкого к нижней границе области
гомогенности — TiCo.si, сопровождается выделением не
углерода, а значительного количества металлического тигана. При
окислении TiC0,5 в определенном интервале составов TiC/)y
число частиц титана, покидающих решетку, в два раза больше
числа частиц углерода, уходящих из нее [1.84].
Появлением вакансий в металлической подрешетке,
по-видимому, вызвано у меньшей иео периода решетки образующейся окси-
карбидной фазы на 0,003 А. В данном случае микротвердость
окисленных образцов резко возрастает и не меняется по глубине
и с ростом температуры (рис. 12).
48
Рис. 6. Электронно-микроскопическая структура окисленных поверхностей
карбида титана:
а - 800° С, X 10 000; б — 1000° С, X 9000; в - 800° С, X 115; г — 1000° С, X 200.
Рис. 8. Электронно-микроскопическая структура поверхности карбида титана,
окисленного при температуре 500° С и различном давлении (X 6500):
а — 10—5; б — 10—3: в — Ю-1; г — 150 тор.
v*; Яг * Ж», . *f^ , -f ^ *£**, j*#. г ■ 4
Рис. 9. Электронно-микроскопическая структура поверхности окисленного на
воздухе плавленого TiC05i (X 6500):
а — 600; б — 1000° С.
Нм>кГ/т
3500
0/23
Расстояние от поверхности, мм
Рис. 12. Изменение
микротвердости по сечению окисленных
образцов TiCjc (6 ч) и ZrQ (30 мин,
600° С):
/ — Т1С0>51, 600, 800, 1000° С; 2 —
TiC0>6, 600, 800, 1000° С; 3 — ZrC; 4—
Т1Со!996' Ю00° С; 5^ТЮ07* 1000° С;
6 -'ZrC0,88-- 7 - ZrC0,7: * - ZrC06.
Данные результаты
свидетельствуют о том, что в
равновесии с кислородно-азотной
газовой фазой могут
существовать только оксикарбиды
таких составов, в которых
кислород замещает углерод
в области гомогенности
соответствующего карбида.
Вероятно, в равновесных условиях содержание углерода в карбиде не
может быть меньше, чем нижний предел области гомогенности
карбида.
В процессе окисления оксикарбидов титана различного состава
образуются тонкие слои оксикарбидов, более богатые кислородом
по сравнению с первоначальными [1.91]. В пользу такого факта
говорит присутствие в продуктах реакции, полученных на
начальной стадии окисления оксикарбидов (до 420° С), свободного
углерода. Это может быть связано с возникновением TiC^O^ такого
состава, который соответствует переходной области (TiC^O^ + Ti2Oa -Ь
+ С) системы Ti—С—О [1.2].
С ростом содержания углерода в карбиде титана и уменьшением
дефектности решетки внедрение кислорода в решетку карбида при
1000° С сопровождается значительным увеличением
микротвердости по сравнению с исходным карбидом в направлении центральной
части образца, где концентрация растворенного кислорода меньше
и где могут преобладать процессы адсорбции кислорода
структурными дефектами решетки (см. рис. 12).
Аналогичные результаты получены в работе [2.17], в которой
установлено, что уровень примесей оказывает различное влияние
на твердость карбидов в пределах области гомогенности. При
небольшом содержании примесей кислорода и азота микротвердость
карбида титана в области гомогенности увеличивается с ростом
и.\ содержания. Напротив, при окислении карбида стехиометриче-
ckoi о состава во всех случаях с повышением температуры микротвер-
дость оксмкарбидных твердых растворов уменьшается в направлении
границы карбид — кислород, т. е. с ростом концентрации рас-
торенного кислорода и образования более дефектных оксикарбид-
пых фаз (см. рис. 7). С ростом содержания кислорода в оксикарби-
дах дефектность металлической и металлоидной подрешеток
•".>::»
49
увеличивается 11.701, что, очевидно, и обусловливает некоторое
снижение микротвердости с дальнейшим повышением температуры в
направлении границы карбид — кислород. При температурах выше
1000° С вследствие преимущественной диффузии титана в решетке
рутила и выхода его в окалину слои оксикарбидных фаз,
прилегающих к окалине, могут иметь значительное количество дефектов
в катионной подрешетке, что приводит к резкому снижению
микротвердости при 1300—1500° С по всей толщине образца.
Следовательно, примеси кислорода уменьшают микротвердость карбида титана.
Как известно, [1, 2.18], примеси кислорода в карбидах титана
и циркония ухудшают его свойства в связи с меньшей прочностью
связи Ti—О по сравнению с прочностью связи Ti—С. При
исследовании температуры плавления и микротвердости карбида титана,
загрязненного кислородом (TiCxOy п2), установлено, что
температура плавления и микротвердость понижаются с увеличением
числа дефектов в решетке и в меньшей степени зависят от сорта
атомов металлоида (при малых х) [1.8]. G увеличением количества
дефектов в решетке оксикарбидов и содержания кислорода
микротвердость образцов сначала уменьшается до г = 0,25 -*- 0,35, а
затем начинает возрастать. Это обусловлено большей
электроотрицательностью атома кислорода, приводящей к увеличению доли
ионной связи.
Появление прослойки углерода на границе окалина — карбид
(см. рис. 6, е, г) может быть вызвано выделением свободного
углерода в процессе замещения его кислородом и распадом
промежуточных оксикарбидных фаз. С увеличением дефектности решетки
карбида прослойка углерода уменьшается и совершенно исчезает
в карбиде TiCo,5i во всей области изученных температур.
Первично фиксируемые фазы в начальной стадии (600—1200° С)
окисления карбида титана — углерод и металлический титан,
выделяющийся преимущественно по границам зерен (см. рис. 6, а, б).
На несколько более поздней стадии процесса в поверхностном слое
обнаруживаются также анатаз, окислы гомологической серии
Ti„02«—it в кристаллической структуре которых, как и в структуре
рутила, преобладает титан [2.19] (см. табл. 10).
Первичным окислом при окислении TiC* является анатаз,
обнаруженный в начальной стадии процесса окисления (600—1000° С,
5 мин). Появление анатаза в начальный период процесса окисления,
по-видимому, связано с распадом промежуточного оксикарбида на
углерод и анатаз, содержащий некоторое количество связанного
углерода. Углерод стабилизирует анатаз и замедляет его
превращение в рутил — наиболее стабильную модификацию Ti02.
Соотношение количеств анатаза и рутила в продуктах реакции зависит
от температуры процесса, степени окисления и состава исходного
карбида.
Увеличение степени окисления одного и того же образца при
постоянной температуре (за счет более длительных выдержек)
на начальных и более длительных стадиях окисления приводило
50
к росту относительного содержания рутила. В промежуточных
продуктах реакции обнаружены анатаз и рутил. Рентгеновский
фазовый анализ окалины показал, что с ростом температуры и при
более длительных стадиях процесса в окалине карбида TiCo,996
увеличивается относительное содержание рутила, а количество
анатаза уменьшается, хотя он и обнаруживается в окалине вплоть
до 1100° С. Так, наружный слой окалины при всех температурах
состоял из рутила; до температуры 900° С в нем присутствовал
также углерод.
При окислении карбида титана в интервале температур 800—
1000° С во внутренних слоях окалины формируются слои окисных
фаз темно-синего и черного цветов. Послойный рентгеновский
фазовый анализ позволил установить, что внутренние слои окалины
кроме анатаза и рутила содержали и окислы Тл^Огл—ь в частности
Ti7013, TI8015, Ti9017, Ti10Ol9. Нестехиометрическая фаза Tii,857—иш
(Ti7013 — Ti10O19) характеризовалась изменением окраски от
светло-серой через светло-голубую до темно-синей [2.14, 2.15].
Образование фаз гомологической серии Ti„02n-i при
окислении карбида титана в широком интервале температур обусловлено
особенностями механизма процесса окисления карбида титана,
характеризующегося выделением титана и углерода. Роль
выделяющегося титана при формировании окислов титана гомологической
серии может быть различной. Вероятно, выделяющийся из решетки
оксикарбидной фазы металлический титан диффундирует во внешние
слои окалины, частично растворяясь в окалине из Ti02. Это
присолит к образованию во внутренних слоях окалины окисных фаз
Ti„02n—1- Их кристаллическую структуру можно рассматривать
как структуру рутила, у которой титановые вакансии и титановые
ионы в междоузлиях расположены упорядоченным образом, хотя
такие структуры еще детально не исследованы [2.19].
Выделяющийся в процессе окисления титан может постепенно
окисляться во внутренних слоях окалины, образуя в условиях
низкого парциального давления кислорода дефектные фазы с
избытком титана. При низких температурах окислы в окалине
появляются лишь при длительном окислении. С повышением
температуры вследствие интенсификации окисления они появляются
и в начальной стадии процесса.
При температурах выше 1100° С состав окалины изменялся —
она состоит только из рутила [2.2, 2.5]. Аналогичные результаты
получены и в работе [1.27].
11олиморфное превращение анатаза в рутил начинается уже
при 300° С [2.20] и может протекать в интервале температур 300—
1000* С [2.21]. Наличие анатаза и углерода в слое окалины наряду
с ру гилом до температуры 900° С и их отсутствие при более высоких
температурах (1000° С) объясняются стабилизирующей ролью
углерода, который, как и другие примеси [2.22], влияет на
превращение анагаза в рутил. Переход от оксикарбида к анатазу
сопровождается большим изменением объема (Т1С0,8зОо,15 • ТЮ2анат = 0,61),
Л*
51
чем переход к рутилу СПС0,8зОо,15 : ТЮ2рут = 0,66), что создает
в первом случае большие механические напряжения, приводящие
к образованию мелкодисперсных окислов [1.91]. Действительно,
при окислении горячепрессованных образцов карбида титана при
низких температурах (300—450° С) образовывался лишь
порошкообразный анатаз, который и не давал прочно сцепленного слоя с
основой [1.37]- Кинетические кривые описывались линейным
законом скорости. При более высоких температурах (>700° С)
появлялась плотная кристаллическая пленка рутила, и процесс окисления
описывался параболическим законом скорости.
Образование анатаза в начальной стадии процесса и при низких
температурах свидетельствует о том, что при окислении
промежуточные оксикарбиды распадаются на фазы Ti02 (CX), содержащие
некоторое количество связанного и свободного углерода.
Послойный рентгеновский фазовый анализ показал [2.5], что на
длительных стадиях процесса анатаз формируется в нижнем слое окалины
и на границе окалина — карбид TiC0,996 в виде коричневых
выделений, примыкающих к прослойке углерода. По мере удаления от
указанной границы количество анатаза несколько уменьшается,
возможно, вследствие уменьшения содержания углерода в окалине.
В промежуточных продуктах окисления карбидов, бедных
углеродом, преобладает рутил, в то время как в образцах, богатых
углеродом, преимущественно образовывался анатаз. Это
обусловлено влиянием углерода, как и других примесей [2.22], на скорость
превращения анатаза в рутил.
Анатаз в отличие от рутила не обладает защитными свойствами
[1.37], чем и объясняется сложная зависимость степени окисления
от состава карбидов (см. рис. 11). При длительном окислении (6 ч)
с ростом дефектности решетки карбида анатаз в окалине отсутствует,
очевидно, вследствие уменьшения количества углерода,
необходимого для его стабилизации. При окислении на воздухе оксикарби-
дов титана TiQO^ с х + у = 0,93 -5-1,00 в промежуточных
продуктах окисления, бедных углеродом оксикарбидов,
преобладал рутил, тогда как для образцов, богатых углеродом, характерно
образование анатаза [1.91]. Наличие последнего определяется
влиянием углерода на скорость превращения анатаза в рутил. Сложную
зависимость степени окисления оксикарбидов TiQOy различного
состава от температуры авторы [1.91] объясняли влиянием главным
образом природы образующихся продуктов реакции.
По-видимому, роль ориентационного соответствия,
способствующего когерентному росту анатаза с кубическим типом упаковки
на кубической матрице карбида титана, зависит не только от
дефектности решетки карбида, но и от особенности формирования
окалины из рутила. Ориентационные соотношения имеют значение
лишь при низких температурах, когда формирование окалины из
рутила осуществляется через диффузию кислорода, растворимость
которого в карбиде еще незначительна. Прослойка из углерода
на границе окалина — карбид отсутствует.
52
С ростом температуры (> 900° С) и увеличением роли диффузии
титана в процессе формирования окалины из рутила возможность
прямого взаимодействия кислорода и карбида с выделением
углерода и титана несколько уменьшается, увеличивается размер
полости на границе окалина — карбид. Это сопровождается
уменьшением количества анатаза в окалине не только благодаря уменьшению
количества стабилизирующей примеси (углерода), но и вследствие
исчезновения непрерывного перехода карбид — оксикарбид —
анатаз по мере расширения полости. Наличие последней исключает
возможность когерентного роста анатаза на карбидной матрице.
При достаточно высоких температурах (> 1000° С) увеличение
окисляемости TiCx с повышением дефектности решетки связано
с увеличением диффузионной подвижности межузельных катионов
титана. Это приводит к уменьшению растворимости кислорода,
выделению углерода и металла, ускоренному росту полости на
границе окалина — карбид, что, очевидно, и определяет исчезновение
анатаза в окалине на дефектных образцах карбида при
температурах 1000 и 1200° С.
При окислении TiCo,996 в области высоких температур диффузия
и растворение углерода в окалине значительно менее выражены,
чем при окислении других карбидов. Образование полости на
границе окалина — карбид, в которой выделяется углерод, в
значительной степени затрудняет дальнейшую диффузию его в окалину
и растворение в решетке рутила, о чем свидетельствует
незначительное содержание его в окалине (рис. 13).
При температуре 800 и 900° С окалина на TiCo,996 состоит из
двух слоев — внутреннего темного пористого из нестехиометриче-
ской модификации Ti02 и внешнего тонкого из стехиометрической
модификации Ti02 с вкраплениями металлического титана. Уже при
температуре 1000° С наблюдается значительное спекание внешнего
слоя окалины, а с дальнейшим ростом температуры толщина
внешнего спеченного слоя увеличивается (см. рис. 6, г). Внутренний
слой остается темным пористым. Формирование окалины из рутила
при температурах выше 950° С путем преимущественной диффузии
межузельных катионов титана [2.16] определяет появление значи-
тельной][полости на границе окалина — карбид (см. рис. 6, г), где
концентрируется значительное количество углерода, а также
чередующиеся слои светлой стехиометрической окалины с нестехиомет-
рнческой. При температурах 1000—1200° С во внешнем слое
окалины образуется бурый ободок.
С дальнейшим ростом температуры (1200—1300° С) происходят
Ш.1Чи гельные морфологические изменения окалины. Более
выраженными становятся эффекты ее спекания и текстура внешнего слоя,
вследствие чего полость на границе окалина — карбид, начиная
с 1300° С, исчезает, наблюдаются непрерывный переход из карбида
в окалину и рост зерен окалины из рутила. Вследствие увеличения
количества и диффузионной подвижности катионов титана в решетке
ругпла с повышением температуры изменяется и цвет окалины —
53
Рис. 13. Зависимость содержания углерода в слое окалины
от температуры:
1 — TiC; 2 — ZrC; S — HfC; 4 — VC; 5 — NbC; 6 — TaC: 7— WC
от красно-коричневого внешнего слоя при 1300° С до ярко-красного
при 1400° С с отдельными включениями монокристаллических
образований Ti02 ярко-красного цвета. При температуре 1500° С
окалина состоит в основном из кристаллов Ti02 ярко-красного цвета.
Замедление скорости окисления в области высоких температур
(1300—1600° С) обусловлено спеканием окалины и ростом зерен,
идущим от наружной поверхности окисла. Спекание окалины и рост
зерен свидетельствуют о том, что при высоких температурах
существенную роль играет подвижность атомов титана в рутиле.
Увеличение спеченной и рекристаллизованной зон окисла с повышением
температуры может замедлять процесс окисления карбида титана.
При температуре 1300—1500° С вследствие значительного
спекания окалины полость на границе карбид — окалина исчезает и
наблюдается непрерывный переход окалины в карбидную матрицу.
Влияние высокой температуры проявляется также в увеличении
зерна основы и в выраженной текстуре внешних слоев окалины.
Совершенно иные морфологические особенности характерны
для окалины, образующейся при окислении чистого титана [2.23].
54
Так, структура окалины, полученной при окислении чистого титана
при 1000° С (рис. 14, см. вклейку), характеризуется образованием
на гранях серии цепочек мелких пор, равномерно расположенных
в направлениях, параллельных поверхности границы окалина —
сплав. Такая структура, очевидно, является результатом
конденсации вакансий в слое окалины. Конденсация протекает при
установлении в окалине определенного градиента концентрации кати-
онных и анионных вакансий. Это становится возможным вследствие
существования при 1000° С встречной диффузии кислорода и
катионов титана. Образование микропор и пустот в окалине, очевидно,
и является причиной ее невысоких защитных свойств при
температуре выше 800° С. При температурах 1100 и 1200° С окалина
титана состоит из верхнего спеченного текстурированного и нижнего
темного пористого слоев. Однако наличие в окалине вплоть до
1200° С пористого внутреннего слоя может быть так же
обусловлено, как и при окислении титана, существованием двухсторонней
диффузии, на что указывалось и в работе [1.35].
Расчет кажущейся энергии активации окисления на более
поздних стадиях процесса (Е — 50 -+- 60 ккал/моль) показал, что
определяющей стадией является, по-видимому, диффузия реагентов
через слой рутила (700—1200° С), о чем свидетельствует и близость
рассчитанных значений энергии активации и энергии активации
диффузии кислорода в Ti02 [2.24—2.26].
Таким образом, исследование закономерностей окисления
карбида титана в области температур 400'—1600° С показало, что
растворение кислорода в решетке карбида сопровождается выделением
углерода и металлического титана. Это, согласно [21—23,1.66],
обусловлено экранирующим влиянием кислорода на Me—Ме-вза-
имодействие и определяет формирование оксикарбидных фаз,
характеризующихся дефектами в металлической и металлоидной
подрешетках [1.1, 1.2, 1.9, 1.11, 1.14]. Выделение не только
углерода, но и металла в поверхностный слой в процессе окисления
TiC^ свидетельствует о появлении дефектов и в металлической под-
решетке оксикарбида в процессе окисления.
Наличие двойной дефектности в металлической и металлоидной
iioAlx'iiKMK.ix карбидов значительно увеличивает массоперенос че-
|)1ч решеткуокспклрбпдон 11.90]. Поэтому образование
оксикарбидных фл.» с дефектами и металлической и металлоидной подрешетках
при окислении TiC является предпосылкой для дальнейшего
ускорения процесса. Однако формирование окалины из рутила с
высокими защитными свойствами обусловливает удовлетворительную
стойкость против окисления карбида титана в интервале
температур 900—1600° С.
Разрыхление продуктов реакции выделяющимися
газообразными продуктами (С02) способствует еще большему увеличению
скорости процесса. И лишь в определенных условиях при
образовании слоя окалины из рутила лимитирующей стадией процесса
становится диффузия кислорода через слой рутила.
Итак, процесс окисления карбида титана может быть
представлен схемой
МеС, + 0.2 -* МеСЛо2адс -> МеСО, + С + Me -> Ме02 (С) + Me + С.
Окисление ZrC
Форма кинетических кривых окисления карбида циркония (рис. 15)
и внешний вид окисленных образцов (рис. 16) свидетельствуют
об удовлетворительной стойкости его против окисления. При
температуре 1000° С образцы сохраняют свою форму, а при 1100—
1200° С появляются продольные трещины и скорость процесса
нарастает. Как и при окислении TiC0,996, растворение кислорода
в решетке карбида циркония сопровождается выделением
свободного углерода (рис. 17, см. вклейку) и металлического оциркония,
а также уменьшением периода решетки на 0,001—0,003 А в
зависимости от температуры окисления. Цирконий обнаруживается
рентгенографически в окалине на начальной стадии процесса в области
температур 500—1000° С и на более поздних стадиях в области
температур 500—800° С (см. табл. 10).
Выделение углерода и циркония из решетки карбида протекает
в начальной стадии процесса предпочтительно по границам зерен.
Выделение углерода на поверхности окисленных образцов при
более длительном окислении становится значительным.
Концентрация углерода увеличивается в направлении границы окалина —
карбид, где образуется даже при низких температурах хорошо
выраженный слой (рис. 17, б, б), сохраняющийся и при более высоких
температурах (рис. 17, г).
Выделение углерода и циркония из решетки карбида
определяет формирование оксикарбидных фаз, микротвердость которых
уменьшается в направлении границы окалина — карбид (рис. 18).
Оксикарбид циркония в отличие от ZrC характеризуется
дефектностью в обеих подрешетках [1.4, 1.10, 1.12, 1.131.
Стойкость к окислению
карбидов циркония увеличивается с
уменьшением содержания углерода,
хотя температура начала заметного
окисления убывает (см. рис. 11).
Последнее, как и в случае карбида
титана, связано с увеличением
центров адсорбции атомов кислорода с
ростом количества вакансий в
кристаллической решетке. При
/!/n/S,M8/CM2
г50"
200 <
Рис. 15. Кинетические кривые окисления
карбида циркония:
; — 700; 2 — 800; 3 — 900; 4 — 1000; 5 —
1600; в— 1200; 6' — 1200° С, П = 20%
56
Рис. 16. Внешний вид окисленных образцов карбида циркония:
а — 600; б — 700; в — 800; a >— 900; д — 1000; е — 1100 (пористый); ж — 1100; a —
1200; и — 1200 (пористый).
окислении карбида ZrCo^i выделялся не углерод, а
металлический цирконий.
Внедрение кислорода в дефектную решетку нестехиометрических
карбидов ZrC* (ZrCo.ei, ZrC0,7, ZrCo,83) в начальный период
взаимодействия (30 мин) сопровождается значительным увеличением
микротвердости поверхностной зоны (50—100 мкм), прилегающей
к границе окалина — карбид (см. рис. 12), в то время как при
окислении ZrC микротвердость резко уменьшается. В начальной стадии
процесса (4 мин) наблюдается более сложная зависимость,
обусловленная, по-видимому, участием в процессе растворения азота. Это
указывает на возможность внедрения кислорода в дефектную
решетку карбида без значительного замещения атомов углерода, и,
напротив, выделения свободного углерода из решетки карбида сте-
хиометрического состава с образованием оксикарбидных твердых
растворов. При более длительном протекании процесса толщина
поверхностных зон твердых растворов увеличивается.
На начальных стадиях окисления (600, 800 и 1000° С, 5 мин)
образующиеся промежуточные оксикарбиды при достижении,
очевидно, фазы предельного состава переходят непосредственно в
кубическую окисную фазу ZrOa, содержащую некоторое количество
связанного углерода. Появление в окалине кубической фазы ZrOa,
устойчивой в области температур выше 1900° С, определяется
стабилизирующим действием углерода, растворенного в решетке Zr02.
Рентгенографическое исследование окалины показало [2.5],
что кубическая фаза относительно устойчива на воздухе. При
57
Нл,кГ/мм2
Рис. 18. Изменение микротвердости по сечению окисленных
образцов карбидов циркония ()—3, 5, 6) и гафния (4, 7):
1 — 700: 2 — 800; 3 — 1000; 4 — 800; 5 — 900: в — 1100; 7 — 1200° С.
более длительном окислении (6 ч) в окалине появляется и
моноклинная фаза. С ростом температуры кубическая фаза Zr02 постепенно
превращается в моноклинную с потерей углерода, в результате
чего количество образующейся при окислении ZrC кубической
фазы уменьшается с увеличением температуры, хотя и
обнаруживается наряду с моноклинной в широком интервале температур
(вплоть до 1200° С) в окалине па дефектных образцах и на образцах
стехиометрического состава.
Количественное соотношение кубической и моноклинной фаз
Zr02 зависит не только от температуры и степени окисления, но
и дефектности ZrC, [2.28]. С увеличением дефектности ZrC*
количество кубической фазы Zr02 в случае примерно одинаковой
степени окисления уменьшается и переход кубической фазы в
моноклинную замедляется. На основании этого высказано
предположение [2.28], что наибольшим сцеплением с исходной фазой и,
следовательно, лучшими защитными свойствами обладает кубическая
фаза, растущая на более дефектной матрице. По
металлографическим данным (см. рис. 17, б—г) возможность образования прослойки
углерода па границе окалина — карбид, являющейся
существенным препятствием для сцепления фазы Zr02 б с карбидом,
уменьшается. При одинаковых степенях окисления наибольшей
стабильностью (определяемой количественным соотношением кубической
и моноклинной фаз в продуктах реакции) характеризуется куби-
58
ческая фаза, формирующаяся при взаимодействии с кислородом
воздуха оксикарбидов циркония, отличающихся меньшим
содержанием углерода, а также кристаллической решеткой,
практически комплектной по металлу и наиболее дефектной по неметаллу
[2.29]. Это согласуется с представлениями, на основании которых
авторы [2.28] предполагают, что для получения более стабильной
кубической фазы необходимо наличие у исходного соединения
соответственно полностью и частично заполненных подрешеток
металла и неметалла.
Кубическая фаза Zr02 обладает защитными свойствами [2.28].
Наиболее устойчив к окислению ZrCo,43012, содержащий меньшее
по сравнению с ZrCo,75024 количество углерода и имеющий
комплектную подрешетку металла и более дефектную неметалла.
Наличие кубической фазы Zr02 уже при низких температурах
и в начальных стадиях процесса свидетельствует о том, что она
формируется главным образом в процессе распада оксикарбида. Это
не исключает возможности образования при более высоких
температурах и длительных выдержках, а также в процессе диффузии
углерода в окалине и растворения его в решетке Zr02MOH, что,
очевидно, определяет существование кубической фазы Zr02 в
окалине в довольно широкой области температур (1200° С) (см. табл. 10).
В условиях изотермического окисления при длительных выдержках
углерод концентрируется на границе окалина — карбид в виде
четко выраженного слоя даже при высоких температурах и
диффундирует через окалину к границе окалина — воздух, что
обеспечивает постоянное растворение его в моноклинной решетке Zr02,
а следовательно, стабилизацию кубической фазы Zr02 вплоть до
высоких температур. По данным послойного рентгеновского
фазового анализа на границе Zr02—ZrC, непосредственно у слоя
углерода обнаруживается лишь кубическая фаза Zr02. Средний слой
состоит из смеси кубической и моноклинной фаз Zr02, а внешний —
из моноклинной. Стабилизация кубоческой фазы установлена
и другими авторами при окислении ZrC в среде кислорода [1.25,
1.36, 1.44]. В гетерофазных продуктах окисления
порошкообразного ZrC в токе кислорода (450—750° С, 10~3 тор) обнаружена
низкотемпературная кубическая (типа CaF2) модификация двуокиси
Zr02, стабилизированная углеродом [1.44]. Позднее о содержащей
связанный углерод Zr02 (С)-фазе упоминалось в работе [1.261.
Вероятно, образование кубической фазы Zr02, обладающей
лучшим сцеплением с исходным карбидом, может играть
положительную роль в увеличении сопротивления ZrC окислению
(создание последовательности ZrCKy6->ZrCxO0Ky6-^ZrO2 б), однако
появление промежуточного слоя из углерода на границе окалина —
карбид (рис. 17, б—г), увеличивающегося с ростом содержания
углерода в карбиде, исключает возможность такого влияния.
Формирование окалины путем распада промежуточных
оксикарбидов на кубическую фазу Zr02 и свободный углерод отражается
59
также на ее морфологических особенностях. При температурах
700 и 800° С окалина состоит из кубической и моноклинной Zr02
темно-серого цвета с равномерно распределенными включениями
углерода (см. рис. 17, б). С повышением температуры (900° С)
вследствие значительного растворения углерода окалина становится
более однородной без явно выраженных включений углерода.
Уменьшение количества углерода в окалине с ростом температуры (см.
рис. 13) вызвано выделением газообразных продуктов (СО и С02).
При температуре 900—1200° С окалина серого цвета, спечена, в ней
появляются трещины (см. рис. 17, в, г), которые развиваются в
направлении внутренней фазовой границы и способствуют
увеличению диффузии кислорода и росту скорости процесса.
В отличие от TiCo,996 при окислении карбида циркония
растрескивание окалины начинается уже при невысоких температурах
(700° С) (см. рис. 17, в) и с дальнейшим ростом температуры до
1200° С становится более выраженным (см. рис. 17, г). Появление
трещин в окалине из Zr02 и увеличение дефектности решеток окси-
карбидов в ряду TiC/)^ — ZrQO^ — HiCxOy [1.70]
обусловливают более высокую склонность к окислению карбида циркония
по сравнению с карбидом титана.
Отличительные закономерности окисления карбида циркония
и чистого циркония [2.31] находят свое отражение и в различной
структуре окалины. Металлографические исследования показали,
что морфологические свойства окалины, полученной при окислении
ZrC (см. рис. 17, б—г) и циркония (рис. 19, см. вклейку) отличаются.
Если при 1000° С наблюдается значительная конденсация вакансий
в окалине, то на карбиде циркония окалина более компактная
с явными признаками спекания. Это вызвано особенностями
структуры кубической фазы Zr02. Углерод при формировании кубической
структуры внедряется в ее полностью свободные октаэдрические
пустоты [2.28]. Подрешетка кислорода остается комплектной, а под-
решетка металла не содержит посторонних ионов. В таком случае,
по-видимому, при окислении не создается градиент анионных
вакансий, обусловливающих конденсацию вакансий в окалине
на чистом цирконии [2.31], и получается окалина отличной
структуры с вкраплениями углерода (см. рис. 17, б—г).
Неравномерность расположения кинетических кривых при
температурах 600—1000° С (см. рис. 15) объясняется частичным
спеканием окалины при 1000° С и выделением летучих пгюлуктов.
Окисление ШС
Карбид гафния в отличие от карбида циркония характеризуется
невысоким сопротивлением окислению (рис. 20, 21) [2.1, 2.3, 2.5,
2.27]. Некоторое отслаивание окалины начинается уже при 900° С,
а при 1000° С появляется мелкий порошок окалины. С дальнейшим
ростом температуры образцы полностью разрушаются. Окисление
60
Рис. 20. Внешний вид окисленных образцов карбида гафния:
а .— 600; б — 700; в — 800; г — 900; д — 1000; е — 1100; дас — 1200° С.
карбида гафния аналогично окислению карбида циркония.
Внедрение кислорода в решетку HfC сопровождается уменьшением
периода решетки (на 0,001—0,004 А), выделением свободного углерода
преимущественно по границам зерен в начальных стадиях, где
более выражено растворение кислорода (рис. 22, см. вклейку)
и металлического гафния. Последний обнаруживается в окалине
в начальном периоде в области температур 600—1000° С и на более
длительных стадиях процесса вплоть до 800° С (см. табл. 10). При
дальнейшем повышении температуры металлический гафний быстро
окисляется до НЮ2. Это, как и при окислении ZrC, когда
образуется окалина из фазы Zr02 л-ти-
па [2.32, 2.33], указывает на
возможность перехода некоторого
количества гафния из решетки
оксикарбидов в поверхностный 125
слой окалины. В отличие от
карбида гафния фазы HfQO^
характеризуются наличием дефектов ^
в подрешетках металла и
неметалла [1.6]. Такие особенности
формирования оксикарбидных
фаз гафния, протекающего с
выделением углерода и
металлического гафния, определяют резкое
уменьшение микротвердости
Ат/5,мг/смг
150~
75-
50
Рис. 21. Кинетические кривые
окисления карбида гафния:
/ — 600, 700; 2 — 800; 3 — 900; 4 — 1000;
5 — 1200°С
25-
61
поверхностных зон оксикарбидных твердых растворов в
направлении границы окалина — карбид (см. рис. 18). При более
длительном окислении количество выделений углерода наибольшее
на границе карбид — окалина и по мере удаления в глубь образца
постепенно уменьшается.
Карбид гафния подвергается более интенсивному окислению,
чем карбид циркония (см. рис. 20, 21). Вплоть до температуры
700° С карбид гафния окисляется незначительно, однако уже при
800° С окалина становится рыхлой и начинает осыпаться, а с
дальнейшим ростом температуры образцы полностью разрушаются, что
отражается и на кинетических характеристиках процесса. Более
низкая стойкость против окисления карбида гафния может быть
связана со структурными особенностями оксикарбидных фаз
HiCxOy, характеризующихся по сравнению с ZrC^O^ большим
количеством вакансий в подрешетке металла [1.6].
Следует отметить, что в отличие от карбида циркония при
окислении карбида гафния образуется менее стабильная фаза НЮ2С*,
которая быстро переходит в моноклинную НЮ2. Поэтому при
окислении ZrC появляется кубическая фаза Zr02, стабильная в
широком интервале температур, а при окислении HfC кубическая
фаза НЮ2 не обнаружена. Пониженная стойкость к окислению HfC
по сравнению с ZrC объясняется невысокой стабильностью фазы
НЮ2СХ П.25].
ОКИСЛЕНИЕ КАРБИДОВ МЕТАЛЛОВ
Va ПОДГРУППЫ
Окисление VC
Карбид ванадия характеризуется довольно высоким
сопротивлением окислению (рис. 23, 24) [2.1, 2.3, 2.5]. Растворение
кислорода в решетке VC сопровождается выделением свободного
углерода и металлического ванадия (рис. 25, а, см. вклейку). Это
обусловливает образование оксикарбидных фаз с меньшим по уравнению
с исходным карбидом периодом решетки (на 0,001—0,003 А) и микро-
Рис 23. Внешний вид окисленных образцов кариида ванадия:
а — 800; б — 900; в — 1000; г — U00; д — 1200° С.
G2
Рис. 24. Кинетические кривые окис- /jm/S M2/CMZ
ления карбида ванадия: 775*
1 — 500, 600; 2—700; 3 — 800; 4 — 900:
5 — 1000; 6 — 1100; 7 — 1200° С.
т
твердостью, уменьшающейся в
направлении границы окалина-
карбид (рис. 26). Оксикарбиды
ванадия характеризуются нали- _
чием вакансий в обеих частях ре- fgg
шетки и сложными
концентрационными зависимостями ее
периодов [1.3, 1.16, 1.251. 75
Металлографические
исследования и химический анализ (см.
рис. 13) указывают на то, что со- 50
держание углерода в окалине
определяется ее защитными
свойствами. При температуре 600° С 25
карбид ванадия еще
незначительно окисляется. На его
поверхности вследствие растворения о 1 2 3 4 т3ч
кислорода появляются
чешуйчатые включения графита. При более высокой температуре (800° С)
окалина довольно пористая и многофазная, но под ней уже отчетливо
проявляется слой углерода. Появление жидкой фазы V205 усложняет
общую картину, приводит к замедлению процесса взаимодействия
карбида ванадия с кислородом и способствует сохранению углерода под
слоем окалины (см. рис. 25, б). При температурах 900 и 1000° С
внешний слой окалины состоит из расплавленного V205, а
внутренний слой из низших окислов ванадия более порист. При
температуре 1100° С углерод концентрируется на границе окалина — карбид
и образует четко выраженный слой значительной толщины с
максимальным содержанием углерода в окалине 4,2% (см. рис. 13).
С повышением температуры (1100 и 1200° С) также отчетливо
наблюдается слой углерода, прилегающий к слою из низших окислов
ванадия, но его толщина и содержание углерода в окалине
уменьшаются вследствие высокой текучести расплава из V205 и утраты
окалиной защитных свойств из-за растрескивания.
Свободный углерод в рассматриваемых процессах играет
особую роль. На рис. 27 представлена температурная зависимость
термодинамического потенциала реакций взаимодействия окислов
металлов IV—VI групп с углеродом:
TiO + C = Ti+CO, (2.1)
Ti02 + С = TiO + CO, (2.2)
2ТЮ, + С = Ti203 + СО, (2.3)
72Zr02 + C = V2Zr+CO, (2.4)
63
1/2ню2 + с =
V5Ta20B + С =
V3Nb205 + С =
1/6Nb205 + C =
V2Nb02 + С =
NbO + С =
VO + C =
v.v.o, + с
v4v2o4-bC =
V5v2o5-bC =
V.va + с =
V3Cr203 + С =
73Mo03 + С =
V8WO, + C =
= V9Hf + CO,
= 2/6Ta + CO,
2/3NbO + CO,
= 2/5Nb + CO,
:V2Nb + CO,
Nb -f CO,
V + CO,
= 2/3V+CO,
= V2V + CO,
= »/BV -f CO,
v.va + co,
= 2/3Cr + CO,
= l/3Mo + CO,
= V8W + CO.
2000-
1000
1 2 3
Расстояние от поберхности,мм
Рис. 26. Изменение микротвердости по сечению окисленных
образцов карбидов ванадия (1—3), ниобия (4—6) и тантала (7, 5):
/ — 700; 2 — 1000; 3, 6 — 1100; 4. 7 — 900; 8 — 1200° С.
Как следует из рисунка, термодинамически возможными
являются многие реакции восстановления окислов металлов IVa
подгруппы. Так, будучи хорошим восстановителем, углерод затрудняет
переход низших окислов ванадия V203 и V204 в пятиокись. Этим,
64
Рис. 14. Микроструктура окисленного
при температуре 1000°С образца
титана (X 200).
I'm-. 17. Микроструктура окисленных образцов карбида циркония:
" - ЮиСГС, -I mi У(Ш; б — 700° С; в — 700° С, X 270; г— 1200° С, X 115.
Нис. 1У. Микроструктура окисленного Рис
при температуре 1000 С образца цир- обр
кони я (X 70).
Рис. 22. Микроструктура окисленных
" 'азиов карбида" гафния (600° С,
4 мин X 200).
Рис. го. лшкросгруктура окисленных образцов карбида ванадия:
а — ООО1' С, 4 мин, X 200; О — У00° С. X 270.
/izf, ккал/моль
Phc.j 27. Зависимость термодинамического потенциала от температуры реакций
взаимодействия окислов металлов IVa—Via подгрупп с углеродом (номера кривых
соответствуют номерам уравнений реакций).
по-видимому, и объясняется наличие лишь низших окислов
ванадия V203, V305 при низких температурах и во внутренних слоях
окалины — при более высоких. При температурах 900 и 1000° С
внешний слой окалины состоит из расплавленного V206, а
внутренний пористый слой — из низших окислов ванадия.
Окисление NbC
Карбид ниобия характеризуется незначительной стойкостью против
окисления (рис. 28, 29) [2.1, 2.3, 2.51. Внешний вид окисленных
образцов NbC свидетельствует о быстром их разрушении в процессе
окисления с ростом температуры. Внедрение кислорода в решетку
NbC сопровождается выделением углерода, удалением из решетки
образующихся оксикарбидных фаз некоторого количества
металлического ниобия, обнаруживаемого в окалине на начальных стадиях
процесса (см. табл. 10), и уменьшением микротвердости
поверхностной зоны оксикарбидных твердых растворов (см. рис. 26).
Металлический ниобий также обнаружен в окалине при
окислении карбида ниобия в среде кислорода при Р — 7,2 тор и
интервале температур 700—1000° С между черной плотно прилегающей
пленкой окисла и слоями с интерференционным окрашиванием
11.48]. Повышение давления приводило к исчезновению
металлического кольца. Наличие металлического ниобия в окалине авторы
работы 11.481 объясняли восстановлением Nb205 до металлического
ниобия, протекающим при небольшом давлении кислорода. Одна-
5 2920 05
ш 4' ft jfB >4
Рис. 28. Внешний вид окисленных образцов карбида ниобия:
а — 600; б — 700; в — 800; г — 900; д — 1100 (пористый); е — 1000; ж — 1100; з —
1200; ы — 1200° С (пористый).
ко восстановление углеродом окисла Nb205 термодинамически
невозможно в исследованном интервале температур (см. рис. 27).
Появление ниобия в слое окалины обусловлено выделением его
в поверхностный слой в процессе растворения кислорода в
карбиде и образования оксинитридной фазы. Исчезновение ниобия с
ростом давления вызвано его быстрым окислением.
В отличие от карбида ниобия оксикарбидные фазы NbC^O^
характеризуются дефектностью в обеих подрешетках [1.5, 1.72].
В процессе окисления промежуточные оксикарбиды переходят
непосредственно в окисную фазу, а- и |3-Nb205, содержащие
некоторое количество углерода, что установлено при окислении
карбидов металлов IV группы [1.25].
Результаты кинетических исследований свидетельствуют о том,
что скорость окисления карбида ниобия существенно зависит
от температуры. Заметное его окисление начинается при 550° С;
с ростом температуры скорость процесса резко увеличивается.
При температурах 450, 500 и 550° С окисление карбида ниобия
описывается линейной зависимостью на длительных стадиях процесса.
При температуре 600—700° С в начальных стадиях процесса
кинетические кривые описываются линейной зависимостью, а более
поздние — параболической.
Окисление карбида ниобия характеризуется рядом
закономерностей, наблюдаемых и при окислении металлического ниобия.
Так, окисление ниобия при температуре ниже 650° С охватывает
допереходный период, за которым наступает быстрое
разрушающее окисление [2.34]. На начальной стадии кислород раство
66
ряется в металле с постепенным образованием металлоподобных
субокислов NbOjc, NbOy, NbOz. Окисленные образцы окрашены
в различные интерференционные цвета.
При переходе к ускоренному окислению появляются зародыши
пятиокиси ниобия в виде пятен на поверхности металла.
Разрушающее окисление обусловлено образованием окисла Nb205, который
не оказывает почти никакого сопротивления окислению. Более
быстрое окисление в начале разрушающей стадии, вероятно,
отражает быстрое зарождение и рост субокислов Nb02. Толстый слой
окалины способен затруднить приток газообразного кислорода к
поверхности раздела металл — окисел, замедляя окисление.
Характерные особенности окисления ниобия при температурах
ниже 650° С состоят в неравномерном, локальном воздействии
кислорода на поверхность металла и в клиновидном врастании окисла
в металл, по-видимому, по направлению особых плоскостей
решетки [2.34]. Все это связано с наличием пластинок субокиси Nb02,
которые проникают в металл, и предпочтительным зарождением
Nb205 на этих пластинках или по соседству с ними. Число
пластинок NbOz зависит от ориентации зерна. Их формирование может
происходить у межзеренных границ и дефектов. При температурах
выше 600° С NbOz разлагается и как промежуточный продукт
не обнаруживается. При более низких температурах окисление до
Nb206 протекает через образование Nb02, а при температурах
выше 650° С — через NbO и Nb02.
При окислении NbC в зависимости от температуры и времени
состав и структура окалины сильно меняются. При температуре
450° С в начальной стадии процесса появляется тонкая сплошная
окисная пленка, хорошо сцепленная с поверхностью образца. В
зависимости от времени окисления верхние слои окалины имели
определенную окраску: сиреневую, фиолетовую, синюю, голубую,
зеленую и желтую. Поперечное сечение окалины, верхний слой
которой был окрашен в светло-желтый цвет, характеризовалось
наличием всех приведенных цветов, напоминающих
интерференционную картину. Рентгеновское исследование показало, что
интерференционная картина на поверхности образцов создается тонкими
окисными пленками, состоящими из фазы Nb205 и субокислов
ниобия, что согласуется с данными [1.481.
В начальной стадии разрушающего окисления при 450—550° С
на поверхности карбида ниобия формировалась темно-серая
пленка окислов, имеющая большое количество трещин и легко
отделяемая от подложки. С увеличением продолжительности окисления
верхние слои пленки осыпались в виде темно-серого порошка,
обнажая поверхность другой пленки, характерной для начальных
стадий разрушающего окисления.
Рентгенографическое исследование показало, что на
разрушающей стадии процесса окисления карбида ниобия верхний слой
подложки (темно-серая фаза) состоит из Nb205 и NbC. Наличие фазы
NbC в верхних порошкообразных слоях окалины, придающее ей
5*
67
темно-серый оттенок, может быть вызвано локальным
формированием окисла Nb205 путем клиновидного врастания в образец
NbC в местах зарождения субокисной фазы Nb02. В этих условиях
образцы разрушались в большей степени, чем при 600° С.
С ростом температуры характер окалины изменяется (см. рис. 28).
Так, при температуре 600° С она состояла из двух слоев. Верхний
слой окрашен в темный цвет, в нем с помощью металлографического
анализа обнаружены мелкие желтоватые зерна высшего окисла
a-Nb205. Второй слой черного цвета плотно прилегает к подложке.
Темно-серый оттенок окисного слоя вызван присутствием фазы
Nb02, которая составляла также внутренний слой окалины и
свободного углерода, выделяющегося в процессе растворения
кислорода в карбиде ниобия.
Создание при 600° С прочно сцепленного с исходным карбидом
окисного слоя темного цвета, состоящего из Nb02, наличие
кристаллов высшего окисла Nb206 свидетельствуют о том, что при данной
температуре отсутствует допереходный период окисления,
связанный с клиновидным врастанием кристаллитов Nb205 в карбид
в местах зарождения субокисных фаз NbOz, а имеет место
формирование окисла Nb205 через низкие его окислы. Здесь образуется
окисная пленка определенной толщины, затрудняющая приток
кислорода к поверхности карбида и тем самым замедляющая
процессы взаимодействия. Этим определяется линейный ход
кинетических кривых в начальной стадии и параболической — на более
поздних этапах взаимодействия. Аналогичные закономерности
наблюдаются и при 700° С с той лишь разницей, что верхние слои
окисной пленки становятся более светлыми.
При более высоких температурах (800—900° С) окисная пленка
теряет защитные свойства: при 800° С она начинает осыпаться с
поверхности образца, а при 900° С почти полностью разрушается до
окалины серого цвета. Быстрое окисление и разрушение образцов
при 800—900° С (см. рис. 29) происходят за счет полиморфного
превращения окислов a-Nb205 ч=* (3-Nb205, увеличивающего
также скорость процесса и при окислении металлического ниобия
(рис. 30). С ростом температуры (1000—1100° С) скорость процесса
понижается, что вызвано не только окислением углерода и
выделением газообразных продуктов реакции, но и появлением верхнего
слоя окалины из окисла (3-Nb205 и ее спеканием. Растрескивание
окалины объясняется быстрым ростом слоя из P-Nb206,
характеризующегося большим объемным соотношением.
Металлографические исследования позволили установить
интересную структуру более низких слоев окалины, образующейся
в области высоких температур. Верхний слой окалины представлял
собой спеченные пластинки желтовато-белого цвета с более низким
пористым слоем. Затем следовали черный, хорошо сцепленный
с поверхностью карбида слой, металлическое кольцо (включения),
слой с интерференционным окрашиванием (желтый, зеленый,
голубой, синий, фиолетовый) и поверхностный слой окисленного кар-
68
№/SyMZ/CM
Рис. 29. Кинетические кривые
окисления карбида ниобия:
/ — 500; 2 — 550; 3 — 600; 4 — 800; 5 —
900; 6 — 1000; 7 — 1100; 8 — 1200° С.
Рис. 30. Кинетические кривые
окисления ниобия:
1 — 500; 2 — 600; 3 — 700; 4 — 800; 5 —
900; 6 — 1000; 7 — 1200° С.
бида коричневого цвета. Послойный рентгеновский фазовый анализ
показал, что интерференционное окрашивание можно отнести к суб-
окисным фазам NbO^., NbOy) NbOz, как и при 550° С.
Металлическое кольцо состояло из ниобия, а темная фаза представляла собой
окисел Nb02. Авторы [1.48] относят появление фаз Nb и Nb02
в слое окалины при высоких температурах не за счет прямого
окисления карбида NbC и оксикарбида ниобия, а за счет восстановления
фазы окисла Nb02 углеродом. Однако, учитывая механизм
окисления NbC, протекающего, как и окисление карбидов металлов IVa—
Va подгрупп и VC, путем растворения кислорода в карбиде, а
также выделения металла и углерода, можно предположить, что окисел
Nb02 получается при окислении выделяющегося во внутренних
слоях окалины ниобия. Металлические кольца в слое окалины
обнаружены и при окислении TiC в широком интервале температур.
Механизмы окисления ниобия и его карбида отличаются между
собой. Так, если чистый ниобий при 500° С окисляется более
интенсивно, чем при 600° С, что связано с его разрушающим окислением
в условиях формирования субокисной фазы NbOz, то уже при
600° С вследствие ее неустойчивости формируется окисел Nb206
через фазу Nb02. Это определяет более низкую скорость окисления
не только ниобия, но и его карбида при температуре 600° С. Характер
кинетической кривой свидетельствует о защитных свойствах
окисной пленки. Поскольку углерод до 500° С не окисляется
(незначительное окисление начинается лишь при температуре 600° С),
можно сравнивать величины окисления, полученные из
кинетических данных. В области температур вплоть до 500° С NbC
окисляется со значительно меньшей скоростью, чем металлический
ниобий.
Это объясняется особенностями растворения кислорода в
карбиде и металлическом ниобии. В первом случае растворение
кислорода сопровождается замещением углерода и образованием
оксикарбидных твердых растворов, что несколько уменьшает возможность
формирования субокисных фаз. Окисление ниобия в данных
условиях сопровождается образованием стабильной при данной
температуре фазы NbOz, вызывающей разрушение поверхностных слоев
образца. С дальнейшим ростом температуры (600° С), когда
субокисел ЫЬОг становится неустойчивым, скорость окисления ниобия
и его карбида уменьшается. Однако скорость окисления карбида
ниобия при 550° С значительно возрастает, а при 600° С становится
намного выше скорости окисления ниобия. В этом проявляется
роль оксикарбидных твердых растворов ниобия,
характеризующихся наличием вакансий в обеих подрешетках [1.19]. При
температуре выше 700° С наблюдается переход к линейной зависимости,
связанный с появлением рыхлых слоев из Nb205. При дальнейшем
повышении температуры вследствие окисления углерода и
образования газообразных продуктов реакции сравнение данных
кинетических исследований становится невозможным.
С помощью рентгеновского фазового анализа установлено,
что в процессе окисления карбида ниобия и чистого ниобия фазы
a-Nb205 и P-Nb205 появляются в одних и тех же температурных
интервалах: a-Nb205 — вплоть до 900° С, а при 1000° С основное
содержание окалины составляет фаза P-Nb205. Полученные
результаты свидетельствуют о том, что в процессе окисления карбида
ниобия углерод не стабилизирует высокотемпературную
модификацию p-Nb2Os и полиморфное превращение протекает в обычном
для ниобия температурном интервале.
Окисление ТаС
Карбид тантала (рис. 31, 32) в интервале температур 500—700° С
характеризуется довольно низким сопротивлением окислению,
хотя и более высоким, чем карбид ниобия [2.1, 2.3, 2.5] и чистый
тантал. При окислении NbC при температуре 800° С образуется
порошкообразный окисел. Образцы ТаС вплоть до 1000° С
сохраняют свою исходную форму, и лишь при 1100 и 1200° С
начинается растрескивание окалины, сопровождающееся увеличением
скорости процесса [2.1, 2.3]. Растворение кислорода в карбиде
тантала также сопровождается выделением углерода и тантала
в слой окалины на начальной стадии процесса (см. табл. 10) и
созданием зоны твердого раствора оксикарбидных фаз, микротвердость
которых уменьшается в направлении границы окалина — карбид,
где концентрация растворенного кислорода больше (см. рис. 26).
70
Рис. 31. Внешний вид окисленных образцов карбида тантала:
а ~ 700; б — 800; в — 900; г — 1000; д — 1100: е — 1200: ж — 1200° С (пористый)
Интересно отметить, что в области низких температур (600° С)
в зоне оксикарбидных твердых растворов происходит клиновидное
растрескивание образцов ТаС вдоль всей боковой поверхности,
хотя с дальнейшим повышением температуры оно не наблюдается
(рис. 33, а, см. вклейку) 12.34, 2.35]. Это может быть обусловлено,
как и при окислении тантала, появлением пластинок метастабиль-
ной фазы субокисла Та02 в местах дефектов структуры с
последующим образованием на них окисла Та205 и клиновидным врастанием
его в матрицу. Клиновидное врастание окалины в металл и вызывает
катастрофическое окисление тантала при 600° С, когда стабилен
окисел Та02 [2.34; 2.35]. В процессе окисления оксикарбиды
переходят непосредственно в фазу |3-Та205 и углерод, который
выделяется на границе окалина — карбид (рис. 33, б). Формирование
окалины путем распада оксикарбидных фаз отражается также на ее
морфологических особенностях и фазовом составе. При температуре
700—900° С окалина двухфазная с диспергированным в ней
углеродом, а слой карбида вблизи границы окалина — карбид пористый.
С ростом температуры окалина становится однородной и светлой,
очевидно, вследствие более значительного растворения углерода
в решетке (3 = Та205 или выделения газообразных окислов.
Интересно сравнить основные закономерности процесса
окисления карбида и металлического тантала. В случае окисления тантала
при 600 и 700° С наблюдается его катастрофическое окисление,
связанное с зарождением субокисной фазы ТаОг, являющейся
промежуточным продуктом, который способствует появлению пятиокиси
71
Рис. 32. Кинетические кривые окисления карбида тантала:
; — 600; 2 — 700; 3 — 800; 4 — 900; 5 — 1000: 6 — 1100: 7 — 1200° С.
тантала. Окисление тантала, как и ниобия, характеризуется
неравномерным возникновением субокисла ТаОг на поверхности металла
и клиновидным врастанием его в металл, что и вызывает
катастрофическое окисление тантала [2.34]. При более высоких температурах
(800° С) Та02 неустойчив, поэтому промежуточным продуктом
реакции становится окисел ТаО, который присутствует в виде следов
на поверхности раздела между металлом и окислом [2.34, 2.35].
Скорость окисления тантала резко понижается при 800° Сие
дальнейшим ростом температуры вновь увеличивается [2.36].
При окислении карбида тантала наблюдаются несколько иные
закономерности. При температурах 500 и 600° С образец
незначительно окисляется и покрывается тонкой, хорошо сцепленной с
основой пленкой окисла. Растворение кислорода в карбидной
матрице сопровождается главным образом замещением и выделением
углерода и образованием оксикарбидных твердых растворов.
Однако последние, несмотря на их дефектность, не вызывают
катастрофического окисления и разрушения карбида тантала, как это
наблюдалось при окислении тантала. Тем не менее роль субокисной
фазы ТаОг велика; она вызывает на окисленных при 600°С образцах
карбида тантала продольные трещины, идущие в глубь образна.
При температурах 700 и 800° С скорость процесса резко
нарастает и кинетические кривые описываются линейной зависимостью
в течение длительного времени. Однако образующаяся окисная
пленка темная и хорошо сцеплена с поверхностью образца.
72
При всех исследованных температурах карбид тантала
окисляется менее интенсивно, чем карбид ниобия (см. рис. 28, 29, 31, 32).
Г Это может быть обусловлено образованием оксикарбидов ТаС/З^
с гексагональной структурой, элементарная ячейка которых
построена более плотно по сравнению с кубической структурой
оксикарбидов ниобия [1.5, 1.18], через которые диффузия кислорода
более облегчена. Более высокая стойкость к окислению карбида
тантала по сравнению с карбидом ниобия может быть вызвана
также отсутствием (в отличие от Nb205) полиморфного превращения
окислов, увеличивающих скорость окисления ниобия и карбида
ниобия в области температур 800—900°С. Поэтому даже при 1000° С
на границе окалина — карбид тантала сохраняется хорошо
выраженный слой углерода (см. рис. 33).
Следовательно, в процессе окисления карбидов металлов IVa—
Va подгрупп, обладающих определенной областью гомогенности,
растворение кислорода в их решетке сопровождается выделением
свободного углерода и соответствующего металла,
обнаруживаемого в окалине на начальной и более поздних стадиях процесса в
широком интервале температур. С этим, по-видимому, связано
уменьшение микротвердости оксикарбидных твердых растворов с ростом
содержания кислорода в направлении границы окалина — карбид.
Полученные результаты согласуются с данными о наличии
дефектности в металлической и метеллоидной подрешетках
оксикарбидных фаз [1.1—1.6, 1.9—1.15, 1.18, 1.20].
Различный механизм окисления карбидов металлов и чистых
металлов V группы и выделение газообразных продуктов при
окислении карбидов определяют и вид соответствующих кинетических
кривых [2.36].
ОКИСЛЕНИЕ КАРБИДОВ МЕТАЛЛОВ
Via ПОДГРУППЫ
До настоящего времени фазы переменного состава на основе
карбидов металлов Via подгруппы, содержащие кислород и азот, мало
изучены. Имеющиеся сведения о составах и равновесных
состояниях, которые позволили бы описать переход Сг3С2, Мо2С и WC
к соответствующим окислам, недостаточны. В системе Мо — С [2.37]
обнаружены твердые растворы Мо2 (С, N) с гексагональной плотно-
упакованной структурой, а в системе W — С [2.38]—структуры
WC и W2C с некоторым количеством азота в твердом растворе.
Термодинамические основы
высокотемпературного окисления карбидов
металлов Via подгруппы
Для выяснения возможного механизма взаимодействия карбидов
металлов Via подгруппы с кислородом проведен
термодинамический расчет термодинамического потенциала всех возможных
73
реакций взаимодействия карбидов металла Via подгруппы с
кислородом (азотом) (рис. 34) [14]:
V2Cr3Q + 02
Сг3С2 + 02
1/2Cr3C2 -f- 02
Сг3С2 + 02 --
4/13Сг3С2 + 02 =
/17СГ3С2 "Т" ^2 ~
23/14Сг3С2 + 02 =
23/28Сг3С2 + О, =
u/6Cr3C2 + 02
7/5Сг3С2 + О, =
4/2iCr7Q + 02 =
4/27Сг7С3 + 02 =
4/ззСг7С3 + 02 =
4/б9Сг23С6 + 02 =
4/8iCr23Ce + 02 =
4/9зСг23С6 + 02 =
%Сг3С2 + 02 =
2/3Сг3С2 + N2
4/3Сг3С2 + N,
- 3/2Сг + С02,
= ЗСг + 2СО,
= /2СГгаз "Т v-vJ2,
= ЗСГгаз + СО,
%3Сг203 + %3СО,
'17^-r2V3 + /17С02,
= 3/14Cr23Ce + 2СО,
= /гвСггзСе + С02,
= 6/5Cr7C3 + 2CO,
= 3/5Сг7С3 + С02,
= %сг а + 4/7с,
14/27Сг203 + */9СО,
14/ззСг203 + Vi,C02,
= 46/C9Cr203 + 8/23С,
= 46/81Сг203 + 8/27СО,
4С/9зСг203 + 8/3iC02,
= 2/3Cr203 + 8/9C,
= 2CrN + 4/3C,
= 2Cr2N + 8/3C.
12.19)
(2.20)
(2.21)
(2.22)
(2.23)
(2.24)
(2.25)
(2.26)
(2.27)
(2.28)
(2.29)
(2.30)
(2.31)
(2.32)
(2.33)
(2.34)
(2.35)
(2.36)
(2.37)
Как следует из рис. 34, реакции взаимодействия карбида хрома
с кислородом, идущие с образованием твердых и газообразных
продуктов, могут иметь место во всей исследованной области
температур. Исключение составляют лишь реакции, протекающие с
выделением газообразного хрома; они возможны в области более
высоких температур.
Наиболее предпочтительна реакция взаимодействия карбида
хрома с кислородом, продукты которой содержат металлический
хром и углекислый газ. В области высоких температур (> 1000° С)
наиболее высоким термодинамическим потенциалом
характеризуется реакция, идущая с получением свободного хрома и окиси
углерода. Возможность ее прохождения увеличивается с повышением
температуры. Все остальные реакции взаимодействия карбида
хрома с кислородом менее термодинамически вероятны. К ним
относится реакции, продукты которых содержат Сг203 и СО (2.23)
или Сг203 и СОа (2.24), а также низшие карбиды хрома и СО, СОа
(2.25) — (2.28).
Следует отметить, что возможность протекания реакций
взаимодействия с формированием низших карбидов хрома и окиси угле-
74
Рис. 34. Зависимость термодинамического потенциала от
температуры реакций взаимодействия карбида хрома с кислородом
при давлении кислорода 760 (/) и 10~5 тор (//) (номера
кривых соответствуют номерам уравнений реакций). •
^,ккал/моль
-100
При температуре 2000 К реакция,
Рис. 35. Зависимость
термодинамического потенциала от температуры
реакций взаимодействия карбидов
молибдена и вольфрама с
кислородом при Р = 760 тор (номера
кривых соответствуют номерам
уравнений реакций).
рода (2.25), (2.27)
увеличивается с ростом температуры,
а термодинамический
потенциал реакций получения этих
карбидов и углекислого газа
(2.26), (2.28) почти не
зависит от температуры. В
отличие от перечисленных
реакции взаимодействия Сг3С2 с
кислородом, идущие с
выделением газообразного хрома
и двуокиси (2.21) или окиси
углерода (2.22), начинаются
только выше 1000 и 1800 К.
в продуктах которой содержатся
газообразный хром и углекислый газ (2.21), характеризуется самой
высокой термодинамической вероятностью протекания, за
исключением реакций (2.19) и (2.20).
Таким образом, в процессе окисления карбида хрома Сг3С2
наиболее вероятны реакции, идущие с образованием свободного
хрома и газообразных окислов углерода, а реакции, в результате
которых получаются газообразный хром и окисел углерода,
протекают лишь в области высоких температур.
Взаимодействие карбида хрома с азотом менее предпочтительно
и возможно только в области довольно низких температур (ниже
1000° С).
Давление кислорода влияет на возможность протекания
реакций окисления карбида хрома. С понижением давления кислорода
термодинамическая вероятность их прохождения уменьшается,
а некоторые реакции становятся термодинамически невозможными.
Так, реакция взаимодействия карбида хрома с кислородом с
образованием свободного хрома и углекислого газа при давлении
10~5 тор полностью прекращается при высоких температурах
(выше 2000 К)- Реакции (2.21) и (2.22), продукты которых
представлены газообразным хромом и окислами углерода, с уменьшением
давления протекают только в области более высоких температур.
Например, реакция (2.22) при Р = 760 тор термодинамически
возможна при температурах выше 1700 К, при Р = 150 тор — выше
2000 К, при Р = Ю-5 тор — 2400 К. Реакция (2.21) образования
газообразного хрома и углекислого газа в случае Р=760тор проте-
76
кает при температуре выше 1000 К, а при Р = 10~"5 тор она
невозможна во всем исследованном интервале температур.
Таким образом, установлено, что в системе карбид хрома —
кислород наиболее предпочтительны реакции взаимодейстия,
идущие с получением свободного хрома и окислов углерода, а также
газообразного хрома и окислов углерода. Высока степень
вероятности прохождения реакций (2.25) — (2.28). Это указывает на
возможность преимущественного окисления углерода по сравнению
с хромом.
На рис. 35 представлена зависимость термодинамического
потенциала реакций взаимодействия карбидов молибдена и
вольфрама (Мо2С, W2C, WC) с кислородом:
4WC + 02 = 2W2C + 2CO, (2.38)
2WC + 02 = W2C + С02, (2.39)
V.W.C + 02 = V.WO, + V.C, (2.40)
Vi3W2C + 02 = 8/13W03 + «/вСО, (2.41)
V4W2C + 02 = V.WO, + V4C02, (2.42)
V2W2C + 02 = W02 + V2Q (2.43)
2/6W2C + 02 - */BW02 + 2/BCO, (2.44)
V3W2C + 02 = 2/,W02 + V3C02, (2.45)
V2WC + 02 = V.WO, + V.CO, (2.46)
2/6WC + 02 = 2/BW03 + 2/6C02, (2.47)
2/7Mo2C + 02 - 4/7Mo03 + 2/7CO, (2.48)
V4Mo2C + 02 = VaMoOg + V«C08, (2.49)
WC + 02 = W + C02, (2.50)
2WC + 02 = 2W + 2CO, (2.51)
Mo2C + 02 == 2Mo + COa, (2.52)
2Mo2C + 02 =» 4Mo + 2CO, (2.53)
V3Mo2C + 02 = 2/3Mo03 + V3C, (2.54)
%WC + 02 = %W03 + 2/3C, (2.55)
2Mo2C + N2 = 2Mo2N + 2C. (2.56)
Все реакции взаимодействия указанных карбидов с
кислородом термодинамически возможны в интервале температур 298—
2000 К. При более высоких температурах (выше 1000 К) наиболее
вероятны реакции взаимодействия карбида с кислородом,
характеризующиеся формированием низшего карбида и окиси углерода
(2.38) или низшего карбида и двуокиси углерода (2.39). Следует
отметить, что образование окислов соответствующих металлов
и окислов углерода (2.46), (2.47) и (2.48), (2.49) более
предпочтительно, чем окислов металлов я свободного углерода (2.54), (2.55).
77
В области высоких температур более возможны реакции,
протекающие с получением свободного вольфрама (или молибдена) и
двуокиси углерода (2.50), (2.52).
Реакции выделения свободных металлов (молибдена и
вольфрама) и окиси углерода (2.51), (2.53) менее вероятны;
термодинамическая возможность их протекания растет с увеличением
температуры.
В отличие от WC и Мо2С, при окислении карбида хрома реакции,
продукты которых содержат свободный хром, характеризуются
наиболее высоким термодинамическим потенциалом.
Взаимодействие карбида молибдена с азотом протекает только
в области низких температур.
Окисление Сг3Сг
Анализ полученных кинетических данных (рис. 36, 37) и
металлографические исследования свидетельствуют о высокой стойкости
к окислению карбида хрома в широком интервале температур [2.1,
2.3, 2.5, 2.36, 2.39]. Металлографические и визуальные
наблюдения, а также рентгеновский фазовый анализ показали, что в
отличие от карбидов металлов IVa—Va подгрупп окисление карбида
хрома Сг3С2 не сопровождается выделением углерода и хрома.
Значительное увеличение микротвердости (рис. 38), приводящее
к росту микротвердости газонасыщенных зон, как и в случае
окисления металлов, может быть обусловлено внедрением кислорода
в октаэдрические междоузлия.
Окисление Сг3С2 и WC на начальной стадии процесса (600—
1000° С, 4 мин) сопровождается значительным повышением
микротвердости поверхностных зон (лз 100 мкм), а на более поздних
стадиях — увеличением микротвердостн по всей глубине
окисленных образцов, которая не изменяется с ростом температуры.
Это влияет на особенности процесса формирования окалины. В
отличие от карбидов металлов IVa—Va 'подгрупп, при окислении
Сг3С2, по-видимому, происходит химическое взаимодействие
элементов, составляющих карбид, с кислородом (азотом).
Действительно, исследование окисления карбида хрома при небольших давле-
Рис. 36. ьнешний вид окисленных образцов карбида хрома:
а — 900; б — 1000; в — 1100; г — 1200° С.
78
ш/з,мг/см2
if
Рис. 37. Кинетические кривые окисления карбида хрома на воздухе:
/ — 700; 2 ~ 800; 3 — 900; 4 — 1000; 5 — 1100; 6 — 1200° С.
ниях кислорода (рис. 39) совместно с результатами
термодинамических расчетов (см. рис. 34) позволило установить ряд интересных
закономерностей. При окислении карбида хрома при небольших
давлениях кислорода наблюдается только убыль массы при всех
исследованных температурах и давлениях. Более существенно
влияет изменение температуры — с ее повышением убыль массы
сильно увеличивается, в то время как изменение давления от Ю-5 до
150 тор не оказывает заметного влияния на кинетические
характеристики процесса.
Согласно металлографическим исследованиям, при окислении
карбида хрома свободный углерод не выделялся, как это имело
место при окислении карбидов металлов IVa—Va подгрупп, что
указывает на иной тип взаимодействия Сг3С3 и кислорода.
При давлении 10—Е тор взаимодействие избирательное, в
первую очередь по границам зерен. Здесь уже при температуре 500° С
отчетливо наблюдается выделение металлического хрома и его
окислов темного цвета. С ростом давления кислорода (Ю-1 и
150 тор) выделение хрома по границам, свидетельствующее об
интенсивности протекания процесса, становится более
выраженными.
С повышением температуры выделение хрома наблюдается более
отчетливо, но одновременно появляется и большое количество
темных окислов хрома, постепенно покрывающих поверхность образца.
Хром выделяется в процессе окисления, но его можно обнаружить
лишь на начальных стадиях процесса и при более низких
температурах (600° С). При высоких температурах и на более поздних
79
нл,кг/ммг
3000V
Расстояние от поберхности>мм
Рис. 38. Изменение микротвердости по сечению окисленных
образцов карбидов ванадия (1), хрома (2) и молибдена
(3-5):
1 — 500—1100; 2 — 600—1200; 3 -=. 500. 600; 4 — 800; 5 — 900;
6 — 1000° С.
стадиях вследствие быстрого окисления хрома в окалине
обнаруживается лишь окисел Сг203.
Результаты кинетических исследований окисления карбида
хрома при небольших давлениях кислорода (см. рис. 39) становятся
понятными, если учесть данные термодинамических расчетов.
Наиболее предпочтительными реакциями взаимодействия карбида
хрома с кислородом являются такие (2.19), (2.20), продукты
которых представлены металлическим хромом и окислами углерода во
всем исследованном интервале температур, а при более высоких
температурах — реакции с образованием газообразного хрома
и окислов углерода (2.21), (2.22). Они все протекают с убылью
массы. По данным металлографических исследований и
рентгеновского фазового анализа окисление Сг3С2 при небольших давлениях
кислорода сопровождается выделением металлического хрома
преимущественно по границам зерен. Это свидетельствует о том, что
взаимодействие Сг3С2 с кислородом при небольшом его давлении
протекает преимущественно по реакциям (2.19) — (2.22) и
сопровождается убылью массы. Большую роль здесь играют и реакции
(2.25) — (2.28), продукты которых содержат низшие карбиды
хрома Сг7С3, Сг23С6 и окислы углерода. Наблюдаемая значительная
убыль массы с повышением температуры может быть связана с тем,
что с увеличением температуры растет термодинамическая
вероятность протекания реакций (2.20) — (2.22), идущих с образованием
газообразных продуктов СО, С02 и О.
При температурах 500 и 1000° С давление кислорода не
оказывает заметного влияния на кинетические характеристики процесса
вследствие преимущественного протекания реакций взаимодействия
карбида хрома с кислородом по реакциям (2.19) — (2.22).
80
Рис. 39. Кинетические кривые окисления
карбида хрома при температурах 500
{1—3) и 1000° С (4—6) и давлении
кислорода 10~5 (/, 4), 150 (2, 5) и Ю-1 тор (3, 6).
При окислении Сг3С2 на воздухе
(Ро2=150 тор, * =500 и 1000° С)
выделяется металлический хром,
причем это даже более выражено, чем
при более низких давлениях
кислорода. Одновременно здесь хром
окисляется до фазы Сг2Оа,
образующейся также по реакциям (2.23),
(2.24). Азот воздуха способствует
появлению новых продуктов —
нитридов CrN и Cr2N. Данный
процесс возможен вплоть до 1000 К и
уменьшается с ростом температуры.
В связи с этим при окислении карбида хрома на воздухе до
температуры 1200° С кинетические кривые характеризуются небольшим
приростом массы и ростом окисной пленки, состоящей из Сг203 и
следов нитрида хрома.
Окисленные образцы карбида хрома при температурах 1000
и 1100° С покрыты двухслойной окисной пленкой. Верхний слой
состоит из окисла Сг203 зеленого цвета. В нижнем слое этот окисел
находится в виде дисперсных включений темного цвета. Во
внутреннем слое окалины имеется низший карбид хрома Сг7С3, что
соответствует данным термодинамических расчетов [14] и свидетельствует
о предпочтительном окислении углерода кислородом. Расход
углерода из карбида значительно превосходит расход хрома [1.53].
Образование фаз Сг203 и Сг7С3 является и термодинамически
возможной реакцией взаимодействия Сг3С2 с кислородом [14] Высокое
сопротивление окислению Сг3С2 можно объяснить тем, что
растворение кислорода в карбиде сопровождается не выделением
углерода и свободного хрома с образованием дефектных
оксикарбидных твердых растворов, как это наблюдается при окислении
карбидов металлов IVa—Va подгрупп, а адсорбцией его структурными
дефектами, созданием зоны с повышенной микротвердостыо и
защитной окалины из окисла Сг203, затрудняющего диффузию
кислорода.
Увеличение скорости окисления Сг3С2 при 1250° С происходит
вследствие отслаивания окалины, обусловленной выделением
газообразной окиси углерода. Свободный хром в окалине появляется
при восстановлении окисла Сг203 углеродом [14].
Произведена оценка вклада процесса испарения металлического
хрома при окислении Сг3С2 [1.53]. Установлено, что скорость
испарения металлического хрома увеличивается в три раза при
повышении температуры на каждые 100° от 900 до 1000° С. При более высоких
292Г 81
/im/S, мг/смг
О 1 2 r^v
температурах (при переходе от 1100 к 1200° С) скорость
испарения значительно уменьшается (примерно в 20 раз) в связи с сильно
увеличивающейся скоростью окисления хрома.
Начиная с температуры 1200° С, Сг203 взаимодействует с Сг3С2
с образованием низшего по содержанию углерода карбида Сг7С3
и некоторого количества хрома [2.40]. Карбид Сг7С3 при более
высоких температурах (1400° С) реагирует с избыточной окисью хрома
до выделения металлического хрома:
2Сг203 + ЗСГдСг = Сг7С3 + 6Сг + ЗС02,
2Cr203 + 3Cr3C2 = 13Cr + 6CO,
Сг7С3 + Сг203 = 9Сг + ЗСО.
Таким образом, при окислении карбида хрома в среде
кислорода и на воздухе преимущественно окисляется углерод. Об этом
свидетельствуют данные кинетических исследований окисления
Сг3С2 в среде кислорода при небольшом его давлении (убыль массы)
и выделение хрома на поверхности окисленных образцов,
указывающее на значительную роль реакций (2.19), (2.20), которые
термодинамически наиболее возможны, а также образование на
внутренней границе окалина — карбид Сг3С2 низших карбидов
Сг7С3 и Сг3С6. Как показали термодинамические расчеты [14],
реакции образования низших карбидов хрома и окислов углерода
(2.25) — (2.28) характеризуются высокой термодинамической
вероятностью, что подтверждают и данные [1.53] по кинетике
образования твердых газообразных продуктов.
Окисление МогС
В интервале температур 500—800° С карбид молибдена окисляется
еще незначительно, однако с дальнейшим ростом температуры
вследствие летучести фазы Мо03, которая является основной
составляющей окалины (см. табл. 10), резко увеличивается скорость
процесса, протекающего с потерей массы (рис. 40, 41) [2.1, 2.5].
В отличие от карбида хрома окисление карбида молибдена
сопровождается выделением углерода в поверхностном слое и на
82
бт/S, мг/см2
-wo
-200-
-300
IT" """U w
■о о о
-*_|
т,ч
Рис. 41. Кинетические кривые окисления карбида молибдена:
1 — 500; 2 — 800; 3 — 900; 4 — 1000; 5 — 1100; б — 1200° С.
границе окалина — карбид, но в значительно меньшей мере, чем
при окислении карбидов металлов IVa—Va подгрупп при тех же
температурах. Стадия растворения кислорода в решетке Мо2С
определяет скорость его окисления в начальный период окисления
[1.45].
Внедрение кислорода в решетку Мо2С вызывает уменьшение
микротвердости тонкого поверхностного слоя толщиной в 150 мкм,
примыкающего к границе окалина — карбид, в начальный период
взаимодействия, а при глубоком протекании процесса на более
длительных стадиях ширина зон твердых растворов значительно
увеличивается (см. рис. 38). Это влияет также на морфологические
особенности и фазовый состав окалины. При низких температурах
(500—700° С) окалина тонкая, светло-серая и состоит из низших
окислов Мо203; на границе окалина — карбид имеется тонкая
прослойка из углерода. Однако с ростом температуры окалина
становится пористой, многослойной и состоит из внешнего бурого слоя
Мо03 и внутреннего Мо203, отчетливо наблюдается прослойка
углерода (см. табл. 10).
Свободный углерод в рассматриваемых процессах играет особую
роль. Будучи хорошим восстановителем окисла Мо03 в области
низких температур (см. рис. 27), углерод может значительно
затруднять переход низших окислов молибдена в трехокись молибдена.
Этим, по-видимому, и объясняется довольно высокое сопротивление
окислению карбида молибдена в области температур 500—800° С,
где еще формируются низшие окислы молибдена Мо203 и
наблюдается резкая убыль массы при более высоких температурах,
связанная с образованием фазы Мо03. Однако и в данном случае
6*
83
углерод способствует формированию слоя низшего окисла Мо4Ош
прилегающего к прослойке из углерода (см. табл. 10).
Кинетические характеристики процесса, а также
морфологические особенности окалины и поверхности окисленных образцов, их
значительная пористость, увеличивающаяся с ростом температуры,
свидетельствуют о значительной роли газообразной трехокиси
молибдена при окислении. Увеличение летучести МоОэ при
температурах выше 800° С вызывает формирование пористой окалины,
постепенное сгорание углерода и утрату защитных свойств окалины.
Окисление WC
Внешний вид окисленных образцов (рис. 42) и данные кинетических
исследований (рис. 43) свидетельствуют о довольно низкой
стойкости карбида вольфрама к окислению. Наблюдаются интересные
закономерности процесса окисления WC [2.1, 2.5]. Внедрение
кислорода в решетку карбида вольфрама уже при низких температурах
не сопровождается выделением углерода и вольфрама (рис. 44,
см. вклейку). Незначительное увеличение микротвердости,
одинаковой по всей толщине окисленных образцов, не изменяется с
ростом температуры.
Это может быть обусловлено адсорбцией кислорода
структурными дефектами (см. рис. 38). При температуре 500° С появляется
многоцветная окисная пленка, состоящая из окислов a-j3-v-W03
и (3-W02 (см. табл. 10). С дальнейшим повышением температуры
образуется темный и темно-зеленый слой окалины из W03 с
тенденцией к отслаиванию по краям образцов. При более высоких
температурах (1100° С) окалина состоит из слоя с отчетливой структурой;
границы зерен окалины обложены темными включениями
углерода (см. рис. 44).
Различные особенности растворения кислорода в карбиде
молибдена и вольфрама влияют па некоторые кинетические
характеристики процесса их окисления. Более высокое сопротивление
окислению МоаС по сравнению с WC в области температур 500—
800° С может быть вызвано тем, что прослойка свободного углерода
на фазовой границе окисел — карбид замедляет скорость образо-
Рис. 42. Внешний вид окисленных образцов карбида вольфрама:
а — 500; б — 600; в — 700; г — 800; д — 900; е — 1000; ж — 1100; з — 1200° С.
84
Рис. 43. Кинетические кривые
окисления карбида вольфрама:
/ — 500; 2 — 600; 3 — 700; 4 — 800;
5 — 900; 6 — 1000; 7 — 1100; 8 —
1200° С.
Ат/Б^мг/см2
вания летучей фазы Мо03 и
определяет образование и
низших окислов, в то время как
при окислении WC слой
свободного углерода отсутствует
и формируется лишь высший
окисел W03. Однако с ростом
температуры вследствие
летучести Мо03 и W03 скорость
процесса резко
увеличивается. В этом случае из-за
образования рыхлой окалины
и интенсификации процесса
газовыделения СО(С02), а
также повышения
летучести окислов Мо03 и W03
скорость процесса зависит не от диффузии кислорода через слой
окалины, а от взаимодействия карбида с кислородом на фазовой
границе окалина — карбид. Углерод в виде газообразных окислов
легко удаляется из окалины и от границы окалины — карбид.
Растворение кислорода в карбиде вольфрама,
сопровождающегося лишь его адсорбцией структурными дефектами решетки и
резким увеличением микротвердости (см. рис. 38), вызывает
значительное его охрупчивание, это приводит к быстрому разрушению
карбида без образования слоя окалины незначительной толщины
(см. рис. 42). Напротив, замещение углерода в процессе
растворения кислорода в Мо2С с формированием зоны твердого раствора
исключает значительную адсорбцию кислорода (азота) и
охрупчивание карбида с последующим его разрушением (см. рис. 40).
Таким образом, различный механизм окисления карбидов
металлов Via подгруппы объясняется особенностями растворения
кислорода в их решетке, связанными с отсутствием или существованием
определенной области гомогенности, а также со свойствами
появляющегося слоя окалины. В карбидах хрома и вольфрама в отличие
от карбидов металлов IVa—Va подгрупп растворение кислорода
характеризуется не замещением углерода в анионной подрешетке,
а только адсорбцией кислорода структурными дефектами решетки.
Это вызывает увеличение микротвердости окисленных образцов
Сг3С2 и WC, не изменяющейся по глубине образца с ростом
температуры. При внедрении кислорода в решетку карбида Мо2С, как
и в случае окисления карбидов металлов IVa—Va подгрупп,
происходят замещение углерода в анионной подрешетке карбида и его
выделение с образованием оксикарбидных твердых растворов с
85
более низкой микротвердостью, чем исходный карбид. Сравнительно
высокие скорости окисления карбида молибдена при высоких
давлениях кислорода и низких температурах авторы [1.45]
объясняли значительным растворением кислорода в Мо2С. При окислении
Сг3С2 вследствие адсорбции кислорода появляются слои с
повышенной микротвердостью, которые препятствуют дальнейшей диффузии
кислорода, и защитные пленки из окисла Сг203 определяют
исключительно высокую стойкость против окисления Сг3С2.
Окисление карбидов хрома и вольфрама протекает по
механизму более простому по сравнению с механизмом окисления карбидов
металлов IVa—Va подгрупп:
Cr,Qs + Oa^Cr + C08,
Сг3С2 + 02->Сг203-ЬС02,
WC + 02->W08 + C02.
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОЦЕССА
ОКИСЛЕНИЯ КАРБИДОВ МЕТАЛЛОВ
IVa—Va ПОДГРУПП
С помощью металлографических и электронно-микроскопических
исследований показано, что механизм высокотемпературного
окисления карбидов металлов IVa—Via подгрупп определяется
следующими факторами:
закономерностями растворения кислорода в карбидах;
особенностями дефектной структуры окислов соответствующих
металлов, определяющими формирование окалины и ее свойства;
процессами взаимодействия на фазовой границе окалина —
карбид.
Внедрение кислорода в решетку карбидов металлов IVa—Va
подгрупп, характеризующихся существованием определенной
области гомогенности (карбиды металлов IVa—Va подгрупп и Мо2С),
сопровождается выделением свободного углерода (см. рис. 6, в, г;
17, 22, 25) и соответствующего металла (рис. 6, а, б; 8, 9) с
образованием широкой зоны оксикарбидных твердых растворов с
меньшими по сравнению с исходным карбидом периодом решетки и
микротвердостью, уменьшающейся с повышением содержания
кислорода (см. рис. 7, 18, 26).
Двойная дефектность в решетках кубических твердых
растворов типа NaCl на основе переходных металлов IVa—Va подгрупп,
появляющаяся в процессе окисления, является, согласно [21—23,
24], следствием гетеродесмичности существующих в них связей
и определяется условиями экранирования взаимодействий Me—Me
атомами неметалла (кислорода). Авторы [1.4, 1.12] появление
структурных вакансий в металлической подрешетке карбидов и
нитридов в свете работ [21, 1.93, 2.41] связывают с тенденцией к
сохранению в устойчивых фазах постоянства числа внешних валентных
электронов, приходящихся на пару узлов элементарной ячейки,
86
в соответствии с чем замещение атомами кислорода атомов углерода
и азота приводит к снижению числа атомов в металлической подре-
шетке.
Наличие структурных вакансий в тугоплавких соединениях
иногда приводит к возникновению упорядочения. Нейтронно-
структурными исследованиями оксикарбида титана состава,
близкого к эквиатомному (TiC0.44O0.57), показано, что в этом соединении
атомы кислорода и углерода расположены в металлической годре-
шетке не статистически, а упорядоченно [1.67].
Таким образом, полученные результаты изучения процессов
окисления карбидов переходных металлов IV—V групп —
выделение из решетки карбидов в процессе растворения кислорода металла
и углерода и создание таким образом вакансий в обеих подре-
шетках — согласуются с теоретическими представлениями [21—23].
Действительно, атомы неметалла (С, N, О) экранируют связи
Me—Me [21, 22, 23, 24]. Согласно [1.55, 1.59. 1.66], в случае
комплектной структуры кубических фаз (типа NaCl) систем металл —
IVa — Va подгрупп — С — N — О обменные взаимодействия
электронов Me—Ме-связи и заполненных оболочек атомов
неметалла (С, N, О), а также кулоновское отталкивание приведут к
увеличению энергии системы (эффект экранирования). Эффект
экранирования увеличивается с ростом концентрации атомов неметалла,
степени перекрывания dg-орбиталей атомов металла и числа
электронов, участвующих в связи Me—Me. В условиях сохранения
структуры тг;па NaCl перевод энергетически невыгодных
экранированных взаимодействий Me—Me в неэкранированные приводит
к образованию вакансий, число которых растет с увеличением
степени экранирования.
Следует отметить, что синтезированные препараты оксикарби-
дов металлов IV—V групп [1.1—1.15, 1.18—1.20] и полученные
в процессе растворения кислорода в решетке карбидов [1.25—1.27]
характеризовались наличием вакансий в металлической и
металлоидной подрешетках. С повышением содержания кислорода степень
заполнения элементарной ячейки оксикарбидов МеС^.0^ убывает
за счет подрешетки как неметалла, так и металла [1.2, 1.4, 1.6,
1,9, 1.11]. Ход концентрационной зависимости степени заполнения
решетки оксикарбидов в соответствии с работами [21, 193, 2.41]
обусловлен тенденцией к сохранению постоянства средней
плотности валентных электронов (средняя плотность валентных электронов
не зависит от состава) [1.4, 1.12, 1.14].
Появление вакансий в обеих подрешетках карбидов в
поверхностной зоне в процессе окисления служит основной причиной их
невысокой стойкости против окисления, установленной
экспериментально. Дефекты облегчают дальнейшее протекание диффузионных
процессов в карбидной матрице. Поэтому при одинаковых условиях
окисления диффузионная зона на титане и цирконии составляет
несколько сот микрометров [2.23, 2.31], в то время как на
соответствующих карбидах она больше в несколько раз
87
Выделение углерода и соответствующего металла в процессе
окисления компактных беспористых образцов карбидов металлов
IVa—Va подгрупп происходит за счет образования более дефектных
чем исходный карбид, оксикарбидных твердых растворов. В
результате этого, вероятно, уменьшается микротвердость поверхностных
зон оксикарбидных твердых растворов с увеличением содержания
кислорода в направлении границы карбид — окалина и с
повышением температуры (см. рис. 7, 18, 26).
Образование двойной дефектности в процессе окисления
карбидов металлов IV—V групп влияет, по-видимому, на скорость
окисления в области низких и высоких температур. При невысоких
температурах, когда коэффициенты поверхностной и межкристаллит-
ной диффузии значительно больше коэффициента объемной
диффузии, влияние дефектности оксикарбидных фаз должно
сказываться в меньшей степени, чем площадь реакционной поверхности.
Поэтому при невысоких температурах карбиды металлов IVa—Va
подгрупп характеризуются довольно близкими значениями
степени окисления (см. рис. 4, 15, 24, 29, 32).
С повышением температуры все большее значение приобретает
увеличение коэффициента объемной диффузии, непосредственно
связанное со степенью комплектности кристаллической решетки,
в связи с чем стойкость против окисления карбидов быстро
уменьшается. В этом случае в условиях создания оксикарбидных твердых
растворов с двойной дефектностью решетки влияние на стойкость
карбидов против окисления оказывают особенности дефектной
структуры окислов соответствующих металлов. Появление при
окислении TiC окалины из рутила, образующейся в области
температуры выше 900Q С за счет преимущественной диффузии ионов
титана наружу (лимитирующей стадией процесса является
диффузия ионов титана наружу), несколько понижает растворение
кислорода в карбиде и образование вакансий, способствующих
увеличению скорости процесса. Этим в основном и объясняется наиболее
высокая стойкость против окисления TiC среди карбидов металлов
IVa—Va подгрупп. Напротив, формирование на остальных
карбидах металлов IVa—Va подгрупп окислов дг-типа на внутренней
фазовой границе путем диффузии кислорода и значительная
рыхлость окалины вследствие высокого объемного соотношения окислов
(Nb20B, Ta205) при создании дефектов в обеих подрешетках
карбидной матрицы вызывают исключительно низкую их стойкость против
окисления. Следует также учитывать и отрицательное влияние
разрыхляющего действия газообразных продуктов (СО, С02),
влияющих в области высоких температур на сплошность окалины и ее
сцепление с основой.
Следовательно, в процессе окисления карбидов металлов IVa—
Va подгрупп микротвердость поверхностных зон оксикарбидных
твердых растворов уменьшается с увеличением содержания
кислорода в направлении границы карбид — кислород, т. е. происходит
ухудшение механических свойств этих зон.
88
Как отмечалось выше, окисление карбидов металлов IVa—Va
подгрупп сопровождается выделением металла и углерода и
созданием вакансий в металлической и металлоидной подрешетках.
Характер изменения электро- и теплофизических свойств окси-
карбидов циркония при комнатных температурах в зависимости
от концентрации дефектов в металлоидной подрешетке [1.7]
подтверждает установленный на оксинитридах титана механизм
проводимости [1.8]. За проводимость дефектных оксикарбидов
циркония ответственна зона, образующаяся на основе взаимодействия
атомов металлической подрешетки. Поэтому, как отмечалось в работе
[1.7], рост дефектов в металлоидной подрешетке оксикарбида
циркония должен приводить к увеличению доли
Zr—Zr-взаимодействий и уменьшению количества связей Zr—X. Следовательно,
увеличение дефектов в металлоидной подрешетке должно существенно
понижать механическую прочность оксикарбидов циркония.
Такое предположение подтверждается данными по температурам
плавления и микготвердости оксикарбидов циркония разного
состава с ростом концентрации дефектов в металлоидной подрешетке
понижаются температура плавления и микротвердости
оксикарбидов циркония) [1.7] и результатами работы [1.8], полученными для
оксикарбидов титана.
Следует отметить, что установленное нами выделение металлов
в процессе окисления карбидов металлов IVa—Va подгрупп
свидетельствует о создании оксикарбидных твердых растворов с
вакансиями в металлической подрешетке, что согласуется с данными
работ [1.1—1.15, 1.18—1.20, 1.25—1.27].
При замещении в МеС* части атомов углерода таким же числом
атомов кислорода из ячейки карбида должно удаляться некоторое
количество атомов металла и дополнительно углерода [1.6, 1.11].
Количества дополнительно удаляемых атомов углерода и гафния
равны. Однако имеются указания на другую закономерность
выделения металла и неметалла в поверхностный слой [1.84]. На
примере окисления TiCo.si показано, что в определенном интервале
составов количество выделившегося металла превышает в два раза
количество выделившегося углерода.
Таким образом, количество дефектов в металлоидной
подрешетке превышает количество дефектов в металлической подрешетке
[1.6, 1.11], в результате чего доля Zr—Zr-взаимодействия, вероятно,
намного больше доли Zr—Х-взаимодействия. Этим, по-видимому,
можно объяснить значительное уменьшение микротвердости
поверхностных зон оксикарбидных твердых растворов карбидов
металлов IVa—Va подгрупп, образующихся при окислении их
на воздухе, несмотря на выделение металла в поверхностный слой.
Понижение микротвердости оксикарбидных твердых растворов
в направлении границы карбид — окалина и данные работ 11.7,
1.8] свидетельствуют о том, что в процессе окисления карбидов
металлов IV—V групп происходит уменьшение механической
прочности поверхностных зон оксикарбидных твердых растворов. Это
89
может оказать решающую роль в процессе эксплуатации изделий
и деталей из карбидов металлов IVa—Va подгрупп или дисперсно-
упрочненных материалов с дисперсными добавками из этих
карбидов.
Совершенно иные закономерности наблюдаются при окислении
карбидов металлов IVa подгруппы (Сг3С2 и WC),
характеризующихся отсутствием определенной области гомогенности. Здесь
взаимодействие карбидов с кислородом также сопровождается
некоторым растворением кислорода в их решетке, однако процесс, по-
видимому, ограничивается лишь его внедрением в октаэдрические
междоузлия решеток, как и при окислении металлов. Об этом
свидетельствуют данные металлографических исследований и
рентгеновского фазового анализа — выделение углерода и металла в
поверхностный слой не обнаружено, микротвердость окисленных
образцов Сг3С2 и WC значительно повышается.
Увеличение микротвердости окисленных образцов по сравнению
с исходным карбидом, не изменяющейся по глубине и с ростом
температуры, указывает на то, что величина адсорбции кислорода
зависит только от концентрации вакансий в решетке карбида,
одинаковой во всем объеме образца и при различных температурах. Тот
факт, что углерод не выделяется, указывает на отсутствие оксикар-
бидных твердых растворов с двойной дефектностью в обеих подре-
шетках и может служить необходимым условием высокой
стойкости против окисления карбидов металлов Via подгруппы.
Действительно, образование защитной окисной пленки из Сг203
способствует исключительно высокому сопротивлению Сг3С2 окислению, в то
время как летучие окислы Мо03 и W03 обусловливают низкую
стойкость Мо2С и WC к окислению. Значительное насыщение
карбида вольфрама кислородом вследствие отсутствия защитной
окисной пленки вызывает его охрупчивание и разрушение при
отсутствии окисной пленки большой толщины.
Термодинамические расчеты показали (см. рис. 34, 35), что при
окислении карбидов металлов Via подгруппы высокой
термодинамической возможностью характеризуются реакции, протекающие
с выделением соответствующего металла и окислов углерода. Для
карбида хрома такие реакции более предпочтительны (см. рис. 34),
а с переходом к карбидам молибдена и вольфрама в области высоких
температур они также наиболее возможны по сравнению с
остальными реакциями взаимодействия WC и Мо2С с кислородом. Это
указывает на то, что при окислении карбидов вольфрама,
молибдена и особенно карбида хрома происходит преимущественное
окисление углерода с получением свободного хрома и окислов углерода
или низших карбидов и окислов углерода.
Металлографическими исследованиями поверхности окисленных
образцов карбидов и рентгеновским фазовым анализом продуктов
реакции в начальной стадии процесса установлено образование
свободного металла или низших карбидов, свидетельствующее об
избирательном окислении углерода. Кинетические данные образо-
90
вания твердых и газообразных продуктов реакции [1.53] также
подтверждают предпочтительное окисление углерода. Это позволяет
считать, что в процессе окисления карбидов металлов Via
подгруппы могут протекать следующие реакции:
ЗСг3С2 + 3/202 = Сг7С3 + 2Сг + ЗСО, 2WC -+- 02 = W2C + С02,
7Сг3С2 + 5/202 - ЗСг7С3 + 5СО, WC + 02 = W + С02,
2Сг + ■/А = СгА. W + 3/202 = W03,
4Сг7С3 + 3302 = 14Сг20, + 12С02, W2C + 402 = 2W03 + С0.2.
Экспериментальные результаты показали, что с ростом
дефектности решетки карбида значительную роль приобретает адсорбция
кислорода, а процессы замещения и выделения металла и углерода
становятся менее выраженными.
Окисление карбида TiCo.si, равного нижней границе области
гомогенности, сопровождается адсорбцией кислорода структурными
дефектами решетки и выделением преимущественно титана. Это
свидетельствует о том, что внедрение кислорода в решетку карбида
сопровождается выделением атомов углерода лишь в пределах
области гомогенности данного карбида. По-видимому, в равновесных
условиях содержание углерода в оксикарбидах не может быть
меньше, чем нижний предел области гомогенности карбида.
Стойкость к окислению исследованных карбидов существенно
зависит от их состава и температуры процесса. Для карбидов титана
и циркония в определенном интервале температур при значительной
или только анионной диффузии в процессе формирования окалины
стойкость против окисления увеличивается с ростом их отклонения
от стехиометрии. При более высоких температурах (1200° С) и на
более длительных стадиях процесса, когда преимущественную роль
в формировании окалины из рутила играет диффузия межузельных
катионов титана, ослабление сил связи в решетке карбида титана
с ростом ее дефектности облегчает выход титана в окалину,
увеличивает ее спекание, толщину спеченного слоя и скорость процесса
Механизм окисления карбидов металлов IVa—Va подгрупп
можно представить в виде
МеС + 02 -> МеС А + С + Me ->Ме02 (С) + Me + С.
В случае отсутствия области гомогенности (карбиды Сг3С2 и WC)
механизм процесса описывается более простой схемой:
МеС + 02 -* МеСо^ -> Me + СО (С02) -* MeХС^ИЗШ,
МеЛнизш + °2 "* Me A + С°2 (СО).
Стойкость против окисления карбидов металлов IVa—Via подгрупп
убывает в следующей последовательности: Сг3С2 — TiC — ZrC —
VC — HfC — TaC — NbC — Mo2C — WC (500— 1200°C). В табл. 11
представлены температуры начала активного окисления
компактных беспористых образцов карбидов и нитридов металлов
IVa—Via подгрупп. Как следует из таблицы, наиболее высоким
91
Таблица 11. Температура начала ак- сопротивлением окислению ха-
тивного окисления карбидов и нитридов растеризуется карбид хрома
переходных металлов iva—Va r> r*
подгрупп ^гзС2. несколько менее стоек
карбид титана и т. д. В этом
проявляются особенности
растворения кислорода в карбидах
и структуры соответствующих
окислов. В процессе
растворения кислорода в карбиде хрома
не образуются промежуточные
оксикарбидные твердые
растворы, характеризующиеся
наличием вакансий в обеих подрешет-
ках [1.1 — 1.6, 1.8—1.15, 1.18—
1.20, 1.25]. Вероятно,
происходит лишь внедрение кислорода
в октаэдрические междоузлия,
приводящие к значительному увеличению микротвердости. Высокие
защитные свойства окисла Сг203 имеют большое значение в
замедлении растворения кислорода на определенных стадиях процесса.
В карбиде титана и металлов IVa—Va подгрупп, напротив,
растворение кислорода сопровождается образованием дефектов
в обеих подрешетках оксикарбидных твердых растворов,
повышающих скорость диффузии. Однако в карбиде титана, в отличие от
остальных карбидов металлов IVa—Va подгрупп, в области высоких
температур образуется фаза ТЮ2 за счет преимущественной
диффузии катионов титана по междоузлиям [2.16]. Это оказывает
замедляющее действие на растворимость кислорода в карбиде и повышает
стойкость против окисления TiC по сравнению с остальными
карбидами металлов IV—V групп, при окислении которых образуются
окислы /г-типа (Zr02, Hf08, Nb205, Та20Б).
Карбид
TiC
ZrC
HfC
VC
NbC
TaC
Lr3C2
Mo2C
WC
Температура,
"С
1200
1100
900
800
600
650
1300—1400
- 900
800
Нитрид
TiN
ZrN
HfN
VN
NbN
TaN
—
—
—
Температура, eC
1200
600
600
700
600
600
—
—
—
Окисление 1J4C
Окислению карбида бора посвящено много исследований [2.42—
2.47], однако в основной части перечисленных работ окислялись
порошкообразные образцы В4С. Установлено [2.42], что вплоть
до температуры 500° С кислород воздействует на В4С, но при
нагреве до 1000° С в струе кислорода наблюдается незначительное
окисление, сопровождающееся образованием С0.2 и В2Оа. Тонко
измельченный порошок карбида бора легко окисляется
кислородом примерно в такой же степени, как и свободный углерод [2.43].
Проведено окисление карбида при температурах 820, 1040, 1080° С
[2.44], и на основании полученных данных о скорости процесса
разработана методика определения в нем свободного углерода
Изучено окисление сплавов системы бор — углерод в
интервале температур 500—1300° С при постоянном токе кислорода и
скорости его протекания 200 мл/мин [2.45]. О степени окисления суди-
92
ли по количеству окисленных углерода и бора за одинаковый период
времени. Показано, что окисление сплавов системы бор — углерод
начинается при температуре 500° С, когда окислению подвергается
лишь бор. Незначительное окисление углерода начинается при
600° С, а заметное окисление сплавов —-при 700° С. В области
температур 700—1200° С окисление карбида бора при всех
соотношениях бора и углерода проходит в течение определенного времени,
а затем прекращается. Резкое увеличение скорости процесса
наблюдалось при температурах 1200—1300° С, когда летучесть В203
становится незначительной. С ростом содержания углерода в сплаве
его стойкость против окисления уменьшалась. При температурах
800—1200° С отношение количества окисленного бора к количеству
окисленного углерода остается постоянным, а для образцов с
дефектной структурой наблюдалось резкое увеличение степени
окисления бора.
Проведенные в работе [2.45] исследования позволили установить,
что каждый сплав системы бор — углерод окисляется до состава
характеризующегося определенной стехиометрической формулой,
сего в системе бор — углерод найдено четыре соединения.
Изучено окисление порошкообразного карбида бора в области
температур 600—1300° С [2.46]. Оно начинается при 600° С, при
700° С скорость процесса резко увеличивается. При температуре
900—1000° С скорость окисления несколько замедлялась, а при
1200—1300° С снова нарастала. Процесс прекращался после
определенного промежутка времени вследствие образования окисной
пленки из В203, препятствующей дальнейшему окислению.
Исследовано окисление тонко измельченных порошков карбида
бора и его сплавов, что создавало благоприятные условия для
протекания процесса [2.43—2.45]. При этом сгорало 10—50 мае. %
исходного материала. Изучена кинетика высокотемпературного
окисления компактного карбида бора в кислороде при давлении
760 тор в интервале температур 500—1200° С [2.47]. Установлено,
что окисление компактного карбида бора начинается при 600° С,
а заметное окисление наблюдается при 700° С. Дальнейшее
повышение температуры до 800 и 900° С вызывает равномерное увеличение
количества конденсированных продуктов. Испарение В203 влияло
на вид кинетической кривой при 1100° С. Резкое увеличение
скорости окисления наблюдалось при температуре выше 1100° С.
В газообразных продуктах окисления В4С при всех
температурах присутствовала только двуокись углерода. В отличие от
данных работы [2.45] количество выгоревшего из карбида бора
углерода больше, чем количества сгоревшего бора [2.47] (по сравнению
с соотношением этих элементов в стехиометрическом соединении).
Авторы [2.47] объясняют это тем, что окисление карбида бора
протекает в диффузионном режиме. Скорость процесса лимитируется
скоростями диффузии отдельных компонентов сквозь слой окалины.
Определяющую роль играет не диффузия кислорода внутрь, а бора
и углерода из основы материала к внешней фазовой границе. При
93
этом скорость диффузии углерода больше, чем бора. Различия в
скоростях диффузии бора и углерода должны приводить к обеднению
углеродом граничащего с окалиной слоя исходного карбида бора.
Микротвердость исходного карбида бора составляла 4980, а
пограничного с окалиной слоя — 3070 кГ/мм2.
В работе [2.47] отмечено, что авторы [2.45, 2.46] изучили
кинетический режим реакции окисления мелкодисперсного порошка
карбида бора. В течение 3 ч окисления компактных образцов
карбида бора расход материала составлял 9,5% начальной массы образца
при 700° С и 1,5 мас.% — при 1000° С. В то же время при
окислении тонко измельченных порошков карбида бора [2.45, 2.46] расход
материала составлял от 10 до 50 мас.% за более короткий период
времени.
Для установления возможности протекания различных реакций
взаимодействия в процессе окисления карбида бора рассмотрена
термодинамическая возможность протекания различных реакций
взаимодействия в системе В4С—02:
V,B4C + 02 = 2/3В203 +V3C, (2.57)
%В4С + 02 = %В203 + %СО, (2.58)
VAC + 02 = VAOa + V4C02, (2.59)
VAC + 02 - В02газ + V4C, (2.60)
VAC + 02 = %В02 газ + 2/9СО, (2.61)
VAC + 02 = %В02 газ+ V.CO,, (2.62)
VAC + 02 = ВяОягаа + V2C, (2.63)
VAC + 02 = 4/5В202Газ + 2/5СО, (2.64)
V3B4C + Оа = VAO,™ + Х/3С, (2.65)
V2B4C + 02 = 2ВОгаз + V2C, (2.66)
2/БВ4С + 02 = 8/5ВО,13 + 2/5СО, (2.67)
V8B4C + 02 = 4/3ВОгаз + V3C02, (2.68)
В4С + 02 = 4В + С02, (2.69)
2В4С + 02 = 8В + 2СО. (2.70)
Результаты расчета равновесий в системе карбид бора —
кислород при различных температурах и давлениях показали, что при
окислении карбида бора протекает ряд реакций взаимодействия
с образованием твердых (В203, В) и газообразных продуктов
реакции (СО, С02, В202, В02, ВО) (рис. 45). Как следует из рис. 45, при
окислении карбида бора наиболее предпочтительны реакции его
взаимодействия с кислородом, идущие с образованием В203 и окислов
углерода (2.58), (2.59), а также В203 и свободного углерода (2.57).
Термодинамическая возможность протекания этих реакций
уменьшается с ростом температуры. Несколько менее предпочтительны
реакции (2.60) — (2.62). Взаимодействие карбида бора с кисло-
S4
Рис. 45. Зависимость
термодинамического потенциала от температуры
реакций взаимодействия карбида бора с
кислородом при давлении 760 (/) и
10~5 тор (//) (номера кривых
соответствуют номерам уравнений реакций).
л2%,ккал/моль
200
100Y
100-
-200
3 0-
-400-
-500
родом, в продуктах которых
содержатся В202, окислы
углерода и свободный углерод
(реакции (2.63) — (2.65)), несколько
менее вероятно. Возможность
протекания всех этих реакций
увеличивается с повышением
температуры.
Следует отметить, что
довольно высокой степенью
вероятности, несколько увеличивающейся
с ростом температуры,
характеризуются реакции
взаимодействия карбида бора с кислородом,
идущие с получением свободно- -ооо
го бора и окислов углерода
(2.69), (2.70). Выделение окисла _7qq
бора ВО, окислов углерода и
свободного! углерода (реакции (2.66) — (2.69)) может происходить
лишь в области довольно высоких температур.
Таким образом, в процессе окисления карбида бора могут
образоваться В203, свободный бор и газообразные окислы бора и
углерода.
Как показали проведенные термодинамические расчеты,
давление кислорода существенно влияет на протекание процесса
окисления карбида бора и на характер изменения термодинамического
потенциала с изменением температуры. С уменьшением давления
кислорода (Ю-5 тор) возможность протекания реакций (2.57),
(2.59) уменьшается. Если при давлении 760 тор термодинамическая
возможность протекания реакций, идущих с образованием окислов
бора В02, В202, углерода и его окислов (2.60) — (2.65),
увеличивается с ростом температуры, то при давлении Ю- тор такая
вероятность сильно уменьшается (например, (2.60), (2.62), (2.63), (2.65)).
При этом некоторые реакции (2.60), (2.62) при достаточно высоких
температурах (около 2000° С) становятся термодинамически
невозможными. Аналогичные закономерности наблюдаются и для
реакций, продукты которых содержат свободный бор и окислы углерода
(2.69), (2.70).
Влияние давления отчетливо наблюдается для реакций (2.66),
(2.68), идущих с образованием газообразного ВО, углерода и
двуокиси углерода. Если при давлении 760 тор реакция (2.68) возможна
95
46. Кинетические кривые окисле-
карбида бора на воздухе (с) и в
е кислорода (б):
/ — 600; 2 — 800; 3 — 1000; 4 —
5 С; б — 1 — 150; 2 — Ю~5; 3 —
: 4 — 10 тор.
"А
-8 \WV
-20 ^-о-о—<^-^—о- «
-241 i I I
5
при температурах выше 700 К, при 150 тор — лишь в области
более высоких температур (выше 1500 К), то при давлении 10~5 тор
она невозможна во всем рассмотренном интервале температур.
Реакция (2.66) при давлении 760 тор осуществима лишь при
высоких температурах (выше 1700 К), а при 10~5 тор ее прохождение
термодинамически невозможно. Следовательно, давление
кислорода оказывает определяющее влияние на вероятность прохождения
реакции.
Изучено окисление карбида бора на воздухе в интервале
температур 600—1200° Сив среде кислорода (10~ — 150 тор) при
1000° С (рис. 46). При температуре 600° С карбид бора на воздухе
практически не окисляется, но с дальнейшим ростом температуры
интенсивность его взаимодействия значительно возрастает (рис.
46, а). При температуре 800° С наблюдается убыль массы,
связанная с образованием газообразных продуктов реакции. При тем-
п?ратуре 1000° С имеет место прирост массы с ускорением процесса
на более поздних стадиях, а при 1200° С — значительная убыль
массы, связанная с ростом летучести В203.
При окислении карбида бора в среде кислорода при небольшом
его парциальном давлении и температуре 1000° С (см. рис. 46, б)
происходит лишь убыль массы, обусловленная образованием
газообразных компонентов реакции — окислов углерода и бора.
Прохождение этих реакций (см. рис. 45) характеризуется большой
степенью вероятности. Возможность образования газообразных
продуктов определяет, по-видимому, сложное влияние давления на
кинетические характеристики процесса.
Учитывая, что давление кислорода существенно влияет на
возможность протекания реакций взаимодействия карбида бора с кис-
Am/S, мг/см
8
Рис.
ния
сред
а —
1200'
ю-1
SG
лородом, представляется закономерным отсутствие монотонной
зависимости между давлением кислорода и кинетическими
характеристиками процесса. Как следует из рис. 46, б, увеличение
давления от Ю-5 тор незначительно влияет на кинетические
характеристики процесса окисления, однако при Р== 10 тор убыль
массы, связанная с выделением газообразных продуктов окисления,
несколько увеличивается.
Металлографические исследования поверхности окисленных
образцов указывают на интересную особенность поведения карбида
бора в среде кислорода и на воздухе. В процессе окисления
карбида бора в кислороде при небольшом его давлении, а также на
воздухе при низких температурах появляется свободный бор. Как
показали термодинамические расчеты, прохождение реакций
взаимодействия карбида бора и кислорода до свободного бора и
окислов углерода характеризуется довольно высокой степенью
термодинамической вероятности. Происходит частичное окисление
свободного бора, в результате чего его цвет меняется от оранжево-
красного до бурого. Буровато-коричневая окраска свободного бора
вызвана неполным окислением поверхности его частиц [2.48]. Так,
в среде кислорода при 1000° С и давлении 10~5 тор поверхность
образца темно-коричневая, пористая, но сквозь коричневые
выделения четко просматриваются ярко-красные вкрапления бора, а
также зеленоватые и ярко-зеленые образования. С повышением
давления (10—', 10 тор) ярко-красные включения, по-видимому,
свободного бора становятся более выраженными, значительное место
занимают также бурые области.
При давлении кислорода 150 тор выделения ярко-красного
цвета еще наблюдаются, но их становится меньше, вероятно, вследствие
окисления. Действительно, на поверхности образца
увеличиваются области, окрашенные в бурый цвет.
При окислении карбида бора на воздухе при низких
температурах (600° С) на поверхности образца также видны оранжевые
области вкрапления бора наряду с бурыми образованиями, а также
отдельные незначительные включения расплавленной фазы В203.
Буровато-коричневая окраска указывает на то, что при окислении
карбида бора свободный бор начинает постепенно
взаимодействовать с кислородом, изменяя свой цвет. На возможность
образования субокисла В70 указывается в работе [2.491.
При окислении карбида бора на воздухе при более высоких
температурах (800° С) поверхность образца покрывалась тонкой
черной пленкой, прочно сцепленной с основой, а вкрапления бора
имелись лишь в некоторых местах во внутренних слоях. При
температуре 1000 и 1200° С формировался толстый пористый слой из
бесцветных стеклообразных образований В203, которые со временем
гидратировались, и на поверхности образца появлялись тонкие
белые пленки. Под внешним слоем В203 находилась тонкая черная
окисная пленка, которая могла быть низшим окислом бора.
7 2920
97
При окислении В4С на воздухе в области более высоких
температур (900—1200° С) окисел В203 образовывался интенсивнее и
свободный бор не выделялся, в то время как при окислении В4С в среде
кислорода при небольшом давлении он обнаруживался на
поверхности в свободном и подкисленном состоянии даже при 1000° С.
Преимущественное окисление углерода по сравнению с бором
показано и с помощью термодинамических расчетов (см. рис. 44). Реакции
(2.69), (2.70) окисления, идущие с выделением свободного бора
и окислов углерода, характеризуются высокой термодинамической
вероятностью протекания.
Следует отметить, что многие термодинамически возможные
реакции взаимодействия (2.61), (2.62), (2.64), (2.65), (2.67), (2.68),
протекающие с образованием только газообразных продуктов,
сопровождаются одинаковым расходом углерода и бора и не
приводят к изменению состава исходного карбида бора.
Термодинамически наиболее вероятные реакции
взаимодействия (2.57) — (2.59), продукты которых содержат твердую фазу
окисла В2СХ{, углерод и его окислы, также не сопровождаются
изменением состава исходного карбида бора, обогащением его
поверхностных слоев одним из элементов — бором или
углеродом.
Следовательно, из всех возможных реакций взаимодействия
карбида бора с кислородом только реакции (2.69), (2.70), продукты
которых представлены свободным бором и газообразными
окислами углерода, определяют предпочтительный расход углерода в
процессе окисления с возможным обогащением бором поверхностного
слоя карбида. Реакции (2.57), (2.60), (2.63), (2.66),
характеризующиеся получением твердых и газообразных окислов бора и
выделением свободного углерода, практически не имеют значения и не
могут определить преимущественный расход бора по сравнению
с углеродом, так как последний начинает активно окисляться уже
при невысоких температурах (400° С) с превращением в
газообразные окислы. Это исключает возможность обогащения исходного
карбида углеродом, выделившимся в процессе окисления в
соответствии с реакциями (2.57), (2.60), (2.63), (2.66).
Анализ всех термодинамически возможных реакций
взаимодействия в системе карбид бора — кислород указывает на
значительную роль реакций (2.69), (2.70), свидетельствующих о высокой
термодинамической возможности предпочтительного окисления
углерода и выделения свободного бора. На более высокий расход
углерода в процессе окисления В4С по сравнению г. бором указывают
и авторы [2.47]., Вероятно, преимущественный расход углерода
при окислении карбида бора определяется не диффузионными
условиями в слое окалины, а термодинамически обусловленным
протеканием реакций, ведущих к изменению состава исходного карбида.
Это приводит к появлению свободного бора на поверхности
окисленных образцов в среде кислорода и на воздухе при низких
температурах. По-видимому, по мере протекания процесса бор окисляется
98
постепенно до окисла В203 с образованием промежуточных фаз
низшего окисла.
Выделение свободного бора на поверхности окисленных
образцов карбида бора на воздухе на начальной стадии процесса и при
небольшом давлении кислорода свидетельствует о том, что в
кинетическом режиме окисления при отсутствии окисной пленки
реакция взаимодействия карбида бора с кислородом может протекать
частично и в соответствии с реакциями (2.69), (2.70).
РОЛЬ УГЛЕРОДА
В ПРОЦЕССЕ ОКИСЛЕНИЯ КАРБИДОВ
Выделение свободного углерода и соответствующего металла в
процессе окисления карбидов вызвано внедрением кислорода в
решетку карбидов и замещением углерода, металлографически
наблюдаемого в зоне твердых растворов оксикарбидных фаз.
Концентрация свободного углерода увеличивается в направлении границы
окалина — карбид, где больше содержание растворенного
кислорода. Углерод и соответствующие окисные фазы Ме02Сх могут
появиться и в процессе распада промежуточного оксикарбида на
границе окалина — карбид. Углерод аккумулируется на границе
окалина — карбид в виде прослойки. Выделение свободного
углерода и образование окислов соответствующих металлов являются
термодинамически наиболее предпочтительными реакциями
взаимодействия карбидов металлов IVa—Via подгрупп с кислородом
[14]. Углерод влияет на морфологические особенности, фазовый
состав окалины и скорость процесса окисления.
Образование прослойки свободного углерода на границе
карбид — окисел. Формирование прослойки углерода на границе
окалина — карбид и ее сохранение в процессе дальнейшего
окисления в некотором интервале температур определяются изменением
роли анионной и катионной диффузии в процессе окисления,
обусловливающей возможность растворения кислорода в решетке
карбидов, и защитными свойствами слоя окалины.
Данные химического анализа, металлографические и
визуальные наблюдения указывают на значительно большее количество
выделений свободного углерода в карбидах металлов IVa—Va
подгрупп, характеризующихся значительной областью
гомогенности по сравнению с металлами Via подгруппы. Если в процессе
окисления карбида циркония при 700° С наблюдается четко
выраженный слой углерода (см. рис. 17, б), то в случае карбида
молибдена углерод находится в виде тонкой прослойки и совсем не
обнаруживается на фазовой границе Сг203—Сг3С2.
При преимущественной диффузии межузельных катионов титана
в процессе формирования окалины из рутила при высоких
температурах (выше 1000° С) внедрение кислорода в решетку карбида
и выделение свободного углерода становятся менее выраженными,
хотя указанные обстоятельства не исключают возможности прямого
7*
99
взаимодействия кислорода и карбида титана. Напротив, при
образовании окалины путем лишь анионной диффузии при условии
высоких ее защитных свойств имеют место значительное
растворение кислорода и замещение углерода в решетке карбида с
появлением значительной прослойки углерода на границе окалина —
карбид (ZrC, VC) (см. рис. 17, 6", 25, б—г).
Однако с ростом температуры и с утратой защитных свойств
окалины выделяются газообразные окислы углерода, и слой
углерода становится менее выраженным. При окислении карбидов
ниобия и тантала уже при сравнительно низких температурах на
начальных стадиях процесса образуется рыхлая отслаивающаяся
окалина; углерод в виде тонкого слоя находится под окалиной.
При более глубоком протекании процесса с ростом температуры
углерод может диффундировать и растворяться в решетке карбида
или в решетке окисла соответствующего металла. Аккумуляция
углерода на внутренней фазовой границе может несколько
изменить скорость диффузии компонентов реакции в процессе
окисления.
Стабилизирующее влияние углерода на различные
модификации окислов. Непосредственным следствием особенностей
протекания процесса окисления карбидов является то, что
промежуточные оксикарбиды переходят непосредственно в окисные фазы,
содержащие некоторое количество связанного углерода [1.25].
Он оказывает стабилизирующее влияние на некоторые
модификации окислов, изменяя область их стабильности (табл. 12) [1.25,
2.1, 2.2, 2.5]. Формирование стабилизированных фаз окислов
Ti62 анатаза и кубической ZrOa в области низких температур
(400 и 500° С) в начальной стадии процесса, где еще незначительны
растворение и диффузия углерода в окалине, свидетельствует о том,
что эти фазы появляются в процессе распада соответствующих
оксикарбидных фаз на свободный углерод и окисные фазы
(МеОаСд), содержащие некоторое количество связанного углерода.
С увеличением степени окисления одного и того же образца
Таблица 12. Стабилизация окисных фаз в процессе окисления карбидов
и нитридов
Карбид,
нитрид
TiC
ZrC
TIN
ZrN
Hi'N
NbN
TaN
Стабилизированная
окисная фаза
Анатаз ТЮ2
Zr02 куб
Анатаз Ti02
Zr02 куб
Hf02
P-Nb205
a-Ta2Os
Область
стабильности, "С
300—1000
1900
300—1000
1900
1700
900
1350
Температурный ин -
тернал
существования в окалине, "С
500—1100
500—1200
400—1100
400—1200
500—1000
500—1200
900—1200
Стабилизирующая
добавка
Углерод
»
Азот
»
»
»
»
100
при постоянной температуре при более длительных выдержках или
с повышением температуры растет относительное содержание неста-
билизированной фазы рутила и моноклинной Zr02, хотя
стабилизированные фазы сохранялись в окалине вплоть до температур
1100 (анатаз) и 1200° С (кубическая Zr02). Это вызвано
полиморфным превращением анатаза в рутил и кубической фазы Zr02 в
моноклинную.
Металлографическим методом и послойным рентгеновским
фазовым анализом установлено, что коричневый слой анатаза и серый
слой кубической фазы Zr02 располагаются в основном во
внутренних слоях окалины, на внутренней фазовой границе, а по мере
удаления от нее количество стабилизированных фаз окислов
несколько уменьшается. Это можно объяснить постоянным
образованием стабилизированных фаз по мере формирования оксикарбид-
ных фаз и постепенным удалением углерода из слоя окалины.
Механизм стабилизирующего действия различных добавок до
настоящего времени еще недостаточно выяснен. Наиболее детально
изучено стабилизирующее влияние различных добавок окислов на
кубическую фазу Zr02 [2.28, 2.29, 2.50]. Имеющиеся сведения
указывают на различное влияние добавок на стабилизацию фазы
Zr02 [2.28, 2.50].
Кубическая фаза ZrOa, полученная в структурном отношении,
отличается от кубической [2.28], стабилизированной по механизму,
описанному в работе [2.50]. Действительно, при формировании
кубической структуры углерода внедряется (прирост массы при
образовании кубической фазы Zr02 100%) в ее полностью
свободные октаэдрические пустоты [2.28]. Подрешетка кислорода остается
комплектной, а подрешетка металла не содержит посторонних
ионов.
Стабилизирующее действие углерода подтверждается, в
частности, и тем, что при окислении титана на воздухе получается только
рутиловая модификация [2.23], а при окислении циркония
кубическая фаза Zr02, стабилизированная азотом, появляется в окалине
лишь при достаточно высоких температурах (800° С) [2.31], когда
значительным становится растворение азота в решетке металла
и на внутренней фазовой границе образуется нитрид циркония.
Ориентационное соотношение, способствующее когерентному
росту окисной пленки и образованию последовательности карбид —
оксикарбид — анатаз, вероятно, никакой роли не играет вследствие
появления прослойки из углерода, а при окислении карбида
титана при достаточно высоких температурах — из-за
формирования полости на границе окалина — карбид.
Окисные фазы стабилизируются и при более глубоком
протекании окисления в процессе дальнейшей диффузии и растворения
свободного углерода в окалине. Действительно, при распаде окси-
карбидных фаз свободный углерод первоначально распределяется
в окалине по границам зерен и другим нарушениям структуры
(см. рис. 17, б) в виде темных включений. Однако с повышением
101
температуры в результате более интенсивного растворения углерода
в решетке окисла с образованием газообразных окислов окалина
становится более однородной, без явно выраженных включений
свободного углерода, который может просматриваться лишь в
трещинах и порах окалины." Растворенный в окисных фазах
углерод сложно влияет на структуру и фазовый состав окалины —
вызывает стабилизацию окисных фаз, изменяет концентрацию
дефектов в решетке окислов, морфологию окалины и ее спекаемость
В отличие от чистого титана при окислении карбида титана
получаются рутиловая модификация TiOa и низшие окислы титана,
что может быть обусловлено не только восстановлением рутила
титаном, выделяющимся наряду с углеродом в процессе
растворения кислорода, но и разрушением структуры рутила при
растворении в его решетке незначительных количеств углерода [2].
Стабилизация окисных фаз при окислении карбидов
свидетельствует о вторичных сложных процессах, протекающих в слое
многофазной окалины, значительно изменяющих во времени фазовый
состав окалины и условия диффузии компонентов реакции.
Установление стабилизации различных окисных фаз является хорошей
иллюстрацией сложной природы фазовых превращений,
вызываемых незначительным содержанием в них примесных элементов
внедрения (С и N2).
Влияние углерода на структуру и спекаемость окалины.
В процессе окисления карбидов титана и циркония при 1000° С
изменяются морфологические особенности окалины на карбидах
титана и циркония. Если в окалине на чистых титане и цирконии
при 1000° С наблюдалась четко выраженная конденсация
вакансий в результате создания противоположно направленных
градиентов катионных и анионных (см. рис. 14) [2.23] или только анионных
вакансий (см. рис. 19), то в окалине на TiC и ZrC при этой
температуре конденсация вакансий не наблюдается и образуется более
компактная окалина. Внешние слои окалины па TiC и ZrC
значительно более спечены, чем па соответствующих металлах (TiC —
1100 и 1200° С, ZrC — 900, 1000° С).
На характер особенностей формирования окалины на карбидах
влияют увеличение сил межатомного взаимодействия в
решетке карбидов титана и циркония по сравнению с чистыми
металлами и значительная растворимость кислорода в карбидах,
связанная с высокой дефектностью оксикарбидных фаз. Отсутствие
конденсированных вакансий в окалине из рутила в процессе
окисления TiC при 1000° С объясняется, очевидно, с одной стороны,
затрудненным по сравнению с титаном выходом катионов Ti4+
в окалине и созданием вследствие этого низкого потока
катионных вакансий в решетке рутила, необходимого для
осуществления конденсаций вакансий. С другой стороны, можно
предположить, что образование дефектных в металлических и
металлоидной подрешетках оксикарбидных фаз способствует интенсивно
протекающим процессам диффузии и растворения кислорода в
102
карбидной матрице. Это, вероятно, определяет создание более
выраженного, чем на титане, потока анионных вакансий.
Растворяясь в решетке окислов, углерод, по-видимому, не
влияет на равновесие дефектов, оказываемое обычно примесными
элементами иной валентности [2.51], а изменяет лишь скорость
диффузии компонентов реакции аналогично катионам одинаковой
валентности, но с большим ионным радиусом. Углерод снижает
диффузионную подвижность межузельных катионов титана в
решетке рутила и кислорода по анионным вакансиям в решетке ТЮ2
и Zr(32, о чем свидетельствует значительно меньшая толщина
окалины на TiC и ZrC, чем на соответствующих чистых металлах, менее
выраженные процессы спекания и уменьшение толщины
спеченного слоя (см. рис. 14, 19). Здесь, несомненно, большое значение
имеет увеличение сил межатомного взаимодействия в решетке TiC
(TiCxO„) no сравнению с титаном, затрудняющих выход в окалину
катионов титана.
Роль азота в процессе высокотемпературного окисления
карбидов. При окислении карбидов металлов IVa—Via подгрупп
(кроме Сг3С2) нитриды соответствующих металлов не образуются.
В промежуточных продуктах окисления оксикарбидных фаз TiCxO«,
по данным химического анализа нитрид отсутствовал [1.90].
Появление нитрида хрома при окислении Сг3С2 может быть обусловлено
иным характером растворения кислорода в решетке карбида
хрома. Микротвердость окисленных образцов Сг3С2 повышается,
вероятно, лишь внедрением кислорода в междоузлия Сг3С2, как
это наблюдалось при окислении металлов IVa—Va подгрупп,
и нитрид хрома Cr2N наряду с окислами хрома является продуктом
реакции взаимодействия Сг3С2 и кислорода.
Испарение газообразных продуктов реакции в процессе
окисления карбидов. Окисление карбидов сопровождается
образованием не только твердых фаз — окислов соответствующих металлов
и свободного углерода, но и его газообразных окислов, которые
в значительной степени влияют на компактность окалины и
скорость процесса. В случае плотной окалины из окислов м-типа с
небольшим объемным соотношением (ZrOa, НЮ2 или ТЮ2)
углерод сохраняется под слоем окалины и его диффузия к внешней
фазовой границе с ростом температуры способствует образованию
газообразных окислов во внешних слоях окалины. При
нарушении компактности окалины с увеличением температуры или
образовании рыхлой отслаивающейся окалины даже при низких
температурах (NbC, TaC) на внутренней фазовой границе образуются
газообразные окислы и происходит значительное разрыхление
окалины.
Согласно [1.39, 1.40, 1.46, 1.49, 1.53], при окислении карбидов
титана, ниобия, хрома выделялся углекислый газ. Авторы работ
11.33, 1.34] при окислении карбида титана в газообразных
продуктах реакции обнаружили окись углерода. Противоречивость
этих данных можно объяснить тем, что в работах [1.39, 1.40, 1.49,
103
1.53] исследования проводились при большом (760 мм рт.
ст.), а в работах [1.33, 1.34] — при небольшом давлении кислорода.
РОЛЬ РЕАКЦИЙ ВЗАИМОДЕЙСТВИЯ
НА ГРАНИЦЕ ОКАЛИНА —
КАРБИД В ПРОЦЕССЕ ОКИСЛЕНИЯ КАРБИДОВ
Процессы взаимодействия на границе фаз при окислении карбидов
можно свести к-следующим: образование промежуточных твердых
растворов типа MeCxOv; взаимодействие типа Ме02—С. Окси-
карбиды могут образовываться путем контактного взаимодействия
на фазовой границе окисел — карбид либо при непосредственном
внедрении атомов кислорода в решетку окисляемого карбида
11.25, 2.52—2.55]. Прямое взаимодействие типа окисел — карбид
заметно протекает лишь при температурах, значительно
превышающих температуры исследования (выше 1200° С) [2.52—2.55].
Протеканию контактных реакций на границе фаз препятствует
формирование прослойки углерода, а при окислении карбида
титана — создание полости на Гранине окалина — карбид при
температурах 1000—1200° С.
Таким образом, появление оксикарбидов в процессе окисления
при температурах (500—1200° С) за счет контактного
взаимодействия маловероятно. Более предпочтительны, очевидно, образование
оксикарбидных соединений за счет диффузии кислорода к границе
карбид — окисел и внедрение его в решетку соответствующих
карбидов.
Внедрение кислорода в решетку карбидов уже на начальной
стадии сопровождается выделением углерода и соответствующего
металла, изменением периода решетки и микротвердости зоны
оксикарбидных твердых растворов. Это имеет место и на более поздних
стадиях процесса при образовании слоя окалины из окислов д-типа
(ZrOa НЮ2). При окислении карбида титана и появлении
окалины из рутила при достаточно высоких температурах (выше 1000° С)
протекание процесса может существенно осложниться
преимущественной диффузией межузельных катионов титана к внешней
фазовой границе, что выражается в резком понижении микротвердости
по всей глубине окисленных образцов (при температурах 1300—
1600° С). Тем не менее это не исключает возможность прямого
взаимодействия кислорода и карбида титана.
Взаимодействие типа окисел — углерод, возможность которого
обусловлена наличием прослойки свободного углерода на фазовой
границе окисел — карбид, термодинамически вероятно в области
температур 500—1200° С лишь для реакции восстановления V2Ob,
Мо03, WOa углеродом (см. рис. 27). Такая возможность
проявляется, в частности, в замедляющем влиянии углерода на скорость
формирования высшего окисла ванадия V205 и в образовании
низших окислов ванадия и молибдена, прилегающих к прослойке
углерода. Этим, по-видимому, объясняется довольно высокое сопро-
104
тивление окислению карбида ванадия в интервале температур 500—
700° С и карбида молибдена до 800° С. На карбиде вольфрама
прослойка углерода на границе карбид — окалина отсутствует, и во
всем интервале температур формируется высший окисел W03,
способствующий более высокой скорости окисления WC по
сравнению с М02С
Рассмотрение особенностей взаимодействий на межфазовых
границах показывает, что их роль в формировании защитных свойств
окалины чрезвычайно важна.
2.1. Пугач Э. А. Исследование высокотемпературного окисления карбидов и
боридов переходных металлов IV—VI групп периодической системы
Д. И. Менделеева : Автореф. дис... канд. хим. наук.— Киев, 1969.— 35 с.
2.2. Войтович Р. Ф., Пугач Э. А. Высокотемпературное окисление карбида
титана.— Порошковая металлургия, 1972, № 2, с. 63—68.
2.3. Войтович Р. Ф., Пугач Э. А. Высокотемпературное окисление карбидов
переходных металлов IV—VI групп.— В кн.: Высокотемпературные карбиды.
Киев : Наук, думка, 1975, с. 143—156.
2.4. Войтович Р. Ф., Пугач Э. А. Некоторые особенности процесса окисления
карбидов металлов IV—VI групп.— В кн.: Карбиды и сплавы на их основе.
Киев : Наук, думка, 1976, с. 233—234.
2.5. Войтович Р. Ф. Исследование высокотемпературного окисления сплавов
переходных металлов и их тугоплавких соединений: Автореф. дис... д-ра
хим. наук.— Киев, 1976.— 52 с.
2.6. Войтович Р. Ф., Головко Э. И. Окисление карбида титана при различном
давлении кислорода.— Порошковая металлургия, 1978, № 3, с. 55—62.
2.7. Мочарнюк Г. Ф. Структурные особенности закиси меди и некоторых
сложных полупроводниковых систем : Автореф. дис ... канд. физ.-мат. наук.—
Львов, 1963.—26 с.
2.8. Lasker A. L. On the determination of activation energy of diffusion through
dislocations.— Indian Phys., 1962, 36, N 7, p. 359—363.
2.9. Кабрера Н. Возникновение ямок травления и центров окисления на
дислокациях.— В кн.: Элементарные процессы роста кристаллов. М. : Изд-во
иностр. лит., 1959, с. 166—174.
2.10. Hirh J. P. On dislocations interactions in the fee lattice.— J. Appl. Phys.,
1961, 32, N 4, p. 700—706.
2.11. Joung E. W., Gwatmey A. G. Development of facets, spirals and etch pits on
copper crystal by testing to high temperatures in high vacua.— J. Appl. Phys.,
1960, 31, N 2, p. 225—230.
2.12. Лаврентьев Ф. Ф., Сойфер Л. M., Старцев В. И. Термическое травление
и отжиг двойниковых прослоек в кристаллах сурьмы.— Кристаллография,
1960, 5, № 3, с. 472—475.
2.13. Андриевский А. И., Мочарнюк Г. Ф. О выделении дислокаций на плоскости
спайности закиси меди.— Кристаллография, 1969, 8, № 5, с. 793—795.
2.14. Агеев Н. В., Резниченко В. Л., Уколова Т. П., Модель М. С. О низших
окислах титана.— Титан и его сплавы, 1959, вып. 11, с. 64—72.
2.15. Филоненко Н. Е., Кудрявцев В. Н., Лавров И. В. Окислы титана в интервале
ТЮ2—Ti203.— Докл. АН СССР, 1952, 86, № 3, с. 561—564.
2.16. Kofstad P. Note on the defect structure of rutile (Ti02).— J. Less-Common
Metals, 1967, 13, N 6, p. 635—638.
2.17. Ramkwist L. Elektronic structure of cubic refractory carbides.— J. Appl.
Phys., 1971, 42, N 5, p. 2123—2120.
2.18. Еременко В. Н. Титан и его сплавы.— Киев : Изд-во АН УССР, 1960.—
500 с.
2.19. Hurlen Т. On the defect structure of rutile.— Acta chem. scand., 1959, 13,
N 2, p. 365—376.
105
2.20. Маковский Ф. А., Усачев Е. П. Выпрямители на основе
полупроводниковой двуокиси титана.— М. : Наука, 1966.— 108 с.
2.21. Физико-химические свойства окислов: Справочник / Под ред. Г. В. Самсо-
нова.— М. : Металлургия, 1978.— 471 с.
2.22. Бондарь И. А., Глушкова В. Б., Цейтлин П. А., Пожарский Б. Г.,
Дербенева Г. Ф., Сазонова П. В. Изучение фазовых переходов в ТЮ9.— Изв.
АН СССР. Сер. Неорган, материалы, 1971, 7, № 7, с. 1183—1187.
2.23. Войтович Р. Ф., Головко Э. И., Дьяконова Л. В. Особенности
высокотемпературного окисления титана.— Журн. физ. химии, 1975, 49, № 5, с. 1164—
1167.
2.24. Jenkins A. E. Study of oxidation on titanium and its alloys at elevated
temperatures.—J. Inst. Metals, 1955/1956, 84, N 1, p. 1—9.
2.25. Richardson L. S., Grant N. J. Reaction of oxygen and nitrogen with
titanium from 700 to 1050.— J. Metals, 1954, 6, p. 69—70.
2.26. Simnad M., Spilncrs A., Katz O. Oxidation of oxygen-saturated titanium.—
J. Metals, 1955, 7, p. 645—646.
2.27. Войтович Р. Ф., Пугач Э. А. Высокотемпературное окисление ZrC и HfC.—
Порошковая металлургия, 1973, № 11, с. 67—74.
2.28. Зайнулин Ю. Г., Жиляев В. А., Алямовский С. И., Швейкин Г. П.
Кубическая низкотемпературная двуокись циркония, стабилизированная
углеродом.— Изв. АН СССР. Сер. Неорган, материалы, 1976, 12, № 2, с. 278—
280.
2.29. Stocher J. Remarques sur la stabilisation de la zircone cubique.— Bull. Soc.
chim. France, 1961, N 1, p. 78—81.
2.30. Guerlet J. P., Lehr C. R. Sur l'oxidation de zirconium par I'oxyde de carbo-
ne.— С r. Acad. sci. C, 1967, N 23, 1833—1843.
2.31. Войтович Р. Ф., Головко Э. И., Дьяконова Л. В. Высокотемпературное
окисление циркония и гафния на воздухе.— Изв. АН СССР. Сер. Металлы, 1975,
№ 1, с. 75—79.
2.32. Kofstad P., Ruziska D. J. On the defekt strukture of Zr02 and НЮ2.— J. Ele-
ctrochem. Soc, 1963, 110, N 2, p. 181—184.
2.33. Keneschea F. J., Douglass D. L. The Diffusion of oxygen in zirconnia as a
function of oxygen pressure.— Oxidat. Metals, 1971, 3, N 1, p. 1 —14.
2.34. Кофстад П. Высокотемпературное окисление металлов.— М. : Мир, 1969.—
392 с.
2.35. Kofstad P. Oxidation of tantalum in the temperature range 500—700° C.—
J. Inst. Metals, 1961/1962, 90, N 7, p. 253—264.
2.36. Войтович Р. Ф., Головко Э. И. Высокотемпературное окисление металлов
и сплавов : (Справочник).— Киев : Наук, думка, 1980.— 295 с.
2.37. Архаров В. П., Конев В. II., Тимофеев II. Ф. Исследование реакционной
диффузии в системах металл — сложный газ. IV. Система молибден —
азот — углерод.— Физика металлов и металловедение, 1960, 9, № 5,
с. 695—700.
2.38. Герасимов А. Ф., Конев В. Н., Тимофеева Н. Ф. Исследование реакционной
диффузии в системах металл — сложный газ. VI Система вольфрам —
углерод — азот.— Физика металлов и металловедение, 1961, И, № 4, с. 596—
600.
2.39. Войтович Р. Ф., Пугач Э. А. Особенности высокотемпературного окисления
карбидов переходных металлов VI группы.— Порошковая металлургия,
1974, № 4, с. 59—64.
2.40. Самсонов Г. В., Крсолапова Т. #. Взаимодействие окиси и карбида хрома
с образованием металлического хрома.— Журн. прикл. химии, 1961, 34,
№ 12, с. 2780—2782.
2.41. Denker Z. P. Relation of bonding and electronic band structure to the
creation of lattice vacancies in TiO.— J. Phys. Chem. Solids, 1964, N 12, 25,
p. 1397—1405.
2.42. Анализ тугоплавких соединений / Г. В. Самсонов, А. Т. Пилипенко,
Т. Н. Назарчук и др.— М. : Металлургиздат, 1962.— 256 с.
2.43. Ridgway R. Boron carbide: A new crystalline abrasive and wear.— resisting
product.— Trans. Electrochem. Soc, 1934, 65, p. 117—133.
106
2.44. Меерсон Г. А., Самсонов Г. В. Определение содержания свободного
углерода в карбиде бора.— Завод, лаб., 1950, 16, № 12, с. 1423—1428.
2.45. Печентковская Л. Е., Назарчук Т. Н. Об устойчивости в кислороде
соединений системы бор — углерод при высоких температурах.— В кн.:
Химические свойства и методы анализа тугоплавких соединений. Киев : Изд-во
АН СССР, 1969, с. 26—32.
2.46. Назарчук Т. Н., Мекханошина Л. Н. К вопросу об окисляемое™ карбида
бора.— Порошковая металлургия, 1964, № 2, с. 46—50.
2.47. Lavrenko V. A., Pomytkin A. P., Kislyi P. S., Grabchuk В. L. Kinetics of
high-temperature oxidation of boron carbide in oxygen.— Oxidat. Metals,
1976, 10, N 2, p. 85—95.
2.48. Самсонов Г. В., Марковский В. Я-, Жигач А. Ф., Валяшко М. Г. Бор, его
соединения и сплавы.— Киев : Изд-во АН УССР, 1960.— 590 с.
2.49. Holcombe С. Е., Ноте P. J. Preparation of boron suboxide B70.— J. Amer.
Ceram. Soc, 55, N 2, p. 106.
2.50. Вишневский И. И., Гавриш А. Г., Сухаревский Б. Я- О возможном
механизме стабилизации кубической Zr02.— Сб. науч. тр. / Укр. ин-т огнеупоров,
1972. вып. 6, с. 74—80.
2.51. Hauffe К. Oxydation von Metallen und Metallegierungen.— Berlin : Sprin-
ger-Verlag, 1956.— 393 S.
2.52. Швейкин Г. П., Гельд П. В. Получение металлического ниобия из оксикар-
бидной смеси.— Цв. металлы, 1961, № 4, с. 39—42.
2.53. Колчин О. П., Сумарокова Н. В., Чувелева Н. П. Получение пластичного
ниобия.— Атом, энергия, 1957, № 2, с. 515—525.
2.54. Гельд П. В., Швейкин Г. П. Некоторые особенности углетермического
восстановления пятиокиси ниобия.— Изв. АН СССР. Сер. Металлургия и
топливо, 1959, № 1, с. 45—49.
2.55. Косолапова Т. Я-, Федорус В. Б., Кузьма Ю. Б. Взаимодействие карбидов
переходных металлов с их окислами.— Изв. АН СССР. Сер. Неорган,
материалы, 1966, № 8, с. 1516—1520.
Глава 3
ДЕФЕКТЫ РЕШЕТКИ
НИТРИДОВ И ОКСИНИТРИДОВ
МЕТАЛЛОВ IVa—Va ПОДГРУПП
До настоящего времени окисляемость нитридов металлов IVa—Va
подгрупп исследована в различных аспектах. В работах [3.1—3.10]
в основном изучены кинетические характеристики и фазовый
состав окалины на поздних стадиях процесса окисления.
Из нитридов металлов IVa—Va подгрупп наиболее изучено
окисление нитрида титана в кислороде и на воздухе [1.25, 1.26,
1.33, 1.46, 1.92, 3.1—3.8]. Установлен интервал окал и ностой кости
нитрида титана, равный 1100—1400° С [1.46]. Поверхностный слой
нитрида титана толщиной несколько микрон полностью разрушается
на воздухе в течение нескольких часов при температурах выше
700° С [3.5].
Исследовано взаимодействие нитрида титана с кислородом при
1200° С [1.33]. Наблюдаемое уменьшение давления в начальной
стадии процесса авторы объясняли более медленной скоростью
выделения азота из решетки нитрида титана по сравнению со
скоростью окисления. Изучено окисление нитрида титана, полученного
осаждением из газовой фазы на подложку из А1203, и спиралей из
нитрида титана в кислороде при давлении 760 тор в области
температур 625—1075° С [3.1, 3,2]. Показано, что окисление
описывается параболическим законом скорости с энергией активации
46,4 ккал/моль, а для линейной стадии процесса энергия активации
составляла 24,5 ккал/моль. Единственным продуктом реакции
был рутил. В опытах с инертными метчиками найдено, что окалина
образуется на внутренней фазовой границе TiN—Ti02.
Исследовано окисление компактных образцов нитрида титана
на воздухе в интервале температур 600—1000° С (1.29). При
обсуждении механизма процесса окисления TiC и TiN было отмечено
образование промежуточных соединений - - твердых растворов
TiO—TiC и TiO—TiN, которые и определяют скорость окисления.
В работах [1.33, 1.46] в качестве начальной температуры
взаимодействия компактных и дисперсных образцов нитрида титана
с кислородом приводятся значения от 500 до 1400° С.
Оптическим методом изучена кинетика окисления
монокристаллов [3.3]. Сравнение данных кинетических исследований для нит-
108
рида титана в поликристаллическом состоянии и для
монокристаллов TiN позволило выявить влияние несовершенств
кристаллического строения на скорость процесса. Найденное значение энергии
активации (46 ккал/моль) незначительно отличается от величины
энергии активации окисления чистого титана [2.24—2.26]. Это
указывает на то, что диффузионная стадия процесса окисления
монокристаллов нитрида титана является определяющей.
При окислении порошка нитрида титана в интервале
температур 400—1000° С оксинитриды титана не образуются [3.4].
Значительное спекание окалины наблюдалось при 1000° С.
Кинетические кривые окисления порошкообразного нитрида титана в
сухом и влажном кислороде в интервале температур от 600 до 700° С
состояли из двух участков — прямолинейного, обусловленного, по
мнению авторов [3.7], химическим взаимодействием, и
криволинейного, связанного с диффузией кислорода через слой продуктов
реакции. Рассчитанные значения энергии активации (54,6 ккал/моль)
соответствовали данным [1.29, 3.6]. Наличие водяных паров (до 6
об. %)на характер и скорость окисления нитрида титана не влияет.
В работе [3.8] указывается на то, что в продуктах
взаимодействия нитрида титана с кислородом воздуха обнаружена окись азота
NO. Однако в последние годы значительное внимание уделялось
начальным стадиям процесса, связанным с растворением кислорода
в решетке нитридов. В связи с этим появились работы [1.25, 1.92,
3.11—3.25] по исследованию области существования и
комплектности решеток оксинитридов металлов IVa—Va подгрупп.
Изучено окисление порошков (30—50 мкм) нитрида титана
TiNo.gs в широком интервале температур [1.25, 1.92]. В продуктах
окисления на различных этапах взаимодействия обнаружена
кубическая оксинитридная фаза с изменяющимся по отношению к
исходному нитриду периодом решетки, а также анатаз и рутил. Авторы
11.92] отмечают, что процесс окисления азотсодержащих
соединений титана при повышенных температурах носит термоавтокатали-
тический характер.
Окисление нитрида циркония и гафния изучено значительно
меньше, чем окисление нитрида титана [1.25, 1.26, 3.4, 3.9].
Показано, что внедрение кислорода в решетку ZrNo,92 и HfNuo приводит
к промежуточным оксинитридным фазам с меньшим (по сравнению
с исходным) периодом решетки. При окислении нитрида ZrNo.72
наблюдаются несколько иные закономерности. В начальный период
взаимодействия наблюдается некоторое увеличение периода
решетки, и только при более глубоком протекании процесса период
решетки уменьшался [1.25].
Данные о стойкости против окисления порошкообразного
нитрида гафния HfNi.io приведены в работе [1.26]. Температура начала
окисления составляла 615° С. Температуры, соответствующие
максимальной скорости окисления, достигали 800—820° С для HfN2-
и Шг^О^-фаз. Полученные результаты согласуются с
выводами работы [3.9], в которой установлено, что температуры окисле-
109
ния ZrNi о и HfNi о до высших окислов составляли соответственно
680 и 810° С
Растворение кислорода в нитриде ванадия сопровождается
появлением оксинитридных твердых растворов с дефектами в
металлической и металлоидной подрешетках [1.25, ЗЛО, 3.22]. При
изучении растворимости кислорода в порошках TiN, HfN, VN при
температурах 1025—1375 К найдено, что в равновесных условиях
образуются оксинитридные твердые растворы с кубической
структурой, а при определенной степени окисления оксинитриды
предельного состава превращаются в окислы соответствующих металлов
[3.15, 3.22—3.25].
До настоящего времени еще окончательно не выяснены
некоторые вопросы механизма окисления компактных беспористых
образцов нитридов металлов IVa—Va подгрупп в широком интервале
температур, не изучены особенности диффузионной зоны на
начальной и более поздних стадиях, а также влияние азота на
структуру, состав и морфологические свойства окалины.
ДЕФЕКТЫ РЕШЕТКИ НИТРИДОВ МЕТАЛЛОВ
IVa—Va ПОДГРУПП
Карбиды переходных металлов IVa—Va подгрупп характеризуются
наличием вакансий лишь в неметаллической подрешетке; данные
о структурных дефектах в нитридах металлов IVa—Va подгрупп
противоречивы. Нитриды титана, циркония, ванадия и ниобия
характеризуются дефектностью в металлической и металлоидной
подрешетках [7, 3.26—3.34]. Для нитрида титана разница в
рентгенографической (ур) и пикнометрической (уп) плотностях [3.32—
3.33] была отнесена за счет дефектности металлической подрешетки,
что подтвердилось результатами нейтронографических и электро-
нографнческих исследований [3.26, 3.341.
Экспериментальные данные указывают на то, что с повышением
содержания азота в нитриде растет дефектность решетки —
количество вакансий в металлической подрешетке. Так, в работе [3.35]
установлено, что на нижней границе области гомогенности в
отожженном образце мононитрида титана (б-фаза) металлическая под-
решетка полностью заполнена, а на верхней границе в ней
содержится 3% вакансий. Степень заполнения неметаллической подрешетки
увеличивается линейно с повышением содержания азота в
образцах. Эти результаты находятся в соответствии с данными [1.76]
о влиянии содержания углерода и кислорода на комплектность
металлической подрешетки оксикарбидов циркония.
Дефектность металлической подрешетки нитрида циркония
увеличивается с ростом содержания азота [1.77, 1.79, 3.36]. Так,
при изучении рентгеновской и пикнометрической плотности фаз
внедрения на основе циркония показано [1.77], что наибольшая
доля заполнения ((Уг/ур) = 0,98) и максимальная уп соответствуют
нестехиометрическому нитриду состава ZrN0.9O0.04. Повышение
110
содержания азота в нитридах приводит к увеличению дефектности
в металлической подрешетке. Степень заполнения металлической
подрешетки Zro.gssHfo.otteNi.os составляет 0,93, а металлоидной —
0,98 [20]. Незначительные примеси (содержание кислорода)
в нитридах влияют на дефектность металлической подрешетки
[1.77, 3.36].
Для азотированных пластинок йодидного циркония (ZrNo.77—0,97)
(содержание кислорода менее 0,015%) заметного различия между
рентгенографической и пикнометрической плотностью не
обнаружено [3.36]. Однако для нитридов циркония, приготовленных из
порошка с различным содержанием кислорода (~0,01), найдено,
что yp =7,08 и Y„ =7,12 г/см3 для ZrNo.wOo.ooi; (—0,04 мае. % 02)
и Yp > Тп Для ZrNo,6oOo,o2 (порошок циркония имел большую
крупность и примерно 0,2 мас.% 02).
Полученные в работах [1.77, 3.36] данные позволили сделать
предположение [1.77], что дефектность металлической подрешетки
нитрида циркония связана с растворением в ней кислорода.
Металлическая подрешетка во всей области гомогенности нитрида
ванадия (б-фазы, тип NaCl) полностью заполнена, а степень заполнения
металлоидной подрешетки линейно возрастает с увеличением
содержания азота [3.37].
ДЕФЕКТЫ РЕШЕТКИ ОКСИНИТРИДОВ МЕТАЛЛОВ
IVa—Va ПОДГРУПП
Согласно [1.55, 1.59, 1.66], энергия связи в мононитридах зависит
от взаимодействия Me—Me и Me—N. Для комплектного нитрида
преимущественными являются Me—N-связи, а для TiNz с
минимальным содержанием неметалла энергия решетки определяется
обоими видами взаимодействия.
В случае комплектной структуры кубических фаз (типа NaCl)
системы металл IVa—Va подгрупп — углерод — азот — кислород
обменное взаимодействие электронов Me—Ме-связи и заполненных
оболочек атомов неметаллов (С, N, О), а также кулоновское
отталкивание будут приводить к увеличению энергии системы
(эффект экранирования). Этим обусловлено наличие структурных
вакансий в подрешетке металла и неметалла в фазах МеСж, МеО>;
[21—23]. Взаимодействие Me—Me экранируется атомами
неметаллов тем сильнее, чем больше электроотрицательность последних
[1.55, 1.59, 1.66]. Перевод части экранированных связей Me—Me
в энергетически более выгодные неэкранированные состояния
способствует образованию вакансий при замещении атомов азота
кислорода [21—23, 1.56, 1.66].
Несмотря на то что азот менее электроотрицателен, чем
кислород, он также экранирует атомы металла [3.38]. Этим объясняется
наличие структурных вакансий в подрешетках металла и неметалла
в широкой области составов ТЖг-фазы [3.35], что подтверждается
данными работы [3.38].
111
Таблица 13. Сопоставление аср и числа частиц на элементарную ячейку (п,[)
TmzOy- и ТЧСгО^-фаз [3.38]
Состав
TiO0,09N0,65
т^0)09с065
TiO0,10N0,50
TiOo,ioCo,50
TiO0.27N0j37
ТЮ0,27Со,37
TiO0)43N0i23
Т^0,4зСо,23
аср-Ю%
град-'
9,3
8,0
9,3
8,5
9,8
9,5
10,3
10,1
nTi
3,92
3,97
3,95
4,00
3,94
3,97
3,92
3,94
nc
2,58
—
2,00
—
1,47
—
0,91
nN
2,55
—
1,98
—
1,40
—
0,90
—
nQ
0,35
0,36
0,40
0,40
1,06
1,07
1,69
1,69
Растворение кислорода вызывает структурные изменения в
решетках нитридов. Внедрение в кристаллическую решетку
нитрида кислорода или замещение последним азота изменяет ее
комплектность и условия экранирования связей Me—Me в MeN20^ атомами
неметалла [3.38]. Повышение концентрации кислорода в MeN20/;
приводит к увеличению числа вакансий в металлической подрешет-
ке [1.25, 1.26, 1.92, 3.22—3.25].
Взаимодействия Me—Me экранируются атомами неметалла тем
сильнее, чем больше электроотрицательность последних [1.55,
1.59, 1.66]. В случае равенства индексов при кислороде, азоте,
углероде в фазах в TiN20„ и TiC^O,, большей дефектностью под-
решетки металла характеризуются оксинитриды титана, особенно
препараты со значительной концентрацией азота. В оксинитридах
титана экранирующее действие атома неметалла проявляется
больше, чем в оксикарбидных фазах [3.381. Данные табл. 13 показывают,
что с увеличением электроотрицательное™ неметалла растет ее
экранирующее действие на атомы металла. Количество дефектов в
подрешетке металла больше в фазах TiN^O^, чем в TiCxOv. Более
значительным экранирующим влиянием атомов азота по сравнению
с атомами углерода объясняется, вероятно, тот факт, что для
появления структурных вакансий в металлической подрешетке карбида
циркония требуется больше кислородных атомов, чем в случае
нитрида [16].
В результате этого, а также в связи с тем, что жесткость связи
Ti—X в ряду TiC—TiN—TiO ослабляется, изменяется
коэффициент термического расширения в TiN2Of/ по сравнению с TiQO/;-
фазой [3.38]. Дефектность решеток оксинитридных фаз металлов
IVa подгруппы изменяется по-разному [1.79, 1.80, 1.85, 3.18].
В квазибинарной системе TiN—TiO образуется непрерывный
ряд твердых растворов (оксинитридов TiN^Ov), элементарная
ячейка которых имеет вакансии в анионной подрешетке.
Изучены некоторые структурные особенности кубических (типа
412
Таблица 14. Структурные характеристики оксинитридов титана, поданным
работы [1. 92]
Состав оксинитрида
lTi
п0
п2
TiN0,95
TiN0,85°0,10
TiN0573°0,23
TiN0,69°0,27
TiN0,61°0,37
TiN0,58°0,39
TiN0,50°0,48
TiN0f42°0,58
TiN0j20O0s82
TiN0s12°0,98
TiO
1,03
4,2358
4,2385
4,2418
4,2480
4,2476
4,2467
4,2433
4,2345
4,2130
4,1830
4,1792
3,84
3,85
3,85
3,86
3,83
3,81
3,78
3,70
3,56
3,34
3,38
3,65
3,28
2,82
2,67
2,34
2,21
1,89
1,55
0,71
0,40
—
0,39
0,89
1,05
1,42
1,49
1,81
2,14
2,92
3,31
3,48
7,49
7,52
7,56
7,59
7,59
7,51
7,48
7,39
7,19
7,05
6,00
NaCl) оксинитридов титана квазибинарного разреза TiNo.i—TiI>0
11.25, 1.14, 1.85, 3.14—3.18]. Данные о структурных особенностях
оксинитридов, богатых металлом (z -f- у ^ 1) и с минимально
возможным содержанием неметаллов, приведены в работе [3.18].
Анализ сведений о комплектности элементарной ячейки препаратов
оксинитридов TiNzO„, по данным работ [1.14, 1.25, 1.85, 3.14—
3.16] позволили сделать вывод [1.25, 3.18] о том, что характер
изменения степени заполнения кристаллической решетки TiNeOv
от состава достаточно сложен (табл. 14). В частности, для образцов
TiNjX),, при z + у <С 1 с ростом z комплектность подрешетки
металла вначале увеличивается (до состава TiNo.s—o,70o,4—о,з),
а затем незначительно убывает. В связи с этим авторы [1.25, 3.18]
Таблица 15 Структурные характеристики оксинитридов титана, по данным
работы [1.85]
Состав
оксинитрида
р, г/см3
кГ/мм2
iTi
п0
2п,
2п
теорет
Число
вакансий
TiN0,12°0,99
™0,22°0,78
TiN0,3',°0,61
TiN0,5l°0,48
TiN0,5b°0,39
TiN0,69°0,27
TiN0)75O0il9
TiN0,84°0,lI
TiN
0,95
4,183
4,200
4,232
4,243
4,247
4,247
4,243
4,240
4,235
4,96
5,09
5,04
5,15
5,22
5,19
5 15
5,07
5,15
1600
1830
1940
2240
2650
2080
1800
1760
1700
3,34
3,58
3,65
3,78
3,87
3,87
3,86
3,79
3,84
0,40
0:79
1,42
1,93
2,24
2,67
2,90
3,18
3,65
3,31
2,79
2,23
1,81
1,51
1,04
0,73
0,42
7,05
7,16
7,30
7,52
7,62
7,58
7,49
7,39
7,49
8,44
8,00
8,00
7,96
7,88
7,84
7,76
7,80
7,80
1,39
0,84
0,70
0,44
0,26
0,26
0,27
0,41
0,31
8 2920
113
о/
Д2
+5
• 4
Х5"
062х &5W5
Л №<&№&-
0,66 0J9
о
0,8Ь
&1,00
/7 oft m<№ "—
°'96 .0.95'W
4,0
3,6
3,6
ЗА
0,7 0,9
ZbTiNzOy
Рис. 47. Зависимость числа частиц в металлической под-
решетке фазы TiN^O^, от состава (цифры у точек означают
сумму индексов z -f у):
1 — [1.141: 2 — [3.14]; 3 — [3.15]; 4 — [1.85]; 5— [3. 18].
считают, что оксинитриды, образующиеся в системе TiNi.o—TiOi.o,
в интервале составов TiOi.o—TiNo,6-o,70o,4—о.з, следует чисто
условно рассматривать как твердые растворы замещения —
внедрения, а в области TiNo,6-o,70o,4—о.з — TiNi.o — замещения —
вычитания. Переход от одного типа твердого раствора к другому
проявляется и в изменении периодов решетки TiN20y (z + у » 1)
[3.18]. Такой характер заполнения узлов элементарной ячейки
объясняется также максимум на кривой зависимости
микротвердости оксинитридных фаз от содержания кислорода [1.85] и
существенно влияет на диффузионную подвижность его атомов в решетках.
Образцы, имеющие максимальное число частиц в элементарной
ячейке, обладали минимальными скоростью окисления и
микротвердостью (табл. 15).
При рассмотрении зависимости комплектности подрешетки
металла оксинитрида TiNzOo от содержания кислорода [3.18]
показано, что в случае оксикарбидов титана [1.2] при z = const с
уменьшением z -\- у (или у) понижается значение tin (рис. 47). Причем
оксинитриды TiN?Oj, с z -f у = 0,48 -f- 0,57 и j/= 0,06 -т- 0,16
имеют уже комплектную подрешетку металла. По мнению авторов
13.18], это косвенно согласуется с работой [3.35], в которой
установлено, что для отожженных образцов TiN2 в области TiNo.63-o.7o
подрешетка металла комплектна; дальнейшее увеличение z
приводит к росту числа Ti-вакансий. Кубические (типа NaCl)
оксикарбиды ZrQO^, богатые цирконием, (х -f У = 0,4-^-0,5;
у ^ 0,15) также имеют комплектную подрешетку металла [1.76].
114
Образование 15%- и 5%-ных структурных вакансий в
кристаллических решетках TiOi.o и TiNi.o вызвано тем, что здесь
энергетически невыгодные антисвязующие уровни остаются
незаполненными [2.41]. Этим же объясняется наличие двойной дефектности в
элементарной ячейке кубических оксинитридов TiN20^ I1.14,
3.11, 3.14—3.17], богатых неметаллами, а следовательно, имеющих
большую концентрацию валентных электронов, а также то, что в
соединениях TiN20y с г + у = const = 0,97 ± 0,02, плотность
внешних электронов остается практически постоянной (0,46 ±0,01)
[3.18]. Такая закономерность несколько напоминает принцип
Юм-Розери [3.39], связывающий стабильность определенных
структур металлических сплавов с числом электронов, приходящихся
на атом. Она также служит причиной образования вакансий
[3.181. .
Рентгенографическим и электронографическим методами
исследованы оксинитриды титана, образующиеся при окислении нитрида
титана и синтезированных оксинитридов [ 1.92]. Найдено, что
в продуктах окисления TiNo.os и TiN20^ на различных этапах
взаимодействия содержится кубическая оксинитридная фаза с
меняющимся по отношению к исходному соединению периодом
решетки, а также анатаз и рутил. В начальный период окисления
параметр решетки образцов TiNo,95 и TiNgO^ сг > 0,7
(фиксируемый в поверхностном слое препарата) по сравнению с исходным
увеличивается, а затем уменьшается, что коррелирует с
концентрационными зависимостями a (TiNjOtJ) = / (у) и /г2 = / (у)
[1.92]. Это позволило сделать предположение [1.92] о том, что
в начальный период окисления нитридов TiNo,„s и TiN/\ сг> 0,7
образуются оксинитриды, построенные по типу замещения, а в
последующий — по типу внедрения.
Дефектность решеток оксинитридных фаз циркония и гафния
с ростом содержания кислорода изменяется по-разному (табл. 16)
[1.79, 1.80]. Комплектность решетки ZrNjO^ (при х -f У — const)
с повышением содержания кислорода понижается [1.79]. Так, если
в ячейке (Zr, 2%Hf) No,95±o,o3 всего 3,5% узлов металла и 1,1%
неметалла остаются незанятыми [3.30], то для фаз ZrN0.83O0.20
и ZrNo,7>Oo,3i {х + у = 1,03) суммарная дефектность равна 8 и
9,75 соответственно 11.79]. Напротив, характер заполнения
элементарной ячейки оксинитрида гафния весьма своеобразный [1.80].
Элементарная ячейка оксинитрида гафния более комплектна, чем
нитридов HfNi.o и HfNi.io, и комплектность ее растет с повышением
содержания кислорода. Большое значение периодов решетки
образцов HfN^O^ по сравнению с HfNi.o и HfNi.io обусловлено в
основном заполнением узлов его элементарной ячейки крупными
атомами металла. Концентрационная зависимость периода решетки
HfN2 (rat = 1,59А) с увеличением содержания металла растет
[1.80], периоды решеток ZrNi.os и ZrN^Oy (г + у = 1,03) остаются
практически одинаковыми 11.79]. Комплектность решетки
оксинитридных фаз оказывает решающее влияние на скорость их окисле-
115
Таблица 16. Структурные характеристики оксинитридов гафния
и циркония
MN,0
г^у
и А
р, г/см3
пм
nN
п0
nN + nO
1,10
1,0
0,85
0,80
0,74
Гафний
0
—
0,15
0,23
0,16
4,511
4,518
4,524
4,525
4,523
11,62
11,696
12,73
12,69
12,72
3,31
3,495
3,68
3,66
3,70
3,64
3,495
3,13
2,93
2,74
—
0,55
0,84
0,59
Цирконий
3,64
3,495
3,68
3,77
3,63
1,05
0,83
0,72
0,20
0,31
4,576
4,576
4,575
6,88
6,95
6,91
3,72
3,78
3,75
3,91
3,14 •
2,70
0,76
1,16
3,91
3,90
3,86
ния. Образцы TiNjQy и TiQO^, с максимальным числом частиц в
элементарной ячейке характеризовались наименьшей скоростью
окисления и максимальной микротвердостью [1.85].
Изучены область существования и комплектность решетки
кубического оксинитрида ванадия [1.14, 1.81, 3.15] и показано,
что кубический оксинитрид ванадия содержит вакансии в подрешет-
ке металла и неметалла. Следует отметить, что наблюдается
большое различие в структурных особенностях оксинитридов металлов
Va подгруппы. Если система VN — VO характеризуется наличием
области твердых растворов со структурой типа NaCl [3.40], то в
системе NbN — NbO еще наблюдается основная кубическая
симметрия при небольшом содержании кислорода в оксинитриде
NbNo.oOo.i, однако с ростом его содержания оксинитридные фазы
характеризуются уже тетрагонально искаженной структурой типа
NaCl. Искажение решетки, по-видимому, определенным образом
связано с увеличением числа дефектов в решетке, обусловленным
повышением содержания кислорода в оксинитридах ниобия
[3.43, 3.44].
В системе тантал — азот — кислород обнаружено четыре
оксинитрида с гексагональной структурой. Эти отличительные
особенности оксинитридных фаз нитридов металлов Va подгруппы и
структурные их различия даже для нитрида NbN должны влиять
на структуру образующихся газонасыщенных зон.
3.1. Miinster A., Schlamp G. Ober die Oxydation des Titannitrids. I. Die Kinetik
der Oxydation.—Z. phys.Chem., 1957, 13, N 1/2, S. 59—75.
3.2. Munster A., Schlamp G. Uber die Oxydation des titannitrids. II. Der Mecha-
nismus der Oxydation.— Z. phys. Chem., 1957, 13, N 1/2, S. 76—94.
116
3.3. Pearce M. L., Basch С. Oxidation kinetics of single crystal titanium nitride
by optical measurements.— J. Amer. Ceram. Soc, 1969, 52, N 9, p. 496—
498.
3.4. Glasson D. R., Yayaweera S. A. A. Formation and reactivity of nitrides. IV.
Titanium and zirconium nitrides.— J. Appl. Chem., 1969, 19, N 6, p. 182—
184.
3.5. Munster A., Ruppert M. Ober flachen Schichten aus hochschmeltzenden Ti-
tanverbindungen.—Z. Elektrochem., 1953, 57, N 7, S. 564—571.
3.6. Munster A. Eigenschaften und Anwendungen von Titannitrid und Titancar-
bid.— Angew. Chem., 1957, 69, N 9, S. 281—290.
3.7. Федосеев И. В., Немкова О. Г. Окисление нитрида титана в сухом и
влажном воздухе.— Журн. неорган, химии, 1962, 7, вып. 5, с. 980—982.
3.8. Гуревич Ю. Г., Семенов Ю. К., Бразгин И. А. Взаимодействие нитрида
титана с кислородом воздуха.— Изв. АН СССР. Сер. Металлы, 1970, № 4,
с. 231.
3.9. Лютая М. Д., Кулик О. П., Качковская Э. Т. Термическое разложение на
воздухе нидридов некоторых переходных металлов.— Порошковая
металлургия, 1975, № 9, с. 63—68.
3.10. Borgianni С, Stefano V., Grimaldi R. On the oxidation of vanadium nitride
in flowing oxygen.— J. Less-Common Metals, 1970, 20, N 4, p. 299—307.
3.11. Schmitz-Dumont O., Steinberg K- Mischkristallbildung in System TiO — TiN.—
Naturwissenschaften, 1954, 41, N 5, S. 117.
3.12. Самсонов Г. В., Верхоглядова Г. С, Львов С. Н., Немченко В. Я. Влияние
кислорода на электрические свойства нитрида титана.— Докл. АН СССР,
1962, 142, № 4, с. 862—865.
3.13. Gilles J. С. Formation d'oxynitrures a partir des oxydes refractaires : Etude
de leurs structures et de leurs proprietes.— Rev. int. hautes temp, et refract.,
1965, 2, N-4, p. 237—262.
3.14. Нешпор В. С., Климашин Г. М., Никитин В. П. Исследование гальвано-
[ магнитных и электрических свойств сплавов TiC—TiO, TiN—TiO, TiC—TiN
и ZrC—ZrN.— В кн.: Тугоплавкие карбиды. Киев : Наук, думка, 1970.
с. 169—182.
3.15. Нечаев Ю. А., Камыиюв В. М. Дефектность решеток оксинитридов титана
и ванадия.— Гетерог. процессы с участием твердых фаз, 1970, вып. 18,
с. 42—52.
3.16. Климашин Г. М., Козловский Л. В., Левина Р. Н. О некоторых структурных
особенностях твердых растворов в системах TiC — TiN, TiC — TiO, TiN —
TiO.—Жури, прикл. химии, 1971, 44, № 7, с. 1646—1648.
3.17. Neumann G., Kieffer R.r Ettmager P. Ober das System Ti—TiN—TiO.—Mo-
natsch. Chem., 1972, 103, N 4, S. 1130—1137.
3.18. Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П. Некоторые структурные
особенности кубических (типа NaCl) оксинитридов титана.— Изв. АН СССР.
Сер. Неорган, материалы, 1976, 12, № 8, с. 1396—1399.
3.19. Морозова М. П., Галъбрайх 9. И., Смирнова В. А. Энтальпия образования
оксинитридов титана.— Изв. АН СССР. Сер. Неорган, материалы, 1968,
4, № 4, с. 523—526.
3.20. Смагина Е. И., Курцев В. С, Ормонт Б. Ф. Исследование равновесия в
системе Zr — N при высоких температурах.— Жури. физ. химии, 1960, 34,
№ 10, с. 2328—2335.
3.21. Этельбаум В. А., Ормонт Б. Ф. О некоторых свойствах реальных
кристаллов нитрида ванадия.— Жури. физ. химии, 1947, 21, № 1, с. 3—10.
3.22. Нечаев Ю. А., Камышов В. И. Исследование растворимости кислорода в
нитридах переходных элементов IV—V групп.— Гетерог. процессы с
участием твердых фаз, Свердловск, 1970, вып. 8, с. 3—30.
3.23. Нечаев 10. А., Камышов В. М. Растворимость кислорода в нитриде
титана.— Изв. АН СССР. Сер. Металлы, 1969, № 6, с. 50—53.
3.24. Камышов В. М., Нечаев Ю. А. Термодинамические свойства системы TiN —
ТЮ.— Журн. физ. химии, 1969, 43, № 11, с. 2761—2765.
3.25. Нечаев Ю. А., Камышов В. М. Растворимость кислорода в нитриде
гафния.— Журн. неорган, химии, 1970, 15, № 12, с. 3249—3253.
117
3.26. Троицкая Н. В. Электронографическое исследование кубического нитрида
титана.— Кристаллография, 1965, 10, № 3, с. 284—286.
3.27. Juza R., Gabel A., Rabenau H., Klose W. Ober eine blaues Zirkonitrid.— Z.
anorg. und allg. Chem., 1964, 329, N 1/6, S. 136—145.
3.28. Резчицкий Л. А. О форме зависимости теплоты образования от состава в
области гомогенности тугоплавких соединений.— Изв. АН СССР. Сер.
Неорган, материалы, 1968, № 5, с. 706—710.
3.29. Hahn Н. Ober das System Vanadium-Stickstoff.— Z. anorg. Chem., 1949,
258, S. 58—68.
3.30. Straumanis M. E., Faunce C.A., James W. J. The defect structure and
bonding of zirconium nitride containing excess nitrogen.— Inorg. Chem., 1966,
5, N 11, p. 2027—2030.
3.31. Straumanis M. E., Faunce C. A. Der unvollkommene Aufbau des Hafnium-
nitrids und das Bindungsproblem.— Z. anorg. und allg. Chem., 1967, 353,
N 5/6, S. 329—336.
3.32. Брегер А. И. Рентгенографическое исследование нитрида титана. III.
Исследование поликристаллических препаратов.— Журн. физ. химии, 1939,
13, № Ю, .с. 1483—1493.
3.33. Ehrlich P. Ober die binaren Systeme des Titans mit den Elementen Stickstoff,
Kohlenstoff, Bor und Beryllium.— Z. anorg. und allg. Chem., 1941, 259, N 1,
S. 1—41.
3.34. Горбунов Ы. С, Шишаков Н. А. и др. Нейтронографическое исследование
карбида и нитрида титана.— Изв. АН СССР. Отд-ние хим. наук, 1961, № 11,
с. 2093—2095.
3.35. Арбузов М. П., Хаенко Б. В., Качковская Э. Т. Исследование реальной
структуры мононитрида титана в области его гомогенности.— Порошковая
металлургия, 1973, № 6, с. 69—74.
3.36. Янчур В. П., Андриевский Р. Л., Спивак И. И., Федотов М. А. Изучение
физико-механических свойств нитрида циркония в области гомогенности.—
Изв. АН СССР. Сер. Неорган, материалы, 1969, б, № 6, с. 1012—1017.
3.37. Арбузов М. П., Хаенко Б. В., Френкель О. А. Рентгенографическое
исследование фаз системы V — N.— Изв. АН СССР. Сер. Неорган, материалы,
1975, И, № 2, с. 236—241.
3.38. Зайнулин Ю. Г., Алямовский С. И., Швейкин Г. П. Коэффициенты
термического расширения и экранирование М—М-связи в кубических оксинитри-
дах титана.— Изв. АН СССР. Сер. неорган, материалы, 1977, 13, № 10,
с. 1783—1786.
3.39. Физическое металловедение/ Под ред. К. Кана.— М. : Мир, 1967.— Вып. 1.
333 с.
3.40. Эпельбаум В. А., Брегер А. X. Рентгенографическое исследование нитрида
ванадия. III. Система VN —VO.— Жури. физ. химии, 1946, 20, № 6, с. 459—
460.
3.41. Вгаиег С, Sander J. Die Nitride des Niobs.— Z. anorg. und allg. Chem., 1952,
270, N 1/6, S. 160—178.
3.42. Schoenberg N. Ternary metallc phases In the Та — С — N, Та — N — О
systems.—Acta chem. scand., 8, N 4, p. 620—626.
3.43. Neuman В., Kroger C, Kunz H. Die Bildungswarmen der Nitride. V. Die Ver-
brennungswarmen einiger Metalle und Metallnitride.— Z. anorg. und allg.
Chem., 1934, 218, N 1/6, S. 379—401.
3.44. Schoenberg N. Some features of the Nb — N and Nb — N — О systems.— Acta
chem. scand., 1954, 8, N 2, p. 208—212.
Глава 4
ОКИСЛЕНИЕ НИТРИДОВ
МЕТАЛЛОВ IVa-Va ПОДГРУПП
ОКИСЛЕНИЕ НИТРИДОВ
МЕТАЛЛОВ IVa ПОДГРУППЫ
Окисление TiN
Нитрид титана характеризуется высоким сопротивлением окисле
нию (рис. 48) [2.5, 4.1]. Для всех исследованных образцов в
интервале температур 500—1200° С получены кинетические кривые
параболического характера. Прямолинейный участок их обусловлен
химическим взаимодействием, а параболический — диффузией
кислорода через слой продуктов реакции.
Внешний вид образцов, окисленных при температурах 400—
600° С, не изменяется. С повышением температуры образцы теряли
металлический блеск и тускнели. При температурах 800—900° С
окисленные образцы покрывались бежево-желтой пленкой окислов,
на которой проступали коричневато-бурые пятна окисных фаз,
возможно, аиатаза. Дальнейшее повышение температуры приводило
Рис. 48. Кинетические кривые окисления нитрида титана:
1 — 500; 2 — 600; 3 — 700; 4 -, 800; 5 — 900; 6 — 1000; 7 — 1100; 8 -= 1200° С.
119
Таблица 17. Результаты рентгеновского фазового анализа окалины, образован
Нитрид
Фазы, содержащиеся
400
500
600
700
TiN,
начальная стадия
TiN, 6 ч
ZrN,
начальная стадия
ZrN, 6 ч
HfN,
начальная
стадия, 5 мин
HfN, 6 ч
VN, 6 ч
NbN,
начальная стадия
NbN, 6 ч
TaN, 6 ч
5 мин Ti
Ti, TiO„
Ti00
■5pyf,
5 мин Zr
I — ZrOs .
Zr, Il-Zrof'
Hf02 , Hf
zMOH *
voliWi v,
I-P = Nb205,
II — a = Nb206
P = Ta206,
TaO*
5 мин Ti
Ti, TiOs
Ti09
РУТ»
12 мин Zr,
Zr02 Л.
2куб»
15 мин Zr,
Zr02 Л
Zr02
1 — Zr02 , ,
„ п<уб>
Zr, II _ Zr02 n
НЮ2 Hf
тмон»
НЮ, Hf,
2тетр
vo1>78. v,
УА
15 мин
1— P = Nb205,
II—ct = Nb206;
1 ч I — p = Nb2Ob
I-P = Nb206,
II—ot = Nb2Ob
(3 = Ta206, TaOx
5 мин Ti; 30 мин
TiO,a „„., Ti
2анат'
' 2РУТ'
Т1°2анат
5 мин Zr,
Zr02 Л
''куб
ZrII-Zr02MOH
Hf02 n , Hf
ЧМОВ
HK4,c*. Hf,
ню2тетр
vo2, v2o3, v.
v2o5
15 мин
I — p = Nb205;
30 мин
I-P = Nb206,
II— a = Nb205
I_P = Nb205,
II—a = Nb206
P = Та2Оь,
ТаО,
Ti, TiO.
TiO
pyT'
2анат
I — ZrCL л
Zr, II — Zr02
HfO.
моь
2moh' Hf
HfO,
Hf,
HfO,
vo2, v3o8, v,
v2o6
I - p = Nb205,
II — a = Nb205
P = Ta206,
ТаОх
к изменению формы образцов, которые становились
бочкообразными, а верхний слой окалины приобретал буровато-лиловый цвет с
металлическими блестками. Окалина была прочно сцеплена с
основой образца. При увеличении температуры до 1200° С окалина
заметно утолщалась, становилась в основном темно-красного цвета.
На начальных стадиях окисления компактных беспористых
образцов нитрида титана внедрение кислорода в решетку нитрида
титана сопровождается выделением свободного металла и азота
(400—600° С, 5 мин.), но с дальнейшим повышением температуры
(800 и 1000° С) в пленке появляется и анатаз ТЮ2 (табл. 17).
Электронно-микроскопические и металлографические
исследования в обычном и поляризованном свете процесса окисления
TiN в среде кислорода при невысоком его давлении (10~* 10~~,
10~ , 10 и 150 тор) и температурах 500, 750 и 1000е С позволили
120
ной при окислении нитридов
п окалине при температуре, °С
800
5 мин ТЮ2анат,
Ti; 18 мин
Ti02„ я , Ti
'анат
Ti, TiOa от,
' ^рут'
TiO.
"анат
5 мин Zr,
2куб»
Zr02
zmoh
Zr02 Л, Zr02 „
НЮ. , Hf
2МОн'
HfO„ , Hf,
zmoh'
ню„
■^тетр
VA
1 4 1—6 =
Nb206, II — a =
= Nb206; 15 мин
6 = Nb2Ob
P = Nb206
P = Та20Б, ТаОу
900
—
—
Zr02 Л,
zmoh
ню2 ,
''moh
ню,
2тетр
v2o6
p = Nb2Ob
3 = Ta205,
TaOy,
a = Ta206
1000
5 мин Ti,
2анат
1 —Ti,
II — Ti02a ят
Ti02
5 мин Zr,
&02куб'
zMOH
Zr02 rt,
^куб'
гю2
НЮ2 , Hf
'MOH
ню2 ,
zmoh'
ню.
^тетп
v2o5p
P = NbaOB
В = Та20Б,
ТаОу,
a = Та20Б
1100
18 мин Ti,
Ti02 ,
2pyT'
ТЮ«анат
1—Ti,
II — ТЮ- ят
■^анат»
Ti02
2 мин Zr,
Zf02 Л
2куб
Zr02 Л.
^куб'
гю2
ню2
''мои
VA
Р = NbaOR
В = Та2Оь,
ТаОу,
а = Та2Оь
1200
18 мин Ti,
Tjo2 т.
TiO„
2анат
I —Ti,
И —Ti02 ,
—
2г°2куб>
Zr°2Mo«
—
2МОН
v2o6
—
Р = Nb2Oe
В = Та205,
ТаОу.
а = Ta205
выявить особенности выделения металлического титана в
поверхностный слой, постепенного окисления титана и формирования окис-
ной пленки. Так, при температуре 500° С и давлении 10~ тор
через 3 ч поверхность образца покрывалась слоем металлического
титана незначительной величины (~ 0,15 мкм), в который уже
вкраплены низшие окислы титана оранжевого, синего и темно-серого
цвета такой же примерно величины (рис. 49, а, см. вклейку).
С ростом давления вследствие усиливающихся процессов
диффузии и растворения кислорода в нитридной матрице выделения
металлического титана в поверхностный слой становятся более
выраженными. Отдельные круглые частички металлического
титана (Р — Ю-1 тор) сливаются в сплошные слои,, в которые частично
вкраплены оранжево-красные и сине-зеленые окислы титана. При
давлении 10 тор выделение титана происходит особенно интенсивно
121
dm/S,Ms/CM2
0 f
Рис. 50. Кинетические кривые
окисления нитрида титана при
температуре 1100° С и различном давлении
кислорода:
/ _ 10—5. 2 -— Ю—1; 3 _ Ю; 4 — 150 тор.
(рис. 49, б). Титан покрывает
поверхность образца сплошным
слоем преимущественно по
границам зерен, а его частичное
окисление приводит к
появлению светло-серой и
светло-голубой окисных пленок. Вследствие
этого образец становится
светлее, чем при более низком
давлении. С ростом давления до
150 тор общая картина не
меняется.
С повышением температуры (800° С) более интенсивными
становятся процессы выделения титана в поверхностный слой с
появлением при более высоком давлении сплошных образований титана
значительной величины. В этом случае формируются низшие
оранжево-красные и синие окислы титана с последующим их
превращением в светло-бежевый окисел, который с ростом давления темнеет.
При температуре 1000° С и давлении кислорода 10~~5 тор на
поверхности еще наблюдаются металлические частички титана
круглой формы (рис. 49, в), сливающиеся при повышении давления
в сплошные слои по границам зерен (рис. 49, г). При более высоком
давлении (10—' тор) образец покрывается буровато-кремовой
пленкой окислов, сквозь которую просматривается зернистая структура
пленки из низших окислов титана, имеющих форму квадратов,
палочек и т. д., плотность распределения которых увеличивается
с ростом давления.
Кинетические исследования (рис. 50, а) указывают на
некоторую убыль массы, связанную е удалением азота из решетки,
образующейся в процессе окисления оксинитридной фазы.
По данным рентгеновского фазового анализа (см. табл. 17)
и электронно-микроскопических исследований (см. рис. 21)
свободный титан обнаруживается в окалине на более длительных стадиях
процесса окисления на воздухе в широком интервале температур
(400—1200° С). Металлографическое исследование окисленных
образцов нитрида титана позволило выяснить особенности, связанные
с образованием окисных, оксинитридных фаз, их цветом на
начальных и более поздних стадиях процесса. При температуре 500—600° С
на начальной стадии процесса постепенно изменяется цвет образцов
нитрида титана, переходящего от светло-золотистого к
темно-золотистому и красновато-золотистому в направлении от середины
образца к границе нитрид — кислород, а у края образца формируется
122
тонкий слой темно-красной фазы оксинитрида титана.
Непосредственно за ним следуют тончайшие включения металлического титана,
покрытые тонкими слоями фиолетово-черных и сине-черных
окислов титана. Верхние слои окисной пленки состоят из буровато-
красных включений анатаза. Появление в слое окисной пленки
окислов титана темного цвета может быть обусловлено частичным
окислением выделяющегося титана в процессе окисления нитрида.
На более длительных стадиях процесса образуются зоны окси-
нитридных твердых растворов, но более выраженными становятся
не слои с красновато-золотистым оттенком, а слои сиреневато-серого
цвета у границы нитрид — окалина. Окисная пленка состоит
из внешних включений рутила серого цвета и красно-бурых
выделений анатаза, расположенных предпочтительно во внутренних
слоях, примыкающих к оксинитридам. Характерным для исходной
структуры нитрида титана на данной стадии процесса является
дробление зерен в поверхностном слое, примыкающем к окисной
пленке.
Повышение температуры до 700° С не изменяет состав окисной
пленки. По краю образца просматривается тонкая нить
металлического титана, над которым расположены незначительные
включения сине-черных и фиолетово-черных окислов титана, затем
следуют красно-бурые включения анатаза с тонким внешним слоем
из рутила серого цвета. Зона оксинитридного твердого раствора
представлена тонким слоем светло-сиреневого цвета,
примыкающего непосредственно к границе окалина — нитрид, затем следует
слой красновато-золотистого цвета незначительной толщины,
который постепенно переходит в слои темно-золотистого и более светло-
золотистого цвета ближе к центру образца.
Начальные стадии процесса окисления при 800° С (20 мин)
характеризуются довольно интенсивным окислением. Ближе к краю
образца имеется зона оксинитрида титана с красноватым оттенком,
изменяющимся в сторону более светлых тонов по мере
перемещения к середине образца. На краю образца расположен тончайший
слой оксинитридной фазы серо-голубого цвета, микротвердость
которой очень высока (2575—2853 кГ/мм), над которой
просматриваются включения металлического титана. Более верхние слои
продуктов реакции представлены красно-бурым анатазом и тонким
внешним слоем рутила серого цвета.
На более поздних стадиях процесса при 800° С образуется
довольно плотная пленка окислов с внутренним слоем из анатаза и
внешним — из рутила. Зона оксинитридного твердого раствора
состоит из таких же, как и на начальной стадии процесса, слоев,
но со значительно более выраженным слоем светло-сиреневого
цвета и, напротив, менее выраженным слоем с
красновато-золотистым оттенком. Внутренний слой окалины хорошо выражен и состоит
из анатаза, внешний слой серого цвета — из рутила. С дальнейшим
повышением температуры до 900° С последовательность
расположения зон оксинитридных и окисных фаз, а также толщина отдельных
123
слоев несколько изменяются. Например, толщина
светло-сиреневой фазы оксинитрида составляет 0,015—0,018 мм, а
расположенный над ним красно-бурый слой анатаза имеет толщину 0,009—
0,001 мм. При этой температуре значительно меньше
промежуточных фаз окислов титана темного цвета, что может быть обусловлено
более интенсивным окислением титана, выделяющегося при
окислении нитрида.
При более высокой температуре (1000° С) для начальной
стадии процесса характерно наличие в окисленных образцах зон окси-
нитридных твердых растворов, цвет которых меняется по мере
перехода к границе нитрид — окалина. Красноватый оттенок окси-
нитридных фаз становится более густым по мере перехода к границе
нитрид — окалина и заканчивается перед слоем окалины
сиренево-серым тонким слоем оксинитрида титана, количество
которого изменяется при продолжительном окислении. Уже на
первой стадии процесса между слоем оксинитрида и слоем окисной
пленки появляется тончайший слой металлического титана. При
температуре 1000° С на более поздних стадиях процесса также
формируются зоны оксинитридных твердых растворов, которые
изменяют свой цвет от золотистого до более густых темно-золотистых
тонов по мере приближения к границе нитрид — окалина, где он
становится красно-бурым с последующим переходом в сиренево-
серый с высокой микротвердостью. Затем следует тонкий слой
(0,018 мм) металлического титана и многофазный слой окалины.
Во внутреннем его слое распределены участки красно-бурого
анатаза, несколько выше — включения металлического титана,
микротвердость которого составляет 120 кГ/мм2.
Дальнейшее повышение температуры до 1100° С приводит к
увеличению в слое окалины количества рутила и красно-бурых
включений анатаза. Как и при температуре 1000° С, намечается
постепенное изменение цвета оксинитридных твердых растворов
от золотистого до темно-золотистого, переходящего к краю образца
в красновато-золотистые фазы, а затем в тонкий слой
серо-сиреневой фазы оксинитрида с высокой микротвердостью. Окалина состоит
из многих слоев. К образцу прилегает слой окалины, в котором
распределены металлические включения титана. За ним следует
слой анатаза бурого цвета. Ближе к внешней фазовой границе
располагается ярко-красный слой рутила. Следует отметить, что
ярко-красные ободки внешних слоев рутила наметились уже при
800° Сие ростом температуры слои ярко-красного цвета
становились более выраженными.
При температуре 1200° С окалина имеет много слоев и фаз.
По краю образца тянется тонкий слой сиренево-серой фазы
оксинитрида титана, за которым следует тонкий слой оксинитрида ярко-
красного цвета, переходящий затем в темно-золотистые и светло-
золотистые оксинитридные фазы. Внутренний слой окалины
темный, пористый. В нем четко виден тонкий светло-серый
металлический слой титана, микротвердость которого составляет 140кГ/мм2.
124
Рис. 51. Изменение
микротвердости по сечению окисленных
образцов нитридов титана (1), гафния
(2) и циркония (3—5):
1,2— 600, 1000° С* 4 мин; 3 — 500° С,
15 мин; 4—700вС, 12 мин; 5 — 1000° С,
4 мин.
На Ж/ИМ
ft
2000
1500 -
1000
О 1 2 3 4
Расстояние от поверхности, мм
Такое значение
микротвердости титана может быть
обусловлено некоторым
растворением кислорода. С обеих
сторон слой титана окружен
красно-бурым анатазом.
Верхний слой окалины состоит из
рутила ярко-красного цвета.
Во внешних слоях окалины
из рутила наблюдается рост
зерен.
При окислении нитрида
титана на начальных стадиях
процесса зоны
красновато-золотистых оксинитридных
твердых растворов более
выражены, чем на более поздних
стадиях, где они представлены тонким слоем. Сиреневато-серая фаза
оксинитрида титана с увеличением продолжительности времени
окисления образует слой большой толщины.
Согласно данным металлографического анализа, при окислении
нитрида титана на начальных и более поздних стадиях
формируются поверхностные зоны оксинитридов титана, цвет которых,
отражая их состав и структурные особенности, меняется по мере
перемещения в глубь образца и зависит от времени и
продолжительности процесса. Такой характер изменения микротвердости
оксинитридных фаз (рис. 51, 52, табл. 18) объясняется структурными
особенностями, появляющимися при растворении кислорода и
выделении металла и азота из решетки оксинитридных фаз.
На более поздних стадиях процесса на границе окалина —
нитрид формируется слой оксинитридной фазы толщиной 150 мкм,
характеризующейся большими параметром решетки (а = 4,24 А)
и микротвердостью, чем исходный нитрид, а более глубокие слои
оксинитридных фаз — низким параметром решетки и
микротвердостью (см. рис. 51, 52).
Следует отметить, что фаза TiNo,580o,38 предельного
состава [3.22] в равновесии с азотно-кислородной газовой фазой, по
данным работы [1.85], действительно характеризовалась
максимальной микротвердостью (2680 кГ/мм2), что согласуется с высоким
значением микротвердости поверхностных зон окисленных нами
образцов нитрида титана (2660 кГ/мм2) при различных температурах
125
Нм,кГ/ммг
3000
2500
2000
1500-
1000-
i 2 3
Расстояние от поверхности,/™
Рис. 52. Изменение микротвердости по сечению окисленных в
течение 6 ч образцов нитрида титана:
/ — 1200; 2 — 900: 3 — 600, 700° С
(700—1200° С). Период решетки этой фазы (4,247 Л) близок к
значениям периода решетки оксинитридов состава TiNo.580o.38- Эти данные
указывают на то, что при длительном окислении компактных
образцов нитрида титана в равновесии с кислородно-азотной газовой
фазой на границе окалина — нитрид может находиться оксинитрид
предельного состава, что согласуется с данными [3.22—3.24].
Действительно, максимально насыщенный кислородом
оксинитрид, находящийся в равновесии с кислородно-азотной газовой
фазой (1023—1073 К), отвечал составу TiNo.eOc» С увеличением
парциального давления кислорода в газовой фазе оксинитрид рас-
126
Таблица 18. Цвет и микротвердость оксинитридных и окисных фаз,
образующихся в процессе окисления нитридов металлов IVa—Via подгрупп
Время
Фаза
Н„ оксинит-
ридной и
окисной фаз,
•<Г/мм2
Цвет
Слой внешней части
образца, окалина
Нитрид титана (Н^ = 2000 кГ/мм2)
600
800
1000
600
800
1000
1200
600
700.
800
900
1000
1100
5 мин
5 мин
5 мин
30 мин
18 мин
20 мин
18 мин
5 ч
5 ч
5 ч
5 ч
5 ч
5 ч
1 ™*о„
ТНЗД
TiN^O,
Ti(Oj
TiNA,
тю2_х
Tiro;
TiN^O,
Ti02_*
Ti(O)
TiN*Op
Ti02__,
Ti(O)
TiN^
Ti02_x
ТЮ2_*
ТЮ2_*
TiN^Oy
TiN^Oy
TiN^
TiNjcOj,
TiN^O^
TiN^O^
TiN^
TiN^O^
TiN*Oj,
TiO^
TiNxO^
TiN*Otf
TINjA,
TiOa--*
TiNxO^
TiNxOy
TiNxOy
ТЮа-л;
TiO.,_x
TiNiOtf
TiN^Oy
TiNvO,,
Ti02_x
ТЮ2_*
—
—
—
594
1272
1483
402
1320
1426
429
1372
1142
579
1226
1065
1142
1610
1788
1030
2600
1650
1050
2650
1170
940
2660
1413
1280
940
2680
1197
1340
960
2700
1372
1049
1450
980
2680
1119
965
Сиреиевосерый
» »
Светло-золотистый
Золотистый
Красновато-
золотистый
Серо-голубой
Золотистый
Красновато-
золотистый
Серо-голубой
Золотистый
Красновато-
золотистый
Серо-голубой
Золотистый
Красновато-
золотистый
Серо-голубой
» »
Светло-серый с
голубым оттенком
Золотистый, темно-
золотистый
Сиреневато-серый
Золотистый
Темно-золотистый
Сиреневато-серый
Светло-золотистый
Темно-золотистый
Сиреневато-серый
Серо-голубой
Светло-золотистый
Темно-золотистый
Сиреневато-серый
Серо-голубой
Светло-золотистый
Темно-золотистый
Сиреневато-серый
Серо-голубой
Серый
Светло-золотистый
Красновато-
золотистый
Сиреневато-серый
Серо-голубой
» »
-
По границам зерен
» » »
» » »
» » »
Поверхностный
Окалина,
По границам зерен
Поверхностный
Окалина
По границам зерен
Поверхностный
Окалина по
границам зерен
Поверхностный
Окалина
»
»
Внутренний
Приповерхностный
»
Внутренний
Приповерхностный
»
Внутренний
Приповерхностный
»
Окалина
Внутренний
Приповерхностный
»
Окалина
Внутренний
Приповерхностный
»
Окалина
»
Внутренний
Приповерхностный
»
Окалина
»
127
Продолжение табл. 18
Время
Фаза
/У„ оксинит-
ридной и
окис ной фаз.
кГ/мм2
Цвет
Слой внешней части
образца,- окалина
1200 5 ч
TiN*0y
ШХ0У
ттхоу
ТЮ,_,
5 мин
5 мин
15 мин
12 мин
5 мин
5 мин
ZrN^
ZtNxOy
ZvNxOy
ZrNxO^
Zr02_*
ZrN^Oy
ZrN^
Zr02__x
ZrN^
ZvNxOy
ZrOa_x
ZrNxO^
ZrNxOy
Zr02_*
1147
980
2680
1095
д циркония
985, 650,
550, 501
713, 501,
480
1102
458
1514
1072
666
1648, 1610
1049
655
1710
1049
655
1740
Светло-золотистый
Красновато-
золотистый
Сиреневато-серый
Серый
(//(х = 1524 кГ/мм2)
Золотистый
»
»
Красновато-
золотистый
Светло-серый с
голубым оттенком
Светло-золотистый
Красновато-
золотистый
Светло-серый g
голубым оттенком
Золотистый
Золотистый с
красноватым оттенком
Светло-серый с
голубым оттенком
Светло-золотистый
Темно -золо тистый
Светло-серый с
голубым оттенком
Внутренний
При поверхности ый
»
Окалина
По границам зерен
» » »
Внутренний
Поверхностный
Окалина
Внутренний
Поверхностный
Окалина
Внутренний
Поверхностный
Окалина
Внутренний
Поверхностный
Окалина
Нитрид гафния {Н^ — 1640 кГ/мм2)
5 мин
5 мин
5 мин
HfN^O,,
HfN^Oy
HfN*Ow
2656, 2575,
1890
2575, 1947
2663, 2336,
2065
Серо-зеленый
По границам зерен
Поверхностный
падается на Ti02 и молекулярный азот [3.24], что подтверждается
и результатами работы [1.92]. При окислении нитрида TiNo,95
и оксинитридов TiNgO^ q появлением в образцах Ti02 период
решетки сосуществующего с ним оксинитрида оставался практически
постоянным. Это дало основание предположить [1.92], что при
окислении богатых азотом препаратов образцов образуется оксинитрид
предельного состава, соответствующего приблизительно составу
TiNo.4-o.50o ,6—0,5.
128
Рис. 33. Микроструктура окисленных образцов карбида 1антала:
а — 600° С. X 450; б — 1000° С. X 500
Рис. 44. Микроструктура окисленного
при температуре 1100° С образца
карбида вольфрама (X 270).
Рис. 49. Электронно-микроскопическая структура поверхности окисленных
образцов нитрида титана:
X 6500;
Металлографические исследования в обычном и
поляризованном свете показали, что цвет океинитридов титана зависит от
содержания кислорода, определяемого временем и температурой
окисления. При длительном окислении цвет океинитридов титана
изменяется от сиреневато-белого в поверхностном слое (Нц = 2500 -f-
2700кг/мм2), золотистого в следующей зоне до светло-золотистого в
средних слоях образца, в то время как на начальных стадиях
процесса промежуточные оксинитридные фазы в зоне, прилегающей к
окалине, были красного цвета (Н^ = 1200 -f-1300 кг/мм2),
переходящие в темно-золотистый и в светло-золотистый в более глубоких
слоях нитрида (см. табл. 18).
Данные габл. 18 указывают на интересную зависимость цвета
и микротвердости оксинитридных фаз в зависимости от
температуры, времени окисления и расстояния от границы нитрид —
кислород. Так, при окислении нитридов титана и циркония цвет
оксинитридных фаз, полученных при кратковременном окислении,
изменяется по глубине от красновато-золотистых оттенков на краю образца
до темно-золотистого в следующем слое и светло-золотистого в более
глубоких слоях.
Следует, однако, отметить, что если при окислении нитрида
циркония наименьшим значением микротвердости характеризуются
фазы ZrNxOlV с красновато-золотистым оттенком на границе
окалина — нитрид, то при окислении нитрида титана наименьшим
значением микротвердости характеризуются фазы с золотистым
оттенком, следующие далее в глубь образца за
красновато-золотистой фазой оксинитрида.
На более длительных стадиях процесса на нитриде титана на
границе нитрид — окалина перед красноватой фазой формируется
сиреневато-серая оксинитридная, которая по микротвердости
значительно превышает исходный нитрид. На начальных стадиях она
образуется лишь в отдельной части по границам зерен. При
окислении нитрида гафния на начальной стадии появляются серо-зеленые
оксинитридные фазы с микротвердостью, значительно большей
микротвердости исходного нитрида. Такие значения
микротвердости сохраняются оксинитридами и при образовании их на более
длительных стадиях окисления.
Существует, по-видимому, непосредственная связь между
цветом оксинитридных фаз титана и их структурными
характеристиками. Оксинитриды титана с большим содержанием азота
характеризуются более высоким числом частиц титана в элементарной
ячейке по сравнению с исходным нитридом T1N0.95 H.923. С ростом
содержания кислорода в оксинитридах вплоть до состава TiNo.6sOo.27
число частиц титана в элементарной ячейке увеличивается.
При окислении чистого титана в парах воды появляется окалина
красно-бурого цвета, что связывалось авторами [4.2] с повышением
концентрации межузельных катионов титана в решетке Ti02.
При окислении нитрида титана в отличие от чистого титана красно-
бурые ободки окалины из рутила образуются при более низких
9 2920
129
температурах (800° С), что может быть обусловлено также
увеличением концентрации катионов титана в окалине из рутила,
вызванным растворением азота.
Вероятно, наблюдаемая красно-бурая окраска слоев оксинит-
ридных фаз также связана с увеличением концентрации катионов
титана в решетке оксинитридных фаз по сравнению с исходным
нитридом при определенном содержании кислорода.
Следовательно, изменение цвета оксинитридов TiN от светло-
золотистого до красного зависит от особенностей образования
оксинитридных фаз, протекающего в определенном интервале
составов путем увеличения числа частиц титана в элементарной
ячейке [1,25, 1.92, 3.181. При окислении нитрида титана в среде
кислорода появление окраски оксинитридов намечается лишь
при высоком давлении кислорода (150 тор) и температуре
1000° С.
Нитрид титана характеризуется значительным сопротивлением
окислению вплоть до температуры 1100° С. Оксинитриды титана
сг> 0,5 (при z + у =1) более стойки к окислению, чем нитрид
титана [1.921, что связано со структурными особенностями этих
оксинитридов. У оксинитридов титана с z >» 0,5 комплектность
кристаллической решетки больше, чем у исходного нитрида TiNo.95.
В оксинитридах с г >• 0,6 число частиц титана в элементарной
ячейке также увеличивается.
Дефектность решетки оксинитридов влияет на сопротивление
их окислению в различных интервалах температур [1.921.
При температуре выше 750° С наиболее стойкими к окислению
оказались образцы, богатые азотом, а при температурах ниже
750° С — образцы, бедные азотом. Это дало основание авторам
[1.923 предположить, что при невысоких температурах, когда
коэффициенты поверхностной и межкристаллитной диффузии
значительно больше коэффициента объемной диффузии, влияние
дефектности оксинитридов должно сказаться в меньшей степени,
чем площадь реакционной поверхности.
С ростом температуры значительную роль начинает играть
увеличение коэффициента объемной диффузии, непосредственно
связанной со степенью комплектности кристаллической решетки.
В этом случае более устойчивы к окислению оксинитриды, богатые
азотом, как наименее дефектные. Увеличению роли объемной
диффузии может способствовать также эффект термоавтокатализа,
проявляющийся при высоких температурах вследствие сильных
локальных перегревов поверхности, в результате высоких
экзотермических эффектов реакции [1.92]. Выделение азота определяет
особенности процесса, не характерные для окисления чистых
металлов, и влияет на кинетические характеристики процесса и
структуру и свойства окалины. Аномальное расположение
кинетических кривых в интервале температур 700—900° С может быть
вызвано улетучиванием азота, а также спеканием окалины (при
900° С).
130
Фазовый состав окалины, образующейся при окислении
нитрида гитана, зависит от особенностей растворения кислорода в
решетке нитрида, сопровождающегося выделением азота и металлнчес-
ского титана, времени и температуры процесса. Азот влияет на
протекание полиморфного превращения анатаз — рутил и
стабилизирует в определенных условиях анатаз. Вначале обнаруживается
анатаз, из которого состоит окалина при низких температурах и
длительных временах окисления (400, 600° С, 6 ч), фиксируемый
наряду с рутилом при более высоких температурах на начальной
стадии процесса (600—1000° С, 5 мин) в широкой области
температур. При длительном окислении (6 ч) его содержание в окалине
понижается с ростом температуры вследствие постепенного
превращения его в рутил. Такое изменение фазового состава окалины при
окислении нитрида титана по сравнению с чистым титаном
объясняется стабилизирующим влиянием азота на анатаз, который
отличается значительной устойчивостью в широком интервале
температур (400—1100° С) и длительным временем окисления.
На начальной стадии процесса окисления анатаз
обнаруживается в слое окалины вплоть до высоких температур (1200° С). Однако
при более длительных стадиях он сохраняется в слое окалины
в узком температурном интервале, что связано со
стабилизирующим влиянием азота на анатаз, который с повышением температуры
и увеличением продолжительности процесса постепенно переходит
в стабильную моноклинную форму (см. табл. 17).
При окислении нитрида титана уже на начальной стадии при
низких температурах (600° С) по данным металлографических
исследований в верхнем слое окалины образуется красно-бурый рутил,
а внутренние слои окалины были фиолетово-черного и сине-черного
цветов. Согласно рентгеновскому фазовому анализу, в данном
случае так же, как при окислении карбида титана, получаются фазы
Ti„C>2«—1. Они обнаруживаются во внутренних слоях окалины
в широком интервале температур (600—1200° С). При высоких
температурах эти фазы появляются при непродолжительном
времени окисления (1200° С, 18 мин).
Вероятно, при окислении нитрида и карбида титана
образование фаз серии Tin02«—i связано с особенностями процесса,
протекающего с выделением в поверхностный слой титана и азота.
Диффузия и растворение титана в слое окалины может определить
образование окислов типа Tin02n— ь характеризующихся в
соответствии с [2.19] избытком титана. Возможно, что данные фазы
появляются при частичном окислении выделяющегося титана,
протекающего во внутренних слоях окалины при недостатке
кислорода.
Однако в отличие от карбида титана при окислении нитрида
титана выделяющийся азот может влиять на дефектность решетки
фазы Ti02. В соответствии с представлениями [2.51] растворение
азота в Ti02 должно сопровождаться увеличением анионных
вакансий, чем, по-видимому, объясняется появление светло-голубого
о*
131
цвета окалины при окислении нитрида титана в широком интервале
температур (500—1200° С) на начальной и более поздних стадиях
процесса. В фазах с недостатком кислорода по отношению к
титану окраска изменялась от светло-серой через светло-голубую до
темно-синей [2.14, 2.15].
В процессе окисления нитрида титана на начальной и поздних
стадиях изменяется цвет окалины. При температуре 800° С
появляется тонкий внешний ободок бурого цвета, а с повышением
температуры (1100—1200° С) изменение цвета становится более выраженным
и охватывает глубокие слои окалины. Изменение окраски рутила
наблюдалось и при окислении титана в парах воды [4.2]. Напротив,
на воздухе при температуре 800° С образуется черная нестехиомет-
рическая модификация ТЮ2. Такое изменение цвета окалины,
наблюдаемое при окислении нитрида титана при низких
температурах на начальных стадиях процесса, может быть обусловлено
влиянием азота на дефектность решетки рутила. Растворение азота
в решетке рутила, дефектная структура которого характеризуется
преимущественной диффузией межузельных катионов титана при
высоких температурах [2.16], значительно повышает их
концентрацию и диффузионную подвижность. Увеличением диффузионной
подвижности межузельных катионов титана определяются
бочкообразная форма окисленных образцов, более выраженное, чем на
чистом титане, спекание окалины из рутила при 1100 и 1200° С и
текстура роста внешних слоев окалины (рис. 53, см. вклейку),
свидетельствующая о перемещении фронта реакции к внешней фазовой
границе.
Таким образом, значительная сопротивляемость нитрида
титана окислению объясняется особенностями структуры окси-
нитридных фаз и дефектной структуры решетки рутила.
Образующийся на более длительных стадиях окисления нитрида титана
во всей исследованной области температур (600—1200° С) слой
оксинитрида титана с более высокими значениями
микротвердости и параметров решетки по сравнению с нитридом титана
препятствует дальнейшей диффузии и растворению кислорода в решетке.
Это может послужить одной из причин повышенной стойкости
против окисления нитрида титана по сравнению с карбидом при
умеренных температурах, когда значительную роль в формировании
окалины из рутила играет диффузия кислорода.
Высокой стойкостью против окисления нитрида титана
объясняется и повышенное сопротивление окислению титано-азотиро-
ванного сплава по сравнению со сплавом, не прошедшим
термообработку [4.3]. Преимущественная диффузия межузельных катионов
титана, определяющая формирование решетки рутила на
чистом титане при температурах выше 950° С [2.23], еще более
активируется при окислении нитрида титана и растворении в решетке
рутила азота, увеличивающего концентрацию и диффузионную
подвижность межузельных катионов титана. Это значительно
снижает температурный предел, выше которого на чистом титане об-
132
разование окалины вызывается в основном диффузией межузель-
ных катионов титана, и уменьшает роль диффузии кислорода.
О преимущественной диффузии титана в процессе роста окалины
из рутила, активируемого растворением азота, свидетельствуют
бочкообразная форма окисленных образцов, значительные
эффекты спекания и текстура роста внешних слоев окалины, а также
появление при сравнительно низких температурах красио-бурых
оттенков в местах максимальной концентрации катионов
титана [4.2].
Высокое сопротивление окислению нитрида титана отражается
и на кинетических характеристиках процесса. В интервале
температур 800—1200° С процесс окисления описывается
кинетическими кривыми параболического типа. Определяющей стадией
является, по-видимому, диффузия кислорода через слой рутила
(Е — 45 ккал/моль).
При окислении моиокристаллических образцов нитрида
титана [3.3] кинетика процесса также контролируется диффузией.
Рассчитанная кажущаяся энергия активации хорошо согласуется с
данными энергии активации для окисления, контролируемого
диффузией для поликристаллических образцов нитрида титана [3.2]
и титана [2.24—2.26].
Следует отметить интересные, но отличительные особенности
поведения нитрида и карбида титана в среде кислорода при давлении 10~а
тор и температуре 1000° С. Если при окислении карбида титана
в этих условиях через 3 ч наблюдается некоторое испарение
титана и углерода, которые осаждаются на нити и тигле [2.6], то в
случае нитрида титана титан не испаряется.
При окислении TiC испарение металлического титана вызвано
не разрывом связи Ti—С, а особенностями окисления карбида
титана, сопровождающегося выделением в поверхностный слой
атомов титана и углерода. В результате этого уже при температуре
1000° С появляется титан в газовой фазе. Как известно, заметное
испарение титана при нагреве образцов TiC в вакууме начинается
лишь при температурах выше 2000° С [15].
Окисление карбида титана [2.6] протекает с выделением титана
и углерода и образованием оксикарбидных фаз [1.25—1.27], а
нитрида титана — с формированием при некоторых условиях более
комплектных в металлической подрешетке оксинитридных фаз
титана [1.25, 1.92, 3.18]. Это определяет особенности поведения
карбида и нитрида титана в среде кислорода.
При окислении нитрида титана наблюдается менее
интенсивное выделение титана в поверхностный слой, чем при окислении
карбида титана.
Следовательно, в процессе окисления нитрида титана при
невысоком давлении кислорода в поверхностный слой выделяется
металлический титан, плотность распределения которого растет
с увеличением давления кислорода. Однако плотность
распределения металлического титана значительно меньше по сравнению с
133
плотностью распределения титана при окислении карбида титана
[2.6], что вызывается различными особенностями формирования
оксикарбидных 11.11, 1.25—1.27] и оксинитридных фаз титана
[1.25, 1.85, 1.92, 3.18]. Оксикарбиды титана в отличие от карбида
титана характеризуются увеличением дефектности в металлической
и металлоидной подрешетках 11.11, 1.25—1.27], а оксинитриды
титана — повышением комплектности металлической подрешетки
[1.25, 1.85, 1.92, 3.18].
Таким образом, окисление нитрида титана и образование
оксинитридных твердых растворов сопровождаются выделением
титана и азота из решетки нитрида титана, диффундирующих в
окалину. С этим связаны особенности изменения микротвердости зоны
оксикарбидных твердых растворов, фазовый состав и структура
окалины.
Окисление ZrN и HfN
Нитрид циркония характеризуется меньшим, чем нитрид гафния,
сопротивлением окислению (рис. 54). Как видно из рис. 54, а,
образцы нитрида циркония незначительно окисляются при
температурах 400 и 500° С. Однако повышение температуры до 550° С
изменяет ход процесса окисления нитрида циркония. При температурах
550 и 600° С скорость процесса увеличивается соответственно через
5 и 3 ч, что объясняется потерей во времени защитных свойств
окалины. Резкое повышение скорости процесса наблюдается при
температурах 700° С и выше. Значительная потеря массы при 800,
900 и 1000° С может быть связана с улетучиванием азота. Однако
при этих температурах на начальных стадиях процесса происходит
некоторое увеличение массы окисленных образцов, что указывает
йт/S, иг/см
а 5
Рис. 54. Кинетические кривые окисдения нитридов циркония (а) и гафния (б):
1 — 400; 2 ~ 500; 3 — 550; 4 — 600; б — 700; 6 — 800; 7 — 900; 8 — 1000; 9 — 1100;
10 — 1200° С.
134
на возможность внедрения кислорода в решетку нитрида без
значительного замещения атомов азота. При температурах 1100 и 1200° С
окисление описывается линейным законом скорости,
свидетельствующим о полной утрате окалиной ее защитных свойств.
Внешний вид образцов, окисленных при температуре 400° С,
не изменяется, что можно объяснить адсорбцией кислорода
дефектами решетки нитрида. При температуре 500° С образцы тускнели,
а при 550° С они покрывались окисной пленкой светло-бежевого
цвета, которая с повышением температуры приобретала чуть
зеленоватый оттенок, связанный, по-видимому, с растворением
азота в решетке Zr02. При более высокой температуре окалина
становилась более светлой и растрескивалась.
При температурах 900 и 1000° С окалина проявляла признаки
спекания, несмотря на значительное растрескивание. В отличие от
нитрида титана окисленные образцы нитрида циркония не изменяли
свою форму, но вид окалины свидетельствовал о протекании
процесса на фазовой границе окалина — нитрид.
Нитрид гафния по сравнению с нитридом циркония отличается
более высоким сопротивлением окислению во всей исследованной
области температур (рис. 54, б). В интервале температур 500—
800° С наблюдается незначительное окисление нитрида гафния,
однако с повышением температуры до 900° С скорость процесса
нарастает, особенно на более поздних стадиях, из-за потери
окалиной защитных свойств. Но и в этом случае степень окисления
нитрида гафния значительно ниже, чем нитрида циркония. С
дальнейшим повышением температуры (до 1100—1200° С) скорость процесса
резко увеличивается н образцы быстро окисляются.
Визуальные и металлографические наблюдения показали, что
при температуре 500° С внешний вид образцов не изменяется, что,
вероятно, связано с адсорбцией кислорода дефектами решетки
нитрида. При температуре 600° С образцы не изменяют своей формы,
но значительно темнеют, утрачивая металлический блеск. При
температуре 700° С на поверхности окисленных образцов
появляются налеты белого цвета, увеличивающиеся с дальнейшим
повышением температуры до 800° С; при 900° С образуется окалина
белого цвета с серыми включениями. С дальнейшим повышением
температуры образцы нитрида полностью окисляются; окалина
представляет собой тонкодисперсный порошок белого цвета. При
температуре 1100—1200° С параллельно с появлением
газообразных продуктов наблюдается значительное спекание окалины.
Полученные результаты показали, что внедрение кислорода в
решетку нитридов циркония и гафния сопровождается выделением
азота, соответствующих металлов и образованием оксинитридных
фаз с более низким параметром решетки, чем исходный нитрид.
Согласно рентгенографическим данным в отличие от чистого
циркония металлический цирконий обнаруживается в окалине,
появившейся при окислении нитрида циркония в начальный период в
широком интервале температур (500—1000° С) (см. табл. 17).
135
/m/S, иг/см2-
16
а б
Рис. 56. Кинетические кривые окисления нитридов циркония (а) и гафния (б)
при температуре 800° С и различном давлении кислорода:
; _ ю—5: 2 — 10—!; 8 — 150 тор.
На более длительных стадиях процесса цирконий
обнаруживается в окалине лишь при более низких температурах (500, 600° С),
а с ростом последней вследствие интенсификации процесса он
окисляется до ZrOa.
Исследование окисления нитридов циркония и гафния при
невысоких давлениях кислорода (10~5, 10, 150 тор) и температурах
500, 800, 1000° С позволило установить особенности выделения
в поверхностный слой из решетки оксинитридной фазы
металлического циркония и гафния, изменение плотности их распределения
с температурой и давлением кислорода, сравнить плотность
распределения металлического циркония и гафния, оксинитриды
которых имеют различные структурные характеристики [1.79, 1.80].
С помощью металлографических, электронно-микроскопических
и рентгенографических исследований найдено, что окисление
нитридов циркония и гафния в среде кислорода и на воздухе
сопровождается растворением кислорода в решетке нитрида и выделением
в поверхностный слой металлического циркония и гафния (рис. 55,
см. вклейку). Плотность распределения увеличивается с ростом
температуры и давления кислорода. Убыль массы (рис. 56)
указывает на выделение и газообразного азота.
Уже при температуре 300° С и давлении 10~5 тор на поверхности
окисленных образцов выделяется некоторое количество
металлического циркония, но с ростом температуры (500° С) плотность этих
выделений увеличивается (рис. 55, а). Однако в местах нарушения
структуры, где более интенсивно протекает растворение кислорода,
цирконий частично окисляется и появляются пленки зеленого и
136
голубого цветов, указывающие на образование субокислов
циркония. С ростом давления кислорода (10 и 150 тор) количество
выделений циркония становится больше, они укрупняются и сливаются
в отдельные образования (рис. 55, б). Наряду с этим происходит
и некоторое окисление циркония до низших окислов синего и
красного цветов, под которыми видны слои оксинитридов золотистого
цвета. Интенсивность процесса увеличивается с ростом давления
кислорода.
С дальнейшим повышением температуры (800° С) уже при
Р = 10~5 тор плотность выделений циркония становится очень
значительной и составляет 1,5 • 109/см2, размеры их увеличиваются.
Одновременно более интенсивным становится их окисление с
образованием пленок субокислов зеленого и голубого цветов. Образец
распадается на части через 20 мин.
Интересно отметить, что количество выделений металлического
гафния в поверхностный слой также значительно увеличивается
(рис. 55, б), но в отличие от нитрида циркония образец нитрида
гафния не разрушается. С повышением температуры повышается
степень его окисления и появляются отдельные зародыши окислов
гафния (рис. 55, г).
С ростом давления (10 тор) эти процессы становятся более
выраженными и разрушение образца ZrN наступает еще быстрее.
При давлении кислорода 150 тор образец через 10 мин
превращается в порошок окиси циркония, в то время как образец HfN не
разрушается.
Повышение плотности выделений металлических циркония и
гафния с ростом давления кислорода и температуры
свидетельствует о глубоко идущем процессе растворения кислорода в нитрид-
ной матрице и, вероятно, связано с увеличением дефектности
металлической подрешетки образующихся оксинитридных фаз [1.79,
1.80].
Плотность распределения металлического гафния значительно
ниже, чем металлического циркония при окислении ZrN и HfN
в одинаковых условиях. Это может быть обусловлено различными
структурными особенностями образующихся оксинитридных фаз
циркония [1.79] и гафния [1.80]. Формирование оксинитридов
гафния сопровождается увеличением комплектности металлической
подрешетки с ростом содержания кислорода [1.80], в то время как
фаза ZrN^Oj, характеризуется дефектностью в обеих подрешетках,
которая растет с повышением содержания кислорода [1.79].
Появление большого количества дефектов в решетке ZrN-tO^
может быть связано с разрушением образца ZrN, окисленного при
800° С и давлении 10~5 тор. Вероятно, созданием оксинитридных
фаз ZrNjtO^co значительно выраженной дефектностью в обеих
подрешетках [1.79] объясняется разрушение образца ZrN при
образовании окисной пленки незначительной толщины, в то время как
образец HfN такой же величины сохраняет свою первоначальную
форму.
137
Увеличение комплектности элементарной ячейки HfNvC\ по
сравнению с HfN [1.80] понижает диффузионную подвижность
кислорода в процессе окисления HfN Вследствие этого и
кинетические характеристики процесса указывают на менее интенсивное
протекание процесса окисления HfN по сравнению с ZrN на
воздухе и в среде кислорода (см. рис. 54, 56). Напротив, более высокая
комплектность металлической подрешетки TiNxOp по сравнению
с TiN [1.25, 1.92, 3.18] обусловливает то, что при окислении
нитрида титана даже при 1000° С и давлении 150 тор через 3 ч появляется
лишь тонкая окисная пленка.
Металлографические и электронно-микроскопические
исследования показали, что выделившиеся в поверхностный слой
металлические цирконий и гафний постепенно окисляются до ZrOa, НЮ2.
Процесс протекает через стадии образования промежуточных
субокислов циркония и гафния, окрашенных в оранжево-красный и
зеленый цвета.
При более глубоком протекании процесса при образовании
пленки из окисла Zr02 n-типа повышение давления кислорода
приводит к значительному увеличению ширины зоны оксинитридного
твердого раствора и содержанию в нем кислорода. Микротвердость
оксинитридного твердого раствора, образованного при окислении
ZrN в начальный период процесса, в направлении границы
окалина — нитрид (см. рис. 51) уменьшается, вероятно, вследствие
выделения азота и металла из решетки оксинитридной фазы и
удалением их в поверхностный слой окалины. Это согласуется с данными
11.25, 3.22], в соответствии с которыми растворение кислорода
в решетке ZrN сопровождается увеличением дефектности в
металлической и металлоидной подрешетках. Оксинитриды циркония
характеризуются наличием дефектов в обеих подрешетках [1.79].
Несколько иные закономерности наблюдаются при окислении
нитрида гафния.
На начальных стадиях процесса окисления ZrN и HfN (4 мин,
400, 600, 800 и 1000° С) на воздухе (см. табл. 17) в окалине на ZrN
рентгенографически обнаруживается цирконий уже при 400° С
(5 мин), а в случае HfN — только при более длительном окислении
поверхности. Это, по-видимому, обусловлено различными
особенностями формирования оксинитридов циркония и гафния [1.25,
1.79, 1.80].
При окислении компактных образцов нитрида циркония и
гафния при высоких температурах, когда образуются окислы ZrOa
и НЮ2 n-типа на границе окалина — нитрид путем диффузии
кислорода по анионным вакансиям и междоузлиям [2.33] большое
значение приобретает и диффузионная подвижность атомов
кислорода в решетках оксинитридных фаз, которая определяется в
основном их структурными характеристиками. Оксинитрид циркония
характеризуется более дефектной анионной и катионной
решетками, чем [1.79], в оксинитриде гафния подрешетка металла более
комплектна, чем в HfN [1.801.
138
На более поздних стадиях процесса при невысоких
температурах (500—800° С) и более глубоком протекании процесса
растворения кислорода металлический гафний обнаруживается также в
окалине, но с дальнейшим повышением температуры он
окисляется до НЮ2. Эти особенности процесса растворения кислорода в
решетке нитридов, сопровождающиеся удалением в
поверхностный слой не только азота, но и некоторого количества
соответствующего металла, отражаются и на изменениях микротвердости
зоны оксинитридных твердых растворов (см. рис. 51). При
окислении ZrN на воздухе она уменьшается в направлении границы
окалина — нитрид.
Микротвердость тонкого поверхностного слоя HfN^O(/,
характеризующегося и более высоким по сравнению с HfN периодом
решетки (а == 4,525), напротив, увеличивается.
Микротвердость поверхностной зоны окисленных образцов
при 600 и 800° С увеличивается вследствие образования фазы
предельного состава ШЫдД, 13.22], комплектность решетки которой
больше, чем у HfN и HfNUo [1.80]. По данным [3.22, 3.25], эта
фаза имела состав HfN0.72O0.26f а фаза HfN0.74O16 (HfN0.80O0.23)
характеризовалась значительным увеличением комплектности
решетки Я.80] с ростом содержания кислорода. Различный характер
заполнения элементарной ячейки оксинитридов циркония и
гафния с повышением концентрации кислорода (уменьшение
комплектности решетки ZrN,Oy и увеличение комплектности решетки HfNxO„
[1.79, 1.80] не только определяют характер изменения
микротвердости по глубине окисленных образцов (см рис. 51), но и влияют
на дальнейшее протекание процессов диффузии и растворения
кислорода в решетках ZrN и HfN, определяя этим морфологические
особенности поверхности окисленных образцов.
Металлографические исследования показали, что уже на
начальной стадии окисления проявляется более значительная
склонность к окислению ZrN по сравнению с HfN. Если при
температурах 800—1000° С на поверхности HfN появляется едва
уловимая пленка окислов с очень мелкими зародышевыми центрами
окислов, то на ZrN образуется слой окислов значительной толщины.
Размеры зерен ZrN после окисления уменьшаются вследствие
значительного растворения кислорода и появления оксинитридных
фаз. На начальных стадиях процесса окисления нитрида циркония
цвет оксинитридных фаз значительно изменяется — от
красновато-золотистого в поверхностном слое, примыкающем к окалине
(Ну, =400 4-600 кГ/мм2),до золотистого в глубоких слоях
образца с более низкой микротвердостью (см табл. 18). На начальной
стадии процесса при температуре 500° С (25 мин) взаимодействие
нитрида с кислородом не очень выражено. Формирование окисных
фаз начинается по границам зерен, размеры которых после
окисления значительно уменьшаются по сравнению с величиной зерна
в исходной структуре нитрида циркония. В поверхностных слоях,
примыкающих к окалине, появляются зоны оксинитридных твер-
139
дых растворов, цвет которых изменяется по мере перемещения к
фазовой границе нитрид — окисел. Золотистый цвет исходного
нитрида меняется на золотистый с более густым оттенком,
переходящим в красновато-золотистый на границе с окалиной
светлосерого цвета с голубым оттенком.
При температуре 700° С (12 мин) наблюдается дробление зерен
исходного нитрида, связанное с растворением кислорода. И в
данном случае зоны оксинитридиых твердых растворов имеют
темно-золотистые оттенки во внутренних слоях окалины и
красновато-золотистые в поверхностной зоне, примыкающей к
окалине серо-голубого цвета. В ней распределены небольшие включения
металлического циркония. Как и при температуре 500° С,
микротвердость оксинитридиых фаз уменьшается в направлении
границы нитрид — окалина. С повышением температуры до 1000° С
(4 мин) окисление протекает более интенсивно, все фазы окислов
и оксинитридные фазы образуются в большем количестве. Зоны
оксинитридиых твердых растворов также четко изменяют цвет от
золотистого до красновато-золотистого у края образца. Под
светло-серой фазой окислов с голубоватым оттенком находится
тончайший слой металлического циркония. При температуре 1100° С
наблюдается примерно такая же картина, как и при 1000° С. И в этом
случае под серовато-голубым слоем окисла просматриваются
небольшие включения и тонкий слой металлического циркония; слой
окалины значительной толщины.
Как указывалось выше, при всех температурах микротвердость
оксинитридиых твердых растворов уменьшается в направлении
границы нитрид — окалина, т. е. с увеличением содержания
кислорода. Так, микротвердость темно-золотистой фазы при этих
температурах повышается от 1049 до 1102 кГ/мм2. Следует отметить,
что микротвердость красновато-золотистой фазы, примыкающей
к окалине, составляет 455—655 кГ/мм2. Мпкротвердость окисного
слоя из кубической фазы ZrOa значительно увеличивается и
составляет 1514—1740 кГ/мм2. Напротив, на поверхности нитрида гафния
образуется очень тонкий лимонно-золотистого цвета слой
оксинитридиых фаз HfN^Oy, примыкающий к окалине,
характеризующийся высоким значением микротвердости. Слой окисла ZrCV-*
окрашен в серый цвет, очевидно, вследствие увеличения дефектности
решетки ZrO^-A-
Создание в процессе окисления более комплектных решеток
оксинитридиых фаз HiN/D^, чем решетка исходного нитрида HfN
[1.80], о чем свидетельствуют высокие значения периода решетки
оксинитридиых фаз и микротвердости (см. рис. 51), играет
большую роль в замедлении процессов диффузии и растворения
кислорода в том случае, когда формирование окалины
определяется диффузией кислорода в глубь образца. При
окислении нитрида гафния диффузия кислорода затрудняется, но
ускоряется при окислении ZrN и образовании менее комплектных
с ростом концентрации кислорода решеток ZrNxO^ [1.79]. Это
140
выражается в повышенной стойкости против окисления нитрида
гафния по сравнению с нитридом циркония на начальных стадиях
(4 мин) и длительных периодах окисления (см. рис. 54).
Анализ кинетических кривых показывает, что нитрид гафния
незначительно окисляется при 500—600° С (см. рис. 54), а нитрид
циркония — при 400—550° С (см. рис. 53). Однако незначительное
увеличение температуры резко повышает скорость окисления.
Выделение азота при окислении определяет особенности
процесса, не характерные для окисления чистых металлов, и влияет
на кинетические характеристики процесса, структуру и свойства
окалины. Выделение азота и нарушение сплошности окисной
пленки могут обусловить неравномерное расположение кинетических
кривых. При температуре 550° С образцы нитрида циркония
покрываются окисной пленкой светло-бежевого цвета, которая с
повышением температуры приобретает зеленоватый оттенок, вызванный,
очевидно, растворением азота.
При окислении нитрида циркония фазовый состав окалины
зависит от степени окисления, определяемой временем и
температурой. В начальный период окисления (5 мин) при средних
температурах (600° С) формируется кубическая фаза Zr02, но с дальнейшим
повышением температуры (до 1100° С) она появляется в окалине
через 2 мин (см. табл. 17). При увеличении времени окисления
кубическая фаза Zr02 формируется даже при более низких
температурах (500° С, 15 мин), а при длительных выдержках (6 ч) она
появляется в слое окалины в широкой области температур (500—
1200° С) на границе окалина — нитрид. В этом случае с ростом
температуры ее содержание в окалине уменьшается вследствие
постепенного превращения ее в моноклинную фазу с потерей азота.
При окислении нитрида циркония в среде кислорода также
образуется кубическая фаза Zr02. Это свидетельствует о том, что
азот, как и углерод, стабилизирует кубическую фазу. Она
становится устойчивой вплоть до высоких температур и при длительном
времени окисления и обнаруживается в окалине наряду с
моноклинной фазой. Кубическая фаза, стабилизированная азотом,
формируется при окислении циркония в процессе взаимодействия
образующегося нитрида циркония с кислородом на границе
окалина — металл (см. рис. 19) [2.31].
На нитриде гафния при температуре 500—700° С образуется
белая окалина с серыми включениями, которая при более высоких
температурах представляет собой тонкодисперсный порошок
белого и зеленого цветов. Рентгеновский фазовый анализ показал, что
при 500—700° С кроме моноклинной фазы НЮ2 появляется
неизвестная фаза, возможно, тетраэдрическая, а зеленый слой окалины
при 900 и 1000° С содержит незначительное количество тетраэдри-
ческой фазы НЮ2, в то время как в белой окалине она отсутствует.
С ростом температуры окалина становится однофазной и состоит
из моноклинной фазы. Такое изменение состава и цвета окалины
с повышением температуры может быть связано с растворением
141
азота в окислах /г-типа (Zr02 и НЮ2) 12.32, 2.33], приводящим к
увеличению числа анионных вакансий, стабилизации кубической
Zr02 и тетрагональной НЮ2 фаз. Микротвердость нестехиометри-
ческой серой фазы ZrCb—* сильно увеличивается с ростом
температуры от 1510 кГ/мм2 при 500° С до 1710 кГ/мм2 при 1100—1200° С.
Следует отметить, что особенности дефектной структуры окислов
n-типа (Zr02 и НЮ2), определяющих формирование окалины на
внутренней фазовой границе [2.32, 2.33], предопределяют ее
растрескивание и утрату защитных свойств уже при низких
температурах. Это способствует дальнейшей диффузии и растворению
кислорода в решетках нитридов и ускоренному разрушению образцов
(даже HfN), характеризующихся на начальной стадии процесса
значительной стойкостью против окисления.
Сопоставление полученных данных показало, что среди
нитридов металлов IVa подгруппы наибольшую стойкость против
окисления имеет нитрид титана, а наименьшую — нитрид циркония.
Действительно, уже на начальной стадии процесса даже при
отсутствии окисных пленок скорость окисления нитрида циркония
значительно выше скорости нитрида титана. Здесь сказываются
различные особенности структуры оксинитридов титана [1.25, 1.85,
1.92, 3.18] и циркония [1.79].
В случае термического разложения на воздухе
порошкообразных образцов нитридов металлов IVa подгруппы устойчивость
нитридов понижается при переходе от TiN к нитриду циркония,
а затем повышается у HfN [3.9]. Нитриды титана и гафния
характеризуются более высоким сопротивлением окислению, чем
соответствующие карбиды. Температура начала окисления нитрида
гафния и оксинитридов циркония и гафния несколько выше по
сравнению с таковой для МеС* и МеСЛ(\ [1.26]. Сопротивление
окислению нитридов уменьшается в последовательности титан —
гафний — цирконий.
Выделение соответствующих металлов и азота при окислении
нитридов металлов IVa подгруппы, связанное с образованием
вакансий, согласно работам [1.55, 1.59, 1.66], обусловлено
экранирующим действием атомов азота на Me—Ме-взаимодействие в
решетке нитридов и переводом части экранированных связей в
энергетически более выгодные неэкранированные.
ОКИСЛЕНИЕ НИТРИДОВ МЕТАЛЛОВ
Va ПОДГРУППЫ
Нитрид ванадия характеризуется невысоким сопротивлением
окислению при температурах выше 600° С (рис. 57) [4.5].
Растворение кислорода в решетке нитрида ванадия сопровождается
выделением азота и ванадия и образованием поверхностного слоя окси-
нитрида с более низким параметром решетки и микротвердостью,
чем исходный нитрид (см. табл. 17). Это согласуется с данными
142
Рис. 57. Кинетические кривые окис- дт/S мг/см2
ления нитрида ванадия:
/ — 500; 2 — 600; S — 700; 4 — 800; 5 —1200' С
[1.14, 1.25, 3.15, 3.22] о
наличии дефектов в металлической
и металлоидной подрешетках
оксинитридов ванадия.
При окислении
порошкообразного нитрида ванадия при
1273, 1323 и 1373 К растворение
кислорода в нем сопровождается
формированием оксинитридных
фаз переменного состава с
кубической решеткой [3.22]. При окислении VN в равновесии с
кислородно-азотной фазой могут существовать оксинитриды только таких
составов, в которых кислород замещает азот в области гомогенности
нитрида. Твердый раствор предельного состава состоял из фазы
VOo,3, N0,75- Окисление нитридов ниобия и тантала также
сопровождается растворением кислорода и выделением в поверхностный
слой металлических ниобия и тантала.
Исследования окисления нитридов ниобия и тантала в среде
кислорода при небольшом его давлении (Ю-', Ю-1, 150 тор)
позволили установить морфологические особенности и плотность
распределения металлических выделений ниобия и тантала, образование
оксинитридных фаз и субокислов NbOz, в результате чего скорость
окисления ниобия в области низких температур повышается
[2.34]. С помощью электронно-микроскопических исследований
поверхности окисленных образцов нитридов ниобия и тантала
показано, что окисление их сопровождается выделением в
поверхностный слой металла (рис. 58, см. вклейку), плотность распределения
которого зависит от давления и температуры. Значительная убыль
массы (рис. 59) свидетельствует о выделении и газообразного азота.
При давлении кислорода Ю-5 тор и низких температурах (300
и 500° С) наблюдается растворение кислорода в решетке нитридов
с выделением металла, сопровождающееся уменьшением
микротвердости (рис. 58, а, б). С повышением температуры плотность
выделившегося металла в поверхностный слой значительно
увеличивается (см. рис. 58, в), одновременно появляются вкрапления
оксинитридов ниобия и тантала достаточно больших размеров,
которые довольно плотно покрывают поверхность образца. В
некоторых местах, где участки оксинитридных фаз становятся более
плотными, сверху образуются фиолетовые и синие, зеленые
низшие окислы ниобия и тантала. Рентгенограммы, снятые с этих
поверхностей, в соответствии с данными [4.7] позволяют пред
положить наличие фаз NbOx, NbO , NbOz в верхнем слое
оксинитридных пленок, а также субокислЪв ТаОх, ТаО^ 14.6]. Имеются и
неизвестные линии, которые можно отнести к оксинитридным
143
фазам, т. е. интерференционная картина на поверхности образцов
создается тонкими окисными пленками, состоящими из субокислов
ниобия и тантала Следовательно, в определенных условиях при
достижении оксинитридом предельного состава образуются
низшие окислы, что согласуется с данными [3.22].
При температуре 1000° С образец нитрида ниобия покрывается
темно-серой пленкой окисла NbO. С повышением давления
кислорода (Ю-1 тор) при 500° С плотность выделившихся металлических
ниобия и тантала увеличивается, что свидетельствует об интенсивно
протекающем процессе растворения кислорода. Однако поверхность
покрывается в основном пленкой оксинитрида NbN/)^, над
которой формируются включения субокислов фиолетового, синего,
зеленого цветов, а затем темно-серая пленка окислов ниобия.
При дальнейшем повышении давления (150 тор) и температуре
500° С интенсифицируется процесс растворения кислорода в нит-
ридной матрице и появления окисной пленки серого цвета с
выделением субокислов ниобия и тантала зеленого, синего, фиолетового
и красного цветов, под которыми просматриваются золотистые
пленки NbN^O^ и TaN^O^,. Однако поверхность образцов TaN
покрывается только окисной пленкой серого цвета, в то время как
окисление NbN протекает с образованием слоя мелкодисперсного
порошка из Nb205.
При более высокой температуре (1000° С) процессы
растворения кислорода и образования окислов протекают настолько
интенсивно, что уже через 1 ч поверхность образцов покрывается темно-
серой пленкой с буроватыми включениями оксинитрида, над
которыми появляется темно-серая пленка окислов Nb02 и ТаОа. На
кварцевой нити выделяется металлический тантал, что указывает на
некоторое его испарение.
Испарение металлического тантала при 1000° С и давлении
кислорода 10 тор связано с механизмом окисления нитрида тантала,
протекающего с выделением тантала. При повышении температуры
и давления по мере насыщения верхних слоев нитридов ниобия
и тантала кислородом на их поверхности формируются оксинитриды
предельного состава [3.22]. Дальнейшее растворение кислорода
влечет за собой образование субокислов NbOx, NbO^, Nb02, TaOx,
ТаО^ фиолетового, синего и зеленого цветов.
Концентрация кислорода в ниобии, находящегося в равновесии
с метастабильными окисными фазами, достигает аномально высокого
значения [4.8—4.10]. Этим можно объяснить появление окисла
Nb205 непосредственно из субокисла ниобия, минуя
промежуточные окислы NbO и Nb02. Растворение кислорода в решетке
нитридов ванадия, ниобия и тантала вызывает измельчение и дробление
зерна.
Следует отметить, что высокое объемное соотношение окислов
металлов Va подгруппы и выделение азота в процессе окисления,
а также увеличение дефектности образующихся оксинитридов
VN^O^ с ростом концентрации кислорода [1.14, 3.15] определяют
144
Рис. 55. Электронно-микроскопическая структура поверхности окисленных
образцов нитридов циркония (а, б) и гафния (в, г) (X 6500):
а — 10~5 Т°Р. 500° С; б — 10 тор, 500° С; в — 10~5 тор, 800° С; г — 10~5 тор. 1000Х.
шшт
V к. :>
: "*?- v -■" - » sJV -JS -:V; »
;
эуктург
разцов нитридов ниобия (а—в) и тантала (г) (X 6500):
., _ 500° С, Ю-5 тор; б — 500° С, Ю-3 тор; е — 800° С, Ю-5 тор; d — 3UIT С, 11Г"' тор.
а б
Рис. 59. Кинетические кривые окисления нитридов ниобия (а) и тантала (б) при
различных температурах и давлении кислорода:
1 — КГ"5; 2 — 10—!; 3 — 150 тор.
невысокую стойкость этих нитридов против окисления. Наиболее
стойким против окисления является нитрид ванадия, хотя и здесь
образование легкоплавкого окисла V205 и его испарение с ростом
температуры способствуют потере защитных свойств окалины
[4.5].
Нитрид тантала начинает активно окисляться уже при 400° С.
Металлографические исследования окисленных образцов NbN и
TaN на воздухе указывают на интенсивное растворение кислорода
по границам зерен. Процесс окисления VN протекает интенсивно.
Окалина на нитриде ванадия многофазна (см. табл. 17). При
температурах 400 и 500° С она состоит из ванадия и его окислов
V203, VOi,78. С повышением температуры (600, 700Q С) в окалине
появляются также фазы V305 и V206, при 800° С окалина
представлена V205 и неизвестной фазой, а при 1200° С состав окалины не
удалось идентифицировать.
При длительном окислении нитрида ниобия при всех
температурах образуется рыхлая осыпающаяся окалина, которая
затрудняет проведение металлографических исследований. В связи с этим
изучены начальные стадии окисления при температурах 500 и
600° С. Согласно кинетическим исследованиям (рис. 60 а), в первые
15 мин окисление протекает интенсивно. Это подтверждается
данными визуальных наблюдений и металлографического анализа.
Процесс окисления начинается по границам зерен. Растворение
кислорода в нитриде, как и при окислении нитридов металлов
Ю 2920
145
Рис. 60. Кинетические кривые окисления нитридов ниобия (а) и тантала (б):
/ — 400: 2 — 500; 3 — 600; 4 — 700; 5 — 800; 6 — 900; 7 — 1000; 8 — 1100; 9 — 1200° С.
IVa подгруппы, сопровождается значительным дроблением зерен;
крупные зерна чередуются с более мелкими. Дробление зерен
может служить дополнительным фактором, активирующим процесс
уже на начальной стадии. Окисная пленка окрашена в серый цвет
с зеленоватым оттенком.
С повышением температуры до 600° С (13 мин) границы зерен
отчетливо проявляются только в центре образца, к краю они более
мелкие, размыты и больше подвергаются окислению. Под светло-
зеленой фазой окислов просматривается серая фаза с
металлическим блеском, возможно, ниобий. Если увеличить
продолжительность окисления (30 мин), серая фаза с металлическим блеском
почти исчезает, по-видимому, вследствие частичного окисления.
Окалина на образце формируется в отдельный слой
серовато-зеленого цвета. С повышением температуры до 800° С (15 мин)
количество окисной фазы растет, пористость образца несколько
повышается, серая металлическая фаза отсутствует.
Данные металлографических исследований свидетельствуют о
том, что при окислении образцов NbN при температуре 500° С
происходит более значительное разрушение, чем при высоких
температурах, с образованием мелкого порошка Nb205. Это может
быть обусловлено формированием низшего окисла Nb02 в местах
дефектов структуры, вызывающего разрушение ниобия [4.10].
Кинетические кривые окисления на начальной'стадии процесса также
указывают на отсутствие защитных свойств окалины и нарастание
скорости процесса во времени.
Первично фиксируемыми фазами при окислении нитрида
ниобия в интервале температур 400—800° С является ниобий и |3-Nb.205.
Послойный рентгеновский фазовый анализ окалины,
образующейся при окислении нитрида ниобия, показал, что в отличие от
146
NbC при окислении NbN уже на начальной стадии процесса
появляется высокотемпературная фаза |3-Nb205. Во внутренних слоях
окалины находится преимущественно фаза P-Nb205 а во внешних —
низкотемпературная модификация a-Nb205.
Время окисления также влияет на состав окалины. Так, при
температуре 800° С на начальных стадиях процесса (15 мин) окалина
состояла в основном из (3-Nb206, а через 1 ч в окалине появляется
фаза a-Nb205. При дальнейшем повышении температуры
количество фазы P-Nb205 растет, и при 1000° С окалина состоит только из
P-Nb205 (см. табл. 17). Такой состав окалины при окислении
нитрида ниобия обусловлен стабилизирующим влиянием азота на
высокотемпературную модификацию p-Nb205. Образование в области
низких температур преимущественно во внутренних слоях окалины
и на начальных стадиях процесса фазы p-Nb205 может быть
вызвано тем, что образующиеся оксинитриды переходят
непосредственно в фазу Nb205Nx, содержащую некоторое количество
связанного азота [1.25]. Таким образом, азот в отличие от углерода
оказывает стабилизирующее действие на высокотемпературную фазу
P-Nb205.
Кинетика окисления нитрида ниобия (см. рис. 60, а) и ниобия
(см. рис. 30) несколько отличается. Значительное окисление
нитрида ниобия наблюдается уже при температуре 400° Сие дальнейшим
ростом температуры до 800° С катастрофически нарастает скорость
процесса. Вид кинетических кривых указывает на полное
отсутствие защитных свойств окалины на более поздних стадиях процесса.
Определяющая роль локального формирования субокислов при
температурах до 500° С, вызывающих ускоренное окисление ниобия
по сравнению с 600° С, менее четко выражена при окислении
нитрида ниобия. Здесь растворение кислорода в нитриде
сопровождается замещением азота и выделением его в поверхностный слой
с образованием оксинитридных твердых растворов. Поэтому в
этих условиях участие кислорода в создании пересыщенных
твердых растворов кислорода в ниобии, необходимых для зарождения
фазы NbOz, менее предпочтительно. Оно может не играть такой
роли, как при окислении чистого ниобия, когда растворенный
кислород расходуется исключительно на формирование субокисных
и окисных фаз Поэтому при окислении NbN степень окисления
с ростом температуры увеличивается, при температуре 500° С и
выше скорость процесса повышается также во времени.
Особенности растворения кислорода в нитриде ниобия,
связанные с замещением азота и формированием дефектных в обеих под-
решетках оксинитридных твердых растворов, определяют при
сравнительно низких температурах (400° С) интенсивное
протекание процесса окисления (см. рис. 60). Напротив, при окислении
металлического ниобия растворение кислорода сопровождается
образованием твердых растворов внедрения кислорода в октаэдри-
ческие междоузлия его решетки, чем объясняется незначительное
окисление ниобия при температуре ниже 500° С (см. рис. 30).
10*
147
Металлографические исследования образцов нитридов тантала,
окисленных при 400° С в течение 6 ч, позволили установить, что
даже при низкой температуре окисление протекает очень активно.
Ближе к краю образца наблюдается зона с несколько измененной
структурой, а непосредственно у края едва заметен серый налет
с металлическим блеском. Повышение температуры до 500° С
приводит, как и при окислении нитрида ниобия, к размельчению зерен,
что также способствует ускоренному протеканию процесса.
Появляется серая зона оксинитрида тантала, которая значительно
увеличивается с ростом температуры до 600° С; окалина имеет
желтый цвет. При повышении температуры до 700 и 800° С
увеличивается рост окалины желтовато-белого цвета. И лишь на начальной
стадии процесса в поверхностных зонах наблюдаются тончайшие
слои оксинитридов тантала.
Аналогично окислению карбида тантала (см. рис. 33) при
окислении нитрида тантала при 600° С образец растрескивается на
значительную глубину вследствие образования в зоне оксинитридного
твердого раствора участков пересыщенных твердых растворов. Они
необходимы для зарождения фазы субокисла TaOz у межзеренных
границ и дефектов [2.34, 2.35, 4.6] с последующим формированием
пятиокиси тантала на этом субокисле, вызывающей клиновидное
разрушение образца. При более высоких температурах из-за
неустойчивости фаза TaOz перестает быть промежуточным продуктом
реакции, вызывающим клиновидное врастание окалины из Та2Об
в нитрид и разрушающее окисление TaN. Здесь в отличие от тантала
разрушение нитрида тантала на наблюдается.
Сравнение данных кинетических исследований тантала [2.36]
и нитрида тантала (см. рис. 60, б) показывает, что они существенно
отличаются между собой. Так, при температурах 600 и 700° С
происходит катастрофическое окисление тантала, обусловленное
образованием субокислов ТаОг, а при более высокой температуре
вследствие их неустойчивости скорость процесса значительно
уменьшается. Напротив, при окислении нитрида тантала слабое окисление
наблюдается до температуры 600° С, а с дальнейшим ее повышением
скорость процесса быстро увеличивается. В этом случае процесс
растворения кислорода в нитриде тантала, протекающий с
замещением азота кислородом и образованием дефектных оксинитрид-
ных твердых растворов, по-видимому, несколько снижает
возможность формирования субоксидных фаз ТаОг, способствующих
катастрофическому окислению тантала при 600 и 700° С. Тем не
менее разрушающее действие указанных фаз проявляется и при
окислении нит{ да тантала при 600° С. Как отмечалось выше, на
образцах TaN, окисленных при температуре 600° С, появляются
продольные трещины, распространяющиеся в глубь образца.
Окалина на нитриде тантала при 500° С содержит кроме фазы
Р-Та205 фазу TaOx, а при 900° С — ТаО^. Высокотемпературная
модификация а-Та205 присутствует в окалине при 900° С в
незначительном количестве, что объясняется ее стабилизацией азотом.
148
Наличие на начальной стадии процесса при низких
температурах стабилизированных фаз окислов свидетельствует о том,
что они образуются при распаде оксинитридных фаз предельного
состава [3.22]. Выделение азота в процессе окисления
обусловливает неравномерное расположение кривых окисления, аналогично
таковым и для нитридов металлов IVa подгруппы (см. рис. 48, 54).
Азот не только разрыхляет окалину, но и изменяет.ее цвет, что
наблюдается при окислении нитрида ванадия (500° С, 6 ч), нитрида
ниобия (600° С, 30 мин), нитрида тантала (600° С, 30 мин).
Таким образом, окисление нитридов ванадия, ниобия и тантала
при небольшом давлении кислорода сопровождается растворением
кислорода в его решетке и выделением в поверхностный слой
металла и азота. Это может быть вызвано структурными особенностями
оксинитридных фаз, созданием дефектов в их металлической и
металлоидной подрешетках. Нитрид тантала более стоек против
окисления, чем нитрид ниобия (см. рис. 60).
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ОКИСЛЕНИЯ
НИТРИДОВ МЕТАЛЛОВ IVa—Va ПОДГРУПП
Исследование окисления нитридов металлов IVa—Va подгрупп
показало, что растворение кислорода в их решетке сопровождается
выделением в поверхностный слой соответствующего металла и
азота. На это указывает некоторая убыль массы в процессе
окисления нитридов.
Выделение соответствующего металла и азота при окислении
нитридов свидетельствует об образовании оксинитридных твердых
растворов с дефектами в металлической и металлоидной
подрешетках. Это согласуется с данными 11.14, 1.25, 1.79, 1.80, 1.85, 3.15],
указывающими на наличие двойной дефектности в оксинитридах
металлов IVa—Va подгрупп. Выделение металла и азота при
окислении нитридов, указывающее на наличие двойной
дефектности в образующихся оксинитридных фазах, как и в оксикар-
бидных фазах, обусловлено гетеродесмичностью связей в нитридах
металлов IVa—Va подгрупп и экранированием Me—Ме-связи
атомами неметалла [21—24, 1.55, 1.66, 3.38], а также переводом части
экранированных связей в энергетически более выгодные неэкрани-
рованные.
Азот более электроотрицателен, чем углерод, и поэтому он
оказывает значительное экранирующее действие на атомы металла,
чем и объясняется наличие структурных вакансий в обеих
подрешетках нитридов металлов [7, 3.26—3.35].
Энергия связи в мононитридах определяется Me—Me- и Me—N-
взаимодействиями [1.55, 1.59, 1.66]. Если для комплектного
нитрида преимущественными являются Me—N-связи, то для TiNz
с минимальным содержанием неметалла энергия решетки
определяется как Me—N-, так и Me—Me-взаимодействием [3.38].
Взаимодействие Me—Me экранируется атомами неметалла тем сильнее,
149
чем больше электроотрицательность последних [21—24, 1.55,
1.66, 3.38]. Поэтому внедрение в кристаллическую решетку
нитрида кислорода или замещение азота кислородом существенно
изменяет степень ее комплектности и условия экранирования
Me—Ме-связей атомами неметаллов [1.55, 3.38].
Повышение концентрации кислорода в оксинитридах приводит
к увеличению количества вакансий в металлической подрешетке
[1.25, 1.79, 1.80, 3.15, 4.11]. Этим объясняется более интенсивное
выделение металлов при окислении нитридов на поздних стадиях
процессов по сравнению с начальной с ростом температуры и
давления кислорода.
Таким образом, в процессе окисления нитридов выделяются
соответствующий металл и азот вследствие замещения азота
кислородом, экранирующего действия неметалла (кислорода) с
большей электроотрицательностью, чем азот (N), на Me—Ме-взаимо-
действие [24, 1.55, 3.38]. Как и в случае окисления карбидов
металлов IVa—Va подгрупп, выделение металлов и азота в процессе
окисления нитридов и образование оксинитридов с дефектами в
обеих подрешетках обусловливают их низкую стойкость против
окисления.
Создание оксинитридных фаз с двойной дефектностью при
окислении имеет большое значение особенно в области высоких
температур, когда увеличивается коэффициент объемной диффузии,
связанный с дефектностью кристаллической решетки. Этим, в
частности, вызвано то, что с ростом температуры скорость окисления
нитридов металлов быстро увеличивается. Однако здесь
наблюдается различие в формировании оксинитридных фаз, что влияет на
сопротивление нитридов окислению. При окислении нитрида
титана в поверхностном слое на границе окалина — нитрид
формируется фаза с более высоким параметром решетки и микротвердостью,
чем исходный нитрид, а в прилегающей к ней зоне, напротив,
микротвердость понижается до 500 кГ/мм2 (см. рис. 51, 52).
Аналогичные закономерности наблюдаются и при окислении нитридов
гафния.
Согласно [1.14, 1.25, 1.85, 3.15, 3.18], в определенном интервале
составов комплектность решетки повышается, т. е увеличивается
число частиц титана в элементарной ячейке оксинитрида титана
TiN^O^. Значительная дефектность Ме-подрешетки оксикарбидов
титана при наличии дефектов в Х-подрешетке облегчает массопере-
нос металла и неметалла [1.90], что согласуется с теоретическими
представлениями [1.86]. В таком случае рост комплектности
решетки в определенном интервале составов и увеличение числа частиц
титана и гафния в элементарных ячейках TiN/)^ и HfN^O^ по
сравнению с TiN и HfN при определенном содержании кислорода
могут существенно замедлить протекание диффузионных процессов
в поверхностных слоях.
Создание на более поздних стадиях окисления поверхностного
слоя оксинитридных фаз TiN^O^, понижает скорость диффузии и
150
растворения кислорода в решетке нитрида титана и может
послужить одной из причин более высокой стойкости к окислению
нитрида титана по сравнению с карбидом титана при умеренных
температурах. Напротив, с ростом температуры (выше 1000° С), когда
формирование окалины из рутила определяется преимущественной
диффузией межузельных катионов титана, вследствие чего и
растворение кислорода в решетке TiC и TiN уменьшается, скорости
окисления карбида и нитрида титана незначительно отличаются между
собой. При окислении нитрида циркония и ванадия растворение
кислорода в решетке и замещение азота сопровождаются удалением
циркония и ванадия в поверхностный слой окалины и появлением
зоны оксинитридных твердых растворов с более низким параметром
решетки, чем исходный нитрид. Микротвердость также уменьшается
с ростом содержания кислорода в направлении границы окалина —
нитрид (см. рис. 51).
Повышенная дефектность решетки оксинитридов по сравнению
с нитридом циркония, увеличивающаяся с ростом содержания
кислорода [1.79, 1.80], что проявляется в резком уменьшении
микротвердости твердых растворов, определяет и более высокую
диффузионную подвижность атомов кислорода в их решетке. При
формировании окалины из слоев n-типа на внутренней границе раздела
фаз путем диффузии кислорода рост дефектности решетки оксинит-
рида циркония в процессе растворения кислорода оказывает
решающее влияние на низкое сопротивление нитрида циркония
окислению. Появление тонких слоев из HfN.,0^, характеризующихся
высоким значением микротвердости, определяет и большее
сопротивление окислению HfN по сравнению с ZrN на начальной
стадии процесса. Здесь стабилизация азотом кубической фазы ZrOg
и образование последовательности нитрид — оксинитрид —
кубическая фаза Zr02 способствуют когерентному росту окисной пленки
и обеспечивают значительное сцепление окалины с нитридом.
Проведенные исследования показали, что, за исключением
нитрида титана, стойкость против окисления нитридов металлов
IVa—Va подгрупп значительно ниже, чем карбидов. Это может
быть обусловлено структурными особенностями оксинитридных
и оксикарбидных фаз. В оксинитрпдах титана экранирующее
действие атомов неметалла более существенно, чем в оксикарбидах [3.38].
В случае равенства индексов при кислороде, азоте и углероде в
TiN^O^ и TiC^O^ большей дефектностью подрешетки металла
характеризуется оксинитрид титана.
Следует отметить, что размельчение зерен исходных нитридов
при растворении кислорода вызывает увеличение реакционной
поверхности и способствует нарастанию скорости процесса окисления.
При окислении нитрида циркония микротвердость
поверхностных зон оксинитридных твердых растворов резко уменьшается.
Микротвердость нитрида циркония, имеющего низкую
концентрацию примеси кислорода, увеличивается с уменьшением
относительного содержания азота в области гомогенности нитрида от
151
15004=100 кГ/мм2 для ZrNi.o до 2700± 100 кг/мм2 для ZrNo./g [4.Ш.
Такие результаты позволили авторам [4.111 предположить, что при
замещении азота атомами кислорода с более высокой валентностью
повышается средняя концентрация валентных электронов и
усиливается экранирование связей между атомами металла (как и в
случае оксикарбидов [22, 24, 25, 1.62, 1.66]). Перечисленные факторы
снижают высоту барьеров Пайерлса-Набарро и уменьшают
твердость нитридов. Влияние кислородных замещений должно
проявляться сильнее, чем противоположное влияние эквивалентного
числа азотных вакансий, так как положительная валентность
кислорода выше, чем азота, а также вследствие появления в оксинит-
риде двойной дефектности в металлической и металлоидной под-
решетках [1.25, 1.14, 4.111.
Сопротивление окислению нитридов металлов IVa—Va подгрупп
понижается в последовательности TiN—VN—HfN—ZrN—TaN —
NbN, что обусловлено структурными характеристиками
образующихся оксинитридных фаз и особенностями дефектной
структуры окислов металлов. Самая высокая скорость окисления
нитрида циркония среди нитридов металлов IVa подгруппы
объясняется наибольшей степенью дефектности оксинитридных фаз [1.79,
1.80] при растворении кислорода не только на начальных стадиях,
но и в условиях формирования окислов /г-типа на более поздних
стадиях процесса (диффузия кислорода к границе окалина —
нитрид). В несколько повышенном сопротивлении окислению нитрида
гафния при образовании однотипного с Zr02 окисла определяющую
роль играет увеличение комплектности оксинитридных фаз.
Наиболее высокая стойкость против окисления нитрида титана вызвана
ростом комплектности [1.25, 1.85, 1.92] оксинитридов с повышением
концентрации кислорода до фазы предельного состава,
находящейся в равновесии с кислородно-азотной средой [3.22, 3.18], и
особенностями дефектной структуры рутила. Последний формируется
в области более высоких температур путем преимущественной
диффузии межузельных катионов титана 14.2], активируемой в
процессе растворения азота, что уменьшает роль диффузии
кислорода при окислении TiN на более поздних стадиях процесса.
Механизм окисления нитридов металлов IV—V групп можно
представить следующей схемой:
MeNx + 02 -> Менаде ->• MeNxOw + Me + N2 -> Me02 (N) +
+ Me + N2.
ВЛИЯНИЕ АЗОТА НА СТРУКТУРУ
И СВОЙСТВА ОКАЛИНЫ
В отличие от карбидов, при окислении которых газообразные
продукты появляются лишь на более поздних стадиях процесса
или в области высоких температур, окисление нитридов сопровож-
152
дается выделением азота. Последний в процессе растворения
кислорода и образования твердых растворов оксинитридов
существенно влияет на структуру, фазовый состав окалины и скорость
процесса. Участие азота в процессе окисления нитридов определяет
также характерные особенности его протекания. ^Формирование
на начальных стадиях и при низких температурах
стабилизированных азотом фаз окислов свидетельствует о том, что они
образуются при распаде соответствующих оксинитридных фаз. Азот
изменяет концентрацию дефектов в решетке окислов и,
следовательно, цвет:
при окислении нитрида титана азот увеличивает концентрацию
межузельных катионов титана и их диффузионную подвижность,
в результате чего появляются красно-бурые оттенки в окалине
в местах с высокой концентрацией катионов титана [4.2]. Это
обусловливает повышенную скорость окисления TiN по сравнению с
титаном, в области высоких температур увеличение спекания
окалины и изменение ее цвета от кремового до красно-коричневого;
при формировании окислов /г-типа, характеризующихся
диффузией кислорода по анионным вакансиям и междоузлиям (в
Тi02 — в области температур до 1000° С), растворение азота
сопровождается ростом числа кислородных вакансий, т. е. увеличением
степени нестехиометричности окислов. Увеличение дефектов
вызывает дополнительную стабилизацию окисных фаз и изменение цвета
окалины в сторону более темных оттенков, внутренние слои
окалины, где больше концентрация растворенного азота, окрашиваются
в зеленоватые цвета (Zr02, НЮ2), верхние — в серо-голубой
(Ti02 и Zr02). В окалине зеленого цвета присутствуют
стабилизированные кубическая Zr02 и тетрагональная НЮ2 фазы окислов.
При окислении нитридов титана и циркония в отличие от
чистого титана и циркония на начальных и более поздних стадиях
процесса при 500—1200° С появляется серо-голубая пленка окислов
Ti02 и ZrOa.
В двуокиси титана с добавкой 0,19 мол.% железа образуются
вакансии кислорода, а электроны проводимости, которые
ассоциируются в центре, создают голубую окраску (квадратом обозначена
вакансия кислорода, а точками — электроны) [2.20]. Вероятно,
выделяющийся при окислении азот растворяется в решетках ТЮ2
и Zr02, увеличивая количество анионных вакансий кислорода.
Электроны проводимости придают окислу голубую окраску.
Азот, как и углерод, стабилизирует модификации окислов (ана-
таза TiOa, кубическую фазу Zr02, тетрагональную фазу P-Nb205)
(см. табл. 12, 17), которые поэтому отличаются значительной
устойчивостью и сохраняются в окалине в широком интервале
температур и длительном времени окисления. Стабилизация окисных фаз
может вызвать п—р-переходы в окалине.
При окислении нитрида тантала при температурах 900—1200° С
наряду с фазой р-Та205 образуется и высокотемпературная
модификация а-Та205 р-типа, стабильная обычно выше 1350° С. Это обус-
153
ловлено растворением азота в решетке р-Та205, увеличением числа
анионных вакансий и переходом от п.- к />типу проводимости
[4.6].
Механизм стабилизирующего действия различных добавок до
настоящего времени недостаточно выяснен. Наиболее детально
изучено стабилизирующее влияние различных окислов на фазу
ZrOa 12.29, 2.50, 4.131.
Паулинг [4.14] на основании теории плотной упаковки атомов
в кристаллах показал, что предел стабильности структур типа
флюорита ограничен отношением ионных радиусов, равным 0,73.
При значениях, меньших 0,73, ионные кристаллы не могут иметь
кубическую структуру, так как вследствие сокращения расстояний
увеличивается электростатическое отталкивание между ионами
кислорода. Последнее приводит к нарушению плотности упаковки
и искажению решетки в случае Zr62 (для ZrOa RJRa = 0,66).
В работе [2.50] отмечается, что решетка Zr02 могла бы быть
кубической при условии увеличения размеров кислородных позиций.
Такой результат можно получить двумя способами: увеличением
среднего радиуса катионов путем замещения ионов Zr4+ ионами
большего радиуса и созданием вакансий в кислородной решетке.
Это может быть достигнуто с помощью окислов металлов, имеющих
решетку, изоморфную Zr02 (Яс!"= 1,02, /?# = 1,10 ЯЙ" = 0,87 А),
либо замещением ионов Zr4+ ионами меньшей валентности.
Лучшими стабилизаторами двуокиси циркония в кубической
форме являются окислы тяжелых редкоземельных элементов и
иттрия [4.13]. Очевидно, количество дефектов в анионной подре-
шетке растет при растворении азота в решетке Zr02 в процессе
окисления и замещения двухвалентных анионов кислорода
анионами азота большей валентности [2.51]. С ростом дефектов,
по-видимому, связана повышенная устойчивость кубической фазы Zr02
в широкой области температур. Вероятно, азот вызывает
увеличение анионных вакансий в решетке Nb205, тем самым стабилизируя
высокотемпературную модификацию 12.51].
Таким образом, стабилизирующее влияние азота более
выражено, чем углерода, несмотря на меньший по сравнению с углеродом
атомный радиус, облегчающий его диффузию наружу.
Выделяющийся в процессе растворения кислорода в решетке
нитридов или распада соответствующих оксинитридных фаз азот
вследствие небольшого значения атомного радиуса может
диффундировать наружу через окалину и растворяться в решетке окисла.
Растворение азота в окисле сопровождается увеличением
микротвердости некоторых окисных фаз (см. табл. 18). Образующаяся при
окислении нитридов титана и циркония окалина из Ti02 и ZrOa
изменяет свой цвет от красновато-белого до сероватого с голубым
оттенком и отличается более высоким значением микротЕердости,
чем окалина, полученная при окислении чистых металлов —
циркония и титана. Микротвердость окалины увеличивается с ростом
температуры:
154
для Zr02_x — 1514 кГ/мм2 при 500° С, 15 мин; 1648 кГ/'мм2
при 700° С, 12 мин; 1710 кГ/мм2 при 1000° С, 4 мин, 1740 кГ/мм-
при 1100° С, 4 мин;
для TiO-2-л —■ 1483 кГ/мм2 при 600° С, 30 мин; 1426 кГ/мм2 при
800° С, 18 мин, 1065—1610 кГ/мм2 при 1200° С, 18 мин.
Это объясняется адсорбцией азота структурными дефектами
решетки окислов или увеличением количества дефектов —
повышением концентрации межузельных катионов титана в рутиле и их
диффузионной подвижности и увеличением концентрации анионных
вакансий в решетке Zr02.
Влияние различных окисных фаз на механические свойства
Zr02 исследовалось многократно в связи со стремлением
стабилизировать кубическую (тетрагональную) модификацию двуокиси
циркония L4.151. Повышение прочности ZrOs происходит при
легировании окислами редкоземельных металлов и комбинированными
окислами. Следовательшэ, влияние азота на механические свой
ства Zr02 и на устойчивость кубической фазы Zr02 аналогично
влиянию легирующих элементов с большим радиусом.
Азот, выделяющийся в процессе растворения кислорода в
решетке нитридов или распада оксинитридных фаз, растворяется в
окалине и повышает концентрацию межузельных катионов титана и
их диффузионную подвижность. Это вызывает усиление (по
сравнению с титаном и карбидом титана) эффектов спекания окалины,
увеличение толщины спеченного слоя, формирование красно-бурых
внешних слоев при 1200° С с высокой концентрацией катионов
титана и более тонких слоев такого же цвета при 800 и 1000° С. Такое
изменение цвета окалины не наблюдается при окислении карбида
титана [2.2] и титана при 800° С [2.23]. Ярко выраженная текстура
роста внешних слоев указывает на перемещение фронта реакции
к внешней фазовой границе [4.16, 2.34]. Следовательно, в отличие
от углерода, действующего как примесь одинаковой валентности,
но с большим атомным радиусом, азот влияет как катион меньшей
валентности и с близким к титану размером ионного радиуса.
Выделяясь при окислении, азот значительно разрыхляет
окалину, что вызывает потерю ее защитных свойств. Нитриды при
более глубоком протекании процесса начинают интенсивно
окисляться. Кинетические кривые окисления описываются линейной
или экспоненциальной зависимостью. Нитриды металлов IVa—Va
подгрупп, за исключением нитрида титана, характеризуются
низкой стойкостью против окисления, уменьшающейся в
последовательности TiN -> HfN -+ ZrN -* VN -> NbN -> TaN.
ВЛИЯНИЕ УГЛЕРОДА И АЗОТА
НА МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ОКАЛИНЫ
Азот и углерод оказывают различное влияние на морфологические
свойства окалины, ее цвет, спекание, величину полости на границе
окалина — нитрид (карбид) и текстуру роста внешних слоев ока-
155
лины. В процессе окисления карбида титана при 1200° С образуется
окалина, однако окрашивание ее внешних слоев значительно менее
выражено, чем при окислении нитрида титана при
соответствующих температурах. При температурах 1000 и 1100° С внешний
ободок окалины рыжего цвета и нечетко выражен, и лишь при
1200° С становится буроватым, но светлее, чем на нитриде титана.
На TiN буроватый ободок окалины, связанный с повышением
концентрации катионов титана в окалине из рутила, появляется
на образце, окисленном при 800° С, и с дальнейшим ростом
температуры он становится более выраженным (шире и гуще краска),
чем на образцах TiC.
Следует отметить, что текстура роста внешних слоев окалины
и спекание окалины на нитриде титана выражены значительнее,
чем на карбиде титана при одинаковых температурах окисления.
Такие морфологические изменения окалины на TiC и TiN
объясняются различной диффузионной подвижностью катионов титана
в слое рутила на TiC и TiN, связанной с различным влиянием
неметаллов (углерода и азота) на диффузионную подвижность
титана. Азот, диффундируя и растворяясь в решетке рутила, повышает
концентрацию и диффузионную подвижность межузельных
катионов титана. Это проявляется в значительном спекании окалины,
в большой толщине спекшегося слоя и формировании
красно-бурых слоев окалины, ярко выраженной текстуре роста внешних
слоев окалины из TiOa на TiN. Азот влияет так же, как и катионы
металлов меньшей валентности [2.51]. Углерод и азот оказывают
различное стабилизирующее действие на окисные фазы.
В процессе окисления карбида ниобия углерод не стабилизирует
фазы а- и |3-Nb205. Поэтому они образуются в тех же интервалах
температур, которые наблюдаются при окислении ниобия.
Растворение углерода в NbaOB не оказывает влияния, необходимого для
перестройки решетки и осуществления полиморфного превращения
а — |3-Nb20B. Напротив, при окислении нитрида ниобия
высокотемпературная модификация |3-Nb205 появляется уже в области
низких температур и на начальной стадии процесса (например,
500° С, 15 мин). Вероятно, азот, растворенный в Nb205, вызывает
увеличение количества анионных вакансий [2.51] до определенного
предела, когда происходит перестройка решетки и переход а-фазы
в P-Nb205.
ОБРАЗОВАНИЕ НИТЕВИДНЫХ КРИСТАЛЛОВ
В процессе окисления карбидов и нитридов наблюдался рост
нитевидных кристаллов (или «пакетов»), состоящих (по данным
измерения микротвердости) из высших окислов соответствующего
металла. Местами зарождения нитевидных кристаллов служат,
как правило, поверхность раздела окалина — карбид (нитрид),
границы зерен карбида (нитрида) и т. д.
При окислении нитридов нитевидные кристаллы появляются при
156
более низких температурах (500 и 600° С) и кратковременных
выдержках, чем при окислении карбидов. При зарождении
нитевидных кристаллов на границе окалина — карбид (нитрид) они растут
в двух направлениях — в окалину (TiC, TiN) или в образец
карбида (нитрида). Направление роста нитевидных кристаллов отражает
особенности роста окалины и соответствующих окислов. При
окислении карбида (900° С, 1 ч) и нитрида титана нитевидные кристаллы
растут от внутренней границы к внешней или от внутреннего
слоя окалины к внешнему, что определяется преимущественной
диффузией катионов титана Ti4+ в формировании окалины из
рутила при высоких температурах. В процессе окисления ZrC, VC,
NbN (500° С, 1 ч) рост нитевидного кристалла протекает от
внутренней границы в глубь образца за счет преимущественной
диффузии кислорода при образовании окислов Zr02, V205, Nb205.
При окислении нитрида титана при 1000—1200° С на границе
окалина — нитрид формируются нитевидные кристаллы
ярко-красного цвета, в то время как при окислении карбида титана
нитевидные кристаллы окрашены в серо-бежевый цвет. Ярко-красная
окраска нитевидных кристаллов из рутила обусловлена высокой
концентрацией катионов титана в его решетке [4.2]. Интересно
отметить, что при окислении нитрида циркония нитевидные кристаллы
в отличие от бесцветных нитевидных кристаллов, образующихся
на ZrC, также красного цвета. При окислении нитрида ванадия
образуются зеленовато-желтые нитевидные кристаллы.
4.1. Войтович Р. Ф., Пугач Э. А. Высокотемпературное окисление нитридов
переходных металлов IV, V групп. I. Окисление нитрида титана.—
Порошковая металлургия, 1975, № 7, с. 57—62.
4.2. Бай А. С, Лайнер Д. И., Слесарева Е. И., Цыпин /И. И. Окисление титана
и его сплавов.— М. : Металлургия, 1970.— 317 с.
4.3. Самсонов Г. В., Бондарь В. Г., Войтович Р. Ф. Исследование окалиностой-
кости титано-азотированного твердого сплава.— Порошковая металлургия,
1975, № 11, с 87—93.
4.4. Войтович Р. Ф., Пугач Э. А. Высокотемпературное окисление нитридов
переходных металлов IV группы. II. Окисление нитридов циркония и
гафния.— Порошковая металлургия, 1975, № 9, с. 63—68.
4.5. Войтович Р. Ф., Пугач Э. А. Высокотемпературное окисление нитридов
переходных металлов IV—V групп. III. Окисление VN, NbN, TaN.—
Порошковая металлургия, 1975, № 12, с. 65—68.
4.6. Kofstad P. Oxidation of tantalum in oxygen at 300—550° C.—J. Inst. Metals,
1962/1963, 91, N 6, p. 209—216.
4.7. Корнилов И. И., Глазова В. В. Взаимодействие тугоплавких металлов
переходных групп с кислородом.— М. : Наука, 1967.— 255 с.
4.8. Hurlenl. Oxidation of niobium.—J. Inst. Metals, 1960/1961, 89, N 3,
p. 273—280.
4.9. Blackburn P. E. The mechanism of the niobium reaction with water vapor
and with oxygen.—J. Electrochem. Soc, 1962, 109, N 11, p. 1142—1150.
4.10. Kofstad P., Kjollesdal H. Oxidation of niobium (Columbium) in the
temperature range 500 to 1200° C— Trans. AIME, 1961, 221, N 4, 285—294.
4.11. Гельд П. В. Концентрационные пределы существования и степень
заполнения элементарной ячейки кубического оксинитрида циркония со
структурой типа NaCl.— Тр. Ин-та химии / АН СССР. Урал, фил., 1973, 25,
с. 21—25.
157
4.12. Нешпор В. С, Ероньян М. А., Петров А. #., Кравчук А. Е.
Микротвердость и микропластичность нитрида циркония.— Изв. АН СССР. Сер.
Неорган, материалы, 1978, 14, № 5, с. 884—888.
4.13. Глушкова В. Б., Сазонова Л. В. Влияние добавок редкоземельных окислов
на полиморфизм двуокиси циркония.— В кн.: Химия высокотемпературных
материалов. Л. : Наука, 1967, с. 83—90.
4.14. Паулине Л. Природа химической связи.— М. : Госхимиздат, 1947.—
440 с.
4.15. Новая керамика/ Будников П. П., Булавкин И. А., Выдрин Г. А. —М. :
Стройиздат, 1969.— 311 с.
4.16. Архаров В. И., Бланкова Е. Б. О структурных характеристиках окалины,
используемых при исследовании механизма реакционной диффузии.—
Физика металлов и металловедение, 1960, 9, № 6, с. 878—887.
Глава 5
ОКИСЛЕНИЕ
НЕМЕТАЛЛИЧЕСКИХ НИТРИДОВ
Широкое использование неметаллических нитридов вызывает
необходимость и более детального изучения процессов их окисления
15.1—5.27]. До настоящего времени исследовано окисление в
основном порошкообразных образцов нитридов бора, алюминия и
кремния на воздухе и в среде кислорода, а данные о стойкости против
окисления компактных образцов более ограничены [10, 5. 9, 5.10,
5.26, 5.27]. Во всех работах использовались порошкообразные
образцы неметаллических нитридов, которые подвергались окислению
более интенсивному, чем компактные, беспористые образцы.
Окисление проводилось, как правило, в среде кислорода при большом
давлении. Поэтому имеющиеся сведения о сопротивлении
окислению этих соединений не дают представления о стойкости против
окисления компактных образцов и изделий из них. Между тем
такие сведения представляют большой интерес в связи с применением
этих нитридов в виде компактных деталей и изделий для работы
в окислительных средах на воздухе, кислороде и вакууме.
В данной главе представлены результаты исследования
окисления компактных образцов нитридов бора, алюминия и кремния в
интервале температур 500—1200° С на воздухе и в среде кислорода
при давлении Ю-5, 10~'> 150 тор и в вакууме. Термодинамические
расчеты равновесий в системах нитрид — кислород в стандартных
условиях и при различных давлениях кислорода позволили
оценить возможность протекания реакций взаимодействия
неметаллических нитридов с кислородом с образованием твердых и
газообразных продуктов, вторичных реакций в окалине (например, диспро-
порционирование твердой моноокиси кремния), изменение
стабильности окисных фаз с повышением температуры (например, SiOr;l3)
С помощью металлографических исследований поверхности
окисленных образцов в. соответствии с данными
термодинамических расчетов выявлены интересные особенности процесса
окисления неметаллических нитридов в широком интервале температур,
на воздухе, в среде кислорода и вакууме, связанные с образованием
159
окисных фаз, их окислением и диспропорционированием с ростом
температуры и давления. Это позволило установить поведение
неметаллических нитридов в процессе их окисления.
Окисление BN
Процесс окисления порошкообразного нитрида бора исследован
во многих работах [5.1—5.8], По данным [5.1], порошок нитрида
бора активно окисляется влажным воздухом при температуре 800—
900° С, а при прокаливании на воздухе в течение 2 ч степень его
окисления составляет 96—97%. В вакууме (10~3 тор) при
температурах 1000 и 1200° С окисление нитрида бора сопровождалось
незначительной убылью массы. Степень окисления порошка нитрида
бора существенно зависит от температуры его предварительного
прокаливания [5.4, 5.5]. При повышении температуры
предварительного прокаливания в азотсодержащей среде от 1000 до 1600° С
скорость его окисления уменьшалась в четыре раза [5.4]. Стойкость
нитрида бора против окисления особенно сильно повышается после
предварительного его прокаливания в азоте при температуре
2200—2400° С. В этом случае сильно уменьшалась удельная
поверхность порошка и его стойкость против окисления приближалась
к стойкости компактного нитрида бора, полученного горячим
прессованием [5.5].
Окисление порошка нитрида бора начинается при 770° С [8]
и протекает тем медленнее, чем больше порошок нитрида загрязнен
борным ангидридом. При более высоких температурах преобладает
улетучивание В203 и порошок окисляется с большей скоростью.
Порошкообразный нитрид бора турбостратной структуры начинает
окисляться при 800—900° С. Наличие в исходных порошках окиси
бора ускоряет процесс окисления и смещает его в сторону меньших
температур [5.6]. По данным [5.7], исходная структура влияет на
окисляемость нитрида бора.
Изучено высокотемпературное окисление гексанита-Р
(сверхтвердого материала на основе вюрцитоподобной модификации
нитрида бора) на воздухе в интервале температур 600—1200° С и
в среде остаточных газов при давлении 1,0 и 10 тор [5.9].
Установлено, что при температуре 600—800° С вюрцитоподобный BN в среде
кислорода при давлении 740 тор не окисляется. Заметное
окисление начинается только при 900° С. При температуре 1200° С на
более поздних стадиях процесса наблюдается убыль массы,
связанная с испарением В203. Окисление гексанита-Р сопровождается
частичным кристаллографическим превращением, приводящим к
изменению структуры материала — частичному переходу
дефектной вюрцитоподобной модификации BN в его более стабильную гра-
фитоподобную форму. Такой переход осуществляется в
поверхностном слое на границе окалина — материал и сопровождается
образованием бурых мелкодисперсных агрегатов с большим показателем
преломления.
100
Высокая стойкость к первичному взаимодействию с кислородом
воздуха при окислении обусловлена кристаллографическими
особенностями вюрцитоподобного BN [5.9], главным образом
прочностью гексагональной решетки этого соединения,
характеризующегося тетраэдрическим распределением атомов, при котором
каждый атом одного сорта окружен четырьмя атомами другого сорта
[5.10]. Зарождение центров окисления на воздухе при давлении
740 тор, образование на них мелкодисперсного окисла В203,
особенно при 900° С, по мнению авторов [5.9], связано с наличием
дефектов структуры. Дефектность структуры вюрцитоподобного BN
исследована в работе [5.11].
Изучено окисление пиролитического нитрида бора в среде
кислорода при давлении кислорода 740 тор в интервале температур
800—1200° С и исследованы состав и кинетика образования
газообразных продуктов реакции [5.12]. Показано, что продуктами
взаимодействия пиронитрида бора с кислородом в приведенном
интервале температур являются В203 и диоксид азота N02. В этих
условиях выделение диоксида азота начинается с 900° С. При нагревании
до 1100—1200° С образующийся оксид бора В203 интенсивно
испаряется. Как отмечается в работе [5.12], N02 получается в
результате окисления моноокиси азота, выделяющейся при окислении
нитрида бора, протекающего в избытке кислорода:
2NO + 02 = 2N02.
Значительное уменьшение количества диоксида азота,
образующегося при 1200° С, несмотря на интенсивное окисление нитрида
бора, авторы 15.12] объясняют термической диссоциацией N02
на азот и кислород. На появление окислов азота в процессе
окисления порошкообразного нитрида бора указывается в работе [5.5].
При этом количество N02 при 1200—1300° С существенно
уменьшается.
Образование монооксида азота при окислении нитрида бора
и его последующее окисление до диоксида азота, по мнению авторов
[5.12], обусловлены следующим. Атом азота в гексагональном
нитриде бора согласно результатам квантовомеханических расчетов
[5.13] несет избыточный отрицательный заряд (~ 1е),
переходящий по гибридным 5/?2-орбиталям о- и зт-симметрии в плоское
бор-азотное кольцо. При разрушении бор-азотных колец в процессе
взаимодействия нитрида бора с кислородом электронная
конфигурация атома азота в нитриде бора оказывается подготовленной к
образованию «нечетной» молекулы NO, имеющей неспаренный
электрон на зт*-орбитали [5.14], в качестве первичного
газообразного продукта окисления. Это требует меньших затрат, чем
непосредственное образование молекул азота, связанное с переносом
заряда.
На стойкость против окисления нитрида бора большое влияние
оказывает пористость. Горячепрессованные плотные образцы
нитрида бора (с пористостью 4—5%) окисляются на воздухе слабо.
11 2920
161
При температурах 700 и 1000° С наблюдается незначительная убыль
массы [5.15]. При нагревании на воздухе компактный нитрид бора
начинает окисляться при 1200° С [5.16].
Термодинамический расчет равновесий в системе нитрид бора —
кислород позволил установить термодинамическую возможность
протекания реакций в этой системе, идущих с образованием
твердых (В203) и газообразных (В202, ВО) окислов бора, а также азота
и его окислов (NaO, NO, NOa):
*/.BN + 02 = 2/3B203 + 2/3N2, (5.1)
2BN + 02 = B202 + N2, (5.2)
2BN + 02 = 2BO + Na, (5.3)
BN + 02 = V,B A + WW (5.4)
V5BN + Oa = 2/5B203 + V5NO, (5.5)
4/7BN + 02 = 2/7B203 + 4/7N02, (5.6)
V.BN + Oa = 2/3B203 + 2/3N2, (5.7)
BN + 02 = V2B202ra3 + NO, (5.8)
2/3BN + Oa = V3B202ra3 + 2/3N02, (5.9)
%BN + 02 = V3BO + 2/3N20, (5.10)
BN + 02 = BO + NO, (5.11)
2/3BN + 02 = 2/3BO + 2/3N02, (5.12)
4BN + 02 = 4B + 2N20, (5.13)
2BN + 02 = 2B + 2NO, (5.14)
BN + 02 = В + N02, (5.15)
V3BN + 02 = 2/3B203 ra3 + 2/3N2, (5.16)
BN + 02 = V2B203 ra3 + V2N20, (5.17)
*/5BN + Oa = 2/5B203 ra3 + V5NO. (5 18)
Как следует из рис. 61, не все рассмотренные реакции
термодинамически возможны. Наиболее высокой термодинамической
возможностью протекания характеризуются реакции взаимодействия
BN с кислородом, идущие с образованием твердого окисла В203
и газообразного азота (реакция (5.1)), В203 и N20 (5.4),
твердого В203 и NO (5.5), твердого В203 и N02 (5.6).
Термодинамическая вероятность протекания перечисленных реакций
уменьшается в указанной последовательности и с ростом температуры.
Довольно высокой степенью вероятности отличаются также
реакции взаимодействия нитрида бора с кислородом, идущие с
образованием газообразной окиси бора В203 и азота (5.16), газообразного
В203 и N20 (5.17), газообразного В203 и NO (5.18).
Следует отметить, что если свободная энергия реакций
взаимодействия, протекающих с получением твердой окиси бора, азота
162
Рис. 61. Зависимость
термодинамического потенциала реакций
взаимодействия нитрида бора с
кислородом от температуры при давлении
кислорода 760 (/) и 10~5 тор (//)
(номера кривых соответствуют
номерам уравнений реакций).
и его окислов (5.1), (5.4)—
(5.6), уменьшается с
повышением температуры при всех
исследованных давлениях, то
для реакций, продукты
которых содержат газообразную
В203, азот и его окислы,
наблюдается более сложная
зависимость величины
термодинамического потенциала от
температуры и давления.
Термодинамическая возможность
протекания реакций (5.16)—
(5.18) при давлении 760 тор
увеличивается с ростом
температуры. Однако при более
низких давлениях кислорода
(150, 10~\ 10~5 тор) имеет "
£lf\ ккал/моль
250
200
150
1О0\-
50
0-
-50-
О 500 1000 1500 2000 Т,К
место обратная зависимость —
вероятность протекания реакций уменьшается с повышением
температуры. Это указывает на то, что при более низких давлениях
кислорода возможность образования газообразного В203, азота и
его окислов понижается с ростом температуры.
Термодинамические расчеты позволили установить, что при
взаимодействии нитрида бора с кислородом образование низших
окислов бора ВО, В202 и азота, этих окислов и окислов азота, а
также свободного бора и его окислов в соответствии с реакциями
(5.2), (5.3), (5.8)— (5.12), (5.13)—(5.15) является термодинамически
невозможным. Термодинамическая вероятность реакций (5.13),
(5.14) несколько увеличивается с ростом температуры.
Представленные на рис. 61 данные показывают, что давление
кислорода существенно влияет на протекание реакций
взаимодействия с ним нитрида бора. С уменьшением давления
термодинамическая возможность протекания реакции понижается. Так, реакции
(5.5) и (5.6), идущие с образованием твердого В203 и NO или
NOa при давлении 760 тор, термодинамически возможны во всем
исследованном интервале температур. С уменьшением давления
вероятность протекания реакций резко понижается. Они становятся
невозможными при низких температурах и давлении кислорода.
Например, реакция (5.6) при давлении Ю-1 маловероятна при
И*
163
температурах выше 1500 К, а при более низком давлении (10~ тор)
она невозможна уже при температуре 1000 К.
Как указывалось выше, с уменьшением давления кислорода
изменяется и характер зависимости термодинамического
потенциала некоторых реакций от температуры. Так, при давлении 760 тор
с ростом температуры возможность протекания реакций (5.16)—
(5.18) уменьшается, а при более низких давлениях (150, 10~ ,
10~5тор) вероятность их прохождения понижается с повышением
температуры и тем сильнее, чем ниже давление кислорода. В этом
случае с уменьшением давления кислорода термодинамический
потенциал реакций почти не изменяется с увеличением температуры
(например, реакция (5.18)), Р = 150 тор).
Таким образом, термодинамический расчет равновесие в
системе нитрид бора — кислород при различных давлениях кислорода
(760, 150, Ю-1, 10~~5 тор) и интервале температур 298—2000 К
позволил установить, что в процессе окисления нитрида бора в среде
кислорода при различном его парциальном давлении
термодинамическая возможность протекания всех реакций уменьшается с
ростом давления кислорода. Наиболее термодинамически возможными
являются реакции, идущие с образованием твердой фазы В203
и азота, а также В203 и окислов азота (реакции (5.1), (5.4)—(5.6)).
Кинетические кривые процесса окисления пиролитического,
горячепрессованного и турбостратного нитридов бора в среде
кислорода и на воздухе представлены на рис. 62 и 63. Исследование
процесса окисления на воздухе пиролитического нитрида бора,
вырезанного параллельно поверхности осаждения, показало, что
до температуры 1000Q С он характеризуется исключительно
высоким сопротивлением окислению (см. рис. 62, а). При окислении
пиролитического нитрида бора на воздухе наблюдается некоторый
прирост массы при температурах 300, 400 и 500° С и, напротив,
растущая убыль массы с дальнейшим повышением температуры.
Прирост массы в интервале температур 300—500° С обусловлен
образованием твердого окисла В203, летучесть которого в данных
условиях незначительна. Образование газообразных продуктов
реакции в соответствии с реакциями (5.1), (5.4)—(5.6) не
вызывает убыли массы образца. Однако в области более высоких
температур (600° С) вследствие усиливающейся летучести В203
наблюдается уже некоторая убыль массы, которая заметна и на
начальной стадии процесса при более высоких температурах
(800° С). При температуре 1200° С потеря массы, связанная со
значительным испарением В203 и образованием газообразных
продуктов, большая (см. рис. 62, а).
При окислении горячепрессованных образцов нитрида бора на
воздухе изменение хода кинетических кривых процесса (см. рис.
62, б) с ростом температуры несколько иного характера. Здесь
убыль массы наблюдается при 800° С во всем изученном интервале
времени, а при температурах 600 и 1000° С — лишь на начальной
164
m/St мг/см2
2{ •
Рис. 62. Кинетические кривые
окисления пиролитического (а), горя-
чепрессованного (б) и турбострат-
ного (в) нитридов бора на воздухе:
/ — 300; 2—400; Л — 600; 4—800; 5—900;
6— 1000; 7—1100; 5— ГгОО'С.
стадии процесса. На более поздних стадиях процесса (1000° С)
происходит прирост массы. При температуре 1200° С в отличие от
пиролитического нитрида бора прибыль массы наблюдается в
процессе окисления в течение 3—4 ч, а убыль массы — спустя 5—6 ч.
Кинетические характеристики процесса окисления турбострат-
ного нитрида бора (см. рис. 62, в) и их изменение с ростом
температуры аналогичны тем, которые имели место при окислении го-
рячепрессованного нитрида бора. И в этом случае образец
незначительно окисляется при 600° С, частично теряет массу при
165
4m/S, мг/смг
D~
тВ00°С)
1(Ю00°С)
5(800 С)
5(Ю00°С)
оътоо°о и
2(Ю00°С)
б(юоо°а
16
жоо°о
5(800°С)
5(1000 V
3(800°С)
о
5(600 С)
Ъ(600°С)
тооЪ
5(1000 °С)
Ъ(ЮОО°С)
Рис. 63. Кинетические кривые
окисления пиролитического (а), горя-
чепрессованного (б) и турбострат-
ного (б) нитридов бора в среде
кислорода при различных температурах
и давлении:
/ — вакуум 10"
2 — ю—1;з — 10
-5:
--- 10~3- 5 — Ю-1: в —150 тор
800° С. С ростом температуры до 1100° С увеличивается масса
окисленных образцов, и только при 1200° С процесс сопровождается
убылью массы во всем изученном интервале времени.
Для процесса окисления турбостратного нитрида бора
характерно то, что процесс протекает интенсивно лишь на начальных
стадиях процесса, после которых скорость не изменяется во
времени. Продолжительность такой начальной стадии уменьшается
с ростом температуры. Так, при температуре 900° С она составляет
4 ч, при 1000° С — 1 ч, при 1100° С — лишь 1/4 ч.
При сравнении результатов кинетических исследований
установлено, что пиролитический, горячепрессованный и турбострат-
ный нитриды бора имеют различную стойкость против окисления.
В процессе окисления пиролитического нитрида бора потеря
массы наблюдается при 600 и 1000° С, а при окислении горячепрес-
сованного и турбостратного нитридов бора прибыль массы
особенно значительная при 1000° С.
Металлографические исследования показали, что при
температуре 600° С на поверхности образца, преимущественно по границам
зерен, появляются расплавленные участки окисла В203,
количество которых увеличивается с ростом температуры. С повышением
166
температуры (1000° С) увеличивается количество фазы В203> но
одновременно усиливается и процесс ее испарения, определяющий
убыль массы. При температуре 1200° С на поверхности образца
образуется значительный слой В203. Его бугристая и неровная
структура указывает на значительное его испарение и на нарушение
сплошности пленки при выделении азота. Увеличение убыли веса
свидетельствует об интенсификации процесса взаимодействия
нитрида бора с кислородом.
Изучено влияние небольших давлений кислорода на окисление
пиролитического, горячепрессованного и турбостратного нитридов
бора (см. рис. 63). Показано, что здесь во всем изученном
интервале температур и давлений имеет место лишь убыль массы.
Наблюдается сложная зависимость убыли массы от температуры
и давления кислорода. При окислении пиролитического и
турбостратного нитридов бора (см. рис. 63, а, в) с повышением
температуры от 800 до 1000° С интенсивность процесса, как правило,
несколько нарастает при давлении 10—' тор. Такая закономерность
соблюдается и при окислении пиролитического нитрида бора в
вакууме (см. рис. 63, а). Однако с уменьшением давления кислорода
(10~5 тор) наблюдается обратная зависимость — убыль массы при
800° С гораздо больше, чем при 1000° С.
Поведение нитрида бора в вакууме и в среде кислорода при
одинаковых давлении и температуре несколько отличается. Так,
при окислении пиролитического нитрида бора при давлении 10—' тор
и температуре 800° С убыль массы образца, окисленного в
вакууме, значительно меньше, чем образца, окисленного в кислороде.
С ростом температуры (1000° С) убыль массы обоих образцов
отличается незначительно. Окисление пиролитического нитрида бора
в вакууме (Ю-1, 10~3 тор) и кислороде (10~ тор) при
температурах 800 и 1000° С характеризуется почти одинаковой убылью массы
(см. рис. 63, а).
Закономерности, наблюдаемые при окислении пиролитического
и турбостратного нитридов бора на воздухе, не сохраняются в среде
кислорода. Так, при окислении пиролитического нитрида бора на
воздухе при 800° С убыль массы значительно меньше, чем при
окислении турбостратного нитрида бора. Напротив, при
температурах 800 и 1000° С и давлении кислорода 10 * тор убыль массы
пиролитического нитрида бора больше, чем турбостратного (см.
рис. 63, а, в) и горячепрессованного (800° С).
Анализ кинетических кривых окисления нитрида бора на
воздухе и в среде кислорода показывает, что на начальной стадии
процесса они описываются линейной зависимостью. Это
свидетельствует о том, что химические реакции взаимодействия на границе
нитрид бора — кислород служат стадиями, определяющими
скорость процесса По мере протекания процесса образуется
защитный окисный слой, и диффузия кислорода к поверхности нитрида
становится стадией, лимитирующей процесс.
167
Кинетическими исследованиями установлено, что окисление
нитрида бора на воздухе и в среде кислорода является сложным
процессом взаимодействия нитрида бора с кислородом,
протекающим с образованием твердых и газообразных продуктов реакции.
Определяющую роль при окислении играет увеличивающаяся о
ростом температуры летучесть фазы В203, достигающая
максимального значения при температуре 1200° С. В области высоких
температур (до 1100° С) наблюдается значительный прирост массы
турбостратного и горячепрессованного нитридов бора. Учитывая,
что взаимодействие нитрида бора с кислородом сопровождается
образованием не только твердой фазы В203, но и газообразных
компонентов реакции (азота, его окислов и В203), можно
предположить, что увеличение массы обусловлено протеканием процесса
окисления в соответствии с реакциями (5.1), (5.4)-—(5.6). Роль
реакций (5.16) — (5.18), идущих с выделением только
газообразных продуктов реакции, менее значительна.
При окислении пиролитического нитрида бора на воздухе и
в среде кислорода происходит значительная убыль массы,
свидетельствующая о наличии газообразных продуктов реакции.
Возможность образования в определенных условиях легкоплавкой
фазы В203 способствует высокому сопротивлению нитрида бора
окислению в определенном интервале температур (вплоть до 1100э С).
Окисление A1N
Окисление порошка нитрида алюминия на воздухе начинается
при температуре 1200° С [5.16], а по данным работы [5.17] — при
900° С. Исследовано окисление нитрида алюминия на образцах,
содержащих 99,1 и 99,8% A1N [5.18]. Параболический характер
изотерм окисления указывает на образование плотной окисной
пленки и диффузионный характер процесса. Скорость окисления
зависит от давления кислорода — приблизительно пропорциональна
давлению газа-окислителя. Эти результаты указывают на то, что
скорость окисления нитрида алюминия зависит от миграции ионов
алюминия из нитрида через пленку окисла к поверхности раздела
окисел — газ.
Пористость существенно влияет на скорость окисления нитрида
алюминия. Так, при окислении спеченного нитрида алюминия
при 1200° С за 1 ч в окись алюминия превращается 11% нитрида,
а при окислении горячепрессованного образца при 1400° С в
течение 30 ч в окись перешло только 1% нитрида [5.19, 5.20].
На рис. 64 представлена температурная зависимость величины
термодинамического потенциала для всех возможных реакций
окисления нитрида алюминия:
%A1N + Оа = 2/3А1203 + 2/3N2, (5.19)
4A1N -f 02 - 2А120 + 2N2, (5 20)
2A1N + 02 = 2АЮ + Na, (5.21)
168
A1N + 02 = ]
A1N + 02 =
V5A1N + 02 =
V3A1N + 02 =
2A1N + 02
4/6AlN-j-02 =
4/3AlN + 02 =
A1N + 02
2/3AlN + 02 =
4A1N + 02
2A1N + 02
A1N + 02
72A1203 + V2N20,
V2A1203 + NO,
2/5Al203 + V5N02,
= 2/3Al20 + V3NO,
= AlaO + NaO,
%Al20 + 4/5N02,
= 4/зАЮ + 2/3N20,
= AlO + NO,
= 2/3АЮ + 2/3N02,
= 4A1 + 2N2Ot
= 2A1 + 2NO,
= Al + NOa.
(5.22)
(5.23)
Г5.24)
(5.25)
(5.26)
(5.27)
(5.28)
(5.29)
(5.30)
(5.31)
(5.32)
(5.33)
//£ ктл/моль
Рис. 64. Зависимость термодинамического потенциала реакций взаимодействия
нитрида алюминия с кислородом от температуры при давлении кислорода
760 (/) и 1СГ~5 тор (//) (номера кривых соответствуют номерам уравнений
реакций).
С помощью термодинамического расчета равновесий в системе
нитрид алюминия — кислород установлено, что наиболее
вероятными реакциями взаимодействия нитрида алюминия с кислородом
будут те, в продуктах которых образуются А1203 и низший окисел
169
дт/S, MS/см
40
Рис. 65. Кинетические кривые
окисления нитрида алюминия на воздухе:
1 — 400; 2 — 800; 3 — 1000; 4 - 1200° С.
азота N20, а также А1203,
свободный азот и окислы NO и
N02 (5.19), (5.22) — (5.24).
Термодинамическая возможность
протекания их уменьшается с
ростом температуры. При
температурах выше 1000° С
реакции образования фазы А1203 и
окислов азота (5.23), (5.24)
более возможные, чем образование
окисла А1203 и свободного азота. Термодинамически
невозможными являются реакции взаимодействия нитрида алюминия с
кислородом, продукты которых содержат низшие и газообразные
окислы алюминия А120 и АЮ, а также азот и его окислы (5.20),
(5.21), (5.25) — (5.30).
В исследованном интервале температур образование свободного
алюминия и окислов азота в процессе окисления нитрида
алюминия является невозможным (5.31) — (5.33), однако
термодинамическая вероятность прохождения этих реакций увеличивается с
повышением температуры.
Парциальное давление кислорода заметно влияет на
термодинамическую возможность протекания различных реакций
взаимодействия нитрида алюминия с кислородом.
С уменьшением давления кислорода термодинамическая
возможность протекания реакции уменьшается. Так, наиболее
вероятная реакция взаимодействия нитрида алюминия с кислородом
(5.22) при давлении 10~ тор становится невозможной в области
температур 2000 К, а реакция (5.24), идущая с образованием А1203
и N02, невозможна при температурах, превышающих 1500 К.
Изменение давления кислорода от Ю-1 до 150 тор
незначительно влияет на термодинамический потенциал реакции. Как следует
из рис. 64, наиболее термодинамически возможной является
реакция взаимодействия A1N с кислородом, протекающая с
образованием А1.203 и низшего окисла азота N20.
При окислении горячепрессованных образцов нитрида
алюминия в интервале температур 400—1200° С (рис. 65) кинетические
кривые указывают на прирост массы, хотя в действительности
происходит также улетучивание газообразных азота и его окислов,
которые служат продуктами термодинамически наиболее вероятных
реакций (5.19), (5.22) — (5.24) (см. рис. 64).
Как следует из рис. 65, нитрид алюминия характеризуется
довольно высоким сопротивлением окислению вплоть до 1200° С.
До температуры 800° С он незначительно окисляется, и с ростом
температуры скорость процесса увеличивается. Характер изо-
170
терм окисления при 1000 и 1200° С свидетельствует об
образовании защитной окисной пленки.
В области низких температур и на начальной стадии процесса
при более высоких температурах появляется пленка из А1203 в
основном по границам зерен. В этом случае скорость процесса
определяется химическим взаимодействием кислорода и нитридной
матрицы. Однако с увеличением времени окисления и температуры
по мере образования непрерывной защитной окисной пленки из
А1203 процесс приобретает диффузионный характер.
Окисление S13N4
В литературе имеются некоторые сведения о сопротивлении
окислению как порошкообразных, так и компактных образцов
нитрида кремния в среде кислорода, на воздухе и в технических газах
15.22—5.32]. По данным [5.22], при действии кислорода на
порошок Si3N4 при 1000° С в течение 3 ч окисляется 14,7, при 1300° С —
23,6, а при 1400° С — 49,5% порошка.
Исследована стойкость против окисления на воздухе
порошкообразного нитрида кремния при 600—1400° С и при 1200° С в парах
воды. Показано, что окисление на воздухе начинается при 1000° С
(со степенью превращения нитрида в окислы 0,11%). С
дальнейшим повышением температуры до 1400° С степень окисления
возрастает (через каждые 100° на 0,2—0,3%) и достигает 1,41%
(вследствие резкого увеличения скорости окисления). В парах воды за
1 ч при 1200° С степень окисления достигает более 20%[5.23].
Устойчивость к окислению в парах воды примерно в три раза
меньше, чем при окислении на воздухе. В присутствии паров воды
нитрид кремния окисляется до кремнезема и аммиака [5.24].
Согласно 15.25], скорость окисления порошкообразного нитрида
кремния в кислороде или во влажном воздухе в два раза больше, чем
в сухом воздухе. При окислении порошкообразного нитрида
кремния происходит постепенное изменение реакционной поверхности
вследствие образования вокруг частиц порошка пленок
кремнезема, которые препятствуют диффузии кислорода [5.3].
Исследовано окисление в среде кислорода нитрида кремния
с различным содержанием а- и ^-модификаций [5.21]. Показано,
что нитрид кремния с более высоким содержанием а-фазы
окисляется значительно больше, чем нитрид кремния с преобладающим
содержанием [3-фазы. С повышением давления кислорода скорость
процесса на начальной стадии увеличивается, что указывает на
влияние адсорбции молекулярного кислорода. При определенных
температурах и парциальных давлениях кислорода образуются
твердый раствор кислорода в a-Si3N4 и оксинитрид Si2ON2 [5.28,
5.29], который постепенно окисляется. Окисление
порошкообразного оксинитрида кремния Si2ON2 описано в работе [5.30].
Нитрид кремния в форме компактных и плотных изделий
устойчив против окисления воздухом до температуры 1200° 110, 5.31]
171
Alf. ктп/моль
600\
-i ^
Рис. 66. Зависимость термодинамического потенциала
от температуры реакций взаимодействия нитрида
кремния с кислородом при давлении кислорода 760 (/) и
10 тор (//) (номера кривых соответствуют номерам
уравнений реакций).
Изучено коррозионное поведение порошкообразного и горяче-
прессованного образцов Si3N4 в воздухе и различных агрессивных
средах при 1400° С [5.32].
В литературе существуют противоречивые данные о
газообразных продуктах реакции, образующихся при окислении нитрида
кремния. В работе [5.241 установлено, что Si3N4 окисляется до
Si02 и азота при высоких температурах в присутствии кислорода
и до Si02 и NH3 в присутствии паров воды. Предполагается [5.24—
5.25], что окисление протекает по реакции
Si3N4 + 302 = 3Si02 + 2N2,
хотя в некоторых случаях может образоваться и оксинитрид
кремния [5.29]:
Si3N4 + %02 = Si2ON2 + Si02 + N..
Сделана попытка выяснения характера основной реакции,
протекающей при окислении Si3N4 [5.33]. Окислению подвергались
172
образцы нитрида кремния на воздухе и в среде кислорода (170 тор)
при тепературах 1000, 1200 и 1400° С в течение 4 ч. Масс-спектро-
метрический анализ газообразных продуктов реакции показал, что
во всех случаях присутствуют частицы NO+, N2", N2"2 (N+); SiO+
не обнаружена. Автор [5.333 предполагает, что реакция
Si3N4 + 502 = 3Si02 4- 4NO
может быть главной при взаимодействии нитрида кремния с
кислородом. Азот выделяется не как первичный продукт реакции
окисления нитрида кремния, а вследствие протекания вторичной
реакции
2NO = N2 + 02
в области высоких температур. Вероятно, стадией, определяющей
скорость реакции, будет диффузия через слой продуктов реакции
из окисла SiOa [5.33]. При окислении Si3N4 в среде кислорода при
высоком давлении (760 тор) образуется диоксид азота [5.34], по-
видимому, вследствие окисления первично образующегося окисла NO.
Для выяснения характера взаимодействия нитрида кремния
с кислородом воздуха и с кислородом при различном его давлении
проведен термодинамический расчет равновесий в системе Si3N4 —
кислород при давлении кислорода 760, 150, Ю-1 и 10~~5тор (рис. 66).
Представлены термодинамические расчеты свободной энергии
для реакций, протекающих в системе нитрид кремния — кислород
с образованием твердых (Si02, SiO) и газообразных продуктов
реакции (N2, N20, NO, N02, SiO) при различных температурах и
давлениях кислорода:
V,Si8N4 + 02 = SiO, + 2/3N2,
V4Si3N4 + 02 = 3/4Si02 + V2N20,
V5Si3N4 + 02 = »/eSiOa + 4/5NO,
V7Si3N4 + 02 = 3/7Si02 + %N02,
2/3Si3N4 + 02 = 2SiOTB + 4/3N2,
2/5Si3N4 + 02 = <V6SiOTB + 4/5N20,
2/7Si3N4 + 02 - 6/7SiOTB + 8/7NO,
2/nSi3N4 + 02 « 6/„SiOTB + 8/„N02,
2/3Si3N4 + 02 - 2Si0Pa3 + 4/3N2,
2/5Si3N4 + 02 = 6/5SiOFa3 = 4/5N20,
a/7Si3N4 f O, = 6/7SiOPa3 + 8/7NO,
/nSi3N. + 02 = 6/tlSOra3 + 8/nN02,
Si3N4 +~л = Si02 + 2SiNrar + N2,
Si3N4 + 02 - 2SiOTE + 4SiNra3 + 2N2,
(5.34)
(5.35)
(5.36)
(5.37)
(5.38)
(5.39)
(5.40)
(5.41)
(5.42)
(5.43)
(5.44)
(5.45)
(5.46)
(5.47)
173
»
2Si3N4 + 02 = 2SiOra3 + 4SiNra3 + 2N2, (5 48)
2Si3N4 + 02 - 6Si + 2N20 + 2N2, (5.49)
V2Si3N4 + 02 = 3/2Si + 2N0, (5.50)
V4Si3N4 + 02 = 3/4Si + N02. (5.5П
Установлены интересные особенности изменения свободной
энергии реакций взаимодействия нитрида кремния g кислородом
в зависимости от температуры и давления кислорода (см. рис. 66).
Наиболее высокой свободной энергией характеризуются реакции
(5.34) — (5.37), идущие с образованием кремнезема, азота и его
окислов. Однако термодинамическая вероятность протекания их
уменьшается с ростом температуры. Несколько менее вероятны
реакции (5.45) и (5.46), продуктами которых являются
газообразная моноокись кремния и Si02 либо кремнезем и газообразные
SiN и N2.
Значительной степенью вероятности характеризуются реакции
(5.38) — (5.41) взаимодействия Si3N3 с кислородом, продукты
которых содержат твердую моноокись кремния SiO, азот и его окислы.
Возможность прохождения реакций (5.38) и (5.40) (образование
азота и его моноокиси) увеличивается с ростом температуры, а
вероятность протекания реакций (5.39) и (5.41) уменьшается.
Следует отметить, что термодинамическая вероятность
протекания реакций (5.42)—(5.43) и (5.48) образования газообразной
моноокиси кремния, азота и его окислов увеличивается с ростом
температуры. Прохождение их становится возможным только в
области высоких температур (выше 1000° С).
Как следует из рис. 64, с понижением давления кислорода
термодинамическая возможность протекания реакций уменьшается.
Например, при давлении 10— тор некоторые реакциии не
осуществляются в области более высоких температур (реакции (5.36), (5.37)).
Для реакций (5.34) — (5.37) с уменьшением давления, так же
как и в стандартных условиях (1 атм), свободная энергия
понижается с ростом температуры.
Таким образом, вероятность образования газообразной
моноокиси кремния и N20 увеличивается с ростом температуры лишь
при большом давлении кислорода. Проведенные
термодинамические расчеты показали, что при окислении нитрида кремния на
воздухе термодинамическая вероятность образования кремнезема
и азота или кремнезема и окислов азота довольно близка.
Для оценки возможности протекания различных вторичных
реакций окисления нитрида кремния с получением твердой и
газообразной моноокиси кремния проведен термодинамический расчет их
термодинамического потенциала следующих реакций:
Si02 + Si = 2SiOra3, (5.52)
SiO„, + VA = SiOa, (5.53)
2SiOTB = Si02 -f Si. (5.54)
174
jZf, ккал/моль
лт/S, мг/см2
12
100
SO
-50
-100
.-~53
53
"Ъ
о{
-4
S~4v-» """?• ~ы rv
4~i - :?*Q"""z ^™"n
ми Л
I
-о*
^o/
~-°2
1
r,y
tf 2 4
Рис. 68. Кинетические кривые
окисления нитрида кремния на воздухе:
/ — 600; 2 — 800; 3 — 1000; 4 — 1100;
5 — 1200° С.
0 500 1000 1500 2000
Рис. 67. Зависимость термодинамического
потенциала от температуры реакций
образования моноокиси кремния при
давлении кислорода 760 (/), 10~"5 (//) и
150 тор (///) (номера кривых
соответствуют номерам уравнений реакций).
Как следует из рис. 67, образующаяся моноокись кремния
может окисляться до фазы Si02. Возможность прохождения
реакции уменьшается с ростом температуры. Моноокись кремния в
этом случае может также диспропорционироваться до фаз Si02
и Si. В области высоких температур (выше 2000 К) возможно
взаимодействие указанных фаз с образованием газообразной
моноокиси кремния.
Следовательно, образование твердой моноокиси кремния
возможно в широком интервале температур в соответствии с
реакциями (5.38) — (5.41). С другой стороны, она может диспропорцио-
нировать с ростом температуры.
Нитрид кремния характеризуется высоким сопротивлением
окислению на воздухе в интервале температур 600—1200° С (рис. 68).
Наблюдаемая убыль массы, определяемая образованием
газообразных продуктов реакции, значительно превалирует над привесом,
вызванным появлением твердых компонентов.
Характер кинетических кривых при 1100 и 1200° С на более
поздних стадиях процесса свидетельствует о наличии защитной
окисной пленки. Металлографическими исследованиями
установлено образование сплошных непроницаемых пленок из кремнезема,
которые исключают возможность взаимодействия нитрида
кремния и кислорода. По данным рентгеновского фазового анализа при
температурах 1100 и 1200° С окалина состояла из кристобалита.
175
dm/S,<MZ/CM2
Рис. 69. Кинетические кривые окисления нитрида кремния в вакууме
и среде кислорода (1000° С):
/ — вакуум Ю-1: 2 — Ю-5; 3 — вакуум Ю-5; 4 — 150; 5 — 10; о —
10-1 тор.
Из данных термодинамических расчетов следует (см. рис. 66),
что окисление нитрида кремния может сопровождаться реакциями,
идущими с образованием твердых и газообразных компонентов.
Термодинамически возможны не только реакции, идущие с
получением твердой фазы Si02, азота и его окислов, но и другие,
характеризующиеся образованием только газообразных продуктов
(5.44) — (5.46), (5.48). Возможность протекания этих реакций
повышается с ростом температуры. Анализ наиболее термодинамически
возможных реакций взаимодействия в системе нитрид кремния —
кислород (реакции (5.34) — (5.37)) показывает, что если бы
окисление Si3N4 протекало в соответствии с перечисленными реакциями,
то наблюдался бы только прирост массы. Однако экспериментально
установленная убыль массы уже в области низких температур
свидетельствует в пользу протекания и реакций типа (5.44) — (5.46),
176
(5.48) с образованием азота, газообразного SiN, SiO и окислов
азота.
При исследовании окисления нитрида кремния в среде
кислорода при небольшом его парциальном давлении (Ю-5, Ю-1, 10 и
150 тор) и температуре 1000° С (рис. 69) найдено, что здесь имеет
место лишь убыль массы, причем на начальной стадии процесса
убывает резко масса окисленных образцов, которая в определенном
интервале времени (примерно 1 ч) незначительно изменяется с
давлением. И только при дальнейшем протекании процесса наблюдается
некоторое влияние давления на интенсивность окисления.
Убыль массы при окислении в среде кислорода при небольшом
его давлении указывает на то, что в этом случае, в отличие от
окисления на воздухе, образование газообразных продуктов
превалирует над формированием твердой фазы кремнезема. Интересно
отметить, что изменение давления кислорода от 10~' до 150 тор
незначительно влияет на интенсивность процесса; убыль массы несколько
возрастает с уменьшением давления.
Термодинамический потенциал реакций взаимодействия
нитрида кремния и кислорода почти незначительно меняется с
понижением давления кислорода от 10 ! до 150 тор, но при Р =10~~5 тор
он резко уменьшается. Это коррелирует с ходом кинетических
кривых. При давлении 10~"5 тор и температуре 1000° С
термодинамически невозможны реакции, конечными продуктами которых
являются только газообразные компоненты — SiO и N02
(реакция (5.45)). Вероятно, поэтому при давлении Ю-5 тор убыль массы
становится значительно меньше, чем при более высоких давлениях
кислорода. Интересно отметить, что убыль массы, связанная с
выделением газообразных компонентов реакции, значительно больше
при окислении в среде кислорода, чем при окислении на воздухе.
Это обусловлено тем, что протекание наиболее вероятной реакции
(5.34) взаимодействия нитрида кремния и кислорода, идущей с
выделением газообразного азота и Si02, на воздухе может в
значительной степени замедляться. Непосредственно с этим связано и
то, что убыль массы при окислении нитрида кремния в вакууме
(Ю-1, Ю-5 тор) значительно меньше, чем при окислении в среде
кислорода при таких же давлениях.
Металлографические исследования позволили выявить
интересные особенности окисления нитрида кремния на воздухе и в
среде кислорода при различном его парциальном давлении. В
процессе окисления Si3N4 на воздухе образуется не только двуокись
кремния, но и твердая моноокись SiO в соответствии с
термодинамически возможными реакциями (5.38) — (5.41). Вероятность их
увеличивается (5.38), (5.40) или уменьшается (5.39), (5.41) с ростом
температуры. Твердая моноокись кремния с повышением
температуры диспропорционируется, процесс начинается при 800° С, и
интенсивность его с повышением температуры заметно возрастает.
Диспропорционирование моноокиси кремния по реакции (5.54)
12 2920
177
является термодинамически возможной реакцией взаимодействия.
Вероятность протекания ее увеличивается с ростом температуры.
Так, при температуре 600° С и 800° С появляются отдельные области
светло-коричневой моноокиси кремния с вкраплениями ее
мельчайших кристалликов ярко-красного цвета. Однако уже при
последней температуре в отдельных местах появляются бесцветные
составляющие (Si02) в виде мелких кристалликов, сливающихся
в более крупные образования, и темные непрозрачные частицы
кремния, вкрапленные в массу кремнезема.
При температуре 1000—1100° С заметно уменьшаются области
коричневых образований моноокиси кремния и более
значительным становится процесс ее диспропорционирования. Вследствие
этого светло-коричневые образования имеются лишь на отдельных
участках моноокиси кремния, остальная поверхность покрыта
бесцветной пленкой из двуокиси кремния. Сквозь пленку
просматриваются небольшие коричнево-красные вкрапления моноокиси
кремния. Черные непрозрачные включения кремния локализуются в
отдельных местах среди бесцветной двуокиси кремния, что
указывает на диспропорционирование твердой фазы SiO.
При температуре 1100° С процесс диспропорционирования
выражен еще больше. На поверхности наблюдаются отдельные
небольшие участки фазы SiO, претерпевающей стадию разложения,—
четко виден светлый, тонкозернистый слой окисла Si02 с
включениями свободного кремния темного цвета. В отличие от 1000° С при
1100° С поверхность образца, покрытая SiOa, становится
стекловидной и более прозрачной. На ней появляются мельчайшие
вкрапления в массу кремнезема. При температуре 1200° С только в
некоторых местах видны еще заметные остатки SiO коричневато-бурого
цвета. Остальная поверхность покрыта неоднородной окисной
пленкой с темными включениями кремния (следы разложения
SiO).
При окислении нитрида кремния в среде кислорода при
различном его парциальном давлении (10~~5—150 тор) и температуре 1000° С
имеют место иные закономерности. При давлении 150 тор
поверхность окисленного образца покрыта светло-коричневыми
образованиями моноокиси кремния. Равномерность распределения ее
больше, чем при 1000° С, но плотность распределения и количество
кристаллов красного цвета меньше. Темно-серые узорчатые
включения состоят из свободного кремния, образовавшегося в процессе
диспропорционирования твердой фазы SiO.
С понижением давления изменяются и морфологические
особенности поверхности окисленных образцов. При давлении 10 тор
коричневые включения моноокиси кремния менее выражены,
плотность их распределения понижена. Протекает процесс
диспропорционирования твердой фазы SiO. Поверхность образца
покрыта сетью серой тонкозернистой смеси кремнезема и мельчайших
вкраплений темного свободного кремния. При более низком
давлении (Ю-1 тор) появляются незначительные участки светло-корич-
178
невого цвета из моноокиси кремния. Основная часть поверхности
образца покрыта серыми мелкозернистыми образованиями ле-
шательерита, среди которых просматриваются мельчайшие
включения кремния.
При давлении 10~5 тор изредка попадаются мельчайшие бурые
и красноватые кристаллы моноокиси кремния, а также тончайшие
серые выделения кремнезема с включениями свободного кремния.
Это свидетельствует о диспропорционировании моноокиси кремния.
Интересно отметить, что в вакууме (10~ тор) выделения
продуктов реакции на поверхности менее выражены, чем при таком же
давлении кислорода. Моноокись кремния не обнаружена.
Таким образом, с уменьшением давления кислорода количество
бурых и ярко-красных выделений SiO резко уменьшается. При
давлении 150 тор они захватывают целые области, при более низком
давлении наблюдаются в виде отдельных включений, а с
дальнейшим понижением давления просматриваются в виде отдельных
редких выделений. Серые участки кремнезема с черными включениями
указывают на диспропорционирование моноокиси кремния.
Следовательно, с ростом температуры при окислении нитрида
кремния на воздухе и с уменьшением давления при определенной
температуре (1000° С) усиливается процесс диспропорционирования
моноокиси кремния. Этим обусловлено исчезновение твердой фазы
SiO с ростом температуры. Металлографические исследования
указывают на выделение кремнезема и свободного кремния вокруг
включений из твердой моноокиси кремния.
Анализируя ход кинетических кривых окисления нитрида
кремния на воздухе и в среде кислорода, можно заметить, что в обоих
случаях начальные стадии процесса окисления (до 30 мин)
описываются линейной зависимостью, свидетельствующей о протекании
химической реакции на поверхности нитрида. На более поздних
стадиях процесс становится диффузионным.
По данным [5.27], на начальной стадии процесса энергии
активации составляли 66,5 и 70 ккал/моль для нитрида кремния с
большим и меньшим содержанием а- и p-Si3N4. Величины энергии
сравнимы со значением энергии связи Si—N, равной 70,2 ккал,
рассчитанной из термодинамических данных. В этом случае
лимитирующей стадией процесса окисления Si3N4 может быть разрыв
связи Si—N. На более поздних стадиях процесса рассчитанная
энергия активации (35 ккал/моль) близка к энергии активации
процесса окисления кремния, оксинитрида кремния и диффузии
кислорода в Si02. Следовательно, на более поздней стадии процесса
при образовании защитной окисной пленки диффузия кислорода
в Si02 является стадией, определяющей скорость реакции.
При окислении нитридов металлов IVa—Va подгрупп
взаимодействие их с кислородом сопровождается внедрением его в
решетку нитридов и замещением азота более электроотрицательным
элементом внедрения — кислородом [1.25]. Дестабилизирующее
влияние его на Me—Ме-взаимодействие 121, 1.93, 2.41] и появление
12*
179
оксинитридных твердых растворов с дефектами в обеих подрешет-
ках [7, 1.25, 1.64, 1.79, 1.80, 1.85,1.92, 3.15, 3.18, 3.22] способствуют
выделению азота и соответствующего металла из решетки
образующейся оксинитридной фазы 12.5, 4.1, 4.4, 4.5]. При окислении
неметаллических нитридов BN, A1N, SisN4 со значительной ионной
и ковалентной связями [81 наблюдаются иные закономерности.
Растворение кислорода в нитриде кремния сопровождается
образованием а-твердого раствора и оксинитрида кремния Si02N2 [5.28,
5.29].
На начальных стадиях окисления нитридов бора, алюминия и
кремния лимитирующей стадией процесса является взаимодействие
их с кислородом.
Более поздние стадии процесса окисления неметаллических
нитридов в условиях образования защитных окисных пленок
(В203, А1203, SiOa) имеют диффузионный характер. Энергия
активации процесса на данной стадии равна энергии активации
диффузии кислорода через окисел Si02 [5.27] при окислении Si3N4, a
при окислении нитрида алюминия скорость определяется
миграцией катионов алюминия через пленку А1203 [5.19].
5.1. Загянский И. Л., Самсонов Г. В. К вопросу окисляемое™ нитрида бора.—
Журн. прикл. химии., 1952, 25, № 5, с. 552—558.
5.2. Ниденцу /С., Даусон Дж. Химия боразотных соединений.— М. : Мир,
1968.— 226 с.
5.3. Coles N. G., Glasson D. R., Jajaweera S. A. A. Formation and reactivity of
nitrides. III. Boron, aluminium and silicon nitrides.— J. Appl. Chem., 1969,
19, N I, p. 178—181.
5.4. Слепцов В. М., Самсонов Г. В. Нитрид бора.— Вопр. порошковой
металлургии и прочности материалов, 1958, вып. 6, с. 65—77.
5.5. Печентковская Л. Е., Дубовик Т. В., Назарчук Т. Н. Некоторые данные по
окисляемости нитрида бора при высоких температурах.— Изв. АН УССР.
Неорган, материалы, 1967, 3, № 6, с. 963—967.
5.6. Подобеда Л. Г., Цапук А. К-, Буравов А. Д. Окисление нитрида бора в
неизотермическом режиме.— Порошковая металлургия, 1976, № 6, с. 44—47.
5.7. Цапук А. К-, Подобеда Л. Г., Ковалевский Н. П. Окисление материалов на
основе нитрида бора.— Порошковая металлургия, 1978, № 3, с. 49—54.
5.8. Glasson D. R., Jajweera S. A. A. Formation and reactivity of nitrides. I.
Boron, aluminium and silicon nitrides.— J. Appl. Chem., 1968, 18, N 1, p. 65—
67.
5.9. Лавренко В. А., Процент Т. Г., Бочко А. В., Примачук В. Л., Лугов'
екая Е. С, Алексеев А. Ф., Францевич И. Н. Высокотемпературное
окисление гексанита — Р.— Докл. АН УССР, 1975, 224, № 4, с. 877—879.
5.10. Bundy F. P., Wentorf R. H. Direct transformation of hexagonal boron
nitride to denser form.—J. Chem. Phys., 1963, 38, N 5, p. 1144—1149.
5.11. Курдюмов А. В., Пилянкевич А. Н., Островская Н. Ф., Францевич И. Н.
Исследование субструктуры вюрцитоподобной модификации нитрида бора.
—Докл. АН СССР, 1973, 209, № 5, с. 1081—1083.
5.12. Алексеев А. Ф., Лавренко В. А., Нешпор В. С, Францевич И. Н.
Высокотемпературное окисление пиролитического нитрида бора.— Докл. АН УССР,
1978, 238, № 2, с. 370—373.
5.13. Хусидман М. Б., Нешпор В. С. Исследование методом электронного
парамагнитного резонанса гексагонального и кубического нитрида бора.—
Порошковая металлургия, 1970, № 8, с. 72—77.
5.14. Коттон Ф., Уилкинсон Дж. Современная неорганическая химия : В 3-х т.—
М. : Мир, 1969.— Т. 1. 224 с.
180
5.15. Taylor K. Hot pressed boron nitride.— Ind. Eng. Chem., 1955, 47, N 12,
p. 2506—2509.
5.16. Renner Th. Herstellung der nitride von Bor, Aluminium, Gallium und Indium
nach dem Aufwachs verfahren.— Z. anorg. und allg. Chem., 1959, 298,
N 1/2, S. 22—33.
5.17. Лютая М. Д., Буханевш В. Ф. Химическая и термическая устойчивость
нитридов элементов III группы.— Жури, неорган, химии 1962, 7, № 11,
с. 2487—2494.
5.18. Купер К- Ф. Синтез и окисление нитрида алюминия.— В кн.: Специальная
керамика. М. : Металлургия, 1968, с. 39—41.
5.19. Geffrey G. A., Parri G. S. Crystal structure of aluminium nitride.— J. Chem.
Phys., 1955, 23, N 2, p. 406—408.
5.20. Long G., Foster L. Aluminium nitride, a refractory for aluminium to 2000° C—
J. Amer. Ceram. Soc, 1959, 42, N 2, p. 53—59.
5.21. Guiochon G., Jacque L. E'tude de cinetique d'oxydation du nitrure AIN.—
Bull. Soc. chim. France, 1963, N 4, p. 836—844.
5.22. Glemser 0., Beltz., Nauman P. Zur Kenntnis des Systems Silicium — Stick-
stoff.—Z. anorg. und allg. Chem., 1957, 291, N 112, S. 51—66.
5.23. Кулешов И. М. О термической устойчивости нитрида кремния.— Журн.
неорган, химии, 1959, 4, № 2, с. 488—491.
5.24. Кайнарский И. С, Дегтярева Э. В., Кухтенко В. А. Карборундовые
изделия на связке из нитрида кремния.— Огнеупоры, 1960, 25, № 4, с. 175—180.
5.25. Horton R. M. Oxidation kinetics of powdered silicon nitride.— J. Amer.
Ceram. Soc, 1969, 52, N 3, p. 121—124.
5.26. Wolf E. G., Alcock С. В. The volatilization of high-temperature materials in
vacuo.— Trans. Brit. Ceram. Soc, 1962, 61, N 10, p. 667—687.
5.27. Tetard D., Lortholary P., Goursat P., Bitty M. Recherches sur les nitrures de
silicium. IV. Cinetique d'oxydation du nitrure Si3N4 pulverulent.— Rev
int. hautes temp, et refract., 1973, 10, N 2, p. 153—159.
5.28. Jack K. H. Sialons related nitrogen ceramic.— J. Mater. Sci., 1976, 11, N 6,
p. 1135—1158.
5.29. Washburn M. E. Silicon oxynitride refractories.— Amer. Ceram. Soc Bull.,
1967, 46, N 7, p. 667—671.
5.30. Lortholary P., Goursat P., Tetard D., Billy M. Etude du systeme silicium—oxy-
gene—azote. II. Corrosion de l'oxynitrure pulverulent par l'oxygene au-des-
sus de 1100°C— Rev. int. hautes temp, et refract., 1972, 9, N 4, p. 325—
331.
5.31. Брохин И. С, Функе В. Ф. Получение и исследование некоторых свойств
керамики из нитрида кремния.— Огнеупоры, 1957, № 12, с. 562—566.
5.32. Schlichting J. Heiskorrosionsverhalten von SiC und Si3N4 im Brennengas.—
Werkstoffe und Korrosion, 1975, 26, N 10, S. 753—758.
5.33. Lin Sin-Zhong. Mass spectrometric analysis of vapors in oxidation of Si3N4
compacts.— J. Amer. Ceram. Soc, 1975, 58, N 3, p. 160.
5.34. Лавренко В. А., Алексеев А. Ф., Казаков В. К- Высокотемпературное окис-
* ление нитрида кремния в кислороде.— В кн. Методы получения, свойства
и области применения нитридов (Рига, февраль 1980 г.) : Тез. докл. Рига :
Зинатне, 1980, с. 105—107.
5.35. Seybolt A. U., Fullman R. L. A rationalisation of the oxygen solid
solubility in some transition metals.— J. Metals., 1954, 6, N 5, p. 548—549.
Глава 6
НЕКОТОРЫЕ ЗАКОНОМЕРНОСТИ
ОКИСЛЕНИЯ КАРБИДОВ И НИТРИДОВ
МЕТАЛЛОВ IVa-Via ПОДГРУПП
И СООТВЕТСТВУЮЩИХ МЕТАЛЛОВ
Высокотемпературное окисление металлов, сплавов и тугоплавких
соединений протекает с растворением кислорода, формированием
окалины и возникновением вторичных реакций, обусловленных
участием неметаллической составляющей тугоплавкого
соединения. В процессе окисления растворение кислорода (азота) в сплавах
сопровождается внедрением кислорода (азота) в их октаэдрические
пустоты, увеличением периода решетки растворителя и, как
правило, микротвердости поверхностной газонасыщенной зоны [2.233.
Только при окислении титана и сплавов на его основе при
температуре выше 1200° С вследствие особенностей формирования
окалины из рутила путем преимущественной диффузии межузельных
катионов титана и перехода в окалину катионов титана
микротвердость увеличивается по мере удаления от границы окалина — сплав
(рис. 70) [2.23].
При окислении тугоплавких соединений имеют место иные
закономерности. Как известно, замещение и образование
соответствующих твердых растворов происходит более легко, чем внедрение
примесных элементов в междоузлиях, связанное с затратой
определенной энергии деформации. Упругое напряжение, вызванное
растворением одного атома кислорода в данном металле,
пропорционально соотношению £7V, где V — октаэдрический объем
металла; Е — его модуль упругости [5.35]. Поэтому на металлах
IVa подгруппы и их сплавах значительная зона твердого раствора
наблюдается лишь в области высоких температур (выше 800° С)
и при длительном окислении. При окислении тугоплавких
соединений зоны оксикарбидных твердых растворов образуются при
низких температурах (400° С) на начальной стадии процесса.
Зависимость величины микротвердости от толщины
газонасыщенной зоны может быть сложной, на нее влияют состав и
структурные особенности формирующихся фа? переменного состава (см.
рис. 7, 18,51). Внедрение кислорода в решетку карбидов и нитридов
металлов IVa—Va подгрупп сопровождается выделением свободного
182
■Нл,кГ/мм
2200\
£m/S,M2/CM2
О 10 2L
О 0,Ь 0,8 1,2 1,6 2,0
Расстояние от поберхности, мм
10 20 30 40 50 ?,ч
Рис. 70. Микротвердость титана,
окисленного в интервале температур 800—
1200° С:
/ — 800; 2 — 1000; 3 — 1200° С.
Рис. 71. Кинетическая кривая
карбида хрома, окисленного при
температуре 1200° С в течение 60 ч.
углерода (азота) и соответствующего металла и уменьшением
микротвердости появляющихся фаз переменного состава, что
согласуется с данными о наличии дефектов в металлической и
металлоидной подрешетках оксисоединений. При образовании окислов п-типа
это облегчает протекание диффузионных процессов и способствует
более высокой скорости окисления карбидов и нитридов (TiC, ZrC,
HfC, VC, NbC, ZrN, VN) по сравнению с чистыми металлами.
Примеси кислорода к карбидам, нитридам металлов IVa—Va
подгрупп ухудшают их свойства вследствие замещения углерода
и азота, выделения металла, углерода и азота и создания окси-
карбидных, оксинитридных твердых растворов с увеличением
дефектов в металлической и металлоидной подрешетках 11.1—1 27,
1.79, 1.80], а при окислении карбида вольфрама — в результате
охрупчивания.
Температура плавления и микротвердость карбидов титана
[1.8] и циркония [1.7], загрязненных кислородом, понижается с
увеличением содержания кислорода и числа дефектов в решетке
[1.7, 1.8]. С увеличением количества дефектов в решетке оксикар-
бидов титана и содержания кислорода [1.8] микрохрупкость
образцов сначала уменьшается, а затем возрастает.
При исследовании основных закономерностей окисления
карбидов металлов IVa подгруппы в области гомогенности установлено,
что внедрение кислорода в решетку карбида стехиометрического
состава сопровождается замещением и выделением свободного
углерода и соответствующего металла, а по мере повышения
степени дефектности решетки карбида увеличивается и роль (степень)
адсорбции кислорода структурными дефектами решетки. Углерод
замещается на определенной стадии, зависящей от температуры,
времени и степени дефектности решетки исходного карбида. Окисление
нестехиометрического карбида состава, близкого или равного
нижней границе области гомогенности, сопровождается уже не
замещением и выделением углерода, а лишь адсорбцией кислорода его
структурными решетками, дефектами и выделением металла. Это
183
Рис. 72. Внешний вид образцов карбида хрома (а) и нитрида титана (б),
окисленных в течение 60 ч при температурах 1200 и 1000° С, и твердосплавных пластинок
ВКЗ после окисления при температуре 700° С в течение 3 ч:
1 — без покрытия; г — с покрытием:
может быть связано с тем, что в равновесии с кислородно-азотной
газовой фазой, как и при окислении нитридов [3.22], существуют
карбиды таких составов, в которых кислород замещает углерод
только в области их гомогенности.
При образовании окислов n-типа с преимущественной
диффузией кислорода по анионным вакансиям и междоузлиям Zr02
и НЮ2 рост дефектности решетки образующихся оксикарбидных
фаз в процессе растворения кислорода облегчает протекание
диффузионных процессов и повышает скорость окисления некоторых
карбидов и нитридов (ZrC, HfC, NbC, ZrN, VN) по сравнению с
соответствующими металлами.
Окисление компактных беспористых образцов карбидов и
нитридов сопровождается уменьшением микротвердости образующихся
фаз переменного состава с увеличением концентрации
растворенного кислорода в направлении фазовой границы окалина —
тугоплавкое соединение. Напротив, при формировании окалины из
рутила, характеризующейся преимущественной диффузией меж-
узельных катионов титана при высоких температурах, диффузия и
растворение кислорода в TiC замедляются. Увеличение прочности
межатомной связи в решетке TiC по сравнению с титаном
затрудняет переход катионов титана в окалину и определяет более
низкую скорость окисления TiC.
Высокое сопротивление окислению нитрида титана обусловлено
структурой образующихся на границе окалина — нитрид слоев
оксинитридных фаз, препятствующих диффузии кислорода, и
дефектной структурой рутила, которая в определенном интервале
температур формируется путем преимущественной диффузии меж-
узельных катионов титана, активируемой в присутствии азота.
Создание эффективного диффузионного барьера из оксинитрида
TiN^O^ повышает стойкость против окисления TiN по сравнению
с титаном. При высоких температурах, когда скорость процесса
лимитируется диффузией титана через слой окалины из рутила
наружу, титан, TiC и TiN окисляются примерно с одинаковой
скоростью.
184
Значительная концентрация дефектов в HfCxO^ [1.6] и более
высокая комплектность фаз HfN^O^ по сравнению с HfN [1.80]
определяют большую скорость окисления HfC, превышающей
скорость окисления нитрида гафния и гафния при 1000° С 12.27].
Напротив, значительная концентрация вакансий в ZrN^O^ 11.79]
обусловливает низкую стойкость к окислению ZrN по сравнению
с ZrC.
В отличие от карбидов и нитридов металлов IVa—Va подгрупп
окисление карбидов металлов Via подгруппы (Сг3С2 и WC),
характеризующихся отсутствием области гомогенности, сопровождается
не появлением промежуточных дефектных оксикарбидных твердых
растворов, выделением углерода и металла, а только адсорбцией
кислорода структурными дефектами решетки Сг3С2 и WC,
значительно увеличивающей микротвердость поверхностной зоны
образцов на начальной стадии процесса. Здесь химическое
взаимодействие сопровождается преимущественным окислением углерода,
предпочтительным образованием хрома и низших карбидов хрома
Сг7С3, Сг23С6, а также окислов углерода при окислении Сг3С2 или
низших карбидов и Со (С02) при окислении WC и Мо2С, или бора
и СО (С02) при окислении В4С.
Особенности процесса растворения кислорода в карбиде хрома,
протекающего без замещения и выделения углерода и хрома,
отсутствие дефектных оксикарбидных твердых растворов и образование
окисла Сг203 с высокими защитными свойствами обусловливают
исключительно высокое сопротивление окислению Сг3С2 (см.
рис. 37), а формирование рыхлой окалины из W03 сопровождается
значительным охрупчиванием и разрушением WC до окалины
значительной толщины (см. рис. 43).
Длительные испытания (60 ч) показали, что карбид хрома и
нитрид титана имеют высокую жаростойкость, значительно
превышающую сопротивление окислению остальных карбидов и
нитридов металлов IVa—Via подгрупп. Характер кинетических кривых
окисления карбида хрома (рис. 71) свидетельствует о высоких
защитных свойствах образующейся на Сг3С2 окисной пленки. На
окисленных образцах карбида хрома и нитрида титана появлялся
тонкий слой окалины, прочно сцепленный с основой (рис. 72).
Высокая стойкость против окисления Сг3С2 и TiN позволяет
их использовать в качестве защитных покрытий. Так, скорость
окисления титано-азотированного сплава значительно снижалась
по сравнению с исходными твердыми сплавами (рис. 72, в, г) [4.3].
Полученные результаты исследования и установленный
механизм процесса окисления карбидов и нитридов металлов IVa—Va
подгрупп являются одним из экспериментальных подтверждений
теоретических концепций [21—25] об экранирующем влиянии
неметаллов (С, N, О) на Me—Ме-взаимодействия.
Приложение
ОСОБЕННОСТИ ВЫСОКОТЕМПЕРАТУРНОГО
ОКИСЛЕНИЯ РАЗНОВИДНОСТЕЙ
ПИРОУГЛЕРОДА
Углерод является составной частью карбидов. При окислении
карбидов он принимает участие в процессе и влияет на кинетические
характеристики процесса, структуру поверхностной диффузионной
зоны оксикарбидных твердых растворов, морфологические
особенности, структуру и фазовый состав окалины. В связи с этим интерес
представляют данные о взаимодействии разновидностей пироугле-
рода и окислительной среды при высоких температурах.
Как известно, искусственные графиты широко применяются
в различных областях машиностроения, в электрометаллургии и
атомной энергетике, где в процессе эксплуатации они подвергаются
воздействию окислительной среды при высоких температурах.
Стойкость углеграфитовых материалов к окислению и различные
аспекты механизма их взаимодействия с кислородом изучены
достаточно хорошо [П. 1—11.3]. Однако появление новых
разновидностей этих материалов требует дальнейших исследований с точки
зрения возможностей практического использования и с целью
определения механизма их окисления.
Значительный интерес представляют разновидности пиролити-
ческого углерода [II.4], получаемые методом химического
газофазного осаждения. Окисление изотропного (вернее, квазиизотропного)
пиролитического углерода почти не исследовано. Известны
особенности окисления пиролитического углерода с четко выраженной
кристаллоориентированной структурой [II.5—II.8].
Рассмотрим особенности окисления разновидностей
отечественного пироуглерода — анизотропного (кристаллоориентированного) и
изотропного на воздухе в интервале температур 400—1000° С
II 1.9]. Образцы получены на Редкинском опытном заводе.
Одной из важных структурных характеристик пироуглерода
является их плотность, которая изменяется в широких пределах
(от 1,7 до 2,1 для изотропной и от 1,6 до 2,25 г/см3 для анизотропной
разновидностей). Это указывает на определенные изменения в
структуре и проявляется в основном в физических свойствах
186
am/S,m/cM2-
0
-w
-80
-120
-160
V
-I
-1
- 1
[ I 1. ._
и
1
—в—
—o-J
1
1
2
i
5 6 тч
Рис. 73. Зависимость убыли
массы во времени при окислении
изотропного пироуглерода с
плотностью 1,98 г/см3 при
температурах 400 (1), 600 (2), 800 (3),
и 1000° С (4).
материала. Плотность
пироуглерода является наиболее
легко контролируемым
технологическим свойством.
Изучено влияние
плотности (в интервале 1,87—
1,98 г/см3) на скорость
окисления изотропного
пироуглерода и на окисление
высокоплотного (у = 2,24ч-
-^-2,25 г/см3)
анизотропного пироуглерода в
направлениях, параллельном и
перпендикулярном
поверхности осаждения, которая
совпадает с направлением преимущественной ориентации осей а
кристаллитов с квазидвухмерной турбостатной структурой.
Образцы имели вид пластинок размерами 15 X 8 X 1 мм.
Размеры кристаллитов в направлении оси с 0(LC) для данной
серии образцов находились в пределах 90—105 А. Значение Lc
определяли по величине физического уширения дифракционного
максимума (002).
Кинетические кривые окисления образца изотропного
пироуглерода с плотностью 1,98 г/см3 приведены на рис. 73. Анализ
кинетических кривых окисления образцов с разной плотностью
показывает, что с изменением плотности пироуглерода различную
роль играют адсорбция кислорода дефектами структуры и
химическое взаимодействие кислорода и углерода с образованием
газообразных продуктов реакции.
При окислении изотропного пироуглерода с плотностью
1,98 г/см3 в интервале температур 400—600° С масса образцов
несколько увеличивается, по-видимому, вследствие адсорбции
кислорода (рис. 73). Это наблюдается и при окислении образцов с
плотностью 1,95 г/см3 при 400° С, а при более высоких температурах
масса убывает.
При уменьшении плотности изотропного пироуглерода (у =
= 1,92 г/см3) убыль массы проявляется уже при более низких
температурах и при наименьшей плотности (у = 1,87 г/см3)
достигает максимального значения. Понижение плотности приводит к
разрыхлению структуры, что облегчает диффузию кислорода и
взаимодействие его с кристаллитами пироуглерода. С ростом тем-
187
V. г/см3
1,87
1,92
1,95
1,98
600—800° С
41,6 ± 2
43,5 ± 2
45,3 ± 2
47,2 ± 2
800—
—1000° С
4,7 ± 1
6,6 ± 1
8,1 ± 1
10,3 ± 1
Таблица 19. Значение пературЫ (выше 800° С) влияние ПЛОТ-
энергии активации окисления ности на скорость окисления пироуг-
(ккал/мОЛЬ) ДЛЯ ИЗОТРОПНОГО „„„,~-„,, „ нмтчтюй ото
' . леоола проявляется в меньшей сте-
пироуглерода различной ./icp^Ao и^лшш^
плотности пени, что обусловлено увеличением
диффузионной подвижности
кислорода.
Рассчитаны константы скорости
окисления К, из температурных
зависимостей которых вычислили
энергии активации окисления.
Зависимость lg/( =/ (1/71) представлена
двумя линейными участками с
разными значениями энергии активации.
В интервале температур 600—800° С энергия активации составляет
41— 47 ккал/моль (табл. 19), а при 800—1000° С — 4—10 ккал/моль.
Понижение энергии активации с ростом температуры связано с
переходом окисления из кинетической области в диффузионную.
Приведенные значения энергии активации согласуются с
данными для электродных графитовых материалов [II.2, II.3] и для
кристаллоориентированного пироуглерода [II.6].
Энергия активации окисления изотропного пироуглерода в
кинетической области в интервале температур 600—800° С
относительно слабо зависит от плотности материала с тенденцией к
небольшому увеличению с ростом плотности, что связано с изменением
адсорбционных характеристик поверхности пироуглерода. В
то же время энергия активации в диффузионной области (800—
1000° С) существенно увеличивается с повышением плотности.
В рассматриваемом диапазоне значений плотности изотропного
пироуглерода увеличение ее коррелирует с ростом размера
кристаллитов и уменьшением в них плотности дефектов [II.4]. Это наряду
с повышением плотности упаковки кристаллитов в материале
затрудняет диффузию кислорода и его взаимодействие с материалом.
Из электронно-микроскопической структуры поверхности
изотропного пироуглерода, окисленного при 700, 800, 1000° С, видно,
что при 700° С окисление протекает на поверхности образца. С
повышением температуры окисление захватывает более глубокие
слои: появляются участки выгоревшего материала. При
температуре 1000° С область выгорания увеличивается.
Исследован анизотропный пироуглерод (пирографит) с
плотностью 2,24 г/осм3, параметрами решетки а = 2,504, с= 6,2 А,
Lc = 200—400 А. Материал получали при температуре выше 2000° С.
Угол разориентировки осей относительно нормали к поверхности
осаждения составлял примерно 20°.
Изучение окисления образцов анизотропного пироуглерода,
вырезанных параллельно и перпендикулярно поверхности
осаждения, позволило установить интересные особенности поведения этого
материала. Кинетические кривые окисления анизотропного и
изотропного пироуглерода аналогичны. Скорость окисления образцов,
188
Рис. 74. Зависимость убыли массы во
времени при окислении образцов крис-
таллоориентированного пироуглерода
в направлении, параллельном (1, 2) и
перпендикулярном (3, 4) поверхности
осаждения, при различной толщине
образцов:
1 — 2,78; 2 — 1.81; 3 — 1,86; 4 — 2.97 мм.
вырезанных параллельно
поверхности осаждения, при 300—
600° С несколько ниже скорости
окисления образцов,
вырезанных перпендикулярно к
поверхности осаждения, что
согласуется с данными [П.6]. Однако
с ростом температуры (выше
600° С) скорость окисления в обоих направлениях становится
практически одинаковой. В кинетической области (600—800° С) в
направлении, перпендикулярном к поверхности осаждения, Е =40±
± 2 ккал/моль, в направлении, параллельном поверхности
осаждения, Е =43 ±2 ккал/моль, а в диффузионной области (800—1000° С)
соответственно Е =6 ± 1 и Е = 8 ± 1 ккал/моль.
Полученные значения энергии активации по порядку величины
согласуются с энергией активации процесса окисления хорошо
ориентированного пироуглерода с поверхности, перпендикулярной
к оси с [II.7].
Исследование структуры поверхности окисленного при
температуре 600° С анизотропного пироуглерода показало, что на базисной
поверхности образца имеются ямки растравливания. На
поверхности образца, вырезанного перпендикулярно к поверхности
осаждения, после окисления при 600° С видны каналы, направленные
перпендикулярно к базисным плоскостям. На торце после
длительного окисления при 600° С в течение 150 ч происходит разрушение
материала с образованием ячеистой структуры.
Следует отметить, что при окислении кристаллоориентированного
пироуглерода линейная зависимость скорости окисления
устанавливается через некоторое время после начала окисления в
кинетической области, что, вероятно, вызвано преимущественным
протеканием на начальной стадии процесса быстрого окисления мест
выхода конусов роста [II.4, 11.101. С этим связано образование на
окисленной поверхности ячеистой структуры. Такие дефекты
отсутствуют в изотропном пироуглероде, что служит причиной
различного поведения материалов в начальный период окисления.
Для выяснения влияния вклада базисной и торцевой
поверхностей в окисление кристаллоориентированного пироуглерода
изучена скорость окисления образцов в направлениях,
перпендикулярном и параллельном поверхности осаждения,в зависимости от их
толщины (рис. 74). Как следует из рисунка, с увеличением
189
толщины образцов скорость их окисления в направлении,
параллельном поверхности осаждения, уменьшается, а в направлении,
перпендикулярном к поверхности осаждения, увеличивается.
Такие результаты свидетельствуют о том, что окисление обусловлено
в большей мере дефектами базисной поверхности.
Значения энергии активации окисления кристаллоориентирован-
ной и изотропной (вернее, квазиизотропной) разновидностей пи-
роуглерода в кинетической и диффузионной областях (в
последнем случае при сравнении наиболее плотного и изотропного пиро-
углерода) отличаются не намного. Это указывает на
преимущественное влияние реальной структуры материала (дефектов
кристаллического строения, и в первую очередь обрывков графитовых сеток)
на кинетику окисления пироуглерода.
Таким образом, скорость окисления изотропного пироуглерода
растет с уменьшением его плотности. Указанная зависимость
особенно четко выражена в интервале температур 400—800° С.
Окисление пироуглерода протекает в две стадии с различными значениями
энергии активации, соответствующими кинетической и
диффузионной областям. Значения энергии активации коррелируют с
плотностью. Скорости процесса окисления кристаллоориентированного
пироуглерода в направлениях, параллельном и перпендикулярном
поверхности осаждения, в интервале 600—800° С практически
одинаковы, а при более низких температурах скорость окисления в
направлении оси с несколько выше. Кинетика окисления
пироуглерода определяется дефектами его кристаллического строения.
П.1. Lang F. M., Magnier P. Influence de la lumiere visible sur cinetique de
l'oxydation (620 C) de la face 0001 du graphite.— С. г. Acad, sci., 1964, 258,'
N 18, p. 4499—4501.
П.2. Gulbransen E. A., Andrew K- F., Brassart F. A. The oxidation of graphite at
temperatures of 600 to 1500° С and at pressures of 2 to 76 torr of oxygen.—
J. Electrochem. Soc, 1963, HO, N 6, p. 476—483.
П.З. Bluhol&er G., Eyring H. Kinetic of grafit oxidation.— J. Phys. Chem., 1959,
63, N 6, p. 1104—1008.
П.4. Нешпор В. С. Структура и физические свойства разновидностей пирогра-
фита.— В кн.: Химическое газофазное осаждение тугоплавких
неорганических материалов. Л. : ГИПХ, 1975, с. 32—65.
П.5. Lang F. M., Magnier P., Sella С, Frillaz J. J. Sur le development morpho-
logique de l'oxydation (par Pair et 1'anhydride carbonique) du graphite
pyrolitique.—С r. Acad, sci., 1962, 254, N 24, p. 4114—4116.
П.6. Levy M., Wong P. The oxidation of pyrolitic graphite at temperatures of
1400—1800° F and air velocities of 25—100 cm/sec—J. Electrochem. Soc,
1964, 111, N 9, p. 1088—1091.
П.7. Rodriguez-Reinoso F., Thrower P., Wahler P. Kinetic studies of the oxydation
highly oriented pyrolytic graphites.— Carbon, 1975, 13, p. 71—80.
П.8. Rellich G., Thrower P., Walher P. Oxidation of compression annealed
pyrolytic graphites.—Carbon, 1975, 13, p. 71—80.
П.9. Винокур Ф. Л., Нешпор В. С, Головко Э. И., Войтович Р. Ф. Особенности
взаимодействия разновидностей пироуглерода с окислительной средой при
высоких температурах.— Изв. АН СССР. Сер. Неорган, материалы, 1979,
15, № 2, с. 270—274.
П. 10. Диффендорф Р. Дж. Огнеупорные пиролитические материалы.— В кн.:
Исследование при высоких температурах. М. : Наука, 1967, с. 340—350.
ОГЛАВЛЕНИЕ
Введение 3
Глава 1. Дефекты решетки карбидов и оксикарбидов металлов IVa—Va
подгрупп 9
Статистико-термодинамический анализ свойств карбидов ... 15
Дефекты решетки карбидов металлов IVa—Via подгрупп .... 19
Дефекты решетки оксикарбидов металлов IVa—Va подгрупп . 19
Глава 2. Окисление карбидов металлов IVa—Via подгрупп 36
Окисление карбидов металлов IVa подгруппы 37
Окисление TiC 37
Окисление ZrC 56
Окисление HfC 60
Окисление карбидов металлов Va подгруппы 62
Окисление VC 62
Окисление NbC 65
Окисление ТаС 70
Окисление карбидов металлов Via подгруппы 73
Термодинамические основы высокотемпературного окисления
карбидов металлов Via подгруппы 73
Окисление Сг3С2 78
Окисление Мо2С 82
Окисление WC 84
Основные закономерности процесса окисления карбидов металлов
IVa—Va подгрупп 86
Окисление В4С 92
Роль углерода в процессе окисления карбидов 99
Роль реакций взаимодействия на границе окалина — карбид в
процессе окисления карбидов 104
Глава 3. Дефекты решетки нитридов л оксинитридов металлов IVa—Va
подгрупп 108
Дефекты решетки нитридов металлов IVa—Va подгрупп ... ПО
Дефекты решетки оксинитридов металлов IVa—Va подгрупп 111
Глава 4. Окисление нитридов металлов IVa—Va подгрупп 119
Окисление нитридов металлов IVa подгруппы 119
Окисление TiN 119
Окисление ZrN и HfN 134
191
Окисление нитридов металлов Va подгруппы 142
Основные закономерности окисления нитридов металлов IVa—Va
подгрупп 149
Влияние азота на структуру и свойства окалины 152
Влияние углерода и азота на морфологические особенности окалины 155
Образование нитевидных кристаллов 156
Глава 5. Окисление неметаллических нитридоз 159
Окисление BN 160
Окисление A1N 168
Окисление Si3N4 171
Глава 6. Некоторые закономерности окисления карбидов и нитридов
металлов IVa—Via подгрупп и соответствующих металлов 182
Приложение. Особенности высокотемпературного окисления разновидностей
пироуглерода 187
Раиса Фоминична Войтович
ОКИСЛЕНИЕ КАРБИДОВ И НИТРИДОВ
Утверждено к печати ученым советом Института проблем
материаловедения АН УССР
Редактор Л. П. Кругляк
Оформление художника Г. М Б а лю на
Художественный редактор В. П. К узь
Технический редактор Т. С. Б е р е з я к
Корректоры Е. А. Д у б а р ь, 3. П. Школьник
Информ. бланк № 4191.
Сдано в набор 12.12.80. Подп. в печ. 27.05.81. БФ 00109. Формат 60Х90Д„. Бумага типогр.
№ 1. Лит. гарн. Вые. печ. Усл. печ. л. 12,5. Уч.-изд. л. 12,61. Усл. кр.-отт. 12,5. Тираж 1000
экз. Зак. 2920. Цена 2 руб. 20 коп.
Издательство «Наукова думка». 252601, Киев, ГСП, Репина, 3.
Изготовлено Нестеровской городской типографией, г. Нестеров, Львовской обл.,
ул Горького, 8, с матриц Головного предприятия республиканского производственного
объединения «Полиграфкнига» Госкомиздата УССР, 252057, Киев-67, Довженко.З.
Зак. 2327.